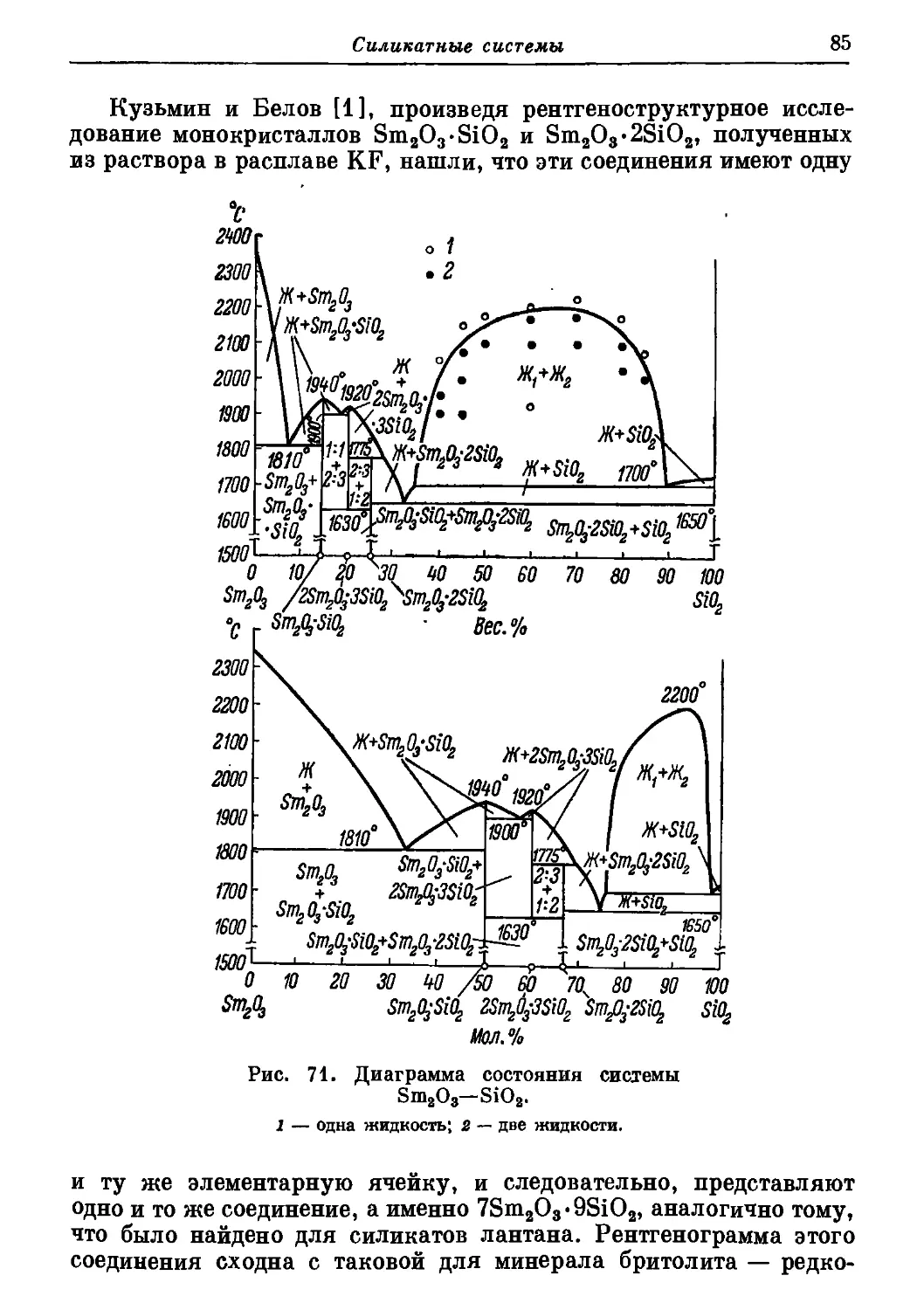
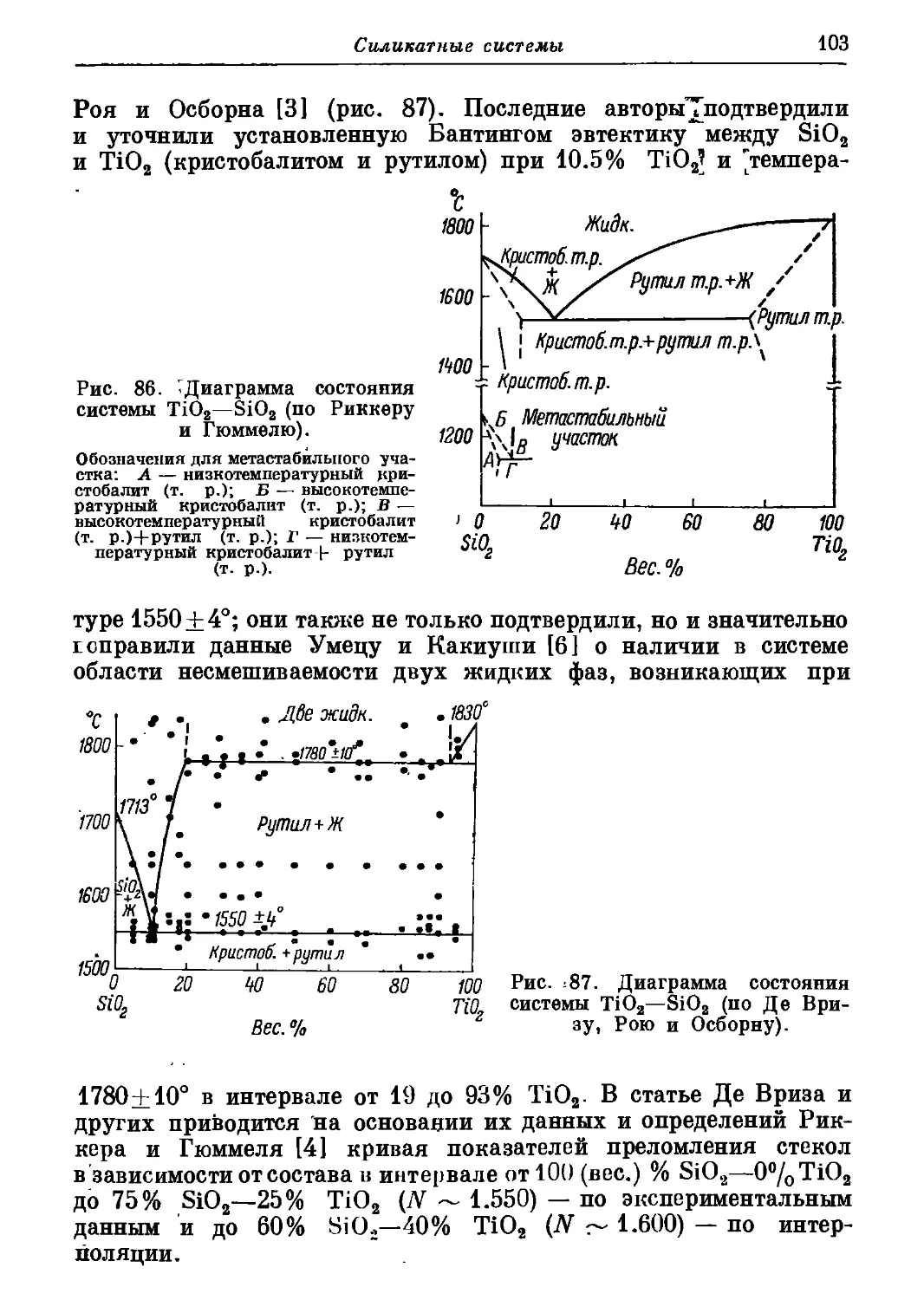
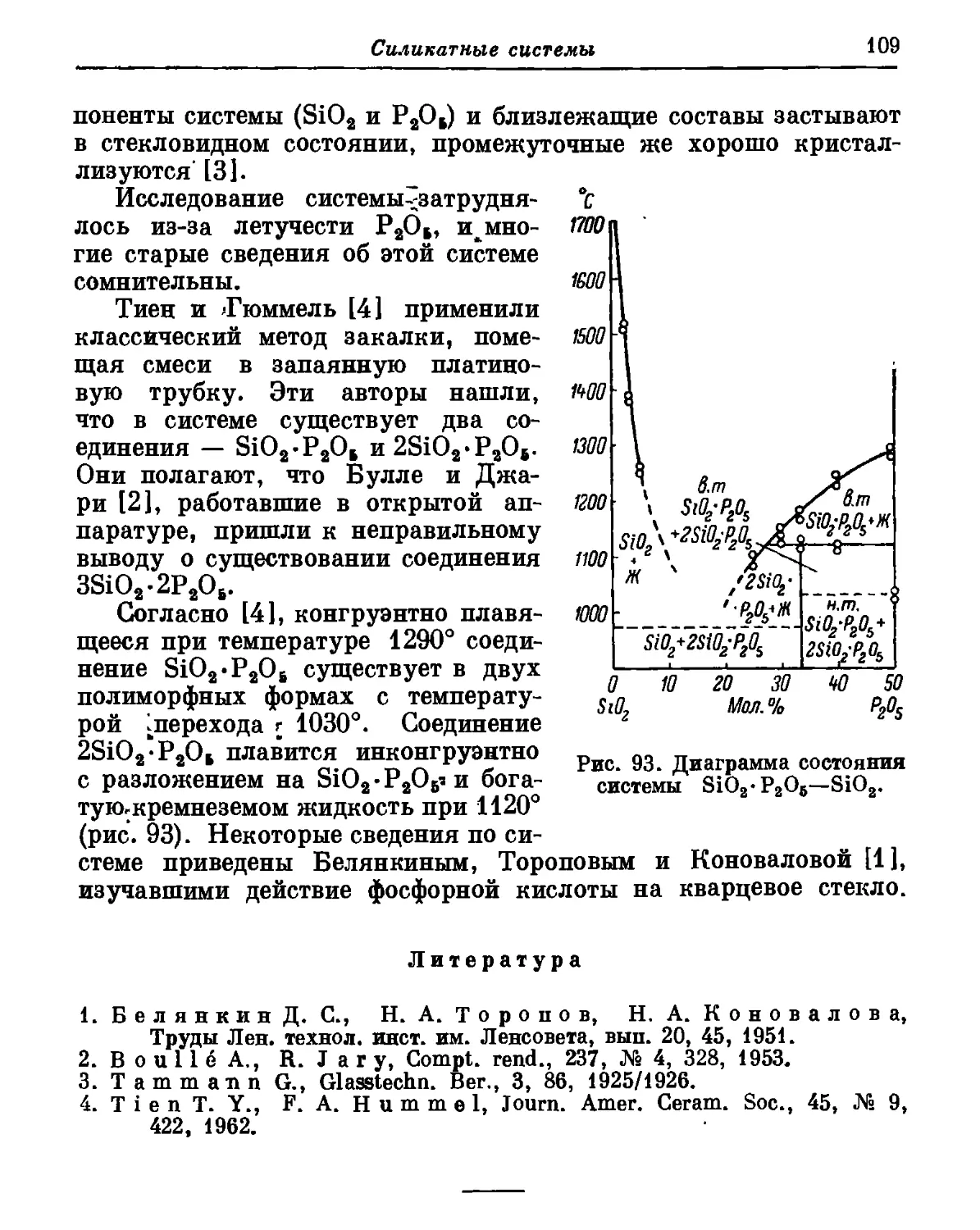
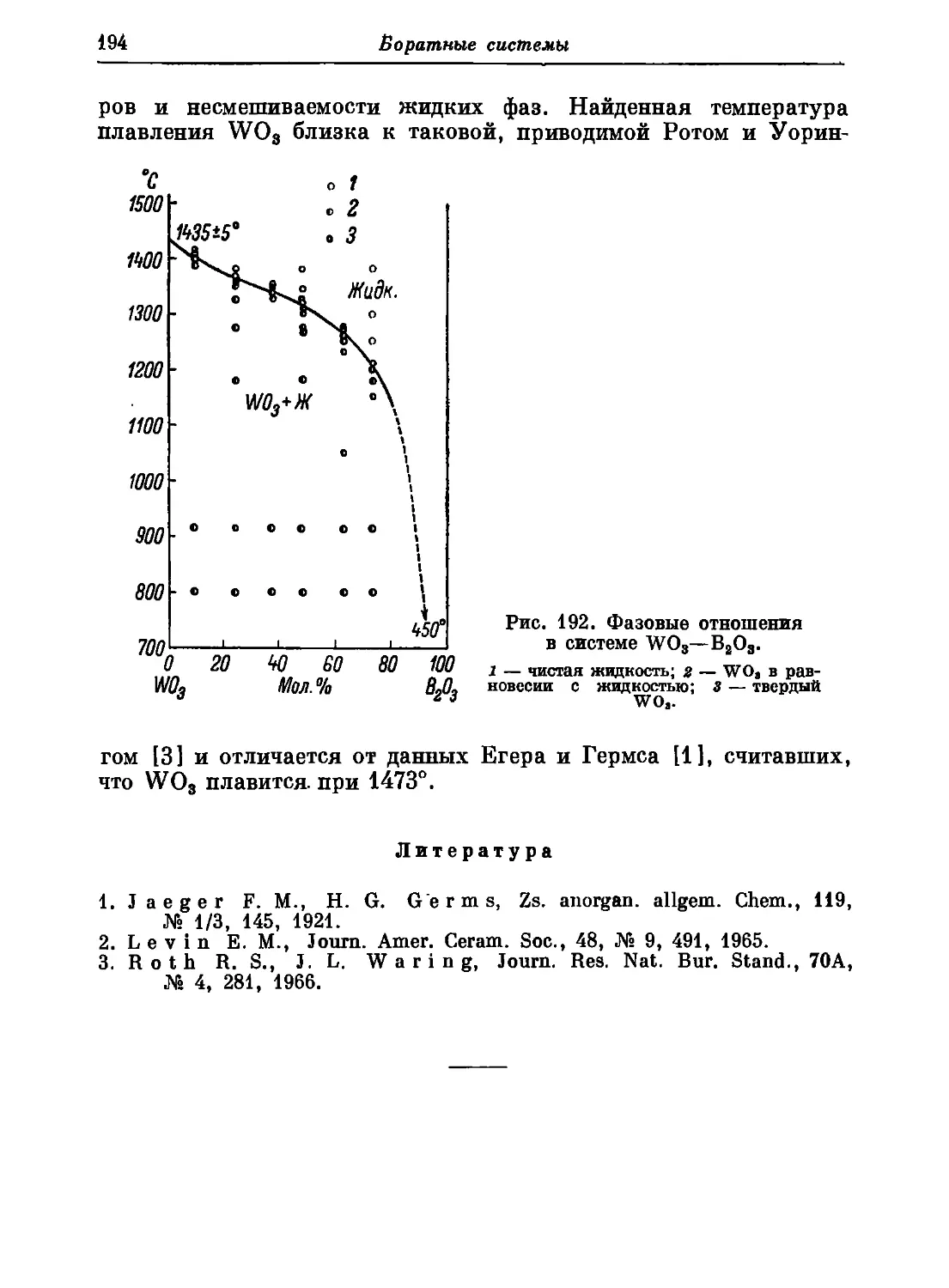
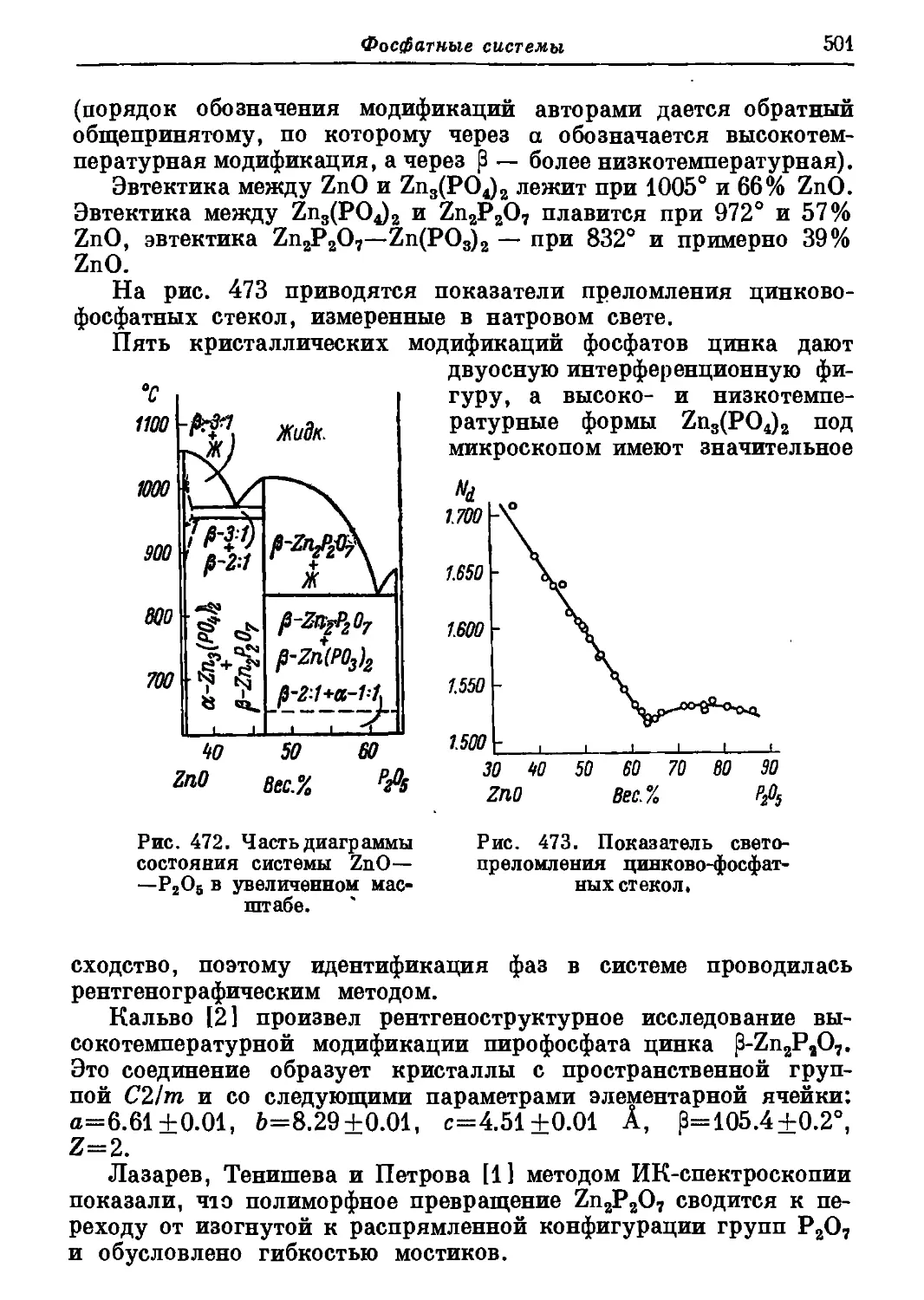
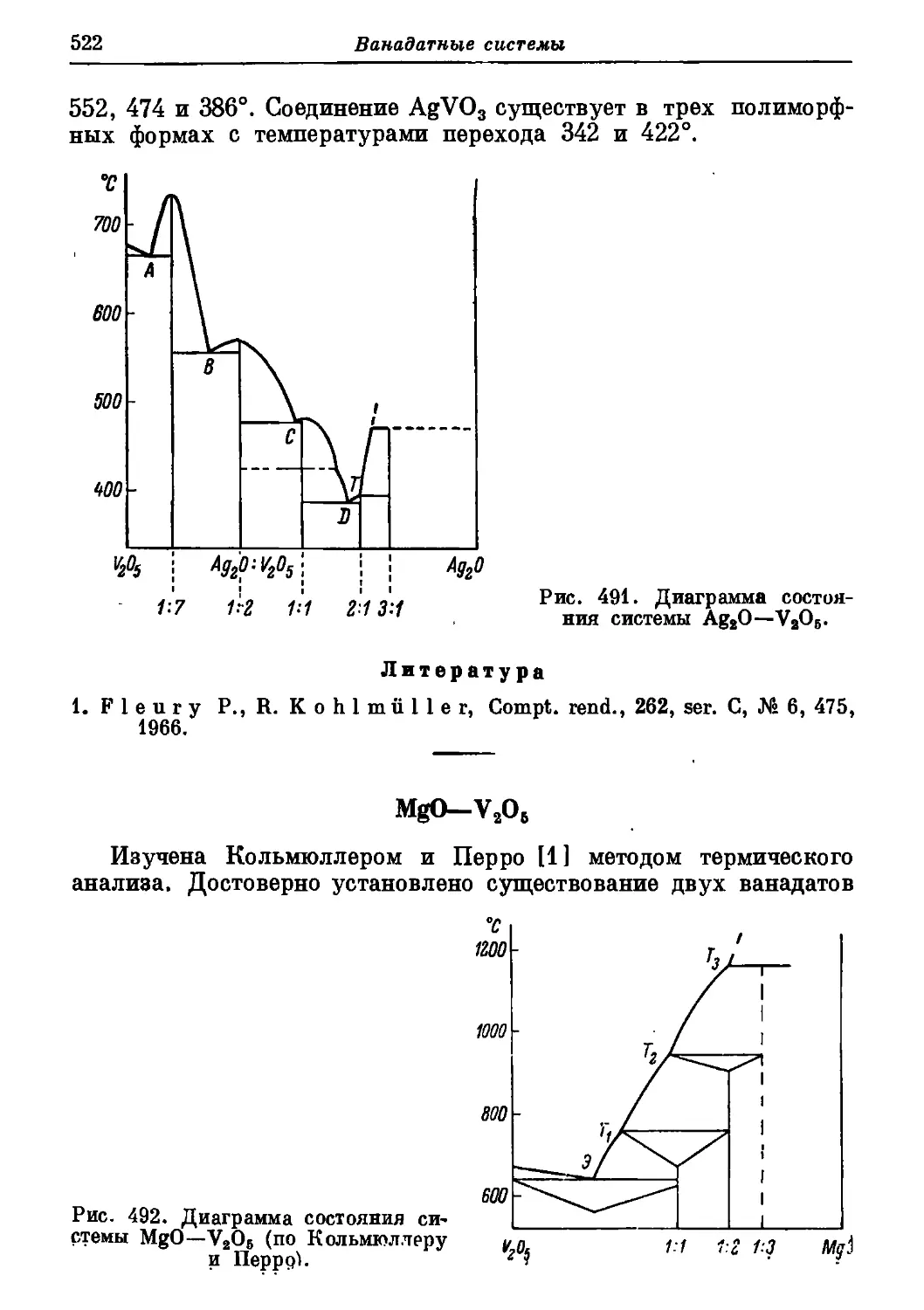
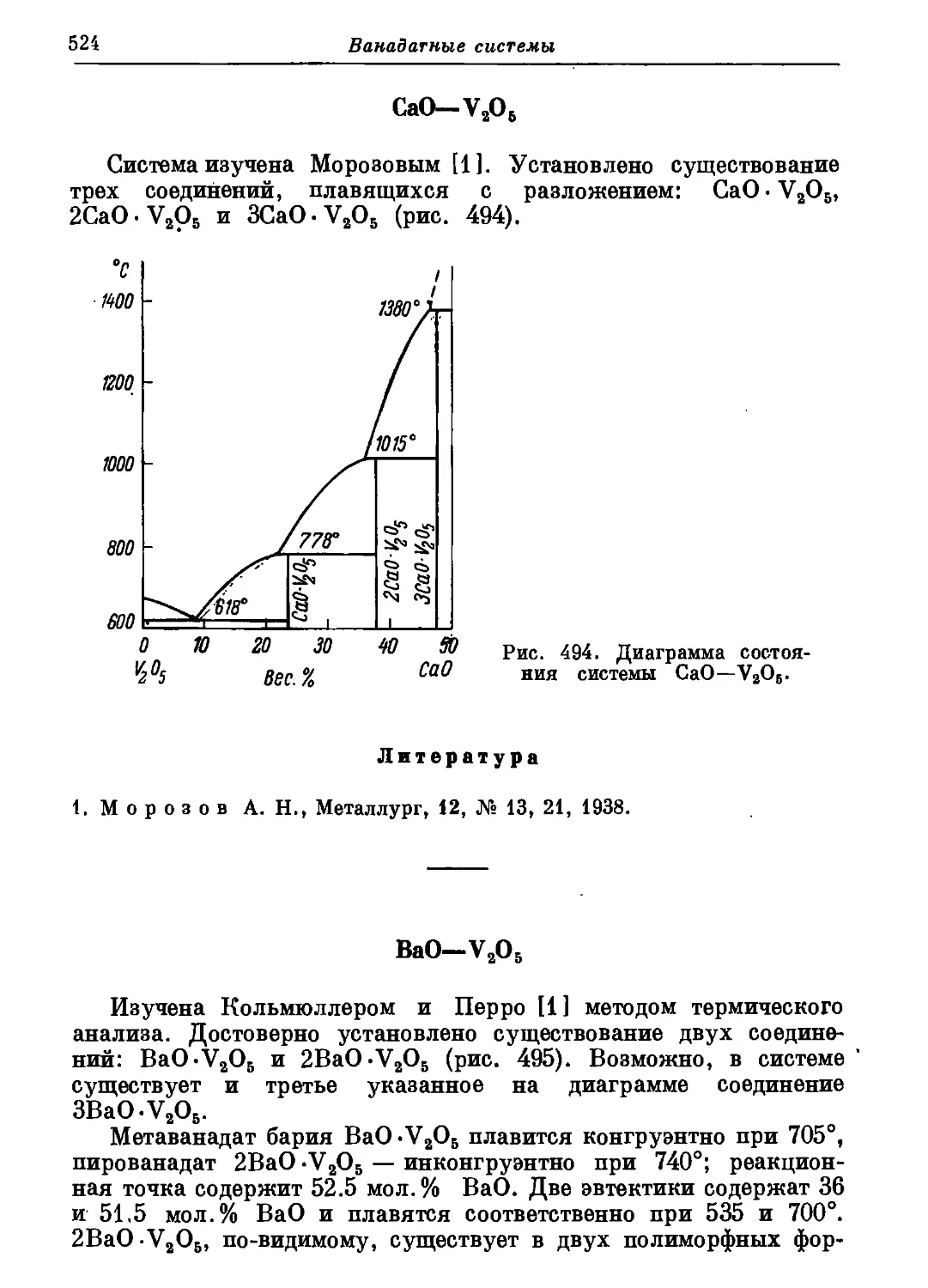
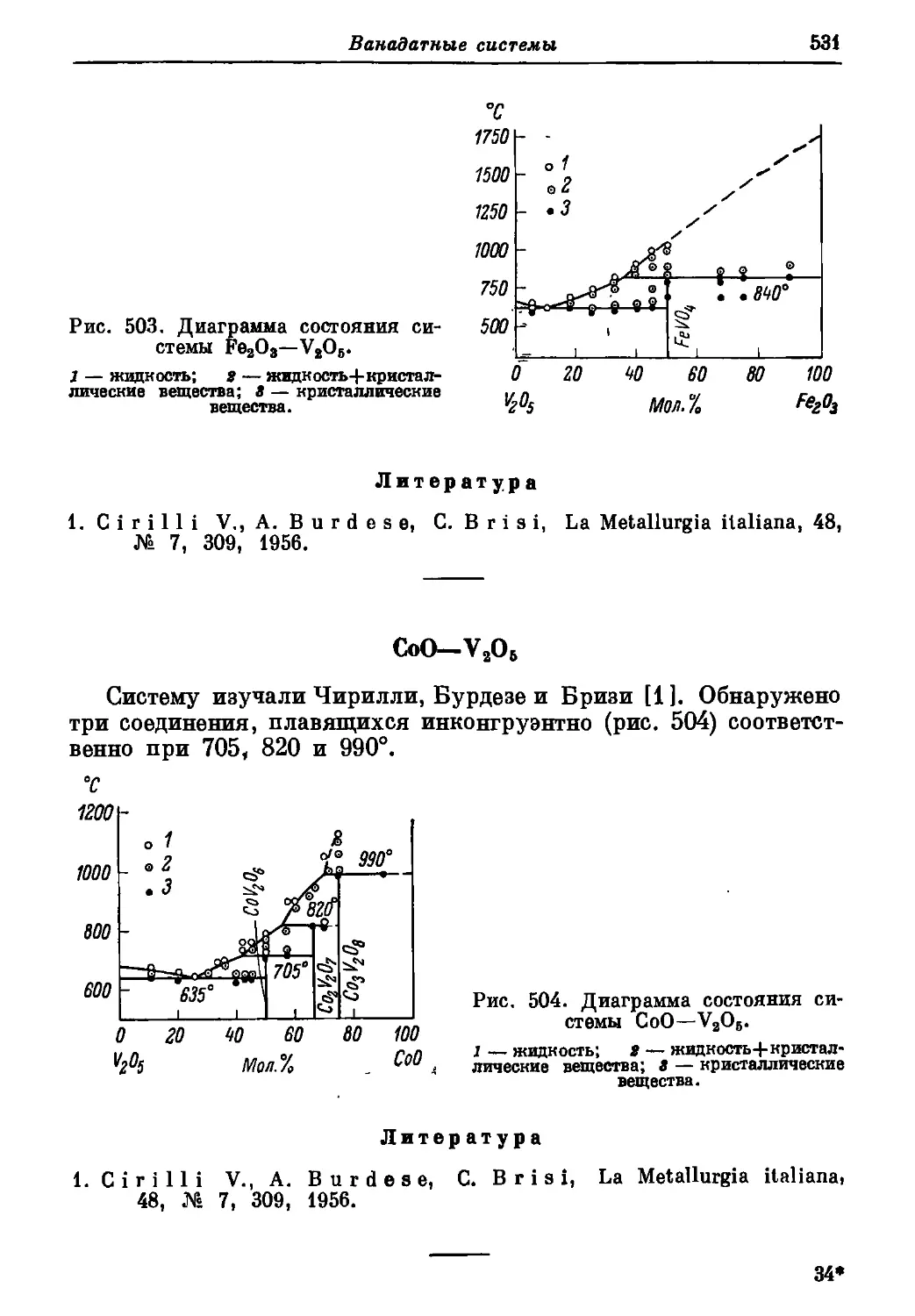
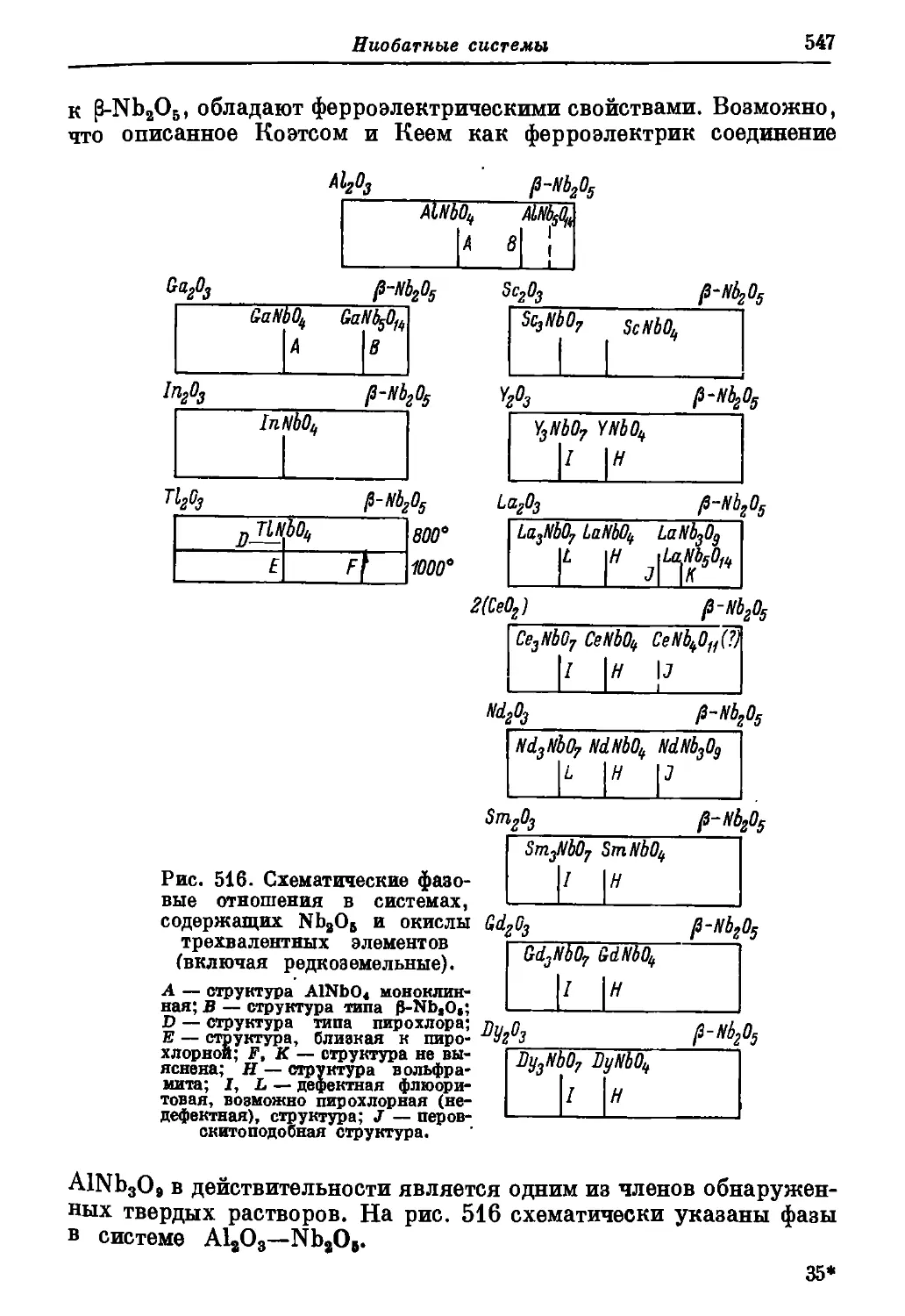
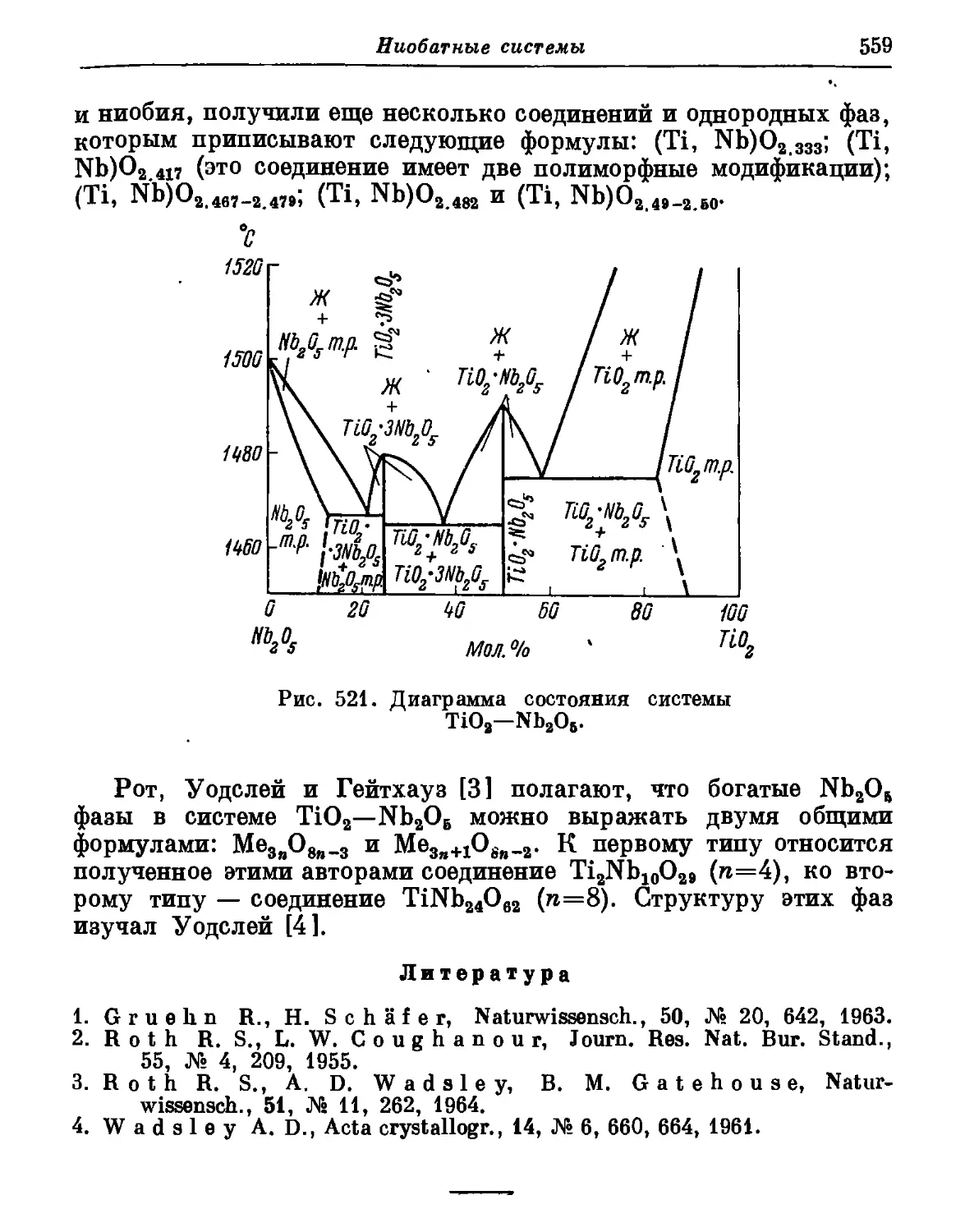
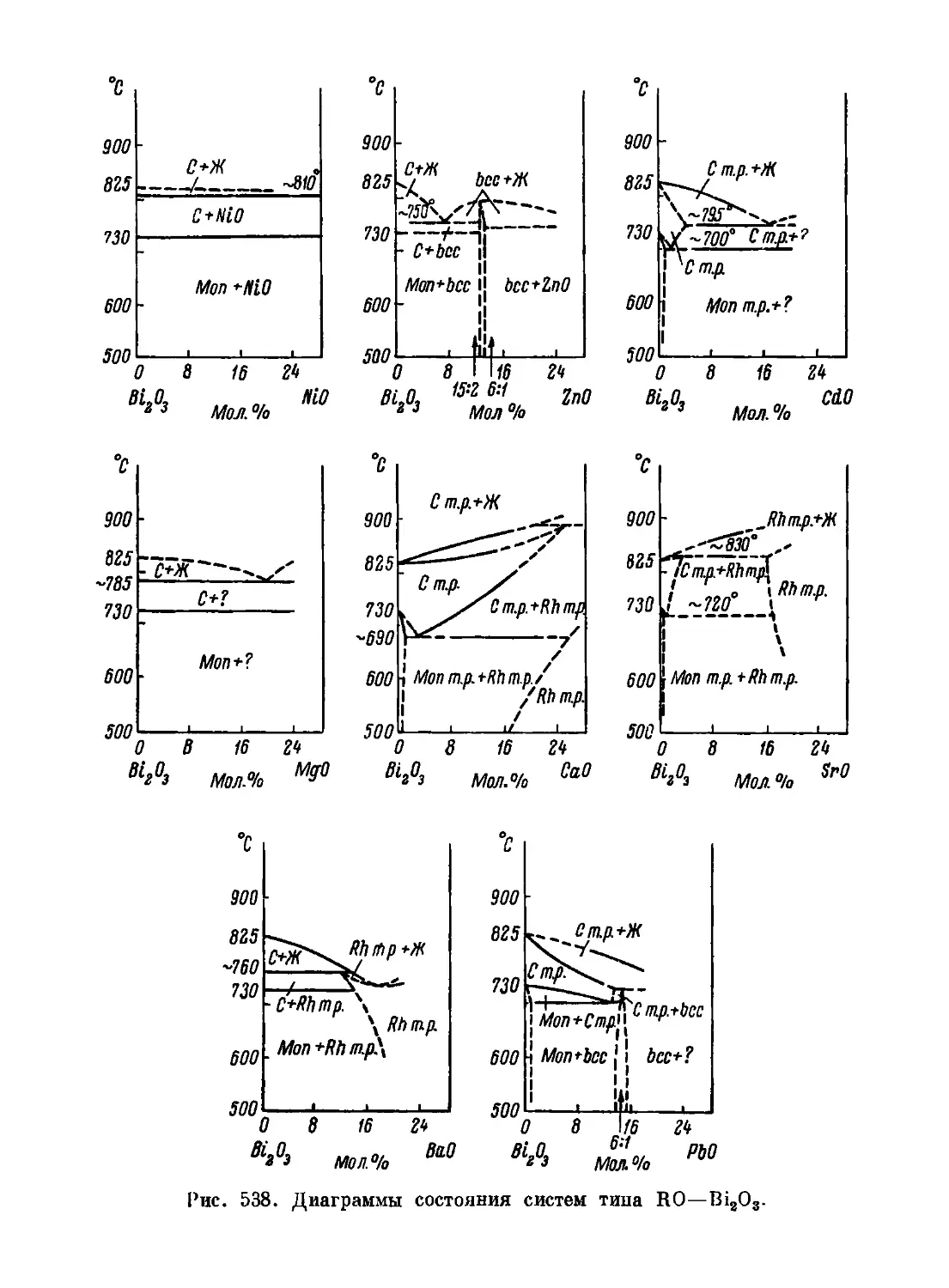
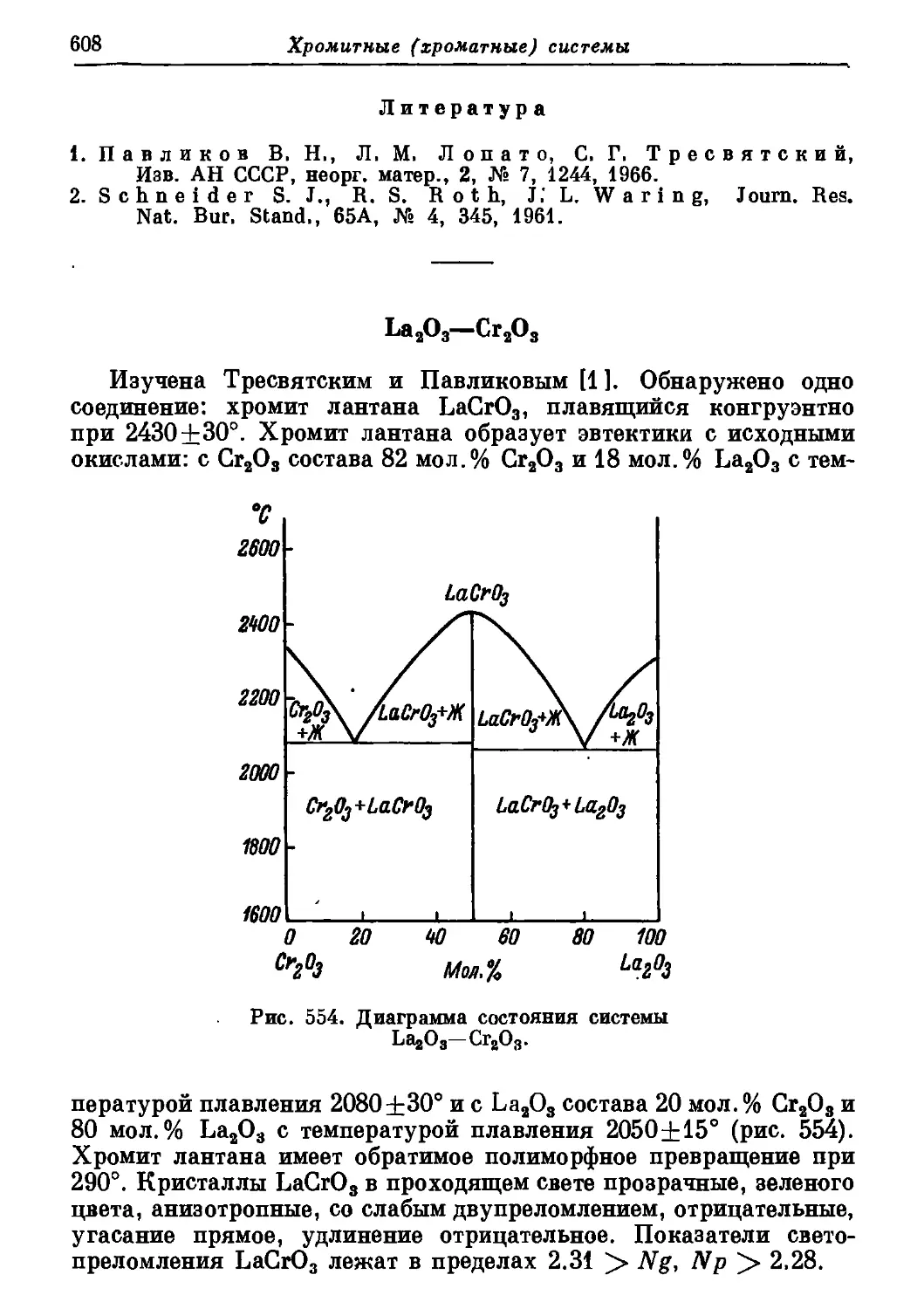
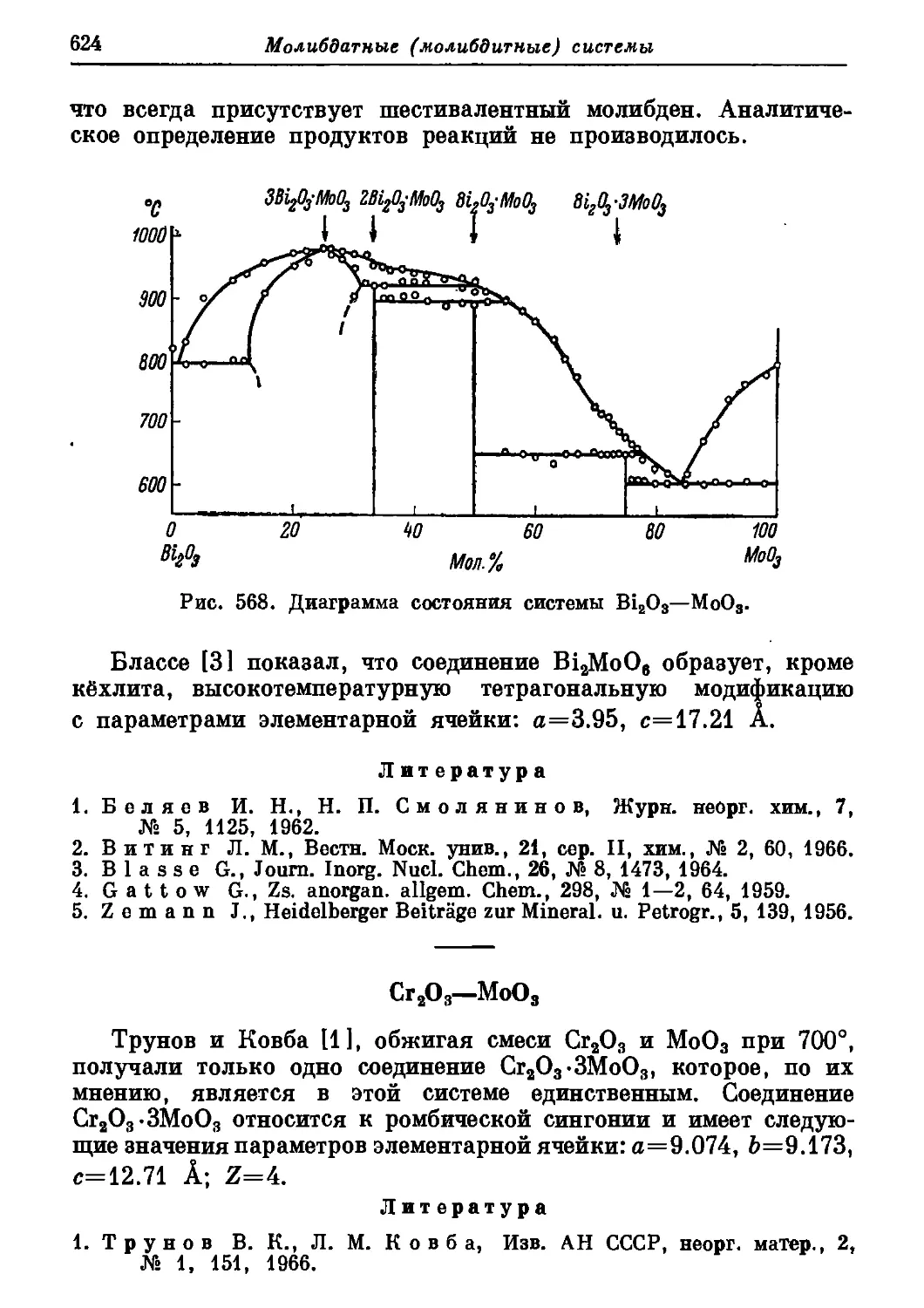
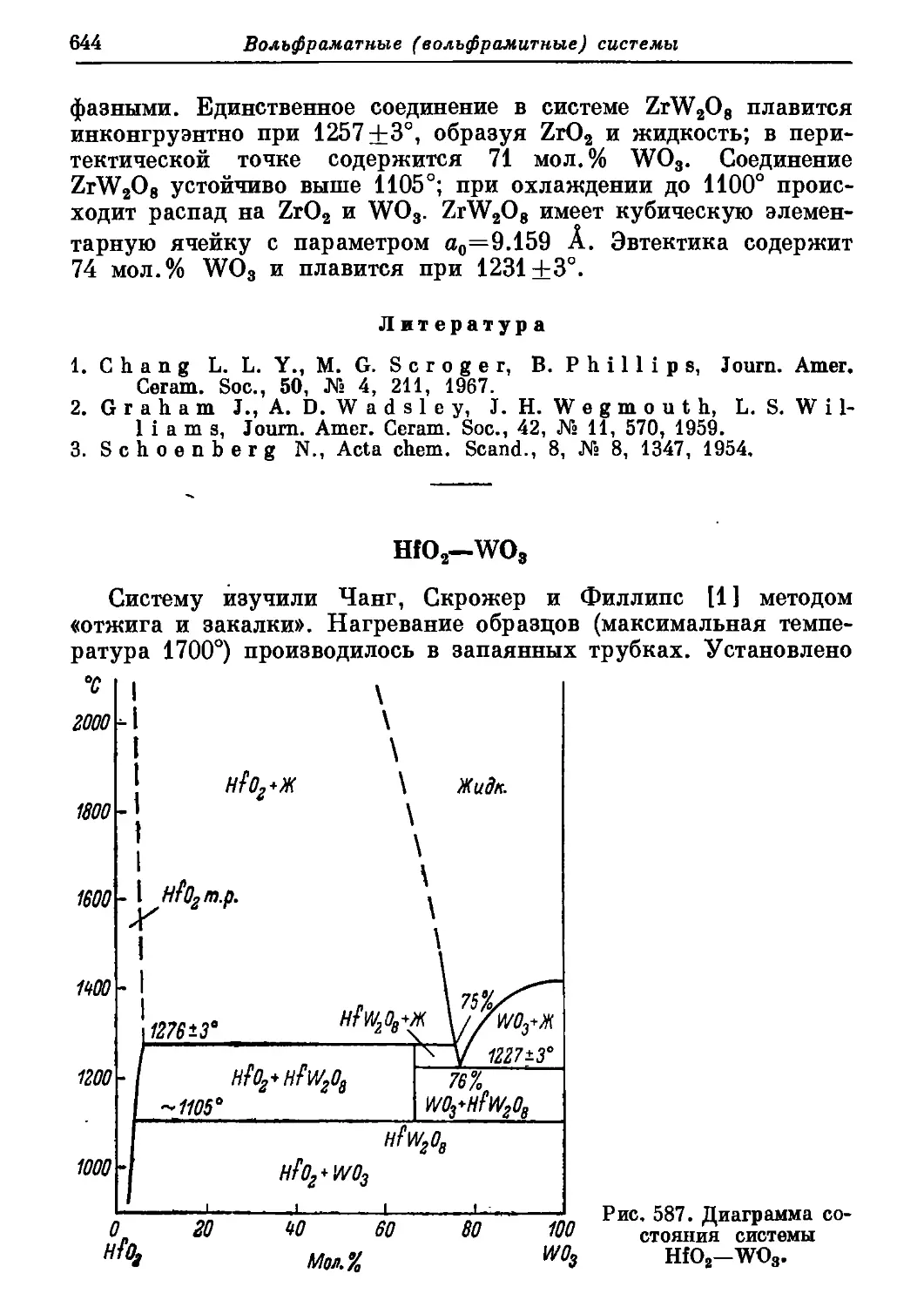
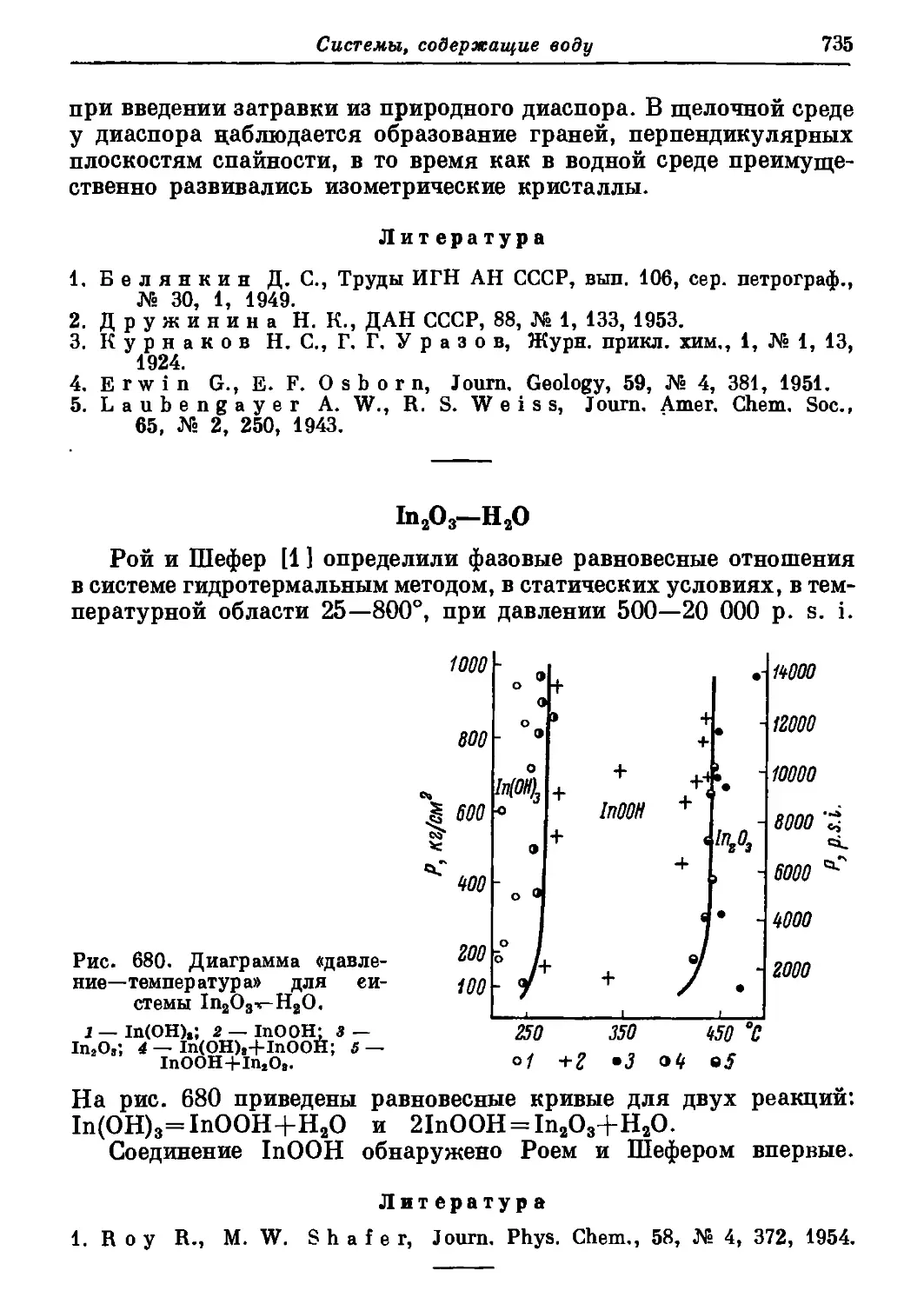
Автор: Торопов Н.А. Барзаковский В.П. Лапин В.В. Бурцева Н.Н.
Теги: силикатные системы двойные системы
Год: 1969
Текст
Диаграммы состояния силикатных систем. Справочник. Выпуск
первый. Двойные системы. Торопов Н, А,, Барзаковский
В. П., Лапин В. В., Бурцева Н. Н. Изд. «Наука», Ленингр.
отд., Л., 1969, 1—822.
В первом выпуске второго издания (значительно расширенном по срав-
нению с первым) справочника «Диаграммы состояния силикатных
систем» содержатся важнейшие сведения о двойных силикатных, алюми-
натных, германатных, титанатных, цирконатных, фосфатных, ванадат-
ных, нпобатных, танталатных, молибдатных, вольфраматных, феррит-
ных, фторидных и других системах, а также системах, содержащих
окислы редкоземельных элементов, хрома, марганца и урана. Эти
системы являются основой производства ряда важнейших материалов
современной техники (разного вида керамики, огнеупоров, электро-
и радиотехнических, конструкционных и других материалов). В зави-
симости от изученности соответствующих систем приводятся равновесные
фазовые диаграммы состояния или указываются области устойчивости
существующих в системах фаз и отдельных химических соединений (вклю-
чая и неравновесные, метастабильные фазы). В справочнике даются
также некоторые физические константы (оптические свойства, струк-
турные характеристики п т. д.). Всего в книге описано 816 систем.
Табл. — 153, илл. — 781, библ. — 1743 пази.
Под редакцией
чл.-корр. АН СССР Н. А. ТОРОПОВА
3-14-1
188а-68 (II)
ПРЕДИСЛОВИЕ
Исследования гетерогенных равновесий в силикатных и близ-
ких к ним других системах, состоящих из окислов, фторидов
и т. п., создают наряду с исследованиями металлических систем
фундаментальные научные основы современного неорганического
материаловедения.
В связи с интенсивным развитием технологии новых материа-
лов для радиоэлектроники, техники высоких температур, созда-
нием новых видов преобразователей энергии, материалов для
атомной энергетики, а также для усовершенствования ранее широко
применявшихся — цементов, стекол, огнеупоров, керамики и
т. д. — требуется разработка все более широкого круга физико-
химических систем.
Все это находит отражение в непрерывно расширяющемся
потоке журнальной информации, описывающей исследования
систем. Необходимость в составлении справочников, обобщающих
результаты всей этой колоссальной работы физико-химиков,
исследующих диаграммы состояния силикатных и других окис-
ных систем, становится особенно острой в настоящее время —
время бурного технического прогресса технологии неоргани-
ческих материалов.
Обилие данных по физико-химическому исследованию окис-
ных систем требует создания многотомного справочника. Вы-
шедший в 1965 г. первый выпуск справочника «Диаграммы со-
стояния силикатных систем», содержащий описание двойных
систем, быстро разошелся. Предлагаемое второе издание этого
выпуска значительно расширено и характеризует состояние
исследования окисных систем к 1968 г.
Следуя традициям, давно уже сложившимся в советской на-
учно-технической литературе по силикатам, авторы настоящей
работы не ограничились собиранием и классификацией одних
только диаграмм состояния, а стремились также дать читателю
наиболее полное описание (кристаллические константы, рентге-
новские постоянные, термина) тех кристаллических фаз, которые
были синтезированы в рассматриваемых системах. Это особенно
важно потому, что соответствующие фазы являются важнейшими
1*
4
Предисловие
синтетическими минералами, входящими в состав технических
материалов, таких как цементный клинкер, огнеупор, ситалл
и т. д. Кроме того, те же самые физико-химические фазы уже
в качестве структурных составляющих конструкционных и за-
щитных материалов и в форме монокристаллов находят, особенно
в последнее время, все более широкое применение.
За последние годы интенсивно стали изучаться системы с окис-
лами, которые только начинают использоваться в практике.
Сюда относятся прежде всего окислы редкоземельных элементов,
а также окислы широко распространенных элементов, но в не-,
обычной валентности, например Ti2O8, WO2 и др. Значительное
количество систем с такими окислами описано в новом издании.
В настоящее время при исследовании окисных систем боль-
шое внимание обращается на процессы, происходящие в низко-
температурной области, т. е. в твердых фазах. Здесь часто обра-
зуются малоустойчивые соединения, разлагающиеся при повыше-
нии температуры. Для этих соединений характерна сложная
стехиометрия, а также наличие областей гомогенности (твердых
растворов). Нередко образующиеся здесь соединения являются
метастабильными и на равновесной фазовой диаграмме не фи
гурируют. Для таких систем приходится рассматривать две диа-
граммы состояния: стабильную (равновесную) и метастабильную
диаграммы. При изложении результатов изучения метастабиль
ных фаз приводились имеющие существенное значение сведения
об условиях синтеза соответствующих соединений. При совре
менном состоянии изучения окисных систем становятся совер
шенно ясными все преимущества принятого нами метода их опв
сания, когда приводятся не только сами диаграммы, но и даете;
текст, содержащий важнейшие сведения об особенностях соот-
ветствующих систем. Если ограничиться только графическим
материалом (как это делается в известном справочнике Левина,
Мак-Мерди и Роббинса «Фазовые диаграммы для керамиков»,
1964), то пользующийся справочником получит лишь самые крат-
кие, подчас и неясные сведения о системе.
Весьма существенным и важным мы считаем также включение
в книгу таблиц инвариантных точек, полученных в цитируемых
системах, поскольку эти данные позволяют проводить ряд рас-
четов процессов кристаллизации, протекающих в технических
материалах в условиях их получения, а также вторичных изм^
нений в различных практических условиях. Приводимая дл
каждой системы основная библиография позволит читателю позн.
комиться с наиболее фундаментальными работами по каждой ci:,
стеме.
Дать в руки и сотруднику исследовательского института,
и работнику заводской лаборатории, а в особенности студентам ।
Предисловие 5
старших курсов и аспирантам самых различных специальностей
(физикам, химикам, металлургам и силикатчикам) наиболее
полную картину фазового строения изучаемых ими неоргани-
ческих материалов в концентрированном виде — вот та цель,
которую поставили перед собой авторы этого справочника.
Как показывает опыт, справочное пособие такого рода оказы-
вается весьма полезным и для широкого круга минералогов, петро-
графов и других специалистов геолого-минералогического профиля.
Н. А. Торопов
ПОЯСНЕНИЕ К ПЕРВОМУ ВЫПУСКУ
Параметры кристаллических решеток химических соединений
и твердых растворов даются в тех же единицах измерения, кото-
рыми пользовались авторы соответствующих литературных источ-
ников. Такими единицами являются: А, а. и. и кХ.
1. А— ангстремы=10"8 см.
2. а. и. — AngstrQm units, а. и. — единица длины, полу-
чающаяся из оптических измерений: длина волны красной линии
кадмия в сухом воздухе при 760 мм рт. ст., g=980.67 CGSE и 15° С
составляет 6438.4696 а. и. Эта единица совпадает с А с точностью
по крайней мере до седьмой значащей цифры.
3. кХ .— килоиксы=1000Х ==1.002063+0.000007 А. X — рент-
геновский стандарт длины волны, определенный с помощью
формулы Вульфа—Брэгга на основании измерений d (200) ка-
менной соли.
Температура всюду дается в градусах Цельсия, исключения
сопровождаются соответствующими указаниями (например, °К).
Для сокращенного обозначения формул химических соеди-
нений применяется два способа: 1) компоненты соединения за-
шифровываются цифрами (например: 5TiO2-2P2O5=5 : 2); 2) оки-
сел обозначается по первой букве элемента (например:
3CaO-SiO2=C3S).
Надписи на рисунках даются обычно в сокращении. Наиболее
часто употребляемыми сокращениями являются: Ж — жидкость,
т. р. — твердый раствор.
СИЛИКАТНЫЕ СИСТЕМЫ
Li2O—SiO2
Система, весьма существенная для технологии ситаллов и
литиевых стекол.
В диаграмме, приведенной Крачеком в 1930 г. [3], указаны
твердые растворы, образуемые Li2Si2O5 с Li2O и SiO2. В его же
работе 1939 г. [4] уже нет ука-
заний на твердые растворы, и
потому нами приводятся диа-
граммы Крачека без твердых
растворов (рис. 1, 2).
Мэрзи и Гюммель [7], вы-
полнившие исследование систе-
мы Li2O—SiO2 в области соста-
вов 50 мол. % Ы2О—100% SiO2,
получили результаты, практи-
чески совпадающие с данными
Крачека. Области твердых рас-
творов Мэрзи и Гюммель не
указывают.
Согласно Г. Донней и
Дж. Доннею [2], метасиликат
лития относится к ромбиче-
ской системе и имеет следую-
щие параметры элементарной
(кристаллической) решетки:
а=5.43+0.002, 6=9.41+0.03,
с=4.660±0.015 A, Z=4. Экс-
С
1700
1600
1500
1300 ЦМк
1713
Трид.
+Ж
iwot
1200
1000-%
9OOio~
Li20
Кристоб.+Ж
1255
1100 S5
ЖиЭк.
LLStOfM „
* *1201°
^/1024° УОЗЗ
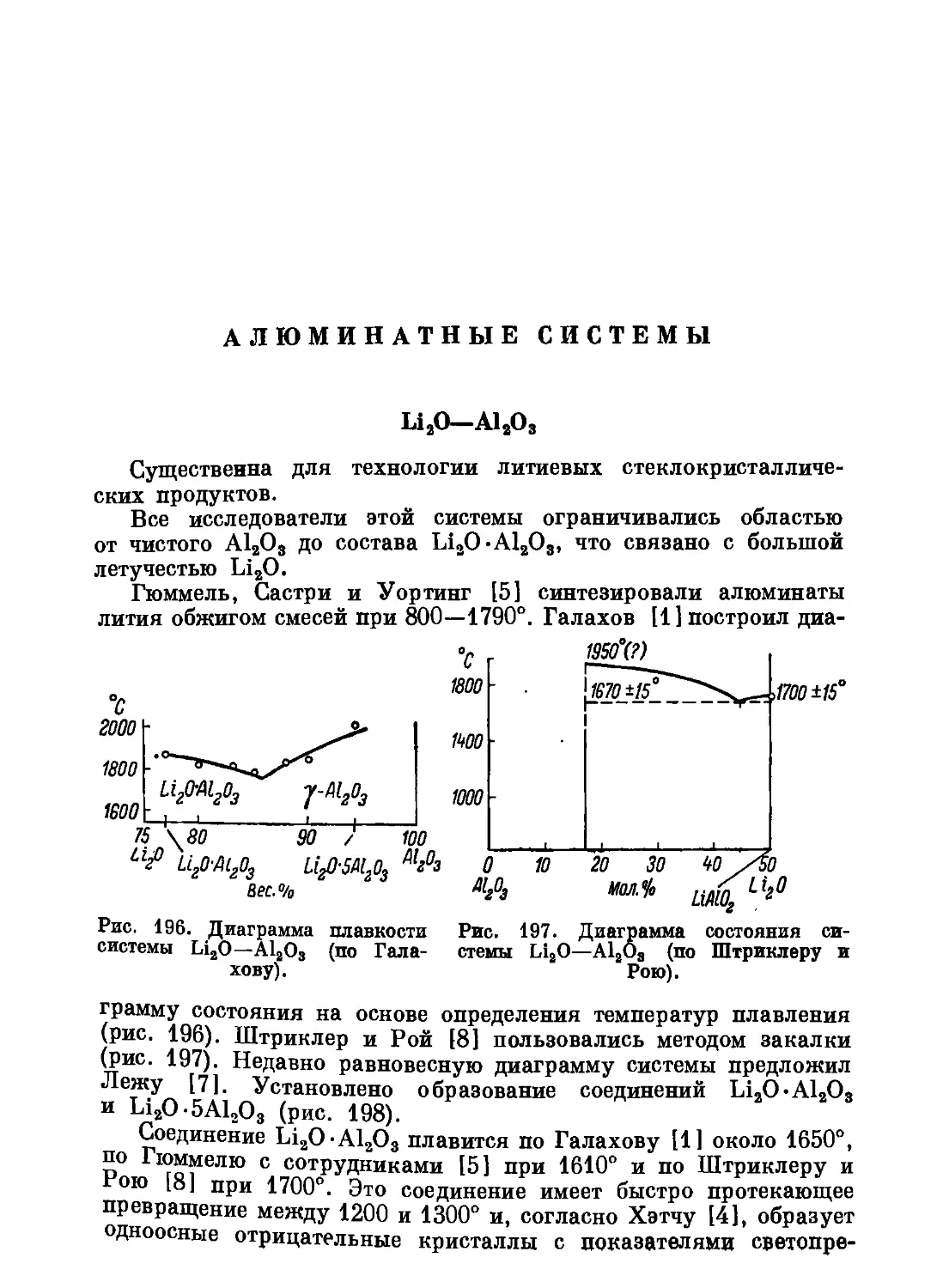
, '939’
60 80
Вес. %
1028
1бЬ°
~ioo
8Юг
Рис. 1. Диаграмма состояния си-
стемы Li2O—SiO2 (по Крачеку).
периментально определенная
(при 25°) плотность 2.520 г/см3, вычисленная 2.50 г/см3.
Кристаллическую структуру метасиликата лития изучал также
Зееманн [9]. Так же как в (NaaSiO3);c, цепи (SiO3")ro направлены
по оси с. Получены следующие параметры элементарной ячейки:
8
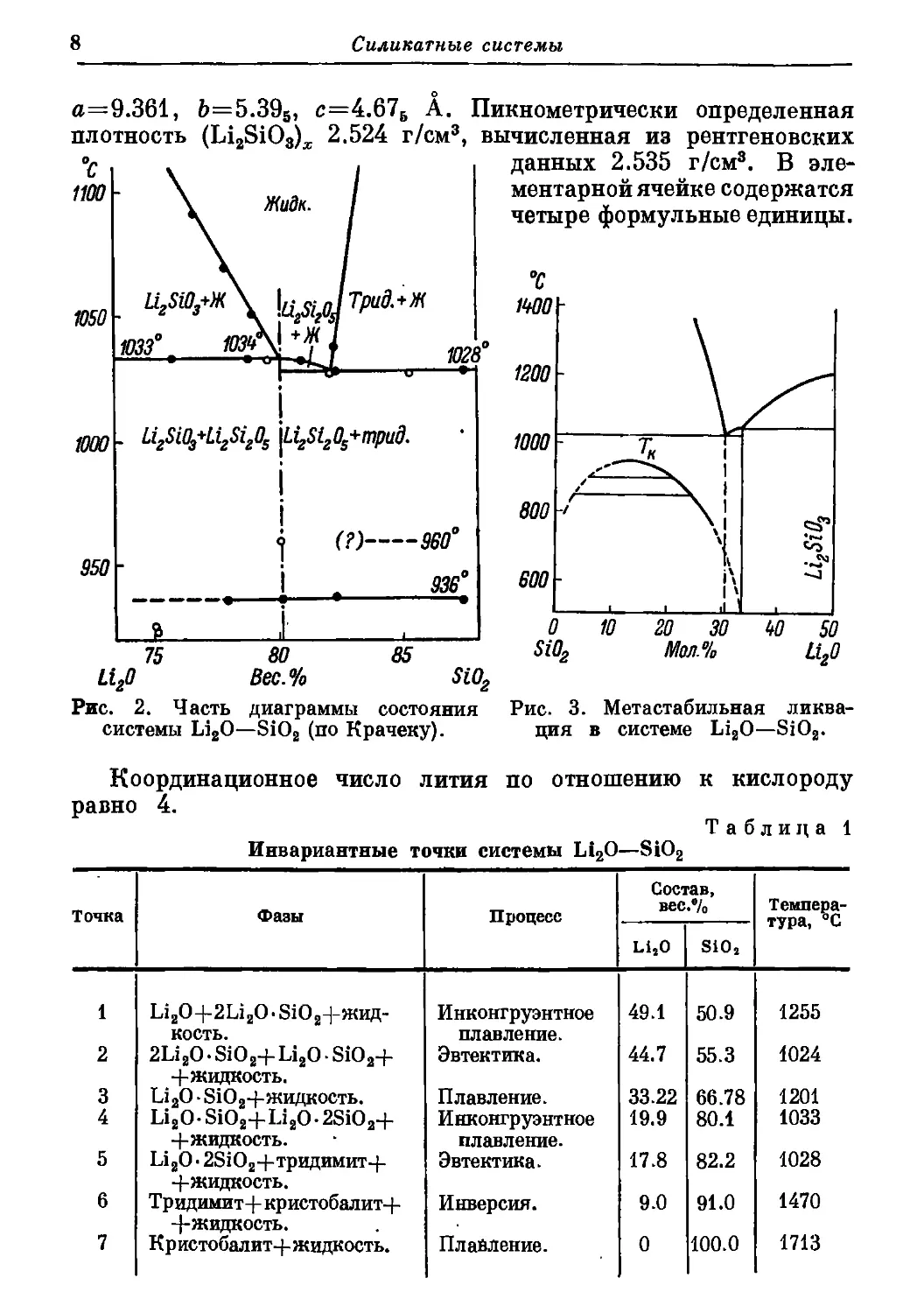
Силикатные системы
а=9.361, Ь=5.395, с=4.67б А. Пикнометрически определенная
плотность (Li2SiO3)x 2.524 г/см3, вычисленная из рентгеновских
Рис. 2. Часть диаграммы состояния
системы Li2O—SiO2 (по Крачеку).
данных 2.535 г/см3. В эле-
ментарной ячейке содержатся
четыре формульные единицы.
Рис. 3. Метастабильная ликва-
ция в системе Li2O—SiO2.
Координационное число лития по отношению к кислороду
равно 4.
Таблица 1
Инвариантные точки системы Li2O—SiO2
Точка Фазы Процесс Состав, вес.% Темпера- тура, °C
Li,0 S1O,
1 LizO-|-2LizO • SiO2-|-жид- кость. Инконгруэнтное плавление. 49.1 50.9 1255
2 2Li2O-SiO24-Li2O-SiO2+ +жидкость. Эвтектика. 44.7 55.3 1024
3 Li2O SiOj+жидкость. Плавление. 33.22 66.78 1201
4 Li2O-SiO24-Li2O-2SiO2+ 4-жидкость. Инконгруэнтное плавление. 19.9 80.1 1033
5 Li2O • 28Ю24-тридимит-|- 4-жидкость. Эвтектика. 17.8 82.2 1028
6 Тридимит-)- кристобалит-)- 4-жидкость. Инверсия. 9.0 91.0 1470
7 Кристобалит-)-жидкость. Плавление. 0 100.0 1713
Силикатные системы
9.
Таблица 2
Кристаллические фазы системы Li2O—SiO2
Соединение Система кри- сталлов Габитус Спайность Плотность, г/см3 Ng ffp 2V° Оптический I 1 знак 1
2Li2O-SiO2. Псевдоге- ксагональ- ная, веро- ятно ром- бическая. Округлые зерна» двойники. — 2.39 1.610 1.602 Очень ма- лый. (+)
Li2O • SiO2. Тригональ- ная (?). Иглы и призмы. По удли- нению. 2.52 1.611 1.591 0 (+)
Li2O-2SiO2. Ромбиче- ская. По трем направле- ниям под углами в 90°. 2.454 1.558 1.547 50—60 (+)
Согласно Г. Донной и Дж. Донною [2], дисиликат лития
относится к ромбической системе и имеет следующие параметры
элементарной ячейки: а=5.80+0.02, Ь=14.66 + 0.05, с=4.806 +
+0.015 A, Z=4. Определенная (при 25°) плотность 2.454 г/см3,
вычисленная 2.438 г/см3.
Либау [5] изучил структуру низкотемпературной модифика-
ции дисиликата лития Li2Si2O5. Кристаллы этого соединения
относятся к моноклинной (псевдоромбической) сингонии и имеют
следующие параметры кристаллической решетки: а=5.82, Ь=
= 14.66, с=4.79 А, (3=90.0°. Элементарная ячейка содержит
четыре формульные единицы. Ионы лития координируются че-
тырьмя атомами кислорода. Пространственная группа, веро-
ятно, Сс.
Рой [8] высказал предположение, что S-образный ход кривой
ликвидуса в области, примыкающей к кремнезему, имеет своей
причиной метастабильную ликвацию. Андреев, Гоганов, Порай-
Кошиц и Соколов [Ц методом рассеяния рентгеновских лучей
под малыми углами действительно обнаружили существование
метастабильного фазового разделения в этих стеклах, но опреде-
лили только три точки на бинодальной кривой.
Маринов и Раденкова-Янева [61 подвергли электронномикро-
скопическому изучению стекла (содержание Li2O от 9.57 до
29.53 мол.%) после кратковременной (10 мин.) термической
.10
Силикатные системы
выдержки их при различных температурах. На рис. 3 показана
обнаруженная экспериментально область метастабильной ликва-
ции с верхней критической температурой £к=950°.
Литература
1. Андреев Н. С., Д. А. Г о г а н о в, Е. А. Порай-Кошиц,
Ю. Г. Соколов, в сб.: Катализированная кристаллизация стекла.
Изд. АН СССР, М.—Л., 46, 1963.
2. D о n п а у G., J. D. D о n п а у, Amer. Mineralogist, 39, № 3—4, 163,
1953.,
3. К г а с е k F. С., Journ. Phys. Chem., 34, № И, 2645, 1930.
4. К r a c e k F. C., Journ. Amer. Chem. Soc., 61, № 10, 2863, 1939.
5. L i e b a u F., Acta crystallogr., 14, № 4, 389, 1961.
6. M a r i n о v M., M. Radenkova-Janeva, Compt. rend. Acad,
bulg. sci., 19, № 10, 917, 1966.
7. Murtny M. K., F. A. Hummel, Journ. Amer. Ceram. Soc., 39,
№ 2, 56, 1955.
8. R о у R., Journ. Amer. Ceram. Soc., 45, № 1, 39, 1962.
9. Seemann H., Acta crystallogr., 9, № 3, 251, 1956.
Na.,0—SiO2
Частная система по отношению ко многим поликомпонентным
системам большого петрографического значения. Имеет большое
значение для стекольной технологии.
Наиболее полно изучена Крачеком [7, 8, 10]. Несколько от-
личные от Крачека данные получили Д’Анс и Леффлер [3], при-
нимающие, что 2Na2O-SiO2 плавится инконгруэнтно при 1083°.
Они же, кроме того, описывают соединение 3Na2O-2SiO2. До-
полнительные данные по системе см. у Моравица [13], Лилли [12].
Будников и Матвеев [1, 2] получили трисиликат натрия
Na2O-3SiO2 с температурой плавления 750° и моноклинными кри-
сталлами, имеющими показатели светопреломления 7Vg=1.502
и 7Vp=1.496.
На рис. 4 приведена диаграмма Крачека с учетом его работы
1939 г., в которой он уже не указывает твердых растворов ди-
силиката натрия. В укрупненном масштабе часть диаграммы,
примыкающая к Na2Si2O5 (из той же работы Крачека), приведена
на рис. 5.
Дисиликат натрия имеет несколько полиморфных модифика-
ций. Кроме превращений при 707 и 678°, указанных на рис. 5,
впоследствии Крачек, Морей и Инглэнд [10] обнаружили поли-
морфные превращения при 593, 573 и 549°. Таким образом, по
Крачеку, существует 6 модификаций дисиликата натрия,
Силикатные системы
И
Грунд и Пизи [6 ] произвели расшифровку структуры кристал-
лов безводного метасиликата натрия Na2SiO3 и получили следую-
щие параметры решетки: а=10.43, Ь=6.02, с=4.81 А. Элементар-
ная ячейка содержит четыре формульные единицы, вычисленная
плотность 2.685 г/см3.
Согласно Г. Донней и Дж. Доннею [4], высокотемпературная
форма дисиликата натрия относится к ромбической системе и
°C
1600
1500
1000
1300
ЖиЗк.
1200
-Naz0\ 2Na,0-StO,
1100
1000
ООО
st
що-зщ.
800
700
KpucmoG. J
Ж Л
110701
NazOSiO,
7 +Ж
yM)’2SiOz
'Трид.+Ж
Z / 867
'\]кварц+Ж
Na20-2SWz+кварц
HaJMSiO, m 678°
30 00 50 60 70 80 90 100
Naz0 Вес. % Si02
Рис. 5. Часть диаграммы состояния
системы Na2O—SiO2 (по Крачеку).
Рис. 4. Диаграмма состояния . си-
стемы Na2O—SiO2 (по Крачеку).
5
имеет следующие параметры кристаллической решетки: а=
=15.45+0.03, *>=4.909+0.005, с=6.428+0.015 A, Z=4. Экспе-
риментально определенная плотность 2.47+0.03 г/см3. Либау [И]
определил структуру высокотемпературного Na2Si2O5. Элемен-
тарная ячейка, содержащая четыре формульные единицы, имеет
следующие параметры: а=6.43, Ь= 15.46, с=4.91 А, а= 3=у=90°.
Низкотемпературная форма дисиликата натрия относится,
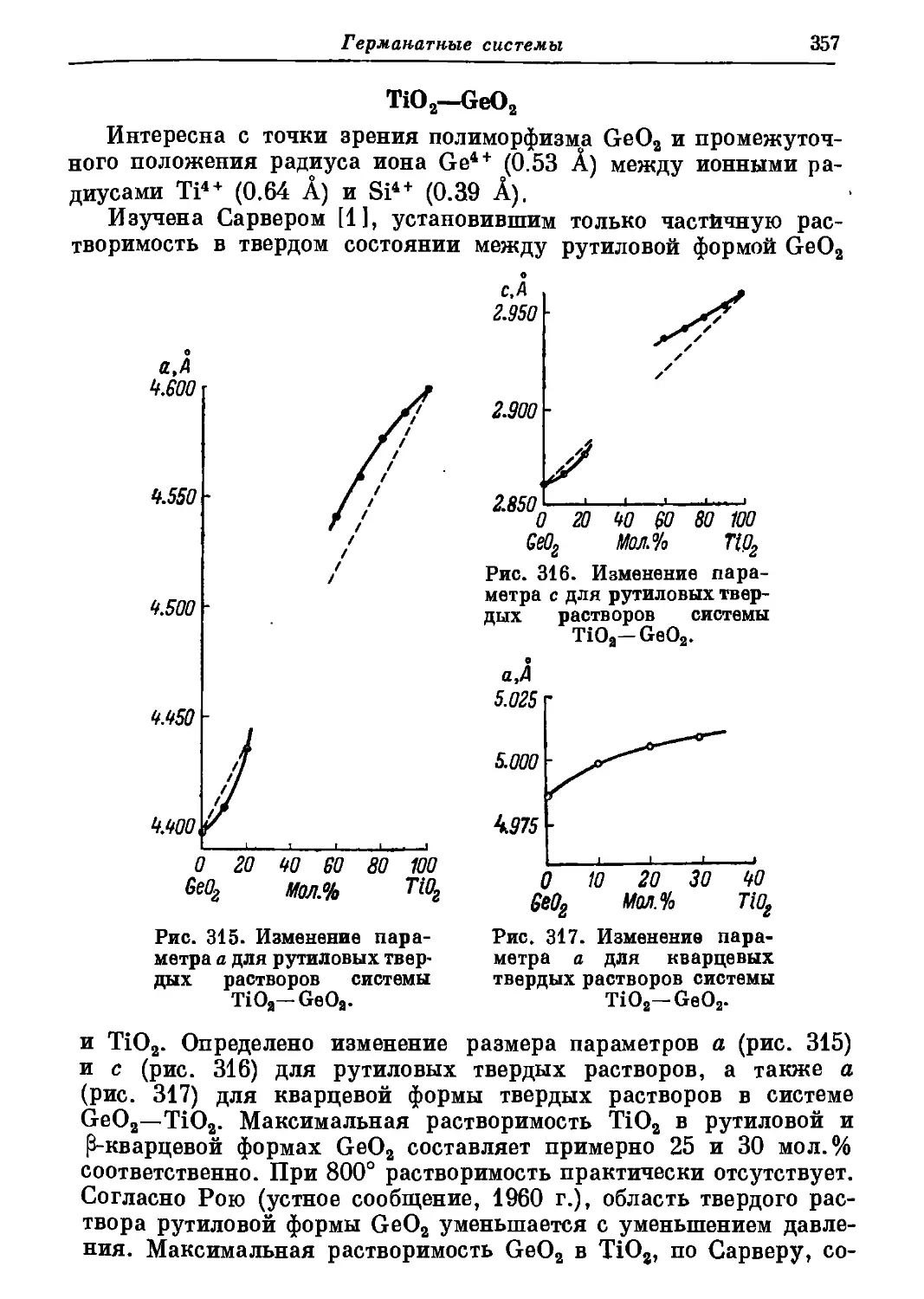
согласно Г. Донней и Дж. Доннею, к моноклинной системе и
имеет следующие параметры кристаллической решетки:
а=12.307+0.005, *>=4.849 +0.003, с=8.124±0.004 А, [3=104.12 +
0.005°. Экспериментально определенная плотность 2.57 ±0.10 г/см3,
вычисленная 2.542 г/см3.
12
Силикатные системы
Таблица 1
Инвариантные точки системы Na2O—SiO2
Точка Фазы Процесс Состав, вес.% Темпера- тура, °C
Na, О S1O,
1 Na2O+2Na2O- SiOg+жидкость. Инконгруэнтное плавление. 59.3 40.7 1118
2 2Na2O • SiO2+Na2O • SiO2+ +жидкость. Эвтектика. 56.9 43.1 1022
3 Na2O SiOj+жидкость. Плавление. 50.79 49.21 1089
4 Na2O SiO2-|-Na2O 2SiO2+ -(-жидкость. Эвтектика. 37.9 62.1 846
5 Na2O 23Ю2+жидкость. Плавление. 34.04 65.96 874
6 Na2O-281О2-|-кварц+жид- кость. Эвтектика. 26.1 73.9 793
7 а-Кварц+а-тридимит+жид- кость. Инверсия. 22 78 870
8 а-Тридимит+а-кристобалит+ +жидкость. » 11.5 88.5 1470
9 a-Na2O • 2SiO2*^f3-N а2О • 2S1O 2. » 34.04 65.96 678
Согласно Грунду [5], низкотемпературная форма Na2Si2O5
имеет следующие параметры элементарной ячейки: а=12.26,
Ь=4.80, с=8.07 а. и., [3=104°18', Z=4. Плотность измеренная
2.56 г/см3, вычисленная 2.628 г/см3.
Вильямсон и Глассер [16], признавая, как и Матвеев, су-
ществование высококремнеземистого кристаллического силиката
натрия, доказывают, что это соединение должно иметь не пред-
положенную Матвеевым формулу Na20-3SiO2, а более сложную:
3Na2O-8SiO2=NaeSi8O19. Свои заключения об указанной формуле
Вильямсон и Глассер делают на основании рентгеновских ис-
следований и определения молекулярной рефракции. Силикат
NaeSi80i9 обнаруживался в продуктах кристаллизацииТстекол,
содержащих 73—75 мол.% SiO2. Соединение 3Na2O-8SiO2 пла-
вится инконгруэнтно при 808 + 2° с разложением на кремнезем
и жидкость. Кристаллы нового силиката натрия относятся
к моноклинной сингонии, пространственная группа С|А—Р2Х/С,
параметры элементарной ячейки: а=4.90+0.02, Ь=23.4+0.1,
с=15.4 А. В элементарной ячейке содержится четыре формуль-
ные единицы. Пикнометрически определенная плотность 2.47 г/см3,
вычисленная из рентгеновских данных 2.50 г/см3. Кристаллы
рассматриваемого соединения двуосны, слабо двупреломляющие,
показатели светопреломления (линия натрия) 1.503.
Таблица 2
Кристаллические фазы системы Na2O—SiO2
Соединение Система кристаллов Габитус Спайность Плот- ность, г/см3 Ng Np 2V° Опти- че- ский знак Оптическая ориен- тировка
a-2NaaO-SiOa. Полисинте- тические двойники. — 1.537 1.524 Двуосный (?). ? Погасание до 8° с двойниковой плоскостью.
f$-2NaaO-SiOa. —. Остроуголь- ные пла- стинки (010)? — 2.5 1.536 — Двуосный. (-) Погасание около 15° относитель- но короткого ребра.
NaaO-SiOa. Ромбиче- ская. Призмы. По призме. — 1.528 1.513 Очень большой. . (-) Погасание пря- мое, удлинение (+)•
NaaO-2SiOa. To же. Пластинки по (010). Совершен- ная по (100), ясная по (010). —. 1.508 1.497 50-55 (-) Плоскость опти- ческих осей (010), х=а.
3NaaO-2SiOa. — Остроуголь- ные пла- стинки. Ясная. 2.96 1.529 1.524 Двуосный. (+)? Плотность стекла равна 2.6 г/см*.
14
Силикатные* системы
Часть нового варианта диаграммы системы Na2O—SiO2, пока-
зывающая область существования силиката 3Na2O-8SiO2, приве-
дена на рис. 6.
В дальнейшем Вильямсон и Глассер [16] показали, что в сме-
сях, содержащих более 67 мол. % SiO2, дисиликат натрия не су-
ществует равновесно с кремнеземом, а в этой концентрационной
Рис. 6. Часть диаграммы состояния
системы Na2Si2O6—SiO2, показы-
вающая поле устойчивости фазы
NaeSieOle (по Вильямсону и Глас-
серу).
области образуются другие си-
ликаты: выше 665° — NaeSi8O19,
а ниже 665° — Na2Si3O7 — и
оба эти соединения сосущест-
вуют с соответствующими мо-
дификациями SiO2.
Вильямсон и Глассер [16]
детально изучили полиморфизм
дисиликата натрия Na2Si2O5.
Осуществляя кристаллизацию
стекла состава Na2O+2SiO2 при
различных температурах и дав-
лениях, авторы получили пять
кристаллических модификаций
дисиликата натрия: 1) форма
а1п, условия кристаллизации
800—850°, 12—24 час.; 2) фор-
ма р, 600— 650°, давление па-
ров воды 20—80 бар; 3, 4) фор-
мы у и 3, 540—590° (200 час.);
5) форма С, 720°, давление па-
ров воды 200 бар. Из этих мо-
дификаций только а-и р-формы
имеют на диаграмме состояния
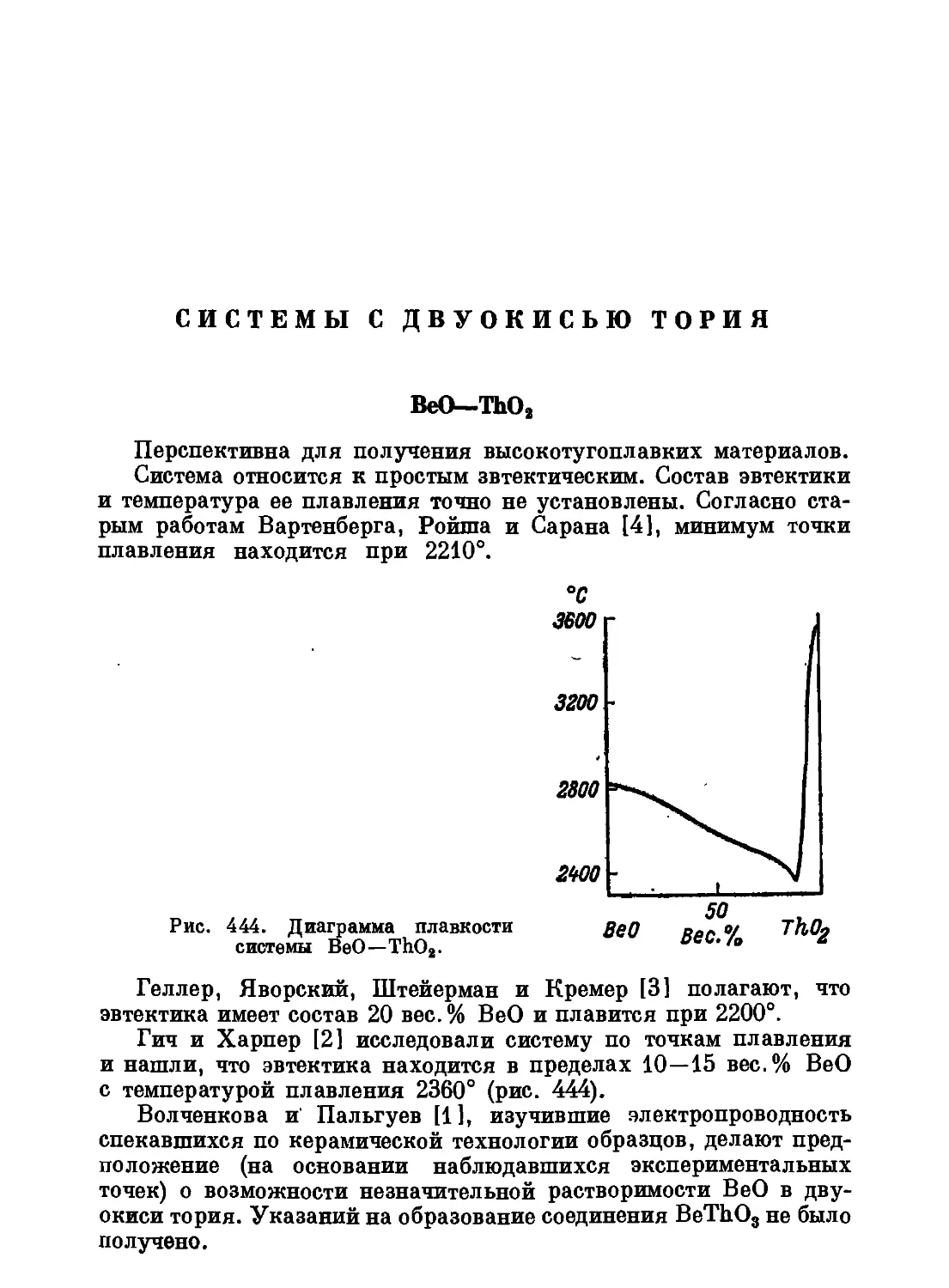
термодинамически стабильное
поле существования. Модифика-
ция а существует в свою оче-
редь в трех полиморфных фор-
мах: уже указанной аш, а также
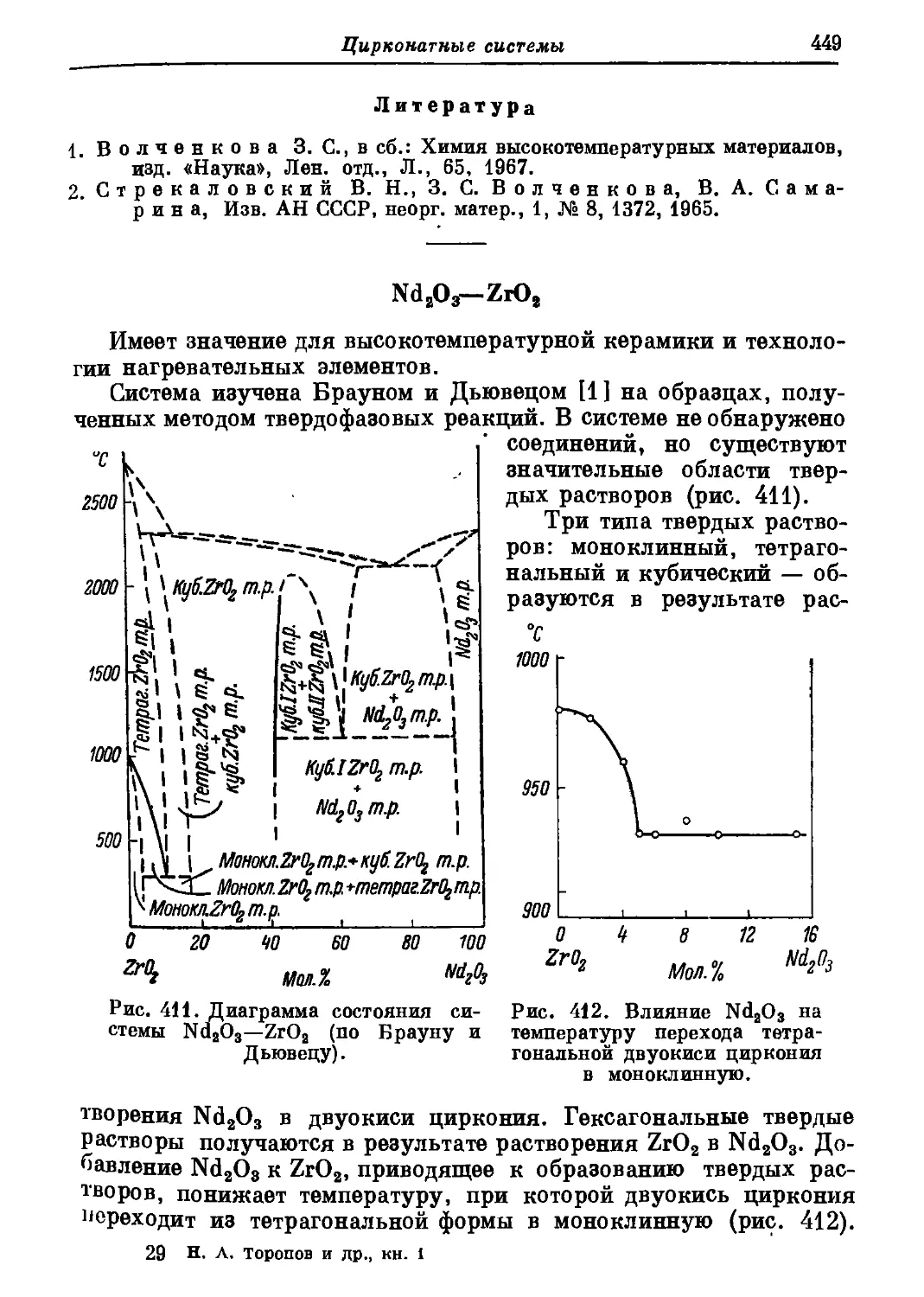
078° 707° 874°
ап и ар с взаимными переходами аш ап аг ^2 жидкость.
Высокотемпературная фаза аг имеет при 750° ромбическую ячейку
с а=6.64, Ь=7.72 и с=4.98 А. Моноклинная фаза ап представляет
искаженную аг-фазу. При 690° параметры элементарной ячейки
(Хц-фазы: а=6.64, Ь=4.94, с=7.72 А, р=91°0'; 8-фаза в виде
пластинчатых ромбических кристаллов имеет о параметры эле-
ментарной ячейки: а=11.95, Ь=4.90, с=8.39 А. Фаза С полу-
чена в виде моноклинных монокристаллов с параметрами эле-
ментарной ячейки: а=8.12, Ь=23.7, с=4.85 А, р=90°0'.
Силикатные системы
15
Вильямсон и Глассер [15] построили схематическую (в не-
которой части неравновесную) диаграмму состояния дисиликата
натрия при атмосферном давлении (рис. 7). Для взаимных пере-
Энергия
Рис. 7. Схематическая диаграмма
состояния системы дисиликата
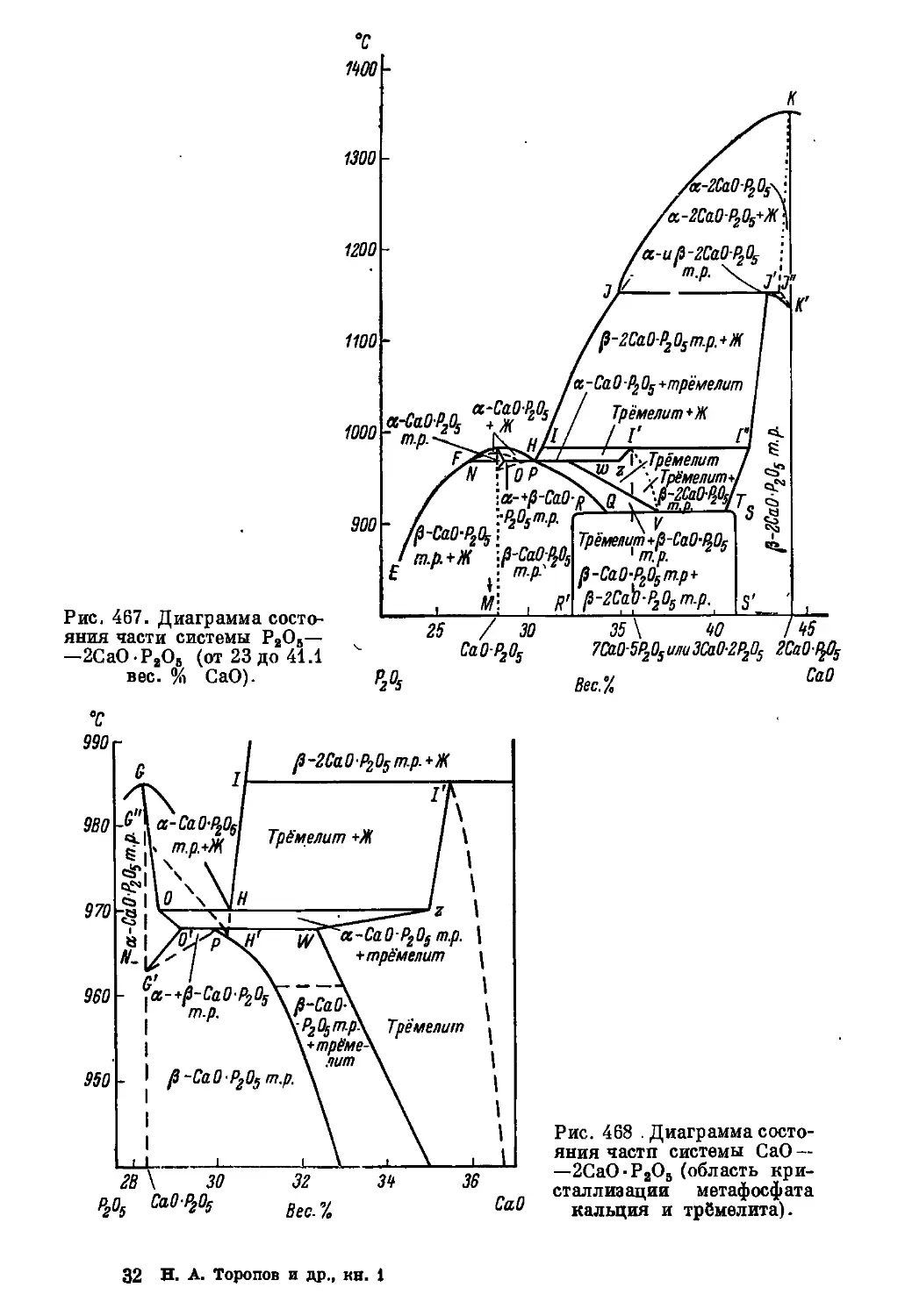
натрия при атмосферном давлении.
Рис. 8. Равновесная диаграмма
состояния системы дисиликата
натрия при повышенных давле-
ниях.
/
/
I 870°
850
800
750
700
650
600
\ I Кварц,, кристоб., трид. +Ж
tt-NogSig 05 ' |
' +Л \ L 790°
-1--—
Кристоб. I
tt.-6a2Siz0s |
Na6Sis0ig । NaBSis013
I + кварц, кристоб.
NaBSig0l3 i
8-Na.,$t,Os и <!• n
_____________________________________Кварц,
~665 ° ’Кристоб. j ~ NdzSi3 07 кристоб.
I
NogSigO, ।
p-NagSigOs ।
I
6+y-NagSigOg
66.7 70 75 80 85
Man.% SiOg
Рис. 9. Неравновесная фазовая диа-
грамма системы NajSi2O6—SiOa.
1 — a-Na2Si2O5; 2 — jJ-Na2Si2O5;
3 — фаза С.
ходов а—^-модификаций и фазы С построена фазовая равно-
весная диаграмма в координатах «давление—температура» (рис. 8).
На рис. 9 представлена неравновесная фазовая диаграмма си-
стемы Na2Si2O5—SiO2, показывающая главнейшие продукты, по-
лученные при кристаллизации стекол, составы которых заклю-
16
Силикатные системы
чены между Na2Si2Og и SiO2. Равновесная фазо'вая диаграмма
системы Na2Si2Og—SiO2 приведена на рис. 6.
Виллгаллис и Ранге [14] считают, что ^-модификация Na2Si2Og
имеет четыре полиморфные формы,"^что отвергают Вильямсон
и Глассер.
Кристаллы] T~Na2SieOg и 8-Na2Si2Og получили недавно
Гофман и Шееле (см. [16]).
Литература
1. Будников П. П., М. А. Матвеев, ДАН СССР, 107, № 4, 547,
1956.
2. Ма’твеев М, А., Труды Моск, хим.-техн. инет. им. Д. И. Менделеева,
вып. 24, 209, 1957.
3. d’Ans J., J. L о f f 1 е г, Zs. anorgan. allgem. Chem., 191, № 1—2, 1,
1930.
4. D о n n a у G., J. D. D о n n a y, Amer. Mineralogist, 38, № 3—4,
163, 1953.
5. Grund A., Bull. Soc.. Franc, mineral., 77, 775, 1954.
6. Grund A., M. M. P i z y, Acta crystallogr., 5, № 6, 837, 1952.
7. К r a c e k F. C., Joum. Phys. Chem., 34, № 7, 1583, 1930.
8. К r a c e k F. C., Journ. Amer. Chem. Soc., 61, № 10, 2863, 1939.
9. К r a c e k F. C., Melting and transformation temperatures of mineral
and allied substances. Geolog. Survey Bull., 1144-D, d-20, Washington,
1963.
10. К r a c e k F. C., G. W M orey, J. L. E ngl and, Carnegie Inst.
Washington, year book 52, 58, 1952—1953.
11. L i e b a u F., Acta crystallogr., 14, № 4, 395, 1961.
12. Lillie H. R., Joum. Amer. Ceram. Soc., 22, № 10, 367, 1939.
13. MorawietzC. W., Zs. anorgan. allgem. Chem., 236, № 1—4, 372,
1938.
14. Willgallis A., K. J. Range, Glasstechn. Ber., 37, 194, 1964.
15. Williamson I., F. P. Glasser, Science, 148, № 3677, 1589,
1965.
16. Williamson I., F. P. Glasser, Phys. Chem. Glasses, 7, № 4,
127, 1966.
K2O—SiO2
Частная система по отношению ко многим многокомпонентным
•системам большого петрографического значения. Существенна
также для стекольной технологии.
Первые предварительные исследования системы произвели
Морей и Феннер [6]. Изучена в области от 50 мол.%] К2О до чи-
стого кремнезема Крачеком, Боуэном и Мореем [3, 4], которые
установили существование соединений K2O-SiO2, K2O-2SiO2 и
Ka0*4SiO2 (рис. 10).
Силикатные системы
17
Имеются данные о получении соединений 2K2O-SiO2 [5] и
K2O-3SiO2; Эйпельтауэр и Мор [1], указывающие на существо-
вание последнего соединения, предложили новый вариант диа-
граммы состояния системы с инконгруэнтно плавящимся трисили-
катом калия (рис. 11).
Рис. 10. Диаграмма состояния си-
стемы К2О—SiO2 (по Крачеку,
Боуэну и Морею).
2Ц 28 32 36 ЬО 44 48 52
Si02 Вес. °/о Кг0
Рис. И. Часть диаграммы состояния
системы К2О—SiO2 (по Эйпельтауэру
и Мору).
Рис. 12. Диаграмма «давление—тем-
пература» для тетрасиликата калия.
Дисиликат калия K2Si2Os имеет полиморфные превращения.
Крачек, Боуэн и Морей наблюдали одно превращение при 596°.
Шейбани [7] дилатометрическим методом обнаружил два превра-
щения: при 530—560° и при 240—250°.
Соединение K2O-4SiO2 при 592° испытывает энантиотропное
превращение, весьма напоминающее а. ^-превращение кварца.
Интересно, что плотность кристаллического тетрасиликата калия
(2.335 г/см3) значительно ниже плотности его в стеклообразном
состоянии (2.384), в связи с чем коэффициент, характеризующий
влияние давления на температуру плавления, будет отрицателен
(как у льда I). Горансон и Крачек[2 ] построили Р—/-диаграмму для
2 н. А. Торопов и др., КН. 1 __ , |—;
18
Силикатные системы
"С
850
800
750
Кг31г05
+
ж
1<х.-Кварц
Ж
С
Р-750 800
“f 750
700
650
'------[Р-1вар
а.-К,51.0.
Ws
OL-ftfy Од а - кварц
60 65 fat 75 80
К,0 вес. % SVL
4 а
700
'Кг61г05
- Ж
а.-Мари
Ж
Р-1300
бар
Кг81г0д
a-KgSi^Og
ОС-Квар^
«‘‘We
60 65 'fat 75 80
Кг0 вес. % StOy
I- > - \2Si0gtKgSlg0S^KgSi^
'fi-.K2S^3
%.} Кварц,
60 65 fa 75 80
KgO вес. % St02
650
Рис. 13. Схематические изобарические диаграммы «концентрация—тем-
пература» вблизи состава К2О • 4SiO2 при различных давлениях.
Таблица 1
Инвариантные точки системы К2О—SiO2
Точка Фазы Процесс Состав, вес.% Темпера- тура, °C
К2О S1O2
1 Кристобалит-(-жидкость. Плавление. 0 100 1713
2 Кристобалит-|-тридимит+ -|-жидкость. Инверсия. 10.3 89.7 1470
3 Тридимит-)- кв ард+ жид- кость. » 25.1 74.9 870
4 Тридимит-)-К2О • 4SiO2+ +жидкость. Эвтектика. 26.4 73.6 767
5 Кварц+К2О» 48Ю2-|-жид- кость. » 27.5 72.5 769
6 К2О • 4SiO 2-|- жидкость. Плавление. 28.16 71.84 770
7 K2O-4SiO2+K2O-2SiO2+ +жидкость. Эвтектика. 32.4 67.6 742
8 К 2О • 2S1O 2+жидкость. Плавление. 43.95 56.05 1045
9 K2O-2SiO2+K2O.SiO2+ +жидкость. Эвтектика. 54.5 45.5 780
10 К2О- SiOj+жидкость. Плавление. 61.06 38.94 976
Таблица 2
Кристаллические фазы системы К20—SiO2
Соединение Система кристаллов Габитус Спайность
K2OSiO2. K2O-2SiO2. Ромбическая. Зерна. Шестисторонние пластинки с углами в 40 и 80°, полисинтетические двойники. (001) совершенная, (010) ясная, (100) несовершен- ная.
K2O-4SiO2. — Таблицы и двойники. —
Продолжение
Соединение Плотность, г/см’ Ng Np 2уо Оптический знак Оптическая ориентировка
K2O-SiO2. — 1.528 1.520 35 + (+) —
K2O-2SiO2. — 1.513 1.503 Большой. (-) Плоскость оптических осей (010).
K2O-4SiO2. 2.335 1.482 1.477 (+) Погасание косое.
20
Силикатные системы
Рис. 14. Фазовая диаграмма высоко-
кремнеземистой области системы
К2О—SiO2 (по Волласту).
тетрасиликата калия (рис. 12).
На рис. 13 приведены диаграммы
для концентрационной области
60—80 вес. % SiO2H давлений 1,
750 и 1300 бар. K2Si4O9 при
давлении выше 140 бар плавится
инконгруэнтно; при ‘ давлении
выше 1250 бар тетрасиликат
уже не кристаллизуется непо-
средственно из расплава.
Большой интерес представ-
ляет опубликованная недавно
Волластом [8] в виде предвари-
тельного сообщения диаграмма
высококремнеземистой области
системы К2О—SiO2 (рис. 14).
По Волласту, из расплавов
при температурах 900—1700°
кристаллизуются не чистые
кристобалит и тридимит, а
твердые растворы кристобали-
товой и тридимитовой струк-
тур, содержащие ионы калия,
вероятно, в междоузлиях. Особо
существенно, что на диаграмме
Волласта есть поле, где равновесно сосуществуют твердые рас-
творы на основе кристобалита и на основе тридимита.
Литература
1. Е i р е 1 t а и е г Е., А. М о г е, Radex Rundschau, № 4, 230, 1960.
2. Goranson R. W., F. С. К г a c e k, Journ. Phys. Chem., 36, № 3,
913, 1932.
3. К г a c e k F. C., N. L. Bowen, G. W. Morey, Journ. Phys. Chem.,
33, № 12, 1857, 1929.
4. К r a c e k F. C., N. L. Bowen, G. W. Morey, Journ. Phys. Chem.,
41, № 9, 1183, 1937.
5. К r og er С., E. F i ng as, Zs. anorgan. allgem. Chem., 213, № 1,35,1933.
6. Morey G. W., Cl. N. Fenner, Journ. Amer. Chem. Soc., 39, № 6,
1173, 1917.
7. SheybanyH. A., Verres et refractaires, 3, № 1, 34, 1949.
8. Wollast R., Silicates Industr., 26, № 2, 89, 1961.
Rb2O—SiO2
Важна для физико-химии щелочных стекол.
Алексеева [1 ] изучила эту систему в области от метасиликата
рубидия до чистого кремнезема (рис. 15).
Силикатные системы
21
Рис.
15. Диаграмма состояния
системы ЙЬ2О—SiO2.
’С
1700
1500
1300
1100
900
700
50 ВО 70 80 90 100
ЙЬгО ЯОЛ.% 5Юг
Таблица 1
Инвариантные точки системы Rb2O—SiO2
Точка Фазы Процесс Состав, мол. % Темпера- тура, °C
RbjO S1O2
1 Rb2O-8Ю24-жидкость. Плавление. 50 50 870
2 Rb2O • SiO2-f- Rb,0 • 2SiO2+ + жидкость2 Эвтектика. 43.5 56.5 745
3 Rb2O • 28Ю24-жидкость. Плавление. 33.1 66.9 1090
4 Rb2O • 2SiO2+ Rb2O • 4SiO2+ + жидкость. Эвтектика. 25.7 74.3 876
5 Rb2O- 48Ю24-жидкость. Плавление. 20 80 900
6 Rb2O • 4SiO 2-j- кварц+ + жидкость. Эвтектика. 15.8 84.2 770
Таблица 2
Кристаллические фазы системы КЬ2О—SiO2
Соединение Габитус Плот- ность, г/сма Ng Np 2V° Опти- че- ский знак
Rb2O-SiO2. — 3.435 — — — —
Rb2O-2SiO2. Иглы и призмы. 3.254 1.513 1.507 Двуосный. (+)
Rb2O-4SiO2. Хорошо ограненные гексагональные пла- стинки. 3.022 1.539 1.532 » (-)
22
Силикатные системы
Обнаружено три силиката рубидия: метасиликат Rb2SiO3
дисиликат Rb2Si2O5 и тетрасиликат Rb2Si4O9.
Литература
1. Алексеева 3. Д., Жури, неорг. хим., 8, № 6, 1426, 1963.
Сз2О—SiO2
Изучена Алексеевой [1 ] в интервале концентраций от 0 до
44 мол.% Cs2O. Установлено образование двух соединений:
дисиликата цезия Cs2O -2SiO2 и тетрасиликата цезия Cs2O-4SiO2
(рис. 16). Оба соединения плавятся конгруэнтно соответственно
SiO2 Мол.Уо СзгО
Рис. 16. Диаграмма сосЯряния
системы Cs2O—SiO2.
при 1070 и 950°. Дисиликат цезия образует оптически отрицатель-
ные двуосные кристаллы с показателями светопреломления
Ng*= 1.563 и Np = 1.560; плотность 3.852 г/см3. Тетрасиликат цезия
кристаллизуется в виде гексагональных пластинок, оптически
отрицательных, с прямым погасанием. Показатели светопреломле-
ния Cs2O-4SiO2: 7Vg=1.579, А/р = 1.573; плотность 3.452 г/см3.
Оба соединения сильно гигроскопичны.
Литература
1. Алексеева 3. Д., Жури, неорг. хим., 11, № 5, 1171, 1966.
Силикатные системы
23
Cu2O(CuO)—SiO2
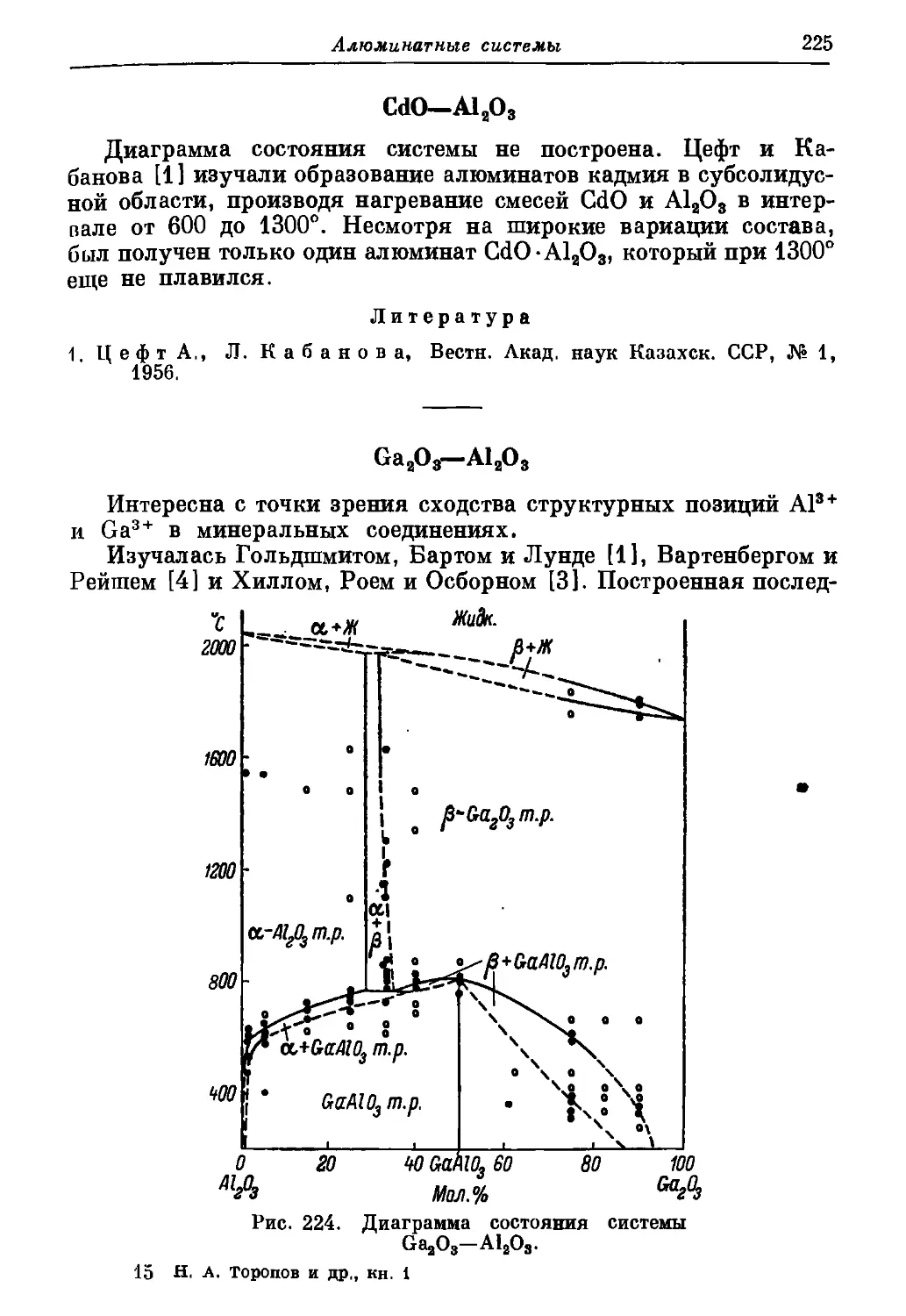
Интересна с точки зрения состава медьсодержащих стекол,
медеплавильных шлаков и службы кремнеземистых огнеупоров
в медеплавильных печах.
Изучалась Бережным, Карякиным и Дудавским [1, 2] и Га-
далла, Фордом и Уайтом [3].
Бережной и Карякин [2] изучали системы CuO—SiO2 и
Си2О—SiO2 в атмосфере воздуха. Ими построены кривые плав-
кости (рис. 17), вероятная диаграмма состояния системы CuO—
С
1800
/
Рис. 17. Кривые плавко-
сти смесей CuO—SiO2 и
Cu2O—SiO2.
1600
МО
1200
1000
/ SiO2 +расллавЛ
/ содержащий Си,0
___________________
’ 1070 CuO+SiOz
8001------1-----—।---------1-----
О 20 W 60 80 100
CuO Вес. % SiO,
Л
Рис. 18. Вероятная диаграмма
состояния системы CuO—SiO2,
построенная для случая, когда
разложение CuO было незна-
чительным (неравновесная си-
стема) .
—SiO2 (рис. 18), построенная для случая, когда разложение GuO
было незначительным (неравновесная система), и практически
равновесная диаграмма состояния системы Gu2O—SiO2 (рис. 19).
В той и другой системах силикаты меди отсутствуют, имеются
эвтектики при небольшом содержании SiO2 (7—8%), присутствуют
обширные области двух несмешивающихся жидкостей. Ими же
приводится идеализированная, и в области с высоким содержанием
окиси меди неравновесная, диаграмма (рис. 20) тройной системы
Си2О—SiO2—GuO с тройной эвтектикой примерно при 1050°.
Гадалла, Форд и Уайт изучали равновесные отношения в си-
стемах GuO—Cu2O и GuO—Gu2O—SiO2 при различных давлениях
кислорода. Они подтвердили отсутствие силикатов меди. Твердые
°C
1800
1600
1400
1200
1000 J~8% Cu20+Si02
!2pacnm6ajA
I
' SiO2+расплав
У2® ш-
800й—‘—I—I—I—
0 20 W 60 80 100
Cuf Bec.% StO2
Рис. 20- Идеализированное строение
системы Cu2O—CuO—SiO2 (схема).
Рис. 19. Диаграмма
состояния системы
CugO— SiO2 (содержа-
ние CuO не более 5%).
°C
1100 г
Си20 1
+Ж-\1 Ж+SilL
1060 *......
Жидк о.21атм. I
С
Сиг0+610г
Парциальное давление
кислорода, атм.
1020 Cu0+Si02
20 W 60 80
CuO Вес.Чо SiOg
°C
1100г ,
СиОЛ)
+Ж
1060-
й . Жидк. 0.5 атм.
Ж+810г
СиО+Ж
. CuO+SiO,
Л
20 Ы 60 80
CuO Bec.% SiOg
1020
,Жидк.
1атм.
Ж+SiQ,
_ 6
Cu0+Si02
20 W 60 80
CuO Bec.% Si02
Рис. 22. Изобарические сечения тройной
системы CuO—Cu2O—SiO2 при давле-
нии кислорода 0.21, 0.5 и 1.0 атм.
Рис. 21. Вариации тем-
пературы начала плавле-
ния в зависимости от давле-
ния кислорода в смесях
CuO—CuaO—SiOz.
ab — температуры начала плав-
ления для эвтектики
CUjO—S1O,; Ьс — температуры
начала плавления для эвтек-
тики CuO—SlOj.
Силикатные системы
25
Рис. 23. Изобарическая фазовая диа-
грамма системы CuO—Си2О— SiO2 при
парциальном давлении кислорода
0.5 атм.
растворы в системе GuO—Cu2O отсутствуют; эвтектики между GuO
и Си2О имеют место при 1096, 1072, 1050 и 1026° при давлениях
кислорода 1.0, 0.5, 0.33 и
0.21 атм. Вариации темпера-
туры начала плавления в за-
висимости от давления кис-
лорода в смесях GuO—Gu2O—
—SiO2 представлены на
рис. 21.
На рис. 22 представлены
изобарические разрезы GuO—
—SiO2-для0.21,0.5 и 1.0 атм.
давления кислорода, а на
рис. 23 — изобарическая фа-
зовая диаграмма системы
GuO—Gu2O—SiO2 при 0.5 атм.
парциального давления кис-
лорода.
По данным Гадалла и
др. [3] в изобарическом се-
чении при 0.21 атм. давле-
ния кислорода для системы
GuO—SiO2 эвтектика образу-
ется при 1060° и 6 % SiO2, а по
данным Бережного и др. [1]—
при 1060° и около 7% SiO2. В истинно бинарной системе Gu2O—SiO2,
по Гадалла и др., эвтектика должна иметь место при более высо-
кой чем 1060° температуре и, по-видимому, при большем чем 8%
содержании SiO2; в истинно бинарной системе GuO—SiO2 эвтек-
тика также ьимеет температуру выше 1070° и, возможно, значи-
тельно более высокое содержание SiO2.
Литература
1. Б е р е ж н о й А. С., Л. И. К а р я к и н, И. Е. Д у д а в с к и й,
ДАН СССР, 83, № 3, 399, 1952.
2. Б е р е ж н о й А. С., Л. И. К а р я к и н, Цветн. металлы, № 2, 26,
1955.
3. G a d а 11 а А. М. М., W. F. F о г d, J. W h i t e, Trans. Brit. Ceram.
Soc., 62, № 1, 45, 1963.
26
Силикатные системы
ВеО—SiO2
Вследствие тугоплавкости и диэлектрических свойств пред-
ставляет интерес для электротехнической керамики. Известно
применение ортосиликата бериллия в качестве люминофора и для
других целей в технике.
Систему изучали Морган и Гюммель [6], Будников и Черепа-
нов [1, 2] и Исупова и Келер [3]. Махачки [5] при нагревании
смесей ВеО и SiO8 выше 1300° наблюдал образование фенакита.
Но при плавке в ацетилено-
„X, кислородном пламени фена-
кит инконгруэнтно плавится,
2300
2100
1900
1700
1500
Жидк.
ВеО+Ж \
\
\
\
_____________\7$
- _ _^_+ 5^г______
' ZBeO-StOfBeO 2Ве0$Щ,+510г
0 20 90/6080 100
ВеО 2BeO-SiO2 S10,
Вес.%
Рис. 24. Ориентировочная диа- Рис. 25. Кривая плавкости
грамма состояния системы смесей в системе ВеО—SiO2
ВеО—SiO2 (по Моргану и Гюм- (по Будникову и Черепа-
мелю). нов у).
и в препаратах рентгенографическим методом удается наблюдать
только линии ВеО. Последующие исследования также показали,
что при высоких температурах происходит диссоциация фенакита
Be8SiO4.
Морган и Гюммель на основании экспериментальных данных
построили диаграмму состояния системы ВеО—SiO8 (рис. 24).
По их данным, фенакит диссоциирует при 1560° на ВеО и SiO8.
Более точная экспериментальная кривая плавкости системы
построена Будниковым и Черепановым (рис. 25). По данным
последних авторов, самая низкоплавкая смесь в системе плавится
при 1660° и имеет состав 17.5 мол.% ВеО и 82.5 мол.% SiO8.
Из чистых окислов фенакит не получается, но может быть синтези-
рован при добавке в шихту 0.2% виллемита (2ZnO-SiO8) при тем-
Кристаллические фазы системы ВеО—SiO2
Соединение Система кристаллов Габитус Спайность
ВеО (бромеллит). 2BeO-SiOa (фенакит). Гексагональная. Тригональная. Призмы. Ромбоэдры и призмы; двойники по (1010). Совершенная по базису. По (1120). Z/ родолжение
Соединение Плотность, г/см3 Ne No 2У° Оптическй знак
ВеО (бромеллит). 2BeO SiO2 (фенакит). 3 3.0 1.733 1.668 1.719 1.654 0 0 (+) (+)
28
Силикатные системы
пературе 1500°. Будников и Черепанов получили фенакит путем
добавки в соответствующую шихту 2 вес. % МпО2 и обжига при
1500°. Исуповой и Келером установлена возможность получения
Be8SiO4 с использованием минерализующих добавок ZnO, МпО2,
Li2GO3 и Fe2O3. Образование фенакита интенсивно происходит
при 1350° и выше.
По Грейгу [4], в системе не наблюдается ликвационных явле-
ний.
Литература
1. Будников П. П., А. М. Черепанов, ДАН СССР, 74, № 5,
1011, 1950.
2. Будников П. П., А. М. Черепанов, в сб.: Вопросы петрогра-
фии и минералогии, т. II, Изд. АН СССР, М., 241, 1953.
3. Исупова Е. Н., Э. К. Келер, Журн. неорг. хим., 5, № 5, 1126,
1960.
4. Greig J., Amer. Journ. Sci., (5), 13, № 74/75, 1, 133, 1927.
5. MachatschkiF., Zs. phys. Chem., 133, № 3/4, 253, 1928.
6. M о r g a n R. A., F. A. H u m m e 1, Journ. Amer. Ceram. Soc., 32,
№ 8, 250, 1949.
MgO—SiO2
Имеет большое значение для технологии магнезиальных огне-
упорных и керамических материалов: оливиновых, форстерито-
вых, магнезитовых и хромомагнезитовых, тальковых, протоэн-
статитовых.
Таблица 1
Параметры решетки и пространственная группа силикатов магния
Соединение а, к ъ, к 0, к а Про- стран- ственная группа
Энстатит 18.230 8.814 5.178 РЪса
Клиноэнстатит 9.618 8.828 5.186 108°30' Р2У1с
Протоэнстатит 9.25 8.74 5.32 —• РЬсп
Детально изучена Боуэном и Андерсеном [7] (рис. 26, область
ликвации дана по Грейгу [17]). Позднее изучена Никитиным [3],
получившим близкие к данным двух названных авторов результаты
(рис. 27 и инвариантные точки в табл. 3).
Эксперименты Ольшанского [4] почти замкнули область ликва-
ции (рис. 28).
Силикатные системы
29
Фазы системы — Mg2SiO4 (форстерит) и MgSiO3 в трех модифи-
кациях: энстатит, протоэнстатит и клиноэнстатит. По Боуэну и
Шереру [8], энантиотропное превращение клиноэнстатита в энста-
тит происходит около 1190°. Однако позднейшие работы Фо-
стера [16], Атласа [5], Моримото [18], Смита [24], Бережного
и Кордюка [1], Брауна, Моримото и Смита [13], Сарвера и Гюм-
меля [22] внесли ряд новых данных в вопрос о полиморфизме
MgSiO3.
На рис. 29 представлена, по Сарверу и Гюммелю, схематиче-
ская диаграмма в координатах «давление—температура», характе-
°C
1900
1700
МдО+Мдг8Юч
1600
мдгб10„
MgSiOg-
МдО+Ж
1850°
1890
Форстерит
Ж
V0„
+Ж
1557'
Кристоб.+жидк.В
Жидк. А
t ЖиВк.А+В \
Жидк. В I 1695° V
1500}-
20
МдО
1593
\ Мд SlO3t пристав
60 \ 80 100
90 .
Mg^SlO^ MgSiO3 ''Клиноэнстатит S10,
+ экидк. А
Вес.°/о
Ш7
I
Рис. 26. Диаграмма состояния системы
MgO—SiO2 (по Боузну и Андерсену).
ризующая полиморфизм MgSiO3, а на рис. 30 (по тем же авторам) —
линейное термическое расширение для кристаллических агрегатов
клиноэнстатита, энстатита и протоэнстатита в сопоставлении
с плавленым кремнеземом.
Стабильный при низких температурах энстатит переходит
при 1042 +3° в высокотемпературный протоэнстатит. Метастабиль-
ное превращение между протоэнстатитом и клиноэнстатитом имеет
место при 865 + 5°. Протоэнстатит, по Смиту, при комнатной тем-
пературе ромбический, с 8 формульными единицами в элементар-
ной ячейке; вычисленная плотность 3.10 г/см3. Бережной и Кордюк
определили теплоту превращения (0.5 ккал./моль) клиноэнстатита
в высокотемпературную форму — протоэнстатит. Температура
этого превращения близка к 1350°. Авторы исправили величину
плотности стекла MgSiO3 (34.4 см3/моль). Учтя эти данные и при-
няв, что изменения объемов при фазовых переходах MgSiO3 при-
близительно равны разности молярных объемов при обычных
температурах, а энтропия плавления составляет около 8.0 э. е.,
30
Силикатные системы
Бережной и Кордюк определили уравнения пограничных прямых
и построили ориентировочную Р—/-диаграмму состояния системы
MgSiO3 (рис. 31). В области IV диаграмма состояния MgSiO3
0 20 Ло /60 80 100
Si02 MgSiO3 M^SiO^ MgO
Вес %
Рис. 27. Диаграмма состояния
системы MgO—SiO2 (по Ники-
тину).
переходит в сечение двойной си-
стемы MgO—SiO2.
При очень больших давлени-
ях, существующих, например,
в глубинах земной мантии, MgSiO3
может перейти в шпинельную фор-
му Mg2SiO4-|-Ko3CHT.
°C
2200
<ч18»19
2100 - 7/4
2000
1900
1800
1700
12
Одна жидн.
>20
,15 16
Две жидн.
8
к ,11
I 3
Ти 7 Кристоб.+две жидн.
.3 t1695°,!f
Кристоб.+Ж Кристоб.+Ж
5 10 15 20 25
Вес. %
о 1 • 2 *3 # Ч л 5
0
зюг
30 35
MgO
Рис. 28. Область существования двух не-
смешивающихся жидкостей в системе
MgO—SiO2 (по Ольшанскому).
1 — одна жидкость: 2 — две жидкости; з — одна
жидкость (по Греигу); 4 — Две жидкости (по
Грейгу); 5 — состав стекол, найденный интер-
поляцией по коэффициенту преломления.
Энстатит рассматривается как политипическая форма MgSiO3,
подобно тридимиту в системе SiO2. Бойд и Инглэнд [9, 10] изучили
влияние давления (до 30 000 атм.) на плавление энстатита и нашли,
что инконгруэнтного плавления энстатита в этих условиях не про-
исходит: энстатит плавится без разложения при давлениях
15 000 атм. и даже, по-видимому, при 6000 атм. Протоэнстатит
при высоких давлениях переходит в ортоэнстатит.
Линия, характеризующая переход «протоэнстатит -> ромби-
ческий энстатит», приблизительно соответствует уравнению
Силикатные системы
31
Таблица 2
Рентгеновские константы модификаций метасиликата магния
h Л 1 20 d. А Uh d.A Uh
Энстатит (ромбич е с к и й )
По Сарверу и Гюммелю [22] По Свонсону [26]
1 2 1 26.95 3.31 33 3.303 35
2 2 1 28.20 3.16 81 3.167 100
3 2 1 30.38 2.94 36 2.941 44
6 1 0 31.20 2.87 100 2.872 87
Протоэнстатит (ромбический)
По Сарверу й Гюммелю [22] По Смиту [24]
2 1 1 27.60 3.23 18 3.240 20
1 2 1 28.15 3.17 100 3.171 100
3 1 0 30.80 2.90 35 2.908 40
Клиноэнстатит
(моноклинный)
По Сарверу и Гюммелю [22] По Атласу [5]
— — — 27.20 3.28 30 3.27 50
— — — 28.15 3.17 58 3.16 70
— — — 30.05 2.97 74 2.97 70
— — — 31.10 2.87 100 2.86 100
Таблица 3
Инвариантные точки системы
MgO—SiO2 по Никитину [3]
Точка Фазы Процесс Состав, вес. % Темпера- тура. °C
MgO SiO,
1 MgO+2MgO • 31О2+жид- кость. Эвтектика. 62 38 1760
2 2MgO • SiO2-f- жидкость. Плавление. 57.1 42.9 1860
32
Силикатные системы
Таблица 3 (продолжение)
Точка Фазы Процесс Состав, вес. % Темпера- тура, °C
MgO SiO2
3 MgO - SiO24-2MgO- SiO2+ 4- жидкбсть. Инконгруэнтное плавление. 37.5 62.5 1563
4 MgO-SiO2-|-кристобалит 4- +жидкость. Эвтектика. 35.0 65.0 1552
5 Кристобалитжидкость А 4- 4-жидкость В. Ликвация. 0.8 99.2 1695
6 Кристобалит4-жидкость А4~ 4-жидкость В. » 31.0 69.0 1695
Таблица 4
Инвариантные точки системы MgO—SiO, по Боуэну и Андерсену [7]
и Грейгу [17]
Точка Фазы Процесс Состав, вес. % Темпера- тура, °C
MgO SiO2
1 MgO4~2MgO- ЗЮ24~жидкость. Эвтектика. 63 37 1850
2 2MgO • SiO24-жидкость. Плавление. 57.1 42.9 1890
3 2MgO- SiO2+MgO- SiOz-|-жид- кость. Инконгруэнт- ное плавление. 37.5 62.5 1557
4 MgO- SiO,4-кристобалит 4- 4-жидкость. Эвтектика. 35.0 65.0 1543
5 Кристобалит4-жидкость A-f- 4-жидкость В. Ликвация. 0.8 99.2 1695
6 Кристобалит4-жидкость A-f- 4-жидкость В. » 31.0 69.0 1695
Кристаллические фазы системы MgO—SiO.2
.. Торопов И др., КН.
Таблица 5
Соединение Система кристаллов Габитус Спайность Плот- ность, г/см3 Ng № 2У° Опти- че- ский знак Оптиче- ская ориенти- ровка
2MgO- SiO2 (форстерит). Ромбическая. Призмы. Ясная по (001) и (010). 3.216 1.668 1.636 85°6' (+) Z=a
MgO- SiO2 * (энстатит). » Волокнистые агрегаты. По (НО) около 90°. 3.175 1.658 1.650 60° (+) Z=c
MgO SiO2 ** (клиноэнста- тит). Моноклинная. Кристалличе- ские агрегаты, полисинтети- ческие двой- ники по (010). По (110) 88°. 3.19 1.660 1.651 53°30' (+) Zac=+22°. Плоскость оптических осей J. (010).
MgO SiOg *** (протоэнста- тит). Ромбическая при комнатной температуре. Прямое пога- сание. Брусковидные кристаллы. Псевдоморфозы по энстатиту. Отли1 ся от ТИТОВ1 более ±0.( 1ают- шста- лх не гем на )02. Боль- шой, —70°. (+) Z=c
* Стекло MgOSiO2: ЛГ=1.581, d=2.758.
** По оптическим свойствам протоэнстатит весьма близок к энстатиту и отличается по рентгеновским
данным.
*** Получен нагреванием природного энстатита с добавкой LiF при 1100° в течение недели.
34
Силикатные системы
t (° G) =985+84 Р (кбар) с тройной точкой «протоэнстатит—ромби-
ческий энстатит—жидкость» при 1650° и 8.0 кбар.
При высоком давлении энстатит плавится конгруэнтно: давле-
ние, при котором плавление изменяется от инконгруэнтного к кон-
груэнтному, составляет менее 5.4 кбар.
В 1964 г. Бойд и Инглэнд [12] представили суммарную диа-
грамму MgSiO3, обобщающую работу этих авторов (рис. 32).
Рис. 29. Схематическая диа-
грамма «давление—темпера-
тура» для MgSiOs.
Рис. 30. Кривая термического
расширения для полиморфных
форм MgSiOs.
1 — клиноэнстатит; 2 — энстатит;
з — протоэнстатит; 4 — плавле-
ный кремнезем.
Линия, характеризующая влияние давления на инверсию энста-
тит—клиноэнстатит (рис. 33), характеризуется уравнением
7=630+2.6 Р, где t — температура (в °G), а Р — давление
(в кбар).
Влияние давления на плавление форстерита Mg2SiO4 изучили
Дэвис и Инглэнд [15]. G ростом давления от 0 до 47 кбар темпера-
тура плавления форстерита возрастает от 1900 до 2125°, т. е. тем-
пературный градиент составляет 5° на 1 кбар.
Помимо известных модификаций, Берч [6] и Рингвуд [19]
доказывают существование для MgSiO3 при высоких давлениях
плотной модификации со структурой корунда.
Рингвуд [20, 21] оценил давление переходов в силикатах маг-
ния и предложил следующую последовательность превра-
щений:
1) 2MgSiO3 (энстатит) -> Mg2SiO4 (форстерит)+SiO2 (стишовит);
V=—4.9 см3/моль, параметры образования стишовита:
Р=135 кбар, +ах=1200°;
Силикатные системы
35
2) Mg2SiO4 (форстерит) -> Mg2SiO4 (структура шпинели);
—3 см3/моль, параметры перехода форстерит -> шпинель:
р=175+55 кбар, £=1500°;
3) Mg2SiO4 (со структурой шпинели) -> MgO (периклаз)+
MgSiO3 (со структурой корунда); V=—2.7 см3/моль;
4) MgSiO3 (структура корунда) -> MgO (периклаз)+SiO2 (сти-
шовит); V=—1.0 см3/моль.
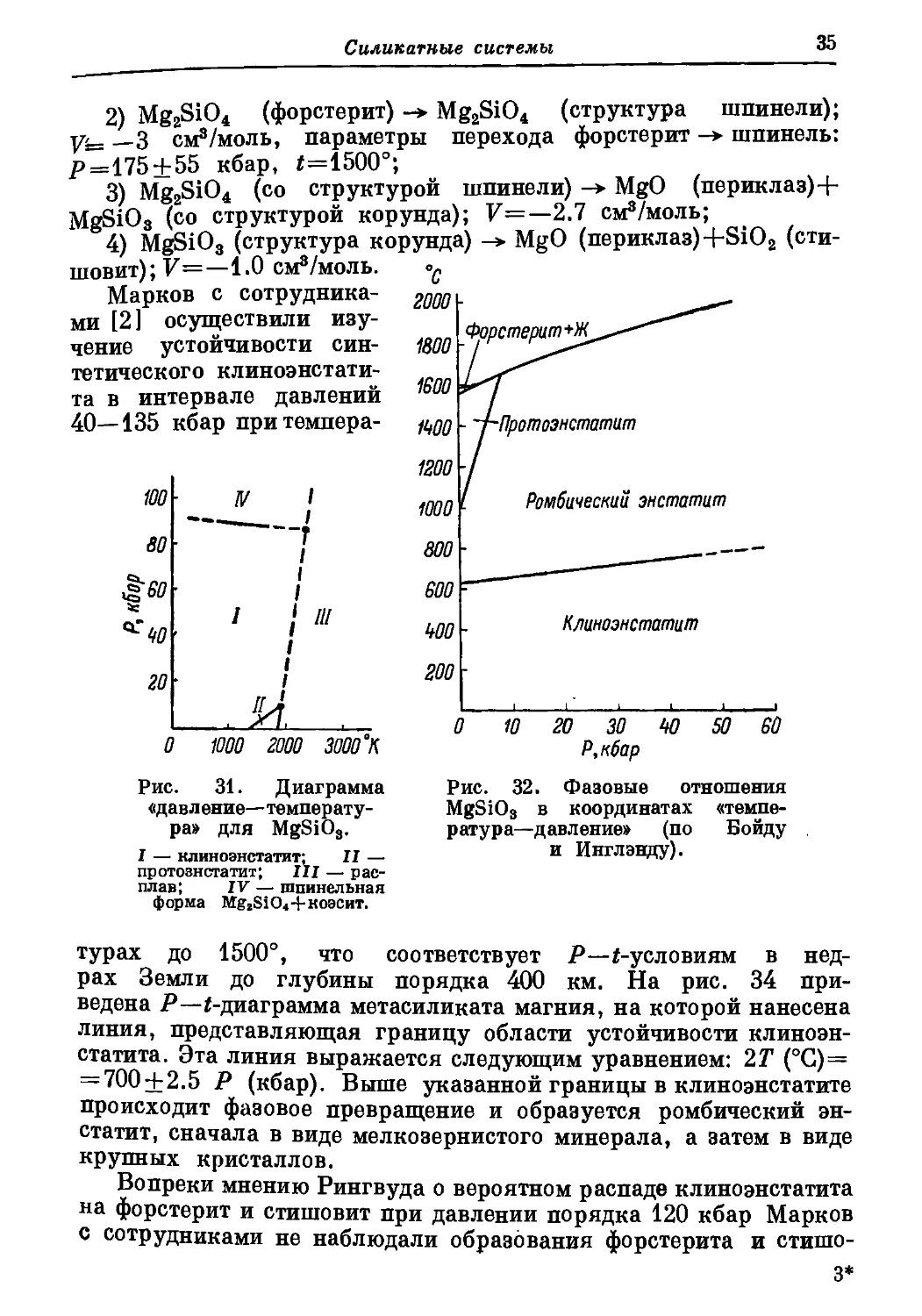
Марков с сотрудника-
ми [2] осуществили изу-
чение устойчивости син-
тетического клиноэнстати-
та в интервале давлений
40—135 кбар притемпера-
юо
во
^60-
40 '
20’
0
IV I
-----------I
г
I
।
I
I ‘ ///
/
।
Рис. 32. Фазовые отношения
MgSiOs в координатах «темпе-
ратура—давление» (по Бойду
и Инглэнду).
1000 2000 3000 ° К
Рис. 31. Диаграмма
«дав л ение—температу-
ра» для MgSiOs.
I — клиноэнстатит; II —
протоэнстатит; III — рас-
плав; IV — шпинельная
форма Mg2SiO4+KO3CHT.
турах до 1500°, что соответствует Р—/-условиям в нед-
рах Земли до глубины порядка 400 км. На рис. 34 при-
ведена Р—/-диаграмма метасиликата магния, на которой нанесена
линия, представляющая границу области устойчивости клиноэн-
статита. Эта линия выражается следующим уравнением: 2Т (°С)=
— 700+2.5 Р (кбар). Выше указанной границы в клиноэнстатите
происходит фазовое превращение и образуется ромбический эн-
статит, сначала в виде мелкозернистого минерала, а затем в виде
крупных кристаллов.
Вопреки мнению Рингвуда о вероятном распаде клиноэнстатита
на форстерит и стишовит при давлении порядка 120 кбар Марков
с сотрудниками не наблюдали образования форстерита и стишо-
3*
36
Силикатные системы
вита. Интересно, что если исходить не из клиноэнстатита, а из эк-
вимолекулярной смеси окиси магния и кремнезема, то процесс
Рис. 33. Влияние давления на превращение
энстатит—клиноэнстатит.
протекает совершенно иначе: при температурах, превышающих
700—900°, смесь окислов переходит в комплекс трех минералов —
клиноэнстатита, форстерита и амфибола. Поскольку течение реак-
500-
i >________!____1_____1----1.. -Д—
0 20 W 60 80 100 120 КО
Р,кбар
Рис. 34. Диаграмма в координатах
«давление — температура» метасили-
ката магния (по Маркову с сотруд-
никами) .
I — линия превращения протоэнстатит—
ромбический энстатит; II — линия плав-
ления; III — линия, характеризующая
границу области устойчивости клино-
энстатита.
ций, а следовательно и конеч-
ные продукты, образующиеся в
определенных Р—/-условиях,
могут существенно зависеть от
состояния исходного вещества,
ставится под сомнение вывод
Скляра с сотрудниками [23] о
наличии участка на диаграмме,
где обнаруживается комплекс
клиноэнстатит + форстерит +
стишовит.
Стефенсон с сотрудника-
ми [25] определили показатели
светопреломления модификаций
MgSiO3. Ортоэнстатит имеет
Ag=1.658, Am=1.652, Np=
=1.650 (Na-свет), 2V=60° (вы-
численный), плотность 3.20 г/см3,
параметры элементарной ячей-
ки: а0=18.2249, Ь0=8.8149,
с0=5.1746 A, 7=831.30 А3.
Низкий клиноэнстатит имеет
Ag=1.660, 7Vm=1.654, Np =
= 1.651, плотность 3.21 г/см3, параметры элементарной ячейки:
ао=9.6065, Ь0=8.8146, с0=5.1688 А, (3=108.335°, 7=415.46 А3.
Силикатные системы
37
Параметры решетки и пространственные группы модификаций
MgSiO3 приводятся в табл. 1 по данным Моримото [18] для энста-
тита и клиноэнстатита и по данным Смита [24] для протоэнстатита.
В табл. 2 приводятся из статьи Сарвера и Гюммеля [22] харак-
терные рентгеновские отражения для модификаций MgSiO3 по дан-
ным различных авторов.
В табл. 3, 4 даны инвариантные точки, а в табл. "5 —^кристал-
лические фазы системы.
Литература
1. Б е р е ж н о й А. С., Р. А. К о р д ю к, Доповщ} АН УССР, № 10,
1417, 1960.
2. Марков В. К., Л. Д. Лившиц, И. С. Д е л и ц и н,
Ю.Н. Рябинин, В. П. П е т р о в, Изв. АН СССР, сер. геол.,
№ 7, 38, 1965.
3. Никитин В. Д., Изв. Сект. физ.-хим. анализа ИОНХ АН СССР, 16,
№ 3, 29, 1948.
4. Ольшанский Я. И., ДАН СССР, 76, № 1, 93, 1951.
5. A 11 a s L., Journ. Geol., 60, № 2, 127, 1952.
6. В i г с h F. Some geophysical applications of high-pressure research. In:
Solids under pressure. Ed. W. Paul and D. M. Warschauer, New York,
chap. 6, 1963.
7. Bowen N. L., 0. A. A n d e r s e n, Amer. Journ. Sci., (4), 37, № 222,
487, 1914.
8. В о w e n N. L., J. F. S c h a i r e r, Amer. Journ. Sci., (5), 29, № 170,
151, 1935.
9. Boyd F. R., J. L. England, Carnegie Inst. Washington, year book
59, 47, 1959—1960.
10. В о у d F. R., J. L. E n g 1 a n d, Carnegie Inst. Washington, year book
60, 115, 1960—1961.
11. Boyd F. R., J. L. England, Carnegie Inst. Washington, year book
62, 118, 1962—1963; Journ. Geophys. Res., 69, № 10, 2101, 1964.
12. В о у d F. R., J. L. England, Carnegie Inst. Washington, year book
64, 117, 1964—1965.
13. В г о w n W. L., N. M orimot o, J. V. S m i t h, Journ. Geol., 69,
№ 5, 609, 1961.
14. C 1 a r k S. P., A. E. R i ng w о о d, Rev. Geophys., 2, № 1, 35, 1964.
15. D a v i s В. T. C., J. L. E n g 1 a n d, Carnegie Inst. Washington, year
book 62, 119, 1962—1963.
16. F о s t e r W. R,, Journ. Amer. Ceram. Soc., 60, № 2, 255, 1951.
17. Greig J. w., Amer. Journ. Sci., (5), 13, № 73, 1, 1927.
18. Morimoto N., Carnegie Inst. Washington, year book 58, 197, 1958—
1959.
пл' R * n g w о о d A. E., Geochim. cosmochim. acta, 13, 303, 1958.
20. Ringwood A. E., Journ. Geophys. Res., 67, № 10, 4005, 1962.
21. Ringwood A. E., M. Seabrook, Nature, 196, № 4857, 883,1962.
22. bar ver J. F., F. A. Hummel, Journ. Amer. Ceram. Soc., 45, № 4,
152, 1962.
23. S с 1 а г С. B., L. C, Garrison, С. M. Schwartz, Journ. Geo-
Q Ph.ys. Res., 69, № 2, 325, 1964.
9T gmith J. V., Acta crystallogr., 12, № 7, 515, 1959.
ЛРйеоп,80„п D- A’ c- B- Sci ar, J, V. Smith, Mineral. Mag.,
35, № 274, 838, 1966.
38
Силикатные системы
26. Swanson Н. Е., М. I. Cook, Е. Н. Evans, J. Н. de Groot,
Standard. X-ray diffraction powder patterns, Nat. Bur. Stand. Circ.,
539, 1960.
CaO—SiO2
Имеет большое значение для познания фазового состава цемен-
тов, доломитовых и других огнеупоров, шлаков черной металлур-
гии и пр. Обнимает составы ряда природных минералов: ранки-
нита (СадЭцО?), килхоанита (низкотемпературная модификация
9С
2600
2000
2200
2000
1800
'Две жи(Ьь
1600
1000
' Живк. л-СМ^ж/ОаО^Ж
УМ---—
Ранкинит р [Са33105+Ж
ж \ I — Ca^iO^oL-Ca^iH,
\Псевво6амааш1т1
——Лез___________Ранкинит
Kpucmofr+fK
Трав.+ж
Трив.+псеввоволлйстонит
'юпнит^псевв^алластонит-
-S’
‘8
I..............
1. ~1. J j-cn^io^oJQ ]
10 to 30' 00^50/60 1 70 30 100
CaOSiO3 3CaO-2SW2 2CaO-Sty ЗОаО-ЗЩ СаО
Вес.%
Рис. 35. Диаграмма состояния системы СаО—SiO2
по новым данным (из работы Глассера [17]).
1200
1000
Трид. + волластонит
Кварц + волластонит
0
SW3
Ca3SlOs+a!-Ca2SiQll
а,'-Саг5Юч+СаО
PaHKUHum+y-Ca2Si.Oll
е
ранкинита), бредигита (a'-Ca2SiO4), ларнита (p-Ca2SiO4), вол-
ластонита (|3-CaSiO3), извести (СаО), кристобалита, тридимита,
кварца (SiO2).
Ранние исследования Фогта [40 ] дали только ориентировочные
представления о равновесиях в системе. Первое подробное ис-
следование выполнено Дэем, Шепердом и Райтом [15]. Дальнейшие
Силикатные системы
39
детали и исправления даны в
работах Шеперда, Ранкина и
Райта [35], Ранкина и Рай-
та, [29], Грейга [20], Карл-
сона [13], Ли и Деш [22], Эй-
теля [16], Колобовой [6],Муана
и Осборна [25], Деллы Рой [31 ],
Уэлча и Гатта [41].
Диаграмма состояния систе-
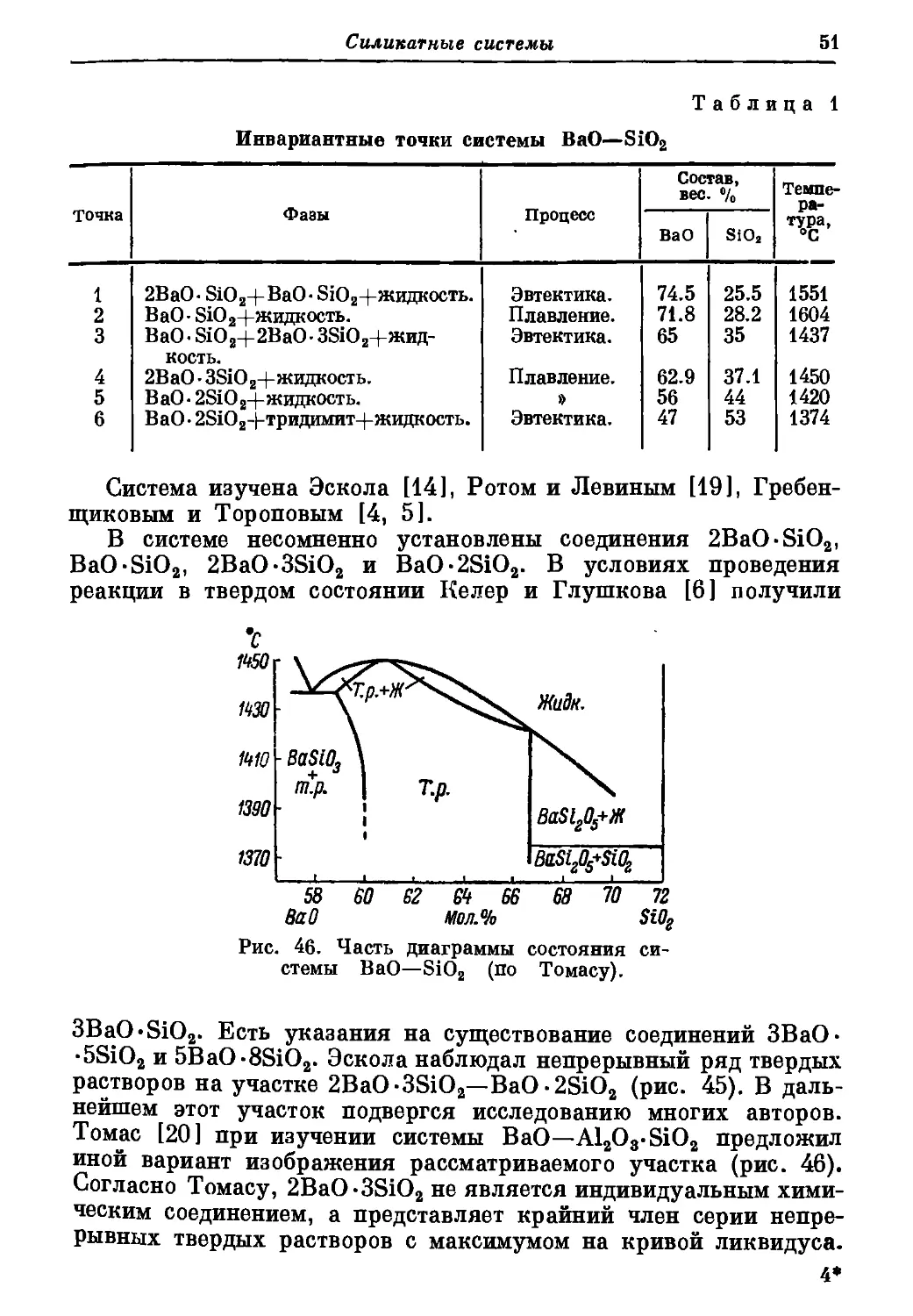
мы по новым данным, приво-
димая в работе Глассера [17], по-
казана на рис. 35, а на рис. 36 —
диаграмма, иллюстрирующая
новые данные Уэлча и Гат-
та [41 ] по характеру плавления
Ga3SiO6. На рис. 37 показана,
по Ольшанскому [8], экспериментально полностью оконтуренная
им область двух жидких фаз, ранее намеченная Грейгом [20].
Рис. 37. Область двух жидких фаз в
системе СаО—SiO2 (по Ольшанскому).
одна жидкость; 2 — две жидкости; з — од-
г?.„>»?Д\К0С7ь (п0 Крейгу); 4 — дВе жидкости (по
грейгу); 5 — составы стекол, найденные интер-
поляцией по коэффициенту преломления.
_ физму Ca2SiO4 содержатся
в Работах Дэя и Шелерда [14], Ранкина и Райта [29], Васени.
на [5 ], Тремеля и Меллера [39], Бредига [12], Тило и Фун
Рис. 36. Часть диаграммы состояния
системы СаО—SiO2 (по Уэлчу и
Гатту).
Существенное практи-
ческое значение имеет по-
лиморфное превращение
Р( a')-T-Ca2SiO4, сопрово-
ждающееся 10%-м увели-
чением объема кристаллов,
вызывающим распад в тон-
кий порошок доменных и
иных богатых известью
силикатных шлаков и це-
ментных клинкеров, со-
держащих значительное
количество двухкальцие-
вого силиката.
Температура превраще-
ния pz^a-CaSiO3 (1125°)
может использоваться в
качестве ориентировочного
геологического термометра
при определении условий
образования некоторых
контактно - метаморфичес-
ких пород.
Данные по полимор-
40
Силикатные системы
Рис. 38. Схема полиморфных
превращений Ca2SiO4 (по Бре-
дигу).
ка [37], Торопова, Волконского и Садкова [10], Д. Рой [31],
Р. Роя [32] и др.
На рис. 38 приводится схема полиморфных превращений
Ca2SiO4, предложенная Бредигом [12], по которой существуют
3 энантиотропные модификации Ca2SiO4: а-гексагональная со
структурой глазерита (a-K2SO4), а'-ромбическая со структурой
B-K2SO4, у-ромбическая со структурой оливина — и одна метаста-
бильная и монотропная по отношению к у-форме модификация —
р-моноклинная с неизвестным ти-
пом структуры.
Судя по диаграмме, (3-форма мо-
жет быть получена из a'-формы при
675°. Переход около 850° из модифи-
кации а с координацией СаО9 и
СаО10 в модификацию у с коорди-
нацией СаОв, согласно расчетам Бре-
дига, должен сопровождаться боль-
шим возрастанием удельного объема
(порядка 12%); переход же а при-
мерно при 675° в нестабильную низ-
котемпературную модификацию р с
ее возможной координацией СаО8
может, по расчетам Бредига, или
вообще не отразиться на удельном объеме, или же изменить его
приблизительно лишь на 1 %.
По Заальфельду [33], происходит следующее изменение пара-
метров элементарной ячейки при превращении a'-Ca2SiO4
в Y-Ca2SiO4:
a'-Ca2SiO4 •f-Ca2SiO4 Изменение параметра, %
а — 6.76 А а = 6.78 А + 0.3
Ь = 5.45 А Ъ •= 5.06 А — 9.1
с = 9.28 А с = 11.28 А +19.5
На рис. 39 представлена диаграмма «свободная энергия —
температура» для Ca2SiO4 как результат ревизии полиморфизма
этого соединения со стороны Д. Рой [31 ] в отношении низкотем-
пературных превращений и a'-»T-Ca2SiO4. На рис. 40
дается заимствованная из статьи Нёрса [28] диаграмма полимор-
физма Ca2SiO4, построенная по данным Торопова и др. [WI и
Нёрса [27]. Штриховые части кривых охлаждения (рис. 40) ука-
зывают на то, что на этих участках образуются фазы, отличаю-
щиеся от получаемых при нагревании в том же температурном
интервале.
Дальнейшее проверочное исследование полиморфизма Ca2SiO4
проведено Смитом, Маджумдаром и Ордвеем [36]. Составленная
Силикатные системы
41
ими гипотетическая схематическая диаграмма зависимости сво-
бодной энергии от температуры для различных модификаций
Ca2SiO4 приводится на рис. 41. Данные для фаз, нагретых ниже
1410°, сходны с данными Д. Рой [31 ]. Для образцов, охлажденных
от температуры выше 1430°, Смитом и другими с помощью рентге-
нографического исследования при высоких температурах уста-
новлены еще две фазы, отвечающие, по-видимому, р'-фазам
Тремеля [38] и Торопова, Волконского и Садкова [10] (рис. 40).
На рис. 41 эти две фазы обозначены ря и ая соответственно, тогда
как хорошо известные |3- и a-фазы обозначены через рл и ая.
500 600 700 800 000 °C
Рис. 39. Диаграмма «свобод-
ная энергия—температура»
для Ca2SiO4.
^^peSa^ а! Перс
у~ «ч,________/447°
Торопов—y^^L^J42£
При охлаждении г fl' а' а"
*У^^&0^05°а’Нёрс «
*^1^25°650а-
Торопов1230^2^
0 200 W 600 80010001200 ЛОО 16ОО°С
Рис. 40. Диаграмма полиморфизма
Ca2SiO4.
Фаза а'И образуется из ot-фазы в процессе охлаждения до 1425°,
и далее около 670° ая-фаза превращается в Ря-фазу. Барьер энер-
гии активации между ря и у более низкий, чем между р£ и у, что
облегчает быстрое и полное превращение рд-фазы в ^-модификацию
около 400° (на рис. 41 — 405°), обусловливая тем самым рассыпа-
ние образца в порошок. Если p-модификация нагревается выше
критической температуры 1420 + 10° (температура превращения
«^« ), то она в процессе охлаждения полностью и быстро пре-
вращается в у-форму и происходит рассыпание; если же образец
не нагревался выше указанной температуры, то при охлаждении
до комнатной температуры в нем присутствует смесь р- и у-форм.
На рис. 42 приводится диаграмма фазовых отношений Ca2SiO4
в зависимости от давления и температуры по данным Д. Рой [31]
и Р. Роя [32].
Высокотемпературная форма Ca2SiO4 может быть сохранена до
обычной температуры при помощи различных стабилизирующих
добавок. Это явление изучали Грин [19], Бредиг [12], Белянкин и
Лапин [1], Торопов и Борисенко [9], Тило и Функ [37], Глас-
42
Силикатные системы
сер и Осборн [18], Куколев и Мельник [7], Будников, Брон и
Хорошавин [4], Смит, Маджумдар и Ордвей [36] и многие другие
исследователи. По Грину стабилизирующими добавками являются
0 lol) W 600 800 Ю00 1200 /Й» №00°С
Рис. 41. Гипотетическая схематическая диаграмма
зависимости свободной энергии от температуры для
различных модификаций Ca2SiO4 (по Смиту, Маджум-
дару и Ордвею).
Сплошные линии — стабильные фазы; штриховые линии —
метастабильные фазы.
Na2O+Fe2O3 или Na2O+Al2O3, по Бредигу — Са3(РО4)2, по
Белянкину и Лапину — магнезиально- и железоортосиликатные
молекулы, по Торопову и Борисенко — 2BaO-SiO2 (не менее
10%), по Ньюмэну и Уэлл-
су [26] — Сг2О3, V2O3, Р2О3, В2О3,
Рис. 42. Диаграмма фазовых от-
ношений Ca2SiO4 в зависимости
от давления и температуры (по
Д. Рой и Р. Рою).
найденная Мидглеем и
Мп2О3, ВаО, по Тило и Функу,
Брону и Хорошавину [3] — Na2O
(0.40%) и т. д.
Трехкальциевый силикат встре-
чается [21 ] в трех разновидно-
стях при комнатной температуре;
1) триклинный, образующийся в
чистых синтетических препаратах
системы GaO—SiO4; ,2) моноклин-
ная форма, обычная в портланд-
цементных клинкерах (алит) и со-
держащая малые количества при-
месей MgO и А12О3; 3) тетраго-
нальная фаза, наблюдаемая в ос-
новных мартеновских шлаках и
Флетчером [23] в некоторых це-
ментных клинкерах; в таких кристаллах могут содержаться не-
большие количества FeO, Fe2O3, MnO, Р2О6, MgO и А12О3.
Яннаквис, Регур, Мазье и Гинье [43],изучая методом высоко-
температурной рентгеновской камеры и ДТА полиморфизм Ca3SiO8,
Силикатные системы
43
Таблица 1
Инвариантные точки системы СаО—SiO2
Точка Фазы Процесс Состав, вес. % Темпера- тура, °C
СаО SiO2
1 а-Кристобалит+жидкость А + Ликвация. 0.6 99.4 1698
+жидкость В.
2 а-Кристобалит+жидкость А + » 28.0 72.0 1698
жидкость В.
3 а-Са81О3+тридимит+жид- Эвтектика. 37.0 63.0 1436
КОСТЬ.
4 a-CaS103-|-жидкость. Конгруэнтное 48.2 51.8 1544
плавление.
5 6 а-Са81О3+Са38цО7+жидкость. Ca3Si ZO7-|- a-CazSi Од -|- жид- Эвтектика. Реакция. 54.5 55.5 45.5 44.5 1460 1464
кость.
7 Ca3S]2O7+a-Ca2SiO4+ жид- кость. Инконгруэнт- ное плавление. 58.2 41.8 1464
8 a-Ca2SiO4-|-жидкость. Конгруэнтное 65.0 35.0 2130
плавление.
9 a-Ca3S104+Ca3Si О6+жидкость. Эвтектика. 69.5 30.5 2050
10 Ca3SiO5+CaO+жидкость. Реакция. 71.5 28.5 2070
И Ca3Si О5 -|- СаО -|- жидкость. Инконгруэит- 73.6 26.4 2070
ное плавление.
12 CasSiO5+Ca2SiO4+CaO. Разложение 73.6 26.4 1250
в твердом состоянии.
13 СаО -|- жидкость. Инконгруэит- 100 — 2572
ное плавление.
14 a-CaSiO3+p-CaSiO3. Полиморфное превращение. 48.2 51.8 1125
15 y-Ca2Si О4+a'-Ca2Si О4. То же. 65.0 35.0 850 *
16 a'-Ca2Si О4-|- a-Ca2Si 04. » » 65.0 35.0 1450 **
17 ci -CazSiO4-|- p-CazSiO4 (мета- 65.0 35.0 670-675
стабильная).
* п50тт^° БрЙЙТУ [121> 830° 110 НёРсУ [27] и около 725° по Д. Рой [31].
ппоп™ П° Нё₽сУ,[27 ], 1447°; при охлаждении a-Ca2SiO4, по Нбрсу, ниже 1425°
превращается в а-форму. J
Кристаллические фазы системы СаО—SiO2
Таблица 2
Соединение Система кристаллов Габитус Спайность Плот- ность, г/см3 Ng Np 2V° Опти- че- ский знак Оптиче- ская ориенти- ровка
Ca3SiO& (алит). Гексагональ- ная. Шестиуголь- ные пластины и зерна. Неясная. 3.20 1.723 1.717 0 (-) —
a-Ca2SiO4. То же. Шестиуголь- ные и непра- вильные зерна. 3.07 при 1500°
a'-Ca2SiO4 (бредигит). Ромбическая. — — 4 41 при 700° — — — — —
y-Ca2SiO4. Ромбическая (оливиновый тип струк- туры). Призмы. Совершенная по (010). 2.97 при 20° 1.654 1.642 60 (+) 2Дс=3°.
0-Ca2SiO4 (метастабиль- ная; белит, фелит, лар- Моноклинная. — Ясная по (010) и (100). 1.735 1.717 Боль- шой. (+) Плоскость оптических осей (100) Х=с.
нит). 1.641
Ca3Si2O7 Призмы. — — 1.650 То же. (+) —
(ранкинит). 1.610 (+)
a-CaSiO8 (псевдовол- ластонит). Псевдогекса- гональная, вероятно триклинная. Зерна, удли- ненные призмы. По (001). Иногда двой- ники по (001). 2.905 1.654 0—8 ХДа=3°.
|3-CaSiO3 (волластонит). Триклинная. Досчатые индивиды. Совершенная по (100); яс- ная по (001). 2.915 1.631 1.616 39 (-) Плоскость оптических осей_[_ удли- нению.
Силикатные системы
45
установили изменения в структуре триклинной модификации при
615 и 750°, переход триклинной модификации в моноклинную
при 917°, резкое изменение в моноклинной структуре при 973°
с образованием формы, весьма близкой к тетрагональной, и окон-
чательное превращение моноклинной структуры в тетрагональ-
ную при 1050°.
Мидглей и Флетчер [23] наблюдали на кривых ДТА для чи-
стого Ca3SiO8 эндотермические эффекты при 595, 747, 916 и 969°.
По данным этих двух авторов, Mg2+ входит в структуру Ga3SiO6
до 2.0% MgO при 1500°. Mg2+ (до 1.5%MgO) может стабилизи-
ровать моноклинную форму при комнатной температуре.
А13+ может входить в структуру GagSiOg до 0.9% А12О3 при
1500°, причем 4А13+ замещают 3Si4+. Сам по себе А13+ не стабили-
зирует при закалке моноклинную форму до комнатной темпера-
туры. Для стабилизации требуется дополнительно Примерно
1% MgO. Дальнейшее замещение на MgO, доходящее до 1.7%
MgO, вызывает лить слабое изменение в моноклинной структуре.
Если количество совместно присутствующих Mg2+ и А13+ сни-
жается до 75% от требуемого для насыщения структуры Ca3SiO4,
при закалке до комнатной температуры наблюдается триклинная
форма.
В 1964 г. Бойкова и Торопов [2], а затем Регур [30] уточнили
схему превращений трехкальциевого силиката. Бойкова, поль-
зуясь методом дифференциально-термического анализа и высоко-
температурным микроскопом, показала, что GagSiOg претерпевает
обратимые эндотермические превращения в следующих темпера-
турных интервалах: 620—640 , 920 —925 , 970—980 и 990—1000°,
причем последнее превращение установлено впервые. Регур вы-
полнила фазовое рентгеновское исследование полиморфизма
Ga3SiO6 и предложила следующую схему: триклинная фор-
т 620° 920° , ттг 980°
ма 1 —> триклинная форма 11 —> триклинная форма 111 —> моно-
, 990° 1060°
клинная форма —> ромбическая форма —► гексагональная форма.
Как видно, первые четыре превращения наблюдались в обеих работах
и могут считаться окончательно установленными. Превращение при
1050° не было обнаружено Бойковой, и его существование остается
пока под вопросом. Переход в гексагональную форму установлен
Регур только рентгенографически. На дифференциально-термиче-
скои кривой ни Бойкова, ни Регур эффекта превращения не об-
наружили.
Миабе и Д. Рой [24] дают такие температуры полиморфных
превращений 3GaO-SiO2: переход низкотемпературной триклин-
нои модификации (а) в высокотемпературную ((3) происходит очень
медленно в интервале от 550 до 700°; а-триклинная модификация
46
Силикатные системы
переходит в моноклинную при 910 + 10°, моноклинная в тетраго-
нальную при 970+10°. Эндотермических процессов при 990 и
1050° Миабе и Рой не обнаружили.
Заальфельд [34] получал кристаллы |3-Ca2SiO4 и T-Ca2SiO4
размером в несколько миллиметров, проводя синтез из смеси СаО
и SiO2 в атмосфере водяных паров соответственно при 1400 и 1100°.
Оказывая сильное влияние на рост кристаллов, вода не входит
в структуру силикатов кальция (это доказано исследованием
ИК-спектров).
Заальфельд [34] доказывает, что полиморфные превращения
Ca2SiO4 представляют сдвиговые превращения (displasive Umwand-
lungen), что объясняется малым различием величины параметров
элементарных ячеек модификаций Ca2SiO4.
Беннет с сотрудниками [11] получили новый силикат кальция
приблизительного состава Ca8Si6O18 (8CaO*5SiO2). Это соединение
(в смеси с y-Ca2SiO4 и волластонитом) получалось в гидротермаль-
ных условиях (давление 10— 200 бар, температура 180—600°).
Соединение имеет ромбическую структуру с параметрами элемен-
тарной ячейки: а=11.54, Ь=5.09, с=28.86 А.
Вильямсон и Глассер [42] быстрым охлаждением расплава
(из области расслаивания жидкой фазы) получали богатые крем-
неземом кристаллы кубической структуры, которые не могли быть
отнесены к известным силикатам кальция. Авторы назвали эти
кристаллы у-фазой. Они имеют гранецентрированную ячейку
с параметром а0=3.92 А.
Литература
1. Б е л я и к и и Д. С., В. В. Лапин, ДАН СССР, 51, № 9, 707, 1946;
60, № 5, 857, 1948.
2. Б о й к о в а А. И., Н. А. Т о р о п о в, ДАН СССР, 156, № 6, 1428,
1964.
3. Б р о н В. А., Л. Б. X о р о ш а в и н, Журн. прикл. хим., 34, № 4,
750, 1961.
4. Будников П. П., В. А. Брон, Л. Б. X о р о ш а в и н, Труды
Моск, хим.-технол. инет. им. Д. И. Менделеева, вып. 36, 15, 1961.
5. Васенин Ф. И., Журн. прикл. хим., 21, № 1, 10,1948; ДАН СССР,
59, № 7, 1321, 1948.
6. Колобова К. К., Журн. прикл. хим., 14, № 7—8, 928, 1941.
7. Куколев Г. В., М. Т. Мельник, ДАН СССР, 109, № 5, 1012,
1956.
8. Ольшанский Я. И., ДАН СССР, 76, № 1, 93, 1951.
9. Торопов Н. А., А. И. Борисенко, Труды 4-го Совещ. по
экспер. минералогии и петрографии, вып. 2, Изд. АН СССР, М., 214,
1953.
10. Т о р о п о в Н. А., Б. В. Волконский, В. Н. Садков,
ДАН СССР, 112, № 3, 467, 1957.
11. Bennet J. М., J. A. G а г d, К. S р е a k m a n, Н. F. W. Т а у-
1 о г, Nature, 209, № 5028, 1127, 1966.
Силикатные системы
47
12. В re d ig М. A., Amer. Mineralogist, 28, № 6, 594, 1943; Journ. Phys.
Chem., 49, № 6, 537, 1945; Journ. Amer. Ceram. Soc.. 33, № 6, 188, 1950.
13. Carlson E. T., Journ. Res. Nat. Bur. Stand., 7, № 5, 893, 1931.
14. Day A., E. Shepherd, Journ. Amer. Chem. Soc., 28, 1089, 1906.
15. D a у A. L., E. S. S h e p h e r d, F. E. W r i g h t, Amer. Journ.
Sci., 4, № 22, 265, 1906.
16. Eitel W., Zs. angew. Mineral., 1, 271, 1938.
17. Glasser F. P., Journ. Amer. Ceram. Soc., 45, № 5, 242, 1962.
18. Glasser F. P., E. F. О s b о r n, Journ. Amer. Ceram. Soc., 41,
№ 9, 358, 1958.
19. Greene К. T., Journ. Res. Nat. Bur. Stand., 32, № 1, 1, 1944.
20. Greig J. W., Amer. Journ. Sci., 13, № 73, 1, 1927.
21. Jeffery I. W., Acta crystallogr., 5 № 1, 26, 1952; Third Internatio-
nal symposium on the chemistry of cement, London, 1952 (published
by the Cement and Concrete Association), London, 1954.
22. Lea F. M., С. H. D e s c h. The chemistry of cement and concrete.
London, 1935.
23. M i d g 1 e у H. G., К. E. Fletcher, Trans. Brit. Ceram. Soc., 62,
№ 11, 917, 1963.
24. Miyabe H., D. M. R о у, Journ. Amer. Ceram. Soc., 47, № 7, 318,
1964.
25. M u a n A., E. F. Osborn, Preprint of paper presented before General
Meeting of American Iron and Steel Institute, at New York, May, 23,1951.
26. Neuman E. S., L. S. W e 11 s, Journ. Res. Nat. Bur. Stand., 36,
№ 2, 137, 1946.
27. Nurse R. W., Third International symposium on the chemistry of
cement, London, 1952 (published by the Cement and Concrete Asso-
ciation), London, 56, 1954.
28. Nurse R. W., Proceedings of the Fourth International symposium on
the chemistry of cement, Washington, 1960, Monograph. Nat. Bur.
Stand., № 43, pt. 1, 1962.
29. Rankin G. A., F. E. Wright, Amer. Journ. Sci., 4th ser., 39,
№ 229, 1915. Русск. перевод: Тройная система СаО—A12OS—SiO2. Изд.
Силикатн. ассоц., Л., 75, 1935.
30. Regourd М., Bull. Soc. Franc, mineral., cristallogr., 87, № 2, 241,
1964.
31. Roy Della M., Journ. Amer. Ceram. Soc., 41, № 8, 293, 1958.
32. Roy R., Proceedings of the Fourth International symposium on the
chemistry of cement, Washington, 1960, Monograph. Nat. Bur. Stand.,
№ 43, pt. 1, 29, 1962.
33. Saalfeld H., Ber. Dtsch. keram. Ges., 30, № 8, 179, 1953.
34. Saalfeld H., Ber. Dtsch. keram. Ges.. 44, № 6, 279, 1967.
35. Shepherd E. S., G. A. R a n k i n, F. E. W r i g h t, Journ. Ind.
Eng. Chem., 3, 211, 1911.
36. Smith D. К., A. I. M a j u m d a r, F. О r d w a y, Journ. Amer.
Ceram. Soc., 44, № 8, 405, 1961.
37. T h i 1 о E., H. Funk, Zs. anorgan. allgem. Chem., 28,- № 1—2, 273,
1953.
38. T г о m e 1 G., Naturwissenschaft, 36, № 3, 88, 1949.
/о тг Г ° m e 1 H. M о 1 1 e r, Fortschr. Mineral., 28, 80, 1949.
/t Tir° B 1 J’ Sil'katschmelzlosungen. Christiania, 1903.
/о «г ? 1 c “ !• H., W. G u 11, Journ. Amer. Ceram. Soc., 42, № 1, 11,1959.
" i И i amso n J,, F. P. Glasser, Nature, 201, № 4916, 286,1964.
W- I a nna qu i s N„ M. R e gou r d, Ch. M a z i e re s, A. G u i-
n i e r, Bull. Soc. Franc, mineral., cristallogr., 85, № 3, 271, 1962,
48
Силикатные системы
SrO—SiO2
Согласно данным румынского исследователя Браниски [4],
возможно получение особых стронциевых цементов на основе си-
ликатов стронция. Система изучена Эскола [7]. Кристаллизацией
из расплава получаются только два соединения: ортосиликат
2SrO* *SiO2 и метасиликат SrO-SiO2 (рис. 43). Эти же соединения
Карлсон и Уэллс [5] получали в гидротермальных условиях.
Не установленная точно температура плавления 2SrO-SiO2 на-
ходится выше 1700°.
Третье соединение 3SrO-SiO2 получали Нёрс [10] и Глушкова
и .Келер [1 ] путем осуществления реакций в твердом состоянии.
°C
1700 -
1500 -
13ООГ
SrO
2!№яы
Иристоб.+/К
та'
SrO;StO}+mpuij.
20\ 60
2SrO-SiO2 'SrO-SiO2
Вес. %
2000 г Одна жидк.
0 5 10 15 20 25 30 35
StO2 Вес. % SrO
Рис. 44. Расслаивание расплавов
в системе SrO—SiO2 (по Ольшан-
скому).
80 100
Si02
Рис. 43. Диаграмма состояния системы
SrO—SiO2.
Грейг [8] установил ликвационные явления в системе. Ольшан-
ский [2 ] экспериментально полностью оконтурил поле двух жидких
фаз в системе (рис. 44). С точки зрения теории изоморфизма ин-
тересно, что 2SrO-SiO2 образует непрерывный ряд твердых раство-
ров как с 2BaO-SiO2 (Даниэль и Чейшвили [6]), так и с 2СаО-
• SiO2 (Торопов и Коновалов [3]).
Хаяси с сотрудниками [9] изучили превращение стронциевых
силикатов при высоких давлениях. При давлении 30 кбар и тем-
пературе 400° моноклинный метасиликат SrSiO3 переходит в ром-
бическую модификацию. При дальнейшем повышении давления и
температуры SrSiO3 реагирует с окисью стронция с образованием
стронциевого оливина. Придавлении 30 кбар и температуре 1100°
присутствует только стронциевый оливин. Превращения Sr2SiO4
из оливиновой в шпинельную модификацию не наблюдалось
вплоть до давления 42 кбар. Жидкая фаза появлялась при 1300°
(давление 30 кбар).
.. Торопов и др., КН.
Инвариантные точки системы SrO—SiO2
Таблица 1
Точка Фазы Процесс Состав, вес. % Темпера- тура, °C
SrO S1O2
1 2SrO- SiO2-j-SrO- 31О2+жид- кость. Эвтектика. 65.5 34.5 1545
2 SrO - 31Оа+тридимит-|-жид- кость. 46.18 53.82 1358
3 SrO • SiOa+жидкость. Плавление. 63.2 36.8 1578
4 Кристобалит-1-жидкость А-[- +жидкость В. Ликвация. 30 70 1693
5 Кристобалит^-жидкость Л + +жидкость В. 2.4 97.6 1693
Таблица 2
Кристаллические фазы системы SrO—SiO2
Соединение Система кристаллов Габитус Ng Np 2V° Опти- че- ский знак Оптическая ориентировка
2SrO • SiO2. Моноклинная (Эскола). Двойники но (100). 1.756 1.7275 32i/2 (+) Плоскость оптических осей (010).
2Sr0-SiO2. Ромбическая (Дани- эль). — — — — — Х/\с = 17°. 4
SrO • SiO2. Гексагональная. Базальные пластинки по (0001), двойники по (0001). 1.637 1.599 0 (+)
50
Силикатные системы
Лит ер а т у р а
1. Г л у ш к о в а В. Б., Э. К. К е л е р, Журн. прикл. хим., 30, 517,
1957.
2. Ольшанский Я. И., ДАН СССР, 76, № 1, 93, 1951.
3. Торопов Н. А., П. Ф. Коновалов, ДАН СССР, 40, № 4, 155,
1943.
4. В г a*h i s k у A., Zement—Kalk—Gips, 10, № 10, 393, 1957.
5. Carlson E. T.,- L. S. Wells, Journ. Res. Nat. Bur. Stand., 51, №2,
73 1953
6. Daniel H. O., L. T s c h e i s c h w i 1 i, Zs. Kristallogr., 104, 348,
1942.
7. E s k о 1 a P., Amer. Journ. Sci., (5), 4, № 23, 331, 1922.
8. Greig J. W., Amer. Journ. Sci., (5), 13, № 73, 1, 1927.
9. Hayashi H., N. Nakayama, M. Yoshida, M. Mizuno,
T. Noguchi, K. Yamamoto, T. Yamamoto, Rep. Govt.
Industr. Res. Inst. Nagoya, 13, № 8, 318, 1964.
10. Nurse R. W., Journ. Appl. Chem., 2, № 5, 244, 1952.
BaO—SiO2
Существенное значение имеет для технологии бариевых сте-
кол и особых сортов керамики. Составы большинства бари-
товых кронов в ряде многокомпонентных систем лежат в не-
Вес.%
Рис. 45. Диаграмма состояния системы BaO—SiO2
(по Эскола).
В — BaO; S — S1O2.
посредственной близости к области этой системы. Перспектива
развития стеклокристаллической керамики позволяет ожидать
получение новых материалов на основе системы ВаО—SiO2.
Эта система существенна также для производства бариевых це-
ментов.
Силикатные системы
51
Таблица 1
Инвариантные точки системы ВаО—SiO2
Точка Фазы Процесс Состав, вес. % Темпе- ра- тура, °C
ВаО SiO2
1 2ВаО- SiO2-|-BaO- 81О2-|-жидкость. Эвтектика. 74.5 25.5 1551
2 ВаО - 8Ю2-|-жидк ость. Плавление. 71.8 28.2 1604
3 ВаО* SiO2-i-2BaO-ЗЗЮ2+жид- кость. Эвтектика. 65 35 1437
4 2ВаО • 38Ю2-|-жидкость. Плавление. 62.9 37.1 1450
5 ВаО- 281О2-|-жидкость. » 56 44 1420
6 ВаО • 281О2-|-тридимит-|-жидкость. Эвтектика. 47 53 1374
Система изучена Эскола [14], Ротом и Левиным [19], Гребен-
щиковым и Тороповым [4, 5].
В системе несомненно установлены соединения 2BaO-SiO2,
BaO-SiO2, 2BaO-3SiO2 и BaO-2SiO2. В условиях проведения
реакции в твердом состоянии Келер и Глушкова [6] получили
Рис. 46. Часть диаграммы состояния си-
стемы ВаО—SiO2 (по Томасу).
3BaO-SiO2. Есть указания на существование соединений ЗВаО-
•5SiO2 и 5BaO-8SiO2. Эскола наблюдал непрерывный ряд твердых
растворов на участке 2BaO-3SiO2—ВаО-2SiO2 (рис. 45). В даль-
нейшем этот участок подвергся исследованию многих авторов.
Томас [20] при изучении системы ВаО—Al2O3-SiO2 предложил
иной вариант изображения рассматриваемого участка (рис. 46).
Согласно Томасу, 2BaO-3SiO2 не является индивидуальным хими-
ческим соединением, а представляет крайний член серии непре-
рывных твердых растворов с максимумом на кривой ликвидуса.
4*
52
Силикатные системы
Рот и Левин опровергают существование твердых растворов
и полагают, что в рассматриваемом участке образуются два
соединения — 5BaO-8SiO2 и 3BaO-5SiO2, причем соединение
5BaO-8SiO2 плавится конгруэнтно, a 3BaO-5SiO2 — инконгру-
энтно (рис. 47).
Большое значение имело познание кристаллического строения
Ba2Si3O8, не имеющего аналогов среди других групп силикатов
щелочных и щелочноземельных элементов. Лазаревым, Гребенщи-
ковым и Тенишевой [7] была высказана идея о наличии в трех
°C
1450
1430
1410
1390
1446° 1448'
1420
BaSi,Oc+M
1423'
BaSiO3
BaSizOs*>H
1374
1370
1350
со
58 GO
8a0
/ MO'
38ttO-5SlOz*1K
38aO'5SiO„
+ »
BaSizOs(e.m.)
3BaO-5SiO2
BnSt.,0,
\ 1350°____________________
,, fi^iSlfOg (Hjn,)*5iOz
BnSiz05(imfSi02
~G2 84 GO 88
Мол.°/о
70 72
SiOz
Рис. 47. Часть диаграммы состояния системы
BaO—SiO2 (по Роту и Левину).
бариевых силикатах: |3-BaSiO3, санборните Ba2Si4O10 и
Ba2Si3O8 — общих для всех этих соединений структурных эле-
ментов, связанных со сходством полимеризации анионных ради-
калов, аналогично тому, что имеет место в пироксен-амфибол-
тальковом ряду. Глубокая связь между указанными тремя сили-
катами видна и из их эквимолекулярного состава: 1 : 1 (BaSiO3)+
+1 : 2 (санборнит)=2:3 (Ba2Si3O8). Наличие цепочечной (пироксе-
ноидной) структуры у |3-BaSiO3 (модификации, получаемой при
твердофазовом синтезе) было показано Тороповым и Гребенщи-
ковым [9] при изучении ими кристаллохимической аналогии
.p-BaSiO3 и p-RbBaFg. В дальнейшем это было подтверждено
другими авторами. Гребенщиков, Лазарев и Тенишева на моно-
кристаллах Ba2Si3O8 по рентгенограммам качания вдоль оси вы-
тянутости определили период идентичности, оказавшийся рав-
Силикатные системы
53
ным ~4.7 А, т. е. очень близким соответствующим значениям для
BaSiO3 и BaSi2O5.
Изучение колебательных ИК-спектров поглощения на порош-
ках Ba2Si3O8 показало наличие в данном силикате нового типа
кремнекислородного пояса SieO138~, образованного полимериза-
цией трех цепочек структурного типа BaSiO3. На рис. 48 пока-
заны схемы полимеризации одиночных метасиликатных цепочек
[Si2Oe la,4- в утроенные цепочки или поясной радикал 3 [Si2Oe J^4 _—
BaSiO3 Ba2Si30e
Рис. 48. Схемы полимеризации одиночных метасиликатных цепочек
в дибариевом трисиликате Ba^igOg.
—20[SieOie]ro8-. Дальнейшая полимеризация лент приводит
к санборнитовой сетке [Si4O]0[^. Подобный характер усложнен-
СО
ных анионных радикалов предполагает полимеризацию цепочек
и лент в одном слое. В табл. 2 сведены основные типы полимерных
радикалов бариевых силикатов в зависимости от отношения
BaO : SiO2. Как видно, для всех радикалов период идентичности
вдоль оси цепочек ленты равен 4.6—4.7 А.
Катшер и Либау [16, 17], выполнившие рентгеноструктурное
исследование дибариевого трисиликата, полностью подтвердили
предложенную Гребенщиковым и Лазаревым структуру Ва^дОд
и получили для этого соединения следующие значенияо параметров
элементарной ячейки: а=12.5, Ь=4.69, с=13.92 А, 8=93.3°,
Z=2.
Полученные структурные данные позволили Гребенщикову и
Торопову [4, 5] предложить новую интерпретацию фазовых от-
ношений на участке Ba2Si3O8—BaSi2O5. Наблюдаемый на этом
54
Силикатные системы
Таблица 2
Основные типы полимерных радикалов бариевых силикатов
Соединение Период идентичности вдоль оси вытянутости кристалла, А Анионные радикалы Примечания
P-BaSIOg . . . 4.6 [Si2Oep- Период повторяемости вдоль оси цепочки [9].
* • • 4.7 [bieOie ]fi Период повторяемости вдоль оси ленты («утроен- ной» цепочки) [7].
5BaO-8SiO2 . . 4.7 [Si8OB1]«>- Данные радикалы соответ- ствуют периодам повто- ряемости «четверных» и
3BaO*5SiO2 . . p-BaSi2Os 4.7 [‘SiioOgeP2 «пятерных» лент соответ- ственно [17].
(санборнит) . . 4.63 [Si4O10 J4 Период повторяемости а в кремнекислородном слое, образованном по- лимеризацией цепочек в плоскости (001) [13].
участке разрыв растворимости (см. ниже) с образованием узкой
области фаз переменного состава может быть вызван достижением
предела конденсации для ленточной структуры, равного пяти
метасиликатным цепочкам (состав 3BaO-5SiO2).
Гребенщиков и Торопов, детально изучившие с применением
спектрографического и рентгенографического методов диаграмму
в области 58—68 мол.% SiO2, показали, что образуются две
группы твердых растворов: на основе 2BaO«3SiO2 (B2S3 т. р.)
и на основе высокотемпературной модификации a-BaO-2SiO9
(a-BS2 т. р.) (рис. 49).
Разрыв смесимости на участке B2S3— BS2 находится в согласии
с предложенной этими авторами кристаллохимической интер-
претацией структурных особенностей гомологического ряда
BaO*SiO2-*2BaO-SiO2-*BaO*2SiO2. Показатели светопреломления
двух серий твердых растворов приведены на рис. 50.
Для дисиликата бария обнаружены две энантиотропные поли-
морфные разновидности: низкотемпературная |3-BaSi2O8 (сан-
борнит) и a-BaSi2O5. Взаимный переход этих модификаций проис-
ходит при 1350°. Дисиликат бария имеет слоистую структуру,
изученную Дугласом [13]. Согласно Гребенщикову [3], дисиликат
Силикатные системы
55
бария имеет плотность 3.71 г/см3 (некоторые сведения о свойствах
писиликата бария см. в статье Гребенщикова и Торопова [5]).
Рис. 49. Твердые растворы в системе
BaO—SiO2 (по Гребенщикову и Торо-
пову).
Расслаивание в жидком расплаве изучалось многими авторами.
Грейг [15] показал, что кривая плавкости кристобалита имеет
Рис. 50. Показгггели светопреломле-
ния твердых растворов системы
BaO—SiO2.
Сплошные линии — данные Гребенщи-
кова и Торопова; штрих-пунктирные
— Данные, заимствованные из ли-
т Р?ЛУРы: г/данные Гребенщикова и
1 оропова [5 ], г — данные Эскола 1114 ],
» данные Рота и Левина [19].,
Кристаллические фазы системы BaO—SiO2
Таблица 3
Соединение Система кристаллов Габитус Спайность Плот- ность, г/см3 Ng Np 2V° Опти- ческий знак Оптическая ориентировка
2BaO-SiOa. Ромбическая (?). Зерна. — 5.21 1.83 1.81 —- —. —.
BaOSiO2. Ромбическая. Зерна и иголь- чатые агре- гаты. По (010). 4.4 1.678 1.673 29 (+) Плоскость оп- тических осей (100)Х= с.
2BaO-3SiO2. » Зерна, пла- стинчатые двойники. Совершенная по (001), слабая по (100) и (010) 3.93 1.645 1.620 54 (+) То же.
BaO-2SiO2. » Призмы. Совершенная по (010), ясная по (100) и (001). 3-73 1.621 1.597 75 (-)
Силикатные системы
57
S-образную форму, указывающую на склонность расплавов к рас-
слаиванию.
Позднее Ольшанский [8] изучил область предполагавшегося
расслаивания при температурах от 1800 до 2570°. Признаков
образования несмешивающихся жидкостей обнаружено не было.
Левин и Клик [18], изучившие ликвацию в системе ВаО—
— В2О3—SiO2 путем экстраполяции, пришли к выводу, что в си-
стеме ВаО—SiO2 имеет место метастабильная ликвация и кри-
тическая точка имеет температуру 1430° и состав 18.5 вес. %
ВаО и 81.5 вес. % SiO2. Аржиль и Гюммель [11, 12] сплавляли
образцы, содержащие 75—95 мол. % SiO2, при температуре
1515—2000°. Стабильная ликвация расплава наблюдалась для
всех указанных образцов, быстро закаленных от 1655—1700°.
Образцы, сплавленные при 2000°, уже не обнаруживали ликва-
ции. Однако размеры областей одной жидкости в другой в опытах
Аржиля и Гюммеля не превышают приблизительно 0.25 мк,
поэтому Галахов [1, 2] считает, что для системы ВаО—SiO2
нельзя говорить о стабильной ликвации в обычном представле-
нии, а скорее следует принимать так называемую микроликва-
цию, установленную Галаховым для ряда бинарных силикат-
ных систем.
Литература
1. Галахов Ф. Я., в сб.: Структурные превращения в стеклах при по-
вышенных температурах, изд. «Наука», М.—Л., 110, 1965.
2. Галахов Ф. Я., С. Ф. Коновалова, ДАН СССР, 155, № 1,
122, 1964.
3. Гребенщиков Р. Г., Труды VI Совещ. по экспер. и техн, мине-
ралогии и петрографии, Изд. АН СССР, М., 295, 1962.
4. Гребенщиков Р. Г., Н. А. Торопов, ДАН СССР, 142,
№ 2, 392, 1962.
5. Г р е б е н щ и к о в Р. Г., Н. А. Торопов, Изв. АН СССР, ОХН,
№ 4, 545, 1962.
6. К е л е р Э. К., В. Б. Глушкова, Журн. неорг. хим., 1, № 10,
2283, 1956.
7. Лазарев А. Н., Т. Ф. Тенишева, Р. Г. Гребенщиков,
ДАН СССР, 140, № 4, 811, 1961.
8. О л ь ш а н с к и й Я. И., ДАН СССР, 76, № 1, 93, 1951.
9. Торопов Н. А., Р. Г. Гребенщиков, Журн. неорг. хим.,
1, № 12, 2686, 1956.
10. Т о р о п о в Н. А., Р. Г. Гребенщиков,. Журн. неорг. хим.,
7, № 2, 337, 1962.
11. А г g у 1 е J. F., F. A. Hummel, in: Advances in glass technology,
pt. 2. New York, 35, 1963.
12. A r g у 1 e J. F., F. A. Hummel, Phys. Chem. Glasses, 4, № 3, 101,
1963.
13. D о u g 1 a s R. M., Amer. Mineralogist, 43, № 5—6, 517, 1958.
14. E s co 1 a P., Amer. Journ. Sci., (5), 4, № 23, 331, 1922.
Jr $Jre 18 ,J- W., Amer. Journ. Sci., (5), 13, № 73, 1, 1927.
io. К at scher Ch., F. L i e b a u, Naturwissensch., 52, № 18, 512, 1965.
58
Силикатные системы
17. Katscher Ch., F. L i e b a u, в сб.: Седьмой международный кон-
гресс и симпозиум по росту кристаллов. Тезисы докладов. Москва,
12—21 июля 1966 г., изд. «Наука», М., 56, 1966.
18. L е v i n Е. М., G. W. С 1 е с k, Journ. Amer. Ceram. Soc., 41, № 5,
175, 1958.
19. R о t h R. S., E. M. Levin, Journ. Res. Nat. Bur. Stand., 62, № 5,
193 1959.
20. T h о m a s R. A., Journ. Amer. Ceram. Soc., 33, № 2, 35, 1950.
ZnO—SiO2
Имеет значение для металлургии свинца и цинка.
Система изучена Бантингом [3] (рис. 51). Определение участка
диаграммы с высоким содержанием ZnO затруднительно из-за
летучести окиси цинка. Установлено образование одного со-
единения — ортосиликата цинка Zn2SiO4. В области, примыкаю-
щей к SiO2, выше 1695° имеет место расслаивание в жидкой фазе.
Ортосиликат цинка известен в трех модификациях (Ингер-
сон, Морей и Таттл [5]). a-Zn2SiO4 — минерал виллемит, в ультра-
фиолетовых лучах флуоресцирующий в зеленых тонах. Расплавы
Zn2SiO4, активизированные марганцем, дают: при медленном
охлаждении материал, флуоресцирующий в зеленых тонах
(a-Zn2SiO4), при быстром охлаждении — в желтых тонах (|3-Zn2SiO4),
при очень резкой закалке — в красных тонах (y-Zn2SiO4).
Флуоресцирующие в желтых и красных тонах формы, т. е. |3-
и y-Zn2SiO4, при нагревании переходят в a-Zn2SiO4, флуоресци-
рующий в зеленых тонах.
Тэйлор [7] получал |3-Zn2SiO4 термической дегидратацией
гемиморфита (Zn4Si2O7(OH)2-H2O) при 700°. |3-Zn2SiO4 при на-
Оптические свойства модификаций Zn2SiO4
Модификация Оптический характер 2V" Показатели свето- преломления Двупрелом- ление Флуорес- центная окраска
Ng Nm Np
a-Zn2SiO4. 0-Zn2SiO4. y-Zn2SiO4. Одноосный. Двуосный. » г. +0 -49 -40 1.715 1.703 1.700 1.700 1.695 1.685 0.020 Около 0.009 0.018 Зеленая. Желтая. Красная.
гревании около 960° переходит в a-Zn2SiO4. |3-Zn2SiO4 имеет
ромбическую элементарную ячейку с параметрами: а=8.40,
Ь=5.10, с=32.2 А; плотность вычисленная 4.29 г/см3.
Силикатные системы
59
'Жидк.А+5
J 1695° 1
\
кристблЖ'
- 1470°
ТриЗ.+Ж
1432'
Tpud.-^Zn2SiOlt
~20 40 60
Мол. %
1700
1600
Жидн. /
/ZnO+Ж
’ 1507°
щбщ+Ж
ZnO+Zn^Sify
1500
Низкотемпературные |3- и ^-модификации Zn2SiO4 являются,
вероятно, метастабильными формами этого соединения, так как
непосредственного превращения
a-Zn2SiO4 в эти модификации до-
стигнуто не было. |3-Zn2SiO4, по-
видимому, относится к интерес-
ному в теоретическом отношении
типу кремнеземноподобных соеди-
нений, значение которых в кри-
сталлохимии силикатов показано
Тороповым [1, 2]. Тэйлор дока-
зывает, что структура |3-Zn2SiO4
может быть выведена из дефект-
ной тридимито- или кристобали-
топодобной сетки, в которой по-
ловина атомов кремния замещена
цинком, а дополнительные атомы
цинка входят в междоузлия.
Вильямсон и Глассер [8] опре-
делили температуры ликвидуса
части системы и нашли некоторое
отличие от данных Бантинга. Так, температура плавления Zn8SiO,
равна
1400
80 ЮО
ZnO
sra.
51. Диаграмма
системы ZnO—SiO2.
Рис.
состояния
1498°, эвтектика между Zn2SiO4 и Si62 плавится при 1421°.
Кристаллизацией стекла состава 40—70
мол. % ZnO (остальное SiO2) при условии
определенной скорости охлаждения были
получены метастабильные |Э- и у-модифика-
ции Zn2SiO4, которые при термической вы-
держке (1000° и ниже) переходят в ста-
бильные фазы (a-Zn2SiO4H кристобалит).
р-Фаза обладает широкой областью гомо-
генности: приблизительно от 36 до
67 мол. % ZnO. Показатель светопрелом-
ления этих твердых растворов, а также
цинк-силикатного стекла представлен на
рис. 52. |3-Zn2SiO4 имеет тридимитопо-
добную структуру с триклинной элемен-
тарной ячейкой с параметрами: а=5.10,
6=9.94, с=15.90 А, а=86°5', (3=82°,
у=60°30'. Подобно тридимиту |3-Zn2SiO4 об-
разует политипические разновидности, от-
личающиеся различным расположением
(толщина слоя—-— =3.98 А). Были полу-
Рис.
светопреломления стек-
лообразного силиката
цинка (/) и твердых рас-
. творов серии
P-Zn2SiO4-SiO2 (2).
52. Показатели
слоев тетраэдров SiO4
чены две политипические разновидности: одна при высокотемпера-
60
Силикатные системы
турной (1200°), другая при низкотемпературной (900°) кристалли-
зации стекла. Описанный Сабатье [6] «псевдовиллемит» не может
рассматриваться как особая модификация Zn2SiO4, а представ-
ляет плохо закристаллизованную вторую из указанных политипи-
ческих разновидностей.
Вильямсон и Глассер [9] быстрой закалкой расплавов из об-
ласти расслаивания получали кристаллы кубической структуры
(а=3.92 А), которые не могли быть отнесены точно к Zn2SiO4,
так как имели повышенное содержание SiO2; они названы у-фазой.
Отсутствующий на диаграмме состояния метасиликат цинка
ZnSiO3 может быть получен при высоком давлении. Хаяси с со-
трудниками [4] получили цинковый пироксен ZnSiO3 в усло-
виях 10—42 кбар и 300—1000°. Наиболее низкое давление, при
котором образовывался ZnSiO3, составляло 30 кбар при 500°.
При высоком давлении ZnSiO3 существует в двух полиморфных
формах: ромбической (ортопироксен) и моноклинной (клино-
пироксен). В процессе синтеза в первую очередь образуется вил-
лемит Zn2SiO4, который в результате реакции Zn2SiO4+SiO2=
=2ZnSiO3 переходит в клинопироксен, в свою очередь переходящий
в дальнейшем в ортопироксен. Переход клинопироксена в орто-
пироксен наблюдается при 37 кбар и 1250°.
Виллемит при 42 кбар и 1500° переходит в оливиновую мо-
дификацию .
Литература
1. Торопов Н. А., Журн. Всесоюзн. хим. общ. им. Д. И. Менделеева,
№ 2, 1963.
2. Н. А. Торопов, В П. Барзаковский. Высокотемператур-
ная химия силикатных и других окисных систем. Изд. АН СССР,
М.—Л., гл. I—III, 1963.
3. В u n t i n g E., Journ. Amer. Ceram. Soc., 13, № 1, 8, 1930.
4. Hayashi H., N. Nakayama, K. Nasegawa, Sh. Mi-
z u k u s a, M. M i z u n o, Sh. О g i s o, Y. T о r i i, Rep. Govt.
Industr. Res. Inst. Nagoya, 14, № 10, 384, 389, 1965.
5. In gers on E., G. W. Morey, O. F. Tuttle, Amer. Journ.
Sci., 246, № 1, 31, 1948.
6. S a b a t i e r G., Bull. Soc. Franc, mineral., cristallogr., 75, № 10/12,
506, 1952.
7. T а у 1 о r H. F. W., Amer. Mineralogist, 47, № 7—8, 932, 1962.
8. W i 11 i a m s о n J., F. P. Glasser, Phys. a. Chem. Glasses, 5,
№ 2, 52, 1964.
9. W i 11 i a m s о n J., F. P. Glasser, Nature, 201, № 4916, 286, 1964.
Силикатные системы
61
CdO—SiO2
Диаграмма состояния системы не построена. Известны два
силиката кадмия: GdSiO3 и Gd2SiO4. GdSiO3 плавится при 1246°,
Gd2SiO4 при 1252°, плотность первого 5.833 г/см3, второго 4.928 г/ см3.
В твердом состоянии образование GdSiO3 (из смеси окислов)
начинается при 600° и происходит интенсивно при 900°. Моно-
кристаллы соединения 2GdO-SiO2 получены действием паров
окиси кадмия на аморфный кремнезем при давлении 200—300 атм.
и температуре 365— 390° [1].
Хаяси с сотрудниками [2] показали, что Gd2SiO4, имеющий
в обычных условиях оливиновую структуру при высоком давлении,
начиная от 750° переходит в шпинельную форму, имеющую пара-
метр элементарной ячейки ао=9.75+0.02 А.
Литература
1. Ч и ж и к о в Д. М. Кадмий. Изд. АН СССР, М., 24,1962.
2. Hayashi Н., N. Nakayama, М. Yoshida, Rep. Govt.
Industr. Res. Inst. Nagoya, 13, № 7, 285, 1964.
B2O3—SiO2
Существенна для технологии боросиликатных стекол типа
пирекс.
Химических соединений в системе не обнаружено. До сих
пор окончательно не выяснена возможность расслаивания пре-
паратов из этой системы в расплавленном состоянии.
Каузен и Тернер [3] полагали, что смеси обоих окислов в рас-
плавленном состоянии полностью смешиваются и ранее описы-
вавшаяся неоднородность этих расплавов могла происходить
лишь в результате недостаточно тщательного их проплавления,
обусловленного вязкостью расплавов.
В последнее время в результате исследования стекол системы
В2О3—SiO2 Жданов и Коромальди [2], Скатулла с соавторами [5]
и другие приходят к выводу о наличии в этой системе областей,
в которых обособленно выделяются SiO2 и В2О3. Однако эти об-
ласти имеют столь малые размеры, что скорее можно говорить
о микроликвации, существование которой в расплавленных
силикатах впервые экспериментально доказали в Институте
химии силикатов Галахов и Коновалова [1].
Роккет и Фостер [4], пользуясь запаянными платиновыми
капсулами, определили выделяющиеся при ^кристаллизации рас-
плавов фазы и построили, как они полагают, равновесную фа-
62
Силикатные системы
зовую диаграмму состояния системы (рис. 53). Кривая ликви-
дуса была нанесена путем определения температур, при которых
стабильная фаза SiO2 полностью растворяется в боросиликатном
расплаве. Фазы идентифицировались оптическим и рентгено-
графическим методами.
Рис. 53. Диаграмма состояния
системы B2OS—SiO2.
Для борного ангидрида принята температура плавления
458+2°. При 451+1° смесь В2О3 и SiO2 образует при плавлении
одну фазу. Эта температура приблизительно характеризует тем-
пературу плавления эвтектики. Состав эвтектики не был опре-
делен. Несмешиваемость расплавов не была обнаружена.
Литература
1. Галахов Ф. Я., С. Ф. Коновалова, ДАН СССР, 155, № 1,
122, 1964.
2. Ж дано в С. П., Е. В. К о р о м а л ь д и, Изв. АН СССР, ОХН,
№ 4, 626, 1959.
3. С о и s е n A., W. Turner, Journ. Glass Techn., 12, 169, 1928.
4. R о c k e 11 T. J., W. R. Foster, Journ. Amer. Ceram. Soc., 48,
№ 2, 75, 1965.
5. Skatulla W., W. Vogel, H. Wessel, Silikattechnik, 9, 51,
1958.
Силикатные системы
63
А12О3—SiO2
Является фундаментальной для керамической технологии;
ее диаграмма состояния, особенно важная для интерпретации
ряда физико-химических процессов, протекающих при обжиге,
плавлении и кристаллизации различных алюмосиликатных огне-
упоров, и понимания явлений, происходящих при взаимодействии
этих огнеупоров с различными агрессивными средами, исследо-
валась неоднократно.
В первом варианте диаграммы состояния системы, опублико-
ванном Шепердом, Ранкином и Райтом [38], описывалось одно
Рис. 54. Диаграмма состояния системы Рис. 55. Диаграмма состояния
А12О3—SiO2 (по Боуэну и Грейгу). системы А12О3—SiO2 (ио Торо-
пову и Галахову, вариант 1951 г.).
химическое соединение — синтетический аналог природного ми-
нерала силлиманита состава Al2O3-SiO2, или Al2SiO8, — плавя-
щееся конгруэнтно при I8600. Это соединение характеризовалось
как образующее две эвтектики с компонентами системы: с А12О3
при 1810° и с SiO2 при 1640°.
Однако отмеченная Райтом уже в первой работе некоторая
неоднородность строения кристаллов синтетического «силлима-
нита», содержавших, как правило, включения изотропного стекла,
а также различия в показателях светопреломления между синтети-
ческим и природным силлиманитом побудили Боуэна и Грейга [17]
произвести новое исследование той же системы. В варианте Боу-
эна и Грейга диаграмма имела совершенно иной вид (рис. 54).
Образующемуся химическому соединению была дана новая
Формула 3Al2O3-2SiO2, или AleSi2O13, и плавление описывалось
как инконгруэнтное. Соединение, вследствие того что хими-
ческий состав его оказался идентичным природному минералу,
обнаруженному незадолго до опубликования работы Боуэна и
64
Силикатные системы
Грейга на острове Мулл в Шотландии, было названо м-улли-
том. На диаграмме состояния вместо двух эвтектик осталась
одна и появилась новая, реакционная точка.
В дальнейшем при исследовании хода кривых кристаллиза-
ции муллита в трехкомпонентной системе окись бария—глино-
зем—кремнезем по положению фазовой пограничной кривой
между областями первичной кристаллизации корунда и муллита
Тороповым и Галаховым [7] в лаборатории гетерогенных равно-
весий Института химии силикатов АН СССР было установлено,
что в действительности, в условиях, при которых глинозем-кремне-
земистые расплавы предохраняются от возможного частичного
улетучивания кремнезема, муллит характеризуется конгруэнт-
ным плавлением и конгруэнтной кристаллизацией из расплавов
соответствующего химического состава.
Таким образом, в новом варианте диаграммы состояния си-
стемы А12О3—SiO2 (рис. 55) имеется один максимум, соответствую-
щий температуре плавления муллита, и две эвтектики, образуемые
этим соединением с компонентами системы. В последующей публи-
кации Филоненко и Лаврова [10] указывалось на наличие дис-
социации кристаллов муллита в ряде расплавов системы Na2O—
—А12О3—SiO2. Это явление, однако, полностью должно быть
обусловлено действием третьего компонента — окиси натрия.
Дальнейшие исследования Будникова, Тресвятского и Кушаков-
ского [2], а также Р. Р. Барта и Ч. Р. Барта [1] подтвердили
конгруэнтный характер плавления муллита, впервые установлен-
ный Тороповым и Галаховым [7].
Дальнейший прогресс в развитии диаграммы состояния си-
стемы был достигнут Тороповым и Галаховым [8| при определении
положения на диаграмме состояния области твердых растворов,
Таблица 1
Инвариантные точки системы А12О3—SiO2
Точка Фазы процесс Состав, вес. °/0 Темпера- тура, °C
А1,Оа Si02
1 А12О з+ жидкость. Плавление. 100 0 2050
2 А1,О«-|-твердый раствор ЗА12О3- 2SiO2-|- жидкость. Эвтектика. 79.0 21.0 1850
3 ЗА) 2О2* 2SiO2-|- жидкость. Конгруэнтное плавление. 71.8 28.2 1910
4 ЗА12О3-2SiOz-|-SiOz-|-жид- кость. Эвтектика. 5.5 94.5 1584
5 SiO 2-[- жидкость. Плавление. 0 100 1713
Силикатные системы
65
образуемых муллитом с глиноземом (рис. 56). Главнейшие ре-
зультаты этой работы свелись к определению положения эвтек-
тики между корундом и кристаллами твердых растворов муллита
при 79% А12О3 и 1850° (табл. 1). Предельный состав муллитовых
твердых растворов соответствует концентрации примерно в 78%
А12О3, что отвечает стехиометрии 2Al2O3-SiO2. Следовательно,
область твердых растворов распространяется от состава, отве-
чающего 3Al2O3-2SiO2, до состава 2Al2O3-SiO2.
Поскольку ко времени опубликования работы Торопова и
Галахова [8] по муллитовой системе появился в печати ряд но-
вых публикаций, в которых муллиту приписывалось все же инкон-
Кристоб.
Ж
с
2000
1900
1800
1700
1600
1500-
0
ЗЮг
1910
ЗАЩ-Ш-^Ж
1585°
Щ Муллит пр.
St * *
'а-ДЩ+Ж
ШГ
Кристоб.+ЗМгО3-251Ог
10 20 30 90 50 60 70 80 X ЮО
Л1Д
Вес. %
Рис. 56. Диаграмма состояния системы
Л12О3—SiO2 (по Торопову и Галахову, ва-
риант ^1956 г.).
груэнтное плавление [26, 30, 37]. Арамаки и Рой [14] провели
детальнейшую работу по новой ревизии диаграммы состояния
системы А12О3—SiO2, в результате которой полностью подтвер-
дились все принципиальные положения работы Торопова и Га-
лахова (рис. 57, 58).
Диаграмма Арамаки и Роя для лучшего сопоставления пред-
ставлена, так же как и диаграмма Торопова и Галахова, в ве-
совых процентах (рис. 56, 57).
Из позднейших работ по физико-химии муллита представляют
наибольший интерес’ установление Галаховым [3, 4] наличия
в системе А12О3—SiO2 метастабильной ликвации при высоких
температурах, а также корректировка тем же автором положения
пограничной кривой полей муллит—корунд во всех трехкомпо-
нентных алюмосиликатных системах.
Конопицкий с сотрудниками [31] получали муллит разными
методами. Муллит, полученный в вакууме, содержал, согласно
качественным определениям, одноокись кремния SiO, что ока-
5 Н. Л. Торопов и др., КН. 1
66
Силикатные системы
зывало влияние, по их мнению, на параметры решетки и струк-
туру муллита и объясняло различный характер плавления мул-
лита. Однако Торопов и Галахов [9] показали, что в подобных
условиях эксперимента систему уже нельзя рассматривать как
истинно бинарную.
Поведение системы глинозем—кремнезем в условиях высоких
давлений стало изучаться только в последние годы.
Работами Григса и Кеннеди [27 ], а затем Кларка, Робертсона
и Берча [22] в результате экспериментального изучения были на-
мечены линии равновесия кианит—силлиманит в условиях высо-
Рис. 57. Диаграмма состояния си-
стемы А12О3—SiO2 (по Арамаки и
Рою).
°C
1900
1850
1800
1750
50 55 60 63 67 70
Sio2 Мол.% А1^
Рис. 58. Деталь диаграммы состояния
системы А12О3—SiO2 (по Арамаки и
Рою).
ких температур и давлений. В работе последних авторов охарак-
теризовано равновесие этих двух минералов в интервале темпера-
тур 1000—1300° и в области давлений от 18200 до 21 000 бар.
В дальнейшем Кларк [21] расширил температурную область
до 1500°, а интервал давлений до 24000 бар. Кларком была по-
строена фазовая граница кианит—силлиманит на участке выше
15 000 бар и 900°.
Миаширо [32] на основании некоторых предположений пред-
ставил отношение между полиморфными разновидностями
Al2O3-SiO2, причем в области высоких давлений, по Миаширо, су-
ществуют только силлиманит и кианит, который сохранял свою
устойчивость при обычных давлениях и низких температурах.
Аналогичную диаграмму предлагает и Томпсон [40] на основании
использования данных об энтропии андалузита, кианита и силли-
манита. Некоторые соображения о фазовых полях муллита, анда-
лузита, силлиманита и кианита были высказаны Соболевым [6],
главным образом на основании геологических данных.
Силикатные системы
67
Рис. 59. Фазовая диаграмма для
соединения Al2SiO6 в координатах
«давление—температура» (по Хита-
рову с сотрудниками).
Хитаров, Пугин, Чжао Бин и Слуцкий [11 ] построили фазо-
вую диаграмму для состава Al2SiO6, исследуя интервал давлений
от 16 000 атм. и ниже и при температурах от 400 до 875°. Отдель-
ные точки были охарактеризованы до 39 000 атм.
Результаты работы Хитарова с сотрудниками представлены
на рис. 59. Наклон фазовой границы андалузит—силлиманит опре-
деляется отношением -^- = 21.4 атм./°С. Уравнение прямой
в интервале от 390 до 600° при
давлениях от4500 до 9000 атм.
выразится в следующем виде:
Р=17.3—21.4 • 10-3 t. Если
принять, что объемный эффект
перехода андалузит—силли-
манит составляет ДУ =
=—1.632 + 0.002 см3/мольпри
25° [111, то при 390° и дав-
лении 9000 атм. этот переход
будет сопровождаться погло-
щением тепла (560 кал./моль).
При 600° и 4500 атм. коли-
чество поглощаемого тепла
составит 738 кал./моль. По-
глощение тепла при превра-
щении андалузита в силлима-
нит связано с тем, что здесь
имеет место переход полимор-
фной разновидности с высо-
ким координационным числом алюминия в разновидность с бо-
лее низкой координацией.
Хитаров с сотрудниками определили положение тройных точек
на диаграмме. Тройная точка кианит—андалузит—силлиманит
имеет координаты: £=390°, Р=9000 атм. Для второй тройной
точки андалузит—силлиманит—муллит+кварц приводятся сле-
дующие параметры: <=600°, Р=4500 атм.
Положение тройной точки андалузит—кианит—силлиманит
определял также Белл [16].
Де Вриз [23] в своих исследованиях доходил до давлений,
превышающих 50 кбар, и температур до 2000°. В качестве исход-
ных материалов использовались природные кианит, силлиманит
и андалузит, а также смесь гелей глинозема и кремнезема в соот-
ношении А12О3 : SiO2=l : 1. Общая схематическая диаграмма
системы Al2SiO5, по Де Вризу, при высоких температурах и давле-
ниях представлена на рис. 60. Выше 1500° и 2500 бар кианит пла-
вится инконгруэнтно на корунд и жидкость. Равновесная кривая,
5*
68
Силикатные системы
Таблица 2
Параметры кристаллической решетки и оптические характеристики
силикатов алюминия (из сводки Арамаки и Роя [15])
Отношение А12О3: SiO2
кианит силлиманит муллиты андалузит
1 :1 1 :1 3 : 2 2 : 1 1 : 1
Пространствен-
ная группа Р1 РЬпт Рттт ? Рппт
а, А 7.09 (а = 90°) 7,481 + 0.002 7.55 7.5 7.797+0.002
ъ, А 7.72 (|3 = 101°) 7.672+0.002 7.69 7.69 7.898+0.002
с, А 5.56 (т = 106°) 294 5.769+ 0.002 5.77 5.77 (х у) 5.551+0.002
к, Аз .... 331 335 337 341.8
Плотность из- меренная,
г/см3 .... — 3.255+0.015 —— 3.16+0.015
Ng 1.728 1.678 1.654 1.651 1.641
Np 1.713 1.658 1.642 1.640 1.630
2V -83 ±25 От ±45 до ±50 ±61 От —83 до —86
Оптическая [ а = х а = х — — а = Z
ориенти- | — с = у — — b = Y
ровна 1 сд2=30° c = Z c = Z — с — Х
разграничивающая поля андалузита и силлиманита, представляется
уравнением P=33.8-10~3i — 26.4.
Диаграмму состояния системы А12О3—SiO2 для давления
25.2 кбар построили Хаскелл и Де Вриз [28], главным образом
на основании термодинамических данных (рис. 61).
Ньютон [34], проводя опыты вгидротермальных условиях,
установил на равновесной границеиакнит—силлиманит одну
точку с координатами: <=750° и Р=8.1 кбар. По данным для энтро-
пии и объемов были рассчитаны величины наклона пограничных
кривых: для границы кианит—силлиманит 17.7±1.0 бар на 1°,
для границы андалузит—силлиманит 7.0 бар на 1° и кианит—ан-
далузит 10.9 бар на 1°. Ньютон построил фазовую диаграмму
Al2SiOs (рис. 62). Согласно данным Ньютона, андалузит не может
быть устойчив при давлениях выше 4.2 кбар. Для чисто синтети-
ческого кианита Ньютон приводит следующие параметры эле-
ментарной ячейки: а=7.125, 6=7.847, с=5.571 А, а=89.92°,
6=101.20° и Т=106.02о.
Силикатные системы
69
Альтгауз [13] в результате гидротермальных экспериментов
приводит следующие равновесные параметры фазовой границы
андалузит—силлиманит: 590° при 7 кбар и 620° при 2 кбар.
Первые исследования струк-
туры муллита произведены Тэй-
лором [39]. В последнее время
°-20
жидк.
Тйумит+ЗЩ/ +Ж, у ,
°ЮОО 1200 МЮ 1600 1800 2000 2200°С
Рис. 61. Предположительная диа-
грамма состояния системы
А1аО3—SiOa для давления
25.2 кбар.
Рис. 60. Фазовая диаграмма для
соединения AlaSiOa в координатах
«давление— темпер ату р а».
Пограничные линии кианит—силлиманит и
силлиманит—муллит+SiOa — по данным
Кларка с сотрудниками; остальные —
по Де Вризу.
структура муллита изучалась Агреллем и Смитом [12], Арамаки
и Роем [14], Саданага, Токонами и Такеучи [35] и Дюровичем [5].
Значения параметров элементарной ячейки крайних членов
твердых растворов муллита и других силикатов алюминия при-
ведены в табл. 2 по Арамаки и Рою [15]. Для членов изоморфного
ряда, находящихся между составами 3Al2O3-2SiO2 и 2Al2O3-SiO2,
Таблица 3
Средний показатель светопреломления муллита и силлиманита
в зависимости от содержания А12О3
Соединение Содержание AliOa, вес. % Средний показатель преломления Литературный источник
Муллит | 72 1.647
75 1.645 | [41]
78 1.642
Муллит («прагит») 77.3 1.649 [1 ]
Муллит Силлиманит . . 78.01 62 1.634 1.658 [12] [41]
70
Силикатные системы
Дюрович [241 предлагает находить значения параметров элемен-
тарной ячейки из следующих уравнений: а=7.629+6.15-10~4 х,
Ъ=7.120+5.83-10"3 х, где х — содержание А12О3 в весовых про-
центах.
Недавно Дюрович [5] провел полный структурный анализ
муллита, имеющего состав: 73.42% А12О3, 25.61% SiO2, 0.84%
Fe2O8 и 0.13% TiO2. Исследованные кристаллы имели следующие
параметры решетки: а=7.549 + 0.008, 6=7.681 + 0.008, с=2.884+
±0.003 А.
Кристаллическая структура
муллита очень близка к структуре
силлиманита. Принципиальным
различием является статистиче-
Рис. 62. Фазовая диаграм-
ма (в координатах «давле-
ние-температура») AljSiO,
(по Ньютону).
Ю 20 30 40 50 60 70
$Ю2 Мол. % А1г03
Рис. 63. Показатель светопрелом-
ления стекол системы А12О3—SiO2.
ское заполнение положений атомов кислорода, соединяющих те-
траэдры (Al, Si)04 только на 84.2% в согласии с химическим
составом исследованного муллита, и в соответствии с этим статисти-
ческое перемещение 15.8% атомов Si и А1 из положений, занимае-
мых ими в силлиманите, в новые тетраэдрические положения,
которые в силлиманите остаются пустыми. Формулу муллита,
по Дюровичу, следует изображать так:
A][-Si^A]xOu_,J
где 1.25 х 1.40 для ряда твердых растворов муллита, со-
ставы которых изменяются от 3Al2O3-2SiO2 до 2Al2O3-SiO2.
Показатель светопреломления твердых растворов муллита,
естественно, изменяется в зависимости от состава. В табл. 2 при-
ведены показатели светопреломления для конечных членов твер-
дых растворов (3Al3O3-2SiO2 и 2Al2O3-SiO2); в табл. 3 дан средний
Силикатные системы
71
показатель светопреломления для муллитов с различным содержа-
нием А12О3.
На рис. 63 приведен показатель светопреломления стекол
системы А12О3—SiO2 по Арамаки и Рою [14].
Структуру силлиманита недавно исследовали Дюрович и Да-
выдова [25 ], которые уточнили прежние данные Хей и Тэйлора [29 ].
Обширные исследования по уточнению структуры кианита выпол-
нил Барнгам [18]. Структуру андалузита исследовали недавно
Барнгам и Бюргер [20].
Сгарлата [36] на монокристаллах рентгеновским методом изу-
чил структуру кианита Al2SiO5. Триклинные кристаллы этого
соединения имеют следующие параметры элементарной ячейки:
а=7.121, 6=7.861, с=5.574 А, а=90.03°, 0=101.08°, 7=105.95°,
Z=4.
Прецизионные определения Барнгама [19] дали следующие
значения параметров элементарной ячейки муллита: а=7.5794±
х0.005, Ъ=7.6873±0.003, с=2.8878±0.0004 А, 7=168.26±0.03 А3.
Литература
1. Барта Р. Р., Ч. Р. Барта, Журн. прикл. хим., 29, № 3, 341, 1956.
2. Будников П. П., С. Г. Тресвятский, В. И. Кушаков-
с к и й, ДАН СССР, 93, № 2, 281, 1953; Журн. прикл. хим., 35, № 10,
2155, 1962.
3. Галахов Ф. Я., в сб.: Химия и практическое применение силикатов,
ЦБТИ Ленсовнархоза, Л., И, 1960.
4. Галахов Ф. Я., Изв. АН СССР, сер. хим., № 8, 1377, 1964.
5. Дюрович С., Кристаллография, 7, № 3, 339, 1962.
6. С о б о л е в В. С., Междунар. геол, конгр., XXI сессия, Докл. сов.
геологов, проблема 14, Гранито-гнейсы, Киев, 1960.
7. Т о р о и о в Н. А., Ф. Я. Г а л а х о в, ДАН СССР, 78, № 2, 299,
1951.
8. Т о р о п о в Н. А., Ф. Я. Галахов, Изв. АН СССР, ОХН, №1,8,
1958.
9. Г о р о п о в Н. А., Ф. Я. Галахов, Труды 7-го Совещ. по экспер.
петрографии и минералогии, Львов, 1964.
10. Ф и л о н е н к о Н. Е., И. В. Лавров, ДАН СССР, 89, № 1, 141,
1953.
И. X и т а р о в Н. И., В. А. Пугин, Чжао Бин, А. Б. Слуц-
кий, Геохимия, № 3, 219, 1963.
*4. A g г е 1 1 S. О., J. V. Smith, Journ. Amer. Ceram. Soc., 43, № 2,
69, 1960.
‘“•Althaus E., Naturwissensch., 53, № 5, 129, 1966.
1 ' Aramaki Sh., R. Roy, Journ. Amer. Ceram. Soc., 45, № 5, 229,
1962. "
A a k i Sh., R. Roy, Amer. Mineralogist, 48, № 11—12, 1322,
Sel1 P. M., Scienc', 139, № 3539, 1055, 1963.
’ °owen N. L., J. W. Greig, Journ. Amer. Ceram. Soc., 7, № 2,
18 n 2381 1924>
' Burnham C. W., Zs. Kristallogr., 118, № 5—6, 337, 1963.
72
Силикатные системы
19. BurnhamTC. W., Carnegie Inst. Washington, vear book, 64, 200,
1964—1965.
20. Burnham C. W., M. Buerger, Zs. Kristallogr., 115, № 3, 269,
1961.
21. Cl ark S. P., Amer. Joum. Sci., 259, № 9, 641, 1961.
22. С1 а г к S. P., E. C. Robertson, F. Birch, Amer. Journ.
Sci., 255, № 9, 628, 1957.
23. D e Vries В. C., Journ. Amer. Ceram. Soc., 47, № 5, 230, 1964.
24. Durovii S., Journ. Amer. Ceram. Soc., 45, № 4, 157, 1962.
25. Durovii S., S. Davidova, Acta crystallogr., 15, № 10, 1051,
1962.
26. Gelsdorf G., H. Miiller-Hesse, H. E. Schwiete,
Arch. Eisenhiittenwesen, 29, 513, 1958.
27. Griggs D. T., G. Kennedy, Amer. Journ. Sci., 254, № 12, 722,
1956.
28. H a s к e 1 1 R. W., R. C. De Vries, Joum. Amer. Ceram. Soc.,
47, № 4, 202, 1964.
29. Hey J. S., W. H. T а у 1 о r, Zs. Kristallogr., 80, № 5/6, 428, 1930.
30. Konopicky K., Bull. Soc. Franc, ceram., № 33, 3, 1956.
31. Konopicky К., I. Patzak, H. Dohr, Forschungsber., №1551,
K61n u. Opladen, 1965.
32. Miyashiro A., Geochim. cosmochim. acta, 4, № 4, 179, 1953.
33. Miiller-Hesse H., Ber. Dtsch. keram. Ges., 40, № 5, 281, 1963.
34. Newton R. C., ’ Sciene, 151, № 3715, 1222, 1966.
35. Sadanaga R., M.' Tokonami, Y. Takeuchi, Acta
crystallogr., 15, № 1, 65, 1962.
36. S g a r 1 a t a F., Period, mineral. (Ital.), 34, № 1, 241, 1965.
37. She ars E. C., W. Archibald, Trans. Iron a. Steel Inst. (Lon-
don), 27, 26, 61, 1954.
38. Shepherd E. S., G. A. Rankin, W. Wright, Amer. Journ.
Sci., 28, 301, 1909.
39. T а у 1 о r W. H., Zs. Kristallogr., 68, № 6, 503, 1928.
40. T h о m p s о n J. B., Amer. Joum. Sci., 253, № 2, 65, 1955.
41. Tromel G., К. H. О b s t, K. Konopicky, H. Bauer,
I. Patzak, Ber. Dtsch. keram. Ges., 34, № 12, 397, 1957.
Ga2O3—SiO2
Представляет интерес с точки зрения аналогии с системой
А12О3—SiO2 и практического применения окиси галлия как ком-
понента силикатных стекол.
Изучена Тороповым и Линь Цзу-сян [1] и Глассером [3].
Система представляет простейший тип с эвтектикой (рис. 64).
Эвтектическая температура соответствует 1560±10° и состав
эвтектики 87 вес. % SiO2 (95.5 мол.% SiOa).
Попытки синтезировать соединение 3Ga2O3-2SiO2 — аналог
муллита, осуществленные Гельсдорфом [2] и указанными выше
авторами с применением гидротермального метода, не увенчались
успехом.
Силикатные системы
73
В системе наблюдается расслаивание расплава. По данным
Глассера, область существования двух несмешивающихся жид-
костей наблюдается выше 1650° для составов приблизительно
от 15 до 70 мол. % SiO2 (рис. 65).
°C
1800-
1700 \
1600 ;
1500 -
Жидк.
Кристоб.+Ж
^1—
Кристоб. +р-Са.г03
Жидк.
1800
1700
1600
1500
100 80 60 00 20 0 100 80 60 00 20 О
Sio, о/ с,аг°з Sto, „ Ga,o,
г Вес. % г з г Мол % г 3
о 1 д 2 • 3
Рис. 64. Диаграмма состояния системы Ga2O3—SiOa (по Торопову
и Линь Цзу-сян).
1 — стекло; 2 — кристобалит; з — р-йа2О,.
°C
1800 •
1700
1600
Две жидк. ,
t
Жристоб.+Ж
^0аг03 +кристоб.
15001---------1---------1-----------1---------1--------
0 20 00 60 80 ' 100
8Юг Мол.% С,аг03
Рис. 65. Диаграмма состояния системы
GaaO3—SiOa (по Глассеру).
Литература
1. Торопов Н. А., Линь Цзу-сян, Журн. неорг. хим., 5, № И,
2462, 1960.
2. Gelsdorf G., Вег. Dtsch. keram. Ges., 34, 211, 1957.
4. Glasser F. Р., Journ. Phys. Chem., 63, № 12, 2085, 1959.
74
Силикатные системы
Sc2O3—SiO2
Интересна для геохимии и минералогии скандиевых минералов
и вмещающих .пород.
Диаграмма состояния изучена Тороповым и Васильевой [1].
В системе установлено существование двух соединений; оксиорто-
Таблица 1
Инвариантные точки системы Sc2O3—SiO2
Точка Фазы Процесс Состав, мол. % Темпера- тура, °C
8с2Оз SiO2
1 SCgOg. Плавление. 100 0 2470+50
2 ScgOg-1- ScgOg* SiOg-i-jKHfl" кость. Эвтектика. 55 45 1850
3 ScaO3- SiOj+жидкость. Плавление. 50 50 1950
4 ЬСдОз* SiOg-j-SCgOg-^SiOg-l- +жидкость. Эвтектика. 45 55 1770
5 Sc2O3- 2SiOa+ жидкость. Плавление. 33.33 66.67 1850
6 Sc2O3 • 2SiOa+ SiO2+жид- кость. Эвтектика. 31.7 68.3 1660
7 БсзОз* 281О2-|-81О2-|-жид- кость. » 3 97 1700
Таблица 2
Кристаллические фазы системы Sc2O3—SiO2
Соединение Система Ng Nm Np 2V° Опти- ческий знак Плот- ность, г, см3
Sc2O3. Кубиче- ская. — 1.99 — — — 3.860
Sc2O3 • SiO2 (оксиортоси- ликат). — 1.850 — 1.835 Двуосный, малый. (+) 3.490
Sc2O3 • 2SiO2 (диортоси- . ликат). 1.803 1.785 1.754 Двуосный. (-) 3.390
Силикатные системы
75
силиката скандия Sc2O(SiO4) и диортосиликата скандия Sc2Si2O7.
Для системы характерно наличие обширной области существо-
вания несмешивающихся жидкостей (рис. 66).
°C
Рис. 66. Диаграмма состояния системы
Зс2Оз SiO2.
Литература
1. Торопов Н. А., В. А. Васильева, Кристаллография, 6, № 16,
968, 1961.
Y2O3—SiO2
Изучена Тороповым и Бондарь [1]. Обнаружено три соедине-
ния: Y2O3-SiO2 — оксиортосиликат, 2Y2O3>3SiO2 — ортосиликат
и Y2O3«2SiO2 — пиросиликат (рис. 67). Последнее соединение
плавится при 1775° с разложением. В системе обнаружена область
двух несмешивающихся жидкостей. Область расслаивания гра-
ничит с полем кристобалита при температуре 1700° в интервале
концентраций 43.0— 95.0 вес. % (74.8— 98.6 мол. %) SiO2. Кри-
тическая точка расслаивания лежит при температуре 2200° и
составе 20 вес. % (6.22 мол. %) У2О3 и 80 вес. % (93.78 мол. %)
SiO2. Кристаллы Y2O3-SiO2 являются двуосными, положитель-
ными, с показателями светопреломления jVg=1.825, JVp=1.807
и средним двупреломлением 0.018.
Соединение 2Y2O3-3SiO2 устойчиво в температурной области
1950-1650°. При 1650° это соединение претерпевает распад с об-
76
Силикатные системы
разованием смеси двух соединений: Y2O3-SiO2 и Y2O3-2SiO2,
причем указанный процесс является обратимым. Кристаллы
2Y2O3-3SiO2 характеризуются гексагональной сингонией, яв-
Мол%
Рис. 67. Диаграмма состояния системы
YaO3—SiOa.
1 — одна жидкость; 2 — две жидкости.
ляются оптически отрицательными, с показателями светопрелом-
ления ДГо=1.780, ДГе=1.765 и двупреломлением 0.015.
Кристаллы соединения Y2O3-2SiO2 являются двуосными, поло-
жительными, обладают в основном косым погасанием, с показате-
лями светопреломления jVg=1.747, ДГр=1.737, двуцреломлением
Силикатные системы
77
Инвариантные точки системы Y2O3—SiO2
Фазы Процесс Состав Темпе- рату- ра, °C
вес. % МОЛ. “/о
y2o8 SiO2 Y2O8 S1O2
Y2O3-I- УдОз* 81Оа+жид- Эвтектика. 87.5 12.5 65.4 34.6 1800
кость.
YaO3- SiOj+жидкость. Плавление. 78.9 21.1 50 50 1980
У 2^з* biO2~|-2Y 2^з‘ ЗЬЮаН" Эвтектика. 75.0 25.0 44.4 55.6 1900
-(-жидкость.
2YaO3 • 38Юа±жидкость. Плавление. 71.4 28.6 40 60 1950
<^У 2^3* У 2^з‘ |- 4-YaO3.2SiO2. Реакция в твердом состоянии. 71.4 28.6 40 60 1950
YaO3-2SiOaH 2Y3O3-3SiOa± ± жидкость. Инконгруэнт- ное плавление. 64.5 35.5 32.5 67.5 1775
Y3O3- 281О3+а-кристоба- Эвтектика. 60 40 28.7 71.3 1660
лит-(-жидкость.
а-Кристобалит±Жх±Ж2. Ликвация. 57.0 43.0 25.2 74.80 1700
а-Кристобалит-}-Ж i+Ж a • » 5 95 1.4 98.6 1700
0.010 и углом оптических осей 2F«s60°. Это соединение характери-
зуется моноклинной сингонией и по своим оптическим свойствам,
по-видимому, близко к минералудталениту.
Литература
1. Торопов Н. А., И. А. Бондарь, Изв. АН СССР, ОХН, № 4f
544, 1961.
La2O3—SiO2
Изучена Тороповым и Бондарь [4—6] и Бондарь [1]. Установ-
лено образование трех химических соединений: La2O3-SiO2,
2La2O3-3SiO2 и La2O3-2SiO2. Соединения La2O3-SiO2 и
2La2O3-3SiO2 плавятся без разложения соответственно при
1930 ±50 и 1975°. La2O3-2SiO2 плавится с разложением при темпе-
ратуре 1750° на 2La2O3"3SiO2 и жидкость (рис. 68).
В системе установлена область двух несмешивающихся жид-
костей, .сосуществующих в равновесии с кристобалитом в интер-
вале концентраций 38.2—90.0 вес. % (77—98 мол.%) SiO2 при
температуре 1675°. На диаграмме состояния область расслаива-
ния выделена бинодальной кривой с критической температурой рас-
78
Силикатные системы
сдаивания 2050° и составом 25 вес. % (6 мол. %) Ьа2О3 и 75 вес. %
(94 мол. %) SiO2.
Кристаллы соединения La2O3-SiO2 имеют показатели свето-
преломления jVg=1.875, ЛГр=1.855, отличаются высоким двупре-
1600
2
2000
1800
1Мги3
•2SiO„
°C
2200
1775
№75
Ж.+Ж.
• о
Ж+SiO,
I____2____
La&Siq, 1625'
1аг0^2310г La^SiOz+Sty
М.---1__L
ЭДая
г:Чг
«00
Si03
2000
1800
С
2200
,'—La2o32Sty
21^-33^ geco/o
LatO3
Чаг0,-ЗЮг
0 10^20^30 40 50 60 70 80 90 100
‘ ...................
Ш 1*2
M+2LaJL-3SiO,
жща-яа,1
^625° >K+SiO21
LcA2Si02+^°2
Ж+Са203
1775°
1д&910г*
2La203-3Si02
LdA+LaASi°e
£-<3-------------------------a ['£
0 io 20 30 00/50 60^70 80 90 100
La A LaA’Sty J Uy)3’2StO2 SiOz
2LasO33SiO3
Мол.%
Рис. 68. Диаграмма состояния системы
La2O3—SiOa.
1 — одна жидкость; 2 — две жидкости.
№00
ломлением: Ng—./Vp=0.020, являются оптически двуосными,
положительными; пикнометрическая плотность d28=5.72 г/см3.
Структурная формула La2O3-SiO2 может быть представлена как
отвечающая оксиортосиликату лантана La2O[SiO4j.
Соединение 2La2O3 • 3SiO2 устойчиво в температурном интер-
вале 1975—1600°, при температуре 1600° оно диссоциирует
Силикатные системы
79
Инвариантные точки системы Ьа2О3—SiO2
Фазы Процесс Состав Темпе- рату- ра, °C
вес. % мол. %
La^Og S1O2 LdgOg SiO,
La2O34-La2O3- 8Ю2-|-жид~ Эвтектика. 90 10 62.4 37.6 1775
кость.
Ьа2О3- 81О24-жидкость. Плавление. 84.5 15.5 50 50 1930
La2O3-SiO2-i-2La2O3.3SiO2+ Эвтектика. 82 18 45.4 54.6 1900
4-жидкость.
2La2O3- 3SiO24-жидкость. Плавление. 78.3 21.7 40 60 1975
2La2O3- 3SiO24“ ^а20з* SiO2-|— -J- La2O3- 2SiO2. Реакция в твердом состоянии. 78.3 21.7 40 60 1600
La2O3* 2biO2-|“2La2O3* • 3SiO2-|-жидкость. Инконгруэнт- ное плавление. 72.0 28.0 32.2 67.8 1750
La2O3- 2§1О34-а-кристоба- Эвтектика. 65 35 24.7 75.3 1625
лит4~жидкость.
а-Кристобалит4-Ж14-Ж3. а-КристобалитЦ-Ж^- Ж2. Ликвация. 61.8 38.2 23.0 77.0 1675
» 10 90 2 98 1675
на La2O3-SiO2 и La2O3-2SiO2. Показатели светопреломления
2La2O3-3SiO2: /Vo=1.852, ДГе=1.837; двупреломление (No—Ne) =
=0.015; кристаллы его являются оптически отрицательными и ха-
рактеризуются гексагональной сингонией. Параметры элементар-
ной ячейки 2La2O3-3SiO2 (La4Si3O12) имеют следующие значения:
а=11.23, с=4.674 кХ, с/а=0.42. Пикнометрическая плотность
5.31 г/см3. В элементарной ячейке содержатся две формульные
единицы, и плотность, вычисленная на основании рентгенов-
ских данных, равна 5.303 г/см3. По-видимому, La4Si3O12 струк-
турно принадлежит к группе оливина с обособленными тетра-
эдрическими анионами [SiO4]4 и является ортосиликатом лантана
La4[SiOJ3.
Соединение La2O3-2SiO2 образует оптически положительные
кристаллы с показателями преломления /Vg=1.762, ЛГр=1.752,
двупреломлением (Ng—Np) =0.010 и плотностью d25=4.85 г/см3.
В структурном отношении этот силикат лантана может быть опи-
сан как пиросиликат состава La2Si2O7.
Пермякова и Лилеев [3] показали, что в результате реакции
между сульфатом лантана и силикатом натрия (при температуре
до 1000°) могут быть получены пиросиликат, оксиортосиликат и,
возможно, ортосиликат лантана.
Кузьмин и Белов [2 ] определили рентгеновским методом струк-
туру силикатов лантана, используя для этой цели монокристаллы,
80
Силикатные системы
полученные из раствора в расплаве KF. Как показали исследова-
ния, силикаты состава La2O3-SiO2 и La2O3-2SiO2 имели одинако-
вые элементарные ячейки и, следовательно, были тождествен-
ными. Порошкограммы изученных силикатов лантана сходны
с порошкограммами бритолита — редкоземельного силиката, кото-
рый является структурным аналогом апатита. Кузьмин и Белов
для обоих соединений приняли одну и ту же формулу, близкую
к формуле бритолита: La4 e7[SiO4]3O или 7La2O3-9SiO2, с пара-
метрами элементарной ячейки а = 9.55, с=7.14 А. При расшифровке
структуры Кузьмин и Белов проверили три возможных варианта
формул: 1) с 5 атомами лантана, и тогда один из них должен быть
двухвалентным; 2) с 4 La3+, и тогда вместо апатитового фтора
была бы нейтральная частица Н2О; 3) со статистическим распре-
делением La3+ по пяти позициям, т. е. принимается предложенная
формула La4 e7[SiO4]3O. Структурные данные подтвердили пра-
вильность последнего варианта, т. е. было получено прямое струк-
турное подтверждение существования соединения состава
La4.e7[SiO4]3O, и авторы считают, что это соединение должно
занять свое место в диаграмме состояния.
Как показали дальнейшие исследования Торопова и Бондарь,
состав монокристаллов силикатов лантана существенно зависит
от среды, в которой производилось их выращивание. При кристал-
лизации из фтористого калия практически при любом соотношении
La2O3 : SiO2 (1 : 1, 1 : 2 и 1 : 3) образуется один вид соединения —
силикат со структурой апатита состава 7La2O3-9SiO2. Если же
выращивание-монокристаллов производить на аппарате Вернейля,
из раствора в расплаве РЬО, а также получать поликристалличе-
ские агрегаты прокаливанием соосажденных гидроокислов, то
образуются также соединения La2O3-SiO2, La2O3-2SiO2, что соот-
ветствует приведенной диаграмме состояния системы.
Литература
1. Бон д а р ь И. А., в сб.: Химия и практическое применение силикатов,
ЦБТИ Ленсовнархоза, Л., 5, 1960.
2. К у з ь м и н Э. А., Н. В. Белов, ДАН СССР, 165, № 1, 88, 1965.
3. Пермякова Т. В., И. С. Л и л е е в, Журн. неорг. хим., 9, № 4,
925, 1964.
4. Т о р о п о в Н. А., И. А. Бондарь, Изв. АН СССР, ОХН, № 3,
554 1959.
5. Т о р о п о в Н. А., И. А. Бондарь, Изв. АН СССР, ОХН. № 2.
153, 1960.
6. Т о р о п о в Н. А., И. А. Бондарь, Изв. АН СССР, ОХН, № 5:
739, 1961.
Силикатные системы
81
Се2О3—SiO2
Силикаты трехвалентного церия интересны по своим электриче-
ским свойствам.
Система не изучена. Леоновым, Руденко и Келером [1 ] в суб-
солидусной области, в области температур 1200—1650° и восстано-
вительной атмосфере синтезированы три индивидуальных сили-
ката трехвалентного церия: CejO^SiOj, 2Ce2O3-3SiO2 и Ce2O3-2SiO2.
При обжиге стехиометрических смесей Се2О3 : SiO2 и
2Се2О3 : 3SiO2 образуются не чистые силикаты, а смеси нескольких
соединений.
Все полученные силикаты при нагревании на воздухе вслед-
ствие окисления Се3+ до Се4+ разлагаются (СеО2 не образует
соединений с SiO2).
Для полученных силикатов определены лишь средние показа-
тели светопреломления: для Ce2O3-SiO2 N =1.880, двупреломле-
ние 0.025; для 2Ce2O3-3SiO2 jVcp=1.850, двупреломление 0.020;
для Ce2O3-2SiO2 ДГср=1.770, двупреломление 0.015. Для соедине-
ния 2Ce2O3-3SiO2 получены параметры решетки (при допущении
гексагональной сингонии): а=11.36, с=4.71 А.
Литература
1. Л е о н о в А. И., В. С. Руденко, Э. К. Келер, Изв. АН СССР,
ОХН, № 11, 1945, 1961.
Nd2O3—SiO2
Изучена Тороповым и Киселевой [1]. Установлено существо-
вание трех соединений: оксиортосиликата Nd2O3*SiO2, орто-
силиката 2Nd2O3’3SiO2 и пиросиликата Nd2O3-2SiO2 (рис. 69).
Соединения Nd2O3-SiO2 и 2Nd2O3-3SiO2 плавятся без разло-
жения соответственно при 1980 и I9600. Соединение Nd2O3-2SiO2
плавится с разложением при 1750°. В системе имеется^три эвтек-
тики состава 66, 45 и 28 мол. % Nd2O3 с температурой плавления
соответственно 1680, 1830 и 1600°. Ортосиликат устойчив только
при высоких температурах и при 1650° разлагается на оксиорто-
силикат и пиросиликат неодима. Обнаружена значительная область
несмешивающихся жидкостей: от состава 72 мол. % SiO2 до
97.5 мол. % SiO2. Наивысшая температура, при которой исчезает
несмешиваемость, 2000°; нижний предел существования ликва-
ции 1660°.
Кристаллы Nd2SiO5 двуосные, положительные, ^показатели
светопреломления: Ng—1.888, ДГр=1.871; пикнометрически опре-
6 Н. А, Торопов и др,, КН, 1
82
Силикатные системы
деленная плотность 4.476 г/см3. Кристаллы Nd4(SiO4)3 одноосные,
отрицательные, характеризуются гексагональной сингонией; по-
°С
NdzO3 Nd2O2SiO2 NdiO32SiOz ЗЮг
M'jLSSiO;,
гз 2 Bec.%
Рис. 69. Диаграмма состояния системы
NdgOg—SiOg*
казатели светопреломления: No= 1.854, ДГе=1.835; плотность
4.424 г/см3. Кристаллы Nd2Si2O7 двуосные, положительные;
показатели светопреломления: /Vg=1.76O, ДГр=1.745; плотность
5.242 г/см3.
Силикатные системы
83
Миллер и Рейз [2], повторившие работу Торопова и Киселе-
вой, отмечая общее согласие в полученных результатах, полагают,
однако, что Nd2Si2O7 устойчиво только выше 1540° (рис. 70).
Рис. 70. Диаграмма состояния
системы Nd2O3—SiO2 (по Миллеру
и Рейзу).
Литература
1. Торопов Н. А., Т. П. Киселева, в сб.: Работы в области фи-
зико-химшГи технологии силикатов, Труды Лен. технол. инет. им. Лен-
совета, вып. 52, Госхимиздат, Л., 76, 1961.
2. М i 1 1 е г R. О., D. Е. Rase, Journ. Amer. Ceram. Soc., 47, № 12,
653, 1964.
Pr2O3—S1O2
Изучалась Годиной, Савченко и Келером [1] в субсоли-
дусной областц. Реакции в твердом состоянии исследовались
в водородной и воздушной атмосфере. Реакция окиси празеодима
с кремнеземом начинается при 1200°. Образуются три соедине-
ния: Pr2Oa"SiO2, 2Pr2O3-3SiO2 и Pr2O3-2SiO2.
При температурах 1200—1500° из эквимолекулярной смеси
образуются совместно силикаты Pr2O3*SiO2 и 2Pr2O3-3SiO2 (с пре-
обладанием фазы ортосиликата). Оксиортосиликат с небольшой
примесью ортосиликата может быть получен при 1600—1650°.
Из смесей, более богатых кремнеземом, при прокаливании
до 1300—1500° обнаруживается только ортосиликат, а при более
высоких температурах возникает Pr2O3-2SiO2.
Литература
1- Година Н. А., Е. П. Савченко, Э. »К. Келер, Труды
6-го Совещ. по экспер. и техн, минералогии и петрографии, Изд.
АН СССР, М., 311, 1962.
6*
84
Силикатные системы
SmO—SiO2
Изучалась Бондарь, Тороповым и Королевой [1 ]. Силикаты
двухвалентного самария получались прокаливанием соответст-
вующих смесей Sm2O3 и SiO2 в токе водорода при температурах
выше 1200°. Были получены два силиката: 2SmO*SiO2 и SmO«SiO2.
Ортосиликат самария 2SmO-SiO2 образует двуосные, оптически
положительные кристаллы ромбической сингонии с показателями
светопреломления jVg=1.865, ДГр=1.850. Метасиликат самария
образует одноосные кристаллы гексагональной сингонии с пока-
зателями светопреломления ДГо=1.760, ЛГе=1.740. Силикат со-
става 3SmO-SiO2 не получен.
Тенишева и Лазарев [2] методом ИК-спектроскопии подтвер-
дили существование указанных двух силикатов двухвалентного
самария и показали изоструктурность силикатов Sm2+ соответ-
ствующим соединениям стронция. Частоты колебаний решетки
изученных силикатов самария не превышают 400 см-1.
Литература
1. Бондарь И. А., Н. А. Торопов, Л. Н. Королева, Изв.
АН СССР, неорг. матер., 1, № 4, 561, 1965.
2. Т е н и ш е.в а Т. Ф., А. Н. Лазарев, Изв. АН СССР, ннорг. матер.,
1, № 4, 569. 1965.
Sm2O3—SiO2
Изучена Тороповым и Бондарь [2]. Установлено существова-
ние трех соединений: Sm2O3-SiO2, 2Sm2O3-3SiO2 и Sm2O3»2SiO2
(рис. 7). Первые два соединения плавятся без разложения,
соединение Sm2O3*2SiO2 плавится инконгруэнтно при 1775°.
Соединение 2Sm2Os-3SiO2 устойчиво в области от температуры
плавления до 1630°, когда происходит диссоциация на два других
из указанных силикатов.
В системе установлено расслаивание в жидкой фазе. Темпера-
тура критической точки расслаивания 2200°, ее состав 70 вес.%
(93.3 мол.%) SiO2. Состав сосуществующих жидкости 1, жид-
кости 2 и а-кристобалита 35—90 вес.% (75.8—98.1 мол. %) SiO2.
Кристаллы Sm2O(SiO4) двуосные, положительные; показатели
светопреломления: jVg=1.885, 2Vp=1.863; двупреломление 0.022;
плотность 6.36 г/см3. Кристаллы Sm4(SiO4)3 одноосные, отрица-
тельные; показатели преломления: ДГтп=1.860, ДГр=1.840; плот-
ность 5.77 г/см3. Кристаллы Sm2Si2O7 двуосные, положительные;
показатели светопреломления: Ng=i.775, АГр=1.765; двупрелом-
ление 0.010; плотность 5.20 г/см3.
Силикатные системы
85
Кузьмин и Белов [1], произведя рентгеноструктурное иссле-
дование монокристаллов Sm2O3-SiO2 и SmaOs^SiOa, полученных
из раствора в расплаве KF, нашли, что эти соединения имеют одну
Рис. 71. Диаграмма состояния системы
Sm2O3— SiO2.
1 — одна жидкость; 2 — две жидкости.
и ту же элементарную ячейку, и следовательно, представляют
одно и то же соединение, а именно 7Sm2O3-9SiO2, аналогично тому,
что было найдено для силикатов лантана. Рентгенограмма этого
соединения сходна с таковой для минерала бритолита — редко-
86
Силикатные системы
земельного силиката, структурного аналога апатита. В резуль-
тате структурных исследований авторы доказывают, что в этом
соединении имеет место статистическое распределение Sm3+
по пяти позициям. Параметры элементарной ячейки: а=9.33,
с=6.85 А.
Литература
1. К у з ь м и н Э. А., Н. В. Белов, ДАН СССР, 165, № 1, 88, 1965.
2 Торопов Н. А., И. А. Бондарь, Изв. АН СССР, ОХН, № 8,
1372, 1961.
EuO—Si0.2
Изучалась Бондарь, Тороповым и Королевой [1]. Силикаты
двухвалентного европия получались прокаливанием соответствую-
щих смесей Еи2О3 и SiO2 в токе водорода при температурах выше
1200°. Было получено четыре силиката: 3EuO*SiO2, 2EuO-SiO2,
3EuO-2SiO2 и EuO-SiO2. Для оксиортосиликата европия
3EuO*SiO2 характерны показате-
ли светопреломления ДГо=1.870,
ДГе=1.855; кристаллы одноосные,
оптически отрицательные. Ортоси-
ликат европия 2EuO-SiO2 имеет
показатели светопреломления
jVg=1.860, ДГр=1.840; кристаллы
двуосные, оптически положитель-
ные. Согласно данным Шефера,
Мак-Гира и Суитса [4], подтвер-
жденных Бондарь, Тороповым и
Королевой, кристаллы 2EuO-SiO2
относятся к ромбической синго-
°С
2000
1600
1200
0 20 W 60 80 100
Si02 Мол.% £и0
Рис. 72.' Фазовая диаграмма си-
стемы EuO—SiO2 (по Шеферу).
нии. Для диортосиликата двухва-
лентного европия 3EuO-2SiO2
2V^=1.835, ДГр=1.820, двупре-
ломление 0.015. Метасиликат двух-
валентного европия EuO«SiO2 характеризуется показателями
светопреломления ДГо=1.805, АГе=1.775; кристаллы одноосные,
оптически отрицательные, по-видимому, относятся к гексаго-
нальной сингонии.
Некоторые сведения о системе EuO—SiO2 приводит Шефер [3].
Он отмечает три соединения: Eu3SiO5, Eu2SiO4 и EuSiO3, полу-
ченные в результате твердофазовых реакций. Согласно Шеферу,
соединение Eu3SiO5 плавится инконгруэнтно с образованием
Eu2SiO4 и жидкости. Ниже 1500° Eu3SiOs диссоциирует на EuO
Силикатные системы
87
и Eu2SiO4. EuSiO3 и Eu2SiO4 плавятся конгруэнтно соответственно
при 1700 и 2000°. Диаграмма состояния системы ЕиО—SiO2
по Шеферу приведена на рис. 72. Eu2SiO4 имеет ромбическую син-
гонию, Eu3SiO5 — тетрагональную. Eu2SiO4 и Eu3SiO5 обладают
ферромагнитными свойствами с точкой Кюри (paramagnetic Curie
temperature) соответственно 10 и 19° К.
Тенишева и Лазарев [2] методом ИК-спектроскопии подтвер-
дили существование указанных выше силикатов двухвалентного
европия. Частоты колебаний решетки изученных силикатов евро-
пия не превышают 400 см-1.
Литература
1. Бондарь И. А., Н. А. Торопов, А. Н. Королева, Изв
АН СССР, неорг. матер., 1, № 4, 561, 1965.
2. Т е н и ш е в а Т. Ф., А. Н. Лазарев, Изв. АН СССР, неорг. матер.,
1, № 4, 569, 1965.
3. S h a f е г М. W., Journ. Appl. Phys., 36, № 3 (pt. 2), 1145, 1965.
4. Shafer M. W., T. R. M c G u г i e, J. C. Suits, Phys. Rev. Lett.,
11, 251, 1963.
Eu2O3—SiO2
Система изучена Бондарь и Тороповым [2] методом «отжига
и закалки». Обнаружено три соединения: Eu2O3>SiO2, 2Eu2O3«
3SiO2 и Eu2O3’2SiO2. Соединение Eu2O3*SiO2 — оксиортосили-
кат европия Eu2O [SiO4] — плавится без разложения при
1980±30°. Кристаллы Eu2O3-SiO2 имеют показатели светопре-
ломления Ng=1.890, Np=1.870, двуосные, оптически положи-
тельные, с прямым погасанием. Соединение 2Eu2O3-3SiO2 пла-
вится без разложения при 1970 ±30°. Это соединение типа орто-
силиката Eu4 [SiO4]3 устойчиво в температурном интервале 1970—
1650°. При 1650° оно распадается на смесь Eu2O3*SiO2 и
Eu2O3*2SiO2. Кристаллооптические константы 2Eu2O3-3SiO2 сле-
дующие: No=1.865, Ne= 1.845; кристаллы одноосные, оптически
отрицательные, относятся к гексагональной сингонии. Соедине-
ние Eu2O3-2SiO2 плавится при 1760 + 30° с разложением
на 2Eu2O3-3SiO2 и жидкость; кристаллы двуосные, оптически
положительные, показатели светопреломления: jVg=1.775,
Np = 1.763.
Монокристаллы силикатов трехвалентного европия получены
методом Вернейля Бондарь, Поповой, Пирютко и Тороповым [1].
88
Силикатные системы
Литература
1. Бондарь И. А., А. А. Попова, М. М. П и р ю т к о, Н. А. То-
ропов, ДАН СССР, 175, № 5, 1051, 1967.
2. Т о р о п о в Н. А., И. А. Бондарь, ДАН СССР, 158, № 1, 173,
1964.
Gd2O3—SiO2
Силикаты гадолиния являются материалом, пригодным для
защиты конструкций от ядерных излучений.
Система изучена Тороповым, Галаховым и Коноваловой [1].
Установлено существование трех соединений: Gd2O3-SiO2 (оксиор-
тосиликат), 2Gd2O3-3SiO2 (ортосиликат), Gd2O3-2SiO2 (пиросили-
кат).
Соединение 2Gd2O3-3SiO2 устойчиво только в интервале 1630—
1950°. Ниже 1630° оно распадается на Gd2O3-SiO2 и Gd2O3*2SiO2.
Таблица 1
Инвариантные точки системы Gd2O3—SiO2
Точка Фазы Процесс Состав Тем- пера- тура,
вес.% мол.%
Gd2Os SiO2 Crd-iOg SiO2
1 Gd2O3-|-Gd2O3- SiO2-(-жид- кость. Эвтектика. 92 8 65.7 34.3 1810
2 Gd2Oa • SiOg-l-жидкость. Плавление. 85.8 14.2 50 50 1900
3 Gd2O3* SiO24-2Gd2O3 • • 3SiO2-|-жидкость. Эвтектика. 83 17 45 55 1850
4 2Gd2O3-318Ю2-|-жидкость. Плавление. 80 20 40 60 1950
5 Gd2O3 • SiOU- Gd2O3- • 2SiO24-2Gd2O3-3SiO2. Реакция в твердом состоянии. 80 20 40 60 1630
6 2Gdo03*3Si024~Gd203« 28Ю2-|-жидкость. Инкон- груэнтное плавление. 71 29 29 71 1720
7 Gd2O2- 2SiO2-|-a-KpиCTOбa- ЛИT-|-ЖИДKOCTЬ. Эвтектика. 68 32 26.4 73.6 1640
8 а-Кристобалит-|-жидкость A-J-жидкость В. Ликвация. 66 34 24.4 75.6 1710
9 а-Кристобалит+жидкость А-|-жидкость В. » 5 95 1 99 1710
Силикатные системы
89
Таблица 2
Кристаллические фазы системы Gd2O3—SiO2
Соединение Показатели преломления Дву- пре- ломле- ние Оптический знак Оптические оси Плот- ность, г/см3
Ng Np
Gd2O(SiO4) (оксиортоси-
ликат) 1.890 1.873 0.017 (+) Двуосный угол опти- ческих осей —75°. 6.552
Gd4(SiO4)3 (ортосиликат) 1.870 1.855 0.015 (-) Прямое погасание. Одноосный. 6.290
Gd2(Si2O,) (пиросиликат) 1.775 1.765 0.010 (+) Прямое погасание. Двуосиый. 5.336
В системе обнаружено расслаивание расплавов. Расслаивание
начинается при 1710°. При этой температуре сосуществуют две
жидкости составов (вес.%):1) 65% Gd2O3, 35% SiO2; 2) 5% Gd2O3,
95% SiO2.
Рис. 73. Диаграмма состояния системы Gd2O3—SiO2.
Верхняя критическая точка области расслаивания лежит
при температуре 2300°; ее состав: 30 вес. % Gd2O3, 70 вес. % SiO2
(рис. 73).
90
Силикатные системы
Литература
1. Торопов Н. А., Ф. Я. Галахов, С. Ф. Коновалова,
Изв. All СССР, ОХН, № 4, 539, 1961.
Dy2°2— SiO2
Интересна для получения новых материалов для электроники.
Изучена Тороповым, Галаховым и Коноваловой [1 ] методом
закалки. В системе установлено существование трех соединений
состава: Dy2O3-SiO2 (оксиортосиликат), 2Dy2O3-3SiO2 (ортосили-
кат) и Dy2O3-2SiO2 (пиросиликат). В системе имеет место рас-
Таблица 1
Инвариантные точки системы Dy2O3—SiO2
Точка Фазы Процесс Состав Темпе- ра- тура, °C
вес. % мол. % .
Dy2O3 S1O2 Dy2O8 S1O.2
1 Dy2O3-|- Dy2O3- •81О2-|-жидкость. Эвтектика. 92 8 64.9 35.1 1790
2 Dy2O3-SiO24-?KHfl- кость. Плавление. 86.13 13.87 50 50 1930
3 Dy2O3 • SiO2-|- 4-2Dy2O3- 3SiO2-|- -j-жидкость. Эвтектика. 82 18 42 58 1880
4 2Dy2O3.3SiO2+жид- кость. Плавление. 80.6 19.4 40 60 1920
5 ^Узрз* SiO2-|~Dy2O3* • 2SiO2-|-2Dy2O3* • 3SiO2 Реакция в твердом состоянии. 80.6 19.4 40 60 1650
6 2Dy2O3- 3SiO,4- +Dy8O3.2&)84- 4-жидкость. Иикон- груэнтное плавление. 73 27 30.4 69.6 1720
7 Dy8O3-2SiO84-a-KpH- стобалит-f-жид- кость. Эвтектика. 67 33 24.50 75.50 1640
8 а-Кристобалит-|- жид- кость А-(-жид- кость В. — 63 37 21.50 78.50 1675
9 а-Кристобалит-|- жид- кость А 4-жид- кость В. 2 98 0.33 99.67 1675
Силикатные системы
91
Таблица 2
Кристаллические фазы системы Dy^Og—SiO2
Соединение Ng Nm Np Дву- пре- ломле- ние Опти- ческий знак Оптические оси
Dy2O(SiO4) (оксиортосиликат) 1.865 — 1.847 0.018 — Двуосный, угол опти- ческих осей 88°.
Dy4(SiO4)3 (ортосиликат) . . . — 1.853 1.838 0.015 (-) Одноосный.
Dy2(Si2O7) (пиросиликат) . . . 1.765 — 1.757 0.008 (+) Двуосный.
сдаивание расплава. Верхняя критическая точка области рас-
слаивания лежит при температуре 2320° и имеет состав: 28 мол.%
Dy2O3, 72 мол.% SiO2 (рис. 74).
состояния системы
Оу2О3 SiO2.
Рис. 74. Диаграмма
Wcw.%
Литература
1. Торопов Н. А., Ф. Я. Галахов, С. Ф. Коновалова.
Изв. АН СССР, ОХН, № 8, 1365, 1961.
92
Силикатные системы
Ег2О3—SiO2
Система интересна для технологии люминесцентных стекол
и некоторых видов монокристальных продуктов. Изучена Торо-
повым, Галаховым и Коноваловой [1]. В системе установлено
существование трех соединений состава: Er2O3-SiO2 (оксиорто-
силикат), 2Er2O3-3SiO2 (ортосиликат) и Er2O3-2SiO2 (пиросили-
кат).
Таблица 1
Инвариантные точки системы Ег2О3—SiO2
Точка Фазы Процесс Состав Тем- пера- T?ga,
вес.% МОЛ.%
Ег2Оэ S1O2 Ег2О8 Sio2
1 Ег2О34-Ег2О3- SiO2+жид- кость. Эвтектика. 89 11 56 44 1880
2 Ег2О2-SiO2-|-жидкость. Плавление. 86.5 13.5 50 50 1980
3 Ег2О2* ЫО2-)-2Ег2О3* • 38Ю24-жидкость. Эвтектика. 83 17 43.5 56.5 1870
4 2Ег2О3- 3SiO2 4-жидкость. Плавление. 81 19 40 60 1900
5 Ег2О3- S102-|-Er203*2S102-|- 4-2Er2O3-3SiO2. Реакция в твердом состоянии. 81 19 40 60 1720
6 2Ег2О2" 3SiO2-|-Er2O2- • 2SiO3-|-жидкость. Эвтектика. 77 23 34.5 65.5 1773
7 Ег2О2 • 28Ю2-|-жидкость. Плавление. 76.1 23.9 33.4 66.6 1800
8 Ег2О3- 2SiO2-|- SiO2 4-жид- кость. Эвтектика. 67 33 24.2 75.8 1680
9 а-Кристобалит 4-жидкость А-|-жидкость В. — 65 35 22.6 77.4 1700
10 а-Кристобалит-|- жидкость А 4-жидкость В. 3 97 0.5 99.5 1700 4
Таблица 2
Кристаллические фазы системы Ег2О3—SiO2
Соединение Ng Nm Np Двупре- ломление Плот- ность, г/смэ
Ei-2O(SjO)4 (оксиортосиликат) . . . 1.28 __ 1.807 0.018 6.80
Er4(SiO4)3 (Ьртосиликат) — 1.800 1.780 0.020 6.22
Er2(Sj.2O7) (пиросиликат) 1.768 — 1.740 0.028 6.10
Силикатные системы
93
В системе имеет место расслаивание расплавов. Верхняя кри-
тическая точка области расслаивания лежит при температуре
2280° и имеет состав: 30 мол.% Ег2О3, 70 мол.% SiO2 (рис. 75).
Рис. 75. Диаграмма
состояния системы
Ег2О2—SiO2.
МОЛ.%
Литература
1. Торопов Н. А., Ф. Я. Галахов, С. Ф. Коновалова,
Изв. АН СССР, ОХН,=Я« 8, 1365, 1961.
YbO—SiO2
Изучалась Бондарь, Тороповым и Королевой [1]. Силикаты
двухвалентного иттербия получались прокаливанием соответ-
ствующих смесей Yb2Os и SiO2 в токе водорода при температурах
выше 1200°. Было получено четыре соединения: 3YbO-SiO2,
2YbO*SiO2, 3YbO*2SiO2 и YbO*SiO2. Силикаты иттербия имеют
следующие кристаллооптические характеристики: 3YbO • SiO2 —
jVg=1.815, АГр=1.805; 2YbO-SiO2 — 7Vg=1.800, ДГр=1.780;
3YbO-2SiO2 — 7Vg=1.780, ДГр=1.760; YbO-SiO2 — 7Vg=1.770,
ATp=1.745.
Тенишева и Лазарев [2] методом ИК-спектроскопии подтвер-
дили существование указанных выше силикатов двухвалентного
иттербия и показали их изоструктурность соответствующим сое-
динениям кальция. Частоты колебаний решетки изученных сили-
катов иттербия не превышают 400 см-1.
94
Силикатные системы
Литература
1. Бондарь И. А., Н. А. Торопов, Л. Н. Королева, Изв.
АН СССР, неорг. матер., 1, № 4, 561, 1965.
2. Тенишева Т. Ф., А. Н. Лазарев, Изв. АН СССР, неорг. матер.,
1, № 4, 569, 1965.
Yb2O3—SiO2
Изучена Тороповым и Бондарь [1]. Установлено существо-
вание трех соединений: Yb2O3*SiO2, 2Yb2Os«3SiO2 и Yb203«2SiO2.
Все эти соединения плавятся без разложения (рис. 76). Соедине-
ние 2Yb2Os*3SiO2 устойчиво от температуры плавления (1920°)
до 1675°.
В системе обнаружена несмешиваемость расплава. Темпера-
тура критической точки расслаивания 2200°, ее состав 70 вес.%
(93.9 мол.%) SiO2. Состав сосуществующих жидкости 1, жид-
кости 2 и а-кристобалита: 30—91.5 вес.% (73.7—98.6 мол.%)
SiO2. Кристаллы Yb20(Si04) двуосные, положительные; показатели
преломления: Л#=1.827, 7V/?=1.807; двупреломление 0.020.
Кристаллы Yb4(SiO4)3 одноосные, отрицательные; показатели
преломления: Аш=1.800, ДГр=1.782; двупреломление 0.018.
Кристаллы Yb2Si2O7 двуосные, положительные; показатели пре-
ломления: jVg=1.770, Лр=1.740; двупреломление 0.030.
Литература
1. Торопов Н. А., И. А. Бондарь, Изв. АН СССР, ОХН, № 8,
1372, 1961.
GeO2—SiO2
Виттманн, Новотный и Мюнстер [2] указывают, что GeO2
(в форме кварца) способен образовывать твердый раствор с кремне-
земом, причем количество SiO2, входящего в твердый раствор,
достигает 60— 70%. Кремнезем (в форме кварца) растворяет
всего лишь около 5% GeO2.
Образование твердых растворов в системе происходит легче,
если исходить из аммонийно-силикогерманатных цеолитов пере-
менного состава (прокаливание при 800°). На рис. 77 приведена
зависимость параметра решетки твердого раствора а (в А) от со-
держания GeO2 при условии получения твердых растворов
из окислов. На рис. 78 та же зависимость дана для твердых рас-
'с
2300
2УЬг03-ЗЗЮг
МОЛ Vo
Рис. 76. Диаграмма состояния системы Yb2O3— SiO2.
1 — одна жидкость; 2 — две жидкости.
Рис. 77. Зависимость параметра ре-
шетки твердого раствора в системе
GeO2—SiO2 от содержания GeO2 при
условии получения твердых раство-
ров из окислов.
; — образцы, для которых не достигнуто
равновесие; 2 — образцы, для которых
достигнуто равновесие; з — средние зна-
чения.
7/1 6/1 5/2 43 J/4 2/5 1/6 1/7
Si/de
Рис. 78. Зависимость параметра ре-
шетки твердого раствора в системе
GeO2—SiO2 от содержания GeO2 при
условии получения твердых раство-
ров из аммонийных силикогерманат-
ных цеолитов.
Рис. 79. Диаграмма состояния системы
GeO2—SiO2 (по Миллеру и др.).
Силикатные системы
97
творов, полученных из аммонийно-силикогерманатных цеолитов.
Миллер и др. [1] изучили фазовые равновесия в низкотемпера-
турной области, проводя опыты в гидротермальной аппаратуре
(рис. 79). При 700° и 0.7 кбар количество GeO2, расстворенного
в кварце, доходит до максимального содержания, составляющего
31 мол.%. При повышении давления (29 кбар, 450°) имеем только
SiO2 (коэсит) и GeO2 (рутил).
Рутиловая и коэситовая фазы не образуют твердых растворов.
После вхождения GeO2 в решетку кварца а (3-превращение
последнего повышается до 870°. При этом также резко повышается
температура превращения кварца в тридимит.
Литература
1. М i 1 1 е г W. S., F. D а с h i 11 е, Е. С. Shafer, R. Roy, Amer.
Mineralogist, 48, № 9—10, 1025, 1963.
2. Wittmann A., H. Nowotny, N. Miinster, Monatshefte
Chem., 90, № 5, 700, 1959.
SnO—SiO2
Ориентировочные исследования в связи с задачами металлурги-
ческой химии осуществлены Кольмейером и Кейселитцем [2].
По-видимому, система относится к чисто эвтектическим, и бинар-
ные соединения здесь не образуются. Эвтектика близка к составу
1710°
°C
1600
1400
800 [..................
to 30 50 70 90
Мол:%
Рис. 80. Диаграмма состоя-
ния системы SnO—SiO2.
о го чо 60 во loo
SnO вес. % SiO,
4
SnO : SiO2=l : 1, который плавится около 890° (рис. 80). Сле-
дует отметить, что фаза SnO в области температур 540—725°
диспропорционирует по уравнению 2SnO SnO2+Sn. Для си-
стемы SnO2—SiO2 Грейг [1] не обнаружил расслаивания. Стекла
этой бинарной системы находят применение для ультрафиоле-
тового излучения.
7 Н. А. Торопов и др., пн. 1
98
Силикатные системы
Литература
1. Greig J. W., Amer. Journ. Sci., (5) 13, № 74/75, 137, 1927.
2. Kohlmeyer F. J., B. Keysselitz, Metall u. Erz, 30, № 10,
185, 1933.
PbO—SiO2
Относится к системам, существенным для технологии стекол и
керамических глазурей.
Изучена Кракау и Вахрамеевым (5, 6], Геллером, Кримером
и Бантингом [7]. Все эти авторы согласны с существованием
Мол. %
У * 16.9 29.2 39.6 98.3 55.3 61.9 66.6
960
990
920
900
880
860
890
820
800
780
760
790
720
700
680
660
160
190
120
РЬО вес.% $Щ>
Рис. 81. Диаграмма состояния системы
РЬО—SiO2.
соединений . 2PbO-SiO2 и
PbO-SiO2. Кроме того, в; си-
стеме существует богатое
окисью свинца соединение.
Кракау полагает, что это
соединение имеет формулу
3PbO-SiO2. Геллер с сотруд-
никами приписывают --ему
формулу 4PbO-SiO2 (рис. 81).
Мак-Мэрди и Бантинг [10],
Кордес [8], Валенков и По-
рай-Кошиц [2] подтверждают
существование соединения
4PbO-SiO2. Кроме указан-
ных соединений, найден при-
родный минерал барисилит
3PbO-2SiO2. Кракау и Вах-
рамеев [6] получали метаста-
бильную кристаллическую
фазу 3PbO-2SiO2 в резуль-
тате длительной выдержки
расплава при 700—715° и
последующей закалки. Кри-
сталлы синтетического ЗРЪО •
•2SiO2 одпоосны, имеют фор-
му табличек; двупреломле-
ние 0.005.
.Соединение 4РЪ0 -SiO2 су-
ществует в виде трех мо-
дификаций. Кракау и Вах-
рамеев обнаружили полиморфное превращение 2PbOSiO2
при 620°. Это же было подтверждено Линднером [9] при
исследовании коэффициента самодиффузии свинца в его сили-
катах. Линднер обнаружил также полиморфное превращение
Силикатные системы
99
Таблица 1
Инвариантные точки системы РЬО—SiO2
точка Фазы Процесс Состав, вес. % Темпера- тура, °C
РЬО SiO2
1 РЬО4-жидкость. Плавление. 100 0 886
2 а-4РЬО- SiO24-PbO 4-жидкость. Инконгруэнт- ное плавление- 93.3 6.7 725
3 а-4РЬО • SiO2^p-4PbO • SiO 24- 4-жидкость. Полиморфное превращение. 93.7 6.3 720
4 P-4PbO-SiO24-2PbO-SiO2+ 4-жидкость. Эвтектика. 91.78 8.22 714
5 fJ-4PbO • SiO24-Y-4PbO • SiO2 Полиморфное превращение. 93.7 6.3 155
6 2PbO- SiO 2 4-жидкость. Плавление. 88.1 11.9 723
7 2PbO- SiO2-j-Pb6- 8Ю2+жид- кость. Эвтектика. 84.6 15.4 716
8 РЬО • SiO24-жидкость. Плавление. — — 764
9 РЬО • SiO2-j-кварц-Ьжидкость. Эвтектика. — — 732
PbO-SiO2 при 585°. Показатели преломления стекол системы
РЬО—SiO2 определены Кракау [4] (рис. 82).
Березкина и Чижиков [1] подтвердили данные американских
авторов о наличии в системе соединения 4PbO-SiO2 и отсутствии
соединения 3PbO-SiO2. Для 4PbO-SiO2 полиморфизм не был
обнаружен. Силикат 3PbO-2SiO2 является неустойчивым и су-
ществует равновесно только в узком температурном интервале
вблизи точки плавления.
Отмечая противоречивость данных о числе кристаллических
фаз в системе и областях их равновесного состояния, Копылов
и Маргулис [3] объясняют это различием условий получения
силикатов свинца и методик проведения исследований. Стабиль-
ное равновесие с образованием термодинамически равновесных
фаз может достигаться длительным выдерживанием при соответ-
ствующих температурах. Так, для 700° время выдержки должно
быть не менее 10 час., иначе в системе устанавливается метаста-
бильное равновесие, зависящее от условий охлаждения. Для не-
которых практических целей, например для разъяснения процес-
сов, происходящих при агломерирующем обжиге свинцовых кон-
центратов, как раз характерны условия, имеющие место для
метастабильных равновесий.
Копылов и Маргулис сделали попытку построить диаграмму
метастабильных состояний при условиях (в смысле скорости
7*
Таблица 2
Кристаллические фазы системы РЬО—SiO2
Соединение Система кристаллов Габитус Спайность Плот- ность, г/см® Ng Np Опти- че- ский знак 2V" Оптическая характеристика
РЬО — глёт. Квадрат- ная. Таблички, пластинки. Совершенная по призме. 9.13 2.665 2.535 (-) 0 Желтовато-красный.
a-4PbO-SiO2. — Призмы. — — 2.38 2.31 (+) 40 Аномальная интерферен- ционная окраска.
P-4PbO-SiO2. — — — — 2.34 — — — —
Y-4PbO- SiO2. Оптичес хи сходна с Э-МОДИ1 )икацие й, кроме Двупр» Ш0МЛ61 ия.
2PbO-SiO2. — Призмы. — — 2.18 2.13 (?) 80 Погасание прямое.
PbO-SiO2. — » — — 1.95 Среднее. (-) 60 —
3PbO-2SiO2 — барисилит. — Пластинки. — — 2.04 — (-) 0
Силикатные системы
101
температурных изменений), близких к агломерационным. В рас-
сматриваемой работе охватывались некоторые разрезы системы
РЬО—SiO2—PbSO4 и была построена диаграмма метастабильно го
состояния системы РЬО—SiO2. Использовался метод дифферен-
циального термического анализа. Сплавленные исходные смеси
(РЬО, кварц, стеклообразный кремнезем или прокаленная кремне-
кислота) выдерживались всего 30—40 мин., а затем снимались
термограммы при охлаждении и вторичном нагревании со скоростью
Рис. 82. Показатель свето-
преломления стекол систе-
мы РЬО—SiO2
16—20 град./мин. При выбран-
ных условиях в системе не обра-
Рис. 83. Диаграмма метаста-
бильного состояния системы
РЬО—SiO2.
1 — эффекты на ДТ-кривых ох-
лаждения; 2 — то же при вторичном
нагревании; з — изменение элек-
тропроводности при изменении тем-
пературы.
зуется индивидуальных кристал-
лических силикатов свинца, но
обнаруживаются твердые растворы РЬО в гипотетическом высоко-
кремнеземистом силикате (у). Диаграмма метастабильного со-
стояния системы (рис. 83) характеризуется ограниченной пери-
тектической растворимостью в твердом состоянии: точка пери-
тектики отвечает содержанию приближенно 4 вес. % SiO2 при
700°. При термической выдержке образцов состава PbSiO3,
PbO-PbSiO3 и 3PbO'PbSiO3 при 700° в течение 3 час. образуется
твердый раствор предположительно РЬО в богатом кремнеземом
силикате, состав которого авторы не приводят.
Образцы, содержащие менее 4 вес. % SiO2, в тех же условиях
обработки давали смесь кристаллической РЬО со стекловидным
силикатным раствором; при большем содержании SiO8 обра-
зуется однородное стекло.
102
Силикатные системы
Литература
1. Б е р е з к и н а Л. Г., Д. М. Чижиков, Журн. неорг. хим.,
7, № 4, 856, 1962.
2. Валенков Н. Н., Е. А. Пора й-К о ш и ц, Журн. физ. хим.,
6, № 6, 757, 1935.
3. Копылов Н. И., Е. В. Маргулис, Изв. АН СССР, металлы,
№ 4, 72, 1965.
4. К р а к а у К. А., в сб.: Физико-химические свойства тройной системы
окись натрия—окись свинца—кремнезем, Изд. АН СССР, М.—Л.,
123, 1949.
5. К р а к а у К. А., Н. А. Вахрамеев, Труды Гос. оптич. инет.,
7, № 70, 1931.
6. К р а к а у К. А., Н. А. Вахрамеев, Керамика и стекло, 8,
№ 1, 42, 1932.
7. Geller Е. F., A. S. Creamer, Е. N. Bunting, Journ. Res.
Nat. Bur. Stand., 13, № 2, 237, 1934.
8. Kordes E., Zs. anorgan. allgem. Chem., 241, № 1, 1, 1939.
9. Lindner R., Acta chem. Scand., 5, Xs 5, 735, 1951.
10. M с M u г d i e H. F., E. N. Bunting, Journ. Res. Nat. Bur. Stand.,
23, № 4, 543, 1939.
TiO2—SiO2
Важна для интерпретации реакции SiO2 с TiO2 при керами-
ческих процессах.
Изучалась Рикке [5], Умецу и Какиуши [6], Богацким [1].
Эти авторы проводили опыты в условиях восстановительной атмо-
Рис. 84. Диаграмма состояния
системы TiO2—SiO2 (по Умецу
и Какиуши).
Рис. 85. Диаграмма состояния
системы TiO2—SiO2" (по Бан-
тингу).
сферы, и потому, возможно, присутствовали Ti2O8 и TisO5. Фазо-
вая диаграмма по Умецу и Какиуши приводится на рис. 84; ха-
рактерно наличие области несмешиваемости двух жидких фаз,
которые не отмечены на диаграмме Бантинга [2] (рис. 85). Риккер
и Гюммель [4] вопреки всем предыдущим исследователям нашли
в системе два ряда твердых растворов (рис. 86), которые не под-
твердились, однако, проверочным исследованием Де Вриза,
Силикатные системы
103
Роя и Осборна [3] (рис. 87). Последние авторыТподтвердили
и уточнили установленную Бантингом эвтектику между SiO2
и TiO2 (кристобалитом и рутилом) при 10.5% TiO2l и 'темпера-
Рис. 86. Диаграмма состояния
системы TiO2—SiO2 (по Риккеру
и Гюммелю).
Обозначения для метастабилыюго уча-
стка: А — низкотемпературный нри-
стобалит (т. р.); Б — высокотемпе-
ратурный кристобалит (т. р.); В —
высокотемпературный кристобалит
(т. р.)+рутил (т. р.); Г — низкотем-
пературный кристобалит h рутил
(т. р.).
С
18001- Жидк.
Кристоб. т.р.
Рутил т.р.+Ж /
/
, ------------{Рутил т.р.
\ [ Кристоб.т.р.+рутил т.р.\
± Кристобт.р.
». Б Метастабильный
1200 \\|g участок
1600
1600
> 0 20
SiOz
60 60 80 100
ТЮ.
Bec.%
туре 1550 + 4°; они также не только подтвердили, но и значительно
г справили данные Умецу и Какиуши [6] о наличии в системе
области несмешиваемости двух жидких фаз, возникающих при
. ’ кристоо. + рцтил • •
1500п----'—-—>—------------>------J
О 20 W 60 80 100
SiO2
Вес. %
Щ
Рис. 87. Диаграмма состояния
системы TiO2—SiO2 (по Де Ври-
зу, Рою и Осборну).
1780+10° в интервале от 19 до 93% TiO2. В статье Де Вриза и
других приводится на основании их данных и определений Рик-
кера и Гюммеля [4] кривая показателей преломления стекол
в зависимости от состава в интервале от 100 (вес.) % SiO2—0%TiO2
до 75% SiO2—25% TiO2 (N — 1.550) — по экспериментальным
данным и до 60% SiO;—40% TiO2 (N ~ 1.600) — по интер-
поляции.
104
Силикатные системы
Литература
1. Богацкий Д., Металлург, 1, 59, 1936.
2. Bunting Е., Journ. Res. Nat. Bur. Stand., 11, № 5, 719, 1933.
3. De Vries R. C., R. Roy, E. F. Osborn, Trans. Brit. Ceram.
Soc., 53, № 9, 525, 1954.
4. R i c k e r R. W., F. A. Hummel, Journ. Amer. Ceram. Soc., 34,
№ 9, 271, 1951.
5. R i e c k e R., Sprechsaal, 41, 405, 1908.
6. U m e l u S., F. Kakiuchi, Bull. Chem. Soc. Japan, 46, 866, 1930.
ZrO2—SiO2
Имеет первостепенное значение в технологии различных видов
циркониевых огнеупоров и т. п.
Диаграмму изучали Жирнова [1], Геллер и Ланг [6], Кертис
и Соуман [5], Торопов и Галахов [2].
Здесь приводятся диаграммы Геллера и Ланга (рис. 88) и
Торопова и Галахова (рис. 89).
°C При изучении системы выяви-
2800 г
2600 [
I ZrO.m.p.f/K
2200 1
\-ZrO,m.p.
1800 -I-.
\ cS*
ZrSiOMK \
I ZrO^rSiO, ZrSiO^SiO2
±
0 20
" ZrO2
W 60
МОЛ. °!о
80
100
Si02
Рис. 88. Диаграмма состояния
системы ZrO2—SiO2 (по Геллеру
и Лангу).
лись разные мнения по двум во-
просам: 1) о характере плавления
циркона; 2) о существовании ли-
квационной области (области рас-
слаивания в жидкой фазе).
Геллер и Ланг полагают, что
циркон ZrSiO4 плавится с разло-
жением при температуре 1775 ± 10°.
Кокко и Шромек [4] приводят
для этого процесса температуру
1720 + 20°.
Кертис и Соуман принимают,
что ZrSiO4 подвергается разложе-
нию еще в твердой фазе около
1540°.
Торопов и Галахов указывают на своей диаграмме разложе-
ние циркона на ZrO2 т. р. и кремнезем.
Предположение о возможности образования в системе ZrO2—
—SiO2 двух несмешивающихся жидкостей высказала Барлетт [3].
Торопов и Галахов определили фазовый состав образцов, выдер-
живавшихся при 2200—2450°, и наблюдали область ликвации
в пределах 58—77 мол. % SiO2.
В 1960 г. Глассер, Варшау и Рой [7] из теоретических сооб-
ражений приняли, что область ликвации ограничена составами
приблизительно 15—55 мол. % SiO2, что находится в резком
Таблица 1
Инвариантные точки системы ZrO2—SiO2
Точка - Фазы Процесс Температура, °C
1 ZrO2 + жидкость. Плавление. 2715
2 ZrO2• SiO2 + ZrO2 твердый раствор + SiO2. Разложение в твердом состоянии. Около 1540
3 ZrO2 твердый раствор + жидкость 1 + жидкость 2 (41% SiO2). Монотектическая реак- ция. 2250
4 ZrO2 твердый раствор + жидкость 1 + жидкость 2 (62% SiO2). То же. 2250
5 SiO2 + ZrO2 твердый раствор + жидкость. Эвтектика. 1675
Таблица 2
Кристаллические фазы системы ZrO2—SiO2
Соединение Система кристаллов Габитус Спайность № Np 2V° Оптическая ориентировка
ZrO2 (бадделеит). Моноклинная. Таблицы. По (001). 2.20 2.13 — Плоскость опти- ческих осей (010).
ZrO2-SiO2 (цир- кон). Квадратная. Призмы, пира- миды, двой- ники. Изредка по призме. 1.968— 2.015 1.923— 1.960 +0 Желтая окраска.
105
Силикатные системы
противоречии с экспериментальными данными Торопова и Га-
лахова.
Розен и Муан [9] определили свободную энергию образова-
ния цирконата из окислов в интервале температур от 1180 до
1366°. Экстраполируя полученную кривую
°C
2800 -
на
более высокие
г
2800
2600
2030
2000
2000
1800
'1 тг
ггОгт.р+Ж
ЛА
1 Ж
\7гп
^\2гОгт.р.
ZrSi04
NJ М——--------
1600- I
\2250'
2200 - (
Жидк.
2600 -
2000
гЛёе жидк.
2200
2000
1800
-ZrO^+Ж
2250'
ггог+ж
-1677°
ZrOfZrSiO,*
’то
2гОг
20
2гОгт,рл5Юг
2г510ч+510г
~80~
00 60
Вес. °/о
100
8Юг
Рис.
НИЯ
89.
системы ZrO2—SiO2 (по
Торопову и Галахову).
Диаграмма
СОСТОЯ-
Кристоб.+Ж
1687° 2гОг+криатб.
Zr SiOi+ кристоб.
ZrSiO4+mpud.
~00 60
ZrO2SiOi
Вес.°/о
Рис. 90. Диаграмма
системы ZrO2—SiO2 (по Муану [8]).
1600
1000„-----J-
0 20
2гОг
80 100
5Юг
состояния
температуры, авторы нашли, что свободная энергия реакции
ZrO2+SiO2=ZrSiO4 становится равной нулю около 1680°. Отсюда
делается вывод, что циркон диссоциирует на ZrO2 и кристалли-
ческий кремнезем при температуре лишь незначительно ниже
температуры эвтектики в системе, что соответствует данным То-
ропова и Галахова. На рис. 90 показан приведенный Муаном [8]
новый вариант фазовой диаграммы системы ZrO2—SiO2.
Литература
1. Жирнова Н. А., Сб. Лабор. Инет, керамики, 7, вып. 45, Л., 31, 1934.
2. Торопов Н. А., Ф. Я. Галахов, Изв. АН СССР, ОХН, № 2,
158, 1956.
3. Barlett Н. В., Journ. Amer. Ceram. Soc., 14, № 11, 837, 1931.
4. Cocco A., N. Schromek, La Ceramica (Milan), 12, № 8, 45, 1957.
5. C ur t i s С. E., H. G. S о w m a n, Journ. Amer. Ceram. Soc., 36, № 6,
198, 1953,
Силикатные системы
107
6. Geller R. F., S. М. Lang, Journ. Amer. Ceram. Soc., 32, № 12,157,
1949.
7. G1 a s s e r F. P., I. Warshaw, R. Roy, Phys. Chem. Glasses,
1, 39, 1960.
8. J о n e s T. S., Sh. Kimura, A. M u a n, Journ. Amer. Ceram.
Soc., 50, № 3, 137, 1967.
9. R о s ё n E., A. M u a n, Journ. Amer. Ceram. Soc., 48, № 11, 603, 1965.
HfO2—SiO2
Согласно Кертису, Доней и Джонсону [1], в системе обра-
зуется одно соединение HfSiO4, аналогичное циркону. HfSiO4
имеет тетрагональную сим-
метрию и показатели свето-
преломления: ATg=1.94—
—1.95, ЛГр=1.89; плотность
3.27 г/см3. Параметры эле-
ментарной ячейки: а=6.60,
с=5.97 А.
Предположение, что крем-
незем образует в небольшой
концентрации твердый раст-
вор с НЮ2, пока не подтвер-
дилось.
Схематически область существования фаз в системе HfO2—
—SiO2 приведена на рис. 91.
HfSity тетрагон.
SiO2
НЩ I
тетрагон. | §
HfOz 11
MOHOMUH..^
SO
Вес.%
90
Hfo.
Рис. 91. Схема областей существования
фаз в системе HfO2—SiO2.
g
Й'й,
18
Литература
1. С u г t i s С. E., L, M, D о n e y, J. R, Johnson, Journ. Amer.
Ceram. Soc., 37, № 10, 458, 1954.
ThO2—SiO2
Имеет значение для производства высокотемпературных мате-
риалов в реакторной технике, а также для интерпретации состава
природных ториевых силикатов.
Согласно Гаррису [1], в системе (рис. 92) существует одно
соединение состава ThSiO4, плавящееся инконгруэнтно при
1975 + 50° с разложением на ThO2 и жидкость. Эвтектика имеет
состав приблизительно 95 вес. % SiO2 и температуру 1700 + 10°.
Th[SiO4] встречается в природе в двух формах: моноклинной,
кристаллизующейся по типу циркона и соответствующей мине-
ралу гуттониту (ао=6.8О, fe0=6.96, с0=6.54 А [5]), и тетрагональ-
108
Силикатные системы
ной, кристаллизующейся по типу монацита, отвечающей минералу
ториту (ао=7.ОЗ, с0=6.25 А [31), который в природе встречается
в метамиктном состоянии. Синтезировать эту модификацию путем
реакций в твердой фазе при 1000 и 1250° при нагревании в те-
чение 1000 час. в отличие
от гуттонита не удалось.
Мумптон и Рой [4] полагают,
что стабильным при всех тем-
пературах является только
гуттонит, а торит представ-
ляет метастабильную фазу,
но последующие работы по-
казали, что обе модифика-
ции стабильны в определен-
ных температурных интер-
валах.
Финч с сотрудниками [1 ],
осуществляя кристаллизацию
силикатов тория из раство-
ра-расплава (молибдаты или
вольфраматы щелочных ме-
в платиновом контейнере с градиентом температур,
что ниже 1225° образуется торит, а выше
С
2200
2000.
1800
П02+Ж
1975 ±50
тля,
TltySiOg g"
тюг
Рис. 92.
жидк.
Щ-8Щ,+Ж
_____1тро.±уГ_________
ThOg-SiQg+StOg
-----1_______ «
20 00 60 80 100
Вес.% SiOg
Диаграмма состояния системы
ThO2—SiO2.
таллов)
показали, что ниже 1225° образуется торит, а
1225° — гуттонит. Таким образом, равновесная температура прев-
ращения (при 1 атм.) равна 1225 + 10°. На монокристаллах были
определены показатели светопреломления: для торита No =
= 1.827+0.003, Ne=i.885 + 0.003; длягуттонита Ag=1.930 + 0.005,
Np=A.900+0.003. Плотность торита 6.63+0.10 г/см3, гутто-
нита 7.20+0.10 г/см3.
Литература
1. F i n c h С. В., L. A. Harris, G. W. Clark, Amer. Mineralogist,
49, № 5—6, 782, 1964.
2. H a r r i s L. A., Journ. Amer. Ceram. Soc., 42, № 2, 74 1959.
3. M e n z e r G., Zs. Kristallogr., 106, № 1, 34, 1945.
4. M u m p t о n F. A., R. Roy, Geochim. cosmochim. acta, 21, № 3/4,
217, 1961.
5. Pahst A., Amer. Mineralogist, 37, № 3—4, 137, 1952.
P2O5—S1O2
Интересна с точки зрения оценки действия фосфорных соеди-
нений на сосуды из кварцевого стекла, а также для многих
вопросов химии сложных силикофосфатных соединений. Ком-
Силикатные системы
109
кристал-
Рис. 93. Диаграмма состояния
системы SiO2-P2O6—SiO2.
поненты системы (SiO2 и Р2ОБ) и близлежащие составы застывают
в стекловидном состоянии, промежуточные же хорошо
лизуются [3].
Исследование системы^затрудня-
лось из-за летучести Р2ОБ, немно-
гие старые сведения об этой системе
сомнительны.
Тиен и Тюммель [4] применили
классический метод закалки, поме-
щая смеси в запаянную платино-
вую трубку. Эти авторы нашли,
что в системе существует два со-
единения — SiO2-P2O2 H2SiO2>PaO8.
Они полагают, что Булле и Джа-
ри [2], работавшие в открытой ап-
паратуре, пришли к неправильному
выводу о существовании соединения
3SiO2-2P2Os.
Согласно [4], конгруэнтно плавя-
щееся при температуре 1290° соеди-
нение SiO2*P2Os существует в двух
полиморфных формах с температу-
рой ^перехода г 1030°. Соединение
2SiO2-P2O2 плавится инконгруэнтно
с разложением на SiO2 • Р2О6* и бога-
тую.кремнеземом жидкость при 1120°
(рис. 93). Некоторые сведения по си-
стеме приведены Белянкиным, Тороповым и Коноваловой [1 ],
изучавшими действие фосфорной кислоты на кварцевое стекло.
Литература
1. Бел янкин Д. С., Н. А. Торопов, Н. А. Коновалова,
Труды Лен. технол. инет. им. Ленсовета, вып. 20, 45, 1951.
2. В о u 11 ё A., R. J а г у, Compt. rend., 237, № 4, 328, 1953.
3. Tammann G., Glasstechn. Вег., 3, 86, 1925/1926.
4. T i e n T. Y., F. A. Hummel, Journ. Amer. Ceram. Soc., 45, № 9,
422, 1962.
110
Силикатные системы
V2O5—SiO2
Температуру плавления смесей У2ОБ и SiO2 определяли Кинг
и Сабер [2] и Лукас, Уэдл и Прис [31. Граветт, Бэрхем и Бар-
ретт [1] построили небольшой
стемы VjOj—SiO2 (область, богатая
V2O8; по Граветту с сотрудниками).
Сплошная линия — равновесная диа-
грамма; штриховая — вычисленная диа-
грамма для кремнеземного стекла. 1 —
термический анализ; 2 — предельная
растворимость; 3 — вычисленная пре-
дельная растворимость для кремнеземного
стекла.
участок диаграммы состояния
системы (в области, примыка-
ющей к V2O8) и изучили вли-
яние V2Ot на полиморфные
превращения кремнезема. Со-
единений в системе не обнару-
жено, по-видимому, ее следует
отнести к простым эвтектичес-
ким. Эвтектика между квар-
цем и V2O8 найдена при со-
держании 1.1 ±0.1 вес. % SiO2
(3.2±0.3 мол. %. SiO^ и тем-
пературе 661 ±3°. На рис. 94,
кроме линий равновесной ди-
аграммы (сплошные линии),
приведены линии, характери-
зующие предельную- раствори-
мость кварцевого стекла в пя-
тиокиси ванадия. При всех
температурах растворимость
стекла выше, чем соответству-
ющего кристалла. Обнаружена
небольшая растворимость У2ОБ
в кремнеземе (кварце или кри-
стобалите). Тридимит неустой-
чив в присутствии V2O8. Об-
наружено непосредственное рав-
новесное медленно протекающее
превращение кварца в кристо-
балит при 855±5° (при повышении температуры). Кристобалит
стабилизируется пятиокисью ванадия и становится устойчивым
по крайней мере до 650°.
Литература
1. G г a v е 11 е N. С., D. В arham, L. R. В а г г е 11, Trans. Brit.
Ceram. Soc., 65, № 4, 199, 1966.
2. King W. B., L. L. Suber, Journ. Amer. Ceram. Soc., 38, № 4, 306,
1955.
3. Lucas G., M. Wed d le, A. P r e e c, Journ. Iron a. Steel Inst., 179,
342, 1955.
Силикатные системы
111
Nb2O5—SiO2
Система является частным сечением тройной системы СаО—
—Nb2O5—SiO2, имеющей значение для интерпретации состава ми-
нерала ниокалита Ca4NbSi2O10“£(O, F).
С
1800
1700
'Одна I пЯ я
жидк.,' Лве31сидк-кристоб.^1725'с
1500
1479
1400
1800
Кристоб.+Ж
Tpud.+Tfi
ыодлж ~
Трид.+КЬг05
40 бГ
Вес. %
1300i—^
тго5
80
1470
1448'
100
SiO2
Рис. 95. Диаграмма состояния системы
Nb2O4—SiO2.
Изучена Ибрагимом и Брайтом [1]. Система включает обшир-
ную область двух несмешивающихся жидкостей в пределах от 5
до 80 вес. % Nb2O8, с минимальной температурой 1695°.
Эвтектика при 1448° имеет состав 95 вес. % Nb2Oj, а при
1695° - 5 вес. % Nb2Os (рис. 95).
Литература
1. Ibrahim М., N. F. Н. Bright, Journ. Amer. Ceram. Soc., 45, № 5,
221, 1962.
CrO—SiO2
Хили и Шоттмиллер [1 ] в связи с исследованием системы
полутораокись хрома (Сг2О3)—кремнезем при пониженных дав-
лениях кислорода дали приближенную диаграмму разреза «СгО» —
—SiO2 (рис. 96). Обнаружено одно соединение Cr2SiO4, получаю-
112
Силикатные системы
щееся из расплава при 1400—1500°. Это соединение имеет по-
казатели светопреломления 7Vg=2.03, jVm=1.94, ЛГр=1.93 и
плотность 4.0 г/см3.
°C
1800
Жидк.
Две жидк.\
1700
Расплав
1600-
1500
МО
Si02 +расплав
Сгг03+ \
'Сг+расплав\
Сгг810ч | SiO^CrgSiO^
1300 ——1---------*—«--------1--------'-------
0 20 W G0 80 100
„СгО” Мол.% Si02
Рис. 96. Ориентировочная фазовая диа-
грамма разреза «СгО»—SiO2 (по Хили
и Шоттмиллеру).
Литература
1. Healy G. W., I. С. Schottmiller, Trans. Metallurg. Soc.
AIME, 230, № 3 , 420, 1964.
Cr2O3—SiO2
Имеет значение для производства высокоогнеупорных мате-
риалов и в современной электрометаллургии.
Изучена Бантингом [51; вероятная диаграмма (рис. 97) по-
строена Кейтом [8] по данным Бантинга. Согласно Кейту, в си-
стеме не обнаружено никаких двойных соединений, а отмечается,
образование двух несмешивающихся жидкостей при высоких
температурах. Эти данные подтверждаются и приводимой в ра-
боте Глассера, Варшау и Роя [7] вероятной диаграммой, на
которой, однако, область несмешиваемости ограничивается участ-
ком примерно от 10 до 67 мол. % Сг2О3.
Силикатные системы
113
Температура плавления Сг2О3 по интернациональной шкале
1948 г. составляет 2265 + 24° [6]. По Ольшанскому и Шлепову [1],
температура плавления Сг2О3 равна примерно 2400°.
Смачная и Сальдау [2], изучавшие систему Сг2О3—SiO2
(рис. 98), установили существование одного химического соеди-
1723
[Жидь.А
I/
4
Жидк.В^
Жидк.А+8 >
Окись хрома+Жу
2200°
Окись хрома
жидк.А
Кристоб.+Ж ^0°
Кристоб.+окись хрома
SW2
2265 i25
2100
1900
1700
1500
13000 20
Сг203
. Cr203+Cr203-3Siq, з
№
^гг°з
Рис. 97. Диаграмма состоя-
ния системы Сг2О3—SiO2 (по
Бантингу, построена Кейтом).
Сгг0ц3810£
La
00 60 80 Ю0
sto2
Мол. о/о
Рис. 98. Диаграмма состоя-
ния системы Сг2О3—SiO3
(по Смачной и Сальдау).
нения состава Cr2O3-3SiO2, плавящегося без разложения при
1995°, и двух эвтектик: Эг — 65 мол. % Сг2О3 и 35 мол. % SiO2,
1750°; Э2 — 5 мол. % Сг2О3 и 95 мол. % SiO2, 1680°. Соедине-
ние 1 : 3 в дальнейшем было отмечено Смачной [3] и в системе
Сг2О3—ZrO2—SiO2 с выделением для него поля устойчивости.
Свойства силиката хрома
Свойства По Цветкову, Ершовой, Матвеевой По Смачной, Сальдау
Ng Np Плеохроизм Погасание Индикатриса Кристаллографическая система Отношение к кислотам 1.905 ±0.05 1.790 +0.05 Ng — вишнево-красный, Np — синий. Прямое. Двуосный эллипсоид. Ромбическая. Растворяется в 0.1 н. НС1. 1.902 +0.01 1.810+0.01 Ng — розовый, Np — зеленый или синий. Предположительно ром- бическая.
8 н. А. Торопов и др., КН. 1
114
Силикатные системы
Проверочными экспериментами с системой Сг—Сг2О3—SiO2
Цветков, Ершова и Матвеева [4] указали на сомнительность
результатов Смачной и Сальдау. Ни при каких условиях Цвет-
кову с соавторами не удалось получить соединения Сг2О3-
•3SiO2. Вместе с тем соединение с аналогичной оптической
характеристикой (см. таблицу) имело состав 2CrO-SiO2. Этот
ортосиликат хрома устойчив в восстановительной и нейтральной
средах в интервале 1540—1760°. Ниже 1540° становится мета-
стабильным; может быть сохранен до комнатной температуры
путем закалки. На воздухе при нагревании легко окисляется.
Характеризуется «оливиновым» или «шаннонитовым» спектром
линий на рентгенограмме.
Литература
1. Ольшанский Я. И., В. К. Ш л е п о в, ДАН СССР, 91, № 3, 561,
1953.
2. Смачная В. Ф., П. Я. Сальдау, Зап. Лен. горн, инет., 32, № 3,
313, 1956.
3. Смачная В. Ф., Изв. высш, учебн. завед., Черн. металлургия, № И,
191, 1962.
4. Цветков А. И., 3. П. Е р ш о в а, Н. А. Матвеева, Изв.
АН СССР, сер. геол., № 2, 3, 1964.
5. Bunting Е. N., Journ. Res. Nat. Bur. Stand., 5, № 2, 325, 1930.
6. Bunting E. N., Journ. Res. Nat. Bur. Stand., 6, № 6, 947, 1931.
7. G 1 a s s e r F. P., I. W a r s h a w, R. R о y, Phys. a. Chem. Glasses,
1, № 2, 44, 1960.
8. К e i t h M. L., Journ. Amer. Ceram. Soc., 37, № 10, 491, 1954.
UO2—SiO,
Существенна для технологии урановых топливных элементов.
Систему изучили Ланг, Кнудсен, Филлмор и Рот [2] на по-
рошкообразных смесях в области температур 800—1600° и для
составов в пределах 10—90 мол. % SiO2. Авторами не обнаружено
химических соединений и твердых растворов. Для эвтектики
дается приблизительный состав 85—90 мол..% SiO2 и температура
1650 + 10° (рис. 99).
Фукс и Гекстра [1] синтезировали в гидротермальных усло-
виях силикат четырехвалентного урана USiO4, соответствующий
минералу коффиниту. Мелкие"кристаллы USiO4 относятся к тетра-
гональной сингонии с параметрами решетки: а=6.981 +0.004,
р=6.250 + 0.005 кХ. Показатель светопреломления образца, про-
Силикатные системы
115
каленного при 750°,— 1.83; прокаленного в вакууме при 1000° —
1.88. Авторы приводят инфракрасные спектры USiO4.
USiO4 стабилен до 1000° в вакууме и до 500° на воздухе.
Лунгу [3], визуально на-
блюдая плавление смесей
UO2-f-SiO2 с последующим мик-
роскопическим изучением зака-
ленных образцов, построил
Рис. 99 Л Диаграмма состоя-
ния системыД1Оа—SiOa.
2800
2600
2000
2200
2000
1800
UOn+SiO?
1600'-----1----------------1-----
О 20 00 60 80 100
U02 Мол.% Si0z
Рис. 100. Диаграмма плавко-
сти системы UOa—SiOa (по
Лунгу).
диаграмму плавкости к системы (рис. 100). Химических со-
единений не наблюдалось. Установлена широкая область не-
смешивающихся жидкостей. Коэффициент термического расши-
рения образцов, содержащих от 50 до 80 мол. % UO2, составляет
80-10-’.
Литература
I. Fuchs L. Н., Н. R. Hoekstra, Amer. Mineralogist, 44, № 9—10,
1057 1959.
2. Lang S. M., F. P. К n u d s e n, C. L. F i 1 1 m о r e, R. S. R о t h,
Nat. Bur. Stand., Circ. № 568, 17, 1956.
3. L u n g u С. H., Rev. de phys. (Roumaine), 7, № 4, 419, 1962.
MnO—SiO2
Имеет значение для фазового анализа металлургических шла-
ков. В природе известны минералы MnjSiO4 (тефроит) и MnSiO3
(родонит).
8*
116
Силикатные системы
Инвариантные точки системы МпО—SiO2[l]
Точка Фазы Процесс Состав, вес. % Темпе- ра- тура, °C
МпО Si О,
1 Кристобалит-)- жидкость. Плавление. . 100 1723
2 Кристобалит-)- жидкость А-|-жидкость В. Ликвация. 1 99 1705
О и Кристобалит-)-жидкость А А-жидкость В. » 45 55 1705
4 Тридимит-1- кристобалит. Полиморфные превращения. — 100— —46.5 1470
5 Родонит (MnSiO3)-|-кремне- зем (SiO2)-(- жидкость. Перитектика. 55.5 44.5 1291
6 Родонит (Мп8Ю3)-|-триди- мит-|-жидкость. Инконгруэнт- ное плавление. 54.14 45.86 1291
7 Тефроит (Mn2SiO4)-|-родо- нит (Мп8Ю3)-|-жидкость. Эвтектика. 61.7 38.3 1251
8 Тефроит (Мп28Ю4)+жид- кость. Конгруэнтное плавление. 70.26 29.74 1345
9 Тефроит (Mn2SiO4)-|- манга- нозит (МпО) -|- жидкость. Эвтектика. 74.5 25.5 1317
10 Манганозит (МпО)-(-жид- кость. Плавление. 100 1850
Наиболее полно изучена Уайтом, Ховат, Хеем [2] и Глассе-
ром [1]. На рис. 101 представлена диаграмма равновесия си-
стемы МпО—SiOa по Глассеру. В отличие от данных Уайта с со-
“С
1800
1850
i
1700 V
КОО - §
Жидк.
13^5
§
Кристов.+Ж
Две жидк.
, 1705° 1723
1500
iwo- |
13°0 Манганозит* L.
1200 тефроит р
0 20 Г U0 \ 60
МпО Mn^SiO^ MnSiO3
1470
Грид. *ж
. . 1291
MnSiO/Ж родошп+трид.
мит*тефроит
вес.%
80 100
5Юг
Рис. 101. Диаграмма состояния системы
МпО—SiO2.
Силикатные системы
117
авторами тефроит плавится, по Глассеру, без разложения при
1345° (по Уайту и др.—с разложением на МпО и жидкость при
1340°).
Литература
1. G 1 a s з е г F. Р., Amer. Joum. Sci., 256, № 5, 398, 1958.
2. W h i t е J., D. Howat, R. H a y, Joum. Roy. Techn. Coll. (Glasgow),
3, 321, 1934.
FeO—SiO,
Интересна для анализа фазового состава шлаков цветной ме-
таллургии, зонального динаса мартеновских печей и пр.
В системе имеется одно двойное соединение Fe2SiO4, отве-
чающее природному минералу фаялиту, конечному члену оли-
виновых твердых растворов фаялит—форстерит (MgaSiO4).
Изучалась Цмелем [1], Боуэном и Шерером [7], Алленом
и Сноу [5] и др.
Цмель определил температуру плавления фаялита 1209°
и эвтектики фаялит—вюстит 1173°, что практически подтверди-
лось данными Боуэна и Шерера; диаграмма состояния по дан-
ным последних приводится на рис. 102. Проверочное исследование
проведено Алленом и Сноу для части системы фаялит—вюстит.
Их диаграмма приводится на рис. 103.
Таблица 1
Инвариантные точки системы FeO—SiO2 (по Боузну и Шереру)
Точка Фазы Процесс Состав, вес. % Темпера- тура, °C
FeO S1O2
1 Кристобалит-|-жидкость А -|- +жидкость В. Ликвация. 3 97 1696
2 Кристобалит-)- жидкость А -|- +жидкость В. » 42 58 1696
3 Тридимит-1- фаялит-|- жидкость. Эвтектика. 62 38 1178
4 Фаялит-|- жидкость. Плавление. 70.5 29.5 1205
5 Фаялит-j-вюстит («FeO»)-(-жид- кость. Эвтектика. 76.0 24.0 1177
6 Вюстит+ жидкость. Плавление. 100 — 1380
118
Силикатные системы
Таблица 2
Кристаллические фазы системы FeO—SiO2
Соедине- ние Система кристаллов Габитус Спайность Плот- ность, г/см3 Ng Np 2V° Опти- ческая ориен- тиров- ка
«ГеО» (вюстит). Fe2SiC>4 (фаялит). Кубиче- ская. Ромбиче- ская. Таблицы по (100). Ясная по (010) и неясная по (100). 4.32 1.886 2.32 1.835 57 х = ь
Температуры плавления фаялита (1204^2°) и эвтектики (1177±
±2°) сходны или одинаковы с таковыми Боуэна и Шерера, но
состав эвтектики различен, а именно: 78.5 вес.% FeO и 21.5% SiOa,
или более точно: 75.0% FeO, 3.6% FeaO3, 21.4% SiOa. Изгиб
°C
1700 4-
1500 L
1300-
Fe2O3 6 жидкости при тетратуре
ликбидуса, бес. % \
^10
- 5
0 20 W 60 I 80 100
SiO, D „ Fe-SiSk FeO
г вес.°/о г *
Рис. 102. Диаграмма состояния системы
FeO—SiO2 (по Боуэну и Шереру).
на кривой ликвидуса вюстита найден при 97% FeO. Присутствие
небольшого количества неидентифицированной фазы, кристал-
лизующейся при 1177° или ниже, указывает, что истинное би-
нарное равновесие не достигнуто. Наиболее «чистый» состав
фаялита (70.16 вес. % FeO, 0.14% Fe2O3, 29.7% SiO2) был полу-
чен при выдержках в течение 1 ч. и 40 м. при 1204° в железном
тигле и в атмосфере СО.
Силикатные системы
119
Бернал [6] высказал предположение, что обычный железистый
оливин при высоком давлении может образовывать структуру
типа шпинели. Действительно, Рингвуд [14] получил шпинель-
ную форму 2FeO-SiOa при давлении 35—40 кбар и температуре
600°. Бойд и Инглэнд [8] подтвердили результаты Рингвуда
и на кривой Р—t обнаружили точку перехода при 60 кбар и тем-
Рис. 104. Влияние давления на плав-
кость и полиморфизм FegSiOi (по
Акимото с сотрудниками).
°С
МО
Si02 Вес.°/о FeO
□ 7 л Z • 3 д 4
Рис. 103. Диаграмма состояния фая-
лит—вюстит (по Аллену и Сноу).
1 — данные Аллена и Сноу для атмосферы
азота; 2 — то же для атмосферы СО/СО2;
з — данные Боуэна и Шерера; 4 — дан-
ные Шумана и Энсио 115].
пературе 1500°. Акимото, Комадо и Куширо [4] изучили влия-
ние давления на плавкость и полиморфизм FeaSiO4, доведя тем-
пературу исследования до 1700°. Результаты этих авторов пред-
ставлены на рис. 104. Тройная точка: Fe2SiO4 (фаялит)—Fe2SiO4
(шпинель)—жидкость находится при 1520° и давлении 62 кбар.
Кривая плавкости оливиновой модификации выражается урав-
_________________________41_____
нением Р (коар) (°К) 1478]4'8_1'
Кривая превращения оливин—шпинель до температуры 1150°
может быть представлена линейной формулой: Р (кбар)=19-]-
4-0.033 t (° С).
120
Силикатные системы
Линдслей, Мак-Грегор и Дэвис [13] показали, что в условиях
повышенных давлений в системе реализуется второе - соедине-
ние FeSiOg — ферросилит. В зависимости от температуры и дав-
ления наблюдаются три полиморфные формы ферросилита:
клиноферросилит, ортоферросилит и ферросилит III. В после-
дующем Линдслей [11 ] показал, что в условиях более повышен-
ных температур существует еще одна не поддающаяся закалке
модификация — протоферросилит. Линдслей и Бойд [12] пока-
°C
1600 —JKpucmog+)p
МО - 1Три&ж
I
-t-Фаялит+трщ}. I
1000 -<Фаялит+а.-квари
800
600 < Фаялит /
+ /
W0 - /3-кварц I
ос.-Кварц+Ж
Козсит
+
ж
Прогп^
Ортоферросилит
Клиноферросилит
200 -
О 10 20 30 W 50
Р,кбар
Рис. 105. Фазовая диаграмма в координатах
«температура—давление» системы для соста-
ва, отвечающего FeSiO3 в равновесии с ме-
таллическим железом (по Линдслею).
зали, что инверсия между ромбическим и моноклинным ферро-
силитом (FeSiOg) происходит при 815° и 20—40 кбар. На P-t-
диаграмме, построенной для состава, отвечающего FeO-SiO2
(рис. 105), предположительно дается поле протоэнстатита, но
при закалке протоэнстатит не получается, а наблюдаются ферро-
силит III и клиноферросилит.
Акимото с сотрудниками [2, 3] синтезировали ферросилит
FeSiOg в бомбе высокого давления из смеси фаялита и кремне-
зема при 900° и 20 кбар. При этих условиях имеет место равно-
весие реакции FeaSiO4+SiO2=2FeSiO3.
Для железистого пироксена описываются две полиморфные
формы: форма ортоферросилита (при низком давлении) и прото-
ферросилита (при высоком давлении).
Параметры элементарной ячейки ортоферросилита: а=18.42+
+0.01, Ь=9.068±0.005, с=5.269+0.006 А.
Силикатные системы
121
Клиноферросилит и ортоферросилит в структурном отноше-
нии являются аналогами полиморфных форм энстатита. Третья
модификация — ферросилит III, по данным Барнхэма [9], об-
ладает триклинной симметрией. В дальнейшем Барнхэм [10],
пользуясь монокристаллами, определил параметры кристалли-
ческой решетки всех трех модификаций и показал, что кристал-
лическая структура ферросилита III сходна с таковой для пиро-
ксеноидного родонита и пироксмангита (табл. 3).
Таблица 3
Параметры кристаллической решетки модификаций FeSiO3
(по Барнхэму)
Клиноферросилит Ортоферросилит Ферроси- лит III ПироКС" мангит
a, A 9.7085±0.0008 18.431 ±0.004 6.57 6.67
b, A 9.0872±0.0011 9.080 ±0.002 7.51 7.56
c, A 5.2284 ±0.0006 5.238+0.001 22.68 17.45
a — __ 115.3° 113.7°
p 108.432 +0.004° — 80.5° 84.0°
V ., __ — 95.5° 94.3е
v, A3 437.6 ±0.1 876.6±0.5 — —
z 8 16 — —
Пространственная группа P2j/c Peca — —
Литература
1. Ц м е л ь И. А., Журн. Русск. металлург, общ., 1, № 6, 783, 1912.
2. AkimotoS., Н. Fujisawa, Т. Katsura, Journ. Geophys.
Res., 70, № 8, 1969, 1965.
3. AkimotoS., T. Katsura, Y. Syono, H. Fujisawa,
E. К о m a d a, Journ. Geophys. Res., 70, № 20, 5269, 1965.
4. A k imo t о S., Е,- К oma d a, I. К u s h i r o, Techn. Rep. Inst.
Solid. State Phys. Univ. Tokyo, ser. A, № 212, 1966.
5. A 11 e n W. C., R. B. Snow, Journ. Amer. Ceram. Soc., 38, № 8, 264,
1955.
6. Bernal J. D., Observatory, 59, 268, Geophysical discussion, 1936.
7. В о w e n N. L., J. F. Schairer, Amer. Journ. Sci., 24, 141, 177,
1932. Русск. перев. в сб.: Классические работы по физико-химии сили-
катов, ОНТИ, Л., 86, 1937.
8. Boyd F. R., J. L. England, Carnegie Inst. Washington, year book
59, 47, 1959—1960.
9. Burnham C. W., Carnegie Inst. Washington, year book 63, 237,
1963—1964.
10. В u r n h a m C. W., Carnegie Inst. Washington, year book 64, 202,
1964—1965.
11. LindsleyD. H., Carnegie Inst. Washington, year book 64, 148,
1964—1965.
122
Силикатные системы
12. LindsleyD. Н., F. R. Boyd, Trans. Amer. Geophys. Union, 46,
№ 1, 181, 1965.
13. LindsleyD. H., I, D. MacGregor, В. T. C. D a v i s, Car-
negie Inst. Washington, year book 63, 174, 1963—1964.
14. R i n g w о о d A. E., Geochim. cosmochim. acta, 15, № 1, 18, 1958.
15. Schuhmann R. Jr., P. J. E n s i o, Joum. Metals, 3, № 5, 401,
1951; Trans, Amer. Inst. Mining Met, Engrs., 191, 401, 1951.
CoO—SiO2
Имеет значение для металлургии кобальта. Теоретически ин-
тересна вследствие аналогий в соединениях двухвалентного же-
леза, кобальта и никеля.
Система частично изучена Асанти и Кольмейером [5]. Кроме
давно известного соединения 2CoO-SiO2, соответствующего фая-
°C
т
1700
1600
1500
1600
1300
Жидк.
f Две жидк. I
л
Оливин/ Кристоб.+Ж
Трив.+Ж
Оливин+трид.
Рис. 106. Диаграмма со-
стояния системы СоО—
SiO2.
СоО
+
' Оливин
0 20/60 60 80 100
Со° 2Co0-Si02 Вес°/а Si02
Рис. 107. Диаграмма состоя-
ния системы СоО—SiO2 (по
Массу и Муану),
литу, авторы получили кристаллы, по-видимому, состава СоО-
•SiO2 (рис. 106).
Шмид [12] синтезировал Co2SiO4 путем проведения реакции
в газовой среде: SiF4 (газ)-|-2СоР2 (газ)-|-4Н2О (газ)=Со2ЗЮ4
(tb.)-[-8HF (газ). Согласно Грейгу [8], в системе наблюдается обра-
зование двух несмешивающихся жидкостей в области, примыкаю-
щей к SiO2. Согласно Бильтцу и Лемке [6], соединение 2CoO-SiO2
плавится при 1345° и имеет плотность 4.677 г/см3. По Дилактор-
скому и Никогосяну [2], кристаллы 2CoO-SiO2 имеют 7Vg=1.94,
АГр=1.89, 2V0 — средний. Дисперсия слабая— r>v; плеохроизм
в розовых и фиолетовых тонах. По Диеву и Грибовскому [1],
ортосиликат кобальта кристаллизуется в ромбических кристаллах.
Силикатные системы
123
Параметры элементарной ячейки определили Чиаллителли и
Кола [7]: а=5.99, 6=4.77, с=10.27 А; расчетная плотность
4.63 г/см3. Рингвуд [11] показал, что обычная оливиновая модифи-
кация Co2SiO4 при давлении приблизительно 70 кбар и темпера-
туре 700° переходит в фазу со структурой типа шпинели
с а=8.140+0.005 А и плотностью (вычисленной) 5.17 г/см3.
Торопов и Бабаян [3] синтезировали ортосиликат кобальта,
исходя из соосажденных гидроокислов, их сплавлением при 1500°
и последующей кристаллизации (1400—1300°). Кристаллы
Co2SiO4 розового цвета, не плеохроируют, оптически отрицательны,
погасание прямое, 2V0 — средний. Показатели светопреломления:
Ag=1.96, Ар=1.90; параметры кристаллической решетки:
а=4.743, 6=10.294, с=5.994 А.
Полную диаграмму состояния системы СоО—SiO2 построили
Масс и.Муан [9] методом «отжига и закалки». Подтверждено
только одно соединение Co2SiO4 со структурой оливина (рис. 107),
плавящееся конгруэнтно при 1415 + 5°. Установлена большая
область несмешиваемости расплавов в районе, богатом кремнезе-
мом. Отмечается, что система не может рассматриваться как строго
бинарная, но содержание кобальта в состоянии 'валентности, пре-
вышающем 2, незначительно.
Акимото с сотрудниками [4] изучили фазовые отношения (по-
лиморфизм) CoSiO3 в диапазоне температур 620—1280° и давле-
ний 12—73 кбар. При повышении давления из эквимолекулярной
смеси Co2SiO4 и SiO2 вначале образуется ромбический пироксен
CoSiO3, который затем переходит в моноклинный пироксен. Урав-
нение границы равновесия реакции оливин+кварц=ромбический
пироксен: Р (кбары)=15-)-0.0071 (°C). Уравнение фазовой границы
ортопироксен—клинопироксен: Р (кбары)=11+0.044 t (°C).
Согласно исследованиям Номура с сотрудниками [10], орто-
силикат кобальта Co2SiO4 при 49 + 2°К претерпевает магнитное
превращение, когда при понижении температуры от парамагнит-
ного состояния переходит в антиферромагнитное. В области пара-
магнитного состояния наблюдается строгое подчинение закону
Кюри—Вейсса с Л^ф — 5.09 + 0.6 рв и 6 = 65+ 2° К.
Литература
1. Д и е в Н. П,, В. В. Грибовский, Журн. прикл, хим,, 18, № 3,
181, 1945,
2, ДилакторскийН. Л., X. С. Н и к о г о с я н, Сов. геология,
№ 2, 101, 1944.
3. Торопов Н. А., С, А. Бабаян, Журн. неорг, хим., И, № 1,
28, 1966.
4. Akimoto S., Т. К a t s и г a, Y, S у о п о, И. F u j i s a w а,
Е. К о m a d a, Journ, Geophys, Res., 70, № 20, 5269, 1965.
124
Силикатные системы
5. Asa nt i P., E, J. Kohlmeyer, Zs. anorgan. allgem, Chem.,
265, № 1—3, 90, 1951,
6, Blitz W., A. Lemke, Zs. anorgan, allgem. Chem,, 203, 331, 1932.
7. C i a 11 i t e 11 i P., M, Cola, Atti Accad. naz, Lincei rend., Cl. sci.
fis,, mat. e natur,, 17, № 5, 172, 1954.
8, Greig J. W., Amer, Journ, Sci,, (5), 13, № 73, 1, 1927.
9, Masse D. P,, A. M u a n, Trans. Amer, Inst, Mining Met. Engrs,,
233, № 7, 1448, 1965.
10. N о m u r a S., R. S a n t о r o, J. F a n g, R. N e w n h a m, Journ.
Phys. Chem. Solids, 25, № 8, 901, 1964.
11. R i n g w о о d A. E., Nature, 198, № 4875, 79, 1963.
12. Schmid H., Zs. anorgan. allgem. Chem., 327, № 1—2, 110, 1964.
NiO—SiO2
Система имеет большое кристаллохимическое и петрологиче-
ское значение.
Григорьев [1] показал, что в системе кристаллизуется только
одно соединение — ортосиликат никеля 2NiO-SiO2, являю-
щийся аналогом фаялита 2FeO*SiO2. Григорьев считал, что си-
ликат никеля образует эвтектики с NiO и SiO2. В работе Фил-
липса, Хутта и Варшау [7] показано, что соединение 2NiO-SiO2
диссоциирует в твердом состоянии при 1545 + 5° и может быть син-
тезировано путем твердофазовой реакции при 1200—1400°.
Как уже наблюдал Грейг [5], в системе имеет место расслаи-
вание богатых кремнеземом расплавов. Филлипс с сотрудниками
показали, что минимальная температура образования двух жидко-
стей равна 1685° (рис. 108). Система NiO—SiO2 относится к простым
эвтектическим с широкой областью расслаивания.
Соединение Ni2SiO4 ромбической системы имеет структуру
оливина [9]. Показатели светопреломления: Ng—2.019, Nm=
=1.987, 7Vp=1.976. Удлинение положительное. Рингвуд [8] пока-
зал, что при температуре 650° и давлении 18 000 атм. оливиновая
модификация Ni2SiO4 переходит в другую кристаллическую форму,
обладающую структурой шпинели. Параметр решетки шпине-
левой формы 8.044 А; вычисленная плотность 5.34 г/см3, что на
9% выше, чем для оливиновой формы.
Торопов и Бабаян [2] синтезировали Ni2SiO4 спеканием со-
ответствующей смеси окислов при 1300—1450°. Кристаллы орто-
силиката никеля светло-зеленого цвета, не плеохроируют, оп-
тически отрицательны, погасание прямое, изредка волнистое,
2V0 — средний. Показатели светопреломления: 7Vg=1.99, Np=
= 1.94; плотность 4.72 г/см3; параметры элементарной ячейки:
а=4.724, 6=10.105, с=5.928 А.
Ньюнхэм с сотрудниками [6], получавшие Ni2SiO4 действием
ортосиликата натрия на нитрат никеля с последующим прокали-
Силикатные системы
125
ванием при 1400°, для параметров элементарной ячейки приводят
следующие величины: а=10.121 + 0.005, 6=5.915 + 0.002,
6=4.727 + 0.002 А; пространственная группа Рптпа с четырьмя
формульными единицами в элементарной ячейке.
Акимото с сотрудниками [4], применяя более усовершенствован-
ную аппаратуру высокого давления, изучили переход оливиновой
модификации NiaSiO4 в шпи-
нельную в температурном ин-
тервале от 700 до 1500° и интер-
вале давлений от 20 до 40 кбар.
Уравнение кривой перехода
оливин—шпинель: Р — 19
0.012 t (°C); ^ = 12бар/град.,
Р выражено в килобарах.
Хаяси с сотрудниками [3]
в условиях высоких давлений
(20-50 кбар, 300-2000°) син-
тезировали ^новое соединение,
по-видимому никелевый пиро-
ксен NiSiO3, имеющий две фор-
мы: моноклинную (получающу-
юся при 50 кбар и 900—1500°)
и ромбическую (37—50 кбар и
1600—2000°). Показатели све-
топреломления ромбического
пироксена: Ag=1.665, Nm=
=1.661, Ар=1.655; моноклин-
ного: jVg=1.661, Nm=A. 656,
‘с
2100
m
1700
1500
Ж+NiO Жи3к\
\ J Двеживк. V
4550110° S \М--------------
---------.—и---------------и
'1545+5 в в “ NiO+кристой. кристоб.
--------- -----в-;---------Е------
Никел. оливин+кристоб.
NiO
никел. оливин “ Никел. оливин+трив.
0 20/40 50 80
то, гто-sto.
Мал. %
о/ п 2 лЗ л4
wo
Рис. 108. Диаграмма состояния си-
стемы NiO—SiO2.
1 — жидкость; 2 — NiO; 3 — никелевый
оливин; 4 — SiOa.
Ар=1.653; параметры элемен-
тарной ячейки соответственно: а0=8.66, Ьо=17.74, с0=4.99 А
и а0=7.75, Ьо=9.О2, с0=5.35 А; 0=9Г39'.
Ньюнхэм с сотрудниками, производившие определение маг-
нитной восприимчивости Ni2SiO4, показали, что парамагнитное—
антиферромагнитное превращение происходит при 34° К. Выше
60° К (в парамагнитной области) зависимость магнитной воспри-
имчивости от температуры подчиняется закону Кюри—Вейсса
с 6 = 7° К и Рвфф = 3.15Ив.
Литература
1. Григорьев Д. П., Бюлл. Моск. общ. испит; прир., секц. геол., 15,
№ 2, 149, 1937.
2. Торопов Н. А., Бабаян, Журн. неорг. хим., 11, № 1, 28, 1966.
126
Силикатные системы
3. Hayashi Н., N. Nakayama, К. Hasegawa, S. Mizu-
k u s a, H. T a к a g i, Y. T о г i i, Rep. Govt. Industr. Res. Inst.
Nagoya, 15, № 6, 185, 1966.
4. AkimotoS., H. Fujisawa, T. Katsura, Journ. Geophys.
Res., 70, № 8, 1969, 1965.
5. Greig J. W., Amer. Journ. Sci., (5), 13, № 74, 133, 1927,
6. Newnh am R., R. S a n t о r o, J. Fang, S. N о m u r a, Acta
crystallogr., 19, № 1, 147, 1965.
7. Phillips B., J. J. H u 11 a, I. W a r s h a w, Journ. Amer. Ceram.
Soc., 46, № 12, 579, 1963.
8. Ringwood A. E., Nature, 187, № 4742, 1019, 1960.
9. Taylor N. W., Zs. phys. Chem., 139, № 4, 241, 1930.
СИСТЕМЫ ТИПА R'2O—R"0 И R'O—R"0
Li.,0—ZnO
Чимино, Марецио и Санторо [1] показали, что некоторое ко-
личество LiOa может входить в решетку окиси цинка, увеличивая
параметры кристаллической решетки последней. Соответствую-
щие данные приведены в таблице.
Изменение параметров элементарной ячейки окиси цинка а и с
при образовании твердого раствора в системе Li2O—ZnO
Li2O, атомн. % Температура обжига, °C а, кХ с, кХ
Нет. 900 3.24314 5.1946,
» 1000 3.24324 5.1953,
» 1150 3.2432, 5.1956,
0.32 900 3.2432,, 5.19544
0.12 1000 3.24311 5.1951!
0.36 1200 3.2430в 5.1960,
0.30 1240 3.24308 5.19574
Литература
1. Cimino А., М. Marezio, A. Santoro, Naturwissensch., 44,
№ 12, 348, 1957.
Cu2O—РЬО
Систему изучали Гофман и Кольмейер [2] и Гебхардт и Об-
ровский [1].
В результате термического анализа Гофман и Кольмейер нашли
эвтектику при содержании 80 вес. % РЬО и температуре 700°
128
Системы типа R20—R"0 и R'O—R"0
(рис. 109). Эти авторы предполагают, что в системе могут быть
твердые растворы и соединение, состав которого им определить
Рис. 109. Диаграмма со-
стояния системы Си2О—
—РЬО (по Гофману и Коль-
мейеру).
Рис. 110. Схематическая
предполагаемая диаграмма
системы CiijO—РЬО (по
Гофману и Кольмейеру).
не удалось (рис. 110). Гебхардт и Обровский полагают, что в си-
стеме существует соединение Си2О-РЬО, устойчивое ниже 580°
(рис. 111).
Рис. 111. Диаграмма состояния
системы Си2О—РЬО (по Геб-
хардту и Обровскому).
Литература
1. Gebhardt Е., W. О b г о w s k i, Zs. Metallkunde, 45, № 6, 332,
1954.
2. Hoffmann -W., J. Kohlmeyer, Zs. Metallkunde, 45, № 6, 339,
1954.
Системы типа R20—R"0 u.R'O—R"0
129
Li2O—МпО
Интересна для керамики с точки зрения электрических и
магнитных свойств образующихся в ней соединений.
Джонстон и Хейкес [1 ] произвели спекание перекиси лития
(Li2O2) и закиси марганца (МпО) при температурах от 550 до 900°
и построили на основании рентгеновских данных для полученных
образцов фазовую диаграмму части системы; Li.cMn(1_.1.)O при
Рис. 112. Фазовая диаграмма
части системы Ti2O—МпО.
Рис. 113. Зависимость магнитной
восприимчивости для Li«Mn(1_x)O
'при различном значении х.
1 — Llo.aeMno.eeO; 2 — Li0.2MH0.eO; 2 —
Lio.iMn0.oO; 4 — Lio.05bl1lo.05O; 5 — МпО.
значении х от 0 до 0.7 (рис. 112). Постоянные решетки ромбиче-
ского соединения LiMnO2: а=2.8117, Ь=5.7634, с=4.579в А;
плотность пикнометрическая 4.23, вычисленная (исходя из двух
формульных единиц в элементарной ячейке) 4.20 г/см3.
Постоянная решетки фазы со структурой МпО колебалась
в зависимости от ее состава от 4.3033 для состава Li0.gosMn,, в92О
до 4.4279 для состава Li0 042Мп0 958О.
Диаграмма зависимости магнитной восприимчивости (х) на
моль МпО от состава для LiJBMntl_a.,0 изображена на рис. 113
по данным [1]. Кривые характеризуют Li^Mn^^jО как материал,
который в зависимости от состава меняет свой характер от ти-
пичного антиферромагнитного до парамагнитного.
Литература
1. JohnstonW. D., R. R. Heikes, Journ. Amer. Chem. Soc., 78,
№ 14, 3255, 1956.
9 H. А. Торопов и др., кн. 1
130
Системы типа R2O—Н"0 и R'O—R''O
Li2O—NiO
Имеет значение в связи с наличием у смешанных окислов ката-
литических свойств; так, например, на полупроводниковые свой-
ства окиси никеля заметно влияет введение в ее решетку ионов
лития.
Феншам [1], изучая твердые растворы Li2O в NiO, показал, что
параметр решетки NiO уменьшается с возрастанием содержания
Li до 5 атомн.%. При более высоком содержании лития в твердом
растворе рентгеновские снимки показали наличие второй фазы —
Рис. 114. Кривые кинетики
изотермического образования
твердых растворов в системе
Ы2О—NiO (исходные веще-
ства — окись никеля и карбо-
нат лития).
Li растворенный,атомн.%
Рис. 115. Параметр эле-
ментарной ячейки твердых
растворов окиси лития в од-
ноокиси пикеля.
металлического никеля. Примерно такие же данные получил
Иошио Иида [3], как зто видно на диаграмме рис. 114, из которой
явствует, что растворимость Li2O в окиси никеля (вес.%) зави-
сит как от температуры, так и от времени выдержки образцов при
образовании твердого раствора.
Иида и Хаяси [4] установили, что предельная концентрация
окиси лития в твердом растворе при 800°, когда растворимость
достигает максимальной величины, составляет 25 атомн.%.
Уменьшение параметра кристаллической решетки NiO при рас-
творении в нем окиси лития показано на рис. 115. В твердом рас-
творе Li2O—NiO присутствует некоторое количество Ni3+, при-
чем количество ионов никеля с повышенной валентностью оказы-
вается таким же, как и количество растворенных ионов Li+.
Хаяси и Иида [2] выражают состав твердых растворов фор-
мулой Ni^Li^NP+O.
Системы типа R20—R"0 и R'O—R"0
131
Литература
1. Fensham P. J., Journ, Amer. Chem. Soc., 76, № 4, 969, 1954.
2. H ayashi H., Y. I i d a, Rep. Govt. Industr. Res. Inst. Nagoya, 14,
№ 8, 291, 1965.
3. lida Y., Journ. Amer. Ceram. Soc., 43, № 2, 117, 1960.
4. I i d a Y., H. H a у a s h i, Bull. Chem. Soc. Japan, 37, № 5, 659, 1964.
MgO—BeO
Система интересна для получения новых высокоогнеупорных
составов.
Руфф, Эберт и Кравчинская [3], Вартенберг и Профет [4],
Вартенберг, Ройш и Саран [5] на основании исследования диа-
граммы плавкости пришли к выводу, что система относится
к простым эвтектическим. Относительно состава и температуры
плавления эвтектики сущест-
вуют различные данные.
Руфф с сотрудниками для
эвтектики приводят состав
2MgO ЗВеО и температуру плав-
ления 1955°. Вартенберг с со-
трудниками в работе [4] ука-
зывают температуру 1670° для
эвтектики состава MgO-ВеО, в
работе [5] — температуру 1875°
при том же составе.
Чзпман [1] в связи с ис-
следованием системы MgO—
—ВеО—ZrO2 привел некоторые
данные о системе MgO—ВеО,
согласно которым эвтектика
содержит 69+2% ВеО и имеет
температуру плавления 1860+
+ 10°.
Кордис в 1964 г. предпринял
Рис. 116. Фазовая диаграмма
системы MgO—ВеО (по Кордису).
повторное, более тщательное ис-
следование системы MgO—ВеО [2], обратив внимание главным
образом на богатую окисью бериллия ее часть. Химическое соеди-
нение ЗВеО-MgO, на которое есть указания в литературе, не было
обнаружено. По Кордису, эвтектика содержит 31 + 2 мол. % MgO
и плавится при 1838+13° (рис. 116).
Рентгеновское определение сплавленных, богатых окисью
бериллия образцов не показало изменения параметров решетки
ВеО, которые оставались в пределах а0=2.698+0.002 и
9*
132 Системы типа R20—R"0 и R'O—R"0
c=4.378+0.004 А. Хотя Кордис таким образом и не обнаружил
растворимости MgO в ВеО, он, однако, не исключает образования
твердых растворов при более высоких температурах.
Вильямс в дискуссионной заметке [6], ссылаясь на опыты Бе-
кера, указывает, что в небольшом количестве (меньше 1%) MgO
может растворяться в окиси бериллия, что видно из следующих
данных. Параметры решетки ВеО без MgO: а=2.69802+ 0.0006,
с=4.37783 ±0.00018 А, с/а=1.62261; с 1% MgO: а=2.69873 +
±0.00005, с=4.37808± 0.00015 А, с/а=1.62227.
Твердых растворов на основе MgO обнаружено не было.
Литература
1, С h а р m а n А. Т., Journ. Amer. Ceram. Soc., 46, № 4, 171, 1963.
2. К ora is J., Journ. Nucl. Materials, 14, 322, 1964.
3. R u f f O., F. E bert, U. К r a w c z у n s k y, Zs. anorgan. allgem.
Chem., 231, № 4, 333, 1933.
4. Wartenberg H., E. Prophet, Zs. anorgan. allgem. Chem., 208,
№ 8, 369, 1932.
5. W a r t e n b e r g H., H. J. R e u s c h, E. S a r a n, Zs. anorgan. all-
gem. Chem., 230, № 3, 267, 1936.
6. Williams J., Journ. Nucl. Materials, 14, 337, 1964.
CaO—BeO
Имеет значение для получения огнеупорной керамики.
Вартенберг, Ройш и Саран [5] экспериментально построили
кривую ликвидуса в системе ВеО—СаО с наинизшей темпера-
турой плавления смеси 1470° для состава, содержащего примерно
65 мол.% ВеО^рис. 117). Адер и Бингл [1] установили в этой си-
стеме соединение Са2Ве3ОБ и эвтектику между ним и СаО при 1360°.
По проверочным экспериментам Поттера и Гарриса [4], эвтек-
тика в системе ВеО—СаО плавится при 1360+5° и имеет состав
60 мол. % ВеО и 40% СаО.
При скорости охлаждения всех смесей от 1585 + 5° примерно 20°
в минуту в продуктах присутствовали только ВеО и СаО, а при
больших скоростях охлаждения установлены: 1) СаО и Са2Ве3ОБ
для смесей, содержащих от 10 до 50 мол.% ВеО; 2) СаВе3ОБ для
смеси с 60 мол. % ВеО; 3) ВеО и Са2Ве3ОБ для смесей, содержащих
от 70 до 40 мол.% ВеО. Авторы считают, что соединение Са2Ве3ОБ
метастабильно; его образование зависит от скорости охлаждения
расплава эвтектического состава (60 мол.% ВеО и 40% СаО).
Система исследовалась также Ориолем и Вурмом [2]. Авторы
указывают на наличие соединения ЗВеО-2СаО с температурой
инконгрузнтного плавления, очень близкой к точке плавления эв-
тектики 1384° (рис. 118).
Системы типа R20—R"0 и R'O—R"0
133
Миллер и Мерцер [3] получали соединения Са2Ве3ОБ в виде
метастабильной кубической фазы, возникающей при быстром ох-
Рис. 117. Диаграмма
плавкости системы
СаО—ВеО.
Рис. 118. Диаграмма состояния системы
СаО—ВеО.
лаждении расплава. При медленном охлаждении получалась эв-
тектика, плавящаяся при 1380+ 5°. Параметр элементарной
ячейки Са2Ве3ОБ а=14.00А.
Литература
1. A de г М., I. В i n g 1 е, Atomic Energy Commission Research and
Development Report, Argonne National Laboratory, ANL-5602, p. 107,
1956.
2. A u г i о 1 A., J. G. W u г m, in: E. M. Levin, C. R. Rob-
bins, H. F. M с M u г d i e. Phase diagrams for ceramists. U. S. A.,
Columbus, p. 99, fig. 215, 1964.
3. M i 11 e г R. P., R. A. M e г с e r, Nature, 202, № 4932, 581, 1964.
4. P о 11 e г R. A., L. A. Harris, Joum. Amer. Ceram. Soc., 45, № 12,
615, 1962.
5. WartenbergH., H. J. Reusch, E. Saran, Zs. anorgan.
allgem. Chem., 230, H. 3, 257, 1937.
SrO—BeO
Изучена Ориолем и Вурмом [1] в концентрационной области
от 0 до 50 вес. % ВеО. Авторы указывают на четыре инконгруэнтно
плавящихся соединения: BeO-3SrO, ВеО-SrO, 3BeO>2SrO и
4BeO>SrO (рис. 119). Твердых растворов не отмечается.
134
Системы типа R20—Н"0 и R'O—R"0
Миллер и Мерцер [2] быстрым охлаждением расплава полу-
чили соединение 28гО-ЗВеО ромбической сингонии с парамет-
рами элементарной ячейки: а=7.13, 5=9.01, с=18.5 А. Кроме
Рис. 119. Диаграмма состояния системы
SrO—ВеО.
того, была обнаружена гексагональная фаза с параметрами:
а=4.6, с=8.44 А. Обе фазы являются устойчивыми, длительно
сосуществуя при 1200°.
Литература
1. А и г i о 1 A., J. G. Wurm, in: Е. М. Levin, С. R. Rob-
bins, Н. F. Me М u г d i е. Phase diagrams for ceramists. U. S. A.,
Columbus, p. 99, fig. 217, 1964.
2. M i 11 e r R. P., R. A. Mercer, Nature, 202, № 4932, 581, 1964.
. BaO—BeO
Систему, интересную для получения высокоогнеупорных мате-
риалов, изучали в субсолидусной области Исупова и Келер [1].
Обнаружено два соединения: Ва2Ве3ОБ и ВаВе3О4 (рис. 120).
Синтезированные соединения имеют температуры плавления 1725
и 1540° соответственно. Устойчивое при повышенных температу-
рах соединение ВаВе3О4 диссоциирует приблизительно при 1280°
па Ва2Ве3ОБ и ВеО.
Соединение Ва2Ве3ОБ относится к ромбической сингонии; кри-
сталлы двуосные, положительные; показатели светопреломления:
2Vg=l.780+0.002, Ар = 1.765+0.002; плотность 4.58 г/см3.
Системы типа В30—R"0 и R'O—R"0
135
Кристаллы BaBe3O4 двуосные, положительные, с тонким поли-
синтетическим двойникованием; показатели светопреломления:
7Vg=l.740+0.002, Np=1.724+0.002; плотность 4.06 г/см3.
с
1800
Жидк.
1725°
А
1W0
Ba^^BaBefl/-
ВаВеЛ.——
* * У9ЛЛ
Жидк. &
\ ыо°
1000
ВаСО/ВаО+Ва^^Ж
Jaleel)
*BaCO3*Ba?Beh:
Ва^е^ВеО
Оиии^ОЧ.лОСМк: ~
------1 1 J 1 J| ° « » * I i ।
9:15-1 3:1 2=13-2 t-1 MI'-Z Г-ЗНЯМ
BaO---• 1'4 BeO
(BaC03)
Рис. 120. Фазы в системе BaO—ВеО,
обнаруженные при изучении реакций
в твердом состоянии.
Рис. 121. Диаграмма состояния си-
стемы ВаО—ВеО (по Ориолю и
Вурму).
Ориоль и Вурм [2] дают диаграмму
зывая на наличие третьего соединения
состояния системы, ука-
Ва3ВеО4 (рис. 121).
Литература
1. Исупова Е. Н., Э. К. Келер, Журн. неорг. хим., 9, № 2, 394,
1964.
2. А и г i о 1 И., J. ,G. W и г m, in: Е. М. Levin, С. R. Robbins,
Н. F. М с М и г d i е. Phase diagrams for ceramists. U. S. A., Columbus,
p. 97, fig. 204, 1964.
CuO—MgO
Изучение системы необходимо для описания поведения магне-
зитовых огнеупоров в медеплавильных печах.
Шмаль, Бартель и Эйкерлинг [3] рентгенографически ис-
следовали прокаленные при 1000° (60 час.) смеси окислов. Уста-
новлено образование твердых растворов замещения в интер-
вале от 0 до 21 мол.% CuO. Обнаружено соединение, содержа-
щее 72 мол.% СпО. Приближенно состав соединения отвечает
формуле Cu3MgO4. Эго соединение характеризуется ромбической
элементарной ячейкой с параметрами: а=3.989, 6=6.387, с=9.345 А;
136
Системы типа R20—В"0 и R'O—R"0
пикнометрическая плотность 5.85 г/см3. Окись магния в не-
большом количестве (меньше 1%) растворяется в СпО.
Систему изучали Рагозинников с сотрудниками [1, 2] мето-
дом «отжига и закалки». Независимо от выбора исходного окисла
меди — Сп2О или СпО — в системе обнаружено образование
одного соединения CuMgO2=CuO-MgO, отвечающего минералу
гюггениту. Температура образования гюггенита из окислов 950°,
выше 1210° происходит распад. Кристаллы гюггенита относятся
к ромбической сингонии с параметрами элементарной ячейки:
а=9.20, 5=6.38, с=5.26 А.
Литература
1. Рагозинников В. А., И. Л. Щетникова, К. В. Во-
робьева, в сб.: Химия высокотемпературных материалов, изд.
«Наука», М.—Л., 213, 1967.
2 Рагозинников В. А., И. Л. Щетникова, В. М. Усть-
янцев, Труды Восточн. инет, огнеупоров, вып. 6, 122, 1966.
3. Sclimahl N. G., I. В а г t n е 1, G. F. Е i к е г 1 i n g, Zs. anorgan.
allgem. Chem., 332, № 5—6, 23Q, 1964.
СаО—MgO
Имеет значение для технологии огнеупоров.
Изучалась Ранкином и Мервином [4] (рис. 122), Тройером
и Конопицким [6 ] (рис. 123), Афанасьевым и Сальдау [1 ] (рис. 124)
и Доменом, Барром, Мак-Нэлли и Альпером [2] (рис. 125).
°C
2800 г
2600 ..... Жидк. ^''мдО+Ж
2400 'СйО+Ж''^^'СаО+MffO
2200г—7
0 20 40 60 80 100
Са0 Вес.%
Рис. 122. Диаграмма состоя-
ния системы СаО—MgO (по
Ранкину и Мервину).
Система относится к простым эвтектическим. Для состава эвтек-
тики и температуры ее плавления приводятся различные дан-
ные. По Ранкину и Мервину, эвтектика имеет состав 67 вес.%
СаО и 33% MgO и плавится при 2300 + 50°. Вартенберг с сотруд-
никами [7] приводят соответственно состав 55% СаО и 2250°,
Руфф с сотрудниками [5] указывают 63% СаО и 2360°. Согласно
Афанасьеву и Сальдау, эвтектика плавится при 2330° и составе
55 мол. % MgO.
Системы типа RjO—R"0 и R'O—R"0
137
Форд и Уайт 13] обнаружили, что MgO растворяется в СаО.
По данным Тройера и Конопицкого, при 1600° в кристалли-
Рис. 123. Диаграмма со-
стояния системы СаО—
—MgO (по Тройеру и
Конопицкому).
Рис. 124. Диаграмма со-
стояния системы СаО—
—MgO (по Афанасьеву и
Сальдау).
Рис. 125. Диаграмма состоя-
ния системы СаО—MgO (по
Домену с сотрудниками).
Рис. 126. Изменение по-
казателя светопреломле-
ния твердых растворов
системы СаО—MgO.
ческой решетке СаО растворяется до 2% MgO. При обычной же
температуре оба окисла образуют простую эвтектику.
Домен с сотрудниками показали, что твердые растворы об-
разуются как на основе СаО, так и на основе MgO. Предельная
138
Системы типа RjO—R"0 и R'O—R"0
концентрация MgO в СаО т. р. при 2370° (температуре эвтектики)
составляет 17 вес.%, предельная концентрация СаО в MgO т. р.
при этой же температуре составляет 7.8 вес.%. Область твердых
растворов резко сужается с понижением температуры, и ниже 1600°
растворимость становится незначительной. Изменение показателя
светопреломления твердых растворов видно из рис. 126.
Литература
1. Афанасьев С. К., П. Я. Сальдау, Зап. Лен. горн, инет., 24,
139 1950.
2. D о m a n R. С., I. В. В а г г, R. N. М с N а 11 у, А. М. А 1 р е г,
Journ. Amer. Ceram. Soc., 46, № 7, 313, 1963.
3. F о r d W. F., J. White, Trans. Brit. Ceram. Soc., 48, № 11, 417, 1949.
4. R a n k i n G. A., H. E. Merwin, Journ. Amer. Chem. Soc., 38, 568,
1916.
5. Ruff 0., F. Ebert, U. К r a w c z у n s k y, Zs. anorgan. allgem.
Chem., 213, № 4, 333, 1934.
6. T r 6 j e r F., К. К о n о p i c k y, Radex Rundschau, № 4, 161, 1949.
7. Wartenberg H., H. J. R e u s c h, E. S a r a n, Zs. anorgan. all-
gem. Chem., 230, № 3, 257, 1937.
CuO—ZnO
Первые попытки изучить систему принадлежат Бэте, Уайту
и Рою [1]. Трудность исследования связана с восстановлением
одноокиси меди в гидротермальных условиях. При 600° полу-
чался, по-видимому, твердый раствор, содержащий 0.5% меди;
при более высоких температурах растворимость еще меньше.
Литература
1. Bates С. Н., W. В. White, R. Roy, Journ. Inorg. Nucl. Chem.,
28, № 2, 397, 1966.
MgO—ZnO
Имеет значение при получении люминофоров.
Смит [5] изучил люминесцентные свойства безактиваторных
люминофоров на основе двойных окислов цинка и магния, син-
тезированных при 940—1000° в области 50 мол. % MgO. Согласно
Смиту, окислы цинка и магния образуют твердые растворы в ин-
тервале концентрации до 25 мол.% MgO. Сапожников, Кондра-
шев, Марковский и Омельченко [2] уточнили данные Смита, рент-
генографически изучив фазовцй состав композиций, полученных
Системы типа ГЦО—R"0 u R'0—R"0
139
Рис. 127. Изменение параметра элементар-
ной ячейки твердого раствора ZnO в окиси
магния.
1, 2—1100°, 1 час с LiCl; 3 — 1300°, 10 час.
без LiCl; 4 — 1300°, 1 час без L1C1. Стрелкой
показан момент появления фазы Zn(Mg)O.
спеканием окислов цинка и магния при 1100 и 1300°, с добав-
кой в качестве активатора 0.05% Сг и в качестве минерализатора
LiCl. В окиси цинка раство-
ряется до 12.0 и 16.0 мол.%
окиси магния, а в окиси
магния — до 26.5 и 35.0 мол. %
окиси
1300°
С,ИХ
5.1950
3.2420
100
ZnO
5.1900
5.1850
5.1800
5.1700
3.2490
а, А
3.2450
3000
2500
2000
3
Периклаз т.р.
1500
1
90
80 70
Кол.°/о
~00 50
MgO
цинка при 1100 и
соответственно. На
Жидк.
Цинкит икр.
Периклаз т.р.+
цинкит т.р
1000
0 20 40 00 80 ЮО
MgO Bec.°h ZnO
Рис. 129. Предположительная
диаграмма состояния системы
MgO—ZnO.
Рис. 128. Изменение параметра эле-
ментарной ячейки твердого раствора
MgO в окиси цинка.
1,1' — 1100°, 1 час с LiCl; г,г' — 1300°,
1 час без LiCl; 3, 3’ — 1300°, 10 час.
без LiCl. Стрелками показаны моменты
появления фазы Mg(Zn)O.
рис. 127 приводится изменение параметра а элементарной
ячейки твердого раствора ZnO в MgO. На рис. 128 показано
140
Системы типа ГЦО—R"0 и R'O—R"O
изменение параметров а и с элементарной ячейки твердого рас-
твора MgO в ZnO.
Сарвер, Катнак и Гюммель [3] приводят для растворимости
ZnO в окиси магния величину 49 вес. %, а для растворимости MgO
в окиси цинка 2 вес.%.
Сегнит и Голланд [4] полу-
чили твердый раствор ZnO в
окиси магния, производя обжи-
ги при 1600°. В этих условиях
твердый раствор содержал
56 вес.% ZnO. На рис. 129
представлена предположитель-
ная диаграмма состояния си-
стемы MgO—ZnO по Сегниту и
Голланду. Эвтектика, как ука-
зывают авторы, нанесена при-
ближенно, но наблюдение в
нагревательном микроскопе по-
казало, что при 1750° еще не
происходит плавления, так что
эвтектика должна лежать вы-
ше 1750°. На рис. 130 показаны
параметры элементарной ячейки
полученных при 1600° твердых
растворов на основе MgO и их показатели светопреломления.
Кондрашев и Омельченко [1] произвели рентгенографическое
исследование системы и показали, что в твердых растворах
окиси магния в ZnO часть ионов магния размещается в окта-
эдрических пустотах структуры ZnO.
N
1.950
1.900
1.850 -
1.800
1.750 У
6
- 9.290 §
9220 §
9200 5
Ǥ
•з*
0 20
МдО
90 00
Вес.%
80 100
ZnO
элементарной
Рис. 130.
ячейки и показатель светопреломле-
ния периклазовых твердых раство-
ров.
Параметр
Литература
1. К о н д р а ш е в Ю. Д., Ю. А. Омельченко, Журн. неорг. хим.,
9, № 4, 937, 1964.
2. Сапожников Ю. П., Ю. Д. К о н д р а ш о в, Л. Я. М а р ко в-
ский, Ю. А. Омельченко, Журн. неорг. хим., 6, № 11, 2550,
1961.
3. Sarver J. F., F. Z. К a t n а с k, F. А. Н u m m е 1, Journ. Electro-
chem. Soc., 106, № И, 960, 1959.
4. S e g n i t E. R., A. E. Holland, Journ. Amer. Ceram. Soc., 48, № 8,
409, 1965.
5. S m i t h A. L., Journ. Electrochem. Soc., 98, 363, 1951.
Системы типа ГЦО—R"0 и R'O—R"0
141
CdO—ZnO
Система интересна для технологии рафинировки окиси цинка.
Изучена Брауном и Гюммелем [1] до температуры 1000°.
Химических соединений не обнаружено. Твердые растворы обра-
5.220
5.210
5.200:
3200}\
о 1000'
—s-----э-
9.700
800'
800'
4.690
1000'
1000'
9.980
800'
- 9.070
3.250;—°-----°-
3.2901--.---и.
0 10 20
Vr
80- 90 100
ZnO Мол.% CdO
Рис. 131. Параметры элементарных ячеек
твердых растворов на основе ZnO и на ос-
нове CdO, показывающие взаимную раство-
римость этих окислов при 800 и 1000°.
зуются как на основе ZnO, так и на основе CdO. Предельная
растворимость CdO в ZnO составляет меньше 1 мол. % при 800°
и 3 мол. % при 1000°. Растворимость ZnO в CdO оценивается
величиной 1 мол.% при 800° и 2 мол.% при 1000°. На рис. 131
представлены значения параметров элементарных ячеек обоих
типов твердых растворов.
Литература
1. Brown J. J., F. А. Н u m m е 1, Journ. Electrochem. Soc., Ill, № 9,
1052, 1964.
PbO—ZnO
Систему исследовали Баулик и Мак-Дауэл [1]. Обнаружены
в небольшой концентрационной области (рис. 132) твердые рас-
творы ZnO в окиси свинца, устойчивые выше 800°. Твердых раство-
142
Системы типа ГЦО—В"0 и В'О—R"0
Рис. 132. Диаграмма состояния системы
РЬО—ZnO.
ров РЬО в окиси цинка не обнаружено. Эвтектика имеет тем-
пературу плавления 861 ±2° и состав 11 мол. % ZnO + 89 мол. %
РЬО.
Литература
1. В a u 1 е k е М. Р., К. О. М с D о w е 11, Journ. Amer. Ceram. Soc.,
46, № 5, 243, 1963.
MgO—MnO
Имеет значение для фазового анализа шлаков и продуктов
их взаимодействия с магнезиальными огнеупорами.
Инвариантные изобарические точки системы MgO—МпО на воздухе
Фазы .Процесс^ Примерный состав, вес.% Темпера- тура, °C
MgO ОКИСЬ марганца, считая на МпО
Периклазманганозитовый твердый раствор -|- шпинель -|- жидкость + + газ (Ро2 = 0.21 атм.). Перитек- тика. 1 99 1587 + 10
С
2800
2W0
2000
1600
Рис. 133. Диаграмма фазовых отношений
в системе MgO—МпО в атмосфере воздуха.
1 — жидкость; 2 — (Mg, Мп)О;
Жидк.
3 — шпинель.
Рис. 135. Параметр элемен-
тарной ячейки твердых раство-
ров в системе MgO—МпО (по
Лью, Стоксу и Ли),
(Мд,Мп)0
(Мд,Мп)0' \
Ж
§
Шпинель
(Мд,Мп)0+ !шпинель+
?(Мд,^
О 20 40 60 / 100
MgO МдО-МлЛ МпО
Вес. %
1200
Рис. 134. Более полная диа-
грамма фазовых отношений
в системе MgO—МпО.
144
Системы типа ГЦО—R"0 и В'О—R"0
Изучена Рибудом и Муаном [3]. Составленная ими диаграмма
фазовых отношений в атмосфере воздуха изображена на рис. 133,
а на рис. 134 та же диаграмма приведена в более полном виде,
с учетом имеющихся литературных данных.
Соединение MgeMnO8, описанное Каспером и Пренером [1],
полученное при 1100° и 1 атм. кислородного давления, не было
найдено в условиях температуры и давления кислорода, при-
мененных в опытах Рибуда и Муана [3].
Рис. 137. Параметры элементар-
ных ячеек твердых растворов в си-
стемах MgO—МпО и СаО—МпО
(по Шенку с сотрудниками).
Рис. 136. Диаграмма состояния
системы MgO—МпО (по Шенку
с сотрудниками).
Для системы характерны обширные твердые растворы (Mg,
Мп)О. Температура инверсии кубической в тетрагональную
Мп3О4 уменьшается при добавке MgO.
Лью, Стокс и Ли [2] определили параметр элементарной
ячейки монокристальных твердых растворов, полученных методом
взаимной диффузии. Были предприняты меры для избежания
образования шпинели. Результаты представлены на рис. 135.
Шенк с сотрудниками [4] определяли температуры солидуса
с помощью высокотемпературного микроскопа. Температуры лик-
видуса находились расчетным путем. На рис. 136 представлена
диаграмма состояния системы, на рис. 137 — параметры кристал-
лической решетки твердых растворов.
Литература
1. К as per J. S., J. S. Р г е п е г, Acta crystallorg., 7, № 3, 246, 1954.
2. L i u Т. S., R. J. S t о k e s, С. H. L i, Journ. Amer. Ceram. Soc., 47,
№ 6, 276, 1964.
Системы типа РЦО—R"0 и R'O—R"0
145
3. R i b о u d Р. V., A. M u a n, Journ. Amer. Ceram. Soc., 46, № 1, 33,
1963.
4. Schenck H., M. G. Frohbe rg, R. Niinninghoff, Arch.
Eisenhiittenwesen, 35, № 4, 269, 1964.
CaO—MnO
Для системы характерно наличие непрерывной серии твердых
растворов. Шенк, Фроберг и Нуннингофф [1], изучавшие систему,
пользовались вакуумной печью с графитовым нагревателем, опи-
санной Шенком и Пфаффом [2J. Определение температуры соли-
дуса производилось с помощью высокотемпературного микро-
скопа. Применяемая печь позволяла доводить нагревание только
Рис. 138. Диаграмма состояния си-
стемы СаО—МпО (по Шенку с со-
трудниками).
до 2400°, и для полного построения диаграммы приходилось про-
изводить экстраполяцию на температуру плавления СаО. Тем-
пература ликвидуса экспериментально не определялась, а рас-
считывалась при допущении идеального в термодинамическом
отношении строения системы. Требуемые для расчета температура
плавления и теплота плавления МпО принимались равными
соответственно 1842° и 10.5 ккал./мол. Диаграмма состояния,
исследованная до содержания 81.3% СаО, представлена на рис. 138.
Обнаружен непрерывный ряд твердых растворов. Параметр
решетки линейно изменяется от 4.45 (для МпО) до 4.8 А (для СаО)
(рис. 137).
Литература
1. Schenck Н., М. G. Frohberg, R. Niinninghoff, Arch.
Eisenhiittenwesen, 35, № 4, 269, 1964.
2. Schenck H., W. Pfaff, Arch. Eisenhiittenwesen, 32, № 3, 741,
1961.
10 Н. А. Торопов и др., кн. I
146
Системы типа R20—R"0 и R'O—R''O
ZnO—MnO
Система интересна для технологии люминофоров и процессов
рафинировки окиси цинка.
Уайтом и Мак-Илвридом [3] система изучалась в темпера-
турном интервале от 1000 до 1300°. Авторы пользовались за-
паянными платиновыми капсулами.
Фазы определялись рентгенографи-
чески. Установлено образование твер-
дых растворов как на основе ZnO,
так и на основе МпО. Предельная
растворимость МпО. в окиси цинка
мало зависит от температуры и со-
ставляет 25—30 мол. %. Цвет этих
твердых растворов изменяется от
желто-оранжевого (1—2мол. % МпО),
через густо-красный (10 мол. %МпО)
до каштанового (20 мол. % МпО).
Согласно определениям Марку-
са [2], растворимость окиси цинка
в МпО составляет 24 мол. %. Най
денная гидротермальным методом
растворимость ZnO в МпО равна
10 мол. % . При’новышенных темпе-
Рис. 140. Изменение
межплоскостных рас-
стояний [112] в окиси
цинка по мере добавле-
ния МпО при 1000, 1100,
1200 и 1300’.
Рис. 139. Фазовая диаграмма системы
ZnO—МпО в субсолидусной области.
ратурах (1200—1300°) всреднейчасти
диаграммы отмечается присутствие на-
ряду с МпО т. р. и ZnO т. р. хими-
ческого соединения ZnMn2O4 — манганата цинка с трехвалент-
ным марганцем и структурой гаусманита.
Системы типа R20—R"0 и R'O—R"0
147
Бэтс, Уайт и Рой [1] построили фазовую диаграмму системы
ZnO—МпО в субсолидусной области (рис. 139), пользуясь гидро-
термальным методом: давление 1000 бар, температурный интер-
вал исследования 500—800°. Растворимость Мп2+ в ZnO дости-
гает 25% при 800°. Параметр решетки окиси цинка значительно
увеличивается с увеличением содержания МпО в твердом растворе.
Параметр кристаллической решетки d [112] твердых раство-
ров на основе ZnO показан на рис. 140.
Литература
1. Bates С. Н., W. В. White, R. Roy, Journ. Inorg. Nucl. Chem.,
2, № 2, 397, 1966.
2. Marcus L. A study of ceramic materials in the system Мпж0„— ZnO.
M. S. Thesis. The Pennsylvania State University, 1956.
3. W h i t e W. В., К. E. M c I 1 v r i e d, Trans. Brit. Ceram. Soc., 64,
№ 10, 521, 1965.
FeO—MnO
В первом исследовании системы, выполненном Хэем, Ховатом
и Уайтом [4], были обнаружены две серии твердых растворов
(рис. 141).
Рейдзо и Китагава [5] пользовались образцами, получен-
ными обжигом-в восстановительной среде при 1150°. Фазовая
диаграмма, представленная на
рис. 142, не может рассматри- "р
ваться как строго бинарная 1800
вследствие присутствия Fe2O3.
На диаграмме в качестве от-
дельных фаз фигурируют маг-'
нетит и феррит марганца МпО •
Fe2O3. Обнаружены твердые поо
растворы как на основе FeO,
так и на основе МпО.
Исследование термодинами- 12 (
ческих свойств дало некото- FeO Вес.°/о МпО
рые сведения о структуре твер-
дых растворов. Исходя из кон- Рис. 141. Диаграмма состояния си-
центрационной зависимости стемы FeO—МпО (по Хэю, Ховату
г и Уайту).
равновесного давления кисло-
рода, Фостер и Велч [3]
утверждают, что растворы идеальны, а по результатам
измерения э. д. с. гальванической ячейки из твердых элек-
тролитов Энгель [2] делает заключение, что активность вюстита
имеет положительное отклонение от идеальности. Такенов, Бала-
10*
148
Системы типа RjO—R"0 и R'O—R"0
кирев и Чуфаров [1] обнаружили отрицательный знак избыточ-
ной интегральной энтропии смешения, что дает основание пред-
Рис. 142. Диаграмма состоя-
ния системы FeO—МпО (по
Рейдзо и Китагава).
1 — жидкость; 2— FeO+жидкость;
3 — магнетит+жидкость; 4 —
твердый раствор на основе FeO;
5 — МпО-Fe2Os 4-магнетит (?); в—
МпО+жидкость; 1 — МпО -FejOj-l-
4-МпО; з — твердый раствор на ос-
нове МпО; 9— MnO-Fe2O3.
полагать, что в твердых растворах FeO—МпО имеется некоторое
упорядочение. По-видимому, это обусловлено элементами ближ-
него порядка или субмикронеоднородностями с ионами одного
сорта.
Литература
1. Такенов Т. Д., В. Ф. Балакирев,' Г. И. Чуфаров,
ДАН СССР, 165, № 6, 1325, 1965.
2. Е n g е 1 Н. J., Zs. phys. Chem. (N. F.), 35, 192, 1962.
3. Foster P. K., A. J. E. Welch, Trans. Farad. Soc., 52, № 12, 1636,
1956.
4. H a у R., D. D. H о w a t, J. White, Journ. West. Scot. Iron a. Steel
Inst., 41, 97, 1933—1934.
5. Re j dz о J. I., S. Kitagawa, Sci. a. Eng. Rev. Doshisha Univ.,
5, № 2, 67, 1964.
MgO—FeO
Имеет значение для выяснения фазового состава магнезитовых
огнеупоров и сталеплавильных шлаков.
Система исследована Боуэном и Шерером [1]. Составленная
ими диаграмма плавкости (рис. 143) имеет ориентировочный ха-
рактер, так как закись железа плавится с разложением. Обра-
зуются непрерывные твердые растворы MgO и FeO — магнезио-
Системы типа RjO—Н"0 и R'O—R"0
149
вюститы. Показатели преломления их, по Боуэну и Шереру, при-
ведены на рис. 144 и в таблице.
Изменение постоянной решетки этих твердых растворов по-
казано на рис. 145 по данным Кокко и Батти [4].
О 20 Ю 60 80 100
№ Вес. %
Рис. 143. Диаграмма плавко-
сти системы MgO—FeO (по
Боуэну и Шереру).
Рис. 144. Показатели светопре-
ломления магнезиовюститов.
Робертс и Мервин [6], Ричардс и Уайт [5] и Вудхауз и Уайт [7]
изучали равновесие на воздухе окиси магния, содержащей же-
лезо, и нашли, что имеется тенденция восстановления окиси
железа при добавке окиси магния к вюститу.
Бринестад и Флоод [3] также изучали равновесие между
закисью и окисью железа в вюстите, содержащем различные
количества окиси магния при различных парциальных давлениях
кислорода и при 1400°. Их экспериментальные данные по равно-
весию между магнезиовюститом и кислородом приведены на
рис. 146.
Светопреломление магнезиовюститов
Вес. % N Вес.% N
MgO FeO MgO FeO
100 . 1.736 + 0.002 50 50 1.948+0.005
90 10 1.768+0.002 21.9 78.1 2.12+0.01
75 25 1.822 + 0.003 — 100 По экстраполя- ции— 2.3
150
Системы muna^R'2O—R"O и R'O—R"O
На этой диаграмме штрих-пунктиром показана пограничная
кривая между областью магнезиовюститов и двухфазовой обла-
стью окись магния—шпинель, нанесенная исходя из того поло-
жения, что пограничные кривые должны проходить через наи-
МдО вес.% FeO
Рис. 145. Изменение пара-
метров кристаллической ре-
шетки твердых растворов
системы MgO—FeO.
Рис. 146. Диаграмма, харак-
теризующая равновесие между
магнезиовюститом и кислоро-
дом.
более отчетливые изгибы на четырех кривых, нанесенных по экспе-
риментальным точкам, как указано на рис. 146.
Брежни [2], нагревая смеси периклаза и вюстита на воздухе,
показал, что начиная от 200° происходит образование магнетита;
в интервале от 600 до 750° образуется парамагнитная модифи-
кация a-Fe2O3, выше 750° начинается образование феррита магния
MgO-Fe2O3.
Литература
1. Bowen N. L., J. F. Schairer, Amer. Journ. Sci., (5), 29, № 170,
151 1935.
2. В r e z n у В., Вег. Dtsch. keram. Ges., 43, № 9, 528, 1966.
3. Brynestad J., H. Flood, Zs. Elektrochem., 62, № 8, 953, 1958.
4. Cocco A., P. В a 11 i, Ann. di Chim., 48, № 8—9, 608, 1958.
5. R i c h a r d s R. G., J. White, Trans. Brit. Ceram. Soc., 53, № 8,
422 1954.
6. Roberts H. S., H. E. Merwin, Amer. Journ. Sci., (5), 21, № 122,
145, 1931.
7. Woodhouse D., J. White, Trans. Brit. Ceram. Soc., 54, № 6,
333, 1955.
Системы типа ГЦО—В"0 и R'O—R"0
151
СаО—FeO
Изучена Алленом и Сноу [1 ] как часть тройной системы СаО—
—FeO—SiO2. Обнаруженное соединение CaO*2FeO является ко-
еГ>’с» 0 _______J
о5» . I
- *
I
I
\
\
\>
у
Известь
поо
1200
ш
СаО
Жидк.
ИзВесть+Ж \
Известь +
кальциовттцт
^—оаКальциовюстит
^хш^Вьй
феррит '
^ДвдхкальЦиеВый
^ишьидоВост^
50 00 80
Вес. %
100
Feo
Рис. 147. Диаграмма состояния системы
СаО—FeO.
Рис. 148. Параметры кристаллической решетки
твердых растворов и соединений в системе
СаО—FeO.
нечным членом непрерывного ряда твердых растворов: FeO (вю-
стит)—CaO-2FeO (рис. 147). Эти твердые растворы авторы на-
зывают кальциовюститом.
152 Системы типа R20—R"0 и R'O—R"0
Обнаружены также твердые растворы на основе СаО. Макси-
мальная концентрация FeO в этих твердых растворах составляет
8 мол. % (10 вес. %). Все эти растворы имеют структуру гране-
центрированного куба. Параметр кристаллической решетки умень-
шается от 4.797 а. и. для чистого СаО до 4.760 + 0.003 а. и. для
предельного твердого раствора (8 мол. % FeO). При этом показа-
тель светопреломления изменяется от 1.838 до 1.87. Изменение
параметра решетки кальциовюститной фазы характеризуется
следующими данными: вюстит — а=4.306 а. и.; предельный твер-
дый раствор — а=4.490+ 0.005 а. и. (рис. 148).
На основании рентгенографических данных авторы высказы-
вают предположение о существовании промежуточного соеди-
нения в пределах стехиометрических составов CaO-5FeO и СаО-
• 7FeO. Параметр решетки в этих пределах равен 4.36 а. и.
Литература
1. А 1 1 е n W. С., R. В. S п о w, Journ. Amer. Ceram. Soc., 38, № 8, 264,
1955.
ZnO—FeO
Систему изучали Исомацу и Китагава [2] на образцах, об-
жигавшихся в восстановительной атмосфере, в интервале тем-
ператур 800—1300°. Обнаружены твердые растворы на основе
Рис. 149. Диаграмма со-
стояния системы ZnO—
—FeO (по Исомацу и Ки-
тагава).
1 — жидкость; 2 — FeO+
-[-жидкость; 3 — магнетит+
+жидкость; 4 — твердый
раствор на основе FeO; 5 —
ZnO-Ре2О3-(-магнетит (?);
6 — ZnO+жидкость; 7 —
ZnO-FejOj+ZnO; 3— твер-
дый раствор на основе ZnO;
9 — ZnO -FetO,.
ZnO и на основе FeO, а также феррит цинка ZnO-Fe2O3, что сви-
детельствует о наличии окисления. Приближенная фазовая диа-
грамма системы представлена на рис. 149.
Системы типа R20—R"0 и 1U0—R"0 153
Бзтс, Уайт и Рой [1] проводили исследование в гидротермаль-
ных условиях. В обнаруженном твердом растворе FeO в ZnO
содержание первого составляет при 800° 7 мол. % (рис. 150).
Здесь в решетку окиси цинка входит действительно двухвалентное
800 -
700
ООО
ZnOm.p.
ZnOm.p.+ 'y-Pez03m.p. \
\^-РегО3т.р.
Рис. 150. Диаграмма состояния
ZnO—FeO (по Бэтсу, Уайту и
Рою).
-----1-----НРЧР-
0 10 20 50 80
ZnO Мола/о
90 100
J-^з
железо; твердого раствора ZnO в FeO авторы не обнаружили.
Второй фазой в системе является шпинельный твердый раствор
на основе у-Ге2О3. Количество окиси цинка, растворенной в окиси
железа, в исследованной температурной области находится в пре-
делах от 5 до 15 мол. %. Авторы не могли выяснить, находится ли
y-Fe2O3 т. р. в стабильном (в результате стабилизации окисью
цинка) или метастабильном состоянии.
Литература
1. Bates С. Н., W. В. White, R. Roy, Journ. Inorg. Nucl. Chem.,
28, № 2, 397, 1966.
2. Isomatsu R., S. Kitagawa, Sci. Eng. Rev. Doshisha Univ.,
5, № 2, 67, 1964.
154
Системы, типа 1Ц0—R"0 и R'O—R"0
СаО—СоО
Изучена Тикканеном [1]. Установлено образование твердых
растворов как на основе СоО, так и на основе СаО (рис. 151).
Рис. 151. Диаграмма состоя-
ния системы СаО—СоО.
а — СоО т. р.; р — СаО т. р.
Литература
1. Tikkanen М. Н., in: Е. М. Levin, С. R. R о b b i n s,
Н. F. М с М u г d i е. Phase diagrams for ceramists. U. S. A., Colum-
bus, p. 101, fig. 228, 1964.
ZnO—CoO
Систему изучали Бэтс, Уайт и Рой [1 ] в субсолидусной об-
ласти в гидротермальных условиях. Обнаружены твердые растворы
на основе ZnO и на основе СоО (рис. 152). Растворимость СоО
в структуре цинкита составляет 6.5 мол. % при 800°. Раствори-
мость окиси цинка в СоО достигает 22 мол. % при 800°. Послед-
Системы типа R20—R"0 и R'O—R"0
155
ний результат расходится с данными Риджамонти [2], обнару-
жившим на основе измерения параметров решетки раствори-
мость, доходящую до 30 мол. %.
Рис. 152. Фазовая диаграмма си-
стемы ZnO—СоО.
Литература
1. В a t е s С. Н., W. В. White, R. Roy, Journ. Inorg. Nucl. Chem.,
28, № 2, 397, 1966.
2. Rigamonti R., Gazz. Chim. Ital., 76, 474, 1946.
CuO—NiO
’ Важна для химической технологии катализаторов.
Шмаль, Бартель и Эйкерлинг [1] рентгенографически изу-
чили прокаленные при 1000° (6 час.) смеси из CuO и N^NO^a*
• 6Н2О. Обнаружены твердые растворы на основе NiO и CuO.
Твердые растворы (типа замещения) установлены в интервале
0—33 мол. % CuO и 0—4 мол. % NiO.
Литература
1. S с h m a h 1 N. G.. J. Barthel, G. F. E i k e r 1 i n g, Zs. anorgan.
allgem. Chem., 332, № 5-6, 230, 1964.
156
Системы, типа R^O—R"0 и R'O—R''O
MgO—NiO
Вартенберг и Профет [2] показали, что MgO и NiO образуют
непрерывный ряд твердых растворов (рис. 153), Лью, Стокс и
Рис. 154. Параметр элементарной
ячейки твердых растворов системы
MgO—NiO.
Рис. 153. Диаграмма состоя-
ния системы MgO—NiO (по
Вартенбергу и Профету).
Ли [1] определили параметр кристаллической решетки твердых
растворов, полученных диффузионным методом (рис. 154).
Литература
1. L i u Т. S., R. J. Stokes, С. Н. Li, Journ. Amer. Ceram. Soc.,
47, № 6, 276, 1964.
2. Wartenberg H., E. Prophet, Zs. anorgan. allgem. Chem.,
208, № 4, 369, 1932.
Системы типа R^O—R"0 и R'O—R"0
157
СаО—NiO
Систему изучал Тикканен [11. Для системы характерны широ-
кие области твердых растворов как на основе NiO, так и на основе
СаО (рис. 155).
Рис. 155. Диаграмма состояния
системы СаО—NiO.
Литература
1. Tikkanen М. Н., in: Е. М. Levin, С. R. Robbins,
Н. F. М с М и г d i е. Phase diagrams for ceramists. U. S. A., Colum-
bus, p. 102. fig. 230, 1964.
BaO—NiO
Интересна для керамики с точки зрения электрических и маг-
нитных свойств образующихся в ней соединений.
Частично изучена Ландером [1], которым построена фазовая
диаграмма (рис. 156). Соединение NiO-BaO стабильно на воздухе,
плавится в атмосфере азота при 1240°; цвет черный, а в проходя-
щем свете бурый; система ромбическая (псевдогексагональная),
а=5.73, 5=0.20, * с=4.73 А. Плотность 5.99 г/см3, по расчету
рентгенографических данных 6.11 г/см3. Соединение NiO*3BaO
* По-видимому, опечатка. Вероятно, следует считать 6=10.20 А.
158
Системы типа ГЦО—R"0 и R'O—R"0
нестабильно на воздухе; цвет чистого NiO-ЗВаО серо-зеленый.
Плотность, вычисленная
‘С
гооо
1600
1200
800
то+т-вао
NiO-BaO*
NiO-3BaO
ШО-ЗВаО
+ ВаО\
О 20 V) 60 80 100
то Мол.% ВаО
Рис. 156. Фазовая диаграмма
системы ВаО—NiO.
из рентгенографических данных,
6.05 г/см3. Плавится около 1160°.
Элементарная ячейка гексагональная
(ромбоэдрическая) с а=7.85, с=
=16.50 А; в ней содержится 18единиц
ВаО и 6 единиц NiO.
Температура плавления NiO при-
нята авторами в 1650°. Раствори-
мость ВаО в NiO очень мала. Эв-
тектика между NiO и NiO-ВаО при-
мерно при 1200°; состав неизвестен.
Взаимная растворимость NiO, NiO •
• ВаО и NiO«3BaO незначительная.
Эвтектика между NiO«ВаО и NiO-
• ЗВаО примерно при 1080°; состав
не определен. При 1250° NiO нерастворима в ВаО; эвтектика меж-
ду NiO-ЗВаО и ВаО не найдена.
Литература
1, Lander J. J., Journ. Amer. Chem. Soc., 73, № 6, 2450, 1951.
ZnO— NiO
Система имеет существенное значение для технологии катали-
заторов и люминофоров.
В субсолидусной области в гидротермальных условиях изучали
Бзтс, Уайт и Рой [1J, обнаружившие твердые растворы на основе
°C
800
''ZnOm.p.
700
NiOm.p+ZnOm.p.
NiOm.p.
600
500\l1-----------
0 20 i/O 60 80 100
ZnO Мол. % NiO
Рис. 157. Фазовая диаграмма
системы ZnO—NiO.
ZnO и на основе NiO. Растворимость NiO в окиси цинка незна-
чительна (рис. 157) и составляет при 800° 0.9 мол.%. Раствори-
мость окиси цинка в NiO доходит до 29 мол.% при 700°.
Системы типа РЦО—R"0 и R'O—R"0
159
Литература
1. Bates С. Н., W. В. White, R. Roy, Journ. Inorg. Nucl. Chem.,
28. № 2, 397, 1966.
МпО—NiO
Система применяется в химической технологии катализаторов.
Барретт и Эванс [11 показали, что NiO и МпО образуют не-
прерывный ряд твердых растворов, обладающих кристалличе-
Рис. 158. Параметр эле-
ментарной ячейки твердых
растворов системы МпО—
-NiO.
ской решеткой типа NaCl (гранецентрированной, кубической).
Для параметра элементарной ячейки твердых растворов получены
следующие данные: NiO — 4.179 А, 25 вес.% МпО — 4.210 А,
50 вес.о% МпО — 4.294 А, 75 вес.% МпО — 4.350 А, МпО —
4.442 А (рис. 158).
Литература
1. Barrett С. А,,
533, 1964.
Е. В, Evans, Journ. Amer. Ceram, Soc., 47, № 10,
CoO—NiO
Существенна для технологии катализаторов.
Т. Саката и К. Саката [1] показали, что в субсолидусной
области образуется непрерывный ряд твердых растворов.
На рис. 159 показана температура (Tj), при которой происходит
объемная диффузия, приводящая к образованию твердого раствора.
160
Системы типа РЦО—R"0 и R'O—R"O
Твердые растворы имеют структуру поваренной соли (область а),
а в области, прилегающей к одноокиси кобальта, — структуру
шпинели (с). В области b сосуществуют обе разновидности твердых
Рис. 159. Характеристика твердых
растворов, образующихся в системе
СоО—NiO.
Т, — температура, при которой начинается
образование твердых растворов; а — об-
ласть твердых растворов со структурой
NaCl; Ь — гетерогенная область; с — об-
ласть твердых растворов со структурой
шпинели.
растворов. Для твердых растворов характерна нестехиометрич-
ность, и их формулу следует выражать в виде Мег_гО, где 8 умень-
шается с ростом температуры.
Литература
1. S a k a t а Т., К. Sakata, Journ. Phys. Soc. Japan, 13, № 7, 675,
1958.
БОРАТНЫЕ СИСТЕМЫ
Li2O—В2О3
Одна из фундаментальных систем стекольной и эмалевой техно-
логии.
Систему изучали Мацетти и Де Чарли [2], Ролле и Буази [3]
и Састри и Гюммель [41.
Рис. 160. Диаграмма состояния системы
Ы2О—В2О3 (по Ролле и Буази).
В системе обнаружены следующие соединения: 3Li2O -В2О3,
ЗЫ2О.2В2Оз, Li2O.B2O3, Li2O-2B2O3, 2Ы2О-5В2О3, Ы2О-ЗВ2О3
и Li2O-4B2O3 (рис. 160, 161). Соединение Li2O-5B2O3, на которое
указывают Мацетти и Де Чарли, отрицается последующими ис-
следователями. Li2O-B2O3 образует пластинчатые или нитевидные
кристаллы, двуосные, отрицательные, с постоянным оптическим уг-
л°м 27 и показателями светопреломления: 2Vg=1.616, Nm=l.§12
и Ар=1.540. Li2O.2B2O3 образует гексагональные кристаллы,
одноосные, оптически отрицательные, с показателями светопре-
11 н. А, Торопов и др., КН. 1
162
Боратные системы
°C ——gffTf-B"
soo -аго-гв^ж
89912е
800 -
700
i-г
г>5
Л3
1-2.
t----
5.
1-2
,856iZ\?:5+M
839 ±9'
LigOOBJfy
1:3 635H(f
L-П?^"
59$±21Л1:3
I 832 ±2' ,,
ирв&ж 7
2Llfi-5Bg03
Li.0-2B.0 +1_1_
Li^-B203 ^1'
600 -
500 -
!ср В,О,(стекло)
‘ •’ +
'•» И-О-ЧВЛ,
Z ,2 3
70
иго
1 ________iL
80 90
Вес.°/о
юо
вго3
Рис, 161. Диаграмма состояния си-
стемы Li2O—В2О3 (по Састри и Гюм-
мелю).
ломления Ло=1.605 и Ле=1.560. Li2O-3B2O3 образует пластин-
чатые кристаллы, оптически отрицательные, двуосные, с оптиче-
Инвариантные точки системы Ы2О—В2О3
Точка Фазы Процесс Состав, вес. °/0 Темпера- тура, °C
Ы2О B2O3
1 2 3 4 5 6 7 8 9 LiaO4-3Li2O* В2О3+жид- кость. LiaO' В2О3-|-жидкость. LiaO • В аО 3+ LiaO • 2В 2О 34- жидкость. Li2O * 2ВаО34-жидкость. LiaO* 2BaO34-2LiaO* • 5В20э4- жидкость. 2Li|jO • 5В2О34- LiaO • •ЗВ2О34~ Li2O • В2О3. 2Li2O - 5В2О34- Li2O • • ЗВаО34~жидкость. Li2O* ЗВ2О34- LijjO * 4В2О34~ 4~Li2O*2B2O3. Li2O • ЗВ аО 34~ Li 2О • 4В2О34~ 4-жидкость. Инкон- груэнтное плавление. Плавление. Эвтектика. Плавление. Инкон- груэнтное плавление. Разложение в твердом состоянии. Инкон- груэнтное плавление. Разложение в твердом состоянии. Инкон- груэнтное плавление. 69.5 30.02 27 ±0.25 17.66 14.65 14.65 12.51 12.51 9.69 30.5 69.98 73 ±0.25 82.34 85.35 85.35 87.49 87.49 90.31 ’ 695 849 ±2 832 ±2 917 ±2 856 ±2 696 ±2 834 ±4 595 ±20 635 ±10
Боратные системы
163
ским углом 75—80° и показателями светопреломления 7Vg= 1.605,
Л0п=1.602 и Ар=1.576. Кристаллы Li2O-4B2O3 отличаются силь-
ным двупреломлением.
Хёне и Кущабский [1 ] определили структуру бората лития
Li2O-B2O3=LiBO2. Моноклинные кристаллы этого соединения
имеют пространственную группу Рс21, параметры элементарной
ячейки: а=5.94±0.05, 5=4.35 +0.05, с=6.55±0.05 А, [3=115.5 ±
+ 0.5°. Плотность 2.14 г/см3. Число формульных единиц в элемен-
тарной ячейке Z=4. Авторы предполагают цепочечную структуру
метабората лития.
Литература
1. Н б h п е Е., L. Kutschabsky, Zs. Chem., 3, № 1, 33, 1963.
2. М a z z е 11 i C., F. De С a r 1 i, Gazz. chim. Ital., 56, 19, 1926.
3. R о 11 e t A. P., R. В о u a z i z, Compt. rend., 240, 2417, 1955.
4. S a s t г у В. S. R., F. A. Hummel, Journ. Amer. Ceram. Soc. 41,
№ 1,7, 1958.
Na2O—B2O3
Составная часть многокомпонентных систем, имеющих большое
значение для технологии стекла, изучена Мореем и Мервином [51.
Рис. 162. Диаграмма состоя-
ния системы NajO—В2О3.
Рис. 163. Вязкость стекол си-
стемы NajO—В2О3 (по Воларо-
вичу и Толстому).
И*
164
Боратные системы
Установлено образование четырех соединений: Na2O*B2O3,
Na2O-2B2O3, Na2O-3B2O3 и Na2O*4B2O3 (рис. 162).
Обширные работы осуществлены по исследованию стекол
системы. Воларович и Толстой [1] изучили вязкость стекол
Рис. 164. Электропроводность сте-
кол системы NaaO—ВаО8 (по Щука-
реву и Мюллеру).
Рис. 165. Плотность сте-
кол системы NaaO—ВаО8.
1 — по Гудингу и Тернеру;
2 — по Стивелсу; з — теоре-
тические величины.
(рис. 163), Щукарев и Мюллер [61 измерили электропроводность
(рис. 164). Плотность стекол изучалась Гудингом и Тернером [4],
Биско и Уорреном [3] и Стивелсом [7] (рис. 165), тепловое расши-
рение — Биско и Уорреном. Данные по показателям светопрелом-
ления стекол системы Na2O—В2О3 обобщены в работе Абе [2].
Литература
1. Воларович М. П., Д. М. Толстой, Изв. АН СССР, № 9, 897,
1930.
2. A b е Т., Journ. Amer. Ceram. Soc., 35, № И, 284, 1952.
3. Biscoe J., В. E. Warren, Journ. Amer. Ceram. Soc., 21, № 8, 287,
1938.
4. G о о d i n g E. J., W. E. S. Turner, Journ. Soc. GlassTechnol., 18,
32, 1932.
5. M о г e у G. W., H. E. Merwin, Journ, Amer. Chem. Soc., 58, 2248,
1936.
Боратные системы
165
6. Schtschukarev S. A., R. L. Muller, Zs. phys. Chem., 150,
* 339 1932
7 Steve Is I. M., Journ. Soc. Glass Technol., 30, 303, 1946.
K2O^—B2O3
Изучена Ролле [2, 3] в пределах 0—58 вес.% К2О кристалли-
зацией соответствующих стекол. Получено пять соединений
Инвариантные точки системы К2О—В2О3
Точка Фазы Процесс Состав, вес. % Тем- пера- T?ga,
К20 ВаОз
1 К20 • В2О3+жидкость. Плавление. 950
2 K2U* B2U8-|~ K2U’ 2В2и3-|~ + ЖИДКОСТЬ. Эвтектика. 45.3 54.7 787
3 К20 • 2В2О3+жидкость. Плавление. — — 815
4 К.2О’2В2О3-|-К2О’ ^B2U3-|- +жидкость. Эвтектика. 37.5 62.5 770
5 К2О • 2В2О8+ К2О - 4ВаО3+ +жидкость. Конгруэнтное плав- ление. 33.5 66.5 825
6 К20 • 4В2О3-|-жидкость. Плавление. — — 857
7 К2О-4В2О3+К2О-5В2О+ +жидкость. Конгруэнтное плав- ление. 21.3 78.7 780
8 К2О-2В2О34-К2О - 4В2О3+ +жидкость (стекло). Метастабильная эв- тектика. 36.5 63.5 752
9 а-К2О-5В203-|-К20‘ 4В2О3 -(-жидкость (стекло). Метастабильное кон- груэнтное плавле- ние. 760
(рис. 166): К2О-2В2О3, К2О-В2О3, К2О-ЗВ2О3, К2О-4В2О3 и
К2О-5В2О3. Плавящееся инконгруэнтно соединение К2О-ЗВ2О3
кристаллизуется с трудом, и иногда удавалось наблюдать метаста-
бильную эвтектику между соседними с К2О -ЗВ2О3 соедине-
ниями — К2О -2В2О3 и К2О-4В2О3 (рис. 166). Соединение
К2О *5В2О3 получено в трех полиморфных модификациях. Высоко-
температурная a-форма устойчива от температуры плавления
этого соединения (780°) до 720°, когда переходит в £-форму(рис. 167).
166
Боратные системы
Высокотемпературная a-форма может непосредственно перехо-
дить в у-форму при 690°. Равновесия Ролле не смог наблюдать.
Кристаллическую структуру пентабората калия изучил Крог-
Му [11.
Рис. 166. Диаграмма состояния си- Рис. 167. Часть диаграммы со-
стемы К2О—В2О3. стояния системы К2О—В2О3.
Штриховые линии — метастабильное рав- Штриховые линии — метастабильное
новесие. равновесие.
Литература
1. Krogh-Moe J., Arkiv Kemi, 14, № 39, 439, 1959.
2. R о 11 е t А.-Р., Compt. rend., 200, № 21, 1763, 1935.
3. R ollet A.-P., Compt. rend., 202, № 22, 1863, 1936.
Rb2O—B2OS
Димитриев, Маринов и Ставракева [11 изучали систему в кон-
центрационных пределах от 27 до 82 вес.% В2О3 методом «отжига
и закалки», дополненным наблюдениями в нагревательном микро-
скопе. На диаграмме состояния приводится пять соединений
ЁоратнЫе системы
167
(рис. 168): Rb2O-B2O3, Rb2O*2B2O3, Rb2O-3B2O3, Rb2O-4BrO3 и
Rb О -5B2O3. Все эти соединения плавятся конгруэнтно. Соедине-
ние Rb2O -5В2О3 существует в двух полиморфных формах: низко-
температурной моноклинной и высокотемпературной ромбической.
Авторами было получено еще соединение Rb2O -9В2О3 ромбической
сингонии.
Кристаллические фазы системы Rb2O—В2О3 (ио Маринову)
Соединение Система Ng Np 2V° Оптический знак
Rb2O-B2O3. II (-)
Rb2O-2BrO3. Ромбическая. — — —— П(+)
Rb2O-3B2O3. » 1.548 1.508 65 II (-)
— 1.545 1.489 — П(+)
Rb2O-5B2O3 низкотемпе- Моноклинная. 1.500 1.450 —— С : А? =27° (+)
ратурный. Rb2O-5B2O3 высокотем- Ромбическая. 1.558 1.481 70 П(+)
пературный. Rb2O*9B2O3. » 1.557 1.481 70 II (±)
Литература
1. D i m i t г i е v J. В., М. R. М а г 1 п о v, D. A. S t a v г a k е v а,
Compt. rend. Acad. bulg. sci., 19, № 11, 1055, 1966.
Cs2O—B2O3
Изучение этой системы имеет значение для структурных ис-
следований боратных стекол.
Систему в интервале составов от 7 до 26 мол. % Cs2O изучил
Крог-Му [1]. Четыре соединения имеют состав (рис. 169):
Cs2O-3B2O3, Cs2O«4B2O3, Cs2O«5B2O3 и Cs2O-9B2O3. Состав пя-
того, богатого борным ангидридом соединения моноклинной синго-
нии определить не удалось. Возможно, это модификация соедине-
ния Cs2O-9B2O3. Соединение Cs2O«3B2O3 ромбической сингонии
имеет параметры решетки: а=6.18, 6=8.48, с=9.17 А; теоре-
тическая плотность 3.39 г/см3. Соединение Cs2O -4В2О3 с псев-
докубической решеткой, а=5.74 А.
Соединение Cs2O -5В2О3 моноклинной сингонии с параметрами
решетки: а=5.66, 6=9.59, с=6.79 А, [3=111°; экспериментально
определенная плотность 3.0 г/см3. Соединение Cs2O • 9В2О3 с тетра-
гональной сингонией имеет параметры решетки: а=8.74,
с=15.72 А; экспериментально найденная плотность 2.47 г/см3.
Коше [2], пользовавшаяся термографическим методом, расши-
рила исследуемую концентрационную область, охватив составы
Инвариантные точки системы Св2О—В2О3 (по Коше)
Точка Фазы Процесс Состав, вес.% Темпера- тура, °C
Са2О B2O3
1 Cs2O • В 2О з+ жидкость. Плавление. — — 732
2 Cs2O • B2Os+Cs2O • 2В2О3+жидкость. Эвтектика. 71.0 29.0 622
3 Gs2O • 2B2Os4-Cs2O • ЗВ2О+жидкость. Инконгруэнтное плавление. 68.5 31.5 691
4 Cs2O • ЗВ2О3+жидкость. Плавление. — — 842
5 Cs2O • 3B2Os+Cs2O • 4В2О3+жидкость. Инконгруэнтное плавление. 49.6 50.4 672
6 Cs2O- 3B2Os4-a-Cs2O • 5B2Os+жидкость. Метастабильная эвтектика. 49.2 50.8 645
7 Cs2O -4B2Os+a-Cs2O 5B2OS+жидкость. Эвтектика. 46.5 53.5 662
8 a-Cs2O • 5B2OS+жидкость. Плавление. — — 669
9 a-Cs2O • 5B2Os+a-Cs2O • 9В2О3+жидкость. Эвтектика- ' 34 66.0 591
10 a-Cs2O • 9В2О3+жидкость. Плавление. — — 596
И a-Cs2O • 5B2Os+P-Cs2O • 9В2О3+жидкость. Метастабильное инконгруэнтное 31 69.0 562
плавление.
Рис. 169. Диаграмма состояния
системы Сз2О—ВаО8 (по Крог-Му).
Рис. 170. Диаграмма состояния системы CSjO—В2О3 (по Коше).
1 — результаты термического анализа; 2 — характеристика продолжитель-
ности выдерживания.
170
Боратные системы
от 20 до 80 мол. % В2О3. Диаграмма состояния системы приведена
на рис. 170. Обнаружено шесть боратов цезия: Cs2O-B2O3,
Cs2O-2B2O3, Cs2O-3B2O3, Cs2O-4B2O3, Cs2O-5B2O3 и Cs2O-9B2O3.
Пентаборат Cs2O -5B2O3 существует в трех полиморфных моди-
фикациях. Высокотемпературная моноклинная модификация (а)
плавится при 669°.Обезвоживанием октогидрата пентабората мо-
жет быть получена у-модификация, которая при 570° переходит
в ^-модификацию, в свою очередь переходящую в d-модификацию
при 639°. Последний переход происходит только при нагревании
и должен рассматриваться как монотропный. Соединение
Cs2O -9В2О3, кроме стабильной модификации, плавящейся при
596°, образует вторую метастабильную модификацию, плавящуюся
при 562°. Коше полагает, что обнаруженное Крог-Му [31 богатое
борным ангидридом соединение моноклинной сингонии пред-
ставляет метастабильную модификацию Cs2O-9B2O3. Триборат и
пентаборат могут образовать метастабильную эвтектику (показана
отдельно на рис. 170), содержащую 50.8 вес. % В2О5 и плавящуюся
при 645°. Впервые полученный метаборат Cs2O-B2O3 легко обра-
зует длинные игольчатые кристаллы, относящиеся к кубической
сингонии. Триборат характеризуется ромбической сингонией,
тетраборат — псевдокубической.
Литература
1. Крог-Му Дж., в сб.: Цезий, ИЛ, М., 54, 1-963; см. также: Krogh-
Moe J., Arkiv Kemi, 12, № 3, 247, 1958.
2. К о с h е j J.,. Compt. rend., 258, groupe 8, № 16, 4061, 1964.
3. К г о g h - М о е J., Acta crystallogr., 13, № 11, 891, 1960.
ВеО—В2О3
Существенна для теории материаловедения ядерных реак-
торов.
Диаграмма состояния не изучена. По-видимому, здесь имеется
только одно соединение ЗВеО-В2О3. Это соединение обнаружили
Мензель и Сливинский [21, а затем Вейр и Фалькенбург [31.
Мазелев’ [11 получил егоТкристаллизацией стекол.
По ВейруТи’Фалькенбургу [3^кристаллы ЗВеО-В«0, двуос-
ные, с 27^90°,’ 2Vg=1.62, Лр=1.574.
Литература
1. Мазелев Л. Я., Изв. АН БССР, 4, 105, 1953.
2. Menzel Н., S. S 1 i w i n s k i, Zs. anorgan. allgem. Chem., 249,
№ 5/6, 357, 1942.
3. W e i г С. E., A. V. F a 1 k e n b u r g, Journ. Res. Nat. Rur. Stand.,
64, № 1, 103, 1960.
Боратные системы
171
MgO—В2О3
Имеет существенное значение для определения условий плав-
кости борных минералов и борных электролитов, используемых
вС
№00
то
1200
1000
800
О 20 /«7 / 60 80 100
Вг03 Мд0Вг03 2МдОВг03 МдО
Вес. %
Рис. 171. Диаграмма состояния
системы MgO—В2О3 (по Торопову и
Коновалову.)
Рис. 172. Диаграмма состоя-
ния системы MgO—В2О3 (по
Дэвису и Найту).
в электрометаллургии бора, а также для оценки влияния добавок
борнокислых соединений на огнеупорность периклазовых изделий
и т. д.
> Систему исследовали Торопов и Коновалов [11 и Дэвис и
Найт [21. В системе констатировано три химических соединения:
Таблица 1
Инвариантные точки системы MgO—В2О3
Точка Фазы Процесс Состав, вес. % Темпера- тура, °C
MgO B2O3
1 MgO-В2О3+жидкость ИН- Н-жидкость В. Ликвация. 0.6 99.4 1142
2 MgO-BjOa+жидкость ДН- П-жидкость В. » 36 64 1142
3 2MgO - В2О3+жидкость. Плавление. 53.66 46.34 1340
4 2MgO • B2O3+3MgO • В2О3+ 4-жидкость. Эвтектика. 57.7 42.3 1313
5 3Mg(J • В2О3+жидкость. Плавление. 63.46 36.54 1363
6 3Mg(J - B2O3+MgO+жид- кость. Эвтектика. 72.5 27.5 1358
Кристаллические фазы системы MgO—В2О3
Таблиц-a 2
Соединение Система кристаллов Габитус Спайность Ng Np Оптиче- ский знак 2У» Оптическая ориентировка
MgOB2Os ? Призмы. — 1.660 1.605 (-) — Знак главной зоны (—)
2MgO-B2Os Моноклинная или три- клинная. Угловатые фрагменты. Совершенная по одному направлению. 1.674 1.589 (-) — —
3MgO-B2Os. Ромбическая. Призмы. Ясная по (100). 1.674 1.652 (+) 26 —
Боратные системы
173
MgO-B2O3, 2MgO-B2O3 и 3MgO.B2O3 (рис. 171 и 172). Указан-
ными авторами приведены различные данные об устойчивости
MgOB2O3. В системе наблюдается область образования двух
несмешивающихся жидкостей. Расслаивание происходит выше
1142° для составов от 0.6 до 36 вес.% MgO.
Куцель [3] при исследовании богатой В2О3 части диаграммы
получил крупные призматические кристаллы нового бората со-
става MgO-2B2O3. Синтез проводился из расплава или гидротер-
мальным путем. Кристаллы этого соединения обладают ромбиче-
ской элементарной ячейкой с параметрами: а0=13.73, д0=7.97,
с0=8.62 А. Пространственная группа D2^—Pbca\ показатели
светопреломления: 7Vg=1.584, JV>n=1.583, Лр=1.542; 2У=15°,
плотность 2.53 г/см8. Куцель полагает, что ранее описанное соеди-
нение MgO-B2O3 имеет состав MgO-2B2O3.
Литература
1. Торопов Н. А., П. Ф. Коновалов, Журн. физ. хим., 14, № 8,
1103, 1940.
2. D a v i s Н. М., М. A. Knight, Journ. Amer. Ceram. Soc., 28, № 4,
97, 1945.
3. К u z el H. J., Neues Jahrb. Mineral., Monatsh., № 12, 357, 1964.
СаО—В 2O 3
Диаграмма состояния этой системы может быть использована
для оценки термического поведения боратных минералов и руд,
* 900 ft
Рис. 173. Диаграмма состояния системы
1500
0 20 Г 40/60\ 80
В& СаО-2ВгО3 СаО-В^ 2Са0-Вг03
Одна жидк.
20 / W
[СаО-ВД+Ж
ЗШ)-Вг03+Са0
ЗСа0-Вг03
100
СаО
применяющихся в качестве плавней при изготовлении эмалей и
глазурей и некоторых сортов стекла.
174
Боратные системы
Таблица 1
Инвариантные точки системы СаО—В2О3
Точка Фазы Процесс Состав, вес. % Темпера- тура, °C
СаО ВгОд
1 СаО-2В3О3-|-жидкость В-|- +жидкость А. Ликвация. 0.7 99.3 975
2 СаО-2В2О8-|-жидкость В-|- +жидкость А. » 23.5 76.5 975
3 СаО • 2В 2О3-|-жидкость. Плавление. 28.71 71.29 986
4 СаО - В20з-|- жидкость. » 44.61 55.39 1154
5 СаО • В 3О3+2СаО • В 2О3+ +жидкость. Эвтектика. 51.5 48.5 1132
6 2СаО • В2О3-|- жидкость. Плавление. 61.70 38.30 1298
7 2СаО • В2О3+ЗСаО • В2О3+ Эвтектика. 64.0 36.0 1291
8 ЗСаО- В2О3+жидкость. Плавление. 70.73 29.27 1479
Таблица 2
Кристаллические фазы системы СаО—В2О3
Соединение Система кристал- лов Габитус Спайность Плот- ность, г/см3 Ng Np 2V° Опти- ческий знак
СаО-2В3О3. . Зерна. 1.638 1.568 0 (-)
СаО-В2О3. Ромби- ческая. Пластин- ки по (100). Совер- шенная по (100), ясная по (101), слабая по (010). 2.65 1.680 1.550 Боль- шой. (-)
2СаО-В3О3. — Зерна. — — 1.667 1.585 Ма- лый. (-)
ЗСаО-В2О3. — » — — 1.728 1.630 0 (-)
Система изучена Карлсоном [1]. Как видно из рис. 173, в си-
стеме существует четыре соединения: ЗСаО-В2О3, 2СаО-В2О3,
СаО-В2О3 и СаО-2В2О3. Харт и Браун [2] методом гидротермаль-
ного синтеза получили еще соединение 2СаО-ЗВ2О3. Для системы
характерно расслаивание расплава в области, прилегающей
к В2О3.
Боратные системы
175
При повышенных давлениях соединение СаО-В2О3 претерпе-
вает полиморфное превращение. Структуру метабората кальция
изучили Марецио, Плетингер и Захариасен [3]. Кристаллы
СаВ2О4 относятся к ромбической сингонии со следующими
параметрами элементарной ячейки: а=6.124±0.003, д=11.604±
±0.004, с=4.285 +0.001 А. Харт и Браун предполагают, что в соеди-
нениях ЗСаО "BjOg и 2СаО -В2О3 имеются анионы (ВО3)3- и (В2О3)4-
соответственно.
Литература
1. С а г 1 s о n Е. Т., Journ. Res. Nat. Bur. Stand., 9, № 6, 825, 1932.
2. H a r t R. В., C. S. В г о w n , Journ. Inorg. Nucl. Chem., 24, № 12,
1057, 1962.
3. M a r e z i о M., H. A. Plettinger, W. H. Zachariasen,
Acta crystallogr., 16, № 5, 390, 1963.
SrO—B2O3
Систему изучали Гертлер [2], Витцманн с сотрудниками [3, 4]
и Ченот [11. Первые авторы получили четыре соединения:
0.0 0.1 0.2 0.3 04 0.5 06 0.1 0.8 0.9 1
Молярное отношение SrO‘-SrO+B2O3
Рис. 174. Диаграмма состояния системы
SrO—В2О3 (по Витцманну и Герцогу).
38гО-В2О3, 28гО-В2О3, 8гО'В2О3 и 8гО-2В2О3. Ченот обезвожива-
нием гидрата 8гО-ЗВ2О3-5Н2О при 820° получил, кроме того,
176
Боратные системы
SrO«3B2O3. В системе обнаруживается расслаивание расплава
(в области, примыкающей к борному ангидриду). Соединения
3SrO-B2O3, 2SrO-B2O3, SrO -В2О3 и SrO-2B2O3 плавятся без разло-
Рис. 175. Диаграмма состояния
системы SrO—В2О8 (по Ченоту).
1 — эндотермический эффект на кри-
вой дифференциального термического
анализа; г — экзотермический эффект
на кривой дифференциального терми-
ческого анализа.
жения, соединение SrO-3B2O3 инконгруэнтно при 890°. Диаграмма
состояния системы по Витцманну-- и Герцогу представлена
на рис. 174 и по Ченоту — на рис. 175.
Инвариантные точки системы SrO—В2О3
Фазы Процесс Температура, °C
по Гертлеру по Витцманну 0 сотрудниками по Ченоту
3SrO • В2О3±жидкость. Плавление. Выше 1200
3SrO- B2O3±2SrO- в2о3± ±жидкость. Эвтектика. Около 1115 — —
2SrO • В2О3±жидкость. Плавление. 1115 1177±10 —
2SrO • B2O8±SrO • В 2О8± +жидк ость. Эвтектика. 980 1062 ±20 —
SrO • В2О3±жидкость. Плавление. 1100 1155 ±10 —
SrO • В 2О8-|- SrO • 2В 2О3-|- жид- кость. Эвтектика. 890 971 ±10 —
SrO- 2В2О3±жидкость. Плавление. 930 994 ±10 —
SrO • 3B2O8-]-SrO • 2В3О3± ±жидкость. Диссоциа- ция SrO- • ЗВ2О3. — — 890
Боратные системы
177
Пироборат стронция Sr2B2OB существует в трех и, возможно,
даже четырех модификациях с нижеуказанными областями устой-
а D Л 373±5°
чивости: расплав -» a-br2B2Us --> промежуточное состоя-
361 ± 5° о с т, 284 ± 10° о „
ние-------->• ₽-Sr2B2OB-------* Y~Sr2B2Os.
Литература
1. С h е п о t С. F., Journ. Amer. Ceram. Soc., 50, № 2, 117, 1967.
2. Guertler W., Zs. anorgan. allgem. Chem., 40, № 2, 225, 337, 1904.
3. Witzmann H., W. Beulich, Zs. phys. Chem., 225, № 5—6,
336, 1964.
4. Witzmann H., G. H e r z о g, Zs. phys. Chem., 225, № 3—4, 197,
1964.
BaO—B2O3
Существенна для физико-химии бариево-боратных стекол.
Изучена Левиным и Мак-Мэрди [1 ]. В дальнейшем несколько
уточнена Левиным и Угриником [3].
С -
Ваш \ °
ОТ
1300
1100
900
700^-
О
ВаО
! 1
а.
го
о ' лве\
№ шесмешшшц.
(\1 жи8к. i
м
^’ж+ВаО-ЬВгОз'
> У50'
80 100
Мз
$ ВаО-Щ&ВаО-г&З
-<0.1____1-1____I__
W ВО
Вес. %
.8
Рис. 176. Диаграмма состояния системы
ВаО—В2О3.
Обнаружены соединения: ЗВаО-В2О3, ВаО-В2О3, ВаО-2В2О3
и ВаО-4В2О3. Установлена область двух несмешивающихся
жидкостей, простирающаяся от 1.5 до 30 вес.% ВаО. Согласно
последующим данным Левина с сотрудниками [2], верхняя крити-
12 Я. А. Торопов и др., кн. 1
178
Боратные системы
Н
1.80
ПО
1.00
.:Ш(илириТ)
А £ (или а.)
' ш(или^с
е (или ।
1
2
3
4
ЗВаО-ВгО3
Два стекла постоянного I
-состава и с постоянным [
показателем-преломления '
i—^_d_^-------- । Ва0-2В,0,
Ва0-4В203 ;
_J_____1 1 1____I 1
20
1.50
ШВ-
0
Уз
40 00
Вес. %
BaO-Bfi,
11____L
80
100
ВаО
Рис. 177. Показатели светопреломления хими-
ческих соединений и закаленных стекол
ВаО—В2О3.
1 — стекла; я — стеклообразный В,Оа по Морею; з —•
соединения; i — кристаллы ВаОа по Крачеку, Морею
и Мервину [4]. т, р и а обозначают соответственно Ng,
Nm, Np', <в и в обозначают No и Ne.
ческая точка расслаивания лежит приблизительно при 1150°
(рис. 176).
Метаборат бария ВаО-В2О3 обнаруживает превращение между
100 и 400°. Показатели светопреломления этого соединения:
7Vg= 1.650, 2Vp=1.609.
Инвариантные точки системы ВаО—В2О3 (по Левину и Мак-Марди)
Точка Фазы Процесс Состав, вес.% Темпера- тура, °C
ВаО В2О3
1 ВаО • 4В2О3-|-жидкость. Плавление. 35.51 64.49 879
2 BaO-4B2O3+BaU- 2В2О3-|~ 4-жидкость. Эвтектика. 40.6 59.4 859
3 ВаО • 2В2О3+жидкость. Плавление. 52.41 47.59 900
4 Вао-2В2О3-|-ВаО-В2О3-|- 4-жидкость. Эвтектика. 55.7 44.3 889
5 ВаО • Ва2О3-|-жидкость. Плавление. 68.7 31.23 1095
6 ВаО • В2О3-|- ЗВаО • В2О3-|- +жидкость. Эвтектика. 77.9 22.1 905
7 ЗВаО • В2О3-|-жидкость. Плавление. 86.85 13.15 1383
8 ЗВаО • В2О3-|- ВаО4~жид- кость. Эвтектика. 87.3 12.7 1370
Боратные системы
179
Соединение ВаО-2В2О3 дает двуосные, оптически^полржитель-
ные кристаллы со средней величиной 2V° и показателями свето-
преломления: 2Vg=1.668, Nm=l.(ilO,*Np=1.595. Стекло, отвечаю-
щее этому составу, имеет показатель преломления 1.615.
Кристаллы соединения ВаО-4В2О3 оптически отрицательные,
одноосные или двуосные с малой величиной 2V° и показателями
светопреломления: 2Vg=1.594 и 2Vp=1.559.
На рис. 177 приведены показатели светопреломления стекол
системы ВаО—В2О3.
Литература
1. L е v i n Е. М., Н. F. М с М u г d i е, Journ. Res. Nat. Bur. Stand.,
42, № 2, 131, 1949.
2. Levin E. M., H. F. M с M и r d i e, F. P. Hall. Phase diagrams
for ceramists. U. S. A., Columbus, p. 42, 1956.
3. Levin E. M., G. U g r i n i c, Journ. Res. Nat. Bur. Stand., 51, № 1,
37, 1953.
4. Kracek F. C., G. W. Morey, H. E. Merwin, Amer. Journ. Sci.,
35A, 143, :1938.
ZnO—В 2O 3
Имеет значение в связи с флуоресцентными свойствами обра-
зующихся соединений.
Изучалась Ингерсоном, Мореем и Тэттлом [3], Тороповым и
Коноваловым [1] и Гаррисоном и Гюммелем [2] (рис. 178, 179).
Низкотемпературная фор-
ма ZnO-B2O3 имеет показа-
тели преломления Ng=
=1.682, 2Vp=1.638 (в отли-
чие от общепринятой терми-
нологии Гаррисон и Гюммель
обозначают ее через а, а вы-
сокотемпературную форму —
через Р); она медленно прев-
ращается в д кубическую до-
декаэдрическую высокотем-
пературную форму при 600°
и очень быстро при 900°.
Точка ее плавления 982 ±3°.
Показатель преломления
7V=1.740.
“0
1200 -
iioo-
900
700
ZnO ZnO+&5ZnO-2B.O,
ж J F-гм- ,
964'
ZnO+a,-5ZnO
-2Вг03
sooy
ZnO
M
962°_________ i
"р-гпо-в-й+ж ” ।
I
^ZnO-BzO3+>K2 I
a-5ZnO-2B20^a.-ZnO-B2O
'"а,-2гО-В^~^~~ ;|
20 5=2 W 1-1 s0 80 100
вео.а/о вг°з
Рис. 178. Диаграмма состояния си-
стемы ZnO—В2О3.
Низкотемпературная форма 5ZnO«2B2O3 двуосная, отрица-
тельная (2Vg«sl.75, JVm=1.741, 2Vp=1.672); по Ингерсону и др.,
вычисленное (—) 2V=30°, р > V. Быстрое обратимое превраще-
8
t
12*
180
Боратные системы
ние 5ZnO-2B2O3 происходит при 964 +4°. Инконгруэнтное
плавление при 1045°.
Эвтектика между 5ZnO«2B2O3 и ZnO-B2O3 лежит при 961+3°
и 65.5 вес. % ZnO.
Одна из двух жидкостей в области несмешиваемости содержит
53.5 вес. % ZnO, и ее стекло имеет 2V=1.640.
1080
ZnO+Ж \
10501- №5°
Жидк.
1000
ZnO+fl6ZnO
2Вг03
969'
^В-52пО-2В,ОлЖ I
' 3 3 'ж}*ж2
-zno-вд+ж;
$—-
950 _
15
ZnO
--------Жо 8 961 АР-Яи-ВД,
7 a-eZnO-ZB^fiZra-B^ +ж2 [
25 5-2--35 95 1-1 55
95 1-1 55
Вес. % вг°з
Рис. 179. Часть диаграммы состояния
системы ZnO—В2О3 в увеличенном мас-
штабе.
Светопреломление стекол меняется по прямой от 1.640 при
53.5 (вес.)% ZnO и 46.5% В2О3 до 1.678 при 68% ZnO и 32% В2О3.
Линейное расширение ZnO-B2O3 между 50 и 600° составляет
35-10-7, а для 5ZnO-2B2O3 —24.4-10-7 см/см/° С.
Низкотемпературная форма 5ZnO -2В2О3 с марганцевым актива-
тором дает оранжевую флуоресценцию, а высокотемпературная
форма ZnO B2O3 — зеленую флуоресценцию при 2537 А. Цин-
ково-боратные стекла и низкотемпературная форма ZnO-B2O3
имеют слабую флуоресценцию.
Литература
1. Торопов Н. А., П. Ф. Коновалов, ДАН СССР, 66, № 6, 1105,
1949.
2. Н а г г i s о n D. Е., F. A. Hummel, Journ. Electrochem. Soc., 103,
№ 9, 491, 1956.
3. I n g e r s о n E., G. W. Morey, O. F. Tuttle, Amer. Journ. Sci.,
246, № 1, 31, 1948.
Боратные системы
181
CdO—В 2О3
Представляет интерес в связи с люминесцентными свойствами
боратов кадмия.
Изучена Мацетти и Де Чарли [2], Суббарао и Гюммелем [3].
По данным последних, система (рис. 180) характеризуется областью
несмешиваемости (46.4—100% В2О3) и четырьмя соединениями:
1) 2CdO-3B2O3 (44.86% В2О3), плавится конгруэнтно при 980+5°,
образует кристаллы гексаго-
нального облика с Ng= 1.630,
Ар=1.617; 2) L3CdO-2B2O3
(26.55% В2О3), с конгруэнтным
плавлением при 1005 ±5°, об-
разует удлиненные кристаллы с
Ag=1.780, Ар=1.745; 3) 2CdO-
• В2О3 (21.33% В2О3), плавится
конгруэнтно при 980° и около
900° испытывает быстрые обра-
тимые ^-превращения; обе
формы различимы, рентгено-
графически; для P-2CdO -В2О3
Ng > 1.790, Np=1.775; 4) 3CdO •
• В2О3 (15.31% В2О3), плавится
конгруэнтно при 1020° и суще-
ствует в двух полиморфных
формах. Обратимые превращения (-—870°) сопровождаются значи-
тельными изменениями объема. Соединение CdO-B2O3 в системе
не было найдено.
Рентгеновские исследования Ханда и Крог-Му [11 отличаются
от данных Суббарао и Гюммеля. Они уверенно характеризуют два
соединения: 1) CdO-2B2O3 ромбической сингонии, а=8.22,
5=8.74, с=14.20 A, d9Mn=3.52+0.08 г/см8, d =3.51, Z=8;
2) 2CdO-B2O3 триклинной сингонии, а=3.47, 5=6.36, с=10.06 А,
Z—2, dpao,=5.24 г/см8. Они указывают, что порошкограммы
в области между составами 2 : 1 и 1 : 2 отвечают порошкограммам
чистых соединений 1:2 и 2:1, а существование 2:3 и 3:2
не было подтверждено.
С
1000
800
900
сгвз
Две жидк.
сгвз+в+ж
7ЛЛ1__J—1___1----1----1--—1
0 ' 20 \ 906080100
СМ 3'12-1 В,0,
Вес.°/о
Рис. 180. Диаграмма состояния си-
стемы CdO—ВаО3.
№
Литература
1- Hand W. D., J. Krogh-Moe, Journ. Amer. Ceram. Soc., 45, № 4,
197, 1962.
2. Mazzetti C., F. De С a r 1 i, Intern. Critical Tables, 4, 55, 1928.
3. S u b b а г а о E. C., F. A. Hummel, Journ. Electrochem. Soc., 103,
29, 1956.
182
Боратные системы
А12О3—В2О3
Рис. 181. Диаграмма состоя-
ния системы AljjOo— В2О8.
Частная система более общих систем, имеющих значение для
стекольной и керамической технологии. Составы, богатые окисью
алюминия, могут найти применение в качестве плавленых огне-
упоров.
Система изучалась Гилиссе и Фос-
тером [1 ] методом закалки образцов,
сплавленных в запаянной платино-
вой трубке. Обнаружено два соеди-
нения: 9А12О3-2В2О3 и 2А12О3-В2О3
(рис. 181). Соединение 2А12О3-В2О3
плавится инконгруэнтно при 1035°.
Предполагается, что соединение
9А12О3 • 2В2О3 также плавится ин-
конгруэнтно, хотя это заключение
сделано путем экстраполяции. Авто-
ры не исключают возможности су-
ществования твердых растворов в
системе и наличия несмешиваемости
в жидкой фазе.
Кристаллы бороалюмината 9А12О3 •
•2В2О3 описываются как ромбичес-
кие, образующие призмы (110), вы-
тянутые по оси С, с совершенной
спайностью по (001) и неясной по
(111). Твердость как у кварца. Плот-
ность 2.93 г/см3. Образуют двойники
прорастания.
Плоскость оптических* осей (010),
Z=c, Y=b и Х=а\ (+) 27=87°.
Острая биссектриса (Z) нормальная
к (001). Ag=1.625, Am=1.603, Ар=1.589. Естественный минерал
состава А12О3-В2О3 называется еремеевитом и по своим свойствам
сильно отличается от искусственного бороалюмината 9А12О3-
•2В2О3. Еремеевит — псевдогексагональный, ромбический, с Nm=
= 1.64, Ng—Np — умеренное (?). 27=52°, плотность 3.28 г/см3.
Литература
1. G i е 1 i s s е Р. J. М., М. R. Foster, Nature, 195, № 4836, 69, 1962.
Боратные системы
183
Т12О-В2О3
Каннери и Морелли [3J изучали область системы в концент-
рационных пределах от 4.7 до 17 вес.% В2О3 (метод термического
анализа). Обнаружено три соединения: ЗТ12О-В2О3, 2Т12О-В2О3
и Т12О-В2О3. Буази и Тубул [1J получили ЗТ12О-В2О3, обезвожи-
Рис. 182. Диаграмма состояния системы Т1аО— В2О3.
1 — ликвидус; 2 — инвариантные точки.
вая гидратированные бораты таллия. Эти же авторы [2] путем
термического анализа по методике, предложенной Ролле [4],
изучили область от 13 до 50 вес.% В2О3. Было установлено суще-
ствование пяти боратов: Т12О-В2О3, Т12О-2В2О3, Т12О-ЗВ2О3,
Т12О-4В2О3 и Т12О-5В2О3. Обнаружена значительная область не-
смешиваемости (рис. 182).
Для системы характерно образование метастабильных обла-
стей, показанных на диаграмме штриховыми линиями. Диборат
Инвариантные точки системы Т12О—В2О3
Точка Фазы Процесс Состав, вес. % Темпера- тура, °C
Т12О B2O3
А Т120 • B20s+y-T12O • 2В203+жидк ость. Метастабильная эвтектика. 83 5 16.5 458
В Т120 • В2О3+а-Т12О- 2В203+жидк ость. » » 84.3 15.7 470
С Т120 • В203+ р-Т12О • 2В203+жидкость. Эвтектика. 85 15 481
D T12OS- 3B2Os+y-T12O- 2В203+жидкость. Метастабильная перитектика. 80.2 19.8 494
F а-Т120 • 2В203+ р-Т12О • 2В2О34-жидкость. Полиморфное превращение. 84.5 15.5 498
Н а-Т12О-2В2О3+жидкость Я(22.1% В20з)+ +жидкость Е (15.2% B2Oj). Критическая точка. — — 536
J Т120 • ЗВ2О3+а-Т12О -2В2О3+жидк ость. Стабильная перитектика. 77 23 542
К Т120- ЗВ2О3+Т12О- 5В2О3+жидкость. Метастабильная эвтектика. 65 35 610
м Т120 • ЗВ2О 3+ Т120 • 4В2О3+жидкость. Стабильная эвтектика. 65.8 34.2 622
N Т120-5В2О3+Т12О-4В20з+жидк ость. Стабильная перитектика. 63.6 36.4 635
Боратные системы
185
Т12О-2В2О3 триморфен; 7-форма этого соединения, метастабиль-
ная при всех температурах, плавится с разложением при 494°
и образует с одноборатом Т12О-В2О3 метастабильную эвтектику
при 458°. р-Т12О-2В2О3 устойчив до 498°, когда переходит
в я-модификацию. Верхняя критическая температура расслаива-
ния находится при 720°, нижняя (метастабильная) около 505°.
Пентаборат Т12О-5В2О3 плавится конгруэнтно при 662°. Инва-
риантные точки системы приведены в таблице.
Литература
1. Bouaziz R., М. Т о u b о и 1, Compt. rend., 258, № 26, 6429, 1964.
2. Bouaziz R., M. T о и b о и 1, Compt. rend., 264, ser. С, № 16, 1374,
1967.
3. Canneri, Morelli, Atti Acad. Lincei, 31, № 5, 109, 1922.
4. R о 11 e t M., Compt. rend., 200, № 21, 1763, 1935.
Sc2O3—B2O3
Систему изучил Левин [2] методом «отжига и закалки» с ис-
пользованием эапаянных платиновых трубок. Диаграмма состоя-
ния, представленная на рис. 183, характеризуется наличием одного
Рис. 183. Диаграмма состояния системы
SCgOg—В2О8.
186
Боратные системы
соединения ScBO3, плавящегося конгруэнтно при 1610±10°.
Обнаружена большая область несмешивающихся жидкостей, рас-
пространяющихся при 1526+5° от почти чистого В2О3 до состава,
содержащего 34.0 мол.% Sc2O3.
Борат скандия ScBO3 имеет структуру типа кальцита, с гек-
сагональной элементарной ячейкой, имеющей параметры: а=
=4.753, с=15.27 А. Показатели светопреломления ScBO3: No=
= 1.872, Ne=1.780. Эти величины отличаются от приводимых Бид-
лем [1]: #0=1.867, #е=1.817.
Литература
1. В i е d 1 A., Amer. Mineralogist, 51, № 3—4, 521, 1966.
2. L е v i n E. M., Journ. Amer. Ceram. Soc., 50, № 1, 53, 1967.
La2O3—B2O3
Систему, интересную для технологии щелочно-боратных сте-
кол, изучили Левин, Роббинс и Уоринг [2]. Обнаружено три сое-
°С
1800
1лг03+Ж
з 3Lo203B203 La2O3B2O3 La^-3^
Мол. °1о
Рис. 184. Диаграмма состояния системы
Ьа2О8—В2О3.
в. гл. — высокотемпературная модификация; н. т.
низкотемпературная модификация.
Боратные системы
187
Оптические свойства кристаллических соединений системы Ьа2О3—В2О3
Соединение Показатели преломления (XD, 25°) Опти- ческий знак 2V° Двупре- ломление
Ng Nm Np
ЗЬаяОз'ВвОз La2O3-B203 (тип араго- 1.953 1.948 1.907 (-) —25 0.046
нита) La2O3-B2O3 (высокотем- пературная форма не- 1.882 1.877 1.800 (-) —20 0.082
известной структуры) 1.878 1.856 1.742 (-) —50 0.136
LftgOg'SBgOg 1.791 1.769 1.694 (-) —50 0.097
N
динения: ЗЬа2О3"В2О3, La2O3-B2O8 и La^g^BgOg (рис. 184).
Соединение Ьа2О3-В2О3 имеет превращение при температуре
1488+5°; структура типа арагонита переходит в высокотемпера-
турную форму с низкой симметрией. Твер-
дых растворов в системе не обнаружено.
В системе имеется область несмеши-
вающихся жидкостей, наблюдаемая выше
1135±5° для составов от почти чистого
В2О3 до 21.5 мол.% (56.2 вес.%) Ьа2О3.
На рис. 185 приведены значения по-
ным ангидридом стекол.
Исупова и Лилеев- [1] изучали реак-
ции в системе Ьа2О3—В2О3 в темпера-
турном интервале 1100—1300°. Получено
два соединения: Ьа2О3-ЗВ2О3—Ьа(ВО2)3
и Ьа2О3"В2О3=ЬаВО3. Эти же соединения получались путем
реакций обмена между сульфатом лантана и боратами натрия.
казателя светопреломления богатых бор
1.700 --1------1-----1-----1
70 80 90 100
Laz03 Мол.о/о В20.
Рис. 185. Показатели
светопреломления стекол
системы Ьа2О3—В2О3.
Литература
1. Исупова Е. Н., И. С. Лилеев, Изв. АН СССР, неорг. матер.,
1, № 2, 222, 1965.
2. L е v i n Е. М., С. R. Robbins, J. L. Waring, Journ. Amer.
Ceram. Soc., 44, № 2, 87, 1961.
Nd2Og—B2O3
Диаграмма состояния системы не построена. Тананаев, Беля-
ков, Джуринский и Беруль [1 ] изучали кристаллизацию боратов
неодима из натриево-боратных расплавов. Отношение Nd2O3 :
188
Боратные системы
В2О3 в жидкой фазе изменялось в пределах (вес.%) от 11.22 :
60.91 до 0.53 : 94.54. Было получено два соединения: Nd2O3«
• В2О3 и Nd2O3-3B2O3.
Литература
1. Т а н а н а е в И. В., И. М. Беляков, Б. Ф. Д ж у р и н с к и й,
С. И. Б е р у л ь, Изв. АН СССР, неорг. матер., 2, № 1, 165, 1966.
РЬО—В 2О з
Представляет интерес с точки зрения производства керамиче-
ских глазурей и некоторых стекол.
Изучена Геллером и Бантингом [1]. В системе обнаружено
четыре химических соединения: 4РЬО*В2О3, 2РЬО«В2О3, 5РЬ0«
•4В2О3, РЬО-2ВаО3. Соединения 4РЬО*В2О3 и 2РЬО-ВаО3 имеют
полиморфные превращения (рис. 186). Система характеризуется
значительной областью ликвации.
Таблица 1
Инвариантные точки системы РЬО—В2О3
Точка Фазы Процесс Состав, вес. % Темпе- рату- ра, “С
РЬО ВгОз
1 РЬО+жидкость. Плавление. 100 0 886
2 РЬО-|~а-4РЬО- B2O3+ +жидкость. Эвтектика. 93.7 6.3 560
3 а-4РЬО-ВаО3+₽-4РЬО. Полиморфное прев- 92.7 7.3 553
4 • Во03. а-2РЬО • B3O3-|-5PbO • • 4B «О 3-|-жидкость. a-2PbO-BaO3+P-2PbO. • в2о3. ращение. Инконгруэнтное плавление 2:1. 86.6 13.4 497
5 Полиморфное прев- ращение. 86.4 13.4 473
6 5PbO.4B2O3+PbO. • 2ВО3+жидкость. И нконгруэнтное плавление 5: 4. 76.1 23.9 548
7 PbO • 2B2O3-|-жидкость. Плавление. 61.4 38.6 768
8 4РЬ0- В2О3-|-жидкость. » 92.7 7.3 565
9 РЬО- 2В2О34-жидкость А-1-жидкость В. Ликвация. 43.0 57.0 742
10 РЬО • 2В2О3+жидкость А 4-жидкость В. 9.0 91.0 742
Боратные системы
189
Таблица 2
Кристаллические фазы системы РЬО—В2О3
Соединение Ng Np 2V° Опти- ческий знак
а-4РЬО • B20s .... 2.20 2.15 ? ?
₽-4РЬО • В2О3 .... 2.24 2.15 80 (-)
а-2РЬО. В203 .... 2.025 1.965 60 (-)
0-2РЬО • В2О3 .... 2.11 2.08 90 (+)
5РЬО-4В2О3 . . . . 1.96 1.91 65 (-)
РЬО • 2ВаО3 1.935 1.915 ? ?
Лидберг, Радерер и Бержерон [2] исследовали несмешивае-
мость жидкостей в системе и доказали метастабильный характер
Рис. 186. Диаграмма состояния системы
РЬО—В2О3.
ликвации. На рис. 187
приведена часть диаграм-
мы системы (примыкающая
Мол.Чо
°С‘
800
700
ООО
500
О 10 20 30 М 50 60
8г03 8есЛ РЬО
Рис. 187. Кривая
части системы РЬО—B26L
область несмешиваемости рас-
плавов (по Лидбергу с со-
трудниками).
1 — кривая ликвидуса по
бергу; 2 — несмешиваемость
жидкостей; з — растворение
сталлов.
ликвидуса
—’2^3 ®
к В2О3) по Геллеру и Бантингу. Здесь
же • нанесены кривые ликвидуса и
область расслаивания по Лидбергу
с сотрудниками. В области А дли-
тельная выдержка (36 час.) не при-
водила к выделению кристаллов или
смешиваемости. Авторы подчеркивают, что ими не были достигну-
Лид-
двух
кри-
возникновению видимой не-
ты равновесные условия.
Литература
1. Geller R., Е. Bunting, Journ. Res. Nat. Bur. Stand., 18, № 5,
585, 1937.
2. L i e d b e r g D. J., C. G. R u d e г e г, C. G. Bergeron, Journ.
Amer. Ceram. Soc., 48,_№ 8,_441, 1965.
190
Боратные системы
TiO2—В2О3
Систему ориентировочно изучал Бирд [1] методом закалки.
Смеси TiO2 (рутил) и стеклообразного борного ангидрида поме-
щались в платиновые капсулы, которые нагревались до 1600°.
Химических соединений и твердых растворов не было обнаружено.
Система относится к простым эвтектическим, причем эвтектика
расположена вблизи В2О3. В системе, по-видимому, имеется об-
ласть несмешивающихся расплавов. При нагревании смесей, бо-
гатых двуокисью титана, выше 1350° в продуктах реакции на-
ходился анатаз. Анатаз также был получен при обжиге в печи
при 1700° (1—2 мин.).
Литература
1. В е а г d W. С. Phase relations in the systems titania and titania-boric
acide. Thesis. Ohio State Univ., 1965, Dissert. Abstr., 26, 2245, 1965.
ThO2—B2O3
Система интересна для выяснения возможных реакций между
сверхогнеупорными материалами и легкоплавкими окислами.
Систему исследовали Рэйз и Лэйн [2], применяя метод за-
Рис. 188. Диаграмма состоя-
ния системы ThO2—В2О8.
верк [1]. Кристаллы этого
калки. Установлено существование
одного соединения ThB2Os (рис. 188).
При 1483 ±5° это соединение плавит-
ся с образованием двух несмешива-
ющихся жидкостей: одной по со-
ставу богаче В2О3 и другой богаче
ThO2, чем ThB2Os. Область несме-
шиваемости распространяется от 20
до 90 мол. % В2О3. Эвтектика между
В2О3 и ThB2Os содержит прибли-
зительно 98% В2О3 и имеет тем-
пературу плавления около 325°.
Вторая эвтектика (между ThO2 и
ThB2Os) содержит 18—20 мол.% В2О3
и плавится немного ниже 1483°.
Борат тория детально исследо-
вали Бэскин, Харада и Ханд-
соединения относятся к моноклинной
сингонии и имеют показатели светопреломления: =1.823,
Л>ге=1.750, Лр=1.729. Угол оптических осей 2У=56°. Пара-
Боратные системы
191
метры элементар ой ячейки: а=11.554+ 0.006, 6=6.937 + 0.004,
с=10.256+0.006 а. и., р=101°28'. Плотность вычисленная
5.502 г/см3, плотность экспериментально найденная 5.53 г/см3.
Литература
1. В a s k i n У., Y. Harada, J. Н. Н a n d w е г к, Journ. Amer.
Ceram. Soc., 44, № 9, 456, 1961.
2. Rase D. E., G. Lane, Journ. Amer. Ceram. Soc., 47, № 1, 48, 1961.
BI2O3--
Изучена Левиным и Мак-Даниелем [1]. Имеет значение как
флюс при выращивании кристаллов и как связка для скрепления
серебряных частиц на керамических диэлектриках.
Рис. 189. Диаграмма состояния системы Bi2O8— В2О8.
’< 'ut. — низкотемпературная модификация; в. т. — высокотемпературная
модификация.
Обнаружено пять соединений: 12Bi2O3*B2O3, 2Bi2O3-B2O3,
‘’BigOj-SBgOs, Bi2O3*3B2O3 и Bi2O3-4B2O3 (рис. 189). В си-
стеме существует область несмешивающихся жидкостей, на-
192
Боратные системы
блюдаемая выше 709° почти от чистого борного ангидрида
до состава с 19.0 мол.% Bi2O3.
Соединение 12Bi2O3>B2O3, по-видимому, является твердым
раствором внедрения. Кристаллы 2Bi2O3*B2O3 имеют слабое
двупреломление, с показателем светопреломления выше 1.80.
Рис. 190. Показатели светопре-
ломления закаленных стекол
системы Bi2O3—В2О3.
Низшее значение показателя светопреломления 3Bi2O3-5B2O3
равно приблизительно 1.88, двупреломление довольно высокое.
Это соединение имеет низкую симметрию и не относится к группе
граната. Соединение Bi2O3*3B2O3 характеризуется показателями
светопреломления Ng выше 1.90, , отличается низкой
симметрией. Сплавы системы В12О3—В2О3 образуют стекла.
Показатели преломления стекол этой системы представлены на
рис. 190.
Литература
1. L е v i n Е. М., С. L. McDaniel, Journ. Amer. Ceram. Soc., 45,
№ 8, 355, 1962.
Nb2O6—B2O3
Изучена Левиным [1 ] методом «отжига и закалки» с примене-
нием запаянных платиновых трубок. Установлено образование
одного химического соединения, состав которого не был точно оп-
ределен. Наиболее вероятным является состав 3Nb2O6*B2O3.
Это соединение инконгруэнтно плавится около 1150°, медленно
распадаясь на богатую В2О3 жидкость и высокотемпературную
модификацию Nb2Os (рис. 191). В системе установлена значитель-
ная область расслаивания жидкой фазы, простирающаяся при
Боратные системы
193
1352° от 10 до 65.7 мол.% Nb2Os. Эта величина находится в со-
гласии с теоретическими расчетами несмешиваемости силикатных
расплавов по Левину [2].
Рис. 191. Диаграмма состоя-
ния системы Nb2O6—В2О8.
1 — нет плавления; я — частичное
плавление; 3 — полное плавление.
Литература
1. L е v i n Е. М., Joum. Res. Nat. Bur. Stand., 70A, Xs 1, 11, 1966.
2. L e v i n E. M., S. Block, Journ. Amer. Ceram. Soc., 40, Xs 3, 95,
113, 1957.
WO3-BaO3
Система изучена Левиным [2] методом «отжига и закалки»
с применением запаянных платиновых трубочек. Из рис. 192
видно, что в системе не обнаружено соединений, твердых раство-
13 Н. А, Торопов и др., кк. 1
194
Боратные системы
ров и несмешиваемости жидких фаз. Найденная температура
плавления W03 близка к таковой, приводимой Ротом и Уорин-
Рис. 192. Фазовые отношения
в системе WOS—B2OS.
1 — чистая жидкость; г — WO, в рав-
новесии с жидкостью; з — твердый
WO,.
гом [3] и отличается от данных Егера и Гермса [1], считавших,
что WO3 плавится, при 1473°.
Литература
1. Jaeger F. М., Н. G. Germs, Zs. anorgan. allgem. Chem., 119,
№ 1/3, 145, 1921.
2. Levin E. M., Journ. Amer. Ceram. Soc., 48, № 9, 491, 1965.
3. R о t h R. S., J. L. Waring, Journ. Res. Nat. Bur. Stand., 70A,
№ 4, 281, 1966.
Боратные системы
195
МпО—В2О3
Систему исследовали Мацетти и Де Чарли [2]. Диаграмма со-
стояния, по данным этих авторов, построена Левиным, Мак-
Рис. 193. Диаграмма состоя-
ния системы МпО—В2О3.
Мэрди и Холлом [1]. Отмечается существование трех соединений:
МпО-В2О3, МпО-2В2О3 и МпО-ЗВ2О3 (рис. 193).
Литература
1. Levin Е. М., Н. F. М с М и г d i е, F. Р. Hall. Phase diagrams
for ceramists. U. S. A., Columbus, p. 57, 1956.
2. Mazzetti C., F. De С a r 1 i. Gazz. chim. ital., 56, 27, 1926.
CoO—B2O3
Имеет значение для производства керамических красок, не-
которых сортов стекла, а также для изготовления эмалей и гла-
зурей.
Система изучена Коноваловым [2]. В системе (рис. 194) на-
блюдается обширная область двух несмешивающихся жидких фаз
и образование двух кристаллических боратов кобальта: 2СоО«
•В2О3 (1150°) с #£=1.86+0.03 и #/>=1.82+0.03 и ЗСоО-В2О3
(1270°) с #£=1.89+0.03 и #/>=1.84+0.03 — и трех эвтектик:
1) между В2О3 и 2СоО-В2О3 (900°, 61.0 вес.% СоО и 39.0% В2О3);
2) между 2СоО-В2О3 и ЗСоО-В2О3 (1080°, 72.5% СоО и 27.5%
ВаО3); 3) между ЗСоО -В2О3 и СоО (1205°, 81.6% СоО и 18.4% В2О3).
Согласно Беляеву [1], твердая фаза 2Со0-В203 не может на-
ходиться в равновесии с двумя жидкими фазами, так как это
противоречит правилу фаз. Можно предположить (рис. 195),
13*
196
Боратные системы
что в системе образуется третье соединение хСоО-уВ2О3, кото-
рое при плавлении (1050°) разлагается на две несмешивающиеся
жидкости.
°C
1500
1300
1100
900
• одюжидк.^
f §»
*йве жидк. 1 ^0
j________«2
1Ж*2СоО'ВгО3ggtf
I ”
1 8,0,*
ЗСоО'ВгО3
ЗСоОв\о,
*СоО\
1 Qg l/j
2Co0'BA 2coo-B£3t3ca-Bifl3
1600
поо
Ш)
юоо
800
воо
0 20
8А
90 S0 80 100
2СоО'80, Q10
вес.% Хо™А
'Жидк ।
•<$>
j Лбе жидк.
L t 1050°
'ж+хСоО-уВД мД/
{ IxOoO-i/B^
I 1+2СоО-ВгО3
'-—^В^хСоО'^О.
1150°
0 20 90 60'
вг°з Вес.% Со°
Рис. 194. Диаграмма состоя-
ния системы СоО—В2О3 (по
Коновалову).
Рис. 195. Диаграмма со-
стояния системы СоО—В2О3
(по Беляеву).
Литература
1. Б е л я е в И. Н., Журн. физ. хим., 30, № 6, 1419, 1956
2. К о н о в а л о в П. Ф., ДАН СССР, 70, № 5, 847, 1950.
АЛЮМИНАТНЫЕ СИСТЕМЫ
Li 20—Al 20 з
Существенна для технологии литиевых стеклокристалличе-
ских продуктов.
Все исследователи этой системы ограничивались областью
от чистого А1аО3 до состава Li2O«Al2O3, что связано с большой
летучестью Li2O.
Гюммель, Састри и Уортинг [5] синтезировали алюминаты
лития обжигом смесей при 800—1790°. Галахов [1] построил диа-
°С
/о \гя/ уи / Ю0
аг° Иг0-Д1г03 И^-5Л1г03 Мг°з
Вес.о/о
Рис. 196. Диаграмма плавкости
системы Ы2О—А12О3 (по Гала-
хову).
Рис. 197. Диаграмма состояния си-
стемы Ы2О—А12О3 (по Штриклеру и
Рою).
определения температур плавления
[8] пользовались методом закалки
грамму состояния на основе
(рис. 196). Штриклер и Рой ___
(рис. 197). Недавно равновесную диаграмму системы предложил
«Лежу [7]. Установлено образование соединений Li2O«AlaO3
и Li2O-5Al2O3 (рис. 198).
Соединение Li2O-Al2O3 плавится по Галахову [1] около 1650°,
по Хюммелю с сотрудниками [5] при 1610° и по Штриклеру и
ою 18] при 1700°. Это соединение имеет быстро протекающее
превращение между 1200 и 1300° и, согласно Хэтчу [4], образует
одноосные отрицательные кристаллы с показателями светопре-
198
Алюминатные системы
ломления: Ао=1.624; Ае=1.606. Согласно Лежу [7], алюминат
LiA10a существует в виде двух модификаций; низкотемпературной
a-LiA102 и высокотемпературной 7-LiAlO2. Первая модификация
получается путем реакции в твердом состоянии при 600°. Высоко-
температурная LiA10a образуется при 900°. При этой температуре
происходит также и переход этих модификаций одна в другую.
a-LiA102 имеет ромбоэдрическую ячейку с параметрами:
а=5.006 А, а—32°30', объем элементарной ячейки 32.205 А3,
плотность 3.38 г/см3.
°C
2100
1700
1300
?-1М10г +Ш1!рвнеупор.
Lit-xAls+f^°iHeynaP-
ЧлДЩнеупор*
&о3__I
7-ИД10,+ИД150в упор.
00----------------------
a.-LiAlOi+LiAls^ упор.
50\ 60 70 80
иг° ЩЩ, Мол°/о
Соединение y-LiAlO»
имеет тетрагональную эле-
ментарную ячейку с пара-
метрами: а=5.181,с=6.29А;
плотность 2.56 г/см3. Кри-
сталлы одноосные, отри-
цательные, с показате-
лями светопреломления:
Ag=1.624, АГр=1.606.
Соединение Li2O •
5А12О3, плавящееся около
2000° [1], образует окта-
ЦД15Овупор.)
А\гО3 ____J
100
Рис. 198. Диаграмма состояния системы эдрические кристаллы и
Li2O—А12О3 (поЛежу). относится к классу шпине-
лей, показатель светопре-
ломления А=1.736 (по
Штриклеру и Рою — 1.725); плотность 3.606 г/см3. Вервей и Хейл-
ман [9] рассматривают две возможные структуры этой шпи-
нели: Al8(Li4Al12)O32 и (Li4Al4)Al18O32.
Соединение Li2O-5Al2O3, согласно Дэтту и Рою [3], суще-
ствует в нескольких своеобразных полиморфных формах. Высоко-
температурная форма со структурой шпинели при 1295+5° пе-
реходит в низкотемпературную с примитивной кубической сим-
метрией. При этом параметр решетки изменяется от 7.921 до
7.909 А. Кроме того, при низкотемпературном синтезе могут быть
получены метастабильные разновидности пятиалюмината лития,
отличающиеся дефектным строением. Лежу интерпретирует поли-
морфное превращение LiAl5O8 как переход из упорядоченного со-
стояния в неупорядоченное. Упорядоченная разновидность кри-
сталлизуется в простой кубической системе и имеет параметр
решетки а=7.908 А. Неупорядоченная разновидность имеет ку-
бическую гранецентрированную структуру типа шпинели с пара-
метром решетки а=7.925 А.
Переход упорядоченного состояния соединения ЫА1Б08 в не-
упорядоченное происходит при 1290°, и этот переход обратим.
Алюминатные системы
199
Упорядоченная фаза имеет молекулярный объем 123.67 А3, не-
упорядоченная — 124.43 А3.
Галахов высказывает предположение о существовании твер-
дых растворов между Li2O-5Al2O3 и у-глиноземом. Образую-
щийся в данной системе у-г’линозем представляет не чистый
А12О3, а своеобразный твердый
здесь является стабилизато-
ром структуры). Содержание
Li2O в у-глиноземе, по-види-
мому, может быть различ-
ным. По данным Барлетт [2]
оно составляет 0.35 вес.%,
раствор Li2O в глиноземе (Li2O
Изменение параметра решетки
шпинельной фазы
в системе ЫА13О8—А12О3
в зависимости от состава
по Хэтчу [4] 2.2—2.8% и по
расчетам Кордеса [6] 0.4%.
Лежу рентгенографически
доказал образование твер-
дых растворов на участке
ЫА1б08—А12О3. Твердые рас-
творы сохраняют шпинель-
ную структуру, и замеще-
ние можно представлять по
схеме 3Li+—► А1++++ 2 □.
I, мол. %
LiAlsOg A12Os
Формула
Здесь □ обозначаетнезамещен-
100
90
80
65
50
35
25
0
10
20
35
50
65
75
LiAl5O8
Lio.se-^U.oi Оо-оз^в1
^1‘с|.83А15.0бП0.11О8
^о.тЗ-^а.ОэОоЛбОв
Ь|‘о.47А15 17По.з808
7.925
7.921
7.919
7.914
7.910
7.909
7.909
ный узел в решетке, или «дырку». Твердый раствор можно изо-
бразить формулой Li^Al хП2яО8-
5 + "з Т
Изменение параметра кристаллической решетки твердого рас-
твора видно из таблицы.
Окись алюминия растворяется только в неупорядоченной фазе
ЫА1б08, а растворимость в упорядоченной практически равна
нулю. Как видно из диаграммы состояния (рис. 198), твердые
растворы существуют только выше 1290°, т. е. в области неупоря-
доченной фазы LiAl6O8. Предельное содержание А1аО3 в твердом
растворе увеличивается с повышением температуры. При 1400°
предельный твердый раствор имеет состав Li0 84А1Б 05 □ 0 ПО8
(6А12О3 • Li2O). Вблизи температуры плавления состав предель-
ного твердого раствора: Li0 Б8А1Б.13п0.29О8 (8.71Al2O3-Li2O).
Лежу обнаружил высокоглиноземистую фазу, для которой
дает формулу Li2O-13Al2O3. Эта фаза устойчива только вблизи
1емпературы плавления, т. е. около 2000°. Лежу обозначает эту
фазу индексом 8. В советской научной литературе такие фазы на-
зывают «(3-глиноземом».
Литература
2 R о Л1а V в Л - Пзв- Ан СССР, ОХН, № 4, 575, 1959.
• о а Г1 е 11 Н. В., Journ. Amer. Ceram. Soc., 15, Xs 7, 361, 1932.
200
Алюминатные системы
3. D a 11 a R. К., R. Roy, Journ. Amer. Ceram. Soc., 46, № 8, 388, 1963.
4. H a t c h R. A., Amer, Mineralogist, 28, № 5, 471, 1943.
5. H u m m e 1 F. A,, B. S. R. S a s t r y, D. Worting, Journ. Amer.
Ceram..^Soc,, 41, № 3, 88, 1958.
6. Kordes|E., Zs. Kristallogr., 91, № 1, 3, 1935.
7. Lejus A. M., Rev. Haut. Temper.‘et Refract., 1, № 1, 53, 1964.
8. Strickler D. W., R. Roy, Joum. Amer. Ceram. Soc,, 44, № 5, 225,
1961.
9. Verwey E. J. W., E. L. H e i 1 m a n n, Journ. Chem. Phys., 15,
№ 4, 174, 1947.
Na Al 2O3
Имеет значение для технологии получения глинозема. Исследо-
вание затруднительно из-за летучести окиси натрия.
В литературе описаны следующие алюминаты натрия: Na6A104,
NaAlOg, NaAlgOg и NaAlnO17.
Ориентировочную диаграмму состояния системы NaAlOg—
—А1аО3 построили Ролен и Фам Ху Тан [9]. Эти авторы получали
образцы для исследования прокаливанием смесей ацетата алюми-
ния и соды при 700°. Построение диаграммы осуществлялось сня-
тием термограмм (кривые охлаждения) по методу, разработанному
Будниковым и Тресвятским [7].
Ролен и Фам Ху Тан полагают, что диаграмма системы
NaAlOg—AlgO3 является простой эвтектической, так как кристал-
лизация эвтектики наблюдалась на всем изученном участке диа-
граммы (рис. 199). Температура инконгруэнтного плавления
NaAlOg равна 1550°. В литературе приводятся указания на более
высокую температуру плавления. Так, Каммермейер и Пек [8]
утверждают, что температура плавления моноалюмината натрия
превышает 1700°. Моноалюминат натрия обнаруживает полиморф-
ное превращение. Аракелян [1], пользуясь методом термического
анализа, показала, что при 465° происходит энантиотропное поли-
морфное превращение NaaO -А1аО3. Применяя высокотемпера-
турную рентгенографию, она обнаружила, что в области темпера-
тур 450—500° решетка алюмината натрия претерпевает заметные
изменения. В дальнейшем полиморфизм NaAlOg изучали Белец-
кий и Саксонов [2] и Тери, Лежу, Бриансон и Коллонг [13].
Белецкий и Саксонов снимали рентгенограммы Образцов алюми-
ната натрия, закаленных от различных температур. Было обна-
ружено, что при температуре выше 400° появляется новая фаза.
При низких температурах устойчивой является тетрагональная
модификация алюмината натрия с параметрами кристаллической
Алюминатные системы
201
NaAL02 Вес.0/» А1г°з
Рис. 199. Диаграмма со-
стояния системы NaaO—
—А1аО3.
решетки: а=12.38, с= 13.40 А. Высокотемпературная фаза имеет
кубическую решетку с параметром а=12.72 А (при 600°).
Тери с сотрудниками уточнили температуру полиморфного
превращения NaA10a, найдя ее равной 470°. По мнению этих
авторов, низкотемпературная форма NaAlOa имеет ромбиче-
скую структуру с параметрами элементарной ячейки: а=5.376,
&=5.216, с=7.075 А; высокотемпературная — тетрагональную
решетку с параметрами: а=Ь=5.325, с=7.058 А.
По данным Торопова и Шишакова [5], алюминат натрия
имеет следующие показатели светопреломления: Ng= 1.58+0.003,
Nm=i-575 + 0.005, Np=i.566 + 0.005; довольно часто наблю-
даются полисинтетические двойники;
NaaO-AlaO3 оптически двуосный, угол
оптических осей 2У=38°. Плотность
(пикнометрическая) 2.693 г/см3.
Длительное выдерживание моно-
алюмината натрия при повышенных тем-
пературах приводит к его разложению
(улетучивание NaaO) с образованием
NaaO 11А1аО3.
Соединение NaaO -5А1аО3 получено
недавно Тери и Бриансоном [11] про-
каливанием смеси а-А1аО3 и NaAlOa
при 1050°. По своей структуре пяти-
алюминат натрия сходен с NaaO -HAlgOs
и может быть отнесен к типу (3-глинозе-
ма. Гексагональная кристаллическая
решетка NaaO-5AlaO3 имеет параметры:
а=5.61, с=33.95 А. Новый алюминат
существует в виде двух модификаций.
Вторая модификация также имеет гексагональную структуру
с параметрами элементарной ячейки: а=5.59, с=22.79 A. NaAl5O8
устойчив до 1250° и выше этой температуры теряет NaaO вследст-
вие испарения. Из данных Тери и Бриансона следует, что в про-
дуктах диссоциации NaaO-5AlaO3 могут существовать твердые
растворы, однако для выяснения этого вопроса требуется дальней-
шая экспериментальная работа.
Высокоглиноземистый алюминат натрия NaaO>llAlaO3 ([3-
глинозем) получается кристаллизацией соответствующего рас-
плава. Кристаллы относятся к гексагональной системе с пока-
ча9АоЯМИ светопРеломления: Ао=1.668, Ае=1.630. Плотность
.249 г/см3. Кристаллическая структура NaaOa-llAlaO3 изучена
Адельскольдом [6]. Кристаллическая решетка характеризуется
следующими параметрами: а=5.59, с=22.49 А,
202
Алюминатные системы
Галахов [3] изучил поведение NaaO-llAlaO3 при термической
обработке. При температуре около 1300° в восстановительной
атмосфере начинается улетучивание окиси натрия и перестройка
решетки [3-фазы в решетку корунда. Это явление с повышением
температуры усиливается: при 1700° наступает полное пере-
рождение в корунд.
Рис. 200. Диаграмма состояния системы Na2O—А12О3
(по Ролану и Фам Ху Тану).
Сильно щелочной алюминат Na5A104 был получен Цинтлем
и Моравитцем [14] действием окиси натрия (NaaO) на глинозем.
Ролен и Фам Ху Тан [10] в 1965 г. дали уточненный вариант
системы NaAlOa—AJaO3 (рис. 200). В изученной области доказы-
вается существование двух высокоглиноземистых соединений:
NaaO-6AlaO3 и NaaO-11А1аО3. Существование этих соединений
со структурой магнетоплюмбита Торопов и Стукалова [4] дока-
зали еще в 1939 г.
Согласно Ролену и Фам Ху Тану, соединение NaaO-6AlaO3
плавится инконгруэнтно при 1580 + 10° (в перитектической точке
Алюминатные системы
203
содержание А1аО3 составляет 35 вес.%). Соединение NaaO-HAlaO3
плавится также инконгруэнтно около 2000°. Для перитектической
точки приводится состав: 17 вес.% NaaO и 83 вес.% А1аО3.
Структура алюминатов натрия, включая новое соединение
NaaO-6AlaO3, описана в статье Тери и Бриансона [12].
Литература
1 Аракелян О. И., Труды Всесоюзн. алюминиево-магниевого инет.,
№ 40, 32, 1957.
2 Белецкий М. С., Ю. Г. Саксонов, Журн. неорг. хим., 4,
№ 5, 972, 1959.
3. Галахов Ф. Я., Труды IV Совещ. по зкепер. минералогии и петро-
графии, вып. 1, Изд. АН СССР, М., 77, 1951.
4. Торопов Н. А., М. М. С т у к а л о в а, ДАН СССР, 24, № 5, 458,
1939.
5. Т о р о п о в Н. А., Н. А. Ш и ш а к о в, Труды II Совещ. по экспер.
минералогии и петрографии, Изд. АН СССР, М., 271, 1937.
6. Adelskold V., Arkiv Kemi, Mineral., Geol., 12A, № 29, 1938.
7. BudnikowP. P., S. G. Treswj a t sk i, Silikattechnik, 12, 396,
1961.
8. К a m m e r m e у e r K., A. Peck, Journ. Amer. Ceram. Soc., 16,
№ 8, 363, 1933.
9. Bolin M., Pham Huu Thanh, Bull. Soc. chim. France, № 5,
1030, 1963.
10. Bolin M., Pham Huu Thanh, Bev. Haut. Temper, et Befract.,
2, № 2, 175, 1965.
11. T h ё г у J., D. Briancon, Compt. rend., 254, № 15, 2782, 1962.
12. T h ё г у J., D. В r i a n с о n, Bev. Haut. Тетрёг. et Infract., 1, № 3,
221, 1964.
13. T h ё г у J., A. M. L e j u s, D. В r i a n с о n R. С о 1 1 о n g u e s,
Bull. Soc. chim. France, № 5, 973, 1961.
14. Z i n t 1 E., W. M о r a w i e t z, Zs. anorgan. allgem. Chem., 236,
№ 1—4, 372, 1938.
CuaO—AlaO3 и CuO—AlaO3
Эти системы, изученные Мизра и Чакладером [3], рассматри-
ваются вместе, так как в зависимости от температурных условий
устойчивы алюминаты одно- и двухвалентной меди. Выше 1000°
(рис. 201) существует соединение СиА1Оа, плавящееся инкон-
груэнтно на воздухе около 1260°. Соединение двухвалентной
меди Си(А1Оа)а образуется при 800° путем реакции в твердом со-
стоянии и устойчиво только до 1000°, когда переходит в СиА1Оа.
В температурной области 900—1000°, не показанной на рис. 201,
сосуществуют СиаО и CuO и, вероятно, оба рассмотренных алю-
мината меди.
204
Алюминатные системы
Некоторые сведения об алюминатах меди можно найти в статьях
Гана и
(/
Лорана [1] и Хольгерсона [2].
Рис.*201. ^Фазовая диа-
грамма системы СиаО—
—А1аО3.
Литература
1. Hahn Н., Ch. de Lorent, Zs. anorgan. allgem. Chem., 279, № 5—6,
281, 1955.
2. Holgersson S., Zs. anorgan. allgem. Chem., 204, № 4, 378, 1932.
3. M i s r a S. К., A. C. D. C h a k 1 a d e r, Journ. Amer. Ceram. Soc., 46,
№ 10, 509, 1963.
BeO—Al aO3
Имеет значение для технологии специальных видов керами-
ческих материалов.
Изучалась Вартенбергом и Ройшем [7], Геллером [3], Гел-
лером и Яворским [4], Геллером, Яворским, Штейерманом и
Кримером [5], Фостером и Ройялем [2], Лангом, Филлмором и
Максвеллом [61.
Фостер и Ройял и Ланг с соавторами не подтвердили данных
Геллера и других о наличии твердых растворов А1аО3 в ВеО -А1аО3.
Фостер и Ройял установили в системе наряду с ранее известным
Алюминатные системы
205
соединением ВеО.А1аО3, отвечающим природному хризобериллу,
новое соединение ВеО-ЗА12О3, по оптическим свойствам (двуос-
ный положительный, с малым или умеренным углом оптических
осей, показатели преломления между 1.735 и 1.745) близкое к та-
ковым синтетического хризоберилла (за исключением того, что
°C
Рис. 202. Два варианта диа-
граммы состояния системы
ВеО—А1аО3 (по Фостеру и
Ройялу).
а — при инконгруэнтном плавле-
нии ВеО.ЗА12Оа; б — при конгру-
энтном плавлении ВеО-ЗА12О3.
2000
1950
1900
1850
5/1о 15 20 / 5/10 15 20 /
ВеО-ЗАЦ^ ВеО-А1гО3 ВеО-ЗА1/)3 ВеО-А1/)3
Д1г03 Вес.% ВеО А1г03 Вес.% ВеО
у хризоберилла удлинение всегда положительное, а у ВеО *ЗА1аО3
иногда встречается также и отрицательное, и, кроме того, у неко-
торых зерен последнего наблюдалось косое (25—30°) погасание
при преобладании прямого, характерного для хризоберилла).
Фостер и Ройял предложили два варианта диаграмм системы
ВеО -А1аО3—А1аО3, изображенные на рис. 202. Различаются
ВеО-А1аО3 и ВеО-ЗА1аО3 по их рентгеновским данным.
Инвариантные точки системы ВеО—А12О3 (по Лангу с соавторами [6])
Точка Фазы Процесс Состав, вес. »/„ Темпе- рату- ра. °C
ВеО А1гОз
1 о п'??3 -4" ВеО ' ЗА]аОя 4- жидкость. Эвтектика. 5.8 94.2 1890
о ВеО • ЗА12о3 4- жидкость. Плавление. 7.6 92.4 1910
о X р 2 ’ .4^3 4- ВеО • А 12Оа 4- жидкость. Эвтектика. 14.1 85.9 1850
К + жидкость. Плавление. 19.7 80.3 1870
О ВеО • А12О3 4- Веб 4- жидкость. Эвтектика. 25 75 1835
206
Алюминатные системы
Ланг, Филлмор и Максвелл в результате проверочного изуче-
ния системы дали ее диаграмму (рис. 203), по которой ВеО-ЗА1аО3
плавится конгруэнтно. В системе установлена под микроскопом
еще не идентифицированная фаза с N от 1.80 до 1.81 в интервале
составов между хризобериллом и глиноземом, а рентгенографи-
BeO+BeO-AlJ)3 Ве0-ЗА1г03 |
60 70 80 90 100
. ВеО Вес.%
Рис. 203. Диаграмма состояния си-
стемы ВеО—А12О3 (по Лангу, Филл-
мору и Максвеллу).
Рис. 204. Участок диа-
граммы состояния си-
стемы ' ВеО—А12О3 (по
Галахову).!?
ческим методом еще и вторая, также не определенная, фаза-
(неизвестного состава) в образцах, по составу находящаяся
между окисью бериллия и хризобериллом.
Галахов [1 ] при изучении системы ВеО—А1аО3 установил
существование нового соединения ЗВеО -A^Oj, которое плавится
при 1980° с разложением на окись бериллия и жидкость. Средний
показатель светопреломления кристаллов ЗВеО-А1аО3 А=1.720,
двупреломление 0.005; погасание прямое; знак главной зоны по-
ложительный.
На рис. 204 представлена диаграмма состояния системы
ВеО—А1аО3 по Галахову.
Литература
1. Г а л а х о в Ф. Я., Изв. АН СССР, ОХН, № 9, 1032, 1957.
2. F о s t е г W. R., Н. F. R о у а 1, Journ. Amer. Ceram. Soc., 32, № 1,
26 1949.
3. G e 11 e r R. F., Journ. Res. Nat. Bur. Stand., 27, № 6, 555, 1941.
4. G e 11 e r R. F., P. J. Yavorsky, Journ. Res. Nat. Bur. Stand., 34,
№ 4, 395, 1945.
5. Geller R. F., P. J. Yavorsky, B. L. S t e i e г m a n,
A. S. Creamer, Journ. Res. Nat. Bur. Stand., 36, № 3, 277, 1946.
Алюминатные системы
207
с г а n a S М, С. L. Fillmore, L-. Н. Maxwell, Journ. Res.
Ь' Nat. Bur. Stand., 48, № 4, 298, 1952.
7 Wittenberg H„ H. J. Reusch, Zs. anorgan. allgem. Chem.,
207, № 1, 1, 1932.
MgO—A12O3
Имеет большое значение для технологии специальных высоко-
огнеупорных материалов.
Изучена Ранкином и Мервином [6], Д. Рой, Р. Роем и Осбор-
ном [5] и др. На рис. 205, а приводится диаграмма системы
MgO—А12О3, на рис. 205, б — системы MgO-Al2O3—А12О3 по дан-
ным [6], а на рис. 206 — по данным [5].
2800 К
2600
2^00
2200
2000
2030°
О 20 W 60 / 80 100
MgO'' МдО-А1гО3 а-А1г03
Вес. %
Рис. 205. Диаграмма состояния системы
MgO—A12OS (по Ранкину и Мервину).
а — диаграмма системы окись магния—глинозем;
б — диаграмма системы шпинель—глинозем.
Твердые растворы шпинели и глинозема, простирающиеся
до состава MgO-5Al2O3, детально изучал Ринне [7]. Его данные
по показателям преломления и плотности этих твердых растворов
были сведены в диаграмму (рис. 207) в работе Белянкина и
Дилакторского [1].
Дальнейшее изучение твердых растворов шпинели и глино-
зема и их распада при нагревании производилось Заальфельдом
И \1ГОДЗИНСКИМ 18], Ягодзинским [3] и Лежу и Коллонгом [4].
Изменение параметра решетки твердых растворов, по данным
последних двух авторов, приводится на рис. 208; он колеблется
50\60 70
М9° MffO-Alfi,
во зо т
Мол.% АУз
Рис. 207. Показатель преломления
и плотность твердых растворов си-
стемы MgO—А12О3.
1 — показатели преломления; 2 — плот-
ность.
Рис. 206. Диаграмма со-
стояния системы MgO—
—AlaOs (по Д. Рой,
Р. Рою и Осборну).
Зачерненная область в нвад-
ратинах показывает выра-
женное в процентах количе-
ство корунда.
МдО Мол. °/> А1г03
Рис. 208. Изменение па-
раметра кристалличе-
ской решетки твердых
растворов системы
MgO--------AlgOg,
Рис. 209. Изменение пара-
метра кристаллической ре-
шетки состава 2.7 А12О3-
•MgO при нагревании до
1000°.
Алюминатные системы
209
от а=8.081 А для состава MgO -бА^Оз до а=7.91 А для MgO -A12O3.
Изменение параметра решетки образца шпинели нестехиометри-
ческого состава 2.7 AlaO3-MgO при нагревании при 1000° в зави-
симости от времени приводится на рис. 209.
Продолжительность нагребания, часы
Рис. 211. Параметр элементарной
ячейки твердых растворов А12О3
в окиси магния
Рис. 210. Кинетика распада
кристаллов Mg0 44Al2 37O4.
S — шпинельная фаза; А — а-гпм-
нозем—норунд; <р — промежуточ-
ная метастабпльная фаза.
В двух последних упомянутых выше работах указывается,
что при нагревании твердого раствора шпинели образуется про-
межуточная фаза ср, имеющая по Заальфельду и Ягодзинскому
состав MgAlaeO40, или 13AlaO3-MgO, а по Лежу и Коллонгу —
Mg0 08А1а е1 □ 0 31О4, или 16А1аО3*
•MgO. На рис. 210 показано, со-
гласно последним авторам, раз-
ложение кристаллов шпинели
состава MgO0 44Ala 37О4 при на-
гревании в зависимости от тем-
пературы и времени.
Фаза ср наблюдалась под
микроскопом только в образ-
цах, нагретых в интервале
900—1050°, а при 1200° она
исчезала.
Согласно исследованиям
Альпера, Мак-Нзлли, Риббе и
Домена [2], в предельном со-
периклазового твердого раствора содержится 18 вес. % А1аО3
(9.5 /о А13+), а в предельном составе .'шпинельного твердого
раствора содержится 39 вес.% MgO (6% Mg2+). Эти твердые
растворы устойчивы выше 1500°.
14 Н. А. Торопов и др., кн. 1
210
Алюминатные системы
Согласно исследованиям Стубичана и Роя [9], предельная
растворимость А1аО3 в MgO при 1880+15°, как зто видно
из рис. 211, где представлен параметр кристаллической решетки
твердых растйоров, составляет 4.3 мол.% А1аО3 (10.2 вес.%).
Эта же величина подтверждена измерениями плотности (рис. 212).
Литература
1. Б е л я и к и и Д. С., Н. Л. Д и л а к т о р с к и й, Избр. труды
акад. Д. С. Белянкина, 1, Изд. АН СССР, М., 198, 1956.
2. А 1 р е г А. М., R. N. McNally, Р. Н. R i b b е, R. С. Doman,
Journ. Amer. Ceram. Soc., 45, № 6, 263, 1962.
3. Jagodzinski H., Zs. Kristallogr., 109, № 4—6, 388, 1957.
4. Lejus A. M., R. Collongues, Bull. Soc. chim. France, № 1,
65, 1961.
5. Osborn E. F., Journ. Amer. Ceram. Soc., 36, № 5, 147, 1953.
6. Rankin G. A., H. E. Merwin, Journ. Amer. Chem. Soc., 38, № 3,
571, 1916.
7. R i n n e F., Neues Jahrb. Mineral., Geol., Paleont., 13B, Abt. A, 58, 43,
1928.
8. SaalfeldH., H. Jagodzinski, Zs. Kristallogr., 109, № 2, 87,
1957.
9. S t u b i с a n V. S., R. R о y, Phys. Chem. Solid, 26, № 8, 1293, 1965.
CaO—Al aO 3
Преимущественное значение имеет для глиноземистых це-
ментов, а также для технологии абразивов. Некоторые алюминаты
кальция входят в состав портланд-цементного клинкера.
Известно применение стекол, богатых алюминатом кальция,
прозрачных для инфракрасного излучения — так называемых
стекол кобал [20].
Систему изучали Ранкин и Райт [28] (рис. 213). В. последую-
щем был уточнен состав некоторых соединений и открыто новое
соединение СаО *6А1аО3.
Таваши [34] установил, что описанному Ранкином с сотруд-
никами алюминату ЗСаО -5А1аОз в действительности соответст-
вует формула СаО ^AlgOg, и зта формула теперь является обще-
принятой. В литературе до сих пор идет дискуссия об истинном
составе соединения, которому Ранкин с сотрудниками приписали
формулу 5СаО -ЗА^Оз. В результате рентгенографических иссле-
дований Бюссем и Эйтель [12 ] предложили формулу 12СаО -ТА^Оз.
Эту формулу считают правильной Джеваратнам, Дент-Глассер
и Глассер [16]. Лагерквист, Валлмарк и Вестгрен [19] дают
формулу 9СаО-5А1аО3. Процентное содержание окислов в этих
трех формулах мало отличается одно от другого, и обычно поль-
зуются формулой 5СаО -ЗА^Оз.
Алюминатные системы
211
На рис. 214 приведена за-
имствованная из книги Ли [3]
диаграмма, в которой учтены
новейшие исследования. Соеди-
нение СаО -бА^Од впервые по-
лучено Вестгреном с сотрудни-
ками. Это соединение является
одной из разновидностей так
называемого (3-глинозема. Фи-
лоненко [8 ] экспериментально
исследовала богатый глинозе-
мом участок системы и на-
несла соединение СаО -бА^Од
на диаграмму состояния, внеся
в последнюю связанные с этим
исправления (рис. 215). По Фи-
лоненко, это соединение пла-
вится при 1850° с разложением
на корунд и жидкость. Некото-
рые исследователи (Шерер [30],
Лангенберг и Чипмзн [18 ]) счи-
тали, что соединение СаО •
• 6А12О3 является метастабиль-
°С
1800
1600
МО
О 20 190 60 80 100
СаО 3:1 5-3 1-1 1=2 АКО,
Вес. % 33
Рис. 213. Диаграмма состояния си-
стемы СаО—А12О3 (по Ранкину и
Райту).
ным, и на тройной диа-
грамме СаО—А12О3—SiO2
не отводили ему соответст-
вующего поля. Однако
Джентайль и Фостер [15]
экспериментально доказа-
ли, что соединение СаО •
•6А12О3 должно рассматри-
ваться как стабильное, а
не метастабильное, под-
твердив этим правильность
работ Филоненко.
Для оптических свойств
СаО -бА^Од приводятся
различные данные. Торо-
пов и Стукалова [6], изу-
чавшие оптические свой-
ства, плотность и способ-
ность СаО-6А12О3 к кати-
онному замещению, дают
No=i.7Q2, Ае=1.667. По
Филоненко [7] и Белян-
С
2300
2100
1900
1100
СаО+Ж
6
АЦ>3/
1500[ СаО+С3А
—»- •
С.Х1+Ж\ СА*Ж;
з____Г Л +Wj
С4г
О
1300^-
СаО
20
/90
С3А
[~бо
(W
|»7 ’ '
100
alo,
С^А-СА 33
Вес. %
Диаграмма состояния системы
Рис. 214. Диаграмма состояния системы
СаО—А12О3, построенная с учетом послед-
них данных.
14*
212
Алюминатные системы
Таблица 1
Иннариантные точки системы СаО—Л12О3
Точна Фазы Процесс Состав, вес. % Темпе- рату- ра, °C
СаО AlaOs
1 СаО-|- жидкость. Плавление. 100 0 2570
2 СаО-j- ЗСаО • А12О3 J- жидкость. » 57 43 1535
3 ЗСаО* А12О3-|-5СаО- 3Al2O3-j-жид- кость. Эвтектика. 50 50 1395
4 5СаО- ЗА12О3-| жидкость. Плавление. 47.8 52.2 1455
5 5СаО • 3 А12О3-|- СаО • А12 О3 -р жид- кость. Эвтектика. 47.0 53.0 1400
6 СаО А12О3 J- жидкость. Плавление. 35.4 64.5 1600
7 СаО • А12О3 СаО • 2 А12О3+жид- кость. Эвтектика. 33.5 66.5 1590
8 СаО • 2А12О3 - жидкость. Плавление. 27.0 73.0 1765
9 СаО • 2А12О3-|- СаО • 6А12О3 жид- кость. Эвтектика. 19.5 80.5 1730
10 СаО- 6А12О3-|- А12О3-(-жидкость. Перитектика(У). 8.0 92.0 1850
11 А12О3 жидкость. Плавление. 0 100 2050
кину, Лапину и Симанову [1, 2], светопреломление СаО-6А12О3
значительно выше: No от 1.743 до 1.760.
Пятикальциевый трехалюминат, кроме устойчивой кубической
формы а-5СаО-ЗА12О3, существует также в виде неустойчивой
Рис. 215. Богатый глиноземом
участок системы СаО—А12О3 (по
Филоненко).
ромбической модификации а'-5СаО-
ЗА12О3. Торопов [4] указывает,
что кристаллизация метастабиль-
ной модификации а'-5СаО-ЗА12О3
наблюдается в портланд-цемент-
пых клинкерах, получаемых об-
жигом на спекательных колосни-
ковых решетках. Эта модифика-
ция присутствует в клинкере
глиноземистого цемента. В по-
следнем случае кристаллы этого
соединения обычно образуют иголь-
чатые или таблитчатые индивиды,
нередко собранные в сферолито-
вые стяжения. В последнее время
ровать
неустойчивую
предприняты попытки синтези-
форму а'-5СаО-ЗА^Оз путем реакции
между окислами в твердом состоянии.
Одуз [9] проводил синтез алюминатов в температурной об-
ласти 900—1600°. Он указывает на образование кубической
Таблица 2
Кристаллические фазы системы СаО—А12О3
Соединение Система кристаллов Габитус Спайность Плот- ность, г/сма Ng Np 2V° Опти- ческий знак Оптическая ориентировка
ЗСаО-А12О8. Кубическая. Зерна. (111) и (110) 3.00 1.710 — — — —
а-5СаО-ЗА12О8. (9 : 5) или (12 : 7). » » Нет. 2.69 1.608 — — — —
а'-5СаО-ЗА12О8 Ромбическая. Пластинки, приз- мы. — — 1.692 1.687 — — —
СаО-А12О8. » Пластинки, трой- ники. (НО) — 1.663 1.643 56 (-) —
СаО-2А12О8. Моноклинная. Призмы и волок- на. — 2.90 1.652 1.617 0-5 (+) Z : с=39°
СаО-6А12О3. Гексагональная. Пластинки. (0001) 3.38 1.702 1.667 0 (-) —
214
Алюминатные системы
и ромбической форм 5СаО-ЗА12О3 и высказывает предположение,
что ромбическая (неустойчивая) форма имеет состав 5СаО-ЗА12О3,
а кубическая форма — состав 12СаО-7А12О3. Таким образом,
по Одузу, рассматриваемые формы являются не полиморфными
Рис. 216. Высокоглиноземная часть
диаграммы состояния системы
СаО—А12О3 (по Ролану и Фам Ху Тану).
модификациями одного и того же
соединения, а различными соеди-
нениями.
Вильямсон и Глассер [35 ], про-
изводившие обжиг смесей СаО и
Рис. 217. Часть диаграммы плав-
кости системы СаО—А12О3 в райо-
не соединения 12СаО-7А12О3.
а — общепринятое представление;
б — полученное на основе высокотем-
пературной микроскопии. 1 — окон-
чательное исчезновение С,гА,; я — ли-
ния ликвидуса соединения С3А; з —
линия ликвидуса соединения С А; 4 —
эвтектическое плавление.
А12О3 в температурном интервале 1045—1405°, утверждают,
что ими не была получена неустойчивая форма 5СаО>ЗА12О3.
Состав и структура алюминатов кальция рассматриваются в до-
кладе Ордвея [27] на IV Международном симпозиуме по химии
цемента.
Стабильность фазы СаО-бА12О3 была подтверждена работами
Висни [36] и Ролена и Фам Ху Тана [29]. Последние авторы,
пользуясь методом термического анализа, определили фазовые
Алюминатные системы
215
отношения в высокоглиноземистой части диаграммы СаО—А12О3
(рис. 216). Было обнаружено, что СаО-6А12О3 существует в двух
полиморфных формах с температурой перехода 1833°. Перитекти-
ческая точка, характеризующая инконгруэнтное плавление СаО-
• 6А12О3, имеет координаты СаО — 9 вес.%, А12О3 — 91 вес.%
и температуру 1903°, т. е. несколько выше, чем у Филоненко.
Существенные изменения в диаграмму состояния системы
СаО—А12О3 предлагают внести Нёрс, Уэлч и Маджумдар [24, 25].
Эти авторы считают, что фаза 12СаО-7А12О3 стабильна в условиях
повышенных температур (950—1350°) только в присутствии па-
ров воды, которая входит в решетку, образуя гидратное соедине-
ние формулы С12А114О32(ОН)2. Содержание воды достигает мак-
симума при 950°, составляя 1.3%. По-видимому, вплоть до плав-
ления можно констатировать присутствие воды.
Наличие гидроксильных групп было доказано методом инфра-
красной спектроскопии. Сопоставление свойств содержащего
гидроксил соединения и практически безводного приведено
в табл. 3.
Бонниксон [10] наблюдал на кривой зависимости теплоем-
кости от температуры для 12СаО-7А12О3 пик при 1037°, что он
Таблица 3
Физические свойства 12СаО-7А12О3
Образец А Образец В
Метод приготовления образцов Плавление при Плавление и отжиг в
, 1500°, отжиг при 1000° и охлаждение до комнатной температуры; все произво- дится в сво- бодной от влаги атмос- фере азота. воздухе. Подвергается действию перегретого пара при 1000° и по- следующему охлажде- нию до комнатной тем- пературы.
Плотность, г/см8 2.68 2.73
Показатель светопреломления . . Параметр элементарной ячейки, А Увеличение веса образца после вы- 1.609 +0.001 1.619+0.001
11.9880 +0.0002 11.9747 ±0.0002
держки па воздухе при 950° . Потеря веса на воздухе между 950 и 1350° 1.3% Нет увеличения веса.
0.8% 0.8%
Гидроксил Плохо разли- чим. Определенно присутст- вует.
Химическая формула Очень близка к Са12А114О33. Са12А114О32(ОН)2.
216
Алюминатные системы
объяснял полиморфным превращением. Нёрс с сотрудниками по-
лагают, что этот пик представляет момент насыщения в прогрес-
сивной гидратации 12СаО-7А12О3 в условиях нагревания на
воздухе нормальной влажности.
На рис. 217 приведены результаты исследования плавкости
в области соединения 12СаО-7А12О3.
с
2100
гооо
1900
1800
1700
1600
1500
1900
Жидк.
Х’Зя
СаО+Ж
□ 1
2
д 3
СаО+С3А
1830'
СА+Ж
С^СА
Ж
^2^3
САе
САг+СА
САе+САг
САг+Ж
'б02°
юго3
+ж
CAg+Ж
1762°
2№5'
\13б0° С^СА
w J Д У'о
1300'----1----и
20 28 36
СаО С3А СА
С3А3 Вес.%
68 76 89 /92 100
^2 /is ^2^3-
Рис. 218. Диаграмма состояния системы
СаО—А12О3 в атмосфере, не содержащей влаги
(по Нёрсу, Уэлчу и Маджумдару).
1 — температура ликвидуса; в — температура солидуса;
3 — температура плавления С„А, (мета стабильное?)
на воздухе.
Нёрс, Уэлч и Маджумдар'[25] по сути дела полагают, что для
системы СаО—А12О3 должно быть две диаграммы состояния.
Одна характеризует поведение фаз в условиях влажного воздуха
и отличается наличием стабильной фазы 12СаО-7А12О3-пН2О.
На другой диаграмме (рис. 218) для случая атмосферы, не содер-
жащей влаги, фаза 12СаО-7А12О3 отсутствует.
Нёрс с сотрудниками приводят несколько иные, чем обычно,
свойства алюминатов кальция, полагая, что СаО-А12О3, СаО-
• 2А1аО3 и СаО-6А12О3 плавятся инконгруэнтно. Соединение ЗСаО«
•А12О3 плавится инконгруэнтно при 1535+5° с разложением на
СаО и жидкость состава (вес.%): СаО — 57.2, А1аО3 — 42.8.
Алюминатные системы
217
С окисью кальция ЗСаО-А12О3 образует эвтектику состава СаО —
49.35 вес.%, А1203 — 50.65 вес.% и плавящуюся при 1360 + 5°.
Соединение СаО-А12О3 плавится инконгруэнтно при 1602+5°
с образованием СаО-2А12О3 и жидкости примерного состава
СаО — 36 вес.%, А12О3 — 64 вес.%. Соединение СаО«2А12О8
плавится инконгруэнтно при 1762+5°, образуя СаО-6А12О3
и жидкость состава СаО — 22 вес.% и А12О3 — 78 вес.%. СаО«
• 6А12О3 плавится инконгруэнтно при 1830+15° с образованием
корунда и жидкости приблизительного состава СаО — 16 вес.%
и А12О3 — 84 вес.%. 12СаО>7А12О3 на воздухе с нормальной влаж-
ностью плавится при 1392°, в сухом воздухе плавится инконгру-
энтно при 1374° с образованием СаО-А12О3 и жидкости.
Джеваратнам, Глассер и Дент-Глассер [17], показали, что
соединение 12СаО>7А12О3 может существовать в чистом состоянии.
Возможность образования 12СаО-7А12О3>Н2О объясняется строе-
нием рассматриваемого алюминтата кальция. Безводный 12СаО*
•7А12О3 содержит в элементарной ячейке два реакционноспособ-
ных иона О2', которые могут полностью или частично замещаться
одновалентными ионами (например, ОН", С1~). При этом происхо-
дит лишь незначительное изменение плотности и размеров эле-
ментарной ячейки.
Мур [22] для уточнения структуры ЗСаО • А12О3 получал ряд твер-
дых растворов на основе этого соединения: алюминий замещался
железом и кремнием, кальций — магнием и натрием. Этот прием
является одним из частных случаев применения предложенного
Тороповым [5] так называемого метода «кристаллохимических
индикаторов». Чистый ЗСаО-А12О3 имеет кубическую ячейку
с параметром а=15.263 +0.003 А. Замещение А13+ на Fes+ при-
водит к уменьшению параметра решетки; в результате замещения
СаО на Na2O параметр решетки уменьшается и решетка из куби-
ческой переходит в ромбическую. Вхождение в решетку ЗСаО-
• А12О3 кремния приводит также к уменьшению параметра решетки.
Вопросы изоморфных замещений трехкальциевого алюмината
рассматривались также в работах Маджумдара [21], Тарта [33],
Шлодта и Рой [31], Конвика и Дей [13], Флетчера с сотрудни-
ками [14], Сузу кава [32],' МюЛер-Гессе и Швите [23].
Предложенная Муром структура ЗСаО-А12О3 существенно
отличается от общепринятой [26], разработанной Бюссемом и
Эйтелем [12].
Бризи и Роландо [11] показали, что разложение трехкаль-
циевого алюмината ЗСаО -AlgOs ускоряется в присутствии CaF2
(или СаС12) и возникающий при этом 12СаО>7А12О3 образует
твердый раствор с CaF2 (или СаС12) путем замещения атома кис-
лорода двумя атомами галоида. Предельный твердый раствор
имеет состав llCaO-7Al2O3*CaF2. Реакция разложения трехкаль-
218
Алюминатные системы
циевого силиката может быть представлена уравнением 7(ЗСаО-
•А12О3)+СаХ2^11СаО-7А12О3.СаХ2+ЮСаО.
Выше 1000° на воздухе нормальной влажности галогенный
твердый раствор неустойчив и переходит (в присутствии СаО)
в трехкальциевый алюминат. Бризи и Роландо считают, что ут-
верждение Уэлча, Нёрса и Маджумдара о нестабильности 12СаО>
•7А12О3 в безводной атмосфере недостаточно доказано эксперимен-
тально и требует дальнейшей проверки.
Литература
1. Беляккик Д. С.,. В. В. Лапик, Ю. П. Симаков,
ДАН СССР, 53, № 6, 533, 1946.
2. Б е л я н к и к Д. С., В. В. Лапик, Ю. П. Симаков,
ДАН СССР, 55, № 6, 529, 1947.
3. Л и Ф. М. Химия цемента и бетона. Перев. с акгл. Под ред. С. М. Рояка.
Стройиздат, М., 1961.
4. Т о р о п о в Н. А. Химия цемектов. Промстройиздат, М., 1956.
5. Т о р о п о в Н. А., А. И. Б о й к о в а, ДАН СССР, 151, № 5, 1114,
1963.
6. Торопов Н. А., М. М. С т у к а л о в а, ДАН СССР, 27, № 9, 974,
1940.
7. Филоненко Н. Е„ ДАН СССР, 43, № 6, 456, 1945.
8. Филокекко Н. Е., ДАН СССР, 64, № 4, 529, 1949.
9. Audouze В., Silicate Industry, 26, № 4, 179, 1961.
10. В onnickson К. R., Journ. Phys. Chem., 59, № 3, 220, 1955.
11. В r i s i С., P. R о 1 a n d о, Ann. chim., 56, № 3, 224, *1966.
12. Biissem W., A. E i t e 1, Zs. Kristallogr., 95, № 3/4, 175, 1936.
13. С о n w i c k e J. A., D. E. D a y, Journ. Amer. Ceram. Soc., 47, № 12,
654, 1963.
14. Fiet c,h e г К. E., H. G. M i d g 1 e у, A. E. M о о r e, Magaz.
Concrete Research, 17, № 53, 171, 1965.
15. G e n t i 1 e A. L., W. R. Foster, Journ. Amer. Ceram. Soc., 46, № 2,
74, 1963.
16. JeevaratnamJ., L. S. Dent-Glasser, F. P. Glasser,
Nature, 194, № 4830, 764, 1962.
17. JeevaratnamJ., F. P. Glasser, L. S. Dent-Glasser,
Journ. Amer. Ceram. Soc., 47, № 2, 105, 1964.
18. L a n g e n b e r g F. C., J. Chipman, Journ. Amer. Ceram. Soc.,
39, № 12, 432, 1956.
19. Lagerqwist K., S. W a 11 m a r k, A. W e s t g r e n, Zs. anor-
gan. allgem. Chem., 234, № 1, 1, 1937.
20. Lindroth A., Glasstechn. Ber., 23, № 9, 241, 1950.
21. M a j u m d a r A. J., Trans. Brit. Ceram. Soc., 64, № 2, 105, 1965.
22. M о о r e A. E., Magaz. Concrete Res., 18, № 55, 59, 1966.
23. Muller-Hesse H., H. E. Schwiete, Zement, Kalk, Gips, 9,
№ 9, 386, 1956.
24. Nurse R. W., J. H. W e 1 c h, A. J. M a junidar, Trans. Brit.
Ceram. Soc., 64, № 6, 323, 1965.
25. Nurse R. W., J. H. Welch, A. J. M a j u m d a r, Trans. Brit.
Ceram. Soc., 64, № 9, 409, 1965.
26. О r d w a у F. Proc, of the third Intern. Symposium on the Chemistry of
Cement, London, 91, 1954.
27. О r d w a у F., Proceeding of the Fourth International Symposium, Wa-
Алюминатные системы
219
shington, October 1960, Nat. Bur. Stand. (U. S.), Monograph., № 43, 1,
39 1962.
28. Rankin G. A., F. E. Wright, Amer. Journ. Sci., IV, 39, № 229,
1—75, 1915 (Г. P а к к и к, Ф. Райт. Тройная система
СаО—А12О3—SiO2. Перев. с англ. Н. А. Торопова. Л., 1935).
29. RolinM., Pham Huu Thanh, Rev. Haut. Temper, et Refract.,
2, № 2, 175, 1965.
30. S c h a i r e r J. F., Joum. Amer. Ceram. Soc., 40, № 7, 215, 1957.
31. Schlaudt С. M., D. M. R о y, Nature, 206, № 4986, 819, 1965.
32. SuzukawaY., Zement, Kalk, Gips, 9, № 8, 345, 390; № 9, 433, 1956.
33. Tarte P., Nature, 207, № 5000, 973, 1965.
34. Ta v asci B., Chim. e Ind., 17, 461, 1935.
35. W i 11 i a m s о n J., F. P. G1 asset, Journ. Appl. Chem., 12, № 12,
535, 1961.
36. W i s n у i L. G. Doctors thesis Rutgers university. New Jersey, 1955
(Dissert. Abstr., 15, № 11, 2498, 1955),
SrO—Al 2O з
Алюминаты стронция подобно алюминатам кальция обладают
гидравлическими вяжущими свойствами, в то время как бариевые
2000
1600
1200
\
1690° \
1630°-
1575
1320°
166СГ
1790
1760
1780
1125
11505
B-ifSrO-
•А1г03 т.р.
0 20
SrO | 3SrO-Al£ SrO-АЩ
Ч$г0'А1г°з Вес % 5г0™г°з
60
80 \ 100
SrO-6Al£Al2O3
Рис. 219. Диаграмма состояния системы
SrO—А12О3.
1100' ЗгО+ЗЗгО-АТД, 1125
2022 291
95гО-А1^ SSrO-АЩ
SrO Вес.% А1г03
Рис. 220. Часть диаграммы
состояния системы SrO—А12О3
в укрупненном масштабе.
гт \
40
алюминаты являются воздушными вяжущими цементами. Си-
стема изучена Массаца [4]. Кристаллооптические исследования
220
Алюминатные системы
Таблица 1
Инвариантные точки системы SrO—А12О3
Точка Фазы Процесс Состав, вес. % Температура, °C
SrO A1,OS
1 SrO-L 4SrO-А12О3+ жидкость. Инконгруэнт- ное плавле- ние. 79.4 20.6 1690+20
2 4SrO А1аО3± 3SrO А1аО3± +жидкость. Эвтектика. 76.5 23.5 1630+20
3 3SrO А12О3+ жидкость. Плавление. — — 1660+20
4 3SrO Al 2O3+SrO Al 2O3± + жидкость. Эвтектика. 67.4 32.6 1505+15
5 SrO- A12O3+ жидкость. Плавление. — — 1790 +20
6 SrO AlaO3+ SrO 2AlaO3+ ±жидкость. Эвтектика. 42.0 58.0 1760+20
7 SrO- 2A12O3+ жидкость. Плавление. — — Выше 1800
8 SrO- 2AlaO3+ SrO 6AlaO3+ -г жидкость. Эвтектика. 25.8 74.2 1780 ±20
9 SrO 6AlaO3+жидкость. Инконгруэнт- ное плавле- ние. 16.0 84.0 Около 1900
алюминантов стронция проведены Тороповым [1]. Установлено
существование соединений 4SrO-Al2O3 (открыто Массаца), 3SrO-
•AlaO3, SrO-AlaO3, SrO-2AlaO3 и SrO-6AlaO3 (рис. 219).
Соединение 4SrO-AlaO3 имеет две модификации: высокотемпе-
ратурную (a-4SrO-А1аО3), устойчивую в области 1320—1690°,
и низкотемпературную (P~4SrO-Al2O3), устойчивую в области 1125—
—1320°. Низкотемпературная модификация 4SrO-AlaO3 образует
Таблица 2
Кристаллические фазы системы SrO—А1аО3
Соединение Система кристаллов Габитус Спайность Ng № Примечание
3SrO • А1аОя Кубическая. (120) 1.728 —
SrO • А12О3 ? Приамы. По одному направле- нию ясная. 1.663 1.649 —
SrO - 2А12О3 Моноклин- ная. Приемы и иглы. По одному направле- нию. 1.640 1.614 Углы пога- сания до 45°, (±)2V большой
SrO • 6А12О3 Гексаго- нальная. Пластинки. (0001) совер- шенная. 1.702 1.694 —
Алюминатные системы
221
лооптическое исследование
Торопова, аналога не имеет.
Соединение 4SrO -А1аО3 не
имеет аналога в кальциевой
системе.
Диар [2 ], обжигавший
образцы (исходные вещества
SrCO3 и А1аО3>НаО) при
1300° и контролировавший
продукты реакции рентге-
ногпаЛически. утвеождает.
твердые растворы с глиноземом (или 3SrO>AlaO3) (рис. 220).
Кристаллы 4SrO-AlaO3 имеют показатель светопреломления
выше 1.74.
Интересно рассмотреть аналогию и различие алюминатов
стронция и кальция. 3SrO-AlaO3 имеет структуру, тождественную
с ЗСаО*А1аО3. Такие же аналогии наблюдаются между SrO-AlaO3
и СаО-А1аО3, SrO>2AlaO3 и СаО*2А1аО3 и, наконец, между SrO>
• 6А1аО3 и СаО-6А1аО3.
Фаза 5СаО -ЗА1аО3 (12СаО °C
• 7А1аО3) в стронциевой си- 2400
стеме, как это показало рент-
генографическое исследова- 2200
ние Лагерквиста, Валлмарка
и Вестгрена [3] и кристал- 2000
1800
1500
0 20 40 60 80 100
SrO Мол.% АЩ
Рис. 221. Диаграмма плавкости системы
SrO—А12О3 (по Старжевскому).
что им синтезировано соедине-
ние 5SrO>AlaO3. Диалюминат стронция SrO-2AlaO3 даже при по-
вторном многократном обжиге Диар не получил (всегда обнару-
живалась смесь двух фаз: SrO-AlaO3 и Sr0>6A103). Соединения
3SrO • 16А1аО3, на которое указывали Лагерквист с сотрудниками,
не было получено:
Старжевский [5] построил диаграмму плавкости системы,
пользуясь визуальным методом, дополненным рентгенографиче-
скими определениями. Обнаружено пять соединений (рис. 221).
Дополнительно, кроме первых обнаруженных Тороповым кристал-
лических фаз, выявлен также алюминат 4SrO*AlaO3, плавящийся
инконгруэнтно при 1880° с разложением на SrO и жидкость, обо-
гащенную А1аО3; соединения 3SrO -А1аО3 и SrO-AlaO3 плавятся
конгруэнтно соответственно при 1820 и 2015°. Соединения SrO*
•2А1203 и SrO>6ALO3 плавятся инконгруэнтно соответственно при
1830 и I9600.
Литер а тур а
Торопов Н. А., ДАН СССР, 23, 1, 74, 1939.
2. D е а г Р. S., Bull. Virginia Polytechn. Inst., 50, Eng. Exp. Stat, ser.,
№ 117, 1957.
222
Алюминатные системы
3. Lagerqw 1st К., S. Wallmark, A. Westgren, Zs. anorgan.
allgem. Chem., 234, № 1, 1, 1937.
4. Massazza F., Chim. e ind., 41, № 2, 108, 1959.
5. Starczewski M., Zesz. nauk. Politechn., Slaskiej, № 106, 1, 1964.
BaO—A12O3
Имеет значение для технологии баритовых огнеупорных це-
ментов, производства глинозема, высокоглиноземистых огнеупо-
ров и бариево-алюминиевых шлаков [1].
Диаграмма состояния построена Тороповым и Галаховым [2]
и Пуртом 14] только на основе определения точек плавления.
На рис. 222 представлены обе диаграммы состояния по данным
Мол. %
Рис. 222. Диаграмма состояния системы
ВаО—А1аО3.
Штриховая линия — по данным Торопова и Гала-
хова; сплошная линия — по данным Пурта.
этих авторов. Отличие заключается в температуре плавления
соединения ЗВаО-AlgOs и температуре плавления эвтектик.
Кристаллооптически алюминаты бария изучались Торопо-
вым [1], рентгенографически — Валлмарком и Вестгреном [5],
Цоллвегом [6] и Пуртом [4].
Соединение ЗВаО>А1аО3 имеет кубическую объемноцентри-
рованную ячейку с параметром а=14.151 А.
Соединение ВаО-А1аО3 с* гексагональной структурой имеет
параметры: а=5.209, с=8.761 А. Структура подобна таковой
Алюминатные системы
223
Таблица 1
Инвариантные точки системы ВаО—А12О3
точка Фазы [Процесс Состав, вес. % Темпе- рату- ра, °C
ВаО A12O3
1 BaO-|-ЗВаО-AlaO3-j-жидкость. Эвтектика. 85 15 1660
2 ЗВаО • А12О3-|-жидкость. Плавление. — — 1750
3 ЗВаО • А1аО3-|- ВаО • А1аО3-|-жид- Эвтектика. 77.5 22.5 1710
4 кость. ВаО-А12Оа+жидкость. ВаО • А1аО3-|-ВаО- 6А1аО3-|-жид- Плавление. 1830
5 Эвтектика. 45 55 1790
6 КОСТЬ. ВаО • бА12О3-|-жидкость. Плавление. __ 1900
7 ВаО- 6А1аО3-[-А1аО3-|-жидкость. Эвтектика. 17 83 1890
Таблица 2
Кристаллические фазы системы ВаО—А12О3
Соединение Система кристаллов Габитус Спай- ность Плот- ность, г-'см3 Ng №
ЗВаО-А12О3 — Волокна, таблицы. — 4.54 1.735 —
ВаО • А12О3 Гексагональная псевдо- кубическая. Зерна. — 3.99 1.683 —
ВаО -6А12О3 Гексагональная. Пластинки. (0001) 3.69 1.730 1.724
минерала хризоберилла. Соединение ВаО-6А1аО3 относится
к типу [3-глинозема с гексагональной решеткой и параметрами:
«---5.577, с=22.67 А.
Кальве, Тибон и Дозул [3] поставили опыты, пытаясь синте-
зировать двухбариевый алюминат 2ВаО-А12О3. Ни высокотемпе-
ратурным синтезом из окислов, ни обезвоживанием гидрата
А12О3-2ВаО-4НаО соединение 2ВаО>А1аО3 не было получено,
как и в опытах Торопова.
Литература
' Торопов Н. А., ДАН СССР, 1, № 2—3, 147, 1935.
-• Торопов Н. А., Ф. Я. Галахов, ДАН СССР, 82, № 1, 69, 1952.
С а 1 v е t Е., Н. Т h i b о n, J. D о z о u 1, Bull. Soc. chim. France,
, № 8, 1915, 1964.
к P u r t G., Radex Rundschau, № 4, 198, 1960.
224
Алюминатные системы
5. Wallmark S., A. Westgren, Arkiv Kemi, Mineral., Geol., 12B,
№ 35, 1, 1937.
6. Zollweg R. J., Phys. Rev., 100, № 2, 671, 1955.
ZnO—A12O3
Частная система более сложных систем, имеющих значение
для металлургии свинца, цинка, латуни и т. д. (шлаки, огнеупоры).
Кристаллические фазы системы ZnO—А12О3
Соединение Плотность, г/см3 Форма кристаллов § а. Ъ еч Двупрелом- ление Оптический знак Цвет Спайность Погасание
ZnO (цинкит) 5.53— 5.7 Призмы гексаго- нальные. 2.020 2.004 0 0.016 (+) Крас- ный. По (0001) Пря- мое.
ZnO • A12O3 (ганит) 4.58 Кубическая система» октаэдры. 1.805 (111)
Ориентировочная диаграмма системы, по Бантингу [1], пред-
ставлена на рис. 223.
Рис. 223. Ориентировочная диаграмма
состояния системы ZnO—A12OS (по Бан-
тингу) .
Литера тура
1. В unling Е. N., Journ. Res. Nat. Bur. Stand., 8, № 2, 279, 1932.
Алюминатные системы
225
CdO—А1а03
Диаграмма состояния системы не построена. Цефт и Ка-
банова [1] изучали образование алюминатов кадмия в субсолидус-
ной области, производя нагревание смесей CdO и А1аО3 в интер-
вале от 600 до 1300°. Несмотря на широкие вариации состава,
был получен только один алюминат CdO-AlaO3, который при 1300°
еще не плавился.
Литература
1 Цефт А., Л. Кабанова, Вести. Акад, наук Казахск. ССР, № 1,
1956.
GaaO3—А1аО3
Интересна с точки зрения сходства структурных позиций А18+
и Ga3+ в минеральных соединениях.
Изучалась Гольдшмитом, Бартом и Лунде [1], Вартенбергом и
Рейшем [4] и Хиллом, Роем и Осборном [3]. Построенная послед-
15
Рис. 224. Диаграмма состояния системы
CaaOg А1аО3.
H. А. Торопов И др,, КН. 1
226
Алюминатные системы
ними’диаграмма равновесия изображена на рис. 224. Температура
плавления GaaO3 определена в 1715+15° по шкале, использован-
ной Грейгом [2], или около 1725° по интернациональной шкале.
^-Твердые растворы GaaO3 простираются от GaaO3 до 67 мол.%
А1аО3 при 1925°. Корундовая серия твердых растворов лежит
в пределах от А1аО3 до 25 мол.% GaaO3.
Изучена зависимость величины межплоскостных расстояний
от состава твердых а- и ^-растворов. Эти твердые растворы, ста-
бильные при высоких температурах, нестабильны при низких,
так как ниже 810+10° становится стабильным соединение GaA103
и обширные серии твердых растворов располагаются от него по
направлению к А1аО3 и к GaaO3; для этих твердых растворов
в работе также приводятся межплоскостные расстояния.
Твердые растворы со структурой а-А1аО3 могут быть получены
в метастабильном состоянии и для составов, содержащих более
25% GaaO3, но при нагревании выше 600° метастабильная а-струк-
тура превращается в структуру |3-GaaO3. Кристаллы GaA103
и его твердого раствора имеют гексагональный, подобный корун-
довому, облик; показатель преломления GaA103 в базальном се-
чении равен 1.69; структура сходна с ильменитовой. Возможно
ожидать диэлектрические свойства у GaA103.
Литература
1. Goldschmidt V. М., Т. Barth, G. Lunde, Skrifter Norske
Videnskaps-Akad. Oslo, Mat. Naturv. Klasse, 7, 21, 1925.
2. Greig J. W., Amer. Journ. Sci., (5), 13, № 73, 1, 1927; № 74, 133,1927.
3. H i 1 1 V. G., В. В о у, E. F. Osborn, Journ. Amer. Ceram. Soc.,
35, № 6, 135, 1952.
4. Wart enberg H., H. J. R e u s c h, Zs. anorgan. allgem. Chem.,
207, № 1, 19, 1932.
ScaO3— AlaO3
В субсолидусной области изучена Шнейдером, Ротом и Уорин-
гом [2]. Диаграмма фазовых равновесий получена (рис. 225)
Тороповым и Васильевой [1]. Последние авторы обнаружили
соединение перовскитового типа ScA103, устойчивое от точки
плавления (1870°) до температуры 1730°, ниже которой диссоци-
ирующее на ScaO3 и твердый раствор. Этот твердый раствор, по-
видимому, с ромбоэдрической ячейкой и не выясненной до сих пор
структурной принадлежностью существует как в субсолидусной
области (при содержании приблизительно 35—60 мол.% А1аО3),
так и в примыкающей к ликвидусу области (65—80 мол.% А1аО3).
В предположении ромбоэдрической ячейки параметры твердого
Инвариантные точки системы Sc2O3—А12О3
Точка Фазы Процесс Состав Температура, °C
вес, % МОЛ. %
1 Sc2O3±Sc2O3 • А12О3± жидкость. Эвтектика. 63.2 36.8 56 44 1820 ±20
2 Sc2O3-A12Os+жидкость. Конгруэнтное плавление. 57.5 42.5 50 50 1870±20
3 Sc2O3+ Sc2O3* А12О3+твердый раствор. Распад в твердой фазе. 57.5 42.5 50 50 1730 ±20
4 Sc2O3-А12О3±твердый раствор-j- ± жидкость. Эвтектика. 41.1 58.9 33.3 64.7 1790 ±20
5 Sc2O3-A12O3+твердый раствор+ ±жидкость. Реакция. 37.8 62.2 31 69 1790 ±20
6 Твердый раствор+А12О3+жид- кость. Перитектическая точка. 28.2 71.8 22.5 77.5 1850 ±20
7 Твердый раствор+А12О3+жид- кость. Реакция. 25.9 74.1 20.5 79.5 1850 ±20
228
Алюминатные системы
раствора 50 мол.% А1аО3 а=4.95 А и а=87.4°; в предположении
гексагональной ячейки а=13.07, с=17.05А.
Твердые растворы в области, примыкающей к ScaO3, были об-
наружены Шнейдером с сотрудниками. Это кубические твердые
Мол. %
Рис. 225. Диаграмма состояния системы
SCjOg-------------AlgOg.
растворы, характерные для окислов редкоземельных элементов.
В высокотемпературной области Торопов и Васильева таких
твердых растворов не обнаружили.
Торопов и Васильева получили соединение ScA103 в метаста-
бильном состоянии путем кристаллизации переохлажденных
расплавов.
Литература
1. Торопов Н. А., В. А. Васильева, ДАН СССР, 152, № 6, 1379,
1963.
2. S с h n е i d е г S. J., R. S. R о t h, J. L. W а г i n g, Journ. Res. Nat.
Bur. Stand., 65A, № 4, 345, 1961.
YaOtf-AlaO3
Перспективна как материал для радиокерамической и полу-
проводниковой техники.
Систему изучали Кейт и Рой [3], Варшау и Рой [5] и особенно
подробно с применением метода «отжига и закалки» Торопов,
Бондарь, Галахов, Никогосян и Виноградова [1]. Кейт и Рой
нагреванием смесей YaO3 и А1аО3 при температуре 1760—1800°
Алюминатные системы
229
получили два химических соединения: YaO3-Al2O3 и 3Y2O3-
•5А12О3. По данным этих авторов, соединение Ya03• А1а03 сущест-
вует в виде двух структурных типов: типа граната, для которого
формулу соединения следует представлять как Y3(YA1)(A1O4)3,
и нового, предложенного этими авторами типа YCrO3. Тип граната
при высокой температуре переходит в тип YCrO3. По данным Кейта
и Роя, параметр элементарной ячейки YaO3-AlaO3 а=11.989±
+ 0.005 А, а соединения 3YaO3-5AlaO3 а=12.01 + 0.02 А.
"С
2400
Жидк.
2000
. 1960
1600
1200
800\_
0
YA
1930
2YtW3
3Y^5Alt03
176^
to Tw to
2Y.0,-Al,0, 3Y,0,-5Al,03
£ w e «7 e w £ v
M0A.°/a
80
iA
юо
AlA
Рис. 226. Фазовая диаграмма системы
Y2O3—А12О3 (по Варшау и Рою).
Варшау и Рой [5] полагают, что устойчиво существуют два
стабильных соединения: 3Y2O5-5A12O3 типа граната и 2Y2O3-
•А12О3 кубической сингонии. Третье соединение Y2O3-A12O3 счи-
тается метастабильным, и потому на диаграмме (рис. 226) оно не
приводится. Линии ликвидуса определены приблизительно и про-
ведены на диаграмме штриховой линией.
Торопов и Бондарь с сотрудниками показали, что в системе
образуются три устойчивых химических соединения: 2Y2O3-
•А12оз, Y2O3.A12O3, 3Y2O3.5A12O3 (рис. 227).
Соединение 2Y2O3-A12O3 существует, как показали иссле-
дования с помощью высокотемпературного микроскопа, в виде
двух полиморфных форм. Кристаллы низкотемпературной формы
принадлежат к триклинной сингонии. Они оптически двуосные,
положительные, образуют полисинтетические двойники, обладают
косым погасанием, имеют показатели преломления: /Vg=1.880
и Np=1.860; пикнометрическая плотность этого соединения
d25=4.45 г/см3.
Соединение 3Y2O3-5A12O2 обладает структурой типа граната;
кристаллы его изотропны и имеют показатель преломления 1.815;
230
Алюминатные системы
Инвариантные точки в системе Y2O3—А]2О3
Точка Фазы Процесс Состав,вес.% Темпе- рату- ра, °C
Y,O3 A12Oj
1 Y 2OS-|- 2Y 2О3 • А 12О3-|-жидкость. Эвтектика. 85 15 1940
2 2Y2O3- А12О3+жидкость. Y 2О 3 • А12О 34~2Y 2О 3 • А12О 5-1- 4-жидкость. Плавление. 81.5 18.5 2020
3 Инконгруэнтное плавление. 65 35 1875
4 Y gOg • Al«Ug-|~ 2^3 ’ AlgUg-|- -f-SYgOg* 5AlgOg. Разложение в твердом состоя- нии. 68.8 31.2 1835
5 YgOg* Al2Og+3Y2Og.5Al2Og4- 4-жидкооть. Эвтектика. 62.5 37.5 1865
6 3 Y2O3 • 5A12О3-|-жидкость. Плавление. 57 43 1930
7 3Y20g> 5А12О34-а-А12Од4-жид- кость. Эвтектика. 40 60 1760
8 2Y2O3* Al2Og-|- 3Y2Os • 5A12O34- 4-жидкость Эвтектика (мета- стабильное рав- новесие). 68.8 31.2 1850
плотность, определенная пикнометрически, d25=4.65 г/см8. Су-
ществование полиморфного превращения 3Y2O3-5A12O8 при тем-
пературе 1970°, указанного Йодером и Кейтом 16], Торопов
с сотрудниками не обнаружили.
Соединение Y2OS-A12O3 устойчиво в очень узком интервале
температур — между 1875 и 1835°. При 1875° оно плавится с раз-
ложением на 2Y2O3-A12O3 и жидкость; при 1835° происходит рас-
пад его на смесь соединений 2Y2O3-A12O3 и 3Y2O3-5A12O3.
Торопов и Бондарь с сотрудниками установили возможность
образования метастабильного состояния в системе. В тех случаях,
когда время выдержки образцов при термической обработке яв-
ляется малым, соединение Y2O3-A12O3 не образуется и устанавли-
вается метастабильное двухфазное равновесие между 2Y2O3-
•А12О3 и 3Y2O3-5A12O3. Детализация участка диаграммы с нанесе-
нием стабильной и метастабильной областей изображена в верхней
части рис. 227. Штриховыми линиями показан метастабильный
участок системы с эвтектикой между 2Y2O3-A12O3 и 3Y2O3-5A12O3
при 1850°; сплошные линии отражают стабильную область суще-
ствования соединения Y2O3-A12O3.
По данным Гиллео и Геллера [2], Y2O3-A12O3 имеет искажен-
ную структуру перовскита (ромбическую). Кристаллы этого сое-
динения обладают высокими показателями светопреломления:
/Vg=1.905, /Vp = 1.890; пикнометрическая плотность 5.18 г/см3.
Сравнение рентгенограмм соединений 3Y2O3-5A12O3 и Y2O3-
•А12О3 указывает на некоторую близость значений межплоскост-
ных расстояний и интенсивностей линий. Можно предположить
Алюминатные системы
231
о существовании твердых растворов между этими двумя соедине-
ниями.
Нака с сотрудниками [4] изучали фазовые взаимоотношения
в системе в субсолидусной области при нормальном давлении и
в условиях повышенных давлений. При нагревании смесей окис-
лов наблюдалось преимущественное образование 2Y2O3-A12O3
(для любых соотношений Y2O3 и А12О3). Только при 1500° образо-
Рис. 227. Диаграмма состояния системы
Y2Os—А12О3 (по Торопову с сотрудниками).
вывались сосуществующие вместе все три соединения: 3Y2OS-
•5А12О3, Y2O3-A12O3 и 2Y2O3-A12O3. Соединение Y2O3-A12O3 могло
быть получено в чистом виде при сплавлении соответствующей
смеси окислов, но при термической выдержке при 1500° проис-
ходило разложение Y2O3-A12O3 на 3Y2O3-5A12O3 и 2Y,O3-A12O3.
Нака с сотрудниками показали, что исходя из соосажденных
гелей можно получить гранат 3Y2O3-5A12O3, применяя давление
5 кбар уже при температуре 400°. Оказалось, что при высоком
давлении получается серия гранатовых твердых растворов, па-
раметр кристаллической решетки которых находится в пределах
12.03—12.04 А. Эти твердые растворы, представляемые форму-
лой {Y3} [Ya.Ala_a.](Al3)O(2, не разлагаются при длительной (24 часа)
выдержке при 1000°.
232
Алюминатные системы
Литература
1. Торопов Н. А., И. А. Б о н д а р ь, Ф. Я. Г а л а х о в,
X. С. Никогосян, Н. В. Виноградова, Изв. АН СССР,
сер. хим., № 7, 1158, 1964.
2. G i И е о М. A., S. Geller, Phys. Rev., 110 № 1, 73, 1958.
3. К е i t h М. L., R. R о у, Amer. Mineralogist, 39, № 1—2, 1, 1954.
4. N a k a S., О. T a k e n a k a, T. S e k i у a, T. N о d a, Journ. Chem.
Soc. Japan, Industr. Chem. Sect., 69, № 6, 1112, 1966.
5. W a r s h a w I., R. Roy, Journ. Amer. Ceram. Soc., 42, № 9, 434, 1959.
6. Y о d e r H. S., M. L. Ke it h, Amer. Mineralogist, 36, № 7—8, 519,
1951.
La aO3—Al aO g
Может иметь значение в радиокерамической и полупроводни-
ковой технике.
Изучена Бондарь и Виноградовой [1]. Обнаружено два хи-
мических соединения: LaaO3«AlaO3 и La2O3-llAlaO3 (рис. 228).
Рис. 228.
Диаграмма состояния системы ЬааО3—А1аО3.
Алюминат лантана LaA103 относится к соединению с перов-
скитовой структурой и, по данным Геллера и Балла [4], имеет при
435+25° модификационное превращение, когда ромбическая
структура переходит в кубическую. Рентгенограмма LaA103
Алюминатные системы
233
была проиндицирована Бондарь и Виноградовой в кубической
сингонии с а=5.37 А. Показатели светопреломления LaA103 :
Ag=2.030, Np=2.025; пикнометрическая плотность d25=5.84 г/см3.
Соединение Ьа2О3-11А12О3 относится к группе [Э-глинозема.
Оно плавится с разложением на корунд и жидкость при темпе-
ратуре 1925 + 20°. Выше этой температуры существуют в устой-
чивом равновесии расплав и корунд. Однако если охлаждение или
нагревание проводить быстро и делать выдержки не больше 1 мин.,
°C
2300
0 20~ W ВО /80 100
Ьаг03 La3O3Al3O3 Bec.fo ^А
Рис. 229. Диаграмма состояния системы
La2O3—А12О3, построенная при условии быст-
рого охлаждения расплавов (с метастабиль-
ной областью).
то область сосуществования корунда и жидкости на диаграмме
состояния не проявляется и образуется только соединение
Ьа2О3-11А12О3, которое имеет явный максимум на кривой ликви-
дуса. На рис. 229 штриховыми линиями выделена метастабильная
область существования соединения Ьа2О3-11А12О3. На практике,
когда охлаждение образцов происходит со значительной скоро-
стью, следует пользоваться диаграммой с метастабильной обла-
стью.
Соединение Ьа2О3-11А12О3 характеризуется гексагональной
сингонией, кристаллизуется в форме шестиугольных пластинок
с показателями светопреломления: Ао=1.780, Ае=1.768 и плот-
ностью 4.03 г/см3. По данным Рота и Хаско [6], La2O3-llAl2O3
имеет параметры элементарной ячейки: а=5.556. с=22.030 А,
с/а=3.965.
234
Алюминатные системы
Инвариантные точки системы La2O3—А].>03
I Точка I Фазы Процесс Состав Температура, °C
вес. ’/. мол. %
6 св И о о сб 6
1 Ьа2О3 4- LaAlO3 4- жид- кость. Эвтектика. 90 10 73.79 26.21 1875
2 LaAIO3 4- жидкость. Плавление. 76.19 23.81 50 50 2100
3 LaAlO3 -|- La2O3 • 11А12О3 -|- + жидкость. Эвтектика. 50 50 23.75 76.25 1830
4 Ьа2О3 • 11А12О3 4- я-А12О3 4- 4- жидкость. Инконгруэнт- ное плавление. 30 70 11.82 88.18 1925
Година и Келер [2] изучили твердофазовые реакции в системе,
исходя из: 1) смесей окислов, 2) смесей Ьа2О3 и A1(NO3)3-9H2O
и 3) соосажденных гелей. В последнем случае реакция образова-
«~А1г03+
вС
МО
1000
600
Lnz03+LnAl03
Lnfl3nH3O+LnAlO3
LnAlO3+
^пг^'^А1303
LnAlO3+arAl3O3
LnAl03+y-Al303
(LnAl03+Alz03)
30 /50
LnAlO3
70 /Ю
Ln30311Al203
Ln303 Вес. % А1г03
ния алюминатов лантана про-
текает при сравнительно низ-
ких температурах, что облегча-
ет выяснение последователь-
ности образования различных
соединений. На рис. 230 пред-
ставлена схема фазовых соот-
ношений в системах Ьп2О3—
—А12О3 при условии, что исход-
ным материалом был соответ-
ствующий соосажденный гель.
Эта схема пригодна для си-
стем Ьа2О3—А12О3, Рг2О3—
—А12О3 и Nd2O3—А12О3.
Процесс образования Ьа2О3-
•11А12О3 является ступенчатым:
в качестве промежуточной фазы
О
Рис. 230. Схема фазовых соотноше-
ний в системах Ln2Os (Ln2Os=
=La2O3, Pr2Os, Nd2Os)—A12O3, полу-
ченная при изучении твердофазовых
реакций (по Годиной и Келеру).
возникает моноалюминат, кото-
рый в дальнейшем реагирует с
А12О3, образуя Ьа2О3-11А12О3.
Для получения La2O3-Al2O3 из
окислов требуется 1600—1650°;
при использовании нитрата алю-
миния синтез осуществляется при 1200°, и из соосажденных
гелей кристаллизация алюмината начинается уже при 800°.
Ролен и Фам Ху Тан [5] исследовали систему Ьа2О3—А12О3
методом термического анализа, ограничившись температурой
Рис. 232. Высокоглиноземистый уча-
сток системы Ьа2О3—А12О3 (по Фрит-
че и Тенсмейеру).
,; . in,
О 20 W SO S"> 80 100
La2O3 Bec.% АЩ
Рис. 231. Диаграмма состояния системы
La2Os—A12OS (по Ролену и Фам Ху Тану).
°C
La2O? Мол.а/о гп ,:,г AIJJ-,
и V b J
236
Алюминатные системы
2000°. Этими авторами было, так же как и другими, получено два
соединения: LaA103 и Ьа2О3-11А12О3. Указываемая температура
инконгруэнтного плавления Ьа2О3-11А12О3 и эвтектика между
LaA103 и La2O3-llAl2O3 (рис. 231) у Ролена и Фама, по-видимому,
занижены, и более правильные данные получены Бондарь и Ви-
ноградовой, пользовавшимися методом «отжига и закалки».
Фритче и Тенсмейер [3] изучили высокоглиноземистый уча-
сток системы с целью уточнения формулы лантанового «[Э-глино-
зема». Из рис. 232 видно, что высокоглиноземистый алюминат
лантана имеет формулу La2O3-llAl2O3, что находится в соответ-
ствии с данными Бондарь и Виноградовой. Температура плавления
рассматриваемого алюмината найдена равной 1995°, что значи-
тельно превышает температуру 1920°, указанную Варшау [7].
Литература
1. Бондарь И. А., Н. В. Виноградова. Изв. АН СССР, сер.
хим., № 5, 785, 1964.
2. Година Н. А., Э. К. Келер, Изв. АН СССР. сер. хим., № 1, 24,
1966.
3. Fritsche Е. Т., L. G. Tensmeyer, Journ. Amer. Ceram. Soc.,
50, № 3, 167, 1967.
4. G e 1 1 e r S., M. Balia, Acta crystallogr., 9, № 12, 1019, 1956.
5. R о 1 i n M., Pham Huu Thanh, Rev. Haut. Temper, et Refract.,
2, № 2, 175, 1965.
6. R о t h R. S., S. H a s k o, Journ. Amer. Ceram. Soc., 41, № 4, 146, 1958.
7. W a r s h a w I. Phase equilibrium and crystal chemical relations in rare
earth systems. Ph. D. Thesis, Pennsylvania State Univ., Pennsylvania,
1961.
CeaO3—A12O3
Система изучалась Леоновым и Келером [2], Леоновым, Анд-
реевой, Швайко-Швайковским и Келером [1].
При нагревании смесей СеО2 и А1аО3 в атмосфере водорода
двуокись церия восстанавливалась до СеаО3, которая вступала
в реакцию с окисью алюминия.
Получено два химических соединения: СеА1О3 и СеаО3-11А1аО3,
плавящихся в атмосфере водорода соответственно при 2030+30
и 1950 ±25°.
Фазовые соотношения системы СеаО3—А1аО3, при условии изу-
чения ее в атмосфере водорода, приведены на рис. 233. В восстано-
вительной атмосфере алюминаты церия устойчивы от комнатной
температуры до температуры плавления. Двуокись церия хими-
чески не взаимодействует с А1аО3, но при прокаливании смесей СеО2
и А1аО3 выше 1600° происходит разложение СеО2 и получающаяся
Алюминатные системы
237
CeaO3 образует с А1аО3 указанные выше соединения: 2СеОа+
+А1аО3=2СеА1О3+|Оа и 2CeOa | UAlaO3 -CeaO3-llAlaO3 | yOa.
Эти реакции обратимы и при понижении температуры вновь об-
разуются СеОа и А1аО3. Путем закалки алюминаты церия могут
быть получены в окислительной атмосфере, при этом они содержат
примеси А1аО3 и СеОа.
°C
2160
2000
2030'
1950
2050
1600
1200
Сег03+а.-СеАЮ3
tt-CeAlO^
Ce^311Al203
800
Cefl3+f1-CeAU)3
900
CeiPtf-CeAlO3
fl-CeAW3+
Ce^UAl^
?-CeA103+
Се^Рз^АТ^Оз
О 20 90 60 80 100
Ceg03 Мал. % А1г03
°C
2600
2900У-
1600 -
2000-
1800° 1900
1200-
800
2050t
СеАЮ3 Сег0311А1г03
CeOg+Al^
CeQ-CBgOgUAIgO^
_____'(метастаб)'
" Седю3 । „
(метаапаб.)\
СеОг+СеА1О3
900 - (мешасшаб.) \се£311 А1203 ]
(метастаб.)\
s>
О 20
Ce2O3
2(СеОг)
90 60 80 100
Мол.% AlgOg
§
I
&
2*
Рис. 233. Фазовые отношения в
системе Се2О3—А12О3 в атмосфере
водорода (по Леонову).
Рис. 234. Фазовые отношения в си-
стеме Се2О3—А12О3 в атмосфере воз-
духа (по Леонову).
Фазовые отношения в системе СеаО3-А1аО3 при исследовании
ее на воздухе представлены на рис. 234.
СеА1О3 имеет два обратимых полиморфных превращения:
при 90+20 и 980+20°. Фазовое превращение при 980° связано
с переходом ромбической симметрии в кубическую. Соединение
СеА1О3 обладает структурой типа перовскита. Параметр решетки,
проиндицированный в кубической сингонии, а=3.77 А; показатель
светопреломления Аор=2.02, двупреломление среднее ~0.01;
плотность 6.17 г/см8.
Соединение Се2О3-11А1аО3, относящееся к типу магнетоплюм-
бита или (Э-А1а03, белого цвета, при нагревании на воздухе в ин-
тервале температур 1200—1400° интенсивно разлагается. Показа-
тель светопреломления Аор=1.80; двупреломление слабое; плот-
238
Алюминатные системы
ность 4.07 г/см8. При комнатной температуре и частоте 7.1-10®
диэлектрическая проницаемость е=17, тангенс диэлектрических
потерь tg 8=34-10-4.
Литература
1. Л е о и о в А. И., А. Б. Андреева, В. Е. Швайко-Швай-
ко в с к и й, Э. К. К е л е р, Изв. АН СССР, неорг. матер., 2,
№ 3, 517, 1966.
2. Л е о н о в А. И., Э. К. К е л е р, Изв. АН СССР, ОХН, № 11, 1905,
1962.
PraOg—А12О3
Изучена в субсолидусной области Годиной и Келером [1],
исследовавшими твердофазовые реакции различным образом при-
готовленных исходных смесей. Обнаружено два соединения:
РгА1О3 и РгаО3-11А1аО3. В случае соосажденных гелей реакция
образования РгА1О3 начинается уже около 1000°. Соединение
РгаО3-11А1аО3 образуется приблизительно при 1300° из РгА1О3
и А1аО3. Схема, показывающая последовательность образования
алюминатов празеодима, приведена на рис. 230.
Литература
1. Година Н, А., Э. К. Келер, Изв, АН СССР, сер. хим., К» 1, 24,
1966.
Nd2O3—А1аО3
Система представляет интерес для производства электрокера-
мических материалов.
Изучена Тороповым и Киселевой [2]. Установлено одно сое-
динение NdaO3>AlaO3 (рис. 235), на существование которого ранее
указывали Кейт и Рой [4], Рот [5] и Олдрид и Уайт [3].
Инвариантные точки системы Nd2O3—А12О3
Точка [Фазы Процесс Состав, мол. % Темпе- ратура,
NdjO3 AJ2O3
1 NdaO3 -j- NdaO3 • А1аО3 + -f- ЖИДКОСТЬ. Эвтектика. 85 15 I860
2 Nd2O3 • А12О3 + жидкость. Конгруэнтное плавление. 50 50 2070
3 -NdoU3 - А12О3 + а-А12О3 + + жидкость. Эвтектика. 20 80 1750
Алюминатные системы
239
Соединение NdA103 имеет перовскитовую структуру. Кри-
сталлы этого соединения тригональные с небольшим двупрелом-
лением и высокими показателями преломления: 7Vg=2.O25,
ДГр=2.015. Плотность моноалюмината неодима 7.03 г/см3, отли-
чается большой твердостью.
"с
2300 г
0 20 40 60 80 100
М2оз Мо/1.% Al/з
Рис. 235. Диаграмма со-
стояния системы NdaO3—
AlgOg.
Параметры кристаллической решетки NdA103, поданным Рота:
а=3.747 А, а=90°23'.
В инфракрасной области спектра NdA103 имеет две полосы
поглощения: 800—850 и 1000—1100 см-1.
Соединение типа [3-глинозема в системе NdaO3—А1аО3 Торо-
повым и Киселевой не обнаружено.
Година и Келер [1 ], исследуя твердофазовые реакции в системе,
брали в качестве исходного материала соосажденный гель.
При 1300° образуется соединение NdaO3-llAlaO3.
Схема образования алюминатов неодима приведена на рис. 230.
Литература
1- Година Н. А., Э. К. Келер, Изв. АН СССР, сер. хим., № 1, 24,
1966. •
2. Торопов Н. А., Т. П. Киселева, Журн. неорг. хим., 6, № 10,
2353, 1961.
3. AldredF. Н., А. Е. W h i t е, Trans. Brit. Ceram. Soc., 58, № 4,
200, 1960.
4. К e i t h M. L., R. R о y, Amer. Mineralogist, 39, № 1—2, 1, 1954,
5- R о t h R. S., Journ. Res. Nat. Bur. Stand., 58, № 2, 75, 1957-
240
Алюминатные системы
Инвариантные точки системы SmgO3—А1аО3 (по Бондарь)
Темпера- тура, °C О^ХО
Состав | мол. % О ч СООО-н 00 о со о об <о 00 НО Г* X
Sm,O3 Г* Q 00 Сй о 00 НО Г*» О с© об СОНО OJ
вес. % О ONQO OJ OJ МО ЦО cq со
о 6 со QOOOO со со о о t*» t*» МО МО 00 Г* МО 00
Процесс Эвтектика. Плавление. Эвтектика. Инконгруэнтное плавле- ние.
Фазы Зт2О3Ч-ЗтА1О3Ч-жидкость. ЗтА1034-жидкость. SmA103-j-Sm203- 11А12О3+жидкость. Sm2O3- 11А12О3+а-А12О3-|- жидкость.
SlH gO 3““ Al gO 3
Изучена Бондарь [1]и Бондарь и
Тороповым [2]. Установлено образова-
ние двух соединений: конгруэнтно пла-
вящегося соединения SmaO3-AlaO3 и
инконгруэнтно плавящегося соедине-
ния SmaO3-llAlaO3 (рис. 236). Инте-
ресно, что последнее соединение может
метастабильно плавиться конгруэнтно,
как это показано на рисунке штрихо-
выми кривыми.
Стабильное состояние соединения
SmaO3-llAlaO3 проявляется в образо-
вании а-А1аО3 и жидкости выше 1920°
и показано на рис. 236 сплошной ли-
нией, метастабильная область представ-
лена штриховой линией.
Кристаллы SmA103, в соответствии
с данными Геллера и Балла [8], ха-
рактеризуются ромбической сингонией;
двупреломление незначительное при
высоком значении показателей свето-
преломления: 7Vg=2.05, 7Vp=2.042;
плотность пикнометрическая 6.12 г/см3.
Кристаллы SmaO3-llAlaO3 слага-
ются из шестиугольных пластинок с
показателями светопреломления No=
=1.780, 7Ve=1.765; пикнометрическая
плотность </а5=4.Ю г/см3.
Алдредом и Уайтом [7] приведена
лишь вероятная диаграмма плавкости.
Экспериментальные значения темпера-
тур солидуса и ликвидуса приведены
только для температурного интервала
1700—1820°, а выше 1820° кривые на
диаграмме наносились условно (рис. 237).
Будников, Тресвятский, Кушаков-
ский и Белеванцев [3, 4, 6] изучали
образование алюминатов самария при
низкотемпературном обжиге соосаж-
денных гидроокисей алюминия и са-
мария. Реакция образования SmA103
заканчивается уже при 880°. Будников
с сотрудниками утверждают, что ими
Рис. 236. Диаграмма состояния системы Sm2Os—А12О3
(ио Бондарь и Торопову).
Рис. 237. Предположительная диа-
грамма плавкости системы
Sm2Os—A12Os (по Алдреду и
Уайту).
Рис. 238. Диаграмма состояния си-
стемы Sm2O3—A12Os (по Будникову
и Тресвятскому).
16 Н. Л. Торопов и др., кн. 1
242
Алюминатные системы
получено соединение 2SmaO3-AlaO3, плавящееся с разложением
при 1920°. Диаграмма состояния системы SmaO3—А1аО3, по Буд-
никову и Тресвятскому, показана на рис. 238.
Согласно определениям Портного и Тимофеевой [5 ], моноалюми-
нат самария SmA103 плавится при 2290° К (2017° С) и имеет плот-
ность 7.04 г/см3.
Литература
1. В о n d а г I. A., Proc, of the Seventh Conference on Silicate Industry,
Budapest, 327, 1965.
2. Бондарь И. A., H. А. Торопов, Изв. АН СССР, сер. хим.,
№ 2, 212, 1966.
3. Будников П. П., С. Г. Тресвятский, Огнеупоры, № 4, 167,
1955.
4. Будников П. П., В. И. Кушаковский, В. С. Белеван-
цев, ДАН СССР, 165, № 5, 1075, 1965.
5. Портной К. И., Н. И. Тимофеева, Изв. АН СССР, неорг.
матер., 1, Ks 9, 1598, 1965.
6. Тресвятский С. Г., В. И. Кушаковский, В. С. Беле-
ванцев, Атомн. энергия, 9, № 3, 219, 1960.
7. А 1 d г е d F., A. W h i t е, Trans. Brit. Ceram. Soc., 58, № 4, 199, 1959.
8. G e 1 1 e r S., V. В. В a 1 1 a, Acta crystallogr., 9, № 12, 1019, 1956.
EuO—Al aO 3
Некоторые сведения о системе приводят Ашард и Альберт|[1 ].
Авторы нагревали смеси ЕпаО3 и А1аО3 в токе водорода при 1500—
2000°. Было получено два соединения: ЕпО-А1аО3 и ЕпО-6А1аО3.
Последнее соединение является более устойчивым, так как нагре-
вание ЕпО-А1аО3 в вакууме при 2000° приводит к образованию
ЕиО'6А1аО3. Полученные алюминаты в структурном отношении
являются аналогичными SrO-AlaO3 и 8гО-6А1аО3, изученным
Диром [2].
Шефер [3] указывает, что им в результате твердофазовых ре-
акций получено три алюмината: ЕпА1аО4, Еп3А1аОв и Еп6А1аО8.
Между EugAlgOg и ЕпБА1аО8 наблюдалась значительная область
твердых растворов. Соединение Еп3А1аО3 имеет псевдо кубиче-
скую структуру. Еп3А1аОв и ЕпБА1аО8 обладают ферромагнитными
свойствами с точками Кюри 10 и 6° К.
Литература
1. А с h а г d J.-C., L. Albert, Compt. rend., 262, ser. C, № 13, 1066,
1966.
2. D e a r P. S., Bull. Virginia Polytechn. Inst., 50, Eng. Exp. Stat, ser.,
№ 117, 1957.
3. S h a f e г M. W., Journ. Appl. Phys., 36, № 3 (pt. 2), 1145, 1965.
Алюминатные системы
243
EuaO3—А12О3
Изучалась Бондарь [1]. Показано существование двух соеди-
нений: ЕпаО3«А1аО3 или ЕиА103 и ЕпаО3»11А1аО3. Соединение
ЕиА103 плавится без разложения при 1980+30° и относится к типу
перовскита с искаженной структурой; кристаллы ЕпА1О3 обладают
слабым двупреломлением и высокими значениями показателей
светопреломления: -i/Vg=2.07, Лр=2.065. Соединение ЕпаО3-
• 11 А1аО3 плавится при температуре 1940+30° с разложением на
корунд и жидкость. Кристаллизуется в форме шестиугольных
пластинок и имеет следующие кристаллические характеристики:
jVo=1.785, Ne=i.770. Соединение ЕпаО3»11А1аО3 относится
к группе [Э-глинозема (структуры магнетоплюмбита).
Литература
1. Bondar I. A., Proc. Seventh Conference on Silicate Industry, Buda-
pest, 327, 1965.
GdaO3—AIaO3
Изучалась Алдредом и Уайтом [4], Тресвятским, Кушаков-
ским и Белеванцевым [3], Будниковым, Кушаковским и Белеван-
цевым [1], Шнейдером, Ротом и Уорингом [5].
°C
2300
2330+20'
2200 -
2100 -
2000
1900-
1800
™°}г
(гд-гРэ
\ 2090+10'
\ 1980±90° ;
20 90 60 80 Ю0
Мол.% А1г03
Верхний предел
-термоэлемент
Рис. 240. Диаграмма состояния
системы GdaO3—А1аО3 (по Буд-
никову с сотрудниками).
Рис. 239. Предположительная диаграм-
ма плавкости системы GdaO3—А12О3
(по Алдреду и Уайту).
£
16*
244
Алюминатные системы
Экспериментальные определения температур ликвидуса и
солидуса Алдред и Уайт производили только до 1820° (рис. 230).
Будников, Кушаковский и Белеванцев подвергали обжигу
соосажденные гели гидроокисей гадолиния и алюминия. Обнару-
жено два соединения: GdA103 и 2GdaO3-AlaO3. Соединение GdA103
имеет структуру перовскита с параметром 3.736+0.005 кХ. Сое-
динение 2GdaO3«AlaO3 плавится с разложением при 1950°. Диа-
грамма состояния системы GdaO3—А1аО3 приведена на рис. 240.
Специальными опытами установлено отсутствие заметной раство-
римости окиси алюминия в GdAlO3.
Согласно определениям Портного и Тимофеевой [2], моноалю-
минат гадолиния имеет температуру плавления 2230° К (1957° С)
и плотность 7.15 г/см8.
Инвариантные точки системы GdaO3—А12О3
| Точка | Фазы Процесс Данные Алдреда и Уайта Данные Тресвятского с соавторами
состав» мол. % темпера- тура, °C состав, мол. % темпера- тура, °C
о Gd2O3 А12Оз « о •в ф
1 GdAlO3 + + жидкость. Эвтектика. 80 20 1740+20 77 23 1760+20
2 GdAIO3 4" жид- кость. Конгруэнтное плавление. 50 50 1980+40 50 50 2060 ±20
3 GdgOg-j- GdAlO3+ + жидкость. Эвтектика. — — — 73 27 1930+20
Литература
1. Б у д н и к о в П. П., В. И. Кушаковский, В. С. Белеван-
цев, ДАН СССР, 165, № 5, 1075, 1965.
2. Портной К. И., Н. И. Тимофеева, Изв. АН СССР, иеорг.
матер., 1, № 9, 1598, 1965.
3. Т р е с в я т с к и й С. Г., В, И, Кушаковский, В. С. Б е ле-
ва н ц е в, Атомн. энергия, 9, .№ 3, 219, 1960.
4. А 1 d г е d F., A. White, Trans. Brit. Ceram. Soc., 58, № 4, 199, 1959.
5. Schneider S. J., R. S. Roth, J. L. Waring, Journ. Res. Nat.
Bur. Stand., 65A, № 4, 345, 1961.
Tb2O3—AIaO3
Изучена Бондарь [1]. Исходная окись тербия ТЬ4О7 в смеси
с А1аО3 обжигалась в воздушной атмосфере при температурах в ин-
тервале 1550—1600° с промежуточным растиранием. Активного
кислорода в конечном продукте не наблюдалось.
Алюминаты тербия представлены тремя соединениями:
2ТЬаО3- А1аО3, ЗТЬаО3-5А1аО3 и ТЬаО3-А1аО3.
Алюминатные системы
245
Соединение 2ТЬаО3»А1аО3 плавится без разложения при
2000 + 20°; показатели светопреломления: Ag=1.890, Ар=1.874;
плотность 6.02 г/см3. Кристаллы оптически двуосные, положитель-
ные, образуют полисинтетические двойники. Соединение ТЬаО3-
• А1аО3 (ТЬА1О3) плавится при 1860+20° с разложением на 2ТЬаО3-
•А1аО3 и жидкость; при охлаждении ниже 1800° оно претерпевает
распад в твердом состоянии на 2ТЬаО3-А1аО3 и ЗТЬаО3-5А1аО3,
т. е. ТЬА1О3 устойчив в узком температурном интервале. Показатели
светопреломления TbA103:Ag=1.915, Ар=1.902; плотность пикно-
метрическая dab=6.35 г/см3. Соединение ЗТЬаО3»5А1аО3 плавится
без разложения при 1900+30° и относится к структурному типу
граната. Кристаллы его изотропны и имеют показатель светопре-
ломления 1.890; плотность пикнометрическая da6=4.47 г/см3.
В рассматриваемой системе не обнаружено соединения типа
«[Э-глинозема».
Литература
1. Bondar I. A., Proc. Seventh Conference on Silicate Industry, Buda-
pest, 327, 1965.
YbaO3—AIaO3
Система изучена Бондарь [1] и Бондарь и Тороповым [2].
Установлено образование двух соединений: инконгруэнтно пла-
°С
гыо
ПЛ Мол % МЛ
& о 6 J
Рис. 241. Диаграмма состояния системы
YD2Og AlgOg.
246
Алюминатные системы
Инвариантные точки системы Yb2O3—А12О;
Темпера- тура, °C 1925 1670 1850 1900 1750
со ю О ЧУ OS I
О ю СО о
о сб о СЧ ОЗ
°' СО Ю со г*
ч
о
2 и ю СО О о ю
о «О о ю ю
Л 03 СО о сч
Я ю со Ю со сч
g
о
о от о Ю СО О
о о ю -ГН О
<< LO о о о
«гН см СО Ю
о
W
к _со о Ю СО г- о
О о Ю 00 о
Л LO об ОЗ ОЗ о
00 00 со ю
и о
cd о
ч R §
и ф о а
и W № л
о а № Л л cd ф S S
й CL, № “ в 3 5- и 3 « п 1 к и § g Е п «
ф к ф cd Я
в 4 я о п
S № о С го
со со
о о
из Ен Ю со nQ1 СО CL, из и о
О о О д Pt S
Й Л Й
S СО cd CL, Й +
2 -к + оО
со со со В
св е о м о ft ф g
со о м Л со о м Л + со о м §++ а СО со §оо во м +< <!
СЧ сч
+ + со о • « со со
со о со о о м Зоо
м м Л
Л Л >>-
и сч СО 00
вящегося 2YbaO3-AlaO3 и кон-
груэнтно плавящегося 3YbaO3-
•5А1аО3 (рис. 241). Большой
интерес представляет факт об-
разования твердых растворов
между соединением 3YbaO3 •
•5А1аО3 и соединением 2YbaO3-
•А1аО3. Эти твердые растворы
следует рассматривать как об-
разовавшиеся на основе иттри-
евого граната (3YbaO3-5AlaO3).
Соединение 2 YbaO3 А1аО3
устойчиво в определенном ин-
тервале температур между 1925
и 1675°. При температуре 1925°
оно плавится с разложением на
Yb2O3 и жидкость; при 1675°
происходит его распад на смесь
Yb2O3 и 3YbaO3-5AlaO3. Кри-
сталлы 2YbaO3-AlaO3 двуосные,
оптически положительные, во
всех разрезах имеют прямое
погасание и, по-видимому, при-
надлежат к ромбической си-
нгонии; показатели светопре-
ломления: Ag=1.900, Np =
=1.885; плотность пикномет-
рическая da6=7.03 г/см8, мик-
ротвердость ~1100 кг/мм8.
Соединение 3 YbaO3 5А1аО3
плавится без разложения при
1900+30°; кристаллы его изо-
тропны; показатель светопре-
ломления N=1.895; плотность
пикнометрическая da6=6.1 Зг/см8.
Параметр кристаллической ре-
шетки а=11.91 А.
Для понимания замещения
алюминия иттербием при обра-
зовании гранатовых твердых
растворов формулу граната
можно представить как
Yb3(Ala)(A104)3. Алюминий здесь
находится как в шестерной,
так и в четверной координа-
Алюминатные системы
247
ции. При образовании твердого раствора происходит замещение
гпестикоординационного алюминия иттербием. Предельный твер-
дый раствор при 1850° отвечает составу 4:5 и содержит 44 мол. %
YbaO3 и 56 мол.% А1аО3. Таким образом, крайними членами твер-
дого раствора являются составы 3 : 5 и 4 : 5. Естественно, при
таком замещении алюминия иттербием наблюдается расширение
решетки твердого раствора.
Литература
1. Bondar I. A., Proc. Seventh Conference on Silicate Industry,
Budapest, 327, 1965.
2. Бондарь И. A., H. А. Торопов, Изв. АН СССР, сер. хим., № 2,
212, 1966.
РЬО—А1аО3
Изучена как часть более общей системы РЬО—AIaO3—SiOa,
имеющей значение в производстве керамических глазурей и сте-
кол. Исследование системы затруднительно из-за сильной лету-
чести РЬО при высоких температурах. Изучалась Геллером и
Бантингом ([2], рис. 242). В системе предполагается существова-
ние соединения РЬО-А1аО3, образующего эвтектику с РЬО при
94% РЬО и 865°. Выше 1000° алюминат свинца разлагается с обра-
зованием р-А1а03 в жидкости. Показатели светопреломления
РЬО-А1аО3 обнаруживают некоторые колебания. Это указывает
на наличие твердых растворов. Возможно, что происходит образова-
ние твердых растворов РЬО в корунде, так как в некоторых слу-
чаях показатели светопреломления а-А1аО3 оказывались близ-
кими к А=1.765. РЬО-А1аО3 — пластинки, оптически одноосные,
отрицательные; jVg=1.91, jVp=1.85.
Торкар с сотрудниками [5], исходя из более активной формы
глинозема т|-А1аО3 и проводя реакции в твердом состоянии, полу-
чили три алюмината свинца: РЬА1аО4, 2РЬО-А1аО3 и РЬО-6А1аО3.
Соединение 2РЬО-А1аО3 было получено при 700°, оно устой-
чиво приблизительно до 1000° и разлагается на расплав и соеди-
нение РЬО-6А1аО3. Алюминат РЬА1аО4 устойчив до температуры
800°, когда в результате твердофазовой реакции переходит в смесь
2РЬО-А1аО3 и РЬО-6А1аО3. Соединение РЬО-6А1аО3 не может
быть получено из чистых окислов и образуется в результате
распада других алюминатов — РЬО-А1аО3 и 2РЬО-А1аО3. Гекса-
алюминат свинца устойчив до 1100°. Выше этой температуры
происходит интенсивное улетучивание РЬО и образуется а-А1аО3.
На рис. 243 представлена предположительная диаграмма
состояния системы к]-А1?О3—желтая РЬО. При построении дид-
248
Алюминатные системы
граммы авторы использовали данные, полученные с помощью
динамической дифференциальной калориметрии [4].
Кристаллы 2РЬО-А1аО3 относятся к кубической симметрии
с параметром кристаллической решетки а=13.24 А; плотность
Рис. 243. Диаграмма со-
стояния системы А1аО3—
—РЬО (желтая) (по Торка-
ру, Кришнеру и Мозеру).
Рис. 242. Диаграмма со-
стояния системы РЬО—
—А1аО3.
6.65 г/см3. Соединение РЬА1а04 Торкар с сотрудниками относят
к моноклинной симметрии и приводят следующие параметры
кристаллической решетки: а=5.27, Ь=5.07, с=8.46 А, р=118°48'.
Соединение РЬО-6А1аО3 относится к типу « р-глинозема» со струк-
турой магнетонлюмбита, кристаллизуясь в гексагональной сим-
метрии с пространственной группой 2)вА4 и параметрами решетки
а=5.58 и с=22.20 А. Монокристаллы РЬО-6А1аО3 получили Лина-
рес [3] и Чез и Уолтен [1].
Литература
1. С h a s е А. В., G. М. W о 1 t е n, Journ. Amer. Ceram. Soc., 48, № 5,
276, 1965.
2. GellerR. F., E. H. Bunting, Journ. Res. Nat. Bur. Stand., 31,
№ 5 255 1943.
3. L i n a re s R. C., Journ. Appl. Phys., 33, № 5, 1747, 1962.
4. T о rkar К., H. P. F г I t z e г, К. L a s s e г, Sprechsaal, 95, 239,
1962.
5. T о г k а г К., H. К r is ch пег, Н. Moser, Вег. Dtsch. keram.
Ges., 43, № 4, 259, 1966.
Алюминатные системы
249
Ti а03—Al a03
Имеет значение для технологии титан- и глинозем содер-
жащих огнеупоров и керамики, фазового анализа титаноглино-
земистых шлаков ит. д.
Система частично изучена
Адлером и Селвудом [1], Шре-
велиусом [5] и Мак-Ки и Але-
шиным [4]. Адлер и Селвуд ка-
чественно установили наличие
твердого раствора TiaO3 в А1а03,
а Шревелиус на основании
рентгенографических данных и
измерения микротвердости оп-
ределил предел растворимости
TiaO3 в А1аО3 в 0.6 мол. %.
Рис. 244. Изменение размеров элементарной ячейки А1аО3 в за-
висимости от содержания TiaOs в системе TiaOs—А12О3 в атмосфе-
ре водорода.
а — 1400°; б — 1600°; в — 1700°. 1 — отражения (10.16); 2 — отражения
(33.0).
Мак-Ки и Алешин производили нагревание смесей TiOa и
А1аО3 в атмосфере водорода при температурах 1400, 1600
и 1700° и рентгенографическое изучение получившихся продук-
тов. Их результаты по изменению размера элементарной ячейки
в зависимости от количества TiaO3 (мол.%) в твердом растворе
глинозема показаны на рис. 244, а—в, из которых следует, что
в отличие от TiOa, практически не растворимой в А1аО3, полутора-
250
Алюминатные системы
окись титана растворяется в А1аО3 в следующих количествах
(мол. %): при 1400° — 1.0 (рис. 244, а), при 1600° — 1.8 (рис. 244, б),
при 1700° — 2 5 (рис. 244, в).
Горибе и Кувабара [3] изучили плавкость системы. Соедине-
ний не обнаружено. Эвтектика с температурой плавления 1720°
находится при содержании 30—40 мол. % А1аО3. Полутораокись
°C
Рис. 245. Диаграмма состояния си-
стемы TiaO3—А1аО3 (по Белону и
Форестье).
Рис. 246. Изменение параметра эле-
ментарной ячейки твердого раствора
в системе* А1аО3—TiaO3.
титана растворяется в а-А1аО3 в следующих количествах: при
1600° — 1.6 мол.%, при 1710° — 2.7 мол.% и при 1840° —
1.7 мол.%.^
Для полутораокиси ^титана принимается формула^/ПаО31
с температурой плавления 1800°.
Белон и Форестье [2] построили полную диаграмму состояния
системы (рис. 245). Химических соединений в системе не найдено,
но установлено образование твердых растворов как на основе
TiaO3, так и на основе А1аО3. Предельная концентрация TiaO3
при растворении последней в окиси алюминия составляет
12.5 мол.% (при 1700°) (рис. 246).
Эвтектика в системе имеет состав 45 мол. % TiaO3 и 55 мол. %
А1аО3 и плавится при 1695 + 30°.
Литература
1. A d 1 е г S. F., Р. W. S е 1 w о о d, Journ. Amer. Chem. Soc., 76, № 2,
346, 1954.
2. Belon L., H. Forestier, Compt. rend., 258, groupe 8, № 17, 4282,
1964. ’
Алюминатные системы
251
3 Н о г i b е Т., S. Kuwahara, Journ. Chem. Soc. Japan, Industr.
Chem. Sect., 67, № 2, 276, 1964.
4 M cK e e W. D., E. Aleshin, Journ. Amer. Ceram. Soc., 46, № 1, 54,
1963.
5. S c h r e w e 1 i u s N. G., Journ. Amer. Ceram. Soc., 31, № 6, 170, 1948.
Cr2O3—A12O3
Имеет значение для технологии плавленой окиси алюминия,
хромовых пигментов и производства хромсодержащих сплавов
и синтеза рубиновых квантовых генераторов.
По экспериментальным данным Бонтрона и Дюррера [4],
в бинарной системе А12О3—Сг2О3 возможна эвтектика приблизи-
тельно при 30 мол.% Сг2О3. Однако Бантинг [5] также экспери-
ментально показал наличие непрерывных твердых растворов
(рис. 247).
Зависимость значений постоянных решеток от состава в ряду
А12О3—Сг2О3 изучали Пассерини [6], Уайлд и Рис [9], Тило,
Яндер и Зееман [8] и Сприггс и Бендер [7]. По данным последних
на рис. 248 приведены значения постоянных решеток а и с.
На рис. 249 приводятся по [8] значения плотностей по рентгено-
графическим и пикнометрическим данным. Согласно этим авторам,
Сг2О3, входящий в решетку рубина до 8 мол.%, обусловливает
красную окраску последнего. С повышением содержания хрома
происходит изменение окраски на зеленую.
Торопов и Андреев [3] синтезировали ряд рубинов с различ-
ным содержанием в них Сг2О3 и установили зависимость показа-
252
Алюминатные системы
телей светопреломления этих
от количества в них СгаО3, а
расстояний.
рубинов для разных длин волн
также изменение межплоскостных
Рис. 248. Постоянные
решетки aQ и с0 твердых
растворов (А1, Сг)2О3.
Рис. 249. Плотность по
пикнометрическим (2) и
рентгенографическим (2)
данным для твердых
растворов А12О3—СгаО3.
Лапиным, Курцевой и Островской [2] в шлаковых рубинах
было определено 3.96% СгаО3 при наличии в них 1.35% FeaO3.
Максимальное содержание СгаО3 в природном корунде было
определено Белянкиным, Лапиным и Шумило [1] в 1.96%.
Литература
1. Б е л я н к и н Д. С., В. В. Лапин, И. М. Шумило, ДАН СССР,
30, № 8, 733, 1941.
2. Л а п и н В. В., Н. Н. К урцева, О. П. О с т р о в с к а я, Труды
Инет, геологии рудных месторождений, петрографии, минералогии
п геохимии, вып. 30, Изд. АН СССР, М., 124, 1958.
3. Т о р о п о в Н. А., И. Ф. А н д р е е в, Труды Ленингр. технол. инет,
им. Ленсовета, вып. 29, 90, 1954.
4. Bonthron К. J. A., R. D и г г е г, Zs. anorgan, allgem. Chem.,
198, № 1—2, 141, 1931.
5. В u n t i n g E., Joum. Res. Nat. Bur. Stand., 6, № 6, 947, 1931.
6. Passerini L., Gaz. Chim. Ital., 60, 544, 1930.
7. S p г i g g s R. M., S. L. Bender, Joum. Amer, Ceram. Soc., 45,
№ 10, 506, 1962.
Алюминатные системы
253
8. Т h i 1 о Е., J. Jander, Н. S е е m a n n, Zs. anorgan. .allgem. Chem.,
279 № 1___________2 2 1955.
<). Wilde W. T., W. J. Rees, Trans. Brit. Ceram. Soc., 42, № 7, 123,
1943.
MnO—AlgO3
A О
Изучена Хейем, Уайтом и Макинтошем [2] (рис. 250). Сущест-
вующее соединение — марганцовистая шпинель (МпО -А1аО3) —
плавится инконгруэнтно при 1560° с выделением кристаллов
корунда. Марганцовистая шпинель растворяет некоторое коли-
чество МпО, образуя твердый раствор р. Гомогенная область
твердого раствора находится приблизительно в пределах 40—
50 вес.% МпО. В соответствии с диаграммой Хея и сотрудников
°C
МпО Вес.% Мг°3
Рис. 250. Диаграмма состояния
системы МпО—А12О3.
Рис. 251. Предположительная
диаграмма состояния системы
МпО—А12О3 (по Новохатскому
с сотрудниками).
этот твердый раствор выделяется в температурном интервале
1520—1560°. МпО образует весьма ограниченный твердый раствор
с окисью алюминия (a-твердый раствор). Эвтектика между этими
двумя твердыми растворами имеет температуру плавления 1520о°.
Параметр кристаллической решетки МпА1аО4 а=8.280+0.007 А;
плотность измеренная 4.12 г/см3, вычисленная 4.08 г/см3.
Новохатский, Ленев, Савинская и Горох [1] изучили систему
до температуры 1800°. Подтверждено существование одного хими-
ческого соединения МпА12О4, плавящегося конгруэнтно при
1850+15°. Это соединение типа шпинели имеет кристаллы с по-
казателем светопреломления 1.815 + 0.005 и параметром решетки
8.195+0.002 кХ. Эвтектика между МпО и МпА1аО4 содержит
76 вес.% МпО и плавится при 1520°, эвтектика между а-А1аО3
н МпА12О4 содержит 73 вес. % А1аО3 и плавится при 1770+15°.
254
Алюминатные системы
На рис. 251 линии ликвидуса проведены предположительно.
Авторы отрицают взаимную растворимость в рядах МпА1а04—
—а-А1а03 и МпО—МпА1а04, но отмечают склонность к образованию
выше 1500° метастабильных твердых растворов со структурой
дефектной шпинели, получающихся путем внедрения в МпА1аО4
окиси алюминия в виде термодинамически неустойчивой у-моди-
фикации, обладающей структурой дефектной шпинели. При 1700°
в алюминате марганца растворяется до 50 вес.% А1аО3, что со-
провождается значительным уменьшением параметра элементар-
ной ячейки (до 8.08+0.01 кХ) и показателя светопреломления
(алюмината) до 1.78±0.01.
Литература
1. Новохатский И. А., Л. М. Л е и е в, А. А. С а в и и с к а я,
А. В. Горох, Журн. неорг. хим., 11, № 2, 427, 1966.
2. Н а у R., J. W h 11 е, А. В. М с I n t о s с h, Journ. West. Scotl.
Iron a. Steel Inst., 42, 39, 1934—1935.
FeO—AlaO3
Частная система многих поликомпонентных систем, имеющих
специальное значение для службы алюмосиликатных огнеупоров
Рис. 253. Диаграмма состояния си-
стемы FeO—А1,О3 (по Фишеру и
Гофману).
Рис. 252. Диаграмма состоя-
ния системы FeO—А1аО3 (по
Макинтошу, Райту и Хею).
Систему изучали Макинтош, Райт и Хей [5] (рис. 252) и Фишер
и Гофман [4]. Согласно данным последних авторов, здесь существует
только одно соединение типа шпинели, FeO •А1аО3 (рис. 253).
Алюминатные системы
255
Таблица 1
Инвариантные точки системы FeO—А12О3 (по Фишеру и Гофману)
Точка [Фазы Процесс Состав, вес. % Темпе- рату- ра, °C
FeO а120э
1 2 3 FeO + FeO А12О3 4- жидкость. FeO А12О3 4- жидкость. FeO А12О3 твердый раствор 4- А12О3 4- + жидкость. Эвтектика. Плавление. Эвтектика. 95 41.3 35 5 58.7 65 1330 1780 1750
Соединение 3FeO -AlgOs, описываемое Макинтошем с сотруд-
никами в субсолидусной области, отрицается Фишером и Гоф-
маном. Твердые растворы глинозема в железистой шпинели
устойчивы только при высоких температурах (выше 1500°), и
максимальное содержание А1аО3 (при 1750°) достигает 64.2 вес. %.
При образовании твердых растворов FeO в А1аО3 изменяются
параметры решетки (в ромбоэдрических координатах): от
а=5.128+0.001 А и а=55°17'+1 для чистого А1аО3 до а=5.135—
•—5.140+0.002 А и а=55°17'+1 для насыщенного закисью железа
а-А1аО3.
Таблица 2
Кристаллические фазы системы FeO—А12О3
Соединение Система кристал- лов Габитус Плот- ность, г/см3 Спай- ность Примечание
Вюстит. Кубиче- ская. — — — 2.32 Темно-зеленый.
• Герцинит FeO . А12О3, То же. Октаэдры. 3.9 — 1.80 По Сноу и Кафи [7], N= 1.82+0.005.
Наличие указанных твердых растворов и их концентрационные
области подтвердились также измерениями электродвижущих
сил с твердыми электролитами [3].
Галахов [1 ] обратил внимание на несоответствие в положении
границы между герцинитом и корундом в двойной диаграмме
ГеО-А1аО3, приведенной Макинтошем с сотрудниками, и трой-
ной диаграмме FeO—А1аО3—SiOa Шерера и Яги [6]. В соответ-
ствии с данными последних авторов здесь должна быть эвтектика.
В результате специального исследования Галахов констати-
ровал наличие эвтектики между FeO-AlaO3 и А1аО3. Состав этой
256
Алюминатные системы
эвтектики: FeO — 36 вес. %, А12О3 — 64 вес. %, и температура
плавления 1750°. На рис. 254 приведена диаграмма по Макинтошу
с сотрудниками, с исправлениями, внесенными Галаховым.
FeO ЗГеО-А1гО3 ГеО-А1гО3 А1г03
Вес.%
Рис. 254. Диаграмма состояния системы
FeO—А12О3 (по Макинтошу с сотрудниками,
с изменениями, внесенными Галаховым).
Новохатский, Белов, Горох и Савинская [2] дали несколько
видоизмененный вариант диаграммы состояния системы FeO—
—А12О3 (рис. 255). Образцы окислов обжигались при 1700° и фазы
FeO Вес.% ^-^з
Рис. 255. Диаграмма состояния
системы FeO—А12О3 (по Ново-
хатскому с сотрудниками).
идентифицировались рентгенографическим и петрографическим
методами. Авторы доказывают, что соединение 3FeO -А12О3 не об-
разуется и отмечается только одно соединение FeO -А12О3 с темпе-
ратурой плавления 1820+15°. Отрицается также взаимная рас-
творимость в твердом состоянии соединений FeAl2O4 и а-А12О3.
Алюминатные системы
257
Литература
1. Галахов Ф. Я., Изв. АН СССР, ОХН, № 5, 525, 1957.
2. Новохатский ‘ И. А., Б. Ф. Белов, А. В. Горох,
А. А. С а в и и с к а я, Журн. физ. хим., 39, № 11, 2806, 1965.
3 Fischer W. A., A. Hoffmann, Arch. Eisenhiittenwesen, 26, № 1,
63, 1955.
4 F i s с h е г W. A., A. Hoffmann, Arch. Eisenhiittenwesen, 27, № 5,
34, 1956.
5, M с I nt о sh A. B., J. B. R a i t, R. H a y, Journ. Roy. Techn. Coll.
(Glasgow), 4, № 1, 72, 1937.
6. Schairer J. F., K. Yagi, Amer. Journ. Sci., Bowen volume, 471,
1952.
7. Snow R. B., W. J. C a u g h e y, Journ. Amer. Ceram. Soc., 25, № 6,
151, 1942.
Fe2O3—A12O3
Имеет значение для фазового анализа глиноземсодержащих
огнеупоров и продуктов их изменения в металлургических печах
под воздействием железосодержащих шлаков, шихтной пыли и пр.
Изучалась Муаном и Ги [3] и Муаном [1,2].
На рис. 256 приводится составленная Муаном [2] диаграмма
фазовых равновесий в системе окисел железа—глинозем на воз-
духе, построенная в основном по данным Муана и Ги [3] с уточ-
нением положения поля соединения Fe2O3-Al2O3; зта фаза неста-
бильна ниже 1318°. Диаграмма для простоты дана в виде двойной,
хотя действительные составы фаз находятся в пределах трой-
ной системы FeO—Fe2O3—А12О3, как было показано в работе
Муана и Ги [ 3], данные которых представлены на рис. 257.
На нижней части рис. 257 приведена треугольная диаграмма
с нанесенными на ней кривыми, представляющими составы фаз
в равновесии вдоль пограничных кривых. Буквенные обозначе-
ния на линиях составов соответствуют таковым на верхней псевдо-
бинарной части диаграммы. Там, где нет надежных данных, линии
составов показаны штриховыми кривыми.
На рис. 258 представлены, по данным Муана [2], четыре диа-
граммы, характеризующие влияние изменения парциального
давления кислорода на равновесие в субсолидусных областях
части системы Fe—Al—О, а именно: а — для давления 1 атм.,
6 — 0.2 атм., в — 0.03 атм., г — для парциального давления
кислорода несколько ниже чем 0.03 атм.
Реакция между фазой Fe2O3-Al2O3 и продуктами ее разложе-
ния в виде гематитовых твердых растворов (Fe, А1)2О3 и корундо-
вых твердых растворов (Al, Fe)2O3 происходит слишком медленно,
чтобы можно было произвести прямое экспериментальное ее изу-
17 Н. А. Торопов и др„ нн. 1
258
Алюминатные системы
чение при температурах ниже 1318°, в связи с чем Муан исполь-
зовал косвенный метод определения относительной стабильности
этих двух фазовых ассоциаций. По мере понижения парциаль-
ного давления кислорода поле соединения FeO-Al2O3 умень-
шается, а при давлении ниже
0.03 атм. оно исчезает.
Общие закономерности в си-
стеме окисел железа—А12О3, изу-
ченной на воздухе и при 1 атм.
парциального давления кисло-
“С
2100
1900
Жидк.
1700
1500
1300
Рис. 257. Диаграмма состояния
в пределах тройной системы
FeO—Fe2O3—А12О3 (по Муану и
Ги).
Шпинель т.р.+ж КоР9н^ /
"Шпинель т.р./ т.р.+корукд т.р.
'Гетд‘т "'^/шпинель m.p.+Fe,OyAl,O. /
оттеши/ ] е о о о /
~ \ s'
—\ 's
vnum т.р.\ feJ3Al2O3*\
ЧзА1А корунд т.р. \ §
Fe2O3-Al2O3 9 \
Гематит т.р.+корунд т. р. \
1100 п
L_
0
20
гл
fe2O3-Al2O3 bU
Вес %
80 100
^2°3
Рис. 256. Диаграмма состояния систе-
мы окись железа—глинозем на возду-
хе, построенная Муаном [2].
рода в температурных пределах от 1085 до 1725°, по данным
Муана и Ги [3], представлены рис. 257. В качестве кристалли-
ческих фаз присутствуют: гематит с корундом в твердом рас-
творе; корунд с гематитом в твердом растворе; фаза 1:1 =
=Fe2O3-Al2O3 (т. р.); шпинельная фаза, являющаяся в основном
твердым раствором между магнетитом (FeO-Fe2O3) и герцинитом
Алюминатные системы
259
(FeO*Al2O3) с некоторым избытком Fe2O3 или А12О3, или того
и другого одновременно.
Система бинарна, если в качестве фаз присутствуют только
гематит (т. р.), корунд (т. р.) и Fe2O3-Al2O3 (т. р.). По мере воз-
С
1500
1300
Шпинель т.р. а
Шпинель т.р+
Гематитяи кПП1.ня т п .
гшпинель 7 KWHI! т-Р- i
т, Р- / /[Шпинельт.р
d +РегРз'^2^з
I ww
а । корунд т.р.
-g/1 ГеЛМ,
^1 Гематит т.р.
Ге203Щ,03(т.р.)
5
Шпинелыпру Шпин£мт.р.
s
то
[ Гематит т.р.+корунд т.р. '
то
. I Гематит т.р.+корунд т.р. \
I ।
°C
1500
Т------1----q------ь.
О 20 Fe^-Aipj 60
Рег°з Вес.%
в
Шпинель / Шпинель т.р.
т.р. / + к
/ корунд т.р.
80
_г
100
А1г03
О
Рег°з
°C
1500
го Ге^МШ, 60
6 0 6 0
Вес.°/о
г
80
- ^п^НрЛЬ / Шпинельт.р.
/ корунд т.р.
1300
ематит тр^-шпинель т.р.
/ ~I ‘J ci
IГематитт.р+Ге203Д1г03\ е
/ + корунд т.р. »/§
I . ’ S&
1300
/Гематит т.р.+
шпинель т.р.
1100
I § Гематит тр+корундт.р.1
1| '
Г<5
1-----1---q-----1_
О 20 Fe,ОМ, 60
С Л 6 v 6 J
Fee°3 Вес.%
_____Т
80 100
м2о3
то
I
.4
е
1 §
। §
I?.
Гематит т.р.
корунд т.р.
о го
Рег°з
т 60
Вес.%
_г
100
ЩЬ
______т
80 100
А1^)3
I е
Рис. 258. Влияние изменения парциального давления кислорода
на равновесие в субсолидусных областях части системы Fe—Al—О.
растания температуры достигается точка, в которой окись железа
начинает диссоциировать на закись железа и кислород с одно-
временным образованием шпинельной фазы дополнительно к дру-
гим присутствующим фазам. Для чистого Fe2O3 эта диссоциация
17*
260
Алюминатные системы
происходит при 1390° на воздухе и при 1455° при 1 атм. давления
кислорода; температура разложения медленно понижается по
мере добавки А12О3. Фаза 1 : 1 разлагается на шпинель (т. р.)
и корунд (т. р.) при 1410° на воздухе и при 1490° при 1 атм. давле-
ния кислорода. Конечный член — окисел железа плавится при
1594°, а А12О3 — примерно при 2050°.
Литература
1. Muan A., Journ. Amer. Ceram. Soc., 40, № 4, 121, 1957.
2. Muan A., Amer. Journ. Sci., 256, № 6, 413, 1958.
3, Muan A., C. L. Ge e, Journ. Amer. Ceram. Soc., 39, № 6, 207, 1956.
CoO—A12Oj
Изучена в субсолидусной области Шмальцридом [1], произ-
водившим обжиг смесей при 1400°. Обнаружено одно соедине-
Рис. 259. Диаграмма со-
стояния системы СоО—
—А13О3 в субсолидусной
области.
ние — СоА12О4. Эта шпинель растворяет значительное количество
А12О3, но СоО в шпинели не растворяется (рис. 259). Ширина
области твердых растворов шпинели почти не зависит от темпе-
ратуры.
Литература
1. Schmalzried Н., Zs. phys. Chem., N. F., 28, № 3—4, 203, 1961,
NiO—Al2O3
Изучалась Вартенбергом и Ройшем [6], Иида [1], Филлипсом,
Хэтта и Варшау [3] и Лежу [2].
Установлено существование одного соединения со структурой
шпинели — NiAl2O4. Изучение системы затрудняется летучестью
Алюминатные системы
261
NiO. По ориентировочным определениям Филлипса с сотруд-
никами, температура плавления NiAl2O4 составляет 2110°. Это сое-
динение образует твердые растворы с глиноземом (рис. 260).
Согласно Филлипсу с сотрудниками, область однородности
никелевой шпинели простирается при 1800° от 50 до 65
мол. % А12О3. Растворения NiO в шпинели обнаружено не
было.
Лежу более детально изучил образование твердых растворов
между NiAl2O4 и А12О3, обозначенных им как фаза у. При темпе-
ратурах ниже 1300° содержа-
ние А12О3 в виде твердого рас-
твора незначительно. Но начи-
ная от этой температуры оно
быстро возрастает, и к моменту
плавления в предельном твер-
дом растворе содержится вы-
ше 80 мол.% А12О3 (рис. 261).
Лежу считает, что при раство-
рении глинозема в шпинели
происходит образование дефек-
тов (пустот) в решетке кати-
онов, так как три иона никеля
замещаются двумя ионами алю-
миния: 3Nia+ -> 2А13++ □ . Из-
менение параметра решетки
твердого раствора приведено в
таблице и представлено на
рис. 262.
’С
2100
Жидк. Никел. шпинель
1800
. NiO+Ж /Никел.
/ шпинель
\ \/ +ж
'N10 т.р.
1700
Nio т.р.+никел.
шпинель
1500 |
о
NiO
го
д /
А/ * •
I
I Никел.шпинель
I» корунд
Iе
I ®
NlO-AlzO3 ВО 80 100
Мол. °/о А1г03
al о 2 *3 х N + 5 лН
+Ж>
у
а
А
1
е
Лежу получил высокогли-
ноземистую фазу, для которой
дает приблизительную 'формулу
NiO-13Al2O3. Это соединение
относится к типу, называемому
обычно ^-глиноземом. Лежу
обозначает это соединение как
фазу с индексом 8. Фаза 8 имеет
Рис. 260. Диаграмма состояния си-
стемы NiO—А12О3 (по Филлипсу
с сотрудниками).
Метод закалки: 1 — NIO, в — корунд,
3 — никелевая шпинель; опыты в каскад-
ной печи: 4 — только жидкость, s —
только твердое тело, 6 — никелевая шпи-
нель.
ограниченную область однородности-и устойчива только вблизи
линии ликвидуса, т. е. около 2000°. Фаза 8 имеет тетрагональную
сингонию со следующими параметрами кристаллической ре-
шетки: а=7.958, с=11.768 А.
Лежу описывает промежуточную, метастабильную фазу <р,
которая образуется в условиях распада шпинельных твердых
растворов или фазы у при температуре 1000—1200°. Окись алю-
миния в небольшом количестве, согласно данным Филлипса,
растворяется в NiO.
262
Алюминатные системы
Параметр кристаллической решетки
предельных твердых растворов А12О3 и NiAl2O4
Температура, °C Содержание А120з, мол. % Формула предельного твердого раствора Параметр решетки, А
1000 50 NiAl2O4 8.043
1300 52 Ni0.94AJ2.04D0.02O4 '8.038
1450 56 Nio.83Al2.11 D0.06O4 8.019
1600 60 N i 0.72AI 2.19D 0.09О4 8.004
1900 80 Ni0.30AJ2.40D0.24O4 7.956
Шмальцрид [5 ] изучил субсолидусную область системы (об-
жиг до 1500°). Обнаружена значительная растворимость А12О3
1000
О 25 50 75 ЮО
№ Мол.°!о Nlz03
Рис. 261. Диаграмма состояния
системы NiO—А12Оа (по Лежу).
а—а-А12Оа; фазы у и 6 объясняются
в тексте.
Рис. 262. Изменение параметра
кристаллической решетки твер-
дого раствора глинозема в нике-
левой шпинели.
в шпинели NiAl2O4 (рис. 263). С увеличением содержания А1аО3
в твердом растворе параметр решетки уменьшается.
Рис. 263. Диаграмма со-
стояния системы NiO—
—А12О3 в субсолидусной об-
ласти (по Шмальцриду).
Алюминатные системы
263
Ромейн [4] в результате рентгенографических исследований
нашел, что NiAl2O4 представляет смешанную шпинель, в которой
Ni и А1 имеют как четверную, так и шестерную координацию:
[Nio.25Alo.75 ]4 lNi0^jAlj 25 ]6О4.
Литература
1. lida Y., Journ. Japan. Soc. Powder Met., 6, № 2, 55, 1959.
2. J e j u s A. M., Rev. Haut. Temper, et Refract., 1, № 1, 53, 1964.
3 P h i 11 i p s B., J. J. H u 11 a, I. W a r s h a w, Journ. Amer. Ceram.
Soc., 46, № 12, 579, 1963.
4. R о m e i j n F. C. Physical and crystallographical properties of some
spinels. Leyden, 1953.
5. Schmalzried H., Zs. phys. Chem., N. F., 28, № 3—4, 203, 1961.
6. Wartenberg H., H. J. Reusch, Zs. anorgan. allgem. Chem.,
207, № 1, 1, 1932.
ГАЛЛАТНЫЕ СИСТЕМЫ
Li2O—Ga2O3
Полностью система не изучена. Марецио и Ремейка [1] полу-
чили соединение LiGaO2, которое существует в двух полиморфных
формах. При нормальных температурах и давлении LiGaO2
относится к ромбической сингонии с вюрцитоподобной структу-
рой, пространственная группа Рпа2г, параметры элементарной
ячейки: а=5.402, 6=6.372, с=5.007 А. Элементарная ячейка
содержит четыре формульные единицы; вычисленная плотность
4.187 г/см8.
При давлении 30 кбар и температуре 850° была получена но-
вая тяжелая модификация LiGaO2 с плотностью (вычисленной)
5.09^ г/см8. Плотная модификация LiGaO2 относится к триклин-
ной сингонии. Пространственная группа R3m, в гексагональной
ячейке содержится три формульные единицы; параметры элемен-
тарной ячейки: а=2.9113+0.003, с=14.466 +0.001 А. Это сое-
динение имеет структуру хлористого натрия и изоструктурно
с NaHF2.
Литература
1. М area io М., J. Р. R е m е i k a, Journ. Phys. Chem. Solids, 26, № 8,
1277, 1965.
MgO—Ga2O3
В субсолидусной области изучена Шмальцридом [1] (обжиг
до 1450°). Фазы определялись рентгенографическим методом.
Установлено образование одного соединения — шпинели
MgGa2O4 — и твердых растворов на ее основе. В шпинели раство-
Галлатные системы
265
ряется значительное количество Ga2O3 и лишь 1—2% MgO
(рис. 264). С увеличением содержания Ga2O3 в шпинели изменение
параметра решетки становится все менее заметным.
Литература
1. Schmalzried H.t Zs. phys. Chem., N. F., 28,'№ 3—4,203, 1961.
СаО—Ga2O3
Фазовые отношения в системе интересны в свете сопоставле-
ния их с таковыми в системе СаО—А12О3.
Система (рис. 265), изученная Дживаратнамом и Глассером [1],
характеризуется наличием трех соединений, трех эвтектик и
одной перитектики.
Оптические свойства галлатов кальция
ЗСаО - Ga2O3 m-СаО • Ga2O3 СаО • Ga,O31 СаО • Ga2O8 II СаО 2Ga,O3
Внешний ВИД . . . Небольшие Таблички Таблички Пластинча- Небольшие
неправиль- или пла- или пла- тые крис- призмати-
ные зерна. стинки. СТИНКИ. таллы с па- ческие кри-
Np (Na) . . 1.765 ±0.005 1.751 +0.005 —1.778 р аллельным погасанием. >1.778 сталлы. 1.741+0.005
У? (Na) . . >1.778 1.778 ±0.005 >1.778 —1.778 1.778+0.005
Двупрелом- ление . . Умеренно Умеренно Умеренное. Умеренное. Умеренно
Оптический характер низкое. Двуосныи. высокое. Двуосный. Двуосный. Двуосный. высокое. Двуосный.
266
Галлатные системы
Соединение 3CaO-Ga2O3 плавится инконгруэнтно с разложе-
нием на СаО и жидкость при 1263°; соединения СаО -Ga2O3 и
СаО -2Ga2O3 плавятся конгруэнтно при 1369 и 1504° соответ-
ственно.
Эвтектика между 3:1 и 1:1 содержит 37.5 мол. % Ga2O3
и температуру 1245°; эвтектика между 1 :1 и 1 :2 — 57.0 мол. %
СаО
Мол.%
Щз
Рис. 265. Диаграмма состояния системы СаО—Ga2O3.
Ga2O3 и 1323°; эвтектика между 1 : 2 и p-Ga2O3 — 68.0 мол. %
и 1457°.
Соединение СаО -Оа2Оз встречается в трех модификациях:
1) wi-CaO"Ga2O3 (m — метастабильная фаза); 2)CaO-Ga2O3I—
орторомбическая решетка, а=5.13 +0.002, 6=6.21+0.02,
с=9.09 +0.04 а. и.; 3) CaO-Ga2O3 II — орторомбическая решетка,
а=5.32+0.02, Ь= 14.32 +0.07, с=16.81+0.08 а. и. Поля устой-
чивости этих трех модификаций не выяснены.
Литература
1. J ее v а га t n am J.,
44, № 11, 563, 1961.
F. Р. Glasser, Journ. Amer. Ceram. Soc.,
Галлатные системы
267
ZnO—Ga 2О з
Диаграмма состояния системы не построена. Чимино, Марецио
и Санторо [1] показали, что некоторое количество Ga2O3 входит
в решетку окиси цинка, изменяя при этом параметры элементар-
ной ячейки последнего. Соответствующие данные приведены
в таблице.
Изменение параметров
элементарной ячейки окиси цинка а и с
при образовании твердого раствора
в системе ZnO—Ga2O3
Сг&зОз) атомн. % Темпера- тура обжига, °C а, кХ с, кХ
Нет. 900 3.24314 5.1946а
» 1000 3.24324 5.19535
1150 3.24345 5.1956а
1.00 1000 3.2433э 5.1954а
1.00 1180 3.24380 5.1946»
1.00 1250 3.2437, 5.1945в
Литература
1. Cimino А., М. Marezio, A. Santoro, Naturwissensch., 44,
№ 12, 348, 1957.
8с20з—Ga2O3 ’
Изучена Шнейдером и Уорингом [2] методом закалки. В си-
стеме обнаружены значительные области твердых растворов и
химическое соединение предполагаемого состава 6Sc2O3-5Ga2O3.
Кроме твердых растворов, образующихся в результате раство-
рения Sc2O3 в Ga2O3 (Ga2O3 т. р.) и Ga2O3 Sc2O3 (Sc2O3 т. р.),
установлен особый твердый раствор — U т. р., пределы существо-
вания которого ограничены содержанием от 55 до 73 мол. % Ga2O3
(рис. 266).
Соединение 6Sc2O3-5Ga2O3 устойчиво в узком интервале тем-
ператур: от 1700 до 1770°, когда оно плавится с разложением
на Sc2O3 и жидкость. Ниже 1700° соединение 6Sc2O3-5Ga2O3
Распадается, образуя смесь твердого раствора на основе Sc2O3
' Сг93 т- ₽•) и указанного выше твердого раствора U т. р.
Фаза U также стабильна только в определенной температур-
ой области, причем область стабильности уменьшается с пони-
268
Галлатные системы
жением температуры. Ниже 1445° твердого раствора U уже не су-
ществует и в системе присутствуют только твердые растворы:
Sc2O3 т. р. и Ga2O3 т. р.
Твердый раствор Ga2O3 в Sc2O3 содержит от 0 до 21 мол. %
Ga2O3 при температуре солидуса. Этот твердый раствор имеет
структуру типа С (тип Т12О3), характерную для окислов редко-
земельных элементов. При 1300° содержание Ga2O3 в твердом
растворе составляет ~15 мол.%.
Рис. 266. Диаграмма состояния системы Sc2O3—Ga2O3
Твердый раствор Sc2O3 в Ga2O3 на линии солидуса распростра-
няется от 0 до 18 мол. % Sc2O3. Этот твердый раствор имеет струк-
туру типа p-Ga2O3. В отличие от других твердых растворов
в системе концентрационная область Ga2O3 т. р. расширяется
с понижением температуры, и при 1405° в твердом растворе со-
держится 44 мол. % Sc2O3.
Шнейдер и Уоринг пытались тщательно определить темпера-
туру плавления окиси галлия и нашли ее равной 1795+15°.
Окись скандия не плавилась даже при 2405°.
Эвтектика между U т. р. и Ga2O3 т. р. имеет температуру пла-
вления 1705°.
Соединение 6Sc2O3-5Ga2O3 имеет орторомбическую структуру
с параметрами кристаллической решетки: а=13.85, &=9.08
Галлатные системы
269
и с=9.58 А. Шнейдер и Уоринг предполагают, что U т. р. имеет
структуру типа каппа-глинозема.
Вхождение Sc2O3 в решетку окиси галлия вызывает сильное
изменение параметров элементарной ячейки Ga2O3. Так, для чи-
стого Ga2O3: а=12.23, &=3.04, с=5.80 А, (3=103.9° [1]; для твер-
дого раствора с содержанием 44 мол. % Sc2O3: а= 12.70, &=3.16,
с=5.92 А, р=102°18'.
Литература
1. GellerS., Journ. Chem. Phys., 33, № 3, 676, 1960.
2. SchneiderS. J., J. L. Waring, Journ. Res. Nat. Bur. Stand.,
67A, № 1, 19, 1963.
ИНДАТНЫЕ СИСТЕМЫ
ВеО— 1п2О3
Интересна с точки зрения возможности образования индатов —
соединений 1п2О3 с другими окислами и их тормозящего дей-
ствия на процесс кристаллизации окислов бериллия и индия.
Энслин и Валентинер [1] изучали индаты кальция, стронция,
цинка, меди, марганца, бериллия и др. Уатт и Миллиган [2]
Фазовый состав обожженных смесей 1п2О3 и ВеО
по Уатту я Миллигану [2]
ТПаОз ВеО Температура обжига образцов, °C
МОЛ % 400 и 500 600 700 и 800
100 0 Кубическая решетка Кубическая решетка 1п2О3. Кубическая ре- шетка 1п2О3.
90 10 То же. То же. То же.
80 20 Рентгеноаморфный. » » » »
70 30 Кубическая решетка 1П2^3" » » » »
60 40 Рентгеноаморфпый. » » » )>
50 50 » Рентгеноаморфный. » »
40 60 » » » »
30 70 » Кристаллический. » »
20 80 » » »
10 90 » Рентгеноаморфпый. » »
0 100 Гексагональная решетка ВеО. » »
также исследовали рентгенографически фазовый состав продук-
тов совместного нагревания гелей окиси индия и окиси бериллия.
Результаты их исследования сведены нами в таблицу.
Из таблицы видно, что в интервале 400—600° ряд составов
смесей 1п2О3 и ВеО является рентгеноаморфным, а часть из них
имеет кубическую решетку 1п2О3 без появления линий новых
Индатные системы
271
соединений. Отсюда авторы заключают о наличии твердых рас-
творов ВеО в 1п2О3. Так как сдвиги линий на рентгенограммах
по мере увеличения в образцах количества ВеО были очень не-
значительными, можно предположить внедрение ионов бериллия,
имеющих малый радиус, в пустоты между крупными ионами
индия и кислорода. Данные Уатта и Миллигана в общем согла-
суются с данными Энслина и Валентинера.
Литература
1. Е n s s 1 i n F., S. Valent iner, Zs. Naturforsch., 2b, № 1/2, 5, 1947.
2. Watt L. M., W. О. M i 11 i g a n, Journ. Phys. Chem., 57, № 9, 883,
1953.
ZnO—In2O3
Представляет интерес для гидрометаллургии цинка.
Изучалась Энслином и Валентинером [2], Чалым и Ро-
женко [1].
Энслин и Валентинер исследовали два препарата — 2ZnO Лп2О3
и ZnO • 1п2О3, из которых последний похож на ВеО • 1п2О3 и является
твердым раствором окислов. Однако Чалый и Роженко, изучив
рентгенографическим способом девять образцов с различным
соотношением ZnO к 1п2О3, показали, что индат цинка ZnIn2O4
в системе не образуется и что область твердых растворов окиси
цинка в окиси индия ограничивается содержанием 8.90 вес.%
ZnO. Различную растворимость ZnO и ВеО в решетке 1п2О3
(имеющей свободные положения, так как вокруг атома индия
атомы кислорода расположены только в 6 из 8 вершин искажен-
ного куба) авторы объясняют большим различием в величине
ионных радиусов (Ве2+—0.34, Zn?+—0.83 А).
Каспер [3], производя обжиг смесей окислов в температурном
интервале 1050—1550°, получил пять соединений: Zn2In2O8,
Zn3In2Oe, Zn4In2O,, Zn8In2O8 и Zn,In2O10. Соединения типа шпи-
нели ZnIn2O4 синтезировать не удалось. Полученные индаты
цинка могут быть выражены общей формулой ZnftIn2Oft+3, где
- 2, 3, 4, 5 и 7. Кристаллы Zn2In2O8 и Zn4In2O, относятся к гекса-
гональной системе, остальные — к ромбоэдрической; параметры
элементарных ячеек и плотность имели следующие значения.
Z1'2ln2O8: а0=3.376+0.001, со=23.154+О.О1 A; Zn3In2Oe:
а -3.355 +0.001, со=42.515+О.О2 A, d=6.226 г/см3; Zn4In2O,:
«о--=3.339+О.ОО2, со=33.52+О.О2 A, d=6.123 г/см3; Zn8In2O8:
«о=-3.313+0.001, со=73.62+О.О4 A, d=5.986 г/см3.
272
Индатные системы
Литература
1. Чалый В. П., С. П. Р о ж е н к о, ДАН СССР, 108, № 6, 1106, 1956.
2. Е n s s 1 i n F., S. W а 1 е n t i п е г, Zs. Naturforsch., 2b, № 1/2, 5, 1947.
3. Kasper H., Zs. anorgan. allgem. Chem., 349, № 3—4, 113, 1967.
ScgOg— In2O3
Образование твердых растворов в системе отмечалось уже
Гольдшмидтом [1]. Полученные им кристаллы содержали
66.8 мол. % Sc2O3 и относились к С-типу (тип Т12О3) с параметром
элементарной ячейки а=9.90 А.
да/
5 ™
9.9
3.71------1-----1-----1-----1------1
0 20 90 60 80 100
1пг03 Мол. % 5сг03
Рис. 267. Параметр элементарной
ячейки твердых растворов систе-
мы Ir^Og—Sc2O3.
Исследование Шнейдера, Рота и Уоринга [3] ограничивалось
получением твердого раствора, содержащего 50:50 мол.%,
относящегося также к типу С.
Петру, Хайек, Калалова и Долежалова [2] полностью иссле-
довали систему Sc2O3—In2O3, получая образцы обжигом соо-
сажденных гелей при 920—940°. Обнаружен непрерывный ряд
твердых растворов при линейном изменении параметра [(рис. 267).
Решетка твердого раствора относится к типу Т12О3.
Литература
1. Goldschmidt V. М., Т. Barth, G. Lunde, Norske Videns-
kaps Akad. Oslo, 1, Matem.-Naturvid. Klasse, № 7, 5, 1925.
2. P e t r u F., В. H a j e k, E. К a 1 a 1 о v a, J. D о 1 e z a 1 о v a, Zs.
Chem., 6, № 5, 190, 1966. '
’З. Schneider S. J., R. S. В о t h, J. L. Waring, Journ. Res. Nat.
Bur. Stand., 65A, № 4, 345, 1961.
Индатные системы
273
Eu20g— In2O3
Система изучена Шнейдером [2] методом закалки. Смеси окис-
лов плавилиы/в иридиевом тигле ,*нагреваемом£в индукционной
печи.
Шнейдер утверждает, что в системе имеется соединение
Eu2O3-In4O3, которое плавится конгруэнтно при 1745 + 10°.
Это соединение, являющееся членом в непрерывной серии твер-
дых растворов, следует рассматривать как бертоллид (по Кур-
никову ([1]).
°C
Г-1
Мол. °/о
1пА
Рис. 268. Диаграмма состояния системы Еи2О3—1п2С^.
1 : 1 — соединение Eu1o1-In,o1; В т. р.— твердый раствор типа В
на основе Eu,Oa; С т. р.— твердый раствор типа С на основе In,Oi.
Соединение Eu2O3-In2O3 образует твердые растворы как
с Еп2О3, так и с 1п2О3. В общем область твердых растворов
на основе Eu2O3-In2O3 распространяется от 31 до 71 мол.%
1п2О3 (рис. 268). Шнейдер отмечает различие некоторых свойств
в двух сериях твердых растворов Eu2O3-In2O3—Eu2O3 и
Eu2O3-In2O3—In2O3 и вводит различные обозначения: 1 :1 т. р. (I)
и 1 : 1 т. р. (II). Соединение Еи2О3Лп2О3'индицировано на ос-
нове псевдогексагональной ячейки с параметрами а=3.69 и
с=12.38 А. В системах Gd2O3—1п2О3 и Dy2O3—1п2О3 также обна-
ружены соединения, изоструктурные с соединением Eu2O3-In2O3.
Твердый раствор окиси индия в окиси европия имеет предель-
18 Н. А. Торопов и др., кн. 1
274
Индатные системы
ную концентрацию около 27 мол.% 1п2О3. Этот твердый раствор
имеет структуру типа В, характерную для окислов редкоземель-
ных элементов. Твердый раствор на основе 1п2О3 имеет кубическую
структуру типа С. Указанная на диаграмме эвтектика содержит
73 мол.% 1п203 и плавится при 1730°.
Согласно специальным определениям Шнейдера, температура
плавления Еп2О3 равна 2240+10°, а 1п2О3 1900+10°.
Литература
1. Курнаков Н. С. Введение в физико-химический анализ. 3-е изд.,
Химтеорет, Л., 54, 1936.
2. SchneiderS. J., Journ. Res. Nat. Bur. Stand., 65A, № 5, 429, 1961.
СИСТЕМЫ С ОКИСЛАМИ
РЕДКОЗЕМЕЛЬНЫХ ЭЛЕМЕНТОВ
Для современной стадии физико-химического изучения высо-
котемпературных окисных систем особенно характерен большой
интерес к тем из них, которые содержат окислы редкоземельных
элементов. Выше уже были приведены диаграммы состояния би-
нарных силикатных систем, содержащих окислы редкоземельных
элементов, детально впервые изученных в лаборатории гетероген-
ных равновесий Института химии силикатов им. И. В. Гребенщикова.
В конце раздела (табл. 1 и 2) приводятся результаты предваритель-
ных ориентировочных опытов по изучению продуктов взаимодей-
ствия в бинарных системах, образованных либо двумя редкоземель-
ными окислами, либо одним из редкоземельных с некоторыми из оки-
слов трехвалентных элементов (А12О3, Ga2O3, Сг2О3, Fe2O3, ScaO^
ТпгОз). Эти работы были проведены Ротом с сотрудниками в Бюро
стандартов в Вашингтоне, а также некоторыми другими авторами.
При более детальном исследовании этих же систем в диаграмму
их состояния внесен ряд существенных поправок. В этом можно
убедиться при сравнении результатов работ Шнейдера, Рота и
Уоринга, с одной стороны, и Торопова и Васильевой — с другой,
ио системе окись скандия—глинозем.
MgO— Sc2O3
Изучена Тресвятским, Лопато и Яременко [1]. Авторы при-
меняли метод «отжига и закалки». Кроме того, для более деталь-
ного изучения обнаруженных твердых растворов последние полу-
чались спеканием при 2120°.
Диаграмма состояния системы MgO—Sc2O3 относится к эвтек-
тическим с ограниченной растворимостью компонентов в твердой
фазе. В системе образуются твердые растворы двух типов: на основе
окиси магния и на основе окиси скандия (рис. 269).
18*
276
Системы с окислами редкоземельных элементов
Рис. 269. Диаграмма состояния
системы MgO—Sc2O3.
Предельная растворимость окиси магния в окиси скандия
составляет 30 мол. %. Параметр элементарной ячейки изменяется
от а=9.846 А (для чистой окиси скандия) до а=9.841 А (для пре-
дельного твердого раствора). Пре-
дельная растворимость окиси скан-
дия в окиси магния, составляет
10 мол.%. Параметр элементарной
ячейки изменяется от значения
а=4.212 А (для чистой окиси
магния) до а=4.225 А (для
твердого раствора, содержащего
10 мол.% Sc2O3). Обнаруженные
твердые растворы относятся к
типу дефектных структур.
Эвтектика содержит 54 мол.%
окиси магния и имеет темпера-
туру плавления 2150+30°. По-
казатели светопреломления твер-
дых растворов изменяются в сле-
дующих /пределах: от 1.737 для
чистой MgO до 1.780 для состава,
содержащего 10 мол. % Sc2O3; от
1.99 для чистой Sc2O3 до 1.96
для состава, содержащего 30 мол. %
MgO (вероятно, эта величина
должна иметь меньшее значение).
Мюллер-Бушбаум [2] получил монокристаллы MgSc2O4, от-
носящиеся к ромбической симметрии с пространственной груп-
пой Л2Лв—Рпат и параметрами элементарной ячейки: а=9.51,
6=10.83, с=3.11 А.
Литература
1. С. Г. Т р е с в я т с к и й, Л. jM. !Л о п а т о, 3. А. Я р е и е и к о,
Порошков, металлургия; 4, № 1, 29, 1964.
2. Miiller-Buschbaum Н., Zs. anorgan. allgem. Chem., 343, № 3—4,
113, 1966.
СаО—-Sc2O8
Тшебятовский и Хорынь [1] выяснили фазовые отношения
в системе. Применялась печь с вольфрамовой трубкой. Устано-
влено образование соединения CaSc2O4, плавящегося при 2110°.
Эвтектики имеют состав: 57.0 (с температурой плавления 1960°)
и 73.5 мол.% ScO18 (с температурой плавления 2015°). В резуль-
Системы с окислами редкоземельных элементов
277
тате определений параметра элементарной ячейки была обнаружена
растворимость ScC^ в в СаО и СаО в ScO4 3, составляющая 3.0
и 0.7 мол. % ScO1S соответственно при 1050 и 1730° и 3.1 и
3.0 мол. % СаО соответственно при 1050 и 1730° (рис. 270).
Растворимости СаО и Sc2O3 в соединении CaSc2O4 обнаружено
не было. Соединение CaSc2O4 относится к ромбической сингонии
с параметрами элементарной ячейки: а=9.481, Ъ=11.12, с=3.152 А.
Пикнометрическая плотность 3.82 г/см3, пространственная группа
D^—Pnam.
Литература
1. Т г z ebiatowski W., R. Н о г у n, Bull. Acad. Polon. Sci., ser.
sci. chim., 13,№ 5, 315, 1965.
Y2O3— Sc2O3
В системе имеется соединение YScO3 типа перовскита и непре-
рывный ряд твердых растворов от Y2O3 до Sc2O3. Монокристаллы
YScO3 получал Р.емейка [3], используя раствор соответствующих
смесей окислов в расплавленной окиси свинца (РЬО). Плавление
осуществлялось при 1300°, кристаллизация при 850°. Геллер [2],
первый изучивший структуру указанного соединения (на моно-
кристаллах), приписал ему перовскитовую структуру с ромби-
ческой сингонией. Параметры элементарной ячейки: а=5.431,
^=5.712, с= 7.894 A; Z=4, плотность 8.94 г/см3. Тшебятовский
278
Системы с окислами редкоземельных элементов
Рис. 271. Диаграмма состояния си-
стемы Y2O3—Sc2O3.
и Хорынь [5] приводят такие величины: а=5.451, 6=5.718,
с=7.909 А; пространственная группа Z>2Aie—Pbnm.
Шнейдер с сотрудниками [4] полагают, что YScO3 существует
как метастабильное соединение, образующееся нагреванием смеси
1 : 1 при 1650°. При 1900° существуют только твердые растворы.
Тшебятовский и Хорынь получали соединение YScO3 в смеси
с твердым раствором обжигом образцов с 40—60 мол. % Y2O3
при 900—1730°. Это соедине-
ние, устойчивое ниже 1730°,
должно рассматриваться как
метастабильное.
Савицкая, Гуревич, Ка-
лабукова и Ситникова [1 ] по-
лучали твердые растворы
методом термического разло-
жения соосажденных окса-
латов иттрия и скандия.
Твердые растворы образуют-
ся при 650—700° за 1—1.5
часа. При методе непосред-
ственного спекания окислов
образование твердых раст-
воров протекает при температурах порядка 1400—1500° и тре-
бует 35—40 час. Твердые растворы относятся к типу Мп2О3;
параметр элементарной ячейки приблизительно изменяется по
закону Вегарда от а=10.61 кХ (для чистой окиси иттрия) до
а=9.85 кХ (для чистой окиси скандия).
Тшебятовский и Хорынь построили диаграмму плавкости си-
стемы, пользуясь печью с вольфрамовой трубкой. Образовавшиеся
фазы изучались после длительного отжига при различных темпе-
ратурах (в пределах от 1900 до 900°) и идентифицировались рентге-
нографически. На кривой плавкости имеется минимум с темпера-
турой 2100° и содержанием 45 мол. % Y2O3 (рис. 271).
Литература
1. С а в и ц к а я Я. С., М. А. Гуревич, С. В. К а л а б у х о в а,
С. И. Ситникова, Журн. неорг. хим., 5, № 10, 2300, 1960.
2. G е 11 е г S., Acta crystallogr., 10, № 4, 243, 1957.
3. Remeika J. P., Joum. Amer. Chem. Soc., 78, № 17, 4259, 1956.
4. S c h n e i d e r S. J., R. S. R о t h, J. L. W a r i n g, Journ. Res. Nat.
Bur. Stand., 65A, № 4, 345, 1961.
5, Trzebiatowski W., R. H о г у n, Bull. Acad. Polon. Sci., ser.
sci. chim., 13, № 5, 311, 1965.
Системы с окислами редкоземельных элементов
279
ВвО—Y20g
Изучали Олдс и Отто [1 ]. Химических соединений не полу-
чено. Обнаружена широкая область твердых растворов на ос-
нове Y2O3 и узкая область на основе ВеО (рис. 272).
Рис. 272. Диаграмма состояния
системы ВеО—Y2O3.
Литература
1. О 1 d s L. Е., Н. Е. О 11 о, in: Е. М. L е v i п, С. R. R о b b i n s,
Н. F. McMurdie. Phase diagrams for ceramists. U. S. A., Columbus,
p. 100, fig. 220, 1964.
MgO—Y2O3
Систему изучали Лопато и Тресвятский [1] и Отто [2]. Со-
гласно первым авторам, использовавшим метод «отжига и за-
калки», система относится к простым эвтектическим (рис. 273).
Эвтектика содержит 52 мол.% MgO и имеет температуру плавле-
ния 2080 + 30°. Твердые растворы не обнаружены.
280
Системы с окислами редкоземельных элементов
Отто [2] указывает на соединения 3MgO-Y2O3 и узкую об-
ласть твердых растворов на основе MgO (рис. 274).
Рис. 273. Диаграмма состояния
системы MgO—Y8O3 (по Лопато
я Тресвятскому).
Рис. 274. Диаграмма со-
стояния системы
MgO—Y2O3 (по Отто).
Литература
1. Лопато Л. М., С. Г. Тресвятский, Порошков, металлургия,
3, № 6, 32, 1963.
2. О 11 о Н. Е., in: Е. М. L е v i n, С. R. R о b b i n s, H. F. M с M u r-
d i e. Phase diagrams for ceramists. U. S. A., Columbus, p. Ill, fig. 263,
1964.
SrO— Y2O3
Шварц и Боммерт [1], обжигая смесь окислов при 100—1300°,
получили соединение SrY2O4 с ромбической структурой типа
CaFe2O4 и параметрами элементарной ячейки: я0= 10.071,
&о=И.914, со=3.4О9 А.
Литература
1. Schwarz Н., D. В о m m е г t, Zs. Naturforsch., 196, № 10, 955, 1964.
Системы с окислами редкоземельных элементов
281
ВаО— Y 2О3
Шварц и Боммерт [1], обжигая смесь окислов при 1000—1300°,
получили соединение BaY2O4 ромбической сингонии, со структу-
рой типа CaFe2O4 и параметрами элементарной ячейки: я0=10.415,
до=12.12О, с0=3.455 А.
Литература
1. Schwarz Н., D. Bommert, Zs. Naturforsch., 196, № 10, 955, 1964.
Tb20g—Y2O3
В связи с тем, что тербий образует с кислородом ряд окислов
(по Бэнцигеру с сотрудниками [1], ТЬО4 Б00, ТЬО4 715, ТЬО181,
ТЬО183 и ТЬО2 0), здесь наряду с собственно системой ТЬО4 Б—
—YOj 5 следует рассматривать также более общую систему ТЬОХ—
—Y2O3. Обе эти системы изучали Вольф и Шваб [2]. Первая изу-
Рис. 275. Параметр элемен-
тарных ячеек твердых раство-
ров систем Tb2O3—Y2O3 (верх-
няя кривая) и ТЪОХ—У2О3
(нижняя кривая).
Рис. 276. Содержание кисло-
рода в окислах системы ТЪОХ—
-Y2O3.
Верхняя кривая—величинах в ТЬОх,
нижняя кривая— значение х' в РЗО#.
чалась в восстановительных условиях, вторая — в окислитель-
ных. Обжиги смесей окислов производились при 1200—1300°.
В системе ТЬО4 Б—YO4 8 образуется непрерывный ряд твердых
растворов, причем параметр кубической (С-форма) элементарной
ячейки закономерно изменяется в соответствии с законом Ве-
гарда (рис. 275, сплошная прямая линия).
В системе ТЬО^.—YO4 в наряду с кубическими твердыми рас-
творами (С-форма) образуются твердые растворы, переходные
между С-формой и флюоритовой формой (обозначаются С—Т).
282
Системы с окислами редкоземельных элементов
Кроме того, в области, примыкающей к окиси тербия, по-види-
мому, образуется ромбоэдрический (слабо деформированный ку-
бический) твердый раствор, характерный для фазы ТЬО1716.
Переходная фаза C—F обнаруживается при содержании
42.5 атомн. % ТЬ; фаза R замечена при содержании 80 атомн. % ТЬ.
Концентрационное изменение параметра элементарной ячейки
твердых растворов системы TbOj.—YOt Б показано на рис. 275.
На рис. 276 приведен полученный в результате аналитиче-
ских определений индекс при кислороде, связанном с тербием (х),
и при кислороде общей формулы РЗО^, где РЗ — весь (и тербий,
и иттрий) редкоземельный элемент, входящий в данный состав
твердого раствора.
Литература
1. Baenziger N. С., Н. A. Eick, Н. S. S с h а 1 d t, L. Е у г i n g,
Journ. Amer. Chem. Soc., 83, № 10, 2219, 1961.
2. W о 1 f L., H. Schwab, Journ. Prakt. Chem., 4 Reihe, 24, № 5—6,
293, 1964.
BeO— L&2^s
Содержит композиции, интересные для получения новых
керамических материалов.
Вейр и Валькенбург [4 ] путем плавления в дуге и проведения
реакции в твердом состоянии (1300°) получали кристаллический
продукт, которому предположительно приписали формулу
°C
0 5 10 15 20 25
Вес.°/о
ВеО
Рис. 277. Диаграмма состояния системы ВеО—LaaO3
(по Ориолю и Вурму).
Системы с окислами редкоземельных элементов
283
2BeO-La2O3. Кристаллы были двуосными с 27^90°; JVg«2.047,
Ур=1.995.
Систему изучали Ориоль и Вурм [1 ] в концентрационной
области от чистого Ьа2О3 до 20 вес. % ВеО. Получено два соеди-
Рис. 278. Фазовая диаграмма системы ВеО—La2O3
(по Ку Чу-кун я Ян Дун-сын).
LB^—L&2O3 *2ВеО; L^Bs-—3L&3O3 *2BeO«
нения — ВеО-Ьа2О3 и 2BeO-La2O3, плавящихся инконгруэнтно
(рис. 277).
Систему изучали также Ку Чу-кун и Ян Дун-сын [2, 3] мето-
дом «отжига и закалки». Установлено существование двух соеди-
нений: 2BeO-La2O3 с температурой плавления 1361+3°
и 2ВеО-ЗЬа2О3, плавящегося инконгруэнтно при 1510+10°
(рис. 278). Соединение 2ВеО-ЗЬа2О3 образует твердый раствор
с окисью бериллия, распространяющийся от соединения
284
Системы с окислами редкоземельных элементов
Инвариантные точки системы ВеО—La2O3
Фазы Процесс Состав, мол. % Темпера- тура, °C
LaOi.s ВеО
ВеО+2ВеО- Ьа203+жидкость. Эвтектика. 40.8 59.2 1356±2
2ВеО- La2O3 ±жидкость. Плавление. 50 50 1361 +3
2ВеО- La2O34-2BeO-3La2O3-|- +жидкость. Эвтектика. 51 49 1362 ±4
2ВеО- 3La2O3+La2O3+жидкость Инконгруэнтное плавление. 66 34 1310+10
2BeO«3La2O3 до состава ВеО-Ьа2О3. Соединение 2BeO-La2O3
относится к ромбической сингонии, соединение 2ВеО -ЗЬа2О3— к
гексагональной.
Литература
1. А и г i о 1 A., J. С. Wurm, in: Е. М. L е v i n, С. R. R о b b i n s,
H. F. M cM u rd i e. Phase diagrams for ceramists. U. S. A., Columbus,
p. 100, fig. 219, 1964.
2. Kuo Chu-kun, Yen Tung-sheng, Scientia Sin, 13, № 11,
1873, 1964.
3. Kuo Chu-kun, Yen Tung-sheng, Journ. Chin. Silicate Soc.,
4, № 2, 82, 1965 (Abstr. China Techn. Sci., 3, № 6, Abs. №852, 1965).
4. W e i г С. E., A. Van Valkenburg, Journ. Res. Nat. Bur. Stand.,
64A, № 1, 103, 1960.
MgO—La2O3
Система изучена Лопато и Тресвятским [1 ] методом «отжига
и закалки». Относится к простым эвтектическим (рис. 279). Эвтек-
тика содержит 48 мол. % MgO и плавится при 2000 +30°.
Рис. 279. Диаграмма состояния
системы MgO—LajO3 (по Лопато
и Тресвятскому).
Системы с окислами редкоземельных элементов
285
Литература
1. Тресвятский С. Г., Л. М. Л опато, веб.: Новые направления
в применении редкоземельных элементов в технике, Изд. АН СССР,
М., 1964.
СаО— La2O,
Барри, Стубичан и Рой [1], исходя из тесно смешанных нит-
ратов кальция и лантана и проводя обжиг в области 1800°, не об-
наружили каких-либо соединений в системе. Растворимость
Ьа2О3 в решетке СаО составляет 0.40 мол. %. Растворимости СаО
в Ьа2О3 не было обнаружено.
Литература
1. В а г г у Т. L., V. S. S t u b i с а п, R. R о у, Joum. Amer. Ceram.
Soc., 49, № 12, 667, 1966.
BaO—La2O3
Ориентировочную диаграмму системы приводят Ориоль и
Вурм [1]. Эти авторы утверждают .о наличии инконгруэнтно
плавящегося соединения ВаО«Ьа2О3 (рис. 280).
Фёкс [2] изучал твердый раствор ВаО в Ьа2О3, получая об-
разцы сплавлением смесей окислов в солнечной печи. Приго-
товлялись также обожженные образцы прокаливанием соосажден-
ных гелей или смесей нитратов. Предельная концентрация ВаО
286
Системы с окислами редкоземельных элементов
в твердом растворе составляет величину 14 мол. %. Параметры
элементарной ячейки (гексагональной) этого твердого раствора:
я=3.96в, с=6.18б А, с/а=1.56.
Шварц и Боммерт [3] получили соединение ВаЬа2О4 ромбиче-
ской сингонии со структурой типа CaFe2O4 и параметрами эле-
ментарной ячейки: а0=10.675, &0=12.645, со=3.7О2 А.
Литература
1. А и г i о 1 A., J. G. W u г m, in: Е. М. L е v i п, С. R. R о b b i n s,
Н. F. М с М и г d i е. Phase diagrams for ceramists. U. S. A., Columbus,
p. 97, fig. 209,1964.
2. Fo e x M., Bull. Soc. chim. France, № 1, 109, 1961.
3. Schwarz H., D. В о m m e r t, Zs. Naturforsch., 19B, № 10, 955,1964.
Yb2O3—La2O3
Система изучена Вольфом и Швабом [1 ] на образцах, полу-
ченных путем испарения смешанных растворов нитратов или окса-
латов с последующим обжигом при 1000, 1350 и 1500°. Образую-
щиеся фазы идентифицировались рентгенографически. Обнару-
жен твердый раствор типа С, образуемый на основе Yb2O3.
Предельная концентрация твердого раствора для 1000° и про-
должительности обжига 8 час. ~12 мол. % Ьа2О3 и для 1350°
и продолжительности обжига 1 час —8 мол. % Ьа2О3. При более
высоком содержании Ьа2О3 возникают гексагональные кристаллы
типа А. Вольф и Шваб утверждают о существовании соединения
LaYbO3 с перовскитовой структурой. Однако получить это соеди-
нение в чистом виде им не удалось. Количество перовскитовой
фазы (в смеси с твердым раствором) увеличивается с повышением
температуры и увеличением продолжительности обжига.
Литература
1. Wolf L., Н. S с h w a b, Journ. Prakt. Chem., 4 Reihe, 13, № 5—6,
337, 1961.
PbO— La2O3
Систему изучили Варзее, Морис, Галла и Рустон [1]. Кривая
ликвидуса была получена путем быстрого (10 сек.) выдерживания
в горячей печи смесей, находящихся на платиновой проволоке.
Диаграмма плавкости системы представлена на рис. 281. Обна-
Системы с окислами редкоземельных элементов
287
ружено одно соединение 4РЬО -Ьа2О3 с точкой плавления 1225 +27°.
Эвтектика с температурой плавления 810° содержит 10 мол. %
Ьа2О3 и вторая эвтектика с 1120° — 47.8 мол. % La2O3. Для смесей,
содержащих от 0 до 70 мол. % Ьа2О3, соединение образуется только
выше 750°.
Рис. 281. Диаграмма состояния Рис. 282. Параметр элементарной
системы РЬО—La2O3. ячейки кубических твердых рас-
творов в системе РЬО—La2O3.
При обжиге соосажденных гелей (700°) обнаружился твердый
раствор, распространяющийся от чистого Ьа2О3 до приблизи-
тельно 30 мол. % Ьа2О3. Этот твердый раствор имеет структуру
типа С-Ьа2О3. Параметр элементарной ячейки изменяется от
а - 5.66 А для Ьа2О3 до а=5.54 А для предельного твердого
раствора (рис. 282). Обнаруженные твердые растворы находятся
в метастабильном состоянии.
Литература
1. W а г z е е М. Н., М. Maurice, F. Н а 11 a, W. R. R u s t о п,
Journ. Amer. Ceram. Soc., 48, № 1, 15, 1965.
288
Системы с окислами редкоземельных элементов
NiO— La2O3
Представляет значительный интерес для технологии никель-
лантановых катализаторов.
Изучена Касседан [3] на образцах, полученных совместным
осаждением гидроокисей с последующим прокаливанием при раз-
личных температурах (от 800 до 1500°). На представленной
диаграмме (рис. 283) высокотемпературная область нанесена
ориентировочно. Кроме соединения NiO -LaaO^LaaNiOJ, в усло-
2500
2000.
1500
1000
500
1дгШ0^1лЛШ^№,
О 50 100
МОЛ. о/о
Рис. 283. Диаграмма состоя-
ния системы NiO—La2O3.
виях проведенных опытов возможно
образование соединения Ni2O3 •La2O3,
неустойчивого при повышенных тем-
пературах.
Жермен [1] в связи с рассмот-
рением окисных полупроводников
p-типа, имеющих значение катали-
заторов, показывает механизм обра-
зования твердого раствора на ос-
нове окиси никеля. Он допускает
некоторую растворимость Ьа2О3 в
NiO.Когда Ьа2О3 входит в решетку
окиси никеля, на каждый ион La3+,
замещающий Ni2+, из кристалла
должен уйти один положительный
заряд. Это достигается за счет пе-
рехода ионов Ni3+, отвечающих
за дырочную проводимость NiO в
Ni2+ : ЗО2- + 2Ni3+ + La2O3 -> 2Ni2++
+2La3++502--|-102.
\ Ж+ба^Оь
т^/л^тОц
ЩЩ+МО
Часть избыточного кислорода NiO в процессе приготовления
твердого раствора уходит в газовую фазу,и ионы La3+располагаются
в катионных вакансиях. Можно себе представить весь процесс
еще и так: в решетке возникают катионные вакансии, компен-
сирующие избыточный заряд La3+.
Некоторые сведения об этой системе приводят Фёкс, Манше-
рон и Лине [4] и Берто и Форра [2]. Обнаружено одно соедине-
ние NiLa2O4, плавящееся конгруэнтно около 1750°. Первым авто-
рам удалось получить (в солнечной печи) монокристаллы NiLa2O4
тетрагональной сингонии с параметрами элементарной ячейки:
а=3.864+0.003, с= 12.63+0.010 А, с/а=3.26в. Плотность этого
соединения экспериментальная 6.95 г/см3, теоретическая 7.05 г/см3.
Прокаливая смесь нитратов (500—600°), Фёкс с сотрудниками
получили NiLaO3 с трехвалентным никелем и структурой типа
перовскита кубической сингонии с параметром элементарной
Системы с окислами редкоземельных элементов
289
ячейки а=3.85 А. Выше 960° NiLaO3 теряет кислород с образо-
ванием NiLa2O4 и NiO.
Литература
1, Жермен Ж. Гетерогенный катализ. Изд. иностр, лит., М., 125, 1961.
2. В е г t a u t F., F. F о г г a t, Journ. Phys. Rad., 17, № 2, 129, 1956.
3. C a s s e d a n n e J., Anais Acad. Brasil, ciens., 36, № 1, 13, 1964.
4 M. F о ё x, A. Mancher on, M. Line, Compt. rend., 250, № 18,
3027, 1960.
BeO—CeOg
Диаграмму плавкости системы изучали Вартенберг, Ройш
и Саран [5] и Вартенберг и Экхардт [4]. Эти авторы пришли
к выводу, что система имеет простую эвтектику с температурой
приблизительно I9600, содержащую 63 мол. % ВеО. Последую-
щие рентгенографические исследования Геллера [3] подтвердили
принадлежность системы к простым эвтектическим.
Чепмен [2] также относит систему ВеО—СеО2 к простым
эвтектическим. Для определения температуры плавления эвтек-
тики Чепмен пользовался разработанным им так называемым
методом «пористого коллектора». Смеси ВеО и СеО2, спрессован-
ные и обожженные в виде тонких, с большой поверхностью пла-
стинок (наподобие вафлей), помещались в печи на пористые
диски («коллекторы») из ВеО и СеО2. Возникающая при нагре-
вании жидкость (эвтектика) впитывалась «коллектором». Наи-
низшая температура, при которой образовывалась жидкость,
определялась визуально и по изменению (уменьшению) веса
пластинки. По изменению химического состава пластинки можно
рассчитывать состав эвтектики. Согласно определениям Чепмена,
эвтектика в системе ВеО—СеО2 содержит 63+3 мол. % ВеО и
плавится при 1890+20°.
В результате изучения чисел переноса, определенных на дис-
ках, изготовленных из смеси ВеО и СеО2, Юшина и Пальгуев [1]
делают заключение, «что небольшая растворимость ВеО в СеО2
должна иметь место». Здесь должны образовываться твердые
растворы типа замещения—вычитания, с дефектами в анионной
части кристаллической решетки.
Литература
1. 10 щ и н а Л. Д., С. Ф. П а л ь г у е в, Труды Инет, электрохимии
Уральск, фил. АН СССР, вып. 4, 91, 1963.
“• Chapman А. Т., Journ. Amer. Ceram. Soc., 46, № 4, 171, 1963.
d. Geller R. F., Journ. Res. Nat. Bur. Stand., 27, № 5/6, 555, 1943.
19 Н, А, Торопов и др., КН. 1
290
Системы с окислами редкоземельных элементов
4. WartenbergH., К. Eckhardt, Zs. anorgan. allgem. Chem.,
232, № 2, 179, 1937.
5. Wartenberg H., J. R eusch, E. S a r a n, Zs. anorgan. allgem.
Chem., 230, № 3/4, 257, 1937.
CaO—CeO2
Полностью система не изучена. Келер, Година и Калинина [1 ]
изучили твердофазовые реакции, обжигая смеси СаСО3 и СеО2
при температурах от 1300 до 1650°. Методом рентгеноскопиче-
ского и химического анализа было установлено образование твер-
дого раствора на основе СеО2 с предельным содержанием около
15 мол. % СаО и параметром элементарной ячейки а=5.420 А
(для СеО2 а — 5.414 А) и плотностью (определенной эксперимен-
тально) 6.60 г/см3. Церата кальция СаСеО3 обнаружено не было.
Кей и Рой [2] также не обнаружили церата кальция.
Литература
1. К е л е р Э. К., Н. А. Г о д и н а, А. М. Калинина, Журн. неорг.
хим., 2, № 1, 209, 1957.
2. Keith М., R. Roy, Amer. Mineralogist, 39, № 1, 1, 1954.
SrO—CeO2
Материалы на основе этой системы интересны для электроники.
Система не изучена.
Рот [3], проведя обжиг при 1525°, получил соединение SrCeO3
ромбической симметрии типа перовскита с параметрами решетки:
а = 5.986, 6 = 8.531, с = 6.125 А.
Келер, Година и Калинина [1, 2] изучали твердофазовые
реакции (обжиг в интервале 1100—1500°) в смесях, составленных
из СеО2 и SrCO3. Установлено образование церата стронция
SrCeO3 и твердого раствора на основе СеО2. Для смесей с 75 и
90 мол. % СеО2 вначале образуется церат, который, реагируя с СеО2,
переходит в твердый раствор.
Церат стронция имеет плотность 5.67 г/см3 и параметры эле-
ментарной ячейки: а = 4.286, с = 4.355 А. Твердый раствор, содер-
жащий 9 мол. % SrO, имеет плотность 6.83 г/см3 и параметр
элементарной ячейки 5.449 А.
Витцманн, Герцог и Энгевальд [4] изучили образование це-
рата стронция в температурном интервале 1000—1200°. При 1100°
часовой обжиг приводит к 100%-му выходу церата.
Системы с окислами редкоземельных элементов
291
Литература
1. К е л е р Э. К., Н. А. Година, Журн. неорг. хим., 2, № 1, 209,1957.
2, Келер Э. К., Н. А. Г о д и н а, А. М. Калинина, Журн. неорг.
хим., 1, № 11, 2556, 1956.
3. Roth R. S., Journ. Res. Nat. Bur. Stand., 58, № 2, 75, 1957.
4 Witzmann H., G. Herzog, K. Engewald, Zs. phys. Chem.,
225, № 4—5, 329, 1964.
BaO—CeO2
Система интересна для получения, новых тугоплавких мате-
риалов.
Рот [2], проводя обжиг при 1450—1525°, получил соединение
ВаСеО3 псевдокубической симметрии типа перовскита с парамет-
ром решетки а=4.387 А.
Келер, Година и Калинина [1] при изучении твердофазовых
реакций (обжиг в интервале 1100—1600°) получили церат бария
ВаСеО3 с плотностью 6.14 г/см3 и параметром элементарной ячейки
а=4.390 А. Твердых растворов в системе ВаО—СеО2не обнару-
жено.
Литература
1. К е л е р Э. К., Н. А. Г о д и н а, А. М. К ал ин ина, Журн. неорг.
хим., 1, № 11, 2556, 1956.
2. R о t h R. S., Journ. Res. Nat. Bur. Stand., 58, № 2, 75, 1957.
Sc2O3—CeO2
Диаграмма состояния системы не построена. Мёбиус, Витцманн
и Циммер [1 ] произвели рентгеновское исследование обожженных
а,А
54г|-
М0^
Рис. 284. Параметр элементар- " w
ной ячейки флюоритовой фазы Сеиг- „ 0,
системы Sc2O3—СеО2. m<ul'
при 1750° смесей окислов. Обнаружена флюоритовая фаза.
При температуре 1750° в двуокиси церия растворяется, вероятно,
19*
292
Системы с окислами редкоземельных злементов
больше 10 мол. % ScOj в. В полученных закалкой образцах об-
ласть флюоритовых твердых растворов находится в пределах
0—5 мол. % ScOi Б (рис. 284).
Литература
1. Mobius Н.-Н., Н. Witzmann, F. Z imme г, Zs. Chem., 4, № 5,
194, 1964.
^20з— СеО2
Брауэр и Градингер [2] показали, что эти два окисла обнару-
живают полную взаимную растворимость, образуя твердые рас-
творы двух типов: флюоритового от чистого СеО2 до 60 мол. %
YOt в и кубического, типа Т12О3 от 60 мол. % YOt в до чистого
Y2O3. Параметр решетки изменяется в соответствии с данными
таблицы.
Параметры кристаллической решетки
твердых растворов системы Y2O3—СеО2
YO,.S> МОЛ. % Параметр решетки, кХ УО.,5, мол. %
10 5.397 (F) 65
20 5.393 (F) 70
30 5.389 (F) 80
40 5.382 (F) 90
50 5.373 (F) 95
60 5.361 (F) 97.5
Параметр
решетки, кХ
5.354 (С)
5.343 (С)
5.328 (С)
5.310 (С)
5.300 (С)
5.295 (С)
Примечание. F — флюоритовая фаза; С — куби-
ческие твердые растворы типа Т1203.
Беван с сотрудниками [1 ] показали, что в равновесных усло-
виях нет непрерывного перехода от флюоритовых твердых рас-
творов к кубическим твердым растворам, характерным для редко-
земельных элементов (типа С).
При температуре 1400—1500° в концентрационной области
от 55 до 70 мол. % YOt в наблюдается разрыв смесимости и со-
существуют две фазы. Граница перехода одной фазы в другую
находится при содержании 5.43 мол. % YOt в. На рис. 285 пока-
заны значения параметра решетки двух типов твердых растворов
в рассматриваемой системе при 1400°.
of *Z D3 a 4 •#
Рис. 285. Параметр элементарной ячейки твердых
растворов в системе У2О3—СеО2.
1 — данные Мак-Каллофа и Бриттона; г — данные Брауэра
и Градингера; 3 — данные Мартина, 1-я серия [1 ]; 4 — данные
Мартина, 2-я серия El ]; з — последние данные Бевана с сотруд-
никами.
Рис. 286. Параметр элементар-
ной ячейки твердых растворов
в системе У2О3—СеО2.
J — данные Мак-Каллофа; г — данные
Хоча с сотрудниками.
294
Системы с окислами редкоземельных элементов
Хоч и Иоон Хуо Суб [3] также обнаружили разрыв смеси-
мости твердых растворов, причем двухфазный район расположен
между 50 и 60 мол. % YOt 6. Фаза типа С впервые появляется
при 50 мол. % YOi 8. На рис. 286 показано изменение параметра
решетки твердых растворов в системе YOt в—СеО2.
Литература
1. Bevan D. J. М., W. W. В а г г е г, R. L. Martin, in: Rare earth
research, III, New York, 441, 1965.
2. В r a u e r G., H. Gradinger, Zs. anorgan. allgem. Chem., 276,
№ 5—6, 209, 1954.
3. Hoch M., Yoon H у о Sub, in: Rare erath research, III, New
York, 665, 1965.
La2O8—CeO2
Предварительное исследование системы выполнили Беван
с сотрудниками [1 ]. На образцах, обжигавшихся при 1600°
в концентрационной области от 0 до 66 мол. % LaOj Б, наблю-
далась флюоритовая фаза. При более высоком содержании
ЬаОг Б обнаруживался чистый Ьа2О3 (в форме Л). Выше 69 мол. %
сосуществуют твердый раствор типа С и чистый Ьа2О3.
Литература
1. В е v a n D. I. М., W. W. В а г k е г, Т. С. Р а г к s, in: Rare earth
research, III, New York, 467, 1965.
Pr2O3—CeO2
Мак-Каллоф [1] обнаружил в системе два типа твердых рас-
творов: типа флюорита при содержании от 0 до 50 атомн. % Рг®+
Системы с окислами редкоземельных элементов
295
и кубических, типа Т12О3 при более высоком содержании Рг2О3.
На рис. 287 приведено изменение параметра элементарной ячейки
твердых растворов.
Рис. 287. Параметр аа кристаллической
решетки твердых растворов в системах
Рг2О3—СеО2 и РгО2— СеО8.
1 — нагревание в вакууме, фаза типа флюо-
рита; 2 — нагревание в кислороде, фаза типа
флюорита; 3 — нагревание в вакууме, фаза
типа С; 4 — нагревание на воздухе, фаза
типа флюорита.
Литература
1. McCullough J. D., Journ. Amer. Chem. Soc., 72, № 3, 1386, 1950.
Nd2O3—CeO2
Систему изучали Мак-Каллоф [3] и Брауэр и Градингер [2].
Первый автор обнаружил два типа твердых растворов: типа флюо-
рита при содержании от 0 до 70 атомн. % Nd3+ и кубических твер-
дых растворов типа Т12О3 выше 70 атомн. % Nd3+. На рис. 288
приведено изменение параметра элементарной ячейки твердых
растворов.
Браузр и Градингер [2] утверждают, что существует три типа
твердых растворов: тип флюорита при содержании от 0
До 50 мол. % Nd2O3; кубические, типа Т12О3 при 50—77 мол. %
Nd2O3; гексагональные при 95—100 мол. % Nd2O3. В области
77—95 мол. % Nd2O3 наблюдается гетерогенная область сосущест-
вования кубических (типа Т12О3) и гексагональных твердых рас-
творов.
Моцци и Джентер [4] изучали систему в субсолидусной об-
ласти (фазы идентифицировались рентгенографически) в темпе-
296
Системы с окислами редкоземельных элементов
ратурном интервале 600—1400°. Концентрационная область огра-
ничивалась составами от 0 до 20 атомн. % церия. Обнаружена
непрерывная серия твердых растворов. До 700° структура кри-
сталлов отвечает форме С, характерной для окислов редкоземель-
ных элементов, и лишь для состава
80 атомн. % Nd-|-20% Се есть ука-
зания на присутствие формы А.
С повышением температуры происхо-
дит увеличение количества формы А за
счет формы С, однако даже при 1400°
присутствуют обе зти фазы. Выше 700°
в очень небольшом количестве наблю-
дается фаза В, исчезающая к 1400°.
Для фазы С, полученной при 1400°,
независимо от состава параметр эле-
ментарной ячейки [равен 11.01 А. Для
сосуществующей формы А соответст-
вующие параметры будут: а=3.81,
с=5.99 А.
СеО2 Nd, атомн. % NdgOj
Рис. 288. Параметр а0 кри-
сталлической решетки твер-
дых растворов в системе
Nd2O3—СеО2.
Беван с сотрудниками [1 ], нагре-
вая соосажденные гидроокислы до
1500—1600°, обнаружили, что флюо-
ритовая фаза распространяется до
61 мол. % >NdOt Б. При повышении со-
держания Nd2O3 наблюдается резкий переход к фазе типа С.
В концентрационной области от 76 до 100 мол. % NdOt Б сосу-
ществуют две фазы — типа С и типа А.
Литература
1. В е v a n D. J. М., W. W. В а г k е г, Т. С. Р а г к s, in: Rare earth
research, III, New York, 467, 1965.
2. В r a u e r, G., H. Gradinger, Zs. anorgan. allgem. Chem., 276,
№ 5______g 209 1954.
3. McCullough J. D., Journ. Amer. Chem. Soc., 72, № 3, 1386, 1950.
4. M о z z i R. L., O. J. Gue n t e rt, Journ. Chem. Phys., 36, № 2, 298,1962.
Sm2O3—CeO2
Браузр и Градингер [2] показали, что зти два окисла образуют
твердые растворы двух типов: флюоритовые от чистого СеО2
до 50 мол. % Sm2O3 и кубические типа Т12О3 от 50 до 100% Sm2O3.
Переход от одного типа твердых растворов к другому происходит
непрерывно, и наблюдается плавное изменение параметра ре-
шетки.
Системы с окислами редкоземельных элементов
297
Беван с сотрудниками [1], также констатировавшие наличие
твердых растворов типа флюорита и типа С, обнаружили разрыв
смесимости между этими фазами. Разрыв смесимости обнаружен
между фазами со структурой типа С и типа В.
Литература
1. В е v a n D. J. М., W. W. В а г к е г, Т. С. Parks,- in: Rare earth
research, III, New York, 466, 1965.
2. В r a u e r G., H. Gradinger, Zs. anorgan. allgem. Chem., 276,
№ 5—6, 209, 1954.
Gd2O3—CeO„
Брауэр и Градингер [2] обнаружили два типа твердых рас-
творов, постепенно переходящих один в другой. В пределах
Рис. 289. Параметры элементарных ячеек твердых раство-
ров в системах GdgO3—CeOg, DygO3—СеО2 и YbgO3—СеО2.
1 — фаза типа флюорита; 2 — фаза типа С.
от чистого СеО2 до приблизительно 40 мол. % Gd2O3 наблюдаются
флюоритовые, от 40 до 100% Gd2O3 — кубические твердые рас-
творы типа TLO,.
а о
298
Системы с окислами редкоземельных элементов
Беван с сотрудниками [1 ] нашли две области несмешиваемости
твердых растворов. При 1600° в пределах 92—100 мол. % GdOt Б
наблюдается двухфазное равновесие между фазой типа С и моно-
клинной модификацией Gd2O3 (фаза типа В). В пределах 54—74
мол. % GdOi 8 сосуществуют флюоритовая фаза и фаза со струк-
турой типа С. На рис. 289 представлены значения параметров
решеток для нескольких температур.
Литература
1. Bevan D. J. М., W. W. В а г к е г, Т. С. Р а г к s, in: Rare earth
research, III, New York, 466, 1965.
2. В r a u e r G., H. Gradinger, Zs. anorgan, allgem. Chem., 276,
№ 5—6, 209, 1954.
DyiOr-CeOa
Интересна для разработки новых материалов для электронной
техники.
Брауэр и Градингер [2] обнаружили два типа твердых рас-
творов, постепенно переходящих один в другой. В пределах
0—60 мол.% Dy2O3 — флюоритовые и от 60 до 100% Dy2O3 —
кубические твердые растворы типа Т12О3.
Плоетц, Маккигроссо, Осика и Джекоби [3], обжигая смеси
Dy2O3 и СеО2 при 1600°, получали кубический твердый раствор
широкой области однородности (от 10 до 40 объемн. % Dy2O3).
Параметр решетки изменяется от 5.412 до 5.390 а. и. При более
высоком содержании Dy2O3 (до 80 объемн.%) наблюдалась вторая
фаза — гранецентрированный кубический твердый раствор. Сое-
динений в системе не обнаружено.
В отличие от Брауэра и Градингера, Беван с сотрудниками [1 ]
обнаружили область несмешиваемости двух типов твердых рас-
творов, распространяющуюся от 58 до 70 мол. % ПуОг 6. Пара-
метр элементарной ячейки твердых растворов типа С изменяется
линейно с составом. Параметр флюоритовых твердых растворов
изменяется в соответствии со следующей формулой второй сте-
пени (рис. 289): а0 = 5.4100 + 2.074.10’4/VDy — 9.207 • Ю^ЛЬу
(2VDy — содержание диспрозия, в атомн. °/о).
Литература
1. В е v а п D. J. М., W. W. В а г к е г, Т. С. Р а г к s, in: Rare earth
research, III, New York, 464, 1965.
2. Brauer G., H. Gradinger, Zs. anorgan, allgem. Chem., 276,
№ 5—6, 209, 1954..
Системы с окислами редкоземельных элементов
299
3. Р 1 о е t z С. L., А. Т. М а с с i g г о s s о, L. М. О s i к a, W. R. J а-
с о b у, Journ. Amer. Ceram. Soc., 43, № 3, 154, 1960.
Ho2O3—CeO2
Краткие сведения о системе приводят Беван с сотрудниками [1 ].
Отмечается большое сходство с системой Y2O3—СеО2, т. е. нали-
чие двух типов твердых растворов: типа флюорита и типа С.
Литература
1. Bevan D. J. №., W. W. В а г k е г, Т. С. Р а г к s, in: Rare earth
research, III, New York, 461, 1965.
Yb2O3—CeO2
Браузр и Градингер [2] обнаружили два типа твердых рас-
творов: типа флюорита при содержании от 0 до 50% Yb2O3 и ку-
бические твердые растворы типа Т12О3 при 92—100 мол.% Yb.,O3.
Более детально систему изучили Беван с сотрудниками 11].
Для зтой системы характерна большая область несмешиваемости
двух твердых растворов: флюоритового типа и типа С (или Т12О3).
Для твердых растворов типа С параметр элементарной ячейки
линейно изменяется с составом; параметр флюоритовых твердых
растворов в концентрационной области 10—45 мол. % YbOx 8
изменяется по уравнению второй степени: а0 = 5.4096 —
(>.744 • 10-4Луь — 1.397 • 10~52V^b. На рис. 289 приведены значе-
ния параметра фазы типа С для различных температур.
Литература
(.Bevan D. J. М., W. W. В а г к е г, Т. С. Р а г к s, in: Rare earth
research, III, New York, 461, 1965.
2. В r a u e r G., H. G. Gradinger, Zs. anorgan..'allgem. Chem., 276.
№ 5—6, 209, 1954.
BaO—Pr2O3
Шварц и Боммерт [1], обжигая смеси окислов при 1000—
1300°, получили соединение ВаРг2О4 ромбической сингонии
со структурой типа CaFe2O4 и параметрами элементарной ячейки:
«0=10.614, &0=12.483 , с0=3.631 А.
300
Системы с окислами редкоземельных элементов
Литература
1. Schwarz Н., D. В о m m е г t, Zs. Naturforsch., 19В, № 10, 955, 1964.
Y„O3—PrO,,
Систему изучали Мак-Каллоф и БриттонЦ]. При нагревании
в атмосфере кислорода здесь обнаружено существование твер-
дых растворов двух типов: типа флюорита и кубических типа С.
Параметр элементарной ячейки флюоритовой фазы изме-
няется в пределах 5.394—5.398 А (0—30 атомн. % Y) и кубиче-
ской фазы типа С — в пределах 5.385—5.304 А (50—100
атомн. % Y). Переход от флюоритовой структуры (/'’-ячейка)
к структуре типа С постепенный, и на рентгенограмме линии,
характерные для структуры С, появляются при 15 атомн. % У.
Литература
1. McCullough J. D., J. D. Britton, Journ. Amer. Chem. Soc.,
74, № 20, 5225, 1952.
CeO2—PrO2
Систему изучил Мак-Каллоф [1]. Здесь образуется непрерыв-
ный ряд твердых растворов типа флюорита. На рис. 287 приведено
изменение параметра элементарной ячейки твердого раствора.
Литература
1. McCullough J. D., Journ. Amer. Chem. Soc., 72, № 3, 1386, 1950.
Nd20g—PrO2
Мак-Каллоф [1 ] обнаружил в системе два типа твердых рас-
творов: тип флюорита при содержании от 0 до 56 атомн. % Nd3+
и кубические твердые растворы типа Т12О3 при более высоком
содержании Nd2O3.
Литература
1. McCullough J. D., Journ. Amer. Chem. Soc., 72, № 3, 1386, 1950.
Системы с окислами редкоземельных элементов
301
MgO—Nd2O3
Диаграмма состояния системы не построена. Бхаргава, Ковба,
Мартыненко и Спицын [1], прокаливая смеси окислов до 1200°,
не обнаружили образования химических соединений и наблюдали
некоторую растворимость Nd2O3 в MgO (параметр элементарной
ячейки MgO уменьшался от а=£. 213 А для чистой MgO
до а=4.207 А).
Литература
1. Бхаргава X. Д., Л. М. Ковба, Л. И. Мартыненко,
В. И. Спицын, ДАН СССР, 153, № 6,1318, 1963.
SrO—Nd2O3
Шварц и Боммерт [1], обжигая смеси окислов при 1000—
1300°, получили соединение SrNb2O4, которое имеет структуру
типа CaFe2O4 (ромбическая сингония), с параметрами элементар-
ной ячейки: а0=10.592, &0=12.454, со=3.6О2 А.
Литература
1. Schwarz Н., D. В о m m е г t, Zs. Naturforsch., 19В, № 10, 955, 1964.
ВаО—Nd2O3
Шварц и Боммерт [1], прокаливая смесь ВаСО3 и Nd2O3,
получили соединение BaNd2O4 ромбической сингонии, со структу-
рой типа CaFe2O4 и параметрами элементарной ячейки: а0=10.592,
&0=12.454, со=3.6О2 А.
Литература
1. Schwarz Н., D. В о m m е г t, Zs. Naturforsch., 19В, № 10, 955, 1964.
Pr2O3—Nd2O3
Изучена Вольфом, Бернигхаузеном и Массоном [1 ] в субсоли-
дусной области. Обжиги смесей окислов, полученных разложением
оксалатов или нитратов, производились при 750, 1000 и 1350°.
В системе обнаружено несколько типов твердых растворов;
302
Системы с окислами редкоземельных элементов
1) С — кубические твердые растворы;
2) А — гексагональные твердые растворы; структура А и С
характерна для окислов редкоземельных элементов;
3) F — твердые растворы со структурой‘флюорита.
nXzzzzzzzzzzzzzzzzzzzsznnzz^
F е а
III Р+А
F C A A
Рис. 290. Фазовые диаграммы системы
PfgOg-------------NdgOg.
1 — смеси получались термическим разло-
жением нитратов, обжиг при 750°, 20 час.;
II — смеси получались термическим раз-
ложением оксалатов, обжиг при 750°,
20 час.; III — обжиг при 1000°, 3 часа;
IV — обжиг при 1350°, 1 час.
На рис. 290 схематически представлены обнаруженные в си-
стеме фазы. Для изученных образцов характерен их цвет, иногда
резко изменяющийся при возникновении новой фазы.
Авторы определили значение параметра элементарной ячейки
флюоритовой фазы и вычислили содержание РгО2 и Рг2О3 в соот-
ветствующих образцах.
Так как для празеодима характерна различная валентность,
фактически исследовалась тройная система РгО2—Рг2О3—Nd2O3.
Литература
1. Wolf L., Н. Barnighausen, J.
Chem., 4 Reihe, 3, № 3—4, 211, 1956.
Massone, Journ. Prakt.
Li2O—Sm2O3
Диаграмма состояния системы не построена. Гондран и
Берто [1 ] описали соединение LiSmO2, которое в структурном
отношении аналогично диаспору а-А1ООН. Параметры элемен-
тарной ячейки LiSmO2: а=5.345, 6=11.45, с=3.485 А; У=53.3 А3,
плотность 5.90 г/см3.
Литература
1. Gondrand М., Е. F. Bertaut, Bull. Soc. Franc. Mineral.,
Cristallogr., 86, № 3, 301, 1963.
Системы с окислами редкоземельных элементов
303
ВеО—Sm,O.
в в
Изучена Тресвятским, Кушаковским и Белеванцевым [2].
Температуры ликвидуса и солидуса определялись с помощью
высокотемпературного термического анализа по методике, раз-
Рис. 291. Диаграмма состояния си-
стемы ВеО—Sm2O3.
работанной Будниковым и Тресвятским [1]. Система относится
к простым эвтектическим (рис. 291). Температура плавления
эвтектики 1420+10°.
Литература
1. Б у д н и к о в П. П., С. Г. Тресвятский, Огнеупоры, № 4, 167,
1957.
2. Тресвятский С. Г., В. И. Кушаковский, В. С. Беле-
ванцев, Атомн. энергия, 9, № 1, 54, 1960.
SrO—Sm2O3
Система изучена Бхаргава [1 ] на прокаленных при 1200
и 1700° смесях Sm2O3 и нитрата стронция. Обнаружено одно сое-
динение SrSm2O4 (уже при 1100°). Наблюдается значительная
(до 30 мол. % SrO) растворимость окиси стронция в окиси сама-
рия. Параметр элементарной ячейки твердого раствора при зтом
изменяется от а=14.18, 6=3.633, с=8.847 А, 0=99.97° для чи-
стого Sm2O3 до а=14.02, 6=3.716, с=8.922 А, 0=101.72° для
твердого раствора с 30 мол. % SrO. Sm2O3 в окиси стронция прак-
тически не растворяется.
Соединение SrSm2O4 изоструктурно с ферритом кальция, рент-
генограммы индицируются в ромбической сингонии, параметры
элементарной ячейки: а=10.11, 6=12.11, с=3.510 А.,
304
Системы с окислами редкоземельных элементов
Шварц и Боммерт [2] для соединения SrSm2O4 приводят
следующие’значения параметров элементарной ячейки: а0=10.141,
&о=12.119, с0=3.522 A; SrSm2O4 ромбической сингонии имеет
структуру типа CaFe2O4.
Литература
1. Бхаргава X. Д. Изучение взаимодействия окислов редкоземельных
элементов с окислами щелочноземельных металлов. Автореф. канд.
дисс., М., 1964.
2. Schwarz Н., D. В от mert,- Zs. Naturforsch.,^19B, № 10, 955, 1964.
ВаО—Sm2O3
Шварц и Боммерт [1], обжигая смесь окислов при 1000—
1300°, получили соединение BaSm2O4 ромбической сингонии
со структурой типа CaFe2O4 и параметрами элементарной ячейки:
а0=10.518, Ьо=12.333, с0=3.562 А.
Литература
1. Schwarz H.,D. Bommer t, Zs.Naturforsch., 19B, № 10, 955, 1964.
Nd2O3— Sm2O3
Изучили Моцци и Гюнтер [1] в субсолидусной области. Ис-
ходным веществом служил смешанный раствор азотнокислых со-
лей, подвергавшийся испарению, для получения смесей нитратов,
в дальнейшем прокаливавшихся при различных температурах,
от 600 до 1400°. Концентрационная область ограничивалась со-
ставами от 0 до 20 атомн. % Sm. Фазы идентифицировались рент-
генографически. Обнаружена непрерывная серия твердых раство-
ров. При 700° структура кристаллов отвечает форме С, характерной
для окислов редкоземельных элементов. При 1400° присут-
ствовала только форма А. В промежуточной температурной об-
ласти форма С постепенно трансформировалась в смесь форм А
и В. Моноклинная форма В для состава 90 Nd : 10 Sm имеет
следующие параметры элементарной ячейки: а=14.277+0.004,
&=3.682+0.001, с=8.953+0.003 А, 0=100.12+0.02°, 7=463.2+
+0.5 А3.
Литература
1. Mozzi R. L., О. J. G u е n t е г t, Journ. Chem. Phys., 36, № 2, 298,
1962.
Системы с окислами редкоземельных элементов
305
РЬО—Sm2O3
Систему изучали Варци, Морис, Халла и Рустон [1]. Образцы
приготовлялись по методике, приведенной в описании системы
РЬО—Gd2O3. Установлено образование одного соединения
4PbO-Sm2O3, плавящегося конгруэнтно при 1200+15°. Соединение
4РЬО-8т2О3,как видим, менее устойчиво, чем 4РЬО • Gd2O3, имеет
более высокую упругость пара РЬО и полностью разлагается
при 1000°, оставляя Sm2O3 в форме В.
Из соосажденных гидроокислов самария и свинца (обжиг
до 700°) были получены метастабильные твердые растворы,
разлагающиеся при нагревании с образованием соединения
4PbO-Sm2O3. Температура перехода твердого раствора состава
2PbO-Sm2O3 в соединение 4PbO-Sm2O3 равна 900°, температурный
предел существования твердого раствора состава 1.5PbO-Sm2O3
составляет 800°.
Литература
1. W а г z е е М. Н., М. Maurice, F. Hall a, W. Ruston, Journ.
Amer. Ceram. Soc., 48, № 1, 15, 1965.
Li2O—Eu2O3
Диаграмма состояния системы не построена. Гондран и
Берто [1] описали соединение LiEuO2, в структурном отношении
аналогичное диаспору а-АЮОН. Параметры элементарной
ячейки LiEuO2: а=5.337, Ь—11.41, с=3.477 A, F=52.96 А3;
плотность 5.98 г/см3.
Литература
1. Gondtand М., Е. F. Bertaut, Bull. Soc. Franc, mineral., cristal-
logr., 86, № 3, 301, 1963.
SrO—Eu2O3
Шварц и Боммерт [1], обжигая смесь окислов при 1000—1300°,
получили’соединение Sr2Eu2O4 со структурой типа CaFe2O4 (ромби-
ческой). SrEu2O4 имеет следующие" параметры элементарной
ячейки: а0=10.131, &о=12.ООЗ, с0=3.496 А.
Литература
1. Schwarz Н., D. В о m m е г t, Zs. Naturforsch., 19В, № 10, 955, 1964.
20 Н. А. Торопов и др., кн. 1
306
Системы с окислами редкоземельных элементов
ВаО—Еи2О3
Шварц и Боммерт [1 ], обжигая смесь окислов при 1000—1300°,
получили соединение ВаЕи2О4 ромбической сингонии со структу-
рой типа CaFe2O4 и параметрами элементарной ячейки: а0=10.499,
&о=12.3О1, с0=3.538 А.
Литература
1. Schwarz Н., D. В о m m е г t, Zs. Naturforsch., 19В, № 10, 955, 1964.
Li 2O^“G d2O3
Диаграмма состояния системы не построена. Гондран и Берто [1]
описали соединение LiGdO2, в структурном отношении аналогич-
ное диаспору а-АЮОН. Параметры элементарной ячейки
LiGdO2: а=5.326, 6=11.34, с=3.448 A, F=51.97 А3; плотность
6.25 г/см3.
Литература
1. Gondr and М., Е. F. Bertaut, Bull. Soc. Franc, mineral., cristal-
logr., 86, № 3, 301, 1963.
BeO—Gd2O3
Изучена Тресвятским, Кушаковским и Белеванцевым [2].
Температуры ликвидуса и солидуса определялись с помощью
Системы с окислами редкоземельных элементов
307
высокотемпературного термического анализа по методу, разра-
ботанному Будниковым и Тресвятским [1].
Система относится к простым эвтектическим (рис. 292). Темпе-
ратура плавления эвтектики 1490+10°.
Хан Вен-лонг и Куо Чу-кун [3], применяя метод «отжига
и закалки», также пришли к выводу, что система относится к про-
стым эвтектическим, с одной эвтектикой, содержащей 53.4 мол.%
GdOi в и плавящейся при 1472+2°.
Однако окись бериллия может образовать с Gd2O3 соединение
2BeO-Gd2O3, которое рассматривается как метастабильное и
на диаграмме не должно присутствовать. Это соединение ромби-
ческой сингонии имеет параметры: а=3.603+0.003, 6=9.85+0.03,
с=10.51+0.02 A; Arg=1.94, А^р=1.89.
Литература
1. Будников П. П., С. Г. Тресвятский, Огнеупоры, № 4, 167,
1957.
2. Тресвятский С. Г., В. И. К у ш а к о в с к и й, В. С. Беле-
ванцев, Атомн. энергия, 9, № 1, 54, 1960.
3. На n Wen-lo ng, Kuo Chu-kun, Journ. Chin. Silicate Soc.,
4, № 4, 211, 19651
CaO—Gd2O3
Некоторые сведения о системе приводят Барри, Стубичан
и Рой[1]. Авторы исходили из смешанных нитратов, проводя син-
тез при 1850°, и получили только одно конгруэнтно плавящееся
соединение CaO-2Gd2O3. В температурной области 1150—1600°
происходит субсолидусная диссоциация с образованием твердых
растворов на основе СаО и на основе Gd2O3 (в форме В). Ниже 1150°
соединение CaO-2Gd2O3 диссоциирует на твердый раствор на ос-
нове СаО и С-тип Gd2O3. В температурном интервале между 1600
и 2100° растворимость Gd2O3 в решетке СаО немного меньше
6 мол. % Gd2O3. Растворимость СаО в Gd2O3 очень мала — меньше
1 мол. % СаО.
Литература
1. В а г г у Т. L., V. S. S t u b i с a n, R. R о у, Journ. Amer. Ceram
Soc., 49, № 12, 667, 1966.
20*
308
Системы с окислами редкоземельных элементов
SrO—Gd2O3
Шварц и Боммерт [1 ] получили соединения SrGd2O4 со струк-
турой типа CaFe2O4 (ромбической). SrGd2O4 имеет следующие зна-
чения параметра элементарной ячейки: а0=10.133, Ьо=12.О59,
с0=3.476 А.
Литература
1. Schwarz Н., D. Bommert, Zs. Naturforsch., 19В, № 10, 955, 1964.
ВаО—Gd2O3
Шварц и Боммерт [1 ], обжигая смеси окислов при 1000—1300°,
получили соединение BaGd2O4 ромбической сингонии, со струк-
турой типа CaFe2O4 и параметрами элементарной ячейки:
а0=10.483, &0=12.260, сэ=3.519 А.
Литература
1. Schwarz Н., D. Bommert, Zs. Naturforsch., 19В, № 10, 955, 1964.
РЬО—Gd2O3
Интересна для полупроводниковой технологии.
Систему изучали Варци, Морис, Галла и Рустон [1]. Спрес-
сованные образцы смесей окислов предварительно, для уплотне-
ния, обжигали при 650° в токе сухого азота, а затем в петельке
платиновой проволоки на 10 сек. помещались в печь. Фазы иден-
тифицировались рентгенографически. Было получено одно сое-
динение — 4PbO-Gd2O3, плавящееся конгруэнтно при 1350 + 20°.
Авторы отмечают сходство диаграммы состояния систем
РЬО—Gd2O3 и РЬО—Ьа2О3 (рис. 281).
Gd2O3 образует с РЬО метастабильные твердые растворы,
если исходить из соосажденных смесей гидроокисей и производить
обжиг приблизительно при 700°. Твердый раствор устойчив при
пониженных температурах и при 1000° переходит в соединение
4PbO'Gd2O3. Температурный предел существования твердого
раствора состава 1.5PbO-Gd2O3 составляет 800°.
Литература
1. Warzee М. Н., М. Maurice, F. Н а 11 a, W. R. Ruston,
Joum. Amer. Ceram. Soc., 48, № 1, 15, 1965.
Системы с окислами редкоземельных элементов
309
SrO—ТЬ2О3
Шварц и Боммерт [1 ] обжигом смесей окислов при 1000—
1300° получили соединение SrTb2O4 со структурой CaFe2O4 (ром-
бической). SrTb2O4 имеет следующие значения параметров эле-
ментарной ячейки: ао=1О.1О5, &0=11.387, с0=3.454 А.
Литература
1. Schwarz Н., D. В ommert, Zs. Naturforsch., 19В, № 10, 955, 1964.
ВаО—Tb2O3
Шварц и Боммерт [1 ] обжигом смесей окислов при 1000—
1300° получили соединение ВаТЬ2О4 ромбической сингонии,
со структурой типа CaFe2O4 и параметрами элементарной ячейки:
а0=Ю.439, &О=12.177, с0=3.495 А.
Литература
1. Schwarz Н., D. Bommert, Zs. Naturforsch., 19В, № 10, 955, 1964.
Pr2O3—Tb2O3
Изучена Брауэром и Пфейфером [1] в субсолидусной области
(обжиг до 1600°). Обнаружен непрерывный ряд твердых растворов,
существующих в виде трех характерных для окислов редкозе-
мельных элементов модификаций — А, В и С. Обжигом при 550°
в атмосфере водорода получен непрерывный ряд твердых раство-
ров, кристаллизующихся в модификации С.
[Области устойчивости высокотемпературных модификаций в за-
висимости от концентрации приведены на рис. 293.
310
Системы с окислами редкоземельных элементов
Для В — модификации чистого ТЬ2О3 — получены следую-
щие параметры элементарной ячейки: а=14.03+0.01, Ь=3.536±
+0.005, с=8.717+0.005 А, 0=100.10+0.05°.
Рис. 293. Области устойчивости различных модифика-
ций твердых растворов в системе Рг2О3—ТЬ2О3 (по
Брауэру и Пфейферу).
I — кристаллическая форма типа А; 2 — одновременное при-
сутствие кристаллических форм типа А и типа В; 3 — кри-
сталлическая форма типа В; 4 — одновременное присутствие
форм типа В н типа С; 5 — кристаллическая форма типа С.
Литература
1. Brauer G., В. Pfeiffer, Zs. anorgan. allgem. Chem., 341, № 5—6,
237, 1965.
Ег2О3—тьоя
Вольф и Шваб [2] производили обжиг смесей окислов зрбия
и тербия в субсолидусной области при 1200 и 1300°, в окислитель-
ной атмосфере. В этих условиях тербий может образовывать ряд
окислов [1]: ТЬО171ь, ТЬО1-81, ТЬОг 83 и ТЬО2. Не устанавливая
точно количество кислорода, связанное с тербием, авторы изу-
ченную систему изображают в общем виде как Ег2О3—ТЬОЯ.
В этой системе обнаружены твердые растворы трех типов: 1) куби-
ческие (С-форма); 2) переходные между С-формой и флюорито-
вой формой (С—F); 3) ромбоэдрические (слабо деформированные
кубические), характерные для фазы ТЬОг П8 (обозначаются R).
Системы с окислами редкоземельных элементов
311
Фрома С обнаруживается в области от 0 до 50 атомн. % тербия,
переходная форма C—F от 50 до 70 атомн. % тербия. При более
высоком содержании тербия появляется форма R.
Рис. 294. Параметр элемен-
тарных ячеек твердых раство-
ров систем ТЪ2О3—Ег2О3 {верх-
няя кривая) и ТЬОЖ—Ег2О3
{нижняя кривая).
xtTWx
х'бРЗО-i
ib
200 -
о го w во во юо
ЕГ.О, ,
г ТЪ, атомн./о
Рис. 295. Содержание кисло-
рода в окислах системы
ТЬОд.—Ег2О3.
Верхняя кривая — значение х'
в РЗОХИ нижняя кривая — значе-
ние х в ТЬОд.
Изменение параметра элементарной ячейки представлено
на рис. 294 (нижняя кривая). На рис. 295 приведено изменение
индекса при кислороде.
Литература
1. Baenziger N. С., Н. А. Е i с k, Н. S. S с h u 1 d t, L. Е у г i n g,
Journ. Amer. Chem. Soc., 83, № 10, 2219, 1961.
2. W о 1 f L., H. Schwab, Journ. Prakt. Chem., 4 Reihe, 24, № 5—6,
293, 1964.
CaO— Dy2O3
Изучена Квейру [1, 2]. Исходными веществами служили CaCO3
и Dy3O3, смеси которых после спекания при 1200° плавились
в отражательной фокусирующей печи. Сплавленные образцы
подвергались термической обработке в интервале от 1000 до 2000°.
Установлено существование соединения CaO-Dy2O3=CaDy2O4,
устойчивого между 1450 и 2000°. Выше 2000° происходит распад
CaDy2O4 на СаО и твердый раствор на основе Dy2O3. Обнаружены
две серии твердых растворов: типа В и типа С. Область гомоген-
ности моноклинного твердого раствора В простирается при 1800°
от 20 до 30 мол. % СаО и ограничивается температурой 1500°,
312
Системы с окислами редкоземельных элементов
при которой находится эвтектоидная точка состава 72 мол. %
Dy2O3 и 28 мол. % СаО. Вхождение иона кальция в решетку Dy2O3
°C
гчоо
гооо
1600
1200
O^CaO/f
I
СаО + 8
СаО+БугСаО^
СаО+С
О 25 50 75 100
Са0 Мол. % ВУг°3
Рис. 296. Низкотемпературная об-
ласть фазовой диаграммы системы
СаО—DygO3.
стабилизирует форму В этого окисла и значительно снижает тем-
пературу превращения С^±В. Равновесная диаграмма состоя-
ния системы СаО—Dy2O3 представлена на рис. 296.
Литература
1. Q и е у г о и х F., Compt. rend., 261, groupe, 8, № 21, 4430, 1965.
2. Queyroux F., Rev. Haut. Temper, et Rdfract., 2, № 4, 307, 1965.
SrO—Dy2O3
Шварц и Боммерт [1], обжигая смесь окислов при 1000—
1300°, получили соединение SrDy2O4 со структурой типа CaFe2O4
(ромбической). SrDy2O4 имеет следующие значения параметров
элементарной ячейки: ао=1О.О94, &0=11.947, с0=3.429 А.
Литература
1. Schwarz Н., D. В о m m е г t, Zs. Naturforsch., 19В, № 10, 955, 1964.
ВаО—Dy2O3
Шварц и Боммерт [1 ], обжигая смесь окислов при 1000—1300°,
получили соединение BaDy2O4 ромбической сингонии, со струк-
турой типа CaFe2O4 и параметрами элементарной ячейки:
а0=10.415, &0=12.147, с0=3.476 А.
Системы с окислами редкоземельных элементов
313
Литература
1. Schwarz Н., D. В omm er t, Zs. Naturforsch., 19В, № 10, 955, 1964.
La20g—Dy2O3
Мюллер-Бушбаум [1], базируясь на данных Шнейдера и
Рота [2], приводит гипотетическую схему фазовых отношений
в системе Ьа2О3—Dy2O3 (рис. 297). Автор доказывает, что переход
°C
1650
Рис. 297. Схематическая фазо-
вая диаграмма системы
Ьа2О3— Dy2O3.
Саг03
О 20 W 60 80 100
°У2°3
твердого раствора из формы В (моноклинной) в форму А (гекса-
гональную) происходит не резко при определенной температуре,
а постепенно, в некотором интервале, который на рисунке пред-
ставлен заштрихованной областью.
Литература
1. Mtiller-Buschbaum Н., Zs. anorgan. allgem. Chem., 355, № 1—2,
41, 1967.
2. S c h n e i d e r S. J., R. S. R о t h, Journ. Res. Nat. Bur. Stand., 64A,
№ 4, 317, 1960.
Gd2Og— Dy2O3
Перес-и-Джорба [1] получила непрерывный ряд твердых рас-
творов в зтой системе. Твердые растворы, так же как и чистые
Gd2O3 и Dy2O3, обнаруживают полиморфное превращение — пере-
ход низкотемпературной кубической формы в высокотемператур-
ную моноклинную.
Для чистого Gd2O3 температура полиморфного превращения
равна 1000°, для состава (Gd0 ,Dy0 3)2О3 1250°, для состава
(Gd0 BDy0 Б)2О3 1550°, для состава (Gd0 4Dy0 e)2O3 1650° и для
чистого Dy2O3 2300°. На рис. 298 приведены значения температур
превращения твердых растворов системы Dy2O3—Gd2O3 в зави-
симости от их молярной концентрации. Превращения фиксирова-
лись рентгенографическим методом.
314
Системы с окислами редкоземельных элементов
Согласно данным Квейру, Гарари и Коллонга [2], Gd2O3
и Dy2O3 образуют непрерывный ряд твердых растворов. Твердые
^УА Мол.
Рис. 298. Температуры превра-
С ^-превращения твердых
растворов в системе Gd2O3— Dy2O3
Формула
Температура
С 2 В-превра-
щения, °C
щения твердых растворов
Dy2O3— GdgO3.
системы
Gd.,O3 ....
(^*i0-7Dy0 3)2О3
(Gd0 5Dy0 5)2О3
(Gd0,4Dy0B)2O3
Dy2O3 ....
1200
1250
1550
1650
1900
растворы готовились из сооса-
жденных аммиаком смешанных
гидроокислов металлов. Для по-
лученных твердых растворов, так
же как и для чистых окислов, ха-
рактерен полиморфный переход из кубической (тип С) формы в
моноклинную (тип В). В таблице приведены температуры
С ^^-превращений твердых растворов.
Литература
1. Perez ylorba М., Ann. Chim., 13, 7, № 7—8, 479, 1962.
2. Queyroux F., A. Harar i, R. Collongues, Bull. Soc. Franc,
ceram., № 72, 37, 1966.
SrO—Ho2O3
Шварц и Боммерт [1 ] обжигом смесей окислов при 1000—
1300° получили соединение SrHo2O4 со структурой CaFe2O4 (ромби-
ческой). SrHo2O4 имеет следующие значения параметров элемен-
тарной ячейки: ао=1О.О64, &0=11.915, со=3.4О9 А.
Литература
1. Schwarz Н., D. В ommert, Zs. Naturforsch., 19В, № 10, 955, 1964.
Системы с окислами редкоземельных элементов
315
В аО—Но 2О,
а о
Шварц и Боммерт [1], обжигая смесь окислов при 1000—1300°,
получили соединение ВаНо2О4 ромбической сингонии, со струк-
турой типа CaFe2O4 и параметрами элементарной ячейки: а0=
=10.404, &о=12.1О7, с0=3.453 А.
Литература
1. Schwarz Н., D. В ommert, Zs. Naturforsch., 19В, № 10, 955, 1964.
. SrO—Ег2О3
Шварц и Боммерт [1 ], обжигая смесь окислов при 1000—
1300°, получили соединение SrEr2O4 со структурой типа CaFe2O4
(ромбической) и параметрами элементарной ячейки: а0= 10.043,
&0=11.867, с0=3.394 А.
Литература
1. Schwarz Н., D. В ommert, Zs. Naturforsch., 19В, №10, 955,1964.
ВеО— Yb2O3
Изучена Отто [1 ]. Химических соединений не получено. Обна-
ружены твердые растворы как на основе УЬ2О3, так и на основе
ВеО (рис. 299).
Рис. 299. Диаграмма состояния си-
стемы ВеО—YbjO,.
316
Системы с окислами редкоземельных элементов
Литература
1. Otto Н.Е., in; Е. М. Levin, С. R.Robbins, Н. F. McMurdie.
Phase diagrams for ceramists. U. S. A., Columbus, p. 100, fig. 221, 1964.
CaO— Yb 2O3
Бхаргава, Ковба, Мартыненко, Спицын [1], прокаливая смеси
окислов и нитратов до температуры 1200°, заметили измене-
ние рентгенограмм, однако каких-либо соединений обнаружено
не было. Квейру [3, 4] обнаружила три соединения: CaO-Yb2O3,
2СаО -Yb2O3 и ЗСаО -Yb2O3. Соединение CaYb2O4 устойчиво только
в температурном интервале 1850—1950° и распадается при 1950°
на Ca2Yb2O8 и твердый раствор типа В. Соединение CaYb2O4
относится к ромбической сингонии со структурой типа CaFe2O4,
однако имеется некоторая моноклинная деформация ромбиче-
ской ячейки. Параметры элементарной ячейки этого соеди-
нения: а=9.729 +0.009, 6=3.322+0.003, с=11.567+0.010 А,
р=89°48'+5', 7=374 A3. Z=4.
Соединение Ca2Yb2O6 устойчиво в температурном интервале
1800—2100°. Соединение ЗСаО • Yb2O3=Ca3Yb2O6, не полученное
в чистом виде, устойчиво только вблизи точки плавления. Квейру
установила также образование твердого раствора на основе Yb2O3.
При зтом возникает моноклинная фаза В, не существующая
для чистой Yb2O3. Рассматриваемый твердый раствор стабилен
вблизи температуры плавления в концентрационной области от 33
до 45 мол. % СаО. Область гомогенности фазы В ограничивается
эвтектоидной точкой, расположенной несколько выше 1900°.
Квейру обнаружила также растворимостьУЬ203 в окиси кальция.
Наиболее полное изучение системы СаО—Yb2O3 принадлежит
Барри, Стубичану и Рою [2]. Установлено образование четырех
соединений: 3CaO-Yb2O3, 2CaO-Yb2O3, CaO-Yb2O3 и CaO-2Yb2O3.
Первые три соединения стабильны в равновесных условиях и
фигурируют на фазовых диаграммах, представленных на рис. 300
и 301. Метастабильное соединение CaO-2Yb2O3 могло быть полу-
чено при быстром охлаждении расплава. Устойчивые при повы-
шенных температурах соединения 3CaO-Yb2O3, 2CaO-Yb2O3 и
СаО -Yb2O3 в районе 1800° диссоциируют на свободные окиси.
Установлено образование твердых растворов на основе СаО.
В температурном интервале 1850—2150° растворимость Yb2O3
в СаО составляет величину около 8 мол. %. Изменение параметра
кристаллической решетки зтих твердых растворов представлено
Системы с окислами редкоземельных элементов
317
и2^3
меньше 1 мол. %.
на рис. 302. Растворимость СаО в Yb2O? если и имеет место,
то составляет величину
°C
2200
2100
Q.
I Cdg YbgOj
* 1 />« v
Са¥ЬгО^
/
/
2000
-W 8+0
1800
I
1700
и.
CaOnip.+O
1900 Ifytyfy
; е^.,Ш
C<LtYb&+C
О
СаО
25 50
Мол. %
75
юо
Рис. 300. Диаграмма состояния системы СаО—Yb2O3.
а — по Квейру; б — по Барри, Стубичану и Рою.
Соединение CaYb2O4 было индицировано на основе моноклин-
ной ячейки с параметрами: а0=9.748, &о=И.6ОО, с0=3.471 А,
318
Системы с окислами редкоземельных элементов
(3=90.40°. Пикнометрическая плотность 7.64 г/см3. Структуру
CaYb2O4 можно рассматривать как моноклинное искажение ромби-
ческой структуры типа CaFe2O4.
Рис. 301. Гипотетическая диа-
грамма «свободная энергия—
—состав» для системы СаО—
—Yb8O3 при 1000’.
Рис. 302. Параметр элемен-
тарной ячейки твердых раство-
ров Yb2O3 в окиси кальция.
Литература
1. Бхаргава X. Д., Л. М. К о в б а, Л. И. Мартыненко,
В. И. С п и ц ы н, ДАН СССР, 153, № 6, 1318, 1963.
2. В а г г у Т. L., U. S. S t u b i с a n, В. В о у, Journ. Amer. Ceram.
Soc., 49, № 12, 667, 1966.
3. Q u e у г о u x F., Compt. rend., 261, groupe 8, № 21, 4430, 1964.
4. Queyroux F., Rev. Haut. Temper, et Refract., 2, № 4, 307, 1965.
SrO—Yb2O3
Лопато, Яременко и Тресвятский [2] получили соединение
SrYb2O4, плавящееся, по-видимому, конгруэнтно при темпера-
туре приблизительно 2100°.
Структура SrYb2O4 отнесена Бхаргава, Ковба, Мартыненко
и Спицыным [1 ] к типу кальциевого феррита.
Литература
1. Бхаргава X. Д., Л. М. Ковба, Л. И. Мартыненко,
В. И. С п и ц ы н, ДАН СССР, 153, № 6, 1318, 1963.
2. Л о п а т о Л. М., 3. А. Яременко, С. Г. Тресвятский,
ДАН УССР, № И, 1945, 1965.
Системы с окислами редкоземельных элементов
319
ВаО— Yb gOg
Бхаргава, Ковба, Мартыненко и Спицын [1], обжигая смеси
ВаО и Yb2O3 до температуры 1300°, получили соединение BaYb2O4,
рентгенограмма которого индицируется в предположении гекса-
гональной ячейки с объемом 111.9 А3. Параметры субъячейки:
а=6.038, с=3.545 А.
Литература
1. Бхаргава X. Д., Л. М. Ковба, Л. М. Мартыненко,
В. И. Спицын, ДАН СССР, 153, № 6, 1318, 1963.
Nd 2О з- Yb 2О з.
В субсолидусной области (обжиг при 800, 1000 и 1350°) си-
стему изучали Вольф с сотрудниками [1 ]. Исходными веществами
1О.В83
10.633
10.583
10.533
10.483
0 10
УЬг03
Мол.%
Рис. 304. Параметр эле-
ментарной ячейки твер-
дого раствора на основе
Nd2O3.
ш.% "А
Рис. 303. Параметр элементарной ячейки твер-
дого раствора на основе Yb2O3.
служили оксалаты или нитраты ниобия и иттербия, смеси которых
выпаривались, а затем прокаливались.
Обнаружены твердые растворы на основе Yb2O3 и Nd2O3.
Предельная концентрация первых зависит от температуры про-
каливания образцов. На рис. 303 представлено значение пара-
метра элементарной ячейки твердых растворов, полученных при
1000°, 8 час. (а) и 1350°, 1 час (б). В первом случае предельная
концентрация составляет величину 38 мол. % Nd2O3 и параметр
элементарной ячейки 10.678+0.005 А. Во втором случае (1350°)
предельная концентрация равна 32 мол. % Nd2O3 и параметр эле-
ментарной ячейки 10.638 +0.003 А.
320
Системы с окислами редкоземельных элементов
Область твердых растворов на основе Nd2O3 простирается до
содержания 43 мол. % Yb2O3 (обжиг при 800°, 72 часа). Изме-
нение параметра элементарной ячейки этих твердых растворов
представлено на рис. 304. Предельный твердый раствор имеет
параметр элементарной ячейки а=10.795+0.006 А.
Литература
1. Wolf L, Н. Schwab, J. Sieler, Journ. Prakt. Chem., 4 Reihe,
32, № 3—4, 113, 1966.
Sm203—Yb2O3
Некоторые сведения о системе приводят Квейру, Гарари
и Коллонг [1 ], которых интересовал главным образом поли-
морфизм твердых растворов, образующихся между Sm2O3 и Yb2O3.
Чистый Sm2O3 имеет моноклинную форму в интервале 876—1950°,
a Yb2O3 имеет кубическую форму типа Т12О3 при всех температу-
рах. Авторы изучили полиморфизм двух членов твердых^растворов:
(Sm0,7»Yb0 21)2О3 и (Sm0 3eYb0 41)2О3. Нагревая (Sm0 7eYb0 21)2O3
до 1150°, получали только кубическую структуру типа Т12О3
с параметром а=10.814 А. После нагревания при 1200° структура
этого твердого раствора соответствует моноклинному типу В.
Твердый раствор Sm0 s»Yb0 41О3 после нагревания при 1380° имеет
кубическую форму типа Т12О3 и при температуре выше 1600°
переходит в моноклинную форму типа В. Таким образом, поли-
морфное превращение В С происходит для этого твердого
раствора в интервале температур 1400—1600°.
Литература
1. Queyroux F., A. Harar i, R. Collongues, Bull. Soc. Frans,
cerarn., № 72, 37, 1966.
SrO— Lu2O3
Шварц и Боммерт [1 ], обжигая смесь окислов при 1000—
1300°, получили соединение SrLu2O4 со структурой типа CaFe2O4
(ромбической) и параметрами элементарной ячейки: aft=9.984,
&0=11.746, с0=3.345 А.
Литература
1. Schwarz Н., D. В о m m е г t, Zs. Naturforsch., 19В, № 10, 955, 1964.
Системы с окислами редкоземельных элементов
321
Таблица 1
Фазы, обнаруженные в системах из двух окислов редкоземельных
элементов, по данным Шнейдера и Рота (S. J. Schneider,
R. S. Roth, Journ. Res. Nat. Bur. Stand., 64A, № 4, 317, 1960)
Система Состав, мол. % Темпе- ратура обжи- га, °C Время, часы Фазы, идентифицированные рентге- новским методом
La2O3— Na2O3 IjALftOo— J Sm2O3 [ L&oOo— (мД L&nOo— ВуД ' L/йоОо— НоД Nd2O.- Sin2O3 Nd2O,- Gd283 Nd2O3- Dy2O3 20:80 50:50 40:60 70.6:29.4 63.5 : 36.5 50:50 25:75 80:20 75:25 70:30 50:50 20:80 18:82 16:84 14:86 12:88 10:90 5:95 78.3:21.7 73:27 50:50 22.6:77.4 14.8:85.2 88:12 81 :19 60:40 50:50 98:2 95:5 90:10 86:14 82:18 82:18 78:22 97:3 93:7 84:16 35 :65 13.3:86.7 1650 1650 1650 1650 1650 1650 1650 1650 1650 1650 1650 1650 1650 1650 1650 1650 1650 1650 1650 1650 1650 1650 1650 1650 1650 1650 1650 1650 1650 1650 1650 1650 1900 1650 1650 1650 1650 1650 1650 6 6 6 6 6 6 6 6 6 6 6 6 6 6 6 6 6 6 6 6 6 6 6 6 6 6 6 6 6 6 6 6 0.083 6 6 6 6 6 6 | Твердый раствор типа А. Твердый раствор типа В. Твердый раствор типа А. Твердые растворы типов А и В. } Твердый раствор типа В. Твердый раствор типа А. Твердые растворы типов А и В. . Твердый раствор типа В. | Твердые растворы типов В и С. Твердый раствор типа С. | Твердые растворы типов А и В. Твердый раствор типа В. | Твердые растворы типов В и С. Твердый раствор типа А. | Твердые растворы типа А + В. | Твердый раствор типа А. Твердые растворы типов А и В. Твердый раствор типа А. Твердые растворы типов А и В. } Твердый раствор типа В. Твердый раствор типа С.
21 H. Л. Торопов и др„ кн. 1
322
Системы с окислами редкоземельных элементов
Таблица 1 (продолжение)
Система Состав, мол.. % Темпе- ратура обжи- га, °C Время, часы
Nd2O3- 50:50 1650 360
Ег2О3
Nd2O3— ( 58:42 1650 360
YbA j 45 •. 55 1650 360
Nd2O3- 50:50 1650 360
LUgOg
50:50 1650 360
Lu2O3
Gd2O3— J 84:16 1650 360
I 32:68 1650 360
86.7:13.3 1650 360
Ho2O3 j 43.3:56.7 1650 360
90:10 1650 360
Er2O3 I 57.5:42.5 1650 360
Gd2O3— 50:50 1650 360
Lu90q
Dy2O3- Lu2O3 50:50 1650 360
80:20 1650 360
80:20 1900 5
75.2:24.8 1650 360
75.2:24.8 1900 5
69:31 1650 360
69:31 1900 5
63:37 1900 5
57:43 1650 360
Ег2О3 57:43 1900 5
50:50 1650 360
50:50 1900 6
50:50 1900 30
45:55 1650 360
45:55 1900 5
40:60 1650 360
40 : 60 1900 5
Ьа2Оз—
Et2O3 40:60 1900 16
Фазы, идентифицированные рентге-
новским методом
Твердый раствор типа В.
Твердые растворы типов В я С.
Твердый раствор типа В.
Твердый раствор типа С.
Твердые растворы типов В и С.
Твердый раствор типа С.
Твердый раствор типа В.
Твердый раствор типа С.
Твердые растворы типов А я В.
Твердый раствор типа А.
Твердые растворы типов А и В и
La2O3 • Ег2О3.
Твердые растворы типов А я В.
Твердые растворы типов В я Ьа2О3-
• Ег2О3.
Твердый раствор типа В.
Твердый раствор типа В + Ьа2О3 •
• Ёг2О3.
Ьа2О3 Ег2О3.
Ьа2О3 • Ег2О3 + твердый раствор
типа В.
La2O3 Ет2О3.
Твердый раствор типа В + Ьа2О3 •
• Ег2О3.
Твердые растворы типов В я С.
Твердые растворы типов В и С +
-|-La2O3-Er2O.
Твердый раствор типа В + Ьа2О3 •
• ЕГ2О3.
Системы с окислами редкоземельных элементов
323
Таблица 1 (продолжение)
Система Состав, мол. % Темпе- ратура обжи- га, °C Время, часы Фазы, идентифицированные рентге- новским методом
35:65 35-.65 1900 1900 5 22 Твердые растворы типов В и С.
Ег2О3 28.8:712 28.8:712 21.6:78.4 1650 1900 1650 360 6 360 Твердый раствор типа C+La2O3. •Ег2О3. Твердые растворы типов В и С. Твердый раствор типа C-j-La2O3- •Ёг2О3.
21.6:78.4 1900 5 Твердые растворы типов В и С.
^а20з—• Ти2О3 50:50 1650 360 ^а2^3‘Г^и2^3*
70:30 1650 180
70:30 62:38 1900 1650 5 180 Твердый раствор типа А + Ьа2О3> •Yb2O3.
62:38 1900 5
Ьа2О3— Yb2O3 50:50 1650 360 La2O3> Yb2O3.
44:56 1650 180
44:56 38:62 1900 1650 5 180 , Твердый раствор типа С + I а2О3- • Yb2O3.
38:62 1900 5
La2O«— Lu2O3 68:32 68:32 50:50 1650 1900 1650 180 5 360 Твердый раствор типа А + Ьа2О3- •Lu2O3. La2O3 • Lu2Og,
43:57 43:57 1650 1900 180 5 Твердый раствор типа С + Ьа2О,- >Lu2O3.
21*
324
Системы с окислами редкоземельных элементов
Фазовый состав в системах типа Ln2O3—R2O3, по данным Шнейдера, Рота
(S. J. Schneider, R. S. Roth, J. L. Waring,
Система Состав, мол. % Термическая обработка Фазы, идентифицированные рентгенографическим методом
темпе- ратура, °C время, часы
I. Системы с оки
Ce2O3—A13O3 50 : 50 1600 1 Се3О3 • А1аО3. *
РГ2О3—"A120j 50 : 50 — — Рг2О3 • А13О3.
66.7 : 33.3 1650 6 Nd2O3 + Nd2O, • A12Os.
Nd2O3-Al2O3 50 : 50 — — Nd2O3 • A12O3>
37.5 : 62.5 1650 6
66.7 : 33.3 1650 6 Sm3O3 4~ Sm2O3 • A12O3>
Sm2O3—-A13O 3 50 : 50 — — Sm2O3 • AlaO3.
37.5 : 62.5 1650 6 »
Eu2O3—A13O3 50 : 50 — — Eu3O3 * A13O3.
66.7 : 33.3 — — 2Gd3O3 * Al2O3a
GdaO3—A12O3 50 : 50 — — Gd2O3 • A13O3.
37.5 : 62.5 1650 6 Gd2O3 * A12O3 A12O3.
50 : 50 1650 6 Dy2O3 • A12O3 -f- 3Dy2O3 • 5A12O3.
Dy2O3—A13O3 \ 50 : 50 1850 0.17 Dy3O3 • A12O3.
37.5 : 62.5 — — 3Dy2O3 • 5A13O3*
HoaO3—A13O3 50: 50 1650 6 2Ho2O3 * A12O3 4~ Ho3O3 • A12O3 4“ 4“ 3Ho2O3 • 5A12O3.
50 ; 50 1850 0.17 To же.
50 : 50 1910 0.5 Ho2O3 * Al3O3a
50 : 50 1650 6 Er2O3 4~ 2Er2O3 • Ala03 -l- Er3O3 * A12O3 4*
+ 3ErsO3 5A12O3.
50 : 50 1800 0.5 To же.
Er3O3—A13O3 50: 50 1850 6 • >
50 : 50 1900 0.75 Er2O3 • A13O3.
50 : 50 1840 0.75
37.5 : 62.5 1650 12 Er3O3 * A12O3 4- 3Er2O3 • 5AlaO3.
50 : 50 1650 6 2Tu2O3 • AlaO3 4“ Tu3O3 * A13O3 4"
4~ 3Tu2O3 • 5A12O3.
Tu2O3—A1SO3 50 : 50 50 : 50 1850 1845 0.7 0.25 To же. > >
37.5 : 62.5 1650 12 3Tu2O3 • 5A12O3. '
Системы с окислами редкоземельных элементов
325
Таблица 2
и Уоринга, полученным путем изучения реакций в твердом состоянии
Journ. Res. Nat. Bur. Stand., 65A, № 4, 345, 1961)
Структурный тип Сингония Параметры элемен- тарной ячейки Примечания
а, А ь, А с, А град.
сью алюминия
Перовскита. Ромбоэдрическая. 3.766 — 90.2 По Роту [5].
» > 5.307 — 60.33 По Геллеру и Ва-
Тип А + перовскита. Гексагональная + ромбо- 5.286 — 60.42 ла [3].
Перовскита. эдрическая. Ромбоэдрическая. По Геллеру и Ва-
» > — — — — ла [3].
Тип В + перовскита. Моноклинная + ромби- — — — —
Перовскита. ческая. Ромбическая. 5.285 5.290 7.473 По Геллеру и Ва-
» » — — ла [3].
> > 5.271 5.292 7.458 —
Неизвестен. Неизвестная. — По Геллеру и Ва-
Перовскита. Ромбическая. 5-247 5.304 7.417 ла [3]. По Вартау и Рою
Перовскита + корун- Ромбическая + ромбо- — — [6]. По Геллеру и Ва-
да. Перовскита + грана- эдрическая. Ромбическая + кубиче- — ла [3].
та. Перовскита. ская. Ромбическая. 5.21 7.38 5.31 —
Граната. Кубическая. — — — — По Варшау и Рою
Неизвестен + перов- Неизвестная + ромбиче- [6].
скита + граната. То же. ская + кубическая. То же. — —
Перовскита. Ромбическая. 5.18 7.36 5.33 —
Тип С + неизвестен+ Кубическая + неизвест- 11.983 — — —
+ перовскита+гра- ната. То же. ная + ромбическая -|- + кубическая. То же. — —
» » » > — — — —•
Перовскита. Ромбическая. — — — —
» » 5.16 7.33 5.32 —
Перовскита + грана- Ромбическая + кубиче- 11.983 — — —
та. Неизвестен + перов- ская. Неизвестная + ромбиче- 5-15 7.29 5.33
скита + граната. То же. ская + кубическая. То же. 11-96 — — —
Неизвестен + перов- Неизвестная + ромбиче- — — — —
скита + граната. Граната. ская + кубическая. Кубическая. 11.96 — — —
326
Системы с окислами редкоземельных элементов
Система Состав, Термическая обработка Фазы, идентифицированные
мол. % темпе- ратура, время, часы рентгенографическим методом
Yb2O3—А12О3 50; 50 50 : 50 50 : 50 37.5 : 62.5 50 : 50 1650 1770 1850 1650 1650 6 0.33 0.33 12 6 Yb2O3 + 2Yb2O3 • А12О3 + 3Yb2O3 • 5А12О3 т. р. То же. 3Yb2O3 • 5А12О3. Lu2O3 4~ 3Lu2O3 * 5А12О3 т. р.
Lu2O3~A12O3 50 : 50 37.5 : 62.5 50 : 50 1800 1650 1500 0.17 6 6 То же. 3Lu2O3 • 5А12О3. 1п2О3 т. р. 4- А12О3.
1п2О3—А12О3 50 : 50 50 : 50 1650 1700 2 0.0 То же. 1щО3 4- неизвестная.
Sc2O3—А12О3 66.7 : 33.3 50 : 50 50 ; 50 50 : 50 1650 1650 1790 1960 6 9.5 0.08 0.08 ScsO3 т. р. 4- (1 — *)SCjO3 • хА13О3 т. р. (1 — x)Sc2O3 • хА13О3 т. р. То же. » »
II. Системы с они
La2O3—Ga2O3 50 : 50 8.2 : 91.8 1500 1350 2 6 2La2O3 Ga2O3. La2O3 • Ga2O3. La2O3 • Ga2O3 4“ Ga2O3.
Рг2О3—Ga2O3 50 : 50 Pr2O3 • Ga2O3.
75 : 25 1500 6 Nd2O3 “I- 2Nd2O3 • Ga2O3.
66.7 : 33.3 1500 6 Nd2O3 4-2Nd2O3 • Ga2O3Nd2O3 * Ga2O3.
Nd2O3—Ga2O3 66.7 : 33.3 1575 6 2Nd2O3 • Ga3O3.
50 : 50 Nd2O3 * Ga2O3.
40 : 60 1350 6 Nd2O3 • Ga2O3 4" 3Nd2O3 • 5Ga2O3.
37.5 : 62.5 1500 6 3Nd2O3 • 5Ga2O3.
75 : 25 1500 6 3Sm2O3 • Ga2O3 4- 2Sm2O3 • Ga2O3.
75 : 25 1575 6 3Sm2O3 • Ga2O3.
Sm2O3—Ga2O3 50 : 50 1500 6 2Sm20j • Ga2O3 4- 3Sm2O3 • 5Ga2O3 t. p.
40: 60 1500 — To же.
37.5 : 62.5 1500 — 3Sm2O5 • 5Ga2O3.
75 : 25 1500 6 3Eu2O3 • Ga2O3 4“ ЗЕи^Оз Ga2O3.
75 : 25 1575 6 3Eu2O3 • Ga2O3.
Eu2O3—Ga2O3 50 : 50 1500 6 2Eu2O3 • Ga2O3 4- 3Eu2O3 • 5Ga2O3 t. p.
40: 60 1500 6 3Eu2O3 • 5Ga2O3 t. p.
37.5 : 62.5 1500 — 3Eu2O3 * 5Ga2Oa,
Системы с окислами редкоземельных элементов
327
Таблица 2 (продолжение)
Структурный тип Сингония Параметры элемен- тарной ячейки Примечания
а, А Ь, А с, А а» град.
Тип С 4- неизвестен 4- +граната. То же. » » Граната. Тип С 4- граната. То же. Граната. Тип С + корунда. То же. Тип С + неизвестен. То же. Неизвестен. » сью галлия Неизвестен. Перовскита. Перовскита 4- бета- окиси галлия (ром- бическая, при 875° переходит в ромбо- эдрическую). Перовскита. Тип А 4- неизвестен. Тип А 4- неизвестен4- 4- перовскита. Неизвестен. Перовскита. Перовскита 4- грана- та. Граната. Неизвестен 4- неизве- стен. Неизвестен. Неизвестен 4- грана- та. То же. Граната. Неизвестен к неивве- стен. Нейв вестей. Неизвестен 4- грана- та. Граната. » Кубическая + неизвест- ная + кубическая. То же. > > Кубическая. Кубическая + кубиче- ская. То же. Кубическая. Кубическая + ромбоэд- рическая. То же. Кубическая + неизвест- ная. То же. Ромбоэдрическая. > > Неизвестная. Ромбическая. Ромбическая 4- моно- клинная. Ромбическая. Гексагональная + неиз- вестная. Гексагональная 4- неиз- вестная 4- ромбиче- ская. Неизвестная. Ромбическая. Ромбическая 4- кубиче- ская. Кубическая. Неизвестная 4- неизвест- ная. Неизвестная. Неизвестная 4- кубиче- ская. То же. Кубическая. Неизвестная 4- неизвест- ная. Неизвестная. Неизвестная 4- кубиче- ская. Кубическая. > 11.946 11.931 11.927 11.912 9.45 5.496 5.465 5.426 12.505 12.505 12.445 12.448 12.434 12.43 12.42. 12.40 5.524 5.496 5.502 — - - - - 3 - 7.787 7.729 7.706 1 1 1 1 1 1 1 1 1 1 1 1 1 1 III III 1 1 1 11 111 11 1 1 Для 1700° проба полу- чена плавле- нием. По Геллеру [2]. По Геллеру [2], По Геллеру [2].
328
Системы с окислами редкоземельных элементов
Система Состав, мол. % Термическая обработка Фазы, идентифицированные рентгенографическим методом
темпе- ратура, время, часы
75 : 25 1500 6 ЗОбгОз * Ga2O3.
75 : 25 1600 6 »
Gd2O3—Ga2O3 50 : 50 1500 6 3Gd2O3 • Ga2O3-|- 3Gd2O3 • 5Ga2O3 т. p.
40 : 60 1500 6 3Gd2O3 • 5Ga2O3 T. p.
37.5 : 67.5 1500 6 3Gd2O3 • 5Ga2O3.
75 : 25 1500 6 3Dy2O3 • Ga2O3.
75 : 25 1600 6 DyaO3 -|- 3DyaO3 • GaaO3.
75 : 25 1650 6 Dy2O3 -|- 3Dy2O3 • Ga2O3.
Dy2O3—GaaO3 66.7 : 33.3 1500 6 3Dy2O3 • Ga2Oj+3Dy2O3 • 5Ga2O3.
50 : 50 1500 6 3Dy2O3 • Ga3O3 + 3Dy2O3 • 5Ga2O3 T. p.
40 : 60 1500 4 3Dy2O3 • 5Ga2O3 T. p.
37.5 : 62.5 1500 6 3Dy2O3 5Ga2O3.
75 : 25 1500 6 Ho2O3 -|- 3HoaO3 • Ga2O3.
75 ; 25 1600 6 To же.
75 : 25 1650 6 > »
Но2О3—Ga2O3 • 66.7 : 33.3 1500 6 3Ho2O3 • Ga2O3 + 3Ho2O3 • 5GazO3 т. p.
50 : 50 1500 6 To же.
40 : 60 1500 4 3Ho2O3 • 5Ga2O3 т. p.
37.5 : 62.5 1500 6 3Ho2O3 • 5Ga2O3.
75-25 1500 6 Y2O3-|_3YaO3 • Ga2O3 -j- 3YaO3 • 5GaaO3 t. p.
66.7 : 33.3 1500 6 ЗУгО3 * Ga2O3 3Y2O3 • 5GaaO3 t. p.
Ya03—Ga2O3 50 : 50 1500 6 To же.
50 : 50 • 1600 6 » »
40: 60 1500 4 3Y2O3 • 5Ga2O3 T. p.
37.5 : 62.5 1500 6 3YaO3 • 5Ga2O3.
90: 10 1500 6 Ег3О3-|- 3Er2O3 • Ga2O3.
80 : 20 1500 6 To же.
80:20 1620 1.3 » »
80 : 20 1625 0.25 Ег2О3 + ЗЕг2О3 • 5Ga2O3 т. p.
75 : 25 1500 6 ЕгаО3 -|- Ег2О3 • Ga2O3 -|- ЗЕг2О3 • 5Ga2O3.
75 : 25 1600 6 Ег2О3 + ЗЕг.Оз • Ga2O3.
Ег2О3—Ga2O3
75 : 25 1650 6 To же.
75 : 25 1700 0.5 Ег2О3 + ЗЕг2О3 • 5Ga.O3 т. р.
50 : 50 1500 6 ЗЕг2О3 • Ga2O3 +ЗЕг2О3 • 5Ga2O3 т. р.
50 : 50 1635 0.25 Ег2О3 -|- ЕггО3 • 5GaaO3 т. р.
40 : 60 1500 4 ЗЕг,О, • 5Ga2O3 т. р.
37.5 : 62.5 1500 6 ЗЕг2О3 • 5Ga2O3.
Системы с окислами редкоземельных элементов
329
Таблица 2 (продолжение)
Структурный тип Сингония Параметры элемен- тарной ячейки Примечания
а,-А ь, А с, А а» град.
Неизвестен. Неизвестная. — — — —
Неизвестен + грана- Неизвестная + кубиче- 12.426 — —
та. ская.
Граната. Кубическая. 12.416 — — —
» » 12.377 — — —
Неизвестен. Неизвестная. — — — —
Тип С + неизвестен. Кубическая + неизвест- — — — —
ная.
То же. То же. — — — —
Неизвестен + грана- Неизвестная + кубиче- — — — —
та. ская.
То же. То же. 12.417 — — —
Граната. Кубическая. 12.349 — — —
» » 12.308 — — —
Тип С + неизвестен. Кубическая + неизвест- — — — —
ная.
То же. То же. — — — —
» » » » — — — —
Неизвестен грана- Неизвестная + кубиче- — — — —
та. ская.
То же. То же. 12.408 — — —
Граната. Кубическая. 12.324 — — —
» » 12.282 — — —
Тип С + неизвестен + Кубическая + неизвест- — — — —
+ граната. ная кубическая.
Неизвестен 4- грана- Неизвестная + кубиче- — — — —
та. ская.
То же. То же. 12.441 — — —
» » » » — — — —
Граната. Кубическая. 12.318 — — —
» » 12.275 — — —
Тип С 4-неизвестен. Кубическая + неизвест- — — — —
ная.
То же. То же. — — — —
» » » » — — — —
Тип с + граната. Кубическая кубиче- — — — —
ская.
Тип с + неизвестен + Кубическая + неизвест- — — — —
+ граната. ная кубическая.
Тип с + неизвестен. Кубическая + неизвест- — — — —
ная.
То же. То же. — — — —
Тип С + граната. Кубическая + кубиче- — — — —
ская.
Неизвестен + грана- Неизвестная + кубиче- 12.400 — — —
та. ская.
Тип с + граната. Кубическая + кубиче- — — — —
ская.
Граната, Кубическая. 12.301 - — —
» » 12.254 — —
330
Системы с окислами редкоземельных элементов
Система Состав, мол. % Термическая обработка Фазы, идентифицированные рентгенографическим методом
темпе- ратура, °C 1 время, часы
50: 50 1500 6 Yb2O3 + 3YbaO3 . 5Ga2O3 т. р.
Yb2O3—Ga2O3 40: 60 1500 4 ЗУЬ2О3 • 5Ga2O3 т, р.
37.5 : 62.5 1500 6 ЗУЬгО3 * 5Ga2O3.
50 : 50 1500 6 Lu2O3 + 3Lu2O3 . 5Ga2O3T. р.
Lu2O3—Ga2O3 40 : 60 1500 4 3Lu2O3 • 5Ga2O3 т, p.
37.5 : 62.5 1500 6 3Lu2O3 * 5Ga2O3.
[ 1ПяОз~"в EI2O3 50 : 50 1450 6 (1 — »)In2O3 . xGa2O3 T. p.
50 : 50 — — (1 — x)Fe2O3 • xGa2O3 t. p.
Fe2O3— Ga,O3 50 : 50 50 : 50 1300 1500 6 6 To же. Fe3O4 t, p, + Ga2O3 t. p.
50:50 1600 6 Cr2O3 t, p, + Ga2O3 t. p.
Сг2О3—Ga2O3 33.3 : 66.7 1500 6 To же.
20: 80 1500 6 Ga2O3 t. p.
Tu2O3—Ga2O3 50 : 50 1500 6 Tu2O3+3Tu2O3 • 5Ga2O3 T. p.
Ш. Системы с они
La2O3—Cr2O3 Рг20з—Cr2O3 Nd2O3—Cr2O3 50 : 50 50 : 50 50:50 66.7 : 33.3 1500 6 La2O3 • Cr2O3. Pr2O3 • Cr2O3. Nd2O3 • Cr2O3. Sm2O3 4- Sm2O3 • Cr2O3«
Sm2O3—Cr2O3 { 50 : 50 — — Sm2O3 * Cr2O3.
1 37.5 : 62.5 1500 6 Sm2O3 * Cr2O3 4-Cr2O3.
Eu2O3—Cr2O3 50 : 50 1600 6 Eu2O3 • Cr2O3.
66.7 : 33.3 1500 6 Gd2O3 4“ Gd2O3 * Cr2O3.
Gd2O3—Cr2O3 50 : 50 — — Gd2O3 * Cr2O3«
37.5 : 62.5 1500 6 Gd2O3 • Cr2O3 4~ Cr2O3.
Dy2O3—Cr2O3 50 ; 50 1600 6 Dy2O3 * Cr2O3«
Y2O3—Cr2O3 50 : 50 — — Y2O3 • Cr2O3.
Er2O3—Cr2O3 50 ; 50 1600 6 Er2O3 • Cr2O3.
66.7 ; 33.3 1500 6 Yb2O34-Yb2O3 • Cr2O3.
Yb2O3—Cr2O3 50 : 50 1600 6 Yb,O3 • Cr2O3.
37.5 : 62.5 1500 6 Yb2O3 • Cr2O3 4“ Cr2O3.
Lu2O3—Cr3O3 50 : 50 1600 6 Lu2O3 • Cr2O3.
In2O3—Cr2O3 50 : 50 1600 6 In2O3 t. p. 4- Сг2О3 t. p.
Системы с окислами редкоземельных элементов
331
Таблица 2 (продолжение)
Структурный тип Сингония . Параметр! тарной >i элемен- ячейки Примечания
а, А Ь. А с, А а» град.
Тип С + граната. Граната. > Тип С + граната. Граната. > Неизвестен. х-Глинозема. Шпинели р-окиси галлия. Корунда + р-окиси галлия. Корунда р-окиси галлия. р-Окиси галлия. Тип С + граната. сью хрома Перовскита. > > Тип В + перовскита. Перовскита. Перовскита + корун- да. Перовскита. Тип В + перовскита. Перовскита. Перовскита + корун- да. Перовскита. > > Тип с + перовскита. Перовскита. Перовскита + корун- да. Перовскита. Тип С + корунда. Кубическая + кубиче- ская. Кубическая. > Кубическая + кубиче- ская. Кубическая. > Неизвестная. Ромбическая. > Кубическая + моноклин- ная. Ромбоэдрическая + мо- ноклинная. То же. Моноклинная. Кубическая + кубиче- ская. Ромбическая. > Моноклинная -1- ромбиче- ская. Ромбическая. Ромбическая + ромбоэд- рическая. Ромбическая. Моноклинная + ромбиче- ская. Ромбическая. Ромбическая + ромбоэд- рическая. Ромбическая. Кубическая + ромбиче- ская. Ромбическая. Ромбическая + ромбоэд- рическая. Ромбическая. Кубическая + ромбоэд- рическая. 12.344 12.232 12.200 12.320 12.231 12.183 8.75 8.73 12.369 5.477 5.444 5.412 5.372 5.33 5.312 5.26 5.247 5.22 5.18 5.17 9.40 9.38 5.514 5.484 5.494 5.502 7.61 5.514 7.50 5.518 7.51 7.51 7.46 5.07 5.08 7.755 7.710 7.695 7.650 5.50 7.611 5.51 7.540 5.51 5.49 5.49 II 1 1 1 1 1 1 II II II III 1 1 1 1 1 1 1 1 1 1 1 1 По Вуду [7]. 1 По Геллеру J [2]. По Геллеру [2]. По Геллеру [2].
332
Системы с окислами редкоземельных элементов
Система Состав, мол. % Термическая обработка Фазы, идентифицированные рентгенографическим методом
темпе- ратура, °C время, часы
1 80:20 1500 6 SejOs т. р. + (1 — ocJSCjOs • хСг2О3 т. р.
Sc2o3—СГ2О3 66.7 : 33.3 1600 6 (1 — x)Sc2O3 • хСг2О3 т. р. + Сг2О3 т. р.
75 : 25 1500 6 (1 — x)Sc2O3 • хСг2О3 т. р.
50 : 50 1600 6 (1 — x)Sc2O3 • хСг2О3 т, р. 4- Сг2О3 т. р.
Ее2О3—Сг2О3 50: 50 1350 6 (1 — x)Fe2O3 • хСг2О3 т. р.
1N. Системы с они
La2O3—F е-2О3 50 : 50 1500 1 La2O3 • Fe2O3.
Рг2О3—Fe-2O3 50 : 50 — — Pr2O3 • Fe2O3.
Nd2O3—Fe2O3 50 : 50 ' — — Nd2O3 • ЕвдОд.
50 : 50 — — Sm2O3 • Fe2O3.
Sm2O3—FeaO3 { 37.5 : 62.5 — — 3Sm2O3 * 5Fe2O3.
50 : 50 — — Eu2O3 • Fe2O3.
Eu-2O3—FesO3 | 37.5 : 62.5 — — 3Eu2O3 • Fe2O<j«
50 : 50 — — Gd2O3 • Fe2O3.
Gd2O3—Fe2O3 37.5 : 62.5 — 3Gd2O3 • SFegOg,
66.7 : 33.3 1350 6 Dy2O3 4- Dy2O3 • Fe-2Os.
Dy2O3—Fe2Oa 50 : 50 50 : 50 1300 6 Dy2O3 • Fe2O3 4“ 3Dy2O3 • 5Fe2O3»
1500 6 Dy2O3 • Fe2O3.
37.5 : 62.5 — — 3Dy2O3 • SFegOg*
50 : 50 1350* 6 Ho2O3 • Fe-2O34~ 3Ho2O3 • SFegOg*
Ho2O3—Fe2O3 50 : 50 1500 6 HO2Og • FeaOg.
37.5 : 62.5 — — 3Ho2O3 * 5Fe2Oa.
50 : 50 1500 1 Y2Og • Fe2O3.
Y2O3—ЕеЛ 37.5 : 62.5 — — 3Y2O3 • 5Fe2O3.
Er 2O3—F e2O3 50:50 37.5 : 62.5 1500 6 Er2O3 • Fe2O3. ЗЕг2О3 * ЗЕвдОэ»
TU2O3—FCgOg 37.5 : 62.5 — — 3Tu2O3 • 5Fe2O3.
66.7 : 33.3 1350 6 Yb2O34-Yb2O3 • Fe2O3.
Yb2O3—F e2O3 50 : 50 1500 6 Yb2Og • FegOg.
37.5 : 62.5 — — 3Yb2O3 • 5Fe2O3.
Системы с окислами редкоземельных элементов
333
Таблица 2 (продолжение)
Структурный тип Сингония Параметры элементар- ной ячейки Примечания
а, А ь, А с, А а, град.
Тип С + неизвестен. Неизвестен + корун- да. Неизвестен. Неизвестен + корун- да. Корунда. Кубическая + неизвест- ная. Неизвестная + ромбоэд- рическая. Неизвестная. Неизвестная + ромбоэд- рическая. Ромбоэдрическая. — — —
сыо железа
Перовскита. Ромбическая. 5.545 7.851 5.562 — По Роту [5].
» » 5.495 5.578 7.810
» & 5.441 5.573 7.753 — 1 По Геллеру и 1 Вуду [4].
$ » 5.394 5.592 7.711 —
Граната. Кубическая. 12.524 — — По Берто и Фор-
ра [1].
Перовскита. Ромбическая. 5.371 5.611 7.686 — По Геллеру и Ву-
ДУ [4].
Граната. Кубическая. 12.518 — — — По Берто и Фор-
ра [fl.
Перовскита. Ромбическая. 5.346 5.616 7.668 — По Геллеру и Ву-
ДУ [4].
Граната. Кубическая. 12.479 — — — По Берто и Фор- ра [fl.
Тип с + перовскита. Кубическая + ромбиче-
ская.
Перовскита + грана- Ромбическая + кубиче-
та. ская.
Перовскита. Ромбическая. 5.30 7.62 5.59 —
Граната. Кубическая. 12.414 — — — По Берто и Фор-
ра [1].
Перовскита + грана- Ромбическая + кубиче-
та. ская.
Перовскита. Ромбическая. 5.30 7.58 5.59 —
Граната. Кубическая. 12.380 — — — По Берто и Фор-
ра [1].
Перовскита. Ромбическая. 5.279 7.609 5.590 —
Граната. Кубическая. 12.376 — — — По Берто и Фор- ра [fl.
Перовскита. Ромбическая. 5.26 7.58 5.58 —
Граната. Кубическая. 12.349 — — — 1 По Берто и
» » 12.325 — — — J Форра [1].
Тип С + перовскита. Кубическая + ромбиче- — — — —
ская.
Перовскита. Ромбическая. 5.22 7.56 5.58 —
Граната. Кубическая. 12.291 — — — По Берто и Фор-
ра [1].
334
Системы с окислами редкоземельных элементов
Система Состав, мол. % Термическая обработка Фавн, идентифицированные рентгенографическим методом
темпе- ратура, время, часы
50:50 1300 6 LU2O3 * РвгОз»
Ll^Og—FfijOs 50: 50 37.5 ; 62.5 1500 6 » ЗЪПгОз * ЬРвгОз*
50: 50 1350 6 Ш2О3 т. р. + Fe2Os т. р.
IH2O3—FC2O3 50 : 50 1500 6 То же.
50 : 50 1350 6 ЗсзОз т. P- + Fe2Os т. р.
SC2O3—FC2O3 50 : 50 37.5 ; 62.5 1500 1350 6 6 ЗсзОз т. р. SC3O3 Т. р. + FejO3 Т. р.
V. Системы с оки
La?O4—Sc?O« 50 :50 — — Ьа2О3 * SC2O3.
Рг2Ов—ScjOg 50: 50 — — РГ2О3 * Sc2O3.
NdjOs—SC2O3 50 :50 — Nd2o3 • ЗСгОв*
Sm2O3—SCjOs 50 : 50 1650 9.5 S1H2O3 * Sc2O8.
EU2O3—“SC2O3 50: 50 1650 9.5 Eu2O3 . SCjO3.
66.7 : 33.3 1650 6 Gd2Os т. р. + Gd2O3 • SCjO3.
Gd 2 О з*-S C2O 3 50 : 50 37.5 : 62.5 1500 6 GdgOs • SC2O3. Gd2O3 • SC2O3 + SC2O3 T. p.
37.5 : 62.5 1650 6 To же.
66.7 : 33.3 1500 6 Dy2Os t. p. + Dy2Os • Sc2Os.
ПугОз SC2O3 50 : 50 1650 9.5 Dy2O3 • SC2O3.
50 : 50 1875 0.3 Ho2Os т. p. + Ho2O3 • Sc2O3 + Sc2O3 t. p.
Ho,O3—SCjOs 50: 50 50 : 50 1900 1950 1 1 To же. » »
50 : 50 2000 6.3 (1 — x)Ho2O3 • хвСзОз T- p. + Ho„Os • Sc,O3.
50: 50 1650 9.5 Y2O3 t. p. + Y3O3 • ScjOj + Sc2O3 t. p.
Y2O3—SC2O3 50 ; 50 1890 0.3 (1 — x)Y20s • хвСзОз т. p.
50: 50 1650 9.5 Er2O3 t. p. + ScjO3 t. p.
Er2Os—SCjOs | 50: 50 1850 0.7 (1 — x)Er2Oa • xSc2O3 t. p.
50*50 1650 9.5 Yb2Os T. p. + Sc2Os t. p.
YbsOtf—SC2O8 50 :50 1850 0.3 (1 — x)Yb2Os • хвСзОз т. p.
LU2O3—SC2O3 50:50 1650 9.5 (1 — x)Lu2O3 • хвСзОз т. p.
If^Os^-SCjOg 50 :50 1350 (1 — x)In2O3 • xSCjOs T. p.
Системы с окислами редкоземельных элементов
335
Таблица 2 (продолжение)
СТРУКТУР™® тип Сингония Параметры элементар- ной ячейки Примечания
а, А Ь.А с, А град.
Перовскита. » Граната. Ромбическая. » Кубическая. 5.21 12.277 7.55 5.55 — По Бе{)то и Фор-
Тип С + корунда. То же. Тип С + корунда. Тип С. Тип С + корунда. сыо скандия Перовскита. » Кубическая + ромбиче- ская. То же. » » Кубическая. Кубическая + ромбоэд- рическая. Ромбическая. » 5.678 5.615 5.787 5.776 8.098 8.027 — | По Геллеру [2].
» » » Тип В + перовскита. Перовскита. » » Моноклинная + ромби- ческая. Ромбическая. 5.574 5.53 5.51 5.487 5.771 7.95 7.94 5.756 7.998 5.76 5.76 7.925 — По Геллеру [2].
Перовскита + тип С. То же. Тип С + перовскита. Перовскита. Тип С + перовскита + + тип С. То же. » » Тип С + перовскита. Тип С + перовскита + + тип С. Тип С. Тип С + тип С. Тип С. Тип С + тип С. Тип С. | Ромбическая + кубиче- ская. То же. Кубическая + ромбиче- ская. Ромбическая. Кубическая + ромбиче- ская + кубическая. То же. » » Кубическая + ромбиче- ская. Кубическая + ромбиче- ская + кубическая. Кубическая. Кубическая + кубиче- ская. Кубическая. Кубическая + кубиче- ская. Кубическая. » » 5.43 7.89 5.71 Ill II II 1 III II II 1
336
Системы с окислами редкоземельных элементов
Система Состав, мол. % Термическая обработка Фазы, идентифицированные рентгенографическим методом -
темпе- ратура, время, часы
LftgOg*- III2O3 КАгОз”- III2O3 SIH2O3—II12O3 вДгОз- I1I2O3 ОугОз—I1I2O3 • НО2О3— III2O3 Er2Os—1П2О3 TU2O з—IJI2O3 УЬгОз—1П2О3 LU2O3—I1I2O3 1. Bertaut 2. Geller S 3. Geller S 50: 50 95 :5 85 : 15 75 : 25 66.7 : 33.3 50 : 50 33.3 : 66.7 66.7 : 33.3 50 : 50 33.3 : 66.7 66.7 ; 33.3 50 :50 33.3 : 66.7 95 :5 75 : 25 66.7 : зз.з 50 : 50 50 :50 33.3 : 66.7 50 : 50 50 : 50 • 50 : 50 50 : 50 50 : 50 Лит F., F. F о г г , Acta cry st; , U. В. В a 1350 1500 1500 1500 1500 1350 1500 1500 1350 1500 1600 1600 1600 1600 1600 1600 1600 1650 1600 1600 1600 1600 1600 1600 epai a t, С dlogr., a, Ac 0.5 2 2 2 2 0.2 2 2 0.5 2 2 1 2 2 2 2 1 3 2 1 1 1 1 1 УРа ,ompt. 10, № ta crys VI. Системы с оки La2O3 * In2O3. (1 — x)Nd2O3 • xIn2O3 т. р. (1 — x)Nd.2O3 • »In2O3 т. р. 4- Nd3O3 • In2O3. То же. » » Nd2Oa * 1п2О3. Nd2O3 • In2O3 -I- In2O3* SmaOs т. p. + Sm2O3 • In2O3. Sm2O3 • In2O3. Sm2O3 In2Oa + In2Oa T. p. Gd2Oa t. p. + Gd2O3 • In2O3. Gd2O3 * In2O3. Gd2O3 In2O3 t. p. + In2O3 t. p. Dy2O3 T. p. + (1 — x)Dy2O3 • xIn2O3 T. p. (1 — »)Dy2O3 • xIn2O3. (1 — x)Dy2O3 • xIn2O3 t. p. + + Dy20a • In2O3 T. p. Dy2Oa • In2o3. (1 — x)Dy2O3 • xIn2O3 T. p. + In2O3 T. p. Dy2O3 • In2O3 T. p. + In2O3 T. p. (1 — X)Ho2O3 • »In2Oa T. p. (1 — х)ЕГ,О3 • xIn2O3 T. p. (1 — x)Tu2O3 • xIn2O3 T. p. (1 — »)YbaO3 • xIn2O3 T. p. (1 — »)LUaO3 • xIn2O3 T. p. к табл. 2 rend., 244, № 1, 96, 1957. 4, 243, 1957. tallogr., 9, Ks 12, 1019, 1956.
Системы с окислами редкоземельных элементов
337
Таблица 2 (продолжение)
Структурный тип Сингония Параметры элементар- ной ячейки Примечания
а, А ь.А с, А град.
СЬЮ индия
Перовскита. Ромбическая. 5.723 8.207 5.914 — По Роту [5].
Тип В. Моноклинная. — — — —
Тип В + перовскита. Моноклинная + ромби- — — — —
ческая.
То же. То же. — — — —
» » » » — — — —
Перовскита. Ромбическая. 5.627 8.127 5.891 — По Роту [5].
Перовскита + тип С. Ромбическая + кубиче- — — — —
ская.
Тип В + перовскита. Моноклинная + ромби- — — — —
ческая.
Перовскита. Ромбическая. 5.589 8.082 5.886 — По Роту [5].
Перовскита + тип С. Ромбическая + кубиче- — — — —
ская.
Тип В + неизвестен. Моноклинная -|- неиз- — — — —
вестная.
Неизвестен. Неизвестная. — — — —
Неизвестен + тип С. Неизвестная + кубиче- — — — —
ская.
Тип С + тип В. Кубическая + моно- — — — —
клинная.
Тип В. Моноклинная. — — — —
Тип В + неизвестен. Моноклинная + неиз- — — — —
вестная.
Неизвестен. Неизвестная. — — — —
Тип В + тип С. Моноклинная + кубиче- — — — —
ская.
Неизвестен + тип С. Неизвестная + кубиче- — — — —
ская.
Тип С. » Кубическая. » — — — —
» » » » — __ — —
4. G е 11 е г S., Е. A. W о о d, Acta crystallogr., 9, № 7, 563, 1956.
5. Roth R. S., Journ. Res. Nat. Bur. Stand., 58, № 2, 75, 1957.
6. Warshaw I., R. R о y, Bull. Amer. Ceram. Soc., 42, № 4, 169,.1959.
7. W о о d E. A., Acta crystallogr., 13, № 9, 682, 1960.
22 H. А. Торопов и др., кн. 1
ГЕРМАНАТНЫЕСИСТЕМЫ
Li 20—GeO 2
Система изучена Будниковым и Тресвятским [1]. Эти авторы
подтвердили существование двух соединений — Li2GeO3 и Li4GeO4,
обнаруженных Шварцем [4].
Рис. 305. Диаграмма состояния
системы LiaO—GeOa.
На рис. 305 представлена диаграмма состояния системы
Li2O—GeO2 по данным Будникова и Тресвятского. Авторы уста-
Таблица 1
Инвариантные точки системы Li2O—GeO2
Точка Фазы процесс Состав, мол. "/„ Темпе- ратура,
Ы20 GeOa
1 Li4GeO4+ жидкость. Плавление. 40 60 1295+3
2 Li4GeO4+Li2GeO3 + жид- кость. Эвтектика. 25 75 1115+3
3 LiaGeO3 + жидкость. Плавление. — — 1237 ±3
4 LiaGeO_, -j- GeOa + жидкость. Эвтектика. 25 75 920+3
5 GeOa рут. + GeOa кварц. + 4- жидкость. Полиморфное превращение. 15 85 1035 +3
6 GeOa -j- жидкость. Плавление. 0 100 1115+3
Кристаллические фазы системы Ы20—GeO2
Таблица 2
Соединение Система кристалла Габитус Спай- ность Ng Nm Np Кристаллическая структура
Li2O. — — — — — — Гранецентрированная кубическая решетка, а=4.602А.
LijGeOg. Кубиче- ская. — Ясная. — 1.686 — 0 бъемноцентрированная кубическая решетка, а=6.795А.
СеО2 кварц. Гексаго- нальная. — — 1.724 — 1.705 а = 4.972, с = 5.648 А
GeO2 рут. Тетраго- нальная — — 1.985 — 1.945 а = 4.396, с = 2.863 А
340
Германатные системы
новили, что при температуре 1035 +3° в составах от 85 до 96 мол. %
GeO2 наблюдается полиморфное превращение GeO2.
Согласно Кришна Мэрзи и Ипу [2], в системе существует пять
соединений с температурами плавления: Li2O-7GeO2—1033°,
3Li2O-8GeO2 — 953°, Li2O-GeO2 - 1245°, 3Li2O-2GeO2 - 1125°
и 2Li2O-GeO2 - 1280°.
Виттманн и Модерн [5 ] синтезировали в виде монокристаллов
пять германатов лития: Li4GeO4, LieGe2O7, Li2Ge4O9, Li4Ge9O20
и Li2Ge7O15.
Модерн и Виттманн [3] определили структуру дигерманата
лития Li2Ge2O5, кристаллы которого получили девитрификацией
соответствующего стекла при 500°. Li2Ge2O5 имеет сложную струк-
туру, изоморфную Li2Si2O5, пространственная группа Се;
параметры элементарной ячейки: а=5.99, Ь=15.19, с=4.97 А,
(3=90.0°; плотность пикнометрическая 3.47 г/см®, вычисленная
3.51 г/см3.
Литература
1. Будников П. П., С. Г. Тресвятский, ДАН СССР, 99, № 5,
761, 1954.
2. Krishna Murthy М., J. I р, Journ. Amer. Ceram. Soc., 47, № 7,
328, 1964.
3. Modern E., A. Wittmann, Monatshefte Chem., 96, № 6,1783,1965.
4. Schwarz R., Ber. Dtsch. chem. Ges., 62, 2479, 1929.
5. Wittmann A., E. Modern, Monatshefte Chem., 96, № 2, 581, 1965.
Na2O—GeO2
Систему изучали Шварц и Гейнрих [5] и Тресвятский [1].
Установлено образование двух конгруэнтно плавящихся соеди-
нений: Na2GeO3 и Na2Ge4O9 (рис. 306). Соединение Na2Ge2O5
не обнаружено. Эвтектика между GeO2 и Na2Ge4O9 содержит
92.5 мол. % GeO2 и между Na2Ge4O9 и Na2GeO3 66.6 мол. % GeO2.
Агайо и Кришна Мэрзи [2 ], подтверждая существование сое-
динений Na2O-GeO2 и Na2O-4GeO2, указывают несколько иные
температуры плавления эвтектик. Так, по их данным, эвтетика
между Na2O-4GeO2 и GeO2 имеет температуру 950+10°.
Ингри и Лундгрен [3] для богатого двуокисью германия сое-
динения принимают формулу Na4Ge9O20(2Na2O-9GeO2). Это сое-
динение образует тригональные кристаллы с параметрами эле-
ментарной ячейки: а=14.98+0.01, с=7.384 +0.005 А.
Кришна Мэрзи и Агайо [4] в работе 1964 г. уже отрицают
формулу Na2O-4GeO2 и принимают соединение 2Na2O-9GeO2
Рис. 306. Диаграмма состояния
системы NaaO—GeO2 (по Тре-
святскому).
Рис. 307. Диаграмма состояния системы NaaO— GeOa
(по Кришна Мэрзи и Агайо).
342
Германатпые системы
с температурой плавления jl073+3° (рис. 307). Эти авторы поль-
зовались методом закалки, дополненным дифференциальным терми-
ческим анализом. Для идентификации фаз применялась рентгено-
графия и микроскопические наблюдения. Соединение Na2O -GeO2
плавилось при 1103+15°. Эвтектика между GeO2 и 2Na2O-9GeO2
содержит 94.5 вес. % GeO2 и плавится при 950+10°, между
2Na2O-9GeO2 и Na2O-GeO2 содержит 75 вес. % GeO2 и плавится
при 790+10°. При охлаждении расплавов, содержащих не больше
25 вес. % Na2O (36 мол. %), получались стекла. Показатель свето-
преломления и плотность стекол имеют максимальное значение
при содержании 16—18 мол. % Na2O.
Литература
1. Т р е с в я т с к и й С. Г., Допов1д> АН УРСР, № 3, 295, 1958.
2. Aguayo J., М. Krishna Murthy, Glass Industry, 44, № 7,
377, 1963.
3. In^ri N., G. Lundgren, Acta chem. Scand., 17, № 3, 617, 1963.
4. Krishna Murthy M., J. Aguayo, Journ. Amer. Ceram. Soc.,
47, № 9, 444, 1964.
5. Schwarz R,, F. He inrich, Zs. anorgan. allgem. Chem., 205, № 1,
44, 1932.
K2O—GeO3
Систему в концентрационных пределах от соединения К2О •GeO2
до чистого GeO2 изучили Шварц и Гейнрих [4]. Кроме ранее
известного соединения K2O-GeO2, получено еще два соединения:
K2O-2GeO2 и K2O-4GeO2 (рис. 308). Все эти соединения плавятся
без разложения.
Кришна Мэрзи [1], исследуя систему методом закалки, полу-
чил четыре соединения: K2O-GeO2, K2O-2GeO2, 3K2O-llGeO2,
K2O-7GeO2. Соединение K2O-4GeO2 не обнаружено. Соединение
K2O-7GeO2 плавится инконгруэнтно при 950° с образованием
3K2O-llGeO2 и жидкости. Эвтектика между K2O-7GeO2 и GeO2
плавится при 895+10° и содержит приблизительно 92.7% GeO2.
3K2O-llGeO2 плавится конгруэнтно при 1055+10°.
Виттманн и Папамантеллос [5], обезвоживая цеолитоподобный
гидрогерманат калия K3HGe7O17 -4Н2О, получили соединение
K4Ge9O20, которое при 620° диссоциирует с образованием K2Ge4O9.
Впоследствии эти же авторы [3] получили K4Ge9O20 путем дли-
тельной кристаллизации стекла выше 500°.
Модерн и Виттманн [2] при низкотемпературной (550°) кри-
сталлизации стекла получили новое соединение K2Ge6O13 с куби-
ческой решеткой (параметр а=13.48 А) и плотностью (пикно-
Германатные системы
343
метрической) 3.93 г/см3. Это соединение распадается уже несколько
выше 600°. Кристаллизацией соответствующего расплава был
получен еще один германат калия К2О -8GeO2(K2Ge8O17), с ромби-
ческой псевдотетрагональной элементарной ячейкой с парамет-
рами а=13.37, Ь=13.37, с=8.855 А; плотность 3.36 г/см3.
Литература
1. Krishna Murthy М., Bull. Amer. Ceram. Soc., 43, № 4, 262,1964.
2. Modern E., A. W i t t m a n n, Monatshefte Chem., 97, № 4,1242, 1966.
3. Papamantellos P., A. Wittmann, Monatshefte Chem., 92,
№ 3, 805, 1961.
4. Schwarz R., F. H e i n r i c h, Zs. anorgan. allgem. Chem., 205, № 1,
44, 1932.
5. Wittmann A., P. Papamantellos, Monatshefte Chem.,
91, № 5/6, 855, 1960.
Rb2O—GeO2
Диаграмма состояния системы не построена. Модерн и Витт-
манн [1 ] в продуктах кристаллизации стекол с высоким содержа-
нием GeO2 обнаружили Rb2Ge6O13, Rb2Ge7O15 и Rb2Ge8O17. Сое-
динение Rb2Ge8Ol3 с кубической решеткой (параметр а=13.63 А)
344
Германатные системы
имеет пикнометрическую плотность 4.27 г/см3. Соединение
Rb2Ge7O15 в виде монокристаллов было получено термической
обработкой стекла (состав 1 : 7) при 750° (40 час.). Оно имеет
триклинную ячейку с параметрами а=7.54, 6=14.13, с=7.52 А,
а=90.5°, р=121.0°, у=90°, Z=2; пикнометрическая плотность
4.40 г/см3. Соединение Rb2Ge8O17 получалось кристаллизацией
стекла при 700°; плавится инконгруэнтно, образуя смесь Rb2Ge6O13
и GeO2 (кварцевая форма). Ромбическая элементарная ячейка
этого соединения имеет параметры: а=13.58, 6=13.58, с=8.84А;
пикнометрическая плотность 4.16 г/см3.
Литература
1. М о d е г n Е., A. W i t t m a n n, Monatshefte Chem., 97, № 4, 1242, 1966.
Cs2O—GeO2
Диаграмма состояния системы не построена. Модерн и Витт-
манн [1 ] кристаллизацией богатого двуокисью германия стекла
при 750° (65 час.), помещенного во избежание улетучивания
в кварцевую ампулу, получили монокристаллы Cs2Ge5On. Моно-
клинная (псевдоромбическая) ячейка этого соединения имеет
параметры: а=11.89, 6=14.36, с=7.02 А, [3=90°; эксперимен-
тальная плотность 4.47 г/см3. Будучи нагрет до 850°, пентагерма-
нат переходит в кубический гексагерманат Cs2GeeO13 с параме-
тром элементарной ячейки а=13.78 А; пикнометрическая плот-
ность Cs2Ge8O13 4.61 г/см3.
Литература
1. Modern Е., A. Wittmann, Monatshefte Chem., 97, № 4,1242, 1966.
MgO—GeO2
Представляет интерес, как и все германатные системы, для
сравнения химии германия и кремния. Двуокись германия
является, как и кремнезем, стеклообразующим окислом и имеет
тетраэдрическую кислородную координацию.
Изучена Роббинсом и Левиным[ 4]; построенная ими диаграмма
равновесия приводится на рис. 309 (температура плавления
2MgO-GeO2 — по данным Рингвуда [2]; температуры инверсии
Германатные системы
345
825 и 1007° — по данным Дачилла и Роя [1 ] и Шефера и Роя [5 ]
соответственно).
Область двух несмешивающихся жидкостей появляется при
1483+10° и простирается от 8 до 34 мол. % MgO. В статье Роб-
Рис. 309. Диаграмма состояния
системы MgO—GeO2.
С — MgO • GeO2 (тип клияоэнстатита?);
Е — MgO • GbO2 (тип энстатита); F —
2MgO • GeO2 (тип форстерита); Gq —
GeO2 (тип кварца); Сд — GeO2 (тип ру-
тила); Н — 4Mgo GeO2; Р — MgO;
S — 2MgO GeO2 (тип шпинели).
2000
1800
1600
moo
1200
1000
BOO
°C
2800
Р+Ж ^55 ±30'
F$
Р+Г
W±/g°g
\j700±2lf
~Ct)P
F*C_^
I555±S°
Е+Ж'
П83±Ю° °-°i;
P+H
H+F
F+E
825
H+S
Е+Ж
1099 ±5°
1007 ±10° ;
^4
1116
<25
0 20 90 60 80 100
Мол % (*еог
бинса и Левина приводятся межплоскостные расстояния для
всех двойных соединений системы.
Структурный тип и оптические и рентгенографические данные
соединений по данным различных авторов приводятся в табл. 1 и 2.
Таблица 1
Структурный тип соединений системы MgO—GeO2
Соединение
MgO-GeO2(C).
MgO.GeOJfi').
2MgO-GeO2(F).
GeO2.
GeO2.
4MgO-GeO2.
MgO.
2MgO-GeO2 (5).
Структурный тип
Возможно, клиноэнстатитовый.
Энстатитовый.
Форстеритовый (оливиновый).
Кварцевый.
Рутиловый.
Относится к гексагональной системе.
Периклаз (NaCl).
Шпинельный.
346
Германатные системы
Рингвуд и Сибрук [3] показали, что в условиях высоких
давлений может быть получена новая модификация MgGeO3
с корундовой структурой.
Таблица 2
Оптические и рентгенографические характеристики соединений системы
MgO—GeO2
Соединение Оптические свойства Параметры решетки, А Примечания
4MgO GeO2 Np =1.740+0.003 Ng = 1.750+0.003 ОДНООСНЫЙ (+) или двуосный с малым (+) 2V Гексаго- нальная а =11.773 с =14.448 Медленно диссоциирует при 1495+10° на MgO и 2MgO • GeO2 (форстери- товая форма).
2MgO GeO2 (шпинель) А = 1.76 а = 8.255 Превращается в форсте- ритовую (оливиновую) структуру при 825°.
2MgO • GeO2 (тип форсте- рита) Ng = 1.765) Атп = 1.7171+0.003 Np = 1.698] (+) 27 st 65° а =4.915 6 = 10.295 с = 6.020 Плавится конгруэнтно при 1855+30°.
MgOGeO2 (тип энста- тита) Ng = 1.759) Nm = 1.755 ]+0.003 Np = 1.741] (—) 2 V st 70° а= 18.661 6 = 8.954 с = 5.346 Превращение выше 1555+5°.
MgO • GeO2 (тип клино- энстатита) Ng — 1.790 Np = 1.757 угол погасания 20—22° , О О СМ со о со чн О О ОО LQ чн IIIIIIII от. Плавится конгруэнтно при 1700+20°. Медлен- но превращается в эн- статитовую форму ниже | 1555°.
Литература
1. D а с h i 11 е F., R. R о у, Geol. Soc. Amer. Bull., 67, № 12, pt. 2,1682,
1956.
2. Ringwood A. E., Amer. Journ. Sci., 254, № 11, 707, 1956.
3. R i n g w о о d A. E., M. S e a b г о о k, Journ. Geophys. Res., 67, № 10,
1690, 1962.
4. Robbins C. R., E. M. L e v i n, Amer. Journ. Sci., 257, № 1, 63, 1959.
5. S h a f e r E. C., R. R о y, Tenth Technical Report on U. S. Army Signal
Corps, Contract DA, 36-039, SC63099, 1956.
Германатные системы
347
СаО—GeO2
Интересна как аналог системы СаО—SiO2 с точки зрения нали-
чия у германатов кальция вяжущих свойств.
Таблица 1
Кристаллооптические свойства 2СаО • GeO2 и ЗСаО • GeO2 [3]
Соединение Габитус Ng Np Двупре- ломле- ние 2уо Примечания
2СаО GeO2 Ромбиче- ские или округлые зерна. 1.734 1.700 0.034 (+)80 Белый или светлый со слабым зеле- новатым или розо- ватым оттенком.
ЗСаО• GeO2 ? 1.759 1.754 0.005 — Светлый с желто- ватым оттенком.
Двухкальциевый германат синтезировался Журавлевым [2, 3],
Людекенсом [7] и Рояком и Прохватиловой [51. Последние два
Рис. 310. Диаграмма состояния системы СаО—GeO2
(по Ширвинской, Гребенщикову и Торопову).
348
Германатные системы
Показатели светопреломления и структурные характеристики германатов кальция
03
а
tr
И
ю
а
Н
Плот- ность, г/смэ Щ 05 СО СО Щ CD тч ID CD L.Q CD Г*. QO CD CO O* co CO CO Nf Nf
Структурный аналог ob SS J о" C/2 Я Я C/2 Я r! cJ я । । я । я я и а со. ид
Параметры элементарной ячейки а=12.43, 6=7.24, с=25.50А; а=90°0', 0=89°48', у=89°54' а=5.49, с=7.09А а=6.82, 6=5.25, с=11.4А а=8.15, 6=7.58, с=7.31 А; а=90°0Г, Р=94°28', у=103°27' а=11.12, с=4.73 А
Симметрия Триклинная. Гексагональная. Ромбическая. Триклинная. Гексагональная.
Показатели светопрелом- ления № | О О ь- 05 ш о со о о- ь- о- о- оо • ш • • • • 2?
Ng | -ч-и 00 -чч Щ 05 Ш 00 г*. г*. Г— г*. 00 тч тч тч тч тч
Соединение CaaGeO& a-Ca2GeO4 y-Ca2GeO4 Ca3Ge2O7 CaGeOg, волластони- товая форма . . CaGe2O6 CaGe4O9
автора синтезировали также
трехкальциевый германат.
Двухкальциевый германат
синтезировался из карбоната
кальция и GeO2 при 1450°
(с повторными обжигами), а
трехкальциевый германат
при 1500° (также с повторны-
ми обжигами). Оба получен-
ные германата кальция при
смешивании их порошков с
водой схватывались и затвер-
девали, причем схватывание
трехкальциевого германата
наступало быстро (конец схва-
тывания через 15 мин.). Оба
минерала растворяются в
15 %-м растворе борной кис-
лоты, как и их аналоги
2CaO-SiO2 и 3CaO-SiO2.
Диаграмму состояния си-
стемы построили Ширвинс-
кая, Гребенщиков и Торо-
пов [6]. В соответствии с
рис. 310 в системе установ-
лено шесть соединений:
Ca3GeO5, Ca2GeO4, Ca3Ge2O7,
CaGeO3, CaGe2O6 и CaGe4O9.
Соединение Ca3Ge2O7 (герма-
ниевый ранкинит) получено
впервые. В системе обнару-
жено поле расслаивания двух
жидкостей в области, про-
стирающейся от 86 до 96
мол. % GeO2. Купол расслаи-
вания ограничен горизонталь-
ной линией, лежащей при
температуре 1280°. Критиче-
ская точка находится при
температуре 1370°. Трех-
кальциевый германатСа3СеОв
(германиевый алит) устойчив
винтервале температур 1320—
1880°. При 1300° Ca3GeOB раз-
лагается в твердом состоянии
Германатные системы
349
на Ca2GeO4 и СаО, которые и являются равновесными фазами
в интервале концентраций от 0 до 33 мол. % GeO2. Для мета-
стабильного Ca3GeOB характерны три фазовых превращения,
протекающих при температурах 754, 1034 и 1163°. Эти превра-
щения связаны со следующими структурными переходами Ca3GeOB:
„ , 754° „ 1034° „ 1163°
триклинныи I —* триклинныи III —» моноклинный —> ром-
боэдрический. Ортогерманат кальция Ca2GeO4 существует
в двух модификациях с точкой перехода 1490°. Выше 1490° устой-
чива гексагональная форма, изоструктурная с a-Ca2SiO4. Низко-
температурная модификация y-Ca2GeO4 имеет оливиновый тип
структуры и является изотипной с y-Ca2SiO4. Германат состава
Ca3Ge2O7 плавится инконгруэнтно по схеме Ca3Ge2O7
T-Ca2GeO4+жидкость с температурой перитектической реак-
ции 1410°.
Метагерманат кальция CaGeO3 в отличие от его силикатного
аналога обнаружен при обычных условиях только в одной струк-
турной разновидности, подобной волластониту. При высоком
давлении была получена новая модификация метагерманата
кальция с гранатовой структурой, в которой германий находится
в четверной и шестерной координации Са^е^ [GeIVO4]3. Опти-
ческие характеристики германатов кальция приведены в таблице.
Кузнецов, Тананаев и Шпирт [4] изучили взаимодействие дву-
окиси германия с СаО до температуры 1000°. В продуктах реакции
обнаружены соединения CaO>GeO2, CaO>2GeO2, 2CaO>GeO2,
а также новая фаза, возможно представляющая третью модифи-
кацию ортогерманата 2CaO*GeO2.
Литература
1. Гребенщиков Р. Г., А. К. Ширвинская, В. И. Шитова,
Н. А. Т о р о п о в, в сб.: Химия высокотемпературных материалов,
изд. «Наука», Лен. отд., Л., 105, 1967.
2. Ж у р а в л е в В. Ф., Журн. прикл. хим., 13, № 8, 1141, 1940.
3. Ж у р а в л е в В. Ф., ДАН СССР, 59, № 6, 1145, 1948.
4. К у з н е ц о в В. Г., И. В. Т а н а н а е в, М. Я. Ш п и р т, Журн.
неорг. хим., 9, № 8, 1934, 1964.
5. Рояк С. М., И. А. П р о х в а т и л о в а, ДАН СССР, 141, № 4, 880,
1961.
6. Ширвинская А. К., Р. Г. Гребенщиков, Н. А. Торопов,
Изв. АН СССР, неорг. матер., 2, № 2, 332, 1966.
7. L u d е k е n s W. L. W., Journ. Inorg. Nucl. Chem., 3, № 5, 281, 1956.
350
Германатные системы
SrO—GeO2
Кристаллические фазы системы интересны как структур-
ные аналоги соответствующих силикатных фаз.
°C
2100
1900
SrO
- +
Ж
Sr3GeO5+)K
\l9907 ,
\rx1880
1700
1500
1300
1100
900
1760
SrO
Sr.fieO'+JK
'Sr3&eOs
SrO+Sr^eO^
Г
A”
SrGeJk+IK
12807Ж+Ж.
1110°
SrGe^Og
+GeO3
1136
Жидк.
ЗгйеО^Ж
1990
1380
1150°
SrOeO3
+5г0еч03
О 20 90 60 80 ЮО
SrO Мол.°/о &е03
Рис. 311. Диаграмма состояния си-
стемы SrO—GeOa.
стеме обнаружена ликвация в
Установлено существова-
ние трех соединений: орто-
германата Sr2GeO4 с оливи-
новой структурой [5], мета-
германата SrGeO3 типа a-вол-
ластонита, имеющего, веро-
ятно, две политипические
модификации [2, 3], и тетра-
германата SrGe4Oe [4].
Метагерманат стронция
имеет гексагональную ячей-
ку: a-7.265, с=10.53 кХ.
Система специфична как
модельная по отношению
к стронциевосиликатной. Пол-
ностью систему изучили Гре-
бенщиков, Ширвинская, Пар-
фененков, Шитова и Торо-
пов [1]. Помимо ранее из-
вестных соединений, впервые
получен трехстронциевый
германат Sr3GeOB, плавящий-
ся конгруэнтно при 1940° и
разлагающийся в твердом со-
стоянии ниже 1300° на Sr2GeO4
и SrO (рис. 311). В си-
концентрационном интервале
90—95 мол.% GeO2; горизонтальная линия находится на уровне
1250°. Показатели светопреломления и плотность германатов
стронция приведены в таблице.
Показатели преломления и плотность германатов стронция
Соединение Ng Np Ng—Np Плотность. г/см3
Sr3GeO6 1.825 1.81 0.015 5.045
Sr»GeO4 SrGeO3 (псевдоволластонитовая • 1.80 1.775 0.025 5.03
форма, кольцевая) 1.724 1.670 0.054 4.35
SrGeO, (цепочечная форма) .... 1.716 1.710 0.006 —
SrGe4O9 1.775 — 4.88
ГерманатНыё системы
351
Литература
1. Гребенщиков, Р. Г., А. К. Ш и р в и н с к а я, В. Н. П а р фе-
не и к о в, В. И. Шит о в а, Н. А. Т о р о п о в, ДАН СССР, 174,
№ 4, 839, 1967.
2. Hilmer W., Naturwissensch., 45, № 10, 238, 1958.
3. Hilmer W., Silikattechnik, 11, № 9, 397, 1960.
4. Robbins C. R., E. M. Levin, Journ. Res. Nat. Bur. Stand., 65A,
№ 2, 127, 1961.
5. S t r u n z H., P. J а с о b, Neues Jahrb. Mineral. Abh., 94, № 2, 681,1960.
BaO—GeO2
Изучена Гребенщиковым, Тороповым и Шитовой [1] в суб-
солидусной области (обжиг при 1200—1450°). Установлено четыре
соединения: 3BaO-GeO2, 2BaO-GeO2, BaO-GeO2 и BaO-4GeO2.
Впервые синтезированный этими авторами трехбариевый гер-
манат Ba3GeO6 устойчив в твердом состоянии в температурном ин-
тервале 20—1500°. Это соединение имеет сложный, еще не изучен-
ный полиморфизм.
Кристаллические фазы системы ВаО—GeO2
^Соединенней г;-"?-*-’" г -'- • Покаватели светопреломлении Плот- ность, г/см3
Ng Np Ng—Np
3BaO-GeO2 1.91 1.90 0.01 5.79
2BaO.GeO2 1.87 1.83 0.04 5.71
ВаО-GeO» 1.726 1.678 0.048 4.73
BaO-4Ge(5a 1.805 1.780 0.025 5.09
GeO2 (кварцевая форма) 1.724 1.705 0.019 4.28
GeO2 (рутиловая форма) 1.985 1.945 0.04 6.28
Метагерманат BaGeO3 кристаллизуется в двух полиморфных
формах: пироксеноидной с цепочечным германокислородным ради-
калом, изученной Либау [7] и Гильмером [6], и псевдоволласто-
нитовой — с кольцевым радикалом. Точка превращения находится
выше 1100°. Последнюю модификацию Эуленбергер, Виттманн
и Новотный [5] индицировали как гексагональную и получили
параметры ячейки: а=7.61, с=10.82 kX. Ba2GeO4 структурно
относится к типу оливинов.
В дальнейшем Гребенщиков, Торопов и Шитова [3] получили
еще два германата: Ba3Ge2O7 и BaGe18O38 — и представили диа-
грамму состояния системы (рис. 312). Ввиду наличия полимор-
352
Германатные системы
физма у трехбариевого германата на диаграмме дана нонвариант-
ная линия инверсии при 1465°. Характер плавления Ba3GeO3
окончательно не установлен. В пользу инконгрузнтного плавления
при 1725° говорит аналогия в характере плавления силикатов и
°C
1900
1800
1100
1600
1500
1400
1300
1200
1100
1000
1917
ВаО'+Ж
1725'
Ba3GeOs+)K
Ваг8е0д+Ж
1835
1700'
ЙЙ?!
>
• BaO+Ba3GeOs (&m.)
1465
BaO+
Ba3GeOs(H.m.)
<&
О
ВаО
Ва30ег07+Ж
1735° /
BagGeOs
+Ж
ВаОецОд+Ж
1530
I
Ваг6е0^Ва^е307 ^uO^igGe^
'Ba3Ge0s (8.m.)+8a3Ge0it
Жидк. ।
1236'
Ва36еОч+Ж
1250°
ВаЕеОя+Ж
I i
1 t
11
Ваг6еОч+
BaGoOg
1105
BaSeOs+BaGeifOg
BaGe^Og
BaGetgOgg
20 40 GO
Мол. %
ё
S’
1130
80 100
6е02
+
£
't
ca
I
Рис. 312. Диаграмма состояния системы ВаО—GeOa (по Гребенщикову,
Торопову и Шитовой).
фторобериллов состава А3ВХ5. На диаграмме вынесен уча-
сток, демонстрирующий возможность конгруэнтного плавления
Ba3GeOB.
Участки бинарных систем BaGeO3—BaGe4O9 и BaGe4O8—
—BaGeieO38 являются простыми эвтектическими системами. В пер-
вой эвтектика находится при 1105°, во второй — при 1250°. Уча-
сток BaGe18O39—GeO2 представляет непрерывную серию твердых
растворов, которые в структурном отношении можно представлять
как дефектные решетки, образующиеся путем внедрения катионов
Германатные системы
353
бария в кварцеподобный каркас двуокиси германия. Соединение
Ba3Ge2O7 имеет средний показатель светопреломления 1.767;
соединение BaGei»O3e имеет Ng= 1.734, Np=1.725.
Роббинс и Левин [8] получили монокристаллы соедине-
ния BaGejOg с температурой плавления 1392+5° тригональной
структуры, пространственная группа РЗ;, параметры элементар-
ной ячейки: а=11.61, с=4.74; Z=3, плотность 5,12 г/см®.
Смолин [4] (определил структуру тетрагерманата бария
BaGe4O8, используя аномальное рассеяние рентгеновских лучей.
Пространственная группа, согласно этим данным, Р31тп; пара-
метры элементарной ячейки: а=11.41, с=4.74 A; Z=3.
Найденная структура, в согласии с предположением, выска-
занным Роббинсом и Левиным [8], содержит циклы германиево-
кислородных тетраэдров Ge3O9 и четвертый атом германия —
катион в шестерной координации (см. также [9]).
Литература
1. Гребенщиков Р. Г., Н. А. Торопов, В. И. Шитова,
ДАН СССР, 153, № 4, 842, 1963.
2. Г р е б е н щ и к о в Р. Г., Н. А. Торопов, В. И. Шитова,
Изв. АН СССР, неорг. матер., 1, № 7, 1130, 1965.
3. Гребенщиков Р. Г., А. К. Ш и р в и н с к а я, В. И. Шитова,
Н. А. Торопов, в сб.: Химия высокотемпературных материалов,
изд. «Наука», Лен. отд,, Л., 105, 1967.
4. С м о л и н Ю. И., Ю. Р. Ш е п е л е в, Изв. АН СССР, неорг. матер.,
3, № 6, 1034, 1967.
5. Eulenberger G., A. Wittmann, Н. Nowotny, Monatshefte
Chem., 93, № 5, 1046, 1962.
6. ? Н i 1 m е г W., Acta crystallogr., 15, № И, 1101, 1962.
7. L i е b a u F., Neues Jahrb. Mineral. Abh., 94, № 2, 1209, 1960.
8. R obbins С., E. L e v i n, Journ. Res. Nat. Bur. Stand., 65A, № 2,
127, 1961.
9. R о b b i n s С., A. P e r 1 о f f, S. В 1 о c k, Journ, Res. Nat. Bur.
Stand., 70A, № 5, 385, 1966.
A12O3—GeO2
Интересна как близкая к муллитовой системе.
Гельсдорф, Мюллер-Гессе и Швите [2] полагают, что в системе
существует единственное, синтезированное ими соединение
3Al2O3-2GeO2, которое они называют «германиевым муллитом»
по причине его структурного сходства с муллитом. Исследование
системы затруднено из-за летучести GeO2.
Перес-и-Джорба, Тарт и Коллонг [4] исследовали твердофазо-
вые реакции в системе, производя обжиги при 900, 1100 и 1350°
(в последнем случае в закрытой ампуле).
23 Н. А. Торопов и др., кн. 1
354
Германатные системы
При 900° появляется соединение с формулой, близкой
к Al2O3-2GeO2, и твердые растворы не обнаруживаются (рис. 313).
При 1100° на основе этого соединения образуются твердые рас-
творы (фаза А), причем область гомогенности распространяется
от 15 до 35 мол. % А12О3. При 1350° зта фаза распадается, образуя
смесь GeO2 и фазу В, обладающую также широкой областью гомо-
генности: от 40 до 65 мол. % А12О3.
Фаза А в структурном отношении сходна с метакаолином
Al2O3-2SiO2. Для фазы А получены параметры решетки: а=5.06,
А1г03, мол. %
33.3 50 SS.S
с -----------¥'------------------
1350 &еОг+В УЯЖШ В+А1г03
ЧОО - VZT&77X
900 ' С,еОг+А *1 А+А1г03 ________
Рис. 313. Фазы, установленные в системе
А12О3—GeO2 при исследовании реакций
в твердом состоянии.
А — фаза типа метакаолинита; В — фаза типа
муллита; С — фаза типа кианита.
Ь=9.18 А. Для метакаолина, по данным Бриндли и Робинсона [1]:
а=5.14, Ь=8.93, с=7.37 А, а=91°8', ₽=104°5', т=90°.
Ромбическая фаза В структурно близка к муллиту. Этот гер-
маниевый муллит имеет значительно более широкую область одно-
родности, чем обычный муллит, и включает состав, отвечающий
формуле Al2O3-GeO2.
Параметры решетки германиевого муллита видны из следую-
щих данных. Для твердого раствора, содержащего 50 мол. %
А12О3: а=7.648, Ь=7.793, с=2.930 А; для состава 60 мол. % А12О3:
а=7.664, Ь=7.780, с=2.926 А; для состава 66.6 мол.% А12О3:
а=7.672, 6=7.779, с=2.924 А. Муллит, по данным Саданага,
Токонами и Такеучи [5], имеет параметры решетки: а=7.583,
&=7.681, с-2.885 А.
Обжигом смеси состава Al2O34~GeO2 при температуре 1100°
была получена третья фаза С (рис. 313), которую можно рассмат-
ривать как аналог кианита.
По Миллеру с сотрудниками [3], ЗА12О3 • 2GeO2 плавится
инконгруэнтно при 1530 ± 15°. Сингония ромбическая. Ng = 1.758,
Np = 1.710. Эвтектика между ЗА12О3 • 2GeO2 и GeO2 плавится
при 1095 + 5°.
Германатные системы
355
Литература
1, Brindley G. W., К. Robinson, Mineral. Mag., 27, № 194, 242,
1946.
2, Gelsdorf G., H.Miiller-Hesse, H, E. Schwiete, Sprech-
saal, 94, № 19, 502, 1961.
3. M i 11 e r J. L., G. R. M cCor m ick, S. G. A m p i a n, Journ. Amer.
Ceram. Soc., 50, № 5, 268, 1967.
4. Perez у Jorba M., P. Tarte, R. Collongues, Compt.
rend., 257, № 22, 3417, 1963.
5. Sadanaga R., M. Tok on ami, Y. Takeuchi, Acta crystallogr.,
15, № 1, 65, 1962.
La2O8—GeO2
Система полностью не изучена. Корнилова, Прихидько и Ли-
леев [1 ] путем обжига смесей Ьа2О3 и GeO2 в интервале 1050—1300°
получили La2O3-GeO2=La2[GeO4]O, La2O3-2GeO2=La2Ge2O7 и
La2O3 •3GeO2=La2[GeO3]3.
Метагерманат лантана La2[GeO3]3 плавится при 1300° с разло-
жением на пирогерманат La2Ge2O7 и двуокись германия.
La2Ge2O7 и La2[GeO4]O плавятся без разложения (см. таблицу).
Некоторые свойства германатов лантана
Соединение Температура плавления, °C Плотность при 20°, г/См® Показатели светопреломления
Ng Np
La2GeOo (метагерманат) .... La2Ge2O7 (пирогерманат) . . . LaJGeOiJO (оксиортогерманат) . 1300+25 2050±25 1970+25 5.94 5.65 5.73 1.995 1.900 1.935 1.980 1.980 1.915
Литература
1. Корнилова Э. Е., Н. Е. Прихидько, И. С. Л и л е е в,
Изв. АН СССР, неорг. матер., 1, № 2, 227, 1965.
РЬО—GeO2
Изучена Филлипсом и Скрожером [1]. Обнаружено пять соеди-
нений. Соединения 4РЬ0 -GeO2, ЗРЬО -2GeO2 и РЬО >GeO2 плавятся
конгруэнтно соответственно при 1000, 745 и 795°. Соединения
PbO-2GeO2 и PbO-4GeO2 плавятся с разложением. Соединение
23*
356
Германатные системы
2PbO-GeO2, аналогичное существующему в системе РЬО—SiO2,
не получено.
Расслаивания расплавов не обнаружено. Показатель свето-
преломления стекол плавно возрастает от 1.60 для чистого
'0
1100
1000
900
В86°
\ PbrfeOgW
Pbo\
Ж '
В00
100
Жидк.
РЪОбдОд
+Ж
GeO2(Q)m.p.+)K I
GeO2(Q)m.p.-'\
PbGe^Og^GeOg (R)
GeOz(R)m.p.
GeO2(R)m.p.+W
'РЬ6б203^РЬ6Вц 0g
PbGeifOg-^Ж
РЬ^вОд+РЬбвдОд
PbGeo3+PbGe4Og
PbGeo3+M
РЬ^вдОу
+Ж
1116
PbtfGsOg
Pb^ez^
_____L—
2O1
W i 60
\ BO
: -,:.o2
PbO kP'bO-GeO2 3PbO-2GeOz PbO-2GeO3 PbO-‘f6eOi
Pb0-6e02 Bec-V°
100
Geo2
Рис. 314. Диаграмма состояния системы РЬО—GeOa.
GeO,(H) — двуонись германия типа рутила; GeOa(Q) — двуонись гер-
мания типа кварца.
GeO2 до величин, превышающих 2.0 для стекол, содержащих
больше 65% РЬО.
Позже Филлипс и Скрожер [2 ] построили диаграмму состояния
системы (рис. 314).
Литература
1. Phillips В., М. G. S с г о g е г, Glass Industry, 44, № 7, 378, 1963.
2. Р h i 11 i р s В., M. G. S с г о g e r, Journ. Amer. Ceram. Soc., 48, № 8,
398, 1965.
Германатные системы
357
TiO2—GeO2
Интересна с точки зрения полиморфизма GeO2 и промежуточ-
ного положения радиуса иона Ge4 + (0.53 А) между ионными ра-
диусами Ti4+ (0.64 А) и Si4+ (0.39 А).
Изучена Сарвером [1], установившим только частичную рас-
творимость в твердом состоянии между рутиловой формой GeO2
СеОг Мол.% Tio2
&ог мол.% Щ
Рис. 315. Изменение пара-
метра а для рутиловых твер-
дых растворов системы
TiOa— GeOa.
Рис. 316. Изменение пара-
метра с для рутиловых твер-
дых растворов системы
TiOa— GeOa.
Ge02 МОЛ. % Щ
Рис. 317. Изменение пара-
метра а для кварцевых
твердых растворов системы
TiOa— GeOa.
и ТЮ2. Определено изменение размера параметров а (рис. 315)
и с (рис. 316) для рутиловых твердых растворов, а также а
(рис. 317) для кварцевой формы твердых растворов в системе
GeO2—TiO2. Максимальная растворимость TiO2 в рутиловой и
P-кварцевой формах GeO2 составляет примерно 25 и 30 мол. %
соответственно. При 800° растворимость практически отсутствует.
Согласно Рою (устное сообщение, 1960 г.), область твердого рас-
твора рутиловой формы GeO2 уменьшается с уменьшением давле-
ния. Максимальная растворимость GeO2 в TiO2, по Сарверу, со-
358
Германатные системы
ставляет примерно 40 мол. % при температуре немного выше 1050°.
Вхождение TiO2 в твердый раствор GeO2 понижает обратимое
°C
1050
/З-Кварцевая форма р~К8ари#8ая форма
ОеОгт.р. 0е0гт.рлТЮгт.р.
-Ц 1023 ±5° -
Ti02m.p.
950
850 -
Рутиловая форма
&еОг т.р.
Рутиловая форма
С,еОгт.р.+ТЮгт.р.
7СП\--------1-------1--------1-------1-----—
О 20 90 50 80 100
Сео2 Мол. % Tioe
Рис. 318. Фазовые отношения
в системе TiOa— GeOa.
превращение рутиловой формы GeO2 в кварцевую форму с 1049 ±5°
до примерно 1023+5°. Составленная Сарвером диаграмма системы
изображена на рис. 318.
Литература
1. S а г v е г J. F., Amer. Journ. Set., 259, № 9, 701, 1961.
ZrO2—GeO2
Интересна для разработки новых материалов для электроники.
Коллонг, Лефевр, Перес-и-Джорба и Квейру [1, 2] изучали
эту систему в области от чистого ZrO2 до ZrGeO4 (50 мол.% GeO2).
Установлены три области твердых растворов (рис. 319):
Рис. 319. Изменение параметра элементарной ячей-
ки и отношения с/а в зависимости от содержания
GeO2 в твердых растворах системы ZrOa—GeGa.
Германатные систеМгЛ
359
1) твердый раствор GeO2 в двуокиси циркония; распростра-
няется от ZrO2 до состава Zr0 9Ge0ЛО2; имеет структуру флюорита;
2) твердый раствор вблизи соединения Zr3GeO8; область гомо-
генности распространяется от Zr3 2Ge0 8О8 до Zr2 8Gex 2О8;
3) область гомогенности вблизи соединения ZrGeO4; распро-
страняется от Zrx 2Ge0 8О4 до ZrGeO4 и имеет структуру типа
шеелита.
Лит ер ату ра
1. Colleagues R., J. Lefevre, М. Perez у Jorba,
F. Queyroux, Bull. Soc. chim. France, № 1, 149, 1962.
2. Lefevre J., Annal. chim., (13), 8, № 1—2, 117, 1963.
HfO2—GeO2
Изучалась Лефевром [1]. Обнаружено два соединения, обра-
зующих некоторую область однородности. Соединение HfGeO4
тетрагональной сингонии имеет структурный тип шеелита с пара-
метрами ячейки: а=4.866, с= 10.49 А; растворимость HfO2
в HfGeO4 невелика.
Соединение Hf3GeO8 также имеет узкую область однородности,
причем эти твердые растворы ниже 1500° диссоциируют по реак-
ции Hf3GeO8 т. р. -г» 2HfO2+HfGeO4 т. р. Hf3GeO8 имеет тетра-
гональную сингонию с параметрами ячейки: а=4.982, с=10.42 А
Литература
1. L е f ё v г е J., Annal. chim., (13), 8, № 1—2, 117, 1963.
Nb2O6—GeO2
Система изучена Левиным [1 ] методом закалки. Установлено
существование одного химического соединения 9Nb2O6-GeO2,
плавящегося инконгруэнтно при 1420° (рис. 320), причем в пери-
тектической точке содержание GeO2 составляет 25 мол.%. Эвтек-
тика между GeO2 и указанным соединением содержит 97 мол. %
GeO2 и плавится при 1090°. Расслаивание расплава в системе не
обнаружено.
Путем закалки расплавов было получено еще две метастабиль-
ные фазы. Так, закалка состава 50 мол. % Nb2O6+50% GeO2
приводит к образованию фазы с псевдоромбической элементарной
ячейкой с параметрами: а=6.17, Ь=3.64, с=3.92 А. В структурном
360
I
Германатные системы
отношении эта фаза сходна с низкотемпературной пятиокисью
ниобия. Вторая метастабильная фаза с гексагональной элементар-
Рис. 320. Диаграмма состояния системы
Nb2O6— GeO2 (по Левину).
ной ячейкой и параметрами а=3.59в и с=3.913 А была получена
путем закалки расплава состава 20Nb206+80Ge02.
Литература
1. Levin Е. М., Journ. Res. Nat. Bur. Stand., 70A, № 1, 5, 1966.
Германатные системы
361
Bi2O3—GeO 2
Система интересна для полупроводниковой техники.
Изучена Сперанской и Аршакуни [1] методом дифференци-
ально-термического и рентгеновского анализов. Авторы построили
две фазовые диаграммы: стабильную и метастабильную.
Рис. 321. Фазовые диаграммы состояния си-
стемы Bi2O3—GeO2.
1 — стабильная диаграмма; 2 — метастабильная диа-
грамма. Вверху дана часть диаграммы, прилегающая
к Bi2Oa, в увеличенном масштабе.
Установлено существование двух соединений: Bi^GeO^j и
BiuGeO23. Первое соединение образуется из GeO2 (кварцевая
форма) и Bi2O3 (у-форма, тетрагональная) при 790° и плавится
при 1044+4°. Bi14GeO23 образуется при 882° и плавится (конгру-
энтно) при 923+3°. Эти соединения фигурируют на стабильной
362
Германатные системы
диаграмме состояния системы (рис. 321, экспериментальные точки
обозначены крестиками). Обнаруженные эвтектики имеют состав:
25 мол.% Bi2O3 (температура плавления 960°) и 67 мол.% Bi2O3
(температура плавления 880°).
Метастабильная фазовая диаграмма была получена, когда
исходными веществами служили гексагональная форма двуокиси
германия и кубическая объемноцентрированная форма окиси вис-
мута (метастабильная у-форма). Приведенная на рис. 321 метаста-
бильная диаграмма также получалась путем снятия кривых охла-
ждения и нагревания, но образцы для термографических исследо-
ваний получались специально подобранным режимом охлаждения
перегретых расплавов. На метастабильной диаграмме фигурирует
только одно соединение — фаза А, состав которого авторы не
приводят. По экстраполяции кривой плавления монотропной
формы Bi2O3 на его ординату определена температура плавления
монотропной f-формы Bi2O3, оказавшаяся равной 836°. Авторы
предполагают, что между силикатами и германатами висмута
существует полный изоморфизм и для силикатной системы, ве-
роятно, возможна реализация метастабильной диаграммы. Соеди-
нение Bi14GeO23 кристаллизуется в кубической сингонии с пара-
метром элементарной ячейки а=10.12 kX, Z=2.
Литература
1. Сперанская Е. И., А. А. А р ш а к у н и, Журн. неорг. хим.,
9, № 2, 414, 1964.
МпО—GeO2
Таубер, Кон, Уинфрей и Бэббаж [1] изучили часть системы,
ограниченную соединениями GeO2 и MnGeO3 (рис. 322). Плавя-
щийся конгруэнтно при 1290+10° метагерманат марганца MnGeO3
1W0
1200
1000
800
> Ж1+ЖП \
|' г
I МпйеО3+)И
ОеОг(кварце&)+Ж ____________
№п0е03+0е0г (кварцев)
Мп0е03+0е0г(рутилов)
100 80 60 Ь0 20 0
МолУ/о МпОеО,
Рис. 322. Диаграмма состояния
системы MnGeO3—GeO?.
Германатные системы
363
изоструктурен с энстатитом (MgSiO3); кристаллы относятся к ром-
бической сингонии, имеют следующие параметры элементарной
ячейки: а=19.29, Ь=9.25, с=5.48 A; Z=16. Показатели преломле-
ния выше 1.81. Специальные рентгенографические исследования
не подтвердили предполагаемого полиморфизма MnGeO3.
Эвтектика в системе плавится при 1095 ±10°. Обнаружена зна-
чительная область двух несмешивающихся жидкостей.
Литература
1. Tauber A., J. A. Kohn, С. G. W h i n f г е у, W. D. В a b b a g е,
Amer. Mineralogist, 48, № 5—6, 555, 1963.
FeO—GeO2
Гордон с сотрудниками [1 ], производя термический анализ
смеси закиси железа и GeO2, около 700° отметили образование
германата двухвалентного железа FeO*GeO2 и около 820° — обра-
зование соединения со шпинельной структурой, которому при-
писали формулу (Fe, Ge)O •Fe^. Заключение о наличии двух-
валентного германия делалось на основании данных потенциалов
возбуждения и ионных радиусов [2]. Протекание реакции
2Fe2++Ge4+-> 2Fe3++Ge2+, таким образом, оказывается возмож-
ным, и ион Ge2+ может быть не менее устойчив, чем ион Ge4+.
Литература
1. Гордон С. А., М. А. М е н к о в с к и й, В. Ф. Ч у р б а к о в, Журн.
неорг. хим., 9, № 4, 917, 1964.
2. М о м д ж и Г. С., ДАН СССР, 101, № 4, 719, 1955.
Fe2O3—GeO2
Имеет значение для химии и технология германия и для его
геохимии.
Система не изучена. Менковским, Гордоном и Чурбаковым [1 ]
при нагревании (термический анализ) соосажденных гидроокисей
железа и германия в различных количествах при соотношениях
Fe2O3 : GeO2=4 : 1, 3:2, 2:3 и 1:4 получены относящиеся
к этой системе два соединения. Продукты нагревания изучались
рентгенографически. При прокаливании смеси 1 : 4 при 620°
получены линии GeO2 и линии новой фазы, а после прокаливания
при 800° — только линии новой фазы, отличной от GeO2 и Fe2O3.
Этой фазе приписывается формула 2Fe2Os*7GeO2.
364
Германатные системы
При нагревании смеси 2 : 3 в области 630—680° кристалли-
зуется германат состава 2Fe2O3-3GeO2, который в интервале
900—910° распадается на 2Fe2O3«7GeO2 и Fe2O3.
Рентгенографические характеристики соединений системы
F е2О3—GeO2
2Fe2Os-7GeO2 SFfeOj-SGeOj
I d — а п I d —• а П I d Л п I d — а п
8 3.342 6 1.692 7 3.794 4 1.652
6 3.077 6 1.650 6 3.400 3 1.576
10 3.037 1 1.601 7 3.085 2 1.421
9 2.960 2 1.575 4 3.006 1 1.330
7 2.602 7 1.549 9 2.789 1 1.288
9 2.518 3 1.470 10 2.606
1 2.324 8 1.427 6 2.523
1 2.260 1 1.364 4 1.945
5 2.036 1 1.335 5 1.874
4 1.859 1 1.289 4 1.737
1 1.735 1 1.255 3 1.693
Нагревание смесей 2 : 3 и 4 : 1 не дало новых фаз.
В таблице приводятся I и а для двух названных германатов.
Перес-и-Джорба и Коллонг [2] изучали взаимодействие
Fe2O3 и GeO2, исходя из соосажденных гелей и смесей окислов
°C
1150
GeOz (K8apneS.)+FeItGeOs
1030
Ре^йе0а+а-Рег03
GeOz (pymuJioS.)+Fe2GeOs
- FezGeOs+FefieOg
950
йеОг(рутилоВ.)+Реч.ОеОв
900'------------1--------->-------—-L----------—
0 25 50 66.6 75 100
Ge03 Мол. % ГегО3
Рис. 323. Области сущест-
вования фаз в системе Fe2O3—
— GeOa (по Перес-и-Джорба и
Коллонгу).
a-Fe2O3 и GeO2 (в кварцевой модификации), производили обжиг
в температурном интервале 900—1150°. Авторы описывают два
соединения — Fe2O3-GeO2 и 2Fe2O3-GeOa.
Соединение Fe2GeOB устойчиво только в узком интервале тем-
ператур: от 950 до 1020° (рис. 323). По своей структуре соединение
Германатные системы
365
Fe2GeOB аналогично кианиту Al2SiOB, имеет триклинную синго-
нию с параметрами элементарной ячейки: а=7.768, Ь=8.581,
с=6.088 А, а=90°07', ₽=101°25', т=106о06'.
Соединение Fe4GeO8 устойчиво до температуры 1150°, при
которой он распадается на a-Fe2O3 и стеклообразную двуокись
германия. Это соединение также имеет триклинную сингонию
с параметрами элементарной ячейки: а=6.202, Ь=11.695,
с=8.271 А, а=91°09', р=90°12', т=93о18'.
Литература
1. Менковский М. А., С. А. Гордон, В. Ф. Чурбаков,
ДАН СССР, 144, № 2, 367, 1962.
2. Perez у J orb а М., R. Collongues, Compt. rend, 262, ser. С,
№ 3, 275, 1966.
СТАНАТНЫЕ СИСТЕМЫ
СаО—SnO2
Система исследовалась Дитцелем и Похом [1 ] в субсолидусной
области. Обнаружены соединения CaSnO3 и 2CaO-SnO2. Эти сое-
динения устойчивы приблизительно до 1800°. Выше этой темпера-
туры происходит сильное испарение SnO2 и в связи с этим опре-
делить температуру плавления указанных соединений не удается.
Литература
1. D i е t z е 1 A., W. Р о с h, Radex Rundschau, № 1, 52, 1960.
ВаО—SnO2
Имеет значение как частная система при разработке керами-
ческих диэлектриков.
Вагнер и Киндер [2] производили плавление в иридиевом
тигле в высокочастотной печи. Изучались составы этой системы
в области концентраций от 0 до 50 мол.%
°C SnO2 (рис. 324). При ~23 мол.% SnO2
2100
ВаО Мол% $пог
Рис. 324. Диаграмма
плавкости системы
ВаО—SnO2.
найдена эвтектика. Установлено существо-
вание двух соединений: метастаната бария
BaSnO3 и ортостаната Ba2SnO4, который
плавится инконгруэнтно. Наличие послед-
него уверенно было доказано твердофазо-
выми реакциями (оптимальные условия: тем-
пература 1250° и выдержка 24 часа). Орто-
станат бария представляет собой почти бес-
цветный порошок с зеленоватым оттенком.
Рот [1 ] показал, что соединение BaSnO3
имеет кубическую симметрию и относится
к типу перовскита с параметром решетки
а=4.114 А.
Согласно определениям Вагнера и Бин-
дера [3], Ba2SnO4 характеризуется тетра-
Станатные системы
367
тональной сингонией. Имеет кристаллическую решетку типа
K2NiF4 со следующими параметрами: а=4.140, с=13.29в А,
с/а=3.21, Z=2. Плотность вычисленная 6.67 г/см®, пикнометри-
ческая 6.79 г/см®.
Литература
1. R о t h R. S., Journ. Res. Nat. Bur. Stand., 58, № 2, 75, 1957.
2. Wagner G., H. В i n d e r, Zs. anorgan. allgem. Chem., 297, № 5—6,
328, 1958.
3. W a g n e r G., H. В i n d e r, Zs. anorgan. allgem. Chem., 298, № 1—2,
12, 1959.
CdO—SnO2
Смит [1 ] изучил твердофазовые реакции в смесях CdCOs
и SnO2 в температурном интервале 1000—1100°. Получено два
соединения: CdSnO3 и Cd2SnO4. Метастанат кадмия CdSnO3 обра-
зует кристаллы ромбической сингонии со структурой неупорядо-
ченного перовскита и параметрами элементарной ячейки: а=5.547,
Ь=7.867, с=5.577 А. Впервые полученное соединение Cd2SnO4
также относится к ромбической сингонии с параметрами элемен-
тарной ячейки: а=10.01, Ь=5.55, с=3.07 А.
Литература
1. S m i t h A. J., Acta crystallogr., 13, № 10, 749, 1960.
A12O3—SnO2
Имеет значение для высокоглиноземистой керамики, содер-
жащей до 20% SnO2 и имеющей аномальное поведение при обжиге
(при 1450° остекловывается, а при нагревании тех же образцов
при 1480—1560° показывает рост пористости и при 1565° снова
остекловывается; максимум усадки при 1620°).
Барчак и Инслей [1] изучили систему и нашли, что она
простая эвтектическая (рис. 325). Эвтектика — примерно при
98 вес. % SnO2 и 1620+5°. Отмеченные выше аномалии обусло-
влены потерей SnO2 за счет улетучивания. Температура плавления
SnO2 определена в 1630 +4°, что близко к определению (1625°)
Руффа, Зейферхельда и Суда [2]. Образование небольших коли-
368
Станатные системы
честв SnAl2O4 при закалке смесей от субсолидусных температур
указывает на появление в этих условиях некоторого коли-
чества SnO.
°С
2000
1800 -
1600'
1620
5пОг
..ж
wook
юд[
А1г03+6п0г
О 20 W 60 80 100
Вес.°/о Sn02
Рис. 325. Диаграмма состояния
системы А1аОа—SnO2.
Литература
1. В а г с z a k V. J., Н. I n s 1 е у, Journ. Amer. Ceram. Soc., 45, № 3, 144,
1962.
2. R u f f О., H. S e i f e r h e 1 d, J. S u d a, Zs. anorgan. allgem. Chem.,
82, № 4, 373, 1913.
La203—SnO2
Pot [1 ] получил соединение La2Sn2O7 co структурой пиро-
хлора с параметром решетки а=10.702 А. Кристаллы имеют куби-
ческую симметрию.
Литература
1. R о t h R. S., Journ. Res. Nat. Bur. Stand., 56, № 1, 17, 1956.
Nd2O8—SnO2
Система не изучена. Рот [ 1] получил соединение Nd2Sn2Q7
со структурой пирохлора с параметром решетки а=10.568 А.
Кристаллы имеют кубическую симметрию.
Литература
1. Roth R. S., Journ. Res. Nat. Bur. Stand., 56, № 1, 17, 1956.
Станатпые системы
369
РЬО—SnO 2
Имеет значение для цветной металлургии (рафинирование
чернового свинца).
Изучена Уразовым, Сперанской и Гуляницкой [1]. Из двух
возможных для олова сочетаний РЬО—SnO и РЬО—SnO2 иссле-
довалась последняя» реакция,
так как, по литературным дан-
ным, SnO устойчива до 380°,
выше'этой температуры она рас-
падается по реакции: 2SnOTB=
Рис. 326. Диаграмма состояния си-
стемы РЬО—SnOs.
A. PbSnOg изоструктурно
= SnO2T,+Sns.
Было установлено, что при
780° в твердом состоянии обра-
зуется одно соединение состава
Pb2SnO4 (2:1). Оно плавится с
разложением при 1060°. Эвтек-
тика между соединением и
окисью свинца соответствует
2.5 мол. % SnO2 и 850° (рис. 326).
Руксби [21 показал, что,
нагревая при 800—950° Pb2SnO4
с небольшим количеством крем-
незема, можно получить соеди-
нение PbSnO3, в котором SiO2
играет роль стабилизатора. Со-
единение PbSnO3 желтого цве-
та, имеет ’кубическую, типа
пирохлора кристаллическую
структуру с пространственной
группой Fd3m и параметром
элементарной ячейки а=10.694
PbjSbjO?, Pb2Sn2O7 и т. д.
Литература
1. Уразов Г. Г., Е. И. Сперанская, 3. Ф. Гуляницкая,
Журн. неорг. хим., 1, № 6, 1413, 1956.
2. R о о k s b у Н. Р., Physics a. Chemistry of Glasses, 5, № 1, 20, 1964.
24 н. А. Торопов и др., КН. 1
370
Станатные системы
Bi2O3—SnO2
Коффин [1J получил соединение Bi2O3-2SnO2. По Роту [2],
соединение Bi2O3>2SnO2 имеет структуру дефектного пирохлора.
Литература
1. Coffeen W., Journ. Amer. Ceram. Soc., 36, № 7, 207, 1953.
2. Roth R. S., Joum. Res. Nat. Bur. Stand., 56, № 1, 17, 1956.
II Л ЮМ ВАТНЫЕ СИСТЕМЫ
К2О— РЬО2
Согласно Турну и Фуасье [1 ], К4РЬ8О12 диссоциирует при 620°
(давление кислорода 1 атм.). Соединение К2РЬ3О7 имеет ромбиче-
скую ячейку с параметрами: а=17.37+0.06, 6=12.60+0.05,
с=3.28+0.01 А; плотность (пикнометрическая) 6.75 г/см3. Сое-
динение К2РЬО3 диссоциирует при 780° (давление кислорода
1 атм.), образует ромбические кристаллы с параметрами элемен-
тарной ячейки: а=10.45 +0.05, 6=6.99+0.01, с=5.95+0.01 А.
Пикнометрическая плотность 4.86 г/см®.
Литература
1. Tournoux М., С. Fouassier, Bull. Soc. chim. France, № 6, 1834,
1965.
BaO—PbO2
Представляет интерес при разработке составов керамических
диэлектриков.
Система изучена Вагнером и Биндером [1 ] только путем
проведения реакций в твердом состоянии. При нагревании смесей
ВаСО3 и РЬО2 в токе кислорода получены соединения ВаРЬО3
и Ва2РЬО4. При соотношении смесей ВаСО3 : РЬО2, равном 1:1,
реакция образования ВаРЬО3 начинается при —500°. При соот-
ношении 2 : 1 в области температур 800—900° наряду с образова-
нием ВаРЬО3 появляется Ва2РЬО4.
При температуре выше 1000° окончательно образуется только
Ва2РЬО4. Последний плавится с разложением при температуре
— 1270°.
Кристаллоструктурные определения Вагнера и Биндера [2]
показали, что ВаРЬО3 имеет кубическую перовскитовую ячейку
24*
372
Плюмбатные системы
с параметром а=4.26в А. Кристаллизующееся в тетрагональной
сингонии соединение Ва„РЬ04оимеет решетку типа K2NiF4 с пара-
метрами: а=4.306, с=13.273 А, с/а=3.08, Z=2. Плотность пикно-
метрическая 7.30 г/см®, вычисленная из рентгеновских данных
7.37 г/см3.
Литература
1. Wagner G., Н. В i n d е г, Zs. anorgan. allgem. Chem., 297, № 5—6,
328, 1958.
2. Wagner G., H. Binder, Zs. anorgan. allgem. Chem., 298, № 1—2,
12, 1959.
ТИТАНАТНЫЕ СИСТЕМЫ
Ы20—ТЮ2
Некоторые сведения о малощелочной области системы приво-
дят Гюммель и Тьен [1 ] в связи с исследованиями спекания дву-
окиси титана в присутствии окиси лития.
В системе отмечается соединение Li2O*3TiO2. Кривые плав-
кости определены приближенно (при большой скорости нагревания).
С
1800
\
\
1600
Жидк.
^йй 'Рутил \
Ж '
1200 -
И-О-ЗПО.+Ж
a a i
Рутил +б1гО'ЗТ1Ог
Рис. 327. Диаграмма плавкости
системы Li2O'3TiO2—TiO2.
ЮОО'—
100
ПО,
6
96
92
„ .. Li,20-3TiD,
Вее. °/о 2 2
Температура плавления эвтектики оценивается в 1230° (рис. 327).
Гюммель и Тьен отмечают возможность растворения соединения
Li2O3-3TiO2 в рутиле.
Джонкер [2] синтезировал (реакции в твердом состоянии
между Li2CO3 и TiO2) три титаната лития: Li2TiO3, Li4Ti5O12
и Li2Ti3O7) которые плавятся между 1000 и 1350°.
374
Титанатные системы
Литература
1. Н u m m е 1 F. A., T.-Y. Tien, Journ. Amer. Ceram. Soc., 42, № 4,
206, 1959.
2. J о n к e r G. H. Trobojas rennion intern, reactin solidos, v. 1. Madrid,
413, 1957.
Na2O—TiO2
Имеет значение для технологии глазурей, стекла, радиоке-
рамики.
Изучалась Ниггли [3], Уошберном и Бантингом [4], Будни-
ковым и Тресвятским [1 ]. По Ниггли, в системе имеется два сое-
Na20 Мол.°/ч Ti02
Рис. 328. Диаграмма со-
стояния системы NaaO—
—TiO2.
динения: Na2Ti2OB ромбической системы
и Na8TiBO14, по-видимому, моноклин-
ной системы; показатель преломления
выше чем 1.74, двупреломление силь-
ное. По Уошберну и Бантингу, в си-
стеме 3 соединения, плавящихся кон-
груэнтно: Na2TiO3 плавится при 1030°,
Na2Ti2OB при 985° и Na2Ti3O7 при 1128°.
Диаграмма состояния части системы,
по Будникову и Тресвятскому, пред-
ставлена на рис. 328. Соединение
Na8TiBO14(4Na2O-5TiO2) в виде много-
гранных зерен округлой формы, по-
казатель преломления выше 1.781,
спайность неясная, двупреломление
сильное. Соединение Na2Ti3O7 в отли-
чие от данных Уошбэрна и Бантинга
плавится инконгруэнтно; прямоуголь-
ные столбчатые кристаллы с ясной
спайностью, прямым погасанием, пока-
затель преломления выше чем 1.781.
Эвтектика между этими двумя соедине-
ниями при 985° и 64 мол. % TiO2. Пе-
ритектическая точка находится при
1130° и 73.5% TiO2+26.5 мол. % Na2O. Соединения Na2TiO3
и Na2Ti2OB не подтвердились.
Кеезманн [2] в гидротермальных условиях в присутствии
NaOH получил Na2Ti3O, (при 490° и давлении 750 атм.) и Na2Ti8O13
(595°, 780 атм.). Кроме того, им были получены еще два титаната,
состав которых не был определен.
Титанатные системы
375
Литература
1. Будников П. П., С. Г. Тресвятский, Доповщ! АН УРСР,
№ 5, 371, 1954.
2. К е е s m a n n I., Zs. anorgan. allgem. Chem., 346, № 1—2, 30, 1966.
3. N 1 g g 1 i P., Zs. anorgan. allgem. Chem., 98, № 4, 241, 1916.
4. Washburn E. W., E. N. Bunting, Journ. Res. Nat. Bur. Stand.,
12, № 2, 239, 1934.
K2O-TiO2
Часть диаграммы состояния системы, пользуясь методом
термического анализа и рентгенографии, построили Шмитц-
Дюмонт и Рекхард [4].
В системе существует четыре соединения: K2TiO3, K2Ti2OB,
K2Ti3O7 и K2Ti5Ou. Два последние соединения, полученные
впервые Шмитц-Дюмонтом и Рекхардом
(рис. 329), плавятся инконгруэнтно соот-
ветственно при 1050 и 1300°.
Дититанат калия K2Ti2O5 кристаллизует-
ся не в ромбической, как полагал Барб-
лан [1], а в моноклинной сингонии с пара-
метрами элементарной ячейки: а=11.38,
Ь=3.85, с=13.16 кХ, (3=99°. Плотность, вы-
численная из рентгеновских данных,
2.949 г/см3, экспериментально определен-
ная 2.923 г/см3. Дититанат калия под дей-
ствием воды подвергается гидролизу с об-
разованием анатаза. При обработке K2Ti2O5
Рис. 329. Диаграм-
ма состояния систе-
мы KaTi2O6—TiOa.
кипящим раствором соляной кислоты в не-
растворимом осадке содержится рутил.
Эвтектика между K2Ti2OB и K2Ti3O7 содер-
жит 95 мол. % K2Ti2O5 и плавится при 947°.
Кеезманн [3] в гидротермальных условиях в присутствии
КОН (450°, 440 атм.) получил гексатитанат калия K2Ti6O13,
уже ранее описанный Берри с сотрудниками [2].
Литература
1. Barblan F. F., Schweiz, mineral, petrogr. Mitt., 23, 295, 1943.
2. В e г г у К. L., V. D. Al t a n d i 1 i a n, W. W. G i 1 Ь e г t,
E. P. H. M e i b о h m,' H. S. Young, Journ. Inorg. Nucl. Chem.,
14, № 3/4, 231, 1960.
3. К e e s m a n n I., Zs. anorgan. allgem. Chem., 346, № 1—2, 30, 1966.
4. Schmitz-Dumont О., H. Reckhard, Monatshefte Chem., '90,
M 2, 134, 1959.
376
Титанатные системы
Rb2O—TiO2
Изучена в концентрационной области от соединения Rb2Ti2OB
до чистого TiO2 Шмитц-Дюмонтом и Рекхардом [1 ] методом
термического анализа.
Кроме известного ранее соединения Rb2Ti2OB) авторы полу-
чили новое соединение Rb2Ti4O9 (рис. 330), плавящееся при 1183°.
Рис. 330. Диаграмма со-
стояния системы
RbgTigOg TiO2.
Две эвтектики в системе Rb2Ti2O5—TiO2 содержат 5 и 79 мол. %
TiO2 (остальное Rb2Ti2O5) и плавятся соответственно при 850.
и 1146°. Дититанат рубидия в воде подвергается гидролизу с вы-
делением анатаза.
Литература
1. Schmitz-Dumont
90, № 2, 134, 1959.
О., Н. Reck hard, Monatshefte Chem.,
Cs2O—TiO2
Изучена в концентрационной области от соединения Cs2Ti2O6
до чистого TiO2 Шмитц-Дюмонтом и Рекхардом [1] методом
термического анализа.
Кроме известного ранее соединения Cs2Ti2O5, описанного
Шмитц-Дюмонтом и Шульцем [2], было получено соединение
Cs2Ti4O9 с температурой плавления 1115° (рис. 331).
Дититанат цезия Cs2Ti2O5 имеет две полиморфные энантио-
тропные модификации: низкотемпературную моноклинную и вы-
Титанатные системы
377
сокотемпературную тетрагональную. Полученная закалкой вы-
сокотемпературная модификация имеет параметры кристалли-
ческой решетки: а=6.92, с=8.86 кХ, с/а=1.28.
Рис. 331. Диаграмма
состояния системы
CS2T12O5 Т1О2.
Две эвтектики в системе Cs2Ti2Os—TiO2 содержат^соответст-
венно 20 и 70 мол. % TiO2 (остальное Cs2Ti2OB) и плавятся при 844
и 1080°. Дититанат цезия в воде подвергается гидролизу с выде-
лением анатаза.
Литература
1. Schmitz-Dumont О., Н. R е с k h а г d, Monatshefte Chem.,
90, № 2, 134, 1959.
2. Schmitz- Dumont О., A. H. Schulz, Monatshefte Chem., 83,
№ 3, 640, 1952.
BeO—TiO2
Представляет интерес для получения новых видов электро-
фарфоровых материалов.
Система изучалась многими авторами и, согласно последним
данным, относится, по-видимому, к простым эвтектическим.
Титанаты бериллия BeTiO3 и Be2TiO4, на которые указывали
Вартенберг, Ройш и Саран [6] и Блюмен [1 ], не были обнаружены
при последующих тщательных исследованиях. Разноречивые
мнения существуют о наличии твердых растворов в области,
примыкающей к двуокиси титана.
Ланг, Филлмор и Максвелл [4] указывают на область твер-
дых растворов, простирающуюся от 85 до 100 вес. % TiO2
378
Титанатные системы
(рис. 332). Меркер [5] отмечает, что твердые растворы между ВеО
и ТЮ2 образуются при плавке в кислородно-водородном пламени.
Кокко [3], производивший обжиг смесей ВеО и ТЮ2 при 1690°,
не обнаружил твердых растворов и химических соединений
0 10 30 50 70
т'°г Вес. % Ве0
Рис. 332. Диаграмма состояния
системы ВеО—TiOa.
между компонентами. Келер и Исупова [2], применяя смеси
гидроокисей бериллия и титана и производя обжиг до 1750°,
не обнаружили взаимодействия ВеО и TiO2 и всегда находили
только исходные компоненты.
Литература
1. Б л ю м е н Л. М., Изв. АН Турки. ССР, 5, 70, 1951.
2. Келер Э. К., Е. Н. И с у п о в а, Журн. неорг. хим., 5, № 2, 433, 1960.
3. Cocco A., Ann. chim. (Roma), 48. № 8—9, 587, 1958.
4. Lang S. M., C. L. Fillmore^ L. H. Maxwell, Journ. Res.
Nat. Bur. Stand., 48, № 4, 298, 1952.
5. M e r k e r L., Pat. USA, 2763558, 18 IX (Ceram. Abstr., № 2, 52, 1956).
6. W art enberg H., H. J. R e u s c h, E. S a r a n, Zs. anorgan. allgem.
Chem., 230, № 3, 257, 1937.
MgO-TiO2
Относится к числу специальных систем, применяемых для
получения электрокерамики, отличающейся высокими диэлектри-
ческими свойствами и малыми диэлектрическими потерями.
Систему изучали Вартенберг и Профет [4], Буссем, Шустериус
и Унгевисс [2] и Кафаноур и де Просе [3].
Вартенберг и Профет полагали, что в системе существуют
только два соединения: 2MgO-TiO2 и MgO«2TiO2 (рис. 333).
Однако последующие исследования, особенно работа Кафаноура
Титанатные системы
379
и де Пресса, показали, что следует принимать три типа титаната
магния: 2MgO«TiO2, MgO-TiO2 и MgO-2TiO2 (рис. 334).
Рис. 334. Диаграмма состояния си-
стемы MgO—TiOa (по Кафаноуру и де
Проссу).
Рис. 333. Диаграмма состоя-
ния системы MgO—TiOa (по
Вартенбергу и Профету).
Буссем с сотрудниками, пользуясь рентгеновским методом,
пришли к выводу о существовании высокотемпературных твер-
Инвариантные точки системы MgO—TiO2
Точка Фазы Процесс Состав, мол. % Темпера- тура, °C
MgO Т1О2
1 MgO + 2MgO TiOa+ жидкость. Эвтектика. 79 21 1707
2 2MgO-TiOa + жидкость. Конгруэнтное плавление. 66.6 33.4 1732
3 2MgOTiOa+MgOTiOa + + жидкость. Эвтектика. 56 44 1583
4 MgO • TiOa + жидкость. Конгруэнтное плавление. 50 50 1630
5 MgO • TiOa + MgO-2TiOa + + жидкость. Эвтектика. 44 56 1592
6 MgO • 2TiOa + жидкость. Конгруэнтное плавление. 33.4 66.6 1652
7 MgO • 2TiOa + TiOa + жид- кость. Эвтектика. 14 86 1606
8 TiOa + жидкость. Плавление. — 100 1840
380
Титапатные системы
дых растворов окиси магния в титанате 2MgO«TiO2. Тщательные
исследования Кафаноура и де Просса, выдерживавших смеси
с большим содержанием MgO при температурах в области 1400—
1500°, не дали указаний на образование твердых растворов.
Оптические свойства титанатов магния определялись Лапи-
ным [1 ] и Кафаноуром и де Проссом [3]. Для ортотитаната магния
(изотропные зерна) из специальной керамики Лапиным опреде-
лено У=1.972. Кафаноур и де Просе нашли У=1.959. Для мета-
титаната магния MgO-TiO2, имеющего одноосные отрицательные
кристаллы, Кафаноур и де Просе приводят: Уе=1.95, Уо=2.28.
Соединение MgO-2TiO2 образует призматические бесцветные кри-
сталлы, двуосные, с положительным удлинением 2Ул$70°. Пока-
затели светопреломления по Лапину: У^=2.32 + 0.05, Np=
= 2.19+0.93; по Кафаноуру и де Проссу: Ng=2.23, Утп=2.19,
Ур=2.11.
Литература
1. Л а п и н В. В., Труды Совещ. по керамич. сырью, Изд. АН СССР, М.,
126, 1948.
2. В u s s е m W., С. Schusterius, A. Ungewiss, Вег. Dtsch.
keram. Ges., 18, 433, 1937.
3. Coughanour L. W., V. A. de P г о s s e, Journ. Res. Nat. Bur.
Stand., 51, № 2, 85, 1953.
4. W art en b erg H., E. P г о p h e t, Zs. anorgan. allgem. Chem., 208,
№ 3/4, 373, 1932.
CaO—TiOa
Система, весьма важная для технологии сегнетоэлектрических
материалов. Титанаты кальция входят в состав высокоглинозе-
мистых и титановых цементов.
Инвариантные точки системы СаО—ТЮ2 (по Роту [8])
Точка Фазы Процесс Состав, мол. % Темпера— । тура, °C •
СаО Т1О2
1 СаО + ЗСаО • 2ТЮ2 + жид- кость» Эвтектика. —77 —23 1725
2 ЗСаО • 2TiOa + 4СаО . 3TiOa + + жидкость. Инконгруэнт- ное плавле- ние 3 : 2. — — 1740
3 4СаО • ЗТЮа + СаО TiOa + + жидкость. Инконгруэнт- ное плавле- ние 4: 3. — — 1755
4 СаО • ТЮ2 + жидкость. Плавление. — — 1915
5 СаО • TiOa + TiO2 + жидкость. Эвтектика. 25 75 1475
Титанатные системы
381
Ранние исследования системы были неточны, и, например,
соединение 2CaO-TiO2, на которое указывают Вартенберг, Ройш
и Саран [10], по-видимому, не существует. Оспаривается также
соединение ЗСаО-TiOa, приведенное на диаграмме Бережного [1].
Ершов [2] в результате изучения твердофазовых реакций открыл
соединение 3CaO-2TiO2.
Рис. 335. Диаграмма состояния системы СаО—TiO2 (по Де
Вризу с сотрудниками).
1 — результаты, полученные методом закалки; г — результаты, по-
лученные в каскадной печи; з — результаты, полученные на обжигав-
шихся образцах; 4 — результаты термического анализа.
Тщательные работы выполнили Де Вриз, Рой и Осборн [4],
Кафаноур, Рот и де Просе [3] и Рот [8]. Кроме соединений
СаО • TiО2 и ЗСаО-2TiO2, указанных на рис. 335, Рот описывает со-
единение Ca4Ti3O10, плавящееся инконгруэнтно, образуя CaTiO3
и жидкость. Возможность образования узких областей твердых
растворов в системе оспаривается Кафаноуром с сотрудниками.
Согласно Мардоху [7], перовскит CaTiO3 имеет псевдокуби-
ческую элементарную ячейку с а=15.26 А. Показатель свето-
преломления CaTiO3 выше 2.3. Соединение 3CaO-2TiO2 обра-
зует двуосные, оптически отрицательные кристаллы с 2V«80°
382
Титанатные системы
и показателями светопреломления: 7Vg=2.22, Nnt=2.20, ЛГр=2.16.
Это соединение имеет объемноцентрированную тетрагональную
ячейку с параметрами решетки: а=3.83, с=19.505 А, Такой же
структурой характеризуется соединение Ca4Ti3O10, однако для
него с=27.147 А [5, 6].
Согласно Тиллока и Перес-и-Джорба [9], все титанаты каль-
ция: CaTiO3, Ca4Ti3O10 и Ca3Ti2O7 — кристаллизуются в ромби-
ческой сингонии и имеют следующие параметры элементарной
ячейки: CaTiO3 — а=5.381, 6=5.443, с=7.645 A; CatTi3O10 —
а=5.404, 6=5.435, с=27.14 A; Ca3Ti2O7 - а=5.412, 6=5.426,
с=19.50 А.
Литература
1. Бережной А. С., Огнеупоры, 15, № 8, 350, 1950.
2. Ершов Л. Д., Труды Гипроцемента, 1, 5, 1940.
3. Coughanour L. W., R. S. R о t h, V. A. d е Р г о s s е, Journ.
Res. Nat. Bur. Stand., 52, № 1, 37, 1954.
4. D e Vries R. C., R. R о у, E. F. О s b о r n, Journ. Phys. Chem.,
58, № 12, 1069, 1954.
5. К а у H. F., P. С. В a i 1 e у, Acta crystallogr., 10, № 3, 219, 1957.
6. Linz A., K. Herrington, Journ. Chem. Phys., 28, № 5, 824, 1958.
7. M u r d о c h J., Amer. Mineralogist, 36, № 7—8, 573, 1951.
8. Roth R. S., Journ. Res. Nat. Bur. Stand., 61, № 5, 437, 1958.
9. Tilloca G., M. Perez у Jorba, Rev. Haut. Temper, et Re-
fract., 1, № 4, 331, 1964.
10. W art enbe rg H., H. J. R e u s c h, E. S a r a n, Zs. anorgan.
allgem. Chem., 230, № 3, 257, 1937.
SrO—TiO2
Дрис и Тшебятовский [2] изучали фазовые отношения в си-
стеме методами термического, микроскопического и рентгено-
графического анализов в концентрационной области от 33
до 100 мол. % TiO2. Обнаружено три соединения: SrO-TiO2,
3SrO-2TiO2 и 2SrO-TiO2 (рис. 336).
Ортотитанат стронция 2SrO-TiO2, плавящийся при 1860+20°,
существует в двух полиморфных модификациях с точкой перехода
1600°. Соединение 3SrO-2TiO2 устойчиво только в низкотемпера-
турной области и при 1640° разлагается на 2SrO-TiO2 и SrO>TiO2.
Конгруэнтно плавящийся при 2040 +20° метатитанат стронция
образует с TiO2 эвтектику, содержащую 75—80 мол. % TiO2,
с температурой плавления 1440+10° и с 2SrO-TiO2 — эвтектику,
содержащую 35—38 мол. % TiO2, с температурой плавления
1830+10°. Согласно Рою [3], в системе имеется только два соеди-
нения (рис. 337).
Титанатные системы
383
Кокко и Массаца [1 ] изучили равновесные соотношения между
SrO и TiO2 при температурах выше 1200°. Образцы подвергались
Рис. 336. Диаграмма состояния системы
SrO—TiO2 (по Дрису и Тшебятовскому).
двухкратному обжигу в окислительной атмосфере. Обнаружено
четыре соединения: 3SrO -TiO2, 2SrO ’TiO2, 3SrO -2TiO2 и SrO -TiOa.
Авторы утверждают также
о наличии твердого раствора
в интервале 3SrO -2TiO2—
—4SrO-3TiO2(рис. 338). Этот
твердый раствор можно рас-
сматривать как растворение
метатитаната стронция в ре-
шетке соединения 3SrO •
• 2TiO2. Предположительно
указывается на ограничен-
ный твердый раствор 3SrO-
• 2TiO2 в SrO-TiO2.
Соединение 2SrO>TiO2
также обнаружено в двух
полиморфных формах с точ-
кой перехода приблизительно
1525°. Кокко и Массаца пола-
гают, что 2SrO-TiO2 плавит-
ся инконгруэнтно при I8600. ,
3SrO-2TiO2 устойчиво ниже 1580°, разлагаясь выше этой темпе-
ратуры на SrO.TiO2 и высокотемпературную форму 2SrO-TiO2.
Рис. 337. Диаграмма состояния системы
SrO—TiO2 (по Рою).
384
Титанатные системы
Открытый итальянскими учеными трехстронциевый титанат
3SrO-TiO2 устойчив только в температурном интервале 1560—
°C
1300
1700
1560120
1500
1860120'
а,
15801%°
&
-1525И0°р
1300
ЗгО.
1330^0" \
тюг
Рис. 338. Диаграмма состояния- си-
стемы SrO—TiO2»(no Кокко и Массаца).
1760°, как выше, так и ни-
же указанного интервала
распадается на высокотемпе-
ратурную форму 2SrO-TiO2
и окисьлстронция. Для эв-
тектики между SrO-TiO2 и
TiO2 приводится температура
плавления 1440+20° и содер-
жание 78 мол. % TiO2, для
эвтектики между 2SrO-TiO2
и SrO соответственно 1800°
и приблизительно 20 мол. %
ТЮ2.
Согласно Тиллока и Пе-
рес-и-Джорба [5], в системе
существует четыре соедине-
ния: SrTiO3, Sr4Ti3O10, SrgT^Oy
и Sr2TiO4. SrTiO3 относится
к кубической сингонии, все
остальные титанаты стронция
относятся к тетрагональной сингонии. Параметры элемен-
тарной ячейки титанатов стронция, согласно Раддлесдену
и Попперу [4], имеют следующие значения: SrTiO3 — а=3.90 А;
Sr4Ti3O10 — а=3.90, с=28.1 A; Sr3Ti2O7 — а=3.90, с=20.38 А;
Sr2TiO4 - а=3.88, с=12.6 А.
Литература
1. Cocco A., F. Massazza, Ann. chim. (Roma), 53, № 7, 883, 1963.
2. D г у s M., W. Trzebiatowski, Roczn. Chem., 31, № 2, 489, 1957.
3. R о у R., in: E. M. L e v i n, C. R. R о b b ins, H. F. M cMurd ie.
Phase diagrams for ceramists. U. S. A., Columbus, p. 119, fig. 298, 1964.
4. Ruddlesden S. N., P. Popper, Acta crystallogr., 10, № 8, 538,
1957; 11, № 1, 54, 1958.
5. Tilloca G., M. Perez у Jorba, Rev. Tlaut. Temper, et Refract.,
1, № 4, 331, 1964.
BaO—TiO2
Важна в связи с получением сегнетоэлектрических титанатов
бария и более сложных соединений на его основе.
После открытия Вулом [3] и Вулом и Гольдманом [4] сегнето-
электрических свойств у титаната бария система ВаО—TiO2
Титанатные системы
385
подверглась неоднократному изучению. Щепочкина [9] доложила
в 1956 г. на 5-м совещании по экспериментальной и технической
°C
2000 •
1800
1600-
поо -
1200 -
100
ВСЮ
1880
X
Жидк.
Ж
гвао-т1о2
1615
15W'
BaO-TiQ. .
гвао-
Т1Рг+
Воотюг
ВаО-
чтюг
МТ
ВаО-УПО,
+ г
Щ(/к/пшл)
О / 60 / 40 I 20\ О
28аО Щ ВаОТЮг ВаО-2ПОг 8аМП0г Щ
Мол. %
Рис. 339. Диаграмма состояния системы
ВаО—TiO2 (по Щепочкиной).
°C
1800
1600
1W0
1860
.s>
К
1200 - 4
XBOgTiO.
Жидн.
\Гж.8аП0,
1563°\^Т
ВагТ10^гекс.\
ВаТЮ3
М0°
ВагЩ
KyS.BaTiOj
Со
/Гекс.8аЩт.р./
m +ж 7 Т10^ж
\Жу6.РаТ103 /
II \ п..р.+ I О
MBanoXnaTi.O.JWB
1т.р.+Ж Ч/ *- -
'1322°
/135Т
то]
1210° § рЛр,
ВаТйРд+Ж
ВаПЛ
К?
тиг
if0 КубВаПО, ВО 80
Ran +ВаПЛ
°аи 117 Мол. в/а
100
ТЮ2
Рис. 340. Диаграмма состояния системы
ВаО—TiOa (по Рейсу и Рою).
минералогии и петрографии результаты изучения системы и дала
ее диаграмму состояния (рис. 339) в пределах от 33.3 до 100 мол.%
TiO2. Она значительно уточнила более раннюю диаграмму Стат-
25 Н. А. Торопов и др., кн. 1
386
Титанатные системы
тона [16], исследование которого имело ряд методических недо-
статков. Другие варианты диаграммы построили по своим работам
Тшебятовский, Дрис и Берак [17] и Рейс и Рой [15].
Диаграмма фазовых равновесий, по данным последних, пред-
ставлена на рис. 340. Тшебятовский и другие получили близкие
к данным Щепочкиной результаты, а именно: температура плавле-
ния (всюду конгруэнтная) Ba2TiO4 1820°, BaTiO3 1610°, BaTi2OB
1315°, BaTi4OB 1465°; эвтектики между ними и Т1О2 отвечают 44,
65, 75 и 85 мол. % TiO2 и плавятся соответственно при темпера-
турах 1585, 1310, 1305, 1455°.
Рис. 341. Часть диаграммы состояния
системы ВаО—TiO2 в укрупненном мас-
штабе (по Рейсу и Рою).
В отличие от данных Щепочкиной, Тшебятовского и других,
по Рейсу и Рою (рис. 341) образуется не четыре, а пять соединений
(добавочный трититанат бария с инконгруэнтным плавлением
при 1357°), и, кроме того, установлено, что BaTi2O5 и BaTi4OB пла-
вятся инконгруэнтно при 1317 и 1428° соответственно. Они ука-
зывают на 3 полиморфные модификации BaTiO3: тетрагональную,
стабильную при комнатной температуре, которая при 120° пре-
вращается в кубическую форму, стабильную до 1460°, после чего
последняя переходит в гексагональную модификацию.
Впервые тетратитанат бария (BaTi4OB) был получен Ска-
нави [7, 8].
Келером и Карпенко [5 ] изучалось взаимодействие ВаСО3
с TiO2 и ZrO2 при нагревании и составлена схема фазового состава
обожженных при температурах от 1100 до 1400° смесей из ВаСО3
и TiO2 при содержании TiO2 от 50 до 100 мол.%.
Титанатные системы
387
Таблица 1
Инвариантные точки системы ВаО—ТЮ2 (по Щепочкиной [9])
Точка Фазы Процесс Состав, мол. % Темпера- тура, °C
ВаО тю.
1 Ba2TiO4 + жидкость. Конгруэнтное плавление. 66.7 33.3 >1880
2 Ba2TiO4+BaTiO3 + жид- кость. Эвтектика. 57.5 42.5 1540
3 BaTiOs + жидкость. Конгруэнтное плавление. 50.0 50.0 1615
4 BaTiO2+BaTi2O5 + жид- кость. Эвтектика. 36.0 64.0 1370
5 BaTijOj + жидкость. Конгруэнтное плавление. 33.3 66.7 1385
6 BaTi2O6+BaTi4O9 + жид- кость. Эвтектика. 31.5 68.5 1370
7 BaTi4O2 + жидкость. Конгруэнтное плавление. 20 80 1445
8 BaTi4O2 + TiO2 + жидкость. Эвтектика. 15 85 1420
Таблица 2
Инвариантные точки системы ВаО—TiO2 (по Рейсу и Рою [15])
Точка Фазы Процесс Состав, мол. % Темпера- тура, °C
ВаО Т1О2
1 BaaTiO4 + жидкость. Плавление. 66.7 33.3 1860
2 Ba2TiO4+ BaTiO3+ жидкость. Эвтектика. 60 40 1563
3 BaTiO3 жидкость. Конгруэнтное плавление. 50 50 1618
4 BaTiO3+BaTi2O5 -|- жидкость. Перитектика. 32.5 67.5 1322
5 Кубич. BaTiO3 т. р.-(-гекса- гон. BaTiO3 т. р. + жид- кость. » 45 55 ~1600
6 Кубич. BaTiO3 + гексагон. BaTiO3. Превращение. 50 50 1460
7 ВаТ12О8-|-ВаТ1яО?-|- жидкость. Эвтектика. 32 68 1317
8 BaTi3O7-j-BaTi4O9 + жид- кость. Перитектика. 29 71 1357
9 BaTi4Oe+TiO2 -|- жидкость. Инконгруэнт- ное плавле- ние. 22 78 1428
10 TiO2 (рутил) + жидкость. Плавление. — 100 1830
25*
Таблица 3
Кристаллические фазы системы ВаО—TiO2 по Щепочкиной (I) и Рейсу и Рою (II)
Соединение Плотность, г/см3 Габитус (I) и кри- сталлическая систе- ; ма ',-5' оЛ •*< и \ Показатели преломления (I) Двупре- ломление Оптический знак Спайность
I II Ng Np
Ba2TiO4 (орто- титанат В а). 549 — SS Неправильные зерна. Поли- синтетические двойники. 1.954 1.891 Высокое — —
ВаТЮ3 (мета- титанат В а). 5.72 Гексагональная система 5.3 Тетрагональная система 5.9 Гексагональная система. 2.49 2.37 Высокое (I и II). Высокое (II). Гексагональ- ная система (+)(1иП). Тетрагональная система (—)(П).
BaTi2O5 (дити- танат В а). 4.16 4.4 Неправильные зерна (I). Длинные кри- сталлы (II). — — Высокое (I и II). (-) 27^80° (I). —
BaTi3O7. — 4.7 — — — Высокое (II). (+) 27° (II). —
BaTi4O2. 4.47 4.6 Ромбическая си- стема (I). 2.42 2.35 Высокое (I и II). (+) 27° (I и II). Под углом 90° (I); от хоро- шей дс со- вершенной, 1 оптиче- ской оси (II).
Титанатные системы
389
По Лапину [6], изотропный метатитанат имеет показатель
преломления JV=2.41 +0.06, а двупреломляющий — JVg=2.50,
ДГр=2.37 с некоторыми колебаниями, по-видимому, из-за возмож-
ных твердых растворов. По Бушу, Флери и Мерцу [И], показа-
тель преломления BaTiO3 при комнатной температуре JV=2.40,
а в точке Кюри при 120° JV=2.46.
Кристаллические структуры титанатов бария описаны Гарри-
соном [14], Айнджером и Гербертом [10], Эвансом [13] и др.
Зависимость сегнетоэлектрических свойств кристаллов BaTiO8
от характера химической связи освещена Беляевым [1], а кри-
сталлохимический анализ температурных фазовых переходов
в сегнето- и антисегнетоэлектрических соединениях со структурой
типа перовскита (BaTiO3) и других — в работе Венецева и Жда-
нова [2].
Микроструктуры керамики из BaTiO8 хорошо показаны в статье
Де Вриза и Бурке [12].
Литература
1. Б е л я е в И. Н., Изв. АН СССР, сер. физ., 22, № 12, 1436, 1958.
2. Венеде в Ю. Н., Г. С. Жданов, Кристаллография, 3, № 6, 751,
1958.
3. В у л Б. М., Электричество, № 3, 12, 1946.
4. Бул Б. М., И. М. Г о л ь д м а н, ДАН СССР, 60, № 1, 41, 1948.
5. Келер Э. К., Н. Б. Карпенко, Журн. неорг. хим., 5, № 3, 668,
1960.
6. Л а п и н В. В., Труды Совещ. по керамич. сырью, Изд. АН СССР, М.,
126, 1948.
7. С к а н а в и Г. И., ДАН СССР, 58, № 1, 41, 1948.
8. С к а н а в и Г. И. Радиокерамические материалы. Госэнергоиздат,
М., 1948.
9. Щепочкина Н. И., Труды 5-го Совещ. по экспер. и технич. мине-
ралогии и петрографии, Изд. АН СССР, М., 493, 1958.
10. A i п g е г F. W., I. W. Herbert, Trans. Brit. Ceram. Soc., 58, № 7,
8, 410, 1959.
11. Busch G., H. F 1 u r y, W. Mer z, Helvet. phys. acta, 21, № 3—4,
212, 1948.
12. DeVries R. C., J. E. В urke, Journ. Amer. Ceram. Soc., 40, № 6,
200, 1957.
13, Evans H. T., Acta crystallogr., 14, № 10, 1019, 1961.
14. Harrison F. W., Acta crystallogr., 9, № 2,198,1956; 9, № 6, 495,1956.
15. R a s e D. E., R. Roy, Journ. Amer. Ceram. Soc., 38, № 3, 102, 1955.
16. S t a 11 о n W. O., Journ. Chem. Phys., 19, №‘ 1, 33, 1951.
17. Tr z eb i a towski W., M. D г у s, I. В e r a k, Roczn. chem.,
28, № 1, 21, 1954.
390
Титанатные системы
ZnO—TiO 2
Имеет значение для производства белых пигментов из двуокиси
титана с небольшими добавками ZnO.
Система, изученная Дулиным и Рейсом [3], характеризуется
(рис. 342) наличием двух соединений: ортотитаната и метатитаната
цинка и двух эвтектик при 32 мол.% TiO2 (1537+5°) и 58 мол;%
TiO2 (1418+5°).
Ортотитанат цинка (Zn2TiO4) плавится конгруэнтно при 1549 +
+5°. Однако некоторые данные свидетельствуют о возможном ин-
конгруэнтном плавлении этого со-
единения, что отображено на диа-
грамме (в круге, в верхней части
диаграммы). Ортотитанат, по Коулу
и Нельсону [21, имеет кубиче-
скую структуру, а0=8.46 а. и.
или, по Бертраму и Слепетису [1 ],
а0=8.456 +0.002 а. и. для плав-
леного продукта и а0=8.471 +
+ 0.002 а. и. для обожженно-
го при 1200°; Z=8, плотность
5.30 г/см3. По Коулу и Нель-
сону экспериментальная плотность
5.12 г/см3, рассчитанная 5.28 г/см3.
Эти авторы указывают на наличие
твердых растворов TiO2 в решетке
Zn2TiO4 вплоть до состава Zn2TiO4 •
• 1.5ТЮ2, что не подтвердилось по-
следующими исследованиями.
Метатитанат цинка (ZnTiO3)
имеет гексагональную структуру
ильменита. Предел устойчивости
при гидротермальных условиях
при атмосферных условиях — при
925+25° [3]. Диссоциирует на ортотитанат и рутил. Рентгено-
графически охарактеризован Бертрамом и Слепетисом [1]:
а0—5.077 +0.002, с0=13.92+0.01 а. и. Последние при изучении
твердофазовых реакций в системе обнаружили ранее неизвестную
фазу Zn2Ti3O8, которая обладает дефектной шпинельной структу-
рой и имеет а0=8.395+0.002 а. и., плотность 4.517 г/см3. Эта фаза
была получена при температуре 800°,. при 1000° она превращается
в ортотитанат и рутил.
Кубо, Като и Митараи и Утида [4] при изучении твердофазовых
реакций в системе нашли, что метатитанат цинка начинает разла-
гаться на рутил и Zn2TiO4 при 970°. Начало образования Zn3TiO4
из смесей ZnO и ZnTiO3 наблюдается при 780°.
°C
1800
1600
190Q
900
700
\(153\
«К
ZnO '
1537'
О
20
ZnO
Жидк. /
Ж+рутил
1918
Ж+
ZnJiO,,
Рис. 342.
Zn2Ti.O,* рутил
995°
ZnTiO3+рутил
&
90 GO
Мол.%
Диаграмма
30
100
П0г
СОСТОЯНИЯ
системы ZnO—TiO2.
находится при 945+25°, а
Титанатные системы
391
Литература
1 Bartram S. F., R. A. Slepetys, Journ. Amer. Ceram. Soc., 44,
№ 10, 493, 1961.
2 . С о 1 e S. S., W. K. Nelson, Journ. Phys. Chem., 42, № 2, 245, 1938.
3 Dulin F. H., D. E. R a s e, Journ. Amer. Ceram. Soc., 43, № 3, 125,
1960.
4 . К u b о T., M. Kato, U. Mi t ara i, K. U t i d a, Journ. Chem. Soc.
Japan, Industr. Chem. Sect., 66, № 4, 403, A31, 1963.
A12O3—TiO2
Диаграмма состояния этой системы имеет существенное значе-
ние для физико-химического освещения роли двуокиси титана,
поскольку последняя является обычной примесью в различных
глиноземистых и алюмосиликатных материалах.
Изучалась Вартенбергом и Ройшем [6], Бантингом [2], Лан-
гом, Филлмором и Максвеллом [3] и Мак-Ки и Алешиным [5].
В системе существует одно двойное соединение Al2TiO5, имеющее,
по Инслею, Nct= 1.975—2.015; (—) 2V° средний; -угасание в призма-
тических разрезах прямое; спайность совершенная по Np, цвет
темный, голубовато-зеленый, а, по данным Брона и Подногина [1 ],
/Vg=2.06 +0.005, А^р=2.035 +0.005; двупреломление 0.035 — 0.040;
знак удлинения отрицательный; (—) 2У=—65—70°, острая биссек-
триса совпадает с осью призмы и перпендикулярна (001); система
ромбическая, бесцветные короткие призмы; спайность отсут-
ствует; плотность 3.681 г/см3; твердость по Моосу 7—7.5. Очень
слабо растворим в H2SO4, НС1 и HNO3 на холоде (а в двух по-
следних и при нагревании). Энергично растворяется в концентри-
рованной H2SO4 при нагревании.
Таблица 1
Инвариантные точки системы А12О3—TiO2
Точка Фазы Процесс Состав, вес. % Темпера- тура, °C
А1,03 Ti02
1 Al2O3±a-Al2O3-TiO2 ± жид- КОСТЬ. Эвтектика. 61.5 38.5 1840 + 10
2 a-Al2O3-TiO2 + жидкость. Плавление. 56.1 43.9 1860
3 «Al2O3-TiO24- Р~А12О3*TiO2+ + жидкость. Полиморфное п зевраще- ние. 45 55 1820
4 р-А1а03 TiO2+TtO2 + жид- кость. Эвтектика. 20 80 1705 ±10
392
Титанатные системы
Таблица 2
Кристаллические фазы системы А12О3—TiO2
Соединение
s
а
к -
Я
л о
о g
ев
Показатели
светопрелом-
ления
Ng Nm
Np
§
s
» S
14ч
a-AI2Os.TiO2
p-Al2Oj«TiO2
Та б ли- 1.93
цы.
Табли- 1.99
цы и
иглы.
1.91
1.97
1.89 Около
90.
1.95 Боль-
шой.
Сред-
нее.
То же
Бесцвет-
ный.
Голубой,
илеохро-
ичный.
|| Np Пря-
мое.
Ц Np То
же
Диаграмма состояния (рис. 343), инвариантные точки и оптиче-
ская характеристика приводятся по данным Ланга, Филлмора и
Максвелла.
Новое рентгенографическое исследование Мак-Ки и Алешина
смесей А12О3 и ТЮ2, нагретых на воздухе до 1700° с различным
°C
2000
1900
1800
1700
О 20 W £0 80 100
^г°з Вес. °!о т^г
Рис. 343. Диаграмма состояния си-
стемы А12О3—TiO2.
°C
1800
1500
1200
AlyTiOj Фазы, богатые
глиноземом
А1гП05
А1г03
ТЮг
+•
МгТЮ5
Т Юг + А1г03
О 25 50 75 100
ТгОг Мол.Чо А1г03
Рис. 344. Схема фазовых отноше-
ний в системе А12О3—TiO2 (по
Лежу с сотрудниками).
временем выдержки, не показало заметных смещений линий,
характерных для стандартного рентгеновского снимка обожжен-
ного глинозема. Во всех случаях, когда в обожженных образцах
наблюдалась вторая фаза, она оказывалась соединением Al2TiO8.
Напротив, при нагревании смесей глинозема и двуокиси титана
в атмосфере водорода рентгенографические данные показали вхо-
Титанатные системы
393
ждение титана (в трехвалентной форме — Ti2O3) в решетку глино-
зема до 2.5 мол.% (см. описание системы А12О3—Ti2O3).
Согласно Лежу с сотрудниками [4], соединение Al2TiO8 устой-
чиво только от 1200° до температуры плавления (около 1850°)
и ниже 1200° подвергается эвтектоидному распаду на рутил и
а-А12О3. Al2TiO2 имеет структуру типа псевдобрукита с парамет-
рами элементарной ячейки: а=9.46, fe=3.60, с=9.65 А. Эти же
авторы полагают, что в системе имеется еще богатая глиноземом
фаза, устойчивая при повышенных температурах (рис. 344).
Литература
1. Б р о н В. А., А. К. Подноги и, ДАН СССР, 91, № 1, 93, 1953.
2. В u n t i n g E. N., Journ. Res. Nat. Bur. Stand., 11, № 5, 719, 1933.
3. Lang S. M., C. L. F i 11 m о r e, L. H. Ma xwell, Journ. Res. Nat.
Bur. Stand., 48, № 4, 298, 1952.
4. L e j u s A. M., D. Goldberg, A. Revcolevschi, Compt.
rend., 263, set. C, № 20, 1223, 1966.
5. McKee W. D.. E. A 1 e s h i n, Journ. Amer. Ceram. Soc., 46, № 1,
54, 1963.
6. Wantenberg H., H. J. R e u s c h, Zs. anorgan. allgem. Chem.,
207, № 1, 18, 1932.
Ga2O3—TiO2
Изучена Лежу с сотрудниками [1] в субсолидусной области.
Установлено соединение Ga2TiO8 и богатая двуокисью титана
’С
1500
1300
1100
I
Ча2Т105
?азаХ/ 1 Щ
1 /М
1 -----------------
\ X + C,a203
V
Рис. 345. Схема фазовых отно-,
шений в системе Ga2O3—TiO2.
I Ti02 + &a203 i
0 25 50 75 100
TiO2 Мол. % Ga,0Q
фаза — фаза X (рис. 345). Соединение Ga2TiOB получалось из смеси
окислов при температуре выше 1300°. Ниже 1300° оно разрушается
с образованием фазы X и окиси галлия. Фаза X устойчива выше
1100° и имеет расширяющуюся с повышением температуры область
394
Титанатные системы
гомогенности. Соединение Ga2TiO6 имеет ромбическую ячейку
типа псевдобрукита с параметрами элементарной ячейки: а=9.80,
Ь=3.61, с=10.00 А.
Литература
1. L е j u s А. М., D. Goldberg, A. Revcolevschi, Compt. rend.,
263, ser. С, № 20, 1223, 1966.
Y2O3—TiO2
Интересна для получения новых типов оптически активных
кристаллов. Изучалась Квейру [1]. Обнаружены три фазы: моно-
клинная (соединение Y2TiO6); кубическая пирохлорная (соеди-
нение Y2Ti2O7 с параметром 10.093 А); гексагональная фаза, рас-
положенная вблизи соединения Y2TiO5. Фаза Y2TiO6 устойчива
от обычной температуры до 1280°. Параметры ее элементарной
ячейки: а=15.75, fe=5.32, с=15.73 А,р=87°34'.
Пирохлорная фаза обладает значительной областью однород-
ности: при 1700° от 32 до 52 мол. % Y2O3, при 1400° от 33 до
35 мол. % Y2O3. Пирохлорная фаза устойчива до температуры плав-
ления. Гексагональная фаза устойчива в температурном интер-
вале от 1300 до 1480°, выше 1480° образуются кубические твердые
растворы типа пирохлора.
Литература
1. Q и е у г о и х F., Compt. rend., 259, groupe 8, № 8, 1527, 1964.
La2O3—TiO2
Интересна своими диэлектрическими свойствами.
Систему изучали Мак-Чесни и Зауэр [1]. Найдено три соеди-
нения: La2O3-TiO2 (плавится конгруэнтно при 1700+10°),
La2O3-2TiO2 (плавится конгруэнтно при 1790+10°) и 2La2O3-
9TiO2 (плавится инконгруэнтно при 1455+5°). Три эвтек-
тические точки имеют состав: 89 вес.% Ьа2О3, 74% Ьа2О3 и
46% Ьа2О3 и соответственно температуры 1630, 1675 и 1445°
(рис. 346).
В системе имеется область расслаивания в жидкой фазе, рас-
положенная между составами 85 вес.% TiO2 и 95 вес.% TiO3
выше температуры 1775°,
Титанатные системы
395
Соединение La2O3-2TiO2, согласно Падурову и Шустериусу [2]
и Роту [3], имеет структуру типа пирохлора. Падуров и Шусте-
Рпс. 346. Диаграмма состояния си-
стемы La203—TiO2.
I — жидкость; 2 — две жидкости; 3 —
Ьа2О9+жидкость; 4 — Ьа2О3-ТЮг+жид-
кость; 5 — Ьа20э-ТЮг+жидкость; в —
Ьа2О9 -2Т1О2-ржидкость; 7 — Ьа2О9 •
2гПО2+жидкость; 8 — ТЮ2+жидкость;
9 — La2O9+La2O9-TiO2; 10 —
La2 О9 TiO2+La2O9 *2TiO2; 11 — La2O9*
2TiO2+2La9O9-9TiO2; 12 — 2La2O9-
• 9TiO2+TiO2.
—i__i__i___i___iiii
f-1„ T-2 1-3 2-9 1-7
2-3 1-.51-.S
Молекулярное отношение
риус указывают на значительную растворимость La2O3 и TiO2
в двутитанате лантана La2O3-2TiO2. На диаграмме Мак-Чесни
и Зауэра образование таких растворов не отмечается.
Литература
1. MacChesney J. В., Н. A. S а и е г, Journ. Amer. Ceram. Soc., 45,
№ 9, 416, 1962.
2. Padurow N. N., C. Schusterius, Ber. Dtsch. keram. Ges., 31,
№ 12, 391, 1954.
3. Roth R. S., Journ. Res. Nat. Bur. Stand., 56, № 1, 17, 1956.
CeO2—TiO2
Система важна для получения новых типов радиокерами-
ческих материалов. В субсолидусной области изучалась Лежу
°C
1000
CeTi20B
+TiOg
CeTi2O6+CeO2
TiO2+CeO2
О 25 SO 75 100
TiO2 Мол.% ' CeO2
Рис. 347. Схема фазовых отиоше-
/ ний в системе СеО2—TiO2.
396
Титанатные системы
с сотрудниками [1 ]. Установлено существование одного соеди-
нения CeTi2Oe, полученного из соосажденных гелей с последующим
прокаливанием их при 1000°. Это соединение неустойчиво ниже
1000° и разлагается на TiO2 и СеО2 (рис. 347). Соединение CeTi2Oe
со структурой типа браннерита (UTi2Oe) имеет моноклинную кри-
сталлическую решетку с параметрами: а=9.84, fe=3.75, с=6.91 А,
р=119°15'.
Литература
1. L е j u s А. М., D. Goldberg, A. Revcolevschi, Compt. rend.,
263, ser. С, № 20, 1223, 1966.
Sm2O3—TiO2
Рот [1 ] получил соединение Sm2Ti2O7, относящееся к типу
пирохлора, с параметром решетки а=10.228 А. Кристаллы имеют
кубическую симметрию.
Литература
1. Roth R. S., Journ. Res. Nat. Bur. Stand., 56, № 1, 17, 1956.
Gd20g—TiO2
Систему изучила Квейру [1 ] в субсолидусной области (обжиг
до 2000°) (рис. 348). Подтверждено открытое Ротом [2] соедине-
Рис. 348. Фазовая диаграмма системы
Gd2O3—TiO2.
ние Gd2Ti2O7 со структурой
типа пирохлора (Р), с обла-
стью однородности (при 1400°)
в'пределах от 27 мол. % Gd2O3
(а=10.168 А) до 33.3 мол. %
Gd2O3 (а=10.180 А).
Второе соединение Gd2TiOs
с моноклинной ячейкой мож-
но рассматривать как фазу с
деформированной флюорито-
вой структурой. Параметры
ячейки этого соединения:
а=15.75, fe=5.326, с=15.73 А,
р=87°34', У=1318 А3.
В области высоких температур существует область флюорито-
вых твердых растворов Сх. При 1550° происходит распад этих
Титанатные системы
397
твердых растворов на соединение Gd2TiO4 и моноклинные твердые
растворы структуры В, характерной^для окислов редкоземельных
элементов. При 1250° твердые растворы В переходят^ кубические
С2 типа Т12О3.
Систему Gd2O3—TiO/подробно изучили Уоринги Шнейдер [3],
построившие фазовую равновесную диаграмму (рис.;349). Изуча-
лись фазы, полученные кристаллизацией расплавов и в результате
реакций в твердом состоянии. Описываются два соединения —
Рис. 349. Диаграмма состояния системы Gd3O3—TiO2 (по Уорин-
гу и Шнейдеру).
Gd2O3>TiO2, Gd2O3>2TiO2 — и кубические гранецентрированные
твердые растворы — FCC т. р. Соединение Gd2O3-TiO2, плавится
инконгруэнтно при 1715° и существует в двух полиморфных
формах с точкой перехода 1712°. Высокотемпературная форма
[Gd2O3>TiO2 (в. т.)] индицируется на основе гексагональной
ячейки с а=3.683 и с=11.995 X. Соединение Gd2O3>2TiO2 плавится
конгруэнтно при-1820°.’Это соединение образует твердый раствор
с TiO2, причем содержание двуокиси титана при 1460° составляет
3 мол.%. Для Gd2O3>2TiO2 и твердых растворов на его основе
характерна пирохлорная£структура с параметром элементарной
ячейки, изменяющимся от/10.181 до 10.169 А. Кубические гране-
центрированные твердые растворыДпри 1750° распространяются
в концентрационной области от 33 до 40 мол.% ^TiO2. Эта фаза
плавится инконгруэнтно в некотором температурном участке от
398
Титанатные системы
перитектической температуры 1840° при 35 мол.% TiO2 до 1775°
при 40 мол. % TiO2 (инконгруэнтная температура плавления
Gd2O3-TiO2). Минимальная температура устойчивости кубической
фазы 1600°, когда в растворе содержится 38 мол. % TiO2. Параметр
кристаллической решетки твердого раствора изменялся от 5.28
до 5.32 А при 1750°.
Литература
1. Que у го их F., Bull. Soc. Franc, mineral., cristallogr., 86, № 3, 295,
1963.
2. Roth R. S., Joum. Res. Nat. Bur. Stand., 56, № 1, 17, 1956.
3. Waring J. L., S. J. Schneider, Joum. Res. Nat. Bur. Stand.,
69A, № 3, 255, 1965.
Dy2°3— TiO2
Одна из важных систем высокотемпературной химии сложных
редкоземельных титанатов, интересна для технологии новых
Рис. 351. Параметр эле-
ментарной ячейки пиро-
хлорной фазы системы
Dy2Os—TiO2.
Рис. 350. Диаграмма состояния си-
стемы Dy2O3— TiO2.
Р — соединение Dy2Ti,O7 типа пирохлора;
Н — фаза с гексагональной элементарной
ячейкой; С, — кубическая фаза типа
флюорита; Сг — кубическая фаза типа
Т12О2; В — моноклинная фаза.
Изучена Квейру [1 ]. Установлено существование двух сое-
динений: Dy2TiOB и Dy2Ti2O7. Кроме того, вблизи соединения
Dy2TiOB обнаружена фаза Н (рис. 350) с гексагональной элемен-
тарной ячейкой. Эта фаза устойчива в температурном интервале
от 1330 до 1650°. Параметры гексагональной фазы: а=3.632,
с=11.837 А.
Титанатные системы
399
Рентгенограмма соединения Dy2TiO8 интерпретировалась на
основе моноклинной ячейки, производной из ячейки типа флюо-
рита. Параметры элементарной ячейки Dy2TiO8: а=15.56,
Ь—5.26, с=15.35 А, р=87°38'. Соединение Dy2Ti2O7 со структу-
рой пирохлора (Р) при низких температурах является стехиомет-
рическим: при повышенных температурах обнаруживается очень
незначительное растворение рутила и значительное, особенно
выше 1600°, растворение Dy2O3. При 1700° содержание Dy2O3
составляет 52.5%. Образующийся твердый раствор постепенно
от пирохлорной структуры переходит к структуре типа флюорита
(CJ; при 52.4 мол.% Dy2O3 наблюдается только последний
тип структуры. Параметр элементарной ячейки от значения
а=10.110 А при 33 мол.% Dy2O3 увеличивается до а=10.360 А
при 52.5 мол.% Dy2O3 (рис. 351).
Литература
1. Q и е у г о и х F., Compt. rend., 259, groupe 8, № 8, 1527, 1964.
Yb2O3—ТЮ2
Система интересна для химии высокотемпературных окислов
редкоземельных элементов.
Изучена Квейру [1] в субсолидусной области (обжиг до 2000°).
Кроме соединения Yb2Ti2O7 пирохлорной структуры (Р) с пара-
Рис. 352. Равновесная диаграмма состоя-
ния системы Yb2O3—TiO2.
метром решетки а=10.030 А, получено новое соединение
YbeTiOn (3Yb2O3-TiO2). Соединение Yb2Ti2O7 обладает значи-
тельной областью гомогенности: при 1400° эта область распростра-
няется от стехиометрического состава Yb2Ti2O7 до содержания
400
Титанатные системы
45 мол. % Yb2O3 (рис. 352). При этом параметр элементарной
ячейки изменяется от 10.028 до 10.146 А. При дальнейшем повыше-
нии содержания Yb2O3 возникает флюоритовая фаза Сг. Область
существования этой фазы при 1400° распространяется от 45 мол. %
Yb2O3 до 55 мол. % Yb2O3 и при 1800° — от 45 до 70 мол. % Yb2O3.
Соединение 3Yb2O3 -TiO2 было получено из соосажденного
геля прокаливанием при 1400°. Это соединение устойчиво от обыч-
ной температуры до 1800°, когда оно распадается на две фазы:
флюоритовую фазу (\ и фазу со структурой Т12О3 (тип С^.
Соединение YbeTiOu имеет триклинную ячейку с параметрами:
а=36.00+0.06, fe=5.131+0.008, с=5.123+0.08 А, а=87°4'+4',
р=85°11'+4', т=84°17'+4'.
Литература
1. Q и е у г о и х F., Bull. Soc. Franc, mineral., cristallogr., 88, К» 3, 521,
1965.
SnO 2—ТЮ2
Изучена Падуровым и Шустериусом [3] и Падуровым [2].
Непрерывный ряд твердых растворов образуется выше 1350°.
Ниже этой температуры наблюдается разрыв смесимости
Рис. 353. Фазовые соотношения в си-
стеме SnO2—TiO2.
(рис. 353). Литц и Надоп [1] также показали, что при низких тем-
пературах (ниже 1000°) имеет место очень ограниченная смеси-
мость SnO2 и TiO2.
Литература
1. L i е t г J., G. N a d о р, Naturwissensch., 42, № 13, 389, 1955.
2. Padurow N. N., Naturwissensch., 43, № 17, 395, 1956.
3. Padurow N. N., C. Schusterius, Ber. Dtsch. keram. Ges,, 31,
391, 1954.
Титанатные системы
401
РЬО—тю2
Рис. 354. Параметры кристаллической
решетки твердых растворов в си-
стеме РЬО—TiO2.
1 — наблюденные величины; г — данные
Лесьежевича [2]; s — монокристалл.
Имеет значение для технологии получения конденсаторной
керамики.
Изучена Беляевым и Нестеровой [1] и Матсуо и Сасаки [3].
Исследования проводились только в области, богатой окисью
свинца (приблизительно до 25 мол. % TiO2).
Беляев и Нестерова утверждают, что ими получено два инкон-
груэнтно плавящихся соединения: РЬО •TiO2 и 2РЬО -ТЮ2. Пере-
ходная точка, соответствующая
инконгруэнтному плавлению
метатитаната, имеет состав 19
мол.% TiO2, 81 мол.% РЬО и
температуру 1024°.
Матсуо и Сасаки [3] обна-
ружили серию твердых рас-
творов, образующихся в ре-
зультате .растворения PbTiO3 в
РЬО. При таком образовании
твердых растворов ромби-
ческая окись свинца перехо-
дит [в тетрагональную, харак-
терную и для твердых раство-
ров. Матсуо и Сасаки отрицают
существование Pb2TiO4, доказы-
вая, 'Что [составы, ^отвечающие
этому соединению, находятся в
области твердых растворов.
Параметры кристаллической решетки тетрагональных твердых
растворов на основе РЬО представлены на рис. 354. Для моно-
кристалла твердого раствора, содержащего 5.3 мол.% РЬТЮ3,
получены параметры решетки: а=3.950, с=4.982 А.
Для получения кристаллов PbTiO3 Беляев и Нестерова реко-
мендуют исходить из смесей с большим избытком окиси свинца.
Фазовые превращения метатитаната свинца изучены Ширане и
Хошин о [4].
Литература
1. Беляев И. Н., А. К. Н е с т е р о в а, Журн. общ. хим., 22, № 3, 396,
1952.
2. Leciejewicz J., Acta crystallogr., 14, № 12, 1304, 1961.
3. Matsuo Y., H. S a s a k i, Journ. Amer. Ceram. Soc., 46, № 8, 409,1963.
4. Shirane G.,S. Hoshino, Journ. Phys. Soc. Japan, 6, № 4, 265,1951.
26 H. А. Торопов и др., кн. 1
402
Титанатные системы
ZrO2—ТЮ2
Представляет интерес для специальных видов керамики.
Систему изучали Соуман и Эндрюс [6], Браун и Дыовец [1],
Кафаноур, Рот и де Просе [3], Валлайес и Шадрон [7], Кокко [21.
Данные Соумана и Эндрюса сведены ими в две диаграммы
(рис. 355, 356), в которых имеются расхождения для составов,
богатых ZrO2. Промежуточные соединения не образуются, присут-
ствуют лишь ограниченные твердые растворы между компонентами.
Диаграмма на рис. 356 дается
нами в несколько видоизменен-
ном Фостером виде (добавлены
две штриховые линии), как
С
2000
2200
2000
1800
1000
1400
Рис. 355. Диаграмма состоя-
ния системы ZrO2—TiO2 (по
Соуману и Эндрюсу).
2400
Жидк, !Кубич.2гОг
I Ж
2тОг т.р. +Ж^——
V +Ж \|
Тетрагон.
'-Т1Ог(рутил)т.р.\ггОг т.р.
Zr02m.p.+Ti02m.p.
™°0 20
тюг
40 00
Вес. %
80 100
ZrO.
в
Рис. 356. Диаграмма состояния
системы ZrO2—TiO2 (модифициро-
ванная Фостером).
в справочнике Левина, Мак-Мэрди и Холла [4].
Несколько иной вид имеют диаграммы более поздних исследо-
ваний; так, на рис. 357 показано наличие соединения ZrTiO4,
плавящегося с разложением. Это соединение показано и на диа-
грамме Кафаноура, Рота и де Просса (рис. 358), составленной
только для интервала температур 1600—1900°; соединение ZrTiO4
плавится инконгруэнтно при 1820° и образует ограниченные твер-
дые растворы. Эвтектика примерно при 1760° и 80 мол.% *TiO2.
В работе Валлайеса и Шадрона приводится диаграмма (рис. 359)
с охватом области более низких температур и появлением в связи
с этим брукитовых твердых растворов, а на рис. 360 дается из
работы Кокко диаграмма части системы ZrO2—TiO2 с р^зграни-
С
3000 r
Жидк.
2000
Тетрагон. >
ZrO2m.p. t
1000
Тетрагон. ZrO2m.p.^
ZJHOtmiUH.ZrO, I1??
т.р.
\ \
\Ионоклин\
XZrO2m.p. \
lg
О
ZrO2
Тетрагон. TiO2
(рутил) т.р.
ZrTfy
+ *
mempaeoii.Ti02m.p.
iMoHOKPUH.ZrO.m.p.
i +ггтю^
20 40 GO 80 100
Мол. °h Tioz
Рис. 358. Диаграмма состояния
системы ZrO2—TiOg (по Кафано-
уру с сотрудниками).
Рис. 357. Диаграмма состояния систе-
мы ZrO2—TiO2 (по Брауну и Дыовецу).
1200
1000
800
ООО
400
Г
тетрУ
%Т.р. тетр, ^'р.'-
А+монокл.
Я X X
2гОгтокл. }$>
$™$брукитт.р. ПУШ"
О 20 40 00 80 100
Zr02 мол. % ТЩ>
Рис. 359. Схема фазовых соотношений си-
стемы ZrO2—TiO2 (по Валлайесу и Шадрону).
26*
404
Титанатные системы
чением на ней
(Л) и твердого
°C
1700
1300-
1100 -
областей: твердого раствора тетрагональной ZrO2
раствора (В), граничащего с составом ZrO2-TiO2.
4+3 |В
Рис. 360. Схема фазовых
J-. соотношений системы
ZrOo—TiO, (по Кокко).
0 Ю 20 30 ZrO2’TiO2
Zr02 Вес.% П02
Структуру ZrTiO2 изучал Ньюнгэм [5]. Была принята ромби-
ческая элементарная ячейка с параметрами: а=4.806, 5=5.447,
с=5.032 A, Z=2.
Литература
1. Brown F. Н., Р. р u w е z, Journ. Amer. Ceram. Soc., 37, № 3,129,1954.
2. Cocco A., Ann. chim. (Roma), 48, № 8—9, 587, 1958.
3. Coughanour L. W., R. S. R о t h, V. A. de P г о s s e, Joum.
Res. Nat. Bur. Stand., 52, № 1, 37, 1954.
4. Levin E. M., H. F. McMurdi e, F. P. H a 11. Phase diagrams for
ceramists. U. S. A., Columbus, p. 70, fig. 140, 1956.
5. Newnham R., Joum. Amer. Ceram. Soc., 50, № 4, 216, 1967.
6. Sowman H. G., A. I. Andrews, Journ. Amer. Ceram. Soc., 34,
№ 10, 298, 1951.
7. Wallaeys R., G. Chaudron. La chimie des hautestemperatures.
Paris, 155, 1955.
шо2—тю2
Существенна для новой высокоогнеупорной керамики.
Изучена в субсолидусной области (обжиг при 1350—1650°)
Годиной, Келером и Руденко [1]. Обнаружено одно соединение —
титанат гафния HfTiO4, кристаллизующееся в ромбической син-
гонии. Параметры решетки: а=4.77, 5=5.05, с=5.58 А.
Обнаружены твердые растворы ограниченной концентрации
в области, примыкающей к рутилу, и в области, примыкающей
к двуокиси гафния. При 1600° граница растворимости HfO2
в TiO2 составляет приблизительно 15—16 мол. % TiO2, a TiO2
в моноклинной HfO2 — 12—13 мол.%.
Литература
1. Г о д и в а Н. А., Э. К. К е л е р, В. С. Руденко, Журн. неорг.
хим., 5, № 12, 2794, 1960.
Титанатные системы
405
ThO2—TiO2
Одна из систем, важных для технологии новых керамических,
высокотемпературных материалов.
Изучалась Лежу с сотрудниками [1 ] в субсолидусной области.
Установлено существование одного соединения ThTi2Oe, получен-
ThTizOe
1300
VThTigOB
+ B-ThTi,06+Th02
ТЮг r 2 6 2
а-П7?206
тчл a,~ThTigOg+ ThO2
Рис. 361. Схема фазовых от-
ношений системы ThO2—TiO2.
0 25 50 75 100
TiO2 Мол.% Th02
ного прокаливанием соосажденных гелей гидроокисей при 1000°.
При 1300° это соединение переходит в высокотемпературную
форму. Фазовые соотношения в системе представлены на рис. 361.
ThTi2Oe имеет моноклинную кристаллическую решетку с парамет-
рами элементарной ячейки: а=9.80, 5=38.3, с=7.05 А, р=118°55'.
Литература
1. Lejus А. М., D. Goldberg, A. Revcolevschi, Compt. rend.,
.263, ser. С, № 20, 1223, 1966.
NbO2—ТЮ2
Интересна для технологии новых материалов, используемых
в электронике.
Гольдшмидт [1 ] исследовал систему в субсолидусной^ области
и нашел, что здесь образуется непрерывный ряд твердых раство-
ров. Для параметров элементарной ячейки приводятся следующие
значения: для NbO2 а=4.830, с=2.980 кХ; для твердого рас-
твора 50 мол.% NbO2-f-50 мол.% TiO2: а=4.714, с=2.99 кХ;
для TiO2: а=4.594, с=2.958 кХ.
Мариндер и Магнели [4] и Мариндер, Дорм’и СелеборгДЗ],
нагревая смеси TiO2 (анатаз), Nb2OB и элементарного ниобия,
помещаемые в эвакуированные, запаянные кварцевые трубки
406
Титанатные системы
(1000°, несколько дней), показали, что образующийся твердый
раствор NbO2—TiO2 сохраняет неизменной рутиловую структуру
(изучалась концентрационная область от 25 до 75 мол. % NbO2).
Для параметров элементарных ячеек твердых растворов получены
следующие значения: Ti0 ,BNb0 2ВО2 — а=
а,с,А
0.2 OJt 0.G 0.8 1.0
X
Рис. 362. Параметры
элементарных ячеек
твердых растворов
системы i\bO2—TiO2.
=4.659, fe=2.986 A;jTi0>B0Nb0 в,Оа— а=4.719,
fe=2.997 A; Ti02BNb0 ",ВО2 - а=4.778, b=
= 2.999 А.
Рюдорф и Лугинсланд [5 ] получили твер-
дые растворы в системе NbO2—TiO2 нагрева-
нием смесей предварительно приготовленной
двуокиси ниобия (получалась восстановле-
нием водородом при 1000°) и TiO2 в эва-
куированных кварцевых ампулах при 1000°.
Рентгенографические исследования,показали,
что переход от структуры, характерной для
TiO2, к структуре, характерной для NbO2,
происходит непрерывно в области, где содер-
жание двуокиси ниобия несколько превыша-
ет 75 мол.%. Параметры кристаллической
решетки твердых растворов (Ti1_a.Nba.)O2 в
зависимости от х представлены на рис. 362. Рюдорф и Лугинсланд
произвели также определение электропроводности и магнитные
измерения. Келлер [2] полагает, что в серии твердых растворов
следует особо выделять соединение TiNbO4.
Литература
1. Goldschmidt Н. J., Metallurgia, 62, № 373, 246, 1960.
2. Keller С., Zs. anorgan. allgem. Chem.,.318, № 1—2, 89, 1962.
3. M a г i n d e г В. О., E. D о г m, M. S e 1 e b о г g, Acta chem. Scand.,
16, № 2, 293, 1962.
4. Marinder В. O., A. Magneli, Acta chem. Scand., 12, № 6, 1345,
1958.
5. Riidorff W., H. H. Luginsland, Zs. anorgan. allgem. Chem.,
334, № 3—4, 125, 1964.
TaO2—TiO2
Шёнберг [2] утверждает, что TaO2 и TiO2 образуют непрерыв-
ный гомогенный ряд твердых растворов типа рутила от одного
компонента до другого.
Рюдорф и Лугинсланд [1 ] обжигали смесь металлического
тантала, Та2Ов и TiO2 в эвакуированной кварцевой ампуле при
1100°. Твердый раствор рутиловой структуры (Ti1_a.TaJO2 обра-
Титанатные системы
407
зуется только для х в пределах от 0 до 0.5. При ж=0.5 возникает
химическое соединение TaTiO4, с дальнейшим увеличением х
твердый раствор не образуется. В твердом растворе титан нахо-
Рис. 363. Параметры эле-
ментарных ячеек твер-
дых растворов системы
ТаО2—TiO2.
дится в трех- и четырехвалентном состоянии, а тантал — в пяти-
валентном, и формулу твердого раствора следует писать в виде
О2> где х находится в пределах от 0 до 0.5.
Параметры кристаллической решетки твердых растворов пред-
ставлены на рис. 363.
Литература
1. Riidorff W., Н. Н. Luginsland, Zs. anorgan. allgem. Chem.,
334, № 3—4, 125, 1964.
2. Schonberg N., Acta chem. Scand., 8, № 2, 240, 1954.
Bi2O3—rTiO2
Представляет интерес для получения диэлектриков с большой
диэлектрической проницаемостью.
В связи с исследованием диэлектрических свойств были синте-
зированы некоторые титанаты висмута. Например, Сканави с со-
трудниками [2] высказали предположение о существовании сое-
динений .BiaTiaO? и Bi2Ti3O9.
Поппер с сотрудниками [5] изучали структуру Bi4Ti3O12i
и показали, что кристаллическая решетка этого соединения слага-
ется из перовскитового типа слоев состава Bi2Ti3Oio, перемежаю-
щихся со слоями Bi2Oa+. Элементарная ячейка Bi4Ti3O12 псевдо-
тетрагональная, объемноцентрированная, с параметрами а= 3.841,'
с—32.83 А.
Беляев с сотрудниками [1 ] при исследовании системы пользо-
вались визуально-политермическим, термографическим, рентгено-
фазовым и дилатометрическим методами. Плавление смесей окис-
408
Титанатные системы
лов производилось в корундовых тиглях; для дилатометрических
измерений служили диски, полученные обжигом смесей окислов
до полного спекания. Полученным соединениям приписываются
формулы: Bi24TiO38(12Bi2O3-TiO2), "Bi4Ti3O12(2Bi2O3-3TiO2) и
Bi2Ti3O9(Bi2O3-3TiO2). Методом плавкости+истема изучена только
до содержания 30.0 мол.%
TiO2, и на кривой (рис. 364,1)
фиксируется только одно сое-
динение Bi24TiO33, плавяще-
еся конгруэнтно при 844° и
образующее две эвтектики,
содержащие 2.5 и 10.0 мол.%
TiO2, с температурой плав-
ления соответственно 797 и
826°. Соединение Bi24TiO33
кристаллизуется в куби-
ческой объемноцентрирован-
1200
1100
1000
1850'
1210 \
°C
1000
а.-Ю'е
900
V
865° '
К,
2-3
900
-10
5
820
0 50 100
Bi203 Мол.а/о Т10г
Рис. 364. Диаграмма плав-
кости системы Bi2O3—TiO2
(по Беляеву с сотрудни-
ками).
1 — кривая ликвидуса; г, з —
кривые коэффициентов линей-
ного расширения.
800 -
700
/3 670
ос__-
500------Р-------
0 25 50
ТЩ> 9-.1 3-2
Мол.%
890'
730°Ма,
75 100
1-9 В1г03
Рис. 365. Фазовая диаграмма
системы Bi2O3—TiO2 (по Спе-
ранской с сотрудниками).
ной решетке. Параметр элементарной ячейки а=9.05 +
+ 0.02 кХ. На кривых коэффициентов линейного расши-
рения имеется три резких излома, отвечающих соединениям
Bi24TiO33, Bi4Ti3O12 и Bi2Ti3O9. Дилатометрические измерения
позволили установить наличие у соединения Bi2Ti3O9 фазового
превращения при 180—260°.
Сперанская, Рез, Козлова, Скориков и Славов [3] построили
равновесную фазовую диаграмму системы. Авторы исследовали
взаимодействие между Bi2O3 и TiO2 методами термического и
рентгенографического анализов. 'Получено три соединения:
Титанатные системы
409
4Bi2O3-TiO2(Bi3TiO14), 2Bi2O3-3TiO2(Bi4Ti3O12) и Bi2O3-4TiO2
(Bi2Ti4On). Соединение 6Bi2O3-TiO2, на которое указывают Ле-
вин и Рот [4] (подробное описание см. на стр. 588), не было полу-
чено; не отмечается также каких-либо твердых растворов. Все
обнаруженные Сперанской с сотрудниками соединения плавятся
инконгруэнтно (рис. 365): Bi8TiO14 при 865°, Bi4Ti3O12 при 1210°
и Bi2Ti4Ou при 1275°. Bi4Ti3O12 имеет обратимый фазовый переход
при 670° (температура Кюри). Два других соединения, по данным
термического анализа, не имеют превращений в исследованной
области температур. Единственная эвтектика в системе имеет
состав 97 мол. % Bi2O3 и 3 мол. % TiO2 и кристаллизуется
при 835°.
Литература
1, Беляев И. П., Н. П. Смоляников, Н. Р. Кальницкий,
Журн. неорг. хим., 8, №2, 384, 1963.
2. Каштанова А. М., Н. Н. Курцева, Г. И. Сканави, Изв.
АН СССР, сер. физ., 24, №2, 114, 1960.
3. Сперанская Е. И., И. С. Рез, JJ. В. Козлова, В, М, Скори-
ков, В.М. Славов.Изв. АН СССР, неорг. матер., 1, №2, 232, 1965,
4, Levin Е. М., R. S. Roth, Journ. Res. Nat. Bur. Stand., 68A, №2,
197, 1964,
5. P о p p e r P., S. Y. R u d d 1 e. s d e n, T. A. Ingles, Trans. Brit, Ce-
ram. Soc., 56, july, 356, 1957.
Cr2O3—TiO2
Имеет значение при определении фазового состава хром- и
титансодержащих огнеупоров и эмалей.
Гамелен [4], Каувил (см. [5]), Хауффе, Грюневальд и Грезе [6]
изучали электрические свойства ряда образцов в этой системе.
Гамелен исследовал реакции, протекающие в системе в твердом
состоянии в интервале температур 1170—1600°. Установлено, что
в образцах с преобладанием TiO2 образуются твердые растворы:
1) твердый раствор В, стабильный при низких температурах, и
2) твердый раствор В', стабильный при высоких температурах.
Дифракционные рентгенограммы твердого раствора В почти иден-
тичны с теми, которые характеризуют продукты восстановления
рутила в системе TiO2—Ti2O3, что согласуется с близостью ионных
радиусов трехвалентных хрома и титана.
Температура превращения твердого раствора В в твердый рас-
твор В’ изменяется с ростом содержания в них окиси хрома при-
мерно с 1440 до 1500°.
410
Титанатные системы
Установлено наличие одного двойного соединения состава
2TiO2-Gr2O3. В присутствии небольших количеств окиси алюми-
ния (тройная система TiO2—А12О3—Сг2О3—Гамелен [5]) стабили-
зируется соединение ТЮ2-Сг2О3, не образующееся в двойной си-
стеме TiO2—Сг2О3. В образцах с высоким содержанием Сг2О3
в последней системе образуются две фазы:
ТЮг
\ Титанохромобый
20 - • окисел
t
30- !
33.3 Ч Т1гСгг07
90- \
е0 ' ) Сгг°з+
70 - / ТЪСгг°7
80-
90-
/
I
I
I
100 J
Сгг°з
2ТЮ2-Сг2О3 и избыточная Сг2О3.
Образцы с небольшим количеством
Сг203 (0.01, 0.1, 0.5, 3.0%), добавленным
к TiO2, обожженные при 1440° в течение
10 мин., имели рентгенограммы рутила.
При содержании в них 0.1 и 0.5% Сг2О3
желтая окраска TiO2 переходила в розо-
вую, а при 3.0% Сг2О3 — в серовато-
черную, металловидную. Образцы с 0.5
и 3.0% Сг2О3 под микроскопом в простом
свете обладали слабым плеохроизмом, а
при скрещенных николях имели отчет-
ливую поляризацию.
Флёрке [3] также изучал твердофазо-
вые реакции в системе TiO2—Сг2О3. Ни-
же 1200° рутил медленно реагирует с
Сг2О3, а выше 1200° происходит реак-
ция до содержания Сг2О3 33.3 мол.%;
свыше этого количества Сг2О3 не раство-
Рис. 366. Схема фазовых
отношений системы
Сг2О3—TiO2.
ряется. Рутиловая решетка принимает
до 3.5 мол. % Сг2О3 без заметного ее из-
менения. При добавках от 3.5 до 12.0 мол. %
Сг2О3 образуются титано-хромовые окислы,
по рентгенограммам сходные с нестехио-
метрическими окислами титана. Эти титано-хромовые окислы гомо-
генны только выше примерно 1450° и могут остаться таковыми при
закалке, причем образуется деформированная решетка, дающая
высокую твердость и диффузные линии на рентгенограммах.
Медленное охлаждение приводит к несмешиваемости этих окислов.
В вакууме реакции между рутилом и Сг2О3 сходны с таковыми в ат-
мосфере кислорода. На рис. 366 показана по Флёрке схема
фазовых отношений в системе TiO2—Сг2О3, построенная по рент-
генографическим данным для температур между 1200 и 1400°.
Андерсон, Сундхолм и Магнели [2], нагревая смеси Сг2О3
и TiO2 при 1300—1400° в инертной атмосфере, получили гомологи-
•ческий ряд смешанных титано-хромовых окислов общей формулы
Т1я_2Сг2О2я_1. Отмечается четыре фазы: Ti4Cr2O11, Т15Сг2Ои,
Ti6Cr2O16 и Ti7Cr2O17. Параметры кристаллической решетки этих
соединений представлены в таблице. Лежу с сотрудниками [7]
Титанатные системы
411
Параметры элементарной ячейки хромитов титана Cr2O3—Т1О2
Фазы
Ti4Cr2On Ti5Cr2O13 5.50
5.50
TieCr2Ols 5.49
Ti7Cr2O17 5.49
7.07 11.89 98.6 120.6 107.4
7.09 15.24 99.1 125.3 108.2
7.08 18.64 99.5 128.2 108.1
7.09 22.13 99.5 130.3 107.3
полагают, что имеется широкая область гомогенности в пределах
4 <Z п 9.
Лежу с сотрудниками отмечают также, что соединение Cr2TiOB
не может быть получено из чистых окислов и должно содержать
стабилизаторы, например следы окислов железа или алюминия.
Мол. % Мол. %
Рис. 367. Фазы, наблюдаемые в системе Сг2О3—ТЮ2
Лежу с сотрудниками считают, что система Сг2О3—TiO2 аналогична
системе Ti2O3—TiO2. На рис. 367 приведена схематическая диа-
грамма обеих этих систем.
Бережной и Гулько [1 ] нашли, что Cr2Ti2O7 плавится конгру-
энтно при 1977° и образует с Сг2О3 при 1977° эвтектику, содержа-
щую около 50 мол. % TiO2. Вторая эвтектика в области, примыкаю-
щей к TiO2, плавится при 1757° и содержит около 97 мол. % TiO2.
Литература
1- Бережной А. С., Журн. Всесоюзн. хим. общ. им. Д. И. Менделеева,
10, № 5, 525, 1965.
3. Anderss on S., A. Sundholm, A. Magneli, Acta chem.
Scand., 13, № 5, 989, 1959.
3. F 1 б г k e O. W., Ber. Dtsch. keram. Ges., 38, № 4, 133, 1961,
412
Титанатные системы
4. Hamelin М., Bull. Soc. ceram. France, 11, 13, 1951.
5. Hamelin M., Bull. Soc. chim. France, № 11—12, 1421, 1957.
6. H a u f f e K., R. Grunewald, H. G r e e s e, Zs. Elektrochem.,
56, 937, 944, 1952.
7. Lej us A. M., D. Goldberg, A. R evcol evschi, Compt.
rend., 263, set. C, № 20, 1223, 1966.
MnO—TiO2
Изучена Гривом и Уайтом [1] методом термического анализа
и микроскопического изучения образцов (рис. 368).
Найдено два соединения: ортотитанат марганца ^MnO-TiOj),
содержащий 36.08 вес.% TiO2, и метатитанат марганца (MnO -TiO2)
Рис. 368. Диаграмма состояния системы
MnO—TiO2.
с 53.05 вес.% TiO2. Метатитанат плавится инконгруэнтно при
1360°. Смеси, содержащие свыше 85% МпО, не могли быть рас-
плавлены в условиях экспериментов Грива и Уайта.
Температура плавления МпО принята 1785°, согласно Уайту,
Ховату и Хею [2].
Литература '
1. Grieve J., J. W h i t e, Journ. Roy. Techn. Coll. (Glasgow), 4, № 4,
660, 1940.
2. W h i t e J., D. D. H о w a t, R. H a y, Journ. Roy. Techn. Coll. (Glas-
gow), 3, № 2, 231, 1934.
Титанатные системы
413
FeO—Т102
Интересна для выяснения состава фаз, образующихся в некото-
рых разновидностях шлаков, и для природного минералооб-
разования, например ульвошпинели (2FeO-TiO2), ильменита
(FeO-TiO2) и др.
Изучалась Гривом и Уайтом [5], Щепочкиной [2] и Мак-Чесни
и Муаном [6]. В отличие от данных Грива и Уайта Щепочкина
(рис. 369) установила новые соединения — дититанат железа (же-
1840^
[2FeO-TiO2+Fe0-TiO2]m.p.*)K
С
1500
{2FeO'TiO^FeO'Ti02](n.p. I
[№2ft0-r^]\»75° \
WTiO/M
«ик0,/ 7ьо(/
2FeO-TiO+)K
/еО*2РеО-ТЮг]
m.p.+2FeO-TiO2
О
FeO
20 / 40
2FeO-TiO,
Рис. 369. Диаграмма состояния системы
FeO—TiO2 (по Щепочкиной).
лезистый аносовит) FeO-2TiO2 и две области ограниченных твер-
дых растворов: ульвошпинели в вюстите (до 11.1 вес.% TiO2)
и ильменита в ульвошпинели (от 35.73 до 40 вес. % ТЮ2). Пара-
метр решетки кубической гранецентрированной ульвошпинели
а=8.51 А; ее отражательная способность 18.4%, а у тригонального
ильменита она равна 20%, у ромбического дититаната железа —
16 %.
Ульвошпинель в аншлифе слабо розоватая, а с масляной им-
мерсией отчетливо розовая; ильменит в аншлифе серый, в скрещен-
ных николях в масляной иммерсии имеет голубоватый цвет.
Ульвошпинель при охлаждении до 700° гомогенна, а при 500°
распадается. Инвариантные точки, по Щепочкиной, представлены
в табл. 1.
414
Титанатные системы
Таблица 1
Инвариантные точки системы FeO—TiO2 по Щепочкиной [2]
Точка Фазы Процесс Состав, МОЛ. % Темпера- тура, °C
FeO TiO.
1 FeO + жидкость, расплав (по Даркену и Гарри [3]). Плавление. 100 — 1380
2 Вюстит (твердый раствор) + + ульвопшинель -|- жидкость. Эвтектика. 88 12 1280
3 Ульвопшинель -|- расплав. Плавление. 66.7 33.3 1375
4 Ульвопшинель (твердый рас- твор) + ильменит + расплав. Эвтектика. 51 49 1350
5 Ильменит -|- расплав. Плавление. 50 50 1365
6 Ильменит + дититанат желе- за + расплав. Эвтектика. 46 54 1360
7 Дититанат железа (железистый аносовит) + расплав. Плавление. 33.3 66.7 Выше 1450°
Таблица 2
Инвариантные точки системы FeO—TiO2 по Мак-Чесни и Муану [6]
Точка Фазы Процесс Состав, мол. % Темпера- тура, °C.
Feo TiO2
1 Вюстит* + расплав. Плавление. 100 1369
2 Вюстит + ульвопшинель -|- + жидкость. Эвтектика. —90 —10 —1312
3 Ульвопшинель -|- расплав. Плавление. —67 —33 —1395
4 Ульвопшинель -j- ильменит -|- + жидкость. Эвтектика. —53 —47 —1363
5 Ильменит + жидкость. Плавление. —47 —53 —1400
6 Ильменит -|- псевдобрукит + + жидкость. Эвтектика. —42 —58 —1390
7 Псевдобрукит + расплав. Плавление. —31 —69 —1494
8 Псевдобрукит + рутил + рас- плав. Эвтектика. —20 —80 —1430
9 Рутиловая фаза с недостатком кислорода + расплав. Плавление. — —100 —1810
* Вюститовая фаза, как и все другие фазы в этой системе, является твердым
раствором, в котором отношение железа к кислороду варьирует.
Титанатные системы
415
Более поздние данные по системе FeO—TiO2, принадлежащие
Мак-Чесни и Муану, проводившим опыты в железных тиглях
1350
1300
1250
ПсевдиИрукит+Ж
МО
W
С
1500
! е
Э+&
I?
/. .
+8юстит
Рутил[
*
•изо! §
вюстит * f
I + ульвошпинель |
I
,[* Псевдобрукит\
I рутил
+§>
If-
11
I
О
FeO
to Гад / 60 7 80
2FeOTiO2 FeO-Tty РеО-2ПОг
вес. %
100
ТЮг
Рис. 370. Диаграмма состояния системы FeO—Т1О2
(по Мак-Чесни и Муану).
и атмосфере азота или в запаянных ампулах из кварцевого стекла
с железовюститовым буфером, приводятся на рис. 370. Здесь
ограниченные твердые рас-
творы показаны для. всех
трех двойных соединений:
ульвошпинели, ильменита
и псевдобрукита (автор
дает это название соедине-
нию FeO*2TiO2, в работе
Щепочкиной называемому
дититанатом железа или
железистым аносовитом).
Для природного псевдо-
брукита в минералоги-
Рис. 371. Диаграмма части системы
Fe—Ti—О.
ческих справочниках да-
ется формула Fe2+TiO6. Эта фазовая диаграмма построена для
парциальных давлений кислорода, определяемых равновесием
416
Титанатные системы
железо—вюстит [3, 41, а для простоты она дается в виде проекции
на разрез FeO—TiO2.
Инвариантные точки по Мак-Чесни и Муану представлены
в табл. 2.
В работе Мак-Чесни и Муана приводится диаграмма (рис. 371)
части системы Fe—Ti—О, показывающая примерные составы сме-
Рис. 372. Диаграммы состояния системы
FeO— ТЮ2.
а — FeO— TiO2 (рутил); б — FeO—TiO2 (брукит).
сей окислов, равновесных при парциальном давлении кислорода,
отвечающем равновесию железо—вюстит в температурном интер-
вале 1250—1350°. Черные кружочки представляют составы, опре-
деленные химическими анализами, а жирная штриховая кривая
проходит примерно через эти точки. Тонкие штриховые линии
представляют ряды твердых растворов (магнетит—ульвопшинель,
гематит—ильменит и псевдобрукитовые твердые растворы).
Новохатский с сотрудниками [1 ] доказывают, что в зависи-
мости от исходного состояния двуокиси титана—рутила или бру-
кита диаграмма состояния системы FeO—TiO2 имеет различный
Титанатные системы
417
вид. Если исходными веществами являются рутил и FeO (вюстит),
то в результате твердофазовых реакций, а также кристаллизацией
расплавов образуются .только два соединения: TeO-TiO2 и
2FeO-TiO2 — и диаграмма состояния имеет вид, в общем сходный
с предложенной Гривом и Уайтом [5], с двумя конгруэнтно пла-
вящимися соединениями: 2FeO-TiO2 и FeO-TiO2 (рис. 372, а).
Новохатский с сотрудниками, привлекая термодинамические
данные, -показали, что соединение FeO-2TiO2 термодинамически
неустойчиво в системе окислов FeO—ТЮ2(рутил). Если смесь
вюстита и анатаза в соотношении 1 : 2 нагревать при 1200° в квар-
цевых трубках, то образуется новое соединение FeO -2TiO2 чер-
ного цвета с плотностью 4.46 + 0.05 г/см3. Если построить диа-
грамму состояния системы FeO—TiO2 (брукит), то здесь уже
будет присутствовать соединение FeO-2TiO2 (рис. 372, б). Но-
вохатский с сотрудниками считают, что Щепочкина фактически
изучила систему FeO—TiO2 (брукит). Образование FeO»2TiO2
в присутствии брукита есть, по-видимому, результат соответ-
ствия элементарных ячеек этого соединения и брукита, кри-
сталлизующихся в ромбической сингонии.
Литература
1. Н о в о х а т с к и й И. А., Л. М. Л е н е в, Д. А. С а в и н с к а я,
Изв. АН СССР, Металлы, № 2, 65, 1965.
2. Щепочкина Н. И., Труды 5-го Совещ. по экспер. и технич. петро-
графии и минералогии, Изд. АН СССР, М., 493, 1958.
3. Darken L. S., R. W. G и г г у, Journ. Amer. Chem. Soc., 68, № 5, 798,
1945.
4. D a r k e n L. S., R. W. Gurry, Journ. Amer. Chem. Soc., 67, № 8,
1398, 1949.
5. G г i e v e J., J. W h i t e, Journ. Roy. Techn. Coll. (Glasgow), 4, № 3,
441, 1939.
6. MacChesney В., A. M u a n, Amer. Mineralogist, 45, № 5—6, 572,
1961.
Fe2O3—TiO2
Представляет интерес в связи с выяснением состава природных
и искусственных титанатов железа.
Согласно данным Эрнста [1], а также Карханавала и Мо-
мина [2], система является простой бинарной с одним соедине-
нием состава Fe2O3-TiO2.
Последние авторы изучали систему методом «сухого» (закалка)
(рис. 373) и гидротермального (рис. 374) экспериментов. В пер-
вом случае (температуры от 620. до 1200°, время 3—250 час.)
27 Н. А. Торопов и др., кн. 1
418
Титанатные системы
обнаружено соединение Fe2O3-TiO2, идентичное природному
псевдобрукиту, и отсутствие каких-либо твердых растворов
С
1200
800
а-Л?г03
^з
• д д а д
I . . д д ддд д д
А А А
А А
<^|Д
Рег03-ТЮг
ЧОО
(II) (13)
(6) (7) (8) (9)(Ю)\(12)\ (Н)(15)(19)
i,ll I I III, III
“0 20 W 60 80 100
Ге2О3 Вес.% ТЮг
• 1 о 2 • 3 д Ч л 5 х 6
Рис. 373. Фазы системы Fe2O8—TiO2 (ме-
тод «сухого» эксперимента).
1 — a-Fe2Oa; 2— a-Fe2O2+Fe2O2-TiO2; 3 —Fe2O2-
•TiO,; 4 — FeI02-Ti02-|-Ti0I; S — TiO, (рутил);
6 — Fe202+X (предположительно 2Fe2Os-3TiO2)-|-
Fe202-T102-|-Ti02 (неравновесное состояние).
Цифрами в скобках обозначены номера образцов.
(1) (2)(ЗХЧ) (5)
в системе,
появление
°C
ЧООг
< I о
200-
(1) №№
। iTii
О 20
^егРз
в 1
Отмечено также недостаточно, однако, доказанное
малых количеств соединения 2Fe2O3>3TiO2 в опытах
при 620°; оно неустойчиво
при более длительном нагре-
।
।
।
1 (10(13)
(ft (7) (8) (9) (СТ|йа|, (П)(15)(18)
40 60 80 100
Вес.% ™г
о2 лЗ р «5
вании и при повышенных
температурах.
При гидротермальных ус-
ловиях (300°, 1200 фунт/дюйм2,
время 5—10 дней) система
также является бинарной с
одним соединением Fe2O3-
•'3TiO2, сходным с природ-
ным минералом аризонитом;
Рис. 374. Фазы системы Fe2O3—TiO2
(метод гидротермального эксперимента).
1 — a-Fe,O,; 2 — a-Fe2O2-|-Fe2O2-3TiO2
(аризонит, следы); 3 — a-Fe2O2-f-Fe2O3 •
• ЗТ1О2+ТЮ2; 4— a-F^O, (следы)-)-Fe,O3 •
• 3TiO2+TiO2; 5 — TiO, (анатаз).
это соединение в условиях
«сухого» эксперимента неус-
тойчиво.
Согласно Пулларду [4],
соединение 2Fe2O3-3TiO2 име-
ет тетрагональную решетку:
ао=9-ЗО, со=9.5О а. и. Однако Карханавала и Момин не смогли
синтезировать это соединение ни в условиях «сухого», ни в ус-
ловиях гидротермального эксперимента.
д
Титанатные системы
419
Лежу с сотрудниками [3] приводят схематическую фазовую
диаграмму системы, на которой указано только одно соединение
Fe2TiOs. Это соединение устойчиво от комнатной температуры
до 1200°, оно имеет ромбическую ячейку с параметрами: а=9.81,
6=3.73, с=9.95 А.
Литература
1. Ernst Th., Zs. angew. Mineral., 4, 394, 1943.
2. Karkhanavala M. D., A. С. M om i n, Journ. Amer. Ceram. Soc.,
42, № 8, 399, 1959.
3 Lej us A. M., D. Goldberg, A. Revcolevschi, Compt.
rend., 263, ser. C, № 20, 1223, 1966.
4. Pouillard E., Ann. chim., (12), 5, Febrary, 164, 1950.
CoO—TiO2
Систему исследовал Стримпль [3]. Диаграмму состояния си-
стемы СоО—TiO2, по данным Стримпля, приводят Левин и Мак-
Мэрди [2]. Обнаружено три химических соединения: 2СоО-ТЮ2
CoO-TiO2 и CoO-2TiO2 (рис. 375).
Детальное исследование /гвер-
дофазовых реакций образования
титанатов кобальта выполнили
Кубо, Като, Наказато и Фуджи-
та [11. В первую стадию реак-
ции происходит образование
CoTiO3, в дальнейшем переходя-
щего в зависимости от состава
в Co2TiO4 или CoTi2Og. Образова-
ние СоТЮ3 происходит при тем-
пературе диссоциации Со3О4 (этот
окисел образуется из СоО при
обжиге на воздухе). Для CoTiO3,
имеющего, вероятно, перовски-
Рис. 375. Предполагаемая диа-
грамма состояния системы
СоО—TiO2 (по Стримплю).
товую структуру, приводятся следующие параметры элемен-
тарной ячейки: ао=5.О7, с0=13.97 А, а0/с0=2.76; плотность
5.048 г/см3, Z=6. Ортотитанат кобальта со шпинельной структу-
рой имеет параметр элементарной ячейки а0=8.444 А, плотность
5.05 г/см3 и Z=8. Шмальцрид (4] изучил диффузионные процессы
и механизм реакции образования Co2TiO4.
27*
420
Титанатные системы
Литература
1. К u b о Т., М. К at о, К. N а к а г a t о, К. F u j i t a, Journ. Chem.
Soc. Japan, Industr. Chem. Sect., 67, № 10, 1502, 1964.
2. Levin E. M., H. F. McMurdie. Phase diagrams for ceramists.
U. S. A., Columbus, pt. II, № 1027, 1959.
3. Strimple J. H., Doctor’s thesis, Rutgers University, State University
of New Jersey, May, 1957.
4. Schwalzried H., Zs. phys. Chem. (N. F.), 32, № 1/2, 76, 1962; 33,
№ 1/4, 111, 1962.
ЦИРКОНАТЫЫЕ СИСТЕМЫ
Li2O^“ZrO2
Диаграмма состояния системы не построена. Дитцель и То-
бер [1 ], обжигая смеси Li2CO3 и ZrO2 при 1350°, получили одно
соединение Li2ZrO3. Шенк [3] указывает на три соединения:
Li4ZrO4, Li2ZrO3 и Li2Zr2OB. Леманн и Эрцбергер [2] при обжиге
(760 и 850°) смесей Li2CO3 и ZrO2 получили одно соединение
Li2ZrO3. Реакция между LiOH и ZrO2 при 750° позволила
получить еще два соединения — Li4ZrO4 и Li2Zr2O5. Эти цир-
конаты при нагревании образуют метацирконат. При 1100° про-
исходит распад Li4ZrO4 -> Li2O+Li2ZrO3, при 800° идет процесс
Li2Zr2OB -> Li2ZrO3+ZrO2.
Литература
1. D i е t z е 1 А., Н. Tober, Вег. Dtsch. keram. Ges., 30, № 3, 47, 1953.
2. Lehmann H.-A., P. E r z b e r g e r, Zs. anorgan. allgem. Chem.,
301, № 5—6, 233, 1959.
3. S c h e n k J., Nucleonics, 10, № 8, 54, 1952.
Na2O—ZrO2
Диаграмма состояния системы не построена. Д’Анс и Леф-
лер [1] и Леманн и Эрцбергер [2] полагают, что в системе имеется
только одно соединение Na2ZrO3.
Литература
1- D’Ans J., J. L б f f 1 er, Вег. Dtsch. chem. Ges., 63, № 3, 1446, 1930.
2. Lehmann H.-A., P. E r z b e r g e r, Zs. anorgan. allgem. Chem.,
301, № 5—6, 233, 1959.
422
Цирконатные системы
K2O^“ZrO2
Диаграмма состояния системы не построена. Леманн и Эрц-
бергер [3], исследуя возможные соединения в системе (обжиг
смесей К2СО3 и ZrO2 при 1100°), получили только дицирконат
K2Zr2O5, существующий, по их данным, в трех различающихся
по рентгенограммам формах. Было обнаружено различие сте-
хиометрии этих форм: форма I с отношением К2О : ZrO2=0.5 : 1;
форма II с К2О : ZrO2 < 0.5 : 1 (К4 84Zr2O4 2); форма III
с К2О : ZrO2 >0.5 : 1. Наиболее стабильной является форма II.
Плотность формы I 3.98 г/см8, формы II 3.90+0.03 г/см8.
Дицирконат калия имеет кубическую или псевдо кубическую
структуру с параметром элементарной ячейки (для формы I)
а=3.96 А.
Гризик, Плющев и Плескова [1, 2] получили трицирконат
и дицирконат в высокотемпературной форме.
Наиболее полно, систему изучил Турну [4], получивший три
соединения: K2ZrO3, K2Zr2OB и K2Zr3O7. Дицирконат K2Zr2OB
Таблица 1
Термический распад цирконатов калия (по Турну)
Температура начала
диссоциации соответ-
ствующих фаз
Температурная
область изучения
термического
распада
Фазы
K,ZrO3, 570° . . . a-k2Zr2O5, 720° . . «570° K2ZrO3
570°<t<720° К 2ZrO3—>a-K 2Zr 2O 5
P-K2Zr2O5, 720° . . 720°<t<850° K2ZrO3“>a-K2Zr2O6“>ZrO2
K2Zr3O7, 720° . . . 850°« K2ZrO3—>p-K2Zr2O5-►
-> К 2Zr3O7->ZrO 2
Таблица 2
Кристаллографические характеристики цирконатов калия
(по Турну)
Фазы Кристаллическая система Параметры элементарной ячейки, А
а ъ с
K2ZrO3. Ромбическая. 10.32 6.97 5.70
a-K2Zr2OB. Гексагональная. 5.74 —. 28.22
P~K2Zr2O6. Ромбическая. 10.763 —. 5.849
К2Л3О7. Т етрагональная. 7.01 — 10.30
ЦирконатНые системы
423
имеет две 'полиморфные модификации: ^высокотемпературную
(по обозначению Турну — p-K2Zr2O8) и низкотемпературную —
a-K2Zr2Os. Температура превращения этих модификаций прибли-
зительно 850°. Все цирконаты калия при нагревании подвер-
гаются термической диссоциации. При распаде K2ZrO3 обра-
зуются K^Zr2O8 и K2Zr3O7 (табл. 1). Кристаллографические ха-
рактеристики цирконатов калия приведены в табл. 2.
Литература
1 Г п и з и к А. А., В. Е. Плющев, Журн. неорг. хим., 7, № 9, 2095,
1962.
2 . Г р и з и к А. А., В. Е. Плющев, И. А. П л е с к о в а, Журн.
неорг. хим., 7, № 12, 2702, 1962.
3 Lehmann H.-A., Р. Erzberger, Zs. anorgan. allgem. Chem.,
301, № 5—6, 233, 1959.
4 . Tournoux M., Rev. Haut. Temper, et Refract., 1, № 4, 343, 1964
BeO— ZrO2
Имеет значение для разработки новых видов огнеупорных
материалов.
Геллер, Яворский, Штейерман и Кремер [2] считают, что
система является простой эвтектической без твердых растворов
и химических соединений. Состав эвтектики: 19 вес.% ВеО и
температура плавления 2240°.
Кокко [1] изучал систему в интервале 0—50 вес.% ВеО,
нагревая смеси при температуре 1600°, и также не обнаружил
соединений и твердых растворов.
Литература
1. Cocco A., Ann. chim. (Roma), 48, № 8—9, 587, 1958.
2. Geller R. F., P. J. Y a v о г s k у, В. L. S t e i e г m a n, A. S. С г e a-
m о r, Journ. Res. Nat. Bur. Stand., 36, № 3, 277, 1946.
MgO—ZrO2
Важна для изготовления высокоогнеупоров и специальных
керамических масс, применякщихся в высокочастотной электро-
технике и других областях новой техники.
Изучалась Эбертом и Коном [4], Жирновой [2] и Дьювецом,
Оделлом и Брауном [3] (гис. 376—378).
424
Цирконатные системы
Для системы характерно наличие широкой области твердых
растворов на основе двуокиси циркония. Цирконатов магния
не обнаружено. Детализацию полиморфизма твердых растворов
°C
Рис. 376. Диаграмма состоя-
ния системы MgO—ZrO2
(по Эберту и Кону).
2800
2W0
2000
1600
1200
f-Моноклин.
I |«+А\ /
U
'I
а±МдО
О 20 W 60 80 100
Zr°2 Мол.% М9°
Рис. 377. Диаграмма со-
стояния системы MgO—ZrO2
(по Жирновой).
двуокиси циркония и окиси магния представили на своей пример-
ной диаграмме Дьювец, Оделл и Браун. По их данным, при высо-
ких температурах (2000°) и до 10 мол.% MgO существуют тетра-
гональные твердые растворы, переходящие при охлаждении в моно-
Та блица 1
Инвариантные точки системы MgO—ZrO2 [2]
Точка Фазы Процесс Состав, мол. % Температура, °C
MgO ZrOa
А ZrO2 + жидкость. Плавление. 0 100 2715
В ZrO2 твердый раствор + + жидкость. Эвтектика. 49 51 2070
с MgO + жидкость. Плавление. 100 0 2800
Цирконатные системы
425
Таблица 2
Кристаллические фазы системы MgO—ZrO2 [2]
Соединение Система кристаллов Ng Np Плот- ность, г/см*
ZrO.? (бадделеит). Моноклинная. 2.20 2.13 5.17
а-Твердый раствор MgO B.ZrO2. Кубическая. 2.08 — —
[i-Твердый раствор MgO (до Моноклинная. (при 13% MgO) 2.29 2.19
4%) в ZrO2. MgO (периклаз). Кубическая. 1.734 — 3.58
клинную форму; при 10—12 мол. % MgO присутствуют две фазы:
тетрагональные и кубические твердые растворы; при 16—
27.5 мол. % MgO — однофазное поле кубической двуокиси цирко-
ния, содержащей MgO в твердом растворе; для составов, содержа-
щих свыше 30 мол.% MgO, существует двухфазный участок,
в котором присутствуют кубические твердые растворы двуокиси
циркония и свободная MgO.
Эберт и Кон и Жирнова полагали, что кубические твердые
растворы, образовавшиеся при высокой температуре, устойчивы
в низкотемпературной области. Година и Келер [1 ] показали,
что ошибочное представление об устойчивости кубических твер-
дых растворов может возникнуть из-за медленности процесса
распада, особенно в присутствии примесей. Проведенное Годи-
ной и Келером специальное исследование показало, что кубиче-
ские твердые растворы двуокиси циркония с окисью магния
при 1200° постепенно распадаются, что подтверждает диаграмму
Дьювеца с сотрудниками.
Вичницки и Стубичан [8] изучили диаграмму состояния си-
стемы в области концентраций от 0 до 50 мол. % MgO, поль-
зуясь соосажденными гелями гидроокислов. Особое внимание
этих авторов было обращено на механизм распада кубических
твердых растворов. Диаграмма состояния системы MgO—ZrO2
приведена на рис. 379. Эти авторы оконтурили, по-видимому,
более точно область кубических твердых растворов, распростра-
нив эту область до чистой двуокиси циркония. Ицверсия тетра-
гональных твердых растворов в кубические для сплава,'содержа-
щего 2 мол.% MgO, происходит при 2343 + 2°, для сплава
с 5.5 мол.% MgO — при^2280 +9°.
Хинц и Дитцель [6] определили фазовые границы между
кубическим магнезиально-циркониевым^твердым раствором и
другими прилегающими фазами (ZrO2 и MgO). В температурном
426
Цирконатные системы
интервале от 1800° до точки плавления граница между кубиче-
ским твердым раствором и двуокисью циркония проходит прибли-
зительно при 7 мол. % MgO. Граница между кубическим твердым
раствором и окисью магния проходит примерно при 20 мол. %
MgO и мало зависит от температуры.
'С
3000 г
вес.%
4 8 12 16 20 24
"С
2500
2000
1500
N
I
|4
iSl.
In \Ky6.ZrO2
m.p. I Ky6.ZrO2mp.
\ I MgO
Жидк.
2000
Кубич.т.р. г MgO
Tempa-j
m°p‘ l Тетрагон.m.p.+MgO
1000
/ TempaeoH.Zr02m.p.+Mg0
1000
S
500
/
' Моноклин. ZrO2 m.p.+MgO
О 10 20 30 40 50
Щ Mon°/Q мдо
i 'MoHOKnuH.Zr02*mempaeoH.Zr0;>
\ Моноклин. m.p.+ MgO
Моноклин. Zr02
0 10 20 30 40 50
Zr°z Мол.% MgO
Рис. 378. Примерная диаграмма Рис. 379. Диаграмма состояния си-
состояния части системы MgO— стемы MgO—ZrO8 (по Вичницки
—ZrO2 (по Дьювецу, Оделлу и и Стубичану).
Брауну).
Грэйн [5] на основании точных определений параметров реше-
ток твердых растворов (тетрагонального и кубического) уточнил
фазовые границы в интервале 1350—1600° и до содержания
30 мол. % MgO.
Рабенау [7] показал, что кубические твердые растворы в си-
стеме MgO—ZrO2 относятся к структурному типу флюорита и
содержат значительное количество анионных вакансий. Пере-
ходящий в интервале 1000—1400° эвтектоидный распад кубиче-
ских твердых растворов происходит с образованием тетрагональ-
ного твердого раствора и окиси магния,
Цирконатные системы
427
Литература
1. Година Н. А., Э. К. К е л е р, Огнеупоры, 26, № 9, 426, 1961.
2, Жирнова Н. А., Журн. прикл. хим., 12, № 9, 1278, 1939.
3. D uw е г Р., F. О d е 1 1, F. Н. В г о w n, Journ. Amer. Ceram. Soc.,
35 К» 5 107 1952.
4. Ebert F., E. С о h n, Zs. anorgan. allgem. Chem., 213, № 4, 321, 1933.
5. Grain C. F., Journ. Amer. Ceram. Soc., 50, № 6, 288, 1967.
tj, Hinz I., A. D i e t z e 1, Ber. Dtsch. keram. Ges., 39, № 11, 530, 1962.
7. Rabenau A., Angew. Chem., 69, № 20, 651, 1957.
8 Viechnicki D.,V. S. Stubican, Journ. Amer. Ceram. Soc., 48,
№ 6, 292, 1965.
CaO—ZrO2
Интересна для технологии высокотемпературных керамиче-
ских материалов.
Система изучалась Руффом, Эбертом и Штефаном [12], Дью-
вецом, Оделлом и Брауном [7], Дитцелем и Тобером [6], Келе-
ром и Годиной [4] и Кокко [5].
Согласно Руффу с сотрудниками, в системе образуется соеди-
нение CaZrO3, плавящееся при 2330° (рис. 380). Дьювец с сотруд-
никами дали более детальную, но все же ориентировочную диа-
грамму в области 0—50 мол.% СаО, причем ими охвачена и суб-
солидусная область с ее полиморфными соотношениями (рис. 381).
Твердые растворы в системе наблюдаются в области, примы-
кающей к двуокиси циркония. В результате растворения СаО
в двуокиси циркония ниже 1000° образуются твердые растворы
моноклинной формы, а выше этой температуры — тетрагональной
(рис. 381). Предельный твердый раствор тетрагональной формы
имеет значительно более высокую концентрацию СаО, чем моно-
клинной. Температура перехода моноклинной формы в тетраго-
нальную снижается по мере повышения концентрации СаО в твер-
дом растворе, но это снижение незначительно.
Кубические твердые растворы типа флюорита образуются
при содержании СаО сверх5 мол.%. За последние годы эти твер-
дые растворы подверглись детальному изучению. Согласно Руффу
с сотрудниками, гомогенная область их распространяется вплоть
до 40 мол.% СаО. Дьювец с сотрудниками для предельной
концентрации СаО в кубическом твердом растворе, указывают
30 мол.% для 2000° и несколько меньше при понижении темпе-
ратуры. Хунд [8] для образцов, приготовленных обжигом при
1460°, дает концентрационные пределы твердых растворов
10—20мол. % СаО. Дитцель и Тобер [6] для образцов, обожженных
при 1800°, принимают предельные концентрации твердого рас-
твора 7—24 мол.% СаО и для образцов, обожженных при
428
Цирконатные системы
1400°, от 14 до 20 мол. % СаО (рис. 382). Согласно Кокко [5],
область стабильного существования кубических твердых раство-
ров в окислительной атмосфере при 1600° ограничивается пре-
делами 5—10 мол.% СаО (рис. 383).
Значительно более широкую область кубических твердых
растворов указывают Волченкова и Пальгуев [1]. На основании
Sec. %
состоя-
Рис. 380. Диаграмма
ния системы СаО—ZrO2 (по
Руффу, Эберту и Штефану).
Рис. 381. Примерная диаграмма
равновесия фаз системы СаО—
—ZrO2 в пределах от 0 до
50 мол. % СаО (по Дьювецу,
Оделлу и Брауну).
1 — моноклинный и тетрагональный
твердые растворы; 2 — кубический
твердый раствор; 3 — смесь кубиче-
ского твердого раствора и цирконата
кальция.
измерения электропроводности
эти авторы нашли для образ-
цов, обожженных при 1500°,
предельные концентрации СаО
от 10 до 40 мол.%.
Тайен и Суббарао [13], также пользуясь измерением электро-
проводности, пришли к выводу, что твердые растворы, получен-
ные при 2000° и закаленные от 1400°, имеют максимальное содер-
жание СаО 22 мол.% (минимальное 12 мол.%). По-видимому,
в опытах Волченковой и Пальгуева образцы с 40 мол.% СаО
содержали некоторое количество цирконата CaZrO3.
Большой интерес представляет вопрос об устойчивости куби-
ческих кальциево-циркониевых твердых растворов в области
температур 1000—1200°. Согласно Дьювецу с сотрудниками,
Цирконатные системы
429
эти твердые растворы в отличие от твердых растворов с окисью
магния устойчивы не только при высоких температурах, но и
°C
1800
1600
ноо
1200
1000
800
j \ буб.
Лт.р.
|ё
ZrO^f
т.р. \ /
Куб. т.р.
CaZrO3
Куб. т.р.
CaZrO-,
+ J
ZrO2 т.р
2гОгмонокл.+CaZr03
О 10 20 30 W 50
Zr02 Мол.% СаО
Рис. 382. Фазовые отно-
шения в системе СаО—
—ZrO2 (по Дитцелю и То-
беру).
при всех изученных температу-
рах вплоть до 800° (рис. 381).
Качалова и Августиник [3] и Го-
дина и Келер [2] полагают, что
кубические твердые растворы дву-
°С
1700
1500
1300
bZrO2 \
\mempX
! Zr% V'W
j тетр. I
[^2#
Zr02 куб.
CaOZrO2
С 5 10 15 20
Zr02 МОЛ.% СаО
Рис. 383. Фазовые отношения
в системе СаО—ZrO2 (по Кокко).
|ьа
окиси циркония с окисью кальция проявляют тенденцию к рас-
паду при 1000—1200°, но степень распада их ограничена. Продук-
тами распада являются моноклинная ZrO2 и CaZrO3.
а, 4
5.12
5.10
508 t,
О 5 10 15
ZrO2 РЛол. °% ^0
Рис. 385. Параметры
кристаллической ре-
шетки кубических твер-
дых растворов системы
СаО—ZrO2 (по Тайепу
и Суббарао).
Рис. 384. Параметры кри-
сталлической решетки ку-
бических твердых раство-
ров системы СаО—ZrO2 (по
Кокко).
Тайен и Суббарао не обнаружили распада кубических твердых
растворов при их длительной выдержке (1000°) и полагают,
430
Цирконатные системы
что при такой термообработке происходит переход из упорядо-
ченного состояния в неупорядоченное.
При исследовании образования кубических твердых растворов
путем проведения твердофазовых реакций между окислами при
температурах 1100—1300° Келер и .Година [4] показали, что
в качестве первого продукта
кальция CaZrO3, который
реакции всегда возникает цирконат
при продолжающемся нагревании
Рис. 386. Часть диаграммы состояния
системы СаО—ZrOs.
взаимодействует с избытком двуокиси циркония и переходит
в твердый раствор. Образование цирконата протекает с большой
скоростью при 1000—1200°, тогда как для получения твердых
растворов требуются значительно более высокие температуры.
Кристаллы CaZrO3, согласно Мегоу [10], относятся к ромби-
ческой сингонии и имеют параметры кристаллической решетки:
а=11.152, 5=11.492, с=7.994 А, а/5=0.9704, с/5=0.6956. Надлер
и Фитцсиммон [9] изучили структуру цирконата кальция, полу-
ченного спеканием СаО и ZrO2 при 1850°. Эти авторы относят
CaZrO3 к моноклинной системе. Параметры элементарной ячейки:
а=с=4.003 ±0.002 а. и., 5=3.997+0.003 а. и., р=91°43'±3'.
Плотность пикнометрическая 4.66 г/см8, вычисленная в предпо-
Цирконатные системы
481
ложении моноклинной псевдоячейки 4.74 г/см8. Параметры ре;
шетки кубических твердых растворов приведены на рис. 384 и 385.
Рой [11] предложил новый вариант диаграммы состояния
(рис. 386).
Литература
1. Волченкова, С. Ф. Пальгуев, Труды Инет, электрохимии
Уральск, фил. АН СССР, вып. 1, 1960.
2. Г о д и и а Н. А., Э. К. К е л е р, Огнеупоры, 26, № 9, 426, 1961.
3. Качалова А. П., А. И. Августиник, Журн. прикл. хим.,
32, № 7, 1451, 1959.
4. Келер Э. К., Н. А. Г о д и и а, ДАН СССР, 103, № 2, 247, 1955.
5. Cocco A., Chim. Industria (Milan), 41, № 9, 882, 1959.
6. D i е t z е 1 A., H. T о b e г, Ber. Dtsch. keram. Ges., 30, № 3, 47, 1953.
7. D uwe z P., F. О d e 1 1, F. H. В rown, Journ. Amer. Ceram. Soc.,
35, № 5, 109, 1952.
8. Hund F., Zs. phys. Chem., 199, № 1/3, 142, 1952.
9. N a d 1 e г M. R., E. S. F i t z s i m m о n, Journ. Amer. Ceram. Soc.,
38, № 6, 214, 1955.
10. Megaw E., Proc. Phys. Soc., 58, № 326, 133, 1946.
11. Roy R., Bull. Soc. chim. Franc., № 4, 1148, 1965.
12. R u I f O., F. Ebert, E. S t e p h a n, Zs. anorgan. allgem. Chem.,
180 № 3 219 1929.
13. Tien T.-Y., E. C. S u b b a r a o, Journ. Chem. Phys., 39, № 4, 1047,
1963.
SrO—ZrO2
Первое исследование системы SrO—ZrO2 принадлежит Вартен-
бергу и Гурру [7], которые приводят кривые плавкости, отмечая
одно соединение SrZrO3, плавящееся конгруэнтно, приблизи-
тельно при 2650° и две эвтектики при 2200 и 2150°, содержащие
соответственно 37 и 75 мол.% ZrO2. Дир [4] исследовал реакции
в твердом состоянии и утверждает, что им получено два соедине-
ния: SrZrO3H Sr2ZrO4. Исхаков и Келер [1] при изучении твердо-
фазовых реакций в системе не обнаружили соединения Sr2ZrO4.
Тиллока и Перес-и-Джорба [6] построили диаграмму состоя-
ния системы (рис. 387). Обнаружено четыре цирконата стронция:
SrZrO3, Sr2ZrO4, Sr3Zr2O7 и Sr4Zr3O10. SrZrO3 плавится без разло-
жения приблизительно при 2800°. Соединение Sr2ZrO4 диссоции-
рует при 1350°, и выше этой температуры присутствуют Sr3Zr2O7
и SrO. Область устойчивости соединения Sr3Zr2O7 простирается
от 1330 до 1650°.
Кокко и Чиациг [3], исследуя твердофазовые реакции в ин-
тервале температур 1400—1700°, не обнаружили соединения
Sr2ZrO4 и отрицают его существование. Эти авторы синтезировали
соединение Sr3Zr2O7, на которое указывали Тиллока и Перес-
432
Цирконатные системы
Кристаллографические характеристики цирконатов стронция
Соединение Кристаллическая ! ^система i , Параметры кристаллической решетки, А
а ь С
SrZrO3. Ромбическая. 5.792 5.818 8.189
Sr4Zr3Ol0. »J "'’г'-; 5.795 5.814 29.34
Sr3Zr3O7. » 5.798 5.808 20.94
Sr2ZrO4. Тетрагональная. 5.801 5.801 12.445
и-Джорба. Sr3Zr2O7 образуется через промежуточную стадию
метацирконата: 3SrO+2ZrO2=2SrZrO3+SrO=Sr3Zr2O7.
Тарнопольская и Гулько [2] определили плавкость системы,
наблюдая. склонение пирамидок, изготовленных из смесей SrO
H_ZrO2. ..
2500-
SrZrqf+M\
\ 5г^2г30^д+Ж
2000
х SrO+Ж
1650
1500
1350
1280
SrZrO^Sr^Ofu
SrtZr30fg+Sr0
- SrZrO3*Sr3Zr2O7
Sr3Zr207+SrO
iooo L
50
SrZr(L*Sr,ZrOt SiyZrOsSrO
J г * SrZrO^SrO *
। Ji
57 60
66.5
ZrO2
Мол. %
SrO
Рис. 387. Диаграмма состояния системы
SrO—ZrO2 (по Тиллока и Перес-и-Джорба).
°C
2700
2500
2300
2100
1900
1700
О 20 W 60 80 100
Sr0 Вес.% ZrOz
Рис. 388. Приближенная
диаграмма состояния си-
стемы SrO—ZrO2 (по Тарно-
польской и Гулько).
После определения плавкости исследуемые образцы анализи-
ровались на содержание свободных SrO и ZrO2. Было обнаружено
два соединения: цирконат SrZrO3 и второй цирконат, состав кото-
рого не отвечал i-формуле Sr2ZrO4, так как в образце состава
2SrO-ZrO2 всегда содержалась свободная окись стронция. Моно-
минеральный фазовый состав был получен в образце, содержащем
41.6% ZrO2, т. е. формулы 5SrO-3ZrO2=SrBZr3Ou. Это соединение
плавится инконгруэнтно при 2200° с образованием SrZrO3 и рас-
Цирконатные системы
433
плава. Набор межплоскостных расстояний и интенсивности линий
соединения Sr5Zr3Ou практически оказались такими же, какие
получил Дир [4] для соединения, которому он приписал
формулу Sr2ZrO4. Показатели светопреломления Sr5Zr3Ou:
ZVg=2.02+0.01, Np=2.00+0.01; плотность 5.02 г/см8. Твердых
Рис. 389. Диаграмма состояния системы
SrO—ZrO2 (по Кокко и Чиацигу).
растворов авторы не обнаружили. На рис. 388 представлена при-
ближенная диаграмма состояния системы SrO—ZrO2.
Привлекая данные других авторов, Кокко и Чиациг [3] по-
строили диаграмму состояния системы SrO—ZrO2, представленную
на рис. 389. Здесь указываются небольшие области твердых рас-
творов на основе SrZrO3 и Sr3Zr2O7. Предельное содержание SrO
в первом из указанных твердых растворов достигает 51.5 мол. %
SrO.
Мегоу и Рот [5], так же как и Кокко и Чиациг, считают, что
кристаллы соединения SrZrO3 имеют ромбическую сингонию.
Литература
1. Исхаков X. Ш., Э. К. Келер, Журн. неорг. хим., 7, № 8, 1946,
1962.
2. Тарнопольская Р. А., Н. В. Гулько, ДАН СССР, 170, № 5,
1140, 1966.
3. Cocco A., I. Chiacig h, Ann. Chim. (Roma), 55, № 12, 1341, 1965.
4. Dear P. S., Bull. Virginia Polytechn. Inst., 50, № 11, 3, 1957.
5. Meg aw H. D., R. S. Roth, Nat. Bur. Stand. Circ., № 539, 9, 1960.
6. Tilloca G., M. Perez у Jorba, Rev. Haut. Temper, et Refract.,
1, № 4, 331, 1964.
7. Wart enberg H., W. G u r r, Zs. anorgan. allgem. Chem., 196, № 4,
381, 1931.
28 H. л. Торопов и др., кн. I
434
Цирконатные системы
ВаО—ZrO2
Имеет значение для получения высокоогнеупорных и электро-
технических материалов.
Диаграмма состояния системы не построена. Келер и Година [2]
изучали твердофазовые реакции, происходящие при нагревании
смесей ZrO2—ВаСО3 и ZrO2—ВаО2. Получающиеся фазы исследо-
вались химическим и рентгеновским анализом. Обнаружено одно
химическое соединение — цирконат бария BaZrO3, образующийся
при 1100—1200°; твердых растворов не обнаружено.
Галкин и Чухланцев [1], исследуя твердофазовые реакции
(в интервале температур 1150—1350°) в смесях с высоким содержа-
нием ВаО (до отношения ВаО : ZrO2=5 : 1), показали, что в этих
условиях образуется ортоцирконат бария Ba2ZrO4. Это соедине-
ние, по-видимому, относится к ромбической сингонии, легко гидро-
лизуется водой. Реакции между Ba2ZrO4 и окисью бария не обна-
ружено.
Келер и Кузнецов [3] приводят некоторые свойства цирконата
бария BaZrO3, синтезированного керамическим методом с обжи-
гом при 1500° (2 часа): температура плавления выше 2480°, плот-
ность 6.33 г/см8, средний коэффициент линейного расширения
в интервале температур 20—1200° 7.05-10"6, диэлектрическая
постоянная при 20° — 28, тангенс угла потерь tg 8-104 при частоте
1-108 гц и температуре 200° — 6.5, при температуре 300° — 29
и при 400° — 40.
Литература
1. Галкин Ю. М., В. Г. Ч у х л а н ц е в, Изв. АН СССР, неорг. матер.,
1, № 11, 1952, 1965.
2. К е л е р Э. К., Н. А. Година, Огнеупоры, 18, № 9, 416, 1953.
3. К е л е р Э. К., А. К. Кузнецов, Журн. прикл. хим., 34, № 10,
2146, 1961.
Цирконатные системы
435
ZnO—-ZrO2
Согласно данным Бартушка и Батракова [1 ], диаграмма состоя-
ния системы ZnO—ZrO2 имеет вид, представленный на рис. 390.
Рис. 390. Ориентировочная
диаграмма состояния системы
ZnO—ZrO2 (по Бартушка и
Батракову).
Литература
1. Бартушка М., Н. А. Батраков, Журн. прикл. хим., 36, № 4,
724, 1963.
А12О3—ZrO2
Кривые плавкости системы определялись Вартенбергом и Гур-
ром [3] и Вартенбергом и Ройшем [4]. Согласно исследованиям
Рис. 391. Диаграмма плавкости системы А12О8—ZrO2.
а — опыты проводились в газовой печи; б — опыты проводились
в печи Таммана.
28*
436
Цирконатные системы
Сузуки, Кимура, Ямада и Ямаучи [1,2], в системе отсутствуют
химические соединения и температура плавления эвтектики со-
става 45 вес.% А12О3 равна 1890+5° (рис. 391, а и б).
Лит ерат ура
1. Suzuki Н., S. Kimura, Н. Yamada, Т. Yamauchi, Journ.
Ceram. Assoc. Japan, 69, № 782 (2), 52, 1961.
2. Suzuki H., S. Kimura, H. Yamada, T. Yamauchi, Journ.
Ceram. Assoc. Japan, 69, № 790 (10), 345, 1961.
3. Wartenberg H., W. Gurr, Zs. anorgan. allgem. Chem., 196, № 4,
374, 1931.
4. Wartenberg H., H. J. Reusch, Zs. anorgan. allgem. Chem.,
207, № 1, 1, 1932.
Sc2O3—ZrO2
Изучена Лефевром [1] в пределах концентрации 0—60 мол.%
ScO1>g на образцах, обожженных до 2000° (рис. 392). В системе,
кроме фаз стабилизированной двуокиси циркония (а и а'), обна-
ружено несколько кубических флюоритовых фаз (р, у, 8), которые
Рис. 392. Фазы, наблюдаемые в си-
стеме ScjjOs—Zr02 при изучении ре-
акций в твердом состоянии.
можно рассматривать как пе-
реходные формы к твердым
растворам, относящимся так-
же к кубическим типам,
образующимся при раство-
2гОг Мол 7,
~60
Рис. 393. ’ Параметр эле-
ментарной ячейки флюорито-
вой фазы системы Sc203—ZrO2.
рении ZrO2 в Sc2O3 (тип Т12О3 или Мп2О3). Фазы, содержащие
10—15% Sc2O3, закаленные от 1600 до 2000°, представляют твер-
дые растворы на основе ZrO2 (стабилизированная двуокись цирко-
ния) тетрагональной сингонии (фаза а).
При закалке этих же составов от температур ниже 1600° обна-
ружены две тетрагональные фазыах иа2. Для образца, содержащего
Цирконатные системы
437
5 мол. % Sc2O3, для этих двух фаз получены следующие параметры
элементарной ячейки: с фаза ах — а=5.082, с=5.155 А; фаза
а2 — а=5.082, с=5.132 А. Фаза 8 интерпретируется как кубическая
с параметром решетки а=5.027 А. а' — кубическая фаза типа
Т12О3 (или Мп2О3), твердый раствор ZrO2 в Sc2O3. Предельная кон-
центрация ZrO2 около 10 мол. % (рис. 392). Фазы р и Т имеют
деформированную кубическую решетку типа CaF2 и индицируются
в ромбоэдрических параметрах: тип р — а=5.085 А, а=88°48';
тип т — а=5.068 А, а=90°19'.
Мёбиус, Витцманн и Циммер [3] на основании рентгеновских
определений нашли, что область флюоритовой фазы у простирается
от 11 до 48 мол.% ScOx в (рис. 393). Лефевр дал описание своих
работ в статье 1964 г. [Й].
Литература
1. Lefdvre J,, Ann, chim,, (13), 8, № 1—2, 117, 1963.
2. Lefevre J., Rev. Haut. Temper, et Refract., 1, № 3 , 229, 1964.
3. M о b i u s H. H., H. Wit zmann, F. Z i m m e r, Zs. Chem., 4, № 5,
194, 1964.
Y2O3—ZrO2
Имеет значение для получения высокотемпературных нагрева-
телей и осветительных элементов (стержней Нернста), а^также
особых видов керамики.
Изучена Дьювецом, Брауном и Оделлом [16], Фань Фу-каном,
Кузнецовым и Келером [2] и Лефевром [7] (рис. 394—397).
Для системы характерно наличие широких областей твердых
растворов. Установлены: 1) твердые растворы на основе двуокиси
циркония; 2) твердые растворы на основе Y2O3; 3) кубические твер-
дые растворы в центральной части диаграммы состояния.
Твердые растворы на основе двуокиси циркония, так же как
и для чистой ZrO2, относятся к моноклинной и тетрагональной
сингонии. При внедрении Y2O3 в решетку ZrO2 резко снижается
температура полиморфного превращения ZrO2. По данным Фань
Фу-кана, Кузнецова и Келера, переход моноклинного твердого
раствора, содержащего 1 мол. % Y2O3, в тетрагональный происхо-
дит при 960° (для чистой двуокиси циркония 1170°). При содержа-
нии 4 мол. % ZrO2 температура превращения составляет всего 550°.
До сих пор нельзя считать окончательно выясненной природу
кубических твердых растворов, однофазная область которых рас-
438
Цирконатные системы
полагается при концентрациях,^близких к 33.3 мол. % Y2O3. Дьювец
с сотрудниками [6], Дитцель и Тобер [5], а также Коллонг,
Перес-и-Джорба и Лефевр [4] полагают, что эти твердые растворы
имеют флюоритовую структуру. Эти авторы не связывают с твер-
дыми растворами какое-либо химическое соединение.
Рот [9] и Келер с сотрудниками доказывают, что рассматри-
ваемые кубические твердые растворы относятся к типу пирохлора,
’С
2500
гооо
1500
Летрагон. ZrO2 m.p.
юо о о о о
ZrO2 m.p. (куб.)
1000 ; I
|< |Q О О О О О Of о о о о о d
\ TempasoH.ZrOy\ п
1 т.р. * ZrO2m.p.i
I + + I
I Ky6.Zr02m.p.\ Yp03m.p. ।
причем признается химиче-
ское соединение Y2Zr2O7 со
значительной областью одно-
родности. С повышением тем-
пературы (в пределах 1750—
2150°) область однородности
расширяется. Фань Фу-кан,
Кузнецов и Келер [2] наш-
ли, что соединение Y2Zr2O7
плавится без разложения
500
MoHOKP.Zr02m.p
\*MoHOKn.Zr02 m.p. + куб.2гОгт.р
J_____I_____I I I_______________I
О 20 W 60 80 100
Zr02 Мол. % Уг°3
Рис. 395. Влияние Y2Os
на температуру превра-
щения тетрагональной
модификации ZrO2 в мо-
ноклинную.
Рис. 394. Ориентировочная диа-
грамма состояния системы Y2O3—
—ZrO8 (по Дьювецу, Брауну и
Оделлу).
при температуре 2530+30°. Параметр гранецентрированной ре-
шетки этого соединения а=10.405 кХ.
Кубические твердые растворы на основе Y2O3 имеют объемно-
центрированную решетку. Предельная концентрация ZrO2 в этих
твердых растворах зависит от температуры. С повышением темпе-
ратуры от 1750 до 2150° эта предельная концентрация увеличи-
вается приблизительно от 20 до 30 мол. % ZrO2.
Стриклер и Карлсон [11], пользуясь методом определения
электропроводности твердых сплавов, содержащих 20—25 мол. %
Y2O3, обнаружили обратимый переход из упорядоченного состоя-
ния в неупорядоченное при 1100°.
Цирконатные системы
439
Нильсен и Лейпольд [8] определили коэффициент термического
расширения образцов, полученных спеканием смеси, содержащей
2500
2000
Куб. т.р.
\^2ZrZ°7
1500
15 вес.% Y2O3. Плотность та-
ких образцов составляла при
2050° 5.44 г/см3 и при 2200°
5.56 г/см3.
Линь Цзу-сян и Юй Хуай-
цзюн [1] исследовали систему
Y2O3—ZrO2 методом «отжига и
закалки» (температура измере-
1000
Тетрагон^
' m.p.ZrO2
; куб.т:р.
500
Монокл.т.р.2гОг
куб.т.р. Y2Zr207
О 20/^0 SO
ZrO2 У^г2°7
80
Мол.%
100
№
Рис.Т 396. Фазы, наблюдаемые
в системе Y20s—Zr02 (по Фань
Фу-кану, Кузнецову и Келеру).
Рис. 397. Участок диаграммы со-
стояния системы Y203—Zr02 (по Ле-
февру).
1 — тетрагональная фаза; 2 — кубиче-
ская фаза; з - двухфазная область (тет-
рагональная и моноклинная фазы).
ния превышала 2000°). Y2O3 и ZrO2 образуют непрерывный твердый
раствор, и соединения с пирохлорной структурой Y2Zr2O7 не об-
Рис. 398. Диаграмма состояния си-
стемы Y2O3— ZrO2 (по Линь Цзу-сян).
Q — тетрагональный твердый раствор;
р1 ~ кубический твердый раствор типа
^at2; с2 — кубический твердый раствор
типа Т12О,.
440
Цирконатные системы
наружено (рис. 398). На кривой ликвидуса при 90 вес.% Y2O3
имеется минимум с температурой 2350°. Ниже солидуса, когда
содержание Y2O3 достигает 10%, образуется тетрагональный твер-
дый раствор, стабильный при комнатной температуре. При 15%
Y2O3 тетрагональный твердый раствор непрерывно превращается
в кубический типа CaF2. Последний при 65% Y2O3 превращался
в кубический твердый раствор типа Т12О3.
Смит [10] в результате нейтронографических исследований
делает вывод, что соединение Y2Zr2O7 в системе не образуется,
а при обжиге состава, отвечающего этому соединению, получается
твердый раствор типа флюорита (CaF2).
Литература
Ю
1,
А.
№
А.
й X уай-цзюн,
22, 1965.
К. Кузнецов,
7, 1141, 1962.
К. Кузнецов,
Журн.
Китайск.
1. Линь Цзу-сян,
силиката, общ., 4, №
2. Фань Фу-кан,
Изв. АН СССР, ОХН,
3. Фань Фу-кан,
Изв. АН СССР, ОХН, № 4, 601, 1'963.
4. Collongues R., М. Perez у J orb a, J.
Soc. chim. France, № 1, 70, 1961.
5. D i е t z е 1 A., H. T о b e r, Ber. Dtsch. keram. Ges., 30, № 1, 71, 1953.
6. Du we z P. S., F. N. В г о w n, F. О d e 11, Journ. Electrochem.
Soc., 98, 360, 1951.
7. Lefdvre J., Ann. chim., (13), 8, № 1—2, 117, 1963.
8. N i e 1 s e п T. H., M. H. L e i p о 1 d, Journ. Amer. Ceram. Soc., 47,
№ 3, 155, 1964.
9. R о t h R. S., Journ. Res. Nat. Bur. Stand., 56, № 1, 17, 1956.
10. Smith D. K., Journ. Amer. Ceram. Soc., 49, № 11, 625, 1966.
11. S t r i c k 1 e г D. W., W. G. Carlson, Journ. Amer. Ceram. Soc.,
47, № 3, 122, 1964.
Э. К.
Э К.
Келер,
Келер,
Lefevre, Bull.
La3O3—ZrO2
Эта система имеет существенное значение для технологии
циркониевых огнеупоров.
Согласно Вартенбергу и Экхардту [8], диаграмма плавкости
системы характеризуется наличием температурного минимума
при 2100° и 40 мол.% ZrO2 (20 вес.%) (рис. 399)
Тромб и Фёкс [7] рентгенографическим методом установили
существование в системе двух типов твердых растворов (рис. 400).
В области, примыкающей к ZrO2, образуются твердые растворы,
имеющие после охлаждения моноклинную структуру, характер-
ную для чистой двуокиси циркония. В области 10—35 мол. %
La3O3 наблюдаются кубические твердые растворы флюоритового
Цирконатные системы
441
типа. При дальнейшем повышении содержания Ьа2О3 образуется
двухфазная область, содержащая флюоритовую фазу и гексаго-
нальные кристаллы трехокиси лантана.
Эти две фазы дают эвтектику прибли-
зительно при эквимолекулярном соот-
ношении.
Параметр кубической флюоритовой
решетки резко изменяется вблизи со-
става, отвечающего La2O3-2ZrO2 (рис.
400). Фазовые изменения в системе
Ьа2О3—ZrO2 хорошо прослеживаются
также по данным измерения электро-
проводности (рис. 401).
Система изучалась также Брауном
и Дьювецом [2] на образцах, получен-
ных спеканием порошков окислов. Эти-
ми исследователями не обнаружено
химических соединений, но установле-
Рис. 399. Диаграмма плав-
кости системы Ьа2О3—ZrO2
(по Вартенбергу и Эк-
хардту).
но существование значительных обла-
стей четырех типов твердых растворов
(рис. 402). Моноклинный, тетраго-
нальный и кубический твердые раст-
воры образуются в результате рас-
творения Ьа2О3 в двуокиси циркония.
Твердый раствор, полученный в результате растворения ZrO2
в Ьа2О3, относится к гексагональному типу.
%гОг Мол.%
Рис. 400. Изменение параметра кристалли-
ческой решетки типа флюорита системы
La2O3—Zr02 (по Тромбу и Фёксу).
442
Цирконатные системы
Прибавление'La2O3 к ZrO2 повышает температуру, при которой
двуокись циркония ^переходит из тетрагональной формы в моно-
клинную' (рис. 402) Л Минимальное количество Ьа2О3, требуемое
для стабилизации двуокиси циркония в кубической форме (при
980°), составляет 30 мол.%. Стабильные, не подвергающиеся поли-
морфным превращениям кубические твердые растворы двуокиси
циркония образуются при добавках 30—40 мол.% Ьа2О3.
2000
1500
°C
2500
I
1000
|'ШйжлЬ-
Рис. 401. Концентрационные изме-
нения электрического сопротивле-
ния образцов системы Ьа203—Zr02
(по Тромбу и Фёксу).
\Laz°3
\m.p.
ZrO2Ky6.mp\
La203m.p. \
MoHOKn.Zr02m.p.
Ky5.ZrOzm.p}
0 20 W 60 80 100
Zr02 Мол.% ' La2°3
Рис. 402. Предполагаемая диа-
грамма состояния системы
La2Os—ZrO2 (по Брауну и
Дьювецу).
Кейзи, Катц и Орр [3] для Ьа2О3 • 2ZrO2 получили параметр
элементарной ячейки 10.8022 +0.0005 А.
Рот [6] предполагает, что в системе образуется соединение
La2Zr2O7, относящееся к типу пирохлора. Однако он не смог опре-
делить характер плавления соединения и приводит два варианта
диаграммы состояния системы Ьа2О3—ZrO2. На рис. 403 диаграмма
дана при условии, что соединение La2Zr2O7 плавится конгруэнтно
и образует твердые растворы как с двуокисью циркония, так и
с Ьа2О3. Диаграмма на рис. 404 дана при условии, что La2Zr2O7
плавится инконгруэнтно и образует твердые растворы только
с Ьа2О3. Остальная часть диаграммы построена по Брауну и Дью-
вецу [2].
Кристаллы La2Zr2O7 имеют кубическую структуру с парамет-
ром решетки по Роту [6] а=10.793 А.
Цирконатные системы
443
В последнее время система подробно изучена Перес-и-
Джорба [5]. Обнаружено единственное соединение La2Zr2O7
со структурой типа пирохлора с температурой плавления
2180°. Это соединение имеет некоторую область однородности
(приблизительно 25—40 мол. % Ьа2О3) и может быть отнесено
”С
°C
0 25 50 75 100
Zr02 Мол.% LaZ°3
Рис. 403. Диаграмма состояния
системы La2Os—Zr02 в предполо-
жении, что соединение La2Zr2O;
плавится конгруэнтно.
5
t
А./
ZrOg memp.m.p. + Ж
Л LazZrz0? т.рл Ж
\т.р+Ж^
\ т.р.
'
<57 '
•-3 La2Z%07mp.\
I LazOj/n.p. \ '
I ГЛ.
1 15
1 <^-2
I A
1 т.р.
La2Zr207
ZrO^MQHjn.p. i
3000
2000
1000
0 25 50 75 100
Zr02 Мол.в/0 LaZ°3
Рис. 404. Диаграмма состоя-
ния La203—Zr02 в предпо-
ложении, что соединение
La2Zr2O7 плавится инконгру-
энтно.
^5
$
к типу так называемых бертоллидов. Твердый раствор стехио-
метрического состава La2Zr2O7 имеет параметр решетки
«=10.797 А.
В системе установлено несколько типов твердых растворов
(рис. 405):
ZrO2 твердые растворы — на основе собственно двуокиси цир-
кония, в области температур, изученной Перес-и-Джорба
(выше 1000°) — тетрагональные;
Сг — твердые растворы типа флюорита, кубические;
Р — твердые растворы типа пирохлора;
А — твердые растворы, гексагональные, образующиеся в ре-
зультате растворения ZrO2 в окиси лантана.
Рис. 405. Диаграмма состояния си-
стемы La2Os—Zr02 (по Перес-и-Джорба).
Рис. 406. Изменение пара-
метра решетки твердых рас-
творов типа пирохлора в систе-
мах LrijOj—Zr02 (по Перес-и-
Джорба).
Рис 407. Часть диаграммы
состояния системы La203—
—Zr02 до содержания 40 мдл.%
La2O3 (по Лефевру).
М — моноклинная фаза; Q —
тетрагональная фаза; С — куби-
ческая фаза.
Рис. 408. Диаграмма состояния си-
стемы LajjOs—ZrO2 (по Линь Цзу-
сян и Юй Хуай-цзюн).
М — моноклинный твердый раствор
на основе ZrO,; С — твердый раствор
типа CaF>; Р — пирохлорный твердый
раствор; Н — гексагональный твердый
раствор на основе LatOt. По оси абсцисс
даны, по-видимому, весовые проценты.
Цирконатные системы
445
На рис. 406 показано изменение параметра решетки в зави-
симости от содержания La2O3-ZrO2.
Лефевр [4] дает более детальную диаграмму в области, бога-
той ZrO2 (до 35 мол. % La2O3) (рис. 407).
Линь Цзу-сян и Юй Хуай-цзюн [1 ] приводят диаграмму
состояния системы, в общем сходную с предложенной
Перес-и-Джорба. Температура плавления La2Zr2O7 принимается
равной 2250°. В перитектической точке (при 2325 ±25°) происходит
реакция: ZrO2 твердый раствор+жидкость твердый раствор
типа CaF2. Флюоритовый твердый раствор устойчив при повышен-
ных температурах — в температурном интервале от 2325 +25
до 1775 +25°.
Эвтектика между Ьа2О3 твердым раствором nJLa2Zr2O7 твердым
раствором плавится при 1925+25° и содержит 82.5+2.5 вес.%
Ьа2О3, эвтектика между La2Zr2O7 твердым раствором и твердым
раствором типа CaF2 содержит 42.5+2.5 вес.% Ьа2О3 и плавится
при 2125+25° (рис. 408).
Литература
1. Линь Цзу-сян, Юй Хуай-цзюн, Журн. Китайск.
силикатн. общ., 3, № 3, 159, 1964.
2. Brown F. Н., Р. D uwe z, Journ. Amer. Ceram. Soc., 38, № 3, 95, 1955.
3. Casey J. J., L. К a t z, W. С. О г г, Journ. Amer. Chem. Soc., 77, № 8,
2187 1953
4. Lefevre J., Ann. chim., (13), 8, № 1—2, 117, 1963.
5. Perez у Jorba M., Ann. chim., (13), 7, № 7—8, 479, 1962.
6. Roth R. S., Journ. Res. Nat. Bur. Stand., 56, № 1, 17, 1956.
7. T г о m b e F., M. F 6 e x, Compt. rend., 233, № 3, 254, 1951.
8. W art enberg H., K. Eckhardt, Zs. anorgan. allgem. Chem.,
232, № 2, 179, 1937.
Ce2O3—ZrO2
Леонов, Андреева и Келер [1], проводя обжиг смесей ZrO2
и СеО2 в восстановительной среде в интервале 900—2000°, получали
образцы, содержащие практически только трехвалентный церий.
В этих условиях обнаружены следующие фазы: 1) твердые рас-
творы на основе двуокиси циркония, тетрагональные (А); 2) твер-
дые растворы на основе двуокиси циркония, моноклинные (Z>);
3) соединение Ce2Zr2O7, с областью гомогенности (С); 4) кубические
твердые растворы на основе двуокиси циркония (В); 5) твердые
растворы на основе Се2О3 (Е).
На приведенной диаграмме соотношения фаз (рис. 409) кривая
ликвидуса (плавкости) получена наблюдениями в высокотемпера-
турном микроскопе.
446
Цирконатные системы
Моноклинная (ниже 1000°) и тетрагональная (выше 1000°)
двуокись циркония растворяет около 3 мол.% Се2О3. С помощью
дилатометрических измерений показано, что в интервале концент-
раций от 0 до 27 мол.% Се2О3 происходит обратимое полиморфное
превращение ZrO2 моноклин. ZrO2 тетрагон, с гистерезисом
Zr02 Мол. 7, Сег°3
Рис. 409. Диаграмма соотношения
фаз в системе Ce^—ZrO2 в вос-
становительной атмосфере.
Твердые растворы: А <— на основе ZrO, тет-
рагональные; В — на основе ZrO, кубические;
С — на основе CetZrtO,; D — на основе ZrO,
моноклинные; Е —на основе Се,О,,
в интервале -.’температур- от
900 до 1200°.(см. заштрихо-
ванную область на-’рис. 409).
Соединение Ce2Zr2O7 отно-
сится к типу пирохлора,
кристаллизуется в кубиче-
ской гранецентрированной
ячейке с параметром а=
=10.70 А и плотностью
6.18 г/см®. (Твердые раство-
ры Ce2Zr2O7 существуют в
интервале от 26 до 40 мол. %
Се2О3 и выше 2200° непре-
рывно переходят в кубиче-
ские твердые растворы. Ку-
бический твердый раствор,
существующий устойчиво,
например при 2000° и ин-
тервале концентраций при-
мерно от 5 до 17 мол.%
Се2О3, при медленном охла-
ждении обратимо распадается
с образованием двух фаз:
ZrO2 тетрагональный твердый
раствор и Ce2Zr2O7 твердый
раствор.
Кубический твердый рас-
твор В, образующийся в ин-
тервале концентраций от 40 до 97 мол.% Се2О3, будучи нагрет до
1700°, распадается с образованием двух фаз: 1) Ce2Zr2O7 твердый
раствор; 2) Се2О8 раствор гексагональный. Вследствие очень мед-
ленного распада при более низких температурах авторам не удалось
ограничить область устойчивого состояния твердого раствора В.
Твердый раствор гексагональной структуры на основе Се2О3
занимает узкую область от 97 до 100 мол.% Се2О3, несколько рас-
ширяющуюся с повышением температуры.
Литература
1. Л е о н о в А. И„ А. Б, Андреева, Э. К. К е л е р, Изв. АН СССР,
иеорг. матер., 2, № 1, 137, 1966.
Цирконатные системы
447
СеОг—ZrOs
Имеет значение для производства специальных огнеупоров.
Изучалась Дыовецом и Оделлом [3] и Пальгуевым, Алямов-
ским и Волченковой [1] на образцах, полученных спеканием. При-
водимые Дыовецом и Оделлом линии, разграничивающие области
солидуса и ликвидуса, проведены путем экстраполяции (рис. 410).
Добавление двуокиси церия к
к образованию твердых растворов
па основе ZrO2, при этом значи-
тельно снижается температура
превращения тетрагональной дву-
окиси циркония в моноклинную.
При добавлении 15% СеО2 тетра-
гональная двуокись'циркония ста-
новится стабильной при обычной
температуре. Стабилизация дву-
окиси циркония двуокисью церия
изучалась Смутом и Рианом [4].
Существующие при высокой
температуре кубические твердые
растворы можно рассматривать
как внедрение ZrO2 в кубическую
СеО2. При 2000° двуокись .церия
растворяет в твердой фазе до 76%
двуокиси циркония с образовани-
ем твердого раствора. С пониже-
нием температуры область взаим-
ной растворимости значительно
сокращается. При 1375° область
двуокиси циркония приводит
Рис. 410. Ориентировочная диа-
грамма состояния системы
СеО2—ZrO2.
твердых растворов ограничена
составом 30 мол. % ггО2-|-70мол.%
СеО2, а при 1100° — 20 мол. %
ZrO2+80 мол. % СеО2.
ально стабилизированная
Специ-
окисью
магния двуокись циркония образует при 2000° непрерывный ряд
твердых растворов с двуокисью церия, распадающийся на две
серии твердых растворов при понижении температуры [3].
Пальгуев с сотрудниками обжигали смеси СеО2 и ZrO2 при
температуре 1550°, выдерживая образцы в течение времени, необ-
ходимого для достижения равновесия структуры. Образцы, со-
держащие от 0 до 50 мол. % ZrO2, представляли твердые растворы
типа флюорита с кубической решеткой. Параметр кристаллической
решетки от величины 5.3991 кХ для чистой СеО2 прямолинейно
изменялся до величины 5.258 кХ для состава 50 мол. % ZrO2+
448
Цирконатные системы
+50 мол. % СеО2. При содержании ZrO2 выше 50 мол. % появля-
лась вторая фаза — тетрагональный твердый раствор двуокиси
церия в двуокиси циркония.
В прилегающей к двуокиси циркония области, охватывающей
составы от 0 до 10 мол. % СеО2, наблюдался только моноклинный
твердый раствор двуокиси церия с ZrO2. Пальгуев с сотрудниками
считают, что структура твердого раствора ZrO2 в СеО2 (кубиче-
ская фаза) является дефектной. Наиболее вероятно наличие пустот
в узлах кристаллической решетки, занимаемых ионами Се4+ и
О2-. Пустоты распределены статистически.
СеО2 не образует химических соединений с ZrO2, но, по-види-
мому, существует цирконат с трехвалентным церием Ge2O3-2ZrO2.
Кейзи, Катц и Орр [2] получали это соединение в смеси хлоридов
в восстановительных условиях. Фаза Се2О3 -2ZrO2 относится к сое-
динениям с пирохлорной структурой.
Литература
1. Пальгуев С. Ф., С. И. А л я м о в с к и й, 3. С. Волченкова,
Журн. неорг. хим., 4, № 11, 2571, 1959.
2. С a s е у J. J., К a t z, W. С. О г г, Journ. Amer. Chem. Soc., 77, № 8,
2187, 1955.
3. D u w e z P., F. О d e 11, Journ. Amer. Ceram. Soc., 33, № 9, 274, 1950.
4. Smoot T. W., J. R. R у a n, Journ. Amer. Ceram. Soc., 46, № 12, 597,
1963.
PrO1.83— ZrO2
Стрекаловский, Волченкова и Самарина [2] ориентировочно
исследовали фазовые соотношения в субсолидной области (обжиг
при 1550°). Фазовый состав образцов определялся рентгенографи-
ческим и химическим методами.
Авторы отмечают четыре типа твердых растворов со структурой
флюорита, а также химическое соединение эквимолекулярного
состава PrO183-ZrO2.
Твердый раствор (\ — это раствор РгО4 83 в ZrO2; максималь-
ная растворимость PrO4 83 определяется параметром а=5.21 кХ.
С4 — твердый раствор ZrO2 в РгО183; предельная растворимость
двуокиси циркония составляет приблизительно 10 мол. %. Твердые
растворы С3 и С4 образуются при распаде соединения PrO183-ZrO2.
Предположительно фазы С3 и С4 принимаются как кубические
типа флюорита. Спеченные на воздухе при 1550° образцы системы
ZrO2—РгО183 в широком интервале составов (от 0 до 70 мол.%
PrOi 83) обладают смешанной (ионной и электронной) проводи-
мостью [1 ].
Цирконатные системы
449
Литература
1. Волченкова 3. С., в сб.: Химия высокотемпературных материалов,
изд. «Наука», Лен. отд., Л., 65, 1967.
2. Стрекаловский В. Н., 3. С. В о л ч е н к о в а, В. А. С а м а-
р и н а, Изв. АН СССР, неорг. матер., 1, № 8, 1372, 1965.
Nd2O3— ZrOs
Имеет значение для высокотемпературной керамики и техноло-
гии нагревательных элементов.
Система изучена Брауном и Дыовецом [1] на образцах, полу-
ченных методом твердофазовых реакций. В системе не обнаружено
“С
2500
2000
1500
1000
500
|'
\ \Куб.ггОгтр
»
’1
111
,S I I
чД I 1^
Ky6.IZrO2 m.p. I
Nd203m.p. I
'|Л i MoHow.Zr02m.p.*Ky6.Zr02 m.p.
MomKn.Zr02m.p.+mempai.Zr02m.p.
^MoHQKn.Z^m.p. ,
соединений, но существуют
значительные области твер-
дых растворов (рис. 411).
Три типа твердых раство-
ров: моноклинный, тетраго-
нальный и кубический — об-
разуются в результате рас-
0 20 00 60 80 100
Мол. %
Рис. 411. Диаграмма состояния си-
стемы Nd2O3—ZrO2 (по Брауну и
Дьювецу).
Рис. 412. Влияние Nd2O3 на
температуру перехода тетра-
гональной двуокиси циркония
в моноклинную.
творения Nd2O3 в двуокиси циркония. Гексагональные твердые
растворы получаются в результате растворения ZrO2 в Nd2O3. До-
бавление Nd2O3 к ZrO2, приводящее к образованию твердых рас-
творов, понижает температуру, при которой двуокись циркония
переходит из тетрагональной формы в моноклинную (рис. 412).
29 Н. Л. Торопов и др., кн. 1
450
Цирконатные системы
Стабильные (не подвергающиеся полиморфным превращениям)
кубические твердые растворы двуокиси циркония образуются
при добавках 20—40 мол. % Nd2Os.
В поле кубических твердых растворов, кристаллизующихся
при содержании 65 мол. % Nd2Os, обнаружен участок, где сосуще-
ствуют две разновидности твердых растворов: ZrO2 кубический
с \Тетраг 2г0гт.р*Ж
Nd2Zr20?m.p.+M
Nd203 т.р +Ж.
2500
2000
M^Z^O? m.p
1 «М
[Nd^rfy m.p. ।
' Nd^mp. *
1500
1000
ll
I
500
i ^Монокл.2гОг m.p.+Nd2Zr207 m.p.
\i ^'З^Монокл.ггО,т.р.+тетраг.2тО, т.р.
xM0H0M.iZr02m.p.i 2 х /
' 0 20 00 60 80 100
ZrOi Мол. %
Рис. 413. Диаграмма состояния системы
NdjOg— ZrO2 (по Роту).
твердый раствор^ I и ZrO2
кубический твердый рас-
твор II. Эти твердые рас-
творы имеют различные
параметры элементарной
ячейки.
Рот [3] полагает, что
в системе имеется соеди-
нение Nd2Zr2O7 со струк-
турой пирохлора, а=
=10.648 А. По Роту,
Nd2Zr2O7 плавится конгру-
энтно и диаграмма состо-
яниясистемы Nd2Os—ZrO2
имеет вид, показанный на
рис. 413. При построении
этой диаграммы исполь-
зовались данные Брауна
и Дьювеца. Принимается,
что Nd2Zr2O7 образует
твердые растворы как с
ZrO2, так и с Nd2Os.
Перес-и-Джорба [2]
подтверждает существова-
ние соединения Nd2Zr2O4
со структурой пирохлора,
которое также образует твердые растворы. Обнаружены следу-
ющие твердые растворы (рис. 414):
ZrO2 т. р. — твердый раствор на основе двуокиси циркония,
в изученной области (выше 1000°) — тетрагональный;
— кубические твердые растворы типа флюорита;
Р — твердые растворы кубические, типа пирохлора; изменение
параметра решетки пирохлорных твердых растворов представлено
на рис. 406; состав, отвечающий стехиометрической формуле
Nd2Zr2O7, имеет параметр а=10.650 А и температуру плавления
2280°;
А — гексагональные твердые растворы на основе гексагональ-
ной модификации Nd2O3.
°с
3000
f/d2Zr207
2000
Р
Ct+A
Е
С
Р+4
4
1000
I
2гОг моя. % Hi203
Рис. 414. Диаграмма состояния системы
NdaO3—ZrO2 (по Перес-и-Джорба).
НО
60
80
100
Рис. 415. Диаграмма образования
мотастабильных фаз в области
системы Nd2O3—ZrO4, богатой
окисью неодима
1 -- кубический твердый раствор, непре-
рывный переход от структуры типа CaFt
к типу Мп2О2; а — кубический типа
Мп2Оа и гексагональный A-типа твердые
растворы', з — гексагональный твердый
раствор А-типа; 4 — твердый раствор
В-типа и примесь твердых растворов А-
и Мп,о,-типов; s — кубический типа пи-
рохлора и кубический типа Мп2О> твердые
растворы; в — твердый раствор типа пи-
рохлора.
Рис. 416. Схематическая диаграмма
состояния системы Nd2O3—ZrO2.
1 — моноклинный твердый раствор
на основе ZrO2; а — тетрагональный твер-
дый раствор на основе ZrO2; 8 — кояо-
клинный, тетрагональный и. кубический
твердые растворы; 4 — тетрагональный и
кубический твердые растворы; s — моно-
клинный и кубический твердые растворы;
в — кубический твердый раствор типа
пирохлора; 7 — кубический твердый рас-
твор типа пирохлора я гексагональный
твердый раствор на основе окиси неодима;
В — гексагональный твердый раствор
на основе окиси неодима; 9 — кубический
типа Мп2О2 и кубический типа пирохлора
твердые растворы; 10 — кубический типа
Мп2Оа и гексагональный твердые растворы.
29*
452
Цирконатные системы
Давтян, Глушкова и Келер и Сазонова [4—6] методами термо-
графии и высокотемпературной рентгенографии исследовали си-
стему Nd2O3—ZrO2 в субсолидусной области до температуры 1700°.
Кроме химического соединения Nd2Zr2O7 пирохлорной структуры,
авторы отмечают следующие типы твердых растворов: 1) моно-
клинный твердый раствор на основе ZrO2; 2) тетрагональный твер-
дый раствор на основе ZrO2; 3) кубический твердый раствор типа
флюорита; 4) кубический твердый раствор типа пирохлора;
5) гексагональный (4-типа) твердый раствор на основе окиси нео-
дима; 6) кубический твердый раствор типа Мп2О3; 7) твердый рас-
твор на основе Nd2O3 со структурой типа В (моноклинный). Авторы
приводят две фазовые диаграммы системы Nd2O3—ZrO2.
На рис. 415 приведена схема образования метастабильных фаз
в области, богатой Nd2O3. На рис. 416 приведена область устой-
чивого равновесного состояния соответствующих фаз. Применяя
соосажденные гели, авторы получили (обжиг при 700—1000°)
кубический твердый раствор типа флюорита. На рис. 415 область
этого твердого раствора, который при увеличении содержания
Nd2O3 непрерывно переходит в кубический раствор типа Мп2О3,
обозначена цифрой 1, а метастабильно существующий твердый
раствор типа В — цифрой 4. При нагревании до 1350—1400°
этот твердый раствор превращается в равновесную смесь твердых
растворов гексагональной и пирохлорной структуры. Из рис. 415
видно также, что кубический твердый раствор на основе окиси
неодима (типа Мп2О3) устойчив только при температурах
выше 1500°.
Литература
1. Brown F. Н., Р. D u w е z. Journ. Amer. Ceram. Soc., 38, № 3, 95,1955.
2. Perez у Jorba M., Ann. chim., (13), 7, № 7—8, 479, 1962.
3. Roth R. S., Journ. Res. Nat. Bur. Stand., 56, № 1, 17, 1956.
4. Г л у га к о в а В. Б., И. А. Д а в т я н, Э. К. К е л е р, Изв. АН СССР,
неорг. матер., 1, № И, 1955, 1965.
5. Давтян И. А., В. Б. Г л у га к о в а, Э. К. К е л е р, Изв. АН СССР,
неорг. матер., 1, № 5, 743, 1965.
6. Сазонова Л. В., И. А. Давтян, В. Б. Г л у га к о в а,
Изв. АН СССР, неорг. матер., 1, № 11, 1965, 1965.
Цирконатные системы
453
Sm2O3—ZrO2
Система изучена в субсолидусной области Перес-и-Джорба [1 ]
на образцах, полученных реакцией в твердых фазах. Материалы
на ее основе перспективны для электроники.
°C
3000-
2000 - s'Zr02m.p.j
Sm^Zr207
Ci+B
1000
l\+c' f Р ' С
Г' ! !
W1—1--J------L_l_
5 20 40 60 ВО 100
Zr02 Мол.% _ ' SmZ°3
Рис. 417. Диаграмма состояния системы
Sm2O2 — ZrO2
Принимается существование только одного соединения со струк-
турой пирохлора Sm2Zr2O7 со значительной областью однород-
ности (рис. 417).
Обнаружено несколько типов
твердых растворов:
ZrO2 т. р. — твердый раствор
на основе двуокиси циркония; в
изученной области (выше 1000°)—
тетрагональной сингонии;
— твердые растворы куби-
ческие, типа флюорита; изменение
параметров решетки этих твер-
дых растворов в зависимости от
содержания Sm2Os представлено
на рис. 418;
Р — кубические твердые рас-
Zr02 Мол. 7. . Ln2°3
Рис. 418. Изменения параметра
кристаллической решетки твер-
дых растворов типа флюорита
в системах Ln2O8—ZrO2.
творы типа пирохлора; изменение
параметра решетки этих раство-
ров представлено на рис. 406;
состав, отвечающий формуле
Sm2Zr2O7, имеет параметр решетки
«=10.57 А;
С2 — кубические твердые растворы типа Т12О3; их следуе
рассматривать как растворы ZrO3 в кубической модификаци
Sm2Os;
454
Цирконатные системы
А — гексагональные твердые растворы на основе гексагональ-
ной модификации Sm2O3;
В — моноклинные твердые растворы на основе моноклинной
модификации Sm2O3.
Литература
1. Perez у J о г Ь а М., Ann. chim., (13), 7, № 7—8, 479, 1962.
Eu2O3—ZrO2
Давтян, Глушкова и Келер [1] в связи с изучением влияния
добавок полутораокиси европия на полиморфизм двуокиси цирко-
ния дали схему фазовых превращений в области, богатой ZrO2
(до 33.3 мол. % Еи2О3).
Образцы готовились обжигом (800—2000°) соосажденных сме-
сей гидроокислов. В системе существует одно соединение — цир-
конат европия Eu2Zr2O7 пирохлорной структуры с параметром эле-
ментарной ячейки а=10.530 А, На основе Eu2Zr2O7 образуется
широкая область твердых растворов, как с недостатком, так и
с избытком окиси европия. Состав этих твердых растворов можно
представить формулой Eu2±xZr2±il.O х □ х . Граница области
7 ±'2
твердых растворов со стороны, богатой двуокисью циркония
(в интервале 800—1400°), находится при х «1.48.
Добавки Еи2О3 значительно снижают температуру моноклинно-
тетрагонального полиморфного превращения двуокиси циркония.
Так, при содержании 2 мол. % Еи2О3 эта температура будет 650°
при нагревании и 500° при охлаждении.
При низкотемпературном обжиге соосажденных гелей гидро-
окислов образуются метастабильные кубические флюоритовые
твердые растворы на основе ZrO2. Длительная термическая вы-
держка (или обжиг при более высоких температурах) приводит
к распаду этих твердых растворов на устойчивые фазы: тетраго-
нальный (или моноклинный) твердый раствор (на основе ZrO2)
и кубический твердый раствор типа пирохлора.
Литература
1. Давтян И. А., В. Б. Г л у ш к о в а, Э. К. К е л е р, Изв. АН СССР,
неорг. матер., 2, Ns 5, 890, 1966.
Цирконатные системы
455
Gd2O3— ZrO2
Изучена в субсолидусной области Перес-и-Джорба [3] и Ле-
февром [1] на образцах, полученных путем твердофазовых реак-
ций.
Показано наличие одного соединения со структурой пирохлора
Gd2Zr2O7 с широкой областью однородности (рис. 419).
В системе обнаружено несколько типов твердых растворов:
ZrO2 т. р. — твердый раствор на основе двуокиси циркония;
в изученной области (выше 1000°) — тетрагональный;
Рис. 419. Диаграмма состояния, системы
Gd2O3—ZnO2.
Су — кубические твердые растворы типа флюорита; изменение
параметра решетки в зависимости от содержания Gd2O3 предста-
влено на рис. 418;
С2 — кубические твердые растворы типа Т12О3; их следует рас-
сматривать как растворы ZrO2 в кубической модификации Gd2O3;
большой интерес представляет распад твердых растворов типа С2
в области, ограниченной составами приблизительно от 56 до
77% Gd2O3 и температурным интервалом от 1500 до 1800°;
па рис. 419 двухфазная система этих твердых растворов обозначена
б'2+С2; учитывая, что эти фазы должны обнаруживать какие-либо
различия, правильнее было бы применять различные обозначения
фаз, например С' и С2;
Р — твердые растворы со структурой пирохлора; изменение
параметра решетки этого твердого раствора представлено
на рис. 406; состав, отвечающий формуле Gd2Zr2O7, имеет параметр
решетки а—10.527 А;
Нг~ гексагональная фаза, имеющая узкие пределы существо-
вания вблизи состава, отвечающего 57 мол. % Gd2O3; для этого
состава параметры репетки: а=10.002, с—18.544 А;
456
Цирконатные системы
Н3 — гексагональная фаза, существующая ниже 1600° в об-
ласти составов 77—87 мол. % Gd2Os; для состава, содержащего
80 мол. % Gd2Os, параметры
решетки: а=10.032, с= с
=18.814 А; 3000 ~
В — моноклинные твер- 1
дые растворы на основе
Gd2O3.
Лефевр [2] изучил диа-
грамму состояния системы
Рис. 420. Диаграмма состояния
системы GdjOs—ZrO2 в области
содержания Gd2O8 от 0 до
10 мол. % (по Лефевру).
1 — тетрагональная фаза; г — псевдо-
кубическая фаза; t—кубическая фаза;
4 — тетрагональная 4- кубическая
фаза.
Рис. 421. Диаграмма состояния системы
Gd2O3—ZrO2 (по Линь Цзу-сян и Юй
Хуай-цзюн).
Q — тетрагональный твердый раствор на ос-
нове ZrOa; Ct — кубический твердый раствор
типа СаРа; Са — кубический твердый раствор
типа TI,O,; G — кристаллы GdaOa.
Gd2Os—ZrO2 до содержания ИО мол. % ^Gd2Os (рис. 420).
Линь Цзу-сян и Юй Хуай-цзюн [1 ] пользовались методом «от-
жига и закалки» и проводили исследование при температурах,
Рис. 422. Показатель светопреломления и плотность твердых
растворов системы Gd2O3—ZrO2.
Цирконатные системы
457
превышающих 2000°. Установлены твердые растворы как на основе
ZrO2, так и на основе Gd2O3 (рис. 421). В обширной области твер-
дых растворов на основе ZrO2 имеет место непрерывный переход
тетрагонального твердого раствора (@) в кубический твердый рас-
твор типа CaF2(C1) и последнего в кубический твердый раствор
типа Т12О3. Эвтектика плавится при 2175+25° и содержит около
91 вес. % Gd2O3. На рис. 422 приведены показатели светопреломле-
ния и плотность имеющихся в системе твердых растворов.
Литература
1. Линь Цзу-сян, Ю й Хуай-цзюн, Журн. Китайск.
силикатн. общ., 3, № 4, 229, 1964.
2. L е f ё v г е J., Ann. chim., (13), 7, № 1—2, 117, 1963.
3. Perez у Jorba М., Ann. chim., (13), 7, № 7—8, 479, 1962.
Dy2O8—ZrO2
Интересна как основа новых материалов для электроники.
Плоэтц, Маккигроссо, Осика и Джекоби [2], проводя обжиги
смеси Dy2O3 и ZrO2 в области 1600—1925°, обнаружили в системе
следующие фазы:
1) от 0 до 10 объемн. % Dy2O3 наблюдаются одновременно кри-
сталлы моноклинной и кубической двуокиси циркония;
Рис. 423. Диаграмма состояния системы
DyaOa—ZrO3.
2) при содержании 10—60 объемн. % Dy2O3 — гранецентриро-
ванные кубические твердые растворы;
3) при содержании выше 60 объемн. % Dy2O3 появляются
объемноцентрированные кубические твердые растворы на основе
°У2О3.
458
Цирконатные системы
Перес-и-Джорба [1] на образцах, полученных методом твердо-
фазовых реакций, обнаружила в субсолидусной области системы
несколько типов твердых растворов (рис. 423):
ZrO2 т. р. — твердые растворы на основе ZrO2 в изученной
области выше 1000° тетрагональной системы;
— кубические твердые растворы типа флюорита; изменение
параметра решетки в зависимости от содержания Dy2O3 предста-
влено на рис. 418;
С2 — кубические твердые растворы типа Т12О3; их следует рас-
сматривать как твердые растворы ZrO2 в кубической форме Dy2O3;
большой интерес представляет распад твердых растворов типа С2
в области, ограниченной составами 55—65 мол.% Dy2O3 и темпе-
ратурами 1450—1600°; на рис. 423 двухфазная область этих твер-
дых растворов обозначена С2+С2, однако, учитывая, что эти фазы
должны обнаружить какие-либо различия, правильнее было бы
применять обозначения, например, G и Сг;
Я2 и Я3 — гексагональные фазы, обнаруженные на различных
участках системы: фаза Н2 на узком участке вблизи состава
55 мол.% Dy2O3; параметры решетки кристаллов этого состава:
а=9.881, с=18.227 А; фаза Н3 на участке 65—80 мол.% Dy2O3;
параметр решетки твердого раствора состава 70 мол. % Dy2O3: а=
=9.902, с=18.573 А;
В — моноклинные твердые растворы на основе моноклинной
формы Dy2O3.
В системе Dy2O3—ZrO2 в отличие от систем с La2O3, Nd2O3,
Sm2O3 и Gd2O3 не обнаружено фазы со структурой типа пирохлора.
Литература
1. Perez у J о г b а М., Ann. chim., (13), 7, № 7—8, 511, 1962.
2. Р 1 о е t z С. L., А. Т. М u с с i g г о з з о, L. М. О з i k a, W. R. J а-
с о Ь у, Journ. Amer. Ceram. Soc., 43, № 3, 154, 1960.
Yb2O3—ZrO 2
Система изучена Перес-и-Джорба [2] в субсолидусной области
методом твердофазовых реакций между компонентами. Соединений
в системе не обнаружено. Автор выявила существование несколь-
ких типов твердых растворов:
ZrO2 т. р. — твердый раствор; в изученной области
(выше 1000°) — тетрагональной системы (рис. 424);
Сх — кубические твердые растворы типа флюорита; изменение
параметра решетки в зависимости от содержания Yb2O3 предста-
влено на рис. 418;
Цирконатные системы
459
С2 — кубические твердые растворы типа Т12О3; их следует рас-
сматривать как твердые растворы ZrO2 в кубической модификации
Yb2O3. Для рассматриваемой системы характерно наличие ромбо-
эдрической фазы Ях и двух гексагональных Я2 и Я3. Для фазы Н1
получены следующие параметры элементарной ячейки: для состава
Рис.‘424. *Диаграмма^'состояния системы
Yb2Oa—ZrO3.
33 мол.% Yb2O3 а=8.178 А и а=72°32'20"; для состава 40 мол.%
Yb2O3 а=8.259 А и а=72°40'20". В системе не обнаружена фаза
со структурой пирохлора.
Фан Фу-кан [1], обжигая соосажденные смеси гидроокиси
иттербия и циркония, получил, по-видимому, соединение типа
пирохлора Yb2Zr2O7, однако обнаруженное для этого соединения
количество характерных для структуры типа пирохлора малоин-
тенсивных рентгеновских линий меньше, чем у соответствующих
соединений элементов цериевой группы (La2Zr2O7, Nd2Zr2O7 и др.).
Литература
1-Фаи Фу-кан. Фазовые соотношения в системе Y2O3—ZrO2 в твердом
состоянии и цирконаты некоторых редкоземельных элементов. Автореф.
канд. дисс. Инет. хим. силикатов им. И. В. Гребенщикова АН СССР,
Л., 1964.
2. Perez у Jorba М., Ann. chim., (13), 7, № 7—8, 479, 1962.
SnO2—ZrO2
Систему исследовали Дитцель и Пох [1]. Соединений не най-
дено. Обнаружена область расслаивания расплава в концентра-
ционной области между 17 и 85 мол. % SnO2, выше 1500°. SnO.,
практически не оказывает влияния на превращение ZrO.. —*
п ^(мовокл.)
ZrO2
^(тетрагон.)*
460
Цирконатные системы
Штокер и Коллонг 12] установили образование твердых рас-
творов касситерита (SnOj) в ZrO2 и ZrO2 в касситерите. Обнаружена
новая фаза состава, близкого к ZrO2-SnO2. Твердый раствор ZrO2
в SnO2 образует тетрагональные кристаллы [пространственная
группа Рчуппп (D4A)]. Параметр элементарной ячейки изменяется
от а=4.735, с=3.185 А для чистого SnO2 до а=4.760, с=3.201 А
для сплава, содержащего 20 мол.% ZrO2. Твердый раствор SnO2
в ZrO2 образует моноклинные кристаллы [пространственная группа
P2Jc (C'ih) ] с параметрами элементарной ячейки, изменяющимися
от а—5.147, й=5.211, с=5.315 А, |Э=88°12' для чистого ZrO2
до а=5.150, й=5.188, с=5.33 А, |Э=98°51' для сплава, содержа-
щего 10 мол. % SnO2.
Фаза ZrO2-SnO2 характеризуется ромбическими кристаллами
с параметрами элементарной ячейки: а=4.88, й=5.20, с=5.66 А.
Эта фаза может быть получена только из соосажденных гелей
гидроокислов. При нагревании до 1100° соединение ZrO2-SnO2
распадается.
Литература
1. D i е t z е 1 A., W. Р о с h, Radex Rundschau, № 1, 52, 1960.
2. Stocker J., R. C oil ongues, Compt. rend., 244, № 1, 83, 1957.
PbO—ZrO2
Система имеет большое значение для сегнетоэлектрической
керамики.
Изучена Фушими и Икеда [2 ] методом закалки. Обнаруженный
цирконат свинца PbZrO3 плавится инконгруэнтно при 1570°.
Рис. 425. Диаграмма со-
стояния системы РЬО—ZrOj
(по Фушими и Икеда)
Цирконатные системы
461
двуокиси циркония до 4 мол.%. Трех-
РЬСН-РЬ2гО3Ц-жидкость представляет
РЬО растворяется в
фазное равновесие
перитектику (рис. 425).
Кристаллы PbZrO3 относятся
к псевдотетрагональной (ромби-
ческой) сингонии (тип перов-
скита) с параметрами элемен-
тарной ячейки: а=4.158, с=
= 4.108 А.
Смоленский, Аграновская
п Крайник [1 ] детально изучили
цирконат свинца PbO-ZrO2.
Синтез этого соединения осу-
ществлялся обжигом смесей ис-
ходных окислов при 1100°. Цир-
Рис. 426. Температурная зави-
симость диэлектрической про-
ницаемости цирконата свинца.
Рис.^427. Температурная кривая удель-
ной теплоемкости цирконата свинца.
Рис. 428. Кривая термического
расширения цирконата свинца.
конат свинца является сегнетоэлектрическим веществом, подобным
титанату бария. Точка Кюри для цирконата свинца находится
около 236°.
Ширане, Савагучи и ТакедаДЗ] изучили температурную за-
висимость диэлектрической проницаемости (рис. 426), удельной
теплоемкости (рис. 427) и термического расширения (рис. 428)
Цирконата свинца.
Литература
К Смоленский Г. А., А. И. Аграновская, Н. Н. К р а й-
ник, ДАН СССР, 91, № 1, 55, 1953.
“• F u s h i m i Sh., Т. I k е d a, Journ. Amer. Ceram. Soc., 50, № 3,129,1967.
•1- Shirane G., E. Sawaguchi, A. Takeda, -Phys. Rev., 80, 485,
462
Цирконатные системы
НЮ2—ZrO2
Ввиду очень высоких температур плавления составы интересны
для технологии производства новых ответственных видов огнеупор-
ных изделий и материалов. Двуокись гафния — промышленный
отход.
Кэртис, Доней Джонсон [1] рентгенографическими иссле-
дованиями обожженных при 1550, 1650, 1800 и 1850° смесей НЮ2
и ZrO2 показали наличие непрерывного ряда твердых растворов.
Мэмптон и Рой [3 ] показали, что образование твердого раствора
приводит к повышению температуры превращения моноклинной
модификации двуокиси циркония в тетрагональную: от 1170°
для чистого 2гО2до 1190° при содержании2% НЮ2 (см. также [2]).
Стансфильд [4 ] произвел дилатометрические определения обож-
женных керамическими методами смесей НЮ2 и ZrO2 (содержание
ZrO2 изменялось от 4 до 71 вес.%) в интервале температур от 900
до 2500°. Скачок на кривой расширения, связанный с моноклинно-
тетрагональным превращением двуокиси циркония, наблюдался,
например, для смеси, содержащей 29 вес.% ШО2, приблизительно
при 1300°. Кажущаяся плотность образцов изменялась в пределах
от 6.40 (для 29 вес.% HfOg) до 9.32 г/см3 (для 96 вес.% HfOj).
Литература
1. С u г t i з С. Е., L. М. D о п е у, J.R. I ohnson, Journ. Amer. Ceram.
Soc., 37, № 10, 458, 1954.
2. Lefdvre J., Ann. chim., (13), 8, № 1-2, 117, 1963.
3. Mumpton F. A., R. Roy, Journ. Amer. Ceram. Soc., 43, № 5, 234,
1960.
4. Stansfield О. M., Journ. Amer. Ceram. Soc., 48, № 8, 436, 1965.
ThO2— ZrO2
Ввиду очень высокой тугоплавкости имеет значение для спе-
циальных видов керамики и огнеупоров.
Чо Руффу, Эберту и Войтинеку [4], существует полная взаим-
ная растворимость при высоких температурах, а ниже 2700°
значительный разрыв смесимости. Температура плавления дву-
окиси тория определена в 3050 +25°. Дьювец и Лох [2] и Мэмптон
и Рой [3] произвели дальнейшее экспериментальное исследование
этой системы. Дьювец и Лох использовали для исследования сол-
нечную печь. Ими построена диаграмма состояния (рис. 429).
В пределах от 20 до 100 мол. % ТЬО2 показано поле твердых рас-
творов при высоких температурах; после длительного нагревания
при 2000 и 1350° они разлагаются на тетрагональную ZrO2 и бога-
тую ТЬО2 фазу, содержащую не менее 99 мол. % ТЬО2.
Цирконатные системы
463
С практической стороны следует учитывать, что в фазах,
богатых ZrO2, всегда будут иметь-место полиморфные превращения
двуокиси циркония и образцы будут очень чувствительными к терми-
ческим ударам. Кривые линейного термического расширения об-
разцов с 10 мол. % двуокиси тория (остальное ZrO2) по Дьювецу
и Лоху приведены на рис. 430, а на рис. 431 представлено (по тем же
авторам) изменение постоянной
решетки кубических твердых
растворов'с флюоритовой/струк-
турой.
Данные Воронова, Войтехо-
вой, Данилина [1 ], изображен-
J ные на рис. 432, почти^полностью
^опровергают данные Руффа, Эбер-
^atyThOg'' X
Т\Лт.р/' Дйат.р. |
>Т*С\ , ।
Т+ТкОгт.р.
i_______________
°C
3000
2000
1000
M+Th02 т.р.
о 20 W 60 80 100
Рис. 430. Кривые линейного
термического расширения об-
разца ZrO2 с 10 мол. %
ThO2.
Zr02 МОЛ.% Tk°2
Рис. 429. Диаграмма состоя-
ния системы ThO2—ZrO2'(no
Дьювецу и Лоху).
М — моноклинная ZrOt; Т — тет-
рагональные твердые растворы дву-
окиси циркония; С — кубические
твердые растворы двуокиси цир-
кония.
та и Войтинека [4 ]: 1) вместо непрерывного повышения температуры
плавления смесей от ZrO2 до ThO2 происходит значительное ее
снижение от чистой ZrO2 до состава, содержащего около 25 мол.%
ThO2; 2) вместо непрерывного ряда твердых растворов образуется
по перитектической реакции смесь кубического гранецентрирован-
ного твердого раствора на основе ThO2, содержащего при темпера-
туре перитектики 87 мол.% ZrO2, и тетрагонального твердого рас-
твора на основе ZrO2, содержащего 10.5 мол.% ThO2; 3) распад
кубического твердого раствора заканчивается эвтектоидной реак-
цией при 1900°, в результате которой твердый раствор, содержа-
464
Цирконатные системы
щий 76.0 мол.% ZrO2, распадается на кубический твердый раствор,
содержащий около 8 мол. % ZrO2, и тетрагональный твердый рас-
Рис. 431. Параметр кри-
сталлической решетки твер-
дых растворов в системе
ThO2—ZrO2.
Zr02 Мол.% Th02
твор примерно с 93 мол. % ZrO2. Начало распада кубического твер-
дого раствора лежит почти на 450° ниже, чем у Руффа и др.
Рис. 432. Фазовая диаграмма си-
стемы ThO2—ZrO2 (по Воронову,
Войтеховой, Данилину).
1 — кубический твердый раствор; г —
кубический и тетрагональный твердые
растворы; a — тетрагональный твер-
дый раствор; 4 — два кубических твер-
дых раствора; в — кубический и тетра-
гональный твердые растворы; в —
кубический и моноклинный твердые
растворы; 7 — тетрагональный и моно-
клинный твердые растворы; a — моно-
клинный твердый раствор.
На рис. 433 представлено, по данным Воронова и др., изменение
параметра решетки смесей, закаленных от различных температур.
Позднее Мэмптон и Рой [3] провели изучение системы ZrO2—
—ThO2, главным образом в области температур ниже 1200°, и по-
Цирконатные системы
465
строили диаграмму (рис. 434), в которой область выше 1000°
дается по Дьювецу и Лоху. Выше 400° во всех образцах уста-
новлены кубическая двуокись тория+моноклинная двуокись
°C
поо
1200
юоо
800
600
400
200
yTempaiZrO^p
I TempaeZrO2m p* Th02mp
YTempaeZrOz mp
[ молоко ZrO^mp
/ Монако. ZrO? mp
MoHoxn.ZrO? mp♦ThO2 m.p.
Рис. 433. Изменение параметра
решетки твердых растворов си-
стемы TliO2—ZrO2.
Сплавы закалены от температур: 1 —
2350е; г — 2300е; 3 — 2225е; 4 — 2020е;
S — 1900е; в — 1770е.
0 20 W 60 80 ЮО
Мол %
Рис. 434. Фазы, обнару-
женные в субсолидусной
области системы ТпО2—
—ZrO2 (по Мэмптону и Рою).
циркония, каждая из них содержит в твердом растворе примерно
менее 2 мол. % другой. Ниже примерно 400° при давлении водяного
пара от 15 000 до 600 фунт/кв. дюйм показана область, в которой
может образовываться непрерывная серия метастабильных куби-
ческих твердых растворов.
Литература
1- Воронов Н. М.,Е. А. Войтехова, А. С. Данилин, Труды
2-й Междунар. конфер. по мири, использ. атомн. энергии (Женева,
1958), т. 3, Ядерное горючее и реакторные металлы, Атомиздат,
М., 315, 1959.
2. D uwez Р., Е. L о с h, Joum. Amer. Ceram. Soc., 40, № 9, 321, 1957.
3. Mump ton F. A., R. Roy, Joum. Amer. Ceram. Soc., 43, № 5, 234,
1960.
4. R u f f O., F. E b e r t, H. W о i t i n e k, Zs. anorgan. allgem. Chem.,
180, № 3, 252, 1929.
30 H. А. Торопов и др., КП. 1
466
Цирконатные системы
Та2О5—ZrO 2
В субсолидусной области систему изучали Кинг, Шультц,
Дэрбин и Дакворт [1]. Для системы характерно наличие несколь-
Рис. 435. Фазовые отношения
в системе Та2О5—ZrO2.
них типов твердых растворов (рис. 435). Диаграмма воспроизводит
более сложные, чем это должно быть в бинарной системе, фазовые
соотношения и представляет собой, вероятно, квазибинарный раз-
рез более сложной диаграммы.
Литература
1. King В. W., J. Schultz, Е. A. Durbin, W. Н. Duckworth,
U. S. Atomic Energy Comm., BMI-1106, № 15, 1956.
CrtO3—ZrO,
Имеет значение для технологии высокотемпературных материа-
лов.
Изучена Смачной и Сальдау [1 ]. Химических соединений
не обнаружено. Установлены твердые растворы ZrO, в Сг2О3
(рис. 436). Эвтектика между двуокисью циркония и твердым рас-
твором имеет состав 54 мол.% Сг2О3 и температуру плавле-
ния 1880°.
Наличие твердых растворов на основе Сг3О3 доказывалось
микроскопическим анализом. Обнаружен постепенно меняющийся
показатель светопреломления: от 2.5 (для чистого Сг3О3) до 2.28
для предельного твердого раствора. Рентгенограммы этих сплавов
Цирконатные системы
467
показывают только линии окиси хрома с постепенным изменением
параметров решетки по мере роста содержания ZrO2 в твердом
растворе.
Рис. 436. Диаграмма 'со-
стояния системы
Сг20з—ZrO2 •
а — твердый раствор ZrO,
в Сг,О,.
Литература
1. Смачная В. Ф., П. Я. Сальдау,
153, 1950.
Зап. Лен. горн, инет., № 24,
FeO—ZrO 2
Система имеет значение при применении циркониевых огне-
упоров.
Изучена Фишером и Гофманом [2]. Авторы пользовались тер-
мическим анализом, рентгеновскими и микроскопическими иссле-
°C
1800 г
1600
7W
Жидк
Ж+дбуокись циркония §.
,Ж*РеО SI
/FeO+дбуокись циркония
о го w 60
М Вес.%
100
ZrO2
Рис. 437. Диаграмма состояния
системы FeO—ZrO2.
дованиями. Они отмечают, что при проведении термического
анализа состав проб во время опытов изменялся. Когда начиналось
плавление, жидкая часть поднималась по внутренним стенкам
30*
468
Цирконатные системы
железного тигля и защитной трубки термопары. Вследствие этого
становилось невозможным определять температуры ликвидуса.
Фишер и Гофман в согласии с данными Дитцеля и Тобера [1 ]
не обнаружили какого-либо соединения в этой системе. Эвтектиче-
ская точка отвечает составу 3 вес.% ZrOs+97 вес.% FeO и темпе-
ратуре 1330+15°. ZrO2 не растворяется в FeO.
Закись железа образует твердый раствор с ZrOs, причем пре-
дельная концентрация FeO уменьшается с ростом температуры.
При 1800° предельный твердый раствор содержит приблизительно
3% FeO и при 1450° приблизительно 4% (рис. 437).
Фишер и Гофман утверждают, что низкотемпературная моно-
клинная двуокись циркония не образует твердых растворов с FeO.
Литература
1. D i е t z е 1 А., Н. Tober, Вег. Dtsch. keram. Ges., 30, № 4, 71, 1953.
2. Fischer W. A., H. Hoffman, Arch. Eisenhtittenw., 28, № 11, 739,
1957.
FesO4—ZrO2
Изучена Муаном с сотрудниками [1 ] методом закалки
в воздушной среде. Обнаружен твердый раствор, образуе-
Рис. 438. Диаграмма состоя-
ния системы РвзО4—ZrO2, по-
лученная в воздушной среде
(по данным Джонса, Кимура
и Муана).
Цирконатные системы
469
мый в результате вхождения ZrO2 в решетку магнетита (обо-
значен М) и решетку гематита (обозначен Н), Химических сое-
динений не обнаружено (рис. 438).
Литература
1. J о п е з Т. S., Sh. Kimura, А. М u a n, Journ. Amer. Ceram. Soc.,
50, № 3, 137, 1967.
ГАФНАТНЫЕ СИСТЕМЫ
MgO—HfOs
В субсолидусной области изучена Годиной и Келером [1].
Обжиги исходных смесей производились в интервале 1300—1600°.
В отличие от других систем с окислами щелочноземельных элемен-
тов в системе MgO—HfO2 не обнаружено химических соединений
и установлено лишь образование кубических твердых растворов
типа флюорита в области, примыкающей к НЮ2. Образование твер-
дого раствора происходит при температуре 1600° и выше. Предель-
ная растворимость MgO в двуокиси гафния порядка 20 мол.%.
Година и Келер [2] показали, что твердые растворы двуокиси
гафния с окисью магния неустойчивы и при 1200° постепенно рас-
падаются на исходные компоненты. Параметр кристаллической
решетки предельного твердого раствора а=5.033 А.
Литература
1. Година Н. А., Э. К. К е л е р, Журн. неорг. хим., 4, № 4, 884, 1959.
2. Година Н. А., Э. К. К е л е р, Огнеупоры, 26, № 9, 426, 1961.
СаО— НЮ2
В субсолидусной области изучена Кертисом, Доней и Джон-
соном [3] и Годиной и Келером [1]. Последние авторы произво-
дили обжиги исходных компонентов в интервале 1000—1600°.
Кертис с сотрудниками производили обжиги при 1550 и 1800°,
и приводимая ими схема (рис. 439) дает только качественную кар-
тину, характеризующую существующие в системе фазы.
Установлено образование соединения СаШО2, а также кубиче-
ских твердых растворов типа флюорита в области, примыкающей
к HfO2. Предельная концентрация СаО в твердом растворе при
температуре обжига 1600° несколько превышает 20 мол.%. Со-
Гафнатные системы
471
гласно Кертису с сотрудниками, параметр решетки твердых рас-
творов изменяется в соответствии с рис. 440. Параметр решетки
"С
1300
1700
1600
Са.Нт03ромб.1 ромб. /niOgl кмн.
I ;ку61 А
/ / I куб.
I / /
0 20 00 60 30 100
СМ Мол.% Hf02
Рис. 439. Области устойчивости от-
дельных фаз в системе СаО—НЮ2
(схема).
твердого раствора, содержаще-
го 17.2 мол.% СаО, а=5.09 А.
По данным этих же авторов,
СаНЮ3 плавится при 2470+20°,
относится к ромбической синго-
а0>*
5.100 -
5.060 .
0
й 20 30 00
£сба6ка СаО, мол.%
50
Рис. 440. Изменение параметра кри-
сталлической решетки кубических
твердых растворов системы
СаО—HfO2 с ростом содержания СаО.
нии и имеет следующие параметры решетки: а=11.08, 5=7.94,
с=11’.42 А. Плотность 5.54 г/см3. Показатель светопреломления
1.957, двупреломление малое,
оптический знак отрицатель-
ный, кристаллы двуосные.
Година и Келер [2] пока-
зали, что при образовании
твердых растворов в качестве
промежуточной стадии реак-
ции возникает СаНЮ3, кото-
рый при дальнейшем нагре-
вании взаимодействует с
ШО2, образуя твердый рас-
твор. Твердые растворы в си-
стеме СаО—ШО2 при тер-
мической обработке в об-
ласти температур 1000—
—1200° подвергаются частич-
ному распаду с выделением
моноклинной двуокиси гаф-
ния и СаШО3. Интересно,
Hfo2*CaHf4Og CaHf40g^CaHf03
0 4 10 /20 to 00 50
Hfo2 CaHfifOg Man./ '
Рис. 441. Диаграмма состояния части
системы СаО—HfO2.
Q — HfO2 тетрагональная; М — HfO2 моно-
клинная; С — кубический твердый раствор.
что распад, достигнув 20—
25 %, уже больше практически не развивается даже при 200-ча-
совой выдержке.
472
Гафнатные системы,
Деламарр и Перес-и-Джорба [4], изучавшие систему
СаО—НЮ2 при более высоких температурах (2000° и выше), утвер-
ждают о существовании еще одного богатого двуокисью гафния
соединения CaHf4Oe. Диаграмма состояния системы, по данным
этих авторов, представлена на рис. 441.
Соединение СаШ4О9 устойчиво ниже температуры 1450°. Оно
кристаллизуется в моноклинной сингонии, и его элементар-
ная ячейка может быть представлена следующим образом:
6Cas+24Hf4+54Os~6 □. Параметры элементарной ячейки этого сое-
динения: а=12.65, 6=8.79, с=13.16 А, р=43°54', 7=1015.5 А3.
Соединение CaHfO3 имеет искаженную решетку типа перовскита
с параметрами элементарной ячейки: а=5.568, 6=5.732, с=
=7.984 А.
Литература
1. Година Н. А., Э. К. К е л е р, Журн. неорг. хим., 4, № 4, 884, 1959.
2. Година Н. А.. Э. К. К е л е р, Огнеупоры, 26, № 9, 426, 1961.
3. Curtis С. Е., L. М. D о ney, J. R. J ohnso n, Joum. Amer. Ceram.
Soc., -37, № 10, 458, 1954.
4. Delamarr С., M. Perez' у Jorba, Rev. Haut. Temper, et
Refract., 2, № 4, 313, 1965.
SrO—HfO2
Изучена в субсолидусной области Годиной и Келером [1].
Обжиги исходных смесей производились в интервале 1000—1300°.
Установлено одно соединение SrHfO3. Твердые растворы
в области, примыкающей к ШО2, несмотря на длительное выдер-
живание смеси с 80% НЮ2 при 1500°, не образуются.
Согласно Гофману [2], SrHfO3 кристаллизуется в кубической
сингонии с решеткой типа перовскита (параметр а=4.069 +
+0.003 А). Нарай-Сабо [3] принимает для SrHfO3 псевдокубиче-
скую (моноклинную) структуру с параметрами элементарной
ячейки: а=6=с=8.138 А, р=90°; Z=8.
Литература
1. Година Н. А., Э. К. К е л е р, Журн. неорг. хим., 4, № 4, 884, 1959.
2. Hoffman A., Zs. phys. Chem., В28, № 1, 65, 1935.
3. Naray-Szabo S. V., Mitteilung Techn. Hochschule, Budapest, 1.
30, 1947.
Гафнатные системы
473
ВаО—HfO2
Изучена в субсолидусной области Годиной и Келером [1 ].
Обжиги производились в интервале 1000—1300°. Получено един-
ственное соединение BaHfOs. Твердые растворы в области, примы-
кающей к HfO2, в отличие от систем с СаО и MgO не образуются.
Литература
1. Година Н. А., Э. К. К е л е р, Журн. неорг. хим., 4, № 4, 884, 1959.
La2O3—HfO2
Система изучена Комиссаровой, Ван Гень-ши, Спицыным и
Симановым [1 ] методами термического и рентгенофазового ана-
лиза. В некоторых случаях
производились определения
электросопротивления. Диа-
грамма состояния системы
представлена на рис. 442.
Границы некоторых областей
отмечены ориентировочно.
Обнаружено одно соедине-
ние La2Hf2O7 типа пирохло-
ра, плавящееся конгруэнтно
при 2300+30°. В интервале
от 0 до 5 мол.% Ьа2О3 на-
блюдается область ограни-
ченного твердого раствора
на основе HfO2. Авторам не
удалось выяснить фазовые
превращения этих твердых
растворов выше 1500°. В ин-
тервале 30—40 мол.% Ьа2О3
(при 1300°) существует об-
ласть твердых растворов на
основе соединения La2Hf2O7.
Границы этой области с по-
вышением температуры ДО Рис. 442. Диаграмма состояния системы
1800° несколько расширя- La2O3—Н 2.
ются (до 30—43 мол.%
Ьа2О3). Третье поле твердых растворов на основе гексагональной
модификации La2O3 расположено в интервале концентраций по-
следнего 95—100 мол.%. Область этих твердых растворов с повы-
474
Гафнатные системы,
шением температуры до 1800° несколько расширяется (до
90—100 мол. % Ьа2О3).
Изменение параметра элементарной ячейки твердых растворов
на основе La2Hf2O7 представлено на рис. 443. Из рисунка видно,
а.,кХ
10.770
10.750
10.760
10740
П. о л
0 20 40 ВО 80 100
Рис. 443. Параметр элементар-
ных ячеек твердых 'растворов
системы La2O3—HfO2.
“1U V niiHhi IIIMH ИМ1У1 tit IH IlnH 1 jldlimi IjdgV/g DuJlUHililCl lb У 1эСа)1И*1Лх1эАС Гм/1
от 10.757 (для La2Hf2O7) до 10.760 кХ при 1300° (1) и от 10.747
до 10.759 кХ при 1800° (2).
что с повышением концентрации La2O3 величина а увеличивается
Литература
1. Комиссарова Л. Н., Ван Гень-ши, Викт. И. Спицын,
Б. П. С и м а н о в, Журн. неорг. хим., 9, № 3, 693, 1964.
СеО2—ШО2
Система изучалась Пассерини [1]. Обнаружены твердые рас-
творы как на основе НЮ2, так и на основе СеО2. Растворимость
СеО2 в двуокиси гафния составляет 25 мол. %, а НЮ2 в СеО2 —
32 мол.%.
Литература
1. Р а з з е г i n i L., Gazz. chim. Ital., 60, 775, 1930,
СИСТЕМЫ С ДВУОКИСЬЮ ТОРИЯ
ВеО—ТЪО2
Перспективна для получения высокотугоплавких материалов.
Система относится к простым эвтектическим. Состав эвтектики
и температура ее плавления точно не установлены. Согласно ста-
рым работам Вартенберга, Ройша и Сарана [4], минимум точки
плавления находится при 2210°.
Рис. 444. Диаграмма плавкости
системы ВеО—ThO2.
Геллер, Яворский, Штейерман и Кремер [3] полагают, что
эвтектика имеет состав 20 вес. % ВеО и плавится при 2200°.
Гич и Харпер [2] исследовали систему по точкам плавления
и нашли, что эвтектика находится в пределах 10—15 вес.% ВеО
с температурой плавления 2360° (рис. 444).
Волченкова и Пальгуев [1], изучившие электропроводность
спекавшихся по керамической технологии образцов, делают пред-
положение (на основании наблюдавшихся экспериментальных
точек) о возможности незначительной растворимости ВеО в дву-
окиси тория. Указаний на образование соединения ВеТЬО3 не было
получено.
476
Системы с двуокисью тория
Литература
1. Волченкова 3. С.,С. Ф. Пальгуев, Труды Инет, электрохимии
Уральск, фил. АН СССР, 4, 67, 1963.
2. G е а с h G. А., М. F. Н а г р е г, Metallurgia, 47, 283, 1953.
3. Geller R. F., Р. J. Y a v о г s к у, В. Y. S t e i erm an, A. S. С r e-
m e r, Journ. Res. Nat. Bur. Stand., 36, № 3, 277, 1946.
4. Wartenberg H., H. J. R eusch, E. S a r a n, Zs. anorgan. allgem.
Chem., 230, № 3, 257, 1937.
MgO— ThOj
Эта система интересна во многих отношениях, вследствие чрез-
вычайно высокой тугоплавкости компонентов и особых электриче-
ских свойств материалов, полученных на ее основе.
Система не изучена. Волченкова и Пальгуев [1 ] в ре-
зультате измерения электропроводности при температурах
от 300 до 1000° сделали заключение о растворимости небольшого
количества MgO в двуокиси тория и о возможности существования
соединения MgO-ThO2, на которое указывали Смит и Велч [2].
Литература
1. Волченкова 3. С., С. Ф. Пальгуев, Труды Инет, электрохимии
Уральск, фил. АН СССР, 4, 67, 1963.
2. Smith A. J., A. J. Е. W е 1 с h, Acta crystallogr., 13, № 8, 653, 1960.
СаО—ThO g
Интересна для техники вследствие тугоплавкости компонентов
и особых электрических свойств материалов, полученных на ее
основе.
Диаграмма состояния системы не построена. Мёбиус, Витцманн
и Витте [3] обжигали смеси окислов при 1800° в токе воздуха.
Установлено образование флюоритовых твердых растворов на
основе ТЬО2. При вхождении СаО в решетку ТЬО2 параметр кри-
сталлической решетки последнего уменьшается (рис. 445). Пре-
дельный твердый раствор содержит приблизительно 8 мол.% СаО.
Торат кальция CaThO3, полученный Нара-Сабо [4], авторы не
обнаружили, полагая, что это соединение неустойчиво при приме-
няемой ими высокой температуре.
Системы с двуокисью тория
477
Кертис [2] приводит более высокую концентрацию СаО в пре-
дельном твердом растворе, оценивая ее в 39 мол.%. Эта величина
а,А
5.539
5.598
5.597
5.596 _____
Рис. 445. Параметр элементарной ’ О 1Q 20 30 40 50
ячейки флюоритовой фазы системы Л « Л
CaO-ThO* П0^ МОЛ.% Са0
находит подтверждение в данных электропроводности, получен-
ных Волченковой и Пальгуевым [1]. При содержании приблизи-
тельно 40 мол.% СаО наблюдается резкое уменьшение электро-
проводности.
Литература
1. Волченкова 3. С., С. Ф. Пальгуев, Труды Инет, электрохимии
Уральск, фил. АН СССР, 1, 127, 1960.
2. С и г t i з С. Е., Progr. Nucl. Energy, ser. V, № 2, 223, 1959.
3. Mobius H.-H., H. W i t z m a n n, W. W i 11 e, Zs. Chem., 4, № 4,
152, 1964.
4. N а г a у - S z a b о S. V., Mitteilung Techn. Hochschule, Budapest,
1, 30, 1947.
SrO—ThO2
Система относится к числу весьма тугоплавких, интересна для
разработок новых керамических материалов.
Диаграмма состояния системы не построена. Волченкова и
Пальгуев [1 ] в результате измерения электропроводности в ин-
а,А
5.603
5.601
5.539
5.597
'71 ।__j---1--ш—1_
о m го зо w so
Пог Мол% s
Q Рис. 446. Параметр элемен-
тарной ячейки флюоритовой
фазы системы SrO—ThO2.
478
Системы с двуокисью тория
тервале температур 300—1000°, а также фазового химического ана-
лиза пришли к выводу о возможности образования флюоритовых
твердых растворов на основе ТЬО2с содержанием 2—3 вес.% SrO.
Указывается также возможность существования при высоких тем-
пературах соединений SrThO3 и SrsThO4. Предположения о суще-
ствовании первого из этих соединений высказывались и ранее [3].
Мёбиус, Витцманн и Витте [2] на образцах, полученных об-
жигом при 1800°, нашли, что растворимость SrO в двуокиси тория
составляет 3—5 мол.% (рис. 446). При температуре 1800° эта рас-
творимость может доходить до 9%.
Литература
1. В о л ч е н к о в а 3. С., С. Ф. П а л ь г у е в, Труды Инет, электрохи-
мии Уральск, фил. АН СССР, 4, 67, 1963.
2. Mobius Н.-Н., Н. Wi t zmann, W. W i 11 е, Zs. Chem., 4, № 4,
152, 1964.
3. Smith A. J., A. J. E. W e 1 c h, Acta crystallogr., 13, № 8/9, 653, 1960.
BaO—ThO2
Волченкова и Пальгуев [1], производя измерения электро-
проводности (в интервале 300—1000°) спекшихся образцов, сде-
лали вывод о существовании соединения ВаТЬО3 и, возможно,
а, А
5.593 -
5.598 -
Рис. 447. Параметр элементарной
ячейки флюоритовой фазы системы
ВаО—ThO2.
0
Th02
10 15
Мм.*/, ' ВаО
ВаО«ЗТЬО2. Указывается на образование твердых растворов на
основе ThOj с содержанием 2—3 вес.% ВаО.
Мёбиус, Витцманн и Витте [2] отмечают существование тората
бария ВаТЬО3 и утверждают, что растворимость ВаО в двуокиси
тория должна составлять всего около 0.5 мол. % (рис. 447).
Литература
1. Волченкова 3. С., С. Ф. Пальгуев, Труды Инет, электрохи-
мии Уральск, фил. АН СССР, 4, 67, 1963.
2. Mobius Н.-Н., Н. Witzmann, W. W i 11 e, Zs. Chem., 4, № 4,
152, 1964.
Sc2O3—ThO2
Систему изучили Тшебятовский и Горынь [4], пользовавшиеся
печью с вольфрамовой трубкой, описанной Немецом и Богацем [2 ],
или радиационной печью [3], что позволяло работать в темпера-
турной области до 3000°. Система относится к простым эвтекти-
ТЩ мол% О ScOt5
Рис. 448. Диаграмма состояния
системы Sc2O3— ThO. (по Тше-
бятовскому и Горынь).
ческим, и твердых растворов,
на которые указывают Мёбиус
с сотрудниками [1], не обнару-
жено. На рис. 448 представ-
лена диаграмма состояния си-
стемы Sc2O3—ThO2. Эвтектика
содержит 38 мол.% ScO1 Б и
плавится при 2220°, здесь же
даны значения параметров эле-
ментарных ячеек фаз Sc2O3 и
ThO2, полученные на сплавлен-
ных образцах, отжигавшихся
при температуре 2110° в ат-
мосфере аргона,
о
М
5.600 -
5.598 -
5.596 ______________________
-----1 1 1 _
0 2-9 6 8 16
Th02 Мол.% 5с01.5
Рис.М49. Параметр элементарной
ячейки флюоритовой фазы систе-
мы Sc2O3—ThO2.
Мёбиус, Витцманн и Циммер [1] на обожженных при 1750°
смесях окислов рентгенографически определили область флюори-
товых твердых растворов. Как видно из рис. 449, растворимость
окиси скандия в ThO2 составляет всего около 0.9 мол.% ScO1 g.
Литература
1. Mobius Н., Н. Witzmann, Т. Z i m m е г, Zs. Chem., 4, № 5,
194, 1964.
2. N i е m i е с J., А. В о g a c z, Chem. Stosowana, 6,147,1962.
3. Trz e bi at owski W., J. В e r a k, J. N iemi ec, Przemys. Chem.,
9, 458, 1954.
4. Trzebiatowski W., R. Horyn, Bull. Acad. Polon. Sci., 13,
№ 5, 303, 1965.
480
Системы с двуокисью тория
Y2Os—ThO2
- Материалы на основе этой системы весьма тугоплавки. Хунд и
Мецгер [2], первые изучавшие небольшую область системы, нашли,
что в двуокиси тория растворяется У2О3. Ими были получены твер-
дые растворы, содержащие (при 1200°) до 30 мол.% YO16 (иссле-
довалась область от 22 мол.% YOX Б).
Хунд и Метцгер определили параметры элементарной ячейки
твердых растворов, полученных обжигом соответствующих смесей
при 1200°. Брауэр и Градингер [1 ] такие же определения произ-
вели для 1400°. Данные перечисленных авторов представлены на
Рис. 450. Параметр элементарных ячеек
твердого раствора в системе Y2O3—ThO2.
1 — данные Хунда и Метцгера для 1200’; г —
данные Брауэра и Градингера для 1400°.
рис. 450. Перегиб на кривой «а—концентрация», по мнению
Брауэра и Градингера, должен находиться в точке, соответству-
ющей 25 мол.% YO15.
Ласкер и Рапп [3] изучали систему с точки зрения возмож-
ности использования ее в качестве твердого электролита в галь-
ванических ячейках. В изученной концентрационной области
до 6 мол. % YOXБ электролит обладает ионной проводимостью
в широкой области Pq2. При высоком РО2 электролит представ-
ляет полупроводник р-типа.
Суббарао с сотрудниками [4] изучили субсолидусную область
(обжиг до 2200° в атмосфере чистого кислорода). Образцы пригото-
влялись обезвоживанием и прокаливанием смешанных оксалатных
растворов. Идентификация фаз производилась рентгенографи-
чески. Обнаружены твердые растворы на основе Th02 и твердые
Рис. 451. Субсолидусные фа-
зовые отношения в системе
Y3O3—ThO2 (по Суббарао с со-
трудниками).
Рис. 452., Параметр элементарной
ячейки твердых растворов в си-
стеме Y3O3—ThO2 (по Суббарао
с сотрудниками).
Рис. 454. Плотность твердых
растворов системы Y2O3—ThO3
(по Уиммеру с сотрудниками).
1 — экспериментальная кривая;
г — анионные вакансии; з — ка-
тионы в междоузлиях.
Рис. 453. Плотность твердых рас-
творов системы Y2O3—ThO2 (по
Суббарао с сотрудниками).
1 — плотность рассчитана из рентге-
новских данных при условии катион-
ных вакансий; 2 — то же при условии
анионных вакансий; 3 — эксперимен-
тальная плотность, определенная па по-
рошках; 4 — то же на обжигавшихся
дисках.
31 Н. А. Торопов и др., кн. 1
482
Системы с двуокисью тория
растворы на основе Y2O3. Между}'этими твердыми растворами
имеется двухфазная область (рис._451). При повышении темпера-
туры область торатных твердых растворов расширяется от
20—25 мол.% YO13 при^1400° до 50—55 мол.% YO16 при 2200°.
Предельный твердый раствор ThO2 в полутораокиси иттрия при
2200° содержит 7 мол. % двуокиси, при 1400° — около 3 мол. %
ThO2.
Параметр элементарной ячейки полученного при 2200° твер-
дого раствора YOXл в ThO2 представлен на рис. 452. Плотность
этих же твердых растворов (определенная экспериментально и
вычисленная) представлена на рис. 453. Результаты исследования
плотности позволяют выразить изученные твердые растворы фор-
мулой Th1_xYa.O2_0 6х. Катионная подрешетка здесь полностью
заполнена ионами Th4+ и Y3+; вакансии имеются только в анион-
ной подрешетке.
Уиммер с сотрудниками [5] определили плотность твердых
растворов на основе Th02 (рис. 454). После корректировки экспе-
риментальных данных (Z) на пористость образцов была получена
истинная плотность, величина которой находится в хорошем согла-
сии с вычисленной в предположении наличия анионных вакансий
в твердых растворах.
Литература
1. Brauer G., Н. Gradinger, Zs. anorgan. allgem. Chem., 276,
№ 5—6, 209, 1954.
2. H u n d F., R. Mezger, Zs. phys. Chem., 201, № 5/6, 278, 1952.
3. Lasker M. F., R. A. Rapp, Zs. phys. Chem., N. F., 49, № 3/5,
198, 1966.
4. S u b b a г а о В. С., P. H, Sutter, J. H r i z o, Journ. Amer. Ceram.
Soc., 48, № 9, 443, 1965.
5. W i m m e r J. M., L. R. В i d w e 11, N. M. T a 11 a n, Journ. Amer.
Ceram. Soc., 50, № 4, 198, 1967.
La2O3—ThO2
Имеет значение для получения высокоогнеупорных изделий
и материалов для электроники.
Систему изучали Хунд и Дюрвехтнер [2] на прокаленных
при 1300° смесях. Ьа2О3 растворяется в двуокиси тория с образо-
ванием кубических твердых растворов флюоритового типа. Пре-
дельная концентрация La2O3 составляет 52 мол. %. При этом пара-
метр решетки возрастает от значения а=5.592+0.001 А, харак-
терного для чистой ThO2, до а=5.645+0.005 А для предельного
твердого раствора.
Системы с двуокисью тория
483
Плотность твердых растворов от величины 9.9в г/см8 для чистой
ThO2 снижается до 7.7» г/см3 для сплава с 48.1 мол.% ThO2.
Путем сопоставления вычисленной из различных предположений
о строении твердого раствора плотности и экспериментально
определенной авторы пришли к выводу, что твердые растворы
имеют совершенную катионную и дефектную анионную части
решетки.
Брауэр и Градингер [1 ] обнаружили два типа твердых раство-
ров: в пределах от 0 до 48 мол.% Ьа2О3 — тип флюорита и от 95
до 100% Ьа2О3 — гексагональные кристаллы, характерные Для
окислов редкоземельных элементов. Область сосуществования
обоих типов твердых растворов простирается от 48 до 95 мол.%
Ьа2О3.
Литература
1. Brauer G., Н. Gradinger, Zs. anorgan. allgem. Chem., 276,
№ 5—6, 209, 1954.
2. H u n d F., W. D fi r rw a c h t n er, Zs. anorgan. allgem.' Chem., 265,
№ 1—3, 67, 1951.
Рг20з—ThO2
Гингерих [1] произвел рентгенографическое исследование
обожженных при 1400° смесей ThO2 и Рг2О3. Обнаружена непре-
рывная серия твердых растворов, простирающихся от 0 до
70 мол.% РгО1Б с точкой перехода от флюоритовой структуры
к структуре типа С при содержании РгО1Б около 50 мол.%.
Образцы, содержащие более 70 мол.% РгОх Б, показывают присут-
ствие гексагональных типа А кристаллов Рг2О3, в которых рас-
творяется около 2 мол.% ThO2. Кубическая окись празеодима
(тип С) растворяет более 10 мол.% ThO2, играющей здесь роль
стабилизатора. В образцах, содержащих более 80 мол. %РгО1 в,
ниже 1100° сосуществуют две кубические фазы типа С.
Литература
1. Gingerich К. A., in: Rare earth research, New York, 321, 1962.
Nd2O3—Th О 2
На основе этой системы интересны новые композиции для полу-
чения тугоплавких материалов.
Брауэр и Градингер [1 ] обнаружили два типа твердых раство-
ров: 1) кубические, типа флюорита, при содержании Nd2O3 от 0
31*
484
Системы с двуокисью тория
до 50 мол.%; 2) гексагональные, характерные для окислов редко-
земельных элементов, при содержании от 95 до 100 мол. % Nd2O3.
Область сосуществования этих обоих твердых растворов распро-
страняется от 50 до 95 мол. % Nd2O3.
Литература
1. Brauer G., Н. Gradinger, Zs. anorgan. allgem. Chem., 276,
№ 5—6, 209, 1954.
Sm2O3—Th О 2
Система интересна для технологии новых керамических мате-
риалов. Брауэр и Градингер [1 ] обнаружили два типа твердых
растворов: тип флюорита от 0 до 60 мол. % Sm2O3 и моноклинные
твердые растворы (тип В) от 95 до 100 мол. % Sm2O3.
Двухфазная область распространяется от 60 до 95 мол. %
Sm203.
Литература
1. В г a u е г G., Н. Gradinger, Zs. anorgan. allgem. Chem., 276,
№ 5—6, 209, 1954.
Eu2O3—ThO2
Изучена Гингерихом и Брауэром [1 ] в субсолидусной области
в интервале температур 1200—1500° (рис. 455). В области, примы-
Предельный состав твердых
растворов в системе Еи2О3—ThO2
в зависимости от температуры
обжига
Температура обжига, °C Предельный состав, мол. % EuOi.t
фаза F фаза С
1200 36 + 1 92±2
1300 40±1 90±2
1400 47+2 87+2
1500 53±1 84+2
кающей к ThO2, обнаружены твердые растворы со структурой
флюорита (F). Твердые растворы типа С, характерного для окислов
редкоземельных элементов, образуются путем растворения ThO2
Системы с двуокисью тория
485
в окиси европия. Кроме того, обнаружены твердые растворы
типа В, также характерного для окислов редкоземельных элемен-
Рис. 455. Схемы фазовых отношений Рис. 456. Параметры элементар-
в системе Eu2Os—ThO2. ных ячеек твердых растворов
системы Eu2Os—ТпО2.
При температуре прокаливания: 1 —
1500’; г — 1400’; 3 — 1300’; 4 —
1200’; 5 — 1000’.
тов. Состав предельных твердых растворов F и С в зависимости
от температуры обжига представлен в таблице.
На рис. 456 показан параметр элементарных ячеек твердых
растворов.
Литература
1. Gingerich К. A., G. В г a u е г, Zs. anorgan. allgem. Chem., 324,
№ 1—2, 48, 1963.
Gd2O3—Th О 2
Систему в субсолидусной области изучали Брауэр и Градин-
гер [1 ]. Обнаружено два типа твердых растворов: при содержании
от 0 до 50 мол.% GdjOs — типа флюорита и при содержании
93—100 мол. % Gd2O3 — кубические твердые растворы типа Т12О3.
В промежуточной области существуют оба типа твердых растворов.
Литература
1. В г а и е г G., Н. G г a d i n g e r, Zs. anorgan. allgem. Chem., 276,
Ns 5—6, 209, 1954.
486
Системы с двуокисью тория
Yb2O3—ThO2
Изучена в субсолидусной области Гингерихом и Брауэром [1].
Обжиг исходных смесей производился при 1400° и более низ-
ких температурах. Обнаружено два типа твердых растворов
Т
МО
<М0
7 93.5
Tty Мол’/,
Рис. 457. Схемы фазовых
отношений в системе
Yb2O3— ThOa.
(рис. 457): 1) тип флюорита (F), образующийся на основе двуокиси
тория; 2) тип С, образующийся путем растворения ThO2 в окиси
иттербия. Предельная растворимость Yb2Os в двуокиси тория за-
Рис. 458. Параметры элементарных
ячеек твердых растворов системы
Yb2Os—ThO2.
1 — образцы быстро закаливались; г —
образцы медленно охлаждались.
висит от температуры обжига. Для образцов, обжигавшихся при
1400°, в твердый раствор входит 10 мол.% YbOx Б, при несколько
более низкой температуре обжига содержание YbOx Б составляло
7.3 мол.%. Параметр кристаллической решетки флюоритовой
фазы предельного состава (полученной при 1400—1420°) а =
=4.579 А (рис. 458).
Растворимость ThO2 в YbOx Б составляет при 1400° всего
1 мол.%.
Литература
1. Gingerich К. A., G. В г a u е г, Zs. anorgan, allgem. Chem., 324,
№ 1—2, 48, 1963.
Системы с двуокисью тория
487
МоО3—Th О 2
Некоторые сведения о системе приводят Фрейндлих и Торе [2],
нагревавшие смеси окислов в закрытых кварцевых трубках при
температурах между 600 и 1000° (рис. 459). Обнаружено одно, впер-
вые открытое Труновым и Ковба [1], соединение ThMo2O8, суще-
ствующее в виде модификаций аире точкой перехода 900°. Низко-
температурная, по обозначению авторов, a-модификация образует
кристаллы ромбической сингонии с параметрами элементарной
1000°
MoOffl fl+ThOz
Мо03 уЗ
Рис. 459. СхемьГфазовых отношений^ системе |МоО3—ThO2.
ячейки: а=9.747, 5=10.225, с=14.33 кХ. р-Фаза авторами не
охарактеризована.
Кроме того, отмечается фаза у, в которую переходила
а-ТЬМо2О8 ниже 900° в присутствии ThO2.
При соотношении ThO2 : МоО3=4 : 5 налицо была только
фаза у (в смеси с чистой ThO2). Авторы не смогли выяснить, сле-
дует ли рассматривать фазу у как третью модификацию ThMo2O8,
стабилизированную двуокисью тория, или как новое соединение
с иным, чем ThMo2O8, составом (с более высоким содержанием
ThO2).
Литература
1. Т р у н о в В. К., Л. М. Ковба, Вести. Моск. унив.. сер. II, хим.,
18, №, 3, 60, 1963.
2. Freundlich W., J. Thoret, Compt. rend., 265, ser. C, Ns 2, 96,
1967.
ФОСФАТНЫЕ СИСТЕМЫ
Li2O—Р2О3
Полностью система не изучена, но исследованы образующиеся
в ней соединения. Наиболее тщательное исследование принадле-
жит Тьену и Гюммелю [1], установившим три фосфата лития:
ортофосфат лития Ы3РО4, пирофосфат лития Li4P2O7 и метафосфат
лития LiPO3. Оптическая характеристика этих фаз приводится
в таблице.
Оптическая характеристика соединений системы Li2O—P2OS
LisPOt Li.P2O, LiPO3
Оптический характер . . Двуосный. Двуосный. Двуосный.
Оптический знак . . . (+) (+) (+)
Угол оптических осей . . st 80° st85° st 85°
Показатели преломления:
Ng . 1.562 1.536 1.543
Nm 1.555 1.524 1.532
Np ....... 1.550 1.513 —
Температура конгруэнтного плавления Li3PO4 по данным тер-
мического анализа 1225°, а по методу закалки 1205 ±5°. Поли-
морфные превращения отсутствуют. Кристаллы — ангедральной
формы без спайности. Температура конгруэнтного плавления пиро-
фосфата лития 885+5° (метод закалки). По данным термического
анализа, при 630° испытывает обратимое полиморфное превраще-
ние. Кристаллы эвгедральные и планковидные с хорошо выражен-
ным двойникованием и двойниковым углом в 43.5°. Температура
конгруэнтного плавления метафосфата лития LiPO3 688 ±5°
(метод закалки) или 665° — по данным термического анализа.
Кристаллы листовидные, легко раскалывающиеся по спайности.
В статье Тьена и Гюммеля приводится таблица межплоскост-
ных расстояний для трех фосфатов лития.
Фосфатные системы
489
Земанн [2] изучил кристаллическую структуру ортофосфата
лития LisPO4. Кристаллы этого соединения относятся к ромбиче-
ской сингонии с параметрами элементарной ячейки: а=6.12,
Ь=10.55, с=4.83 А.
Литература
1. Tien T.-Y., F. А. Н u m m е 1, Journ. Amer. Ceram. Soc., 44, № 5, 206,
1961.
2. Z e m a n n J., Acta crystallogr., 13, № 11, 863, 1960.
Na2O—P2O8
Существенна для химии фосфатных и силикофосфатных стекол
и других материалов подобного типа.
Морей и Ингерсон [1 ] изучили систему в концентрационных
пределах, (Ограниченных' соеди-
нениямир^аРОз и Na4P2O7 (рис.
460). В более широких преде-
лах (от 40 до 80 мол. % Na2O)
система изучена Туркдоганом и
°C
1600 -
1583'
a-3Na20P205
+ Ж im
“C
1000\-
900
800
Жидк /
J Na„P20^ Ж
700
NaP03*)K
600
500
/VaP^Na^Oig ,
0 2
NaP03
У^Р^Ж Na&°«>
^чрг°7
к 6 8 10
Вес. % ^р2°7
iwo
1200
1000
800
600
400 _
40
№
13-ЗНа20-Р205 + Ж
На^Р^Ж
2ИагОРг05+Ж
9Щ
В-ЗНаЛР-А
+ZNa20P205
——|ж°
То-------
60 70 80
Мол.% Na2°
Рис. 460. Диаграмма состояния Рис. 461. Диаграмма состояния
системы NaPO.—Na4P2O, системы Na2O—P2OS (по Туркдо-
(по Морею и Ингерсону). гану и Мэддоксу).
Мэддоксом [2]. Обнаружено четыре соединения: Na2O>P2O8,
^5Na2O>3P2O8, 2Na2O-P2O8 и 3Na2O.P2Oe (рис. 461).
Соединение NaPOs, получающееся кристаллизацией соответ-
ствующего стекла, существует в двух формах. Первая форма,
490
Фосфатные системы
отличающаяся меньшими значениями показателя светопреломле-
ния, получается кристаллизацией стекла вблизи (несколько ниже)
температуры плавления. Вторая форма получена кристаллизацией
стекла при температуре около 450°.
Рис. 462. Зависимость удельного объема
от состава в системе NajO—Р2О5.
Соединение Na5P3O10 также получено в двух формах. Первую
высокотемпературную форму получают быстрым охлаждением
от 600° до комнатной температуры, вторую форму — путем охла-
ждения закристаллизованного расплава в печи, что сопрово-
ждается рассыпанием в порошок.
Таблица 1
Инвариантные точки системы Na2O—P2OS
Точка Фазы Процесс Состав, вес. % Тем- пера- тура, °C
Na, О РгО5
1 a-3Na2O-P2O5 + жидкость. Плавление. 75.00 25.00 1583
2 a-3Na2OP2O5 -j- [3-3Na2O-Р2О5+ -17 жидкость. Превращение. 74.10 25.90 1474
3 р-31\а2и-Р2и5 4“ Hl\la2U’P2O5 4“ 4- жидкость. Эвтектика. 69.75 30.25 944
4 2Na2O-P2O5 + жидкость. Плавление. 66.67 33.33 978
5 2Na2O-P2O5 + Na2O-P2O5 + + жидкость. Эвтектика. 57.00 43.00 546
6 Na2O-P2O5 + жидкость. Плавление. 50.00 50.00 588
Фосфатные системы
491
Соединение Na3PO4 имеет полиморфное превращение при 1474°.
Соединение Na5P3O10 плавится при 622° с разложением на
Na4PsO7 и жидкость, содержащую 49.5 вес.% Na4P2O7. Эвтектика
Таблица 2
Кристаллические фазы системы Na2O—Р2О5
Соединение Система Ng Nm Np 2уо Примечание
NaPO3 (1-я форма). ? 1.480 1.478 1.474 (-)80 Стекло NaPO3 имеет N= = 1.4847.
NaPO3 (2-я форма). Ромбиче- ская (?). 1.529 1.510 1.498 (+) 78
(1-я высокотемпе- ратурная форма). ? 1.504 1.478 1.477 (+) 21 Стекло Na5P3O10 имеет N= = 1.4814.
Na3P3Ujo (2-я форма). ? 1.502 1.477 1.470 (+) 57
Na^P 2O7. a-Na3PO4. Квадрат- ная. ? Данных нет. 1.525 — (+)0 Дву преломле- ние около 0.025.
₽-Na3PO4. Форма зе- рен непра- вильная округлая. 1.535 Двупреломле- ние около 0.004-0.005.
(между NaPO3 и Na3P3O10) плавится при 552° и содержит 31 вес.%
Na4PsO7.
Туркдоган и Мэддокс произвели определение удельных объемов
кристаллических фосфатов натрия (рис. 462).
Литература
1. М о г е у G. W., Е. Ingerson, Amer. Journ. Sci., 242, № 1, 1, 1944.
2. Turkdogan E. T., W. R. Maddock s, Journ. Iron a. Steel Inst.,
172, pt. I, 1, 1952. (Реферат: Journ. Soc. Glass Techno!., 37, № 177,
54 A, 1953).
492
Фосфатные системы
Ks0—Р2О8
Составы этой системы являются компонентами более сложных
силикофосфатных и других фосфорсодержащих стекол.
Таблица 1
Инвариантные точки системы К4Р2О7—КРО3 (по Морею)
Точка Фазы Процесс Состав Температу- ра, °C
КРОз, весовая фракция К.Р2О„ весовая фракция К2О, молярная фракция Р2О5, молярная фракция
1 К4Р2О7 + жид- кость. Плавление. 0 1.00 — — 1104
2 К4Р2О7 + + ksp Зо10 + + жидкость. Инконгруэнт- ное плавле- ние. 0.54 0.46 0.58 0.42 641.5
3 К3Р 3О10-|- КРО3+ + жидкость. Эвтектика. 0.59 0.41 0.571 0.429 613
4 КРО3+жидкость. Плавление. 100 0 — — 813
Часть системы, ограниченная составами К4Р2О7 и КРО3, изу-
чена Мореем [1] (рис. 463). В пределах указанной области обна-
„ Мол. доли Р205
С 0.35 ОЛО 0Л5 0.50
1200
1000
800
600
О 20 W 60 80 100
КчРг07 Вес.% КР03
Рис. 463. Диаграмма состояния системы
К2О—Р2О5.
ружено соединение К8Р3О10, плавящееся инконгруэнтно, а также
соединения, ограничивающие изученную область: К4Р2О7 и КРО3.
Фосфатные системы
493
Таблица 2
Кристаллические фазы системы К20—Р2О5 (по Морею)
Соединение Ng Np Оптический знак
К«Р 2O7 1.502 1.498 (+)
1.520 1.483 1.516 1.465 (-) (+)
Литература
1. М о г е у G. W., Journ. Amer. Chem. Soc., 76, № 18, 4724, 1954.
MgO—PSO8
Изучена Бераком [1 ] в концентрационной области 0—78 вес. %
РаОБ методами термографии, рентгенографии и микроскопии.
Атомн.7, Рг05
10 20 30 40 50
°C
1400
1300
1200
1100
1000
900
Рис. 464. Диаграмма состояния системы
MgO-Р2ОБ.
494
Фосфатные системы
Обнаружено три соединения: 3MgO -P20e, 2MgO -Р2О2 и
MgO-Р20Б (рис. 464), плавящихся без разложения^соответственно
при 1357, 1382 и 1165°. sjg
Соединение 3MgO -Р20в имеет две полиморфные”формы_с_точкой
перехода 1055°. Превращение низкотемпературной формы в вы-
сокотемпературную сопровождается увеличением объема. Высоко-
температурная форма не сохраняется при закалке в воде.
Высокотемпературная форма 3MgO-P2Oe способна образовы-
вать с 2MgO-P2Oj твердый раствор с очень узкой концентрацион-
ной областью. Температура превращения трехмагнезиального
фосфата снижается в результате растворения 2MgO -Р2Ов до 940°.
MgO, по-видимому, не растворяется в 3MgO-P2Oe, так как не ока-
зывает влияния на температуру превращения последнего. Три
эвтектики в системе имеют следующий состав и температуру
плавления: 52 вес.% Р20в, 1325°; 57.5 вес.% Р20в, 1282°; 76 вес.%
Р2О6, 1150°.
Соединения MgO P20g и 2MgO *P20g могут быть получены охла-
ждением в воде в виде стекла.
Рой, Мидлесуарт и Гюммель [4] нашли, что пирофосфат маг-
ния Mg2P2O7 имеет фазовый переход при 68°. Кальво [21 на основа-
нии рентгенографических исследований полагает, что этот переход
происходит при 62+1°. При этом переходе параметры кристалли-
ческой решетки изменяются непрерывно. Согласно Кальво, вы-
сокотемпературная модификация Mg2P2O7 имеет при 95° следующие
параметры элементарной ячейки: а=6.494 +0.007, 5=8.28+0.1,
с=4.522+0.005 А, (3=103.8+0.1°, Z=2. Лукашевич [3] показал,
что (высокотемпературная) форма Mg2P2O7 изоструктурна с торт-
вейтитом (Sc2Si2O7).
Литература
1. В е г a k J., Roczn. Chem. 32, № 1, 17, 1958.
2. С а 1 v о С., Canad. Journ. Chem., 43, № 5, 1139, 1965.
3. Lukaczewicz К., Roczn. Chem., 35, № 1, 31, 1961.
4. R о у R., E. T. Mi d dleswar t h, F. A. H u m m e 1, Amer. Mi-
neralogist, 33, № 7/8, 458, 1948.
СаО—P 2O j
Частная система ряда важных для технологии силикатов и
фосфорных минеральных удобрений многокомпонентных силико-
фосфатных систем. Характеризуется сложностью фазовых соот-
ношений и наличием твердых растворов.
Участок диаграммы состояния в пределах от Р20в до 2СаО-
•P2Og детально изучен в работе Хилла, Фауста и Рейнольдса [11,
Таблица 1
Инвариантные точки системы Р2О5—2СаО Р2ОВ
Точка Фазы Процесс Состав, вес.% Темпера- тура,°C
СаО Р2О5
А Р2Ов±жидкость. Плавление. 0 100 580 ±5
С СаО 2Р2ОБ+жидкость. » 16.49 83.51 810 ±5
G а-СаО • Р205+жидкость. » 28.32 71.68 984 ±1
G" Р-СаО • Р20Б+жидкость. Плавление метастабильное. 28.32 71.68 977+1
G' а- и Р-Са0-Р20Б. Полиморфное превращение. 28.32 71.68 963 ±2
К а-2СаО- Р2ОБ+жидкость. Плавление. 44.12 55.88 1353 ±3
К' а- и ₽-2СаО-Р2ОБ. Полиморфное превращение. 44.12 55.88 1140±1
В Р20Б±Са0-2Р20Б+жидкость В. СаО-2Р2ОБ+2СаО-ЗР2ОБ+жидкость D. 2СаО-ЗР2ОБ+Р-СаО-Р2ОБ твердый раствор Эвтектика. 6.3 93.7 490 ±5
D » 18.9 81.1 746 ±5
L Реакция. 21.5 79.5 774 ±2
М* (около 28% СаО)±жидкость Е
F (20.5% СаО). a-СаО-Р20Б+р-Са0-Р20Б твердый раствор Полиморфное превращение. 26.7 73.3 969±1
N (около 28% СаО)+жидкость F. 69.7 970 ±1
Н а-СаО-Р«ОБ твердый раствор О (28.6+ +0.2% СаО)±трёмелит 2(35±0.1% СаО)± Эвтектика. 30.3
±жидкость Н.
Р a-СаО-Р20Б твердый раствор (У (29.2+ Полиморфное превращение. 30.0 70.0 968 ±1
+0.3% СаО)±р-СаО-Р2ОБ твердый раст- вор Р (30.0 ±0.5% СаО)±трёмелит W
(32.2+0.2% СаО). 985 ±1
I Трёмелит (35.5% СаО)±0-2СаО-Р2ОБ твер- Реакция. 30.7 69.3
дый раствор I" (42.0 ±0.3% СаО)±жид- кость I.
J а-2СаО • Р»ОБ твердый раствор 7" (43.5% СаО)+р-2СаО-Р2ОБ твердый раствор J' Полиморфное превращение. , 34.9 65.1 1157 ±2
(43.0 ±0.2% СаО)±жидкость J. 915 ±5
V Р-2СаО-Р2ОБ твердый раствор Q (около 34% СаО)±р-2СаО-Р2ОБ твердый раствор Реакция в твердом состоянии. 37.1 62.9
Т (40.8% СаО)±трёмелит V.
2R * Положение точки М на рисунках не показано.
‘С
2000 -
1800
1600
1400
1200
т
800
600
а.-ЗСаОР2О5
“Л1
Жидк.
CaO^Og
f-2CaOP2O5
Са
«3_
"§
/ ж
4СаОР^Ж
-4Ca0-J>205
a-3CaOfyO5
p-3Ca0P205
а-2Са0Р205
р-ЗСаОРгО5
+ Ж
а-2Са0-Р205
_ р-2Са0 Р205+Ж *Ж
р-СаО-^Ж
- 2СаО-3$ОрЖ
Са0-2Рг0к
-*ж 25
Р2^Ж
of" (S’
а*»
сЬ
«з,
СаО
4Са0Р205
400
CaO2PzOs Q
PW i 5
О 10 ,
рг°5 CaO-2fyOs
<3
Са^
а Са
' с*«\
са
и
20 30 40 50 60 70 80
СаО
2Са0-ЗР205
Рис. 465. Диаграмма состояния системы
СаО—РаО5, полученная путем объединения
диаграмм Трёмеля и Хилла, Фауста и
Рейнольдса.
С?.С2Р,О5 2Са0-3%05
Pg05 Вес.% СаО
Рис. 466. Диаграмма состояния
части системы Р2О5—2СаО P2OS
(от 0 до 23 вес. % СаО).
Рис. 467. Диаграмма состо- яния части системы РаО5— —2С.яП . Р.П. 1т 2.3 пл 44 4 /&-2СаОР2О5/ /а-2Са0Р20а^ж\ 1200 - /а-ир-2Са0Рг05 ; (/ т Р' \ /4 1100- /р-2СаОР2О5т.р+Ж I 1а-Са0Р205*трёмелит / агСа-ОРО. а~+аж'?г°Ч / Трёмелит*Ж / то - Jg„/z/ / Г Г < g 900 - L p„n n n‘P205,nP- \ V /Г CaO P2fy,Tpeugnum+B-CaO-ROg Д J т.рлж \?-Са0№ 'mP- £ m-P- p-Ca0-P205m.p* , m\ , Л р-гс^о-р^т-р. i 25 / 30 35 \ 90 /95 CaO P,Of 7СаО-5Р,О,илиЗСаО2Р2О. PCaOMk
X 2V8 \V4 «V rAV/ -XX.X О ч вес. % СаО). P205 °C 990 r I $ I [З-ЗСаОРгОэт-р.+Ж /Т\ 1 I'h 980 -0"\ a-CaO-ROg _ . w /\ т.р+Ж / Трёиелит^Ж / \ ' г 1 «I /0^'^\/1' ИА a-Oa0 P20sm.p. | 3/. / X \ +трё'мелит । 960 ' ^ЛСра0 Рг^-^\ 1 Трё'мелит . । \+трёме\ 1 . \ лит \ | 950 - 1 p~CaO P2Osm.p. \ \ । : \ \ .1 । । । । J । i i u 28 \ 30 32 39 36 Р205 CaOP2Os Bec7ii CaO Bec.7. Ca0 Рис. 468 . Диаграмма состо- яния части системы СаО — —2СаО-Р2О5 (область кри- сталлизации метафосфата кальция и трёмелита).
32 Н. А. Торопов и др., кн. 1
498
Фосфатные системы
участок от 2СаО-Р2О6 до 65 вес.% СаО — в работе Трёмеля и
Фикса [5] и Уэлча и Гатта [6].
На рис. 465 приводится общая диаграмма состояния системы
СаО—Р2О6, полученная путем объединения диаграмм Хилла
с сотрудниками [11 и Трёмеля [3]. На рис. 466—468 приведены
Рис. 469. Диаграмма состояния части системы
СаО—РаО8 (от 40 до 65 вес. % СаО).
1 — данные Фауста, Хилла и Рейнольдса; г — тер-
мический анализ; 3 — плавление в условиях насы-
щения; 4 — нагревательный микроскоп; s —
спекание и плавление.
некоторые детализированные участки ее из работы Хилла с сотруд-
никами, на рис. 469 — из работы Трёмеля и Фикса [5].
Соединение ЗСаО*Р2ОБ плавится без разложения при тем-
пературе 1810°. Соединение 4СаО-Р2ОБ плавится с разложением
на СаО и жидкость при температуре 1710°.
Большой интерес представляет фаза переменного состава,
названная трёмелитом. Она кристаллизуется в интервале кон-
центраций от 32 до 37 вес.% СаО. Температурные пределы устой-
чивости лежат между 985°, выше которой она плавится инкон-
груэнтно, и 915°, ниже которой она является^метастабидьной.
Фосфатные системы
499
Таблица 2
Кристаллические фазы системы СаО—P2OS
Соединение Оптический характер 2°V Дву- пре- ломле- ние Показатель преломления Показа- тель пре- ломления стекла
Ng Nm №
а-2СаО-Р2О5. Двуосный (—). 50 0.021 1.605 1.599 1.584 1.594
₽-2СаО-Р2ОБ. Одноосный (+). 0 0.009 1.639 __ 1.630 1.594
Трёмелит. Двуосный (-j-). Двуосный (—). 88 0.021 1.605 1.594 1.584 1.560
a-CaO-P2Os. Око- ло 90 0.008 1.595 1.591 1.587 1.544
₽-СаО.Р2Ов То же. 80 0.023 1.596 1.587 1.573 1.544
2СаО-ЗР2ОБ. » » 23 0.036 1.513 1.511 1.477 1.523
CaO.P2Os. » » 15 0.029 1.499 1.497 1.470 1.507
Р2ОБ (тетрагональ- ный?). Вероятно, од- ноосный (+). 0 0.025 1.624 — 1.599 1.518
Р2ОБ (ромбический). Двуосный (—). 65 0.044 1.589 1.578 1.545 1.51
Р2ОБ (гексагональ- ный). Одноосный (-)-). 0 0.002 1.471 — 1.469 1.51
Трёмель и Фикс некоторые
в условиях насыщения. Здесь
точки получали путем плавления
применяется тигель, изготовлен-
'С
Рис. 470. Диаграмма состояния
части системы СаО—Р2О5 (по
Уэлчу и Гатту).
1 — определенные оптическими ме-
тодами температуры а—а'-превра-
щения твердых растворов на основе
3CaO-PtO5; 2— температуры на-
чала образования жидкости; з —
точки, для которых определения
производились на закаленных об»
разцах с помощью рентгеновской
камеры Гинье; 4 — температуры
ликвидуса. Штриховые линии —
пограничные кривые, проведенные
произвольно.
СаО ,4
1300
1700
1500
1355°
1300
Жидк.
. и, 1777°„w
к-С3Рт.р.*Ж
а-С3Рт.р.
СцР+СаО
1125°
Ptn.p* CifP
1Z87~
а.-Ы> *а-С,Рг,
СаО*Ж
1720°
1580*
a-C3Pm.p*C^>
1430°
р-С3Р*а.-С3Ртр
goo P'C7P^~C3PmP
СгР45
Ж
a-i
а-С3Рт.р*Ж^^
а-С,Р*Ж
1100
50
a-C3Pm.p&'
-Sp_________। I ।
C3P 55 60 CtfP 65 C5P
Р2°5 Вес.% СаО
• 3 о 4
ный из того же вещества, которым должен насыщаться расплав,
например из трикальцийфосфата или тетракальцийфосфата.
32*
500
Фосфатные системы
Нёрс, Уэлч и Гатт [2], а затем и Трёмель и Фикс, кроме а-
и ^-модификаций ЗСаО-Р2ОБ с переходом при 1110°, обнаружили
новую, устойчивую выше 1470° модификацию, которая названа
«супер a-модификацией». Уэлч и Гатт [6] обнаружили твердые
растворы между ЗСаО-Р2ОБ и 2СаО-Р2ОБ (рис. 470).
Литература
1. Н i 1 1 W. L., R. F a u з t, D. S. R е у п о 1 d s, Amer. Journ. Sci.,
242, № 9, 447, 1944.
2. N u г s е R. W., J. H. W e 1 c h, W. G u t t, Nature, 182, № 4644, 1230,
1958.
3. T r 6 m e 1 G., Stahl u. Eisen, 63, № 1, 21, 1943. •
4. Tromel G., H.-J. H a r k о r t, W. Hotop, Zs. anorgan. allgem.
Chem., 256, № 5—6, 253, 1943.
5. Tromel G., W. Fix, Arch. Eisenhiittenw., 32, № 4, 209, 1961.
6. W e 1 c h J. H., W. G u 11, Journ. Chem. Soc. (London), № 10, 4442,
1961.
ZnO—P 2ОБ
Интересна для приготовления люминесцентных материалов.
Изучена Катнаком и Гюммелем [3] на воздухе в пределах
между ZnO и Zn(PO3)2. Установлено три конгруэнтно плавящихся
°C
1100
1000
900
800
700
600
Zn0+a-Zn3(P04)2
/3-2-7
P~Zn2P2°7
p-Zn(P03)2
О 10 20 30 90 ' 50 60
z™ вес.7, ' p2°5
Рис. 471. Диаграмма состояния системы
ZnO—Zn(PO3)2.
соединения: 1) ортофос-
фат Zn3(PO4)2, испытывает
полиморфное р -> а-пре-
вращение при 942° и пла-
вится при 1060 +8°; 2) пи-
рофосфат Zn2P2O7, с обра-
тимым превращением при
132° и плавлением при
1017°; 3) метафосфат
Zn(PO3)2, испытывает необ-
ратимое превращение меж-
ду ^600 и 700° в зависи-
мости от скорости нагре-
вания образца, плавится
при 872°.
Низкотемпературная
форма не может быть'полу-
чена нагреванием закаленной^высокотемпературной формы на возду-
хе, но стекло метафосфатного*состава при нагревании'при 550° в те-
чение 16 час. дает смесь из низко- и высокотемпературных форм.
Диаграмма состояния приводится на рис. 471, а на рис. 472 дается
ее часть в увеличенном виде для участка Zn3(PO4)2—Zn(PO3)2
Фосфатные системы
501
(порядок обозначения модификаций авторами дается обратный
общепринятому, по которому через а обозначается высокотем-
пературная модификация, а через р — более низкотемпературная).
Эвтектика между ZnO и Zn3(PO4)2 лежит при 1005° и 66% ZnO.
Эвтектика между Zn3(PO4)2 и Zn2P2O7 плавится при 972° и 57%
ZnO, эвтектика Zn2P2O7—Zn(PO3)2 — при 832° и примерно 39%
ZnO.
На рис. 473 приводятся показатели преломления цинково-
фосфатных стекол, измеренные в натровом свете.
Пять кристаллических модификаций фосфатов цинка дают
двуосную интерференционную фи-
гуру, а высоко- и низкотемпе-
ратурные формы Zn3(PO4)2 под
микроскопом имеют значительное
Рис. 472. Часть диаграммы
состояния системы ZnO—
—P2OS в увеличенном мас-
штабе.
ZnO Вес.% РА
Рис. 473. Показатель свето-
преломления цинково-фосфат-
ных стекол.
сходство, поэтому идентификация фаз в системе проводилась
рентгенографическим методом.
Кальво [2] произвел рентгеноструктурное исследование вы-
сокотемпературной модификации пирофосфата цинка (3-Zn2P2O7.
Это соединение образует кристаллы с пространственной груп-
пой С2!т и со следующими параметрами элементарной ячейки:
а=6.61+0.01, 5=8.29+0.01, с=4.51+0.01 А, (3=105.4+0.2°,
Z=2.
Лазарев, Тенишева и Петрова [1] методом ИК-спектроскопии
показали, что полиморфное превращение Zn2P2O7 сводится к пе-
реходу от изогнутой к распрямленной конфигурации групп Р2О7
и обусловлено гибкостью мостиков.
502
Фосфатные системы
Литература
1. Лазарев А. Н., Т. Ф. Т е н е ш е в а, М. А. Петрова, Изв.
АН СССР, неорг. матер., 1, № 8, 1379, 1965.
2. С а 1 v о С., Canad. Journ. Chem., 43, № 5, 1147, 1965.
3. К a t п а с к F. L., F. A. Hummel, Journ. Electrochem. Soc., 105,
№ 3, 125, 1958.
CdO-P205
Имеет значение для технологии люминесцентных материалов.
Изучена Брауном и Гюммелем [1]. Установлено существо-
вание четырех фосфатов кадмия: Cd(POs)2, Cd2P2O7, Cds(PO4)2
и Cd4P2Oe (рис. 474). Соединение Cd4P2O8 устойчиво на воздухе
Рис. 474. Равновесная фазовая диаграмма системы
CdO-CdOP2O5.
до 1000° и выше этой температуры диссоциирует на CdO (пар) и
Cd3(PO4)2. Другие фосфаты кадмия не диссоциируют и не испа-
ряются до температуры плавления. Соединение Cd4P2O8 изострук-
турно Са4Р2Ов.
Литература
1. В г о w n J. J., F. А. Н u m m е 1, Journ. Electrochem. Soc., Ill, № 9,
1052, 1964.
Фосфатные системы
503
BjOj--Р2ОВ
В системе обнаружено одно соединение ВРО4, синтезированное
Хорном и Гюммелем [2]. Фосфат бора, вероятно, существует
в нескольких модификациях. Кварцевая модификация ВРО4
получена Дэхиллом и Дент-Глассер [1], применявшими давле-
ние до 50 000 бар (350—600°).
Элементарная ячейка ВРО4 содержит три молекулы и имеет
параметры: а=4.470 ±0.005, с=9.926±0.01 А, с/а=2.2. Пока-
затели светопреломления: Ng=l.647±0.002, Ар=1.639±0.002.
Литература
1. Dachille F., L. S. D е n t Glasser, Acta crystallogr., 12, № 10,
820, 1959.
2. H о r n W. F., F. A. H u m m e 1, Journ. Soc. Glass Technol., 39, № 187,
113, 1955.
A12O3—
Фосфаты алюминия — новый вид керамических материалов.
Фазы системы интересны в качестве кристаллохимических ана-
логов кремнезема.
Систему изучали Стоун, Иган и Лер [2] в области 20—
—30 вес. % А12О3. Обнаружено два соединения: А12О3 «Р2Ов и А12О3 •
• ЗР2ОВ. Температура плавления А12О3-ЗР2ОВ могла быть опре-
делена только экстраполяцией кривой плавления и принимается
равной 1490 ±5°. Соединение А12О3-ЗР2О5 интенсивно разла-
гается выше 1100°. Эвтектика между А12О3-ЗР2ОВ и А12О3-Р2ОВ
имеет состав 28£вес. % А12О3 и температуру плавления 1212°.
Кристаллические фазы системы А12О3— Р2ОВ (по сводке Стоуна, Игана
и Лера [2])
Соединение Кристалли- ческая система Опти- ческий харак- тер 2уо Дву- пре- ломле- ние Показатели свето- преломления
Ng Nm Np
А12Оя - Р2ОВ (форма Гексаго- (+) 0 0;006 1.530 — 1.524
₽-кварца). А1й03 - РЙОВ (форма кри- нальная. Кубиче- — — — — 1.474
стобелита). А1,ОЯ • Р20к (форма три- ская. То же. — — — — 1.461
димита). А12О3 • ЗР 2ОВ. » » — — — — 1.545
504
Фосфатные системы
Наиболее детально изучен ортофосфат алюминия А1РО4,
являющийся моделью кремнезема SiO2. А1РО4 — единственное
модельное соединение, обнаруживающее все три модификации,
соответствующие кварцу, тридимиту и кристобалиту.
Согласно работе Флёрке и Лахенмайра [1], кварце-
подобная фаза А1РО4 имеет полиморфное превращение при 580°,
тридимитоподобная при 90° и кристобалитоподобная при 220°.
Литература
1. F 1 о г к е О. W., Н. Lachenmavr, Вег. Dtsch. keram. Ges., 39,
№ 1, 55, 1962.
2. S t о n e P. F., E. P. E g a n, J. R. Lehr, Journ. Amer. Ceram. Soc.,
39, № 3, 89, 1956.
Ga2O3—P SO6
Диаграмма состояния системы не изучена. Установлено на-
личие одного соединения GaPO4.
Перлоф [1] изучил полиморфизм GaPO4, полученного гидро-
термальным методом (200—300°). GaPO4 имеет три полиморфные
формы: типа низкотемпературного кварца (тип берлинита), типа
низкотемпературного кристобалита, типа высокотемпературного
кристобалита.
Для кристаллических форм GaPO4 получены следующие пара-
метры решетки: тип низкотемпературного кварца (гексагональ-
ный), а=4.917, с=2х5.55 А; тип низкотемпературного кристо-
балита (тетрагональный), а=4.92, с=6.87 А; тип высокотемпе-
ратурного кристобалита (кубический), а=7.16 А (при 1200°).
GaPO4 не обнаруживает модификаций типа высокотемператур-
ного кварца и тридимита.
Литература
1. Perloff A., Joum. Amer. Ceram. Soc., 39, № 3, 83, 1956.
EuO—Р2ОБ
Система не изучена. Шефер [1 ] путем твердофазовых реак-
ций получил два соединения: Еи3(РО4)2 ромбической сингонии;
Еи2Р2О7 тетрагональной сингонии. Оба соединения обладают
ферромагнитными свойствами с точками Кюри соответственно
при 5 и 3° К.
Литература
1. Shafer М. W., Joum. Appl. Phys., 36, № 3, pt. 2, 1145, 1965.
Фосфатные системы
505
РЬО—Р2О8
Систему, интересную для физико-химии свинцовых силико-
фосфатных стекол, в области составов 0—40 мол.% Р2О8 иссле-
°С
1000
900
800
' 700
300
200
0 5 10 15 20 25 30 35 00
рЬ° Мол. 7о РА
Рис. 475. Диаграмма состояния системы
РЬО-Р2О8.
Инвариантные точки системы РЬО—Р2О5
Точка Фазы Процесс Состав, мол. % Темпера- тура, °C
РЬО Р2ОВ
1 РЬ0-|-8РЬ0-Р2О64-жид- кость. Эвтектика. 93.5 6.5 818
2 8РЬ0 • Р20.4-жидкость. Плавление. 88.9 11.1 —850
3 8РЬО.Р2О6+4РЬО.Р2О5+ 4-жидкость. Эвтектика. 86.8 13.2 840
4 4РЬ0 Р2О84-жидкость. Плавление. 80.0 20.0 —975
5 4РЬ0 • PjOs+ЗРЬО- РаО8+ 4-жидкость. Эвтектика. 78.3 21.7 957
6 ЗРЬО • Р2О64-жидкость. Плавление. 75.0 25.0 1014
7 ЗРЬО • Р2Ов4-5РЬО • 2Р2О84- 4-жидкость. Эвтектика. 72.0 28.0 940
8 5РЬ0 • 2Р2О84-жидкость. Плавление. 71.4 28.6 —950
9 5РЬО-2Р2О84-2РЬО- Р2О84- 4-жидкость. Эвтектика. 67.0 33.0 820
10 2РЬ0 • Р2О84-жидкость. Плавление. 66.7 33.3 —830
Примечание. Таблица составлена по данным рисунка. У Петча и Дитцеля
температуры эвтектики для точек 1, 3, 5, 7, и 9 даны соответственно: 815, 838 , 954, 942,
835°; температуры плавления соединений не приводятся.
506
Фосфатные системы
довали Петч и Дитцель [1]. В указанной области установлено
существование следующих химических соединений: 8РЬО«Р2О6,
4PbO.PsOs, 3PbOP2Os, 5PbO-2PsOs и 2РЬОР2О8 (рис. 475).
Соединение 8PbO-P2Os, отличающееся очень высоким свето-
преломлением, плавится приблизительно при 850°. Соединение
4PbO-P2Og с кристаллами игольчатого габитуса и температурой
плавления 975° имеет две полиморфные модификации с темпе-
ратурой перехода 256°. Соединение ЗРЬО-Р2О6 с температурой
плавления 1014° имеет две полиморфные модификации с тем-
пературой перехода 171°. Получаемые медленным охлаждением
расплава кристаллы имеют гексагонально-призматический га-
битус, одноосные, оптически отрицательные, с показателями све-
топреломления: Ng= 1.970, Np=1.934. Плотность 7.220 г/см3
(низкотемпературная модификация).
Ли тература
1. Р а е t s с h Н. Н., A. D 1 е t l е 1, Glasstechn. Вег., 29, № 9, 345, 1956.
TiO2—Р2О8
Интересна для технологии стекла и керамики.
Образующиеся в системе соединения изучались Леви и Пей-
ронелем [2] и Гаррисоном и Гюммелем [1]. По Леви и Пейронелю,
соединение TiP2O7 кубической сингонии, ао=7.8О А; вычисленная
плотность 3.106 г/см3.
Рис. 476. Кривые расширения соединений
TiOa*P2Os и 5TiOa*2PjO5.
Гаррисон и Гюммель изучили участок системы от соединения
TiO2-Р2О6 (TiP2O7) до 100% TiO2 и установили наличие двух
соединений — TiP2O7 и Ti6P4O20(5TiO2 -2P2Og), условно обозна-
чаемых 1 : 1 и 5 : 2.
Фосфатные системы
507
Кристаллы ТЮ2-Р2ОБ получены нагреванием смеси окислов
в интервале от 1000 до 1400°. Двупреломление слабое, средний
показатель преломления примерно равен 1.88. В статье приводятся
межплоскостные расстояния. Кривая ликвидуса резко падает
от соединения 1:1 по направлению к низкотемпературному
участку около соединения 5 : 2. При нагревании 1 : 1 в интер-
вале 1400—1520° идет процесс улетучивания Р2О6 и образования
жидкой фазы, однако при очень резком нагревании до 1520°
соединение вначале полностью расплавляется, а затем разла-
гается.
Соединение 5 : 2 плавится конгруэнтно при 1260 ±3°. Обла-
дает высоким двупреломлением (интерференционная окраска вто-
рого и третьего порядков) и средним показателем преломле-
ния 1.97.
Кривые расширения соединений 1:1 и 5 : 2 приводятся на
рис. 476.
По обе стороны 5 : 2 имеются две эвтектики с температурой
плавления примерно 1250°: 1) эвтектика между 5 : 2 и рутилом
имеет, возможно, состав 3:1; 2) вторая эвтектика располагается
между молекулярными отношениями TiO2 : P2Og=9 :4 и
2 : 1.
Стекла в интервале 5 : 2 низкоплавкие (между 53 и 65 вес.%
TiO2). Полученные плавкой при 1300° стекла коричневого цвета
имели относительно высокую абсорбцию инфракрасных лучей
в интервале 8—10 мк.
Литература
1. Harrison D. Е., Hummel F. A., Journ. Amer. Ceram. Soc., 42,
№ 10, 487, 1959.
2. Levi I. R., Peyronel G., Zs. Kristallogr., 92, № 3/4, 190, 1935.
MnO—P2O6
Изучена Пирсоном, Тэркдоганом и Фенном [1] в интервале
концентраций от 59.7 (т. е. соединения Мп3Р2О8) до 68.95 вес.%
МпО. Применялся метод термического анализа в атмосфере азота.
508
Фосфатные системы
Система МпО—Мп3Р2О8 является простой эвтектической
(рис. 477). Эвтектика содержит приблизительно 64—65 вес.% МпО
и имеет температуру плавления 1044°.
Р2°-> МОЛ. Vo Мп0
Рис. 477. Диаграмма состояния
системы |МнО—ЗМнО • Р2О5.
Литература
1. Pearson J., Е. Т. Т u г k d о g a n, Е. М. F е n n, Joum. Iron a. Steel
Inst., 176,J№ 4, 441, 1954.
Fe2O3—P 2Og
Интересна для теории металлургического передела фосфори-
стых железняков^типа руд Керченского полуострова.
Система изучена Вентрупом [1] в области~составов (рис. 478),
содержащих три соединения: 2Fe1O3-P1Oi, Fe2O3-P2Og и 2Fe2O3-
Рис. 478. Диаграмма
состояния системы
Fe2O3 — P20g.
Фосфатные системы
509
• ЗР2ОБ. Эти соединения имеют полиморфные превращения:
2Fe2O3-P2O2 при 869°, Fe2O3-P2O2 при 889 и 784°, 2Fe2O3-3P2O6
при 865°.
Литература
1. Went г u р Н., Arch. Eisenhiittenw., 9, № 1, 57, 1935—1936.
СоО—Р 2ОБ
Система изучена Сарвером [1] в концентрационной области
от 50 до 100 мол. % СоО методом дифференциального термического
анализа. Установлено образование трех соединений: Со(РО3)2,
Со2Р2О7 и Со3(РО4)2 (рис. 479). Метафосфат кобальта Со(РО3)2
плавится конгруэнтно при 1105°. Пирофосфат Со2Р2О7 плавится
Рис. 479. Диаграмма состоя-
ния системы СоО—Р2О8
(по Сарверу).
конгруэнтно при 1240° и претерпевает^фазовое превращение
при 304°, аналогичное превращению Mg2P2O7. Высокотемпера-
турная форма не может быть закалена охлаждением до комнат-
ной температуры. Ортофосфат кобальта Co^POJj плавится кон-
груэнтно при 1160°. Кристаллы этого соединения с моноклинной
сингонией имеют параметры элементарной ячейки: а=7.557,
5=8.365, с=5.067 А, 0=94.05°.
Литература
1. Sarver J. F., Trans. Brit. Ceram. Soc., 65, № 4, 191, 1966.
510
Фосфатные системы
NiO—Р2О6
Система изучена Сарвером [1 ] в концентрационной области
от 50 до 100 мол.% NiO методом дифференциального термического
анализа. Установлено образование трех соединений: Ni(PO3)s,
Рис. 480. Диаграмма состоя-
ния части системы N1O—Р2О6.
NijPjO7 и Ni3(PO4)s, плавящихся конгруэнтно соответственно
при 1280, 1395 и 1350° (рис. 480). Для пирофосфата никеля об-
наружено полиморфное превращение при 575 ±5°. Высокотем-
пературная форма не могла быть получена при комнатной тем-
пературе закалкой.
Литература
1. Sarver J. F., Trans. Brit. Ceram. Soc., 65, № 4, 191, 1966.
ВАНАДАТНЫЕ СИСТЕМЫ
LijO—V 2О3
Система изучалась Каннери [1], Кольмюллером и Марти-
ном [2] и Рейзманом и Минео [3] На рис. 481 изображена мета-
стабильная система Li2O—V2O6 по Рейзману и Минео, причем
область от 100 до 25 мол. % V2O5 представляет равновесие между
LisO и V2Og, а в области от 25 до 0 мол. % V2O5 карбонат Li2CO3
при давлении воздуха, равном 1 атм., присутствует как псевдо-
бинарный компонент, и этот интервал можно рассматривать как
систему ЗЫ2О-¥2О2—Li2CO8.
Инвариантные точки метастабильной системы Ы2О (или Ы2СО3)—V2OS
Точка Фазы Процесс Состав, мол. % Темпе- рату- ра, СС
Ы20 (или Ы,СО3) V2O5
1 VaOs4-жидкость. Плавление. 0 100 674
2 V.Os-j-2Li ,0- 5V2Oe+жидкость. 2Li2O • 5V2Os+жидкость. Эвтектика. 22.5 77.5 591
3 Конгруэнтное пла- вление. 28.5 71.5 603
4 2Li2Oe bVaOg-f" ^2^* жид- кость. Эвтектика. 41 59 560
5 Li2O. V2Os4-жидкость. Конгруэнтное пла- вление. 50 50 616
6 bi2O • VgOg-f- 6-3Li2O • V^Og-p +жидкость. Эвтектика. 45 55 592
7 a-3Li2O- V2OS-|-жидкость. Конгруэнтное пла- вление. 75 25 1152
8 8-3LiaO. V2O6+Y-3Li2O. V2O5. Полиморфное пре- вращение. 75 25 724
9 y-3Li2O. V2O6+₽-3Li2O • V2O5. P-3Li2O-V2O5+a-3Li„O. V2O5. То же. 75 25 773
10 » » 75 25 1036
И S-3Li2O-V2O6+ а-Ь12СО34-жид- кость. Эвтектика. 99 1 707
12 o-Li2COg-l-P-Li2COg. Полиморфное пре- вращение. 100 — 410
Рис. 481. Диаграмма состояния системы
LiaO—VjOg (метастабильная система).
Рис. 482. Предполагаемая стабильная
равновесная диаграмма состояния си-
стемы LijO—V2O5.
513
Ванадатные системы
Рентгеновским анализом в этой области обнаружено три кон-
груэнтно плавящихся соединения: 2Li2O-5V2OB, Li2O-V2OB и
3Li2O • V2OB. Инвариантные точки в метастабильной системе
Li2O (или Li2COs)—V2OB приведены в таблице.
На рис. 482 изображена, по Рейзману и Минео, предполагае-
мая стабильная равновесная диаграмма системы Li2O V2O6
О 4 8 12 16 20 24 28 32 36
Мол.7°
Рис. 483. Плотность химических соединений
в системе Li2O—V2O5.
в области 100—50 мол. % V2OB. Она характеризуется в отличие
от диаграммы рис. 481 наличием инкогруэнтно плавящегося
соединения 2Li2O-17V2OB (89.5 мол. % V2OB, 621°), а соединение
2Li2O-5V2OB (71.4 мол.%) показано на ней также как инконгру-
энтно плавящееся при 601°.
Штриховой кривой на рис. 482 нанесена эвтектика между
V2OB и 2Li2O-5V2OB при 591°. Диаграмма значений плотности
для стабильной системы Li2O—V2Og (0—36 мол.% Li20) пред-
ставлена на рис. 483.
Литература
1. Саппе г i G., Gazz. chim. Ital., 58, 6, 1928.
2. Kohlmiiller R., J. Martin, Bull. Soc. chim. France, № 4, 748,
1961.
3. R e i s m a n A., J. M i n e o, Journ. Phys. Chem., 66, № 6, 1181, 1962.
Na2O—V2OB
Исследование этой системы ограничилось областью от V2OB
до NaVO3. Флуд и Сорум [2] при кристаллизации расплавов
обнаружили выделение кислорода, что объяснили переходом
пятивалентного ванадия в четырехвалентный. Ими получено два
соединения, которым приписываются формулы: Na2O •V2O4-5V2OS
33 н. А. Торопов и др., кн. 1
514
Ванадатные системы
(P-фаза) и 5Na2O-V2O4»llV2OB (f-фаза). Представленная на
рис. 484 диаграмма, учитывая различное валентное состояние
ванадия, не может рассматриваться как строго бинарная.
Илларионов с сотрудниками [1] пользовались термическим
методом. Диаграмма состояния системы NaVO3—V2OB по их
данным представлена на рис. 485. Установлено образование
двух конгруэнтно плавящихся соединений, которые также обоз-
начаются р- и f-фазами. р-Фаза, плавящаяся при 738°, содержит
пяти- и четырехвалентный ванадий и может быть представлена
Рис. 484. Схематическая диаграм-
ма фазовых отношений в системе
VjO5— NaVO3 (по Флуду).
Рис. 485. Диаграмма состояния си-
стемы NaVOg—VaO5 (по Илларионову
с сотрудниками).
формулой Na0 33V2O5. Это соединение относится к классу натрий-
ванадиевых бронз и образуется по реакции Na2O+6V2OB=
= 6Na0 33У2Ов-|—2-О2. Для Na033V2OB характерна некоторая область
гомогенности. Природу второго соединения, f-фазы, авторы
не смогли окончательно установить и отмечают, что, возможно,
это не вторая натрий-ванадиевая бронза, а поливанадат натрия.
Флуд и Сорум приписывают р- и f-фазам значительные области
гомогенности, а также указывают на образование твердых раст-
воров на основе V2OB и NaVO3. Пользуясь более совершенной
рентгеновской аппаратурой, Илларионов с сотрудниками не об-
наружили никаких изменений в размерах элементарных ячеек
V2O5 и NaVO3 при добавлении соответственно Na2O и V2OB.
Эвтектика между V2OB и P-фазой плавится при 655° и содер-
жит 6.5 мол.% NaVO3. Положение эвтектической точки между Р-
Ванадатные системы
515
и ^-фазами соответствует содержанию 58 мол.% NaVO3. Эвтектика
между f-фазой и метаванадатом содержит 83 мол.% NaVO3.
Литература
1. Илларионов В. В., Р. П. Озеров, Е. В. Кильдишева,
Журн. неорг. хим., 2, № 4, 883, 1957.
2. F1 о о d Н., Н. S о г u m, Tidskr. Kjemi Bergvesen Met., 3, №5, 55,
1943.
k2o-v2o,
Система интересна в связи с большой каталитической актив-
ностью поливанадатов калия.
Диаграмма состояния части этой системы, а именно KVO3—
—V2O5, (рис. 486) термографически и рентгенографически изучена
Илларионовым, Озеровым и Кильдишевой [2], согласно которым
в системе существует два поливанадата: 1) стабильный октава-
Инвариантные точки системы К2О (или К2СО3)—VaO5
Точка Фазы Процесс Состав, мол. % Темпе-
К,О (или К,СО,) v,os
1 УаО4±жидкость. Плавление. 0 100 674 ±5
2 КаО- 4У2О4±жидкость. Инконгруэнтное плавление. 20 80 520
3 К2О • 4VaO»+ К2О • V2O»+ 4-жидкость. Эвтектика. 39 61 390
4 К2О • УаО4±жидкость. Конгруэнтное пла- вление. 50 50 520
5 К2О-V2O4±16K2O- 9VaO»+ 4-жидкость. Эвтектика. 52.9 47.1 500
6 16KaO.9VaOs+P-2KaO- • У2О4+жидкость. Перитектика. 60.4 39.6 696
7 Р-2Ка0 • V2O4±a-K2O • V2O4 • Полиморфное пре- 66.67 33.33 740
8 а-2КаО • У2О4+жидкость. Конгруэнтное пла- вление. 66.67 33.33 910
9 а-2КаО • V2O4±3KaO • VaO4+ 4-жидкость. Эвтектика. 69 31 884
10 ЗКаО • У2О4±жидкость. Конгруэнтное пла- вление. 75 КаСОа 25 1300± ±20
И ЗК2О- VaOj-^KgCOj)--}- жид- кость. Эвтектика. 89 касоа И 818
12 КаСО2±жидкость. Плавление. 10б — 891
33*
516
Ванадатные системы
надат K2O-4V2OB зеленого цвета, плавящийся без разложения
при 540+3°, который с V2OB образует эвтектику с температурой
528° и составом 0.66 мол. долей V2OB; 2) пентаванадат 2K2O-5V2OB
малинового цвета, плавящийся с разложением на октованадат
и жидкость при 488 +0.3°. Последний с KVO3 образует эвтектику
при 389° и составе 0.225 мол. долей V2OB.
Установлен также образующийся при различных условиях
охлаждения один ванадико-ванадат (ванадито-ванадат) калия
примерного состава К2О -5V2OB (соединение переменного
состава с колебанием содержания компонентов в узком пределе),
Рис. 486. Диаграмма состояния системы
KVO3—V2O5 (по Илларионову, Озерову
и Кильдишевой).
це. На рис. 487 область от 0 до
обладающий моноклинной
кристаллической решеткой:
цвет черный с синеватым ме-
таллическим блеском, длин-
ные иглы, не растворимые в
воде при кипячении в отли-
чие от ванадатов калия. По
данным Гольцберга, Рей-
змана, Берри и Беркенбли-
та [4], в системе К2О или
К2СО3—V2OB (рис. 487)
существует пять соедине-
ний: K2O-4V2OB, K2O-V2Ob,
16K2O.9V2O„ 2K2O-V2Ob и
3K2O-V2OB.
Соединение IV испыты-
вает a -► ^-превращение при
740°. Инвариантные точки в
системе К2О(или К2СО3)—
—V2OB приведены в табли-
75 мол. % К2СО3 предста-
вляет равновесие между К2О и V2OB, а в области свыше 75 мол. %
одним из компонентов является К2СО3. При переходе от одной
области к другой разрыва нет, так как К2О и К2СО3 эквивалентны.
Келмерс [5], изучавший соединения в системе KVO3—V2OB,
проводя плавку и кристаллизацию в атмосфере кислорода,
получил два поливанадата, для которых приводит формулы:
K3VbO14=3K2O-5V2Ob и K2V8O21=K2O.4V2Ob.
Фотиев с сотрудниками [3] изучили область, ограниченную
составами KVO3 и V2OB, осуществляя кристаллизацию соответ-
ствующих расплавов в условиях медленного охлаждения (15—
—20 час.). В указанном интервале концентраций образуются че-
тыре химических соединения: два из них — KV6O1B (a-фаза)
и KV4O10 J.J. ([3-фаза) — содержат четырехвалентный ванадий и
относятся к классу ванадиевых бронз; соединения KV3O8
Ванадатные системы
517
(Т-фаза) и KV2O55 (8-фаза) представляют поливанадаты. Схемати-
ческая диаграмма состояния системы KVO3—V2O5 приведена
на рис. 488.
а-Фаза обнаруживалась только при условии кристаллизации
в определенном участке температур (вблизи 500°) и при низких
температурах не получалась. Для фазы р предлагается формула
KV4O10 ъ_х, что указывает на переменный состав этого соединения.
Максимальное содержание V2O4 в p-фазе составляет 2.05%.
VZ°5
Кг0
кгсо3
Рис. 487. Диаграмма состояния системы К2О—V2OS (по Гольдбергу,
Рейзману, Берри и Беркенблиту).
Келмерс [5] при проведении опытов в атмосфере азота также
получал две фазы, содержащие V2O4 (ванадиевые бронзы). Для
более богатого ванадием соединения предлагается формула
KVeO15=K2O»V2O4-5V2O5. Состав второй ванадиевой бронзы
Келмерс не смог установить.
Поливанадат KV3O8=K2O»3V2O5 получен Фотиевым в виде
пластинчатых моноклинных кристаллов, окрашенных в красно-
желтый цвет. Оптический знак отрицательный; 2К=36—37°,
#g=2.40, Мп=2.34, #р=1.805.
8-Фаза имеет некоторую область гомогенности на основе сое-
динения KV2O5 Б=К2О-2V2O5. Область однородности, по данным
оптического анализа, находится в пределах 32.5—35.Q мол. %
518
Ванадатные системы
К20. Под микроскопом, на столике Федорова, вещество прояв-
ляет себя как одноосный кристалл, и его следует отнести к одной
из сингоний среднего класса.
Глазырин и Фотиев [1 ] определили кристаллооптические свой-
ства ванадатов калия. Кристалл KVO3 оптически двуосный,
положительный, 2У=(+)66°, #£=1.902, #тп=1.800, #р=1.760,
Рис. 488. Схематическая диаграмма
состояния системы KVO3—VaO5 (по
Фотиеву с сотрудниками).
сингония ромбическая. K32V18Oel(16K2O-9V2O5) образует опти-
чески двуосные кристаллы, положительного характера, 2У=76—
78°, #g=1.736, #тп=1.718, #р=1.706. Кристаллы K4V2O7
оптически двуосные, отрицательные, 2У=(—)84°, Ng= 1.724,
#m=1.714, #р=1.702.
Соединение KV2O55 образует призматические кристаллы,
в порошке вишнево-красного цвета. Погасание относительно
Np почти прямое, #£=2.34, #р = 1.745.
Литература
1. Глазырин М. П., А. А. Ф о т и е в, Кристаллография, 9, № 4, 506,
2. И л л а р и о н о в В. В., Р. П. О з е р о в, Е. В. К и л ь д и ш е в а,
Журн. неорг. хим., 1, № 4, 777, 1956.
3. Фотиев А. А., М. П. Глазырин, С. И. Алямовский, Журн.
неорг. хим., 12, № 5, 1325, 1967.
4. Holtzberg F., A. Reiaman, М. Berry, М. Berkenblit,
Journ. Amer. Chem. Soc., 78, № 8, 1536, 1956.
5. К e 1 m e г s A. D., Journ, Inorg. Nucl, Chem., 23, № 3—4, 279, 1961,
Ванадатные системы
519
Rb2O—V2O5
Система изучена Беляевым и Головановой [2] термографиче-
ским и визуально-политермическим методами. Вследствие склон-
ности к переохлаждению при построении диаграммы использо-
вались только данные, полученные по кривым нагревания. Обна-
ружено пять соединений: Rb2O-3V2O5, Rb2O-V2O5, 16Rb2O-9V2O#,
2Rb2O-V2O5 и 3Rb2O-V2O5 (рис. 489). Кроме того, в смесях, бо-
Рис. 489. Диаграмма состояния системы
Rb2O—V2O6.
гатых V2O5, в области 10—20 мол. % Rb2O имеется фаза так
называемой ванадиевой бронзы с ванадием в разных степенях
окисления [3].
Гексаванадат Rb2O-3V2O5 представляет темно-красные кри-
сталлы; метаванадат Rb2O -V2O5 в виде белых легко рассыпаю-
щихся кристаллов имеет фазовое превращение при 518°; соеди-
нение состава 16Rb2O -9У2О5 (аналогичное соответствующим ка-
лиевому [4] и цезиевому [1]), плавится с разложением при 736°
и обнаруживает фазовое превращение при 662°; пированадат
рубидия 2Rb2O*V2O5 имеет фазовое превращение при 706°. Темпе-
ратура плавления ортованадата —1200° была найдена путем
экстраполяции.
520
Ванадатные системы
Инвариантные точки системы Rb2O—V2O5
Фазы Процесс Состав, мол. % Темпера- тура, °C
ньго V2o5
VSO5-|-жидкость. Плавление. 0 100 675
V»O5-|- Rb«O - 3V2O5-|-жидкость. RnsO • 3V2O5-|-жидкость. Эвтектика. 21 79 498
Плавление. — — 508
Rb2O- SVgOj-pRbgO* У2Об+жид- Эвтектика. 41 59 380
кость. Rb2O • V2O5+жидкость. Плавление. 560
RbaO • V2O5-|- 16Rb2O • 9У2О5+жид- Эвтектика. 54 46 514
KQCTb. 16Rb3O • 9VaO5+2Rb2O V2O6+ Перитектика. 62 38 736
4-жидкость. 2Rb2O • V2O54-жидкость. Плавление. 930
2Rb2O • V2Os4-3Rb2O • УаО&4-жид- Эвтектика. 69 31 910
КОСТЬ. 3Rb2O- У2О5+жидкость. Плавление. 1200
3Rb2O V2O5-j-Rb2COa4- жидкость. Эвтектика. 92 8 816
НЬаСО34-жидкость. Плавление. — — 896
Литература
1. Беляев И. Н., Т. Г. Голованова, Журн. неорг. хим., 9, № 1>
228, 1964.
2. Беляев И. Н., Т. Г. Голованова, Изв. высш, учебн. завед.,
Металлургия, 7, № 4, 117, 1964.
3. Илларионов В. В., Р. П. Озеров, Е. В. Кильдишева,
Журн. неорг. хим., 1, № 4, 777, 1956; 2, № 4, 883, 1957.
4. Holz berg F., A. Reisman, М. В е г г у, М. В е г k е n b 1 i t,
Journ. Amer. Chem. Soc., 78, № 8, 1536, 1956.
Cs2O—V2O5
Система изучена Беляевым и Головановой [1 ] методами ви-
зуального политермического анализа и термографии. Исходными
веществами служили V2O5, полученная разложением метаванадата
аммония, и Cs2CO3.
Диаграмма состояния системы Cs2O—V2O5 приведена на
рис. 490. Установлено шесть соединений: 3Cs2O>V2O5, 2Cs2O-V2Oe,
16Cs2O-9V2O5, Cs2O-V2O5, Cs2O-2V2O5 и Cs2€).3V2O5.
Три соединения: ортованадат 3Cs2O-V2O5, пированадат
2Cs2O.V2O5 и метаванадат Cs2O-VaOs — обнаружили фазовые
превращения соответственно при 460,342 и 402°. 3Cs2O 'У2О5 имеет,
кроме того, второе низкотемпературное превращение при 160°.
Ванадатные системы
521
Рис. 490. Диаграмма состояния системы
Cs3O—V2O8.
Литература
1. Б е л я е в И. Н., Т. Г. Голованова, Журн. неорг. хим., 9, № 1,
228, 1964.
Ag2O—V 2О8
Изучена Флери и Кольмюллером [1]. Установлено существо-
вание пяти соединений: AgV7O18, Ag2V4Ou, AgVO3, Ag4V2O7
и Ag3VO4 (рис. 491). Соединение AgV7O18 плавится при 732°,
AgVO3 при 478°. Температура перитектической точки Т равна
392°. Четыре эвтектики в системе (А, В, С и D), содержащие 6.2,
23.3, 48.5 и 63 мол. % Ag2O, плавятся соответственно при 664,
522
Ванадатные системы
552, 474 и 386°. Соединение AgVO3 существует в трех полиморф-
ных формах с температурами перехода 342 и 422°.
Рис. 491. Диаграмма состоя-
ния системы Ag2O—VaO5.
Литература
1. Fleury Р., R. Kohlmiiller, Compt. rend., 262, ser. С, № 6, 475,
1966.
MgO—V2O5
Изучена Кольмюллером и Перро [1 ] методом термического
анализа. Достоверно установлено существование двух ванадатов
Рис. 492. Диаграмма состояния си-
стемы MgO—V2O5 (по Кольмюллеру
и Перррк
Ванадатные системы
523
магния: MgO-V2O8 и 2MgO>V2O8 (рис. 492). Предположительно
на диаграмме указано третье соединение — 3MgO • V2O5. Все эти
соединения плавятся инконгруэнтно соответственно при 760,
950 и 1165°, и реакционные точки (Tlt Т2, Т3) содержат 32.5,
°C
2100-
1900
1700
Жидк.
1523°
1500
1300
1100
900
700
7МдО-ЗУ205*Ж
Fl
? I
ЗМд0Щ05*Уг05
g\3Mff0-2V205*V?°5
100 80 / 00\ 90 к 20 о
7Мд0-ЗЩ 3Mg0-2V2O5MgO-ZV2O5 V20s
MgO Мол. % V2°3
I»1 §
I I
>1
I ,Mg0
1 j. w
ЗМд0-2У20^Ж
3Mg0-2V20&
Mg0+2V205
Мд0-2Уг0^Ж
Уг05*Ж
Рис. 493. Диаграмма состояния
стемы MgO— V2O6 (по Леманну с
трудниками).
си-
со-
48.0 и 64.5 мол. % MgO. Единственная эвтектика (Э) в системе
содержит 24.5 мол. % MgO и плавится при температуре 640°.
Леманн с сотрудниками [2] описывают три ванадата магния:
7MgO • 3V2O6, 3MgO • 2V2O6 и MgO • 2V2O6, плавящихся инкон-
груэнтно при 1162, 1091 и 710° (рис. 493). Эвтектика между V2O5 и
MgO-2V2O5 плавится при 616° и имеет состав 15 мол. % MgO.
Литература
1. Kohlmiiller R., I. Р е г г a u d, Bull. Soc. chim. France, № 3,
642, 1964.
2. Lehmann H., S. Kienow, P. A r t e 11, Toninduatr. Ztg., 88,
№ 7, 153, 1964.
524
Ванадатные системы
СаО—V2O5
Система изучена Морозовым [1]. Установлено существование
трех соединений, плавящихся с разложением: СаО • V2O5,
2CaO-V2O5 и 3CaO-V2O5 (рис. 494).
Рис. 494. Диаграмма состоя-
ния системы СаО—VaO5.
Литература
1. Морозов А. Н., Металлург, 12, № 13, 21, 1938.
ВаО—V2O5
Изучена Кольмюллером и Перро [1] методом термического
анализа. Достоверно установлено существование двух соедине-
ний: BaO-V2O5 и 2BaO-V2O5 (рис. 495). Возможно, в системе
существует и третье указанное на диаграмме соединение
ЗВаО-У2О5.
Метаванадат бария BaO-V2O5 плавится конгруэнтно при 705°,
пированадат 2ВаО -V2О5 — инконгруэнтно при 740°; реакцион-
ная точка содержит 52.5 мол.% ВаО. Две эвтектики содержат 36
и 51.5 мол.% ВаО и плавятся соответственно при 535 и 700°.
2ВаО -V2O5, по-видимому, существует в двух полиморфных фор-
Ванадатные системы
525
мах, что авторы заключают на основании различия рентгенограмм
пированадатов, полученных
методами.
пирогенным и гидротермальным
Рис. 495. Диаграмма состояниясистемы ВаО—V2O5 (по Кольмюллеру
й Перро).
Литература
1. Kohlmiiller R., J. Р е г г a u d, Bull. Soc. chim. France, № 3,
642, 1964.
ZnO—V2O5
Приближенную диаграмму плавкости системы построила Чап-
лина [1], получившая мета-, пиро- и ортованадаты цинка.
Указанная на рис. 496 эвтектика содержит 27 мол.% ZnO и
Рис. 496. Ориентировочная
диаграмма плавкости системы
ZnO— V2O8 (по Чаплиной).
V2°S Мол.7, Zn0
526
Ванадатные системы
плавится при 603—608°. Относящаяся к метаванадату перитектика
имеет состав: 52 мол.% ZnO и 48 мол.% V2OB.
Поллардом [3] обнаружены три соединения: ZnO-V2OB,
2ZnO -У2ОВ и 3ZnO -YjOg, для которых указываются конгруэнт-
ные температуры плавления: 665, 880 и 897°. Для четырех эвтек-
тик (в порядке от ZnO к V2OB) приводятся соответственно темпе-
ратуры плавления: 895 , 866, 695 и 634°, при содержании 23, 27,
46 и 64 мол.% V2OB.
°C
1000
900
800
700
600
500
7п0+ж\ 899*10°
znu+M х I 8П±10
-890*10° 877*'t
ZnO+y-Z3Vm.p'
835*25" !
Zn(hfl-Z3Vmi/>.
_ p-Z3Vm.p. »
ZnO*a-Z3Vni.p.
ЖиЭк.
795*5° \
'/3-Z3V*fi-ZsV\
p-z3v*x
645±1O^^2V'¥ZV
815*10°
x-Z# a~zzv*®
ZV * V305
го to
60 80 100
ZnO Мол. % V2°5
а-2/
Рис. 497. Диаграмма состояния системы ZnO—V2O5
(по Брауну и Гюммелю).
Система детально изучена Брауном и Гюммелем [2]. Эти ис-
следователи подтвердили образование трех уже указанных выше
соединений (рис. 497). Однако только соединения Zn8(VO4)2
и Zn2V20j плавятся конгруэнтно, соответственно при 890 и 877°;
Zn(VO3)2 плавится инконгруэнтно при 645°. Zn3(VO4)2- при 795°
испытывает медленное, а при 815° быстрое обратимое превращение,
Zn2V2O7 испытывает быстрое обратимое превращение при 615°.
Окись цинка образует твердый раствор с ^-модификацией
Zn3(VO)2; возможно, что ZnO незначительно растворима и в дру-
гих модификациях ортованадата.
Литература
1. Чаплина И. М., Журн. прикл. хим., 37, № 8, 1835, 1964.
2. Brown J.J.,F. A. Hummel, Trans. Brit. Ceram. Soc., 64, № 9, 419,
1965.
3. Pollard A. J., U. S. Goverm. Res. Rept., 98, № 22, 148, 1963.
Ванадатные системы
527
А120з—V 2O5
Изучена Бурдезе [2]. В системе обнаружено одно, плавящееся
инконгруэнтно при 695° соединение A1VO4 (рис. 498). Наблю-
даемая эвтектика содержит приблизительно 30 мол. % А12О3
и плавится при 640+5°.
800
700
600
695°
AlVOfM
AlVO^AltO3
0 20
40 г.1 60
Мол.0/о
80 100
А1,0,
6 «9
Рис. 498. Диаграмма состояния Рис. 499. Предположительная
системы А12О3—V2O5 (по Бурдезе). диаграмма состояния части си-
стемы А12О3—V2O5 (по Бер-
гаму).
I — данные термического анализа;
г — данные растворимости насы-
щения.
Бергам [1] показал, что соединение A1VO4 выше 625° не
обнаруживается. Небольшой участок диаграммы состояния си-
стемы приведен на рис. 499.
Литература
1. Barham D., Trans. Brit. Ceram. Soc., 64, № 7, 371, 1965.
2. Burdese A., Ann. chim. (Roma), 47, № 7—8, 797, 1957.
PbO— V2O5
Система изучена Витингом и Голубковой [1 ] методом терми-
ческого анализа.
В соответствии с диаграммой состояния (рис. 500) образуется
три конгруэнтно плавящихся ванадата свинца: 8PbO-V2O6
(794°), 3PbO-V2O8 (958°) и 2PbO-V2O8 (722°).
528
Ванадатные системы
Рис. 500. Диаграмма состояния
системы РЬО—VpO5 (по Витинг
и Голубковой).
Литература
1. Витинг Л. М., Г. П. Г о л у б к о в а, Вести. Моск, унив., 19, сер. II,
хим., № 3, 88, 1964.
TiO2-VO2
Мариндер и Магнели [1], исходя из смеси, содержащей в раз-
личном соотношении ТЮ2 (анатаз), V2Og и металлический ванадий
или смеси TiO2 (анатаз), V2O5 и V2O3, и производя нагревание
в запаянных эвакуированных кварцевых трубках при 1000°
в течение нескольких дней, получили две фазы*. 1) со структурой
рутила, в концентрационных пределах от TiO2 до Ti0 25V0 75О2;
2) ромбическую фазу при более высоком содержании ванадия.
Рутиловая фаза имеет следующие параметры элементарной
ячейки: Ti0 7BV0 2ВО2 — а=4.581, с=2.954 А; То B0V0_В0О2 —
а=4.566, с=2.938 X; Ti0,2SV075O2 — а=4.550, с=2.905 к. Хими-
ческих анализов, подтверждающих валентное состояние катио-
нов, авторы не приводят.
Литература
1. Marinder В.-О., A Magneli, Acta chem. Scand., 12, № 6, 1345,
1958.
Ванадатные системы
529
Та2О6—V2O5
В субсолидусной области изучена Труновым, Ковба и Си-
роткиной [1]. Обнаружено образование одного соединения, со-
став которого точно не установлен. Указываются две формулы:
6Та2О5-V2O5 (14.3 мол.% V2O5) и 17Ta2O5-3V2O5 (15 мол.% V2O5).
Описываемое соединение имеет очень узкую область гомоген-
ности.
Литература
1. Т р у и о в В. К., Л. М. К о в б а, Е. И. С и р о т к и и а, ДАН СССР,
153. № 5, 1085, 1963.
Сг2О3—V2O5
Систему, интересную для службы огнеупоров, изучили Чи-
рилли, Бурдезе, Бризи [2]. Обнаружено одно соединение CrVO4,
плавящееся инконгруэнтно при 810+10° и составе 43 мол.%
Рис. 501 Диаграмма состояния системы
Сг2О2—V2Og.
1 — жидкость; 2 — жидкость+кристалли-
ческие вещества; 3 — кристаллические ве-
щества.
Сг2О8 (рис. 501). Согласно Брандту [1], это соединение характе-
ризуется ромбической симметрией и имеет параметры решетки:
а=5.568, 6=8.208, с=5.977 к.
Литература
1. Brandt К., Arkiv Kemi, Mineral., GeoL, 17A, № 6, 1,1943.
2. C i r i 11 i V., A. В u r d e s e, С. В r i a i, La Metallurgia italiana,
48, № 7, 309, 1956.
34 H. А. Торопов и др., кн. 1
530
Ванадатные системы
ТеО2—V2O5
Представляет интерес для получения стекол с полупроводни-
ковыми свойствами. Изучена Чезом и Филлипсом [1 ] методом
термографии. В исследованной области от 0 до приблизительно
Рис. 502. Диаграмма состояния системы
ТеО2—V2O8.
50 вес. % V2O8 обнаружено одно соединение 2TeO2-V2O5, плавя-
щееся конгруэнтно при 484.9+1.5°. Для указанной на рис. 502
эвтектики авторы приводят температуру плавления 468.6+1.5°.
Литература
1. С h a s е G. А., С. J. Р h i 11 i р э, Journ. Amer. Ceram. Soc., 47, № 9,
467, 1964.
Fe2O3—V2O5
Систему, интересную для теории металлургии железных руд,
содержащих ванадий, изучили Чирилли, Бурдезе и Бризи [1].
Обнаружено одно соединение FeVO4, плавящееся инконгруэнтно
при 840+10° (рис. 503) и содержании 35 мол. % Fe2O3. Оно имеет
низкую симметрию. Эвтектика имеет состав 10% Fe2O3 и темпера-
туру плавления 635 +5°.
Ванадатные системы
531
Рис. 503, Диаграмма состояния си-
стемы FeaO3—V2O5.
1 — жидкость; г — жидкостьЦ-кристал-
лические вещества; t — кристаллические
вещества.
Литература
1. С i г i 11 i V., А. В и г d е s е, С. В г i a i, La Metallurgia italiana, 48,
№ 7, 309, 1956.
СоО—V2O5
Систему изучали Чирилли, Бурдезе и Бризи [1 ]. Обнаружено
три соединения, плавящихся инконгруэнтно (рис. 504) соответст-
венно при 705, 820 и 990°.
Рис. 504. Диаграмма состояния си-
стемы СоО—V2O5.
1 — жидкость; г — жидкость-1-кристал-
лические вещества; 3 — кристаллические
вещества.
Литература
1. С i г i 11 i V., А. В u г d е s е, С. В г i э 1, La Metallurgia italiana,
48, № 7, 309, 1956.
34»
532
Ванадатные системы
МЬ-Ч-Ръ
Систему изучили Чирилли, Бурдезе и Бризи [1]. Обнаружено
три соединения: NiV2O6, Ni2V2O7 и Ni3V2O8, — плавящихся
инконгруэнтно (рис. 505) соответственно при 720, 880 и 1220°.
Рис. 505. Диаграмма состояния
системы NiO—V2O5.
I — жидкость; 2 — жидкость+кри-
сталлические вещества; 3 — кристал-
лические вещества.
Литература
1. Ci rill i V., А. В u г d е а е, С. В г i э i, La Metallurgia italiana,
48, № 7, 309, 1956.
НИОБАТНЫЕ СИСТЕМЫ
Na2O(Na2CO3)-Nb2O3
Система интересна с точки зрения аномального диэлектри-
ческого поведения ниобата натрия.
Изучена Рейзманом, Гольдбергом и Бенксом [3]. Область
от 25 до 100 мол. % Nb2OB (рис. 506) представляет равновесие
°C
1600
1400
1200
1000
800
600
ЧОО
200
-<s
юг
I+U
Жидк.
^а-ЫЬ^Ж пгг
а-Ш+Ж
387'
а-ШЧУ
И+a-lIl
Ihy-Ш
IV+Ж
Ц' •--\ Я«й°
sw°
p-mw 5вг°
7-ШЧ\Г В
' 354° <
п+З-ш
3-hhv <
IV+a-Na3C03
485°
3s^p-Na3C03
IV*T-N(tfO3
О 20
ИЬ20}
60
Мол. %
т
Nt^O
Нй3003
s
ы
Рис. 506. Диаграмма состояния системы Na2O(Na2CO3) —
—NbjOj.
между Na2O и Nb2O5, а в области от 0 до 25 мол. % Nb2O5
Na2CO3 присутствует как второй компонент. Поскольку Na2O
и Na2CO3 молекулярно эквивалентны, разрыва между двумя
названными областями не существует. Система характеризуется
534
Ниобатные системы
Инвариантные точки системы Na2O (или Na2CO3)—Nb2O5
Точка Фазы Процесс Состав, мол. % Темпе- рату- ра, ®С
Na,0 (или Na,COs) Nb2O5
1 y-Nb2O54-a-Nb2O5. Полиморфное пре- — 100 830
2 а-ХЬ2О6-|-жидкость. Плавление. — 100 1491
3 Na2O- 14Nb2O8-|-a-Nb2Oe-|- Инконгруэнтное 6.67 93.33 1309
-|-жидкость. плавление.
4 Na2O-4Nb2O5-|-Na2O. То же. 20 80 1277
5 • 14КЬ2О5-|-жидкость. Na2O-4Nb2O5+Na2O • NbaO6+ Эвтектика. 32.5 67.5 1235
-f-жидкость. Полиморфное
6 8-Na«O- Nb2O5-|-Y-Na2O- • NbjOg. Y-Na«O- Nb2O5-|-0-Na2O- • NbgOg. 0-NasO- Nb2O54-a-NaaO- • NbgOg. a-Na2O- Nb2O5-|- жидкость. пре- 50 50 354 ±1
7 вращение. То же. 50 50 562 ±1
8 » » 50 50 640 ±4
9 Конгруэнтное пла- 50 50 1422
Ц вление.
' 10 a-Na2O- Nb2O5-|-3Na2O- • NbjOg-1-жидкость. 3N a2O • Nb2O6-|-жидкость. Эвтектика. 69.5 30.5 987
И Конгруэнтное пла- 75 25 997
вление.
12 3Na«tO* NbaOn-J-NeaCOjt--}- Эвтектика. 94 6 800
+жидкость. Полиморфное (Na2CO3)
13 &2GU3--}- &2GU3. пре- 100 — 355
0-Na2CO3-|-a-Na2CO3. вращение.
14 То же. 100 — 485
15 a-N а2СО2-|-жидкость. Плавление. 100 — 854
наличием четырех соединений и трех эвтектик. Инвариантные
точки системы приведены в таблице. Согласно данным авторов,
Na2O-4Nb2O5 имеет ромбическую ячейку: а=12.39, 6=36.98,
с=3.97 А; пикнометрическая плотность 4.62 г/см8 при 25°. Мета-
ниобат Na2O-Nb2O5 обладает полиморфизмом, причем превраще-
ние при 562° обнаруживается только после многократного прока-
ливания проб.
Превращение 7—a-Nb2O5 при 830° является лишь предполо-
жительным. Значения плотностей при 25° для девяти составов,
начиная от 18 мол.% Na2O — 82 мол.% Nb2O8 до 100% Nb2O5,
показаны на рис. 507.
Полиморфизм метаниобата натрия NaNbO3 изучался многими
авторами. Теннери [4] произвел рентгенографическое исследова-
ние чистого NaNbO3 в температурном интервале 25— 705°.
Ниобатные системы
535
Обнаружены фазовые превращения при 372, 420, 478, 527, 576 и
640+5°. При 372, 576 и 640° в пределах узкого температурного
интервала образец состоит из двух фаз, что указывает на пре-
вращения первого порядка. На рис. 508 показано изменение
параметров перовскитовой подъячейки и объема NaNbO3 в за-
висимости от температуры. Вертикальные линии на рисунке
Температура, °C
Рис. 508. Изменение параметров перовскито-
вой элементарной подъячейки и объема мета-
ниобата натрия в зависимости от температуры.
Лертикалъние линии показывают фазовые превра-
щения.
указывают фазовые переходы. Теннери полагает, что занижен-
ные значения температуры первого превращения: 360° по Со-
ловьеву, Веневцеву и Жданову [2] и 355° по Исмаилзаде
[11 — следует объяснить наличием примесей. Особенно сильно
снижает температуру превращения NaNbO3 ион Та5.
536
Ниобатные системы
Литература
1. И смай л з ад е И. К., Кристаллография, 8, № 3, 363, 1963.
2. Соловьев С. П., К). Н. В е н е в ц е в, Г. С. Жданов, Кри-
сталлография, 6, № 2, 218, 1961.
3. R е i s m a n A., F. Holtzberg, Е. Banks, Journ. Amer. Chem.
Soc., 80, № 1, 37, 1958.
4. T e n n e г у V. J., Journ. Amer. Ceram. Soc., 48, № 10, 537, 1965.
KaO— NbgOg
Систему, интересную для металлургии ниобия, изучили Рейз-
ман и Гольдберг [3] методом дифференциального термического
анализа. Обнаружено пять соединений: 3KaO>NbaO3, KaO-NbaO5,
2KaO-3NbaO5, KaO-3NbaO5 и 3KaO-22NbaO5. Система KaO-NbaO5
представлена на рис. 509.
Инвариантные точки системы КаО—Nb2O5
Точка Фазы Процесс Состав, иол.% Темпе- рату- ра, °C
К,0 Nb2O5
1 Nb2O5-|-жидкость. Плавление. 0 100 1486
2 Nb2O5+3K2O-22Nb2O6+ жидкость. Инконгруэнтное плавление. 18.5 81.5 1279
3 3KaO-22NbaO5+K2O- • 3Nb2O5-|-жидкость. К2О- 3NbaO5+2KaO- 3Nb2O5+ жидкость. То же. 25 75 1234
4 Эвтектика. 35 65 1150
5 2КаО- ЗИЬ2О6Ч-жидкость. Плавление. — — 1163
6 2КаО • 3Nb2O5+ КаО NbaO5+ +жидкость. Инконгруэнтное плавление. 50 50 1039
7 КаО • Nb2O5+ ЗК2О • Nb2O5+ 4- жидкость. Эвтектика. 66.5 33.5 845
8 ЗК2О • Nb2O5 +жидкость. Плавление. — — 950
9 ЗК2О* Nb2O5-|-К2СО3+жид- кость. Эвтектика. 89 (К2СО3) и 794
10 К2СО3+ жидкость. Плавление. 100 (К2СО3) — 891
Герше [1] осуществил термический анализ ряда смесей КаСО3
и NbaO5 и, помимо фаз, обнаруженных Рейзманом и Гольдбергом,
указал на две новые фазы (обозначаемые X и У), богатые пяти-
окисью ниобия, состав которых не был определен. Синтезирован-
Ниобатные системы
537
ный Герше метаниобат K2O-Nb2O5 имел псевдокубическую струк-
туру с перовскитовой решеткой и параметром элементарной ячейки
а=4.029 А.
Кестигиан с сотрудниками [2] получили монокристаллы сое-
динения K4Nb6O17 (2K2O-3Nb2O5) и высказали предположение
о том, что они относятся к моноклинной сингонии.
Литература
1. Guerchais J. Е. Contribution a 1’Etude des Niobates de Potassium.
Theses. Strasbourg, 1961.
2. К i s t i g i a n M., F. D. Le i pzige r, J. R. C a r t e r, F. G. Ca-
ra b e d i a n, Journ. Amer. Ceram. Soc., 49, № 9, 517, 1966.
3. R e i s m a n A., F. Holtzberg, Journ. Amer. Chem. Soc., 77, № 8,
2115, 1955.
Cs2O—Nb2O6
Изучена Рейзманом и Минео [11 в области 0—66 мол. % Cs2O
(рис. 510). Найдено пять соединений, из которых одно,
5Cs2O-13Nb2O5 (27.7 мол.%) Cs2O), изоморфное с рубидиевым
538
ЙиобаТныС системы
аналогом, плавится конгруэнтно при 1416°. Другие: 2Cs2O-
•15Nb2Og, Cs2O*2Nb2Og, 2Cs2O»3Nb2Og и Cs2O-Nb2O5 — плавятся
инконгруэнтно при 1403, 1153, 972 и 857° соответственно. Состав
перитектик: 11.76, 46, 51 и 56 мол.%.
Рис. 510- Диаграмма состояния
системы Cs2O—Nb2O6.
I — 2Ce,0 • 1 SNbjO,; II — 5Cs, О •
•ISNbjO,. Ill — Cs,0.2Nb,OC, IV —
2Св,0.3Nb,Ot; V — Cs,0 -NbjO,.
Существуют две эвтектики: первая содержит 17.5 мол. %
Cs2O и плавится при 1372°, вторая — 62 мол. % Cs2O и плавится
при 748°.
Литератур а
1. R е i s m а п A., J. М i п е о, Journ. Phys. Chem., 65, № 6, 996, 1961.
MgO—Nb2Og
Система в субсолидусной области изучалась Гольдшмидтом [1 ].
М§О,грастворяется в fi-Nb2O5,* образуя твердый раствор с пре-
дельной концентрацией, немного меньшей 10 мол. % MgO.
В области средних концентраций обнаружены рутиловая (7?)
и'колумбитовая (С) фазы, каждая с широкой областью однород-
ности. Рутиловая фаза устойчива при более высоких температу-
рах, и при понижении температуры переходит в колумбитовую
фазу, что связано с частичным разложением: R -> СЦ- p-Nb2O5.
В области, богатой окисью магния, обнаружена гематитовая
* Здесь и далее под P-Nb2Og, по-видимому, подразумевается высоко-
температурная модификация.
Ниобатные системы
539
фаза (Я). Для состава, содержащего 50 мол. % MgO, рутиловая
фаза имеет параметры кристаллической решетки: а=4.739, с=
=3.063 кХ; колумбитовая фаза: а=5.162, 6—4.174, с=5.339 кХ.
Литератур а
1. Goldschmidt Н. J., Metallurgia, 62, № 374, 242, 1960.
СаО—Nb2OB
Имеет значение для производства электрокерамических ма-
териалов.
Изучена Ибрагимом, Брайтом и Роуландом [2 ] методом плавки
прессованных конусов. В системе обнаружено три соединения:
CaO-Nb2O5, 2CaO-Nb2O5 и 3CaO-Nb2O5, плавящегося инкон-
груэнтно при 1560° (рис. 511).
Таблица 1
Инвариантные точки системы СаО—Nb2Os [2]
Точка Фазы Процесс Состав, вес. % Темпе- рату- ра, °C
Nb2O5 СаО
1 Nb2OB-|-жидкость. Конгруэнтное пла- вление. 100 — 1479
2 NbaO«-|-СаО- NbaOB-|-жидкость. СаО • NbaOB-|- жидкость. Эвтектика. .6 94 1362
3 Конгруэнтное пла- вление. 17.4 82.6 1560
4 СаО- Nb2OB-|-2CaO • NbaOB-|- +жидкость. Эвтектика. 23 77 1492
5 2СаО- NbaOB-|-жидкость. Конгруэнтное пла- вление. 29.7 70.3 1576
6 2СаО- NbaOB-|-CaO- NbaOB-|- +жидкость. Эвтектика."! 34 66 1535
7 ЗСаО • МЬ2О6-|-СаО-|-жидкость. Инконгруэнтное плавление. 38.8 61.2 1560
8 СаО+жидкость. Плавление. — 100 2570
Соединение 3CaO-Nb2O5 существует в двух формах.
3CaO-Nb2OB (I) имеет гранецентрированную кубическую струк-
туру с параметром решетки а=7.978 A. 3CaO-Nb2O5, кроме того,
образует сверхструктуру с параметром а=23.934 А. Форма
3CaO-Nb2O5 (II) дает кристаллы ромбической сингонии (псевдо-
тетрагональная, неупорядоченная кубическая решетка) с пара-
метрами: а—11.51, 6=11.10, с=15.98 А. Этим параметрам отве-
чает большая ромбическая ячейка, содержащая 12 формульных
540
Ниобатные системы
Таблица 2
Физические свойства соединений системы СаО—Nb2O5 [2]
Соединение Сингония и габитус № Nm Np Опти- ческий знак Плот- ность, г/см3
СаО • Nb2O в (синтети- Ромбическая, 2.19 2.10 2.07 (+) 4.72
ческий). плоские призмы.
СаО • Nb2O в (природ- ный ферсмит). Ромбическая. — —2 — (+) —
2CaO-Nb2OB. Моноклинная, тонкие пластинки двойни- ковые, спайность (100). 2.17 2.16 1.97 (-) 4.39
3CaONb2OB. Кубическая гране- центрированная, кристаллы слабо- двупреломляющие, почти -изотропные. —2.2 1 4.23
единиц 3CaO-Nb2OB, т. е. с формулой Ca3eNb24O9e. Кроме того,
структуру [ЗСаО‘Nb2OB (II) можно рассматривать как имеющую
малую элементарную ячейку с параметрами: а=5.754, 6=5.551
‘С
Рис. 511. Диаграмма состояния
системы СаО—Nb2O5.
и с= 7.990 А. В этом случае в элементарной ячейке содержится
полторы формульные единицы и брутто-формула будет: Са4 BNb3O12.
Авторы не смогли определить области устойчивости поли-
морфных форм трехкальциевого ниобата и на диаграмме состоя-
ния системы СаО—Nb3OB соответствующих полей не приводят.
Ниобатные системы
541
Крылов и Алексеев [1 ] синтезировали метаниобат кальция
Са(ИЬОз)2 обезвоживанием Ca(NbO3)2-2H2O. Авторы полагают,
что метаниобат кальция образует кубическую решетку типа
флюорита с параметром а=8.35 А. Пикнометрическая плотность
3.776, вычисленная из рентгеновских данных 3.65 г/см3. Темпе-
ратура плавления CaO-Nb2O5, по данным Крылова и Алексеева,
1310 ±20°.
Литература
1. Крылов Е. И., Ю. И. Алексеев, Журн. общ. хим., 25, № 6,
1052, 1955.
2. Ibrahim М., N. F. Н. В г i g h t, J. F. R owl and, Journ. Amer.
Ceram. Soc., 45, № 7, 329, 1962.
SrO— Nb2OB
Изучалась Гольдшмидтом [1 ] в субсолидусной области. Обна-
ружена растворимость SrO в p-Nb2O5, причем с понижением
температуры предельная концентрация SrO в этом твердом рас-
творе уменьшается. Получены четыре ниобатные фазы (фазы I,
J, К и Р). Гольдшмидт для фазы I приводит состав Nbr 2Sr0 05О3,
для фазы J — Nbr д8г0 2О3, для фазы К — Nbr aSr0 35О3, для чет-
вертой, перовскитовой фазы Р — состав NbSr0 5О3.
Литература
1. Goldschmidt Н. J, Metallurgia, 62, № 374, 243, 1960.
ВаО—Nb2O6
Имеет значение при производстве электрокерамических мате-
риалов.
Изучена Ротом и Уорингом [5]. Некоторые исследования
выполнили Андреева и Келер [1 ]. В системе установлено шесть
химических соединений: 5ВаО -2Nb2O5, ВаО -Nb2O5, бВаО *7Nb2O5,
3BaO«5Nb2O5, BaO*3Nb2O5 и 6BaO-Nb2O5. Соединение 2ВаО-
•Nb2O5, на которое указывает Исмаилзаде [2], не было
обнаружено Ротом и Уорингом. В системе установлено несколько
серий твердых растворов: 1) на основе соединения BaO’Nb^;
542
Ниобатные системы
2) на основе соединения 3Ba€b5Nb2OB; 3) на основе соединения
BaO-3Nb2O5; 4) на основе Nb2O5. Соединения 3BaO-5Nb2O5
и BaO-3NbBOB являются конечными членами непрерывной серии
твердых растворов между этими соединениями (рис. 512).
Соединение BaO-Nb2OB было открыто Крыловым и Алексее-
вым [3], которые считали, что оно имеет кубическую структуру
с параметром а=9.02 А. Однако Рот и Уоринг утверждают, что
BaO*Nb2O5 имеет иное строение. Стабильная форма метаниобата
бария является ромбической с параметрами кристаллической
Рис. 512. Диаграмма состояния системы ВаО—Nb2O5,
решетки: а=12.194, 6=10.268, с=7.856 А. Кроме того, при опре-
деленных условиях может быть получена метастабильная гекса-
гональная модификация. Франкомб [4], открывший эту модифика-
цию, полагал, что она образуется при температурах, близких к тем-
пературе плавления. Рот и Уоринг получали метастабильный
ниобат BaO-Nb2O5 при температурах между 900 и 1100°. Пара-
метры элементарной ячейки этого соединения: а= 12.074, с=3.95 А.
Гексагональная фаза рассматривается Ротом и Уорингом как мета-
стабильная, промежуточная структура между ромбической
BaO-Nb2O5 и структурой типа вольфрамовой бронзы.
Впервые описанное Ротом и Уорингом соединение
5BaO-2NbO# было индицировано на основе гексагональной эле-
ментарной ячейки с параметрами; а=5.794, с=11.784 А.
Ниобатные системы
543
Существование соединения бВаО ‘Nb2O5 подтвердили Андреева
и Келер [1], синтезировавшие его путем проведения реакций
в твердом состоянии при температурах от 750 до 1200°. Образова-
ние 6BaO‘Nb2OB протекает через промежуточное соединение
5ВаО ‘Nb2OB, кристаллизуется в кубической гранецентрированной
решетке с параметром а=8.697+0.021 А. Плотность рассчитанная
5.98 г/см8, пикнометрическая 5.78 г/см3 (обжиг при 1100°).
Соединение BaO-Nb2O5, растворяя Nb2OB, образует твердые
растворы с предельной концентрацией Nb2O5 16 мол. % при тем-
пературе солидуса. В системе имеется две эвтектики: первая,
между соединениями 5BaO-2Nb2O5 и BaO-Nb2O5, содержит
62 мол. % ВаО и плавится при 1320°, вторая, представляющая ми-
нимальную температуру в серии твердых растворов, содержит
35 — 36 мол.% ВаО (температура плавления 1288°).
Литература
1. А и д р е е в а Г. Т., Э. К. К е л е р, Журн. неорг. хим., 9, № 3, 633,
1964.
2. Исмаилзаде И. Г., Изв. АН СССР, сер. физ., 22, № 12, 1483, 1958.
3. Крылов Е. И., Ю. И. Алексеев, Журн. общ. хим., 25, № 6, 1052,
1955.
4. Francombe М. Н., Bull. Amer. Phys. Soc., ser. II, 4, № 5, 1959.
5. Roth R. S., J. L. W a r i ng, Journ. Res. Nat. Bur. Stand., 65A, № 4.
337, 1961.
ZnO—Nb2O5
Представляет интерес в связи с выяснением фазового состава
продуктов, образующихся при высокотемпературном окислении
поверхности металлического ниобия, защищенного от окисления
воздухом при помощи диффузионного слоя из металлического
цинка.
Система изучена Поллардом [1 ]; характеризуется наличием
двух конгруэнтно плавящихся соединений — 3ZnO-Nb2O5 и
ZnO-Nb2OB — и трех эвтектик (рис. 513). Состав и температуры
плавления эвтектик и соединений показаны на диаграмме. Нио-
баты цинка кристаллизуются в виде иглоподобных кристаллов;
первый имеет светло-желтую окраску, второй — красную.
Согласно рентгеновским данным, отмечается некоторая раствори-
мость окиси цинка в окиси ниобия и окиси ниобия в окиси цинка,
не показанная на диаграмме. В статье Полларда приводятся меж-
плоскостные расстояния и интенсивности для двух указанных
ниобатов.
544
Ниобатные системы
Уоринг и Рот [2], изучившие богатую Nb2O5 часть диаграммы,
нашли соединение с избытком кислорода: ZnNbuO29 (вместо
стехиометрического Zn2/3Nb111/3O28).
Литература
Рис. 513. Диаграмма состояния
системы ZnO—NbaOs.
1 — обнаружена жидкость; я — окон-
чательное плавление.
1. Pollard A. J., Journ. Amer. Ceram. Soc., 44, № 12, 630, 1961.
2. W о r i n g J. L., R. S. R о t h, Journ. Res. Nat. Rur. Stand., 69A, № 2,
119, 1965.
CdO—Nb2O5
Система представляет интерес в связи с ферроэлектрическими
свойствами образующихся в ней соединений.
Построенная Ротом [5 ] на основе его данных фазовая диаграмма
приведена на рис. 514. Температура плавления CdO выше 1500°,
но точное определение ее при атмосферном давлении оказалось
невозможным. Соединение 2CdO-Nb2O5, по данным Бистрома [1 ]
и Кука и Яффе [2], относится к кубической системе с пирохлор-
ной структурой при комнатной температуре; а=10.370 а. и.
Фазовых превращений до точки плавления (1410+5°) у 2CdO-
•Nb2O5 не обнаружено. Соединение CdO-Nb2O5, по Левису
и Уайту [3], имеет структуру колумбитового типа. Параметры ром-
бической решетки: а=5.13, 6=14.75, с=5.842 а. и. Фазовых пре-
вращений до температуры плавления (1435 +5°) не найдено. Состав
эвтектики в богатой Nb2O5 части системы точно не установлен
(примерный ее состав при молярном отношении CdO : Nb2Oft =
= 1 : 2).
Ниобатные системы
545
Рид [4], пользуясь методом дифференциального термического
анализа, получил несколько иные температуры плавления ниоба-
Рис. 514. Диаграмма состояния системы
CdO—NbaO5.
Штриховой линией ивображена принимаемая
Ротом [5] кривая ликвидуса. 1 — почти
полностью расплавившиеся образцы; 2 —
частично расплавившиеся; 3 — нерасплавив-
шиеся.
тов кадмия: для Cd2Nb2O, приводится 1430+10° и для CdNb2Oe
1450+10°. Эвтектика между этими ниобатами плавится при
1370+10°.
Литература
1. Bystrom A., Arkiv Kemi, Mineral., Geol., A18, pt. 6, № 21,
1, 1944.
2. С о о k W. R. a. H. J a f f e, Phys. Rev., 88, № 6, 1426, 1952; 89, № 6,
1297 1953
3. Lewis В., Ё. A. W h i t e, Journ. Electronics, 1, № 6, 646, 1956.
4. Reed L., Journ. Amer. Ceram. Soc., 44, № 11, 576, 1961.
5. Roth R. S., Journ. Amer. Ceram. Soc., 44, № 1, 49, 1961.
A12O3— Nb2O5
Имеет значение для технологии изготовления конденсаторной
керамики.
Система изучалась Гольдшмидтом [4], Мюллером и Николь-
соном [7] и Лейденом [6]. Все эти исследователи согласны с суще-
ствованием соединения Al2O3-Nb2OB. Различные мнения выска-
35 Н. А. Торопов и др., кн. 1
546
Ниобатные системы
заны о характере фаз в области, примыкающей к Nb2O5. Гольд-
шмидт полагает, что А12О3 входит в твердый раствор на основе
Nb2OB, причем предельную концентрацию оценивает в 15 мол. %
А12О3. Коэтс и Кей [3] отмечают соединение Al2O3-3Nb2O5. Лей-
ден доказывает существование двух соединений — А12О3 ‘9Nb2OB
и Al2O3«25Nb2OB — и отрицает образование твердого раствора
на основе Nb2O5 (рис. 515).
Замеченная Гольдшмидтом растворимость Nb2OB в А12О3 и
Рис. 515. Диаграмма состояния системы
А1аО3—NbgOg.
Соединение AlNbO4 по своей структуре, как утверждают Мюл-
лер и Никольсон, не может быть отнесено к обычному рутиловому
типу, характерному для многих соединений формулы MInMvO4.
Лейден доказывает, что соединения Al2O3-9Nb2O5 и
А12О3 -25]ЯЬ2О5 соответствуют дискретным фазам в системе
Nb—О, обнаруженным Нориным и Магнели [8]. Так, соединению
А^Од • 9Nb2Os соответствует фаза Nb2 соединению
А12О3 • 25Nb2Os — фаза МЬО2Д^=1).
В субсолидусной области (обжиг до 1450°) систему изучали Дай
и Уайт [5 ]. Обжиг смесей окислов проводится в две стадии: 1) обжиг
при 100—1150° и измельчение; 2) обжиг при 1250—1450°. Этот же
способ приготовления применялся для остальных систем, которые
изучали Дай и Уайт. Кроме соединения AlNbO4 с моноклинной
структурой, обнаружены области твердых растворов, распростра-
няющиеся от ₽-Nb2O5 до состава, отвечающего формуле AlNb5O14.
Эти твердые растворы, в структурном отношении примыкающие
Ниобатные системы
547
к {3-Nb2O5, обладают ферроэлектрическими свойствами. Возможно,
что описанное Коэтсом и Кеем как ферроэлектрик соединение
Рис. 516. Схематические фазо-
вые отношения в системах,
содержащих Nb2O6 и окислы
трехвалентных элементов
(включая редкоземельные).
А — структура AlNbO« моноклин-
ная; В — структура типа fJ-Nb,O(;
D — структура типа пирохлора;
И — структура, близкая к пиро-
хлор нои; F, К — структура не вы-
яснена; Н — структура вольфра-
мита; I, L — дефектная флюори-
товая, возможно пирохлорная (не-
дефектная), структура; J — перов-
скитоподобная структура.
AlNb3O, в действительности является одним из членов обнаружен-
ных твердых растворов. На рис. 516 схематически указаны фазы
в системе AlgO3—NbgO#.
35*
548
Ниобатные системы
Рот с сотрудниками [10] показали, что в области, богатой пяти-
окисью ниобия, существует три соединения: Alx2NbM_5Ов2,
Alo.jNbjo.jOa? и AlNbnOst.
Трунов с сотрудниками [1], изучившие богатую Nb2O5 часть
системы, получили соединение Al2O3-HNb2O5 (AlNbuO29), харак-
теризующееся моноклинной сингонией с параметрами элементар-
ной ячейки: а=15.60±0.02, 6=3.815+0.001, с=20.61+0.02 А;
р=113°40'+12', Z=2. Al2O3»HNb2O5 изоструктурно моноклинной
модификации Ti2Nb10O29. По мнению Трунова с сотрудниками,
Лейден неправильно установил состав богатых Nb2OB ниобатов
алюминия.
Некоторые сведения о системе приводят Бурдезе и Борлера [2]
и Педерсен [9 ].
Литература
1. Т р у и о в В. К., 3. Я. П о л ь щ и к о в а, Л. М. К о в б а, Вести.
Моск, унив., сер. II, хим., № 3, 89, 1966.
2. Burdese А.,М. L. В о г 1 е г a, Ric. eci. rend., (2), 3, № 7, 1025,
1963.
3. С о a t е s R. V., Н. F. К а у, Phil. Mag., (8), 3, № 36, 1449, 1958.
'4. Goldschmidt Н. J., Metallurgia, 62, № 373, 211, 1960.
5. Dyer A. J., E. A. D. White, Trans. Brit. Ceram. Soc., 63. № 6,
301, 1964.
'6. Layden G. K., Journ. Amer. Ceram. Soc., 46, № 10, , 506, 1963.
-7. Muller E. К., B. J. Nicholson, Journ. Amer. Ceram. Soc.,
45, № 5, 250, 1962.
8. Norin R., A. M a g n e 1 i, Naturwissensch., 47, № 15, 354, 1960.
9. P e d e r s e n B. F., Acta chem. Scand., 16, № 2, 421, 1962.
10. R о t h R. S., A. D. W a d s 1 e у, В. M. C a t a h о u s e, Naturwis-
sensch., 51, № 11, 262, 1964.
GaaOa-—Nb2O8
Диаграмма состояния системы не построена. Фильгрин [2],
обжигая при 1300—1330° смеси, содержащие от 20 до 66 мол.%
Ga2O3, получил соединение Ga2O3-Nb2OB(GaNbO4) с моноклин-
ной сингонией. Предполагается возможность образования других
фаз в системе.
Систему изучали Дай и Уайт [11 в субсолидусной области (об-
жиг до 1450°). Обнаружено два соединения: GaNbO4 с моноклин-
ной сингонией типа AlNbO4 и богатое пятиокисью ниобия соеди-
нение, которому приписывается формула GaNbBO14. В структурном
отношении это соединение сходно с [3-Nb2O5. На рис. 516 схема-
тически указаны фазы в системе Ga2O3—Nb2O5.
Ниобатные системы
549
Литература
1 Dyer A. J., Е. A. D. W h i t е, Trans. Brit. Ceram. Soc., 63, № 6, 301,
1964.
2 . Philgreen F. A., Journ. Amer. Ceram. Soc., 47, № 1, 49, 1964.
In2O3—Nb2O5
В субсолидусной области (обжиг до 1450°) систему изучали
Дай и Уайт [1]. Обнаружено одно соединение InNbO4 со струк-
турой типа колумбита (рис. 516).
Литература
1. Dyer A. J., Е. A. D. W h i t е, Trans. Brit. Ceram. Soc., 63, № 6, 301,
1964.
T12O3—Nb2O5
В субсолидусной области систему изучали Дай и Уайт [1].
В зависимости от температуры обжига получены различные фазы
(рис. 516). При 800° наблюдалась таллиево-ниобатная фаза
TlNbO4 пирохлорной структуры. Обжиг при 1000° приводил к об-
разованию несколько измененного в структурном отношении со-
единения TlNbO4 и появлению богатой Nb2O5 фазы неизвестной
структуры.
Литература
1. Dyer A. J., Е. A. D. W h i t е, Trans. Brit.'Ceram. Soc., 63, № 6, 301,
1964.
Sc2O3— Nb2O5
В субсолидусной области (обжиг до 1450°) систему изучали
Дай и Уайт [1 ]. Обнаружено два соединения: ScNbO4 со структу-
рой типа вольфрамита и параметрами элементарной ячейки
ао=4.8О, Ьо=5.65, со=5.О9 А, р = 88.3° и Sc3NbO, с дефектной
флюоритовой структурой (возможно, пирохлорной) (рис. 516).
Литература
1- Dyer A. J., Е. A. D. W h i t е, Trans. Brit, Ceram. Soc., 63, № 6, 301,
1964.
550
Ниобатные системы
Y2O3—Nb2O5
Интересна для технологии новых керамических материалов и
минералогии редкоземельных ниобатов.
В субсолидусной области систему изучали Дай и Уайт [1].
Обнаружено два соединения: YNbO4, обладающее структурой
типа фергусонита, с параметрами элементарной ячейки ао=5.3О,
Ьо= 10.96, со=5.О8 А, 0=94.6°, и Y3NbO7 с дефектной флюоритовой
(или пирохлорной) структурой (рис. 516).
Литература
1. Dyer A. J., Е. A. D. W h i t е, Trans. Brit. Ceram. Soc., 63, № 6, 301,
1964.
La2O3—Nb2OB
Система интересна для технологии новых керамических мате-
риалов.
В субсолидусной области (обжиг до 1450°) систему изучали
Дай и Уайт [2]. Обнаружено четыре соединения: LaNbO4 со струк-
Рис. 517. Фазовый состав прокаленных смесей
в системе La2O3—NbaOB.
Фазы, обнаруживаемые в малых количествах, заключены
в скобки.
турой типа фергусонита (это соединение получалось в виде моно-
кристалла из раствора-расплава PbF2) с параметрами элементар-
ной ячейки а0=5.56, Ь,=11.54, со=5.2О А, 0=94.0°; La3NbO7
Ниобатные системы
551
ромбической сингонии, с дефектной Структурой типа флюорита—
веберита; LaNb3O, с перовскитовой структурой; LaNb5O14 неизвест-
ной структуры (рис. 516).
Систему позднее детально изучили Савченко, Година и Ке-
лер [11. Согласно этим авторам, образуются следующие соедине-
ния (рис. 517): LaNbO4, La3NbO7, LaNb3O, и La2Nb12O33 (La2O3-
Рис. 518. Ориентировочная диаграмма состояния
системы Ьа^Оз—Nb2O6.
•6Nb2O6). Последнее соединение, по-видимому, является идентич-
ным полученному Дай и Уайтом, которые принимали формулу
LaNb5O14. LaNbO4 конгруэнтно плавится при 1620+30°. В темпе-
ратурном интервале 450—500° (по данным Руксби и Уайта [3,4])
или 550—600° (по данным Савченко и других) LaNbO4 претерпевает
обратимое полиморфное превращение, переходя из моноклинной
формы в тетрагональную, имеющую параметры кристаллической
решетки: ао=5.4О, с0=11.66 А. Соединение LaNb3O, в зависимости
от условий плавится конгруэнтно при 1470+30°или инконгруэнтно.
La3NbO, плавится конгруэнтно при 1780+30°. Образование нио-
батов лантана начитается уже около 900°, причем первичным
продуктом при любых соотношениях Ьа2О3 и Nb2O5 является
552
Ниобатные системы
La3NbO7, который в дальнейшем, реагируя с Nb2O5, дает осталь-
ные ниобаты. Ориентировочная диаграмма состояния системы
La2O3—Nb2O5 приведена на рис. 518.
Литература
1. Савченко Е. П., Н. А. Г о д и н а, Э. К. К е л е р, в сб.: Химия
высокотемпературных материалов, изд. «Наука», Лен. отд., Л., 99,
1967.
2. Dyer A. J., Е. A. D. W h i t е, Trans. Brit. Ceram. Soc., 63, № 6, 301,
1964.
3. R ooksby H. P., E. D. H. White, Journ. Amer. Ceram. Soc., 47,
№ 2, 94, 1964.
4. R ooksby H. P., E. D. H. White, Journ. Amer. Ceram. Soc., 48,
№ 9, 447, 1965.
CeO2—- Nb2O3
Изучена в субсолидусной области Гольдшмидтом [3], приме-
нявшим препарат, содержащий, кроме СеО2, большое количество
(до 50%) окислов других редкоземельных элементов. Обнаружено
два химических соединения с широкой областью однородности.
Фаза Q с тетрагональной сингонией относится к типу перовскита.
Для соединения, на основе которого образуется эта фаза, при-
нимается состав 3Nb2O5 ^СеОа. Вторая фаза I неизвестной струк-
туры более богата СеО2. Соединение, характерное для фазы I,
имеет примерный состав 3CeO2-7Nb2O5.
Обнаружено образование твердых растворов как в области,
примыкающей к ₽-Nb2O5, так и в области, примыкающей к СеО2.
В двуокиси циркония растворяется до 12 мол.% 0-Nb2O5. Рас-
творимость СеО2 в ₽-Nb2O6 составляет приблизительно 5%.
Иные, чем у Гольдшмидта, фазы описывают Дай и Уайт [2].
Эти авторы производили обжиг порошкообразных смесей (макси-
мальная температура 1450°). Гольдшмидт приготовлял образцы
дуговой плавкой. В трех соединениях, полученных Дай и Уайтом,
принимается трехвалентный церий: CeNbO4 со структурой типа
фергусонита и параметрами элементарной ячейки а0=5.48,
Ьо= 11.30, с0=5.13 А, р=94.5°; Ce3NbO, с дефектной флюоритовой
или пирохлорной структурой; нестехиометрический CeNb4Ou
с перовскитоподобной структурой (рис. 516).
Година с сотрудниками [1], обжигая смеси СеО2 и Nb2O6,
также получали соединения трехвалентного церия: CeNbO4,
Ce3NbOj и CeNb3O,. Кроме того, этими авторами получен ниобат
с формулой Ce2Nb12O33.
Ниобатные системы
553
Литература
1. С а в ч е и к о Е. П., Н. А. Г о д и и а, Э. К. К е л е р, в сб.: Химия
высокотемпературных материалов, изд. «Наука», Лен. отд., Л., 99,
1967.
2. Dyer A. J., Е. A. D. W h i t е, Trans. Brit. Ceram. Soc., 63, № 6, 301,
1964.
3. Goldschmidt H. J., Metallurgia, 62, № 373, 246, 1960.
Pr2O3— Nb2O5
Систему в субсолидусной области изучали Савченко, Година и
Келер II]. Исходными веществами служили Рг6Оп и Nb2O5.
Для выявления вступившей в реакцию окиси празеодима опреде-
лялось содержание активного кислорода. Установлено образова-
ние трех соединений: PrNbO4, Pr3NbO7 и PrNb3O,.
Литература
1. Савченко Е. П., Н. А. Година, Э. К. Келер, в сб.: Химия
высокотемпературных материалов, изд. «Наука», Лен. отд., Л., 99,
1967.
Nd2O3—Nb2O3
Система важна для технологии новых керамических мате-
риалов.
Изучали Дай и Уайт [2] в субсолидусной области (обжиг до
1450°). Обнаружено три соединения: NdNbO4 со структурой типа
фергусонита и параметрами элементарной ячейки а0=5.45,
Ь0=Н-24, с0=5.13 А, р=94.5°; Nd3NbO, с ромбической или де-
фектной (типа флюорита—веберита) структурой; NdNb3O, с перов-
скитоподобной структурой (рис. 516).
Савченко с сотрудниками [1 ] в результате изучения твердо-
фазовых реакций методом термографии с последующим рентгенов-
ским и фазовым химическим анализом обнаружили три соедине-
ния: NdNbO4, NdNb3O9, Nd3NbO7. Установлен ступенчатый харак-
тер образования этих ниобатов. В качестве первичного продукта
реакции образовывались соединения, более богатые окислами
редкоземельных элементов.
Литература
1. С а в ч е н к о Е. П., Н. А. Г о д и и а, Э. К. К е л е р, в сб.: Химия
высокотемпературных материалов, изд. «Наука», Лен. отд., Л., 99,
1967.
2. Dyer А. I., Е. A. D. W h i t е, Trans. Brit. Ceram. Soc., 63, № 6, 301,
1964.
554
Ниобатные системы
Sm2O3— Nb2O5
Система интересна для технологии новых редкоземельных
керамических материалов.
В субсолидусной области (обжиг до 1450°) систему изучали
Дай и Уайт [1]. Обнаружено два соединения: SmNbO4 со струк-
турой типа фергусонита и параметрами элементарной ячейки
а0=5.41, Ьо=11.15, с0=5.12 А, р=94.7°; Sm3NbO7 с дефектной
флюоритовой или пирохлорной структурой (рис. 516). SmNbO4
при 700—750° имеет полиморфное превращение, переходя в тетра-
гональную симметрию с параметрами элементарной ячейки
а0=5.28, со=11.3О А.
Литература
1. Dyer A. J., Е. A. D. W h i t е, Trans. Brit. Ceram. Soc., 63, № 6, 301
1964.
Gd2Oj—Nb2O5
В субсолидусной области, приблизительно до 1400°, изучена
Ротом [21, ограничившимся концентрационной областью от со-
единения GdNbO4 до чистого Gd2O3 (рис. 519).
Кроме соединения GdNbO4, обнаружено несколько типов твер-
дых растворов: т. р. —
твердый раствор типа флюо-
рита с дефектной структу-
рой; Ст. р. — кубический,
типа флюорита; В т. р. —
твердый раствор со структу-
рой типа В, характерной
для окислов редкоземельных
элементов.
Соединение GdNbO4 су-
ществует в виде двух мо-
дификаций: высокотемпера-
турной, тетрагональной со
структурой типа шеелита и
низкотемпературной, моно-
клинной со структурой типа
фергусонита. Точка перехода одной модификации в другую 850°.
Дай и Уайт [1 ], помимо GdNbO4, отмечают соединение Gd3NbO7
(рис. 516) с дефектной флюоритовой или пирохлорной структурой.
"C
1000
Tempae+Tz mp.
- 850°
Моноклин+Тгт.р
Bmp
Тг mp+Cmp. V
i. । A
E=
Cm.p.+
Bmp.
70 80 90 100
Мол.°/о
S0 ВО
Рис. 519. Диаграмма состояния системы
Gd2O3— GdNbO4.
ё
Ёиобатные системы
555
Твердых растворов имине обнаружено. Низкотемпературная форма
GdNbO4 имеет параметры элементарной ячейки: а0=5.37, Ьо—11.09,
с0=5.11 А, ₽=94.7°.
Литература
1. Dyer A. J., Е. A. D. W h i t е, Trans. Brit. Ceram. Soc., 63, № 6, 301,
1964.
2. Roth R. S., in: Rare Earth Research, New York, 92, 1961.
Nb2Os
Интересна для получения новых полупроводниковых мате-
риалов.
Плоетц, Маккигроссо, Осика, Джекоби [2], проводя обжиги
смесей Dy2O3 и Nb2O5 в области 800—1850°, нашли соединение
DyNbO4 и твердые растворы DyNbO4 в Dy2O3. Соединение DyNbO4
плавится при 1950+20° и имеет показатель светопреломления
выше 2.11.
Дай и Уайт [1 ], помимо соединения DyNbO4, обнаружили вто-
рое соединение Dy3NbO, (рис. 516) с дефектной флюоритовой или
пирохлорной структурой. DyNbO4 моноклинной сингонии со
структурой типа фергусонита имеето параметры элементарной
ячейки: а0=5.23, Ьо=11.О2, со=5.1О А, р=94.5°.
Литература
1. Dyer A. J., Е. A. D. W h i t е, Trans. Brit. Ceram. Soc., 63, № 6, 301,
1964.
2. P 1 о e t z C. L., A. T. Muccig rosso, L. M. 0 s i k a,
W. R. J acoby, Journ. Amer. Ceram. Soc., 43, № 3, 154.. 1960.
PbO— Nb2O5
Химические соединения, образующиеся в этой системе, имеют
первостепенное значение для разработки новых материалов для
электронной техники. Систему наиболее полно изучил Рот [3, 4].
Им обнаружено большое количество соединений (рис. 520).
Полученное Ротом соединение 3PbO-Nb2O5 имеет дефектную
пирохлорную структуру. Параметры гранецентрированной тетра-
гональной ячейки этой фазы следующие: а=10.658, с=10.824 А.
556
Ниобатные системы
Соединение 5РЬО ^NbaOg, по данным того же автора, имеет
ромбоэдрическую структуру пирохлорного типа с параметрами:
а= 10.709 А, ал=88°14'.
Соединение 2PbO*Nb2O5 относится к ромбоэдрической си-
стеме и имеет, по Роту, параметры элементарной ячейки: а=
= 10.676 А, а=88°44'.
'С
1400 -
1200
1000
600
100
РЬО
Ж*Р5М2-Р2Нт.р.
1220°^a
985' „
/ )K+P3N
>o 835
Р m.p.* P3N
p3n+p5n2------
Ж+T-PN m.p. ж+PN
)K+P2N T-PNm.p\ Ж*РМ2тр. / 2
1Z3T] 1343°-^
э
1175'
T-PNmp
R-PNm.p.
„ 1233 Я ° о
P^mA Nm.p.
T-PNm.p. 1
PN2m.p. 1
P2N
P3N2
№
P,N
m.p.
Рз^г
R-PN
R-PNm.p.
Р Ng m.p.
R-PNm.p.
80 I I \ \
p2n p3N2 pn
—PN2m.p.
40
PNg
20
0
иЬго5
800 W
1
1
Мол.7. о1 а2 »3
Рис. 520. Диаграмма состояния системы РЬО—Nb2O5.
Р — желтая РЬО, ромбическая; PaN—3PbO.NbaO6; P6Na—5РЬО .2NbaO6;
PjN—2PbO.NbaO(; P»N,—3PbO.2NbjO6; T-PN—тетрагональный PbO.NbaOb:
R-PN—ромбоэдрический PbO-NbaOs; PN,—PbO.2Nb,O6; N — Nb2Os. 1 —
плавления не обнаружено; г — частичное плавление; з — полное плавление.
Соединение 5PbO-2Nb2O5 изоструктурно с 2PbO-Nb2O5, и
эти два ниобата образуют непрерывную серию твердых растворов.
Соединение PbO-Nb2O5 существует в двух стабильных фор-
мах — низкотемпературной ромбоэдрической и высокотемпера-
турной тетрагональной модификациях. Согласно Роту, элемен-
тарная ячейка первой модификации имеет параметры: 1) для ромбо-
эдрической ячейки а= 7.184 А, а=93°55'; 2) для гексагональной
ячейки а=10.510, с=11.562 А. По Куку [1], параметр ромбо-
эдрической элементарной ячейки а=7.168 А, а=93°52'; пара-
метры гексагональной элементарной ячейки а= 10.473, с=11.549 А
Инвариантные точки системы РЬО—Nb2O5
Точка Фазы Процесс Состав, мол. % Темпера- тура, “С
РЬО Nb2O6
1 РЪО-|-жидкость. Плавление. 100 0 883 ±5
2 РЪО+ЗРЬО- ИЬ2О6+жидкость. Эвтектика. 94 6 835
3 ЗРЬО- Nb2O84-5PbO- 2Nb2O8-|-жидкость. Инконгруэнтное плавление. — — 985
4 5РЪО- 2Nb2O8+(5PbO- 2Nb8O8+2PbO- Nb2O8) т. p. 4-жидкость. Плавление. — — 1220
5 (5PbO-2Nb2O84-2PbO-Nb8O8) т. p.±2PbO- • ИЪ2О84-жидкость. » — — 1233
6 2PbO-Nb2O84-3PbO-2Nb2O8-|-жидкость. Эвтектика. 66 34 1225
7 ЗРЬО • 2Nb2O84- PbO • Nb2Oe тетрагон.-(-жидкость Инконгруэнтное плавление. — — 1233
8 PbO-Nb2O8 тетрагон.-|-(PbO-Nb2Oe тетрагон.) т. p.-(-жидкость. Плавление. — — 1343
9 (PbO-Nb2O8 тетрагон.) т. p.-|-PbO-Nb8O8 т. р. 4-жидкость. Эвтектика. 41 59 1310
10 PbO-2Nb2O8 т. р.-J-РЬО-2Nb2O8+жидкость. Плавление. — — 1337
11 PbO-2Nb8O84-Nb2O8 т. р.4-жидкость. Эвтектика. 30 70 1334
12 Nb2O84- жидкость. Плавление. 0 100 1500 ±10
13 PbO-Nb2O8 тетрагон.-j-РЬО-Nb2O8 ромбич. Полиморфное превращение. — — 1150
14 (PbO-Nb2O8 тетрагон.) т. p.+(PbO-Nb2O8 ром- бич.) т. р. То же. — — 1175
558
Ниобатные системы
Высокотемпературная тетрагональная модификация РЬО ^Ь2ОБ
индицирована на основе тетрагональной элементарной ячейки
с параметрами: а=12.56, с=3.925 к [2]. Температура перехода
ромбоэдрической модификации в тетрагональную 1150°. Кроме
того, существует метастабильная ромбическая ферроэлектри-
ческая модификация с параметрами элементарной ячейки:
а=17.63, 6=17.93, с=3.868 к. При нагревании (от комнатной
температуры до 700°) метастабильный ниобат свинца переходит
в стабильную ромбоэдрическую форму.
Интересный тип твердых растворов наблюдается в области,
примыкающей к РЬО. Эти неравновесные твердые растворы вслед-
ствие большого различия ионных радиусов РЬ2+(1.20 к) и Nb6+
(0.69 к) должны относиться к типу твердых растворов внедрения.
Кеммлер-Зак и Рюдорф [2 ] приводят • параметры элементар-
ных ячеек соединений Pb2Nb2O7, Pb2 BNb2O7 в и Pb3Nb2O8, мало
отличающиеся от найденных Ротом. Для соединения ЗРЬО-2Nb2OB
с кубической решеткой а= 10.55 к. Плотность для каждого состава
определялась на двух образцах. Приводятся следующие данные:
ЗРЬО -2Nb2OB - 6.72 и 6.71 г/см8; 2РЬ0 -Nb2OB - 7.43 и 7.26 г/см8;
5РЬ0 -2Nb2OB - 7.75 и 7.45 г/см3; ЗРЬО Nb2OB - 7.99 и 7.98 г/см8.
Литература
1. Cook W. R., Bull. Amer. Ceram. Soc., 37, № 4, 33, 1958.
2. К e m m 1 e r - S a c k S., W. Rudorfi, Zs. anorgan. allgem. Chem.,
344, № 1—2. 23, 1966.
3. R о t h R. S., Acta crystallogr., 10, № 6, 437, 1957.
4. R о t h R. S., Joum. Res. Nat. Bur. Stand., 62, № 1, 27, 1959.
TiO2—NbaOB
Изучена Ротом и Кофаноуром [2]. Обнаружено два конгру-
энтно плавящихся соединения: TiO2-3Nb2OB и TiO2-Nb2OB, с тем-
пературами плавления 1480 и 1490° соответственно (рис. 521).
Три эвтектики в системе имеют следующий состав и температуру
плавления: 21 мол. % TiO2, 1467°; 38 мол. % TiO2, 1465°; 58 мол. %
TiO2, 1475°. При эвтектической температуре 1467° в окиси ниобия
растворяется 12—13 мол. % ТЮ2. При эвтектической темпера-
туре 1475° в твердый раствор на основе ТЮ2 входит 17 мол. %
Nb2OB.
Груэн и Шэфер [1 ], обжигая в температурном интервале 1100—
—1400° совместно осажденные из водного раствора окислы титана
Ниобатные системы
559
и ниобия, получили еще несколько соединений и однородных фаз,
которым приписывают следующие формулы: (Ti, Nb)O2 333; (Ti,
Nb)O2 417 (это соединение имеет две полиморфные модификации);
(Ti, Nb)O2,4в7-2л?»! (Ti> Nb)O2.482 и (Ti, Nb)O2 49_2 B0.
°C
Рис. 521. Диаграмма состояния системы
TiO2—NbaOB.
Рот, Уодслей и Гейтхауз [3] полагают, что богатые Nb2OB
фазы в системе TiO2—Nb2OB можно выражать двумя общими
формулами: Ме3яО8я_3 и Ме3я+1О8я_2. К первому типу относится
полученное этими авторами соединение Ti2Nb10O29 (ге=4), ко вто-
рому типу — соединение TiNb24O62 (ге=8). Структуру этих фаз
изучал Уодслей [4].
Литература
1. Gruelin R., Н. Schafer, Naturwissensch., 50, № 20, 642, 1963.
2. Roth R. S., L. W. Coughanour, Journ. Res. Nat. Bur. Stand.,
55 № 4 209 1955.
3. R о t h R. S., A. D. W a d s 1 e у, В. M. Gatehouse, Natur-
wissensch., 51, № 11, 262, 1964.
4. W a d s 1 e у A. D., Acta crystallogr., 14, № 6, 660, 664, 1961.
560
Ниобатные системы
ZrO2— Nb2O5
Интересна для получения полупроводниковой керамики.
В системе, согласно Роту и Кофаноуру [2], существует одно
соединение 6ZrO2-Nb2O5 и широкая область твердых растворов
(рис. 522). 6ZrO2-Nb2O5 изоструктурен с ZrO2-TiO2 и имеет ром-
бическую симметрию со следующими параметрами элементарной
ячейки (для образцов, зака-
ленных от 1550°): оа=4.964,
6=5.120, с=5.289 А. Соеди-
нение 6ZrO2-Nb2O5 плавится
инконгруэнтно приблизитель-
но при температуре 1670°.
Эвтектика между Nb2O5
т. р. и 6ZrO2-Nb2OB т. р.
имеет температуру 1435°.
Гольдшмидт [1 ], проведя
исследование на образцах,
полученных спеканием окис-
лов, наблюдал кубические
твердые растворы в области
концентраций приблизитель-
но 55—70 мол. % ZrO2. Гольд-
шмидт отрицает существо-
вание твердых растворов на
основе соединения 6ZrO2 •
• Nb2O5 и считает, что в системе
имеются твердые растворы
трех типов: Nb2O5 твердый
раствор, кубический ZrO2 твердый раствор и моноклинный
ZrO2 твердый раствор для образцов, полученных спеканием
при 800°.
Уоринг и Рот [3] показали, что твердые растворы на основе
Nb2OB содержат в действительности дискретные фазы. Ими опи-
сывается соединение ZrNb24O62, изоструктурное TiNb24O62.
Литература
1. Goldschmidt Н. J., Metallurgia, 62, № 373, 217, 1960.
2. R о t h R. S., L. М. Coughanour, Journ. Res. Nat. Bur. Stand.,
55, № 4, 209, 1955.
3. Woring J. L., R. S. R о t h, Journ. Res. Nat. Bur. Stand., 69A, № 2,
119. 1965.
Ниобатные системы
561
V02— NbO2
Мариндер и Магнели [1], нагревая в запаянных эвакуиро-
ванных кварцевых трубках при 1000° в течение нескольких
дней смесь V2O5, Nb2O5 и металлический ниобий в различном
соотношении, получили твердый раствор, в котором ванадий
и ниобий были, как утверждают авторы, в четырехвалентном
состоянии. Однако химических анализов, подтверждающих такое
валентное состояние, не приведено. Эта фаза имела область го-
могенности, находящуюся по крайней мере в пределах от состава
Vo 25Nb0 7БО2 до Vo 75Nb0 25О2. Параметр элементарной ячейки
образцов указанных составов был соответственно: а=4.759,
с=3.018 А и а=4.602, с=2.956 А.
Рис. 523. Параметры элементарной ячейки
(а и с) рутиловой фазы (V1_xNbx)O2.
Рюдорф и Мерклин [2] получали смешанные окислы нагре-
ванием смеси NbO2, V2O3 и V2O5 в эвакуированной кварцевой
ампуле при 1000—1100°. Изменение параметров элементарной
ячейки полученных твердых растворов (V1_a.Nba.)O2 представлено
на рис. 523. Тетрагональная рутиловая фаза распространяется
при 20° от ж=0.1 до ж=0.9. Препарат (Vo ,5Nb0 05)О2 обнаружи-
вает характерную для VO2 моноклинную структуру. Измерение
магнитной восприимчивости и электропроводности показало,
что рутиловая фаза в рассматриваемой системе состоит из твер-
дых растворов двух типов. При значении а: от 0 до 0.5 твердые
растворы следует выражать формулой (Vfi^Vs+Nb^jOj, т. е. здесь
налицо ионы четырех- и трехвалентного ванадия, а весь нио-
бий находится в пятивалентном состоянии. При х, изменяю-
щемся от 0.5 до 1.0, формула твердого раствора будет
(VjJj:>Nb5+tNb|i_1)O2, т. е. здесь в различной валентности при-
36 Н. А. Торопов и др., кц. I
562
Ниобатные системы
сутствует ниобий. При составе, отвечающем Vo 5Nb0 5О2=
=VNbO4, весь ванадий находится в трехвалентном, а ниобий
в пятивалентном состоянии. Таким образом, систему VO2—NbO2
следует рассматривать состоящей из двух частей: 1) твердого
раствора VO2 в VNbO4; 2) твердого раствора NbO2 в VNbO4.
Приводимые значения валентности ниобия и ванадия недо-
статочно убедительны, так как авторы не пользовались методами
ядерного и магнитного резонанса.
Литература
1. М arinder В.-О., А. М a g n е 1 i, Acta chem. Scand., 12, № 6, 1345,
1958.
2. Rii d or f i W., J. M ark 1 i n, Zs. anorgan. allgem. Chem., 334, № 3—4,
142, 1964.
V2O5—Nb2O5
Изучена в субсолидусной области Гольдшмидтом [1 ]. Твердые
растворы образуются только в области, примыкающей к Nb2O5.
Здесь обнаружено два типа твердых растворов: фаза р (в струк-
турном отношении сходная с p-Nb2O5) и фаза р' с несколько от-
личной рентгенограммой. Фаза р содержит до 10 мол.% V2O5,
для фазы р' характерна более высокая концентрация V2O5.
При пониженных температурах фаза р' находится в равно-
весии с V2O5, и на диаграмме имеется двухфазная область:
P'+V2O5. В высокотемпературной области фаза Р' переходит
в рутиловую фазу приблизительного состава Nbx 5V0 5О5.
В системе Nb2O5—V2O5 обнаружена такая последовательность
фаз по мере увеличения концентрации V2O5. Область повышенных
температур: фаза р-> рутиловая фаза -> V2O5; область понижен-
ных температур: фаза р~>фаза р'-> V2O5.
Детально систему исследовали Уоринг и Рот [2] методом
закалки с использованием запаянных платиновых трубок. Опи-
сывается три инконгруэнтно плавящихся соединения: V2O5>
•9Nb2O5 (VNb,O25), нестехиометрическое соединение V2Nb23O62
и соединение с неустановленной формулой (соединение X), содер-
жащее приблизительно 93—94 мол.% Nb2O5. Обнаружен твердый
раствор на основе Nb2O5. В решетку Nb2O5 входит около 5 мол.%
V2O5, причем точка плавления Nb2O5 от 1485° снижается до 1332°.
Возможно, на участке 90—99 мол.% Nb2O5 имеется несколько
дискретных фаз, но обнаружить их не удалось.
Ниобатные системы
563
На рис. 524 представлена равновесная фазовая диаграмма
системы; примыкающий к №Ь2ОБ участок в укрупненном масштабе
представлен на рис. 525. Растворения Nb2OB в пятиокиси ванадия
не было обнаружено. Эвтектика вблизи V2OB содержит прибли-
зительно 1 мол.% Nb2OB и плавится при 648°. Согласно новым
данным, полученным в Бюро стандартов (США), в качестве тем-
пературы плавления V2OB принимается 675+5°.
°C
Рис. 524. Диаграмма состояния системы V2OB—Nb2O6.
1 — отсутствие плавления; g — частичное плавление;
3 — полное плавление.
Соединение V2OB-9Nb2OB, плавящееся с разложением при
1290°, было индицировано на основе объемноцентрированной
тетрагональной ячейки с параметрами: а=15.72, с=3.821 А.
Это соединение изоструктурно с целой серией соединений, полу-
ченных этими же авторами: PNb9O2B, PTa9O2B, VTa9O2B, Та2Ов •
•2Nb2OB.
На основании структурных соображений (изоструктурности
отсоединением TiO2-12Nb2OB) авторы считают, что для инконгру-
энтно плавящегося при 1322° соединения следует принимать
36*
564
Ниобатные системы
формулу V2Nb23O62, а не 2V2O5-23Nb2O5, т. е. относить к типу
соединений МеБ0О124, а не МеБ0О12Б. Соединение V2Nb23Oe2 было
индицировано на основе моноклинной ячейки с параметрами:
°?
1900-
1300
133Г _
~ _7+ж_ _
2V205-23Nb20s^
1288’
1220
Nb205m.p.*X
Nb2°5 m.p.
2V205-23N^X
~7^ ~1Z89°~ ।
1 NbJkmps
V^-ONb^X
ЯГ| 99~
2-23 ФазаХ
Мол. %
91
95
Мго5
№
Рис. 525. Часть диаграммы состояния системы,
показывающая область, богатую Nb2O5.
а=29.77, 6=3.823, с=21.05 А, р=95°1.6. Фаза X имеет рентгено-
грамму, сходную с таковой для высокотемпературной модифика-
ции Nb2O5, однако имеющиеся различия в малоугловой области
не позволяют считать фазу X твердым раствором на основе Nb2OB.
Литература
1. Goldschmidt Н. J., Metallurgia, 62, № 373, 215, 1960.
2. Waring J. L., R. S. R о t h, Joum. Res. Nat. Bur. Stand., 69A, № 2,
119, 1965.
Ta2O5— Nb2O5
Имеет значение в электронной технике, производстве жаро-
прочных сплавов и пр.
По рентгенографическим данным Шефера, Дюркопа и Иори [2],
Nb2O5 и Та2ОБ, существующие в нескольких модификациях, обра-
зуют в твердом состоянии твердые растворы (Nb, Та)2ОБ с обрати-
мыми превращениями в них. В некоторой узкой концентрацион-
ной области сосуществуют твердые растворы на основе Nb2Og
и Та2Ов.
Ниобатные системы
565
Гольдберг и Рейзман [1 ] в результате проверочного изучения
системы Nb2O5—Та2ОБ предложили диаграмму состояния, изобра-
женную на рис. 526.
Соединение 2Nb2O5 -Та2О5 имеет объемноцентрированную ку-
бическую элементарную ячейку с а=15.76 А. Ниже 1450° оно
1800 ‘ Жидк /w?
1700 ~ ' "а~Та-А т-ру> х
m a-Nb2Osm.p.*^\'^2NbzOiT(Lz(K^''
\ а-Таль m.p.
—\а-Т(1205т.рл г s г
mp.
пп Wb^-TaM —‘--i- -7"
Wm6biM<Hra<«|i«<4> X 1360
р-Таг0Гт.р. — -=• ,
-t2Nb,0j~Ta20j х х
1300 '“•••••••»«•••• <х хх - х хх хх х:
a-Nb2O5m.p. “а^/а^тр. ft-Ta205 т.р
12G0<~* • • • « «» • « « « • «*х хх х хх х х х::
11(Ю ~ « •« • « • х х х хх )
1000 ----L,--L_J«_1_L»-----Л—Х-1----it--Ц<-----i---i
'0 10 20 30 90 50 60 70 80 90 100
мЪг0} Мол.% Ta2°s
,1 ,2 оЗ х9
Рис. 526. Диаграмма состояния системы
Та2О8—NbgOg.
1 — a-NbaO( т. р.; г — <х-Та1О, т. р.; з — 2NbaO( •ТааОа;
4 — ₽-ТааО, т. р.
разлагается, образуя две фазы в области, простирающейся от
25 до 51 мол.% Та2ОБ: a-Nb2O5 твердые растворы и |3-Та2ОБ
твердые растворы. Превращение 2Nb2O5-Ta2O5 в указанные а-
и |3-фазы требует значительной перестройки, и равновесие дости-
гается после 3-недельной или 6-месячной тепловой выдержки.
Литература
1. Holtzberg F.,A. Reisman, Journ. Phys. Chem., 65, № 7, 1192,
1961.
2. Schafer H., A. D u r k о p, M. J о r i, Zs. anorgan. allgem. Chem.,
275, № 6, 289, 1954.
566
Ниобатные Системы
Bi2O3—Nb2O3
Систему изучили Рот и Уоринг |1]. Обнаружено пять соеди-
нений, из которых только одно Bi2O3-Nb2O3 плавится конгруэнтно
при 1245°. Соединения 5Bi2O3-3Nb2O3, 4Bi2O3-9Nb2O3 и Bi2O3?_
• 6Nb2O3 плавятся инконгруэнтно (соответственно при 1193,
1183 и 1242°). Интересно, что пятое соединение Bi2O3-5Nb2O3
устойчиво только при низких температурах и диссоциирует в твер-
дом состоянии при 1095° на 4Bi2O3-9Nb2OB и Bi2O3-6Nb2O3. По-
следние два соединения, наоборот, устойчивы только при повы-
шенных температурах и диссоциируют соответственно при 1070
и 1002°.
Установлена растворимость Nb2O5 в Bi2O3. Предельный твер-
дый раствор содержит 23.5 мол.% Nb2O3. Этот твердый раствор
существует в виде двух модификаций — кубической С т. р. и
псевдокубической С т. р. Морфотропное превращение происходит
при содержании 19.5 мол.% Nb2O3 в твердом растворе. В связи
с образованием твердых растворов снижается температура поли-
морфного превращения Bi2O3 кубич. -> Bi2O3 моноклин, (от 730
до 610°).
Соединение Bi2O3-Nb2O5 существует в двух модификациях —
низкотемпературной ромбической и высокотемпературной три-
клинной с температурой перехода 1020°. Параметры элементар-
ных ячеек: ромбической — а=4.980, 6=11.70, с=5.675 А; три-
клинной — а=7.611, Ь=5.536, с=7.91. А, а=89.88°, р= 77.43°,
7=87.15°.
Соединение 5Bi2O3-3Nb2O6 может быть индицировано на ос-
нове тетрагональной дефектной пирохлорной структуры с пара-
метрами: а=10.912, с=10.496 А.
Соединение 4Bi2O3-9Nb2O3 может быть Индицировано на ос-
нове гексагональной элементарной ячейки с параметрами: а=6.447,
с= 19.778 А.
Соединения Bi2O3-5Nb2O3 и Bi2O3-6Nb2O5 имейт низкую сим-
метрию и в структурном отношении являются производными
чистой окиси ниобия (Nb2O3).
Литература
1. R о t h R. S., J. L. Waring, Journ. Res. Nat. Bur. Stand., 66A, № 6,
451, 1962.
Ниобатные системы
567
Сг2О3—Nb2O3
В работах Гольдшмидта [3] и Фелтена [2] приводятся лишь
краткие сведения о системе. Установлено образование одного
соединения CrNbO4 и некоторая растворимость Сг2О3 в пяти-
окиси ниобия. Фелтен, обжигая смеси Сг2О3 и Nb2O5 при 1200°,
установил, что предельная растворимость Сг2О3 находится в ин-
тервале между 2 и 4 мол.%. Согласно Гольдшмидту, CrNbO4
имеет структуру рутила (тетрагональную) с параметрами эле-
ментарной ячейки: а=4.675, с=3.009 А.
Трунов, Полыцикова и Ковба [1 ] изучили богатый Nb2O3
участок системы. Обнаружено соединение Cr2O3-49Nb2O5l имею-
щее весьма заметную область гомогенности и характеризующееся
моноклинной сингонией с параметрами элементарной ячейки:
а=29.79 +0.02, 6=3.821+0.001, с=21.12+0.02 А, ₽=95°05'+11',
Z=l.
Литература
1. Т р у и о в В. К., 3. Я. П о л ь щ и к о в а, Л. М. Ковба, Вести.
Моск. гос. унив., сер. II, хим., № 3, 89, 1966.
2. F е 1 t е n Е. J., Journ. Less-Common. Metals, 9, № 3, 206, 1965.
3. Goldschmidt H. J., Metallurgia, 62, № 374, 211, 241, 1960.
U3O8—Nb2O3
Прокаливая смеси исходных окислов при температурах не
выше 1050°, Комков и Белопольский [1, 2] получили три дис-
кретные фазы, отвечающие составам: U3O8-4.5Nb2O5, U3O8-
•1.5Nb2O5 и 4U3O8-Nb2O5. При повышении температуры прокали-
вания возникают гомогенные области (твердые растворы). При
температуре 1200° наблюдается непрерывная однофазная об-
ласть, простирающаяся от U3O8 до 2U3O8-1.5Nb2O5, при этом
параметры элементарной ячейки (псевдоячейки) закономерно
изменяются от а'=6.72, 6'=3.968, с'=4.148 А (для U3O8) до а' =
= 6.58, 6'=3.846, с'=4.074А (для 2U3O8-1.5Nb2O5).
Соединение U3O8‘4.5Nb2OB характеризуется гексагональной
элементарной ячейкой и параметрами а=12.77, 6=15.91 А;
соединение U3O8-1.5Nb2O5 ромбической сингонии имеет пара-
метры кристаллической решетки: а0= 32.32, 60= 30.26, с0=32.16 А;
ромбическая фаза 4U3O8-Nb2O5, сходная по своей структуре
с U3O8, имеет параметры (псевдоячейки): а'=6.66, 6'=3.912,
с'=4.Ц4 А.
568
Ниобатные системы
Литература
1. К о м к о в А. И., в сб.: Рентгенография минерального сырья, № 5,
изд. «Недра», М., 45, 1966.
2. К о м к о в А. И., М. П. Белопольский, ДАН СССР, 160,
№ 5, 1172, 1965.
FeO— Nb2O5
Систему изучили Бурдезе и Борлера [1 ]. Установлено су-
ществование пяти соединений: 4FeO-Nb2O6, FeO-Nb5O5, FeO-
• 7Nb2O5, FeO-18Nb2O5 и FeO-34Nb2O6. Кроме того, отмечаются
области^твердых растворов (рис. 527).
‘С
1600
мо
1200
1000
150015"
* 1475*-5" 1360:10° 1460! 10
1455*-5°
М4 1:7
- t-а
6е0ЫЬг05
(рутил)
А 1365--10°
?200'-57
(копимби
FeQlw205\'
FeO )
4FeO NbzO51 (вюстит]
0 20 40 60 80 100
Nh°5 Мол. % Fe0
Рис. 527. Диаграмма состояния системы
FeO—Nb2O5.
Соединение FeNb2Oe существует в двух полиморфных формах
с температурой перехода 1360+10°. Плавящаяся при 1460+10°
высокотемпературная (типа рутила) модификация имеет пара-
метры элементарной ячейки: а0=4.754, со=З.О72 А, с/а=0.646.
Низкотемпературная модификация имеет структуру типа колум-
бита с параметрами ячейки: ао=5.О37, Ьо=14.19О, с0=5.697 к.
Соединение 4FeO-Nb2O5, плавящееся инконгруэнтно около 1200°,
имеет структуру гематита. Богатые Nb2O5 фазы: FeO-7Nb2O5,
FeO-18Nb2O5 и FeO-34Nb2O5 — могут рассматриваться как про-
изводные близких Nb2O5 окислов ниобия NbO3 40, NbO2 4e и
Ниобатные системы
569
NbO2 48 соответственно. В соединении FeO • 7Nb.2Os отношение
- п ° ^у-=2.400, в соединении FeO-18Nb2O5 это отношение со-
ставляет величину 2.460 и в соединении FeO —2.478. Эв-
тектика, плавящаяся при 1345+5°, содержит 30 мол. % FeO, пла-
вящаяся при 1190° — 75 мол. % FeO.
Литература
1. В u г d е s е А., М. L. В о г 1 е г a, Metallurgia Ital., 57, № 4, 150, 1965.
Fe2O3— Nb2OB
Систему изучили Бурдезе и Борлера [2], исследуя твердофазо-
вые реакции в интервале 1100—1500°. Кривые ликвидуса нанесены
ориентировочно (рис. 528).
Установлено существование четырех соединений: Fe2O3-Nb2O5,
Fe2O3-9Nb2O6, Fe2O3-25Nb2O6 и Fe2O3-49Nb2O5. Ниобат трех-
валентного железа FeNbO4 плавится конгруэнтно при 1445+10°
и существует в двух полиморфных формах с точкой перехода
1340+10°. Высокотемпературная форма гексагональной сингонии
со структурой типа рутила имеет параметры элементарной ячейки:
а=4.718, со=З.О52 А, с/а=0.647. Низкотемпературная ромбиче-
ская форма имеет структуру колумбита и следующие параметры
элементарной ячейки: а0=4.993, Ь0=13.95 и с0=5.581 А. Обе кри-
сталлические формы FeNbO4 образуют твердые растворы с Nb2O5.
В предельном твердом растворе высокотемпературной формы
содержится 30 мол.% Fe2O3, а параметры элементарной ячейки
возрастают до значений: а0=4.74, со=3.04 А.
Твердый раствор колумбитовой формы имеет максимальное
содержание Fe2O3 40 мол.% и параметры элементарной ячейки:
а0=4.97, Ь0=13.91, с0=5.61 А.
Инконгруэнтно плавящиеся высокониобатные фазы: Fe2O3-
•9Nb2O5, Fe2O3 • 25Nb2O5, Fe2O3 • 49Nb2O5 — рассматриваются
Бурдезе и Борлера как производные близких к Nb2O5 окислов
ниобия NbO2 40, NbO2 4в и NbO2 48 соответственно. В соединении
Fe2O3-9Nb2Os отношение ш° v составляет величину 2.400,
в соединении Fe2O3-25Nb2O5 это отношение равно 2.462 и в соеди-
нении Fe2O3-49Nb2O5 — 2.480. Две эвтектические точки системы
при 1360 +5 и 1370+5° содержат соответственно 23 мол.% Fe2O3
и 70 мол.% Fe2O3.
570
Ниобатные системы
Трунов, Полыцикова и Ковба [1], изучившие богатую Nb2OB
часть системы, получили два соединения: Fe2O3-llNb2OB и Fe2O3-
•49Nb2OB. Первое соединение ромбической сингонии (изострук-
Рис. 528. Диаграмма состояния системы
Ке2О3—Nb3OB.
турное ромбической модификации Ti2Nb10O29) имеет параметры
элементарной ячейки: а=28.70 +0.03, 6=3.829 +0.002 А,
0=20.65+10, Z=4.
Соединение FeNb49O124 имеет заметную область гомогенности,
оно относится к моноклинной сингонии с параметрами элементар-
ной ячейки: а=29.76+0.02, 6=3.18+0.001, с=21.16+0.02 А,
Р=95°05'+10', Z=l.
Литература
1. Т р у н о в В. К., 3. Я. П о л ь щ и к о в а, Л. М. Ковба, Вести.
Моск. гос. унив., сер. II, хим., № 3, 89, 1966.
2. Burdese А., М. L. В о г 1 е г a, Metallurgia Italiana, 57, № 4, 150,
1965.
Со304—NbaOj
Систему в субсолидусной области изучал Гольдшмидт [1 ],
получавший образцы для исследования по керамической техно-
логии. Обнаружена значительная (порядка 10 мол.%) раствори-
мость Со3О4 в 0-Nb2O5 (высокотемпературная модификация),
несколько уменьшающаяся с понижением температуры. Вблизи
Ниобатные системы
571
состава Co3O4-2Nb2O5 обнаружена рутиловая фаза с некоторой
областью гомогенности; при понижении температуры рутиловая
фаза переходит в другую модификацию — колумбитовую. При
более высоком содержании Со3О4 появляется гематитовая фаза,
в которой отношение металл : кислород равно 2 : 3. Вероятно,
здесь некоторое количество Со3О4 переходит в СоО. Фаза со струк-
турой гематита имеет некоторую узкую область гомогенности.
В зависимости от температурных условий кислородное соеди-
нение кобальта было обнаружено в виде шпинельной фазы — Со3О4
(при пониженных температурах) либо фазы СоО1+х со структурой
поваренной соли (при повышенных температурах). В общем фазо-
вые переходы (по мере повышения содержания Со3О4) можно пред-
ставить в виде следующей схемы:
ml рутиловая фаза ,
ГОЬЛл -* ——з---------------> гематитовая фаза -►
i 6 колумбитовая фаза т
С°О1+Ж (тип поваренной соли)
Со3О4 (тип шпинели)
Литература
1. Goldschmidt Н. J., Metallurgia, 62, № 373, 212, 1960.
NiO—Nb2O5
Интересна для технологии смешанных кристаллических ката-
лизаторов.
Гольдшмидт [1] изучал фазы, образующиеся при сплавлении
и прокаливании (800°, 14 дней) смесей NiO и Nb2OB. Обнаружен
твердый раствор NiO в Nb2O5, доходящий до 10 мол.% NiO. Уста-
новлено образование соединения NiO-Nb2O6, имеющего широкую
область гомогенности и существующего в двух модификациях:
1) рутиловой, устойчивой при высокой температуре; 2) со струк-
турой типа колумбита, устойчивой при пониженных температурах.
Превращение R -> С сопровождается отделением небольшого
количества Nb2O5, т. е. в образующемся колумбите имеется избы-
ток NiO против стехиометрии NiNb2Oe. Кроме того, найден твердый
раствор со структурой типа гематита вблизи состава 4NiO-Nb2O6
(т. е. с брутто-формулой ReO9).
Соединение NiO-Nb2O5 в модификации рутила имеет параметры
элементарной ячейки: а=4.717, с=3.038 кХ, с/а=0.644; в виде
модификации колумбита: а=4.991, 6=12.423, с=5.905 кХ.
Литература
I. Goldschmidt Н. J., Metallurgia, 62, № 373, 212,. 1960.
ТАНТАЛАТНЫЕ СИСТЕМЫ
Li2O-Ta2O5
Интересна для выяснения сходства и различия систем из ще-
лочных окислов и пятиокисей ванадия, ниобия и тантала.
Система Li2O—Та2О5 изучена Рейзманом [2] в пределах от 45
до 100 мол.% Та2О5 путем рентгенографического анализа образцов,
полученных нагреванием соответствующих смесей в твердом
состоянии при 1350°. Установлено три соединения: Ы2О-ЗТа2ОБ
(I), Li2O Ta2O5 (II) и 3Li2O.Ta2O5 (III).
В интервале 100—75 мол.% Та2О5 найдены Та2О5 и I, при
75 мол.% Та2О5 — только I, от 75 до 50 мол.% Та2О5 — соеди-
нения I и II, при 50 мол.% Та2О5 — только II, а в интервале
50—45 мол. % Та2О5 — соединения II и III. Соединение Ы2О-Та2ОБ
было описано Лапицким и Симановым [1 ] как метасоединение
с ромбоэдрической ячейкой. Твердые растворы в изученном участке
системы не установлены. Соединения Ы2О-Та2ОБ и 3Li2O-Ta2O5,
по-видимому, плавятся конгруэнтно, а Ы2О-ЗТа2ОБ — инкон-
груэнтно. Диаграмма состояния изученной части системы Рейз-
маном не построена.
Литература
1. Л а п и ц к и й А. В., Ю. П. Симанов, Журн. физ. хим., 29, № 7,
1201, 1955.
2. Reisman A., Journ. Phys. Chem., 66, № 1, 15, 1962.
Na2O—Та2ОБ
Интересна как аналог ряда систем из щелочных окислов (Na2O,
К2О, Li2O, Cs2O) и пятиокисей ванадия, ниобия и тантала.
Кинг, Шульц, Дэрбин и Дакворт [1 ] нашли в системе три
конгруэнтно плавящихся соединения — Na2O-2Ta2O5 (или
Танталатные системы
573
Na2O -ЗТа2О5), Na2O -Та2О5 и 3Na2O -Та2О5 и твердые растворы в ин-
тервалах около 65— 75° и 90—100 мол.% Та2О5.
Позднее система изучена Рейзманом [2] в интервале составов
от 5 до 100 мол.% Та2О5 и температурах 700—1300°. При 1300°
в интервале 100—75 мол.% присутствовали Та2О5 и Na2O-2Ta2O5
(II), при 75 мол.% Та2О5 — только Na2O-3Ta2O5 (I), а при со-
ставах от 75 до 67.5 мол.% Та2О5 — смесь из Na2O-3Ta2O5 (I)
и Na2O-2Ta2O5 (II). В интервале 65— 60 мол.% Та2О5 обнаружены
Na2O-Ta2O5n Na2O-3Ta2O5. При 50 мол.% Та2О5 присутствовала
лишь фаза Na2O-Ta2O6 (III). Фаза Na2O-2Ta2O5 ромбическая,
с а=6.00, 6=2-3.83, с=5.08 А (искаженная перовскитовая струк-
тура).
Рейзман указывает на существование соединения Na2O-3Ta2O5
с более простой, чем у Na2O-2Ta2Ob, решеткой, являющейся иска-
женной тетрагональной или ромбической, типа перовскитовой
структуры WO3. Принимая для Na2O-3Ta2O5 ромбическую ре-
шетку, параметры последней можно представить в виде: а=2-3.87,
6=2-5.96, с=5.96 к.
Для ромбической элементарной ячейки Na2O;Ta2O5 определены
параметры: а=5.5237, 6=2-3.8961, с=5.4781 А. Плотность (вы-
численная) 7.0969 г/см8 при 25°.
Таким образом, равновесная диаграмма системы Na2O—Та2О5
состоит из пяти двухфазных полей, содержащих четыре танталата
натрия, но сама диаграмма в работе Рейзмана не приводится.
Литература
1. К i n g В. W., J. Schultz, Е. A. Durbin, W. Н. Duck-
worth, U. S. Atomic Energy Comm., BMI-1106, № 9, 1956.
2. R e i sm a n A., Journ. Phys. Chem., 66, № 1, 15, 1962.
K2O(K2CO3)-Ta2O5
Интересна в связи с общими исследованиями танталитов, нио-
битов и ванадатов щелочных металлов.
Система (рис. 529), изученная Рейзманом, Гольдбергом, Бер-
кенблитом и Берри [1], характеризуется наличием четырех со-
единений: К2О-5Та2О5 (I), К2О-2Та2О5 (II), К2О-Та2О5 (III) и
ЗК2О-Та2О5 (IV), из которых соединение III обладает ферроэлек-
трическими свойствами.
Область 0—75 мол.% К2СО3 представляет равновесие между
К2О и Та2Ов, а в области 75—100 мол.% К2СО3 является одним из
574
Такта латные системы
соединений. Так как К2О и К2СО3 эквивалентны в молекулярном
отношении, то нет разрыва при переходе от одной части диаграммы
к другой.
Инвариантные точки системы К2О(К2СО3)—Та2О5
Точка Фазы Процесс Состав, иол. •/□ Темпера- тура, °C
К2О (или К2СО3) TsjOg
1 {3-ТааО5. Плавление. 0 100 1785 ±30*
2 а-Та2ОБ. » 0 100 1872±10
3 p-Ta2Us -|- a-'l a2Us. Полиморфное пре- вращение. z 0 100 1360±5
4 КаО • Ы aaUg (1) -f- а-1 ааО5+ +жидкость. Инкогруэнтное плавление. 16.67 83.33 1645
5 К2О -5Ta2Ofi(I) -Н-Та2О5+ 4-жидкость. Перитектика. 25 75 1645
6 К2О • 2Та2ОБ (II) -|- К2О- •5TaoOs (I) 4- жидкость. К2О • 2ТаД (II) 4- КаО- •5Ta2Os (I) 4- жидкость. Инконгруэнтное плавление. 33.33 66.67 1520
7 Перитектика. 40 60 1520
8 КТаО3 (III) 4- К2О • 2Та.О, (II) + жидкость. “ 3 Инконгруэнтное плавление. 50 50 1370
9 КТаО3 (III) 4- ЗК2О • Та2О, (IV) + жидкость. ® Эвтектика. 67.7 32.3 1090
10 ЗКаО • 1 ааО5 (I V) -|- жид- кость. Конгруэнтное плавление. 75 25 1330
11 3K2O.Ta2Os (IV)4-K2CO34- 4- жидкость. Эвтектика. 88.7 11.3 800
12 К2СО3. Плавление. 100 0 891
Метатанталат калия, КТаО3, по данным Ваусдена [2], имеет
перовскитовую структуру (а=3.9885 А); с KNbO3 образует серию
непрерывных твердых растворов. Остановки на термических кри-
вых в интервале составов 51—67% мол. К2О при температурах 1090
и 1123° Рейзманом и другими объясняются или модификационным
превращением К2О-Та2О6, или скорее наличием ограниченного
твердого раствора. Рейзманом с соавторами были определены плот-
ности пикнометрическим методом: для КТаО3 6.96 г/см8, для
а-Та2Ов 8.37 г/см8 и для ^-Та2ОБ 8.18 г/см8 при 25°.
* Рейзман и другие указывают, что им удалось определить темпера-
туру плавления более низкотемпературной модификации р-Та2ОБ благо-
даря большой скорости нагрева (50° в минуту) и медленности перехода
^-модификации в a-модификацию Та2О5.
Танталатные системы
575
Инвариантные точки в системе К2О(К2СО3)—Та2О5 приведены
в таблице.
Рис. 529. Диаграмма состояния системы К2О(К2СО3)—Та2О6.
Литература
1. ELe i s m a n A., F. Holtzberg, M. Berkenblit, M. Berry,
Journ. Amer. Chem. Soc., 78, № 18, 4514, 1956.
2. V о u e d e n P., Acta crystallogr., 4, № 4, 373, 1951.
MgO—Ta2O5
Изучена Бэскином и Шеллом [1 ] в субсолидусной области;
их данные представлены на предварительной фазовой диаграмме
(рис. 530), на которой примерное положение ликвидусной кривой
нанесено по данным Кинга, Шульца, Дэрбина и Дакворта [2].
В системе образуются три соединения, кристаллографические
данные для которых приводятся в таблице.
576
Танталатные системы
Структурные характеристики соединений системы MgO—Та2Ов
Соединение Кристаллическая система Параметр . решетки, А (±0.2%) Плотность, г/см3 Число моле- кул в элемен- тарной ячейке
а ь с наблю- денная вычис- ленная
Mg4TazO9. Гексагональная. 5.162 14.038 5.9 6.18 2
Mg3l 'ao08. Ромбическая. 10.238 11.456 10.065 6.2 6.33 8
MgTa2b68 Тетрагональная. 4.713 — 9.187 7.9 7.85 2
В статье Бескина и Шелла приводятся таблицы межплоскост-
ных расстояний для этих трех соединений. Соединение Mg4Ta2O9,
*С
2000
1800
1600
1900
1200
1000
/Ид, Та2 0я *Мд3Та20я
m9it^0s
'Мд„Га.20я
+ дд ,
-МдО
J I____
^МдТаМ „
МдяТа20я
МдТа20е
MgTa20e+a-Ta205
МдТа206^-Га205
О 10 20 30 90 50 60 70 80 90 100
м9° Мол.% Таг°5
|Рис. 530. Диаграмма'"состояния системы
MgO—Та2О6.
1 — по Баскину и Шеллу; 2 — по Кингу с сотруд-
никами.
по данным Кинга и других, плавится примерно при 1830°. Соеди-
нение Mg3Ta2O8 очень медленно разлагается при 1475° на Mg4Ta2O9
и MgTazO6. Согласно Кингу и др., Mg3Ta2O8 стабилен только между
1475 и 1675° и разлагается выше и ниже этих температур на
Mg4Ta2O9 и MgTa2O8. Структура Mg3Ta2O8 ильменитовая. Согласно
Кингу и др., MgTa2O8 плавится около 1770° и имеет структуру
тапиолитового (FeTa2Oe) или трирутилового типа. Инверсия
0 -> а-Та2О5 происходит по Бэскину и Шеллу между 1260 и
1360°, а по Лагергрену и Магнели [3] — при 1320 ±15°.
Литература
1. Baskin Y., D. С. Schell, Journ. Amer. Ceram. Soc., 46, № 4,
174, 1963.
Танталатные системы
577
2. К i n g В. W., J. Schultz, Е. A. Durbin, W. Н. Duck-
worth, U. S. Atomic Energy Comm., BMI-1106, № 12, 1956.
3. Lagergren S., A. Magneli, Acta chem. Scand., 6, № 3, 444,
1952.
В субсолидусной области систему изучали Кинг, Шультц,
Дэрбин и Дакворт [21. Характерно образование различного типа
твердых растворов (рис. 531). Диаграмма воспроизводит более
Рис. 531. Фазовые отношения в системе
AlgOg TagO5.
сложные, чем это должно быть в бинарной системе, фазовые со-
отношения и представляет собой, вероятно, квазибинарный разрез
более сложной диаграммы.
Дай и Уайт [1] обнаружили широкую область моноклинных
твердых растворов, образованных на основе предположительно
существующего соединения «А1ТаО4» (рис. 532).
Литература
1. Dyer A. J., Е. A. D. White, Trans. Brit. Ceram. Soc., 63, № 6,
301, 1964.
2. King B. W., J. Schultz, E. A. Durbin, W. H. Duck-
worth, U. S. Atomic Energy Comm., BMI-1106, № 13, 1956.
37 H. А. Торопов и др., кн. 1
Al^Oj Ta^Of
2(СеОг)__________________Таг0?
СеТаО^
I" ?!
Nd203 Та.г05
Nd3TaO7 Nd.Ta.Oif
I1 I" ?!
Рис. 532. Схематические фа-
зовые отношения в системах,
содержащих Та2О5 и окислы
трехвалентных элементов
(включая редкоземельные).
С—колумбитоподобная структура;
D — структура типа пирохлора;
Е—структура, близкая к пирохлор-
ной; G, я — структура вольфра-
мита; I, L — дефектная флюорито-
вая, возможно пирохлорная (не-
дефектная), структура; J — перов-
скитоподобная структура; М, N —
структура не выяснена; О — твер-
дый раствор, обнаруживающий из-
менение структуры от бронзопо-
добной до модифицированной
фазы К.
Sm3TaO7 SmTaOf
_____I' I» ?!
ТагО5
ОуЛ_____________________, Таг05
Dy-^aO-f ПцТаО^
I' I" ?!
Танталатные системы
579
Ga2O8—Ta2Os
В субсолидусной области (обжиг до 1450°) систему изучали
Дай и Уайт [1 ]. Обнаружено одно соединение GaTaO4 с колумбито-
подобной структурой (рис. 532).
Литература
1. D у е г A. J., Е. A. D. White, Trans. Brit. Ceram. Soc., 63, № 6,
301, 1964.
In2O3—Ta2Os
Система интересна для технологии новых полупроводниковых
материалов.
В субсолидусной области (обжиг до 1250—1450°) изучали Дай
и Уайт [1]. Обнаружено одно соединение со структурой типа
колумбита: 1пТаО4.
Литература
1. Dyer A. J., Е. A. D. White, Trans. Brit. Ceram. Soc., 63, № 6,
301, 1964.
Sc2Os—Ta2O8
В субсолидусной области (обжиг до 1450°) систему изучали
Дай и Уайт [1 ]. Обнаружено два соединения*. ScTaO4 со структурой
вольфрамита и параметрами элементарной ячейки ао=4.8О,
Ь0=5.65, с0=5.10 А, р=88.5° и Sc3TaO7 с дефектной флюоритовой
или пирохлорной структурой (рис. 532).
Литература
1. Dyer A. J., Е. A. D. White, Trans. Brit. Ceram. Soc., 63, № 6,
301, 1964.
Y2O3—Ta2Os
В субсолидусной области (обжиг до 1450°) систему изучили
Дай и Уайт [1 ]. Обнаружено два соединения: УТаО4 со структурой
типа фергусонита и параметрами элементарной ячейки аф=5.34,
37*
580
Танталатные системы
Ь0=10.94, со=5.О7 А, р=95.3° и У3ТаО7 с дефектной флюоритовой
или пирохлорной структурой. Кроме того, предполагается суще-
ствование фазы типа перовскита (рис. 532) в области, богатой
Та2О8.
Литература
1. D у е г A. J., Е. A. D. White, Trans. Brit. Ceram. Soc., 63, № 6,
301, 1964.
CeO2(Ce2Os)—Ta2O8
Дай и Уайт [2] обжигали смеси CeO2 и Та2О8 на воздухе. По-ви-
димому, в процессе обжига происходило выделение кислорода,
так как полученное соединение СеТаО4 со структурой фергусонита
отвечает трехвалентному церию. Обнаружена также область твер-
дых растворов (рис. 532), вероятно граничащая с составом СеТа40п
(по аналогии с CeNb40u).
Година с сотрудниками [1 ] изучали систему в концентрацион-
ном интервале от 20 до 80 мол. % Та2О5. Обжиг смесей СеО2 и Та2О8
производился в температурном интервале 900—1800°. Обнаружены
СеТаО4, плавящееся конгруэнтно около 1900°, СеТа3О», плавя-
щееся около 1800°, и Се3ТаО7.
Литература
1. Савченко Е. П., Н. А. Година, Э. К. Келер, в сб.: Химия
высокотемпературных материалов, изд. «Наука», Лен. отд., Л., 99,
1967.
2. D у е г A. J., Е. A. D. Whit е, Trans. Brit. Ceram. Soc., 63, № 6,
301, 1964.
Pr2O3—Ta2O8
Савченко, Година и Келер [2 ] изучали реакции в твердых фазах
между Та2О8 и РгвОп в температурном интервале 900—1800°.
В качестве методов исследования применялись рентгеновский,
фазовый химический и термический анализы. Для выявления
количества прореагировавшей окиси празеодима также определя-
лось содержание активного кислорода [1]. Были получены со-
единения РгТаО4, Рг3ТаО7 и РгТа3О». РгТаО4 плавится конгруэнтно
при 19004-30°, имеет плотность 7.90 г/см3. Ортотанталат празео-
дима может быть получен в моноклинной форме, свойственной
ортониобату празеодима, но не в чистом виде, а с примесью фазы,
Танталатные системы
581
изоструктурной LaTaO4 и СеТаО4. Получение моноклинной
РгТаО4 осуществлялось при прокаливании образцов состава
Рг6Оц+Та2О5 в температурном интервале 1400—1550°. Последую-
щее прокаливание этих образцов при 1600—1750° приводило к не-
обратимому переходу моноклинной РгТаО4 в кристаллическую
форму, изоструктурную LaTaO4 и СеТаО4 и устойчивую вплоть
до плавления. Рг3ТаО7 плавится без разложения в температурном
интервале 1990—2030°, РгТа3О» — в температурном интервале
1780-1810°.
Литература
1. К е л е р Э. К., Н. А. Година, Изв. АН СССР, отд. хим. наук, № 10,
1735, 1961.
2. Савченко Е. П., Н. А. Година, Э. К. Келер, в сб.: Химия
высокотемпературных материалов, изд. «Наука», Лен. отд., Л., 99,
1967.
Nd2O3—Та2О8
В субсолидусной области систему изучали Дай и Уайт [2].
Обнаружено два соединения: NdTaO4 со структурой типа фергусо-
нита и параметрами элементарной ячейки а0=5.52, Ьо=11.27,
с0=5.128А, р=95.6° и Nd3TaO7 с ромбической или дефектной
структурой типа флюорита—веберита [3]. Кроме того, обнаружена
область твердых растворов на участке, примыкающем к Та2О8
(рис. 532).
Савченко, Година и Келер [1] для смесей окислов, содержащих
от 20 до 80 мол. % Та2О8 и обжигавшихся в температурном интер-
вале 900—1800°,г получили три соединения: NdTaO4, Nd3TaO7
и NdTa3O». Ортотанталат неодима и соединение Nd3TaO7 плавятся
конгруэнтно соответственно при 1920+30 и 2000 +30°. NdTa3O»
плавится инконгруэнтно в температурном интервале 1780—1810°.
NdTaO4 кристаллизуется в моноклинной сингонии, имеет плот-
ность 8.42 г/см3. При взаимодействии Nd2O3 с Та2О8 независимо от
соотношения окислов в исходной смеси в качестве первичного
продукта реакции образуется Nd3TaO7. При дальнейшем прока-
ливании Nd3TaO7 реагирует с Та2О8, образуя NdTaO4 и NdTa3O».
Л итератур а
1. Савченко Е. IL, Н. А. Година, Э. К. Келер, в сб.: Химия
высокотемпературных материалов, изд. «Наука», Лен. отд., Л., 99,
1967.
2. D у е г A. J., Е. A. D. Whit е, Trans. Brit. Ceram. Soc., 63, № 6,
301, 1964.
3. R ooksby H. P., E. A, 9. White, Acta crystallogr., 16, № 9, 888,
1963.
582
Танталатные системы
SnO—Та2О8
Систему в субсолидусной области (до 1200°) изучали Трунов,
Симанов и Ковба [1]. Установлено образование фазы переменного
состава в пределах концентраций от 2SnO>Ta2O8 до 3SnO*Ta2O8
со структурой типа пирохлора и параметрами элементарной ячейки
от а=10.542 + 0.003 (для состава Sn2Ta2O7) до а=10.586+0.003 кХ
(для состава Sn3Ta2O8). При большем содержании Та2О8 образуется
фаза, близкая по составу к SnTa40u. Гасперен [2] указывает на
соединение SnTa4O12 с четырехвалентным оловом.
Литература
1. Трунов В. К., Ю. П. Симанов, Л. М. Ковба, Журн.
структурн. хим., 4, № 2, 277, 1963.
2. Gasperin М., Bull. Soc. Franc, mineral., cristallogr., 83, Ks 1, 1,
1960.
PbO— Ta2O8
Интересна для технологии ферроэлектрических материалов.
Субсолидусные фазовые отношения изучены Суббарао [4]
(рис. 533). Рентгенографическое исследование обнаружило сле-
дующие фазы: 1) РЬО-2Та2О8, 2) РЬО-Та2О8, 3) ЗРЬО-2Та2О8,
4) 2РЬО-Та2О8,5) 5РЬО-2Та2О8, 6) ЗРЬО-Та2О8. Соединения Та2О8
и РЬО *Та2О8 имеют по 2 модификации. Температура превращения
а-» |Э-Та2О8 равна примерно 1450+25°. Соединение РЬО-Та2О8,
синтезированное выше 1150°, имело ромбическую систему, а при
синтезе ниже 1150° оно было ромбоэдрическим.
Полная серия твердых растворов образуется между 2РЬ0*
•Та2О8 и 5РЬО>2Та2О8; в Та2О8 растворяется от 5 до 10 мол. %
РЬО.. В других соединениях твердые растворы, по-видимому, со-
ставляют меньше 2% или вообще отсутствуют. РЬО-Та2О8, по
Смоленскому и Аграновской [21, проявляет ферроэлектриче-
ские свойства, а Суббарао, Ширане и Иона [5] нашли новую, не-
ферроэлектрйческую модификацию этого соединения. По их
данным, низкотемпературная ромбоэдрическая модификация
РЬО -Та2О8 имеет: ал=7.147 а. и., а=94°47'; в гексагональной ячейке
ан —10.52, ся=11.30 а. и. Ромбическая модификация РЬО -Та^
при комнатной температуре имеет почти равные постоянные ре-
шетки а и b (отношение b/а около 1.002): а0=17.68, ЬО=17.72,
с0=7.754 а. и.
В связи с весьма малыми отклонениями от ромбической решетки
порошкограмма может быть рассчитана на основе тетрагональной
элементарной ячейки. Высокотемпературная ромбическая моди-
Танталатные системы
583
Некоторые физические свойства соединений системы РЬО—Та2О5
Соединение Темпе- ратура спека- ния, °C Линейное термиче- ское расширение Диэлектрическая постоянная
пределы темпера- тур, 5С коэффици- ент на 1° С пределы темпе- ратур, °C значения при 25° С
ЗРЬО-2Та2О5 1300 20—600 65-10-7 От—180 до 380 45
2PbO-TasO8 1300 20-600 94.10-’ — —
РЬО-Та2О5 (ромбоздрич.) 950 20-600 62-10-’ От 25 до 320 36
PbO.TasO8 (ромбич.) 1450 20—260 40-10-’ — 300
260—600 80-10-’ — —
фикация РЬО-Та2О8, по Исмаилзаде [1], не отклоняется от тетра-
гональной симметрии и имеет ат=17.688, ст=7.785 а. и. Измере-
ние двупреломления от комнатной температуры до 365° показывает,
что выше фазового изменения при ферроэлектрической темпера-
°С
поо
1200
1000
800
ООО
Та205Л
т.р.
S'
a-Ta20g
§ т.р.
2:1 +
I
(
О 20 W 60 80 100
Мол. % ^а2°5
Рис. 533. Субсолидусные фазовые отношения
в системе РЬО—TasO6.
туре Кюри 260° кристаллы показывают даже меньшее отклонение
от тетрагональной симметрии, чем ниже этой температуры. Кри-
сталлы остаются двуосными. _
[Соединение РЬО-2Та2О6, по рентгенографическим данным,
очень сходно с ромбическим (псевдотетрагональным) РЬО-Та2О8.
ЗРЬО-2Та2О8 имеет структуру кубического пирохлора:
а=10.551 а. и. Формула — Pbj 8Та2Ов 6.
2РЬО«Та2О8 — с ромбической ячейкой: aR= 10.691 а. и.,
а=88°19'. Структура пирохлорная.
584
Танталатные системы
5РЬО-2Та2О8 (28.5 мол.% РЬО), по рентгеновской порошко-
грамме, весьма сходен с 2РЬО -Та2О8.
ЗРЬО*Та2О8, по порошкограмме, сходен с -ЗРЬО*2Та2О8,
2РЬО-Та2О8 и 5РЬО*2Та2О8.
Физические свойства соединений в системе РЬО—Та2О8 при-
водятся в таблице по Суббарао [4].
Кеммлер-Зак и Рюдорф [3] приводят структурные характе-
ристики некоторых фаз системы. Для соединения ЗРЬО*2Та2О8
характерна кубическая пирохлорная структура с параметром
ячейки а=10.54 А. Однофазная область, ограниченная составами
2РЬО*Та2О8 и 5РЬО-2Та2О8 с ромбической структурой, имеет
параметры ячейки, изменяющиеся от а=10.71 А и а=88°26' до
а=10.73 А и а=87°58'. Тетрагональная фаза ЗРЬО>Та2О8 имеет
параметры ячейки: а=10.62, с=10.86 А. Плотность определялась
для каждого состава на двух образцах. Приводятся следующие
данные: для ЗРЬО-2Та2О8 — 8.67 и 8.64 г/см3; для 2РЬО-Та2О8 —
9.13 и 9.19 г/см3; для 5РЬО-2Та2О8 — 9.41 и 9.36 г/см3; для
ЗРЬО -Та2О8 - 9.74 и 9.71 г/см3.
Литература
1. И с м а и л з а д е И. Г., Кристаллография, 4, № 5, 658, 1959.
2. Смоленский Г. А., А. И. Аграновская, ДАН СССР, 97,
№ 2, 237, 1954.
3. Kemmler-Sack S., W. Riidorff, Zs. anorgan. allgem. Chem.,
344, № 1-2, 23, 1966.
4. S ubbarao E. C., Journ. Amer. Ceram. Soc., 44, № 2, 92, 1961.
5. Subbarao E. £., G. S h i г a n e, F. J о n a, Acta crystallogr.,
13, № 3, 226, 1960.
NbO2—TaO2
Моравитц [1], обжигая соответствующие смеси металличе-
ского тантала, пятиокиси тантала, металлического ниобия и пяти-
окиси ниобия в атмосфере аргона при 1600°, получил твердые
растворы ряда NbO2—ТаО2. В противоположность чистому NbO2
смешанные кристаллы обладают «идеальной» рутиловой решет-
кой. Препараты, содержащие NbO2 больше, чем соответствует
формуле 0.8Nb02*0.2Ta02, образуют, по-видимому, двухфаз-
ную систему. Для состава 0.8Nb02.0.2Ta02 параметры элемен-
тарной ячейки имеют значения: а=4.8002, с=3.0319 А; для
0.4 Nb02-0.6ТаО2: а=4.7860, с=3.0384 А. Промежуточные составы
обладают параметрами, лежащими между указанными значениями.
Литература
1. Morawietz Н., Journ. Inorg. Chem., 28, № 4, 941, 1966.
АНТИМОНАТНЫЕ СИСТЕМЫ
РЬО— SbaO4 (SbaO3, SbaO8)
Имеет значение для познания процессов рафинирования
свинца и для химии антимонатов.
Изучена Уразовым и Сперанской [1 ]. Так как процесс окисли-
тельного рафинирования свинца проводится при 600—700°,
то фазовые диаграммы изучены для изотермы 700°. При нагре-
Рис. 534. Схема фазовых
соотношений системы
РЬО—Sb2O4 при 700° в ат-
мосфере азота.
1 — однофазная; 2 — двух-
фазная.
0 20 W 60 80 100
SbA Мол.% рЬо
,1 °2
Рис. 535. Схема фазовых
соотношений системы
РЬО—Sb2O3 в атмосфере
воздуха при 700°.
1 — однофазная; 2 — двухфаз-
ная.
вании в токе азота смесей порошков РЬО и Sb2O4 при 640° проте-
кает реакция в твердой фазе с образованием двух соединений
(рис. 534): первое — 1:1, PbSbaO5, состава 50 мол.% РЬО и
50 мол. Sba04, желтого цвета, плотность его определена в толуоле
и равна 7.43+0.01 г/см3; второе соединейие — 3:1, Pb3Sb2O, —
75 мол.% РЬО и 25 мол.% Sb2O4, зеленого цвета, с плотностью,
равной 8.08+0.01 г/см3.
586
Антимонатные системы
При взаимодействии РЬО с Sb2O3 в присутствии воздуха сна-
чала происходит окисление сурьмы в окисел: ЭЬ2О3-|-кислород=
=Sb2O3, где у < 5; далее он реагирует с РЬО, образуя соеди-
нения 3:1 и 1:1 (рис. 535).
Соединение 3 : 1 Pb3Sb2O8-;rO состава 75 мол.% РЬО и
25 мол. % Sb2O3 имеет коричневый цвет; рентгенограмма его ана-
логична таковой металлического свинца
(кубический, гранецентрированный), но
отличается размерами параметров.
Соединение 1 : 1 PbSb2Oe имеет
состав 50 мол.% РЬО и 50 мол.%
Sb2O3 и светло-зеленый цвет. Интервал
40—50 мол.% РЬО представляет со-
бой, согласно данным рентгеноана-
лиза, область однородности на основе
соединения PbSb2Oe. Составы области
70—95—98 мол.% РЬО содержат пере-
менные количества активного кисло-
рода, природа связи которого не ус-
тановлена.
.7 02
Рис. 536. Схема фазовых
соотношений системы
PbO-Sb2O6 при 700°.
1 — однофазная; а — двухфаз-
ная.
Диаграмма системы РЬО—Sb2O5 в
присутствии воздуха (рис. 536) харак-
теризуется наличием трех соединений:
3 : 1, 3 : 2, 1 : 1. Рентгенограммы 3 : 1
и 3 : 2 аналогичны друг другу, а так-
же рентгенограмме металлического свинца, но отличаются раз-
мерами параметров.
Тагаи и Симохира [2] описывают соединения 3PbO-Sb2O3 и
PbO-Sb2O3. В образцах состава 2PbO-Sb2O3 обнаружена смесь
PbO-Sb2O3 и 3PbO-Sb2O3.
Литература
1. Уразов Г. Г., Е. И. Сперанская, Журн. неорг. хим., 1, № 6,
1418, 1956.
2. Т a g a i Н., Т. Simohira, Journ. Ceram. Assoc. Japan, 71, № 808,
71, 1963.
As2O3—Sb2O3
Систему изучали Хейк, Инама и Шатц [1 ]. Обнаружены широ-
кие области твердых растворов. Синтез твердых растворов осу-
ществлялся кипячением аммиачных растворов тартратов сурьмы
и мышьяка. Полученные фазы изучались рентгенографическим
методом и с помощью ИК-спектроскопии. Установлено два типа
Антимонатные системы
587
твердых растворов: моноклинные твердые растворы на основе
As2O3 в концентрационной области от 70 до 100 мол.% As2O3
и кубические на основе Sb2O3 протяженностью от 30 до 100 мол. %
Sb2O3.
Литература
t. Hayek Е., Р. I n a m a, R. Schatz, Monatshefte Chem., 94,
№ 2, 366, 1963.
СИСТЕМЫ, СОДЕРЖАЩИЕ ОКИСЬ
ВИСМУТА:
Li2O—Bi2O3, Rb2O—Bi2O3, MgO—Bi2O3, CaO—JBiaO3, SrO—Bi2O3,
BaO—Bi2O3, ZnO—Bi2O3, CdO—Bi2O3, PbO—Bi^O^) JViO—Bi2O3,
B2O3—Bi2O3, A12O3—Bi2O3, Ga2O3—Bi2O3, La2O3—Bi,O3,
Sm2O3—Щ2О3, Lu2O3—Bi2O3, Sb2O3—Bi2O3, Mn2O3—Bi2Oa^
^Og—BiaQ3, СеО2—Bi2O3, SiO2—Bi2O3, GeO2—Bi2O3, TiO2—Bi2O3,
SnO2—Bi2O3, ZrO2—Bi2O3, ThO2—Bi2O3, TeO2—Bi2O3, U02—Bi2O3
, - -ЧР^О^——Bi2O3, V2O8—Bi2O3, Nb2O8—Bi2O3, Ta2O6—Bi2O3,
4CrO3—Bi2O3, WO3—Bi2O3, MoO3—Bi2O3, Li2O—Bi2O8, BaO—Bi2O8
Системы, содержащие окись висмута, приобретают в настоящее
время большое значение в технологии новых материалов для
электронной техники.
Здесь приводятся новые данные ряда работ, преимущественно
Левина и Рота, Гаттова с сотрудниками, Хунда и некоторых
других, для уже описанных систем Bi2O3—В2О3 (стр. 191),
Bi2O3—SnO2 (стр. 370), Bi2O3—Nb2O8 (стр. 566) и Bi2O3—МоО3
(стр. 623). Кроме того, в соответствующих разделах дано опи-
сание систем Bi2O3—GeO2 (стр. 361), Bi2O3—TiO2 (стр. 407),
Bi203—WO3 (стр. 649), Bi2O3—Fe2O3 (стр. 704).
Левиным и Ротом [7] исследованы 33 системы, одним из ком-
понентов которых была окись висмута (Bi2O3). Содержание вто-
рого компонента ограничивалось 10—15_ мол.%, Результаты
работ Левина и Рота представлены на рис. 537—542.
Для удобства сопоставления большого количества систем
мы не даем описания отдельных диаграмм состояния и излагаем
суммарный материал, полученный в различных работах.
Чистая окись висмута образует две стабильные кристалличе-
ские формы: низкотемпературную моноклинную (обозначается на
диаграммах Д/ои) и высокотемпературную кубическую (С)., Пре-
вращение одной формы в другую происходит при 730+5°. Для мно-
гих систем характерно образование твердых растворов на основе
окиси висмута: кубических (С т. р.) и моноклинных (Моп т. р.).
На диаграммах Левина и Рота указаны еще три фазы (твердые
растворы): Ьсс — объемноцентрированная кубическая фаза, Rh —
Системы, содержащие окись висмута
589
ромбоэдрическая фаза и неизвестная фаза (обозначена знаком
вопроса). Кроме того, отмечается тетрагональная фаза, обнару-
женная только как метастабильная и потому не фигурирующая
на рисунках.
Моноклинные твердые растворы на основе Bi2O3 обнаружены
в системах Bi2O3—СаО, Bi2O3—SrO, Bi2O3—CdO и Bi2O3—Sb2O3.
Эти твердые растворы имеют очень узкую область существования.
Кубические твердые растворы (С) обнаружены не только в систе-
мах, для которых констатировано наличие моноклинных твердых
растворов, но и в ряде других систем с РЬО, ZrO2, V2O4, окислами
900
825
С+Ж
730, , ,
.^690
Моп+Ж
600 -
Моп+?
500'------1-----4------1—
О 8 12
Slz°3 Мол.% £1г°
°C
900
825
730
600
500
с+ж /
-710° Моп+Ж
Моп + ?
____I____I__в—ц
Blz°3 . мол.%Г Rbz°
С
0 9 8 12
РисЛ537. Диаграммы состояния систем типа
RSO—BisOs.
редкоземельных элементов. Твердые растворы типа С имеют зна-
чительно более широкую по сравнению с моноклинными твердыми
растворами концентрационную область. Переход кубических1
(высокотемпературных) твердых растворов в моноклинные про-
исходит обычно при более низких температурах, чем соответ-
ствующее превращение чистой окиси висмута.
Для систем Bi2O3—La2O3 и Bi2O3—Та2О3 охлаждением образ-
цов из поля «жидкость+С1 т. р.» были получены метастабильные
кубические твердые растворы.
Объемноцентрированные кубические твердые растворы (бес)
обнаружены для многих систем. Эти твердые растворы об-
разуют [на диаграммах узкие’ поля иТдаже, как например для
системы Bi2O3—В2О3, дискретную фазу. Эти твердые растворы
образуются обычно* на' основе соединения с соотношением
12Bi : 1Ме. Такие соединения характерны для систем с четырех-
валентными элементами (Si, Ti, Ge), для которых рассматриваемая
°C
900 825 CtM ._/ -810
Ct NiO
600 500 £ Mon tffiO
9 h°3 8 16 Мол. % 2b NiO
’С
900-
beet ж
825
730
Моп+Ьсс
600
500 <-
0
Ьсс+ЪпО
8 I \16 29
°C
900
825 Cm.ptЖ
730 \-795*"'- \У-700° Coipt?
r\
600 I Monmp.t?
500 1 1 L__
О 15=2 6:
’3 Мол %
н ।
О 8 16 24
ZnO
Мол. %
CdO
°C
900
825
-785
730
600
500
~-~С~Ж
Ct?
Моп+?
о в 16 г*
8lA Мол.% Са0
°C
900
825
730
600
500
<5830°
। Rbm.p.
720 1 r
Mon т.р. tRhm.p.
В1г°з Мол.% Мзг°
0 8 16 2b
Bi3°3 Мол % Sr0
C
’С
900
825
-760
730
^j^RhfnptfH
900
825
600
C+Rbmp. \
\ Rhnp.
. Mon+Rhm.p\
500*-----1----l_
0 8 16
мол.%
2b
BaO
730
^~^Ст.р+ж
'Coiptbcc
bcc+?
j Моп+Стр
600 i Montbcc
5001—
О
B‘LZB3
8
\16 29
Рис. 538. Диаграммы
состояния систем тина
RO—Bi2O3.
с
с
’о
900 -
825
730
632
-600
С+Ж
Моп+Ж
Mon+bcc i bee+2:1 1 1
^12:18 12
Мол.% ВА
5000
в<-А
°с
900 -
825 -
-790
730-----«д
600
С+Ж Ьсс+Ж
C+bCCi
>i апаб.)
-bee I!
500'-----------1-----—।
5 4\ 8 12
Bi2°3 м a, Fe2°3
2 3 Мол.Ча 3 3
°C
900 -
825
730
• Стр. / Стр.+?
600
Моп+?
555 ---1---1--1—I
5 4 5/2
BlA Мол.Ча L,LA
900 -
825
-770
730
Ж+1--2
~810°
l~n к А+1:г
_c+bccjl
- ll
Mon+bcc\ ( bcc+1:2
600 - |j
500*—
О
15:18 12
МолЧа ^А
С
900
825
-790
730
600
500*—
О
81г03
,'ж+гг
‘ C?1-2
---------
Mon+1-2
W
20 W 60
,, п, Мп,О,
МОЛ. Ча 2 3
Ст.р.,''7"
730
°C
900
825
Cm.p.
i
600 } Mon+Rh np.
Cm.p.
f Rh rnp.
500^—
О
9 8 12
МОЛ. Ча SmA
900 -
825
800
730
Ьсс+ж
.?_&k]j'“755°
/non*taj( bcc+1:2
600 *'
500'----1----1----1—
5 4 8 /2
BlA Мол.% ea3°3
°C
900
825
С гл.р.+Ж^^Ь т.р+Ж.
—925'
Ст.р. /Cm.p.+Rbm.p
~705~
730
600
Mon+Rhm.p.
5001----1---1----L_J
5 4 5/2
Л.5, .. 0. PQ.,0
2 3 Мол.Ча 2 3
Рис. 539. Диаграммы состояния систем типа RgO3— Bi8O3.
°C
’С
SOO
825
800
730
600
-900
/Ьсс+Ж |j
——4|
0+bee II Ьсс*Ж
Ьсс+Ж
-935
900-
820° .|
825
C+bcc | bcc+2-З
730
Моп+Ьсс
600
— II
*!
Моп+Ьсс | |
II
500 ‘—
О
ВЧ°з
8
6:1
Мол.%
24
50°0
ВЧ°з
8
116 26
./'7 а. GeO,
Мол.% г
°C
900
825
730
600
500
°'7 ПО,
Мол.% я
81г03
‘С
900
825
730
600
500
/
' / 1--2+Ж
^/__2-80_0°___
C + 1~2~
Моп +1:2
I______I_____L
О 8 16 26
6i,03 о/ М
* Мол. % 2
°C
900 •
730
600 ।
/ 2гОг(Моп)+Ж
-860°
/ 0 т.р.+1гОг
~7/0°
Моп +2гОг
500'—
О
ВЧ°з
8 16 26
Мол.% 2г0г
°C
900 / СоОг+Ж -860°
825 730 f Ст.р.+СеОг
ООО Моп+СеО, 6
500 * - 1
Sl»°3 Мол.% Се°г
°C
900
.'"С т.р.+Ж
825
730
’ Ст Р-/ст.р.+1
600 ]
Моп+?
500^-
О 8 16 26
Bi3°3 Мол.% Те0з
Рис. 540. Диаграммы состояния систем типа ROS—В^Оз-
Системы, содержащие окись висмута
593
фаза имеет состав 6Bi2O3-RO2. Для систем Bi2O3—А12О3,
Bi2O3—Ga2O3, Bi?03-Fe,0a фаза Ъсс значительно богаче Bi2O3
и отвечает составам 15 : 1 и даже 24 : 1 (для системы с Fe2O3).
Рис. 541. Диаграммы состояния систем типа
R2O3—Bi2O3.
конгруэнтно (системы с SiQ^ GeOj и TiOg) или инконгруэнтно
(системы с РЬО, В2О3 и А12О3).
Большой интерес представляет образование метастабильных
твердых растворов типа Ъсс. Так, метастабильные объемноцентри-
рованные твердые растворы возникали при охлаждении распла-
вов в системах с Rb2O, NiO и CdO.
38 Н. А. Торопов и др., кн. 1
594
Системы, содержащие окись висмута
Ромбоэдрические твердые растворы обнаружены в системах
с СаО, SrO, ВаО, Ьа2О3 и Sm2O3. Такие твердые растворы с пер-
выми тремя указанными окислами получали Ауривиллиус [4]
и Силлен и Ауривиллиус [10]. Последние авторы получали твер-
дые растворы, простирающиеся от 14 мол.% SrO в сторону SrO
с ромбоэдрической решеткой, имеющей вакансии в анионной под-
решетке.
' Неуймин с сотрудниками [1 ] методом электродвижущих сил
I с твердыми электролитами показали, что твердые растворы и рас-
! сматриваемой системе обладают значительной^долей ионной
: проводимости.
Рис. 542. Диаграммы состояния систем типа RO3—Bi2Oa.
Тетрагональные твердые растворы Левин и Рот получали
только как метастабильные фазы, охлаждая образцы, относящиеся
к полю «жидкость+кубические твердые растворы» в системах
с Lu2O3, Sm203 и Nb2O5.
В изученных Левиным и Ротом системах обнаружено не-
сколько химических соединений. Соединения общей формулы
Bi2O3-2R2O3 образуются с окислами В2О3. Такие соединения полу-
чены с А12О3, Ga2O3 и Мп2О3 (рис. 539). Сокисью железа (Fe^g)
окись висмута образует феррит BiFeO3, который, однако, не мог
быть подучен в виде индивидуальной фазы и рассматривается
Левиным и Ротом как метастабильное соединение. Существование
указываемых Ройеном и Сварсом [81 в системе Bi2O3—Fe2Os
соединений 30 : 1, (12—13) : 1 и 2:1 опровергается Левиным
и Ротом.
Тутов с сотрудниками [3] показали, что химический состав
соединения 1:2, на которое указывают Левин и Рот, отвечает
Системы, содержащие окись висмута
595
формуле2_В12О3 >2Мп2О3 4. Кристаллы этого соединения относятся
к ромбической сингонии с параметрами элементарной ячейки:
а=7.47, 6=8.52, с=5.75 А; пикнометрическая плотность^.ЗЗг/см3.
Систему Bi2O3—V2O8 изучили Смолянинов и Беля‘ев [2] ви-
зуально-политермическим, рентгенофазовым и дилатометриче-
ским методами. Обнаружено четыре соединения; 7Bi2O3-V2Os,
BiVO4, Bi4(V2O7)3 и Bi(VO3)3 (рис. 543). Первые два плавятся^без
разложения соответственно при 955 и 958°. Другие два соедине-
ния плавятся с разложением: Bi4(V2O7)3 при 832° и Bi(VO3)3 при
720°. При кристаллизации из расплава
соединение 7Bi2O3-V2O8 образует непре-
рывные ряды твердых растворов с Bi2O3
без экстремумов и с BiV04 с минимумом
состава 37.5 мол.% V2O8 и температурой
плавления 870°.
Гаттов и Фрикке [51 изучили системы
Bi2O3—SiO2, Bi2O3—GeO2 и Bi2O3—SnO2,
производя сплавление смесей с после-
дующей выдержкой в температурной об-
ласти 600—800°.
В системах Bi2O3—SiO2 и Bi2O3—GeO2
обнаружены химические соединения
BiJSiOJg и^ BiJGeOJa типа эвлитина с
кубическими кристаллами и^ парамет-
ром решетки соответственно а= 10.299 +
+ 0.008 и 10.526+0.003 А. В этих же?си-
В^°3 МОЛЛ,
Рис. 543. Диаграмма со-
стояния системы V2O5—
fl------BlgOg.
стемах^ получены соединения с высоким
содержанием Bi2O3, а именно: Si2Bi24O40
(соответственно Ge2Bi24O40) и 6Bi2O3-SiO2 (соответственно
6Bi2O3-GeO2). Соединение Si2Bi24O40 с объемноцентрированной
кубической решеткой имеет параметр а=10.098 +0.004 А;
соответствующее германиевое соединение имеет параметр ре-
шетки а=10.145 +0.005 А. Гаттов и Фрикке обозначают эти
соединения как f*-Bi2O3. В рассмотренной выше работе Левина
и Рота эти соединения обозначались символом Ъсс. Соединение
6Bi2O3«SiO2 с гранецентрированной кубической решеткой имеет
параметр а=5.542+0.006 А. Соответствующее германиевое со-
единение имеет параметр решетки а=5.572+0.008 А. Этот тип
соединений обозначается; у Гаттова и Фрикке — 8*-Bi2O3,
у Левина и Рота — С.
В системе Bi2O3—SnO2 Гаттов и Фрикке не получили соедине-
ний типа эвлитина и других кубических форм.. Синтезированное
здесь соединение 6Bi2O3-SnO2 (тип р*-В12О3 по Гаттову и Фрикке)
кристаллизуется в тетрагональной сингонии и имеет параметры
решетки: а=10.93+0.01, с=5.56+0.01 А, а/с=1.94.1
38*
596
Системы, содержащие окись висмута
Хунд [6] изучил фазы, образуемые в системах UO2—BiO18,
ThO2—BiOj 5, GeO2—BiOj 6 и ZrO2—BiOj 5 при обжиге в интер-
вале 800—1000°.
В системе UO2—BiOt s фаза типа флюорита распространяется
от 0 до 100% BiO15 (8-Bi2O3); в системе ThO2—BiO1B фаза типа
флюорита распространяется от 0 до 60 мол.% BiOx в; в системе
СеО2—ВЮ1>6 фаза типа флюорита распространяется от 0 до
40 мол.% BiOj 5.
В системе ZrO2—BiO16 в концентрационной области 30—
—100 мол. % BiOls обнаружена, флюоритовая фаза со сверхструк-
турой.
Шолдер, Гантер, Глэзер и Мерц [9], нагревая смеси Bi2O3
и Li2O в атмосфере кислорода, получили соединения, отвечающие
пятивалентному висмуту: Li3BiO4, Li5BiO5 и Li7BiOe. Темпера-
тура диссоциации этих соединений повышалась с увеличением
содержания Li2O. При окислительном обжиге смесей Bi2O3 с ВаО
при 950—1000° полное окисление до пятивалентного висмута
достигалось при условии ВаО : Bi2O3 5 t 1. Были получены
соединения Ba7(BiOe)2 и Вав(В1О5)2. При действии перекиси натрия
на Bi2O3 Шолдер с сотрудниками получили Na5BiO5.
Лит ерату р а
1. Неуймин А. Д., Л. Д. Ю ш и и а, Ю. М. Овчинников,
С. Ф. Пальгуев, Труды Инет, электрохимии Уральск, фил.
АН СССР, вып. 4, 111, 1963.
2. С м о л я н и н о в Н. П., И. Н. Беляев, Журн. неорг. хим., 8,
№ 5, 1219, 1963.
3. Т у т о в А. Г., И. Е. Мыльникова, Н. Н. Парфенова,
В. А. Боков, С. А. К и ж а е в, Физика тверд, тела, 6, № 4,
1240, 1964.
4. Aurivillius В., Arkiv Kemi, Mineral., Geol., 16A, № 17, 1, 1943.
5. Gattow G., H. Fricke, Zs. anorgan. allgem. Chem., 324, № 5—6,
287, 1963.
6. H u n d F., Zs. anorgan. allgem. Chem., 333, № 4—6, 248, 1964.
7. L e v i n E. M., R. S. Roth, Journ. Res. Nat. Bur. Stand., 68A,
№ 2, 197, 1964.
8. R о у e n P., K. Swats, Angew. Chem., 69, № 24, 779, 1957.
9. S c h о 1 d e r R., K.-W. Ganter, H. Glaser, G. Merz,
Zs. anorgan. allgem. Chem., 319, № 5—6, 375, 1963.
10. Sillen L. G., B. Aurivillius, Zs. Kristallogr., 101, № 6,
483, 1939.
ХРОМИТНЫЕ (ХРОМАТНЫЕ) СИСТЕМЫ
Na2O—СгО3
Существенна для технологии производства солей: хромитов
и хроматов.
Диаграмма состояния системы не построена. Известно четыре
хромата натрия: Na2CrO4 с температурой плавления 792° и слож-
ным полиморфизмом; Na2Cr2O7, плавящийся около 350° и выделяю-
щий кислород при 400°; Na2Cr3O10; Na2Cr4O13, устойчивый только
до 40°. Последние два соединения получаются действием СгО3
на Na2Cr2O7.
Писториус [1 ] построил фазовую диаграмму Na2CrO4 в пара-
метрах «температура—давление» (до 45 кбар). Было обнаружено
пять модификаций Na2CrO4. На рис. 544 представлена фазовая
Таблица 1
Данные, характеризующие пограничные линии между
фазами Na2CrO4
Пограничная линия Наклон град./бар ар t = а + ЬР + cP2 (t в град. С, Р — в барах)
II/I 0.0046±0.0005 i = 849 — 38.5Р + 0.62Р» (+ 7 °)
п/ш —
II/IV —0.015+0.005
III/IV —0.0010+0.0005
IV/I 0.0074 +0.0005
IV/V — t = 416 + 5.18Р + О.ОЗЗР» (+6°)
V/I — t = 205 + 18.1Р —0.091Р» ( + 6°)
1/жидк. 0.027 +0.002 при Р = 0
598
Хромитные (хроматные) системы
диаграмма Na2CrO4 до 45 кбар, в интервале температур 250—1250°.
В табл. 1 дана характеристика пограничных линий, а в табл. 2 —
параметры инвариантных точек.
Таблица 2
Параметры, характеризующие
тройные точки
Тройная точка Давление, кбар Температура,
1/II/IV 11.3+1 472+5
11/III/IV 14.6+1 421+7
I/IV/V 20.4+1 536+7
Рис. 544. Фазовая диаграмма со-
стояния системы NagCrOj в пара-
метрах «температура—давление»
в интервале 250—1250°
и 0—45 кбар.
Литература
1. Pistorius С. W. F. Т., Journ. Chem. Phys., 43, № 8, 2895, 1965.
Cu2O—Cr2O3
' Рагозинников, Щетникова и Воробьева [1 ], исследуя хром-
содержащие огнеупоры после службы в медерафинировочных
печах, установили образование соединения Cu2O-Cr2O3, характе-
ризующегося призматическими кристаллами с сильным двойным
Хромитные (хроматные) системы
599
отражением и полисинтетическим двойникованием. Соединение
Cu2O-Cr2O3 образуется из окислов при температуре 800°, при
нагревании до 1400° и последующем охлаждении не разлагается.
Литература
1. Рагозинников В. А., И. Л. Щетникова, К. В. Воро-
бьева, в сб.: Химия высокотемпературных материалов,
изд. «Наука», Лен. отд., Л., 213, 1967.
ВеО—Сг2О3
Систему, перспективную для получения новых тугоплавких
материалов, исследовали Ланг, Рот и Филлмор'[1 ]'и Вейр и Валь-
кенбург [2 ].
В системе обнаружено одно соединение ВеО -Сг2О3. Темпера-
тура эвтектики (между ВеО и ВеО-Сг2О3) несколько ниже 2050°.
Твердых растворов окиси бериллия или Сг2О3 в ВеО -Сг2О3 не об-
наружено.
Хромит бериллия образует четко ограниченные прозрачные
темно-зеленые кристаллы, имеющие красноватый плеохроизм.
ВеО -Сг2О3 относится к ромбической системе; кристаллы двуосные,
оптически отрицательные, с 2V«s45°, Ag= 2.230, Np=2.143;
плотность 4.42 г/см3 (вычисленная — 4.654 г/см3 при 25°). Пара-
метры элементарной ячейки: а=9.792, 6=5.663, с=4.535 А.
Литература
1. L a n g S. М., R. S. Roth, С. L. Fillmore, Journ. Res. Nat. Bur.
Stand., 53, № 4, 201, 1954.
2. Weir С. E., A. Van V a 1 k e n b u r g, Journ. Res. Nat. Bur. Stand.,
64A, № 1, 103, 1960.
MgO—Cr2O3
Важна для технологии высокоогнеупорных материалов. Изу-
чена Уайлдом и Рисом [7], Смачной и Смальдау [2], Ключаревым
и Чень’Ди-цзянь [1 ] и Альпером, Мак-Нэлли, Доменом и Кей-
ном [3].
Уайлд и Рис ограничились получением кривой ликвидуса
и не заметили существующих здесь твердых растворов.
Смачная и Сальдау построили диаграмму состояния (рис. 545),
согласно .которой в системе существует два соединения:
MgO-Cr2O3 — магнезиохромит, относящийся к классу шпинелей,'и
600
Хромитные (хроматные) системы
MgO-2Cr2O3 — магнезиобихромит с температурой плавления 2290°.
Однако Ключаров и Чень Ди-цзянь, обжигая массы, отвечающие
составу магнезиобихромита, при 1400 и 1750° получили рентгено-
граммы, представляющие сумму интерференционных максимумов
магнезиохромита и окиси хрома. Специальными опытами по за-
калке выдержанных при 1500° образцов состава MgO-|-2Cr2O3
было исключено предположение, что образовавшийся MgO -2Сг2О3
Рис. 545. Диаграмма состояния си-
стемы MgO—Сг2О3 (по Смачной и
Сальдау).
а — твердый раствор на основе MgO.
Рис. 546. Диаграмма состояния
системы MgO—MgCr2O4 (по Аль-
перу с соавторами).
1 — полностью расплавившиеся об-
разцы; 2 — частично расплавившиеся;
з — нерасплавившиеся; 4 — образцы
с твердыми растворами.
при медленном охлаждении подвергался разложению. Рентгено-
графический анализ закаленных образцов показал, что они также
состоят только из магнезиохромита MgO -Сг2О3 и окиси хрома.
Таким образом, Ключаров и Чень Ди-цзянь доказали, что един-
ственным устойчивым до 1750° соединением является MgO-Cr2O3.
Все зто ставит под сомнение данные Смачной и Сальдау относи-
тельно соединения MgO-2Cr2O3. Смачная и Сальдау, по-видимому,
впервые обнаружили твердые растворы Сг2О3 в периклазе (MgO)
и нашли, что предельная концентрация Сг2О3 составляет 20 мол. %.
Альпер и соавторы построили фазовую равновесную диаграмму
MgO—MgCr2O4 (рис. 546). На основании петрографических и
Хромитные (хроматные) системы
601
рентгенографических определений было найдено, что в периклазо-
вую решетку при 2350° в виде твердого раствора входит 47 вес.%
Рис. 547. Параметр кристал-
лической решетки твердых рас-
творов в системе MgO—Сг2О3.
Образцы закалены от 2165°.
Рис. 548. Показатель свето-
преломления твердых раство-
ров в системе MgO—Сг2О3.
Образцы закалены от 2165°.
Сг2О3. С понижением температуры количество вошедшей в твер-
дый раствор окиси хрома уменьшается. При 2165° это количество
составляет 32вес.%, при 1600°—
И вес.%, при 1400° — 5 вес.%,
при I 1200° — 2.5 вес. %, и при
1000° растворимость Сг2О3 прак-
тически равна нулю. Альпер
с сотрудниками- установили так-
же, что MgO растворяется в
шпинельной решетке MgCr2O4.
Предельная концентрация это-
го твердого раствора составляет
около 5 вес.% MgO.
Параметр кристаллической ре-
шетки периклаза уменьшается
пропорционально введенному ко-
личеству Сг2О3 (рис. 547). Пока-
затель светопреломления, как
зто видно из рис. 548, по мере
Рис. 549. Параметры элементар-
ной ячейки твердого раствора
(Mg8_xCr^*)ivCrle®*vio32 (но Сту-
бичану и Гресковичу).
увеличения содержания Сг3*
повышается.
Магнезиохромит MgCr2O4 имеет показатель светопреломления
2.07 и плотность 4.43 г/см3.
Дерен и Габер [4, 5] изучили образование хромита магния
MgCr2O4 в результате твердофазовых реакций. Было показано, что
602
Хромитные (хроматные) системы
образование MgCr2O4 из MgO и Сг2О3 при обжиге на воздухе пред-
ставляет сложный процесс, состоящий из нескольких стадий:
1) покрывание зерен MgO окисью хрома; 2) окисление находящихся
на поверхности ионов Сг3* до Сг*+; 3) восстановление образовав-
шегося MgO-CrO2 до MgO-Cr2O3 (через промежуточное образова-
ние основного хромита 2MgO-Cr2O3=Mg2Cr2O8).
Стубичан и Грескович [6] доказывают, что при нагревании
смеси MgO и Сг2О3 (от 50 до 66 мол.%) в интервале 1800—2000°
в слабо восстановительной атмосфере получаются шпинельного
типа твердые растворы, содержащие ионы двухвалентного хрома.
На основании магнитных измерений и определения электропро-
водности для элементарной ячейки рассматриваемых твердых рас-
творов предлагается формула:
Если количество ионов Ст2* (х) равно единице, возникает тетра-
гональное искажение (эффект Яна—Теллера) и элементарная
ячейка уже характеризуется двумя параметрами: а и с (рис. 549).
Литература
1. Ключаров Я. В., Чень Ди-цзянь, в сб.: Химия и прак-
тическое применение силикатов, изд. ЦБТИ, Ленсовнархоз, 83, 1960.
2. Смачная В. Ф., П. Я. Сальдау, Зап. Лен. горн, инет., 24, 153,
1950.
3. А 1 р е г А. М., R. N. McNally, R. С. Doman, F. G. К е i h n,
Journ. Amer. Ceram. Soc., 47, № 1, 30, 1964.
4. D e r e n J., J. Haber, Zs. anorgan. allgem. Chem., 342, № 5—6,
277, 1966.
5. D e r e n J., J. Haber, Zs. anorgan. allgem. Chem., 342, № 5—6,
288, 1966.
6. St ubica n V. S., C. Greskovich, Journ. Amer. Ceram. Soc.,
49, № 9, 518, 1966.
7. W i 1 d e W. T., W. J. Rees, Trans. Brit. Ceram. Soc., 42, № 2, 123,
1943.
CaO—Cr2O3
Имеет значение при исследовании фазового состава металлур-
гических шлаков. Изучение реакций между окисью хрома и окисью
кальция очень важно для выяснения процессов разрушения огне-
упоров мартеновских и цементных вращающихся печей.
Система изучалась Фордом и Рисом [10], Фордом и Уай-
том [11], Вартенбергом, Ройшем и Сараном [15], Ольшан-
ским, Цветковым и Шлеповым [7], Нисино и Мотеки [14] и Клю-
чаревым и Егером [6].
Хромитные (хроматные) системы
603
В работах Форда с сотрудниками, Нисино и Мотеки, Ключарова
и Егера исследования проводились в условиях равновесия с воз-
духом, т. е. по существу рассматривалась часть системы
СаО—Сг2О3—СгО3. В этих условиях при низких температурах
устойчивы хроматы кальция, а при высоких — однокальциевый
хромит СаО-Сг2О3 (рис. 550). Кроме того, в окислительных усло-
виях образуются оксихромиты
кальция, количество и состав ко-
торых ещё окончательно не уста-
новлены. Большинство авторов
сходятся на составе оксихро-
мита 9СаО '4СгО3-Сг2О3; Форд
г
2000
1800
1600
1000
1200
1000
800
9Са0-‘)Сг03-Сгг03
30a02Cr032Cify ~ ~
800°„9^:1^СаСго}
CaO^CaCrOi! ,
__ -
зсаогсгОзгсгд
Сг203*0аСг0ч
0 20 00 60 80 100
СаО вес. % СггО3
Рис. 551. Диаграмма состояния
системы СаО—CrsO3 (в нейтраль-
ной атмосфере, по Ольшанскому,
Цветкову и Шлепову).
Рис.' 550. Возможное равновесие
фаз в псевдобинарной системе
СаО—Сг2О3 (в атмосфере воздуха,
по Форду с сотрудниками).
с сотрудниками указывают на промежуточное соединение
ЗСаО-2СгО3-2Сг2О3. Нисино и Мотеки указывают на получение
ими оксихромита с формулой 18СаО-10СгО3-Сг2О3. Существование
оксихромита 2СаО-Сг2О5 (6СаО-4СгО3-Сг2О3), описанного Васе-
ниным [4], отрицается Ключаревым и Егером. Последние не по-
лучили также и соединения ЗСаО-2СгО3-2Сг2О3. Сомнительно
существование соединений 8СаО -40103 -2Сг2О3 и ЗСаО -СгО3 -Сг2О3,
на которые указывают Атавал и Джатвар [8].
В нейтральных условиях система СаО—Сг2О3 изучалась Вар-
тенбергом с сотрудниками и Ольшанским с сотрудниками. Было
установлено лишь одно соединение СаО -Сг2О3, плавящееся кон-
груэнтно (рис. 551) и существующее в двух формах — а и р,
с температурой перехода 1570°, тогда как, по Форду и Рису, эта
температура значительно выше — около 1900°.
604
Хромитные (хроматные) системы
Хромиты кальция изучались Васениным [2—4], Журавле-
вым [5], Бурдезе [9], Белянкиным и Лапиным [1], Хиллом,
Пейзером и Райтом [13].
Низкотемпературная форма хромита кальция [3-СаО-Сг2О3 —
ромбической сингонии, с показателями преломления (по [7]):
Ng=2.33 +0.02, 7Vp=2.18+0.02. Кристаллы игольчатого габитуса,
двуосные, положительные, [3-хромит кальция, полученный спека-
нием, образует призмы с плеохроизмом по Ng темно-зеленые,
по Np светло-зеленые (по [3]). Параметры кристаллической ре-
шетки: по данным Бурдезе — а=9.03, 6=10.58, с=2.96 А; по дан-
ным Хилла с сотрудниками — а=9.07+0.02, 6=10.61+0.03,
с=2.99±0.04 А.
Высокотемпературная a-форма СаО*Сг2О3, по данным Ольшан-
ского с сотрудниками, образует кристаллы тетрагональной син-
гонии Ng=2.18 +0.003, Np=l.869 +0.005; пластинки с плеохро-
измом по Ng — более густо-зеленые, чем по Np; (—) 2V=10—15°.
Практически такие же данные приводят Белянкин и Лапин для
а-СаО-Сг2О3, полученного из шлака. Глассер и Дент-Глассер [12]
получали монокристаллы а-СаСг2О4 плавлением в кислородно-
водородном пламени. Эти авторы относят кристаллы а-СаСг2О4
к гексагональным и приводят следующие параметры элементар-
ной ячейки: а=11.67 +0.001, с=11.07±0.001 А.
Оксихромит 9СаО • 4СгО3 • Сг2О3 был получен Васениным
в виде анизотропных кристаллов неправильной формы пере-
менного состава с показателями преломления: ^=2.29 ±0.01,
Np=2.20+0.02.
Литература
1. Б е л я н к и н Д. С., В. В. Лапин, ДАН СССР, 91, № 4, 911, 1954.
2. Васенин Ф. И., Цемент, № 10, 36, 1938.
3. Васенин Ф. И., Журн. прикл. хим., 12, № 5, 651, 1939.
4. Васенин Ф. И., Журн. прикл. хим., 21, № 5, 429, 1948.
5. Журавлев В. Ф., Труды Лен. технол. инет., им. Ленсовета, вып. 7,
211, 1939.
6. К л ю ч а р о в Я. В., В. Г. Егер, Труды Лен. технол. инет,
им. Ленсовета, вып. 52, 179, 1961.
7. Ольшанский Я, И,, А, И. Цветков, В, К, Ш л е п о в,
ДАН СССР, 96, № 5, 1007, 1954.
8. Athavale V. Т., S. К. К. Jatvar, Journ. Indian Inst. Sci.,
20A, 55, 1937.
9. Burdese A,, Atti Accad. sci. Torino, Classe sci. fis.-mat. e nat., 86,
314 1951____1952.
10. F о r d W, F,, W. I. Rees, Trans. Brit. Ceram, Soc., 47, № 6, 207,
1948; 48, № 8, 291, 1949.
11. Ford W. F., J. White, Trans. Brit. Ceram. Soc., 48, №11,417,
1949.
12. G 1 a s s e r F. P., L, S. D e n t - G 1 a s s e r, Inorg. Chem., 1, 428,
1962.
Хромитные (хроматные) системы
605
13. Н i 11 Р. М,, Н. S. Р е i s е г, J. R. R a i t, Acta crystallogr,, 9,
№ 12, 981, 1956.
14. N i s i n о T,, К. M otek i, Journ. Ceram. Assoc, Japan, 69, № 785,
130, 1961.
15. Wartenberg H,, H, J, R e u s c h, E, S a r a n, Zs, anorgan,
allgem. Chem., 230, № 3, 266, 1937.
Sc2O3—Cr2O3
Система изучена Тресвятским, Павликовым и Лопато [2] на
образцах, подвергавшихся термообработке в среде аргона в высоко-
температурной печи до 2500° (методику см, [1]). Обнаружено сое-
Рис. 552. Диаграмма состояния системы
SCgOg-------------СГдОд.
динение (f-фаза на рис. 552), состав которого точно установить
не удалось. Это плавящееся инконгруэнтно соединение имеет
предположительно состав с отношением Cr2Os : Sc2Os=l : 3
или 1 : 4.
В системе установлено несколько видов твердых растворов.
606
Хромитные (хроматные) системы
Инвариантные точки системы Sc2O3—Сг2О3
Фазы Процесс Состав, мол.% Темпера- тура, ’С
SCjOj Сгаоя
Сг2О3 твердый раствор + 7-фаза + жидкость. Эвтектика. 37 63 2060
7-Фааа + твердый раствор + жидкость. Перитектика. 60 40 2130
ScjjOp твердый раствор + 7-фааа + жидкость. Инконгруэнтное плавление. 72-87 28-13 2130
1. На основе окиси хрома (Сг2О3 т. р.) со структурой ромбо-
эдрического типа, с предельной растворимостью до 28 мол.% Sc2O3.
С понижением температуры предельная растворимость Sc2O3
уменьшается до 17 мол.% Sc2O3. Изменение параметров элементар-
ной ячейки в гексагональных осях составляет от а=4.955 +0.003,
с=13.590 ±0.003 А до а=5.115 +0.005, с=13.944±0.005 А.
2. Твердый раствор на основе Sc2O3 (Sc2O3 т. р.) с предельной
концентрацией окиси хрома 10 мол.%. С понижением темпера-
туры предельная растворимость Сг2О3 уменьшается до 5 мол.%.
3. Твердые растворы на основе обнаруженного соединения
с отношением Cr2O3 : Sc2O3=l : 3 (или 1:4) — f-фаза, распро-
страняющаяся (при 1300°) от 73 до 85 мол.% Sc2O3. При более
высоких температурах эта область несколько расширяется. f-Фаза
имеет искаженную кубическую (С-тип) структуру окиси скандия.
Кристаллы f-фазы оптически одноосные, отрицательные, что
указывает на их принадлежность по структурному типу к классу
средних сингоний. Двупреломление зерен высокое, наблюдается
плеохроизм: по Np окраска лиловая, по Ng — красно-бурая.
Литература
1. Л о п а т о Л. М., С. Г. Тресвятский, 3. А. Яременко,
Порошков, металлургия, 1, № 1, 29, 1964.
2. Т р е с в я т с к и й С. Г., В. Н. Павликов, Л. М. Л опато,
Изв. АН СССР, неорг. матер., 2, № 2, 269, 1966.
Хромитные (хроматные) системы
607
Y2O3—Сг2О3
Изучена Павликовым, Лопато и Тресвятским [1] методом
«отжига и закалки». Образцы синтезировались кристаллизацией
из расплава с последующим отжигом. В случае содержания сво-
бодной окиси хрома смеси плавились в виде стержней, подвешен-
ных на вольфрамовой проволоке, остальные смеси плавились
в тиглях из молибденовой жести. Фазовый анализ образцов про-
водился с помощью рентгеновского, микроскопического и спектро-
скопического методов. Фазовые превращения соединений изуча-
Рис. 553. Диаграмма состояния системы
Y2Og--------------СГдОд.
лись с помощью дифференциального термического анализа, ди-
латометрических измерений и высокотемпературной микроскопии.
Установлено образование одного химического соединения YCrO3
перовскитовой структуры, плавящегося без разложения при
2290+30°. Хромит иттрия имеет обратимое полиморфное превра-
щение при 1820+15°. Шнейдер с сотрудниками [2] высказали
предположение о существовании в системе твердых растворов на
основе структуры типа граната, но Павликов их не обнаружил.
Диаграмма состояния системы представлена на рис. 553. Хромит
иттрия образует эвтектики: 1) с Сг2О3 с температурой плавления
2070+30° и содержащей 20 мол.% Y2O3; 2) с Y2O3, плавящейся
при 2020+15° и содержащей 72 мол.% Y2O3.
608
Хромитные (хроматные) системы
Литература
1. Павликов В, Н,, Л, М. Лопат о, С. Г, Тресвятский,
Изв. АН СССР, неорг. матер., 2, № 7, 1244, 1966.
2. Schneider S. J., R. S. Roth, JI L. Waring, Joum. Res.
Nat. Bur, Stand., 65A, № 4, 345, 1961.
La2O3—Cr2Os
Изучена Тресвятским и Павликовым [1 ]. Обнаружено одно
соединение: хромит лантана LaCrO3, плавящийся конгруэнтно
при 2430 +30°. Хромит лантана образует эвтектики с исходными
окислами: с Сг2О3 состава 82 мол.% Сг2О3 и 18 мол.% Ьа2О3 с тем-
Рис. 554. Диаграмма состояния системы
Ьа^з— Сг2О3.
пературой плавления 2080 ±30° и с La2O3 состава 20 мол.% Сг2О3 и
80 мол.% Ьа2О3 с температурой плавления 2050+15° (рис. 554).
Хромит лантана имеет обратимое полиморфное превращение при
290°. Кристаллы LaCrO3 в проходящем свете прозрачные, зеленого
цвета, анизотропные, со слабым двупреломлением, отрицательные,
угасание прямое, удлинение отрицательное. Показатели свето-
преломления LaCrO3 лежат в пределах 2.31 > Ng, Np > 2.28.
Хромитные (хроматные) системы
609
При обжиге смеси окислов на воздухе (460°) образуется новое
соединение, вероятно пятивалентного хрома ЬаСгО4, которое раз-
лагается при 650° на хромит лантана и кислород.
Литература
1, Тресвятский С, Г,, В, Н. Павликов, веб.; Вопросы теории
и применения редкоземельных металлов, Изд. АН СССР, М., 159,
1964.
Nd2O8—Cr2Os
Изучена Павликовым и Тресвятским [1 ] методом «отжига и
закалки». Установлено существование одного соединения NdCrO3,
°C
2400 - Nd,CrO3
2200
2000
Cr^NdCrOj NaCrOfNd^
I ill I
Рис. 555. Диаграмма состоя-
ния системы NdsO3—Cr2O3.
0 20 40 60 80 100
Mon.°/9 Nd303
плавящегося конгруэнтно при 2330 ±30°. Две эвтектики содержат
78 и 24 мол.% Nd2O3 и плавятся соответственно при 2080 ±30
и 2060+30°. Диаграмма состояния системы представлена
на рис. 555.
Литература
1. Павликов В, Н,, С. Г. Тресвятский, Журн. неорг. хим.,
И, № 6, 1442, 1966.
Sm2O3—Сг2О3
Изучена Павликовым с сотрудниками [1 ] методом «отжига
и закалки». Установлено образование одного соединения —
SmCrO3, плавящегося конгруэнтно при 2300+30°. Две эвтектики
содержат 80 и 16 мол.% Sm203 и плавятся соответственно при
1980+30 и 2080+30°. Хромит самария, возможно, имеет поли-
морфное превращение выше 900°. Диаграмма состояния системы
представлена на рис. 556. Средний коэффициент линейного расши-
39 Н. А. Торопов и др., кн. 1
610
Хромитные (хроматные) системы
рения хромита самария от комнатной температуры до 900° соста-
вляет величину 86«10-7.
о го 40 во во юо
Сгг°3 Мол.% Sm2°3
Рис. 556. Диаграмма состоя-
ния системы Sm2O3—Сг2О3.
Литература
1. Павликов В. Н., Л, М. Лопато, 3, А, Яременко,
А, В. Шевченко, Изв, АН СССР, неорг, матер,, 2, № 6, 1050,
1966.
Gd2O3—Cr2Os
Диаграмма состояния системы изучена Шевченко с сотруд-
никами [1, 2] методом «отжига и закалки». Установлено образо-
Рис. 557, Диаграмма состояния системы
GdgOg-------------Сг2О3
Хромитные (хроматные) системы
611
вание одного химического соединения — CdCrO3 с температурой
плавления 2350+30° (рис. 557). Эвтектики с температурой плавле-
ния 2120 ±30 и 2060+30° (рис. 557) содержат соответственно 15
и 77 мол.% Gd2O3. Авторы предполагают, что при температурах
выше 900° возможно полиморфное превращение GdCrO3.
Литература
[.Павликов В. Н., А. В. Шевченко, Л. М. Л о п а т о,
С. Г. Тресвятский, в сб.: Химия высокотемпературных ма-
териалов, изд. «Наука», Лен. отд., Л., 52, 1967.
2. Ш е в ч е н к о А. В., Л. М. Л о п а т о, С. Г. Т р е с в я т с к и й,
Изв. АН СССР, неорг. матер., 2, № 7, 1240, 1966.
РЬО—СгО3
Частная система более сложных силикатных систем, имеющих
значение в производстве керамических глазурей и стекол.
Изучена Егером и Гермсом [1], результаты представлены
на рис. 558 для участка РЬО—РЬСгО4. Существует четыре
г
950 -
39*
612
Хромитные (хроматные) системы
соединения: РЬбСгО8, РЬ7Сг2Ои, РЬ2СгО8 и РЬСгО4. Соединение АбВ
(А=РЬО, В=СгО3) устойчиво ниже 815°. Соединение А7В2плавится
при 854° и имеет обратимое полиморфное превращение при 744°;
А2В не имеет превращений и плавится при 920°. АВ известен
в природе как минерал крокоит, который триморфен: 1) «-моди-
фикация (моноклинная сингония) стабильна ниже 707°; 2) р-форма
стабильна между 707 и 783°; 3) f-форма стабильна выше 783°.
Негас [21, нагревая смесь РЬО и Сг2О3 в присутствии кислорода
при 700°, получил новое соединение PbCrO4-2PbO=Pb3CrOe.
Негас отрицает существование соединения РЬ7Сг2О13(2РЬСгО4-
•5РЬ0). При обжиге смеси 14PbO+2Cr2O3 была получена смесь
РЬСгО4>2РЬО и РЬСгО4«4РЬО. При 737° соединение РЬСгО4-2РЬО
распадается на РЬСгО4-4РЬО и РЬСг04-РЬ0.
Литература
1. J а е g е г F. М., Н. С. Germs, Zs. anorgan. allgem. Chem., 119,
№ 2, 153, 1921.
2. N e g a s T., Journ. Amer. Ceram. Soc., 48, № 10, 550, 1965.
FeO—Cr2O3
Система важна для минералогии хромошпинелидов и техноло-
гии огнеупоров.
В связи с изучением равновесия окислов железа и Сг2О3 в при-
сутствии газовой фазы, содержащей водород и углекислоту, Рибо
Рис. 559. Диаграмма состоя-
ния системы FeO—Cr2Os.
и Муан [11 построили часть диаграммы состояния системы
FeO—Сг2О3 (рис. 559), которая, строго говоря, не является бинар-
ной вследствие присутствия FejOa. В перитектической точке
Хромитные (хроматные) системы
613
в равновесии находятся твердый раствор на основе вюстита (со-
держащий 6% Сг2О3), шпинель (FeO, Сг2О3) и жидкая фаза, содер-
жащая 3% Сг2О3.
Литератур а
1. R i b о u d Р. V., А. М u a n, Trans. Metallurg. Soc. AIME, 230,
№ 1, 88, 1964. ’ ’
( NiO—Cr2O3
Диаграмма состояния системы не построена. Цима [1 ] изучил
двойной окисел никеля и хрома, образуемый на поверхности оки-
сляющегося Ni-Cr сплава. Содержание хрома в окисном слое до-
ходило до 6 атомн.%. Установлено также образование шпинели
NiCr2O4.
Литература
1. Z i m a G. Е., Trans. Amer. Soc. Met., 49, 924, 1957.
МОЛИБДАТНЫЕ (М О Л И Б ДИ Т НЫЕ) СИСТЕМЫ
Li2O—МоО2
Изучена в температурном интервале 800—1100° Фуассье и
Ро [1], проводившими опыты в железной бомбе. В этих условиях
получено три соединения: Li4MojO12, LijMoOa и LieMo2O7. Соеди-
нения LijMojOs, на которое указывали Губерт [31 и Глейтцер [2],
не было получено (см. также [4]). Из представленной схемы (рис. 560)
видно, что между Li2MoO3 и LieMo2O7 существует непрерывный ряд
°C
1100 -
1000 •
МоОг
L0^2
______т-р._
Li^MOjO^
Liг Mo 03
Т.р.
L 16 @7
аго
0 to 20 /30 io /io /0
MoO2 Li3MoO3 LI2MO2O2 .
Мол.%
"Рис. 560. Схема фазовых соотношений системы
Ы2О—МоО2.
твердых растворов: около 1100° область твердых растворов расши-
ряется и от соединения LieMo2O7 простирается до Li4MojO12. Все
синтезированные соединения обнаруживают рентгенограммы, ана-
логичные полученным для Li^nOa [51, что позволяет индицировать
молибдиты лития на основе моноклинной ячейки с пространствен-
ной группой C2lcCzh- Параметры элементарных ячеек: Li4Mo6O12 —
а=4.95±0.02, 6=8.58+0.02, с=10.57+0.03 А, 0=99°ОО'±О.4О';
LijMoOg — а=4.97+0.02, 6=8.61 ±0.02, с=10.10+0.03 А.
Р=99°30,±0.40'; LieMo2O7 - а=4.98±0.02, 6=8.62+0.02,
Молибдатные (молибдитные) системы
615
с= 10.05+0.03 А, р=99°30' +0.40'. Плотность (в этой же последо-
вательности): 5.19 +0.05 , 4.84 +0.05 и 4.02+0.05 г/см3 (рис. 561).
Рис. 561. Плотность твердых
растворов серии Li4MoBOi2—
LieMo2O7.
Литература
1. Fouassier С., J.-M. Reau, Compt. rend., 263, ser. С, № 10, 671,
1966.
2. Gleitzer Ch., Bull. Soc. chim. France, № 6, 1913, 1966.
3. H u b e r t P. H., Compt. rend., 259, № 14, 2238, 1964.
4. Kohlm uller R., Anu. Chim., 4, 1183, 1959.
5. L a n g G., Zs. anorgan. allgem. Chem., 276, № 1, 77, 1954.
MgO—MoO2
Систему частично изучали Русаков с сотрудниками [1 ]. Исход-
ная МоО2 получалась восстановлением МоО3 в токе 50—60% СО
(остальное — COj) при 650°. Смеси MgO и МоО2 обжигались
в восстановительной атмосфере (60% СОа), причем конечная
температура составляла 1400°. Получено только одно соединение,
имеющее, по мнению авторов, формулу MgO-МоО2, с температурой
плавления выше 1600°. Гексагональные, металлически-черные
кристаллы имеют параметры элементарной ячейки: а=4.58,
с=14.67 А; плотность 5.20 г/см3, твердость 4.0—4.5 (по шкале
Мооса), немагнитны.
Л ит ератур а
1. Русаков Л. Н., И. А. Новохатский, Л. М. Л е и е в,
А. А. С а в и н с к а я, ДАН СССР, 161, № 2, 410, 1965.
616
Молибдатные (молибдитные) системы
V02—МоО2
Мариндер и Магнели [1], нагревая смесь V2O8, V2O3, МоО3
с металлическим молибденом в запаянных кварцевых трубках
при 1000° в течение нескольких дней в различных соотноше-
ниях, получили широкую область твердого раствора состава от
Vo 90Mo0.ioOa Д° Vo 30Мо0ф70О2, по своей структуре относящегося
к типу рутила. Параметр элементарной ячейки изменялся от ве-
личины а=4.573, с—.2.860 А для более богатого ванадием сплава
до а=4.747, с=2.831 А для состава V0 30Mo0 70О2.
Литература
1. Marinder В.-О., А. М a g n е 1 i, Acta chem. Scand., 12, № 6, 1345,
1958.
NbO2—MoO2
Нагревая смеси MoO3 с металлическим ниобием в запаянных
кварцевых трубках при 1000° в течение нескольких дней, Марин-
дер и Магнели [1 ] получали рутилоподобную фазу, один из соста-
вов которой, Nb0 33Мо0.ctOj, имел параметры элементарной
ячейки: а=4.855, с=2.883 А. Химических анализов, подтвер-
ждающих валентное состояние катионов, авторы не приводят.
Литература
1. Marinder В.-О., А. М a g n е 1 i, Acta chem. Scand., 12, № 6; 1345,
1958.
CrO2—MoO2
Производя нагревание смеси Cr2O3, MoO2 (переменное содер-
жание) и МоО3 в запаянной кварцевой трубке при 1000° в течение
нескольких дней, Сундхольм с сотрудниками [1 ] получили фазу
со структурой типа рутила с некоторой областью гомогенности.
Для состава Сг0 33Мо0 в7О2 параметры элементарной ячейки имели
значения: а=4.696,ос=2.886 A, 7=63.64 А3; для Сг0 22Мо0 78О2
а=4.749, ос=2.858 А, 7=64.44 А3; для Сг01вМо0 81О2 а=4.760,
с=2.848 А, 7=64.53 А3. Химических анализов, подтверждающих
валентное состояние катионов, авторы не приводят.
Молибдатные (молибдитные) системы
617
Литература
1. Sundholm A., S. Andersson, A. Magneli, В.-О. Mari п-
d е г, Acta chem. Scand., 12, № 6, 1343, 1958.
FeO—MoO2
Русаков с сотрудниками [1 ] обжигали смеси FeO и МоО2 в вос-
становительной среде (60% СО), конечная температура составляла
1200° (5 час.). Исходная МоО2 получалась восстановлением МоО3
в проточной восстановительной атмосфере (50% СО, 50% COj)
при температуре 650°. В полученных соединениях авторы прини-
мают четырехвалентный молибден, хотя прямых доказательств,
указывающих на валентность молибдена, не приводят. Соедине-
ние FeO • МоО2 имеет температуру плавления 1580°, 2FeO-MoO2
плавится при 1400°.
FeO-MoO2 кристаллизуется в гексагональной системе с пара-
метрами элементарной ячейки: а=4.66, с=15.00 кХ, металлически-
черного цвета, непрозрачно, твердость (по шкале Мооса) 4.0—4.5,
плотность 6.0 г/см3, сильно анизотропно, немагнитно.
Для соединения 2FeO-MoO2 характерна кубическая решетка
с а=8.48 кХ, кристаллы черного цвета, непрозрачны, изотропны,
магнитны, плотность 5.75 г/см3, твердость (по шкале Мооса)
4.5-5.0.
Литература
1. Русаков Л. Н., И. А. Н о в о х а т с к и й, Л. М. Л е н е в, А. А. Са-
ви н с к а я, ДАН СССР, 161, № 2, 410, 1965.
Li2O—МоО3
Часть диаграммы в концентрационной области от Li2MoO4
до чистого МоО3 изучена Хоерманном [1 ] методом термического
анализа (рис. 562). Обнаружено четыре соединения: Li2MoO4
(плавится конгруэнтно при 705°), Li2O-2MoO3 (плавится ин-
конгруэнтно при 532°), Ы2О-ЗМоО3 (плавится инконгруэнтно
при 549°) и Li2O-4MoO3 (плавится инконгруэнтно при 568°).
Эвтектика содержит 53 мол.% Ы2МоО4 и 47 мол.% МоО3 и имеет
температуру плавления 529°.
Молибдаты лития отличаются высоким светопреломлением.
Так, для Ы2О-ЗМоО3 показатель преломления выше 1.74. Кри-
сталлы Li2O-2MoO3 имеют ромбическую сингонию.
618
Молибдатные (молибдитные) системы
Рис. 562, Диаграмма состояния
системы Li2MoO4—МоО3.
Литература
1. Hoerm an п F., Zs. anorgan. allgem. Chem., 177, № 2—3, 145, 1928.
Na2O—MoO3
Представляет интерес с точки зрения образования молибдатов
натрия в качестве нелетучих продуктов при взаимодействии трех-
Рис. 563. Диаграмма состоя-
ния системы Na?MoO4—МоОч.
Na^MoOi,
Мол.%
MoOj
Молибдатные (молибдитные) системы
619
окиси молибдена с хлористым натрием, поскольку оксихлориды
молибдена практически не существуют выше 400°.
Изучена Зеликманом и Горовицем [1 ] в интервале температур
400-700° (рис. 563).
Литература
1. Зеликман А. Н., Н. Н. Г о р о в и ц, Журн. общ. хим., 24, 11, 1916,
1954.
К2О—МоО3
Изучена Спицыным и Кулешовым [1 ] визуально-политермиче-
ским методом. В отличие от данных Амадори [2] и Германна [31
этими авторами обнаружено существование ди-, три- и тетрамо-
Рис. 564. Диаграмма состоя-
ния системы К2МоО4—МоО3.
либдатов калия, а также неустойчивых гекса- и октамолибдатов.
В таблице и на рис. 564 представлены результаты изучения системы.
Наличие перитектик и F2 на кривой ликвидуса и изменение
внешнего вида выделяющихся кристаллов указывают на существо-
620
Молибдатные (молибдитные) системы
Инвариантные течки системы К2МоО4—МоО3
Содержа-
ние МоО3,
мол. %
Темпера-
тура кри-
сталлиза-
ции, °C
Внешний вид выделяю-
щейся твердой фазы
Процесс
0
45
50
53
67.5
73
75
78
100
926
467
489
481
571
553
559
547
795
Точечные кристаллы.
Прозрачные ромбические
пластинки.
Плавление К2МоО4.
Эвтектика Е±.
Плавление К2Мо2О7.
Тонкие иглы.
Призматические кристал-
лы.
Эвтектика Ег.
Плавление К2Мо3О10.
Эвтектика Е3.
Плавление К2Мо4О13.
Эвтектика £4.
Плавление молибденового ан-
гидрида.
вание, по-видимому, нестойких соединений, гекса- и октамолиб-
датов калия, которые плавятся инконгруэнтно.
Литература
1. Спицын В. И., И. М. Кулешов, Журн. общ. хим., 21, № 8, 1365,
1951.
2. Am adori М., Atti reale 1st. Veneto sci., 72, II, 896, 1912—1913.
3. Hoermann F., Zs. anorgan. allgem. Chem., 177, № 2—3, 145, 1928.
Rb2O—MoO3
Изучена (рис. 565) Спицыным и Кулешовым [1 ] визуально-
политермическим методом. Rb2MoO4 плавится при 929°. В системе
четыре эвтектики: Ег (458°) отвечает 44 мол.% молибденового
ангидрида, Е2 (478°) — 51 мол.%, Е3 (549°) — 73 мол.% и
Et (546°) — 79 мол.% МоО3. В системе существуют ди- (479°), три-
(563°) и тетрамолибдаты (554°) и, по-видимому, образуются гекса-
и октамолибдаты.
Димолибдат рубидия образует блестящие бесцветные ромбиче-
ские пластинки; тримолибдат выделяется в форме тонких иголь-
Молибдатные (молибдитные) системы
621
чатых кристаллов. Призматические кристаллы тетрамолибдата
имеют серый цвет. Гекса- и октамолибдаты рубидия образуют
друзы из призм.
Рис. 565. Диаграмма состоя-
ния системы RbsMoO<—МоО3.
Литература
1. С п.и ц ы н В. И., И. М. Кулешов, Журн. общ. хим., 21, № 8, 1368,
1951.
Cs2O—МоО3
Система изучена (рис. 566) Спицыным и Кулешовым [1 ] ви-
зуально-политермическим методом.
В системе найдены три эвтектические точки: Ег (458°) отвечает
содержанию 45 мол.% МоО3, Еъ (523°) — 72 мол.%, Е3 (530°) —
77 мол.% МоО3; две перитектические: и F2 (82 и 84 мол.%
МоОз). Точки плавления предполагаемых гекса- и октамолибдатов
цезия равны 556 и 581°.
Тримолибдат цезия образует тонкие игольчатые кристаллы,
тетрамолибдат — призмы. Гексамолибдату цезия соответствуют
622
Молибдатные (молибдитные) системы
друзы из укороченных призм, октамолибдату — друзы из более
удлиненных призм. Для системы характерно отсутствие димолиб-
дата.
Рис. 566. Диаграмма состоя-
нияХсистемы Сз2МоО4—МоО3.
Литература
1. Спицын В. И., И. М. К у л е ш о в, Журн. общ. хим., 21, № 8, 1372,
1951.
NbjO8—МоО3
Трунов, Ковба и Сироткина [1 ] изучили в концентрационных
пределах 10—90 мол.% МоО3 субсолидусную область системы
(обжиги при 700 и 1100° в запаянных кварцевых ампулах).
Обнаружено три соединения:' ?,4Nb2OB-МоО3, 2Nb2OB-MoO3 и
Nb2OB-3MoO3.
Авторы предполагают, что Nb2O5 -ЗМоО3 имеет тетрагональную
элементарную ячейку типа ReO3 с параметрами: а=23.12,
с= 3.995 А.
Литература
1. Трунов В. К., Л. М. К о в б а, Е. И. С и р о т к и н а, ДАН СССР,
153, № 5, 1085, 1963.
Молибдатные (молибдитные) системы
623
Синтезированная фаза
0 50 700
8lA Мол.% м°°з
Рис. 567. Диаграмма со-
стояния системы
Bi2O3—МоО3.
Bi2O3—МоО3
Имеет значение в связи с изучением природных молибдатов
висмута, например кёхлита Bi2MoOe.
Структура последнего была охарактеризована Земан-
ном [51: ромбо-пирамидальный, а=5.50+0.02, 6=16.24+0.06,
с=5.49+0.02 A, Z=4.
Гаттов [4], синтезируя кёхлит, получил кубическую фазу
состава 2Bi2O3-MoO3 или Bi4MoO« с параметром решетки
а=5.654 +0.01 A, Z=*li, расчетная плотность, хорошо согласую-
щаяся с экспериментальной, 7.91 г/см3,
кристаллизуется по типу CaF2 и отно-
сится к пространственной группе 0^ со
статистическим распределением Bi и Мо.
При 870° отмечается превращение в тетра-
гональную модификацию, которая сущест-
вует до температуры плавления 920°.
Диаграмма состояния системы Bi2O3—
—МоО3 приводится в работе Беляева и
Смолянинова [1]. В системе обнаружено три
конгруэнтно плавящихся соединения (рис.
567): Bi2(MoO4)3 с температурой плавления
648°/Bi2MoOe (970°) и ЗВЦО3.МоО3 (990°).
Последнее образует с Bi2O3 и BigMoOg
твердые растворы. Соединение Bi2(MoOg)3
образует эвтектики с BigMoOg при' 636°
и 72.5 мол.% МоО3 и с МоО3 при 618° и
81.5 мол.% МоО3.
Витинг [2] исследовал систему методом термического анализа,
дополненного визуально-политермическими наблюдениями и ис-
следованием микроструктуры образцов. Исходными веществами
служили Bi2O3 и молибденовой ангидрид; плавка производилась
в платиновом тигле. В соответствии с диаграммой состояния
(рис. 568) обнаружено четыре соединения: 3Bi2O3-MoO3, плавя-
щееся конгруэнтно при 985°, 2Bi2O3-MoO3, Bi2O3-MoO3 и Bi2O3 •
• ЗМоО3, плавящиеся инконгруэнтно соответственно при 925 , 900
и 650°. Соединение 3Bi2O3-MoO3 образует твердый раствор с из-
бытком своих компонентов. Эвтектика между Bi2O3 и 3Bi2O3 -МоО3
содержит ~1.5 мол.% МоО3 и плавится при 800°. Таким образом,
в рассматриваемой системе существует не три конгруэнтно плавя-
щихся соединения как утверждали Беляев и Смолянинов [1],
а* лишь одно. Витинг подтвердил наличие соединения 2Bi2O3 •
• МоО3, найденного Гаттовым. Валентное состояние молибдена
в полученных соединениях Витинг специально не изучал, полагая,
624
Молибдатные (молибдитные) системы
что всегда присутствует шестивалентный молибден. Аналитиче-
ское определение продуктов реакций не производилось.
Рис. 568. Диаграмма состояния системы Bi2O3—МоО3.
Блассе [31 показал, что соединение BigMoOe образует, кроме
кёхлита, высокотемпературную тетрагональную модификацию
с параметрами элементарной ячейки: а=3.95, с= 17.21 А.
Литература
1. Беляев И. Н., Н. П. Смолянинов, Журн. неорг. хим., 7,
№ 5, 1125, 1962.
2. Витинг Л. М., Вести. Моск, унив., 21, сер. II, хим., № 2, 60, 1966.
3. В 1 a s s е G., Joum. Inorg. Nucl. Chem., 26, № 8, 1473, 1964.
4. Gattow G., Zs. anorgan. allgem. Chem., 298, № 1—2, 64, 1959.
5. Z e m a n n J., Heidelberger Beitrage zur Mineral, u. Petrogr., 5, 139, 1956.
Cr2O3—MoOs
Трунов и Ковба [1], обжигая смеси Сг2О3 и МоО3 при 700°,
получали только одно соединение Сг2О3-ЗМоО3, которое, по их
мнению, является в этой системе единственным. Соединение
Сг2О3-ЗМоО3 относится к ромбической сингонии и имеет следую-
щие значения параметров элементарной ячейки: а=9.074, 6=9.173,
с=12.71 A; Z=4.
Литература
1. Т р у и о в В. К., Л. М. Ковба, Изв. АН СССР, неорг. матер., 2,
№ 1, 151, 1966.
Молибдатные (молибдитные) системы
625
Fe2O3—МоО3
Трунов и Ковба [1 ] обжигали смеси, отвечающие составам
Fe2O3 : МоО3 и Fe2O3 : ЗМоО3 при 700°. В обоих случаях обнаружи-
валось только одно соединение Fe2O3-3MoO3, по мнению авторов,
единственное в этой системе. Fe2O3-3MoO3 кристаллизуется в ром-
бической сингонии и имеет следующие параметры элементарной
ячейки: а=9.111, 6=9.222, с=12.81 A; Z=4. Fe2O3-3MoO3 изо-
структурно соединению А12О3-ЗМоО3.
Литература
1. Трунов В. К., Л. М. К о в б а, Изв. АН СССР, неорг. матер., 2, № 1,
151, 1966.
40 Н- А- Торопов и др,, кн, 1
ВОЛЬФРАМАТНЫЕ (ВОЛЬФРАМИТНЫЕ)
СИСТЕМЫ
Na2O—WO2
Полностью система не изучена. Значительный интерес пред-
ставляют так называемые вольфрамовые бронзы.
Розен, Пост и Банкс [1], а затем Такамори и Томозава [2],
пользуясь данными дилатометрии, показали, что нестехиометри-
ческий вольфрамит натрия (кубическая натриево-вольфрамовая
бронза NaxWO3) обнаруживает превращение, температура которого
зависит от величины индекса х в формуле NaxWO3. По данным Ро-
зена с сотрудниками для х=0.692 температура превращения равна
175°, для! я=0.845 она составляет 250°; по Такамори и Томозава
для 2=0.8 температура превращения 180°.
Литература
1. Rosen С., В. Р о s t, Е. В a n k s, Acta crystallogr., 9, № 6, 477, 1956.
2. Т а к a m о г 1 Т., М. Т о m о z a w a, Journ. Amer. Ceram. Soc., 47,
№ 9, 472, 1964.
MoO2—WO2
Мариндер и Магнели [1] получали твердые растворы ряда
МоО2—WO2, нагревая смеси, состоящие из МоО3, WO3, молибдена
и вольфрама, в запаянных кварцевых трубках при 1000° в течение
нескольких дней. Состав, отвечающий формуле ~Mo0 50W0 50О2,
имел структуру деформированного рутила (тип МоО2). Химиче-
ских анализов, подтверждающих валентное состояние катионов,
авторы не приводят.
Литература
1. М a rji n d е г В.-О., А. М a g n е 1 i, Acta chem. Scand., 12, № 6, 1345,
1958.
Вольфраматные (вольфраматные) системы
627
Li2O—W03
Часть диаграммы в концентрационной области от Li2WO4
до чистого WO3 изучена Хоерманном [1 ] методом термического
анализа (рис. 569).
Обнаружено три соединения: Li2WO4 (плавится конгруэнтно
при 742°), Li2O-2WO3 (плавится конгруэнтно при 745°) и Li2O •
Рис. 569. Диаграмма состоя-
ния системы Li2WO4—WO3.
•4WO3 (плавится инконгруэнтно при 800°). Эвтектика между
Li2WO4 и дивольфраматом имеет температуру плавления 696° и
между дивольфраматом и тетравольфраматом — температуру пла-
вления 740°.
Литература
1. Н oermann F., Zs. anorgan. allgem. Chem., 177, № 2—3, 145, 1928.
Na2O—WO8
Часть диаграммы в концентрационной области от Na2WO4
до чистого WO3 изучена Хоерманном [1 ] методом термического
анализа (рис. 570). Обнаружено три соединения: Na2WO4 (плавится
40*
628
Вольфраматные (вольфрамитные) системы
конгруэнтно при 700°), Na2O-2WO3 (плавится конгруэнтно при
738°) и Na2O-4WO3 (плавится инконгруэнтно при 784°). Эвтектика
Рис. 570. Диаграмма состоя-
ния системы Na2WO4—WO3.
между тетра- и дивольфраматом имеет состав 47.5 мол.% Na2WO4
и 52.5 мол.% WO3. Дивольфрамат натрия имеет полиморфное
превращение при 547°.
Литература
1. Hoermann F., Zs. anorgan. allgem. Chem., 177, № 2—3, 145, 1928.
K2O-WOg
Часть диаграммы в концентрационной области от K2WO4
до чистого WO3 изучена Хоерманном [1] методом термического
анализа (рис. 571). Обнаружено три химических соединения:
K2O-WO3 (плавится конгруэнтно при 921°), K2O-3WOS (плавится
Вольфраматные (вольфраматные) системы
629
инконгруэнтно при 660°) и K2O-4WO3 (плавится инконгруэнтно
при 930°). Эвтектика в системе имеет состав: 54.5 мол.% K2W04
и 45.5 мол.% WO3 и плавится при 600°.
Рис. 571. Диаграмма {состоя-
ния системы K2W04—WO3.
Л ит ератур а
1. Н oermann F., Zs. anorgan. allgem. Chem., 177, № 2—3, 145, 1928.
Rb2o—wo3
Система изучена Спицыным и Кулешовым [1 ] визуально-поли-
термическим методом в пределах от 0 до 85 мол.% WO3. Кривая
ликвидуса системы приведена на рис. 572, а результаты экспери-
ментальных данных приведены в таблице.
Все изополивольфраматы рубидия отличаются нестойкостью
и плавятся инконгруэнтно.
630
Еолъфраматные (волъфрамитные) системы
Инвариантные точки системы Rb2WO4—WO3
Содержа- ние WO3, мол. % Темпера- тура кри- сталлиза- ции, °C Внешний вид выделяющихся фаз Процесс
0 952 Точечные шелковистые. Плавление Rb2WO4.
39 563 — Эвтектика Е.
40 589 Мелкие коричневые кри- сталлы в нижней части расплава. Выделение Rb2W2O7.
50 681 То же. Плавление Rb2W2O7 (М).
51 680 — Перитектика Р,- Выделение RbsW3O10.
52 700 Блестящие золотистые пластинки в объеме расплава.
67 858 То же. Плавление Rb2W3O10.
68 862 Прямоугольные призмы, возникающие одновре- менно во всем рас- плаве. Перитектика Р». Начало вы- деления Rb2W3O19.
84 1053 — Перитектика Rb®WeO1B (Ря).
85 1069 Мелкие призматические кристаллы. Выделение вольфрамового ан- гидрида.
Рис. 572. Диаграмма состоя-
ния системы RbsWO4—WO3.
Литература
I. Спицын В. И., И. М. Кулешов. Журн. физ. хим., 24, № 10,
1197, 1950.
Вольфраматные (вольфрамитные) системы
631
ВеО—W03
Систему изучили Чанг, Скрожер и Филлипс [1 ] методом
закалки с использованием закрытых платиновых капсул. Резуль-
таты представлены на рис. 573, из которого видно, что единствен-
Рис. 573. Диаграмма состоя-
ния системы ВеО—WO3.
ная эвтектика содержит 37.0 мол.% WO3 и плавится при 1185±5°.
По определениям авторов, температура плавления WO3 равна
1430+5°, а фазовое превращение WO3 происходит при 745+5°.
Литература
1. Chang L. L. Y., М. G. Scroger, В. Phillips, Journ. Amer.
Ceram. Soc., 49, № 7, 385, 1966.
MgO—wo3
Изучена Чангом, Скрожером и Филлипсом [1 ] методом закалки
с использованием запаянных платиновых капсул. Установлено
образование соединения MgW04, плавящегося конгруэнтно при
1358 +5°. WO3 и MgW04 образуют эвтектику, содержащую
28.5 мол. % MgO и плавящуюся при 1120+5°; эвтектика между MgO
и MgW04 содержит 55.0 мол.% MgO и плавится при 1318+5°
(рис. 574). Вольфрамат магния существует в виде двух модифика-
632
Вольфраматные (вольфрамитные) системы
ций: низкотемпературная, типа вольфрамита модификация устой-
чива до 1165+5°; структурную принадлежность высокотемпера-
турной модификации авторы не смогли определить.
°C
1900
1700
1500
1300
1100
900
700
. MgO+MgWO^l}
MgWO^WO,
*(гпетр.) J
7№5'
о го
МдО
W 60
Мол.7.
80 100
W03
Рис. 574. Диаграмма состоя-
ния системы MgO—WO3.
Литература
1. С h a n g L. L. Y., М. G. S а г о g е г, В. Р h i 11 i р s, Joum. Amer.
Ceram. Soc., 49, № 7, 385, 1966.
CaO—WO3
Резухина, Левицкий и Френкель [1 ] в связи с изучением термо-
динамических свойств вольфраматов кальция указывают, что
в системе существует два соединения: ЗСаО •WO3=Ca3WOe и
СаО •WO3=CaWO4. Реакция 2Ca0+CaW04=Ca3W0e характери-
зуется наибольшей отрицательной величиной изобарного потен-
циала ДС°. Параметр элементарной ячейки соединения Ca3WOe
а=8.03+0.01 А.
Диаграмму состояния системы построили Чанг, Скрожер и
Филлипс [2], применяя метод закалки с использованием запаян-
ных платиновых ^капсул. Обнаружены соединения CaWO4 и
Вольфраматные ( вольфрамитные) системы
633
Ca3WOe, плавящиеся конгруэнтно соответственно при 1580+5
и 2250 + 20°. Авторы смогли экспериментально охарактеризовать
только две эвтектики: содержащую 56.5 мол. % СаО и плавящуюся
при 1490 +5° (между двумя вольфраматами) и содержащую
Рис. 575. Диаграмма состояния
системы СаО—WO3.
2250±20°
L
1900
1700
1500
1300
1100
900
700
- СаО
Ca3W0B
- 1450 ±5°
56.5%СаО
Ctt3W0g
CaWOb
\
\ Ca3W0g^)K
CaWo'^X
25.0 %СаО
CaW0^W03
(memp.)
745 ±5°
CaWO^W03
0 20
CaO
40 60
Мол.%
BO 100
W03
25 мол.% СаО с температурой плавления 1135+5° (между WO3
и CaWOJ. На основе визуального наблюдения принимается, что
третья эвтектика плавится вблизи 2100° (рис. 575). Мелкие белые
кристаллы Ca3WOe имели структуру, которую нельзя отнести
к кубической.
Литература
1. Резухина Т. Н., В. А. Левицкий, М. Я. Френкель,
Изв. АН СССР, неорг. матер., 2, № 2, 325, 1966.
2. Chang L. L. Y., М. G. S с г о g е г, В. Р h i 11 i р s, Journ. Amer.
Ceram. Soc., 49, № 7, 385, 1966.
SrO—WO3
Изучена Чангом, Скрожером и Филлипсом [1 ] методом закалки
с использованием запаянных платиновых капсул. Исходными ве-
ществами служили SrCO3 и WO3. Обнаружено два соединения:
634
Вольфраматные (волъфрамитные) системы
SrW04 и Sr3WOe (рис. 576). SrW04 изоморфен CaW04. Соединение
Sr3WOe при 1100° претерпевает полиморфное превращение. Вы-
‘С
1900
1700
1500
SrO
-Sr^V06
(куб.)
1300
1100
Sr,WO.
J+
Ж
141O±5
57.0%
SrO
Sr3W0B
*SrWPjt_
SrWO^
1535*5°
Жидк.
900
700
SrO
Sr3W06
(некуб.)
< 0
SrO
Sr3W06
SrWOi,
SrWQ
** r W03^
1073*5 3
24.0 7a SrO
SrWOfWfyimemp.)
745*5’_________
5rWO<+WO3(pOM6)
го 40 во
Мол. 7,
80 100
W03
Рис. 576. Диаграмма состоя-
ния системы SrO—WO3.
сокотемпературная форма имеет кубическую структуру [типа
(NHJgFeFJ, структура низкотемпературной формы не может быть
отнесена к кубической.
Л ит ератур а
1. С h an g L. L. Y., М. G. Scroger, В. Phillips, Journ. Amer.
Ceram. Soc., 49, № 7, 385, 1966.
BaO—WO3
Система интересна для технологии вольфрамовых сплавов.
Изучена Пуртом [4] (рис. 577). Обнаружено два соединения:
ВаО -WO3 и ЗВаО -WO3, указания на которые были сделаны ранее
Силленом и Ниландером [6] и Руксби и Стьюардом [5]. Соедине-
ние ВаО >WO3 имеет тетрагональную элементарную ячейку, кри-
сталлизуется по структурному типу Ве04иимеет параметры эле-
ментарной ячейки: а=5.6, с=12.5 А. Соединение 3BaO-WO3
имеет псевдокубическую гранецентрированную ячейку с парамет-
ром а=8.60 А.
Вольфраматные (вольфрамитные) системы
635
Инвариантные точки системы ВаО—WO3
Точки Фазы Процесс Состав, мол. % Темпера- тура, °C
WO, ВаО
1 ВаО-|-ЗВаО. WO. + жидкость. ЗВаО- WO3-|-BaO. WO3 -|- жид- кость. Эвтектика. —8 -—92 1590
2 41.5 58.5 1320
3 ЗВаО- W03 + жидкость. Плавление. 25 75 1770
4 ВаО- WO3 + жидкость. 50 50 1490
5 BaO-WO3 -|- WO3 + жидкость. Эвтектика. 75 25 938
Шивахаре [2] получал вольфраматы бария в водном растворе
путем добавления хлорида бария к подкисленному раствору
Рис. 577. Диаграмма состояния системы
ВаО—WO3.
вольфрамата натрия. Синтезированы следующие соединения:
BaO-WO3, BaO-2WO3, BaO-3WO3, BaO-4WO3 и 5BaO-12WO3.
Чанг, Скрожер и Филлипс [3] построили диаграмму состояния
системы, работая методом закалки и помещая образцы в запаян-
636
Вольфраматные (вольфрамитные) системы
ные платиновые капсулы. Соответствующая диаграмма приведена
на рис. 578. Температуры плавления соединений BaW04 и Ba3WOe
довольно близки к полученным Пуртом. Соединение Ba3WOe
°C
1900
1700
1500
1300
1100
900
700
BaO* Ж
_JL
1590
BaO
Ba3W0g
(куб)
1320*5'
53.2%8a0i
(некуб.)
*8aW0^
Ba3W06
BaWOt,
W034K
935*5'
„ '25.O°/„BaO
BaWOfWB,
795*5°
BaW0^W03
Ва3№06+Ж
Жидк.
1975*5°
BaWOif+Ж
BaO
Ba3W03
0 20 90 BO BO 100 Рис. 578. Диаграмма состояния си-
BaO .. „ WQ, стемы ВаО—WO« (по Чангу, Скро-
мол-/<‘ J жеру и Филлипсу).
выше 805° имеет идеальную кубическую структуру. Соединения
2ВаО-WOs, на которое указывают Жмудь и Остапченко [1],
Чанг с сотрудниками не обнаружили.
Литература
1. Жмудь Е. С., Е. П. Остапченко, Журн. структурн. хим., 2,
№ 1, 33, 1945.
2. Ш и в а х а р е Г. С., Журн. неорг. хим., 11, № 6, 1478, 1966.
3. С h a n g L. L. Y., М. G. S с г о g е г, В. Р h i 11 i р s, Journ. Amer.
Ceram. Soc., 49, № 7, 385, 1966.
4. P urt G., Zs. phys. Chem., N. F., 35, № 1-3, 133, 1962.
5. R о о k s b у H. P., H. G. S t e wa r d, Acta crystallogr., 4, № 6,503,1951.
6. S i 11 e n L. G., A. L. N у 1 a n d e r, Arkiv Kemi, Mineral., Geol., A17,
Яг 1, 1, 1943.
Вольфраматные (вольфрамитные) системы
637
A12O3-WO3
Система изучена Уорингом [2]. Нагревание смесей т-А12О3
и WO3 производилось в запаянных трубках. Обнаружено одно
конгруэнтно плавящееся при 1254° соединение 2A12O3-5WO3
(рис. 579). Интересной особенностью этого соединения является
его большое термическое расширение. Так, спрессованный диск
°C
1900
1700
1500
1300
1100
900
700
’ л! п .ж \ Жи3к-
2Al203-5W03^
7. фЗО*..........'1190 °
Al20^2Alz03-^W03
--1 I______L.
М^О^М^
о го чо 60 во ioo
А^г°з Мол.7. w°3
Рис. 580. Участок диаграм-
мы состояния системы
AljjOj—WOa (по Кислякову
и Лопатину).
Рис. 579. Предположительная фазовая
диаграмма системы А12О3—WO3 (по Уо-
рингу).
состава 2A12O3+WO3, нагретый при 1160° (в течение 6 час.), будучи
исследован при комнатной температуре, показывал увеличение
объема больше чем на 25%.
Кисляков и . Лопатин [11 обжигали при 1200° смеси вблизи от
состава А12О3 : WO3=1 : 1. Установлено существование соеди-
нения A12O3.3WO3[A12(WO4)J, плавящегося с разложением по
перитектической реакции при 1320° (рис. 580).
Литература
1. Кисляков И, П., Б. П. Л о п а т и-н, Изв. АН СССР, неорг, матер.,
3, № 4, 903, 1967.
2. W о г i n g J. L., Journ. Amer, Ceram. Soc., 48, № 9, 493, 1965.
Y2O3—wo3
Система изучена Борхардтом [1]. Смеси окислов нагревались при
температурах, не превышающих 1700° и исследовались рентгено-
графически. Установлено существование пяти соединений:
638
Вольфраматные (волъфрамитные) системы
YaO3-3WO3 (фаза I), YaO3-WO3 (фаза II), 15YaO3.8WO3 (фаза III),
9YaO3.4WO3 (фаза IV), 3YaO3.WO3 (фаза V). Кроме того, обна-
ружено метастабильное соединение 3YaO3-2WO3 (фаза X), обра-
зующееся при обжиге соответствующей смеси окислов в темпера-
турном интервале 750—1000°. Нагревание при 1100° приводит
к исчезновению этой фазы.
На рис. 581 приведена диаграмма состояния системы
YaO3—WO3. Соединение YaO3-3WO3 с плотностью 4.85 г/см3
Рис. 581. Диаграмма состояния системы YaOs—WOa.
По оси абсцисс отложены молекулярные проценты YOj.g.
плавится конгруэнтно при 1495°. Оно образует с WO3 эвтектику,
содержащую приблизительно 30 мол.% YO1S и плавящуюся при
1155°. Соединение YaO3>WO3, имеющее плотность 6.63 г/см3,
плавится инконгруэнтно при 1700 ±20°. Температура плавления
остальных трех соединений не была определена и автор только
указывает, что они плавятся выше 2200°, два из них (фазы III
и IV), по-видимому, конгруэнтно.
Соединение 3YaO3>WO3 было индицировано на основе гране-
центрированной кубической элементарной ячейки с параметром
а=5.276 А. Это соединение между 1700° и температурой плавления
испытывает полиморфное превращение. Плотность 3YaO3*WO3
равна 6.00 г/см3. Соединения 15YaOs-8WO3 и 9YaO3>4WO3 имеют
плотность соответственно 6.08 и 5.95 г/см8.
Литература
1. Borchardt Н. J., Inorg. Chem., 2, № 1, 170, 1063.
Вольфраматные (вольфрамитные) системы 639
W03
Изучена Тюшевской, Афонским и Спицыным [1] в субсолидус-
ной области. Смеси Ьа2О3 и WO3 предварительно спекались при
800°, а затем в зависимости от состава обжигались при различных
температурах (1000° для богатых WO3 и до 1700° для богатых
La2O3). Фазы определялись рентгеновским методом. Установлено
образование пяти соединений: 3La2O3-WO3, 3La2O3-2WO3,
llLa2O3-9WO3, La2O3-WO3 и La2O3-3WO3. Вольфрамат лантана
La2O3 *WO3 претерпевает фазовое необратимое превращение:
высокотемпературная форма получалась нагреванием при 900°
(25 час.) и при 1200° (6 час.). Длительное нагревание высокотемпе-
ратурной формы при 800° не приводило к появлению низкотемпе-
ратурной формы.
Литература
1. Тюшевская Г. И., Н. С. Афонский, В. И. Спицын,
ДАН СССР, 170, № 4, 859, 1966.
Nd2O3-WO3
Имеет значение для получения лазеров.
Изучена Роде и Карповым [1] методом термического анализа
(снимались кривые нагревания отожженных смесей окислов).
Рис. 582. Фазовые отношения
в системе NdsO3—WO3.
Фазы идентифицировались рентгенографически. В системе обна-
ружено пять соединений: Nd2(WOi)3, Nd2WOe, Nd2W2O», Nd4W0»
и NdeWO12. Последние три соединения получены впервые. Диа-
640
Вольфраматные (вольфрамитные) системы
грамма состояния системы Nd2O3—WO3 приведена на рис. 582.
Нормальный вольфрамат неодима Nd^WOJa плавится при 1140°
и образует с WO3 эвтектику состава 17.5 мол.% Nd2O3 с темпера-
турой плавления 1037°. Соединение Nd2W2O» обнаружило два
полиморфных превращения — при 438 и 1248°.
Показатели светопреломления описанных соединений имеют
следующие значения: для Nd2(WOa)3 7Vg=2.O12, ДГт=1.992 и
Лр=1.967; для Nd2W2O» и Nd2WOe показатели светопреломления
больше 2.027.
Л ит ератур а
1. Роде Е. Я,, Д, К а р п о в, Изв. АН СССР, неорг. матер., 2, № 4, 683,
1966.
Sm2O3—WO3
В субсолидусной области исследовали Чанг и Филлипс [1 ].
Обнаружено четыре соединения: 3Sm,O3-WO3, 7Sm,O3-4WO3,
Sm2O3.WO3 и Sm2O3-3WO3.
Диаграмма, иллюстрирующая фазовые отношения в системе,
построенная Чангом, Скрожером и Филлипсом [2], представ-
лена на рис. 583. Смеси Sm2O3 и WO3 нагревались в запаян-
ных платиновых трубках; фазы идентифицировались рентгено-
графически и микроскопически в отраженном свете; температура
плавления определялась методом дифференциального термиче-
ского анализа. Обнаружено пять вольфраматов самария:
3Sm2O3-WO3, 7Sm2O3-4WO3, Sm2O3-WO3, Sm2O3.2WO3 и
Sm2O3-3WO3. Соединения 3Sm2O3-WO3 и 7Sm2O3-4WO3 плавятся
конгруэнтно соответственно при 2240+20 и 2190 ±20°. При 1400°
соединения 3Sm2O3-WO3 и 7Sm2O3-4WO3 обнаруживают области
гомогенности соответственно от 73.5 до 75.5 мол. % Sm2O3 и от
63.3 до 64.5 мол. % Sm2O3. С повышением температуры область
гомогенности этих соединений расширяется, доходя при 1700°
для 3Sm2O3-WO3 до 71.8—76.8 мол. % Sm2O3 и для
7Sm2O3-4WO3 до 62.5—65.8 мол.%. WO3 растворяется в Sm2O3‘.
при 1700° предельная растворимость составляет 2 мол. % WO3.
Соединение Sm2O3-WO3 плавится инконгруэнтно при 1690+10°
с образованием 7Sm2O3-4WO3 и жидкости. Заключение о инкон-
груэнтном плавлении Sm2O3-3WO3 сделано на том основании, что
смесь Sm2O3-3WO3 и Sm2O3-2WO3 плавится при той же темпера-
туре, что и соединение Sm2O3-WO3.
Соединение 3Sm2O3 -WO3 имеет дефектную пирохлорную струк-
туру с а=10.80 А. Соединение 7Sm2O3-4WO3 также может быть
Вольфраматные (вольфрамитные) системы
641
индицировано на основе кубической структуры, с некоторым ис-
кажением вследствие замещения большого иона Sm3+ малым
°C
2000
1800
1600
1900
1200
1000
_ ^Smfym.p.
ЗЗт2031/Щу
m.p.
3m20/33m203W03
m.p.
0 20
Sm.2O3
2290*20°
2190*20° \
\7Sm203-9W(^m.p.
I * \16ЯП‘
7Sm3039W03
TSmfi^WO,.
тр
+
\
Sm203-W03 \
*Ж \ '
1238° \™5'
Sm.g03-W03
Зтг03-2W03 §.*
90 60
Мол. /.
Жидк.
Зтг03-2М03*Ж /
Ж f W03*H
1000°
< Ц Зт&ЗУМ^У/О,
100
W03
I 1
Рис. 583. Диаграмма состояния системы Sm2O3—WO3
ионом We+. При температурах выше 1700° это искажение устра-
няется, структура переходит в идеально кубическую, в результате
чего становится возможным полный изоморфизм с 3Sm2O3-WO3.
Литература
1. С h a n g L. L. Y., В. Phillips, Inorg. Chem., 3, № 12, 1792, 1964.
2. С h a n g L. L. Y., M. G. S с г о g e r, B. Phillips, Journ. Inogr.
Nucl. Chem., 28, № 5, 1179, 1966.
PbO—wo3
Система PbO—PbWO4 изучена Егером и Гермсом [2] (рис. 584)
и Смоляниновым и Беляевым [1]. Наряду с PbWO4 в системе
образуется еще одно соединение — Pb2WO5, которое плавится
при 899° и не имеет полиморфных превращений. Вольфрамат
•
41 Н. А. Торопов н др., кн. 1
642
Вольфраматные (вольфрамитные) системы
свинца плавится при 1123° и испытывает при 877° обратимое
превращение. В природе известен как минералы штольцит (тетра-
гональная система) и рас-
пит (моноклинная система).
В работе Смолянинова и
Беляева приводится диа-
грамма системы РЬО—WO3
(рис. 585), для которой под-
тверждено наличие соедине-
ний PbWO4 и Pb2WO5. Между
100 80 60 00 го О W0 50 РЬО
рЪ0 Моп.% РЪУЩ Мои.%
Рис. 584. Диаграмма со-
стояния системы
РЬО—PbWO4 (по Егеру
и Гермсу).
Рис. 585. Диаграмма
состояния системы
РЬО—WO3 (по Смо-
лянинову и Беляеву).
PbWO4 и WO3 впервые обнаружена эвтектика с температурой
плавления 930° и составом 67.5 мол. % WO3.
Литература
1. Смолянинов Н. П., И. Н. Беляев, Журн. неорг. хим., 7,
№ 11, 2591, 1962.
2. J а е g е г F. М., Н. С. Germs, Zs. anorgan. allgem. Chem., 119, № 2,
157, 1921.
ZrO2—WO3
Шёнберг [3] ограничился изучением более богатой двуокисью
циркония части диаграммы и показал, что в интервале от 25 до
50 мол.% WO3 образуется твердый раствор типа флюорита.
Вольфраматные (вольфрамитные) системы
643
Грэм с сотрудниками [2] исследовали твердофазовые реакции
между ZrO2 и WO3 в интервале 1000—1400°. Было получено соеди-
нение ZrW2O8, устойчивое только между 1150 и 1400° и получаемое
всегда в смеси с другими веществами. ZrW2O8 характеризуется
кубической сингонией и имеет параметр элементарной ячейки
я0=9.154 А. При медленном охлаждении диссоциирует на ZrO2 и
WO3. Фаза с флюоритовой структурой не получена.
°C
2000
1800
1600
1400
1200
1000
0 20 40 60 80 100
Мол. 7,
W03
ZfOz
Рис. 586. Диаграмма состояния системы
ZrO2—WO3.
Диаграмму состояния системы построили Чанг, Скрожер и
Филлипс [1], пользовавшиеся методом «отжига и закалки».
Нагревание смесей окислов производилось в запаянных платино-
вых трубках. Результаты исследования представлены на рис. 586.
Переход моноклинной двуокиси циркония в тетрагональную на-
блюдался при 1180°. По мере растворения WO3 в двуокиси цирко-
ния указанный переход происходит при более низких темпера-
турах. В двуокиси циркония растворяется при 1250° около
4.5 мол.% WO3, но ниже 1000° эта растворимость ограничивается
величиной менее 2.5 мол.%. Растворимость ZrO2 в WO3 если и
существует, то не превышает 2.5 мол. %, так как образцы этого
состава при всех температурах между 1000 и 1400° были двух-
41*
644
Вольфраматные (вольфрамитные) системы
фазными. Единственное соединение в системе ZrW2O8 плавится
инконгруэнтно при 1257 +3°, образуя ZrO2 и жидкость; в пери-
тектической точке содержится 71 мол.% WO3. Соединение
ZrW2O8 устойчиво выше 1105°; при охлаждении до 1100° проис-
ходит распад на ZrO2 и WO3. ZrW2O8 имеет кубическую элемен-
тарную ячейку с параметром а0=9.159 А. Эвтектика содержит
74 мол.% WO3 и плавится при 1231+3°.
Л ит ератур а
1. С h a n g L. L. Y., М. G. S с г о g е г, В. Р h i 11 i р s, Journ. Amer.
Ceram. Soc., 50, № 4, 211, 1967.
2. G r a h a m J., A. D. W a d s 1 e y, J. H. W e g m о u t h, L. S. Wil-
li a m s, Joum. Amer. Ceram. Soc., 42, № 11, 570, 1959.
3. Schoenberg N., Acta chem. Scand., 8, № 8, 1347, 1954.
HfO2—wos
Систему изучили Чанг, Скрожер и Филлипс [1] методом
«отжига и закалки». Нагревание образцов (максимальная темпе-
ратура 1700°) производилось в запаянных трубках. Установлено
Рис. 587. Диаграмма со-
стояния системы
НЮ8—WO3.
Вольфраматные (вольфрамитные) системы
645
образование одного соединения HfW2O8 и твердого раствора на
основе НЮ2 (рис. 587). Соединение HfW2O8 плавится с разло-
жением при 1276+3°; в перитектической точке содержится
75 мол.% WO3. В эвтектической точке, плавящейся при 1227+3°,
содержится 76 мол.% WO3.
Литература
1. С h a n g L. L. Y., М. G. Scroger, В. Phillips, Journ. Amer.
Ceram. Soc., 50, № 4, 211, 1967.
Nb2O8—WO3
Трунов, Ковба и Сироткина [2], и Ковба, Трунов и Симанов [1 ]
изучили субсолидусную область, обжигая смеси окислов при
1100—1200°. Указывается на образование следующих соединений:
4Nb2O5-WO3 (20 мол.% WO3), 2Nb2O5-WO3 (33.3 мол.% WO3),
4Nb2O3-7WO3 (63.6 мол.% WO3) и Nb2O5-3WO3. Кроме того,
отмечаются твердый раствор WO3 в [3-Nb2O5 и твердый раствор
пятиокиси ниобия в WO3. В качестве особой фазы предпола-
гается соединение Nb2O5>nWO3, где п приблизительно равно 50.
Фазу Nb2O5-nWO3, по мнению авторов, нельзя считать твердым
раствором, так как между Nb2O5-nWO3 и WO3 существует гетеро-
генная область. Фазы 4Nb2O5-WO3 и 2Nb2O5-WO3 имеют очень
узкие области гомогенности. В |3-Nb2O5 растворяется менее
10 мол.% WO3. Растворимость пятиокиси ниобия в WO3 ме-
нее 2 мол.%.
Соединение 4Nb2O5-7WO3, так же как и соединение
Nb2O5-3WO3, имеет, вероятно, решетку типа ВеО3. Элементарная
ячейка этого соединения является ромбической, псевдотетраго-
нальной, с параметрами «=12.219+0.0006, Ь=36.66+0.02 А;
Z=2. Линии рентгенограммы Nb2O5-3WO3 индицируются в пред-
положении тетрагональной элементарной ячейки. Фаза
Nb2O5-nWO3 имеет моноклинную субъячейку с а=5.277, Ь=5.172,
с= 3.832 А и ₽=87°50'.
Слайт [5] также изучил низкотемпературную область (1200—
1400°), ограниченную содержанием от 20 до 50 мол. % Nb2O5.
В этих концентрационных пределах обнаружено соединение
4Nb2O5-9WO3 (Nb16W18O94). На полученных монокристаллах уста-
новлена ромбическая сингония. Для рассматриваемого соедине-
ния замечена некоторая область гомогенности, и в общем виде
формулу соединения следует представлять Nb4a.W30_3sO90+j., где
х находится в пределах от 4 до 3. Пространственная группа соеди-
нения Nb16W18O94 Р2,2,2, параметры элементарной ячейки:
а=12.251, Ь=36.621, с=3.94° А.
646
Вольфраматные (вольфрамитные) системы
Груэн [3] изучил богатую Nb2O8 область системы. Обжиг
проводился при 1200—1400° и фазы идентифицировались рентгено-
графически. Груэн утверждает, что им получены следующие но-
вые фазы: 13Nb2O8 -4WO3, 9Nb2O8 -8WO3 (низкотемпературная
модификация) и фаза с областью гомогенности от 40Nb2O8-WO3
до 20Nb2O5-WO3. Груэн подтвердил существование фаз
Рис. 588. Диаграмма состояния системы Nb2O6—WO3.
7Nb2O5-3WO3, 8Nb2O8-5WO3, обнаружил также фазу с областью
гомогенности от 8Nb2O5-WO3 до 6Nb2O8-WO3 и высокотемпера-
турную модификацию 9Nb2Os-8WO3. Соединения Nb2O8-WO3,
4Nb2O8-WO3, 2Nb2O8-WO3 и 15Nb2O8-WO3 отрицаются Грузном.
В работе 1966 г. Рот и Уоринг [4], применяя метод «отжига
и закалки», получили тринадцать кристаллических фаз, твер-
дые растворы на основе WO3 и дали равновесную фазовую диа-
грамму системы (рис. 588).
Вольфраматные (вольфрамитные) системы
647
Для восьми соединений: 6Nb2O5-WO3, 13Nb2O5-4WO3,
7Nb2O5.3WO3, 8Nb2O5-5WO3, 9Nb2O5-8WO3, Nb2O5-WO3,
4Nb2O3-9WO3 и 2Nb2O5-7WO3 —на монокристаллах был точно
определен химический состав. Для фаз 30Nb2O3>WOs,
6Nb2O5-HWOs, Nb2O6-llWO3 и Nb2O5-15WO3 состав был опре-
делен приблизительно. Фазы 6Nb2O5-WO3, «6Nb2O5 «HWOs»,
4Nb2O5-9WO3 и 2Nb2O5-7WO3 плавятся конгруэнтно соответ-
ственно при 1476, 1378, 1380 и 1357°. Фазы «30Nb2O5 -WOj»,
7Nb2O5-3WO3, 8Nb2O5.5WO3, 9Nb2O5-8WO3, «Nb2O6 .UW03> и
«Nb2O5 >15WO3» плавятся инконгруэнтно соответственно при 1470,
1440, 1385, 1375, 1356 и 1358°. Фазы 13Nb2O5-4WO3 и Nb2O5-WO3
устойчивы при низких температурах и разлагаются до плавле-
ния соответственно при 1435 и 1115°. Фазы 8Nb2O5-5WO3,
9Nb2O5-8WO3, «6Nb2O5-HWO3>, 2Nb2O5-7WO3, «Nb2O5’.HWO3>
и «Nb2O5 -15WO3» устойчивы при повышенных температурах и
разлагаются при охлаждении соответственно при 1090, 1265,
1210, 1245, 1275 и 1270°. Кроме того, обнаружена фаза с некоторой
областью гомогенности вблизи состава 3Nb2Oa -8WO3. Эту фазу
авторы считают метастабильной и на рисунке ее область показы-
вают пунктиром. Твердых растворов на основе Nb2O5 не обнару-
жено. В трехокиси вольфрама растворяется не больше 3 мол.%
Nb2O5 и образующийся твердый раствор обнаруживает такой же
полиморфизм, как и чистый WO3.
В структурном отношении соединения 6Nb2O5-WO3,
7Nb2O5-3WO3, 8Nb2O5-5WO3, 9Nb2O5.8WO3, 13Nb2O3-4WO3 и
30Nb2O5WO3 сходны с пятиокисью ниобия. Соединение 6Nb2O5 -WO3
имеет моноклинную элементарную ячейку с параметрами:
я=22.282, 5=3.824, с=17.724 А; 0=123°22'.
Соединение 7Nb2O5-3WO3 имеет объемноцентрированную те-
трагональную элементарную ячейку с параметрами: я=21.002,
с=3.820 А. Пространственная группа 141m. Соединение
8Nb2O5-5WO3 имеет С-центрированную моноклинную ячейку
с параметрами: я=29.638, 5=3.820, с=23.126 А, р=126°27'.
Пространственная группа С2. Соединение 9Nb2O5-8WO3 имеет
объемноцентрированную тетрагональную элементарную ячейку
с параметрами: а=26.270, с=3.814-А. Вероятная пространствен-
ная группа Z4. Соединение 13Nb2O5-4WO3 имеет С-центрирован-
ную моноклинную элементарную ячейку с параметрами: а=29.74,
5=3.823, с=26.02 А; р=92°18'. Соединения Nb2O5-WO3,
4Nb2O5-9WO3, 2Nb2O5-7WO3, «6Nb2O5-llWO3» и фаза
3Nb2O5-8WO3 имеют иную структуру. Соединения Nb2O5-WO3
и 4Nb2O6>9WO3 образуют ромбические кристаллы с параметрами
элементарной ячейки соответственно: а=16.615, 5=17.616,
с=3.955 А и я=36.6Э2, 5=12.191, с=3.945 А. Кристаллы соеди-
648
Вольфраматные (вольфрамитные) системы
нения 2Nb2O5-7WO3 относятся, по-видимому, к тетрагональной
симметрии с параметрами кристаллической решетки: я=24.264,
с=3.924 А. Соединение «6Nb2O5-HWO3» с ромбическими кри-
сталлами имеет параметры элементарной ячейки: я=36.740,
Ь=12.195, с=3.951 А.
Литература
1. К о в б а Л. М., В. К. Т р у н о в, Ю. П. С и м а н о в, Журн. неорг.
хим., 9, № 8, 1930, 1964.
2. Т р у н о в В. К., Л. М. Ковба, Е. И. Сироткина, ДАН СССР,
153, № 5, 1085, 1963.
3. G г u е h n R., Monatshefte Chem., 96, № 6, 1789, 1965.
4. R о t h R, S., J. L. Waring, Journ. Res. Nat. Bur. Stand., 70A, № 4,
281, 1966.
5. S 1 e i g h t A. W., Acta chem. Scand., 20, № 4, 1102, 1966.
Ta2O5—WO3
Первое исследование системы принадлежит Гольдшмидту [3],
который обнаружил фазу Ta2O5-3WO3.
Ковба и Трунов [1 ] обнаружили две фазы: Ta2OB>3WO3 (изо-
структурна Nb2O5>3WO3) и фазу 3Ta2O5>4WO3. Соединение
Ta2O5-3WO3 характеризуется тетрагональной сингонией с пара-
метрами элементарной ячейки: я=12.27, с=3.881 А.
Фелтен [2] подтверждает существование фазы Ta2O5-3WO3 и
описывает ромбическую фазу, приблизительно отвечающую со-
ставу Ta2O5-WO3 с параметрами элементарной ячейки: я=8.87,
Ь=16.72, с=7.78 А. По-видимому, эта ромбическая фаза и фаза
3Ta2O5-4WO3, обнаруженная Ковбой и Труновым, — одна и та же
фаза.
Груэн [4 ], производя обжиг смесейТа2О5 и WO3 при 1300—1400°,
обнаружил фазу, которой он приписывает формулу 9Та2О5 -8WO3,
отрицая существование соединения 3Ta2O5-4WO3. Им устано-
влена область гомогенности, примыкающая к пятиокиси тантала.
Эта область распространяется до соединения 13Ta2O5-4WO3
(при 1300°).
Слайт [6] изучил субсолидусную область (температуры 1200 и
1400°) в концентрационном диапазоне от 0.2ТаО2 5 -0.8WO3
до 0.5ТаО2 5-0.5WO3. Исходными веществами служили порошко-
образные металлические тантал и вольфрам, которые смешивались
в соответствующих пропорциях и окислялись при 500° (либо
металлы сначала окислялись и затем окислы смешивались).
Обжиг смесей производился в запаянных платиновых трубках.
В желто-белом порошке встречались игольчатые монокристаллы,
Вольфраматные (вольфрамитные) системы
649
которые позволили приписать им ромбическую сингонию. Слайт
наблюдал одну фазу, идеальная формула которой была Ta16W18O94.
По своей структуре найденная фаза сходна с тетрагональной
калиево-вольфрамовой бронзой [5 ] и может быть изображена сле-
дующей общей формулой: W30_3xTa4xO90+x. Верхний предел содер-
жания вольфрамового ангидрида в рассматриваемой фазе соста-
влял 0.8WO3.
Литератур а
1. К о в б а Л. М., В. К. Т р у н о в, ДАН СССР, 147, № 3, 622, 1962.
2. F е 1 t е n Е. L., Journ. Less-Common Metals, 9, № 3, 206, 1965.
3. Goldschmidt M., Metallurgia, 62, № 374, 241, 1960.
4. G r u e h n R., Monatshefte Chem., 96, № 6, 1789, 1965.
5. M a g n e 1 i A., Arkiv Kemi, 1, № 2, 213, 1949.
6. Sleight A. W;, Acta chem. Scand., 20, № 4, 1102, 1966.
Bi2O3—wo3
Имеет значение в связи с использованием висмут-вольфрамовых
окислов в качестве катализаторов в процессах окисления и оки-
слительного аммонолиза непредельных углеводородов.
Система Bi2O3—WO3 впервые была изучена Силленом [5 ] и
Силленом и Лундборгом [6 ] на образцах, полученных сплавлением
Bi2O3 и WO3. Рентгенографически было обнаружено пять фаз,
состав которых можно выразить общей формулой Bi1_2.Wa.O15(1+x),
где х для этих пяти фаз имеет значения 0.05, 0.145, 0.167, 0.4 и 0.6.
Фаза Bi2O5-1.3WO3 (х=0.4) имеет моноклинную сингонию с пара-
метрами элементарной ячейки: а=Ь=7.674, с=16.398 А, р=90°.
В последующих работах фазовые отношения в системе были изу-
чены более детально.
Смолянинов и Беляев [2 ] исследовали систему в концентрацион-
ной области от 0 до 85 вес. % WO3 визуально-политермическим ме-
тодом. Были обнаружены три конгруэнтно плавящихся соедине-
ния: Bi2(WO4)3, Bi2O3-WO3 и 3Bi2O3-WO3.
Гаттов и Шредер [3] получили соединение 2Bi2O3-WO3 со
структурой 8-Bi2O3.
Гальперин, Ерман, Колчин, Белова и Чернышев [1 ] изучили
систему рентгенографическим методом, пользуясь сплавленными
образцами, отожженными при 650°. Авторы описывают шесть
фаз: 1) соединение Bi2WO6, имеющее область гомогенности,
вплоть до состава Bi2O3-1.4WO3; 2) фаза переменного состава
Bi2O3-3WO3—Bi2O3-2WO3 (у-фаза); 3) фаза переменного состава
2Bi2O3-WO3—5Bi2O3-WO3, обозначается 8*-Bi2O3; 4) -Q-фаза
состава 10Bi2O3-WO3; 5) |3*-фаза (p*-Bi3O3) состава 30Bi2O3-WO3;
Характеристика фаз в системе Bi2O3—W03
Обозначение фазы Состав или область гомогенности Параметры элементарной ячейки Моле- куляр- ный вес z Плотность, г/см3 Простран- ственная группа
at A b, A c, A 3° экспери- менталь- ная при 25° вычислен- ная
Bj2O3 3WO3— 1162 2/3 7.91
а' 5.43 — — 8.23*
—Bi2O3.2WO3- 930 8/9 — 8.43
Bi,O3 3VVO3- 1162 3 8.29 8.24
а 5.43 23.72 5.42 — 8.59
—Bi2O3 2WO3 930 4 — 8.81 Рппа
Bi2O3 1.4WO3— 814 3.33 8.96 8.94
т 5.436 5.456 16.416 — 698 4 9.38 9.46 Рссп
—BiQO3 WO3
2Bi,O3-WO3— 5.546 1164 4/5 9.12 9.05
71*-Bi2O3 — — —
—5 Bi2(J3 WO3 5.591 2562 4/11 8.89 8.83
•q* 10 Bi2O3 VVO3 • 5.496 5.49 5.764 — 4892 4/21 9.05 8.85
P*-Bi2O3 30Bi2O3. WOS- 10.93 — 5.63 — 14212 16/61 9.08 9.15 Р4Ъ2
a*-Bi.2O3 75Bi2O3. WO3- 5.83 8.14 7.48 67°7' 35182 8/151 9.29 9.41
* Для состава Bi2O3 2.5WOg.
Вольфраматные (вольфрамитные) системы
651
6) a*-Bi2O3 фаза состава 75Bi2O3-WO3. Последние три фазы пред-
ставляют стабилизированные трехокисью вольфрама различные
модификации Bi2O3. Эти фазы построены на основе гранецентриро-
ванной кубической решетки высокотемпературной модификации
8-Bi2O3. Стабилизация структуры &-Bi2O3 при комнатной тем-
пературе возможна при введении более 9 вес. % WO3; при меньшем
содержании WO3 стабилизируется метастабильная модификация
Рис. 589. Параметр эле-
ментарной ячейки твер-
дого раствора 2Bi2O3-
•WO3— 5Bi2O3-WO3
(8*-Bi2O3) (по Гальпе-
рину с сотрудниками).
1 — закаленные образцы;
г — отожженные образцы.
Рис. 590. Плотность твердых раство-
ров 2Bi2O3-WO3—5Bi2O3-WO3
(8*-Bi2O3) (по Гальперину с со-
трудниками).
P-Bi2O3. Растворимость Bi2O3 в решетке WO3 если и имеется,
то незначительная. Авторы получали модификацию a'-Bi2O3-3WO3
только в метастабильной состоянии и температуру перехода a—a'
не определяли.
T-Фазу можно рассматривать как сверхструктуру на основе
ромбически искаженной a-структуры. Изменение параметра эле-
ментарной ячейки 8*-Bi2O3 в зависимости от состава представлено
на рис. 589. На рис. 590 показана плотность отожженных образцов
фазы 8*-Bi2O3 в зависимости от состава. В таблице приведены
характеристики фаз в системе Bi2O3—WO3.
Хей и Баннистер [4 ] определили структуру минерала русселита
(—BijOs-WOs), имеющего тетрагональную решетку: а=Ь=5.42,
с=11.3 А.
Литература
1. Гальперин Е. Л., Л. Я. Е р м а н, И. К. К о л ч и н, М. А. Б е-
л о в а, К. С. Ч е р н ы ш е в, Журн. неорг. хим., И, № 9, 2125, 1966.
2. Смолянинов Н. П., И. Н. Беляев, Журн. неорг. хим., 7, № 11,
2591, 1962.
652
Вольфраматные (вольфрамитные) системы
3. Gattow G., Н. S с h г a d е г, Zs. anorgan., allgem, Chem., 318, № 3/4,
176, 1962.
4. Hey M. H., F. A. В anni st e i, Mineral. Magaz., 25, № 161, 41, 1938.
5. Sillen L. G., Zs. Kristallogr., 103, № 4, 274, 1941.
6. S i 1 1 e n L. G., K. L u n d b о r g, Arkiv Kemi, A17, № 1, 21, 1943.
Cr2O3—WO3
Диаграмма состояния системы не построена. При обжиге сме-
сей окислов в пределах от 6Cr2O34~WO3 до Cr2O34~3WO3 при 1000—
1200° Трунов и Ковба [1 ] обнаружили только одно соединение —
Cr2O3-WO3. Байером [2] путем обжига смесей окислов также был
получен только Cr2WO6. Соединение Cr2WO6 относится к структур-
ному типу трирутила, т. е. характеризуется тетрагональной син-
гонией. Параметры элементарной ячейки: а=4.571, с=8.853 А,
Z=2.
Литератур а
1. Т р у н о в В. К., Л. М. К о в б а, Изв. АН СССР, неорг. матер., 2, № 1,
151, 1966.
2. Bayer G., Journ. Amer. Ceram. Soc., 43, № 9, 495, 1960.
MoO8—WO8
Систему изучал Рикк [1 ], который ограничился концентрацион-
ной областью 0—40 мол.% МоО3. Система относится к простым
Рис. 591. Диаграмма состоя-
ния системы МоО3—WO3.
эвтектическим. Эвтектика, расположенная вблизи МоО3, имеет
температуру плавления 770° (рис. 591).
Литература
1. R ieck G. D., Rec. Trav. chim., Pays-Bas, 62, 429, 1943.
Вольфраматные (вольфрамитные) системы
653
ио2—wo8
Диаграмма состояния системы не построена. Розанова, Трунов
и Ковба [2], исследуя взаимодействие двуокиси урана с вольфра-
мовым ангидридом и вольфраматом уранила, получили два соеди-
нения: UfWOJ й U2WO8. Для этих соединений характерны ром-
бические элементарные ячейки с параметрами: для U(W04)
а=9.545+0.003, 6=10.245 +0.005, с=14.26+0.01 А, для U2WO8
а=6.658+0.006, 6=23.32+0.04, с=4.093+0.001 А. При 1000°
оба соединения медленно разлагаются с образованием фаз U^WOs
и (U, W)O2+a:, полученных и изученных ранее Труновым и
Ковба [1, 3].
Литература
1. Ковба Л. М., В. К. Трунов, Вести. Моск. гос. унив., хим., № 6,
32, 1964.
2. Розанова О. Н., В. К. Т р у и о в, Л. М. К о в б а, Изв. АН СССР,
неорг. матер., 2, № 2, 319, 1966.
3. Трунов В. К., Л. М. К о в б а, ДАН СССР, 141, № 1, 114, 1961.
Fe2Og—WO8
Диаграмма состояния системы не построена. Трунов и Ковба [2 ]
обжигали смеси окислов, отвечающие составу lFe2O3+lWO8 и
lFe2O8+3WO8 при 1000°. В обоих случаях обнаруживалось только
одно соединение Fe2WOe. Это, вероятно, то самое соединение, кото-
рое ранее получил Козманов [1 ]. Fe2WOe кристаллизуется в ромби-
ческой сингонии и имеет следующие параметры элементарной
ячейки: а=4.566, 6=16.72, с=4.954 A, Z=4. Пространственная
группа точно не установлена, предполагается, что это может быть
или D&.
Литература
1. Козманов Ю. Д., Журн. физ. хим., 31, № 8, 1861, 1957.
2. Т р у н о в В. К., Л. М. К о в б а, Изв. АН СССР, неорг. матер., 2, К» 1,
151, 1966.
УРАНАТНЫЕ СИСТЕМЫ
ВеО—U02
Изучалась Эпстейном и Хауландом [2], Лангом, Кнудсеной,
Филлмором и Ротом [3] и Будниковым, Тресвятским и Куша-
ковским [1].
о/ • ? лЗ
Щ Мол.% ВеО
Рис. 592. Диаграмма состоя-
ния системы ВеО—UO2 (по
Будникову, Тресвятскому и
К ушаковскому).
1 — температуры, определенные
термическим анализом; г — темпе-
ратуры, определенные путем ми-
кроструктурного исследования
сплавов; 3 — температуры, опреде-
ленные методом деформации кону-
сов; 4 — температуры, определен-
ные путем визуального исследо-
вания сплавов или измерением
температуры образца во время
плавления.
Рис. 593. Диаграмма состоя-
ния системы ВеО—UO8 (по
Лангу с сотрудниками).
На рис. 592 представлена
диаграмма состояния по послед-
ним авторам, а на рис. 593 —
по данным Ланга и др. На рис.
602 (см. описание системы
UO2—А12О3) показаны теорети-
ческие данные Эпстейна и Ха-
уланда. М
Система простая эвтектическая, без двойных соединений и твер-
дых растворов. Составы и температуры эвтектики следующие:
Уранатные системы
655
по Будникову и др. — при 68 мол.% ВеО и 2170+20°, по Лангу
и др. — при 63 мол.% ВеО и 2150+10°, по Эпстейну и Хау-
ланду — при 65 мол.% ВеО и 2060°.
Лит ератур а
1. Будников П. П., С. Г. Тресвятский, В. И. Кушаков-
ский, Труды 2-й Междунар. конфер. по мирн. использ. атомн.
энергии (Женева, 1958), 3, Ядерное горючее и реакторные металлы,
Атомиздат, М., 322, 1959.
2. Е р s t е i n L. F., W. Н. Н owl and, Journ. Amer. Ceram. Soc., 36,
№ 10, 333, 1953.
3. L a n g S. M., F. P. К n u d s e n, C. L. F i 11 m о г e, R. S. Roth,
Nat. Bur. Stand. Circ., № 568, 5, 1956.
MgO—uo2
Изучалась Ламбертсоном и Мюллером [4], Эпстейном и Хау-
ландом [3], Андерсоном и Джонсоном [2], Лангом, Кнудсеной,
Филлмором и Ротом [5 ] и Будниковым, Тресвятским и Кушаков-
ским [1].
Рис. 594. Зависимость пара-
метра кристаллической решет-
ки UO2 от содержания MgO и
температуры отжига образцов.
Рис. 595. Зависимость
параметра' решетки твер-
дого раствора в системе
MgO—UOa от его состава.
По данным последних авторов, параметр решетки двуокиси урана
зависит от температуры отжига образцов и от содержания в об-
разцах окиси магния (рис. 594). Ими установлена зависимость па-
раметра решетки твердого раствора MgO в UO2 от состава (рис. 595).
баб
Уранатные системы
Будников и другие считают, что, поскольку растворимость MgO
в UO2 зависит от избытка окиси MgO, система UO2—MgO является
5.23 I ।_________।___।____।
О 20 W 60 80 100
и02 Мол. % м9°
Рис. 596. Зависимость
параметра решетки
твердого раствора в си-
стеме MgO—UO2, синте-
зированного на воздухе,
от его состава.
не истинной конденсированной системой,
а разрезом тройной системы UO2—MgO—О
(источником кислорода является сама
MgO, диссоциирующая при нагревании).
Диаграмма рис. 596, иллюстрирующая за-
висимость параметра решетки твердого рас-
твора MgO в UO2, синтезированного на
воздухе, от состава раствора, подтвер-
ждает повышение растворимости MgO
(до 37 мол.% при 1600—1700°) в UO2
в кислородсодержащей среде.
Построенная Будниковым и другими
диаграмма состояния системы UO2+a.—MgO
в среде воздуха показана на рис. 597, а в
идеализированном виде, без учета окисле-
ния двуокиси урана кислородом окиси
магния, при температурах выше 1500° —
на рис. 598 (сплошные линии), на кото-
ром для сопоставления штрихами на-
несены и данные Ламбертсона и Мюллера. Как видим, по Буд-
никову и др., идеализированная система UO2—MgO — простая
Мдо мол.% и°г
-----------1--------г
Рис. 598. Диаграмма состоя-
ния идеализированной системы
MgO-UO2.
1 — по Будникову с сотрудниками;
2 — по ламбертсону и Мюллеру.
м9° Мол.%
Рис. 597. Ориентиро-
вочная диаграмма состо-
яния системы MgO—
—UO2+a; (по Будникову
с сотрудниками).
Уранатные системы
657
эвтектическая, а установленная Ламбертсоном и Мюллером область
двух жидких фаз в средней части диаграммы, по данным Будникова
и др., отсутствует. Состав эвтектики — 50 мол. % MgO и 50 мол. %
UO2, т. е. такой же, как по работе Ланга и др. [5 ] и по теоретиче-
скому расчету Эпстейна и Хауланда (см. рис. 602 к системе
А12О3-UOa).
По данным последних, эвтектика плавится при 2159°, что не-
сколько ниже, чем по данным Будникова и др.
Литература
1. Будников П. П., С. Г. Тресвятский, В. И. К у ш а к о в-
с к и й, Труды 2-й Междунар. конфер. по мирн. использ. атомн.
энергии (Женева, 1958), 3, Ядерное горючее и реакторные металлы,
Атомиздат, М., 322, 1959.
2. A n d е г s о n I. S,, К. D, В. J ohnson, Journ. Chem. Soc., June,
1731, 1953.
3. E p s t e i n L. F., W. H. Howland, Journ. Amer. Ceram. Soc.,
36, № 10, 334, 1953.
4, L a m b e r t s о n W. A,, M. H. Mueller, Journ. Amer. Ceram. Soc.,
36, № 10, 332, 1953.
5. L a n g S. M., F. P. К n u d s e n, C. L, F i 11 m о г e, R. S. R о t h,
Nat. Bur. Stand. Circ., № 568, 7, 1956.
CaO— UO2
Ланг, Кнудсен, Филлмор и Рот [1 ], изучая взаимодействие СаО
и UO2 в твердом состоянии, обнаружили соединение типа перов-
скита, для которого правильнее считают принимать формулу
Ca(U, Са)Ол, а не CaUO3. Соединение имеет ромбическую структуру
и следующие параметры элементарной ячейки: я=5.78, Ь=8.29,
с=5.97 А.
Авторы подтвердили наличие кубических твердых растворов
флюоритового типа, получающихся в результате растворения СаО
в UO2.
Литература
1. L a n g S. М., F. Р. К n u d s е n, С. L. Fillmore, R. S. R о t h,
Nat. Bur. Stand. Circ., № 568, 7, 1956.
42 H. А. Торопов и др., кн. t
658
Уранатные системы
СаО—U03
Диаграмма состояния системы не построена. Якеш с сотруд-
никами [1 ] получили четыре соединения: CaUO4, CaU2O7, Ca3UOe
и Ca2UOs, соосаждая гидроокиси (исходные вещества — уранил-
нитрат и азотнокислый кальций) с последующим прокаливанием
при 800—1200°. Приведенные соединения не относятся ни к куби-
ческой, ни к тетрагональной системе. Получены инфракрасные
спектры этих соединений.
Лит ератур а
1. Jakes D., J.Moravec, I. Kf ivy, L. Sedlakova, Zs. anorgan.
allgem. Chem., 347, № 3—4, 218, 1966.
SrO—UO2
Ланг, Кнудсен, Филлмор и Рот [1] нагревали смеси SrO+UO2
(25—75 мол.% SrO) при 1800—1900° в атмосфере аргона. Обнару-
жены кубические твердые растворы окиси стронция в UO2 флюори-
тового типа и соединение Sr(U, Sr)Ox с параметрами элементарной
ячейки: я=6.01, Ь=8.60, с=6.17 А, имеющее структуру перов-
скита.
Литература
1. L a n g S. М., F. Р. К n u d s е п, С. L. F i 11 m о г е, R. S. R о t h,
Nat. Bur. Stand. Circ., № 568, 12, 1956.
BaO—UO2
Ланг, Кнудсен, Филлмор и Рот [1 ] нагревали смеси BaO+UO2
(25—75 мол. % ВаО) при 1800 и 1900° в атмосфере аргона.
Обнаружены кубические твердые растворы со структурой флюо-
рита с содержанием (максимально) 20—30% ВаО. Соединение
BaUO3 относится к псевдокубическому типу с параметром решетки
я=4.3874 А.
Литератур а
1. L a n g S. М., F. Р. К n u d s е п, С. L. F i 11 m о г е, R. S. R о t h,
Nat. Bur. Stand. Circ., № 568, 13, 1956.
Уранатные системы
659
CdO— U02+x
Интересна для технологии реакторных материалов.
Келлер [1 ] показал, что в системе образуются в присутствии
кислорода фазы со структурой флюорита на основе UO2 общей
Рис. 599. Параметр решетки
флюоритовой фазы в системе
CdO-UO^.
формулы (CdO)xUO2+J., где максимальное значение х достигает 0.43.
На рис. 599 показан параметр решетки флюоритовой фазы в за-
висимости от х (Z) и фазы иО2+г (II). Маринкович [2] нашел, что
предельная растворимость CdO в UO2 составляет 13 мол.%.
Л ит ератур а
1. Keller С., Zs. anorgan. allgem. Chem., 317, № 3—4, 241, 1962.
2. Marinkovich S., Journ. Nucl. Mater., 8, № 2, 187, 1963.
A12O3-UO2
Система изучалась Ламбертсоном и Мюллером [3], Лангом,
Кнудсеной, Филлмором и Ротом [4], Будниковым, Тресвятским и
Кушаковским [1 ]. Данные перечисленных авторов показаны на
рис. 600 и 601, из которых видно, что система эвтектическая и двой-
ные соединения и твердые растворы в ней отсутствуют, j
Исследование Будникова с сотрудниками не подтвердило дан-
ные работы [31 о наличии области двух жидкостей. Эвтектика со-
держит 74 мол.% А12О3 и 26% UO2 и плавится при 1900+10°.
Эпстейн и Хауланд [2] построили теоретические фазовые диа-
граммы (рис. 602) систем UO2—А12О3, UO2—MgO и UO2—ВеО на
42*
660
Уранатные системы
основе закона идеальных растворов и положения, что энтропия
плавления многоатомных молекул равна NR, где N — число
Рис. 600. Диаграмма со-
стояния А12О3—UO2 (по
Будникову с сотрудниками).
Рис. 601. Диаграмма состоя-
ния системы AlgO3—UO2.
1 — по Ламбертсону и Мюл-
леру; 2 — по Лангу с сотруд-
никами.
атомов в молекуле, R — молярная энтропия плавления всех окис-
лов на атом. Температура плавления для UO2 была принята 2878°,
Рис. 602. Теоретические фазо-
вые диаграммы некоторых ура-
натных систем.
а для А12О3 2034°. Для эвтектики в системе UO2—А12О3 получились
данные, весьма близкие к экспериментальным.
Литература
1. Будников П. П., С. Г. Тресвятский, В. И. Кушаков-
ский, Труды 2-й Междунар. конфер. по мирн. использ. атомн.
энергии (Женева, 1958), 3, Ядёрное горючее и реакторные металлы,
Атомиздат, М., 322, 1959.
Уранатные системы
661
2. Е р s t е i n L. F., W. Н. Н о w 1 a n d, Journ. Amer. Ceram. Soc., 36,
№ 10, 334, 1953.
3. Lambertson W. A., M. N. Mueller, Journ. Amer. Ceram. Soc.,
36, № 10, 329, 1953.
4. L a n g S. M., F. P. К n u d s e n, C. L. F i 11 m о г e, R. S. R о t h,
Nat. Bur. Stand. Circ., № 568, 14, 1956.
Sc20g—UO2
Система изучалась Тшебятовским и Хориным [3 ], осуществляв-
шими плавление в печи с вольфрамовой трубкой [2 ] и в радиацион-
ной печи [1 ] в атмосфере из смеси аргона и водорода. Система отно-
сится к простым эвтектическим (рис. 603). Эвтектика содержит
82 мол.% ScOx 5 и плавится при 2280°. Твердых растворов не об-
Мол.7.
Рис. 603. Диаграмма состояния
системы SCgOg—UO2.
"i., мол.7. 5с0’>
Рис. 604. Параметр элементарной
ячейки и плотность окисленного
твердого раствора Sc2O3—UO2 и
твердого раствора, полученного
обжигом смеси ScgOg-j-UOg-f-UOg.
наружено. Если обжиг проводить в присутствии кислорода или
вводить UO3 в исходную смесь, то на основе UO2+X образуются твер-
дые растворы. На рис. 604 показано изменение параметра элемен-
тарной ячейки и плотности образцов, полученных двумя методами:
1) обжигом в присутствии кислорода при 2240° в течение 0.5 часа;
2) из смеси UO2, UO3 и Sc2O3 с обжигом при 1350° в течение 4 час.
Твердый раствор выражается формулой U^+Mex_^O2 с п > 4.
В этом твердом растворе заполнены катионная и анионная подре-
шетки.
662
Уранатные системы
Литература
1. N iemiec J., А. В о g а с z, Chem. Stosowana, 6, 147, 1962.
2. Trzebiatowski W., J. Berak, J. Niemiec, Przemysl.
Chem., 9, 458, 1954.
3. Trzebiatowski W., R. H о г у n, Bull. 1’Akad. Polon. Sci., ser.
sci. chim., 13, № 5, 303, 1965.
Y2O8-UO2
Интересна для технологии реакторных материалов.
Ланг, Кнудсен, Филлмор и Рот [2] для смеси Y2O3+2UO2,
подвергнутой термической обработке при 1600°, обнаружили твер-
дый раствор на основе UO2 с параметром а=5.351 А и небольшое
количество другого твердого раствора, вероятно, образовавшегося
на основе Y2O3.
Фергусон и Фогг [1 ] нашли, что в системе Y2O3—UO2 имеется
два рода твердых растворов, разделенных областью несмешивае-
мости. Твердый раствор на основе UO2 со структурой типа флюо-
рита распространяется до содержания 65 мол.% YOX 5. Другой
твердый раствор с кубической структурой типа Т12О3 занимает
область от 96 до 100 мол.% YOX 5.
Литература
1. F е г g u s о n Т. F., Р. G. Т. F о g g, Journ. Chem. Soc., August, 3679,
1957.
2. L a n g S. M., F. P. Knudsen, C. L. Fillmore, R. S. Roth,
Nat. Bur. Stand. Circ., № 568, 15, 1956.
La2O3— UO2+x
Имеет значение как реакторное топливо.
Изучалась Хундом и Пеетцом [2 ] и Хиллом [1 ] в субсолидусной
области. Образцы получались обжигом соответствующих смесей
в различных условиях.
Для системы характерно образование кубических твердых рас-
творов типа флюорита, которые могут представляться формулой
Uo 6La0 6ОХ 76+а. Химические соединения определенного состава не
указываются.
В/ EZJ2 EZ3J
Рис. 605. Область существования
кубических твердых растворов
типа флюорита в системе
LagOg UOg+x*
I — кубический твердый раствор типа
флюорита; 2 — UaOs; 3 — Ъа2Оа+ку-
бический твердый раствор типа флю-
орита. а — обжиг в кислороде
при 1000°; б — обжиг в окислительной
атмосфере при 1-650°; в — обжиг в во-
дороде при 1750°; г — обжиг в вакууме
при 900°.
Рис. 606'. Параметр кристаллической
решетки твердых растворов в си-
стеме La2O3—UO2+X.
1 — обжиг в вакууме при 900°, 210 час.;
2 — спекание в водороде при 1750°,
21 час; з — обжиг в окислительной атмо-
сфере при 1650°, 22 часа.
Отношение кислорода
к металлическим атомам
Рис. 607. Влияние стехио-
метрии на параметр кристал-
лической решетки твердых рас-
творов Uo.5La0.501.T5+.I;.
Рис. 608. Изменение параметра
кристаллической решетки стехио-
метрических соединений МО2.в и
дефектных соединении МО2_у.
1 — стехиометрические соедине-
ния МО„ _; 2 — дефектное соединение
’ М°2-Г
664
Уранатные системы
Хилл показал, что концентрационные пределы существования
твердых растворов сильно зависят от условий синтеза. Из рис. 605
видно, что область твердых растворов значительно шире при их
получении в восстановительной среде.
Валентность урана непостоянна в твердых растворах, и отно-
шение «кислород—металл» определяется составом и условиями
синтеза. Параметры элементарной ячейки твердых растворов,
по данным Хилла, представлены на рис. 606—608.
Литература
1. Н i 11 D. С., Journ. Amer. Ceram. Soc., 45, № 6, 258, 1962.
2. H u n d F., U. Peetz, Zs. anorgan. allgem. Chem., 271, № 1, 6, 1952.
CeO2—UOS
Система интересна для разработки новых керамических мате-
риалов.
Ланг, Кнудсен, Филлмор и Рот [2] изучали смеси, содержащие
15 и 60 мол.% СеО2 после нагревания при 1700 и 1900° в аргоне.
Рис. 609. Параметр твердых рас-
творов типа флюорита в системе
СеО2—UO2.
1 — закон Богарда; 2 — по Магнели
и Кильборгу; 3 — по Хунду с сотруд-
никами; 4 — по Хунду с сотрудни-
ками, образцы нагревались на воз-
духе; 5 — по Лангу с сотрудниками.
Было обнаружено два кубических твердых раствора флюоритового
типа (для смеси 35 мол.% СеО2) с очень близкими параметрами
(я=5.445 А). Кубический твердый раствор, полученный для смеси
с 60 мол. % СеО2, когда наблюдалась только одна фаза, имел
параметр решетки а=5.431 А.
Уранатные системы
665
На рис. 609 приводятся значения параметров кубической флюо-
ритовой решетки для разного состава по данным различных авторов
(Магнели и Кильборга [3], Хунда, Вагнера и Пеетца [1], Ланга
с сотрудниками [2]), а также полученные по правилу Вегарда [4].
Литература
1. Н u n d F,, R. Wagner, U. Р е е t z, Zs. Elektrochem., 56, № 1, 61,
1952.
2. L a n g S. M., F. P. К n u d s e n, C. L. F i 11 m о г e, R. S. R oth,
Nat. Bur. Stand. Circ., № 568, 19, 1956.
3. M a g n e 1 i A., L. К i h 1 b о r g, Acta chem. Scand., 5, № 4, 578, 1951.
4. V e g a r d L., Zs. Phys., 5, № 1, 17, 1921.
NdaOg—UO2
Ламбертсон и Мюллер [1 ] установили в системе широкую
область (от 0 до 64 мол.% Nd2O3) кубических твердых растворов
со структурой флюорита (рис. 610). Эвтектика имеет состав при-
близительно 66 мол.% Nd2O3 и температуру 2200°.
Рис.' 610. Диаграмма состоя-
ния системы Nd2O3—UO2.
FCC — гранецентрированный, ку-
бический твердый раствор.
3000
2600
2200
1800
Жидк.
FCCm.p. I1™™™
I Ndq03
0 25 5'0 75 W
U0z Мол. % Мд^Оз
Ланг, Кнудсен, Филлмор и Рот [2] также обнаружили широкую
область кубических твердых растворов флюоритового типа и вы-
сказывают предположение о возможности образования соединения
Nd2U2O7 типа пирохлора.
Лит ератур а
1. Lambertson W. А., М. Н. Mueller, U. S. А. Е. С. Unclas-
sified report A. N. L., 5312 (Sept. 14), 1954.
2. L a n g S. M., F. P. К n u d s e n, C. L. F i 11 m о r e, R. S. Roth,
Nat. Bur. Stand. Circ., № 568, 16, 1956.
вбв
Уранатные системы
Eu2O3—U02+a.
Хауг и Вайгель [1] изучили систему в субсолидусной области,
производя обжиг соответствующих образцов при 1000—1100°.
Образование тех или иных фаз фиксировалось рентгенографически.
ао,А
5Л20- х
5.Ш -
5.380 -
Флюоритовая,,. Искаженная
/раза *ио,с\ ^^'^«юоритобт
0 20 40 60 80 100
УОг+х Мол. %
Рис. 611. Параметр элементарной
ячейки твердых растворов (фаз) си-
стемы Еи2О3—иО2+д:.
На рис. 611 показано измене-
ние параметра кристалличес-
кой решетки. Обнаружено три
типа флюоритовых ^твердых
растворов. В 'области, примы-
кающей к’ UO2, наблюдаются
флюоритовые твердые растворы,
сосуществующие с ромбической
UO2 6. При содержании окиси
европия в пределах 38—64мол. %
образуется кубическая фаза со
структурой типа флюорита,
причем параметр элементарной
ячейки изменяется от 5.4065
до 5.3910 А. В области, при-
мыкающей к окиси европия, также наблюдается фаза со струк-
турой типа флюорита с сильно дефектной кристаллической решет-
кой. Переход к кубической структуре типа С, характерной для
окислов редкоземельных элементов, происходит при концентра-
ции ЕиОх 6, превышающей 90 мол.%.
Литература
1. Haug Н., F. Weigel, Journ. Nucl. Mater., 9, № 3, 355, 1963.
Gd2O3—UO2
Билс и Хандверк [1 ] осуществили рентгеновское исследование
обжигавшихся на воздухе, в аргоне или водороде при 1700° смесей
UO2 и Gd2O3. Производился также химический анализ на весь
уран и U4+. Была установлена широкая область гранецентрирован-
ных кубических твердых растворов, простирающаяся, по-види-
мому, от чистого UO2 до почти чистого Gd2O3. На рис. 612 предста-
влены параметры элементарных ячеек ураново-гадолиниевых твер-
дых растворов, получавшихся в различных газовых средах. На
рис. 613 показано отношение О : Me для всех полученных образцов.
Обнаружен резкий перелом в ходе зависимости параметра
элементарной ячейки при содержании приблизительно 40 мол. %
GdOx 5. Авторы связывают эту аномалию параметров элементарных
Уранатные системы
667
ячеек с иной стехиометрией, возникающей в востановительной и
инертной атмосфере. Для образцов, обжигавшихся в воздушной
Рис. 612. Параметры элементарных
ячеек ураново-гадолиниевых твер-
дых растворов (спекание при 1700°).
1 — в водороде; 2 — в аргоне; 3 — на воз-
духе.
атмосфере, образование твердых
растворов происходит в более
узком концентрационном интер-
вале. При содержании в образцах
Рис, 613. Отношение «кислород:
металл» для ураново-гадолиниевых
твердых растворов (спекание
при 1700°).
1 — в водороде; 2 — в аргоне; 3 — на воз-
духе.
менее 30 мол.% GdOx 5 в них обнаруживается свободный окисел
урана U3O8, а свободная моноклинная окись гадолиния присут-
ствует в образцах, содержащих выше 60 мол. % GdOx s.
Литература
1. В е а 1 s R. J., J. Н. Handwerk, Journ. Amer. Ceram. Soc., 48,
№ 5, 271, 1965.
Dy 2O3—UO2
Плоетц, Маккигроссо, Осика, Джекоби [1], проведя обжиги
смесей Dy2O2 и UO2 в области 1750—1900°, обнаружили широкую
серию гранецентрированных кубических твердых растворов (от 0 до
70 вес.% Dy2O3). При дальнейшем повышении содержания Dy2O3
обнаружена вторая фаза твердых растворов на основе Dy2O3.
Литература
1. Р 1 о е t z С. L., А. Т. М и с с i g г о s s о, L. М. О s i k а,
W. R. J а с о b y, Journ. Amer. Ceram. Soc., 43, № 3, 154, 1960.
668
Уранатные системы
SnO2—U02
Ланг, Кнудсен, Филлмор и Рот [1 ] изучали систему на порошко-
образных смесях в области температур 600—1400°. Химических
соединений и твердых растворов не было обнаружено.
Лит ератур а
1. Lang S. М., F. Р. Knudsen, С. L. Fillmore, R. S. Roth,
Nat. Bur Stand.. Circ., № 568, 19, 1956.
PbO—uo2
Изучена в субсолидусной области методами термического и
рентгенофазового анализа Кузнецовым, Киркинским и Макаро-
вым [1].
Взаимодействие РЬО и UO2 начинается при 530—550° и при-
водит к образованию только одного соединения переменного со-
става (фазы К). Область этого твердого раствора заключается в пре-
делах от состава PbUO4 до PbUO3 49. В составе твердого раствора
находятся атомы четырехвалентного и шестивалентного урана.
Если обнаруженную фазу переменного состава представить форму-
лой Pb(U^.vUy_IJO4_x, то х будет изменяться в пределах от 0 до
0.51. Аналогичное соединение было получено Фонделем и Бэрне-
сом [2] в гидротермальных условиях, однако у этих авторов коэф-
фициент х варьировал от 0 до 0.2.
Обнаруженное соединение в низкотемпературной области имеет
кубическую решетку; выше 800° устойчивой является ромбоэдри-
ческая модификация, возникающая в результате небольшого иска-
жения кубической ячейки по тройной оси. Кристаллическая струк-
тура обнаруженного соединения близка к структуре UO2, отли-
чаясь от последней значительно бблыпим параметром. Параметр а
кубической (или псевдокубической) решетки является переменной
величиной и зависит от величины х в приведенной выше формуле и
изменяется от 5.526 до 5.614 А. Растворимость РЬО в UO2 в твер-
дом состоянии в условиях опытов Кузнецова и сотрудников обна-
ружена не была.
Литература
1. Кузнецов Л. М., В. А. Киркинский, Е. С. Макаров,
Журн. неорг. хим., 9, № 5, 1187, 1964.
2. F о n d е 1 С., I. В а г n е s, Acta crystallogr., 11, № 8, 562, 1958.
Уранатные системы
669
PbO-U2O5
Диаграмма состояния системы не построена. Кеммлер-Зак и
Рюдорф [1], нагревая смеси PbO4-UO24~UO3 в различном
соотношении (длительное ступенчатое нагревание в интервале
от 400 до 800°), получили только одну фазу с широкой областью
гомогенности: от Pbx 5U2O6 6 до Pb2 6U2O7 6. В пределах этой фазы
наблюдалось постепенное изменение структуры от кубической
через псевдокубическую к ромбоэдрической. Так, составы
Pbx.gU2O6 и Pb2U2O7 обнаружили кубическую решетку с я=11.18
и я=11.19 А. Для составу Pb2 25U2O7 26 характерна псевдокубиче-
ская решетка с я=11.23 А. Наконец, крайний состав Pb2 5U2O7 5
имеет ромбоэдрическую ячейку с я=11.23 А и р=90°15'. Соедине-
ний PbU2O6 и Pb3U2O8 не обнаружено. Для плотности изученных
уранатов свинца приводятся следующие данные (для двух опре-
делений): Pbx 6U2O6 5 — 9.67 г/см8; Pbx,75U2O6 75 — 9.47 и
9.48 г/см8; Pb2U2O7 — 9.44 и 9.42 г/см8; Pb2 26U2O7 26 — 9.81 и
9.42 г/см8; Pb2 gU2O7 5 — 10.21 и 9.97 г/см8.
Литература
1. К е m m 1 е г - S а с k S., W. R u d о г f f, Zs. anorgan. allgem. Chem.,
344, № 1—2, 23, 1966.
TiO2— uo2
Система не изучена. В результате ряда работ синтезировано
два соединения: Ti2UO8 [1, 3, 4] и Ti3UO8 [2].
Л ит ератур а
1. К a i m a n S., Canad. Mineral., № 6, 389, 1959.
2. Manojlovic L. M., M. М. R i s t i c, S. S. Maleic, New Nucl.
Mater. Including Non-Metal. Fuels, Proc. Confer., Prague, 1, 245, 1963.
3. P a t c h e 11 J. E., E. W. N u f f i e 1 d, Canad. Mineral., № 6, 483, 1960.
4. Schrocke H. H., Neues Jahrb. Mineral., Monatsh., № 2/3, 70, 1958.
ZrO2—UO2
Изучалось Ламбертсоном и Мюллером [5], Вольтеном [8],
Белле [2], Вороновым, Войтеховой и Данилиным [1], Мэмптоном
и Роем [6] и Эвансом [3].
Приводятся диаграммы состояния системы по Ламбертсону
и Мюллеру (рис. 614), Вольтену (рис. 615) и по Воронову, Войте-
ховой и Данилину (рис. 616).
Uty Мол. 7в ^2
Рис. 614. Диаграмма состоя-
ния системы ZrO2—UO2 (по
Ламбертсону и Мюллеру).
1 — гранецентрированный куби-
ческий твердый раствор; 2 — твер-
дый раствор неизвестного состава;
3 — тетрагональный твердый рас-
твор; 4 — смесь 1 и з.
Мол.7,
иог
ZrOz
Рис. 615. Диаграмма состоя-
ния системы ZrO2—UO2 (по
Вольтену).
1 — твердые растворы; 2 — ку-
бический твердый раствор с флю-
оритовой структурой; 3 — тетра-
гональный твердый раствор (раз-
упорядоченная флюоритовая струк-
тура); 4 — моноклинный твердый
раствор.
Рис. 616. Диаграмма состоя-
ния системы ZrO2—UO2 (по
Воронову, Войтеховой и Да-
нилину).
1 — гранецентоированный куби-
ческий твердый раствор; 2 — гране-
центрированный тетрагональный
твердый раствор; 3 — моноклин-
ный твердый раствор; 4 — смесь
3 и 2; 5 — смесь 1 и 2; в — смесь
1 и 3.
Рис. 617. Зависимость параметроь
кристаллической решетки закален-
ных от 2300° твердых растворов в
системе ZrO2—UO2.
1 — данные Вольтена: кружки, светлые —
а», кружки черные — с»; 2 — данные Лам-
бертсона и Мюллера; 3 — данные Руффа
и Эбертя.
Уранатные системы
671
Диаграмма Воронова и других отличается от диаграммы Лам-
бертсона и Мюллера, тем, что распад исходного твердого раствора
начинается не при 1900, а при 1675° и что образующийся в резуль-
тате этого распада твердый раствор на основе UO2 содержит в три
раза меньшее количество ZrO2, а растворимость UO2 в ZrO2 при
температурах ниже 1600° в полтора раза меньше, чем по данным
Ламбертсона и Мюллера. По Вольтену [9], выше 1950° существуют
непрерывные твердые растворы, и на его диаграмме показана по-
граничная кривая между тетраго-
нальной и моноклинной фазами.
Белле изучил двухфазную моно-
клинно-тетрагональную область, со-
держащую менее 15 мол.% UO2.
Наблюдалось разрушение спеков
после их выдержки в воде при высо-
кой температуре. По-видимому, тем-
пература превращения моноклинной
ZrO2 была понижена из-за влияния
твердого раствора UO2 в ZrO2 и про-
исходило изменение объема образца
при испытании. Это явление в моно-
клинно-тетрагональных составах си-
стемы UO2—ZrO2 ограничивает их
пригодность в качестве ядерного топ-
лива.
По данным Мэмптона и Роя, при
1300° UO2 растворяет только 8 мол. %
ZrO2, а последний растворяет ме-
нее 4 мол.% UO2.
На рис. 617 и 618 приведена за-
fl го «А 60 80 100
иог Man./. %гОг
Рис. 618. Параметр решетки
кубических и тетрагональных
твердых растворов в системе
ZrO2—UO2, подвергнутых раз-
личной термической обработке
(по данным Воронова и др.).
Для кубической фазы: .1 — об-
разцы отожженные, 2 — закален-
ные от 1400°; з — закаленные
от 1550°; для тетрагональной фазы
по оси с: 4 — образцы, закаленные
от 1500°, 5 — отожженные; для
тетрагональной фазы по оси а:
в—образцы, закаленные от 1550°,
7 — отожженные.
висимость параметра решетки от состава твердых растворов
UO2—ZrO2 и термообработки.
Одновременно с Мэмптоном и Роем система была изучена также
Эвансом [3], применившим солнечную печь во избежание загрязне-
ния шихты.
Рентгеновские дифракционные снимки производились для
плавленных в атмосфере гелия образцов и для тех же образцов
после длительного нагревания их при 1350° в атмосфере гелия.
Эвансом на основании своих и литературных данных построена
фазовая диаграмма (рис. 619). Существует узкая двухфазная область
около эвтектики при высоких температурах, значительно расши-
ряющаяся при понижении температуры. Высокотемпературная
форма ZrO2 не стабилизируется добавкой UO2. На рис. 620 приво-
дится зависимость параметра решетки от состава твердых раство-
ров по Эвансу.
672
Уранатные системы
По Эвансу [4], данные Вольтена [8] об устойчивости при ком-
натной температуре тетрагональных растворов, богатых ZrO2,
не подтверждаются.
’С
3000
гооо
то
100 во во и го о
иог Мол.% zro2
о/ т2 »3
Рис. 620. Параметры^ и с кри-
сталлической решетки твер-
дых растворов системы
ZrO2—UO2 (сплавленные об-
разцы, по данным Эванса),
Рис. 619. Фазовая диаграмма
состояния системы ZrO2—UO8
(по Эвансу).
1 — гранецентрированные, куби-
ческие твердые растворы; . г —
тетрагональные твердые растворы;
3 — гранецентрированные куби-
ческие твердые растворы+тетра-
гональные твердые растворы.
Литература
1. Воронов Н. М., Е. А. В о й т е х о в а, А. С. Д а н и л и н, Труды
2-й Междунар. конфер. по мирн. использ. атомн. энергии (Женева,
1958), 3, Ядерное горючее и реакторные металлы, Атомиздат, М.,
315, 1959.
2. В е 11 е J., Technical Progress Report, Pressurized Water Reactor
(P. W. R.); report for period October 24, 1958, to December 23, 1958,
Westinghouse Atomic Power Division — MRP-77, 52, 1958.
3. E v a n s P. E., Joum. Amer. Ceram. Soc., 43, № 9, 443, i960.
4. Evans P. E., Joum. Amer. Ceram. Soc., 44, № 12, 631, 1961.
5. Lambertson W. A., M. H. Mueller, Journ. Amer. Ceram. Soc.,
36, № 11, 365, 1953.
6. M a m p t о n F. A., R. R о y, Joum. Amer. Ceram. Soc., 43, № 5, 234,
1960.
7. R u f f 0., F. E b e г t, Zs. anorgan. allgem. Chem., 180, № 1, 19, 1929.
8. W о 11 e n G. M., Joum. Amer. Chem. Soc., 80, № 18, 4772, 1958.
9. W о 11 e n G. M., Joum. Amer. Ceram. Soc., 44, № 3, 148, 1961.
Уранатные системы
673
ThO2—U02
Представляет интерес как ядерное топливо.
Изучена Словинским и Эллиотом [7] и Ламбертсоном, Мюл-
лером и Гунцелем [5]. Словинский и Эллиот нашли, что ThO2
и UO2 образуют непрерывную серию твердых растворов в темпе-
ратурном интервале между 1000 и 1200°. Ламбертсон, Мюллер и
Гунцель построили диаграмму фазовых равновесий (рис. 621)
с непрерывной серией кубических гранецентрированных твердых
Рис. 621. Диаграмма состояния
системы ThO2—UO2.
1 — жидкость; 2 — твердое тело;
3 — твердое тело и жидкость.
растворов при температурах на-
чиная от 2875° для U02 и до
3200° для ThO2. Темпера-
тура плавления ThO2, по этим
авторам, по-видимому, равна
3300+100°. Ими также постро-
ена диаграмма (рис. 622) зави-
симости параметра решетки этих
твердых растворов от состава.
Рис. 622. Параметр кристалличе-
ской решетки твердых растворов
в системе ТпО2—UO2.
Влияние ThO2 на концентрацию кислорода в двуокиси урана,
на стабилизацию ее кубического твердого раствора с флюоритовой
структурой и влияние отношения кислород—уран на размер
элементарной ячейки твердого раствора UO2—ThO2 изучали
Груэн [2], Андерсон, Эджингтон, Робертс и Уайт [1], Хунд и
Ниссен [4] и Линч, Хандверк и Хэниг [6]. По Грузну, замещение
U4+ на Th4+в твердом растворе UO2—ThO2 лимитирует возрастание
отношения кислород—уран выше 2.0 и ограничивает изменение
исходной кубической решетки флюоритового типа.
Андерсон с соавторами наблюдали экспериментально это ста-
билизирующее действие тория и установили, что 22 мол.% ThO2
43 Н. А. Торопов и др., кн. 1
674
Уранатные системы
стабилизируют кубическую, флюоритового типа структуру UO2
на воздухе вплоть до 1400°. Хунд и Ниссен нашли, что по крайней
мере 43.5 мол.% ThO2 необходимо для стабилизации решетки,
а за пределами этого содержания возникает двухфазная область
Отношение кислород -уран
Рис. 623. Влияние отно-
шения кислород : уран
в твердых растворах си-
стемы ThO2— UO2 на пара-
метр кристаллической ре-
шетки.
из кубического предельного твердого раствора и U3O8. Линч с со-
авторами получили нестехиометрический твердый раствор в си-
стеме UO2—ThO2 при спекании U3O8—ThO2 на воздухе. По их
данным на рис. 623 изображена кривая, показывающая влия-
ние отношения кислород : уран на размер элементарной ячейки
твердого раствора 70.4 мол.% UO2—29.6 мол.% ThO2, образовав-
шегося путем обжига на воздухе в интервале 1000—1250° смеси
U3O8—ThO2.
Литература
1. Anderson J. S., D. N. Е d g i n g t о n, L. E. R о b e r t s, E. W e i t',
Journ. Chem. Soc., September, 3324, 1964.
2. Gruen D. M., Journ. Chem. Phys., 21, № 11, 2083, 1953.
3. Gruen D. M., Journ. Amer. Chem. Soc., 76, № 3, 2117, 1954.
4. H u n d F., G. N i e s s e n, Zs. Elektrochem., 56, № 10, 972, 1952.
5. Lambertson W. A., M. H. Nfueller, F. H. Gunzel, Journ.
Amer. Ceram. Soc., 36, № 12, 397, 1953.
6. L у n c h E. D., J. H. H a n d w e r k, C. L. H о e n i g, Journ. Amer.
Ceram. Soc., 43, № 10, 520, 1960.
7. S 1 о w i n s k i E., N. Elliot, Acta crystallogr., 6, № 5, 768, 1952.
VO2-UO2
Ланг, Кнудсен, Филлмор и Рот [2], нагревая смеси UO2 и
V2Og при 700—900°, наблюдали восстановление V2OB до VO2.
UO2 при этом переходит в окислы состава от UO2 2 до UO2 6. VO2
образует с UO2 две фазы. Возможно, что эти фазы представляют
Уранатные системы
675
соединения VO2>UO2 и 3VO2-UO2. Не исключено, что одна из фаз
является твердым раствором типа замещения (V, U)O2.
Ковба с сотрудниками [1] и Манойлович с сотрудниками [3]
установили существование соединения UO2-2VO2 (UV2O6), полу-
чавшегося при прокаливании смеси UO2 с V2Og или VO2 при 1000°
в атмосфере аргона. Возможно, что Ланг также получал соедине-
ние UO2-2VO2, а не две указанные им фазы.
Для параметров элементарной ячейки соединения UV2O3
Ковба приводит значения: я=4.996, с=4.765 А.
Литература
1. Ковба Л. М., Ван Ши-ху а, Е. И. Сироткина, ДАН СССР,
148, № 1, 113, 1963.
2. L a n g S. М., F. Р. Knudsen, С. L. Fillmore, RJS. R o't h,
Nat. Bur. Stand. Circ., № 568, 23, 1956.
3. M a n о j 1 о v i 6 L. M., R. M. H e r a k, G. M. Z о г c i.6 - К n e z e v i 6,
Bull. Boris Kidri6 Inst. Nucl. Sci., 16, № 4, 201, 1965.
Cr2Og—UO2 (UO3)
В системе изучено лишь одно соединение Cr2O3-2UO3, кратко
описанное Берчардтом [1 ] и подробнее Смитом, Клайном и Сэнд-
сом [2].
Последние исследователи получили его двукратным обжигом
смеси UO2 (78 вес.%) и Сг2О3 (22 вес.%) при 1250° в платиновых
чашечках. Соединение относится к ромбической системе с тройни-
ками прорастания, обусловливающими псевдогексагональный об-
лик кристаллов. Параметры ’ решетки: я0=4.857 +0.010, Ьо=
=11.692 + 0.010, с0=5.074+0.010 A; V= 288.0 А®, Z=2; вычи-
сленная плотность 8.36 г/см3. Цвет золотисто-коричневый. Пока-
затели преломления выше 2.11. В статье Смита с соавторами
приводится таблица межплоскостных расстояний нового соеди-
нения. 1
Литература
1. Borchardt Н., Journ. Inorg. Nucl. Chem., 12, № 1/2, ИЗ, 1959.
2. S m i t h D. К., C. F. С 1 i n e, D. S. S a n d s, Nature, 192, № 4805,
861, 1961.
43*
СИСТЕМЫ,
СОДЕРЖАЩИЕ ОКИСЛЫ МАРГАНЦА
СаО—Мп ^О з
Имеет значение для фазового анализа шлаков.
Изучена Рибудом и Муаном [1 ]. Составленная ими диаграмма
фазовых отношений в атмосфере воздуха изображена на рис. 624,
а на рис. 625 та же диаграмма дается в более полном виде с учетом
Рис. 624. Диаграмма фазовых отношений
в системе СаО—Мп2О3 (в атмосфере воз-
духа).
литературных данных. Система не является бинарной, а предста-
вляет изобарическое (РО2=0.21 атм.) сечение через тройную си-
стему Мп—Са—О.
В системе существуют четыре фазы, стабильные в изученном
интервале температур.
Системы, содержащие окислы марганца
677
Инвариантные изобарические точки системы СаО—Мп2О3 на воздухе
Точка Фазы Процесс Состав, вес.% Темпера- тура, °C
СаО окисел марганца
1 CaOj-CaMnOj -|- жид- кость J- газ (Ро,= =0.21 атм.). Перитектика. 40 60 1588±10
2 CaMnO8-|-CaMn2O4 J- жид- кость j- газ. » 25 75 1455 ±5
3 СаМп2О4 шпинель + + жидкость J- газ. Эвтектика. 18 82 1439 ±5
1. Твердый раствор (СаО—МпО), имеющий состав от
чистого СаО до максимального содержания 14 вес.% МпО (на
воздухе), — структурный тип
хлористого натрия.
2. Фаза СаМпО3, находя-
щаяся в интервале от 42 до
62 вес. % окиси марганца (в рас-
чете на Мп2О3). По мере возра-
стания содержания окиси мар-
ганца в этой фазе от левой по-
граничной кривой до «стехио-
метрического» состава СаМпО3
(«СаМпО3») структура непре-
рывно изменяется от тетраго-
нальной (размеры элементар-
ной ячейки я=Ь=7.35, с=8.06 А)
до дефектной кубической
(я=7.46 А). Содержание трех-
валентного марганца уменьша-
ется по мере возрастания ко-
личества окиси марганца в этой
фазе от Мп4+/Мп3+=0.54 у ле-
вой пограничной кривой до
0.33 для стехиометрического
(Са/Мп=1) соединения.
3. Фаза СаМп2О4 является
2600
гот । \
2200
Жидк
2000
1В00
1600
1000
1200
\ Известь \
\ *
I CaMnl^^\caMn.0t
Шпинель *Ж
Известь
+
СаМпО3
9 g
ОТ
О
СаО
20
,Са0-Мп02
100
Мпг03
Вес.% Са0-Мп203
Рис. 625. Диаграмма состояния
системы СаО—МпзОз.
твердым раствором, содержа-
щим от 74 до 78 вес.% окиси марганца (в расчете на Мп2О3).
4. Шпинельная фаза является твердым раствором примерного
состава Мп3О4-СаМп2О4 и содержит максимум 16 вес.% СаМп2О4.
Шпинельная структура Мп3О4 превращается в тетрагональную
678
Системы, содержащие окислы марганца
ниже 1160° в системе окислов марганца; по мере добавки в си-
стему СаО температура равновесного сосуществования кубической
и тетрагональной фаз возрастает максимум до 1200°.
Литература
1. R i Ь о u d Р. V., А. М u a n, Journ. Amer. Ceram. Soc., 46, № 1, 33,1963.
СаО—MnO2
Шретьен и Туссен [3], нагревая смесь СаО и МпО2 при 800°,
получили три соединения: СаМпО3, Са2МпО4 и СаМп3О7.
Соединение СаМпО3 образует кубические кристаллы, по мне-
нию Якеля [5], типа перовскита. Параметр решетки я=7.46 А.
Кристаллы Са2МпО4, по данным Шретьена и Туссена, относятся
к кубической сингонии с параметром решетки я=8.53 А. Раддлес-
ден и Поппер [4] относят это соединение к тетрагональной синго-
нии, однако экспериментально найденная плотность (3.203 г/см3)
лучше соответствует кубическим кристаллам.
Соединение СаМп3О7 в соответствии с рентгеновскими данными
Шретьена и Туссена может рассматриваться и как тетрагональное,
и как гексагональное. В первом случае параметры решетки:
я=16.0, с=4.57 А, во втором я=23.32, с=6.169 А.
Бризи и Луччо-Борлера [1,2] показали, что, кроме известных
ранее СаМпО3, Са2МпО4 и Са3Мп2О7, в системе существует соеди-
нение Са4Мп3О10, получаемое нагреванием (1400—1500°) эквимоле-
кулярной смеси СаМпО3 и Са3Мп2О7. Отмечая, что соединение
Са4Мп3О10 как равновесное должно найти себе место на диаграмме
Кристаллохимическая характеристика соединений системы СаО—МпО2
Соединение Структура Сингония и параметр эле- ментарной ячейки, А
СаМпО3. Перовскитовая деформирован- ная. Кубическая, а0 = 7.465.
Са4Мп3(_)10. Три перовскитовых блока, перемежающихся с одним слоем. Тетрагональная, а0 = 3.731, с0 = 26.89.
CagMngO?. Два перовскитовых блока, перемежающихся с одним слоем. Тетрагональная, а0 = 3.71, с0 = 19.50.
Са2МпО4. Один перовскитовый блок, перемежающийся с одним слоем. Тетрагональная, а0 = 3.674, с0 = 12.09.
Системы, содержащие окислы марганца
679
состояния, авторы этой диаграммы не приводят. Структура
Са4Мп3О10 может быть представлена на основе тетрагональной
элементарной ячейки с параметрами: а0=3.731, с0=26.89 А. Оно
изоморфно Sr4Ti3O10 и Ca4Ti3O10.
Кристаллохимическая характеристика соединений в системе
СаО—МпО2 представлена в таблице.
Литература
1. Brisi С., М. Lucco-Borlera, Atti Accad. sci. Torino, 96, 805,
1961—1962.
2. Brisi С., M. Lucco-Borlera, Journ. Inorg. Nucl. Chem., 27,
№ 9, 2129, 1965.
3. Chretien A., H. Toussaint, Compt. rend., 251, № 25, 2967, 1960.
4. Ruddlesden S. N., P. Popper, Acta crystallogr., 10, № 8, 538,
1957.
5. Y a k e 1 H. L., Acta crystallogr., 8, № 4, 194, 1955.
Co3O4—Mn3O4
Изучена Аукрустом и Муаном [1 ] в воздушной атмосфере мето-
дом закалки (температуры 1190—1750°) и методом термогравимет-
рии (температуры 917—1360°).
Рис. 626. Диаграмма фазовых
отношений в системе СозО4—
—Мп304 на воздухе.
°C
2000 Г Жидк.
\Mn,Co)3Oil+(Mn.,Co)2O3
(Mn,Co),O-t
ьпр\ ,_______,______,______
О 20 ‘tO 60 80 100
Мп304 Мол.% Со3О4
Обнаружены четыре серии твердых растворов, область суще-
ствования которых определяется температурой (рис. 626). С рас-
плавом граничат твердые растворы (Со, Мп)О и шпинельные твер-
680 Системы, содержащие окислы марганца
jjfne растворы (в области, примыкающей к MngO^. Температура
превращения кубических шпинельных твердых растворов в тетра-
гональные твердые растворы (Мп, Со)3О4 определена приближенно
(штриховая линия). Инверсия кубической Мп3О4 в тетрагональную
Мп3О4 происходит при 1160° [2]. Ниже температуры 877°, когда
Мп3О4 окисляется до Мп2О3, образуются твердые растворы
(Мп, Со)2О3.
Литература
1. A u к г u s t Е., А. М u a n, Journ. Amer. Ceram. Soc., 46, № 10, 511,
1963.
2. V a n Hook H. J., M. L. К e i t h, Amer. Mineralogist, 43, № 1—2,
69, 1958.
ФЕРРИТНЫЕ СИСТЕМЫ
Li2O—Fe2O3
Изучена Штриклером и Роем [6] в пределах составов Fe2O3—
—LiFeO2. Получено два конгруэнтно плавящихся соединения:
—LiFeO2 и LiFe5O8. При исследовании в субсолидусной области
были обнаружены твердые растворы между Fe2O3 и LiFe5O8
(рис. 627). Образование этих
твердых растворов начинает-
ся ’от 800—900°, и при 1390°
имеет место полная раство-
римость в ряду LiFe5O8—
—Fe2O3.
Соединение fLiFe5O8, ко-
торое Гортер [4] представ-
ляет как Fe(Li0 5Fex g)O4,
имеет шпинельную структу-
ру. Образование твердых
растворов следует рассмат-
ривать как вхождение Fe2O3
в решетку LiFe6O8, так как
структура твердых раство-
ров также остается шпи-
нельной. Выше 1000° про-
исходит восстановление Fes +
до Fe2+, и потому в высоко-
температурной области- более
твердого раствора считать Fe3O4.
Параметр кристаллической решетки LiFe8O8 а = 8.334 + 0.004
а. и. Браун [1 ] полагает, что при температуре 735 — 755° в этом сое-
Рис. 627. Диаграмма состояния’системы
LiFeO2— Fe2O3.
1 — шпинельные твердые растворы; г — ге-
матит+шпинельный твердый раствор; з —
LiFe,O,; 4 — LiFetO.+LiFeOj.
правильно одним из компонентов
динении происходит переход от упорядоченного состояния к не-
упорядоченному .
Штриклер и Рой методом термического анализа не обнаружили
такого перехода.
682
Ферритные системы
Парамагнитное соединение LiFeO2 с кубической сингонией
имеет параметр кристаллической решетки а=4.141 +0.005 а. и.
и показатель светопреломления 2.140+0.04. Соединение LiFeO2
имеет сложный полиморфизм. Согласно Фиарду [2, 3], для этого
соединения характерны три аллотропические формы: 1) кубиче-
ская неупорядоченная (С); 2) тетрагональная упорядоченная,
стабильная (/), 3) тетрагональная упорядоченная, метастабиль-
ная (II). Монотропное превращение II—I происходит ниже 580°,
и выше этой температуры существует только неупорядоченная
фаза. Превращение С—I имеет место при 670°.
Фазовые превращения в ферритах лития LiFeO2 и LiFe5O8
изучал также Като 15]. Для LiFeO2 переход наблюдался в интер-
вале 555—585°, для LiFe5O8 (литиевой феррошпинели) — при 750°.
Литература
1. Brann Р. В., Nature, 170, № 4339, 1123, 1952.
2. Fay а г d М., Compt. rend., 248, № 15, 2214, 1959.
3. Fayard М., Compt. rend., 251, № 25, 2955, 1960.
4. G о г t e г E. W., Nature, 165, № 4203, 798, 1950.
5. К a t о E., Bull. Chem. Soc. Japan, 31, 108, 1131, 1958; 32, 631, 1959.
6. Strickler D. W., R. R о y, Journ. Amer. Ceram. Soc., 44, № 5, 225,
1961.
Na2O—Fe2Os
Имеет значение при исследовании продуктов, получающихся
в производстве глинозема.
Согласно экспериментальным данным Кника и Кольмейера [5 ],
в системе (рис. 628) существует простая эвтектика при 64 мол.%
Fe2O3. В твердом состоянии установлены только две фазы: Fe2O3
и Na2O-Fe2O3. Оптические и рентгенографические данные для
Na2O -Fe2O3 (JVg=2.08+0.01, JVp=2.01+0.01) приведены в работах
Торопова и Шишакова [2] и Аракелян [1].
Феррит натрия существует в двух формах: 1) а-ромбоэдриче-
ской — а=5.59 А, а=31°20' [4]; 2) ^-ромбической — а=5.672,
Ь=7.316, с=5.377 А; плотность вычисленная, исходя из 4 фор-
мульных единиц в элементарной ячейке, 3.36 г/см3[3].
Тери и Коллонг [7] указывают на наличие у феррита натрия
ромбоэдрическо-ромбических превращений при 760°, сопрово-
ждающихся значительным расширением. Кроме NaFeO^, ими
Ферритные системы
683
получено еще соединение с формулой 3Fe2O3-2Na2O или
Fe6Na4Olx квадратной сингонии с а=Ь=7.2, с=18.2 кХ.
Шолдер и Мансманн [6] в ре-
зультате изучения соединений типа NogOFefy
р-глинозема указывают на образова- q
ние соединений типа R2O-6R2O3 °C
наряду с общепринятой в ли-1600
тературе формулой R2O-11R2O3.
Ими экспериментально показано, 1400
что соединение K2O-6Fe2O3 сущест-
вует, а аналогичный феррит натрия 1200
состава Na2O-6Fe2Os не образуется.
Они нашли фазу Na2O-1.58Fe2O3, ЮОО
по составу близкую к 2Na2O-ЗРе^
по Тери и Коллонгу. Эта фаза
Мол.7. /зд
33.3 57.2 75.0 88.9 100
представляет собой желто-коричне-
вый порошок, растворимый в 2 н.
НС1. Определенная пикнометрически
в бромбензоле плотность равна
3.86 г/см3.
Руимэнс [8] доказал, что в си-
50 60 70 80 90 100
Ма.г0 Fe,0,
ЧагС03 Мм. %
Рис. 628. Диаграмма состоя-
ния системы Na2O-
• Fe2O3—Fe2O3.
стеме существует еще одно соеди-
нение формулы Na3Fe5O2 с моноклинной ячейкой, параметры кото-
рой составляют: я=13.390, Ь=12.076, с=5.294 А, р=89°10'. Плот-
ность экспериментальная 3.825, вычисленная 3.820 г/см3. Na3Fe5O,
антиферромагйитен.
Литература
1. А р а к е л я н О. И.. Труды ВАМИ, № 40, 32, 1957.
2. Торопов Н. А., Н. А. Шишаков, Труды 2-го Совещ. по экспер.
минералогии и петрографии, Лзд. АН СССР, М., 271, 1937.
3. Bertaut F., Р. В 1 u m, Compt. rend., 239, № 5, 429, 1954.
4. Goldsztaub S., Compt. rend., 196, № 4, 280, 1933.
5. Knick R., E. I. К о h 1 m e у e r, Zs. anorgan. allgem. Chem., 244,
№ 1, 67, 1940.
6. Scholder R., M. M a n s m a n n, Zs. anorgan. allgem. Chem., 321,
№ 5-6, 246, 1963.
7. Thery J., R. Coll ongues, Compt. rend., 247, № 22, 2003, 1958.
8. R о о у m a n s C. J. M., Journ. Phys. Soc. Japan, 17, № 4, 722, 1962.
CuO—Fe2O3
Частная система более сложных многокомпонентных феррит-
ных систем, образующих ферромагнитные керамические мате-
риалы. Эту группу материалов называют «оксикубами» вследствие
684
Ферритные системы
образования ими кристаллов кубической сингонии со структу-
рами, подобными шпинелевым.
Фазовые соотношения в системе исследованы Тороповым и
Борисенко [1,2].
Система является устойчивой в температурных пределах до
1200°. Выше этой температуры начинается термическая диссоциа-
ция окиси меди и окиси железа. В системе обнаружена область
твердых растворов со шпинельной структурой в пределах содер-
жания Fe2O3 от 66.74 до 83.38 вес.%.
Эту однородную фазу можно рассматривать как раствор Fe2O3
в феррите меди CuO-Fe2O3. Вне пределов однородной фазы воз-
никают гетерогенные смеси со свободной Fe2O3, либо в области
с повышенной концентрацией окиси меди — со свободной CuO.
Параметр решетки CuFe2O4 я=8.462 +0.002 А, плотность вычи-
сленная 5.28 г/см3.
Согласно Кордесу и Реттингу [5 ], CuFe2O4 выше 900° относится
к кубической сингонии, ниже этой температуры тетрагонален.
Кушима и Аманима [6] показали, что с повышением температуры
область указанных выше растворов расширяется. Предполагаемый
некоторыми авторами [3, 4, 9] феррит меди Cu2FeeOn, по-види-
мому, должен рассматриваться как один из членов ряда твердых
растворов.
Полиморфизм CuFe2O4 изучали также Левинштейн с сотруд-
никами [7] и Ониши и Теранищи [8].
Литература
1. Торопов Н. А., А. И. Борисенко, Журн. прикл. хим., 23,
№ 11, 1165, 1950.
2. Торопов Н. А., А. И. Б о р и с е н к о, ДАН СССР, 71, № 1, 69,1950.
3. В е г t a u t, F., Compt. rend., 230, № 2, 213, 1950.
4. Hilpert R. S., A. Hoffmann, F. Huch, Ber. Dtsch. chem.
Ges., 72, № 4, 848, 1939.
5. К о r d’e s E., E. R 6 11 i g, Zs. anorgan. allgem. Chem., 264, № 1, 34,
1951.
6. Kuschima I., T. Amanima, Journ. Mining Inst. Japan, 68, 267,
1952 (Chem. Abstr., 48, 3739, 1954).
7. L e v i n s t e i n H. J., T. J. S c h n e 111 e r, E. M. G у о г y, Joum.
Appl. Phys., 36, № 3 (pt. 2), 1163, 1965.
8. Ohnishi H., T. Teranishi, Journ. Phys. Soc. Japan. 16, № 1, 35,
1961.
9. Verwey E. J., E. L. H e i 1 m a n, Joum. Chem. Phys., 15, № 1, 174,
1947.
Ферритные системы
685
MgO—Fe2O3
и
171,
141,
Имеет большое значение для фазового анализа магнезитовых
(периклазовых) и хромомагнезитовых огнеупоров, мартеновских
и других металлургических шлаков.
Изучалась Робертсом и !Мервином [11], Ричардсом
Уайтом [10], Вудхаузом и Уайтом [12], Коицуми и Роем
Флудом и Хиллом [6], Бринестадом и Флудом [5 ], Блэкманом
Паладино [8] и Филлипсом, Сомия
и Муаном [9]. °C
На рис. 6292изображена, по дан-^ЯДО
ным Филлипса и других, диаграмма,
иллюстрирующая равновесные т-7600
ношения системы окись магния—
окись железа на воздухе в интер-^00
°C
Жидк.
\
\
\
ггоо
1800
1600
im
1200
50 60 70 80 90 100
М9° Вес. % F'&
Рис. 629. Диаграмма фазовых отноше-
ний в системе MgO—Fe2O3 на воздухе
(по Филлипсу с сотрудниками).
?ооо
S.
Магнезиобюстит
\Магнезио-
'^МагкезиоХ феррит
\ вюстит' +
Магнезиобюстит
магнезиоферрит /
е».
&£
- §
I I
0 20 ~в0 601 I 100
MgO Вес.% M9°'FeAFe^03
Рис. 630. Диаграмма фазовых
отношений в системе MgO—Fe2O3
на воздухе (построена на основе
данных Филлипса с сотрудниками
и других авторов).
вале температур от 1415 до 1800°, а на] рис. 630 — составлен-
ная Филлипсом и другими на основании их собственных и ли-
тературных данных полная диаграмма фазовых отношений для
той же системы на воздухе.
Система MgO—Fe2O3 не является бинарной из-за присутствия
закисного и окисного железа в различных соотношениях. Маг-
незиоферритовая фаза, по-видимому, плавится инконгруэнтно
при 1713+5° с разложением на магнезиовюстит и жидкость, содер-
жащую около 92 вес. % окиси железа (из расчета на Fe2O3). Жидкие
686
Ферритные системы
магнезиоферритовая и магнезиовюститовая фазы при изученном
Филлипсом и другими изобарическом равновесном состоянии
(на воздухе) содержат примерно 92.86 и 70 вес.% окиси железа
(вычисленного в виде Fe2O3) соответственно.
Субсолидусные отношения в системе изучал Аллен [2]. Резуль-
таты его исследования приведены на рис. 631.
Феррит магния MgFe2O4 характеризуется следующими^свой-
ствами. При 450° на термограмме обнаруживается эндотермиче-
ский эффект, отвечающий точке Кюри. Смит и Виин [13] для точки
Кюри указывают 440°. По Блек-
ману [3], в зависимости от стехио-
метрии и термической обработки
точка Кюри может находиться
°C
1600
1400
1200
1000
800
600
400
35 40 45 50 55 60
Рис. 631. Субсолидные фазо-
вые отношения в системе
MgO—FejO3 (по Аллену).
1 — периклаз; 2 — Fe,O„
-I.. ।------1______। । । ।
200 000 600 800 1000 1200 1400 1600 °C
Рис. 632. Параметр элементарпой ячейки
феррита магния в зависимости от тем-
пературы, при которой производилась
закалка.
1 — поХПаладино; 2 — по Аллену,!’
в пределах от 285 до 340°. Величина параметра элементарной
ячейки MgFe2O4 зависит от температуры, при которой производи-
лась закалка. Соответствующие данные представлены на рис. 632.
Плотность феррита магния, закаленного от низких температур,
равна 4.486 г/см1 * 3, от высоких температур — 4.522 г/см3; показа-
тели светопреломления соответственно 2.34 и 2.35.
Бессонов и Устьянцев [1 ] изучили взаимодействие между MgO
и Fe2O3, пользуясь установкой для одновременной высокотемпе-
ратурной съемки (при атмосферном давлении воздуха) кривых
электросопротивления и рентгенограмм. Авторы ограничились
исследованием только одной смеси: 90% MgO4-10% Fe2O3. Уже
при 580° было обнаружено образование свободного магнезиофер-
рита MgFe2O4, количество которого растет до 1030°, дальнейший
нагрев приводит к быстрому растворению магнезиоферрита в пери-
клазе, которое заканчивается при 1300°. При охлаждении начиная
Ферритные системы
687
от 1150° происходит распад твердого раствора MgFe2O4 в периклазе,
причем магнезиоферрит выделяется в свободном состоянии прак-
тически полностью.
Л ит ератур а
1. Бессонов А. Ф., В. М. Устьянцев, Огнеупоры, 30, № 8, 30,
2. А 11 е n W. С., Journ. Amer. Ceram. Soc., 49, № 5, 257, 1966.
3. В 1 a c k m a n L. C. F., Journ. Electron. Control., 5, № 4, 373, 1958.
4. В 1 a c k m a n L. C. F., Journ. Amer. Ceram. Soc., 42, № 3, 143, 1959.
5. В г у n e s t a d J., H. F 1 о о d, Zs. Elektrochem., 62, № 9, 953, 1958.
6. Flood H., D. G. H i 11, Zs. Elektrochem., 61, № 1, 18, 1957.
7. Koizumi M., R. R oy. Subsolidus equilibria in some MFejO4— FegOg
systems, presented at the Sixtieth Annual Meeting. The Amer. Ceram.
Soc., Pitsburgh, Bull., Basic Science, 37, № 4, 23, 1958.
8. Paladino A. E., Journ. Amer. Ceram. Soc., 43, № 4, 183, 1960,
9. P h i 11 i p s B., S. Somiya, A. M u a n, Journ. Amer. Ceram. Soc.,
44, № 4, 167, 1961.
10. Richards R. S., J. W h i t e, Trans. Brit. Ceram. Soc., 53, № 7, 422,
1954.
11. R о b e r t s H. S., H. E. M erwi n, Amer. Journ. Sci., (5), 21, № 122,
145, 1931.
12. Woodhouse D., J. White, Trans. Brit. Ceram. Soc., 54, № 6,
333 1955.
13. Smit J., H. P. J. W i у n. Ferrits. New York, 1959.
CaO—Fe2O3
Имеет значение для технологии огнеупоров и железистых порт-
ланд-цементов, фазового анализа шлаков и проч.
Таблица 1
Инвариантные точки системы СаО—Fe2O3
Точка Фазы Состав, вес. % Температура, °C]
СаО FeO КвзОд Ро2==о-21 атм. РО2 = : 1 атм.
1 Магнетит + жидкость. 27.0 73.0 1594
2 То же. — 24.0 76.0 — 1583
3 Магнетит + гематит. — — — 1390 1455
4 Магнетит+гематит-j- жидкость 13.0 7.0 80.0 1358 —
5 То же. 10.5 8.0 81.5 — 1430
6 7 Гематйт + CF2 + жидкость. То же. “ 19.0 20.0 2.5 2.0 78.5 78.0 1226 1228
8 Гематит + CF2 + CF. — — — 1155 1172
9 CF2 + CF + жидкость. 20.0 2.0 78.0 1205 —
10 То же. 21.5 1.5 77.0 — 1206
11 CF + C2F + жидкость. 24.0 1.0 75.0 1216 —
12 C2F + жидкость. =?3 41.5 — 58.5 1449 —
13 C2F + СаО + жидкость. 42.0 — 58.0 1438 —
°C
1700
1600 -
СаО*Ж
КСЮ -
мо -
I к СаО
I 2570°
2Ca0-Fe203*M
I ё
Магнетит т.р.Л | g
Магнетит I § |
Жидк А § Й
СаО-2РеД*ж£ 1358° L *
1300 - =£
1200 - <g
1100- л
М3
OCaO-FejOg ^l^'pz^^^reMamum т.р §
_1216°:Ж \| Z/ с
Ca0-Fe20j^ z
Ca0-2Fe203
Z / *Ж 1226° §!3-
1155° $
Ca0-2Fe20f гематит
1000 - &
000\.
2Ca0-Fe203
Ca0-Fe20,
Ca0-Fe203* гематит
СаО 2Ca0-Fe-flj
егир . । „ ।
70 80 I 90
CaO'Fe2O3 CaO-2Fe203
100
Fse^
Bea %
Рис. 633. Диаграмма фазового равновесия
в системе СаО—Fe2O3 на воздухе.
На верхнем рисунке изображено равновесие в виде
двойной системы СаО—Fe,O31 а на нижнем показаны
составы жидкостей при ликвидусных температурах
(кривая АА') с учетом присутствия в образцах за-
киси железа. Точки alt at, at на кривой АА' соот-
ветствуют инвариантным точкам на верхнем рисунке.
°C
1700 r
- СаО |
+
. Ж
-ч>—
юоо
1500
1900
1300
1200 -
S3
1100 - <
1000 -
к CaO
2570°
2Са.0-Гег0^Ж
Жидк. 1930
Магнетит mp
Магнетит тр.+Ж
E
1
E
§
I
9001.
О
CaO 2СаО-Гег03
2CaO-Fe^.
СаОРе^+Ж
Са0Рег03
Ca02Fe203
2CaDFe203
CaO-Fe2O3
Тю
СаО-гГе^Жу?Гематит mp.
Гематит т.р*Ж
1228°
1172^
Ca0-2Fe30f гематит
Ca0-Fez03* гематит
О/ ВО \ 90
CaO-Fefy Ca0-2Fe203
Вес.%
100
^03 .
Рис. 634. Диаграмма фазового равновесия в си-
стеме СаО—Fe2O3 при давлении кислорода 1 атм.
Точки &(, 6„ &. на кривой ВВ' соответствуют инвариант-
ным точкам на верхнем рисунке.
44 Н. А. Торопов и др., кн. 1
690
Ферритные системы
Кристаллооптическая характеристика соединений системы СаО—Fe2O3
сб
S
R
ю
сб
ь
Цвет о Я И «о R и § • § « g И S « S а о о R Я S' Й я ® s . В s а и ® о °, Q. ¥ и 3 3 3 g о и ° « ф Ф«Э yoHRShjjOB S' S' fi S
Опти- ческий знак + 1 1 я-
сч Сред- ний ?
Np +1 irto^co # <М СО СО 'чГ со с4 CQ
Ng 2.29 (Li) 2.465 (Li); 2.58 (Na) 2.58* + (0.01) ?
Плотность, г/см9 CD -• ’ „ о H Н Я • Но о 'сг и м , а 1 g.e 1 г. о о” ю *
Габитус Иголь- чатый. Непра- виль- ный.*
| Система ' • ‘ • о в S в S в tn сб ЯЮ Я । сб И S я S « О й о ° о ° й к Р" Р" д
Соединение со . е? О ” О « О G4 ® CQ Ф См ® Ьн • См <м о Сб о о rj « сб ся Q U
Система изучена Со-
сманом и Мервином [12] с
невысокой степенью точ-
ности вследствие интенсив-
ной потери кислорода при
высоких температурах.
Филлипс и Му ан [И] ис-
следовали фазовые равно-
весия в этой системе на
воздухе (Ро^О.21 атм.)
и при • давлении кисло-
рода в 1 атм. Диаграммы
системы для двух различ-
ных условий приведены
на рис. 633 и 634, инва-
риантные точки — в табл. 1.
Известны три соедине-
ния: 2CaO-Fe2O3, CaO-Fe2O3
и CaO-2Fe2O3. Последнее
было обнаружено Тава-
чи [13], подтверждено Та-
вачииМуласом [14], Эдст-
ромом [9], Батти [3], а
также Филлипсом и Муа-
ном [И]. Согласно рент-
геновским данным Чирил-
ли и Бурдезе [7] 2СаО-
• Fe2O3 имеет Oq=5.32,
Ьо= 14.63, с0=5.58 A, Z=4,
рентгеновская плотность
4.01 г/см3, а по данным
Берто, Блюма и Санье-
-i ра [4] двухкальциевый
“ феррит имеет ромбиче-
§ скую структуру и пара-
и метры а0=5.64, Ьо=
S = 14.68, с0=5.39 A, Z=4,
с рентгеновская плотность
| 4.06 г/см3.
и По Хиллу, Пэйзеру и
5 Райту [10], а также по
о Декеру и Касперу [8],
монокальциевый феррит
имеет ромбическую синго-
нию: а0=9.230 ±0.012,
Ферритные системы
691
Ьо= 10.705+0.14, с0= 3.024+0.04 A, Z=4, рентгеновская плот-
ность 4.81 г/см8, экспериментальная плотность 4.53 г/см3.
Бризи [5] указывает на существование промежуточной тетра-
гональной модификации CaO-Fe2O3, для которой а0=5.48 и с0=19 А.
Чессин и Таркдоган [6] установили для CaO-2Fe2O3, получен-
ного при 1220° на воздухе, гексагональную сингонию; а0=5.992 +
±0.004, с0=31.121+0.008 А; рентгеновская плотность 4.54 г/см8,
экспериментальная плотность 4.56 г/см8. Они доказали отсутствие
в этом соединении Fe2+.
Леонтьев, Богословский и Чуфаров [1 ] подвергли рентгеногра-
фическому исследованию обожженные при 1200° (30 час.) смеси
ферритов: CaO-Fe2O3 и 2CaO-Fe2O3 и не обнаружили заметной
взаимной растворимости между этими соединениями.
Литература
1. Леонтьев Л. И., В. Н. Богословский, Г. И. Чуфаров,
Журн. неорг. хим., 8, № 1, 257, 1963.
2. П я т и к о п П. Д., ДАН СССР, 120, № 3, 592, 1958.
3. В a 11 i Р., Chimica е industria (Milan), 38, № 10, 864, 1956.
4. Bertaut E. F., P. Blum, A. Sagnieres, Acta crystallogr.,
12, № 2, 149, 1959.
5. В г i s i C., Ann. chim. (Roma), 43, 40, 1953.
6. Chessin H., E. T. T u r k d о g a n, Journ. Amer. Ceram. Soc.,
45, № 12, 597, 1962.
7. C i г i 11 i V., А. В u г d e s e, Ricerca Sci., 21, 195, 1185, 1951.
8. Decker B. F., J. S. К a s p e r, Acta crystallogr., 10, № 4, 332, 1957.
9. Edstrom J. 0., Jernkont. Ann., 140, № 2, 101, 1956.
10. H i 11 P. M., H. S. P e i s e r, J. R. R a i t, Acta crystallogr., 9, № 12,
981, 1956.
11. Phillips В., A. M u a n, Journ. Amer. Ceram. Soc., 41, № 11, 455,
1958.
12. S о s m a n R. W., H. E. Merwin, Joum. Wash. Acad. Sci., 6, 532,
1916.
13. T a v a s c i B., Ann. chim., app. 26, № 7, 1936.
14. T a v a s c i B., G. M u 1 a s, Chimica e industria (Milan), 35, № 8, 551,
1953.
BaO—Fe2O3
Имеет значение для производства специальных цементов.
Система (рис. 635), изученная Гото и Такада [2], характери-
зуется наличием трех соединений: 2BaO-Fe2O3, BaO-Fe2O3 и
BaO-6Fe2O3 — и двух эвтектик: между 2BaO-Fe2O3 и BaO-Fe2O3
(1330° и 41.2 мол.% Fe2O3) и между BaO-Fe2O3 и BaO-6Fe2O3
(1370° и 60.0 мол.% Fe2O3). BaO-Fe2O3 в незначительной степени
растворяется в BaO-6Fe2O3. Молярные отношения ВаО : Fe2O8
44*
692
Ферритные системы
в BaO-6Fe2O3 твердых растворах составляют 18.2:81.8
(BaO-4Fe2O3) при 1350° и 16.7:83.3 (BaO-5Fe2O3) при 800°.
Fe2O3 в состав этих твердых растворов не входит, не отмечается
Молекулярное отношение Fe2O3 Ba.O
05 1.0 15 2 3 if 10
х1 лЗ о?
Рис. 635. Диаграмма состояния
системы ВаО—FegO3.
1 — две твердые фазы; 2 — одна твер-
дая фаза; а — сосуществующие жид-
кая и твердая фазы; 4 — одна жидкая
фаза.
также растворимость ВаО -Fe2O3 в 2ВаО -Fe2O3. Значения парамет-
ров решетки для ферритов бария приведены в таблице.
Параметры для однобариевого феррита несколько отличаются
от данных Окасаки, Кубота и Мори [3], согласно которым а=5.95,
с=9.38 а. и. Значения параметров для двух других ферритов хо-
рошо согласуются с данными Аделскольда [1 ] и Окасаки и др. [3].
Параметры кристаллической решетки соединений системы ВаО—Fe2O3
Соединение Сингония а» а. и. С, а. и.
2BaO-Fe2O3. Кубическая. 8.07
BaO-FegOs. Тетрагональная. 6.02 9.45
BaO. BFejOj. Гексагональная. 5.877 23.02
Литература
1. A d е 1 s к б 1 d V., Arkiv Kemi, Mineral., Geol., 12A, № 6 (29), 1, 1938.
2. Goto Y., T. T a к a d a, Journ. Amer. Ceram. Soc., 43, № 3, 150, 1960.
3. Okazaki T., T. Kubota, S. M о г i, Nat. Techn. Rep. Japan,
1, № 1» 23, 1955.
Ферритные системы
693
ZnO— Fe 2O3
Имеет важное значение как составная часть магнитных керами-
ческих материалов.
Фазовые соотношения в системе изучены Тороповым и Бори-
сенко [1, 2].
Имеющееся в системе соединение феррит цинка ZnO-Fe2O3
кристаллизуется в кубической сингонии с образованием струк-
туры шпинельного типа (нормальный тип). При повышенных тем-
пературах наблюдается термическая диссоциация окиси железа
и улетучивание ZnO. Вплоть до 1100° не наблюдается разложения
Fe2O3 и система находится в устойчивом состоянии. Рентгеногра-
фическое и микроскопическое (в отраженном свете) исследование
показало, что в указанных условиях существуют твердые растворы
между ферритом цинка и окисью железа в пределах содержания
Fe2O3 от 66.24 до 83.07 вес.%. Это соответствует непрерывному
ряду ZnO-Fe2O3—2ZnO-5Fe2O3. Последний состав является, таким
образом, предельным твердым раствором f-Fe2O3 в ZnO -FejCh.
Параметр кристаллической решетки феррита цинка а=8.4 А.
Плотность измеренная 5.33 г/см3, вычисленная 5.50 г/см3.
Литература
1. Торопов Н. А., А. И. Борисенко, ДАН СССР, 82, № 4, 607,
1952.
2. Торопов Н. А., А. И. Борисенко, Журн. прикл. хим., 28,
№ 12, 1347, 1955.
CdO—Fe2O3
Диаграмма состояния системы не построена. Известно только
одно соединение CdO-Fe2O3 типа шпинели с параметром элемен-
тарной ячейки а= 8.684 А. Феррит кадмия образуется из окислов
при 700—800°, обладает магнитными свойствами, плотность
5.76 г/см3 [1].
Литература
1. Чижиков' Д. М. Кадмий. Изд. АН СССР, М., 23, 1962.
694
Ферритные системы
Se2O3—Fe2O3
• Систему изучили Касседан и Форестье [1 ]. Соединений не
обнаружено. Установлены твердые растворы на основе Fe2O3
и на основе Sc2O3 (рис. 636). Ромбоэдрический твердый раствор со
структурой типа Fe2O3 (Г’) содержит максимально 27 мол.% Sc2O3
(обозначается на рисунке а). Кубический твердый раствор (Р)
Рис. 636. Фазовая диаграмма
системы Sc2O3—Fe2O3 (по Кас-
седан и Форестье).
со структурой типа Sc2O3 (D|) содержит максимально 55 мол.%
Sc2O3. Выше 1350° Fe2O3 начинает переходить в магнетит и возни-
кают магнетитовые твердые растворы. На рис. 636 представлена
область существования Fe3O4 твердого раствора.
Твердый раствор Sc2O3 в окиси железа обладает ферромагнетиз-
мом, причем точка Кюри изменяется линейно с составом. Для пре-
дельного твердого раствора точка Кюри находится при 490°.
Литература
1. Cassedanne J., Н. Forestier, Compt. rend., 250, № 17, 2898,
1960.
Y2O3—Fe2O3
Систему изучали Касседан [3] и Ван-Гук [7]. Отдельные сое-
динения были получены Нильсеном и Дирборном [5], Берто и
Форра [2] и Форестье с сотрудниками [4].
Касседан производила рентгенографические исследования
обожженных смесей Y2O3 и Fe2O3. Получено два химических соеди-
нения: Y2O3-Fe2O3 и 3Y2O3 -5Fe2O3. В области, примыкающей
Ферритные системы
695
к окиси иттрия, обнаружены твердые растворы, пределы существо-
вания которых расширяются с повышением температуры (рис. 637).
В образцах, богатых окисью железа, обожженных выше 1380°,
железистая фаза представляется магнетитом Fe3O4 (на рисунке
обозначена М). Линия, разграничивающая фазы a-Fe2O3 и Fe3O4,
представлена на рисунке пунктиром.
Ван-Гук [7] изучал, пользуясь методом закалки, фазовые со-
отношения в тройной системе Fe2O3—FeO—YFeO3 и привел дан-
ные для двойной системы окись железа—YFeO3 при условии
"С
°C
1500
1400
Fe30if+y3Feg012
1410°
^гО3-У/е5О1г
О 10 20 30/40 (50
YM3
Fe/3 Мол.%, У203
Рис. 6.37. Диаграмма состоя-
ния системы Y2O3—Fe2O3.
G — 5Fe,O, -SYjO,; P — Fe,O,.
•Y,O,; M — FesO« (по Касседан).
Рис. 638. Схематическая фа-
зовая диаграмма системы
YFeO3—Fe2O3 (по Беретка).
проведения опытов в атмосфере воздуха, кислорода и углекислого
газа. Ван-Гук указывает на узкую область твердых растворов,
примыкающую к окиси железа.
В зависимости от внешней газовой среды температура инкон-
груэнтного плавления иттриево-железистого граната Y3Fe6O12
различна. Так, на воздухе эта температура, по данным Ван-Гука,
равна 1555+3°, в атмосфере кислорода 1582+3° и в атмосфере
углекислого газа 1495+7°. Эвтектика между магнетитом и грана-
том также имеет различную температуру плавления: на воздухе
эта температура равна 1469 + 2°, в кислороде 1455+2° и в атмо-
сфере углекислоты 1467+4°. Специальное исследование влияния
давления кислорода на температуру инконгруэнтного плавления
Y3Fe5O12 [8] показало, что с увеличением давления кислорода
606
Ферритные системы
эта температура повышается и при давлении 100 атм. достигает
1647°.
Соединение Y2O3-Fe2O3 имеет структуру перовскита, соеди-
нение 3Y2O3-5Fe2O3 относится к типу гранатов. Параметры кри-
сталлической решетки этих соединений, по данным Шнейдера,
Рота и Уоринга [6], представлены в таблице (см. стр. 332—333).
Обнаруженный твердый раствор имеет структуру, характерную
для чистой Y2O3. Ван-Гук показал, что в зависимости от внеш-
него давления кислорода формула иттриевого железистого гра-
ната в той или иной степени отличается от идеальной Y3FesO12.
Беретка [1] пользовался методом дифференциального термиче-
ского анализа. Обнаружено два соединения: гранат состава
Y3Fe6O12 и феррит иттрия YFeO3. Приближенная диаграмма со-
стояния приведена на рис. 638.
Нильсен и Дирборн [5] разработали метод получения моно-
кристаллов магнитного граната Y3Fe50j2 из расплава состава:
РЬО — 52.5 мол. %, Fe2O3 — 44 мол. %, Y2O3 — 3.5 мол. %. Со-
гласно данным этих авторов, Y3FeBO12 плавится инконгруэнтно
приблизительно при 1580°.
Литература
1. В е г е t k a J., Austral. Journ. Appl. Sci., 15, № 1, 1, 1964.
2. Bertaut F., F. F о r r a t, Compt. rend., 242, № 3, 382, 1956.
3. Cassedanne J., Compt. rend., 252, № 21, 3261, 1961.
4. Forestier H., G. Guio t - G uillai n, R. Pauthenet,
Compt. rend., 239, № 1, 155, 1954.
5. Nielsen J. W., E. F. Dearborn, Journ. Phys. Chem. Solids,
5, 202, 1958.
6. S c h n e i d e r S. J., R. S. R о t h, J. L. W a r i n g, Journ. Res. Nat.
Bur. Stand., 65A, № 4, 345, 1961.
7. V a n H о о к H. J., Journ. Amer. Ceram. Soc., 45, № 4, 162, 1962.
8. V a n H о о к H. J., Journ. Amer. Ceram. Soc., 46, № 5, 248, 1963.
La2O3—Fe2O3
Систему изучали Моруцци и Шефер [3]. Обнаружено два соеди-
нения: La2O3-Fe2O3 и LaFe12O19. Соединение LaFe12O19=La2O3-
• 2FeO-HFejOs существует только в температурной области
1421—1380°, т. е. ниже температуры плавления эвтектики между
LaFeO3 и Fe2O3 (Fe3O4) (рис. 639).
Соединение LaFeO3 относится к типу перовскита, кристаллы —
к ромбической системе. Соединение LaFe12O19 имеет структуру
магнетоплюмбита (тип Р~А12О3) с параметрами гексагональной
ячейки: а=5.879, с= 22.8807 а. и.
Ферритные системы
697
При проведении опытов на воздухе фактически изучается
изобарный разрез тройной системы FeO—Ее2О3—Ьа2О3. Для
области, богатой окисью железа, приводится кривая, показываю-
щая состав жидкости при температуре ликвидуса (рис. 639, 6).
С
2000
1800
\ LaFeO,+M
^а2°3
+
• ж
° 1600
- LaJ)3+LaFeO3
LaFef3O^LaFeO3.
Жидк.
LaFeO3
Ж
О
МОЛ g
отн. j
к La.fi
го ОО
| LaFeO3 вес. %
г 1
1 1
LaFeO3*Fe3O3
W | 60
Л-J О/
50 II \т
1Ге,03
10 г3
1 1 hl 1
к FeO
Fe^
?егРз
6 912\1839
m
Рис. 639. Диаграмма состояния системы
La2O3— Fe2O3.
а — фазы, присутствующие в системе La3O3—Fe3O3
на воздухе (изобарическое сечение через тройную
систему FeO—Fe3O3—La3O3); б — часть тройной
системы FeO—Fe3O3—La3O3. Светлые кружки —
состав жидкости при температуре ликвидуса.
- Рот [4] также получал ромбические кристаллы LaFeO3 про-
каливанием смеси окислов при 1500°. Соединение LaFeO3 имеет
параметры ячейки: а=5.545, £>=7.851, с—5.562 А.
Систему La2O3—Fe2O3 изучали Гото, Кетамура, Такада и
Каши [2]. Согласно данным этих авторов, соединение LaFeO3
плавится с разложением • при 1850°. Эвтектическая реакция
LaFeO34-Fe2O3 жидкость наблюдалась при 1490° и содержании
83.3 мол.% Fe2O3. Взаимной растворимости компонентов системы
в твердом состоянии не набдюдалось.
698
Ферритные системы
Касседан и Форестье [1] также не обнаружили каких-либо
твердых растворов. Для соединения La2O3-Fe203 приводятся пара-
метры элементарной ячейки: а=5.544, Ь=5.544, с=7.854 А.
Литература
1. Cassedanne J., Н. Forestier, Compt. rend., 250, № 17, 2898,
1960.
2. Goto Y., T. Ketamura, T. Takada, S. Kachi, Journ. Japan
Soc. Powder Metallurgie, 7, № 5, 227, 1960.
3. M о r u z z i V. L., M. W. Shafer, Journ. Amer. Ceram. Soc., 43,
№ 7, 367, 1960.
4. Roth R. S., Journ. Res. Nat. Bur. Stand., 58, № 2, 75, 1957.
Eu2Os—Fe2O8
Система перспективна для получения новых типов магнитно-
керамических материалов.
Ориентировочно изучена Беретка [1 ] методом дифференциаль-
ного термического анализа. Обнаружены два соединения: Eu3FesO12
'С
\Жидк. /
к./ ;
/Гранат]
со
1>юо
Ре»Оь+еранат
14 ______
е
Рег03+гранат
0 10 20 30/io 50
Su3Pe5012
РегО3 Мол0/, iuFeO3
Рис. 640. Схематическая фа-
зовая диаграмма системы
EuFeOj—FejO3 (по Беретка).
(тип граната) и феррит EuFeO3. Приблизительная диаграмма со-
стояния системы представлена на рис. 640.
Литература
1. В е г е t k a J., Austral. Journ. Appl. Sci., 15, № 1, 1, 1964.
Ферритные системы
699
Gd2O3—Fe2O3
Систему, существенную для технологии ферритных материалов,
изучали Варшау и Рой 15]. Обнаружено два соединения —
Gd2O3-Fe2O3 и 3Gd2O3 -5Fe2O3, температурй плавления которых
‘С
2200
1800
поо
Жидк.
3Gd^03a5Fр^ 03
1550° +Fe3°d/
/ 1580°
...7...../ж
3GdgO$'5Fe^,
+ Fe203
150б~-£-
+ В
1030°
1000 ------------------------
о
Gd203-F9203+С~Сд20з
го
60 \ 80
юо
Gd203 Gd203Fe203 SGdzOjSFefy Fefy
Мол.%
Рис. 641. Диаграмма состояния системы
Gd2O3 FeaO3.
B-Gd,O, — моноклинная форма; C-GdlO1 — кубическая
форма.
определены приближенно (рис. 641). Соединение 3 : 5 относится
к группе гранатов, соединение 1 : 1 имеет дефектную перовскито-
вую структуру.
°C
1500
/ GdFeO3*K
/ Gd3Fes0/2
+Ж \/ 1450" +Ж
Fe30if+GiL3FesO12
1400- w/7°
Fe203+Gd3Fe5012
0 10 20 30/40 <50
Gd^FoijOffl GdFeO3
Fe^O^ Мол.°/о Gd203
ti
$2
Рис. 642. Схематическая фа-
зовая диаграмма системы
GdFeO3— Fe2O3 (по Беретка).
В условиях опытов Варшау и Роя необходимо считаться с на-
личием FeO в области выше солидуса, Богатые железом составы
содержат FeO и в области солидуса. Пунктирная линия при 1390°
характеризует переход Fe2O3 -> Fe3O4.
700
Ферритные системы
Структура и магнитные свойства соединений описаны Гелле-
ром 13], Бертро и Форра [2], Геллером и Вудом [4].
Беретка [1 ] методом дифференциального термического анализа
обнаружил два соединения: Gd3Fe5O15 (тип граната) и феррит со-
става GdFeO3. Приближенная диаграмма состояния приведена
на рис. 642.
Литература
1. Beretka J., Austral. Journ. Appl. Sci., 15, № 1, 1, 1964.
2. В e r t a u t F., F. F о r r a t, Compt. rend., 242, № 3, 382, 1956.
3. Geller S., Journ. Chem. Phys., 11, № 4, 1236, 1943.
4. Geller S., E. A. W о о d, Acta crystallogr., 9, № 7, 563, 1956.
5. Warshaw J., R. Roy, Journ. Amer. Ceram. Soc., 42, № 9, 434, 1959.
Tb4O7 (Tb2O3)-Fe2O3
Ориентировочно изучена Беретка [1 ] методом дифференциаль-
ного термического анализа. Обнаружено два соединения, содер-
'С
1500
\ЖиВк. f
Fe$t /Fb^Fe50n
★Ж V +ж W3‘ £
Fe30^Tb3Fe5012
1Ю7
Н00
Fe203+Tb3Fe50tt
о to го зо/w^so
Tb$Fe§0f2 TbFeO$
^2^3 Мм, % Tb^Op
Рис. 643. Схематическая фа-
зовая диаграмма системы
TbFeO3—Fe2O3 (по Беретка).
жащих трехвалентный тербий Tb3Fe6O12 (тип граната) и феррит
состава TbFeO3. Приближенная диаграмма состояния системы при-
ведена на рис. 643.
Литература
1. Beretka J., Austral. Journ. Appl. Sci., 15, № 1, 1, 1964.
Ферритные системы
701
Dy2O3—Fe2Og
Ориентировочное исследование системы проведено Беретка [1 ]
методом дифференциального термического анализа. Установлено
°C
1500
КОО
\лшак. /_ I
\ /Гранат
Fe,O> ' +Ж I
Лг \//477*5° \ Du FeO,
Магнетит * гранат гранат
Гематит ♦ гранат
Рис. 644. Схематическая фа-
зовая диаграмма системы
DyFeOj—FegOj (по Беретка).
О 10 го 30 но 50
Ге2°3 Мол."/, OyFe03
оу^о^з
образование граната Dy3Fe5O12 и феррита DyFeO3. Примерная
диаграмма состояния системы представлена на рис. 644.
Литература
1. В е г е t k a J., Austral. Journ. Appl. Sci., 15, № 1, 1, 1964.
Ho2O3—Fe2O3
Ориентировочно изучена Беретка [1 ] методом дифференциаль-
ного термического анализа. Обнаружены соединения: Ho3Fe5O12
(тип граната) и феррит HoFeO3.
Литература
1. В е г е t k a J., Austral. Journ. Appl. Sci., 15, № 1, 1, 1964.
Er2Os—Fe2O3
Ориентировочное исследование системы осуществлено Бе-
ретка Ц] методом дифференциального термического анализа.
Обнаружено два соединения: гранат состава Er3Fe5O12 и феррит
ErFeO3. Приблизительная диаграмма состояния системы при-
ведена на рис. 645.
702
Ферритные системы
°C
1500-
' Жидк. /
\ / I
V 1475+-30 I
1435 ±3'
1400-
я
О 10 20 30
40 foO
irFeO3
FeZ°3 Моп.°/, &гг03
Рис. 645. Схематическая фа-
зовая диаграмма системы
ErFeOs—Fe2Os (по Беретка).
Литература
1. В eretka J., Austral. Joum. Appl. Sci., 15, № 1, 1, 1964.
; PbO— Fe2O3
Имеет значение для технологии ферромагнитной керамики.
Система изучалась многими авторами, получившими весьма
противоречивые результаты.
"С
1W0
1200
1000
800
600
Молекулярное отношение PbOFefy
О 20
РЬО
40 60
Мол.7»
80 100
Fe303
Рис. 646. Диаграмма состояния системы
РЬО—Fe2O3.
1 — одна твердая фаза; 2 — две твердые фазы; з — жид-
кая-]- твердая фазы.
Ферритные системы
703
Согласно Кокко [5], в
системе существуют соеди-
нения с отношением РЬО :
: Fe2O3 2:1, 2 : 5 и 1 : 5;
Бергер и Павлек [3] так-
же отмечают наличие сое-
динения 2:1, но вместо
двух последних соедине-
ний указывают на образо-
вание 1 : 2 и 1 : 6. л
Маргулис и Копы- о
лов [1], изучая систему £
РЬО—Fe2O3 термо графи- I
ческим, микроскопическим л
и рентгенографическим ме-
тодами, установили только |
одно соединение постоян- g
ного состава PbO-4Fe2O3, §
плавящееся с разложением :Я
при 1140°. Последнее с §
РЬО * образует эвтектику и
состава РЬО : Fe2O3==5 : 1 |
при 720°. =
Маунтвала и Равич [7] я
исследовали систему рент- я
генографическим методом g
(рис. 646) и пришли к вы-
воду, что система не яв- g
ляется строго «равновес- »
ной», поскольку невозмож- «
но было в некоторых слу- §
чаях достичь равновесия «
сверху и снизу, т. е. при g?
охлаждении и нагревании. Й,
В системе существуют три &
фазы, плавящиеся инкон-
груэнтно: [3-фаза представ-
ляет собой твердый раствор
состава от PbO-5Fe2O3 до
PbO-6Fe2O3, у-фаза — от
РЬО *2Fe2O3 до РЬО •
• 2x/2Fe2O3 и &-фаза соста-
ва 2PbO-Fe2O3.
В природе ферриты
свинца найдены в виде
I csi oq I Ю I so
R 8о .05 1 1 | 1 1
СО
Од eq сч eq eq
^ч о о о о 00
О сб сб сб сб иб
^ч eq eq eq eq
s_e_x
а Йе ай eq 00 00 00 СО Од
ёр б со со ОС ю 00 ю 00 00 16 00 г>
о иб ^ч
А Jd л л
S S § ~ §
и м и и
2 g 1 я * о
И S |l i 1 « ’ © § й И о- * 5? fs
₽-ч Ен м Ен Ен
СО
о
со о <г
©
tx
со eq
rt 6 6
л л
S л •а л
Д 1 1
со й со
2 о сч © о Рч S © go Рн м
а & eq
е со 6 6
о сч л Ан ч о Ан, ол
со м со cq я
РЬО. 6 л л сб X о Л Л сб 1 Од яу Ан се
704
Ферритные системы
двух минералов: магнетоплюмбита — PbO*6Fe2O3 и плюмбо-
феррита — PbO*2Fe2O3.
Маунтвала и Равия указывают, что f-фаза имеет весьма сход-
ную структуру с соединением 1 : 6. Рентгеновские данные для
ферритов свинца приведены в таблице.
Литератур а
1. М а р г у л и с Е. В., Н. И. К о п ы л о в, Журн. неорг. хим., 5, № И,
2471, 1960.
2. Adelskold V., Arkiv Kemi, Mineral., Geol., 12A, № 29 , 9, 1938.
3. Berger W., F. P a w 1 e k, Arch. Eisenhiittenw., 28, № 2, 101, 1957.
4. В e г г у G. G., Amer. Mineralogist, 36, № 5—6, 512, 1951.
5. С о с c o’JA., Ann. chim. (Roma), 45, № 9/10, 737, 1955.
6. Johansson K., Zs. Kristallogr., 68, № 1/2, 87, 1928.
7. M о u n t v a 1 a A. J., S. F. R a v i t z, Journ. Amer. Ceram. Soc., 45,
№ 6, 285, 1962.
8. S m i t J., H. P. J. W i j n, Ceram. Abstr., June, 150, 1959.
Bi2O3—Fe2O3
Интересна для получения новых магнитных керамических мате-
риалов.
Систему изучали Ройен и Сваре [8], Левин и Рот [7] и Сперан-
ская, Скориков, Роде и Терехова [2]. В работах [1, 4, 5, 6] описы-
ваются условия синтеза отдельных ферритов висмута и даются их
структурные характеристики вместе с некоторыми физическими
свойствами.
С определенностью установлено существование двух соеди-
нений: Bi2O3-Fe2O3 и Bi2O3-2Fe2O3. Утверждение Ройена и Сварса
о получении ими соединения 2Bi2O3-Fe2O3 последующими рабо-
тами не было подтверждено. Кроме того, всеми исследователями
указывается соединение, богатое Bi2O3, однако состав этого соеди-
нения точно не установлен. Так, первые исследователи [8] пола-
гали даже, что существует два соединения — 30Bi2O3-Fe2O3 и
12—13Bi2O3>Fe2O3, но в последующих работах всегда указывается
только одно соединение. Левин и Рот приводят состав 24Bi2O3-
• Fe2O3, отмечая некоторую область гомогенности этого соединения
(см. рис. 539). Сперанская с сотрудниками в первой работе дают
предположительный состав 20Bi2O3 -Fe2O3, а в работе 1966 г. [3]
уже указывается состав 23Bi2O3>Fe2O3.
Сперанская с сотрудниками приводят фазовую диаграмму си-
стемы Bi2O3—Fe2O3, полученную методом термографии (рис. 647).
Отмечается три соединения: Bi2O3>2Fe2O3, Bi2O3-Fe2O3 и'
20Bi2O3-Fe2O3, плавящиеся инконгруэнтно соответственно при
960, 930 и 795°.
Ферритные системы
705
При 785° кристаллизуется эвтектическая смесь низкотемпе-
ратурной формы -BiFeO3:r и соединения
Феррит висмута BiFeO3
имеет обратимое полиморф-
ное превращение при 825 ° ч
(эта температура подтвержде-
на монокристальными иссле-
дованиями). BiFeO3, по [3],
имеет структуру перовскито-
вого типа с параметрами эле-
ментарной ячейки: я=3.962 +
±0.001 А, а=89°24'+3'
(небольшое ромбоэдрическое
искажение кубической перов-
скитовой ячейки). Пикно-
метрическая плотность, по [1],
8.31 г/см3, рентгеновская, по
[6], 8.37 г/см3. BiFeO3 явля-
ется сегнетоэлектриком (сла-
бым ферромагнетиком), тем-
пература Кюри ^=850° С,
температура Нееля 7’n=
20Bi2O3-Fe2O3.
1000
960
-~930° \
900
800
700 -
600 \_____L.
0 20
^е2°3
/3 825
\
\ 890°
^\795°/
785°\^
730^^
2:1 1:1
1:20
90 ВО
Мол. /
80 100
Bt^Oj
=370° С [5].
Тутов с сотрудниками [4 ]
показали, что в системе су-
ществует еще одно соедине-
ние Bi2O3'2Fe2O3, получен-
Рис. 647. Фазовая диаграмма состояния
системы Bi2O3—Fe»O3 по термографиче-
ским данным (по Сперанской с сотруд-
никами) .
а
ное в виде монокристал-
лов (кристаллизация из расплавов), относящихся к ромбической
сингонии с параметрами элементарной ячейки: я=7.88, Ь=8.40,
с=6.00 А; плотность пикнометрическая 6.81 г/см3. При 265° К,
по-видимому, происходит переход из парамагнитного в антиферро-
магнитное .состояние.
Литература
1. Заславский А. И., А. Г. Т у т о в, ДАН СССР, 135, № 4, 815,1960.
2. Сперанская Е. И., В. М. С к о р и к о в, Е. Я. Р о д е, В. A. Te-
pe х о в а, Изв. АН СССР, сер. хим., № 5, 90, 1965.
3. Томашпольский Ю. Я., В. М. С к о р и к о в, Ю. Н. В е н е в-
цев, Е. И. Сперанская, Изв. АН СССР, неорг. матер., 2,
№ 4, 707, 1966.
4. Т у т о в, А. Г., И. Е. М ы л ь н и к о в а, И. Н. Парфенова,
В. А. Быков, Физика тверд, тела, 6, № 4, 1240, 1964.
5. Федулов С. А.,Ю. Н. Веневцев, Г. С. Жданов, Е. П. С ма-
не е в с к а я, Кристаллография, 6, № 5, 795, 1961; 9, № 4, 516, 1964.
45 Н. А. Торопов и др., кн. 1
706
Ферритные системы
6. Ф и л и п ь е в В. С.,Н. П. Смо ля ииио в, Е. Г. Фесенко,
И. Н. Беляев, Кристаллография, 5. № 6, 958, 1960.
7. Levin Е. М., R. S. R о t h, Journ. Res. Nat. Bur. Stand., 68A, № 2,
197, 1964.
8. R о у e n P.,K. Swars, Angew. Chem., 69, № 24, 779,1957.
Cr 2O3— Fe2O3
Имеет значение для фазового анализа огнеупоров, шлаков и
окалины, образующейся на сплавах на основе железа и хрома.
Изучалась Вретбладом [4], Ди Цербо и Сейболтом [1 ] и Муаном
и Сомия [2, 3].
0 20 40 60 80 ЮО
Fe203 вес.% Сгг03
Fez°3 Сгг°з
FeOFe203^^^^/FeOCT2Oj
Пмутораокисьч'
m.p. \ У Шпинель
\/ т.р.
FeO
Рис. 648. Диаграмма фа-
зовых отношении в системе
Сг2О3—Fe2O3.
Диаграмма фазовых отношений оки-
сел железа — Сг2О3 на воздухе дается
на рис. 648 по данным Муана и Со-
мия [2, 3]. В верхней ее части система
показана ради простоты в виде проекции
на двойной разре» Fe2O3—Сг2О3. Ниж-
няя треугольная часть диаграммы
представляет схематически примерные
составы конденсированных фаз. Соста-
вы твердых растворов полутораокисей
Fe2O3 и Сг2О3 представлены линией
Fe2O3—Сг2О3, составы шпинельных твер-
дых растворов — штриховой кривой
а—б, составы жидкости — штриховой
кривой с—d—Сг2О8, причем состав
жидкости на отрезке с—d находится
в равновесии со шпинелями, составы
которых представлены кривой а—Ь,
а жидкости вдоль кривой d—Сг2О3
находятся в равновесии с полутораоки-
сями, представленными линией Fe2O3—
—Сг2О3. Диаграмма рис. 648 показывает
наличие непрерывных твердых раство-
ров гексагональной структуры между
гематитом (Fe2O3) и окисью хрома
(Сг2О3 — природный минерал эсколаит).
На рис. 649 показано, по дан-
ным Вретблада, изменение величины
угла ромбоэдра и длины его ребра в зависимости от состава
твердого раствора Fe2O3—Сг2О3. На рис. 650 приведены данные
Муана и Сомия по изменению межплоскостного расстояния (d)
в зависимости от состава твердых растворов Fe2O3—Сг2О3. Ими
Рис. 649. Изменение величины
угла ромбоэдра (а) и длины
его ребра (г) в зависимости
от состава твердого раствора
в системе Сг2О3—Fe2O3 (по
данным Вретблада).
Рис. 650. Изменение меж-
плоскостных расстояний (d)
в зависимости от состава
твердых растворов в си-
стеме Cr«Os—Fe2Os (по дан-
ным Муана и Сомия).
Fe2°i вес. % Сгг°з
Рис. 651. Изменение пара-
метра кристаллической ре-
шетки твердых растворов
системы Сг2О3—Fe2O3.
1 — по Вретбладу; г — по Ди
Цербо и Сейболту.
Ъ°з Вес.% СгА
Рис. 652. Изменение меж-
плоскостных расстояний
(d) твердых растворов си-
стемы Сг2О3—Fe2O3
(по Ди Цербо и Сейболту).
45*
708
Ферритные системы
установлено, что межплоскостное расстояние (d) для шпинельных
твердых растворов в этой системе изменяется с изменением их
составов очень незначительно.
На рис. 651 изображена кривая изменения постоянной решетки
(а0) в зависимости от состава ромбоэдрических твердых растворов
a-Fe2O3—Сг2О3 по данным Ди Цербо и Сейболта в сопоставлении
с прежними данными (5 треугольничков) Вретблада. Постоянные
решетки по оси с на графике не нанесены, но авторами приводятся
в таблицах. Они меняются от 13.599+0.002 для чистого Сг2О3до
13.749 а. и. для чистого Fe2Os.
На рис. 652 по данным Ди Цербо и Сейболта показано измене-
ние межплоскостных расстояний (d), вычисленных из параметров
решетки, для тех же твердых растворов, для различных кристалло-
графических направлений (ЛЙ).
Литература
1. Di Cerbo R. К., A. U. S е у b о 11, Journ. Amer. Ceram. Soc., 42,
№ 9, 430, 1959.
2. M u a n A., S. S omiy a, Journ. Amer. Ceram. Soc., 42, № 12, 603,
1959.
3. M u a n A., S. S о m i у a, Journ. Amer. Ceram. Soc., 43, № 4, 204, 1960.
4. W r e t b 1 a d P. E., Zs. anorgan. allgem. Chem., 189, № 4, 329, 1930.
MnO—Fe2O3
Рикк и Дриссене [1] изучили структуру марганцевой шпинели
MnxFej_xO4 при х, изменяющемся от 0.25 до 1.5. Стехиометри-
ческую шпинель MnFe2O4 авторы представляют в виде формулы
Mn^Mn^+Fe^Fe^tgO*-. р может изменяться в пределах от 0.025
до 0.18, и параметр элементарной ячейки при этом изменится
от 8.505 до 8.521 А.
Литература
1. Rieck G. D., F. С. М. D г i е s s е n s, Acta crystallogr,, 20, № 4, 521,
1966.
Mn2Os—Fe2Os
Интересна для выяснения состава шлаков и природных и ис-
кусственных минералов (биксбиит, ситапарит, партриджеит).
Мэзон [1 ] с целью уточнения состава и классификации природ-
ных минералов общего состава (Мп, Fe)2Os построил на основании
Ферритные системы
709
изучения рентгеновских порошкограмм синтетических препаратов
фазовую диаграмму системы Мп2О3—Fe2O3. Максимальное заме-
щение Мп2О3 на Fe2O3 составляет примерно 30% при 600° и быстро
возрастает до 60% при 1000°. При температуре выше 1000° полу-
тораокиси диссоциируют. Растворимость Мп2О3 в Fe2O3 значи-
тельно меньше. Предлагается сохранить для природных минералов
0 20 W 60 80 100
Fefy вес.% Мпг03
Рис 653. Диаграмма состояния системы
Mn2O3—Fe2O3 (по Муану и Сомия).
названия «биксбиит» и «ситапарит», исключив, как излишнее,
название «партриджеит» (браунит, содержащий до 10% железа и
выше).
Более детально система изучена Муаном и Сомия [2]. Соста-
вленная ими диаграмма фазовых отношений, изученных в воздуш-
ных условиях, представлена на рис. 653. Их данные согласуются
с данными Мэзона по взаимной растворимости Fe2O3 и Мп2О3 при
температурах примерно до 1000°. Однако кривая диссоциации
полутораокисей имеет более сложный, чем у Мэзона, характер.
Из этой диаграммы следует, что переход магнетита в гематит,
710
Ферритные системы
на воздухе в чисто железоокисной системе происходящий при 1390°.
при добавлении окиси марганца снижается до минимума при 997°.
Аналогично переход Мп2О3 в тетрагональную Мп2О3, в чисто
марганцевой системе происходящий при 877°, при добавлении
окиси железа возрастает до максимума при 932°. Превращение
из тетрагональной формы в кубическую Мп$О4, в системе Мп—О2
имеющее место примерно при 1160°, с добавкой окиси железа по-
нижается до минимума при 932°. Фазовые ассоциации и темпера-
туры двух изобарических бинарных инвариантных состояний в си-
стеме таковы: 1) при 997° сосуществуют в равновесии гематит,
содержащий примерно 13 вес. % Мп2О3 в твердом растворе, шпи-
нель (—60 вес. % Fe3O4 и 40 вес. % Мп3О4) и газ (РОг=0.21 атм.);
2) при 932° в стабильном равновесии с газом (Ро,=0.21 атм.Нахо-
дится шпинель (—30 вес. % Fe3O4 и 70 вес. % MnaOJ, Мп2О3 при-
мерно с 42 вес. % Fe2O3 в твердом растворе и тетрагональная Мп3О4,
содержащая около 2% Fe3O4 в твердом растворе. Температура
ликвидуса очень медленно понижается от того и другого компо-
нентов системы к минимуму примерно при 1565°.
Литература
1. М a s о п В., Amer. Mineralogist, 29, № 1—2, 66, 1944.
2. М u a n A., S. Somiya, Amer. Journ. Sci., 260, № 3, 230, 1962.
Mn3O4—Fe3O4
Представляет интерес для технологии производства магнитно-
керамических материалов и для изучения фазового состава не-
°C
1591
1200
600
900
1565°
Твердая раза Ж
Одноразная
область
0 20 90 60 80 100
Мол.% Мп&
Рис. 654. Диаграмма со-
стояния системы Mn3O4—Fe3O4
(по Мэзону).
Ферритные системы
711
которых шлаков и природных минералов (гаусманит, магнетит,
якобсит).
Данные по системе приводятся в работах Мэзона [2] (рис. 654),
Мак-Мэрди, Салливана и Мауэра [3] (рис. 655), Ван-Гука и
Рис. 655. Диаграмма состоя-
ния системы Mn3O4—Fe3O4 (по
данным Мак-Мэрди, Салли-
вана, Мауэра).
Рис. 656. Диаграмма состояния
системы Mn3O4—Fe3O4(поданным
Ван-Гука и Кейта).
Кейта [7] (рис. 656), Муана и
Сомия [5, 6].
Муаном и Сомия система изу-
чалась на воздухе и при низких
температурах; устойчивыми яв-
лялись полутораокиси Мп2О3 и
2 — максимальная температура,
при которой обнаруживается только
одна тетрагональная фаза; 2 —
температуры, при которых обна-
руживаются вместе кубическая и
тетрагональная фазы; 3 — наиниз-
шие температуры, при которых
обнаруживается только одна куби-
ческая фаза.
Fe2O3 и их твердые растворы, а при более высоких — Мп3О4
и железо-марганцевые шпинели (Мп3О4—FegOJ. В связи с этим
в их работах, относящихся к 1961 и к 1962 гг., приводится одна и
та же диаграмма, но в работе 1961 г. компонентами диаграммы по-
казаны Fe3O4 и Мп3О4, а в работах 1962 г. — Fe2O3 и Мп2О3 (она
приведена нами при описании системы Fe2O3—Мп2О3, см. рис. 653).
На рис. 657 приводятся изменения размера элементарной
ячейки тетрагональных и кубических твердых растворов. Между
54 и 91 % Мп3О4 находится двухфазная область. Кубические твер-
712
Ферритные системы
дне растворы в этой области устойчивы только при закалке от вы-
соких температур и метастабильны при комнатной температуре.
Тетрагональный твердый раствор, который может быть получен
ментарнои ячейки тетрагональ-
ных и кубических твердых рас-
творов в системе Мп3О4—Fe3O4.
скостных расстояний .шпинель-
ных твердых растворов в системе
Mn3O4—Fe3O4.
1 — по Вервею и Ван-Бруггену; 2 —
по Мэаону; 3 — по Ван-Гуку и Кейту.
при опытах в атмосфере воздуха,
возможно, имеет, по Ван-Гуку и
Кейту, более низкое отношение
1 — по Муану и Сомия, образцы зака-
лены от 1447°; 2 — по Муану и Сомия,
образцы закалены от 1400°; з — по Му-
ану и Сомия, образцы закалены от
1196°; 4 — по Муану и Сомия, образ-
цы закалены от 1101°; 5 — по Вер-
вею и Ван-Бруггену; в — по Монто-
ро; 7 — по Мэаону; з — по Ван-
Гуку и Кейту; 9 — по Батлеру.
катион : кислород, чем у R3O4,
и они могут быть сопоставлены с R3O4—R2O3 — твердыми раство-
рами Вервея и Ван-Бруггена [8], данные которых показаны
на рис. 657.
На рис. 658 приводится диаграмма Муана и Сомия [6 J, пока-
зывающая изменения межплоскостных расстояний в зависимости
от состава для (440)-отражения у шпинельных твердых растворов,
в сопоставлении с данными ряда других исследователей.
Литература
1. Butler S. В.А study of the variations in the valence and distribu-
tion of iron and manganese and their effect on the magnetization and
crystal structure of manganese ferrite. Ph. D. dissertation, The Pensil-
vania State University, 1960.
Ферритные системы
713
2. М a s о п В., Geologiska Forenigens, Stockholm Forh., 65, № 2, 97, 1943.
3. M с M u r d i e H. F., В. M. S u 11 i v a n, F. A. M a u e r, Journ.
Res. Nat. Bur. Stand., 45, № 1, 35, 1950.
4. M о n t о г о V., Gazz. chim. Ital., 68, 728, 1938.
5. M u a n A., S. S о m i у a, Amer. Mineralogist, 46, № 3—4, 364, 1961.
6. Muan A., S. Somiya, Amer. Journ. Sci., 260, № 3, 230, 1962.
7. V a n Hook H. J., M. L. К e i t h, Amer. Mineralogist, 43, № 1—2,
69, 1958.
8. Verwey E. J., M. S. V a n В r u g g e n, Zs. Kristallogr., 92, № 1/2,
136, 1935.
CoO—Fe2O3
Имеет значение как частная система, входящая в состав более
сложных систем, образующих ферромагнитные керамические ма-
териалы.
Изучена Тороповым, Порай-Кошицем и Борисенко [1 J. Опре-
деленно установлено существование одного соединения — феррита
кобальта СоО -Fe2O3. Между СоО -FejOg и Fe2O3 образуются твер-
дые растворы в пределах от 68.06 до 84.20 вес. % Fe2O3. Это соот-
ветствует фазовой области, лежащей между СоО • Fe2O3 и
2СоО -5Fe2O3. Последний состав, однако, следует рассматривать не
как стехиометрическое химическое соединение, а как предельный
твердый раствор Fe2O3 в СоО >Fe2O3.
Система СоО—Fe2O3 является термически устойчивой вплоть
до температуры 1200°, когда начинается диссоциация окиси железа.
Параметр кристаллической решетки CoFe2O4 8.37 А. Вычислен-
ная плотность 5.34 г/см3. Для экспериментально определенной
плотности приводятся различные величины в пределах 5.19—
5.5 г/см8.
Литература
1. Т о р о п о в, Н. А., Е. А. Порай-Кошиц, А. И. Борисенко,
ДАН СССР, 66, № 5, 905, 1949.
Со304—Fe2O3
Имеет значение для технологии магнитно-керамических мате-
риалов.
Изучена рентгенографически в низкотемпературной области
Робеном и Бенаром [2]. Выше 1000° вследствие диссоциации Со3О4
равновесие в системе более точно описывается фазовыми соотно-
шениями в системе СоО—Fe2O3[l 1. В пределах до 400° наблюдается
образование непрерывного ряда однородных, но метастабильных
714
Ферритные системы
твердых растворов со структурой шпинели (рис. 659). При более
высоких температурах происходит распад однородных твердых
Рис. 659. Диаграмма состоя-
ния системы Со3О4—Fe2O3
в области низких температур.
I — а-РеаОа-|-шпинель; II —
смесь двух твердых растворов
со структурой шпинели; III —
шпинель; IV — шпинель+фаза
типа СоО; V — фаза типа СоО;
VI — метастабильные твердые
растворы со структурой шпинели.
растворов с образованием двух типов твердых растворов также
со структурой шпинели. О характере структурных различий этих
твердых растворов авторы сведений не приводят.
Литература
1. Торопов Н. А., Е. А. Порай-Кошиц, А. И. Борисенко,
ДАН СССР, 66, № 5, 905, 1949.
2. Robin J., J. В enard, Compt. rend., 234, № 7, 734, 1952.
NjO—Fe2O3
Представляет частную систему, входящую в состав более слож-
ных многокомпонентных ферритных систем, используемых для
получения магнитной керамики.
Изучена Тороповым и Борисенко [1 ]. Единственное соединение
в системе — феррит никеля NiO-Fe2O3 — подобно ферриту магния
и ряду других ферритов двухвалентных элементов имеет шпинель-
ную структуру.
Между ферритом никеля NiFe2O4 и окисью железа f-Fe2O3
наблюдается образование твердых растворов ограниченной кон-
центрации в пределах 68.13—76.23 вес. % Fe2O3. При увеличении
содержания окиси железа наблюдается выделение кристаллов
Ферритные системы
715
a-Fe2O3 (гематит). Избыточная против стехиометрии NiO : Fe2O3=
=4 : 1 закись никеля не образует твердого раствора с ферритом.
Система NiO—Fe2O3 является устойчивой в отношении терми-
ческой диссоциации окиси железа вплоть до 1200°. Параметр кри-
сталлической решетки NiFe2O4 а=8.43 А. Плотность измеренная
5.165 г/см8, вычисленная 5.24 г/см8.
Касседан [3] изучила субсолидусные отношения в системе на
образцах, полученных совместным осаждением гидратов окислов,
подвергавшихся в дальнейшем нагреванию в температурном интер-
Рис. 661. Данные исследования
образования феррита никеля, по-
лученные из магнитных измерений.
А—данные Экономоса[4], длительность
выдержки 24 часа; В — данные Эко-
номоса и Клевенжера [5], 8 час.; С —
данные Блюма и Ли [21 5 час.; D —
данные Клайнерта [6], без выдержки;
Е — данные Клайнерта [6], 3 часа.
Рис. 660. Приближенная диаграм-
ма состояния системы NiO—Fe2O3
(по Касседан).
вале 800—1550° (24 часа). Фазы
идентифицировались рентгенов-
ским методом. Результатысведе-
ны в фазовую диаграмму, пред-
ставленную на рис. 660. При температурах выше 1380° a-Fe2O3
переходит в Fe3O4, что не позволяет считать эту систему строго би-
нарной. Магнетит образует твердые растворы с ферритом никеля
Fe2NiO4. Эти твердые растворы, обладающие структурой шпинели,
устойчивы только при повышенных температурах. Касседан для
температуры плавления NiFe2O4 принимает 1650°.
За последние годы выполнены исследования процесса образова-
ния феррита никеля. На рис. 661 представлены данные ряда авто-
ров, причем на оси ординат отложена величина магнитного насы-
щения
[2, 4-6].
716 Ферритные системы
Литература
1. Торопов Н. А., А. И. Борисенко, ДАН СССР, 63, № 6, 705,
1948.
2. В 1 u m S. L., Р. С. L i, Journ. Amer. Ceram. Soc., 44, № 12, 611, 1961.
3. C a s s e d a n n e J., C. Anais. Ac. Brasil, cienc, 36, № 1, 13, 1964.
4. Economos G., Journ. Amer. Ceram. Soc., 42, № 12, 628, 1959.
5. Economos G., T. R. Clevenger, Journ. Amer. Ceram. Soc.,
43, № 1, 48, 1960.
6. Kleinert P., Monatsber. Dtsch. Akad. Wissensch. Berlin, 5, № 2, 99,
1963.
CJH С Т Е М Ы,
СОДЕРЖАЩИЕ ДВУОКИСЬ ИРИДИЯ
Y2O8—1гО2
Изучалась Шнейдером с сотрудниками [1 ], получено соединение
(обжигом смеси окислов при 1000°) Y2O3.2IrQ2 типа пирохлора
с параметром элементарной ячейки а=10.177 А. Обнаружена еще
одна фаза, состав которой не был установлен. Соединение
Y2O3 >21гО2 диссоциирует при 1220°, образуя Y2O3, иридий и кисло-
род.
Литератур а
1. S с h n е i d е г S. J., J. L. W а г i n g, R. Е. Т г е s s 1 е г, Journ. Res.
Nat. Bur. Stand., 69A, № 3, 245, 1965.
Nd2O3—lrO2
Система изучена методом закалки Шнейдером, Уорингом и
Тресслером [1 ], результаты представлены на рис. 662. Смеси окис-
лов предварительно (19 час.) обжигались при 800—1000°. При^тер-
мической выдержке смеси помещались в трубку из «викора»
(кремнеземистый материал) или в иридиевый тигель (для 2000°).
Системы двуокиси иридия с А12О3, Sc2O3, In2O3, Er2O3, Tu2O3,
Yb2O3 и Lu2O3 исследовались по этой же методике. Установлено
образование двух соединений: 3Nd2O3-2IrO2 и Nd2O3.21гО2. Эти
соединения устойчивы соответственно до 1300 и 1190°. В резуль-
тате разложения этих соединений при указанных температурах
образуются Nd2O3, металлический иридий и выделяется кислород.
Чистый 1гО2 на воздухе при атмосферном давлении диссоциирует
на металлический иридий и кислород. 3Nd2O3-2IrO2 при 1195°
718
Системы, содержащие двуокись иридия
имеет полиморфное превращение. Соединение Nd2O3-2IrO2 отно-
сится к семейству пирохлоров с гранецентрированной кубической
симметрией с параметром элементарной ячейки а=10.383 А.
Рис. 662. Схематическая диаграмма состояния систем
Nd2O3—1гО2 и Nd2O3— Ir на воздухе.
Литература
1. S с h n е i d е г S. J., J. L. W а г i n g, R. Е. Т г е s s 1 е г, Journ.
Res. Nat. Bur. Stand., 69A, № 3, 245, 1965.
Sm2O3—IrO2
Изучалась Шнейдером с сотрудниками [1 ]. Получено (обжигом
смесей окислов при 1000°) соединение Sm2O3-2IrO2 типа пирохлора
с параметром элементарной ячейки а=10.313 А и вторая фаза,
состав которой не установлен; возможно, это 3Sm2O3>IrO2. Соеди-
нение Sm2O3>2IrO2 диссоциирует при 1210°.
Литература
1. Schneider S. J., J. L. W а г i n g, R. Е. Т г е s s 1 е г, Journ. Res.
Nat. Bur. Stand., 69A, № 3, 245, 1965.
Системы, содержащие двуокись иридия
719
Еи2О3—IrO2
Изучалась Шнейдером с сотрудниками [1 ]. Обжигом смесей
окислов при 1000° получено соединение Eu2O3-2IrO2 типа пиро-
хлора с параметром элементарной ячейки а=10.293 А, диссоции-
рующее на Еи2О3, иридий и кислород при 1220°. Кроме того, обна-
ружено еще одно соединение, состав которого определить не уда-
лось.
Литература
1. S с h n е i d е г S. J., J. L. W а г i n g, В. Е. Т г е s s 1 е г, Journ.
Res. Nat. Bur. Stand., 69A, № 3, 245, 1965.
Gd2O3—IrO2
Изучалась Шнейдером с сотрудниками [1 ] обжигом смеси окис-
елов при 1000°. Получено одно соединение Gd2O3-2IrO2 типа пиро-
хлора с параметром элементарной ячейки а=10.265 А. При 1240°
это соединение диссоциирует, образуя две твердые фазы — Gd2O3
и металлический иридий — и кислород.
Литература
1. Schneider S. L., J. L. W а г i n g, R. Е. Т г е s s 1 е г, Journ. Res.
Nat. Bur. Stand., 69A, № 3, 245, 1965.
ВУгОз—Ir02
Изучалась Шнейдером с сотрудниками [1 ]. Обжигом смеси
окислов при 1000° получено соединение Dy2O3-2IrO2 типа пиро-
хлора с параметром элементарной ячейки а=10.207 А. Обнаружена
еще одна фаза, состав которой установить не удалось. Dy2O3-2lrO2
диссоциирует на Dy2O3, Ir и кислород при 1250°.
Литература
1. S с h n е i d е г S. J., J. L. W а г i n g, R. Е. Т г е s s 1 е г, Joum. Res.
Nat. Bur. Stand., 69A, № 3, 245, 1965.
720
Системы, содержащие двуокись иридия
Но2О3—1гО2
Изучалась Шнейдером с сотрудниками [1 ]. Получено (обжигом
смесей окислов при 1000°) соединение Но2О3-21гО2 типа пирохлора
с параметром элементарной ячейки а=10.180 А, диссоциирующее
при 1225° на Но2О3, 1г и кислород.
Литература
1. S с h n е i d е г S. J., J. L. W а г i n g, R. Е. Т г е s s 1 е г, Journ. Res.
Nat. Bur. Stand., 69A, № 3, 245, 1965.
Er2O3—IrO2
Изучена Шнейдером с сотрудниками [1], обжигавшими смеси
окислов с последующей закалкой. Установлено образование соеди-
°C
2000 -
1000
Ь,203*11'
1220°
1:2*1г —
Ег,0.*1:2
1;2*IrOz---------
1020
1г
0 20 «7 60\ 80 100
£гг°3 Моя.?,'2 1г°г
Рис. 663. ^Схематическая фа-
зовая диаграмма системы
Ег2О3— 1гО2 на воздухе.
нения Ег2О3 -21гО2, диссоциирующего на Ег2О3, металлический ири-
дий и кислород при 1220° (рис. 663). Соединение относится к типу
пирохлора и имеет параметр элементарной ячейки a=10.163 А.
Литература
1. Schneider S. J., J. L. W а г i n g, R. Е. Т г е s s 1 е г, Journ. Res.
Nat. Bur. Stand., 694, № 3, 245, 1965.
Системы, содержащие двуокись иридия
721
Ти2О3—1гО2
Изучена Шнейдером с сотрудниками [1 ] обжигом смеси окислов
при 1000°. Получено соединение Ти2О -21гО2 типа пирохлора с пара-
Рис. 664. Схематическая фазо-
вая диаграмма системы
Tu2Oj— 1гО2 на воздухе.
2000\- Ти203*1г
______1210°
1-2 *1? ~|=5
Ти20,*1:2
< 1-2*1г02~
20 40 50'
1000
1020
1г
0 .
Ти^03
.. „ 80 100
Л 2 1г 0,
Мол7. 2
метром элементарной ячейки а=10.134 А и диссоциирующее при
1210° на Ти2О3, иридий и кислород (рис. 664).
Литература
1. Schneider S. J., J. L. W а г i n g, R. Е. Т г е s s 1 е г, Journ.
Res. Nat. Bur. Stand., 69A, № 3, 245, 1965.
¥Ь20з—IrO2
Изучена Шнейдером с сотрудниками [1 ] обжигом смеси окислов
при 1000°. Получено одно соединение Yb2O3-2lrO2 типа пирохлора
°C
2000
Vb203*Ir
_________1185°
ЮООГ 1:2*1г-\=^
УЬ,0,*1:2
1-.2Щ —
1020
1г
0 20 М 60\ 80 100
Мол.%'г 1г02
Рис. 665. Схематическая фазо-
вая диаграмма системы
Yb2O3— IrO2 на воздухе.
с параметром элементарной ячейки а=10.115 А, диссоциирующее
при 1185° на Yb2O2, иридий и кислород (рис. 665).
Литератур а
1. Schneider S. J., J. L. W а г i n g, R. Е. Т г е s s 1 е г, Journ. Res.
Nat. Bur. Stand., 69A, № 3, 245, 1965.
46 H. А. Торопов и др., кн. 1
722
Системы, содержащие двуокись иридия
1л12Оз—“1гО2
Изучена Шнейдером с сотрудниками [1 ]. Обжигом смеси окис-
лов при 1000° получено одно соединение Lu2O3-2lrOa типа пиро-
°С
2000
1000
Lu203+Ir
0 20 ЦО 60 \ 80 100
Lu203 Мол.% « 1г0г
Рис. 666. Схематическая фа-
зовая диаграмма системы
LU2O3—1гО2 на воздухе.
хлора с параметром элементарной ячейки а=10.096 А, диссоции-
рующее при 1165° на LuaO3, 1г и кислород (рис. 666).
Литература
1. Schneider S. J., J. L. W а г i n g, R. S. Т г е s s 1 е г, Journ. Res.
Nat. Bur. Stand., 69A, № 3, 245, 1965.
Сг2О3—IrO2
Мак-Даниель и Шнейдер [1 ] помещали смеси Сг2О3 и 1гО2 в пла-
тиновую трубку, которая запаивалась. Образующиеся фазыопре-
°С
Рис. 667. Схематическая фазовая диаграмма системы
Cr?Oa—1гОа на воздухе.
Системы, содержащие двуокись иридия
723
делились после закалки от различных температур (до 2100°).
Обнаружено образование твердого раствора на основе 1гО2.
Чистый 1гО2 диссоциирует (с образованием металлического иридия)
при 1020°; 1гО2 т. р. диссоциирует при 1040°. Фазовая диаграмма
представлена на рис. 667. Предельная концентрация Сг2О3 в твер-
дом растворе равна 21 мол. %.
Литература
1. McDaniel С. L., S. i. Schneider, Joum.' Amer. Ceram. Soc.
49, № 5, 285, 1966.
СИСТЕМЫ,
СОДЕРЖАЩИЕ ДВУОКИСЬ ПЛУТОНИЯ
MgO—PuO2
Имеет значение для технологии ядерного горючего.
Изучена Кэрроллом [1 ]. Твердых растворов и химических
соединений не обнаружено, и система должна быть отнесена к про-
°С
3000
2500
2000
1500
1000
500
Жидк.
РиОг.х+Ж
MgO+Ж
РиОг.х+МдО
О 20 W 60 80 100 Рис. ®®8’ Диаграмма состоя-
РиОг.х Мол.% MgO ния системы MgO—PuO2.
стым эвтектическим (рис. 668). РиО2 легко теряет кислород и дает
нестехиометрический окисел, поэтому на рис. 668 принято обо-
значение РиО2_х, где 0 х 0.1. Эвтектика содержит 43 мол. %
MgO и плавится при 1985 + 35°.
Литератур а
1. С а г г о 11 D. F., Journ. Amer. Ceram. Soc., 47, № 12, 650, 1964.
Системы, содержащие двуокись плутония
125
СеО2—РпО2
Мэлфорд и Еллингер [1 ] изучали зависимость параметра ре-
шетки от состава непрерывных твердых растворов; результаты их
исследований показаны на рис. 669 и в таблице.
Параметры решетки твердых растворов СеО2—РиО2
Содержание PuO2, мол. % Параметр элементарной ячейки при 25°, А Содержание РиО2> мол. % Параметр элементарной ячейки при 25°, А
0 5.4112±0.0003 65.0 5.4000 ±0.0005
15.0 5.4083 ±0.0003 85.0 5.3976 ±0.0005
38.4 5.4054 ±0.0004 100 5.3960±0.0003
50.0 5.4040 ±0.0005
Все образцы дали по рентгеновским порошкограммам одну фазу
с флюоритовой структурой, за исключением одного образца
Рис. 669. Параметр кристал-
лической решетки твердых рас-
творов в системе СеО2—PuOg.
5.36 L—-L-
о го
СеО.
по2
~60 60 80 100
Риог
Мол. %
(85% CeOjj), на порошкограмме которого присутствовала добавоч-
ная неидентифицируемая линия.
Названные авторы отмечают, что, хотя химия урана и плуто-
ния не всегда идентична, но в случае образования непрерывных
твердых растворов ThO2 и СеО2 с UO2 проявляется сходство.
Литература
1. Mulford R. N. R., F. Н. Е 11 i n g е г, Journ. Phys. Chem., 62, № 11,
1466, 1958.
726
Системы, содержащие двуокись плутония
Еи2Оя—РиО2
Система изучена Хаугом и Вайгелем [1 ] в субсолидусной об-
ласти на образцах, обжигавшихся при 1100°. Образующиеся фазы
характеризовались рентгенографически. До содержания 42 мол. %
ЕиОх 6 образуется фаза типа флюорита, параметр кристаллической
решетки которой при 0—15 мол. % EuOx s остается постоянным и
равным параметру решетки РиО2. Резкий перегиб величины пара-
метра решетки при 15 мол. % ЕиО16 связан с окислением плуто-
ния, валентность которого становится выше четырех. Фаза типа
флюорита, наблюдаемая в области, превышающей 42 мол. % EuOl s,
имеет сильно дефектную кристаллическую решетку. При содер-
жании ЕпО15, превышающем 60 мол. %, имеет место переход
к структуре типа С, характерной для окислов редкоземельных эле-
ментов.
Литература
1. Haug Н., F. W е i g е 1, Journ. Nucl. Mater., 9, № 3, 360, 1963.
ZrO2—PuO2
Интересна в отношении получения в пределах системы потен-
циального ядерного топлива.
Изучалась Кэрроллом [1], предложившим диаграмму фазового
равновесия системы (рис. 670). Существует фаза кубического гране-
Шг
Рис. 670. Диаграммы состоя-
ния системы ZrO2—PuO2.
центрированного твердого раствора в пределах от чистого РиО2
до 77 мол. % ZrO2. Участок от 77 до 99.8 мол. % ZrO2 содержит
две фазы, находящиеся в равновесии при комнатной температуре:
Системы, содержащие деуокцсъ плутония
727
1) моноклинная ZrO2; 2) гранецентрированный кубический твер-
дый раствор РиО2 — 77 мол. % ZrO2. При высоких температурах
существуют непрерывные кубические твердые растворы.
Литература
1. Carroll D. F., Journ. Amer. Ceram. Soc., 46, № 4, 194, 1963.
Th О 2—PuO2
Даусон [1 ] измерил магнитные свойства образцов системы
ThO2—PuO2 и установил, что образующийся твердый раствор под-
чиняется закону Вегарда.
Параметры решетки твердых растворов ThO2—PuO2
Содержание РиО2, мол. % Параметр элементарной ячейки при 25°, А Содержание РиО,, мол. % Параметр элементарной ячейки при 25°, А.
0 5.598 +0.001 46.7 5.502 ±0.001
15.0 5.568 +0.004 63.5 5.4693 ±0.0004
26.0 5.5462 ±0.0004 82.5 5.428 ±0.001
36.9 5.526±0.001 100.0 5.3960 ±0.0003
Мэлфордом и Еллингером [2] система изучена в отношении
зависимости постоянной решетки от свойств непрерывных твердых
растворов, обладающих флюоритовым типом структуры. Их
данные представлены на рис. 669 (см. описание системы СеО2—
—РиО2) и в таблице.
Литература
1. Dawson J. К., Journ. Chem. Soc., June, 1882, 1952.
2. Mui ford R. N. R., F. H. E 11 i n g e r, Journ. Phys. Chem., 62, Ks 11,
1466, 1958.
UO2—PuO2
Интересна с точки зрения процессов, происходящих в ядерных
реакторах (ядерное топливо).
Мэлфорд и Еллингер [3] определили параметры решетки
твердых растворов, имеющих флюоритовый тип структуры. Чи-
728
Системы, содержащие двуокись плутония
калла [2] изучил плавление смесей в системе U02—PuO2, а Брэтт
и Рассел [1 ] исследовали спекаемость в различных условиях и ста-
о бильность при плавлении в аргоне
Рис. 671. Кривые ликвидуса и
солидуса твердых растворов си-
стемы UO2—РиО2 (по Чикалла).
1 — экспериментальная кривая; г —
теоретически вычисленные.
смесей серии (PuU)O2.
По Чикалла,точка плавления
в атмосфере гелия для UO2
2730+30°, а для РиО2 2280+30°.
РиО2 при плавлении и закалке
в атмосфере гелия не восстанав-
ливается до закиси; она, однако,
выделяет кислород с расширением
при этом решетки. Диссоциация
РиО2 дает окисел с атомным отно-
шением О : Ри, равным 1.62. Та^
ким образом, 2280° не является
истинной температурой плавления
РиО2, которую надо определять
под парциальным давлением кис-
лорода.
На рис. 671 дается экспериментальная кривая ликвидуса
(сплошная кривая твердых растворов UO2—PuO21 обозначенных а),
Рис. 673. Параметры кристалли-
ческой решетки твердых раство-
ров системы UO2—РиО2 (по Брэт-
ту и Расселу; спекание в аргоне).
Рис. 672. Параметры кристалличе-
ской решетки твердых растворов
системы UO2—РиО2 (по Чикалла) t
1 — экспериментальные данные; 2 —
вычисленные по правилу Вегарда.
по Чикалла, в сопоставлении с теоретически вычисленными кри-
выми ликвидуса и солидуса. На экспериментальной кривой имеется
Системы, содержащие двуокись плутония
729
максимум при 2825° и 90 вес. % UO2—10% PuO2. На рис. 672
приводится по Чикалла изменение параметров решетки твердых
растворов UO2—РиО2 в зависимости от их состава.
По Брэтту и Расселу, максимальная плотность спеков в во-
дороде получается примерно при 800° для богатых UO2 порошко-
вых проб и около 400° для богатых РиО2 проб. Составы в пределах
от 0 до 20 мол. % РиО2 оставались однофазными в процессе водо-
Рис. 674. Параметры кристалличе- Рис. 675. Плотность образцов
ской решетки твердых растворов системы UO,—РиО2, спекавших-
системы UO2—РиО2 (плавка в дуге, ся при 1650° в различной атмо-
атмосфера аргона). сфере.
1 — двуокись углерода; 2 — водород;
з — аргон.
родного спекания в дуге, а составы с 40 мол. % РиО2 и более при
охлаждении превращались в двухфазную смесь, по-видимому,
из (PuU)O2 и твердых растворов UO2—РиОх в2.
На рис. 673 приводятся по Брэтту и Расселу параметры ре-
шетки в зависимости от состава твердых растворов UO2—PuO2,
спеченных в атмосфере аргона (3 часа) при 1400° (кружки) и 1650°
(крестики); образуется фаза с флюоритовой структурой (гране-
центрированная кубическая фаза); штриховая линия — линия,
вычисленная по правилу Вегарда. На рис. 674 — то же для смесей
серии (PuU)O2, полученных плавлением в дуге в атмосфере аргона.
Светлыми кружками показана гранецентрированная фаза — г. ц. к.,
а зачерненными кружками — объемноцентрированная фаза —
о. ц. к.; штриховые линии — то же, что на рис. 673; количество
присутствующих фаз (в %) указано около кружков.
На рис. 675 показано изменение плотности спеченных при 1650°
в течение 3 час. образцов серии (PuU)O2.
730
Системы, содержащие двуокись плутония
Литература
1. В г е 11 N. Н., L. Е. Russell, Trans. Brit. Ceram. Soc., 62, № 2,
97, 1963.
2. Chicalla T. D., Journ. Amer. Ceram. Soc., 46, № 7, 323, 1963.
3. M u 1 f о r d N. R., F. H. E 11 i n g e r, Journ. Amer. Chem. Soc., 80,
№ 8, 2023, 1958.
СИСТЕМЫ, СОДЕРЖАЩИЕ ВОДУ
Na2O— NaOH
Систему исследовали Родин и Рекапе [2] и Буази, Папэн и
Ролле [1]. Диаграмма состояния системы Na2O—NaOH, по Буази
с сотрудниками, представлена на рис. 676. Система относится к про-
стым эвтектическим. Эвтектика содержит 13.0+0.5 вес. % Na2O
Рис. 676. Диаграмма состоя-
ния системы Na2O—NaOH.
и плавится при 309°. Авторы обнаружили три модификации окиси
натрия. Указанная на рис. 676 температура плавления высокотем-
пературной модификации Na2O (1127°) относится к продукту,
содержащему перекись натрия. Чистая Na2O должна плавиться
при 1132+4°. В точках Lx и L2, характеризующих превращение
Na2O, содержание Na2O составляет соответственно 45.0 и
74.0 вес. %. Гидрат окиси натрия NaOH, плавящийся при 320.5°,
имеет полиморфное превращение при 297°.
132
Системы, содержащие воду
Литература
1. Bouaziz R., G. Р а р i n, А.-Р. R о 11 е t, Compt. rend., 262, ser. С,
№ 13, 1051, 1966.
2. R>o 1 i n M., J. M. R ecapet, Bull. Soc. chim France, № 9, 2110, 1964.
CdO—H2O
Исследовалась Дент-Глассер и Роем [1] до давлений 3000 бар
(рйс. 677). Cd(OH)2 получен в виде гексагональных кристаллов,
Рис. 677. Равновесная диаграмма
системы CdO—Н2О в координа-
тах «давление—температура».
одноосных, отрицательных, с показателями светопреломления
Nw=1.802 +0.004, 7Ve=1.7O и параметрами кристаллической ре-
шетки а—3.496, с=4.702 А.
Литература
1. Dent Glasser L. S., R.R о у, Journ. Inorg. Nucl. Chem., 17, № 1—2,
98, 1961.
A12O3—H2O
Существенна для расшифровки многих процессов переработки
глиноземистого сырья: бокситов, диаспоровых пород и т. д.
При обезвоживании гидратов окиси алюминия при атмосфер-
ном давлении точки взаимных превращений гидратов вследствие
аморфной или скрытокристаллической структуры получающихся
продуктов сильно варьируют в пределах до 200° [1 ]. Лучшие ре-
зультаты могут быть получены при применении гидротермального
метода, когда испытуемое вещество подвергается воздействию пере-
гретого пара в стальной бомбе.
Описаны следующие гидратные формы глинозема: гидрар-
гиллит (гиббсит) и байерит состава А12О3-ЗН2О, диаспор и
бёмит состава А12О3-Н2О и у-глинозем. Последний обычно со-
Характеристика гидратов окиси алюминия
Наименование и формула Кристалличе- ская система Простран- ственная группа Параметр элементарной ячейки, к Плот- ность, г/см3 Твердость Показатели преломления
Гидраргиллит (гиббсит) А12О3.ЗН2О. Моноклин- ная. P2j/c-qn а = 8.64, 6 = 5.07, > = 9.71, |3 = 85О26'. 2.42 2.5—3 Ng = 1.585—1.595, Nm = 1.554—1.581, Np = 1.554-1.568.
Гидраргиллит, изучен- ный Заальфельдом. Триклин- ная. — а = 17.33, 6 = 10.08, с = 9.73, а = 94°10', |3 = 92°08', 7 = 90’00'. — — —
Байерит А12О3-ЗН2О. Моноклин- ная. Р21/а~С2/т а = 5.06, 6 = 8.67, с = 4.71, р = 90°07'. 2.53 — Asti. 58
Бёмит; А12О3 • Н2О/ Ромбиче- ская. Cmrm—DV а = 2.85, 6 = 12.24, с = 3.69. 3.0—3.2 3.5—4.0 Ng = 1.665, Am = 1.659, Ap = 1.649.
Диаспор А12О3 • Н2О. То же. Phnm—£)je а = 4.40. 6 = 9.42, с = 2.84. 3.4 6.5—7 Ng= 1.750, Am = 1.722, Np = 1.702.
734
Системы, содержащие воду
держит весьма йезначительное (1—2°/0) количество Н2О, но неиз-
бежно превращается в корунд при удалении этой воды.
Курнаков и Уразов [3 ] получили кривую нагревания кристалли-
ческого искусственного гидрата глинозема А12О3-ЗН2О. Были
обнаружены остановки, отвечающие двум гидратным формам
глинозема, встречающимся в природе: трехводному гидрату —
гидраргиллиту — и одноводному — диаспору.
Согласно наблюдениям Лаубенгайера и Вейсса [5], в гидротер-
мальных условиях корунд является стабильной формой выше
Рис. 679. Диаграмма состояния системы
А1аО3— Н2О.
Рис. 678. Кривые устой-
чивости фаз -для систе-
мы А1аО3— Н.О.
450 +5° (рис. 678), у-глинозем в температурном интервале 10—
—500° является нестабильным, диаспор устойчив в пределах темпе-
ратур 450—280°. Бёмит устойчив между 155 и 280°, гиббсит и байе-
рит выше 155° будут нестабильны. Есть указание, что ниже 155°
байерит менее устойчив, чем гиббсит. По наблюдениям других
авторов, проведенным в условиях нормального давления, у-глино-
зем переходит в корунд выше 900°. Диаспор и бёмит неустойчивы
выше 400—500°, гиббсит и байерит разлагаются при температурах
от 120 до 200° с потерей двух молекул воды.
Изучение условий равновесного сосуществования отдельных
кристаллических фаз в системе А12О3—Н2О в гидротермальных
условиях было произведено Эрвином и Осборном [4]. Р—i-диа-
грамма состояния системы А12О3—Н2О приведена на рис. 679.
Синтетический диаспор был получен Дружининой [2] в сталь-
ной бомбе в щелочной и водной средах при температуре 315°
Системы, содержащие воду
735
при введении затравки из природного диаспора. В щелочной среде
у диаспора наблюдается образование граней, перпендикулярных
плоскостям спайности, в то время как в водной среде преимуще-
ственно развивались изометрические кристаллы.
Литература
1. Белянкин Д. С., Труды ИГН АН СССР, вып. 106, сер. петрограф.,
№ 30, 1, 1949.
2. Дружинина Н. К., ДАН СССР, 88, № 1, 133, 1953.
3. К у р н а к о в Н. С., Г. Г. У р а з о в, Журн. прикл. хим., 1, № 1, 13,
1924.
4. Erwin G., Е. F. О s Ь о г n, Journ. Geology, 59, № 4, 381, 1951.
5. Laubengayer A. W., R. S. Weiss, Journ. Amer. Chem. Soc.,
65, № 2, 250, 1943.
In2O3—H2O
Рой и Шефер [1 ] определили фазовые равновесные отношения
в системе гидротермальным методом, в статических условиях, в тем-
пературной области 25 —800°, при давлении 500—20 000 р. s. i.
Рис. 680. Диаграмма «давле-
ние-температура» для си-
стемы 1п2О3^Н2О.
1 — 1п(ОН),; 2 — InOOH; 3 —
In2Os; 4 — In(OH),+InOOH; 5 —
InOOH+InjO,.
На рис. 680 приведены равновесные кривые для двух реакций:
In(OH)3=InOOH+H2O и 21пООН = 1п2О3+Н2О.
Соединение InOOH обнаружено Роем и Шефером впервые.
Лит ератур а
1. Roy R., М. W. Shafer, Journ. Phys. Chem., 58, № 4, 372, 1954.
736
Системы, содержащие воду
Sc2O^-HaO
Шефер и Рой [2 ] изучали систему в гидротермальных условиях
(давление до 1000 кг/см8, температура до 600°). Авторы принимают
стабильными фазы ScO(OH) и Sc2O3. Структура соединения
1000
800
Д воо
Ш
200
100
ЗсОфН)
100 300 500 °C
+ 2 03
14
12
10
8
6
4
г
Рис. 681. Диаграмма «давление—
—температура» для системы
ScaOg—Н2О.
1 — ScO(OH); 2 — Sc,О,; 3 — ScO(OH)+
+ SC2O,.
ScO(OH) относится к типу диаспора. Диаграмма «давление-
температура» для реакции 2ScO(OH)=Sc2O3+H2O приведена на
рис. 681.
Аузр-Вельсбах и Зайферт [1 ] получали f-ScOOH путем разло-
жения карбида ScC на воздухе. y-ScOOH имел структуру бёмита
со следующими параметрами решетки: а=4.007, Ь=13.016,
с=3.238 кХ.
Литература
1. Auer-Welsbach Н., К. Seifert, Monatschefte Chem., 93,
№ 5, 1110, 1962.
2. S h a f e r M. W., R. Roy, Zs. anorgan. allgem. Chem., 276, № 5—6,
275, 1954.
Y2O3-H2O
Система изучена Шефером и Роем [1 ] до давлений водяного
пара около 20 000 англ, фунт/кв. дюйм. Области устойчивости
гидратов У(ОН)3и YOOH и безводного окисла показаны на рис. 682.
Системы, содержащие воду
737
В условиях гидротермальной обработки Y2O3 имеет структуру
типа С, характерную для окислов редкоземельных элементов.
Рис. 682. Равновесная диаграмма
системы Y2O3—Н2Ов координатах
«давление—темпер атура».
Кристаллы Y(OH)3 имеют показатели светопреломления Ne=
=1.714+0.003, Nw=i.676 +0.003, а кристаллы YOOH —
N=l.845 ±0.008.
Литература
1. Shafer М. W., R. Roy, Journ. Amer. Ceram. Soc., 42, № 11, 563,
1959.
La 2O3—H2O
Система изучена Шефером и Роем [1 ] до давлений водяного пара
около 25 000 англ, фунт/кв. дюйм. Вследствие экспериментальных
трудностей, связанных с чрезвычайно большим сродством окиси
О 200 МО 600 000°0
Рис. 683. Предполагаемая диа-
грамма системы La2Og—Н2О
в координатах «давление—тем-
пература».
лантана к воде, авторы смогли построить лишь ориентировочную
диаграмму системы La2O3—Н2О (рис. 683). В отличие от систем с
Nd2O3 и Sm2O3 в рассматриваемой системе не фигурирует гидро-
окись LaOOH.
47 Н. А. Торопов и др., кн. 1
738
Системы, содержащие воду
Кристаллы La(OH)3 одноосные, положительные, имеют пока-
затели преломления Ne=1.768 +0.005 и Ло)=1.740 ±0.005. Гидрат,
существующий при высоких давлениях, имеет 7У=1.760+0.015.
Литература
1. S h a f е г М. W., R. Roy, Journ. Amer, Ceram. Soc., 42, № 11, 563,
1959.
Nd2O3—H2O
Система изучена Шефером и Роем [1 ] до давлений водяного
пара около 25 000 англ, фунт/кв. дюйм. Равновесная диаграмма
в координатах «давление—температура» представлена на рис. 684.
Авторы получили новую, существующую при давлениях выше
Рис. 684. Равновесная диа-
грамма системы Nd2O3—Н2О
в координатах «давление—тем-
пература».
2000 англ, фунт/кв. дюйм фазу, представляющую, по-видимому,
особую^плотную разновидность Nd(OH)3.
Кристаллы Nd(OH)3 одноосные, положительные, имеют ^пока-
затели преломления1' JVe=l.768 +0.005, Nw=i.740+0.005;« кри-
сталлы NdOOH имеют N=l.850 +0.08, и кристаллы новой, суще-
ствующей при высоких давлениях фазы имеют N=l.78+0.02.
Литература
1. Shafer М. W., R. Roy, Journ. Amer. Ceram. Soc., 42, № 11, 563,
1959.
Sm2O3—H2O
Система изучена Шефером и Роем [1 ] до давлений водяного
пара около 25 000 англ, фунт/кв. дюйм. Равновесная диаграмма
в координатах «давление—температура» представлена на рис. 685.
Системы, содержащие воду
739
Кроме гидратов Sm(OH)3 и SmOOH, автора обнаружили новую
фазу, существующую при высоких давлениях (выше 9000 фунт/кв.
дюйм), состав которой им определить не удалось. На основании
определения потери веса при прокаливании указывается пример-
ная формула Sm2O3>3.6H2O.
Рис. 685. Равновесная диа-
грамма системы SmaOs—Н2О
в координатах «давление—тем-
пература».
Кристаллы Sm(0H)3 одноосные, положительные, имеют пока-
затели светопреломления Ле=1.768 +0.005, Nw=i.740 +0.005.
Кристаллы SmOOH имеют N=1.860 +0.008. Новый гидрат, су-
ществующий при высоких давлениях, имеет показатель преломле-
ния N=1.780 +0.015.
Лит ератур а
1. Shafer М. W., R.
1959.
Roy, Journ. Amer. Ceram. Soc., 42, № 11, 563,
Cr2O3—H2O
Шефер и Рой [2] изучали зту систему, доводя давление
до 1000 кг/см2 и температуру до 600е. Эти авторы принимают сле-
дующие стабильные фазы в системе: Сг2О3, СгО(ОН) и Сг(ОН)3.
Диаграммы «давление—температура» для реакций Сг(ОН)3=
=СгО(ОН)+Н2О и 2СгО(ОН)=Сг2О3+Н2О приведены на рис. 686.
Более ранние исследования системы принадлежат Лаубен-
гайеру и Мак-Кьюну [1].
47*
740
Системы, содержащие воду
£
1000
+ +
800
+
СгО(ОН)
< ЧОО
200
100\-л1
600 - л
-1W00
- 10000
- 6000
2000
0 100 200 300 ЧОО 500 и
Л1 +г °3 *4
Рис. 686. Диаграмма «давление—температура»
для системы Сг2О3—Н2О.
1 — Сг(ОН),; 2 — СгО(ОН); 3 — 0,0,; 4 — в образцах
обнаруживается «у-Сг,О,» или кубическая окись хрома.
Литература
1. Laubengayer A. W., Н. McCune, Joum. Amer. Chem. Soc.,
74, № 9, 2362, 1952.
2. S h a f e г M. W., R. Roy, Zs. anorgan. allgem. Chem., 276, № 5—6,
275, 1954.
MnO—H20 и Mn2O3—H20
Клингсберг и Рой [1 ] изучили равновесие пирохроит—манга-
нозит, т. е. реакцию Мп(ОН)2=МпО+Н2О до давления паров воды
Рис. 687. Диаграмма «давление—температура» для системы
МпО—Н20.
i — Мп(ОН),; 2 — МпО; 3 — Мп,О, • Н,0; 4 — Мп,О,.
Системы, содержащие воду
741
45 000 р. s. i. и температуры 450° (рис. 687, а). Эти же авторы изу-
чали равновесие манганит—биксбиит, т. е. реакцию 2Мп00Н =
=Мп2О3+Н2О (рис. 687, б).
Литература
1. Kli'ngsberg С., R. Roy, Amer. Mineralogist, 44, № 7—8, 819,
1959.
СИСТЕМЫ ОКИСЛОВ С ФТОРИДАМИ
И ДРУГИМИ БИНАРНЫМИ
СОЕДИНЕНИЯМИ
MgO—MgF8
Систему изучили Берак и Томшак [1]. Из рис. 688 видно, что
система относится к простым эвтектическим. Эвтектика содержит
Рис. 688. Фазовая диаграмма
системы MgO—MgFa (по Бе-
раку иТомчак).
8 мол. % (5.3 вес. %) MgF2 и плавится при 1226°. MgF2 при 848°
испытывает полиморфное превращение.
Литература
1, В era k J., I. Totnczak, Roczn. Chem., 39, № 4, 519, 1965.
Системы окислов с фторидами и другими бинарными соединениями 743
MgO—CaF2
Имеет значение для технологии получения огнеупорных мате'
риалов. Изучалась Бережным [1 ]
Рис. 689. Диаграмма плав-
кости системы MgO—CaFa.
Будниковым и Тресвятским [2].
Диаграмма плавкости, по-
строенная методом деформа-
ции конусов, по данным Буд-
никова и Тресвятского при-
ведена на рис. 689, а линии лик-
видуса и солидуса на рис. 690.
Рис. 690. Линии лик-
видуса и солидуса систе-
мы MgO—CaF2.
В системе существует эвтектика при 18 мол. % MgO и 82 мол. %
CaF2 с температурой плавления 1350°.
Литература
1. Бережной А. С., ДАН УССР, № 4, 248, 1951.
2. Будников П. П., С. Г, Тресвятский, Укр. хим, журн.,
19, № 5, 552, 1953.
СаО—CaF 2
Имеет значение для анализа процессов, протекающих в основ-
ных шлаках и цементных клинкерах, при условиях добавок пла-
викового шпата.
Исследовалась Эйтелем [2], а позже Будниковым и Тресвят-
ским [1 ]. Последние авторы пользовались методом деформации
конусов и методом кривых нагревания до 1500° (рис. 691).
744 Системы окислов с фторидами и другими бинарными соединениями
Будников и Тресвятский значительно уточнили данные Эйтеля
для’линии ликвидуса составов, лежащих между СаО и эвтектикой.
По их определениям, эвтектика
имеет состав 23.5 мол. % СаО и
76.5% CaF2 и температуру 1360°.
На рис. 692 представлены общие
результаты исследования системы.
Рис. 691. Диаграмма плавко-
сти системы СаО—CaF2.
1 — по данным Будникова и Тре-
святского; г — по данным Эйтеля.
Рис. 692. Линии ликвидуса и соли-
дуса системы СаО—CaF2.
Согласно Макержи [3], эвтектика в системе содержит
80.5 вес. % CaF2 и плавится при температуре 1419+1° (рис. 693).
Макержи не обнаружил расслаивания расплава.
Рис. 693. Диаграмма состоя-
ния системы СаО—CaF2
(по Макержи).
Системы окислов с фторидами и другими бинарными соединениями 745
Литература
1, Будников П. П., С. Г. Тресвятский, ДАН СССР, 89, № 3,
479, 1953.
2. Е i t е 1 W., Zement, 27, № 30, 455, 469, 1938.
3. М u k е г j i J., Journ. Amer. Ceram. Soc., 48, № 4, 210, 1965.
A12O3—NaF
Имеет значение при производстве окиси алюминия.
Система не может интерпретироваться как бинарная, так
как NaF реагирует с А12О3 согласно реакции 6NaF-j-2Al2O3=
=3NaA102+Na3AlFe. Изучена Фостером [1] до 10 вес. % А12О3
Рис. 694. Диаграмма
плавкости системы
А12О3— NaF.
Рис. 695. Тетраэдр четвер-
ной системы NaF—А12О3—
—Na2O—A1F3, показываю-
щий отдельные разрезы
более простых систем.
(рис. 694). При содержании А12О3 выше 5.4 вес. % появляется
₽-А12О3 вместо исходного а-А12О3, что свидетельствует о некоторой
растворимости А12О3 (или алюмината) в жидкости. Фостером рас-
сматривается также положение частного сечения NaF—А12О3
в более сложных Tpex-(NaF—А12О3—Na3AlFe) и четырехкомпо-
нентных (NaF—а-А12О3—Na2O—AIF3) системах (рис. 695).
Литература
1. Foster W. R., Journ. Amer. Ceram. Soc., 45, № 4, 145, 1962.
746 Системы, окислов с фторидами и другими бинарными соединениями
Д]2О3—CaF2
Имеет значение в технологии производства различных высоко-
глиноземистых материалов и металлического алюминия.
°C
2000
1800
ЖиЗк.
1000
Т.р.в+Ж//
7/
I Т.р. в
1Ш0
и
Т.р.А+Ж И
Т.р. А + Т.р. 8
1200'——I—*—j----1—
О 20 W 60
Cafz 8ес.%
80 100
А1г0,
Рис. 696. Диаграмма состояния си-
стемы А12О3—CaFa.
А — твердый раствор AltOa в CaF»;
В — твердый раствор CaFt в AltOt.
Изучена Паскалем [1 ]. Обнаружено образование твердых рас-
творов на основе CaF2 и А12О3. Твердые растворы на основе А12О3
охватывают очень широкую концентрационную область (рис. 696).
Литература
1. Р a s k а 1 Р., Zs. Elektrochem., 19, 610, 1913.
SiO2—CaF2
Изучена Гиллертом [1]. Охлажденные после термической вы-
держки образцы исследовались рентгенографически и под микро-
скопом. Система относится к простым эвтектическим (рис. 697).
Эвтектика, плавящаяся при 1240°, содержит 47 вес. % SiO2.
Наблюдается значительная область несмешивающихся жидкостей:
в концентрационной области между 57 вес. % CaF2 и 77 вес. % CaF?
и в пределах температур между 1420 и 1290°.
Системы окислов с фторидами и другими бинарными соединениями 747
В метастабильной области ниже 1230 и 1210° образуются соеди-
нения соответственно SiO2-2CaF2 и SiO2-CaF2 вместе со стеклооб-
°C
1700
1ZOO
1713
1600
1500
1400
1300
43%Sify+57% ВаГг
’ 47 % 310,+53% Oaf,
*_______________£
11001—
о
SiOg
14Z0
Ы.1+]Жи31у^
Жидк.2 /1330°
23%310^+77%СаК
, | 'StyCaR SiOg-ZCafg
20 40 50 80 100
Вее. % 2
1418
23%310г+77%СаК
Рис. 697. Диаграмма состояния системы
SiO2—CaF2.
разной фазой, состав которой лежит соответственно между
50 вес. % SiO2+50 вес. % CaF2 и 47 вес. % SiO2+53 вес. % CaF2.
Литература
1. Hille rt L., Acta chem. Stand., 18, № 10, 2411, 1964.
TiO2—CaF2
Изучена Хиллертом [1 ] методом закалки. Соединений в системе
не обнаружено. Характерна большая область расслаивания рас-
плава выше 1365°, распространяющаяся от состава 55 вес.%
TiO2+45 вес,% CaF2 до состава 6 вес.% Т1О2+94 вес.% CaF2
(рис. 698). Эвтектика при 1360° имеет состав 57 вес.% Ti02+
+43 вес.% CaF2.
748 Системы окислов с фторидами и другими бинарными соединениями
Рис. 698. Диаграмма состояния системы TiO2—CaF2.
Литература
1. Hillert L., Acta chem. Scand., 19, № 6, 1516, 1965.
Nb2O5—NbF5(NbO2F)
Диаграмма состояния системы не построена. Андерсон и
Астрём [2], проводя синтез при температурах до 800°, получили
два соединения: Nb3O,F и Nb5O12F.
Андерсон [1], осуществив обжиг до 1100°, обнаружил еще два
оксифторида ниобия: Nb31O77F и Nb17O42F, являющихся членами
гомологического ряда М3в+1Х8я_2 при п=10 и п=11. Астрём [3]
детально исследовал структуру этих соединений. Оба оксифторида
ниобия имеют моноклинную сингонию. Параметры элементарной
ячейки для Nb31O77F: а=37.54, Ь=3.832, с=21.18 А, {3=91.92°,
пространственная группа С2; для Nb17O42F: а=21.09, Ь=3.827,
с=23.02 А, ₽=116.22°.
Литература
1. Andersson S., Acta chem. Scand., 19, № 6, 1401, 1965.
2. Andersson S., A. Astro m, Acta chem. Scand., 18, № 10, 2233,
1964.
3. A s t r 6 m A., Acta chem. Scand., 20, № 4, 969, 1966.
Системы окислов с фторидами и другими бинарными соединениями 749
LiF—Nb2O5
Система исследовалась Лундбергом и Андерсоном [1 ] в запаян-
ных платиновых трубках в температурном интервале 800—1200°.
Были получены две фазы: состава LiNbeOuF и приближенного
состава LiF-10—12Nb2O6. Первое соединение было получено в виде
бесцветных монокристаллов ромбической симметриио с парамет-
рами элементарной ячейки: a=16.64, Ь=3.96, с=8.89 А; простран-
ственная группа Pmma\ плотность экспериментальная 4.62 г/см3,
вычисленная 4.67 г/см3. Начиная от 900° происходит терми-
ческая диссоциация LiNbeO16F в соответствии с уравнением:
3LiNbeO15F=NbOF3t-3LiNb3Ost-4Nb2O5.
Соединение LiF-10Nb2O5 имеет структуру, близкую к пяти-
окиси ниобия в JV-форме. 7V-Nb2O6 впервые была синтезирована
Шефером с сотрудниками [2].
Литература
1. Lundberg М., S. Andersson, Acta chem. Scand., 19, № 6,
1376, 1965.
2. Schafer H., F. Schulte, R. Gruehn, Angew. Chem., 76,
№ 12, 536, 1964.
A12O3—-A14C3
Систему изучили
образование двух
Фостер, Лонг и Хантер [1]. Установлено
оксикарбидов: 4А18О3 • А14С3=А14О4С и
°C
Рис. 699. Диаграмма
состояния системы
AlgOj—AI4C3.
750 Системы окислов с фторидами и другими бинарными соединениями
А12О3 • А14С3=А12ОС^ (рис. 699). Глинозем кристаллизуется не
в виде a-модификации, а образует-кристаллы 8-А12О3.
. Оксикарбид А14О4Слобразует кристаллы, относящиеся к ром-
бической'сингонии,_с параметрами элементарной ячейки, содержа-
щей две формульные единицы А14О4С : а=9.23, Ь=8.64, с=
=5.П а. и., 7=460 (а. и.).8 Оксикарбид А12ОС образует гекса-
гональные кристаллы с параметрами элементарной ячейки: а=3.19,
с=5.09 а. и.; вычисленная плотность 3.00 г/см8.
Литература
1. F о s t е г L. М., G. Long, М. S. Hunter, Journ. Amer. Ceram.
Soc., 39, № 1, 1, 1956.
A12O3—AIN
Система имеет значение для высокоглиноземистой керамики и
огнеупоров. Лонг и Фостер [2] изучили фазовый состав плавленого
глинозема при добавках к нему различных количеств нитрида
алюминия (от 0.38 до 16.9% A1N). .
Полученные продукты изучались рентгенографически. В пла-
вленых образцах, содержащих 0.13% азота (0.38% A1N), обна-
ружены только линии а-А12О3, а при содержании 0.34% азота
(1 % A1N) снимок показывал смесь а-А12О3 и 8-А12О3 (дельта-глино-
зем). При содержании 1% азота (3% A1N) в образце присутствовал
только 8-А12О3 (ромбическая ячейка). Повторное нагревание да-
вало линии 8-А1аО3, до тех пор пока содержание азота не умень-
шилось до очень низких значений, при которых^устойчивым ста-
новится не 8-глинозем, а а-А12О3 (корунд).
Дзета (С)-глинозем (кубическая решетка) в отличие от дельта-
глинозема не относится к группе гамма (т)-глиноземов (хи-,
гамма-, эта-, дельта-, каппа- и тета-модификации), образующихся
при нагревании моногидрата глинозема (перечисленные разновид-
ности у-глиноземов по Штумпфу с соавторами [3] являются от-
дельными кристаллическими фазами, а по Йеллинеку и Фанку-
хену [1 ] они представляют собой лишь различную степень кри-
сталличности у-глинозема).
Образцы плавленого глинозема, содержащие 1.7% азота
(5%A1N) и 2.1% азота (6% A1N), состояли из смесей дельта-
и дзета-глиноземов. (Подобно тому как для образования |3-глино-
зема требуется небольшое количество щелочных или щелочно-
земельных окислов, для стабилизации дзета-глинозема требуются
малые количества окиси лития; ^-глинозем — гексагональный,
а дзета-глинозем — кубический). При содержании в плавленом
Системы окислов с фторидами и другими бинарными соединениями 751
образце 3.9% азота (11.4% A1N) в нем присутствовал только дзета-
глинозем, а при более высоких содержаниях A1N в образцах со-
держалась смесь дзета-глинозема и нитрида алюминия (A1N).
Дзета-фаза, как и дельта-фаза, превращается в а-глинозем (корунд)
при удалении из нагреваемых образцов азота.
Механизм указанных превращений в глиноземе, содержащем
нитрид алюминия, не изучен.
Литература
1. Jellinek М. Н., J. Fankuchen, Ind. Eng. Chem., 37, № 2,
158, 1941; 41, № 10, 2259, 1945.
2. L о n g G., L. M. Foster, Journ. Amer. Ceram. Soc., 44, № 6, 255,
1961. 4R
3. Stumpf H. C., A. S. R u s s e 11, J. W. Newsome, С. M. Tu-
cker, Ind. Eng. Chem., 42, № 7, 1398, 1950.
MnO—MnS
Систему, существенную для стимулированной кристаллизации
шлакоситаллов, исследовали Чао, Смит и Ван Флак. Система от-
носится к простым эвтектическим. Эвтектика имеет температуру
плавления 1232+5° и содержит 64 вес.% MnS. Обнару-
жены твердые растворы как на основе МпО, так и на основе MnS.
Максимальная растворимость МпО в MnS составляет 1.7+0.2%
и MnS в МпО соответственно 1.8+0.2%. Эти величины были по-
лучены в присутствии жидкости при 1260°.
Литература
1. С h а о Н. С., Y. Е. Smith, L. Н. Van V 1 а с k, Trans. Amer.
Inst. Mining a. Metal. Eng., 227, № 3, 796, 1963.
up—uo2
Имеет значение как высокотемпературный реакторный мате-
риал.
Изучена Бэскиным [1]. Смеси исходных веществ предвари-
тельно обжигались при 2000° в вакууме, а затем их температура
плавления определялась в атмосфере гелия. Из диаграммы, пред-
752 Системы окислов с фторидами и другими бинарными соединениями
ставленной на рис. 700, видно, что система относится к простым
эвтектическим. Эвтектика содержит 62 вес.% UO2 и плавится
при 2390+30°. Приведенные температуры плавления UP и UO2
соответственно 2535 и 2729° несколько занижены вследствие того,
что в условиях проведенных опытов эти вещества имели нестехио-
метрический состав. Потеря веса вследствие испарения в вакууме
при 2000° не превышала ~5%.
Литература
1. Baskin Y., Journ. Amer. Ceram. Soc., 48, № 12, 652, 1965.
БИНАРНЫЕ ФТОРИДНЫЕ СИСТЕМЫ
Физико-химические системы, содержащие фтористые соли,
представляют большой интерес прежде всего вследствие все более
широкого их использования в технологии различных неорганиче-
ских материалов, например фторидных оптических стекол, стекол,
устойчивых к воздействию паров плавиковой кислоты, кислото-
упорных цементов, в качестве нуклеаторов кристаллизации
в производстве стеклокристаллических материалов, минерализа-
торов обжига портланд-цемента и др. В физической химии силика-
тов фторидные системы широко применяются в качестве моделей
более тугоплавких силикатных систем, так как содержат кри-
сталлохимически близкие кристаллические фазы, наблюдаемые
и в соответствующих силикатных системах (Гольдшмидт, Тило,
Торопов, Рой, Гребенщиков). Так, система NaF—BeF2 является
моделью по отношению к системе СаО—SiO2 и т. д.
Для некоторых фторидных систем дано краткое описание. Ббль-
шая часть фторидных систем (рис. 715—781) представлена только
в виде соответствующих диаграмм состояния.
LiF— BeF2
Согласно Рою с сотрудниками [1], система может рассматри-
ваться как модель системы ZnO—SiO2 (рис. 701). Различия
сводятся к более низким температурам плавления во фтороберил-
Рис. 701. Диаграмма состояния
системы LiF—BeF2 (по Р. Рою,
Д. Рой и Осборну).
Q в. т. — типа высокотемпературного
кварца; Q н. т. — типа низкотемпе-
ратурного кварца.
0
BeFg
№F;,(Q.6.myuBe2Fs
ВеР2<Д1.туж
веЛг(0.1.т)+1лгВеЪ,
40 ВО
МОЛ. °/q
LigBeF^+Ж / LiF+Ж
LlgBeF^+LiF
SeF2(aS.m.)
100
LiF
48 Н. А. Торопов и др., кн. 1
754
Бинарные фторидные системы
латной системе и к отсутствию в ней области ликвации в составах,
богатых фтористым бериллием. Это явление вообще характерно
для данного рода систем.
Рис. 702. Диаграмма состояния системы
LiF—BeF2 (по данным сотрудников Окриджской
лаборатории [2]).
Q в. т. —типа высокотемпературного кварца; Q н. т. —
типа низкотемпературного кварца.
Соединение Li2BeF4 является кристаллохимическим аналогом
виллемита Zn2SiO4. В системе установлено наличие двух эвтектик:
при 70 мол.% LiF и 456° и при 48 мол.% LiF и 356°.
Уточненную диаграмму (рис. 702) дали сотрудники Окридж-
ской лаборатории (Тома [2]).
Литература
1. R о у D. М., R. Roy, Е. F. Osborn, Journ. Amer. Ceram. Soc.,
33, № 3, 85, 1950.
2. T h о m a R. E., ed. Phase diagrams of nuclear reactor materials.
ORNL-2548, 1959.
NaF—BeF2
Представляет модель системы СаО—SiO2, имеющей первосте-
пенное значение в химии силикатов. Температуры плавления во
фторобериллатной системе являются, однако, значительно более
низкими, что облегчает ее экспериментальное изучение. Первый
вариант диаграммы состояния, по данным Новоселовой, Левиной,
Симанова и Жаслина [2], приведен на рис. 703. Уточненный
вариант области системы с высокой концентрацией BeF2, по дан-
Рис. 703. Диаграмма состояния си-
стемы NaF— BeFa (по Новоселовой
с сотрудниками, 1947).
Рис. 704. Часть диаграммы си-
стемы NaF— BeFa (по Р. Рою,
Д. Рой и Осоорну).
°С
1000 к
900 Р
Л
сз
800 ' tof+Ж
700 -
600 -
500 -
BaF+3Ba.F-BeF2\~
NOO -BHaF-BeF+a-Ha'M
ХаГ+а-Ва^
s
.1
300 -p-Nu2BeFt+a-NiiBeF3 "
NaF+p-Na.2BiF
200--------!— *
li-lte^eF^p-NnBEF/
fOO - Haf+f-HagBe^
a-Na38eF^+ot.-Na.BeF3
)K+a.-Na8eF3
Ji Beffi fp. Ш%1ё5(?Т
? N la-fcae^ t a-Na.Be% +8eF3_
_____2^ [-ЗВа.5-2веРг+а-На.ВеРг
Г-На-гВе^
p-ltaBeFj
о го
NaF
3 § j Т.р.22.8%ВеГг(>)
Xes-l 0 p-NaBeF+BeF.
________________i_ 3
NO 60 80
Мал. %
100
ВеГг
Рис« 705. Диаграмма состояния системы
NaF—BeF2 (по Тило и Шредеру).
48*
756
Бинарные фторидные системы
ным Роя с сотрудниками [3], Тило и Шредера [4] и Новоселовой
с сотрудниками [1], представлен на рис. 704—706.
Соединение Na2BeF4 является аналогом Ca2SiO4 и обладает
подобно последнему тремя полиморфными модификациями —
гексагональной и двумя ромбическими.
"6
1000
а
800
600
400
NaF+Ж
р-ВеЕг+Ж
ЁНафеЁ,
+NaBeF3
а-ВеЕ,+Ж
BaF+ct-Bii^e^
;_______2^
-HaF->3HaF-8eF,
BiF+a-Ha.-BeF,,
~u------M
HaF+ar-Ba^eE
—о------«4
Pft________n-0
ВеЕг(а6.т)+Ж
a.-Na3BeF,+M
3HaF-8eFt
a-fa2BeFll
Nt8eF3
НавеЕ+Ж
800
nHa.^F2+BsFz[0t.m)
200
FaF+/-lta2BeFt
0 25
NaF
1
50
-+-*—er011
We^+BeF^lU)
NaJte^-flleFjaiuty
Мол. %
°C
1000
6
600
400
NaF+Ж
naF+tt-Hn^F^
Na^eF*
IHgBeF^+Ж
JNaF-BeFg+x-lta^
Ba..BeF+Ha.BeF.
~Fa.F+a.-Ha.iBeFll
—в----
А—
с НаЕ+а.'-Ыа.гВеР3
200
+Na.8eF3
NaBeF3
5---О---О---
—о—С
IblifrMFjM
HaBezFs+BeFfiiu^
75 100
8eF2
-“ч®
§
u*»
€
0 25 • 50
Na.F
Мол. %
75 100
BeF3
NaBeE+Ж /BeF^Bj^tTK
о
о
HaF+f-lkjBeF^
Рис. 706. Диаграмма состояния системы NaF—BeF2 (по Новоселовой
с сотрудниками, 1958).
а — стабильное равновесие; б — ветвь кристаллизации кварцеподобного BeF>, метаста-
бильна. Штрихами показана нижняя граница существования 3NaF BeFs. Q в. m. —
типа высокотемпературного кварца; Q н. т. — типа низкотемпературного кварца.
Соединение NaBeF3 — аналог силиката CaSiQ3 — обнаружено
только в форме, аналогичной низкотемпературному волластониту.
BeF2 в системе кристаллизуется только в одной форме, обладающей
структурой кварца.
Литература
1. Новоселова А. В., М. Е. Левина, М. П. Савельева,
Журн. неорг. хим., 3, № 11, 2562, 1958.
2. Новоселова А. В., М. Е. Левина, Ю. П. Симанов,
А. Г. Ж а с л и н, Журн. общ., хим., 14, № 6, 385, 1947.
3. R о у D. М., R. Roy, Е. F. Osborn, Journ. Amer. Ceram. Soc.,
33, № 3, 85, 1950.
4. T h i 1 о E., H. Schroder, Zs. phys. Chem., 197, 41, 1951.
Бинарные фторидные системы
757
RbF—BeF2
Изучена Роем с сотрудниками [2] в области между BeF2 и
RbBeF3. Диаграмма состояния приведена на рис. 707.
Рис. 707. Часть диаграммы со-
стояния системы RbF—BeFg (по
Р. Рою,УД. Рой и Осборну).
RbF
Рис.
Мол. % BeFi
708. Диаграмма состояния системы RbF— BeF2
(по Гребенщикову).
Q н. тп. — типа низкотемпературного кварца.
758
Бинарные фторидные системы
Аналог SiO2 — фтористый бериллий — и в этой системе, по-
добно тому, как это наблюдается в системах NaF—BeF2 и LiF—BeF2,
кристаллизуется . только в кварцеподобной модификации.
Рис. 709. Диаграмма состояния системы
RbF—BeFg (по данным сотрудников Окриджской
лаборатории [3]).
В последнее время систему изучал Гребенщиков [1 ] и сотруд-
ники Окриджской лаборатории [3] (рис. 708, 709).
Литература
1. Гребенщиков Р. Г., ДАН СССР, 114, № 2, 316, 1957.
2. R о у D. М., R. Roy, Е. F. Osborn, Joum. Amer. Ceram. Soc.,
33, № 3, 85, 1950.
3. T h о m a R. E., ed. Phase diagrams of nuclear reactor materials.
ORNL-2548, 1959.
MgF2—• BeF2
MgF2 является структурным аналогом рутила TiO2, и потому
система MgF2—BeF2 представляет модель важной шлаковой си-
стемы TiO2—SiO2. В обеих системах эвтектики расположены очень
Бинарные фторидные системы
759
близко к составам компонентов BeF2 и SiO2 и формы кривых лик-
видуса для MgF2 и TiO2 весьма сходны между собой.
Рис. 710. Диаграмма состояния
системы MgF2—BeF2.
Система изучена Каунтсом, Роем и Осборном [1]. Диаграмма
состояния приведена на рис. 710.
Литература
1. С о u n t s W. Е., R. Roy, Е. F. Osborn, Journ. Amer. Ceram.
Soc., 36, № 1, 12, 1953.
CaF2—BeF2
Представляет интерес в качестве «кристаллохимического ана-
лога» систем, образуемых более тугоплавкими окислами, обладаю-
щими структурой, сходной со структурой компонентов рассматри-
ваемой системы. Обычной моделью SiO2 в подобных системах слу-
жит BeF2. Структурно с CaF2 особенно близким является ThO2.
Однако система ThO2—SiO2 изучена еще недостаточно подробно.
По-видимому, можно говорить только об аналогии между систе-
мами ZrO2—SiO2 и рассматриваемой CaF2—BeF2.
Изучена Каунтсом, Роем и Осборном [1 ]. Диаграмма приведена
на рис. 7Ц. Так же как в системе ZrO2—SiO8, наблюдается одно
760
Бинарные фторидные системы
соединение CaBeF4, плавящееся инконгруэнтно (циркон, веро-
ятно, разлагается уже в твердом состоянии).
°C
0 20 40 00 80 100
Са/г Мал. °/о
Рис. 711. Диаграмма состояния
системы CaFa—BeF2.
Литература
1. С о u n t s W. Е., R. Roy, Е. F. Osborn, Journ. Amer. Ceram.
Soc., 36, № 1, 12, 1953.
LiF—MgF2
Является аналогом системы MgO—ZrO2.
По данным Бергмана и Дергунова [1], в системе при высоких
температурах наблюдается образование непрерывной серии твер-
Рис. 712. Диаграмма состояния
системы LiF—MgFa.
Бинарные фторидные системы
761
дых растворов. Согласно позднейшим наблюдениям Каунтса,
Роя и Осборна [2], при более низких температурах происходит
распад этих твердых растворов (рис. 712).
Литература
1. Бергман А. Г., Е. П. Дергунов, ДАН СССР, 31, № 8, 754,
1941.
2. С о u n t s W. Е., R. Roy, Е. F. Osborn, Journ. Amer. Ceram.
Soc., 36, № 1, 12, 1953.
KF— NiF2
Эта система является кристаллохимическим аналогом системы
ВаО—TiO2, имеющей первостепенное значение для технологии
сегнетоэлектрической керамики.
Изучена Вагнером и Бальцем [1 ]. Обнаружено два химических
соединения: K2NiF4 и KNiF3 (рис. 713). Соединение K2NiF4 пла-
Рис. 713. Диаграмма состоя-
ния системы KF—NiF2.
вится инконгруэнтно при 930°, распадаясь на KNiF3 и расплав
KF—NiF2, содержащий 23.3 мол. % NiF2. Температура плавления
KNiF3 определена в 1130+2°. Эвтектика между KNiF3 и NiF2
отвечает содержанию 65.5 мол.% NiF2 и плавится при 1084°.
Диаграмма состояния системы сходна с таковой для систем
KF—MgF2 и RbF—MgF2.
Литература
1. Wagner G., D. Balz, Zs. Elektrochem., 56, № 2, 574, 1952.
Инвариантные точки системы NaF—A1F3
Таблица 1
Точка Фазы Процесс Температура, °C
1 NaF + жидкость. Плавление. 990
2 NaF твердый раствор + криолит + жидкость. Эвтектика. 885
3 Криолит + жидкость. Плавление. 1000
4 5NaF-3AlFs + криолит + жидкость. Перитектика. 725
5 5NaF- 3A1F8 -j- A1F3 + жидкость. Эвтектика. 685
— 3NaF-AlF3. Превращение из моноклинной в куби- 565
ческую.
Кристаллические фазы системы NaF—A1F3
Таблица 2
Соединение Система кристаллов Габитус Спайность Ng Np 2V° Плотность, г/см3 Оптическая ориентировка
3NaF-AlF8 (криолит). Моноклинная. Псевдокубиче- ский (001) и (110). Двойники по (110). Совершенная по (001) и ясная по (110) и (101). 1.340 1.338 +43 2.95-3.0 Zac=44°. Пло- скость оптиче- ских осей и Х1(010).
5NaF-3AlF8 (хиолит). Квадратная. Пирамиды. Совершенная по (001) и ясная по (111). 1.3486 1.3424 —
NaF (вильо- мит). Квадратная (псевдокуби- ческая). (100) и (001) 1.3258
Бинарные фторидные системы
763
NaF—A1FS
Изучена Федотьевым и Ильинским [1 ]. Их диаграмма предста-
влена на рис. 714. Важнейшее соединение системы криолит при-
Рис. 714. Диаграмма состоя-
ния системы NaF— AlFa.
меняется в качестве растворителя окиси алюминия при произ-
водстве алюминия электролизом, а также как глушитель в эма-
левом производстве.
Литература
1. Федотьев П. П., В. П. Ильинский, Изв. Петербургск.
политехи, инет., 18, № 1, 355, 1912.
Диаграммы состояния бинарных
фторидных
систем
Рис. 715. Система LiF—NaF
(Бергман, Дергунов [1|).
(Бергман, Дергунов [1]).
Рис. 718. Система LiF—CsF
(Тома [29]).
Рис. 717. Система LiF— RbF
(Тома [29]).
Рис. 719. Система KF—NaF
(Бергман, Дергунов [1]).
Рис. 720. Система KF—BeF2 (Бор-
зенкова с соавторами [2]).
Рис. 721. Система NaF—MgFa
(Бергман, Дергунов [1]).
Рис. 722. Система KF—MgF2 (Де Вриз,
Рой [20]).
Рис. 723. Система
LiF—CaF2 (Руфф,
Буш [25]).
Рис. 724. Система NaF—CaFg
(Федотьев, Ильинский [11])
Рис. 725. Система KF—
—CaF2 (Ишань [22]).
Рис. 726. Система RbF—
—CaFj (Тома [29]).
Рис. 727. Система KF—
—BaFg (Пущин, Басков[10]).
Рис. 728. Система LiF—
—ZnF2 (Шмитц-Дюмон,
Борнефельд [27]).
Рис. 729. Система NaF—
—ZnF2 (Шмитц-Дюмон,
Борнефельд [27]).
Рис. 730. Система NaF—ZnF2
(Тома [29]).
Рис. 731. Система KF—ZnF2
(Тома [29]).
Рис. 732. Система KF—
—ZnF2 (Шмитц-Дюмон, Бор-
нефельд [27]).
Рис. 733. Система RbF—
—ZnF2 (Шмитц-Дюмон, Бор-
нефельд [27]).
Рис. 734. Система CsF—
—ZnF2 (Шмитц-Дюмон, Бор-
нефельд [27]).
Рис. 735. Система AgF—ZnFa (Де Вриз,
Рой[20]).
Рис. 736. Система NaF—CdF2
(Путин, Басков 110]).
Рис. 737. Система NaF—PbF2
(Путин, Басков [10]).
Рис. 738. Система LiF—A1F3
(Федотьев, Тимофеев [12])-
Рнс. 739. Система KF—
—A1F3 (Федотьев, Тимо-
феев [12]).
J/249 Н. а- Торопов п др., кн. t
Рис. 740. Системы LiF—
—YF3, NaF—YF3, KF—YF3,
RbF—YF3, CsF—YF3 (Дер-
гунов [3]).
Рис. 741. Системы NaF—
—LaF3, KF—LaF3, RbF—
—LaF3, CsF—LaF3 (Дер-
. гунов [3]).
Рис. 742. Система LiF—
—CeF3 (Тома [29]).
Рис. 743. Система NaF—CeF3 (Бартон,
Редман, Стрелов [16]).
1 — термический анализ; 2 — метод закалки.
Рис. 744. Системы NaF—PrF3,
KF—PrF3, RbF—PrF3, CsF—PrF3
(Дергунов [5]).
Рис. 745. Системы
KF—SmF3, RbF—SmF3,
CsF—SmF3 (Дергу-
нов [5]).
Рис. 746. Системы
Рис. 747. Система LiF—
—UF3 (Тома [29]).
KF—ErF3, RbF—ErF3,
CsF—ErF3 (Дергунов
15]). '
49*
Рис. 748. Система NaF—UFS
(Тома [29]).
Рис. 749. Система LiF—PuF3
(Бартон, Стрелов [17]).
°C
1200 '
Ж+у-ВиВе^
Рис. 750. Система NaF—PuFg (Бар-
тон, Редман, Стрелов [16]).
1000
800
ООО
400
р-ВаВе^+Ж
Ba,F2+
_р-Ва£е^
гоо
г
p-BaBeFf)K\
15-ВавеР+ВеРг
Ва^к-ВаВЦ
, л-BaBeF+BeF
i * 2
0
Ba.F2
25 50 15 100
Мол.%
Рис. 751. Система
BaF2—BeF2 (Киркина,
Новоселова, Симанов [6]).
Рис. 752. Система CaF2—MgF2
(Бек [18]).
Рис. 753. Система BaF2—MgF2
(Окамото, Нисиока [23]).
°C
BOO
РЬРг'ВеРгт.р.+ж
x Жойк.
- ,\ 3PbF,-BeF,iM
Kyb.
PbfrM
PbF2'BeF+)K
W0
200
Jyt.PbFi
ЗРЬРг-ВеРг
Ромб.
PbF,
-3PbFz-BeFz
О 20 У0 ’ 60 80
pbf2 Мол %
OPBF^BeF,
PbF2-BeF2
8еРг((1б.т)+Ж
I PbFz’8eFzm.p.
РЬ£’8еРггп.р.+ВеРг(0.8.т.)
PbF2'BeF2+BeF2(Q.H.rn)
100
BeFt
Рис. 755. Система MgF2—
—ScF3 (Комиссарова, По-
кровский [7]).
Рис. 754. Система BeF2—PbF« (Д. Рой,
P. Рой, Осборн [24]).
Q в. m. — типа высокотемпературного кварца;
Q н. т. — типа низкотемпературного кварца.
50 Н, А. Торопов и др., кн. 1
Pbff (
г • Мол. %
Рис. 756. Система PbF,—YF3
(Сато, Хукуда [26]).
Рис. 757. Система BaF2—UF3
(Д’Эй, Мартин [19]).
S, — твердый раствор UFS в ВаР»
S, — твердый раствор ВаР2 в UFe.
Рис. 758. Система LiF—ZrF4
(Тома [29]).
Рис. 759. Система NaF—ZrF4 (Бартон
с соавторами [15]).
Рис. 760. Система KF—ZrF4 (Но-
воселова, Коренев, Симанов [9]).
Фазовые поля: 1 — KF+Ж; 2 —
К,2гР,+Ж; t 3 — Кв2г,Рц+Ж; 4 —
т. р.+Ж; 3 — 6-К22гРв+Ж; 6 —
V-KjZrF.+Ж: 7 — y-KZrFj+Ж;
а — ₽-ZrF4+HC; 9 — а-ггР4+Ж;
10 — KF+K,ZrF,; 11 — KsZrF,+
-f-KtZraPi-,: 12 — т. Р.; 13 — т. p.-f-
6-K2ZrPe; 14 — т. p,+v-K2ZrPe; 15 —
т. p.+a-K2ZrP,; 16 — K2ZrP,+
4-V-KZrF,; 17 — v-K2ZrP«+p-KZrP2;
18 — v-K2ZrPe+a-KZrPs; 19 —
V-K2ZrF,+K,Zr,F21; 29-v-K2ZrFe+
+p-K2Zr2Pu; 21—y_K2ZrP2-^-
+a-K2Zr2Fu; 22 — a-K2ZrPe+
+<l-K2Zr2Pu; 23 — p-K2Zr2Pu-}-
“bKiZreFsij 24 — a-K,Zr2Pu+K,Zr,K21;
25 — a-KZrFj+K,ZreF,i; гв — a-
KZrPB+a-ZrP4; 27—p-KZrP2+a-ZrP4;
28 — v-KZrPs+a-ZrP4.
Рис. 761. Система KF—ZrF4
(Тома [29]).
Рис. 762. Система RbF—ZrF4
(Тома [29]).
50*
Рис. 763. Система CsF—ZrF4
(Тома [29]).
Рис. 764. Система NaF—HfF<
(Тома [29]).
Рис. 765. Система LiF—ThF4
(Тома [29]).
Рис. 766. Система KF—ThF4 (Аскер,
Сегнет, Уайли [13]).
Рис. 767. Система NaF—ThF4
(Тома [29]).
Рис. 768. Система RbF—
—ThF4 (Дергунов, Берг-
ман [4]).
Рис. 769. Система CsF— ThF4 (Тома, Карл-
тон [30]).
Рис. 770. Система LiF—UF4
(Бартон с соавторами [14]).
%
Рис. 771. Система NaF— UF4 (Бартон
с соавторами [14]).
Рис. 772. Система KF—UF4
(Тома с соавторами [31]).
Рис. 773. Система RbF—UF4
(Тома с соавторами [31]).
Рис. 774. Система CsF—UF4
(Тома [29]).
°е
О 20 40 ВО 80 100
Мол %
Рис. 775. Система BeFs— ZrF4 (Ново-
селова [8]).
Q в. т. — типа высокотемпературного
кварца.
Рис. 776. Система BeF2—UF4
(Тома [29]).
Рис. 777. Система PbF2—UF4
(Тома [29]).
Q в. т. — типа высокотемпературного
кварца.
Рис. 778. Система ZrF4—UF4
(Бартон с соавторами [15]).
Рис. 779. Система ThF4—UF4 (Уивер
с соавторами [34]).
Рис. 780- Система BF3—UFe
(Фишер, Фогель [21]).
1 — по Гальдебранду; 2 — экспе-
риментальная кривая; 3 —
идеальная кривая.
Ряс. 781. Система BFS—UF6
(Фишер, Фогель [21]).
780
Бинарные фторидные системы
Литература
для бинарных фторидных систем
1. Б е р г м а н А. Г., Е. П. Дергунов, ДАН СССР, 31, № 8, 753,
1941.
2. Борзенкова М. П., А. В. Новоселова, Ю. П. Сима-
нов, В. И. Черных, Е. И. Я р е м б а ш, Журн. неорг. хпм.,
1, № 9, 2071, 1956.
3. Д е р г у н о в Е. П., ДАН СССР, 60, № 7, 1185, 1948.
4. Д е р г у н о в Е. П., А. Г. Бергман, ДАН СССР, 60, № 3, 391,
1948.
5. Дергунов Е. П., ДАН СССР, 85, № 5, 1025, 1952.
6. Киркина Д. Ф., А. В. Новоселова, Ю. П. Симанов,
Журн. неорг. хим., 1, № 1, 128, 1956.
7. Комиссарова Л. Н., Б. И. Покровский, ДАН СССР,
149, № 3, 599, 1963.
8. Н о в о с е л о в а А. В., ДАН СССР, 149, № 6, 1337, 1963.
9. Н о в о с е л о в а А. В., Ю. М. Коренев, Ю. П. Симанов,
ДАН СССР, 139, № 4, 892, 1961.
10. Пушин Н., А. Басков, Zs. anorgan. Chem., 81, № 3, 347,
1913.
11. Федотьев П. П., В. П. Ильинский, Zs. anorgan. allgem.
Chem., 129, № 1/3, 101, 1923.
12. Ф e д о т ь e в П. П., К. Тимофеев, Zs. anorgan. allgem. Chem.,
206, № 3, 263, 1932.
13. A s k e r W. J., E. R. S e g n i t, A. W. Wylie, Journ. Chem. Soc.,
November, 4471, 1952.
14. В a r t о n C. J., H. A. Friedman, W. R. Grimes, G. I li-
sle y, R. E. Moore, R. E. Thoma, Journ. Amer. Ceram.
Soc., 41, № 2, 67, 1958.
15. В a r t о n C. J., W. C. Grimes, H. I n s 1 e y, R. E. Moore,
R. E. Thoma, Journ. Phys. Chem., 62, № 6, 666, 1958.
16. В a r t о n C. J., J. D. Redman, R. A. Strehlow, Journ.
Inorg. Nucl'. Chem., 20, № 1/2, 45, 1961.
17. В a r t о n C. J., R. A. Strehlow, Journ. Inorg. Nucl. Chem., 18,
№ 3, 143, 1961.
18. Beck E., Metallurgie, 5, 504, 1908.
19. D’Eye R. W. M., F. S. Martin, Journ. Chem. Soc., May, 1851,
1957.
20. D e Vries R. C., R. Roy, Journ. Amer. Chem. Soc., 75, № 10,
2479 1953
21. F i s c h e r J., R. C. Vogel, Journ. Amer. Chem. Soc., 76, № 19,
4829, 1954.
22. I ch ague M., Bull. Soc. chim. France, № 1—2, 128, 1952.
23. Okamoto M., U. N i s i о k a, Sci. Repts Johoku Imp. Univ.,
ser. 1, 24, 142, 1935-1936.
24. R о у D. M., R. Roy, E. F. Osborn, Journ. Amer. Ceram. Soc.,
37, № 7, 303, 1954.
25. R u f f O., W. Busch, Zs. anorgan. allgem. Chem., 144, № 1/3, 87,
1925.
26. Sato M., Sh. H u k u d a, Journ. Ceram. Assoc. Japan, 70, № 804
(12), 343, 1962.
27. S c h m i t z - D u m о n t О., H. Bornefeld, Zs. anorgan. allgem.
Chem., 287, № 3, 120, 1956.
28. T h i 1 о E., H. Schroder, Zs. phys. Chem., 197 , 41, 1951.
Бицарные фторидные системы
781
29. Т h о m a R. Е., ed. Phase diagrams of nuclear reactor materials.
ORNL-2548, 1959.
30. T h о m a R. E., T. S. Carlton, Journ. Inorg. Nucl. Chem., 17,
№ 1-2, 88, 1961.-
31. T h о m a R. E., H. I n s 1 e у, B. S. Landau, H. A. Fried-
man, W. R. Grimes, Journ. Amer. Ceram. Soc., 41, № 12, 542,
1958.
32. V e n t u r e 11 о G., Atti reale Accad. sci. Torino, 76, pt. 1, 559,
1941.
33. Wagner G., D. Balz, Zs. Elektrochem., 56, № 2, 576, 1952.
34. W e a v e r C. F., R. E. Thoma, H. I n s 1 e у, H. A. Fried-
man, Journ. Amer. Ceram. Soc., 43, № 4, 213, 1960.
ДОПОЛНЕНИЕ*
Na2O—SiO2
Порай-Кошиц и Аверьянов [1] обнаружили метастабильную ликва-
цию, аналогичную найденной для системы Li2O—SiO2. Критическая тем-
пература ликвации (вершина купола) имеет координаты: 860° и 7.5 мол. %
Na2O. Растворимость Na2O в кремнеземе (левая ветвь бинодальной кривой),
составляя около 1 мол. %, мало изменяется с увеличением температуры
до 800°, после чего до 865° резко возрастает. Содержание кремнезема в бо-
гатой щелочью фазе непрерывно увеличивается с температурой. В общем
для бинодальной кривой характерна значительная асимметричность.
Литература
1. Porai-Koshits Е. А., V. I. Averyanov, Journ. Non-Cry-
stalline Solids, 1, № 1, 29, 1968.
CaO—SiO2
Учитывая, что свободная энергия должна убывать с ростом температуры,
Фостер [2] дал новый вариант диаграммы полиморфных превращений двух-
кальциевого силиката. Бредиг [1 ] высказал свое согласие с этой новой трак-
товкой.
Спикмен с сотрудниками [3 ] детально - выяснили условия получения
нового соединения Ca8Si5O18 из смеси T-Ca2SiO4 с кремнеземом. Отношение
Са : Si должно находиться в пределах 1.5 : 1.75. Условия гидротермаль-
ного синтеза варьировали от 180° й 10 бар до 600° и 200 бар. CagSi6O18 по-
лучалось в смеси с другими соединениями. Средний показатель светопре-
ломления Ca8SiBO18 1.65, плотность 2.97 г/см®. Структура CaeSiBO18 пред-
ставляет перемежающиеся слои r-Ca2SiO4 и килхоанита Ca3Si2O;.
* Здесь приведено краткое описание некоторых новых систем, изучен-
ных в самое последнее время, а также' даны существенные дополнения
к системам, описанным в основном тексте. Системы, включенные только
в «Дополнение», помечены звездочкой.
Дополнение
783
Литература
1. В г е d i g М. A., Journ. Amer. Ceram. Soc., 51, № 6, 354, 1968.
2. Foster W. R., Journ. Amer. Ceram. Soc., 51, № 6, 353, 1968.
3. Speakman К., H. F. W. T a yl о r, J. M. Be n ne 11, J. A. G ar d,
Journ. Chem. Soc., (A) № 7, 1052, 1967.
BaO—SiOa
Сивард с сотрудниками [1] определили область метастабильной ликва-
ции в субсолидусной области. Критическая температура 1460° при содер-
жании ВаО около 10 мол. %.
Литература
1. S е w а г d Т. Р., D. R. U h 1 m a n n, D. Turnbull, Journ. Amer.
Ceram. Soc., 51, № 5, 278, 1968.
ZnO—SiOs
Рингвуд и Мэжор [1] наблюдали превращение Zn2SiO4 при 130 кбар
и 900° в новую модификацию, рентгенограмма которой, однако, не вполне
соответствует оливиновой структуре. При давлении 150 кбар (900°) возни-
кает новая плотная (приблизительно на 23% плотней виллемита) фаза с Net=
= 1.87.
Литература
1. Ringwood А. Е., A. Major, Nature, 215, № 5108, 1367, 1967.
В2О3—SiO2
Чарльз и Вагстафф [1] показали наличие субсолидусрой метастабиль-
ной ликвации, распространяющейся от 0 до 100% В2О3 с критической тем-
пературой 520°.
Литература
1. Charles R. J., F. Е. W a g s t a f f, Journ. Amer. Ceram. Soc., 51,
№ 1, 16, 1968.
784
Дополнение
А12О3—SiOj
Старонка с сотрудника ми [4] покривым охлаждения (с вольфрам-ре-
ниевой термопарой) построили диаграмму состояния системы. Найдено,
что муллит плавится конгруэнтно при 1934°, положение эвтектик: с глино-
земом 78 вес. % А12О3и 1912°; с кремнеземом 9 вес.% А12О8 и 1546°. Твердых
растворов на основе муллита не обнаружено.
Положение тройной точки, где находятся в равновесии кианит, анда-
лузит и силлиманит, изучалось многими авторами. Вайл [5] дает для этой
точки координаты: 410°, 2.4 кбар. По Файфу и Тернеру [2], эта точка на-
ходится на линии от 430°, 2.1 кбар до 480°, 2.8 кбар. Холм и Клеппа [3]
на основании термодинамических расчетов приводят координаты 430°,
5.9 кбар.
Альтгауз [1] приводит координаты 6.5 ±0.5 кбар и 595 ±10°, что сильно
отличается от перечисленных выше данных. В согласии с Винклером [6]
Альтгауз считает, что рассматриваемая тройная точка не может находиться
в поле пирофиллита, а тем более каолинита, между тем у всех предшествую-
щих авторов тройная точка попадала в поля указанных гидросиликатов.
Литература
1. А 11 h a u s Е., Contributions Mineral., Petrol., 16, № 1, 1, 1967.
2. Fyfe W. S., F. J. Turner, Contributions Mineral., Petrol., 12, № 4,
354, 1966.
3. Holm J. L,, О. J. Kleppa, Amer. Mineralogist, 51, № 11—12, 1608,
1966.
4. Staronka A., H. Pha m, M. R о 1 i n, Rev. Haut. Temper, et Re-
fract., 5, 2, 111, 1968.
5. W e i 11 D. F., Geochim. Cosmochim. Acta, 30, 223, 1966.
6. W i n k 1 e r H. G. F. Die Genese der metamorphen Gesteine. 2 Auf., Ber-
lin—Heidelberg, 1967.
ZrO2— SiO2
Баттерман и Фостер [2] нашли, что циркон (ZrSiO4) устойчив до 1676 ±7°,
когда диссоциирует на тетрагональный ZrO2 и кристобалит. Эвтектика вблизи
SiOs имеет температуру плавления 1687 ±4°, т. е. всего на 10° выше макси-
мальной температуры устойчивости циркона.
Будников с сотрудниками [1], обжигая смесь, содержащую 10 вес.%
SiO2, не получили твердых растворов на основе ZrO2.
Литература
1. Будников П. П., А. П. Пащенко, Е. А. Старчевская,
В. С. Гумен, Изв. АН СССР, неорг. матер., 4, № 5, 785, 1968.
2. В u 11 е г m a n W. С., W. R. F о s t е г, Amer. Mineralogist, 52, № 5—6,
880, 1967.
Дополнение
785
HfO2—SiO2
Парфененков с сотрудниками [1 ] визуально наблюдали плавление смесей
(до 2750°) и, пользуясь методом закалки, построили диаграмму состояния.
Обнаружено одно соединение HfSiO4, плавящееся инконгруэнтно при 1650°.
Эвтектика содержит 98 мол.% SiO2 и плавится при 1680 ±15°. Расслаивание
жидкости и твердых растворов не обнаружено.
Литература
1. Парфененков В. Н., Р. Г. Гребенщиков, Н. А. Торопов,
ДАН СССР, 185, № 4, 840, 1969,
Р2О3—SiO2
Либау и Биссерт [1], применяя различные формы SiO2 и Р2ОБ, проводя
реакции в твердом и жидком состоянии, пользуясь методом транспортных
реакций, получили семь модификаций P2O3SiO2: кубическую, тетрагональ-
ную, две моноклинных, ромбическую, гексагональную и псевдогексагональную.
Получена также гексагональная фаза переменного состава 811+БжР4(7_ж)О72,
в которую входят соединения P2O5-2SiO2 и 2P2OB-3SiO2.
Литература
1. Liebau F., G. Bisser t, Bull. Soc. Chim. France, Numfero special,
1742, 1968.
Bi2O 3— SiO 2
Сперанская с сотрудниками [1], пользуясь методом дифференциально-
термического анализа, построили диаграмму состояния системы. Обнару-
жены соединения 6Bi2O3-SiO2 и 2Bi2O3-3SiO2, плавящиеся конгруэнтно
соответственно при 880 и 1020°.
Литература
1. Сперанская Е. И., В. М. Скориков, Г. М. Софронов,
Г. Д. И т к и н а, Изв. АН СССР, неорг. матер., 4, № 8,1374, 1968.
ВеО— LijO*
Тернер и Бертрам [1] изучили плавкость части системы от 65 до
100 мол. % ВеО. Обнаружено соединение 2BeO-Li2O, плавящееся конгру-
энтно при 1150 +40°. Эвтектика между этим соединением и ВеО плавится
приблизительно при 750° и содержит 78.5 мол.% ВеО. Полученное соеди-
нение имеет плотность 2.52 г/см®. Его элементарная ячейка может описы-
ваться в моноклинных или гексагональных осях.
Литература
{.Turner Р. Р., S. F. В а г t г a'in, Inorg. Chem., 6, № 4, 833, 1967.
786
Дополнение
SrO—СаО*
Обет и Мюнхберг [1], обжигая смеси окнелов при 1500°, получали не-
прерывный ряд твердых растворов между крайними членами. Окись маг-
ния не растворяется в этом твердом растворе.
Литература
1. О b s t К. Н., W. Munchberg, Tonindustr. Ztg., 92, № 6, 201, 1968.
MgO—ZnO
Колташкина и Попов [1], обжигавшие смеси окислов при 1100°, обна-
ружили образование ограниченных кубических твердых растворов на ос-
нове MgO до содержания 20 мол.% ZnO. Растворения MgO в гексагональ-
ной ZnO не обнаружено.
Литература
1. Колташкина С. Ф., П. П. Попов, Научн. труды Волгоградск.
политехи, инет., 644, 1967.
SrO— EuO*
Брауэр и Шульц [1] получили непрерывный ряд твердых растворов,
нагревая смеси SrO, Eu2Os, SrH2 и ЕиН2 при 800°. Параметр элементарной
ячейки типа NaCl прямолинейно изменяется от 5.1601 +0.0005 А (для^ЭгО)
до 5.1426 А (для EuO).
Литература
1. В г а и е г G., N. Schultz, Journ. Less-Common Metals, 13, № 2,
213, 1967.
Rb2O—B2O3
Коше [1] уточнила структуру и полиморфизм боратов рубидия. Моно-
борат R2O'B2O3 имеет полиморфное превращение прн 695° и плавится при
860°. Rb2O'2B2O3 и RbsO-3B2Os кристаллизуются в триклинной сингонии.
Тетраборат КЬ2О-4В2Оз’подвергается при 735° перитектическому распаду.
Пентаборат Rb2O-5B2Os существует в виде трех модификаций с точками
перехода 570 и 663°. Соединение Rb2O-9B2O8 устойчиво ниже перитектики
572°.
Л итература
1. Kocher J., Bull. Soc. Chim. France, № 3, 919, 1968.
Дополнение
787
CSgO—BgO3
По Коше [1], кристаллы Cs2OB2O3 кубические (а=6.82 A), Cs2O-3B2Os
ромбической сингонии, Cs2O-4B»O3 — псевдокубической (а=5.74 А). Пента-
борат Cs2O-5B2O3 триморфен. Температуры превращения 570 и 640°. Cs2O
9В2О3 имеет две модификации: высокотемпературную тетрагональную, пла-
вящуюся при 596°, и метастабильную моноклинную.
Литература
1. К оо her J., Bull Soc. Chim. France, № 3, 919, 1968.
СаО—B2O3
Шефер [1] получал монокристаллы 2CaO-B»O3 (2:1) и ЗСаО-В2О3
(3:1). 2:1 моноклинной сингонии, плотность 2.85 г/см3; 3 : 1 ромбоэдри-
ческой, Ng= 1.716 +0.001, Np=l.632 +0.001, плотность 3.11 г/см3.
Литература
1. Schafer U. L., Neues Jahrbuch Mineral., Monatsh., № 3—4, 75, 1968.
Li2O—A12O3
Стевнер и Гоппе [1 ] исследовали богатую Li2O часть системы и получили
соединение Li3A104, существующее в виде двух модификаций с температурой
превращения в интервале 750—800°. Обе формы ромбические.
Литература
1. S t е w n е г F., R. Н о р р е, Naturwissenschaften, 55, № 6, 297, 1968.
Cs2O— А12О3*
Семенов с сотрудниками [1 ] показали, что в системе существуют два
соединения: Cs2O-A12O3 и CsjO-11A12O3. Получаемый обжигом смесей Cs2CO3
и А12О3 при 700—800° моноалюминат подвергается термическому разложе-
нию при 1000—1200° с образованием Cs2O11ALO3. Изотропные кристаллы
CsA102 имеют N= 1.520 и плотность 4.7 г/см3. Кристаллы Cs2O-11A12O3
относятся к гексагональной сингонии, No= 1.675 ±0.003, Ne=1.659 +0.003,
плотность 3.63 г/см3.
Литература
1. Семенов Н. Н., А. Г. Меркулов, И. А. Ворсина, Изв.
Сибирск. отд. АН СССР, сер. хим. наук, № 2 (122), вып. 1, 75, 1967.
788
' Дополнение
MgO—А120д
Рой и Кобл [3] нашли, что растворимость MgO в А12О3 в вакууме (вы-
раженная в виде атомного отношения Mg : Al) составляет 1.1-10 ~4, 3-10-.4,
6.8-10*4 и 1.40-10*3 соответственно при 1530, 1630, 1730 и 1830°.
Колен [1] для области гемогенности шпинельной фазы дает пределы
от 50MgQ+50Al203 до 12MgO-|-88Al2O3. Лежу [2] отмечает существова-
ние тетрагональной, богатой глиноземом фазы (S-фаза), состав которой на-
ходится вблизи MgO13Al2Os.
Литература
1. С о 1 i n F., Rev. Haut. Temper, et Refract., 5, № 4, 267, 1968.
2. L e j u s A. M., Rev. Haut. Temper, et Refract., 1, № 1, 53, 1964.
3. Roy S. K., R. L. Coble, Journ. Amer. Ceram. Soc., 51, № 1, 1, 1968.
ZnO—A12O3
Колен [1], нагревая шпинель ZnAl2O4 (при этом происходит испарение
ZnO), получил новые богатые глиноземом соединения: 4ZnO-llAl2O3 гекса-
гональной сингонии; 6ZnO-94Al2O моноклинной сингонии; ZnO-99Al2O
моноклинной сингонии.
Для шпинели установлена широкая область гомогенности (до состава
25ZnO-75Al2O3).
Литература
1. С о 1 i n F., Rev. Haut. Temper, et Refract., 5, № 4, 267, 1968.
CdO—A12O3
Колен [1] показал, что соединение CdAl2O4 относится к типу фенакита
(Be2SiO4) с ромбоэдрической сингонией. Нагреванием CdAl2O4 были полу-
чены новые соединения: CdO-2Al2O3 моноклинной сингонии, устойчивое
ниже 1180°; СйО-бА^Оэ типа бета-глпнозема, гексагональной сингонии,
устойчивое до точки плавления.
Л итература
1. С о 1 i n F., Rev. Haut. Temper, et Rdfract., 5, № 4, 267, 1968.
Fe2O3—A12O3
Макдональд с сотрудниками [1] нашли, что предельный твердый рас-
твор А12О3 в FeAlO3, полученный при 1430° в атмосфере кислорода, отвечает
содержанию 55 ±1 мол. % А12О3.
Литература
1. М а с d о n а 1 d J., J. A. G а г d, F. Р. G 1 a s s е г, Journ. Inorg. Nucl.
Chem., 29, № 3 , 661, 1967.
Дополнение
789
NiO—А12О3
Колен [1], нагревая NiO-Al2O3 в восстановительных условиях, полу-
чал две высокоглиноземистые моноклинные фазы с отношением А12О3 : NiO,
равным 91.7 : 8.3 и более 99 : 1. Кроме того, были получены три метаста-
бильных соединения: NiAl6O10, NiAl]8O29 и NiAl10O16 (с некоторой областью
гомогенности).
Литература
1. С о 1 i n F., Rev. Haut. Temper, et Refract., 5, № 4, 267, 1968.
Li2O—Ga2O3
Стевнер и Гоппе [1], исследуя область, богатую Ы2О, получили новое
соединение Li6GaO4, существующее в двух ромбических формах с темпе-
ратурным интервалом превращения 750—800°.
Литература
1. Stewner F. R., Hoppe, Naturwissenschaften, 55, № 6, 297, 1966.
Li2O—Ga2O3, Na2O—Ga2O3*, K2O—Ga2O3*
Эти системы изучали Гофман и Браун [1 ]. Для всех установлено обра-
зование двух типов соединений: R2O-Ga2O3 и R2O-5Ga2O3. Все соединения
1:5 плавятся выше 1450°. Соединения 1:1 плавятся, вероятно, инконгруэнтно
между 1000 и 1300° в последовательности KGaO2 > NaGaO2 > LiGaOs.
Литература
1. Н о f f m а n С. W. W., J. J. Brown, Joum. Inorg. Nucl. Chem., 30,
№ 1, 63, 1968.
MgO—Ga2O3
По Гофману и Брауну [1], единственное соединение MgGa2O4, плавя-
щееся около 2000°, образует ограниченные твердые растворы с MgO и Ga2O3.
Литература
1. Н о f f m а n С. W. W., J. J. Brown, Joum. Inorg. Nucl. Chem., 30,
№ 1, 63, 1968.
790
Дополнение
SrO—Ga2O3*
Плахтий с сотрудниками [1] изучили систему в субсолидусмой области,
прокаливая смеси SrCO3 и Ga2O3 при 1200°. Получены соединения 3SrO-
2Ga2O3, SrO-Ga2O3 и SrO-2Ga2O3. Кроме того, установлены две фазы пере-
менного состава: (4±i)SrO-Ga?O3 и ySrO • Ga2O3(y%2). SrO-Ga2O3 сущест-
вует в виде двух модификации.
Литература
1. Плахтий Л. А., Н. С. Афонский, 3. Я. Польщикова,
Л. М. Ковба, Журн. неорг. хим., 13, № 4, 1210, 1968.
SrO—Ga2O3*, ВаО—Ga2O3*
Гофман и Браун [1] получили в обеих системах три соединения: 4:1,
3:1 и 1:1. Все соединения устойчивы до 1550°. SrGa2O4 плавится при
1575 ±10°.
Литература
1. Н о f f m а n С. W. W., J. J. Brown, Journ. Inorg. Nucl. Chem., 30,
№ 1, 63, 1968.
ZnO—Ga2O3, CdO—GasO3*
Для этих систем Гофман и Браун [1 ] обнаружили одно соединение 1 : 1
со шпинельной структурой.
Литература
1. Hoffman С. W. W., J. J. Brown, Journ. Inorg. Nucl. Chem., 30,
№ 1, 63, 1968.
PbO—Ga2O3*
Гофман п Браун [1] получили два соединения: PbO-Ga2O3, устойчивое
выше 520° и плавящееся выше 1400°; 2PbO-GasO3, устойчивое между 670
и 720°.
Литература
1. Hoffman С. W. W., J. J. Brown, Journ. Inorg. Nucl. Chem., 30,
№ 1, 63, 1968.
Дополнение
791
СаО—Gd»O3, SrO—Gd2O3*, BaO—Gd2O3*, CaO—Ho2O3*,
SrO—Ho2O3, SrO— Yb2O3, BaO—Yb2O3
Барри и Роем [1] в гадолиниевых системах были получены соедине-
ния 1 : 1 (для Sr и Ва) и 1 ; 2 (для Са и Sr); для гольмиевых систем — сое-
динение 1 ; 1 (для Са и Sr) и 2 : 1 (для Са); для иттербиевых систем — сое-
динения 1 : 1 (для Са, Sr и Ва) и 2 : 1 (для Са).
Литература
1. Barry Т. L., R. Hoy, Journ. Inorg. Nucl. Chem., 29, № 5, 1243, 1967.
EuO—La2O3* (1), EuO—Ce2O3* (2), EuO—Pr2O3* (3),
EuO—Nd2O3* (4), EuO—Sm2O3* (5), EuO—Gd2O3* (6),
EuO—Dy2O3* (7), EuO— Ho2O3* (8), EuO—Er2O3* (9),
EuO—Lu2O3* (10), EuO—Y2O3* (11), EuO-Sc2O3* (12)
Лопато с сотрудниками [1] показали, что в системах (1), (2), (3) и (4)
образуются соединения общей формулы 2Ln2O3-EuO, в системах (5), (6),
(7), (8), (9), (10), (И) и (12) — соединения Ln2O3EuO.
Литература
1. Л о п а т о Л. М., О. В. Шевченко, И. Е. Кирьякова, ДАН
УССР, сер. Б, 9, 826, 1968.
CdO—Ga2O3*
Датта и Рой [1 ] показали существование единственного соединения
CdGa2O4 типа шпинели, растворяющего значительное количество Ga2O3.
Система относится к эвтектическому типу.
Литература
1. D a t t a R. К., R. Roy, Journ. Amer. Ceram. Soc., 51, № 5, 297,
1968.
BaO— Yb2O3
Спицын с сотрудниками [1] показали, что гексагональная фаза обра-
зуется при соотношении ВаО : Yb2O3, равном 1.5. и имеет формулу ЗВаО-
2Yb2O3. При распаде этого соединения образуется сразу Yb»O3 и соединения
1 : 1 не существует. Соединения общей формулы Ba3Ln4O9 образуются также
для Ln = La, Tu, Er, Ho, Dy, Gd.
Л итература
1. Спицын В. И., Л. М. Ковба, М. В. П а р о м о в а,
И. В. Юдинская, И. Г. Прокофьева, ДАН СССР, 180,
№ 4, 879, 1968.
792
Дополнение
La2O3— Sm2O3
Мюллер-Бушбаум [1] показал, что в интервале 0—23 мол. % La2O3
(при 2300°) существует моноклинная В-форма. В интервале 24—28 мол. %
La2O3 происходит постепенный переход в гексагональную 4-форму, рас-
пространяющуюся до чистого Ьа2О3.
Литература
1. Miiller-Buschbaum H.-К., Zs. anorgan. allgem. Chem., 355,
№ 1—2, 41, 1967.
La2O3— Yb3O3
Мюллер-Бушбаум и Теске [1 ], получая сплавы при 1600° и выше 2000°
(плазменная печь), показали, что область кубического твердого раствора
на основе Yb2O3 простирается до 8 мол. % La«O3, а перовскитовый твердый
раствор находится в пределах от 45 до 60 мол. % Ьа2О3. На монокристаллах
LaYbO3 были определены параметры ее ромбической элементарной ячейки
типа GdFeO3: а=6.01, 5=5.81, с=8.39 А.
Литература
1. Muller-Buschbaum Н., С. Teske, Inorg. Nucl. Chem. Lett.,
4, № 3, 151, 1968.
Cs2O—GeO2
Ланглет и Мишель [2] на основании дифференциального термического
анализа смесей CsNO3+GeO2 доказывают, что в системе существует соеди-
нение 2Cs2O-HGeO2, а не 2Cs2O-10GeO2, как полагал Лаббе [1]. Полученное
соединение плавится при 1090°, имеет кубическую элементарную ячейку
(а= 13.77 А), а при 892° обнаруживает полиморфное превращение.
Л итература
1. Labbe J. Р., Ann. Chim., 10, № 7-8, 317, 1965.
2. L a n g 1 е t G., A. M i c h e 1, Rev. chim, mineral., 3, № 3, 579, 1966,
Cu2O—GeO2*
Сперанская [1 ] изучила систему методом термографии, помещая смеси
в атмосферу азота. Система эвтектическая. Обнаружены твердые растворы:
в интервале 1.7—6.5 мол. % Си2О на основе тетрагональной Ge02 и на ос-
нове Си2О с предельной концентрацией 15 мол. % GeO2.
Литература
1. Сперанская Е. И., Изв. АН СССР, неорг. матер., 3, № 8, 1458,
1967.
Дополнение
793
CuO—GeO2*
Сперанская [1] исследовала систему в окислительных условиях. Обна-
ружено соединение CuGeO3, имеющее размытый максимум плавления
при 1173°, за которым окисная медь переходит в закисную.
Л итература
1. Сперанская Е. И., Изв. АН СССР, неорг. матер., 3, № 8, 1458,
1967.
In2O3—GeO2*
Саркисов с сотрудниками [1 ] изучили систему в субсолидусной области
(нагревание при 1200°). Обнаружено одно соединение In2O3'2GeO2 — пиро-
германат индия.
Литература
1. Саркисов Э. С., Ю. М. X о ж а и н о в, Р. А. Лидин, Изв.
АН СССР, неорг. матер., 4, № 3, 473, 1968.
Ег2О3—GeO2*
Петрова и Бондарь [1 ] изучили систему методом закалки. Установлено
существование трех соединений: Er2O3-GeO2 и Er2O3-2GeO2, плавящихся
конгруэнтно соответственно при 2000 и 1875°, и низкотемпературного
2Er2O3-GeO2, диссоциирующего при 1600°. Вблизи GeO2 существует область
несмешивающихся жидкостей.
Литература
1. Петрова М. А., И. А. Бондарь, Изв. АН СССР, неорг. матер.,
5, 1969.
РЬО—GeO2
Гужю с сотрудниками [1] полностью изучили систему по кривым охла-
ждения сплавленных образцов. Обнаружено четыре соединения: PbO-4GeO3
плавится инконгруэнтно при 844° и испытывает полиморфное превращение
при 816°; PbO-GeO2 плавится конгруэнтно при 802°; 3PbO-2GeO2 плавится
инконгруэнтно при 733°; 3PbO-GeO2 плавится конгруэнтно при 738°. Для
первых трех соединений характерна ромбическая сингония.
Литература
1. Gouju D., J. Fournier, R. Kohlmuller, Compt. rend.,
266, ser. C., № 14, 1063, 1968.
51 H. А. Торопов и др., ни. 1
794
Дополнение
Fe2O3—GeO2
Менковский с сотрудниками [1] построили диаграмму плавкости си-
стемы. Наблюдение за температурой плавления смесей Fe2O3 и GeO2, поме-
щенных на нагреваемую электрическим током,' платиновую пластинку,
производилось с помощью микроскопа. Соединение 2F2O3-3GeO2 плавится
инконгруэнтно при 1335 ± 5°, FesO3.4GeO« — конгруэнтно при 1180 + 5°.
Германат, ранее рассматриваемый как 2Fe2O3-7GeO2, оказывается по составу
ближе к Fe2O3-4GeO2.
Литература
1. Менковский М. А., В. Ф. Ч у р б а к о в, Н. И. Ч е р н о в,
А. Н. Спектор, Ю. С. К а р а б а с о в, Т, И. Ч у р б а-
к о в а, Журн. неорг. хим., И, № 2, 430, 1966.
ВаО—TiO2
Тиллмане [1], нагревая смесь, богатую TiO2, получил небольшие кри-
сталлы, в которых, по данным исследования с помощью электронного
микроанализатора, отношение Ba : Ti оказалось равным 1 : 5. Новое соеди-
нение, по-видимому, моноклинной сингонии, вычисленная плотность
4. 58 г/см3.
Литература
1. Tillmanns Е., Naturwissenschaften, 55, № 2, 81, 1968.
Сг2О3—ТЮ2
Барри с сотрудниками [2] получали смешанные окислы хрома и титана
в плазменной горелке. Обнаружены твердые растворы в широкой области
концентраций. Дискретные фазы, отвечающие £ формуле TiB_2Cr2O2„_1,
предложенной Андерсоном с сотрудниками [1], не обнаружены.
Л итература
1. Anderson S., A. Sundholm, A. Magneli, Acta chem.
Scand., 13, № 5, 989, 1959.
2. Barry T. I., R. K. Bayliss, L. A. Lay, Journ. Materials Sci.,
3, № 3, 239, 1968.
LisO— ZrO2
Шольдер с сотрудниками [1 ] исследовали систему в субсолидусной
области (обжиг до 1000°). Получены соединения Li2O-ZrO2, 2Li2O-ZrO2 и
4Li2O-ZrO2.
Литература
1. Scholder R., D. R a d е, Н. Schwarz, Zs. anorgan. allgem.
Chem., 362, № 3—4, 149, 1968.
Дополнение
795
СаО— ZrO2
Гарви [1] утверждает о существовании соединения CaO-4ZrO2, имею-
щего полиморфное превращение при 1650°. Поле этого соединения примы-
кает к полю кубических твердых растворов.
Литература
1. G а г v i е R. С., Journ. Amer. Ceram. Soc., 51, № 10, 556, 1968.
T12O3—ZrO2*
Плющев с сотрудниками [1 ] изучали систему, нагревая соосажденные
гидроокислы в интервале 500—740. Образование соединений и твердых
растворов не было констатировано.
Литература
!• Плющев В. Е., В. И. К ушаковский, Б. А. Жидков,
Л. И. Тренин, И. А. Р о з д и н, Изв. АН СССР, неорг. матер.,
4, № 5, 738, 1968.
La2O3— ZrO2
Руане [1 ] изучал систему при высоких температурах, доводя опыты
до плавления. Применялся термический анализ и высокотемпературная
рентгенография. Соединение La2Zr2O7 плавится конгруэнтно при' 2280°.
На стороне Ьа2О3 обнаружено два гексагональных твердых раствора и куби-
ческий (при более высокой температуре).
Литература
1. R ouanet A., Compt. rend., 267, ser. С, № 5, 395, 1968.
SnO3—ZrO3
Коллинз и Фергусон [1 ] рентгенографически исследовали моноклинные
твердые растворы на основе ZrO2, получаемые соосаждением гидроокислов,
с последующим прокаливанием при 900°. Предельная концентрация SnO2
составляла 15 мол. %.
Литература
1, Collins J. F., I. F. Ferguson, Journ. Chem. Soc., (A), № 1,
4, 1968.
51*
796
Дополнение
HfO2— ZrOa
Ру с сотрудниками [1 ] определили точки плавления смесей HfO2 и ZrO2
(предварительно сплавленных) и нашли, что HfO2 и ZrO2 образуют непрерыв-
ную серию твердых растворов, однако параметр элементарной ячейки моно-
клинных твердых растворов обнаруживает отрицательное отклонение от пра-
вила Вегарда. Точки плавления твердых растворов расположены прибли-
зительно на прямой линии, соединяющей точки плавления чистых окислов.
Температура превращения моноклинной модификации в тетрагональную
повышается с ростом содержания HfO2 в твердом растворе.
Литература
1. Ruh R., Н. J. Gerrett, R. F. D о m a g а 1 a, N. М. Т а 11 а п,
Journ. Amer. Ceram. Soc., 51, № 1, 23, 1968.
Cr2O3— ZrO2
Коллинз и Фергусон [1] изучили моноклинные твердые растворы на
основе ZrOa, получаемые соосаждением гидроокислов с последующим обжй-
гом при 900°. Предельная концентрация Сг2О3 составляла 30 мол. %.
Литература
1. Collins J. F., I. F. Ferguson, Journ. Chem. Soc., (A), № 1,
4, 1968.
Fe2O3—ZrO2
Коллинз и Фергусон [1 ] изучали рентгеновским методом моноклинные
твердые растворы на основе ZrO2. Смеси готовились соосаждением гидро-
окислов с последующим обжигом при 900°. Предельное содержание Ре«Оз
в моноклинном твердом растворе составляло приблизительно 20 мол. %.
Литература
1. Collins J. F., I. F. Ferguson, Journ. Chem. Soc., (A), № 1,
4, 1968.
LisO—H1O2*
Шольдер с сотрудниками [1] изучали систему в субсолидусной области
(обжиг до 1000°). Получены соединения Li2O-HfO2, 2Li2O-HfO2 и 4Li2O-
HfO2.
Литература
1. S с h о 1 d е г R., D. R a d е, Н. S с h w а г z, Zs. anorgan. allgem.
Chem., 362, № 3-4, 149, 1968.
Дополнение
797
Tl2O3-HfO2*
Плющев с сотрудниками [1 ] изучали систему, нагревая соосажденные
гидроокислы в температурном интервале 300—740°. Химических соединений
и твердых растворов не было обнаружено, хотя некоторая стабилизация
тетрагональной двуокиси гафния констатирована.
Литература
1. Плющев В. Е., В. И. К у ш а к о в с к и й, Б. А. Жидков,
Л. И. Тренин, И. А. Р о з д и н, Изв. АН СССР, неорг. матер.,
4, № 5, 738, 1968.
Sm2O3—ШО2*
Исупова, Глушкова и Келер [1 ] построили диаграмму состояния (ниже
ликвидуса) в области, богатой HfO2. Обнаружены: 1) моноклинный твердый
раствор на основе HfO2 с содержанием 2 мол. % Sm^ (при 1000°); 2) обшир-
ная область кубических флюоритовых твердых растворов; 3) пирохлорная
фаза на основе соединения Sm2O3-2HfO2, устойчивая ниже 1000°.
Литература
1. Исупова Е. Н., В. Б. Глушкова, Э. К. Келер, Изв.
АН СССР, неорг. матер., 4, № 3, 399, 1968.
UO3—ТЬО2*
Бексхоттен и Кема [1 ] показали, что систему следует изучать гидро-
термальным методом, исходя из соосажденных гидроокисей. При 230—260°
образуются твердые растворы на основе ThO2 с максимальным содержанием
UO3 25 мол. % и соединение UThO3, не получаемое «сухим» способом. Гекса-
гональная решетка UThO3 на воздухе разрушается при 850—1000° и в азоте
при 800—900°.
Литература
1. Boekschotten Н. J. С., N. V. Кета, Journ. Inorg. Nucl.
Chem., 30, № 1, 119, 1968.
СаО—V2O3
Макаров с сотрудниками [1] изучили кристаллооптические свойства
ванадатов кальция. Игольчатые кристаллы CaO-V2O8 характеризуются
моноклинной сингонией (Р = 105°40'), 7Vg==2.13, Nm= 1.995, АГр=1.916,
плотность 3.59 г/см3. 2CaO-V2O5 кристаллизуется в моноклинной сингонии
(₽= 112°), /Vg=2.132, JVm=2.00, АГр=1.942, плотность 3.36 г/см3. ЗСаО-
• V2O3 кристаллизуется в моноклинной сингонии, Ng= 1.890, Nm = 1.885,
Np = 1.864, плотность 3.16 г/см3.
Литература
1. Макаров В. А., А. А. Фотиев, Л. Н. Серебрякова,
Кристаллография, 13, 2, 333, 1968.
798
Дополнение
Na2O— Nb2O8
Андерсон [1] в «сухих» условиях на участке от NaNbO3 до Nb2O8 полу-
чил только два соединения: Na2O-3Nb2O8 и Na20.13Nb2O8.
Брюссе с сотрудниками [2] доказывают, что в системе существуют со-
единения Na2O-Nb2O8, Na2O-2Nb2O8. Na^^NbgOg, и Na2O-13Nb2O8. Для
этих соединении приведены межплоскостные расстояния.
Литература
1. Andersson S., Acta chem. Scand., 21, № 7, 1777, 1967.
2. Brusset H., H. Ci 11 i er-Pandraud, J. P. Belle, Bull.
Soc. Chim. France, № 8, 2784, 1967.
Ag2O- Nb2O8*
Брюссе с сотрудниками [1] синтезировали из смеси Ag2SO4 и Nb2O8 при
различных температурах (от 700 до 1000°) шесть ниобатов: Ag„O • 13Nb2O8,
Ag2O-7Nb2O8, Ag2O-4Nb2O8, Ag2O-3Nb2O8 (возможно, 3Ag2O-8Nb2O8), Ag2O-
2Nb2O8. и Ag2O-Nb2O8. Соединения 1 : 7, 1 : 3 (3 : 8) и 1 : 2 были получены
впервые.
Л итература
1. Brusset Н., Gillier-Pandraud, J. Р. Belle, Bull.
Soc. Chim. France, № 7, 2276, 1967.
SrO—Nb2O8
Уистон и Смит [1] описывают соединения Sr6Nb2Ou с гранецентрирован-
ной кубической ячейкой (а = 8.3055 ±0.0008 A), Sr8Nb40i8 с гексагональной
ячейкой, ромбический SrNb2O6 с плотностью 5.1 г/см3, SrNb6O16 и Sr3Nb1(.Os«,
оба с тетрагональными ячейками и плотностью соответственно 4.8 и 4.9 г/см3.
Литература
1. W h i s t о n C. D., A. J. Smith, Acta crystallogr., 23, № 1, 82, 1967.
BaO-- Nb2O8
Уистон и Смит [1] показывают, что соединению 6BaO-7Nb2O8 правиль-
нее приписывать формулу 5BaO-6Nb2O8.
Литература
1. W h i s t о п С. D., A. J. Smith, Acta crystallogr., 23, № 1, 82, 1967.
Дополнение
799
Ag2O— Та2О8*
Брюссе с сотрудниками [1], обжигая смеси Ag2SO4 и Та2О8 при различ-
ных температурах от 700 до 1350°, получили соединения; Ag2O-Ta2O8, Ag2O>
•2Та2О8 и Ag2O-4Ta2O8. При 1200° Ag2O-Ta2O8, теряя Ag2O, переходит
в Ag2O-2Ta2O5, который при 1250° переходит в Ag2O-4Ta2O8.
Литер а’т ура
1. В russet Н., J. J. Р. Martin, G. I a n s о n, Bull. Soc. Chim.
France, № 4, 1323, 1968.
SrO—Ta2O8*
Уистон и Смит [2] методом твердофазовых реакций получили три со-
единения: Sr6Ta2Ou кубической сингонии, SrTa2Oe тетрагональной сингонии
и Sr8Ta2Ou. Соединение Sr2Ta2O7, на которое указывал Исмаил-Заде [1],
не получено.
Литература
1. Исмаил-Заде И. Г., Кристаллография, 4, 618, 1961.
2. WhistonC. D., A. J. Smith, Acta crystallogr., 23, № 1 82, 1967.
Eu2O3—Та2О8*
Пинаева с сотрудниками [1,2] исследовали систему в окислительной
атмосфере при 1350 и 1550°. Обнаружено три соединения, названные мета-
танталат (25 мол. % Еи2О3), ортотанталат (50 мол. % Еи2О3), плавящийся
конгруэнтно при 1800°, и паратанталат (ЗЕи2О3-Та2О8). Соединения харак-
теризуются соответственно моноклинной, ромбической и кубической син-
гонией. Кроме того, была обнаружена фаза с молярным отношением
Ei^Os : Та2О8, равным 1 : 5 или 1 : 6. Этот политанталат при 1350—1400°
претерпевает перитектический распад на а-Та2О8 и метатанталат.
Литература
1. Пинаева М. М., Е. И. Крылов, В. М. Р я к о в, Изв.
АН СССР, неорг. матер., 3, № 9, 1612, 1967.
2. Пинаева М. М., Е. И. Крылов, В. М. Р я к о в, Изв.
АН СССР, неорг, матер., 4, № 7, 1118, 1968.
ТЮ2—Та2О8*
Уоринг и Рот [1] изучили систему методом закалки. Обнаружено моно-
клинное соединение TiO2-Ta2O8, плавящееся конгруэнтно при 1662°, и
соединения TiO2-7Ta2O8, устойчивое до 1190°, и TiO2-49Ta2O8, устойчивое
до 1230°; Та2О8 растворяется в TiO2 до 9 мол. % (при 1630°).
Литература
1. Waring J. L., R. S. Roth, Journ. Res. Nat. Bur. Stand., 72A,
№ 2, 175, 1968.
800
Дополнение
СаО—Bi2O3
Витинг с сотрудниками [1] визуально-политермическим методом изу-
чили часть системы, примыкающую к Bi2O3. Обнаружено конгруэнтно пла-
вящееся (890°) соединение 2CaO-3Bi2O3, обладающее некоторой областью
гомогенности. Предполагается существование соединения, более богатого СаО.
Литература
1. Витинг Л. М., Н. Н. Голубева, Г. П. Горбовская,
Вести. Моск, унив., 22, сер. II, Химия, № 6, 89, 1967.
PbO—Bi2O3
Витинг и Горбовская [1] визуально-политермическим методом нашли
два соединения: 2PbO-Bi2O3 (плавится конгруэнтно при 655°) и 2PbO-3Bi2O3
(плавится инконгруэнтно при 640°).
Литература
1. Витинг Л. М., Г. П. Горбовская, Вести. Моск, унив., 22,
сер. II, Химия, № 6, 92, 1967.
ВаО—Сг2О3*
Гордеев и Сердюков [1] изучили систему методом закалки. Обнаружено
два соединения: ВаО-Сг2О3, плавящееся конгруэнтно при 1430°, кубической
сингонии, N=2.2, плотность 5.05 г/см3; ЗВаО-Сг2О3, плавящееся конгруэнтно
при 1440°, кристаллы двуосны, /Vg=1.95, плотность 4.67 г/см3. Авторы син-
тезировали оксихромит бария ЗВаО-Сг2ОБ.
Литература
1. Г о р д е е в С. Я., В. И. Сердюков, Изв. АН СССР, неорг. матер.,
3, № 9, 1653, 1967.
Еи2О3—Сг2О3
Портной с сотрудниками [1] построили диаграмму плавкости, показав
наличие одного конгруэнтно плавящегося (2290°) соединения ЕпСгО3 с ром-
бической решеткой типа перовскита и плотностью 7.38 г/см3.
Литература
1. Портной К. И., О. А. Мордовии, Н. И. Тимофеев,
Изв. АН СССР, неорг. матер., 4, № 8, 1368, 1968.
Дополнение
801
Li2O— МоОз
Ван дер Вилен с сотрудниками [1] подтвердили существование четырех
соединений, обнаруженных Хоерманном (см. стр. 617), однако нашли, что
LisO-2MoO3 и LijO-ЗМоОз плавятся конгруэнтно соответственно при 593
и 607°. Инконгруэнтное плавление Li2O-4MoO3 наблюдается при 591°.
Литература
1. Van der W i е 1 е n J. С., H. H. Stein, J. М. S t е v е 1 s, Journ.
Non-Crystalline Solids, 1, № 1, 18, 1968.
Na2O—МоОз
Согласно Кайлле [1], Na2Mo4O13 растворяет MoO3. Предельная концен-
трация твердого раствора отвечает составу Ма2Мо4О13-2МоОз. Соединение
Na2O -3MoO3 не обнаружено.
Литература
1. С a i 11 е t Р., Bull. Soc. Chim. France, № 12, 4750, 1967.
K2O—МоО3
Согласно Кайлле [1], К2Мо4О13 растворяет МоО3 в количестве, отве-
чающем составу К2Мо4О13'4МоО3.
Литература
1. С a i 11 е t Р., Bull. Soc. Chim. France, № 12, 4750, 1967.
CuO—MoOs*
Кольмюллер и Фори [1], построившие диаграмму состояния системы,
обнаружили два соединения: СиО-МоО3, плавящееся инконгруэнтно при
850°, имеющее полиморфное превращение при 550° (высокотемпературная
форма гексагональная), и ЗСиО-2МоО3, плавящееся инконгруэнтно при 870°,
ромбической сингонии, с плотностью 4.67 г/см3.
Литература
1. Kohlmuller R., J. Р. F a u г i е, Compt. rend., 264, ser. С, № 22,
1751, 1967.
802
Дополнение
СаО—МоО3*
Кунев с сотрудниками [1] изучали систему МоО3—СаМоО4, исходя
из смеси трехокиси молибдена и молибдата кальция методом термографии.
Соединении с более высоким, чем СаМоО4, содержанием МоО3 не обнаружено,
и систему следует отнести к простым эвтектическим. Эвтектика, плавящаяся
при 727 ± 3°, содержит 25 вес. (19.4 мол.) % СаМоО4. Молибдат кальция
плавится конгруэнтно при 1515°.
Литература
1. Кунев Д. К., Л. В. Беляевская, А. Н. Зеликман,
Журн. неорг. хим., 11, № 8, 1989, 1966.
ZnO—МоО3*
Частично изучена Куневым с сотрудниками [1]. Имеющееся соединение
ZnMoO4 плавится инконгруэнтно при 1000°. Между МоО3 и ZnMoO4 наблю-
дается эвтектика, содержащая 42 вес. (31.8 мол.) % ZnMoO4 и плавящаяся
при 707°.
Литература
1. Кунев' Д. К., Л. В. Беляевская, А. Н. Зеликман,
Журн. неорг. хим., 11, № 8, 1989, 1966.
A1SO3—МоО3*
Трунов с сотрудниками [1] изучили систему в субсолидусной области
(обжиг при 750°). Установлено образование только одного соединения А1,О3-
ЗМоО3, кристаллизующегося в ромбической сингонии, плотность 5.01 г/см®.
Литерату р-а
1. Трунов В. К., В. В. Луценко, Л. М. Ковба, Изв. Высш,
учебн. завед., Химия и хим. технология, 10, № 4, 375, 1967.
РЬО—МоО3*
Кунев с сотрудниками [1], пользуясь методом термографии, показали,
что система МоО3—РЪМоО4 относится к простым эвтектическим. Эвтектика
содержит 49.0 вес. (27.4 мол.) % РЪМоО4 и плавится при 672°. Молибдат
свинца плавится конгруэнтно при 1063.5°
Литература
1. Кунев Д. К., Л. В. Беляевская, А. Н. Зеликман,
Журн. неорг. хим., 11, № 8, 1989, 1966.
Дополнение
803
HfO2—MoOg*
Фреундлих и Торе [1] нагревали смеси HfO2 и МоО3 в запаянной квар-
цевой трубке в интервале 600—900°. Фазы фиксировались рентгенографи-
чески. Установлено существование одного соединения HfMo2O3, диссоции-
рующего на исходные окислы выше 1000°. Кристаллы полученного молибдата
гафния относятся к тригональной сингонии. Плотность пикнометрическая
4.88 г/см3.
Л итература
1. Freundlich W., J. Т h о г е t, Compt. rend., 265, ser. С, № 2,
96, 1967.
NasO—WO3
Кайлле [1] показал, что Na2W4O13 растворяет WO3, до состава
Na2W4O13-2WO3.
Л итература
1. С a i 11 е t Р., Bull. Soc. Chim. France, № 12, 4750, 1967.
K2o—wo3
Гельзинг с сотрудниками [2] построили диаграмму плавкости визуаль-
ным’методом. Перитектики для трех инконгруэнтно плавящихся соединений
K2O-2WO3, K2O-3WO3h К2О-4WO3 находятся при соотношениях WO3 : К2О,
равных 1.92, 2.31 и 3.45, и температурах 654, 718 и 898°. K2O WO3 плавится
конгруэнтно при 913°. Кайлле [1] показал, что K2W4O13 растворяет WO3
до состава K2W4O13-4WOg.
Литература
1. Caillet Р., Bull. Soc. Chim. France, № 12, 4750, 1967.
2. Gelsing R. J. H., H. N. Stein, J. M. S t e v e 1 s, Rec. trav.
chim. Pays-Bas, 84, № 11, 1452, 1965.
CdO—WO3*
Кисляков и Лопатин [1], пользуясь термографическим методом, пост-
роили диаграмму состояния, показывающую наличие только одного соеди-
нения, CdWO4, плавящегося без разложения около 1300°. Эвтектика, содер-
жащая 65 мол. % WO3, плавится при 1100°.
Литература
1. Кисляков И. П., Б. П. Лопатин, Журн. неорг. хим., 12,
№ И, 3163, 1967.
804
Дополнение
Л12О8—WO8
Трунов с сотрудниками [1] изучили систему в субсолидусной области
(обжиг при 1000°). Установлено существование только одного соединения
AlaOg-3WOg ромбической сингонии с плотностью 3.46 г/см3.
Литература
1. Трунов В. К., В. В. Луценко, Л. М. Ковба, Изв. Высш,
учебн. завед., Химия и хим. технология, 10, № 4, 375, 1967.
NdjOg— WO3
Трунов с сотрудниками [1] изучили систему в субсолидусной области
(обжиг при 1250°) от 50 до 100 мол. % Nd2O3. Обнаружено два соединения:
Nd2Og-WOg и 3Nd2O3-WO3, относящиеся соответственно к моноклинной и
тетрагональной сингонии.
Литература
1. Трунов В. К., Г.. И. Т ю ш е в с к а я, Н. С. Афонский,
Журн. неорг. хим., 13, № 4, 936, 1968.
Ег2О3—WO3*
Трунов с сотрудниками [1] исследовали систему в интервале 50—75 мол. %
Ег2О3 (обжиг при 1250°). Получено три соединения: 3Er2O3-WO3, пред-
положительно llEr2O3-6WOg и ErsWO0, — относящиеся соответственно
к ромбоэдрической, гексагональной и моноклинной сингонии.
Литература
1. Трунов В. К., Г. И. Т ю ш е в с к а я,
Журн. неорг. хим., 13, № 4, 936, 1968.
Н. С. Афонский,
Sm2O3—WO3, Eu2O3— WO3*, Gd2O3—WO,*, Tb2O3—WO3*
Амосов и Плющев [1] синтезировали (обжиг в интервале 600—1000°)
соединения общей формулы Ln2O3*3WO3, однако отмечают возможность
существования более основных вольфраматов. Все изученные соединения
общей формулы LngO3’3WO3 имеют моноклинную решетку, температуру
плавления (в последовательности Sm—Ей—Gd—ТЬ) 1220, 1260, 1290 и
1360° и плотность 7.23, 7.36, 7.47 и 7.59 г/см3.
Литература
1. Амосов В. М., В. Е. Плющев, Журн. неорг. хим., 12, № 5,
1125, 1967.
Дополнение
805
MoOg—WO3
Семикина и Лимонов [1] изучили систему в субсолидусной области (обжиг
на воздухе при 430°). В соответствии с данными рентгенографии образуется
три соединения: WO3-MoO3 и два соединения с точно не установленной фор-
мулой — 3WO3MoO3 или 2WO3-MoO3 и WO3-2MoO3 или WO3-3MoOg.
Возможно, что неопределенный состав двух последних соединений связан
с образованием твердых растворов.
Литература
1. Семикина Л. Е., В. Е. Лимонов, Журн. неорг. хим., 13,
№ 7, 1932, 1968.
Eu2O3—UO2
Гроссман, Льюис и Руней [1] на основании изучения фаз в системе
в условиях нейтральной атмосферы методами термического анализа, рент-
геновской дифракции и керамографии установили широкую растворимость
EugOg (более 60 мол. % при 2100°) в UO2 (флюоритовая структура) и незна-
чительную растворимость UO2 в моноклинной Еи2О3. Кубический Еи2О8
в присутствии UO2 стабилен до 1885°. Эвтектика между флюоритовой фазой
и моноклинной EugOg имела место при 80 мол. % Еи2О3 и 2125°.
Литература
1. Grossman L. N., J. Е. Lewis, D. М. Rooney, Journ. Nucl.
Mater., 21, № 3, 302, 1967.
ZrOg—UO2
Ромбергер с сотрудниками [1] исследовали систему в субсолидусной
области (600—1130°), выдерживая смеси в расплавленных фторидах (при
перемешивании). Область ниже 1500° представлена по-новому. При 1110°
и 97.2 мол. % ZrO2 существует эвтектическая точка, в которой находятся
в равновесии: 1) ZrO2 тетрагональный (2.8 мол. % UO2), 2) ZrO2 моноклин-
ный (0.2 мол. % UO2), 3) кубическая фаза (0.38 мол. % ZrO2).
Литература
1. Romberger К. А., С. F. Baes, Н. Н. Stone, Journ. Inorg.
Nucl. Chem., 29, № 7, 1619, 1967.
806
Дополнение
Y2Og—PdO* (1), La2Og—PdO* (2), Nd2O3—PdO* (3),"i
Sm2O3—PdO* (4), Eu2O3— PdO* (5), Gd2O3—PdO* (6),
Dy2Og—PdO* (7), Ho203— PdO* (8), Er2O3—PdO* (9),
Tu2Og—PdO* (10), YbsO3—PdO* (11), Lu2O3—PdO* (.12)
Системы изучили Мак-Даниель и Шнейдер [1]. PdO при 800° диссоции-
рует с образованием металлического палладия. В (3), (4) и (5) обнаружено
три соединения: 2:1 (2Ln3Og-PdO)I 1 :1 и 1: 2; в (2);обнаружено 2:1 и 1:2,
в (6) — 1 : 1 и 1 : 2, в (7) — 1:1. Все эти соединения диссоциируют вблизи
1000°. В остальных системах соединений не обнаружено.
Литература
1. McDaniel С. L., S. J. Schneider, Journ. Res. Nat. Bur.
Stand., 72A, № 1, 27, 1968.
UO2—PuO2
Лион и Вайли [1] изучили диаграмму состояния системы UO3—PuO2.
Установлены непрерывные твердые растворы без максимума или минимума.
Температура плавления UO2 2840 ±20°, а РиО2 2390 ±20°.
Литература
1. Lyon W. L., W. Е. В a i 1 у, Journ. Nucl. Mater., 22, № 3, 332,
1967.
А12О3—Н2О
Хаушильд [1] описывает третью форму состава А1(ОН)3, названную
им нордстрандитом. Эту модификацию открыли Ван Нордстранд, Хеттингер
и Кейт [2 J. Новое соединение получалось в водных растворах этилендиамина
в виде пластинчатых кристаллов с плотностью 2.51 г/см3, с отличной от дру-
гих гидратов рентгенограммой и ИК-спектрограммой.
Литература
1. Н auschil’d -U., Zs. anorgan. allegem. Chem., 324, № 1—2, 15, 1963.
2. Van N о r d s t r a n d R. A., W. P. Hettinger, C. D. Keith,
Nature, 177, № 4500, 173, 1956.
АЛФАВИТНЫЙ УКАЗАТЕЛЬ СИСТЕМ
AgF— ZnF2 768
AgsO—NbsOB 798
Ag2O—Та2О6 799
А14Сз—A12Os 749
AlFg—KF/ 769
A1F3— LiF 769
A1F3— NaF 763
AIN—ALOg 750
ALOg—Al4Cg 749
AljOg—B2Og 750, 182
AlgOg—BaO 222
A12O3—BeO 204
AlgOg—BLOg 588
Al2Og—CaF2 746
A12O3—CaO 210
AlgOg—CdO 225, 788
A12O3—Ce2O3 236, 324
AlgOg— CoO 260
AlaO3—Cr2Og 251
AlgOg—CsgO 787
AlaO3—CuO 203
AlgOg—Cu2O 203
AlgOg—Dy2O3 324
ALOg—Er2O3 324
A12O3—EuO 242
AlgOg—EugOg 243, 324
AlgOg—FeO 254
A12O3—Fe2O3 257
ALOg—Ga2Og 225
AlgOg— Gd2O3 243, 324
ALOg—GeCL 353
A12O3—H2O 732 , 806
A12O3—HogO3 324
AlgO3— In2O3 326
AlgOg—LagO3 232
AlgOg—LigO 197, 787
ALOg—LugOg 326
ALOg—MgO 207, 788
ALOg—MnO 253
AlgOg—MoOg 802
ALOg— NaF 745
AlgOg Na2O 200
ALOg—NbgO3 545
ALOg—NdgOg 238, 324
AlgOg—NiO 260, 789
A12O3—P2O3 503
Al2Og—PbO 247
AlgO3—Pr2O3 238, 324
AlgOg—SCgOg 226, 326
AlgOg—SiOg 63, 784
AlgOg—SnigOg 240, 324
AlgOg— SnOg 367
AlgOg—SrO 219
AlgOg—Ta2O6 577
AlgOg— ТЬ2О3 244
AlgOg—TiOg 391
AlgOg—TigO3 249
AlgOg—TugOg 324
AlgOg—UOg 659
AlgOg—VgOg 527
AlgOg—WOg 637, 804
AlgOg—YgOg 228
AlgOg—YbgOg 245, 326
AlgOg—ZnO 224, 788
AlgOg—ZrOg 435
AsgOg—SbgOg 586
BF3—UF6 779
BFb—UFe 779
BgOg—AlgOg 182
В2О3—BaO 177
В2О3—BeO 170
В2О3—BigOg 191
BgOg—CaO 173, 787
В2О3—CdO 181
В2О3—CoO 195
BgOg—CsgO 167, 787
BgOg—К2О 165
В2О3—LagOg 186
В2О3—LigO 161
BgOg—MgO 171
В2О3—MnO 195
В2О3—NagO 163
BgOg—NbgOg 192
BgOg—NdgOg 187
WWWWWWWWWWWCdWWWWWWWWWWWWWWWWWlXlWWWWW
ФФФФФФФФФФФФФФФФС?ФФС?С?ФС?С?С?С?ФС?С?ЙЗСЗС?С?С?С?С?С?С?С?С?£?ФС?ФФФ»»»О«Э»»»»»»
ЛЧЛч’»ч1Лч»Ч»ЧооОСОООСОООООООООООООООООООООООООЧЧЧЧрррОрррррр
II I I I I I I I I I I I I I I I I I I I I I I I I I I I I I I I I I I I I I I I I I I I I I I I I I I I I II
ggoow
OD
w
3gg£^
>£Ч WJF* QQ
со
co
S? 2? О
^ССС-^ОТ^
сл
о
со
о
8
00
Алфавитняй указатель систем
. Торопов и др., КН.
Алафвитный указатель систем
810
Алфавитный указатель систем
Cr2Og—Al2Og 251
Cr2O3—ВаО 800
Cr2Og—ВеО 599
Сг2О3—СаО 602
Cr2Og—Cu2O 598
Cr2Og—DyaO3 330
Cr2O3—Er2O3 330
Cr2Og—EtinOg 330, 800
Cr2O3—FeO 612
Cr2O3— FeaO3 332
Cr2O3— GaaO3 330
Cr2O3— Gd2O3 330, 610
Cr2O3—H2O 739
Cr2Og—InaO3 330
Cr2O3— IrO. 722
Cr2O3—La2O3 330, 608
Cr2O3—Lu203 330
Cr2Og—MgO 599
Cr2Og—MoO3 624
Cr2O3—Nb2O6 567
Cr2O3—Nd2O3 330, 609
Cr2O3—NiO 613
Cr2O3—PbO 611
Cr2O3—Pr2Os 330
Cr2O3—SCgO3 332, 605
Cr2Og—SiO2 112
Cr2O3— Sm2O3 330, 609
Cr2O3—TiO2 409, 794
Cr2O3—UO2 675
Cr2O3—UO3 675
Cr2O3—V,O5 529
Cr2O3—WOg 652
Cr2O3—Y.O3 330, 607
Cr2O3—YbjOg 330
Cr.O3—ZrO2 466, 796
CsF—ErF3 771
CsF—LaFg 770
CsF—LiF 764
CsF— PrF« 771
CsF— SmF3 771
CsF—ThF4 777
CsF—UF4 778
CsF—YF. 770
CsF—ZnF2 768
CsF—ZrF4 776
CSjO—A12O3 787
Cs2O—B2O3 167, 787
Cs2O—GeO2'344, 792
CsaO—MoO2 621
Cs2O—Nb2O5 537
Cs2O—SiO2 22
CSjO—TiO, 376
CSjO—V2OB 520
CuO—Al2Og 203
CuO—Fe2Og 683
CuO—GeO, 793
CuO—MgO 135
CuO—MoO3 801
CuO—NiO 155
CuO—SiO2 23
CuO—ZnO 138
CuaO—Al2Og 2Q3
Cu2O—Cr2O3 598
Cu2O—GeOa 792
Cu2O—PbO 127
Cu2O—Si6a 23
Dy2Os—AlgOg 324
DyaO3—BaO 312
Dy8Og—CaO 311
DyaO3—CeO2 298
DyaOg—CraOg 330
DyaO3—EuO 791
DysOg—FeaO3 332
Dy2O3- Ga2Og 328
DyaOg—Gd2O3-313, 322
DyaO3 In2O3 336
°УаО3—IrO2 719
DyaOg—LaaOg 313, 321
ОуЛ—LuaO3 322
DyaO3—Nd2Og 321
DygO3— PdO 806
DyaOg-Sc.O» 334
Dy«O3—SiO2 90
Dy3O3—SrO 312
DyaOg—TiO2 398
DyaO3—UO2 667
DyxO3—ZrO2 457
ErFg—CsF 771
ErFg-KF 771
ErF3—RbF 771
Er2O3—ALjOa 324
EraO3—Cr2Og 330
Er2O3—EuO 791
Er2O3—Fe2O3 332
Er2O3— Ga2O3 328
Er2O3—Gd,O3 322
Er20g—Ge02 793
Er2Og—In20g 336
Er2O3—IrO. 720
EraO3—La.O3 322, 323
EraO3—Nd2Og 322
Er2O3—PdO 806
Er2Og—ScaOg*r334
EraO3—SiOat92
Er2Og—SrO 315
Er2O3—TbO, 310
EraO3-WO3 804
EuO—Al.Og 242
EuO—P3OS 504
EuO—CegOg 791
EuO—DyaOg 791
EuO—Er3O3 791
Алфавитный указатель систем.
811
EuO— Gd,0. 791
ЕиО—Ho2Os 791
EuO—La2Og 791
EuO—Lu2O8 791
EuO—Nd20g 791
EuO— Pr2O3 791
EuO—ScgOg 791
EuO—SiOg 86
EuO—Sm20s 791
EuO—SrO 786
EuO—YgO3 791
EugO3—А1а03 243, 324
EugOg—BaO 306
EugOg—CraOg 330, 800
EugOg—FeaOg 332
EugOg— GagOg 326
EugOg— IngOg 273
EugOg— IrOg 719
EugOg— LLO 305
Еи2О3—PdO 806
EugOg— PuOg 726
Еи2О8— SCgOg 334
EugOg—SiOg 87
EugOg—SrO 305
EugOg— TaaO8 799
EugOg—ThOg 484
EugOg—UO2 805
EugOg—UOg+a. 666
Л-WOg 804
a—ZrOg 454
-А12О8 254
FeO—CaO 151
FeO—Cr2Og 612
FeO—GeOg 363
FeO—MgO 148
FeO—MnO 147
FeO—MoO. 617
FeO—NbgO6 568
FeO—SiO2 117
FeO—TiOg 413
FeO—ZnO 152
FeO—ZrOg 467
FegO»-AlgOg 257, 788
FegOg—BaO 691
FegOg—BigOg 588, 704
FegOg—CaO 687
Fe2Og—CdO 693
FegOg—CoO 713
FegOg—CogO4 713
FegOg—CrgOg 332, 706
FegOg—CuO 683
FegO,-DygOg 701
FegOg—Er2Og 332, 701
FegOg EugOg 332, 698
FegOg— GagOg 330
FegOg—GdgOg 332, 699
FegOg— GeO, 363 , 794
FegOg—HogOg 332, 701
FegOg—IngOg 334
FegOg—LagOg 332, 696
FegOg—LigO 681
FegOg—LugOg 334
FegOg—MgO 685
Fe2Og—MnO 708
FegOg—MnsOg 708
FegOg—Mn8O4 710
Fe2Og—MoOg 625
Fe2Og—NagO 682
Fe2Og—NbgOB 569
Fe2Og—NdgOg 332
FegOg—NiO 714
FegOg—Р2О6 508
FegOg—PbO 702
FegOg—Pr2Og 332
FegOg—SCgOg 334, 694
FejjOg—SmgOg 332
FegOg—ТЬ2О3 700
FegOg—Tb4O7 700
FegOg—TiOg 417
FegOg-Ти.О8 332
FegOg—VgO6' 530
FegOg-WO, 653
FegOg—YjOg 332, 694
FegOg— YbgOg 332
FegOg—ZnO 693
FegOg—ZrOg 468, 796
FegO4—Mn,04 71Q
Fe3O4—ZrOg 468
Ga2Og—AlgOg 225
Ga2Og—BaO 790
GagOg—BigOg 588
GagOg—CaO 265
GagOg—CdO 790
Ga2O3—Cr2Og 330
GagOg—DygOg 328
Ga2Og— Ег2О3 328
Ga2Og—EugOg 326
GagOg—Fe«Og 330
Ga2Og—GdgOg 328
GagOg—Ho2Og 328
Ga2Og—IngOg 330
Ga2Og—К2О 789
Ga2Og—LaaOg 326
GagOg—LigO 264, 789
GagOg—LugOg 330
GagOg—MgO 264, 789
GasOg—NagO 789
GagOg-NbgO6 548
GagOg-Nd«Og 326
GagOg—P„O5 504
GagOg—PbO 790
GagOg-PrgOg 326
52*
812
Алфаивтный указатель систем
Ga203— SCjOa 267
GagOg—SiO2 72
Ga2Og—Sm2O3 326
Ga2O8— SrO 790
Ga2O3—Ta2O5 579
Ga2Oa—TiO2 393
Ga2O3—Tu2O8 330
Ga2O3-Y2O3 328
Ga2O3-Yb2O3 330
GasjOg—ZnO 267, 790
Gd2O3-Al2O3 324
GdaOg— BaO 308, 791
GdjO3—BeO 306
Gd2O3— CaO 307, 791
GdgO3—CdO 791
GdgOg—CeO2 297
Gd2O3—Cr2Og 610, 330
GdgOg—Dy2Og 322
GdgOg—EuO 791
Gd2O3—Fe2O3 332
GdgOg— Ga2Og 328
GdgOg—Ho2O3 322
Gd2O3— In303 336
Gd20s—IrO2 719
GdgOg—LagOg 321
GdgOg—Li2O 306
GdgOg—Lu2O8 322
GdgOg—Nb2O3 554
GdgOg—NdgOs 321
GdjOa—PbO 308
Gd2Oa—SCjOg 334
GdgOa—SiO2 88
Gd2O3—SrO 308, 791
GdgOg—ThO2 485
Gd203—TiO2 396
GdaOa—UO2 666
Gd2O3-WO3 804
GdgOg—ZrO2 455
GeO2—AlgOg 353
GeO2— BaO 351
GeO2—Bi2O3 361
GeO2—CaO 347
GeO2—CsgO 344, 792
GeO2—CuO 793
GeO2—Cu2O 792
GeO2—FeO 363
GeOg— Fe2Os 363, 794
GeOg—Er2O3 793
GeO2—HfO2 359
GeOg—In2O3 793
GeO2—K2O 342
GeOg— La2O3 355
GeOg—LigO 338
GeO2—MgO 344
GeO2—MnO 362
GeO3—NagO 340
GeO2—Nb2OB 369
GeOg—PbO 355, 793
GeOg— Bb2O 343
GeO2—SiO2 94
GeOg—SrO 350
GeO2—TiO2 357
GeO2—ZrO2 358
H8O—ALOa 732, 806
H2O—CdO 732
H2O—Cr2Os 739
H2O—In2O3 735
H2O—La2O8 737
H2O—MnO 740
H2O—MnaOg 740
H2O—Nd2O3 738
H2O— SCjOa 736
H2O—Sm2O3 738
H2O—Y2O3 736
HiFg—NaF 776
HfO2—BaO 473
HfO«—CaO 470
HfO2—CeO2 474
HfO2—GeO2 359
HfO2— La2Og 473
HfO2—LigO 796
HfO2—MgO 470
HfO2—MoO3 803
HfO2—SiO2 107, 785
HfO2—Sm203 797
H£O2—SrO 472
HfO2—TiO2 404
HfO2—Tl2Oa 797
HfO2—WO3 644
HfOg—ZrO2 462, 796
Ho,Og—AlgOg 324
Ho2O3—BaO 315
Но2Оз—CaO 791
Ho2Oa— Ce02 299
HogOg— EuO 791
HogOg—Fe2Og 332
Но2О3— GagOg 328
HogOg-Gd2Og 322
HogO3—In2O3 336
HogOg—IrOg 720
Но2О3—LagOg 321
HogOg-PdO 806
Но2О3—SCgOg 334
Но2О3— SrO 314, 791
IngO3—AlgOg 326
IngOg—BeO 270
IngOg—Cr2O3 330
IngOg—Dy2Og 336
In2O3—Er2O3 336
IngOg—EugOg 273,
IngOg—Fe2Og 334
Алфавитный указатель систем
813
In2O3— Ga2Og 330
In2O3— Gd2O3 336
IngOg— GeOg 793
In2O3—Н2О 735
In2O3—Но2О3 336
In2O3— La2O3 336
In2O3—Lu2O3 336
In2O3—NdgOg 336
In2O3—SCgOa 272, 334
In2O3—Sm2O3 336
In2O3—Ta2OB 579
In2O3— Tu2O3 336
IitjOg— Yb20g 336
1па03—ZnO 271
IrO2—Cr2O3 722
IrO2—Dy2O3 719
IrO2— Er2O3 720
IrO2—EugOg 719
IrOg— GdgOg 719
IrO2—Но2О3 720
IrO2—LugOg 722
IrOg— NdgOg 717
IrOg—Sm2O3 718
IrOg—Tu.Og 721
IrOg— YgOg 717
IrOg—YbgOg 721
KF—AlFg 769
KF—BaFg 766
KF—BeFg 765
KF—CaFg 766
KF—ErFg 771
KF—LaFg 770
KF—LiF 764
KF—MgFg 765
KF—NaF 764
KF—NiFg
KF—PrFg
761
771
KF—SmFg 771
KF—ThF4 776
KF—UF4 778
KF—YF3 770
KF—ZnFg 767
KF—ZrF4 775
К2О—В2О3 165
K2O—Ga.Og 789
K2O—GeOg 342
K2O—МоО3 619, 801
KgO—NbgOg 536
K2O—PgOB 492
K2O—РЬО2 371
K2O—SiOg 16
KgO—TagOg 573
KgO-TiOg 375
KgO—VgOB 515
KoO-WOg 628, 803
KgO—ZrOg 422
LaFg—CsF 770
LaFg—KF 770
LaFg—NaF 770
LaFg—RbF 770
La3Og—AlgOg 232
La2O3—В2О3 186
La3O3—BaO 285
LagOg—BeO 282
LagOg—BigOg 588
La2Og—CaO 285
La2O3— СеО2 294
La2Og—Cr2Og 330
LagOg—DygOg 313, 321
LagOg—Er2Og 322, 323
LagOg—EuO 791
La2Og—FegOg 332
La2Og—Ga2Og 326
La2Og—GdgOg 321
LagOg—GeOg 355
La2Og—HgO 737
LagOg—HfOg 473
La2Og—HogOg 321
La3Og—IngOg 336
LagOg—LugOg 323
La2Og—MgO 284
La2Og—NbgOg 550
La2Og—NdgOg 321
La3Og—NiO 288
La2Og—PbO 286
LagOg—PdO 806
La3Og—SCgOg 334
La2Og—SiOg 77
LagOg—SnigOg 321, 792
LagOg—SnOg 368
La2O3— ThOg 482
La2Og—TiOg 394
La2Og—TugOg 323
La3Og—UHg+x 662
LagOg—WOg 639
LagOg—YbgOg 286, 323, 792
La3Og—ZrOg 440, 795
LiF—AlFg
LiF—BeFg
LiF—CaFg
LiF—CeFg 770
LiF—CsF 764
LiF—KF 764
LiF—MgFg 760
LiF—NaF 764
LiF—NbgOg 749
LiF— PuF3 772
LiF—RbF 764
LiF—ThF4 776
LiF—UF3 771
LiF—UF4 777
LiF—YFg 770
769
753
765
814
Алфавитный указатель систем
LiF—ZnP2 767
LiF—ZrF4 774
LigO—AlgOg 197, 787
Li2O—B2Og 161
LigO—BeO 785
LigO—BigO3 588
LigO—EiigOg 305
LigO—FegOg 681
LigO— Ga2O3 789
LigO— Gdg Og 306
LigO—GeOg 338
LigO—HfOg 796
LigO—MnO 129
LigO—МоО2 614
LigO—MoOg 801
LigO—NbgOB 749
LigO—NiO 130
LigO—PgOB 488
LigO—SiOg 7
LigO—SnigOg 302
LigO—TagOg 572
LigO—TiOg 373
LigO—VgOB 511
LigO—WOg 627
LigO—ZnO 127
LigO—ZrOg 421, 794
LUgOg—Al2Og 326
LugOg—BigOg 588
LugOg—Cr2Og 330
LugOg—Dy2Og 322
LugOg—EuO 791
LugOg—FegOg 334
LiigOg—GagOg 330
LugOg— GdgOg 322
LugOg—IngOg 336
LugOg—IrOg 722
LugOg—La2Og 323
LugOg— NdgOg 322
LugOg—PdO 806
LugOg—ScgOg 334
LugOg—SnigOg 322
LugOg—SrO 320
MgFg—BaFg 773
MgFg—BeFg 758
MgFg—CaFg 773
MgFg-KF 765
MgFg—LiF 760
MgFg—NaF 765
MgFg—ScFg 773
MgO—AlgOg 207, 788
MgO—BgOg 171
MgO—BeO 131
MgO—CaFg 743
MgO—CaO 136
MgO—Cr2Og 599
MgO—FeO 148
MgO—CuO 135
MgO—Fe2O3 685
MgO—GagOg 264, 789
MgO— GeOg 344
MgO—HfO2 470
MgO—La2O3 284
MgO—MgFg 742
MgO—MnO 142
MgO—NbgOB 538
MgO—Nd2O3 301
MgO—NiO 156
MgO-P2OB 493
MgO—PuO2 724
MgO—Se»Og 275
MgO—SiO2 28
MgO—Ta2Og 575
MgO—ThO2 476
MgO—TiO2 378
MgO—UO2 655
MgO—VgOB 522
MgO—WOg 631
MgO—Y2O3 279
MgO—ZnO 138, 786
MgO—ZrO2 423
MnO—A12O3 253
MnO—B2O3 195
MnO—CaO 145
MnO—FeO 147
MnO—Fe2O3 708
MnO—GeO2 362
MnO—Н2О 740
MnO—LigO 129
MnO—MgO 142
MnO—MnS 751
MnO—NiO 159
MnO— P,O5 507
MnO—SiO2 115
MnO—TiOg 412
MnO—ZnO 146
MnOg—CaO 678
MngOg—Bi2O3 588
MngOg— CaO 676
MngOg—FegO3 708
MngOg—H2O 740
Мп304—CogO4 679
MngO4—Fe3O4 710
MoO2—CrO2 616
MoOg—FeO 617
MoOg—LigO 614
MoO2—MgO 615
MoO2— NbOg 616
MoOg—VOg 616
MoO2—WOg 626
MoOg—AlgOg 802
MoOg— Bi2Og 588, 623
MoOg—CaO 802
Алфавитный указатель систем
815
МоО3—Сг2О3 624
МоО3— Cs,0 621
МоО3—CuO 801
МоО3—Fe»O3 625
МоО3—HfO2 803
МоО3— К2О 619, 801
MoOs—Li20 617, 801
МоО3— Na2O 618
МоО3— Nb2Ot 622
МоО3— PbO 802
МоО3— RbaO 620
МоО3—ThO2 487
МоО3— WOg 652, 805
МоО3—ZnO 802
NaF—A1F3 763
NaF—A12O3 745
NaF— BeF2 754
NaF—CaF2 766
NaF—CdF2 769
NaF—CeF3 770
NaF—HfF4 776
NaF—KF 764
NaF—LaF3 770
NaF—LiF 764
NaF—MgF2
NaF—PbF2
NaF—PrF3
NaF—PuF3
NaF—ThF4
765
769
771
772
777
NaF—UF3 772
NaF—UF4 778
NaF—YF3 770
NaF—ZnF2 767
NaOH—Na2O 731
NaF—ZrF4 774
Na2O—A12O3 200
Na2O— B2O3 163
Na2O—CrO3 597
Na2O—Fe2O3 682
Na2O—Ga.O3 789
Na2O— GeOg 340
Na2O— MoO3 618
Na2O— NaOH 731
Na2O— Nb2O5 533, 798
Na2O—P2OB 489
Na2O—SiO2 10
Na2O—Ta2O5 572
Na20—TiO2 374
NagO—V2O5 513
NaZO—WO2 626
J&O-WO, 627, 803
Na2O-ZrO2 421
Nbb2-MoO2 616
'NbO2-TaO2 584
NbH»"vn 2 415
Nb<VVO? 561
Nb2O5— Ag2O 798
Nb2O5— AI2O3 545
Nb2O5- B2OS 192
Nb2O5—BaO 541, 798
Nb2O6— Bi2O3 566, 588
Nb2O5—CaO 539
Nb2O5—CdO 544
Nb2O5— CeO2 552
Nb2OB—CogO4 570
Nb2O5—Cr2O3 567
Nb2OB—Cs2O 537
Nb2OB—Dy2Og 555
Nb2OB— FeO 568
NbaOB— Fe2O3 569
Nb2O5— Ga2O3 548
Nb2O5—Gd«O3 554
Nb2O5— GeO2 359
Nb2O5—IngOg 549
Nb2O5—K2O 536
Nb2O5—La2O3 550
Nb2OB— LiF 749
Nb2O5—MgO 538
Nb2O5—MoO3 622
Nb2O5—Na2O 533, 798
Nb2O5—Na2CO3 533
Nb2O}— NbFB 748
Nb2O5—Nd2O3 533
Nb2OB— NiO 571
Nb2O5—PbO 555
Nb2O5—Pr2Og 553
Nb2O5—SCjOg 549
Nb2OB—SiO2 111
Nb2OB—Sm203 554
Nb2O5—SrO 541, 798
Nb2O5— Ta2O5 564
Nb2O5— TiO2 558,
Nb2O5—T12O3 549
Nb2O5—U3Og
Nb2O5-V2O5
Nb2O5—Y2O3
Nb2OB— ZnO
Nb2O5—ZrO2
Nd2O3—A12O3
Nd2O3—B2OS 187
Nd2O3— BaO 301
Nd2O3—CeO2 295
Nd2O3—Cr2O3 330
Nd2O3— Dy2O3 321
Nd2O3-Er2O3 322
Nd2O3— Fe2O3 332
NdjOg— Ga2O3
N d2O3— Gd2O3
Nd2O3— H2O 738
Nd2O3—In^Og 336
Nd2O3—IrO2 717
Nd2O3—La2O3 321
567
562
550
543
560
238, 324
326
321
816
Алфавитный указатель систем
Nd2O3—Ы2О3 322
Nd2O3—MgO 301
Nd2O3— PdO 806
NdaO3— PrO2 300
Nd2O3— Pr2O3 301
Nd2O3—Sc2O3 334
Nd2O3—SiO2 81
Nd2O3—Sm2O3 304
Nd2O3— SnO2 368
NdaO3—SrO 301
Nd2Og—Ta2OB 581
Nd2O3—ThO2 483
Nd2O3— UO2 665
Nd2O3—WO3 639, 804
Nd2O3— Yb2O3 319, 322
Nd2O3—ZrO2 449
NiF2— KF 761
NiO—A12O3 260, 789
NiO—BaO 157
NiO—Bi2O3 588
NiO—CaO 157
NiO—CoO 159
NiO—Cr2O3 613
NiO—CuO 155
NiO—Fe2O3 714
NiO—LaaO3 288
NiO—LiaO 130
NiO—MgO 156
NiO—MnO 159
NiO—P2OB 510
NiO—SiO2 124
NiO—VaOB 532
NiO—ZnO 158
P2OB—A12O3 503
P2OB—B2O3 503
P2O3—Bi2O3 588
P2O5—CaO 494
P2O5—CdO 502
P2O5—CoO 509
P2OB—EuO 504
P2OB—FeaO3 508
P2O3—-Ga2O3 504
P2OB—K2O 492
P2OB—Li2O 488
PaOB-MgO' 493
P2O5—MnO 507
P2OB— Na2O 489
P2OB—NiO 510
P2OB—PbO 505
P2OB—SiO2 108, 785
P2OB—TiO2 506
P2O5—ZnO 500
PbF2— BeF2 773
PbF2— NaF 769
PbFa—UF4 779
PbF2—YFg 774
PbO—A12O3 247
PbO—B2O3 188
PbO—Bi2O3 588, 800
PbO—Cr2O3 611
PbO—Cu2O 127
PbO—Fe2O3 702
PbO—Ga2O3 790
PbO—Gd2O3 308
PbO—GeOa 355, 793
PbO—K2O 371
PbO—LaaO3 286
PbO—MoO3 802
PbO—Sb,O3 585
PbO—SbaO4 585
PbO—Sb2O5 585
PbO—SiOa 98
PbO—Sm2O3 305
PbO—SnO2 369
PbO— Ta2O5 582
PbO—TiO2 401
PbO—UO2 668
PbO—U2O5 669
PbO—V2O5 527
PbO—WO3 641
PbO—ZnO 141
PbO—ZrO2 460
PbO2—BaO 371
PbOa—K2O 371
PdO—DyaO3 806
PdO—Er2O3 806
PdO— Eu2O3 806
PdO—Gd2O3 806
PdO—Ho2O3 806
PdO—LaaO3 806
PdO— LuaO3 806
PdO—NdaO3 806
PdO—SingOs 806
PdO—Tu2O3 806
PdO—YaO3 806
PdO—YbaO3 806
PrF3— CsF 771
PrF3—KF 771
PrF3— NaF 771
PrF3— RbF 771
PrOi.g3—ZrO2 448
PrO2—CeOa 300
PrO2— NdaO3 300
PrO2—YaO3 300
Pr2O3—AlaO3 238, 324
Pr2O3— BaO 299
Pr2O3— CeO2 294
Pr2O3—Cr2O3 330
Pr2O3— EuO 791
Pr2O3— Fe2O3 332
Pr2O3—GaaO3 326
817
Алфавитный указатель систем
727, 806
726
757
766
771
770
Pr2Og— Nb,OB 553
Pr2O3—Nd2O3 301
Pr2O3—SCgO3 334
Рг2О3—S1O2 83
₽г2О3—Та2О5 580
Pr2O3—Tb2O3 309
₽г2О3—ThO2 483
PuF3— LiF 772
PuF3—NaF 772
PuO2— CeO2 725
PuO2—EuaO3 726
PuO2—MgO 724
PuO2— ThO2 727
PuO2—UO2 —
PuO2—ZrO2
RbF—BeF2
RbF—CaF»
RbF—ErF3
RbF—LaF3
RbF—LiF 764
RbF—PrF, 771
RbF—SmF3 771
RbF—ThF3 777
RbF—UF4 778
RbF—YF3 770
RbF—ZnF2 768
RbF—ZrF4 775
Rb2O—BaO3 166, 786
RbaO—Bi2O3 588
Rb2O—GeOa 343
Rb2O—MoO3 620
Rb2O—SiO2 20
RbgO—TiO2 376
Rb2O—V2O3 519
Rb2O3—WO3 629
Sb2O3—As2O3 586
Sb2O3—Bi2O3 588
Sb2O3—PbO 585
Sb2O4—PbO 585
Sb2O5—PbO 585
ScFg—MgF2 773
Sc2Og—AlaO3 226, 326
Sc2O3—B2O3 185
Sc2Og—CaO 276
SCgO3—CeO2 291
Sc2O3—Cr2O3 332
Sc2Og Dy2O3 334
SCgOs—Er2O3 334
Sc2O3—EuO 791
Sc2O3—Eu2O3 334
Sc2O3—Fe2O3 334, 694
Sc2Og—GaaO3 267
Sc<,O3—Gd2O3 334
ScaO3—H2O 736
SCgO3— Ho2O3 334
Sc2Os— In2O3 334
SCgOg—LasO3 272, 334
SCgOg—LUgO3 334
Sc2O3—MgO 275
Sc2O3—Nb2O3 549
Sc2O3—Nd«O3 334
SCgO3— Pr2O3 334
Sc2O3—SiO2 74
Sc2O3—Sm2O3 334
Sc2O3—Ta2O6 579
Sc2O8— ThO2 479
Sc2O3—UO2 661
Sc2O3— Y»O3 277, 334
SCgO3— Yb2O3 334
Sc2O3— ZrO2 436
SiO2—A12O3 63, 784
SiO2— B2O3 61, 783
SiO2—BaO 50, 783
SiO2— BeO 26
SiO2—Bi2O3 588, 785
SiO2—CaFa 746
SiOg—CaO 38, 782
SiO2— CdO 61
SiO2—Ce2O3 81
SiOa— CoO 122
SiO2—CrO 111
SiO2—Cr2O3 112
SiO2—Cs2O 22
SiO2— CuO 23
SiOa— Cu2O 23
SiO2—Dy2O3 90
SiO2—EraO3 92
SiO2—EuO 86
SiO2—Eu2O3 87
SiO2—FeO 117
SiO2—GaaO3 72
SiO2—Gd.Og 88
SiO2—GeO2 94
Si02—Се,О8 81
SiO2—HfO2 107, 785
SiO2\—K2O 16
SiO2—La2O3 77
SiO2—LigO 7
SiO2—MgO 28
SiO2—MnO 115
Si02—NasO 10
SiOg— Nb2O5 111
Si02—NdaOg 81
SiO2—NiO 124
Si02—PaO6 108, 785
SiO2—PbO 98
SiO2—Pr2O3 83
SiOg—RbgO 20
SiO2— SCgO3 74
SiO2— SmO 84
SiO2— SmgOa 84
SiOg—SnO 97
818
Алфавитный указатель систем
SiO2—SrO 48
SiO2—ThO2 107
SiO2—TiO2 102
SiO2-UOa 114
SiO2—V2O5 110
SiO2-Y,O3 75
SiO2— YbO 93
SiO2—Yb2O. 94
S1O2—ZnO 58, 783
SiO2—ZrO2 104, 784
SmF3—CsF 771
SmF3— KF 771
SmF3—RbF 771
SmO—SiO2 84
Sm2O3— A12O3 240, 324
SnijOa— BaO 304
ЗпцОз—BeO 303
Sma03—Bi2O3 588
Sm203—CeO2 296
Sm2O3-Cr2O3 330
SnijOg—EuO 791
SmjOj—Fe2O3 332
SmjOj—Ga2O3 326
SmjOj—H«O 738
Sm2Og—HfO2 797
SmjOg— In2O3 336
Sm203—IrO« 718
Sm2O3—La203 321, 792
SnijOa—Li2O 302
SmgOs-LUjOg 322
SmjOg-Nb2Oe 554
SmjOs—Nd2Os 304, 321
SniaOj—PbO 305
Sm2O3—PdO 806
Sm2O3—Sc2O3 334
Sm203— SiO2 84
Sm2O3—SrO 303
SnijOg— ThO2 484
SuljOu— TiO2 396
Sm2O3—WO3 640, 804
Sm2O8—Yb2O3 320
Sm,03—ZrO2 453
SnO—SiO2 97
SnO—Ta2O5 582
SnO2—Al2Og 367
SnO2—BaO 366
SnO2— Bi2Os 370, 588
SnO2—CaO 366
SnO2—CdO 367
SnO2—La.Og 368
SnO2—Nd2Og 368
SnO2—PbO 369
SnO2—SiO2 97
SnO2—TiO2 400
SnO2—UO2 668
SnO2—ZrOa 459 , 795
SrO—ALO3 219
SrO—B»03 175
SrO—BeO 133
SrO—Bi2O3 588
SrO—CaO 786
SrO—CeO2 290
SrO—Dy2O3 312
SrO—Er2O3 315
SrO—EuO 786
SrO—Eu2O3 305
SrO—Ga2Og 790
SrO—Gd2O3 308, 791
SrO—GeO2 350
SrO—HfO3 472
SrO—Ho2O3 314, 791
SrO—Lu2Og 320
SrO—Nb2O5 541, 798
SrO—Nd2O3 301
SrO—SiO2 48
SrO—Suu O3 303
SrO—Ta2O5 799
SrO—Tb2O3 309
SrO—ThO2 477
SrO—TiO2 382
SrO—UO2 658
SrO—WO3 633
SrO—Y2O3 280
SrO—Yb,O3 318,
SrO—ZrOg 431
TaO2— NbO2 584
Ta2O3—Ag2O 799
Ta2O5—AI2O3 577
Ta2O5—Bi2O3 588
Ta2O5—CeO2 580
580
791
T a2O5—Ce2O3
Ta2O5—Eu2O3 799
Ta2O5—Ga2O3 579
Ta2O5— InaO3 579
Ta2O5— K2O 573
Ta2O5— K2CO3 573
Ta2O5— LigO 572
Ta2O5—MgO 575
Ta2O5— Na2O 572
Ta2O5— Nb2O5 564
Ta2O3—Nd«O3 581
Ta2O5—PbO 582
Ta2O5— Pr2O3 580
Ta2O3—SCgOg 579
Ta2O5— SnO 582
Ta2O5—SrO 799
Ta2O6— TiO2 799
Ta2OB-V2OB 529
TagOB-WOg
Та2ОБ—Y2O3
Ta2Og—ZrO2
648
579
466
Алфавитный указатель систем
819
ТЪО_-Ег.О. 310
Tb2O3-Af2O3 244
ТЪ2О8— ВаО 309
Tb2Og-Fe2O3 700
Tb2O3—WO3 804
Tb2Og—Рг2О3 309
Tb2O3-SrO 309
Tb3Og-Y3O3 281
Tb4O,—Fe3O3 700
TeO2— Bi2Og 588
TeO2—V2OB 530
ThO2— B,O3 190
ThO2— BaO 478
ThO2— BeO 475
ThO2— BLO3 588
ThO2— CaO 476
ThO2— Eu2O3 484
ThO2— Gd2O3 485
ThO2— LJfeOg 482
ThO2— MgO 476
ThO2— MoO3 487
ThO2— Nd2O3 483
ThO2— Pr2O3 483
ThO2—Sc2Og 479
ThO2—SiO2 107
ThO2—SmgOg 484
ThO2— SrO 477
ThO2— TiO2 405
thO2— UO2 673
jThO2—UO3 797
ThO2—Y3O3 480
ThO2— Yb2O3 486
*ГЬО2—ZrO2 462
• TiO2—ALO3 391
TiO2—B2Og 190
TiO2— BaO 384, 794
TiO2—BeO 377
TiO2—Bi2O3 407, 588
TiO2— CaO 380
TiO2—CaF2 747
TiO2—CeO2 395
TiO2— CoO 419
TiO2—Cr2O3 409, 794
TiO2— Cs2O 376
TiO2— Dy2O3 398
TiO2— FeO 413,
TiO2— Fe2O3 417
TiO2— Ga2O3 393
TiO2— Gd«O3 396
TiO2—GeO2 357
TiO2—HfO2 404
TiO2—K2O 375
TiO2—La2Og 394
TiO2—Li2O 373
TiOg—MgO 378
TiO2—MnO 412
TiO2— Na2O 374
TiO2— NbO2 405
TiO2—Nb2OB 558
TiO2— P3OB 506
TiO2— PbO 401
TiO2— Bb2O 376
TiO2—SiO2 102
TiO2—SmgOg 396
TiO2—SnO2 400
TiO2—SrO 382
TiO2—TaO2 406
TiO2—Ta2O5 799
TiO2— ThO2 405
TiO2— UO2 669
TiO2—VO2 528
TiO2— Y3O3 394
TiO2—Yb2O3 399
TiO2— ZnO 390
TiO2—ZrO2 402
Ti2O3—AlgOg 249
T12O-B2O3 183
T12O3—HfO2 797
T12O3-Nb2O3 549
Tl2Og—ZrO2 795
Tu2O3— A12O3 324
TugOg— FeaO3 332
Tu2O3— Ga2O3 330
Tu2O3—IngOg 336
Tu2O3—La2Og 323
Tu2Og—PdO 806
UF3— BaF2 774
UF3— LiF 771
UF3— NaF 772
UF4—BeF2 779
UF4—CsF 778
UF4—KF 778
UF4—LiF 777
UF4—NaF 778
UF4—PbF2 779
UF4—RbF 778
UF4—ThF4 779
UF4—ZrF4 779
UF6— BF3 779
UF6— BFB 779
UP—UO2 751
UO2—Al2Og 659
UO2—BaO 658
UO2—BeO 654
UO2—BigOg 588
UOg—CaO 657
UO2—CeOg 664
UO2—Cr2Og 675
UO2—Dy2Og 667
UOg— Eu2Og 805
UO3—GdgOg 666
820
Алфавитный указатель систем
UO2—MgO 655
UO2—Nd2O3 665 '
UO2—PbO 668
UO2—PuO2 727
UO2—SCjOa 661
UO2—SiO2 114
UO2—SnO2 668
UO2—SrO 658
UO2—TiO2 669
U02—ThO2 673
UO2—UP 751
UO2—VOS 674
UOa—WO3 653
UO2-Y2O3 662
UO2—ZrO2 669, 805
CdO—иО2+ж 659
UOa+x-Eu2Oa 666
UO2+x-La2Oe 662
UO3—СаО 658
UO3—Cr2O3 675
UO3—ThO2 797
U2O5—PbO 669
U3O3—Nb2OB 567
V02—MoO2 616
VO2—NbO2 561
VO2—TiO2 528
VO2—UO2 674
V2O5-Ag2O 521
V2OB—A12O3 527
V2OB—BaO 524
V2O5—Bi2O8 588
V2OB—CaO 524
V2O5— CoO 531
V2O5—Cr2O3 529
VaOB—Cs2O 520
V2O3—Fe2O3 530
VgOg-K.0 515
V2O5—Li3O. 511
V^O5—MgO 522
V2O5— Na2O 513
VgOg-NbOg 562
V2Og—NiO 532
V2OB—PbO 527
V2O5— Bb2O 519
V2O5—SiO2 HO
V2O3—Та«ОБ 529
V2O5—TeO2 530
V2O5—ZnO 525
WO2—MoO2 626
WO2— Na2O 626
WO3—A12O3 637
WO3-B2Og 193
WO3—BaO 634
WO3—BeO 631
WO3— Bi2O3 588, 649
WO3— CaO 632
WO3— CdO 803
WO3-Cr2O3 652
WO3- EraO3 804
WO3—Eu2O3 804
WO3—Fe»O3 653
WO3- Gd2O3 804
WO3-HfO2 644
WO3—K2O 628, 803
WO3—La2O3 639
WO3— Li2O 627
WO3—MgO 631
WO3— MoOs 652, 805
WO3—Na2O 627, 803
WO3— Nb2O5 645
WO3—Nd2O3 639, 804
WOg—PbO 641
WO3—Bb2O 629
WO3—SniaOa 640, 804
WO3—SrO 633
WO3—Ta2Og 648
WO3—Tb2O3 804
WO3—UO2 653
WO3—Y2O3 637
WO3—ZrOa 642
YFg— CsF 770
YFS— KF 770
YF3— LiF 770
YF3—NaF 770
YF3—PbF2 774
YF3—RbF 770
Y2O3—Al2Og 228
Y2O3—BaO 281
Y2O3—BeO 279
Y2O3—CeO2 292
Y2O3—Cr2O3 330
YaO3—EuO 791
Y2O3—Fe2O3 332
Y2Og— Ga,Og 328
Y2O3-H2O 736
Y2O3—IrO2 717
Y2O3—MgO 279
YaO3—Nb«OB 550
Y2O3—PdO 806
Y2O3—PrO2 300
Y2O8—Sc2O3 277, 334
Y2O3—SiOa 75
Y2O3—SrO 280
Y2Og- Ta2OB 579
Y2O3—Tb2O3 281
Y3O3—TiO2 394
Y2O3-UO2 662
Y203-W03 637
YgOa— ZrOa 437
YbO—SiO2 93
Yb2O3—A12O3 245, 326
Yb2O3—BaO 319, 791
Алфавитный указатель систем
821
Yb2O3—ВеО 315 Yb2Og—СаО 316 Yb2O3—СеО2 299 Yb2O3— Fe2O3 332 Yb2O3—Ga,O3 330 Yb2O3— In2O3 336 Yb2Og— IrO2 721 Yb2O3— La.O3 286, 323, 792 Yb2Og-Nd2O3 319, 322 Yb2O3— PdO 806 Yb2O3—SCgOg 334 Yb2O3—SiOa 94 Yb2O3—Sm-A 320 Yb2O3—SrO 318, 791 Yb2O3—ThO2 486 Yb2O3—TiO2 399 Yb2O3— ZrO2 458 ZnF2—AgF 768 ZnF2—CsF 768 ZnF2— KF 767, 768 ZnFa—LiF 767 ZnF2—NaF 767 ZnF2—RbF 768 ZnO—A12O3 224, 788 ZnO—B2O3 179 ZnO—BiaO3 588 ZnO—CdO 141 ZnO—CuO 138 ZnO—FeO 152 ZnO—Fe2O3 693 ZnO—Ga2O3 267 , 790 ZnO—In2O3 271 ZnO—LLO 127 ZnO—MgO 138, 786 ZnO—MnO 146 ZnO—MoO3 802 ZnO—NbgOg 543 ZnO—NiO 158 ZnO— P2O5 500 ZnO—PbO 141 ZnO—SiO2 58, 783 ZnO—TiO2 390 ZnO—V2O5 525 ZnO—ZrO2 435 ZrF4— BeF2 778 ZrF4— CsF 776 ZrF4— KF 775 ZrF4—LiF 774 ZrF4—NaF 774 ZrF4— RbF 775 ZrF4— UF4 779 ZrO2—A12O3 435 ZrO2—BaO 434 ZrO2— BeO 423 ZrO2— Bi2O3 588 ZrO2— CaO 427, 795 ZrO2—CeO2 44? ZrO2—Ce2O3 445 ZrOa—Cr2O3 466, 796 ZrO2—Dy2Og 457 ZrO2—En2O3 454 ZrO2— FeO 467 ZrO2—Fe2O3 796 ZrOa—Fe304 468 ZrO2—Ga2O3 455 ZrO2—GeO2 358 ZrO2— HfO2 462, 796 ZrO2— K2O 422. ZrO2—La2O3 440, 795 ZrO2— LiaO 421, 794 ZrO2—MgO 423 ZrO2— Na3O 421 ZrO2—Nb2OB 560 ZrO2—Nd2Og 449 ZrO2— PbO 460 ZrO2—РгО1-вз 448 ZrO2—PuO2 726 ZrO2— SCaOg 436 ZrO2— SiO2 104, 784 ZrO2—SnbjOa 453 ZrO2— SnO2 459, 795 ZrO2—SrO 431 ZrO2—Ta2O5 466 ZrO2— ThO2 462 ZrO2—TiO2 402 ZrO2— TlaO3 795 ZrO2— UO2 669, 805 ZrO2—WO3 642 ZrO2—Y»OS 437 ZrO2—Yb2O3 458 ZrO2—ZnO 435
ОГЛАВЛЕНИЕ
Стр.
Предисловие ................................................... 3
Пояснение к первому выпуску.................................... 6
Силикатные системы............................................. 7
Системы типа В2'О—В"О и В'О—В"О............................. 127
Боратные системы............................................ 161
Алюминатные системы......................................... 197
Галлатные системы............................................ 264
Индатные системы............................................ 270
Системы с окислами редкоземельных элементов.................. 275
Германатные системы......................................... 338
Станатные системы ........................................... 366
Плюмбатные системы.......................................... 371
Титанатные системы........................................... 373
Цирконатные системы......................................... 421
Гафнатные системы........................................... 470
Системы с двуокисью тория................................... 475
Фосфатные системы........................................... 488
Ванадатные системы.......................................... 511
Ниобатные системы........................................... 533
Танталатные системы.......................................... 572
Антимонатные системы........................................ 585
Системы, содержащие окись висмута............................ 588
Хромитные (хроматные) системы............................... 597
Молибдатные (молибдитные) системы ........................... 614
Вольфраматные (вольфрамитные) системы....................... 626
Уранатные системы .......................................... 654
Системы, содержащие окислы марганца......................... 676
Ферритные системы ......................... 68р
Системы, содержащие двуокись иридия.................. 717
Системы, содержащие двуокись плутония................ 724
Системы, содержащие воду ......................... 731
Системы окислов с фторидами и другими бинарными соединениями . . 742
Бинарные фторидные системы ................................. 753
Дополнение .................................................. 782
Алфавитный указатель систем................................. 807
Никита Александрович Торопов,
Валентин Павлович варзаковский
Владимир Васильевич Лапин,
Нина Николаевна К у р ц е в а
ДИАГРАММЫ СОСТОЯНИЯ
СИЛИКАТНЫХ СИСТЕМ
Справочник, Выпуск первый.
Издание второе, дополненное
Утверждено к печати
Институтом химии силикатов
им. И. В. Гребенщикова
Академии наук СССР
Редактор издательства А. Л. Иванова
Художник В. В. Грибакин
Технический редактор М. Н. Кондратьева
Корректоры Л. В. Жукоборская,
О. М. Лаушкина и Т. Г. Эдельман
Сдано в набор 26ДХ 1968 г. Подписано
к печати 13/VIII 1969 г. РИСО АН СССР
Ml 24-63В. Формат бумаги 60X90*/,,.
Вум. л. 253/,. Печ. л. 51*/,=51*/, усл. печ.
Уч.-изд. л. 45,36. Изд. № 3785. Тип. зак.МИЗЗЭ.
М-55107. Тираж 3000. Бумага № 1.
Цена 2 р. 60 к.
Ленинградское отделение издательства
«Наука»
Ленинград, В-164, Менделеевская лин., д. 1
1-я тип. издательства «Наука». Ленинград,
В-34, 9 линия, д. 12