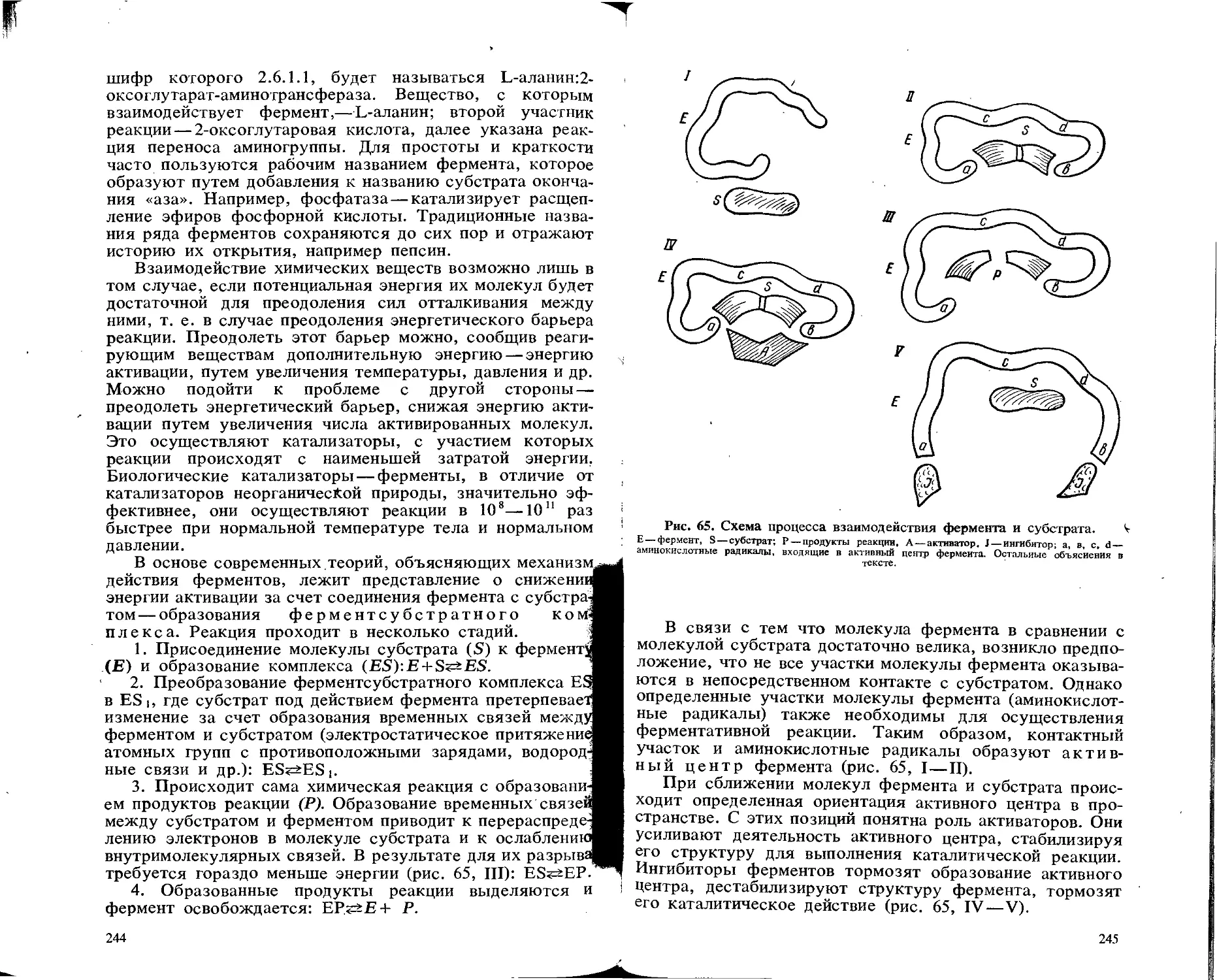
Текст
УДК 616-074(075.32)
Л 93
ББК 53.4
Клинические лабораторные исследовання/А. Я. ЛЮБИНА, Л. П. ИЛЬИЧЕВА, Т. В. КАТАСОНОВА, С. А. ПЕТРОСОВА. М.: Медицина, 1984, 288 с., ил.
Авторы—преподаватели московских медицинских училищ, имеющие большой опыт педагогической работы.
В учебнике освещены современные унифицированные клинические лабораторные методы исследования желудочно-кишечного тракта, органов дыхания, системы крови, мочевыделения и т. д. Все методы рассматриваются в тесной взаимосвязи, с физиологией, патофизиологией и биохимией соответствующих органов и систем при различных заболеваниях. Дается характеристика современных приборов и аппаратуры.
Учебник соответствует программе, утвержденной Министерством здравоохранения СССР, и предназначен для учащихся медицинских училищ.
Рисунков 69. Таблиц 15.
Рецензенты: Л. В. Козловская—ст. науч. сотр. кафедры терапии профзаболеваний I ММИ им. И. М. Сеченова; Л. М. Бабушкина— преподаватель Харьковского медицинского училища № 1.
Анна. Яковлевна Любина, Людмила Павловна Ильичева, Татьяна Викторовна Катасонова, Стелла Арменовна Петросова
КЛИНИЧЕСКИЕ ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ
Зав. редакцией С. Д. Крылов. Редактор И. В. Войтехова.
Худ. редактор О. С. Шанецкий. Переплет художника В. С. Сергеевой. Технический редактор С. П. Танцева. Корректор Т. Р. Тверитнева.
ИБ № 3556
Сдано в набор 26.10.83. Подписано к печати 21.04.84. Т-02513. Формат бумаги 84хЮ81/„. Бумага кн.-жури. Гарнитура Таймс. Печать высокая. Усл. печ. л. 15,96. Усл. кр.-огг. 18,48. Уч.-изд. л. 18,20. Тираж 100 000 экз. Заказ 2559. Цена 95 к.
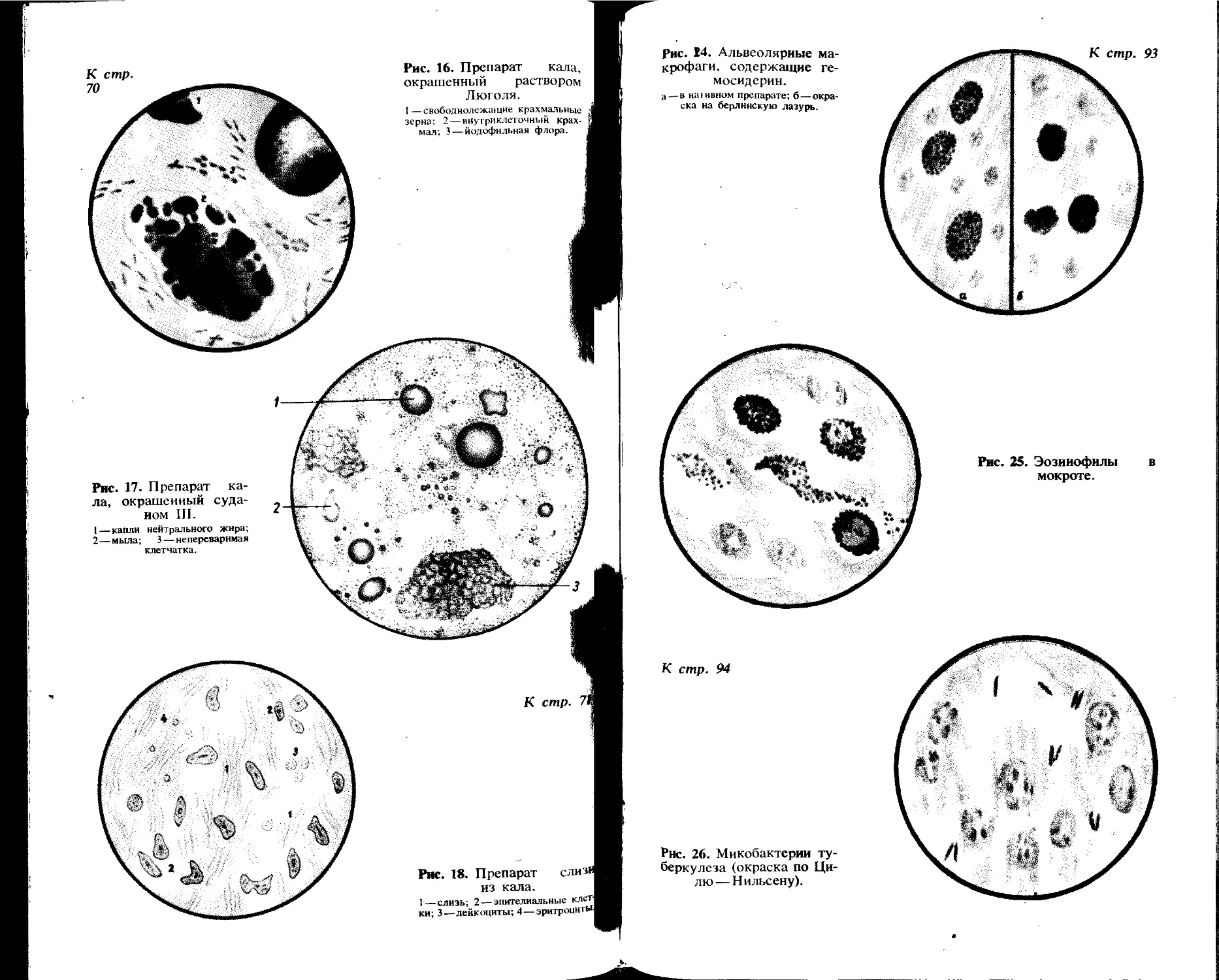
Ордена Трудового Красного Знамени издательство «Медицина», Москва, Петроверигский пер., 6/8
Ордена Октябрьской Революции и ордена Трудового Красного Знамени Первая Образцовая типография имени А. А. Жданова Союзполнграфпрома при Государственном Комитете СССР по делам издательств, полиграфии и книжной торговля. 113054, Москва, Валовая, 28
Отпечатано в типографии № II Союзполнграфпрома.
„ 4109000000—251
Л-----------------77—84
039(01)—84
© Издательство «Медицина», Москва, 1984
ПРЕДИСЛОВИЕ
Методы клинических лабораторных исследований являются одним из основных профилирующих предметов в курсе подготовки фельдшеров-лаборантов. Большинство выпускников фельдшерско-лаборантских отделений медицинских училищ работает в клинико-диагностических лабораториях, обслуживающих лечебно-профилактические учреждения.
Теоретические знания необходимы лаборанту для осмысленного подхода к производимым исследованиям, понимания клинического значения каждого анализа. В связи с этим в учебнике даны основы патофизиологических процессов, происходящих в организме человека при различных заболеваниях, а также практические методики исследований, результаты которых подтверждают клинические проявления болезней.
В учебнике нашли отражение современные достижения медицинской науки и практики. Приведены унифицированные методы исследования, определенные приказами Министерства здравоохранения СССР. Показатели лабораторных анализов и нормативы даны в единицах Международной системы (СИ).
Излагаемый материал соответствует программе подготовки фельдшеров-лаборантов, утвержденной Министерством здравоохранения СССР.
ВВЕДЕНИЕ
Клинические лабораторные исследования — это комплекс методов, используемых для получения объективных данных о состоянии функциональных систем организма человека. Эти данные необходимы врачу для . оценки физиологических процессов, происходящих в различных органах и системах и выявления патологических - изменений в них.
Лабораторные исследования помогают врачу установить диагноз заболевания, наблюдать за течением болезни, за правильностью проводимого лечения и составить представление об исходе болезни (прогнозе). Широкое применение нашли лабораторные исследования при массовых профилактических обследованиях населения.
Клинические анализы производятся в специальных подразделениях лечебно-профилактических учреждений — клинико-диагностических лабораториях, в которых выполняются различные виды исследований: общеклинические, гематологические, биохимические, серологические и иммунологические, микробиологические и т. д.
Общеклинические анализы — это исследования мочи, желудочного и дуоденального содержимого, испражнений, мокроты, спинномозговой жидкости, экссудатов, транссудатов и др.
Гематологические анализы включают в себя морфологические и физико-химические исследования крови.
Биохимические анализы позволяют судить об обменных процессах, о химическом составе биологических жидкостей человеческого организма.
Серологические и иммунологические анализы — это методы выявления различных антигенов с помощью соответствующих антител.
Микробиологические анализы дают возможность обнаружить микробов — возбудителей болезней.
Клиническая лабораторная диагностика как дополнительная, прикладная область знаний теснейшим образом связана со многими науками: химией, физикой, математикой, биологией, нормальной и патологической анатомией и физиологией, гистологией, клинической медициной и др. Знание строения и функций живого организма, обменных 4
процессов, механизмов их регуляции, взаимодействия организма с внешней средой, клиники внутренних болезней и др. делает работу лаборанта осознанной, целенаправленной. Целый ряд клинико-диагностических исследований (химическое исследование мочи, клинико-биохимические исследования) проводится методом качественного и количественного анализа. Для любого исследования нужно уметь приготовить реактивы, что невозможно сделать без знания способов выражения концентрации, свойств веществ и их растворов. Знание физики (оптики, электричества) необходимо для овладения сложной лабораторной аппаратурой.
Развитие различных областей естествознания обогащает клиническую медицину новыми методами исследования.
Краткий исторический очерк. Первые примитивные клинико-диагностические исследования связаны с попыткой применения в медицине методов химического анализа. Они относятся к позднему средневековью, началу эпохи Возрождения.
В XVII веке голландский естествоиспытатель И. Ван-Гельмонт доказал, что у лихорадящих больных относительная плотность мочи выше, чем у здоровых людей. Он же установил наличие кислоты в желудке.
К XVII веку относится и появление микроскопа, усовершенствованного голландцем А. Левенгуком, который добился увеличения рассматриваемых объектов в 300 раз, что позволило впервые увидеть сложный мир микроорганизмов.
Начало научной микроскопии в России относится к XVIII веку и связано с именем гениального русского ученого, основоположника многих наук М. В. Ломоносова. Он впервые применил микроскоп для исследования кристаллов. Кроме того, им внесен ряд усовершенствований в конструкцию микроскопа.
Дальнейшие успехи естествознания в конце XVIII и начале XIX веков, изобретение новых, более точных лабораторных приборов способствовали быстрому развитию лабораторного дела в различных отраслях теоретической и практической медицины.
Для русской медицины этого периода характерно последовательное применение достижений передового естествознания. Инициатором создания в России новой клиники, основанной на данных физиологии и опирающейся на лабораторно-экспериментальные исследования, стал крупнейший отечественный ученый, основоположник петербургской терапевтической школы С. П. Боткин. Большое значение он придавал клиническим лабораторным исследованиям для подтверждения диагноза заболевания и наблюдения за течением болезни. Именно С. П. Ботки-
ным была впервые создана лаборатория при терапевтической клинике Военно-медицинской академии.
Современник С. П. Боткина, выдающийся врач Г. А. Захарьин, возглавлявший факультетскую терапевтическую клинику Московского университета, подчеркивал значение тщательного исследования больного. Г. А. Захарьину принадлежит огромная заслуга в деле организации лабораторий при клиниках Московского университета. Им разработан оригинальный метод исследования элементов крови, который он рекомендовал врачам.
Огромный вклад в развитие лабораторного дела внес отечественный ученый Д. Л. Романовский. Предложенный им метод окраски крови позволил выявить структуру различных частей клетки. Подбирая краски для окрашивания малярийных плазмодиев и клеток крови, Д. Л. Романовский выяснил, что по-разному окрашиваются не только различные клетки, но и ядро, цитоплазма и зернистость. Он предложил использовать комбинацию основной краски— метиленовой синей и кислой — эозина, которая давала красочный эффект, получивший название «принципа или эффекта Романовского». Этот принцип используется большинством лабораторий для окрашивания мазков крови и в настоящее время.
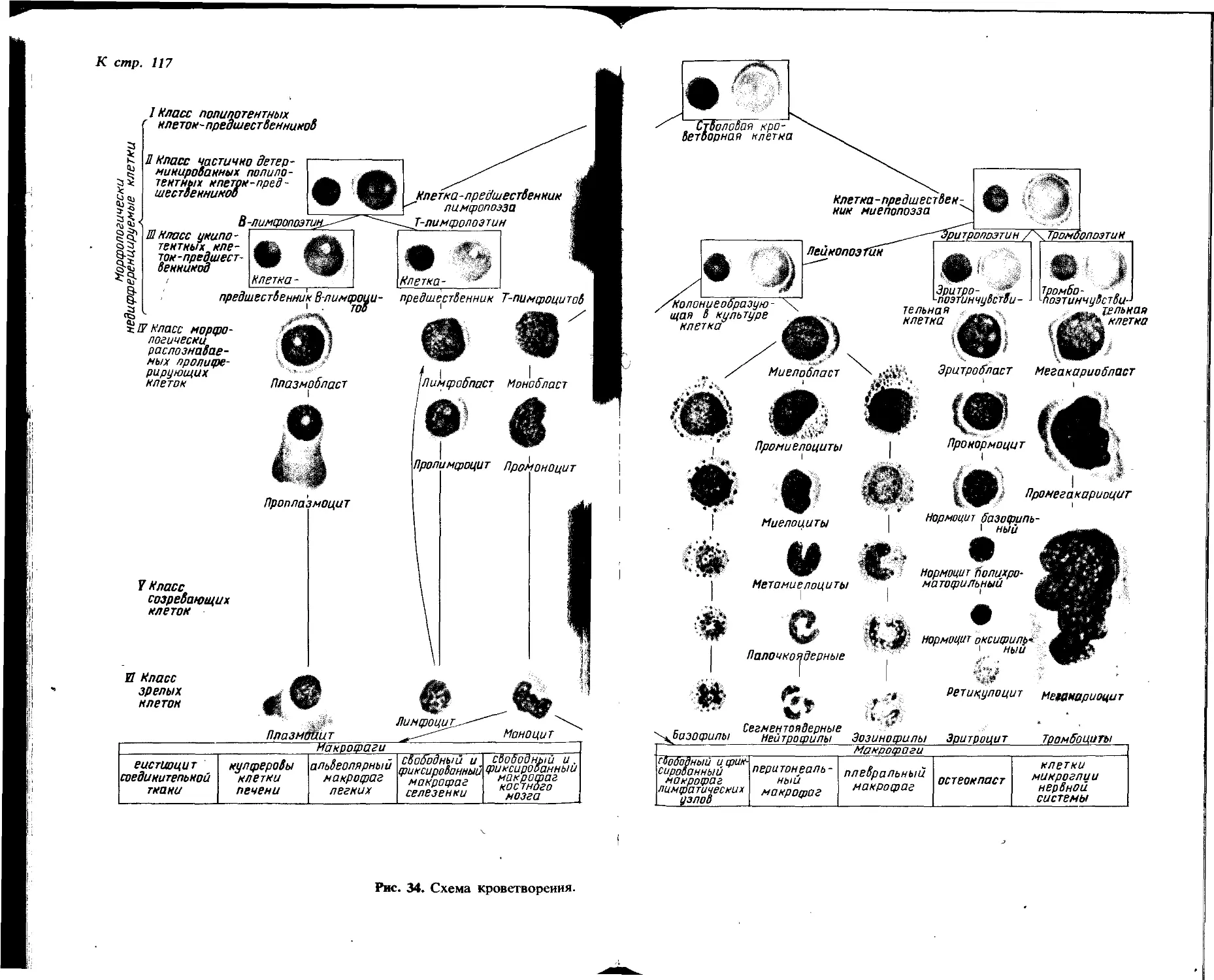
Большое влияние на развитие современной гематологии оказали работы русского ученого А. А. Максимова, создателя унитарной теории кроветворения, согласно которой все клетки крови происходят из одной родоначальной клетки. Выдвинутое А. А. Максимовым положение было подтверждено экспериментально работами последних лет.
Значительный вклад в лабораторное дело внес В. Е. Предтеченский, впервые на русском языке издавший оригинальное руководство по клиническим лабораторным исследованиям, не утратившее значение и в настоящее время.
Достижения русской клинической медицины были восприняты и развиты советской медицинской наукой. Выдающиеся советские ученые внесли свой вклад в развитие лабораторной клинической диагностики.
Большую роль в развитии морфологической гематологии сыграл советский ученый А. Н. Крюков, создавший две классические монографии и «Атлас крови».
Замечательным достижением советской науки служит предложенный М. И. Аринкиным метод прижизненного получения и исследования костного мозга—«фабрики крови». Сконструированная им игла для получения костного мозга путем прокола грудины и усовершенствованная затем выдающимся советским гематологом И. А. Кассирским, стала использоваться гематологами всего мира.
Введенный И. А. Кассирским в гематологическую практику метод комплексного исследования крови, пун-ктатов костного мозга, лимфатических узлов и селезенки дает богатый материал для диагностики заболеваний системы крови. Им совместно с Г. А. Алексеевым создан фундаментальный труд «Клиническая гематология».
В развитии морфологического направления лабораторной диагностики большую роль сыграли работы С. Л. Эрлиха. Он основал первую школу лабораторной диагностики в Харькове. Его учеником А. Я. Альтгаузеном написано руководство «Лабораторные клинические исследования» для подготовки фельдшеров-лаборантов и разработаны многие методы лабораторной диагностики.
Пропаганде и развитию лабораторного дела в нашей стране посвятила свою деятельность исследователь широкого профиля, опытный педагог Е. А. Кост. Она явилась организатором Всесоюзного научного общества врачей-лаборантов и журнала «Лабораторное дело».
Лабораторная служба в СССР. После Великой Октябрьской социалистической революции Советское государство взяло на себя заботу об охране здоровья трудящихся. Свидетельством заботы Коммунистической партии и Советского правительства о совершенствовании здравоохранения служат постановления ЦК КПСС и Совета Министров СССР «О мерах по дальнейшему улучшению здравоохранения и развитию медицинской науки в стране» (1968), «О мерах по дальнейшему улучшению народного здравоохранения» (1977), «О дополнительных мерах по улучшению охраны здоровья населения» (1982) и принятые Верховным Советом СССР «Основы законодательства Союза ССР и союзных республик о здравоохранении» (1969).
Конституцией Союза Советских Социалистических Республик (1978 г.) закреплено право граждан СССР на охрану здоровья. В статье 42 сказано, что это право обеспечивается бесплатной, квалифицированной медицинской помощью, оказываемой государственными учреждениями здравоохранения; расширением сети учреждений для лечения и укрепления здоровья граждан; проведением широких профилактических мероприятий; мерами по оздоровлению окружающей среды; особой заботой о здоровье подрастающего поколения.
Из года в год растет сеть лечебно-профилактических учреждений и вместе с ними количество клинико-диагностических лабораторий. Их насчитывается в стране более 55 тысяч. В лабораториях страны ежегодно производится более 1 млрд, анализов.
Работа клинико-диагностических лабораторий с каждым годом усложняется. Наряду с количественным ро
стом лабораторные исследования претерпевают и глубокие качественные изменения. В соответствии с достижениями медицинской науки и техники они непрерывно обогащаются новыми методами, проведение которых требует применения разнообразной и сложной аппаратуры.
Для улучшения качества производимых анализов, повышения надежности полученных результатов, внедрения современной техники создаются специализированные централизованные лаборатории: гематологические, биохимические, иммунологические, микробиологические и др. Преимуществом централизованной лаборатории является возможность применения научной организации труда лабораторных работников. Приготовление больших партий реактивов, серийное производство однородных анализов увеличивает производительность их труда.
Клинико-диагностические лаборатории оснащаются новыми современными приборами: автоматическими биохимическими анализаторами, которые позволяют определять одновременно несколько биохимических показателей с большой скоростью (до 180 проб в час); автоматическими счетчиками форменных элементов крови; анализаторами состава вещества—спектрофотометрами, фотоэлектроколориметрами, пламенными фотометрами и т. д.
Облегчает труд лаборантов и делает его более производительным использование малой механизации: механизированных пипеток и дозаторов.
Лабораторные исследования производятся по унифицированным методикам. Унифицированными называются единые, утвержденные Министерством здравоохранения СССР методы исследования, обязательные для всех лабораторий Советского Союза. Использование унифицированных методов необходимо для обеспечения преемственности ведения больного, получения сравнимых результатов исследований, произведенных в различных медицинских учреждениях. Унификация методов исследования позволяет улучшить их качество.
Одним из важных достижений лабораторной службы служит внедрение в практику работы лабораторий методов контроля качества исследований. Контроль качества заключается в сопоставлении исследуемых материалов со стандартными. Качество исследований проверяется по стандартным материалам, содержащим вещества известной концентрации. Если в результате анализа получают цифры, соответствующие стандартным, то производимые в лаборатории аналогичные исследования делаются правильно.
Для стандартизации лабораторных исследований и управления их качеством организовано производство отечественных контрольных материалов, готовых наборов реак-8
тивов для унифицированных методов (определения гемоглобина, глюкозы, белка крови и др.), а также экспресс-тестов, используемых при выполнении срочных анализов.
Стандартизация осуществляется и в применении Международной системы единиц (СИ) для выражения результатов исследований.
Усложнение и возрастание объема исследований предъявляет все новые и более высокие требования к квалификации лабораторных работников. Подготовкой кадров для клинико-диагностических лабораторий занимаются кафедры клинической лабораторной диагностики институтов усовершенствования врачей. Средний медицинский персонал для лабораторий готовят фельдшерско-лаборантские отделения медицинских училищ. Работающие лаборанты совершенствуют свои знания в училищах и на курсах повышения квалификации и специализации средних медицинских кадров.
Обязанности лаборанта. Обязанности лаборанта клинико-диагностической лаборатории сложны и многообразны. Он является первым помощником врача-лаборанта.
Лаборант производит взятие материала для исследования— крови из пальца, кожных чешуек, ногтей, волос. В его обязанности входит приготовление реактивов и красителей и правильное их хранение. Он готовит препараты для микроскопирования.
Лаборант самостоятельно производит ряд анализов: определение физических свойств и химическое исследование мочи, желудочного и дуоденального содержимого, испражнений, мокроты и т. д.; подсчет количества форменных элементов крови, определение физико-химических ее свойств; постановку серологических реакций. Лаборант имеет право подписи под произведенными им анализами.
На лаборанте лежит обязанность ведения ежедневной учетной и периодической отчетной документации.
Вся работа лаборатории тщательно документируется. Материал может быть принят на анализ только при наличии направления, где указывается:
1) фамилия, имя и отчество больного;
2) возраст больного (особенно, если это ребенок);
3) предполагаемый диагноз;
4) характер исследования, которое должна произвести лаборатория;
5) наименование отделения или номер истории болезни;
6) дата выполнения анализа;
7) подпись врача или медицинской сестры.
Материал для исследования, поступающий в лабораторию, регистрируется. Для каждого вида исследуемого материала (мочи, крови, желудочного содержимого и др.) ведется отдельный регистрационный журнал. На обложке
должно быть указано, для регистрации каких анализов он предназначен, дата начала заполнения и окончания. Нумерация во всех журналах начинается с 1 января каждого года. В журнал записываются данные из направления и результаты исследования.
В условиях клиники удобно заводить картотеку. На каждого больного заводится отдельная карточка, в которую вносятся результаты всех лабораторных исследований. Это позволяет проследить за изменением состояния и эффективностью лечения больного.
Результаты анализов выписываются на специальных бланках, утвержденных Министерством здравоохранения СССР для различных видов исследований. Бланк без подписи врача или лаборанта, а также без даты считается недействительным. Бланк с результатом исследования направляется в отделение или в кабинет врача (как было указано в направлении).
В конце каждого месяца, а также в конце года лаборант составляет отчет о проделанной работе, в котором указывает количество различных видов анализов, произведенных лабораторией за определенный срок.
Лаборант должен владеть техникой лабораторных работ. Имея навыки работы с лабораторной посудой, приборами, зная особенности приготовления различных растворов, владея техникой титрования, микроскопии, фотометрии и т. д., он может освоить любые методы исследования.
Для правильной оценки полученных результатов исследований лаборанту необходимо знать нормальные величины лабораторных показателей. О значительных отклонениях от нормы он обязан немедленно сообщить врачу.
В лабораторной работе нет мелочей. Сотрудник лаборатории не имеет права допускать небрежности в работе. От него требуется большая точность в выполнении методик (строго по прописи). При малейшем сомнении в правильности результатов исследования анализ нужно повторить, так как ошибка может стоить больному жизни.
Техника безопасности. При работе в клинико-диагностической лаборатории должны соблюдаться правила техники безопасности. Пренебрежение этими правилами может привести к несчастным случаям. Производя анализы, лаборант часто работает с концентрированными кислотами, едкими щелочами, легковоспламеняющимися жидкостями; пользуется электроприборами. Исследуемый материал может быть заразным. Работа с ним требует специальных мер предосторожности.
Лаборант должен пользоваться средствами индивидуальной защиты: носить халат, застегнутый сзади, и
шапочку, иметь резиновые перчатки, прорезиненный фартук защитные очки.
На рабочем месте должны находиться только необходимые для данного исследования реактивы, оборудование и приборы.
Концентрированные кислоты (азотная, хлористоводородная, серная, уксусная) следует хранить в толстостенной стеклянной посуде в вытяжном шкафу. Всю работу с летучими кислотами следует производить только в вытяжном шкафу, чтобы избежать попадания паров в атмосферу помещения.
Для разбавления серной кислоты следует приливать кислоту к воде, а не наоборот, и только в фарфоровых стаканах, так как при разведении происходит значительное выделение тепла.
Категорически запрещается при работе с крепкими или летучими кислотами пользоваться пипетками без специальных приспособлений, чтобы избежать попадания кислоты в рот при засасывании. Следует использовать пипетку с резиновым баллоном, либо бюретку со стеклянными кранами.
Отработанные кислоты нельзя выливать в раковину. Они должны быть нейтрализованы, сильно разбавлены и только после этого вылиты в раковину под тягой.
Работа с легковоспламеняющимися жидкостями (эфир, спирт, ацетон, бензол) должна проводиться в вытяжном шкафу, особенно если она требует нагревания. Эти вещества нельзя нагревать на открытом огне. Необходимо использовать водяную баню с закрытым электрическим подогревом.
Все электроприборы в лаборатории должны быть заземлены. Работать следует только с исправной аппаратурой.
Несоблюдение правил работы с легковоспламеняющимися веществами и использование неисправной аппаратуры может привести к пожару в лаборатории. В каждой лаборатории должны быть наготове средства тушения пожара: огнетушители, ящики с песком, покрывала из асбеста или войлока.
Лаборанту следует помнить о возможности заражения при работе с инфицированным материалом. Во избежание заражения необходимо работать в защитной одежде. Отработанный материал, применявшаяся для исследования посуда, поверхность лабораторного стола обрабатываются дезинфицирующими растворами хлорамина, хлорной извести, сулемы или фенола.
Клинико-диагностическая лаборатория располагается обособленно от других помещений лечебнопрофилактического учреждения и имеет несколько ком
нат: собственно лабораторные помещения и вспомогательные. Количество комнат определяется объемом работы лаборатории и характером производимых анализов. Предусматриваются препараторская, моечная, место для хранения реактивов. Лаборатория должна быть хорошо освещена. Светильники располагаются над лабораторными столами. Желательно, чтобы окна в лаборатории выходили на север и прямой солнечный свет не попадал на лабораторные столы, так как под его воздействием разлагаются реактивы и портятся препараты. Кроме того, солнечный свет мешает микроскопированию.
Лабораторные помещения должны хорошо вентилироваться: иметь приточно-вытяжную вентиляцию и вытяжные шкафы. Лаборатория обязательно снабжается водопроводом, канализацией, центральным отоплением.
В помещении лаборатории запрещается принимать пищу и курить.
Помните, недооценка мер предосторожности, тем более нарушение мер безопасности, является не признаком храбрости, а наоборот — показателем небрежности или слабой подготовки!
ОБЩЕКЛИНИЧЕСКИЕ ИССЛЕДОВАНИЯ
Глава I ИССЛЕДОВАНИЕ МОЧИ
СОСТАВ И СВОЙСТВА В НОРМЕ И ПРИ ПАТОЛОГИИ
Моча__это биологическая жидкость, в составе кото-
рой из организма выводятся конечные продукты обмена веществ. Образование ее происходит путем фильтрации плазмы крови в почечных клубочках и обратного всасывания большинства растворенных в ней веществ и воды в канальцах. Составные части мочи доставляются к почкам в готовом виде кровью. Сами почки их не вырабатывают. В них образуются только аммиак и гиппуровая кислота. Моча содержит около 150 различных компонентов. Сюда относятся азотистые продукты белкового обмена — мочевина, мочевая кислота, креатинин, индикан; минеральные вещества—ионы калия, натрия и других металлов; соли — хлориды, фосфаты, сульфаты и др. Кроме того, моча содержит пигменты — урохром, уробилин; ферменты— пепсин, амилазу и др.; гормоны — половые, коры надпочечников; витамины — комплекс В, С и многие другие вещества.
Состав мочи может меняться в зависимости от употребляемой пищи и выпитой жидкости. Большое влияние на него оказывает нервно-психическое и физическое состояние обследуемого. Изучение состава мочи, ее физических свойств, элементов мочевого осадка дает ценные сведения о процессах, происходящих в организме, обмене веществ, действии лекарственных средств, получаемых больным. Особенно важное значение исследование мочи имеет для диагностики и лечения заболеваний почек и мочевыводящих путей.
§ 1. Физические свойства
При изучении физических свойств мочи оценивают ее количество, цвет, прозрачность, реакцию, запах, осадок, видимый на глаз, относительную плотность.
Количество. Зависит от многих причин, и прежде всего, от объема выпитой жидкости и функционального состояния почек.
Выделение мочи за единицу времени принято называть Диурезом. Можно определить суточный диурез, ночной,
дневной, часовой и т. д. Оценивают обычно количество мочи, выделенной за сутки. Суточный диурез здорового взрослого человека равен 1000—2000 мл. Он складывается из дневного и ночного диуреза. Дневной диурез превышает ночной приблизительно в 3 раза.
Полиурия — увеличение выделения мочи — может быть физиологической (связана с употреблением большого количества жидкости и нервным возбуждением) и патологической (при сахарном и несахарном диабете, хронической почечной недостаточности).
Олигурия — уменьшение выделения мочи — может быть физиологической (при ограничении питьевого режима, потере жидкости в жаркую погоду с потом) и патологической (при длительных рвотах и поносах, высокой лихорадке, кровотечениях, остром гломерулонефрите, образовании отеков).
Анурия — полное прекращение выделения мочи — чаще всего связана с наличием в мочевыводящих путях препятствия к мочеотделению (камня, опухоли). Такая анурия называется неистинной. Истинная анурия возникает при нарушении мочевыделительной функции почек (острая почечная недостаточность, тяжелые формы острого гломерулонефрита).
Никтурия — преобладание ночного диуреза над дневным наблюдается при хронической почечной недостаточности и нарушении сердечной деятельности.
Цвет. Свежевыделенная моча здорового человека имеет различные оттенки желтого цвета—от светлого до насыщенного. Цвет мочи зависит от содержания в ней пигментов (урохрома, уробилина, уроэритрина и порфирина) и тесно связан с количеством ее и плотностью. При полиурии моча светло-желтая; при олигурии—насыщенножелтая.
Цвет мочи меняется при различных патологических состояниях и приеме некоторых лекарственных веществ. Присутствие в моче желчных пигментов придает ей зеленовато-бурый цвет (цвет «пива»). Моча зеленоватобурого цвета выделяется также при приеме ревеня и александрийского листа. Чтобы решить, чем обусловлена окраска мочи, ее взбалтывают до образования пены. При наличии желчных пигментов’пена окрашивается в желтый цвет.
Кровь окрашивает мочу в различные оттенки красного цвета. Примесь свежей крови придает моче ярко-красный цвет. Моча бурого или красновато-бурого цвета (цвет «мясных помоев») свидетельствует о примеси измененной крови. Розоватый цвет моче придают лекарственные вещества — амидопирин, ацетилсалициловая кислота.
Моча оранжево-коричневого цвета (цвет «крепкого 14
чая») свидетельствует об увеличении в ней количества уробилина.
После приема внутрь или внутривенного введения метиленового синего или индигокармина выделяется моча Синего цвета.
На цвет мочи оказывает влияние и состав принимаемой пищи. Так, употребление свеклы, моркови, черноплодной рябины и других пищевых продуктов с интенсивной окраской может придать моче необычный цвет.
Прозрачность. Свежевыделенная моча здорового человека прозрачна. При стоянии она мутнеет, что, чаще всего, связано с выпадением солей. При заболеваниях может выделяться мутная моча. Помутнение в этом случае обычно обусловлено присутствием крови, слизи, гноя, бактерий или большого количества солей. Причины помутнения и способы устранения мутности представлены в табл. 1.
Таблица 1. Способы удаления мутности мочи
Факторы, вызывающие мутность Способы удаления
Клеточные элементы Слизь Жир Бактерии Соли: ураты фосфаты оксалаты карбонаты Центрифугирование, фильтрование » » Смешивание с эфиром Фильтрование через бактериальный фильтр Нагревание, добавление щелочей Добавление кислот » хлористоводородной кислоты » уксусной »
Прозрачность мочи обозначают как полную или неполную. Если моча мутная, то определяют степень помутнения (слабо мутная, мутная).
Реакция. В обычных условиях при питании смешанной пищей реакция мочи слабокислая или нейтральная. При питании преимущественно мясной пищей реакция мочи кислая, растительной — щелочная. Резко кислая моча выделяется при сахарном диабете, подагре. Резко щелочная— при цистите, беременности.
Реакцию определяют при помощи индикаторной бумаги или жидкого индикаторного раствора в свежей моче, так как при стоянии реакция сдвигается в щелочную сторону.
Запах. В норме запах мочи не резкий, специфический и обычно исследователем не отмечается. Он приобретает значение в редких случаях; так, при сахарном диабете моча имеет запах ацетона из-за присутствия кетоновых тел, при цистите—резкий аммиачный запах.
Осадок. Описывают осадок, видимый на глаз, который выпадает при наличии в моче большого количества солей, гноя, слизи, крови. Лаборант отмечает характер осадка, цвет, объем. Осадок может быть аморфный или кристаллический, белый, розовый или красный; значительный (обильный) или незначительный.
Относительная плотность. Зависит от количества растворенных в моче плотных веществ и выпитой жидкости. Относительная плотность отражает концентрационную способность почек и в норме при обычном пищевом режиме в течение суток колеблется от 1,008 до 1,024.
При физиологической полиурии, связанной с употреблением большого количества жидкости, выделяется моча с низкой относительной плотностью. При ограниченном питьевом режиме или потере жидкости при рвоте, поносах, усиленном потоотделении выделяется более концентрированная моча.
Определение относительной плотности имеет большое значение для оценки функционального состояния почек.
§ 2. Количество и относительная плотность мочи — показатель функционального состояния почек
У здорового человека почки обладают замечательным свойством приспосабливаться к суточным колебаниям жидкости, поступающей в организм. При этом в широких пределах изменяются количество мочи, выделяемой за сутки, и относительная плотность ее. Способность почки концентрировать и выводить мочу определяется пробой Зимницкого. Она физиологична и проста по технике проведения.
Больной находится в условиях обычного водного и пищевого режима. При этом учитывается вся жидкость, выпитая за сутки. После опорожнения мочевого пузыря в 6 ч утра собирают мочу в течение суток через каждые 3 ч. Все порции помещают в отдельные склянки. Таким образом, за сутки собирают 8 порций мочи, которые доставляют в лабораторию. В каждой порции измеряют количество и относительную плотность. Результат исследования заносят в специальный бланк. При этом учитывают суточный, дневной и ночной диурез, соотношение выпитой и выделенной жидкости.
У здорового человека суточный диурез колеблется в пределах нормы и составляет 60—80% от количества выпитой жидкости. Дневной диурез преобладает над ночным. О хорошей работе почек свидетельствуют колебания количества (40—300 мл) и относительной плотности (1,008—1,024) мочи в отдельных порциях. При этом, чем 16
больше эти колебания, тем выше адаптационная способность почки (табл. 2, пример 1).
При нарушениях функции почек отмечаются низкие величины относительной плотности —тип осте нурия (до 1 008_1,012) и незначительные колебания ее значений
в течение суток. Гипостенурия в сочетании с полиурией свидетельствует о преимущественном поражении канальцевого аппарата, а в сочетании с олигурией—о вовлечении в патологический процесс клубочков. При этом нарушается процесс образования первичной мочи (см. табл. 2, пример 2).
Таблица 2. Результаты исследования функционального состояния почек (проба Зимницкого)
Пример 1 Пример 2 Пример 3
§ 5 3 к . з . |
Время сбора мо- о х о X
ни, ч е 5 j е 5й е 5й
а ё □ а Ё8 а ё8
я* 5 а £ § 2S § 8? 9* u S
2 5S 3 5а 2 5§
6 265 1014 90 1010 130 1010
9 230 1012 80 1012 80 1010
12 150 1015 70 1014 225 1010
15 115 1018 100 1010 230 1010 '
760 340 665
Дневной
диурез
18 115 1023 125 1011 215 1011
21 85 1021 90 1008 200 1011
24 60 1018 95 1012 240 1010
3 40 1020 ПО 1011 225 1010
Ночной
диурез 290 320 880
Суточный
диурез 1050 660 1545
При потере канальцами почки способности концентрировать мочу, относительная плотность последней колеблется в течение суток в очень узких пределах и составляет 1,010—1,011 (относительная плотность первичной мочи). Это явление называется изостенурией и служит опасным признаком почечной патологии (см. табл. 2, пример 3).
Для более точной оценки концентрационной функции почек определяют осмотическую концентрацию мочи. В этом случае измеряют концентрацию всех ионов и раство
ренных в моче молекул методом криоскопии, т. е. по точке замерзания. Чем больше концентрация мочи, тем выше ее осмотическое давление и тем ниже точка замерзания и наоборот.
§ 3. Патологические изменения химического состава
Протеинурии
За сутки через почечные клубочки фильтруется 30— 50 г белка. В конечную мочу попадает незначительное количество его, которое не выявляется обычными методами. Принято считать, что в моче здорового человека белка не содержится. Появление его в моче называется протеинурией.
Протеинурии возникают при фильтрации белка из крови в почке или присоединении белка к моче в мочевыводящих путях. В зависимости от причины, вызвавшей протеинурию, различают ренальную (почечную) и экстра-ренальную (внепочечную) протеинурию.
Ренальные протеинурии делят на органические и функциональные. Среди органических протеинурий по механизму происхождения условно выделяют клубочковую и канальцевую.
Клубочковая протеинурия возникает при повышении проницаемости почечного фильтра.
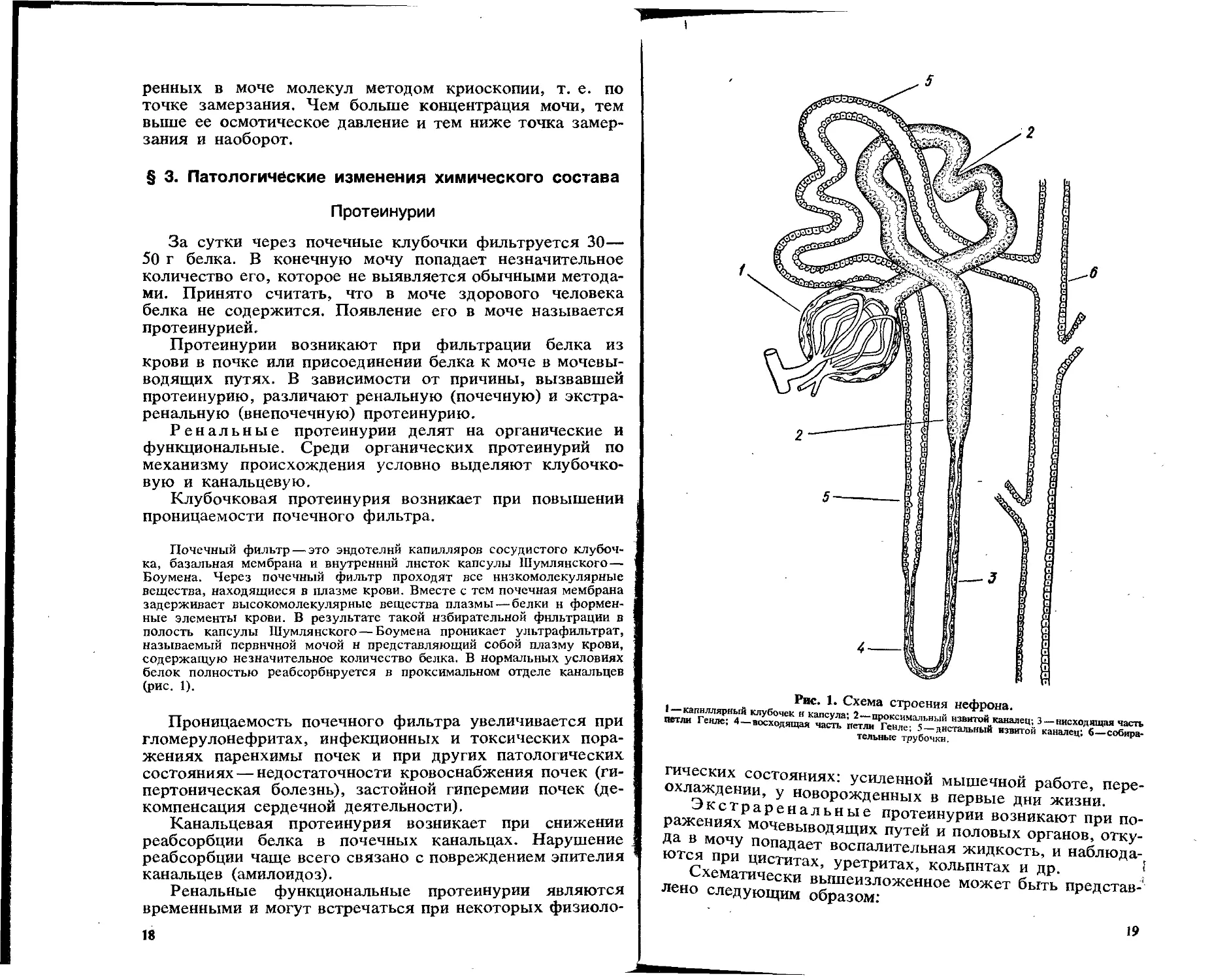
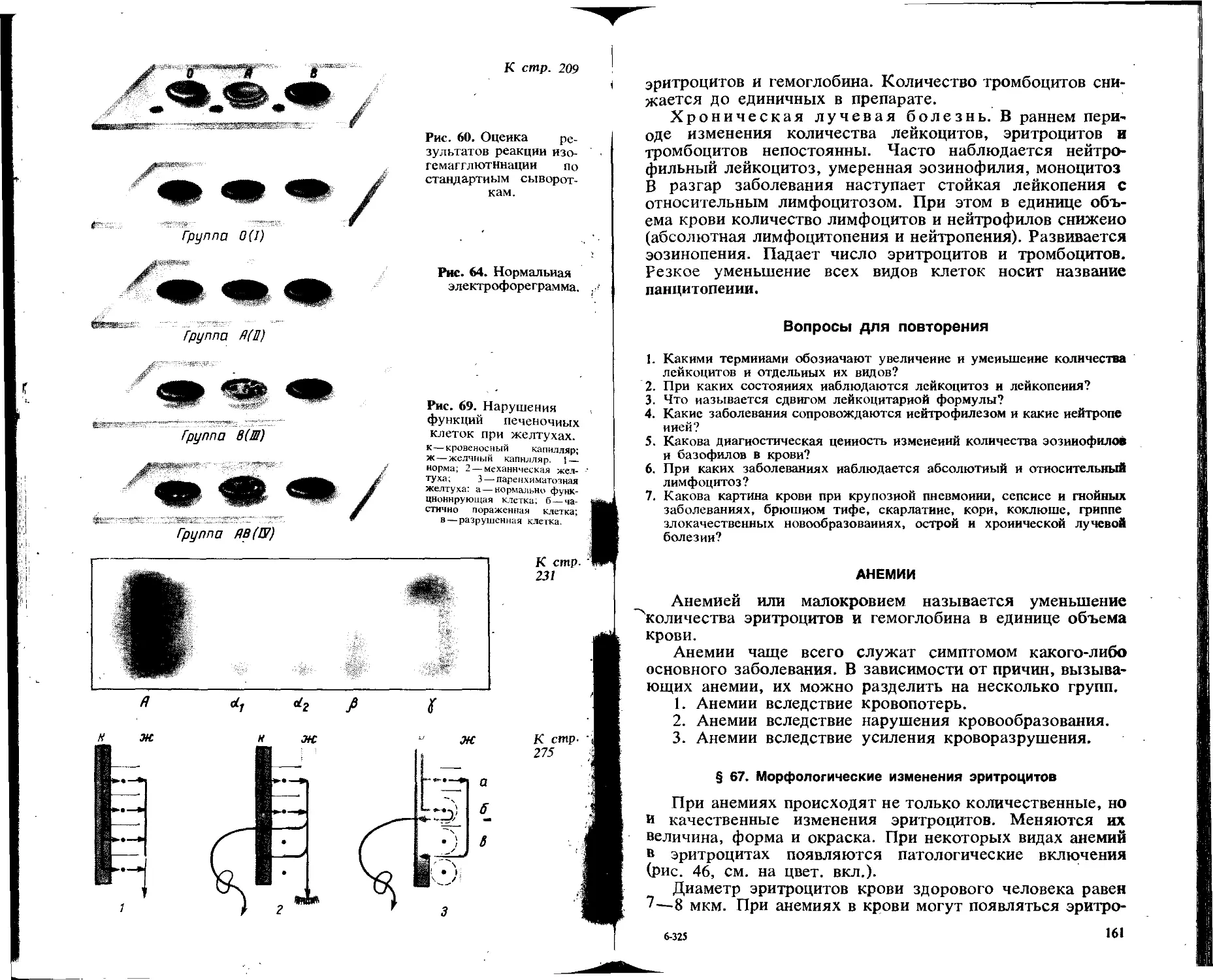
Почечный фильтр — это эндотелий капилляров сосудистого клубочка, базальная мембрана и внутренний листок капсулы Шумлянского— Боумена. Через почечный фильтр проходят все низкомолекулярные вещества, находящиеся в плазме крови. Вместе с тем почечная мембрана задерживает высокомолекулярные вещества плазмы — белки н форменные элементы крови. В результате такой избирательной фильтрации в полость капсулы Шумлянского — Боумена проникает ультрафильтрат, называемый первичной мочой н представляющий собой плазму крови, содержащую незначительное количество белка. В нормальных условиях белок полностью реабсорбируется в проксимальном отделе канальцев (рис. 1).
Проницаемость почечного фильтра увеличивается при гломерулонефритах, инфекционных и токсических поражениях паренхимы почек и при других патологических состояниях — недостаточности кровоснабжения почек (гипертоническая болезнь), застойной гиперемии почек (декомпенсация сердечной деятельности).
Канальцевая протеинурия возникает при снижении реабсорбции белка в почечных канальцах. Нарушение реабсорбции чаще всего связано с повреждением эпителия канальцев (амилоидоз).
Ренальные функциональные протеинурии являются временными и могут встречаться при некоторых физиоло-
5
Рис. 1. Схема строения нефрона.
I—капиллярный клубочек я капсула; 2—проксимальный взвитой каналец; 3 — нисходящая часть петли Генле; 4—восходящая часть петли Генле; 5 — дистальный извитой каналец; 6—собирательные трубочки.
гических состояниях: усиленной мышечной работе, переохлаждении, у новорожденных в первые дни жизни.
Экстраренальные протеинурии возникают при поражениях мочевыводящих путей и половых органов, откуда в мочу попадает воспалительная жидкость, и наблюда-^ ются при циститах, уретритах, кольпитах и др. ’
Схематически вышеизложенное может быть представлено следующим образом:
Ренальные
Органические f-----------
Клубочковая
Протеинурии
Экстраренальные
------1
Канальцевая
Функциональные
Глюкозурии
В моче здорового человека глюкоза находится в столь незначительном количестве, что обычными качественными пробами не обнаруживается. Появление глюкозы в моче называется глюкозурией.
Глюкоза относится к веществам с высоким почечным порогом выделения. Почечный порог — это определенная концентрация вещества в крови, превышение которой ведет к прекращению его реабсорбции в почечных канальцах. В этих случаях процесс фильтрации преобладает над процессом реабсорбции. Эпителий канальцев почки обладает способностью к избирательному обратному всасыванию. В зависимости от степени обратного всасывания различают пороговые и непороговые вещества. Пороговыми называются такие вещества, которые в норме в конечной моче не содержатся, а появляются в ней только при превышении порога. К таким веществам относятся глюкоза, аминокислоты, калий, фосфаты. Обычно, при нормальном содержании их в плазме крови, они реабсорбируются в канальцах полностью.
Глюкоза появляется в моче при превышении порога, т. е. при гипергликемии, которая может быть связана с различными физиологическими и патологическими процессами. Так, гипергликемия, а следовательно и глюкозурия, возникает при употреблении с пищей большого количества углеводов (алиментарная), эмоциональных напряжениях (эмоциональная). Эти глюкозурии принято называть физиологическими, быстропроходящими, в отличие от патологических. Патологические глюкозурии возникают при нарушении функции эндокринных желез, регулирующих уровень глюкозы крови, заболеваниях печени, нервной системы.
Наиболее стойкая патологическая глюкозурия наблюдается при недостатке в организме инсулина — гормона поджелудочной железы, понижающего уровень глюкозы в крови. Недостаточная секреция инсулина отмечается при сахарном диабете, остром панкреатите. Глюкозурии, воз-йикающие при этих заболеваниях, называют инсулярными в отличие от экстраинсулярных, которые наблюдаются при повышении деятельности щитовидной железы, коры и
мозгового слоя надпочечников, передней доли гипофиза, травмах и опухолях мозга.
Иногда глюкозурия наблюдается и без гипергликемии, т е. при нормальном уровне глюкозы в крови, что связано с нарушением реабсорбции глюкозы в канальцах почки (почечный диабет).
Наряду с определением глюкозы в моче определяют лактозу, фруктозу, галактозу и т. д. Повышенная концентрация в моче этих видов сахаров называется соответственно лактозурией, фруктозурией, галактозурией и т. д.
Кетонурии
Кетонурия (ацетонурия) — это проявление в моче кетоновых тел. В состав кетоновых тел входят (3-оксимасляная кислота, ацетоуксусная кислота и ацетон—продукты неполного окисления аминокислот и жирных кислот.
У здорового человека углеводы, жиры, часть белков окисляются до углекислого газа и воды, освобождая при Ътом значительное количество энергии. При некоторых патологических состояниях, в частности при сахарном диабете, снижается выработка инсулина. В печени сокращаются запасы гликогена, многие ткани организма находятся в состоянии энергетического голода. В этих условиях активизируются процессы окисления белков и жиров в печени, но недостаток гликогена ведет к неполному их окислению и накоплению в крови недоокисленных продуктов жирового и белкового обмена—кетоновых тел. Вследствие накопления в крови кетоновых тел (кетонемии) наступает сдвиг pH крови в кислую сторону. Это состояние называется ацидозом. Моча такого больного имеет резко кислую реакцию и пахнет ацетоном.
Голодание, употребление преимущественно белковой и жирной пищи, исключение из питания углеводов приводит к усиленному образованию кетоновых тел и выделению их с мочой.
В раннем детском возрасте кетонурия встречается чаще, чем у взрослых и не имеет большого клинического значения. Это явление представляет интерес для педиатра при «ацетонемической рвоте», связанной с погрешностями в диете.
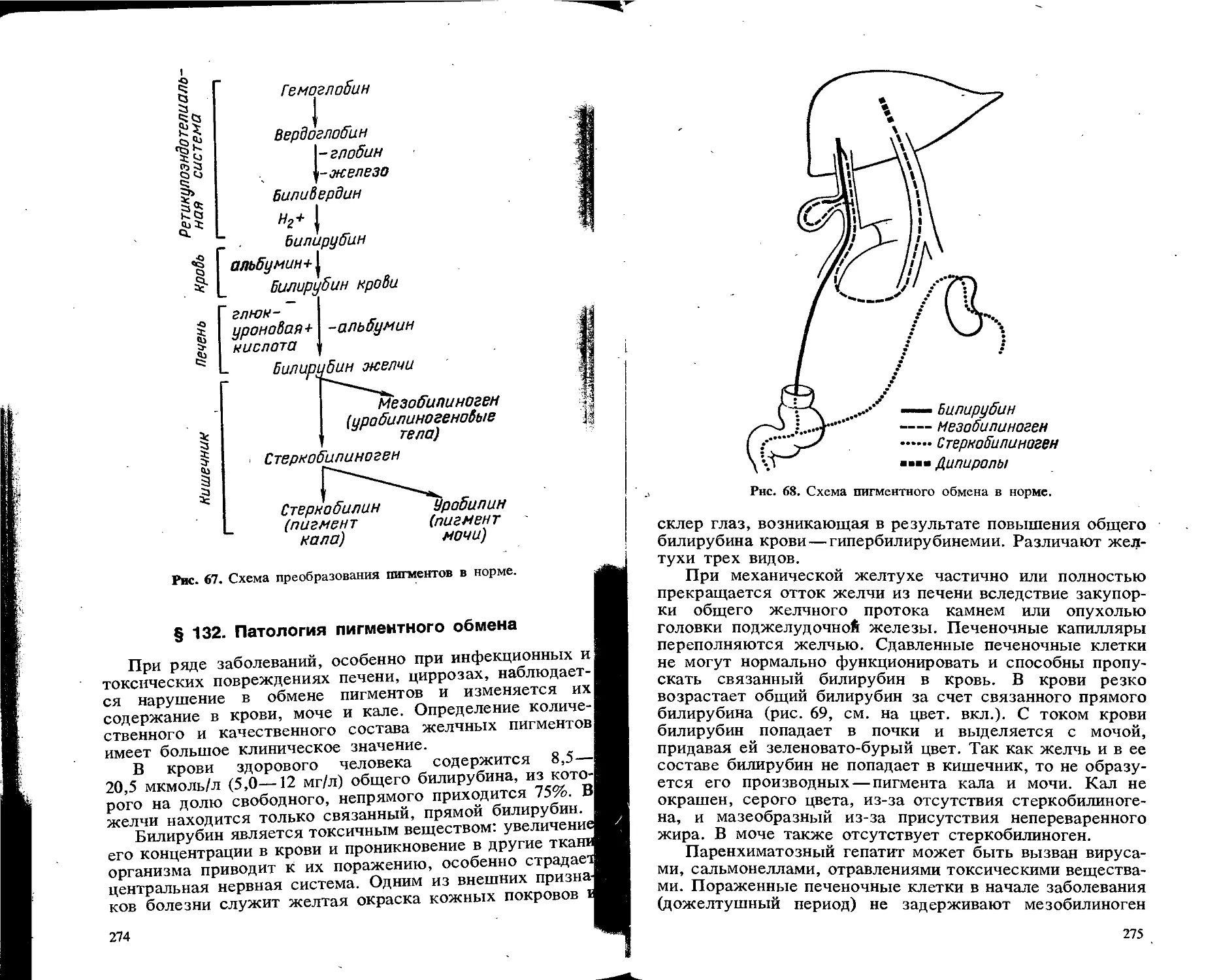
Пигментный состав
Моча здорового человека окрашена пигментами урохромом, уробилином и уроэритрином.
При заболеваниях печени и желчных путей в моче могут появиться желчные пигменты — прямой билирубин и иливердин, которые в норме окрашивают желчь. При
увеличении количества прямого билирубина в крови он выводится с мочой, придавая ей зеленовато-бурый цвет (цвет «пива»). Такое состояние наблюдается при паренхиматозных гепатитах, механических желтухах.
При гемолитических анемиях и гепатитах, осложненных циррозом печени, в моче увеличивается количество уробилина, и моча приобретает оранжево-коричневый цвет (цвет «крепкого чая»), В крови при этом увеличивается количество непрямого билирубина, который в моче появиться не может, так как адсорбирован на молекуле белка.
Состояния, сопровождающиеся усиленным разрушением (гемолизом) эритроцитов (гемолитические анемии, отравление бензолом, анилином, мышьяковистым водородом) сопровождаются появлением в моче свободного гемоглобина, и носят название гемоглобинурии. Моча при этом имеет характерную красноватую окраску, но под микроскопом эритроциты не видны, так как они гемолизированы.
Индиканурии
Индикан является составной частью мочи, но количество его настолько незначительно, что обычными реакциями он не обнаруживается.
Индикан — производное токсичного вещества индола, образующегося при гниении белков в кишечнике. При гниении аминокислоты триптофана образуются индол и скатол. Всасываясь в кровь, они поступают в печень, где обезвреживаются, соединяясь с серной и глюкуроновой кислотами и образуя индоксилсерную и индоксилглюкуроновую кислоты. Калиевая соль индоксилсерной кислоты называется индиканом.
Количество индикана в моче увеличивается при повышении его концентрации в крови (индиканемии). Индикане-мия, и связанная с ней индиканурия, возникает при тяжелых хронических заболеваниях почек, усилении гнилостных процессов в кишечнике (запоры, заворот кишок, ущемление грыжи), усиленном разложении белков в организме (опухоли, эмпиемы, абсцессы).
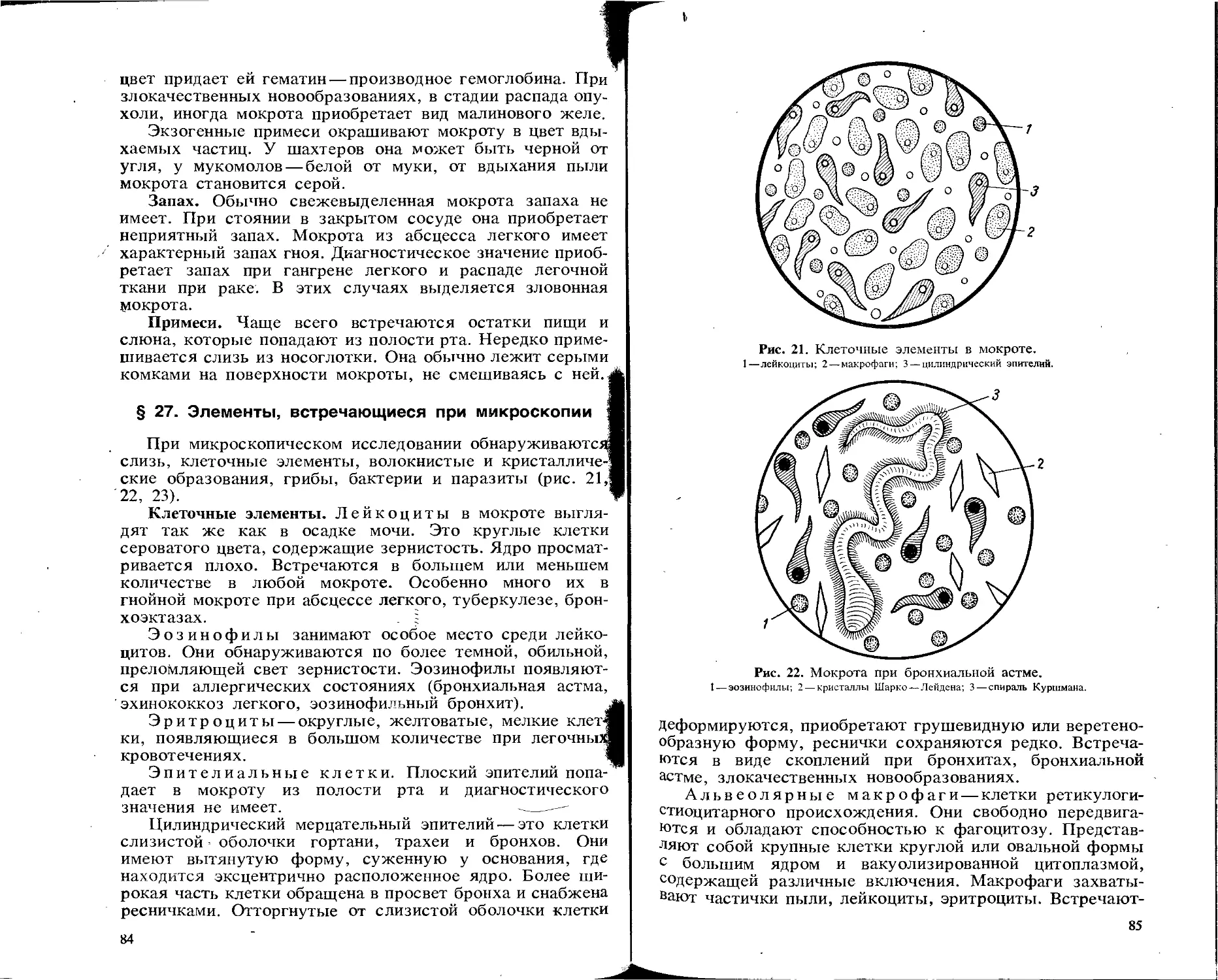
§ 4. Элементы, встречающиеся при микроскопии
Микроскопическое исследование осадка мочи является неотъемлемой и важнейшей частью общеклинического исследования. Данное исследование часто служит основанием для диагностики заболеваний почек и мочевыводящих путей.
Мочевой осадок бывает двух видов: организованный и неорганизованный.
Неорганизованный осадок состоит из солеи и кристаллических образований, встречающихся в нормальной и патологической моче. Соли осадка различны в зависимости от реакции мочи. В кислой моче встречаются мочевая кислота, ураты, оксалаты (рис. 2, см. на цвет. вкл.).
Мочевая кислота имеет вид красивых ярко-желтых или золотисто-желтых разнообразных кристаллов, встречающихся в виде ромбов, шестигранников, бочонков. Отдельные кристаллы образуют розетки, пучки, снопы.
Ураты—это мочекислые солн натрия, кальция, калия__представляют собой коричневый или сероватый
песочек, часто покрывающий все поле зрения. В этих случаях соли необходимо растворить, не изменяя и не разрушая клеточные элементы. Ураты хорошо растворяются в реактиве Селена (4 г буры, 4 г борной кислоты, 100 г воды). Реактив Селена следует налить на осадок, затем осадок размешать и вновь отцентрифугировать.
Оксалаты—соли щавелевой кислоты—имеют форму почтовых конвертов и хорошо преломляют свет. Размер кристаллов может быть различным, при этом мелкие оксалаты трудно отличить от эритроцитов. Оксалаты встречаются как в кислой, так и в щелочной моче.
В щелочной моче могут встречаться аморфные фосфаты, трипельфосфаты и кислый мочекислый аммоний (рис. 3, см. на цвет. вкл.).
Аморфные фосфаты имеют вид бесцветной аморфной массы, состоящей из мелких зернышек, и очень похожи на ураты.
Трипельфосфаты имеют характерную форму, напоминающую гробовые крышки. Встречаются в свежей моче при циститах.
Кислый мочекислый аммоний имеет форму коричнево-желтых шаров, расположенных поодиночке или скоплениями. Очень часто кристаллы имеют шиповидные выросты. Встречаются как в кислой, так и в щелочной моче.
Неорганизованный осадок мочи не имеет большого диагностического значения, так как очень часто зависит от характера питья и питания, состояния водно-солевого обмена. Например, даже при почечнокаменной болезни по осевшим солям нельзя распознать природу камня. Количественно неорганизованный осадок не оценивается. В анализе дается только указание словами: «много» солей или «немного» солей.
При тяжелых поражениях печени, глубоких нарушени-
ях обмена веществ в моче могут появиться кристаллы лейцина, тирозина, ксантина, цистина, билирубина.
К организованному осадку относятся форменные элементы крови — эритроциты и лейкоциты; эпителиальные клетки и цилиндры (рис. 4, 5, 6, см. на цвет. вкл.).
Лейкоциты имеют вид небольших серых зернистых клеток округлой формы и представлены главным образом нейтрофилами. В моче здорового человека встречаются единичные лейкоциты в поле зрения: у женщин 1—2, у мужчин 0—2.
Увеличение выделения лейкоцитов с мочой (лейкоциту-рия или пиурия) свидетельствует о воспалительных процессах в почке или мочевыводящих путях. Если количество лейкоцитов в поле зрения не превышает двадцати, то говорят о лейкоцитурии, а если лейкоцитов больше шестидесяти — о пиурии. Лейкоцитурия (пиурия) встречается при пиелонефритах, туберкулезе почки, пиелитах, циститах, уретритах.
У женщин лейкоциты могут попадать в мочу из половых органов, поэтому в случае пиурии мочу повторно берут катетером.
Эритроциты в первой утренней порции мочи в норме могут обнаруживаться в виде единичных клеток в препарате. Форма и размеры их меняются в зависимости от реакции мочи и ее концентрации. Неизмененные эритроциты имеют вид круглых небольших образований, слегка желтоватых или бесцветных, без зернистости. Измененные эритроциты могут быть сморщенными, с неровными зазубренными краями, или разбухшими, потерявшими пигмент, с тонкой оболочкой.
Наличие крови в моче называется гематурией. Пс происхождению различают почечную (ренальную) и вне-почечную (экстраренальную) гематурию. Почечная гематурия возникает при поражениях почки (острый гломерулонефрит, острая почечная недостаточность, травма, инфаркт и туберкулез почки), а внепочечная — при воспалительных процессах в мочевыводящих путях или их травме, Если крови в моче так много, что она вызывает изменение цвета мочи и видна на глаз, то говорят о макрогематурии; если же эритроциты обнаруживаются микроскопически — о микрогематурии.
При микроскопии иногда эритроциты бывает трудно отличить от дрожжевых клеток и мелких оксалатов. В этом случае к препарату добавляют уксусную кислоту, вызывающую гемолиз эритроцитов, при этом грибы и оксалаты остаются без изменений.
Эпителий разделяют на плоский, переходный s почечный. Плоский эпителий попадает в мочу из влагали ща и наружных половых органов. Это большие овальные 24
или полигональные клетки с маленьким ядром, расположенным в центре. В моче у женщин этих клеток встречается больше, чем у мужчин. Обнаружение клеток плоского эпителия в моче не имеет диагностического значения. Г Переходный эпителий — это эпителий мочевого пузы-пя мочеточников и почечных лоханок. Клетки переходно-о ’ эпителия обладают следующими признаками: имеют различную величину и форму (чаще продолговатую); окрашены в желтоватый цвет урохромом. В моче здорового человека встречаются единичные клетки. Усиленное слущивание их наблюдается при циститах, пиелитах, новообразованиях в мочевыводящих путях.
Почечный эпителий выделяется из канальцев почки и в моче здорового человека не встречается. Наличие клеток почечного эпителия, в сочетании с протеинурией и цилин-друрией, указывает на воспалительный процесс в канальцах почек, а также на дегенеративные изменения в почечной ткани, встречающиеся при гломерулонефритах и нефротическом синдроме. Клетки почечного эпителия неправильно округлой формы, небольшие. Цитоплазма желтоватого цвета, с мелкими зернами, ядра часто не выявляются. Эти признаки указывают на дегенерацию клетки.
Цилиндры — белковые образования, не встречающиеся в моче здорового человека. Образуются в канальцах нефрона и имеют цилиндрическую форму с закругленными концами, т. е. повторяют форму канальцев.
Цилиндры бывают гиалиновые, зернистые, восковидные, лейкоцитарные и др.
Гиалиновые цилиндры появляются при заболеваниях почек, а также при функциональной протеинурии в случае переохлаждения тела, при большой физической нагрузке. Это нежные, бледные почти прозрачные образования различной ширины и длины.
Зернистые цилиндры встречаются при острых и хронических заболеваниях почек и состоят из дегенерированно-го, распавшегося на глыбки белка или клеток почечного эпителия в стадии перерождения. Они непрозрачны, густо покрыты зернышками различного размера, часто очень короткие и толстые с поперечными перехватами.
Восковидные цилиндры отличаются однородной структурой, непрозрачны, окрашены в желтый цвет. Они значительно больше остальных цилиндров, резко контури-рованы и встречаются при хронических процессах в почкетяжелых интоксикациях.
Лейкоцитарные, эритроцитарные и эпителиальные цилиндры отмечают в том случае, если принадлежность их ^ВЬ13ЫВаеЗ сомнения- Особое значение для диагностики олевании почек приобретает обнаружение эритроцитар-
ных и лейкоцитарных цилиндров в сочетании с гематурией и лейкоцитурией.
От цилиндров следует отличать цилиндроиды, ко торые похожи на гиалиновые цилиндры, но более длин Ные. Один конец их закруглен, а другой расщеплен иля вытянут в виде нити. Считают, что цилиндроиды образу ются из слизи и могут встречаться в нормальной моче.
Среди прочих элементов организованного осадка мочи можно встретить уретральные нити (при хроническом уретрите), элементы спермы и простатического сока, элементы новообразований.
Организованный осадок можно исследовать двумя способами: ориентировочным и количественным.
Ориентировочный метод наиболее распространен, но Наименее точен и дает приблизительные результаты. Полученные результаты зависят от количества мочи, от того как снят осадок и приготовлен препарат. Оценка содержания отдельных элементов мочи производится в препарате или поле зрения.
Количественный метод позволяет точно подсчитать? форменные элементы осадка в 1 мл мочи или в суточном? ее объеме.
§ 5. Моча при некоторых заболеваниях
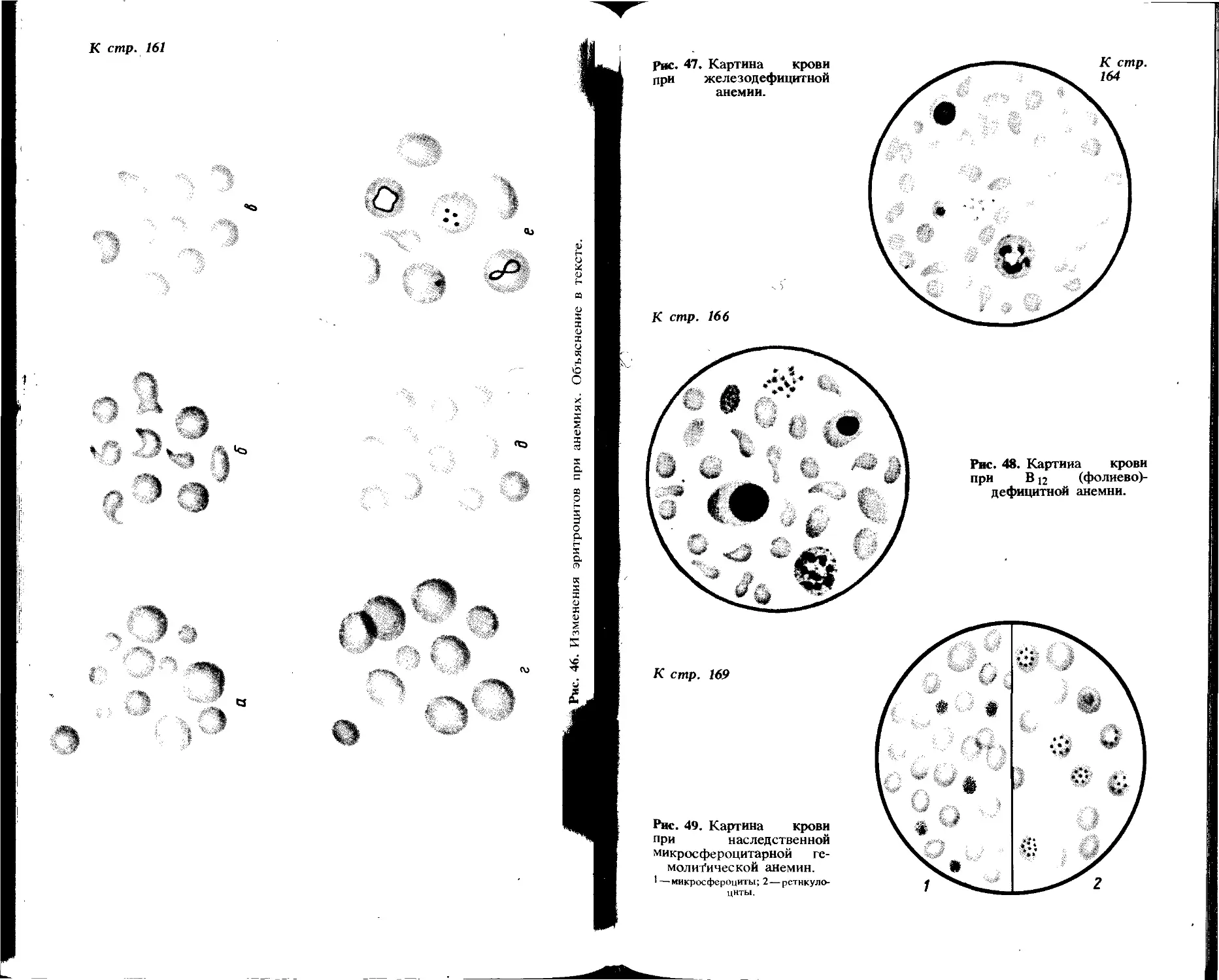
Острый гломерулонефрит. Суточный диурез уменьшен (олигурия). В начале заболевания моча может приобрести цвет «мясных помоев» из-за выделения значи тельного количества крови (макрогематурия). Моча мутная, относительная плотность ее выше нормальной (гиперстену рия), реакция чаще кислая. Появляется белок до? 1 — 3 г/л. Микроскопически обнаруживается значительной количество неизмененных эритроцитов (до 100 и более в поле зрения), лейкоцитов немного (6—8 в поле зрения).] Встречаются гиалиновые цилиндры и клетки почечного? эпителия.
Нефротический синдром различной этиологии. Олигурия, цвет мочи насыщенно-желтый, прозрачность? неполная. Относительная плотность несколько повышена, реакция кислая. Характерно высокое содержание белка (от 5 до 20—40 г/л). При микроскопии обнаруживают лейкоциты (до 20 в поле зрения), небольшое количество эритроцитов (1—2 в поле зрения), много различного вида цилиндров — гиалиновых, зернистых, восковидных.
Хроническая почечная недостаточность-Умеренное увеличение суточного диуреза (полиурия). Моча становится светло-желтой, водянистой, прозрачности полная. Важным симптомом, свидетельствующим о нарушении концентрационной функции почек, служит изостену-
рия__выделение мочи с относительной плотностью равной
относительной плотности первичной мочи (1,010—1,011). Может быть гипостенурия (относительная плотность 1 003_1,007). Реакция кислая, наблюдается протеинурия
(1__2 г/л). При микроскопии осадка обнаруживается не-
большое количество лейкоцитов (8—10 в поле зрения) и измененных эритроцитов (3—4 в поле зрения), единичные цилиндры, небольшое количество клеток почечного эпителия, слизь.
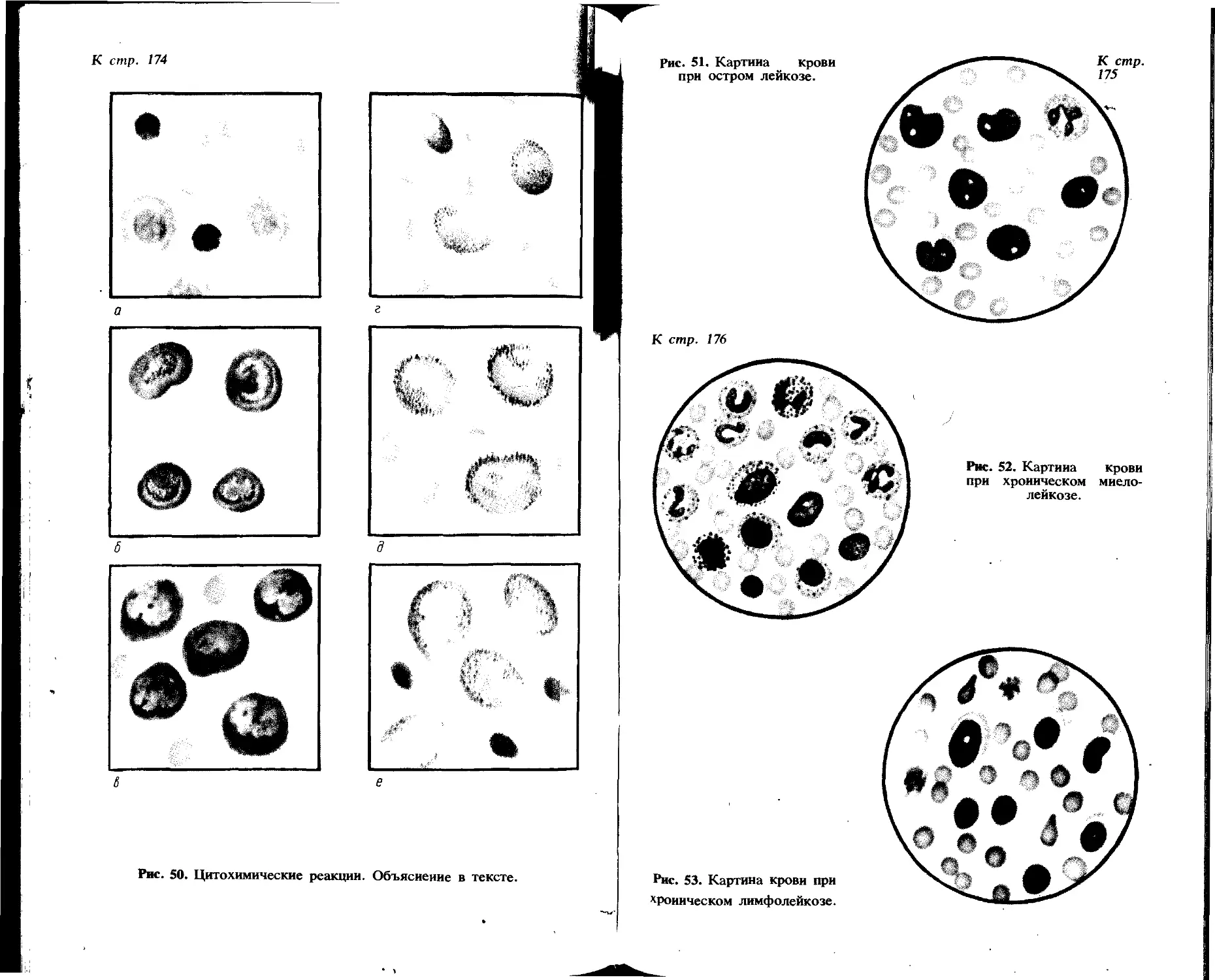
Пиелонефрит. Незначительная полиурия, в связи с чем цвет мочи светло-желтый. Прозрачность неполная, может быть мутная моча. Относительная плотность нормальная, реакция слабокислая или щелочная. Отмечается протеинурия (до 2 г/л). Для микроскопической картины характерно большое количество лейкоцитов (до 20—100 и более в поле зрения). Значительно меньше эритроцитов (1 —10 в поле зрения). Могут встретиться различные виды цилиндров: гиалиновые, зернистые, лейкоцитарные (0—1 в поле зрения). Характерно наличие слизи и бактерий.
Цистит. Диазурические расстройства; больные мочатся часто, малыми порциями, мочеиспускание болезненное. Цвет мочи желтый или «мясных помоев». Она мутная, обладает резким, неприятным запахом, реакция щелочная, относительная плотность в пределах нормы. Протеинурия носит экстраренальный характер и не достигает высоких цифр (менее 1 г/л). При микроскопии в осадке обнаруживают большое количество лейкоцитов (часто они покрывают все поле зрения), значительное количество эритроцитов (до 100 в поле зрения), много полиморфного эпителия, слизи и бактерий.
Сахарный диабет. Значительная полиурия (до 3—4 л в сутки и более). Моча светло-желтая, водянистая, прозрачная. Несмотря на полиурию, относительная плотность ее выше нормы (1,030—1,035 и выше) за счет содержащейся в ней глюкозы. Могут быть обнаружены кетоновые тела. Моча имеет резкокислую реакцию, белка не содержит. При микроскопии осадка отклонений от нормы не обнаруживают. Часто встречаются значительные количества мочевой кислоты.
Вопросы для повторения
2 За°счаК°е моча? Где она образуется?
3 От чЛ1 каких процессов осуществляется образование мочи?
4 Что пта„1“ИСИТ состав конечной мочи? Каков он в норме?
стическое значки!/ понятие Физические свойства мочи? Каково диагно-
5 . Что так6™6 определения физических свойств мочи?
различных забоХванияТ? КаКИС изменения Диуреза наблюдаются при и цвет ^ее?ЧеГ° зависит Чвет мочи? Как взаимосвязаны количество мочи
7. Как изменяется цвет мочи при заболеваниях печени, почек приеме медикаментозных средств, влиянии алиментарного фактора?
8. Почему при стоянии мочи образуется муть? Чем вызвана мут ность свежевыделенной мочи?
9. Какую функцию почки отражает относительная плотность мочи' Как она изменяется?
10. Назовите виды протеинурии? Каковы пути попадания белка , мочу?
11. Каков уровень глюкозы в крови при ренальной и экстрареналь ной глюкозурии? Каковы причины глюкозурий?
12. Что входит в понятие кетоновые тела? Каковы причины и; появления в моче?
13. Какие пигменты могут попадать в мочу при патологии? Как ою меняют ее цвет?
14. Что такое индиканурия? Каковы ее причины?
15. Что понимают под термином неорганизованный осадок мочи' Каково диагностическое значение обнаружения его в моче?
16. Каковы компоненты организованного осадка мочи? Каким! методами можно исследовать организованный осадок? В чем ценност! каждого из ннх?
17. Какова цель постановки пробы Зимницкого? По каким показате лям оценивают работу почки при пробе Зимницкого?
МЕТОДЫ ИССЛЕДОВАНИЯ
В клинической практике анализ мочи является основным и наиболее доступным для исполнения. При условии тщательного и правильного сбора мочи и точного выполнения методик этот анализ имеет большую диагностическую ценность.
В лаборатории моча может подвергаться различным видам исследования: химическое исследование на билирубин, индикан, кровь, меланин и др.; микроскопическое исследование на опухолевые клетки; бактериоскопическое и паразитологическое исследования. Обычно производят общий или клинический анализ, включающий следующий определения:
1) описание физических свойств;
2) химическое исследование на белок и глюкозу;
3) микроскопическое исследование осадка.
Исследования, не входящие в клинический анализ делают только по специальному требованию врача, для чего на направлении указывается вид исследования.
§ 6. Правила сбора
Для получения достоверных результатов необходимо правильно собрать мочу. Для клинического анализа желательно брать первую утреннюю порцию, так как она наиболее концентрирована и с ней вымываются патологические элементы, скопившиеся в почках и в мочевыводя-щих путях за ночь. Перед сбором мочи необходим тщательный туалет наружных половых органов, чтобы в
мочу не попали выделения из них. Мочу удобнее собрать сначала в мочеприемник, а затем уже перелить в склянку. Мочеприемники (горшки, судна, утки) хорошо очищают от скопившихся солей и тщательно промывают водой. Склянки и мочеприемники нельзя мыть раствором соды, так как в этом случае моча быстро ощелачивается.
Склянки для анализа должны быть чистыми, сухими из светлого стекла. На склянке укрепляют направление.
Иногда мочу берут катетером. Эта особенность должна быть отмечена в направлении.
Суточную мочу собирают, придерживаясь следующих правил. Первую, после сна, утреннюю порцию не берут. Мочу собирают, начиная со второй порции, весь день и ночь, захватывая утреннюю порцию следующего дня. Заранее готовят склянку вместимостью не менее 2 л. При собирании суточной мочи ее необходимо оберегать от брожения и загнивания, поэтому в течение суток мочу следует хранить на холоде. Можно добавлять к ней консервирующие средства (толуол, тимол). Консерванты иногда мешают нормальному проведению анализа, поэтому к выбору консерванта следует подходить очень осторожно.
Специальные виды исследования требуют особенно четкого выполнения всех требований по сбору материала. Так, при исследовании осадка мочи по НечипоренкО берется не более 15—20 мл, но обязательно в середине мочевой струи первой утренней порции. При исследовании по Каковскому — Аддису мочу собирают за 10—12 ч. Больной мочится перед сном, отмечает время и после сна собирает мочу в течение 10—12 ч. При исследовании на диастазу следует использовать свежевыделенную теплую мочу, чтобы сохранить активность фермента.
§ 7. Исследование физических свойств
Клинический анализ мочи делают в следующей последовательности:
1) отстаивают не менее 1 —1,5 ч;
2) собирают осадок со дна посуды;
3) центрифугируют;
4) описывают физические свойства (цвет, прозрачность, запах, осадок, видимый на глаз);
5) определяют реакцию;
6) определяют относительную плотность;
7) делают химические исследования (качественное и количественное определение белка, глюкозы); обнаружение ацетоновых тел, индикана и пигментов производится о специальному требованию врача. Если лаборант считает необходимым проделать какую-либо реакцию дополни-
1,000
1,010 i.o го 1,030 1,040 1,050
Рис. 7. Определение относительной плотности мочи.
тельно, то исследование производится без специальных указаний;
8) микроскопируют осадок.
Все физические свойства мочи оцениваются лаборантом визуально, результаты исследования записывают в специальные бланки.
Определение реакции. Данное исследование производят сразу же после доставки мочи, так как при стоянии реакция изменяется. Для определения можно использовать индикаторную бумагу. Наибольшее распространение получила универсальная индикаторная бумага типа «АГ-. ФАН» (ГДР) и «Рифан». Ин-1 дикаторную бумагу смачивают исследуемой мочой и сравнивают изменение ее окраски со стандартной колориметрической шкалой, каждая полоска которой соответствует определенному значению pH.
Более точно определяют pH мочи с помощью жидкого индикатора бромтимолового синего.
Приготовление реактива: 0,1 г тонко растертого в фарфоровой ступке индикатора растворяют в 20 мл теплого этилового спирта и после охлаждения до комнатной температуры доводят водой до объема 100 мл.
Ход определения. В химическую пробирку наливают 2—3 мл мочи, прибавляют 1—2 капли индикатора, перемешивают. Желтый цвет индикатора соответствует кислой реакции, бурый — слабокислой, травянистый— нейтральной, зеленоватый — слабощелочной, синий — щелочной реакции мочи.
Относительная плотность. Определение производя! урометром — ареометром, который отградуирован на определение относительной плотности в пределах от 1,000 до 1,050. Наименьшее значение относительной плотности нанесено на шкале вверху, а наибольшее — внизу. Глубина погружения зависит от плотности жидкости. С уменьшением относительной плотности урометр погружается глуб
же Урометр хранится в склянке с водой и с мягкой подстилкой на дне склянки (рис. 7).
Техника определения. В узкий цилиндр вместимостью 50 мл осторожно по стенке наливают мочу, так, чтобы не появилась пена. Если пена появилась, ее следует убрать фильтровальной бумажкой. Урометр медленно погружают в жидкость, стараясь не намочить часть, оставшуюся над жидкостью. Когда урометр перестанет погружаться, его следует слегка толкнуть сверху. После прекращения колебаний жидкости снимают показания по верхнему мениску, если моча мутная, и по нижнему мениску, если моча прозрачная.
§ 8. Исследование химического состава
Белок Качественные пробы
Каждый клинический анализ мочи включает качественное определение белка. Если белок в моче обнаружен, т. е. качественная проба положительная, то обязательно определяют его количество. Все качественные пробы основаны на способности белка коагулировать под действием кислот и температуры. В результате реакции свернувшийся белок дает муть, поэтому обнаружить его можно только в прозрачной моче. Мутную мочу следует предварительно профильтровать.
Проба с сульфосалициловой кислотой. Наиболее чувствительной и распространенной является проба с 20% раствором сульфосалициловой кислоты.
Ход определения. Две химические пробирки помечают: «О» — опыт и «К» — контроль. В обе пробирки наливают 4—5 мл прозрачной мочи. В опытную пробирку добавляют 4—5 капель 20% раствора сульфосалициловой кислоты, хорошо перемешивают. Обе пробирки рассматривают рядом на черном фоне. При наличии белка в опытной пробирке отмечается помутнение. Контрольная пробирка служит для сравнения. Чувствительность пробы с сульфосалициловой кислотой 0,015 г/л.
Продукты расщепления белка — альбумозы — также дают^ положительную реакцию с сульфосалициловой кислотой. Для выяснения причины помутнения пробу нагревают. При этом помутнение, вызванное присутствием альбумоз, исчезает, а помутнение, вызванное присутствием белка, усиливается.
Кольцевая проба Геллера. Ход определения. В центрифужную пробирку наливают 1 —1,5 мл 50% азотной кислоты или реактива Ларионовой. Затем наслаивают на
I
кислоту такое же количество мочи, так, чтобы жидкости не смешивались. При наличии белка на границе жидкостей возникает белое кольцо. Реакцию оценивают на черном фоне и учитывают время появления нитевидного кольца. Чувствительность пробы 0,033 г/л. При таком содержании белка на границе жидкостей появляется белое нитевидное кольцо между 2-й и 3-й минутами.
Техника наслаивания. Мочу всегда наслаивают на кислоту, так как относительная плотность мочи ниже, чем кислоты. Наслаивание производят пастеровской пипеткой с баллоном, которой набирают небольшое количество мочи. Затем мочу вносят в узкую часть центрифужной пробирки, держа ее наклонно, наслаивают по каплям, медленно опуская мочу по стенкам пробирки.
Недостаток пробы заключается в появлении пигментного кольца от окисления урохрома азотной кислотой. Это коричневатое кольцо может мешать определению. В моче, содержащей ураты, иногда появляется беловатое кольцо выше границы жидкостей.
Более четкий результат пробы Геллера получается, если вместо 50% раствора азотной кислоты используют реактив Ларионовой (1% раствор азотной кислоты в насыщенном растворе хлорида натрия).
Количественное определение <
Количество белка в моче можно определить двумя способами: 1) методом Брандберга—Робертса — Столь-никова с разведением мочи; 2) по помутнению, образующемуся при добавлении 3% сульфосалициловой кислоты.
Метод Брандберга—Робертса — Стольникова. В основу этого метода положена кольцевая проба Геллера. Известно, что при содержании белка в моче в количестве 0,033 г/л образуется нитевидное кольцо на 2—3-й минуте. Если белка в моче содержится больше, чем 0,033 г/л, то кольцо появляется раньше, причем не нитевидное, а широкое. Такую мочу следует развести дистиллированной водой и вновь уже с разведенной мочой проделан наслоение на азотную кислоту. Если после наслоенш появляется нитевидное кольцо между 2-й и 3-й минутами, то разведение следует считать законченным. Количество белка в этом случае определяют, умножая 0,033 г/л н1 степень разведения мочи. Разведение мочи подбирают пользуясь следующей ориентировочной оценкой свойст! кольца: если после наслаивания сразу появилось нитевид ное кольцо, мочу разводят в 2 раза, если сразу появилос! широкое кольцо — в 4 раза, если сразу появилось компаК тное кольцо — в 8 или 10 раз.
Разведение мочи делают в мерной центрифужной пробирке, наливая мочу до метки 1 мл и доливают водой до той метки, во сколько раз делается разведение. Содержимое пробирки тщательно перемешивают пастеровской пипеткой с баллоном.
Иногда приходится разводить мочу несколько раз. В этом случае при подсчете количества белка учитывают все разведения. Пример. При наслаивании цельной мочи появилось сразу компактное кольцо. Разводят мочу в мерной центрифужной пробирке в 10 раз (1 мл мочи и 9 мл воды до метки 10). Наслаивают разведенную в 10 раз мочу на азотную кислоту. Если сразу появляется широкое кольцо, то определение не закончено, его следует продолжить. Из первого разведения в 10 раз необходимо сделать еще разведение в 4 раза. Общая степень разведения в этом случае будет равна 40 (10x4). С разведенной в 40 раз мочой вновь ставят кольцевую пробу Геллера. При появлении нитевидного кольца между 2-й и 3-й минутами определение следует считать законченным.
При работе можно пользоваться поправкой Эрлиха — Альтгаузена, в случае, если нитевидное кольцо появляется ранее 2-й минуты. Чтобы не разводить мочу дополнительно, авторы предложили определить время появления нитевидного кольца и внести в расчет поправку на время. В этом случае количество белка рассчитывают умножая 0,033 г/л на степень разведения и на поправку. Значения поправок сведены в табл. 3.
Таблица 3. Значения поправок для определения белка
Время образования^ кольца, мин Поправка Время образования кольца, мнн Поправка
1—р/4 1,3/8 2-21/г 1'/16
1J/4—1‘/2 1*/4 11/2—3- 1
1 /2-Р/4 >3/16 3-3>/2 15/16
Р/4—2 1'/8 3>/2—4 7/з
Фотометрический метод. Основан на том, что белок с сульфосалициловой кислотой дает помутнение, интенсив-ность которого прямо пропорциональна концентрации белка. Материалом для исследования служит моча в количестве, не менее 2,5 мл.
P».aKJ?1Bbi: D 3% раствор сульфосалициловой кисло-ы, Z) о,9% раствор хлорида натрия; 3) 1% стандартный раствор альбумина.
Ход определения. 2 мерные центрифужные про-ппР«И помечают: «О» — опыт и «К» — контроль. В обе ро ирки наливают по 1,25 мл профильтрованной мочи. В 1тную прибавляют 3,75 мл (до метки 5) 3% раствора
2-325
33
сульфосалициловой кислоты, в контрольную ^-3,75 мл (до метки 5) 0,9% раствора хлорида натрия. Оставляют нд 5 мин, а затем фотометрируют на ФЭКе при длине волны 590—650 нм (оранжевый или красный светофильтр) в кювете с толщиной слоя 5 мм против контроля. Расче-ведут по калибровочному графику.
Построение калибровочного графика. Гото вят стандартный раствор альбумина. Для этого отвешива ют 1 г лиофилизированного, высушенного до постоянно) массы, альбумина и растворяют его в небольшом количе» стве хлорида натрия в мерной колбе вместимостью 100 мл После растворения объем жидкости в колбе доводят д< метки хлоридом натрия. Для стабилизации к реактив] добавляют 1 мл 5% азида натрия. Приготовленный таки» образом реактив годен к употреблению в течение 2 мес при условии хранения в холодильнике.
В 1 мл раствора содержится 10 мг альбумина. Из стандартного раствора готовят разведения. В 5 градуированных пробирок наливают соответственно 0,05; 0,1; 0,2; 0,5 и 1 мл стандартного раствора альбумина. В каждую пробирку доливают до объема 10 мл 0,9% раствора хлорида натрия. Концентрация белка в этих растворах соответственно составит 0,05; 0,1; 0,2; 0,5 и 1 г/л. Каждую пробу обрабатывают как опыт. Измерения производят на ФЭКе и регистрируют показатели экстинкции, которые используют для построения калибровочного графика (подробно см. § 109).
Г люкоза
Качественные пробы
При проведении общеклинического анализа мочи обязательным является определение глюкозы, которое проводится несколькими методами. Наиболее часто в клинической лаборатории пользуются пробой Гайнеса, а также экспресс-методами с применением готового набора реактивов или с помощью индикаторной бумаги «Глюкотест» или «АГ-ФАН» (ГДР).
Проба Гайнеса. Эта проба относится к широко распространенным редукционным методам и ^снована на способности глюкозы при нагревании в щелочной среде восстанавливать дигидроксид меди (желтого цвета) в моногид роксид меди (оранжево-красного цвета).
Реактив Гайнеса готовят по следующей прописи
1) 13,3 г кристаллического сульфата меди (х. ч.) ра створяют в 400 мл дистиллированной воды; •
2) 50 г гидроксида натрия растворяют в 400 мл дистил лированной воды;
3) 15 г глицерина растворяют в 200 мл дистиллированной воды;
4) смешивают 1-й и 2-й реактивы; к ним приливают третий; полученный реактив стоек.
Ход определения. В химическую пробирку вносят 4 мл реактива Гайнеса и добавляют 8—12 капель мочи. Нагревают в водяной бане или над пламенем горелки до кипения. В присутствии глюкозы появляется желтая или оранжевая окраска жидкости и осадок.
В связи с достижениями медицинской науки в лабораторной диагностике заметна тенденция к совершенствованию принци
пов исследования и к уп- । Рис. 8. Поляриметр, рощению методик их выполнения. Поэтому в рабо-
те клинической лаборатории широкое применение находят разнообразные экспресс-тесты. Основные положения по
использованию экспресс-тестов будут изложены в специальном параграфе, в том числе и использование экспресс-тестов для определения глюкозы в моче. .
Количественное определение
К количественному определению глюкозы приступают только после положительной качественной реакции. Количество глюкозы определяют поляриметрическим методом или по цветной реакции с ортотолуидином.
Поляриметрический метод. Основан на способности глюкозы вращать плоскость поляризованного луча вправо. Это свойство и положено в основу действия прибора-поляриметра (рис. 8), схема которого представлена на Рис. 9.
Световой луч от источника света (1), прошедший через призму Николя (поляризатор), называется поляризованным. Все волны такого луча идут в одной плоскости, глюкоза, отклоняет поляризованный луч вправо, и чем оольше глюкозы содержится в моче, тем больше угол
Рис. 9. Ход лучей в поляриметре. Объяснение в тексте. й
отклонения луча. По углу отклонения (вращения) поляр!« зоваиного луча можно определить количество глюкозы.™ На пути поляризованного луча на определенном расМ стоянии от призмы-поляризатора (2) находится в приборД вторая призма-анализатор (5), оптическая ось которое параллельна оси поляризатора. Если между поляризатсЯ ром и анализатором поставить кювету с дистиллированно^ водой, плоскость поляризации останется без изменений и поле зрения, наблюдаемое через окуляр (7), будет равномерно освещено. Если же в кювету (3, 4) налить жидкость, содержащую оптически активное вещество, то плоскость поляризации изменится, и поляризованный луч отклонится на определенный угол. Световой луч не сможет проникнуть в анализатор, и поле зрения будет затемнено.
Луч света может пройти через анализатор только в том случае, если повернуть его на такой угол, чтобы плоскость поляризованного луча совпадала с оптической осью анализатора. Анализатор поворачивают кольцом вращения (6), которое в свою очередь связано с подвижной шкалой-нониусом. Над нониусом расположена неподвижная угловая шкала-лимб (8). Лимб и нониус составляют отсчетное устройство поляриметра. Угловая шкала разделена на градусы. Каждый градус лимба соответствует 1% глюкоз зы. Цена деления нониуса — 0,1°, что соответствует 0,1?? глюкозы. Лимб позволяет отсчитывать целые цифры, г нониус — десятые доли градусов (или процентов глюкозы).
Моча, предназначенная для поляриметрии, должна удовлетворять следующим требованиям: быть бесцветна, прозрачна, иметь кислую реакцию и не содержать белка, так как белок является также оптически активным веществом и вращает плоскость поляризации влево. Мочу, содержащую белок, следует освободить от него. Для этого белковую мочу нагревают с концентрированной уксусной кислотой до кипения, затем охлаждают и фильтруют через бумажный фильтр.
Для обесцвечивания и подкисления к моче добавляют 30% раствор ацетата свинца, подкисленного уксусной кислотой. Добавлять следует из расчета 1 мл реактива на ждые Ю мл мочи- Моча, смешанная с реактивом, будет г /-гшгтной но мутной. Ее необходимо профильтровать SpS бумажный фильтр.
Порядок работы с прибором. Перед определением глюкозы необходимо провести установку прибора:
а) в кювету прибора наливают дистиллированную воду. Кювета — это полая трубочка с винтовой нарезкой на концах. К каждой кювете прилагаются два стеклышка и дВа колпачка, закрывающие отверстия кюветы;
б) воду в кювету наливают осторожно, чтобы не образовались пузырьки воздуха, а вода над уровнем кюветы стояла куполообразно. Стеклышко надвигают сбоку, как бы срезая им купол. Завинчивают кювету колпачком;
в) вытирают кювету снаружи мягкой тряпочкой и вставляют в муфту;
г) проверяют, чтобы «0» лимба и «0» нониуса совпадали (нулевое положение прибора);
д) если прибор исправлен, то в окуляре видно равномерно освещенное поле зрения без линий раздела и затемнения, так как вода не является оптически активным веществом.
После установки прибора проводят определение глюкозы:
а) подготовленную мочу наливают в чистую сухую кювету, вытирают ее и помещают в муфту;
б) через 3—5 мин, когда прекратятся колебания жидкости, в окуляре видно поле зрения, середина которого затемнена (поляризованный луч отклонился);
в) под контролем зрения медленно вращают кольцо анализатора вправо до тех пор, пока поле зрения вновь не будет равномерно освещено;
г) снимают показания по лимбу и нониусу. Целое число процентов глюкозы равно числу делений, на которое нуль нониуса отошел от нуля лимба. Далее отмечают, какое деление нониуса совпадает с одним из делений лимба. Это деление нониуса показывает десятые доли процента глюкозы;
д) отсчет следует производить 3 раза и взять среднее арифметическое из этих показаний.
После работы кювету промывают уксусной кислотой, чтобы растворить налет ацетата свинца. Затем тщательно несколько раз ополаскивают кювету дистиллированной водой и высушивают.
Определение глюкозы в моче по цветной реакции с ортотолуидином см. § 124.
Кетоновые тела
Для обнаружения кетоновых тел используют пробу Ланге или экспресс-методы.
Проба Ланге. Кетоновые тела образуют с нитропруссидом натрия в щелочной среде комплексное соединение фиолетово-красного цвета.
Реактивы. 1) Нитропруссид натрия (готовят непосредственно перед определением): в пробирку вносят несколько кристалликов реактива и приливают 2—3 мл воды; взбалтывают до получения розовато-красного раствора (цвет «крепкого чая»); при этом на дне пробирки должна остаться часть кристаллов в нерастворенном состоянии; 2) крепкая уксусная кислота; 3) 25% раствор аммиака.
Ход определения. В химическую пробирку наливают 8—10 мл мочи и прибавляют 8—10 капель крепкой уксусной кислоты и 5—6 капель свежеприготовленного раствора нитропруссида натрия. Затем наслаивают 2—3 мл раствора аммиака. Проба оценивается на белом фоне и считается положительной, если на границе между раствором аммиака и раствором в пробирке в течение 1 — 2 мин появится фиолетово-красное кольцо.
Определение кетоновых тел производят по специальному указанию врача или без него, если в моче больного обнаружена глюкоза. Результат исследования записывается в бланке словами: кетоновые тела «обнаружены» или «не обнаружены».
Пигментный состав
Обнаружение билирубина производят пробами Розина или Гаррисона — Фуше.
Проба Розина. Основана на окислении билирубина мочи (оранжево-желтого цвета) в биливердин (зеленого цвета) под действием йода.
Реактивы. Раствор Люголя (1 г йода и 2 г йодида калия растворяют в 300 мл дистиллированной водь;) или 1% спиртовой раствор йода.
Ход определения. В пробирку наливают 4—5 мл мочи и осторожно наслаивают на нее спиртовой раствор йода или раствор Люголя. При наличии в моче билирубина на границе жидкостей появляется зеленое кольцо (такое же кольцо получается после приема больным антипирина).
Проба Гаррисона — Фуше. Основана на окислении билирубина хлоридом железа (III), входящим в состав реактива' Фуше, после осаждения его хлоридом бария.
Реактивы: 1)15% водный раствор хлорида бария;' 2) реактив Фуше (25 г трихлоруксусной кислоты растворя-38
юТ в 100 мл дистиллированной воды и прибавляют 1 г хлорида железа).
Ход определения. К 10 мл мочи прибавляют 5 мл 15% раствора хлорида бария, перемешивают и фильтруют. Фильтр вынимают из воронки и раскладывают в чашке Петри на сухой фильтровальной бумаге. На пятно хлорида бария наносят 1—2 капли реактива Фуше. В присутствии билирубина на фильтре появляются сине-зеленые пятна.
Эта проба очень чувствительна и ставится в том случае, если проба Розина дает нечеткий результат.
Обнаружение уробилина в моче производят пробами Богомолова или Флоранса.
Проба Богомолова. Основана на способности уробилина давать с сульфатом меди соединение розово-красного цвета.
Реактивы: 1) насыщенный раствор сульфата меди; 2) хлороформ.
Ход определения. Пробу проводят в прозрачной моче. Если моча мутная, то ее следует профильтровать. 10—15 мл профильтрованной мочи наливают в пробирку и добавляют насыщенный раствор сульфата меди. Если появляется муть, то приливают 3—4 капли концентрированной хлористоводородной кислоты для просветления. Оставляют на 5 мин, затем приливают 2—3 мл хлороформа. Перемешивают содержимое пробирки и дают отстояться до образования двух слоев. В нижнем слое находится хлороформ, который при наличии большого количества уробилина окрашивается в розовый цвет. При нормальном содержании уробилина в моче проба отрицательна. Проба малочувствительна.
Проба Флоранса. Основана на способности уробилина образовывать с хлористоводородной кислотой соединение красного цвета.
Реактивы: 1) диэтиловый эфир; 2) концентрированная серная кислота; 3) концентрированная хлористоводородная кислота.
Ход определения. Готовят эфирную вытджку из мочи. Для этого в пробирку с плотно закрывающейся пробкой помещают 8—10 мл мочи и подкисляют ее 2—3 каплями концентрированной серной кислоты. Перемешивают содержимое и добавляют 2—3 мл эфира. Пробирку плотно закрывают пробкой и осторожно перемешивают в течение 2—3 мин. Дают содержимому отстояться для более полного извлечения уробилина. Жидкость расслаивается: при этом в верхнем слое находится эфирная вытяжка, содержащая уробилин. В другую пробирку наливают 1—2 мл концентрированной хлористоводородной кислоты, и на нее наслаивают эфирную вытяжку из первой пробирки. При нормальном содержании уробилина
в моче на границе жидкостей появляется бледно-розовое кольцо. При более интенсивной окраске содержание уробилина считают повышенным. Проба очень чувствительна.
Обнаружение кровяного пигмента в моче производят в основном экспресс-тестами или пробой Грегерсена с бензидином, которая подробно будет описана при исследовании кала на скрытую кровь.
Индикан
Для обнаружения индикана чаще всего используют пробу Яффе и пробу Обермейера, которые основаны на одном и том же принципе: индикан, окисляясь, превращается в краску индиго, которая окрашивает хлороформ в синий, голубой или розовый цвета.
Проба Яффе. Реактивы: 1) хлороформ; 2) тиосульфат натрия; 3) 2% водный раствор перманганата калия; 4) концентрированная хлористоводородная кислота.
Ход определения. К 3—4 мл мочи, освобожденной от белка, добавляют равное количество концентрированной хлористоводородной кислоты, 1 мл хлороформа и 2—3 капли 2% раствора перманганата калия. Пробирку плотно закрывают пробкой и тщательно перемешивают содержимое. При этом хлороформ извлекает из раствора индиго и окрашивается им. Содержимому дают несколько минут отстояться. Жидкость в пробирке расслаивается. В нижнем слое находится окрашенный хлороформ.
Розовый цвет хлороформу может также придать йод, что наблюдается в случаях приема йодистых препаратов. Чтобы установить точную причину окраски хлороформа, верхний слой жидкости из пробирки сливают, а к хлороформу добавляют несколько кристалликов тиосульфата натрия. Если окраска хлороформа была вызвана присутствием йода, то он обесцвечивается. Окраску хлороформа, вызванную индиканом, тиосульфат натрия не изменяет. При нормальном содержании индикана в моче реакция Яффе отрицательная; при увеличенном — положительная.
Проба Обермейера. Реактивы: 1) ацетат свинца; 2) реактив Обермейера [в цилиндр вместимостью 100 мл вносят 0,2—0,4 г хлорида железа (III) и постепенно приливают концентрированную хлористоводородную кислоту до метки].
Ход определения. К 10 мл мочи прибавляют около 2 г ацетата свинца, тщательно перемешивают и фильтруют через бумажный фильтр. К 5—6 мл фильтрата приливают такое же количество реактива Обермейера. Оставляют на 6—8 мин и добавляют 2—3 мл хлороформа. Пробирку плотно закрывают пробкой и тщательно перемешивают содержимое. Затем выдерживают несколько минут для
расслаивания жидкости. При увеличенном содержании индикана в моче осевший хлороформ окрашен в синий цвет, при нормальном — хлороформ не окрашивается.
§ 9. Микроскопическое исследование осадка
Ориентировочный метод
Анализ начинают со снятия осадка, так как в противном случае он будет потерян. Осадок снимают пипетками или стеклянными трубками диаметром 5—6 мм с оплавленными краями. На пипетку надевают баллон и осторожно погружают ее на дно склянки. Передвигая трубочку по дну склянки, набирают жидкость с осадком в пипетку, не допуская попадания ее в баллон. Из пипетки мочу переносят в центрифужную пробирку.
Практикуется и другой способ — осадок мочи не собирают со дна, а ограничиваются простым взбалтыванием мочи перед тем, как отлить ее в центрифужную пробирку.
Центрифужные пробирки, заранее пронумерованные в соответствии с нумерацией бутылок с мочой, следует наполнять почти доверху, отступая от края на 1—2 см. После каждого собирания осадка пипетку с баллоном следует промывать водой, чтобы не занести элементы осадка одного анализа в другой. Пробирки, содержащие осадок мочи, помещают в противостоящие гнезда центрифуги и центрифугируют 5—10 мин при 1500 об/мин. После Остановки центрифуги их вынимают и одним быстрым движением сливают надосадочную жидкость. В пробирке остаются осадок и несколько капель жидкости, которые тщательно перемешивают. Каплю осадка переносят пастеровской пипеткой с баллоном на предметное стекло, которое должно быть помечено тем же номером, что и центрифужная пробирка. Осадок накрывают покровным стеклом, не допуская попадания пузырьков воздуха. Приготовленный препарат является нативным (естественным, неокрашенным).
Осадок мочи оценивают вначале под малым увеличением микроскопа (объектив 8х, окуляр 7х), а затем переводят на большое увеличение (объектив 40х, окуляр 7х, при опущенном конденсоре).
Под малым увеличением делают общий обзор препарата. При этом обнаруживают и подсчитывают цилиндры, составляют общее представление о количестве солей, слизи и др.
Под большим увеличением детализируют отдельные элементы осадка, приблизительно подсчитывают количество лейкоцитов и эритроцитов в поле зрения, составляют
окончательное суждение об осадке в целом. Для этого необходимо просмотреть не менее 10—15 полей зрения. Результат такого исследования заносят в бланк.
Количественные методы
Эти методы позволяют определить точное количество эритроцитов, лейкоцитов и цилиндров, выделенных с мочой. Это особенно важно для диагностики заболевания, динамического наблюдения за его течением и контроля за проводимым лечением хронических, скрытых и вялотекущих форм гломерулонефрита и пиелонефрита. Наибольшее распространение получил метод Каковского — Аддиса и метод Нечипоренко.
Метод Каковского—Аддиса. Основан на определении количества форменных элементов (эритроцитов, лейкоцитов и цилиндров) в суточном объеме мочи с помощью счетной камеры. Материалом для исследования служит моча, которую собирают за 10—12 ч. В день сбора для поддержания постоянных величин относительной плотности и pH мочи необходимо ограничить прием жидкости больным. Наиболее рационально собирать ночную порцию мочи: больной мочится перед сном, отмечая время, а затем собирает мочу в течение 10—12 ч в один сосуд. Для предотвращения разрушения клеточных элементов в сосуд прибавляют кристаллик тимола.
Ход определения. Собранную мочу тщательно размешивают и измеряют ее объем. Для центрифугирования берут объем мочи, выделенный за 12 мин ('/5 ч). Это количество мочи рассчитывают по следующей формуле:
v 0= t~,
где Q—объем мочи, выделенный за 12 мин (мл); V—объем мочи, собранный за 10—12 ч (мл); t—время сбора мочи (ч); 5 — коэффициент пересчета на '/5 ч.
Рассчитанное количество мочи центрифугируют в мерной центрифужной пробирке при 3500 об/мин в течение 3 мин или при 2000 об/мин в течение 5 мин. Пастеровской пипеткой с баллоном отсасывают верхнюю часть жидкости, оставляя в пробирке точно (!) 0,5 мл осадка. Если осадок обильный, то оставляют 1 мл. Осадок тщательно перемешивают, и каплю его переносят в счетную камеру (техника заполнения камеры и ее устройство подробно изложены в § 56). Подсчитывают раздельно количество лейкоцитов, эритроцитов и цилиндров в камере и делают пересчет количества элементов на 24 ч (сутки).
Подсчет клеточных элементов можно производить в счетной камере Горяева или счетной камере Фукс —
Розенталя. Объем камеры Горяева равен 0,9 мкл, поэтому количество форменных элементов в 1 мкл определяют по формуле:
Л X = oJ>
где х—количество форменных элементов в 1 мкл; А—количество форменных элементов, подсчитанных во всей камере Горяева; 0,9—объем камеры Горяева, мкл.
Для камеры Фукс — Розенталя, объем которой равен 3,2 мкл, формула для подсчета имеет следующий вид:
А
Х~3,2 ‘
Количество форменных элементов, выделенных с мочой за сутки, рассчитывают по формуле:
В=х-500-5-24=х -60000,
где В—количество форменных элементов, выделенных за сутки; х—число форменных элементов в 1 мкл мочи (см. выше); 500 (0,5) — количество мочи, оставленное после центрифугирования для исследования, мкл (мл), если оставляют 1000 мкл (1 мл), то соответственно в формулу берется эта цифра; 5 и 24 — коэффициенты пересчета выделенного количества клеток на 24 ч, т. е. за сутки.
У здорового человека за сутки с мочой может выделиться до 2 000 000 (2-106) лейкоцитов, до 1 000 000 (Г106) эритроцитов, до 20 000 (2-Ю4) цилиндров.
Недостатком данного метода является длительное время сбора и хранения мочи, что может привести к частичному лизису клеточных элементов. Метод Нечипо-ренко лишен этого недостатка, так как учет количества клеточных элементов ведется в разовой порции.
Метод Нечипоренко. Основан на определении количества клеточных элементов в 1 мл свежесобранной мочи с помощью счетной камеры. Материалом для исследования служит утренняя порция мочи в середине мочевой струи. Сразу же определяют pH ее, так как в щелочной моче может быть частичный распад клеточных элементов.
Ход определения. В мерную центрифужную пробирку помещают 10 мл мочи и центрифугируют при 3500 об/мин в течение 3 мин. Пастеровской пипеткой с баллоном отсасывают верхнюю часть жидкости, оставляя в пробирке точно (!) 0,5 мл осадка. При обильном осадке оставляют 1 мл. Осадок тщательно перемешивают и переносят одну каплю в счетную камеру. Если подсчет ведется в камере Горяева, то клеточные элементы считают отдельно в 100 больших квадратах сетки Горяева и в Дальнейшем делают пересчет по следующей формуле:
где N—количество форменных элементов в 1 мл мочи;
х =------количество форменных элементов в 1 мкл
0,9
мочи; А—количество форменных элементов, подсчитанных в камере; 500 (0,5) — количество мочи, оставленное для исследования после центрифугирования, мкл/(мл), если оставляют 1000 мкл (1 мл) мочи, то соответственно в формулу берется эта цифра; V—количество мочи, взятое для центрифугирования, мл. В камере Фукс — Розенталя подсчитывают клеточные элементы по всей сетке отдельно. Расчет количества элементов в 1 мл мочи ведут также по предыдущей формуле, но количество клеточных элементов в 1 мкл (х) рассчитывают по формуле:
А
Х “3,2 '
В норме в 1 мл мочи выделяется до 2000 лейкоцитов, до 1000 эритроцитов, цилиндры отсутствуют.
§ 10. Экспресс-тесты и их применение
Современный уровень развития медицинской науки привел к значительному совершенствованию лабораторных исследований. Вместе с этим эффективность работы лабораторно-диагностической службы зависит от того, как быстро сделано то или иное определение. В этой связи экспресс-тесты обладают рядом качеств, определивших их широкое применение в последние годы. Среди этих положительных качеств необходимо отметить следующие:
— быстрота выполнения анализов в неотложных случаях, когда результат анализа необходимо получить срочно у постели больного при диагностике угрожающих жизни состояний;
— отсутствие дополнительных реактивов;
— простота проведения анализа (проведение исследования в услових отделения врачом-клиницистом или обученной медицинской сестрой);
— достаточная точность;
— большая устойчивость сухих реактивов по сравнению с жидкими и удобство при транспортировке.
В практике лабораторной службы применяются^ экспресс-тесты отечественного производства и производ-1 ства народных предприятий ГДР и ЧССР. 1
Они представляют собой сухие пробы, позволяющий проводить быстрые качественные и полуколичественные
определения компонентов биологических жидкостей (мочи, крови и др.). Экспресс-тесты чаще всего выпускаются в виде реактивных таблеток, порошков или полосок фильтровальной бумаги, пропитанных соответствующей смесью реактивов.
Принцип действия тестов основан на тех же или на аналогичных химических реакциях, что и классических методов анализа. Ход исследования обычно сводится к нанесению на таблетку или на полоску индикаторной бумаги исследуемой жидкости (чаще полоску бумаги погружают в исследуемую жидкость).
Результат исследования оценивается по времени появления окраски, по величине окрашенной зоны или по интенсивности окраски. При этом можно судить не только о наличии определяемого вещества, но и о примерном количественном содержании его.
Экспресс-тесты выпускаются для определения как одного компонента (монотесты), так и нескольких компонентов (политесты). В табл. 4 приведены экспресс-тесты, наиболее часто используемые при исследовании мочи.
Таблица 4. Экспресс-тесты для исследования мочи
Название Производство Назначение
Бумага лакмусовая синяя СССР Определение pH
» » красная. » индикаторная
универсальная 9» »
Бумага «Рифан» » нитразиноьая » »
желтая ГДР » »
Биофан-З » pH, белок, глюкоза
Альбуфан ЧССР » » »
АГ-ФАН pH, белок восстанавливающие вещества, глюкоза
Тетрафан То же
Пентафан Набор для экспресс-анализа глю- » pH, восстанавливающие вещества, белок, глюкрза, кетоновые тела
козы Реактивная бумага «Глюко- СССР Глюкоза Полуколичественное
тест» Набор для экспресс-анализа аце- определение глюкозы Определение кетоно-
тона Реактивные таблетки для обиа- » вых тел
ружения кетоновых тел Реактивные таблетки для обна? ГДР То же
ружения билирубина Реактивные таблетки для обна- ГДР Билирубин
Ружения гемоглобина у * Г емоглобин
Основные правила по применению экспресс-тестов.
1. Работу вести строго по прилагаемой инструкции.
2. Материал для исследования должен быть свежим.
3. Цветную шкалу предохранять от воздействия прямых солнечных лучей.
4. Хранить в плотно закрытых упаковках в прохладном месте, так как тесты очень чувствительны к действию влаги и тепла.
5. На результат исследования могут оказывать влияние лекарственные препараты, принимаемые больным. После прекращения приема лекарств исследование необходимо повторить.
Г л а в а II
ИССЛЕДОВАНИЕ СОДЕРЖИМОГО ЖЕЛУДКА И КИШЕЧНИКА
СОСТАВ И СВОЙСТВА СОДЕРЖИМОГО ЖЕЛУДКА В НОРМЕ И ПРИ ПАТОЛОГИИ
Желудочный сок — это секрет многочисленных трубчатых желез, расположенных в слизистой оболочке желудка. Желудочный сок участвует в сложном процессе пищеварения и секретируется через 5 —10 мин после приема пищи. Вне пищеварения желудочный сок не выделяется. Нарушение секреторной функции желудка приводит к расстройству пищеварения. Исследование желудочного сока имеет важное значение для оценки функционального состояния желудка.
§ 11. Физико-химические свойства
Желудочный сок—это бесцветная жидкость без запаха, имеющая резкокислую реакцию (pH 1,5—2,5). Желудочный сок без примеси слизи имеет более высокую концентрацию водородных ионов (pH" 0,8 —1,0).
В состав желудочного сока входят многочисленные органические и неорганические соединения. Из неорганических соединений следует отметить соляную кислоту и соли (хлориды, сульфаты, фосфаты и бикарбонаты). Соляная кислота обеспечивает кислую реакцию желудочного сока. Концентрация ее колеблется в пределах 143 — 160 ммоль/л. Она содержится в виде диссоциированных ионов водорода и хлора (свободная соляная кислота) и в форме недиссоциированных молекул в связи с белками (связанная соляная кислота). Значение соляной кислоты для нормального пищеварения чрезвычайно велико. Она
создает оптимум для действия ферментов желудка; способствует набуханию соединительной ткани и растительной клетчатки, что облегчает их дальнейшее переваривание; обладает слабым бактерицидным действием и т. д.
Из органических соединений в желудочном соке важнейшими являются протеолитические и непротеолитические ферменты. Протеолитические ферменты (пепсин, гастрин, ренин) расщепляют белки. Пепсин выделяется в неактивном состоянии в виде пепсиногена и активируется соляной кислотой. Гастрин, кроме гидролиза белков, стимулирует кислотообразующую функцию желудка, секрецию поджелудочной железы и желчи.
К непротеолитическим ферментам относится липаза, расщепляющая эмульгированные жиры молока и поэтому имеющая большое значение в пищеварении грудных детей.
Органические соединения желудочного сока представ-' лены также незначительным количеством органических кислот (молочной, АТФ), гастромукопротеином и слизью. Последняя играет защитную роль, предохраняя слизистую оболочку желудка от механических и химических повреждений. Гастромукопротеин способствует усвоению пищевого витамина В |2, необходимого для нормального кроветворения.
У здорового человека количество и состав желудочного сока зависят от пищевого режима и колеблются в определенных пределах. При обычном пищевом режиме у человека за сутки в процессе пищеварения выделяется 2—2,5 л желудочного сока. Вне пищеварения, натощак, в желудке должно содержаться не более 20—40 мл желудочного сока. Увеличение его объема до 50 мл и более следует считать признаком патологии. Это явление может наблюдаться у лиц с повышенной желудочной секрецией, при задержке пищи в желудке (сужение, спазм привратника, язвенная болезнь, злоупотребление курением).
Сведения о количестве, составе и свойствах желудочного сока получают при фракционном зондировании, которое продолжается не менее 2 ч. За это время получают 9—11 порций (фракций) желудочного содержимого.
§ 12. Патологические изменения
Физические свойства
В доставленном материале определяют количество, Цвет и отмечают наличие примесей.
Количество. Измеряют в каждой порции и отмечают объем содержимого желудка в порции, полученной натощак. На основании этих данных рассчитывают часовое
напряжение секреции. На объем желудочного сока может влиять примешивание слюны, остатков пробного завтрака, желчи и т. д.
Лаборант обязательно должен отметить наличие примесей.
Цвет. В норме желудочное содержимое беловатосерого цвета с заметной опалесценцией. Примесь желчи придает полученному материалу зеленовато-желтый цвет, примесь крови — алый, бурый цвет. В порции, полученной натощак, могут быть заметны на глаз кровянистослизистые клочки или комочки слизи. При описании физических свойств лаборант должен отметить эти особенности.
Химические свойства
При химическом исследовании желудочного сока оценивают кислотообразующую и ферментативную функции желудка.
Для оценки кислотообразующей функции желудка определяют общую кислотность, свободную, связанную кислоту, а также кислотный остаток (органические кислоты и кислореагирующие соли). Определение производят методом титрования и выражают кислотность в ммоль/л (мэкв/л). Общая кислотность желудочного сока равна количеству 0,1 н. раствора едкого натра, пошедшего на титрование 100 мл желудочного сока и составляет обычно 40—60 ммоль/л. Она складывается из свободной соляной кислоты, уровень которой — 20—40 ммоль/л; связанной — 10—20 ммоль/л и кислотного остатка, на который приходится до 10 ммоль/л.
Количество желудочного сока и его состав меняются при функциональных и органических заболеваниях желудка, печени, кишечника. Повышенное отделение желудочного сока—гиперсекреция может наблюдаться при язве желудка, желчнокаменной болезни. Обычно гиперсекрецию сопровождает увеличение содержания соляной кислоты в желудочном содержимом — гиперхлоргидрия. Пониженное отделение желудочного сока — гипосекреция— обычно сопровождается уменьшением содержания соляной кислоты в нем и называется гипохлоргидрия. Такое состояние наблюдается при гастрите, раке желудка^ злокачественном малокровии. Полное отсутствие в желу^ дочном соке соляной кислоты — ахлоргидрия може-сопровождаться снижением содержания пепсина, но чащ содержание его остается нормальным. Отсутствие в желу дочном соке соляной кислоты и пепсина обозначают термином ахилия. Она чаще всего наблюдается при р;-.к( желудка и В 12 (фолиево)-дефицитной анемии.
Дебит соляной кислоты. Под дебитом соляной кислоты понимают абсолютное количество ее, выделенное за определенный промежуток времени.
При определении дебита соляной кислоты учитывают концентрацию ее и количество выделенного желудочного сока. Расчет делают для каждой порции фракционного исследования. Полученные данные подставляют в формулу, которая имеет следующий вид:
„ V-36,5 E-V
Она— 2000 Мг ИЛИ ^на— jooo' ММОЛЬ,
где Ина — дебит соляной кислоты, мг или ммоль; V—количество желудочного сока, извлеченного за определенный промежуток времени, мл; Е—свободная соляная кислота, ммоль/л; 36,5 — относительная молекулярная масса соляной кислоты.
После определения дебита соляной кислоты в отдельных порциях рассчитывают дебит за час—дебит-час (Д-ч). Принято определять дебит-час базальной (полученной натощак) и дебит-час стимулируемой (после пробного завтрака) секреции. Для этого складывают показатели дебита свободной соляной кислоты в отдельных порциях или пользуются следующей формулой:
Vl-Et+V2-E2+VyE3+V4-E4 Д.ч=----------—----------- ,
где Д-ч—дебит соляной кислоты за час, ммоль/л.
Дебит можно узнать, не пользуясь формулами. В лабораторной практике широкое применение нашел способ Калиниченко, при котором пользуются графиком (номограммой). При работе с номограммой необходимо соединить линейкой цифры, обозначающие кислотность в ммоль/л и объем желудочного содержимого в миллилитрах, расположенные на противоположных ветвях кривой. В месте пересечения с вертикальной линией находят значение дебита свободной соляной кислоты (рис. 10).
Нормы дебита свободной соляной кислоты в ммоль/л: базальная секреция—1—4, стимулируемая капустным раздражителем — 1 — 4,5, стимулир уемая гистамином — 6,5 — 12.
Показатели дебита соляной кислоты находятся в прямой зависимости от массы обкладочных клеток, поэтому дают возможность судить о состоянии слизистой оболочки желудка, и более точно отражают кислотообразующую Функцию его.
Дефицит соляной кислоты. При отсутствии в содержимом желудка свободной соляной кислоты определяют ее дефицит. Для этого титруют желудочный сок
0,1 н. раствором соляной кислоты до появления качественной реакции на свободную соляную кислоту.
Дефицит соляной кислоты указывает на содержание щелочных компонентов, не связанных с кислотой. Дефицит соляной кислоты выше 20 ммоль/л чаще всего говорит о присутствии продуктов распада, гноя, крови. Дефицит соляной кислоты выше 40 ммоль/л указывает на прекращение секреции кислоты, т. е. на абсолютную ахлоргидрию.
При химическом исследовании желудочного содержимого определяют и органические кислоты. Наибольший интерес для диагностики представляет молочная кислота. В нормальном содержимом желудка молочная
кислота обычными реакциями не определяется. Она обнаруживается реакцией Уффельманна при увеличении ее количества. Количество молочной кислоты увеличивается при застойных явлениях в желудке в отсутствие свободной соляной кислоты, как результат усиленного размножения палочек молочнокислого брожения. Количество молочной кислоты увеличивается также при раковых опухолях в желудке, так как она появляется в результате жизнедеятельности опухолевых клеток.
Ферментативная функция. В желудочном соке содержится целая группа протеолитических ферментов, но чаще всего определение ферментообразующей функции желудка связывают с определением активности пепсина.
Предложено несколько методик, отличающихся друг от друга субстратом для переваривания и временем контакта с ферментом. Одним из наиболее распространенных является метод Туголукова, с помощью которого можно определить пепсин желудочного сока, пепсиноген крови и уропепсиноген (пепсиноген, попавший в мочу из крови). Сопоставление полученных данных позволяет полнее оценить ферментообразующую функцию желудка. Отсутствие пепсина в желудочном соке чаще всего наблюдается при новообразованиях.
§ 13. Элементы, встречающиеся при микроскопии
Значение микроскопического исследования невелико, но его проводят во всех порциях желудочного содержимого, потому что оно позволяет получить дополнительные сведения о состоянии слизистой оболочки желудка.
Особенно тщательно изучают содержимое порции натощак для обнаружения в ней элементов застоя и новообразований.
Все элементы, встречающиеся прн микроскопии, принято делить на элементы слизистой, остатки пищи и микроорганизмы (флору) (рис. 11, см. на цвет. вкл.).
Элементы слизистой. В содержимом желудка встречаются слизь, лейкоциты, эпителий, эритроциты, происходящие из слизистой оболочки желудка. В желудочном содержимом всегда обнаруживают немного слизи, которая является его составной частью. Под микроскопом слизь имеет вид полупрозрачных тяжей или комков.
Лейкоциты чаще всего встречаются в виде голых ядер без цитоплазмы, которая разрушается действием соляной кислоты. При ахилии лейкоциты хорошо сохраняются и Имеют вид зернистых образований.
Эпителий представлен главным образом полуперева-Ренными клетками цилиндрического эпителия. При нормальной кислотности желудочного содержимого они име-
ют вид округлых ядер, без цитоплазмы, располагающихся группами в слизи. При снижении кислотности эпителий представлен клетками конической формы с овальным ядром в суженной части.
Эритроциты в содержимом желудка не обнаруживаются, так как быстро разрушаются соляной кислотой. При разрушении эритроцита освобождается гемоглобин, который с соляной кислотой образует хлорид гематина—• соединение коричневого цвета. Гематин окрашивает слизь и содержимое в коричневатый цвет. При ахилии эритроциты не разрушаются и могут встречаться в виде неизмененных клеток.
Остатки пищи. Могут встретиться при нарушении эвакуации содержимого желудка, т. е. при застое. К элементам застоя относят: крахмальные зерна, мышечные волокна, нейтральный жир, растительную клетчатку. Остатки пищи в содержимом желудка при фракционном зондировании обычно не обнаруживаются.
Крахмальные зерна имеют вид бесцветных округлых слоистых образований. Раствором Люголя окрашиваются в синий цвет.
Мышечные волокна встречаются в виде цилиндрических образований различной величины желтоватого цвета с поперечной или продольной исчерченностью.
Нейтральный жир имеет вид круглых капель различной величины. Окрашивается краской судан III в ярко-оранжевый цвет.
Растительная клетчатка может выявляться в двух формах: непереваримая и переваримая. Непереваримая клетчатка — это грубые части растений, которые не перевариваются и выделяются в неизмененном виде. Под микроскопом имеют вид разнообразных клеток, часто окрашенных в желтоватый или коричневатый цвет. Переваримая клетчатка—это нежные части растений,которые обычно подвергаются расщеплению в результате действия микробной флоры кишечника. Под микроскопом видна в форме круглых нежных клеток с тонкой оболочкой. Иногда содержит крахмал, поэтому окрашивается раствором Люголя в синий цвет.
В содержимом желудка при фракционном зондировании микроорганизмы не обнаруживаются. При застойных явлениях в желудке размножаются палочки молочнокислого брожения, сарцины и дрожжевые грибы. Дрожжевые клетки имеют вид небольших овальных образований. Часто встречаются почкующиеся формы в виде восьмерок.
Палочки молочнокислого брожения — грубые, длинные, слегка изогнутые микроорганизмы, располагающиеся под углом друг к другу. Сарцины — кокки, которые 52
делятся в трех перпендикулярных плоскостях и имеют вид перевязанных тюков.
Для микроскопического исследования готовят нативный (неокрашенный) препарат из слизи, а также препараты, окрашенные раствором Люголя и краской судан III.
МЕТОДЫ ИССЛЕДОВАНИЯ СОДЕРЖИМОГО ЖЕЛУДКА
§ 14. Способы получения
. Все методы исследования функций желудка делятся на зондовые и беззондовые.
Зондовые методы
Исследование желудочного содержимого, полученного путем зондирования, служит одним из важнейших методов диагностики заболеваний желудка. В том случае, если зондирование производят толстым зондом и получают одну порцию желудочного содержимого, то говорят об одномоментном зондировании. Если получают несколько порций (фракций) желудочного содержимого, то говорят о фракционном (многомоментном) зондировании. Фракционное зондирование проводят тонким зондом без оливы.
В последнее время широкое распространение получил электрометрический метод определения pH желудочного содержимого, при котором зондирование делают тонким зондом с оливой (металлической головкой), в которую вмонтированы электроды. Метод позволяет получить точные данные о динамике секреции, об истинной кислотности желудочного сока. Исследование чаще всего проводится в условиях специально оборудованного кабинета и требует особой подготовки медицинского персонала, поэтому в поликлинических условиях этот метод не применяется.
В поликлинических условиях исследование проводят одномоментным и фракционным методами. Одномоментный метод не позволяет получить истинную картину желудочной секреции в динамике, а дает лишь ориентировочные сведения о секреторной и моторной функциях желудка.
Более полные и точные сведения о секреторной, эвакуаторной и кислотообразующей функциях желудка получают при фракционном зондировании. Существует Много способов проведения фракционного зондирования. Наиболее распространены те из них, которые дают возможность исследовать желудочную секрецию на разных этапах деятельности желудка. Базальной называ
ют секрецию голодного желудка. В этом случае желудочный сок выделяется в ответ на раздражение слизистой оболочки желудка зондом. Исследование проводят в течение часа, откачивая шприцем через каждые 15 мин все содержимое желудка. Получают 4 порции. Стимулируемой называют секрецию, возникшую в ответ на введение раздражителя (стимулятора секреции). Ее также определяют в течение часа, через каждые 15 мин.
Объем содержимого желудка, полученного за час, называют часовым напряжением секреции. Часовое напряжение базальной секреции составляет 50—100 мл, а стимулируемой— 60—ПО мл.
Раздражители желудочной секреции принято делить на энтеральные и парентеральные. К группе энтеральных раздражителей, вводимых через зонд, относятся капустный отвар, бульонный завтрак и др. Капустный отвар готовят из сухой капусты (21 г сухой капусты заливают 500 мл воды и варят до тех пор, пока объем не уменьшится до 300 мл; отвар остужают и фильтруют через двойной слой марли); бульонный завтрак готовят из говядины (400 г тощей говядины кипятят в литре воды до тех пор, пока не останется 400 мл бульона; бульон остужают, фильтруют и используют для работы); энтеральных раздражителей (пробных завтраков) предложено несколько десятков, но они обладают рядом недостатков: состав их непостоянен, при зондировании они примешиваются к желудочному содержимому и т. д. Парентеральные раздражители лишены этих недостатков. Они вводятся внутримышечно, подкожно или внутривенно. К числу парентеральных раздражителей относят гистамин, препараты гастрина, инсулин. Состав их постоянен, они обладают сильным сокогонным эффектом, но часто при введении дают побочные реакции. У больных возникает чувство жара, тошнота, головокружение, снижение артериального давления и т. д. Появление в последнее время сильных антигистаминных препаратов позволяет предотвращать токсическое влияние раздражителей.
Выбор зондового метода зависит от условий и задач, поставленных перед исследователем. При первичном обследовании больного в условиях поликлиники рекомендуется фракционное исследование с применением капустного раздражителя. Схема зондирования с применением капустного раздражителя выглядит следующим образом:
Получение желудочного сока Кислотность, ммоль/л
Базальная секреция
Натощак — 20—40 мл ' 20—30
через 15 мин
» 30 » Часовое напряже-
J
через 45 мин ние секреции —
» 60 » 50—100 мл 40—50
Введение раздражителя через зонд
через 10 мни
» 15 » 60—80 мл Не определяют
Стимулируемая секреция
через 15 мни
» 30 » Часовое напряже-
» 45 » нне секреции—
» 60 » 60—100 мл 40—60
Если в качестве раздражителя применяют гистамин, то отсасывание желудочного содержимого лучше производить непрерывно. Для этой цели применяют вакуум-установку для непрерывной аспирации.
Гистамин служит более сильным раздражителем. При его введении часовое напряжение базальной секреции составляет от 50 до 100 мл, общая кислотность — 40— 50 ммоль/л, свободная соляная кислота — 20—40 ммоль/л; часовое напряжение стимулируемой секреции—100— 150 мл, общая кислотность — 60—80, свободная соляная кислота—50—70 ммоль/л.
Результаты исследования общей кислотности и свободной соляной кислоты изображают в виде кривых.
В норме после введения капустного раздражителя кислотность медленно нарастает и достигает максимума через 55—60 мин, затем постепенно снижается (рис. 12).
В патологии при оценке кислотообразующей функции желудка различают: возбудимый, астенический, инертный и постоянно высокий типы кислотности (рис. 13).
Возбудимый тип характеризуется быстрым нарастанием и быстрым падением кислотности, астенический — медленным нарастанием и быстрым падением после достижения максимальных цифр, инертный — незначительным подъемом после введения раздражителя.
Высокий тип кислотности характеризуется постоянно высокими цифрами общей кислотности и свободной соляной кислоты.
Беззондовые методы
Фракционный метод исследования с помощью зонда Дает важный и обширный материал для врача-клинициста, но это исследование не физиологично и плохо переносится больными.
Некоторым больным зондирование противопоказано (аневризма аорты, гипертоническая болезнь, тяже-
Рис.» 12. Кислотная кривая в норме после применения капустного раздражителя.
А — общая кислотность; Б—свободная соляная кислота.
Рис. 13. Типы кислотных кривых в патологии после применения капустного раздражителя.
5—возбудимый тип; 2—астенический тип; 3 — инертный тип; 4—постоянно высокая кислотность. А—общая кислотность; Б—свободная соляная кислота.
J
лые заболевания сердца, сужения пищевода). В этих случаях для изучения секреторной функции желудка пользуются беззондовыми методами.
Эти исследования легко переносятся больными, но они не могут заменить зондовых методов. Данные беззондо-вых исследований менее точны и дают лишь ориентировочное представление о желудочной секреции. К беззон-довым методам относятся: десмоидная проба по Сали, метод ионообменных смол, ацидотест, гастротест.
Десмоидная проба по Сали. Кислотность содержимого желудка оценивают по окраске мочи метиленовым синим при введении его в желудок. Метиленовый синий помещают в мешочек из тонкой эластичной резины. Этот мешочек завязывают кетгутовой нитью № 5 (кетгут — шовный материал, имеющий белковое строение), концы которой коротко обрезают. После приготовления мешочек погружают на 24 ч в воду для проверки его герметичности. Если вода окрасится в синий цвет — мешочек недостаточно герметичен и для исследования не пригоден.
В процессе исследования больной натощак проглатывает мешочек, а затем завтракает. В желудке соляная кислота и пепсин переваривают кетгут и мешочек открывается. Метиленовый синий всасывается в кровь и выводится с мочой. За время исследования собирают 3 порции мочи через 3, 5 и 20 ч. Отмечают время появления и интенсивность окраски мочи. При нормальной секреции кислоты железами желудка 1-я порция мочи не окрашена, 2-я — бледно-зеленого цвета, 3-я — сине-зеленого цвета. При гиперхлоргидрии все 3 порции окрашены, при гипох-лоргидрии—окрашивается только 3-я порция. При ахлоргидрии моча не окрашивается.
Метод ионообменных смол. Основан на приеме внутрь ионообменных смол, связанных с каким-либо низкомолекулярным соединением (индикатором). Чаще всего в качестве индикатора используют хинин, парааминосалициловую кислоту и т. д. В желудке при наличии свободной соляной кислоты ионы индикатора обмениваются на такое же количество водородных ионов соляной кислоты, при этом индикатор освобождается из смолы, всасывается в кишечнике и выделяется с мочой, где его и обнаруживают.
Наибольшее распространение для определения кислотности желудочного сока нашел метод с применением ионообменных смол, насыщенных красителями. Для проведения исследования серийно выпускаются ионообменные смолы насыщенные красителями в виде драже под названием гастротест, диагнес-блю, ацидотест. К каждой пробе прилагается инструкция по проведению исследования и цветная шкала для сравнения окраски.
§15. Исследование физико-химических свойств
В практике работы клинико-диагностических лабораторий, особенно в поликлинических условиях, физические свойства оценивают на глаз. Наиболее распространенным исследованием является титрометрическое определение кислотности желудочного содержимого. ’ ’
Кислотность
Для определения пользуются методами Михаэлиса или Тепфера. Реактивы: 1) 0,1 н. раствор едкого натрия;
2) 1% спиртовой раствор фенолфталеина (в кислой среде бесцветен, в щелочной—розового цвета);
3) 0,5% спиртовой раствор диметиламидоазобензола (в присутствии свободной соляной кислоты дает красное окрашивание);
4) 1% водный раствор ализаринсульфоновокислого натрия (в кислой среде имеет желтую Окраску; при нейтрализации всех кислых валентностей, кроме связанной соляной кислоты — серо-фиолетовую).
Метод Михаэлиса. Ход определения. Желудочное содержимое фильтруют через марлевый фильтр. Для титрования отмеривают мерной центрифужной пробиркой 10 или 5 мл фильтрата. Фильтрат помещают в химический стаканчик, прибавляют 1—2 капли фенолфталеина и 1—2 капли раствора диметиламидоазобензола. Жидкость в стаканчике окрашивается диметиламидоазобензолом в красный цвет. Отмечают исходный уровень раствора едкого натрия в бюретке и начинают титрование. Титруют желудочное содержимое до появления розово-желтого (цвет «семги») окрашивания. Записывают количество щелочи, пошедшей на титрование (1-я отметка от нуля). Продолжают титрование до появления лимонно-желтого окрашивания. Количество израсходованной щелочи записывают (2-я отметка от нуля). Далее титруют жидкость до появления стойкого розового окрашивания (3-я отметка от нуля).
По 1-й отметке (индикатор диметиламидоазобензол) определяют свободную соляную кислоту. Расчет делают, умножая количество щелочи, пошедшей на титрование, на 10 или 20, так как пересчет кислотности ведется на 100 мл желудочного сока.
Общую кислотность определяют по 3-й отметке (индикатор фенолфталеин). Расчет делают, умножая количество щелочи, пошедшей на титрование (3-я отметка), на Ю или 20.
Связанную соляную кислоту определяют косвенно путем расчета. Сначала находят общее количество соля
нОй кислоты. Для этого среднее арифметическое между 2-й и 3-й отметкой умножают на 10 или 20. Зная общее количество соляной кислоты и свободную соляную кислоту, находят связанную.
Пример расчета. Для титрования взято 10 мл желудочного содержимого. Исходный уровень 0,1 н. раствора щелочи у деления «0».
При появлении розово-желтого окрашивания уровень 0,1 н. раствора щелочи у деления 3,6 мл (1-я отметка); при появлении лимонно-желтого окрашивания — у деления 4,5 мл (2-я отметка); при появлении стойкого розового окрашивания — у деления 5,3 мл (3-я отметка).
Свободная соляная кислота: 3,6x10=36 ммоль/л
4,5+5,3
Общая » » :-------X 10=49 ммоль/л
2
Связанная соляная кислота 49-36=13 ммоль/л
Общая кислотность: 5,3x10=53 ммоль/л
Кислотный остаток: 53—49=4 ммоль/л
Метод Тепфера. Ход определения. В 2 химических стаканчиках отмеривают по 5 мл желудочного содержимого. К 1-й порции содержимого прибавляют 1—2 капли фенолфталеина и 1—2 капли диметиламидоазобензола. Записывают исходный уровень 0,1 н. раствора щелочи в бюретке и начинают определение. Титруют до появления розово-желтой окраски, записывают количество щелочи, пошедшей на титрование (1-я отметка). Продолжают титрование до появления розового окрашивания (2-я отметка). Появление лимонно-желтого окрашивания отмечать не надо. 1-й стаканчик отставляют в сторону, но титрование продолжают, не меняя уровень щелочи в бюретке. Ко 2-й порции желудочного содержимого приливают 1—2 капли ализаринсульфоновокислого натрия, появляется желтое окрашивание. Титруют раствором из бюретки до появления серо-фиолетового окрашивания. Отмечают уровень щелочи в бюретке (3-я отметка).
В 1-й порции определяют общую и свободную соляную кислоту по методу Михаэлиса.
Разность между 3-й и 2-й отметкой дает возможность определить количество щелочи, пошедшей на титрование второй порции. Чтобы вычислить связанную соляную кислоту, нужно из общей кислотности вычесть количество Щелочи, пошедшей на титрование 2-й порции. Кислотный остаток определяют, вычитая из общей кислотности сумму свободной и связанной соляной кислот.
Пример расчета. Для титрования было взято по
5 мл желудочного содержимого в двух порциях. Исходный уровень 0,1 н. раствора щелочи у деления «0».
При появлении розово-желтого окрашивания уровень 0,1 н. раствора щелочи у деления 2,0 мл (1-я отметка); при появлении розового окрашивания — у деления 3,0 мл (2-я отметка); при появлении серо-фиолетовой окраски во 2-й порции — у деления 5,2 мл (3-я отметка).
Свободная соляная кислота: 2,0 x 20 = 40 ммоль/л
Общая кислотность: 3,0x20=60 ммоль/л .:
Все кислореагирующие валентности, кроме связанной:
(5,2-3,0)х20=44 ммоль/л (т. е. количество щелочи, пошедшей на титрование второй порции).
Связанная соляная кислота: 60 —44=16 ммоль/л
Кислотный остаток: 60—(40+16)=4 ммоль/л
Молочная кислота
Определение молочной кислоты делается только по специальному требованию врача. Методов определения много, но наиболее часто пользуются пробой с фенолом.
Проба с фенолом (реакция Уффельманна). В присутствии молочной кислоты соли трехвалентного железа дают лимонно-желтое окрашивание, вследствие образования лактата железа.
Реактивы: 1) 1% раствор фенола; 2) 10% раствор хлорида железа.
Ход определения. В химическую пробирку вносят 2—3 мл раствора фенола и прибавляют 1—2 капли раствора хлорида железа. Раствор в пробирке приобретает темно-фиолетовую окраску. Полученный раствор разводят водой до светло-фиолетового тона. По каплям добавляют профильтрованный желудочный сок. В присутствии молочной кислоты появляется лимонно-желтое окрашивание.
Ферментативная активность
Метод Туголукова. В основе метода лежит протеолитическое действие ферментов желудочного сока на плазму крови. По количеству переваренного белка судят о количестве пепсина и его активности.
Реактивы: 1) дистиллированная вода; 2) 2% раствор сухой плазмы крови в 0,1 н. растворе соляной кислоты; 3) 10% раствор трихлоруксусной кислоты.
Ход определения. Готовят 2 пробы желудочного содержимого: опытную и контрольную. Для опытной пробы в химическую пробирку наливают 9,9 мл дистиллированной воды и прибавляют 0,1 мл профильтрованного
желудочного содержимого. 1 мл разведенного в 100 раз желудочного содержимого переносят в специальную пробирку, предложенную Туголуковым, добавляют 2 мл раствора плазмы и инкубируют при температуре 37° С в термостате в течение 20 ч. После инкубации добавляют 2 мл 10% раствора трихлоруксусной кислоты, тщательно перемешивают и оставляют на 2—3 мин для полного свертывания белка. Центрифугируют 10 мин при 1500 об/мин и измеряют величину осадка в пробирке.
Контрольную пробу ставят, как опытную, но желудочное содержимое предварительно кипятят, инактивируя (разрушая) фермент.
Вычисляют показатель переваривания по формуле:
М=(А-В)хт,
где М—показатель переваривания; А—величина осадка в контроле; В—величина осадка в опыте; 40—постоянная, установленная экспериментальным путем. Расчет ведут по табл. 5.
Таблица 5. Пересчет показателей переваривания белкового субстрата (раствор сухой плазмы) на содержание пепсина в желудочном содержимом и пепсиногена в моче
Показатель переваривания (М) Содержание пепсина или уропепсиногена, г/л Показатель переваривания (М) Содержание пепсина или уропепсиногена, г/л
1 0,005 20 0,08
2 0,008 21,5 0,09
3 0,01 22,5 0,1
4 0,015 23 0,12
5 0,017 24 0,16
6 0,02 25 0,2
7 0,025 26 0,27
8 0,027 27 0,34
9 0,03 28 0,42
10 0,035 29 0,50
И 0,037 30 0,59
12 0,040 31 0,68
13 0,045 32 0,77
14 0,047 33 0,86
15 0,05 34 0.96
16 0,055 35 1,06
17 0,062 36 1,2
18 0,067 37 1,5
19 0,075 — —
Находят соответствующее показателю переваривания содержание фермента в исследуемой биологической жидкости, выраженное в граммах стандартного пепсина.
Пример расчета. Величина осадка в контрольной
пробирке — 2,5 мл, в опытной—1 мл. Показатель переваривания белка (М) будет равен:
40 ?
М=(2,5-1,0)Хгу=24. j
Находим в таблице эту величину. Она соответствует j
0,16 г пепсина в 1 л желудочного содержимого. j
В норме содержание пепсина в желудочном соке после ; капустного раздражителя 0,21—0,45 г/л, после гистамино- ! вого — 0,5—0,65 г/л.
Определение активности пепсина можно производить беззондовым методом по концентрации уропепсиногена в моче.
СОСТАВ И СВОЙСТВА СОДЕРЖИМОГО КИШЕЧНИКА В НОРМЕ И ПРИ ПАТОЛОГИИ
Пищеварение в кишечнике тесно связано с пищеварением в желудке. В процессе переваривания пищи помимо кишечного сока принимают участие секрет поджелудочной железы (панкреатический сок) и печени (желчь).
Изучение содержимого кишечника имеет большое значение для диагностики заболеваний органов пищеварения.
§16. Дуоденальное содержимое
Исследование содержимого двенадцатиперстной кишки имеет большое значение для диагностики заболеваний печени, желчевыводящей системы, поджелудочной железы и двенадцатиперстной кишки.
Для получения дуоденального содержимого используют тонкий зонд с оливой длиной не менее 1,5 м. Метки на зонде расположены через каждые 10 см. Для данного исследования важно обратить внимание на метки, расположенные на уровнях: 0,45—0,5 м (расстояние до кардиальной части желудка), 0,65—0,7 м (вход в привратник), 0,9 м (расстояние до двенадцатиперстной кишки) от оливы.
Зонд вводят больному утром, натощак, в сидячем положении до метки 0,45—0,5 м. Затем укладывают больного на кушетку без подушки, на правый бок. На область проекции печени кладут теплую грелку и подкладывают валик так, чтобы нижняя часть туловища была приподнята. В таком положении больной медленно проглатывает зонд до метки 0,65—0,7 м. В течение 40—60 мин зонд втягивается в двенадцатиперстную кишку, благодаря перистальтическим движениям желудка, и продвигается по ней до метки 0,8—0,9 м. Свободный конец зонда опускают в одну из пробирок. Пробирки помещают в штативе, который установлен ниже изголовья больного. Первая порция
желчи вытекает самостоятельно и ее собирают в соответствующую пробирку. Дальнейшее зондирование можно проводить двумя методами: классическим трехфазным и многомоментным (фракционным).
Способы получения
Трехфазный метод. Фаза I—получение порции А (дуоденальная желчь). Поступает самостоятельно из общего желчного протока (рис. 14, см. на цвет. вкл.). Это прозрачная соломенно-желтого цвета жидкость, щелочной реакции. При примешивании желудочного содержимого эта порция может быть мутноватой. Мутная желчь выделяется при наличии в ней слизи, гноя. Появление этих элементов указывает на патологическое состояние двенадцатиперстной кишки. Все патологические элементы подвергаются затем микроскопическому исследованию.
Фаза II — получение порции В (пузырная желчь). Получают из желчного пузыря, для чего необходимо вызвать сокращение его и раскрытие мышечного жома (сфинктера), стягивающего проток желчного пузыря. Это достигается введением через зонд желчегонных средств (33% раствор сульфата магния, 10% раствор сорбита, 10% раствор пептона). В настоящее время все чаще в качестве раздражителя используют холецистокинин, который употребляют парентерально, т. е. внутривенно. Раздражители применяют сразу после получения порции А, а после введения их на зонд накладывают зажим. Через 10— 15 мин зажим снимают и собирают выделившуюся желчь. Она коричневого или темно-желтого цвета, прозрачная, щелочной реакции, вязкая. Темно-коричневая или зеленовато-коричневая желчь выделяется при застое в желчном пузыре.
Фаза III — получение порции С (печеночная желчь). Постепенно пузырная желчь начинает светлеть и отделяется золотисто-желтая жидкость, прозрачная, щелочной реакции. Эта порция выделяется из печеночных ходов самой печени. Обычно собирают не более 2 пробирок печеночной желчи и на этом заканчивают зондирование. Полученную желчь исследуют немедленно в течение 30 мин с момента получения. При длительном стоянии состав желчи изменяется.
Фракционный метод. Для определения функционального состояния желчевыводящих путей и желчного пузыря используют фракционный метод зондирования, при котором регистрируют ритм поступления желчи в двенадцатиперстную кишку. Каждую фракцию собирают в отдельную пробирку, при этом строго по секундомеру учитывают время поступления и измеряют объем выделившейся
желчи. Данные отмечают в виде столбиков на диаграмме^ Всего в процессе зондирования различают 5 фаз. :
Фаза I — общего желчного протока. Начинается с момента попадания зонда в двенадцатиперстную кишку и длится до введения раздражителя. У здорового человека! эта фаза продолжается 20—30 мин. За это время получав ют 20—35 мл золотисто-желтой желчи. I
Фаза II—закрытого сфинктера общего желчного npoJ тока. Начинается введением раздражителя, стимулирующего сокращение желчного пузыря, после чего выделение желчи прекращается, вследствие спазма сфинктера общего желчного протока. У здорового человека фаза длится 2—6 мин (точно по секундомеру!) и заканчивается появлением новой порции золотисто-желтой желчи. Появление ее свидетельствует о расслаблении сфинктера и начале фазы III.
Фаза III — получение желчи порции А. Начинается открытием сфинктера общего желчного протока и заканчивается появлением темной пузырной желчи. Обычно у здорового человека эта фаза длится 3—4 мин. За это время выделяется 3—5 мл светло-желтой желчи.
Фаза IV — получение порции В. Начинается появлением темно-коричневой пузырной желчи, которая выделяется в результате сокращения желчного пузыря. У здорового человека фаза длится 20—30 мин. За это время выделяется 20—50 мл желчи.
Фаза V — получение порции С. Начинается появлением золотисто-желтой желчи из печеночных ходов и печени. Собирают жидкость в течение 25—30 мин.
Все пробирки, полученные при фракционном зондировании, направляют в лабораторию для исследования. В лаборатории порции подвергаются макроскопическому (описанию физических свойств), химическому и микроскопическому исследованиям.
Физико-химические свойства
В понятие физические свойства включают: определение количества, цвета, прозрачности, консистенции, реакции, относительной плотности.
Количество желчи в порциях указано при описании методов получения.
Цвет обусловлен наличием желчных пигментов. Наиболее концентрированной и интенсивно окрашенной является порция В.
Относительная плотность измеряется ареометром (урометром) так же, как и мочи. Она равняется в порции А—1,007—1,015; в порции В—1,016—1,034; в порции С—1,007—1,010 и увеличивается при застойных явлениях
64
в желчном пузыре и желчных протоках. Все порции желчи здорового человека прозрачны. Помутнение чаще всего связано с наличием слизи, клеточных элементов, микроорганизмов.
При химическом исследовании определяют количество билирубина, холестерина теми же методами, что и в сыворотке крови. В последнее время в клиническую практику введены методы определения желчных кислот, уровня липидного комплекса, количества мукоидных веществ и т. д. Все эти исследования безусловно расширяют диагностические возможности, но пока они еще сложны для выполнения и поэтому мало доступны для широкой практики.
В практике работы клинико-диагностических лабораторий чаще всего ограничиваются определением билирубина, холестерина. При определении билирубина по методу Иендрашека в норме содержание его составляет: порции А и С — 513,12—1026,24 мкмоль/л; порция В —1710,4 — 3420,8 мкмоль/л.
Повышение концентрации билирубина в порциях А и В указывает на застой и сгущение желчи, а пониженный уровень билирубина свидетельствует о нарушении концентрационной функции желчного пузыря.
Уровень холестерина в желчи определяют методами, в основу которых положена реакция Либермана — Бурхарда. В норме содержание холестерина в желчи составляет: в порциях А и С 1,04—2,08 ммоль/л; в порции В — 5,2— 10,4 ммоль/л.
Концентрация холестерина в порциях В и С повышается при хронических бескаменных холециститах, при желчнокаменной болезни.
Большое диагностическое значение имеет холато-холестериновый коэффициент (х/х)—отношение концентрации желчных кислот к концентрации холестерина в порции В. В норме х/х коэффициент выше 10; снижение его ниже 11 свидетельствует о способности желчи к камнеобразованию.
Элементы, встречающиеся при микроскопии
Каждую порцию желчи выливают в чашку Петри и Рассматривают поочередно на черном и белом фоне, выбирая на предметное стекло плотные комочки, слизистые тяжи. Выбранный материал помещают на предмет-стекло, накрывают покровным и микроскопируют. Практикуется и другой метод приготовления препаратов Для микроскопического исследования. При этом методе ^елчь центрифугируют 7 —10 мин, над осад очную жид
кость сливают, а из осадка готовят препарат для микро, скопии.
Все элементы микроскопического исследования желч® принято делить на клеточные, кристаллические образова-ния, паразиты.
Клеточные элементы. Представлены лейкоцитами и эпителиальными клетками. У здорового человека все порции желчи содержат единичные лейкоциты и эпигели-альные клетки. Увеличение числа лейкоцитов в желчи свидетельствует о воспалении в желчевыводящей системе. Лейкоциты могут попадать в дуоденальное содержимое также из полости рта, желудка и органов дыхания. Лейкоциты желчного происхождения чаще всего располагаются в слизи совместно с большим количеством цилиндрического эпителия.
Кристаллические образования. Представлены билируби-натом кальция в виде аморфных крупинок золотистожелтого цвета. Если этих образований много, говорят о «желчном песке». Иногда билирубинат кальция встречается вместе с кристаллами холестерина. В норме ом содержатся в порции В в незначительном количестве. Кристаллы холестерина имеют вид тонких бесцветных четырехугольных пластинок с обломанным углом.
При нарушении коллоидной устойчивости желчи, при предрасположенности к камнеобразованию в желчи можно увидеть микроскопические камни (микролиты). Это компактные, многогранные образования, состоящие из холестерина, слизи и извести.
Паразиты. Иногда в желчи обнаруживают лямблий-простейших, паразитирующих в двенадцатиперстной ( тощей кишках. Они подвижны и имеют грушевидную форму. Подвижность паразит сохраняет только в свеже полученной желчи, поэтому для обнаружения лямблш микроскопируют свежую, или теплую желчь. В содержи мом двенадцатиперстной кишки нередко обнаруживаю! личинки угрицы, яйца глистов (аскарид, печеночной и кошачей двуусток).
§ 17. Физико-химические свойства каловых масс
; Кал — содержимое кишечника, выделяющееся при акт< дефекации. В норме кал содержит 80% водь; и 2$ плотного остатка, состоящего из клеток желудочно кишечного тракта, мертвой бактериальной флоры и оста! ков пищи. При обычном пищевом режиме состав 1 характер каловых масс зависит от процессов ферментати» кого расщепления пищевых продуктов, всасывания, ; также оз’ функционального состояния кишечника, жизИ« деятельности кишечной флоры и, т. д.
Изучение состава кала помогает при диагностике ки-щечных инфекций (дизентерия, брюшной тиф), язвенных и воспалительных процессов, нарушений функции печени в поджелудочной железы, инвазий кишечными паразитами.
Клинический анализ кала включает: определение физических свойств, химическое и микроскопическое исследования.
Физические свойства. При осмотре на глаз определяют количество (при специальном указании), форму, консистенцию, цвет, запах, реакцию, примеси.
Количество. Зависит от количества принятой пищи и функционального состояния слизистой оболочки желудочно-кишечного тракта; у здорового человека за сутки составляет 120—200 г. При белковом питании выделяется меньше кала, чем при питании растительной пищей. При нарушении усвоения пищи выделяется большое количество кала. Такое явление наблюдается при панкреатитах (воспалении поджелудочной железы), ахилии, когда выпадает действие основных пищеварительных ферментов. К калу могут примешиваться кровь, слизь, что также ведет к увеличению его объема.
Форма. При нормальном функционировании желудочно-кишечного тракта каловые массы выделяются в виде цилиндрических образований (колбасовидный кал). При наличии препятствий в прямой кишке (опухоль, геморроидальные узлы) кал лентовидный, уплощенный. При спастических состояниях заднепроходного отверствия, прямой и сигмовидной кишок кал может быть карандашевидным. При спастическом состоянии нижних отделов толстой кишки выделяется овечий кал в виде отдельных комочков.
Консистенция. Зависит от содержания жидкости; в норме консистенция кала мягкая. При длительных запорах, голодании, атонии кишечника выделяется кал твердой консистенции. Полужидкий, кашицеобразный кал встречается при употреблении растительной пищи, ускоренной эвакуации из кишечника, приеме слабительных средств. Жидкий неоформленный кал наблюдается при обильном выделении стенкой кишечника воспалительного экссудата и слизи. При бродильных процессах в кишечнике выделяется пенистый кал, как бы пронизанный пузырьками газа. При заболеваниях поджелудочной железы весьма характерен мазевидный вязкий кал с большим количеством жира. Кал такой же консистенции выделяется при желтухах.
, Цвет. Окраска фекалий обусловлена наличием стерко-°илина. В норме цвет свежевыделенного кала коричневый, Ври стоянии становится более темным. Цвет зависит от
характера пищи. Если в пище преобладает мясо, окраска кала более темная; при растительно-молочной диете — светло-желтая. Зеленоватую окраску калу придают черника, черная смородина. Красноватый отенок может сообщить свекла, морковь, малина и др. Окраска меняется в результате приема некоторых лекарственных препаратов. Зеленоватую окраску дает висмут, черную — уголь, зеленовато-черную— препараты железа, гематоген, красноватый оттенок — сантонин, александрийский лист, фенолфталеин. Серовато-белый кал выделяется после приема бария (при рентгенологическом обследовании). При ускоренной эвакуации каловых масс при энтерите билирубин желчи не успевает превратиться в пигмент кала стеркобилин и тогда кал имеет золотисто-желтую окраску. Изменения цвета отмечаются при заболеваниях желудочно-кишечного тракта. Так, при желтухах выделяется сероватый, мазеобразный (ахоличный) кал; при кровотечениях из верхнего отдела кишечника (язва или опухоль желудка, двенадцатиперстной кишки) — черный, дегтеобразный кал. При кровотечении из дистальных отделов кишок к цвету кала присоединяется красноватый оттенок. При кровотечениях из толстой кишки кал окрашивается в красный, кровянистый цвет.
Реакция. В норме при смешанном питании нейтральная или слабощелочная. Резкощелочная реакция отмечается при усилении гнилостных процессов в кишечнике, а резкокислая — при преобладании бродильных процессов. Определяют реакцию бумажным универсальным индикатором, предварительно смоченным дистиллированной водой.
Запах. Обусловлен наличием индола и скатола; обычно неприятный, но не резкий. При питании преимущественно мясной пищей запах кала более резкий, при растительной диете — кисловатый. Резкокислый запах обнаруживается при бродильных процессах.
Примеси. Можно разделить на две большие группы: пищевого и непищевого происхождения. Рассматривая кал невооруженным глазом, можно обнаружить пищевые примеси в виде сухожилий, кусочков хрящей, а также грубых частей растений (кожицы фруктов, ягоды, косточки и т. д.). К примесям непищевого происхождения относятся слизь, кровь, гной. Слизь является нормальной составной частью кала. Она перемешана с массами и в норме на глаз не обнаруживается. При воспалительных процессах в кишках количество слизи резко увеличивается. Кровь является патологической примесью, и наличие ее говорит о кровотечениях из разных отделов пищевого канала. Она появляется при геморрое, язвенном колите, раке прямой кишки, трещинах заднепроходного отверстия. Гной появ-
дяется при дизентерии, туберкулезе, распаде раковой опухоли. Обычно гной выделяется вместе с кровью.
В кале могут быть обнаружены гельминты — особи круглых червей и членики ленточных.
Химическое исследование включает: определение скрытой (невидимой на глаз) крови, стеркобилина, белка и муцина.
Скрытая кровь в кале появляется при незначительных кровотечениях, вызванных изъязвлениями и опухолевыми процессами в верхних отделах желудочно-кишечного тракта. Скрытую кровь в кале определяют несколькими реакциями. Чаще других пользуются бензидиновой пробой Грегерсена.
Стеркобилин — пигмент кала, который придает ему коричневую окраску. При отсутствии стеркобилина кал обесцвечивается. Ахоличный кал выделяется при паренхиматозных гепатитах и механических желтухах. Светлый кал может выделяться при ускоренной эвакуации из кишечника, при питании исключительно молочной пищей. Реакцию на стеркобилин ставят только в тех случаях, когда кал не имеет свойственной ему коричневой окраски. Наибольшее распространение получила проба Шмидта с раствором сулемы.
При воспалительных и язвенных процессах, связанных с клеточным распадом, кровотечениями и экссудацией тканевой жидкости, в кале появляются нуклеопротеиды— белки, входящие в состав клеточных ядер и структурных элементов цитоплазмы. В период обострения язвенных и воспалительных процессов реакция на белок (нуклеопротеиды) и муцин (слизь) бывает положительной. Иногда эту реакцию ставят при дизентерии в период выздоровления, чтобы решить, насколько глубок еще воспалительный процесс. Эта реакция в лабораторной практике известна как реакция Трибуле — Вишнякова.
§ 18. Элементы, встречающиеся при микроскопии кала
Микроскопическое исследование испражнений дает обширную информацию о состоянии слизистой оболочки кишечника, а также позволяет судить о нарушениях пищеварительной и моторной функции желудка и кишечника. При микроскопии в кале можно выявить детрит, остатки пищевого происхождения, элементы слизистой оболочки кишок, кристаллы, микроорганизмы, а также Простейших и яйца гельминтов.
Детрит. Составляет основную массу кала и под микроскопом имеет вид аморфных образований, чаще всего серовато-желтого цвета. Иногда детрит имеет вид мелких
зерен, но даже в этом случае невозможно определить к какому виду веществ они относятся.
Остатки пищевого происхождения. Можно разделить на три основные группы: остатки белковой пищи, остатки углеводной пищи и остатки жирной пищи.
Мышечные волокна и соединительная ткань — остатки мясной пищи и в кале здорового человека не обнаруживаются или обнаруживаются в виде единичных овальных или округлых образований желтого цвета без исчерченности. Эти мышечные волокна принято называть переваренными, в отличие от непереваренных, имеющих вид цилиндрических образований с обрезанными краями и хорошо заметной поперечной (реже продольной) исчерченностью (рис. 15, см. на цвет. вкл.). Обнаружение мышечных волокон в большом количестве служит признаком патологии и указывает на нарушение переваривания белковой пищи. Отмечается при понижении секреторной функции желудка, недостаточности поджелудочной железы, ускоренной эвакуации пищи из желудка или кишечника. Соединительная ткань в кале здорового человека не обнаруживается. Она появляется при ахилии, недостаточной функции поджелудочной железы, а также при употреблении в пищу плохо проваренного или прожаренного мяса. Под микроскопом имеет вид нежных волокон, сероватого цвета, слабо преломляющих свет.
Растительная клетчатка и крахмал относятся к остаткам углеводной пищи. Растительную неперевари-мую клетчатку всегда обнаруживают в кале и нередко в большом количестве, что связано с постоянным употреблением растительной пищи. Переваримая клетчатка в кале здорового человека отсутствует, так как подвергается расщеплению микробной флорой кишечника (рис. 16, см. на цвет. вкл.). При ахилии и ахлоргидрии в желудке из-за отсутствия соляной кислоты не происходит разрыхления переваримой клетчатки. Она не переваривается и появляется в кале в виде больших групп клеток. Крахмал находится в крахмальных зернах. В норме крахмальные зерна в кале отсутствуют. Появление крахмальных зерен чаще всего связано с нарушением амилолитического или бактериального расщепления крахмала. Крахмальные зерна в каловых массах встречаются внеклеточно и в клетках картофеля, бобов. Внеклеточные (свободнолежащие) крахмальные зерна имеют вид неправильных обломков. При добавлении раствора Люголя, в зависимости of стадии переваривания, крахмал окрашивается в фиолетовый или красноватый цвет.
В кале здорового человека всегда обнаруживается небольшое количество жирных кислот и их солеи (рис. 17, см. на цвет. вкл.). Нейтральный жир отсутствует'
Жирные кислоты имеют вид длинных заостренных игл, иногда глыбок или капель. После нагревания препарата глыбки жирных кислот сливаются в капли, а при остывании вновь образуют глыбки. Очень часто глыбки становятся неровными, бугристыми и из них образуются характерные игольчатые кристаллы. Соли жирных кислот (мыла) образуют кристаллы, очень сходные с кристаллами жирных кислот, но более короткие, часто располагающиеся пучками. При нагревании они не сплавляются в капли.
При переваривании и усвоении жира основное значение имеют липаза поджелудочного сока и. желчь. При заболеваниях поджелудочной железы, когда выпадает действие липазы, в кале появляется значительное количество нейтрального жира (стеаторея). Нейтральный жир в нативном препарате имеет вид бесцветных капель. При окраске метиленовым синим капли нейтрального жира остаются бесцветными, а капли жирных кислот окрашиваются в синий цвет. Увеличение в кале жирных кислот и мыл имеет место при нарушении желчеотделения. При энтеритах, при ускоренной эвакуации из кишечника отмечается увеличение всех видов жиров.
Клеточные элементы. В кале можно обнаружить слизь, клетки цилиндрического эпителия, эритроциты, лейкоциты.
Слизь под микроскопом имеет вид сероватых бесструктурных тяжей с единичными клетками цилиндрического эпителия, кровяными элементами, остатками пищи (рис. 18, см. на цвет. вкл.). В кале здорового человека может находиться небольшое количество клеток цилиндрического эпителия. При катаральном состоянии слизистой оболочки кишок появляется большое количество отдельных клеток эпителия или целые пласты их. В кале всегда встречаются клетки плоского эпителия из заднепроходного отверстия. Нахождение их не имеет практического значения.
Лейкоциты могут находиться либо в слизи, либо вне ее. Количество лейкоцитов резко увеличивается при катаральном состоянии слизистой оболочки кишечника, особенно при язвенных процессах в нижних его отделах. Эритроциты можно наблюдать неизмененные или в виде теней, которые трудно распознать. Присутствие эритроцитов указывает на язвенный процесс. Если кровь выделяется из нижнего отдела кишечника, то встречаются неизмененные эритроциты. При поражении верхних отделов пищеварительного тракта эритроциты или разрушаются совсем или трудно распознаваемы.
Кристаллические образования. Обычно представлены веществами лекарственного, пищевого и эндогенного происхождения. Диагностическую ценность имеет обнаруже
ние в кале кристаллов эндогенного происхождения. К таковым относят кристаллы трипельфосфатов, гематоиди-на, билирубина, Шарко — Лейдена. Кристаллы трипельфосфатов встречаются в кале с резко щелочной реакцией при усилении гнилостных процессов. Кристаллы гемато-идина имеют коричневатую или золотисто-желтую окраску и достаточно разнообразную форму. Могут встречаться в виде ромбов, треугольников и т. д. Обычно появляются после кровотечений, так как гематоидин является производным гемоглобина крови. Кристаллы Шарко — Лейдена бесцветны, имеют форму вытянутого ромба. Обнаружение их свидетельствует об аллергическом процессе в кишечнике. Очень часто появляются при наличии гельминтов.
Флора. В кишечнике человека находится большое количество микроорганизмов. Кал на 40—50% состоит из отмерших бактерий. При усилении процессов брожения, особенно при бродильной диспепсии, в кале можно обнаружить йодофильную флору. Она располагается кучками и скоплениями. Морфология ее различна: палочки, кокки, дрожжевые клетки и др. Все они обладают свойством окрашиваться раствором Люголя в черный или темносиний цвет. В норме йодофильная флора в кале отсутствует.
§ 19. Копрологическая картина при некоторых заболеваниях
Недостаточность желудочного пищеварения (хронический гастрит с ахилией). Форма кала непостоянна. Он мож.ет быть оформленным или неоформленным. В зависимости от этого консистенция его плотная или кашицеобразная. Цвет темно-коричневый, реакция щелочная. При микроскопии обнаруживают большое количество переваримой клетчатки. Характерно наличие непереваренных мышечных волокон, обывков соединительной ткани.
Недостаточность поджелудочной железы. Увеличение количества фекалий (до 1 кг в сутки). Кал неоформленный, мазевидной консистенции, сероватожелтого цвета. Реакция щелочная, запах резкий, зловонный. Для микроскопической картины характерно наличие большого количества нейтрального жира, переваримой клетчатки и непереваренных мышечных волокон.
Недостаточность желчеотделения (механическая, паренхиматозная желтуха). Наиболее типично выделение ахоличного кала беловато-серого цвета. Кал обычно оформленный, мазевидной консистенции, реакция кислая-Проба на стеркобилин отрицательна. При микроскопий
обнаруживают большое количество жирных кислот и мыл.
Недостаточность пищеварения в тонкой кишке (энтериты, ускоренная перистальтика). Вследствие ускоренной эвакуации кал неоформленный, жидкой или кашицеобразной консистенции. Цвет желтый, реакция слабощелочная, проба на билирубин положительная. При микроскопии выявляются большие количества жирных кислот, мыл, переваримой клетчатки, внеклеточного крахмала, мышечных волокон в различной стадии переваривания, слизи.
Недостаточность пищеварения в толстой кишке (бродильная диспепсия). Характерно выделение неоформленного, кашицеобразного, пенистого кала кислой реакции. Цвет его светло-коричневый, запах кислый. При микроскопии находят большое количество переваримой клетчатки с внутриклеточным крахмалом. Типично наличие йодофильной флоры в значительном количестве.
Воспалительные процессы в толстой кишке. Колит с запором. Форма кала комковатая («овечий кал»). Консистенция твердая, цвет темно-коричневый, реакция щелочная. Выделяется значительное количество слизи в виде хлопьев и тяжей. Микроскопическая картина характерных особенностей не имеет, за исключением большого количества слизи.
Дизентерия. В остром периоде заболевания кишечные выделения представляют собой слизистокровянистую вязкую массу с примесью гноя. Реакция обычно кислая. При микроскопическом исследовании обнаруживают большое количество клеточных элементов: лейкоцитов, эритроцитов, цилиндрического кишечного эпителия. Все эти клетки расположены в слизи. Элементов нормального кала нет. Характерно наличие белка в кале, который выявляется реакцией Трибуле — Вишнякова.
§ 20. Краткая морфологическая характеристика яиц гельминтов
Инвазии людей паразитическими червями распространены довольно широко. В СССР осуществляется система мероприятий по борьбе с гельминтозами, предусматривающая массовую дегельминтизацию населения, общественную и личную профилактику.
Диагностикой гельминтозов занимаются клинические и паразитологические лаборатории санитарно-эпидемиологических станций. Лаборанты должны знать не только
методики, которыми можно выявить тех или иных гельминтов, но и основы их биологии, что особенно важно при проведении лечебных мероприятий.
Важнейшим звеном всей работы служит гельминтологическая диагностика. Для постановки диагноза гельмин-тозов исследуют испражнения, дуоденальное содержимое, мокроту, мочу, содержимое кист, кровь, перианаль-ную и ректальную слизь, содержимое подногтевых пространств. • 1
В клинической лаборатории чаще всего подвергангН исследованию кал. Для анализа достаточно иметь неболь-! шое количество материала.
В кале можно обнаружить самих гельминтов, их фрагменты или яйца.
Для яиц гельминтов характерна четкая морфологическая структура. Все они имеют оболочку определенного строения, что отличает их от других образований, попадающих в кал.
Яйца каждого вида гельминтов имеют свои постоянные размеры и могут содержать яйцеклетку, развитые личинки или желточные клетки.
Фасциола (Fasciola hepatica). Яйцо правильной овальной удлиненной формы. Оболочка гладкая, тонкая, желтого цвета с крышечкой на одном полюсе и плоским бугорком на другом. Оно заполнено множеством желточных клеток. Размеры 130x145x70 — 90 мкм.
Описторхис (Opisthorchis felineus). Яйцо овальное, вытянутой формы, слегка асимметрично. Оболочка гладкая, тонкая, светло-желтого цвета. На одном полюсе слабо различимая крышечка, на противоположном — бугорок. Внутри яйца содержится развитая личинка (микроцидий). Размеры 26—32x11 —14 мкм.
Лентец широкий (Diphyllobotrium latum). Яйцо овальное желтоватого цвета. Оболочка гладкая, прозрачная, толстая. На верхнем полюсе хорошо просматривается крышечка, на противоположном — бугорок. Внутри яйца многочисленные желточные клетки. Размер 68— 71 х45 мкм.
Вооруженный цепеиь (Taenia solium) и невооруженный цепень (Taeniarhynchus saginatus). Яйца круглые или слегка овальные с толстой коричневой радиально исчерченной оболочкой. Внутри яйца видна онкосфера (зародыш) с тремя парами крючьев. Яйца обоих видов неразличимы. Размер 31x40 мкм.
Карликовый цепень (Hymenolepis папа). Яйцо эллипсоидной формы. Оболочка бесцветная с онкосферой внутри-Онкосфера имеет 3 свои оболочки темно-коричневого цвета. Хорошо заметны 3 пары эмбриональных крючьев. Размер 40x50 мкм (рис. 19, см. на цвет. вкл.).
Власоглав (Trichocephalus trichiurus). Яйцо имеет форму лимона. Оболочка толстая, многослойная, золотистожелтого или коричневого цвета. На полюсах имеются бесцветные пробковидные образования. Размер 50— 54x22 — 23 мкм.
Анкилостома (Ancylostoma duodenale). Яйцо овальной формы с закругленными полюсами. Оболочка тонкая, прозрачная, бесцветная. В свежеотложенном яйце хорошо различимы 4 бластомера. Размер 54—70x36—40 мкм.
Аскарида (Ascaris lumbricoides). Оплодотворенное яйцо овальной формы, имеет толстую, многослойную оболочку. Наружная оболочка белковая, крупнобугристая, желто-коричневого цвета. Некоторые яйца бывают лишены белковой оболочки. Яйцо бесцветное или с серо-зеленым оттенком. Размер 50—70x40—50 мкм.
Неоплодотворенное яйцо вытянутой неправильной формы. Наружная белковая оболочка темно-желтого цвета, тонкая, мелкобугристая, уплощена на полюсах. Внутри яйца крупные желточные шары. Иногда встречаются яйца без белковой оболочки, зеленоватого цвета. Размер 50— 106x40—50 мкм.
Острица (Enterobius vermicularis). Яйцо овальное, асимметричной формы, одна сторона выпуклая, другая уплощена. Оболочка гладкая, бесцветная, многослойная. Внутри яйца зародыш на разных стадиях развития. Размер 50—60x20—30 мкм (рис. 20, см. на цвет. вкл.).
Вопросы для повторения
1. Каков состав желудочного сока в норме?
2. Как меняется количество и кислотность желудочного сока при различных состояниях?
З. Каким исследованиям в лаборатории подвергается желудочное содержимое?
4. Что определяют при макроскопическом исследовании? химическом исследовании? микроскопическом исследовании?
5. В чем диагностическая ценность фракционного метода исследования желудка?
6. Как получают желудочное содержимое при фракционном зондировании?
7. Какие раздражители желудочной секреции Вам известны?
8. Какие беззоидовые методы исследования функций желудка Вам известны? Когда их проводят?
9. Как получают дуоденальное содержимое?
Ю. Как исследуют полученные порции желчи?
И. Какое диагностическое значение имеет исследование испражнений? 12. Каковы физические свойства каловых масс?
13. Какие химические реакции проводят при исследовании кала? В чем их диагностическая ценность?
14. Какие группы элементов обнаруживают при микроскопии кала?
15. По каким признакам можно различить яйца гельминтов?
16- Как выглядят яйца наиболее распространенных гельминтов?
МЕТОДЫ ИССЛЕДОВАНИЯ ФЕКАЛИЙ
§ 21. Правила собирания и обеззараживания
Клинический анализ кала обычно производят без специальной подготовки больного. Однако для получения достоверных результатов исследования обращают внимание на следующие моменты: доставляют свежий кал не позже чем через 8—12 ч после его выделения; собирают испражнения за одну дефекацию в чистую сухую посуду, желательно в стеклянную банку или парафинированный стаканчик. Недопустимо направлять кал на исследование в спичечных и картонных коробках, так как при этом меняется форма и консистенция кала. Кал не должен содержать посторонних примесей (мочи, крови). Нельзя собирать фекалии после клизм, особенно масляных; после приема медикаментов, меняющих характер кала и вызывающих функциональные изменения желудочно-кишечного тракта (препараты железа, висмута, слабительные средства и др.).
При проведении исследования на скрытую кровь больному за 2—3 дня до анализа назначают безмясную и безхлорофильную диету. На это время из пищи больного исключают рыбу, мясо, зеленые части растений, так как эти пищевые вещества могут катализировать реакции, которые применяются для обнаружения крови.
Способы обеззараживания испражнений, посуды, предметов, использованных в работе. Кал обеззараживают сухой хлорной известью или 10% раствором ее в течение 2 ч. Можно пользоваться 3% раствором хлорамина, которым заливают материал или посуду. Материал в этом случае обеззараживают в течение 10 ч, а посуду — в течение 6—12 ч. Покровные стекла заливают концентри-j рованной серной кислотой, затем отмывают и погружают! в 96% спирт. Высушивают и вновь используют для! работы. I
При работе с паразитологическим материалом посудуд стекла обезвреживают кипячением или помещают их в бак| с 5% раствором карболовой кислоты, 10% раствором лизола на 6 ч. Деревянные палочки, шпатели, бумагу и другие материалы сжигают. Столы обдают кипятком, протирают спиртом, микроскоп также обрабатывают спиртом.
§ 22. Исследование химических свойств
В фекалиях определяют скрытую кровь (бензидиновая проба), стеркобилин (реакция с сулемой), белок и муцин (проба Трибуле — Вишнякова).
Бензидиновая проба (проба Грегерсена). Основана на способности пигмента крови гемоглобина расщеплять перекись водорода. В процессе расщепления освобождается активный кислород, окисляющий бензидин, в результате чего бензидин меняет свой цвет.
Реактивы: 1) раствор ацетата бензидина (25 мг гидрохлорида бензидина) растворяют в 5 мл 50% уксусной кислоты и добавляют 5 мл 3% раствора перекиси водорода; готовят перед употреблением.
Ход определения. На предметном стекле делают толстый мазок кала. Прибавляют 2—3 капли свежеприготовленного реактива и тщательно перемешивают. При положительной реакции через 1—2 мин на мазке появляется зеленое или сине-зеленое окрашивание. Окрашивание, наступившее позднее этого срока, не учитывают. Реакцию оценивают на белом фоне. Проба очень чувствительна.
Реакция с сулемой (проба Шмидта). В присутствии солей ртути стеркобилин приобретает розовую окраску, а билирубин— зеленую.
Реактивы: насыщенный раствор сулемы (7 г сулемы растворяют в 100 мл дистиллированной воды при нагревании; охлаждают и фильтруют через бумажный фильтр).
Ход определения. Небольшой комочек кала растирают в ступке с 3—4 мл реактива до консистенции жидкой кашицы. Переносят смесь в чашку Петри и оставляют стоять на сутки. В присутствии стеркобилина развивается розовое окрашивание, интенсивность которого зависит от содержания пигмента. При наличии билирубина развивается зеленое окрашивание за счет образования биливердина. При отсутствии пигментов окраска не возникает.
Проба Трибуле — Вишнякова. Основана на способности белка или муцина коагулировать под действием кислот и выпадать в осадок, адсорбируя частицы кала.
Реактивы: 1) 20% раствор трихлоруксусной кислоты; 2) 20% раствор уксусной кислоты; 3) дистиллированная вода.
Ход определения. Готовят 3% эмульсию кала (в ступке растирают 3 г кала со 100 мл дистиллированной воды). В 3 химические пробирки наливают по 15 мл эмульсии. В 1-ю прибавляют 2 мл 20% раствора трихлор-Уксусной кислоты, во 2-ю — 2 мл 20% уксусной кислоты, в 3-ю — 2 мл дистиллированной воды. Хорошо перемешивают и оставляют при комнатной температуре на 24 ч, после чего учитывают результат. При полном просветле-нии жидкости над осадком реакцию оценивают как резкоположительную; при значительном просветлении — как положительную; при небольшом просветлении — как слабо
положительную; при мутности одинаковой с контрольной пробиркой — как отрицательную.
Просветление в 1-й пробирке указывает на наличие сывороточного белка и нуклеопротеидов, во 2-й — на наличие слизи (муцина).
§ 23. Микроскопическое исследование
Микроскопическое исследование кала проводят во влажных нативных и окрашенных препаратах. Для приго- i товления препаратов предварительно растирают комочек кала в небольшом количестве дистиллированной воды до консистенции жидкой кашицы. Затем по капле эмульсию наносят на 4—5 предметных стекол.
На 1-м стекле готовят нативный препарат. Содержимое препарата накрывают покровным стеклом. На 2-м ; стекле готовят препарат с раствором Люголя. Каловую эмульсию хорошо перемешивают с раствором Люголя и i исследуют на присутствие крахмальных зерен и йодофиль- ? ной флоры. На 3-м стекле готовят препарат с метиленовым синим для обнаружения жирных кислот, мыл и нейтрального жира. На 4-м стекле готовят препарат с , глицерином. К каловой эмульсии добавляют глицерин для | просветления препарата. В таком препарате отыскивают ]. яйца гельминтов.
В практике работы лабораторий очень часто готовят и 5-й препарат с краской судан III для более четкой дифференциации капель нейтрального жира, которые окрашиваются в ярко-оранжевый цвет. Изучение препаратов производят сначала под малым, а затем под большим увеличением. ;
§ 24. Обнаружение яиц гельминтов
При копрологической диагностике гельминтозов нельзя каким-либо одним методом выявить яйца или личинки всех видов гельминтов, обитающих в пищеварительной системе человека. Полное гельминтологическое исследование включает макроскопическую и микроскопическую диагностику.
Макроскопическое исследование |
Служит для обнаружения в кале целых гельминтов и 4 их фрагментов невооруженным глазом или с помощью 1 ручной лупы. J
Для исследования испражнения смешивают с водой до I жидкой консистенции и переносят небольшими порциями в | чашку Петри, тщательно осматривая на черном фоне.| та I
Пинцетом или препаровальными иглами извлекают все подозрительные на фрагменты гельминтов белые частицы. Крупные образования помещают между двумя предметными стеклами и рассматривают под лупой.
Дифференцировать отдельные виды гельминтов можно с учетом их анатомо-морфологических признаков. Так, определить вид нематод можно только по целым экземплярам, реже по крупным фрагментам. Цестоды можно диагностировать по зрелым членикам, сколексам.
Микроскопическое исследование
Метод мазка. Самый простой и удобный метод исследования испражнений. Нативный мазок готовят с 50% раствором глицерина.
Техника приготовления мазка. Деревянной палочкой из разных мест доставленного кала берут для исследования частицу величиной со спичечную головку и готовят несколько препаратов. Кал тщательно растирают на предметном стекле с несколькими каплями 50% раствора глицерина до получения достаточно равномерного и прозрачного мазка, который занимает почти всю поверхность стекла. Микроскопируют мазок, не применяя покровных стекол. Раствор глицерина хорошо просветляет препарат и предохраняет его от высыхания. При отсутствии глицерина препарат можно готовить с изотоническим раствором хлорида натрия или водой.
Согласно действующим инструкциям нельзя ограничиваться исследованиями только нативных препаратов. Вероятность обнаружения яиц гельминтов увеличивается при применении метода толстого мазка.
Метод толстого мазка (по Като). Яйца гельминтов обнаруживают в толстом мазке фекалий, просветленных глицерином и подкрашенных малахитовой зеленью.
Реактивы: 1) 3% водный раствор малахитовой зелени; 2) глицерин; 3) 6% водный раствор фенола.
Из этих компонентов готовят смесь Като: 6 мл раствора малахитовой зелени, 500 мл глицерина и 500 мл раствора фенола смешивают и хранят в закрытой посуде при комнатной температуре. Раствор стабилен, его используют для приготовления пластинок по Като. Для приготовления их из целллофана нарезают прямоугольные пластинки размером 20x40 мм и погружают их в смесь Като на 24 ч, после чего они готовы к употреблению. Хранят готовые пластинки в смеси Като, в хорошо закрытой посуде при комнатной температуре.
Ход обнаружения. Кусочек фекалий, величиной с горошину, наносят на предметное стекло, покрывают Пластинкой по Като и придавливают резиновой пробкой
так, чтобы фекалии размазались по стеклу в пределах пластинки. Мазок оставляют при комнатной температуре для осветления на 30—40 мин. Затем просматривают поду микроскопом. I
Описанным методом можно выявить яйца нематод и цестод. |
Кроме метода мазков, применяют более сложные, но й более эффективные методы — методы обогащения, -J основанные на концентрации яиц в препаратах. Эти методы условно можно разделить на две большие группы: 1-я группа — концентрация яиц на поверхности жидкости (методы флотации, всплывания), 2-я группа — концентрация яиц в осадке (методы осаждения, седиментации).
Метод Калантарян (с флотационным раствором). Основан на том, что в жидкости с высокой относительной плотностью яйца гельминтов, как более легкие, всплыва-; ют на поверхность, где и концентрируются. '
Реактив: флотационный раствор по Калантарян (1 кг» нитрата натрия растворяют в 1 л воды; смесь кипятят до1 образования пленки, остужают; относительная плотность! раствора 1,38). I
Ход обнаружения. В химическом стакане тщатель-| но размешивают стеклянной палочкой 5—10 г фекалий со 100—200 мл флотационного раствора. Сразу же после размешивания удаляют всплывшие на поверхность крупные частицы. Стаканчик покрывают предметным стеклом так, чтобы оно соприкасалось с поверхностью жидкости. Если жидкости мало, ее следует долить до полного соприкосновения смеси с предметным стеклом. Оставляют для всплывания яиц на 20—30 мин, после чего предметное стекло снимают, кладут под микроскоп и просматривают без покровного стекла.
Метод довольно широко используется в клинической лаборатории для выявления яиц аскарид, власоглава, цестод и трематод.
Метод Красильникова (с применением детергентов). Под действием поверхностно-активных веществ, входящих в состав детергентов (стиральных порошков), яйца гельминтов освобождаются от фекальных масс и концентрируются в осадке.
Реактив. 1% раствор стирального порошка «Лотос» (порошок высушивают в сушильном шкафу при 100° С в течение 1—2 ч; 10 г сухого порошка растворяют в 1 л водопроводной воды).
Ход обнаружения. В центрифужную пробирку помещают комочек кала и приливают раствор детергента. Соотношение кала к жидкости 1:10. Хорошо перемешивают их до образования суспензии. Через 30 мин содержи^
мое пробирки встряхивают 1—2 мин и центрифугируют 5 мин при 1500 об/мин. Из осадка готовят 2 препарата на одном стекле.
В практике работы лаборатории пользуются и другим способом. В этом случае жидкость не подвергается центрифугированию, а отстаивается 24 ч для образования осадка, из которого также готовят мазки для микроскопии. Этим методом можно выявить яйца всех видов гельминтов.
Диагностика энтеробиоза. Для диагностики энтеробиоза применяются специальные методы взятия материала: соскоб шпателем и снятие яиц липкой полиэтиленовой лентой. Применение этих методов основано на биологической особенности самок остриц откладывать яйца на перианальные складки кожи при выползании ночью из кишечника. В кале яйца, как правило, не обнаруживаются. Материал для исследования получают утром до дефекации или вечером, после 1,5 ч пребывания в постели. Для этого берут кусок липкой ленты шириной около 2 см и длиной около 10 см. Прикладывают липким слоем середину ленты к перианальным складкам кожи, затем приклеивают ее на предметное стекло. Выходящие за край стекла концы ленты отрезают. В лаборатории ленту отклеивают, вносят под нее на большом протяжении 1—2 капли вазелинового масла и просматривают под микроскопом.
Широко применяется метод перианального соскоба деревянным шпателем. Шпатель (или плоско заточенную спичку) смачивают 50% раствором глицерина. Осторожно производят соскабливание с поверхности складок в окружности ануса и нижнего отдела прямой кишки. Затем материал тщательно соскабливают со спички краем покровного стекла, помещают его на предметное стекло в каплю 50% раствора глицерина. Накрывают тем же покровным стеклом и микроскопируют. Шпатель после однократного пользования сжигают. Соскоб с перианаль-ных складок производят троекратно.
Глава 111 ИССЛЕДОВАНИЕ МОКРОТЫ СОСТАВ И СВОЙСТВА
§ 25. Происхождение и состав
Мокрота—это патологическое отделяемое легких и Дыхательных путей — бронхов, трахеи, гортани. Она выделяется во время кашля или отхаркивания при таких
заболеваниях, как трахеит, бронхит, бронхиальная астма, бронхоэктатическая болезнь, а также при пневмониях, туберкулезе, абсцессе, раке, гангрене легкого и других болезнях дыхательных органов.
У здоровых людей мокрота не выделяется. Однако при работе в запыленной атмосфере (в шахте, асбестовом, ткацком производстве и др.) мокрота появляется у практически здоровых людей. Выделяют мокроту и люди, труд которых связан с напряжением голосового аппарата и дыхательных путей (певцы, лекторы, педагоги, музыканты, играющие на духовых инструментах, стеклодувы). Кроме того, обильно выделяется мокрота у курильщиков, постоянно раздражающих свои дыхательные пути никотином и дымом. При этом возникает предрасположение к заболеваниям легких, бронхов, голосовых связок.
Мокрота по составу неоднородна. Она может содержать слизь, гной, серозную жидкость, кровь, фибрин, причем одновременное присутствие всех этих элементов не обязательно. Слизь секретируют многочисленные железы слизистой оболочки трахеи и бронхов. Гной образуют скопления лейкоцитов, возникающие в месте воспалительного процесса. Воспалительный экссудат выделяется в виде серозной жидкости. Кровь в мокроте появляется при изменениях стенок легочных капилляров или повреждениях сосудов.
Состав и связанные с ним свойства мокроты зависят от характера патологического процесса в органах дыхания.
Клинический анализ мокроты включает описание ее физических свойств и микроскопическое исследование. Химический анализ не имеет большого диагностического значения, обычно ограничивается микрохимической реакцией на гемосидерин. г
§ 26. Физические свойства |
Описание физических свойств или макроскопическое исследование включает в себя измерение количества мокроты, определение ее характера, консистенции (вязкости), цвета и запаха, наличия примесей.
Количество. Учитывают не всегда, в основном это делают при кавернозном туберкулезе, гангрене и абсцессе легкого, бронхоэктатической болезни, т. е. во всех тех случаях, когда образуются полости в легких и бронхах. Большое количество мокроты — от 0,5 до 2 л выделяется в момент прорыва в бронх абсцесса легкого или эмпиемы.
Скудное отделяемое — 2—5 мл наблюдается при воспалениях дыхательных путей (трахеит, острый бронхит», бронхиальная астма). ( 1
Характер. Зависит от составляющих частей, в соответ-») 82 I
ствии С чем мокрота может быть слизистой, гнойной, кровянистой, серозной, фибринозной, гнилостной. Чаще всего мокрота имеет смешанный характер: серозногнойная, гнойно-слизистая, слизисто-гнойно-кровянистая и т. Д-
Слизистая мокрота выделяется при острых бронхитах, бронхиальной астме. Слизисто-гнойной мокрота называется тогда, когда гной тесно смешан со слизью, представляя однородную массу. Это наблюдается при хронических бронхитах, трахеитах, бронхопневмониях. Гнойнослизистая мокрота состоит из гноя и слизи в различных соотношениях. Гной находится в слизи в виде прожилок и комочков. Такой характер мокрота имеет при хронических бронхитах, бронхоэктатической болезни. Гнойная мокрота (без слизи) выделяется редко: при прорыве в бронх абсцесса легкого или эмпиемы. Слизисто-гнойнокровянистый характер мокрота имеет при тяжелых бронхоэктазах, кавернозном туберкулезе, раке легкого, когда к слизи и гною присоединяется кровь. Кровавая мокрота образуется при легочных кровотечениях, связанных с туберкулезом, злокачественными новообразованиями, с ранениями легкого. Кровавая мокрота бывает пенистой из-за наличия в ней пузырьков воздуха. Серозная мокрота образуется при отеке легкого, при отравлении боевыми отравляющими веществами. Гнилостный характер мокрота приобретает при гангрене легкого, распаде опухоли. Фибринозная мокрота отделяется в начальной стадии крупозной пневмонии.
Консистенция (вязкость). Зависит от состава. Серозная мокрота — жидкая, слизистая — полувязкая, гнойная — вязкая, фибринозная — клейкая. При смешанном характере мокроты вязкость определяет преобладающая часть ее состава.
При абсцессах легкого, кавернозном туберкулезе, бронхоэктатической болезни мокрота при стоянии делится на слои различной консистенции. При абсцессе мокрота Двухслойная: нижний слой — гной, верхний — серозная жидкость; при бронхоэктазах — трехслойная: гной, серозная жидкость, над которой располагается слой слизи.
Цвет. Обусловлен характером и примесью вдыхаемых Частиц. Серозная — серовато-желтая, гнойная —
желтовато-зеленоватая или серовато-желтая в зависимости от микроорганизмов, вызвавших воспалительный процесс. Слизистая мокрота бесцветная или беловатая. При бронхиальной астме она имеет характерный вид — стекловидная мокрота (слизистая, прозрачная, вязкая). Кровь окрашивает мокроту в различные оттенки красного Цвета от малинового до бурого. При крупозной пневмонии в начале заболевания выделяется ржавая мокрота. Такой
цвет придает ей гематин — производное гемоглобина. При злокачественных новообразованиях, в стадии распада опухоли, иногда мокрота приобретает вид малинового желе.
Экзогенные примеси окрашивают мокроту в цвет вдыхаемых частиц. У шахтеров она может быть черной от угля, у мукомолов — белой от муки, от вдыхания пыли мокрота становится серой.
Запах. Обычно свежевыделенная мокрота запаха не имеет. При стоянии в закрытом сосуде она приобретает неприятный запах. Мокрота из абсцесса легкого имеет - характерный запах гноя. Диагностическое значение приобретает запах при гангрене легкого и распаде легочной ткани при раке. В этих случаях выделяется зловонная мокрота.
Примеси. Чаще всего встречаются остатки пищи и слюна, которые попадают из полости рта. Нередко примешивается слизь из носоглотки. Она обычно лежит серыми комками на поверхности мокроты, не смешиваясь с ней.
§ 27. Элементы, встречающиеся при микроскопии
При микроскопическом исследовании обнаруживаются слизь, клеточные элементы, волокнистые и кристаллические образования, грибы, бактерии и паразиты (рис. 21, '22, 23).
Клеточные элементы. Лейкоциты в мокроте выглядят так же как в осадке мочи. Это круглые клетки сероватого цвета, содержащие зернистость. Ядро просматривается плохо. Встречаются в большем или меньшем количестве в любой мокроте. Особенно много их в гнойной мокроте при абсцессе легкого, туберкулезе, бронхоэктазах. I
Эозинофилы занимают особое место среди лейкоцитов. Они обнаруживаются по более темной, обильной, преломляющей свет зернистости. Эозинофилы появляются при аллергических состояниях (бронхиальная астма, эхинококкоз легкого, эозинофильный бронхит).
Эритроциты — округлые, желтоватые, мелкие клет« ки, появляющиеся в большом количестве при легочный кровотечениях. 1
Эпителиальные клетки. Плоский эпителий попадает в мокроту из полости рта и диагностического значения не имеет. -——-
Цилиндрический мерцательный эпителий — это клетки слизистой оболочки гортани, трахеи и бронхов. Они имеют вытянутую форму, суженную у основания, где находится эксцентрично расположенное ядро. Более широкая часть клетки обращена в просвет бронха и снабжена ресничками. Отторгнутые от слизистой оболочки клетки
Рис. 21. Клеточные элементы в мокроте.
1—лейкоциты; 2 — макрофаги; 3 — цилиндрический эпителий.
Рис. 22. Мокрота при бронхиальной астме.
1—эозинофилы; 2 — кристаллы Шарко — Лейдена; 3 — спираль Куршмана.
Деформируются, приобретают грушевидную или веретенообразную форму, реснички сохраняются редко. Встречаются в виде скоплений при бронхитах, бронхиальной астме, злокачественных новообразованиях.
Альвеолярные макрофаги — клетки ретикулоги-стиоцитарного происхождения. Они свободно передвигаются и обладают способностью к фагоцитозу. Представляют собой крупные клетки круглой или овальной формы с большим ядром и вакуолизированной цитоплазмой, содержащей различные включения. Макрофаги захватывают частички пыли, лейкоциты, эритроциты. Встречают-
Рис. 23. Эластические волокна в - мокроте.
1—неизмененные; 2 — коралловидные.
ся обычно в виде скоплений при пневмониях, бронхитах и др. При хронических воспалительных процессах нередко подвергаются жировому перерождению. Цитоплазма таких клеток заполнена капельками жира (зернистые шары). Жир может быть окрашен Суданом III в оранжевый цвет. Зернистые шары встречаются при новообразованиях, актиномикозе, туберкулезе легких.
При застойных явлениях в легких, когда имеет место нарушение кровообращения в малом круге, при инфаркте легкого появляются макрофаги, содержащие гемосидерин в виде золотисто-желтых включений. Разрушаясь в ткани легкого, гемоглобин превращается в тканевой пигмент гемосидерин, который поглощают альвеолярные макрофаги. Гемосидерин может быть выявлен специальной микрохимической реакцией.
Опухолевые клетки встречаются при злокачественных новообразованиях в виде атипичных клеток или комплексов (конгломератов). Атипичные клетки обычно крупные, полиморфные, с большими ядрами, содержащими нуклеолы. Встречаются многоядерные клетки. Цитоплазма их резко базофильна, вакуолизирована. Они часто сливаются, образуя комплексы, без четких границ между отдельными клетками. Различная форма и величина ядер, неравномерное, беспорядочное расположение клеток в комплексе служат характерным признаком злокачественности.
Волокнистые образования. Эластические волокна появляются при распаде легочной ткани. Стенки альвеол состоят из однослойного альвеолярного эпителия, окутанного тонкими прослойками соединительной ткани, содержащей эластические волокна. Распад легочной ткани
сопровождается разрушением эпителиального слоя и освобождением эластических волокон, которые выделяются с мокротой. Эти волокна имеют вид блестящих, ветвящихся, серых нитей, иногда складывающихся пучками. Часто они повторяют строение альвеол. Располагаются на фоне лейкоцитов и детрита. Такие волокна обнаруживаются при туберкулезе, абсцессе, гангрене, новообразованиях легкого.
Коралловидные волокна выделяются при хронических заболеваниях легких, таких, как кавернозный туберкулез. В полости каверны эластические волокна покрываются солями жирных кислот, мылами и становятся грубыми, бугристыми, похожими по виду на морские кораллы.
Обызвествленные эластические волокна— это те же волокна, только пропитанные солями кальция. Они теряют свою эластичность, становятся хрупкими, ломкими и приобретают вид пунктирной линии, как бы состоящей из отдельных, сероватых, преломляющих свет палочек. При этом сохраняется форма эластических волокон. Выделяются с мокротой при распаде обызвествленного участка легкого.
Фибрин в виде беловатой бесструктурной массы или тонких волоконец появляется в мокроте больных фибринозным бронхитом и крупозной пневмонией в начальной ее стадии.
Спирали Куршмана образуются при спастическом состоянии бронхов и наличии в них слизи. Во время кашлевого толчка вязкая слизь выбрасывается в просвет более крупного бронха, закручиваясь спиралью. Эта осевая нить спирали Куршмана окутывается более жидкой слизью — мантией. Обнаруживаются при бронхиальной астме, опухолях легких, сдавливающих бронхи.
Кристаллические образования. Кристаллы Шарко— Лейдена имеют ромбическую форму, бесцветны, прозрачны. Обычно выявляются в мокроте, содержащей эозинофилы. Их образование связывают с распадом эозинофилов. Встречаются у больных бронхиальной астмой, эозинофильным бронхитом, а также при глистных поражениях легких.
Кристаллы гематоидина образуются при распаде гемоглобина в бескислородной среде — в глубине кровоизлияний. Это желтокоричневые кристаллы, имеющие форму ромбов или игл, складывающихся в пучки. Встречаются при распаде легочной ткани и располагаются обычно на фоне эластических волокон и детрита.
Кристаллы холестерина — тонкие бесцветные Кристаллы четырехугольной формы с обломанными в виде ступеней углами. Они нередко налагаются друг на друга.
Образуются в полостях в результате распада жира и жирно перерожденных клеток при туберкулезе, новообразованиях, абсцессах, эхинококкозе легких.
Кристаллы жирных кислот имеют вид сероватых игольчатых образований, расположенных на фоне детрита, бактерий. Обнаруживаются при застое мокроты в полостях при туберкулезе, абсцессе легкого, бронхоэктазах.
Пробки Дитриха — комочки желтовато-серого цвета, имеющие неприятный запах. Состоят из детрита, бактерий, жирных кислот, капелек жира. Их появление характерно для хронических воспалительных процессов с распадом легочной ткани (бронхоэктазы, абсцессы, гангрена легкого).
Тетрада Эрлиха. Состоит из четырех элементов: обызвествленного детрита, обызвествленных эластических волокон, кристаллов холестерина и микобактерий туберкулеза. Появляется при распаде обызвествленного первичного туберкулезного очага. Причиной такого распада может быть пневмония, новообразование.
Паразиты. В легких паразитируют некоторые виды гельминтов и простейших. При исследовании мокроты могут быть обнаружены элементы эхинококка (крючья и обрывки хитиновой оболочки), яйца легочного сосальщика, а из простейших — трихомонады и пневмоцисты.
Грибы. При грибковых поражениях легких в мокроте можно выявить возбудителя заболевания. Актиномикоз легких вызывается лучистым грибом — актиномицетом. В гнойно-кровянистой мокроте обнаруживаются друзы лучистого гриба. Микроскопически они представляют собой округлые сплетения нитей мицелия, которые заканчиваются колбообразными утолщениями.
При длительном лечении антибиотиками могут возникнуть кандидозные пневмонии, сопровождающиеся выделением слизисто-гнойной, иногда кровянистой мокроты. Эти поражения вызываются дрожжеподобными грибами рода кандида. При микроскопическом исследовании гриб обнаруживается в виде почкующихся клеток, расположенных скоплениями, и нитей мицелия.
Бактерии. В окрашенных мазках обнаруживают разнообразные микроорганизмы, которые в небольшом количестве всегда находятся в дыхательных путях здорового человека. При особо неблагоприятных условиях (переохлаждение, снижение сопротивляемости организма) эта флора, усиленно размножаясь, становится патогенной и вызывает заболевания.
Микобактерии туберкулеза являются ’возбудителями туберкулеза легких и перибронхиальных лимфатических желез. Пневмококки встречаются при крупозной пневмс^
нии, особенно в начале заболевания, в слизистокровянистой (ржавой) мокроте и при хроническом бронхите.
Стрептококки и стафилококки обнаруживают в гнойной мокроте, главным образом, при абсцессе легкого, бронхоэктазии, эмпиеме, а также при бронхитах и пневмониях. Клебсиелла (диплобацилла Фридлендера) встречается при пневмониях и других заболеваниях.
Бактериоскопическое исследование мокроты не имеет большого диагностического значения. Окончательное заключение о возбудителе данного заболевания можно сделать путем посева мокроты на питательные среды и получения чистой культуры.
§ 28. Мокрота при различных заболеваниях
Острый бронхит. В начале заболевания выделяется небольшое количество слизистой, вязкой мокроты. В дальнейшем течении болезни количество мокроты увеличивается. Она становится слизисто-гнойной. При микроскопическом исследовании обнаруживается значительное количество цилиндрического эпителия, лейкоциты, эритроциты.
Хронический бронхит. Обычно выделяется много слизисто-гнойной мокроты, нередко с прожилками крови. Микроскопически обнаруживается большое количество лейкоцитов, эритроциты, альвеолярные макрофаги. При фибринозном бронхите встречаются фибринозные слепки бронхиол. Много разнообразных микроорганизмов.
Бронхиальная астма. Выделяется скудное количество слизистой, вязкой, стекловидной мокроты. Макроскопически можно увидеть спирали Куршмана. При микроскопии особенно характерно наличие эозинофилов и Цилиндрического эпителия. Встречаются кристаллы Шарко— Лейдена.
Бронхоэктатическая болезнь. Выделяется очень много гнойной мокроты (по утрам до 1 л) зеленовато-сероватого цвета. При стоянии она делится на три слоя: слизистый, серозный и гнойный. В гное находят пробки Дитриха. Микроскопически обнаруживается большое количество лейкоцитов, кристаллы жирных кислот, иногда кристаллы гематоидина и холестерина, разнообразная микрофлора.
Крупозная пневмония. В начале заболевания отделяется небольшое количество очень вязкой (клейкой) Ржавой мокроты. В период разрешения болезни мокрота Выделяется обильно, приобретая слизисто-гнойный характер.
Ржавая мокрота содержит свертки фибрина и изменен, ную кровь, придающую ей буроватый оттенок. Микроскопически в начале заболевания обнаруживаются эритроцц. ты, зерна гемосидерина, кристаллы гематоидина, небольшое количество лейкоцитов, много пневмококков. В конце заболевания количество лейкоцитов нарастает, а эритроцитов уменьшается, много альвеолярных макро-фагов.
Абсцесс легкого. В момент прорыва абсцесса в бронх выделяется большое количество гнойной, зловонной мокроты (до 600 мл). При стоянии жидкая мокрота становится двухслойной. Микроскопически обнаруживается много лейкоцитов, эластические волокна, обрывки легочной ткани, кристаллы жирных кислот, гематоидина и холестерина, разнообразная микрофлора.
Туберкулез легких. Количество мокроты зависит от стадии заболевания. При наличии каверн в легких оно может быть значительным. Характер мокроты слизистогнойной, нередко она содержит примесь крови. Макроскопически в мокроте можно обнаружить рисовидные тельца (линзы Коха), состоящие из элементов распада легочной ткани. Под микроскопом находят эластические волокна, кристаллы жирных кислот, гематоидина. При распаде старого обызвествленного туберкулезного очага обнаруживается тетрада Эрлиха.
Для диагностики заболевания наибольшее значение имеет наличие в мокроте микобактерий туберкулеза.
Рак легкого. Количество мокроты может быть различным. При распаде опухоли—значительным. Характер— слизисто-гнойно-кровянистый. При осмотре могут быть замечены обрывки ткани. Микроскопически обнарул живаются атипические клетки\и их комплексы. Я
I
Вопросы для повторения Я
1. Каково диагностическое значение исследования мокроты.' Я
2. Каков состав мокроты? Д
З. Что входит в понятие физические свойства мокроты? т!
4. При каких заболеваниях выделяется большое количество мокроты?
5. От чего зависят характер и консистенция мокроты?
6. Чем обусловливается цвет мокроты?
7. Каково диагностическое значение клеточных элементов, встречающихся при микроскопии мокроты?
8. Каково диагностическое значение волокнистых образований в мокроте?
9. Каково диагностическое значение обнаружения кристаллических образований в мокроте?
10. Какие бактерии могут быть обнаружены в мокроте?
11. Каков состав мокроты при остром и хроническом бронхитах, бронхиальной астме, бронхоэктатической болезни, крупозной пневмонии, абсцессе и туберкулезе легких?
МЕТОДЫ ИССЛЕДОВАНИЯ
§ 29. Правила собирания и обеззараживания
Больным необходимо разъяснять, что для исследования нужно собирать мокроту, выделенную при откашливании, а не слюну и слизь из носоглотки. Для сбора мокроты используют чистую, сухую, широкогорлую склянку. Существуют индивидуальные плевательницы из темного стекла, с завинчивающимися крышками и градуировкой на боковой поверхности.
Мокроту желательно собирать утром до приема пищи, примесь которой мешает исследованию. Перед откашливанием больной должен прополоскать рот и горло, вычистить зубы. Анализ мокроты производят в день ее выделения. Если это невозможно, то ее следует сохранять в холодильнике.
Мокрота чаще всего инфицирована, поэтому по окончании работы исследуемый материал, посуду, в которой он находился, предметные стекла следует обеззаразить. Обеззараживание производят физическими и химическими методами. К физическим методам относят кипячение в воде с добавлением соды в течение часа, а также автоклавирование при температуре 120° С в течение 30 мин.
Препаровальные иглы после употребления немедленно прокаливают на огне.
Для обеззараживания химическим методом используют активированные аммонийными соединениями растворы хлорамина и хлорной извести (50 г хлорамина и 50 г сульфата или хлорида аммония на 1 л дистиллированной воды). Заливают инфицированный материал двойным количеством дезинфицирующего раствора и оставляют на 4 ч.
Можно использовать ДТСГК (двутретьосновная соль гипохлорида кальция), обладающую большой бактерицидной активностью. После обезараживания посуду моют обычными средствами.
§ 30. Выбор материала для приготовления препаратов
От выбора материала, из которого готовят препараты, во многом зависит успех исследования. Мокроту выливают на чашку Петри и, раздвигая препаровальными иглами, рассматривают на белом и черном фоне.
Макроскопически могут быть обнаружены комочки гноя, прожилки крови, спирали Куршмана, фибринозные свертки, пробки Дитриха, рисовидные тельца, обрывки
легочной ткани, друзы актиномицета, элементы эхинококка.
Спирали Куршмана имеют вид беловатых, закрученных нитей, резко отграниченных от остальных частей мокроты.
Фибринозные свертки представляют собой беловатокрасноватые клубочки, которые при отмывании обнаруживают ветвистое строение. Длина свертков от нескольких миллиметров до 10—12 см.
Пробки Дитриха—это маленькие творожистые комочки белого или желтовато-серого цвета.
Рисовидные тельца — желтовато-зеленоватые плотные образования творожистой консистенции величиной с булавочную головку.
Обрывки легочной ткани представляют собой некротизированные кусочки легкого различной величины, темное серого цвета.
Друзы актиномицета имеют вид мелких желтоватых или сероватых зерен.
Пузыри эхинококка встречаются в мокроте редко. Чаще при разрыве эхинококковой кисты обнаруживают обрывки хитиновой оболочки пузыря в виде сероватобелых пленчатых образований.
Эти элементы употребляют для приготовления нативных и окрашенных препаратов. Прожилки крови для исследования не берут, так как,) они содержат только эритроциты.
§ 31. Приготовление нативных и окрашенных препаратов
Нативный
препарат готовят из
выбранных
элементов
мокроты. Препаровальными иглами помещают комочек
мокроты на середину предметного стекла и накрывают покровным стеклом. Чистым концом препаровальной иглы слегка надавливают на покровное стекло, делая препарат более плоским, полупрозрачным. При этом следят, чтобы мокрота не выходила за края покровного стекла. Готовят не менее четырех нативных препаратов из различных участков мокроты.
Микроскопируют вначале под малым увеличением — обзорная микроскопия (ок. 7 или 10, об. 8), а затем под большим увеличением (ок. 7 или 10, об. 40).
Окрашенные препараты готовят по-разному в зависимости от цели исследования.
Эластические волокна содержатся не в каждой капле мокроты, поэтому для их обнаружения прибегают к методу концентрации. С этой целью к нескольким миллилитрам мокроты добавляют двойное количество 10%
раствора щелочи и кипятят до растворения слизи. Эластические волокна при этом не растворяются. Охлажденную жидкость центрифугируют и добавляют к ней несколько капель 1% спиртового раствора эозина. Каплю осадка помещают на предметное стекло, накрывают покровным и микроскопируют. Эластические волокна имеют вид двухконтурных тонких ветвящихся волоконец красного цвета;
Альвеолярные макрофаги с золотисто-желтыми включениями могут содержать гемосидерин. Для его обнаружения ставят специальную микрохимическую реакцию Перльса.
Реакция на гемосидерин. Реактивы: 1) 5% раствор железистосинеродистого калия (желтой кровяной соли); 2) 2% раствор хлористоводородной кислоты.
Ход определения. Комочек мокроты помещают на предм- гное стекло, наливают 1—2 капли раствора желтой кровяной соли и оставляют на 2—3 мин. Добавляют 1—2 капли хлористоводородной кислоты, перемешивают и накрывают покровным стеклом. В течение 2—3 мин зерна гемосидерина в альвеолярных макрофагах окрашиваются в сине-зеленый цвет. Микроскопируют вначале под малым, а затем под большим увеличением.
Реакция считается положительной только при внутриклеточной окраске (рис. 24, см. на цвет. вкл.).
Микроскопия окрашенных препаратов производится с целью обнаружения микроорганизмов и некоторых клеточных элементов.
Для дифференциации клеточных элементов (эозинофилов, атипичных клеток и т. д.), обнаруженных в нативном препарате, надо снять с него покровное стекло, высушить и окрасить.
Эозинофилы в нативном препарате выявляются нечетко, поэтому их окрашивают по Романовскому (см. § 60) или специальным методом.
Окраска эозинофилов. Реактивы: 1) 0,5% спиртовой раствор эозина; 2) 1% водный раствор метиленового синего.
Техника окраски. Препарат фиксируют над пламенем горелки. На теплое стекло наливают раствор эозина и окрашивают в течение 3 мин. Затем мазок промывают водой и докрашивают несколько секунд метиленовым синим. Краску смывают водой, препарат высушивают на воздухе. Микроскопируют с иммерсионной системой (ок. 7, об. 90). На синем фоне четко выделяется красная зернистость эозинофилов (рис. 25, см. на цвет. вкл.).
Для выявления клеток злокачественных новообразований мокроту окрашивают одним из способов, применяемых для окраски мазков крови.
§ 32. Бактериоскопическое исследование
Для бактериоскопического исследования мазки мокроты приготавливают, растирая тщательно выбранный кусочек между двумя предметными стеклами, таким образом, чтобы мазок занял не более двух третей поверхности стекла. Препараты высушивают на воздухе и фиксируют
над пламенем горелки.
Микобактерии туберкулеза обнаруживают в
мазке, окрашенном по Цилю — Нильсену.
Окраска по Цилю — Нильсену. Реактивы: 1) карболовый фуксин Циля (1 г основного фуксина растирают в ступке с 10 мл 96% этилового спирта; приготовленный раствор
вливают
90 мл
7%
раствора фенола,
тщательно
шивают; хранят в посуде из темного стекла);
2) 3% спиртовой раствор хлористоводородной
переме-
кислоты
(3 мл концентрированной хлористоводородной кислоты добавляют к 97 мл 96% этилового спирта);
3) 1% водный раствор метиленового синего.
Техника окраски. На препарат накладывают поло-
ску фильтровальной бумаги, которая должна быть уже предметного стекла. Наливают 2 — 3 мл карболового фук-
сина Циля.
Держа
препарат
пинцетом,
подогревают
пламенем горелки до трехкратного отхождения паров. При этом растворяется жировосковая капсула микобактерий и они воспринимают красную окраску.
Остужают, бумажку сбрасывают, препарат промывают водой и полностью обесцвечивают, погружая стекло в 3% спиртовой раствор хлористоводородной кислоты. Обесцве
чиваются все части мокроты, кроме кислото- и спиртоустойчивых микобактерий.
Промывают водой и докрашивают в течение 30 с
метиленовым синим. При ваются в синий цвет,
окраши-туберку-
этом все части мокроты кроме микобактерий
леза.
Вновь промывают препарат водой и высушивают на воздухе. Микроскопируют с иммерсионной системой.
На синем фоне хорошо различимы микобактерии туберкулеза красного цвета. Они полиморфны, имеют вид тонких, слегка изогнутых палочек различной длины, могут быть колбовидной, пунктирной формы, располагаться поодиночке или группами (рис. 26, см. на цвет. вкл.).
Метод флотации Потенджера. Микобактерии туберкулеза неравномерно распределяются в мокроте, при количестве менее, чем 100 000 в 1 мл, обнаружить их в препарате не всегда удается. Методы накопления позволяют сконцентрировать микобактерии. Для их концентрации чаще всего пользуются методом флотации.
В основе метода лежит адсорбирование микобактерий
туберкулеза бензином, толуолом или ксилолом, которые всплывают на поверхность более плотной жидкости.
Реактивы: 1) 0,5% раствор едкого натра (или кали); 2) бензин (ксилол, толуол); 3) дистиллированная вода.
Техника флотации. Свежевыделенную мокроту помещают в стерильную узкогорлую бутылку вместимостью 200—250 мл с хорошо пригнанной пробкой. Для флотации достаточно 10—15 мл мокроты. Ее заливают двойным объемом щелочи и энергично встряхивают 10 — 15 мин в аппарате для встряхивания. При этом мокрота гомогенизируется, растворяются слизь и гной, освобождаются микобактерии. Затем в эту же бутылку приливают 1 мл бензина и 100 мл дистиллированной воды для разжижения мокроты. Снова встряхивают 10—15 мин для эмульгирования бензина. Доливают дистиллированную воду до горлышка бутылки. Смесь оставляют при комнатной температуре на 40—50 мин. За это время капельки бензина с адсорбированными на них микобактериями всплывают, образуя в горлышке бутылки сливкообразное флотационное кольцо.
Препараты готовят на новых обезжиренных предметных стеклах, которые предварительно подогревают до 60° С на воздушной бане. На подогретые стекла пастеровской пипеткой наносят капли из флотационного кольца, высушивают и снова наносят капли на то же место. Каждую последующую каплю наносят на высохшую предыдущую. Таким образом все флотационное кольцо переносят на предметные стекла. Готовят 3—4 препарата, фиксируют и окрашивают по Цилю — Нильсену.
Окраска по Граму. Реактивы: 1) карболовый раствор генцианового фиолетового (1г генцианового фиолетового растирают в ступке с 10 мл 96% этилового спирта; раствор вливают в 90 мл 2% раствора фенола, хорошо перемешивают; хранят в бутылке из темного стекла);
2) раствор Люголя (1г йода и 2 г йодата калия растворяют в 5 мл дистиллированной воды; после растворения навески доливают 295 мл дистиллированной воды);
3) 96% этиловый спирт;
4) фуксин Пфейффера (10 мл карболового фуксина Циля смешивают с 90 мл дистиллированной воды).
Техника окраски. Мазок фиксируют над пламенем горелки. На зафиксированный мазок накладывают полоску фильтровальной бумаги и наливают раствор генцианового фиолетового на 1,5—2 мин. Все части препарата окрашиваются в фиолетовый цвет. Сбрасывают бумажку и заливают мазок раствором Люголя на 2 мин. При этом фиолетовая окраска закрепляется на грамположительной флоре. Сливают раствор Люголя. Препарат обесцвечивают 96% этиловым спиртом до сероватого цвета. Грамполо-
жительная флора фиолетовую окраску сохраняет. Промы вают водой и докрашивают фуксином Пфейффера j течение 10—15 с. Все части препарата, кроме грамполо жительной флоры, окрашиваются в красный цвет. Снова промывают водой и высушивают на воздухе.
Микроскопируют с иммерсионной системой. На красном фоне четко видны фиолетовые грамположитель ные микроорганизмы.
В препаратах, окрашенных по Граму, обнаруживают пневмококки, клебсиеллы, стрептококки, стафилококки друзы актиномицета и другие микроорганизмы.
Грамположительная флора окрашивается в фиолето вый цвет, грамотрицательная — в красный (рис. 27, см. на цвет. вкл.).
Пневмококки представляют собой женные грамположительные округлые диплококки, окруженные капсулой.
Клебсиеллы имеют вид толстых
5
попарнорасполо или вытянутые
грамотрицатель ных палочек различной величины с закругленными конца ми, расположенных попарно и окруженных капсулой.
Стрептококки представляют собой круглые, мел кие, расположенные цепочками разной длины, грамполо жительные кокки. Находятся внутри лейкоцитов и сре ди них.
Стафилококки — круглые грамположительные кок ки различной величины, располагаются единично или группами. Часто встречаются одновременно со стрепто кокками.
Друзы актиномицета имеют вид сплетений темно фиолетового цвета. Каждая нить сплетения заканчивается колбовидным утолщением, окрашенным в красный цвет.
Глава IV
ИССЛЕДОВАНИЕ СПИННОМОЗГОВОЙ ЖИДКОСТИ
СОСТАВ И СВОЙСТВА В НОРМЕ И ПРИ ПАТОЛОГИИ
§ 33. Краткие сведения об образовании и функциях
Спинномозговая жидкость (ликвор) циркулирует между оболочками мозга, в его желудочках, цистернах и в спинномозговом канале (рис. 28).
К внутренней поверхности костей черепа прилегает твердая мозговая оболочка, под которой находится па утинная оболочка, покрывающая в виде очень тонкого прозрачного бесструктурного листка, головной мозг. КнИ зу эта оболочка переходит в паутинную оболочку спинно
3
Рис. 28. Циркуляция спинномозговой жидкости в центральной нервной системе.
I—желудочки мозга; 2—цистерны; 3 — подпаутинное пространство головного мозга; 4—подпаутинное пространство спинного мозга.
го мозга. Вся поверхность мозга окутана разветвленной сетью сосудов, заключенных в мягкую мозговую оболочку, покрывающую ткань мозга в глубине борозд, щелей и ямок. Паутинная оболочка переходит с одной возвышенности на другую, образуя различной величины подпаутинные вместилища. Наиболее крупные из них получили название цистерн.
Между паутинной и мягкой оболочками находится так называемое подпаутинное (субарахноидальное) пространство. Оно заполнено спинномозговой жидкостью и является единым для головного и спинного мозга.
Спинномозговая жидкость образуется в желудочках мозга путем пропотевания плазмы крови через стенки сосудов, а также секретируется клетками сосудистых сплетений. Из желудочков она поступает в цистерны мозга и в субарахноидальное пространство. Затем через кровеносные капилляры всасывается в венозную и частично лимфатическую систему.
За сутки образуется от 400 до 600 мл спинномозговой
4-325 97
жидкости. Циркуляция ее происходит непрерывно; в субарахноидальных пространствах содержится одновременно 100—150 мл спинномозговой жидкости.
Спинномозговая жидкость выполняет важную роль в процессах жизнедеятельности мозговой ткани: поддерживает постоянство ее солевого состава и осмотического давления, участвует в питании и процессе обмена веществ, предохраняет мозг от механического повреждения.
Для исследования спинномозговую жидкость получают путем прокола — пункции. Пункцию всегда производит врач в условиях операционной, специальной иглой, которая вводится в подпаутинное пространство. Прокол делают в строго определенных местах: между III и IV поясничными позвонками — поясничная (люмбальная) пункция, между затылочной костью и II шейным позвонком, в большую цистерну мозга—подзатылочная (субокципитальная) или цистернальная пункция и в месте сочленения височной, лобной и теменной костей — желудочковая (вентрикулярная) пункция.
Из иглы спинномозговая жидкость вытекает свободно. Ее собирают в 2 пробирки, хотя общее количество ее чаще всего невелико (не более 10 мл). С полученным материалом следует обращаться очень бережно, так как пункция довольно тяжелая манипуляция для больного. После прокола он должен находиться на строгом постельном режиме в течение 2—3 дней.
Исследование состава и свойств спинномозговой жидкости имеет диагностическое значение при заболеваниях центральной нервной системы и мозговых оболочек, таких, как энцефалиты (воспаления головного мозга), менингиты (воспаления твердой мозговой оболочки), арахноидиты (воспаления паутинной оболочки), сифилис мозга, опухоли, травмы и др.
§ 34. Физические свойства Я
Спинномозговая жидкость — прозрачная, бесцветнаЯ При описании физических свойств обращают внимание на цвет, прозрачность, наличие осадка и фибринозной пленки, относительную плотность.
Цвет. В норме бесцветна как вода. При заболеваниях может быть окрашена в сероватый, красный или желтый цвет.
Примесь крови придает спинномозговой жидкости красный цвет. Кровь может появиться в результате кровоизлияний при попадании в субарахноидальное пространство, во время пункции из поврежденных кровеносных сосудов. Если примесь крови незначительна, спинномозговая жидкость окрашивается в серовато-желтоватый
цвет, если крови много — в ярко-красный. Для того чтобы отличить случайную примесь крови от кровоизлияния, спинномозговую жидкость центрифугируют. Эритроциты, цопавшие в нее во время пункции, оседают, надосадочная жидкость остается бесцветной. Если после центрифугирования цвет остается красноватым или буроватым, то это служит признаком кровоизлияния; цвет обусловлен наличием кровяного пигмента гемоглобина.
При давних кровоизлияниях гемоглобин распадается с образованием пигментов билирубина и биливердина, которые придают спинномозговой жидкости различные оттенки желтого цвета от зеленовато-желтого до янтарного. Желтая окраска может встречаться при некоторых заболеваниях центральной нервной системы. Это явление носит название ксантохромии.
Прозрачность. В норме прозрачна. Помутнение зависит от увеличения содержания клеточных элементов — эритроцитов, лейкоцитов, эпителиальных клеток или от наличия большого количества микроорганизмов.
Чтобы заметить незначительные изменения цвета и прозрачности, спинномозговую жидкость сравнивают с дистиллированной водой в пробирках одинакового диаметра.
Осадок. В норме отсутствует. При наличии мутности форменные элементы могут выпадать в осадок. Эритроциты образуют осадок красного цвета, лейкоциты — зеленовато-желтого. Микроорганизмы осадка не дают.
Фибринозная пленка. Появляется при стоянии при содержании большого количества грубодисперсных белков. Образование пленки часто наблюдается при туберкулезном менингите. Она представляет собой полупрозрачное беловато-сероватое сплетение нитей фибрина, спускающееся в виде конуса от поверхности жидкости ко дну пробирки. Для получения фибринозной пленки спинномозговую жидкость берут в отдельную пробирку, которую нужно предохранять от сотрясений.
Относительная плотность. В норме равна 1,006—1,007. Определяется ареометром малого размера. В большинстве случаев это определение произвести трудно из-за малого количества получаемого материала.
§ 35. Химические свойства
Нормальная спинномозговая жидкость на 99% состоит из воды, 1% составляют плотные вещества, находящиеся в растворенном состоянии,— белки, сахара, минеральные соли, ферменты. Наибольшее клиническое значение имеет определение белка, глюкозы и хлоридов.
Белки. Нормальная спинномозговая жидкость содержит небольшое количество белка (0,15—0,3 г/л).
Значительное увеличение общего белка наблюдается при гнойных менингитах и сдавлении спинного мозга, когда нарушена циркуляция спинномозговой жидкости в спинномозговом канале (застойный ликвор). При других заболеваниях центральной нервной системы и мозговых оболочек количество белка повышается незначи
тельно.
Исследованием состава белков и их коллоидной устойчивости пользуются для дифференциации воспалительных и дегенеративных процессов в головном и спинном мозге. Это исследование имеет значение, главным образом, для диагностики сифилиса центральной нервной си
стемы.
Глюкоза. В спинномозговой жидкости здорового человека содержится 2,8—3,9 ммоль/л (0,5—0,7 г/л) глюкозы.
Увеличение количества глюкозы наблюдается при энцефалитах, сотрясениях и опухолях мозга, а также у больных сахарным диабетом, уменьшение — при менин
гитах.
Хлориды. Представлены главным образом хлоридом йатрия и составляют у здорового человека 195— 215 ммоль/л (7,0—7,5 г/л) или 120—130 ммоль/л (4,2— 4,6 г/л) — хлорид-иона.
Увеличение энцефалитах,
концентрации
хлоридов отмечается при
уменьшение — при менингитах, опухолях
мозга.
Реакция. Слабощелочная, pH 7,4—7,5. При заболева
ниях почти не меняется.
§ 36. Клеточный состав
В норме элементами.
спинномозговая
жидкость
бедна
клеточными
Они представлены только лейкоцитами (лим-
фоцитами). Эритроциты отсутствуют.
Количество клеток, содержащихся в единице объема спинномозговой жидкости, называется цитозом. Цитоз взрослого здорового человека составляет 1 • 106—3-106 лейкоцитов в 1л. У детей он несколько выше — до 7-Ю6—10-Ю6 в 1 л.
Увеличение числа клеточных элементов спинномозговой жидкости носит название плеоцитоза. Наиболее значительный плеоцитоз (до 5-109 клеток в 1 л) наблюдается при гнойных воспалениях мозговых оболочек, менее выраженный— при туберкулезном менингите, энцефалитах, полиомиелите.
Диагностическую ценность представляет не только подсчет общего числа клеток в единице объема спинномозговой жидкости, но и определение их вида. Из клеточных элементов в норме в спинномозговой жидкости содержатся только лимфоциты. При различных заболеваниях могут встречаться все клетки, входящие в состав периферической крови и тканевые клеточные элементы.
Изучение клеточного состава имеет значение для диагностики различных видов менингитов. При гнойных менингитах увеличение количества клеточных элементов происходит главным образом за счет нейтрофилов. При серозном и туберкулезном менингитах — плеоцитоз лимфоцитарный.
Количество эозинофилов увеличивается при аллергических состояниях, глистных инвазиях мозга (эхинококкоз, цистицеркоз). Наличие плазматических клеток служит показателем хронического течения воспалительного процесса.
Из тканевых клеток встречается арахноэндотелий, полибласты, макрофаги и клетки опухолей (рис. 29, см. на цвет. вкл.).
Арахноэндотелий — это разновидность эпителия, выстилающего мозговые желудочки и спинномозговой канал. Клетки имеют неправильную форму, крупное овальное или круглое фиолетовое ядро, базофильную цитоплазму.
Полибласты — фагоцитирующие клетки различной величины, неправильной формы с эксцентрично расположенным округлым или овальным темно-фиолетовым ядром и резко базофильной' вакуолизированной цитоплазмой.
Макрофаги—крупные клетки с круглым или овальным светло-фиолетовым ядром и вакуолизированной цитоплазмой, содержащей разнообразные включения (эритроциты, нейтрофилы, кристаллы). Макрофаги, заполненные жировыми каплями, окрашивающиеся Суданом III в оранжевый цвет, носят название «зернистых шаров». Макрофаги появляются в стадии рассасывания воспалительных процессов.
При опухолях центральной нервной системы встречаются клетки, не похожие ни на одну из описанных форм, — атипичные.
Кроме клеточных элементов, при патологии обнаруживают кристаллы гематоидина, холестерина, билирубина.
При менингитах методом бактериоскопии могут быть выявлены возбудители заболеваний: микобактерии туберкулеза, менингококки, стрептококки, стафилококки, пневмококки и др.
Вопросы для повторения
1. Где циркулирует спинномозговая жидкость?
2. Какие функции выполняет спинномозговая жидкость?
3. Каковы физические свойства спинномозговой жидкости в норме и патологии?
4. Каков состав спинномозговой жидкости в норме и как он изменяется при различных заболеваниях?
5. Что называется цитозом и каково диагностическое значение его определения?
6. Каков клеточный состав спинномозговой жидкости в норме н патологии?
МЕТОДЫ ИССЛЕДОВАНИЯ
§ 37. Определение белка
Количественные методы
Количество белка в спинномозговой жидкости определяют теми же методами, что и в моче.
Метод Брандберга— Робертса — Стольникова. Основан на образовании белого кольца при наслаивании исследуемой жидкости на 50% раствор азотной кислоты или на реактив Ларионовой (см. § 8).
Получаемые количества спинномозговой жидкости невелики, поэтому рекомендуется, приступая к определению белка, развести ее в 5 раз. При появлении кольца ранее 3 мин ее разводят в 10—15 раз и т. д. Разводящей жидкостью служит изотонический раствор хлорида натрия.
Фотометрический метод. Белок с сульфосалициловой кислотой дает помутнение, интенсивность которого пропорциональна концентрации белка.
Реактивы. 1) 6% раствор сульфосалициловой кислоты; 2) 14% раствор безводного сульфата натрия; 3) рабочий раствор (свежеприготовленная смесь равных объемов реактивов 1 и 2); 4) 0,9% раствор хлорида натрия; 5) стандартный 1% раствор альбумина для построения калибровочного графика (приготовление реактива и построение графика см. § 8).
Ход определения. В пробирку наливают 5 мл рабочего раствора и 0,5 мл спинномозговой жидкости. Тщательно перемешивают, оставляют на 10 мин при комнатной температуре. Жидкость мутнеет. Нефелометриру-ют на ФЭКе в кювете с толщиной слоя 10 мм против контроля при длине волны 410—480 нм (сине-фиолетовый светофильтр).
Контроль. 0,5 мм спинномозговой жидкости и 5 мл 0,9% хлорида натрия.
Расчет ведут по калибровочному графику.
Глобулиновые реакции
Реакция Панди. Основана на осаждении глобулинов спинномозговой жидкости насыщенным раствором карболовой кислоты.
Реактив: насыщенный раствор карболовой кислоты (100 г карболовой кислоты смешивают с 1 л дистиллированной воды, энергично перемешивают и оставляют в термостате при 37° С на 6—10 ч; затем выдерживают 7 дней при комнатной температуре; надосад очную жидкость сливают и используют в качестве реактива).
Ход определения. На часовое стекло, помещенное на черную бумагу, наливают 1—2 капли реактива. По краю стекла или в его центр наслаивают каплю исследуемой спинномозговой жидкости.
Оценка полученных результатов. В случае положительного результата в месте соприкосновения реактива и исследуемой спинномозговой жидкости образуется молочно-белое облачко, переходящее в муть. Степень помутнения выражают, пользуясь цифровыми обозначениями: значительное помутнение—4, умеренное — 3; заметная опалесценция — 2; слабая опалесценция—1, отсутствие помутнения — 0.
Реакция Нонне — Апельта. Основана на свойстве некоторых солей в определенных концентрациях осаждать избирательно глобулины из спинномозговой жидкости.
Реактив: насыщенный раствор сульфата аммония (NH 4)280 4 (85 г х.ч. сульфата аммония растворяют в 100 мл кипящей дистиллированной воды; полученный раствор выдерживают 48 ч при комнатной температуре; фильтруют; реактив должен иметь нейтральную реакцию).
Ход определения. В пробирку вносят 0,5 мл спинномозговой жидкости и равный объем насыщенного раствора сульфата аммония. Хорошо перемешивают. В контрольную пробирку равного диаметра наливают 1 мл дистиллированной воды.
Оценка полученных результатов. Регистрация результатов производится не позднее, чем через 3 мин после смешивания спинномозговой жидкости с реактивом. При более поздней регистрации помутнение может произойти и в нормальной спинномозговой жидкости. Оценивая результаты, рядом с опытной нужно держать для сравнения контрольную пробирку с дистиллированной водой и рассматривать их вместе на черном фоне. Степень помутнения выражают, пользуясь цифровыми обозначениями: значительное помутнение — 4; умеренное — 3; заметная опалесценция — 2; слабая опалесценция—1; отсутствие помутнения — 0.
При выполнении глобулиновых проб необходимо соб
людать точность в выполнении методики, так как появление мути может быть обусловлено осаждением всех белковых фракций спинномозговой жидкости, а не только глобулинов.
Источники ошибок: 1) поздняя регистрация результатов реакции; 2) грязная лабораторная посуда; 3) кислотность или щелочность реактива.
§ 38. Коллоидные реакции
Коллоидные реакции используются для распознавания дегенеративных и воспалительных процессов центральной нервной системы и ее оболочек. Дегенеративные (необратимые) изменения мозговой ткани наступают при сифилисе мозга, рассеянном склерозе, опухолях головного и спинного мозга, размягчении его. Изменения воспалительного характера появляются при менингитах различного происхождения.
Коллоидные растворы в присутствии нормальной спинномозговой жидкости не меняют своих свойств. При взаимодействии с патологической спинномозговой жидкостью дисперсность коллоидных растворов изменяется, в результате чего появляется помутнение, образуется осадок или изменяется цвет.
Реакция с хлорным золотом (реакция Ланге). Коллоидный раствор хлорного золота при взаимодействии с патологической спинномозговой жидкостью в присутствии электролитов претерпевает изменение дисперсности. Это проявляется изменением цвета и выпадением осадка.
Реактивы: 1) 0,45% раствор хлорида натрия (4,5 г на 1 л дистиллированной воды); 2) 1% раствор хлорида золота; 3) 1% раствор цитрата натрия; 4) рабочий раствор хлорного золота (к 9 мл дистиллированной воды приливают 1 мл 1% раствора хлорного золота, подогревают до 90—95° С. Затем добавляют 5 мл 1% раствора цитрата натрия и кипятят до тех пор, пока раствор не примет вишнево-красный цвет. Во время кипячения цвет раствора меняется от синего и фиолетового до красного и вишневого; приготовленный раствор хранят в темном месте при комнатной температуре).
Ход определения. Для постановки реакции посуда должна быть химически чистой. Спинномозговую жидкость исследуют в 11 пробирках. В 1-ю наливают 0,9 мл 0,45% раствора хлорида натрия, в остальные — по 0,5 мл того же раствора. В 1-ю пробирку приливают 0,1 мл спинномозговой жидкости и после перемешивания 0,5 мл смеси переносят во 2-ю пробирку, из 2-й — в 3-ю и т. д. до 10-й. Из 10-й пробирки после перемешивания 0,5 мл смеси удаляют. Таким образом получают ряд последовательных
разведений спинномозговой жидкости в 10, 20, 40, 80, 160, 320, 640, 1280, 2560, 5120 раз. В 11-ю пробирку спинномозговую жидкость не добавляют (контрольная проба). Затем во все И пробирок приливают по 2,5 мл раствора хлорного золота. Пробирки энергично встряхивают и оставляют на 16—18 ч при комнатной температуре.
Оценка полученных результатов. Практически результаты регистрируют на следующий день после постановки реакции. При нормальной спинномозговой жидкости смесь во всех И пробирках остается пурпурнокрасной или в одной из первых пробирок становится красно-фиолетовой. В случае патологии цвет жидкости меняется на красно-фиолетовый, красно-синий, голубой и, наконец, полностью обесцвечивается. Результаты отмечают цифрами, указывающими условное изменение цвета в каждой пробирке. 0 — обозначает отсутствие изменений в окраске (пурпурно-красный цвет), 1—красно-фиолетовый цвет, 2—фиолетовый, 3 — красно-синий, 4 — синий и синефиолетовый; 5 — светло-синий и голубой, 6 — бесцветный.
Результаты можно изобразить графически (рис. 30). По горизонтальной оси откладывают номера пробирок с разведениями спинномозговой жидкости, а по вертикали — название цвета с соответствующим номером. Точками отмечают изменение цвета в каждой пробирке. Затем все точки соединяют и получают характерные кривые. Различают следующие типы кривых: нормальный, дегенеративный и воспалительный.
В норме график выглядит в виде прямой; цифровое выражение отрицательной реакции будет 00000000000 или 00010000000.
При дегенеративном типе изменения цветов начинают-
ся с 1-й пробирки и более выражены в левой половине кривой. Первые пробирки бесцветны, имеют осадок, в последующих наблюдается переход от голубого через синий и фиолетовый к красному цвету. Дегенеративная кривая будет иметь выражение: 66666543210.
При воспалительном типе изменения цветов более выражены в центре кривой и в правой ее части. В первых пробирках цвет красный, затем, в зависимости от интен-
сивности воспалительного процесса, он изменяется до синего, голубого или полного обесцвечивания жидкости, возвращаясь в конце ряда к красному цвету. Цифровое выражение воспалительной кривой может быть следующим: 00124566530.
Фуксин-сулемовая проба (реакция Таката — Ара). Основана на коагуляции белка спинномозговой жидкости раствором сулемы. При этом изменяется цвет фуксин-сулемовой смеси.
Реактивы: 1) 10% раствор карбоната натрия; 2) 0,2% раствор основного фуксина; 3) 0,02% раствор фуксина (готовят из 0,2% раствора); 4) 0,5% раствор сулемы; 5) фуксин-сулемовая смесь (0,02% раствор фуксина и 0,5%
раствор сулемы смешивают в равных объемах; при смешивании сулему следует добавлять к фуксину).
Ход определения. В пробирку наливают 0,5 мл спинномозговой жидкости, добавляют каплю 10% раствора карбоната натрия и 0,15 мл фуксин-сулемовой смеси, перемешивают. Оставляют при комнатной температуре на 24 ч.
Оценка полученных результатов. Результат реакции может быть трех типов. Первый тип — отрицательный или нормальный (фиолетовый цвет жидко-
сти не изменяется в течение 24 ч; она остается прозрач-
ной); второй тип
дегенеративный
вызывает остается
выпадение сине-фиолетового прозрачная жидкость);
(прибавление
реактива
осадка, третий
над
ним
тип
воспалительный (розовая окраска смеси с течением времени обесцвечивается, осадок отсутствует).
§ 39. Подсчет форменных элементов в счетной камере
Подсчет форменных элементов в спинномозговой жид| кости необходимо производить сразу же после ее получе! ния, так как они при стоянии в пробирке быстро разрушая
ются.
Для
облегчения
подсчета лейкоциты подкрашивают,
эритроциты разрушают. Подсчет лейкоцитов производят в счетной камере.
Реактив: 10% раствор уксусной кислоты, подкрашенный метиловым фиолетовым (0,1 г-на 50 мл).
Ход определения. Приступая к подсчету форменных элементов, спинномозговую жидкость тщательно перемешивают, катая пробирку между ладонями в течение 2 мин.
На часовое стекло пастеровской пипеткой наносят 10 капель спинномозговой жидкости и добавляют 1 каплю 10%
раствора уксусной кис-
лоты, подкрашенной метиловым фиолетовым. Перемеши-
вают, заполняют смесью счетную камеру.
Для подсчета цитоза пользуются обычно камерой Фукс — Розенталя. Камера представляет собой толстое
предметное стекло, прорезанное четырьмя поперечными бороздами. Борозды делят середину стекла на пластинки— 2 боковые и среднюю. Средняя пластинка на 0,2 мм ниже боковых. Она разделена поперечной бороздкой на 2 равные части, на каждой из которых нанесена сетка. Принадлежностью камеры является шлифованное покровное стекло. Его следует притереть к боковым пластинкам.
Между средней пластинкой и покровным стеклом остается щель. Это и есть камера, в которую заливают исследуемую жидкость.
Сетка Фукс — Розенталя состоит из 16 больших квадратов, каждый из которых разделен на 16 малых (рис. 31). Сторона сетки равна 4 мм, площадь ее — 4-4=16 мм5. Глубина камеры 0,2 мм, следовательно объем ее 16-0,2=3,2 мм3.
Подсчет лейкоцитов производят во всех квадратах сетки и полученное число делят на 3,2 (объем камеры). Результат деления будет соответствовать количеству форменных элементов в 1 мкл спинномозговой жидкости, разведенной уксусной кислотой.
Чтобы узнать количество форменных элементов в 1 мкл неразведенной спинномозговой жидкости, необходимо сосчитанное во всех квадратах камеры число «А»
разделить на 3,2 и умножить на степень разведения
11 I
ликвора— —: I
А-11 _А-11_ А I
3,2-10 32 3 I
Чтобы узнать количество форменных элементов в 1 л спинномозговой жидкости, необходимо цифру, получен! ную при расчете, умножить на 10”. "
Дифференцировать форменные элементы можно в ка-'мере и в окрашенном мазке.
Для приготовления мазков спинномозговую жидкость центрифугируют не менее 30 мин. Жидкость сливают с осадка, осадок хорошо встряхивают и выливают на чистое обезжиренное предметное стекло. Препарат высушивают, фиксируют в смеси Никифорова (смесь спирта и эфира 1:1) или метиловом спирте, окрашивают азур-эозином.
Окраска методом Возной. Мазок высушивают под стеклянным колпаком в течение 20—24 ч. Фиксируют и окрашивают слабым раствором азур-эозина (1—2 капли краски на 5 мл дистиллированной воды) в течение часа. Затем, не смывая краски, наливают на мазок более крепкий раствор азур-эозина (2 капли краски на 1 мл дистиллированной воды). Докрашивают 5 мин. Краску сливают, мазок осторожно промывают водой, наливая ее на ребро стекла. Высушивают на воздухе. Микроскопиру-ют с иммерсионной системой. Окраска этим методом дает наилучшие результаты.
§ 40. Бактериоскопическое исследование
Бактериоскопическое исследование спинномозговой жидкости производят с целью обнаружения возбудителей инфекционных заболеваний.
Для приготовления препаратов спинномозговую жидкость центрифугируют и из осадка делают мазки, высушивают на воздухе, фиксируют на пламени и окрашивают по Граму или по Цилю — Нильсену. Так как фибринозная пленка, образующаяся при туберкулезных менингитах, захватывает имеющиеся в спинномозговой жидкости туберкулезные бактерии, целесообразно использовать эту пленку для приготовления препарата. Спинномозговую жидкость, собранную в стерильную пробирку, ставят в холодильник на 18—20 ч для образования фибринозной пленки. Содержимое пробирки осторожно сливают на предметное стекло так, чтобы фибринозная пленка распласталась по его поверхности (важно, чтобы она не 108
-
свернулась в комочек). Препарат высушивают, фиксируют и красят по Цилю — Нильсену.
В мазке, окрашенном по Граму, при бактериоскопии можно обнаружить менингококки — грамотрицательные диплококки, чаще всего находящиеся внутри нейтрофилов. Стрептококки и стафилококки, также вызывающие гнойные менингиты, окрашиваются по Граму положительно. Они легко могут быть обнаружены, так как в препарате находятся обычно в большом количестве.
Глава V
ИССЛЕДОВАНИЕ ЖИДКОСТЕЙ ИЗ СЕРОЗНЫХ ПОЛОСТЕЙ
СОСТАВ И СВОЙСТВА ЭКССУДАТОВ И ТРАНССУДАТОВ
§ 41. Происхождение
Внутренние полости организма — грудная, брюшная и полость перикарда, покрыты серозными оболочками. Эти оболочки состоят из двух листков: наружного и внутреннего. Наружные выстилают грудную и брюшную полости, а также полость перикарда. Заворачиваясь, они переходят во внутренние, покрывающие жизненно важные органы (легкие, кишечник, сердце и др.). Между серозными листками имеется небольшое щелевидное пространство, образующее так называемую серозную полость (рис. 32). Серозные оболочки состоят из соединительнотканной основы и покрывающих ее клеток мезотелия. Эти клетки выделяют небольшое количество серозной жидкости, которая увлажняет соприкасающиеся поверхности листков, что позволяет им легко смещаться.
В норме между серозными листками полость фактически отсутствует. Она образуется при различных патологических состояниях, связанных с накоплением жидкости. Жидкости, появляющиеся в полостях в результате воспалительных процессов, называются экссудатами. Жидкости, образующиеся в результате нарушения общего и местного кровообращения, называются транссудатами.
При перитоните (воспалении брюшины) в брюшной полости скапливается экссудат. При плеврите в плевральной полости появляется также экссудат. При Тяжелых пороках сердца, сопровождающихся нарушением кровообращения, в брюшной полости накапливается выпотная Жидкость невоспалительного происхождения — транссудат.
Рис. 32. Серозные полости.
1—плевральная; 2 — перикардиальная; 3—брюшная.
Для того чтобы отличить экссудат от транссудата, исследуют их свойства.
Материал для исследования получают путем прокола (пункции), который производят специальной толстой иглой. Плевральную пункцию делают обычно в восьмом или девятом межреберье, брюшную— по средней линии живота.
Выпотную жидкость собирают в сухую чистую посуду и доставляют в лабораторию, где ее сразу же исследуют.
§ 42. Физико-химические свойства
Под физическими свойствами экссудатов и транссудатов подразумевают их характер, консистенцию, цвет, прозрачность, запах и относительную плотность.
Физические свойства определяются составом выпота, в который могут входить серозная жидкость, гной, кровь, лимфа, фибрин.
Характер. Экссудат может быть серозным, серозно-фибринозным, серозно-гнойным, гнойным, гнилостным, геморрагическим, хилезным, хилусоподобным.
Транссудат всегда имеет серозный характер.
Консистенция чаще всего жидкая, но гнойный и гнилостный экссудаты могут быть полувязкими или вязкими за счет большого количества клеточных элементов и детрита.
Цвет. Серозный экссудат бледно- или золотистожелтый, гнойный — серовато-желтый или желто-зеленый, гнилостный — бурый, геморрагический — розовый, темнокрасный или бурый. Хилезный экссудат цветом напоминает разбавленное молоко.
Транссудаты обычно бледно-желтого цвета.
Прозрачность. Серозный экссудат прозрачен или слегка опалесцирует. Серозно-гнойный, гнойный, гнилостный, геморрагический экссудаты мутны. Муть обусловлена обилием лейкоцитов и эритроцитов. Хилезный и хилусоподобный экссудаты мутные от наличия в них большого количества жира и детрита (распавшиеся жирно перерожденные клетки).
Транссудат всегда прозрачен или немного опалесцирует.
Запах. Обычно отсутствует. Неприятный зловонный запах имеет только гнилостный экссудат.
Относительная плотность у экссудатов колеблется в пределах 1,018—1,022, у транссудатов ниже—от 1,006 до 1,012. Измеряется урометром, так же как относительная плотность мочи (см. § 7).
Химическое исследование полостных жидкостей обычно сводится к определению в них белка. Экссудаты содержат его относительно много — от 30 до 80 г/л. В транссудате белка значительно меньше — от 5 до 25 г/л.
Состав белковых фракций экссудата почти такой же как в сыворотке крови. Экссудат содержит 0,5—1 г/л фибриногена, который обусловливает его способность к самопроизвольному свертыванию.
В транссудате фибриноген почти отсутствует. В нем содержится много альбуминов и небольшое количество глобулинов.
§ 43. Клеточный состав
Полостные жидкости всегда содержат клеточные элементы. В транссудатах их небольшое количество, в экссудатах — значительно больше. Количество клеток и их состав в экссудатах зависит от характера патологического процесса.
Среди клеточных элементов различают элементы крови (эритроциты и лейкоциты различных видов) и тканевые клетки (рис. 33, см. на цвет. вкл.).
Эритроциты имеются в любой полостной жидкости в небольшом количестве. Они попадают в выпот в момент его получения при проколе. В геморрагическом экссудате эритроцитов очень много.
Лейкоциты в небольшом количестве (до 15—20 в поле зрения) содержатся всегда в транссудатах. В экссудатах, особенно гнойных, они покрывают все поля зрения. В жидкостях воспалительного происхождения встречаются все виды лейкоцитов, содержащиеся в крови.
Нейтрофилы обнаруживают в любых экссудатах. При благоприятном течении воспалительного процесса
число их постепенно уменьшается, при неблагоприятном (развитие гнойного воспаления)—резко возрастает.
Лимфоциты в том или ином количестве имеются в транссудате и в каждом экссудате. В серозных экссудатах (например, при туберкулезе в разгар заболевания) их особенно много. Они составляют 80—90% всех лейкоцитов.
Эозинофилы могут встретиться в серозных и геморрагических экссудатах и служат признаком аллергического процесса. При эозинофильных плевритах они появляются в значительном количестве и составляют до 30—80% всех клеточных элементов.
Плазматические клетки обнаруживаются при затяжных воспалительных процессах в серозном или гнойном экссудате, а также в период рассасывания геморрагического экссудата.
Полибласты — тканевые клетки различной величины, имеющие базофильную цитоплазму и фиолетовое округлое или овальное ядро. Встречаются в гнойных экссудатах.
Макрофаги — крупные клетки с вакуолизированной цитоплазмой светло-голубого цвета, содержащей нередко фагоцитированные элементы. Светло-фиолетовое ядро имеет неправильную форму, расположено эксцентрично. Обнаруживаются при гнойных плевритах, кровоизлияниях, опухолях.
Мезотелий — очень крупные клетки (до 20—30 мкм в диаметре) с центрально расположенным круглым светлофиолетовым ядром и базофильной цитоплазмой. Встречаются дву- и трехъядерные формы. Мезотелий обнаруживается в транссудатах при сердечных и почечных заболеваниях. В экссудатах их можно видеть в начальной стад иг воспалительного процесса и при опухолях.
Клетки опухолей могут быть различных размеров. Цитоплазма вакуолизирована, резко базофильна. Встречаются перстневидные формы, в которых вакуоль занимает большую часть клетки, оттеснив ядро к периферии. Ядра крупные, содержат много нуклеол. Характернс наличие комплексов, в которых отдельные клетки не имеют четких границ.
§ 44. Общая характеристика различных видов экссудатов и транссудата
Серозные и серозно-фибринозные экссудаты появляются при туберкулезе (экссудативный плеврит, туберкулезный перитонит), ревматизме (ревматический плеврит).
Имеют различные оттенки желтого цвета, прозрачны, содержат около 30 г/л белка. При микроскопии находят небольшое количество клеточных элементов, преимущественно лимфоцитов и эозинофилов. Присутствуют клетки мезотелия, макрофаги.
Серозно-гнойные и гнойные экссудаты наблюдаются при гнойных перитонитах и плевритах. Гнойный экссудат желтовато-зеленого цвета, мутный, полувязкий или вязкий. Содержит до 50 г/л белка. Под микроскопом обнаруживают большое количество сегментоядерных нейтрофилов, элементы клеточного распада, капли жира, кристаллы холестерина, бактерии.
Гнилостный экссудат встречается при гангрене легкого с прорывом в полость плевры, при гангрене кишечника. Имеет зеленовато-коричневый цвет, мутный, полувязкий, характерен зловонный, гнилостный запах. Содержит много детрита, бактерий, кристаллов холестерина.
Геморрагический экссудат появляется при злокачественных новообразованиях, геморрагических диатезах, травмах грудной и брюшной полости. Это красноватого или буроватого цвета мутная жидкость, содержащая более 30 г/л белка. При микроскопии главную массу клеток составляют эритроциты, присутствуют нейтрофильные лейкоциты и лимфоциты. В период рассасывания обнаруживаются эозинофилы, макрофаги, мезотелиальные клетки.
Хилезный экссудат возникает при разрыве крупных лимфатических сосудов брюшной и реже плевральной полости. Он молочного цвета, мутный, содержит большое количество жира. Количество белка в среднем 35 г/л. При прибавлении эфира и щелочи жидкость просветляется вследствие растворения жира. При микроскопии обнаруживают большое количество капель жира, лимфоцитов и эритроцитов. Имеется немного нейтрофилов.
Хилусоподобный экссудат наблюдается при хроническом воспалении серозных оболочек при туберкулезе, Циррозе печени, опухолях. По цвету похож на хилезный экссудат, мутный, но жира содержит значительно меньше (при прибавлении эфира со щелочью не просветляется). Количество белка в среднем 30 г/л. При микроскопии обнаруживается большое количество жирно-перерож-Денных клеток и капли жира.
Транссудат появляется при декомпенсации сердечной деятельности, тяжелой почечной недостаточности, сдавлении сосудов опухолью (местное нарушение кровообращения). Всегда имеет серозный характер, бледно-желтый цвет, прозрачен или немного опалесцирует. Относительная плотность от 1,006 до 1,012. Количество белка
колеблется от 5 до 25 г/л. При микроскопии находят небольшое количество эритроцитов и лимфоцитов, мезотелиальные клетки.
Вопросы для повторения
1. Какие полости называются серозными, чем онн образованы?
2. Каково происхождение экссудатов н транссудатов?
3. Каковы фнзнко-хнмические свойства экссудатов н транссудатов?
4. Какие клеточные элементы встречаются в экссудатах и транссудатах?
5. Какова общая характеристика серозного, серозно-фибринозного, серозно-гнойного, гнойного, гнилостного, геморрагического, хилезного и хилусоподобного экссудатов?
6. Чем отличается экссудат от транссудата?
МЕТОДЫ ИССЛЕДОВАНИЯ
§ 45. Определение белка. Дифференциальные пробы
Экссудаты и транссудаты содержат большое количество белка, поэтому перед его определением выпотные жидкости необходимо развести 0,9% раствором хлорида натрия в 100 раз (0,1 мл жидкости+ 9,9 мл хлорида натрия). Степень разведения определяют по пробе с сульфосалициловой кислотой. При очень высоком содержании белка в экссудате разбавление можно продолжить, пользуясь основным разведением (1:100). При расчете учитывают степень разведения.
Белок определяют методом Брандберга — Робертса— Стольникова или на ФЭКе (см. § 8).
К дифференциальным относят пробы Ривальты и Лукерини. Их используют для того, чтобы отличить серозный экссудат от транссудата. Экссудат содержит серомуцин — мукополисахаридный комплекс, свертывающийся под воздействием кислот. В транссудатах этот комплекс отсутствует.
Проба Ривальты. Реактив: концентрированная уксусная кислота. Ход определения. В цилиндр вместимостью 100 мл наливают дистиллированную воду. Подкисляют ее 2—3 каплями концентрированной уксусной кислоты. Сверху вносят по каплям исследуемую выпотную жидкость. Если капля свертывается, то исследуемая жидкость является экссудатом. Капля транссудата не образует помутнения.
Проба Лукерини. Реактив: 3% раствор перекиси водорода. Ход определения. На часовое стекло наливают 2 мл 3% раствора перекиси водорода. Прибавляют каплю исследуемой жидкости и рассматривают на черном фоне. Если это экссудат, то появляется помутнение. В случае транссудата помутнения нет.
-ah .
§ 46. Приготовление препаратов для микроскопического исследования
Препараты готовят для исследования клеточного состава и обнаружения патогенной флоры. С этой целью жидкость центрифугируют в течение 5 мин. Гнойные экссудаты центрифугировать не надо. Экссудат, содержащий большое количество фибрина, может свернуться до или во время центрифугирования, что делает осадок непригодным для исследования. Чтобы предотвратить свертывание, к выпотной жидкости добавляют цитрат натрия (1г на 1л) или гепарин. Осадок исследуют в нативном и окрашенном препаратах.
Для приготовления нативного препарата каплю осадка помещают на предметное стекло, накрывают покровным и микроскопируют сначала при малом, а затем при большом увеличении. Микроскопия нативного препарата дает ориентировочное представление о количестве клеточных элементов, их качественном составе, о наличии комплексов опухолевых клеток.
Для приготовления окрашенных препаратов осадок равномерно распределяют по предметному стеклу, высушивают на воздухе, фиксируют метиловым спиртом или смесью Никифорова. Для изучения клеточного состава мазки окрашивают также как и кровь (см. § 60), но продолжительность окраски значительно меньшая — до 10 мин. Микроскопируют с иммерсионной системой. В препаратах изучают морфологию клеточных элементов, подсчитывают соотношение различных видов клеток.
Для бактериоскопического исследования мазки окрашивают по Граму и Цнлю — Нильсену. Для выявления микобактерий туберкулеза экссудат обрабатывают флотационным раствором (см. § 32). Однако возбудитель туберкулеза в выпотных жидкостях обнаруживается редко. При окраске по Граму выявляется гноеродная флора: пневмококки, стрептококки, стафилококки, энтерококки, клебсиеллы, кишечная палочка и др.
ГЕМАТОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ
Глава I
КРОВЕТВОРЕНИЕ. СОСТАВ И ФУНКЦИИ КРОВИ
НОРМАЛЬНОЕ КРОВЕТВОРЕНИЕ
Кровь—это жидкая подвижная ткань, заполняющая разветвленную сеть кровеносных сосудов. Количество мельчайших сосудов — капилляров огромно: нет ни одного органа, где бы расстояние между капиллярами превышало доли миллиметра. Через стенки капилляров свободно происходит обмен веществ между тканями и кровью, которая, омывая все клетки организма, осуществляет постоянную связь между органами и системами. Таким образом, кровь является «внутренней средой организма», обеспечивающей нормальную его жизнедеятельность.
Кровь состоит из жидкой части — плазмы и взвешенных в ней форменных элементов: эритроцитов, лейкоцитов и тромбоцитов. Плазма составляет 55—58% ее объема, на долю форменных элементов приходится соответственно 45—42%.
Форменные элементы и плазма осуществляют все разнообразие функций крови — обеспечение всех органов и тканей необходимыми продуктами питания, кислородом, удаление из них углекислого газа. Через кровь осуществляется гормональная регуляция функций организма, выведение конечных продуктов обмена веществ, защита организма от инфекционных заболеваний. Способность, крови свертываться предотвращает кровопотери.
Состав крови здорового человека относительно постоянен. Имеются лишь незначительные физиологические колебания, связанные с полом, возрастом и др.
Всякие отклонения от нормального функционирования организма приводят к изменениям в составе крови, поэтому ее исследование играет важную роль в диагностике заболеваний.
§ 47. Схема кроветворения
Учение о кроветворении имеет большое теоретическое и практическое значение. Оно дает представление о нормальном созревании клеток крови, помогает разобраться в сущности заболеваний кроветворной системы и изменений состава крови при патологических процессах.
Кроветворение — гемопоэз — это процесс развития клеточных элементов, который приводит к образованию зрелых клеток периферической крови.
Процесс кроветворения можно изобразить в виде схемы (рис. 34, см. на цвет, вкл.), в которой клетки расположены в определенной последовательности, основанной на степени их созревания. Согласно современным представлениям о кроветворении все клетки крови происходят из одной, которая дает начало трем росткам кроветворения: лейкоцитарному, эритроцитарному и тромбоцитарному.
В схеме кроветворения клетки крови разделены на 6 классов. Первые четыре класса составляют клетки-предшественники, пятый класс — созревающие клетки и шестой— зрелые.
Класс I. Представлен стволовыми клетками, количество которых в кроветворной ткани составляет доли процента. Эти клетки способны к неограниченному само-поддержанию в течение длительного времени (больше, чем продолжительность жизни человека). Стволовые клетки полипотентны, т. е. из них развиваются все ростки кроветворения. Большая часть стволовых клеток находится в состоянии покоя и только около 10% из них делятся. При делении образуются два типа клеток — стволовые (само-поддержание) и клетки, способные к дальнейшему развитию (дифференцировке). Последние составляют следующий класс.
Класс II. Представлен ограниченно полипотентными клетками, т. е. клетками, которые способны дать начало либо лимфопоэзу (образованию клеток лимфоидного ряда), либо миелопоэзу (образованию клеток миелоидного ряда). В отличие от стволовых клеток они способны лишь к частичному самоподдержанию.
Класс III. В процессе дальнейшей дифференцировки образуются клетки, называемые унипотентными предшественниками. Они дают начало одному строго определенному ряду клеток: лимфоцитам, моноцитам и гранулоцитам (лейкоцитам, имеющим в цитоплазме зернистость), эритроцитам и тромбоцитам.
В костном мозге обнаруживается две категории клеток-предшественников лимфоцитов, из которых образуются В- и Т-лимфоциты. В-лимфоциты созревают в костном мозге, а затем заносятся кровотоком в лимфоидные органы. Из предшественников В-лимфоцитов образуются плазмоциты. Часть лимфоцитов в эмбриональном периоде поступает через кровь в вилочковую железу (thymus) и обозначается как Т-лимфоциты. В дальнейшем они дифференцируются в лимфоциты.
Клетки этого класса также не способны к длительному
самоподдержанию, но способны к размножению и дифференцировке.
Класс IV. Представлен молодыми, способными к делению клетками, образующими отдельные ряды миело-и лимфопоэза. Все элементы этого ряда имеют окончание «бласт»: плазмобласт, лимфобласт, монобласт, миелоб-ласт, эритробласт, мегакариобласт. Из клеток этого класса в процессе деления образуются клетки следующего класса.
Класс V. Представлен созревающими клетками, названия которых имеют общее окончание «цит». Все элементы этого класса расположены в схеме по вертикали в определенной последовательности, обусловленной стадией их развития.
Названия клеток первой стадии начинаются приставкой «про» (перед): проплазмоцит, пролимфоцит, промоноцит, промиелоцит, пронормоцит, промегакариоцит. Элементы гранулоцитарного ряда проходят еще две стадии в процессе развития: миелоцит и метамиелоцит («мета» означает после). Метамиелоцит, находящийся на схеме ниже миелоцита, представляет переход от миелоцита к зрелым гранулоцитам. К клеткам этого класса относят также и палочкоядерные гранулоциты. Пронормоциты в процессе эритропоэза проходят стадии нормоцитов, которые, в зависимости от степени насыщения гемоглобином цитоплазмы, имеют добавочные определения: нормоцит базофильный, нормоцит полихроматофильный и нормоцит оксифильный. Из них образуются ретикулоциты — незрелые эритроциты с остатками ядерной субстанции.
Класс VI. Представлен зрелыми клетками, неспособными к дальнейшей дифференцировке с ограниченным жизненным циклом. К ним относятся: плазмоцит, лимфоцит, моноцит, сегментоядерные гранулоциты (эозинофил, базофил, нейтрофил), эритроцит, тромбоцит.
Зрелые клетки поступают из костного мозга в периферическую кровь.
§ 48. Морфологическая характеристика клеток костного мозга и периферической крови
Особенности строения клеток, выявляемые при окраске и микроскопии, позволяют отличать их друг от друга. При описании клетки следует обращать внимание на ее размер, строение ядра и цитоплазмы, их соотношение, характер зернистости.
Клетки первых трех классов внешне неотличимы дрУг от друга. Они имеют круглую или неправильную форму, ядро фиолетовое округлое или почкообразное с одним илй двумя ядрышками. Светло-голубой узкий ободок цитоп
лазмы зернистости не содержит. Существуют эти клетки в двух формах: бластной и лимфоцитоподобной. Бластные клетки имеют ядро нежной структуры, одно или несколько ядрышек в нем. Ядра лимфоцитоподобных форм плотные. Возможен переход из одной формы в другую. Принадлежность клеток к тому или иному из первых трех классов определяется цитохимическими методами или получением колоний в культуре тканей.
Начиная с класса IV, клетки обладают характерными, различимыми под микроскопом, особенностями.
Морфология клеток гранулоцитарного ряда. К клеткам гранулоцитарного ряда относятся: миелобласт (класс IV), промиелоцит, миелоцит, метамиелоцит и палочкоядерные гранулоциты (V класс), а также сегментоядерные гранулоциты (класс VI).
Миелобласт — родоначальная клетка гранулоцитарного ряда, диаметром 15—20 мкм. Ядро округлой формы занимает большую часть клетки, окрашено в краснофиолетовый цвет, имеет нежно-сетчатую структуру хроматина, содержит от 2 до 5 ядрышек сине-голубого цвета. Ядро окружено узким пояском ярко-синей (базофильной) цитоплазмы, в которой содержится в небольшом количестве красная (азурофильная) зернистость.
Промиелоцит — крупная клетка, достигающая 25 мкм в диаметре. Ядро овальной формы занимает большую часть клетки, окрашено в светло-фиолетовый цвет, имеет тонкую сетчатую структуру; в нем можно видеть ядрышки. Цитоплазма широкая, голубого цвета, содержит обильную красную, фиолетовую или коричневую зернистость. По особенностям зернистости можно определить видовую направленность промиелоцита: нейтрофильную, эозинофильную или базофильную.
Миелоциты — более зрелые клетки гранулоцитарного ряда диаметром 12—16 мкм. Ядро овальной формы, эксцентрично расположенное, светло-фиолетового цвета. Структура его более грубая, чем у промиелоцита, ядрышек нет. Цитоплазма окружает ядро широким поясом, окрашена в светло-фиолетовый цвет, содержит зернистость. В зависимости от характера зернистости различают миелоциты нейтрофильные, эозинофильные и базофильные. Нейтрофильная зернистость мелкая, синефиолетового цвета, эозинофильная — крупная, желтокрасного цвета, базофильная — темно-синего цвета.
Метамиелоциты — клетки диаметром 12—13 мкм с бобовидным эксцентрично расположенным ядром бледнофиолетового цвета, компактной структуры. Ядро окружено широкой цитоплазмой розоватого цвета, которая содержит нейтрофильную, эозинофильную или базофильную зернистость.
Палочкоядерные гранулоциты имеют диаметр 10—12 мкм. Ядро изогнуто в виде палочки или подковы, фиолетового цвета, грубой структуры. Цитоплазма розовая, занимает большую часть клетки, содержит фиолетовую зернистость. У эозинофильного палочкоядерного гранулоцита цитоплазма не видна из-за обильной, часто расположенной, крупной желто-красной зернистости. Палочкоядерная стадия базофильного гранулоцита обычно не встречается.
Сегментоядерные гранулоциты такого же размера, как и палочкоядерные. Ядро разделено на отдельные сегменты, соединенные тонкими перемычками. Количество сегментов колеблется от 2 до 5. Ядро фиолетовое, расположено обычно в центре клетки. Сегментоядерный нейтрофил имеет розовую (оксифильную) цитоплазму, содержащую мелкую фиолетовую зернистость. Ядро эозинофила состоит обычно из двух сегментов, занимает меньшую часть клетки, большее пространство которой заполняет крупная, частая желто-красная зернистость. Ядро базофила состоит как правило из трех сегментов. Светло-фиолетовая цитоплазма содержит крупную синюю или темно-фиолетовую зернистость, которая налагается на ядро, поэтому контуры его видны нечетко.
Морфология клеток лимфатического ряда. К клеткам лимфатического ряда относятся: лимфобласт и плазмоб-Ласт (класс IV), пролимфоцит и проплазмоцит (класс V), лимфоцит и плазмоцит (класс VI).
Лимфобласт—родоначальная клетка лимфатического ряда диаметром 15 — 20 мкм. Ядро округлое с нежносетчатой структурой хроматина, бледно-фиолетовое, расположенное в центре. В нем отчетливо видны 1—2 ядрышка. Цитоплазма светло-синяя, окружает ядро узким пояском, зернистости не содержит. Участок цитоплазмы около ядра имеет более светлую окраску (перинуклеарная зона).
Пр о лимфоцит — небольшая клетка диаметром 11 — 12 мкм. Ядро круглое, бледно-фиолетового цвета, с нежной хроматиновой сетью. Иногда содержит остатки ядрышек. Цитоплазма голубая, окружает ядро то в виде узкого, то более широкого ободка, иногда содержит азурофильную (красно-фиолетовую) зернистость.
Лимфоцит—зрелая клетка диаметром от 7—9 до 12—13 мкм в зависимости от величины цитоплазмы. Ядро округлое (иногда имеет вдавление) темно-фиолетового цвета, компактное. Ядрышек не содержит. Встречаются малые лимфоциты с узким ободком голубой цитоплазмы, которая в некоторых случаях почти незаметна; средние и, большие лимфоциты, цитоплазма которых занимает большую часть клетки, менее интенсивно окрашена и содер
I
жит азурофильную зернистость. Вокруг ядра всегда выражена перинуклеарная зона.
Плазмобласт—крупная клетка диаметром 16— 20 мкм с округлым центрально или эксцентрично расположенным большим, нежной структуры ядром, имеющим несколько ядрышек. Цитоплазма ярко-синего цвета широким поясом окружает ядро, вокруг которого отчетливо видна перинуклеарная зона.
Проплазмоцит — клетка диаметром 20—25 мкм. Ядро расположено эксцентрично, имеет более компактную структуру, фиолетовый цвет, содержит одно небольшое ядрышко. Цитоплазма базофильная широкая, часто содержит вакуоли.
Плазмоцит имеет различные размеры — от 10 до 20 мкм. Ядро круглое, компактное, расположено эксцен-, трично. В нем чередуются темно- и светло-фиолетовые участки, расположенные радиально (от центра к периферии), что напоминает спицы в колесе — колесовидная структура ядра. Ядрышек не имеет. Цитоплазма интенсивно синего цвета, широкая, вакуолизированная. Отчетливо видно околоядерное просветление (перинуклеарная зона).
Морфология клеток моноцитарного ряда. К клеткам моноцитарного ряда относятся: монобласт (класс IV),. промоноцит (класс V) и моноцит (класс VI).
Монобласт — родоначальная клетка моноцитарного ряда, диаметром от 12 до 20 мкм. Ядро округлое, иногда дольчатое, нежной структуры светло-фиолетового цвета. Содержит от 2 до 5 ядрышек. Цитоплазма нежно-голубая, занимает меньшую часть клетки.
Промоноцит имеет диаметр от 12 до 20 мкм. Ядро крупное, рыхлое, бледно-фиолетовое, с остатками нукле-ол. Цитоплазма широкая серо-фиолетового цвета.
Моноцит — зрелая клетка, диаметром от 12 до 20 мкм. Ядро рыхлое, светло-фиолетового цвета, может приобретать разнообразные формы: бобовидную, дольчатую, подковообразную. Цитоплазма серо-фиолетовая, светлая, широкая. Иногда содержит очень мелкую обильную азурофильную зернистость.
Морфология клеток эритроцитарного ростка. К клеткам эритроцитарного ряда относятся: эритробласт (класс IV), пронормоцит, нормоциты и ретикулоцит (класс V) и эритроцит (класс VI).
Эритробласт — родоначальная клетка эритроцитарного ростка диаметром 20 — 25 мкм. Ядро нежной структуры, округлое, занимает большую часть клетки, красно-Фиолетового цвета, содержит от 1 до 5 ядрышек. Цитоплазма насыщенно синего цвета, зернистости не содержит, «округ ядра заметна зона просветления.
Про нормоцит — клетка диаметром 12—18 мкм. Яд
ро грубее, чем у эритробласта, но еще сохраняет нежную сетчатую структуру. Нуклеолы отсутствуют. Цитоплазма базофильная, зернистости не содержит.
Нормоцит — клетка несколько меньшего размера (8—12 мкм). Различают базофильный, полихроматофильный и оксифильный нормоциты в зависимости от степени насыщения их цитоплазмы гемоглобином. Наиболее крупные — базофильные нормоциты, наименее — оксифильные. Ядра имеют грубую структуру, окрашиваются в темно-фиолетовый цвет. Цитоплазма базофильного нормоцита— синяя, полихроматофильного — серовато-фиолетовая, оксифильного — розовая.
Нормоцит вызревает в эритроцит через стадию ретикулоцита, молодого предшественника эритроцита, сохранившего остатки базофильной субстанции (РНК) цитоплазмы, которая выявляется при помощи специальной окраски.
Ретикулоцит — клетка диаметром 9—И мкм. В зависимости от способа окраски, может быть голубого или зеленого цвета. Содержит нитчато-сетчатую субстанцию, окрашивающуюся в синий цвет.
Эритроцит — зрелая клетка периферической крови диаметром 7—8 мкм, розово-красного цвета. Имеет форму двояковогнутого диска, что обусловливает неравномерность окраски клетки — более интенсивная по периферии и более светлая в центре.
Установлено, что процесс созревания эритроцитов происходит под влиянием эритропоэтина—гормона белковой природы, относящегося к гликопротеинам. Он вырабатывается преимущественно почками и способствует превращению клеток — предшественников эритроцитов (класс III) в эритробласты и дальнейшей дифференцировке их в эритроциты.
Морфология клеток мегакариоцитарного ростка. К клеткам мегакариоцитарного ростка относятся: мегакариоб-ласт (класс IV), промегакариоцит и мегакариоцит (класс V) и тромбоцит (класс VI).
Мегакариобласт — родоначальная клетка мегакариоцитарного ряда диаметром 20—25 мкм. Ядро округлой формы, нежной структуры, красно-фиолетового цвета, имеет ядрышки. Цитоплазма интенсивно базофильная, сравнительно небольшая, зернистости не содержит. Вокруг ядра зона просветления.
Промегакариоцит — клетка значительно более крупная, чем мегакариобласт. Ядро грубое, ядрышек не содержит. Цитоплазма базофильна, занимает большую часть клетки. Зернистость отсутствует.
Мегакариоцит — гигантская клетка костного мозга диаметром от 60 до 120 мкм. Ядро грубое, принимает различные, иногда причудливые формы. Цитоплазма от-
дичается очень большими размерами, содержит зернистость розово-фиолетового цвета. От цитоплазмы мегакариоцита отшнуровываются тромбоциты.
Тромбоциты (кровяные пластинки)—зрелые элементы крови. Имеют круглую или овальную форму, размеры 1,5—3 мкм. Периферическая часть — гиаломер — светло-базофильная, центральная — грануломер —
розовато-фиолетового цвета, состоит из мелких гранул.
ФИЗИОЛОГИЧЕСКАЯ РОЛЬ ФОРМЕННЫХ ЭЛЕМЕНТОВ КРОВИ. ГЕМАТОЛОГИЧЕСКАЯ НОРМА
§ 49. Состав и функции
В состав периферической крови входят зрелые клетки класса VI: эритроциты, лимфоциты, моноциты, сегментоядерные нейтрофилы, базофилы, эозинофилы и тромбоциты.
Из клеток класса V в периферической крови циркулируют ретикулоциты и палочкоядерные нейтрофилы.
Каждая из названных клеток выполняет определенные функции, совокупность которых обеспечивает нормальную жизнедеятельность организма.
Эритроциты составляют основную массу форменных элементов крови. В них содержится пигмент гемоглобин, состоящий из железосодержащей части — гема и белка— глобина. В крови человека имеется несколько типов гемоглобина: в эмбриональном периоде обнаруживаются HbF — фетальный (от лат. fetus — плод), НЬА] и НЬА 2 (от лат. adultus — взрослый). Все 3 вида гемоглобина находятся в крови детей и после рождения. К концу первого года жизни в крови остается в основном НЬА i — гемоглобин взрослого.
Важнейшая функция эритроцитов — перенос кислорода от органов дыхания к клеткам организма, т. е. участие в тканевом дыхании. На основе тканевого дыхания, или биологического окисления, осуществляются энергетические процессы в организме. Переносчиком кислорода служит гемоглобин, находящийся в эритроцитах. Гемоглобин, насыщаясь кислородом в легочных капиллярах, переносит его в ткани. В тканевых капиллярах он соединяется с углекислотой и доставляет ее в легкие. Таким образом осуществляется газообмен. Этим функции эритроцитов не исчерпываются. Гемоглобин эритроцитов игра-ет роль «буфера» в регуляции кислотно-основного состояния крови. Он обеспечивает сохранение pH крови в пределах физиологической нормы и препятствует возникновению ацидоза (pH ниже нормы).
Эритроциты участвуют в доставке питательных ве
ществ (аминокислот, липидов) к клеткам и тканям, выполняя питательную функцию. Защитная функция эритроцитов осуществляется за счет их способности связывать токсины и переносить на своей поверхности антитела. Эритроциты принимают участие и в процессе свертывания крови.
В эритроцитах содержатся разнообразные ферменты, катализирующие жизненно важные биохимические процессы, происходящие в организме: синтез гемоглобина, поддержание его в восстановленном состоянии, выработку АТФ и др.
Продолжительность жизни эритроцитов от 90 до 120 дней. Старые эритроциты разрушаются (гемолизируются) в клетках ретикуло-эндотелиальной системы, в основном в селезенке.
Количество эритроцитов здорового человека составляет для женщин 3,7-1012—4,7-IO"2 в 1 л крови, для мужчин 4-1012—5,1-1012 в 1 л крови.
Количество гемоглобина в норме у женщин 120— 140 г/л (12—14 г%), у мужчин 130—160 г/л (13—16 г%).
Лейкоциты составляют количественно значительно меньшую, чем эритроциты, но не менее важную в функциональном отношении, группу.
Основная функция лейкоцитов—защита организма от действия различных вредоносных агентов. Так как группа лейкоцитов неоднородна, то эта функция осуществляется ими по-разному.
Нейтрофилы участвуют в фагоцитозе и способны переваривать с помощью ферментов захваченные бактерии, вирусы, грибы и другие частицы. Эти клетки могут самостоятельно передвигаться, выходить из кровяного русла в окружающие ткани, перемещаться между клетками, проникать через клеточные мембраны, направляясь к очагу воспаления. Они участвуют во всех этапах воспалительного процесса.
Эозинофилы, так же как и нейтрофилы, обладают способностью к фагоцитозу. Участвуют в аллергических процессах, в обмене гистамина. Выполняют транспортную функцию — адсорбируют на своей поверхности продукты распада белков, являющихся антигенами, переносят их к лимфатическим узлам, способствуя выработке антител. Образуют антитоксины, обезвреживающие продукты жизнедеятельности бактерий.
Базофилы содержат в своих гранулах гистамин, что обусловливает их участие, наряду с эозинофилами, в аллергических и воспалительных реакциях. Кроме того, в гранулах базофилов содержится гепарин, который обладает противосвертывающим действием.
Лимфоциты выполняют в основном иммунологиче
ские функции. Им принадлежит важная роль в процессах клеточного иммунитета (Т-лимфоциты) и в выработке антител, которые нейтрализуют действие попавших в организм человека чужеродных веществ (В-лимфоциты).
Моноциты обладают значительной подвижностью. Активно участвуют в процессах фагоцитоза, захватывая частицы более крупные, чем нейтрофилы, иногда целые клетки, малярийные плазмодии, микобактерии туберкулеза и т. д. Кроме того, им принадлежит значительная роль в реакциях клеточного иммунитета.
Различные виды лейкоцитов имеют неодинаковую продолжительность жизни—от нескольких дней (гранулоциты) до нескольких лет (лимфоциты).
Общее количество лейкоцитов у здорового человека колеблется от 4-Ю9 до 9-109 в 1 л крови.
Тромбоциты (кровяные пластинки) являются осколками цитоплазмы мегакариоцитов. В сосудистом русле располагаются вдоль стенок сосудов, в малоподвижном слое плазмы, богатом фибриногеном. Эритроциты движутся в центре сосуда. Такое краевое стояние тромбоцитов предотвращает выход эритроцитов за пределы сосудистой стенки.
Выполняют важные биологические функции в организме, участвуя в процессе гемостаза (остановка кровотечения). Обладают способностью к агрегации и адгезии, т. е. могут склеиваться между собой, группироваться и прилипать к поврежденной поверхности сосуда, при этом образуется первичная тромбоцитарная пробка, останавливающая кровотечение.
В тромбоцитах содержится большое количество фер-ментов, с действием которых связана их биологическая активность. Способны поддерживать спазм поврежденных сосудов, принимают участие в процессе свертывания крови.
Продолжительность жизни тромбоцитов 7—10 дней. Количество тромбоцитов у здорового человека колеблется от 180-109 до 320-109 в 1 л крови.
§ 50. Понятие о лейкоцитарной формуле
Процентное соотношение различных видов лейкоцитов носит название лейкоцитарной формулы.
Нормальные показатели лейкоцитарной формулы Взрослого человека следующие: нейтрофилы палочкоядерные составляют от 1 до 6%, сегментоядерные — от 45 да 70%, эозинофилы — 0 — 5%, базофилы—0—1%, лимфоциты—18 — 40%, моноциты — 2 — 9%.
Лейкоцитарная формула позволяет судить лишь об °тносительных числах отдельных видов лейкоцитов
(процентное содержание). Содержание отдельных видов лейкоцитов в 1 л крови называется их абсолютным количеством.
Зная общее количество лейкоцитов в 1 л крови и процентное содержание каждого вида лейкоцитов, можно вычислить абсолютное их число, т. е. определить сколько клеток каждого вида содержится в 1 л крови.
Например, число лейкоцитов в 1 л крови — 6-10В 9 *, содержание сегментоядерных нейтрофилов 55%. Абсолютное количество нейтрофилов в 1 л крови составит:
t ГО9—100% х=Л±!£!=з,з.109.
х — 55% 100
В норме абсолютное содержание нейтрофилов составляет 2,01-109—5,8-109, эозинофилов — 0—0,3-109,
базофилов—-0—0,06-109, лимфоцитов— 1,2-109—3-109, моноцитов — 0,09-109—0,6-109 в 1 л крови.
Нормальные показатели периферической крови взрослого человека представлены в табл. 6.
Таблица 6. Показатели крови в норме
Показатели крови Пол Пределы нормальных -колебаний
Эритроциты, в 1 л м 4 10 е2—5,110 е2
Гемоглобин, г/л ж м 3,7 -10 е2—4,7 1012 130—160
Цветовой показатель Ретикулоциты, % мм/ч ж м 120—140 0,86—1,1 2—10 1 — 10
Тромбоциты, в 1 л Лейкоциты » Нейтрофилы палочкоядериые, % » » в 1 л Нейтрофилы сегмеитоядерные, % » » в 1 л Эозинофилы, % » в 1 л Базофилы, % » в 1 л Лимфоциты, % » в 1 л Моноциты, % » в 1 л ж 2—15 180 10’—320-10’ 4-10’—9-10’ 1—6 0,01 10’—0,3-10’ 45—70 2-10’—5,5-10’ 0—5 0—0,3-10’ 0—1 0—0,06-10’ 18—40 1,2-10’—3,0-10’ 2—9 0,09 -10’—0,6-10’
§ 51. Изменения состава в различные возрастные периоды
В различные возрастные периоды состав человеческой
крови неодинаков.
Ребенок рождается с высоким, по сравнению со
Возраст
Рис. 35. Изменение соотношения нейтрофилов и лимфоцитов в зависимости от возраста.
взрослым человеком, количеством гемоглобина и эритроцитов. В первые сутки жизни уровень гемоглобина достигает 165—225 г/л, а эритроцитов—6-1012—6,5-1012 в 1 л крови.
Затем, в течение первых 2 — 3 мес жизни, происходит довольно резкое падение показателей красной крови: количество гемоглобина уменьшается до ПО—130 г/л, а эритроцитов до 3,5-1012 в 1 л крови.
К концу первого года жизни цифры гемоглобина и эритроцитов начинают постепенно нарастать и к 14—15 годам достигают нормативов взрослого человека.
Более или менее стабильными эти цифры продолжают оставаться от 16—18 до 60 лет. После 60 лет показатели красной крови несколько увеличиваются.
При рождении ребенка количество лейкоцитов значительно повышено, в среднем до 20-109 в 1л крови. В течение первых двух недель жизни оно довольно интенсивно уменьшается до 9-Ю9—12-109 в 1 л крови, а затем показатели белой крови снижаются медленнее, достигая Уровня взрослого человека к периоду полового созревания.
Лейкоцитарная формула детей также существенно отличается от таковой у взрослого человека. При рождении ребенка соотношение между нейтрофилами и лимфоцитами у него такое же, как у взрослых, т. е. приблизительно 65% нейтрофилов и 25% лимфоцитов. Постепенно число нейтрофилов уменьшается, а лимфоцитов возрастает и к четвертому дню жизни количество их становится прибли
зительно одинаковым. Это так называемый первый перекрест кривой нейтрофилов и лимфоцитов.
Вслед за этим количество лимфоцитов продолжает возрастать, достигая к концу первого года жизни максимальных цифр, приблизительно 65%, а количество нейтрофилов падает к тому же периоду до 25%. Начиная со второго года жизни, количество лимфоцитов уменьшается, а нейтрофилов растет, так что к четвертому году их количества становятся равными. Это второй перекрест кривой нейтрофилов и лимфоцитов.
В дальнейшем количество нейтрофилов постепенно нарастает, а лимфоцитов уменьшается, достигая к периоду полового созревания цифр нормальных для взрослого человека (рис. 35).
Таким образом, у ребенка в возрасте приблизительно от 4 дней до 4 лет в лейкоцитарной формуле преобладают лимфоциты.
Вопросы для повторения
1. Какова физиологическая роль крови в организме?
2. Каков состав крови в норме?
3. По какому принципу классифицированы клетки крови (построение схемы кроветворения)?
4. Каковы свойства и общие морфологические особенности клеток первых трех классов?
5 Какие клетки относятся к классу IV и каковы их морфологические особенности?
6. Каковы особенности расположения в схеме кроветворения клеток класса V>
7 Каковы морфологические особенности клеток класса V?
8. Каково строение клеток класса VI?
9. Каковы функции, выполняемые гемоглобином и эритроцитами?
10. Какие функции выполняют лейкоциты?
11. Какие функции выполняют тромбоциты?
12. Что такое лейкоцитарная формула?
13. Каковы нормальные показатели гемоглобина и форменных элементов крови?
14. Каковы изменения состава К0ови в различные возрастные периоды?
МЕТОДЫ ИССЛЕДОВАНИЯ
§ 52. Понятие о клиническом анализе
• В понятие клинический, или общий, анализ крови входят следующие исследования:
1) определение количества гемоглобина;
2) подсчет количества эритроцитов в 1 л крови;
3) вычисление цветового показателя;
4) подсчет количества лейкоцитов в 1 л крови;
5) подсчет лейкоцитарной формулы;
6) определение скорости оседания эритроцитов (СОЭ)-
Другие морфологические или физико-химические исследования производятся по специальному требованию врача. Сюда относится подсчет количества тромбоцитов и ретикулоцитов, определение времени кровотечения, вязкости, свертываемости крови и др.
Взятие крови для клинического анализа в стационаре производится обычно утром натощак. В поликлинических условиях, где кровь берется дважды в течение дня, придерживаться этого правила необязательно, так как некоторое увеличение количества лейкоцитов, связанное с приемом пищи, всегда будет иметь место в привычное время завтрака или обеда.
При взятии крови для клинического анализа следует придерживаться определенного порядка. Это связано с тем, что для различных исследований требуется неодинаковое количество крови и разное время для их выполнения. Некоторые исследования (определение количества гемоглобина по Сали, СОЭ) делаются одновременно со взятием крови, другие (подсчет форменных элементов и лейкоцитарной формулы) производят позже.
Порядок взятия крови: 1) делают мазки; 2) набирают кровь для определения СОЭ; 3) берут кровь для определения гемоглобина, эритроцитов и лейкоцитов.
Делать мазки в конце взятия крови не рекомендуется, потому что к этому моменту кровь идет хуже, выдавливание ее из пальца деформирует клетки и нарушает их соотношение в связи с поступлением тканевой жидкости.
Взятие крови удобно производить за столом, покрытым стеклом или пластиком. На нем должны быть реактивы и приборы, необходимые только для взятия крови и тех исследований, которые производятся одновременно с ним.
Обработка игл и капилляров после взятия крови. Использованные иглы и капилляры промывают проточной водой и погружают на 15 мин в горячий моющий раствор. Для приготовления 1 л моющего раствора берут 978 мл водопроводной воды, подогретой до 50° С, вносят в нее 17 мл пергидроля с 33% содержанием перекиси водорода и 5 г моющего препарата. В качестве моющего средства можно употреблять порошки «Новость», «Лотос», «Астра».
Инструменты погружают в раствор полностью, полости капилляров должны быть им заполнены.
Обработанные предметы прополаскивают проточной, а затем дистиллированной водой.
Качество мытья определяют путем постановки бензидиновой пробы на наличие крови (см. § 22).
Копья-скарификаторы складывают в центрифужные пробирки по 10—15 штук острием вниз, закрывая их
ватно-марлевыми тампонами, пипетки заворачивают в бумагу по 10 штук. Стерилизуют в сухожаровом шкафу при температуре 180° С в течение часа. Стерильность сохраняется 1 нед. Сведения о стерилизации вносят в специальную тетрадь с указанием даты и условий стерилизации.
§ 53. Техника прокола кожи для взятия крови
Обычно кровь берут из IV пальца левой руки. Прокол делают влево от срединной линии, немного отступя от ногтя. При ожогах и обморожениях кистей рук, у лиц с утолщенной и загрубевшей кожей на пальцах, кровь можно взять из мочки уха. У грудных детей ее берут из большого пальца стопы или из пятки.
Место прокола предварительно протирают ватным тампоном, смоченным спиртом или смесью Никифорова, для дезинфекции и обезжиривания. После обработки кожа должна высохнуть, иначе выступившая после прокола кровь растекается по пальцу.
Для прокола кожи пользуются стерильным копьем-скарификатором или иглой-ланцетом для одноразового пользования. Это тонкие металлические пластинки с треугольным выступом на конце. Иглы очень острые с плоской режущей поверхностью. При проколе кожи такой иглой ранка получается не круглой, а вытянутой, как небольшой порез. Иглу следует поставить перпендикулярно месту предполагаемого прокола, так, чтобы разрез пришелся поперек кожных линий пальца. В этом случае ранка будет зиять, кровь из нее пойдет легко и обильно. Разрез, расположенный вдоль кожных линий, быстро спадается. Не следует делать прокол около самого ногтя, так как в этом случае кровь затекает под него и набирать ее для исследования будет трудно.
Во время взятия крови больной сидит слева от лаборанта. Лаборант держит палец больного, из которого берет кровь левой рукой. Первый палец лаборанта располагается с тыльной поверхности кисти больного, а остальные— с ладонной. В момент прокола лаборант слегка сдавливает ногтевую фалангу пальца больного. Первую каплю крови стирают ватным тампоном. Для каждого исследования кровь набирают из новой капли. После взятия крови место прокола обрабатывают йодом.
§ 54. Определение гемоглобина по Сали
Количество гемоглобина определяется колориметрическим методом, т. е. путем сравнения цвета исследуемого раствора с цветом стандартов, концентрация которых известна.
130
Рис. 36. Гемометр Сали (ГС-3), а—гемометр с принадлежностями; б—шкала градуированной пробирки.
Устройство гемометра Сали. Гемометр Сали представляет собой простейший колориметр (рис. 36). Наиболее распространена модель ГС-3. Прибор имеет пластмассовый корпус, задняя стенка которого сделана из матового стекла, рассеивающего свет. В корпус вмонтированы три небольшие стеклянные пробирки, которые видны сквозь прорези. Две боковые, запаянные с обеих концов, содержат стандартный раствор хлорида гематина в глицерине. Цвет жидкости в стандартных пробирках соответствует цвету 2% раствора хлорида гематина.
Между двумя стандартами вставлена градуированная пробирка. На всех трех пробирках нанесены по две круговые метки: нижняя соответствует вместимости 0,2 мл, верхняя — 2 мл. Пробирки установлены на горизонтальной пластине, и при равенстве их диаметров все контрольные круговые метки должны находиться на одном уровне.
Средняя пробирка гемометра имеет шкалу, которая
градуирована в грамм-процентах (г%), т. е. выражае-fn количество гемоглобина в граммах, содержащееся в 100 мл крови. Нижняя отметка шкалы 2г%, верхняя — 23 г%. Цена одного деления шкалы 0,2 г%.
К гемометру придается капилляр, имеющий одну отметку — 0,02 мл (капилляр Сали), резиновая трубочка со стеклянным наконечником, тонкая стеклянная палочка и глазная пипетка.
Реактивы: 1) 0,1 н. раствор хлористоводородной кислоты; 2) дистиллированная вода.
Техника определения. В градуированную пробирку гемометра наливают 0,1 н. раствор хлористоводородной кислоты до нижней круговой метки 0,2 мл.
Кожу пальца дезинфицируют, дают ей высохнуть и делают прокол. Первую выступившую каплю крови стирают. Слегка надавливая на палец, выжимают новую куполообразную каплю.
На сухую капиллярную пипетку Сали надевают резиновый баллон. Кончик капилляра погружают в каплю крови и набирают ее строго до метки 0,02 мл. Соотношение количества крови и хлористоводородной кислоты должно соблюдаться точно—1:10. ?
У каждого больного кровь берут отдельным стериль-Г ным капилляром. j;
Капиллярную пипетку погружают в среднюю пробирку гемометра и выдувают из нее кровь на дно пробирки. Недопустимо образование при этом пузырей. Капилляр следует 2—3 раза промыть хлористоводородной кислотой из верхнего прозрачного слоя жидкости. Кровь в пробирке тщательно перемешивают с хлористоводородной кислотой и оставляют на 5 мин. За это время эритроциты гемолизируются и гемоглобин превращается в хлорид гематина бурого цвета. По истечении указанного времени в градуированную пробирку по каплям вносят дистиллированную воду. Содержимое пробирки размешивают тонкой стеклянной палочкой. Разведение продолжают до полного совпадения цвета жидкости в градуированной пробирке с цветом стандарта. Сравнение цветов необходимо производить всегда при одном и том же источнике света, так как интенсивность освещения влияет на результат определения.
Показания гемометра снимают по нижнему мениску жидкости в градуированной пробирке. Полученная цифра указывает концентрацию гемоглобина в грамм-процентах. Для того чтобы выразить концентрацию гемоглобина в единицах Международной системы (СИ), т. е. в граммах на литр крови (г/л), нужно количество гемоглобина в г% умножить на 10.
§ 55. Определение гемоглобина на фотоэлектроколориметре
Колориметрический визуальный метод определения (сравнение цвета исследуемой жидкости со стандартом глазами наблюдателя) всегда субъективен и поэтому неточен.
Окраска раствора отражает степень поглощения им света. Для получения точных объективных данных о светопоглощении применяются приборы, снабженные фотоэлементами,— фотоэлектроколориметры, спектрофотометры и др.
Способы определения гемоглобина на ФЭКе основаны на образовании стойких, окрашенных соединений при взаимодействии его с различными веществами: аммиаком, ацетонциангидрином и др.
Гемиглобинцианидный метод. Гемоглобин, взаимодействуя с ацетонциангидрином, в присутствии железосинеродистого калия K3[Fe(CN)6] образует гемиглобинцианид красного цвета, интенсивность окраски которого пропорциональна содержанию гемоглобина в пробе крови.
Реактивы: 1) трансформирующий раствор (0,5 мл ацетонциангидрина, 0,2 г железосинеродистого калия, 1 г гидрокарбоната натрия NaHCl3 растворяют в 1 л дистиллированной воды; реактив стоек, хранится в посуде из темного стекла); 2) стандартный раствор гемиглобинцианида. (раствор, выпускаемый фирмой «Ренал», содержит 59,75 мг% гемиглобинцианида; раствор фирмы «Иммуна» — 64,23 мг%. Это соответствует концентрации гемоглобина в крови 150 и 154 г/л при разведении ее в 251 раз).
Ход определения. К 5 мл трансформирующего раствора добавляют 0,02 мл (капилляр Сали) крови. При этом кровь разводится в 251 раз. Оставляют пробирки на 10 мин при комнатной температуре.
Фотометрируют при зеленом светофильтре (длина волны 500—560 нм) в кювете с толщиной слоя 10 мм против дистиллированной воды.
Стандартный раствор фотометрируют при тех же условиях, что и опытную пробу.
Расчет. Содержание гемоглобина определяют по калибровочному графику, который строится по стандартному раствору гемиглобинцианида (табл. 7).
Приготовленные разведения фотометрируют против дистиллированной воды («холостая» проба). Концентрацию гемоглобина крови можно рассчитать по формуле:
где Еоп— экстинкция опытной пробы; ЕсТ—экстинкция стандартного раствора; С—концентрация гемиглобинцианида в стандартном растворе, мг%; К—коэффициент разведения крови; 0,01—коэффициент для пересчета в граммы на литр.
При С=61,23 мг% гемиглобинцианида: г
НЪ=т?~-61,23-251-0,0144-154 г/л. t
xiCT ‘'ст
При С=59.75 мг% гемиглобинцианида: 1
^оп ^оп
НЬ=р--59,75-251-0,01 = ^--150 г/л.
*^ст *'ст
Таблица 7. Приготовление растворов гемиглобинцианида для построения калибровочного графика
Стандартный раствор, мл Трансформирующий раствор, мл Концентрация гемоглобина крови, г/л
6 «Холостая» проба
2 4 50
4 2 100
6 — 150
§ 56. Подсчет эритроцитов и лейкоцитов в счетной камере
Для подсчета количества форменных элементов в 1 л крови необходимо ее развести. Для разведения берут точно отмеренное количество крови и точно определенное количество разводящей жидкости.
Для разведения эритроцитов применяется 3% раствор хлорида натрия. В тех случаях, когда нельзя произвести подсчет вскоре после взятия крови, для лучшего сохранения эритроцитов пользуются жидкостью Гайема.
Жидкость, разводящая лейкоциты, должна одновременно растворять эритроциты, иначе подсчет лейкоцитов будет невозможен. Этому требованию удовлетворяет 3% раствор уксусной кислоты, который растворяет эритроциты, не повреждая лейкоцитов.
Реактивы: 1) 3% раствор хлорида натрия; 2) 3% раствор уксусной кислоты; 3) жидкость Гайема (0,5 г сулемы, 1 г хлорида натрия, 5 г сульфата натрия, дистиллированная вода до объема 200 мл).
Техника взятия и подготовки крови. В химические пробирки разливают по 4 мл 3% раствора хлорида натрия пипеткой вместимостью 5 мл или из бюретки вместимостью 25 мл. В видалевские пробирки пипеткой
Рис. 37. Камера Горяева.
вместимостью 1 мл или из микробюретки вместимостью 2 мл с большой точностью разливают по 0,4 мл 3% раствора уксусной кислоты. Следует постоянно пользоваться одной и той же пипеткой или бюреткой.
На пробирках карандашом по стеклу пишут номер, соответствующий регистрационному номеру в журнале.
Прокол кожи пальца делают только после того, как будут разлиты разводящие жидкости. Кровь насасывают в капиллярную пипетку от гемометра Сали до метки 0,02 мл. Капилляр опускают в пробирку с разводящей жидкостью, куда выдувают кровь. Манипулировать нужно быстро, чтобы кровь не свернулась в капилляре. Капилляр несколько раз промывают верхним слоем этой же жидкости. Кровь тщательно перемешивают с разводящей жидкостью, вращая пробирку между ладонями или постукивая пальцем по ее стенке.
Сначала берут кровь для подсчета эритроцитов, затем этим же капилляром для подсчета лейкоцитов. Необходимо придерживаться этого порядка, так как хлорид натрия не оказывает влияния на лейкоциты и количество их не изменяется от присутствия его следов в капилляре. Уксусная же кислота разрушает эритроциты, и после взятия крови для подсчета лейкоцитов воспользоваться тем же капилляром, не промыв его, нельзя; так как часть эритроцитов будет разрушена и результат исследования неточен.
При внесении 0,02 мл крови в 4 мл раствора хлорида натрия получается разведение в 2Q0 раз, что необходимо Для подсчета эритроцитов.
При внесении 0,02 мл крови в 0,4 мл уксусной кислоты получается разведение в 20 раз, что требуется для подсчета лейкоцитов.
Для подсчета форменных элементов разведенную кровь помещают в счетную камеру, в которой клетки располагаются в один слой. Зная объем камеры и разведение крови, высчитывают количество форменных элементов в 1 л крови.
Устройство камеры и сетки Горяева. Камера Горяева (рис. 37) представляет собой толстое предметное стекло, прорезанное четырьмя поперечными бороздами. Борозды делят стекло на пластинки — две боковые и среднюю. Средняя пластинка на 0,1 мм ниже боковых. Она разделена поперечной бороздкой на 2 равные части. На каждой половине средней пластинки нанесена сетка Горяева.
Принадлежностью камеры служит шлифованное покровное стекло. Его следует наложить так, чтобы оно покрыло обе боковые и среднюю пластинки. Нажимая большими пальцами на края стекла, его притирают к боковым пластинкам до появления радужных колец (кольца Ньютона).
Так как боковые пластинки выше средней, между нею и покровным стеклом остается щель. Это и есть камера, в
которую заливают разведенную кровь. Глубина камеры 0,1 мм.
Нанесенная на дно камеры сетка Горяева квадратна. Сторона ее — 3 мм, площадь — 9 мм2. Сетка разграфлена на 225 больших квадратов—15 по горизонтали и 15 по вертикали. Часть больших квадратов (через два на третий) разделена на 16 малых квадратов. Сторона малого квадрата равна 1/20 мм (рис. 38).
Техника подсчета. Правильное заполнение счетной камеры разведенной кровью обеспечивает точность подсчета форменных элементов. Перед заполнением камеры содержимое пробирки перемешивают, вращая ее между ладонями в течение 2 мин. Разведенную кровь наносят на среднюю пластинку камеры пастеровской пипеткой с баллоном или стеклянной палочкой, помещая ее около края покровного стекла. По закону капиллярности жидкость затекает под стекло, заполняя камеру.
После заполнения камеру нужно положить на стол на 2—3 мин, пока движение жидкости в ней не прекратится и клетки не расположатся неподвижно на фоне квадратов сетки. При заполнении камеры жидкость не должна стекать в борозды. Недопустимо попадание в камеру пузырьков воздуха.
Подсчет производят под малым увеличением микроскопа (об.8, ок. 10 или 15), конденсор должен быть опущен, а диафрагма закрыта.
Подсчет эритроцитов производят в 5 больших квадратах сетки Горяева, разграфленных на 16 малых и расположенных по диагонали. Последнее условие связано с тем, что форменные элементы распределяются по сетке не абсолютно равномерно и подсчет их нужно производить на различных ее участках.
Подсчет лейкоцитов производят в 100 больших нераз-графленных квадратах, расположенных по всей сетке группами по четыре.
Для того чтобы дважды не сосчитать одни и те же клетки, лежащие на пограничных линиях, следует соблюдать следующие правила: к данному квадрату принадлежат клетки, находящиеся большей своей половиной внутри него; клетки, разделенные пограничной линией пополам, считают только на верхней и левой границе квадрата; клетки же, лежащие большей своей половиной вне данного квадрата не считают вовсе.
После подсчета эритроцитов в камере определяют их количество в 1 мкл крови. Для этого полученное при подсчете число эритроцитов умножают на 10 000. Этот коэффициент получен при следующем расчете: в 1 большом квадрате сетки содержится 16 малых, а в 5 больших квадратах — 80 малых (16-5). Сторона малого квадрата
равна ’/го мм, а его площадь ’/го-‘/20= 'Лоо мм2. Высота 1 камеры ’/ю мм, следовательно объем крови над малым квадратом составляет:
1 1 1 з
400*10 4000 ММ
Если количество эритроцитов, подсчитанное в 5 больших квадратах или 80 малых, обозначить буквой а, то количество эритроцитов в одном малом квадрате будет равно . Как указано, объем крови над малым квадратом оО
равен
мм3, поэтому для того, чтобы узнать количе
ство эритроцитов в 1 мкл, т. е. в объеме, в 4000 раз большем, необходимо количество эритроцитов, содержа-
щееся в одном малом квадрате ( ), умножить на 4000.
\ *0 /
Кровь для подсчета эритроцитов была разведена в 200 раз. Чтобы узнать количество эритроцитов в цельной крови, полученную дробь умножают на разведение:
-------- . Это математическое выражение можно пред-80
ставить в виде сомножителей:
4000-200 1
а 80 •
Дробный сомножитель состоит из постоянных величин. < • При их подсчете получают 10 000 и все выражение J $ приобретает следующий вид: а-10 000. Итак, количество^ эритроцитов в 1 мкл крови равно числу эритроцитов, подсчитанному в пяти больших квадратах сетки Горяева, <; умноженному на 10 000. ; <
Например: в 5 больших квадратах сетки Горяева сосчитано 427 эритроцитов. В 1 мкл крови количество эритроцитов будет равно 427-10 000=4 270 000, или 4,27-106.
Для того чтобы определить содержание эритроцитов в 1 л крови, нужно число эритроцитов, выраженное в миллионах, умножить на 10. В нашем примере количество эритроцитов в 1 л крови равно 4,27-10|2.
Чтобы определить количество лейкоцитов в 1 мкл крови, число их, полученное при подсчете в камере, умножают на 50. Этот множитель получен при следующем расчете: лейкоциты подсчитывают в 100 больших квадратах, содержащих по площади 1600 малых квадратов (16-100). Если количество лейкоцитов, сосчитанных в 100 больших квадратах, обозначить буквой в, то в одном 138
малом квадрате содержится лейкоцитов. Объем крови над малым квадратом равен мм3. Разведение крови для подсчета лейкоцитов равно 20.
т. „ в-4000-20
Количество лейкоцитов в 1 мкл крови =—-т—— или 1ои0
после подсчета постоянных множителей: в-50. Следовательно, количество лейкоцитов в 1 мкл крови равно числу лейкоцитов, подсчитанному в 100 больших квадратах, умноженному на 50.
Например: в 100 больших квадратах сетки Горяева сосчитано 130 лейкоцитов. В 1 мкл крови количество лейкоцитов будет равно 130-50=6500, или 6,5-103.
Для того чтобы определить содержание лейкоцитов в 1 л крови, нужно число лейкоцитов, выраженное в тысячах, умножить на 109.
В нашем примере количество лейкоцитов в 1 л крови равно 6,5-109.
§ 57. Подсчет форменных элементов с помощью автоматических счетчиков
Автоматические устройства, предназначенные для подсчета частиц, взвешенных в жидкостях (эритроцитов, лейкоцитов, тромбоцитов), широко применяются в биологии и медицине.
Существуют различные модели этих аппаратов, построенные по единому принципу. Прибор регистрирует и подсчитывает импульсы, возникающие в момент прохождения каждой частицы через капиллярное отверстие, включенное в электрическую цепь. Частицы должны быть взвешены в растворе электролита, который является хорошим проводником электрического тока. Протекая через капиллярное отверстие, электролит не изменяет напряжения в цепи. Когда же через отверстие проходит частица, обладающая меньшей электропроводностью, сопротивление в электрической цепи резко возрастает. Возникают импульсы напряжения, которые регистрируются и суммируются электронным счетным устройством.
Наибольшее распространение получили такие приборы, как целлоскоп, измеритель концентрации микрочастиц (ИКМ), пикоскале.
Рассмотрим устройство и работу автоматических счетчиков форменных элементов крови на примере прибора пикоскале.
Устройство прибора. На передней панели (рис.39) расположены: измерительная трубка 1 с капиллярным отверстием 2; соединительная головка с резиновым коль-
Рис. 39. Пикоскале (передняя панель прибора). Объяснение в тексте.
цом 3; электроды 4, 5, 6; измерительный стакан 7 с исследуемой суспензией 8; подвижная подставка (держатель) 9; счетное устройство 10; поворотная кнопка 11.
Диаметр капиллярного отверстия измерительной трубки должен соответствовать величине подсчитываемых частиц. К прибору придается набор измерительных трубок с капиллярными отверстиями различного диаметра, которые подбирают к соответствующему исследованию. Например, для подсчета эритроцитов диаметр измерительного капилляра должен быть 62±3 мкм, а для подсчета более крупных лейкоцитов — 72±3 мкм.
Измерительная трубка удерживается в соединительной головке резиновым кольцом. Соединительная головка несет два электрода, слева от нее расположен еще один электрод.
Для подсчета частиц измерительная трубка и электрод 6 должны быть погружены в исследуемую жидкость, в которой взвешены подсчитываемые частицы (суспензия).
В верхней части прибора расположено счетное устройство, связанное с поворотной кнопкой.
К внутренней поверхности передней стенки прибора
присоединен механический насос, Который также связан с поворотной кнопкой.
Подготовка прибора к работе. Прибор включают в сеть с напряжением 220 В. Он должен быть заземлен. Вставляют измерительную трубку с капиллярным отверстием, диаметр которого соответствует производимому исследованию. Поворотную кнопку устанавливают на отметку «0».
Включают прибор с помощью тумблера, расположен- . ного на его задней стенке. Аппарат сразу же готов к работе.
Техника работы с прибором. Измерительный стакан с исследуемой суспензией помещают на подвижную подставку и поднимают его до погружения в жидкость измерительной трубки и электрода 6.
Поворотную кнопку переводят из положения «0» в измерительное положение «М», вращая ее в направлении, указанном стрелкой. Включается мотор, всасывающий взвесь через капиллярное отверстие в измерительную трубку. Когда уровень жидкости в измерительной трубке достигает электрода 4, начинается подсчет частиц. Насос продолжает всасывать исследуемую суспензию до соприкосновения ее с электродом 5. Автоматическое устройство, ограничивающее объем жидкости в измерительной трубке, переключает насос с всасывания жидкости на давление.
Подсчет прекращается на несколько секунд. В измерительной трубке создается избыточное давление, превышающее давление жидкости в стакане. Разница давлений, возникающая по обе стороны капиллярного отверстия, заставляет суспензию вытекать из измерительной трубки. Столбик жидкости в ней опускается ниже электрода 5, и подсчет частиц начинается снова. Он прекращается, когда жидкость опустится ниже электрода 4. По окончании подсчета поворотную кнопку ставят в положение «0». Снимают показания счетного устройства.
Подсчет продолжается 30—50 с. Его повторяют несколько раз и берут среднее арифметическое из полученных данных.
Работа аппарата должна производиться только в чистой не запыленной лаборатории. Содержащиеся в воздухе частицы могут попасть в исследуемый раствор и вызвать закупорку капиллярного отверстия измерительной трубки.
Техника разведения крови й подсчет эритроцитов и лейкоцитов. Разводящей жидкостью для крови является 0,9% раствор хлорида натрия. Его нужно тщательно предохранять от загрязнений, мешающих при Подсчете,— от пыли, бактерий, грибов. При хранении
разбавителя рекомендуется применение консерванта — нейтрального формальдегида (0,7 мл 2% раствора на 1 л раствора хлорида натрия).
Для подсчета эритроцитов и лейкоцитов берут одну общую пробу крови. В химическую пробирку наливают 5 мл 0,9% раствора хлорида натрия и вносят 0,02 мл (капилляр Сали) крови. Хорошо перемешивают, но не взбалтывают во избежание появления пузырьков воздуха, мешающих точному подсчету. Получают основное разведение в 251 раз.
Эритроциты считают при разведении крови в 63 000 раз. Второе разведение производят в измерительном стакане. В него вносят 12,5 мл 0,9% раствора хлорида натрия и 0,05 мл основного разведения. Осторожно перемешивают.
Результат, показанный счетным устройством, умножают на 10 000, получая количество эритроцитов в 1 мкл крови.
Для подсчета лейкоцитов кровь следует развести в 630 раз. Эритроциты гемолизируются раствором сапонина. Одновременно производят второе разведение крови. В измерительный стакан наливают 12,5 мл 0,9% раствора хлорида натрия и добавляют в него 3 капли 2% раствора сапонина. Туда же вливают всю основную пробу (то, что для подсчета эритроцитов из нее было взято 0,05 мл, роли не играет). Тщательно, но осторожно перемешивают и оставляют на 30 с.
Заменяют измерительную трубку, применявшуюся для подсчета эритроцитов (диаметр 60 мкм), на трубку с белой полоской (диаметр 70 мкм) и производят определение.
Показания счетного устройства умножают на 100, получая количество лейкоцитов в 1 мкл крови. В соответствии с Международной системой единиц (СИ) необходимо произвести пересчет количества эритроцитов и лейкоцитов на 1 л крови.
§ 58. Расчет среднего содержания гемоглобина J в одном эритроците и вычисление цветового fl показателя fl
Выполнение эритроцитами их функций во многом зависит от степени насыщения их гемоглобином. Среднее содержание гемоглобина в одном эритроците рассчитывают путем деления концентрации гемоглобина на число эритроцитов в 1 л крови. Эта величина выражается в пикограммах (пг). 1 г равен 1012 пг.
Для простоты расчета принимают за нормальную концентрацию гемоглобина 150 г/л, а за нормальное число 142
эритроцитов 5-1012 в 1 л крови. Переводят граммы в пикограммы: 150 г/л= 150-1012 пг/л. Таким образом, среднее содержание гемоглобина в одном эритроците равно:
150-1012 150
----й-==-г-=30 пг.
5-Ю12 5
Практически среднее содержание гемоглобина в одном эритроците рассчитывают по формуле:
НЪ в г/л
Число эритроцитов в миллионах ’
В норме содержание гемоглобина в одном эритроците колеблется от 27 до 33,3 пг.
Величина 33,3 пг условно принимается за единицу и называется цветовым показателем. Цветовой показатель отражает соотношение между концентрацией гемоглобина и числом эритроцитов в крови. Его вычисляют путем деления утроенного числа гемоглобина в граммах на литр на первые 3 цифры числа эритроцитов.
НЬ в г/л-3 3 первые цифры числа эритроцитов '
Например: концентрация гемоглобина 150 г/л, число эритроцитов 4,5 • 1012 в 1 л крови.
Цветовой показатель = 1,0.
Цветовой показатель величина относительная и выражается в отвлеченных цифрах. В норме цветовой показатель колеблется от 0,86 до 1,1.
Для облегчения работы можно определять среднее содержание гемоглобина в одном эритроците (СГЭ) и цветовой показатель (ЦПК), пользуясь номограммой (рис. 40), имеющей 4 шкалы. На левой шкале нанесены количества эритроцитов (Э) в миллионах в 1 л крови, на средней — концентрация гемоглобина (Г) в граммах на литр, на правой — ЦПК и СГЭ в пикограммах. Для определения пользуются линейкой, которую располагают на номограмме таким образом, чтобы ее ребро проходило через цифры полученного количества гемоглобина и эритроцитов. Точка пересечения ребра линейки с правой шкалой покажет цифры цветового показателя слева от оси шкалы и содержания гемоглобина в одном эритроците справа от оси шкалы.
Рис. 40. Номограмма для определения ц_ зтового показателя.
§ 59. Определение скорости оседания эритроцитов (СОЭ)
Если предотвратить свертывание крови и поместить ее
в вертикальный сосуд, эритроциты постепенно оседают I
над ними остается желтоватая прозрачная жидкость^: плазма крови. В зависимости от состояния организм! изменяются физико-химические свойства плазмы и оседа> ние эритроцитов идет с различной скоростью. j i
Для определения СОЭ необходимо следующее обору j дование: 1) аппарат Панченкова с капиллярами; 2) часовьк ; стекла или агглютинационные пробирки; 3) часы. s
Реактив: 5% водный раствор цитрата натрия.
Ход определения. СОЭ определяют в аппарат^'
Панченкова, который представляет собой штатив для! •
Рис. 41. Аппарат Панченкова. установки стеклянных капилляров в вертикальном положении. Каждому капилляру соответствует порядковый номер на штативе (рис. 41).
Капилляры Панченкова — это пипетки с делениями от О (верхняя отметка) до 100 мм. На уровне деления 50 нанесена буква «Р» (реактив), а на уровне отметки 0 — буква «К» (кровь). Капилляры должны быть стерильными.
Капилляр промывают раствором цитрата натрия, набирают его до метки «Р» и выливают на часовое стекло. В тот же капилляр набирают кровь из пальца до метки «К». По закону капиллярности, кровь затекает в пипетку, когда конец ее опущен. При набирании крови в капилляр следят за тем, чтобы в него не попали пузырьки воздуха. Набирать кровь нужно быстро, иначе она свернется. Из капилляра кровь выдувают в каплю реактива, перемешивают. Снова набирают кровь из пальца в этот же капилляр и смешивают ее с каплей на часовом стекле. Соотношение реактива и крови—1:4.
Наклонив стекло, набирают цитратную кровь в тот же капилляр до метки 0. Зажав верхнее отверстие капилляра пторым пальцем, вытирают кровь с его кончика и ставят в аппарат Панченкова в строго вертикальном положении. ' При косом положении капилляра оседание эритроцитов
ускоряется и результат пробы извращается. В стационаре у постели больного при взятии крови вместо часового стекла удобно пользоваться агглютинационными пробир ками. В них смешивают кровь с цитратом, ставят соответ ствующий номер, а определение СОЭ производят позже лаборатории. Не рекомендуется ставить пробу на месте так как при переносе аппарата Панченкова с капиллярами оседание эритроцитов ускоряется.
Поставив капилляр с кровью в аппарат Панченкова лаборант сейчас же записывает фамилию больного, номер на штативе, на который поставлен его капилляр в аппара те, и время, когда нужно читать результат.
Оседание эритроцитов происходит в течение часа. 3 это время эритроциты оседают и над ними в капилляре образуется столбик светло-желтой прозрачной плазмь Отмечают его высоту, отсчитывая количество миллиме! ров сверху вниз. Если кровь свернулась, столбика плазм! не образуется или эритроциты оседают всего на 0,5-1 мм. Для того чтобы проверить, не свернулась ли кровь капилляр вынимают из штатива. Если кровь из нег вытекает свободно, значит определение произведено пр; ВИЛЬНО.
После определения капилляры тут же промывают струей водопроводной воды. Если на стенках остались сгустки крови, их вычищают, вводя тонкую проволочку, снова промывают. Сильно загрязненные капилляры моя но обрабатывать химически, погружая их в раствор бихромата калия в концентрированной серной кислоте.
Скорость оседания эритроцитов выражается в милли метрах в час. Норма оседания эритроцитов в течение час для мужчин 1 —10 мм, для женщин 2—15 мм.
§ 60. Приготовление и окраска мазков
Техника приготовления мазка. Мазок крови делают на предметном стекле. Стекло должно быть чистым и обезжиренным. Малейшие следы жира делают невозможным нанесение крови ровным слоем. Новые стекла промывают проточной водопроводной водой, опс ласкивают дистиллированной, а затем на 2—3 дня поме щают в банку со смесью Никифорова для обезжиривания
По мере необходимости стекла извлекают из смеси Никифорова пинцетом и протирают тканью, не оставля ющей ворсин. Обработанные предметные стекла кладут закрывающиеся коробки, чтобы предохранить от пыли.
Стекла, бывшие в употреблении, кипятят в мыльном растворе. Во время кипячения смываются мазки крови обезжириваются стекла. После кипячения их промывают проточной водой и далее обрабатывают, как указано выше
8
И
Мазок делают шлифованным предметным стеклом со срезанными углами.
После прокола пальца первую каплю крови стирают ватным тампоном. К куполу следующей капли прикасаются предметным стеклом на расстоянии 1,5—2,0 см от его края. Не сле
Рве. 42. Техника приготовления мазков крови.
дует прикасаться им к
коже пальца.
Шлифованное стекло помещают перед каплей крови под углом в 45° и делают движение назад к капле с тем, чтобы кровь растеклась равномерно по ребру стекла. Затем быстро и легко
без нажима ведут шли-
фованное стекло справа налево, равномерно распределяя кровь по предметному стеклу (рис. 42).
Требования, предъявляемые к мазку: а) вся капля крови должна быть использована для мазка. При
этом условии мазок заканчивается неровно— «метелочкой»; б) мазок должен занимать примерно 3/4 предметного стекла; в) хорошо должен быть выражен край мазка; г) мазок должен быть полупрозрачен и иметь желтоватый тон. Толстый мазок не пригоден для исследования, так как форменные элементы в нем располагаются в несколько слоев и деформируются. В слишком тонком мазке трудно сосчитать нужное количество лейкоцитов.
Полученный мазок быстро высыхает на воздухе. Посредине его пишут простым (не химическим) карандашом фамилию и инициалы больного или его регистрационный номер. Для анализа делают не менее двух мазков.
Фиксация мазков. Перед окраской мазок следует зафиксировать. Фиксация предохраняет эритроциты от гемолиза и закрепляет мазок на стекле.
Мазки помещают в четырехугольную кювету с высокими стенками и крышкой (фиксатор). В кювету вставлен Штатив для предметных стекол.
В качестве фиксирующих жидкостей применяют метиловый спирт, смесь Никифорова, этиловый спирт. Реже Употребляют для этой цели хлороформ и формалин.
Метиловым спиртом мазки фиксируют 3—5 мин, смесьюЯ Никифорова 10—15 мин. При этом нужно помнить, что^ эфир быстро испаряется, поэтому фиксатор должен быть закрыт во время работы. Продолжительность фиксации 96% этиловым спиртом 20—25 мин. Для фиксации хлороформом мазок опускают в него лишь на несколько секунд.а В формалине мазок фиксируют 1 мин. я
Зафиксированные мазки вынимают из фиксатора вмеЛ сте со штативом. В штативе стекла располагаются верти-1 кально, что способствует скорейшему их высыханию.® Высохшие на воздухе мазки окрашивают. Я
Техника окраски мазков. Штатив с зафиксиро-Я ванными мазками помещают в другую кювету с разведен-!3 ной краской. В зависимости от метода окраска продолжается от 20 до 40 мин. Окрашенные мазки промывают водопроводной водой и высушивают на воздухе. Можно окрасить мазки, размещая стекла на «мостиках». Это параллельно расположенные над лотком стеклянные трубки одинакового диаметра, скрепленные резиновыми трубочками.
Стекла укладывают на «мостик» строго горизонтально, на небольшом расстоянии друг от друга, но не вплотную, иначе вся окраска, налитая на мазки, стечет в щели между ними. Краску наливают пипеткой, не касаясь ею поверхности мазка, чтобы не поцарапать его. На окраску одного мазка нужно 3—4 мл краски. При нанесении ее на мазок недопустимо образование пузырей воздуха, так как под ними кровь не окрасится. По истечении времени окраски промывают стекла водопроводной водой. Мазки ставят в штатив для предметных стекол и просушивают на воздухе.
На окраску отрицательно влияет кислая среда. Нельзя I красить мазки в комнате, где воздух насыщен парами кислот. Нельзя хранить красители в одном шкафу с I кислотами. Для разведения краски пользуются дистилли- I рованной водой, имеющей нейтральную реакцию или | фосфатным буферным раствором, который обеспечивает нейтральность среды.
Приготовление фосфатного буферного раствора. Отдельно готовят два раствора фосфатов. Навески делают на аналитических весах:
а) 17,838 г двузамещенного фосфата натрия Na2 НРО4 растворяют в мерной колбе вместимостью 1 л дистиллиро-1 ванной водой; I
б) 13,614 г однозамещенного фосфата калия КН2 РО<| растворяют в мерной колбе вместимостью 1 л дистиллиро-1 ванной водой. I
Для приготовления рабочей буферной смеси растворы смешивают в равных объемах (1:1).
Вся посуда, употребляемая для составления и разведения красителей, должна быть химически чистой. Применение этой посуды для другой работы недопустимо.
Окраска мазков. В основу современных методов окраски мазков крови положено открытие русского ученого Д. Л. Романовского. Применяя для окраски крови смесь красок — метиленового синего с эозином, он получил качественно новый краситель — азур, который дает возможность выявить отдельные структурные элементы клетки. Эти красители имеют различную реакцию: метиленовый синий — щелочную, а эозин — кислую.
Структурные части клетки (ядро, цитоплазма, зернистость) поглощают краситель противоположной реакции и им окрашиваются: щелочные части клетки окрашиваются кислой краской в красный цвет, а кислые — щелочной в синий цвет. Например, зернистость эозинофилов имеет щелочную реакцию; она поглощает кислую краску (эозин) и окрашивается в красный цвет. Цитоплазма лимфоцитов кислой реакции окрашивается щелочной краской (метиленовым синим) в голубой цвет. Получаемая при хорошей окраске мазков многокрасочная картина позволяет изучить детали клеточного строения лейкоцитов.
Окраска по Романовскому. Краску Романовского изготовляют фабричным способом и выпускают во флаконах и бутылях из темного стекла с указанием на этикетке даты выпуска и серии. В ее состав входят азур II (смесь равных количеств азура и метиленового синего) и эозин. Краска Романовского выпускается и в порошке. В этом случае делают навеску 3,8 г и растворяют ее в 250 мл метилового или этилового 96% спирта. В течение нескольких дней раствор вызревает в темном месте. Для лучшего растворения краски его нужно часто взбалтывать. Когда краска растворится приливают 250 мл х. ч. глицерина и вновь оставляют на 3—5 дней, часто помешивая.
Основной раствор краски Романовского концентрирован. Для окраски мазков крови он нуждается в разведении. Разведение может быть различным в зависимости от качества красителя. Наилучшие для окраски разведение и время устанавливают опытным путем.
Титрование краски Романовского. В трех цилиндрах готовят различные разведения краски из расчета 1 капля концентрированного красителя на 1 мл дистиллированной воды, 2 капли на 1 мл и 3 капли на 1 мл. Каждым из растворов окрашивают 5—6 зафиксированных мазков крови в течение различного времени: 20, 25, 30, 35 и 40 мин. Да каждом мазке отмечают время, в течение которого он будет окрашен. Окрашенные таким способом мазки микроскопируют и определяют то разведение краски и время, при Которых получена наилучшая окраска. Разведение прини-
мается за титр данной серии краски, а время окраски — дЯ постоянную экспозицию. Эти данные указывают на этикея ке бутыли. Например, титр — 2 капли на 1 мл, экспозиция-Я 25 мин. а
Краска, приготовленная в лаборатории, также должна быть оттитрована указанным выше способом.
Для окраски мазков крови всегда используют свежеприготовленный рабочий раствор краски. Его готовят из расчета 3—4 мл разведенной краски на 1 мазок.
Окраска по Нохту. Раздельно готовят 2 красителя: раствор желтого водного эозина (1 г в 1 л дистиллированной воды) и раствор краски азур II (1 г в 1 л дистиллированной воды). Красители нуждаются в вызревании в течение 2 нед в темном месте. Их необходимо часто размешивать, чтобы предотвратить оседание краски. Красители смешивают в мерном цилиндре непосредственно перед окраской мазков. Соотношение азура и эозина непостоянно. Оно изменяется в зависимости от качества красителей и pH дистиллированной воды. Для разведения лучше пользоваться буферным раствором.
Обычно соотношение красителей на 100 мл краски следующее: 25 мл азура II, 20 мл эозина, 55 мл буферного раствора. Если при окраске мазка крови ядра лейкоцитов выглядят слишком красными, то при изготовлении новой краски нужно увеличить количество азура, а если эритроциты выглядят синеватыми — нужно увеличить количество эозина. Свежеприготовленную краску наливают на зафиксированный мазок. Продолжительность окраски 20—30 мин. При окраске по Нохту клеточные элементы выглядят так же, как при окраске по Романовскому.
Окраска по Крюкову—Папенгейму. Для окраски мазков применяются два красителя: краситель-фиксатор) Май — Грюнвальда и краска Романовского.
Мазки не нуждаются в предварительной фиксации, так как краска Май — Грюнвальда, приготовленная на метиловом спирте, одновременно фиксирует и красит мазок. I
На нефиксированный мазок наносят 2 мл краски! Май — Грюнвальда на 3 мин. Затем доливают столько же! дистиллированной воды и красят еще 1 мин. Краску! сливают, смывают ее водой и на 15—20 мин заливают! мазки краской Романовского. Стекла промывают водопроЧ водной водой и высушивают иа воздухе.
§ 61. Подсчет лейкоцитарной формулы
Окрашенный мазок крови микроскопируют с иммерсИ-1 онной системой (от лат. immersio — погружаю). I
Используют ок. 7 или 10 и об. 90. Иммерсионный! объектив служит для получения наибольшего увеличения! 150 I
\
работа с иммерсионным объективом производится, когда он погружен в жидкость, нанесенную на поверхность исследуемого препарата. Применяемая жидкость — иммерсионное масло — должна быть прозрачной и преломлять световые лучи так же, как линзы объектива. Для создания однородной среды между препаратом и объективом иммерсионное масло должно обладать достаточной вязкостью, чтобы не растекаться по поверхности препарата. Этими свойствами обладает в наибольшей мере кедровое масло.
Для получения хорошей освещенности поля зрения конденсор поднимают до упора, а диафрагму открывают.
На мазок наносят каплю иммерсионного масла, объектив погружают в него до соприкосновения с препаратом. Под контролем глаза медленным осторожным движением макровинта поднимают тубус до получения изображения. Четкости его добиваются с помощью микровинта.
Лейкоциты располагаются в мазке неравномерно: более тяжелые (эозинофилы, моноциты) встречаются чаще по краю мазка, а более легкие (лимфоциты) — в середине. Поэтому подсчет следует вести как по середине, так и по краю мазка в тонкой его части, где хорошо просматривается структура клеток.
Считают все встречающиеся лейкоциты, дифференцируя их по видам. Всего сосчитывают 200 клеток, подсчитывают число лейкоцитов каждого вида и делят на 2, чтобы получить количество их относительно 100 клеток, т. е. процентное соотношение. Наиболее употребительный метод подсчета заключается в том, что по верхнему и нижнему краю мазка сосчитывают по 100 клеток, двигая его по ломаной линии. Просмотрев 5—6 полей зрения по краю, мазок передвигают на 5—6 полей зрения к середине стекла, а затем в сторону на столько же и возвращаются к краю. Снова просматривают край и т. д. (рис. 43,а).
Можно также подсчитывать клетки в начале мазка от края до края поперек него, затем 5—6 полей зрения по краю и снова поперек мазка, потом по противоположному краю и т. д., пока не будет сосчитано 200 клеток (рис. 43, б).
Регистрация лейкоцитов во время подсчета. Наиболее удобен для регистрации клеток при подсчете лейкоцитарной формулы счетчик лабораторный СЛ-1 (рис. 44). Это простейший арифмометр, снабженный 11 клавишами. Восемь клавиш имеют буквенные обозначения, соответствующие определенным лейкоцитам, а три с Цифровыми обозначениями «1», «2», «3» служат резервными и могут быть использованы для регистрации различных патологических элементов.
При нажатии клавиши в смотровом окне, расположен-
Рис. 43. Техника подсчета лейкоцитарной формулы. Объяснение в тексте.
Рис. 44. Счетчик лабораторный СЛ-1.
ном над ней, появляются цифры, соответствующие количеству лейкоцитов данного вида. При каждом отсчете автоматически суммируется общее количество клеток. Сумма обозначается красными цифрами в крайнем смот-эовом окне справа. За суммой лаборант может не следить, гак как, когда будет подсчитано 100 и 200 клеток, эаздастся звонок. Записывают показания счетчика.
Для подсчета следующей лейкоцитарной формулы цифры на счетчике надо сбросить поворотом рукоятки, расположенной справа, до появления во всех смотровых окнах нулей.
При отсутствии лабораторного счетчика можно фиксировать результаты подсчета на бумаге. Для этого чертят сетку, состоящую из 100 квадратов—10 по горизонтали и 10 по вертикали. В квадраты вписывают начальные буквы
иазваний встретившихся лейкоцитов. Когда вся сетка заполнена, т. е. сосчитано 100 клеток, подсчитывают количество лейкоцитов каждого вида, получая их процентное соотношение. Подсчет производят дважды и выводят среднее арифметическое.
§ 62. Определение количества тромбоцитов
Тромбоциты (кровяные пластинки) могут быть подсчитаны в окрашенных мазках крови, счетной камере или с помощью автоматического счетчика.
Подсчет тромбоцитов в мазках крови по Фонио. Метод основан на определении количества тромбоцитов, встречающихся при подсчете 1000 эритроцитов.
Реактив: 14% раствор сульфата магния или 6% раствор этилендиаминтетраацетат натрия (ЭДТА). Эти реактивы предотвращают аггрегацию и адгезию тромбоцитов, способствуя равномерному их распределению в мазке.
Техника приготовления мазков. Капилляр Панченкова промывают одним из указанных растворов. Набирают реактив до метки 75 и переносят его в серологическую пробирку. Кровь из пальца берут тем же капилляром до метки 0 («К») и перемешивают ее с реактивом.
Одновременно берут кровь для подсчета эритроцитов.
Из смеси крови с реактивом готовят тонкие мазки, высушивают их на воздухе, подписывают, фиксируют и окрашивают краской Романовского в течение 1 —2 ч. Краску смывают водопроводной водой, мазки высушивают на воздухе. При окраске по Романовскому тромбоциты окрашиваются в фиолетовый цвет, эритроциты — в розовый.
Техника подсчета. Окрашенный мазок микроскопируют с иммерсионной системой (ок. 7 или 10, об. 90), конденсор поднят, диафрагма открыта. Иммерсионное масло наносят на край мазка в наиболее тонкой его части, ближе к «метелочке». Подсчет эритроцитов и тромбоцитов ведут одновременно. При данном увеличении в поле зрения микроскопа видно около 200 эритроцитов. При подсчете их легко сбиться: одни и те же клетки учесть несколько раз, а другие пропустить. Поэтому прибегают к ограничению поля зрения, для чего в окуляр вкладывают кружок из черной бумаги с прорезанным посередине его Ромбическим отверстием. В ограниченном поле зрения Должно быть видно около 50 эритроцитов. Среди них Располагаются отдельные тромбоциты, которые встречается не в каждом поле зрения (рис. 45, см. на цвет. вкл.). Сосчитав 1000 эритроцитов, суммируют общее количество Встретившихся тромбоцитов. Определяют количество
эритроцитов в 1л крови. Количество тромбоцитов рассчитывают по формуле: , i
g-e fj
x-iooo’
S -5
где x—количество тромбоцитов в 1 л крови; а—количество тромбоцитов на 1000 эритроцитов; в—количество эритроцитов в 1 л крови.
Например: при подсчете 1000 эритроцитов встретилось 75 тромбоцитов. Количество эритроцитов в 1л крови— 4,2-10'2. Количество тромбоцитов в 1 л крови= 75-4,2-1012 9 »
=—7^— = 75-4,2-109=315-10 . 1ULHJ
Практически количество тромбоцитов в 1л крови можно получить, умножив число сосчитанных в мазке кровяных пластинок на цифру эритроцитов в миллионах и на 109.
Подсчет тромбоцитов в камере. Определяется количество тромбоцитов в 1 л крови при постоянном ее разведении; подсчет производят в камере Горяева.
Реактив: 1% водный раствор оксалата аммония (прокипяченный и профильтрованный).
Техника подсчета. В химическую пробирку наливают 4 мл оксалата аммония, вносят в нее 0,02 мл (капилляр Сали) крови, хорошо перемешивают. Получают разведение крови в 200 раз. Пробирку оставляют на 20—30 мин для гемолиза эритроцитов. Снова перемешивают и заполняют камеру Горяева. Помещают ее во влажную камеру на 5 мин. Тромбоциты подсчитывают в 25 больших квадратах. Определяют количество тромбоцитов в 1 л крови по формуле: ;
А-200-4-109 Г;
Х~ 400 ’ "
где х—количество тромбоцитов в 1 л крови; А—количество тромбоцитов, сосчитанных в 25 больших или 400
малых квадратах; 200 — разведение крови; 4-Ю9— множитель, приводящий результат к объему 1 л, так как 1
объем жидкости под малым квадратом; 400—число малых квадратов.
Практически формула сводится к следующему выражению:
x=A-2'109 тромбоцитов в 1 л крови.
Для лучшего выявления тромбоцитов в камере можно пользоваться фазово-контрастным устройством, которое дает более отчетливое их изображение.
Подсчет тромбоцитов с помощью электронноавтоматических счетчиков. Тромбоциты подсчитывают в плазме крови после самопроизвольного оседания эритроцитов. Может быть использован любой автоматический счетчик частиц типа «Целлоскоп», «Культер». Принцип их действия основан на определении числа электрических импульсов, вызываемых исследуемыми частицами, взвешенными в электропроводной жидкости.
Венозную кровь, смешанную с антикоагулянтом (цитрат натрия), оставляют на несколько часов для оседания эритроцитов и лейкоцитов. Тромбоциты практически не оседают и остаются равномерно распределенными в плазме крови. Плазму разводят изотоническим раствором хлорида натрия и пропускают через счетчик. Используется измерительная трубка с капиллярным отверстием для подсчета тромбоцитов (диаметр 50 мкм). Затем производят второй подсчет, пользуясь измерительной трубкой с большим капиллярным отверстием для подсчета оставшихся в плазме не осевших эритроцитов (диаметр 60 мкм). Разность между результатами первого и второго подсчета показывает истинное количество тромбоцитов.
§ 63. Определение количества ретикулоцитов
Ретикулоциты — молодые незрелые формы эритроцитов, при обычных методах окраски в мазке не выявляются и выглядят так же, как зрелые эритроциты. При специальной окраске в ретикулоцитах обнаруживается нежная сеточка или зернистость — нитчато-сетчатая субстанция.
Особенность окраски ретикулоцитов заключается в том, что они воспринимают краску только в момеш, пока клетка, выведенная из кровеносного русла, еще жива. В это время и можно выявить нитчато-сетчатую субстанцию, окрасив ее. Такая окраска называется суправитальной. В высохшем, а тем более зафиксированном мазке крови выявить ретикулоциты уже невозможно.
Окраска азуром II. Приготовление краски. В колбу помещают 1 г краски азур II, 0,4 г хлорида натрия, 5 г цитрата натрия и 45 мл дистиллированной воды. Хорошо перемешивают до полного растворения навесок. Колбу закрывают пробкой и ставят в термостат при температуре 37° С на 2 сут для вызревания. Периодически краску помешивают. Созревшую краску фильтруют в пузырек из темного стекла.
Техника приготовления мазков. В агглютина-ционную пробирку вносят микропипетками 0,05 мл раствора краски азур II и 0,2 мл крови. Тщательно перемешивают. Оставляют на 30 мин для прокрашивания, после чего Делают тонкие мазки.
Окраска азуром I. Приготовление краски, g колбу помещают 1 г краски азур I, 0,4 г оксалата аммония, 0,8 г хлорида натрия, 10 мл этилового спирта 96% и 90 мл дистиллированной воды. Перемешивают до полного растворения навесок. Колбу плотно закрывают пробкой и помещают в термостат при температуре 37° С на 2—3 сут периодически помешивая. Краситель фильтруют в темную склянку.
Техника приготовления мазков. В серологическую пробирку помещают 0,3—0,5 мл раствора краски азур I. Кровь набирают в капилляр Панченкова и вносят в ту же пробирку (5—6 капель). Кровь с краской тщательно, но осторожно перемешивают, пробирку закрывают пробкой и оставляют на 1 —1,5 ч. По истечении этого времени содержимое пробирки снова перемешивают, стеклянной палочкой наносят на предметное стекло и делают тонкие мазки.
Окраска бриллиантовым крезиловым синим. Приготовление краски: 1 г бриллиантового крезилового синего растворяют в 80 мл абсолютного спирта. Хорошо и длительно перемешивают до полного растворения краски. Хранят в бутылке из темного стекла с притертой пробкой.
Техника приготовления мазков. Стеклянной палочкой наносят капли краски на предметные стекла и делают тонкие мазки. Краска быстро высыхает. Мазки из краски подготавливают заранее и хранят в темном сухом месте.
Перед взятием крови готовят влажную камеру. Можно воспользоваться чашкой Петри, положив по ее окружности валик из смоченной водой ваты. В закрытой чашке создается определенная влажность.
Поверх мазка краски на предметном стекле делают мазок крови и, не давая ему высохнуть, помещают во влажную камеру на 8—10 мин. За это время происходит прокрашивание нитчато-сетчатой субстанции ретикулоцитов. Затем мазки высушивают на воздухе, подписывают.
При всех описанных методах окраски мазки в фиксации не нуждаются.
Подсчет ретикулоцитов производят с иммерсионной системой. При окраске любым из описанных методов эритроциты окрашиваются в желтовато-зеленоватый цвет, а нитчато-сетчатая субстанция — в синий (при окраске азуром II и бриллиантовым крезиловым синим) и в фиолетово-синий цвет (при окраске азуром I).
Техника подсчета. Имеет много общего с подсчетом тромбоцитов, отличаясь тем, что при определении количества тромбоцитов их считают отдельно от эритроцитов, а ретикулоциты входят в число сосчитанных 156
. 1
эритроцитов. Иными словами, определяют, сколько незре-ЛЬ1Х клеток встречается среди 1000 эритроцитов.
Поле зрения микроскопа должно быть ограничено, чтобы облегчить подсчет эритроцитов.
Количество ретикулоцитов выражают на 1000 эритроцитов, то есть в промилле (%о). В норме содержание ретикулоцитов в крови составляет 2—10 на 1000 эритроцитов (2—10%о, или 0,2—1%).
Глава II
ПАТОЛОГИЧЕСКИЕ ИЗМЕНЕНИЯ СОСТАВА КРОВИ § 64. Лейкоцитоз и лейкопения
Клинический анализ крови представляет диагностическую ценность в сочетании со всей симптоматикой болезни. Сравнение данных клинических анализов при повторных исследованиях больного дает возможность судить о течении патологического процесса, эффективности лечения и возникновении осложнений, а также предсказать исход заболевания.
Нормальные показатели лейкоцитов в периферической крови 4-109—9-109 в 1 л. Увеличение их количества более 9-109 в 1л крови называется лейкоцитозом, уменьшение ниже 4-109— лейкопенией. Лейкоцитоз может возникнуть в результате заболевания кроветворной системы (лейкозы) и как реакция кроветворной ткани на воздействие различных патологических агентов (реактивный лейкоцитоз). Он возникает при многих инфекционных, септических, гнойно-воспалительных процессах. Со значительным лейкоцитозом протекают такие заболевания, как крупозная пневмония, коклюш, аппендицит, сепсис и т. д. Лейкоцитоз может возникнуть при некрозе ткани, например при инфаркте миокарда. Высокие степени лейкоцитоза, протекающие с омоложением состава лейкоцитов, носят название лейкемоидных реакций.
Реактивный лейкоцитоз носит временный характер и при выздоровлении исчезает.
Лейкопения появляется при различных заболеваниях, а также в результате угнетающего воздействия на кроветворение некоторых токсических веществ (бензола), медикаментов и ионизирующей радиации.
Уменьшение количества лейкоцитов наблюдается при Пластической анемии и других заболеваниях кроветворной системы, заболеваниях печени, ряде инфекционных (брюшной тиф, бруцеллез) и вирусных (грипп, корь, кРаснуха и т. д.) болезней.
Лейкопения может наступить при приеме лекарственных препаратов (амидопирин, сульфаниламиды, некоторые антибиотики), которые действуют как антигены, вызывающие образование антител против собственных лейкоцитов. Особенно выраженным лейкопеническим свойством обладают препараты, применяемые для лечения опухолевых заболеваний — цитостатики.
§ 65. Лейкоцитарная формула
При различных заболеваниях изменяется не только количественный, но и качественный состав лейкоцитов.
Увеличение количества нейтрофильных лейкоцитов (нейтрофилез) характерно для воспалительных процессов и отражает их течение. При этом часто наблюдаются и качественные изменения группы нейтрофилов: возрастание числа палочкоядерных клеток, появление еще более молодых форм и токсигенной зернистости. Наличие ток-сигенной зернистости служит показателем дегенеративных изменений в нейтрофилах и тяжести течения заболевания. В отличие от нежно-фиолетовой пылевидной зернистости нормальных нейтрофилов она выглядит грубой, комковатой, окрашивается в насыщенно-фиолетовый цвет.
Нейтрофилез — увеличение количества нейтрофилов— часто сопровождается сдвигом лейкоцитарной формулы влево. Такой сдвиг характерен для целого ряда патологических процессов, главным образом инфекционных и нагноительных (крупозное воспаление легких, менингит, аппендицит, флегмона, сепсис и др.).
При нейтропении—уменьшении количества нейтрофилов— отмечается сдвиг лейкоцитарной формулы вправо. При этом среди нейтрофилов преобладают зрелые формы с 5—6 сегментами.
Сдвиг вправо встречается у 20% здоровых людей. Кроме того, его можно наблюдать в патологии при злокачественных новообразованиях, В ,2 (фолиево)-дефицитных анемиях. Нейтропения наблюдается при брюшном тифе, лекарственном агранулоцитозе — снижении числа гранулоцитов.
Эозинофилия — увеличение количества эозинофилов отмечается при глистных инвазиях, аллергических состо-яних (бронхиальная астма, сывороточная болезнь, крапиву ница и др.). Для большинства инфекционных заболеваний характерно уменьшение количества эозинофилов— эозинопения или полное их исчезновение из крови в острый период болезни — анэозинофилия. Исключение представляют скарлатина, хорея, протекающие с эозинофилией. Появление эозинофилов в крови при других
инфекциях служит благоприятным прогностическим признаком, говорящим о начале выздоровления.
Базофилия — повышение количества базофильных лейкоцитов— встречается достаточно редко: при хроническом миелоидном лейкозе, полицитемии (увеличение количества всех видов клеток в крови), после лечения железодефицитных и фолиеводефицитных анемий.
Лимфоцитоз — увеличение количества лимфоцитов — сопровождает хронические воспалительные процессы (некоторые формы туберкулеза и сифилиса), встречаются при брюшном тифе, коклюше, гриппе и др. Наиболее резко выражен лимфоцитоз при хроническом лимфолейко-зе. Различают абсолютный и относительный лимфоцитоз. При лейкоцитозе и процентном увеличении количества лимфоцитов имеет место абсолютный лимфоцитоз, т. е. увеличение числа лимфоцитов в 1 л крови (коклюш). При лейкопении процентное увеличение лимфоцитов остается относительным, т. е. их количество в 1л крови не увеличено (брюшной тиф, грипп).
Лимфоцитопения — уменьшение числа лимфоцитов — чаще бывает относительной на фоне нейтрофилеза. Абсолютное уменьшение количества лимфоцитов наблюдается при лучевой болезни, лимфогранулематозе.
Моноцитоз — увеличение количества моноцитов — имеет место при септическом эндокардите, инфекционном мононуклеозе, натуральной и ветряной оспе, иногда при малярии, бруцеллезе. Моноцитопения наблюдается при септических заболеваниях, тяжелых формах брюшного тифа.
§ 66. Картина крови при некоторых заболеваниях
Изменения картины крови при различных заболеваниях не являются строго специфичными. На их характер влияют не только этиологические моменты, но и стадия заболевания, тяжесть течения болезни, общее состояние больного в момент исследования. Тем не менее можно привести примеры изменений состава крови, наиболее часто наблюдаемых при конкретных заболеваниях.
Крупозная пневмония. Наблюдается лейкоцитоз с нейтрофилезом. Сдвиг лейкоцитарной формулы влево до метамиелоцитов. Иногда могут встретиться миелоциты. В нейтрофилах появляется токсигенная зернистость, которая исчезает после кризиса. Относительная лимфоцитопения, эозинопения; СОЭ увеличена.
Сепсис. Гнойные заболевания (флегмона, остеомиелит, абсцессы органов). Характерен высокий лейкоцитоз, нейтрофилез со сдвигом влево до метамиелоцитов и миелоцитов. Индекс сдвига достигает 0,3—0,4. Резко
выражена токсигенная зернистость нейтрофилов, анэози-нофилия. В крайне тяжелых случаях лейкоцитоз сменяется лейкопенией с нейтрофилезом и ядерным сдвигом влево, что указывает на падение сопротивляемости организма и служит плохим прогностическим признаком. Возникает тромбоцитопения. В красной крови снижается количество эритроцитов и гемоглобина; наблюдается значительное увеличение СОЭ.
Брюшной тиф. Характерна нейтропения, наступающая на 2-й неделе болезни. Одновременно с падением количества нейтрофилов нарастает относительное число лимфоцитов. Лимфоцитоз и нейтропения со сдвигом влево держатся до конца болезни. Анэозинофилия. Появление эозинофилов рассматривается как благоприятный прогностический признак. Снижается количество тромбоцитов. В начале заболевания СОЭ не ускоряется, с течением болезни постепенно нарастает.
Скарлатина. Наблюдаются нейтрофильный лейкоцитоз со сдвигом влево и токсигенная зернистость в нейтрофилах. Моноцитоз и лимфоцитопения. Эта инфекция в отличие от других протекает с эозинофилией, достигающей иногда больших цифр. С исчезновением сыпи прекращается и эозинофилия.
Коклюш. Появляется высокий лейкоцитоз с абсолютным лимфоцитозом и моноцитозом. У маленьких детей может наступить лейкемоидная реакция с количеством лейкоцитов до 50-109 в 1л крови и высоким содержанием лимфоцитов.
Г р и п п. Заболевание протекает с нормальным количеством лейкоцитов или лейкопенией. При этом наблюдается нейтропения с умеренным сдвигом влево. Индекс сдвига до 0,1—0,2. Умеренный относительный лимфоцитоз, снижение количества эозинофилов.
Злокачественные новообразования. Типичные изменения в крови наступают на поздних стадиях заболевания и отчасти зависят от локализации опухоли. Характерно наличие умеренного лейкоцитоза с нейтрофилезом без левого сдвига, моноцитоз; тромбоцитоз. Наблюдается снижение количества эритроцитов и гемоглобина. СОЭ резко увеличена.
Острая лучевая болезнь. В первые часы после облучения появляется нейтрофильный лейкоцитоз, в тяжелых случаях быстро сменяющийся лейкопенией с нейтрофилезом. СОЭ обычно несколько замедлена. В период разгара болезни наступает резкое угнетение функции костного мозга, что проявляется в подавлении всех ростков кроветворения. В периферической крови отмечается лейкопения с нейтропенией и токсигенной зернистостью нейтрофилов. Катастрофически падает количество 160
К стр. 24
Рис. 4. Организованный осадок мочи.
1—полиморфный эпителий; 2— эритроцит; 3 — плоский эпителий; 4—лейкоциты.
Рис. 5. Организованный осадок мочи.
I—измененные и неи вмененные эритроциты; 2 — лейкоциты; 3 — почечный эпи i един; 4—цилиндры: а— fмалиновые, б— зернистые, в — восковидные.
К стр. 63
К стр. 70
Рис. 15. Нативный препарат кала.
детрит; 2 — мышечные подокна Переваренные и непереваренные: •' — соединительная ткань; 4 — непе-Реваримая клетчатка; 5 — переварная клетчатка; 6 — капли жира: 7 — мыла; 8 — жирные кислоты.
рис. 14. Альвеолярные макрофаги, содержащие гемосидерин.
а.—в вшивном препарате; б—окраска на берлинскую лазурь.
Рис. 25. Эозинофилы в мокроте.
К стр. 94
Рис. 26. Микобактерии туберкулеза (окраска по Цилю — Нильсену).
Рис. 45. Тромбоциты и эритроциты в ограниченном поле зрения.
1—эритроциты; 2—тромбоциты.
К стр. 153
К стр. 117
1 Класс полипотентных клеток-предшественников
8*
в Класс частично детерминированных поли латентных клеток-предшественников
ЗУ
Клетка-предшественник ,_____ ' лимфопоэза
В-лимфопоэзиц^'"' —у^т-лимфолозтин
Ш класс инипо-тенткьгх кле-ток-предшест-веннинод
Клетка-
Kпeткa-
предшественник В-лимфоуи-
предшеутвенник
SZ7 класс морфологически распознаваемых пролиферирующих клеток
Т-пимсроцитов
Плазмобласт
\ПимфоВпаст
V Класс созревающих клеток
И Класс зрелых плеток
гистиоцит соединительной ткани
Проплазмоцит
Плазмоцит
МоноВласт
Пролимфоцит
п I
Промоноцит
Моноцит
Макрофаги _____________
купферовы альвеолярный фцкщювинный фиксированный клетки макрофаг макрофаг
печени легких селезенки мп£п
селезенки
мозга
Рис. 34. Схема кроветворения.
Стдолодая кро-детоорная клетка
ЛейкопозТйн
Клетка-предшественник миепопозза
'ритропоэтин /\ ТромболоэтиН
'колсниеобраэую -щая в культуре клетка
тоэтинчувстви-
Миелобласт
тельная . клетка j
Чюэтинчудстби-
тельная клетка
Эритробласт
Мегакариобласт
Пронормоци
Метомиелоциты
Папочкоядерные
Ретикулоцит Мегакариоцит
Нормоцит Полихроматофильный
Промегакариоцит
Нормоцит базофипь-। ный
Промиелоциты
Миелоциты
'^Базофилы
Сегментоядерные Ней трощилы
свободный и фин-сированный макрофаг
лимфатических узлов
нормоцит окситрилр-
-L
Эозинофилы Эритроцит тромбоциты
Макрофаги
перитонеаль- плевральный ныи г
макрофаг
макросраг
остеокласт
клетки микроглии нервной системы
46. Изменения эритроцитов при анемиях. Объяснение в тексте.
Рис. 50. Цитохимические реакции. Объяснение в тексте.
Рис. 53. Картина крови при хроническом лимфолейкозе.
Рис. 60. Оценка результатов реакции изо-гемагглютннации по стандартным сывороткам.
Группа 0(1)
Группа В(Ш)
Рис. 64. Нормальная электрофореграмма.
Рис. 69. Нарушения функций печеночных клеток при желтухах, к—кровеносный капилляр; Ж— желчный капилляр. 1 — норма; 2 — механическая желтуха; 3 — паренхиматозная Желтуха: а—нормально функционирующая клетка; б—частично пораженная клетка;
в — разрушенная клетка.
К стр.
231
К стр-275
Группа ЙВ(Ш)
эритроцитов и гемоглобина. Количество тромбоцитов снижается до единичных в препарате.
Хроническая лучевая болезнь. В раннем периоде изменения количества лейкоцитов, эритроцитов и тромбоцитов непостоянны. Часто наблюдается нейтрофильный лейкоцитоз, умеренная эозинофилия, моноцитоз В разгар заболевания наступает стойкая лейкопения с относительным лимфоцитозом. При этом в единице объема крови количество лимфоцитов и нейтрофилов снижено (абсолютная лимфоцитопения и нейтропения). Развивается эозинопения. Падает число эритроцитов и тромбоцитов. Резкое уменьшение всех видов клеток носит название панцитопении.
Вопросы для повторения
1. Какими терминами обозначают увеличение и уменьшение количества лейкоцитов и отдельных их видов?
2. При каких состояниях наблюдаются лейкоцитоз и лейкопения?
3. Что называется сдвигом лейкоцитарной формулы?
4. Какие заболевания сопровождаются иейтрофилезом и какие иейтропе иней?
5. Какова диагностическая ценность изменений количества эозинофилов и базофилов в крови?
6. При каких заболеваниях наблюдается абсолютный и относительный лимфоцитоз?
7. Какова картина крови при крупозной пневмонии, сепсисе и гнойных заболеваниях, брюшиом тифе, скарлатине, кори, коклюше, гриппе злокачественных новообразованиях, острой и хронической лучевой болезни?
АНЕМИИ
Анемией или малокровием называется уменьшение количества эритроцитов и гемоглобина в единице объема крови.
Анемии чаще всего служат симптомом какого-либо основного заболевания. В зависимости от причин, вызывающих анемии, их можно разделить на несколько групп.
1. Анемии вследствие кровопотерь.
2. Анемии вследствие нарушения кровообразования.
3. Анемии вследствие усиления кроворазрушения.
§ 67. Морфологические изменения эритроцитов
При анемиях происходят не только количественные, но и качественные изменения эритроцитов. Меняются их величина, форма и окраска. При некоторых видах анемий в эритроцитах появляются патологические включения (рис. 46, см. на цвет. вкл.).
Диаметр эритроцитов крови здорового человека равен 1—8 мкм. При анемиях в крови могут появляться эритро-
циты как больших, так и меньших размеров. Эритроциты с диаметром менее 6,5 мкм называются микроцитами, а с диаметром более 9 мкм—макроцитами. Одновременное появление в крови эритроцитов разных размеров нйсит название анизоцитоза. Анизоцитоз служит ранним признаком анемии и встречается почти при всех видах малокровия.
Эритроциты здорового человека имеют форму двояковогнутого диска. При тяжелых анемиях они становятся вытянутыми, грушевидными, серповидными, овальными, шаровидными и т. д. Изменение формы эритроцитов носит название пойкилоцитоза.
Нормальные эритроциты при окрасе по Романовскому приобретают розовый цвет. Они окрашиваются неравномерно— более интенсивно по периферии клетки с участком просветления в центре. Такие эритроциты называют нормохромными. При анемиях окраска эритроцитов может измениться. Уменьшение интенсивности окраски носит название гипохромии. Гипохромные эритроциты бледно-розовые, центральное просветление выступает резче. Гипохромия обусловлена либо уменьшением содержания гемоглобина в эритроцитах, либо уменьшением их толщины.
Эритроциты, имеющие более интенсивную темнорозовую окраску с уменьшенным центральным просветом, носят название гиперхромных. Гиперхромия зависит от увеличения толщины эритроцитов (но не от увеличения содержания гемоглобина в них).
Наличие в мазке эритроцитов различной окраски называется анизохромией.
При резко выраженном малокровии могут наблюдаться и качественные изменения в окраске эритроцитов. Появляются эритроциты различных оттенков фиолетового цвета— полихроматофилы. Это молодые недозревшие формы эритроцитов, поступающие из костного мозга в периферическую кровь при усиленной регенерации. Фиолетовый оттенок обусловлен сохранением части базофильной окраски эритробластов, которая смешивается с розовым цветом гемоглобина эритроцитов. Полихроматофилы крупнее нормальных эритроцитов. Они обычно являются ретикулоцитами, т. е. при специальных методах окраски в них выявляется нитчато-сетчатая субстанция.
При нарушении созревания эритроцитов в них можно обнаружить остатки ядер нормоцитов в виде мелких, круглых фиолетово-красных включений. Они встречаются по 2—3 в одном эритроците и носят название телец Ж олли. В тех же случаях можно увидеть и бледно-розовые включения в эритроцитах в виде эллипсов или восьмерок—кольца Кебота.
При отравлениях свинцом и тяжелых анемиях в эритроцитах могут встретиться до 5—20 светло-синих пятнышек различной величины — базофильная пунктация (см. рис. 50, ж).
У здорового человека нормоциты в периферической крови отсутствуют. У новорожденных детей они могут быть обнаружены в первые дни жизни. Это явление физиологическое. В патологии нормоциты встречаются в периферической крови при некоторых видах анемий.
§ 68. Анемии вследствие кровопотерь
Анемии вследствие кровопотерь, или постгеморрагические, бывают острыми и хроническими.
Острая постгеморрагическая анемия возникает при быстрой потере большого количества крови. Значительные кровопотери могут быть вызваны разрывом крупных сосудов при травмах, маточных, легочных, почечных, желудочных кровотечениях.
В течение острой постгеморрагической анемии наблюдается несколько фаз.
Картина крови. В различные фазы заболевания неодинакова. В первые часы после кровопотери, несмотря на абсолютное уменьшение массы эритроцитов, показатели эритроцитов и гемоглобина в единице объема крови остаются неизменными. Это происходит вследствие сгущения крови, ибо уменьшение объема ее при кровотечении происходит в основном за счет потери плазмы Уменьшение массы эритроцитов ведет к нарушению дыха тельной функции крови. Развивается кислородное голодание— гипоксия.
Через 1—2 дня в кровяное русло поступает тканевая жидкость, в результате чего объем крови восстанавливается. Количество эритроцитов и гемоглобина в единице ее объема равномерно снижается. Цветовой показатель при этом остается в пределах нормы — нормохромная анемия.
Падение концентрации кислорода в тканях стимулирует выработку эритропоэтина, который, воздействуя на кроветворную ткань, способствует усиленному образованию и выбросу в периферическую кровь эритроцитов.
На 4—5-й день происходит восстановление клеточного состава периферической крови. Появляется много ретикулоцитов. Одновременно увеличивается количество гемоглобина, но его нарастание происходит медленнее и в результате развивается гипохромия. В мазке крови наблю Дается анизоцитоз (макроцитоз), встречаются полихрома-тофилы.
В этой фазе заболевания развивается лейкоцитоз до 12-109—20-109 в 1 л крови, отмечается сдвиг лейкоцитар
ной формулы влево до метамиелоцитов. В течение нескольких дней держится тромбоцитоз. СОЭ повышена.
Хроническая постгеморрагическая анемия развивается в результате небольших, но часто повторяющихся кровопотерь (при геморрое, язве желудка и двенадцатиперстной кишки, опухолях желудочно-кишечного тракта, меноррагиях, носовых кровотечениях и т. д.). При этом значительно снижается содержание железа в крови — развивается железодефицитная анемия.
§ 69. Железодефицитные анемии
Железодефицитные анемии относятся к группе анемий, возникающих вследствие нарушения кровообразования.
Основная функция эритроцитов — перенос кислорода к тканям — осуществляется за счет гемоглобина. Для синтеза гемоглобина необходимо железо, которое поступает в организм с пищей. В организме здорового человека содержится 3—4 г железа. Почти все оно соединено с белками. Большая часть железа (до 85%) входит в состав гемоглобина эритроцитов. Остальное — депонируется в тканях, главным образом в мышцах. Часть железа находится в депо в виде ферритина и гемосидерина. Небольшое количество его содержится в сыворотке в виде трансферрина — белка, переносящего железо.
При недостатке железа в организме развивается анемия. Причинами возникновения железодефицитных анемий могут быть:
1) недостаточное поступление железа в организм при нарушении питания (голодание, молочно-растительная диета);
2) повышенные потери железа при хронических постгеморрагических анемиях;
3) повышенное потребление железа в периоды роста, беременности и лактации;
4) недостаточное усвоение железа при хронических энтеритах, резекции части тонкого кишечника и желудка.
Картина крови. Отмечается резкое снижение уровня гемоглобина в крови. В то же время количество эритроцитов уменьшается в меньшей степени, оставаясь в некоторых случаях на нижней границе нормы. Цветовой показатель снижен, иногда значительно (до 0,5—0,6). Все железодефицитные анемии являются гипохромными. В мазке крови отмечаются анизоцитоз, пойкилоцитоз, гипохромия эритроцитов. В тяжелых случаях появляются нормоциты (рис. 47, см. на цвет. вкл.). Содержание ретикулоцитов нормальное или иногда повышенное. Количество лейкоцитов в пределах нормы, число тромбоцитов иногда повышено. СОЭ незначительно увеличена.
§ 70. В12 (фолиево)-дефицитные анемии
В и (фолиево)-дефицитные анемии также относятся к заболеваниям, возникающим вследствие нарушения образования крови.
Недостаток витамина В ,2 вызывают анемию, которую описали в конце XIX века Аддисон и Бирмер. Заболевание, получило название пернициозной (злокачественной) анемии Аддисона — Бирмера. Эта болезнь в то время была абсолютно неизлечимой.
В начале XX века из печени было выделено вещество, которое давало лечебный эффект при пернициозной анемии. Почти одновременно Кастл высказал предположение, что в печени животных содержится «внешний фактор», который, соединяясь с «внутренним фактором» желудка, оказывает влияние на нормализацию кроветворения. В дальнейшем из печени был выделен «внешний фактор» и назван витамином В ,2. В настоящее время стала известна химическая структура этого вещества (цианкоба-ламин) и его стали получать синтетическим путем.
«Внутренний фактор» Кастла — это белок глюкопротеин (гастромукопротеин), вырабатываемый железами слизистой оболочки желудка. «Внутренний» и «внешний» факторы образуют антианемический комплекс.
Витамин В ,2 человек получает с пищей. Содержание его в организме взрослого человека 2—5 мг. Значительная часть его депонируется в печени и лишь 200— 1000 пг/мл находится в сыворотке крови.
Дефицит витамина В ,2 может возникнуть вследствие нарушения его всасывания или повышенного расходования.
Нарушение всасывания связано либо со снижением секреции «внутреннего фактора», либо с нарушением абсорбции его эпителием кишечника. Доказано, что пищевой витамин В ,2 может всосаться в кровь лишь в комплексе с «внутренним фактором». У большинства больных пернициозной анемией в крови обнаруживаются антитела, направленные против «внутреннего фактора». При атрофии слизистой оболочки желудка гастромукопротеин отсутствует в желудочном соке. Он может отсутствовать также при раке желудка и операционном удалении части желудка. В этих случаях развивается В ,2-дефицитная анемия.
Всасывание комплекса витамин В ,2— гастромукопротеин происходит в тонком кишечнике. Нарушение этого процесса может быть связано с общим снижением кишечного всасывания при энтерите, резекции тощей кишки и т. д.
Повышенное расходование витамина В ,2 происходит
при инвазии широким лентецом, который поглощает витамин В ,2 непосредственно в кишечнике.
Витамин В12 относится к специфическим факторам кроветворения. Как витамин В и, так и фолиевая кислота необходимы для нормального течения эритропоэза. Фолиевая кислота содержится в большом количестве в листьях шпината («листьевая кислота») и в некоторых других продуктах. В организме она находится в связанном, неактивном состоянии в печени. Под влиянием витамина В i2 происходит активация фолиевой кислоты. Она превращается в фолиновую кислоту, действующую непосредственно на костный мозг. При дефиците витамина В ,2 и фолиевой кислоты нарушается обмен нуклеопротеидов, синтез ДНК и РНК, что приводит к замене нормального кроветворения патологическим. В результате из клеток-предшественников эритропоэза образуются мегалобласты, которые в дальнейшем дифференцируются в гигантские эритроциты—мегалоциты. Причины резкой анемиза-ции при этом заключаются в расстройстве митотических процессов. При мегалобластическом кроветворении в костном мозге уменьшается число клеточных делений и этот процесс протекает медленнее. Вместо трех митозов, свойственных нормальному эритропоэзу, мегалобластический эритропоэз протекает с одним митозом. Это означает, что в то время, как 1 пронормоцит продуцирует 8 эритроцитов, из 1 промегалоцита образуется всего 2 мегалоцита. В то же время в костном мозге происходит усиленное разрушение мегалобластов и ядросодержащих эритроцитов. Таким образом процессы разрушения клеток красного ростка в костном мозге преобладают над процессами кровообразования и в периферическую кровь поступает мало эритроцитов.
Картина крови. Количество эритроцитов резко снижено, в отдельных случаях их менее 1-1012 в 1 л крови. Концентрация гемоглобина также чрезвычайно низкая (до 20 г/л). Однако число эритроцитов падает интенсивнее, чем количество гемоглобина, и цветовой показатель обычно выше 1, а в тяжелых случаях достигает 1,4—1,8. Эта анемия гиперхромного типа. Характерно появление в периферической крови мегалоцитов (рис. 48, см. на цвет, вкл.), которые отличаются от эритроцитов величиной и строением. Их диаметр достигает 12—14 мкм, а объем в 2 раза больше объема эритроцита. За счет этого в них увеличено содержание гемоглобина. В мазке крови они выглядят интенсивно окрашенными, не имеющими центрального просветления — гиперхромны. Эритроциты же на высоте заболевания окрашены бледно, размер их меньше обычного. Таким образом наблюдается анизоцитоз, макроцитоз и анизохромия. Появляются дегенератив
ные формы: эритроциты с базофильной пунктацией, с остатками ядра в виде телец Жолли и колец Кебота, нормоциты. Часто в периферической крови можно видеть промегалоциты и даже мегалобласты. Наблюдается резкий пойкилоцитоз, встречаются обломки эритроцитов — шизоциты.
Количество ретикулоцитов в острый период заболевания резко уменьшено, повышение их числа говорит о правильно проводимом лечении и близости ремиссии.
Характерны и изменения белой крови: развивается лейкопения с нейтропенией, относительный лимфоцитоз, анэозинофилия. Среди нейрофилов появляются крупные клетки с гиперсегментацией ядра (8—10 сегментов), палочкоядерные нейтрофилы отсутствуют—сдвиг лейкоцитарной формулы вправо. Количество тромбоцитов снижено.
§ 71. Апластические анемии
Апластические анемии относятся к группе анемий, возникающих в результате нарушения кровообразования. Апластическая анемия—это синдром, характеризующийся снижением количества кроветворных элементов в костном мозге и резкой панцитопенией в периферической крови, что является следствием угнетения кроветворения в костном мозге. Заболевание начинается с анемии, затем присоединяются тромбоцитопения и агранулоцитоз, которые свидетельствуют о поражении двух других ростков кроветворения.
Установлен ряд факторов, оказывающих подавляющее влияние на костный мозг. Апластические анемии могут возникнуть после приема некоторых лекарств, являющихся аллергенами (амидопирин, некоторые антибиотики), а также длительного воздействия ряда химических веществ (бензол), оказывающих токсическое воздействие на костный мозг. Развитию апластической анемии способствуют хронические заболевания (туберкулез, сифилис) и длительное применение при них лекарственных препаратов, а также вирусная инфекция — инфекционный гепатит.
Ионизирующая радиация также является фактором, вызывающим аплазию костного мозга.
Апластические анемии могут возникнуть и без воздействия токсических факторов. Такие анемии, причины возникновения которых не выяснены, называют идиопатическими. Возможно, что в этих случаях против антигена клеток костного мозга вырабатываются антитела, которые подавляют размножение и созревание костномозговых элементов на самых ранних стадиях. Считается, что
одной из причин апластической анемии является уменьшение количества стволовых клеток.
Апластические состояния бывают и конституциональными, передающимися по наследству. При этих типах анемии обнаружены изменения в структуре хромосом, что подтверждает генетическую основу болезни.
Картина крови. Наблюдается резкое, но равномерное уменьшение количества эритроцитов и гемоглобина. Гемоглобин может снижаться до 20—30 г/л, количество эритроцитов уменьшается до 1-1012 и ниже в 1 л крови. ЕНю анемии нормохромного типа. Анизоцитоз и пойкило-цитоз выражены незначительно. Признаки восстановления (регенерация) красной крови отсутствуют. Количество ретикулоцитов 0—3%о. Выраженная лейкопения 1-109 в 1 л, абсолютная нейтропения и относительный лимфоцитоз, эозинопения. Наблюдается тромбоцитопения. СОЭ возрастает до 30—50 мм/ч.
§ 72. Гемолитические анемии
Продолжительность жизни эритроцитов здорового человека 90—120 дней. Стареющие эритроциты разрушаются в селезенке, печени и костном мозге. Процесс разрушения происходит внутриклеточно, за счет фагоцитоза, который осуществляется клетками фагоцитирующих мононуклеаров. При внутриклеточном распаде эритроцитов освобождается гемоглобин, который, претерпев ряд изменений, превращается в билирубин, поступающий в кровь.
Небольшая часть эритроцитов разрушается внутри сосудистого русла. При этом дальнейшее удаление освобожденного гемоглобина производится печенью и костным мозгом.
Гемолитические анемии — это заболевания, основным признаком которых является повышенное кроворазруше-ние — гемолиз, вследствие укорочения продолжительности жизни эритроцитов или созревающих в костном мозге клеток эритроцитарного ростка — эритрокариоцитов. При гемолитических анемиях процессы кроворазрушения преобладают над процессами кроветворения.
Гемолитические анемии могут быть наследственными и приобретенными.
Наследственные гемолитические анемии вызываются дефектами структуры мембраны эритроцитов, нарушением активности их ферментов, нарушением синтеза гемоглобина. Механизмы возникновения анемий, вызванных перечисленными аномалиями эритроцитов и гемоглобина, различны, поэтому неодинаковы и изменения в крови.
При наследственных гемолитических анемиях, связан
ных с нарушениями мембраны эритроцитов, последние приобретают необычную форму — сферическую, овальную и др. Мембрана этих эритроцитов обладает повышенной проницаемостью для ионов натрия, что приводит к накоплению в них воды. Эритроциты, набухая, приобретают шаровидную форму. Изменение формы эритроцитов делает их менее эластичными, что затрудняет их прохождение через узкие отверстия базальной мембраны синусов селезенки. Проходя через эти отверстия, эритроциты теряют часть своей поверхности. Однако, они не гемолизируются, а оборвавшиеся края оболочки соединяются. При этом сохраняется сферическая форма эритроцита, но уменьшается его диаметр. Образуются микросфероциты, поступающие в общий кровоток. Эти эритроциты разрушаются быстрее нормальных. Особенностью микросфероцитов является понижение устойчивости к воздействию гипотонических растворов солей — снижение осмотической резистентности.
Картина крови. Наследственный микросфероцитоз протекает циклично — с обострениями и ремиссиями. Во время гемолитического криза количество гемоглобина и эритроцитов значительно снижается, но затем быстро восстанавливается. В период ремиссии общее количество эритроцитов и содержание гемоглобина в них нормально. Цветовой показатель близок к 1. Это нормохромная анемия. Наблюдается анизо- и пойкилоцитоз — эритроциты шаровидной формы, уменьшены в диаметре, увеличена их толщина, равномерно окрашены без центрального просветления (рис.49, см. на цвет. вкл.). Содержание ретикулоцитов достигает 100%о, после массивного гемолиза оно может увеличиться до 500—600%о. В период гемолитического криза появляются нормоциты, полихро-матофилы. Количество лейкоцитов чаще всего нормальное, в период обострения — лейкоцитоз с нейтрофиле зом. Число тромбоцитов остается в пределах нормы. Снижена осмотическая резистентность эритроцитов. Характерно повышение количества билирубина в крови.
Уменьшение активности ферментов эритроцитов приводит к возникновению ферментодефицитных анемий.
Недостаток активности ферментов гликолиза нарушает выработку энергии (АТФ), что приводит к изменению ионного состава эритроцитов и уменьшению продолжительности их жизни. Эритроциты разрушаются при этом внутриклеточно макрофагами селезенки и печени.
При нарушении активности ферментов пентозофосфат-ного цикла и глутатионовой системы эритроциты теряют способность противостоять воздействию окислителей. Это приводит к окислению гемоглобина, образованию переки-
си непредельных жирных кислот мембраны эритроцитов и их гибели. Разрушение эритроцитов при этом происходит в основном внутри сосудов. Освобожденный гемоглобин выделяется с мочой, придавая ей черный цвет. Наиболее часто встречаются гемолитические анемии, связанные с нарушением активности глюкозо-6-фосфатдегидрогеназы (Г-6-ФДГ). .Окислителями, вызывающими гемолиз, могут быть многочисленные медикаменты (ацетилсалициловая и аскорбиновая кислоты, викасол, сульфаниламиды и др., а также употребляемые в пищу конские бобы).
Картина крови. Содержание эритроцитов и гемоглобина вне криза уменьшено незначительно. При гемолитическом кризе наблюдается снижение гемоглобина до 40—60 г/л. Цветовой показатель около 1. Это анемии нормохромного типа. Может быть выраженный анизоцитоз (микросфероциты и макроциты), пойкилоцитоз и полихроматофилия. В эритроцитах при специальной окраске обнаруживаются включения округлой формы — тельца Гейнца. Могут появляться мишеневидные эритроциты, тельца Жолли, базофильная пунктация. Характерен рети-кулоцитоз. Количество лейкоцитов увеличенное или нормальное, тромбоцитов — нормальное. В крови повышено содержание непрямого билирубина.
При нарушении синтеза или структуры цепей глобина образуются аномальные гемоглобины. Таких патологических форм существует около 150. Все они отличаются по своим физико-химическим свойствам. Под влиянием различных внешних повреждающих факторов (высокая температура, недостаток кислорода и т.д.) эритроциты, содержащие аномальные гемоглобины, быстро разрушаются. Гемолитические анемии, связанные с нарушением синтеза' или структуры гемоглобина, носят название гемоглобинопатий.
Картина крови. Эритроциты приобретают необычную форму — мишеней, серпов и т.д. Анемия бывает нормохромная или гипохромная. Часто обнаруживается базофильная пунктация эритроцитов, анизоцитоз, полихромазия. Количество ратикулоцитов всегда повышено. В крови увеличено содержание непрямого билирубина.
Приобретенные гемолитические анемии могут возникать в результате воздействия антиэритроцитарных антител, которые вызывают повреждение и повышенный гемолиз эритроцитов. Это иммунные гемолитические анемии. В зависимости от характера антигена, воздействующего на кровь больного, различают изоиммунные, гете-роиммунные и аутоиммунные гемолитические анемии.
В тех случаях, когда антитела или антигены, против которых у больного есть антитела, попадают в организм извне, возникают изоиммунные гемолитические ане-170
мии. Это бывает, например при гемолитической болезни новорожденных.
Гете р о и ммунн ы е гемолитические анемии связаны с воздействием антигена, появившегося на поверхности эритроцита. Таким новым антигеном могут быть лекарственные вещества (пенициллин, сульфаниламидные препараты) или вирусы. Антитела против лекарственного препарата или вируса фиксируются вместе с антигеном на поверхности эритроцита, что приводит к его гибели.
При аутоиммунных гемолитических анемиях антитела вырабатываются против антигена собственных эритроцитов.
Картина крови. При иммунных гемолитических анемиях содержание гемоглобина и эритроцитов бывает низким. Анемия нормохромного типа. Отмечается анизоцитоз эритроцитов, полихромазия. Количество ретикулоцитов увеличено, лейкоцитов — нормальное, но иногда может появиться лейкопения. Количество тромбоцитов в норме. СОЭ чаще увеличена. Содержание билирубина в крови повышено.
Усиленное разрушение эритроцитов может быть при их механическом повреждении. Это наблюдается при операциях на сосудах и сердце или при значительной и длительной физической нагрузке на нижние конечности— маршевая гемоглобинурия. Выделяющийся с мочой гемоглобин окрашивает ее в черный цвет.
Вопросы для повторения
1. Что называется анемией?
2. На какие группы делятся анемии?
3. Каковы морфологические изменения эритроцитов при анемиях?
4. Каковы причины возникновения постгеморрагических анемий?
5. Какова картина крови при острой постгеморрагической анемии?
6. Каковы причины возникновения железодефицитных анемий?
7. Какие характерные изменения в крови наблюдаются при железодефицитных анемиях?
8. Каков механизм возникновения В 12 (фолиево)-дефицитиых анемий?
9. Чем характеризуется картина крови при В 12 (фолиево)-дефицитиой анемии?
10. Каковы причины возникновения апластических анемий?
11. Какова картина крови при апластических анемиях?
12. Каковы причины возникновения гемолитических анемий?
13. Каков механизм возникновения микросфероцитоза?
14. Какова картина крови при наследственном микросфероцитозе?
15. Какова картина крови при гемолитических анемиях, связанных со снижением активности ферментов?
16. Каковы причины возникновения гемоглобинопатий?
17. Какие причины обусловливают возникновение приобретенных гемолитических анемий?
18. Какова картина крови при иммунных гемолитических анемиях?
ЛЕЙКОЗЫ
Лейкозы — это опухолевые заболевания кроветворной системы. Термин «лейкозы» собирательный. Он объединяет многочисленные новообразования, возникающие из кроветворных клеток. При этом в первую очередь поражается костный мозг.
§ 73. Происхождение
Единой общей причины возникновения лейкозов нет. Обнаружено множество разнообразных причин, вызывающих различные формы лейкозов. В одних случаях — это воздействие вируса, в других — ионизирующей радиации, в третьих — химических веществ. Все перечисленные и многие другие факторы вызывают повреждение и изменение Свойств генетического аппарата кроветворных клеток (мутацию). Из поврежденной клетки возникает опухоль. Опухоль представляет собой клон, то есть потомство одной измененной клетки. Опухолевый рост начинается с клеток — предшественников кроветворения.
Кроветворная ткань подвижна. Клетки ее обладают способностью, покидая костный мозг, поступать в кровеносное русло, поэтому опухоли крови очень быстро метастазируют. Лейкозные клетки образуются обычно в костном мозге. Патологические (анаплазированные) клетки бурно разрастаются и вытесняют элементы нормального кроветворения. Метастазы возникают прежде всего в кроветворных органах — селезенке и лимфатических узлах, поэтому заболевание носит системный характер. Кроме того, опухолевые клетки заносятся и в другие органы и ткани, где образуются метастатические очаги патологического кроветворения.
§ 74. Классификация
В основу классифицирования лейкозов положены свойства клеток, нз которых состоит опухоль (субстрат опухоли).
По клеточному составу опухолей все лейкозы разделены на 2 группы: острые и хронические. Это деление не клиническое, т. е. не отражает течения заболевания, а морфологическое — основанное на особенностях строения опухолевых клеток.
Группу острых лейкозов объединяет общий признак — субстрат опухоли составляют самые молодые клетки. Это либо клетки — предшественники кроветворения, либо бластные формы — родоначальники отдельных рядов гемопоэза. По схеме кроветворения это клетки классов II, III, IV.
При хронических лейкозах субстрат опухоли составляют созревающие или зрелые клетки, т. е. класс V и VI схемы кроветворения.
Внутри групп острых и хронических лейкозов классификация проводится по названиям тех клеток, из которых возникла опухоль. Таким образом, острый лейкоз может быть миелобластным, промиелоцитарным, монобластным, лимфобластным, плазмобластным, эритробластным или мегакариобластным—если субстрат опухоли составляют клетки класса IV, и недифференцируемым, если субстрат опухоли представлен клетками классов II и III, морфологически неотличимыми друг от друга. К группе хронических лейкозов относятся хронический миелолейкоз, хронический лимфолейкоз, эритремия, хронический моноцитарный лейкоз, миелофиброз, миеломная болезнь.
§ 75. Морфологическая и цитохимическая характеристика лейкозных клеток
Решающая роль в постановке диагноза принадлежит лабораторному исследованию морфологического состава крови, костного мозга, лимфатических узлов и селезенки.
В лаборатории подсчитывают количество форменных элементов костного мозга и изучают его клеточный состав в мазке, приготовленном и окрашенном так же, как и мазок крови. Важное значение придается количеству лейкоцитов в единице объема крови, лейкозы могут протекать как с нормальным числом лейкоцитов, так и с лейкоцитозом и лейкопенией. Количество лейкоцитов— признак непостоянный для какого-либо вида лейкоза. Кроме того, число лейкоцитов в единице объема крови зависит от стадии заболевания.
Лейкозные клетки обладают целым рядом морфологических и химических особенностей, отличающих их .от нормальных клеток. Анаплазированные клетки характеризуются увеличением ядра, наличием в нем крупных грубых нуклеол. Отмечается вакуолизация ядра. Цитоплазма резко базофильна, часто вакуолизирована. В цитоплазме некоторых молодых опухолевых клеток встречается зернистость. Степень анаплазии клеток значительно более выражена при острых лейкозах, чем при хронических.
В определении формы лейкоза решающее значение имеет, наряду с морфологическим, цитохимическое исследование. Благодаря цитохимическим методам удается выявить целый ряд различий между лейкозными клетками.
Цитохимические исследования дают возможность проводить микрохимический анализ клеточных структур, биохимические исследования на уровне клетки. В клетках определяется наличие липидов, гликогена, мукополисаха
ридов и активность ряда ферментов: пероксидазы, кислой и щелочной фосфатаз, неспецифических эстераз (рис. 50, см. на цвет. вкл.).
Пероксидаза обнаруживается с помощью бензидина во всех элементах нейтрофильного ряда от миелоцитов до сегментоядерных нейтрофилов. Цитоплазма клеток при наличии пероксидазы окрашивается в желтый цвет (а). В лимфоидных клетках пероксидаза отсутствует. Этот признак используется для дифференцировки миелобластного и лимфобластного лейкозов.
Гликоген содержится во всех клетках в большем или меньшем количестве. Он обнаруживается преимущественно в зрелых гранулоцитах. В миелобластах гликоген или вовсе не содержится, или представлен в виде гомогенной массы розового цвета при окраске фуксином, входящим в состав реактива Шиффа. В лимфоцитах гликоген выявляется в виде гранул красного цвета (б). Его содержание повышается при хроническом лимфатическом и остром лимфобластном лейкозах.
Липиды выявляются при окраске черным Суданом в клетках миелоидного ряда в виде зерен черного цвета, содержащихся в цитоплазме и в ядре (в). В лимфоидных клетках липидов мало и поэтому они не обнаруживаются.
Кислая фосфатаза активна в молодых предстади-ях нейтрофилов и в монобластах. В местах активности фермента появляется красное или коричневое окрашивание цитоплазмы в зависимости от способа окраски (г). В зрелых нейтрофилах кислая фосфатаза теряет активность. Диагностическое значение имеет при острых миелобла-стных и монобластных лейкозах.
Щелочная фосфатаза обнаруживается в зрелых нейтрофилах в виде зерен черного или коричневого цвета, выявляемых специфической реакцией. При хроническом миелолейкозе ее активность в лейкемических нейтрофилах снижается, что имеет большое значение для диагностики данного заболевания.
Неспецифическая эстераза практически содержится во всех клетках крови и костного мозга, но в клетках нейтрофильного ряда содержание ее выше, чем в лимфоидных элементах. Наибольшей активностью неспецифическая эстераза обладает в клетках моноцитарного ряда. При специальном методе окраски цитоплазма монобластов заполняется мелкой темно-бурой зернистостью (д). Реакция используется для диагностики острого моно-бластного лейкоза (рис. 54, д).
Кислые мукополисахариды содержатся главным образом в зернистости незрелых гранулоцитов. Наиболее специфично их выявление при остром промиелоци-174
тарном лейкозе. Специальные методы окраски позволяют обнаружить в цитоплазме промиелоцитов крупные розововишневые гранулы.
§ 76. Картина крови при остром лейкозе
Для всех форм лейкозов характерно резкое изменение кроветворения, т. е. полное или почти полное замещение нормальной кроветворной ткани патологической тканью опухоли. Субстрат опухоли составляют бластные клетки. Эти патологические клетки теряют способность к созреванию. В периферической крови появляются бластные формы: миелобласты, лимфобласты, эритробласты и др. Морфологически бластные клетки мало отличаются друг от друга, поэтому для их дифференцировки применяются цитохимические методы.
В мазке периферической крови и костного мозга преобладают «бласты» (до 99%), но встречаются и единичные зрелые клетки (1—5%). Созревающих клеток, промежуточных между ними, нет. Эго явление называется «лейкемическим зиянием» и характерно только для острого лейкоза (рис. 51, см. на цвет. вкл.).
В пунктате увеличенных лимфоузлов, печени и селезенки обнаруживают те же бластные формы (метаплазия).
Острый лейкоз часто протекает с лейкоцитозом в периферической крови (до 100-10’—300-10 ’ в 1 л). Однако это заболевание может сопровождаться резкой лейкопенией (до 0,2-10’—0,3-10’ в 1 л крови). Иногда количество лейкоцитов может оставаться нормальным.
Вследствие бурного разрастания опухолевой ткани угнетаются эритроцитарный и тромбоцитарный ростки кроветворения. Это проявляется резкой анемией: снижением гемоглобина (до 0,3—1 г/л) и эритроцитов (до 1-Ю12—1,5-1012 в 1 л крови). Параллельно развивается тромбоцитопения. СОЭ значительно возрастает.
§ 77. Картина крови при хронических лейкозах
Хронические лейкозы характеризуются меньшей степенью анаплазии, чем острые. Субстрат опухоли представлен созревающими и зрелыми клетками. В отличие от острого лейкоза бластных форм в периферической крови мало. Они появляются, главным образом, при обострениях. Общим признаком хронических лейкозов служит значительное увеличение количества лейкоцитов.
Хронический миелолейкоз — это опухоль миелоидной ткани, которая сохраняет способность дифференцироваться до зрелых клеток. Субстрат опухоли составляют
нейтрофилы. Клеточный состав костного мозга мало чем отличается от нормального. В нем представлены все виды клеток, но изменено их соотношение. Количество лейкоцитов увеличивается в 5 —10—20 раз.
В периферической крови высокий лейкоцитоз, до 200-Ю9—400-Ю9, а иногда количество лейкоцитов достигает 1000-109 в 1 л крови.
При хроническом миелолейкозе периферическая кровь полностью повторяет картину костного мозга. В ней содержатся промиелоциты, миелоциты, метамиелоциты, зрелые формы нейтрофилов. Могут встречаться единичные миелобласты. Характерно увеличение количества эозинофилов и базофилов (рис. 52, см. на цвет. вкл).
Морфологически лейкозные клетки почти не отличаются от здоровых. Только хромосомный анализ обнаруживает их различие. Во всех клетках крови больных хроническим миелолейкозом вместо нормальной хромосомы из 22 пары обнаруживается патологическая хромосома с укороченным длинным плечом, так называемая Ph-хромосома (филадельфийская).
В начале заболевания количество гемоглобина, эритроцитов и тромбоцитов остается в пределах нормы. При обострении и в терминальной (предсмертной) фазе болезни, когда развивается так называемый «бластный криз», картина крови напоминает острый лейкоз: увеличивается количество миелобластов, развивается резкая анемия и тромбоцитопения. СОЭ увеличена до 30—70 мм/ч.
Хронический лимфолейкоз — это опухоль лимфоидной ткани, субстрат которой составляют морфологически зрелые лимфоциты. Заболевание протекает чаще всего со значительным лейкоцитозом — до 100-109 и более лейкоцитов в 1 л крови. В пунктате костного мозга и в периферической крови количество лимфоцитов достигает 80—90 %. Строение этих лимфоцитов незначительно отличается от морфологии нормальных клеток. Однако мембраны лейкозных лимфоцитов легко повреждаются, что приводит к быстрому их лизису. При приготовлении мазка крови часть лимфоцитов неизбежно разрушается. Наличие таких клеток лейколиза типично для хронического лимфолейкоза. Кроме зрелых лимфоцитов в мазке встречаются пролимфоциты и единичные лимфобласты. Небольшое количество гранулоцитов всегда находится в периферической крови. Постепенно развивается анемия (рис. 53, см. на цвет. вкл).
Хронический моноцитарный лейкоз— опухолевый процесс, который характеризуется значительным увеличением в костном мозге и периферической крови моноцитов и моноцитоподобных клеток. Количество лейкоцитов может быть нормальным или несколько повы-176
шейным до 15-109-20-109 в 1 л крови. Количество эритроцитов и тромбоцитов обычно нормальное, лишь иногда возникает анемия. Число моноцитов в лейкоцитарной формуле увеличено до 30—40%. Морфологически моноцитоподобные клетки почти не отличаются от нормальных моноцитов. В мазке крови часто встречаются нормобласты. СОЭ у большинства больных значительно увеличена.
Характерной особенностью хронического моноцитарного лейкоза служит повышение в крови и выделение с мочой фермента лизоцима.
Эритремия — опухоль кроветворной ткани, характеризующаяся разрастанием клеток эритроцитарного ростка костного мозга. Субстратом опухоли служат зрелые клетки — эритроциты.
Начальная фаза заболевания характеризуется панцито-зом, т. е. увеличением количества всех видов форменных элементов крови. Число эритроцитов возрастает до 61012—8-1012 в 1 л крови, количество гемоглобина превышает 180—220 г/л. Лейкоцитоз обычно колеблется в пределах от 10-109 до 15-109 в 1 л крови, но в отдельных случаях достигает 50-109 . Количество тромбоцитов повышено до 1000-109 в 1 л крови.
В мазке крови отмечается анизоцитоз, пойкилоцитоз, полихромазия, базофильная пунктация эритроцитов. Появляются единичные нормоциты.
В лейкограмме — нейтрофилез со сдвигом лейкоцитарной формулы влево. Наблюдается токсигенная зернистость нейтрофилов.
Характерным признаком эритремии служит повышение вязкости крови и гематокритной величины — соотношения объемов форменных элементов и жидкой части крови. СОЭ уменьшена, иногда эритроциты совсем не оседают.
В терминальной фазе заболевания все гематологические показатели изменяются. Возникает анемия, снижается количество тромбоцитов. В периферической крови появляются молодые формы гранулоцитов, картина крови становится схожей с острым или хроническим миелолейкозом, или же с миелофиброзом.
Миелофиброз характеризуется одновременным опухолевым поражением костного мозга и разрастанием в нем фиброзной ткани, что приводит к постепенному угнетению костномозгового кроветворения.
В начале заболевания наблюдается панцитоз: увеличивается количество лейкоцитов до 10-109—40-109, появляется эритроцитоз и тромбоцитоз. В лейкоцитарной формуле обнаруживается нейтрофилез со сдвигом влево до метамиелоцитов и миелоцитов. Иногда встречаются и миелобла-сты. Увеличено количество базофилов.
По мере замещения костного мозга фиброзной тканью развивается анемия, которая часто носит аутоиммунный характер. Нейтропения, СОЭ повышена незначительно.
Миеломная болезнь — опухолевое заболевание кроветворной системы, характеризующееся злокачественным разрастанием плазматических клеток. Плазматические клетки в норме принимают участие в гуморальном иммунитете, в образовании иммуноглобулинов. Патологически измененный клон плазматических клеток при миеломной болезни усиленно вырабатывает однородный (мо-ноклоновый) белок—парапротеин. Повышается общее количество белка в крови. Происходит выделение парапротеина с мочой (белок Бенс — Джонса).
В костном мозге появляются так называемые миеломные клетки. Это типичные плазмобласты — крупные клетки с резко выраженной базофилией и вакуолизацией цитоплазмы, с одним или несколькими ядрами, содержащими крупные нуклеолы.
В начальной стадии заболевания заметных изменений в крови нет. При прогрессировании болезни нередко развивается лейкопения, нормохромная анемия. Характерно резкое увеличение СОЭ до 50—90 мм/ч.
Вопросы для повторения |
1. Что называется лейкозом? '3
2. Каков механизм возникновения лейкозов? ’
3. Каковы основные принципы классификации лейкозов?
4. Каковы общие морфологические и цитохимические изменения лейкозных клеток?
5. Какими гематологическими признаками характеризуются острые лейкозы?
6. Какова картина крови при хроническом миелолейкозе, хроническом лимфолейкозе, хроническом моноцитарном лейкозе, при эпитремии, миелофиброзе, миеломной болезни? j
СПЕЦИАЛЬНЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ § 78. Определение гематокритной величины
Гематокрит — это соотношение между объемом фор менных элементов крови и объемом плазмы. Метод основан на разделении плазмы и эритроцитов с помощью центрифугирования.
Для определения гематокрита необходимо следущее оборудование: микроцентрифуга, капиллярные трубки, которые придаются к центрифуге (рис. 54).
Реактив: гепарин 5000 мЕ/мл, разведенный дистиллированной водой в соотношении 1:5 или трилон-Б (ЭДТА натрия или калия).
Рис. 54. Микроцентрифуга для определения гематокритной величины.
Рис. 55. Вискозиметр.
Для исследования пригодна как капиллярная, так и венозная кровь.
Ход определения. Для предотвращения свертывания крови капилляры перед работой промывают одним из предложенных растворов антикоагулянта и высушивают. Заполняют капилляр на 7/8 его длины кровью из пальца или из вены и закупоривают с одного конца пластилином. Капилляры помещают в центрифугу таким образом, чтобы закупоренные концы упирались в резиновую прокладку на периферии радиально расположенных желобков. Центрифугируют в течение 5 мин при 8000 об/мин.
Гематокритную величину определяют с помощью отсчетной шкалы, прилагаемой к центрифуге.
В норме объем массы эритроцитов меньше объема плазмы. Гематокритная величина у женщин составляет ^6—42 %, у мужчин—40—48 %.
Увеличение гематокрита наблюдается при эритремии и обезвоживании организма, уменьшение—при анемиях.
§ 79. Определение вязкости
Определение вязкости крови основано на сравнении скорости продвижения крови й дистиллированной воды в одинаковых капиллярах в вакууме при комнатной температуре.
Вязкость крови определяется в приборе вискозиметре (рис. 55).
Устройство прибора. В вискозиметре имеются 2 параллельно идущие капиллярные градуированные пипетки одинакового диаметра, соединенные с одного конца трехходовым краном. Этот кран может соединять капиллярные трубочки между собой и каждую из них с резиновой трубкой, через которую отсасывают воздух, создавая в приборе отрицательное давление. Второй конец пипеток свободен. Капиллярные пипетки закреплены на подставке.
Пипетки вискозиметра должны быть безукоризненно чистыми. Перед работой и после нее их промывают насыщенным раствором аммиака, спиртом или эфиром и тщательно высушивают.
Ход определения.В правую капиллярную пипетку набирают дистиллированную воду до метки 0, следя за тем, чтобы в нее не попали пузырьки воздуха. В левый капилляр насасывают кровь из пальца, которая должна вытекать из места прокола без всякого давления. Набирают кровь без пузырьков воздуха также до нулевой отметки. Проворачивают трехходовый кран таким образом, чтобы соединить обе капиллярные пипетки с резиновой трубкой, через которую втягивают воздух из обеих пипеток для образования вакуума. При этом столбики воды и крови продвигаются вперед с разной скоростью, которая зависит от их вязкости. Как только столбик крови дойдет до метки 1 втягивание воздуха прекращают. За это время вода, обладающая меньшей вязкостью, продвигается значительно дольше, чем кровь. Вязкость крови определяется по длине пути, пройденного водой, который отсчитывается по шкале градуированной пипетки.
Вязкость крови в норме равна для мужчин 4,3—5,4, а для женщин 3,9—4,9 делений шкалы.
Наблюдается зависимость вязкости крови от количества и объема эритроцитов, общего содержания белка и соотношения его фракций в плазме, а также от содержания в крови углекислоты.
Повышение вязкости отмечается при сгущении крови и некоторых видах лейкозов (эритремия, миелофиброз), понижение — при анемиях.
§ 80. Определение осмотической резистентности эритроцитов
Осмотическая резистентность—это устойчивость эритроцитов по отношению к гипотоническим растворам содей. В растворе с осмотическим давлением, равным осмотическому давлению крови, эритроциты не изменяются. Солевой раствор, имеющий осмотическое давление, одинаковое с осмотическим давлением крови, называется изотоническим. Изотоническим является раствор хлорида натрия в концентрации 0,85—0,9%. При помещении эритроцитов в раствор меньшей концентрации — гипотонический раствор, они набухают и гемолизируются. В гипертоническом растворе эритроциты сморщиваются, так как вода из них выходит в раствор с большим осмотическим давлением. На этих свойствах эритроцитов основано определение их осмотической резистентности.
Степень гемолиза их измеряется в гипотонических растворах хлорида натрия определенной концентрации.
Реактив: основной раствор (27,31 г двузамещенного фосфата натрия Na2HPO4, 4,86 г однозамещенного фосфата натрия NaH2PO4-2H2O, 180 г хлорида натрия в 2 л дистиллированной воды); PH раствора 7,4.
По своей осмотической концентрации основной раствор соответствует 10% раствору хлорида натрия. Его разводят в 10 раз, получая рабочий раствор, осмотическая концентрация которого соответствует 1% раствору хлорида натрия. Из рабочего раствора готовят разведения хлорида натрия следующих концентраций: 0,85; 0,75; 0,70; 0,65; 0,60; 0,55; 0,50; 0,45; 0,40; 0,35; 0,30; 0,20 и 0,10%. Можно готовить сразу по 100 мл этих растворов и хранить в течение 2 нед в холодильнике.
Ход определения. В 2 стерильные пробирки, содержащие по 2 капли гепарина, берут по 1,5 мл крови. 1-ю пробирку помещают на сутки в термостат, 2-ю — используют в день взятия крови.
В 14 центрифужных пробирок разливают по 5,0 мл приготовленных растворов с последовательно понижающейся концентрацией. В 1-ю пробирку помещают 5,0 мл рабочего раствора с концентрацией 1%. В каждую пробирку прибавляют по 0,02 мл гепаринизированной крови, перемешивают и оставляют на 30 мин при комнатной температуре (20° С). Центрифугируют при 2000 об/мин в течение 5 мин. Надосадочную жидкость из каждой пробирки сливают в чистую пробирку с соответствующим номером.
Фотометрируют на ФЭКе при длине волны 500—560 нм (зеленый светофильтр) в кювете с толщиной слоя 10 мм пРотив холостой пробы.
Холостая проба—надосадочная жидкость в пробирке, содержащей 1% раствор хлорида натрия.
Расчет. За 100% гемолиза принимают гемолиз в пробирке, содержащий 0,1% раствор хлорида натрия. Сравнивая величины экстинкции надосадочной жидкости остальных пробирок с экстинкцией, принятой за 100%, вычисляют процент гемолиза в каждой пробирке по формуле:
Ех-100
“ЁТ"’
где Ej — экстинкция надосадочной жидкости в пробирке с 0,1% раствором хлорида натрия; Ех — экстинкция исследуемой пробы; 100 — процент гемолиза в пробирке с 0,1% раствором хлорида натрия.
На следующий день повторяют исследование с кровью, инкубированной 24 ч в термостате при 37° С. Это связано с тем, что в ряде случаев при микросфероцитарной гемолитической анемии понижение осмотической резистентности выявляется только в инкубированной крови.
Нормальные величины гемолиза в свежей и инкубированной крови представлены в табл. 8.
Таблица 8. Нормальные величины гемолиза
Концентрация Гемолиз, % %
% в свежей крови в крови, инкубиро*
ванной в течение
суток
0,20 98—100 95—100
0,30 97—100 85—100
0,35 90—100 75—100
0,40 50—100 65—100
0,45 5—45 55—95
0,50 0—6 40—85
0,55 0 15—70
0,60 0 0—40
0,65 0 0—10
0,70 0 0—5
0,75 0 0
0,85 0 ' 0
Глава III СИСТЕМА ГЕМОСТАЗА. ГЕМОРРАГИЧЕСКИЕ ДИАТЕЗЫ МЕХАНИЗМЫ ГЕМОСТАЗА
Гемостаз — это совокупность физиологических процессов, обеспечивающих остановку кровотечения.
Существует два механизма остановки кровотечения: сосудисто-тромбоцитарный и гемокоагуляционный (свертывание крови).
§ 81. Сосудисто-тромбоцитарный гемостаз
В остановке кровотечения из мельчайших сосудов принимают участие как сами сосуды, так и форменные элементы крови—тромбоциты и эритроциты. При повреждении кровеносных капилляров происходит их рефлекторный спазм, что ведет к кратковременной остановке кровотечения. Этот спазм поддерживается веществами, которые выделяют тромбоциты — серотонином, адреналином и норадреналином.
Участие тромбоцитов в процессе гемостаза этим не ограничивается. Они обладают способностью приклеиваться к поврежденным участкам сосудистой стенки (адгезия). Направляясь к месту повреждения сосуда, тромбоциты изменяют свою форму. Они округляются, выпускают множество нитчатых отростков (ложноножек), что способствует их склеиванию между собой и образованию скоплений по 15—20 тромбоцитов (агрегация). К первично адгезированным тромбоцитам приклеиваются агрегаты, организуя тромбоцитарную пробку, которая быстро закрывает просвет сосуда, прекращая кровотечение. Таким образом останавливается кровотечение из мельчайших сосудов. При повреждении более крупных сосудов с высоким кровяным давлением кровоток быстро «смывает» тромбоцитарную пробку и кровотечение возобновляется. В этих случаях в остановке кровотечения принимает участие свертывающая система крови.
§ 82. Свертывающая система крови
В основе современных представлений о свертывании крови — гемокоагуляции — лежит теория, предложенная в конце прошлого века русским ученым А. А. Шмидтом. Согласно этой теории процесс свертывания крови проходит три фазы.
Фаза I — образование тромбокиназы (плазменного тромбопластина).
Фаза II — образование тромбина.
Фаза III — образование фибрина, который составляет основу сгустка.
Все эти процессы протекают в присутствии ионов кальция (Са2+).
Тромбокиназа | с... Протромбин > Тромбин
Фибриноген-->Фибрин
В результате дальнейших исследований выяснилось, Что свертывание крови представляет собой сложный
ферментативный процесс, в котором участвует множество факторов, находящихся в плазме крови, в клетках крови и в тканях. Плазменные факторы свертывания обозначают, ся римскими цифрами, клеточные — арабскими.
Фактор I (фибриноген) — грубодисперсный белок, находящийся в плазме в растворенном состоянии. В процессе свертывания крови он становится нерастворимым, образуя фибрин, состоящий из тонких нитей — фибрилл, переплетающихся между собой в виде сети.
Фактор II (протромбин) — грубодисперсный белок плазмы— неактивный предшественник тромбина.
Тромбин (Па) способствует превращению фибриногена в фибрин, активирует тромбоциты, из которых под его влиянием освобождаются клеточные факторы свертывания.
Фактор III (тромбопластин) — липопротеид, который освобождается при повреждении тканей. Поступая в плазму крови, он воздействует на протромбин, превращая К его в тромбин. Аналогичным действием обладает тромбо-
киназа плазмы.
Фактор IV (ионы кальция Са2+) принимает участие в процессе свертывания на разных его этапах.
Фактор V (проакцелерин) — неактивная форма акцелерина.
Фактор VI (акцелерин)—белок плазмы крови глобулиновой природы, ускоряющий превращение протромбина в тромбин.
Фактор VII (проконвертин) — неактивная форма фермента конвертина (белка глобулиновой природы), активизирующего действие тканевого тромбопластина.
Фактор VIII (антигемофильный глобулин А) принимает участие в образовании тромбокиназы.
Фактор IX (Крисмас-фактор, антигемофильный глобулин В) катализирует образование тромбокиназы.
Фактор X (фактор Стюарта—Прауэра) — белковый компонент, участвующий в образовании тромбокиназы и, непосредственно, в превращении протромбина в тромбин.
Фактор XI (фактор Розенталя) ускоряет образование тромбокиназы.
Фактор XII (фактор контакта или фактор Хагемана)— белковый компонент плазмы глобулиновой природы, с которого начинается процесс свертывания крови.
Фактор XIII (фибринстабилизирующий фактор или фибриназа) участвует в переходе растворимого фибрина в нерастворимую форму.
Кроме плазменных, в свертывании участвует ряд клеточных факторов, выделяемых форменными элементами крови. Первостепенную роль играют тромбоцитарные факторы. При агрегации тромбоцитов из них выделяются
вещества, которые ускоряют процесс свертывания крови. Наибольшее значение для свертывания имеет тромбоцитарный фактор 3 (фосфолипид).
Все перечисленные факторы являются ускорителями свертывания крови и называются акцелераторами (активаторами). Большинство из них ферменты, которые синтезируются в печени. Для синтеза факторов II, VII, IX и X необходим витамин К.
В кровяном русле имеются также вещества, замедляющие свертывание — ингибиторы.
Все факторы крови находятся в неактивном состоянии, ио при повреждении сосудистой стенки происходит их быстрая и последовательная активация, результатом которой является свертывание крови.
Существует два основных механизма свертывания крови: внутренний и внешний. Внутренний механизм «включается» при изменении состояния сосудистой стенки. При соприкосновении крови с поврежденной поверхностью сосуда активизируется фактор контакта XII, который действует на фактор XI, приводя его в активное состояние.
Активированный фактор XI (Х1а) активизирует фактор IX, превращая его в 1Ха. Он в свою очередь действует на VIII неактивный фактор, превращая его в Villa. Активированные факторы IX и VIII в присутствии Са2+ воздействуют на фактор X, вызывая его активацию. Ха фактор вместе с плазменным фактором V и фосфолипидным фактором 3 тромбоцитов в присутствии ионов кальция образует активное вещество — тромбокиназу. На этом заканчивается первая фаза процесса свертывания крови.
Под воздействием тромбокиназы протромбин превращается в тромбин. Это вторая фаза процесса свертывания.
Тромбин действует на фибриноген, превращая его в фибрин. Небольшие количества тромбина активируют фактор XIII (фибринстабилизирующий), который делает фибрин нерастворимым. Образование фибрина происходит следующим образом: от молекулы фибриногена отщепляется небольшой фрагмент, а оставшаяся часть молекулы образует качественно новое вещество — фибрин-мономер. Мономеры соединяются между собой (полимеризуются), превращаясь в фибрин-полимер. Это растворимое вещество— фибрин s (от лат. solubile — растворимый). Под влиянием ионов кальция и фибринстабилизирующего фактора он переходит в нерастворимое состояние — фибрин i (от лат. insolubile — нерастворимый). Этим заканчивается третья фаза свертывания.
Таким образом, процесс свертывания крови представляет цепь последовательных реакций — ферментативный каскад, в котором активизированные ферменты предыду-
Внутренний механизм
Внешний механизм
Контакт, коллаген, протеазы, катехоламины
ш
I Кининоген « Комплекс 1 I <Ф Фицжеральда) |зпу Лда + п кинин
Прекалликреин
(Ф- Флетчера) тканевый
\ тромбопластин
,^-Калликреин \ комплекс 1а
Антитромбин Ш + гепарин
Кинин
-спа
комплекс 2
Комплекс 3
1k
па------
j- t t
Фибриноген хша
* f
Фибрин Фибрин S ’^Фибрин I Мономер
Рис. 56. Каскадно-комплексная схема свертывания крови.
Тонкие стрелки—активирующее влияние; толстые стрелки—превращения факторов в активную форму «а»; пунктирные линии—действие антикоагулянтов.
щей реакции служат катализаторами для активации после-дующих факторов.
Процесс взаимодействия факторов свертывания весьма сложен. Согласно современным представлениям, различные плазменные факторы действуют не изолированно, а в комплексе с фосфолипидом тромбоцитов (фактор 3) и ионами кальция. Этот процесс изображают в виде каскадно-комплексной схемы свертывания крови (рис. 56).
Внутренний механизм свертывания протекает медленно— за 5—10 мин. Большая часть этого времени уходит на первую фазу, а вторая и третья фазы протекают за 20—30 с. По внутреннему механизму происходит свертывание крови и в пробирке при ее контакте со стеклом.
Внешний механизм свертывания крови «включается» при повреждении тканей. Из них в кровь поступает тканевой тромбопластин (фактор III). Взаимодействуя с фактором VII плазмы, в присутствии ионов кальция, он активирует фактор X. Активированный Ха фактор, вместе с факторами V и 3 (тромбоцитарным) в присутствии ионов кальция, действует так же, как тромбокиназа, т. е. превращает протромбин в тромбин.
Внешний механизм «запуска» процесса свертывания крови протекает быстро. Он длится около 20 с и служит пусковым для внутреннего механизма свертывания. Кроме того, образующееся при этом небольшое количество тромбина стимулирует агрегацию тромбоцитов и освобождение клеточных факторов гемостаза.
Внутренний и внешний механизмы свертывания не изолированные, а тесно взаимосвязанные процессы. Связь осуществляется с помощью калликреин-кининовой системы. Калликреины и кинины — это белковые вещества, предшественники которых синтезируются в печени и циркулируют в крови. Калликреин-кининовая система стимулируется ХПа фактором. Она ускоряет активацию факторов XI и VII, т. е. компонентов как внутреннего, так и внешнего механизма свертывания крови.
В результате процесса свертывания образуется сгусток крови. Через 15—20 мин начинается его ретракция, т. е. сокращение. В этом процессе участвуют тромбоциты, выделяющие вещество тромбостенин. Тромбоциты прилипают к нитям фибрина и под влиянием тромбостенина происходит скручивание и укорочение этих нитей. Одновременно сокращаются псевдоподии тромбоцитов, которые тянут за собой фибрин. Сгусток сокращается и уплотняется. Ретракция продолжается от 30 мин до 30 ч.
Свертывание крови — защитный механизм, который предохраняет организм от значительных кровопотерь. В физиологических условиях кровь находится в сосудах в жидком состоянии. Сохранение крови в сосудистом русле в жидком состоянии обеспечивается динамическим равновесием между свертывающей и противосвертывающей системами крови.
§ 83. Противосвертывающая система крови
Противосвертывающая система крови представлена двумя группами антикоагулянтов: физиологическими, которые образуются независимо от свертывания крови и фибринолиза (растворение сгустка) и антикоагулянтами, образующимися в процессе свертывания крови и фибринолиза. Эти вещества состоят из белков, липидов, фосфатидов, мукополисахаридов.
К физиологическим антикоагулянтам относятся анти-тромбокиназы (антитромбопластины), антитромбины, гепарин и др. Все эти вещества оказывают ингибирующее влияние на различные фазы процесса свертывания крови.
Антитромбокиназы тормозят начальную фазу свертывания и угнетают активность образовавшейся тромбокиназы.
Антитромбины замедляют переход протромбина в тромбин и препятствуют воздействию тромбина на фибриноген.
Гепарин нарушает образование тромбокиназы, инактивирует тромбин, связывает фибриноген, т. е. тормозит все фазы процесса свертывания.
Ко второй группе антикоагулянтов относятся веще
ства, которые образуются в результате свертывания крови и фибринолиза и обладают антикоагулянтным действием.
Одновременно со свертыванием крови осуществляется и самоторможение этого процесса. Каждый активированный фактор свертывания тормозит действие активатора. Так, фибрин адсорбирует на себе и инактивирует тромбин, который образовался в процессе свертывания. Фактор XI, который активизировался под влиянием фактора ХПа, тормозит действие фактора XII и т. д.
Фибринолиз (растворение сгустка) — это ферментативный процесс, в котором также принимают участие активаторы и ингибиторы. Вся система, участвующая в растворении сгустка, носит название фибринолитической системы. Фибринолиз происходит при взаимодействии плазменных, тканевых и микробных факторов. На него оказывают влияние и ферментные системы крови (калликреин-кининовая и др.). Таким образом, фибринолитическая система, так же как и свертывающая, имеет и внутренний и внешний механизм активации.
Основной фермент фибринолиза — плазмин или фибринолизин содержится в плазме в виде неактивного предшественника плазминогена (профибринолизина). Плазмин расщепляет фибрин, фибриноген, протромбин и тромбин. Тормозит его действие ингибитор — антиплазмин.
Фибринолитическая система связана со свертывающей системой. Ее активизация происходит одновременно с началом свертывания крови, с активации фактора XII.
В результате фибринолиза растворяются образовавшиеся сгустки крови и фибрин, отложившийся в протоках желез, в мальпигиевых тельцах почки. Этим обеспечивается восстановление кровотока, проходимость протоков желез, нормальное мочеотделение.
Вопросы для повторения
1. Что называется гемостазом?
2. Как осуществляется сосудисто-тромбоцитарный механизм гемостаза? .Jt
3. Каковы основные фазы процесса свертывания крови? Ж
4. Какие факторы принимают участие в процессе свертывания кровИяВ
5. Каков внутренний механизм процесса свертывания крови? Ж
6. Каков внешний механизм процесса свертывания кровн?
7. Каким образом осуществляется взаимосвязь между внутренним и внешним механизмами свертывания крови?
8. Как происходит ретракция кровяного сгустка?
9. Почему в физиологических условиях кровь в сосудах не свертывается?
10. Каково действие физиологических ингибиторов свертывания?
11. Чем характеризуется группа ингибиторов, образующихся в процессе свертывания крови и фибринолиза?
12. Каков механизм фибринолиза?
ГЕМОРРАГИЧЕСКИЕ ДИАТЕЗЫ
§ 84. Классификация
Нарушение процесса гемостаза называется коагулопатией. Различают два вида коагулопатий: одни сопровождаются кровотечениями и носят название геморрагических диатезов, при других — наблюдается склонность к тромбозам.
Геморрагические диатезы — это различные заболевания, общим признаком которых служит склонность к кровоточивости. Различают наследственно-семейные и приобретенные формы этих заболеваний.
В зависимости от механизмов возникновения геморрагических диатезов их разделяют на несколько групп.
Группа I — заболевания, связанные с количественными и качественными изменениями тромбоцитов —
тромбоцитопении и тромбоцитопатии.
Группа II — заболевания, связанные с нарушениями коагуляционного гемостаза, т. е. с изменениями в свертывающей системе крови.
Группа III — заболевания, обусловленные нарушениями гемостаза, связанными с изменением сосудистой стенки.
§ 85. Тромбоцитопении и тромбоцитопатии
Уменьшение количества тромбоцитов носит название тромбоцитопении. Тромбоцитопении могут возникать при усиленном разрушении кровяных пластинок, повышенном их потреблении или недостаточном образовании. Различают наследственные и приобретенные тромбоцитопении.
При наследственных тромбоцитопениях имеет место нарушение функциональных свойств тромбоцитов. По наследству передаются дефекты в строении мембран тромбоцитов, снижение их ферментативной активности, недостаток выработки тромбопоэтинов — веществ, способствующих образованию тромбоцитов.
При приобретенных тромбоцитопениях угнетается тромбоцитопоэз в костном мозге (например, при апластических анемиях).
Повышенное потребление тромбоцитов наблюдается при тромбозах. Причиной разрушения тромбоцитов может быть их механическое повреждение искусственными клапанами сердца. Усиленное разрушение тромбоцитов возникает и при воздействии на них антитромбоцитарных антител — это так называемые иммунные тромбоцитопении. При этих состояниях количество мегакариоцитов в костном мозге чаще всего бывает повышенным или
нормальным. Тромбоцитопения же появляется вследствие резкого укорочения продолжительности жизни кровяных пластинок: они живут всего несколько часов вместо 7—10 дней.
Картина крови. Резкое снижение числа тромбоцитов, иногда полное их исчезновение. Кровяные пластинки могут быть больших или малых размеров, наблюдается пойкилоцитоз, появляются базофильные тромбоциты, уменьшается зернистость.
Содержание гемоглобина и эритроцитов может быть нормальным. При кровопотерях возникает постгеморрагическая анемия и соответственно увеличивается число ретикулоцитов. Количество лейкоцитов нормальное или немного увеличенное. Может быть эозинофилия.
Удлиняется время кровотечения, определяемое по Дуке. Нарушается ретракция кровяного сгустка. Свертываемость крови остается нормальной.
Повышенная кровоточивость может быть обусловлена не только уменьшением количества тромбоцитов, но и качественной их неполноценностью.
Нарушения гемостаза, возникающие в результате качественных изменений в тромбоцитах, называются тромбоцитопатиями. При тромбоцитопатиях количество тромбоцитов бывает обычно нормальным или немного сниженным. Имеются значительные нарушения адгезивной и агрегационной функций тромбоцитов, а также снижение активности фактора 3.
Основным лабораторным признаком этих состояний служит удлинение времени кровотечения.
§ 86. Геморрагические диатезы, связанные с нарушениями в системе свертывания крови
Эти заболевания возникают при недостатке любого из плазменных факторов, принимающих участие в процессе свертывания крови. Дефицит факторов может возникнуть при нарушении их синтеза, повышении потребления или действии ингибиторов свертывания.
Эти заболевания бывают наследственными и приобретенными.
Наследственные, генетически обусловленные коагулопатии, связаны с дефицитом плазменных факторов свертывания крови. Чаще всего встречаются формы, вызванные недостатком фактора VIII. Это заболевание носит название гемофилии А.
Болеют гемофилией А в основном мужчины. Рецессивный ген локализуется в Х-хромосоме, поэтому у женщин, имеющих вторую Х-хромосомуг как правило, не бывает 140
Х'У
Здоровый мужчина
О Здоровая женщина
Рис. 57. Схема наследования гена гемофилии.
*
гемофилии. Они являются переносчицами (кондукторами) этого заболевания, так как передают патологический ген с Х-хромосомой своим сыновьям, которые заболевают гемофилией (рис. 57).
Реже встречается гемофилия В, вызванная недостатком фактора IX. При дефиците других факторов свертывания крови развиваются коагулопатии, которые встречаются редко.
При гемофилии происходит нарушение первой фазы свертывания крови, т. е. процесса образования тромбокиназы.
Картина крови. После значительных кровотечений возникает постгеморрагическая анемия. Значительно удлинено время свертывания крови и рекальцификации плазмы. Замедлено образование тромбокиназы. Выявляется дефицит факторов, участвующих во внутреннем механизме свертывания крови (XII, XI, IX и VIII).
Приобретенные коагулопатии связаны с нарушениями как в свертывающей системе крови, так и в других звеньях механизма гемостаза. Они возникают при поражении печени, в которой ситезируется большинство факторов свертывания. Геморрагические диатезы могут появиться и при недостатке витамина К. Витамин К жирорастворим, для его всасывания необходимо присутствие в Кишечнике желчи. При нарушении желчевыделительной Функции печени и заболеваниях желудочно-кишечного
тракта витамин К не усваивается и нарушается активация синтеза факторов II, VII, IX и X.
При передозировке антикоагулянтов в процессе лечения также нарушается синтез факторов, зависящих от витамина К, или блокируются активированные факторы свертывания и возникает кровоточивость.
Koai улопатии возникают при массивных переливаниях крови и при операциях, когда вследствие усиленного разрушения форменных элементов и попадания тканевого тромбопластина в кровь происходит распространенное свертывание крови в капиллярах. Развиваются тромбозы. Этими тромбами потребляется фибриноген крови. Кровь теряет способность свертываться, возникают кровотечения.
Нарушения свертываемости крови могут быть обусловлены также появлением антител к различным факторам свертывания.
§ 87. Геморрагические диатезы, связанные с изменением сосудистой стенки
К наследуемым геморрагическим диатезам этой группы относятся различные кровоточащие сосудистые опухоли, так называемые гемангиомы. Кроме того, часто встречаются генетически обусловленное нарушение сосудистой стенки, при котором происходит истончение отдельных ее участков и расширение просвета сосуда. В неполноценных участках сосуда нарушается процесс гемостаза— возникает кровотечение.
Из приобретенных геморрагических диатезов, связанных с изменениями сосудов, наиболее часто встречается геморрагический васкулит или болезнь Шенлей-на — Геноха. При этом заболевании поражаются мельчайшие капилляры под воздействием различных факторов: аллергена, инфекции, холода и др. Под влиянием аллергена вырабатываются антитела, и на эндотелии сосудов образуется комплекс — антиген — антитело, который разрушает клетки эндотелия. Поражаются сосуды кожи, почек и других внутренних органов. Развиваются тромбозы и кровотечения.
При этих формах геморрагических диатезов нет изменений в свертывании крови и тромбоцитах. Поэтому количество тромбоцитов, свертываемость крови, длительность кровотечения, ретракция кровяного сгустка остаются нормальными.
В тяжелых случаях, при значительных кровопотерях может развиться анемия и ретикулоцитоз, нейтрофильный лейкоцитоз со сдвигом лейкоцитарной формулы влево. СОЭ увеличена.
Вопросы для повторения
1. Что обозначает термин «геморрагические диатезы»?
2. На какие группы разделены геморрагические диатезы?
3. Каковы причины тромбоцитопений?
4. Как изменяется состав и свойства крови при тромбоцитопениях?
5. Что обозначается термином тромбоцитопатия?
6. Какими причинами обусловлено возникновение гемофилий?
7. Какими причинами вызываются приобретенные коагулопатии?
8. Каков механизм возникновения геморрагического васкулита?
МЕТОДЫ ИССЛЕДОВАНИЯ
К методам исследования свертывающей системы крови относится ряд морфологических, биохимических и инструментальных анализов.
Приводимые ниже методы исследования ориентировочно характеризуют различные фазы гемокоагуляции. Время свертывания крови, время рекальцификации плазмы дают общее представление о внутреннем механизме первой фазы процесса свертывания. Определение активности факторов протромбинового комплекса характеризует внешний механизм первой фазы процесса свертывания и вторую его фазу. Исследование концентрации фибриногена отражает сущность третьей фазы процесса свертывания.
Процесс фибринолиза исследуется с помощью определения фибринолитической активности эуглобулиновой фракции плазмы.
В общих чертах весь процесс свертывания отражает тромбоэластография и коагулография.
Для диагностики различных видов геморрагических диатезов существуют дифференциальные тесты, позволяющие обнаружить дефицит каждого фактора в отдельности. Эти сложные методы исследования производят в специализированных коагулологических лабораториях.
Подсчет количества тромбоцитов и их морфологическая характеристика приведены в § 62.
§ 88. Определение времени свертывания крови
Определение времени свертывания капиллярной крови (метод Сухарева). Кровь берут из пальца в чистый и сухой капилляр от аппарата Панченкова. Первая капля крови содержит примесь тканевой жидкости и для исследования не пригодна. В капилляр набирают столбик крови высотой 25—30 мм и переводят ее в середину капиллярной трубки. Включают секундомер и через каждые 30 с наклоняют капилляр вправо и влево под углом 30—45°. Кровь свободно перемещается внутри капилляра. С началом
свертывания ее движение замедляется. В момент полного свертывания кровь перестает двигаться. По секундомеру отмечают моменты начала и конца свертывания.
Начало свертывания в норме наступает в период от 30 с до 2 мин, конец от 3 до 5 мин.
Определение времени свертывания венозной крови (метод Ли — Уайта). Кровь берут из вены сухой иглой без шприца. Первые капли выпускают в ватный тампон. Затем в 2 сухие градуированные пробирки набирают по 1 мл венозной крови. Секундомер включают сразу же при соприкосновении крови с пробиркой. Пробирки с кровью ставят в водяную баню при температуре 37° С. Через 2 мин после взятия крови, а затем через каждые 30 с пробирки наклоняют на 45—60°. При этом, если кровь не свернулась, она растекается по стенке пробирки. Свертывание считается законченным, когда кровь не выливается при переворачивании пробирок вверх дном. В этот момент секундомер выключают.
Время свертывания выражается в минутах (среднее значение из двух определений).
В норме время свертывания венозной крови 5—10 мин.
§ 89. Определение времени рекальцификации плазмы
Метод основан на определении времени свертывания плазмы при добавлении к ней оптимального количества хлорида кальция.
Реактивы: 1) 1,34% раствор оксалата натрия; 2) 0,025 М раствор хлорида кальция; 3) 0,85% раствор хлорида натрия.
Ход определения. Исследование проводят с плазмой, содержащей тромбоциты. Кровь берут из вены сухой стерильной иглой в градуированную центрифужную пробирку с находящимся в ней раствором оксалата натрия. Соотношение крови и антикоагулянта должно быть 9:1. Осторожно перемешивают кровь с раствором оксалата и помещают пробирку в баню со льдом до начала исследования. Центрифугируют 10 мин при 1500 об/мин.
В сухую пробирку вносят микропипеткой 0,2 мл раствора хлорида кальция и 0,1 мл изотонического раствора хлорида натрия. Ставят в водяную баню при температуре 37° С для прогревания. Через 1 мин добавляют 0,1 мл плазмы и включают секундомер. Периодически осторожно покачивают пробирку до момента появления сгустка. Выключают секундомер. Отмечают время свертывания плазмы. Определение повторяют 2—3 раза и выводят среднее значение.
В норме время рекальцификации плазмы 60—120 с.
§ 90. Определение активности факторов протромбинового комплекса
При избытке тромбопластина и оптимальном содержании кальция время образования сгустка в плазме зависит от активности факторов протромбинового комплекса (II, V, VII, X). Исходя из этого, в реакционную смесь вводят тканевой тромбопластин и хлорид кальция. Источником факторов протромбинового комплекса служит исследуемая плазма. Если в ней снижена активность одного или нескольких факторов, время образования сгустка в плазме будет замедлено. Замедление времени образования сгустка может быть и при очень низком содержании фибриногена в плазме, и при избытке антитромбинов. Это определяется дополнительными тестами.
Определение протромбинового времени плазмы (метод Квика). Реактивы: 1) 3,8% раствор цитрата натрия или 1,34% раствор оксалата натрия; 2) 0,025 М раствор хлорида кальция; 3) 1% раствор тромбопластина.
Ход определения. Для получения плазмы кровь берут из вены сухой стерильной иглой в градуированную центрифужную пробирку с находящимся в ней раствором оксалата или цитрата натрия. Соотношение крови и антикоагулянта должно быть 9:1. Осторожно перемешивают кровь с раствором антикоагулянта и центрифугируют 10 мин при 1500 об/мин.
В пробирку вносят микропипеткой 0,1 мл цитратной или оксалатной плазмы и 0,1 мл раствора тромбопластина. Ставят в водяную баню при температуре 37° С на 1 мин. Затем добавляют 0,1 мл раствора хлорида кальция и тотчас же включают секундомер. Периодически осторожно покачивают пробирку до момента появления сгустка. Выключают секундомер.
Время от момента добавления раствора хлорида кальция до образования плотного сгустка фибрина соответствует протромбиновому времени и выражается в секундах. Определение повторяют 2—3 раза и выводят среднее значение.
Определение протромбинового времени капиллярной крови. Реактивы: 1) 3,8% раствор цитрата натрия; 2) 0,5% раствор хлорида кальция; 3) 1% раствор тромбопластина.
Ход определения. Кровь берут из пальца микропипеткой вместимостью 0,1 мл. В эту пипетку до метки 0,02 набирают раствор цитрата натрия, а затем 0,08 мл свободно выступающей крови и немедленно выдувают в пробирку. Перемешивают. Точно так же набирают цитратную кровь еще в 2 пробирки.
Пробирки с цитратной кровью устанавливают в водя
ной бане при температуре 37° С. Нагревают в течение 1 мин. Затем добавляют по 0,1 мл раствора хлорида кальция и 0,1 мл тромбопластина. Включают секундомер. Периодически покачивая пробирки, наблюдают за образованием сгустка крови. В момент его появления выключают секундомер. Определяют время свертывания крови.
Протромбиновая активность крови (ПАК) определяется по формуле: ПАК=(А:В)-юо%, где А—протромбиновое время крови здорового человека, указанное на флаконе с тромбопластином (проверяется каждый раз при работе с новой серией тромбопластина), с; В—протромбиновое время исследуемой крови, с.
В норме активность факторов протромбинового комплекса (ПАК) равна 93—107%.
§ 91. Определение концентрации фибриногена в плазме
Количество фибрина, образовавшегося при свертывании плазмы, эквивалентно содержанию в ней фибриногена.
Определение фибриногена в плазме весовым методом (метод Рутберг). Определение основано на свертывании фибриногена плазмы хлоридом кальция с последующим быстрым высушиванием и взвешиванием сгустка фибрина. Для ускорения процесса используют раствор тромбина или смесь тромбопластина с хлоридом кальция. Растворы тромбопластина и тромбина не должны содержать взвешенных частичек, так как это может привести к увеличению массы фибриногена. Удаление мельчайших примесей из раствора тромбопластина производят центрифугированием в течение 5 мин при 2000 об/мин.
Реактивы: 1) 3,8% раствор цитрата натрия; 2) 5% раствор хлорида кальция.
Ход определения. В мерную центрифужную пробирку вносят 0,5 мл цитрата натрия. Кровь берут из вены сухой иглой без шприца в ту же пробирку до объема 5 мл. Осторожно перемешивают ее с цитратом. Центрифугируют при 2000 об/мин в течение 10 мин. Плазму отсасывают пастеровской пипеткой с баллоном и переносят в чистую сухую пробирку. Если плазма содержит даже незначительную примесь форменных элементов, ее подвергают повторному центрифугированию.
1 мл прозрачной плазмы помещают в сухую пробирку, добавляют микропипеткой 0,1 мл 5% раствора хлорида кальция, перемешивают и тотчас же включают секундомер. Устанавливают время свертывания плазмы, которое в норме равно 7—15 мин.
Образовавшийся фибрин наматывают на стеклянную
палочку, которую вынимают из пробирки только после того, как в ней полностью закончится появление даже мельчайших сгустков или нитей фибрина. Фибрин снимают с палочки с помощью беззольного фильтра. Тем же фильтром тщательно просушивают фибрин. Сгусток последовательно перемещают по фильтру и при этом сжимают до тех пор, пока на бумаге в проходящем свете не будет заметно следов влаги.
В том случае, если при свертывании образуется плотный сгусток, не наматывающийся на палочку, содержимое пробирки переносят в чашку Петри и затем уже фибрин высушивают на бумажном фильтре, как указано выше.
Использование беззольного фильтра предотвращает попадание на фибрин бумажных волокон, что возможно при применении обычной фильтровальной бумаги.
Высушенный таким образом фибрин тотчас взвешивают на заранее уравновешенных торзионных весах (точность 1 мг).
Для пересчета концентрации фибриногена в граммах на литр полученную массу фибриногена в миллиграммах умножают на коэффициент 0,222. Этот коэффициент выведен экспериментальным путем и применим только для плазмы человеческой крови.
Коэффициент пересчета в единицы СИ (мкмоль/л) равен 0,0293. В норме концентрация фибриногена в плазме колеблется в пределах 5,9—11,7 мкмоль/л (2—4 г/л).
§ 92. Определение ретракции кровяного сгустка
Кровь берут из вены сухой иглой без шприца в градуированную пробирку в количестве 10 мл. Оставляют на 24 ч при комнатной температуре. За это время происходит свертывание крови, образуется сгусток, он уплотняется и отжимает сыворотку. Учитывают количество отделившейся сыворотки, которая в норме составляет ‘/з—’/г часть объема взятой для опредления крови. Вычисляют индекс ретракции путем деления объема сыворотки на общий объем взятой для исследования крови.
В норме индекс ретракции равен 0,3—0,5.
§ 93. Определение фибринолитической активности крови1
При низкой температуре в кислой среде осаждается эуглобулиновая фракция белков плазмы. Эта фракция содержит плазминоген, фибриноген, протромбин и другие факторы свертывающей системы крови. Полученный оса
1 Метод Ковальского, Копека, Ниверовского.
док эуглобулинов растворяют. Фибриноген с помощью хлорида кальция превращают в фибрин. Фибринолитическая активность крови выражается временем от момента образования сгустка фибрина до его растворения.
Реактивы: 1) 1,42% раствор оксалата аммония или 1,34% раствор оксалата натрия; 2) 1% раствор уксусной кислоты; 3) боратный раствор (9 г хлорида натрия и 1 г бората натрия растворяют в 1 л дистиллированной воды); 4) 0,025 М раствор хлорида кальция.
Ход определения. Кровь, взятую из вены (без жгута), смешивают с антикоагулянтом в соотношении 9:1. До определения ее помещают в баню со льдом. Центрифугируют 10 мин при 1500 об/мин. Полученную плазму отсасывают и помещают в чистую сухую пробирку.
В пробирку наливают 0,5 мл плазмы, 8 мл дистиллированной воды, смешивают и добавляют 0,15 мл уксусной кислоты (pH смеси 5,3). При этом из плазмы выпадает эуглобулиновая фракция белка. Содержимое пробирки перемешивают и оставляют на 30 мин в холодильнике при 4° С. Центрифугируют в течение 5 мин при 1500 об/мин. Сливают надосадочную жидкость и удаляют остатки ее, опрокинув пробирку на фильтровальную бумагу.
Осадок эуглобулинов растворяют в 0,5 мл боратного раствора. В 2 агглютинационные пробирки вносят по 0,2 мл раствора эуглобулинов и помещают в водяную баню при температуре 37° С. Через 1 мин к каждой пробе добавляют по 0,2 мл раствора хлорида кальция. Отмечают время образования сгустка. Пробирки помещают в термостат при 37° С. Время лизиса определяется как момент полного исчезновения (растворения) сгустка.
В норме сгусток лизируется в течение 183—263 мин.
§ 94. Определение длительности кровотечения1
Определение может производиться при проколе кончика пальца или мочки уха. Глубина прокола должна быть не менее 3 мм. При соблюдении этого условия кровь выделяется самопроизвольно без нажима. После прокола включают секундомер. К первой же выступившей капле прикасаются полоской фильтровальной бумаги, которая впитывает кровь. Далее фильтровальной бумагой снимают вновь выступившую каплю через каждые 30 с. Постепенно капли становятся все меньше. Продолжают эту манипуляцию до тех пор, пока на фильтровальной бумаге не перестанут оставаться следы крови. Секундомер выключают.
Несоблюдение правил этой простой пробы может
1 Метод Дуке.
служить источником ошибок. Прокол должен быть достаточно глубоким, недопустимо поспешное снятие капель вытекающей крови и прикосновение фильтровальной бумагой к коже, что способствует преждевременной остановке кровотечения.
В норме длительность кровотечения по Дуке 2—4 мин.
§ 95. Тромбоэластография
Для исследования свертывающей системы крови применяют тромбоэластографы и коагулографы. Использование приборов, регистрирующих процессы гемокоагуляции, позволяет значительно уменьшить ошибки, возникающие при других методах исследования.
Тромбоэластография основана на графической регистрации изменений, происходящих в фибрин тромбоцитарной структуре крови в процессе ее свертывания.
Принцип работы прибора. Кровь или плазму в количестве 0,36 мл помещают к кювету прибора. Кювета термостатизирована, т. е. температура находящейся в ней крови поддерживается постоянно на уровне 37±1°С с помощью полупроводникового регулятора.
В кювету, не касаясь ее краев, опускают цилиндр, закрепленный на тонкой стальной нити. Эта нить связана с графическим регистрирующим устройством. Кювета, в которой находится кровь, совершает вращательные возвратно-поступательные движения. В жидкой крови ци линдр не перемещается. Как только кровь начинает свертываться и становится более вязкой, цилиндру сообщаются движения кюветы. Колебания цилиндра передаются регистрирующему устройству и записываются чернильно-пишущим самописцем на диаграммной бумаге. Полученные кривые носят название тромбоэластограмм.
Современные тромбоэластографы позволяют одновременно записывать до четырех проб крови или плазмы. Приборы графически регистрируют все фазы процесса свертывания крови, количественные изменения тромбоцитов, фибриногена и фибринолиз.
Тромбоэластограмма (рис. 58) отражает три фазы процесса свертывания крови: фаза I—образование тромбокиназы, обозначается буквой R (время реакции) и измеряется отрезком прямой от начала записи до расширения в 1 мм. В норме время реакции 9—14 мин.
Фаза II — образование тромбина, обозначается буквой К и определяется по расстоянию от расширения кривой в 1 мм до расширения в 20 мм. Эта часть графика соответствует скорости, с которой идет образование тромбина. В норме равна 5—8 мин.
Фаза III — образование фибрина, характеризуется величиной Е (максимальной эластичностью сгустка) и отражает функциональную способность тромбоцитов, количество и качество фибриногена. Величина Е рассчитывается по формуле:
100-ма Е=--------,
100—ма
где ма — максимальная амплитуда кривой, мл. Нормальные величины Е варьируют от 80 до 180.
На форму тромбоэластограммы влияет концентрация в крови фибриногена, поэтому при изменении его количества удлиняется время реакции и снижается максимальная эластичность.
§ 96. Коагулография
Метод основан на регистрации изменения электропроводности крови в процессе ее свертывания с цомощью прибора коагулографа.
Принцип работы прибора. Кровь вносят в ячейку прибора, которая рассчитана так, что обеспечивает точную дозировку пробы — 0,28 мл. Ячейка сделана из фторопласта—несмачиваемой пластмассы. В ее дно впаяны электроды. Заполненную кровью ячейку помещают в воздушный термостат прибора, где автоматически поддерживается температура 37±0,5° С. Специальное устройство придает ячейке колебательные движения. Перемещающаяся в ней кровь то замыкает, то размыкает электроды. При этом возникают импульсы, передающиеся на записывающее устройство.
По мере свертывания крови она движется все медленнее и электроды размыкаются менее плотно, а когда 200
Рис. 59. Коагулограмма.
образуется сгусток, размыкание их совсем прекращается. Уплотнение сгустка приводит к изменению его электропроводности, а выделившаяся при его ретракции сыворотка, перемещаясь по качающейся ячейке, вызывает изменение сопротивления в цепи. Все это отражается в виде импульса на диаграммной ленте самописца.
Амплитуда импульсов соответствует электропроводности крови: пока она не свернулась — амплитуда наибольшая, по мере свертывания она постепенно уменьшается.
Коагулограмма (рис. 59) регистрирует начало и конец процесса свертывания крови, его скорость, плотность сгустка, начало ретракции и фибринолиза, а также величину гематокрита, которой соответствует максимальная амплитуда колебаний. По изменению формы коагулограммы можно судить о том, какая фаза свертывания крови нарушена.
Глава IV
ИММУННЫЕ СВОЙСТВА ЭРИТРОЦИТОВ
УЧЕНИЕ О ГРУППОВОЙ И РЕЗУС-ПРИНАДЛЕЖНОСТИ КРОВИ
§ 97. Антигены эритроцитов
На поверхности эритроцитов человека находится большое количество различных антигенов. Под воздействием антигенов В-лимфоцитами вырабатываются антитела.
Антиген состоит из двух частей: высокомолекулярного белка, несущего антигенные свойства, и небелковой группы— гаптена, который обусловливает специфичность
антигена. По химической структуре белковая часть антигена представляет собой полипептид. Свойствами аминокислот, входящих в состав полипептида, определяется вид антигена.
Различают три основные разновидности антигенов, покрывающих эритроциты: гетерофильные, видовые и специфические.
Широко распространены в природе гетерофильные антигены, отличающиеся от антигенов человека. Они встречаются в клетках некоторых животных, например в эритроцитах барана, обезьяны макаки-резус. В крови других животных, например у кролика, их нет. К гетерофильным («чужим») антигенам относятся некоторые лекарственные вещества (сульфаниламиды, антибиотики) и вирусы, которые, фиксируясь на поверхности эритроцита, вызывают выработку антител.
Антигены, имеющиеся только у человека, называются видовыми или неспецифическими. Они есть у всех без исключения людей, т. е. присущи человечеству как виду.
Специфические антигены встречаются лишь у ограниченного числа людей. К ним относятся групповые антигены.
В 1900 г. Ландштейнер установил, что при смешении эритроцитов одного человека с сывороткой другого часто происходит агглютинация эритроцитов. Производя перекрестные реакции между эритроцитами и сывороткой различных людей, он обнаружил, что одни эритроциты агглютинируются некоторыми сыворотками, а другие нет. Это наблюдение привело к открытию специфических антигенов эритроцитов, обозначенных им буквами латинского алфавита А и В. В зависимости от наличия или отсутствия этих антигенов на эритроцитах кровь всех людей делится на четыре группы.
Антигены эритроцитов носят название агглютиногенов, так как они способны агглютинироваться (склеиваться) с антителами—агглютининами, находящимися в сыворотке.
Антигены А и В по химическому составу являются мукополисахаридами. Они содержатся не только в эритроцитах, но и почти во всех тканях и секретах организма.
Агглютиноген А обладает большой антигенной силой: с антителами анти-А он дает резко выраженную реакцию агглютинации. Он неоднороден по своему составу. Разновидности антигена А — А2, Aj, А4—имеют более слабые антигенные свойства.
Агглютиноген В менее сложен, чем агглютиноген А, и способность к агглютинации сыворотками анти-В у него менее выражена.
При дальнейших исследованиях были открыты и другие специфические антигены — М, N, Fy и др., антигенная активность которых невелика.
В 1940 г. Ландштейнером и Винером был открыт еще один антиген эритроцитов, который был назван резус-антигеном и обозначен Rh. Он получил свое наименование от названия обезьян macacus Rhesus. Эритроцитами этих обезьян иммунизировали кроликов, после чего сыворотка крови этих кроликов приобретала способность агглютинировать эритроциты макак. Далее оказалось, что эта сыворотка вызывает склеивание не только эритроцитов обезьян, но и большинства людей. Таким образом был выявлен новый антиген. Резус-антиген содержится в крови 85% людей. Присутствие его в крови обозначают как Rh+ (резус-положительная кровь). Кровь 15% людей этого антигена не содержит. Такая кровь обозначается как Rh_ (резус-отрицательная).
Резус-антиген не однороден. Наиболее часто встречается D-антиген, реже С, Е и другие антигены системы резус.
Антигенные свойства крови передаются по наследству.
§ 98. Антиэритроцитарные антитела
Антигены эритроцитов человека открыты с помощью их антагонистов — соответствующих антител. Антитела — это сывороточные белки глобулиновой природы, которые обладают способностью образовывать комплексы с соответствующими антигенами.
Общие свойства антител. 1. Специфичность действия. Антитела фиксируются только на соответствующих антигенах. Они могут быть гетеро-, изо- и аутоантителами. Гетероантитела активны по отношению к эритроцитам животных разных видов. Изоантитела (групповые) действуют на эритроциты некоторых людей, содержащих специфические групповые антигены А и В. Аутоантитела активны по отношению к собственным антигенам человека.
2. Температурный оптимум. Определенные антитела проявляют свое действие наилучшим образом при различных температурах. Одни из них действуют при низкой температуре (ниже 15° С) — холодовые антитела, другие — при температуре тела — тепловые антитела.
3. Оптимум pH среды. Для действия антител необходима определенная реакция среды.
4. Титр антител. Титр—это наибольшее разведение сыворотки, содержащей антитела, при котором еще проявляется их действие.
5. Характер появления. Одна часть антител содержит
ся в плазме человека вне зависимости от контакта с соответствующим антигеном (естественные антитела), другая — появляется в результате воздействия антигена (иммунные антитела). Аутоиммунные антитела возникают при таких изменениях в структуре антигенов человека, которые вызывают срыв существующей в организме устойчивости к собственным антигенам.
6. Характер действия. Различают агглютинины, гемолизины, опсонины и преципиТины. Агглютинины вызывают склеивание эритроцитов, гемолизины способствуют лизису эритроцитов, опсонины участвуют в фагоцитозе эритроцитов лейкоцитами, преципитины вызывают реакцию осаждения из раствора комплекса антиген — антитело. Иногда антитела могут нести несколько функций.
7. Серологические свойства. Различают полные и неполные антитела. Полные антитела могут путем обычного контакта вызвать агглютинацию эритроцитов, содержащих соответствующий антиген. Эта реакция происходит в любой среде — солевой или коллоидной. К таким антителам относятся агглютинины анти-А и анти-В. Полный агглютинин можно представить себе как двухвалентную молекулу, оба конца (или валентности) которой способны реагировать как в солевой, так и в альбуминовой среде.
Неполные антитела в солевой среде не могут вызвать непосредственную агглютинацию. Они вызывают ее лишь в коллоидной среде (например, в желатине или альбумине). Неполные агглютинины встречаются в сыворотке людей, имеющих контакт с антигенами, которых эти лица лишены. В результате этого контакта вырабатываются антитела. Неполные антитела могут появляться в сыворотке и на собственных эритроцитах при аутоиммунных гемолитических анемиях.
Агглютинины — наиболее часто встречающаяся разновидность антиэритроцитарных антител. В плазме человека всегда содержатся естественные, полные, холодовые изоантитела к агглютиногенам А и В. Агглютинин анти-А чаще обозначается буквой греческого алфавита а, а агглютинин анти-В — буквой £. Изоантитела характеризуются специфичностью действия по отношению к одному из групповых антигенов. Агглютинины а дают реакцию агглютинации с агглютиногеном А, агглютинины р — с агглютиногеном В. Такая реакция носит название реакции изогемагглютинации.
К антигенам М, N, Fy и др. естественных антител в крови здорового человека нет. При воздействии этих антигенов на кровь, эритроциты которой их не содержат, вырабатываются иммунные антитела.
При попадании антигена резус в кровь резус-
отрицательных людей, в ней появляются резус-антитела. Это также иммунные антитела. По серологическим признакам различают полные и неполные резус-агглютинины. Молекулы полных агглютининов большего размера, чем молекулы неполных. Последние выявляются реакцией в коллоидной среде.
§ 99. Группы крови
На основании реакции изогемагглютинации определяют групповую принадлежность крови людей. В зависимости от наличия или отсутствия агглютиногенов А и В и агглютининов а и 0, от их комбинаций в крови людей все человечество разделяют на 4 группы.
В крови человека никогда не встречаются одноименные агглютиногены и агглютинины.
У людей, имеющих группу крови I, эритроциты не Содержат агглютиногенов, а в сыворотке имеются оба агглютинина аир. Группа крови I обозначается как 0(1).
В эритроцитах людей с группой крови II находится агглютиноген А, а в их сыворотке — агглютинин р. Принятое обозначение — А(П).
Эритроциты группы крови III несут агглютиноген В, в сыворотке крови этой группы содержится агглютинин а. Принятое обозначение — В(П1).
На поверхности эритроцитов людей с группой крови IV находятся оба агглютиногена А и В, но в их сыворотке нет агглютининов. Обозначается группа крови IV как АВ (IV).
Схематически групповую принадлежность людей по системе АВО можно представить следующим образом:
Группа крови Агглютиноген
I 0
II А
III В
IV АВ
Агглютинины
Р а 0
Обозначение
0(1) А(П) В(Ш) АВ (IV)
Распределение людей по группам крови неравномерно. Наиболее часто встречаются люди с группой 0(1) — 33,5%. Несколько реже—с группой А(П)—27,5%. Группа В(Ш) составляет 21%, a AB(IV)—8%.
§ 100. Клиническое значение
В основе реакции гемагглютинации лежит взаимодействие между антигенами эритроцитов и соответствующими антителами сыворотки. Эта реакция имеет большое значение в практике переливания крови.
Переливание крови как терапевтическое средство ши
роко применяется в клинике. Однако при этом возможен целый ряд осложнений, проявляющихся в виде гемолитических реакций. Эти опасные осложнения могут привести к смерти больного вследствие массивного разрушения эритроцитов донора антителами реципиента — человека, которому переливают кровь.
Определение групп крови и резус-фактора делает переливание крови безопасным. Существуют определенные правила, которых необходимо придерживаться при переливании крови: эритроциты донора не должны содержать антигенов, соответствующих антителам реципиента, т. е. А и а, В и ₽. При этом агглютинины донора можно не учитывать. Если титр их невысок, они разводятся плазмой крови реципиента.
Следовательно, кровь группы 0(1), не содержащую агглютиногенов, можно переливать людям с любой группой крови. Лица, имеющие группу крови 0(1), считаются «универсальными донорами». Кровь группы А(П) переливается реципиентам группы А(П) и группы AB(IV), не содержащей агглютининов. По той же причине кровь группы В(Ш) может быть перелита лицам с группой В(Ш) и АВ (IV). Эти правила могут быть изображены в виде следующей схемы.
Из приведенной схемы видно, что людям с группой крови AB(IV) может быть перелита кровь людей любой группы. Лица группы AB(IV) названы поэтому «универсальными реципиентами».
При переливании незначительных количество крови этой схемой можно пользоваться. Однако в современной хирургической практике, когда переливаются большие количества крови, замена трети или половины массы крови групп А(П), В(Ш) или AB(IV) кровью группы 0(1) может привести к разрушению оставшегося количества крови реципиента антителами донорской крови. Поэтому в настоящее время рекомендуется переливать только одног-руппную кровь.
Переливание крови, несовместимой по резус-фактору, также, приводит к серьезным осложнениям. При однократном переливании резус-положительной крови человеку резус-отрицательному в его организме начинается выработка антител. Анти-резус агглютинины образуются не сразу, поэтому реакция на переливание несовместимой по резус-фактору крови бывает замедленной. При повторных переливаниях резус-отрицательному реципиенту резус-положительной крови титр антител возрастает, что приводит к массивному гемолизу эритроцитов реципиента.
Серологические реакции также играют значительную роль в выявлении механизма возникновения изоиммунной гемолитической анемии новорожденных.
В случае беременности резус-отрицательной женщины, плод, унаследовавший резус-антиген от отца, вызывает в крови матери выработку иммунных агглютининов антирезус. При повторной беременности титр антител нарастает. Неполные иммунные антитела способны проникать через плаценту. Они оседают на эритроцитах плода, вызывая их агглютинацию и последующий гемолиз. Это может привести к гемолитической анемии новорожденного или, в тяжелых случаях, к внутриутробной гибели плода.
Вопросы для повторения
1. Что представляют собой антигены эритроцитов?
2. Какие разновидности антигенов находятся на поверхности эритроцитов?
3. Каковы химические и антигенные свойства агглютиногенов А и В?
4. Каким образом был открыт резус-антиген?
5. Какая кровь называется резус-положнтельной и какая резус-отрицательной?
6. Что такое антитело?
7. Каковы общие свойства антител?
8. Что подразумевается под специфичностью и характером действия антител, характером нх появления?
9. Каковы серологические свойства антител?
10. Каковы по характеру появления агглютинины аир?
11. Каковы свойства резус-антнтел по характеру появления и серологическим признакам?
12. Что положено в основу деления кровн на группы?
13. Каково клиническое значение определения групп крови?
14. Каково клиническое значение определения резус-фактора?
РЕАКЦИИ ИЗОГЕМАГГЛЮТИНАЦИИ
§ 101. Определение групп крови системы АВО при помощи стандартных сывороток
Реакцией агглютинации с помощью стандартных сывороток определяют групповые агглютиногены в эритроцитах. Это дает возможность судить о групповой принадлежности исследуемой крови.
Реагенты: 1) стандартная сыворотка группы 0аР(1) двух различных серий; 2) стандартная сыворотка группы Ар(П) двух различных серий; 3) стандартная сыворотка группы Ва(Ш) двух различных серий; 4) стандартная сыворотка группы ABO(IV).
Сыворотки можно применять неокрашенными или окрашенными: группы Ар(П) — в синий, группы Ва(Ш)— в красный и группы ABO(IV) — в желтый цвет. Сыворотка группы 0«р(1) обычно не окрашена.
Хранят сыворотки в холодильнике. Срок годности указан на этикетках.
5) 0,85% раствор хлорида натрия.
Ход определения. Определение группы крови производят в помещении с хорошим освещением при температуре 15—25° С. Ампулы или флаконы со стандартными сыворотками двух различных серий каждой группы ставят в 2 штатива, имеющих по 3 гнезда каждый или в 1 штатив с двумя рядами гнезд. В левые гнезда ставят сыворотку группы 0<х(3(1), в средние — группы Ар(П) и в правые — группы Ва(Ш). Отдельно ставят сыворотку группы ABO(IV), употребляемую в качестве дополнительного контроля. Сухие пипетки опускают во все ампулы со стандартными сыворотками и в пробирку с изотоническим раствором хлорида натрия. Для промывания стеклянных палочек и пипеток подготавливают химические стаканы с водой и изотоническим раствором хлорида натрия. Определение производят на белых пластинах или тарелках. Н: левой стороне делают надпись OafJ, в середине — Ар справа — Ba. На верхнем крае пластины указывают фами лию и инициалы лица, у которого определяют группу крови. Под соответствующей надписью наносят по 0,1 (1 большая капля) каждой стандартной сыворотки. Всего получается шесть капель (2 ряда по 3 капли в каждом) в следующем порядке слева направо: Oap(I), Ap(II), Ba(III). Пипетку, которой берут сыворотку из ампулы, тотчас же после того, как из нее выпущена сыворотка, опускают в ту же ампулу, из которой она взята. Кровь для исследования берут из пальца. 0,01 мл (I маленькая капля) крови сухой стеклянной палочкой наносят рядом с каждой каплей стандартной сыворотки. Перемешивают капли стандартной сыворотки с находящимися рядом с ними каплями исследуемой крови (каждую отдельной палочкой). После этого пластину покачивают, затем на 1 —2 мин оставляют в покое и снова периодически покачивают. Наблюдение за ходом реакции проводят не менее 5 мин, несмотря на то что агглютинация начинается в течение первых 10—30 с, так как возможна поздняя агглютинация, например с эритроцитами группы А2(П). По мере наступления агглютинации, но не ранее чем через
3 мин, в те капли, в которых наступила агглютинация, добавляют по 1 капле изотонического раствора хлорида натрия и продолжают наблюдение при покачивании пластинки до истечения 5 мин, после чего оценивают результат.
Оценка результатов. Реакция в каждой капле может быть положительной или отрицательной. При положительной реакции в смеси появляются видимые невооруженным глазом мелкие красные зернышки (агглю-тинаты), состоящие из склеенных эритроцитов. Они постепенно группируются в более крупные зерна или хлопья неправильной формы. При этом сыворотка полностью или частично обесцвечивается. В случае отрицательной реакции на протяжении всего времени наблюдения (5 мин) жидкость остается равномерно окрашенной в красный цвет, и в ней не обнаруживают агглютинатов. Результаты реакции в каплях с сыворотками одной группы обеих серий должны быть одинаковыми. Возможны четыре различных комбинации реакций (рис. 60, см. на цвет, вкл.):
1) сыворотки всех трех групп дали отрицательную реакцию, т. е. остались равномерно окрашенными в красный цвет без признаков агглютинации: испытуемая кровь принадлежит к группе 0(1);
2) сыворотки групп 0а[3(1) и Ba(III)) дали положительную реакцию, а сыворотка группы А(3(П) — отрицательную: испытуемая кровь принадлежит к группе А(П);
3) сыворотки группы Oap(I) и Ар(П) дали положительную реакцию, а сыворотка группы Ba(III) — отрицательную: испытуемая кровь принадлежит к группе В(Ш);
4) сыворотки всех трех групп дали положительную реакцию. В этом случае для исключения неспецифической агглютинации проводится дополнительное контрольное исследование со стандартной сывороткой ABO(IV).
Для этого на пластинку наносят 0,1 мл (1 большая капля) стандартной сыворотки группы ABO(IV), добавляют 0,01 мл (1 маленькая капля) исследуемой крови, перемешивают и наблюдают за результатом при периодическом покачивании пластинки в течение 5 мин. Отсутствие агглютинации в этой капле, при наличии ее во всех остальных, позволяет считать реакцию специфической и отнести исследуемую кровь к группе AB(IV). Наличие агглютинации с сывороткой группы ABO(IV) говорит о неспецифической агглютинации. В этих случаях исследование следует повторить с отмытыми эритроцитами.
Примечание. При получении сомнительного или нечеткого результата исследуют кровь данного лица повторно со стандартными
сыворотками других серий. Если результаты остаются неясными, то следует определить группу крови перекрестным способом при помощи стандартных сывороток и стандартных эритроцитов.
§ 102. Определение групп крови системы АВО перекрестным способом
Одновременное определение групповых антигенов эритроцитов и агглютининов сыворотки позволяет установить полную групповую формулу исследуемой крови. Групповые антигены определяют при помощи стандартных эритроцитов.
Реагенты: 1) стандартная сыворотка группы 0«р(1) двух различных серий; 2) стандартная сыворотка группы Ар(П) двух различных серий; 3) стандартная сыворотка группы Ва(Ш) двух различных серий; 4) стандартная сыворотка группы ABO(IV); 5) 0,85% раствор хлорида натрия; 6) стандартные эритроциты групп 0(1), А(П), В(Ш). В центрифужную пробирку, содержащую 0,25 — 0,5 мл 3,8% раствора цитрата натрия, добавляют 2—4 мл крови специально отобранных доноров, затем пробирку на 3/4 заполняют изотоническим раствором хлорида натрия. Перемешивают и центрифугируют или оставляют стоять до оседания эритроцитов. Отмытые стандартные эритроциты хранят в холодильнике. Срок годности 2—3 дня.
Ход определения. Определение группы крови производят в помещении с хорошим освещением при температуре 15—25° С. Ампулы со стандартными сыворотками двух различных серий каждой группы ставят в 2 штатива. Отдельно ставят сыворотку группы ABO(IV). Пробирки со стандартными эритроцитами устанавливают в отдельный штатив с тремя гнездами в следующем порядке: слева — группы 0(1), в середине — группы А(П) и справа — группы В(Ш). Сухие пипетки опускают во все ампулы (флаконы) со стандартными сыворотками, в пробирку с изотоническим раствором хлорида натрия и в пробирки со стандартными эритроцитами.
На пластинке делают надписи слева направо: 0«р, АР и Ва для стандартных сывороток и 0, А и В—для стандартных эритроцитов. На верхнем крае пластинки надписывают фамилию и инициалы лица, у которого определяют группу крови.
Под соответствующими обозначениями наносят по 1 большой капле всех стандартных сывороток. Получается 6 капель, которые образуют 2 ряда по 3 капли в следующем порядке (слева направо): 0ар(1), Ар(П), Ва(111). На нижнюю часть пластинки, так же у соответствующих обозначений, наносят по 1 маленькой капле (величиной с булавочную головку) стандартных эритроцн-210
1|И|в
iiillliiiiill
Исследуемая нрсдь группы 8(Ш)
illililllllliill
Исследуемая ерсдь группы Яв (ff)
Рис. 61. Оценка результатов реакции нзогемагглютинации по стандартным эритроцитам.
тов. Исследуемую кровь берут из вены, пальца или из мочки уха в сухую пробирку. Для отделения сыворотки кровь центрифугируют или оставляют стоять на 20— 30 мин.
Из пробирки, содержащей исследуемую кровь, пипеткой извлекают сыворотку так, чтобы не взболтать эритроциты, и капают по 1 большой капле на подготовленные стандартные эритроциты. После этого той же пипеткой набирают со дна пробирки эритроциты исследуемой крови и наносят их по 1 маленькой капле рядом с каждой каплей
подготовленной стандартной сыворотки. Сыворотку тщательно перемешивают с эритроцитами сухими стеклянными палочками. Пластинку слегка покачивают, затем на 1—2 мин оставляют в покое и снова периодически покачивают.
Наблюдение за ходом реакции продолжается не менее 5 мин. Агглютинация в каплях со стандартной сывороткой обычно начинается через 10—30 с. Агглютинация в каплях со стандартными эритроцитами может наступить позже, даже к концу 5-й мин, если титр содержащихся в исследуемой сыворотке агглютининов низок. Через 3 мин в те капли, в которых наступила агглютинация, добавляют изотонический раствор хлорида натрия и продолжают наблюдение при покачивании пластинки до истечения 5 мин.
Оценка результатов. Результаты реакций, полу- j ценных при помощи стандартных сывороток и стандартных эритроцитов, должны совпадать, т. е. указывать на содержание агглютининов и агглютиногенов, соответствующих одной и той же группе крови. Возможны четыре варианта реакций (рис. 61):
1) реакция со стандартными сыворотками указывает на отсутствие агглютиногенор, т. е. на принадлежность исследуемой крови к группе 0(1). При этом сыворотка исследуемой крови дает отрицательную реакцию со стандартными эритроцитами группы 0(1) и положительную — с эритроцитами групп А(П) и В(1П). Это указывает на наличие в сыворотке агглютининов а и р, т. е. подтверждает принадлежность исследуемой крови к группе 0(1); |
2) реакция со стандартными сыворотками указывает на наличие в исследуемой крови агглютиногена А. При этом сыворотка исследуемой крови дает отрицательную реакцию со стандартными эритроцитами групп 0(1) и А(П), но положительную — с эритроцитами группы В(Ш). Это указывает на наличие в сыворотке агглютининов (3, т. е. подтверждает принадлежность исследуемой крови к группе А(П);
3) реакция со стандартными сыворотками указывает на наличие в исследуемой крови агглютиногена В. При этом сыворотка исследуемой крови дает отрицательную реакцию со стандартными эритроцитами групп 0(1) и В(П1), но положительную — с эритроцитами группы А(П)-Это указывает на наличие в сыворотке агглютининов а, то есть подтверждает принадлежность исследуемой крови К группе В(Ш);
4) реакция со стандартными сыворотками указывает на наличие в исследуемой крови агглютиногенов А и В. При этом сыворотка исследуемой крови дает отрицательную реакцию со стандартными эритроцитами всех трех
групп, т. е. не содержит агглютининов, что подтверждает принадлежность исследуемой крови к группе ABO(IV).
Несоблюдение всех деталей методики определения групп крови может привести к ошибкам.
Причины ошибок: 1) ошибочный порядок расположения стандартных сывороток или стандартных эритроцитов в штативах; 2) ошибочный порядок нанесения стандартных сывороток или стандартных эритроцитов на пластинку; 3) неправильное соотношение количества сыворотки и эритроцитов (при избытке крови реакция может быть оценена как отрицательная при фактическом наличии агглютинации); 4) несоблюдение времени наблюдения (при учете результатов реакции до истечения 5 мин поздно наступившая агглютинация может быть пропущена, а при слишком долгом наблюдении более 5 мин смесь эритроцитов и сыворотки начинает подсыхать, и агрегация эритроцитов по периферии капли может быть принята за агглютинацию); 5) отсутствие дополнительного контрольного исследования со стандартной сывороткой группы ABO(IV), в результате чего феномен аутоагглютинации может быть расценен как положительный результат реакции; 6) грязная или мокрая посуда, применяемая в реакции; 7) использование недоброкачественных стандартных сывороток: недостаточно активных (с истекшим сроком годности), загрязненных или частично высохших; 8) несоблюдение температурных условий проведения реакции (при температуре воздуха выше 25° С агглютинация может быть незамечена, ниже 15° С — может появиться неспецифическая агглютинация); 9) образование «монетных столбиков» из эритроцитов, которые невооруженным глазом можно принять за агглютинацию (прибавление изотонического раствора хлорида натрия с последующим покачиванием разрушает их); 10) если пластинку, на которой проводится определение, не покачивают, то эритроциты оседают на дно и образуются отдельные скопления их, которые симулируют агглютинацию.
§ 103. Определение резус-фактора методом конглютинации с применением желатина
Исследуемые эритроциты инкубируют со стандартной сывороткой антирезус, содержащей неполные антитела-резус, в коллоидной среде — растворе желатина. Если исследуемые эритроциты резус-положительны, происходит их склеивание — конглютинация, которая обнаруживается после добавления в инкубационную смесь изотонического раствора хлорида натрия. Резус-отрицательные эритроциты не склеиваются.
Реагенты: 1) стандартные сыворотки антирезус с
неполными антителами двух различных серий. Группа стандартной сыворотки должна быть совместима с труп» пой исследуемой крови: сыворотка антирезус 0(1) пригодна для определения резус-фактора в эритроцитах группы 0(1); сыворотка антирезус группы А(П) пригодна для определения резус-фактора в эритроцитах группы 0(1) и А(П); сыворотка антирезус группы В(Ш) пригодна для определения резус-фактора в эритроцитах группы 0(1) и B(III); сыворотка антирезус группы AB(IV) и специально приготовленная «универсальная» сыворотка пригодны для определения резус-фактора в эритроцитах группы AB(IV) и любой другой группы крови. Хранят стандартные сыворотки в холодильнике, срок годности указан на этикетке;
2) 10% раствор желатина в ампулах заводского изготовления. Вскрытые ампулы хранят в холодильнике не более 2—3 дней. Мутный с хлопьями или не застывающий при комнатной температуре раствор желатина употреблять нельзя;
3) 0,85% раствор хлорида натрия;
4) 3,8% раствор цитрата натрия (изотонический);
5) стандартные эритроциты для контроля (применяют стандартные резус-положительные эритроциты группы 0(1) или той же группы, что и исследуемая кровь; стандартные резус-отрицательные эритроциты должны быть обязательно той же группы, что и исследуемая кровь).
Подготовка к определению. Кровь берут в сухую пробирку без стабилизатора в количестве 1—3 мл. На пробирке надписывают фамилию, инициалы и группу крови лица, у которого взята кровь. Для исследования берут эритроциты, оставшиеся свободными после свертывания крови. Если их окажется недостаточно, пробирку со свернувшейся кровью энергично встряхивают для отделения большего количества эритроцитов.
Можно брать кровь с изотоническим раствором цитрата натрия (0,25 мл на 1 мл крови), но тогда эритроциты необходимо отмыть. Для этого пробирку с кровью на 3h заполняют изотоническим раствором хлорида натрия, содержимое перемешивают и центрифугируют. Хранят кровь в течение 2—3 сут в холодильнике.
Ход определения. В штатив устанавливают 3 ряда пробирок: в каждом ряду по количеству исследуемых лиц и образцов эритроцитов для контроля. На каждых трех пробирках надписывают фамилию и инициалы лица, кровь которого будут исследовать.
В одинаково обозначенные 3 пробирки каждого ряда вносят по 0,05 мл (1 капля) исследуемых эритроцитов. В 3 контрольные пробирки помещают по 0,05 мя (1 капля) стандартных резус-положительных эритроцитов группы
0(Г) или группы, одноименной с исследуемой кровью. В другие 3 контрольные пробирки — по 0,05 мл (1 капля) стандартных резус-отрицательных эритроцитов той же группы, что и исследуемая кровь.
Затем во все пробирки добавляют по 0,1 мл (2 капли) 10% раствора желатина, предварительно подогретого при 48° С (до разжижения). Слегка встряхивают для перемешивания. После этого во все пробирки первого ряда вводят по 0,1 мл (2 капли) сыворотки антирезус одной серии, во все пробирки второго ряда—по 0,1 мл (2 капли) сыворотки антирезус другой серии. В пробирки третьего ряда не вводят сыворотки антирезус, эти пробирки служат контролем на отсутствие неспецифической агглютинации исследуемых эритроцитов в присутствии желатина. Содержимое пробирок перемешивают встряхиванием и помещают в водяную баню при 48° С на 5 мин или в термостат при той же температуре на 30 мин. После прогревания приливают по 8—10 мл подогретого изотонического раствора хлорида натрия, содержимое пробирок перемешивают и затем просматривают на свет невооруженным глазом или через лупу.
Оценка результатов. Результат может быть положительным и отрицательным. Когда кровь резус-положительна, в пробирке наблюдаются легко различимые красные зерна или хлопья, состоящие из склеенных эритроцитов, на прозрачном, почти обесцвеченном, фоне жидкости. Если эритроциты резус-отрицательны, в пробирке видна равномерно окрашенная в розовый цвет, слегка опалесцирующая жидкость.
Результаты следует считать истинными при совпадении их в обеих сериях стандартной сыворотки антирезус. В контрольных образцах стандартные резус-поло-жительные эритроциты одноименной группы или группы 0(1) с сывороткой антирезус должны дать положительный результат, а стандартные резус-отрицательные эритроциты одноименной группы — отрицательный. Кроме того, отрицательный результат должен быть также во всех пробирках третьего ряда, т. е. без сыворотки антирезус.
КЛИНИКО-БИОХИМИЧЕСКИЕ ИССЛЕДОВАНИЯ
Биологическая химия—наука о качественном составе и количественном содержании сложных природных соединений, из которых состоит живая материя, а также о преобразовании их в результате жизнедеятельности организма.
Особое свойство живой материи заключается в том, что она способна поддерживать собственное существование путем постоянного поглощения химических веществ из внешней среды, преобразуя их в элементы своего тела и выведения во внешнюю среду продуктов распада. Этот непрерывно совершающийся и саморегулируемый круговорот веществ, протекающий в живых организмах, называется обменом веществ.
Обмен веществ представляет собой сочетание разнообразных и противоположных процессов. Та часть обмена, которая заключается в поглощении и накоплении веществ из окружающей среды, образовании из них элементов своего тела, называется анаболизмом. Другая часть, заключающаяся в разрушении элементов живого организма и выделении во внешнюю среду продуктов распада, называется катаболизмом. Следовательно, обмен веществ есть диалектическое единство противоположных процессов — анаболизма и катаболизма, обеспечивающих существование живой материи.
Современные достижения в области биохимии и молекулярной биологии позволяют рассматривать обмен веществ не только на уровне целостного организма, но и на клеточном и молекулярном уровнях.
Организм человека — одна из самых сложных и совершенных систем живой материи, нормальная жизнедеятельность которого требует достаточно строгого постоянства его внутренней среды.
С помощью лабораторных методов исследования изучается строение клеток и тканей организма, происходящих в них и в организме в целом биохимических процессов. Эти процессы могут существенно изменяться при воспалительных, инфекционных, аллергических, опухолевых и других заболеваниях.
Основной задачей лабораторных анализов является
получение объективных данных о функциональном состоянии организма в целом, с целью диагностики заболеваний и контроля за успехом лечения.
Так, чтобы судить о тяжести патологического процесса в почках необходимо определить насколько нарушено выделение продуктов обмена веществ из крови. Для этого определяют в крови мочевину, креатинин, индикан.
В настоящее время особое развитие получили методы определения ферментов в крови, показатели активности которых возрастают при заболеваниях сердца, печени, легких и используются для характеристики тяжести патологического процесса.
Методы биохимического анализа служат едва ли не единственным средством, позволяющим поставить диагноз широкого круга наследственных заболеваний.
Уровень развития современной клинической биохимии позволяет продуманно составить перечень биохимических исследований, которые целесообразно использовать при диагностике заболеваний сердца, сосудов, паренхиматозных органов и др.
Материалом для исследования служат биологические жидкости организма: кровь, моча, спинномозговая жидкость н т. д. Чаще исследованию подвергается не цельная кровь, а сыворотка или плазма крови. Для получения сыворотки берут кровь в количестве 10—15 мл из вены сухой иглой непосредственно в пробирку, ставят в термостат при температуре 37° С. Когда образуется плотный сгусток, осторожно отделяют верхний слой от стенок пробирки тонкой стеклянной палочкой. Пробирку помещают в холодильник. Когда сгусток сократится, центрифугируют и отсасывают сыворотку. При исследовании цельной крови и плазмы необходимо предотвратить процесс свертывания крови. В качестве антикоагулянтов используют оксалаты натрия и калия, фторид натрия, гепарин. Концентрация антикоагулянта зависит от его вида и цели исследования.
Ввиду того что кровь и ее производные являются ценным, дефицитным материалом организма, на лабораторные исследования можно брать лишь минимальные ее количества. Это и определяет главную особенность клинико-биохимических исследований — применение микро- и ультрамикрометодов.
Кроме того, содержание в крови многих органических и минеральных веществ незначительно, следовательно для их определения в малых объемах крови необходима безукоризненная точность и чистота в работе. Она достигается строгим выполнением нижеперечисленных требований.
1. Соблюдать все правила приготовления реактивов.
Использовать химически чистые вещества, при необходимости перекристаллизованные, высушенные до постоянной массы. Взвешивание производить на электрических демпферных весах высокой точности, растворять навески в дистиллированной или дважды дистиллированной воде. Проверять точность приготовленных реактивов, соблюдать сроки годности и правила хранения.
2. Работать с химически чистой посудой. Для некоторых методик посуда подвергается особой обработке (например, паром — для определения минеральных веществ).
3. Апробировать каждый новый метод исследования с веществами известной концентрации.
4. Проводить исследования в двух параллельных опытах, расхождение результатов которых должно быть минимальным.
5. Параллельно с опытными ставить 2 контрольные (холостые) пробы.
Внедрение в практику лабораторных методов контроля качества исследований позволяет избежать проведения повторных анализов, экономить время и материалы, повысить ответственность работников лаборатории за результаты исследований, выявить наиболее рациональные методы и, главным образом, улучшить качество производимых исследований.
При проведении биохимических анализов в лабораториях пользуются методами выделения веществ из биологических жидкостей и их количественного определения на основе современных достижений медицинской науки и техники, обеспечивающих высокое качество исследований, механизацию и автоматизацию труда лаборанта.
Из методов разделения биологического материала наиболее перспективными являются: электрофорез (основан на движении заряженных частиц в электрическом поле), хроматография (основана на разделении веществ по зонам их максимальной концентрации), ультрацентрифугирование.
Из методов количественного анализа широкое применение находят оптические методы с использованием современных приборов, таких, как фотоэлектроколориметр, спектрофотометр, позволяющих по измерению оптической плотности веществ определить их концентрацию.
К другой группе приборов относится пламенный фотометр, позволяющий регистрировать излучение атомов и молекул исследуемого вещества.
Из электрообъемных методов количественного анализа широкое применение находит потенциометрия, используемая для точного определения концентрации водородных ионов в биологических жидкостях.
В практике современных лабораторий все большее
применение находят технические средства, обеспечивающие комплексную механизацию и автоматизацию лабораторных исследований.
Разработаны и серийно выпускаются автоматические анализаторы для биохимических исследований, предназначенные для определения целого ряда компонентов в биологических жидкостях. В состав автоанализатора входят: пробоотборник, дозирующее устройство, диализатор, термостат, измерительный блок (фотоколориметр, пламенный фотометр и т. д.), самописец, печатающее устройство. Производительность такого анализатора чрезвычайно велика, зависит от видов исследования и колеблется от 30 до 120 анализов в час.
Глава I
БЕЛКОВЫЙ ОБМЕН
ПОКАЗАТЕЛИ, ХАРАКТЕРИЗУЮЩИЕ СОСТОЯНИЕ БЕЛКОВОГО ОБМЕНА
§ 104. Белки и белковые фракции
Наиболее важной составной частью организма являются белки, представляющие собой высокомолекулярные азотсодержащие органические вещества — биополимера!. Основной структурной единицей их—мономером — служит аминокислота.
В белках аминокислоты связаны пептидными связями, которые образованы карбоксильными и аминогруппами соседних аминокислот. Построенные таким образом полимеры называют пептидами. Количество и последовательность расположения аминокислот в белке строго определены. Длинные цепочки аминокислот — полипептиды — располагаются в пространстве определенным образом, благодаря взаимодействиям между радикалами и другими активными группами в молекуле белка. Пространственное расположение белковой молекулы зависит от растворителя и реакции среды.
Если белок содержит по две и более полипептидных цепей, тогда о нем говорят, что он состоит из субъединиц (гемоглобин). Свойства и биологическая активность белков зависят от их строения.
Именно с белками связаны основные проявления жизни: пищеварение, раздражимость, сократимость, способность к росту, движение, размножение.
Белки служат главным пластическим материалом, из которого построена структурная единица всех видов тканей — клетка.
Пищеварение происходит при участии ферментов, которые являются белками. В основе мышечного сокращения лежат изменения свойств белка—актоминозина, взаимодействующего с аденозинтрифосфатом (АТФ). Опорную функцию выполняют белки соединительной ткани— коллаген и эластин.
Нуклеопротеидам принадлежит главная роль в передаче наследственных признаков. Выработкой иммунных белков — антител отвечает организм на действие болезнетворных микроорганизмов. Удивительное свойство крови свертываться, предохраняющее организм от кровопотери, зависит от взаимодействия целого ряда факторов — ферментов.
Белки плазмы крови поддерживают коллоидноосмотическое давление, являются одной из важнейших буферных систем, играют большую роль в транспорте Питательных веществ, витаминов, гормонов и лекарственных препаратов.
Современные физико-химические методы исследования позволили открыть и описать более 100 различных белковых компонентов плазмы крови. В зависимости от способа разделения получают различные фракции (группы) белков, сходных по некоторым свойствам. Главные из них — альбумины, глобулины и фибриноген. С помощью метода электрофореза на бумаге в сыворотке крови было обнаружено 5 фракций белков: альбумины а,-, а2-, Р- и -у-глобулины. Методом электрофореза в крахмальном геле выявляется до 17 фракций белков. Наибольшее число фракций — до 30 можно получить методом иммунофореза, который представляет собой комбинацию методов электрофореза и реакции преципитации в одной среде.
На долю альбуминов приходится более половины общего количества белков плазмы крови. Эти низкомолекулярные белки обладают высокой гидрофильностью (объем сухой молекулы альбумина увеличивается в 2 раза при растворении в воде). Благодаря этому свойству альбумины удерживают воду в организме, поддерживая коллоидноосмотическое давление крови. Они выполняют транспортную функцию, образуя временные комплексы с билирубином, желчными кислотами, кальцием, гормонами, лекарственными веществами.
Альбумины сравнительно быстро обновляются в организме. Местом их образования является печень.
Глобулины представлены различными по химическому составу и функциям белками. Среди них отмечают гликопротеиды, содержащиеся, в основном, в аг и а2-фракциях; липопротеиды, содержащиеся, главным образом, в p-фракции, и иммуноглобулины, составляющие 'у-фракцию. Общее свойство белков этой группы — 220
нерастворимость в воде. 80% их образуются в печени.
Из фракций а гглобулинов выделяют белки, транспортирующие гормоны тироксин и ретинол. Они обладают тормозящим действием на протеолитические ферменты. Из а 2-глобулинов выделяют церулоплазмин, гаптоглобины и протромбин. Церулоплазмин способен связывать медь и поддерживать ее концентрацию в тканях. Гаптоглобины обладают способностью соединяться с гемоглобином, предупреждая его потерю организмом через почки. Протромбин является неактивным предшественником тромбина — белка, способствующего превращению фибриногена в фибрин.
P-Глобулины представлены в основном липопротеидами. В их состав, помимо белкового компонента, входят свободный и эфиросвязанный холестерин, фосфолипиды, триацилглицерины. В p-фракции, кроме липопротеидов, обнаружены трансферрин и С-реактивный белок. Функция трансферрина заключается в связывании и переносе железа в ткани. Содержание С-реактивного белка увеличивается при патологических состояниях, сопровождающихся воспалением и распадом тканей.
-/-Глобулины (иммуноглобулины) представлены антителами.
Фибриноген составляет 3—5% от общего количества белка. Нормальное содержание фибриногена в крови здорового человека 5,9—11,7 мкмоль/л. Он образуется в печени, обладает большой молекулярной массой и участвует в заключительной стадии свертывания крови — формировании сгустка.
§ 105. Патология белкового обмена
Общее количество белка крови меняется при целом ряде заболеваний. Снижение количества белка называется гипопротеинемией, увеличение — гиперпротеинемией.
Гипопротеинемия может быть вызвана нарушением процесса образования белков в печени при паренхиматозных гепатитах, циррозах печени, хронических отравлениях некоторыми химическими веществами и др. Другая причина гипопротеинемии — потеря организмом белков с мочой. Это наблюдается при заболеваниях почек, когда в результате поражения почечного фильтра фильтруются в основном альбумины как более мелкие (липоидный и амилоидный нефроз, нефросклероз, хронический нефрит).
Причиной гипопротеинемии могут быть также острые и хронические кровопотери, белковое голодание организма (в результате низкого содержания белка в пище или отсутствия незаменимых аминокислот).
Приводят к гипопротеинемии заболевания желудочно-кишечного тракта (при нарушении процессов переваривания и всасывания пищи), распад опухолей, лихорадочные состояния.
Гиперпротеинемии встречаются сравнительно редко. Кратковременная, относительная гиперпротеинемия наблюдается при сгущении крови из-за потери жидкости организмом. Это отмечается при усиленном потоотделении, неукротимой рвоте, поносе, несахарном диабете.
Незначительная гиперпротеинемия встречается при раздражении ретикулоэндотелиальной системы инфекционным или токсическим процессом за счет увеличения 7-глобулинов.
При миеломной болезни (плазмоцитоме) и макроглобу-линемии Вальденстрема в костном мозге плоских костей черепа появляются очаги образования патологических белков — парапротеинов. Содержание белков плазмы крови достигает 100—160 г/л. Среди патологических белков одни отличаются чрезвычайно большой молекулярной массой, другие — малой молекулярной массой. Последние способны проходить через почечный фильтр, появляться в моче (белковые тела Бенс-Джонса).
Не все заболевания сопровождаются ярко выраженными количественными изменениями общего белка плазмы крови. Чаще изменяется процентное отношение отдельных белковых фракций, хотя общее содержание белка остается в пределах нормы. Такое состояние носит название диспротеинемии. Это особенно важно для ранней диагностики и наблюдения за патологическим процессом в развитии. При острых воспалительных процессах в организме (пневмония, острые инфекционные заболевания, сепсис, полиартрит) характерно, помимо уменьшения альбуминов, возрастание аг и а2-глобулинов. При нефрозах, нефритах, нефросклерозах отмечается значительное уменьшение альбуминов, повышение а2- и р-глобулинов при умеренном понижении 7-глобулинов.
Для гепатитов, токсических поражений печени, гемолитических процессов характерно умеренное уменьшение альбуминов, увеличение 7-глобулинов и резкое увеличение р-глобулинов. Для механических желтух характерно умеренное увеличение а2-, Р- и 7-глобулинов.
§ 106. Понятие об остаточном азоте и его компонентах
Конечными продуктами гидролиза белков в организме служат аминокислоты. Определенная часть аминокислот используется организмом для построения специфических белков, ферментов, гормонов и других биологически
г
важных соединений. Свободные аминокислоты подвергаются в печени преобразованию в другие аминокислоты (переаминирование) или полностью окисляются до углекислого газа, воды и аммиака с выделением энергии.
Аммиак является чрезвычайно токсичным веществом, и организм выработал определенные механизмы его обезвреживания. В клетках нервной, почечной, печеночной и других тканей происходит присоединение аммиака к глутаминовой и аспарагиновой аминокислотам с образованием нетоксичных соединений—глутамина и аспарагина.
Главная роль в обезвреживании аммиака принадлежит печени, которая осуществляет синтез мочевины.
В почках происходит процесс образования из аммиака аммонийных солей. При этом из организма удаляются аммиак, остатки кислот и сохраняются необходимые катионы натрия и калия. Благодаря этим механизмам обезвреживания содержание аммиака в крови незначительно.
Небольшая часть аминокислот, в том числе триптофан, -под влиянием гнилостных бактерий кишечника превращается в токсические вещества — индол и скатол, которое удаляется из организма в виде индикана.
При распаде нуклеопротеидов в организме образуется мочевая кислота, которая так же является конечным продуктом обмена ядерных белков.
। Кроме перечисленных продуктов обмена белков, в ! плазме крови содержатся креатин и креатинин, играющие определенную роль в механизме мышечного сокращения, полипептиды, нуклеотиды, билирубин и др. соединения.
Таким образом, в организме человека в результате | обменных процессов образуются промежуточные и конеч-I ные продукты распада простых и сложных белков: аминокислоты, аммиак, мочевина, мочевая кислота, индикан, * креатин, креатинин, полипептиды и др. Все они являются , низкомолекулярными азотсодержащими соединениями, подлежащими, в основном, удалению из организма. В ! биохимической лаборатории производят определение азо-! та перечисленных соединений — небелкового азота крови.
Так как азот является постоянным химическим элементом белков, то определение небелкового азота производят в крови, после осаждения в ней белков. Азот небелковых компонентов крови называют остаточным азотом. Оста-. точный азот крови в норме составляет 14,3—28,6 ммоль/л. ' Содержание компонентов остаточного азота в сыворотке крови здорового человека и процентное соотношение I азота каждого компонента приведено в табл. 9.
Из таблицы видно, что на долю мочевины приходится половина всего остаточного азота, четвертую часть составляет азот аминокислот. Определение остаточного азо-
Таблица 9. Содержание остаточного азота и его компонентов в сыворотке крови здорового человека
Показатель ' Содержание азота каждой фракции от всего остаточного азота, %
Остаточный азот 100
Мочевниа 50(46—60)
Амииоазот (азот аминокислот) 25
Мочевая кислота 1 4
Креатин 5
Креатнини 2,51 7,5
Индикан 0,5 J
Небелковые вещества 13
та и его компонентов в крови имеет важное диагностическое значение для оценки состояния белкового обмена, изучения выделительной функции почек, многообразных синтетических функций печени.
§ 107. Причины и виды азотемий
У здорового человека колебания остаточного азота незначительны и зависят от количества принятых с пйщей белков. 1
Увеличение содержания остаточного азота в крови называется азотемией. По причинам возникновения азотемию подразделяют на ретенционную и продукционную.
Ретенционная азотемия наступает в результате недостаточного выделения остаточного азота с мочой при нормальном его поступлении в кровь. Если эта задержка связана с нарушением выделительной функции самой почки, то такая азотемия носит название почечной ретенционной азотемии. Она встречается при гломерулонефрите, пиелонефрите, сморщенной почке, туберкулезе почки. Внепочечная ретенционная азотемия возникает в результате нарушения кровоснабжения почки или препятствия к оттоку мочи. Она наблюдается при врожденных пороках сердца, профузных кровотечениях, опухоли мочевого пузыря и предстательной железы, почечнокаменной болезни.
Продукционная азотемия возникает при избыточном поступлении компонентов остаточного азота в кровь, когда происходит усиленный распад тканевых белков в организме. Она наблюдается при распаде опухолей, лейкозах, тяжелых инфекциях, кишечной непроходимости, голодании.
Для начальных стадий ряда заболеваний характерно не столько повышение остаточного азота крови, сколько изменение в количественном содержании компонентов
остаточного азота, соотношения между ними и общим азотом. Например, при острой почечной недостаточности, когда остаточный азот крови может быть в пределах нормы, концентрация мочевины достигает очень больших цифр, так как выделение ее с мочой резко сокращается. Для оценки тяжести состояния определяют отношение азота мочевины к остаточному азоту в процентах. В норме такое отношение составляет 48%, а при почечной недостаточности может достигнуть 90%.
Для характеристики очистительной способности почек пользуются условным показателем, который называется коэффициентом очищения или клиренсом. Этот показатель рассчитывают по способности почки выделять креатинин из крови. Такое исследование носит название пробы Реберга.
Устойчивое повышение в крови индикана и мочевой кислоты указывает на нарушение работы почечного фильтра при острых и хронических пиелонефритах, сморщенной почке.
В целях диагностики заболеваний, связанных с патологическими процессами в мышечной ткани, определяют уровень креатина крови, который возрастает при дистрофиях мышц и миопатиях. Определение содержания мочевой кислоты имеет значение для диагностики подагры — заболевания, связанного с нарушением обмена нуклеопротеидов.
§ 108. Роль печени в белковом обмене
Печень в организме человека выполняет целый ряд разнообразных и жизненно важных функций. Печень участвует практически во всех видах обмена: белковом, углеводном, жировом, минеральном, пигментном. В ней происходит синтез и распад белков. В норме печень синтезирует за сутки от 13 до 18 г белка. Альбумины, фибриноген, протромбин образуются полностью в печени, «-глобулины — до 90%, р-глобулины— до 50%. В связи с этим при печеночных заболеваниях определение общего белка и его фракций имеет большое значение. Чем тяжелее заболевание, тем значительнее снижается содержание белка в плазме крови, причем, в основном, за счет альбуминов. Больная печень начинает вырабатывать белки с измененными физико-химическими свойствами, в частности, снижается их коллоидная устойчивость. Такие белки легче выпадают в осадок при действии осадителей. Обнаружить изменение свойств белков можно при помощи проб на коллоидоустойчивость или осадочных проб. Наиболее распространенные осадочные пробы — это проба Вельтмана, тимоловая и сулемовая.
Говоря о роли печени в синтезе белков, необходимо отметить образование в ней белков, обеспечивающих процесс свертывания крови — фибриногена, протромбина ц других факторов. Нарушение синтеза этих белков, недостаток витамина К, вследствие нарушения желчеобразования и желчевыделения, приводит к геморрагическим явлениям.
Как указывалось, образующиеся в результате гидролиза белков аминокислоты подвергаются в печени процессам дезаминирования и переаминирования. При тяжелых заболеваниях печени процесс дезаминирования нарушается, что приводит к увеличению концентрации аминокислот в крови и выделению их с мочой. В этих случаях в моче обнаруживаются кристаллы аминокислот — лейцина и тирозина.
Образование мочевины из аммиака происходит только в печени. При нарушении этой функции в крови резко уменьшается количество мочевины и возрастает количество аммиака, который обладает чрезвычайно токсичным действием, прежде всего на центральную нервную систему. Развивается печеночная кома, которая может привести к гибели больного.
В клетках печени содержатся ферменты, обеспечивающие процессы переаминирования. При гепатитах, особенно при болезни Боткина, печеночные клетки подвергаются разрушению вирусом и ферменты поступают в кровь. Увеличение этих ферментов в крови еще в дожел-тушный период, служит чрезвычайно важным диагностическим показателем. В клинической практике проводят определение аспартатаминотрансферазы, аланинаминотрансферазы и лактатдегидрогеназы.
Вопросы для повторения
1. Какова роль белков в организме?
2. На какие фракции делятся белки при электрофорезе на бумаге?
3. Какими свойствами обладают альбумины, глобулины и фибриноген? Какова их роль в организме?
4. Каковы причины гипо- и гиперпротеинемий?
5. Что такое парапротеииы, какими свойствами они обладают?
6. Что такое диспротеииемии, каковы их причины?
7. Каким превращениям подвергаются аминокислоты в организме?
8. Каковы механизмы обезвреживания аммиака в организме?
9. Что такое остаточный азот и каковы его компоненты?
10. Каковы причины ретенционной азотемии?
11. Каковы причины продукционной азотемии?
12. Какова диагностическая ценность определения отдельных компонентов остаточного азота?
13. Какова роль печени в белковом обмене?
14. Какие функциональные пробы применяют для выявления заболеваний печени?
15. Из каких компонентов состоит остаточный азот и как они изменяются при заболеваниях печени?
МЕТОДЫ ИССЛЕДОВАНИЯ
§ 109. Определение общего белка сыворотки крови по биуретовой реакции
Белки в щелочной среде реагируют с сульфатом меди, с образованием комплексных соединений, окрашенных в фиолетовый цвет. По интенсивности окрашивания, которое пропорционально количеству белка, определяют содержание его в сыворотке крови.
Реактивы: 1) 0,9% раствор хлорида натрия (0,9 г соли на 100 мл дистиллированной воды);
2) 0,2 н. раствор едкого натра, свободного от углекислоты (20 мл 1 н. раствора щелочи доводят до объема 100 мл прокипяченной дистиллированной водой);
3) основной биуретовый реактив (4,5 г сегнетовой соли— виннокислого калия-натрия КМаСдНдОб, растворяют в 40 мл 0,2 н. раствора едкого натра; после растворения прибавляют 1,5 г гидросульфата меди CuSO4-5H2O и 0,5 г йодида калия, доливают до метки 100 мл 0,2 н. раствором едкого натра; хранят в темном месте или в посуде из темного стекла не более месяца);
4) 0,5% раствор йодида калия (0,5 г соли растворяют в 100 мл 0,2 н. раствора едкого натра; хранят в посуде из темного стекла не более 2 нед);
1 5) рабочий раствор биуретового реактива (20 мл основ-
ного биуретового реактива смешивают с 80 мл раствора йодида калия в растворе едкого натра); хранят в темном месте не более 2 нед;
6) стандартный 10% раствор альбумина в 0,9% растворе хлорида натрия (1 г альбумина из человеческой или бычьей сыворотки растворяют в 6—7 мл 0,9% раствора хлорида натрия и доводят изотоническим раствором хлорида натрия до объема 10 мл; 1 мл стандартного раствора содержит 0,1 г белка).
Ход определения. К 5 мл рабочего раствора биуретового реактива (5) добавляют, избегая образования пены, 0,1 мл сыворотки крови. Через 30 мин (не позднее 1 ч) производят измерения на ФЭКе в кювете с толщиной слоя 5 мм при зеленом светофильтре (540—560 нм) против контроля (5 мл рабочего раствора биуретового реактива). Расчет ведут по калибровочному графику, на основе которого для удобства составляют таблицу пересчета или с помощью экспериментально полученного коэффициента.
Построение калибровочного графика. Готовят рабочие стандартные растворы. Для этого из стандартного 100 г/л, т. е. 10 г на 100 мл, раствора белка готовят серию разведений, как указано в табл. 10.
10 20 30 40 50 60 70 80 90 100 С(г/л)
Рис. 62. Калибровочный график для определения общего белка сыворот-ки крови.
\ Е—экстинкция; С—концентрация белка.
Таблица 10. Схема приготовления стандартных растворов
Стандартный раствор белка, мл 0,9% раствор NaCl, мл Концентрация белка - -
г/100 мл г/л
0,4 '0,6 4 40
0,6 0,4 6 60
0,8 0,2 8 80
1,0 — 10 100
Из каждого разведения берут по 0,1 мл раствора и j вносят в чистые пробирки, куда добавляют по 5 мл | рабочего биуретового реактива (5). Через 30—60 мин I измеряют экстинкцию на ФЭКе против контроля, начинай 1 с наименьшей концентрации.
Обычно для калибровки не ограничиваются одной серией определений и разведений. Для каждой концентрации делают не менее 2—3 определений. Данные наносят на миллиметровую бумагу. На оси абсцисс (горизонтальной) равномерно наносят значения концентраций, на оси ординат (вертикальной)—средние значения оптической плотности (экстинкций), соответствующие взятым концентрациям белка.’Через полученные точки (а при необходимости— между ними) проводят прямую линию. Масштаб выбирают так, чтобы линия располагалась под углом, близким к 45°.
Иногда характер графика для больших концентраций несколько отклоняется от прямой линии, однако если
результаты стабильно повторяются, то такой график вполне пригоден для работы.
Калибровочную кривую нужно время от времени проверять. При этом достаточно проверить 2—3 точки. Если они укладываются на прежнем графике, то он не переделывается. Для облегчения подсчетов составляют таблицу. Пример калибровочного графика приведен на рис. 62.
Норма общего белка: 65—85 г/л.
§ 110. Определение белковых фракций сыворотки крови методом электрофореза на бумаге
Белки сыворотки, обладающие электрическим зарядом различной величины, под воздействием постоянного тока движутся по смоченной буферным раствором бумаге к положительному полюсу. Скорость движения белковых молекул зависит от величины заряда и молекулярной массы частиц, что и позволяет разделить белки сыворотки крови на 5 основных фракций: альбумины и глобулины — аь а2, Р, у- При дальнейшей обработке фракции белков выявляются при помощи красителей, которые связываются с ними пропорционально их содержанию.
Реактивы: 1) барбитал-натриевый буферный раствор, pH 8,6 (10,32 г барбитал-натрия растворяют в 300 мл дистиллированной воды в химическом стакане, добавляют 1,84 г барбитала и нагревают на водяной бане при помешивании до растворения; после охлаждения переносят в мерную колбу или цилиндр вместимостью 1 л, доводят до метки дистиллированной водой и перемешивают; определяют pH при помощи индикаторной бумаги); иногда применяют другие буферные смеси: 2) бромфеноловый синий (0,5 г бромфенолового синего, 10 г кристаллического сульфата цинка, 20 мл ледяной уксусной кислоты растворяют в 500 мл дистиллированной воды); сульфат цинка и уксусную кислоту добавляют для фиксации белков;
3) 2% раствор уксусной кислоты для отмывания избытка красителя (980 мл дистиллированной или водопроводной воды смешивают с 20 мл крепкой уксусной кислоты);
4) 0,01 н. раствор едкого натра для элюирования (извлечения) краски из электрофореграмм (10 мл 0,1 н. раствора щелочи помещают в колбу вместимостью 100 мл и доводят до метки дистиллированной водой; реактив готовят перед началом исследования).
Устройство прибора для электрофореза. Разделение белковых фракций проводят на различного типа аппаратах для электрофореза, используя в качестве носителя специальную фильтровал:. ' -згу. В зависи-
2
2
Рис. 63. Схема камеры для электрофореза на бумаге. Объяснение тексте.
мости от типа камеры для электрофореза бумагу нарезают полосками требуемого размера (2,5x26 или 3,5x40 см).
К настоящему времени предложено много самых различных аппаратов для электрофореза на бумаге. Основным требованием к используемому прибору является наличие источника постоянного тока, который должен подавать на клеммы выпрямленный ток силой 50—100 мА при напряжении 180—400 В. Аппарат для электрофореза на бумаге (рис. 63) представляет собой камеру (1) из толстого стекла, закрывающуюся крышкой (2). На дне камеры устанавливаются свободно вынимающиеся кюветы (5), в которые опущены концы электродов (3). Посередине камеры установлена свободно вынимающаяся рамка, на которой укрепляют бумажные ленты (4). В камере должна создаваться и поддерживаться определенная влажность воздуха для предохранения бумаги от высыхания.
Ход определения. Устанавливают камеру строго горизонтально по уровню с помощью установочных винтов (7). В оба отделения кювет наливают буферный раствор до одинакового уровня, соединяют эти отделения полоской хроматографической бумаги — фитилем (6). Фитиль служит электрическим мостиком между отделениями кювет и препятствует изменению pH на лентах. Подготавливают полоски хроматографической бумаги требуемого размера, отмечают место нанесения сыворотки («старт») мягким карандашом на расстоянии 4—8 см от катода (минуса). Полоски смачивают буферным раствором, слегка отжимают между листами обычной фильтровальной бумаги и кладут на рамку между кюветами. Лента должна 230
быть равномерно натянута, .концы ее погружают в буферный раствор внутренних отделений кювет. На ленту, в месте отмеченного старта, помещают 0,005—0,01 мл неге-молизированной сыворотки. Производят эту операцию краем шлифованного стекла (покровного, предметного), на который микропипеткой наносят сыворотку, равномерно распределяя ее по краю стекла. Ширина стекла должна быть на 6—8 мм уже хроматографической ленты, тогда края ленты будут свободны от сыворотки. Стекло переворачивают сывороткой вниз, прикладывают под острым углом к поверхности бумаги и придерживают в этом положении несколько секунд, пока сыворотка не перейдет на ленту.
После нанесения сыворотки плотно закрывают камеру крышкой и включают прибор. Через бумажные ленты начинает проходить постоянный электрический ток и осуществляется собственно электрофорез. Электрофоретическое разделение белков сыворотки крови проводят при комнатной температуре и напряжении тока от 3 до 8 В на 1 см длины ленты. Время электрофореза определяется опытным путем и обычно составляет от 6 до 20 ч.
По окончании электрофореза ток выключают, ленты извлекают из камеры, концы их обрезают или отжимают фильтровальной бумагой. Ленты сушат 15—20 мин в сушильном шкафу при 95—105° С: происходит коагуляция белка, и он закрепляется на ленте. После этого ленту окрашивают, погружая на 20—30 мин в эмалированные кюветы с раствором красителя. Фракции белков адсорбируют краску пропорционально своей концентрации. Ленты извлекают, избыток красителя удаляют, промывая их в 3—4 порциях 2% уксусной кислоты. Сушат при комнатной температуре, желательно в затемненном месте.
Электрофореграмма сыворотки крови представлена на рис. 64 (см-, на цвет. вкл.).
Количественные соотношения отдельных белковых фракций можно определить с помощью прибора денситометра. В приборе производится автоматическая запись концентраций окрашенных зон, где располагаются отдельные фракции. Определение осуществляется путем пропускания светового пучка через электрофореграмму. Количество света, прошедшее через участки электрофореграммы, обратно пропорционально количеству красителя, адсорбированного отдельными фракциями.
Более просто определение белковых фракций производится методом элюирования (извлечения) краски из бумаги и колориметрического измерения ее количества. Для этого электрофореграмму разрезают на отдельные полоски, ориентируясь на светлые участки между белковыми фракциями. Каждую полоску с индивидуальной фракцией
помещают в отдельную пробирку или стаканчик. К глобулиновым фракциям добавляют по 5 мл 0,01 н. раствора j
- едкого натра, а к фракции альбумина—15 мл. Содержи- 1 мое пробирок осторожно встряхивают и оставляют на 3 40—60 мин. Измерение производят на ФЭКе с зеленым светофильтром в кювете с толщиной слоя 5 мм. Все 3 величины экстинкции (оптической плотности) складывают : (экстинкцию альбумина умножают на 3). Принимая сумму : экстинкций за 100%, вычисляют процентное содержание каждой фракции.
Пример. Экстинкция альбуминов — 0,21; глобулинов: О] — 0,05; а.2—0,07; [3 — 0,12; у — 0,18. Сумма равна 1,05 (с учетом умножения экстинкции альбуминов на 3). Принимая данную сумму за 100%, вычисляем содержание ! отдельных фракций:
_ 0,63-100 _ д
альбумин =—=60,0%; д
0,05-100 л ®
। глобулины oi=—j-gj—=4,8%;
0,07-100 ’
а2=------=6,7%;
1,05
„ 0,12-100 _
3=-[^5-=П,4%;
0,18-100
^=^-=17,1%.
Зная концентрацию общего белка, можно легко вычислить значения всех фракций в граммах на литр.
Пример. Концентрация общего белка—85 г/л. Воспользуемся теми же значениями экстинкций. Тогда доля - 0,63-85 л
альбуминов равна: —--=51 г/л. л
Таким образом производят расчет и для всех осталь-1 ных фракций. J
Процентное соотношение белковых фракций в норма составляет: альбумины — 56,5—66,8%; а i-глобулйны-J 3,0—5,6%; аг-глобулины — 6,9—10,5%; р-глобулины —<| 7,3—12,5%; -у-глобулины—12,8—19,0%. 1
§ 111. Определение остаточного азота крови прямой реакцией с реактивом Несслера
В процессе минерализации фильтрата крови выделяющийся азот взаимодействует с серной кислотой и образует сульфат аммония. При добавлении к нему реактива Несслера образуется комплексное соединение желтого цвета, интенсивность окраски которого пропорциональна содержанию азота в крови.
Реактивы: 1) реактив для осаждения белка (в колбу вместимостью 100 мл помещают небольшое количество воды, 0,5 г сульфата натрия, 0,5 г фосфорномолибденовой кислоты Н7Р(Мо2О7)б и 9,5 мл серной кислоты (с относительной плотностью 1,84); доводят объем до Ю0 мл дистиллированной водой);
2) реактив Несслера (выпускают в готовом виде); хранят в темной склянке;
3) 50% раствор едкого натра;
4) серная кислота концентрированная (относительная платность 1,84);
5) стандартный раствор сульфата аммония (на аналитических весах в стеклянном бюксе взвешивают 0,4716 г сульфата аммония и растворяют его в небольшом количестве дистиллированной воды; растворенный реактив из бюкса количественно переводят в мерную колбу вместимостью 100 мл, затем доливают дистиллированной водой до метки; приготовленный реактив содержит 1 мг азота в 1 мл раствора);
6) рабочий стандартный раствор (разводят стандартный раствор в 20 раз; раствор содержит 0,05 мг азота в 1 мл);
7) пергидроль.
Ход определения. У обследуемого микропипеткой набирают 0,2 мл крови (можно использовать сыворотку или плазму крови в таких же количествах) и помещают в центрифужную пробирку, содержащую 2,8 мл реактива для осаждения белка. Содержимое пробирки перемешивают, оставляют на 10 мин при комнатной температуре, затем центрифугируют. В 2 пробирки из тугоплавкого стекла вносят по 0,5 мл центрифугата и прибавляют 0,05 мл концентрированной серной кислоты. В 2 контрольные пробирки наливают по 0,05 мл концентрированной
серной кислоты. Пробирки ставят в наклонном положении ' на песочную баню (во избежание перегрева пробирки должны касаться только верхнего слоя песка). В пробирки вставляют неплотные пробки из увлажненной ваты для улавливания выделяющегося сернистого ангидрида. Сжигание проводят в вытяжном Шкафу. В момент, когда исследуемая жидкость буреет, пробирки снимают с бани, охлаждают и в каждую добавляют по 2 капли пергидроля. Затем пробирки вновь устанавливают на песчаную баню. Сжигание считается законченным, когда жидкость в пробирках станет совершенно бесцветной. После этого пробирки снимают с бани, охлаждают и прибавляют в каждую по 10 мл свежепрокипяченной дистиллированной воды. Содержимое пробирок нейтрализуют 50% раствором щелочи до слабощелочной реакции (контроль по изменению цвета лакмусовой бумаги от красного до синего
цвета). Излишек щелочи при нейтрализации приводит к помутнению раствора, а недостаток — к выпадению солей ртути. После нейтрализации во все пробирки наливают по 0,5 мл реактива Несслера, и содержимое пробирок окрашивается в желтый цвет разной интенсивности в зависимости от содержания азота. Контрольные пробы имеют слегка желтоватый оттенок, соответствующий окраске реактива Несслера. Более темное окрашивание жидкости в контрольных пробирках указывает на непригодность реактивов. Далее количественное определение остаточного азота в крови можно проводить титрометрическим или колориметрическим способами.
Титрование контрольных проб проводят на белом фоне стандартным раствором до совпадения окраски контрольных и опытных проб. При получении одинаковой окраски в контрольной и опытной пробах отмечают количество израсходованного стандартного (рабочего) раствора и производят расчет по формуле:
3-х • 10-0,05 .
—0 2-0 5—= 150-х мг/100 мл азота,
где х—количество стандартного рабочего раствора, пошедшего. на титрование, мл; 3 — количество исходной смеси (0,2 мл крови и 2,8 мл реактива для осаждения белка, мл); 0,2 — количество крови в 3 мл исходной смеси, мл; 0,5 — количество центрифугата, взятого в опыт, мл; 0,05 — количество азота, содержащегося в 1 мл стандартного рабочего раствора, мл.
Измерения производят на ФЭКе в кювете с толщиной слоя 5 мм против контроля при фиолетовом светофильтре (440—450 нм). Параллельно с опытными пробами обрабатывают стандартную пробу (0,2 мл стандартного раствора, 0,05 мл концентрированной серной кислоты, 0,3 мл 50% раствора едкого натра, 0,5 мл реактива Несслера и 9,8 мл дистиллированной воды). Стандартную пробу измеряют при тех же условиях, что и опытные (окраска устойчива в течение 15—20 мин). Контроль ставится, как стандартные пробы, но вместо сульфата аммония добавляют воду. Расчет производят по формуле:
^оп 30*НОП
e'en С*СТ С- с- 9
^СТ ^ст
где Соп—концентрация остаточного азота, мг/100 мл; £оп — экстинкция опытной пробы; Сст—концентрация остаточного азота в стандарте, 30 мг/100 мл; Ест — экстинкция стандартной пробы.
Норма остаточного азота составляет 20—40 мг/100 мл. Коэффициент пересчета в единицы СИ (ммоль/л) равен 0,7140.
§ 112. Определение мочевины в сыворотке крови и моче по цветной реакции с диацетилмонооксимом
Мочевина в кислой среде образует с диацетилмонооксимом в присутствии тиосемикарбазида и солей железа окрашенные соединения, интенсивность окраски которых прямо пропорциональна содержанию мочевины в сыворотке крови и в моче.
Реактивы: 1) ‘ 10% раствор трихлоруксусной
кислоты;
2) 2,5% водный раствор диацетилмонооксима (реактив стоек);
3) 0,25% водный раствор тиосемикарбазида или 0,32% водный раствор хлорида тиосемикарбазида; оба реактива стабильны при хранении в темной посуде при комнатной температуре;
4) основной 5% раствор хлорного железа (5 г хлорного железа растворяют в 100 мл дистиллированной воды и подкисляют добавлением 1 мл концентрированной серной кислоты); из основного раствора готовят рабочий раствор (1 мл основного раствора доводят до объема 100 мл дистиллированной водой, затем добавляют 8 мл концентрированной серной кислоты и 1 мл 85% ортофосфорной кислоты); хранят в темном месте; годен в течение 2 нед;
5) цветной реактив (к 30 мл рабочего раствора хлорного железа добавляют 20 мл дистиллированной воды, 1 мл 2,5% раствора диацетилмонооксима и 0,25 мл 0,25% раствора тиосемикарбазида); готовят каждый раз перед употреблением;
6) стандартный раствор мочевины (1 г мочевины растворяют в 100 мл растворителя). В качестве растворителя можно использовать дистиллированную воду или 0,2% раствор бензойной кислоты. Стандарт, приготовленный на основе бензойной кислоты, более стабилен, чем водный. При работе оба раствора должны давать небольшие колебания экстинкции. В противном случае следует приготовить новый стандартный раствор. 1 мл стандартного раствора содержит 1 мг мочевины.
Ход определения в сыворотке крови. В центрифужную пробирку вносят 0,8 мл дистиллированной воды, 0,2 мл сыворотки и 1 мл 10% раствора трихлоруксусной кислоты, перемешивают. Через 15—20 мин смесь центрифугируют.
В чистую пробирку вносят 0,5 мл над осад очной жидкости и 5 мл цветного реактива. Пробирку выдерживают в кипящей водяной бане в течение 20 мин, затем охлаждают 2—3 мин под водопроводной водой. Измерение проводят на ФЭКе при длине волны 500—560 нм (зеленый свето
фильтр) против контрольной пробы в кювете с толщиной слоя 10 мм.
Контрольную пробу ставят так же, как опытную, но вместо надосадочной жидкости берут 0,5 мл дистиллированной воды.
В стандартную пробу вносят вместо сыворотки 0,2 мл стандартного раствора мочевины, далее определение проводят как опытное. Расчет производят по формуле:
где х—концентрация мочевины, мг/100 мл; Еоп— экстинкция опытной пробы; — экстинкция стандартной пробы; 100 — концентрация мочевины в стандартном растворе, мг/100 мл;
Коэффициент пересчета в единицы СИ (ммоль/л) равен 0,1665, отсюда:
Е Е
х=р—100-0,1665=-р—-16,65 ммоль/л.
Лст £-ст
Норма мочевины в сыворотке крови 3,33—8,32 ммоль/л.
Ход определения в моче. Перед определением профильтрованную мочу (из суточного количества) разводят изотоническим раствором хлорида натрия в соотношении 1:25 илн 1:50. Определение производят также, как в сыворотке крови, но вместо сыворотки берут 0,2 мл разведенной мочи. Параллельно обрабатывают стандартную пробу, как и для определения мочевины в сыворотке крови.
Расчет мочевины на суточное количество мочи производят по следующей формуле: (
х__^~*ст ‘ ^°п' ‘
Ест б -1000 ’
где х—количество мочевины в суточной моче, г; Еоп — экстинкция опытной пробы; Ест — экстинкция стандартной пробы; Сст — количество мочевины в стандартной пробе, мг; а—суточное количество мочи, мл; б—количество мочи, взятое для анализа, мл; К—коэффициент разведения мочи; 1000 — коэффициент перевода величины экскреции мочевины из миллилитров в граммы.
В суточном объеме мочи содержится 20—35 г мочевины. Коэффициент пересчета в единицы СИ (ммоль/л) равен 16,650.
§ 113. Определение креатинина в сыворотке крови и моче по цветной реакции Яффе1
Креатинин в щелочной среде реагирует с пикриновой кислотой с образованием окрашенных соединений. Интенсивность окраски пропорциональна концентрации креатинина.
Реактивы: 1) насыщенный раствор пикриновой кислоты (2 г пикриновой кислоты растворяют в 100 мл горячей дистиллированной воды на водяной бане при температуре 70—80° С; раствор оставляют на 24 ч, периодически помешивая, после чего фильтруют); реактив стоек; хранят в темной посуде. Обращаться осторожно, яд! Пикриновая кислота содержит 15—20% воды, но сушить ее не следует, взрывоопасно!
2) основной стандартный раствор креатинина (100 мг креатинина растворяют в 100 мл 0,1 н. раствора хлористоводородной кислоты); хранят в холодильнике в посуде с притертой пробкой. Рабочий стандартный раствор получают разведением основного раствора дистиллированной водой в 100 раз; 1 мл рабочего раствора содержит 0,01 мг креатинина; реактив нестоек; х
3) 10% раствор едкого натра;
4) 0,1 н. раствор хлористоводородной кислоты.
Ход определения в сыворотке крови. Смешивают в пробирке 2 мл сыворотки с 6 мл насыщенного раствора пикриновой кислоты. Через 5 мин пробирку помещают на 15—20 мин в кипящую водяную баню, а затем центрифугируют (или фильтруют).
К 4 мл центрифугата добавляют 0,2 мл 10% раствора щелочи и тщательно перемешивают. Иногда после подщелачивания раствор мутнеет вследствие выпадения фосфатов. В таком случае его следует еще раз отцентрифугировать. Затем раствор доводят до объема 10 мл дистиллированной водой.
Через 10 мин пробу фотометрируют при зеленом светофильтре (длина волны 500—560 нм) в кювете с толщиной слоя 20 мм против контрольной пробы. Интенсивность окраски не изменяется в течение часа.
Контрольная проба. Змл насыщенного раствора пикриновой кислоты и 0,2 мл раствора гидроокиси натрия доводят до объема 10 мл дистиллированной водой.
Стандартная проба. К 1 мл рабочего стандартного раствора креатинина добавляют 3 мл пикриновой кислоты, 0,2 мл 10% раствора щелочи и 5,8 мл дистиллированной воды.
1 Метод Поппера.
Расчет производят по формуле:
£Ст
где х—содержание креатинина в сыворотке, мг/л; Еап — экстинкция опытной пробы; Ест — экстинкция стандартной пробы; 10 — концентрация креатинина в стандартной пробе, мг/л.
Расчет может быть произведен по калибровочному графику. Измерения экстинкции производят в тех же условиях, что в опытных пробах. Для пересчета в единицы СИ (ммоль/л) полученные результаты умножают на коэффициент 0,0088.
Нормальное содержание креатинина в крови женщин 0,044—0,088 ммоль/л; в крови мужчин 0,044— 0,101 ммоль/л.
Ход определения в моче. В мерной колбе или цилиндре вместимостью 100 мл смешивают 0,5 мл мочи (из суточного количества) с 3 мл раствора пикриновой кислоты. Смесь тщательно встряхивают и добавляют 0,2 мл 10% раствора щелочи.
Выдерживают при комнатной температуре в течение 10 мин, доводят дистиллированной водой до объема 100 мл. Экстинкцию измеряют против контроля на ФЭКе в кювете шириной 10 мм при зеленом светофильтре (длина волны -500—560 нм).
Контрольная проба. КЗ мл раствора пикриновой кислоты добавляют 0,2 мл 10% раствора щелочи и доводят дистиллированной водой до объема 100 мл.
Стандартная проба. К 0,5 мл основного стандартного раствора (содержащего 0,5 мг креатинина) прибавля-' ют 3 мл раствора пикриновой кислоты и 0,2 мл 10?? раствора щелочи. Далее пробы обрабатывают, как опытные. Расчет производят по формуле:
Ь'оп
х=т—1000,
Сст
где х—концентрация креатинина в моче, мг/л; Еоп — экстинкция опытной пробы; Ест— экстинкция стандартной пробы; 1000 — концентрация основного стандартного раствора креатинина, мг/л.
Расчет количества креатинина в суточной моче:
Сст-£од-Д Еоп-Д Хг~ Ест-а ” Ест ’
где хг — количество креатинина в суточной моче, г; Сст — количество креатинина в стандартной пробе, мг; Еоп— экстинкция опытной пробы; Ест— экстинкция стандартной 238
пробы; Д—суточное количество мочи, мл; а—количество мочи, взятое для анализа, мл;
В норме содержание креатинина в суточной моче составляет 500—2000 мг. Коэффициент пересчета в единицы СИ (ммоль/л) равен 0,0088.
§ 114. Пробы коллоидоустойчивости
Проба Вельмана (модификация Гейфеля). При добавлении к сыворотке крови раствора хлорида кальция определенной концентрации и нагревании происходит нарушение коллоидной устойчивости белков. Белки коагулируют и выпадают в виде хлопьевидного осадка.
Реактив: 0,5% раствор хлорида кальция; готовят из 10% раствора кристаллического хлорида кальция СаС12-6Н2О или 5% безводного хлорида кальция СаС12; может быть использован раствор хлорида кальция в ампулах (для внутривенных введений); при его отсутствии рекомендуется готовить раствор из СаС12-6Н2О с относительной плотностью 1,040, который соответствует 5% раствору безводного СаС12.
Ход определения. К 4,9мл дистиллированной воды прибавляют 0,1 мл сыворотки (свежей, негемолизи-рованной), тщательно перемешивают и прибавляют 0,1 мл 0,5% раствора хлорида кальция. Содержимое пробирки встряхивают и нагревают над пламенем горелки до однократного закипания смеси. Пробирку охлаждают и рассматривают содержимое в проходящем свете. Если белых хлопьев не обнаруживают, то добавляют еще 0,1 мл СаС12 и раствор вновь нагревают до кипения. Процедуру повторяют до тех пор, пока не выпадает хлопьевидный осадок. Результат оценивают, подсчитывая общее количество хлорида кальция, пошедшее на реакцию. В норме коагуляция наступает при добавлении 0,4—0,5 мл хлорида кальция.
Реакция коагуляции белков сыворотки может изменяться в двух направлениях: в'сторону увеличения или уменьшения количества раствора СаС12, пошедшего на реакцию. Применяют термины «сдвиг вправо» (уменьшение СаС12 для реакции) и «сдвиг влево» (увеличение СаС12 для реакции).
Сдвиг вправо отмечается при болезни Боткина, острой желтой атрофии печени, циррозах, многих воспалительных заболеваниях (пневмонии, плеврите, туберкулезе легких).
Сдвиг влево обнаруживается при острых воспалительных и экссудативных процессах — остром ревматизме, нефрозах, злокачественных опухолях, больших потерях жидкости и др.
Тимоловая проба (по Хуэрго и Поппер). При взаимодействии сыворотки крови с тимолово-барбиталовым буфером появляется мутность, вследствие образования глобулино-тимоловофосфолипидного комплекса.
Реактивы: 1) 10% спиртовой раствор тимола (10 г очищенного тимола растворяют в 96% этиловом спирте в мерной колбе вместимостью 100 мл);
2) буферный раствор (2,76 г барбитала, 2,06 г барби-тал-натрия растворяют в мерной колбе вместимостью 1 л дистиллированной водой и доводят объем до метки); | хранят в холодильнике; при выпадении осадка реактив Я негоден к употреблению; 3
3) тимолово-барбиталовый буфер, pH 7,55—7,6 (в 1 мерной колбе вместимостью 100 мл смешивают 80 мл а буферного раствора и 1 мл спиртового раствора тимола, 4 встряхивают и доливают буферным раствором до метки); 1 проверяют pH: д
4) стандартный раствор — суспензия BaSo4: а) раствор 1 хлорида бария (1,175 г хлорида бария ВаС12-2Н2О раство- | ряют в мерной колбе вместимостью 100 мл и доводят до J метки дистиллированной водой); б) 0,2 н. раствор серной | кислоты; в) перед употреблением 3 мл раствора хлорида J бария наливают в мерную колбу вместимостью 100 мл и I доводят до метки 0,2 и. раствором серной кислоты при I температуре 10° С. I
Ход определения. К 6 мл тимолово-барбиталового I буфера прибавляют 0,1 мл сыворотки крови, оставляют на 1 30 мин при комнатной температуре. Фотометрируют с I красным светофильтром (длина волны 660 нм) в кюветах с I толщиной слоя до 10 мм против раствора тимолово- I барбиталового буфера. Расчет ведут по калибровочному I графику. I
Построение калибровочного графика. .Из I стандартного раствора (суспензии) сульфата бария готовят I разведения, соответствующие единицам помутнения по л Shank и Hoagland (S—Н), как указано в табл. 11. Л
Таблица 11. Схема приготовления стандартных суспензий
Суспензия
BaSO4, мл
0,2 и. H.SO.. Единицы помутнения
мл (S—Н)
1,35
2,70
5,40
4,65
3,30
0,60
5
10
20
Стандартные растворы смешивают, встряхивают и тотчас измеряют при тех же условиях, что и опытные против воды.
Нормальные данные тимоловой пробы 0—4 единиц (S-H).
Высокие цифры (единицы) тимоловой пробы отмечаются при острых гепатитах, циррозах печени в стадии обострения. Увеличенные цифры после перенесенного гепатита свидетельствуют о том, что патологический процесс в печени полностью не прекратился.
Глава II
ФЕРМЕНТЫ И ИХ РОЛЬ В ОРГАНИЗМЕ
ФЕРМЕНТЫ —БИОЛОГИЧЕСКИЕ КАТАЛИЗАТОРЫ
§ 115. Свойства
Ферментами называются вещества белковой природы, которые способны каталитически ускорять протекание биохимических реакций в живом организме. Синтезируемые в клетках ферменты обеспечивают реакции преобразования веществ, составляющих материальную и энергетическую основу жизни. И. П. Павлов сказал о ферментах, что они есть «в полном смысле возбудители жизни».
В настоящее время вопрос о белковой природе ферментов решен настолько определенно, что под словом фермент автоматически подразумевается белок. По строению ферменты могут быть простыми белками — протеинами и сложными — протеидами. В состав последних входит, помимо белковой части, добавочная группа небелковой природы, часто составляющая незначительную часть всей молекулы фермента.
Химическая природа добавочных групп достаточно разнообразна: витамины или вещества, построенные с их участием, нуклеотиды и их производные, ионы металлов. Необходимо отметить, что только комплекс белка с добавочной группой обладает каталитической активностью. Ферменты, как и белки, характеризуются строго определенным составом аминокислот, их последовательностью и расположением полипептидной цепи в пространстве (например, в форме клубка или диска). Некоторые ферменты состоят из нескольких субъединиц, между которыми возможны комбинации. Ферменты, образованные комбинациями субъединиц, называются изоферментами.
Будучи веществами белковой природы, ферменты об- . ладают свойствами белков, отличающих их от катализаторов неорганической природы.
Специфичность действия — одно из основных свойств ферментов. Некоторые ферменты обладают абсо-
лютной специфичностью, т. е. каталитически ускоряют одну единственную реакцию [например, карбамид — амидогидролаза (уреаза) катализирует реакцию гидролиза мочевины с образованием аммиака]. Большая часть ферментов обладает относительной специфичностью. Так, трипсин гидролизует пептидные, амидные или эфирные связи, образованные аминокислотами лизином или аргинином, липаза — эфирные связи в триацилглицеринах, с образованием глицерина и жирных кислот. Аминотрансферазы осуществляют перенос аминогруппы с аминокислоты на кетокислоту.
Термолабильность ферментов выражается в их чувствительности к действию температуры. При повышении температуры более 50° С происходит снижение активности ферментов, и дальнейшее нагревание приводит к свертыванию белка — разрушению фермента.
При снижении температуры ниже 20° С активность ферментов падает, но не происходит их разрушения. Этим обстоятельством пользуется современная медицина при проведении операций в условиях низких температур. Температура, при которой проявляется максимальная актив-ность фермента, называется температурным оптимумом. Для ферментов человеческого организма он лежит в ,, пределах 37—40° С.
Активность фермента зависит от значения pH среды. Для каждого фермента имеется определенное значение pH, при котором скорость реакции оптимальная. При отклонении от этого значения pH в любую сторону, J скорость реакции снижается. Для пепсина оптимум pH 1,5 ] (резкокислая среда), для щелочной фосфатазы плазмы—| 9—10 (резкощелочная среда). Для большинства фермен-я тов организма человека оптимум pH лежит близко к.;1 нейтральной точке (pH около 7). При проведении исследо-1 ваний с использованием ферментов необходимо поддержи-’! вать постоянное значение pH с помощью соответству-д ющих буферных растворов. 1
Активность ферментов зависит от присутствия в среде I активаторов и ингибиторов. Вещества, усилива-1 ющие действие ферментов, называются активаторами. К] их числу относятся ионы металлов (кальция, магния,] цинка и др.), сами ферменты, промежуточные продукты] обмена веществ. Ионы кальция активируют ферменты-1 факторы плазмы крови, участвующие в процессе сверты-1 вания, ионы водорода — пепсин; энтеропептидаза активи-1 рует трипсиноген, желчные кислоты — липазу. I
Вещества, тормозящие действие ферментов, называют-1 ся ингибиторами. Механизм замедления или полного! прекращения деятельности ферментов заключается в том,! что ингибиторы, соединяясь с ферментом, препятствуют! . 242 J
соединению его с сусбстратом (конкурентное ингибирование) или изменяют структуру фермента. Ингибиторами ферментов служат ядовитые для организма вещества: цианид, монооксид углерода (угарный газ), ртуть, мышьяк, свинец, токсины патогенных микроорганизмов и др. При нарушении обмена веществ в организме образуются промежуточные и конечные продукты, которые также являются ингибиторами ферментов. Изучение механизма подобных нарушений чрезвычайно перспективно и позволит определить пути и способы борьбы с рядом тяжелых заболеваний.
§ 116. Понятие о классификации. Механизм действия
Наука о ферментах — ферментология (энзимология) долго не располагала строго научной номенклатурой и классификацией ферментов. В 1961 г. V Международным биохимическим конгрессом, проходившим в Москве, была принята систематическая классификация и номенклатура ферментов. Все ферменты подразделяются на 6 основных классов по типу осуществляемых ими важнейших биохимических реакций.
< 1. Оксидоредуктазы — катализируют окислительно-
восстановительные реакции.
2. Трансферазы — катализируют реакции переноса атомных групп.
3. Гидролазы — катализируют реакции гидролиза.
4. Лиазы — катализируют присоединение атомных групп по месту двойной связи или отщепление групп с образованием двойной связи.
5. Изомеразы — катализируют реакции внутримолекулярных превращений.
6. Лигазы — катализируют реакции синтеза двух молекул с расщеплением энергетически богатых веществ (АТФ и др.).
Каждый класс ферментов подразделяется иа подклассы (группы) и подподклассы (подгруппы). В подподклассе ферменты располагаются по порядковому номеру. Классификация позволяет определить фермент при помощи шифра. Например, шифр фермента 2.6.1.1. значит, что фермент относится к 2 классу (трансферазы), 6 подклассу (переносит атомные группы, содержащие азот), 1 подподклассу (переносит аминогруппу), порядковый номер в подподклассе—1.
Название фермента складывается из названия вещества, с которым взаимодействует фермент — субстрата, Участника реакции или продукта реакции, типа реакции и окончания «аза». Например, приведенный выше фермент,
шифр которого 2.6.1.1, будет называться Ь-аланин:2-оксоглутарат-аминотрансфераза. Вещество, с которым взаимодействует фермент,— L-аланин; второй участник реакции — 2-оксоглутаровая кислота, далее указана реакция переноса аминогруппы. Для простоты и краткости часто пользуются рабочим названием фермента, которое образуют путем добавления к названию субстрата окончания «аза». Например, фосфатаза — катализирует расщепление эфиров фосфорной кислоты. Традиционные названия ряда ферментов сохраняются до сих пор и отражают историю их открытия, например пепсин.
Взаимодействие химических веществ возможно лишь в том случае, если потенциальная энергия их молекул будет достаточной для преодоления сил отталкивания между ними, т. е. в случае преодоления энергетического барьера реакции. Преодолеть этот барьер можно, сообщив реагирующим веществам дополнительную энергию — энергию активации, путем увеличения температуры, давления и др. Можно подойти к проблеме с другой стороны — преодолеть энергетический барьер, снижая энергию активации путем увеличения числа активированных молекул. Это осуществляют катализаторы, с участием которых реакции происходят с наименьшей затратой энергии, Биологические катализаторы — ферменты, в отличие от катализаторов неорганической природы, значительно эффективнее, они осуществляют реакции в 108—1011 раз быстрее при нормальной температуре тела и нормальном давлении.
В основе современных.теорий, объясняющих механизм действия ферментов, лежит представление о снижении энергии активации за счет соединения фермента с субстра! том — образования ферментсубстратного ком! плекса. Реакция проходит в несколько стадий. |
1. Присоединение молекулы субстрата (S) к ферменту (Е) и образование комплекса (ES):E + S^ES. J
2. Преобразование ферментсубстратного комплекса ЕЯ в ES|, где субстрат под действием фермента претерпевает! изменение за счет образования временных связей между] ферментом и субстратом (электростатическое притяжения атомных групп с противоположными зарядами, водород! ные связи и др.): ES?±ESi. |
3. Происходит сама химическая реакция с образований ем продуктов реакции (Р). Образование временных связей между субстратом и ферментом приводит к перераспреде! лению электронов в молекуле субстрата и к ослаблению! внутримолекулярных связей. В результате для их разрыва] требуется гораздо меньше энергии (рис. 65, III): ES«=*EP.
4. Образованные продукты реакции выделяются и фермент освобождается: ЕР?±Е+ Р.
Рис. 65. Схема процесса взаимодействия фермента и субстрата.
Е —фермент, S—субстрат; Р —продукты реакции. А—активатор. J —ингибитор; а, в, с. d_
аминокислотные радикалы, входящие в активный центр фермента. Остальные объяснения в тексте.
В связи с тем что молекула фермента в сравнении с молекулой субстрата достаточно велика, возникло предположение, что не все участки молекулы фермента оказываются в непосредственном контакте с субстратом. Однако определенные участки молекулы фермента (аминокислотные радикалы) также необходимы для осуществления ферментативной реакции. Таким образом, контактный участок и аминокислотные радикалы образуют активный центр фермента (рис. 65, I—II).
При сближении молекул фермента и субстрата происходит определенная ориентация активного центра в пространстве. С этих позиций понятна роль активаторов. Они усиливают деятельность активного центра, стабилизируя его структуру для выполнения каталитической реакции. Ингибиторы ферментов тормозят образование активного Центра, дестабилизируют структуру фермента, тормозят его каталитическое действие (рис. 65, IV—V).
§ 117. Диагностическая ценность определения | некоторых ферментов Ч
Исследования ферментов в биологических жидкостях, организма расширили возможность лабораторной диагностики целого ряда заболеваний, в том числе наследственных. Наблюдение за изменением активности ферментов в динамике позволяет судить об эффективности применя-| емых методов лечения и о прогнозе заболевания. I
Наиболее широко в клинической практике изучаются! ферменты крови. Это объясняется доступностью взятия! материала и возможностью многократных исследований.] Ферментный состав крови здорового человека относитель-| но постоянен. В крови содержатся: I
1) собственные ферменты (факторы свертывания крови); 1
2) ферменты форменных элементов крови (тромбокина-1 за тромбоцитов); I
3) ферменты, попавшие в кровь из органов пищеваре! ния (амилаза и пепсин); I
4) ферменты из клеток органов и тканей. I
При патологических состояниях возможно увеличение и уменьшение активности ферментов. Вследствие нарушения проницаемости клеточных мембран, распада клеток и гиперфункции органов наблюдается появление в крови ферментов, отсутствующих у здорового человека.
Особую диагностическую ценность получили исследования, включающие определенный перечень ферментов, изменение активности которых характерно для дифференциальной диагностики заболеваний сердца, печени, легких и др. Для диагностики заболеваний сердечной мышцы (инфаркта миокарда, стенокардии) производят определение следующих ферментов: L-лактат: НАД-
оксидоредуктазы (лактатдегидрогеназа—ЛДГ), L-acnap-тат: 2-оксоглутарат-аминотрансферазы (аспартатаминотрансферазы— АсАТ), L-аланин: 2-оксоглутарат-
аминотрансферазы (аланинаминотрансферазы — АлАТ), АТФ: креатинфосфотрансферазы (креатинфосфокиназы).
Активность перечисленных ферментов резко возрастает при инфаркте миокарда, когда происходит некроз мышечной ткани. При стенокардии не отмечается повышение активности АсАТ, АлАТ, креатинкиназы.
При заболеваниях печени и для дифференциации желтух производят определение АлАТ, АсАТ, фосфомоноэстеразы (щелочной фосфатазы) и вычисляют соотношения между ними-. При паренхиматозных желтухах резко возрастает активность перечисленных ферментов, которые освобождаются при распаде клеток печени. ПрИ механических желтухах, не сопровождающихся клеточ-
ным распадом, активность этих ферментов остается в пределах нормы.
При заболеваниях поджелудочной железы, сопровождающихся клеточным распадом, резко повышается активность фермента а-1,4-глюкан-4-глюканогидролазы (а-амилазы). При заболеваниях костной ткани (рахит, опухоли) повышается активность фосфомоноэстеразы (щелочной фосфатазы). Снижение активности ацетилхолингидро-лазы (холинэстеразы) отмечается при болезни Боткина, инфаркте миокарда, отравлении фосфорорганическими соединениями.
Врожденная недостаточность D-глюкозо-б-фосфат-фосфогидролазы (глюкозо-6-фосфатазы) приводит к тяжелым нарушениям углеводного обмена — гипогликемии, ацидозу, избыточному отложению гликогена в печени и почках. Этот фермент способствует образованию свободной глюкозы.
В практике биохимических лабораторий при проведении ферментативных анализов необходимо учитывать специфику исследуемых веществ.
О количестве фермента судят по производимому им действию. За единицу (Е) любого фермента принимают то его количество, которое катализирует превращение одного микромоль субстрата или образование одного микромоль продукта реакции в одну минуту при заданных условиях. При этом активность фермента выражается в единицах на литр (Е/л).
При проведении анализа необходимо строго соблюдать условия реакции: температуру, pH среды, концентрацию субстрата и др.
Особые требования предъявляются к исследуемому материалу. Кровь на исследование лучше брать натощак, как можно скорее отделять сыворотку от сгустка, не допускать употребления гемолизированной сыворотки. Следует иметь в виду, что длительное хранение сывороток приводит к снижению активности ферментов. При получении плазмы крови необходимо выбирать соответствующий антикоагулянт, так как он может влиять на результат исследования. Например, оксалат и цитрат влияют на активность а-амилазы.
Вопросы для повторения
1. Какие вещества называются ферментами?
2. Какова химическая природа ферментов?
3. Каковы специфические свойства ферментов?
4. Каков принцип классификации ферментов?
5. Какую роль в осуществлении ферментативной реакции играет фер-ментсубстратиый комплекс?
6. Что такое активный центр фермента и какое влияние на него оказывают активаторы и ингибиторы ферментов?
7. На какие группы можно разделить ферменты, содержащиеся в крови человека?
8. Какие ферменты определяются и как изменяется их активность при ' инфаркте миокарда? стенокардии?
9. Какие ферменты определяются и как изменяется их активность при-паренхиматозных и механических желтухах?
10. Почему увеличивается активность а-амилазы при панкреатите, щелочной фосфатазы при опухолях костной ткани? <
11. При каких заболеваниях снижается активность холинэстеразы? J
12. Что принимают за единицу активности фермента? •’
13. Какие правила необходимо соблюдать при проведении определениям ферментов в клинико-биохимических лабораториях?
МЕТОДЫ ИССЛЕДОВАНИЯ
§ 118. Определение активности а-амилазы1
Крахмал в присутствии ионов йода окрашивается сине-фиолетовый цвет. а-Амилаза осуществляет расщепление крахмала с образованием продуктов, не дающих цветной реакции с йодом. Об активности фермента судят по уменьшению концентрации крахмала.
Реактивы: I) субстратно-буферный раствор, pH 7,0 (13,3 г безводного двузамещенного фосфата натрия и 4,3 г бензойной кислоты растворяют в 250 мл дистиллированной воды, доводят до кипения; 0,2 г растворимого крахмала размешивают в небольшом количестве воды и выливают при перемешивании в кипящую смесь, кипятят 1 мин. охлаждают, переносят в мерную колбу вместимостьк 500 мл и доводят дистиллированной водой до метки;
2) 0,1 н. основной раствор йода (готовят из фиксанала);
3) 0,01 н. рабочий раствор йода (готовят из 0,1 н. раствора перед работой).
Ход определения. В мерную колбу вместимостьк 50 мл помещают 5 мл субстратно-буферного раствора нагревают 5 мин при 37° С, добавляют 0,1 мл сыворотк или профильтрованной мочи. Инкубируют 7,5 мин пр 37° С. Сразу же добавляют 5 мл рабочего раствора йода доводят объем дистиллированной водой до 50 мл. Тотча измеряют экстинкцию на ФЭКе в кювете с толщиной ело 10 мм при красном светофильтре (630—690 нм) проти воды.
Контрольную пробу ставят как опытную, но сыворо? ку или мочу добавляют вместе с рабочим раствором йод после инкубации. Измерение экстинкции проводят также как в опытной пробе. -
Расчет. Активность а-амилазы выражают в грамма
1 Метод Каравея.
крахмала, расщепленного 1 л сыворотки (или мочи) за 1 ч инкубации при 37° С. Расчет производят по формуле:
ЕК~£ОП „ £К-£оп
х=—р-----2-8-10=—=---’160,
где х—активность амилазы; Ек— экстинкция контрольной пробы; Еоп—экстинкция опытной пробы; 2 — количество крахмала, введенное в пробу, мг; 8 — коэффициент пересчета на 1 ч инкубации; 10—коэффициент пересчета на 1 мл сыворотки или мочи.
Полученный ответ в мг/(ч-мл) численно равен ответу в г/(ч*л).
В норме активность а-амилазы в сыворотке крови — 12—32 г/(ч-л), в моче 20—160 г/(ч-л).
§ 119. Определение активности аланинаминотрансферазы в сыворотке крови1
Аланинаминотрансфераза катализирует обратимую реакцию переноса аминогруппы с DL-аланина на а-кетоглутаровую кислоту с образованием пировиноградной и L-глутаминовой кислот. Пировиноградная кислота взаимодействует с 2,4-динитрофенилгидразином в щелочной среде с образованием динитрофенилгидразона пирови-< ноградной кислоты красного цвета. Интенсивность окраски пропорциональна количеству образовавшейся пировиноградной кислоты. По количеству образованной пировиноградной кислоты судят об активности АлАТ.
Реактивы: 1) 0,1 М фосфатный буфер, pH 7,4 (предварительно готовят 2 раствора: а) 17,4 двузамещенного фосфата натрия КагНРОг^НгО растворяют в 1 л дистиллированной воды; б) 13,6 г однозамещенного фосфата калия КН2РО4 растворяют в 1 л дистиллированной воды. Для получения буферного раствора смешивают 840 мл раствора а и 160 мл раствора б; полученный раствор должен давать с индикатором бромтимоловым синим голубую окраску);
2) субстратный раствор (29,2 мг а-кетоглутаровой кислоты и 1,78 г DL-аланина отвешивают на аналитических весах, растворяют в 1н. растворе едкого натра, добавляя его небольшими порциями до полного растворения навесок и получения pH 7,4; раствор переносят в мерную колбу вместимостью 100 мл, ополаскивают посуду, в которой растворялись навески, 0,1 М фосфатным буфером и доливают им до метки; приготовленный раствор тщательно перемешивают, прибавляют 1 каплю хлороформа); хранят в холодильнике в замороженном виде;
1 Метод Райтмана и Френкеля.
3) раствор 2,4-динитрофенилгидразина (19,8 мг сухого вещества растворяют в небольшом количестве 1 н. раствора хлористоводородной кислоты при нагревании на водяной бане в мерной колбе вместимостью 100 мл; после охлаждения доводят объем хлористоводородной кислотой до метки); фильтруют через 24 ч, хранят в склянке темного стекла в холодильнике;
4) 0,4 н.раствор едкого натра;
5) стандартный раствор пирувата натрия СН3СОСО-ONa (11 мг кристаллического пирувата натрия растворяют в небольшом количестве дистиллированной воды, перено- : сят в мерную колбу вместимостью 100 мл и доводят до : метки водой); 1 мл раствора содержит 110 мкг пировиноградной кислоты; раствор используют для построения; калибровочного графика.
Ход определения. В пробирку вносят 0,5 мл субстратного раствора и нагревают при 37° С в течение 5 мин. Добавляют 0,1 мл сыворотки и помещают в термостат при j 37° С на 30 мин. Затем вносят 0,5 мл раствора динитрофе-нилгидразина, оставляют при комнатной температуре на 20 мин. Приливают 5 мл 0,4 н. раствора едкого натра, тщательно перемешивают, оставляют для развития окра-I ски на 10 мин при комнатной температуре. I
Экстинкцию измеряют на ФЭКе с зеленым светофиль-1 тром (530 нм) в кювете с толщиной слоя 10 мм против ! контроля. Контроль ставят как опыт, но раствор динитро- I фенилгидразина добавляют до инкубации. I
Расчет активности фермента производят по калибро-I вочному графику, показывающему зависимость оптиче-1 ской плотности от содержания пировиноградной кислоты. I
Построение калибровочного графика. Из1 стандартного раствора пирувата натрия готовят ряд-разве-! дений, как указано в табл. 12. J
Таблица 12. Схема разведения стандартного раствора ]В|
№№ Раствор
Пробирки пирувата
натрия, мл
Цистил- Содержание пировино- Количество
лирован- градной кислоты микромолей
мая во- --------- । » пировиноград-
да, мл мкг мкмоль ной кислоты
на I л сыво-
ротки за t ч инкубации
1 0,05 0,55 4,4 0,05 1,0
2 . 0,10 0,50 8,8 0,10 2,0
3 0,15 0,45 13,2 0,15 3,0
4 0,20 0,40 17,7 0,20 4,0
5 0,25 0,35 22,0 0,25 5,0
6 0,30 0,30 26,4 0,30 6,0
В пробирку с разведенным пируватом натрия приб ют по 0,5 мл раствора динитрофенилгидразина, дале
пробы обрабатывают как опытные. Измеряют экстинкцию на ФЭКе при тех же условиях, что и опыт, но вместо контроля используют дистиллированную воду.
Пересчет активности АлАТ в микромоли пировиноградной кислоты, образовавшейся при инкубации 1 л сыворотки в течение 1 ч, производят по калибровочному графику или по формуле:
С-2-10
Ал AT- 88 ,
где С—пировиноградная кислота, найденная по калибровочному графику, мкг; 10 — коэффициент пересчета на 1 мл сыворотки; 2 — коэффициент пересчета на 1 ч инкубации; 88 — масса 1 мкмоля пировиноградной кислоты, мкг.
В норме активность АлАТ составляет 0,1—0,68 мкмоль пировиноградной кислоты на 1 л сыворотки за 1 ч инкубации при 37° С.
Глава III
УГЛЕВОДНЫЙ ОБМЕН
ПОКАЗАТЕЛИ, ХАРАКТЕРИЗУЮЩИЕ СОСТОЯНИЕ УГЛЕВОДНОГО ОБМЕНА
§ 120. Краткие сведения об обмене углеводов
Для осуществления биохимических реакций, лежащих в основе жизнедеятельности организма, необходима энергия. Источником этой энергии являются углеводы. Поступающие с пищей в организм полисахариды (крахмал, гликоген) и олигосахариды (сахароза, лактоза) подвергаются расщеплению ферментами в желудочно-кишечном тракте до моносахаридов (глюкоза, фруктоза, галактоза и др.) и всасываются в кровь. С током крови по воротной вене моносахариды доставляются в печень, где фруктоза, галактоза и другие преобразуются в глюкозу. Глюкоза частично превращается в гликоген (глюкогенез) и откладывается в печени и мышцах как запасной энергетический материал. Другая ее часть доставляется кровью к клеткам органов и тканей, где окисляется с образованием энергии путем гликолиза, аэробного окисления, фосфоглюконат-ным (пентозофосфатным) путем. Окисление глюкозы в клетках происходит через ряд превращений с образованием промежуточных продуктов, важнейшими из которых служат молочная и пировиноградная кислоты, ацетилкоэн-зим-А (ацетил-КоА), рибоза. При определенных условиях в организме из этих веществ образуются жиры и белки. Например, пировиноградная кислота превращается в аце
тил-КоА, который используется для синтеза жирных кислот и холестерина, или служит исходным веществом для образования аминокислот — аланина, валина и лейцина. Рибоза используется для синтеза рибонуклеиновых и дезоксирибонуклеиновых кислот.
Несмотря на постоянное потребление глюкозы клетками ее уровень в крови здорового человека относительно постоянен и составляет 3,34—5,55 ммоль/л (0,6—0,9 г/л). Это постоянство обеспечивается прежде всего центральной нервной системой и ее высшим отделом — корой головного мозга, вегетативной нервной системой, железами внутренней секреции и печенью. Регуляция осуществляется на клеточном уровне путем влияния на целую систему ферментов, сосредоточенных, главным образом, в клеточных структурах — митохондриях. Ключевыми ферментами, осуществляющими реакции превращения глюкозы в организме, служат гексокиназа, фосфофруктокиназа, пируваткиназы, фосфорилазы, альдолаза, лактатдегидрогеназа, гликогенсинтетаза. Сохранение постоянства концентрации глюкозы в крови можно рассматривать как пример ответа организма на воздействия, которые приводят к изменению концентрации вещества в крови и влекут за собой целый ряд преобразований, направленных на восстановление его нормальной концентрации. При поступлении большого количества углеводов с пищей уровень глюкозы в крови повышается. Кровь, обогащенная глюкозой, вызывает возбуждение нервных центров в продолговатом мозге и гипоталамусе. Импульсы из центров передаются по блуждающему нерву в (3-клетки островков Лангерганса поджелудочной железы, вызывая выделение гормона инсулина в кровь. Инсулин стимулирует ферменты печени, осуществляющие превращение глюкозы в гликоген, и уровень глюкозы в крови снижается.
Инсулин является одним из главных гормонов, регулирующих углеводный обмен. Он обеспечивает проникнове-, ние глюкозы через клеточные мембраны и ее окисление с: образованием энергии, способствует переводу избытка; глюкозы в жиры и белки.
При голодании или усиленном потреблении глюкозы клетками ее уровень в крови уменьшается. Из нервных центров поступают импульсы по симпатическому нерву в мозговое вещество надпочечников, которые выделяют гормон адреналин. Адреналин стимулирует ферменты, осуществляющие распад гликогена в печени и мышцах до глюкозы (гликогенолиз), и ее уровень в крови восстанавливается до нормы.
В регуляции углеводного обмена принимают участие и другие гормоны, результатом действия которых служит повышение уровня глюкозы в крови. Глюкагон — гормон
а-клеток островков Лангерганса поджелудочной железы, усиливает распад гликогена в печени до клюкозы. Тироксин— гормон щитовидной железы, усиливает процесс окисления глюкозы в клетках и распад гликогена в печени до глюкозы. Глюкокортикоиды — гормоны коры надпочечников, активизируют образование глюкозы из аминокислот— глюконеогенез. Гормоны передней доли гипофиза оказывают влияние на углеводный обмен, стимулируя выработку гормонов другими железами внутренней секреции. Соматотропный гормон усиливает выделение глюкагона, адренокортикотропный гормон (АКТГ) — адреналина и кортикостероидов, тиреотропный гормон — тироксина, которые в свою очередь вызывают повышение уровня глюкозы в крови. Инсулин является единственным гормоном, способствующим уменьшению содержания глюкозу в крови, а все остальные гормоны обладают противоинсу-лярным действием—увеличивают содержание глюкозы в крови. У здорового человека гормональная система находится в подвижном (динамическом) равновесии и обеспечивает, под контролем центральной нервной системы, постоянство уровня глюкозы в крови.
Современный уровень биохимических знаний позволил выявить сложные механизмы саморегуляции ферментативных процессов на клеточном уровне, которые зависят от концентрации фермента, наличия субстрата, расхода энергии и продуктов реакции. Например, достаточное образование энергии в клетке в виде АТФ выключает механизмы ферментативного расщепления глюкозы — гликолиз. Избыток промежуточного продукта окисления жиров — ацетил-КоА, включает механизм образования глюкозы из аминокислот.
§ 121. Патология углеводного обмена
Изменение уровня глюкозы в крови может происходить в сторону увеличения ее содержания — гипергликемия и уменьшения — гипогликемия. Гипергликемии делятся на две большие группы: связанные с изменением функции поджелудочной железы — инсулярные, и не связанные — экстраинсулярные. Инсулярные гипергликемии вызываются уменьшением выработки инсулина и наблюдаются при панкреатическом сахарном диабете и остром панкреатите. При сахарном диабете отмечается поражение р-клеток островков Лангерганса поджелудочной железы и, как следствие,— недостаточность выработки инсулина. Уровень глюкозы в крови может достигать очень высоких цифр 13—18 ммоль/л, превышающих сахарный порог (9—10 ммоль/л) и глюкоза начинает выделяться с мочой: возникает глюкозурия. Присутствие
больших количеств глюкозы увеличивает осмотическое давление крови, вызывая у больного чувство жажды. Больной принимает много жидкости и, соответственно, много выделяет ее с мочой — возникает полиурия. Разбавленная моча слабо окрашена, но имеет высокую относительную плотность из-за присутствия глюкозы.
Несмотря на высокое содержание глюкозы в крови, клетки организма испытывают энергетический голод, так как без инсулина не происходит ее усвоение. Это явление получило меткое определение — «гибель среди изобилия». Для обеспечения клеток энергией организм активно мобилизует жиры из жировой ткани, которые, окисляясь в печени, дают некоторое количество энергии и в большом количестве промежуточный продукт окисления — ацетил-КоА. При нормальном течении обмена веществ ацетил-КоА, поступая в цикл трикарбоновых кислот (цикл Кребса), окисляется с образованием большого количества энергии в виде АТФ. В условиях энергетического голода при сахарном диабете в организме активизируется процесс образования глюкозы из аминокислот — глюконеогенез и участники цикла Кребса — трикарбоновые кислоты — вовлекаются в этот процесс. Цикл Кребса тормозится. Избыток ацетил-КоА приводит к образованию большого количества его производных — ацетоуксусной, р-оксимасляной кислот и ацетона (кетона), называемых кетоновыми (ацетоновыми) телами. Увеличение концентрации кетоновых тел в крови — кетоне ми я приводит к выделению их с мочой — кетонурии. Кетонемия вызывает сдвиг pH крови в сторону кислой реакции — ацидоз. При этом у больного наблюдается расстройство дыхания, сердечной деятельности, потеря сознания — развивается диабетическая кома. От больного исходит специфический запах ацетона (запах прелых фруктов). Это обстоятельство надо помнить медицинским работникам, которые могут встретиться с ситуацией оказания первой помощи человеку, потерявшему сознание.
Экстраинсулярные гипергликемии отмечаются при некоторых физиологических состояниях и патологических процессах, связанных с нарушением функции центральной нервной системы, эндокринных желез и печени. Физиологические экстраинсулярные гипергликемии наблюдаются при приеме большого количества легко усвояемых углеводов (мед, сахар, виноград) и носят название алиментарной гипергликемии. При сильных эмоциональных возбуждениях (чувство страха, радости), вследствие раздражения центральной нервной системы и повышенного выделения адреналина в кровь, активизируется распад гликогена в печени до глюкозы и ее уровень в крови повышается. Такая гипергликемия носит временный характер. Патоло-254
гические экстраинсулярные гипергликемии наблюдаются при травмах и опухолях мозга, токсикозах и, главным образом, при гиперфункции желез внутренней секреции — тиреотоксикозах, опухоли надпочечников, гипофиза. Гипергликемии, связанные с нарушениями функции печени, выявляются лишь при тяжелых поражениях печени, благодаря ее большим резервным возможностям (см. ниже).
Явление гипогликемии отмечается при повышенном выделении инсулина р-клетками островков Лангерганса поджелудочной железы при аденоме (опухоли) или введении больших доз инсулина больным сахарным диабетом, при гипофункциях желез внутренней секреции, когда резко снижается выделение гормонов, способствующих повышению глюкозы в крови (гипотиреоз, аддисонова болезнь). Гипогликемия может возникнуть так же вследствие усиленного выделения глюкозы почками при нарушениях процесса реабсорбции ее в почечных канальцах. Кроме того, необходимо отметить гипогликемии как следствие голода или недоедания.
К патологии углеводного обмена относится целый ряд наследственных болезней, связанных с недостатком ферментов, участвующих в регуляции обмена углеводов на клеточном уровне. Гликогеновая болезнь (болезнь Гирке) связана с резким снижением активности фермента, способствующего образованию свободной глюкозы — глюкозо-6-фосфатазы. Вследствие этого у больного наблюдается накопление гликогена в печени, почках и других органах, одновременно развивается гипогликемия, в крови увеличивается количество молочной и пировиноградной кислот. Существуют заболевания, связанные с нарушением обмена фруктозы (наследственная непереносимость фруктозы) и галактозы.
С целью выявления заболеваний, протекающих с нарушением углеводного обмена, в клинико-биохимических лабораториях наиболее часто проводят определение количества глюкозы в крови и в моче, реже определяют количество галактозы и фруктозы, промежуточных продуктов обмена — пировиноградной и молочной кислот, а также активность ряда ферментов углеводного обмена.
Наиболее распространенным заболеванием является сахарный диабет, основной лабораторный признак которого — гипергликемия.
Для выявления скрытых форм сахарного диабета в клинической практике применяют методы однократной или двукратной нагрузки глюкозой—тест толерантности к глюкозе (глюкозотолерантный тест). Смысл исследования заключается в том, чтобы определить, справляется ли организм с явлением искусственно вызванной гиперглике
мии. У обследуемого натощак берут кровь из пальца и определяют в ней содержание глюкозы. Если уровень глюкозы превышает норму, нагрузку проводить не рекомендуется. После этого больному дают выпить раствор глюкозы в воде (50 г глюкозы на 200— 250 мл воды). Затем в течение 3 ч через каждые 30 мин берут кровь и определяют в ней содержание глюкозы. У здорового человека после нагрузки наблюдается увеличение концентрации глюкозы в крови, которое через час достигает максимального значения, не превышающего, однако, «сахарный порог» (9,0—10,0 ммоль/л). Затем наступает снижение и через 2 ч глюкоза может достичь уровня даже более низкого, чем исходный — гипогликемическая фаза, что объясняется выделением инсулина в кровь с некоторым запасом. К 3-му часу уровень глюкозы в крови равен исходному. У больного сахарным диабетом отмечается увеличение содержания глюкозы натощак и высокая гипергликемия через час (более И ммоль/л), через 2 ч уровень глюкозы остается на высоком .уровне (более 8 ммоль/л), и к 3-му часу не приходит к исходному уровню. Как правило, отмечается глюкозурия.
При двукратной нагрузке глюкозой обследуемый получает 2 порции глюкозы с интервалом 1 ч. У здорового человека после приема 2-й порции глюкозы ее максимальный уровень в крови должен быть меньше, чем он был после приема 1-й порции. При скрытых формах сахарного диабета, когда инсулина вырабатывается недостаточно, уровень глюкозы в крови после 2-го приема глюкозы оказывается выше.
Лабораторный контроль за лечением больных сахарным диабетом сводится к периодическому определению уровня глюкозы в крови натощак и после приема пищи, исследованию мочи на сахар и кетоновые тела. При коматозном состоянии определяют кислотно-основное состояние и содержание калия и натрия в крови (см. § 136). При передозировке инсулина, применяемого для лечения больных сахарным диабетом, развивается гипогликемия. Ее симптомы возникают при снижении уровня глюкозы в крови ниже 3 ммоль/л.
§ 122. Роль печени в углеводном обмене
Как отмечалось выше, в печени осуществляются ключевые процессы углеводного обмена: образование гликогена из глюкозы и других промежуточных продуктов, распад гликогена до глюкозы и образование глюкозы из других моносахаридов (например, из галактозы). Это позволяет сделать вывод о том, что печени принадлежит основная роль в обеспечении постоянства концентрации
глюкозы в крови, что достигается регуляцией соотношения между синтезом и распадом гликогена.
Для оценки роли печени в углеводном обмене применяют функциональные пробы — нагрузки глюкозой. Однако нагрузка глюкозой не достаточно полно отражает функциональное состояние печени, так как гликогенез идет и в мышцах. Существует специфическая функциональная проба печени—нагрузка галактозой. Преимущества этой пробы заключаются в том, что только в печени происходит превращение галактозы в глюкозу и отложение ее в виде гликогена. Почечный порог галактозы очень низок и неиспользованная галактоза быстро выделяется с мочой. Обследуемый принимает утром натощак 40 г галактозы, растворенной в 0,4 л воды. После этого в течение 4—6 ч собирают всю выделившуюся мочу и определяют в ней количество галактозы. У здорового человека через 3—5 ч после нагрузки выделится не более 3 г галактозы с мочой, так как галактоза переводится в глюкозу и затем в гликоген печени. Если у больного будет выделяться более 3 г галактозы, проба считается положительной и свидетельствует о повреждениях паренхимы печени. Однако, хотя проба с галактозой и специфична, она мало чувствительна, так как и при тяжелых заболеваниях печени Часто бывает отрицательной.
Для оценки роли печени в углеводном обмене показательно определение уровня молочной кислоты в крови. При тяжелых поражениях печени концентрация молочной кислоты возрастает в 2 раза. Кроме того, определение активности специфических ферментов печени показательно для оценки тяжести поражения печеночных клеток патологическим процессом.
Вопросы для повторения
1. Как используются в организме поступающие с пищей углеводы?
2. Какими органами и системами осуществляется регуляция углеводного обмена?
3. Как осуществляется регуляция постоянства глюкозы в крови при ее временном избытке и недостатке?
4. Какие гормоны способствуют увеличению содержания глюкозы в крови?
5. Какова роль инсулина в организме?
6. Какова роль ферментов в регуляции достоинства глюкозы в крови?
7. Каковы причины иисуляриых гипергликемий?
8. Какие изменения в крови и моче отмечаются у больных при сахариом диабете?
9. Каковы причины экстраинсуляриых гипергликемий?
10. Каковы причины гипогликемий?
И. Как проводится исследование методом нагрузки глюкозой?
12. Какова роль печени в углеводном обмене? Какими функциональными пробами она определяется?
9-325
МЕТОДЫ ИССЛЕДОВАНИЯ
§ 123. Определение сахара в крови по методу Хагедорна — Йенсена
Глюкоза в щелочной среде при кипячении восстанавли- вает трехвалентное железо в составе красной кровяной И соли в двухвалентное с образованием желтой кровяной И соли. Последняя выводится из реакции осаждением в виде И двойной цинк-калиевой соли. Остаток красной кровяной И соли, непрореагировавший с глюкозой, определяетсяИ йодометрически. И
Реактивы: 1) 0,45% раствор кристаллического суль-И фата цинка ZnSO4-7H2O готовят из 45% раствора каждыеИ 7—10 дней;
2) 0,1 н. раствор едкого натра; И
3) 0,005 н. содово-щелочной раствор красной кровянойИ соли — железносинеродистого калия K3[Fe(CN)6] (1,65 гИ железосинеродистого калия и 10,6 г безводного карбоиатаЦ натрия NajCOj растворяют отдельно в небольшом количе-И стве воды; оба раствора наливают в мерную колб^^И вместимостью 1 л и доводят до метки дистиллированно!^^ водой); реактив стоек; И
4) хлорцинкйодистый раствор—тройная смесь (отве^В шивают 250 г хлорида натрия и 50 г кристаллическоп|И сульфата цинка; обе навески помещают в цилиндр вместиВИ мостью 1 л и, постепенно растворяя дистиллированной™ водой, доводят до метки, фильтруют; перед употреблением прибавляют йодид калия из расчета 2,5 г на каждые 100 мл раствора);
5) 3% раствор уксусной кислоты;
6) 1% раствор растворимого крахмала; для устойчивости реактива его готовят на насыщенном растворе хлорида
натрия;
7) 0,005 н. раствор тиосульфата натрия (готовят перед работой из 0,1 н. раствора тиосульфата натрия разведением в 20 раз; учитывают коэффициент поправки).
Для определения используют ватные фильтры. Вату дважды кипятят в дистиллированной воде и высушивают в термостате. Хранят в плотно закрытой банке.
Ход определения. В 2 опытные и 2 контрольные пробирки разливают по 5 мл 0,45% раствора сульфата цинка и по 1 мл 0,1 н. раствора едкого натра. В микропипетку набирают по 0,1 мл крови из пальца и выдувают в опытные пробирки. Микропипетку 3 раза промывают содержимым пробирки. Все пробирки помещают в кипящую водяную баню на 3 мин. При этом в опытных пробирках белки крови коагулируют. Готовят ватные фильтры. Вату помещают в воронку и смачивают неболь
шим количеством дистиллированной воды. Содержимое пробирок встряхивают и, не охлаждая, фильтруют в соответствующий «сахарный» стакан. Каждую пробирку дважды промывают 3 мл дистиллированной воды и сливают через фильтры в стаканы, фильтры отжимают. Воронки вынимают из стаканов. Затем в каждый стакан приливают по 2 мл 0,005 н. раствора красной кровяной соли. Стаканы ставят в кипящую водяную баню на 15 мин, отсчитывая время с момента закипания воды, после погружения проб. Через 15 мин стаканы вынимают, охлаждают, прибавляют в каждый 2 мл тройной смеси, 2 мл 3% раствора уксусной кислоты и 2—3 капли крахмала, перемешивают. Титруют 0,005 н. раствором тиосульфата натрия из микробюретки до исчезновения синего окрашивания. Титрование начинают с контроля.
Зная сколько было взято красной кровяной соли для реакции, определив йодометрически сколько ее осталось после реакции, можно вычислить, сколько красной кровяной соли прореагировало с глюкозой и сколько содержалось в крови глюкозы. Содержание глюкозы в крови вычисляют по таблице, составленной для 0,005 н. раствора тиосульфата натрия. Количество сахара во всех пробах находят в зависимости от объема 0,005 н. раствора тиосульфата натрия, пошедшего на титрование (табл. 13).
Пример расчета. На титрование опыта 1 пошло 1,40 мл 0,005 И. раствора Na2S2O3, опыта 2—1,42 мл. Вычисляют среднее арифметическое:
Оп(+Оп2 1,40+1,42 .
2 - 2 = 1 ’41 •
На титрование контроля 1 пошло 1,98 мл 0,005 н. раствора Na2S2O3, контроля 2—1,96 мл. Вычисляют среднее арифметическое:
Ki+Ki 1,98+1,96 2 - 2 —1»97.
По таблице находят, что содержание глюкозы в опыте составляет 1040 мг/л, в контроле — 50 мг/л. Следовательно, содержание глюкозы в исследуемой крови равно: 1040 мг/л—50 мг/л=900 мг/л. Норма содержания сахара по этому методу 800—1200 мг/л или 4,44—6,66 ммоль/л. Коэффициент пересчета в единицы СИ (ммоль/л) равен 0,00555.
§ 124. Определение глюкозы в крови и моче по цветной реакции с ортотолуидином
Глюкоза при нагревании с ортотолуидйном в растворе уксусной кислоты дает зеленое окрашивание, интенсивность которого пропорциональна концентрации глюкозы.
Реактивы: 1) ортотолуидиновый реактив (0,15 г тиомочевины растворяют в 94 мл ледяной уксусной кислоты и смешивают с 6 мл бесцветного или слегка желтоватого ортотолуидина; ортотолуидин очищают путем перегонки; реактив стоек, хранят на холоду); ,•
2) 3% раствор трихлоруксусной кислоты; J
3) стандартный раствор глюкозы 5000 мг/л (в мерной | колбе вместимостью 100 мл растворяют 500 мг высушен- i ной до постоянной массы при температуре 100° С глюкозы -в 0,2% растворе бензойной кислоты; для приготовления , раствора бензойной кислоты отвешивают 0,2 г кристалли- i ческой бензойной кислоты и растворяют ее в небольшом количестве дистиллированной воды, которую нагревают 1 на водяной бане до полного исчезновения кристаллов; I после охлаждения до комнатной температуры раствор а переносят в мерную колбу вместимостью 100 мл, и доли- 1 вают до метки дистиллированной водой; хранят в холо- 1 дильнике). j
В качестве материала для исследования используют я кровь и мочу с положительной качественной пробой на 1 глюкозу. Исследуемую мочу разводят дистиллированной | водой (степень разведения 2—10 раз в зависимости от / характера качественной реакции). t
Ход определения. В пробирку наливают 0,9 мл 3% / раствора трихлоруксусной кислоты и выдувают (на ее стенку) 0,1 мл крови. Встряхивают и центрифугируют. К 0,5 мл центрифугата добавляют 4,5 мл ортотолуидинового реактива. Пробирку со смесью помещают в кипящую водяную баню на 8 мин (точно), вынимают, охлаждают Под водопроводной водой до комнатной температуры. Экстинкцию измеряют на ФЭКе при длине волны 590— * 650 нм в кювете с толщиной слоя 10 мм против контроля.
Контроль. 0,5 мл трихлоруксусной кислоты и 4,5 мл ортотолуидинового реактива.
Стандартная проба. Ставят как опытную, но вместо сыворотки берут стандартный раствор глюкозы с концентрацией 1000 мг/л (3000 или 5000 мг/л в случае высокого содержания глюкозы в крови).
Расчет ведут по формуле:
Еоп Соп— г; Ссг, ^СТ
где Соп—концентрация глюкозы в крови, мг/л; Сст— концентрация глюкозы в стандарте, мг/л; Еоп— экстинкция пробы; Ест—экстинкция стандарта.
Определение глюкозы в моче производят так же, как и в крови. При расчете результатов учитывают степень разведения мочи.
Таблица 13. Количество глюкозы в крови по Хагедорну и Йеисену (мг/л)
Содержание глюкозы в крови здорового человека составляет 3,34—5,55 ммоль/л. Коэффициент пересчета в единицы СИ (ммоль/л) равен 0,00555.
Глава IV ЛИПИДНЫЙ ОБМЕН
ПОКАЗАТЕЛИ, ХАРАКТЕРИЗУЮЩИЕ СОСТОЯНИЕ ЛИПИДНОГО ОБМЕНА
§ 125. Понятие об общих липидах и их фракциях
В состав клеток и тканей организма человека вместе с белками и углеводами входят жиры и жироподобные вещества, объединенные в большую группу органических соединений, называемых липидами. Они нерастворимы в воде, но растворяются в органических растворителях (этанол, эфир, хлороформ), разнообразны по химическому строению. В группе липидов выделяют: жирные кислоты, триацилглицерины (нейтральные жиры), сфинголипиды, фосфолипиды, стероиды, липопротеиды.
Физиологическая роль липидов в организме многооб-' разна. Жирные кислоты используются как энергетический , и строительный материал для нейтральных жиров, фосфо-; липидов, сфинголипидов, эфиров холестерина и др.
Важную группу ненасыщенных жирных кислот состав-j ляют простагландины. Они обладают высокой биоло-1 гической активностью. Их действие можно сравнить С’ действием гормонов и медиаторов (веществ, участвующих в передаче нервного возбуждения). Простагландины влияют на скорость кровотока в капиллярах, сократимость гладкой мускулатуры матки и желудочно-кишечного тракта, агрегацию (склеивание) тромбоцитов, участвуют в воспалительных реакциях организма. Изучение этих веществ чрезвычайно важно в целях диагностики целого ряда заболеваний и использования в качестве лекарственных препаратов.
Триацилглицерины входят в состав цитоплазмы клеток (протоплазматический жир). Они содержатся, главным образом, в форме запасного или резервного жира в подкожной жировой клетчатке, сальниках, околопочечной жировой капсуле. Представляют собой наиболее концентрированный источник энергии. При окислении 1 г нейтрального жира образуется 38,94 кДж (9,3 ккал), что более чем в 2 раза превышает энергетическую ценность углеводов и белков. Кроме того, при окислении жиров образуется достаточно много воды, поэтому резервный
жир можно считать своеобразной формой запаса воды в организме.
Фосфолипиды и сфинголипиды являются основными компонентами клеточных мембран, они обеспечивают проницаемость и активный перенос через мембрану в клетку веществ, нерастворимых в воде. В большом количестве содержатся в нервной ткани (в миелиновом волокне нерва составляют до 60% сухой массы). Фосфолипидами богата печень, где они образуются из триацилглицеринов и азотистых оснований (холин, зтаноламин и др.) при участии АТФ.
К сфинголипидам относятся ганглиозиды и цереброзиды— вещества, содержащиеся в большом количестве в нервной ткани, печени и селезенке. В их состав входят аминоспирт и жирные кислоты, содержащие длинную цепочку атомов углерода, а также глюкоза, галактоза и сиаловые кислоты.
К группе стероидов относятся холестерин и его производные, содержащиеся в большом количестве в печени и нервной ткани. Холестерин синтезируется из ацетил-КоА в печени. Он является структурным компонентом клеточных мембран. Из него образуются желчные кислоты, мужские и женские половые гормоны, гормоны коры надпочечников и витамин D при ультрафиолетовом облучении.
Транспортной формой липидов крови являются липопротеиды. Жиры циркулируют в кровеносном русле только в связи с белком.
§ 126. Физиология липидного обмена
Жиры, поступающие с пищей в организм, служат источником незаменимых ненасыщенных жирных кислот и жирорастворимых витаминов.
Основное место переваривания пищевых липидов — тонкий кишечник. Поступающие с желчью в просвет двенадцатиперстной кишки желчные кислоты — таурохолевая и гликохолевая — эмульгируют жиры и активируют липазу. Панкреатическая липаза гидролизует жиры с образованием глицерина и жирных кислот. Эстеразы осуществляют гидролиз эфиров холестерина с образованием холестерина и жирных кислот. Фосфолипазы гидролизуют фосфолипиды до глицерина, жирных кислот, азотистых оснований и остатков фосфорной кислоты. Продукты расщепления липидов всасываются в тонком кишечнике. Глицерин, азотистые основания и фосфорная кислота, как растворимые в воде, легко всасываются в клетки слизистой оболочки кишечника. Нерастворимые в воде жирные кислоты образуют комплекс с желчными кисло
тами (холеиновыи комплекс), который способен пройти через стенку слизистой оболочки кишечника. При помощи ферментных систем холеиновыи комплекс распадается, освободившиеся жирные кислоты соединяются с глицерином и происходит ресинтез триацилглицеринов (нейтральных жиров). Холестерин, жирорастворимые витамины,
некоторые стероидные гормоны всасываются в кишечнике
тоже с помощью желчных кислот.
Осуществив перенос, освободившиеся желчные кислоты с током крови по воротной вене возвращаются в
печень и вновь выделяются с желчью в двенадцатипер-
стную кишку. В этом круговороте часть желчных кислот
теряется с калом в относительно небольших количествах.
Из слизистой оболочки кишечника продукты расщеп-
ления пищевых жиров поступают в лимфу, а отсюда в кровь через грудной лимфатический проток. Как уже
отмечалось, липиды практически нерастворимы в воде. Они транспортируются кровью в виде хиломикронов, представляющих собой частицы диаметром около 1 мкм и состоящих из липидов и белка. Поступающие в кровь
триацилглицерины в форме хиломикронов приносятся, главным образом, в печень и жировую ткань. В жировой
ткани происходит отложение (депонирование) жира, кото-
рый служит
запасным
источником
энергии
голодания используется организмом для осуществления обменных процессов, необходимых для поддержания
и в
жизни.
Для выяснения более тонких механизмов обмена липидов и связи его с обменом других веществ, необходимы
краткие представления о превращениях липидов на клеточном уровне. На поверхности клеточных мембран фер-
мент липопротеидлипаза гидролизует триацилглицерины ' на Жирные кислоты и глицерин. Глицерин вовлекается : клетками в процессы биосинтеза углеводов и фосфолипи- ; дов. Жирные кислоты окисляются в митохондриях клеток до ацетал-КоА, который может быть иснользован:
1) в цикле трикарбоновых кислот с образованием большого количества энергии в виде АТФ и конечных продуктов (СО 2 и Н2О);
2) для синтеза жирных кислот;
3) для синтеза холестерина;
4) в процессе образования кетоновых тел.
Напомним, что ацетил-КоА может образовываться в
клетках, как промежуточный продукт окисления глюкозы и некоторых аминокислот. Следовательно, он является общим промежуточным продуктом белкового углеводного и жирового обменов. При этом становится ясным, почему при избыточном питании углеводной и белковой пищей в
организме накапливается жир..
Регуляция обмена липидов на уровне целостного организма осуществляется центральной нервной системой и железами внутренней секреции. Например, инсулин способствует синтезу жирных кислот и накоплению резервного жира. Гормоны надпочечников, гипофиза и глюкагон вызывают мобилизацию жира из депо и его окисление. Центральная нервная система осуществляет согласованность действия гормонов. У здорового человека при нормальном питании существует динамическое равновесие процессов синтеза и распада липидов, при этом резервные липиды непрерывно используются, а вновь образованные депонируются.
§ 127. Патология липидного обмена
С целью диагностики сердечно-сосудистых заболеваний, болезней печени и почек, а также нейро-эндокринных расстройств в клинической практике производят определение общих липидов и их фракций. Нормальное содержание общих липидов в сыворотке крови составляет 4—8 г/л. Увеличение общих липидов называется гиперлипемией.
Как физиологическое явление гиперлипемия наблюдается после приема пищи через 1—4 ч. Высокое содержание липидов отмечается при сахарном диабете и голодании, когда гиперлипемия вызвана усиленной мобилизацией из жировых депо жира, необходимого для утоления «энергетического голода» клеток организма. Особенно высоких цифр достигают липиды сыворотки крови при липоидном нефрозе. При этом заболевании отмечается появление липидов в моче—липурия. При острых гепатитах гиперлипемия постоянное явление, особенно в период появления желтухи. Кроме того, гиперлипемией сопровождается микседема (гипофункция щитовидной железы).
Уменьшение содержания липидов сыворотки крови — гиполипемия — отмечается при тяжелых поражениях печени (циррозах) и при гипертиреозе вследствие повышенного окисления жиров. ’
Наряду с определением общих липидов в клинико-диагностических лабораториях 'производят определение липидных фракций: свободных жирных кислот, триацил-глицеринов, холестерина и фосфолипидов. Соотношение между ними часто имеет решающее значение в диагностике целого ряда заболеваний.
Триацилглицерины (нейтральные жиры) — нормальное содержание в сыворотке крови составляет 0,27— 1,65 ммоль/л. Увеличение их содержания наблюдается при ожирении, нефрозе, диабете, атеросклерозе, гипофункции щитовидной железы параллельно с увеличением общих липидов.
Фосфолипиды—нормальное содержание в сыворотке крови составляет 1,9—4,9 ммоль/л. Повышение содержания фосфолипидов отмечается, в основном, при тех же заболеваниях, которые сопровождаются увеличением три-ацилглицеринов (диабет, нефроз, гломерулонефрит, гипо- Я функция щитовидной железы). Уменьшением уровня фос- л фолипидов сопровождаются тяжелые формы острого re- 1 патита и жировая дистрофия печени, так как именно в -л печени происходит образование фосфолипидов. Я
Холестерин—чрезвычайно важный компонент липид- ной фракции. Его содержание в сыворотке крови зависит Я от возраста. У детей составляет 3,6—3,9 ммоль/л, у Я пожилых людей—3,9—6,5 ммоль/л. Увеличение содержа-JI ния холестерина — гиперхолестеринемия—наблюдается Я при диабете, липоидном нефрозе, атеросклерозе, механи- я ческой желтухе, гипофункции щитовидной железы. Осо- Я бенно высокое содержание холестерина отмечается при | наследственной гиперхолестеринемии, когда нарушены Я процессы регуляции синтеза и распада холестерина. 1
Снижение содержания холестерина—гипохолес- Я теринемия сопровождает острый панкреатит, острые инфекционные заболевания, туберкулез легких, гиперфункцию щитовидной железы. Особую диагностическую ценность имеет определение холестерина при гепатитах. В начальной стадии заболевания содержание холестерина увеличивается, а затем падает ниже нормы. При этом снижение происходит за счет эфиров холестерина, быстрое уменьшение содержания которых служит плохим прогностическим признаком. Нормальное содержание эфиров холестерина в сыворотке крови составляет около 40% от общего холестерина.
Нарушение обмена холестерина служит причиной накопления и неустойчивости его в растворе желчи, вследствие чего может наблюдаться образование холестериновых камней. Определению холестерина придается большое значение при диагностике атеросклероза. В стенках пора- I женных сосудов отмечается избыточное отложение холе- I стерина, вследствие чего уменьшается их просвет и I нарушается кровоснабжение органов и тканей. При этом I заболевании наблюдается изменение в составе липидных I фракций, главным образом, липопротеидов. I
Большую диагностическую ценность представляет on- I ределение отношения фосфолипидов к холестерину, кото
рое в норме составляет 1,5:1. При атеросклерозе, гипертонической болезни, тяжелых формах острого гепатита наблюдается уменьшение соотношения фосфолипиды/хо-лестерин.
Липопротеиды, как уже отмечалось, служат транспортной формой липидов в крови. Это сложные комплексные
соединения липидов с белками, которые разделяются на фракции (группы) методом ультрацентрифугирования и электрофореза. Методом электрофореза липопротеиды подразделяются на 4 фракции: а-липопротеиды, Р-липопротеиды, пре-р-липопротеиды и хиломикроны.
а-Липопротеиды богаты белками и фосфолипидами; (3-липопротеиды содержат меньше белка и богаты холестерином; пре-р-липопротеиды образуются в печени и служат транспортной формой образованных в организме триацилглицеринов; хиломикроны образуются в кишечнике и содержат небольшое количество белка, связанного с пищевыми триацилглицеринами и холестерином.
Определению соотношения между липопротеидными фракциями придается большое значение для диагностики заболеваний сердечно-сосудистой системы, печени и оценки состояния липидного обмена. При атеросклерозе, сочетающемся с развитием сердечной недостаточности, наблюдается увеличение р- и пре-р-липопротеидов, имеющих высокое содержание холестерина и триацилглицеринов. Повышение уровня пре-р-липопротеидов при небольшом увеличении холестерина наблюдается при диабете и ожирении. При паренхиматозных поражениях печени уменьшается содержание п-липопротеидов, при механических желтухах увеличивается содержание р-липо-протеидов.
$ 128. Роль печени в обмене липидов
Печень принимает участие во всех основных процессах обмена липидов, начиная с их переваривания и кончая их обменом на клеточном уровне. В печени образуются желчные кислоты, эмульгирующие пищевые жиры, активирующие липазу и обеспечивающие всасывание в кишечнике продуктов расщепления. С желчью из организма удаляется ряд веществ, которые не могут быть выделены почками с мочой, так как имеют крупные молекулы, которые не проходят через почечный фильтр.
Печень служит местом переработки нейтральных жиров. Из жировых депо током крови они доставляются в печень, где используются на образование фосфолипидов при наличии азотистых оснований и активной фосфорной кислоты. При недостатке АТФ и азотистых оснований или веществ, способствующих их синтезу (холин, серин, витамин В12), печеночные клетки переполняются жиром и разрушаются — развивается жировая дистрофия печени. Если процесс прогрессирует, то может произойти замещение печеночных клеток соединительной тканью — наступает фиброз.
Причиной жирового перерождения и фиброза могут быть паренхиматозные поражения печени, отравление фосфором или хлороформом, хронический алкоголизм. К жировой инфильтрации печени может привести усиленный транспорт жира из депо в связи с энергетическими нуждами организма. Это наблюдается при углеводном голодании и сахарном диабете.
В печени осуществляется синтез холестерина из аце-тил-КоА, количество которого превышает поступление его с пищей. Часть холестерина превращается в желчные кислоты и стероидные гормоны. Другая часть соединяется с жирными кислотами, образуя эфиры холестерина. Избыток холестерина выводится из организма с калом. Нарушения в обмене холестерина, сопровождающиеся его отложением в печеночных клетках, могут привести к фиброзу.
В клетках печени чрезвычайно активно происходит окисление жирных кислот до ацетил-КоА и только в печени происходит образование из него кетоновых тел. При нормальном течении обмена липидов и углеводов кетоновые тела присутствуют в крови в незначительных количествах, так как в клетках органов и тканей окисляются до конечных продуктов (СО 2 и Н2О). При голодании и диабете, когда образование кетоновых тел намного превышает возможность их окисления в тканях, развивается кетонемия.
Таким образом, для оценки роли печени в липидном обмене большую диагностическую ценность представляет определение в крови триацилглицеринов, фосфолипидов, холестерина и его эфиров.
Вопросы для повторения
1. Какие вещества относятся к группе липидов?
2. Какова физиологическая роль различных липидов в организме?
3. Где и как осуществляется гидролиз пищевых липидов? ;
4. Как осуществляется всасывание продуктов расщепления липидов?
5. Как используются организмом продукты расщепления липидов? Как осуществляется связь между углеводным, белковым и липидным обменами?
6. Как осуществляется регуляция липидного обмена в организме?
7. Какова норма содержания общих липидов в сыворотке крови?
8. При каких состояниях наблюдается гиперлнпемия? гиполипемия?
9. Какова диагностическая ценность определения триацилглицеринов и фосфолипидов?
10. Какие заболевания сопровождаются гипер- и гнпохолестерннемией?
11. Какую диагностическую ценность представляет определение соотношения фосфолипидов и холестерина в сыворотке кровн?
12. На какие фракции разделяются липопротеиды методом электрофореза?
13. Как изменяется соотношение фракций липопротеидов при атеросклерозе, диабете, гепатитах?
14. Какова роль печени в переваривании и всасывании пищевых липидов?
15. Каковы причины жировой дистрофии печени?
16. Какова роль печени в обмене холестерина?
17. Какова роль печени в образовании кетоновых тел?
МЕТОДЫ ИССЛЕДОВАНИЯ
§ 129. Определение общего холестерина в сыворотке крови1
Холестерин в присутствии уксусного ангидрида и смеси уксусной и серной кислот дает зеленое окрашивание.
Реактивы: 1) смесь из 1 части ледяной уксусной кислоты, 5 частей уксусного ангидрида и 1 части концентрированной серной кислоты; процесс смешивания идет с выделением тепла, поэтому сначала смешивают уксусную кислоту с уксусным ангидридом, а затем, при постоянном охлаждении, помешивая, медленно добавляют серную кислоту; полученная смесь должна быть бесцветной или слегка желтоватой; хранят в посуде из темного стекла с притертой пробкой в холодильнике;
2) стандартный раствор холестерина—1800 мг/л (180 мг холестерина растворяют в 2,5 мл хлороформа в мерной колбе вместимостью 100 мл и доводят до метки абсолютным спиртом); раствор хранят в посуде из темного стекла с притертой пробкой, которую парафинируют; 1 мл раствора содержит 1,8 мг холестерина.
Ход определения. К 2,1 мл смеси реактивов (1) добавляют 0,1 мл негемолизированной сыворотки. Добавляют медленно, так, чтобы сыворотка стекала по стенке пробирки. Пробирку энергично встряхивают 10—12 раз и помещают в термостат иа 10 мин при температуре 37° С. Измерения производят на ФЭКе против реактива 1 при красном светофильтре (630—690 нм) в кювете с толщиной слоя 5 мм.
Расчет ведут по калибровочному графику.
Построение калибровочного графика. Из основного стандартного раствора холестерина (2) готовят ряд разведений (табл. 14).
Рабочие стандартные растворы обрабатывают так же, как опытные пробы.
В норме содержание холестерина в сыворотке крови составляет 3,1—6,5 ммоль/л. Коэффициент для пересчета в единицы СИ (ммоль/л) равен 0,0026.
1 Метод Илька.
Таблица 14. Схема приготовления стандартных растворов
Na№ пробирки Количество стандартного холестерина, мл Количество реактива 1, мл Количество холестерина в пробе, мг Концентрация холестерина
мг/л г/л
1 0,05 2,15 0,09 900 0,9
2 0,10 2,10 0,18 1800 1,8
3 0,15 2,05 0,27 2700 2,7
4 0,20 2,0 0,36 3600 3,6
5 ' 0,25 1,95 0,45 4500 4,5
§ 130. Определение общих фосфолипидов в сыворотке крови по содержанию фосфора
Фосфолипиды осаждаются трихлоруксусной кислотой вместе с белками крови. Осадок подвергают минерализации с помощью раствора хлорной кислоты. Неорганический фосфор образует с молибденовой кислотой фосфор-номолибденовую кислоту, которая восстанавливается эйкогеном (аминонафтосульфоновая кислота) и бисульфитом натрия в молибденовую синь. По интенсивности окраски судят о количестве неорганического фосфора.
Реактивы: 1) 10% раствор трихлоруксусной кислоты;
2) 80% (800 г/л) раствор хлорной кислоты (относительная плотность 1,5);
3) 4% раствор молибдата аммония (4 г измельченного х. ч. молибдата аммония растворяют в 100 мл дистиллированной воды; раствор хранят в холодильнике);
4) основной раствор аминонафтолсульфоновой кислоты— эйкогена (в 100—150 мл дистиллированной воды растворяют 30 г бисульфита натрия NaHSO4 и добавляют 0,5 г эйкогена; раствор перемешивают стеклянной палочкой до полного растворения; отдельно в небольшом количестве воды растворяют 6 г безводного сульфита натрия NaSO3; оба раствора смешивают и доводят водой до объема 250 мл в мерной колбе; через 2—4 ч раствор фильтруют; хранят в холодильнике в посуде из темного стекла; перед употреблением 10 мл основного раствора разводят дистиллированной водой в 2,5 раза);
5) основной стандартный раствор однозамещенного фосфорнокислого калия КН2РО4, высушенного до постоянной массы при температуре 120° С (4,39 г КН2РО4 растворяют дистиллированной водой в колбе вместимостью 1 л и добавляют 1 каплю хлороформа в качестве консерванта; 1 мл раствора содержит 1 мг фосфора);
6) рабочий стандартный раствор готовят разведением основного стандартного раствора в 100 раз; 1 мл его содержит 0,01 мг фосфора; оба раствора хранят в холодильнике.
Ход определения. 0,2 мл сыворотки помещают в пробирку, содержащую 3 мл воды. Добавляют 3 мл 10% раствора трихлоруксусной кислоты: первые 1,5 мл по каплям, остальное сразу. Оставляют стоять не более 1—2 мин, затем центрифугируют 3—5 мин. Над осадочную жидкость сливают. К осадку добавляют 1 мл 80% раствора НС1О4 и для равномерного кипения 1—2 бусинки. Пробирку нагревают 20—30 мин на песочной бане (температура 180° С) пока смесь не станет бесцветной. После охлаждения добавляют дистиллированную воду до объема 7 мл.
Контрольная проба. 0,8 мл 80% раствора хлорной кислоты доводят водой до объема 7 мл.
Стандартные пробы. Готовят 3 пробирки. Берут по 2 мл рабочего стандартного раствора и 0,8 мл 80% раствора хлорной кислоты. Все пробы доводят до объема 7 мл дистиллированной водой.
Для определения фосфора пробирки располагают в следующем порядке: контрольная, 2 стандартные, опытная, стандартная. В каждую прибавляют по 1 мл 4% молибдата аммония, перемешивают и прибавляют до 1 мл раствора эйкогена, доводят объем до 10 мл водой. Снова перемешивают. Через 20 мин после прибавления эйкогена производят измерения на ФЭКе при красном светофильтре (630—690 нм) в кювете с толщиной слоя 10 мм против контроля.
Расчет ведут по формуле:
„ _м . , 0,02-1000 Son
Липидный фосфор =-g----—=—-100 мг/л,
где 0,02—содержание фосфора в 2 мл стандарта, мг; 0,2—количество взятой сыворотки, мл; 1000—
коэффициент пересчета из 1 мл в 1 л.
В норме концентрация липоидного фосфора составляет 1,97 —4,68 ммоль/л (61 —145 мг/л). Концентрация общих фосфолипидов вычисляется умножением полученного липоидного фосфора на 25.
Глава V
ПИГМЕНТНЫЙ ОБМЕН
ПОКАЗАТЕЛИ, ХАРАКТЕРИЗУЮЩИЕ СОСТОЯНИЕ ПИГМЕНТНОГО ОБМЕНА
§ 131. Краткие сведения об образовании пигментов
Источником образования пигментов в организме служит гемоглобин. Это сложный белок, состоящий из пигментной (окрашенной) части — гема и белковой — глобина. Основу пигментной части составляет порфириновое кольцо, образованное четырьмя замещенными пирролами с атомом железа в центре (рис. 66). Гемоглобин содержится в эритроцитах, которые в среднем через 120 дней разрушаются. При этом освобождается гемоглобин. В клетках ретикулоэндотелиальной системы происходит его постепенный распад при участии ферментов (рис. 67):
1) разрывается связь в порфириновом кольце, гемоглобин окисляется и образуется пигмент вердоглобин;
2) освобождается железо и белок — глобин, цепь пиррольных колец распрямляется и образуется пигмент зеленого цвета — биливердин;
3) образовавшийся биливердин ферментативным путем восстанавливается в пигмент оранжевого цвета — билирубин.
Из клеток ретикулоэндотелиальной системы билирубин поступает в кровь. Он плохо растворим в воде и легко адсорбируется на белках плазмы крови, следовательно, не может пройти через почечный фильтр и попасть в мочу. Этот пигмент носит названия, связанные с его свойствами: нерастворимого (в воде), непрямого (не дает прямой реакции — розового окрашивания — с диазореактивами из-за связи с белками), свободного. Током крови свободный билирубин доставляется в печень, где соединяется с двумя молекулами глюкуроновой кислоты. Образуется комплекс—билиру бин-диглюкуронид, хорошо растворимый в воде, дающий прямую реакцию с диазореактивами. Из печеночных клеток растворимый, прямой, связанный (с глюкуроновой кислотой) билирубин поступает в желчные капилляры. Так как концентрация билирубина в клетке меньше, чем в желчном капилляре, то для осуществления его переноса через клеточную мембрану затрачивается энергия. Такой перенос вещества в сторону большей концентрации называется переносом против градиента концентрации. В составе желчи по общему желчному протоку билирубин поступает в двенадцатиперстную киш-
Строение гема
Рис. 66. Структура гема.
ку, где под действием ферментов и восстанавливающих микроорганизмов превращается в мезобилиноген. Небольшая часть мезобилиногена (уробилиногеновых тел) всасывается через стенку кишечника в кровь и по воротной вене доставляется в печень, где расщепляется до дипирролов (соединений, содержащих два пиррольных кольца), которые задерживаются печенью и не поступают в общий кровоток.
Большая часть мезобилиногена в кишечнике при участии микроорганизмов восстанавливается в стеркобилиноген. В нижних отделах толстой кишки часть стеркобилиногена всасывается через стенку кишечника в кровь и через систему геморроидальных вен попадает в большой круг кровообращения и затем выводится с мочой (в клинической практике носит название уробилина). Другая часть стеркобилиногена выделяется с калом, сообщая ему цвет и являясь его нормальным пигментом. Схема образования пигментов представлена на рис. 68.
Гемоглобин
Вердоглобин
I -глобин -железо биливердин
билирубин
Билирубин крови
глюкуроновая* кислота
-альбумин
Билир(^бин^жети
Мезобилиноген (уробилиногеновые тела)
Стеркобилиноген
Стеркобилин (пигмент кала)
Уробилин (пигмент ночи)
Рис. 67. Схема преобразования пигментов в норме.
§ 132. Патология пигментного обмена
При ряде заболеваний, особенно при инфекционных и токсических повреждениях печени, циррозах, наблюдается нарушение в обмене пигментов и изменяется их содержание в крови, моче и кале. Определение количественного и качественного состава желчных пигментов) имеет большое клиническое значение.
В крови здорового человека содержится 8,5— 20,5 мкмоль/л (5,0—12 мг/л) общего билирубина, из которого на долю свободного, непрямого приходится 75%. В желчи находится только связанный, прямой билирубин. I
Билирубин является токсичным веществом: увеличение» его концентрации в крови и проникновение в другие ткани организма приводит к их поражению, особенно страдает! центральная нервная система. Одним из внешних призна-1 ков болезни служит желтая окраска кожных покровов и
Рнс. 68. Схема пигментного обмена в норме.
склер глаз, возникающая в результате повышения общего билирубина крови — гипербилирубинемии. Различают желтухи трех видов.
При механической желтухе частично или полностью прекращается отток желчи из печени вследствие закупорки общего желчного протока камнем или опухолью головки поджелудочной железы. Печеночные капилляры переполняются желчью. Сдавленные печеночные клетки не могут нормально функционировать и способны пропускать связанный билирубин в кровь. В крови резко возрастает общий билирубин за счет связанного прямого билирубина (рис. 69, см. на цвет. вкл.). С током крови билирубин попадает в почки и выделяется с мочой, придавая ей зеленовато-бурый цвет. Так как желчь и в ее составе билирубин не попадает в кишечник, то не образуется его производных — пигмента кала и мочи. Кал не окрашен, серого цвета, из-за отсутствия стеркобилиногена, и мазеобразный из-за присутствия непереваренного жира. В моче также отсутствует стеркобилиноген.
Паренхиматозный гепатит может быть вызван вирусами, сальмонеллами, отравлениями токсическими веществами. Пораженные печеночные клетки в начале заболевания (дожелтушный период) не задерживают мезобилиноген
(уробилиногеновые тела). Он попадает в общий кровоток и через почки выделяется с мочой, усиливая ее окраску. Моча приобретает оранжево-коричневый цвет. Уробилино-генурия (мезобилиногенурия) — первый и важный признак начальной стадии поражения печени. На высоте заболевания, когда поражается большая часть печеночных клеток, образованный связанный билирубин поступает не в желчный капилляр, а в кровь, так как пораженным вирусом клеткам не хватает энергии переводить билирубин против градиента концентрации. В крови отмечается гипербилирубинемия за счет прямого билирубина. С током крови прямой билирубин доставляется в почки и выделяется с мочой, сообщая ей зеленовато-бурый цвет. Желчь резко бедна билирубином. Следовательно, уменьшается содержание его производного — стеркобилиногена — пигмента кала и мочи, вплоть до полного исчезновения. Появление стеркобилина в моче служит благоприятным признаком.
При гемолитических анемиях в организме резко усиливается процесс распада эритроцитов — гемолиз. В результате этого в клетках ретикулоэндотелиальной системы из гемоглобина распавшихся эритроцитов образуется большое количество свободного билирубина. В крови отмечается гипербилирубинемия. В печени из большого количества свободного билирубина образуется большое количество связанного билирубина, а из него в кишечнике — большое количество стеркобилиногена — пигмента кала и мочи. Поэтому кал имеет интенсивно коричневый цвет, а моча — оранжево-коричневый.
Вопросы для повторения
1. Каковы нормальные пигменты эритроцитов и плазмы крови? Каково их количественное содержание и место образования?
2. Как и где образуется прямой билирубин?
3. Каков нормальный пигмент мочи, из какого пигмента и где он образуется?
4. Каков нормальный пигмент кала, из какого пигмента ‘ и где он образуется?
5. Какие изменения в составе пигментов плазмы крови отмечаются при механических желтухах и почему?
6. Какие изменения в составе пигментов мочи отмечаются при механических желтухах и почему?
7. Как изменяется окраска кала при механических желтухах и почему?
8. Какие изменения пигментов мочи отмечают в начале инфекционного гепатита?
9. Как изменяется общий билирубин и его фракции при паренхиматозной желтухе в разгар заболевания?
10. Каков цвет мочи и какими пигментами он обусловлен при паренхиматозной желтухе в разгар заболевания?
11. Каков цвет кала и содержание в нем пигментов при этом заболевании?
12. Каковы изменения в содержании пигментов крови, мочи и кала при гемолитических процессах?
МЕТОДЫ ИССЛЕДОВАНИЯ
§ 133. Определение билирубина в сыворотке крови1
При взаимодействии сульфаниловой кислоты с нитритом натрия образуется диазофенилсульфоновая кислота (диазосмесь), которая дает со связанным (прямым) билирубином сыворотки розово-фиолетовое окрашивание. По его интенсивности судят о концентрации связанного билирубина, дающего прямую реакцию. При добавлении к сыворотке крови кофеинового реактива несвязанный (непрямой) билирубин переходит в растворимое диссоциированное состояние и также дает розово-фиолетовое окрашивание с диазосмесью одновременно с прямым билирубином. По интенсивности окраски, образующейся после добавления кофеинового реактива, определяют концентрацию общего билирубина. По разнице между общим и связанным (прямым) билирубином находят содержание несвязанного (непрямого) билирубина.
Реактивы: 1) кофеиновый реактив (5 г ч. кофеина, 7,5 г бензоата натрия, 12,5 г ацетата натрия CH3COONa растворяют в 90 мл дистиллированной воды, нагревают до 50—60° С и хорошо перемешивают; после охлаждения доводят дистиллированной водой до объема 100 мл); срок хранения 2 нед;
2) 0,9% раствор хлорида натрия;
3) диазосмесь: а) диазореактив I (5 г сульфаниловой кислоты растворяют при нагревании в 300—400 мл дистиллированной воды до полного растворения, прибавляют 15 мл концентрированной хлористоводородной кислоты с относительной плотностью 1,19; после охлаждения объем раствора доводят до 1 л дистиллированной водой); реактив стоек; хранят в посуде из темного стекла; б) диазореактив II (0,5% раствор нитрита натрия NaNO3); реактив нестойкий; хранят в посуде из темного стекла около 2—3 нед; желтый оттенок — признак непригодности реактива; в) диазосмесь готовят перед работой, смешивая 10 мл диазореактива I и 0,3 мл диазореактива II.
Ход определения. В 3 пробирки (ддя общего билирубина, прямого и для контроля) вводят реактивы в порядке, указанном в табл. 15.
Для определения прямого билирубина в пробе измерения на ФЭКе производят спустя 5—10 мин после добавления диазосмеси, так как при более длительном стоянии в реакцию вступает непрямой билирубин.
При определении общего билирубина пробу оставляют
Метод Иендрашика.
Таблица 15. Схема определения билирубина в сыворотке крови
Ингредиенты, мл Билирубин Контроль
общий связанный (прямой)
Сыворотка 0,50 0,50 0,50
Кофеиновый реактив 1J5 — 1,75.
0,9% раствор NaCl — 1,75 0,25
Диазосмесь 0,25 0,25
стоять 20 мин. При дальнейшем стоянии окраска не изменяется.
Контроль на мутность сыворотки ставят для каждого опыта.
Измерение экстинкции производят на ФЭКе при зеленом светофильтре (500—560 нм) против воды в кювете с толщиной слоя 5 мм. Из показателей общего и прямого билирубина вычитают показатель контроля. Расчет производят по калибровочному графику. Находят содержание общего и прямого билирубина. Для определения непрямого билирубина из общего вычитают прямой билирубин.
Построение калибровочного графика удобно произво>-дить с помощью набора «Билирубин-эталон» (фирма «Лахема», ЧССР). Набор содержит лиофилизированный (сухой) билирубин, альбумин и инструкцию по построению графика.
Результаты выражают в миллиграммах на литр; для этого концентрацию билирубина, найденную по графику, умножают на 2000, так как для исследования было взято 0,5 мл сыворотки. Коэффициент пересчета в единицы СИ (мкмоль/л) равен 1,7104. В норме содержание общего билирубина 8,5—20,5 мкмоль/л.
Глава VI1
ВОДНО-СОЛЕВОЙ ОБМЕН
ПОКАЗАТЕЛИ, ХАРАКТЕРИЗУЮЩИЕ СОСТОЯНИЕ ВОДНО-СОЛЕВОГО ОБМЕНА
§ 134. Роль воды и минеральных веществ в организме
Вода вместе с растворенными в ней органическими и минеральными веществами составляет среду, в которой осуществляются биохимические процессы, обеспечивающие жизнедеятельность организма. Способность организма к поддержанию постоянства и единства внутренней среды (гомеостаз) представляет собой одно из наиболее существенных достижений эволюции.
Являясь универсальным растворителем для многих соединений и транспортируя их, вода обеспечивает связь всех органов и систем. Ее количество составляет 60—65% от массы тела. Большая часть воды входит в состав внутриклеточных жидкостей. Внеклеточная вода содержится в межклеточной и внутрисосудистой жидкостях. В то же время вода находится в свободном и связанном состоянии.
Значительная ее часть связана, главным образом, с белками, обеспечивая поддержание структуры молекул белков и их устойчивость в коллоидном растворе. Кроме того, вода связана с волокнистыми образованиями межклеточного пространства и с клеточными мембранами. Свободная вода входит в состав биологических жидкостей: крови, лимфы, мочи, спинномозговой жидкости и др.
Количество минеральных веществ в организме невелико — 3,5—4% от массы тела, однако, это не исключает их большого физиологического значения. Наиболее широко представлены в организме щелочные и щелочноземельные металлы: натрий, калий, кальций, железо. Из неметаллов—хлор, фосфор, азот, сера и др. В небольшом количестве содержатся марганец, йод, цинк, медь, фтор и др.
Минеральные вещества в организме находятся в различных состояниях: в тесной связи с органическими соединениями, в виде нерастворимых солей и, главным образом, в виде ионов — катионов и анионов. Пластическая роль минеральных веществ заключается в их способности соединяться с белками, гормонами, ферментами, обеспечивая устойчивую структуру молекул и их биологическую активность. Например, цинк входит в состав гормона инсулина, кобальт—в состав витамина В ,2, железо— в состав гемоглобина, йод — в состав гормона тироксина. Минеральная часть костей и зубной эмали представлена, главным образом, фосфатами кальция, с включением карбонатов, фторидов, гидроксидов и цитратов.
Большая часть минеральных веществ находится в виде катионов и анионов, содержащихся во внеклеточной и внутриклеточной жидкостях. Основными внеклеточными ионами являются Na+, СГ, НСО3~, внутриклеточными — К+, Н2РО4", НРО42-. Через полупроницаемые клеточные мембраны происходит перемещение ионов и воды, однако сохраняется преимущественное содержание натрия во внеклеточном пространстве, а калия внутри клеток. Сохранение такого динамического постоянства состава обеспечивается так называемым «натриевым насосом», осуществляющим «выкачивание» ионов натрия из клетки и перемещение калия в клетку.
Достаточно высокое содержание ионов Na+ и СГ во внеклеточных жидкостях, в том числе в плазме крови, обеспечивает одну из важнейших характеристик состояния внутренней среды организма—осмотическое давление.
Катионы Na+ и К+ совместно с анионами СГ и НСО3", располагаясь по разные стороны клеточных мембран, создают некоторый избыток положительно заряженных ионов на наружной поверхности мембран, уравновешенных отрицательно заряженными ионами на внутренней их поверхности, благодаря действию «натриевого насоса». Таким образом, возникает двойной электрический слой, т. е. разность потенциалов. Возбудимость клеток, проведение нервных импульсов, мышечные сокращения связаны с наличием определенного электрического потенциала.
Второй важной характеристикой гомеостаза служит постоянство реакции жидкостей организма, которое характеризуется показателем концентрации водородных ионов — pH. В норме pH крови колеблется в пределах 7,37—7,44, то есть близко к нейтральной реакции. Несмотря на поступление кислых и основных продуктов обмена веществ в кровь, у здорового человека сохраняется кислотно-основное состояние, которое обеспечивают буферные системы: бикарбонатная, фосфатная и белковая. Бикарбонатный буфер состоит из угольной кислоты Н2СО3 и бикарбоната натрия NaHCO3, фосфатный — из однозамещенного фосфата натрия NaH2PO4 и двузамещенного— Na2HPO4. Каждый буфер состоит из слабой кислоты и соли, обеспечивает определенное значение pH и стремится его сохранить. При поступлении кислых продуктов в кровь NaHCO3 их нейтрализует с образованием натриевых солей и угольной кислоты. Соли удаляются из организма почками, а угольная кислота, распадаясь на СО 2 и Н2О, покидает организм с выдыхаемым воздухом через легкие. Таким образом, в крови ликвидируется угроза сдвига pH в кислую сторону. Бикарбонатная система функционирует совместно с гемоглобином (белковый буфер), который участвует в транспорте кислорода к тканям и углекислого газа к легким.
Многие катионы играют большую роль в обеспечении жизненно важных функций организма. Катионы калия оказывают существенное влияние на деятельность сердечной мышцы и почек. Катионы кальция являются необходимыми участниками мышечных сокращений и процесса свертывания крови. Катионы магния и марганца необходимы для синтеза белка в клетках. Наконец, многие катионы активно участвуют в ферментативном катализе, способствуя или препятствуя образованию ферментсубстратного комплекса.
§ 135. Краткие сведения о регуляции водно-солевого обмена
Регуляция водно-солевого обмена является одним из наиболее сложных механизмов гомеостаза. Известно, что при небольшом поступлении воды в организм уменьшается ее выделение почками с мочой, и, наоборот, при избыточном приеме жидкости увеличивается выделение мочи. Регуляция всасывания воды в почечных канальцах осуществляется гормоном вазопрессином, который вырабатывается гипофизом. Сигналом для активной выработки вазопрессина служит увеличение осмотического давления крови, которое может быть вызвано повышенным потреблением соли или обезвоживанием организма при рвотах, поносах и других состояниях. Гормон альдостерон, вырабатываемый корковым веществом надпочечников, стимулирует реабсорбцию натрия в почечных канальцах, калий при этом выделяется с мочой. При высокой концентрации хлорида натрия в крови почки выделяют концентрированную мочу — организм избавляется от избытка соли — реабсорбция натрия в канальцах уменьшается. При снижении концентрации хлорида натрия в крови выделяется разбавленная моча — организм сохраняет соль — усиливается реабсорбция натрия в канальцах. Кроме того, потребление воды организмом регулируется центральной нервной системой.
Поддержание постоянства кислотно-основного состояния обеспечивается, как уже отмечалось, буферными системами и легкими. Особая роль в этом процессе принадлежит почкам. В клетках почечных канальцев происходит реабсорбция ионов натрия и секреция ионов калия и водорода. Натрий, вернувшись в кровь, соединяется с ационом НСО3~ и увеличивается основной (Щелочной) резерв крови. Остатки кислых продуктов в виде анионов кислот соединяются в почках с ионами аммония NH< (вместо Na+ и частично К+) и покидают организм в виде аммонийных солей; кроме того, с мочой выделяются фосфаты в виде кислой соли (NaH2PO4).
Процессы, происходящие в почках, обеспечивают сохранение необходимых катионов Na+; К+, Mg+ и др. и удаление из организма токсичного аммиака и кислых продуктов, т. е. почкам принадлежит большая роль в поддержании постоянства внутренней среды организма.
§ 136. Патология обмена натрия и калия
Нормальное содержание натрия в плазме крови составляет 130,5—156,6 ммоль/л. Расстройство обмена натрия может сопровождаться уменьшением содержания натрия в
организме — гипонатриемией и увеличением — гипер-
натриемией.
Причиной гипонатриемии может быть абсолютный недостаток натрия вследствие его потерь при поносах и рвотах, нарушении реабсорбции в почечных канальцах при гипофункции надпочечников.
Относительная недостаточность натрия возникает вследствие избыточного поступления воды в организм или задержании его в выпотных жидкостях, образующихся в плевральной, брюшной полостях и др.
Уменьшение содержания натрия в крови приводит к задержке воды в тканях — возникают отеки. При этом количество воды в плазме уменьшается, что приводит к сгущению крови, увеличению ее вязкости, нарушению кровоснабжения почек и развитию почечной недостаточности.
Гипонатриемия может привести к изменению pH крови. Например, при гипофункции надпочечников (аддисонова болезнь) развивается ацидоз, так как потеря натрия уменьшает щелочной резерв крови (NaHCO3) и увеличивает кислотный (Н2СО3).
Гипернатриемия возникает чаще всего вследствие увеличения выработки надпочечниками гормона альдостерона. Происходит усиленная задержка натрия в организме. Следствием этого является повышение осмотического давления крови, возникновение чувства жажды, полиурия, сдвиг pH в щелочную сторону (алкалоз).
Гипернатриемия может развиться вследстйие больших потерь воды при несахарном диабете, сморщенной почке.
Содержание калия в эритроцитах составляет 78— 95,7 ммоль/л, а в плазме крови — 3,48—5,32 ммоль/л.
Увеличение содержания калия в плазме крови — гиперкалиемия наблюдается при гипофункции надпочечников, усиленном распаде тканей и гемолизе эритроцитов, когда калий из разрушенных клеток переходит в кровь. Задержка калия в организме наступает в результате почечной недостаточности, сопровождающейся олигурией и анурией. Гиперкалиемия ведет к серьезным расстройствам сердечной деятельности, вплоть до остановки сердца.
В клинической практике встречаются больные с уменьшением содержания калия в плазме крови — гипокалиемией. Такие состояния характеризуются дегенеративными изменениями в сердечной мышце и почечных канальцах.
Причинами гипокалиемии могут быть гиперфункция надпочечников и гипофиза, состояния, сопровождающиеся полиурией, сахарный диабет и др. Потеря 282
калия может происходить через желудочно-кишечный тракт при рвотах и поносах. Большой недостаток калия в организме приводит к алкалозу.
§ 137. Патология обмена кальция и фосфора
Основная масса кальция находится в скелете (до 98%), в виде фосфатов и карбонатов. Остальная его часть содержится в клетках и неклеточных жидкостях в свободном состоянии—в виде ионов и в связи с альбуминами. Между кальцием, содержащимся в костях, и ионизированным кальцием существует динамическое равновесие. Регуляция обмена кальция осуществляется гормонами паращитовидных желез — паратгормоном и кальцитонином. Паратгормон вызывает мобилизацию кальция из костей, увеличивает реабсорбцию его в почечных канальцах и всасывание в желудочно-кишечном тракте. Необходимо отметить влияние витамина D на процесс всасывания кальция в кишечнике. Активная форма витамина D образуются в печени и почках, поэтому при заболеваниях этих органов нарушается процесс задержки кальция в организме.
Кальцитонин действует противоположно паратгормону. Он стимулирует отложение кальция в костях и оказывает влияние на способность почек образовывать-активную форму витамина D.
Нормальное содержание кальция в плазме крови составляет 2,25—2,75 ммоль/л. Изменение содержания кальция в плазме крови имеет диагностическое значение при нарушениях функции паращитовидных желез, поражении костей, заболеваниях печени и почек, недостатке или избытке витамина D. При гипофункции паращитовидных желез, после операций щитовидной железы может наступить резкое снижение выделения гормонов и, как следствие этого, снижение количества кальция в организме — гипо кал ьциемия.
Гипокальциемия сопровождается повышенной нервно-мышечной возбудимостью, наблюдаются резкие и длительные сокращения мышц — тетанические судороги, которые могут привести у грудных детей при отсутствии лечения к летальному исходу. При недостатке витамина D, активная форма которого стимулирует всасывание кальция в кишечнике, у детей развивается рахит, одним из проявлений которого является нарушение процесса обызвествления костей. Кроме того, гипокальциемия отмечается при нефротическом синдроме, сопровождающемся уменьшением количества белка в плазме крови, вследствие его потери с мочой.
Гиперфункция паращитовидных желез сопровождается
гиперкальциемий. У больных наблюдается рассасывание минеральной основы костей, образование множества полостей в костях, что приводит к переломам. Высокое содержание кальция в крови сопровождается повышенным выделением его почками. Вследствие малой растворимости кальциевых солей у больных может наблюдаться образование мочевых камней. Гиперкальциемия наблюдается при заболеваниях, сопровождающихся распадом костной ткани, а также при передозировке витамина D. Кроме того, может наблюдаться патологическое отложение кальция в различных тканях. При оссифицирующем миозите отмечается отложение кальция в мышцах — окостенение мышц, что ведет к полной неподвижности. Отложение кальция в стенках кровеносных сосудов при атеросклерозе и в очагах некроза легочной ткани при туберкулезе свидетельствует об участии кальция в этих патологических процессах.
Фосфор в организме содержится в виде неорганических солей и в связи с органическими соединениями. Фосфорные соединения кальция, магния, калия и др. широко представлены в костной ткани и зубной эмали. В клетках организма фосфор содержится в составе нуклеиновых кислот, липидов, углеводов, АТФ и других энергетически богатых соединений. В плазме крови он содержится в виде анионов НРО42- и Н2РО4'.
Обмен фосфора регулируется тем же механизмом, что и обмен кальция. Паратгормон способствует выделению фосфатов почками, снижая его содержание в сыворотке крови. Между содержанием фосфора и кальция в сыворотке крови обычно наблюдается обратная зависимость: когда снижен фосфор, повышен кальций, и наоборот. Костная ткань служит резервуаром фосфора. При избытке его в крови он откладывается в костях, при недостатке—поступает из костей в кровь.
Нормальное содержание неорганического фосфора в сыворотке крови составляет 0,65—1,4 ммоль/л. Увеличение содержания фосфора в сыворотке наблюдается при гипофункции паращитовидных желез, передозировке витамина D, заболевании почек, когда нарушается выделение фосфатов с мочой. Уменьшение содержания фосфора в сыворотке крови отмечается при гиперфункции паращитовидных желез и, особенно, при рахите, на ранних стадиях заболевания.
В клинической практике, кроме натрия, калия, кальция и фосфора, находит широкое распространение определение ионов хлора и железа. Как уже отмечалось, ионы хлора в организме тесно связаны с ионами натрия и обеспечивают осмотическое давление крови. Кроме того, ионы хлора содержатся в составе желудочного содержи
мого и в моче. Нормальное содержание ионов хлора в сыворотке крови составляет 95-‘—ПО ммоль/л.
Увеличение содержания хлоридов в крови___________________
гиперхлоремия отмечается при недостаточном поступлении воды в организм и избыточном поступлении соли, при нефритах, нефрозах, нефросклерозах вследствие нарушения выделительной функции почек.
Гипохлоремия — уменьшение содержания хлоридов в сыворотке крови — отмечается при рвотах и поносах, образовании выпотных жидкостей, пневмонии, ренальном диабете и др.
Диагностическая ценность определения железа особенно велика в связи с его участием в образовании гемоглобина. Снижение содержания железа в сыворотке крови наблюдается при железодефицитных анемиях, воспалительных, гнойных, септических инфекциях и интоксикациях, ревматизме. Высокое содержание железа в сыворотке крови имеет место при недостаточном использовании железа либо при его повышенном поступлении в организм. Недостаточное использование железа при хронических гепатитах и циррозах, нарушениях синтеза гема при некоторых видах анемий (наследственная сидеробластная анемия).
Изменение содержания железа служит важным показателем динамики лечения больных железодефицитными анемиями.
Вопросы для повторения
1. Какова роль воды и как она распределена в организме?
2. В каких состояниях находятся минеральные вещества в организме?
3. Какова пластическая роль минеральных веществ в организме?
4. Какие ионы обеспечивают важнейшие показатели постоянства внутренней среды?
5. Какими гормонами и как обеспечивается регуляция воды в организме?
6. Какими органами и системами обеспечивается постояйство pH крови?
7. Какова роль натрия в организме?
8. Каковы причины гипер- и гипонатриемий?
9. Какова роль калия в организме?
10. Каковы причины гипер- и гипокалиемий?
11. Какова роль кальция в организме?
12. Какими гормонами осуществляется регуляция содержания кальция в • организме?
13. Какие заболевания сопровождаются гипо- и гиперкальциемией?
14. Какова роль фосфора в организме?
15. Каковы причины уменьшения и увеличения содержания фосфора в сыворотке крови?
16. Каковы причины гипо- и гиперхлоремий?
17. Какова диагностическая ценность определения железа в сыворотке крови?
МЕТОДЫ ИССЛЕДОВАНИЯ
§ 138. Определение кальция в сыворотке крови с применением мурексида1
Свободный мурексид в щелочной среде имеет сине фиолетовый цвет, а связанный в комплекс с кальцием — розово-оранжевый. При титровании раствором более силь ного комплексообразователя (комплексон III) это' комплекс разрушается, и связанный с кальцием мурексщ освобождается. Проба приобретает фиолетовый цвет.
Реактивы: 1) раствор комплексона III; синонимы трилон-Б, ЭДТА (1,665 комплексона III вносят в мернук колбу вместимостью 1 л и доводят дистиллированно! водой до метки);
2) 9 н. раствор едкого натра (36 г щелочи растворяют 1 небольшом объеме воды, переносят в колбу вместимостьк 100 мл и доводят дистиллированной водой до метки);
3) мурексид, смешанный с хлоридом натрия в соотношении 1:50 и растертый в тонкий порошок; хранят в полиэтиленовой посуде.
Ход определения. В маленькую коническую колбу вносят 50 мл дистиллированной воды, 0,4 мл 9 н. раствора щелочи и прибавляют на кончике ножа смесь мурексида. Появляется сине-фиолетовое окрашивание свободного мурексида. Жидкость делят пополам: одна часть раствора служит эталоном окраски («свидетель»), другая — используется для опытной пробы. К ней добавляют 1 мл сыворотки крови, появляется розово-оранжевое окрашивание. Раствор тотчас титруют комплексоном III до синефиолетового окрашивания (сравнивают с окраской «свидетеля»). Расчет производят по формуле:
х=1,8-а,
где х—концентрация кальция, ммоль/л; 1,8 — фактор пересчета, соответствующий концентрации комплексона; а—количество комплексона, мл.
§ 139. Определение ионов хлора в сыворотке крови, моче и спинномозговой жидкости меркуриметрическим методом с индикатором дифенил карбазоном
Ионы хлора в биологических жидкостях титруют нитратом ртути, применяя в качестве индикатора дифенил-карбазон. В эквивалентной точке избыток нитрата ртути образует с индикатором комплекс, окрашенный в синефиолетовый цвет.
1 Метод Моизиса и Зака.
Реактивы: 1) раствор нитрата ртути (2 г двухвалентного нитрата ртути х. ч. растворяют в 200 мл дистиллированной воды, добавляют 20 мл 2 н. раствора азотной кислоты и доводят объем водой до 1 л); реактив стойкий;
2) раствор индикатора (100 мг дифенилкарбазона растворяют в 100 мл 96% этанола; раствор хранят в холодильнике в течение месяца);
3) 2 н. раствор азотной кислоты (14 мл концентрированной азотной кислоты доводят до объема 100 мл дистиллированной водой);
4) 0,01 н. стандартный раствор хлора (584,5 мг хлорида натрия х. ч. высушенного до постоянной массы при 120° С, доводят до объема 1 л дистиллированной водой; 1 мл раствора содержит 0,01 ммоль/л хлора).
Ход определения. В «сахарный» станкан отмеривают 1,8 мл дистиллированной воды, добавляют 0,2 мл исследуемой биологической жидкости, 4 капли индикатора и титруют нитратом ртути из микробюретки до появления сине-фиолетового окрашивания. Для стандартизации раствора нитрата ртути к 2 мл стандартного раствора хлорида натрия добавляют 4 капли индикатора и титруют раствором нитрата ртути как опытную пробу. Расчет производят по формуле:
0,02-А-5-1000 А 100 х=-----------=-----,
Б Б
где х—количество иоиов хлора, ммоль/л; 0,02 — количество хлора в 2 мл стандартного раствора, ммоль/л; 5-1000 — коэффициент пересчета на 1 л биологической жидкости; А—количество раствора нитрата ртути, израсходованного на титрование опыта, мл; Б—количество раствора нитрата ртути, израсходованного на титрование стаидратного раствора, мл.
В норме содержание ионов хлора в сыворотке крови составляет 95 — ПО ммоль/л, в спинномозговой жидкости—120—130 ммоль/л, в моче—170—210 ммоль/л.
ОГЛАВЛЕНИЕ
Предисловие................................ ............... 3
Введение.............................................. 4
Общеклинические исследования ........;..................... 13
Глава I. Исследование мочи............................... 13
Глава II. Исследование содержимого желудка и кишечника 46
Глава III. Исследование мокроты.............................. 81
Глава IV. Исследование спинномозговой жидкости............. 96
Глава V. Исследование жидкости из серозных полостей ........ 109
Гематологические исследования............................. 116
Глава I. Кроветворение. Состав и функции крови............ 116
Г л а в а II. Патологические изменения состава крови ....... 157
Глава III. Система гемостаза. Геморрагические диатезы....... 182
Глава IV. Иммунные свойства эритроцитов .................... 201
Клинико-биохимические исследования............................... 216
Глава I. Белковый обмен.................................. 219
Глава II. Ферменты н их роль в организме................... 241
Г лав а III. Углеводный обмен ......................... 251
- Г лава IV. Липидный обмен ............................ 262
Глава V. Пигментный обмен................................... 272
Глава VI. Водно-солевой обмен............................... 278