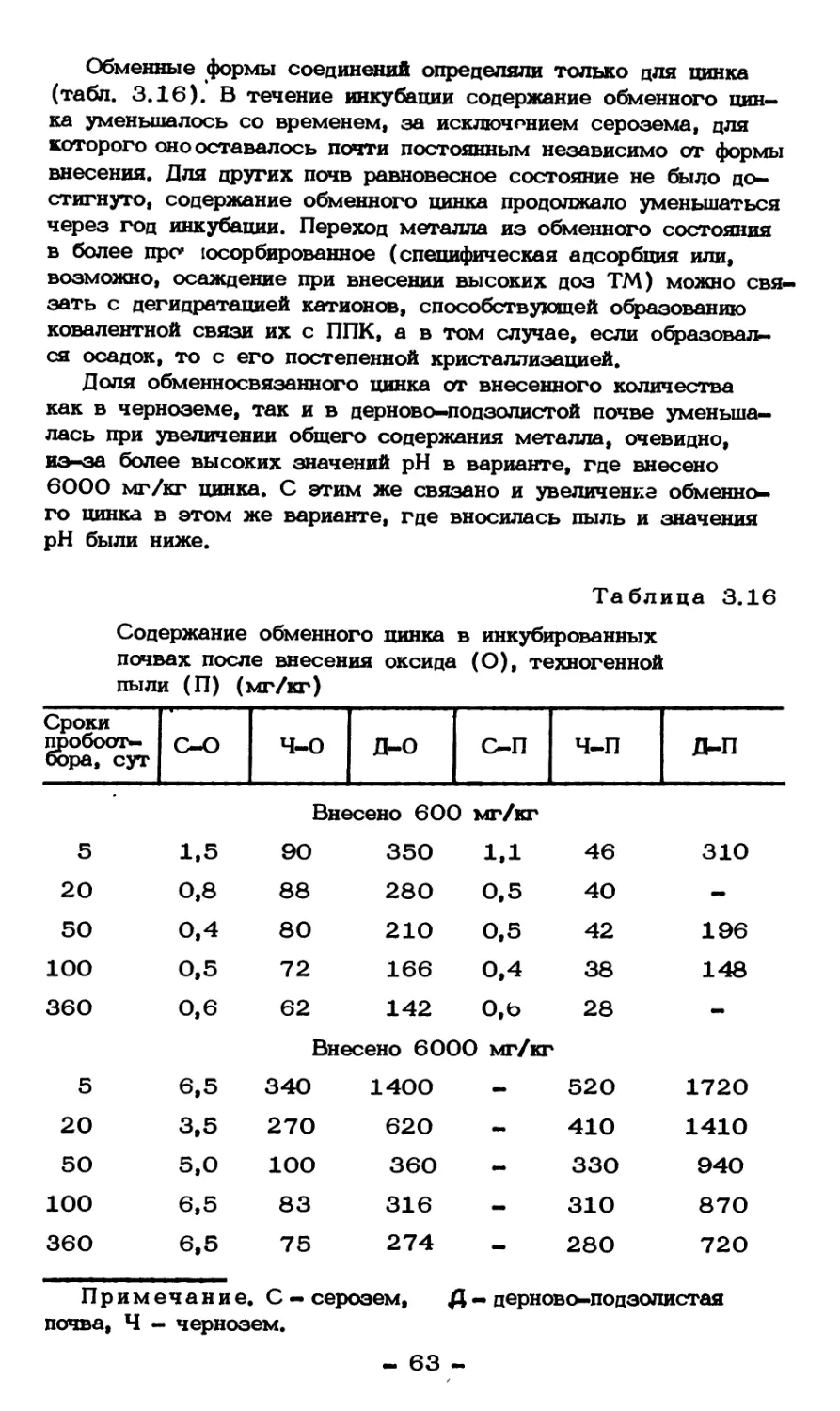
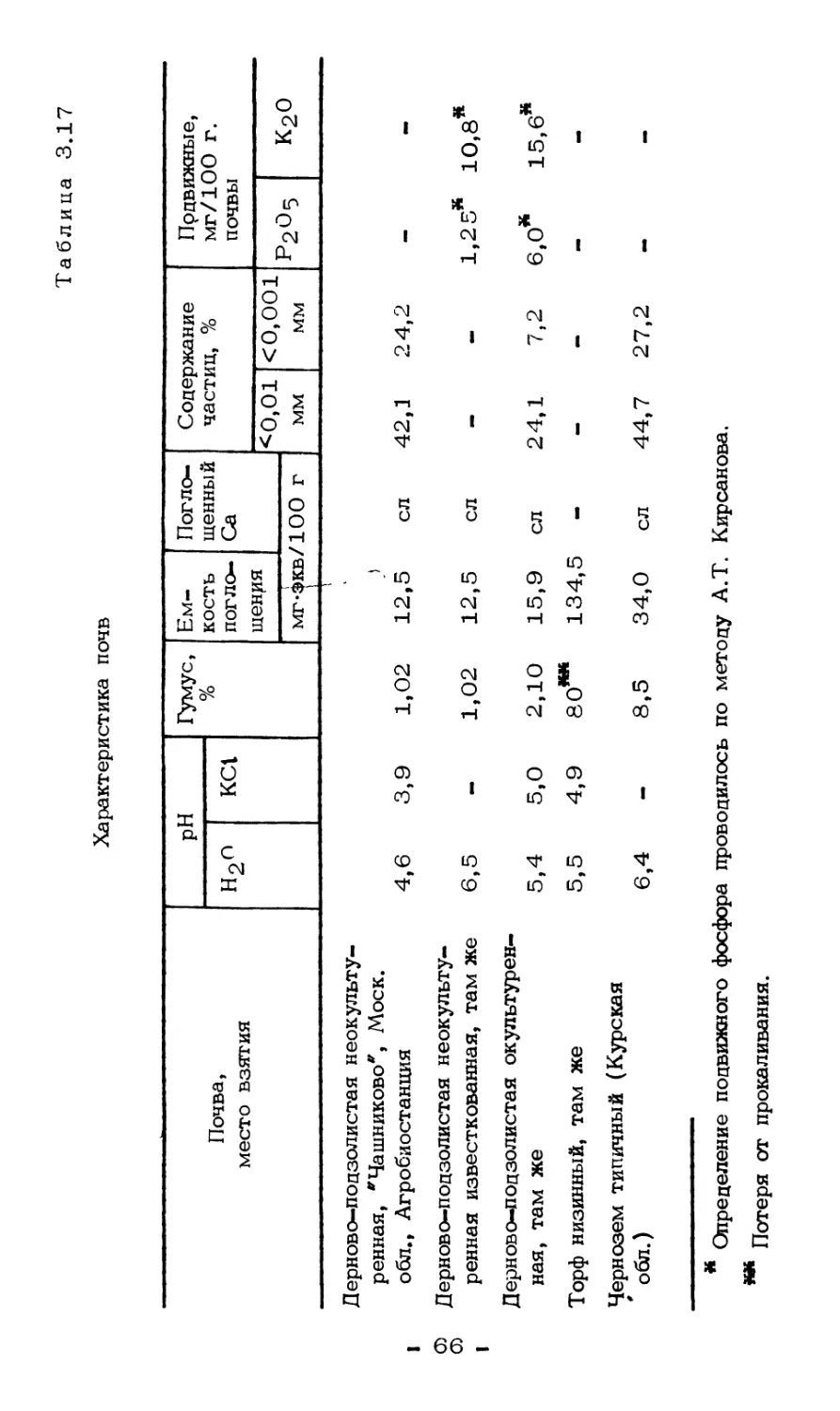
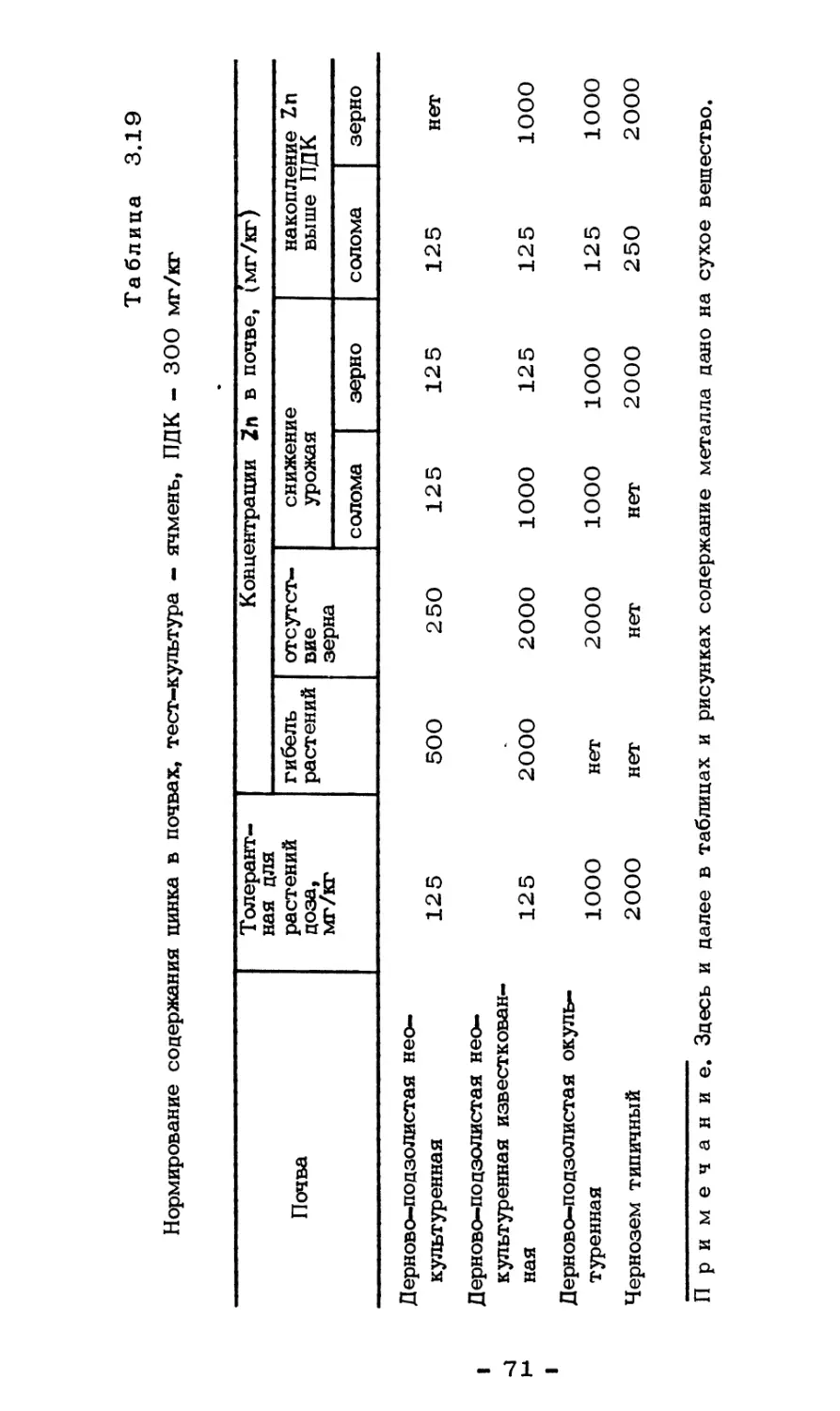
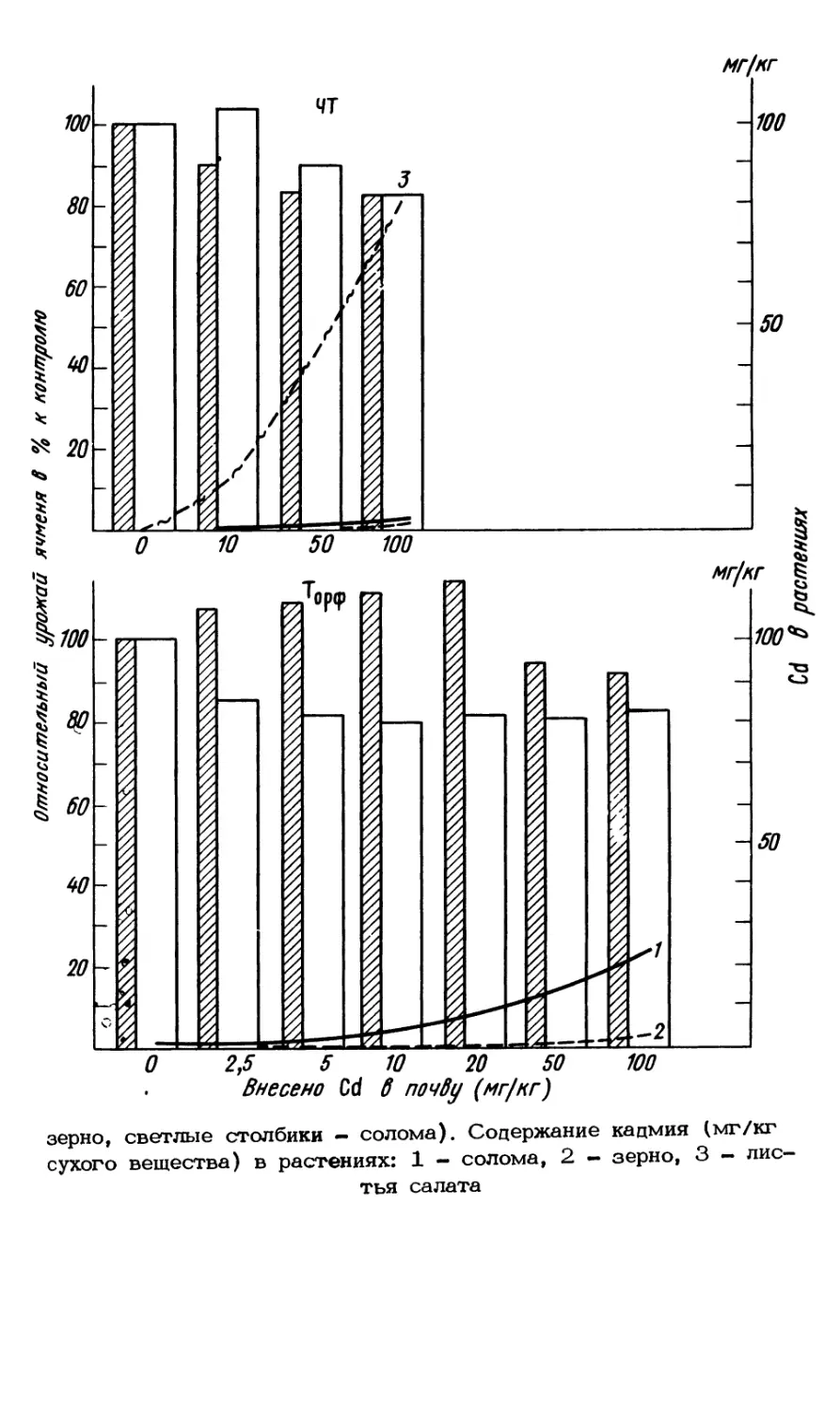
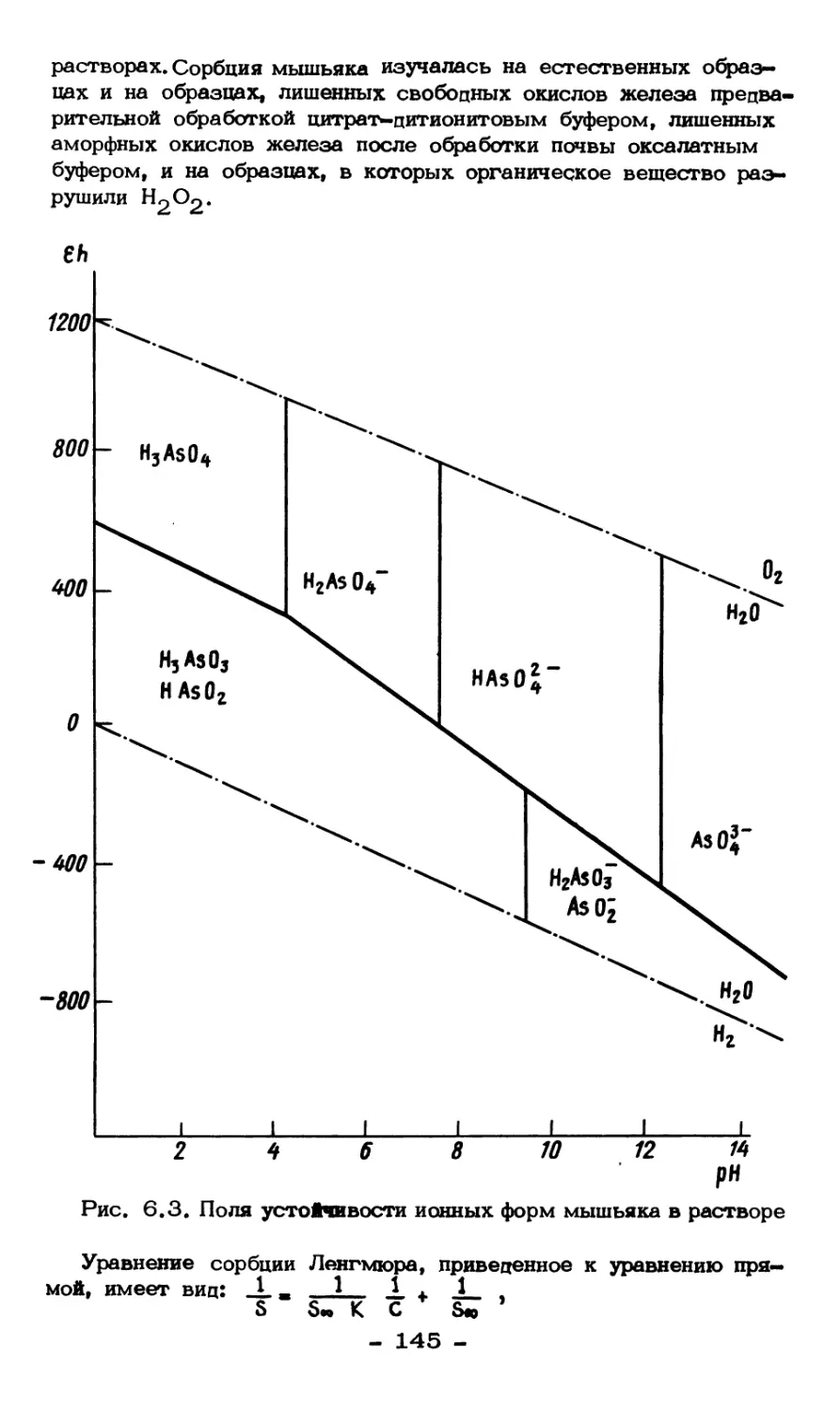
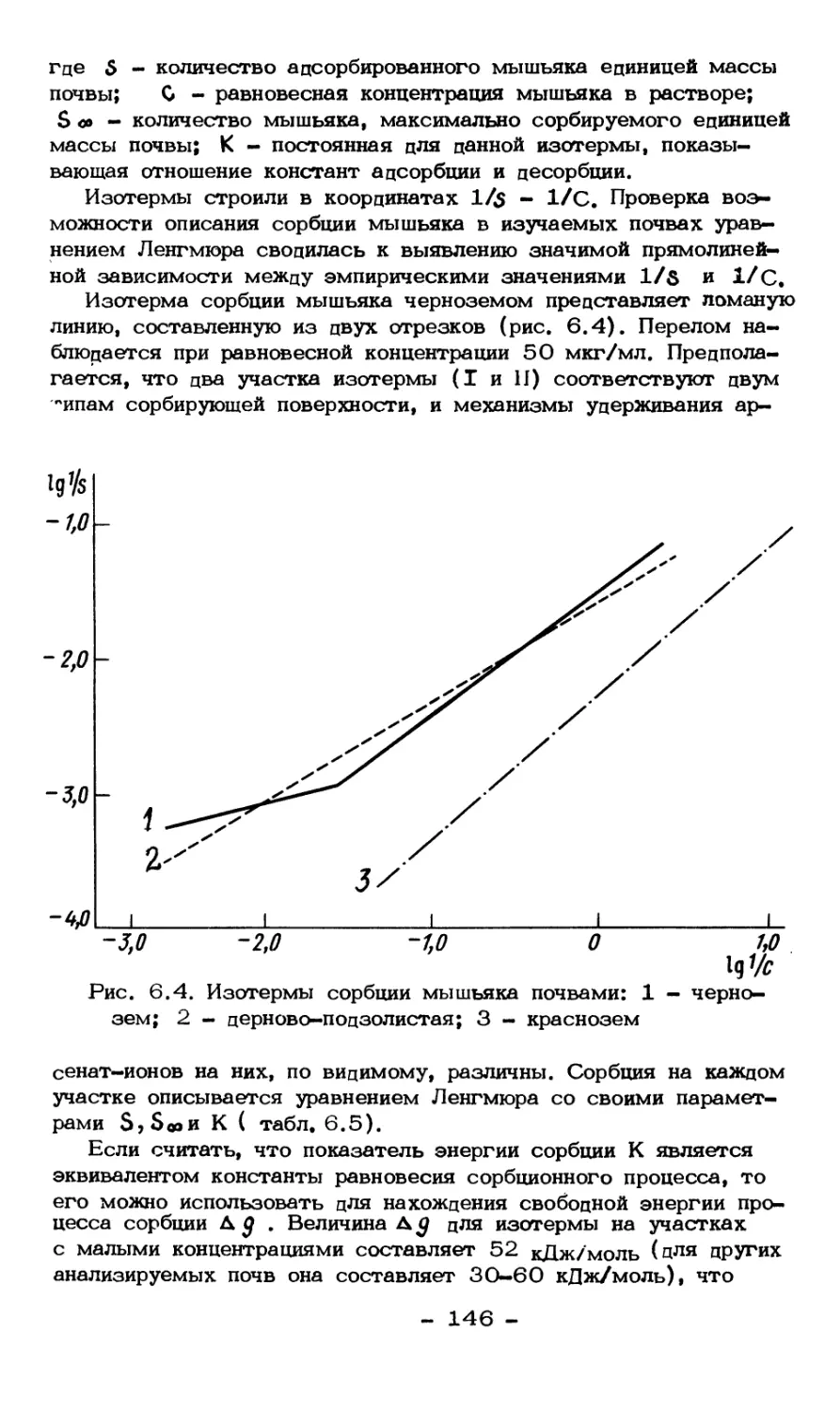
Текст
им
химия
ТЯЖЕЛЫХ
МЕТАЛЛ
шШшША
ОЛИЩЕНА
В ПОЧВАХ
_**Ц. ■ . ■_
ХИМИЯ ТЯЖЕЛЫХ МЕТАЛЛОВ,
МЫШЬЯКА И МОЛИБДЕНА
В ПОЧВАХ
Под редакцией
проф. Н.Г. Зырина
и канд. биол. наук Л* К. Садовниковой
Издательство
Московского университета
1985
УДК 631.82
Химия тяжелых металлов, мышьяка и молибдена в почвах
/Под ред. Н.Г. Зырина и Л.К. Садовниковой - М.: Иэд-во Моск.
ун-та, 1985 - 208 с, ил.
В книге содержатся обобщенные литературные данные и
результаты собственных исследований авторов, посвященные
закономерностям поведения тяжелых металлов и токсичных
элементов в почвах, ландшафтах и растениях, а также сведения по
нормированию содержания элементов и их соединений в почвах.
Для почвоведов, географов, экологов, биологов, работающих
в научно-исследовательских и производственных организациях,
а также для студентов вузов перечисленных специальностей.
Библиогр. 399 назв. Ил. 18.
Печатается по постановлению
Редакционно-издательского совета
Московского университета
Рецензенты:
канд. биол. наук В.А. Большаков,
канд. биол. наук Н.В. Стасюк
В написании глав и разделов коллективной монографии
принимали участие А#А.Алексеев /3/, В.С.Горбатов /3/,
Б.А.Звонарев /4/, Н.Г.Зырин /1-8/, Е.В.Каплунов /3,5/,
ЕА.Карпова /6/, М.С.Малинина/2,7/, Г.В.Мотузова /6/,
ВА.Надбжкин /2/, Т.Д.ОбуховсКая /4/, Л.К.Садовникова
/1,4,8/, А.В.Сердюкова /5/, В.Д.Симонов /5/, Л.СЯри-
лова /6/.
v 3802020000 -114 00 ал
х 077 (02) - 65 г* " tt4
ф Издательство Московского университета, 1985
1. ВВЕДЕНИЕ
Под химией тяжелых металлов, мышьяка и молибдена в
почвах в монографии понимаются все протекающие в почве
химические реакции и процессы с их участием, включая
физико-химические, коллоидно-химические, сорбцик^адгезию и окклюзию
катионов, анионов и чх соединений. Отдельными разделами в болышшст*-
ве глав включены описания опытов по трансформации вносимых
в разные почвы различных соединений тяжелых металлов и
потребление их растениями, нормированию содержаний элементов
в почвах, что связывает их педохимию с транслокацией
металлов в системе почва - растение.
Учение о микроэлементах является достижением нашего
века, хотя еще и ранее было известно о значении малых количеств
для растений ряда химических элементов, не признанных тогда
облигатными {18б]. Первое физиолого-биохимическое
обоснование роли марганца для растений Бертраном в оксидазной
системе показало общебиологическое значение и необходимость
этого элемента. Вскоре многочисленные экспериментальные
исследования доказали, что для роста и развития растений,
получения высоких урожаев сельскохозяйственных культур,
полноценных кормов и продуктов питания требуется обязательное присут*-
ствие в любой питательной среде, в том числе и почве,
достаточного количества, но в микроконцентрациях многих элементов
и в первую очередь В, Мп, Со, Си, Мо и J , последнего
особенно для животных и человека. Валовому содержанию и
подвижным соединениям этих элементов в почвах европейской
территории СССР посвящены две коллективные монографии,
изданные Московским университетом: 'Микроэлементы в почвах
СССР", вып. 1, 1973 и под тем же названием вып. 2, 1981.
Эпохальное значение в учении о биосфере, микроэлементах
имели работы В.И. Вернадского - создателя геохимии,
показавшего тесную химическую связь межцуЛсоставом организмов и
окружающей средой, роль биопроцессов в круговороте веществ
в биосфере и земной коре.
В своей классификации химических элементов В.И.
Вернадский выделил 44 элемента Периодической системы Д.И.
Менделеева в группу "циклических или органогенных", которые
составляют 47,82% от всех элементов Периодической системы,
- 3 -
» 2*10^^m, или 99,7% массы земной коры. Эта группа
элементов принимает активное участие в биологических процессах,
в нее входят все необходимые для растений и животных
элементы, в их числе тяжелые — черные - металлы группы железа и
цветные металлы Сы, Zti, Cd, Но, РЬ, а также неметаллы AS,
Mo.
Особенно плодотворное развитие идеи В.И. Вернадского
получили в работах А.П. Виноградова. Они дают основы
современному прогрессу, многим направлениям в науке и практике. Его
обширные и разносторонние исследования состава организмов и
определения в них широкого спектра элементов позволили
установить средний минеральный состав живого вещества и
классифицировать элементы на макро-, микро- и ультрамикроэлементы.
Терминология, предложенная А.П. Виноградовым, широко
использовалась в разных отраслях знания. Однако первоначальный ее
смысл, связанный с составом живого вещества, не
выдерживался, и термин 'микроэлементы* часто заменяли другими: 'следе—
вые' ( spuren )э 'малые* (minor )% 'редкие* и 'рассеянные*,
отражающие только концентрацию элемента. Нестрогое
использование терминологии в последнее время можно наблюдать и в
публикациях по охране природной среды.
Пожалуй, только в почвоведении, агрохимии, физиологии
растений, животных и человека, в медицине и ветеринарии
сохранилось предложенное А.П. Виноградовым и правильное
использование термина *микроэлемент* - как облигатный для живых
организмов химический элемент в микроколичествах. В агрохимии
и животноводстве многочисленные экспериментальные работы
позволили выявить в первом приближении оптимум, дефицит и
избыток, дисбаланс микроэлементов в почвах, растениях, кормах,
в организмах животных, наметить пути устранения негативных
влияний на организмы таких отклонений от нормального
содержания микроэлементов. Но при этом основное внимание было
обращено на естественные колебания содержаний
микроэлементов в почвах и организмах.
Химическая экология, основателем которой был А.П.
Виноградов, явилась новым направлением в биогеохимии.
Непосредственной задачей ее изучения стало влияние химии геосреды на
живые организмы. Параллельно развивалось другое направление -
геохимические методы поисков месторождений полезных
ископаемых, основанные на выявлении повышенных концентраций
химических элементов в ореолах их рассеяния и потоках.
В то время как в агрохимии и почвоведении основное внимание
обращалось на нативные концентрации микроэлементов в почвах,
растениях и применение микроудобрений, в геологии широко
исследовались территории с повышенными содержаниями металлов
в различных природных объектах, в том числе в' почвах,
материнских породах и растениях, в связи с литолого—геохимической
съемкой. Не забывались при этом вопросы состояния растений
- 4 -
и животных» здоровья человека в условиях геохимических
аномалий. Разрабатывались методы массового определения широкого
спектра элементов. В публикациях по геохимическим поискам
полезных ископаемых разные авторы использовали различную
терминологию групп элементов.
В конце 50-х особенно в 60-х гг. нашего века актуальными
вопросами стали локальное (импактное), региональное и
глобальное загрязнение биосферы многими токсическими при высокой
концентрации веществами, в том числе тяжелыми металлами и
неметаллами, поступающими в атмосферу с газопылевыми
выбросами промышленных и химических предприятий,
автотранспорта и авиации: в результате сжигания жидного и твердого
топлива, сброса сточных вод, бытовых отходов и их сжигания.
В объектах окружающей среды при локальном загрязнении,
например на территории вблизи предприятий и автодорог,
накапливается» в почве в П'10- П-100 раз и более элемента по
сравнению с содержанием его в почве природного ландшафта.
Такие содержания элементов нельзя относить к
микроконцентрациям. Целесообразно сохранить термин 'микроэлемент* в его
первоначальном понимании, а для экзогенных концентраций тех
же элементов использовать другое название, предложенное в
геохимической или промышленной классификации. Поэтому мы в
название предлагаемой читателю книги включили широко
распространенный термин 'тяжелые металлы' (ТМ) для Cu,2n, Cd9
На и Pb, a As и Mo - типичные халькофилы - называем
'неметаллами' (НМ). Считаем малоприемлемым причисление всех
этих элементов к 'токсическим', так как эти элементы
токсичны для живых организмов при определенной концентрации и
подвижности в окружающей среде.
Значительная доля веществ, загрязняющих природную среду,
попадает в почву. Почвенный покров служит мощным их
аккумулятором и практически не теряет их со временем. Особенно
прочно фиксируют тяжелые металлы и многие неметаллы вер&»
ние гумуссодержащие горизонты, т.е. наиболее плодородный
слой. Как показали наши и многие другие исследования, этот
слой, часто в пределах 0-20 см, прочно удерживает все
количество выпавших из атмосферы газопылевых выбросов или
поступающих в почву другими путями, например с пойменными и
оросительными водами. Загрязненная почва служит вторичным
источником загрязнения приземного воздуха (пыль), природных вод,
что приводит к потере качества питьевых вод, поступлению
высоких количеств ряда элементов в организмы животных и
человека.
Наземные биоценозы поставляют человечеству более 90%
продуктов питания, большую массу сырья для разнообразной
промышленности и быта людей. Основной базой и средством
производства при этом служит почвенный покров. Продукты питания
и корма для животных должны не только отвечать требованиям
- 5 -
по биохимическому составу, но и не содержать токсических
концентраций тяжелых металлов, халькофилов, неметаллов. Такие
продукты можно получить на почвах с нормальным содержанием
этих элементов. В почвах техногенных ландшафтов неизбежно
повышается содержание ряда полюантов. Одновременное и
многолетнее осаждение газовых ( S03t SO21 H2SQj?FtN0pH
газопылевых выбросов тяжелых металлов и других элементов может
приводить к полному уничтожению растительного покрова,
смыву почв и образованию 'техногенной* пустыни.
Почвы обладают буферностью к негативному влиянию
газопылевых выбросов, причем их устойчивость и способность
противостоять их влиянию, сохранять удовлетворительные
экологические условия для растительного покрова зависят от состава почв
и тем сильнее, чем выше содержание органических веществ,
тяжелее механический состав, больше емкость катионного
обмена, а в составе почвенно—поглощаюшего комплекса выше
содержание катионов щелочноземельных металлов (Са и Мл ).
Свободные карбонаты этих металлов, как и повышение рН
почвенного раствора, увеличивают буферную емкость почв.
Последняя является показателем активного воздействия почв
на соединения элементов, поступающих в почву, детоксикации
и трансформации их, перевода мобильных соединений в
труднорастворимые. В разных зонах и в разных типах почв эта
способность будет различна. От нее зависит, как показали описанные
в монографии модельные опыты, транслокация элементов из
почвы в растения, т.е. накопление в них концентраций тяжелых
металлов, ведущих к гибели растений, снижающих урожай зерна,
вегетатичной массы, к накоплению элементов выше их
предельно допустимых количеств в кормах и продуктах питания.
[ Трансформация соединений элементов в почве и потребление
металлов растениями являются сложной функцией, зависящей от
многих переменных состава почв, почвенно-экологических
условий роста и развития растений. Зависимость между составом
почв и их буферной емкостью, способностью к трансформации
поступающих в нее соединений элементов, модельные опыты с
выявлением скорости и направленности этих процессов
позволяют наметить пути детоксикации и рекультивации загрязненных
'больных* земель.
Групповой состав соединений многих элементов и особенно
тех, которые поступают в больших количествах в почву с
техногенными выбросами, мало изучен, а пути трансформации
соединений тяжелых металлов и халькофилов мало освещены в
литературе.
Предлагаемая книга является, пожалуй, первым опытом,
освещающим столь сложные вопросы химии ряда элементов в
почве. Надеемся, что она вызовет интерес у многих читателей и
критические замечания, которые принесут пользу авторам
монографии.
- 6 -
2. МЕДЬ
2.1. МЕДЬ В ПОЧВАХ И ПОРОДАХ
Медь относится к (Л-элементам I группы 4-го периода
Периодической системы элементов Л.И. Менделеева. Электронное
строение периферии атома: За
ю4$1
Один электрон
может переходить на внешнюю -оболочку, и полная
стабилизация 18-электронной структуры на третьем квантовом уровне
тогда не достигается, что позволяет элементу участвовать в
донорно—акцепторной связи. При возбуждении и в образовании
химической связи могуг участвовать 1 или 2 электрона,
проявляя при этом соответствующую валентность. Наиболее
характерно для меди состояние Cull. Трехвалентная медь неустойчива
и в природных условиях не встречается.
Общее содержание меди в земной коре сравнительно
невелико и не превышает 0,01% /26/. В почвах меди в 4-5 раз
меньше, 2* 10*"^%. Известно 170 медьсодержащих минералов, 17
используются в металлургической промышленности. В рудных
толах медь чаще всего встречается в виде сульфидов, ей
сопутствуют цинк, никель, свинец, мышьяк, серебро, золото, редкие и
рассеянные элементы и др. Некоторые медьсодержащие минералы
приведены в табл. 2.1. Медь может входить в качестве
изоморфной примеси в состав минералов. Она тяготеет к железомагнс-
зиальным минералам, замещая атомы в решетке минералов.
Способность ряда минералов к накоплению меди следующая: биотит >
гранат > плагиоклаз > гиперсген ^ оливин /127/.) Магнетит
FeO'Fe^C^ может иметь примесьСм *Fa2^4» в магнетит
изоморфно входит ряд микроэлементов, в том числе и Си ^+ /181/.
Пироксен содержит меди до 30 мг/кг, биотит - 40 мг/кг, гранат
25 мг/кг, плагиоклаз, оливин - до 150 мг/кг /13,187/.
Таблица 2.1.
Мець в составе минералов /13/
Минерал
Медь самородная
Борнит (пестрая медная руда)
Состав и содержание
меди (%)
"сЗ ~ —
Cu5FeS4 6з,3
- 7 -
Продолжение табл. 2.1
Минерал
Состав и содержание
меди (%)
CuFe S2
Cu2S
CuS
CuPbSbS3
Cu3SbS3
Cu3 As S3
Cu20
Си2[СОз] [ОН] 2
Cu3[C(b]2[OH|2
34,6
79,8
66,5
13,0
30-53
—
88,8
57,4
69,2
Халькопирит (медный колчедан)
Халькозин (медный блеск)
Ковеллин
Буранит
Тетраэдрит
Теннантит
Куприт
Малахит
Азурит
Наиболее высоким содержанием меди отличаются основные
изверженные породы, менее богаты кислые
массивно-кристаллические породы, мало меди в известняках, доломитах, валунных
суглинках и особенно в песках. К факторам, увеличивающим
содержание меди в почве, относятся: высокое содержание
минералов тяжелой фракции и глинистых минералов, тяжелый
механический состав, богатство коллоидами, наличие органического
вещества.
Медь в почвах находится в различных соединениях. А.П.
Виноградов /26/ выделил следующие формы соединений элементов
в почве, включая и медь: 1) водорастворимые соли; 2) обмен-
нопоглощенные ионы; 3) медь, связанную с органическим веществ
вом почвы (органические соединения меди - солеобразные и
комплексные, включая хелатные); 4) медь, находящуюся в решетке
алюмосиликатов и других минералов.
Микроэлементы в твердой фазе почвы представлены
следующими соединениями: 1) ионообменными формами тонко дисперсных
глинистых минералов, карбонатов и оксидов, гуминовых
соединений; 2) прочнофиксированными микроэлементами в
кристаллической решетке тонкодисперсных глинистых минералов, в оксидах
железа, алюминия, коагелях их с кремневой кислотой, в форме
комплексных хелатных труднорастворимых соединений с гуми-
новыми веществами; 3) микроэлементами первичных минералов;
4) оксидами, гидроксидами, труднорастворимыми солями
микроэлементов /53/.
За средней величиной скрываются большие колебания
концентраций валовой меди (табл. 2.2), что говорит о большом
разнообразии в содержании этого элемента в различных почвах.
Имеются противоречивые данные о влиянии
почвообразовательного процесса на распределение меди в минеральном субст*-
рате. В подзолистых и серых лесных почвах отмечены вынос
меди из горизонта А2 и накопление ее в иллювиальной толще /26,
115/. Профиль черноземов характеризуется более или менее
равномерным распределением меди по горизонтам. Есть
довольно большое количество работ, свидетельствующих о биогенном
- 8 -
накоплении меди /61, 26, 35/. В почвах Белоруссии,
напротив, не отмечено приуроченности меди к горизонту А^, четкой
связи между количеством меди и содержанием в почве гумуса
нет /92/.
Таблица 2.2
Содержание валовой меди (мг/кг) в почвах
Советского Союза /77/
Почвы
Соде]
ние
^ржа-
Пределы
колебаний
Число
определений
Почвы тундры
Дерново-подзолистые
Серые лесные
Черноземы
Каштановые
Сероземы
Засоленные
Красноземы и
желтоземы
Болотные
Торфяник верховой
Дерново-карбонатные
Прибалтики
9
15
15
30
10
11
27
76
11
3
5
2-23
0,1-47,9
5-38
7-18
0,6-20
5-20
4-42
27-140
2-37
1-5
1,2^-18,5
8
29
10
26
8
11
7
9
57
12
31
Во многих исследованиях отмечено перемещение меди в глубь
почвенного профиля. Возможности биогенного накопления меди
в почвах не одинаковые. Элемент больше аккумулируется в
хорошо гумусированной и незатронутой элювиальным процессом
почве по сравнению со слабогумусированной и подвергающейся
оподзоливанию, лессивированию, осолодению и др. В почвах, где
представлены оба процесса (аккумулятивный и элювиальный),
результирующий эффект от бионакопления и элювиальных потерь
очень часто бывает отрицательным, свидетельствуя об обеднении
медью верхней части профиля /62/. Элювиальный процесс
вызывает перемещение тонко дисперсных частиц, содержащих медь,
вниз по профилю, способствуя обогащению иллювиального слоя.
Чем ярче выражен подзолистый процесс, тем больше разница в
содержании меди между горизонтами А и В подзолистых почв.
Аналогично перемещение меди при формировании осолоделых и
солонцеватых почв. В почвах полугидроморфного и гидроморфно-
го ряда микроэлементный профиль усложняется процессами
гидрогенной аккумуляции меци из почвенно-грунтовых вод. В под-
анпистс-глеевых почвах обычно повышенное содержание меди
приурочено к глеевым горизонтам, в солончаках - к солевым
/191, 192/, В илистой фракции почв сосредоточен основной
- 9 -
запас меди, на ее долю приходится до 60-80% общего
количества элемента в почве. Содержание меди в илистой фракции
меняется более четко, чем в почве, и отражает влияние процесса
почвообразования.
Водорастворимая медь представлена солями двухвалентной
меди: хлоридами, нитратами, сульфатами и комплексными орга-
но-минеральными и минеральными соединениями /158, 240/.
Си присутствует не только в окислительной, но и в
восстановительной обстановках (в частности, в кислых болотных почвах),
поскольку для перехода в Си + требуются низкие значения
окислительно—восстановительного потенциала. Нормальный
окислительно-восстановительный потенциал Си +g S Си =0,167 В.
Комплексные соединения меди образуются в широком интервале
рН. Растворимые комплексы медь образует с фульвокислотами,
а также при взаимодействии карбонатов меди с содовым
раствором. В почвах содержится менее 1% водорастворимой меди от
валового количества элемента /26/. В торфяных почвах на долю
этой фракции приходится 2,1-2,7% /100/. Концентрация меди в
почвенном растворе, выделенном из карбонатных почв штата
Колорадо (США), составляет 0,005-0,016 мкг/мл, причем
98 % этой фракции находится в форме комплексов с
органическими веществами /275/. В сероземах Голодной степи
обнаружена водорастворимая медь в количествах от 5,6 до 11,4%
общего содержания меди /82/. По А.П. Виноградову /26/, особенно
мало водорастворимой меди в кислых почвах, так как она,
вероятно, при рН < 4,5-5,0 из твердой фазы легко переходит в
растворы и вымывается. При рН выше 4,5 кроме Cu^t CuOH+
возможно появление Cu(OH)2t CUHPO4 и CuS , когда
присутствует S ^—. Последние соединения малоподвижны и фиксируются
почвой. рН осаждения Си(ОН)2 - 5,4-6,1 и зависит от
концентрации элемента в растворе. Растворимость Сц(ОН)2 - 2,34х
Х10-6 г/100 мл /14/. Наличие карбоната кальция является
весьма важным фактором, определяющим закрепление меди в
торфе и почве, хотя растворимость СиСОз не так мала -
1.69-1СГ4 г/100 мл /5/.
Содержание в почве ионообменной, мади мало изучено /62/.
Видимо, доля обменной меди в почве не очень велика, хотя в
отдельных случаях и может достигать значительной величины;
в одном килограмме илистого субстрата в природных условиях
содержалось от 0,1 до 12 мг обменной меди, или 0,25-25%
ее общего количества /90/. В раствор CuSO^ из
поверхностных горизонтов почв штата Миннесота переходило 35-70%
общего содержания элемента. Эту фракцию, очевидно, включающую
водорастворимую медь, авторы назвали диффундирующей /287/.
Органическое вещество может связывать металлы путем
адсорбции, ионного обмена и комплексообразования, включая
внутренние комплексы - хелаты, не исключено и совместное
осаждение гидроксидов металлов с гуминовыми кислотами. Содержа-
- 10 -
ние меди в органическом веществе различных почв довольно
сильно колеблется. Для дерново-подзолистых почв размах
колебаний содержания меди составляет от О до 100% от валового
содержания /183/, или 1-10% /46/. Среднее содержание - 13%,
причем на илистую фракцию приходится до 40% от содержания
меди в почве /160/. В органическом веществе черноземов и
каштановых почв находили 33-50% меди от валового содержания
/147, 160/. Прочность органо-минеральных. соединений меди
выше, чем у Мп, Мо и В, но ниже, чем у Хп . Установлено,
что в гуминовых кислотах основных типов почв СССР
концентрация меди изменяется в пределах 430-650 мг/кг абсолютно
сухого препарата гуминовой кислоты /А/.-
По Н.Г. Зырину /60/, гетерополярные соли представляют гу-
маты и фульваты, которые образуются в результате обменных
реакций при взаимодействии гуминовых кислот и фульвокисло! с
катионами оснований. Медь может вступать в реакции в вице
двухвалентных ионов (Си ) и комплексных одновалентных ионов
(СиОН ). В условиях кислой и нейтральной среды в реакции
участвует водород карбоксильной группы, в щелочной - феноль-
ной и спиртовой групп. Ионы тяжелых металлов образуют
соединения с целым рядом органических веществ: цитратами, оксала-
тами, аминокислотами, гуминовыми кислотами и фульвокислота-
ми. Наиболее прочные комплексные соединения с почвенными
органическими веществами медь способна образовывать с
гуминовыми кислотами при рН 2,5-3,5,с фульвокислотами при рН 6
/100/. Поэтому возможна миграция меди в составе низкополи-
меризованных гумусовых кислот и аккумуляция элемента при
осаждении нерастворимых гуматов и фульватов. При разных рН
отрицательные десятичные логарифмы констант устойчивости
меди с гуминовой кислотой составляют от 2,5 до 7,9.
Прочность адсорбции увеличивается с возрастанием степени
гумификации. Некоторые авторы /352/ полагают, что в почвах,
богатых органическим веществом и отличающихся небольшой емкостью
поглощения минеральной части, медь связывается
преимущественно в форму гумата. Р. Митчелл /323/ располагает элементы по
энергии поглощения их глинами в следующий ряд: Си^+ > РЬ^+
>Ni > Co2+>Zn2+> Са2+. Медь связывается монтоморил-
лонитовыми глинами и сильно гумусированными почвами прочнее,
чем Са и Mg ^ . Но даже при очень низких степенях
насыщения (0,1% от емкости обмена) медь бентонитовых глин доступна
растениям /243/. Каолинит при рН 5 поглощает больше меди,
чем кальция, монтмориллонит- одинаковые количества элементов.
С возрастанием концентрации меди в растворах поглощение ее
почвой возрастает. При повышении рН связывание меди почвой
усиливается не только за счет обменных реакций, но и за счет
осаждения меди в виде гидроксида, не способного растворяться
в щелочных условиях /324/. В структуре монтмориллонита
имеются специфические обменные места для меди. Сорбция меди
- 11 -
и цинка осуществляется за счет замещения иона Н+ гидроксила
в алюмогидроксильных октаэдрах глинистых минералов с
образованием связи типа - Си — О - А^ -. Часть меди фиксируется
глинистыми минералами необратимо. Это явление связывают с
проникновением катионов микроэлемента внутрь решетки монт*-
мориллонита, иллита с замещением ими алюминия в октаэдри-
ческих слоях /323/. Подобное закрепление обусловлено
образованием комплексных ионов металлов типа СиОН или CuCl+ и
осаждением их внутри или на поверхности глинистой структуры.
Фиксация меди и цинка монтмориллонитом объясняется
осаждением гидроксидов элементов внутри и на поверхности
кристаллов, а при рН, препятствующем их осаждению (рН ^4), —
заменой иона Н+ минерала на двухвалентные ионы (Ме2+) и
одновалентные ионы типа МеХ+, где X - анионы С\~9 CH3COCF",
ОН". Ионная сорбция каолинитом очень мала и почти
необратима /205/.
Медь из разбавленных водных растворов поглощается
минеральными почвами по ионообменному механизму с высокими
константами обмена. Условная зарядность иона меди показывает,
что поглощение происходит в форме сложных гидроксс—аквакомп-
лексных ионов. Почвы, богатые органическими веществами,
поглощают медь хемосорбционно. Наибольшее количество ее (~709ф
связано с фракцией фульвокислот /67/. Почвенная глинистая
фракция сорбирует микроэлементы в 3-4 раза больше, чем
чистые глинистые минералы, благодаря присутствию органического
вещества /338/. Микроэлементы, сорбированные иллитом и
каолинитом, менее подвижны, чем фиксированные монтмориллонитом.
Повышенная способность каолинита фиксировать медь связана с
тем, что на 50% элемент сорбируется в виде иона и
гицратированный ион меди удерживается в наибольшем количест*-
ве каолинитом. Ион Си оказывается в шестерной координации,
три гидроксильных иона притягиваются им из воды, три других
принадлежат кристаллу каолинита, на обнаженной поверхности
которого фиксируется элемент /320/. При обычном
механическом анализе вместе с глинистыми минералами в илистой
фракции оказывается много оксидов железа /373/. Р. Митчелл
/323/ обнаружил, что в экстракте кислого оксалата аммония,
в который переходило около 5% всей массы образца,
содержалось 50% меди и других микроэлементов. По П.В. Елпатьевско-
му /44/, гидроксидами удерживается 33% меди. Адсорбция
происходит на участках поверхности с некомпенсированными
валентными силами, появление которых часто обусловлено
дефектами кристаллической решетки. Адсорбция меди на гетите
осуществляется за счет обмена на ионы, находящиеся на поверх^
ности гетита /262/. Поглощение начинается с рН 3 и с
повышением рН увеличивается. Предполагается, что медь
сорбируется предпочтительно на тонкодисперсном материале. Позднее
окклюзия меди внутри агрегатов, образованных гидроксидами или
- 12 -
оксидами железа, даже магнетитом, приводит к малой
подвижности элемента в почвах, богатых железом.
Н.П. Вардья с соавторами /19/ изучали сорбцию и
десорбцию меди почвенными образцами, взятыми из разных
генетических горизонтов супесчаной и суглинистой дерново-подзолистых
почв. Содержание и поглощение меди почвой зависело от
механического состава почвы и содержания органического вещества.
На суглинистых почвах сорбция проявлялась сильнее, а
десорбция слабее, чем на супесчаных. 82% меди закреплялось
органическим веществом почвы. Также была изучена сорбция меди
естественными почвами разного состава и переведенными в Н -
и Са - форму /383/. Почвы приводили в равновесие с
растворами 0,05 М СаС1 2» содержащими 0-20 мг/л Си. По
уравнению Ленгмюра рассчитывали максимальную специфическую
сорбцию ( а ) и показатель энергии связи (b ), показатель
неспецифической адсорбции находили по емкости катионного
обмена (ЕКО). Н+ и Са почвы сорбируют меньше меди, чем
почвы в естественном состоянии. Показатели а и Ь имеют
максимальное значение в аллювиальных почвах, минимальное — в
красных почвах. Неспецифическая адсорбция связана обратной
зависимостью с рН, имеет максимальное значение в торфяных почвах,
минимальное - в аллювиальных.
Для извлечения подвижных форм соединений меди используют
различные реагенты. В результате даже при анализе одной и
той же почвы получаются разные результаты. Довольно пестрая
картина в содержании подвижной меди наблюдается при
исследовании черноземных почв. Пределы колебаний подвижной меди в
в почвах СССР достигают широкого диапазона (табл. 2.3.).
Таблица 2.3
Содержание подвижной меди в гор. Апах почв СССР
(в 1н. HCI ) /69, 117, 62, 53, 74, 92/
Почвы
Медь
Район
песчаная
супесчаная
суглинистая
1Д
1.8
3,0-5,4
Брянская обл.
Московская обл.
Московская обл.
Дерново—подзолистая
Дерново-подзолистая
Серая лесная
0,5-6,7 Калининская обл.
Латвийской ССР
2,2 УССР
1.5 БССР
9.6 Карельская АССР
6,6-7,8 Горьковская,
Калужская обл.
- 13 -
Продолжение табл. 2.3
Почвы
Черноземы
чернозем мощный
черноземы
чернозем предкавказ-
ский
чернозем
чернозем солонцеватый
Каштановые
Бурые пустынные
Сероземы
Почвы таежно-лесной
нечерноземной зоны
Красноземы
Торфяно-глеевая
Торфянисто-дерново-гле—
евая
Дерново-подзолистая
Коричневая
Чернозем мощный
Южный карбонатный
чернозем
Серозем
Дерново-подзолистая
на мощных песках:
пашня
лес
Медь
4,5-10
4,1-4,2
30-50
6,5
4,6-8,8
4,6
8-14
6-12
2,5-10
0,11-11
7,4
2,0
8,6
1,92
5,54
3,10
8,2
1.6
0,8
0,6
Район
Центр и юг СССР
Курская обл.
Алтай
Сев. Осетия
Молдавская ССР
Барабинская низм.
я »
» ж
Ср. Азия и Казахстан
я *
Анасеули ГССР
Карельская АССР
Амурская с.-х.
опытная станция
Крым
и
я
т
ш
Белорусская ССР
ш г
Дерново-подзолиста я:
песчаная с близким
уровнем почвенно-грун-
товых вод
Дерново-подзолистая
супесчаная
заболачиваемая
Песчанисто-легкосуглинистая
Пылевато-легкосугли-
нистая
0,76
1,00
0,87-1,11
1,00-1,23
- 14 -
Продолжение табл. 2.3
Почвы
Медь
Район
Дерново-подзолистая
пылевато-легкосугли-
нистая на мощных
лёссовых и
лёссовидных суглинках
Торфяно-болотная
низинного типа
1,65
3,50
Белорусская ССР
Количество наиболее важной в сельскохозяйственном отношении
фракции меди - подвижной, как свидетельствуют работы многих
авторов, сильно отличается не только в разных по генезису,
но и в родственных почвах. Выявлено, что среднее содержание
подвижной меди в почвообразуюших породах различных почв
Дагестана составляет 0,34 мг/кг, в песчаных отложениях -
0,1 мг/кг /149/. Среди почвообразующих пород наибольшее
количество подвижной меди обнаружено в суглинистых породах,
на которых формировались солончаки (0,48 мг/кг). Все
исследованные почвообразующие породы бедны подвижной медью. На
96% территории содержится менее 1 мг/кг почвы подвижной
меди, что свидетельствует о высоком дефиците подвижной меди
в почвах данного региона и заставляет применять медные
удобрения. Почвы легкого механического состава сильно нуждаются
в применении медных удобрений, а легкосуглинистые почвы
средне нуждаются, что и необходимо учитывать при внесении
медных удобрений /153/. Установлена положительная
корреляция между содержанием доступных форм Си и содержанием
илистой фракции, гумуса и величиной pHj^ci /237/.
Сведения о распределении общего количества и форм
соединений микроэлементов в почвах необходимы прежде всего для
рационального и эффективного применения микроудобрений,
решения вопросов медицинской и ветеринарной географии /54/
(табл. 2.4).
Таблица 2.4
Градации обеспеченности почв медью /54/
Обеспеченность
Содержание меди в почве, мг/кг
lH.HCi
ацетатно-аммоний-
ный буфер, рН 4,8
1-я группа растений (невысокого выноса
микроэлементов)
Низкая
Средняя
Высокая
0,5
0,5-1,5
1.5
ОД
0,1-0,2
0,2
Продолжение табл. 2.4
Обеспеченность
Содержание меди в почве, мг/кг
1н.НС1
ацетатно-аммоний-
ный буфер, рН 4,8
2-я группа растений (повышенного выноса
микроэлементов)
Низкая 2 0,2
Средняя 2-4 0,2-0,5
Высокая 4 0,5
3-я группа растений (высокого выноса
микроэлементов)
Низкая 5 0,5
Средняя 5-7 0,5-1,0
Высокая 7 1,0
2.2. МЕДЬ В ГИДРОСФЕРЕ
Природные воды в отличие от химически чистой воды
представляют сложный раствор различных веществ. Существенного
различия в содержании микроэлементов в водах различных
классов химического состава не наблюдается. Как правило,
значительно возрастает количество веществ, переносимых во
взвешенном состоянии в реках сульфатного и гидрокарбонатно-суль-
фатного классов.
Среднее содержание меди в гидросфере 3*10~'%, причем в
речных водах ее содержание незначительно отличается от вод
океана - 5» 10""^%. Содержание меди в воде главных рек СССР
и вынос ими элемента представлены в табл. 2.5. Наибольшее
количество меди приурочено к болотным и пойменным почвам
Московской и Псковской областей - 20 мкг/л; немногим
меньше содержится в почвенно—грунтовых водах, приуроченных к
зоне засоленных почв Западной Сибири, - 14 мкг/л; в болотных
почвах Западной Сибири почвенно-грунтовые воды несут малое
количество меди - 5 мкг/л, так же как и воды района
черноземов Казахстана. В геохимической классификации элементов
по особенности миграции в ландшафтах /121/ медь занимает
положение в группе элементов, подвижных и слабоподвижных в
окислительной и глеевой обстановках (Кх - О,п-п ) и
инертных в восстановительной сероводородной обстановке (Кх<0,п).
Кроме меди в эту группу входят Zn,Ni,Pb,Cd.OHH осаждаются
на сероводородном барьере, хорошо мигрируют в кислых водах
окислительной1 и даже не имеющей S 2- глеевой обстановки и
- 16 -
осаждаются на щелочном барьере, причем для меди и цинка
биогенное накопление играет существенную роль в судьбе элемента.
В почвах гидроморфного ряда вместе с почвенно-грунтовыми
водами приносится добавочное количество элемента. Медь
накапливается в результате гидрогенной аккумуляции в луговых,
болотных и полуболотных почвах таежной зоны, причем в глеевом
горизонте дерново-глеевой оподзоленной почвы ее содержится
в 4 раза больше, чем в горизонте A-^t в глеево-поцзолистой -
в 2,2 раза /191/. В местах, где на коротком расстоянии
кислая среда сменяется щелочной, возникает щелочной барьер, на
котором концентрируется медь. Очень характерны щелочные
барьеры для зоны окисления сульфидных руд в известняках.
Здесь сернокислые растворы, образующиеся при окислении
пирита, нейтрализуются известняками; в результате на щелочном
барьере происходит ожелезнение, осаждение малахита, азурита
и других карбонатов меди, а также свинца и цинка. Медь
накапливается и на сорбционном барьере, поглощается
отрицательно заряженными коллоидами. В лесной и лесостепной зонах
умеренных широт, а также во влажных тропиках и субтропиках
широко распространены коллоидные гидроксиды марганца, в
которых нередко обнаруживаются медь и другие катионы
микроэлементов. В таежных и других ландшафтах влажного климата
медь сравнительно легко выщелачивается из кислых почв, здесь
местами наблюдаются дефицит меди и связанные с ним болезни
растений и животных. В степях и пустынях с характерными для
них слабощелочными растворами медь малоподвижна.
В реках медь в основном мигрирует в адсорбированном
состоянии на глинистых и гумусовых частицах /61 /. Медь более
подвижна в кислой и слабокислой среде и менее подвижна в
нейтральной и щелочной. Миграция меди осуществляется также в
ионной форме в составе легкорастворимых солей минеральных
кислот в виде хлоридов, нитратов, сульфатов /118, 161/,
возможно в виде взвеси обломков сульфидов и других минералов.
Таблица 2.5
Медь в воде рек и вынос ее главнейшими реками СССР
/80/
Река, бассейн
Медь,
мкг/л
Вынос,
т/год
.Западная Двина (г.Плявинас)
Днепр (г. Берислав)
1он (г. Аксай)
Кура (г. Сальяны)
Сырдарья (г. Казалинск)
Обь (г. Салехард)
97,8
12,1
5,2
6,6
14,1
21,2
нет данных
т ш
* V
* »
If U
т ш
- 17 -
Продолжение табл. 2.5-
Река, бассейн
Бассейн Балтийского моря
Бассейн Черного и Азовского
морей
Бассейн Арало-Каспийского
моря
Бассейн Баренцева и Белого
морей
Бассейн Тихого океана
Медь,
мкг/л
-
_
—
шт
шш
Вынос,
т/год
3340
1370
1900
2830
7110
В зоне гипергенеза во влажном климате с мощным развитием
растительного и почвенного покрова важная роль принадлежит
миграции элемента в форме органо-мин ера льны х комплексных
соединений, легкорастворимых солей органических кислот
(лимонной, уксусной, щавелевой и др.) /118/. Миграция меди
зависит от окислительно-восстановительных условий, что связано
с неодинаковыми свойствами соединений меди различной
валентности. Соединения, в которых медь формально одновалентна,
малорастворимы. Соединения Си^+ характеризуются различной, но
более высокой растворимостью в зависимости от анионного
состава раствора. Сульфаты меди легкорастворимы, поэтому медь
передвигается преимущественно в форме сульфатов, которые в
благоприятных условиях переходят в основные карбонаты меди
/190/. Накопление меди в осадках происходит в виде
коллоидной взвеси карбонатов меди.
Для обширных водных бассейнов характерна четкая
гранулометрическая сортировка материала. Поскольку миграция меди
осуществляется преимущественно в адсорбированном состоянии
тонкодисперсной взвесью, тс наибольшая ее концентрация
приурочена к глубоководным центральным частям. Это справедливо
как для пресных, так и для морских водоемов. Медь,
адсорбированная гелями железа, марганца и др., частично вовлекается
в биологический круговорот, поступая при отмирании организмов
в коллоидальные осадки. Среди живых организмов морей и
океанов известны концентраторы меди. По В.И. Вернадскому /23/,
в морских организмах происходит концентрирование меди в ГО^
раз по сравнению с содержанием меди в воде.
2.3. МЕДЬ В СИСТЕМЕ ПОЧВА - РАСТЕНИЕ
О необходимости меди для растений ученые впервые пришли
к выводу в начале 30-х гг. нашего столетия. В настоящее вре-
- 18 -
мя твердо установлено, что медь необходима для жизни всех
растительных и животных организмов и не может быть
заменена каким-либо другим элементом или суммой их /69/.
Количество меди в растениях колеблется от 0,5 до 30 мг/кг
сухого вещества, но может достигать 100 мг/кг /74/. По
Я.В. Пейве /116/, в среднем содержание меди в растениях
составляет: в зерне пшеницы, ячменя, кукурузы-3,0 - 6,0 мг, в
соломе злаков - 2,0-6,0, в сене бобовых - 5,0-6,0, в корнях
сахарной свеклы - 5,0-7,0, в листьях сахарной свеклы - 4,0-
7,0 мг.
По А.В. Виноградову, среднее содержание меди в составе
живого вещества составляет 2*10~4%. Содержание меди в
растениях, как и всякого другого элемента, зависит прежде всего
от видовых особенностей растения, а также от почвенных
условий. При недостатке меди нижние листья и другие органы
содержат ее больше, чем верхние; растения при этом не
мобилизуют медь из нижних органов для построения верхних листьев
/28/. Содержание меди зависит от условий произрастания
(табл. 2.6). Разные сельскохозяйственные культуры значительно
различаются между собой по содержанию меди. Содержание
меди в растениях, выращенных на дерново-подзолистой почве,
значительно выше, чем у растений на черноземе.
Таблица 2.6
Содержание меди (в мг/кг воздушно-сухого вещества)
в некоторых сельскохозяйственных культурах /69/
Растения
Ячмень:
зерно
солома
Овес:
зерно
солома
Вика яровая, сено
Пшеница яровая, зерно
Фасоль:
семена
солома
Подсолнечник:
семена
стебли, листья
В растениях
на мощном
черноземе
5,7
3,8
3,6
3,7
4,7
5,2
8,5
5,4
8,1
3,4
В растениях
на дерново-
подзолистой
суглинистой
почве
7,2
в9в
5,8
7,5
12,2
-
-
-
-
—
П,Р9Д9Дге«ие табл,2.6
Растения
В растениях
на мощном
черноземе
В растениях
на дерново-
подзолистой
суглинистой
почве
Лен:
семена
солома
Клевер, сено
Люпин желтый,
зеленая масса
Картофель:
клубни
ботва
Свекла кормовая:
корни
листья
Свекла сахарная:
корни
листья
Свекла полусахарная:
корни
листья
Капуста, кочны
Горчица:
Семена
солома
-
-
-
-
-
-
7,5
6,4
6,5
6,9
-
-
-
-
—
20,5
7,7
14,7
18,0
6,0
18,0
6,5
8,3
6,4
8,4
5,8
8,0
7,3
Наименьшее поступление меди в растения наблюдается на
торфянистых почвах; затем в возрастающем порядке идут
чернозем, серозем, известкованные дерново-подзолистые и,
наконец, неизвесткованные дерново-подзолистые почвы.
Вунш и др. /397/ изучали поглощение тяжелых металлов
различными культурными растениями при использовании в
вегетационном опыте почв с высоким содержанием меди.
Тяжелосуглинистые почвы с рН 4,9 и содержанием меди 579 мг/кг
известковали до рН 5,8 и 6t6f высевали различные растения
(ячмень, овес, фасоль и др.) и определяли содержание металла
в почве и в расгениях. На неизвесткованной почве растения
содержали 15-82 мг/кг меди. После известкования содержание
меди в растениях снижалось до 8-59 мг/кг. При этом в
биомассе возрастала доля железа в сумме тяжелых металлов.
Известкование вело к снижению содержания в почве обменных
- 20 -
форм соединений Си (от 62-84 до 10-13 мг/кг) и Мп (от
227-264 до 43-75 мг/кг) и повышало урожай растений. При
малых дозах Си (10 мг/кг) вносимых в почву, содержание
меди в растениях мало изменялось» при более высоких дозах
С а (20-40 мг/кг) известкование снижало содержание меди в
растениях по сравнению с вариантами без известкования.
Применение известкования позволило выращивать культуры при
высоких и токсичных (90-240 мг/кг) дозах меди /279/.
Отдельные органы растений весьма существенно
различаются по содержанию меди. Б органах яровой пшеницы и льна
наиболее высоким содержанием меди отличались листья растений;
содержание элемента в стебле было значительно ниже; колосья
пшеницы и коробочки льна характеризовались более высоким
содержанием меди по сравнению со стеблями /69/. Для целей
диагностики содержания меди предложено использовать три верхь
них листа либо всю надземную часть растений овса, убираемых
в фазе цветения, а также зерно овса /291, 398/. Определено
содержание меди в образцах рендзины на мергелистых
отложениях, взятых с глубины 0-20, 20-40 и 40-60 см, а также
в сене люцерны и в растительных образцах, взятых в различные
фенологические фазы /291/. Показано, в частности, что
содержание меди падало в люцерне к концу вегетации от 11,16 до
9,77 мг/кг сухого вещества. По данным В.В. Ковальского /72/
наибольшие концентрации меди содержат лишайники и мхи (табл.
2.7 и 2.8), меньше - листья деревьев и кустарников, а также
Таблица 2.7
Средние содержания меди (Л -10""^%) в некоторых
высших растениях различных природных зон /72/
Природная
зона
Субарктическая тундра
Таежная,
хвойных лесов
Лесная
широколиственная
Лесостепная
Степная
2х-1070
8оих&
растений
пределы
1-100
1-100
0.&-37
4-40
2-54
среднее
10
14
12
11
6,5
- 2
Почва
пределы
0,8-9
1-20
1-37
1-12
0,6-9
1 -
среднее
3-5
2,9
2,4
2,8
1,5
РПК* меди
пределы
среднее
0,2-20 2,9
1-22 4,1
3-11 5,0
3-5 4,1
1,5-8 4,3
Продиркщиз Tfl&bZJ
Природная
зона
Зола
растений
пределы сред-
Почва
РПК* меди
пределы
среднее
пределы
среднее
Пустынная
Тропическая
Срецнее
1-34
3-52
11
12
11
0,5-4,5
1,5-9
1,8
3,2
2,6
4-10
1-15
в.2
3,8
4,2
РПК - растительно-почвенный коэффициент.
Таблица 2.8
Среднее содержание меди в золе
различных растений /72/
Группа
растений
Травянистые
Древесные и
кустарни-
вые
Мхи
Лишайники
Надземные
части
пределы
среднее
2-30 8
3-30* 10*
5-40 14
6-60 20
10-100
30
Семена или
плоде
пределы
среднее
10-60 24
6-40 15
-
-
-
Корни
пределы
среднее
3-40 12
5-30 12
-
-
-
В числителе - содержание меди в листьях, в знаменателе - в
ветвях.
травянистые растения. У древесных, кустарниковых и
травянистых растений несколько большие количества меди содержат
семена или плоды, а также их ветви. Распределение меди в золе
различных надземных частей растений относительна однородно.
Несколько повышенными содержаниями Си отличаются листья
(хвоя) и древесина. У травянистых растений на почвах медных
месторождений элемент концентрируется в корнях.
Поступление меди в растения играет важную роль в
процессах метаболизма (табл. 2.9). Медь является активатором
отдельных ферментов и целых ферментных систем, связанных с
окислительно-восстановительными реакциями клетки. Ферменты
этой группы в основном представляют либо очень прочный ком
плекс специфического белка и металла, как это имеет место ш
- 22 -
многих медьсодержащих белках, либо столь же прочное
комплексное соединение белка, металла и простетической группы.
Медь может и не являться конституционным составляющим
ферментов, а быть неспецифическим активатором биохимических
процессов, находясь в активном центре комплекса металл -
фермент (белок) /180/. Активность медьпротеидных оксидаз
как показатель снабжения растений медью изучена в
вегетационных опытах на почвах, бедных медью /348/.
Таблица 2.9
Растения-индикаторы несбалансированного
содержания меди (мг/кг сухого вещества) /123Д24/
Растения
Содержание меди в
растениях
при
симптомах
недостатка
в норме
ЧУВСТВСТ^ЬНые е недостатку Qu
Злаковые (хлеба)
Розоцветные (плодовые деревья)
Рутовые (цитрусовые)
4YBCTg«T9qfrHbie Е убытку Си
Злаковые (кукуруза)
Бобовые (клевер, люцерна, фасоль)
Рутовые (цитрусовые)
Маревые (шпинат)
Растения-концентраторы
Гвоздичные (линуарция, смолевка
и др.)
Губоцветные
0,5-8,5 2-18
1,0-6,7 3,2-41
0,7-10 4-25
10
32
23
140-336
350-1660
160- 1960
Активность полифенолоксидазы более пригодна в качестве
показателей снабжения растений медью, чем активность аскорби-
ноксидазы. При недостатке меди активность полифенолоксидаз
в растениях была очень низкой, при внесении в почву меди ее
активность резко повышалась. Имеются данные,
устанавливающие участие фенолоксидаз и аскорбатоксидазы в нормальном
дыхании растений в качестве конечных компонентов дыхатель-
- 23 -
ной цепи. Участие меди в общем обмене и ее влияние на
многие процессы и функции растений в значительной степени
определяются наличием металла в составе дыхательного фермента
цитохромоксидазы и медьсодержащего белка пластоцианина.
Пластоцианин функционирует как переносчик электронов при
фотосинтезе.
Установлено, что медь активирует реакцию восстановления
нитритов, фиксацию молекулярного азота и, наконец, есть все
основания связывать действие меди с функцией протеаз.
Недостаток меди, особенно при питании растений аммиачными формами
азота, не оказывает заметного влияния на синтез растворимых
соединений азота (аминокислот, амидов, оснований), однако
резко тормозит синтез белковых соединений /124, 28/.
2.4. МЕДЬ В ПИШЕВЫХ И КОРМОВЫХ ЦЕПЯХ
Медь - необходимый для животных элемент. Среди животных
наиболее богаты медью некоторые беспозвоночные (у моллюсков
и ракообразных в гемоциане содержится 0,15-0,26% меди).
Поступая с пищей, медь всасывается в кишечник, связывается
с белком сыворотки крови - альбумином, затем поглощается
печенью, откуда в составе белка церулоплазмина возвращается
в кровь и доставляется органам и тканям. Содержание меди у
человека колеблется (на 100 г сухой массы) от 5 мг в
печени до 0,7 мг в костях; в жидкостях тела - от 100 мкг (на
100 мл) в крови до 10 мкг в спинномозговой жидкости!
всего меди в организме взрослого человека около 100 мг.
Таблица 2.10
Содержание меди (мг/кг сухого вещества)
в растениях при эндемических заболеваниях,
связанных с недостатком элемента /124/
\
Болезнь
Содержание меди
в растениях
при
заболевании
в норме
'Болезнь обработки' (хлеба) 0,5-8,5 5,2-18
Суховершинность (плодовые
розоцветные) 1,0-6,7 4,&-41
Экзантема (цитрусовые) 1,0-10
- 24 -
На некоторых территориях отмечены заболевания костной
системы .населения эндемической анемией, эндемической
атаксией. Эндемическая анемия проявляется в районах как с
недостатком меди в почвах и растениях» так и при ее избытке
(табл. 2.10). Эндемический деформирующий артроз, известный
под названием уровская болезнь, возникает в районах с
нарушенным нормальным соотношением в окружающей среде
некоторых элементов, в состав которых входит и медь /9/. Таким
образом, медь играет большую роль в обмене веществ
растительных и животных организмов и требует дальнейшего
изучения механизма воздействия элемента на организмы.
3. ЦИНК И КАДМИЙ
3.1. СОДЕРЖАНИЕ И ФОРМЫ СОЕДИНЕНИЙ ЦИНКА
И КАДМИЯ В ПОЧВАХ И ПОЧВООБРАЗУЮЩИХ ПОРОДАХ
Валовое содержание цинка в естественных незагрязненных
почвах обусловлено содержанием элемента в материнской
породе и определяется генезисом, петрохимией, фациальными
различиями материнского субстрата и процессами
почвообразования /27, 77/. Помимо этих факторов содержание цинка в почвах
также связано с реакцией среды и содержанием в почве
органического вещества /2.1/% биологическим круговоротом элемента,
механическим составом, с процессами миграции элемента в поч-
венно-грунтовом слое с участием природных вод и с
неоднородностью видового состава растительного покрова. Пестрота
содержания цинка в почвах обусловлена также его
дифференциацией по минералам-носителям. На небольших территориях
уровни элемента в обломочном кварце и высокодисперсных частицах
различаются в 100 и более раз. Биологический круговорот в
системе почва - растение обеспечивает поступление
микроэлементов в верхние горизонты. Различные миграционные процессы,
эрозия и дефляция почв могут нивелировать процессы
биологической аккумуляции, поэтому верхние гумусовые горизонты
иногда содержат меньше цинка, чем иллювиальные горизонты
или порода.
В почвообразующих породах и педосфере цинк представлен
рядом минеральных и органических соединений. Наиболее
распространенными минералами являются: цинковая обманка
(сфалерит - Zn S ), вюртцит ( Zn S )f смитсонит или цинковый шпат
(Zn С03)? каламин ( Zn2Si04- H2 0» Zn C03 ),
ганит ( Zn AI2O4 ),
Но значительная доля элемента представлена в вице изоморфных
примесей в слюдах, амфиболах, роговых обманках и других
минералах. Изоморфные примеси элемента в глинистых минералах
верхних горизонтов различных типов почв составляют 31-67%
от валового содержания /59/. Zn наряду с другими тяжелыми
металлами соосаждается или окклюдируется гидроксидами Fe и
AI , с которыми в почвах связано до 60% цинка /104/.
- 26 -
Содержание цинка в горных породах изменяется в широких
пределах: в ультраосновных - 50-118 мг/кг, в основных -
104-220, в средних - 35-120, кислых - 30-140 и
осадочных - 57-125 мг/кг /27, 187/. Почвы таежно-лесной
Нечерноземной зоны (табл. 3.1) содержат в среднем 38 мг/кг Zn ,
серые лесные почвы и черноземы лесостепной и степной зоны
51 и 87 мг/кг соответственно^ почвы сухостепной,
полупустынной и пустынной - 80 мг/кг, горные почвы - 67 мг/кг /74/.
Таблица 3.1.
Среднее содержание цинка в А (или А±)
почв европейской части СССР
■ ■ 1 I I ) I
Почвы
Подзолистые
Дерново-подзолистые
Дерново-карбонатные
Бурые лесные (предгорные и горные
ландшафты)
Серые лесные
Болотно-подэолистые
Дерново-глеевые
Торфяно-болотные
Пойменные аллювиальные
Черноземы
Каштановые
Горные
Средневзвешенное содержание
Среднее содержание,
мг/кг
5,57
32,3
46,9
80,1
62,9
21,3
52,5
40,6
41,9
61,2
44,7
102,5
40.0
С учетом площади, занимаемой отдельными типами и
подтипами.
Распределение цинка по профилю почв, как правило,
достаточно равномерное, и различные колебания связаны с
содержанием в почвенных горизонтах органического вещества, глинистой
фракции, карбонатов, а также с палеопроцессами
почвообразования, если они существенно влияют на современный состав почв
и педогенез.
Содержание кадмия в почвах определяется теми же
факторами, что и цинка. Так как Си является химическим аналогом
цинка, можно предполагать некоторую однотипность почвенной
химии этих элементов. Но химическая аналогичность не означает
полной тождественности их поведения в почвах. ,СЛ присутствует
в горных породах и минералах (табл. 3.2 и 3.3).
- 27 -
Таблица 3.2
Содержание кадмия в некоторых почвообразующих
породах /52/
Почвообразующая порода
Содержание
Cd, мг/кг
Флювиогляциальные отложения
(Карельская АССР)
Морена (Псковская обл.)
Покровный суглинок (Тульская обл.)
Лёссовидный суглинок (Тульская обл.)
Лёссовидный суглинок (Воронежская обл.)
Красноцветная кора выветривания
(Аджарская АССР)
0,55
1,00
0,50
0,80
1,80
1,70
Таблица 3.3
Содержание кадмия в некоторых горных породах
и минералах /334/
Горная порода
Изверженные:
гранит
гранодиорит
обсидиан
андезит
базальт
габбро
Осадочные:
битуминозные сланцы
бентонит
мергель
сланец
известняк
Метаморфические:
эклогит
серый гнейс
Содержание кадмия мг/кг
Jim
0,001-0,60
0,016-0,10
0,220-0,29
-
0,006-0,60
0,080-0,20
0,30 -11
0,30 - 11
0,40 - 10
0,30 -8,4
-
0,04 - 0,26
0,12 - 0,16
среднее
0,12
0,07
0,25
0,25
0,22
0,11
0,80
1,40
2,60
1,00
0,035
0,11
0,14
Количестве
образцов
44
5
2
2
39
8
84
10
8
66
-
6
2
- 28 -
Фоновое содержание элемента в верхнем слое почв
составляет: в подзолистых и дерново-подзолистых - 0,70-2,31 мг/кг,
серой лесной - 0,65, черноземах — 0,7-1,0 и красноземе -
1,25 мг/кг /52/.
Наибольшие концентрации кадмия характерны для
красноземов, выщелоченных черноземов и дерново-палевоподзолистых
почв.
Распределение элемента по профилю незагрязненных почв
равномерное с небольшим максимумом в гумусовом горизонте.
Факторы, влияющие на перераспределение кадмия в почвенном
профиле, аналогичны цинку. В почвах у дорог с интенсивным
движением транспорта наблюдается заметное накопление кадмия,
его содержание на расстоянии 0-5 м от дороги составляет
0,3 мг/кг, 5-20 м - 0,2 и 20 м - 0,1 мг/кг /32/.
Аккумуляция кадмия в верхних горизонтах почв происходит в районах
с геохимически повышенным содержанием элемента в ареолах
рассеяния месторождений цинковых, свинцовых и никелевых руд.
В черноземе (гор. А, 0-5 см) вблизи месторождения никелевых
руд обнаружено 45 мг/кг кадмия /98/, а на глубине 25-30 см -
16 мг/кг.
Газопылевые выбросы в атмосферу предприятиями разного
характера и особенно цветной металлургии - основная причина
появления загрязненных почв с аномально-высокими
содержаниями тяжелых металлов. /В США вклад цветной металлургии
(вторичная и первичная выплавка свинца и цинка) в суммарную
атмосферную эмиссию составляет для кадмия - 61,3%, для
цинка - 33,9% /242/. На тонну выплавленного свинца приходится
около 0,1 кг кадмия и 2,3 кг свинца атмосферных эмиссий
этих металлов. При производстве цинка выбросы металла в
атмосферу (без очистки) достигают 62,5-77,5 кг на тонну
выплавленного цинка. Значительные количества Zn и cd поступают
в воздух при сжигании топлива и бытовых отбросов. Однако для
каждого конкретного предприятия количества и соотношения ТМ,
поступающих в атмосферу, могут колебаться в весьма широких
пределах, определяемых технологией и системой очистки
отходящих газов и пыли. Поступление ТМ на поверхность почвы
зависит от метеорологических факторов, топографии местности,
высоты труб источника загрязнения и также размеров
частиц пыли в выбросах, их плотности, формы, гигроскопичности.
Эти факторы определяют и пространственную протяженность
распределения ТМ в почвах на территории вокруг источника
загрязнения.
Поведение ТМ в почвах, их взаимодействие с почвенными
компонентами во многом зависят от химического состава и
форм соединений металлов, поступающих в почву при их
загрязнении. Частицы пыли атмосферных выбросов свинцово-цинковых
заводов содержат значительные количества основных
выплавляемых элементов. Их потери происходят при подготовке шихты.
- 29 -
алгомерирующем обжиге и выплавке металлов. Высокая
температура агломерирующего обжига (650-750°С) и выплавления
металлов (до 1500°С) способствует улетучиванию свинца,
цинка и кадмия, имеющих высокую упругость паров при высокой
температуре. Пары металлов взаимодействуют при охлаждении
с кислородом воздуха, образуя оксиды, которые могут попадать
в атмосферу, несмотря на систему очистки. Такая же ситуация
складывается при сгорании топлива и городского мусора. В
атмосферных выбросах свинцово-цинковых комбинатов следует
ожидать преобладание оксидов свинца, цинка и сопутствующих им
элементов (Cd, Си, Hg и др). Кроме цветных ТМ в пыли
всегда присутствуют соединения Fe, Ca,Si и оксиды серы,
особенно если последняя не утилизируется для производства
серной кислоты.
Для количественной оценки поступления основных элементов-
загрязнителей (Рь, Znf cd ) на поверхность почвы определено
содержание ТМ в снеге, отобранном на расстоянии 1-1,5 км
от крупного свинцового завода (табл. 3.4). Судя по
суммарному поступлению ТМ в почвы, в выбросах преобладает свинец,
на что указывает и вычисленное среднее соотношение между
свинцом, цинком и кадмием (50:25:1), которое довольно
близко к соотношению содержаний металлов в почвах, отобранных на
тех же площадках /154/.
Таблица 3.4
Поступление тяжелых металлов на поверхность почвы
вблизи крупного свинцового завода (кг/га год)
Расстояние до завода,
(км)
Zn
Cd
Pb
86
17
27
26
34
3,7
1.1
1,1
1,1
1,2
190
62
52
51
62
1,0
1,5
1,5
1,5
1,5
Пыль, взятая с рукавных фильтров тонкой очистки выбросов,
близка по составу к пыли, осажденной и поступающей в почву
(табл. 3.5). Формы соединений ТМ в пыли определяли
принятыми в металлургии методами фазового анализа пылей и кеков
/173/.
В составе пыли преобладают оксиды металлов (86% от
всего количества цинка и 71% кадмия). Количество сульфидов
невелико, так же как и водорастворимой фракции пыли. По
сравнению с выбросами пыли, поступающей d почвы, пыль с фильт-
-30 -
Таблица 3.5
Фазовый состав пыли с фильтров тонкой очистки
свинцового завода (мг/г)
Общее содержание ТМ
Zn
Cd Г Pb
В составе: а) оксиды 200 15,4 295
б) сульфиды 18 0,4 29
в) водорастворимая
фракция 3 5,8 -
г) неопр. остаток 11 - . 1JL
ров обогащена цинком и особенно кадмием, соотношение между,
металлами более узкое -Zn: рь ; Cd = 11:15:1.
Большое значение для скорости трансформации соединений
ТМ имеют размеры частиц выбросов. Средний диаметр частиц
пыли из пылеуловителей тонкой очистки свинцовых заводов
колеблется в пределах 0,5-1,75 мкм /40/. Размер частиц очень
мал и близок к коллоидным. Некоторое укрупнение частиц
может происходить после очистки в фильтрах в самой трубе за
счет конденсации и агломерации. Частицы эмиссий, содержащие
кадмий, могут достигать размеров 4-8 мкм /233/.
Попадающая в почву техногенная пыль изменяет не только содержание
ТМ в почвах, но и существенно влияет на реакцию почвенного
раствора, тем самым изменяя подвижность ТМ в почвах.
Водные суспензии пыли и смеси оксидов (примерно с тем же
содержанием ТМ) имеют довольно высокое значение рН: смесь
оксидов ТМ - рН 9,9; пыль - рН 7,6. Более низкое значение
рН суспензии пыли объясняется, по-видимому, присутствием в
составе пыли некоторого количества сульфатов ТМ.
Как природные, так и поступающие в почвы из разных
источников цинк и кадмий присутствуют в виде различных
соединений. При оценке и анализе групп соединений элементов в
почвах можно выделить два аспекта. J3 первом случае определяют
'доступную* растениям форму соединений посредством
химических экстракций с помощью различных растворителей (растворов
солей, разбавленных сильных и слабых кислот, органических
комплексообразователей и др.). Во втором исследуют
содержание цинка и кадмия и их соединений в минеральной и
органической частях почв: в составе первичных и вторичных
минералов, оксидов и гидроксидов Fe, Мп и А1 , стабильных и лабиль-
- 31 -
ных гумусовых веществ в целях глубокого понимания химии и
миграции соединений элементов в почвах, в ландшафте и
поведения в процессах выветривания и почвообразования. В
практике почвенно-химических исследований эти два аспекта
являются, как правило, сопутствующими.
Для определения группового или фракционного состава цинка
и кадмия используют два метода: 1) рациональный
(вещественный) химический анализ и 2) механическое разделение пробы
/189/. Первый метод базируется на селективной
растворимости группы соединений элементов в различных по составу
растворителях /39/. Н.Г. Зырин и др. /53/ среди форм соединений
цинка выделяет 3 группы: 1) мобильные соединения -
непосредственный источник и резерв питания растений -
водорастворимые, ионообменные, непрочнофиксированные формы соединений,
2) фиксированные соединения - потенциальный резерв питания
растений: хемосорбированные ионы, труднорастворимые соли
(ПР< 10~6), Zn^ входящий в состав комплексных соединений
стабильных органических веществ; 3) изоморфные примеси в
минералах - стратегический резерв. Метод механического
разделения исследуемой почвенной пробы используют для изучения
распределения элементов по гранулометрическим фракциям
/104, 59/.
Классификация форм соединений строится с учетом методов
выделения форм и перехода соединений элементов в различные
растворители: 1) водорастворимые; 2) обменноспособные;
3) легкорастворимые (непрочносвязанные); 4) кислотораство-
римые; 5)фиксированные и прочнофиксированные. Эту общую
классификацию детализируют: Zn B составе органического
вещества, легко- и труднорастворимых соединений железа, глинистых
и первичных минералов, карбонатов и т.д.
При поступлении цинка в почву из различных источников
происходят следующие процессы: 1) растворение в почвенной
жидкой фазе; 2) ионообменные реакции, поглощение цинка в
виде образующих коллоидных его форм; 3) образование
малорастворимых неорганических соединений (цинкатов кальция,
фосфатов и силикатов цинка); 4) образование малорастворимых
соединений, в том числе и комплексных, с органическим
веществом почв /137/. Компоненты вытесняющего раствора не
должны образовывать комплексные соединения высокой
стабильности с ионом вытесняемого тяжелого металла и иметь рН
ниже рН осаждения гидроксида вытесняемого металла.
Предпочтительно, чтобы анион экстрагента был анионом слабой
кислоты и не образовывал сильной кислоты при извлечении
обменного водорода. Конечно, если исходить из всех перечисленных
требований, то трудно и практически невозможно подобрать
идеальный экстрагент. Именно этим объясняется широкий
диапазон используемых экстрагентов.
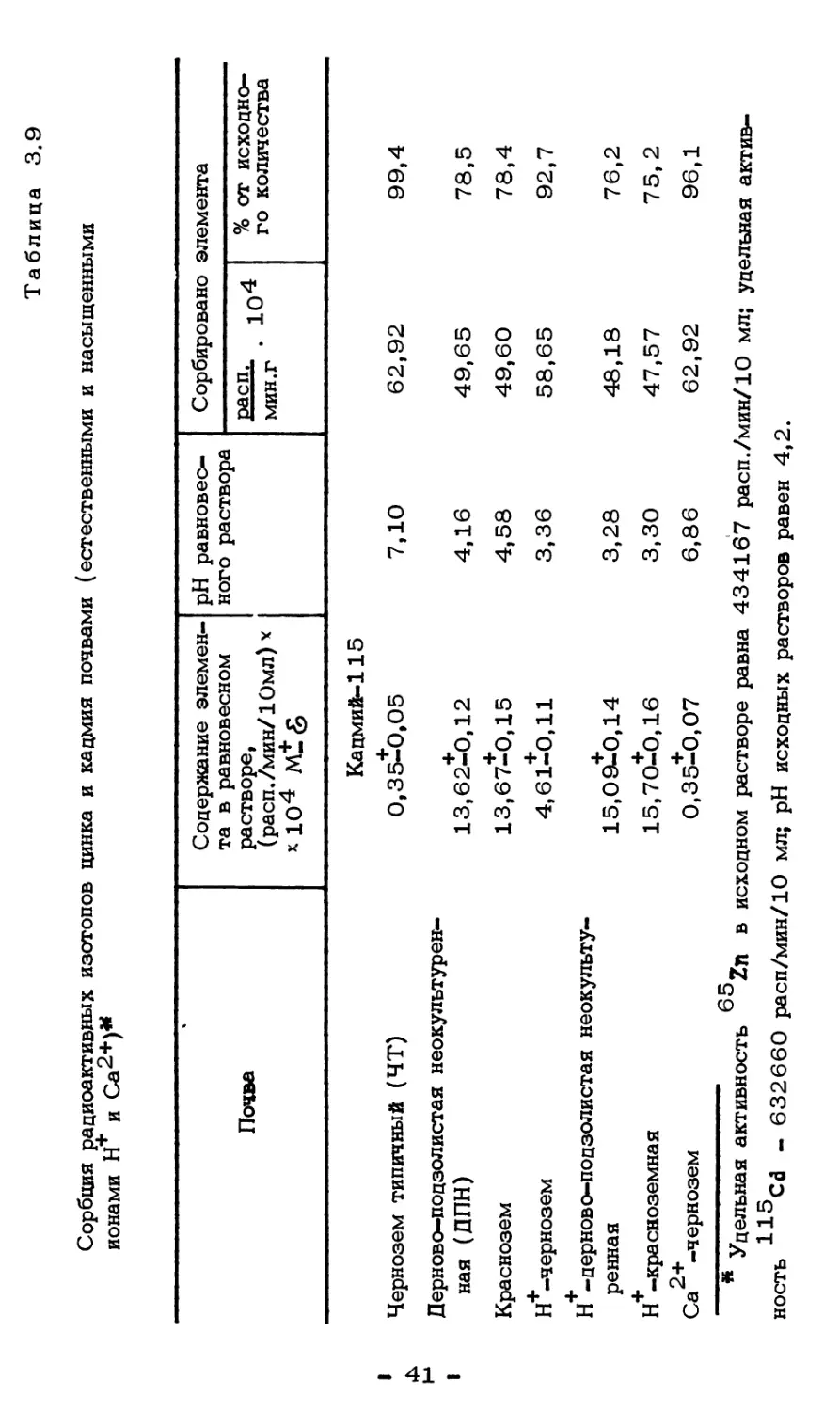
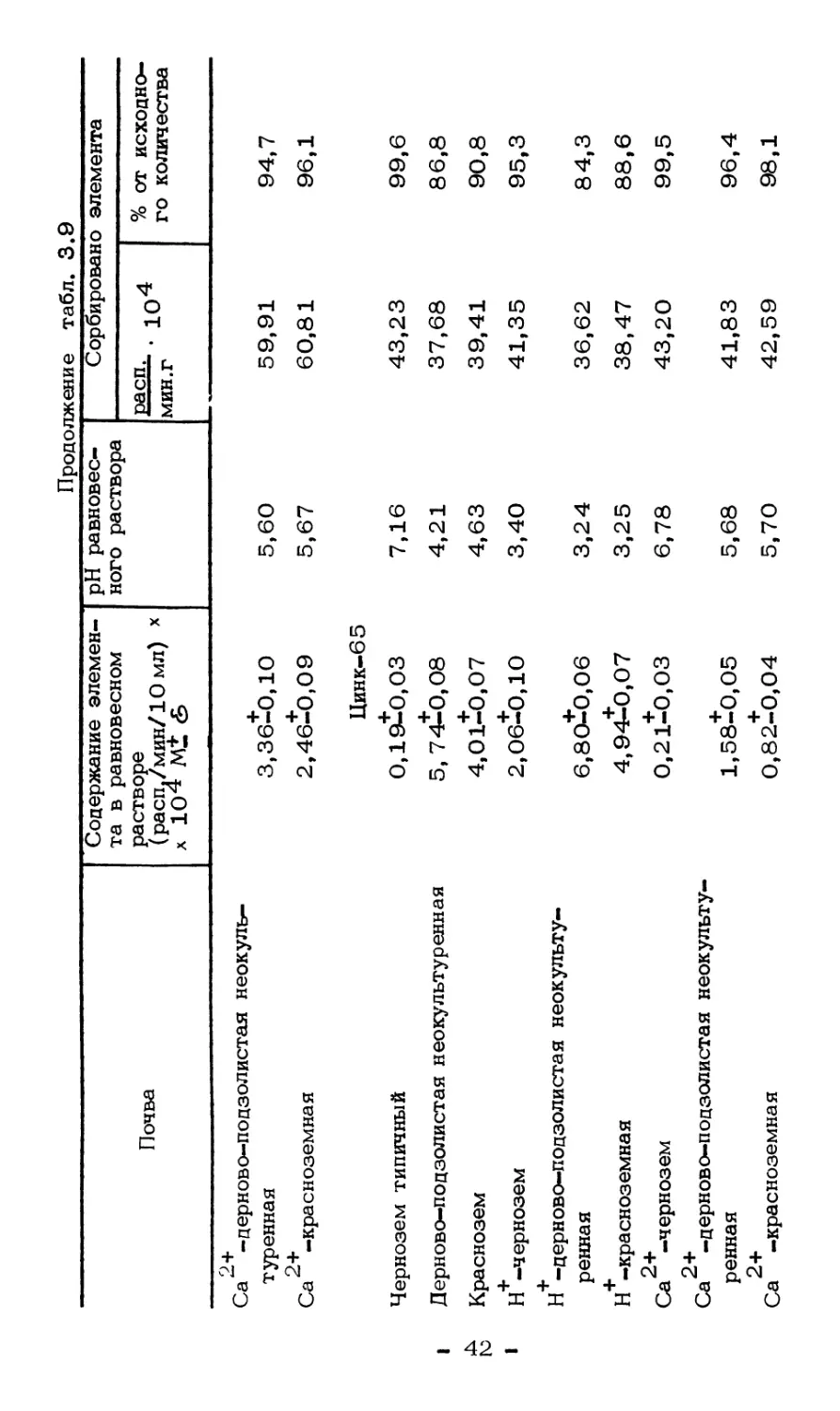
В наших исследованиях обменноспособные Zn и Cd извлекали
последовательно 5-7-кратной экстракцией 1 н. Са (^03)2-
- 32 -
Предварительно исследовали пригодность и эффективность
различных наиболее широко употребляемых экстрагентов: N Н^Ас,
NaAc, NaCl04, NH4N03, NaN03, NaCl , CaCJ 2, Ca(N03)2
(табл. 3.6). Максимальное количество цинка и кадмия
экстрагируют ацетатные соли аммония и натрия.
Таблица 3.6
Экстрагируемость обменных катионов цинка
и кадмия из загрязненной бурой лесной почвы
№
тракции
NH4Ac
мкг
%
Zn
Ca(N03)2
мкг
%
NaN03
мкг
%
NH4Ac
мкг
%
Cd
Ca(N03fc
мкг
%
NaN03
мкг
%
I 97 53 42 65 25 49 Afk 52 3,6 60 2,6 42
II 130 71 52 85 38 74 6,4 76 5,2 87 4,2 68
Ш 151 83 56 92 43 84 7,4 88 6,2 100 5,0 81
1Y 164 90 59 97 45 88 7,8 93 6,2 100 5,4 87
V 172 95 61 100 48 94 8,2 98 6,2 100 5,8 94
VI 178 98 61 100 49 96 8,4 100 6,2 100 6,2 100
YIJ 182 100 61 100 51 100 8,4 100 6,2 100 6,2 100
Ацетат—ион, по-видимому, оказывает растворяющее действие
на соединения гумусовых кислот с ТМ, что проявляется в
окрашенности ацетатных вытяжек гумусовыми веществами. В рс=
зультате комплексообразования железа с ацетат-ионом (IgK =
8,3) ранее связанные с железом гумусовые кислоты
освобождаются, образуя xitp&uio растворимые гуматы аммония или
натрия. Суммарные количества ТМ, десорбируемые экстрагентами
из бурой лесной почвы, хорошо согласуются с устойчивостью
комплексных соединений, которые вытесняемые катионы
металлов образуют с анионами экстрагентов (табл. 3.7). Ацетаты
аммония и натрия переводят непрочно связанные соединения ТМ
с гумусом в раствор и в результате в экстракт поступает
примерно в 2-3 раза больше цинка, чем в другие экстрагенты.
Кадмий извлекается ацетатными вытяжками в меньшей степени,
чем цинк. Хлориды натрия и кальция экстрагируют больше
обменного Cd, чем нитраты NanCa, а среди нитратов более
эффективен катион NH4+. Перхлорат натрия, не образующий
комплексов с Zn и Cd^ , оказался, как и следовало ожидать,
наименее слабым "вытеснителем" обменных ионов этих ТМ из
почв.
- 33 -
Таблица 3.7
Константы устойчивости комплексных ионов пинка
и кадмия /5/
Комплексный ион
lg К
[Cd(NH3)4]2+ 6,56
[Zn(NH^)4l2+
6Ц* 9,40
[cda4)2- 2>90
[CdAc4]2^ 2,00
[>АсЗ| - 8|3
Двухвалентный катион кальция предпочтительнее
адсорбируется ППК, чем одновалентный натрий, и замещает соответственно
большие количества ТМ. Однако эти различия заметны лишь при
первых двух-трех экстракциях, а затем нивелируются по мере
заполнения поглощающего комплекса и к седьмой экстракции
становятся почти не значимы. Однократной экстракцией
нитратом кальция вытесняется около половины всех обменных
металлов, если принять количества ТМ, извлекаемых семью
последовательными вытяжками, за 100%.
Распределение цинка и кадмия по групповому составу
соединений в загрязненных почвах неодинаково (табл. 3.8). Наименее
прочно связанная с ППК обменная фракция ТМ извлекается
исчерпывающим экстрагированием 1 н. Са (N03)2- Выбор этого
группового экстрагента основан на невысокой и примерно
одинаковой способности нитрат-иона образовывать комплексы с
цинком и кадмием, экстрагировать обменные катионы.
Цинк и кадмий различаются по их количествам в
ионообменном состоянии. Большая часть кадмия связывается обменно
(56,1-83.7%), тогда как максимальное содержание обменно-
способного цинка в кислой бурой лесной почве не превышает
35,5% от валового. С увеличением степени загрязнения почв
возрастает содержание обменных форм соединений ТМ, однако
процент извлечения по отношению к валовому содержанию
остается примерно одинаковым. По количеству металлов, связанных с
органическим веществом почв, ТМ выстраиваются в тот же ряд,
что и по устойчивости их металл-гумусовых комплексов, т.е.
Pb>Zn >Cd /355, 374/. Кадмий почти не связывается
гумусом, а цинк занимает промежуточное положение (19,3-31,8%)
между Cd и Pb.
Многие исследователи /304, 394/ отмечали большую роль
оксидов и гидроксидов железа в связывании ТМ. Обнаружено,
что в среднем оксиды железа удерживают 45-50% меди и до
- 34 -
80% цинка /304, 394/. По нашим исследованиям, свободные
оксиды железа играют большую роль в закреплении ТМ в
загрязненных почвах (см. табл. 3.9). Оксиды железа особенно
обогащены цинком (26,6-61,4%), в меньшей степени кадмием.
Таблица 3.8
Групповой состав соединений тяжелых металлов
в гумусовых горизонтах загрязненных почв
(числитель дроби - содержание ТМ в мг/кг,
знаменатель - процент от валового содержания)
образец
Фракции**
обменная
связанная
с орг.
в—в ом
связанная
с Fe203
остаток
Водорастворимые
ТМ,
мкг/мл
Чернозем
56
15,6
Цинк
70
19,4
180
50,0
54
15,0
0,29
Бурая
лесная
(пыль)
Дерново-
подзолистая (пыль)
60
44
45
20
35,5
83
17,2
но
26,0
95
19,8
-А£2_
26,7
250
52,1
210 .
11,8
52
10,9
28
21,6
31,7
41,2
5,5
0,53
0,33
2,7
Чернозем
L5Q
76,2
Кадмий
9.29
9,5
Q.34
16,2
-9.04
-1,9
0,0020
Образцы чернозема и бурой лесной почвы отобраны вблизи
предприятий цветной металлургии. В другие две почвы вносили
пыль с фильтров свинцового завода и инкубировали в течение
года.
Связанные с гумусом металлы определяли после
обработки образцов 30%-ной Н2О2 и экстрагирования ТМ 1 н. Са(1Ч0з)2;
связанные с оксидами (гидроксидами) железа
определяли по Мера—Джексону, но без обработки Н2О2.
- 35 -
Продолжение табл. 3.8
Образец
Бурая
лесная
Чернозем
(пыль)
Дерново-
подзолистая
(пыль)
обменная
6,4
71Д
23
56,1
36
83,7
96Н
Фракции
связанная
с орг.
в—вом
1.0
ИД
6.0
4,7
1.2
2,8
связанная
с Fe203
2.4
26,7
10.5
24,7
6,6
15,3
остаток
-0.8
-8,8
1,5
3,6
-0.8
-1,9
Водорастворимые
ТМ,
мгк/мл
0,0082
0,0900
0,0700
Некоторая часть ТМ остается неизвлеченной ("ъ остатке*),
особенно в почвах с невысоким валовым содержанием ТМ
(чернозем, р.221). Отчасти это объясняется неполным окислением
гумуса перекисью водорода, а также исходным повышенным
содержанием ТМв глинистых и первичных минералах почв.
3.2. ПОГЛОЩЕНИЕ СОЕДИНЕНИЙ ЦИНКА И КАДМИЯ
ПОЧВАМИ^ МИГРАЦИЯ ЭЛЕМЕНТОВ В ПОЧВАХ
Изучение состояния и процессов миграции нативных и
поступающих в почву соединений цинка и кадмия - важная
научно-теоретическая и практическая задача, решение которой позволит
прогнозировать не только характер и количественные
закономерности распределения элементов по профилю почв, но и
поступление их в растения. Миграция является результатом несколь=
ких одновременно протекающих процессов: диффузии, массоперс=
носа, биологического круговорота, жидкого и твердого стока.
Роль каждого из этих процессов в передвижении ТМ в разных
природных зонах сильно различается, и доля их участия в общем
миграционном потоке не определена. Если по биологическому
круговороту цинка накоплен большой фактический материал, то
относительно диффузии и массопереноса наши знания весьма
фрагментарны.
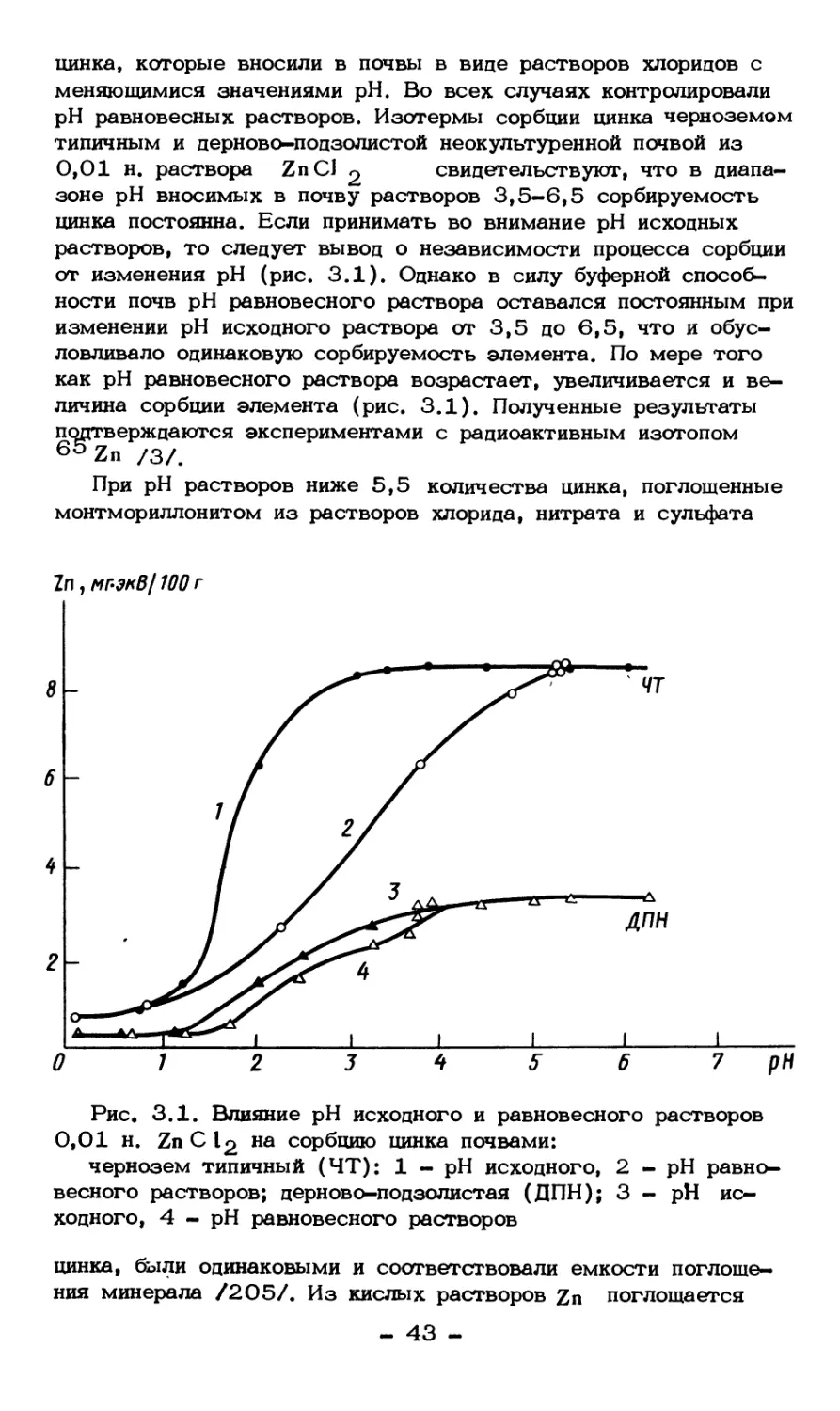
Интенсивность химических, физических и физико-химических
процессов миграции ТМ в почвах связана функциональными
зависимостями с процессами сорбции-десорбции и формами
соединений элементов. Поэтому изучение состояния внесенных соеди-
- 36 -
нений цинка и кадмия и поведение в системе почва - раствор
позволяет получить первичную информацию о характере
миграции. Одним из основных процессов, определяющих удаление кати- i
онов тяжелых металлов из раствора и распределение их между
твердой и жидкой фазами почв, является адсорбция - поглощение
ТМ активной поверхностью компонентов, составляющих почву.
Наряду с адсорбцией ТМ могут фиксироваться за счет осаждения,
коагуляции, межпакетного поглощения глинистыми минералами.
Однако ведущим являются адсорбционные явления вследствие
преобладания отрицательного заряда поверхности почвенных
частиц.
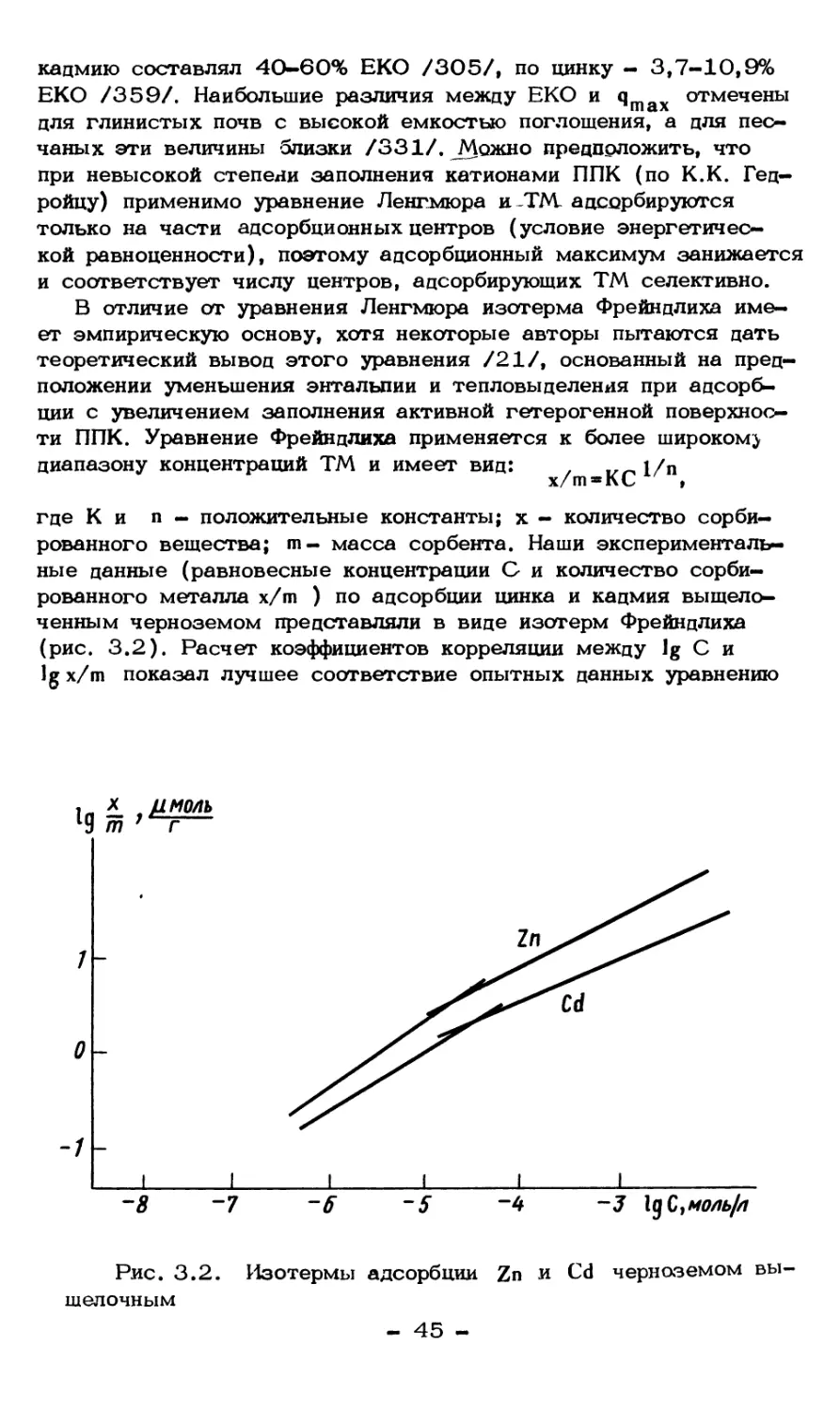
Изотермы сорбции позволяют грубо разделить процесс
сорбции и соответствующее время на три стадии: 1) быстрая - до
1 ч, 2) среднескоростная - 1-2 ч и 3) медленная - свыше 2ч.
Принято говорить, что состояние равновесия между
соединениями в твердой и жидкой фазах достигается по окончании средне-
скоростной стадии, и определение состояния равновесия до
некоторой степени условно. Кинетика адсорбции неодинакова для
разных типов почв. Равновесное состояние для чернозема
типичного и темно—каштановой почвы достигалось за 1 ч
взаимодействия раствора ^Znc почвами, тогда как для краснозема и
дерново-подзолистой ноокультуренной — за 2-4 ч. Величина
сорбции также различалась и была значительно больше в почвах
степного педогенеза по сравнению с кислыми почвами. Эту
разницу нельзя объяснить содержанием в почве органического
вещества или механическим составом. Например, содержание
гумуса в красноземе выше, чем в темно—каштановой почве, а
содержание илистой фракции приблизительно одинаково. Однако
краснозем сорбирует меньше цинка, чем темно—каштановая
почва. Величина сорбции связана со значениями рН почв: чем выше
рН почвы, тем больше она сорбирует цинка. Аналогичные
результаты получены при исследовании кинетики сорбции 1-'-5Cd .
Изотермы сорбции кадмия идентичны изотермам сорбции цинка, но
сорбируемость кадмия для всех периодов времени и для каждой
отдельной почвы меньше, чем цинка.
Параллельно исследованию динамики сорбции кадмия
измерены рН равновесных растворов непосредственно после
центрифугирования суспензий. Из растворов с более высокими
значениями рН сорбируется больше кадмия. Установление равновесного
состояния il*>cy. B системе почва - раствор следует
установлению кислотно-щелочного равновесия в системе. Такая же
зависимость прослежена и для цинка. Более низкие значения рН
в начальные моменты контакта почвьГс раствором
обусловливают более высокое огносительное содержание обменноспособ-
ной и непрочносвязанной форм соединений элементов в почвах.
По мере увеличения времени взаимодействия почвы с раствором
происходит рост рН, что вызывает постепенное возрастание доли
кислоторастворимого цинка или кадмия. Отмеченная закономер-
-.37 -
ность характерна для нескольких часов взаимодействия
растворов с почвой. После того как рН достигает постоянного уровня,
дальнейший процесс трансформации обменных и непрочносвязан—
ных форм соединений элемента в кислоторастворимую и прочно-
фиксированную формы протекает медленно и обусловлен другими
причинами /3/. Полученные результаты показывают, что
равновесное состояние в системе почва - раствор соли цинка или кад-
~мия достигается быстро /385/. Как показывают
исследования В.М. Прохорова и Е.А. Громовой /137/, равновесие меи&-
ду соединениями цинка в твердой и жидкой фазах при отношении
почва: раствор меньше 1:1 достигается за более длительное
время, равное 20 суткам.
Адсорбцию ионов на границе раздела жидкость - твердое
тело часто разделяют на неспецифическую и специфическую.
Адсорбция ионов почвой, сопровождающаяся одновременной
десорбцией эквивалентного количества ионов, входящих в ППК, получи^
ла название обратимой ионообменной адсорбции. Термин 'неспеш-
фическая адсорбция* указывает на то, что она не зависит от
индивидуальных особенностей иона^за исключением егр заряда*
Если рассматривать почву как коллоидную систему, где «а
границе между заряженной твердой поверхностью и раствором
возникает двойной электрический слой, то неспецифически
адсорбированные ионы будут располагаться либо во внешнем слое Гель-
мгольца, отделенном от твердой фазы по крайней мере одной
молекулой воды, либо в диффузном слое Гуи - Чепмена.
Неспецифически адсорбированные ионы всегда гидратированы. С точки
зрения типа химической связи с ППК неспецифически
адсорбированные ионы образуют ионный тип связи, т.е. обусловленную
дальнедействующими силами связь между ионами в диффузном
слое (внешний слой Гельмгольца) и заряженной поверхностью.
Эти силы неселективны для ионов, имеющих одинаковый заряд.
Почвенный поглощающий комплекс всегда заполнен катионами
(обычно Са2+, Mg , Н+ и др.), и адсорбция ТМ является ка-
тионообменным процессом, который описывается законом
действующих масс:
qCa2* аМе погл
аМе2+ аСа погл
где К - константа равновесия ионообменной реакции; а -
активности катионов кальция (для случая моноионной почвы) и
тяжелого металла в поглощенном состоянии и в растворе.
Неспецифическая ионообменная адсорбция для одинаково заряженных
обмениваемых катионов должна характеризоваться константой
обмена, близкой к единице. Константа ионного обмена цинка и
кадмия на кальций при адсорбции на глинистых минералах
близка к единице /207/.
В плотной части двойного слоя ионы удерживаются за счет
не только электростатических сил ( неспецифическая адсорбция).
- 38 -
но и сил специфической адсорбции, т.е. силами некулоновского
происхождения. Сила и величина специфической адсорбции
зависят от индивидуальных особенностей иона: ионного (гидратиро-
ванного) радиуса, поляризуемости, потенциала ионизации,
сродства к электрону, электроотрицательности, энтальции и энтропии
гидратации, способности к гидролизу и образованию
координационных связей и др. Специфическая адсорбция ионов определяется и
свойствами поверхности адсорбента, стерическими факторами.
Специфически адсорбированные ионы расположены во
внутреннем слое Гельмгольца, как правило, 'это дегидратированные
ионы. Специфический тип адсорбции характеризуется разнообра
зием типов связей с ППК, действующих на коротких
расстояниях: ван-дер-ваальсовы, водородная, координационная (лиганд-
ный обмен) и ковалентная. vВан-дер-ваальсовы силы
существенны в адсорбции незаряженных комплексов, полияцерных
продуктов гидролиза и комплексов тяжелых металлов с гумусовыми
кислотами. Водородная связь важна в адсорбции на поверхности
оксидов органических лигандов, связанных с ТМ. Возможность
специфической адсорбции ТМ почвой определяется наличием
функциональных групп в ППК, способных образовывать
координационную или ковалентную связь с катионами ТМ. Даже глинистые
минералы, имеющие на сколах частично диссоциирующие группы
Si ОН, способны специфически связывать ТМ путем лигандного
обмена. Однако большее значение для специфической адсорбции
ТМ имеют органическое вещество почв и оксиды (гидроксиды)
железа, алюминия и марганца. Оксиды и гидроксиды железа,
алюминия и марганца при значениях рН, обычно встречающихся
в почвах, имеют положительный заряд, и поэтому основным
I типом поглощения ТМ является не электростатическое
ионообменное взаимодействие, а реакции специфической адсорбции.
Квирк и Познер /341/ предложили следующий механизм
адсорбции цинка на гетите:
он . он
n„Fe-OH , -** n^- Fe-Or^L__^ +
°-Fe-OH + Z" -+°^Fe—0^==:*Zn + 2H
ОН Н Z^0"
Такая реакция идет с выделением двух протонов, и цинк не
вытесняется ионом Ва^+. Источником десорбируемых протонов
являются гидроксо- или аквагруппы, хотя последние, ьероятно,
диссоциируют легче, чем гидроксильные. Аналогичный механизм
позднее предложен Форбесом и др. для адсорбции Cd гетитом
/249/. Близкие выводы и результаты получены в работе Колба-
си и др. /292/ по адсорбции Zn гидроксидами железа и
алюминия. По способности адсорбироваться гидроксидами железа и
алюминия ТМ образуют ряд селективности РЬ >Zn > Cd /249/.
Основным фактором, определяющим место металла в ряду,
предполагают способность металлов образовывать координационную
связь с кислородом или гидроксильной группой. Этот ряд се-
- 39 - ,
лективности ТМ (в отличие от щелочных и щелочноземельных
металлов) остается неизменным практически для любой поверх-
-ности /329/.
Комплексообразование тяжелых металлов с гумусовыми
кислотами (ГК) почв можно отнести к явлениям специфической
адсорбции. Сам факт существования комплексов ГК-металл уже
не вызывает сомнений и подтверждается неспособностью ионов
щелочных и щелочноземельных металлов вытеснить связанный
с ГК металл, уменьшением рН среды при взаимодействии ГК и
ТМ f изменением ИК-спектров, уменьшением активности
свободных ионов ТМ, сдвигом полярографической волны,
характерным для образования комплексов, и др. явлениями /354,
374/. Механизм взаимодействия ГК и ТМ в принципе не
отличается от реакции ТМ с полуторными гидроксидами и
представляет взаимодействие металла с донорами электронов молекулы
гумусовой кислоты. Наиболее вероятные донорные атомы 0,N
и донорные группы ОН, входят в состав функциональных групп
гуминовых кислот - карбоксильной, фенольной, и возможно,
кетонной и аминной.
Реакции гумусовых кислот с ТМ практически всегда
сопровождаются появлением в растворе протонов:
^ СООН о — ^ с0° \ w
R ^ +Ме2 5^ RC1 N Me + Н+
^ ОН ^ О ^
Показателем, характеризующим возможность образования и
устойчивость гумусовых соединений с ТМ, являются их
константы устойчивости. В целом можно отметить тот же порядок
металлов в ряду устойчивости соединений ГК - металл (Pb>ZnVCd)
что в ряду поглощения этих ТМ полуторными гидроксидами
/329/.
В процессах поглощения цинка и кадмия почвами Часто
ведущую роль играют кислотно-щелочные условия. Вопрос/о
влиянии рН на сорбцию ТМ почвами является одним из наиболее
сложных в почвенной химии /137/. Уменьшение кислотности
суспензий глинистых минералов и почв приводит к возрастанию
сорбируемости цинка и кадмия, хотя эта зависимость
прослеживается не всегда /101, 137/. Результаты наших
исследований по сорбции 6*5 Zn образцами естественных почв, а также
насыщенных Н+- или Са^+-ионами, показали, что почвы,
насыщенные ионом водорода, сорбировали значительно меньше
цинка и кадмия, чем естественные образцы. Насыщение
дерново-подзолистой почвы и краснозема ионом Са^+ приводило к
увеличению сорбируемости ТМ. Са-форма чернозема типичного
и естественный образец чернозема поглощали примерно
одинаковые количества элементов. Определяющее влияние на уровень
сорбции цинка и кадмия почвами оказывал рН, но не вид
насыщающего катиона (в данном случае Са^+) (табл. З.Э).
Для выяснения влияния рН на поглощение цинка нами
проведены эксперименты со стабильным и радиоактивным изотопами
- 40 -
^
0)
а>
ю
со
г-
^Г
со
г-
г-
СМ
О)
см см н
со" ю" со
г- ^ а>
(О
W
Й
I
см
(В
СМ*
со
ю о ю
ч ч ч
О) аГ со
^ ^ ю
00 h Й
тН СО <&
^ ^ со
I
X
х
2 СМ
о
ю
s q
СО
СО 00 СО
гН Ю СО
^ ^ СО*
СМ Ю тН
гН тЧ гЧ
d d о
+ 1 +1 +1
СМ Г- гН
(О (D (О
СО* СО* ^
о
a
СО О СО
СМ С0^ 00
СО СО CD H
^ СО 1>
тЧ И О
о" о" о
+J +1 +1
CD О Ю
о ^ со
ю ю* с5
тЧ тЧ
a
3
а
8
о
55
8
ф
г-
со
гН
<*
СО
^
сО
X
a
ф
а.
о
я
8.
9
о
о
я
8
a
X
§
а
о
X
о
К
X
9
н
г
i
I
X
Ф
5
о
ф
м
W
СО
6 §
43
о
Й сб
ф w
ф
«
К
ев
со
а
о
Is
3
3
со
о
N
Ю
со
о а а s в ^
» ф ф и а . >
О Я* Cf m US +
СО
а + +
нС Дн Ж
' ь + ,е>,в
Д О
С
о
&
О
СО
со
см
со
со
•а
U
ю
£rt
8
О
X
- 41 -
Г- тН
^ со
0) а>
СО 00 00 СО
05 СО О Ю
0) 00 05 0)
О Г-
со со
ю~ ю"
00 СМ
с
>>
*
о
ф
X
§
h
о
S
§
со
CJ
о
с
А
л
° tn
к 2
a 2
® S
1 ф
+ й
СМ Г»
СО Ь
о
05
2
X
2
ф
СО
о
к
о
со
а
1
+ 1
см
5
СО
^
00
со
СО
00
ю
0)
0)
^
со
0)
гН
0)
О)
ю
тН
00
о"
со
со
см
со
^
00
со
Is-
СО
гН
^
О)
СО
ю
СО
н
^
см
со
со
СО
Г-
^
00
со
о
см
со
^
СО
00
н
^
05
ю
СМ
^
со и со О
Н СМ СО 1*
г- ^ ^ со
ю
со
о
н
о
со
со
О)
о
о
+ 1
со
^
1,
X
X
СО
О
О
+<£
н
00
о
О
+4
г-
г-
о
о
+д
о
о
Н
о
+ 1
со
о
О ю
^ Ю СО 00 О
см см^ г^ Ч ^
со" со" со* ю ю
СО F"
о q
о" о
+* i ■■
со °1 о{
со" ^" о"
со
о
о"
+ 1
о о
о" о"
+ 1+1
00 СМ
Ю 00
S
ф
X
W
cd
SB
§
с
S
2
ф
СО
о
я
ф
Т
X
§
СО
о
с
А
д
о
х
ф
d
2
ш
СО
о
к
о
a
*
ф
со
о
X
а,
ф
7
+ 1
X
СО
о
с
А
0
О
Д
а
ф
Cf
+ ■
X
I
со
о
X
и
Й
S.
о
ф
к
W
со
со
о
о
§ 8.
ф *
I СМ СМ
о
к
§*«
+ Ж +
ф
б б
см
СО
О
- 42 -
цинка, которые вносили в почвы в виде растворов хлоридов с
меняющимися значениями рН. Во всех случаях контролировали
рН равновесных растворов. Изотермы сорбции цинка черноземом
типичным и дерново-подзолистой неокультуренной почвой из
0,01 н. раствора ZnCl ^ свидетельствуют, что в
диапазоне рН вносимых в почву растворов 3,5-6,5 сорбируемость
цинка постоянна. Если принимать во внимание рН исходных
растворов, то следует вывод о независимости процесса сорбции
от изменения рН (рис. 3.1). Однако в силу буферной
способности почв рН равновесного раствора оставался постоянным при
изменении рН исходного раствора от 3,5 до 6,5, что и
обусловливало одинаковую сорбируемость элемента. По мере того
как рН равновесного раствора возрастает, увеличивается и
величина сорбции элемента (рис. 3.1). Полученные результаты
подтверждаются экспериментами с радиоактивным изотопом
65Zn /з/.
При рН растворов ниже 5,5 количества цинка, поглощенные
монтмориллонитом из растворов хлорида, нитрата и сульфата
1г\,мг-экВ1Ю0г
Рис, 3.1. Влияние рН исходного и равновесного растворов
0,01 н. Zn С I2 на сорбцию цинка почвами:
чернозем типичный (ЧТ): 1 - рН исходного, 2 - рН
равновесного растворов; дерново-подзолистая (ДПН); 3 - рН
исходного, 4 - рН равновесного растворов
цинка, были одинаковыми и соответствовали емкости
поглощения минерала /205/. Из кислых растворов Zn поглощается
- 43 -
преимущественно ионообменно. При рН выше 6,5 сорбированные
количества превышали емкость поглощения. Рассчитанные по
экспериментально определенным в растворах концентрациям цинка и
гидроксильных ионов произведения растворимости
соответствовали величине ПР гидроксида цинка Zn (ОН)2. Аналогичные
результаты получены при исследовании поглощения цинка
карбонатными почвами /385/. Реакция среды образования в
почвах Zn(OH)2t по данным разных авторов, различна: рН > 5,9
/358/, рН > 7,5 /385/, Это обусловлено тем, что
равновесное состояние соединений цинка в системе твердая фаза почвы -
раствор помимо адсорбционно-десорбционного равновесия может
определяться и растворимостью труднорастворимых соединений.
Методом рентгендифрактометрического анализа доказано
образование в почвах гидроксида цинка /292/. Однако это соединение
метастабильно и существует только в течение нескольких
недель. В карбонатных почвах возможно осаждение в виде Z11CO3
/292,385/. Также обнаружены следующие твердофазные
соединения цинка: Zn5(C03)2 (°н)б» Са [Zn(OH)3]2 " 2Н20, а
после внесения ZnS Од и NH4 НоРОд идентифицированы
Zn3(P04)2*4H20 и NH4ZnP04 /3*15/.
Количественное описание закономерностей адсорбции
элементов с помощью изотерм адсорбции необходимо для предсказания
распределения элементов между твердой и жидкой фазами почв
и полезно для сравнения экспериментальных данных,
полученных разными исследователями. Наиболее
часто для этих целей используют теоретическое
уравнение Ленгмюра и эмпирическое уравнение Фрейндлиха.
Уравнение Ленгмюра Ч=Чтах КС/1+КС выведено для описания
монослойной адсорбции газа на поверхности вещества при
условии, что все сорбционные места энергетически равноценны
и не влияют друг на друга, а также, что максимальная
адсорбция соответствует полному заполнению моноионного слоя (в
уравнении q - количество сорбированного вещества при
равновесной его концентрации - С, q — адсорбционный максимум,
К - константа, характеризующая энергию связи адсорбтива с
адсорбентом). Как правило, в почвенных системах
вышеперечисленные условия не выполняются, но поскольку любой тип
адсорбционных реакций, достигающих насыщения при увеличении
концентрации, может быть аппроксимирован уравнением
Ленгмюра и все простые ионообменные реакции хорошо описываются
этим уравнением при низких концентрациях и малой степени
заполнения поглощающего комплекса, то неудивительно, что
уравнение Ленгмюра широко применяется в химии почв. С его
помощью описана адсорбция почвами Jr\tCd и рассчитаны
адсорбционные максимумы для этих элементов. Хотя адсорбционные
максимумы коррелируют с емкостью катионного обмена (ЕКО),
но обычно они ниже ЕКО. Так, адсорбционный максимум по
- 44 -
кадмию составлял 40-60% ЕКО /305/, по цинку - 3,7-10,9%
ЕКО /359/. Наибольшие различия между ЕКО и qmax отмечены
для глинистых почв с высокой емкостью поглощения, а для
песчаных эти величины близки /331/. JV\qjkho предположить, что
при невысокой степени заполнения катионами ППК (по К.К. Гед-
ройцу) применимо уравнение Ленгмюра и-ТМ адсорбируются
только на части адсорбционных центров (условие
энергетической равноценности), поэтому адсорбционный максимум занижается
и соответствует числу центров, адсорбирующих ТМ селективно.
В отличие от уравнения Ленгмюра изотерма Фрейндлиха
имеет эмпирическую основу, хотя некоторые авторы пытаются дать
теоретический вывод этого уравнения /21/, основанный на
предположении уменьшения энтальпии и тепловыделения при
адсорбции с увеличением заполнения активной гетерогенной
поверхности ППК. Уравнение Фрейндлиха применяется к более широкому
диапазону концентраций ТМ и имеет вид:
х/т«КС
1/п
где К и п - положительные константы; х - количество
сорбированного вещества; т- масса сорбента. Наши
экспериментальные данные (равновесные концентрации С и количество
сорбированного металла х/т ) по адсорбции цинка и кадмия
выщелоченным черноземом представляли в виде изотерм Фрейндлиха
(рис. 3.2). Расчет коэффициентов корреляции между lg С и
lg x/m показал лучшее соответствие опытных данных уравнению
1с
7
0
1
-X . ЦМОЛЬ
т ' г
I I I
I I I
-8
-7
-6
-4
-J 1дС,мо/1ь//1
Рис. 3.2. Изотермы адсорбции Zn и Cd черноземом вы-
шелочным
- 45 -
Фрейндлиха, чем Ленгмюра. Изотермы разделялись на две части:
первая - с большим угловым коэффициентом 1/п в диапазоне
невысо*Ц1Х концентраций и вторая - более пологая в области
высоких концентраций. Такое разбиение изотерм часто
используют для обоснования различий взаимодействия сорбгива и
сорбента /49, 346/, и правомочность такого разделения
основывается на более высоких коэффициентах корреляции для
отдельных частей, чем изотермы в целом. Разделение изотерм
адсорбции на два участка связывают с энергетической гетерогенностью
адсорбционных мест /125, 366/. Известно, что почва
характеризуется совокупностью различных типов адсорбционных мест,
отличающихся по энергии связи с ТМ (гумусовые вещества,
гидроксиды Fe, Al, Mn, сколы и плоскости спайности глинистых
минералов). При низких концентрациях заполняются места с
более высокой энергией связи (специфическая адсорбция ТМ
гумусовыми кислотами, полуторными гидроксидами и сколами
глинистых минералов), а затем с более низкой
(неспецифическая ионообменная адсорбция), соответствующей участку II
изотерм. Именно такой неоднородностью адсорбционных центров
можно объяснить несовпадение экспериментальных результатов
с уравнением Ленгмюра, требующего энергегической однородности
адсорбента.
Еще одной возможной причиной уменьшения поглощения ТМ
с увеличением степени заполнения ППК следует считать
изменение кислотности раствора в результате гидролиза солей ТМ,
вытеснения обменного водорода из ППК и выделения протонов
при специфическом взаимодействии ТМ с компонентами почвы.
Протон оказывает сильную конкуренцию ТМ за адсорбционные
места, адсорбция ТМ заметно подавляется при низких значениях
рН /3/.
3.3. ПОДВИЖНОСТЬ И ДОСТУПНЫЕ РАСТЕНИЯМ
ФОРМЫ СОЕДИНЕНИЙ ЦИНКА И КАДМИЯ В ПОЧВАХ
3.3.1. Цинк и кадмий в почвах
Цинк принадлежит к облигатным для растений
микроэлементам, значение и роль кадмия для них пока не ясна. До 50-х гг.
почвоведы и агрохимики рассматривали поглощение элементов
растениями из почвы как процесс, связанный с проникновением
корней в почву и поглощением соединений элементов в активных
зонах около корневых волосков. Подвижность питательных
веществ оценивали методами, характеризующими: 1) величину
емкости поглощения элемента почвой; 2) количества
(концентрации) элемента, переходящие из почв в разные вытяжки;
- 46 -
3) содержание элемента в растениях. Основной недостаток этих
диагностических приемов - отсутствие надежного критерия
'подвижности*. В литературе термины 'подвижный* ('подвижные
формы соединений*), *мобильный* являются синонимами и
часто считаются равнозначными термину * доступный* растениям.
Наиболее простым, быстрым и достаточно надежным способом
определения *доступных* растениям форм соединений
микроэлементов до сих пор является экстракция их различными
растворителями. Критерием пригодности экстрагента для этих целей
обычно служит достоверная корреляционная связь между
экстрагируемыми количествами элемента из почвы и содержанием
его в растениях. Определяемая таким образом 'доступная*
форма соединений, конечно же, не является полностью доступной
и поглощаемой растениями. Во-первых, растения поглощают
весьма незначительную часть того количества микроэлемента,
которое экстрагируется из почвы; во-вторых, любой из
применяемых экстрагентов не может полностью имитировать
деятельность корневых систем растений в процессе потребления элс«
мента. Однако простота и быстрота метода, способность, хотя
и приближенно, диагностировать обеспеченность почв
микроэлементами обусловили его широкое применение. "Доступные*
Растениям формы соединений цинка и кадмия извлекают из почв
неагрессивные экстрагенты, например, предложенный Н.К.
Крупским и A.M. Александровой /85/ ацетатне-аммонийный
буферный раствор с рН 4,8, апробированный в ряде исследований
/3, 54/. Растворы сильных кислот, имеющие концентрацию 1 н.
и выше, не могут характеризовать доступность цинка и кадмия
для растений /3, 54/.
Важное практическое значение имеют градации почв по
обеспеченности растений цинком (табл. 3.10).
Таблица 3.10
Градации обеспеченности почв цинком, растворимым
в CH3COOtfH4 с рН 4,8 /54/
Обеспеченность
Содержание цинка в почве, мг/кг
I группа
растений
(невысокий вынос)
II группа
растений
(повышенный вынос)
III группа
растений
(высокий вынос)
Низкая 1 2 5
Средняя 1-2 2-5 5-10
Высокая 2 5 10
- 47 -
Подвижность или передвижение соединений цинка в почвах
с точки зрения питания растений в соответствии с
современными представлениями можно рассматривать как суммарный
процесс передвижения, обусловленный диффузией и массопереносом.
Из всех методов определения подвижности ТМ наилучшими
являются диффузионные эксперименты с радиометкой, поскольку
вносимый в почву в микроколичествах радиоактивный изотоп в
очень небольшой степени воздействует на состав почвы.
Определение собственно подвижности элементов в почвах в
геохимическом аспекте с помощью проростков имеет существенные
недостатки, а именно корневые выделения растений, воздействуя
на соединения в почвенном растворе и в твердой фазе,
повышают их мобильность, что в свою очередь вызывает более
интенсивное поступление элементов в фитомассу. В общем случае
подвижность определяется прочностью связи элемента с
почвами. Величина сорбции, часто используемая для оценки
подвижности, во многих случаях не можег характеризовать прочность
связи, так как она различается при одинаковом уровне сорбции
элемента.
Определение подвижности с помощью селективных
экстракций различными химическими реагентами — быстрый и надежный
метод, но пригодность экстрагента для определения подвижной
фермы соединений элемента должна быть проверена
экспериментально. Кроме того, экстракции не дают количественной
характеристики скорости передвижения элемента в почвах, а лишь
указывают на степень извлечения соединений из почв.
Коэффициенты диффузии цинка и кадмия в почвах наилучшим образом
оценивают подвижность элементов, их спонтанный поток,
различающийся по масштабам в зависимости от состава почв,
энергетического состояния в них воды. В естественных условиях
параллельно диффузии протекает конвекционное передвижение
вещества.
3.3.2. Диффузия цинка и кадмия в почвах,
"подвижные*" соединения элементов
Работами В.М. Прохорова и его сотрудников /134, 135,
136/ показано, что диффузия наряду с другими процессами
(конвективный перенос, корневой перехват) является одним из
главных механизмов не только миграции катионов и анионов в
почвах, но и их поступления в растения. Диффузия представляет
результат4 спонтанного хаотического теплового движения
молекул и ионов разной концентрации, в результате которого
вещество переносится из одной части системы в другую. С этой точки
зрения процесс диффузии является частным случаем более
общего закона, согласно которому все неоднородные системы
стремятся стать однородными.
- 46 -
СО
<0 S
ю
CQ ©
К
q oS
s a +
о о
f* a
4 oS
CO
^ о
s
г-
ю
о
+ 1
CM
Н
00
СО
^
ю
со
О)
тН
о
г^
СО
ю
о"
+с£
CD
ю
0)
СО
со
СО
о
СМ
^
0)
см
^
о"
ч
со
ю
о
^
ю
о
ю
СО
°1
г^
ю
г-
о"
+ 1
г-
0)
г-
^
^
со
о
см
и
СО
0)~
ю
СМ
о*
+Л
со
со
см
СО
ю
см
СМ
^
°1
г^
СО
О)
о*
*<4
ю
ю
со
СМ
г-
СХ)
iH
о
СО*
ее
^f
ч
О)
со
0>
н
г-
ю
со
0)
^г
со
^f
+ 1
3
Н
СМ
н
ю
^
^
^
Н
О)
со"
О)
СМ
о
-л
tH
тг
со
СМ
о
+ 1
со
г-
см
см
тН
о
+ 1
см
ю
r-i
СМ
со
о"
+с£
^
со
со
о
о
ч
00
о
г-
^
о"
+ 1
00
00
ю
о
♦S
СО
н
СО
со
+ 1
н
со
ю
СО СО h О)
см н см ^
г- см ю см см
СО СО СО СО СМ
*
2
£
§
а
ф
Г
a
ф
2 *
£ g
б 2
5 2
ф ф
о « о
аз «
US (X
ф *** ф
•г or1
о
а
со
со
G,
О
§
а
о*
0)
СО
ю
СМ
8
Г- СМ
СМ О
О) СО
СМ ^
W
СО
а ф
2
ф
§
a
о
i
9
a
ф
§
а
ф
§•
о
О
a
ф
ф
s
ф
о
ф
a
a
со
я*
ф
a
а
1С
- 49 -
I
•см
B2?
4 o^
1 •
2 +
ф^
2 «
U S
Я о
О -*
н о 6
*с^'
eras
о
| Га
00 О О Г- 05 СО
О Г- О СО тГ СО
тН 0) О СО Ю СО
^ со "^ ^f со со
О о! О со ^ О*
о г- со о а> о
М Ю СО ^ h О
СМ Н СМ гН СО Н
со о со со со ю
(D О CAl h (О СО
О Н О О О со
со 4 со w со (i
О) СО ^ Г^ 0^ СМЛ
^f о со* cS со со
ю см со со о 0)
тН CM iH СМ Ю СО
со о
ю ю
г^ н
со
СО
г*
г- со
со со
тг
о
н
+ 1
н
0)
н
см
гН
со
ю
н
+ 1
СО
СМ
о
СО
СО
СМ О
со см ю ^ со со о ю
со со со со см м см ^Г
к
в
ф ф ф О >
8 § 8 § 8
s « » с о
S
а, л . „ _ „
Ф Ф at ф Ф Ф
F F £ О «3 П
1
3
8
I
I
i
В
ф
&
ф
я
и
сб
Л«
ф
S
a
- 50 -
Величины коэффициентов диффузии цинка и кадмия,
определенных нами, представлены в табл. 3.11 и 3.12. Наряду с
величинами коэффициентов рассчитаны величины коэффициентов
диффузии цинка и кадмия в поровом растворе. В почве ионы и
молекулы представлены как в сорбированном состоянии, так и в
растворе. Поскольку процесс диффузии протекает медленно, го
можно допустить, что существует локальное равновесие между
ионами в растворе и в сорбированном состоянии. По величине
коэффициентов диффузии цинка (Д^) почвы можно разделить на
две группы: 1) кислые почвы (дерново-подзолистая неокульту-
ренная и краснозем), в которых имеет относительно
высокую диффузионную подвижность и Дц порядка л 10Г& — п • 1СГ&
см^/с, и 2) почвы степного педогенеза и дерново-подзолистая
окультуренная с нейтральной и слабощелочной реакцией, в
которых Д имеет очень низкую величину ( п- 10е"*1 - п. 10~
см /с) Гтабл. 3.11).
С помощью корреляционного анализа мы попытались
вычленить основные свойства почвы, влияющие на скорость
передвижения цинка. Установлено, что между Д и рН^^почв
коэффициент корреляции равен: г - 0,95 (значим на уровне 0,001);
с количествами элемента, растворимыми в NH^Ac (pH 4,8),
получен г = 0,81 (значим на уровне 0,05), для карбонатных
почв г - 0,85 (значим на уровне 0,05). Состояние
соединений цинка в почвенном растворе порового пространства почв
оказывает существенное влияние на скорость диффузионного
передвижения элемента. Преобладание в почвенном растворе
кислых почв Zn 2+ обусловило большую скорость диффузии цинка
в поровом растворе дерново-подзолистой неокультуренной почвы
и краснозема по сравнению с почвами, имеющими нейтральную
и слабощелочную реакцию. Если рассматривать подвижность
цинка и кадмия в почвах с точки зрения процесса диффузии, то
полученные нами результаты позволяют внести ясность в вопросы
терминологии, касающиеся подвижности элементов. Это
относится к термину 'подвижные* фоомы соединений, которым часто
характеризуют соединения, изв^ ^аемые из почв как солевыми
растворами, так и разбавленными растворами сильных кислот.
Справедливость отнесения соединений со столь различной
растворимостью к подвижным исследователи не обосновывали
экспериментальными результатами, а поэтому понятно предложение
Г.Я. Ринькиса /142/ отказаться от термина "подвижная* форма
соединений элемента. На основе значимой связи между скоростью
диффузионного передвижения цинка и кадмия в почвах и
количествами элементов, растворимыми в ацетатно-аммонийном
буферном растворе с рН 4,8, сделан вывод, что такие соединения
можно называть подвижными. Между коэффициентами диффузии
цинка и кадмия в почвах и кислоторастворимой формой
соединений элементов существовала обратная корреляционная связь.
- 51 -
Кислоторастворимый цинк или кадмий не следует называть
подвижным. Заметим, что ацетатно-аммонийная экстракция
переоценивает подвижные формы соединений элементов в карбонатных
почвах.
В кислых почвах кадмий диффундировал в несколько сотен
раз быстрее, чем в почвах с pHj^O > 6,9. Из всех свойств
почв, представленных в табл. 3.12, значимый коэффициент
корреляции с Д кадмия был получен для рН ( г - +0,97 при
уровне значимости 0,001). Статистическая обработка данных
показала, что другие свойства почвы не оказывали
существенного влияния на коэффициент диффузии. Возможно, это могло
быть результатом взаимного маскирующего влияния свойств
почв. Диффузия происходит тем быстрее, чем больше энергия
адсорбции катионов, занимающих обменные места, по сравнению
с энергией адсорбции диффундирующего катиона, иными словами,
чем труднее диффундирующему катиону вытеснить катионы с
адсорбционных мест. Ион водорода является энергичным
конкурентом для кадмия за обменные места, способствует переходу
ионов кадмия из сорбированного состояния в раствор и может
вызвать повышенную скорость диффузии элемента в кислых
почвах. Окультуривание кислой дерново-подзолистой почвы
приводит к существенному снижению подвижности кадмия, что
обусловлено известкованием, увеличением рН почвы и содержания в
ней поглощенного кальция. Прочность связи кадмия в
окультуренной почве намного выше, чем в неокультуренной.
По величине коэффициента диффузии кадмия в поровом
растворе (табл. 3.12) исследованные почвы можно разделить на
две группы: 1) почвы с нейтральной и слабощелочной реакцией,
в которых кадмий имеет величину от 1,00 до 1,70-10"^ см^/с,
и 2) почвы с кислой реакцией, в которых подвижность
элемента в поровом растворе почв почти на порядок выше (Дп равен
7,56 и 11,50-10~7 см2/с). Почвы, разделенные на две
группы по величинам Дп, достаточно четко группируются по
значениям рН, что обусловлено влиянием кислотно-щелочных условий
на состояние соединений кадмия и их подвижность в поровом
растворе. В литературе не имеется данных по коэффициентам
диффузии кадмия в водной среде при различных рН. Наши
данные позволяют предположить, что подвижность кадмия в воде с
кислым рН будет выше, чем в водном растворе с нейтральным
или слабощелочным рН. Как видно из значений коэффициентов
диффузии, скорость диффузионного транспорта кадмия в кислых
почвах намного выше, чем в почвах степного педогенеза и
дерново-подзолистой окультуренной почве. За одинаковый период
времени кадмий, попавший на поверхность почвы в результате,
например, выброса промышленного предприятия, будет
передвигаться в глубь по профилю кислых почв намного дальше и
быстрее, чем в почвах с нейтральной и слабощелочной реакцией.
В связи с повышенной подвижностью кадмия в кислых почтах,
- 52 -
подверженных техногенному загрязнению, возрастает опасность
токсического влияния элемента на организм человека, так как
будет легко попадать в растительную пищевую продукцию, что
подтверждается вегетационными опытами.
Для характеристики диффузионного процесса удобно применять
величину среднего смещения ( х ) диффундирующего элемента,
которая для случая диффузии из бесконечно тонкого слоя равна
/132, 133/: ,
х=2 y/Dt/n ,
Величина среднего смещения показывает, что на расстояние,
большее х , проникает 42,5% от общего количества
диффундирующего элемента; > 2Х - 11,1%; > Зх - 1,66% и >4х - 0,14%.
Используя величины коэффициентов диффузии кадмия, получим
следующие значения среднего смещения за 1 год для
чернозема типичного при весовой влажности \s/ 16,6% хГ = 0,09 см,
при W 38,2 х = 0,11 см; для краснозема при W 16,7%
Т- 0,4 см, при \Л/48,8% х = 1,16 см; для
дерново-подзолистой неокультуренной почвы при VV 16,4% х •» 1,30 см и при
VV 28,3% х - 1,50 см. Таким образом, расстояние, на которое
может проникнуть кадмий в дерново-подзолистой почве за 1 год,
будет составлять около 6 см, а в черноземе не превысит 1 см.
3.3.3. Влияние диффузионных процессов на
поступление цинка и кадмия в растения
Транспорт элементов питания к корням растений и
поглощение элементов обусловливают три механизма: диффузия,
конвективный перенос и в меньшей степени корневой перехват.
Имеются доказательств^ .диффузионного поступления кадмия в растения.
В экспериментах с отделенными корнями ячменя установлено,
что пс гупление кадмия в растительные ткани является
результатом диффузии с последующей фиксацией элемента /228/.
Мы попытались в самом первом приближении оценить
возможную роль диффузионных процессов в поглощении цинка и кадмия
проростками чумизы. Микровегетационный опыт с проростками
был проведен в условиях, не исключавших массопереноса
элементов в почвах. Выявить роль корневого перехвата и
количественно оценить его чрезвычайно трудно. Заметим также, что
когда рассматривают математические модели для оценки поступлю -
ния элементов в растения, изучают поглощение корневыми
системами. Мы'же сравнивали скорость диффузионного передвижения
цинка и кадмия в почвах с содержанием радиоактивных
изотопов этих элементов в сухой биомассе растений. Но с точки
зрения сельскохозяйственной практики накопление микроэлементов,
тяжелых мегаллов в надземной продукции зерновых культур
имеет более важное значение, чем поступление в корни растений,
хотя эти процессы могут быть взаимосвязаны. Связь между со-
- 53 -
J-
,t15mi
10 20 JO 40
Содержание (расп./мин г ) /0~*
50
Cd
Рис. 3.3,
Зависимости между Дк цинка (2) или кадмия (1) и
содержанием элементов в фитомассе проростков
держанием радиоактивных изотопов цинка и кадмия в фитомассе
проростков чумизы и коэффициентами диффузии элементов в
почвах, на которых были выращены проростки, выражалась
коэффициентами корреляции 0,81 и 0,85, значимыми на уровне 0,05
и 0,01 соответственно. Зависимости между кажущимися
коэффициентами диффузии цинка и кадмия в почвах и содержанием
элементов в проростках представлены на рис. 3.3. Коэффициент
диффузии элементов лучше отражал поступление элементов в
растения, чем * доступные'' растениям формы соединений ^^ 2п
или 1 ^ Cd, определяемые с помощью экстракции ацетатно-
аммонийным буферным раствором с рН 4,8. Скорость, с
которой осуществляется транспорт цинка и кадмия в корневой
системе растений, является не менее важным фактором, чем
содержание соединений элементов в доступной для растений форме.
Низкие скорости диффузионной миграции цинка и кадмия в
почвах, полученные в нашей работе, являются косвенным
доказательством преобладающей роли процесса диффузии в транспорте
элементов к корням растений. Кроме того, низкие концентрации
5 Zn и ! Cd в почвенном растворе приводят к тому, что
передвижение элементов с почвенным раствором под
воздействием транспирационного тока воды (массопоток или
конвективный перенос) является небольшим.
- 54 -
При прогнозах накопления цинка и кадмия в растениях
следует учитывать не только свойства и состав почв, "доступные*
растениям формы соединений, но и скорость, с которой
осуществляется диффузионный транспорт этих соединений в почве.
3.3.4. Трансформация соединений цинка
и кадмия в почвах
Поступающие в почву соединения цинка и кадмия
подвергаются частичному или полному изменению под воздействием
разнообразных факторов. Также происходит превращение образующихся
в почвах форм соединений элементов. Эти процессы получили
название трансформации. Установлено, что со временем
происходит медленный процесс превращения легкодоступных форм цинка
в недоступные или иммобильные соединения /215/. Изучение
трансформации форм соединений цинка и кадмия в почвах
позволяет так же получить дополнительную информацию о природе
образующихся в почве соединений элементов. Исследования,
проведенные нами, позволили установить, что с увеличением времени
взаимодействия раствора соли цинка с почвой происходят
заметные изменения в содержании различных форм соединений цинка.
Количества 65 Zn, переходящие в ацетатно-аммонийный
буферный раствор с рН 4,8, быстро уменьшаются в течение первых
60 мин взаимодействия ^5 Zn с почвой. При дальнейшем
увеличении времени контакта почвы с раствором 6^ZnC] 2
снижение содержания этой формы соединений было очень медленным.
Таким образом, кинетика сорбции обменноспособного и непроч-
носвязанного цинка разделяется на две стадии - быструю и
медленную. Вышеописанный процесс сопровождается почти
параллельным увеличением доли кислоторастворимого цинка.
Дальнейший процесс трансформации соединений цинка и
кадмия в почвах изучали по данным микровегетационного опыта.
В почвы вносили отдельно ^5ZnCl 2 и "*" CdCl 2 из расчета
0,11 и 0,04 мкКи/г соответственно. После 7 сут
инкубирования почв при 60% полевой влагоемкости отбирали почвенные
образцы для анализа и высевали чумизу, через 45 дней после
посева снова отбирали образцы почв. Десорбцию соединений
цинка и кадмия проводили на воронках последовательными
исчерпывающими экстракциями Н2О; CHgCOO NH^ с рН 4,8;
2,5% СН3СООН и 1н. H2S04 (табл. 3.13, 3.14).
Содержание водорастворимого цинка и кадмия в почвах
определяется типом почвы и ее физико-химическими свойствами.
Содержание водорастворимого, а также обменоспособного и
непрочносвязанного цинка и кадмия выше в почвах с более
низкими значениями рН. Со временем происходило снижение
количества цинка, переходящего в NH^Ac, особенно сильно
выраженное на красноземе. Для кадмия скорость уменьшения содер-
- 55 -
Содержание в почвах внесенного Zn
различных экстрагентах (в числителе -
знаменателе —
Почвы
Чернозем типичный (ЧТ)
Дерново-подзолистая
неокультуренная (ДПН)
Дерново-подзолистая
окультуренная (ДПО)
Краснозем
Серозем
Каштановые
Чернозем южный (ЧЮ)
Чернозем
обыкновенный (ЧО)
Общее содержание
65 Zn ю4 мхб
(расп./мин«г)
24.13J0.92
23.64io.53
24.00l0.60
22.65io.47
23.12Jl.40
22.89io.79
23.55JQ.30
22.84io.25
22.99J0.83
23.llio.29
21.26JQ.34
21.05io.18
22.49JQ.83
22.34il.37
20t26Jjt,56
20.26il.49
н2о
1*
0,12io,03
следы
1.23JQ.15
0,6lio,34
p.ioio.os
следы
0.34JQ.06
0,14io,02
0.13JQ.01
следы
следы
слепы
следы
след"
следы
2Ш
0.5
5.1
2.9
0.4
-
1.5
0,6
-2i6_
0.5
-
-
* (расп./минтМО4, М±6;
** Процент от общего содержания в почве 6^Zn.
и количества элемента, растворимые в
данные по почвам первого отбора, в
второго)
Таблица 313
JtfH 4Ас, РН 4,6
1
5.72-0.25
3,22io,10
16.4_lo.53
9,12io,26
lp.22lo.23_
6, Зэ1о,36
14.83JQ.27
6,94^0,45
4.34I0.3I
3,12^0,23
6.1б1р.Г7
4,58^0,25
6.8CW0.30
5,73io,43
з.?^о___
2,48io,22
Экстрагент
2
23.7
13,6
68,5
40,3"
44.2
27,9
63.0
30,4
______
13,5
29.0
21,7
30.2
25,7
18.7
12,3
НАс 2,5%
1
O.67I0.O6
0,85io,09
1,5оЬ),_3
0,88lo,14
2.30-0.15
l,5lio,12
1.74-0.01
1,74-0,08
1.3з1о.09
0,98io,07
1.05-6.06
0,4б1о,04
1.09-0.05
1,14-0,10
0.59-0.05
0,69-0,07
2
2,8
3,6
6.6
3,9
10,0
6,6
7.4
7,6
5.8
4,3
5.0
2,2
_____
5,1
2.9
3,4
1 н. H2S04
1
16.97-0.51
17,00-0,18
5.38lp.2(_
5,25-0,21
9,78-0t32
9,13-0,35
J5.85lo.4_£
5,60-0,24
16.54-0.79
13,59-0,51
jj_40^0._l__
ll,68io,31
13.46_0._36
14,35-0,77
14,1-16,317
13,52lo,92
2
70.3
71,9
22.4
23,2
42.3
39,9
24.8
24,5
72.0
58,8
58.4
55,5
______
64,2
69.7
66,8
Содержание в почвах внесенного! 15»»» Cd
в различных акстрагентах (в числителе
в знаменателе
Обозначения почв такие же,
Почва
1
ЧТ-2
ЧО-2
Каштановые
Сероземы
ДПО
дпн
Красноземы
Общее содержание
115mcdio4
(расп./минт)
8.86^0.69
8,2lio,49
6,44^1,1^
6,27^0,35
7^41q.??
6,29io,59
7.43^0.64
7,08io,51
7,7^,03
7,7в1о,52
7,7^9.32
7.58^0,18
8^5^9,21
7,37io,35
7,67-9.99
6,71^0,48
н2о
1*
слепы
слецы
следы
следы
слепы
следы
следы
следы
следы
следы
следы
следы
9,43Ч>,9?
0,07iof01
0.07-0,93
0,02^0,03
2т
-
в
-
-
-&JL
0,9
0,3
HfH4Ac, рН
1
4.2СМЭ.35
2,77io,14
3.63^0.58
2,42io,16
5,99^о,;9
3,63^0,24
5.2С&).43
4,loio,28
5.38-0.60
5,32^0,35
4,90^9,^,9
3,70i0,21
6.24^0.2^5
5,08^0,35
5,S<Au2
4,79^0,20
* (расп./минт)-104; &£б
Процент от общего соде]
115т^,
в почве Со
Таблида 3.14
я количества элемента, растворимые
- данные по почвам первого отбора,
- второго)
как на табл. 3.13
Экстрагент
4,8
2
47.4
33,7
56.4
38,5
69.3
57,7
70,0
57,9
69,6
67,5
63,2
48,8
73,0л
68,8
68.6
71,4
НАс, 2,5%
1
0.20^0.02
0,19io,02
0.17-0.04
0,2о1о,Г
олэЬхо!
0,27io,03
1.21-0Д4
o,i9io,oi
0.2llo.03
0,6б1о,05
0.32^0.03
0,61^0,06
q.59^0.02
0,53^0,07
0.4б1о.02
0,50i0,08
2
2.2
2,3
2.6
3,3
2.6
4,3
16.3
2.7
2*1.
8,4
AS.
8,0
6.9
7,2
.5*2-
7,5
1 н. Н^С^
1
4,35&),22
4,68^0,38
2.09Ь).38
3,06^0,24
1„6710Д2
2,07io,15
0.80^0.17
2,25io,19
1,57^0,25
1,1э£о,09
Д,97Ь),13
2,49^0,19
О.ббиО.Об
l,18io,09
А.^О.РЭ
1,42^0,13
2
49.1
57,0
32.4
48,8
22,8
33,0
10.8
31,8
20.3
15,1
25^,5
32,8
7,7
16,0
2Q.6
21,2
жания обменноспособного и непрочносвязанного кадмия меньше,
а на сероземе и красноземе заметных изменений не наблюдали.
В данном эксперименте не выявлено значительного
увеличения содержания кислоторастворимого цинка и в некоторых случаях
отмечено даже снижение. Но при этом происходило возрастание
содержания прочнофиксированной формы соединений (соединения
цинка, не вытесняемые экстракцией 1н. H~S04). Кадмий по
сравнению с цинком менее прочно фиксировался в почве, и за
время эксперимента происходило возрастание кислотораствори-
мой формы соединений. Подвижность кадмия в почвах,
определенная по количествам элемента, экстрагируемого различными
растворителями, выше, чем цинка.
Полученные нами результаты эксперимента позволяют
наметить следующую схему процесса трансформации цинка и кадмия
в почвах:
Водорастворимые Обменные и непроч- кислотораст-
формы соединений носвязанные формы ~~ воримые
соединений формы сое—
м
динений
Прочнофиксированны е
формы соединений
Пути трансформации форм соединений можно определить
проведением следующих расчетов. Количества цинка, извлекаемые
из почв первого отбора водой, буферным раствором, 2,5%
уксусной кислотой и 1н. НС1, составляли от 91 до 100%. В почвах
второго отбора общие количества элемента, растворимые во
всех экстрагентах составляли только 63,1—89,1% (без ЧЮ).
Соединения, не растворимые в 1 н. HCl , мы назвали прочно-
фиксированными. Содержание прочнофиксированного цинка (в
процентах от общего содержания ^Zn B почве) составило для
ЧТ-2 10,9%, ДПН - 29,7, ДПО - 25,6, краснозема - 36,9,
серозема - 23,4, каштановой - 20,6, ЧЮ - 5 и ЧО-2 - 17,5%
(данные по почвам второго отбора). Количество соединений
цинка в прочнофиксированной форме, которое образовалось в почвах
за время проведения эксперимента, равно для ЧТ—2 - 8,3%,
ДПН - 29,7, ДПО - 22,5, краснозема - 33,8, сероземе - 20,8,
каштановой - 13,5 и для ЧС^-2 - 8,8%. Для полного
балансового расчета проведем также вычисление количеств элемента в
обменноспособной и непрочносвязанной форме, которые
трансформировались в более прочносвязанные соединения. Эти
количества равны разнице в содержании обменноспособного ^Zn
в почвах первого к второго отборов и составляли для ЧТ-2 —
10,1%, ДПН - 28,2, ДПО - 16,3, краснозема - 32,6,
серозема - 5,4, каштановой - 7,3, ЧЮ - 4,5 и для ЧО^-2 - 6,4%.
Из сравнения убыли в содержании ^5Zn , экстрагируемого из
- 60 -
почв ЫИ^Ас с содержанием прочнофиксированного цинка,
образовавшегося в почвах в ходе проведения микровегетационного
опыта, следует, что обменноспособная и непрочносвязанная
формы соединений внесенного цинка в черноземах типичном и обыкр-
новенном, в дерново-подзолистой окультуренной и неокультурен-
ной почвах, а также в красноземе трансформируются в прочно-
фиксированный цинк.
В другом эксперименте изучали трансформацию внесенных в
почвы твердофазных соединений цинка и кадмия. Серии навесок
почв в 550 г сег зема типичного, чернозема выщелоченного и
дерново-подзолистой почвы тщательно перемешивали с тремя
дозами смеси оксидов ТМ и пыли, взятой из рукавов фильтров
тонкой очистки выбросов свинцового завода (см. табл. 3.15).
Полученные смеси помещали в полиэтиленовые чашки.
Содержание тяжелых металлов в вариантах инкубируемых почв примерло
соответствовало уровню умеренно, средне- и сильнозагрязненных
почв и представлено в табл. 3.15. Почвы инкубировали при 60%
от полевой влагоемкости при комнатной температуре. Образцы
почв для определения рН, водорастворимых и обменных форм ТМ
отбирали через 5, 20, 50, 100, 220, 360 сут. Водные вытяж^
ки готовили с соотношением почва: раствор в 1:2,5. Обменные
ТМ вытесняли в 1 н. Са (N03)2 ПРИ соотношении почва:раствор-
- 1:10. Время взаимодействия в обоих случаях - сутки.
Трансформация твердофазных соединений ТМ в почвах
представляет суммарный процесс: 1) растворения оксидов
вследствие их неустойчивости в почвенных условиях; 2) адсорбции
ионов ТМ твердой фазой почвы; 3) образования новых твердых
фаз осадков (если для этого процесса есть условия).
Влияние характера соединений, в которых ТМ вносили в
почвы, на содержание водорастворимых форм проявляется,
по—видимому, только косвенно через воздействие на реакцию среды почв.
В сероземе, где рН оставался практически на одном уровне
независимо от форм и доз внесенных ТМ, содержание
водорастворимых металлов изменялось мало, что можно объяснить
образованием в процессе трансформации труднорастворимых карбонатов
металлов. Понижение концентрации до низкого и почти
одинакового уровня может вызываться и хемосорбцией ТМ на
поверхности кальцита. Такой процесс доминирует в карбонатных почвах и
предшествует осаждению самостоятельной твердой фазы
карбоната кадмия.
В модельных опытах с дерново-подзолистой почвой и
черноземом, так же как и для серозема, источник ТМ (оксиды,
техногенная пыль) существенно не влияет на уровень
водорастворимых ТМ. Увеличение дозы внесенных ТМ влечет к
возрастанию концентраций ТМ в водной вытяжке, которое было бы более
заметным, если бы ни возрастающее с дозой значение рН.
Внесение самой высокой дозы, возможно, приводит к образованию
труднорастворимых соединений ТМ.
- 61 -
Пыль с фильтров
Оксиды ТМ
С
А
Т
О
доза
(мг/кг)
Д-П
1 аг
°
Вариант
доза
(мг/кг)
СМ_ Г^ г*.
см см сГ
см
со
СО
о
о
о
СО
г-
о
о
о
см
00
н
н со
ю ю
о
со
со
1-*
о
г*-
о
<5
о
о
i4
1
н
^
С\Г
см
0,1
со
о
о*
о
ю
н
1
н
СО
СО
о
СО
о
о"
о
о
^
д
1—«
0)
со*
н
со
о*
V
о
6
о
о
со
д
и—А
со
со
1
о
о
§
д
н
ю*
о
н
н
н
о
о
о
о
со
д
ю
о
о
о
о
о
о
о
о*
о
н
Кадмий
012 1-
о
о*
СО
о
о
04 0,0
о
о
о
со
и
ю
о
о
о*
см
о
о
<э
о
^
047 II-
о
о*
о
н
о
02 0,0<
о
о
о
см
тН
д
о
о
см
г-
с
1
о
о
^
120 III-
q
о"
см
о
14 0,0
о
о
о
о
см
тЧ
д
г-
ю
СО
СО*
н
°i
ю
с»
ю
СО
СО
*н
о
со
°1
Ф
^
*
ю
см
со*
^
со
»—*
со
со
1
о
со*
^1
1>
Is-
00 |
s
- 62 -
Обменные формы соединений определяли только для цинка
(табл. 3.16). В течение инкубации содержание обменного
цинка уменьшалось со временем» за исключонием серозема, для
которого оно оставалось почти постоянным независимо от формы
внесения. Для других почв равновесное состояние не было
достигнуто, содержание обменного цинка продолжало уменьшаться
через год инкубации. Переход металла из обменного состояния
в более про- юсорбированное (специфическая адсорбция или,
возможно, осаждение при внесении высоких доз ТМ) можно
связать с дегидратацией катионов, способствующей образованию
ковалентной связи их с ППК, а в том случае, если
образовался осадок, то с его постепенной кристаллизацией.
Доля обменносвязанного цинка от внесенного количества
как в черноземе, так и в дерново—подзолистой почве
уменьшалась при увеличении общего содержания металла, очевидно,
из-за более высоких значений рН в варианте, где внесено
6000 мг/кг цинка. С этим же связано и увеличение
обменного цинка в этом же варианте, где вносилась пыль и значения
рН были ниже.
Таблица 3.16
Содержание обменного цинка в инкубированных
почвах после внесения оксида (О), техногенной
пыли (П) (мг/кг)
Сроки
пробоот*-
бора, сут
5
20
50
100
360
5
20
50
100
360
1»|
с-о
1.5
0,8
0,4
0,5
0,6
6,5
3,5
5,0
6,5
6,5
4-0
Вне
90
88
80
72
62
Вне
340
270
100
83
75
Д-0
юено 60(
350
280
210
166
142
юено 60(
1400
620
360
316
274
С-П
) мг/кг
1.1
0,5
0,5
0,4
о,ь
Ю mt/ki
-
-
-
-
-
ч-п
46
40
42
38
28
520
410
330
310
280
д-п
310
-
196
148
••
1720
1410
940
870
720
Примечание* С — серозем, fi~ дерново-подзолистая
почва, Ч - чернозем.
- 63 -
3.4. ЦИНК И КАДМИЙ В РАСТЕНИЯХ
Изучение почв и растений как целостной системы, связанной
потоком химических элементов и их соединений, широко
применяется в агрохимии. Такой же подход может служить основой
для определения влияния тяжелых металлов на растения и
почвенную биоту, животных и человека по пищевой цепи. На
поглощение цинка и кадмия растениями влияет множество факторов.
Среди них в зоне влияния источника загрязнения можно
выделить: 1) расстояние до источника загрязнения и его мощность;
2) количество и состав газопылевых выбросов, выпадающих на
растения и почву; 3) педохимия элемента, трансформация и
состояние его соединений; 4) свойства и состав почв,
динамика почвенных процессов; 5) физиологические особенности
растения.
Высокие концентрации цинка и кадмия негативно влияют на
растения, обладая высокой фитотоксичностью. Это объясняется
значительной подвижностью этих элементов в почвах и
отсутствием блокирующего механизма поступления их в растения /326/.
Избыток микроэлементов приводит к дисбалансу компонентов
питания в растениях и влияет отрицательно на синтез и фуню-
ции многих биологически активных соединений: ферментов,
витаминов, гормонов. В процессе приспособления у организмов
вырабатываются механизмы регуляции применительно к
экзогенным высоким концентрациям элементов, но существуют
допустимые количества поглощенных Zn и Cd , выше которых
регулирующая система растений уже не справляется.
По мнению В.Б. Ильина, у большинства растений нет
специфического (только от тяжелых металлов) защитного механизма,
так как в естественных условиях им не приходилось
адаптироваться к высоким концентрациям микроэлементов, но в
растении существует несколько систем контроля за поступлением
ионов ТМ /65/. Покровная ткань корней обладает
значительной адсорбирующей способностью, поэтому поступление ионов
металлов из почвы в надземную часть может тормозиться за
счет этого барьера /79/. Также подвижность тяжелых
металлов может снижаться за счет хелатирования их разнообразными
органическими соединениями - продуктами метаболизма
растений. Определенную защитную функцию могут выполнять клетки
пояска Каспари /63/. Таким образом, найденное в корнях
большое количество тяжелых металлов приурочено главным образом
к эпидермису и эндодерме, а поступающий в ксилему
надземных органов поток элементов значительно очищается от
токсических соединений. Под особой защитой в растениях находятся
репродуктивные органы. Слабое влияние высокого содержания
элементов в почве на их концентрации в плодах и семенах
проявляется в видовом постоянстве биохимического состава или
- 64 -
в ограниченном поступлении минеральных компонентов в
результате сложившегося в процессе эволюции раздельного ксилемно—
го и флоэмно: „ потоков веществ /66/.
Распределение необлигатных элементов и тяжелых металлов
по органам растений носит отчетливо акропетальный характер:
корни > стебли ^ листья > плоды (семена). Эта тенденция
слабее проявляется на почвах с нормальным содержанием
микроэлементов и хорошо заметна на почвах с избыточным
количеством ряда тяжелых металлов и неметаллов.
Известно также, что с обогащением почвы ТМ происходит
четко выраженная видовая дифференциация фитоценоза.
Различные виды растений в значительной степени отличаются по
способности поглощать эти элементы из почвы. Так, в золе Si-
lensinflata содержится 2,1% цинка, a Thlaspi calaminari -
более 13% цинка, что вызывает гибель всех других видов /201/.
Растения хорошо растут и развиваются при определенных
диапазонах количеств элемента в почве, для цинка это содержание
составляет примерно 30-70 мг/кг в почве, в растениях - 20-
70 мг/кг сухой массы.
Токсическое действие цинка и кадмия увеличивается вблизи
предприятий. Примерно 60% элемента поступает в растения из
почвы и только 40% из атмосферы /334/. Предполагается, что
кадмий адсорбируется в почве преимущественно в обменной
^форме, что приводит к значительной аккумуляции его
растениями. Например, при валовом содержании кадмия в загрязненной
почве 100 мг/кг количество его в корнеплодах редиски было
387 мг/кг сухой массы. Одни растения (например, бобовые)
оказались более чувствительными к повышенному содержанию
Cd в субстрате, другие (ячмень, капуста, томаты) менее чувств
вительными /334/. В ряде случаев повышенное содержание
кадмия в почве не оказывает заметного влияния на урожай сель=
скохозяйственных культур, однако в растениях наблюдается
заметное повышение содержания кадмия, особенно в зеленых
овощах и такой культуре, как салат /317/.
В последнее время уделяется большое внимание роли
почвенных условий на поступление цинка и кадмия в растения.
Наибольшее влияние, как принято считать, оказывает реакция
почвы на транслокацию элемента /39/. На почвах с рНр^О > 6
большая часть цинка находится в недоступной для растений
форме, а с увеличением кислотности почвы содержание
доступного цинка резко возрастает. Такая же закономерность
наблюдается и для соединений кадмия. Наименьшая растворимость
для кадмия в условиях эксперимента получена для карбонатных
почв при рН 6,6 /350/, рН осаждения гидроксида элемента
имеет широкий диапазон (5,4=8,0). Известкование и внесение
в почву органических удобрений, в том числе сидератов,
снижают подвижность тяжелых металлов в почвах /380/.
- 65 -
Подвижные,
мг/100 г.
почвы
Содержание
частиц, %
см
1 1° 1
! о
СМ I
<0,001
мм
<0,01
мм
Поглощенный
Са
Емкость
поглощения
с 1
о
о
Н I
\ 1
Ч
ь 1
2
о" 1
I
KCt
с
СМ
х
Почва,
место взятия
1
1
см
^
СМ
т-1
СМ
^
о
. *"■ ю
СМ
н
СМ
о
н
(D
СО*
СО
^f
1
s н
£|
§£
ф » «
о а
W Й И
51 о J
ь « 2
о я ft
§ § S
1 w <
Д я Г
ернс
рен:
обл
Ч
*
00
о"
1
1
о
ю
см
гН
см
со
н
1
ю
СО
■8.8
s §
Я 2
О g
со 2
о §
я
О £
d
Ж
со
ю"
н
*
о
со"
сч
г-~
Т-»
^
см
о
0)
ю
н
о
н
см"
о
ю"
ч.
ю
ф
ft
S
о
СО
о
О Ф
СО *
о *
§ 2
о 8
|8
П
1
1
1
1
1
ю
со
н
1
о
00
0)
^г"
ю
ю"
ф
*
2
СО
5
я
1
я
ь
№
3
&
'Я
§
я
S
с:
а
£-*
ф
8
ф
у
1
СМ
Г-"
см
г-
^
^г
о
о
^
со
ю
СО
1
ч.
со"
«•—ч
о
%
.
§
я
8
а
н
<
>>
о
S
2
о
я
§
о
§
&
СО
I
д
о
ь
в
в
о
я
ф
а
я
ф
ф
ф
*
W
a
я
1
§
я
8
Ф
ё
с
1
66 -
Нами проводилосл изучение трансформации соединений цинка
и кадмия в зависимости от состава почв и поступление их в
растения в условиях вегетационных опытов. В вегетационном
опыте с Zn , заложенном в 1979 г., были использованы Ai и
Апах ряда почв: дерново-подзолистой слабоокультуренной (ДПН),
той же почвы, известкованной из расчета 1,5 гидролитической
кислотности (ДПИ); дерново-подзолистой окультуренной (ДПО);
чернозема типичного (ЧТ), торфа (т) (табл. 3.17).
Опыт закладывали в полиэтиленовых сосудах емкостью 5 л.
Почву предварительно измельчали и просеивали через сито 2 мм.
В каждый сосуд помещали по 5 кг воздушно-сухой почвы, 2л
вносили в виде Zn(NC>3)2 и ZnO (табл. 3.18).
Таблица 3.18
Количество внесенного в почвы цинка, мг/кг
Форма
внесения
Варианты
1
2
3
4
5
6
Zn(N03)a ° 125 250 50° 100°
конт-
ZnO роль 125 250 500 1000 2000
Повторность опыта трехкратная, продолжительность - 2 года,
Для изучения влияния известкования на мобильность Zn и
доступность его растениям дерново-подзолистую неокультуренную
почву известковали из расчета 3,5 г СаСОз на 1 кг. В опыте
с внесением Zn (N03)2 все варианты выравнивались по азоту.
В качестве тестовых культур использовали ячмень, салат,
петрушку. Полив производили дистиллированной водой, поддерживая
влажность на уровне 60% от полной полевой влагоемкости. В
растениях (солома и зерно ячменя, листва салата, листья и
корни петрушки) определяли цинк поело сухого озоления и
растворения остатка в 1 н. Н NO3 атомно-абсорбционным методом
(пламенный вариант). В почвах определяли цинк, переходящий в
вытяжки: NH4Ac с рН 7,0; NH4Ac с рН 4,8; 1 н. HNO3,
бидистиллированная вода.
Как показали фенологические наблюдения, всхожесть семян
ячменя сорта 'Московский 121' достоверно снижалась на ДПН
независимо от внесенного соединения цинка при дозе 1000 мг/кг.
Статистически значимое снижение урожая зерна и соломы на
этой почве наблюдалось уже при 125 мг/кг цинка, а к 40-му
дню аегетации наступила гибель растений при дозе элемента
250 мг/кг ( ZnO и Zn(N0o)2). На этой почве растения испы-
- 67 -
тывают неблагоприятное влияние как повышенных доз цинка, и
воздействие кислой реакции среды, высокой мобильности цинка.
На ДПИ и ДПО растения в течение всего вегетационного
периода развивались нормально. Статистически значимое снижение
урожая с вероятностью 0,95 отмечено при дозе 1000 мг/кг
цинка независимо от формы внесения элемента. На черноземе
прослежено наименьшее снижение урожая культур с увеличением
дозы цинка. Инактивирующее свойство чернозема связано с
образованием элементоустойчивых комплексных соединений с
органическим веществом, а также с образованием
труднорастворимых соединений, возможно карбонатов, бикарбонатов,
фосфатов и гидроксидов.
Большинством авторов отмечена высокая корреляционная
связь между содержанием цинка в растениях и его количеством,
переходящим в раствор ацетатно-аммонийного буфера с рН 4,8
(далее подвижный Zn ). В нашем опыте со всеми почвами
такой коэффициент корреляции колебался в пределах 0,91-0,99 с
уровнем значимости 0,05. Наибольшее количество подвижных
форм соединений цинка обнаружено в ДПН (70-80%) от внесен-/
ного количества, наименьшее в черноземе типичном (50-60%).
В соломе ячменя наибольшая концентрация цинка отмечена на
ДПН по сравнению с растениями с одинаковой дозой элемента,
но выращенных на других почвах. На этой почве уже при дозе
125 мг/кг в надземную массу растения поступает количество
элемента выше установленного ПДК для кормов и продуктов
питания (ПДК принято 300 мг/кг) /199/. Накопление
металла в соломе вызывает гибель растений на ДПН уже при
содержании цинка в почве 250 мг/кг.
После известкования этой кислой почвы поступление из нее
цинка резко снижается. Известкование кислой почвы приводит
к повышению рН почвенного раствора, следовательно, к
снижению обменных и доступных растениям форм соединений цинка.
Низкое содержание органического вещества и вследствие этого
незначительное количество органических комплексов металла
приводят к тому, что элемент легко мобилизуется
корневыми выделениями растений. По сравнению с ЧТ, богатым
органическим веществом (рНц20 ~ 6»4)» на ДПИ поступление
элемента в солому ячменя при повышенном содержании его в корйео-
битаемом слое достигает относительно высоких значений. Так,
при дозе 1000 мг/кг накопление цинка в соломе в 18 раз
превышает его концентрацию в контрольных растениях и
достигает 2985 мг/кг сухого вещества. Содержание элемента в
зерне почти в 10 раз ниже, чем в соломе. Однако при высоких
дозах содержание цинка в зерне ячменя заметно возрастает и
достигает 401 мг/кг при 1000 мг/кг элемента в почве, что
почти в 7 раз превышает концентрацию цинка в контрольном
зерне и выше ПДК в кормах.
Салат по сравнению с зерновыми (ячмень) оказался более
требовательным к условиям произрастания. Всхожесть семян
- 68 -
салата на кислой ДПН почве не превышала 5-10% даже в
контрольном варианте, гибель растений наступала при самой малой
дозе элемента. Отмечено высокое содержание цинка в листьях
салата на ДПИ, приводящее к гибели растений при дозе
500 мг/кг. Наблюдается резкий скачок в накоплении цинка
биомассой салата при переходе от контроля к вариантам с
повышенным содержанием цинка в почве. При дозе 125 мг/кг
поступало элемента в фитомассу почти в 10 раз, а при 250 мг/кг
в 30 раз больше, чем в контроле. Концентрации цинка в почве,
приводящие к гибели салата, оказываются менее токсичными
для растений ячменя, хотя уровень накопления элемента
биомассой салата и соломой ячменя примерно одинаков.
На ДПО поступление цинка в солому ячменя несколько выше,
чем на ДПИ, Это связано с более низким значением рН
почвенного раствора (рНр^О 6,1) и, как следствие этого,
повышенным содержанием подвижных соединений цинка по сравнению с
ДПИ (рис. 3.4). Однако ДПО достаточно хорошо обеспечена
элементами минерального питания, содержит больше гумуса.
Поэтому растения легче переносят на ней повышенные
концентрации цинка и степень угнетения их выражена значительно
слабее. Содержание элемента в зерне ячменя и в растениях
салата достоверно не отличается на этих почвах.
и
12
10
8
b
4
2
г/к г
-
-
-
■к
Z
А
I
/
^^2
й^4
I
7 2
16
74
12
10
8
6
4
2
—
-
-
В
1^1 1
У^^^**
1_
Zn
1 2 5
в почве (мг/нг-10г)
20
Рис. 3.4. Подвижный цинк в почвах: А - опыт с внесением
Zn(N03)2» Б - опыт с внесением ZnO. Почвы: 1 - ДПН,
2 - ДПИ, 3 - ДПО, 4 - ЧТ
Наименьшее поступление цинка в растения характерно для
чернозема типичного. Высокое содержание органического
вещества гуматного характера, большая емкость поглощения,
нейтральная реакция почвенного раствора способствуют переводу большей
части подвижного цинка в труднорастворимые малодоступные для
- 69 -
растений соединения. Однако превышение ПДК цинка для
кормов на черноземе (солома ячменя) наступает при 250 мг/кг
элемента в почве. Можно также отметить, что на всех почвах
опыта поступление цинка в растения салата ниже при внесении
в почву труднорастворимого оксида, чем азотнокислой его соли.
Распределение цинка в надземной и подземной частях
петрушки строго дифференцировано. Поступление его в корни резко
возрастает при увеличении концентрации в почве, при 1000 мг/кг
содержание цинка в корнях в 250 раз превышает его
содержание в контрольных растениях. По сравнению с корнями
надземная часть петрушки накапливает в 10 раз меньше элемента.
Наиболее сильное влияние оказывают дозы 1000 и 2000 мг/кг
Zn, происходит резкое увеличение поступления элемента в листья.
На более низких дозах содержание его в листьях петрушки
увеличивается незначительно - от 2 до 40 мг/кг сухого вещества.
Однако даже при самой высокой дозе цинка в почве содержание
его в надземных органах не достигает критического уровня.
Хотя на черноземе поступление избыточных количеств цинка
в растения значительно ниже, чем в растения на других почвах
опыта, однако ЧТ инактивирует подвижные соединения цинка в
меньшей степени, чем можно было ожидать. Мобилизация
элемента растением из этой почвы возможна не только за счет
достаточно высокого количества обменного элемента, но и за
счет корневых выделений растений и микроорганизмов, которыми
богат чернозем.
Результаты эксперимента позволяют отвести ведущую роль
в регулировании поступления цинка в растения составу и свойств
вам почвы. Физиологические и видовые особенности культур
также во многом определяют накопление цинка растениями и
распределение элемента по органам. Корни растений до
определенного предела обеспечивают защиту надземных органов. Листья
петрушки, например, содержат незначительное количество цинка
по сравнению с его концентрацией в корнях. Если, несмотря на
защитную функцию корней, токсикант проникает в стебель и
листья, то растение способно ограничить его поступление в
репродуктивные органы (зерно ячменя).
Проблема установления ПДК тяжелых металлов при контроле
за загрязнением среды приобретает все большую актуальность.
Однако сложность в решении этой задачи заключается в том,
что основное количество химического элемента поступает в
организм человека не прямым путем, а через растения, животных,
воду. В настоящее время в нашей стране и за рубежом имеются
методики по нормированию вредных веществ в почве /103,122/,
однако, они не учитывают состав и свойства почв,
трансформацию токсикантов в почвенно-экологических условиях.
В. В. Ковальский /73/ считает, что концентрация цинка в
почве, в пределах которой нормально функционируют
регулирующие системы организмов, составляет 30-70 мг/кг почвы. По
- 70 -
н
со
d
к
ю
н
фг:
II
СО А
X ffl
Ф
Si
X tt
ф CQ
fc a
о ф а
ё§8
й и
" ф
I
К со
«
CO Q hj
Ф*а 2 *Ь
s
о
о
ю
ю
СМ
Н
о о о
о о
ф
X
ю
СМ
н
ю
СМ
н
ю
см
н
о
ю
СМ
о
н
ю
СМ
н
ю
СМ
тН
О
о
о
н
о
о
о
см
о
н
ю
см
н
о
о
о
н
о
о
о
н
о
о
о
гм
о
СМ
о
ю
СМ
о
о
о
см
X
о
со
ест]
вещ
ф
о
к
о на су
3
а
rrt
[еталлг
2
ф
X
одержан
о
X
S
о
о
о
СМ
Ю
см
I 8
X я
О О
о о
о о
Н СМ
&
со
я
ю
СО
ф
ф
со
а
к
из
аг
со
ф*
к
«
СО
Ф
К
Си
- 71 -
мг/кг
W0\-Vy
2,5 5
Внесено
. 20 50 100
Cd В почОу (ж/кг)
Рис. 3.5. Влияние кадмия на урожай ячменя и Поступление
его в различные части растения (заштрихованные столбики -
мг/кг
2,5 5 10 20 50
Внесено Cd 6 почбу (мг/кг)
зерно, светлые столбики - солома). Содержание кадмия (мг/кг
сухого вещества) в растениях: 1 - солома, 2 - зерно, 3 -
листья салата
И.Е. Зимакову /51/, содержание цинка в дерново-подзолистой
опесчаненной почве 150-190 мг/кг не оказывает отрицательного
влияния на растения. Превышение этого порогового содержания,
по данным автора, приводит к угнетению растений и снижению
урожая (дозы Zn 250 и 500 мг/кг действуют угнетающе).
Некоторыми зарубежными авторами предлагаются максимально
толерантные концентрации цинка в растениях: 250-300 мг/кг /199/
200 и 400 мг/кг /193/.
Необходимо проводить комплексное изучение всех
необходимых показателей и в первую очередь использовать
общепринятые в почвенно-агрохимической практике методы, постановку
вегетационных и полевых опытов. Предлагаем считать
концентрации цинка, превышающие оптимальный диапазон содержания
элемента, необходимого для нормального протекания
биохимических процессов в растениях, но не ведущие к угнетению и
гибели - толерантными. Нами сделана попытка выявить
границы токсичных концентраций для растений в различных почвах,
вызывающих гибель растений, снижение урожая зерна и соломы, х
приводящие к накоплению элемента в кормах и продуктах
питания. Основой таких градаций послужили результаты
вегетационного опыта (табл. 3.19).
Вегетационный опыт с кадмием проводили на почвах:
дерново-подзолистой неокультуренной (ДПН), дерново-подзолистой
окультуренной (ДПО), черноземе типичном (ЧТ), торфе (Т);
схема опыта представлена в табл. 3.20.
Таблица 3.20
Количество внесенного в почвы Cd
Почва
■ i »
Варианты
1
2
3
4
5
6
7
ДПН О 2,5 5,0 10 20 50 100
ДПО О 2,5 5,0 10 20 50 100
ЧТ О - - 10 - 50 100
Т О 2,5 5,0 10 20 50 100
Фенологические наблюдения, проводимые в период вегетации,
показали, что токсическое действие кадмия в 1980 г (3-й
год опыта) наблюдали только на дерново-подзолистой
неокультуренной почве при высоких дозах элемента (50 и 100 мг/кг
Cd ). Статистически значимое снижение урожая соломы с
вероятностью 0,95 обнаружено на этой почве при доз^е 50 мг/кг
(рис. 3.5). На других почвах токсическое действие кадмия не
проявилось,
- 74 -
Количество 'подвижных соединений кадмия на всех почвах
возрастает пропорционально дозе внесения элемента в почву,
хотя наибольший процент приходится на ДПН (92-98%). На
дерново-подзолистой окультуренной почве ацетатно-аммонийный
буферный раствор (рН 4,8) извлекает 65-70% от внесенного
количества элемента, а на черноземе около 52% (рис. 3.6).
60 80
100 20 40
Cd в почве (мг/кг)
60 80 100
Рис. 3.6. Формы соединений кадмия в почвах; А -
ацетатно-аммонийный буферный раствор с рН 7,0, Б -
ацетатно-аммонийный буферный раствор с рН 4,8; почвы: 1 - ДПН, 2 -
ДПО, 3 - Т, 4 - ЧТ.
Увеличение подвижности соединений кадмия в торфе (Т) до
86-96%, по-видимому, можно объяснить тем, что в кислую
вытяжку могут частично переходить растворимые фульватные
комплексы элемента.
Таблица 3.21
Нормирование содержания кадмия в почвах,
данные 1980 г. тест-культура-ячмень;
ПДК - 3 мг/кг
Почва
ДПН
ДПО
ЧТ
Т
рантная для
растений
доза,
мг/кг
Концентрации Cd в почве, мг/кг
гибель
растений
отсутствие
зерна
снижение
урожая
солома
зерно
10 >100 50 50 10
100 То же >100 >100 >100
100 То же то же то же то же
100
то же
то же
то же
то же
накопление
Cd выше ПДК
солома
зерно
2,5 10
5,0 100
100 100
10
100
- 75 -
Буферная способность почвы по отношению л кадмию
обусловливаете* в первую очередь свойствами и составом самой почвы,
Сильногумусированные горизонты почв с высоким значением рН
способны связывать большие количества элемента в
малодоступные растениям соединения, инактивация же избыточных количеств
тяжелых металлов значительно ниже в слабогумусированных
кислых почвах. Утяжеление механического состава также
увеличивает буферную емкость почв. Поступление элемента в растения
обусловлено в первую очередь составом и свойствами самой
почвы, которые активно влияют на трансформацию соединений
элементов, вносимых в почву. По количеству подвижных
соединений и адекватно с этим степени накопления кадмия
растениями почвы расположены в следующий ряд: ДПН > ДПО > Т > ЧТ.
Различные культуры способны по-разному накапливать
элементы; листья салата по сравнению с соломой ячменя содержат
в 1,5-2 раза больше кадмия при равных дозах его в почве.
Наименьшее количество элемента поступает в зерно ячменя
(см. рис. 3.5). Кадмий по сравнению с цинком даже при
малых количествах в почве (табл. 3.21) приводит к превышению
ПДК для кормов и продуктов питания (3 mi /кг сухого
вещества) /199/, особенно на кислой ДПН почве. Это
свидетельствует о том, что растения в меньшей степени защищены от
избыточных количеств кадмид, чем это характерно для свинца.
4. РТУТЬ
4.1. ХИМИЧЕСКАЯ ХАРАКТЕРИСТИКА РТУТИ
И ЕЕ СОЕДИНЕНИЙ
Ртуть находится во второй группе Периодической системы
элементов Д.И. Менделеева. Ее порядковый номер 80, атомный
вес 200,61, внешняя электронная конфигурация 5<|^ 6§^,
атомный радиус 1,60А» радиус иона Hg (II) 1,10 А. Для
ртути характерна высокая летучесть: давление насыщенного пара
элемента при 20°С составляет 1,268«10~^ мм рт,сг. Ртуть
испаряется при всех температурах, вплоть до температур ниже
точки плавления (-38,87°С) /34/.
В соединениях ртуть может быть как двухвалентной, так и
формально одновалентной. По данным рентгеноструктурного
анализа и результатам измерений электропроводности в
соединениях ртути Hg (I) обнаружена связь между атомами - Hg -
Hg, которая не разрывается при электролитической диссоциации,
а в раствор переходит ион Hg 2 . Ртуть характеризуется
высокими потенциалом ионизации и окислительным потенциалом и
является химически стойким элементом.
Ртуть не окисляется в атмосфере сухого воздуха, но
медленно окисляется кислородом при повышенных температурах. Ртуть
реагирует с галогенами, серой, фосфором, селеном и
некоторыми неметаллами /34/. Растворимость ртути в воде в
отсутствие кислорода при 20°С составляет 6,1*10"^ г/л и
существенно зависит от рН раствора /138/. Минимальная растворимость
наблюдается при рН 8, с увеличением кислотности или
щелочности растворимость возрастает, что обусловлено амфотерностью
гидроксида ртути /34/. /
Число устойчивых соединений Hg (I) ограничено вследствие
реакции диспропорционирования и поэтому мало вероятно наличие
их в почве.
Оксид ртути HgO растворим в разбавленных соляной и
азотной кислотах, нерастворим в спирте и эфире, слабо растворим
в воде.
Гидроксид ртути Hg(QH)o очень неустойчив; равновесие
Hg(0H)2^^ HgO + H2O сильно смещено вправо. Несмотря
- 77 -
на это, длительное существование HtfO в почве мало вероятно,
так как оксид ртути способен действовать как окислитель на
многие органические соединения, восстанавливаясь до
металлической Hjr.
Сульфид ртути HyS - наиболее устойчивое соединение
элемента (ПР - 4,0.10-53 при 20°С). Он может присутствовать
в почвах и породах при очень низком значении Eh и наличии S
(табл. 4,1).
Таблица 4.1
Стандартный потенциал ртути в различных растворах
Уравнение
Н^ + 20Н~ « HgO + Н20 + 2е
2Ну + 50^- = H$2S04 + 2e
Ну + 4С1- = HgCl|- + 2e
2Ну + СгО^~ = Ну2 Сг04 + 2е
2Hg- + 2С1~ = Нр2 С\2 + 2е
Hg- + 4£ = Hg-J^"" + 2e
Hg + S2" = HgS + 2e
Eo(B)
+0,926
+0,615
+0,48
+0,41
+0,268
-0,04
-0,70
Сульфат HgS Од - водный раствор этой соли гицролизуется
с образованием основного сульфата, С сульфатами щелочных
металлов ртуть образует комплексы типа Na2 S O4 • 3 Hg S O4 • 2, Но О,
Галогениды Hg (например, Hg С] 2 - сулема) легкораствори—
мы в воде, кислотах и некоторых органических растворителях
(спирте, пиридине, эфире, бензоле) /34/.
Одной из главных особенностей иона ртути является способ^-
ность к образованию комплексных соединений с
координационными числами от 2 до 8. Связь ртуть - лиганд во всех
комплексах является ковалентной. Наиболее устойчивы комплексы' с
лигандами, содержащими атомы галогенов, углерода, азота,
фосфора, серы. Галогенидные комплексы образую! ^леду1 чй ряд
устойчивости:
Г > ВГ > СГ > F~
В водных растворах ионы Hg(IJ) с ионами CJ"", Вт", J"
образуют комплексы типа HgX , HgX^ , HgX^, HgX^| при
концентрации Hg £ 0,01 г • ион/л. При бопег высоких
концентрациях ртути образуются полиядерные комплексы. Известны также
- 78 -
прочные комплексы ртути с цианид- и роданид ионами, рядом
кислородсодержащих анионов, с аммиаком /34, 93/. Ртуть
образует также значительное число комплексов с органическими
реагентами, характеризующихся высокой прочностью, особенно,
в случае серосодержащих лигандов (8 - меркаптохинолин, тио—
мочевина и др.).
Известны и ртутьорганические соединения типа RHgX или
R2Hg, обнаруженные в последнее время в ряде объектов
окружающей среды (донные осадки, природные воды). Если X (С1 "",
Br"", j", С N", ОН*", SCN-"), то RHgX предста^яет неполярное
ковалентное соединение, менее растворимое в воце, чем в
органических растворителях. Анионы типа S О^"" и NO^
образуют солепоцобные, легкорастворимые в воде соединения,
например, RHg+NO". Диалкилы и диарилы R2^g ~ неполярные,
летучие твердые вещества, проявляющие слабую реакционную
способность по отношению к кислороду, воце и к органическим
функциональным группам /34/. Соединения типа Ro^g, как
правило, термически нестойки и разлагаются при температуре
100-120°С.
Таким образом, физические и химические свойства ртути
обусловливают разнообразие неорганических и органических
соединений элемента, часть из которых обнаружена в почве.
Переходя к рассмотрению поведения ртути в почве, необходимо
учитывать химические свойства элемента и его соединений, а
также такие почвенные факторы, как
окислительно—восстановительные условия, реакция среды, наличие органических веществ,
состав минерального субстрата, микробиологическая активность
почв.
4.2. ИСТОЧНИКИ ПОСТУПЛЕНИЯ РТУТИ В ПОЧВУ
Основными источниками поступления ртути в биосферу
являются газопылевые выбросы горнодобывающих и
перерабатывающих промышленных предприятий, сжигание угля и
нефтепродуктов, промышленные и сточные воды, применение ртутьорга-
нических фунгицидов и пестицидов s сельском хозяйстве,
вулканические выбросы и термальные воды (до 1000 т/год). По
оценкам исследователей, при ежегодном потреблении ртути в
Мире порядка 10 000 т примерно половина этого количества
рассеивается в окружающей среде /301/.
В природе ртуть находится в основном в рассеянном
состоянии. Среднее содержание ртути в земной коре составляет
5-7» 10""6 маС'% /152/; в горных и осадочных породах кларки
ртути составляют в мае. % /14, 26/:
- 79 -
Силикатная фаза каменных ~
метеоритов-хондритов 1-10
Основные породы (базальты,
габбро, нориты, диабазы) 9'10"
—5
Кислые породы 4-10
.-6
—5
Осадочные породы (глины, сланцы) Ф10
Песчаники 3«10""
Карбонатные породы 4»10""
Ртуть встречается в природе как в самородном состоянии,
так и в соединениях, образуя самостоятельные ртутные
минералы: киноварь HgS - 56,2%; тиманит HgSe - 71,7; ливингсто-
нит HgS -2SB2S3 - 22t монтроидит HgO - 92,61% и др.
Ртуть входит в качестве изоморфной или механической примеси
в реальгар, антимонит, молибденит, пирит, пирротин, сфалерит,
халькопирит и другие минералы, среднее содержание ртути в
каменном угле 1-1СГ6%.
В осадочных породах литосферы ртуть распределяется
довольно равномерно, хотя можно отметить тенденцию к
обогащению ртутыб кислых горных пород и глинистых сланцев /150,
286/. Характерно, что содержание ртути в осадочных породах
порядка 3,5* 10""6% ниже ее кларка в земной коре.
Высокая упругость паров ртути обусловливает ее наличие
в атмосфере. Кларк ртути в атмосфере -С 2*10""8 мг/л (или
< 0,02 мкг/м^) /152/. Обнаружено существование ртутных
воздушных ареалов над некоторыми месторождениями.
Особенно высока концентрация ртути в газах вулканов и горячих
источников (3-23,3 мг/м3}, в воздухе крупных промышленных
центров - до 3-39 мг/м3 /14/. Содержание ртути в
гидросфере составляет 3*10"" %, в гидротермальных водах 10-7 -
10-6 г/л /152/.
4.3. СОДЕРЖАНИЕ РТУТИ В ПОЧВАХ
ТЕХНОГЕННЫХ И ФОНОВЫХ ЛАНДШАФТОВ
Содержание ртути в почвах фоновых территорий изменяется
в очень широких пределах -отп-10 доИ-10" %, что обусловлено
действием многих факторов и прежде всего содержанием
элемента в почвообразующих породах (табл. 4.2). Уровень содержания
ртути в почвах, как правило, выше,чем в почвообразующих
породах, в 1,5-15 раз /286/.
Аномально высокие уровни концентраций элемента,
обусловленные влиянием материнских пород, найдены в почвах
Донецкого угольного бассейна - п »10~^%, что почти в 1000 раз
- 80 -
Таблица 4.2
Содержание ртути в почвообразуюпдах породах
Порода
Hg*, мас.%
Морена карело-польская (Мурманская
обл.) 0,15-10
—5
Морена карбонатная (Псковская обл.) 0,67«10
—5
Покровный суглинок (Тульская обл.) 0,77*10
Лёссовидный карбонатный суглинок
(Тульская обл.) 0,54-10
Лессовидный некарбонатный суглинок
(Воронежская обл.) 0,25*Ю-"
Отложения Хвалынской трансгрессии
(Волгоградская обл.) 0,20*10
г-5
превышает кларк ртути в литосфере /41/. В горных почвах
рудных провинций Алтая концентрация ртути составляет 2«1СГ"4%
/43/. Повышенное содержание ртути обнаружено в почвах,
сформированных на продуктах выветривания вулканических пород
/68, 112/. Независимо от состава почвообразующих пород,
повышенные в 2-3 раза концентрации ртути отмечены в
пойменных почвах аккумулятивных ландшафтов /157/.
В нейтральной и слабощелочной среде миграция ртути
ограничена, и ее распределение по почвенному профилю
характеризуется низкой контрастностью: содержание ртути в гумусовом
горизонте обычно выше, но мало отличается от содержания в
мелкоземе элювия коренных пород. В пойменных почвах
незаселенного ряда (болотные, лугово-болотные, луговые)
установлено повышенное фоновое значение ртути: средний кларк
концентрации относительно местного фона составляет 3,4.
Значительные концентрации ртути в луговых почвах обусловливаются
как повышенной гумусностью, так и принадлежностью почв к су-
пераквальным ландшафтам, являющимся конечным пунктом
транспортировки вещества от автономного через трансэлювиальный и
аккумулятивно-аллювиальный к супераквальному.
Многие авторы указывают на обогащение ртутью верхних
гумусовых горизонтов, независимо от типа почвы (табл. 4.3).
Иногда это связано с поступлением ртути в поверхностный
слой вследствие применения в сельском хозяйстве ртутьсодер-
жащих препаратов /339/ или выбросов ртути в атмосферу
промышленными предприятиями /232/, но в большинстве случаев
обогащение ртутью верхних горизонтов является результатом
- 81 -
фиксации ртути органическими веществами почвы. Установлено
существование корреляционной зависимости между содержанием
гумуса и ртути /195, 316/.
Дифференциации ртути в почвенном профиле способствуют
промывной тип водного режима и кислая реакция среды. В
таких условиях ртуть подвижна и способна мигрировать в
почвенном профиле, аккумулируясь на геохимических барьерах. По
нашим данным /56/, в почвах со слабокислой реакцией среды
(выщелоченные черноземы и дерново—глеевые почвы Северной
Осетии) наблюдается слабая аккумуляция ртути в иллювиальном
горизонте. В этих горизонтах увеличение содержания ртути
совпадает с накоплением в них илистой фракции и (или)
окислов железа, которые, очевидно, сорбируют ртуть, вынесенную
из верхних горизонтов. Распределение ртути в предкавказских
черноземах и лугово-черноземных почвах, характеризующихся
непромывным типом водного режима, нейтральной реакцией
почвенного раствора, монотонным распределением илистой
фракции, носит равномерный характер с некоторым о.богащением
гумусовых горизонтов.
В профиле бурых горно-лесных и дерново-подзолистых почв
максимальное количество ртути находится в разложившемся
слое подстилки и в гумусовых горизонтах, что обусловлено
особенностями биологического круговорота лесных почв и
сорбцией ртути органическим веществом. Оподзоленные горизонты
почв обеднены ртутью. В иллювиальном горизонте происходит
накопление вынесенной из верхней части профиля ртути, но
концентрация ее в горизонте В меньше, чем в гумусовом. В бу*»
рых лесных почвах на продуктах выветривания ракушечников,
песчаников и известняков заметно накопление ртути в
карбонатном горизонте. Резкое повышение рН до 7,0-8,5 на
границе появления карбонатов ведет к понижению растворимости
ртути и отложению ее на щелочном барьере.
Таблица 4.3
Содержание ртути в почвах, мг/кг
Районы,
почвы
1
Среднее
2
Пределы
колебаний
3
Источники
4
Почвы Европы
Швеция 0,06 0,004-0,992 /195/
Великобритания
(садовые) 0,01-0,06 /390/
Нидерланды 0,01-0,09 /250/
- 82 -
Районы^
почвы
1
Среднее
2
Продолжение табл. 4.3.
Пределы
колебаний
3
Источники
4
Франция
(коричневые)
Австрия
Почвы США
Сельскохозяйственные районы
И н дустриальны е
районы
Восточные районы
Пенсильвания
Почвы Канады
Северо-западная
часть
Саскатчеван
Альберта
Почвы Японии
Рисовые
Почвы Африки
Почвы СССР
Дерново-подзолистые
Дерново-подзолисты е
(Агробиостанция
Чашниково, Моск.
обл.)
Дерново-подзолисты е
(Алтай)
Дерново-подзолистые
(Средний Урал)
Серые лесные
(Тульская обл.)
0,04
0,095
0,11
0,10
0,071
0,214
0,023
0,005-0,34
0,055-4,60
0,002-0,0146
0,05-0,14
0,01-0,06
0,016-0,041
0,086-0,333
0,04-0,75
0,02-0,10
0,06-0,20
0,05-0,09
0, 10-0,80
/250/
/395/
/297/
/297/
/362/
/319/
/316/
/260/
/238/
/258/
/195/
/2/
Данные
авторов
/43/
Данные
авторов
/42/
- 83 -
Продолжение табл. 4.3,
Районы*
почвы
Среднее
Пределы
колебаний
Источники
Серые лесные
(Средний Урал)
Черноземы:
0,049
Данные
авторов
типичные
(Курская обл.)
выщелоченные
(Северная
Осетия)
предкавказские
карбонатные
(Северная Осетия) 0,05
Бурые горно-^лес-
ные (Северная
Осетия)
Сероземы (Южный
Казахстан)
0,10-0,40
0,08-0,30
ОД 5-0,47
0,05-0,1
/56/
/56/
/55/
Данные
авторов
В оглеенных горизонтах отмечается аккумуляция ртути,
что объясняется идущим при процессе оглеения разрушением
крупных фракций и относительным обогащением
тонкодисперсным материалом, сорбирующим ртуть /157/.
Информация о закономерностях распределения и поведения
ртути в загрязненных почвах весьма ограничена. Среди
важнейших источников поступления ртути в окружающую среду
основной вклад в загрязнение почвы вносят выпадения газопылевых
выбросов промышленных предприятий /250/. Обогащение почв
ртутью в районах геохимических аномалий весьма значительно
и во многих случаях превышает воздействие техногенных
факторов, однако необходимо учитывать, что число ртутных
месторождений на земном шаре ограничено и все они расположены,
как правило, в предгорных и горных областях, т.е. находятся
в достаточном удалении от густонаселенных районов и почвы
этих территорий не вовлекаются в сферу
сельскохозяйственного использования.
Подробное изучение распределения ртути в почвах
проведено нами в районе действия предприятия свинцово-цинкового
профиля. Повышенные концентрации ртути в почвах
распространяются на расстояние не более 5-6 км от источника
загрязнения. Конфигурация загрязненной территории существенно
зависит от "розы ветров" в регионе: наибольшая протяженность
зоны загрязнения совпадает с направлением преобладающих
воздушных потоков. Среднее содержание элемента в почвах
- 84 -
зоны максимального загрязнения составляло 1,02 мг/кг при
фоновом содержании 0,09 мг/кг. Загрязнение почвенной толщи
ограничивается верхними 20-30 см и в нижних горизонтах
достигает значений, характерных для фоновых почв.
Сопоставление найденных значений содержания ртути в
почвах с их свойствами показало наличие прямой связи
концентрации ртути в почве с расстоянием и направлением от источника
загрязнения, а за детали ее распределения в почвах фоновых
территорий ответственны почвенные параметры (рН, содержание
гумуса, илистой фракции).
4.4. ФОРМЫ СОЕДИНЕНИЙ РТУТИ В ПОЧВАХ
4.4.1 Метилирование и восстановление соединений
ртути в педосфере
В почве происходят реакции взаимных превращений между
органическими и минеральными соединениями ртути.
Предложена схема транокэрмации соединений ртути в природе, согласно
которой ион Hg2+ Может присутствовать в составе
индивидуальных ртутьорганических соединений (метил-, этил-, фенилртуть
и др.) /306/, Кроме того, ионы Hg и Hg2 могут быть
связаны с минералами как часть их кристаллической решетки и
присутствовать между плоскостями решетки, адсорбированы на
поверхности глинистых минералов, могут быть связаны с
органическими компонентами почвы, могут входить в состав
комплексных ионов и молекул солей.
Сульфид ртути Н yS образуется в почвах в
восстановительных условиях и способен накапливаться в затопленных рисовых
почвах /241, 258/. Образование HpS в почвах способствует
иммобилизации элемента. Модельные опыты Melean /313/
показали прочную фиксацию в почве ртути в присутствии серы,
что позволяет использовать внесение серы в сильнозагрязненные
почвы для связывания ртути в нерастворимое соединение.
Явление метилирования ртути носит нежелательный характер,
так как метил- и диметилртутные соединения устойчивы в
воде, летучи. В результате метилирования возрастает мобильность
ртути в почвах и возможность испарения из верхнего горизонта
в атмосферу. Кроме того, ртутьорганические соединения сильно
токсичны, что представляет угрозу для организмов при попадании
метилртутных соединений в пищевую цепь. Возможность
химического и микробиологического восстановления и метилирования
соединений ртути была показана исследователями в условиях
модельных экспериментов. В нативных же почвах содержание
метилртути ничтожно и составляет менее 1% от валового коли-
- 85 -
чества элемента /245, 306/. Можно сделать предположение,
что восстаьовление и улетучивание ртути из почв фоновых
территорий, если оно и происходит, имеет крайне небольшое
значение в балансе элемента в педосфере. однако на почвах,
интенсивно обрабатываемых ртутьорганическими фунгицидами и
испытывающих действие техногенных источников загрязнения, из
труб и факелов которых часть ртути поступает в почву в виде
паров металла /310/, масштабы улетучивания элемента
значительно расширяются и в ряде случаев могут существенно влиять
на ртутную обстановку'7 в регионе.
4.4.2. Соединения ртути с гумусовыми веществами
В последнее время были предприняты попытки выяснения
природы и механизма связывания ртути органическим веществом,
поскольку почвенному гумусу отводится важная роль в судьбе
тяжелых металлов в педосфере. Strohal и HuJjev /371/
показали, что ионы Hgr образуют с гуминовой кислотой прочный, но
обратимый комплекс, константа диссоциации которого 1,7» 10"" .
О прочности связи свидетельствовало то, что добавленные ионы
Na, Co, Ba, Mo, Fe, At, Zn , Мп не вытесняли Hg из Hg-ГК-
комплекса. Некоторые исследователи связывают фиксацию Hg>
гумусовыми кислотами с присутствием содержащих серу
функциональных групп. ГК способна связывать до 2, 5 мг/г ртути;
ртуть, добавленная сверх этого количества, присутствует в
растворе в форме Hg-+ /285/. Прочное комплексное соединение
Hg* образует с фульвокислотами (ФК), порядок сродства
тяжелых металлов к ФК: Cd < Си < Hg /22 3/.
В последнее время в литературе появляется все больше
доводов в пользу преобладания в почвах, особенно богатых
гумусом, форм соединений ртути, связанных с органическими
компонентами почв. Anders son /195/ нашел, что при низких
значениях рН почвенной суспензии большая часть ртути
сорбируется органическим веществом, по мере увеличения рН возрастает
количество элемента, связанного с почвенными минералами.
Японские исследователи показали /2 59/, что около 60%
валового содержания ртути в почве может существовать в ассоциации
с почвенным гумусом. Высказано предположение, что
ртуть-гумусовые комплексы адсорбируются на илистых частицах, что в
еще большей мере уменьшает их растворимость.
В органогенных горизонтах 70-80% общего количества
ртути приурочено к гумусовым веществам почв, что
подтверждается совпадением интервалов максимальной потери компонента на
кривых улетучивания элемента из почвы и кривой потери веса
ГК при нагревании ее до постоянного веса (рис. 4.1).
Связывание ртути гумусовыми кислотами почв осуществляется
кислыми функциональными группами, преимущественно карбоксилами,
- 86 -
фенольными и спиртовыми гидроксилами, так как в интервале
температур от 125°С до 250°С происходит их интесивное
отщепление от молекул FK. 10-15% ртути приходится на
высоколетучие формы, представленные низкомолекулярными
органическими соединениями. В иллювиальных горизонтах со значительным
содержанием гумуса 30-40% (а в некоторых случаях до 50%)
от валового содержания ртути связано с компонентами
почвенного гумуса. Около 20% приходится на легколетучие формы,
примерно столько же приурочеьо к первичными минералам, о чем
свидетельствует количество элемента, оставшееся в почве после
нагревания образца при температуре 550°С. Нижние горизонты
бурых лесных почв не содержат ртути, связанной с
органическим веществом, природа присутствующих в них соединений
элемента остается неясной. Для оподзоленных горизонтов почв
характерно наличие наиболее термостойких соединений ртути, при
этом 30% общего количества элемента не улетучивается из
почвы даже при нагревании до 550°С. Таким образом,
значительное преобладание соединений ртути, связанных с
органическими компонентами почвы в верхних горизонтах почв, а
также незначительное количество высоколетучих форм элемента,
свидетельствует о прочной связи ртути с почвенной массой.
Т,°С
Рис. 4.1. Кривые улетучивания ртути из разных горизонтов
почв Северной Осетии: 1 - потери веса гуминовой кислоты;
2 - чернозем выщелоченный, гор. А ; 3 - чернозем
выщелоченный, гор. В-^; 4 - аллювиально-г-луговая почва, гор. Вд;
5 - бурая горно-лесная почва, гор. ВС,
- 87 -
4. 4.3. Экстрагируемые формы
соединений ртути в почвах
Содержание экстрагируемых форм является показателем,
характеризующим относительное количество миграционноспособных
соединений элементов в почве. Ртуть в заметных количествах
переходит из почвы только в 1 н, НС1 и крайне мало или
совсем не извлекается ацетатно-аммонийным буфером (рН 4, 8)
и 1 н. HNOg. Эффективность действия 1 н. НС1 обусловлена
высокой кислотностью экстрагента и наличием в его составе
хлоридного лиганда, образующего с ртутью прочные
растворимые комплексы /50/, Малая экстрагируемость элемента
перечисленными реагентами свидетельствует о том, что ртуть
находится в почве в прочной связи с ее компонентами, причем
ртуть связана с ними гораздо прочнее других катионов
тяжелых металлов, таких, как Си, Zn , Рв, Cd, для которых не
только 1 н. HNO3, но и ацетатно-аммонийный буфер являются
эффективными экстрагентами.
По нашему мнению, вытяжка 1 н. НС1 извлекает из почвы
соединения ртути, связанные с минеральными компонентами, не
затрагивая при этом форм соединений элемента с органическим
веществом. Об этом свидетельствует характер профильного
распределения HCt - экстрагируемых форм ртути в фоновых
почвах с минимумом их концентрации в гумусовом горизонте и
заметным увеличением абсолютного и относительного содержания
с глубиной /56/. Кроме того, при сопоставлении концентраций
HCt- экстрагируемой ртути в гумусовых горизонтах почв с
содержанием органического вещества в них ( п = 37) -
обнаружена статистически значимая обратная связь (1* = -0,68, значимая
с РО 99 (табл. 4.4.). Более уоедительное подтверждение
высказанного положения дает использование
информационно-логического анализа.
Таблица 4.4
Зависимость экстрагируемости ртути из верхних
горизонтов почв от содержания гумуса в них
Градации содержания
гумуса в почве, %
Градации содержания НС
I-экстрагируемых форм соединений Hg- в
почве (% от валового содержания)
<4
4-5
5-6
6-8
>&
>16
>16
12-16
10-12
<8
- 88 -
Загрязненные почвы характеризуются повышением
концентрации ртути в солянокислых вытяжках из верхних горизонтов при
аналогичной фоновым почвам картине распределения в нижней
части профиля. Такое увеличение позволяет предположить, что
часть ртути, имеющей техногенное происхождение, представлена
относительно растворимыми соединениями, по крайней мере
растворимыми в 1 н. HCV, но доля экстрагируемых форм невысока,
что свидетельствует о быстром связывании вновь поступающих
количеств элемента в соединения с органическим веществом /56/.
Таким образом, гумусовый горизонт почв выступает барьером
на пути миграции техногенной ртути в почвенном профиле и
грунтовой толще и мощным природным инактиватором токсического
действия высоких концентраций элемента, переводя соединения
ртути в прочносвязанные, трудно экстрагируемые формы.
4. 5. Сорбционно-десорбциошюе взаимодействие
ртути с почвами и ее компонентами
Сорбция как результат связывания ионов и соединений
элемента является одним из основных механизмов, контролирующих
его содержание в почвенном растворе. В связи с этим сорб-
ционные процессы могут оказывать важное влияние на судьбу
техногенных поступлений тяжелых металлов, в частности ртути
в почве, на ее способность закрепляться почвой и ее
компонентами, мигрировать в профиле и ландшафте, поглощаться и
накапливаться растениями.
Начальным этапом во всех сорбциоиных исследованиях
является определение времени установления равновесия между твердой
и жидкой фазами в исследуемой системе. Равновесное состояние
между соединениями элемента в твердой и жидкой фазах
наступило через 10-30 мин контакта раствора ртути /Hg»(N03)2
2 мкг/л/ с сорбентом. Обнаружен высокий процент сорбции
ртути почвами и гидроксидом железа в состоянии равновесия
(97-98%). Несколько ниже эта величина для глинистых
минералов: монтмориллонита - 93%, вермикулита - 86, каолинита -
76%. Минеральные компоненты почвы способны быстро и в
больших количествах сорбировать ионы ртути.
На сорбцию ртути значительное влияние оказывают
кислотно-щелочные условия среды, что связано с присутствием разных
соединений ртути в растворе. Гидролиз Hg^+ становится
заметным уже при рН 2, ниже этого значения рН в растворе
присутствует более 50% ртути в виде Hg2+, моногидроксильные
комплексы существуют в интервале рН 2,2-3, 8 /264/, при
более высоких значениях рН (4 и выше) преобладают
незаряженные комплексы Hg(0H)°2. Максимум сорбции элемента нахо-
- 89 -
дится, как правило, в области рН 4,5-5,5, что отмечено при
сорбции ртути бентонитом /327/, кварцем /318/, гелем гиц-
роксица железа /2 96/, гетитом /248/. При более высоких и
низких значениях рН сорбция ртути снижалась.
Наши исследования для образцов гумусового к иллюаьллъ-
ного горизонтов двух почв показали наличие интервала
максимальной сорбции элемента в области значений р-Н 4,75-6,50,
при этом в кислой области снижение сорбции более
выражено для иллювиального горизонта, в щелочной для
гумусового. Аналогичная закономерность отмечена при сорбции
ртути гидроксидом железа, однако в этом случае максимум
сорбции ртути наблюдается при рН 5-8 (рис. 4.2). Для
глинистых минералов величина сорбции достигает максимального
значения около рН 5, но в щелочной среде ее снижение не
отмечено. Таким образом, во всех изучаемых системах максимальное
количество ртути сорбируется при тех значениях рН, при
которых в растворе сущесгвуют гицроксокомплексы ртути Hg(0H)°>
или Н^0Н+.
Важную роль в сорбции Hg-(0H)°2 играют гидроксильные ли-
ганды, служащие своеобразными мосгиками между поверхностью
сорбента и сорбируемым ионом ртути. Поскольку комплекс
Hg-(0H)°2 является линейной молекулой, он может
сорбироваться с несколько искаженной конфигурацией молекулы (в форме
"банана*) параллельно к поверхности сорбента, образуя два гид-
роксильных мостика. Если формируется один гидроксильный
мостик, то молекулы располагаются перпендикуляры* поверхности
сорбента /248/. Подобный механизм может иметь место в
случае сорбции ртути глинистыми минералами, гидроксидом железа,
а также сорбентами иллювиального горизонта бурой
горно-лесной почвы. Кроме того, необходимо учитывать, что гидратацион-
ная оболочка нейтрально заряженной частицы Hg^OH)^
значительно меньше, чем катиона Н^+, что способствует более
легкому и близкому проникновению ее к поверхности сорбента.
Принимая во внимание прочность комплексов ртути с ГК и ФК /223,
376/, можно предположить, что гидроксильные лиганды не
способны выдерживать конкуренции за ион ртути с лигандами
почвенного гумуса, вследствие чего связь ртути с этими
функциональными группами происходит в вице Н|?+ (в крайнем случае,
в виде Н{гОН+) после разрушения гидроксокомплекса.
Идентичность в ходе кривых зависимости сорбции от рН и
близкие величины снижения сорбции ртути в кислой и щелочной
областях для гидроксида железа и глинистых минералов, с одной
стороны, и для иллювиального горизонта бурой горно-лесной
почвы - с другой, наводят на мысль, что именно эти компоненты
обусловливают поглощение элемента из раствора в этом
горизонте (см. рис. 4.2). При малых значениях рН, где ртуть
присутствует в растворе в виде Hg» и HgOH+, снижение сорбции
определяется конкуренцией Н+ с ионами ртути за сорбционные
места, а также, по-видимому, частичным протонированием поверх*-
ностных гицроксильных группировок сорбентов, вызывающим вза-
- 90 -
100
80
J£
I 60
I
!
s
40
20
..•• с
//> 7
/
/
2,0
V
0,0
0,0
10,0 12,0 pH
Рис. 4.2. Сорбция ртути минеральными компонентами почъ
при различных значениях реакции среды: 1 - гидроксид железе,
2 - монтмориллонит, 3 - вермикулит, 4 - каолинит
имное отталкивание одноименно заряженных ионов. В щелочной
среде снижение сорбции может обусловливаться перезарядкой
такого сорбента, как гидроксид железа, и увеличением
отрицательного заряда его поверхности, что вызывает электростатическое
отталкивание образующихся при высоких значениях рН
комплексов Hg>(OH)"~3' В гумусовом горизонте снижение сорбции ртути в
кислой области не превышает 10% относительно максимальной
величины, что указывает на образование прочных соединений с
почвенным органическим веществом, при этом Н явно не выдерживал
конкуренции с Hg»^4" rt HgOH+. Значительное снижение сорбции
ртути эгим горизонтом при высоких значениях рН равновесного
раствора мы связываем с растворяющим действием щелочных
растворов на гумусовые вещества почвы, в результате чего
экстрагированные в этих условиях органические лиганды
связывают ртуть в прочные комплексы в растворе и снижают сорбцию
твердой фазой.
Информация об изотермах сорбции ртути почвами в
литературе довольно ограничена. В частности, было получено хорошее
соответствие экспериментальных данных уравнению Ленгмюра
/277/. Сравнение величин сорбционных максимумов для двух
- 91 -
исследуемых этими авторами почв показало, что большая
емкость сорбции ртути соответствует почве с большим
содержанием органического вещества и илистой фракции, участвующим
в сорбции элемента.
Нами были получены изотермы сорбции ртути 10 образцами
гумусовых горизонтов почв, имеющих широкие вариации в
содержании гумуса, илистой фракции и величине емкости поглощения.
При этом во всех исследованных почвах было отмечено
разделение изотерм на две линейные части, каждая из которых
описывалась уравнением Фрейнцлиха (рис. 4.3). Подобное явление
обычно объясняют или различным механизмом поглощения сор-
бата при низких и высоких концентрациях, прежде всего
подразумевая соответственно сорбцию и осаждение, или наличием в
почве компонентов, характеризующихся сорбционными местами
с неодинаковой энергией связи сорбата с сорбентом. Поскольку
применяемые концентрации ртути явно недостаточны для
достижения ПР Н^О, наиболее вероятного в этих условиях соединения,
lg X} мкг/кг
3,5\-
3,0
щ
0,5
W
Ь5
2,0
IgC
Рис. 4.3. Изотермы сорбции ртути почвами: 1 - дерново—
глеевая почва в отсутствие С1~; 2 - чернозем, выщелоченный
в отсутствие С1~; 3 - чернозем, выщелоченный в присутствии
С1"; 4 - дерново-глеевая почва в присутствии Ct";
которое могло бы выпасть в осадок, то часть II изотерм
сорбции вряд ли соответствует процессу осаждения. Наличие двух
- 92 -
частей изотерм сорбции ртути почвами связано с
энергетической неоднородностью мест на почвенных сорбционных
поверхностях и в соответствии с термодинамическими законами сначала
происходит сорбция на местах с наиболее высокой энергией и
затем на всех остальных.
Расчет парных и множественных коэффициентов корреляции
между сорбционными характеристиками изотерм (1/п и Кд )
и свойствами почв позволил выявить компоненты почвы,
ответственные за сорбцию ртути при разных ее концентрациях (табл.
4.5). Особенность изотерм сорбции ртути почвами состоит в
том, что в каждой из частей элемент преимущественно
связывается с разными компонентами почвы: в части 1-е
почвенным гумусом, в части II - наряду с органическим веществом
также с минеральными составляющими.
Таблица 4.5
Коэффициенты корреляции между сорбционными
характеристиками и свойствами почв (ЕКО - емкость
катионного обмена)
Фактор
Гумус
Ил
ЕКО
Гумус +
ил
Гумус +
ЕКО
Ил +
ЕКО
1/Щ 0,840** -0,204 0,065 0,846** 0,888** 0,391
1/г\т1 0,377 -0,038 0,395 0,390
К d I ~0'255 0,192 0,190 0,277
dll
К „ _ 0,431 -0,050 0,402 0,444
0,632™ 0,647
0,286 0,204
0,682* 0,672
«к
Коэффициент корреляции с р в 0,95.
Коэффициент корреляции с р - 0,99.
Сравнение изотерм сорбции ртути одними и теми же почвами
на фоне сантимолярных растворов Са (МОз)2 и CaCl2
показало, что в общих чертах их ход идентичен, однако в случае
0,01М CaCt2 величина сорбции заметно ниже, что, безусловно,
связано с образованием комплексов ртути с хлорид-ионом
(см. рис. 4.3). Подавление сорбции ртути в присутствии С1"~
различными сорбентами наблюдалось неоднократно и
связывалось с тем фактом, что константа стабильности образующихся
хлоридных комплексов ртути выше, чем прочность связи
элемента с поверхностными функциональными группами сорбента /248/.
Снижение величины сорбции ртути в большей степени
выражено, во-первых, для почвы с меньшим содержанием гумуса и,
- 93 -
во-вторых, для части 1J изотермы по сравнению с частью I.
Учитывая высокую прочность связи ртути с ГК и ФК и
неспособность ртути сорбироваться в вице хлоридных комплексов,
можно заключить, что функциональные группы гумусовых
компонентов эффективно конкурируют с хлорид-ионом за образование
комплексов с ртутью (часть I изотермы). Напротив, при
высоких концентрациях элемента, когда роль почвенного гумуса в
сорбции ртути снижается и в большей степени начинают принимать
участие минеральные компоненты, С1"" с большим успехом
выдерживает конкуренцию с их активными центрами, в результате
чего в равновесном растворе обнаруживается большая
концентрация ртути (часть П изотермы).
Несколько иной характер изотерм наблюдается при сорбции
ртути глинистыми минералами и гидроксидом железа. Для этих
систем изотермы сорбции показывают прямолинейную
зависимость между равновесной концентрацией (С) и сорбируемым
количеством ртути (х/тп), которая описывается уравнением вида:
х/тп « КС (рис. 4.4). Наличие подобной зависимости указывает
на то, что в изучаемом диапазоне концентраций поверхность f
сорбентов не насыщена сорбатом и в пределах каждого
сорбента энергия связи ртути с поверхностью остается одинаковой.
По величине сорбции исследуемые компоненты почв
расположились в следующий ряд: каолинит < вермикулит < монтмориллонит
<: гидроксид железа.
Величина десорбции традиционно используется как показатель
относительной прочности связи сорбата с сорбентом.
Трехкратная экстракция ртути 1 М раствором Л/q Л/О^с изучаемых
минеральных сорбентов показала, что связь ртути с глинистыми
минералами носит весьма непрочный характер: с каолинита,
монтмориллонита и вермикулита десорбировалось 90%, 84 и 81%
сорбированной ртути соответственно.
Принимая во внимание, что формы соединений тяжелых
металлов, десорбируемые трехкратной экстракцией раствором Са $03)2
считаются обменными или неспецифически сорбируемыми /382/,
можно предположить, что подавляющая часть ртути сорбируется
на глинистых минералах на местах ионного обмена. Косвенным
подтверждением такого механизма сорбции служит тот факт, что
возрастающие концентрации Н а+ снижают величину сорбции
ртути минералами, хотя Ма из-за своей высокой способности к
гидратации сорбируется слабо и не может быть достойным
конкурентом ртути за сорбционные места.
Характер связи ртути с гидроксидом железа представляется
иным. Если в глинистых минералах ртуть в основном
представлена легкообмениваемыми формами, то в гидроксиде железа
примерно 75% сорбированной ртути является специфически
связанной. Очевидно, механизм, предложенный Forbes et ai .
/248/, а именно взаимодействие гицроксильных мостиков
комплекса Н^г(ОН)°2 с поверхностью полуторных оксидов является
- 94 -
строго специфичным для данных сорбентов, обусловливая
высокое сродство ртути к гидроксиду железа.
/1
по
120
^ 100
53
SJ
^
1^0
§
5 60
40
20
-
-
/
/'
/'
/'
/'
/ ^^ .^
- //^-"""
/ ^^-"
/ ^<^-
/^'
&- L— I
/'
/
v
0,5
1,0
Ьб
Ьра8н.
Рис. 4.4. Изотермы сорбции ртути минеральными
компонентами почв: 1 - гицроксид железа, 2 - монтмориллонит, 3 -
вермикулит, 4 - каолинит
Десорбция ртути 1 М Mfl NOj и 1 М НС1 зависят от
начальной концентрации ртути в растворе и от свойств почвы,
что отражается на характере изотерм сорбции, а именно в ее
I части на местах с высокой энергией происходит прочное
закрепление элемента и понижение его способности к десорбции.
Менее прочная связь ртути с почвой в части И изотерм
способствует ее экстракции в данные вытяжки. Так как вытяжка 1 М
НС1 извлекает преимущественно формы ртути, связанные с
минеральными компонентами почвы, то следует признать, что
во всем* диапазоне концентраций участие в сорбции принимают
и органические, и минеральные составные почвы.
- 95 -
В процессе сорбции почвы удерживают ртуть очень прочно,
что подтверждается низким относительным количеством
обменных форм ртути» извлекаемых вытяжкой 1 М NqNOj (табл. 4.6).
Таблица 4.6
Соотношение групп соединений сорбированной ртути
в почве
Почва,
гумус, %
Дг. 9,4
дг. 2«7
Дг. 2,7
ЧК, 5,9
ЧВ, 4,9
ЧЛ. 3,7
4е. 7,9
Примечани
С
нач.
40
800
40
800
40
800
40
800
40
800
40
800
[я: С
-нач.
2
Формы соединений ртути в почве,
% от сорбированного количества
I
0,4
1.7
1,3
2,4
0,7
0,8
0,5
1,4
0,6
1,9
0,6
2,1
начальная
обменные
прочносвж
2
26,4
48,9
31,6
46,9
• 30,3
47,5
35,4
56,9
37,2
42,3
27,7
36,4
3
73,2
49,4
67,1 *
50,7
69,0
51,7
64,1
41,7
62,2
55,8
71,7
61,5
концентрация ртути, мкг/л;
(1 М NaNOa);
эанные (1 М НС1 - 1 М
Дг~
Чк -
Чв -
ЧЛ -
NaN05);
сорбированные на местах с наибольшей
энергией связи, преимущественно
связаны органическим веществом (не экст*-
рагируются 1 М НС1);
дерново—глеевая почва;
чернозем предкавказский;
чернозем выщелоченный;
черноземно-луговая почва.
- 96 -
Подавляющая часть свежесорбированной ртути представлена
трудноэкстрагируемыми формами соединений, при этом
количество ртути, связьюаемое минеральными компонентами почв,
представлено разницей в десорбции элемента вытяжками 1 М HCt
и 1 М КаЫОз» Неэкстрагируемая 1 М HCt ртуть сорбирована
на местах с наибольшей энергией связи компонентами
почвенного гумуса. Если при низких концентрациях ртути (40 мкг/л)
неэкстрагируемая доля элемента составляет около 2/3
сорбируемого количества, то при высоких концентрациях ртути (800 мкг/л)
количество элемента, связанное с органическими компонентами
почвы, составляет около 50%. Уменьшение доли участия
почвенного гумуса в сорбции высоких концентраций ртути,
соответствующих части II изотерм сорбции, компенсируется в основном
увеличением прочносвязанных минеральными компонентами форм
соединений элемента.
4.6. РТУТЬ В РАСТЕНИЯХ
Основной источник ртути для растений - почва. В
сельскохозяйственные культуры она может поступать также при
опылении посевов и опрыскивания фруктовых деревьев ртутьсоцержа-
щими гербицидами, обработке семян, внесении осадков сточных
вод. Вблизи ртутных месторождений или промышленных
предприятий ртуть сорбируется листовой пластинкой растений из
атмосферы /253/. Высшие растения, как правило, не накапливают
ртуть в своих органах. Фоновое содержание ее в растениях
обычно находится на том же уровне, что и в почвах, и не превышает
5* 1СГ^% /98, 148, 363/. Значительное увеличение
концентрации элемента в почвах обусловливает наличие повышенных
содержаний его в растениях; высокие концентрации ртути в
растениях встречаются на почвах вблизи ртутных месторождений
/307/. Она может поглощаться растениями в количествах, в
30-100 раз превышающих нормальнре содержание. Высокие
концентрации ртути в растениях приурочены также к зонам
промышленного загрязнения. В зависимости от характера
промышленного предприятия повышенное количество ртути в почвах и
растениях наблюдается на расстоянии до 7 км. Содержание
ртути в загрязненных растениях достигает 10""^% /17, 299, 342/.
Внесение ядохимикатов, осадков сточных вод и предпосевная
обработка семян в одних случаях не приводят к заметному
увеличению содержания ртути в обрабатываемых почвах и
сельскохозяйственных культурах /238, 289/, в других - содержание
ртути в растениях может увеличиться в 2-50 раз /86, 263,
311/. Различия в содержании ртути в растениях обусловлены
видовыми особенностями растений. Некоторые культуры способ-
- 97 -
ны поглощать из питательной среды значительные количества
элемента. К ним относятся бобовые, салат, редис, картофель,
томаты, морковь /282, 311/. Максимальное накопление ртути
отмечено у группы эпифитов, это указывает на способность
низших растений поглощать элемент из атмосферы. Поступая в
растения, ртуть не равномерно распределяется по всем его
органам, а накапливается главным образом в корнях, в которых
содержится до 95% всего количества элемента в растении /202/.
Состав и свойства почв, влияющие на прочность фиксации
элемента, являются важным фактором, обусловливающим
содержание ртути в растениях. В наибольшей степени применение
ртуть-соцержащих фунгицидов способствовало накоплению ртути
в рисе, выращенном на периодически затопляемых почвах /293,
330/. Резкая смена окислительного и восстановительного
режимов, кислая реакция среды, переменная увлажненность почв
способствуют мобилизации соединений ртути и поступлению ее
в растения.
Наиболее прочно фиксируется ртуть почвами тяжелого
механического состава с близкой к нейтральной реакцией среды и
высоким содержанием органического вещества. Внесение ртути
в дозе 10 мг/кг почвы практически не влияло на содержание
ее в культурах на суглинистых почвах, торфе и черноземе.
Применение тех же доз на песчаных почвах и засоленном
суглинке привело к накоплению до 5,7 мг/кг воздушно-сухой массы
Н £ в соломе озимой пшеницы и невызреванию урожая овса.
Нами изучено влияние внесения различных доз ртути на
поступление ее в растения в вегетационном эксперименте в
условиях почвенной культуры. Тест-растением был выбран ячмень.
В качестве субстрата использовали чернозем типичный (ЧТ),
дерново-подзолистую окультуренную и неокультуренную почвы
(ДПО, ДПН). Возрастающие дозы ртути от 1 до 50 мг/кг поч^-
вы вносили в виде раствора Н^(МОз)2 в одно время при
закладке опытов (химическая характеристика почв приведена в
разделе 3.4).
В начальный период роста (14 сут) всхожесть семян и
внешний вид растений показывают, что они не испытывают
влияния внесенных доз ртути в почвах. В последующие периоды
обнаруживается отставание в развитии ячменя на ДПН и ДПО почвах
на 1-2 не д. при внесении 50 мг/кг Hg. К концу
вегетационного периода это отставание становится незаметным, и к моменту
уборки урожая растения на всех почвах независимо от дозы
внесения токсиканта находятся на одной стадии органогенеза.
Морфология растений ячменя не изменяется под влиянием
внесенной ртути, признаки хлороза не обнаружены. Колос ячменя
на ДПО и ДПН почвах при внесении 20 и 50 мг/кг ртути
слабо редуцирован, среднее количество колосков в колосе
снижается с 12-13 на контроле до £^-10.
- 98 -
Поступление ртути в солому ячменя постепенно возрастает
с увеличением концентрации элемента в почвах, но поступление
элемента в растения отстает от увеличения его доз в почве.
При изменении содержания ртути в почвах в 100-200 раз
(контроль - доза 20 мг/кг) содержание ее в соломе возрастает в
2,5-5 раз. Внесение ртути в дерново-подзолистую почву
практически не влияет на биомассу соломы ячменя. Урожай зерна
снижается при внесении 20 и 50 мг/кг Hj. Биомасса ячменя,
выращенного на черноземе типичном, не зависит от содержания
ртути в почве.
Токсичным считается такой уровень тяжелых металлов в
почве, который снижает рост и изменяет морфологию растений
или уменьшает их урожай на 10% и более. Дозу ртути выше
20 мг/кг можно считать токсичной для ячменя на
дерново-подзолистой окультуренной и неокультуренной почвах (табл. 4.7).
При внесении 50 мг/кг ртути на всех почвах поступление
элемента в солому резко возрастает, и содержание элемента в ней
начинает превышать предельно допустимые концентрации,
предложенные для растений /253/. Содержание ртути в зерне
ячменя составляет 0,01-0,02 мг/кг воздушно-сухой массы и
незначительно увеличивается с возрастанием концентрации ртути
в почвах. Наибольшие накопления элемента в соломе происходят
на ДПН при внесении максимальной дозы ртути. Независимо от
вносимой дозы содержание ртути в зерне ячменя ниже ПДК для
продуктов питания /253/.
Характер распределения ртути в зеленой массе растений
свидетельствует о наличии у растений защитного механизма,
препятствующего поступлению токсиканта /62/. Защитный барьер,
ограничивающий поступление ртути в солому ячменя, работает
при невысоких концентрациях элемента в почве ( ^ 20 мг/кг),
при 50 мг/кг защитный механизм уже не справляется с
функцией ограничения поступления ртути в зеленую массу растений
и содержание токсиканта в соломе увеличивается, особенно
резко на ДПН почве, хотя поступление элемента в репродуктивные
органы ограничено.
Поступление ртути в растения зависит прежде всего от
количества элемента в почве, доступного для них и
характеризуемого содержанием водорастворимых соединений. Содержание
водорастворимой ртути в почвах изменяется в широких пределах
в зависимости от вносимой дозы, времени взаимодействия с
почвой и свойств почвы (табл. 4.8). Через 3 дня после
внесения раствора Нд(КЮз)2 содержание водорастворимой ртути
составляет 2,5-18% от ее валового количества. Такие
невысокие концентрации Hg- можно объяснить тем, что в почве после
3 дней инкубации при влажности, равной 60% наименьшей влаге—
емкости, преобладают прочнофиксированные соединения ртути.
Трансформация водорастворимых форм происходит и далее в
течение длительного времени. Через месяц после внесения
- 99 -
Ф О
И СО
3, 2
q
>> X
5 о
5 «
ф v,
° 2
ф
X
(X
ф
со
ф
о
ч
о
о
СМ ^ Ю Ю CD СО 00
тЧ Н Н тН тЧ тЧ тЧ
О О <Э О О О О
о" о* о* <э о" о* о
со со со оо
о о о о
тЧ О
СМ 00
о о* о" о" о* о 6
О О О iH со
тЧ тЧ тЧ тЧ тЧ
о о о о о
о" о о* 6* о"
г- г- г- г- оо
о о о о о
б* о* о* о" о*
I >>
.о S
I г °
, 1
я
ф 93
2
I
СО
я
ф
со
о
ф
СО ^ СО Ю ^ СМ О
^f ^ ч£ т£ ^ у? со
О со СМ И (^1
Ю* 10* Ю* Ю* 10
i 5 о
о
ф
СО Ю 00 ^ ® 03 h О) СО (О 00 СО
с\Г см* см* см* ^ тЧ тч
СМ СМ СМ СМ <^ СМ СМ
ю со in ю ю
см см см см см
о^
нтрс
и
н
СМ
ю о
О
СМ
о
ю
tH OJ Ю
g
- 100 -
Ю CD
тН тЧ
О О
о" о"
о
00
О) 00
СМ СМ ^ Ю СО Q О
тН тН Н Н гЧ H СМ
о о о о о о о
о" о" о" о* о о* о"
г- г- г- о со ю см
О О О Н t-| со н
со оооооо
СМ СО СМ Н О) СО ^
t 1* I' t СО СО СО
ю
^
СМ
г-
^г
СМ
0)
О)
н
^
о
СМ
00
о
СМ
г-
О)
гН
г-
а>
н
о
о
СМ
см
а>
тЧ
о о 3
СМ Ю Л
I
СМ Ю
о о о
Н СМ Ю
00
^
СО
Cf
S
13
ю
СО
ь
ОКИ
(X
о
ф
S
&.
■8
s
&
е
СО
§•
а
о
д
ф
Ф
сг
О
О
о
ф
ю
I of
со
ф
о
ф
2
со
ф
8-
О
ф
2
СО
ф
а
ф
«
а
| со
Ф
а;
в
О
а
СМ
- Ю1 -
1
я W i
« К
о ° 1
&
О)
1
со
СО
а
а
вах
л*
о
я л.
<N
BS<"*»
&2
« ьо
2*
8 «
2 с?
Р
is.
2g
«а
S3
5 ©
S я
Зи
аш
ш s
58
О"
0)
&
^ 1
Ф I
2
^
(0 1
ф 1
a I
ф 1
&* 1
° 1
ф 1
2
н 1
со 1
ф 1
си 1
ф 1
w 1
s 1
G 1
СО 1
со I
ф 1
а I
ф 1
*
Я**
1 S^4
щ^
2
1 &*
о
а
1
г?
о
о
о
о
о
о
ю
о
о
с о
о
о"
гЧ г-! И СС IC СО Н
С С О О С О см
с о о <э о^ о ов
с о" о 6 о о" о
ю
о
о
о
н
о
о
см Ю
о о
о о
о
о"
о
см а
Н iH
о о
О* еэ
со
о
ю
о
о
о
СМ СМ Ю 1^ О СО
О О О О СМ СМ
о о о о о о
о о о о о о
ю
О СО L0 Г-
о о о о
° °т ° 9.
о" о" с о
о
^
о
о
СМ
^
о
о
о
CD
О
о
ю
о
Н
о
ю
о
о
о
о
^
о
о
о
ю
н
о
о
1-
н
о
о
а>
н
о
о
ю
со
о
о
СО
^
о
о
ю
о
с
о
о
CD
н
о
о
0)
тН
о
о
CD
СМ
о
о
о
н
СО
о
со
со
СО
о
ю
со
*
о
н
ю
о
н
1С
о
о
о
о
о
см
И
о
СМ
со
И
о
со
ю
Н
о
н
CD
СМ
о
^
см
со
о
со
CD
г-
о
ю
о
о
о
о
н
г-
И
о
ю
СО
iH
о
СО
СМ
ю
о
ю о о о
н см ю
а,
В
о
см ю
о о о
н см ю
8
И СМ Ю
н
у
- 102 -
о о
о о
о" о"
Н^(ЫОз)2 равновесное состояние в системе гпс
в£-р:створ" еще не постигнуто. Ф г «г *»ш« ртути
твердой фазой почвы продолжается, и содержание
Ф ^ водорастворимой ртути уменьшается до долей про-
н см цента. С увеличением ва; эвого содержания ртути
в почве концентрация ее ;-. водной вытяжке также
возрастает. Со временем происходит постепенное
выравнивание концентрации ртути в водной
вытяжке при внесении различных доз токсиканта.
Значительная часть внесенной Hg(NC>3)2
переходит в труднорастворимые формы соединений.
Через 9,5 мес после внесения водорастворимая
oj ю и обменная ртуть в сумме составляет около 1%
от ее валового количества. Содержание обменной
ртути несколько выше в черноземе типичном, чем
в ДПО и ДПН почвах. 1 н. НС1 переводит в
раствор 40-60% от валового содержания ртути в
почве. Это может быть ртуть фосфатов, гидроксида
и гицроксокарбоната. Действие
хлористоводородной кислоты основано на растворении и разруше-
g £0 нии некоторых компонентов минеральной части
О тн почвы, а также на связывании ртути в прочный
О О комплекс. Оставшаяся часть ртути прочно
удерживается почвой.
Сложность педохимии ртути не позволяет на
данном этапе разработать научно обоснованное
нормирование элемента в почве. При нормировании
ртути в почвах необходимо учитывать следующие
показатели: транслокационный, характеризующий пос-
со см тупление ртути в растения; миграционный водный -
§§ ^ переход в водные потоки; миграционный воздушный -
О н переход в воздух; общесанитарный - характеризует
влияние элемента на самоочищающую способность
почвы и почвенную биоту. Различное действие
ртути на растения при одинаковой концентрации
на разных почвах обусловлено разной кинетикой и
различной трансформацией внесенных соединений
элемента, а также связано с плодородием почв и
q q защитным действием самих растений. Оценить
см Ю роль почвы в круговороте элемента и правильно
нормировать содержание ртути в почвах и в
системе почва - растение можно только с учетом
педохимии элемента в разных почвах.
5. СВИНЕЦ
5.1. ХИМИЯ ЭЛЕМЕНТА И ПОСТУПЛЕНИЕ
ЕГО В БИОСФЕРУ
Свинец-элемент 1У группы Периодической системы Д.И.
Менделеева с атомным весом 207,49. Внешние электронные
оболочки атома 6S 6р . Энергия активации РЬ° ** РЬ^-"1" -
- 17,415, РЬ1+ ^ РЬ - 15,028 еВ.
Свинец относительно инертный металл. На воздухе он
покрывается слоем оксида, защищающим его от дальнейшего
окисления. Характерной особенностью свинца является его тенденция
к образованию соединений слабой растворимости с главными
компонентами - анионами природных вод и почвенного раствора.
Гидроксиды, карбонаты и сульфиды свинца могут выступать в
качестве ограничителей растворимости и миграции элемента. Для
широкого диапазона природных условий ( Eh-pH) свинец
присутствует в двухвалентной форме (рис. 5.1). Растворимость
соединений свинца в диапазоне рН 8,5-11,0 и в восстановительных
условиях при рН 2 низкая - менее чем 1 мкг/л; е интервале
рН 6-8 растворимость элемента является сложной функцией рН,
концентрации СО2 и соединений серы в воде. В природных
растворах с рН ниже 6,5, если активность СО2 менее 10"~3М,
растворимость свинца может быть выше, чем указано на
диаграмме. Концентрация свинца в пределах поля устойчивости
PLSO4 составляет <5 мг/л /268/, ниже рН 2 растворимость
увеличивается за счет образования HSO4. Восстановительные
условия ведут к образованию осадка сульфида РЦ который
характеризуется очень низкой растворимостью (табл. 5.1).
Соединения Рь02 и Pl^Ocj имеют узкие поля устойчивости
и не играют большой роли в гипер генных процессах. Наличие
значительных количеств фосфат-ионов в природных растворах
снижает концентрацию свинца. Но, как правило, в природных
водах фосфат-ионы не присутствуют в достаточно большом
количестве, чтобы определять судьбу растворенного свинца, однако
этот фактор может быть определяющим в почвенном растворе
при внесении фосфорных удобрений (табл. 5.1). Выше рН 6 из
0,1 М растворов соединений свинца осаждается его гидроксид,
который неустойчив и, теряя гидратную воду, переходит в РЬО.
- 104 -
Рис 5.1. Поля устойчивости соединений свинца в системе
Pb + CO2 + S + Н£0 при 25°С и 1 атм. Активность
растворенного СС>2 и соединений S ЮМ. Ионная сила раствора
0,005 /268/
Свинец широко и интенсивно используется в народном
хозяйстве. По показателю "технофильности* — отношению ежегодной
добычи в тоннах к кларку в литосфере в процентах,
характеризующему степень использования человеком химического
элемента, он уступает лишь углероду, хлору и золоту /110/. Добыча,
переработка, выплавка металла, а также использование
соединений и сплавов свинца сопровождаются значительным рассеива-
- 105 -
нием его в биосфере, причем
наиболее часто в более активной
форме, чем природные
соединения.
Основным источником
поступления свинца на земную
поверхность является сжигание
жидкого и твердого топлива.
В США в 1970 г. было
выброшено в атмосферу при
сжигании бензина 300 тыс. т
свинца, на каждую тонну готовой
продукции при первичной
выплавке свинца в воздушный
бассейн поступает 2,37 кг РЬ
/83/. Применение отходов
различных химических
производств, использование шлама,
сточных вод в качестве
удобрений ведут к повышению
концентраций металла в почве.
Систематическое и
многолетнее выпадение из
атмосферы соединений свинца в почву
вблизи предприятий и
автомагистралей ведет к локальному
увеличению содержания
элемента до уровней, значительно
превышающих фоновые и
способных отрицательно влиять
на почвенную биоту, растения,
а по пищевой и кормовой
целям - на животных и человека.
Поэтому геохимический
мониторинг элемента в объектах
окружающей среды является
необходимой мерой. Свинец
включен в список приоритетных
загрязнителей /325/.
Большое число работ
посвящено исследованию содержания
свинца в почвах вдоль
автомобильных дорог, подверженных
загрязнению этим элементом
/109, 265/. Придорожные, в
разной степени загрязненные
почвы составляют в ФРГ 7%
сельскохозяйственных угодий.
- 106 -
Наибольшая концентрация элемента в почве прослеживается в
1,5-2 м от бровки дороги, достигая величин 500-G00 мг/кг
/218/. Влияние эмиссий автотранспорта pacnpoci раняется на
>асстоьяие 10-30 м, реже 300 м от сороги Между концент-
; -лцией свинца в почве и расстоянием от дороги существует
экспоненциальная зависимость. Загрязнение атмосферы с
развитием индустрии хорошо иллюстрирует изменение содержания
свинца в ледниковом покрове Северной Гренландии. 800 лет до
н.э. лед содержал 0,001 мкг/кг свинца, а в современном льде-
0,2 мкг/кг /83/. Высокое содержание свинца найдено в снеге
вершины Монблан на высоте 4250 м, которое превышало
концентрацию элемента в снеге Гренландии на порядок /214/.
Угроза интоксикации в крупных промышленных странах становится
все реальнее. Поступление элемента в организм чоловека по
пищевым цепям ведет к расстройству нервной системы /16,29/.
Глобальное техногенное загрязнение планеты свинцом
затрудняет оценку вклада естественных источников объектов
окружающей среды. Знание фоновых уровней содержания элемента в
них необходимо для правильного представления о степени
загрязнения свинцом почв, растений, воды, воздуха в регионах
влияния источников разного типа.
5.2. СВИНЕЦ В МИНЕРАЛАХ
И ГОРНЫХ ПОРОДАХ
Общее количество свинца в земной коре составляет, по
В.И. Вернадскому /23/, Ют, среднее содержание его в зем-
иой коре 1,6*10""^% /27/. Хотя большая часть элемента
находится в рассеянном состоянии, он входит в состав более чем
200 минералов, и только три из них образуют промышленные
запасы элемента: галенит - РЬ5, англезит - РЬБОф церру-
сит - РЬСОз.
Свинец входит в состав многих породообразующих минералов.
Количество элемента в одном и том же минерале может
колебаться в значительных пределах. Например, в калиевых полевых
шпатах (ортоклаз и микроклин) в Норвегии найдено от 10 до
280 мг/кг свинца. Содержание его в плагиоклазах
увеличивается с повышением концентрации SiOg , в меньшей степени Са,
но главным образом с увеличением содержания калия за счет
способности свинца замещать его позиции в кристаллической
решетке минералов вследствие близости их ионных радиусов:
Рь2+ - 0,126, К+ - 0,146, Са4* - 0,108 нм /165/. Большую
долю в содержании свинца изверженных и метаморфических
пород вносят полевые шпаты, хотя некоторые акцессорные
минералы часто содержат больше элемента, но вклад последних в
- 107 -
общее содержание свинца невелик. В слюдистых минералах
(мусковит, биотит) и в хлоритах свинца меньше, чем в широко
распространенных породообразующих минералах (табл. 5.2). В
осадочных глинистых породах концентрация элемента
значительно варьирует - от 10 до 30 мкг/кг. Сведения о содержании
свинца в почвообразующих породах фрагментарны. Для основных
типов почвообразующих пород европейской части СССР диапазон
концентраций элемента 12,5-39 мг/кг. По нашим данным,
среднее содержание свинца в почвообразующих породах Северной
Осетии (желто-бурые карбонатные глины) не превышает 30 мг/кг.
В табл. 5.3 приведены концентрации свинца в почвообразующих
породах европейской части СССР.
Таблица 5.2
Свинец в основных типах горных пород
Породы
Свинец, %
Литературные
источники
Ультра основны е
Основные
Базальты, габбро,
диориты, диабазы
Средние
Диорит, андезит
Кислые граниты,
липариты, биотиты
Гранит, гранодиорит
Метаморфические -
гнейсы
Тонкозернисты е
песчаники,
неизвестковые сланцы
Песчаные сланцы
Известняки,
доломиты
Осадочные глины
Речные осадки
2-3-10
-4
6-10
6-8-10~4
1-10-3
1,2-1,5-10~3
1,5-2,0- Ю-3
2,2-3,0-10~3
2-10"3
2,3-10"3
1.7-1СГ3
1,1-Ю"3
2, Ю-3
2,5-Ю"3
/187, 247/
/187, 247/
/27,247/
/187/
/27, 247/
/27, 187/
/247/
/247/
/247/
/247/
/247/
/27/
/27/
- 108 -
Таблица 5.3
Содержание свинца в почвообразующих породах
европейской части СССР /52, 146/
Местонахождение
Карельская АССР
Псковская обл.
Тульская обл.
Тульская обл.
Воронежская обл.
Аджарская АССР
Кабардино-Сун-
женский хребет
Силтанукская
возвышенность
Моздокская степь
Породы
флювиог ляциа льны е
отложения
морена
покровный суглинок
лессовидный
суглинок
лёссовидный
суглинок
красноцветная кора
выветривания
лессовидные
карбонатные глины
то же
V
Содержание
свинца, мг/кг
17,5
22,5
32,5
25,0
15,0
12,5
30
25
40
Южная часть Северо-
Осетинской
наклонной равнины
Северный склон
передовой цепи
Черных гор
Северо-Осетинска я
наклонная равнина
желто-бурые
лёссовидные
карбонатные глины и су-
40
30
Там же
и
Передовые отроги
Черных гор
глинки
мелкозем валунно—га-
лечниковых отложений
аллювиальные
отложения
продукты выветривания
песчаника
20-26
26-32
22-30
40
- 109 -
Местонахождение
Породы
Содержание
свинца, мг/кг
Передовые отроги глинистый элювий-
Черных гор делювий 45
Там же продукты
выветривания глинистых
сланцев 50
Данные авторов.
5.3. СВИНЕЦ В ПОЧВАХ ПРИРОДНЫХ
И ТЕХНОГЕННЫХ ЛАНДШАФТОВ
Среднее содержание свинца в почвах составляет 1-10 %,
в почвах Русской равнины оно колеблется от 2,6 до 43 мг/кг
/27/. Почвы США, не связанные с ореолами рассеяния рудных
тел, содержат от 2 до 200 мг/кг свинца /378/, преобладают
величины от 5 до 25 мг/кг; 95% проб (из 964) содержали
менее 30 мг/кг, 58-16 мг/кг, с колебаниями в большинстве
случаев от 15 до 30 мг/кг. В верхних горизонтах черноземных
почв Канады концентрация элемента равна 6-12 мг/кг,
приблизительно столько же имеют пахотные почвы Дании - 18,6 мг/кг.
Значительно больше элемента в почвах Западной Канады -
52 мг/кг /283/, для поверхностных почв Англии и Уэльса -
50 мг/кг /288/. Фоновые участки почв некоторых районов
Польши имеют концентрацию элемента 40 мг/кг /236/.
Почвы тундр и сероземы отличаются меньшим количеством
свинца - от следов до 6 мг/кг, в остальных изученных почвах
содержится от 10 до 50 мг/кг (табл. 5.4), с некоторым
увеличением в почвах европейской части Союза с севера на юг
/179/. По-видимому, предложенный А.П. Виноградовым /27/
кларк свинца в почвах занижен в 1,5 - 2 раза.
Уровень содержания в почвообразующей породе определяет
концентрацию элемента в почвах природного ландшафта,
особенно эта связь заметна для слаборазвитых почв /377, 239/.
Миграция и конечное распределение элемента в почвах
происходит под действием факторов почвообразования, влияния
биологического круговорота элемента, определяющих накопление (вынос)
элемента в профиле почв,
Свинец хорошо сорбируется почвенно-поглощающим
комплексом почвы и с трудом вытесняется другими элементами, причем
двухвалентный ион свинца сорбируется более прочно, чем
одновалентный ион калия, имеющий сходный ионный радиус /196/.
- 110 -
Свинец в щелочных почвах штата Пенджаб удерживается сорб-
ционно, а наибольшую роль в этом процессе играют ил,
органическое вещество и карбонаты /357/. Фиксация свинца в первую
очередь определяется присутствием органического вещества,
контролирующего потребление элемента растениями. Осаждение
элемента карбонатами и сорбция гидроксидами металлов, по-
видимому, играют все же второстепенную роль /399/.
Неоднозначны выводы авторов, изучавших связь свинца с
органическим веществом почвы. В длительно сезонномерзлотных
почвах лесостепной зоны Западной Сибири отмечается
аккумуляция элемента в гумусовых горизонтах, подстилках. Он способен
сорбироваться на тонкодисперсном материале и мигрировать в
слабокислых условиях в составе комплексов с фульвокислотами
и с высоко дисперсными продуктами /52/. Об аналогичных
закономерностях, свидетельствующих о положительной связи
свинца с органическим веществом почв фоновых территорий,
отмечено во многих работах /372, 203/. В.В. Ковальский и
А.И.Макарова /75/, изучая связь свинца с отдельными компонентами
бурой горно-^лесной почвы биогеохимической провинции,
обогащенной свинцом, установили, что содержание элемента,
находящегося в легкоподвижной (водорастворимой) форме, составляет
1,4%, обменного 10% от валового; более 8% свинца связано с
органическим веществом, причем наибольшая часть этого
количества приходится на фульваты, 1,3% на гуматы. С
минеральной частью почвы связано 79% свинца. Элемент накапливается
в иллювиальном горизонте подзолистых и латеритизованных почв
/372/, в почвах Канады (черноземы и лювисоли)
распределение свинца по профилю равномерное /239/.
Любое загрязнение природного комплекса ведет к изменению
элементного состава почв, при этом прослеживается увеличение
в них целой гаммы веществ. На территории воздействия свин-
цово-цинковых предприятий приоритетными
элементами-загрязнителями являются РЬ, Zn , Cd , а также оксиды серы, азота.
Негативное действие всех этих токсикантов суммируется.
Загрязнение свинцом почв достигает 15-30 км в направлении
господствующих ветров, реже до 100 км /268/. На
распространение и уровень накопления свинца в почвах вокруг
промышленных предприятий оказывают влияние метеорологические факторы,
рельеф местности, специфические особенности источника
загрязнения /314, 221/. В зоне влияния заводов на расстоянии до
10 км содержание свинца в почвах остается повышенным /2,°.1,
279, 315, 335/. Высокими» иногда аномально-высокими
концентрациями свинца характеризуются почвы территорий,
прилегающих к предприятиям по добыче, переработке и очистке свинец-
содержащего сырья. Так, например, в Югославии почвы вблизи
свинцового завода, функционирующего в течение века,
содержали до 2% элемента /312/.
- 111 -
Таблица 5.4
Свинец в почвах /11, 52, 131, 17 9/
Почвы
Район
Валовое
содержание РЬ, %
Свинец,
переходящий
в 1 н
HN03,' %
Источники
Торфяно-пе-
регнойно-
глеевая
Дерново-
палево—
подзолистая кон-
тактно-
оглеенная
супесчаная
Дерново-
среднелод-
золистая
Чернозем
мощный
Чернозем
предкавказ-
ский
карбонатный
Чернозем
выщелоченный
Дерново-
луговые
Дерново-
глеевые
Валдайская воз -
вышен-
ность
А 2,4-10
о
.-3
Там же А-^Э-Ю'
-3
Ярославская обл.
Курская
обл.
Краснодарский
край
Воронеж^
екая обл.
Притис-
сенская
низменность
1,5'10'
-3
2,3-10'
-3
2,5-10
-3
3,5-10'
-2
6,1-10'
-3
Там же 6,7-10'
.-3
4-10
-4*
3-10
11
11
179
179
179
0,4-Ю""4 52
131
131
- 112 -
Почвы
Валовое соцер- Свинец, пе-
жание РЬ, % ! рехоцящий
в 1 н.
HN03, %
Источники
Темно-каш- Херсон-
тановая со- екая обл. 2,7*10
лонцева-
тая
Краснозем Грузин-
-3
екая ССР 3,54 0
к-3
179
179
Краснозем
Бурые
лесные
Бурые
псевцо-
подзолистые
Батумс-
кий бот-
сад
Закарпатье
и
J.O !
-3
5,6-10
4,0-3 0
-3
52
131
131
Свинец, переходящий в вытяжку 1 н.НС/ .
5.4. СОДЕ1"КАНИЕ СВИНЦА В
ГРАНУЛОМЕТРИЧЕСКИХ ФРАКЦИЯХ ПОЧВ
Наибольшее содержание свинца приурочено к илистой и пред-
илистой фракциям, выделенных из гумусовых горизонтов почв
(рис. 5.2). Установлено также, что с уменьшением размера
частиц концентрация свинца увеличивается в
дерново-подзолистой, серой лесной почвах, черноземах мощном и предкавказском
карбонатном, а также темно—каштановой почве /60/.
Рентгенограммы илистых и предилистых фракций почв свидетельствуют
о присутствии в них вермикулита, гидрослюды, в небольших
количествах каолинита, хлорита. В илистой фракции сорбентами
свинца могут быть иллит и гидроксиды алюминия и железа,
вторичные глинистые минералы, органическое вещество. Высокое
содержание элемента в пылеватых и песчаных фракциях,
вероятно, связано с первичными минералами, например полевыми
шпатами, в которых он находится в качестве изоморфной примеси.
Накопление свинца в илистой фракции и фракции физического
- 113 -
песка показано в церново-сьрнтоподзолистых почвах /11/. Для
краснозема концентрация РЬ увеличивалась в ряду ил-песок—пыль
/60/. Высокие коэффициенты накопления свинца цля крупных
фракций почв связаны с ореолом рассеяния рудных
месторождений и обогащенностью первичных минералов элементом /75/.
В почвах Северо-Осетинской наклонной равнины, напротив,
доля крупных фракций ( > 0,01 мм) в балансе свинца в почве
сравнительно невелика. Если учесть, что вблизи предприятий
могут выпадать частицы размерами до 50 мк, а количество
поступающей пыли достигает 1 г/м^ в сутки, то можно
предположить, что происхождение свинца в крупных фракциях может
быть с вязано с выпадающей на поверхность почвы техногенной
1ё
I
1
20
_L_
АО
_!_
2.
%от валового
1
Ал
0-9
< 0,001
0,001-0,005
0,01-0,05 ОМгОЛЬ
yy.y.mLMho о о о о о о\jLM5-w
.;.;. ;.;.;|_г_~1Г-Г1г^ о о о о о о -
#1
Рис. 5.2. Свинец в гранулометрических фракциях почв
пылью /238/. Распределения свинца по гранулометрическим
фракциям могут быть использованы для диагностики
техногенных неоаккумуляций элемента.
5.5. ГЕОХИМИЧЕСКИЕ ПОТОКИ СВИНЦА
Информация по геохимической миграции свинца в различных
природно-климатических условиях пока малочисленна. Скорость
и мощность потока элемента определяют подвижность и степень
токсичности элемента в ландшафге. Изучены формы миграции
тяжелых металлов Си, Zn , Pi, Cd в эродированной и с
полноразвитым профилем почвах под естественной растительностью.
- 114 -
Возможна миграция РЬ в составе и чещённого вещества, в
коллоидной фазе и в ионнорастворимии ф-.>{.м«*. В полноразвитом
профиле ионнорастворимые формы преобладают в водах верхнего
горизонта, но с глубиной концентрация элементов в коллоидной
взвеси увеличивается /8/. В автономных ланцшафгах происходит
освобождение соединений свинца из органо-минеральных
соединений, выщелачивание их и накопление в подчиненных ланцша<}>-
тах, для которых характерна замедленная минерализация
органического вещества. Здесь поступившие с поверхностным стоком
соединения свинца сорбируются и накапливаются /110/. Г.Д. Бе-
лицына с соавтор. /10, 11/ исследовали миграцию свинца в
основных компонентах ландшафта ельника-кисличника Валдайской
возвышенности. Установлено влияние восстановительных
процессов, механического сосгава для почв бологного ряда, где в гле-
евых горизонтах возрастает содержание свинца. Для почв
исследованного ландшафта прослежена роль сорбционного, щелочного,
глеевого барьеров в сорбции свинца. Нейтральные
слабоминерализованные грунтовые воды характеризовались невысоким
содержанием свинца и невысокой интенсивностью водной миграции.
Большое значение в процессах миграции имеет перенос
свинца водами рек. В подземных водах свинец обнаруживается редко.
Из вод, формирующихся под влиянием месторождений, свинец
энергично поглощается твердой фазой. Поэтому для потоков
рассеяния рудных месторождений характерна сравнительно
небольшая их протяженность /127/. На концентрацию свинца в речной
воде влияют минерализация рек, температура и другие факторы.
В речных водах присутствует 0,8-0,9* 10""^% водорастворимого
свинца /88/, однако глазной формой его миграции является
перемещение в составе тонкой терригенной взвеси, особенно для
рек гидрокарбонатного и сульфатного состава /14/. Реки с
небольшой мутностью (Дунай, Днепр) несут воды, в которых доля
растворенного свинца выше, чем ь горных реках с высокой
мутностью. В большей степени накапливают свинец тонкоцисперсные
фракции взвесей - до 99,6%.
Свинец техногенного генезиса накапливается в поймах и
донных отложениях рек и озер. Донные отложения "интегрируют"
геохимические особенности водосборной площади,что позволяет
по их химическому составу выделить техногенные потоки
рассеяния и оценить степень техногенной нагрузки на всю водосборную
площадь /148/. Свинец в донных отложениях тесно связан с
гидроксидами железа и органическим веществом, с фульвокислс—
тами и в меньшей степени гуминовыми кислотами. Значительная
часть свинца сорбируется на оксидах железа /6/. С водами
суши значительные количества свинца выносятся в океан, за счет
чего увеличивается содержание металла в морской воде /42/.
- 115 -
5.6. РОЛЬ МИНЕРАЛЬНЫХ КОМПОНЕНТОВ ПОЧВ
И ГУМИНОВОЙ КИСЛОТЫ В ФИКСАЦИИ СВИНЦА
Почва - мощный и активный поглотитель ряда веществ, она
способна прочно связывать и тем снижать поступление
токсикантов в растения, в почвенно-грунтовые воды. Но емкость
поглощения почвы не беспредельна. Активно инактивируют соединения
свинца минеральные и органические компоненты почвы. Однако
среди множества исследований, посвященных этому вопросу,
лишь небольшая часть дает представление о Фопмах связи
свинца и других тяжелых металлов с минеральными и органическими
компонентами почвы.
Основным механизмом фиксации свинца является
координационное связывание его за счет свободной пары электронов
различными функциональными группами /209, 356/.
Интенсивность связывания элемента органическим веществом почвы и
стабильность связей возрастают при подщелачивании среды.
Устойчивость компонентов свинца с фульвокислотой возрастала при
повышении рН среды от 3,5 до 5,0 /355/. Аналогичные данные
приводятся и для гуминовых кислот (ГК) /379/, Одним из
возможных механизмов связи ТМ с органическим веществом
является образование гуматов, В работе Д.С. Орлова, Н.В. Нестеренко
/114/ доказана возможность образования гуматов никеля,
кобальта и меди за счег карбоксильного водорода с образованием
ионизированных карбоксильных групп.
Для понимания механизма и прочности связи ионов и
соединений свинца с почвенными компонентами нами проведены
эксперименты по насыщению 1н. раствором РЬ (N03)2 с рН 4,5
вторичных глинистых минералов, гуминовой кислоты и илистых
фракций почв с последующей экстракцией сорбированного свинца
последовательно ацетатно-аммонийным буферным раствором с
рН 7,0 и 4,8, затем раствором 1н. HNO3. Для многих
препаратов определена емкость поглощения по Ва^ . Структурные
изменения в илистых фракциях почв и минералов проверяли рент-
генодифрактометрическим методом до и после насыщения их
свинцом. Подготовку ориентированных образцов и
рентгеносъемку проводили в соответствии с рекомендациями /172/.
В насыщенном Р^"+ монтмориллоните в водной среде базаль-
ное межплоскостное расстояние уменьшилось до 12,6 А
(рис. 5.3). Сольватированный глицерином образец сохранил
такую же величину ^001» как и исходный образец
(ненасыщенный Ffc>2), но более диффузный рефлекс в области 17,5-18,9 А.
После прокаливания при 350° <^Q01 монтмориллонита,
насыщенного РЬ i составляло 12,3 А, т.е. больше на 2 А, чем
после такой же термической обработки нативного образца. При
этом интенсивность рефлексов значительно уменьшалась, что
свидетельствует о нарушении ориентации пакетов минералов и
- 116 -
о межпакетном положении ионов свинца в монтмориллоните,
вероятнее, F\>0+ или Рь • *\ Н2О, чем РЬ , с наклоном к
плоскости (001). Использованный в нашем опыте вермикулит
имеет смешанослойную хлоритвермикулитовую структуру: после
прокаливания при 350° сжатие решетки не происходит ( d 001 ш
■14 А). Межплоскостное расстояние не изменялось и после
прокаливания до 550° (см. рис. 5.3). В образцах, насыщенных
Рь, интенсивность всех рефлексов уменьшается, а межплоскост—
ное расстояние 14,7 А изменяется до 12,6А; после насыщения
глицерином образца с поглощенным Рь2+ изменений в
положении рефлексов не отмечено. Для каолинита при насыщении
свинцом структурных изменений обнаружено не было.
Емкость поглощения монтмориллонита, вермикулита по
свинцу значительна и превышает 100 мг • экв/100 г и
практически весь свинец является 'обменным*. Из вермикулита в
ацетатно-аммонийную вытяжку с рН 7,0 переходит 77%
поглощенного свинца (табл. 5.5).
Многие исследователи отмечают близость размеров радиусов
ионов К+ и Рь2+ - 1,33 и 1,32 А соответственно /15, 165/.
Ионы свинца проникают в межпакетные промежутки вермикулита
и вызывают изменение рефлексов dgOl на рентгенограмме.
В отличие от монтмориллонита свинец фиксируется
вермикулитом прочнее, что соответствует сведениям о структуре и
характере адсорбционных центров в межпакетном пространстве этого
минерала. Примечательно также, что емкость катионного обмена
(ЕКО) по свинцу у этого минерала оказалась выше, чем по
барию. Это связано с большим радиусом иона бария и в связи с
этим стерическими затруднениями проникновения ионов элемента
в межпакетное пространство минерала.
Установлено, что адсорбция свинца в почвах подчиняется
изотермам Ленгмюра и Фрейндлиха в широком диапазоне
концентраций /369/. Емкость и характер сорбции определяются главным
образом содержанием органического вещества и илистой фракции.
Количество поглощенного свинца превышает ЕКО, определяемую
обычными методами. Авторы полагают, что это может быть
вызвано адсорбцией свинца не только в форме Рь^+, но и в форме
PL (OH)+, поскольку равновесные значения рН суспензий были
5,5-7,0, что могло способствовать частичному гидролизу
свинца, а в некоторых почвах элемент мог осаждаться в виде
карбонатов и гидроксида.
В наших исследованиях наиболее ясные структурные
изменения в минералах при насыщении свинца получены для илистой
фракции чернозема южного. В этой почве присутствует
разбухающий минерал группы монтмориллонита. При насыщении
свинца происходит изменение ориентировки частиц образца в
сторону уменьшения интенсивности рефлексов. При насыщении Рь ^001
14,7 А разбухающего минерала сменяется диффузным пиком в
области ^001 11.3-15,5 А, несколько уменьшается d qoi
- 117 -
I Л/4,7
-10,3 к
Чернозем южный В Монтмориллонит
Рис. 5.3. Рентгенодифрактограммы минералов илистой фракции
чернозема южного: I - исходный образец, II - насыщенный
свинцом, А - образец водный, Б - насыщенный глицерином,
В - прокаленный при 350°
2
я
>>
я
я
к
a
о
о
с
»я
§
е
S
§
S
С
§
ф
§
3
3
ф
я
я
I
I
с
Ш
Я 1
W
3
А
А
Я
з
«
о
3
0)
о,
О)
с
a.
№
Лф+ 1
'2 о о Ь
Шс с 2
о
iH
*°
о о +
Ф « ^ п
О 5 О rQ
Шш в k J
со
О
2Г
X
#
Я
тЧ
00
^
£
2
?
<
О
г^
X
Q*
i
i
X
Я
<
ФК
! S Я 1
^ со Ф
Я Э« 1
О
2
ь
о
о
н
О) № 1
°ч Я Я 1
СО Ф I
я я*
9
ь
ь 1
о
ф № 1
к я 1
СО Ф I
я и*
л
со
k
2
г-
о
о
н
я
о
СО
СО
а,
ю !
С
(М 0) Ю
оГ г- т-Г
О гН тН
0) h Ю СО
I I
I Ю
CD
h СО СО 0) Ю О
^f г^ с\Г О? c\f со"
тЧ Н CD CM И
тЧ тЧ
^ тЧ
со ^
см
Ю С0^ СО О
^ ю ^ со" 2
t4 СМ СМ СМ ^
о ^
CD
О
СО
1 н
1.0
СО
^
\Г
1 г^
0)
о
CD
^
CD
Н
г-
Н
г-
о
со"
°1 ю
СМ ^
СО Ю
со
0) 00 ^ ^ 0) CD
1 с\Г cd" о" о" со* о*
^ о ю ^
^ СМ со ^
(D со Н 0) t О
Н гЧ~ СО"
ю
°1
Г- 2 ю" CD
СО ^ СМ СМ
Г^ Г^ СО Ч Г^ О
h h со" О fsT о"
СО Н
о
^ ^ ^ ч
r^* of of см"*
СО
о %
CD
г-
см
0)
СО
106
ю
ю
ю
CD
CD
^
CD
125,
О
CD
гЧ
00
^Г
тГ
СО
СО
СО
^
СО
н
о
о
со
о
to
о
о
ю
о
CD
ю
ю
i4
О)
СО
ю
ю
тЧ
о
СМ
г-
i4
см
0)
г-
тЧ
г-
о
н
со
со
о
о
СП
о
X
с
'
СМ
о
• т-*
сл>
X
8
«■>
<
СО
F
о
я
X
и
d
со
и1
о
с
S3
а
Ч
•8;
о
ь
7?
5J*
5
н
эг
- 119 -
ю
ю
ё
СО
Ф
Я
О
а
о
а,
|«в
Jo
ф
|ф
|с
Я
Щ и
А о о
Шеи
28 +
Ф « СМ
Ш ф я Qs
СО Ф
яг
is
CO
CO
\o
О
CO
r-
Ю
0)
Ю
Ю
0)
CM
CD
H
Ю
CM
CM
CD
CM
*
CO
Ю
о
CD
Ю
^
H
CO
О
CO
Ю
CM
Ю
^
со
H
CD
CD
0)
Ю
О
^
^
CM*
r-
t-
CM
10
CD
CD
CO
Г-
CO
t-
CM
H
^
H
00
i-T
r-
см
CM
о
а>
0)
CD
г-
о
г-
О)
см
Is-
ю
CD
н
О)
^
н
ю
^
1
о
о
ю
г-
со
о
ю
н
ю
СМ
CD
о
Я
о
те же, чт
л
S
я
8
S
со
со
ния в н
1
кра
о
о
'§
m
ый раст]
Я
я
Н СМ
ю
см
CD ^ СО 0) О) &
^ СМ* СО СО* Г^ °
Г^ Г- CD Г- CD 2
я
г- г- ^ о
и о" о t-~
°1
ф
{3*
В Si
я ^
У q q У
i
3
СО
г
. О
Ф СО
Я*
СО И
&* §
Ф 9
2 Н
я S
&
- 120 -
10 А, характерное для иллита. В образце, насыщенном свинцом,
затруднено проникновение в межпакетные промежутки глицерина,
и по этой причине не изменяется величина рефлекса 001 после
обработки препарата глицерином. Свинец прочно связывает
пакеты монтмориллонита, но в то же время он целиком вытесняется
ацетатно-аммонийной вытяжкой с рН 4,8. В дерново-подзолистой
почве присутствуют иллит (гидрослюда) и каолинит. Изменения
межплоскостных расстояний после насыщения свинцом не были
отмечены, хотя интенсивность соответствующих рефлексов
уменьшилась.
По способности поглощать свинец почвы образуют следующий
ряд: Т > ЧЮ "> ЧТ > ДПИ - ДПН. ЕКО по свинцу и барию для
них близки. ЕКО по двум элементам илистых фракций дерново-
подзолистых почв тоже совпадали, но для черноземов,
особенно типичного, были выше по свинцу, чем по барию. Обьясняс ся
это высоким содержанием органического вещества и связыванием
свинца функциональными группами с образованием комплексных
соединений, не поглощающих щелочноземельных элементов.
Сравнение рентгенодифрактограмм илистых фракций,
выделенных из загрязненной и фоновой почвы, показывает, что они не
имеют качественных различий. Межплоскостные расстояния
монтмориллонита, в илистой фракции которого присутствует свинец
в количестве **1565 мг/кг, не изменяются. Однако это не
отрицает возможности фиксации свинца в загрязненных почвах
глинистыми минералами, так как степень загрязненности почвы
сравнительно невелика (1565 мг/кг свинца составляет всего
лишь 1,5 мг«экв/100г) /169/. Вероятно, именно органическое
вещество илистой фракции участвует в сорбции свинца.
Количество илистой фракции в загрязненных верхних горизонтах
невелико (9-14%), а значит, доля свинца, связанного с илистой
фракцией, незначительна при высоком абсолютном содержании в
ней элемента.
В фиксации экзогенного свинца могут участвовать как
органические, так и минеральные компоненты, обладающие разной
емкостью поглощения элемента. Органическое вещество очень
активно и в больших количествах сорбирует свинец. ЕКО гуми-
новой кислоты по свинцу достигает 400 мг«экв/100 г, она
образует прочные связи с Рь, и только ^63% поглощенного
свинца можно считать 'обменной* и 'легкорастворимой формой*.
Остальная его доля вытесняется лишь 1 н. HNO3 и представляет,
видимо, формы соединений свинца с гуминовой кислотой по
типу комплексных соединений.
В опытах по сорбции свинца из раствора Рь (НОз)я смесью
Са-насыщенного торфа и бентонита было установлено, что торф
сорбировал свинец сильнее, чем бентонит /216/. Связь между
двухвалетными катионами металлов и ГК осуществляется через
две карбоксильные группы (включая группы фталевой кислоты)
или через СООН- и ОН-группы /379/. Кроме ионных связей,
- 121 -
в образовании комплексов участвуют координационные связи
через недиссоциирующие, слабокислые функциональные группы
(-ОН Сахаров, фенолов и др.).
По нашим данным, ИК-спектры гуминовой кислоты
чернозема, насыщенные свинцом в статических условиях и при соосаж-
дении, показывают полное замещение карбоксильных групп
(исчезновение полосы 1725 см""*) и появление ионизированных
групп СОО" при 1400 см"*-. Полученные осаждением
минеральные компоненты в присутствии свинца (гидроксиды железа и
алюминия, карбонат кальция и кремневая кислота)
характеризуются сравнительно невысоким захватом свинца. Однако
фиксация свинца FeOOH и СаСОо по сравнению с глинистыми
минералами оказывается более прочной. Гидроксиды железа и аллю-
миния имеют аморфную структуру (возможно, с крыто
кристаллическую), даже через год после осаждения свинец может
препятствовать дальнейшей кристаллизации аморфных гидроксидов
железа и алюминия, что подтверждено в ряде работ. Равные
количества свинца были фиксированы аморфным гидроксидом железа
и гематитом, на основании чего предполагается, что адсорбция
тяжелых металлов зависит больше от характеристик
поверхности сорбента, чем от кристаллической структуры его, и
интерпретируется как хемосорбция /272/.
В наших экспериментах, кроме сорбции, гидроксиды железа
и алюминия в значительной степени "захватывают*
(окклюдируют) свинец, возможно в виде Pk^+ или Рк»(ОН)+, в щелочной
среде - Fb(OH)2i который легко переходит далее в РьО. По
окклюдирующей способности минеральные, искусственно
приготовленные препараты, располагаются в ряд: FeOOH» 11Н2О ^
А100Н'пН20 ^Si02#nH20. Нужно отметить, что первая
стадия взаимодействия ионов свинца в растворе соли элемента с
почвой и ее компонентами и образование всех групп
предполагаемых соединений в системе Pt^ (раствор) - твердая фаза
происходят за короткое время (часы - дни).
Емкость поглощения почв часто намного превышает
количество техногенного свинца в них. Таким образом, почва обладает
высокой способностью закреплять поступающий в нее
экзогенный свинец, являясь естественным барьером на пути миграции
и поступления элемента из почвы в растения и грунтовые воды,
что подтверждает особую рель педосферы в круговороте
элемента в ландшафтах и на планете, в глобальном круговороте
веществ.
5.7. СВИНЕЦ В СИСТЕМЕ ПОЧВА-РАСТЕНИЕ
Вегетационный опыт с различными почвами проводился с
целью установления влияния состава и свойств почв на транс—
- 122 -
формацию внесенных соединений элемента и поступление его в
растения. Свинец вносили в вице Рь (НС>з)2» опытные
культуры - ячмень, салат листовой. Для опыта взяты верхние (А±
или Апах) горизонты почв, характеристика и названия которых
даны ранее в разделе 3.4.
В динамике определяли содержание соединений свинца в
почвах: водорастворимые (бидистиллированная вода), условно
ионообменные (ацетатно-аммонийный буферный раствор рН 7,0),
условно подвижные (ацетатно-аммонийный буферный раствор
рН 4,8), кислоторастворимые (1 н. HNO3).
Токсическое действие элемента начинает проявляться с
самого начала роста растений, но в различной степени на разных
почвах и дозах. Хуже всего чувствуют себя растения на кислой
дерново-подзолистой почве (даже на контрольном варианте).
Статистически значимое снижение урожая соломы ячменя
отмечено на этой почве в 1978 г. при 250, в 1979 г. при 500,
а в 1980 г. при 2000 мг/кг свинца. Ослабление
токсического действия высоких доз элемента со временем можно объяснить
инактивацией внесенных соединений и постепенным переходом
их в фиксированное состояние даже на кислой неокультуренной
почве. Еще активнее и быстрее процесс трансформации РЬ(М0^)о
проходит в дерново-подзолистой окультуренной почве,
В 1978 г. на ДПО признаки угнетения растений проявляются
при концентрации свинца 2000 мг/кг и особенно сильно при
3000 мг/кг. В 1979 г и 1980 г. статистически значимое
снижение урожая соломы ячменя отмечено только при 3000 мг/кг
свинца. На черноземе типичном и торфе во все годы урожай
соломы статистически значимо не снижался ни при одной дозе.
Дерново-подзолистая неокультуренная почва характеризуется
неблагоприятными свойствами: кислой реакцией среды, малым
количеством гумуса, низкой буферной емкостью, ненасыщенностью
основаниями. В таких условиях соединения свинца являются
наиболее подвижными, но несмотря на это содержание
водорастворимого элемента невелико и колеблется от 0,004 мг/кг (4, ОХ
х10-8г/100 мл в равновесном растворе) на контроле до
7,9 мг/кг (2,9-Ю""5г/100 мл) при внесении 3000 мг/кг Рь,
что составляет 0,10-0,26% от количества внесенного
элемента. На других почвах концентрация свинца практически не
меняется с увеличением дозы и не превышает 0,1%. Уровень
концентрации свинца в водной вытяжке из почв (даже в кислой
неокультуренной почве) не достигает растворимости таких
соединений, как Рь(ОН)2 (1,3-10""4г/100 мл), РьНР04 (3,6х
XI0~4г/100 мл). Дерново-подзолистая неокультуренная почва
отличается относительно высоким содержанием 'обменных* форм
соединений свинца. В вытяжку 1 н. СН3СОО N H4 (рН 7,0)
переходит в первый год опыта от 6,5 до 43,6% общего
количества свинца в зависимости от дозы внесения элемента, во
второй от 5,6 до 32%, а в третий от 4,5 до 20%. Такая же
- 123 -
закономерность наблюдается и в отношении подвижных форм
соединений элемента, переходящих в вытяжку
ацетатно-аммонийного буферного раствора (рН 4,8). В эту вытяжку
вследствие малой буферной ДПН переходят не только легкорастворимые
соединения свинца, но и часть труцнорастворимых: в первый
год опыта до 77% от внесенного количества свинца, во второй
до 66%, в третий от 32 до 48%. За три года прослеживается
резкое снижение подвижности свинца и, как следствие,
уменьшение угнетающего действия его на растения при внесении в
почву водорастворимой соли элемента. Дерново-подзолистая
окультуренная почва отличается от неокультуренной более
высоким содержанием гумуса, pHj-joO ee совпадает с рН начала
осаждения гицроксида свинца. На этой почве соединения
элемента в большей степени подвержены переходу в малоподвижное
состояние. В черноземе и торфе органическому веществу
принадлежит, по-видимому, основная роль в фиксации свинца (см.
разд. 3). Из чернозема в водную вытяжку переходит в 1,5-2
раза меньше свинца в первый год опыта и в 3—4 раза меньше во
второй и третий по сравнению с ДПО. Количество обменных
форм составляет в 1978 г. 3,5-8,4% от внесенного количества
свинца в 1980 г. - 3—4£%. Количество фиксированных,
потенциально доступных растениям соединений свинца независимо от
типа почвы и дозы внесения элемента составляет 75-100%
(экстрагент 1 н. HNO3).
Как и следовало ожидать, поступление свинца в растения
идет более интенсивно на кислой ДПН почве, наименьшее оно
на черноземе, причем за три года накопление элемента
растениями снижается.На ДПН почве при дозе 500м1/кг свинца в
первый год опыта растения ячменя погибли, во второй были
ослаблены и имели признаки хлороза, а содержание элемента в
соломе достигало 58,7 мг/кг сухого вещества; в третий год
признаков угнетения растений на этой дозе не было, а
содержание свинца было меньше 10 мг/кг. На дерново-подзолистой
окультуренной почве, черноземе и торфе наименьшее содержание
элемента определено также в третий год опыта. Превышение
принятого ПДК в кормах и продуктах питания (10 мг/кг) /199/
и на второй год отмечено на этих почвах при 1000 мг/кг
свинца, в третий при 2000 мг/кг (табл. 5.6).
Культура салата листового оказалась наиболее
требовательной к условиям произрастания по сравнению с зерновыми.
Всхожесть семян салата даже на контроле ДПН почвы не превышала
5-10%. В опыте 1980 г. по сравнению с ячменем салат
накапливает в 1,5-2 раза больше свинца в расчете на воздушно-
сухую навеску. Прослежена высокая корреляционная связь меж^-
ду содержанием свинца в растениях и его количеством,
переходящим в раствор ацетатнс—аммонийного буфера с рН 4,8.
Коэффициент корреляции для всех почв оказался значим на уровне
не ниже 0,05 и колебался в пределах 0,90-0,96. '
- 124 -
Таблица 5.6
Содержание свинца в зерне ячменя
(опыт 1978-1980 гг.)
Почва,
год
дпн
1978
1979
1980
дпо
1978
1979
1980
ЧТ
1978
1979
1980
Т
1978
1979
1980
К
нет
0,05
0,06
0,08
0,05
0,04
0,062
0,04
0,02
0,068
0,09
0,02
125
нет
0,88
0,37
0,14
0,17
0,15
-
-
-
0,10
0,44
0,09
Дозы Рь в почве, мг/кг
250
нет
3,29
0,54
0,25
0,30
0,18
нет
0,83
0,08
0,18
0,61
0,28
500
нет
6,82
0,73
0,78
0,67
0,42
нет
1,2
0,26
0,56
0,78
0,39
1000
нет
8,80
1.5
1,30
2,13
0,74
нет
1.6
0,54
1,20
1,08
0,65
2000
нет
нет
нет
1,92
4,8
2,1
-
-
-
1,80
1,65
1.2
3000
нет
нет
нет
нет
7,5
3,5
-
-
-
3,40
2,55
2,7
Примечание. 'Нет* - отсутствие зерна в колосе, г-г -
опыт с черноземом заложен по сокращенной схеме (нет
соответствующей дозы).
Актуальность проблемы нормирования вредных веществ в
окружающей среде бесспорна, но решение ее осложняется тем,
что поступление токсикантов в организм человека происходит
чаще всего по сложной цепи: почва - растение - человек;
почва - растение - животное — человек; почва - вода - человек;
почва - воздух - человек. Однако в рекомендациях
вегетационный опыт предлагается проводить на песчаном субстрате, что
- 125 -
может привести к ложным заключениям об уровнях ПДК, так
как почва в отличие от песка активно химически и
биологически действует на экзогенное соединение свинца. На основании
подобных опытов Институтом коммунальной гигиены им. Сысина
были предложены ПДК свинца в почве - 20 мг/кг, что, видимо,
нельзя принять для всех почв и даже кислых
дерново-подзолистых. Очевидно, при решении вопросов нормирования веществ в
системе почва - растение необходимо учитывать многообразие
почвенных экологических условий роста и развития растений.
Детальное изучение степени токсичности свинца в кормах
для животных проведено Хапке с соавторами /266/. Ими
показано, что количество свинца в кормах, превышающее 15 мг/кг
сухой массы, может оказать негативное действие на жвачных
животных, концентрация 100 мг/кг в корме вызывает
нарушение активности ферментов, а корма с содержанием больше
250 мг/кг Рь при применении их в течение недели дают
клинические симптомы отравления /266/. Для нормального
протекания биохимических процессов в растительном организме
существует оптимальный диапазон концентрации элемента.
Концентрации, превышающие средний их уровень, но не ведущие к
угнетению и гибели растений, будем считать толерантными для
растений. Мы пытались также выявить границы токсичных
концентраций свинца для растений на различных почвах с градацией
содержаний элемента, вызывающих гибель, снижение урожая соломы
и зерна, приводящих к накоплению свинца выше ПДК в кормах.
На основании литературных данных за максимальную
толерантную концентрацию свинца для животных в кормах нами принята
10 мг/кг (табл. 5.7).
Первые стадии процесса трансформации внесенных соединений
свинца протекают быстро, но они продолжаются в течение многих
лет. Об этом свидетельствует увеличение толерантной
концентрации элемента для растений в течение трех лет вегетационного
опыта. На всех изучаемых почвах (кроме дерново-подзолистой
неокультуренной, на которой растения погибли в первый год
опыта при 500 мг/кг Рь) даже при 3000 мг/кг в зерне
ячменя содержание свинца было ниже ПДК (10 мг/кг). В соломе
накопление элемента выше ПДК на дерново-подзолистой
неокультуренной почве в первый и второй год отмечено уже при
250 мг/кг свинца, а в третий год при 500 мг/кг, на других
почвах опасным содержанием можно считать дозы 1000 мг/кг
и более. На черноземе как в первый, так и в последующие годы
опыта токсические дозы оамые высокие по сравнению с другими
почвами. Таким образом, для правильного нормирования ТМ в
почвах необходимо учитывать в первую очередь состав почвы,
а также пецохимию элемента и физиологические особенности
растений.
- 126 -
ф
ПГ2
I* со
Is 8*
psd
Вф2-
•л а::
15 « ф о
со
о
о
W
К
«а
ф
о
8
8
U
ф
S
Я К
SO Q<
каш
о£>со
ф
*1о
Зой
е
о о
£
I
И 8
4
о
°
°
со]
g
о
о
о
°
о
о
ч
°
со
°
°
СО
1000
о
о
о
0-3
о
о
СМ
о
о
о
СМ
о
о
о
0-1
о
ю
нет
о
о
о
СО
4
о
°
см
о S
col к
I
ф
8
- 127 -
6. МЫШЬЯК
6.1. ХИМИЧЕСКАЯ ХАРАКТЕРИСТИКА
Среднее содержание мышьяка в земной коре составляег
2,0 мг/кг /27/. Мышьяк - высокотоксичный элемент.
Увеличение концентрации его в атмосфере, в природных водах, почвах
отрицательно сказывается на живых организмах. Источником
поступления избыточных количеств мышьяка в растения и далее
по пищевым цепям в организм животных и человека является
почва, поэтому изучать поведение мышьяка начали сразу же
после установления его токсичности. Первое упоминание о
присутствии мышьяка в почве относится к 1913 г. /261/. Вскоре
появились сведения о том, что мышьяк - постоянный компонент
почвы.
Нахождение мышьяка в земной коре и его поведение зависят
от строения атома элемента. В.М. Гольцшмидт /38/,
положивший в основу классификации элементов строение электронных
оболочек атомов и величины атомных объемов, отнес мышьяк
к элементам-халькофилам, которые имеют 18-электронный слой
и после потери 5 электронов - 45 , 4р^, активных в
химических реакциях. Халькофилы в кислой среде при действии H2S
образуют сульфиды с низким произведением растворимости (AsoSz»
ASiSs).
Занимая место во второй половине больших периодов в
нечетном ряду V* группы Периодической системы Менделеева, мышьяк
проявляет выраженные свойства неметаллов. Гидраты трехоксида
мышьяка Ад (ОН) о неустойчивы и обладают амфотерными
свойствами; оксид мышьяка А $2^5 - промежуточными между
кислотными свойствами Р2О5 и 51>20з; сульфиды мышьяка
проявляют кислотный характер.
Как элемент, образующий ковалентные или металлические
связи, мышьяк имеет большее сродство к 6, чем к О, и
предпочитает соединяться с S, Se, Те. Валентность мышьяка в
природных соединениях Sf 3* 37 редко 2t Пятиоксид мышьяка
обладает отчетливо выраженными кислотными свойствами, оксид
трехвалентного мышьяка имеет свойства слабого основания. Пя-
тисернистый мышьяк (А$2^5) среди сульфидов - "сильная*'
кислотаг, а реальгар (As4 S4) соответствует амфотерным
оксидам /38, 182/.
- 128 -
А.И. Перельман /120/, классифицируя элементы по
особенностям их гипергенной миграции, отнес мышьяк к слабоподвиж-
ным элементам. X. Ониси и Э. Санделл /113/ указывают, что
по миграционной способности мышьяк занимает промежуточное
положение между высокоатмофильными элементами, такими, как
Н и С1, с одной стороны, и металлами типа С а и 2 г» - с
другой. Способность мышьяка к миграции определяется
особенностями физических и химических свойств его соединений: AsCl^
^кип. + 130»2°с) и AsH3 ^сжиж# -55°) - легколетучие
соединения даже при относительно низких температурах, A S2^3»
A S2O5 - легкопоцвижные, растворимые в воде соединения.
Мобильность сульфидов ограничена: они растворяются лишь в
щелочных растворах.
6.2. МИНЕРАЛЫ МЫШЬЯКА, МЫШЬЯК В ГОРНЫХ
И ПОЧВООБРАЗУЮЩИХ ПОРОДАХ
Основная часть мышьяка находится в земной коре в
рассеянном состоянии, присутствует как примесь, особенно в сульфидных
рудных и нерудных образованиях, в том числе железа, меди,
ртути, свинца. В природе известно более 120 минералов,
содержащих мышьяк. Чаще встречаются арсениды, сульфиды, тиоарсе—
наты, оксиды мышьяка. Сульфиды мышьяка (реальгар AsS или
А$4 S4 и аурипигмент As2 S3) растворяются в щелочах и в
карбонатных растворах с образованием тиосолей (солей тиокис-
лот H3ASS3 и НзА5в4)- Тиосоли мышьяка растворимы в
воде. Арсениды - устойчивые к кислотам интерметаллические
соединения: мышьяковый колчедан или арсенопирит FeAsS ,
мышьяковистый колчедан или лёлленгит FeASo» никелевый колчедан
NiA&2» кобальтовый блеск CoA&S и т.д. При выветривании и
окислении Fe As 9 переходит в скородит FeAs04*2H20 и
другие водные арсенаты железа. Примером тиоарсенатов могут
служить мышьяково-серебряная обманка 3 Ag*2& • As2 S3' теНв"
нантит Cu^S *As 2 S3» энаргит 3CH2S #As2S5* Встречающийся
в природе трехоксид мышьяка A S2O3 называется арсенолитом
или клаудезитом. При растворении его образуется
мышьяковистая кислота H3ASO31 при последующем окислении - мышьяковая
кислота H3ASO4. Эти редкие минералы встречаются только на
участках месторождений мышьяка. Самородный мышьяк
отлагается обычно из гидротерм. При выветривании он переходит в ар—
сенолит. Доля собственных минералов мышьяка в балансе
элемента невелика /151/.
Мышьяк может входить в состав некоторых
породообразующих минералов. Содержание элемента в магнетитах колеблется
от 2,7 до 16,4 мг/кг, в амфиболах, пироксенах и полевых шпа-
- 129 -
тах оно составляет в среднем 1 мг/кг и менее /113/. В
кварце, агате его содержится 0,5-1,3 мг/кг. Нахождение мышьяка
в кварце обусловлено тем, что ионные радиусы трех- и
пятивалентного мышьяка (0,58 и 0,46 А соответственно) близки
ионному радиусу кремния (0,43А) и возможно изоморфное
замещение последнего в кремнекислороцных тетраэдрах. Мышьк может
замещать Si vAt в полевых шпатах, в магнетите мышьяк, по
всей вероятности, замещает Fe^ .
Изверженные породы обычно бедны мышьяком, среднее
содержание элемента в них составляет 2,0 мг/кг. Особенно мало
мышьяка в кислых породах - 1,6 мг/кг. Средняя концентрация
мышьяка в основных породах составляет 2,0 мг/кг, в средних -
2,4 мг/кг. В кристаллических сланцах содержится 2-18 мг/кг
мышьяка, в глинистых сланцах - 5-15 мг/кг, в известняках -
1-2 мг/кг, в песчаниках - менее 1 мг/кг /113/. На
содержание мышьяка в горных породах влияют условия образования.
Поэтому содержание мышьяка в однотипных породах различно
для разных геологических районов. Содержание элемента в
породах современного или недавнего вулканизма повышено до
2 О мг/кг. В осадочных породах, если при диагенезе или аути-
генезе образуются минералы мышьяка, содержание последнего
может достигать 50-60 мг/кг /113, 18/. Повышенные
количества элемента в породах могут быть обусловлены также и
изоморфными замещениями мышьяка в ряду Р, Sb, V /27/.
Уровень содержания мышьяка в почвообразующих породах в
основном наследуется от исходных горных пород, однако процесс
выветривания приводит к относительному рассеиванию и
перераспределению элемента между различными минеральными
компонентами. Содержание мышьяка в породах европейской части
СССР колеблется от 1,8-2,1 мг/кг в моренных и покровных
суглинках Русской равнины /21/ до 11,0-25,0 мг/кг в
продуктах выветривания глинистых сланцев Северного Кавказа /105/.
Лёссовидные и карбонатные суглинки содержат 2,9-4,8 мг/кг
мышьяка /21/, элювий песчаников и известняков Северного
Кавказа - 6,0-8,0 мг/кг /105/, элювий основных пород Западной
Грузии - 3,9-11,3 мг/кг. Содержание мышьяка в элюво-делювии
липаритов среднего Сихотэ-Алиня составляет 4,4-12,9 мг/кг,
в элювиально-делювиальных отложениях кислых пород
смешанного состава - 8,0-15,4, трахитов - 5,9-11,0, филлитов -
16,5-29,2 мг/кг. Причиной повышенного содержания мышьяка
в почвообразующих породах Сихотэ-Алиня и Северного Кавказа
является наличие в регионе пород, богатых полиметаллическими
рудами. В накоплении микроэлементов в почвообразующей
породе сказывается обогащение их полуторными оксидами в
несиликатной форме и тонкоцисперсной фракции (табл. 6.1).
- 130 -
Таблица 6.1
Зависимость содержания мышьяка в почвообразующих
породах от их состава
Почвообразующая порода
Элюво-делювий липаритов
Элюво-делювий липаритов
Аллювиальные отложения
Элювий трахитов
Элюво-делювий трахитов
Элювий филлитов
Элюво-делювий филлитов
As
(мг/кг)
12,9
9,5
4,4
5,9
11,0
16,5
16,9
R2o3(%)
21,65
16,61
18,02
14,29
22,44
21,79
21,15
<0,001
мм (%)
3,24
7,75
2,76
7,55
8,63
12,10
10,13
6.3. МЫШЬЯК В ПРИРОДНЫХ ВОДАХ
Чаще всего мышьяк в природных водах находится в форме
анионов мышьяковой и мышьяковистой кислот. Преобладают
ионные формы мышьяковой кислоты: H2As04 и НА50|- /185/.
В природных водах были также обнаружены метилированные
формы мышьяка: метиларсоновая кислота СНзАзО(ОН)2 (МА) и
диметиларсиновая кислота (СНз)2 AsO(OH) /ДМА/. Эти
органические соединение мышьяка довольно устойчивы к окислению.
Содержание мышьяка в природных водах, как правило, составляет
л -lO"*3 - п -Ю""8 г/л вне ореолов рассеяния рудных тел: в
речной воде в среднем 3*1 СГ ' - 3.10-6 г/л /129/, в воде
прудов - 1-2-10-3 г/л, озер - 1,8-3,6-10~3 г/л /212/, в
морской воде 10""3 - п *10""3 г/л. Концентрации элемента в
природных водах среднего Сихотэ-Алиня представлены в табл. 6.2
В подземных водах концентрация мышьяка не превышает
10-4 г/л> но существует большая группа глубоко залегающих
вод, связанная с кайнозойскими осадочно—вулканическими
толщами, а также с глинистыми породами, в которых содержание
мышьяка достигает 2-10""3 г/л. В водах месторождений
содержание элемента доходит до п -10~3 г/л и более /141/.
Максимальные концентрации мышьяка в природных водах могли бы
быть охарактеризованы следующими величинами растворимости:
А&2°3 - 5,2-Ю-4 г/л> Ca3(As04)2 - 0,13 г/л. Однако
концентрация мышьяка в природных водах не достигает этих величин
- 131 -
Таблица 6.2
Содержание мышьяка в природных водах среднего
Сихотэ-Алиня
Источник
As г/л
Ключ Благодатный 3,7*1СГ
Оз. Благодатное 8,2*10""
Р. Лагерная бД-Ю"6
Р. Серебрянка 4,0-10""6
Руч. Кабаний 1,4-10""5
о+ 9+ 3+
из-за присутствия ионов Fe , Ва , At и некоторых других,
которые образуют с ними труднорастворимые соединения /185/.
Процесс поступления мышьяка в подземные воды может быть
двояким: выщелачивание рудных масс и мышьяка, находящегося
в породах в рассеянном состоянии, и поглощение подземными
водами эндогенных эманации.
В последнее время возрастает влияние техногенного фактора
на содержание мышьяка в природных водах и в атмосфере. Так,
в составе веществ, смытых с листьев дуба и находящихся в
зоне промышленного комплекса, присутствовал мышьяк в
водорастворимой форме /7/. Содержание мышьяка в атмосферных осадках
в зоне воздействия металлургического завода, на расстоянии
2,5 км составляло 12 мкг/л, а на расстоянии 6 км - 5 мкг/л.
В условно фоновых метеоосадках содержание элемента
составляло 0,7 мкг/л.
Сильно изменяется состав природных вод в результате
сброса сточных вод шахт, электростанций, обогатительных фабрик,
металлургических и химических заводов, предприятий
целлюлозно-бумажной промышленности, заводов по производству
инсектицидов, пестицидов, красителей, а также в результате стоков
с сельскохозяйственных угодий, где применялись ядохимикаты.
Установлено, что ПДК мышьяка в сточных водах составляет
0,2 мг/кг, а ПДК для водоисточников коммунального
использования - 0,05 мг/мл (ПДК вредных веществ в воздухе и воде,
1975).
Благодаря способности адсорбировать мышьяк почвы
являются барьером, предотвращающим загрязнение грунтовых вод. В
подпочвенных водах содержание мышьяка значительно меньше,
чем в поверхностных /128/. Так, например, в поверхностных
- 132 -
склоновых водах, питающих одну из рек Восточного Забайкалья,
содержалось 10-20 мкг/л элемента, в то время как в
подпочвенных водах найдены только следы мышьяка.
6.4. МЫШЬЯК И ЕГО СОЕДИНЕНИЯ В ПОЧВАХ
Среднее содержание мышьяка в почвах мира составляет
5-6 мг/кг /27, 308/ при колебании от 1 до 40 мг/кг.
Среднее содержание мышьяка в почвах европейской части СССР, по
данным А.П. Виноградова /27/, составляет 3,6 мг/кг и
колеблется от 1 до 10 мг/кг. В подзолистых почвах содержится
1,2-2,7 мг/кг, в серых лесных и черноземах 2,9-9,6, в
каштановых и сероземах 2,0-2,8, в красноземах 1,3-4,9 мг/кг
мышьяка /21/.
Сведения о соединениях элемента в почвах являются
важнейшей характеристикой при изучении его подвижности,
доступности растениям. Распределение форм соединений мышьяка зависит
от свойств почвы. Элемент может находиться в виде
индивидуальных химических соединений различной растворимости, в
адсорбированном состоянии, в составе первичных и вторичных
минералов, в соединении с органическими веществами. Однако
последние достаточно быстро подвергаются микробному разложению.
Сведений о связи элемента со специфическими гумусовыми
веществами в литературе нет.
Содержание мышьяка в составе первичных минералов
невелико. Оксид мышьяка А $2 Ос устойчив при окислительных
условиях и высоких значениях Eh . При снижении Eh равновесие
сдвигается в сторону образования AS4 0~, а затем и Аб^^з»
В сильно восстановительных условиях As2 S3
восстанавливается до элементарного мышьяка и даже до газа арсина ASH3
(рис. 6.1). Оксид и сульфид мышьяка неустойчивы в зоне ги-
пергенеза /210/.
Образование газообразных продуктов может происходить в
увлажненных почвах только при участии микроорганизмов /197/.
Из загрязненных мышьяком почв может выделяться такое
количество газообразных мышьяковистых продуктов, что они
способны угнетать растущие на них растения. Предполагается, что
эту функцию выполняют грибы Scopulariopsic fungi. Одни
авторы считают, что газообразные соединения мышьяка
представлены образующимися в восстановительных условиях из
неорганических - арсином и из органических соединений - алкилар-
синами /396/. Другие авторы признают возможным образование
только алкиларсинов, а появление арсина в естественных
почвенных условиях считают маловероятным /234/.
- 133 -
Схема (рис. 6.1) не учитывает соединения мышьяка с
углеродом, а также арсенаты и арсениты железа, алюминия, кальция,
которые распространены в почвах значительно больше, чем
сульфиды и оксиды мышьяка. Арсениты - соли очень слабой
мышьяковистой кислоты H«As03 (pKjl « 9,20, pK2 e 13,50). Ар-
сенаты - соли кислоты средней силы, мышьяковой кислоты
H3As04 (рКх - 2,19, рК2 - 6,94, рК3 в 11,5) /182/. Соли
с щелочными катионами этих кислот легкорастворимы и могут
вымываться из почвенного профиля. Соли щелочных земель -
среднерастворимы. Арсенаты и арсениты тяжелых металлов
относятся к труднорастворимым солям. Растворимость ряда
встречающихся в почвенных условиях арсенатов характеризуется
следующими значениями десятичных логарифмов их произведения
растворимости (-lg ПР): Pb3(AsC>4)2 в 44,87, Mn3(As04)2 =
- 32,66, Ca3(As04)2 я 18.71, FeAs04 e 20,24, AlAs04 -
- 15,80.
Наибольшие количества мышьяка в почвах находятся в форме
соединений с железом (кислые почвы) и с кальцием
(карбонатные почвы). Сведения о соотношении Fe - As и At-As носят
противоречивый характер. Большая часть мышьяка связана с Fe,
a Al-As - соединения начинают преобладать в тех кислых
почвах, которые содержат мало железа в форме активных оксидов и
гидроксидов /197, 274/. Другие авторы, напротив, считают,
что мышьяк связан преимущественно с алюминием. Формы связи
мышьяка с железом и алюминием различны: это могут быть
индивидуальные химические соединения (арсенаты железа и
алюминия разной окристаллизованности), представленные отдельными
частицами, а также анионы элемента, осажденные на поверхности
алюмосиликатов, гиббсита, оксидов железа, физико-химически-
и хемосорбированные, окклюдированные оксидами железа и
алюминия.
Гидроксид железа сорбирует мышьяк почти в 2 раза больше,
чем гидроксид алюминия, и удерживает его прочнее /273/.
Сорбция мышьяка полуторными оксидами обусловлена величиной
рН. Fe(OH)3 наиболее активно удерживает мышьяк при рН 8,
At (ОН)3 - при рН 4. В аналогичных условиях сорбируется
почти в 3 раза больше арсенат-ионов, чем арсенит-ионов /197,
280/.
Мышьяк может удерживаться полуторными оксидами путем
соосаждения с ними. As (Y) соосаждается лучше, чем As(HI).
As (V) в форме ASO4"" количественно (90-99%) соосаждается
с Fe(OH)3 при рН 6-9, As (III) при рН 7-9; As (Y) в форме
AsO^ количественно соосаждается А1(ОН)3 при рН 6-9,
As(Hl) полностью не соосаждается с А1(ОН)3 /126/.
Изучение соединений мышьяка в почвах осложнено
отсутствием надежной методики. Для выделения органических соединений
элемента методика окончательно не разработана. Минеральные
соединения мышьяка по аналогии с фосфатами можно разделить
- 134 -
Eh,
мВ
Шк
800\-
400\-
-4001
-800
fiS90
2и5
As40
<*иь
As7S
2°3
Н20
О 4 8 11 рН
Рис. 6.1. Поля устойчивости оксидов и сульфидов мышьяка
на три группы, которые находятся в динамическом равновесии:
арсениты и арсенаты почвенного раствора, полностью доступные
растениям; арсенаты, осажденные (включая химическое
поглощение иона) или адсорбированные на поверхности твердой фазы
почвы, способные при нарушении равновесия между жидкой и
твердой фазой переходить в раствор (резерв подвижного и,
следовательно, доступного растениям мышьяка); арсенаты
труднорастворимые, а также окклюдированные гидратами полуторных оксидов,
карбонатами и др.
При изучении минеральных форм соединений мышьяка в
почвах наиболее часто используется метод Чанга - Джексона /246/.
Применяются также и его модификации, отличающиеся от метода
Чанга-Джексона в основном последовательностью экстракций
различных форм арсенатов. В Советском Союзе впервые для этих
целей О.Т. Вециной /21/ был использован метод
Гинзбург-Лебедевой /33/, которым пользовались и авторы. Все названные
выше методы изначально разработаны для фракционирования
фосфатов. Применимость их для определения минеральных форм
соединений мышьяка обусловлена аналогией геохимии As и Р, что
связано с близостью химических свойств этих элементов.
Формы соединений мышьяка, связанные с Ре, в почвах с
рН 4,4-5,0 составляют от 20 до 90% и больше, связанные с
At - от 8 до 50% и связанные с Са - до 20% /396/. Методом
фракционирования по Чангу-Джексону меченого As^ было на*,
дено, что фракция Fe-As преобладала и составляла 36-54%;
At-As - 11-41%; Ca-As - 9-32%. В почвах с рН 6,18-7,08
и содержанием Са 4,5-10 мг#экв/100 г фракция Ca-As доспь»
гает 74% /396/. Соотношение минеральных форм соединений
мышьяка колеблется в широком диапазоне в зависимости от
типа почв и генетического горизонта.
В почвах часто преобладают соединения мышьяка с
активными оксидами железа (вытяжка NaOH), причем максимальное
содержание этих форм соединений(85,0%) отмечается в
горизонте А^А2 (табл. 6.3) подзолистой альфе-гумусовой почвы,
обогащенном несиликатным железом, а минимальное - в горизонтах
В2 и С краснозема (5,0%), хотя общее содержание мышьяка
в этих горизонтах сравнительно велико - 6,1-7,2 мг/кг.
Очевидно, по мере передвижения по профилю красноземов железо
кристаллизуется и переходит в менее растворимые формы,
окклюдируя соединения мышьяка, которые не извлекаются
растворителями по Гинзбург—Лебедевой.
Содержание фракции At-As (VIH4F - вытяжка)
максимально в горизонте А^В бурой горно-лесной оподзоленной почвы
(55,5%) и значительно в горизонте А^ бурой горно-лесной
почвы (24,2%). Во всех остальных горизонтах оно не превышает
10%. Процентное содержание фракций рыхлосвязанных арсенатов
Са, Mg, Fe(IJ) (СН3СООЫН4+СН3СООН - вытяжка) и проч-
несвязанных арсенатов Са (Н2&О4 - вытяжка) убывает вниз
- 136 -
СО
со
ю
5
с
ф
i
и
8
О
1
К
Ь
ш
•^ 3*
О ю
СМ О
X
а: * 1
ЫаО
од
ас о
i «*
В 8 .
Р О *
!со со н
О О
Г*
S
см?5
Р
см
X
II-
Валовое
содержа
ние As
мг/кг
*
1 ft
Hi"
fe°
^
4
О
СО
г-
ф
ю
Nr
СО
СМ
и
*1
HI
Ю|Ю
СО|СО
о#
и
о
к
col
S
S
СО
О
Я
О
СО
СМ
СО
см
< w
r-i И
< 0Q
О
о]
см|
о
см*
СО
СМ
со
I
со
см
о
СМ
ш
§
&
S
с0
S
8
2
S
Я
ш
о
of
н
05
1см"
fiCM
■нем
001
СМ|
О
о
00
со
ю
со
(4
- 137 -
О)
00
Ч1
CD
°1
оо
н
СМ
*\
°1
COI СО Ю| CD
о>
СО
С01Г-
Iю
ю1ч
о
о
со|ю о|ю
^1-7 ЮГ
Я
ю|ю
о
и
о
в
о|о?
CD
О
О
&
&
со
Ф
§
&
°°i s °i Н °4 sL
cmJcm^ S h[cd ojJcm cmjcm cnjIcm
d|co* ф d|oT oJcnT 6|h o|h
olr-
Ю
CO
Ю
о
о
0)
1°
°l
H
o]
olco
olo
со ^
О со
о о
00
со"
<0
со
о
О
с
о
«
S
Ш
о
СО
со*
н
о
о
СМ
н
О
CD
о|
о]
0)
см
ю
о
я
сэ
см
50
S
О
со
о
о
с
о
в
ф
см|
о
00
см
СО
г-
со
ю
CD
CD
СО
^^
г-
н
1
CD
СМ
Ю
1
Г-
н
CQ
СМ
PQ
О)
I
i
см
см
СО
I
о
0Q
О
г-
I
СМ
со
о
н
I
CD
СМ
~ 138 -
О)
оо
СМ| СМ|
о|ю dlco
со
СМ
О
о
^ ^
ю о
о
г-
ю|
ю
о]
О)
0)
о
о
оГ
н
00
о
н
00
о"
сч
(D
°^
1-3
г-
о
о
о
Ю СМ
н о
О)
СО
см|
^1
о
CD
СО
CMI
J* CM|(D
о|н dlco
^|см
41.
0|tH
CO
*1
C0j<D
A •
о|ю
col
col
н
ol
p
*
10
q
s
8
ф
о
о
о
о
ь
д
о
со
СО
И
о"
со
ю см
СМ О
^
Н СО
ю о
о
со
ю
см
о
со
со
ф
о
a
ю
001
О)
ТГ
1
21/
^
г-
о
о"
Ю
н
Н
oh
о|н
1
И
i4ja>
о1н
-ч
1
о
N
4
§
СО
»
Ф
2
со
со
о
СО
СО*
о
к
со*
I
о
X
ю
О
ю
о
и
со
ю
СМ
ф
СО
о
Я
о
00
СО"
о
к
со
о
X
3
S
с
Ь
2
со
<
СМ
О
Ю
°1
ю"
СО
СО*
ю
со"
ю
оо"
со
ю
со
£
^-^
со
М1
6
СО
'W
н
0
о
см
н
6
н
н
о
о
СМ
^ н
10 Д
СМ О
6 д
"»w %-•
<С 0
- 139 -
О
со
см
6
ю
см
>w•
и
*-ч
о
0-2
—'
<*—ч
о
ю
6
V
"ч—'
^-^
о
со
н
i
ю
н
ние,
СО
F
Ф
2
55
Си
■с
CM w
m
о
по профилю. Только в черноземах отмечается обратная
закономерность, связанная со спецификой распределения в них кальция.
Обогащение верхних горизонтов почв соединениями мышьяка с
кальцием связано с увеличением содержания в них последнего в
результате биологической аккумуляции.
Доля от валового содержания мышьяка, определяемая по
сумме всех экстрагированных форм соединений, меняется в
различных почвах от 8,1% в горизонте С краснозема до 98,1% в
горизонте А А2 подзолистой альфе-гумусовой почвы. Неизвлекае—
мые применяемыми вытяжками соединения элемента
представляют окклюдированные формы, а также мышьяк, входящий в
кристаллическую решетку первичных и вторичных минералов.
В ряде почв количество элемента в составе минералов может
быть велико и в конечном итоге обусловливать повышенные
концентрации мышьяка в почвах. Например, резкое превышение
фоновых концентраций мышьяка в некоторых бурых горных лесных
почвах Северной Осетии было нами оценено как проявление
геохимической аномалии, связанной с влиянием исходных горных
пород, продукты выветривания которых могли сохраниться в
почвенном профиле как обогащенные мышьяком первичные
минералы. Для проверки этого предположения из ряда бурых горных
лесных почв была получена фракция 0,05-0,25 мм, из нее
выделены тяжелые минералы, далее был определен
минералогический состав тяжелых минералов и содержание в них мышьяка
(табл. 6.4). В почвах с содержанием мышьяка 7-12 мг/кг
количество тяжелых минералов составляет 0,15-0,79% от веса
фракции 0,05-0,25 мм, а концентрация мышьяка в них 119-
333 мг/кг, что обеспечивает накопление в них 0,1-2,0% As
от общего содержания в почве. Повышенная до 17-29 мг/кг
концентрация мышьяка в почве р. 2 связана с высоким
содержанием тяжелых минералов (40% от веса фракции 0,05-025 мм),
обогащенных мышьяком (176-435 мг/кг), которые
накапливают в своем составе до 80% общего содержания элемента. Можно
предполагать, что источником обогащения почвообразующей
породы и собственно почвы мышьяком были сульфиды мышьяка и
арсенопириты. При их разрушении элемент мог закрепляться в
почве в виде минералов типа скородита, питтицида или других
труднорастворимых арсенатов тяжелых металлов.
Наши результаты анализа фракции < 0,001 мм (табл. 6.4)
и данные О. Т. Be диной /21/ показали, что в
дерново-подзолистых, серых лесных и бурых горных лесных почвах, черноземах^
красноземах, желтоземах разнообразного механического состава
установлена значимая с высоким уровнем вероятности
корреляционная связь между общим содержанием мышьяка в почве и
содержанием фракции < 0,001 мм. Не установлено значимой
связи между этими показателями в красноземах, что вызвано
определяющим влиянием на миграцию мышьяка в этих почвах
вторичных оксидов железа, которые аккумулируются не только
- 140 -
в тонкодисперсных, но и в крупных механических фракциях
красноземов.
Концентрации металлов в илистой фракции, как правило,
превышают концентрации в почве. Степень обогащения илистой
фракции по сравнению с почвой зависит от состава исходных
пород и от интенсивности процесса почвообразования. В
наибольшей мере оно проявилось в бурых горных лесных почвах
Северного Кавказа, сформированных на элюво-делювии глинистых
сланцев и смешанном элюво-делювии, содержащем продукты
выветривания глинистых сланцев, а также в красноземах и
желтоземах Грузии, развитых на продуктах выветривания основных
пород и глинистых сланцев /21/. Концентрация мышьяка в илис-
Таблица 6 4
Содержание мышьяка в бурых лесных почвах
Северной Осетии
Разрез,
глубина,
см
Р.1
0-10
25-30
45-50
50-60
7CV-80
100-110
135-140
Р. 2
0-11
11-20
20-30
35-49
50-70
82-99
110-120
Почва,
мг/кг
7,5
13,6
8,7
8,2
12,9
11.1
8,6
19,0
19,6
24,3
28,5
22,3
25,0
17,2
Фракция
мг/кг
фракции
15,8
19,9
18,2
17,4
18,2
19,1
17,1
30,0
25,6
24,2
30,6
30,5
36,4
36,6
< 0,001 мм
% от
содержания
в почве
69,6
67,5
85,6
62,4
38,3
65,2
48,9
36,4
26,8
45,1
67,0
87,8
50,1
52,6
Тяжелые
минералы из фракции
0,05-0,25 мм
мг/кг
минералов
228,8
н.о.
н.о.
333,0
287,8
н.о.
414,3
422,0
353,5
435*3
355,1
416,8
350,8
176,6
% от
держания в
почве
1.5
н.о.
н.о.
2,3
0,2
н.о.
0,2
1.1
3,7
4,7
10,5
5,9
28,1
48,4
- 141 -
Продолжение табл. 6.4
Разрез,
глубина,
см
Почва,
мг/кг
Фракция < 0,001 мм
мг/кг
фракции
% от
содержания
в почве
Тяжелые
минералы из фракции
0,05-0,25 мм
мг/кг
минералов
% от
держания в
почве
р. 3
1-5
5-24
24-43
62-84
84-104
104-124
7,6
7,9
8,2
8,9
8,0
8,1
17,9
16,4
13,3
17,2
16,6
13,0
32,3
38,7
56,6
84,7
90,7
94,4
189,0
н.о.
316,6
н.о.
119,0
н.о.
0,4
н.о.
0,7
н.о.
0,1
н.о.
тых фракциях бурых горных лесных почв колеблется от 12,8 до
45,8 мг/кг при соответствующей концентрации в почве 8,0-
28,8 мг/кг. Отношение содержания мышьяка в илистой
фракции к содержанию в почве колеблется от 1,1 до 3,7. В связи
с близким забеганием полиметаллических руд с повышенным
содержанием мышьяка содержание его в горных породах
Северного Кавказа превышает кларк и достигает 17 мг/кг. Буроземо-
образование в этих условиях ведет к аккумуляции в илистой
фракции оксидов и гидроксндов железа, покрывающих пленками
тонко дисперсные частицы и накапливающих в своем составе
соединения мышьяка. Ферсиалитизация и красноземообразование,
протекающие в условиях высоких температур, промывного режима
и кислой реакции почв Западной Грузии, тоже способствуют
обогащению илистой фракции вторичными минеральными соединениями
(глинистыми минералами и оксидами железа и алюминия), с
которыми может накапливаться мышьяк.
В серых лесных почвах, черноземах концентрация элемента
в илистой фракции в 1,1-1,3 раза превышает концентрацию в
почве. В дерново-подзолистых и подзолистых почвах этот
коэффициент не превышает 1 или близок к 1 /21/. Практическое
отсутствие кумуляции мышьяка в серых лесных почвах, в темно-
серых лесных и в ряде черноземов обусловлено слабым
разрушающим действием почвенных процессов на мышьяксодержащие
компоненты почв.
Содержание мышьяка в илистой фракции составляет до 85%
от валового. Вероятно, оксиды и гидроксицы железа, входящие
- 142 -
в состав илистой фракции, играют большую роль в
концентрировании мышьяка, чем глинистые минералы. Однако строение
глинистых минералов оказывает двоякое влияние на сорбцию арсе-
нат-ионов. Каолинит содержит больше гиьроксильных ионов,
которые могут быть замещены на арсепаг-гстты при
ионообменной сорбции их; удельная же поверхп >сп> монтмориллонита в
2,5 раза больше, чем у каолинита, ч сорбционная способность
минерала пропорциональна его удельной поверхности. Кроме
того, монтмориллонит содержит на сьолах кристаллов реактивные
группы А1(ОН)з» способные к сорбции арс< нот-ионов. ]Макси-
мальная сорбция As (Y) глинистыми ьинсра^ъми при рН Г>, при
повышении и понижении реакции среды cor оция его
уменьшается. As (Y) сорбируется в форме E^AsOjJ. As (Ш) в
сильнокислой среде (рН<3) минералами не сорбируется, при повышении
рН от 3 до сильнощелочной сорбция As (Ml) постепенно
увеличивается. При рН 5-6 As (Ш) сортируется как As3^5~ при
рН 7-9 - как H2ASO3 или А5 20ф"при рН >10 в виде HASO3
/111/.
Для установления связи между содержанием мышьяка в
илистой фракции и ее минералогическим составом были исследованы
илистые фракции, выделенные из некоторых бурых лесных почв
Северного Кавказа. Глинистые минералы представлены в них
каолинитом, иллитом, монтмориллонитом. Однако между
количеством разных групп минералов и содержанием мышьяка в илистой
фракции связи не обнаружено. Возможно, в изучаемых почвах
влияние минерального состава ила затушевано и уступает
воздействию других: более сильных факторов, скорее всего оксидов
и гицроксидов железа и алюминия.
В почвенном растворе мышьяк присутствует в форме арсе-
нат-ионов, арсенит-ионов и в форме органических соединений
МА и ДМ А. Соотношение наиболее распространенных в составе
почвенного раствора форм As(Y) в зависимости от рН показано
на рис. 6.2. Однако форма нахождения минеральных соединений
мышьяка в растворе зависит не только от кислотно-основных,
но и от окислительно-восстановительных условий (рис. 6.3)
/185/. Снижение потенциала несколько увеличивает
растворимость твердой фазы соединений мышьяка, так как кислородные
соединения As (III) более растворимы, чем As (Y). В
аэрируемых почвах (Eh « 400-600 мВ) неорганический мышьяк
почвенного раствора существует в форме арсенат-ионов, в кислых
и нейтральных плохо аэрируемых почвах - в форме
арсенит-ионов. И те, и другие доступны растениям. На кислых
затопленных почвах мышьяк находится в форме арсенидов и недоступен
растениям. В диаграмме (см. рис. 6.1) не учтены соединения
мышьяка с углеродом.
Сопоставление диаграмм состояния мышьяка в растворе и
в твердой фазе показывает, что арсенат-ионы в растворе более
устойчивы к восстановлению, чем оксид (AS2°5) B твердой
фазе ; As (III) отличается большей устойчивостью в твердой
- 143 -
фазе, чем в растворе. Соотношение арсенат-арсенит мало
зависит от концентрации мышьяка. Существование форм НА$09 и
AsO" ограничено условиями очень низких значений Eh.
Рис. 6.2. Диаграмма распределения соединений AS (v)
Наибольшее количество растворимых соединений мышьяка
обнаруживается в затопленных почвах с Eh= 25-100 мВ,
богатых органическим веществом /269/. В модельном опыте
были получены самые благоприятные условия для растворения
мышьяка в затопленных почвах с Eh<150 и рН 4,2 в
присутствии глюкозы. После высушивания почвы на воздухе мышьяк
переходил в вытяжки в следовых количествах. Предполагается,
что его растворимость связана с восстановлением Fe AsO л до
Feo(AsC>4)2 и их растворением /234/. Арсениты, образование
которых возможно в затопленных почвах, более токсичны для
растений и могут угнетать их рост и развитие. Мышьяк
почвенного раствора активно сорбируется почвами. Количество
удерживаемого почвами мышьяка и механическое поглощение его
зависят от свойств почв и от концентрации элемента в
растворе.
Объектом для изучения сорбции мышьяка в наших опытах
/106/ были выбраны образцы гумусированных горизонтов
дерново-подзолистой почвы (Московская обл.), чернозема
типичного (Курская обл.), краснозема (Грузинская ССР) (табл. 6.5).
Сорбцию мышьяка изучали статическим методом с
использованием растворов 0,01 М СаС19 (рН 4,0), содержащих 1-
800 мкг/мл As. Количество сорбированного мышьяка находили
по разности концентраций элемента в исходном и равновесном
- 144 -
растворах. Сорбция мышьяка изучалась на естественных
образцах и на образцах, лишенных свободных окислов железа
предварительной обработкой цитрат—дитионитовым буфером, лишенных
аморфных окислов железа после обработки почвы оксалатным
буфером, и на образцах, в которых органическое вещество
разрушили Н2О2.
eh
I 1 I I I I I L
2 4 6 8 10 12 М
РН
Рис. 6.3. Поля устойчивости ионных форм мышьяка в растворе
Уравнение сорбции Ленгмюра, приведенное к уравнению
прямой, имеет виц: «L« 1 i + _1_ ,
S Soo К С Sm
- 145 -
где $ - количество адсорбированного мышьяка единицей массы
почвы; О - равновесная концентрация мышьяка в растворе;
S оо - количество мышьяка, максимально сорбируемого единицей
массы почвы; К - постоянная для данной изотермы,
показывающая отношение констант адсорбции и десорбции.
Изотермы строили в координатах 1/5 - 1/С. Проверка
возможности описания сорбции мышьяка в изучаемых почвах
уравнением Ленгмюра сводилась к выявлению значимой
прямолинейной зависимости между эмпирическими значениями 1/& и 1/С.
Изотерма сорбции мышьяка черноземом представляет ломаную
линию, составленную из двух отрезков (рис. 6.4). Перелом
наблюдается при равновесной концентрации 50 мкг/мл.
Предполагается, что два участка изотермы (I и II) соответствуют двум
липам сорбирующей поверхности, и механизмы удерживания ар-
-2,0
-3,0
-w
_1_
-3,0 -2,0 -1,0 О W
ЦУс
Рис. 6.4. Изотермы сорбции мышьяка почвами: 1 -
чернозем; 2 - дерново-подзолистая; 3 - краснозем
сенат-ионов на них, по видимому, различны. Сорбция на каждом
участке описывается уравнением Ленгмюра со своими
параметрами S,So>h К ( табл. 6.5).
Если считать, что показатель энергии сорбции К является
эквивалентом константы равновесия сорбционного процесса, то
его можно использовать для нахождения свободной энергии
процесса сорбции Л д . Величина Л д для изотермы на участках
с малыми концентрациями составляет 52 кДж/моль (пля других
анализируемых почв она составляет 30-60 кДж/моль), что
- 146 -
<0 §
<£
^ О 2
со
О
см
ф
I >»
§*
S3
CD
I
со
I
О
н
о
г-
00
со
ю
н
ю
05
о
со
I
со
I
см ю
ю н
I СО
О L
q q
о «о
А 5
гГ *
ю
ю
СМ
ю
СО о
СО
со
о
^
^
н
со
О
н
^
СМ
k<
ново-п
^ е
ф §
d со
н
0)
СМ
СМ
0)
ю
<
нозем
и
со
а
*
СО
г-
о
г-
СМ
0)
<
озем,
«
a
ф
ГГ
СО
а
- 147 -
выше AJ для изотермы на участках с большими концентрациями.
Очевидно, что при малых концентрациях арсенат-ионов в раст*-
воре они сорбируются на поверхностях с большей энергией связи,
после заполнения которых при возрастании концентрации элемент
начинает сорбироваться на энергетически менее активных сорб-
ционных позициях. Судя по величинам изменения свободной
энергии системы, можно предполагать, что при малых концентрациях
арсенат-ионы удерживаются силами химической сорбции, при
больших - физической сорбции.
Для образцов краснозема и дерново-подзолистой почвы
прямолинейная зависимость между величинами 1/S и 1/С
сохраняется во всем диапазоне используемых концентраций.
По-видимому, при заданных концентрациях на однородной поверхности
протекает сорбционный процесс единого механизма, а именно
химическая сорбция. Очевидно, дальнейшее увеличение
концентрации раствора вызвало бы переход сорбируемого иона на новый
вид сорбирующей поверхности. Максимально фиксируемое почвами
количество мышьяка составляет 5-10 мг/г, причем силами
предполагаемой физической сорбции удерживается элемента больше,
чем за счет химической сорбции.
Сопоставление So? для почв и препаратов, предварительно
освобожденных от свободных оксидов железа и органического
вещества, показало (табл. 6.6), что удаление аморфных оксидов
железа не влияло на боев черноземах, но привело к снижению
максимально удерживаемого мышьяка в дерново-подзолистой
почве и в красноземе. Удаление свободных оксидов железа
снизило $оо во всех образцах. Удаление органического вещества не
влияло на величину S о» . Наибольшую величину 5 о. имеет в
красноземах, так как эти почвы тяжелее по механическому составу,
богаты свободными оксидами железа и имеют большую удельную
поверхность.
Таблица 6.6
Влияние почвенных компонентов на величину S*> (мг/г)
Название
почвы
Почва
в
целом
Почва, ли- Почва,
лишенная амор-шенная
сводных 1 бодных
Fe2°3 J Ре2Оз
Почва,
лишенная орг.
вещества
Дерново-подзолистая 3,0 2,8 2,6 3,0
Краснозем 9,0 8,4 7,8 9,2
Чернозем 4,2 4,2 3,8 4,4
Анализ изотерм сорбции позволил определить буферность
почв к загрязнению мышьяком. Для того, чтобы равновесная
- 148 -
концентрация мышьяка составляла 50 мкг/мл, в пахотные
горизонты дерново-подзолистой почвы необходимо внести 230 мг/кг
мышьяка, черноземов - 270 мкг/кг, красноземов - 1990 мг/кг.
Следовательно, наиболее опасно загрязнение мышьяком для
дерново-подзолистых почв, более устойчивы к загрязнению
элементом красноземы.
Характер распределения мышьяка в почвенном профиле в
основном представлен тремя типами кривых. В тяжелосуглинистом
черноземе мышьяк равномерно распределяется по профилю
аналогично распределению валового железа и илистой фракции
/21/. В подзолистых альфегумусовых почвах, поцбурах Сихотэ-
Алиня, красноземах Западной Грузии и бурых горно-лесных
почвах Северного Кавказа распределение элемента носит
элювиально-иллювиальный характер, близкий к распределению
несиликатного железа (рис. 6.5). Максимальные содержания элемента
приурочены к иллювиальным горизонтам. Для
дерново-подзолистых и некоторых бурых горно-лесных почв наблюдается
распределение элемента элювиального типа. Среди бурых горно-лесных
почв доля почв с элювиальным характером распределения
невелика. В подавляющем большинстве изучаемых почв накопление
мышьяка в гумусовом горизонте не наблюдается. Аккумуляция
элемента не выражена в почвах с большим содержанием гумуса.
6.5. Мышьяк в системе почва - растение
Мышьяк всегда обнаруживается в растениях, в малых
количествах может быть полезен для них, в больших - вреден,
необходимость его для растений не доказана. Установлено, что
внесение в суглинистые почвы 25 мг/кг As в форме Na2HA$ O4
стимулировало рост и развитие бобов, картофеля, гороха,
пшеницы, а 75 мг/кг - рост гороха и пшеницы. Угнетение роста
и гибель растений наступали при концентрации As 250 мг/кг.
Внесение 500 мг/кг As ь ; >рме Саз(А$С>4)2 в глинистую
почву положительно влияло на кукурузу, сорго, сою, хлопок
/375/. Предполагается, что стимулирующее действие
обусловлено частично стерилизацией почвы. Возможно, что мышьяк как
восстановитель усиливает действие окислительных ферментов
в клетках растений. При этом увеличиваются ассимиляция
глюкозы, образование лимонной, щавелевой, гликолевой кислот
/175, 186/.
Негативное действие мышьяка проявляется в подавлении
роста растений, снижении урожая, слабом развитии корневой
системы, плазмолизе корней, увядании листьев, отмирании
верхушек листьев, снижении транспирации и поступления воды в
растения /175, 186/. Концентраторами мышьяка являются
- 149 -
Рис. 6.5. Распределение мышьяка по профилю главнейших
типов почв: 1 - дерново-поДзолистая; 2 - подбур; 3 -
подзолистая альфегумусовая; 4 - чернозем; 5 - бурая горно-лесная;
6 - краснозем
псевдотсуга, зайцегуб, полынь, кузиния /71/, из культурных
растений - тыква. М.Г. Коломийцева, Р.Д. Габович /78/
приводят содержания мышьяка в пищевых культурах (табл. 6.7).
Таблица 6.7
Содержание мышьяка в сельскохозяйственных культурах
Культура
Пшеница, рожь, овес (зерно)
Ячмень
Гречиха
Горох
Фасоль
Капуста белокочанная, лук, тыква
Картофель (клубни), морковь
- 150 -
Среднее содержание
(мг/кг сырого веса)
0,51
0,43
0,47
0,56
0,03
0,05
0,07
Растения по адаптации к высоким концентрациям мышьяка
образуют группы /129/:
1) очень устойчивые: аспарагус, картофель, томаты, морковь,
табак, ежевика, виноград, малина;
2) среднеустойчивые: земляника, кукуруза, свекла, тыква,
кабачок;
3) слабоустойчивые и неустойчивые: лук, горох, огурцы,
люцерна.
Наибольшей резистентностью обладают бесхлорофильные
растения. Низшие растения и водоросли нормально развились в
растворе, содержащем 2,3 г/л мышьяковой или 0,19 г/л
мышьяковистой кислоты /175/. Количество мышьяка, поглощенное
растениями и приводящее к торможению роста, составляло (в мг/кг
сухого вещества): для бобов - 50, для картофеля - 78, для
пшеницы - 52, для гороха - 193, для редиса - 940.
Наименьшее количество поглощенного растениями мышьяка,
вызывавшего их гибель, в мг/кг сухого вещества: для картофеля - 524,
для бобов - 628, для гороха - 1190 и 940 для редиса.
Различные соединения мышьяка обладают неодинаковой
токсичностью по отношению к растениям. Пятивалентный мышьяк
значительно менее ядовит, чем трехвалентный, так как он в
4-10 раз менее растворим /234/. Наибольшую опасность мышьяк
представляет в плохо аэрируемых почвах или в периоды
затопления. На фитотоксичность мышьяка влияют свойства почвы. На
почвах, сформированных на вулканическом пепле, обладающих
большой сорбционной способностью по отношению к мышьяку и
содержащих 1000 мг/кг мышьяка, не отмечалась задержка
роста растений,а на каолинитовой глине растения страдали при
концентрации 100 мг/кг мышьяка /396/. Чем выше в почве
содержание активных соединений железа и алюминия, тем менее
токсичны высокие концентрации элемента.
На фитотоксичность оказывают влияние
окислительно-восстановительные условия в почве. При низком
окислительно-восстановительном потенциале увеличивается подвижность мышьяка, но
не из-за восстановления мышьяка, а вследствие восстановления
соединений железа и увеличения мобильности соединений
мышьяка /234/. Фитотоксичность мышьяка уменьшается с
увеличением в почве подвижных фосфатов. Внесение фосфорных
удобрений понижает токсическое действие мышьяка на растения : при
изменении в почве отношения Ее: As от 7:1 до 42:1
токсическое действие мышьяка существенно снизилось, особенно на
суглинистых почвах. Понижающее действие на фитотоксичность
мышьяка оказывает кислотность почв. Так, например, ячмень
улучшил свой рост на загрязненной мышьяком почве с рН 6 и
ниже в результате внесения СаНРО^ и не реагировал на
внесение фосфатов в нейтральные и слабокислые почвы.
Изучение влияния внесенного мышьяка в почвы на состояние
растений в различные периоды их развития проводилось нами
- 151 -
в условиях вегетационного опыта. При закладке опыта
применялись приемы, широко практикуемые при агрохимических
исследованиях. В качестве тест—культуры был выбран ячмень, в
качестве субстрата - почвы: А чернозема типичного (Курская обл.),
дерново-подзолистой окультуренной и А. дерново-подзолистой
неокультуренной под лесом (Московская обл.). Мышьяк
вносился в виде As^Oo в растворенном состоянии в следующих дозах:
О, 5, 10, 257 3D, 100 мг/кг почвы. Каждый вариант имел
три повторности. Влияние внесенного мышьяка сказалось на
всхожести растений только на черноземной почве при дозах
мышьяка 50 и 100 мг/кг. Процент всходов от контроля на
них составлял 90 (табл. 6.8).
В начальный период роста ячмень испытывал влияние
высоких доз мышьяка (50-100 мг/кг) на всех почвах: растения
имели меньший рост, утонченный стебель. Особенно четко это
было заметно на черноземной почве. На дерново-подзолистых
почвах разница в росте и состоянии растений при самых
высоких дозах мышьяка к концу первого месяца вегетации почти
сгладилась. Меньше всего она проявилась на неокультуренной
почве. На черноземной почве влияние двух последних доз
мышьяка на развитие ячменя наблюдалось в течение всего
вегетационного периода. Внесенный мышьяк замедлял начало стадии
колошения незначительно на дерново-подзолистой окультуренной
почве (2-3 дня) и отчетливо на черноземе (7-8 дней).
Данные о биомассе соломы и урожае зерна, полученные на
трех почвах с разными дозами внесенного мышьяка, были
обработаны статистически. На дерново-подзолистой неокультуренной
почве внесение всех доз мышьяка не вызывало значимого
изменения урожая соломы и зерна ячменя (табл. 6.9). На
дерново-подзолистой окультуренной почве токсическое действие
мышьяка проявилось при дозе внесения 100 мг/кг As и
вызывало значимое (с А =0, 05) снижение биомассы соломы, на
урожае зерна эта доза не сказывалась. Величина биомассы
ячменя является более характерным показателем загрязнения
кислых почв мышьяком, чем урожай зерна. Такая же
закономерность отмечена и на черноземе: внесение 50 и 100 мг/кг
мышьяка привело к значимому с А = 0,05 снижению биомассы
соломы, а урожай зерна ячменя значимо падал лишь при
внесении 100 мг/кг мышьяка. Отрицательный эффект от внесения
100 мг. кг в разной мере сказался на урожае соломы и зерна
ячменя: биомасса соломы снизилась в 1,3-1,6 раза, а урожай
зерна понизился в 8-10 раз.
Различия в фитотоксичности мышьяка на разных почвах
обусловлены их свойствами: в черноземе элемент находится в
составе более подвижных и доступных растениям формах
соединений (кальциевые соли), чем в дерново-подзолистых почвах
(соединения аниона с ионами железа и алюминия).
- 152 -
зеков
1 *-»
1 о
1 w
1 о
исл
кг
и
ф *
со
* а
1 0
1 °Л
«в
колос
-й де
1 о^
1 ею
1 °
1 s<s
hr*
роста
1 2
аза
1-6-
1 о 1
1 с
1?
1 °
CQ J
НИИ (
ф
со
а
<с
^
о
1 Л
CQ
X
С
с*
8
ct
с_,
У
<о
X
О.Ф
CQ «
CQ x
sS
1
Г-
СО
X
X X
« ф
О-
о
а
с
Ц
о
о
*-*
3 со j? 2
\ Q-a , S
<0 с .Ц о
Iffl о
-с
1 с
!дпн
Го|
с
kt
Гм
[У |
[х|
1с I
5 |
"ol
51
"м
у |
х 1
с
d 1
5
ь
у
я
с
CJ
S
с
d
ь
т
см
СО
СМ
00
00
О
см
О
СМ
0)
CD
i4
0)
тЧ
i4
CD
i4
О
см
СО
г^
о
см
0)
гЧ
Г-
14
СО
О
СМ
00
О
н
Г-
СМ
СО
ю
о
о
СО СО О) СО
ю
о 9
О) О) 00 СО
оэ
CD
00
тЧ
О)
со
ю
со
ю
СО
СО
СО
СО
со
l4
О)
CD
ю
00
ю
см
со
СО
со
СО
тЧ
О)
г-
ю
со
ю
СМ
со
СО
со
гЧ
О)
ю
со
ю
СМ
со
СО
СО
ю
гЧ
О)
ю
см
ю
тЧ
со
тЧ
со
нет
О)
СО
ю
со
о
СО
о
со
см см о г- ю
со со со см см
ю
О)" О) СО
ю
^ о ю о о
тН СМ Ю О
- 153 -
Таблица 6.9
Биомасса соломы и урожай зерна ячменя, выращенного
на почвах с внесением различных доз мышьяка,
(усреднено по трем вариантам)
Дозы, А$,
мг/кг
ЧТ
биомас-1
са
соломы
урожай
зерна
ДПО
биомас-]
са
соломы
урожай|
зерна
ДПН
биомас-1
са
соломы
урожай
зерна
9,57 3,00 10,54 1,15
8,79 2,27 9,25 0,90
9,49 2,36 10,94 0,58
10,12 3,07 10,20 0,61
9,33 3,22 9,09 0,83
8,33 2,50 9,07 О, 88
1,40 О, 95 1,60 0,58
Примечание. НЗР - наименьшая значимая разность.
6.6. МЫШЬЯК В ЗАГРЯЗНЕННЫХ ПОЧВАХ
Контроль
5
10
25
50
100
НЗР
9, 37
9,00
9,39
8,25
7,83
5,78
1,37
2,03
1,74
2,24
1,52
1,39
0,18
0,69
Повышенные концентрации мышьяка обнаруживаются в
пахотных почвах, на которых сельскохозяйственные растения
обрабатывались мышьяксодержащими препаратами. В качестве
пестицидов и инсектофунгицидов для обработки посевов овощей,
хлопка, плодовых культур применяются неорганические соединения
мышьяка: арсенат натрия Ма^АдОф арсенит натрия (смесь
Ma3As03 и Ца2НА$04), арсенит кальция Са( Аз02>2 и
органические соединения мышьяка: метиларсоновая кислотаСН^AsO(ОН) 9»Ди-
метиларсиновая кислота (СНз)2А$0(ОН), натриевые и
кальциевые соли этих кислот NaCH3 AsO(OH), (CH3)2 AjCgONa).
Повышенные концентрации A S обнаруживаются на почвах
техногенного загрязнения и в пахотных почвах, на которых
сельскохозяйственные растения обрабатывались мышьякосодер-
жащими препаратами. Так, обработка сельскохозяйственных
растений этими препаратами в ряде ферм США привела к
увеличению содержания As в почвах до 165-830 мг/кг при
фоновом содержании 13-14 мг/кг /261, 396/, в садовых почвах
Канады - до 124 мг/кг /206/. Поступление мышьяка возмож-
- 154 -
но и при внесении в почву минеральных удобрений, всегда в
разной степени им загрязненных. В почву с нитратами,
сульфатами, мочевиной попадает 1-10 мг/кг мышьяка, с двойным и
тройным суперфосфатом вносится 30-300 мг/кг элемента /361/.
Концентрация мышьяка в почвах может резко возрастать в
результате техногенного загрязнения. В почвах окрестностей
тепловых электростанций в Польше содержание мышьяка
повысилось до 25 мг/кг при фоновом содержании 5-8 мг/кг /251/;
в Норвегии в почвах, окружающих рудники по переработке
полиметаллических руд, содержание мышьяка колебалось от 50 до
1475 мг/кг, составляя в незагрязненных почвах в среднем
5 мг/кг /300/. Верхние горизонты почв юго-западной Англии
вблизи медеплавильных предприятий содержали 380 мг/кг /227/.
Эти примеры иллюстрируют многократные случаи загрязнения
почв мышьяком. Следует отметить, что техногенное загрязни
ние мышьяком, часто поступающим в форме сульфидов, обычно
сопровождается увеличением кислотности почв, что
отрицательно сказывается на растительном покрове.
Для понижения токсичности мышьяка рекомендуется вносить
в загрязненные им почвы соединения железа, алюминия,
кальция. Роль этих соединений неодинакова. При внесении железа
и алюминия мышьяк связывается в труднорастворимые
соединения, в результате чего концентрация его в почвенном растворе
понижается. Если почвы исходно богаты свободными оксидами
и гидроксидами железа и алюминия, то внесение солей кальция
не дает снижения токсичности мышьяка. При малом содержании
в почве полуторных оксидов в свободном состоянии» внесение
кальция может повысить негативное действие мышьяка в
результате образования более растворимых соединений. В почвах с
промывным режимом соли кальция могут вызывать прямо
противоположное действие благодаря выносу из почвенного
профиля соединений As.
Другой путь снижения фитотоксичности мышьяка - это
внесение в почву фосфора, который вытесняет мышьяк из его
соединений. Промывание загрязненной мышьяком почвы раствором
К2НРО4 обеспечивает удаление из почвы 77% мышьяка /340/.
Растворы других солей менее эффективны. По способности
вымывать соединения мышьяка из почвы соли образовывали
убывающий ряд: MaH2P04, (NH4)2 Ь°4' КС! , NaN03, Са(КОэ)2.
Рекомендуется увеличивать продолжительность времени
между внесением или выпадением из атмосферы в почву соединений
As и посадкой растений. За этот период в условиях
промывного режима наиболее подвижные соединения мышьяка частично
вымываются из почв, а оставшиеся представлены прочнофиксиро-
ванными и менее доступными для растений соединениями.
Высокий уровень концентрации мышьяка в почвах может
быть понижен естественным путем за счет выщелачивания и
улетучивания его. Потери газообразных соединений мышьяка
- 155 -
могут составить 2-11% от валового содержания в почве /396/.
Чем меньше в почве полуторных оксидов в свободном состоянии,
тем быстрее происходит выщелачивание мышьяка из почв с
промывным режимом.
О скорости возможного самоочищения почв можно судить по
приводимым в литературе результатам опытов с органическими
соединениями элемента. Опыты показали /347/, что внесение в
течение двух лет по 144 мг/кг натриевой соли метиларсоновой
кислоты привело к возрастанию концентрации мышьяка в слое
0-15 см от 7 мг/кг до 30 мг/кг, а при дозе 288 мг/кг за
4 года в слое 0-30 см до 34 мг/кг. Однократное внесение
этих же доз не увеличивало запас мышьяка в этих почвах. В
почвах с высоким содержанием элемента через 5 лет его
количество снизилось вдвое. Модельные опыты показали, что при
промывании водой колонок с супесью, содержащей поверхностно
внесенную натриевую соль метиларсоновой кислоты, удалялось
50% мышьяка; из суглинка же элемент не вымывался, 50% его
оставалось в верхнем 2, 5 см слое /235/. А$-содержащие
пестициды концентрировались в слое 0-5см,но через год элемент
обнаруживали на глубине 30 см. При внесении 15-150 мг/кг
арсената Са в дерново-подзолистые и черноземные почвы
отмечено, что максимально элемент накапливался в верхних 10 см,
но в течение вегетационного периода даже в черноземе
проникал на глубину 30-40 см. Все эти данные позволяют
предполагать, что в почвах процесс самоочищения от избытка
мышьяка достаточно эффективен. Однако конкретное время значимого
понижения концентрации элемента может быть установлено
только с учетом дозы, формы внесения и свойств почв.
7. МОЛИБДЕН
7.1. ХИМИЯ МОЛИБДЕНА
Молибден химический элемент YI группы Периодической
системы Менделеева, с атрмным номером 42 и атомным весом
95, 94. В природе представлен семью стабильными изотопами
с массовыми числами 92, 94, 98, 100, из которых ^®Мо
имеет наибольшее распространение /32, 89/. Строение
электронных периферических оболочек атома молибдена следующее: 4р6
4d^ 4-fO 5$-*-. Молибден - типичный элемент промежуточного
характера и несет все черты, свойственные элементу с
пропусками в заполнении электронных оболочек. Элемент испытывает
сродство к железу и кислороду (сидерофильность) /89/ и сере
(халькофильность) /102/. Для ионов молибдена характерны
явления сильной поляризации и специфическая окраска
соединений молибдена /171/.
Молибден разновалентный элемент, причем в природных
соединениях встречается преимущественно в виде шестивалентного
молибдена (молибдаты Са, Рь, Fe^+, Сц), четырехвалентного
молибдена (ильземаннит) Mo IY (молибденит) (табл. 7.1).
Многовалентность молибдена является следствием разноквантовос-
ти валентных электронов. Высокозарядность иона молибдена
оказывает поляризующее действие и придает летучесть его
галоидным соединениям. Асимметричность строения атомов
молибдена ведет к легкости образования комплексов, гетерополисоеди-
нений с кремниевой, фосфорно^ мышьяковой и другими
кислотами, имеющими близкие к М0О4- радиусы ионов. В этих
соединениях молибден играет роль аддендов внутренней сферы в виде
Моо£\ Мо207 .
7.2. МОЛИБДЕН В МИНЕРАЛАХ И ПОЧВООБРА-
ЗУЮЩИХ ПОРОДАХ
Кларк молибдена в литосфере пока уточняется и различен
разных авторов: L10-3 /171/, 1.10~4% /391/. Сущест-
- 157 -
Таблица 7.1
Молибден в минералах
Минерал
Химическая формула
Содержание Мо, %
Основные молибденосодержащие минералы /171,
13, 32/
Молибденит MoS>2 60
Колюзит (Cu,Fe,Sn,Zn,Mo) 44Sb,Te, As,S)3
Молибдит М0О3 -
Ильземаннит Мо02'МоОз#80з'Н20 -
Вульфенит РЬМо04 М0О3-З8, 6
Повеллит СаМо04 Мо03-72,0
Ферримолибдит Fe2(Mo04) з*7 НзО -
Чиллагит Pb(Mo,W)04
Линдгренит Сиз(Мо04)2'(ОН)2
3+
Бетпакдалит CaFe2 AsMoj^^ 14^0 -
Минералы, в состав которых молибден входит
в виде примесей /162, 388, 360/
_4
Плагиоклаз 1«10
-4
Пироксен 2-10
—3
Оливин 1*10
Сфен (3, 90-3, 37-Ю"3)
Циркон (1,3-10,9). 10""3
—3
Магнетит (1,5-3,7)«10
—3
Ильменит 32,8* 10
«4
Гиперстен 3,0*10
Роговая 4
обманка 3,0*10
вует около 15 молибденовых минералов (см. табл. 7.1).
Кристаллохимия Мо IV определяется размерами его радиуса,
высокой плотностью заряда и в связи с этим сильными
поляризационными свойствами. Он встречается в акцессорных минералах,
таких, как циркон, сфен, магнетит, ильменит. Молибден спосо-
- 158 -
бен изоморфно замещать Tt в Т(02, в ильмените, магнетите;
Fe2+, Fe^+ , иногда Si4+ (М0О4 - SIO4) и алюминий.
Молибден может входить в состав акцессорных минералов (магнетита)
на основе близости ионных радиусов (ионный радиус Fe III,
О, 67А) /96/.
В окислительных условиях преобладает щестивалентный
молибден. По Ферсману /171/, все элементы, имеющие
валентность выше 4, не сохраняются в природе в виде катионов, так
как образуют с кислородом комплексные анионы. Эти анионы
дают с ионами, оказывающими высокое поляризующее действие,
труднорастворимые соединения, которые довольно слабо
мигрируют. Состав молибдатов в общем виде может быть изображен
так: Ме(МоС>4) или Me (MoC^)- ПН2О. В качестве Me могут
быть ионы Са, Рь , реже Си, Вt, Fe3+. В основе
структур этих минералов лежат деформированные тетраэдры (Мо04/*-+
которые близки по кристаллохимическим свойствам тетраэдрам
(WC>4^+). Поэтому в природе встречаются изоморфные смеси
молибдатов и вольфраматов. Молибден в большей мере связан с
щелочными и плагиоклазовыми полевыми шпатами. 79%
молибдена от общего количества его в породах находится в полевых
шпатах /89/, при этом в калиевых полевых шпатах молибдена
меньше, в слюдах 3-16%, в кварце - не более 3-5% /134/.
Молибден присутствует в породообразующих минералах в
невысоких концентрациях - 3- 10~4 - 3- 1СГ"2% Концентрация
элемента в одноименных горных породах разных регионов
довольно постоянна, некоторое возрастание отмечается в кислых
изверженных породах и особенно в породах осадочного
происхождения, богатых органическим веществом (угли, углистые
сланцы) (табл. 7. 2).
Таблица 7.2
Молибден в горных и почвообразующих порода?
/384, 391, 171, 27, 187, 165, 102, 77, 192/
Породы
Изверженные
Ультраосновные
Основные
Средние
Андезиты
Средний базальт
- 159 -
Мо, %
1, 15.10"3
4. 10"5
1, 4- lCf4
0, 6-11- 10"5
9, OlCf5
0, 58-1,6-10"4
1-10Г4
Продолжение табл. 7. 2
Поооды
Мо, %
Средний гранит
Диабаз
Кислые
Гранит, гранито-гнейс
Осадочные
Лёссы и лёссовидные
карбонатные суглинки
Покровные суглинки
Суглинистая морена
Супесчаная и песчаная морена
Флювиогляциальные пески и древ-
неаллювиальные пески
Шунгитовые породы
Морские глины
Известняки
Песчаники
Сланцы
Глинистые сланцы
Черные сланцы
Кварцевые сланцы
Силурийские сланцы
Кварцит
Нефть
Асфальты
Угли
Серпентин
Оливин-габбро
2-10
5-10
-4
-5
1, 9-10
-4
1,1- 10
I- 1С"4
«4
2-10
3-15.10'
-4
-4
3, 30. 10'
-4
3,15- 10
-4
2,9-10
-4
8,6-10'
-5
8,0*10'
-5
1,9- 10
-4
1,5-10
-3
О, 7-9-10"
-4
О, 1-0,5-10
0,1-1,0- 10'
-4
1-10
2,6- 10
-4
i
-4
-4
0,2-5^10
«4
5-10
-4
1-10
1-10'
-4
-.4
.-2
1,5-10
10, 3
2, 0-Ю-2
«4
1-10
2-10
-4
- 160 -
Глинистые сланцы Западной Грузии морского происхождения,
образовавшиеся в восстановительных условиях, обогащены
молибденом (2«10~"с*%). Другие почвообразующие и горные породы
Западной Грузии содержат молибден в количестве, близком к
кларковому /57/. Основной формой миграции микроэлементов в
этом регионе является твердый сток. Тонкодисперсная часть
твердого стока, попавшего в реки, сносится в море.
Содержание молибдена в илах рек Западной Грузии мало и колеблется от
0,9«10"~ до 5,2*10"" %. Сильно обогащены молибденом (3,5 10" %)
илы рек, в которые сбрасываются промышленные отходы
обогатительных фабрик месторождений марганцевых руд. Молибден
в этом регионе мигрирует в водном потоке со взвесями, чему
способствуют горный и холмистый рельеф местности и большое
количество атмосферных осадков. Кислая среда ведет к
активации трехвалентного железа и препятствует образованию
растворимых в воде соединений элемента, и он легко сорбируется
на тонкодисперсных частях. В условиях более высоких значений
рН следует ожидать увеличения доли водорастворимых форм
соединений элемента в общей миграции молибдена.
7.3. МОЛИБДЕН В ПОЧВАХ
Почвообразующие породы являются основным источником
поступления молибдена и других микроэлементов в почвы.
Почвообразовательный процесс производит перераспределение
различных компонентов в генетическом профиле почвы. Кларк
молибдена в почвах равен 2'10~ /26/, 3.10~4% /77/. По
данным Ю.Н. Зборищука /48/, изучавшего кларки концентраций
физиологически важных элементов в почвах, молибден
относится ко II группе элементов-аналогов (В, Мо, 2п ), кларки
концентраций (КК) которых колеблются в широких пределах. При
содержании гумуса 1,0-1, 5% и низких значениях рН бор и
молибден не накапливаются в почвах (КК < 1), при
повышении содержания гумуса до 3-5% и рН до 5,0-7,5 КК растет
и для молибдена начинает превышать 2. Таким образом,
почвообразовательный и другие гипергенные процессы, а также
состав и свойства почвообразующей породы оказывают
значительное влияние на содержание и распределение молибдена в почвах.
В почве молибден может встречаться в виде таких
природных соединений, как повеллит, вульфенит, молибденит и ферри-
молибдит. Образование повеллита можно ожидать только в
нейтральных почвах при высоких содержаниях молибдена и кальция
в растворе /12/. Соли щелочных металлов, аммония и
молибденовых кислот хорошо растворяются в воде. Меньше
растворимость солей кальция и магния; оксиды элемента растворимы
- 161 -
в щелочной и слабощелочной среде (рН 7,3-8,5).
Растворимость ферримолибдита в воде с рН 6-7,5 - 0,1-16 г/л, а
Mo-содержащих гидроксидов - О, 01-0,02 г/л. В кислых водах
этот процесс идет медленнее. Содержание молибдена в составе
первичных минералов основных типов почв СССР (фракции
0,01-0, 25 мм) колеблется от следовых количеств (в дерново-
подзолистой почве и красноземе) до 0,8 мг/кг в черноземах,
что составляет от 0,32 до 8% от общего содержания в почве
/95/.
В почвах преобладают соединения шестивалентного
молибдена, производные молибденовой кислоты Н2М0О4 в виде молиб-
дат-иона МоО^. Соединения шестивалентного молибдена
характеризуются заметной подвижностью в щелочной среде. В почвах
Молдавии была изучена относительная подвижность ряда
микроэлементов, в том числе молибдена /139/. Так, в этих почвах
по интенсивности профильной миграции молибден занимает
пятое место в ряду в порядке уменьшения: J , Sr , Mi , Ga , Mo,
V , Be, Co, Ct*, B, Y , Ba, Zr , а по величине коэффициента
водной миграции - третье после иода и серебра: J , Ag-, Mo,
РЬ, Со, Mh, Y , Ti . В кислой среде миграционная способность
молибдена может снижаться за счет адсорбции аниона М0О4
положительно заряженными коллоидами гидроксидов железа и
алюминия, а также за счет образования нерастворимых
соединений с фосфатами /115, 119/. Многие исследователи обращали
внимание на фиксацию молибдена гидроксидами железа и
алюминия. Предполагалось /287/, что в результате обмена на
поверхности гидроксидов железа и алюминия образуются соединения
молибдата железа следующего состава Fe2(MoC>4)3« Было
показано, что процесс осаждения молибдена железом и алюминием
в большинстве случаев идет за счет обмена молибдена на ион
ОНГ; выдвинуто предположение, что в процессе обмена образуются
полимолибдаты. Отношение Mo/At постоянно и отвечает
формуле 2 (A t (Н 2О) ^OHL'MoO.. Наименьшая растворимость молибдата
алюминия наблюдается при рН 4,8, а молибдата железа при
рН 2,7 /344/. Поэтому сильнокислые почвы, имеющие большое
количество активных соединений железа, должны прочно
фиксировать молибден: слабокислые фиксируют молибден с
образованием соединений с гидроксидами алюминия. При растворении
молибденсодержащих гидроксидов железа наблюдается тесная
зависимость между количеством молибдена и железа,
переходящих в раствор, что подтверждает предполагаемую связь Мо с
гидроксидами железа /321/. Основная масса молибдена в
почвах связана с железом /37/, что подтверждается: 1) прямой
зависимостью содержания валозого, химически связанного
молибдена и Fe2C>3; 2) тем, что на долю железа приходится
около 70% валового молибдена; 3) близким совпадением
растворимости почвенного молибдена с растворимостью природных
молибденсодержащих гидроксидов железа в зависимости от рН.
- 162 -
Наши данные также подтверждают связь основной массы
молибдена с полуторными оксидами в кислых красноземных и жел-
тоземно-подзолистых почвах Западной Грузии* Были
проанализированы образцы красных и сизоватых прослоев - остатков зеб-
ровидных глин,содержащихся в профиле этих почв. Эти
прослои по своему минералогическому составу представлены в
основном каолинитом /30/, по химическому составу - железом.
Содержание Fe2^3 в илистой Фракции красноокрашенных прослоев в
4-5 раз превышает содержание оксида в сизоо крашенных
образцах /143/. В красноземах содержание молибдена в составе
красноокрашенных пятен в 7 раз превышает содержание его в
сизоватых прослоях, в желтоземно-подзолистых почвах - в
2,8-3,5 раза.
В модельных опытах растворы молибдата смешивали с
почвой и инкубировали при постоянных, но разных температурах
различное время (до 224 дней) /200/. После этого было
определено содержание молибдена в растениях, выращенных на этих
почвах. Содержание молибдена в жидкой фазе уменьшалось с
увеличением периода контакта почвы с раствором молибдата.
Авторы полагают, что увеличение содержания
адсорбированного молибдена происходит в результате перехода молибдатов в
более прочносвязанные соединения. Молибден не может теряться
при выщелачивании, адсорбируясь полуторными оксидами
сначала на поверхности, а затем переходя в менее растворимую форму.
Значительные количества молибдена становятся прочносвязанны-
ми даже после нескольких часов инкубации, а в некоторых
случаях происходит полное связывание добавленного молибдена
/370/.
Сорбция молибдена происходит и на глинистых минералах.
Поглощение молибдат— иона происходит в обмен на гидроксил-
ион и идет с подщелачиванием среды /252, 37, 170/. Сорбция
молибдена глинами происходит в виде Мо20уН~. Количество
сорбированного иона и прочность сорбции зависят от реакции
среды. Связь между рН раствора и количеством сорбированных
ионов выражается кривой, близкой к параболе, с максимумом
адсорбции при рН 4-5. Нонтронит и галлуазит сорбируют
молибден в пределах рН 1-7, метагаллуазит - 1-10. Вторичными
минералами молибден сорбируется в убывающем порядке (по
емкости его поглощения):
А1 (ОН)з > галлуазит > нонтронит Жаолинит
Fe (ОН)з > бемит > метагаллуазит
На долю молибдена, связанного обменно и хемосорбционно с
полуторными оксидами и глинистыми минералами в гор. Апах
различных типов почв, приходится от 1,4 до 10,3%.
Содержание легкообменных форм незначительно. В красноземах весь
молибден, связанный с оксидами железа и алюминия, обменно
или химически сорбирован. С минеральной частью прочно
связаны 87-93,6% молибдена. Содержание гидроксидов железа и
- 163 -
алюминия резко снижает доступность молибдена растениями при
рН субстрата от 4,8 до 8,4. Для учета торможения поглощения
элемента растениями в зависимости от содержания гидроксидов
железа и алюминия был выведен коэффициент, для удобства
выраженный величиной, соответствующей 1% содержания
полуторных оксидов в субстрате, и для молибдена равный 2,8 (для
меди Kq^I.5 и цинка К^п =1,3) /142/. Возможно,
поглощенные молибдат-ионы находятся в ионогенном слое мицеллы
гидроксидов железа и алюминия, откуда могут вытесняться другими
анионами, такими, как фосфаты; реальна и в почвах возможна
необменная фиксация Мо гидроксидами железа с образованием
внутрикоординационных цепочечных комплексов.
Количество адсорбированных почвой анионов зависит
частично от присутствия в растворе отрицательно заряженных ионов,
которые способны образовывать координационные связи с ионом
металла; например Fe^+, а также от присутствия в растворе
других ионов (кроме Н+), которые способны отдавать протон
/273, 274/. Очевидно, что в большей или меньшей степени
молибдат-ион может адсорбироваться при рН, свойственных
большинству кислых почв. Установлено, что адсорбироваться
могут только мономерные формы /345/. С увеличением
концентрации молибдена в растворе присутствуют мономерные и
полимерные формы молибдена, но при концентрации элемента около
0,1 рртп в растворе будут присутствовать только мономерные
формы /219/. В регулировании концентрации молибдена в
почвенном растворе большое значение имеет рН среды. В
разбавленных растворах при рН 5 и выше преобладает форма МоОф
при рН 2,5-1,0 господствует Р^МоО^; при рН < 2 появляются
катионные формы. В большинстве почв рН больше 5, поэтому
преобладает анионная форма М0О4. Восстановительные условия
могут привести к растворению некоторой части молибденсодер-
жащих гидроксидов железа (Fe^+—^-Fe^+) и увеличению
подвижности элемента. Но высвободившийся молибден в
восстановительных условиях сразу может перейти в недоступное для
растений состояние. Накопление молибдена в глеевых горизонтах
почв, видимо, связано с восстановлением шестивалентного
молибдена до пятивалентного и образованием нерастворимых
соединений,
С повышением рН молибден делается легкоподвижным и
быстро выщелачивается из верхних горизонтов. Передвижение
молибдена возможно путем диффузии и передвижения с жидкой
фазой /302/. Характер передвижения зависит от содержания
форм его подвижных соединений в почве. Передвижение
элемента за счет диффузии преобладает, когда его концентрация в
насыщенном растворе меньше 0,004 мкг/мл. Миграция
молибдена с жидкой фазой проявляется при концентрации>0,004мкг/мЛ,
- 164 -
Сведения о способности молибдена к биоденной аккумуляции
достаточно противоречивы. Многие авторы отмечают биогенную
аккумуляцию элемента в перегнойно-аккумулятивном горизонте
большинства почв /26, 231/. Молибден образует более прочные
связи с соединениями, содержащими гидроксильные группы. Он
склонен к реакциям комплексообразования и может вступать в
реакции с простыми и сложными органическими соединениями
/100/. Комплексообразование молибденовой кислоты с карбоно-
выми кислотами (щавелевой, винной, лимонной) происходит за
счет кислородного атома по типу гетерополикислот, а также по
типу комплексов молибдена с фенолами /170/. В
экспериментальных условиях связывание молибдена активными группами
гуминовой кислоты (-ОН, -СООН) при рН 3 происходит почти
полностью,на 97% /100/. Все органические оксисоединения,
содержащие группу -ОН в ортоположении, спирты, фенолы, ок-
сикислоты и другие многоосновные органические кислоты
способны образовывать с молибденом комплексы, которые большей
частью растворимы в воде, а с металлами-катионами и
аминами давать нерастворимые соли. Гуминовые кислоты не могут
связывать анионы путем адсорбции /155/. Препарат гуминовой
кислоты при низких значениях рН восстанавливает М0О4 в
пятивалентный молибден, который в виде катиона хорошо связывается
с гуминовой кислотой. Молибден сорбируется органическим
веществом в виде катиона. Закрепление молибдена органическим
веществом почв может происходить только при рН 1-2, а при
рН 5-7 в присутствии гумусовых веществ остается в растворе
/159/.
С органическим веществом почв связано от 1,5% Мо в
красноземах до 3-4% Мо в черноземах и окультуренных
дерново-подзолистых почвах, причем с гуминовыми кислотами
связано 1,2-4%тс фракцией свободных фульвокислот 0,1-0,6%. В
нейтральных же почвах практически весь молибден связан с
первой группой гумусовых веществ /95/. Гумусовые вещества
черноземов и дерново-подзолистых почв, обладающие наиболее
выраженными способностями к сорбции многих элементов-био-
филов, по отношению к анионам (борат, молибдат) не проявляют
их в такой степени, как по отношению к другим элементам
(М,5, Р, Mn,Zh ) /64/. Авторы отнесли молибден к
элементам группы "выноса" с коэффициентом накопления меньше 1
для дерново-подзолистых почв и к группе стабильных
элементов с коэффициентом накопления <1.
Исследования содержания микроэлементов, и в том числе
молибдена, в гуминовых и фульвокислотах почв Молдавии /139/
показали, что гумусовые кислоты накапливают от 1 до 13%
валового содержания микроэлементов в почве в целом, причем
концентрируют Мо и Ag;Vn Mo связываются гуминовыми
кислотами кислых почв и фульвокислотами черноземов. Эти элемен-
- 165 -
ты в щелочных условиях приобретают большую подвижность,
обусловленную связью с фульвокислотами. Для почв Молдавии
корреляционная связь между молибденом и гуминовыми
кислотами слабая и средняя /139/. Таким образом, разнообразные
связи молибдена с гумусом, почвенными минеральными
коллоидами, особенно, полуторными оксидами, оказывают влияние на
перераспределение его по почвенному профилю. Однако
коэффициенты накопления для молибдена в большинстве случаев равны
или меньше 1, только для солонцов (гор. Ах) отмечается
значение коэффициента накопления, равное 6 /76/.
Тенденция накопления молибдена в илистой фракции
различных типов почв для молибдена выражена не очень четко, хотя
коэффициенты накопления его в илистой фракции почв достигают
значений 5-6 для верхних горизонтов дерново-подзолистых почв
/76/. Тонкодисперсная фракция в значительной мере
контролирует уровень содержания молибдена в почвенном покрове
Западной Грузии. Однако приуроченность примерно половины запасов
валового молибдена к илистой фракции красноземов и желтоземно-
подзолистых почв Западной Грузии обусловлена не столько
повышенной концентрацией элемента в этой фракции, сколько
тяжелым механическим составом почв и высоким содержанием
тонкодисперсных фракций. Концентрация молибдена в более крупных
фракциях (0,25-0,01 мм) красноземов (1,00 мг/кг) лишь
немного уступает его концентрации в илистой фракции этих почв
(1,12 мг/кг). Более крупные почвенные частицы покрыты
сверху пленкой оксидов и гидроксидов железа, что, очевидно,
способствует повышенному содержанию молибдена в этих частицах.
Содержание молибдена в почвах СССР и его подвижных
соединений колеблется в широких пределах (табл. 7.3 и 7.4).
Ландшафтно-геохимическое распределение молибдена
является прямым следствием участия элемента в различных
почвообразовательных процессах. По А.И. Перельману /121/,
молибден относится к водным мигрантам, подвижным и
слабоподвижным в окислительной обстановке и инертным в
восстановительной, осаждающимся на сероводородном и глеевом барьерах.
Молибден более подвижен в щелочной среде, чем в кислой, и
может осаждаться на кислом барьере. Молибден и другие
элементы накапливаются и на сорбционном барьере, особенно там,
где этим барьером служат положительно заряженные коллоиды -
гидроксиды железа, алюминия и др. Роль этих барьеров
особенно велика для ландшафтов с влажным климатом и слабой
минерализацией вод. В аридных ландшафтах в присутствии
испарительного геохимического барьера (шоровые солончаки, засоленные
почвы) молибден может концентрироваться в соленосном
горизонте, хотя для почв аридных районов с щелочной реакцией
среды характерно увеличение подвижности элемента и его
выщелачивание. Для почв различных зон и сопряженных
ландшафтов характерно накопление молибдена в аккумулятивных и су-
пераквальных аккумулятивных ландшафтах.
- 166 -
Таблица 7.3
Молибден в основных типах почв СССР (валовое
содержание) /115, 166, 62, 77, 156, 74, 84,
163, 58, 176/
Почвы
1
Торфяники
Дерново-подзолистые
Дерново-подзолистые,
серые лесные
Дерново-подзолистые
Подзолистые
Дерново-подзолистые,
серые лесные
Почвы таежно-лесной
зоны
Серые лесные
Серые лесные
Серые лесные
Черноземы
Черноземы
Черноземы
Черноземы, каштановые
Черноземы
Черноземы, каштановые
Каштановые
Каштановые
Сероземы
Красноземы
Красноземы
Район
2
Прибалтика
»
Средняя Сибирь
юг Западной
Сибири
то же
Украина
европейская
часть СССР
юг Западной
Сибири
—
Украина
Молдавия
Центр РСФСР
Казахстан
юг Западной
Сибири
средняя Сибирь
юг Зап. Сибири
-
-
-
Зап. Грузия
- 167 -
Мо, мг/кг
3
О, 13-7,5
0,25-1,1
1,8-1,9
0,4-3,52
1,0-4,0
0,4-8,0
2,3
1,99
0, 6-1,8
0,7-4,0
2,4-5,6
1,1-6,0
2,3
0,4-2,0
0,6-1,8
4,6-5,1
0,0-2,31
0,2-2,0
0,7-2,0
0,9-4,0
0,9-1,0
Продолжение таблицы 7,3
1
Желтоземно-подзолистые
Желтоземы
бурые горно-лесные
Бурые горно-лесные на
глинистых сланцах
Бурые лесные
Горные
Солонцы, солончаки
Солонцы
Солонцы, солончаки
Луговые, болотные
Горно-луговые
Черноземы
Дерново-глеевые,
иловато-глеевые
Дерново-кар бонатные
Почвы зоны БАМ
(западный участок)
Почвы бассейна оз. Байкал.
Горные
2
Зап. Грузия
- t —
-
-
европейская
часть СССР
то же
ш
средняя Сибирь
юг Зап. Сибири
то же
Зап. Грузия
европейская часть
СССР
Зап. Грузия
т
европейская
часть СССР
3
0,5-1,3
0,7
0,9
19,3
2,68
0,5-12,0
3,86
5,8
0,33-11,6
0,7-7,9
0,5
2,27-3,71
1,1
0,6
1,7-12,4
до 18,0
2,91
Резюмируя сказанное, можно отметить, что на подвижность
молибдена и распределение его в почвенном профиле влияет
много факторов, однако его содержание и миграцию в
значительной степени обусловливает содержание полуторных оксидов,
особенно железа.
Подвижные формы соединений молибдена обычно определяют
с помощью оксалатной вытяжки по Григгу. Оксалатораствори -
мая форма составляет в среднем 20% валового содержания
/117/. В некоторых торфяных низинных почвах Латвии весь
молибден входит в состав подвижной фракции. Усвояемый
растениями молибден в кислых почвах представлен главным
образом анионами М0О4 7 находящимися в обменном состоянии и в
- 168 -
Таблица 7.4
Подвижный Mo в почвах СССР (оксалаторастворимый)
/115, 62, 191, 58/
Почвы, район
Дерново-подзолистая (европейская
часть СССР)
Дерново-подзолистые и дерново-глеевые
(Латв ССР)
Торфяные низменные (ЛатвССР)
Торфяно-болотная (европейская часть
СССР)
Черноземы
Черноземы
Каштановые
Бурые
Сероземные
Дерново-подзолистые (юг Зап. Сибири)
Серая лесная (юг Зап. Сибири)
Чернозем солонцеватый (юг Зап.
Сибири)
Каштановая (юг Зап. Сибири)
Красноземы (Зап. Грузия)
Желтоземно-подзолистые (Зап. Грузия)
Бурые горно-лесные на глинистых
сланцах
Бурые горно-лесные (Зап. Грузия)
Дерново-глеевые (Зап. Грузия)
Дерново-карбонатные (Зап. Грузия)
Горные
Мо, мг/кг
0,07-0,15
следы - 0,97
0,2-1,30
0,15
0,02-0,33
0,20-0,34
0,00-0,02
0,06-0,12
0,03-0,15
0,14
0,30
0,25
0,10
0,06-0,07
0,03-0,07
0,34
0,04
0,10
0,09
0,22
Засоленная (солонцы, солончаки)
(европейская часть СССР)
0,41
незначительной степени водорастворимыми
Усиление почвенной кислотности вызывает
- 169 -
формами соединений,
повышение содержа-
ния активных форм полуторных оксидов и марганца в почве, что
в свою очередь способствует закреплению молибдена и переводу
его в труднодоступное состояние. Потребность растений в
молибденовых удобрениях обычно проявляется на кислых почвах с
рН ниже 5,2 /69/. Данные оксалатной вытяжки подтверждают
тесную сорбционную связь молибдена с подвижными формами
гидроксидов железа /44/. Отмечено отсутствие связи
отзывчивости бобовых на молибденовые удобрения при сопоставлении
с его количествами, переходящими в оксалатную вытяжку /309/.
Щелочная среда способствует усилению подвижности молибдена.
Поэтому многие исследователи отмечают улучшение питания
растения при известковании кислых почв /244, 392/.
Установлено, что внесение извести и молибдена в дерново-подзолистую
почву не только усиливает процесс нитрификации, но и повышает
содержание водорастворимого и подвижного фосфора /149/.
Анионы фосфорной кислоты способны замещать молибдат-ионы в
сорбционном комплексе с гидроксидами железа, алюминия и
глинистыми минералами,и, таким образом, делают его
доступным для растений. Поэтому предлагается применять
молибденовые удобрения в комплексе с известкованием и внесением
суперфосфата /392/. Увеличение концентрации 1^НР04 вызывало
уменьшение сорбции МоО^, причем влияние добавляемого
фосфата зависело как от способности почвы связывать МоОф так и
от рН водной суспензии, что наиболее сильно проявлялось при
рН 6. Кроме того, эффект добавления фосфата снижался, если
до его добавления почва около 84 дней контактировала с мо-
либдатом /257/. Однако А.П. Виноградов /27/ и А.И. Перельман
/119/ высказывают предположение об образовании труднораст—
воримых комплексов молибдатов с фосфатами в условиях кислой
реакции и снижении в результате этого доступности молибдена
растениям. Таким образом, существуют различные точки зрения
о влиянии фосфатов и других анионов на сорбцию и подвижность
соединений молибдена в почвах, но большинство авторов
склоняются к мнению, что применение фосфорных удобрений в
комплексе с молибденовыми на кислых почвах оказьюает
положительное влияние на подвижность почвенного молибдена и усвоение
его растениями.
Для получения хорошего эффекта от молибденовых удобрений
необходимо учитывать и рН почв, и дозы вносимых удобрений,
и сроки их внесения. Так, при оптимальном для развития сои
рН 5,8-6,5 эффективность молибденовых удобрений была
неустойчива или отсутствовала, но была высокой и устойчивой при
рН 5 /332/. В опытах по внесению молибденовых удобрений
на красноземах (рН 5,9) под белый клевер на фоне ^120^90
эффективность удобрений не зависела от формы микроудобрения
(М0О3 или СаМо04). Дефицит молибдена устранялся при
наименьших дозах 37 г/га, и эффективность малых доз
уменьшалась со временем. Применение высоких доз (150 г/га и
больше) обеспечивало высокую (более 90%) эффективность молиб-
- 170 -
деновых удобрений в течение 5 лет. Рассматривалась
продолжительность действия молибдена при запасном внесении в
составе фосфорно-калийно-молибденового удобрения /174/. На
дерново-подзолистой почве со средним содержанием подвижного
молибдена внесение этого элемента дало достоверную прибавку
урожая вико-овсяной смеси и клевера в течение 7 лет.
Внесение молибденовых удобрений надо производить часто, поскольку
элемент сильно поглощается почвой, особенно кислой, и доля
его доступных растениям форм соединений снижается (кроме
черноземов) /256/.
Таким образом, в кислых почвах можно ожидать
недостаточного количества доступного растениям молибдена, а внесенный
молибден быстро фиксируется почвой, особенно полуторными
оксидами, и через некоторое время снова становится
недоступным для растений. Поэтому при прогнозе возможной
эффективности молибденовых удобрений нужно исходить из этих позиций,
и в кислых почвах вносить эти удобрения в комплексе с
известкованием и фосфорными удобрениями. Молибденовые удобрения
будут эффективными для почв западных и средних частей зоны
БАМ, где их нужно применять совместно с известкованием
/167/. Молибденовые удобрения нередко вносятся в запас в
больших дозах /174/, однако при этом содержание молибдена
во все годы (10 лет) в вико-овсяной смеси и клевере не
превышало допустимых норм. Данные других авторов говорят о
том, что повышенные концентрации молибдена в почвах в
вегетационных опытах с кукурузой, рапсом, рожью и райграсом при
внесении Na2MoO^ вызывают увеличение содержания
молибдена в растениях в 15 раз, хотя урожай увеличивается
незначительно /256/.
7.4. МОЛИБДЕН В СИСТЕМЕ ПОЧВА-РАСТЕНИЕ
Широкое применение молибденовых микроудобрений в
сельскохозяйственной практике фактически началось только в
послевоенные годы. Это, очевидно, связано с незначительным
потреблением молибдена высшими растениями. Именно поэтому
молибден долгое время не считали микроэлементом, необходимым
растениям. В настоящее время необходимость молибдена для
жизнедеятельности растений доказана. Он играет большую роль
в фиксации атмосферного азота клубеньковыми бобовыми
растениями и микроорганизмами. Потребность растения в молибдене
объясняется прежде всего участием соединений металла в
восстановлении нитратов, нитритов и гидроксиламинов до аммиака
и, следовательно, важной ролью в биосинтезе аминокислот.
Элемент повышает активность ферментов, катализирующих вос-
- 171 -
становление и ассимиляцию нитратов у растений - нитратредук-
тазы, нитритредуктазы и гидроксиламинредуктазы. Одним из
путей воздействия молибдена на синтез белков является
ускорение синтеза аминокислот и включение их в состав белков.
Молибден может реагировать с фосфором нуклеотидов. При этом
синтез РНК происходит более интенсивно. Кроме того, металл
может взаимодействовать с рибосомами, которые
непосредственно осуществляют биосинтез белка при участии РНК и
активированных аминокислот. Обеспеченность молибденом положительно
влияет на цитрусовые растения как на фоне аммиачного, так и
нитратного азота /386/. Доказано влияние Мо на синтез
хлорофилла /180,198/.
Одним из характерных признаков влияния молибдена на
развитие растений является ускорение их цветения. Многими
авторами отмечен антагонизм молибдена и алюминия при питании
растений. При повышенном содержании обменного • алюминия,
токсичном для растений (8 мг/кг), молибден усиливает синтез
белка, оказывая таким образом защитное действие против
негативного действия алюминия на кислых почвах.
Поступление молибдена в растения зависит от многих
факторов. Оно затормаживается с увеличением дисперсности
субстрата, с повышением содержания органического вещества при
увеличении кислотности среды. Фактором, тормозящим
поступление элемента в растения, является увеличение в питательном
субстрате содержания полуторных оксидов /140/. При
исследовании влияния молибденовых удобрений на растения цветной
капусты было предложено уравнение, показывающее влияние
молибдена на рост и развитие растений. В этом уравнении величина
урожая и содержание молибдена рассматриваются как
прямолинейная функция от рН почв и содержания в них активных оксидов
железа /294/. Наибольший урожай был получен при внесении в
почву 2 г/га молибдена и 10 кг/га железа /224/. При
изучении действия железа и молибдена на растения кукурузы,
подсолнечника и ежи сборной было доказано, что недостаток железа
увеличивал содержание в растениях катионов К , Са^ , Mg^"1"
больше, чем анионов NOI, PO^, SO^", Ct" , а также
содержание органических кислот. Возрастание содержания катионов
по отношению к анионам было вызвано не уменьшением
поступления анионов в растения, а более высокими концентрациями К,
С а и М^. Недостаточность железа и молибдена для растений
может быть охарактеризована увеличением содержания К, Са,
Mgr и более высокой концентрацией органических кислот в фи-
томассе /276/. Антагонизм при поглощении питательных
элементов из почв между молибденом и медью, молибденом и
железом не является строго определенным, а зависит от
соотношения взаимодействующих элементов. В одних случаях выражен
антагонизм, в других наблюдается синергетическое действие
одного или другого элемента.
- 172 -
Размещение молибдена по органам растений довольно
неравномерно, он быстро поглощается корневыми системами и
передвигается через стебли к листьям. Поступление элементов,
содержание которых в растении составляет малую долю их
концентрации в почве, П.Х. Най и П.Б. Тинкер объясняют таким
образом: достаточное для растений количество требуемого
элемента может быть растворено в слое часто обнаруживаемой на
поверхности слизи корня, толщиной несколько нм /107/.
Молибден, адсорбированный на гидроксиде железа, возможно,
поглощался именно так /336/. На авторадиограммах почв,
меченных 99Мо и другими элементами, вокруг корней наблюдаются
узкие зоны истощения /387/. Ионы из раствора
адсорбируются на поверхности корней с относительно большей скоростью,
чем вода, и их концентрация в почвенном растворе у поверхг с-
ти корня должна уменьшаться /107/. В результате ионы
твердой фазы высвобождаются и буферят концентрацию. Однако у
поверхности корня будет происходить некоторое понижение
концентрации, что вызывает диффузию ионов по направлению к
корню. Перенос молибдена к растению в большинстве почв
осуществляется конвекцией.
Было установлено, что большая часть молибдена
накапливается между жилками листа, в проводящих же тканях его содер-*
жится гораздо меньше. Скорость передвижения молибдена в
растения гороха и бобов достаточно велика - больше 1 см/мин
/28/, причем локализуется он прежде всего в молодых
растущих органах в верхней части растений. Данные по содержанию
молибдена в некоторых видах растений приведены в табл. 7.5.
Симптомы молибденовой недостаточности установлены более
чем у сорока видов высших растений /69/. Прежде всего
недостаток молибдена сказывается на бобовых растениях, что
связано с большой ролью молибдена в азотном обмене и азотфикса-
ции. Растения-индикаторы несбалансированного содержания
молибдена приведены в табл. 7.6 /124/. В табл. 7.7 приведено
содержание элемента в растениях при эндемических
заболеваниях, связанных с недостатком молибдена. Недостаток
молибдена для растений наблюдается обычно в тех случаях, когда
содержание элемента в растениях падает ниже 0,1 мг/кг сухого
вещества /69/. Однако критический уровень содержания Мо в
растениях, ниже которого проявляется потребность их в
молибденовых микроудобрениях, значительно варьирует в
зависимости от ряда факторов. Повышенное содержание элемента в
растениях может вызвать молибденовый токсикоз у животных и
подагру у человека. Заболевание отмечается, когда содержание
молибдена в растениях достигает 20 мг/кг сухого вещества
/69/. Растения из "здоровых" местностей содержат около
2-4 мг/кг сухого вещества. Приводятся такие пороговые
концентрации молибдена /72/ в почвах:
- 173 -
Таблица 7.5
Молибден в растениях (кг/кг на сухое вещество)
/77, 69, 142, 58/
Растения
Злаки
Разнотравье
Бобовые травы, семена
Бобовые древесные, семена
Виноград, листья
Виноград, ягоды
Пшеница яровая:
зерно
солома
Овес, зерно
Картофель:
клубни
ботва
Подсолнечник, зеленая масса
Свекла кормовая:
корни
листья
Свекла сахарная:
корни
листья
Клевер красный, сено
Люпин желтый, зеленая масса
Ячмень:
зерно
солома
Мо, мг/кг
среднее
0,6
1,2
4,0
4,0
0,4
0,15
0,16
0,33
0,19
0,22
0,30
0,36
0,16
0,70
0,16
0,60
0,91
1Д2
0,94
0,73
Мо, мг/кг
пределы колебаний
0,2-1,0
0,3-3,0
0,5-20,0
0,6-10,0
0,1-0,89
0,003-0,37
-
-
-
-
-
-
-
-
-
-
-
-
-
_
- 174
Продолжение таблицы 7.5
Растения
Свекла сахарная:
корни
листья
Люцерна, сено
Гречиха
Люпин
Чайный куст:
листья
флеши
семена, стебли,
корни
Мо, мг/кг
среднее
0,36
1,97
0,98
0, 3
0, 2
0,1
Мо, мг/кг
пределы колебаний
-
-
-
0,13-5,25
0, 83-14, 00
-
-
-
Таблица 7.6
Растения-индикаторы несбалансированного содержания
молибдена (мг/кг сухого вещества) /124/
Растения
Чувствительные к недостатку i
Крестоцветные (капуста)
Пасленовые (томаты)
Маревые (свекла, шпинат)
Бобовые
Злаковые (овес)
Чувствительные к и.
Крестоцветные (цветная капусте
Пасленовые томаты
Растения-концентра
Бобовые (астрагалы, клевер)
Зверобойные (зверобой)
Норичниковые (норичник)
Сложноцветные (олеария)
Содержание Мо в растениях
(мг/кг сухого вещества)
при симптомах
недостатка
0,03-0,06
0,10-0,13
0,01-0,15
0,01-0,28
0,10-0,29
3 б Ы Т К у
0
торы
5£
6с
50-.
5*
1
L0
ЭО
в норме
1,2-16
0,68-1,1
0,20-20,0
0,34-2,11
0,47-3,90
16,0
10,0
0
- 175 -
1) недостаточное содержание (нижняя пороговая
концентрация) до 1,5 мг/кг. После этого предела начинается
заболевание растений (клевер);
2) норма (в пределах нормальной регуляции функций)
1,5-4 мг/кг;
3) избыточное (верхняя пороговая концентрация) - 4 мг/кг,
возможна подагра у человека и молибденовый токсикоз У
животных.
Отмечены симптомы молибденовой недостаточности у
цитрусовых /303, 208/. Нами было изучено распределение
молибдена по органам мандаринового дерева и потребление им этого
элемента /58/. Наибольшая концентрация молибдена приурочена
к самым мелким питающим корням (до 1,1 мг/кг сухого
вещества). Молибден легко усваивается корневой системой
растений и быстро передвигается к молодым растущим частям
растений и накапливается в листьях 0,4-0,5 мг/кг сухого вещества).
Плоды мандаринового дерева занимают среднее положение в
составе мандаринового дерева по содержанию молибдена. Если
учесть биомассу отдельных органов, то можно судить о выносе
и отчуждении молибдена с урожаем. Накопление его происходит
в листьях мандаринового дерева (коэффициент биологического
поглощения 7,0), самых мелких корнях (7,0) ив плодах (7,7).
Потребление молибдена мандариновым деревом составляет
0,65-0,69 г/га (без учета плодов), с плодами отчуждается с
одного дерева при средней урожайности 75 т/га и влажности
их 89,7% до 1,7 г/га элемента. Вынос молибдена с зеленым
листом чая при среднем урожае 4500 кг/га /36/ колеблется
в зависимости от типа почв Западной Грузии незначительно -
0,21-0,24 г/га. Потребление в зависимости от типа почв
колеблется от 10,5 до 18,5 г/га. Очевидно, что потребление
элемента чайным кустом значительно выше, чем мандариновым
деревом.
Таблица 7.7
Содержание молибдена в растениях при эндемических
заболеваниях, связанных с недостатком элемента
(мг/кг сухого вещества) /124/
Болезнь, растение
Синяя мякина (овес)
Хлыстовидный хвост
(кресто цветные)
Желтая пятнистость
(цитрусовые)
Мо, мг/кг
при заболеваниях
в норме
0,10-0,29
0,03-0,06
0,03-0,08
- 176 -
0,41-3,90
1,20-16,0
0,05-0,29
При различном содержании молибдена в почвах у разных
видов растений могут содержаться разные количества элемента
(табл. 7.8). Например, пихта, ель, хвощ могут быть отнесены
к растениям, для которых существует некоторый предел
поглощения элемента, несмотря на повышение содержания его в
почве, это барьерные растения. В качестве эталона обычно
принимается один из наиболее распространенных или важных для
данного исследования видов, ОСВР которых остается примерно
одинаковым как при низких, так и при высоких концентрациях
элемента в субстрате - это безбарьерные растения /71/. В
табл. 7.9 приведена группировка растений по значениям ОСВР,
выращенным при кларковых содержаниях их в почве.
Таблица 7.8
Относительное содержание молибдена в видах
растений (ОСВР) (золе) Канады при различных
концентрациях его в иван-чае /71/
Интервалы содержания Мо в золе иван-чая, 10-3%
растений
0,1-1,
1,0-10,0
10- 3fc
1
2,4
1,4
1,6
1,9
2,0
2,7
1,0
0,6
0,7
0,8
0,8
1,1
2,1 0,9
3,9 1,6
10-100
100-1000
эталонного
Мо
10-3%
ОСВР
Иван-чай 0,4 1,0
Ива 0,24 0,6
Ольха 0,24 0,7
Пихта 0,40 1,0
Ель 0,40 1,0
Рододендрон 0,45 1,1
Хвощ 0,44 1,1
Псевдотсуга 0,36 0,9
Сосна 0,50 1,2
Примечание. ОСВР
вида.
Примечание. ОСВР - С изучаемого вида /С
вида.
Мо
1о~Щ
ЮСВР
Мо
10-%
ОСВР
85
-
60
-
45
87
14
31
100
1,0
-
0,7
-
0,5
1,0
0,2
0,4
1,2
380
100
260
85
90
430
160
-
„.
1,0
0,3
0,7
0,2
0,2
1,1
0,4
-
_.
- 177 -
Таблица 7.9
Группировка растений по значениям ОСВР молибдена /71/
Группировка видов растений и значения их ОСВР
пониженного
поглощения ОСВР=0,4-0,71
среднего поглощения
ОСВР = 0,7-1,4
повышенного
поглощения ОСВР=1,5-2,5
Можжевельник 0,5 дуб 0,8 клевер 1,6
Держидерево 0,6 курильский чай 0,9 пасленовые 1,7
Ива 0,7 малина 0,9 люцерна 1,68
Ива 0,7 псевдотсуга 0,9 маревые 2,0
Крыжовник 0,7 крестоцветные 0,9
береза
осина
дубровник
граб
злаковые
ель
пихта
жимолостные
лиственница
осоковые
кедр
сосна
смородина
полынь
брусника
голубика
рододендрон
спирея
багульник
иван-чай
барбарис
хвощ
бобовые
1,0
1,0
1,0
1,0
1,0
1,0
1,0
1,0
1,0
1,1
1,1
1,1
1,2
1,2
1,2
1,3
1,3
1,4
1,3
1,3
1,3
1,3
1,4
- 178 -
По данным А.Л. Ковалевского /71/, значительная часть
молибдена находится в растениях в водорастворимой форме - в
зеленой траве 70-80%, в сухом сене 40%, после
замораживания растения 7%. По мнению автора, молибден является одним
из самых подвижных элементов в отношении выщелачивания из
свежих листьев и хвои.
8. ЗАКЛЮЧЕНИЕ
Обобщение литературы и обсуждение накопленного полевого
и экспериментального материала привело к ряду выводов и
выявлению пробелов в исследованиях и тем самым позволило
наметить перспективы предстоящих работ по педохимии тяжелых
металлов, мышьяка и молибдена в почвах. Химические реакции*
и процессы с участием тяжелых металлов в почве отличаются
от тех, которые хорошо известны для щелочных и
щелочноземельных элементов. Такое различие связано прежде всего с
тем, что, в отличие от N а+, Са^+ и Mg^+, ионы тяжелых
металлов и их соединения являются активными комплексообразо-
вателями, дающие прочные соединения с гумусовыми
веществами. При обычной для почвенного раствора реакции тяжелые
металлы могут выпадать в осадок в виде гидроксидов, карбонатов
и фосфатов. Ионообменные реакции осложнены комплексообразо-
ванием. Поэтому, как показали эксперименты, трудно подыскать
экстрагент, селективно вытесняющий ионообменные катионы
тяжелых металлов, когда в процессах сорбции одновременно
участвуют минеральные и органические соединения почвы.
Глинистые минералы связывают эти катионы в основном в
обменной форме, полуторные оксиды железа и, по-видимому,
алюминия адсорбируют их на поверхности частиц и окклюдируют при
длительном взаимодействии; возможно также образование
соединений типа шпинелей.
В почвенном растворе непосредственно доступны корням
растений водорастворимые соединения и ионообменные катионы
а металлов. Эти формы соединений элементов легко
передвигаются в почвенной массе в результате конвекционного и
диффузионного потоков, компенсируя уменьшение концентрации вблизи
поглощающей поверхности корней. Комплексные органические
соединения тяжелых металлов мало доступны растениям, что
объясняет высокую детоксикацию и малое из поступление в
сельскохозяйственные культуры из богатых гумусом почв с высоким
содержанием элементов.
Емкость поглощения почв, особенно ее органической части,
велика и, как правило, превышает количество тяжелых
металлов, поступивших в почву с газопылевыми выбросами или
другими их потоками. Емкость поглощения мышьяка и молибдена
(точнее их анионов) пока подробно не изучена, но можно уже
- 180 -
и сейчас утверждать, что ее определяет содержание активных
оксидов железа и алюминия. Прочность соответствующих
соединений пелика, растворимость низка, и поэтому токсичность для
растений мышьяка проявляется при высоких его дозах. Педохи-
Мия анионов молибдена и мышьяка во многом аналогична педо-
химии фосфат-ионов. Для изучения групп соединений мышьяка и
молибдена, прогноза их поведения в почвах можно с успехом
использовать накопленную информацию по химии фосфора в
почвоведении и агрохимии.
Значительное внимание в монографии было уделено различным
модельным и вегетационным опытам. Опыты с сопряженным
изучением трансформации вносимых соединений и потребления
металлов растениями, наблюдением'за состоянием растений и
учета урожая культур на различных почвах с разными дозами
металла позволили наметить пути и дать первый вариант
нормирования содержания тяжелых металлов и мышьяка в почвах
разного состава и свойств. Конечно, остановиться на результатах
этих исследований нельзя, их надо продолжать, расширяя число
элементов - реальных или потенциальных токсикантов (сурьма,
селен и др.) и тестовых растений.
Научно обоснованным подходом нормирования тяжелых
металлов и неметаллов в почве, в системе почва - растение и других
объектах природной среды, разных потоков токсикантов является
почвенно-экологический подход. Для разных таксономических
уровней почв, типов, подтипов, родов и разновидностей по
механическому составу, различной интенсивности ведения
сельскохозяйственного производства, видов и сортов культур
неизбежны свои градации, которые могут иметь генерализованные или
более детальные шкалы в зависимости от задач нормирования.
По степени токсичности концентраций элемента для растений
предложены следующие градации:
а) толерантная, не вызывающая каких-либо изменений в
росте, развитии и урожайности культуры;
б) снижающая урожай проростков, вегетативных и
репродуктивных органов растений (соломы и зерна злаковых), в
процентах к нормальным показателям;
в) летальная (аналогичная LDn) с указанием гибели, в
процентах к общему числу растений;
г) концентрация элемента в почве, ведущая к накоплению
элемента в растении выше предельно допустимой концентрации
в кормах и пищевых продуктах.
Следует отметить, что накопление элемента в растении
выше ПДК происходит, как правило, при более низкой дозе
элемента, чем угнетающая растение концентрация элемента. При
высоких концентрациях (в 50-100 раз и более, чем фон) валовое
содержание элемента в почве и подвижные формы его
соединений адекватно характеризуют состояние растений.
- 181 -
При проведении вегетационных опытов создаются
искусственные условия водного режима почв в сосудах. Более
объективную и привязанную к конкретным почвенно-климатическим
условиям информацию по негативному воздействию на растения,
потреблению ими металлов и неметаллов можно получить на
основе полевых, мелкоделяночных опытов и на территориях,
подверженных комплексному влиянию предприятия или других
источников полюантов, где будут воздействовать все поступающие в
почву элементы и скажется их влияние на состояние растений,
состав приземного слоя (пыль, газы, "кислые дожди"). Такие
опыты следует закладывать на разном расстоянии от источника.
Вероятно, шкала нормирования по данным вегетационных и
полевых опытов будет различаться, особенно по результатам,
полученным на делянках вблизи источника полюантов.
Нормирование содержаний экзогенных концентраций тяжелых
металлов и неметаллов в почвах необходимо для определения
пригодности почв на конкретной территории для
сельскохозяйственного использования, составления карт содержания этих
элементов в почвах с рационально разработанной шкалой градации
содержания или форм соединений металлов и неметаллов,
с учетом их негативного действия на растительный покров.
Остается малоразработанным и экспериментально трудным
определение форм соединений элементов, селективного учета всех
и, в частности, той группы, которая является диагностической
при определении уровня негативного влияния на растение и
ведущего к накоплению в растениях концентраций выше ПДК.
Единственный путь решения этих вопросов - сопряженный
анализ почв и растений в модельных, вегетационных и полевых
опытах» При этом нужно подробное изучение форм соединений
элементов в почве, общей концентрации в растениях, проведение
полного биохимического анализа растений. Можно полагать, что
угнетающее действие на.растения высоких концентраций
тяжелых металлов и неметаллов в первую очередь связано с
нарушением ферментативной активности.
Е.П. Троицкий (1960) писал, что микроэлементы выступают
активаторами ферментов, акторами биохимических процессов в
сложной цепи метаболизма отдельных биоорганических
соединений. Но так протекает процесс при нормальном содержании
микроэлементов. Те же элементы в макроколичествах в растениях
приводят к ингибированию биокатализаторов, блокируя их
активные центры, вытесняя нужные для цикла элементы. Процессу
"отравления" растений большими концентрациями тяжелых
металлов уделено мало внимания в физиологии растений, причины
гибели или угнетения растений, синергизм и антагонизм
элементов остаются неразработанными.
Мы всегда должны помнить завет В. И. Ленина:
землю-кормилицу беречь как зеницу ока.
- 182 -
В нашей стране защита окружающей среды стала всенародным
делом. Это нашло свое отражение в решениях XXIY, ХХУ и
XXYI съездов КПСС. Продовольственная программа СССР,
принятая на майском Пленуме ЦК КПСС в 1982 г., подчеркивает
важность сохранности и улучшения качества почв, их
плодородия, рационального использования земель.
В нашей коллективной монографии многие разделы
непосредственно касаются возможности восстановления плодородия
''больных" - загрязненных земель и сохранности земельного фонда.
Технический прогресс нельзя остановить, но можно значительно
снизить отрицательное влияние техногенеза на состояние
природного комплекса и почв в зоне влияния источника, учитывая
факторы, которые погашают негативное влияние высоких
концентраций тяжелых металлов и неметаллов. Нормирование их
содержаний в почве позволит объективно оценить угрозу здоровью
человека при размещении городов в пределах зон воздействия
источника загрязнения, возможности использования почв на
территории с повышенным содержанием элементов для организации
плодоовощных хозяйств вблизи городских и поселковых
агломераций и индустриальных центров.
ЛИТЕРАТУРА
1. Агрохимические методы исследования почв, М., 1975.
2. Айдиньян Н.Х., Троицкий А.И., Белавская Г.А.
Распределение ртути в различных почвах СССР и
Вьетнама. - Геохимия, 1964, № 7.
3. Алексеев А.А. Подвижность цинка и кадмия в почвах. -
Автореф. канд. дис. М., 1979.
4. Алиев С.А., Шакури Б.К. Концентрация микроэлементов
в гуминовых кислотах почв. - Тез. докл. VII Всесоюз. совещ.
"Биологическая роль и практическое применение
микроэлементов", т. 1, Рига, 1975.
5. Алимарин И.П., Ушакова Н.Н. Справочное пособие по
аналитической химии. М., 1977.
6. Антропова Л.В. Формы нахождения свинца*в потоках
рассеяния. - Советская геология, 1968, №1.
7. Аржанова B.C. Индикация пылевых атмосферных
выпадений методом отмывки древесной растительности. - В кн.:
Геохимия зоны гипергенеза и техническая деятельность
человека. Т. 1, Владивосток, 1976.
8. Аржанова B.C., Елпатьевский П.В., Седова В.М.
Труды И Всесоюзного совещания по исследованию миграции
загрязняющих веществ в почвах и сопредельных средах, М.,
1980.
9. Бабенко Г.А. О влиянии микроэлементов на обмен веществ
и реактивность организма. - В кн.: Биологическая роль
микроэлементов и их применение в сельском хозяйстве и
медицине. М., 1974.
10. Белицына Г.Д., Окуне в a P.M., Пачепская Г.А.
Свинец в основных компонентах ландшафта ельника-кисличника
Валдайской возвышенности. - В кн.: Геохимия ландшафтов
и борьба с загрязнением природной среды. М., 1977.
11. Белицына Г.Д., Пачепская Т.А. Особенности
поведения свинца в некоторых почвах дерново-подзолистой
подзоны. - В кн.: Тяжелые металлы в окружающей среде^ М.,
1980.
12. Белякова Е.Е. и др. Гидрохимический поиск рудных
месторождений. М., 1962.
13. Бетехтин А.Г. Курс минералогии. М., 1956.
- 184 -
14. Бе ус А. А., Грабовская Л.И., Тихонова Н.В.
Геохимия окружающей среды. М., 1976.
15. Бокий Г.В. Кристаллохимия. М., 1971.
16. Борисова Е.Н. Содержание свинца в почвах и пищевых
продуктах. - Труды биогеохим. лаб., т. П. М., I960.
17. Бояркина А.П., Васильев Н.В., Глухов Г.Г. и др.
О содержании золота и ртути в сфагновых торфах. - Бюл.
Почв, ин-та, ВАСХНИЛ, 1980, № 24.
18. Бурьянова Е.З. Термодинамический аспект условий
образования главнейших минералов мышьяка в осадочных
породах. - Записки Всесоюзного минералогического о-ва,-
1977, т. 106, № 3.
19. Вардья Н.П., Дрель Р.И., Травицкая Э.О.,
Христофоров а Л.И. Поглощение некоторых микроэлементов
дерново-подзолистой супесчаной и суглинистой почвами. - Зап.
Ленингр.с.-х. ин-та, 1976.
20. Вашкулат Н.А. Гигиенические мероприятия по защите
почв от загрязнения соединениями мышьяка. - В кн.:
Гигиена населенных мест. Киев, 1974, вып. 13.
21. Ведина О.Т. Атомно-адсорбционное определение и
содержание мышьяка в почвах. - Автореф. канд. дис. М., 1979.
22. Вернадский В.М. Биохимические очерки. М.-Л., 1940.
2 3. Вернадский В.И. Сочинения. М., 1956, т. 1.
24. Вернадский В.Й. Химическое строение биосферы Земли
и ее окружения. М., 1965.
25. Виноградов А.П. Мышьяк в почвах СССР. -
Почвоведение, 1948, №1.
26. Виноградов А.П. Закономерности распределения
химических элементов в земной коре* - Геохимия, 1956, №1
27. Виноградов А.П. Геохимия редких и рассеянных
элементов в почвах. М., 1957.
28. Влас ю к П. А. Биологические элементы з
жизнедеятельности растений. Киев, 1969.
29. Вредные вещества в промышленности, т. II. Л., 1971.
30. Г авва Л.И. Минералогический состав илистой фракции
красноземных и желтоземно-подзолистых почв Западной
Грузии. - Автореф. канд. дис. М., 1976.
31. Гигиенические критерии состояния окружающей среды.
3. Свинец. - ВОЗ, Женева, 1980.
32. Гинзбург А.И. Геохимия молибдена и вольфрама. М.,
1971.
33. Гинзбург К.Е., Лебедева Л.Е. Методика определения
минеральных форм фосфатов в почвах.- Агрохимия, 1971,
№ 1.
34. Гладышев В.П., Левицкая С.А., Филиппова Л.М.
Аналитическая химия ртути. М., 1974.
35. Глазовская М.А. Геохимические основы типологии и
методики исследований природных ландшафтов. М., 1964.
- 185 -
36. Годзиашвили Б.А. Влияние различных химических
мелиорантов на изменение химизма почв старых чайных
плантаций, длительно удобряемых физиологически кислыми
минеральными удобрениями. - Субтропические культуры, 1968,
№2.
37. Голубев И.М. Содержание и состояние Мо в почвах и
растениях Чувашской АССР. - Автореф. канд. дис. М.,
1968.
38. Гольдшмидт В.М., Петере К.К. К геохимии мышьяка. -
В кн.: Геохимия редких элементов. М.-Л., 1938.
39. Громова Е.А. Влияние основных свойств почвы на
химическое состояние в ней цинка. - Агрохимия, 1973, №1.
40. Гуд им а Н.В., Шейн Я.П. Краткий справочник по
металлургии цветных металлов. М., Металлургия, 1975.
41. Дворников А.Г., Герасимова Л.И., Пономарева В.А.
Формы нахождения ртути в почвах на Чернобурском
ртутном месторождении. - Геохимия, 1974, № 6.
42. Добровольский В.В. Изучение биогеохимии тяжелых
металлов как необходимая часть природоохранных
исследований. - В кн.: Актуальные направления современной
географии. М., 1976.
43. Егоров В.П., Мальгин М.А. Ртуть в почвах и
поверхностных водах Горного Алтая. - В кн.: Вопросы химизации
с.х. Алтая. Барнаул, 1966.
44. Елпатьевский П.В. О формах нахождения тяжелых
металлов во вторичных ореолах рассеяния. - В кн.:
География почв и геохимия ландшафтов. М., 1967.
45. Елпатьевский П.В. Формы закрепления меди в
подзолистых и серых лесных почвах геохимически аномальных
ландшафтов восточного склона Урала. - В кн.:
Микроэлементы в ландшафтах Советского Союза. М., 1969.
46. Журавлева Е.Г. К вопросу о содержании
микроэлементов в органическом веществе почъ. - Почвоведение, 1965,
№ 12.
47. Журавлева Е.Г. Цинк, медь и кобальт в почвах
Читинской области. - В кн.: Микроэлементы в некоторых почвах
СССР. М., 1964.
48. Зборищук Ю.Н. Кларки концентраций физиологически
важных микроэлементов в почвах. - Вестн. Моск. ун-та. Сер.
почвовед., 1977, № 4.
49. Звонарев Б.А. Ртуть в почвах Северной Осетии. -
Автореф. канд. дис. М., 1981.
50. Звонарев Б.А. К вопросу об экстрагируем ости ртути из
почв. - Вестн. Моск. ун-та. Сер. почвовед., 1982, №2.
51. Зимаков И.Е. Миграция цинка из почвы в некоторые
сельскохозяйственные растения. - В кн.: Проблемы
ветеринарной санитарии. М., 1978, т. 11.
- 186 -
52. Золотарева Б.Н. и др. Содержание и распределение
тяжелых металлов (свинца, кадмия и ртути) в почвах
Европейской территории СССР. - В кн.: Генезис, плодородие и
мелиорация почв. Пущино, 1980.
53. Зырин Н.Г., Большаков В.А., Пацукевич З.В. и др.
Микроэлементы в почвах и использование микроудобрений
в виноградарстве. М., 1972.
54. Зырин Н.Г., Важенин И.Г., Дубиковский Г.П., Збо-
рищук Ю.Н. Состояние и задачи картографирования
содержания микроэлементов в почвах СССР. - В кн.:
Физиологическая роль и практическое применение микроэлементов.
Рига, 1976.
55. Зырин Н.Г., Звонарев Б.А., Ким З.Н. Ртуть в бурых
лесных почвах Дагестана и Северной Осетии. - Вестн.
Моск. ун-та, Сер. почвовед., 1978, №2.
56. Зырин Н.Г., Звонарев Б.А., Садовникова Л.К.,
Воронова Н.И. Распределение ртути по профилю почв
равнинной части Северной Осетии. - Почвоведение, 1981, №9.
57. Зырин Н.Г., Малинина М.С. Содержание валового Мо
в почвах и породах Западной Грузии. - Вестн. Моск. ун-та.
Сер. почвовед., 1977, №2.
58. Зырин Н.Г., Малинина М.С. Подвижный молибден в
почвах Западной Грузии и содержание молибдена в
мандариновом дереве и чайном кусте. - Агрохимия, 1978, №3.
59. Зырин Н.Г., Мотузова Г.В., Обухов А.И. Формы
соединений микроэлементов (Мп , Си, Со, Zn ) в почвах и
методы их изучения. - Тез. докл. X Междунар. контр,
почвоведов. М., 1974, т. 11.
60. Зырин Н.Г., Чеботарева Н.А. К вопросу о формах
соединений меди, цинка, свинца в почвах и доступности их для
растений. - В кн.: Содержание и формы микроэлементов в
почвах. М., 1979.
61. Иванов Д.И. Распределение меди в почвах и роль медных
удобрений в повышении урожайности сельскохозяйственных
культур. - Тр. Почв, ин-та им. Докучаева, М., 1950, с. 34.
62. Ильин В.Б. Биогеохимия и агрохимия микроэлементов
(Мп, Сц, Мо, В) в южной части Западной Сибири.
Новосибирск, 1973.
63. Ильин В.Б., Гармаш Г.А. Поступление тяжелых
металлов в растения при повышенном содержании в почве. - Изв.
СО АН СССР. Сер. биол. наук, 1981, вып. 10.
64. Ильин В.Б., Мае лова И.Я. Содержание элементов-био-
филов в иле черноземов и дерново-подзолистых почв. -
Почвоведение, 1979, №9.
65. Ильин В.Б., Степанова М.Д. Защитные возможности
системы почва - растение при загрязнении почвы
тяжелыми металлами. - Тр. ин-та почвоведения и агрохимии СО
АН СССР, 1977.
- 187 -
66. Ильин В.Б., Степанова М.Д. Относительные
показатели загрязнений в системе почва - растение. -
Почвоведение, 1979, №11.
67. Канунникова Н.А. Поглощение меди почвами. - Тр.
Ижевск, с.-х. ин-та, 1976, вып. 27.
68. Карасик М.А., Морозова В. И. Особенности
распространения ртути в продуктах грязевого вулканизма Керченско-
Таманской провинции. - Геохимия, 1966, №6.
69. Каталымов М.В. Микроэлементы и микроудобрения.
М.-Л., 1965.
70. Качур А.Н. Некоторые особенности химического состава
атмосферных осадков в связи с техногенезом. - В кн.:
Геохимия зоны гипергенеза и техническая деятельность
человека. Владивосток, 1976.
71. Ковалевский А.Л. Биогеохимические поиски рудных
месторождений. М., 1974.
72. Ковальский В.В. Биохимические пути
приспособляемости организмов к условиям геохимической среды. - В кн.:
Биологическая роль микроэлементов и их применение в
сельском хозяйстве и медицине. М., 1974.
73. Ковальский В.В. Теоретические основы геохимического
районирования. - Геохимия, 1976, №8.
74. Ковальский В.В., Андрианова Г.А. Микроэлементы
в почвах СССР. - Тез. докл. У Всесоюз. совещ.
"Микроэлементы в сельском хозяйстве и медицине", Улан-Удэ,
1966, т. 1.
75. Ковальский В.В., Макарова А.И. Субрегионы
биосферы и биохимические провинции Армении, обогащенные
свинцом. - В кн.: Биохимическое районирование - метод
изучения экологического строения биосферы. М., 1978.
76. К овд а В.А. Основы учения о почвах. Кн. II. М., 1973.
77. Ковда В.А., Якушевская И.В., Тюрюканов А.Н.
Микроэлементы в почвах Советского Союза. М., 1959.
78. Коломийцева М.Г., Габович Р.Д. Микроэлементы в
медицине. М., 1980.
7 9. Колосов Н.И. Поглотительная деятельность корневых
систем растений. М., 1962.
80. Коновалов Т.С. Вынос микроэлементов главнейшими
реками СССР. - Докл. АН СССР, 1959, т. 129, № 4.
81. Кочарян А.Г. Подвижные формы металлов в донных
отложениях водоемов как источник их вторичного
загрязнения. - Тр. Ин-та ВодГео, вып. 69. М., 1977.
82. Круглова Е.К. Микроэлементы в почвах и их*влияние
на хлопчатник. Ташкент, 1966.
83. Круговорот вещества в природе и его изменение
хозяйственной деятельностью человека. Под ред. проф. A.M. Ряб-
чикова. М., 1980.
- 188 -
84. Крупенников И.Л., Стрижова Г.П. Закономерности
распределения микроэлементов в почвах Молдавии. - Тез.
докл. v Всесоюз. совещ. "Микроэлементы в сельском
хозяйстве и медицине". Улан-Удэ, 1966, т. 1.
85. Крупский Н.К., Александрова A.M. К вопросу об
определении подвижных форм микроэлементов. - В кн.:
Микроэлементы в жизни растений, животных и человека.
Киев, 1964.
86. Куликова А.Х., Нургалиева Г.М. Динамика
органических соединений ртути в выщелоченном черноземе и
поступление их в сельскохозяйственные культуры. - Почвоведение,
1979, № 12.
87. Лисицына Н.А., Глаголева М.А. К геохимии коры
выветривания основных пород Батумского побережья Кавке^. -
В кн.: Кора вьюетривания, 1968, вып. 10.
88. Лубченко Ю.И. Геохимия свинца в осадках современных
водоемов. М., 1977.
89. Лукашев К.И. Геохимическое поведение элементов в
гипергенном цикле миграций. Минск, 1964.
90. Лукашев К.И., Добровольская И.А.О микроэлементах
поглощающего комплекса четвертичных пород Белоруссии. -
Почвоведение, 1969, № 2.
91. Лукашев К.И., Петухова Н.Н. Миграции и формы
аккумуляции меди в породах, почвах и растениях
Юго-Восточного Полесья. - Докл. АН БССР, 1962, т. 6, №5.
92. Лупинович И.С., Дубиковский Г.П. и др.
Микроэлементы в почвах БССР и эффективность микроудобрений.
Минск, 1970.
93. Лурье Ю.Ю. Справочник по аналитической химии. М.,
1979.
94. Лурье Ю.Ю., Рыбникова А.И. Химический анализ
производственных сточных вод. Раздел 47, Мышьяк. М.,
1974.
9£. Любимова И.Н. Методы определения и формы соединений
в почвах молибдена, ванадия, хрома. - Автореф. канд. дис.
М., 1970.
96. Ляхович В.В. Некоторые данные о составе акцессорного
магнетита^ - Тр. Ин-та минерал., геохим. и
кристаллохимии редких элементов. М., 1959, вып. 3.
97. Макеев О.В. Общие закономерности распределения
микроэлементов в почвах СССР и микроэлементный состав
некоторых почв Восточной Сибири. - Тр. I конф. по
микроэлементам Вост. Сиб. и Д. Востока. Улан-Удэ, 1961.
98. Мал юг а Д.П. О кадмии в организмах. - Докл. АН СССР,
1941, т. 31, № 2.
99. Малюга Д.П., Махова Н.Н., Никитина Р.Г. К
биогеохимии ртути в почвах и растениях. - Тр. Бурят, ин-та
естеств. наук. Сер. биогеохим., 1969, вып. 2.
- 189 -
100. Манская О.М., Дроздова Т.В. Значение природных
органических соединений в концентрировании и миграции
микроэлементов. - В кн.: Применение микроэлементов ь
сельском хозяйстве и медицине. Рига, 1959.
101. Махонина Г.И., Молчанова И.В. Исследование
поведения микроколичеств железа и цинка в почвах. - Науч.
докл. высш. школы. Биол. науки, 1961, № 4.
102. Мейсон Б. Основы геохимии. М., 1971.
103. Методические рекомендации по установлению ПДК
химических веществ в почве. М., 1976.
104. Мотузова Г.В. Формы соединений микроэлементов (В,
Мп, Сц, Zn ) в субтропических почвах Западной Грузии. -
Автореф. канд. дис. М., 1972.
105. Мп тузов а Г. В., То л очко В.В. Мышьяк в почвах
Северного Кавказа. - В кн.: Геохимия тяжелых металлов в при-
роьнмч и техногенных ландшафтах. М., 1983.
106. М с i > (ива Г. В., Фи л и м о н и •> а А. В. Сорбция мышьяка
почвам и - Тез. IX Всесоюз. конф. "Микроэлементы в
биоюгии и сельском хозяйстве*. Кишгнев, 1981.
107. На.! П.Х., Т инк ер П.Б. Движение растворов в системе
почиа - растение. М., 1980.
108. Никитин B.C. Предупреждение вредного воздействия
предприятий горной промышленности нч окружающую
среду п США и Канаде. - Горный журнал, 1975, № 9.
109. Никпф рова Е.М. Загрязнение природной среды
свинцом от вь?хлопных газов автотранспорта. - Вестн. Моск.
ун-та. Сер. геогр., 1975, № 3.
110. Никифорова Е.М., Смирнова Р.С. Техногенная
миграция Рь и Hg в ландшафтах - Вестн. Моск. ун-та. Сер.
геогр., 1976, № 5.
111. Нико; <^'Ь А.В., Мазурова А.А. К захвату
мышьяковой и мышьяковистой кислот на природных минералах. -
Изв. СО АН СССР. Сер. хим., 1972, вып. 6, jsfe 14.
112. Озерова Н.А., Айдиньян Н.Х. Ртуть в осадочном
процессе. - В кн.: Очерки геохимии эндогенных и
гипергенных процессов. М., 1966.
113. Ониси X,, Санделл Э. Геохимия мышьяка. - В кн.:
Геохимия редких элементов. М., 1959.
114. Орлов Д.С., Нестеренко Н.В. Образование гуматов
кобальта, никеля, меди, цинка. - Науч. докл. высш. школы
Биол. науки, 1960, № 3.
115. Пейве Я.В. Микроэлементы и их значение в сельском
хозяйстве. М., 1961.
116. Пейве Я.В. Руководство по применению микроудобрений.
М., 1963.
117. Пейве Я.В. Об основных закономерностях
распределения валовых запасов и подвижных форм микроэлементов
в почвах СССР. - Докл. vlll Ме;кдунар. конгр. почвовед.
118. П i» p e ;.' 1 м а н А.И. Очерки геохимии ландшафтов. М.,
1955.
119. Перельман А.И., Борисенко Е.Н. Очерки геохимии
меди в зоне гипергенеза. - Тр. Ин-та геологии рудных
месторождений, петрографии, минер, и геохим. М., 1961
вып. 70, т. 3.
120. Перельман А.И. Геохимия ландшафтов в зоне
гипергенеза. М., 1974.
121. Перельман А.И. Геохимия ландшафта. М., 1975.
122. Перелыгин В.М., Разнощик В.В. Гигиена почвы и
санитарная очистка населенных мест. М., 1977.
123. Петрунина Н.С. Микроэлементы и болезни
сельскохозяйственных растений. - В кн.: Биологическая роль
микроэлементов и их применение в сельском хозяйстве и
медицине, т. 1. Л., 1970.
124. Петрунина Н.С. Геохимическая экология растений в
провинциях с избыточным содержанием микроэлементов
(никеля, кобальта, меди, цинка, свинца, молибдена). -
Тр. Биогеохим. лаб., 1974, N? 13.
125. Пинский Д.Л. Равновесие обмена кальция и свинца на
образцах выщелоченного чернозема. - Почвоведение,
1980, № 2.
126. Плотников В.И., Усато в а Л.П. Соосаждение малых
количеств мышьяка с гидроокисями металлов. - ЖАХ,
1964, вып. 10, т. 19.
127. Поликарпочкин В.В. Вторичные ореолы и потоки
рассеяния. Новосибирск, 1976.
128. Поликарпочкин В.В., Гапонцев Г.П., Жукова Р.И.
и др. Изменение состава вод малых рек Восточного
Забайкалья в связи с их режимом и некоторые вопросы
гидрохимического метода поисков. - В кн.: Ореолы
рассеяния месторождений Восточной Сибири. М., 1971.
129. Потатуева Ю.А., Залегина В.А. Агрохимическое
значение мышьяка (содержание в удобрениях, почвах,
растениях). - Агрохимия, 1981, № 7.
130. Предельно допустимые концентрации вредных веществ в
воздухе и воде. Л., 1975.
131. Приходько Н.Н. Ванадий, хром, никель и свинец в
почвах Приенисейской низменности и предгорий Закарпатья. -
Агрохимия, 1977, }h 4.
132. Прохоров В.М. Исследование диффузии 90 $r B почвах.
Автореф. канд. дис. Л., 1965.
133. Прохоров В.М. Прогнозирование миграции *3 • Cs в
почвах. - Почвоведение, 1975, № 11.
134. Прохоров В.М. Математическая модель поглощения
элементов растениями из почв. - Агрохимия, 1970, № 7.
135. Прохоров В.М. Диффузия ионов в почвах и ее роль в
- 191 -
миграции радионуклидов. - В кн.: Современные проблемы
радиобиологии, т. 2. Радиоэкология. М., 1971.
136. Прохоров В.М., Фрид А.С. Вклад адсорбированных
ионов в диффузию ^^ Sr в почвах. - Радиохимия, 1972,
т. 14, вып. 4.
137. Прохоров В.М., Громова Е.А. Влияние рН и
концентрации солей на сорбцию цинка почвами. - Почвоведение,
1971, № 11.
138. Пугачевич П.П. Работа со ртутью в лабораторных и
производственных условиях. М., 1972.
139. Рабинович И.З., Пилипенко А.Д. Микроэлементы в
гумусовых кислотах основных почв Молдавии. - В кн.:
Влияние мелиорации и удобрений на плодородие почв.
Кишинев, 1981.
140. Рам а не Х.И., Фрейберг Т.Н. Поступление молибдена
в растения в зависимости от почвенных условий. - В кн.:
Биологическая роль молибдена. М., 1972.
141. Резников А.А., Муликовская Е.П. Методы анализа
природных вод. М., 1954.
142. Ричькис Г.Я. Поступление молибдена в растения в
зависимости от количества других элементов в
питательном субстрате. - В кн.: Биологическая роль молибдена.
М.. 1972.
143. Ромашкевич А.И. Формирование красноземных почв и
кор выветривания Западной Грузии. - В кн.: Генезис и
география почв по исследованиям советских географов.
(Докл. IX Междунар. контр, почвовед.), М., 1968.
144. Рочев В.А. Влияние извести и молибдена на
мобилизацию почвенного азота и фосфора. - Тр. Свердл. с.-х.
ин-та, 1979, вып. 54.
145. Рощин А.В., Орджоникидзе Э.К., Шал генов а И.В.
Дозоэффективная взаимосвязь и ее значение в
гигиеническом нормировании металлов. - Тр. Центр, ин—та усоверш.
врачей, 1979, вып. 209.
146. Рубилин Е.В. Микроэлементы в почвах Северного
Кавказа. Л., 1968.
147. Руденская К.В. Содержание марганца и меди в
органическом веществе некоторых почв Ростовской области. -
В кн.: Микроэлементы и естественная радиоактивность
почв. Ростов, 1962.
148. Сает Ю.Е., Янин Е.П., Григорьева О.Г.,
Сорокина Е.П. Микроэлементы в донных отложениях рек
как индикаторы загрязнения антропогенных ландшафтов. -
В кн.: Геохимические методы мониторинга. Минск, 1980.
149. Салманов А.Б., Абдуллаева С.А. Содержание
подвижной меди в почвах Ногайской степи Дагестана. - В
кн.: Микроэлементы в почвах Терско—Кумской
низменности Дагестана. Махачкала, 1981.
- 192 -
150. С ay ко в А. А, Геохимия ртути. - Тр. ИГН, минер.-геохим.,
1946, вып. 78, № 17.
151. Сауков А.А. Геохимия. М., 1975.
152. Сауков А.А., Айдиньян Н.Х., Озерова Н.А. Очерки
геохимии ртути. М., 1972.
153. Седлухо Н.Я. Содержание подвижной меди в некоторых
почвах Могилевской области. - В кн.: Сб. научн. тр.
Белорус, с.-х. акад., 1980, № 69.
154. Серебренникова Л.Н., Горбатов B.C., Старце-
ва Е.Ф. Вариабельность содержания тяжелых металлов
(свинца, цинка, меди, кадмия) в почвах, растениях
техногенных ландшафтов. - В кн.: Тяжелые металлы в
окружающей среде. М., 1980.
155. Силади М. О сорбции молибдена на гуминовых
препаратах. - Геохимия, 1967, № 12.
156. С ироченко И.А., Лейденская Л.Д., Оноприй-
чук О.Т. Эффективность марганизированного
суперфосфата в связи с содержанием марганца в почвах Украинской
ССР. - В кн.: Микроэлементы в сельском хозяйстве и
медицине. Киев, 1963.
157. Смирнова P.M. Ртуть в компонентах географической
оболочки. - Автореф. канд. дис. М., 1975.
158. Стамболиев М., Папалезова-Данова Р. Формы
меди в карбонатном черноземе и их изменение при
применении минеральных удобрений. - Почвознание и агрохимия
(болг.), 1977, № 6.
159. Степанова М.Д. Взаимодействие микроэлементов с
органическим веществом почв. - Почвоведение, 1974,
№ 12.
160. Степанова М.Д. Микроэлементы в органическом
веществе чернозема и дерново-подзолистой почвы. - Тез. докл.
VII Всесоюз. совещ. "Биологическая роль и практическое
применение микроэлементов". Рига, 1975.
161. Страхов Н.М. Основы теории литогенеза. Т. 1,2. М.,
1960.
162. Студенникова З.В. и др. К геохимии молибдена и
вольфрама. - В кн.: Геохимические циклы. М., 1962.
163. Султанбаева У.Н., Солодникова Е.А. Содержание
микроэлементов в почвах Кустанайской, Целиноградской
и Семипалатинской областей Казахстана. Киев, 1963.
164. Таусон Л.В. Геохимия редких элементов в гранитоидах.
М., 1961.- Ч
165. Тейлор С. Геохимия андезитов. - В кн.:
Распространение элементов в земной коре. М., 1972.
166. Токовой Н.А., Майборода Н.М. Микроэлементы в
почвах Красноярского края и их роль в получении
высоких урожаев. Красноярск, 1963.
- 193 -
167. Трейман А.А», Бахшов В.И. Прогноз возможной
эффективности макро- и микроудобрений на почвах западной
и средней частей зон БАМ. - В кн.: Почвы зоны БАМ.
М., 1979,
168. Троицкий Е.П. Основные проблемы учения о
микроэлементах в системе почва - растение. - Вестн. Моск. ун-та.
Сер. почвовед., I960, N? 5.
169. Трофименко К.И., Кизяков Ю.Е. Органическое
вещество отдельных гранулометрических фракций основных
типов почв Предкавказья. - Почвоведение, 1967, № 2.
170. Туе в Н.А. Поглощение молибденовых соединений
некоторыми глинистыми минералами. - В кн.: Микроэлементы и
естественная радиоактивность почв. Кн. 1. Петрозаводск,
1965.
171. Ферсман А.Е. Геохимия. Л., 1937-1939.
172. Физико-химические методы исследования почв. М., 1980.
173. Филиппова Н.Л. Фазовый анализ руд цветных металлов
и продуктов их переработки. М., 1963,
174. Фомин П.И., Потатуева Ю.А., Фомина Ю.А.
Продолжительность действия молибдена при запасном внесении
в составе фосфатно-калийно-молибденового удобрения. -
Химия в с.-х., 1979, т. 17, № 8.
175. Хализев А.Я. Химические стимулянты. М., 1934.
176. Хицкая Е.В. Распределение токсичных металлов в
почвах Западного участка трассы БАМ и побережья озера
Байкал. - В кн.: Почвы территорий нового освоения, их
режимы и рациональное использование, Иркутск, 1980.
177. Хокс Х.Е., Уэбб Дж. С. Геохимические методы
поисков минеральных месторождений. М., 1964.
178. Хрусталева М.А. Тяжелые металлы в ландшафтах
бассейна Можайского водохранилища. - В кн.: Тяжелые
металлы в окружающей среде. М., 1980.
179. Чеботарева Н.А. Амальгамная полярография с
накоплением и ее использование для изучения форм содержания
меди, цинка, свинца в почвах. - Автореф. канд. дис. М.,
1970,
180. Чернавина И.А. Физиология и биохимия
микроэлементов. М., 1970.
181. Чистяков В.К. К вопросу о формах вхождения
элементов - примесей в магнетит, - Геохимия, 1970, № 2.
182. Чухланцев И.Т. Определение констант диссоциации
мышьяковой кислоты. - Физ. химия, 1959, т. 33, вып. 1.
183. Шарова А.С. Содержание микроэлементов в Некоторых
почвах Латвийской ССР. - Почвоведение, 1957, № 3.
184. Шведа С,А. Изучение факторов, определяющих
содержание и подвижность меди в почвах Литовской ССР. - В
кн.: Микроэлементы в сельском хозяйстве и медицине,
Киев, 1963.
- 194 -
185. Шемякин В.Н., Павлов А.Н. О формах миграции
мышьяка в природных водах. - В кн.: Подземные воды Сибири и
Дальнего Востока, 1971.
186. Школьник М.Я. Микроэлементы в жизни растений. М.,
1974.
187. Шоу Д. Геохимия микроэлементов кристаллических пород.
М., 1969.
188. Шетинина Л.Л. Микроэлементы в почвах и растениях
Центрального Полесья УССР. - Автореф. докт. дис. Омск,
1967.
189. Ягодин Б.А., Собачкин Л.Н. Методы определения
различных форм микроэлементов в почвах. - Почвоведение,
1977, № 5.
190. Яковлева М.Н. Экспериментальные исследования к
вопросу накопления меди в осадочных породах. - Бюл.
МОИП, отд. геол., 1952, вып. 27, № 6.
191. Якушевская И.В. Микроэлементы в природных
ландшафтах. М., 1973а.
192. Якушевская И.В. Медь. Объяснительные записки к
схематическим картам содержания микроэлементов в
почвах (А. , А ) европейской части Советского Союза. М.,
19736.1 ПаХ
193* A11 a w а у W. Agronomic controls over the environmental cycling of trass
elements. - Advin agron. 1968, vol.20.
194. Andersson A. Heavy metals in Swedish soils: on their retention,
distribution and amounts. - Swedish J.agr. Res., 1977, vol.7, N 1.
195. Andersson A. Kvicksilvret i marken. - Grundforbattring, 1967, vol.20,
N3-4.
196. Andersson A. The distribution of heavy metals in soils and soil
materials or influenced by the ionic reding. - Swedish J. of agricultural research,
1977, vol.7.
197. A kins M.В., Levis R. Distribution of As added to soil as DSMA-As.-
S.S.S.Am.J., 1976, vol.40, N5.
198. Arnon D.I., Ichioka P.S., Wessel G. et al. Molybdenum in relation to
nitrogen metabolism. I. Assimilation of nitrate nitrogen by Scendesmus. -
Physiol.Plant, 1955, vol.8, N3.
199. Baker D.E., Chesnin L. Chemical monitoring of environmental
quality and animal and human health. - Advin Agron., 1975, voJ.27.
200. Barrow N.J., Shaw T.C. The slow reactions between soil and anions:
effect of time and temperature of contact between soil and molybdate on
uptake of molybdenum by plants and on between on the molybdate conentration
in the soil solution. - Soil Sci., 1975, vol.119, N4.
201. Baumeister W. Ubzden. Einfluss dess zinks bei silen inflata. - Smith
Ber. deutsch.bot. Ges., 1954, vol.67.
202. Beavford W., Barber J., Barringer A.R. Uptake and distribution
of mercury within higher plants.- Physiol.Plantarum, 1977, vol.39, N4.
203. Borrow M.L., Mitchell R.L. Location of trace elements in soil
profiles: total and extractable contents of individual horizons.— Trans.Roy, Soc.
Edinburgh. Earth Sci., 1980, vol.71, N2.
204. В ie о Iron J., La loch a E. Wplyw orke pelney na zawartosc niektorych
metalicierkich w glebach rejonu przemys towege. — Sylwan, 1979, vol.123,
205. Bingham F.T., Page A.L.,Sims G.R. Retention of Cu and Zn by
H-montmorillonite. - Soil Sci. Am, Proc, 1964, voJ.28.
206. Bishop R.T., Chisholm. Arsenic accumulation Annapolis valley orchard
soils. - Canad. J. of S.S., 1962, vol.42, N 1.
207. Bittel I.E., Miller R.I. Lead, cadmium and calcium selectivity
coefficients in a montmorillonite, illite, and Koolinite. - J. E«v. Qual., 1974,
vol.3.
208. В Ion del A.M., Blanc D. Accidents vegetatifs for agrumes en Corse. -
Ann. agron., 1975, vol.26 (3).
209. Blum W. Fixation of emitted lead by soils. - Z. Pflanzenern. Bodenk.,
1975, vol.3.
210. Bohn H. Arsenic Eh-ph diagramm and comparisons to the soil chemistry
of phosphorus. - Soil. Sci., 1976, vol.121, N2.
211. Bolt G.H., Bruggenwert (Eds.) Soil chemistry. - A. Basic elements.
Elsevier, Amsterdam, 1976.
212* В г am an R.S., Forback G.C. Methylated gorms of arsenic in the
environment. Science, 1973, vol.172, N4118.
213.Братнова Д. Зам'рся ване на почви и растения с олово. -Был.
ЧТИ Нипроруда, 1980, N?4.
214. Briat M. Evaluation of levels of Pb, V, Cd, Zn and Cu in the snow of
Monblane during the last 25 years. - Atmos. Pollut., Amsterdam, 1978.
215. Brown A.L., Krontz M.B., Martin P.E. The residual effect of zinc
applied to soils. - Soil Sci. Soc. Amer. Proc, 1964, vol.28.
216. Bun zl K.,Schultz W. Competitive sorption of Pb by bentomte and
sphagnum peat. - Z. Pflanzenern ah г und Bodenk., 1980, vol.143, N 2.
217. Cadigan R.A. Mercury in sedimentary rocks of Colorado Plateau
Region. -In: Mercury in the environment. US Geol. Survey Prof. Paper, 1970,
vol.713.
218. Cannon H.L. Lead in the atmosphere, natural and artifically occuring
lead and the effect of lead on health. - Lead in the environment. 1976,
vol.957.
219. CarpeniG. Sur la cbnstitution des aqueonees diacide molybdique et de
molybdates alkalins. - IV Bull. Soc. Chim., 1947, vol.50, N 11.
220. Carrow R.N., Riere P.E., Ellis B.G. Growth of Turfgrasses as
affected by Soil Phosphorus and arsenic, - Soil Sci. Soc. Amer. Proc, 1975,
vol,39, N6.
221. С art wrigh t В., Merry R.H., Tiller K.G. Heavy metal contamination
of soils around a lead smelter at Port Pirie. South Australia. - Austral. J.
Soil Res., 1977, vol.15, N 1.
222. Catani G., Alcarde J.C.,Furlani P.R. A ad sorcao de molybdenio
pelo solo.~An. Esc. Super Agr.-L. de qneiroz», 1970, 27.
223. С he am V., Gamble D.S. Metal- fulvic acid chelation equilibrium in
aqueous NaN03 solution. Hg(II) and Cu(II) fulvate complexes. - Can. J.
Soil Sci., 1974, vol.54, N 4
224. Cheng B.T.Action mutuelle du fer et du molibdene daus un sol acide du
Quebees el loam sable-gravelleux saint-andre. - Agriculture (Can)., 1980,
vol.37, N 4.
225. Chrenekova E. Entenzita toxickuchucinkov arzenic nanveho ioni pri
rozum sposobe jeho aperikaie. - Polnohospodarstvo, 1973, vol.XIX.
226. Clarke F.W., W a sh in gton H.S. The data of geochemistry, - 5th
edition. U.S.Geol. Surv. Bull., 1924, vol.770.
227. Col bourn P. Arsenic and heavy metalls in soils associated with geo-
chemical anomalies in south west England. - Sci. Total Environment,l975,
- 196 -
vol.4, N4.
228.Culter J.M., Rains D.W. Characterization of cadmium uptake by plant
tissue. - Plant Physiol., 1974, vol.54, N l!
229. Czarnowska K. Akumylacja metali ciezick w glebach, roslinach i ni-
ectorych zwierzetach no tererie Warszawy. - Rocz. glebozn., 1980, vol.31,
N1.
230. С zarno w sk a K. Kadm w glebach okolic Warszawy. - Rocz. glebozn.,
1978, vol.29, N1.
23b Da vies E.B. Factors effecting molybdenium availability in soils. -Soil
Sci., 1956, vol.81, N3.
232. Davies B.E. Mercury content of soils in Western Britain with special
reference to contamination from metal mining. - Geoderma, 1976, vol. 16, N3
233. Davis W.E. et al. Report to nation air pollution control administration.
N.-Y., 1970.
234. Duel L.E., Swoboda A.R. Arsenic solubility in a reduced environment.
S.S.S.Am.Pr., 1972, vol.36, N2.
235. Dickens R., Hiltbolt A.E. Movement and persistence of MSMA in
soil. - Weed Sci., 1967, vol.15, N 4.
236. D о brzan sk i В., Gl in ski A., Unsiak S. The occurence of some
elements in soils of the Pzeszow Province in relation to the parent rock
and typology of soils. - Ann. Univ. Marie Curie Sklodowska. 1969, vol.24.
237. Dostal P., Vaculik H. Pristupne mikroelementy (Mn, Zn, Си, В, Mo)
v pudach. - Acta Univ. Agr., 1980, vol.A28, N 1.
238. Dudas M.J., Pawluk S. Heavy metals in cultivated soils and in
cereal crops in Alberta. - Can. J. Soil Sci., 1977, vol.57, N3.
239. Dudas M.J., Pawluk S. Naturl abundance and mineralogical partitio
ning «if trace elements in selected Alberta soils. - Can. J. Soil Sci., 1980,
vol.60, N4.
240. E 1 rash id i M.A., Shehata A., Wahab M. Copper in some saline
alkali soil of Egypt. - Agrochimica, 1977, vol.21, N3-4.
241.Engler R.M., Patrick J.W.H. Stability of sulfides of manganese, iron,
zinc, copper and mercury in flooded and nonflooded soil. - Soil Sci., 1975,
vol.119.
242. Environmental sources and emissions handbook. Marshall Sittig, 1975.
243. Epstein x Z., Stout R.R. The micronutrient cations iron, manganese
zinc and copper. Their uptake by plants from adsorbed stake. - Soil Sci.,
1951, vol.72, N1.
244. Evans H.S., Purvis E.R., Bear F.E. Effect of soil reaction on
availability of molybdenum. - New Zealand Soil Sci. Tech., 1956, vol.134,
N18.
245. Faasen H.G., van. Methylation of mercury compounds in soil, sediment
and sewage-sludge samples. — Plant and Soil, 1976, vol.44. N2.
246. Fa ssbender H.W. Gehalt Formen Tixierung von Arsenat in verglich zu
Phosphat in Waldboden. - Z.Pflanz. und Bodenk, 1974, vol.137, N 3.
247. Fleisher M. Lead in igneous and metamorphjc rocks and their rockfor-
ming minerals. Lead in the environment, 1976.
248. Forbes E.A., Posner A.M., Quirk J.P. The specific adsorption of
inorganic Hg(II) species and Co(IH) complex ions on goethite. - Coll.
Interface Sci., 1974, vol.49.
249. Forbes E.A., Posner A.M., Quirk J.P. The specific adsorption of
divalent Cd, Co, Cu,Pb, and Zn on goethite. - J. of Soil Sci., 1976, vol.27,
N2.
- 197 -
250. Frissei M.J., P о е 1 s t га Р. et al. The contamination of Dutch soils
with mercury and a few other heavy metals.- Geologic, en mijnbonw., 1974,
vol.53(4).
251. Galba J. Determination area of arsenic compounds contained in the fly
aches of the thermal power station ENO.- Pol nohospodarstyo, 1977, vol.23,
N3.
252. Gallego A., Jolin B.T. Estiduce sorbe refensions molybdato рог las
availlas.- Ciencias, i960, vol.25, N4.
253. G al op pin i C. II mercurio nelle piante. - Agr.ital., 1974, vol.74, N 1.
254. G arcia-Miragoy a I., Page A.L. Sorption of trace quantities of
cadmium by soils with different chemical and minaralogical composition. -
Water, Air, and Soil Pollut., 1978, vol.9, N 3.
255.Goldberg F.L., Van don i M.V. L'inguinamento da metalli del suolo e
delle culture - Agricoltura Italiano, 1975, N5.
256. Gorlach E.,Gorlach K. Wplyw Sposoby i czasu zastosowama mik—
ronawozow miedsi owego i moJibdenowego na pobiranie miedzi i molibde—
nu przez rosliny. — Acta agr. et silv., Ser. Agr., 1978, vol.18, N 1.
257. Gorlach E., Gorlach K., Compala A. The effect of phosphates
on sorption and desorption of molybdates in the soil. — Agrochimica, 1969,
vol.13, N6.
258. Gotoh S., Koga H. Mercury in rice soils developed on Saga polder
lands, Nothern Kyushu, Japan. -Plant and Soil, 1977, vol.47, N 1.
259. Gotoch S., Tokudo e S., Koga H. Mercury in soil derived from ig-
neons rock in Nothern Kyushu, Japan. - Soil Sci. Plant nutr., 1978, vol.24,
N3.
260. Gracey H.J., Stewart J.W.B. Distribution of mercury in
Saskatchewan soils and crops. — Can. J. Soil Sci., 1974, vol.54, N 1.
261. Greaves J.E. Arsenic in soils. - Biochem. Bull, 1913, N2.
262 Grimme H. Die fraktionierte Extraktion von Kupfer aus Boden. - Zeit
fu'r Pflanz und Buden, 1967, Bd.6, 116, N 3a.
263. Haan de S. Die chemische Zusammensetzung von Gewachsen aufmit
Klarschlamm behandelten Boden. - Landwirt. Forsch., 1975, Sonderh.31/1.
264.Hahne H.C.H., К го on t j e W. Significance of pH and chloride
concentration on behavior of heavy metal pollutants; mercury (II), cadmium (II),
zinc (II), lead (II). -J. Envir. Qua!., 1973, vol.2, N4.
265. Haney A., Carl son J.A., R ol f e C.L. Lead contamination of soils and
plants along highway gradients in east central Illinois, — Frans. 111. State
Acad. Sci., 1974, vol.67, N3.
266. H арке Н.А., Prigge E. Neue Aspekte der Bleifergiftung bei Vider-
kaern. — Bejliner und Munchener TierascpJische Wochenschrift, 1973, Bd86,
H.21.
267. H ardh J.E. Raskasmetallit ravintokasveissa ja maasa. - J. Sci. Agric.
Soc. Finland, 1977, vol.49, N3.
268. Hem J.D. Inorganic chemistry of lead in water. — Lead in the
environment,1976.
269. Hess R.E., В 1 a?i ch а г R.W. Dissolution of arsenic from waterlogged
and aerated soils. - S.S.S. Am. J., 1977, vol.41, N5.
270. H i 1 d e bran d E.E., Blum W.E. Fixation of emitted lead by soils. -
Z. Pflanzenernah. Bodenk, 1975, N3.
271. H i J debrand E.E., Blum W.E. Lead fixation by clay minerals. - Na-
turwissenschaften, 1974 a, vol.61, N4.
- 198 -
272. H il de brand К.E., Blum W.E. Lead fixation by iron oxides. - Natur-
wissenschaften, 1974b, vol.61, N4.
273- H ings ton F. Y. et al. Specific adsorptions of anions. - Nature, 1967,
vol.215.
274. H ings ton F.Y. et al. Specific adsorptions of anoins on goethite. -Int.
Soil Sci., 19-th Congr., Adelaide, 1968, vol.1.
275. Hodgson J.F.,Lindsay W.L., T r ie w ell e г J.F. Mickronutrient
cation complexingin soil solution: II Complexing of zinc and copper in
displaced solution from calcereous soils. - Soil Sci. Soc. Am. Proc, 1966,
vol.30, N6.
276. Hofner M., Grieb R. E.influb von Fe- und Mo— Man gee auf den Zonen-
gehalt mono unddikotyler Pflanzen unterschiedlicher ChloroscanfMJ ligkeit.-
Z. Pflanzenerhahr und Bodenk, 1979, vol.142, N4.
277. Hogg T.J., Stew art J.W.B., Bettan у J.R. Influence of the chemical
form of mercury on its adsorption and ability to leach through soils. — J.En-
vir. Qual., 1978, vol.7, N 3.
278. H u tch i son F., Wai C.M., Jernegan M., Hicks W. Distribution of
Cadmium, Lead and zinc in soil around two phosphate processing plants
in pocatello, Idaho. -. Bull. Environ. Cqntam. and Toxical., 1979, vol.22,
N3,
279. J u rk о w sk a H., Rogor A. The influence of liming on copper concen~
tration in plants in relation to the dose and kind of copper fertilizer.-Pol.
J. Soil Sci., 1977 (1978), vol.10, N2.
280. Jacobs J.W., Syern J.K., Keeney D.R. Arsenic sorption by soils.-
S.S.S. Am. Pr., 1970, vol.34, N 5.
281. Jensen S., JerneJov A. Biological methylation of mercury in aquatic
organizms. - Nature, 1969, vol.223.
282. John M.K. Cadmium adsorption maxima of soils as measured by the lan-
gmuir isoterms. — Can. J. Soil Sci., 1972t vol.52.
283. J ohn M.K. Lead contamination of some agricultural soils in Western
Canada. - Env. Sci. Techno!., 1971.
284. John M.K. Mercury uptake from soils by various plant species!.- Bull.
Envir. Con tarn, and Toxicol., 1972,vol.8.
285. Jon as son I.R. Mercury in the natural environment: a rewies of recent
work.- Geol.Surv. Can. Pap., 1970.
286. J onaseon I.R», Boyle R.W. Geochemistry of mercury and origins of
natural contamination of the enrironment. - Can. Inst.Mining and Met. Bull.,
1972, vol.65.
287. Jones L.H.P. Solubility of molybdenium in simplified systems and
aqueous soil suspensions.- J. of Soil Sci., 1957,vol.8, N2.
288. Jones L.H.P., J а г vi s S.C., Co w 1 int D*W. Lead uptake from soils by
perennial ryegrass and its relation to the supply of on essential elements
(sulphur).-Plant andSoil, 1973, vol.38.
289. Jones R.L., Hinesly T.D. Total mercury content in Morrow plot soils
over a period of 63 years. - Soil Sci. Soc. Amer. Proc, 1972, vol.36.
290. J on son D.L. Simultaneous determination arsenate and phosphate in
natural waters. - Environ.Sci. Technol., 1971, vol.5, N5.
29l.Jovandic P. Sadrzaj mangana, cinkai bakra u rendzini i lucerki tokom
vegetacije.- Agrochemija, 1980, N5-6.
292. Kalbasi M.„Racz G.J., L oe w en- R u ndgers L.A. Mechanism of
zinc adsorption by iron and aluminium oxides. - Soil Sci., 1978, vol.l25,N3.
- 199 -
293. Kanazawa J. Residual mercury in soil of paddy fields, - Noyaku Kagaku,
1974.
294. Kariman N., Cox F.R. Molybdenum availiability as predicted from se -
lected soil chemical properties. - Agron.J., 1979, vol.71, N 1.
295. Kerridge P.C., White R.F. The residual effect of molybdenum fertilizer
on a krasnozem on basalt at Maleny,South-East Queensland. - Austral. J.
Exp. Agr. and Anim. Husb., 1977, vol.17, N 87.
296. Kin ni burgh D.J., Jackson M.L. Adsorption of mercury (II) by iron
hydrous oxide gel. - Soil Sci. Soc. Amer. J., 1978, vol.42, N 1.
297. Klein D.H» Some general and analytical aspects of environmental
mercury contamination. - J. Chem. Educ, 1972» vol.49.
298. Kline J., Rust R.H. Fractination of copper in neutron activated soils.-
Soil Sci. Soc. Am. Proc, 1966, vol.30, N2.
299. К loke A» Zur Belastung von Bod en und Pflanzen mit Schadstoffen in und
urn Ballungsbereichen. - Ber. Landwirt., 1977, vol.55. N 4.
300. Lag J. Arsenic pollution of soils at old industrial sites. - Acta. Acric.
Scand., 1978, vol.28, N 1.
301. Lagerwerff J.V. Lead, mercury and cadmium as environmental
contaminants. — In: Micronutrients in agriculture, Wisconsin, 1972*
302. Lavy T.L., Barber S.A. Movement of molybdenum in the soil and its
effect on availiability to the plant. - Soil Sci. Soc. Amer. Proc, 1964»
vol. 28, N1.
303. Leonard CD. Low yielding groves take on new look with micronutri
ents. - Citrus Journal, 1968, N418.
304. Le Rich H.H., Wear A.N. A method of studing trace elements in soil
fractions. - Soil Sci., 1965, vol.14.
305. L e vi-M eu zi R., Soldatini G.F. Cadmium adsorption by soils. -
J. Soil Sci., 1976, vol.27, N 1.
306. Lexmond Т., Ha an de F.A.M., Frissel M.J. On the methylation of
inorganic mercury and the decomposition of organomercury compounds -
a review. - Neth. J. Agric. Sci., 1976, vol.24, N 2.
307. Lindberg S.E., Jack son D.R.,H u с к abee J.W. et al.
Atmospheric emission and plant uptake of mercury from agricultural soils near Alma-
den mercury mine. - J. Envir. Qua!., 1979, vol.8, N4.
308. Lisk D.J. Trace metals in soils, plants and animals. — Adv. Agron.,
1972, vol.24.
309. Little J.P., К erridge P.C. A laboratory assessment of the
molybdenum states of nine Qeensland soils— Soil Sci., 1978, vol.125, N 2.
310.L ock e re tz W. Deposition of airborne mercury near point sources. —
Water.Air and Soil Pollut., 1974, vol.3, N2.
311. Loon J.C. van. Mercury contamination of vegetation due to application
of sewage sludge as a fertilizer. - Envir. Lett., 1974» vol.6, N3.
312. L urn an C. Migration of lead during oxidation and weathering of lead
deposits. — Lead in the environment, 1976.
313* Maklean A.J. Effect of soil properties and amendments on the
availability of zinc in soils. - Can. J. Soil Sci., 1974. vol.54, N 1.
314. Masek V. Wirkung van Staubemissionen aus lisenhuften auf den Bo-
den. - Staub-Reinhalt. Luft, 1978, vol.38, N 12.
315. Marczak M., Biedran J. Ot<W, kadm i miedz w glebach lesnych
pozostajacych pool wplywem emisji przemystowych. - Sylwan, 1978,
vol.122, N2.
- 200 -
316. McKeaque J.A., Kloosterman В. Mercury in horizons of some
soil profiles in Canada. — Can, J. Soil Sci.f 1974, vol.54. N4.
317. McLean A.J. Mercury in plants and retention of mercury by soils in
relation to properties and added sulphur. - Can. J. Soil Sci., 1974,vol.54,N3.
318. McN aughton M.G., James R.O. Adsorption of aqueous mercury (II)
complexes at the oxide/Water interface. - J. Coll. Interface Sci., 1974,
vol.47.
319. McNeaJ J., Rose A.W. The geochemistry of mercury in sedimentary
rocks and soils in Pennsylvania. - Geochim. Cosmochim. Acta., 1974,
vol.38, N12.
320. M e n z e 1 R.G., Jackson M.L. Mechanism of sorption of Hydroxy Cupric
ion by clay. - Soil Sci. Soc. Am. Proc, 1951» vol.1, N 5.
321. Michael G.,Trobish S. Der Molybdanversorgungsgrad mitteldeatsche-
rackerboden. - Z. Pflanzen Diing Bodenk, 1961, Bd93. Hf.l.
322* M in ami K«, Araki K. Distribution of trace element in arable soil
affected by automobile exhaust. - Soil Sci. Plant Nutr., 1975» vol.21, N2.
323* Mitchell R.L. Soil aspects of trace element problems in plants and animals. -
J. Royal Agricultural Society, 1963»
324. M iill er J. Exchanges des ionscuiviques sur les colloides mineraux. -
Ann. Inst. nat. reach Agr., All, i960, N 1.
325. Munn R.E. Global environmental monitoring system. — SCOPE,Toronto,
1973, Rep.3.
326.Murty K.S., Mehta B.V. Studies on fixation of zinc. - Plant and soil
1974, vol.41, N1.
327. Newton D.W., Ellis R.]., Paulsen G.M. Effect of pH and complex
formation on mercury (II) adsorption by bentonite. - J. Envir. Qual.» 1976,
vol.5, N3.
328.Николов Б. Раапространенме на няком тяжки метали в почвите на
Софийската котловина. - Проол. геогр. (НРБ), 1980, No 1.
329. Norwel I W.A. Surface reactions of heavy metals with clays, oxides, and
humic substances. - Agrochemicals in Soils, 1980.
330. Nose K. Determination of thiomalic acid Hg in soil - J. Pestic. Sci., 1976,
vol.1, N2.
331«Navrot J., Singer А., В on in A. Adsorption of cadmium and its
exchange characteristics in some Israeli soils.- J. Soil Sci., 1978, vol.29,N4.
332.0dom J.W., Thurlon D.L., Eason J.T. et al. Molybdenum deficiensy
triggled by low soil pH. - Highlights Agr. Res., 1980, vol.27, N 1.
333. Olschowy G. Function des Barden im Statthausshalt der OkosphUren. -
Natur und Unweltschutz in der Bundesrepublick Deutchland, 1978.
334* Page A., Bingham F. Cadmium residues in the environment. -
Residue Revs., N„ Y, 1973, vol.48.
335. Page A.L., Chang A.C. Contamination of soil and vegetation by
atmospheric deposition of trace elements. - Phytopathology, 1979, vol.69, N9.
336. Passioura J.B. The amounts of nutrients contacted by roots.- Tech.
Rep. Ser. 1966, N65.
337. P auling L. The size of ions and the structure of ionic crystals. - J.
Amer. Chem. Soc, 1927, vol.49.
338. Plessis S.F.O., В urger R.DU.T. Die specifieke adsorpsic van coper
deur Kleiminerale on graund fraksies. - Agrichemophysica, 1971, vol.3, N1.
339.Poelstra P., Frissel M.J. et al. Accumulation and distribution of
mercury in Dutch soils. - Neth. J.Agric. Sci., 1973» vol.21.
- 201 -
340. Pol асе к S. Sorpcia arsenicnanov za kinetickych podmienok vo vybranych
podnichtypoch. - Acta fytotechn., 1973,(1974), vol.28.
341. Quirk I.P., Posner A.M. Trace element adsorption by soil minerals. -
In: Trace elements in soil-plant-animal system. Acad. Press., N.. Y, 1975.
342. Qu inch e J.-P., Bolay A., Dvorak V. La pollution par le-mer-
cure des vegetaux et des sols de la Suisse romande. Essiis de methy—
lation in vitro du mercure par des champignous. - Rev. Suisse Agr.f
1976, vol.8, N5.
343.Rauta CNastea St.,Dumitru M. et al. Contributii la cunoos-
terea starii de acumulare in sol si platita a unor metale neferoase (Zn, Pb,
Cu) provenite din emisii industriale. — An. Inst* cere, pedol. si aorochim,
1978, vol.43.
344. R eisen auer H.M., Tabich A.A., Stout P.H. Molibdenium reactions
with soil and hydrous oxides of iron, aluminium and titanum.- Soil Sci.
Soc. Amer. Proc, 1962, vol.26, N 1.
345. Reyes E.D., j^arinak J.J. A mechanism ofmolybdate adsorption on
a-F^^S' - Soil Sci. Soc. Amer. Proc, 1967, vol.31.
346. R if f aid i R., Levi-Men si R., Sol da tin i G.F. Pb adsorption by
soils. - Water, Air and Soil Pollut., 1976, vol.6, N 1.
347. Robinson E.J. Arsenic in soil with five annual applications of MSMA.-
S.S.S.Am.Pr., 1970, vol.34, N5.
348. R u szko wska M., Lisrez S. ' Pamietnik Pulaw*. 1975, N62.
349. Ryden J.C., Syers J.K. Charge relationships of phosphate sorption. -
Nature, 1975, vol.225.
350. S an ti 1 an- Me dr an о J., Jurinak J.J. The chemistry of. lead and
cadmium in soil; Solid phase formation. - Soil Sci. Soc. Amer. Proc, 1975,
vol.39, N5.
35b Sapek B. Study on the copper sorption kinetic by peatmuck soils. —
Proc. 5-th Int. Peat Congr. Posnan, Warsawa, 1976, vol.2.
'352. Sch arrer K., Schaumloffel E. Die Bestimmunf Keeinster Mengen
Kupferals Cu-Diathyldithiocarbaminat durch Verdrangungareaktian. — Z.
Pflanzen. Dung Bodenk., 1959, Bd 89, Hf. 1.
353. Schni tzer M., Kerndorff H. Effects of pollution on hum ic substances.-
J. Envir. Sci. and Health, 1980, vol.l5,N4.
354«Schnitzer M», Khan S.U. Humic substances in the environment. —
Marcel Dekker, N.Y., 1972.
355. Schn i tzer M., Skinner S.J.M. Organo—metallic interactions in soils.
7. Stability constants of Pb++, Nif+, Mn*+, Co+\ Ca+* and Mg**fulvic acid
complexes. - Soil Sci., 1967, vol.103, N4
356. Schni tzer M., Skinner S.J.M. Organo—metallic interactions in soils.
4. Carboxil and hydroxil groups in organic matter and metall retention. -
Soil Sci., 1965, vol.99, N4.
357. Schwertmann U. Der Boden als Stoffpuffer der Landschaft. - Rauer.
Landwirt. Jarb, 1973, Bd 50, Hf.2.
358. Singh В., Sehhon G.S. The effect of soil properties on adsorption and
desorption of zinc by alkaline soils. - Soil Sci., 1977, vol.124, N6.
359. Sin ha M.K., Dhillon S.K. et al. Chemical equilibria and quantity—
intersity relationship of zinc in some acid soils of India. - Geoderma,
1975, vol.13.
360. Sen A., Deb D.L. Mobility of zinc in soils. - J. Indian Soc. Soil Sci.,
1975, vol.23, N3.
- 202 -
361. Sen Л., Noeholds S.R., Allen R. Trace elements in min- » '• nr
rocks of southern Californis Batolit. - G.C.A., 1959, vol.16.
362. Sh ас к I e 11 e H.T., Boerngen J.G., Turner R.L. Mercury in ho
environment — surficial materials of the coterminous United States. - IS
Geol. Surv. Circ. 644, Washington, D.C., 1971.
363. Shacklette H.T. Mercury content of plants. - In: Mercury in the
environment, Geol. Surv. Prov. Pap. 713, US. Government Print Office, Washington,
D.C., 1970.
364. Sharpl ess R.G., Wa 1 1 i h о п Е.Т., Peterson F.F. Retention of Zn by
some arid zone soil materials treated with Zn sulfate. — Soil Sci., Soc. Am.
Proc, 1969, vol.33.
365. Shay an A., Davey B.G. A universal dimentionless phosphate
adsorption osotherms for soil.- Soil Sci. Soc. Amer. J., 1978, vol.42, N6.
366. Shukla U.C., Mittal S.B. Characterization of zinc adsorption in
some soils of India. - Soil Sci. Soc. Am. J., 1979, vol.43, N 5.
367. Shukla U.C.,Mittal S.В., Gupta R.K. Zinc adsorption in some soils
as affected by exchangeable cations. - Soil Sci., 1980, vol.129, N6.
368. Singh В., Sekhon G.S. Adsorption, desorption and solubility
relationships of lead and cadmium in some alkali soils. *- J. Soil Sci., 1977, vol.28,
N 2.
369. Sol datini G.F., R i f f al d i R., Levi-Munzi R. Pb adsorption by
soils. I. Adsoption as measured by the langmuir and freundlish isotherms. —
Water, Air and Soil Pollut., 1976, vol.6, Nl.
370. Smith B.N., Leeper G.W. The fate of applied molybdate in acidic
soils. - J. Soil Sci., 1969, vol.20, N2.
371.Sorteberg A. The effect of some heavy metals on oats in a pot
experiment with three defferent soil types. — J. Scient. Agric. Soc. Finland, 1974,
vol.46. N3.
372. St ah г К., Zottle H.W., H ad rich F. Spurenelement transport (Be, Cd,
Cu, Pb) in verschiedenen Okosystemen eines Kleinen Wassere einzugsge—
bietes im Schwarzwald.- 11th Int. Congr. Soil Sci., Edmonton, 1978, vol.1.
373. Stan ten D.A., Burger R. Studies on Zn in selected orange free state
soils.Zn content of Fe concretion occuring in the soils. — S. Agric. Sci.,
1967, vol.10, N2.
374. Stevenson F.I. Stability constants of Cu, Pb and Cd complexes with
humic acids. - Soil Sci. Soc. Am. J., 1976, vol.40.
375. Stewart J., Smith E.S. Some relations of arsenic to plant growth. -
Soil Sci., 1922, vol.14.
376. Strohal P., Huljev D. Investigation of mercury—pollutant interaction
with humic acidsby means of radiotracers.— In; Nuclear techniques in
environment pollution, Proc. series, IAEA, Vienna, 1971.
377. Swaine D.J. Lead in the environment. - Journal and Procedings, Royal
Society of New South Wales, vol.3, 1978.
378. Swaine D.J. The trace element content of soils. — Common wealth Bur.
Soil Sci., 1955, vol.48.
379. T akom atsu Т., Yoshida T. Determination of stability constants of
metal—humic acid complexes by potentiometric titration and ion—selective
electrodes. - Soil Sci., 1978, vol.125, N6.
380. Tan K.H., King L.D., Morris H.D. Complex reactions of Zn with
organic matter extracted from sewage sludge. - Soil Sci. Soc. Amer. Proc,
1971, vol.35, N5.
- 203 -
38l.Tervis P.E., T i e f en b ас h В., С h a 11 о p a h у а у Л. Determination
of trace cadmium in biological materials by neutron and photon activation
analyses. - Can. J. Chem., 1974, vol.52, N 17.
382. Tiller K.G., lloneysett J.L., II a 11 s w о г t h E.G. The isotopically
exchangeable forms of native and applied cobalt in soils. - Aust. J. Soil
Res., 1969, vol.7c^
383. Ti wary R.C., Kumar B.M. Specific adsorption of copper and zinc in
different soils. - Proc. Indian Nat. Sci. Acad., 1980, A46, N 4.
384. Turekian G.K., W ed epo h 1 G. Distribution of the elements in some
major units of the earth's crust. - Bull. Geol. Soc. Amer., 1961, vol.72,N2.
385. D do E.J., Bohn H.L., Tucker T.C. Zinc Adsorption by calcereous
soils. - Soil Sci. Soc. Amer. Proc, 1970, vol.34, N3.
386. Vans el о w A.P., Datta N.P. Molybdenum deficiency of citrus plant. -
Soil Sci., 1949, vol.67.
387. Vasey E.H., Barber S.A. Effect of placement on the absorption Rb°°
and P^2 from soil by corn root. - Soil Sci. Amer. Proc, 1963, vol.27.
388. Wager L.R., M i tch el 1 R.L. The distribution of trace elements during
strong fractionation of basic magma - a further study of the Scaegard
intrusions.- East Greenland, Geochimica at cosmochimica Acta., 1951, vol.1.
389. Ward a Z. ModeJowe ladania intensywnosci kumulacji metali cilzkich w
glebie i roslinach. - An. Universit. Mariae Curie Sklodowska, 1976, vol.3L
N 18.
390. Warren H.V., D e 1 a v au 1 t R.E. Mercury content of some British soils.
Oikos, 1969, vol.20, N2.
39l.Wedepohl K.H. Geochemic B. Summlung Goschen, 1967, Bd 1224.
392* Wells N. Lime—superphosphate fertiliser topdressing of soils basalt and
its effects of elements levels of grass. — In: Plant analyses and fertilizer
problems. P*»ris, 1956.
393. Wershow R.L. Organic chemistry of lead in natural water system. -
Lead in the environment, 1976.
394. White M.L. The occurence of Zn in soil. - Econ. geol, 1957, vol.52, N6.
395. Wimmer J., Haunold E. Untersuchungen iiber den Quecksilber-gehalt
Osterrichischer Boden mit hilfe der Neutronenaktivierungsanalyse. - Bo—
denkultur, 1973, vol.24.
396. Wool son E.A., Axl ey J.H., Kearney P.S. The chemistry and phyto-
toxity of As in soils. I. Contaminated field soils. - SSSAm. Proc, 1971,
vol.35, N6.
397. Wiinsch N., Amberger A., Gutser R. Schwermetallaufnahme ver-
schichiedener Kultur plan zen im Gefasfersuch aus einein Boden mit hohem
Kupfernivean. - Landmirt. Forsch., 1979, Bd 32, Sonderh. 35.
398. Zietecka M. Badania had zawartoscia, miedzi w gJebach i wroslinach.
CZII. Wspolzaleznose miedzy Zawartoscia miedzi w glebach i w roslinach.-
Rocz. glebozn., 1977, vol.28, N2.
399. Zimdahl R., Skogerbol R.K. Behavior of lead in soil - Envir. Sci.
and Technol., 1977, vol.H, N 13.
ОГЛАВЛЕНИЕ
1. ВВЕДЕНИЕ 3
2. МЕДЬ 7
2.1. Мець в почвах и породах 7
2.2. Мець в гидросфере 16
2.3. Медь в системе почва - растение • 13
2.4. Медь в пищевых и кормовых цепях 24
3. 11ИНК И КАДМИЙ 26
3.1. Содержание и формы соединений цинка и кадмия в
почвах и почвообразующих породах 26
3.2. Поглощение соединений цинка и кадмия почвами,
миграция элементов в почвах 36
3.3. Подвижность и доступные растениям формы соединений
цинка и кадмия в почвах 46
3.3.1. Цинк и кадмий в почвах 46
3.3.2. Диффузия цинка и кадмия в почвах, ''подвижные*
соединения элементов 48
3.3.3. Влияние диффуозных процессов на поступление
цинка и кадмия в растения 53
3.3.4. Трансформация соединений цинка и кадмия
в почвах 55
3.4. Цинк и кадмий в растениях 64
4.РТУТБ 77
4.1. Химическая характеристика ртути и ее соединений 77
4.2. Источники поступления ртути в почву 79
4.3. Содержание ртути в почвах техногенных и фоновых
ландшафтов 80
4.4. Формы соединений ртути в почвах 85
4.4.1. Метилирование и восстановление соединений
ртути в педосфере ., 85
4.4.2. Соединения ртути с гумусовыми веществами 86
4.4.3. Экстрагируемые формы соединений ртути в почвах 88
4.5. Сорбционно-десорбционное взаимодействие ртути с
почвами и ее компонентами •• 89
4.6. Ртуть в растениях 97
5. СВИНЕЦ 104
5.1. Химия элемента и поступление его в биосферу 104
5.2. Свинец в минералах и горных породах 107
5.3. Свинец в почвах природных и техногенных ландшафтов ••• 1Ю
5.4. Содержание свинца в гранулометрических фракциях почв. 113
5.5. Геохимические потоки свинца • 114
5.6. Роль минеральных компонентов почв и гуминовой
кислоты в фиксации свинца 116
5.7. Свинец в системе почва - растение 122
6. МЫШЬЯК 128
6.1. Химическая характеристика 128
6.2. Минералы мышьяка, мышьяк в горных и почвообразующих
породах 129
- 205 -
6.3. Мышьяк в природных водах 131
6*4. Мышьяк и его соединения в почвах 133
6.5. Мышьяк в системе почва - растение •• 149
6.6. Мышьяк в загрязненных почвах 154
7. МОЛИБДЕН 157
7.1* Химия молибдена 157
7.2. Молибден в минералах и почвообразующих породах 157
7.3. Молибден в почвах 161
7.4. Молибден в системе почва - растение 171
8. ЗАКЛЮЧЕНИЕ 180
ЛИТЕРАТУРА л> 184
ХИМИЯ ТЯЖЕЛЫХ МЕТАЛЛОВ,
МЫШЬЯКА И МОЛИБДЕНА В ПОЧВАХ
Зав. редакцией Н.М. Глазкова
Редактор Н.Г. Комлева
Обложка художника Л. П. Муштаковой
Художественный редактор Е.М. Демина
Технический редактор Е.Д. Захарова
Корректоры В.П.Кададинская, ЛХ.Клочкова
Тематический план 1984 г. N? 22
ИБ№1864
Подписано к печати 08.01.85. Л-68014. Формат60х90 1/16.
Бумага офсет. № 1. Офсетная печать. Усл.печ.л. 13,0. Уч. изд. л.
11,72. Тираж750 экз. Заказ Ю70 . Цена 1 р. 80 к. Изд.№2631
Набор выполнен на наборно-пишущих машинках в ордена 'Знак
Почета" издательстве Московского университета.
103009, Москва, ул. Герцена, 5/7.
Типография ордена 'Знак Почета" изд-ва МГУ.
119899,Москва,Ленинские горы