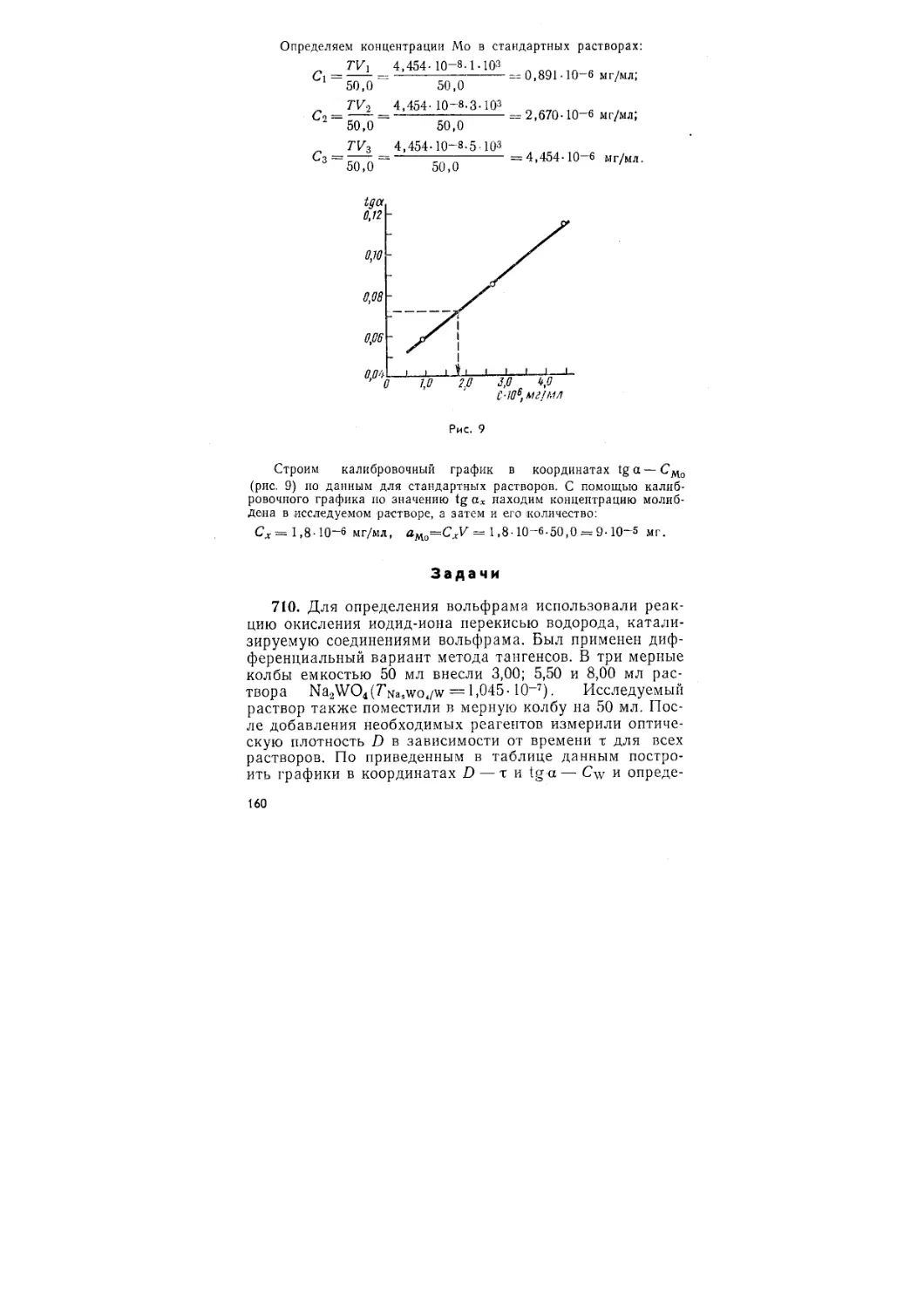
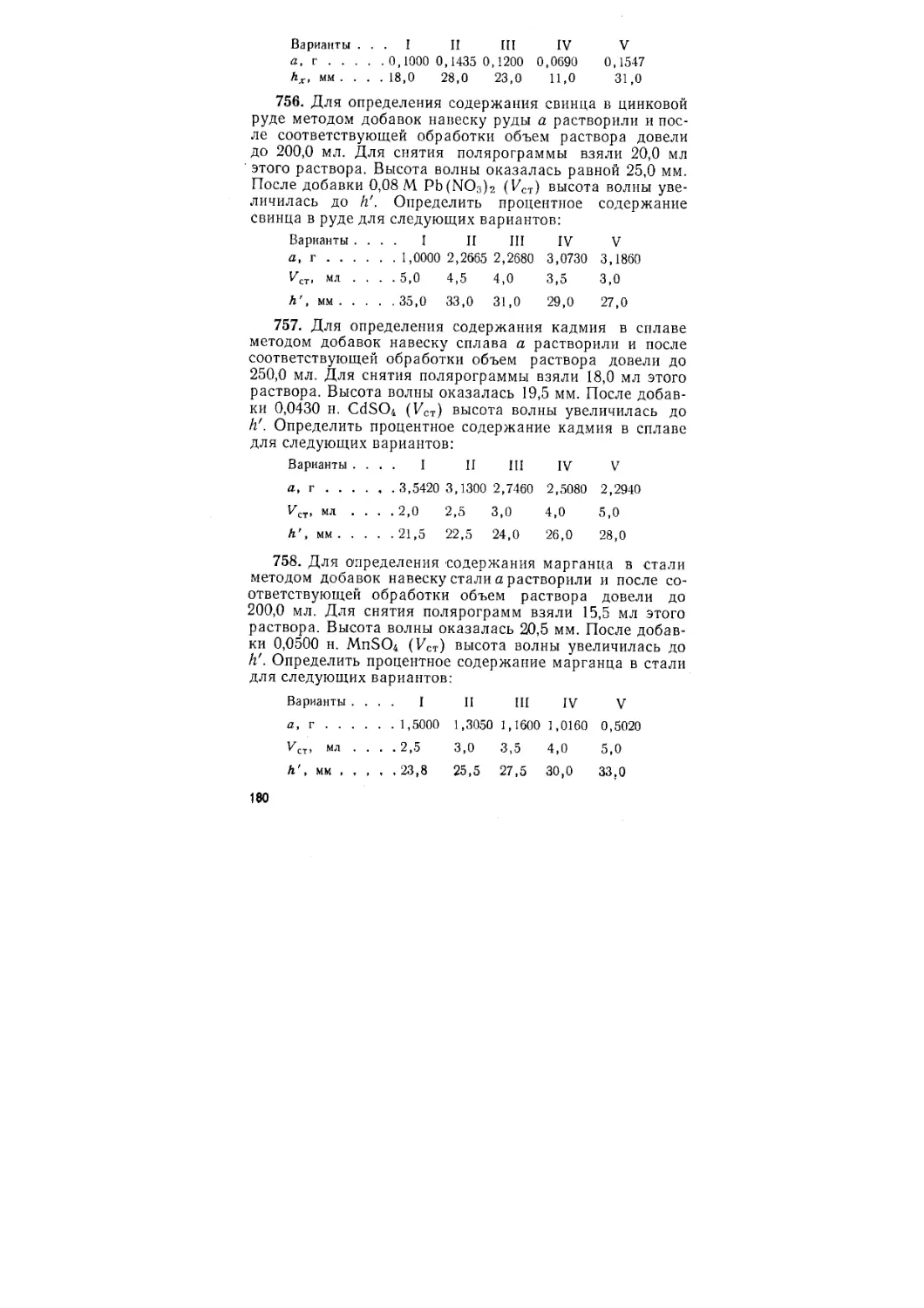
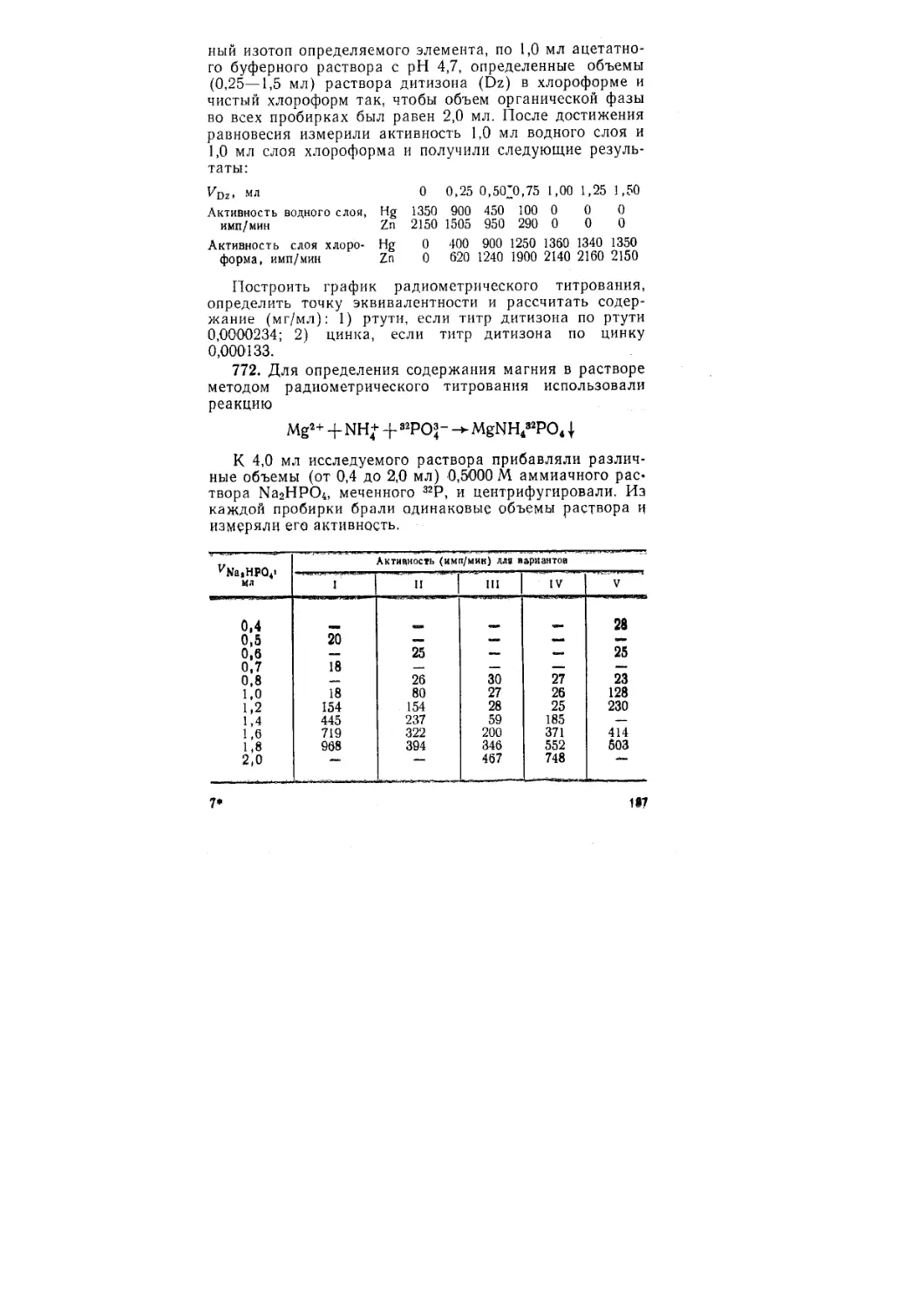
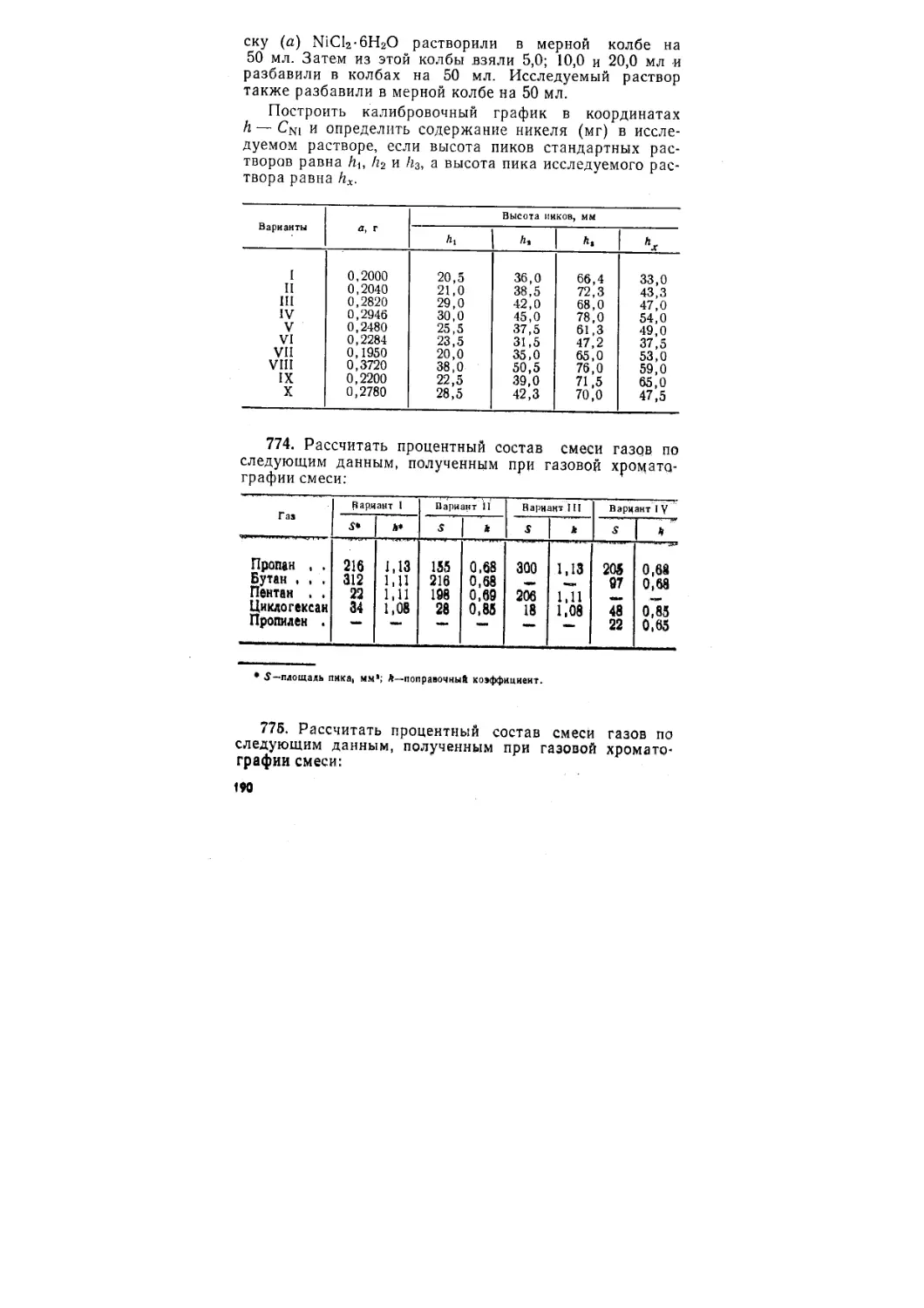
Автор: Васильев В.П. Калинина В.Е. Кочергина Л.А. Куракин А.Н.
Теги: аналитическая химия химия задачи по химии
Год: 1976
Текст
СБОРНИК ВОПРОСОВ
И ЗАДАЧ
ПО АНАЛИТИЧЕСКОЙ ХИМИИ
Под редакцией проф. В. П. Васильева
Допущено Министерством
высшего и среднего
специального образования СССР
в качестве учебного пособия
для студентов
химико-технологических
специальностей вузов
МОСКВА «ВЫСШАЯ ШКОЛА» 1976
543
C23
УДК 543@76)
Рецензенты: доц. 3. Е. Гольбрайх (ЛТИ им. Ленсовета) и кафедра
аналитической химии КХТИ им. С. М. Кирова
Авторы:
Васильев В. П., Калинина В. Е., Кочергина Л. А., Куракин А. Н.,
Милюков П. М., Прик Г. А.
Сборник вопросов и задач по аналитической химии.
С23 Под ред. В. П. Васильева. Учеб. пособие для вузов. М.,
«Высш. школа», 1976.
216 с. с ил.
На обороте тит. л. авт.: В. П. Васильев, В. Е. Калинина,
Л. А. Кочергина [и др.].
Сборник охватывает практически все разделы аналитической химии и со-
состоит из трех частей: ионного равновесия в растворе, количественного аналя-
за и физико-химических методов анализа. Наиболее значительное место
отведено физико-химическим методам анализа. В этом разделе рассматри-
рассматриваются эмиссионный спектральный анализ, абсорбционная спектроскопия,
нефелометрия и турбидиметрия, люминесцентный анализ, кинетические методы
анализа, электрогравиметрический анализ, кулонометрия, кондуктометрия, по-
тенцнометрические методы анализа, полярография и амперометрическое титро-
титрование, радиометрические методы анализа, хроматографические методы анали-
анализа, экстракция.
В каждой главе даны примеры решения типовых задач.
20506—154 543
С 73—76
001@1)—76
© Издательство «Высшая школа», 1976 г.
ОГЛАВЛЕНИЕ
Стр.
Предисловие : . . . 5
Часть первая
ИОННЫЕ РАВНОВЕСИЯ В РАСТВОРЕ
Глава I. Равновесия в водных растворах кислот и ос-
оснований ' 6
Вопросы для самопроверки 6
Решение типовых задач 7
Задачи Ю
Глава II. Равновесия в растворах гидролизующихся со-
солей 16
Вопросы для самопроверки 16
Решение типовых задач 17
Задачи 20
Глава III. Равновесия в растворах малорастворимых
соединений 23
Вопросы для самопроверки 23
Решение типовых задач 24
Задачи 28
Глава IV. Равновесия в растворах координационных
(комплексных) соединений 33
Вопросы для самопроверки 33
Решение типовых задач 35
Задачи 39
Глава V. Равновесия при протекании окислительно-вос-
окислительно-восстановительных процессов 44
Вопросы для самопроверки 44
Решение типовых задач 46
Задачи 49
Глава VI. Влияние ионной силы на равновесия в раст-
растворах электролитов 55
Вопросы для самопроверки 55
Решение типовых задач 55
Задачи 59
Часть вторая
КОЛИЧЕСТВЕННЫЙ АНАЛИЗ
Глава VII. Гравиметрический (весовой) анализ .... 60
Аналитические весы и взвешивание .... 60
Решение типовых задач 60
Задачи 63
Расчеты в гравиметрическом (весовом) ана-
анализе 65
Вопросы для самопроверки 65
Решение типовых задач 67
Задачи 71
Глава VIII. Титриметрический (объемный) анализ ... 80
Вопросы для самопроверки 80
Решение типовых задач 90
Задачи 97
Часть третья
ФИЗИКО-ХИМИЧЕСКИЕ МЕТОДЫ АНАЛИЗА
Глава IX. Эмиссионный спектральный анализ .... 125
Вопросы для самопроверки 125
Решение типовых задач . . 127
Задачи 130
1 л а в а X. Абсорбционная спектроскопия 135
Вопросы для самопроверки 135
Решение типовых задач 140
Задачи 144
Глава XI. Нефелометрия и турбидиметрия 152
Вопросы для самопроверки 152
Задачи 153
Глава XII. Люминесцентный анализ 155
Вопросы для самопроверки 155
Задачи 156
Глава XIII. Кинетические методы анализа 158
Вопросы для самопроверки 158
Решение типовых задач 158
Задачи 160
Глава XIV. Электрогравиметрический (электровесовой)
анализ 165
Вопросы для самопроверки 165
Решение типовых задач 165
Задачи 166
Глава XV. Кулонометрия 167
Вопросы для самопроверки 167
Решение типовых задач 167
Задачи 168
Глава XVI. Кондуктометрия 170
Вопросы для самопроверки 170
Задачи 171
Глава XVII. Потенциометрические методы анализа . . . 174
Вопросы для самопроверки 174
Задачи 175
Глава XVIII. Полярография и амперометрическое титрова-
титрование 178
Вопросы для самопроверки 178
Задачи 179
Глава XIX. Радиометрические методы анализа .... 182
Вопросы для самопроверки 182
Решение типовых задач 183
Задачи 184
Глава XX. Хроматографические методы анализа .... '88
Вопросы для самопроверки 188
Решение типовых задач 189
Задачи 189
Глава XXI. Экстракция 192
Вопросы для самопроверки 192
Задачи 192
Глава XXII. Математическая обработка результатов ана-
анализа . . . 193
Вопросы для самопроверки 193
Решение типовых задач 194
Задачи 201
Ответы к задачам 204
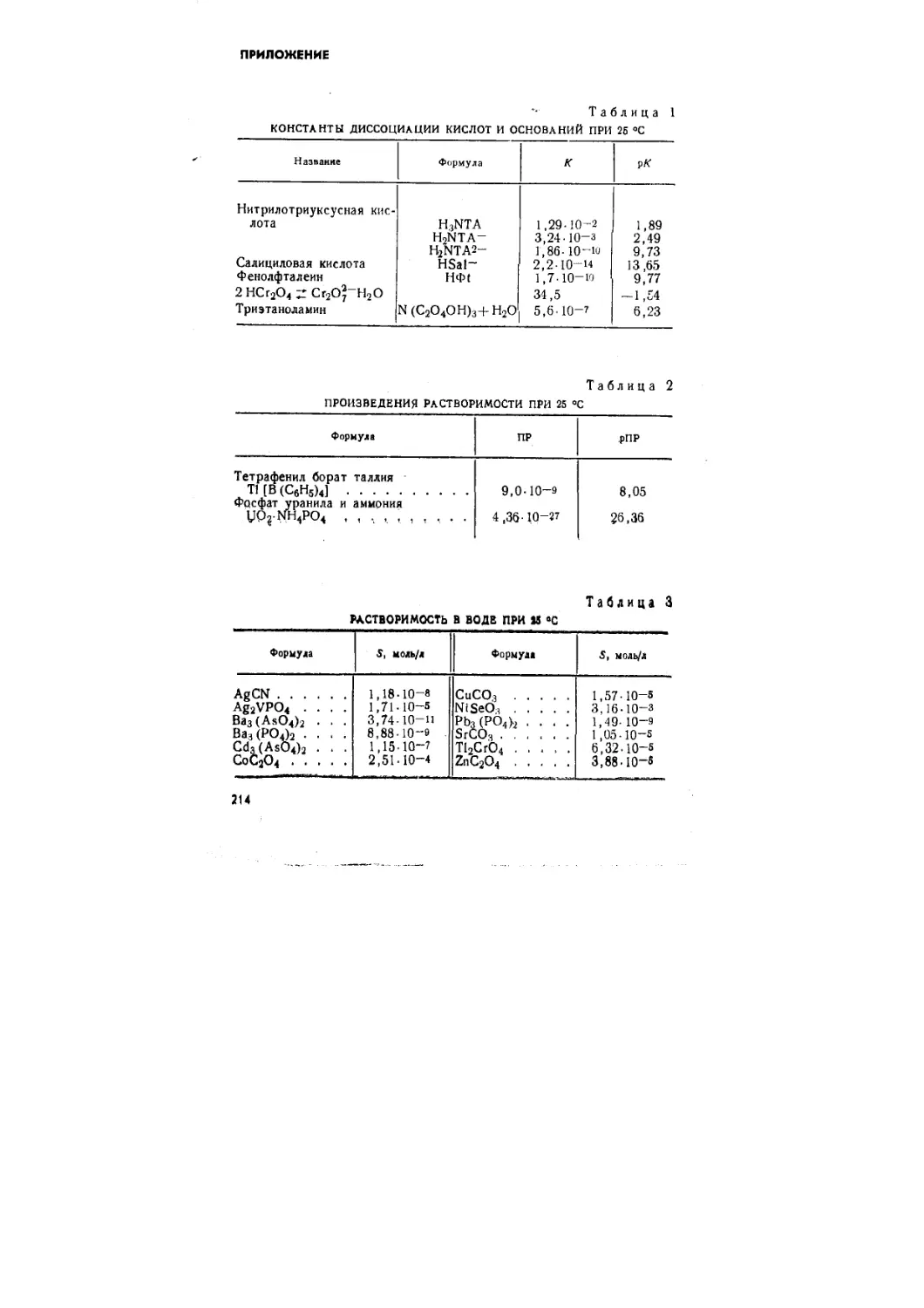
Приложение . 214
ПРЕДИСЛОВИЕ
Настоящий сборник вопросов и задач по аналитиче-
аналитической химии составлен в соответствии с программой для
химико-технологических высших учебных заведений.
Значения физико-химических констант, использован-
использованных в сборнике, взяты, за небольшим исключением, по
справочнику *. Им же рекомендуется пользоваться при
решении задач. Величины, отсутствующие в справочнике,
приведены в приложении. Вопросы для самопроверки ох-
охватывают общетеоретический и специальный материал,
изучение которого в курсе аналитической химии является
обязательным. При разборе типовых задач даются крат-
краткие пояснения теоретического характера и более подроб-
подробно рассматривается их решение. Дать решения задач всех
типов, встречающихся в сборнике, невозможно, так как
не все они достаточно «типичны». Однако в приведенных
примерах содержатся основные элементы решения прак-
практически любой задачи.
При подготовке сборника авторы опирались, главным
образом, на многолетний опыт и традиции преподавания
аналитической химии в Ивановском химико-технологиче-
химико-технологическом институте. В составлении и решении задач помимо
авторов сборника принимали участие все преподаватели
кафедры аналитической химии, которым авторы выра-
выражают глубокую благодарность. Авторы также глубоко
признательны рецензентам задачника: доц. 3. Е. Голь-
брайху (ЛТИ им. Ленсовета) и сотрудникам кафедры
аналитической химии Казанского химико-технологическо-
химико-технологического института им. С. М. Кирова за ценные советы.
* Л у р ь е Ю. Ю Справочник по аналитической химии. 1Ъд. 4-е,
М., «Химия», 1971.
ЧАСТЬ ПЕРВАЯ
ИОННЫЕ РАВНОВЕСИЯ В РАСТВОРЕ
Большинство реакций аналитической химии протекает
в растворе. Глубокое изучение и понимание этих реакций
невозможно без выполнения многочисленных расчетов на
основе закона действия масс и других фундаментальных
соотношений. Поэтому первая часть сборника посвящена
задачам «а расчет ионных равновесий, возникающих в
растворе при проведении химико-аналитических реакций.
За исключением специальной главы расчеты выполнялись
в предположении, что закон действия масс применим в
его классической фор!ме, т. е. в терминах концентраций.
Вопрос об учете коэффициентов активности кратко рас-
рассматривается в гл. VI. Это не означает, что эффект ион-
ионной силы не следует изучать до проработки материала
первых пяти глав.
Глава I
РАВНОВЕСИЯ В ВОДНЫХ РАСТВОРАХ КИСЛОТ
И ОСНОВАНИЙ
Вопросы для самопроверки
1. Какие соединения являются в водном растворе кис-
кислотами, а какие основаниями с точки зрения протолити-
ческой теории Бренстеда— Лаури:
НСЮ4, NH3, СОз~, НСОз~, Н2СО3, S2-, NH|, CH3COO-?
2. Каково значение рН дистиллированной свежелере-
гнанной воды при 25°С? Как изменяется рН воды при
повышении температуры?
3. Чему равно ионное произведение воды (Kw) при
25° С? Как изменится Kw, если растворить в воде
1 моль/л NaNO3?
4. В каком 'водном растворе степень диссоциации наи-
наибольшая:
а) 0,Ш СН3СООН, 0,Ш НСООН, 0,1М HCN;
б) O,1MNH3, 0.01M NH3?
5. Как зависит степень диссоциации слабого электро-
электролита от константы диссоциации и концентрации его в
водном растворе? Вывести соответствующую формулу.
6. Как влияет добавление одноименных ионов и по-
постороннего электролита на степень диссоциации слабого
электролита?
7. Какие растворы называют буферными? Привести
примеры.
8. Что такое буферная емкость? Чем она характери-
характеризуется?
9. Вывести формулу для расчета рН: а) ацетатного
буферного раствора; б) аммонийного буферного рас-
раствора.
10. Какие реагенты следует добавить к раствору,
рН которого 0, чтобы создать слабокислую среду: 1МНз,
NaOH, CH3COONa, HC1, СН3СООН, NH4C1? .
11. Какие реагенты из указанных в задаче 10 следует
добавить к раствору, рН которого 12, чтобы создать сла-
слабокислую -среду?
12. Какой буферный раствор следует использовать,
чтобы поддерживать постоянную величину рН: а) 8—10;
б) 4—6; в) 3—5?
Решение типовых задач
При решении задач рекомендуется соблюдать следую-
следующую последовательность:
1. Написать уравнение химической реакции (равнове-
(равновесия) в ионной форме.
2. Записать выражение константы равновесия и найти
ее численное значение (например, по справочнику
Ю. Ю.Лурье).
3. Обозначить равновесные концентрации реагирую-
реагирующих веществ, причем через х рекомендуется обозначить
наименьшую равновесную концентрацию, и записать их
под химическими формулами веществ в уравнении реак-
реакции.
4. Подставить равновесные концентрации в выраже-
выражение для константы равновесия и произвести возможные
упрощения.
5. Выполнить расчет.
Пример 1. Вычислить концентрацию продуктов ступенчатой
диссоциации в 0,1 М Н3РО4. Рассчитать степень диссоциации НзРО*
в этом растворе.
Решение. Ступенчатая диссоциация фосфорной кислоты
(I ступень) Н3РО4 ^t H+ + Н2РО7
0,1—х х х
(II ступень) HjPO^ ^± H++
(III ступень) НРС>4~ ^t H+ +
характеризуется следующими константами диссоциации:
[Н3РО4]
[НРО2Г]
Значения Ki и Кг различаются примерно в 10s раз, поэтому
концентрацию ионов водорода можно вычислить с учетом диссоциа-
диссоциации НзРО4 только по первой ступени. Такое допущение не вызы-
вызывает существенных погрешностей, если К\ многоосновной кислоты
превышает Кг примерно в 1000 и более раз. Равновесные концентра-
концентрации указаны под уравнением диссоциации фосфорной кислоты по
I ступени. Подставим равновесные концентрации в выражение Ki.
=7,6-10-3,
*i n f
0,1 — х
или
дг2+ 7,6-10-Зх—7,6-10-4 = 0.
Решая квадратное уравнение, получаем
/^
7,6-Ю-з _. / G,6-10-3J
' + 1/ — ~+7,6-10-3.10-1 =
+ 1/
= 2,4-10-2 г-ион/л.
Если кислота очень слабая, то [Н+] < СНА и СНА—[Н+] ~СНД.
Равновесную концентрацию ионов Н+ в таких растворах следует
вычислять по формуле
НА-
Такое допущение вполне оправдано для кислот с р/(>4 (при
условии, что СНА >А"на)- Концентрация иона Н^РО^ практически
определяется диссоциацией НзРСХ по I ступени. Следовательно,
[Н2РО^] =[Н+]= 2,40-10-2 г-ион/л.
Значения Кг и Кз различаются в 105 раз, поэтому находим кон-
концентрацию иона НРО4~, учитывая диссоциацию кислоты только по
II ступени:
[НРО;Н =АГ2 ' *, =Ki = 6,2-10-8 г-ион/л.
Концентрация аннона, образующегося в результате диссоциации
слабой кислоты Н2А по II ступени, численно равна Кг, т. е.
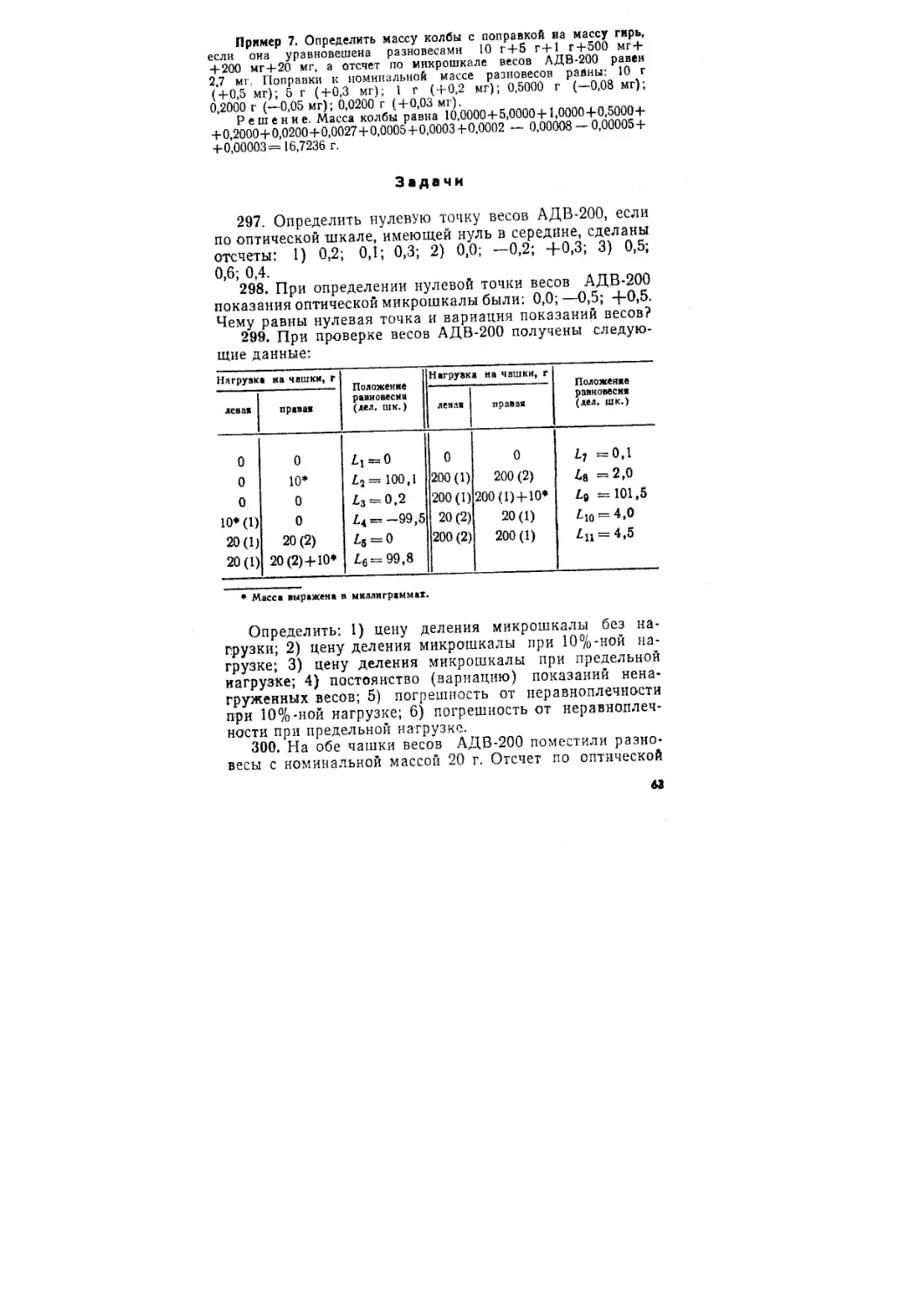
[А2-] = К^'Л-
Это положение является общим для большинства многоосновных
кислот: H2S, Н2СО3, Н2С2О4, Н3РО4 и др.
Зная равновесные концентрации ионов Н+ и НРО4~, вычис-
вычисляем концентрацию иона РО4~:
г ч 1 ГНРО|~] 4,2-10-13.6,2-10-8
[РОМ = Кг, L -1- = —¦ 1 =1,1- Ю-18 г-пон/л.
L 4 j ^ [н+] 2,4-10-2
По равновесным концентрациям продуктов диссоциации Н3РО4
находим степень диссоциации (а) НзРО/, по псем трем ступеням:
[НгРО^] 2,4-10-2
а, = l—z L = = 0,24, или 24?;;
ЬН3РО4 и''
[НРОН 6 2-10-8
4M J= 2,58-10-6, или 2,58-10-1%;
= 4M
[HjPO^] 2,4-10-2
[POM 1,1-10-is
В растворах, где [Н+] " СНА, величина а может быть опреде-
определена по уравнению
Отсюда
Пример 2 Сколько граммов твердого формиатя натрия HCOONa
надо добавить к 100 мл 0.2 М HCI. чтобы получить буферный рас-
раствор с рН 4,3.
Решение. При добавлении достаточного количества формиата
натрия соляная кислота практически полностью замещается муравьи-
муравьиной, так чтоСнсоон = СНС| =0,2 моль/л. Диссоциация муравьиной
кислоты
нсоон :? н+ + нсоо-
0,2-5-10-5 5-10-5 5.10-5 +
характеризуется константой диссоциации НСООН:
[Н+ПНСОО-]
181
Кнсоон=
[НШ0Н]
Равновесная концентрация ионов Н+ в растворе с рН 4,3 равна
5 • 10—s г-ион/л.
При действии одноименного формиат-иона диссоциация муравьи-
муравьиной кислоты резко уменьшится. Следовательно,
[НСООН] = 0,2—5- 10-5~0,2 моль/л и [НСОО-] = 5 • 10-' +
"г L HCOONa — иHCOONa-
Подставляем равновесные концентрации в выражение /(нсоон:
1,8-10-4= 5-10~2
отсюда
CHCOONa = 02 МОЛЬ/Л.
Общая концентрация добавленного формиата натрия, т. е. израс-
израсходованного на реакцию с соляной кислотой и вошедшего в состав
буферной смеси, составляет
0,2 + 0,72 = 0,92 моль/л.
Масса добавленного HCOONa равна
-L— .100-68,0 = 6,2 г/100 мл,
где 68,0 — молекулярный вес HCOONa.
Задачи
1. Вычислить и сравнить рН растворов: 1) 0,1 М НС1
и 0,1 М СНзСООН; 2) 5%-ного раствора НС1 и 5%-ного
раствора СН3СООН; 3) растворов, содержащих 7 г/л
НС1 и 7 г/л СНзСООН соответственно.
2. Вычислить концентрацию ионов НСОО~, Н+ и
рН в: 1) 0,03 М НСООН; 2) 5%-ном растворе НСООН;
3) в растворе, содержащем 4,6 г/л НСООН.
Ю
3. Вычислить концентрацию ионов ОН~, Н+ и рН в:
1) 0,01 М NH2OH; 2) 0,1%-ном растворе NH2OH.
4. Указать примерное значение рН, если в присутствии
фенолфталеина раствор бесцветен, а при добавлении ро-
золовой кислоты становится красным.
5. Указать примерное значение рН, если при введе-
введении бромкрезолового пурпурного раствор становится
желтым, а добавление конго красного приводит к окра-
окрашиванию раствора в красный цвет.
6. Указать примерное значение рН, если при введении
n-нитрофенола раствор бесцветен, а при добавлении
бромкрезолового синего окрашивается в синий цвет.
7. Вычислить концентрацию ионов Н+ и рН в 0,01 М
H2Se.
8. Вычислить концентрацию ионов. Н+, НБОГ и SC>4~
в 0,2М H2SO4.
9. Вычислить концентрацию ионов водорода и сали-
цилат-ионов в 0,001 М салициловой кислоте.
10. Вычислить концентрацию ионов H+,HSO7 и SO-T
0,2 М H2SOa.
11. Вычислить концентрацию ионов Н+ и рН в
0,1МН3РО4.
12. Вычислить концентрацию ионов НРС>4~ и РО^
в 0,2М Н3РО4.
13. Вычислить концентрацию ионов Н+, H2As0r и
HAsO2rB0,lMH3AsO4.
14. Вычислить концентрацию ионов AsOil" B
0,1М H3As04.
15. При какой концентрации СН3СООН диссоцииро-
диссоциирована на 30%?
16. При какой концентрации НСООН диссоциирована
на 50%?
17. Концентрация ионов Н+ в растворе СН3СООН
10~4 г-ион/л. Вычислить молярность этой кислоты.
18. Вычислить молярность раствора НСООН, имею-
имеющего рН 3,0.
19. Вычислить молярность раствора HCN, имеющего
рН 5,0.
20. Вычислить молярность раствора триэтаноламина,
имеющего рН 10, 0.
21. При какой концентрации N2H4 в растворе диссо-
диссоциирован на 0,23%?
и
22. Концентрация ионов Н+ в 0,1 М СН3СООН
1,3- 10~3 г-ион/л. Вычислить константу и степень диссо-
диссоциации кислоты.
23. Вычислить константу диссоциации НСООН, если
рН 0,04 М раствора ее 2,57.
24. Вычислить константу диссоциации НСООН, если
в 0,46%-ном растворе она диссоциирована на 4,2%.
25. Рассчитать константу диссоциации HN3, если в
0,2М растворе она диссоциирована на 1,0%?
26. Вычислить константу диссоциации NH3, если сте-
степень диссоциации его в 0,3 М растворе составляет 0,77%.
27. Вычислить константу диссоциации диметиламина,
если в 0,2 М растворе он диссоциирован на 7,42%.
28. Концентрация ионов ОН~ в 0,5М растворе гидра-
гидразина 7 • 10~4 г-ион/л. Вычислить его константу диссоциа-
диссоциации.
29. При каком рН следует насыщать раствор серово-
сероводородом (Ch,s = 0,1 моль/л), чтобы концентрация иона
S2~ составляла: 1) 2-10~16 г-ион/л; 2) 5-10~14 г-ион/л;
3) 4-Ю-12 г-ион/л; 4) 5-10'17 г-ион/л; 5) 3-Ю"9 г-ион/л?
30. Вычислить концентрацию иона S2~ в насыщенном
растворе H2S (Ch2s =0,1 моль/л), содержащем: 1) 0,2 М
СНзСООН+0,1 М CH3COONa; 2) 0,1 М НСООН+
+ 0,2 М HCOONa; 3) 0,5 М NaHCO3 + 0,2M Na2CO3;
4) 0,1 М NH3+0,5M NH4C1; 5) 0,1М NaHoPO4+
+0,lMNa2HPO4.
31. Вычислить концентрацию ацетат-ионов и степень
диссоциации СН3СООН, если к 1 М. СН3СООН прибави-
прибавили НС1 до рН 0,8.
32. Вычислить концентрацию анионов и степень дис-
диссоциации НСООН, если к 40 мл 0,2%-ного раствора
НСООН прибавили 30 мл 2%-ного раствора НС1.
33. Вычислить концентрацию ионов аммония и сте-
степень диссоциации NH3, если к 0,1 М NH3 прибавили
NaOH до рН 12,5.
34. Вычислить степень диссоциации триэтаноламина,
если к 0,1 М раствору его прибавили NaOH до рН 11,5.
35. Вычислить степень диссоциации в растворе, полу-
полученном при смешении 70 мл 0,1%-«ого раствора N2H4,
20 мл 0,1%-ного раствора его хлористоводородной соли
и 10 мл воды.
36. Как изменится рН и степень диссоциации
СН3СООН в 0,2М растворе, если к 100 мл этого раство-
раствора прибавили 30 мл 0,3 М CH3COONa?
12
37. Как изменится рН и степень диссоциации 1%-ного
раствора НСООН, если к 230 мл этого раствора приба-
прибавить 540 мл 0,5%-ного раствора НСООК?
38. Как изменится рН и степень диссоциации 2%-но-
го раствора СН2С1СООН, если к 80 мл этого раствора
прибавить 50 мл 3%-ного раствора CH2ClCOONa?
39. Определить степень диссоциации 10~5М метило-
метилового оранжевого в растворе, содержащем: 1) 0,01 моль/л
НС1; 2) 0,1 моль/л CH3COOH-f-0,l моль/л CH3COONa.
Указать окраску каждого раствора.
40. Определить степень диссоциации 4-10-бМ бром-
фенолового синего в растворе, содержащем: 1) 0,2 моль/л
НСООН+2 моль/л HCOONa; 2) 0,001 моль/л НС1О4.
Указать цвет каждого раствора.
41. Определить степень диссоциации 10~6М метило-
метилового красного в растворе, содержащем: 1) 0,05 моль/л
НС1; 2) 0,001 моль/л HCN. Указать цвет каждого рас-
раствора.
42. Определить степень диссоциации 5- 10~6М фе-
фенолфталеина в растворе, содержащем: 1) 0,01 моль/л
NaOH; 2) 0,1 моль/л NH3. Указать окраску каждого рас-
раствора.
43. Определить степень диссоциации 10~6М тимолово-
тимолового синего в растворе, содержащем: 1) 2 моль/л NH3+
+0,2 моль/л NH4C1; 2) 0,001 моль/л NaOH. Указать цвет
каждого раствора.
44. Рассчитать рН полученного раствора, если к
100 мл 0,0375 М СН3СООН прибавили 0,102 г
CH3COONa.
45. Вычислить концентрацию ионов Н+, ОН~ и рН рас-
раствора, полученного смешением 25 мл '0,2 М СНзСООН и
15 мл 0,1 MCH3COONa.
46. Вычислить рН полученного раствора, если в 1 л
воды содержится 60,05 г СН3СООН и 82,03 г CH3COONa.
47. Вычислить концентрацию ионов Н+, ОН~ и рН
раствора, полученного смешением 15 мл 0,1 М НСООН и
12 мл 0,2 М HCOONa.
48. Вычислить рН раствора, если к 2 л воды приба-
прибавили 23 г НСООН и 21 г НСООК-
49. Вычислить рН раствора, полученного при сме-
смешении:
13
1) 50 мл 0,1 М КН2РО4 и 25 мл 0,2 М К2НРО4;
2) 30 мл 0,1 М Na2CO3 и 15 мл 0,1 М NaHCO3;
3) 70 мл 0,2 М KH2Cit * и 30 мл 0,1 М KaHCit;
4) 30 мл 0,2 М КН2РО4 и 10 мл 0,1 М. НС1;
5) 210 мл 0,lMNa2CO3 и 90 мл 0,1 М НС1;
6) 50мл0,15МК2НРО4 и45млО,ЗМНС1;
7) 30 мл 0,1 М КН2РО4 и 25 мл 0,2 М КОН;
8) 40 мл 0,2 М КН2РО4 и 10 мл 0,2 М КОН.
50. В 100 мл воды растворили 0,34 г трилона Б
(№2Н2ЭДТА-2Н2О) ** и добавили 10 мл 0,05 М HNO3.
Вычислить рН раствора.
51. В 100 мл воды растворили 0,34 г трилона Б и доба-
добавили 10 мл 0,05 М NaOH. Вычислить рН раствора.
52. Вычислить рН раствора, полученного смешением:
1) 20 мл 0,02 М трилона Б и 30 мл 0,01 М НС1; 2) 40 мл
0,02 М трилона Б и 10 мл 0,01 М NaOH.
53. Сколько миллилитров 0,2 М NaOH надо прибавить
к 40 мл 0,1 М H3Cit, чтобы получить .раствор с рН 3,0?
54. Сколько миллилитров 0,4%-ного раствора NaOH
надо прибавить к 23,0 мл 0,2 М Н3РО4, чтобы получить
раствор с рН 2,3?
55. Сколько граммов NaOH надо растворить в 100 мл
0,1 М NaHCO3, чтобы получить раствор с рН 10,0?
56. Сколько граммов NaHCO3 надо растворить в 30 мл
1%-ного раствора NaOH, чтобы получить раствор с
рН 10,0?
57. Сколько миллилитров 0,2 М НС1 надо прибавить
к 50 мл 0,1 М Na2CO3, чтобы получить раствор с
рН 10,5?
58. Сколько граммов №2СОз надо растворить в 200 мл
0,1 М НС1, чтобы получить раствор с рН 10,5?
59. Сколько грам(мов Na3PO4 надо растворить в
250 мл 0,1 М НС1, чтобы получить раствор с рН 12,0?
60. Сколько миллилитров 0,1 М НС1 надо прибавить
к 40 мл 0,1 М К3РО4, чтобы получить раствор с рН 12,0?
61. Сколько миллилитров 0,2 М НС1 надо добавить к
20 мл 0,2 М КН2РО4, чтобы получить раствор с рН 3,0?
62. Сколько граммов КН2РО4 надо растворить в
100 мл 0,1 М НС1, чтобы получить раствор с рН2,5?
63. Сколько граммов КН2РО4 надо растворить в 50 мл
0,2 М К2НРО4) чтобы получить раствор с рН 7,0?
* Cit3~ — анион лимонной кислоты.
** ЭДТА^Г" — анион этилендиаминтетрауксусной кислоты.
64. Сколько граммов КОН надо растворить в 140 мл
0,2 М КН2РО4, чтобы получить раствор с рН 7,0?
65. Сколько миллилитров 0,2 М NaOH надо прибавить
к 40 мл 0,1 М NaH2PO4, чтобы получить раствор с
рН 7,0?
66. Сколько миллилитров 0,4 М НС1 надо добавить к
250 1мл 0,2 М Na2HPO4, чтобы получить раствор с
рН 6,0?
67. Сколько миллилитров 0,1 М КОН надо добавить к
100 мл 0,2 М К2НРО4, чтобы получить раствор с рН 11,5?
68. Сколько граммов К2НРО4 надо растворить в
100 мл 0,1 М КОН, чтобы получить раствор .с рН 11,5?
69. Сколько граммов К2НРО4 надо растворить в 50 мл
0,05 М НС1, чтобы получить раствор с рН 7,0?
70. Сколько граммов КНгСН надо р-астворить в
200 мл 0,2 М КдНСН, чтобы получить раствор с рН 4,0?
71. Сколько граммов КгНСН надо растворить в 100 мл
0,1 М КНгСИ, чтобы получить раствор с рН 4,0?
72. Сколько миллилитров 0,2 М НС1 надо прибавить
к 50 мл 0,1 М КНгСН, чтобы получить раствор с рН 3,0?
73. Сколько граммов КОН надо растворить в 370 мл
0,02 М KH2Cit, чтобы получить раствор с рН 4,5?
74. Сколько миллилитров 0,1 М HNO3 надо добавить
к 30 мл 0,02 М Ыа2Н2ЭДТА, чтобы получить раствор с
рН 2,0?
75. Сколько миллилитров 0,1 М NaOH надо добавить
к 30 мл 0,02 М №2Н2ЭДТА, чтобы получить раствор с
рН 10,0?
76. Сколько граммов Ыа2Н2ЭДТА-2Н2О надо раство-
растворить в 70 мл 0,01 М HNO3, чтобы получить раствор с
рН 3,0?
77. Сколько граммов Na2H2 ЭДТА-2НгО надо раство-
растворить в 40 мл 0,01 М NaOH, чтобы получить раствор с
рН 5,5?
78. Сколько граммов Na4P2O7 надо растворить в
300 мл 0,2 М НС1, чтобы получить раствор с рН 9,0?
79. Сколько миллилитров 0,1 М НС1 надо добавить к
раствору, 100 мл которого содержат 2,66 г Na4P2O7, что-
чтобы получить раствор с рН 9,0?
80. Сколько миллилитров 0,1 М NaOH надо добавить
к 20 мл 0,1 М Н4Р2О7, чтобы получить раствор с рН 2,0?
81. Сколько миллилитров 0,1 М NaOH надо добавить
к 100 мл 0,1 М Н4Р2О7, чтобы получить раствор с рН 3,0?
15
Глава II
РАВНОВЕСИЯ В РАСТВОРАХ ГИДРОЛИЗУЮЩИХСЯ
СОЛЕЙ
Вопросы для самопроверки
1. Написать уравнения реакций гидролиза следующих
ионов:
a) NH4+, CH3COO-, COt; б) CN~, РОГ, Sn2+;
в) Sb3+, S2-, NO2~; r) Bi3+, B4O7~, Ag+.
Указать, что является кислотой и основанием с точки
зрения протолитической теории.
2. Какую среду (кислую, нейтральную или щелочную)
имеют водные растворы солей: a) KNO3, Na2CO3,
(NH4JSO4, NiCl2, Ba(NO3J; 6) CH3COONa, NaCl,
Pb(NO3J, BiCl3, (NH4JCO3; в) Na3PO4, A12(SO4K,
Hg(NO3J, CaCl2(NH4I?
3. Как влияют основные характеристики ионов (заряд,
радиус, строение электронной оболочки) на склонность к
гидролизу?
4. Что называется константой гидролиза? Зависит ли
ее величина от температуры, кислотности раствора, кон-
концентрации постороннего электролита в растворе?
5. Вывести уравнение для расчета констант гидроли-
гидролиза: a) Na2S, СоС12; б) СН3СООК, (NH4JCO3;
в) Bi(NO3K, Na3PO4; г) AgNO3, Na3AsO4; д) ZnSO4,
Na2Si03; e) CuCl2, KjSOa; ж) МпС12, NaNCfe; 3) SbCl3,
NaF; и) Cr(CH3COOK) KCN; к) SnSO4, Na3As03;
л) (NH4JS, FeCl3; м) CdSO4> KCNO.
6. Вывести уравнение для расчета рН в растворе соли,
гидролизующейся: а) по катиону; б) по аниону; в) и по
катиону, и по аниону.
7. В растворе какой соли одинаковой концентрации
среда более щелочная: a) Na2CO3 или Na2Si03; б) Na2S
или (NH4JS; в) Na3PO4 или CH3COONa; г) (NH4JCO3
или К2СОз?
8. В растворе какой соли одинаковой концентрации
среда более кислая: a) NH4C1 или NH4F; б) BiCl3 или
FeCl3; в) ZnSO4 или C11SO4; г) SnCb или SnCl4?
16
9. Что называется степенью гидролиза? Вывести урав-
уравнение, связывающее степень гидролиза с константой гид-
гидролиза и с концентрацией гидролизугощейся соли.
10. Вывести фор-мулу для расчета степени гидролиза в
растворе: a) CH3COONa; б) CH3COONa + NaOH;
в) NH4Cl;r) NHiCl HCI
Решение типовых задач
Пример 1. Вычислить рН и степень гидролиза в 0,1 М РЬ(МОзЬ-
Решение. Соль Pb(NO3J в водном растворе практически на-
нацело диссоциирована на ионы, т. е. С 2+ = 0,1 г-ион/л. Катион РЬ2+
гидролизуется ступенчато:
(I ступень) РЬ2+ + Н2О^±РЬОН+ + Н+
0,1—jr х х
(II ступень) РЮН+ -f H2O ;± Pb (OHJ + Н+
Запишем выражения ступенчатых констант гидролиза и вычис-
вычислим их численные значения:
гидр _ [РЬОН+] [Н+] _ [PbOH+]
^l ~ [Pb2+] ~ [Pb2+] [0H-]
= ppbOH + A:tt, = 7,94-106.1,0-10-i'' = 7,94-10-8,
Min_[Pb(OHJ][H+]_ [Pb(QHJ] m+ir0H,
" [PbOH+] [PbOH+][OH-] l JL
= »рь(он)Л« = 7'94'10M -0' 10"И = 7'94-1Q-n-
Величина константы гидролиза по второй ступени в 1000 раз
меньше, чем по первой ступени, поэтому гидролизом по второй сту-
ступени можно пренебречь и вести расчет с учетом только первой сту-
ступени. Подставим равновесные концентрации в выражение для к\ияр:
[РЬОН+][Н+] Х1
Л> =—\№\ ^^тгзт^7-94-10"8-
Видно, что К]ГИЯр ^ 10—4. Следовательно, величина х мала и
0,1 —дгж0,1. Тогда
х - [Н+] = /0,1-7,94.10-8 = 8,9- 10 5 г-ион/л,
рН = —Ig8,9-10-5 = 5 — lg 8,9=4,05.
Степень гидролиза иона РЬ2+ вычисляем по уравнению
Агидр = __? _; 8,9-10-5 = 8,9-10—4 или 8,9-10-2%,
17
то же самое значение йГидр получаем и по уравнению
j /1,0-10-14.7,9-106
=1/ F1 =8,9-10-1.
*гндр=
Покажем расчетом, что второй ступенью гидролиза РЬ2+ мож-
можно пренебречь. Уравнение гидролиза по первой ступени показывает,
что равновесные концентрации ионов Н+ и РЬОН+ равны между со-
собой. Из выражения для второй константы гидролиза следует:
[РЬ (ОНJ] = К™*9 = 7,94. Ю-" моль/л.
Такова же концентрация ионов водорода, связанная с гидроли-
гидролизом по второй ступени. Следовательно, пренебрежение второй сту-
ступенью гидролиза при расчете концентрации ионов Н+ заметно не
искажает результаты расчета.
Пример 2. Чему равен рН 0,1 М Na2HPO4?
Решение. Соль Na2HPO4 в водном растворе диссоциирована
практически полностью:
Na2HPO4->2Na+
по первой
Н2О z? Н2РО^ + ОН- A)
Ион НРО^~ гидролизуется по первой ступени:
и далее по второй ступени:
Н2РО^ + Н2О ^ Н3РО4 + ОН- B)
Запишем выражения констант гидролиза и найдем их численные
значения:
.гидр ["'РОГ] ЮН-] KW 1,0- 10-и
Kl = 1"Р°М ~ «Н.РО- ~*'2-10-* '
[H3PO4][OH-i Kw 1,0-Ю-'*
^ - [Н2РОГ] - K^VQt -7,6-10-3 -1'310 •
/([идр в — 105 раз превышает А"™лр, поэтому гидролизом по второй
ступени можно пренебречь.
Ион НРО4~, кроме того, диссоциирует:
^ ^t Н+ + РО^ C)
Для этого процесса
_[н+][ро-М
[ню»-] ¦
Ионы водорода, появляющиеся в результате реакции C),
[Н+] = [РО4~], связываются ионами гидроксила, которые образу-
образуются по реакции A),{ОН-]= [Н2РО^]. Поэтому равновесная
18
концентрация ионов водорода в растворе Na2HPO4 определяется
разностью
[Н+] = [РО*"] - [Н2РО4-]
или D)
[ОН-] = [Н2РО4-] - [POJ-]
Выразим концентрацию ионов ^РО^ и РО4~~через константы равно-
равновесий A) и C):
г/
Из ионного произведения воды следует, что — =[Н+],
[ОН-]
поэтому соотношение E) принимает вид
[ИРО^1 [Н]
[Н2РО4~] =- J • G)
НаРО~
Подставляем в уравнение D) концентрации РО4~ и Н^РО^ из соот-
соотношений F) и G):
['1 ['1
После преобразований получаем
где А^н ро_, равная 6,2-10"8, много меньше [HPO4"j, так как кон-
n
центрация ионов НРО4 практически равна начальной концентрации
ооли Na2HPO4, т. е. 0,1 г-ион/л. Поэтому К „„_+f
Н flPCJ L
4
як 1НРО4~1 и уравнение (8) принимает вид
19
По этой формуле рассчитываем рН в 0,1 М
рН='/2G,21+ 12,38) =9,80
Аналогично можно показать, что в растворе соли NaH2PC>4 рН вы-
вычисляется по формуле
Расчет рН в растворе любой кислой соли состава МНА производится
по формуле
состава М2НА — по формуле
2(/С А:) т. д.
Задачи
82. В 0,5 л раствора содержится 4,1 г СНзСООЫа.
Вычислить рН и степень гидролиза соли.
83. В 200 мл раствора содержится 0,65 г KCN. Опре-
Определить рН и степень гидролиза -соли.
84. К 30 мл воды прибавили 5 мл ЗМ KNO2. Вычис-
Вычислить рН раствора и степень гидролиза соли.
85. В 500 мл раствора содержится 2,52 г Na2CO3. Оп-
Определить рН раствора и степень гидролиза соли.
86. Вычислить рН и степень гидролиза в 0,05 М
Na2CO3. Чему будет равен рН, если раствор разбавить
водой в 5 раз?
87. Вычислить рН и степень гидролиза соли в 0,05 М
Na2C2O4. Чему будет равен рН, если раствор разбавить
водой в 10 раз?
88. К 100 мл 0,2 М НСООН прибавили 100 мл 0,2 М
КОН. Вычислить рН и степень гидролиза соли.
89. К 250 мл 0,4 М HCN прибавили 250 мл 0,4 М
NaOH. Вычислить рН и степень гидролиза соли.
90. Рассчитать рН раствора, полученного при слива-
сливании разных объемов 0,1 М Н2С2О4 и 0,2М NaOH. Вычис-
Вычислить степень гидролиза соли.
91. Сколько граммов CH3COONa нужно прибавить к
500 мл воды, чтобы получить раствор с рН 8,52?
92. Сколько граммов Na2S находится в 100 мл раство-
раствора, если рН 12,94? Вычислить степень гидролиза соли.
93. Сколько граммов Na2C2O4 находится в 25 мл рас-
раствора, если рН 8,28? Вычислить степень гидролиза соли.
20
94. Сколько граммов K.CN находится в 10 мл раство-
раствора, если рН 11,10?
95. Смешано 40 мл 0,3 М НСООК, и 20 мл 0,15 М КОН.
Рассчитать рН и степень гидролиза соли.
96. Вычислить рН и степень гидролиза в 0,1 М Na2CO3,
содержащем 0,1 моль/л NaOH.
97. Вычислить рН раствора, если: 1) степень гидро-
гидролиза в 0,5 М СНзСООЫа будет равна 3%; 2) в 0,1 М
Na3VO4 25%; 3) в 0,05 М KNO2 5%; 4) в 0,2 М Na2CO3
5%; 5) в 0,1 М Na3PO4 3%; 6) в 0,1 М Na3As04 2%;
7) в 1 М KCN 10%; 8) в 0,1 М Na2S 10%.
98. Вычислить вторую константу диссоциации Н2СО3,
если.у 0,1 М Na2CO3 рН 11,65.
99. Вычислить константу диссоциации НЫОг, если у
0,1 MNaNO2pH 8,15.
100. Какой цвет имеют следующие растворы: 1) 0,1 М
Ыа2СО3-)-тимоловый синий; 2) 0,1 М СНзСООЫа+фено-
ловый красный; 3) 0,2 М НСООК+бромтимоловый си-
синий; 4) 0,05 М Ыа3РО4+фенолфталеин?
101. Вычислить рН и степень гидролиза соли в 0,05 М.
NH4VO3. Чему будет равен рН, если раствор разбавить
водой в 10 раз?
102. В 250 мл раствора содержится 0,535 г NH4C1. Вы-
Вычислить рН и степень гидролиза соли.
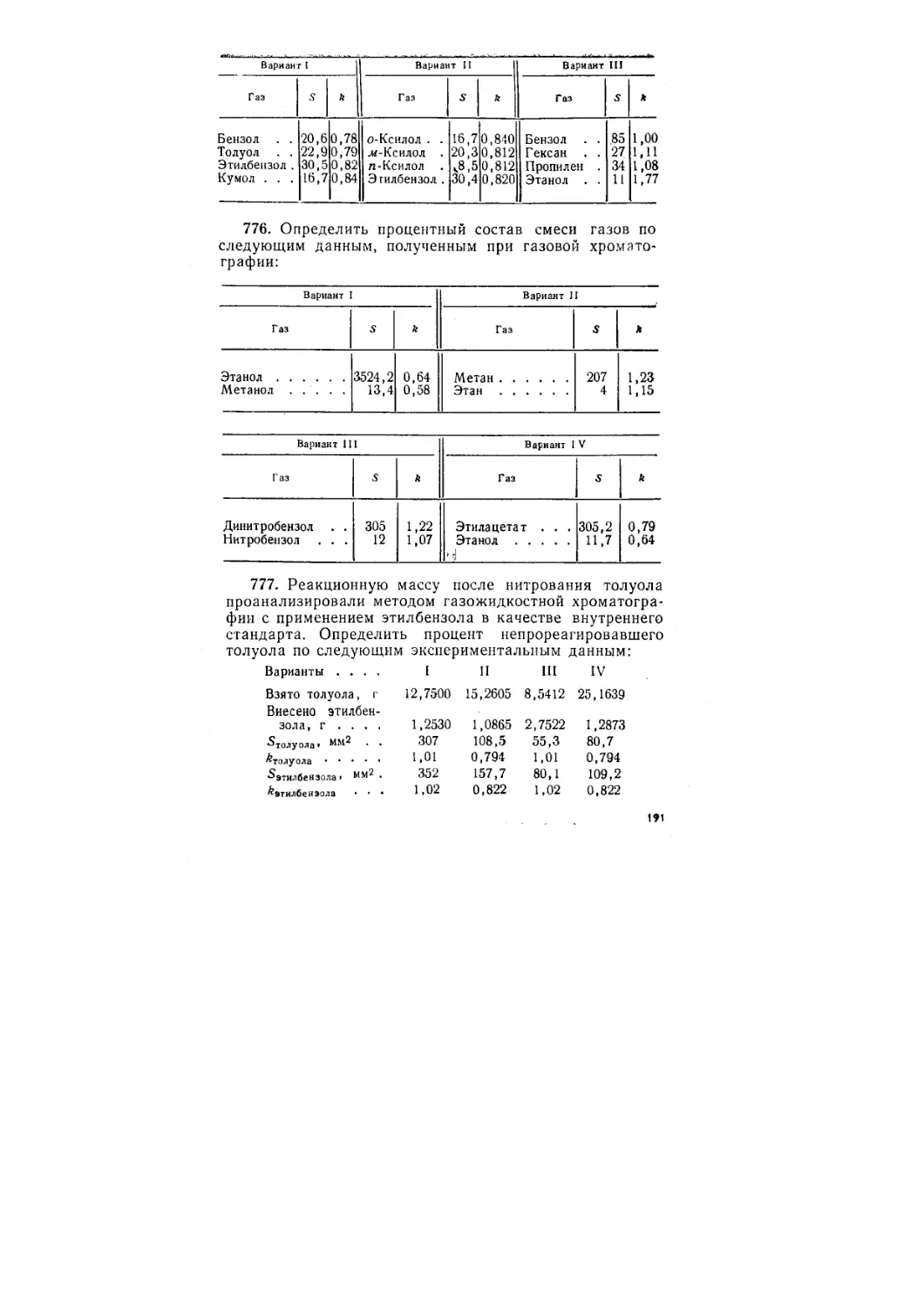
103. Вычислить рН и степень гидролиза соли в рас-
растворе, полученном при сливании 250 мл 0,02 М NH2OH
и 250 мл 0,02 М НС1.
104. Вычислить рН раствора, полученного сливанием
500 мл 0,2 М этиламина и 500 мл 0,2 М НС1. Вычислить
степень гидролиза образовавшейся соли.
105. Вычислить рН растворов и степень гидролиза
соли в: 1) 0,01 М ZnCl2;2) 0,01 М СоС12; 3) 0,01 М МпС12;
4) 0,1 М Cu(NO3J; 5) 0,05М Fe(NO3K; 6) 0.02М
Hg(NO3J; 7) О.ОЗМ Th(NO3L; 8) 0,01 М T1(NO3K;
9) 0,05М Cd(NO3J; 10) 0,02М A1(NO3K,- 11) 0.02М
Ce(NO3L; 12) 0,01 М FeCl2; 13) 0,02 М SnCl2.
106. Сколько граммов NH4C1 содержится в 1 л рас-
раствора, если рН его 5,8?
107. При какой концентрации (моль/л) NH4NO3 рас-
раствор имеет рН 5,6?
108. В 1 л раствора содержится 0,1 моля NH4C1 и
10~4 моля НС1. Определить степень гидролиза соли.
109. Вычислить рН раствора, если: 1) степень гидро-
гидролиза в 0,2 М Co(NO3J будет равна МО-4 %; 2) в 0,02 М
21
Cd(NO3J 1%; 3) в 0,05 M FeCl3 1%; 4) в 0,2 М Cu(NO3J
0,1%; 5) в 0,01 М Zn(NO3J Ы0-3%; 6) в 0,02М
Mn(NO3J 1%; 7) в 0,1 М NH4NO3 2%?
ПО. Какой цвет имеют следующие растворы: 1) 0,1 М
Hg(NO3J+метиловый оранжевый; 2) 0,1 М Pb(NO3J+
+бромкрезоловый пурпуровый; 3) 0,1 М NHiCl-f-метило-
вый красный.
111. Вычислить рН и степень гидролиза в: 1) 0,1 М
(NH4JSe03; 2) 0,01 М (NH4JS; 3) 0,02 М CH3COONH4;
4) 0,03 М (NH4KPO4; 5) 0,05 М (NH4LP2O7; 6) 0,02 М
(NH4KVO4; 7) 0,03 М (NH4KAs04; 8) 0,02 М NH4CN;
9) 0,05 М NH4C1O; 10) 0,1 М NH4F; 11) 0,02 М NH4CNO;
12) 0,05 М (NH4KNTA*.
112. Вычислить константу диссоциации HCN, если
0,2 М NH4CN имеет рН 9,23.
113. Вычислить константу диссоциации НСООН, если
0,1 М HCOONH4 имеет рН 6,50.
114. Какой цвет имеют следующие растворы: 1) 0,01 М
1МН4Р-|->бромтимоловый синий; 2) 0,2 М CH3COONH4-f-
+ тимоловый синий; 3) 01М NH^+метиловый красный?
115. Вычислить рН: 1) 0,2 М Na2HPO4; 2) 0,5 М
КНС2О4; 3) 0,1М NaHCO3; 4) 0,3 М NaHSeO3; 5) 0,05 М
NaH2As04; 6) 0,1 М NaH2PO4; 7) 0,03 M NaHS; 8) 0,3 М
Na2HAs04; 9) 0,2 М NaH2PO3; 10) 0,1 М Na2H2P2O7;
11) 0,2 М KHSO3; 12) 0,2 М №2Н2ЭДТА; 13) 0,3 М
Na3HP2O7; 14) 0,1 М Na2HNTA; 15) 0,5М NaH3P2O7;
16) 0,1 М NaHSal**.
116. Вычислить рН раствора, полученного при смеше-
смешении: 1) 50 мл 0,1 М КН2РО4 с 50 мл 0,1 М КОН; 2) 25 мл
0,1 М KaHPCU с 25 мл 0,1 М НС1; 3) 20 мл 0,15М
NaH3P2O7 с 40 мл 0.15М NaOH; 4) 20 мл 0.15М
NaH3P^O7 с 20 мл 0,15М NaOH; 5) 15 мл0,1М
Ыа2Н2ЭДТА с 15 мл 0,1 М НС1; 6) 15 мл 0,1 М
№2Н2ЭДТА с 15 мл 0,1 М NaOH; 7) 40 мл 0,2 М KaCit с
30 мл 0,2 М НС1; 8) 40 мл 0,2 М K3Cit с 40 мл 0,2 М НС1;
9) 10 мл 0,01 М фумаровой кислоты с 1,0 мл 0,1 М NaOH;
10) 35 мл 0,4 М КгН2Р2О7 с 35 мл 0,4 М НС1; 11) 35 ,мл
0,4 М К2Н2Р2О7 с 35 мл 0,4 М КОН; 12) 25 мл 0,01 М
яблочной кислоты с 2,5 мл 0,1 М NaOH; 13) 30 мл 0,02М
сульфосалициловой кислоты с 3 мл 0,2 М NaOH;
14) 15 мл 0,02 М малеиновой кислоты с 3 мл 0,1 М NaOH;
15) 20 мл 0,015 М глутаминовой кислоты с 3 мл 0,1 М
* NTA3" — анион нитрилотриуксусной кислоты.
** Sal2- — аннон салициловой кислоты.
22
NaOH; 16) 25 мл 0,02 M аскорбиновой кислоты с 5 мл
0,1 М NaOH; 17) 20 мл 0,04 М винной кислоты с 3 мл
0,2 М NaOH.
117. Какой цвет имеют следующие растворы: 1) 0,1 М
№Н2АзО4+бромфеноловый синий; 2) 0,3 М NaHCO3-+-
+бромтимоловый синий; 3) 0,2 М №Н2РО4+метиловый
оранжевый; 4) 0,2 М №НС2О4+бромфеноловый синий?
Глава III
РАВНОВЕСИЯ В РАСТВОРАХ МАЛОРАСТВОРИМЫХ
СОЕДИНЕНИЙ
Вопросы для самопроверки
1. Как влияют температура, рН, добавление одноимен-
одноименных ионов и посторонних электролитов на растворимость
малорастворимых соединений?
2. Одинакова ли растворимость MgF2 и ВаСОз, если
известно, что их произведения растворимости близки
между собой?
3. Какой осадок будет выпадать первым при постепен-
постепенном прибавлении раствора AgNO3 к раствору, содержа-
содержащему хлорид- и бромид-ионы одинаковой концентрации?
4. В какой последовательности будут выпадать осад-
осадки сульфатов, если к раствору, содержащему одинаковые
количества ионов Ва2+, Са2+ и Sr2+, постепенно добав-
добавлять H2SO4?
5. Растворимость каких соединений — BaSO4, СаСОз,
AgCl, ZnS, (MgOHJCO3— не зависит от кислотности
раствора? Почему?
6. В каком растворителе растворимость Mg(OHJ
максимальная и в каком минимальная в: а) воде; б) рас-
растворе аммиака; в) растворе аммонийной соли; г) раство-
растворе минеральной кислоты?
7. В каком растворе будет более полное осаждение
бария бихроматом в: а) 2М СН3СООН; б) 2М НС1;
в) 0,2MCH3COONa?
8. В каком растворе растворимость гидроокиси магния
больше: с рН 7 или рН 10?
9. Какой из сульфатов — PbSO4, BaSO4 или SrSO4 —
полнее превращается в карбонат при нагревании с рас-
раствором соды одной и той же концентрации?
23
10. Вывести формулы для расчета: а) концентрации
аниона в растворе слабой одноосновной кислоты при из-
известном рН; б) концентрации анионов в растворе слабой
двухосновной кислоты; в) рН раствора, насыщенного
сероводородом при атмосферном давлении.
11. Какой из сульфидов — ZnS или MnS — осаждает-
осаждается сероводородом при более низком рН?
12. Почему катионы третьей аналитической группы
осаждают групповым реагентом в присутствии аммоний-
аммонийной буферной смеси?
13. Какой из реактивов обеспечит наибольшую полно-
полноту осаждения катионов третьей аналитической группы:
a) Na2S (рН 13,9); б) (NH4JS (рН 9,3); в) смесь
(NH4JS+NH4OH+NH4C1 (рН 9,0); г) NH4HS (рН 8,1);
д) насыщенный раствор H2S (рН 4,5); е) 0,3 н. НС1-|-
+ H2S (pH0,5)?
14. Назвать продукты, образующиеся при растворении
сульфидов металлов в соляной и азотной кислотах и в
царской водке.
15. При каком рН B,0; 8,0; 7,0; 9,0) растворимость
CoS наибольшая. При каком наименьшая?
16. Почему СаСОз легко растворяется, а СаС2О4 не
растворяется в разбавленной уксусной кислоте, хотя оба
соединения имеют близкие ПР?
17. Вывести формулу для расчета константы равнове-
равновесия в реакциях взаимодействия: a) ZnS с НС1; б) B12S3
с НС1; в) СаС2О4 с НС1; г) ВаСО3 с СН3СООН; д) SrCO3
cHCl.
Решение типовых задач
Пример 1. Вычислить (без учета гидролиза) ПР фосфата сереб-
серебра, если растворимость этой соли в воде при комнатной температуре,
равна 4,68 ¦ 10~в моль/л. -Вычислить рН насыщенного раствора Ag3PO/,.
Чему равно Г1Рдг>рол с учетом гидролиза?
Решение. В насыщенном растворе Ag3PO4 существует равно-
равновесие
3-4,68-10-6 4,68-10-6
Если растворимость соли 4,68- \0~6 моль/л, то в соответствии с
записанным равновесием и без учета гидролиза
[РО^~] =4,68-10-6 г-ион/л,
[Ag+] = 3 [РО^~] =3-4,68-10-6 г-ион/л.
По этим данным вычисляем nPAgspOi:
nPAgiPOl = [Ag+]3[POj-] =C-4,68-10-6K D,68-10-6) = 1,3-10-20
24
Образующийся при растворении ион РО^ подвергается гидролизу.
РО^~ + Н2О ^t НРО^- + ОН-
х 4,68-10-6— х 4,68.10-6— х
Запишем выражение константы гидролиза:
У|д 1( - 1НР0М t°H~l _ [НР°4'] [ОН-1 [Н+] _
[ро^~] [р°3Г] 1н+1
Kw 1,0-10-н
=--- — = = 2,38-10-2.
. Гидролиз иона РО^ по первой ступени при концентрации
4,68- 10~с г-ион/л протекает практически полностью, поэтому за наи-
наименьшую равновесную концентрацию х берем равновесную концен-
концентрацию ионов РО^~>т. е.
[PO^]=^jc и [НРО^] =[ОН-] = 4,68-10--<5 —дгг-нон/л.
Подставим равновесные концентрации в выражение Ктпр- ,
D,68-10-6 —л-J
KrHW = 2,38-10-2 = -Ь >— .
Допустим, 4,68-10-6 —х«4,6810--в. Тогда
2,38-10-^-* = D,68-10-6J; je = 9,20-10—Ю г-ион/л.
Следовательно,
[ОН-] =4,68-10-6-* = 4,68-10-6-9,20- 10-ю = 4,68-10-6 г-ион/л,
рН= 14 + lg 4,68-10-6 = 8,67.
Гидролизом по катиону можно пренебречь, так как константа
гидролиза Ag+ очень мала (АГ^^ = 2-10-12). При [Ag+] =
= 3 - 4,68 - 10-° = 1,40 • 10-5 г-ион/л и [ОН-] = 4,68 • 10 г-ион/л кон-
концентрация AgOH составляет
[AgOH] = pAg0H [Ag+] [ОН-] = 2-102- 1,4-10-5-4 ,68-10-6 =
= 1,31-10-8 моль/л,
т. е. всего 0,1% от начальной концентрации ионов Ag+. Следователь-
Следовательно, поправка к рН, учитывающая гидролиз по катиону в насыщен-
насыщенном растворе Ag3POi, несущественна. nPAgjPOi, вычисленное с уче-
учетом гидролиза, составит
nPAg.POt = fAS+33 [p°4~] = C-4,68-10-6K (9,20-10-Ю) =
= 2,55-10-24.
Это значение ПРА„ ро значительно отличается от величины, найден-
найденной без учета гидролиза.
Пример 2. К раствору, содержащему 0,1 моль/л РЬ(МОз)я
и 0,01 моль/л Hg2 (N03J, постепенно добавляют раствор КС1. Какой
25
из катионов — РЬ2+ или Hg|+—начнет осаждаться первым и какой
процент его останется в растворе к началу осаждения второго?
Решение. Найдем, при каких концентрациях хлорид-ионов бу-
будут достигнуты величины ПРрьс^ и riPHg!Cli, пренебрегая изменением
концентраций Pb (NO3J и Hg2 (NO3J при введении КС1 за счет разбав-
разбавления, т. е. принимая, что [РЬ2+] = 0,1 г-ион/л, а [^&2+] =
= 0,01 г-ион/л:
ПРрьс, = [рЬ2+] (СМ2 = 1,6-10-s и nPHgiCI, =
= [Hg22+][Cl-p= 1,3-10-18,
отсюда
¦='
¦».
Расчет показывает, что для достижения nPHgjCi,требуется мень-
меньшая концентрация хлорид-ионов, следовательно, хлорид ртути (I)
будет осаждаться первым. Осаждение РЬСЬ начнется при [С1~]=
= 1,26-Ю-2 г-ион/л.
Концентрация ионов Hg2," при этой концентрации хлорид-ионов
равна
Ги 2+1 ПРне,С1, 1,3-10-18
Hgo = = =8,2-10—IS г-ион/л.
L S2 J [Cl-]2 A,26-10-2J
8,2-10-15-100
Это составляет = 8,2-10—11О/о от исходной кон-
U у U1
центрации
Пример 3. Сколько миллиграммов BaSCU можно превратить в
ВаСОз при обработке его 3 мл 2 М ЫагСОз?
Решение. Запишем уравнение реакции карбонизации
BaSO4 (к) + СОз~ z?. ВаСО3 (к) + SOf~
2 — х х
и найдем константу равновесия этой реакции:
[SO2'] [SOl~] [Ва2+]_ nPBaSO, _ l.l-lQ-io
К== [СО2-] = [СО|-] *[Ва2+]~ ПРВаСОа ~ 5,1-10-9"
= 2,16-10-2.
Подставим равновесные концентрации в выражение К:
х
2-х
отсюда
= 2,16-10-2,
х = [SOj-] = 4,23-10-2 г-ион/л.
26
Концентрация иона SO4 равна количеству сульфата бария, превра-
превратившегося в карбонат бария под действием 1 л 2 М Na2CO3. При
обработке BaSOi 3 мл того же раствора Ыа->СОз будет превращено
в ВаСОз:
4,23-10-2-233,40-3
— ¦ = 0,0296 г = 29,6 мг BaSO4,
где 233,40 — молекулярный вес BaSCU.
Пример 4. Рассчитать, при каком минимальном рН возможно
количественное разделение ионов Мп2+ и Си2+ в виде сульфидов
при насыщении раствора сероводородом (CHjS=0,l моль/л), если
концентрации их соответственно равны: С 2+ = о,ОЗ г-ион/л и
С° 2+ =0,05 г-ион/л.
Решение. При насыщении сероводородом раствора, содержа-
содержащего ионы Мп2+ и Си2+, возможны реакции образования сульфидов-.
Mn2+ + H2S^tMnS + 2H+ A)
0,03 0,1 х
Cu2+ + H2S^tCuS + 2H+ B)
Вычислим константы равновесия реакций A) и B):
[Н+]2 [Н+Р [S2-] K\,i
Kl = [Mn2+] [H2S] = [Mn2+][H2S] ' [SM = ПРМп5 =
1,3-10-20
= 1^з_ш—= 5 20.Ю-11.
2,5-10-Ю
То же для реакции B):
_ [Н+]2 К 1,2 _ 1,3- 10-20
[Cu2+] [H2S] = ПРСи5 = 6,3-10-36
Численные значения Kt и Кг показывают, что более вероятно
осаждение сульфида меди.
Вычислим, при каком минимальном рН не будет осаждения суль-
сульфида марганца. Обозначим равновесную концентрацию ионов Н+
через х, тогда [Н+] = д; г-ион/л, [Мп2+] = 0,03 г-ион/л и [H2S] =
= 0,1 моль/л.
Подставим равновесные концентрации выражения в К]'.
= 2,06-1015.
отсюда
х = [Н+] = /0,03-0,1-5,20- Ю-" =3,95-10-7 г-ион/л
и рн = — lg 3,95. 10-7 = 7—0,60 = 6,40.
Вычислим равновесную концентрацию ионов меди при этом рН,
используя Кг.
27
[нр дC.«иоя
[Cu2+][H2S] [Cu2+]-0,l
отсюда
Концентрация меди в растворе значительно меньше 10~в г-ион/л,
характеризующей количественное осаждение данного иона.
Таким образом, при рН 6,40 и ниже сульфид марганца не обра-
образуется, а ионы меди количественно осаждаются в виде CuS. Это
можно показать также сравнением произведения концентрации ионов
[Cu2+] [S2-] с величиной FlPcus. При рН 6,40 в соответствии с урав-
уравнением
1,3-10-20.0,1
1^= C,95-10-7J =8,33.10-9 „„он/л.
Тогда
[Cu2+][S2-] = 0,05-8,33-10-9 = 4,17-10-ю,
что значительно превышает величину nPcus=6,3 • 10--1в, следова-
следовательно, осадок CuS образуется.
Если концентрация ионов водорода близка величине Ki или
меньше, то концентрация сульфид-ионов вычисляется по уравнению
[S2-] =
1 J
Задачи
118. Вычислить произведение растворимости: 1) хро-
хромата серебра, если в 500 мл воды растворяется 0,011. г
Ag2CrC>4; 2) бромата серебра, если в 200 мл воды раство-
растворяется 0,35 г AgBrCV, 3) пирофосфата бария, если в
100 мл воды растворяется 8,78- \0~3 г Ва2Р2О7; 4) PbCIF,
если в 250 мл воды растворяется 3,52- 10~4 моля этой со-
соли; 5) селенита цинка, если в 200 мл воды растворяется
1,95-10~2 г ZnSeO3; 6) фторида кальция, если раствори-
растворимость CaF2 2,16- 10~4 моль/л; 7) роданида меди (I), если
в 500 мл воды растворяется 4,21 • 10 г CuSCN; 8) циа-
цианида никеля, если растворимость его 2,17 ¦ 10~6 г/л.
119. Вычислить растворимость (г/100 мл) по данным
ПР: 1) Hg2Cl2; 2) AgVO3; 3) AgSCN; 4) BaSeO4;
5) Ba3(As04J; 6) Ag3Fe(CN)f,; 7) CoHg(SCNL; 8) CsBF4;
9) K3Co(NO2N; 10) Cd2Fe(CNN; 1) UO,NH4PO4;
12) K2SiF6; 13) NaSb(OHN; 14) Rb2SiF6; 15) TI2PtCl6.
. 120. Какая соль из двух сравниваемых более раство-
растворима в воде и во сколько раз: 1) SrCCb или ВаСОз",
2) Ba2Fe(CNN или Co2Fe(CN)B; 3) Са3(РО4J или BiPO4;
4) Hg2Br2 или PbBr2; 5) ВаСгО4 или SrCrO4; 6) Zn(CNJ
или Cd(CNJ; 7) Са(Ю3J или РЬ(Ю3J; 8) СиС2О4 или
28
FeC2O4; 9) BaSO4 или CaSCy, 10) Ni2Fe(CNN или
Ni(IO3J?
121. Вычислить растворимость (моль/л): 1) AgCl в
воде; 2) AgCl в 0,01 М КС1; 3) СаС2О4 в воде; 4) СаС2О4
в 0,01 М (NH4JC2O4; 5) SrSO4 в воде; 6) SrSO4 в 0,1 М
KaSO4; 7) Hg2Cl2 в воде; 8) Hg2Cl2 в 0,1 М КС1; 9) AgIO3
в воде; 10) AgIO3 в 0,1 М AgNO3; 11) AgIO3 в 0,2 М
КЮ
^ 150 мл насыщенного раствора AgCl прибавле- (
но ЧТГмл 3%-ного раствора NaCl. Сколько грамм-ионов
серебра останется в растворе?
{12&уК 125 мл насыщенного раствора PbSO4 прибав- /
лено 5 мл 0,5% раствора H2SO4. Сколько грамм-ионов \
свинца останется в растворе?
^24^К 20 мл 0,08 М NajAsO/, прилили 30 мл 0,12 М
AgrTOV Сколько миллиграммов мышьяка останется в
pacjaope?
(^125уСколько миллилитров 0,1 М (NH4JC2O4 следует
добавить в 1 л насыщенного водного раствора СаСгСч '¦¦'
для понижения его растворимости до 0,1 мг/л?
i2J)) Какова концентрация ионов магния в растворе !*"
J, если рН 11,0?
Ш: 50 мл 0,02 М СаС12 прибавили 50 мл 0,03 М
колько CaSO4 (г/л) останется в растворе?
Выпадет ли осадок Mg(OHJ при действии на
0,2 М MgSO4 равным объемом: 1) 0,2 М NH3; 2) смеси
0,2M~NH3h2MNH4C1?
•ШЯуСмешали равные объемы 0,2 М MgSO4 н 0,2 М
NH^TK этой смеси добавили NH4C1 до концентрации
0,2 М. Произойдет ли в этом растворе осаждение
MgLQHJ?
\30\ Насыщенный раствор CaSO4 смешали с равным
объемом раствора, содержащего 0,0248 г (МН4JС2О4 в
1 л. Длоизойдет ли образование осадка СаС2О4?
VJ31^ К раствору, содержащему 50 г MgCl2, прилили
50 мл 6 М NH3. Сколько граммов NH4C1 необходимо до-
добавить к смеси, чтобы после разбавления ее водой до 1 л
ocaj&K Mg(OHJ не выпал? *
•.. (Q^p При какой концентрации ионов магния начнется
выпадение осадка Mg(OHJ из раствора, имеющего
рН8,7
"\/!лЗЗЛПри какой концентрации ионов хромата начнется
вьтйТГение осадка РЬСгО4 из 0,1 М Pb(NOsb?
29
134. При каком рН начнется выпадение осадка
Со(ОНJиз0,1МСоС12?
135. Будет ли осаждаться SrSO4 при добавлении 5 мл
насыщенного раствора CaSO4 к 20 мл раствора, содер-
содержащего 0,5 мг-ион стронция?
136. В 200 мл раствора содержится по 0,02 г-экв хло-
хлорида и оксалата натрия. К раствору добавляют AgNO3.
Какова будет концентрация хлорид-иона, когда начнет-
начнется осаждение Ag2C2O4?
137. Какое вещество начнет осаждаться первым при
постепенном приливании AgNO3 к раствору, в 1 л кото-
которого содержится 0,01 моля КО и 0,1 моля К2СЮ4?
^ 100 мл раствора содержится по 0,01 г-экв ионов
и Sr2+. Сколько молей КгСгО4 следует ввести в рас-
раствор, чтобы осадить барий, но избежать осаждения
стронция? Вычислить концентрацию бария, оставшегося в
растворе.
¦ 139. В 100 мл раствора содержится 200 мг-ионов Ва2+
и 1 мг-ион РЬ^. Какое вещество будет осаждаться пер-
первым при постепенном приливании К^СгО4. Можно ли
количественно разделить указанные катионы в этом рас-
растворе с помощью хромата калия?
140. Раствор содержит 0,02 г-ион/л Вг~ и 0,003 г-ион/л
1~. Можно ли разделить эти ионы при помощи осаждения
солью свинца?
141. В 20 мл раствора содержится 20 мг КгСгО4 и
15 мг K2SC4. К раствору прибавляют малыми порциями
Pb(NO3J- Какая соль будет осаждаться первой?
142. К раствору, в 1 л которого содержится по
0,01 г-ион/л Ва2+ и Са2+, постепенно прибавляют K2SO4.
1. Сколько грамм-ионов SO^" нужно прибавить
к 1 л раствора, чтобы начал выпадать осадок CaSO4?
2. Вычислить концентрацию кальция в растворе после
того, как 99,9% бария перейдет з осадок.
143. Какую концентрацию ионов Ю~ надо создать в
0,003М КгСгО4, чтобы при добавлении Pb(NO3J осадок
РЬ(Ю3J образовался прежде, чем РЬСгО4?
144. Избыток BaSO4 обработали 3MNa2CO3. Вычис-
Вычислить концентрацию сульфат-иона в равновесном рас-
растворе.
145. Сколько миллиграммов BaSO4 превратится в
ВаСО3 при взаимодействии его с 5 мл 1,5 М КгСО3?
30
146. Сколько миллиграммов SrSO4 превратится в
SrCO3 при взаимодействии его с 3 мл 2 М Na2CO3?
147. Сколько миллиграммов PbSO4 превратится в
РЬСО3 при взаимодействии его с 2 мл 2 М Na2CO3?
148. Вычислить концентрацию хромат- и карбонат-
ионов в равновесном растворе, полученном при обработ-
обработке хромата свинца 1,5 М Na2CO3.
149. Вычислить концентрацию фторид- и карбонат-
ионов в равновесном растворе, полученном при обработке
фторида кальция 1,5 М Na2CO3.
150. Сколько миллиграммов CaF2 превратится в
СаСО3 при обработке его 3 мл 2,5 М Na2CO3?
151. Сколько миллиграммов AgBr превратится в
Ag2CO3 при обработке AgBr 2 мл 1,5 М Na2CO3?
152. Сколько миллиграммов хромат-ионов перейдет в
раствор при обработке Ag2Cr04 2 мл 1,5 M Na2COj?
153. Сколько миллиграммов бромид-ионов может
перейти в раствор при обработке AgBr 5 мл 2 М Ыа2СОз?
154*. Какой максимальный рН нужно поддерживать в
0,1 М Zn(NO3J, чтобы предотвратить осаждение ZnS
при насыщении раствора сероводородом?
155*. При каком рН можно количественно осадить:
1) Zn2+ в виде ZnS; 2) Cd2+ в виде CdS; 3) Ni2+ в виде
NiS, насыщая раствор сероводородом.
156*. При каком минимальном рН начнет выпадать
осадок: 1) FeS из 0,1 М FeSO4; 2) CoS из 0,05 М СоС12;
3) MnS из 0,1 М МпС12 при насыщении раствора серо-
сероводородом.
157*. Произойдет ли осаждение PbS при насыщении
сероводородом раствора, содержащего 2-10~3 моль/л
Pb(NO3J, срН 1,0?
158*. Выпадет ли осадок NiS, если раствор, содержа-
содержащий 0,2 моль/л НСООН и 0,05 моль/л NiCl2, насыщать
сероводородом?
159*. Выпадет ли осадок ZnS, если раствор, содержа-
содержащий 0,02 моль/л ZnCl2 и 0,2 моль/л СН3СООН, насыщать
сероводородом?
160*. Выпадет ли осадок MnS, если раствор, содержа-
содержащий 0,5 моль/л НС1 и 0,005 моль/л МпС12, насыщать се-
сероводородом?
161*. Выпадет ли осадок FeS, если раствор, содержа-
содержащий 0,2 моль/л НСООН и 2-10~3 моль/л FeSO4, насыщать
сероводородом?
* В задачах 154—171, обозначенных звездочкой, концентрация
H2S в насыщенном растворе составляет 0,1 моль/л.
31
162*. Выпадет ли осадок PbS, если раствор, содержа-
содержащий 1 моль/л СНзСООН и 0,02 моль/л Pb(NO3J, насы-
насыщать сероводородом?
163*. Выпадет ли осадок MnS, если раствор, содержа-
содержащий 0,5 моль/л СН3СООН и 0,05 моль/л МпС12, насыщать
сероводородом?
164*. Выпадет ли осадок MnS, если раствор, содер-
содержащий 0,02 моль/л МпС12 и 0,2 моль/л NH4C1, насыщать
сероводородом?
165*. Выпадет ли осадок CoS, если раствор, содержа-
содержащий 0,03 моль/л СоС12, 0,1 моль/л СН3СООН и 0,2 моль/л
CH3COONa, насыщать сероводородом?
166*. Выпадет ли осадок NiS, если раствор, содержа-
содержащий 0,01 моль/л NiCl2, 0,2 моль/л СН3СООН и 0,1 моль/л
CH3COONa, насыщать сероводородом?
167*. Сколько миллиграммов №С12 должно содер-
содержаться в 5 мл раствора с рН 3,5, чтобы при насыщении
его сероводородом образовался NiS?
168*. Сколько миллиграммов МпС12 должно содер-
содержаться в 20 мл раствора с рН 6,0, чтобы при насыщении
его сероводородом образовался MnS?
169*. Сколько миллиграммов Cd(NO3J должно содер-
содержаться в 10 мл раствора с рН 1,5, чтобы при насыще-
насыщении его сероводородом образовался CdS?
170*. Сколько миллиграммов Zn(NO3J должно содер-
содержаться в 200 мл раствора с рН 3,5, чтобы при насыще-
насыщении его сероводородом образовался ZnS?
171*. Сколько миллиграммов Pb(NO3J должно содер-
содержаться в 100 мл раствора с рН 0,5, чтобы при насыщении
его сероводородом образовался PbS?
172. Вычислить растворимость: 1) ZnS в 1 М
СН3СООН; 2) ZnS в растворе, содержащем по
0,5. моль/л СН3СООН и CH3COONa; 3) NiS в 2М НС1;
4) Bi2S3 в растворе с рН 0,5; 5) NiS в 2 М СН3СООН;
6) CoS в растворе с рН 1,5; 7) ВаСгО4 в 2М СН3СООН;
8) SrCrO4 в 2М СНзСООН; 9) Ag2C2O4 в 2М
СН3СООН; 10) Ag2C2O4 в 1 М HNO3.
173. Вычислить растворимость РЬС2О4 в растворе с
рН: 1J,1, 2) 3,2.
174. Сколько молей CH3COONa нужно прибавить к
1 л 1 М СНзСООН, чтобы обеспечить условия для от-
32
крытия иона Ва2+ в присутствии Sr2+ посредствомСгО2~
[Ba2+] = [Sr2+] = 0,2 г-ион/л.
175. При каком минимальном рН можно количест-
количественно разделить смеси катионов при насыщении рас-
раствора сероводородом (Ch,,s=0, 1 моль/л) и какова кон-
концентрация осаждаемого иона при этом рН: 1) 0,01 М
NiCl2 и 0,02М CdCl2; 2) 0,01 М СоС12 и 0.05М BiCl3;
3) 0,02 М ZnC!2 и 0,05 М СиС12; 4) 0,05 М МпС12 и 0,03 М
СиС12; 5) 0,001 М CdCl2 и 0,02 МСиС12; 6) 0,02 М ZnCl2 и
0,03 М CdCl2; 7) 0,04 М NiCl2 и 0,02 М СиС12; 8) 0,01 М
СоС12 и 0,03 М СиС12; 9) 0,03 М МпС12 и 0,02 М CdCl2;
10) 0,05 М FeCl2 .и 0,01 М CdCl2?
176. Вычислить рН насыщенного раствора:
1) Mg(OHJ; 2) Zn(OHJ; 3) Со(ОНJ; 4) Cu(OHJ;
5) Cd(OHJ; 6) Pb(OHJ; 7) T1(OHK; 8) Pu(OHK;
9) Mo(OHL; 10) Mn(OHJ; 11) Ni(OHJ; 12) Mn(OHK.
177. Вычислить ПР с учетом гидролиза и рН насы-
насыщенного раствора: 1) AgCN*; 2) Ва3(РО4J;
3) Cd3(As04J*; 4) CoC2q; ; 5) CuCO* ; 6) NiSeO3;
7) РЬа(РО4)Г ; 8) Т12Сг0;; 9) SrSO3; 10) Ag2HVO4*;
11) ZnC2O4*; 12) Ba3(As04J* -.
178. При каком рН начнет выпадать осадок***:
1)А1(ОНK из 0,1 М А1С13; 2) Fe(OHK из 0,2 М FeCh.
179. Образуется ли осадок***: 1) А1(ОНK, если в
0,02 М А1С13 создать рН 3,2; 3) Fe(OHK, если в 0,05 М
FeCl3 создать рН 2,5?
Глава IV
РАВНОВЕСИЯ В РАСТВОРАХ КООРДИНАЦИОННЫХ
(КОМПЛЕКСНЫХ) СОЕДИНЕНИИ
Вопросы для самопроверки
1. Назвать типы координационных соединений, наибо-
наиболее часто применяемых в качественном анализе.
2. Привести примеры применения комплексных соеди-
соединений в анализе для: а) открытия ионов; б) маскировки
мешающего иона; в) растворения осадков; г) изменения
* При решении учесть равновесие НгО +Z Н++ОН".
** Решить с учетом гидролиза по аниону (I ступень) и катио-
катиону (I ступень).
*** Решить: 1) с учетом и 2) без учета образования гидроксо-
комплексов по первой ступени.
2— 4022 33
окислительно-восстановительных свойств; д) изменения
кислотно-основных свойств.
3. Написать уравнения диссоциации следующих солей
в водном растворе: a) [Си(МНзL]С12; б) K2[HgI4];
в) [Ni/NHaUSOi; г) K3[Fe(CN)d; д) К[ВП4];
е) К2[СсГ(СЫLГ
4. Что называется константой устойчивости к?ордина-
ционного соединения? Зависит ли она от температуры,
концентрации самого комплексного соединения и концен-
концентрации постороннего электролита?
5. В каком растворе концентрация ионов никеля наи-
наименьшая и в каком-—наибольшая: а) 0,1 М NiSO4;
б) 0,1 М Ni (NH3)eSO4; в) 0,1 М Ni (NH3NSO4 —при со-
содержании 1 моль/л NH3?
6. Вывести формулы для расчета констант равновесия
реакций растворения осадков в растворах: a) AgCl в
NH3; б) AgBr в Na2S2O3, в) Agl в KCN; г) AgaCrO* в
NH3; д) Ni(OHJ в NH3; e) HgS в KI; ж) Ag3PO4 в NH3;
з) Zn(OHJBNaOH.
7. Вычислить константу равновесия реакций взаимо-
взаимодействия в растворе: a) Fe(SCN)s и KF; б) K.3Cu(CN)i и
NH3; в) Cd(NH3LSO4 и НС1; г) (NH4JHg(SCNL и КС1.
8. Почему HgS не растворяется в концентрированной
соляной или азотной кислоте, но растворяется в царской
водке?
9. Можно ли растворить сульфид ртути (II) в:
a) 3HC1+HNO3; б) HC1+KI; в) НС1; г) HNO3? Напи-
Написать уравнения реакций.
10. Образуются ли осадки, если на отдельные порции
раствора, содержащего Cd(CN)^~) подействовать:
а) H2S (рН0,5); б) NaOH; в) Na2HPO4?
11. Образуются ли осадки при добавлении: а) К2Сг04;
б) KI; в) КС1; г) K2SO4 к растворам AgNO3;
Ag(NH3JNO3 и KAg(CNJ?
12. Образуется ли осадок сульфида меди при насыще-
насыщении сероводородом растворов, содержащих:
a) Cu(NH3L+;6) Cu(CN)'r; в) CuCl2,-?
13. Указать состав осадка, который образуется при
действии H2S на раствор-, содержащий: a) Cd(CN)^~ и
Cu(CNK4-, б) Cd(NH3)*+ и Cu(NH3L2+.
14. Появится ли окраска роданида железа
(III) при добавлении NH4SCN к 0,01 М растворам:
a) (NH4bFe(SO4b-12H2O; б) KsFe(CNN; в) FeCls;
г) K3FeF6; д) K3Fe(PO4J?
34
Решение типовых задач
Пример 1. Вычислить концентрацию ионов Cda+ в растворе,
I л которого содержит 0,1 моля Cd(NO«)j и 2 моля K.I.
Решение. В указанных условиях практически весь нон Cd1+
связывается в комплексный нон Cdl^~. Равнопесие образования этого
комплекса
характеризуется константой устойчивости:
8 , = —J ^-J— --= 1, Ж 10».
При значительном избытке лиганда и достаточ.чо большой вели-
величине константы устойчивости можно принять, 4To[CdI^~] = Ccd2+=
=0,1 г-ион/л, [I—\—С\——4C^j2+ =2—4 0,1 = 1,6 г-ион/л. Равновесную
концентрацию аква-нопов кадмия рассчитывают по формуле:
d 0 1
[Cd2+] = —
A<l2+) 1.26-106.A.6L
= 1,21-10-8 г-ион/л.
Введение KI в раствор Cd(NO3)a понизило концентрацию Cd2+
от 0,1 до 1,21- Ш"8 г-ион/л.
Пример 2. Вычислить растворимость H^S (моль/л) в 1 М НВг.
Решение. Исходя из уравнения реакции растворения
HgS + 2Н+ + 4Вг- ¦?: HgBr^- + H.S
1 — 2х 1 — Ах х х
найдем константу равновесия:
[gj-] [H2S] [S2-]
[H
= a:,,,
1,6-10-52.1,0.1021
= = 1,23-10-11.
1,3-10-2"
Подставим равновесные концентрации в выражение константы рав-
равновесия:
К = — =- 1,23- Ю-".
A 2*JA 4*L
Значение К достаточно мало, поэтому 1— 2хеа\ и 1 — 4х&
«1 г-ион/л. Отсюда х2= 1,23-10"" и х = 3,5Ы0-в г-ион/л.
Пример 3. Вычислить начальную концентрацию раствора NHj,
обеспечивающую максимальную полноту осаждения NKOH)» из
0,0SMNi(NO,)«-
2' 35
Решение. При добавлении аммиака к раствору нитрата никеля
образуется гидроокись Ni(OHJ и в растворе появляется 2 0,02
г-ион/л NH.J":
2NH3 + 2HjO :+ N1 (ОНJ| + 2NH+ A)
Ni(OH)j может растворяться вследствие комплексообразования:
Ni (OHJ + 4NH3 -?. Ni (NH3L+ + 2ОН- B)
Растворимость 5 осадка Ni(OHJ равна
S = [NH+]+[Nl(NH3)J+] C)
Начальная концентрация аммиака Сщ1а определяется соотно-
соотношением
2+] (°) D)
Вычислим равновесную концентрацию NH3. Для этого выразим
концентрации Ni + и Ni (NH3L+ через константы равновесий соглас-
согласно уравнениям A) и B):
„ [NHJ]' \rntY
[Ni2+][NH3p [Ni2+][NH3p [OH-p ПРК1@Н),
[Ni (NH3L+] [OH-p [Ni (NH3)^+] [OH-]2 [Nj2+
2 ~ [NH3]4 ~ [NH3]4 ' [Ni2+
= nPNl<OH),PN1(NHjJ+-
Отсюда
[NH|]2
2,0-10-15 B0,02J 1,03-10-8
A,76-10-5J [NH3]2 [NH3]2
и так как в соответствии с уравнением B) [Ni (NH3L+] = 2 [ОН-],
то
[Ni (NH3)^+] =y/-"l/4nPNI(OHbPNi(NHjJ+ [NH3]4 =
= ^1/4-2,0-10-15-2,95- 1О'ЛЩП7= 2,45- Ю-3- [NH,]4/3.
Подставим эти значения в уравнение C):
Чтобы найти минимум функции, приравняем нулю производную
S по [NHi]:
36
Решая это уравнение относительно [NHi], находим: растворн-
мость Ni(OHJ имеет минимальное значение при [NHj] =
= 1,10-10~2 моль/л. Отсюда по уравнению D) находим:
C°NHt= 1,10-10-2 + 4-2,45- 10-з. (ijo-10-2)^3 +
+ 2-0,02 '¦—'¦ =0,051 моль/л.
[ A,10-10-2J J
Пример 4. Вычислить равновесные концентрации продуктов сту-
ступенчатой диссоциации в 1М Zn(NH3L(C10iJ.
Решение. В водном растворе Zn(NH3).i(C10.tJ практически
полностью диссоциирован на ионы Zn (NH3)^+ и С1О^", причем
C2+ =CZn(NH,).(C101).=
СС1ОГ = 2CZn(NH.).(ClO1I = 2 Г-
Диссоциация комплексного нона Zn (Nr^* происходит ступен-
ступенчато.
Для расчета необходимы табличные данные о константах устой-
устойчивости аммиакатов цинка:
-'•'¦¦*
[Zn(NH3J+]
Введем обозначения:
z,,(NHj,^ Zn(NH., Zn(NH.)J
2. о т
цы, состав которой указан нижним индексом у а.
И далее:
J_ Pi [NH3] h
a D ' aZnNH2+ ~ "
J3[NH3]3
aZn(NH,K+ ?) " aZn(NH8J
где D = 1 + Pi [NH3] + h [NH3]2 + ps [NH3]3 + p4 [NH3]4.
Чтобы вычислить долю каждой частицы сц, необходимо знать
равновесную концентрацию ЫНз в данном растворе. Для ее расче-
расчета используем метод последовательных приближений. В первом при-
приближении оценим равновесную концентрацию NHs на основании сум-
суммарной константы образования:
Ах 1 — х
37
Принимая 1—xtxl г-ион/л, получаем
1
,8-10-u = 6,0-10-» г-
),0.108-4*
Следовательно,
[NH3] = 4F,0-10--3) = 2,4-10-2 моль/л „ ,0 = 262,0.
Отсюда
2+= 1/262,0 = 3,82-10-3, a f „+= 3,65/262,0 — 1,3<
eJ+
^= 76.0/262,0 = 2,90.10-».
aZn (NHlJ+ == 165,9/262,0 = 6,33-10—1.
Составим контрольный баланс по NHj:
в комплекс Хп(Ш3)\+ его вошло 3,33-10-1-1-4 = 2,532 г-ион/л
» > Zn(NH3J+ » » 2,90-10-1-1-3 = 0,870 г-ион/л
» » Zn(NH3J+ » » 5,92-10-2.1-2 = 0,118 г-ион/л
» > Zn(NH3J+ , , 1,39-10-2.Ы =0,014 г-нон/д
Всего в комплекс связано NH3 3,534 моль/л
Следовательно, несвязанного аммиака будет 4,000—3,554 =
= 0,466 моль/л. Эта равновесная концентрация NH3 существенно
отличается от той, которой мы задались в расчете B,4. 10~2 моль/л).
Дальнейшее решение задачи выполняем так, чтобы методом после-
последовательных приближений найти, при какой концентрации лиганда
заданное и найденное по расчету значения ее совпадут. Задаемся
величиной [NH3] = 0,l моль/л. При этом D = 55785 , а aZn2+ =
-= 1.7Э- 10-iS. aZr(NHiJ+ = 2,73.10-4, a^^ = 4,82- Ю-,
Концентрация NHs, связанного в комплекс, составляет
@,896• 1 ¦ 4) + @,099 ¦ 1 ¦ 3) + @,005 - 1 ¦ 2) = 3,891 моль/л, а равновесная
концентрация ЫНз, равная 4,000 — 3,891=0,109 моль/л, практически
совпадает с заданной. Пользуясь значениями af последнего прибли-
приближения, определим равновесные концентрации всех частиц в 1М
Zn(NH,L(C104J:
[NH3] = 1,09-10-1 моль/л,
[Zn2+]»aZu2+C;i](NHi)i(C1Oi)i= 1,79-10-5-1 = 1,79.10-8 г-ион/л,
[Zn (NH3)*+] - aZiiMHS+C;D(NHib(C1Ol)l - '2,73.10-4.l «
38
[Zn(NH3)S+]
= 2,73-10—> г-ион/л,
S+] -«Zn(NHi)s+Czn(N.h.)l(c,o4).= 4,82-10-«.l =
==4,52 lO-з г-нон/л,
°=0,099.1»0,099 г-ион/л,
[Zn(NH3J+j =«Zn(NHsJ+CL(NH,)l(Cio4b --=0,896.1=0,896 .-«он/л
Примечание. Если концентрация лиганда намного превышает
концентрацию центрального иона, то, очевидно, равновесная и об-
общая концентрации лиганда близки между собой, поэтому необхо-
необходимость в методе последовательных приближений отпадает. В этом
случае в формулу для р подставляют общую концентрацию лиганда.
Задачи*
180. В каком растворе больше концентрация Cd2+:
в 0,1 М Cd(NH3LCl2 или в 0,1 AVK2Cd(CNL?
181. Где больше концентрации Ag^: в растворе, со-
содержащем 1 моль/л AgNO3 и 2 моль/л K.CN, или в ра-
растворе, содержащем 0,1 моль/л AgNC>3 и 1 моль/л NHg?
182. Вычислить концентрацию иона-комплексообразо-
вателя в растворе, содержащем 0,1 г-ион/л Ag (NHj)*
и 0,5 моль/л NH3.
183. Вычислить концентрацию Hg2+ в растворе, содер-
содержащем 0,01 моль/л Hg(NO3)a н 0,08 моль/л KI.
184. Вычислить концентрацию Сс!2+ з растворе, содер-
содержащем 0,02 моль/л СсЦЫОзЬ и 1 моль/л NHg.
185. К 0,2 М NiSO4 добавили равный объем 2 М NHj.
Вычислить концентрацию Ni2+, если считать, что в ра*
створе образуются комплексные ионы Ы1(ЫН,L+.
186. В 1 л раствора содержится 0,1 моля C11SO4
и 2,4 моль ЫНз. Вычислить концентрацию свободных
иоиов Си2+, если считать, что образуются комплексные
ионы Cu(NH,f<+.
187. Вычислить концентрацию Hg2+ в растворе, содер-
содержащем 0,05 моль/л Hg(NO3J и 0,4 моль/л NaCl.
188. В 0,6 М K2Cu(CNK ввели цианид-ион так, что
концентрация последнего получилась 0,005 г-ион/л.
Определить концентрацию Си+ в растворе.
• При решении задач 180—240 достаточно учитывать существо-
существование только одного, доминирующего соединения. В задачах 241—
248 следует учитывать ступенчатые равнозесия комплексообразо-
¦ания.
39
189. К 1 мл раствора, содержащего 5 мг Cd2+, доба-
добавили 1 мл 1 М KCN. Вычислить равновесные концентра-
концентрации ионов Cd2+, CN^ и Cd(GNJ4~ в растворе.
190. К раствору, содержащему 25,96 г/л СоС12, доба-
добавили равный объем раствора аммиака с концентрацией
2,8 моль/л. Вычислить концентрацию свободных ионов
Со2+, если считать, что в растворе образуются комплекс-
комплексные ионы Co(NH3L+.
191. В 10 мл воды растворили 0,3684 г K4Fe(CNN.
Чему равна концентрация Fe2+ в растворе?
192. Навеску 5,315 мг AgCl обработали 1 мл 6 М NH3,
в результате чего осадок растворился полностью. Вычис-
Вычислить равновесные концентрации Ag+, NH3 и Ag(NHsJ".
193. Сколько молей аммиака необходимо ввести в 1 л
0,5 М AgNO3, чтобы снизить концентрацию Ag+ до
10~5 г-ион/л, если в растворе образуются комплексные
попы Ag (NH3J~?
194. Сколько молей NH4SCN необходимо ввести
в 1 л 5-10~5 М Н?AХЮзJ, чтобы снизить концентрацию
Hg2+ до Ю-11 г-ион/л за счет образования комплексных
ионов Hg(SCN)J"?
195. Сколько граммов NaOH необходимо для образо-
образования Zn(OHL~ из 50 мл 0,8 М ZnCl2, если концентра-
концентрация Zn2+ в конечном растворе не должна превышать
Ю-13 г-ион/л?
196. Сколько миллилитров 1 М K.I нужно прибавить
к 10 мл 0,1 М Hg(NO3J, чтобы получить в растворе ком-
комплексную соль K2HgI4, а концентрация Hg2+ в нем
не превышала 10~26 г-ион/л?
197. Определить равновесные концентрации ионов
NOf, CN~~, Ag+ и Ag (СЫ)Г в растворе, полученном
при добавлении 0,4 моля KCN к 1 л раствора, содержа-
содержащего 0,1 г-ион/л Ag(NO2)T.
198. Сколько граммов твердого KI надо внести в 5 мл
раствора, содержащего 0,1 г-ион/л CdClit" и 0,6 моль/л
NaCl, чтобы превратить 99,9% ионов CdCU" в CdU?
199. Вычислить концентрацию ионов HgCU~, Hg2+,
Hgl4~, I~ и С1~ в растворе, полученном при добавлении
0,830 г KI к 10 мл раствора, содержащего 0,1 г-ион/л
HgCl2r и 0,6 моль/л КС1.
200. К раствору, содержащему 0,1 моль/л Fe(SCN)$
и 2 моль/л K.SCN, добавили 20%-ный раствор K.F. Общий
40
объем смеси 1 л. Сколько миллилитров раствора KF при-
прилили, если 99,99% Fe(SCNK превратилось в FeFr?
Чему равна равновесная концентрация F~?
201. Вычислить растворимость AgCl в 1 л 0,1 М NH3.
202. Сколько граммов AgCl растворится в 1 мл
25%-ного раствора NH3?
203. Сколько миллиграммов AgBr растворится
в 100 мл 1 М NH3?
204. Сколько миллилитров 25%-ного NH3 нужно для
растворения 0,1 г AgCl?
205. Растворится ли 0,1 г AgBr в 100 мл 1 М NH3?
206. Растворится ли 0,05 г Agl в 200 мл 1 М NH3?
207. Вычислить растворимость Cu2S в 1 л 3 М KCN,
если при растворении образуются только комплексные
ионы Си (СЫ)з~-
208. Сколько миллилитров 1 М NH3 необходимо для
растворения 0,1 г Ag2Cr04?
209. Вычислить растворимость 7п(ОНJ в 1 л 1 М
NH3, если в растворе образуются только комплексные
ионы Zn(NH3)=+.
210. Вычислить растворимость №(ОНJ в 1 л 0,05 М
ЫНз, если в растворе образуются только комплексные
ионы Ni(NH3J4+.
211. Вычислить растворимость А1(ОНK в 1 М NaOH.
212. Вычислить растворимость А1(ОНK в 1 М NH3.
213. Вычислить растворимость Ag3Fe(CNN в 1 л
0,2 М NH3.
214. Для получения комплексной соли K3AgI4 сме-
смешали равные объемы 0,2 М растворов AgNO3 и K.I.
Сколько молей KI нужно добавить к 1 л этой смеси,
чтобы осадок Agl растворился? Чему равна равновесная
концентрация 1~ в растворе?
215. Какова начальная концентрация раствора KCN,
в 2 мл которого растворили 18,8 мг AgBr и при этом
образовался комплексный ион Ag(CNJ~?
216. Вычислить начальную концентрацию Na2S2O3,
необходимую для полного растворения в 1 л его 0,4 мо-
молей Ag2C2O4, если считать, что в растворе образуются
только ионы Ag (S2OSJ~-
217. Сколько граммов АпВг растворится в 20 мл
0,1 М (NH4JCO3?
218. Вычислить растворимость AgCl и Agl (г/л) в 1 М
(NH*JCO3. Будет ли достигнуто разделение этих гало-
41
генидов, если смесь 0,05 г AgCl и 0,05 г Agl обработать
10 мл 1 М (NH4JCO3?
219. Выпадет ли осадок AgCl, если в 1 л воды раство-
растворили 0,1 моля AgNO3, 0,1 моля NaCl и 0,7 молей NH3?
220. В раствор, содержащий 0,1 моль/л СоС12 н
1,4 моль/л NH3, пропустили сероводород до начальной
концентрации иона S2~, равной lO3 г-ион/л. Выпадет ли
в осадок CoS?
221. Раствор содержит 0,1 г-ион/л Cd (CNL~,
0,1 г-ион/л Си (CNL~ и 0,05 моль/л KCN. При пропуска-
пропускании сероводорода создана концентрация сульфид-иона, '
равная 10"~1Э г-ион/л. Будет ли происходить осаждение
Cu2S и CdS?
222. Образуется ли осадок РЫ2, если к 1 л 0,1 М
Pb(NO8J прибавить 1 мл раствора, содержащего
1,0 моль/л KI и 1,0 моль/л Cd(NO3J?
223. Образуется ли осадок AgsPOt, если в 1 л ра-
раствора, содержащего 0,1 г-ион Ag(NH3)a" и 1 моль NHs,
растворили 1 г ЫазРО^?
224. К 1 л раствора, содержащего 0,1 моль Н§(ЫОз)г
и 0,1 моль KI, прибавили 1 г Pb(NO3J- Образуется ли
осадок РЬЬ?
225. Образуется ли осадок Fe(OHK, если к I л ра-
раствора, содержащего 0,1 моль NrfNOsb и 0,1 моль NH3,
добавить 0,1 моля Ре(Ж)з)з?
226. К 1 л раствора, содержащего 0,1 моль AgNO3
и 1,2 моль NH3) добавляют по каплям раствор КВг. При
какой концентрации бромид-иона начнется образование
осадка AgBr?
227. Смешали 5 мл 0,1 М AgNOj и 5 мл 25%-ного
раствора NHs. Сколько миллилитров 0,1 М КВг следует
прибавить к полученному раствору, чтобы началось вы-
выделение осадка AgBr?
228. Вычислить начальную концентрацию раствора
NH3, обеспечивающую максимальную полноту осажде-
осаждения Cd(OHJ из 0,1 М Cd(NO3J.
229. Вычислить начальную концентрацию раствора
NaOH, обеспечивающую максимальную полноту осажде-
¦няя РЬ(ОНJ из 0,05 М Pb(NO3J.
230. Вычислить начальную концентрацию раствора
KGI, обеспечивающую максимальную полноту осажде-
иияРЬС12из0,1 MPb(NO3J.
42
231. Вычислить начальную концентрацию раствора
К1, обеспечивающую максимальную полноту осаждения
Agl из 0,05 М AgNO3.
232. Вычислить начальную концентрацию раствора
KI, обеспечивающую максимальную полноту осаждения
Bil3 из 0,1 М Bi(NO3K.
233. Вычислить начальную концентрацию раствора
Na2C2O4, обеспечивающую максимальную полноту осаж-
осаждения MgCjO* из 0,2 М MgCl2.
234. Вычислить начальную концентрацию НС1, обес-
обеспечивающую максимальную полноту осаждения AgCl
из 0,1 М AgNO3.
235. Вычислить начальную концентрацию NH3, обес-
обеспечивающую максимальную полноту осаждения Си (ОН) 2
из 0,2МСи(Ш3J.
236. Вычислить начальную концентрацию KCN, обес-
обеспечивающую максимальную полноту осаждения Ni(CNJ
из0,05МЩШ3J.
237. Вычислить начальную концентрацию NaOH,
обеспечивающую максимальную полноту осаждения
Zn(OHJ из 0,2 М Zn(NO3J.
238. Вычислить начальную концентрацию ЫагСгО.),
обеспечивающую максимальную полноту осаждения
МпС2О4 из 0,1 М МпС12.
239. Вычислить начальную концентрацию KCN, обес-
обеспечивающую максимальную полноту осаждения AgCN
из 0,05 М AgNO8.
240. Вычислить начальную концентрацию NHs, обес-
обеспечивающую максимальную полноту осаждения А1(ОН)з
из 0,2 М A1(NO8K.
241. Навеску 2,7150 г HgCl2 растворяли в 100 мл
0,2 М НС1. Вычислить равневесные концентрации Hg2+,
HgCl+, HgCl2, HgCir, HgGl5~ и Cl- в растворе.
242. В 1 л воды растворили 45,4 г Hgl2 и 33,2 г KI.
Вычислить равновесные концентрации Hg2+, Hgl+, Hgb,
Hglr, HgI4~ и 1~ в растворе.
243. Вычислить равновесные концентрации Cd2+,
Cdl+, Cdl2, Cdir> СёЦ" и I~ в растворе, полученном
при растворении 0,3662 г Cdb в 10 мл 1 М KI.
244. Вычислить равновесные концентрации Ag+,
AgNOa, Ag(NOaO и N07 в растворе, содержащем
0,02 моль/л K«Ag(NO2)j и 0,1 моль/л KNO2.
43
245. Вычислить равновесные концентрации Ag+,
Ag (NH3J" и NH3 в растворе, содержащем
0,05 моль/л Ag(NH3JC104.
246. Вычислить равновесные концентрации Mg2+,
МдСгО4, Mg (С2О4J~ и С2С>4~~ в растворе, содержащем
0,05 моль/л Mg(NO3J и 0,2 моль/л Na2C2O4.
247. Навеску 0,5793 г Ag2O растворили в 50 мл 0,4 М
Na2S2O3. Вычислить равновесные концентрации Ag+,
AgS2O3~, Ag(S2O3J~ Ar(SO)~ и SO-
248 В
C) B3) ,
248. В 10 мл 2 M НС1 растворили 0,1267 г FeCl2. Вы-
Вычислить равновесные концентрации Fe2+, FeCl+, FeCl2
иС1".
Глава V
РАВНОВЕСИЯ ПРИ ПРОТЕКАНИИ
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ ПРОЦЕССОВ
Вопросы для самопроверки
1. Привести примеры использования реакций окисле-
окисления— восстановления в качественном анализе для:
а) растворения твердых соединений; б) разделения и
маскировки ионов; в) открытия ионов.
2. Что принято в качестве условного нуля отсчета
шкалы потенциалов? Как устроен водородный электрод?
3. Что называется стандартным окислительно-восста-
окислительно-восстановительным потенциалом?
4. Написать уравнение Нернста. Пояснить физический
смысл величин, входящих в это уравнение.
5. Как влияют на окислительно-восстановительный
потенциал температура, кислотность, соотношение кон-
концентраций окисленной и восстановленной форм?
6. Что называется стандартным электродным потен-
потенциалом? Рядом напряжений? Какие выводы можно сде-
сделать на основании этого ряда?
7. Пользуясь таблицей окислительно-восстановитель-
окислительно-восстановительных потенциалов, предложить реагенты для окисления:
а) I- до 12; б) Вг- до Вг2; в) NO2~ до N07; г) S3~ до SO^I
д) Fe2+ до Fe3+; e) S2O3~ до S4O^; ж) AsO3~ до AsC>4~:
з) SnCl4~ до SnClS"; и) SO23~ до SO4~; к) Мп*+ до
44
MnO(OH),; л) Мп«+ до МпОГ; м) Сг8+ до СгОГ; н) SbClJ"
до SbCir.
8. Можно ли двуокисью свинца в кислой среде окис-
окислить:
а) I- до 12; б) Мп«+ до МпОГ; в) С1~ до С1г; г) N07
до N07?
9. Можно ли действием перманганата калия в щелоч-
щелочной среде окислить:
a) S3- до S; б) 12 до 103~"; в) Вг- до ВгО~; г) Со2+ до
Со(ОНK?
10. Можно ли действием нитрита натрия в кислой
среде восстановить:
а) МпОГ ДО Мп2+; б) Zn2+ до Zn; в) С10Г ДО С1~;
г) Сг2О2~ до Сг3+?
11. Можно ли действием бихромата калия в кислой
среде окислить:
a) Fe2+ до Fe3+; б) БО2Г до S2O28""; в) Мп2+ до МпОГ;
г) SOl" до SO24~?
12. Назвать соединения, наиболее часто используемые
в аналитической практике в качестве окислителей; в ка-
качестве восстановителей.
13. В каких реакциях соединения: a) KNO2; б) Н2О2;
в) МпОг являются окислителями и в каких восстанови-
восстановителями?
14. Как влияет кислотность раствора на окислитель-
окислительно-восстановительный потенциал систем:
а) Сг2О2Г, Сг3+; б) МпОГ/Мп2+; в) SO2~/H2S; г)
д) NO2~7NO; e)
15. Почему реакцию окисления Сг3+ перекисью водо-
водорода выполняют в щелочной среде, а не в кислой?
16. Почему ртуть не растворяется в H2SO4, но раство-
растворяется в HI с выделением водорода?
17. Вывести уравнение для расчета константы равно-
равновесия окислительно-восстановительной реакции.
45
18. От каких факторов (температура, концентрация,
кислотность, ионная сила) и как зависит константа рав-
равновесия окислительно-восстановительной реакции?
19. Как можно изменить направление окислительно-
восстановительных реакций:
а) 2l |
б) 21- + 4Н+ + SO* ~- 2Н2О +Ц + SOaf
в) Br-+BrO- + 2H+-.Bra + HaO
г) 2Mn2+ + 5Br0- + 60H-— :ШпО4-+5Вг-+ЗНаО
Решение типовых задач
Пример 1. Вычислить потенциал водородного электрода в 0,5 М
растворе ацетата натрия.
Решение. Окислительно-восстановительный потенциал водо-
водородного электрода в заданных условиях вычисляется по уравнению
?Н,/2Н+ = ?Н./2Н+ + ^Г 'S [H + F = ?Н,/2Н+ + °'
Концентрация ионов водорода в растворе определяется гидроли-
гидролизом ацетат-иона:
СН3СОО- + Н2О ^t CHsCOOH + ОН-
Концентрацию гидроксил-ионов вычисляем по формуле
[он ] = К/(г„дрСс у к^ сс= у 1>74.io~s
= 1,7-10-5.
Из ионного произведения воды получаем
К 1 10~ 4
? ^59101
Подставляем найденную концентрацию ионов водорода в урав-
уравнение окислительно-восстановительного потенциала:
?н,/2Н+ = ° + °-059 '2 E,9-Ю-Ю) = -0,545В,
где 4,/2Н+=0В.
Пример 2. Вычислить э. д. с. гальванического элемента:
№|№(ЖKJ0,2моль/л, NH3 2моль/л || Hg2 С12 (к), КС1 0,1моль/л|Нг
Р ешение. В гальваническом элементе на электродах протека-
протекают следующие реакции:
-2e=tNl, ??..,+ ,.,. =-0,23В
Hg22+ + It 5t 2Hg, ?°Hg2+/2He - +0
Окислительно-восстановительный потенциалы этих электродов
вычисляем по следующим уравнениям:
л 0,059
O| + -у" lg [N13+],
Е -Е° , 0,059
Для расчета необходимо знать равновесные концентрации ионов
Nia+ и Hgj". Равновесная концентрация ионов никеля определяет-
определяется процессом комплексообразования, протекающим в избытке NHj.
Примем, что в растворе доминирует Ni(NH3)t~^~ и рассчитаем концент-
трацию ионов никеля:
[№а+]
Кн.-<У 2,95.107B-4-0.2L
= 3,27-10-9 г-ион/л,
следовательно,
?Nla+/N1 =-0.23+ ^lg3,27-10-» =-0,48 а
Равновесная концентрация ионов ртути (I) определяется как рас-
растворимость Hg2Cb в 0,1 М КС1:
Отсюда
Э. д. с. гальваническою элемента составляет
Пример 3. Вычислить равновесные концентрации ионов Nil+,
Н+, S2~ и NO^~ в растворе, полученном при растворении 0,325 г
a-NiS в 10 мл 2 М HNOS.
Решение. Растворение сульфида никеля в азотной кислоте
3N1S + 2NO- + 8Н+ = 3N13+ + 3S + 2NO + 4Н2О
целесообразно рассматривать как сумму двух процессов:
H2S A)
47
3H2S + 2N0J" + 2H+ ^t 3S + 2N0 + 4H2O B)
2 NOf + 4H+ + 3e ^t NO + 2H2O, ?° _ =
Для расчета /f2 воспользуемся формулой
(fij— ?^N @,96—0,14N
0,059
Отсюда
Концентрация ионов никеля в конечном растворе определяется
количеством взятого для растворения NiS:
где 90,77 — молекулярный вес NiS.
На растворение NiS расходуется часть взятой азотной кислоты,
причем ионов водорода расходуется в 4 раза больше, чем ионов
NOJ", а именно:
С„+ =-jj-[Nia+]= 8°:358 =0,96 г-ион/л
израсх 6 6
2 2-0,358
и С = — [N12+] = 1 =0,24 г-ион/л.
NO3 израсх 3 3
Следовательно, в конечном растворе концентрации ионов Н+ и
,~СН+ =2-0,96 = 1,04 г-ион/л,
NO3 составляют
израсх
[NOГ] = C°HNOa - CNQ_ = 2 - 0,24 = 1,76 г-ион/л.
3 израсх
Равновесная концентрация H2S в растворе рассчитывается
по Кг'
Ю-83
lH2S]= V К2 [NO3-]2[H+]2 \ 2,5A,76L1.04J
= I .06-10—28.
Концентрация сульфид-ионов в растворе H2S равна
1,3-10-20.1,06-10-28
Задачи
249. Вычислить окислительно-восстановительный по-
потенциал в растворе, содержащем: 1) МпОГ =1 г-ион/л,
Мп2+= 1 г-ион/л, Н+= Ю-1 г-ион/л: 2) МпОГ = 1 г-ион/л,
Мп2+=1 г-ион/л, рН 3,0; 3) МпОГ = 1 г-ион/л, Мп2+ =
= 1 г-ион/л, рН 5,0; 4) МпО- =0,027 г-ион/л, Мп2+ =
= 0,013 г-ион/л, рН 6,59; 5) 0,2 моль/л КМпО4, 0,4 моль/л
MnSO4, 0,5 моль/л HNO3; 6) 0,1 моль/л КМпО4,
0,2 моль/л MnSO4, 0,5 моль/л H2SO4; 7) 15,8 г/л КМпО4,
0,1 моль/л MnSO4, рН 2,7.
250. Вычислить окислительно-восстановительный по-
потенциал в растворе, содержащем 0,2 моль/л КгСг2О7,
0,3 моль/л Cr2(SO4K и 0,5 моль/л HNO3.
251. Вычислить окислительно-восстановительный по-
потенциал системы, содержащей 0,1 моль/л КМпО4,
0,01 моль/л NaOH и МпО2 (тв).
252. Рассчитать окислительно-восстановительный по-
потенциал в растворе, полученном смешением 20 мл 0.05М.
Na3As03 и 18 мл 0,05 М 12 при рН 8.
253. Рассчитать электродный потенциал в системе:
1) РЬ
РЬС12 (тв) 2) Cd
0,5М КС1
CdCO3 (тв) 3) Ag
0,3M Na2CO3
AgBr (тв)
0.22М КВг
4) РЬ
РЬВг2 (тв) 5) Ag
50 г/л NaBr
AgCl
(нас. р-р)
254. Вычислить потенциал системы Си*±Си2++2е
з растворе, содержащем 0,1 моль/л CuSO4 и 2,0 моль/л
NH3.
255. Какая из систем имеет больший окислительно-
восстановительный потенциал:
Cu|Cu (NH3L+ = 0,l г-ион/л, NH3= 1,5 М или Cu|Cu(CNJ3"
= 0,1 г-ион/л, KCN=1,5M?
256. Вычислить потенциал никелевого электрода в ра-
растворе, содержащем 0,1 моль/л NiCl2 и 2, 7 моль/л NH3.
257. Вычислить потенциал серебряного электрода
в растворе, содержащем 0,1 моль/л AgNO3 и KCN, если
равновесная концентрация цианид-ионов 1 г-ион/л.
258. Вычислить потенциал кадмиевого электрода
в растворе, содержащем 0,02 моль/л CdCb и 1,5 моль/л
NH3.
4»
259. Вычислить потенциал ртутного электрода в ра-
растворе, содержащем 0,05 моль/л Hg(NO3J и 1,6 моль/л
NaCl.
260. Вычислить потенциал серебряного электрода
з растворе, содержащем 3,4 г/л AgNO3 и 2,5 моль/л NHS.
261. Вычислить потенциал никелевого электрода в ра-
растворе, 1 л которого содержит 7 г Ni(NOgJ и 51 г NHj.
262. Вычислить потенциал водородного электрода
в растворе, 1 л которого содержит 5,61 г КОН.
263. Вычислить потенциал водородного электрода
в 0,3 М НСООН.
264. Вычислить потенциал водородного электрода
в 5%-ном растворе NH4C1.
265. Вычислить потенциал водородного электрода
в растворе, в 1 л которого содержится 0,65 г KCN.
266. Вычислить потенциал водородного электрода
в растворе, 1 л которого содержит 10,7 г NH4C1
и 0,1 моля NH3.
267. Рассчитать потенциал водородного электрода
в растворе, полученном смешением 10 мл 0,5 М НС1
и 20 мл 0,25 М КОН.
268. Вычислить потенциал водородного электрода
в растворе, полученном смешением 32 мл 0,25 М НСЮ*
и 19 мл 0,4 М КОН.
269. Рассчитать потенциал водородного электрода
в растворе, полученном при смешении 250 мл 0,4 М HCN
и 250 мл 0,4 М KCN.
270. Рассчитать потенциал водородного электрода
в растворе, содержащем 0,1 моль/л ЫагСОз.
271. Определить потенциал водородного электрода
в растворе, который получен прибавлением к 43 мл воды
2,5 мл 0,18 М НС1 и 4,5 мл 0,1 М NH3.
272. Вычислить потенциал водородного электрода в
растворе, 1 л которого содержит 0,5 моля СН3СООН и
0,5 моля Са(СН3СООJ.
273. Вычислить потенциал водородного электрода в
растворе, полученном смешением 1 л 0,1 М NaCH3COO
и 100 мл 0,1 М СНзСООН.
274. Вычислить потенциал водородного электрода в
растворе, 200 мл которого содержат 1,2 г СН3СООН и
3,3 г CH3COONa.
275. Вычислить потенциал водородного электрода в
растворе, полученном смешением 20 мл 0,5 М НС1 и 30 мл
0,6 М NH,.
50
276. Вычислить э. д. с. гальванического элемента, по-
построенного из следующих пар:
1) Zn|Zna+@,001 r-ион/л jJl Cu"+ (.0,1 г-ион/л)| Си
2) AI| А11+ @,05 г-ион/л)||Ag+ @,03 r-noH/Vi)|Ag
3) Pt
4) Pt
5) Pt
6) Pt
Sn" @,01 г-ион/л)
SnIV @,001 г-ион/л)
Sn"@,0I г-ион/л)
SnIV @,001 г-ион/л)
Fe2+@,01 г-ион/л)
Fe3+ (Ю-6 г-ион/л)
Mn2+ @,05 г-ион л)
МпОГ @,03 г-ион/л)
CH3COOH Aмоль/л)
Fe2+ @,001 г-ион/л)
Fe3+ @,01 г-ион/л)
Pt
Fe(CNjr @,1 г-ион/л)
Fe(CN)G @,1 г-ион/л)
Сг2О?~@,1 г-ион/л)
Сг3+A0-в г-ион/л) рНО
Pt
Pt
Fe2+ @,05 г-ион/л)
Fe3+@,l г-ион/л)
Pt
7) Н2(Р1)|НСЮ4E%чшй p-p) || AgGl (нас. р-р)| Ag
8) Hg|Hg2Cl2(TB), 2о/о-ный p-p КС1||0,1н. HCl|Ha(Pt)
Б каком направлении пойдет соответствующая хими-
химическая реакция?
277. Вычислить константы равновесия окислительно-
восстановительных реакций:
2) S,
3)
4)
5) 2Cr3+ + 6Fe8+ + 7H2O ^ Сг2О?~ + 6Fe2+ + 14H+
6) SO2r + 2I- + 4H+^H2SO, + I2 + H2O
7) 2МпОГ + 5HNOa + H+ ^ 2Мп2+ + 5ЫОГ + 3H.0
51
8) Cr,0?
9) 5Cra0?~ + 6Mna+ + 22H+ ^ 10Cr3+ + 6МпОГ4
10) 2Fes+ + SnCl^ + 2Cl~^: 2Fe2+ + SnCl6~
В каком направлении пойдут реакции при смешении
эквимолярных количеств реагентов?
278. Вычислить равновесные концентрации ионов
МпО^, Мп2+, Fe3-»- и Fe2+ в растворе, полученном смеше-
смешением 20 мл 0,1 М КМпО4 и 20 мл 0,1 М FeSO4 при рН 0.
279. В 1 л раствора, содержащего 0,1 М Н2О2 и 1 М
НС1, растворили 33,2 г KL Вычислить равновесные кон-
концентрации Н2О2, 1~ и 1г-
280. Вычислить равновесные концентрации ионов
S2- и NOj" в растворе, полученном растворением
0,0146 г ZnS в 5 мл 3 М HNO3.
281. Сколько граммов Сг(ОН)з растворится в 5 мл
0,3 М Н2О2 при рН 14. Какова равновесная концентрация
НО<Г в растворе?
282. Рассчитать равновесные концентрации ионов
Fe2+, Fe3+, I~ и 12 в растворе, полученном растворением
16,60 г KI и 16,22 г FeCl3 в 1 л 1 н. кислоты.
283. Вычислить равновесные концентрации ионов
Сг3+, Сг.2О7~ и Н2О2 в растворе, содержащем 0,2 моль/л
СгС13 и 0,3 моль/л Н2Ог при рН 1.
284. К. раствору 0,2 М MnSO4 добавили избыток
NaBiO3 при рН 0. Вычислить равновесные концентрации
ионов Мп2+, МпОГ и Bi3+.
285. Подобрать коэффициенты в следующих уравне-
уравнениях реакций:
2)
3)
4)
5)
6)
7)
8)
52
?S
(sc
(Ig
-1 (ое
ОгН + ON + S + +вШ - +H + JON + ESS!8 FS
(82
ОгН + +^N + -HO + _*(Ю *- eO1bn + 2(HO)
+ы -i
f + (OS
(ei
(81
(Zl
(91
(SI
огн + +zim+'osvch — +н+2O"w+8osveh (ei
+H + _JOS +B(HO) O"W — ОгН + .«O'S + +SUW (П
огн+-^я+4оо^-но+^а++6ю (oi
osh+ioi++Buw — +н+-i+lom F
34)
35)
36) Bis+ + Sn (OH)*" + OH — Bi + Su (OH)e^
37) HgS -f NOr + H+ + Cl- — HgCtf" + HSOr + NO+H2O
38) SnS + HA + OH-— Sn(OH)e~
39) As2
40) AsO3~+Al -f H2O -. AsH3 + Al (ОН)Г
41)
42)
43) ШГ
44)
45)
46) Zn+NOr + OH- +HaO-.Zn(OH^~
47)
48) VO2+ + SnCl2 + H+ + Cl- — VOa++SnClJ- + H2O
49) + +
50)
51)
52)
53) SbCl^ + Fe—Sb-f Fe2++Cl-
54) Sb + NOr + Cl- + H+ —SbC!6~+NO+HaO
55) Br-
56)
57) H8As04+
54
Глава VI
ВЛИЯНИЕ ИОННОЙ СИЛЫ НА РАВНОВЕСИЯ
В РАСТВОРАХ ЭЛЕКТРОЛИТОВ
Вопросы для самопроверки
1. Что называют ионной силой раствора? Вычислить
ионную силу: а) 0,1 М НС1; б) 0,5 М НС1; в) 1.0М HNO*;
г) 0.05М NaOH; д) 0,1 М СаС12; е) 0,5 М MgSO*;
ж) 1,0 М Na2SO4; з) 0,3 М А1С13; и) 0,5MScBr3;K) 0,1 М
A12(SO4K.
2. Что называют активностью и коэффициентом ак-
активности? Как связаны они между собой?
3. Привести уравнение- предельного закона Дебая
для коэффициента активности и уравнение Дэвиса.
4. Что называют солевым эффектом? С чем он свя-
связан?
5. Какое действие оказывает «индифферентный» элек-
электролит на растворимость малорастворимых солей?
6. Чем объясняется увеличение силы слабых кислот в
присутствии «индифферентных» электролитов?
7. Как влияет увеличение ионной силы на устойчи-
устойчивость комплексных соединений?
8. Привести соотношение между концентрационной и
термодинамической константами: а) устойчивости комп-
комплексных соединений; б) диссоциации слабых кислот.
9. В какую сторону изменится рН 0,1 М CHjCOOH
при введении 0,1 моля NaCl?
10. В какую сторону изменится рН 0,1 М NHs при вве-
введении 0,1 моля КС1?
Решение типовых задач
Пример 1. С учетом коэффициентов активности рассчитать сте-
степень диссоциации и рН: 1) 0,1 М HF; 2) 0,1 М HF в присутствии
0,5MNaClO4.
Решение. 1. Ионная сила раствора создается за счет диссо-
диссоциации HF и Н2О
F-
Находим приближенно концентрацию ионов Н+ при диссоцна-
цич HF
{? - |/б,8-10*-«.0,1-0,825- 10-»
= 8,25-10-3 г.„он/л.
S5
Следовательно, ионная сила раствора приближенно равна
= -i-(8,25-Ю-з. 1 + 8,25-10-3-1) = 8,25-10-з.
(Вклад в ионную силу за счет диссоциации воды пренебрежимо
мал.)
Находим константу диссоциации HF при этом значении ионной
силы по уравнению Дэвиса:
—0.2-/ },
1 + /1/2
Где дг ^j продуктов реакции ' > исходны^ веществ', '1, ^ —
стехиометрические коэффициенты; г — заряд иона.
В данном случае
Л*2 = г2п+ + г\_- г2нр = 1 + 1 - 0 = 2.
Подставив численные значения в ранее написанное уравнение,
получаем:
Н
3,17— 2-0,5 (—У8'25'10 3——о.2-8.251О-з) =
\ 1 + 1/8,25-Ю-з /
С помощью этой константы рассчитаем более точно концентра-
концентрацию ионов Н+:
[Н+] = /8,12-10-4-0,1 = 0,90-10-2 = 9,0-Ю-з.
Следовательно, более точно / = 0,009. Константа диссоциации HF
при /=0,009 равна
р/С = 3,17— 2-0,5 ( ^9'10 3 —0.2-9-Ю-з 1 = 3.08.
\ 1 1/910я /
Эта величина только на 0,01 логарифмической единицы отли-
отличается от значения, полученного в предыдущем приближении, поэто-
поэтому для расчета степени диссоциации а и рН оставляем /Снр =
= 8,12-10-'. В соответствии с этой константой [Н+]=9,0-10. Сле-
Следовательно, рН = 2,05. Отсюда
9 0-Ю-з
а = = 9,0-10-2. или 9,0%.
и, 1
56
2. Ионная сила раствора создается аа счет диссоциации HF л
1ЬО, а также за счет полностью диссоциированного NaCIO4: "
J_/c 22 +с z2 _ + c2 +z2 + + C г2-
2 \ Na+ Na+ С104~ * Н Н F
= — @,5-1 + 0,5-1 + 0,01-1+0,01-1) = 0,51.
Константа диссоциации HF при / = 0,51 равна
р# =3.17— ' + 0.2-0.51 = 2,85, К = 1,4-10-3.
1 + /0.51
Концентрацию ионов Н+ рассчитываем по формуле (Н+] =
[Н+] = /1,4-10-з.0,1 = 1.19-10-2, РН= 1,92.
Степень диссоциации
СНР О'1
Пример 2. По значениям ПР и констант устойчивости хлорид-
ных комплексов свинца рассчитать растворимость PbCU в
0,6 М КС1.
Решение. В насыщенном растворе РЬСЬ существуют следу-
следующие равновесия:
РЬС12(к);?РЬ2++2С1- A)
С1- B)
PbC12(K):?PbCl2(p) C)
bClf D)
При этом
= 1,6-10-5,
К°2= [РЬС1+] [С1-] YPbC1+ Yc^ = ПР°РЬС11р;ьС1+ =
= 1,6-10-5-41,7 = 6,66-10-1,
K°3 = [PbCl2] Ypbcu = ПР°РЬС1/РЬСи= 1,6-10-5.2,76-102 =
= 4.32-10-3,
[PbCl3-]
= 1,6-10-5-1,1.102= 1,76-10-3.
В первом приближении принимаем, что ионная сила определяет-
57
ся только хлоридом калия (/=0,6), и рассчитываем константы рав-
равновесия при этом значении ионной силы. В реакции A)
Л*2 = 2г2а„ + г2п2+ - 4ьс>, -2 + 4-0 = 6,
/ /1/2 \
рПР=рПРв—Дг2-0,5 ¦—— 0,2/ =
V I + /1/2 /
= 4,80 — 6-0,5[-^~=L — 0,2-0,6 | =3,85,
1 /б )
тогда ПР=1,410-4. В реакции B)
= 3,18- 2-0,5(-^—-
\1 + /0,б
,б)=»|2,86,
/С2=1,4 10-з,
lg Кг = Ig /fg! lg /D = Ig < (так как [Д*я = 0).
Растворимость PbClj равна общей концентрации свинца в рас-
растворе:
ПРРЬС1а
Подставляем в уравнение E) значения констант и [С1~] = 0,6:
1,4-10-4 1,4-10-8
5рьс, = -^- + -Чб- + 4'32-10-3+1'76-10-3'°'6==
= 3,89-10-4 + 2,33- 10-з + 5,37-10—а = 8,09.10-з.
Рассчитываем более точно равновесную концентрацию хлорид-
нона:
[С1-] = СкС1 + 2[РЬ2+] + [PbCl + ]— [PbClf]
[С1-] = 0,60 + 2.3,89-10-4 + 2,33-10—з— 1,05-10—з = 0,602 .
Эта величина незначительно отличается от использованной для рас-
расчета растворимости, следовательно, нового приближения можно не де-
делать, Более точно ионную силу находим суммированием:
5ЬС,
3 Ъ
2,33-10-3.1 + 1,05-10-8-1) = 0,606.
Полученное значение ионной силы практически совпадает с задан-
заданным при расчете констант равновесия, следовательно, необходимость
в новом приближении отпадает.
Задачи
286. С учетом коэффициентов активности рассчитать
степень диссоциации и рН растворов: 1) 0,1 М KF;
2) 10-3М НС1; 3) 0,2М H2SO4; 4) 0,1 М Н3РО4; 5) 0;1 М
СНзСООН; 6) ОД М НСООН; 7) 0,1 М H2S.
287*. Учитывая солевой эффект, рассчитать рН рас-
растворов: 1) 0,1 М LiCl; 2) 0,3MNaBr;3) 0,7MKI;4) 0,1 М
CaBr2; 5) 0,05 М MgCl2; 6) 0,2 М SrCl2; 7) 0,1 У. MgSO4,
288*. Рассчитать степень диссоциации и рН 0,1 М
СНзСООН в присутствии: 1) 0,1 М NaCl; 2) 0,8 М NaCl;
3) 0,05 М СаС12; 4) 0,2 М СаС12; 5) 0,05 М А1С13; 6) 0,1 М
А1С13; 7) 0,02 М Al2 (SO4K.
289. Рассчитать рН ацетатного буферного раствора,
содержащего уксусную кислоту и ацетат натрия одинако-
одинаковой концентрации: 1) 0,1 М; i!) 0,5 М; 3) 1,0 М.
290. Рассчитать рЫ аммонийного буферного раствора,
содержащего хлорид аммония и аммиак одинаковой кон-
концентрации: 1) 0,1 М; 2) 0,5 М; 3) 1,0 М.
291. Рассчитать рН ацетатного буферного раствора,
содержащего 0,5 МСН3СООН, 0,1 М CH3COONa и 0,5 М
NaCl.
292. Рассчитать рН аммонийного буферного раствора,
содержащего 0,5 М NH3, 0,1 М NH4C1 и 0,5 М КС1.
293. По значению ПР рассчитать растворимость
КС1О4 с учетом коэффициентов активности.
294*. По значению ПР рассчитать растворимость
BaSO4 в присутствии: 1) 0,1 М LiCl; 2) 0,5М NaBr;
3) 0,1 М НС!; 4) 0,2 М MgCU; 5) 0,2 М MgSO4; 6) 0,2 М
K2SO4.
295. По значению ПР и констант устойчивости хлорид-
ных комплексов свинца рассчитать растворимость РЬС12
в присутствии: 1) 0,2 М NaCl; 2) 0,25 М СаСЬ..
296. По значению ПР и констант устойчивости иодид-
ных комплексов свинпа рассчитать растворимость РЫ2 в
0,1 М Lil.
• В задачах, обозначенных звездочкой, все соли считать диссо-
диссоциированными нацело.
ЧАСТЬ ВТОРАЯ
КОЛИЧЕСТВЕННЫЙ АНАЛИЗ
Настоящий раздел содержит задачи на так называе-
называемые классические методы количественного анализа —
гравиметрический (весовой) и титриметрические (объем-
(объемные). В этом разделе приведены задачи, в которых точка
эквивалентности фиксируется при помощи индикаторов
(т. е. по изменению цвета раствора или выпадению осад-
осадка). Задачи на титриметрические методы, в которых точка
эквивалентности определяется с помощью физико-химиче-
физико-химических измерений (потенциометрическое титрование, ампе-
рометрическое и т. д.), а также задачи на кулонометрию
и некоторые другие вынесены в раздел физико-химиче-
физико-химических методов анализа.
Статистическая обработка результатов анализа, рас-
расчет ошибок и т. д. вынесены в гл. XXII, задачи из кото-
которой рекомендуется использовать и при изучении настоя-
настоящего раздела.
Глава VII
ГРАВИМЕТРИЧЕСКИЙ (ВЕСОВОЙ] АНАЛИЗ
АНАЛИТИЧЕСКИЕ ВЕСЫ И ВЗВЕШИВАНИЕ
Решение типовых задач*
Пример 1. Определить пулевую точку весов АДВ-200, если по
оптической шкал"е, имеющей нуль в середине, были сделаны отсчеты:
0,0; +0,1; —0,1 (дел. шкалы).
Решение. Для определения нулевой точки в АДВ-200 делают
три отсчета по оптической шкале после полной остановки стрелки
и вычисляют среднее арифметическое по формуле
h + h + h
'о = ; •
* Здесь приведены примеры расчетов и задачи, связанные с ис-
использованием автоматических демпферных весов, которые в настоя-
настоящее время широко применяются в аналитической практике.
60
В данном случае /0 =
0,0 + 0,1 — 0,1
=0,0.
Пример 2. Определить постоянство показаний весов АДВ-200,
если при трехкратном определении нулевой точки были получены
результаты: 0,0; —0,5 —1,0 (дел. шкалы).
Решение. Постоянство показаний весов АДВ-200 определяет-
определяется как среднее отклонение от средней точки из трех определений:
0,0— (—0,5) =0,5 дел.; —0,5—(—0,10) =0,5 дел.
Постоянство показаний весов АДВ-200 равно 0,5 дел. микро-
микрошкалы. По паспорту допускается вариация показаний не более одно-
одного деления микрошкалы, т. е. не более 0,1 мг.
Пример 3. Определить цену деления весов АДВ-200 без нагруз-
нагрузки, при 10 и 100%-ной нагрузке, если при проверке получены сле-
следующие результаты:
Нагрузка на
чашки, г
левая
О О О О
правая
0
10*
0
0
Положение
равновесия
(дел. шкалы)
Z.! = 0,0
/.2= 100,0
?3 = 0,5
Ц = -99,5
Нагрузка на чашки, г
левая
20
20
200
200+10*
правая
20
20+10*
200
200
Положение
равновесия
(дел. шкалы)
?5 = 0,0
L6= 100,0
i7 ==0,5
Ц = — 99,5
• Масса выражена в миллиграммах.
Решение. Цена деления 50 микрошкалы без нагрузки вычис-
вычисляется по формуле
s 2г
0 A2-Ц) + (L3-Ц) '
где г — образцовая гиря с номинальной массой 10 мг;
2-10
S = 0,1 мг/дел.
0
A00,0 — 0,0) + 0,5— ( — 99,5)
Цена деления микрошкалы при 10 и 100%-ной нагрузке вычис-
вычисляется соответственно по формулам:
г ' 10
5, по = — = 7тг~„ ггг = 0.1 иг/дел;
sioo%- ,
100,0 — 0,0
10
¦ = 0,1 мг/дел.
s 0,5— (—99,5)
Пример 4. Чему равна масса образца, если при взвешивании на
весах АДВ-200 он уравновешен гирьками 10 г + 2 г, на планке поме-
помещены кольцевые разновесы 200 мг+20 мг, отсчет по микрошкале
+ 8,6?
Решение. Масса образца равна алгебраической сумме разно-
разновесов и отсчета по оптической шкале с учетом знака:
10,0000+2,0000+0,2000+0,0200+0,0086= 12,2286 г.
61
Пример 5. Определить погрешность из-за неравноплечности ве-
весов АДВ-200, если при проверке получены следующие данные:
Hrfpyaxa и* чашки, г
левая
0
20A)
20B)
0
праааа
0
20B)
20A)
0
Положение
равновесна
(дел. шкалы)
Z1==0
?2 = 2,0
/•3 = 1.5
/,4=0
Нагрузка на чашки, г
леваа
200A)
200 B)
0
правая
200 B)
200A)
0
Положение
равновесна
(дел. шкалы)
/-5 = 3,0
/¦6 = 4,0
/.7 = 0,5
Решение. Погрешность от неравноплечности
10%-ной нагрузке вычисляется по формуле
„ _ / 1* + L* Lj + L, ,
»10% — 9 ~ 9 '
весов при
2,0+ 1,5
— 0 0,1 =0,18 ^0,2 мг,
где 5 — цена одного деления микрошкалы, равна 0,1 мг.
Погрешность от неравноплечности при 100%-ной нагрузке вы-
вычисляется аналогично:
К + U La + L
У юо% =
3,0 + 4,0 0 + 0,5
0,1 = 0,33 «0,3 мг.
Для достижения равновесия необходимо прикладывать допол-
дополнительный груз на правую чашку, следовательно, правое плечо коро-
короче левого. При взвешивании погрешность следует вычитать из мас-
массы гирек на правой чашке весов.
Пример 6. При двойном взвешивании тигля на весах АДВ-200
получены следующие результаты: 4,3552 г-на левой и 4,3556 г —
на правой чашке весов. Чему равна действительная масса тигля?
Решение. Действительная масса при способе двойного взве-
взвешивания равна среднему геометрическому из результатов обеих взве-
взвешиваний:
Так как обычно Pi и Рг различаются мало, что Р можно вычислить
как среднее арифметическое:
Следовательно, действительная масса тигля равна
4,3554 г, я га
: 4,3554 г.
Пример 7. Определить массу колбы с поправкой на массу гирь,
если она уравновешена разновесами 10 г+5 г+1 г+500 мг+
+ 200 мг+20 мг, а отсчет по иикрошкале весов АДВ-200 равен
2,7 мг. Поправки к номинальной массе разновесов равны: 10 г
(+0,5 мг); 5 г (+0,3 мг); 1 г (+0,2 мг); 0,5000 г (—0,08 мг);
0,2000 г (—0,05 мг); 0,0200 г (+0,03 мг).
Решение. Масса колбы равна 10,0000+5,0000+1,0000+0,5000+
+0,2000+0,0200+0,0027+0,0005+0,0003+0,0002 — 0,00008 — 0,00005+
+0,00003= 16,7236 г.
Задачи
297. Определить нулевую точку весов АДВ-200, если
по оптической шкале, имеющей нуль в середине, сделаны
отсчеты: 1) 0,2; 0,1; 0,3; 2) 0,0; —0,2; +0,3; 3) 0,5;
0,6; 0,4.
298. При определении нулевой точки весов АДВ-200
показания оптической микрошкалы были: 0,0;—0,5; +0,5.
Чему равны нулевая точка и вариация показаний весов?
299. При проверке весов АДВ-200 получены следую-
следующие данные:
Нагруака на чашки, г
лева!
0
0
0
10» A)
20A)
20A)
права»
0
10*
0
0
20B)
20 B)+10*
равновесия
(дел. шк.)
?, = 0
?2= 100,1
?3 = 0,2
?4 = -99,5
?5 = 0
?6=99,8
Нагруака на чашки, г
леяая
0
200A)
200A)
20B)
200 B)
правая
0
200 B)
200A)+10*
20A)
200 A)
равновесия
(дел. шк.)
L7 =0,1
Ц =2,0
Ц =101,5
?10 = 4,0
?„ = 4,5
* Масс* выражена в миллиграмма!.
Определить: 1) цену деления микрошкалы без на-
нагрузки; 2) цену деления микрошкалы при 10%-ной на-
нагрузке; 3) цену деления микрошкалы при предельной
нагрузке; 4) постоянство (вариацию) показаний нена-
груженных весов; 5) погрешность от неравноплечности
при 10%-ной нагрузке; 6) погрешность от неравноплеч-
неравноплечности при предельной нагрузке.
300. На обе чашки весов АДВ-200 поместили разно-
разновесы с номинальной массой 20 г. Отсчет по оптической
A3
шкале —3,0 дел. Разновесы поменяли местами и получи-
получили отсчет —2,0 дел. Цена деления шкалы 0,1 мг/дел.
Нулевая точка равна 0,0. Определить погрешность (мг)
из-за неравноплечности весов.
301. При взвешивании бюкса на левой чашке весов
АДВ-200 его уравновесили гирями 5 г + 200 мг+100 мг +
+ 20 мг, показания оптической шкалы+ 6,8 мг. При взве-
взвешивании бюкса на правой чашке на левую поместили
гири 5 г+1 г, на планке находились кольца 500 мг +
+ 100 мг + 50 мг + 20 мг, показания оптической шкалы
+ 2,8 мг. Какова действительная масса бюкса с учетом
неравноплечности весов?
302. В выпускном аттестате весов даны следующие по-
поправки к номинальной массе гирь:
Номинальная
масса гири,
г
100
50
20
10A)
10B)
5
Поправка,
мг
+0,5
+0,3
+0,7
+0,5
+0,3
+0,4
Номинальная
масса гири,
г
2A)
2B)
1
500*
200*
100* A)
Поправка,
мг
+0,2
-0,4
-0,3
+0,01
-0,01
0,00
Номинальная
масса гири,
г
100* B)
50*
20*
10* (I)
10* B)
Поправка,
мг
-0,04
-0,05
-0,02
+0,04
+0,01
* Масса выражена в миллиграммах.
Определить массу образца с поправкой к номинальной
массе гирь, если при взвешивании образец уравновеси-
уравновесили разновесами:
1) 20 г+10 г A) +1 г + 500 мг + 200 мг+10 г (показа-
(показание шкалы +5,2 мг);
2) 20 г+10 г B) +2 г A) +200 мг+100 мг A) +
+ 20 мг (показание шкалы —2,5 мг);
3) 10 г A)+5 г + 2 г B)+50 мг + 20 мг (показание
шкалы +7,8 мг);
4) 1 г + 500 мг+ 100 мг B) +20 мг (показание шкалы
+ 4,7 мг);
5) 500 мг + 200 мг+100 мг A)+20 мг+10 мг A) +
+ 10 мг B) (показание шкалы —7,7 мг).
64
РАСЧЕТЫ В ГРАВИМЕТРИЧЕСКОМ (ВЕСОВОМ]
АНАЛИЗЕ
Вопросы для самопроверки
1. Назвать основные операции гравиметрического ана-
анализа.
2. Что называется формой осаждения и какие требо-
требования к ней предъявляются?
3. Назвать наиболее пригодную форму осаждения при
определении: а) кальция; б) бария; в) свинца. Какое сое-
соединение наиболее пригодно в качестве формы осаждения:
а) океихинолят алюминия или А1(ОН)з; б) диметилгли-
оксимат никеля или Ni(OHJ; в) океихинолят магния или
MgNH4PO4? Объяснить выбор.
4. Какое соединение можно предложить в качестве
формы осаждения при весовом определении Mg, Ca, Cd,
Си, Fe, Bi, Zn, Ba, Pb, К, Р?
5. Что такое весовая форма и какие требования к ней
предъявляются?
6. Какое соединение наиболее пригодно в качестве ве-
весовой формы при количественном определении Ca, Pb, Sr,
Ni, Zn, Cu?
7. Как влияют на полноту осаждения: а) температура
раствора; б) количество осадителя; в) присутствие по-
посторонних электролитов?
8. Какую цель преследуют, употребляя при осажде-
осаждении избыток оеадителя? Почему нельзя брать слишком
большой избыток?
9. Что такое относительное пересыщение? Как оно
связано с числом центров кристаллизации, скоростью
кристаллизации, размером кристаллов?
10. Как влияют на размер кристаллов осадка: а) тем-
температура раствора; б) количество осадителя; в) присут-
присутствие в растворе посторонних электролитов?
11. Как зависит растворимость осадка от размера
его частиц?
12. Какие процессы происходят при выстаивании рас-
растворов и созревании кристаллических осадков?
13. Почему осаждение сульфата бария производится:
а) из разбавленных растворов; б) в кислой среде; в) при
нагревании растворов; г) в присутствии солей аммония?
14. Что такое соосаждение? Какие физико-химические
процессы в растворе приводят к соосаждению?
3-4022 *5
16. В чем сущность осаждения с коллектором? При-
вести примеры.
16. Как влияют на чистоту осадка: а) присутствие в
растворе солей аммония; б) температура раствора;
в) скорость осаждения?
17. Что такое адсорбция? Указать факторы, влияющие
на адсорбцию ионным кристаллом. Что такое обменная
адсорбция?
18. Какие ионы будут адсорбироваться на поверхно-
поверхности осадка в начале осаждения: а) ВаСЬ раствором
Na2SO4; б) СаС12 раствором (NH^aCzO*; в) Na2SO4 рас-
раствором ВаС12?
19. Какую соль бария — Ba(NO3J, ВаВг2 или
ВаСЬ—целесообразно использовать в качестве осадите-
ля для получения наиболее чистого осадка BaSO*?
Объяснить, почему?
20. Какие соединения —< К2С2О4, NazCsCU, H2CjOi,
(NHiJaCjCU—следует использовать для осаждения
кальция?
21. Что такое окклюзия? Привести примеры.
22. Какие аналитические приемы применяются для
уменьшения адсорбции и какие — для уменьшения ок-
окклюзии?
23. С какой целью используется переосаждение?
24. Каковы условия осаждения аморфных осадков?
Почему осаждение их проводят из концентрированных
растворов?
25. Как влияют количество промывной жидкости и
кратность промывания на эффективность промывания?
26. В чем сущность метода декантации?
27. Какие растворы используются в качестве промыв
ной жидкости при весовых определениях? Привести при-
примеры.
28. В каком случае потери при промывании осадка
CaCjOi будут наибольшими и в каком — наименьшими:
а) 100 мл воды; б) 100 мл 0,1 М- (NH4)aC2O4; в) 500 мл
воды?
29. Что такое фактор пересчета и каков его физиче-
физический смысл?
30. Составить расчетную формулу для определения
процентного содержания вещества по следующим дан-
данным: а —навеска образца; g — масса полученного
осадка; F — фактор пересчета.
66
31. Вычислить рН раствора, необходимый для количе-
количественного разделения: a) Fe3+ и Mg2+; б) А\*+ и Mg*+.
32. Назвать наиболее распространенные органические
реактивы, которые используются в весовом анализе. Ка-
Какие достоинства имеют эти реактивы?
33. Как при помощи оксихинолина провести разделе-
разделение ионов: a) Al3* и Mg2+; б) А13+ и Cd2+: в) Fe^
и А13+?
34. Привести примеры количественного разделения
ионов путем окисления или восстановления одного на
компонентов смеси.
35. Какие физико-химические методы используются
для разделения ионов?
36. Какие весовые способы применяются для опреде-
определения: а) магния, олова, сульфида; б) меди, кальция,
иодида; в) алюминия, молибдена, фосфата; г) цинка,
серебра, сульфата; д) железа, висмута, бромида;
е) свинца, ртути, хлорида; ж) бария, марганца, хромата.
37. Как проводится гравиметрическое определение:
a) SiO2 в силикате; б) РЬ, Си, Fe, Zn в рудах; в) Р2О5 в
фосфоритах, суперфосфатах, преципитатах; г) S, Fe в
колчедане; д) S в каменном угле; е) Си, Pb, Zn в брон-
бронзе; ж) РЬ в латуни; з) СаО и MgO в цементах.
38. Указать преимущества и недостатки гравиметри-
гравиметрического анализа.
Решение типовых задач
Пример 1. Вычислить фактор пересчета для определения калня,
если после осаждения его в виде КгРЮв получена весовая форма
платины.
Решение. Чтобы иметь ] г-атом платины, необходим 1 моль
KjPtCle, на получение которого идут 2 г-иона К+. Фактор пересчета
равен
где Лк — атомный вес калия; Apt-—атомный вес платины.
Пример 2. Рассчитать навеску силикатной породы, содержащей
около 5% СаО, которая необходима для определения кальция в ви-
виде CaSOi, если g — масса осадка CaSO» 0,3 г.
Решение. Если Мею — молекулярный вес определяемого ве-
вещества, a -^c»so —молекулярный вес весовой формы, то
из Мгзо г получается МСл&Ол г весовой формы
»*»» g » » »
3' 47
Из пропорции следует
Зная примерное содержание СаО в анализируемом веществе
F %), рассчитаем навеску а для аналитического определения-.
лг-100 МСл0 юо 100
а = = .& = F е .
При определении СаО в виде CaSO4 фактор пересчета равен
Навеска силикатной породы равна
а = 0,41190,3—— = 2,5 г.
Вычисляют навеску приближенно, а взвешивают с обычной ана-
аналитической точностью (±0,0002).
Пример 3. Вычислить потери (г и %) за счет растворимости
осадка СаСгО^НгО, если к 20 мл 0,1 М СаС12 добавили: а) эквива-
эквивалентное количество 0,1 М (NH4bC2O4: б) полуторный избыток 0,1 М
(NH4JC2O4.
Решение а) Масса осадка СаС2О4Н2О (Af = 146,12), образу-
образующегося при осаждении, равна
—— 146,12 = 0,2922 г СаС2О4Н2О.
Объем раствора после добавления эквивалентного количества
осадителя 20 + 20=40 мл; ПРСаС2О4 = 2,3-10~9. Обозначим [Са2 + ] =
== [С2О4~] = х г-ион/л-
Отсюда
х = /2,3-10-9 = 4,80-10-5 г-ион/л.
Следовательно, потери за счет растворимости СаСгО4-Н2О со-
составляют 4,80.• 10~5 моль/л. Вычислим, сколько граммов ССОНО
находится в 40 мл раствора:
4,80-10-5-146,12.40 =2<806.10_4
1000
Потери за счет растворимости составляют
2,806-10-4-100
0,2922
: 0,096, или>0,1%.
б) При использовании полуторного избытка осадителя масса
осадка остается практически неизменной — 0,2922 г CaC|Ot-HjO.
Объем раствора после осаждения равен 20+20-1,5 — 50 мл. При до-
68
бавлении полуторного количества осадителя избыток его составляет
10 мл 0,1 М (гШ^гСгО^ Вычислим концентрацию ионов С2О4 в по-
полученном растворе:
г ч т 0,1-Ю
[С2О^~ J = — = 0,02 г-ион/л.
Обозначим через х моль/л растворимость СаСгО^ Тогда
[Са2+] = х г-ион/л, [С2С>4~"] =0,02 4- х г-ион/ л. Исходя из вели-
величины ПР, запишем
[Са2+] [C2Oj~] = х @,02 + х)= 2,3-10-9.
Так как *«0,02, то 0,2+*« 0,02, следовательно, дг-0,02=
=2,3-10"*. Отсюда
2,3-10-9
лг=——-—=1,15 -10-7 г-ион/л.
Растворимость СаС2О4 1,15-10-' моль/л. Следовательно, потери
за счет растворимости в 50 мл составляют
1000
8.40-10—7-100
0,2922
= 2,9-10-1
Пример 4, Сколько процентов составят потери за счет раство-
растворимости при промывании 0,2 г осадка Mg(OHJ 250 мл воды? Какова
должна быть концентрация аммиака в промывной жидкости, чтобы
потери при промывании осадка таким же объемом составляли не
более 0,1%?
Решение. На основании nP = [Mg2+][OH-]2 = 6,0-10-10 опре-
определяем концентрацию Mg2+ и равную ей концентрацию Mg(OHb B
водном насыщенном растворе.
Обозначим через х моль/л растворимость Mg(OHJ, тогда
[Mg2+] = .r г-ион'л. Отсюда [ОН~] = 2х г-ион/л. Исходя из величины
ПР, запишем
х-BхJ = 6,0- 10-ю,
*/" 6,0-1'
-у —
10-ю
-=5,31-10—» г-ион/л.
Значит, потери за счет растворимости Mg(OHJ (Af=58,320) в
250 мл составляют
7,74.10-з.ЮО
U i л.
При использовании в качестве промывной жидкости раствор»
аммиака растворимость Mg(OH)i понижается за счет введения одно-
«9
жмениих « осадком ионов ОН~. Зная, что потери должны составлять
•\1°А, яахедЯм вастюримость Му(ОН)в в моль/л:
• ,2.0,Ы000
Следовательно, [Mg'+l—l.^-lO-1 г-ион/л.
Обояначив концентрацию [ОН~] через х, составляем на основа-
основании произведения растворимости уравнение
6,0-10-10= [Mg2+][OH-]2=-l,37-10-s-.t2.
5,0-10-10
¦ 6,62-Ю-з г-ион/л.
Г-10-5
На основании константы диссоциации NHS
[NH+] [ОН-]
К ~ [NH3]
вшчислаем концентрацию NH3 ¦ растворе, в котором [ОН~]>
0~' r-иои/л. Так как в водном растворе аммиака [NH/]=
Ч~\ те И иястанты диссоциации следует
I F,62-10-3J
- = ¦_„ .„ , = 2,5 моль/л.
8, Ив навески каменного угля 2,6248 г после соответ-
соответствующее «бработки получили осадок BaSO4 массой 0,3248 г. Вы-
«нелкть процентное содержание севы в каменном угле. Пересчитать
првцеятиее содержание серы на абсолютно сухое вещество, если со-
содержание влаги в нем 2,58%.
Решение. Если As — атомный вес серы, a jWBaS0 —молеку-
лярньй вес весовой формы, то
из А5 г получается MBaS0 г
g
М
BaSOj
Если * а (г) образца содержится х (г) S, то процентное содержа-
содержание (*) равно:
а а
32,064 100
03248
Зная процентное содержание исследуемого элемента и влажность
материала с% Н2О, найдем процентное содежание серы в абсолют-
абсолютно сухом веществе:
6.100 1,70-100
Ь
Ш-е - ISO-2,58
Вример 6. При ©пределении окислов щелочных металлов из об-
р^ЗДй «ликатной породы 1,2505 г выделили смесь NaCl и КС1 мас-
ctfi l.laffo г.
70
После многократной обработки этой снеси серной кислотой полу-
получили сульфаты NasSOi н KaSOt массой 0,1800 г. Вычислить процмт-
ное содержание Na2O и КаО в силикатной породе.
Решение. Обозначим через х число граммов Na»O в
a KsO — через у. Следовательно,
из х г
получится х
М
> у, > К2О
Na.O
JKC1
г NaCl
» КС1
^к.о
2-58,44 , 2-74,56 E
Масса NaiSOi и KaSOi, полученных из этой смеси,
М М
* ./'S ' +У- ./S0< -0.18Q0,
142,04
174,27
= 9,1806.
61,98 " 94,20
Решаем полученные уравнения н находим:
х=0,0533 г NaaO, у = 0,0313 К.О,
К.О,
Задачи
303. Вычислить фактор пересчета в следующих при-
примерах:
Вари-
Варианты
1
2
3
4
5
6
7
8
9
10
Определя-
Определяемое
кщество
Na2SA
Ва
А1
Na2O
СаСО3
СаО
Са3(РО4J
FeO
FeSO4
Н3РО4
Весовах форма
ВаЗО4
i'aSO4
АЬ,О3
NaCi
CaSO4
СаСО3
СаО
Fe2O3
FeA
MgjPA
Вари-
4ШТЫ
и
12
13
14
15
16
17
18
19
20
Onредел»-
euoc
Btuiecrao
Pb3O4
Fea04
N
CuO
K2O
AgaO
MoO3
P2O5
К
MgO
В«сов»« фарш
PbSO4
HeaO8
(NH4J PlCle
CuSCN
K2^CI6
AgCl
(NH4KPO4.12MoOa
(NH4KPO412A\oO3
K2SO4
Mg2Pj07
7\
304. Вычислить фактор пересчета Для определений
NH3 по хлорплатинатному методу, при котором весовой
формой является металлическая платина (NH3—*¦
—>-(NH4JPtCl«—»-Pt).
305. Вычислить фактор пересчета, если при опреде-
определении мышьяка сначала осадили As2S3, затем окислили
серу до SC>4~, осадили сульфат хлоридом бария и взве-
взвесили BaSO4?
306. Анализ карбида кальция выполняли по схеме:
СаСг—*Н2С2—*-AgaC2—»-AgCl. Вычислить фактор пере-
пересчета для определения СаСг.
307. Определение содержания серы выполняют по
схеме: S—*-H2S—>-CdS—*CuS—>-CuO. Вычислить фак-
фактор пересчета для определения S по СиО.
308. Вычислить фактор пересчета для определения
HF, если анализ выполняли по схеме: HF—*-CaF2—у
309. Для определения сульфата в растворе ^
осадили Fe(OHK и после прокаливания осадка получи-
получили весовую форму Fe2O3. Вычислить фактор пересчета.
310. Вычислить фактор пересчета для определения
Р2О5, если анализ выполняли по схеме: Р2О5—*-РО1~—>-
—*-(NH4)8PO4- 12MoOj—»»PhMo04.
311. Какую навеску пирита, содержащего около 30%
серы, нужно взять для анализа, чтобы получить 0,3 г
осадка BaSOt?
312. Сколько вещества, содержащего около 50%
железа, следует взять для анализа, чтобы масса прока-
прокаленного осадка РеаОз была 0,1 г?
313. Какую навеску Fe3O4 следует взять для получе-
получения 1,0 г FeaO3?
314. Рассчитать навеску фосфорита, содержащего
около 20% Р2О5, необходимую для получения
0,3 Mg2P2O7.
315. Какую навеску цемента, содержащего около 20%
магния, следует взять для анализа, чтобы получить 0,3 г
осадка оксихинолята магния Mg(C9H6ONJ?
316. Какие навески сплава, содержащего около 65%
РЬ и 15% Sn, потребуются для определения этих эле-
элементов, если свинец определяют в виде PbSCU (масса
осадка 0,5 г), а олово в виде SnO2 (масса осадка 0,2 г)?
317. Какую навеску вещества, содержащего около
20% NaCl и 30% КС1, следует взять для определения
хлорида в виде AgCl (масса осадка 0,5г)?
72
318. Рассчитать навеску вещества, содержащего око-
около 1% K2SO4 и 3% КС1, необходимую для получения
0,2 г осадка КСЮ4.
319. Технический хлорид бария содержит около
97% ВаС12-2Н2О. Какую навеску следует взять для по-
получения 0,3 г осадка BaSO4?
320. Сульфат алюминия содержит около 88%
A12(SO4K- I8H2O. Рассчитать навеску, необходимую для
определения алюминия в виде А12О3, если масса А1гОз
0,1 г.
321. Какой объем 0,5 М Na2HPO4 потребуется для
осаждения магния в виде MgNH4PO4 из 0,5 г сплава,
содержащего 90% Mg, при стехиометрическом соотноше-
соотношении реагирующих веществ?
322. Какой объем 2%-ного раствора NH3 потребуется
для осаждения железа из 0,2 г руды, содержащей 20%
Fe2O3, если вещества берутся в стехиометрическом соот-
соотношении?
323. Какой объем 5%-ного раствора NH3 потребует-
потребуется для осаждения полуторных окислов из навески 1,5 г
силикатной породы, содержащей около 14% А12О3 и 6%
Fe2O3, если вещества берутся в стехиометрическом соот-
соотношении?
324. Какой объем 3,5%-ного раствора
(NH4JC2O4 H2O потребуется для осаждения оксалата
кальция из навески 0,15 г апатита Саз(РО4J-СаС12 при
стехиометрическом соотношении реагирующих веществ?
325. Сколько миллилитров 0,1 М ВаС12 потребуется
для осаждения серы в виде BaSO4 из навески 2,0 г камен-
каменного угля, содержащего около 4% S, если осадитель до-
добавлен в стехиометрическом соотношении?
326. Сколько миллилитров соляной кислоты (d=
= 1,17 г/см3) потребуется для осаждения серебра в виде
AgCl из 2,0 г сплава, содержащего 22% Ag, при стехио-
стехиометрическом соотношении реагирующих веществ?
327. Какой объем 0,1 н. AgNO3 потребуется для осаж-
осаждения хлора на 1,0 г смеси, содержащей одинаковы; ко-
количества граммов ВаС12-2Н2О и NaCl, если осадитель
добавляется в стехиометрическом соотношении?
328. Сколько миллилитров 5%-ного раствора оксихи-
нолина C9H6NOH (d=l,07 г/см3) потребуется для осаж-
осаждения магния из 20 мл раствора, полученного при рас-
растворении 5 г доломита CaCCvMgCC^ в 200 мл соляной
73
кислоты, если реагенты берутся в стехиометрических
количествах?
329. Какой объем 20%-ного раствора MgCb (d=
«1.17 г/смя) потребуется для осаждения фосфора в ви-
виде MfNHiPd из навески 5,0 г фосфорита, содержащего
около 25% PjOj, если реагенты берутся в стехиометри-
стехиометрических количествах?
330. Навеску 5,0 г сплава, содержащего около 3% Ni,
растворили в мрпной колбе объемом 200 мл. Сколько
миллилитров 1%-ного раствора диметилглиоксима
C»H|NtOj ffif=0,93 г/см3) потребуется для осаждения
диметилглиоксимата никеля из 20 мл полученного раст-
раствора при стехиометрическом соотношении реагирующих
веществ? V|
331. Для определения серы навеску 2.0 г руды, со-
содержащей около 20% S, сплавили с Na->Oo. Плав раство-
растворили в 200 мл воды. Сколько миллилитров 0,25 М ВаСЬ
иотребуется для осаждения серы в виде BaSO4 из 20 мл
иолученного раствора при стехиометрическом соотноше-
соотношении реагирующих веществ?
332. Какой объем H?SO4 (d= 1,24 г/см3) потребуется
для превращения 0,35 г СаО в CaSO4?
338. Сколько миллилитров 0,1 М (NH4) 2С?О4 необхо-
необходимо для осаждения кальция и стронция из 200 мл рас-
раствора, содержащего в 1 л 0,555 г СаСЬ и 0,317 г SrCb,
если осадитель добавляют в стехиометрическом количе-
количестве?
334. Вычислить потери PbSC>4 (г и %) за счет раство-
растворимости осадка, полученного при добавлении к 20 мл
0,1 М Pb(NOsJ и полуторного избытка 0,1 М H2SO4.
335. Вычислить потери BaSO4 (моль/л) за счет рас-
растворимости осадка при осаждении бария эквивалентным
количеством сульфата. Какова потеря от растворимости,
если концентрацию SO^"" -ионов повысить до 0,01 г-ион/л?
ЗЗв. Вычислить потери Са (г и %) за счет раствори-
растворимости осадка СаС2О4, если к 20 мл раствора, содержа-
содержащего 0,1 г кальция, прибавили 35 мл 0,25 М
(NH4hC3O4.
337. Сколько граммов СаСОз перейдет в раствор при
промывании 0,3 г осадка 250 мл воды? Какой процент
от мяосы осадка составят потери вследствие растворимо-
растворимости СаСОз?
74
338. Сколько процентов составят потери за счет рав-
творимости AgCl при осаждении 0,15 г хлорид» эквива-
эквивалентным количеством нитрата серебра в 1 л раствора?
оЗУ. Сколько граммов кальция составят потери за
счет растворимости осадка СаСгО* при промывании
ciUU мл 1,6%-ного раствора (ЫН^гСгО^НгО?
34и. Сколько миллилитров воды потребуется при про-
промывании 0,?) г осадка MgiSiHiPOi-bHaO, чтобы потери
за счет растворимости не превышали 0,05%?
.341. сколько миллилитров 0,1 н. (iNihUjjSC^ нужно
прибавить к 3U0 мл воды, чтобы при промывании осадка
0,5 г BaSO4 этим раствором потери за счет растворимо-
растворимости не превышали 0,017о <
342. Сколько миллилитров 25%-ного NH3 нужно до-
добавить к 1DU мл промывной жидкости, чтобы при про-
промывании осадка MgNH^PO* потери за счет раствори-
растворимости составили не оолее 0,0001 г MgO?
543. Сколько процентов составят потери при промы-
промывании 3U0 мл воды осадка АЦОН)а> полученного и*
U.1UUU г A12CV
344. Из навески технического сульфида натрия
0,3001) г после окисления сульфида до сульфата получили
0,8250 г babCV Определить процентное содержание се-
серы и сульфида натрия и сравнить его с теоретическим
содержанием.
345. Сколько процентов NaaSaCVbriiO содержится в
образце технического тиосульфата натрия, если нз навес-
навески препарата 0,1852 г после окисления ?>i^jj~ до i»U'~
получили осадок BaSO* 0,3448 г?
346. При анализе технических алюмокалневых квас-
квасцов навеску 2,Ь7 Ш г растворили в 1200 мл воды и осадили
сульфат оария из 20 мл полученного раствора.
Сколько процентов алюминия содержится в препарате,
если масса прокаленного осадка БаЬО4 0,2b80 n
347. Навеску технического хлорида натрия 0,2120 г
растворили в 200 мл воды и из 2U мл полученного рас-
раствора осадили Na2n(UO?J3(C2H3O2jebHaU, масса кото-
которого оказалась 0,5578 г. Сколько процентов натрия в
пересчете на Na2O содержится в исследуемом продукте?
348. Из навески цемента 1,5000 г получили прокален-
прокаленный осадок МфРгО? 0,2105 г. Сколько процентов MgO
содержится в цементе?
349. Из навески 0,5000 г карналлита поел* раст-
растворения, осаждения KaPtCU и восстановления платины
75
получили 0,1308 г Pt. Вычислить процентное содержа-
содержание КС1 в карналлите. Пересчитать это содержание на
К2О.
350. Из навески 0,5302 г суперфосфата, содержащего
14,50% влаги, получили 0,3240 прокаленного осадка
МдгРаОу. Вычислить процентное содержание Р2О5 в су-
суперфосфате при расчете на влажное и на абсолютно
сухое вещество.
351. Из навески 0,1000 г апатито-нефелиновой руды,
содержащей в основе кристаллический апатит
ЗСаз(РО4J-Сар2, получили 0,9017 г осадка
(КН4)зР(МозОшL. Вычислить процентное содержание
ЗСаз(РО4J-СаРг в руде. Пересчитать это содержание
на Р2О5.
352. Из раствора хлорида магния получили осадок
оксихинолината магния Mg(C9HeONJ 0,2872 г. Сколько
граммов Mg в исследуемом растворе?
353. Из навески 0,2350 г фосфорита получили 0,2711 г
CaS>04 и 0,1693 г Mg2P2Oy. Вычислить процентное со-
содержание СаО и Р2О5 в фосфорите. Пересчитать резуль-
результаты анализа на абсолютно сухое вещество, если фосфо-
фосфорит содержит 5,42% влаги.
354. Каково процентное содержание Pb, Zn и Sn в
бронзе, если из образца 1,0000 г получили 0,0430 г
PbSO4) 0,1553 г Zn2P2O7 и 0,0632 г SnO2?
355. Из навески 1,2000 г специальной стали выдели-
выделили фосфор в виде (NH4KP(Mo3OioL и после соответст-
соответствующей обработки получили 0,4450 г весовой формы
РЬМоО4. Для определения никеля из этой же навески
стали осадили диметилглиоксимат NiCsHuNjCU массой
0,1812 г. Вычислить процентное содержание Р и Ni в
стали.
356. Из навески 1,0000 г стали получили осадок
SiO2 и WO3 общей массой 0,1021 г. После обработки
осадка HF и удаления SiO2 масса остатка WO3 стала
0,0712 г. Вычислить процентное содержание Si и W
в стали.
357. Из 2,7000 г сплава получили 0,2004 г А12О3 и
0,0518 г SiCb. Сколько процентов А1 и Si в сплаве?
358. Сколько процентов FeO содержится в образце
технического железного купороса, если из навески
0,9200 г в результате анализа получили 0,2545 г РегОз?
Вычислить процентное содержание FeSO4 • 7Н2О в иссле-
исследуемом продукте.
74
359. Из навески алюминиевого сплава 5,0000 г полу-
получили 0,5022 г ZnHg(SCNL, 0,1255 г Mg2P2O7 и 0,0560 г
SnCb. Сколько процентов Zn, Mg и Sn в сплаве?
360. Из навески 0,1500 г серного колчедана получили
осадок BaSO4 0,5155 г. Сколько процентов серы в кол-
колчедане? Пересчитать содержание серы на абсолютно су-
сухое вещество, если влажность колчедана 2,55%.
361. Вычислить процентное содержание Со в сплаве,
если из навески 0,2100 г после осаждения кобальта
а-нитрозо-р-нафтолом получили прокаленный осадок.
Со3О4 0,1012 г?
362. Сколько процентив Na2SO4 и NaCl в техническом
сульфате натрия, если из навески 0,3500 г было получе-
получено 0,5032 г BaSO4 и 0,1304 AgCl. Пересчитать содержа-
содержание Na2SO4 и NaCl на абсолютно сухое вещество, если
влажность продукта 10,98%.
363. Вычислить процентное содержание Ag, если из
навески анализируемого сплава 0,2466 г после соответ-
соответствующей обработки получили осадок AgCl 0,2675 г-
364. Вычислить процентное содержание NaCl в тех-
техническом хлориде натрия, если из навески 0,3000 г по-
получили осадок AgCl 0,6280 г? Каково содержание NaCl
в абсолютно сухом веществе, если влажность техниче-
технического продукта 3,58% ^
365. Из навески 0,4500 г суперфосфата с влажностью
11,52% получили 0,1136 г Mg2P2O7. Вычислить процент-
процентное содержание Р2О5 во влажном и абсолютно сухом
суперфосфате.
366. Рассчитать процентное содержание MgO в иссле-
исследуемом образце после прокаливания, если до прокали-
прокаливания навеска состояла из 36,00% MgCO3, 51,00%
Mg(OHJ, 10,00% Н2О и 3,00% SiO2.
367. Из навески 0,8000 г силиката получили осадок
полуторных окислов (Al2O3+Fe2O3+TiO2) 0,2566 г.
Сколько процентов А12О3 в силикате, если дополнитель-
дополнительный анализ показал, что образец содержит 0,61% Fe и
0,42% Ti?
368. Из навески известняка 5,0000 г получили прока-
прокаленные осадки 0,1080 г Fe2O3 и 0,2660 г Mg2P2O7. Фильт-
Фильтрат, полученный после осаждения MgNH4PO4, разбави-'
ли до 200 мл и из 20 мл раствора осадили СаСгС^. Окса-
лат кальция превратили в CaSO4 массой 0,6105 г.
Вычислить процентное содержание FeO, MgO и СаО в
известняке.
77
369. Вычислить процентное содержание Fe3O4 в маг-
магнитном железняке, если из навески руды 0,5000 г полу-
получили 0,3989 г Fe2O3.
370. Из 25 мл раствора сульфата магния получили
осадок BaSO4 0,3247 г. Сколько граммов Mg2P2O7 полу-
получится из 10 мл этого же раствора MgSO4?
371. Из навески А1РО4 получили 0,1126 г Mg2P2O7.
Сколько граммов А12О3 получится из этой же навески?
372. Навеску каменного угля в 1,0000 г высушили до
постоянной массы 0,9678. Из этой навески после соответ-
соответствующей обработки получили осадок 0,2531 г BaSO4.
Сколько процентов влаги содержал образец? Вычислить
процентное содержание серы во влажном и абсолютно
сухом веществе.
373. Из навески 0,5502 г доломита получили осадки:
0,0552 г А1(С9Н6Ж))з, 0,1650 г СаО и 0,2465 №g2P2O7.
Вычислить процентное содержание А12О3, СаСО3 и
MgCO3 в образце доломита?
374. Из навески 0,4525 г криолита получили 0,0809 г
А12О3. Вычислить процентное содержание Na3AlF6 в кри-
криолите?
375. Из навески 1,2250 г суперфосфата получили
прокаленный осадок CaSO4 0,3756 г. Вычислить процент-
процентное содержание Са3(РО4J в суперфосфате. Чему равно
это содержание в пересчете на СаО?
376. Вычислить число молекул воды в молекуле кри-
кристаллогидрата хлорида бария, если из его навески
0,3245 г получили 0,3100 г BaSO4.
377. Сколько молекул воды содержится в молекуле
кристаллогидрата сульфата магния, если из его навески
0,5520 г получили 0,2492 Mg2P2O7?
378. Сколько молекул воды содержится в молекуле
кристаллогидрата сульфата алюминия, если из его навес-
навески 0,7000 г получили 0,0535 г А12О3?
379. Вычислить число молекул воды в молекуле кри-
кристаллогидрата сульфата кобальта, если из его навески
0,4800 г получили 0,3985 г BaSO4.
380. Вычислить число молекул воды в молекуле
кристаллогидрата сульфата хрома, если из его навески
0,8500 г получили 0,1803 г Сг2О3.
381. Вычислить число молекул воды в молекуле же-
лезоамтионийных квасцов, если из навески квасцов
0,5020 г получили 0,0891 г Fe2O3.
7в
382. Вычислить число молекул воды в молекуле кри-
кристаллогидрата сульфата марганца, если из его навески
0,3240 г получили 0,3137 г BaSO4.
383. Сколько молекул воды в молекуле кристалло-
кристаллогидрата хлорида кальция, если из его навески 1,0000 г
получили 0,2560 г СаО?
384. Из навески частично выветрившегося сульфата
натрия 0,4000 г получили 0,3262 г BaSO4. Сколько моле-
молекул воды содержится в молекуле кристаллогидрата?
385. Вычислить число молекул воды в молекуле кри-
кристаллогидрата нитрата никеля, если из его навески
0,3000 г получили осадок диметилглиоксимата никеля
0,2980 г.
386. Из образца технического сульфата цинка 1,1350 г
получили осадки: 0,5298 г Zn2P2O7 и 0,9052 г BaSO4. Вы-
Вычислить процентное содержание основного компонента
ZnSO« и примеси K2SO4 в техническом продукте.
387. Из навески смеси х. ч. NaCl и КС1 общей массой
0,1225 г получили осадок AgCl 0,2850 г. Вычислить про-
процентное содержание NaCl и КС1 в смеси.
388. Из навески 1,0000 г силикатной породы получили
смесь солей NaCl и КС1 общей массой 0,1015 г. Из этой
смеси получили осадок I^PtCb 0,2040 г. Вычислить про-
процентное содержание Na2O и КаО в силикате.
389. Смесь х. ч. AgCl и AgBr содержит 65,85% Ag.
Вычислить процентное содержание брома и AgBr
в смеси.
390. Из навески 0,4500 г смеси х. ч. NaCl и Nal по-
получили осадок, содержащий AgCl и Agl, обшей массой
0,9785 г. Вычислить процентное содержание 12 и Nal в
исходной смеси.
391. Из навески 1,5000 г силиката получили смесь
NaCl и КС1 общей массой 0,1322 г. Из этой смеси осади-
осадили 0,1022 г КС1О4. Вычислить процентное содержание
Na2O и КгО в силикате.
392. Из навески 0,7500 г смеси х. ч. Na2SO4 и K2SO4
получили осадок BaSO.( 0,1120 г. Вычислить процент-
процентное содержание Na2SCh и K2SO4 в исходной смеси.
393. Из навески 0,5000 г смеси х. ч. СаО и ВаО по-
получили 0,9151 г смеси CaSCU и BaSO4. Найти процентное
содержание Са, Ва и СаО в исходной смеси.
394. Из образца 0,5000 г цинковой руды получили
осадок 2пгР2О7 и СсЬРгО? общей массой 0,7532 г. Из
этой смеси выделили сульфид цинка и прокалили его
7»
до ZnO, масса которого оказалась 0,3942 г. Вычислить
процентное содержание Zn и Cd в руде.
395. Кристаллогидрат магния Mg(NO3h-6H2O со-
содержит примесь хлорица магния MgCl2 • 6Н2О. Вычис-
Вычислить процентное содержание компонентов в препарате,
если из навески 0,2812 г получили прокаленный осадок
Mg2P2O7 0,1242 г.
396. Из образца 0,4925 г смеси ZnS и CdS получили
осадок Zn2P2O7 и Cd2P2O7 общей массой 0,6895 г. Вычис-
Вычислить процентное содержание ZnS и CdS в образце.
397. Из навески 0,9876 г смеси х. ч. СаСО3 и MgCO3
после прокаливания получили смесь СаО и MgO общей
массой 0,5123 г. Вычислить процентное содержание Са
и Mg в исходной смеси.
398. Навеску 0,7000 г х. ч. Fe2O3 и А12О3 восстановили
в токе водорода. Конечный продукт, содержащий Fe и
А12Оз, имеет общую массу 0,6350 г. Вычислить процент-
процентное содержание Fe2O3 и А12О3 в исходной смеси.
Глава VIII
ТИТРИМЕТРИЧЕСКИЙ (ОБЪЕМНЫЙ!) АНАЛИЗ
Вопросы для самопроверки
Метод нейтрализации
1. Какие требования предъявляются к реакциям, ис-
используемым в объемном анализе?
2. Что называется грамм-эквивалентом вещества?
Как определяется грамм-эквивалент в реакциях нейтра-
нейтрализации?
3. Чему равны грамм-эквиваленты кислот, оснований
и солей в следующих реакциях:
a) H2SO4 + Ca(OHJ=CaSO4
б)
в)
г) H4P2O7+2NaOH==Na2H2P2O7
д) H4P2O7+3NaOH = Na3HP2O7+3H2O
е) H4P20,+4Na0H=Na4P207+4H20
ж) 2AI(OHK + 3H2SO4~=Al2(SO4K-h6H2O
з) H2SO4+NaCl=NaHSO4
60
4. Что такое рабочий (стандартный, титрованный)
раствор? Какие концентрации рабочих растворов обыч-
обычно используют в методе нейтрализации?
5. Как выражают концентрацию растворов в титри-
метрическом анализе? Дать определение понятий: титр,
нормальность, нормальность с поправочным коэффици-
коэффициентом, титр по определяемому веществу.
6. Написать формулу для расчета нормальности рабо-
рабочего раствора, если известен: а) титр раствора; б) титр
раствора по определяемому веществу.
7. Написать формулу для расчета результатов прямо-
прямого титрования, если концентрация рабочего раствора вы-
выражена в единицах: а) нормальности; б) титра; в) титра
по определяемому веществу.
8. Написать формулы для расчета результатов титр-о-
ваний: а) прямого; б) обратного; в) по методу замеще-
замещения, если концентрация рабочего раствора выражена в
единицах нормальности.
9. Что называется кривой титрования?
10. Что такое точка эквивалентности? В какой области
рН (кислой, нейтральной, щелочной) лежит точка экви-
эквивалентности при титровании раствора: а) сильной кисло-
кислоты сильным основанием; б) слабой кислоты сильным
основанием; в) слабого основания сильной кислотой?
11. В каком из перечисленных титрований точка эк-
эквивалентности соответствует рН 7, рН>7 и рН<7:
a) HNOa+NaOH; б) HCOOH+NaOH; в) HIO.,+NaOH;
г) СН3СН,СООН+КОН; д) NH3+HC1; e) КОН+НС1;
ж) H2NC6H4SO4H + NaOH; з) C6H5NH, + HC1;
и) C5H,N+HC1; к) C2H5NHo+HCl; л) KCN+HC1;
м) Na2CO3+HCl?
12. Что называется скачком титрования?
13. Какие факторы (константа диссоциации кислоты
или основания, температура, концентрация растворов,
объем титруемого раствора, скорость титрования) влия-
влияют на: а) положение точки эквивалентности; б) величи-
величину и положение скачка титрования?
14. Как практически фиксируется точка эквивалент-
эквивалентности?
15. Какие вещества называются кислотно-основными
индикаторами?
16. Какие соединения используются в качестве кис-
кислотно-основных индикаторов?
81
17. Как объясняется изменение окраски индикатора с
точки зрения ионной теории? Указать недостатки этой
теории.
18. Как объясняется изменение окраски индикатора
с точки зрения ионно-хромофорной теории?
19. Какие группы являются хромофорами и какие —
ауксохромами: —ОН, — СН,, O = N—, —NH2, —N=N—,
= N—NH—, — ОСНз, —N(CH3J? Как изменяются свой-
свойства соединений при наличии этих групп в молекуле?
20. Назвать основные характеристики кислотно-ос-
кислотно-основных индикаторов.
21. Что называют показателем титрования рТ и интер-
интервалом перехода индикатора?
22. Какая связь существует между константой диссо-
диссоциации и интервалом перехода индикатора?
23. Какими способами подбирают индикаторы при
титровании по методу нейтрализации?
24. Какой из индикаторов (метиловый оранжевый,
фенолфталеин, лакмус) пригоден для определения контта
титрования: а) С«Н5СООН4-NaOH; б) HCOOH4-NaOH;
в) HNO3+NaOH; г) NH3+HC1; д) СНяШя+НС!;
е) CeHeNH,+HCl; ж) Na2CO,+HCl; з) Na2CO3+2HCI;
и) KCN+HC1; к) Na3PO4+HCl; л) Na3PO4+2HCI?
25. Назвать типы индикаторных ошибок.
26. Какие индикаторные ошибки следует учитывать
при титровании с метиловым оранжевым и фенолфталеи-
фенолфталеином: a) HCl+NaOH; б) CH3COOH+NaOH; в) NH3+
+НС1; г) Na2CO3+HCl?
27. При каком условии можно провести ступенчатое
титрование многоосновных кислот или смеси кислот?
28. Какие из следующих кислот: Н2С2О4, Н2СО3,
Н3РО4, Н4Р2О7, H2B4O7, Н2Те04 — можно оттитровать как
одно-, двух-, трех-, четырехосновные с погрешностью не
больше чем I % ?
29. Вычислить грамм-эквивалент Н3РО4 в методах,
основанных на осаждении: а) фосфоромолибдата аммо-
аммония и последующем его растворении; б) Аосфата кальция
с последующим титрованием выделившейся соляной кис-
кислоты.
30. Как приготовить рабочие растворы: а) 0,1 н. НС1;
б) 0,1 н. NaOH; в) 0,1 н. Na2COa; г) 0,1 н. H2SO4. Как
установить их точную нормальность?
31. Назвать основные установочные вещества для оп-
определения нормальности: а) кислоты; б) щелочи.
•2
32. Как определить содержание: а) КгСО8 и КНСО3;
б) NaOH и 1\а2СОз, если они присутствуют совместно?
33. Раствор, в котором может находиться одно из ве-
веществ: NaOH, NaHCO3, Na2CO3 — или одна из смесей:
NaOH+NaaCO3; Na2CO3+NaHCO3 —титруется раство-
раствором НС1 с фенолфталеином (ф-ф) и метиловым оранже-
оранжевым (м. о), применяемыми последовательно. Какое ве-
вещество или какая смесь титруется, если объем израсхо-
израсходованной кислоты составляет:
Вариант ....абвгдежзик л
УНС1/ф.ф. мл. . . 10 7 18 13 — 20 9 10 — 25 23
^HCi/м.о. мл--- 10 15 6 L16 - 9 23.. 15 8 J
34. Привести примеры титрований: а) прямого;
б) обратного; в) по замещению — в методе нейтрализа-
нейтрализации.
35. Какими способами определяется содержание:
а) аммиака в солях аммония; 6) карбонатов в щелочи;
в) СО2 в воде; г) азота в органических соединениях?
Записать уравнения реакций и расчетные формулы.
36. Что такое жесткость воды? Как определяется вре-
временная и постоянная жесткость воды?
Методы осаждения и комплексообразования
37. Привести примеры реакций титрования, основан-
основанных на образовании осадка.
38. Какие требования предъявляются к реакциям в
методах осаждения? Образование kjkhx осадков:
AgCl, Fe(OHK, CaSO4, PbCl2, AgBr, A1(OHJ3 — исполь-
используется при титровании по методу осаждения?
39. Вычислить грамм-эквиваленг определяемого ве-
вещества (указано первым) в следующих реакциях:
NaCl + AgNOs = AgCl \ + NaNO
a
NH4SCN + AgNO, = AgSCN | + NH4
3ZnbO4 -f 2K4 [Fe (CN л\ = K2Zn8 [Fe iCN )e]21+3K2SO4
MgCl,4-NH4OH4-Na2HPO4=MgNH4PO«|+H,O + 2NaCl
40. Как зависит величина скачка титрования в мето-
методах осаждения от температуры, произведения раствори-
растворимости, ионной силы раствора, концентрации растворов?
83
41. В каком случае скачок титрования будет наи-
наибольший и в каком — наименьший, если раствором
AgNOa титруют: а) 0,1 н. растворы KI, KBr, KC1;
б) 0,01 н. KI, 0,1 н. KI, 1 н. KI?
42. В каком порядке будут выпадать осадки при ар-
гентометрическом определении смеси, содержащей ионы
С1~, Br-, I-, одинаковой концентрации? Какой вид будет
иметь кривая титрования?
43. Вывести формулы для вычисления рС1 при титро-
титровании 0,1 н. NaCl 0,1 н. раствором: a) AgNOa;
б) Hg2(NO3J, если определяемое вещество оттитровано
на 99,9; 100 и 100,1%?
44. Как приготовить рабочий раствор AgNO3 и уста-
установить его нормальность? Каковы условия хранения это-
этого раствора?
45. Какие способы фиксирования точки эквивалент-
эквивалентности применяются при аргентометрическом определе-
определении галогенидов?
46. В чем сущность безындикаторного метода титро-
титрования хлоридов раствором AgNO3?
47. В чем сущность титрования до «точки просветле-
просветления»? Для определения каких ионов этот метод приме-
применяется на практике?
48. Назвать индикаторы, которые применяются при
аргентометрическом определении галогенидов.
49. В чем сущность определения галогенидов по ме-
методу: а) Мора; б) Фаянса; в) Фольгарда? Назвать рабо-
рабочие растворы, индикаторы. Записать основные уравне-
уравнения реакций.
50. Указать причины индикаторных ошибок при тит-
титровании по методу: а) Мора; б) Фольгарда?
51. В каких условиях применяют метод Мора? Какие
ионы мешают определению этим методом?
52. Какие ионы: Cl~, Bi™, I~, SCN~, Ag+ — можно on
ределить титрованием по методу Мора? Дать обоснова-
обоснование вашему выбору.
53. Как определяется концентрация ионов Ag+ и С1~
роданометрическим методом? Записать соответствующие
расчетные формулы.
54. Сравнить преимущества и недостатки методов
Мора и Фольгарда при определении галогенидов.
55. При титровании какого раствора точность родано-
метрического определения будет выше: NaCl или NaBr
84
одинаковой концентрации? Какие меры принимаются для
более четкого фиксирования точки эквивалентности?
56. Каков механизм действия адсорбционных индика-
индикаторов?
57. Что такое изоэлектрическая точка? Что происхо-
происходит с осадком, находящимся в растворе, при переходе
через изоэлектрическую точку?
58. Какие требования предъявляются к адсорбцион-
адсорбционным индикаторам? Почему хлориды нельзя титровать с
эозином?
59. Какие адсорбционные индикаторы используются
при определении: а) хлоридов; б) бромидов; в) иодидов?
60. В чем сущность метода меркурометрии? Назвать
рабочие растворы, индикаторы. Записать основное урав-
уравнение реакции.
61. Как приготовить рабочий раствор Hg2(NO3b и
установить его нормальность? Каковы условия хранения
этого раствора?
62. При титровании какого раствора скачок титрова-
титрования будет наибольший, если титруют раствором
Hg2(NO3J: а) 0,01 н. NaCl, 0,1 н. NaCl и 1 н. NaCl;
б) 0,1 н. растворы NaCl, NaBr, Nal?
63. Каков механизм действия железороданидного ин-
индикатора при меркурометрическом титровании галогени-
дов?
64. Какие вещества можно определить методом мер-
меркурометрии?
65. Сравнить достоинства и недостатки методов мер-
меркурометрии и аргентометрии.
66. Как фиксируется точка эквивалентности с помо-
помощью внешних индикаторов? Привести примеры титрова-
титрования с внешним индикатором.
67. В чем сущность гексацианоферроатометрии? На-
Назвать рабочие растворы, индикаторы. Записать основное
уравнение реакции определения цинка.
68. Как приготовить рабочий раствор K4Fe(CNN и
установить его нормальность?
69. В какой среде будет наименьшая ошибка при оп-
определении цинка осаждением в: а) слабокислой среде;
б) нейтральной среде; в) щелочной среде?
70. Каков принцип действия индикатора — дифенил-
дифениламина при определении цинка с ферроцианидом калия?
85
71. В чем сущность метода меркуриметрии? Назвать
рабочие растворы, индикаторы. Записать основное урав-
уравнение реакции определения Вг~.
72. Как приготовить рабочий раствор Hg(NO3J и
установить его нормальность? Каковы условия хранения
этого раствора?
73. Каков механизм действия индикаторов метода
меркуриметрии: а) нитропруссида натрия; б) дифенил-
карбазона?
74. При каких условиях выполняется титрование гало-
генидов по методу меркуримеурии?
75. Каковы преимущества и недостатки меркуримет-
рического метода анализа?
76. Что такое комплексоны? К какому классу соеди-
соединений они относятся и каковы их свойства?
77. В чем сущность метода комплексонометрии? На-
Назвать рабочие растворы, индикаторы. Записать основное
уравнение реакции определения Mg2+.
78. Как приготовить рабочий раствор трилона Б и
установить его нормальность?
79. Какие металлохромные индикаторы вы знаете?
Каков механизм их действия?
80. Как зависит величина скачка титрования в ком-
комплексонометрии от температуры, константы устойчивости
комплексного соединения, концентрации растворов, рН
среды?
81. В каком случае величина скачка титрования ока-
окажется наибольшей и в каком — наименьшей, если титру-
титруют раствором трилона Б: а) 0,01 М растворы MgSO4,
COSO4, Z11SO4; б) 0,1 М и 0,01 М растворы 2nSO4?
82. Вывести формулы для вычисления рМе при титро-
титровании 0,01 М СаС12 0,01 М трилоном Б, если определяе-
определяемое вещество оттитровано на 99,9; 100; 100,1%.
83. Почему комплексонометрическое определение
ионов Со2+, Zn2+, Gd2+ проводят в щелочной среде? Какой
аналитический прием используют для предупреждения
образования осадков гидроокисей металлов в этом слу-
случае?
84. Какие ионы определяются с помощью комплексо-
нометрического титрования в кислой среде?
85. Как определить жесткость воды с помощью три-
трилона Б? Привести расчетную формулу. Укаватк инди-
индикаторы.
86
86. Какие вещества определяются комплексонометри-
чески методами прямого и обратного титрований и по
•амещению?
87. Охарактеризовать особенности комплексономет-
рического определения: а) Со; б) Ni; в) РЬ; г) Cd;
д) Zn; e) Fe; ж) SO*—, з) РЬ из осадка PbSO4; и) Mg из
осадка
Методы окисления — восстановления (оксидиметрия]
88. Какие требования предъявляются к окислительно-
восстановительным реакциям, используемым в объемном
анализе?
89. Перечислить основные окислительно-восстанови-
окислительно-восстановительные методы объемного анализа. Какие рабочие рас-
растворы и индикаторы применяются в каждом из этих ме-
методов?
90. Дать краткую характеристику (основное уравне-
уравнение реакции, рабочие растворы, индикаторы, области
применения) методов окисления—восстановления:
а) перманганатометрии; б) хроматометрии; в) иодомет-
рии; г) броматометрии; д) ванадатометрии; е) церимет-
рии.
91. Как определяется грамм-эквивалент в реакциях
окисления — восстановления? Определить величину
грамм-эквивалента окислителя и восстановителя пои ти-
титровании: a) I24-Na?S2Ov. б) НоСп04+КМп04;
в) FeSO;+KMnO4; г) H2O2-f-KMnO4; д) FeCl24-K2Cr207.
92. В каких координатах строятся кпивые титрования
в методах окисления — восстановления?
93. От каких факторов зависит величина скачка тит-
титрования в методе окисления — восстановления?
94. В каком случае величина скачка титрования будет
наибольшей ({Н+]= 1 г-ион/л): а) 0,1 и. FeSOt титпуется
0.1 н. КМпО,. или 0,01 н. FeSO/, титруется 0,01 н. КМпО4;
б) 0,1 н. FeSO4 титпуется 0,1 н. КМпО. или 0,1 н. FeSO4
титруется 0,1 н. КгСьО?: в) 0,1 н. FeSO* титруется 0,1 н.
КгСггО7 или 0,01 н. FeSO4 титруется 0,01 и. К2Сг207?
95. Написать формулы для расчета окислительно-вос-
окислительно-восстановительного потенциала Е при титровании 0,1 М
FeSO4 0,1 М раствором: а) КМпО4; б) КзСг?07, если оп-
определяемое вещество оттитровано на 99,9; 100,0: 100,1%.
96. Как влияет введение в раствор ионов POJ~ и F~
87
на величину скачка титрования при перманганатометри-
ческом определении железа?
97. Указать способы фиксирования точки эквивалент-
эквивалентности в методах окисления — восстановления.
98. Какие индикаторы используются при оксидимет-
рических титрованиях?
99. Объяснить принцип действия редокс-индикаторов.
Указать наиболее распространенные из них.
100. Назвать основные характеристики редокс-инди-
редокс-индикаторов.
101. Что называется интервалом перехода редокс-ин-
редокс-индикаторов? Чему он равен?
102. Как подбираются редокс-индикаторы окислитель-
окислительно-восстановительного титрования?
103. От каких факторов зависит скорость реакции
окисления — восстановления?
104. Какие реакции называются автокаталитическими?
105. Какие реакции называют индуцированными? Как
объясняются реакции сопряженного окисления?
106. Можно ли по точной навеске КМпО4 приготовить
его титрованный раствор?
107. Написать уравнения реакций возможного разло-
разложения перманганата калия в водном растворе. Что спо-
способствует протеканию этих реакций?
108. Какие вещества используются для установления
титра перманганата калия?
109. Каковы условия (температура, рН, скорость до-
добавления титранта) титрования оксалата натрия перман-
ганатом калия?
110. Почему при титровании щавелевой кислоты пер-
манганатом калия первые капли обесцвечиваются мед-
медленно, но затем обесцвечивание происходит практически
мгновенно?
111. Чему равен грамм-эквивалент перманганата ка-
калия при проведении реакции в кислой и нейтральной сре-
средах. Записать соответствующие уравнения реакций.
112. Привести примеры титрований: прямого, обрат-
обратного и по методу замещения — в методе перманганато-
метрии.
113. Как перманганатометрически определяют содер-
содержание: а) железа в соли Мора; б) железа в рудах;
в) перекиси водорода; г) нитритов; д) кальция; е) МпО2
в пиролюзите; ж) К2СГ2О7?
88
114. Написать расчетные формулы для указанных в
п. 113 определений.
115. Каков механизм сопряженного окисления ионов
С1~ при титровании Fe (II) перманганатом калия в со-
солянокислой среде?
116. Указать назначение каждого из компонентов за-
защитной смеси в перманганатометрическом определении
Fe (II).
117. Как приготовить титрованный раствор бихромата
калия?
118. Указать преимущества и недостатки методов
перманганатометрии и хроматометрии.
119. Как проводят определение Fe (II) методом хро-
хроматометрии с внешним и внутренним индикаторами?
120. Написать формулы для расчета содержания
Fe (II) и Fe (III) при их совместном присутствии мето-
методом хроматометрии.
121. Для какой цели прибавляют фосфорную кислоту
при хроматометрическом определении Fe (II)?
122. Как приготовить рабочие растворы иода и тио-
тиосульфата натрия и установить их нормальность?
123. За счет каких процессов происходит изменение
титра растворов тиосульфата натрия и иода при их хра-
хранении?
124. При каких условиях (температура, кислотность
раствора и т. д.) выполняются иодометрические титро-
титрования?
125. Почему иодометрические определения нельзя
проводить в среде с рН^8 и рН^О?
126. На чем основано иодометрическое определение:
а) окислителей; б) восстановителей; в) кислот;г) «актив-
«активного» хлора в хлорной извести; д) сульфата; е) арсенита
и арсената; ж) меди; з) бихромата калия и Fe (III) при
их совместном присутствии; и) МпО2 в пиролюзите?
127. Записать расчетные формулы для указанных в
п. 126 определений.
128. Объяснить направление протекания реакции, ис-
используемой для иодометрического определения меди.
129. Чему равен грамм-эквивалент свинца при опре-
определении его методом иодометрии, основанном на следу-
следующих реакциях:
2РЬСЮЛ +2Н+ =2РЬа+ + СгаО27-+НаО
2H3I 7H
130. Чему равен грамм-эквивалент Na2SO4 при иоДо-
метрическом его определении, основанном на следую-
следующих реакциях:
+Ва2+(изб)=BaSO4
Ваа+ + CrO^- (изб)=
131. Как приготовить основной рабочий раствор а ме-
методе броматометрии и установить его нормальность?
132. Какие индикаторы используются в броматометри-
ческом методе анализа? На чем основано их действие?
133. Как броматометрически определяют содержание:
а) магния; б) алюминия; в) сурьмы?
134. Написать расчетные формулы для указанных в
п. 133 определений.
Решения типовых задач
Пример 1. Чему равен грамм-эквивалент КМвО» в следующей
реакции:
Сг2 (SO4K + 2KMnO4 + 8KOH = 2К2СгО4 + 2МпО21 +
+ 3K2SO4 + 4Н2О
Решение. Запишем уравнение соответствующей пол у реакции
+ 2Н2О + 3е — МпО2+4ОН-
На восстановление одной молекулы перманганата калия до
МпОз необходимо три электрона, следовательно,
Л* 158,04
Пример 2. Определить грамм-эквивалент свинца при иодомет-
рическом определении его по схеме
PbCrO4 + 31- + 8Н+ = Cr3+ + 4HSO + 3/212
Решение. Согласно по л у рее юане
\ + 8Н+ + Ъе -
*§
но 1 г-иои хромата реагирует с 1 г-ионом РЬ5+, следовательно,
Пример 3. Сколько миллилитров концентрированной соляной
кислоты (пл. 1.17 г/см3) требуется для приготовления 500 мл 6,1 н.
раствора?
Решение. Молярная концентрация раствора НС1 с пл. 1,17
равна 10,97 моль/л. Очевидно, JVHci = AfHci= 10,97. Поскольку число
грамм-эквивалентов кислоты при разбавлении не меняется, можно за-
записать:
10,97-VHC1= 500-0,1.
отсюда
., 500-0.1
^ 456
Пример 4, На титрование 2,025 г Na2C2O4 идет 24,10 мл рас-
раствор! KMnOi. Рассчитать: а) титр раствора КМпОг, б) титр KMnOi
по NajCiO*; в) нормальность KMnOi.
Решение. Вычисления целесообразно вести в следующей по-
последовательности:
7-кмпО/м со = ^^ = ^-=0,08403 г/мл,
KMnO./NaX.O. VKMn0 24,10
^KMnO./tfa.CO
•"KMnO, = ч
•^NCO
поскольку QjO^ =2CO2+2«,
0,08403-1000
"кмпп = =-=1,254 г-экв/л.
КМпО, 6700
Так как MnO^ -f 8H+ + 5е = Мп2+ + 4Н2О
158,038
- кмпо. 158,038
5КМп0, = 1 = 1 = 31,61 г,
^ЭкмпО. 1,254-31,61
1000
=0,03964 г/мл.
Пример 5. Какую навеску негашеной извести, содержащей 90%
СаО и 10% индифферентных примесей, требуется взять для ана-
анализа, чтобы на ее нейтрализацию израсходовать 20,00 мл раствора
НС1 с титром по СаО 0,009000 •?
* Титр выражен всюду в г/мл.
91
Решение. Найдем число граммов СаО в навеске негашеной
извести:
Тогда навеска негашеной извести определится как
gc»O100 ^Hd/CaO^HCi100 0,009000-20,00-100
^изв~ 90 ~ 90 ~ 90 -0.2 г.
Пример 6. Какую навеску вещества, содержащего 60% NaCl и
37% КС1 (остальное — индифферентные примеси), следует взять для
анализа, чтобы расход 0,1 н. AgNOs на титрование не превышал
20,00 мл?
Решение. Если для анализа взято х г вещества, то число
грамм-эквивалентов NaCl и КС1, содержащееся в навеске, равно
"NaC1 = 100.3NaC1 " Лкс1~100-
Кроме того,
"NaCl + "КС1 = "AgNO.i
где Яд-но = —— — число грамм-эквивалентов раствора
1000
AgNCh, затраченное на титрование.
Сочетание этих соотношений дает
JC-60 Jf-37 ™AgNO, AgNO,
loo- 3NaC1 + юо-зКС1 = looo •
Подставляя численные значения, получаем
JC-60 jc-37 0,1-20,00
1- = — ¦ , x = 0,1313 г.
100-58,443 100-74,555 1000
Пример 7. Навеска хлорида аммония обработана избытком ще-
щелочи. Выделившийся аммиак поглощен 50,00 мл 0,5120 и. НС1 и по-
полученный раствор разбавлен до 250,0 мл. На титрование 50,00 мл
полученного раствора израсходовано 25,73 мл 0,05 н. КОН (К* =
= 0,9740). Сколько граммов NH3 содержал хлорид аммония?
Решение. Число грамм-эквивалентов НС1, введенное с исход-
исходным раствором кислоты, составит
"' ~ юоо •
С учетом разбавления этого раствора до 250 мл (Уовщ) найдем
число грамм-эквивалентов НС1, взятое для анализа (гц),
1000
o6al
* К ~ поправочный коэффициент к нормальности.
где Va.niiKB — объем разбавленного раствора HCI, взятый для ана-
анализа.
Число грамм-эквивалентов КОН (л2), израсходованное на тит-
титрование избытка кислоты, определим из формулы
1000
Очевидно, Л!— я2 = Пз, т. е. числу грамм-эквивалентов аммиа-
аммиака, содержащегося в аликвотной части раствора. Отсюда
Уоб'-Д о
1000 Vo6ui 1000 }V,m NH'-
Подставляя численные значения, получаем
@,5120-50,00-50,00/250—0,05-0,9740-25,73J50/50,00
1000
E,120—1,253)-17,03-5 3,867-17,03^
1000 1000
= 0,3293 г.
Пример 8. В мерной колбе емкостью 500 мл растворили
5,3600 г KCI. К 25,00 мл раствора прибавили 50,00 мл 0,1 н. AgNO3
(/(=0,8470). На титрование избытка Ag+ расходуется 23,88 мл рас-
раствора роданида аммония G"NHiSeN/Ag:== 0.01068). Вычислить про-
процентное содержание КС1 в образце.
Решение. Определим число грамм-эквивалентов AgNOs (ni),
введенное с раствором AgNOa:
N
1000
Число грамм-эквивалентов (пг) NH4SCN, израсходованное на
титрование избытка иона Ag+, составит
Тогда число грамм-эквивалентов (n3) KC1 определится как раз-
разность:
П3 = Л2Л1= ^
Процентное содержание КС1 в образце вычислим по формуле
х
Гооо
.SCN \
)
0,1-0,8470-50,00 0,01068-23.88 \
юоо
Пример 9. Для определения постоянной жесткости воды к
100 мл воды прибавили 30,00 мл раствора Na2CO3(Jrf|a1co3/CaO =
= 0,001025), полученную смесь выпарили досуха и сухой остаток
растворили в дистиллированной воде. На титрование фильтрата из-
израсходовано 25,00 мл НС1 (Т'на/СаО = 0,000812). Сколько милли-
миллиграммов СаО в 1 л воды?
Реше ние. Число миллиграммов СаО, содержащееся в 100 мл
воды, взятой для анализа, находим как разность:
Отсюда содержание СаО (мг) на 1 л воды составит
1000
HCl) W00-—^— МГ/л,
«С.0 ™ @,001025-30,00— 0,000812-25,00) -j^p-1000 -
—=A,025-30,00—0,812-25,00) 10 = 104,5 мг.
Пример 10. Навеску 1,80 г сплава, содержащего 1,50% хрома,
растворили в HjSOi и окислили ионы Сг3+ до С^О?"- К раствору
добавили 25,00 мл раствора FeSO4; на титрование избытка послед-
последнего израсходовали 5,00 мл раствора КМпОЧ. Предварительно опре-
определили, что на титрование 25,00 мл раствора FeSO4 расходуется
24,80 мл раствора КМпО4. Рассчитать: а) Ткто/С(; б) ^КМпО^
в) TVeSO,-
Решение. Для определения условного титра 7"кМпО,/Сг не'
обходимо вычислить число граммов хрома, содержащееся в навеске:
*Сг-1.50
gct ~ 100 '
а также объем раствора КМпО^, соответствующий содержанию хро-
хрома ?сг, г:
24,80 — 5,00 = 19,80 мл,
следовательно,
= ^СГ = !'п°,п'оп = 0,001364 г/мл.
кКМпО. 100-19,80
рассчитываем по формулам
Г00
' FeSO.
Учитывая, что
Сг2О^ + 14Н+ + <зе = 2Сг3+ + 7Н2О
Fe2+ = Fe^+ + в
можно записать: 3Сг = АСт/'6 = 17,332 и 3FeSC,4 = MFe.sc,4 =* 151 '^l-
Отсюда
0,001364-1000
*КМпО4 = 17^ = 0'07870 Г-9КВ/Л-
0,07870-24,80-151,91
ГР кп = ' ¦ = 0,01186 г/ил.
Fet>0, 25,00-1000
Пример 11. Чему равна индикаторная ошибка титрования 0,1 н.
НС1 0,1 н. раствором NaOH с метиловым красным (р2 =5)?
Решение. Поскольку титрование закончится при рН 5, то на-
наличие в растворе сильной кислоты вызовет Н+-ошибку (со знаком
«—», так как раствор недотитрован).
10Va lO1
Н+-ошибка = --100 = 100,
NV NV
где Vi — объем титруемой кислоты; Vi — общий объем раствора в
конце титрования.
Так как при титровании использовались растворы одинаковой
концентрации, то Vs=2V,i. Н+-ошибка равна
10-5-2Vi
Н+-ошибка = 100 = — 0,02%.
Ошибка мала, поэтому для титрования пригоден индикатор метило-
метиловый красный.
Пример 12. Можно ли оттитровать 0,02 и. NaOH 0,02н. раство-
раствором НС1 с: а) фенолфталеином (р7=9); б) метиловым оранжевым
(РГ=4)?
Решение, а) Точка эквивалентности достигается в этом слу-
случае при рН7. По окончании титрования (рН9) в растворе еще имеет-
имеется неоттитрованная сильная щелочь, которая вызовет ОН^-ошибку
ОН--ошибка = — 100 « — 100,
NV NV
ОН--ошибка » , ¦ 100 ^ — -^—^ 100 = - 0,1 %.
Следовательно, индикатор вполне пригоден для титрования.
б) В этом случае титрование заканчивается при наличии в рас-
растворе избытка сильной кислоты (рН 4), т. е. будет наблюдаться
Н+-ошибка (со знаком «+>, так как раствор перетитроаан):
10-*-2^1
Н+-ошибка «* — 100 « 1 %.
О |U^* г J
Большая ошибка не позволяет использовать индикатор метиловый
ераижевый в данном титровании.
#5
Пример 13. Вычислить ошибку титрования 0,1 н. этаноламина
0,1 н. раствором НС1 с: а) метиловым красным (р7"=5); б) фенол-
фенолфталеином (рГ=9).
Решение. Рассчитаем рН в точке эквивалентности. В этой
точке этаноламин нацело превращается в соль RNH3C1, которая под-
подвергается гидролизу:
RNHJ + HOHzTRNH3OH + Н+
0,05—х х х
• [RNH3OH][H+1 Ю-" ц
К 5510 10
Поскольку объем раствора при титровании удваивается,
,i ~ 0,05 моль/л. Подставляя равновесные концентрации в вы-
выражение для /Сгидр, находим
= 5,5-10-10.
0,05— х
Поскольку 0,05 — х « 0,05,
* =/5,5-10-10-5-10-2 = 5,24-10-6 г-ион/л,
рН = — lg[H+]= —lg E,24-10-6) = 6- 0,72 = 5,28.
а) При использовании метилового красного титрование заканчи-
заканчивается не при рН 5,28, а при рН 5,0, т. е. в растворе имеем неболь-
небольшой избыток сильной кислоты, которая вызовет Н+-ошибку:
10-5.21Л
Н+-ошибка = — 100= +0,02%.
Следовательно, индикатор метиловый красный пригоден для данно-
данного титрования.
б) При титровании с фенолфталеином по окончании титрования
(рН 9) в растворе еще имеется неоттитрованное слабое основание
RNH3OH, которое вызовет щелочную ошибку титрования:
ROH-ОШибка = 10Р*+РГ-14= Ю4-75 + 9-14 _ 10-0,25)
отсюда
lg (ROH-oшибка)= —0,25 = 1,75, ROH-ошибка = 0,56.
Это значит, что из 1,56 первоначально взятого амина RNHaOH
остаются неоттитрованными 0,56 весовой части, т. е.
1,56—100%
0,56—л: %
0,56-100
ROH-ошибка = — = — 36%.
1,56
Следовательно, индикатор фенолфталеин непригоден для данного
титрования.
Пример 14. Рассчитать индикаторную ошибку титрования 20 мл
0,1 н. VOSO4 0,1 н. раствором КМпСч при рН 0 с N-фенилантрани-
ловой кислотой в качестве индикатора (интервал перехода равен
?инд ± 0,03В)-
н .J
Решение. При расчете необходимо использовать Е" следую-
следующих полуреакций:
V0+ + 2H+ + erVO2+ + Н2О, ?° = 0,9994В, д=1
и
MiiOJ" + 8Н+ -!- 5е^Мп2+ -.- -ПГО,?§,----= 1,51В, А = 5
Отсюда в точке эквивалентности
ЬЕ1 @,9994)-, 5-1.51
д + й б
где а н fc — числа отданных и принятых электронов N-фенилантра-
инловой кислоты. Еии t = 1,08В, поэтому интервал перехода ее ра-
рацеи ?°ид ±0,03, т. е. 1,08±0,03= 1,11-1-1,05 В. Следовательно, при
использовании этого индикатора раствор будет недотитрован, а по-
потенциал в конце титрования будет равен 1,11 В. Отсюда
1,11 = 0, 9994 +0,059 lg
[VO2+] 1,11-0,9994 0,1106
Iff : =: ^=: =zz I , 87 ,
6 [VO2+] 0,059 0,059
=_.loi,87 = 74i „л„ [VO2+]=74[VO2+]
[VQ2+]-100 [VQ2+].1OO
[VO2+] + [VO+] ~ [VO2+] + 74 [VO2+]
100
75
¦- 1,33%.
Следовательно, при титровании с N-фенилаптраниловой кислотой
раствор VO2+ будет недотитрован на 1,33%. Для точных титрова-
титрований индикатор рекомендовать нельзя.
Задачи
Метод нейтрализации
399. Вычислить нормальность раствора H2SO4, титр
которого равен 0,02446.
400. Вычислить нормальность раствора NaOH, титр
которого равен 0,004020.
401. Вычислить нормальность раствора, если ГНа/кон =
= 0,01353.
402. Вычислить нормальность раствора, если
7\-аОН/СаО = 0,0029 14.
4—4022 97
403. Вычислить нормальность раствора, если
7n.oh/so, =0,02174.
404. Нормальность раствора H2SO4 равна 0,1008. Рас-
Рассчитать rH2so4-
405. Нормальность раствора NaOH равна 0,09981.
Рассчитать 7^аон-
406. Нормальность раствора НС1 равна 0.09798. Рас-
Рассчитать ГНС1/К2О-
407. Нормальность раствора NaOH равна 0,1021. Рас-
Рассчитать ^NaOH/SO,-
408. Найти Гна/к,о, если 7"Hci = 0,03798.
409. Найти rKOH/H2so4, если 7"Кон = 0,005727.
410. Найти 7"h2so4, если 7'h2so1/koh = 0,005643.
411. Найти 7"NaoH, если 7"Na0H/Hci = 0,003645.
412. Вычислить Тпг504, если для 0,01 н. раствора К=
= 0,9123.
413. Вычислить Гкон, если для 0,05 н. раствора К=
= 0,8549.
414. Имеется 0,1046 н. НС1. Определить МОЛЯр-
НОСТЬ, Тцс\ И Гнсг/СаО-
415. Найти нормальность, молярность H2SO4 и
^H,so4/cao, если THisot= 0,004852.
416. В 500 мл раствора содержится 2,6578 г Na2CO3.
Рассчитать 7"Najco3> ^Na2co3/Hci и нормальность этого рас-
раствора: 1) при нейтрализации до СО2; 2) при нейтрализа-
нейтрализации до NaHCO3.
417. Вычислить истинную нормальность, молярность,
TnlSot H.7-Hlso./NaOH 0,1 н. H2SO4 (/(=0,9808).
418. В воде растворили 28,00 г х. ч. КОН и 40,20 г
х. ч. NaOH и разбавили раствор до 1500 мл. Рассчитать
нормальность полученного раствора.
419. К 550 мл 0,1925 н. НС1 прибавили 50,00 мл рас-
раствора НС1 с титром 0,02370. Вычислить нормальность и
титр полученного раствора.
420. Сколько миллилитров воды надо добавить к 1 л
0,5300 н. НС1, чтобы получить 0,5000 н. раствор?
421. Сколько миллилитров 4 н. НС1 надо прибавить к
500 мл раствора НС1 с титром по СаО 0,08400, чтобы полу-
получить раствор с титром по СаО, равным 0,09000?
422. Сколько миллилитров соляной кислоты (d=
= 1,19 г/см3) необходимо для приготовления 1,0 л 0,1 н.
раствора?
98
423. Сколько миллилитров серной кислоты (d —
= 1,835 г/см3) требуется для приготовления 2,5 л 0,2 н.
раствора?
424. Для приготовления 500 мл раствора было взято
20,00 мл соляной кислоты (of=l,19 г/см3). Вычислить
нормальность полученного раствора.
425. Сколько граммов щелочи, содержащей 98%
NaOH и 2% индифферентных примесей, необходимо для
приготовления 200 мл 0,1 н. раствора?
426. Из 8,5 г едкого натра, содержащего, кроме
NaOH, 4% Na2CO3 и 8% Н2О, приготовили 1 л раствора.
Определить нормальность полученного раствора, если
Na2CO3 нейтрализуется до Н2СО3.
427. Вычислить нормальность и титр раствора НС1,
если на титрование 0,4217 г буры израсходовано 17,50 мл
этой кислоты.
428. Какую навеску х. ч. безводной соды нужно взять,
чтобы на ее титрование израсходовав 20 мл 0,1 М
H2SO4?
429. Какую навеску щавелевой кислоты
Н2С2О4-2Н2О нужно взять, чтобы на ее титрование израс-
израсходовать 20,00 мл 0,1 н. NaOH?
430. Вычислить нормальность H2SO4, если к 10 мл ее
добавили избыток ВаС12. Масса полученного осадка пос-
после фильтрования, прокаливания и взвешивания оказа-
оказалась 0,2762 г.
431. Навеску 0,6000 г H2C2Oi-2H2O растворили в мер-
мерной колбе емкостью 100 мл. На титрование 20,00 мл полу-
полученного раствора израсходовали 18,34 мл NaOH. Опре-
Определить нормальность раствора NaOH и его титр по
н2с2о4.
432. Определить Гкон/р.о, раствора едкого кали, ис-
используемого при определении Р2О5 в суперфосфате
(Н3РО4 титруется до КН2РО4), если на титрование
18,00 мл 0,1 н. НС1 (/(=0,9064) израсходовано 19,32 мл
КОН.
433. Вычислить нормальность раствора НС1, если на
титрование 20,00 мл его израсходовано 19,20 мл 0,10 н.
NaOH, приготовленного из фиксанала.
434. Навеску 0,5341 г щелочи, содержащей 92% NaOH
и 8% индифферентных примесей, растворили в мерной
колбе емкостью 100 мл. Определить нормальность и титр
НС1, ^HCi/NaOH, если на титрование 15,00 мл раствора
NaOH израсходовали 19.50 мл кислоты.
4* 99
435. Нормальность раствора H2SO4 была установлена
по карбонату кальция, содержащему 91,90% СаСО3 без
примеси других оснований. К навеске 0,6724 г добавили
29,87 мл кислоты и избыток ее оттитровали 10,27 мл рас-
раствора NaOH A мл H2SO4 эквивалентен 1,024 мл NaOH).
Вычислить нормальность H2SO4 и NaOH.
436. Определить нормальность раствора КОН, если на
титрование 15,00 мл его израсходовали 18,70 мл раствора
НС1 Gна = 0,002864).
437. До какого объема нужно довести раствор, в ко-
котором содержится 1,530 г NaOH, чтобы на титрование
20,00 мл раствора израсходовать 14,70 мл НС1 G"На =
= 0,003800)?
438. Сколько граммов Na2CO3 содержится в растворе,
если на нейтрализацию до №НСОз израсходовали
21,40 мл раствора НС1 (Тиа = 0,002789)?
439. Вычислить число граммов N2O5 на 1 л раствора
HNO3, если на титрование 20,00 мл раствора кислоты из-
израсходовано 21,12 мл 0,1120 н. NaOH.
440. На титрование раствора, полученного из 0,1370 г
щавелевой кислоты, израсходовано 22,10 мл 0,09840 н.
NaOH. Сколько молекул кристаллизационной воды со-
содержала кислота?
441. Построить кривые титрования и подобрать инди-
индикаторы для титрования: 1) 0,2 н. НС1 0,2 н. раствором
NaOH; 2) 0,1 н. H2SO4 0,1 н. раствором КОН; 3) 0,3 н.
HNO3 0,2 н. раствором NaOH; 4) 0,2 н. СН3СООН 0,2 н.
раствором NaOH; 5) 0,1 н. НСООН 0,2 н. раствором
КОН; 6) 0,3 н. С6Н5СООН 0,3 н. раствором NaOH;
7) 0,2 н. NH3 0,2 н. раствором H2SO4; 8) 0,1 н. CH3NH2
0,1 н. раствором НС1; 9) 0,3 н. C2H5NH2 0,3 н. раствором
НС1; 10) 0,2 н. KCN 0,2 н. раствором НС1; 11) 0,2 М
NaaCOa 0,2 н. раствором НС1; 12) 0,1 н. H2NCH2CH2OH
0,1 н. раствором НС1; 13) 0,1 н. HF 0,1 н. раствором
NaOH; 14) 0,1 М Н2С2О4 0,1 н. раствором NaOH; 15) 0,1 М
HsPOi 0,1 н. раствором NaOH.
442. Рассчитать индикаторную ошибку титрования
0,01 н. НС1 0,01 н. раствором NaOH с фенолфталеином
(рГ=9).
443. Можно ли титровать 0,01 н. НС1 0,01 и раство-
раствором NaOH с бромфеноловым синим (рГ=3,8)?
444. Чему равна индикаторная ошибка титрования
0,1 н. NaOH 0,1 н. раствором НС1 с метиловым красным
(рГ=5)?
100
445. Рассчитать индикаторную ошибку титрования
0,1 н. NaOH 0,1 н. раствором НС1 с тимолфталеином
(рГ=10).
446. Вычислить индикаторную ошибку титрования
0,2 н. НС1 0,2 н. раствором NaOH с метиловым красным
(РГ=5).
447. Вычислить индикаторную ошибку титрования
0,1 н. НС1 0,2 н. раствором NaOH с метиловым красным
(р7"=5).
448. Можно ли точно оттитровать 0,2 н. НС1 0,2 н.
раствором NaOH с о-крезолфталеином (рГ=9) ?
449. Рассчитать индикаторную ошибку титрования
0,01 н. NH3 0,01 н. раствором НС1 с метиловым оранже-
оранжевым (рГ=4).
450. Можно ли оттитровать 0,01 н. NH3 0,01 н. раство-
раствором НС1 с фенолфталеином (рГ=9)?
451. С каким индикатором можно оттитровать раствор
NH3, чтобы ROH-ошибка не превышала 0,1%?
452. Вычислить индикаторную ошибку титрования
0,01 н. NH3 0,01 н раствором НС1 с тимолфталеином
(рГ=1О).
453. С каким индикатором можно оттитровать рас-
раствор СНзСООН, чтобы кислотная ошибка не превышала
0,1%?
454. Можно ли оттитровать 0,01 н. СН3СООН 0,01 н.
раствором NaOH с нейтральным красным (рГ = 7)?
455. Вычислить индикаторную ошибку титрования
0,1 н. НСООН 0,1 н. раствором NaOH с метиловым оран-
оранжевым (рГ = 4).
456. Рассчитать индикаторную ошибку титрования
0,1 н. HF 0,1 н. раствором NaOH с фенолфталеином
(рГ=9).
457. Какую навеску х. ч. безводной соды нужно взять,
чтобы на ее титрование до COj израсходовать 20 мл 0,1 н.
НС1?
458. Какую навеску вещества, содержащего 40% СаО,
50% СаСО3 и 10% индифферентных примесей, нужно
взять, чтобы на ее титрование израсходовать 20 мл
0,1 н. НС1?
459. Какую навеску NaOH нужно взять, чтобы на тит-
титрование ее израсходовать 22,00 мл раствора НС1
G"нс1/№.,о = 0,003514)?
460. Какую навеску кальцита, содержащего 60%
СаСО3, нужно взять для анализа, чтобы на титрование ее
израсходовать 15,00 мл раствора НС1 (ГНс1=0,003820)?
461. Навеску 2,0712 г технической буры растворили в
мерной колбе емкостью 100 мл. На титрование 20,00 мл
раствора израсходовали 21,80 мл НС1 G"над*аон =
=0,003974). Вычислить процентное содержание х. ч.
Na2B4O7-10H2O.
462. Навеску 1,000 г суперфосфата обработали водой.
На титрование фильтрата до перехода Н3РО4 в NaH2PO4
израсходовали 17,60 мл раствора NaOH (Гмаон/р^ =
= 0,007251). Вычислить процентное содержание Р2О5 в
суперфосфате.
463. На титрование раствора, содержащего 3,1580 г
технического КОН, израсходовано 27,45 мл раствора НС1
(T^Hci/NaOH =0,07862). Вычислить процентное содержание
КОН в образце.
464. Для анализа взяли 50,00 мл раствора соляной
кислоты и разбавили водой до 1000 мл. На титрование
20,00 мл раствора NaOH G"NaoH/H,so1=0,004189) израсхо-
израсходовали 18,20 мл полученного раствора кислоты. Вычис-
Вычислить концентрацию НС1 в исходном растворе (г/л).
465. Проба для анализа представляет собой смесь х. ч.
Na2CO3 и х. ч. К2СО3. Для нейтрализации 0,1000 г этой
смеси до СОг израсходовали 22,00 мл раствора НС1. Оп-
Определить нормальность кислоты, если содержание
Na2CO3 в смеси 37,00%.
466. На нейтрализацию 0,2140 г смеси, состоящей из
карбонатов кальция и бария, израсходовали 15,00 мл
0,2000 н. раствора кислоты. Вычислить процентное содер-
содержание СаСО3 и ВаСО3 в смеси.
467. На нейтрализацию 0,4000 г смеси, состоящей из
х. ч. карбонатов натрия и калия, израсходовали 22,00 мл
0,3000 н. раствора кислоты. Вычислить процентное содер*
жание NajCOs и К2СО3 в смеси.
468. Навеску 2,0000 г неизвестного вещества раство-
растворили в мерной колбе емкостью 100 мл. На титрование
25,00 мл раствора израсходовали 20,00 мл 0,4455 н. НС1.
Определить, что входило в состав анализируемого веще-
вещества: КОН или NaOH.
469. Навеску 0,3251 г технической гидроокиси натрия
растворили в мерной колбе емкостью 100 мл. На титро-
титрование 25,00 мл раствора с фенолфталеином израсходова-
израсходовали 18,40 мл 0,1000 н. НС1, а с метиловым оранжевым
18,80 мл кислоты. Вычислить процентное содержание
NaOH в образце.
102 З
470. На титрование с фенолфталеином навески
0,4478 г, состоящей из Na2CO3, NaHCO3 и NaCl, потре-
потребовалось 18,80 мл 0,1998 н. раствора кислоты. При тит-
титровании с метиловым оранжевым на ту же навеску из-
израсходовали 40,00 мл раствора кислоты. Вычислить про-
процентное содержание Na2CO3 и NaHCO3 в образце.
471. Навеску 0,4000 г технической гидроокиси натрия
растворили в мерной колбе емкостью 100 мл. На титро-
титрование 20,00 мл раствора с метиловым оранжевым израс-
израсходовали 19,20 мл раствора НС1 (Гнс1=0,003600). Такую
же иробу раствора обработали 2 н. ВаСЬ до полноты
осаждения карбонатов и при титровании с фенолфталеи-
фенолфталеином израсходовали 18,80 мл раствора НС1. Определить
процентное содержание карбонатных примесей в препа-
препарате.
472. Определить временную жесткость воды, если на
¦титрование с метиловым оранжевым 200 мл исследуемой
воды израсходовали 10,00 мл раствора НС1 GHci=
= 0,001760).
473. В мерной колбе емкостью 200 мл растворили
5,00 мл смеси соляной и фосфорной кислот. На титрова-
титрование 20,00 мл полученного раствора с метиловым оранже-
оранжевым израсходовали 18,20 мл 0,1012 н. NaOH; при титро-
титровании такой же пробы раствора с фенолфталеином израс-
израсходовали 34,70 мл раствора NaOH. Сколько граммов НС1
и Н3РО4 содержится в 100 мл смеси?
474. В мерной колбе емкостью 500 мл растворили
10,00 мл смеси технических серной и фосфорной кислот.
25,00 мл этого раствора оттитровали 26,40 мл раствора
NaOH (^NaOH/Hci = 0,003600) по метиловому оранжевому.
Такую же пробу оттитровали по фенолфталеину 40,00 мл
раствора NaOH. Сколько граммов H2SO4 и Н3РО4 содер-
содержалось в 1 л смеси?
475. Навеску 2,000 г суперфосфата поместили в сухую
мерную колбу емкостью 100 мл. Объем раствора довели
ацетоном до метки. 50,00 мл фильтрата разбавили втрое
водой, прибавили несколько капель метилового красного
и оттитровали 15,00 мл 0,1020 н. КОН до желтой окрас-
окраски. Затем прибавили фенолфталеин и оттитровали до ро-
розовой окраски, затратив 7,00 мл раствора КОН. Вычис-
Вычислить процентное содержание H2SO4 и Н3РО4 в суперфос-
суперфосфате.
476. Какую навеску нашатыря, содержащего около
30% NH3, взяли для анализа, если после добавления к
103
ней 50,00 мл 0,1000 н. NaOH и нагревания до полного
удаления аммиака, избыток NaOH оттитровали 25,00 мл
0,1000 н. НС1?
477. Какую навеску х. ч. NaNO3 взяли для анализа по
методу восстановления NOj" до NH3, если выделивший-
выделившийся аммиак был поглощен 40,00 мл 0,1245 н. НС1 и избы-
избыток кислоты оттитрован 22,40 мл 0,1002 н. NaOH?
478. Пробу соли аммония в 1,000 г обработали избыт-
избытком концентрированного раствора NaOH. Выделившийся
аммиак был поглощен 50,00 мл 1,0720 н. НС1. Избыток
кислоты был оттитрован 25,40 мл раствора NaOH
(^NaOH = 0,004120). Вычислить процентное содержание
NH3 в образце.
479. Навеску (NH4JSO4 растворили в мерной колбе
емкостью 100 мл. К 20,00 мл раствора прибавили 50,00 мл
0,1122 н. NaOH и нагрели до полного удаления NH3.
Остаток щелочи оттитровали 18,00 мл раствора НС1
B0,00 мл раствора NaOH эквивалентны 21,00 мл раство-
раствора НС1). Сколько граммов (NH4bSO4 содержалось в рас-
растворе?
480. Азот из навески органического вещества переве-
перевели в соль аммония. Аммиак, выделившийся при кипяче-
кипячении с концентрированной щелочью, перегнали в
50,00 мл раствора НС1 (Гна=0,003905); избыток кисло-
кислоты оттитровали 22,40 мл раствора NaOH (rNa0H =
=0,004020). Какую навеску следует взять для анализа,
если содержание азота в веществе не превышало 30%?
481. Навеску 0,1032 г Na2COa обработали 50,00 мл
0,09496 н. НС1, избыток кислоты оттитровали 24,80 мл
0,1 н. NaOH (/(=1,298). Вычислить процентное содержа-
содержание индифферентных примесей в образце.
482. Определить постоянную жесткость воды, если к
100 мл исследуемой воды прибавили 20,00 мл раствора
Na2CO3 (^Na2co3/cao= 0,003000) и после фильтрования
осадка карбонатов кальция и магния избыток №2СОз
оттитровали 17,30 мл раствора НС1 B0,00 мл раствора
Na2CO3 эквивалентны 21,00 мл раствора НС1).
483. Определить: 1) временную; 2) постоянную и
3) общую жесткость воды, если на титрование 100,0 мл
воды израсходовали 2,00 мл 0,1010 н. НС1. После титро-
титрования раствор обработали 50,00 мл щелочной смеси
(Na2CO3-r-NaOH), общая нормальность которой 0,09876
[при этом Са2+—>-СаСОз и Mg2+—^Mg(OHJ]. Раствор с
осадком количественно перенесли в мерную колбу емко-
104
стью 200,0 мл и довели водой до метки. На титрование
избытка щелочной смеси в 50,00 мл с метиловым оранже-
оранжевым израсходовали 11,00 мл раствора НС1.
484. В каком объеме соляной кислоты G"иа=
=0,003814) нужно растворить навеску 0,1234 г СаСО3,
чтобы на титрование избытка кислоты израсходовать
19,50 мл раствора NaOH (ГМаОН/сао =0,002910)?
485. Навеску 0,1938 г силава, содержащего магний,
растворили в соляной кислоте, и магний осадили гидро-
гидрофосфатом натрия в среде аммонийного буфера. Осадок
растворили в 50,00 мл 0,1 н. НС1 (/(=0,9981), на титро-
титрование избытка кислоты израсходовали 18,00 мл раствора
NaOH (TNaOH=0,004000). Определить процентное содер-
содержание Mg в сплаве.
486. К 50,00 мл 0,1012 н. MgSO4 прибавили 25,00 мл
0,2514 н. NaOH и смесь разбавили водой в мерной колбе
емкостью 100 мл. Затем 50,00 мл фильтрата оттитровали
0,1046 н. НС1. Сколько миллилитров кислоты израсходо-
израсходовали на титрование?
487. К 0,4789 г. смеси х. ч. SrCO3 и х. ч. Li2CO3 доба-
добавили 40,00 мл 0,5100 и. НС1. Избыток кислоты оттитро-
оттитровали 20,00 мл NaOH (ГЫаон/на = 0,01825). Вычислить про-
процентное содержание SrCO3 и поСОз.
488. К 1,000 г смеси х. ч. Na2CO3-10H2O и х. ч.
NaHCO3 добавили 50,00 мл 0,1000 н. НС1. Избыток кис-
кислоты оттитровали 20,00 мл 0,1 н. NaOH (/(=1,543) по
фенолфталеину. Вычислить процентное содержание ком-
компонентов в смеси.
489. К 0,5000 г смеси, содержащей Na2CO3 и NaHCO3,
прибавили 25,00 мл раствора НС1 (ГНа=0,004000). На
титрование избытка кислоты израсходовали 15,00 мл рас-
раствора NaOH (ГКаон=0,002000). Вычислить процентное
содержание Na2CO3.
490. Навеску 4,8215 г смеси х. ч. NaH2PO/, и х. ч.
Na2HPO4 растворили в 200 мл 0,1982 и. НС1. На титро-
титрование 20,00 мл раствора с фенолфталеином израсходова-
израсходовали 21,00 мл раствора NaOH G"Naoii=0,002000). Каково
процентное содержание NaoHPO/, в смеси?
491. К навеске 0,1000 г Na3PO4 прибавили 25,00 мл
0,2 М H2SO4. На обратное титрование избытка кислоты с
метиловым оранжевым израсходовали 15,00 мл раствора
NaOH. Определить нормальность раствора NaOH.
492. Какой объем 0,1012 н. НС1 прибавили к навеске
0,2000 г Na3PO4, если на титрование избытка кислоты с
105
фенолфталеином затратили 25,00 мл раствора NaOH
GW)h=0,O03400)?
493. Навеску 5,000 г суперфосфата растерли в ступке
с небольшим количеством воды. Фильтрат перенесли в
мерную колбу емкостью 250 мл, добавили 102,5 мл
0,1000 и. НС1 и довели водой до метки. На титрование
25,00 мл полученного раствора до перехода красной ок-
окраски метилового оранжевого в желтую израсходовали
18,00 мл 0,1000 н. NaOH. Вычислить процентное содержа-
содержание свободного Р2О5 в суперфосфате.
494. Навеску 5,000 г апатитовой муки после кипячения
с царской водкой перенесли в мерную колбу емкостью)
250 мл и довели водой до метки. Из мерной колбы взяли
5,00 мл исходной вытяжки и осадили РО|~ в виде фосфо-
ромолибдата аммония. Полученный осадок растворили в:
50,00 мл 0,2000 н. КОН, избыток которого оттитровали
30,00 мл 0,1971 н. H2SO4. Определить процентное содер-
содержание Р:>О5 в образце.
495. Какую минимальную навеску метилового спирта
нужно взять для определения в нем воды, чтобы на тит-
титрование израсходовать 10,0 мл иодпиридинового раство-
раствора с титром по воде 0,002000, если содержание влаги в
растворителе не превышает 0,4%?
496. Какой объем этилового спирта, содержащего;
0,2% воды, нужно взять для анализа, чтобы на титрова-
титрование израсходовать 8,00 мл иодпиридинового раствора с
титром по воде 0,002500?
497. Вычислить процентное содержание влаги в орга-
органическом растворителе, если на титрование 5,00 мл его^
израсходовали 7,00 мл реактива Фишера с титром по во-
воде 0,003000.
498. Вычислить процентное содержание воды в ацето-
ацетоне, если на титрование 4 г его израсходовали 5,00 мл!.
реактива Фишера с титром по воде 0,002000.
499. На титрование 4 г метанола, содержащего 0,1%
воды, израсходовали 2,00 мл иодпиридинового раствора..
Определить титр реактива Фишера по воде.
500. Какую навеску фенола, содержащего около 3%
индифферентных примесей, нужно взять для анализа, что-
чтобы на титрование ее в среде метилэтилкетона с азофиоле-
товым израсходовать 5,00 ;мл 0,1 н. бензольно-метаноль-
ного раствора тетраэтиламмония?
501. На титрование 0,0200 г а-нафтола в среде метил-
метилэтилкетона израсходовали 1,40 мл бензольно-метаноль-
106
ного раствора тетраэтиламмония. Определить нормаль-
нормальность титранта.
502. Определить объем 0,1 н. бензольно-метанольного
раствора тетрабензиламмония, израсходованный на тит-
титрование 0,01560 г гидрохинона в среде метилэтилкетона.
503. Навеску 0,03274 г анилина растворили в 50,00 мл
безводной уксусной кислоты и оттитровали 0,1 н. НС1О4
в безводной уксусной кислоте с кристаллическим фиоле-
фиолетовым. Определить объем титранта, израсходованный на
титрование.
504. Навеску 0,1300 г анилина растворили в 100,0 мл
безводной уксусной кислоты. На титрование 50,00 мл рас-
раствора израсходовали 6,80 мл 0,1 н. НСЮ4 в дпоксане.
Вычислить процентное содержание индифферентных при-
примесей в образце.
505. Определить процентное содержание толуидина в
образце, если на титрование 0,06928 г его в среде метил-
метилэтилкетона с кристаллическим фиолетовым израсходова-
израсходовали 6,00 мл 0,1 н. метилэтилкстонового раствора хлорной
кислоты.
506. Определить процентное содержание диметилапи-
лина в пробе, если на титрование 0,04890 г ее в среде ме-
тнлэтилкетона израсходовали 4,00 мл 0,1000 н. метил-
этилкетонового раствора хлорной кислоты.
507. Определить процентное содержание бензиланили-
на в пробе, если на титрование 0,0964 г в среде метил-
метилэтилкетона израсходовали 5,00 мл 0,1000 н. метилэтклке-
тонового раствора хлорной кислоты.
508. К навеске 0,1000 г гидролизного сернокислотного
лигнина добавили 15,00 мл днметилформамида п оттит-
оттитровали 6,00 мл 0,03 М раствора метплата калия в бензо-
бензоле. Определить процентное содержание фенола в об-
образце.
509. К навеске 0,0500 г биохимического лигнина до-
добавили 15,00 мл диметилформамнда и оттитровали
5,20 мл 0,03 М раствора метнлата калия в бензоле. Опре-
Определить процентное содержание фенольных ОН-групп в
биохимическом лигнине.
510. Какую навеску биохимического лигнина, содер-
содержащего 5% фенольных ОН-групп, нужно взять для ана-
анализа, чтобы на титрование ее в среде диметилформамида
израсходовать 4,50 мл 0,03 М раствора метилата калия
в бензоле?
107
511. В колбу с навеской 0,099? г гвоздичного масла
добавили 30,00 мл этилендиамина и оттитровали 9,50 мл
0,1 н. бензольно-метанольного раствора метилата натрия.
Определить процентное содержание фенолов в навеске.
Методы осаждения и комплексообразования
512. Построить кривые титрования по методу осажде-
осаждения: 1) 0,1 н. AgNO3 ОД н. раствором NH4SCN; 2) 0,05 п.
KI 0,05 н. раствором AgNO3; 3) 0,05 н. NaBr 0,05 п. рас-
раствором AgNO3; 4) 0,2 н. КгСгО4 0,2 и. раствором AgNO3;
5) 0,1 н. КС1 0,1 н. раствором Hg2(NO3J; 6) 0,05 н. КВг
0,05 н. раствором Hg2(NO3J; 7) 0,02 н. KI 0,02 н. раство-
раствором Hg2(NO3J; 8) 0,1 и. ВаС12 0,1 и. раствором Na2SO4;
9) 0,2 н. Ba(NO3J 0,2 н. раствором К2Сг04; 10) 0,1 н.
Pb(NO3J ОД н. раствором КЮ8; 11): ОД н Pb(NO3J
ОД н. раствором Na2Cr04; 12) 0,05 н. NiSO4 0,05 н. раст-
раствором диметилглиоксима (H2Dm).
513. Построить кривые титрования по методу комплек-
комплексообразования: 1) 0,05 н. КВг 0,05 н. раствором
Hg(NO3J; 2) 0,03 н. КС1 0,03 н. раствором Hg(NO3J;
3) ОД н. NaCl ОД н. раствором Hg(NO3J; 4) ОД н. FeCl3
ОД н. раствором трилона Б; 5) ОД н. СаС12 ОД н. раство-
раствором трилона Б; 6) ОД н. NiCl2 ОД н. раствором KCN;
7) 0,02 н. CdCl2 0,02 н. раствором трилона Б; 3) 0,03 п.
NiCl2 0,03 н. раствором трилона Б; 9) 0,04 н. МпС12
0,04 н. раствором трилона Б; 10) 0,03 н. MgCl2 0,03 н.
раствором трилона Б; 11) 0,02 н. Pb(NO3b 0,02 и. раство-
раствором трилона Б; 12) 0,02 н. ZnSO4 0,02 н. раствором три-
трилона Б.
514. На титрование 20,00 мл 0,05 н. (/(=0,9640) NaCl
израсходовали 19,64 мл раствора AgNO3. Определить
нормальность и титр раствора AgNO3.
515. При анализе серебряного сплава, содержащего
85,00% Ag, взяли навеску 0,5000 г. Вычислить нормаль-
нормальность раствора KSCN, чтобы на титрование потребова-
потребовалось 50,00 мл этого раствора.
516. Рассчитать нормальность раствора Hg2(NO3J,
если на титрование навески NaCl 0,0585 г израсходовали
20,00 мл этого раствора.
517. Сколько граммов Hg2(NO3J-2H2O требуется для
приготовления 500 мл 0,05 н. раствора?
518. На титрование 20,00 мл раствора NaCl (Тцяс\/с\ =
108
= 0,001890) израсходовано 25,00 мл раствора Hg2(N03h.
Определить нормальность, поправочный коэффициент и
титр раствора Hg2(NO3J-
519. Рассчитать нормальность раствора NaCl, 20,00 мл
которого оттитровываются 18,62 мл 0,1000 н. Hg(NO3J.
520. Рассчитать нормальность раствора Hg2(NO3J,
если на титрование 0,1050 г NaCl израсходовано 20,00 мл
раствора Hg2(NO3J-
521. На титрование раствора, полученного растворе-
растворением 0,2082 г NaBr, израсходовано 22,80 мл раствора
Hg2(NO3J. На титрование 20,00 мл Hg2(NO3J затрачено
19,82 мл раствора NH4SCN. Определить нормальность и
титр раствора NH4SCN.
522. Навеску 4,856 г KSCN растворили в мерной кол-
колбе емкостью 500 мл. На титрование 25,00 мл раствора
израсходовано 24,95 мл раствора Hg(NO3J. Определить
нормальность, поправочный коэффициент и титр раствора
Hg(NO3J.
523. Вычислить нормальность и титр раствора трило-
на Б, если на титрование 25,00 мл его израсходовано
24,45 мл 0,1100 и. ZnSO4.
524. Сколько граммов Hg(NO3J-H2O требуется для
приготовления 250 мл 0,05 н. Hg(NO3J?
525. Какую навеску КС1 следует взять для приготов-
приготовления 250 мл 0,05 н. раствора?
526. Сколько граммов KCI содержится в 250 мл рас-
раствора, если на титрование 25,00 мл его израсходовано
34,00 мл 0,1050н. AgNO3?
527. Сколько граммов NaCl содержится в 250 мл рас-
раствора, если на титрование 25,00 мл его израсходовано
26,45 мл 0,05000 н. AgNO3.
528. Сколько граммов NaCl содержится в 1 л рассо-
рассола, если после разбавления 10,00 мл его в мерной колбе
емкостью 500 мл на титрование 25,00 мл раствора потре-
потребовалось 24,42 мл 0,1 н. AgNO3 (/(=0,9245).
529. В мерную колбу емкостью 250 мл поместили
25,00 мл разбавленной HCI и довели водой до метки. На
титрование 20,00 мл раствора израсходовано 24,37 мл
0,9850 и. AgNO3. Сколько граммов НС1 содержится в 1 л
исследуемой кислоты?
530. Сколько граммов КС1 содержится в 250 мл рас-
раствора, если на титрование 25,00 мл его израсходовано
17,00 мл 0,05252 н. Hgz(NO3h?
109
531. Сколько миллиграммов бериллия содержится в
1 л раствора BeCfo, 20,00 мл которого оттитровываются
18,16мл 0,1032и. Hg(NO3) а?
532. Сколько граммов KCN находится в растворе, на
титрование которого до появления неисчезающей мути
требуется 20,05 мл 0,1215 н. Ag-NO3?
533. Рассчитать навеску поваренной соли, содержа-
содержащей около 80% NaCl, необходимую для приготовления
500 мл 0,05 н. NaCl.
534. Сколько граммов чистой ртути следует раство-
растворить в 25,00 мл азотной кислоты, чтобы на титрование
25,00 мл раствора расходовалось 20,00 мл раствора
NaCl (Тлаа=0,002900)?
535. Какую навеску NaBr, содержащего около 10%
индифферентных примесей, следует взять для анализа,
чтобы на титрование ее потребовалось около 15 мл 0,1 н.
Hg(NO3J?
536. Какую навеску цинковой руды, содержащей око-
около 15% Zn, следует взять для анализа, чтобы после рас-
растворения и отделения мешающих примесей Zn в ней отти-
тровывался 20 мл 0,1 М трилона Б?
537. Какую навеску Co(NO3J-6H2O, содержащего
около 7% индифферентных примесей, следует взять для
анализа, чтобы на ее титрование потребовалось около
10 мл 0,1 М трилона Б?
538. Сколько граммов металлического цинка следует
растворить в 100,0 мл серной кислоты, чтобы на титрова-
титрование 20,00 мл раствора расходовалось 20,00 мл 0,2000 М
трилона Б?
539. Сколько миллилитров 0,1000 н. AgNO3 потребу-
потребуется на титрование 12,00 мл раствора, содержащего
6,50 г/л КС1?
540. Сколько миллилитров раствора Hg2(NO3J
g(NO3)a-2H3o = 0,01403) потребуется на титрование
25,00 мл раствора, полученного растворением 0,5910 г
NaCl в мерной колбе емкостью 250,0 мл?
541. Сколько миллилитров 0,05925 М K4Fe(CNN по-
потребуется на титрование 20,00 мл 0.1045М ZnSO4?
542. Рассчитать объем 0,05000 н. Hg(NO3J, который
потребуется на титрование 0,2734 г образца, содержаще-
содержащего 28,0% хлора.
543. Сколько миллилитров 0,1056 н. KCN потребуется
для титрования 20,00 мл AgNO3 (rAgNo3 =0,01126)?
110
544. На титрование 20,00 мл раствора NiCl2 израсхо-
израсходовано 21,22 мл 0,02065 М трилона Б. Определить кон-
концентрацию раствора соли никеля (г/л).
545. Определить концентрацию (г/л) раствора МпСЬ,
если на титрование 20,00 мл его израсходовано 17,26 мл
0,6905 М трилона Б.
546. Навеску 0,8180 г смеси NaCl и NaNO3 растворили
в мерной колбе емкостью 200 мл. На титрование 20,00 мл
раствора израсходовали 18,35 мл раствора AgNO3
G\gNO3/Kci= 0,003442) . Вычислить процентное содер-
содержание NaCl в смеси.
547. Навеску 2,4080 г технического NaCl растворили
в мерной колбе емкостью 500 мл. На титрование 25,00 мл
раствора израсходовали 20,35 мл 0,1 н. AgNO3 (K=
= 0,9860). Вычислить процентное содержание хлора в
исходной соли.
548. Навеску 6,7000 г технического ВаС12 растворили
в мерной колбе емкостью 1000 мл. На титрование
25,00 мл раствора израсходовали 28,95 мл раствора
AgNO3 (^AgNo3 =0,008048). Вычислить процентное содер-
содержание хлора в образце.
549. Навеску 1,7450 г серебряного сплава растворили
в HNO3 и раствор разбавили водой до объема 200 мл. На
титрование 10,00 мл раствора потребовалось 11,75 мл
0,05 н. NHiSCN (/( = 0,9344). Вычислить процентное со-
содержание Ag в сплаве.
550. Навеску 0,3838 г технического КВг растворили и
оттитровали 23,80 мл раствора AgNO:G\gNo3/ci=0,003546).
Вычислить процентное содержание КВг в образце.
551. На титрование раствора, полученного из 0,2122 г
серебряного сплава, израсходовали 32,40 мл 0,05 н. KSCN
(./(=1,0200). Вычислить процентное содержание Ag в
сплаве.
552. Определить процентное содержание Ag в сплаве,
если после растворения навески 0,2000 г на титрование
израсходовано 39,60 мл раствора, содержащего 0,4103 г
KSCN в 100 мл.
553. Навеску 10,0500 г Hg2(NO3J растворили в мер-
мерной колбе емкостью 250 мл. На титрование 20,00 мл рас-
раствора израсходовали 30,00 мл раствора NH4SCN
Gnh1scn=0,007092). Вычислить процентное содержание
Hg2(NO3h-2H2O в образце.
554. Навеску 2,2040 г карналлита растворили в мерной
колбе емкостью в 250 мл. На титрование 20,00 мл рас-
Ш
твора израсходовали 17,80 мл раствора 0,1 н. Hg2(N03h
(/С=0,8975). Вычислить процентное содержание хлора в
образце.
с^555ь)Определить процентное содержание индиффе-
индифферентных примесей в ацетате свинца, если на титрование
раствора, полученного из 0,1000 г его, израсходовано
5,84 мл 0,05000 М трилона Б.
556. Определить процентное содержание Mg в алю-
алюминиевом сплаве, если после растворения 0,5000 г и уда-
удаления мешающих элементов объем раствора довели до
100,0 мл и 20,00 мл его оттитровали 12,06 мл 0,01000 М
трилона Б.
557. Определить процентное содержание индиффе-
индифферентных примесей в MgSO4-7H2O, если после растворе-
растворения навески 0,1000 г магний оттитровывается 7,32 мл
0,05000 М трилона Б.
558. После соответствующей обработки 3,0340 г стек-
стекла перевели в раствор и объем раствора довели водой до
100,0 мл. 20,00 мл раствора оттитровали 7,06 мл
0,005000 М трилона Б. Определить процентное содержа-
содержание Fe в стекле.
559. Определить процентное содержание Мп в медном
сплаве, если после растворения 0,2062 г пробы и маски-
маскировки мешающих элементов Мп оттитрован 15,42 мл
0,05000 М трилона Б.
560. Определить процентное содержание № в стали,
если после растворения 1,0000 г пробы никель осадили
днметилглиоксимом и осадок растворили в НС1. Объем
раствора довели до 50,00 мл и 20,00 мл его оттитровали
5,45 мл 0,1000М трилона Б.
561. Какую навеску силиката, содержащего около
20% А12Оэ, следует взять для анализа, чтобы после
сплавления и соответствующей обработки пробы А1 был
отделен и оттитрован 10 мл 0,1 М трилона Б.
562. Навеску соли магния 0,2000 г растворили в мер-
мерной колбе емкостью 100 мл. На титрование 20,00 мл рас-
раствора израсходовали 20,25 мл 0,02500М трилона Б. Вы-
Вычислить процентное содержание Mg в соли.
563. Вычислить процентное содержание СаСО3 и
MgCO3 в известняке, если после растворения 1,0000 г
пробы и соответствующей обработки объем раствора до-
довели водой до 100,0 мл и на титрование 20,00 мл его для
определения суммы Са и Mg затратили 19,25 мл
112
0.05140 М трилона Б, а на титрование Mg израсходовали
6,26 мл того же раствора трилона Б.
564. Образец 3,1540 цинковой руды растворили в мер-
мерной колбе емкостью 250 мл. На титрование 20,00 мл рас-
раствора израсходовали 4,90 мл раствора K4Fe(CNN
G*K,Fe<CN),/znO = 0,01285). Вычислить процентное содержание
Zn в руде.
565. Навеску 0,2775 г соли цинка растворили и после
соответствующей обработки оттитровали 6,48 мл раство-
раствора, содержащего 0,03876 г/мл K4Fe(CNN. Вычислить про-
процентное содержание ZnO в образце.
566. Определить процентное содержание ВаС12-2Н2О
в образце соли, если на титрование раствора, полученно-
полученного из 0,2034 г ее, израсходовано 15,62 мл 0,09850 н.
Hg(NO3J.
567. На титрование навески 0,0973 хлористой соли из-
израсходовано 14,30 мл 0,1 н. Hg(NO3J (/(=0,9120). Вы-
Вычислить процентное содержание хлора в образце.
568. Навеску 0,1506 г технического бромида калия
растворили в воде и оттитровали 22,02 мл 0,05 н.
Hg(NO3J (/(=1,0107). Вычислить процентное содержа-
содержание КВг в образце.
569. Навеску 2,8530 г хлористой соли растворили в
мерной колбе емкостью 500 мл. На титрование 20,00 мл
раствора израсходовали 19,95 мл 0,1 н. Hg(NO3J (K=
= 1,055). Вычислить процентное содержание хлора в об-
образце.
570. Вычислить процентное содержание брома в тех-
техническом бромиде натрия, если на титрование раствора,
полученного из навески 3,9856 г его, израсходовано
21,20 мл 0,2500 H.Hg(NO3J.
571. Вычислить процентное содержание Ni в никеле-
никелевом сплаве, если на титрование раствора, полученного из
навески 0,2548 г его, израсходовано 25,00 мл 0,05000 н.
KCN.
572. К 0,2266 г. хлористой соли прилили 30,00 мл
0,1121 н. AgNO3, избыток которого оттитровали 15,00 мл
0,1158 и. NH4SCN. Вычислить процентное содержание
хлорида в веществе.
573. В мерной колбе емкостью 250 мл растворили
3,0360 г технического КС1. К 25,00 мл раствора прибави-
прибавили 50,00 мл 0,1045 М AgNO3. На титрование раствора,
содержащего избыток ионов Ag+, израсходовали
113
20,68 мл раствора NH4SCN (rNHlscN/Ag = 0,01166). Вы-
Вычислить процентное содержание КС1 в образце.
574. Навеску 0,1160 г поваренной соли перевели в рас-
раствор и обработали 40,00 мл 0,06540 н. AgNO3. На титро-
титрование избытка AgNO3 израсходовали 9,05 мл 0,1 н. KSCN
(К = 1,0500). Вычислить процентное содержание NaCl в
поваренной соли.
575. К 25,00 мл раствора NaCl прибавили 50,00 мл
0,1100 н. AgNO3, разбавили водой до 100,0 мл, отобрали
50,00 мл и оттитровали их 5,23 мл 0,09800 н. KSCN.
Сколько граммов NaCl содержалось в первоначальном
растворе?
576. Сколько граммов ВаС12 содержится в 250,0 мл
раствора, если после прибавления к 25,00 мл этого рас-
раствора 40,00 мл 0,1020 н. AgNO3 на обратное титрование
избытка AgNO3 израсходовано 15,00 мл 0,09800 н.
NH4SCN?
577. Навеску 1,4790 г смеси хлористых солей раство-
растворили в мерной колбе емкостью 250 мл. К 25,00 мл полу-
полученного раствора прилили 50,00 мл 0,1 н. AgNO3 (K~
=0,9580). На титрование избытка AgNO3 израсходовали
25,50 мл 0,1 н. KSCN (/С= 1,1200). Вычислить процент-
процентное содержание хлора в образце.
578. Навеску 0,1130 г смеси хлористых солей раство-
растворили и обработали 50,00 мл раствора AgN03(rAgN0a=
= 0,01721). На титрование избытка AgNO3 израсходова-
израсходовали 56,40 мл 0,05 н. KSCN (/(=0,8532). Вычислить про-
процентное содержание хлорида в смеси.
579. Навеску 0,2058 г технического NaBr растворили
в воде, к раствору добавили 40,00 мл 0,09980 н. AgNO3.
На титрование избытка AgNO3 израсходовали 21,20 мл
раствора KSCN. Вычислить процентное содержание при-
примесей в дбразце, если 1,00 мл раствора AgNO3 эквива-
эквивалентен 1,06 мл раствора KSCN.
580. В мерной колбе емкостью 250 мл растворили
2,0025 г технического КВг. К 25,00 мл раствора приба-
прибавили 50,00 мл 0,05560 н. Hg2(NO3J. На титрование из-
избытка раствора Hg2(NO3J израсходовали 25,02 мл рас-
раствора NaCl G"Naci = 0,002922). Вычислить процентное со-
содержание КВг в образце.
581. К раствору, полученному после соответствующей
обработки 0,1624 г цинковых белил, прибавлено 22,40 мл
раствора K4Fe(CN)r,, на титрование избытка которого
израсходовано 2,82 мл раствора ZnSC^. Вычислить про-
114
центное содержание ZnO в образце (Г к.Ре <cnL ="
= 0,006517, а 1,00 мл его эквивалентен 1,08 мл раствора
ZnSO).
582. Сколько миллиграммов вещества, содержащего
60% NaCl и 37% К.С1, следует взять для анализа, чтобы
после добавления 25,00 мл 0,1000 н. AgNO3 избыток его
оттитровался 5,00 мл раствора NH4SCN A,00 мл раство-
раствора NH4SCN эквивалентен 1,10 мл раствора AgNO3).
583. Определить нормальность и титр раствора
Pb(NO3J, если после прибавления к 20,00 мл его
20,00 мл 0,09940 М трилона Б на обратное титрование по-
последнего израсходовано 15,24 мл 0,1036 н. ZnCh.
584. Сколько граммов сульфата содержится в пробе,
если после прибавления 20,00 мл 0,06315 М ВаС12 избы-
избыток его оттитрован 15,64 мл 0,04640 М трилона Б.
585. К 20,00 мл 0,1000 М NiSO4 прибавили 20,00 мл
исследуемого раствора NaCN. Определить молярную кон-
концентрацию его, если на титрование избытка NiSO4 израс-
израсходовали 10,24 мл 0,05000М трилона Б.
586. Сколько миллиграммов ртути содержится в
50,00 мл раствора, если после прибавления 25,00 мл
0,01000 М трилона Б избыток его оттитровывается
10,50 мл 0,01000 М MgSO4?
587. В мерной колбе емкостью 100 мл растворили
0,5100 г технического MnSO4. К 10,00 мл раствора приба-
прибавили 25,00 мл 0,01036 М трилона Б. На титрование из-
избытка его израсходовали 15,94 мл 0,01049 н. Z11SO4. Вы-
Вычислить процентное содержание MnSO^ в образце.
588. На титрование 20,00 мл раствора Hg(NO3J пос-
после добавления избытка Na^Mg ЭДТА затрачено 19,85 мл
0,05 М раствора трилона Б (/(=1,055). Вычислить кон-
концентрацию раствора Hg(NO3J (г/л).
589. К 25,00 М Ba(NO3J добавили избыток
NaaMg ЭДТА. На титрование полученной смеси затраче-
затрачено 18,05 мл 0,1 М трилона Б (#=0,9878). Вычислить
концентрацию раствора Ba(NO3h (г/л).
590. Навеску ВаС12-2Н2О 1,2515 г растворили в
100,0 мл воды. К 20,00 мл раствора добавили избыток
ЫагЛ^ЭДТА. На титрование полученной смеси израсхо-
израсходовали 17,65 мл 0,05085 М трилона Б. Вычислить про-
процентное содержание ВаС12-2Н2О в образце.
591. Определить процентное содержание алюминия в
сплаве, если после растворения 0,6500 г его и удаления
мешающих элементов объем раствора довели до
250,0 мл и к 20,00 мл этого раствора добавили избыток
115
Na2Mg3flTA. На титрование полученной смеси затрати-
затратили 15,18 мл 0,05023 М трилона Б.
592. В мерной колбе емкостью 100,0 мл растворили
0,5370 г NiSO4-nH2O. К 15,00 мл раствора прибавили
25,00 мл 0,01082 М трилона Б. На титрование избытка
трилона Б израсходовали 11,87 мл 0,01135 М ZnSO4. Вы-
Вычислить процентное содержание Ni в образце.
593. В мерной колбе емкостью 200 мл растворили
1,1256 г MgSO4-nH2O. К 20,00 мл раствора прибавили
25,00 мл 0,01238М трилона Б. На титрование избытка
трилона Б израсходовали 9,05 мл 0,01015 М ZnSO4. Вы-
Вычислить процентное содержание Mg в образце.
594. В мерной колбе емкостью 250,0 мл растворили
0,7634 г Hg(NO3J-«H2O. К 25,00 мл раствора прибавили
50,00 мл 0,01007 М трилона Б. На титрование избытка
трилона Б израсходовали 23,83 мл 0,01178 М ZnSO4. Вы-
Вычислить процентное содержание Hg(NO3b в образце.
Методы окисления — восстановления (оксидиметрия)
595. Построить кривые титрования и подобрать инди-
индикатор для титрования: 1) 0,1 н. FeSO4 0,1 н. раствором
КМпО4 при концентрации ионов водорода, равной
1,0 г-ион/л и 10~3 г-ион/л; 2) 0,1 н. H3As03 0,1 н. раство-
раствором КМпО4 при рН 2; 3) 0,02 н. Na2S2O3 0,02 н. раство-
раствором 12; 4) 0,1 н. Ce(SO4J 0,1 н. раствором FeSO4;
5) 0,1 н. FeSO4 0,1 и. раствором NH4VO3 при [Н+]=
= 1,0 г-ион/л; 6) 0,1 н. SnCl2 0,1 н. раствором NH4VO3
при [Н+]=1,0 г-ион/л; 7) 0,02 н. H2S 0,02 н. раствором
NaCIO при рН 0 (H2S окисляется до SO^~).
596. Рассчитать область скачка титрования, окисли-
окислительно-восстановительный потенциал в точке эквивалент-
эквивалентности и подобрать инициатор при титровании:
1) 0,05 н. FeSO4 0,05 н. раствором КСЮ3, если [Н+]=
= 0,1 г-ион/л;
2) 0,1 н. FeSO4 0,1 н. раствором КВгО3, если [Н+]=
= 1,0 г-ион/л;
3) 0,1 н. Na2SO3 0,1 н. раствором КМпО4, если [Н+] =
= 1,0 г-ион/л и 10~3 г-ион/л;
4) 0,01 н. FeSO4 0,01 н. раствором К2Сг207, если [Н+] =
= 0,1 г-ион/л;
116
5) 0,1 H. NaNO2 0,1 н. раствором КМпО4, если [Н+]=
= 10~~2 г-ион/л и 0,1 г-ион/л;
6) 0,1 н. SnCl2 0,1 н. раствором КВгО3, если рН 0 и 3;
7) 0,02 н. Na2SO3 0,02 н. раствором 12, если рН 0 и 3;
8) 0,05 н. H3As03 0,05 н. раствором КЮ3, если [Н+]=
= 3 г-ион/л;
9) 0,1 н. NaNO2 0,1 и. раствором КС1О3, если [Н+] =
= 1,0 г-ион/л;
10) 0,1 н. H3As03 0,1 н. раствором 12, если [Н+]=
= 10 3 г-ион/л.
597. Вычислить индикаторную ошибку титрования
раствора V (III) раствором КгСггСЬ в сернокислой среде
при рН 0: 1) с ферроином (интервал перехода индикато-
индикатора равен Еатг ± 0,06 В); 2) с одианнзидином (интервал
перехода ?°Н1 ± 0,06 В); 3) с дифениламином (интервал
перехода Е°нял ± 0,03 В).
598. Вычислить индикаторную ошибку титрования рас-
раствора Мо (V) раствором NH4VO3 в сильнокислой среде:
1) с дифениламином (интервал перехода индикатора ра-
равен Е°ия + 0,03 В); 2) с дифениламинсульфонатом натрия
(интервал перехода ?°нд + 0,03 В); 3) с N-фенилантра-
ниловой кислотой (интервал перехода ?"°^д±0,03В).
599. Вычислить индикаторную ошибку титрования рас-
раствора FeSO4 раствором КМпО4 в среде 2 М H2SO4:
1) с ферроином (интервал перехода индикатора равен
^инд ± 0i06 В); 2) с дифениламином (интервал перехода
El* ± °'03 В).
600. Сколько граммов KMnCU надо взять, чтобы при-
приготовить 1,5 л 0,05 н. раствора его для титрования в кис-
кислой среде?
601. Сколько граммов Na2S2O3-5H2O следует взять
для приготовления: 1) 500,0 мл 0,1 н. раствора; 2) 200,0 мл
раствора с титром по иоду 0,01500?
602. Сколько граммов КгСьО7 необходимо взять для
приготовления 2 л раствора с титром по железу 0,002792?
Какова нормальность раствора К.2Сг2О7?
603. До какого объема следует разбавить 500,0 мл
0,1000 н. КгСг2О7 для получения раствора с титром по
железу 0,005000?
604. Сколько миллилитров 1,000 и. К.2СГ2О7 надо при-
прибавить к 1000 мл раствора КгСггСЬ с титром по железу
0,003500, чтобы получить раствор с титром по железу
0,004500?
117
605. На титрование 20,00 мл Н2С2О4 G7H,c!1o.-2Hto =
= 0,006900) израсходовали 25,00 мл раствора КМпО4.
Рассчитать нормальность и титр раствора КМпО4.
606. Анализ показал, что 1,00 мл раствора
КНС2О4-Н2С2О4-2Н2О эквивалентен 0,20 мл раствора
KMnO4, a 1,00 мл раствора КМпО4 эквивалентен 0,1117 г
Fe. Какова нормальность раствора КНС2О4-Н2С2О4Х
Х2Н2О?
607. Рассчитать нормальность раствора КМпО4, если
40,00 мл его окислили такую навеску КНС2О4-Н2С2О4Х
Х2Н2О, какая потребует для своей нейтрализации
30,00 мл 0,5000 н. NaOH.
608. Кальций осадили в виде СаС2О4-Н2О, осадок
отфильтровали, промыли и растворили в разбавленной
H2SO4. Образовавшуюся кислоту Н2С2О4 оттитровали
20,15 мл раствора КМпО4 с титром по СаО 0,01752.
Сколько граммов кальция содержалось в пробе?
609. На титрование 25,00 мл раствора FeSO4 в H2SO4
израсходовали 31,25 мл 0,1000 н. К2Сг2О7. Сколько воды
нужно добавить к 200,0 мл раствора соли железа, чтобы
сделать раствор точно 0,05000 н.?
610. Рассчитать навеску Н2С2О4-2Н2О, которую следу-
следует взять в мерную колбу емкостью 500 мл, чтобы на тит-
титрование 25,00 мл раствора израсходовать 30,25 мл рас-
раствора, содержащего 1,5800 г/л КМпО4.
611. Вычислить нормальность раствора 12, если на тит-
титрование 0,3002 г As2O3 израсходовано 40,00 мл этого рас-
раствора.
612. Чему равен титр раствора I2 no As2O3, если
1,00 мл его эквивалентен 0,03000 г Na2S2O3?
613. Вычислить процентное содержание Н2С2О4 в тех-
техническом препарате щавелевой кислоты, если 0,2003 г ее
оттитровали 29,30 мл раствора КМпО4, 1,00 мл которого
эквивалентен 0,006023 г Fe?
614. Из 1,4500 г технического Na2SO3 приготовили
200 мл раствора. На титрование 20,00 мл раствора израс-
израсходовали 16,20 мл раствора 12, титр которого по As2C>3
равен 0,002473. Определить процентное содержание
Na2SO3 в образце.
615. Какую навеску руды, содержащей около 60%
Fe2O3, взяли для анализа, если после соответствующей
обработки на титрование полученной соли железа (II)
израсходовали 20 мл 0,1 н. КМпО4?
118
616. Рассчитать навеску вещества (г), содержащего
0,3% серы, чтобы на титрование полученного из нее H2S
потребовалось 10,00 мл 0,05000 н. 12.
617. Сколько граммов Н2О2 содержится в пробе, если
при титровании израсходовано 14,50 мл раствора КМпО4,
1,00 мл которого эквивалентен 0,08376 г Fe?
618. Навеску 5,0000 г пергидроля растворили в мерной
колбе емкостью 500 мл. На титрование 25,00 мл раствора
израсходовали 37,43 мл 0,1 н. 1<МпО4 (/(=1,1240). Вы-
Вычислить процентное содержание Н2О2 в образце.
619. Навеску образца 0,1000 г, содержащего 99,98%
Fe, растворили в H2SO4 без доступа воздуха и- оттитро-
оттитровали 0,1000 и. КМпО4. Сколько миллилитров КМпО4 из-
израсходовали на титрование?
620. Сколько миллилитров раствора, содержащего
25,00 г/л К2Сг2О7, эквивалентны 3,4000 г FeSO4-7H2O в
кислой среде?
621. Вычислить процентное содержание железа в ру-
руде, если после растворения 0,7100 г руды и восстановле-
восстановления железа до Fe2+ на титрование израсходовали
48,06 мл КМпО4 A,00 мл КМпО4 эквивалентен 0,0067 г
НгС2О4). Сколько граммов КА\пО4 содержится в 1 мл
раствора?
622. Железо в навеске 0,5000 г руды восстановили до
Fe2+ и оттитровали 35,15 мл раствора К.2Сг2О7, 15,00 мл
которого по окисляющей способности эквивалентны
25,00 мл раствора KMnO4, a 1,00 мл КМпО4 эквивален-
эквивалентен 0,004750 г Fe. Рассчитать процентное содержание
Fe2O3 в руде.
623. Навеску в 0,2250 г пробы, состоящей только из
Fe и Fe2O3, растворили, восстановили железо до Fe2+ и
оттитровали 37,50 мл 0,09910 н. КМпО4. Вычислить про-
процентное содержание Fe и Fe2O3 в пробе.
624. Определить процентное содежание Sn в бронзе,
если на титрование раствора, полученного из 0,9122 г
бронзы, израсходовано 15,73 мл 0,03523 н. 12.
625. После растворения навески 0,1000 г неизвестного
окисла железа и восстановления металла до Fe2+ на тит-
титрование израсходовано 12,61 мл 0,09930 н. КгСг2О7. Оп-
Определить, какую формулу имел анализируемый окисел:
FeO, Fe2O3 или Fe3O4?
626. Навеску 1,7950 г руды перевели в раствор, вос-
восстановили железо в Fe2+ и довели до 250,0 мл. На тит-
титрование 20,00 мл раствора израсходовали 18,65 мл
119
К2СГ2О7 с титром 0,002857. Вычислить процентное содер-
содержание Fe в образце.
627. Навеску технического Na2SC>3 1,4680 г прибавили
к 100,0 мл 0,1000 н. 12. Избыток 12 оттитровали 42,40 мл
раствора Na2S2O3, 1,00 мл которого эквивалентен количе-
количеству 12, выделяющемуся из 0,01574 г KI. Вычислить про-
процентное содержание Na2SO3 в образце.
628. К навеске в 1,5000 г технического Na2SO3 после
растворения прибавили 100,0 мл 0,1000 н. 12. На титро-
титрование избытка 12 израсходовали 40,00 мл раствора,
в 200,0 мл которого содержится 2,4820 г Na2S2O3. Опре-
Определить процентное содержание Na2SO3 в образце.
629. К 25,00 мл раствора H2S прибавили 50,00 мл
0,01960 н. 12, избыток 12 оттитровали 11,00 мл 0,02040 н.
Na2S2O3. Сколько граммов H2S содержалось в 1 л иссле-
исследуемого раствора?
630. Рассчитать навеску образца, содержащего около
65% МпО2, чтобы после взаимодействия с 50 мл 0,1 н.
Н2С2О4 избыток ее оттитровывался 25 мл раствора
К.МпО4 A,00 мл раствора КМпО4 эквивалентен 1,035 мл
раствора Н2С2О4).
631. К раствору, содержащему 0,1510 г технического
КС1О3, прилили 100,0 мл 0,09852 н. Na2C2O4, избыток ко-
которого оттитровали 48,60 мл 0,05320 н. КМпО4. Вычис-
Вычислить процентное содержание КС1О3 в образце.
632. Навеску 0,2000 г руды, содержащей МпО2, обра-
обработали 24,00 мл Н2С2О4 в присутствии H2SO4 и на титро-
титрование не вошедшего в реакцию избытка Н2С2О4 израсхо-
израсходовали 20,00 мл 0,02000 и. КМпО4. Найти процентное со-
содержание Мп в руде, если на 25,00 мл раствора Н2С2О4
израсходовали 45,00 мл раствора КМпО4.
633. Вычислить процентное содержание МпО2 в при-
природном пиролюзите, если образец 0,4000 г обработали
разбавленной H2SO4, содержащей 0,6000 г Н2С2О4-2Н2О,
и избыток Н2С2О4 оттитровали 26,26 мл 0,1000 н. КМпО4.
634. Сколько граммов кальция содержится в 250,0 мл
раствора СаС12, если после прибавления к 25,00 мл его
40,00 мл 0,1000 н. (NH4JC2O4 и отделения образовавше-
образовавшегося осадка СаС2О4 на титрование не вошедшего в реак-
реакцию (ЫШЬСгО/, израсходовали 15,00 мл 0,02000 н.
КМпО4?
635. К раствору КСЮз прибавили 50,00 мл 0,1048 н.
FeSO4, избыток которого оттитровали 20,00 мл 0,09450 н.
120
KMnO4. Сколько граммов 1<С1О3 содержалось в рас-
растворе?
636. После растворения 1,2430 г стали хром окислили
до СгО^~. К раствору прибавили 35,00 мл раствора соли
Мора и избыток Fe2+ оттитровали 16,12 мл раствора
КМпО4 (Гкмпо.^0,001510 25,00 мл раствора соли Мора
эквивалентны 24,10 мл раствора КМпСч). Рассчитать
процентное содержание Сг в стали.
637. Навеску стали 0,2548 г, содержащей 1,09% мар-
марганца, растворили, окислили до МпО~ и оттитровали
18,50 мл раствора Na3As03. Рассчитать титр Na3As03 по
марганцу.
638. Навеску руды в 2,000 г растворили в кислоте и
хром окислили до Cr2Oj-. После разрушения избытка
окислителя раствор разбавили до 100,0 мл, 20,00 мл рас-
раствора обработали 25,00 мл раствора FeSO4. На титрова-
титрование избытка FeSO4 израсходовали 15,00 мл 0,04500 н.
К2СГ2О7 B5,00 мл FeSO4 эквивалентны 35,00 мл К2СГ2О7).
Вычислить процентное содержание Сг в руде.
639. Вычислить нормальность раствора Na2S2O3, если
1,00 мл раствора К2Сг207 эквивалентен 0,005584 г Fe, при
взаимодействии 20,00 мл раствора К2Сг207 с K.I выде-
выделяется такое количество Ь, которое оттитровывается
32,46 мл раствора Na2S2O3.
640. К кислому раствору KI прибавили 20,00 мл
0,1133 н. КМпО4 и выделившийся 12 оттитровали 25,90 мл
раствора Na2S2O3. Рассчитать нормальность раствора
Na2S2O3.
641. К 40,00 мл раствора КМпО4 A,00 мл КМпО4 эк-
эквивалентен 0,0050 г железа) добавили KI и выделивший-
выделившийся 12 оттитровали 35,90 мл раствора Na2S2O3. Рассчитать
титр раствора Na2S2C>3 по меди.
642. К 25,00 мл раствора КМпО4 с титром по кисло-
кислороду 0,0008110 добавили KI. Выделившийся 12 оттитро-
оттитровали 24,14 мл раствора Na2S2O3. Рассчитать титр Na2S2O3
по иоду.
643. Рассчитать навеску К2СГ2О7, чтобы на титрова-
титрование 12, выделившегося после взаимодействия его с избыт-
избытком KI, израсходовать 32,45 мл раствора Na2S2O3 с тит-
титром по 12 0,01270.
644. Из 25,00 мл раствора свинец осадили в виде
РЬСгО4, отфильтровали, промыли, растворили в кислоте
и добавили избыток KI. На титрование выделившегося
121
12 израсходовали 5l,50 мл 0,1010 н . Na2S2O3. Рассчитать
концентрацию свинца в растворе.
645. Сколько граммов Na2SO4 содержится в исследуе-
исследуемом растворе, если эквивалентное количество СгО^" вы-
выделяет из KI столько 12, что на его титрование расходу-
расходуется 30,40 мл 0,01980 н. Na2S2O3?
646. Навеску 0,2600 г технического CuCl растворили
в избытке солянокислого раствора NH4Fe(SO4J. На тит-
титрование образовавшегося Fe2+ израсходовали 20,18 мл
0,1200 н. К2Сг207. Найти процентное содержание CuCl в
образце.
647. Рассчитать нормальность раствора Na2S2O3, если
анализ выполнен по следующей схеме:
Для этого взяли навеску меди 0,1530 г, а на титрование
выделившегося 12 израсходовали 24,18 мл раствора
Na2S2Oa.
648. Серу из навески 0,1906 г угля перевели в SO2,
который уловили разбавленным раствором крахмала и
оттитровали 20,45 мл 0,02088 н. 12. Рассчитать процент-
процентное содержание серы в угле.
649. К 25,00 мл раствора KI прибавили КЮ3 и кис-
кислоту. На титрование выделившегося 12 израсходовали
30,00 мл 0,1048 н. Na2S2O3. Вычислить молярную концен-
концентрацию раствора KI.
650. К 25,00 мл раствора KI прилили разбавленной
НС1 и 10,00 мл 0,05000 М КЮ3. Выделившийся 12 отогна-
отогнали, к охлажденному раствору прибавили избыток KI, ко-
который вступил в реакцию с оставшимся КЮ3. На титро-
титрование выделившегося 12 израсходовали 21,14 мл 0,1008 и.
Na2S2O3. Вычислить молярную концентрацию первона-
первоначального раствора KI.
651. Установлено, что 50,00 мл раствора 12 по своей
окисляющей способности эквивалентны 49,47 мл раствора
К2Сг207, 1,00 мл которого выделяет из KI 0,004263 г 12.
Вычислить нормальность обоих растворов.
652. Рассчитать процентное содержание меди в ру-
руде, если из навески 0,6215 г руды медь перевели в рас-
раствор в виде Си2+, при добавлении к этому раствору KI
выделился 12, на титрование которого израсходовали
18,23 мл раствора Na2S2O3 G*Na,s5oa/cu = 0,006208).
122
653. К подкисленному раствору НгСЬ прибавили избы-
избыточное количество KI и несколько капель раствора
(NH4JMo04 как катализатора. Выделившийся 12 оттит-
оттитровали 22,40 мл 0,1010 н. NaaS2O3. Сколько граммов
НгО2 содержалось в растворе?
654. К навеске 0,1500 г К2СГ2О7 добавили избыточное
количество КД и соляной кислоты. Выделившийся U от-
оттитрован 21,65 мл раствора Na2S2O3. Рассчитать нормаль-
нормальность раствора Na2S2O3 и его титр по иоду.
655. Навеску 0,2940 г К2Сг207 растворили в мерной
колбе на 200,0 мл. На титрование иода, выделенного
25,00 мл полученного раствора из K.I, израсходовали
20,00 мл раствора Na2S2O3. Рассчитать титр раствора
Na2S2O3 и грамм-эквиваленты окислителей и восстано-
восстановителей, участвующих в реакциях.
656. К растаору К2СГ2О7 добавили избыток КЛ и выде-
выделившийся 12 оттитровали 48,80 мл 0,1000 н. Ыа2Б2Оз.
Сколько граммов К2Сг207 содержалось в растворе?
657. Сколько миллилитров раствора Н2О2, приготов-
приготовленного разбавлением 25,00 мл 3%-ного раствора до
250,0 мл, следует взять, чтобы на титрование полученно-
полученного раствора после обработки его НС1 и K.I израсходо-
израсходовать 25,00 мл 0,1500 н. Na2S2O3?
658. Сколько миллилитров хлорной воды, содержащей
около 2% хлора, следует взять, чтобы на титрование ее
после соответствующей обработки израсходовать около
30 мл раствора Na2S2O3 GVa3s,o,-5Hao — 0,02500)?
659. В мерную колбу емкостью 250 мл поместили на-
навеску 3,3590 г белильной извести и добавили воды до
метки. Для титрования 25,00 мл полученной суспензии
после соответствующей обработки потребовалось 13,29 мл
раствора Na2SaOaG'Na,s,o,-5HJo = 0.02453). Вычислить
процентное содержание активного хлора в белильной из-
извести.
660. Навеску 4,8900 г технического FeCl3 растворили
в мерной колбе емкостью 250 мл. К 25,00 мл раствора
в кислой среде добавили KI. Выделившийся 12 оттитро-
оттитровали 32,10 мл 0,09230 н. Na2S2O3. Вычислить процентное
содержание FeCl3 в образце.
661. Из навески 0,1862 г известняка, растворенной в
НС1,Са2+осадили в виде CaCsCh. Промытый осадок рас-
растворили в разбавленной H2SO4 и оттитровали 22,15 мл
раствора КМпО4(^кмпо,/сасо3 = 0,005820). Рассчитать про-
процентное содержание СаСО3 в известняке,
123
662. На окисление 0,2000 г Na2C2O4 в кислой среде по-
потребовалось 31,00 мл КМпО4. Сколько миллилитров
0,1000 н. Na2S2O3 израсходовали при иодометрическом
титровании 25,00 мл того же раствора КМпО4?
663. Из 3,2057 г сплава осадили свинец в виде PbCrO4.
Действием на осадок кислоты и KI выделили 12, на тит-
титрование которого израсходовали 9,15 мл 0,1028 н.
Na2S2O3. Рассчитать процентное содержание РЬ в сплаве.
664. Навеску 0,2000 г руды, содержащей МпО2, обра-
обработали концентрированной НС1. Образовавшийся при ре-
реакции хлор отогнали и поглотили раствором KI. Выде-
Выделившийся 12 оттитровали 42,50 мл 0,05200 н. Na2S2O3.
Вычислить процентное содержание МпО2 в руде.
665. Сколько граммов НС1 содержится в 200,0 мл со-
соляной кислоты, если на титрование 12, выделенного из
20,00 мл избытком смеси (КЮ3+К1), израсходовали
18,25 мл 0,02 н. Na2S2O3 (/(=0,9825).
ЧАСТЬ ТРЕТЬЯ
ФИЗИКО-ХИМИЧЕСКИЕ МЕТОДЫ АНАЛИЗА
Глава IX
ЭМИССИОННЫЙ СПЕКТРАЛЬНЫЙ АНАЛИЗ
Вопросы для самопроверки
1. Какова природа спектров излучения?
2. Почему атомные спектры имеют линейчатый харак-
характер?
3. Какими квантовыми числами описывается энергети-
энергетическое состояние электрона в атоме?. Что характеризуют
квантовые числа п, I, ти та и /'?
4. Сформулировать правило Гунда.
5. Вывести термы следующих атомов и ионов в основ-
основном состоянии-, a) Ni; б) Сг, в) Мп2+; г) Fe2+; д) Си2+;
е) Fe3+; ж) А1; з) Со; и) V2+.
6. Какие электронные переходы называются разре-
разрешенными, запрещенными, резонансными?
7. Назвать основные правила отбора.
8. Спектры каких частиц обозначаются символами
Na—I. Na—II, Na—III?
9. Назвать основные узлы спектральных приборов и
указать их назначение.
10. Каковы достоинства и недостатки следующих
средств возбуждения: а) пламени; б) электрической ду-
дуги; в) конденсированной искры?
11. В каких случаях применяются в качестве средств
возбуждения микроискра, плазменная дуга (плазмотрон),
лазерный микрозонд?
12. Дать сравнительную характеристику призмы и ди-
дифракционной решетки как диспергирующих устройств.
13. Что понимают под разрешающей способностью
спектрального прибора?
125
14. Каковы достоинства и недостатки призм, изготов-
изготовленных из стекла и кварца?
15. Какие приемники спектра (рецепторы) использу-
используются в эмиссионной спектроскопии?
16. Каковы особенности глаза человека как рецеп-
рецептора?
17. Как действует свет на фотопластинку (фото-
(фотопленку)?
18. Какие процессы происходят при проявлении и за-
закреплении фотопластинки? Написать соответствующие
уравнения реакций.
19. Для какой области длин волн предназначены
спектральные фотопластинки? Что представляют собой
сенсибилизированные фотопластинки?
20. Чем характеризуется чувствительность фотопла-
фотопластинки? Что такое экспозиция?
21. Что называется почернением фотопластинки, в ка-
каких пределах изменяется эта величина?
22. Что представляет собой характеристическая кри-
кривая фотопластинки?
23. Что означают «вуаль», инерция и фактор контра-
контрастности фотопластинки?
24. Каковы достоинства и недостатки фотопластинки
как рецептора?
25. Вывести основное уравнение, связывающее почер-
почернение фотопластинки с экспозицией.
26. Какие фотоэлементы используются как приемники
спектра излучения?
27. Привести оптическую схему спектрографа ИСП-28.
Каковы особенности этого прибора?
28. На чем основан качественный спектральный ана-
анализ? Какие приборы используются в этом анализе?
29. Вывести расчетную формулу для определения дли-
длины волны исследуемой линии по вторичному стандарту
(спектру железа или меди).
30. Как производится отождествление спектральных
линий?
31. Как выполняется качественный спектральный ана-
анализ: а) с помощью планшетов спектральных линий;
б) по «последним» линиям?
32. На чем основаны методы количественного спект-
спектрального анализа?
126
33. Как зависит Интенсивность спектральных линий от
условий возбуждения? Что представляет собой относи-
относительная интенсивность спектральных линий?
34. Что называется гомологической парой линий?
35. Привести оптическую схему стилоскопа. Какие ос-
основные задачи решаются с помощью этого прибора?
36. В чем сущность следующих методов полуколичест-
полуколичественного спектрального анализа: а) появления чувстви-
чувствительных линий; б) спектров сравнения; в) гомологических
пар?
37. Привести уравнение Ломакина и дать характери-
характеристику входящих в него величин.
38. Вывести основное уравнение фотографических ме-
методов количественного эмиссионного анализа.
39. В чем сущность следующих методов: а) трех эта-
эталонов; б) одного эталона; в) постоянного графика;
г) фотометрического интерполирования?
40. Привести принципиальную оптическую схему и
объяснить принцип работы микрофотометра МФ-2.
41. Рассказать о фотоэлектрических методах эмисси-
эмиссионной спектроскопии и привести принципиальную схему
прибора типа ФЭСА-6.
42. Что представляет собой пламенная фотометрия?
Каковы достоинства и недостатки этого метода?
43. Привести принципиальную схему пламенного фо-
фотометра.
44. Привести примеры определений методом спектро-
спектроскопии пламен в неорганической химии, органической,
в биологии и медицине.
Решение типовых задач
Пример 1. При анализе стали на хром по методу трех эталонов
на микрофотометре МФ-2 измерено почернение (S) линий гомологи-
гомологической пары в спектрах эталонов и исследуемого образца. Найти
процентное содержание хрома (Ссг) по следующим данным:
Эталон I II III
Ссг.% 0,50 1,23 4,17
SCr 0,07 0,37 0,86
SFe 0,27 0,23 0,27
Анализируемый образец ныеет Scr = 0,61 и 5ре = 0,25.
Решение. В методе трех эталонов используется зависимость
разности (&.S) почернений линий гомологической пары от логариф-
логарифма концентрации определяемого элемента. При определенных усло-
условиях эта зависимость близка к линейной. По показаниям измеритель-
127
ной шкалы микрофотометра находим AS (AS=Scr — Sfe) для трех
эталонов: Д5,, = 0,07—0,27= —0,20; Д52=0,37 —0,23=0,14; Л53 =
= 0,86 — 0,27=0,59.
Определяем по данным таблицы логарифмы концентраций:
lgCi = — 0,30; lgC2 = 0,09; lgC3 = 0,62 и строим калибровочный гра-
график в координатах AS — ]gC (рис. 1).
Находим AS для анализируемого образца: Д5х = 0,61—0,25 =
= 0,36 и по калибровочному графику определяем lgCcr: lgCcr =
= 0,35, Ccr=2,24%.
Пример 2. При анализе алюминиевого сплава на кремний по ме-
методу одного эталона получили почернение E) линий гомологической
пары в спектрах эталона (Ssi = 1,09 и 5ai = 0,37 при Csi = 0,95%) и
анализируемого образца (Ssi = 0,86 и SAi = 0,34).
Определить процентное содержание кремния в образце, если
Д5 = 0при ^=0,45%.
Решение. В методе одного эталона калибровочный график в
координатах AS = lgC строим лишь по двум точкам, одна из кото-
которых известна заранее: AS = 0 при lg Csl = Ig 0,45 = — 0,35.
По данным фотометрирования находим координаты второй точ-
точки и строим калибровочный график (рис. 2):
A5j= SS, — SA1 = 1,09—0,37= 0 ,72; lgCi = IgO,95= —0,02.
Определяем ASX для исследуемого образца: ASx = 0,86 — 0,34=
= 0,52 и с помощью графика находим содержание кремния: \gCx =
= —0,11, что соответствует Csi = 0,78%.
Пример 3. При определении олова в бронзе методом постоян-
постоянного графика сфотографировали на одной пластинке спектры четы-
четырех эталонов и получили следующие результаты:
Эталон I II III IV
Д5 = 55п — SCu .... 0,690 0,772 0,831 0,910
CSn, % 6,23 8,02 9,34 11,63
Спектр одного из эталонов снят через трехступенчатый ослаби-
ослабитель; при этом для выбранной линии Sn разность почернений двух
ступеней Д5СТуп= 1,065.
Спектр анализируемого образца сняли на другой пластинке так-
также через трехступенчатый ослабитель и получили следующие резуль-
результаты: Д5ступ = 0,925 —разность почернений двух ступеней выбран-
выбранной линии олова; AS^= 0,695 — разность почернений линий гомо-
гомологической пары Sn—Си.
Определить процентное содержание олова в образце.
Решение. Находим по значениям CsQ логарифмы концентра-
концентраций для четырех эталонов (lg Ci = 0,795; lgC2 = 0,904; lg C3 = 0,970;
lg СЛ= 1,068) и строим калибровочный график в координатах
AS — \gC (рис. 3).
Определяем переводной множитель k, позволяющий использо-
использовать этот график для анализа образцов, спектры которых получены
на разных фотопластинках:
128
где у я v'~ коэффициенты контрастности двух фотопластинок со
спектрами эталонов и анализируемого образца соответственно. Под-
Подставляем численные значения AS:
1,065
*1ы
-0,30
-0/t -0,2 С 0,2
Рис. 1
0,6
c
igc
-0,4 -0,3 -0,1 -0,1 0,0
Pkc. 2
Находим значение разности почернении линий гомологической
пары в спектре анализируемого образца с учетом переводного мно-
множителя:
ASX = A-AS^ = 1,151-0,695 = 0,800.
Рис. 3
По калибровочному графику находим lgCi = 0,933, что соответ-
соответствует CSn = 8,57%.
Примечание. Переводной множитель k можно определять,
не пользуясь трехступенчатым ослабителем. В этом случае необхо-
5—4022
129
димо знать разность почернений двух соседних линий основы на
основной пластинке и на пластинке, на которой снят спектр анализи-
руемогв образца. Отсюда k = Д50С„/Д5„сн. Дальнейший ход ре-
решения задачи аналогичен описанному выше.
Задачи
Метод трех эталонов
666. Определить процентное содержание марганца в
стали по следующим значениям почернений S линий го-
гомологической пары:
Варианты
I
II
III
Параметры
Смп. %
|ре
СМп, /о
|ре
Смп> %
•SFe
Эталоны
I
0,33
1,33
0,95
0,10
0,98
0,71
0,05
0,72
0,53
п
0,89
1,24
1,06
0,38
0,94
0,90
0,21
0,74
0,90
ш
3,03
1,14
1,20
1,90
0,99
1,24
0,30
0,78
1,03
Исследуемый
образец
1,08
0,96
0,75
0,61
0,73
0,91
667. Определить процентное содержание марганца в
стали, если при фотометрировании получены следующие
данные:
Эталон I II III
м
AS
1,20
0,47
0,94
0,39
0,48
0,17
Анализируемый образец имеет ASx = 0,30.
668. Определить процентное содержание хрома в ста-
стали, если при фотометрировании получены следующие
данные:
Эталон I II
AS
0,93
0,23
1,97
0,60
Ill
2,34
0,71
Анализируемый образец имеет А5ж = 0,44.
669. Определить процентное содержание никеля в ста-
стали, если при фотометрировании получены следующие
даннйе:
Эталон I II Ш
CN,, % 0,56 1,42 1,97
AS 0,054 0,44 0,60
130
Анализируемый образец имеет AS.t; = 0,23.
670. Определить процентное содержание хрома в ста-
стали, если при фотометрировании получены следующие
данные:
Эталон I II III
ССг, % 0,50 1,23 4,17
SCr 0,07 0,29 0,86
SFe 0,27 0,15 0,27
Анализируемый образец имеет SCr=0,73 и SFe=0,33.
671. Определить процентное содержание никеля в ста-
стали, если при фотометрироваини получены следующие
данные:
Эталон I II III
Ст, % 1,86 3,80 10,23
SN1 0,082 0,108 0,122
SFe 0,062 0,066 0,047
Анализируемый образец имеет Sm= 0,106 и Spe=
-=0,067.
672. Определить процентное содержание меди в алю-
алюминии, если при фотометрировании получены следующие
данные:
Эталон I II III
Ccu, % 0,25 0,80 1,20
SCu 0,25 0,54 0,61
S.m 0,42 0,44 0,41
Анализируемый образец имеет SCu=0,41 и SAi=0,35.
673. Определить процентное содержание кремния в
сплаве, если при фотометрировании получены следующие
данные:
Эталон I II III
Csi, % 0,63 1,65 3,86
SS1 0,186 0,189 0,191
SA, 0,184 0,184 0,184
Анализируемый образец имеет Ssi=0,190 и SM=
=0,184.
674. Определить процентное содержание вольфрама в
стали, если при фотометрировании получены следующие
данные-.
5* 131
Эталон I II III
Cw, % 0,78 1,37 2,19
Sw 0,388 0,472 0,494
SFe 0,462 0,464 0,424
Анализируемый образец имеет Sw=0,516 и Spe=
=0,452.
675. Определить процентное содержание ванадия в
стали, если при фотометрировании получены следующие
данные:
Эталон . I И III
См, % 0,11 0,97 2,79
Sv 0,228 1,015 1,328
SPe 0,608 0,662 0,575
Анализируемый образец имеет S\= 1,190 и SFe=
=0,640.
Метод одного эталона
676. При определении марганца в бронзе Д5=€ соот-
соответствовала концентрации С^п=1,77%, а для эталона с
концентрацией Ci = 0,83% ASt = —0,54. Построить калиб-
калибровочный график ;и определить процентное содержание
марганца >в исследуемом образце, если ASX = —0,33.
677. При определении олова в бронзе AS=0 соответ-
соответствовала концентрации С°п = 10,2%, а для эталона с
концентрацией Ci = 5,2% ASt =—0,52. Построить калибро-
калибровочный график и определить процентное содержание оло-
олова в исследуемом образце, если Л5Х = —0,28.
678. При определении магния в алюминиевом сплаве
Д5=0 соответствовала концентрации C^g = 0,57%,
а для эталона с концентрацией С! = 0,97% A5i=0,27.
Построить калибровочный график и определить процент-
процентное содержание магния в исследуемом образце, если
ASx = 0,19.
679. При определении железа в алюминиевом сплаве
Д5 = 0 соответствовала концентрации Сре —0,23%,
а для эталона с концентрацией С, = 0,54% ASj = 0,60.
Построить калибровочный график и определить про-
процентное содержание железа в исследуемом образце,
если AS* = 0,32.
680. При определении кремния в алюминиевом спла-
сплаве AS = 0 соответствовала концентрации G^ = 1,70%,
а для эталона с концентрацией Ci = 0,72% A5i = —0,48.
132
Построить калибровочный график и определить про-
процентное содержание кремния в исследуемом образце,
если ASX = —0,24.
681. При определении марганца в алюминиевом спла-
сплаве AS = 0 соответствовала концентрации ^мп' а для
эталона с концентрацией С4 получено AS\. Построить
калибровочный график и определить процентное содер-
содержание марганца в исследуемом образце, если получе-
получено ASX:
Образцы I II III IV V
С°т, % 0,14 0,37 0,42 0,56 1,40
С,, % 0,22 0,19 0,66 0,29 2,20
AS, 0,26 -0,44 0,39 -0,66 0,52
ASX 0,14 -0,25 0,25 -0,34 0,27
Метод постоянного графика
682. Для построения калибровочного графика при
определении олова в бронзе получены следующие дан-
данные:
CSn, % 6,23 8,02 9,34 11,63
&S = SSn—SCu 0,690 0,772 0,831 0,910
Фотометрирование спектра, снятого через трехсту-
трехступенчатый ослабитель, показало, что для двух ступеней
выбранной линии Sn ASCTyn= 1,055. При фотометрирэ-
вании спектра образца бронзы, сфотографированного на
другой пластинке, для двух ступеней той же линии Sn
получено Д-^т„п, а для аналитической пары Sn—Си з
спектре образца на той же пластинке AS/. Определить
процентное содержание олова в образцах:
Образцы I II III IV V
\S'cryn 0,930 0,920 0,890 0,900 0,910
\S'X 0,635 0,663 0,746 0,725 0,694
683. Для построения калибровочного графика при оп-
определении никеля в бронзе были получены следующие
данные:
CNI, % 3,00 3,42 3,84 4,24
bS = Sm— SCu 0,580 0,662 0,740 0,821
Для двух соседних линий меди, являющейся основой
сплава, ASOCH=0,828. При фотометрировании спектра
133
образца бронзы для той же пары линий меди получено
д5^сн, а для аналитической пары Ni—Си в спектре об-
образца на той же пластине д5^. Определить процентное
содержание никеля в образце:
Образцы I II III IV V
AS'0Cii 0,765 0,828 0,822 0,804 0,790
AS'X 0,566 0,708 0,764 0,820 0,538
Фотометрия пламени
684. Навеску стекла 0,1000 г растворили в смеси
H2SO4 и HF, раствор выпарили, остаток смочили соля-
соляной кислотой и перенесли в мерную колбу на 250 мл.
Полученный раствор фотометрировали в пламени так
же, как и стандартные растворы, приготовленные из
NaCl.
Данные фотометрирования приведены в таблице
(Аэтн — относительная интенсивность излучения).
Параметры
Сха> МГ/л
' отн
Стандартные растворы
1
10
16,0
2
20
31,5
3
30
47,5
Образцы
I
24,0
II
35,0
III
42,5
Построить калибровочный график в координатах
^отн — С и определить процентное содержание натрия в
образце.
685. Навеску удобрения 2,0000 г обработали при кипя-
кипячении насыщенным раствором оксалата аммония, после
охлаждения раствор разбавили в мерной колбе на
500 мл и профильтровали. Аликвоту фильтрата 5,00 мл
разбавили до 250,0 мл. Полученный раствор фотометри-
фотометрировали в пламени так же, как и стандартные растворы,
приготовленные из КС1. Данные фотометрирования при-
приведены в таблице.
134
Параметры
Сц, МГ/л
' отн
Стандартные растворы
I
5
8,0
о
10
15,0
3
15
24,2
Образцы
1
12,7
п
18,4
Ш
20,8
Построить калибровочный график и определить про-
процентное содержание калия в исследуемом образце.
686. Порцию исследуемой воды объемом 25,00 мл раз-
разбавили дистиллированной водой в мерной колбе на
500,0 мл и фотометр-ировали в пламени так же, как и
стандартные растворы, приготовленные из СаСО3. Ре-
Результаты фотометрирования приведены в таблице.
Параметры
ССа, мг/д
' отн
1
10
1,6
Стандартные растворы
2
30
47,6
3
50
80,2
4
70
111,0
Образцы
I
32,0
11
76,9
111
101,8
Построить калибровочный график и определить кон-
концентрацию (мг/л) кальция в исследуемой воде.
Глава X
АБСОРБЦИОННАЯ СПЕКТРОСКОПИЯ
Вопросы для самопроверки
1. Что называется коэффициентом пропускания Т и
оптической плотностью D? В каких пределах изменяют-
изменяются эти величины?
2. Какими уравнениями выражается основной закон
светопоглощения Бугера — Ламберта — Бера?
3. Что означает свойство аддитивности оптической
плотности?
4. Действие каких факторов может привести к нару-
нарушению линейной зависимости оптической плотности от
концентрации раствора?
135
5. Будет ли сохраняться линейная зависимость D от
С, если: а) состав анализируемого раствора с разбав-
разбавлением не изменяется; б) при разбавлении раствора про-
происходит гидролиз определяемого вещества; в) при раз-
разбавлении раствора происходит диссоциация определяе-
определяемого вещества, например:
г) с изменением кислотности раствора происходит сдвиг
равновесия, например:
2СтО\- + 2Н+:? Сг2О72- + Н2О
д) коэффициент преломления раствора существенно из-
изменяется с изменением концентрации определяемого ве-
вещества.
6. Каков физический смысл молярного коэффициента
погашения е? Какие факторы влияют на е: а) темпера-
температура; б) длина волны проходящего света; в) концентра-
концентрация раствора; г) природа вещества?
7. Что называется спектром поглощения и в каких
координатах его можно представить?
8. Чем определяются число и положение полос в
спектре поглощения?
9. Чем характеризуется высота максимума в спектре
поглощения?
10. Какие электронные переходы обусловливают
большую высоту максимума в спектре поглощения:
а) внутри атома; б) от атома к атому?
11. Какой величиной характеризуют форму максиму-
максимума в спектре поглощения и от каких факторов зависит
эта величина?
12. Какое математическое уравнение характеризует
полосу в электронном спектре поглощения?
13. Какова природа светопоглощения в ультрафиоле-
ультрафиолетовом, видимом и инфракрасном участках спектра?
14. Вывести оптимальное значение Т и D, при кото-
которых обеспечивается наименьшая относительная ошибка
измерения.
15. В каком интервале значений оптической плотности
рекомендуется работать на приборах типа ФМ-56
и ФЭК-М?
16. Как можно рассчитать минимальную, оптималь-
оптимальную и максимальную концентрации определяемого веще-
вещества в исследуемом растворе при известном значении е?
136
17. Привести конкретные примеры использования в
фотометрическом анализе для получения окрашенных
веществ следующих типов химических реакций: а) комп-
лексообразования; б) образования малорастворимых
соединений; в) окисления — восстановления; г) синтеза
и разрушения органических соединении.
18. Привести примеры определений по собственному
светопоглощению вещества.
19. Какие факторы необходимо учитывать при выбо-
выборе рабочей длины волны, если спектр поглощения ана-
анализируемого вещества имеет несколько максимумов?
20. Какие факторы необходимо учитывать при выбо-
выборе толщины светопоглощающего слоя (кюветы)?
21. Как определяют концентрацию вещества фотомет-
фотометрическим методом, используя среднее значение моляр-
молярного коэффициента погашения?
22. Как определяют концентрацию вещества фотомет-
фотометрическим методом с помощью одного стандартного рас-
раствора? Указать недостатки и достоинства этого метода.
23. В чем сущность метода калибровочного графика
и каковы его особенности?
24. Какова сущность метода добавок? Вывести фор-
формулу для расчета концентрации определяемого вещества
этим методом.
25. В каких случаях используют метод дифференци-
дифференциальной спектроскопии и каковы особенности этого ме-
метода?
26. В чем сущность качественного анализа раство-
растворов по светопоглощению?
27. На чем основано фотометрическое определение
смеси окрашенных веществ без их предварительного раз-
разделения?
28. Каким образом решается задача определения
двух компонентов в их смеси, если спектры поглощения
обоих компонентов в значительной мере накладываются
друг на друга?
29. Что называют фотометрическим титрованием?
Назвать особенности этого метода и области примене-
применения.
30. Начертить кривые фотометрического титрования
в координатах D—V, мл, и привести конкретные при-
примеры для следующих случаев: а) определяемый компо-
компонент и титрант не поглощают, а продукт реакции погло-
поглощает свет; б) определяемый компонент поглощает,
137
а титрант и продукт реакции не поглощают свет; в) оп-
определяемый компонент и продукт реакции не поглоща-
поглощают свет, а титрант поглощает; г) определяемый компо-
компонент и титрант поглощают, а продукт реакции не погло-
поглощает свет.
31. Назвать особенности спектрофотометрнн в ульт-
ультрафиолетовой области спектра.
32. Привести примеры количественных определений
по поглощению в ультрафиолетовой области спектра.
33. Каковы особенности инфракрасных спектров? Ка-
Какова природа поглощения в инфракрасной области
спектра?
34. На чем основан качественный анализ по погло-
поглощению в инфракрасной области спектра?
35. Привести примеры количественных определений по
поглощению в инфракрасной области спектра в: а) неор-
неорганической химии; б) органической химии.
36. Назвать достоинства и недостатки спектрофото-
метрии в инфракрасной области спектра.
37. Назвать основные узлы приборов для анализа по
светопоглощению. Каково назначение каждого из этих
узлов?
38. Назвать фотометрические приборы, предназначен-
предназначенные для работы в: а) видимом участке; б) ультрафиоле-
ультрафиолетовом участке; в) инфракрасном участке спектра.
39. Назвать источники света, используемые в: а) уни-
универсальном фотометре типа ФМ-56; б) фотоэлектроколо-
риметре типа ФЭК-М; в) спектрофотометре СФ-5;
г) спектрофотометре СФ-4; д) инфракрасном спектро-
спектрометре ИКС-12 или ИКС-14.
40. В каком спектральном интервале в качестве ис-
источника света используются лампа накаливания, водо-
водородная лампа, штифт Нернста, силитовый глобар, prv-т-
ная лампа?
41. Какими устройствами для получения монохрома-
монохроматического света снабжены перечисленные в п. 39 при-
приборы?
42. Какой из светофильтров обладает наименьшей
шириной полосы пропускания: желатиновый, стеклянный
или интерференционный?
43. Сравнить достоинства и недостатки монохрома-
торов: светофильтров, призм и дифракционных решеток.
44. Из каких материалов изготовляют оптические де-
138
тали приборов абсорбционной спектроскопии? Чем обу-
обусловливают выбор материала?
45. Для каких областей спектра предназначены при-
приборы, оптические детали которых выполнены из: а) стек-
стекла; б) кварца; в) поваренной соли; г) флюорита?
46. В каких фотометрических приборах применяют
следующие приемники света: а) глаз человека; б) фото-
фотоэлементы с внешним фотоэффектом; в) фотоэлементы с
вентильным фотоэффектом; г) термоэлементы.
47. Назвать основные характеристики фотоэлементов.
48. Дать сравнительную оценку фотоэлементов с
внешним, вентильным и внутренним фотоэффектом.
49. Объяснить принцип действия фотоумножителей и
указать области их применения.
50. Начертить принципиальную оптическую схему:
а) фотометра ФМ-56; б) фотоэлектроколориметра
ФЭК-М; в) спектрофотометра СФ-4 или СФ-5; г) инфра-
инфракрасного спектрометра ИКС-12 или ИКС-14.
51. На каких принципах основывается работа фото-
фотометра, фотоэлектроколориметра, спектрофотометра?
52. Что представляют собой нулевые растворы или
растворы сравнения?
53. В чем состоит подготовка прибора к работе и ка-
каков порядок работы на: а) универсальном фотометре
М-56; б) фотоэлектроколориметре ФЭК-М?
54. В виде каких соединений определяют фотометри-
фотометрическим методом следующие элементы: a) Fe, Cr, Zn;
б) Ni, Mn; A1; в) Со, Си, V; г) Bi, Ti, Sb.
55. Указать особенности фотометрического определе-
определения: а) железа в присутствии никеля; б) железа в при-
присутствии кобальта; в) хрома и марганца при совместном
присутствии; г) молибдена и ванадия при совместном
присутствии; д) двух красителей без их предварительного
разделения.
56. Каковы правила эксплуатации приборов ФМ-56
и ФЭК-М?
57. В чем сущность фотометрического определения
рН раствора с использованием цветных индикаторов?
58. Вывести расчетную формулу фотометрического
метода определения рН с: а) одноцветным индикатором;
б) двухцветным индикатором.
59. Как по поглощению в ультрафиолетовой области
спектра определяют: а) молибден в стали; бензол в цик-
логексане?
139
60. Какие способы приготовления образцов исполь-
используются в ИК-спектростапии в зависимости от агрегатно-
агрегатного состояния исследуемого вещества?
61. В чем сущность количественного анализа в
ИК-спектроокопии по методу базовой линии?
62. В чем сущность количественного анализа в ИК-
спектросколии с помощью внутреннего стандарта?
63. В чем сущность дифференциального метода коли-
количественного анализа по ИК-спектрам?
64. Что такое характеристические частоты? Какова их
роль в анализе по ИК-спектрам?
65. Как выполняется качественный анализ по ИК-
спектрам с помощью диаграмм характеристических ча-
частот?
Решение типовых задач
Пример 1. При определении ванадия по методу добавок навеску
стали 0,5036 г перевели в раствор и его объем довели до 50,0 мл.
В две мерные колбы на 50 мл отобрали аликвоты раствора по
20,0 мл; в одну из этих колб добавили стандартный раствор, содер-
содержащий 0,003 г V, затем в обе колбы — перекись водорода. Растворы
в колбах довели до метки, профотометрировали и получили: Dx =
= 0,20 и i>i:+cT = 0,48. Рассчитать процентное содержание ванадия
в стали.
Решение. Находим концентрацию стандартного раствора ва-
ванадия (Сст) с учетом разбавления:
где ау(ст) — количество ванадия в стандартном растворе, г; V —
объем раствора, мл.
Вычисляем концентрацию ванадия в растворе (Сх):
С' = С« Вх+1-вГ*Л*-* 0,48-0,20 -4,28-10-5 г/мл.
Определяем количество ванадия в навеске с учетом разбавления
растворов:
50-50
av = 4,28- 10—5 ——- = 5,35-10-з г.
Процентное содержание ванадия в стали равно
ду-100 ^ 5,35-Ю-3-100
0,5036
¦=1,06%,
где аСТа л и — навеска стали.
Пример 2. Из навески стали 0,2542 г после соответствующей об-
обработки получили 100,0 мл окрашенного раствора окисленного ди-
140
метилглиоксимина никеля. Относительная оптическая плотность этого
раствора Dx @ТН) оказалась 0,55. Для построения калибровочного гра-
графика взяли три стандартных раствора с содержанием никеля 8,0; 10,0 и
12,0 мг в 100 мл, профотометрировали их и получили относительные
оптические плотности (D0TB) соответственно 0,24-, 0,46 и 0,70. Раствор
"от и
0,6
ОМ
0Л
6,0
8,0
10,0
Ш
12,0
Рис. 4
сравнения содержал 6 мг Ni в 100 мл. Определить процентное со-
содержание никеля в стали.
Решение. Строим калибровочный график, откладывая на оси
ординат значения относительных оптических плотностей, а на оси
абсцисс — концентрации растворов никеля в мг/100 мл (рис.4). Рас-
Раствор сравнения дает четвертую точку графика, лежащую непосред-
непосредственно на оси абсцисс.
Откладываем на графике Di(Oth)=0,55 и находим соответству-
соответствующую ей величину Сх=10,7 мг/100 мл. Следовательно, количество
никеля в анализируемом растворе с учетом разбавления составит
10,7-10~3 г. Отсюда находим процентное содержание никеля в стали:
10,7-10-3.100
0,2542
= 4,200/0.
Пример 3. Навеску стали 0,2025 г растворили, отделили мешаю
щие ионы, окислили Мп до МпО4 и Сг до Cri&i ¦ Объем раство-
раствора довели до 100,0 мл и измерили его оптическую плотность на
ФМ-56 при двух выбранных светофильтрах.
При построении калибровочных графиков использовали исход-
исходные растворы марганца и хрома с ТКМпС,4/Мп =0,0001090 и
^К.СгЛ/Сг =0,001210, 10,00, 15,00 и 20,00 мл каждого стандартного
раствора разбавляли водой до метки в колбах на 100,0 мл и фото-
метрировали с теми же светофильтрами. Определить процентное
содержание Мп и Сг в стали по следующим данным:
141
М светофильтра
(с. ф.)
5
(Xi = 533 нм)
8
(Х2 = 432 нм)
Стандартные растворы, мл
КМпО<
10,00
15,00
20,00
КаСг.О,
10,00
15,00
20,00
Исследуе-
Исследуемый раст-
раствор (смесь
Мп и Сг)
Оптическая плотность
0,23
0,10
0,35
0,14
0,47
0,18
0,43
0,60
0,78
0,32
0,72
В
0,6
С.2
Решение. Строим калибровочные графики / и // (рис. 5) в
координатах D—С по данным
для растворов КМпО4. Концен-
Концентрации стандартных растворов
рассчитываем следующим обра-
образом (в пересчете на марганец):
TVj_ 0,0001090-10
1 = Too"= юо =
= 1,09-10-5 г/мл;
TV2 0,0001090-15
1,2
2,0
* 100 100
= 1,64-10—s г/мл;
ТУ3 0,0001090-20
3=="Тоо"== юо ~
= 2,18-10-5 г/мл.
s ?>Мп (раствор хрома при этой
длине волны свет практически не поглощает), то по прямой / нахо-
находим См о в анализируемой смеси:
Смп = 1,5-10-5 г/мл или аМп=СМп.100=1,5.10-зг.
Процентное содержание марганца в стали равно
1,5-10-3-100
',5
Рис. 5
Поскольку на с. ф. № 5
"мл00
0,2025
= 0,74%.
Строим калибровочный график /// (см. рис. 5) по трем стан-
стандартным растворам К2СГ2О7, используя данные по светопоглощению
яа с. ф. № 8 и следующие значения концентраций растворов бихро-
мата калия (в пересчете на хром):
TVX 0,001210-10
100
100
= 1,2Ы0~4 г/мл;
142
TV*
100
C3 =
100
0,001210-15
100
0,001210-20
mo
= 1,82-10-4 г/мл;
= 2,42-10-4 г/мл.
При с. ф. Л*° 8 ().i) свет поглощают оба раствора, т. е.
Dc*4 = D^r + D^a. Поэтому сначала с помощью прямой // (см.
рис. 5) находим величину D'^n, п:пользуя значение Сцп, найденное
по прямой/: ?>д^п = 0,13.
Затем находим светопоглощение хрома в смеси:
Dc\ =Dcm —DMr. =0,72 — 0,13 = 0,59.
Далее по прямой /// определяем
ССг = 1,77-10-4 г/мл или ас_=1,77-10-4.100 =1,77-10-2 г.
Процентное содержание хрома в стали равно
1,77-10-2. 1
V100
0,2025
= 8,74V
Пример 4. В смеси углеводородов с помощью ИК-спектров сняли
кривые светопоглощенпя в области 11,6 мкм для исследуемого рас-
раствора (С*) и трех растворов с известными концентрациями цикло-
циклогексаиа (ССт). В кювету сравнения во всех случаях помещали рас-
раствор с одинаковой концентрацией циклогексана. Методом базовой
линии получили следующие данные:
Интенсивность
поглощения
iA ....
1в • - ¦ -
Стандартнь
С„.,-73,51
57
65
5
2
е раств^рь
., = 80,45
49,7
62,6
0/
1 /0
Ссх.3 =
46
64
84,35
,7
,7
Исследуемый
раствор
53,2
64,6
Определить концентрацию циклогексаиа в исследуемом растворе.
Решение. На рис. 6 представлена часть ИК-спектра, содержа-
содержащего аналитическую линию циклогексаиа (А). Общую энергию в об-
области полосы поглощения измеряют отрезком /Д) заключенным меж-
между линией 100%-ного поглощения 2 и базовой линией 1, проведенной
в основании аналитической полосы поглощения. Пропускание 7"^
в методе базовой линии определяется отношением Т = IА/1в,
где /,—отрезок между 100%-ным пропусканием и максимумом
поглощения аналитической полосы А.
Удобнее пользоваться величиной оптической плотности
7"= -lg ~
143
так как
На основании этого соотношения достаточно определить опти-
оптические плотности нескольких растворов известных концентраций, по-
построить калибровочный график
и, зная Dx, найти искомую кон-
концентрацию определяемого веще-
вещества (ей/ постоянны). Рассчи-
Рассчитываем оптические плотности
цля каждого раствора:
= lg 1,134 = 0,055;
1r 62.6
Х,тм ^«.2 = ig " ¦¦
= lg 1,260 = 0,100;
/
Т~ = lg—'- = lg 1,385 = 0,142;
'а 46,7
= lg -3- = igEl^ =
,214 = 0,084.
По DCt и Сст строим калибровочный график (рис. 7), по кото-
которому находим Сх = 78,70%.
Ъ
ОД
0,10
CfiS
0,BS
80 85
Сциклоггхсан ' %
Рис. 7
Задачи
Метод добавок
687. В две мерные колбы на 100 мл влили одинако-
одинаковые объемы V сточной воды, содержащей медь. Туда же
144
ввели необходимые количества аммиака н раствора ру-
беановодородной кислоты. В одну из колб добавили
10,00 мл стандартного раствора CuSO4 G'cuso</cu = 0,001),
содержимое обеих колб довели до метки. После фильт-
фильтрования растворы фотометрировали, получив значения
оптической плотности Dx и Dx+ct- Определить концен-
концентрацию меди в сточной воде (г/л) по следующим дан-
данным:
Варианты I II Ш IV
V, мл 10,00 20,00 30,00 40,00
Dx 0,24 0,28 0,32 0,40
DX+CT 0,38 0,43 0,47 0,56
688. При определении ванадия методом добавок на-
навеску стали а растворили, объем раствора довели до
50,0 мл. Затем аликвоты раствора по 20,0 мл отобрали
в две мерные колбы на 50 мл. В одну из них добавили
навеску соли ванадия, содержащую 0,0030 г V. В обе
колбы добавили перекись водорода и объемы довели до
метки. Вычислить процентное содержание ванадия в ста-
стали, если при фотометрировании растворов получили сле-
следующие результаты:
Варианты I II III IV
а, г 0,5000 0,7468 0,9580 0,6572
?>, 0,20 0,25 0,28 0,23
Dx+Qr 0,48 0,50 0,48 0,49
689. При определении титана методом добавок на-
навеску стали а растворили, объем раствора довели до
50,0 мл. Затем аликвоты раствора по 20,0 мл отобрали
в две мерные колбы по 50 мл. В одну из них добавили
навеску соли титана, содержащую 0,0010 г Ti. В обе
колбы добавили перекись водорода и объемы довели до
метки. Вычислить процентное содержание титана в ста-
стали, если при фотометрировании растворов получены сле-
следующие результаты:
Варианты I II III IV
а, г 0,5000 0,4828 0,4600 0,6150
Dx 0,22 0,19 0,20 0,25
?>.t+cl 0,44 0,39 0,42 0,45
145
Дифференциальная спектрофотометрия
690. Навеску сплава а растворили в колбе на 100,0 мл.
В мерную колбу ,на 50 мл отобрали 2,00 мл раствора,
добавили раствора цирконола и довели объем до метки
водой. Относительная оптическая плотность этого рас-
раствора, измеренная по отношению к раствору сравнения,
содержащему 1 мг Zr в 50,0 мл, оказалась D^oth)-
Относительные оптические плотности четырех стан-
стандартных растворов, содержащих в 50,0 мл 1,2; 1,5; 1,7
и 2,0 мл раствора с концентрацией 1 мг/мл Zr, оказа-
оказались соответственно 0,28; 0,35; 0,40 и 0,47.
Построить калибровочный график в координатах
.Doth—Czr и определить процентное содержание цирко-
циркония в сплаве для следующих вариантов:
Варианты I II III
я, г 0,0800 0,1092 0,0984
^(отв) О-32 0,44 0,38
691. Из навески стали а после соответствующей об-
обработки получили 50,0 мл раствора КМпО4. Относитель-
Относительная оптическая плотность этого раствора, измеренная по
¦отношению к раствору сравнения, содержащему в
50,0 мл 10,00 мл раствора КМпО4(ГКмп0( = 0,00126), ока-
оказалась ЦГ@ТН).
Относительные оптические плотности четырех стан-
стандартных растворов, содержащих в 50,0 мл 5,00; 7,00;
8,00 и 9,00 мл раствора КМпО4 с тем же титром, изме-
измеренные по отношению к тому же раствору сравнения,
•оказались соответственно 1,19; 0,72; 0,49 и 0,24.
Построить калибровочный график в координатах
-Doth — Сип и определить процентное содержание мар-
марганца в стали для следующих вариантов:
Варианты I II III
а, г 0,0500 0,0602 0,0680
Д,(«т„) °.88 0,60 0,34
692. Из навески стали а после соответствующей обра-
обработки получили 1000 мл окрашенного раствора диметил-
глиоксимина никеля. Относительная оптическая плот-
плотность этого раствора, измеренная по отношению к рас-
раствору сравнения, содержащему 30 мг Ni в 1000 мл,
оказалась DX@TH).
146
Относительные оптические плотности четырех стан-
стандартных растворов, содержащих 9,00; 15,0; 18,0 и 24,0 мг
Ni в 1000 мл, оказались соответственно 0,22; 0,48; 0,60
и 0,87.
Построить калибровочный график в координатах
?>отн — (Сср — Сст) и определить процентное содержа-
содержание никеля в стали для следующих вариантов:
Варианты I II III IV
а, г 0,1750 0,2162 0,3170 0,2555
?>_,(ота) 0,78 0,66 0,37 0,55
693. При фотометрированпи раствора сульфосалици-
латного комплекса железа получили относительную оп-
оптическую плотность 0,29. Раствор сравнения содержал
0,0576 мг Fe в 50,0 мл, толщина кюветы 5 см.
Определить концентрацию железа в растворе, если
известно, что молярный коэффициент погашения комп-
комплекса в этих условиях составлял 3000.
694. Молярный коэффициент погашения комплекса
индия с пирокатехиновым фиолетовым равен 35900 при
630 нм. Определить содержание индия в растворе (г/л),
если относительная оптическая плотность исследуемого
раствора, измеренная в кювете с /=1 см по отношению
к раствору сравнения, содержащему 6-10~5 г-ион/л In,
оказалась 0,45.
695. Определить молярный коэффициент погашения
хромата калия, если относительная оптическая плот-
плотность 2,65- 10~3М К2СЮ4, измеренная при?. = 372,5 нм в
кювете с / = 2,3 мм по отношению к раствору сравнения,
содержащему МО моль/л КгСгО4, оказалась 1,38.
Определение смеси двух окрашенных веществ
696. Навеску стали 0,2000 г растворили, отделили ме-
мешающие ионы, окислили Мп до МпО~, Сг до Сг3О^ и
объем раствора довели до 100,0 мл.
Для построения калибровочных графиков использо-
использовали раствор КМпО4 с титром по марганцу 0,0001090 и
раствор К2СГ2О7 с титром по хрому 0,001210. Брали
5,00; 8,00 и 10,00 мл каждого стандартного раствора,
разбавляли водой до метки в колбах на 100 мл и фо-
тометрировали, используя светофильтры 5 и 8.
Построить калибровочные графики и определить про-
процентное содержание Мп и Сг в стали, если при измере-
147
нии оптической плотности стандартных растворов и ис-
исследуемого получили следующие результаты (кювета
1 см):
e-e-
Л и
Стандартные растворы, мл
5,00
8,00
10,00
К,Сг2О,
5,00
8,00
10,00
Исследуемый раствор
Варианты
III
IV
Оптическая плотность
0,23
0,10
0,36
0,15
0,47
0,18
0,43
0,63
0,28 0,47
0,780,820,61
0,330,370,42
0,760,720,62
697. Перекисные комплексы титана и ванадия при
ЛЭфф=432 нм (с. ф. 8) интенсивно поглощают свет. При
ЯЭфф = 619 нм (с. ф. 3) поглощает практически только
комплекс ванадия. Для построения калибровочного гра-
графика приготовили по четыре стандартных раствора пере-
кисных комплексов, содержащих по 0,2; 0,4; 0,5 и
0,6 мг/мл V и TL Исследуемый раствор довели водой до
объема 100,0 мл.
Построить калибровочный график и определить со-
содержание V и Ti (г) в исследуемом растворе, если при
измерении оптической плотности стандартных растворов
и исследуемого получили следующие результаты (кюве-
(кювета 1 см):
у.
-а; Я
Стандартные растворы, мг/мл
V
0,2
0,4
0,5
0,6
Т1
0,2
0,4
0,5
0,6
Исследуемый раствор
Варианты
III
IV
Оптическая плотность
0,16
0,36
0,28 0,34 0,40
0,68 0,83
О
1,000,51
0
1,10
1,40
1,68
1,54
0,380,200,320,220,26
1,58:
1,70
1,32
1,55
698. При ХЭфф=496 нм (с. ф. 6) светопоглощение ро-
данидного комплекса железа намного превышает свето-
светопоглощение соответствующего комплекса никеля. Для
148
построения калибровочного графика в колбах на
50 мл приготовили три стандартных раствора, содержа-
содержащих 5.0С; 8,00 и 10,00 мл исходного раствора
.\rH4Fe(SO4J-12H2O (ГГе=0,00005). Исследуемый рас-
раствор, содержащий железо и никель, довели до 100,0 мл,
взяли 20,0 мл в колбу на 50 мл, добавили 5 мл 2 н.
HCL 5 мл 10%-ного KSCN и довели до метки водой.
Построить калибровочный график и определить со-
содержание железа (мг) в исследуемом растворе, если при
измерении оптической плотности стандартных растворов
и исследуемого получили следующие результаты:
Стандартные
5,00
0,36
мл
8,00
0,58
растворы,
10,00
0,75
0
Исследуемый раст
Варианты
I
и
III |
Оптическая плотность
,43
0,46
0,66
юр*
I
о,
V
74
0
V
,79
* Поправку оптический илотнисти на поглощение никеля вт веек ва^мштах б'ать
0,08.
Количественный анализ по ИК-спектрам
699. Для анализа конечной газовой смеси при синте-
синтезе азотной кислоты в паровой фазе использовали метод
базовой линии. ИК-спектры снимали при помощи одно-
лучевого прибора в области 1,44 мкм. В зависимости от
температуры t°C, давления Р, соотношения концентра-
концентраций NO2 и Н2О в исходной смеси (л=[К'Ог]: [Н2О]) полу-
получили следующие значения интенсивностей полос IА н 1 в'-
1, "С*
25
50
75
100
150
200
л=2
'а
67,6
65,4
62,5
63,5
65,7
67,7
'в
68,2
68,5
67,4
67,8
68,1
67,6
л=4
'а
61,4
60,2
56,4
57,4
59,4
61,2
'в
62,3
63,1
61,3
61,6
61,8
62,2
п =
!А
64,7
61,3
58,8
59,7
61,3
63,0
6
'в
65,2
74,6
64,2
63,7
63,9
64,2
л =8
'а
57,8
54,5
54,2
54,3
55,3
55,6
'в
58,4
57,8
58,8
58,6
58,2
57,6
атм A,03 • I05 Па).
149
t, °C*
50
75
100
150
200
f
'a
51,3
50,2
47,8
51,2
53,6
=2 атм
'в
55,8
56,5
55,2
55,7
56,2
P = 4
'a
51,4
49,2
48,3
51,6
55,3
атм
I
59
58
59
60
59
в
,6
,У
,8
2
,2
bl
bO
47
60
P-C
л
,1
,5
,8
,1
атм
'
67
67
08
6/
В
,2
,8
,2
,b
* /1=2.
На основании этих данных найти процентное содер-
содержание азотной кислоты при:
№
п/п
1.
2.
3.
4.
5.
6.
7.
8.
9.
10.
/, °С
25
75
50
100
100
150
150
100
200
150
п
2
4
2
2
6
2
8
9
4
4
Р,атм
1
1
4
4
1
6
1
6
1
1
№
п/п
11.
12.
13.
14.
15.
16.
17.
18.
19.
20.
t, °С
200
50
100
150
75
200
150
75
50
25
п
2
6
8
2
2
2
2
2
4
4
Р, атм
4
1
1
2
4
6
4
6
1
1
Для построения калибровочного графика использо-
использовать следующие данные:
%- L48 1,71 2,07 2,58 3,18 4,35 5,95
. . 64,8 64,2 62,0 60,1 58,7 55,6 49,8
.. 70,5 71,0 69,8 69,5 70,8 71,2 70,2
/в
700. При анализе циклогексана в смеси углеводоро-
углеводородов в области 11,6 мкм сняли дифференциальные ИК-
спектры ряда смесей по отношению к одному и тому же
раствору сравнения. Методом базовой линии получили
следующие значения 1А и /вдля смесей с известным и
неизвестным содержанием циклогексана:
150
с, %
77,00
81,16
85,10
86,56
90,61
'л
51,5
50,4
51,4
48,6
51,1
'в
48,1
51,4
57,6
57,3
63,0
№ смеси
1
2
3
4
5
б
7
8
9
10
'а
56,4
51,6
59,9
52,2
53,2
49,8
52,1
48,7
48,3
54,1
'в
61,1
58,4
62,7
63,1
60,3
58,2
58,6
47,&
52,2:
57,2-
Определить процентное содежание циклогексана в
смесях 1 —10 методом калибровочного графика.
701. Для определения поливинилацетата в смеси
полимеров сняли ИК-спектры в области 5,8 и
4,7 мкм смеси твердых образцов с КВг и KSCN,.,
выполняющим роль внутреннего стандарта. Аналитиче-
Аналитическая полоса поглощения поливинилацетата (ПВА) на-
находится в области 5,8 мкм (группа >С=0), а полоса
поглощения KSCN — в области 4,7 мкм. Для приготов-
приготовления образцов с известным содержанием ПВА исполь-
использовали двойное последовательное разбавление броми-
бромистым калием, содержащим 0,2% KSCN; при этом каждый-
раз массу смеси доводили до 100 мг. Конечная смесь
превращалась в таблетки, для которых методом базовой
линии получили следующие значения IA и 1 в. Данные
для смесей с известным содержанием ПВА приведены в
табл. 1.
Таблица 2
Взятые навески
первое разбавление
(смесь 1), мг
100%-ный
ПВА
10
10
10
10
10
КВг+0,2%
KSCN
90
90
90
90
90
второе разбавление
(смесь 2), мг
0,39
0,58
1,02
1,51
2,55
КВг + 0,2%
KSCN
99,61
99,42
98,98
98,49
97,45
Величина поглощения
при 5,8
/о
В
54,2
58,4
59,2
54,8
57,0
мкм
I.
А
42,3
45,2
43,5
41,6
40,9
при 4,7 мкм-.
/ „
В
56,2
57,7
56,6
55,8
53,2
'а
32,5
32,4
35,8
42,6-
43,9
15»
По данным табл. 1 построить калибровочный график
в координатах A — h.&lhj— концентрация поливинила-
цетата (СПВА) и определить процентное содержание по-
ливинилацетата в образцах 1—11, используя данные
табл. 2.
Таблица 2
образ-
образца
1
¦3
4
5
6
7
8
9
10
11
Взятые i
первое разбавление
(смесь I), мг
поли-
полимер
40
30
50
25
35
55
45
30
35
40
50
КВг+0,2%
KSCN
60
70
50
75
65
45
55
70
65
60
50
{авески
второе
разбавление
(смесь 2), мг
смесь
I
2,5
15,0
5,0
10,0
3,5
2,5
1,0
1,5
4,0
5,0
6,0
КВг+0,2%
KSCN
97,5
85,0
95,0
90,0
96,5
97,5
99,0
98,5
96,0
95,0
94,0
Величина
при 5,
'в
63,8
61,2
58,3
62,2
56,3
61,3
58,3
62,7
59,8
61,6
62,5
8 мкм
'а
49,1
44,8
43,4
44,6
42,0
46,4
44,5
47,0
43,7
46,3
43,7
поглощения
при 4,7 мкм
'в
Р5,7
63,2
62,5
58,7
58,6
59,6
61,2
60,8
58,2
62,3
60,8
'а
37,6
44,2
47,3
45,2
48,0
34,6
40,5
41,3
48,1
50,2
48,7
Глава XI
НЕФЕЛОМЕТРИЯ И ТУРБИДИМЕТРИЯ
Вопросы для самопроверки
1. На чем основаны методы нефелометрии и турби-
диметрии?
2. Привести основной закон светорассеяния (уравне-
(уравнение Релея) и характеризовать величины, входящие в это
уравнение.
3. Исходя из уравнения Релея, вывести зависимость
кажущейся оптической плотности от концентрации ве-
вещества в анализируемой суспензии.
4. Построить графики зависимости DKam от С; 7каж от
С И DKa>« ОТ lg С.
5. Привести оптическую схему нефелометра (НФМ).
На каком принципе основана работа этого прибора?
6. Каков порядок работы на НФМ?
152
7. Какие условия необходимо соблюдать для обеспе-
обеспечения достаточной точности пефелометрических опреде-
определений?
8. Почему основным приемом анализа в нефеломет-
нефелометрии является метод калибровочного графика?
9. Назвать примеры нефелометрических определений
и указать условия проведения анализа.
10. Как связана интенсивность света, прошедшего че-
через суспензию, с концентрацией анализируемого вещест-
вещества в методе турбидиметрии?
11. Какие условия необходимо соблюдать для обес-
обеспечения достаточной точности турбидиметрических опре-
определений?
12. Какие приборы используют в методе турбидимет-
турбидиметрии?
13. В чем сущность фотонефелометрического и фото-
тур бидиметрического титрования?
14. Какой вид кривых нефелометрического и турби-
диметрического титрования?
15. Назвать достоинства и недостатки методов нефе-
нефелометрии и турбидиметрии.
Задачи
702. Для построения калибровочного графика при не-
фелометрическом определении сульфат-иона 25,0 мл рас-
раствора H2SO4, содержащего 0,215 мг/мл SO3, поместили
в мерную колбу на 100 мл. Затем в мерных колбах на
100 мл, содержащих 20,0; 15,0; 10,0; 6,00 и 2,00 мл этого
раствора, приготовили суспензии BaSO4 и измерили их
кажущиеся оптические плотности:
VH so , мл 20,0 15,0 10,0 6,0 2,0
?>каж 0,51 0,62 0,80 0,98 1,22
По этим данным построили калибровочный график.
Анализируемый раствор 50,0 мл разбавили в мерной
колбе на 100 мл. Затем 20,0 мл этого раствора перенес-
перенесли в мерную колбу емкостью 100 мл, приготовили в ней
суспензию BaSO4 и довели водой до метки. Кажущаяся
оптическая плотность этого раствора оказалась:
Варианты I II III IV
Я,(к.«) • ¦¦ 0,72 0,54 1,08 0,90
6-4022 153
Определить содержание SO3 в анализируемом рас-
растворе (мг/л).
703. Для нефелометрического определения серы в ка-
каменном угле приготовили стандартный раствор, разба-
разбавив 2,5 мл 0,01000 н. H2SO4 водой до 1000 мл (раствор
1). Затем в мерные колбы емкостью 100 мл добавили
20,0; 15,0; 12,0; 8,0; 4,0 и 2,0 мл раствора 1, приготовили
в них суспензии BaSO4 и измерили их кажущиеся опти-
оптические плотности:
VH>SO , мл . . . 20,0 15,0 12,0 8,0 4,0 2,0
?)каж .* 0,21 0,33 0,42 0,60 0,80 0,92
По этим данным построили калибровочный график.
Навеску каменного угля а растворили, разбавили во-
водой до 1000 мл. Затем 20,0 мл этого раствора после со-
соответствующей обработки поместили в мерную колбу
емкостью 250 мл, приготовили в ней суспензию BaSO4 и
довели водой до метки. Кажущаяся оптическая плот-
плотность раствора оказалась:
Варианты I II III IV
а, г 0,1348 0,1832 0,1008 0,1212
?>л.{каж) 0,46 0,30 0,69 0,54
Определить процентное содержание серы в каменном
угле.
704. При нефелометрическом определении хлорид-
иона для построения калибровочного графика 20,0 мл
раствора КС1, содержащего 0,5 мг/мл С1, поместили в
мерную колбу емкостью 100 мл. Затем в мерных колбах
на 50 мл, содержащих 8,0; 6,0; 4,0 и 2,0 мл этого раство-
раствора, приготовили суспензии AgCl и измерили их кажу-
кажущиеся оптические плотности:
VKCh мл 8,0 6,0 4,0 2,0
?)каж 0,12 0,22 0,39 0,66
По этим данным построили калибровочный график.
Анализируемый раствор 25,0 мл разбавили в мерной
колбе емкостью 100 мл. Затем 5,00 мл раствора поме-
поместили в мерную колбу емкостью 50 мл, приготовили в
ней суспензию AgCl и довели водой до метки. Кажу-
Кажущаяся оптическая плотность этого раствора оказалась:
Варианты I II III IV
О1(ш) , 0,29 0,50 0,16 0,26
154
Определить содержание хлорид-иона в анализируе-
анализируемом растворе (мг/л).
705. При нефелометрическом определении цинка для
построения калибровочного графика в мерные колбы ем-
емкостью 50 мл ввели 18,0; 14,0; 10,0; 6,0 и 2,0 мл стан-
стандартного раствора соли цинка, содержащего 5 мг/мл Zn,
приготовили в них суспензии K2Zn3tFe(CNN]2 и измери-
измерили их кажущиеся оптические плотности:
V, мл 18,0 14,0 10,0 6,0 2,0
?>каж 0,18 0,22 0,33 0,54 0,90
Анализируемый раствор 25,0 мл поместили в мерную
колбу емкостью 50 мл и приготовили в ней суспензию
K2Zn3[Fe(CN)«]2. Кажущаяся оптическая плотность это-
этого раствора оказалась:
Варианты I II III IV
Dx(Kax) 0,42 0,20 0,29 0,59
Определить содержание цинка в анализируемом рас-
растворе (г/л).
Глава XII
ЛЮМИНЕСЦЕНТНЫЙ АНАЛИЗ
Вопросы для самопроверки
1. Что называется люминесцентным излучением и ка-
какова его природа?
2. Какие виды люминесценции различают в зависи-
зависимости от способа возбуждения?
3. Что такое фосфоресценция и флуоресценция?
4. На чем основан качественный люминесцентный
анализ?
5. Привести примеры качественных определений ме-
методом люминесценции в технике, сельском хозяйстве,
медицине и т. д.
6. Какая зависимость используется в количественном
люминесцентном анализе?
7. Назвать основные узлы приборов люминесцентно-
люминесцентного анализа и привести принципиальную схему флуори-
метра.
6* 155
8. В чем сущность следующих приемов люминесцент-
люминесцентного анализа: а) метода шкалы; б) метода калибровоч-
калибровочного графика; в) метода добавок?
9. Привести примеры количественных определений
элементов и веществ методом люминесценции.
10. Что представляют собой люминесцентные индика-
индикаторы и в каких случаях они применяются?
11. Каковы достоинства и недостатки люминесцент-
люминесцентного анализа?
Задачи
706. Для построения калибровочного графика при
флуоресцентном определении магния с люмомагнезоном
ИРЕА 0,1054 г Mg(NO3J-6H2O растворили в мерной
колбе емкостью 100 мл. Затем 1,0 мл раствора разба-
разбавили в колбе на 100 мл (раствор 1).
Для приготовления четырех стандартных растворов в
мерные колбы на 50 мл внесли 1,5; 2,5; 3,5 и 5,0 мл рас-
раствора 1 и раствор люмомагнезона ИРЕА и довели объем
до метки. Интенсивность флуоресценции (/) стандарт-
стандартных растворов оказалась 0,37; 0,56; 0,75 и 1,03 соответ-
соответственно.
10,0 мл исследуемого раствора разбавили в колбе на
100 мл. Затем 5,0 мл этого раствора внесли в колбу на
50 мл, добавили раствора люмомагнезона ИРЕА и дове-
довели объем до метки (раствор 2). Построить калибровоч-
калибровочный график в координатах /— Си определить концент-
концентрацию магния (мг/мл) в анализируемом растворе, если
интенсивность флуоресценции раствора 2 равна 1Х:
Варианты I II III IV V
1Х 0,45 0,71 0,95 0,63 0,83
707. Для люминесцентного определения бора в руде
навеску а растворили и после соответствующей обработ-
обработки довели объем раствора до 100,0 мл. Затем к 1,00 мл
раствора добавили спиртовый раствор бензоила и изме-
измерили интенсивность люминесценции полученного раство-
раствора. Она оказалась 1Х.
Стандартные растворы содержали 4,00; 10,0 и 20,0 мг
бора в 100 мл. После прибавления к 1,00 мл каждого
стандартного раствора тех же реактивов и в тех же ко-
количествах, как и в случае исследуемого раствора, интен-
интенсивность люминесценции их оказалась 0,38; 0,65 и !,08
соответственно,
156
Построить калибровочный график и определить про-
процентное содержание бора в руде для следующих вариан-
вариантов:
Варианты . . I II III IV V
а, г . . . . ¦ 0,2000 0,3600 0,1750 0,2182 0,2500
1Х 0,60 1,00 0,52 0,74 0,86
708. Для люминесцентного определения алюминия в
латуни навеску а растворили и после соответствующей
обработки довели объем раствора до 500,0 мл. Затем
10,0 мл раствора перенесли в колбу емкостью 100 мл,
прибавили раствор кислотного хром-сине-черного и до-
довели объем до метки. Интенсивность люминесценции по-
полученного раствора оказалась 1Х.
Интенсивность четырех стандартных растворов, со-
содержащих в 100 мл 10,0; 20,0; 30,0 и 40,0 мкг алюминия,
равна 0,60; 0,82; 1,04 и 1,26 соответственно. Построить
калибровочный график и определить процентное содер-
содержание алюминия п латуни для следующих вариантов:
Варианты . . I] II -"III IV V
а, г 0,1000 0,0800 0,1600 0,1500 1,4400
1Х 72 56 109 91 118
709. Для люминесцентного определения рибофлавина
(витамина В2) в пищевом продукте методом добавок
0,2000 г продукта растворили и после соответствующей
обработки измерили интенсивность люминесценции полу-
полученного раствора. Она оказалась 0,30. После добавления
стандартного раствора, содержащего а (мкг) витамина
В2, интенсивность люминесценции увеличилась до
Лг+ст"
Варианты I II III IV V
а, мкг 17 33 50 26 40
/_г+ст 0,50 0,70 0,90 0,60 0,80
Определить процентное содержание витамина В2 в
продукте *, если интенсивность люминесценции холо-
холостого раствора /0=0,05.
* Формула для расчета результатов люминесцентного анализа
по методу добавок имеет следующий вид:
дст (/л--/,,) 10-4 %
Ux+c.t—/x)g
где х — содержание определяемого вещества, %; ост — добавка
определяемого вещества, мкг; /х, /.г+гт и /. — интенсивность люми-
люминесценции исследуемого раствора, того же раствора с добавкой стан-
стандарта и холостого раствора соответственно; g —навеска анализи-
анализируемого образца, г.
157
Глава XIII
КИНЕТИЧЕСКИЕ МЕТОДЫ АНАЛИЗА
Вопросы для самопроверки
1. В чем сущность кинетических методов анализа?
2. Что называют индикаторной реакцией и индика-
индикаторным веществом? Какие требования предъявляются к
индикаторным реакциям?
3. Какие вещества называются катализаторами, акти-
активаторами (промоторами) и ингибиторами?
4. Назвать наиболее распространенные способы изме-
измерения скорости химических реакций, используемые в ки-
кинетических методах анализа.
5. Охарактеризовать основные приемы кинетических
методов анализа: а) метод тангенсов; б) фиксированной
концентрации; в) фиксированного времени; г) индукци-
индукционного периода.
6. Что представляют собой дифференциальный и ин-
интегральный варианты кинетических методов анализа?
7. Указать факторы, влияющие на точность опреде-
определений с помощью кинетических методов анализа.
8. Назвать индикаторную реакцию, способ измерения
скорости реакции и метод обработки данных при опре-
определении: а) Мо (VI); б) Со (II); в) W (VI); г) V (V);
Д) Си (II).
9. При каких условиях возможно раздельное опреде-
определение находящихся в смеси веществ (катализаторов)
кинетическими методами анализа?
10. В чем сущность каталиметрического титрования?
11. Какие приборы используются при выполнении
анализа кинетическими методами?
12. Назвать области применения, достоинства и не-
недостатки кинетических методов анализа.
Решение типовых задач
Пример 1. Для определения молибдена кинетическим методом
использовали реакцию окисления иодид-ионов перекисью водорода,
катализируемую соединениями Мо. Применен дифференциальный
вариант метода тангенсов. В три колбы на 50 мл было прибавлено
1,0; 3,0 и 5,0 мл стандартного раствора молибдата аммония
( (NH ЬМоО /mo=^'^4' 10~8);в четвертую колбу помещен исследуемый
раствор. Поочередно в каждую колбу прибавлены необходимые реа-
реагенты (KI, HC1, НгО2 и крахмал) и после доведения объема раство-
158
pa до метки измерена зависимость оптической плотности D от вре-
времени т. Определить содержание Мо н растворе по нижеприведенным
жсиерпментальным данным.
¦с, мин
2,0
2,5
3,0
3,5
4,0
4,5
5,0
5,5
6,0
6,5
7,0
7,5
8,0
Стан
1,0
—
0,012
0,030
0,057
0,090
0,120
0,145
0,175
0,205
0,232
Оптическая плотность, L
аартные растворы, мл
3,0
0,020
0,052
0,094
0,140
0,181
0,225
0,265
0,304
0,340
0,374
0,402
0,428
5,0
0,025
0,073
0,135
0,198
0,248
0,300
0,365
0,408
0,446
0,477
0,509
—
—
)
Исследуемый
раствор
0,020
0,050
0,090
0,119
0,164
0,192
0,234
0,270
0,301
0,335
0,356
С'Я
0,2
6,0 7,0
Х,мин
Рис. а
Решение. Строим графики зависимости оптической плотно-
плотности раствора от времени (рис. 8). При этом необходимо учитывать,
что точки, соответствующие начальному и конечному периодам изме-
¦ рений, могут не располагаться на прямой линии. В первом случае
это связано с недостаточной точностью измерений оптической плот-
плотности при малых значениях D, во втором случае — с отклонением
зависимости D— % от линейной при достаточно глубоком протекании
индикаторной реакции. Поэтому эти точки практически отбрасы-
отбрасываются.
Рассчитаем значения тангенсон угла наклона всех четырех Пря*
мых:
tg си = 0,0583;
tga2 = 0,0850;
tg «з = 0,1147;
tgar = 0,0725.
159
Определяем концентрации Mo в стандартных растворах:
7V] 4,454-10-8-1-103
Cl=^7o = я* = 0,891-10-6 мг/мл;
TV2 4,454-10-8.3.103
у-> - • ^
2~500~
50,0
TV3 4,454-10-8-5-103
3~500~
50,0
= 2,670-10-6 мг/мл;
= 4,454-10-6 мг/мл.
,0 3,0 ...
С-10°, мг/мл
Рис. 9
Строим калибровочный график в координатах tga— С
Мо
(рис. 9) но данным для стандартных растворов. С помощью калиб-
калибровочного графика по значению tg a* находим концентрацию молиб-
молибдена в исследуемом растворе, а затем и его количество:
С* = 1,8-10-6 мг/мл, aMo=C^V= 1,8-10-6.50,0 = 9-10-5 мг.
Задачи
710. Для определения вольфрама использовали реак-
реакцию окисления иодид-иона перекисью водорода, катали-
катализируемую соединениями вольфрама. Был применен диф-
дифференциальный вариант метода тангенсов. В три мерные
колбы емкостью 50 мл внесли 3,00; 5,50 и 8,00 мл рас-
раствора Na2WO4(r^wo^/vy = 1,045- Ш). Исследуемый
раствор также поместили в мерную колбу на 50 мл. Пос-
После добавления необходимых реагентов измерили оптиче-
оптическую плотность D в зависимости от времени т для всех
растворов. По приведенным в таблице данным постро-
построить графики в координатах D — т и tga— Cw и опреде-
160
лить содержание вольфрама (г) в исследуемых раство-
растворах.
X, МИН
2,0
2,5
3,0
3,5
4,0
4,5
5,0
5,5
6,0
6,5 .
7,0
7,5
8,0
Оптическая плотность, D
Стандартные растворы, мл
3,00
0,065
0,077
0,093
0,107
0,120
0,136
0,150
0,165
0,178
0,195
0,210
0,225
0,241
5,50
0,115
0,140
0,166
0,192
0,220
0,246
0,275
0,300
0,327
0,355
0,380
0,410
0,425
8,00
0,180
0,220
0,262
0,302
0,340
0,380
0,420
0,455
0,490
0,530
0,560
Исследуемые растворы
I
0,085
0,102
0,123
0,140
0,156
0,176
0,196
0,214
0,230
0,250
0,268
0,287
0,306
II
0,102
0,124
0,145
0,170
0,195
0,220
0,245
0,266
0,291
0,315
0,342
0,367
0,380
III
0,145
0,180
0,210
0,245
0,280
0,310
0,345
0,375
0,413
0,440
0,465
0,490
0,520
711. Для определения молибдена использовали реак-
реакцию окисления иодид-иона перекисью водорода, катали-
катализируемую соединениями молибдена. В три мерные кол-
колбы на 50 мл внесли 5,0; 10,0 и 15,0 мл раствора
(NH4JMoO4 (T(NHi),Mo0)/mo =4,45-Ю-8). Исследуемый
раствор также поместили в мерную колбу на 50,0 мл.
После добавления необходимых реагентов измерили оп-
оптическую плотность D в зависимости от времени т для
всех четырех растворов и построили график, по которо-
которому определили тангенсы углов наклона прямых (tga),
приведенных в таблице.
tg
0
Стандартные растворы
а,
75
tg<4
1,00
tg
1
"а
,25
0
I
,95
Исследуемый раствор
Варианты
II
1,10
III [
0,85
1
IV
,21
1
V
,31
Построить калибровочный график в координатах
tga—Смо и определить содержание молибдена (г) в
исследуемых растворах.
712. Для определения вольфрама использовали реак-
реакцию окисления иодид-иона перекисью водорода, катали-
катализируемую соединениями W. В три мерные колбы на
161
50 мл внесли 1,0, 3,0 и 5,0 мл раствора Na2WO4
(TNa,wo4/w = 1,045-10). Исследуемый раствор также по-
поместили в мерную колбу на 50 мл. После добавления
необходимых реагентов измерили оптическую плотность
D в зависимости от времени т для всех четырех раство-
растворов и построили график, по которому определили тан-
тангенсы углов наклона прямых (tga), приведенных в таб-
таблице.
Стандартные растворы
0,020
tga.
0,033
tg «а
0,045
Исследуемый раствор
Варианты
I
0,039
II
0,024
III
0,036
IV
0,052
V
0,030
Построить калибровочный график в координатах
tga — Cw и определить содержание вольфрама (г) в ис-
исследуемых растворах.
713, Для определения содержания палладия в раство-
растворе методом фиксированной концентрации использовали
реакцию окисления a-нафтиламина нитрат-ионами, ката-
катализируемую соединениями палладия. Определить кон-
концентрацию палладия (мкг/мл) в исследуемом растворе,
если при измерении времени т, необходимого для дости-
достижения оптической плотности, соответствующей оптиче-
оптической плотности раствора с концентрацией палладия
2,8 мкг/мл, получили следующие результаты:
Параметры
Cpd, МКГ/МЛ
Т, МИН . . .
Стандартные растворы
1
1,0
18,2
1
2,3
7,7
3
2,8
6,3
4
3,5
5,1
5
4,5
4,0
Исследуемые растворы
I
12,0
и
•)
7,1
Ш
?
4,4
714. Для определения содержания серебра в растворе
методом фиксированной концентрации использовали ре-
реакцию окисления л-фенитидина персульфат-ионами,
в которой соединения Мп (II) являются катализатором,
а соединения серебра — активатором.
Определить концентрацию серебра (мкг/мл) в иссле-
исследуемом растворе, если при измерении времени т, необ-
необходимого для достижения оптической плотности,
соответствующей оптической плотности раствора с кон-
162
tietifрацией серебра ?,0-1(Н мкг/мл, поручили слеДуй-
щие результаты:
Параметры
Сд2, МКГ/МЛ
Т, МИН . . .
Стандартные растворы
1
2
13,3
2
4
6,3
3
6
4,2
4
7
3,6
5
00 СО
6
10
2,5
Исследуемые растворы
I
4,80
и
3,85
2,80
715. Для определения содержания тория в растворе
методом фиксированной концентрации.использовали ре-
реакцию окисления иодид-иона перекисью водорода, ката-
катализируемую соединениями тория. 2,0 мл исследуемого
раствора разбавили до 100,0 мл в мерной колбе, и полу-
полученный раствор разбавили еще в 10 раз.
Определить концентрацию тория (г-атом/л) в иссле-
исследуемом растворе, если при измерении времени г, необ-
необходимого для достижения оптической плотности, соот^
ветствующей оптической плотности раствора с концент-
концентрацией тория 8,2-10^6 г-атом/л, получили следующие ре-
результаты:
Параметры
Cxtr Ю6, г-атом/л
т, мин
Стандартные растворы
1
3,0
10,0
2
4,5
6,7
3
6,0
5,0
4
8,2
3,7
5
9,0
3,3
6
12,0
2,5
Исследуемые растворы
I
?
4,3
II
->
8,3
ill
?
2,9
716. Для определения содержания рения в руде ме-
методом фиксированного времени использовали реакцию
восстановления сульфосалицилатного комплекса железа
(III) хлоридом олова (II), катализируемую перренат-
ионами. Оптические плотности стандартных растворов,
измеренные через 30 мин после начала реакции, оказа-
оказались равными:
CRe-102, мкг/мл .... 1,5 3,0 4,5 7,5
Азо мин 0,42 0,39 0,36 0,30
Из навески руды а после соответствующей обработки
получили 100,0 мл раствора; 10,0 мл раствора разбавили
в мерной колбе на 50 мл. Определить процентное со-
содержание рения в руде, если через 30 мин после начала
реакции получили следующие значения оптической плот-
плотности исследуемых растворов:
163
Варианты I II III
а, г 0,1280 0,0520 0,0674
Дзо мии • . • 0,33 0,40 0,38
717. Для определения содержания палладия (II) в
растворе методом фиксированного времени использова-
использовали реакцию восстановления мышьяковистой кислоты
хлоридом олова (II), катализируемую соединениями
палладия (II). Оптические плотности стандартных рас-
растворов, измеренные через 3 мин после начала реакции,
оказались равными:
Cpd-107, г/мл ... 6,0 8,0 10,0 12,0 14,0
.. . -?>3мин 0,22 0,29 ^0,36 0,43 0,50
Для проведения реакции с исследуемым раствором
25,0 мл его разбавили водой до 1000 мл, затем 10,0 мл
полученного раствора вновь довели до объема 1000 мл.
Определить содержание палладия (г/л) в исследуемых
растворах, если получили следующие значения оптиче-
оптической плотности, измеренной через 3 мин после начала
реакции:
Варианты I II III
?>змин • • • ¦ • 0,33 0,38 0,46
718. Для определения содержания ртути в фармацев-
фармацевтическом препарате методом фиксированного времени
использовали реакцию превращения гексацианоферрат
(II)-иона в аква-пентацианоферрат (II)-ион и далее в
присутствии нитрозобензола — в окрашенный ион
[Fe(CNMC6H5NO]3-. Эта реакция катализируется соеди-
соединениями ртути. Оптические плотности стандартных рас-
растворов, измеренные через 15 мин после начала реакции,
оказались равными:
Снг-Ю3, мкг/мл 10,0 16,0 21,0 26,0
Аз мин 0,17 0,27 0,36 0,44
Из навески препарата а после соответствующей обра-
обработки получили 500 мл раствора. 10,0 мл раствора дове-
довели до объема 250 мл, из которого взяли 10,0 мл в мер-
мерную колбу на 100 мл.
Определить процентное содержание ртути в препара-
препарате, если получили следующие значения оптической плот-
плотности исследуемых растворов, измеренной через 15 мин
после начала реакции:
Варианты I II III
а, г 0,4350 0,3140 0,1735
?>15мИн 0,31 0,29 0,40
164
Глава XIV
ЭЛЕКТРОГРАВИМЕТРИЧЕСКИЙ
(ЭЛЕКТРОВЕСОВОИ) АНАЛИЗ
Вопросы для самопроверки
1. В чем сущность электрогравиметрического ана-
анализа?
2. Что такое электрохимический эквивалент веще-
вещества?
3. Что называется потенциалом разложения и пере-
перенапряжением?
4. Какое значение при электролизе имеют сила и
плотность тока?
5. Что представляет собой выход по току и каким об-
образом его учитывают в расчетах?
6. Какие аналитические цели достигаются с помощью
электролиза?
7. Какие металлы могут осаждаться на аноде?
8. Какими способами можно сократить время элек-
электролиза?
9. Каковы особенности электролиза на ртутном ка-
катоде?
10. Что представляет собой метод внутреннего элек-
электролиза? Каковы области применения, достоинства и не-
недостатки этого метода анализа?
Решение типовых задач
Пример 1. Навеску сплава 0,6578 г растворили и через получен-
полученный раствор в течение 20 мин пропускали ток силой 0,20 А, в резуль-
результате чего на катоде полностью выделилась медь. Определить про-
процентное содержание меди в сплаве, если выход по току составлял
80%.
Решение. В соответствии с законом Фарадея
где а — количество выделенного металла, г; / — сила тока, А; х —
время электролиза, с; А — атомный вес металла; F — постоянная
Фарадея; л — число электронов, участвующих в электрохимическом
процессе; г] — выход по току, %•
Отсюда процентное содержание меди в сплаве равно
0,20-20-60-63,55-80
95 %
лп 100 ^ 96500 • 0,6578 -2 = 9'5 % '
165
Задачи
719. Определить процентное содержание индиффе-
индифферентных примесей в образце медного купороса, если
после растворения его навески а в азотной кислоте и
электролиза полученного раствора выделено на плати-
платиновом катоде х меди:
Варианты I II III
flCuSCVSH2o, г 0,4556 0,5237 0,6274
*Си, г 0,1145 0,1322 0,1586
720. При электролизе раствора нитрата свинца на
аноде выделилось х РЬОг. Определить нормальность рас-
раствора РЬ(ЫОзJ, если для анализа взяли V мл раствора:
Варианты I II III
V, мл 20,0 30,0 40,0
¦*рьо2, г 0,2500 0,2345 0,2136
721. Навеску сплава а обработали соответствующим
образом и получили сульфатноаммиачный раствор, из ко-
которого электролизом при постоянной силе тока 0,5 А пол-
полностью выделили на платиновом катоде никель за вре-
время т. Рассчитать процентное содержание никеля в спла-
сплаве по следующим данным:
Варианты • . . I II III
а, г 1,0000 1,1000 1,2000
v, мин ¦ • . . 12 10 8
722. Определить время, теоретически необходимое
для полного выделения на катоде кадмия из V мл рас-
раствора CdSO4 указанной нормальности, если электролиз
проводился при силе тока 0,1 А и выход по току соста-
составил 100%:
Варианты I II III
V, мл 20,0 40,0 50,0
0,0622 0,0466 0,0435
723. Электролизом раствора ZnSO4 осаждено на ка-
катоде за время т 0,1200 г цинка. Какую силу тока необ-
необходимо поддерживать при электролизе, если выход по
току составил 90%:
Варианты I II III
и, с 786 1310 1965
166
724. Из анализируемого раствора, содержащего ионы
трехвалентного металла, в результате электролиза при
силе тока 1 А за время т было выделено на катоде х ме-
металла п получены следующие данные:
Варианты I II III
х, г 0,2800 0,3774 0,6510
t, мин 50 35 15
Какой был металл?
Глава XV
КУЛОНОМЕТРИЯ
Вопросы для самопроверки
1. В чем сущность метода кулонометрии при контро-
контролируемом потенциале? Привести примеры аналитических
определений.
2. Каковы особенности кулонометрического анализа
при контролируемой силе тока?
3. Привести примеры кулонометрического титрова-
титрования: а) электрогенерированными окислителями; б) элек-
трогенерированными восстановителями; в) с использова-
использованием реакций осаждения и комплексообразования; г) ио
методу нейтрализации.
4. Назвать наиболее распространенные способы фик-
фиксирования точки эквивалентности в кулонометрическом
титровании.
5. В каких координатах строят кривые кулонометри-
кулонометрического титрования?
6. На чем основывается кулонометрическое опреде-
определение воды?
7. Привести принципиальную схему установки для
выполнения кулонометрического анализа.
8. Указать достоинства и недостатки кулонометриче-
ских методов анализа.
Решение типовых задач
Пример 1. Навеску 0,6000 г вольфрамовой присадки перевели
в раствор и выделили алюминий в виде сжсихинолята. Осадок после
очистки растворили в небольшом количестве концентрированной НС1,
раствор внесли в кулономстрнческую ячейку и оттитровали выделив-
167
лийся 8-оксихинолин бромом, генерируемым в электролите. Точку
эквивалентности определили биамперометрически.
Вычислить процентное содержание алюминия в исследуемом об-
образце, если титрование велось при постоянной силе тока 8,0 мА в
течение 125 с.
Решение. Вычисления производят на основе закона Фарадея
(см. стр. 165):
AI, % =
дА1-100 /иЛА1-100
Добр Fnao6p
Величину я в данном случае находят из следующих соображе-
соображений. Кулонометрическое титрование провели по методу .замещения,
так как генерированный бром непосредственно реагировал не с алю-
алюминием, а с 8-оксихинолином. Последний был связан с алюминием
в стехиометрическом соотношении 3 ¦. 1.
По уравнению реакции
Вг
+ 2Вг2-
Вг-
2Н+ + 2Вг-
|N | N
ОН ОН
на один моль 8-оксихинолина приходится 4 эквивалента брома. Сле-
Следовательно, число электронов, участвующих в электрохимическом
превращении в расчете на один атом алюминия, составляет я —
= 3-4=12.
Подставляем численные значеиия в формулу и находим процент-
процентное содержание А1 в образце:
0,008-125-26,98-100
А1'* = 96500-12-0,6000 =3'W%-
Задачи
725. Титрование раствора, содержащего уран (IV),
провели кулонометрическим методом с помощью ионов
церия (IV), которые электрогенерируются в сернокис-
сернокислом растворе при постоянной силе тока 5,0 мА. Точку
эквивалентности определили амперометрически, при
этом время электролиза т составило:
Варианты ...... I II III IV V
и, с 102 120 140 160 180
Сколько миллиграммов урана содержалось в рас-
растворе?
726. Для определения иодид-ионов использовали ку-
лонометрический метод, титруя 1~ ионами МпО~ кото-
168
рые электрогенерируются в анодном пространстве в сер-
сернокислой среде. Точку эквивалентности установили по-
тенциометрически.
Вычислить количество 1~ в растворе (мг), если тит-
титрование продолжалось т, а сила тока равнялась /
и была постоянной
Варианты I II III
т, с 272 240 225
/, мА 18,0 16,0 14,0
727. Для определения 8-оксихинолина исследуемый
раствор кулонометрически титровали бромом, электро-
генерируемым из KB г в присутствии H2SO4 при постоян-
постоянной силе тока 6,0 мА. Конец реакции определили биам-
перометрически.
Найти количество 8-оксихинолина (мг), если время
электролиза составило т, а для окисления 1 моля ок-
сихинолина требуется 4 мг-экв брома:
Варианты I II III IV V
¦в, с 75,5 ;87 100 112 125
728. Раствор бихромата калия объемом V оттитрова-
оттитровали электролитически генерируемыми ионами железа
(II) при силе тока / в течение времени т:
Варианты I II III
V, мл 20 25 30
/, А 0,20 0,25 0,25
v, мин 15 20 35
Определить нормальность раствора бихромата ка-
калия.
729. Навеску сурьмы а перевели в раствор и содер-
содержащийся в качестве примеси алюминий выделили в ви-
виде оксихинолята. После очистки и растворения осадка в
соляной кислоте провели кулонометрическое титрование
раствора бромом, полученным в ходе электролиза из
КВг при постоянной силе тока 8,5 мА. Точка эквивалент-
эквивалентности, найденная биамперометрически, соответствовала
времени электролиза т. Рассчитать процентное содержа-
содержание алюминия в сурьме по следующим данным:
Варианты . . I II III IV V
а, г .... 0,5000 0,5346 0,5824 0,6712 0,7015
и, с 114 108 125 137 140
730. Навеску алюминия а растворили и содержащие-
содержащиеся в виде примеси ионы Fe3+ кулонометрически оттитро-
169
вали электровосстанавливаемыми ионами Sn2+ при по-
постоянной силе тока 4,0 мА. Точка эквивалентности
фиксировалась потенциометрическим методом, время
электролиза т определялось с помощью хронометра.
Определить процентное содержание железа в алюми-
алюминии по следующим данным:
Варианты I П III
а, г 1,0000 1,2245 1,5136
т, с 100 80 60
731. Для определения уксусной кислоты в ацетонит-
риле использовали метод кулонометрического титрова-
титрования с помощью ОНл-нонов, образующихся при электро-
электролизе воды в катодном пространстве. Точку эквивалентно-
эквивалентности установили потенциометрически. Какова молярность
СН3СООН, если сила тока составляла 25,0 мА, а время
электролиза — т и объемы исследованных растворов V
были следующими:
Варианты ... I II III IV V
х, с 107 92 85 75 60
V, мл 40,0 50,0 60,0 80,0 100,0
732. Кальций в растворе оттитровали этилендиамин-
тетраацетатом, который генерировался из соответствую-
соответствующего ртутного комплекса. Конец реакции установили
потенциометрически. Вычислить содержание кальция
(мкг) в растворе, если титрование велось при силе то-
тока 4 мА в течение времени т (в генерировании 1 иона
этилендиаминтетраацетата участвовало 2 электрона):
Варианты I II III IV V
х, с 59 83 100 123 165
Глава XVI
КОНДУКТОМЕТРИЯ
Вопросы для самопроверки
1. В чем сущность кондуктометрического метода ана-
анализа?
2. Что называют удельной электропроводностью и эк-
эквивалентной электропроводностью раствора?
3. Как влияет на электропроводность: а) природа
электролита и растворителя; б) концентрация электро-
электролита (сильного, слабого); в) температура?
170
4. Назвать области применения метода прямой кон-
дуктометрии.
5. Что представляет собой кондуктометрическое тит-
титрование и каковы особенности этого метода?
6. Какой вид имеют кривые кондуктометрического
титрования для реакций: а) кислотно-основного взаимо-
взаимодействия; б) осаждения; в) комплексообразования?
7. Как ведется кондуктометрическое титрование сме-
смесей веществ?
8. Привести схему установки для измерения электро-
электропроводности растворов.
9. Что такое хронокондуктометрическое титрование?
10. В чем сущность высокочастотного титрования и
каковы особенности этого метода анализа?
Задачи
733. Для определения концентрации HF используют
зависимость удельной электропроводности % от содержа-
содержания кислоты в растворе:
CHF, моль/л 0,004 0,007 0,015 0,030 0,060 0,1210,243
х-104, Om-1-cm-i . . . 2,5 3,8 5,0 8,0 12,3 21,0 36,3
Построить по этим данным калибровочный график в
координатах lgx — lg^HF и с его помощью определить
концентрацию фтористоводородной кислоты, если ее
удельная электропроводность равна:
Варианты I II III IV V
х-104, Om-1-cm-i ¦ • ¦ 3,2 9,2 14,4 20,1 28,2
734. При титровании 50 мл соляной кислоты раство-
раствором NaOH получили следующие данные:
VNa0H'
мл
0
2
4
6
8
10
Электропроводность
I
=0,0100
1,50
1,09
0,672
0,633
0,991
1,35
И
= 0,1000
1,42
0,85
0,70
1,15
1,62
раствора.
III
JV*J qit =
=0,6230
4,49
3,00
1,52
1,50
2,25
3,04
m-IO» (Ом),
IV
-1,012
4,05
1,93
2,35
3,27
—
для вариантов
V
-1,503
8,72
2,88
2,72
5,52
Построить график титрования в координатах
«а — VNaOH- Определить точку эквивалентности. Рассчи-
Рассчитать нормальность соляной кислоты.
171
735. При титровании 50 мл раствора, содержащего
NaOH и NH4OH, 0,01 н. НС! получили следующие дан-
данные:
I/ МП
1/нс1, мл
0
I
2
3
4
5
6
7
8
9
10
Электропроводность,
I
6,30
5,41
4,52
3,62
3,71
4,79
5,85
6,93
9,00
12,08
15,13
ш-Ю3 (Ом~
II
5,68
4,46
3,20
3,00
3,84
4,68
5,50
7,00
10,80
14,55
), для вариантов
III
6,60
5,93
5,30
4,68
4,05
—
4,45
5,70
7,80
12,02
16,20
Построить график титрования, определить точки эк-
эквивалентности и рассчитать концентрацию (г/л) NaOH и
NH4OH в исследуемом растворе (первая точка эквива-
эквивалентности соответствует оттитровыванию NaOH, вто-
вторая — сумме NaOH и NH4OH).
736. При титровании раствора ВаС12 0,2000 н. H2SO4
получили следующие данные по шкале высокочастотно-
высокочастотного прибора:
2,0
4,0
6,0
8,0
10,0
Показавия прибора для вариантов
I
62,0
43,0
29,5
22,0
19,2
п
68,3
50,5
34,5
28,0
21,5
in
71,4
55,1
39,2
31,2
. 24,6
Построить график титрования и определить содержа-
содержание ВаС1г (г) в исследуемом растворе.
737. Навеску а смеси слабых оснований растворили
в безводной уксусной кислоте и оттитровали кондукто-
метрическим методом 0,2000 М раствором хлорной кис-
кислоты. Результаты титрования показаны на рис. 10, а и б.
Определить процентное содержание компонентов в
смеси.
172
Варианты
I
II
III
IV
Состав смеси
я-Нитроанилин
Диэтиламин+дифениламин
Диэтиламин+я-нитроанилин+мочевина
Диэтила мин+и-хлоранилин+дифениламин +аце-
тамид
а, г
0,0920
0,2134
0,1425
0,1512
0,2
OC-W1*
0,80
0,68
0,56
0,32
0,2
Г
я
irCfV^l I 1 1 1 1 1
Рис. 10
738. Навеску а смеси соляной и серной кислот дове-
довели до 100,0 мл безводной уксусной кислотой. Результа-
Результаты кондуктометрического титрования полученного рас-
раствора 0.2000М СНзСООЫ показаны на рис. 11.
Определить процентное содержание H2SO4 и НС1 в ана-
анализируемой смеси *:
Варианты I ц щ
а, г . 0,1010 0,1390 0,0790
* Изломы на кривых соответствуют процессам нейтрализации в
следующей последовательности: 1-я ступень диссоциации H2SO4,
затем НС1 и, наконец, HSO"".
173
При расчете содержания серной кислоты испбльЗб-
вать оба скачка титрования.
Рис. 11
Глава XVII
ПОТЕНЦИОМЕТРИЧЕСКИЕ МЕТОДЫ АНАЛИЗА
Вопросы для самопроверки
1. На чем основаны потенциометрические методы
анализа?
2. Привести уравнение Нернста и пояснить смысл
входящих в него величин.
3. Какие электроды называют электродами I и
II рода?
4. Какой электрод называют индикаторным и какой
электродом сравнения?
5. В чем сущность потенциометрического определе-
определения рН раствора? Назвать основные индикаторные элек-
электроды.
6. Какова сущность потенциометрического титрова-
титрования? Указать его достоинства и недостатки.
7. Какие требования предъявляются к реакциям, ис-
используемым в потенциометрическом титровании?
8. Какой вид имеют кривые потенциометрического
титрования?
9. Привести принципиальную электрическую схему
установки для потенциометрического титрования.
174
10. Привести примеры потенциометрического титро-
титрования с использованием реакций нейтрализации, осаж-
осаждения и окисления — восстановления.
Задачи
739. Рассчитать рН раствора по следующим экспери-
экспериментальным данным:
Вари-
Варианты
I
II
III
IV
V
VI
VII
VIII
IX
X
Элемент
Pt(H2)|CH3COOH|0,l н. KCI, Hg.2Cl2|Hg
Хиигидронный
электрод
Хингидронный
электрод
NH4OH
NH4OH
NH4CI
нас. КС1, Hg2Clo
нас. КС!, Hg2Cl2
Hg
Hg
Pt(H2)HCOOH|0,l н. KCI, AgC!|Ag
Pt (H2)|N2H4-H,O| 1 н. KCI, AgCllAg
Pt (H2) | LiOH | HgO | HR
Хингидронный
электрод
HrSO4
Hg2SO4
Hg
Pt(H2)|NH4CI|0,l н. КС1, AgCl|Ag
Хингидронный
электрод
HCOONa
1 н. КС1, AgCl
Ag
Pt (H2) | HI, Agl Ag
Э.л.с,
В
0,498
0,004
0,016
0,580
0,772
0,626
0,104
0,642
0,006
0,142
k
30
18
18
20
20
25
20
20
20
25
740. Построить кривые потенциометрического титро-
титрования в координатах Е— V и AE/AV— V. Определить
концентрацию НС1, если при титровании 20,00 мл анали-
анализируемого раствора кислоты 0,1000 н. NaOH получили
следующие результаты:
^NaOH. мл • . 10,0 18,0 19,0 19,9 20,0 20,1 21,0 22,0
рН 1,48 2,28 2,59 3,60 7,00 10,60 11,49 11,68
— Е, мВ . . 86 132 150 209 406 615 666 678
741. Построить кривые потенциометрического титро-
титрования в координатах Е— V и AEJAV— V и определить
концентрацию СН3СООН, если при титровании 10,0 мл
анализируемого раствора кислоты 0,1000 н. КОН полу-
получили следующие результаты:
VKOn, мл . . 10,0 18,0 19,0 19,5 19,9 20,0 20,1 20,5 21,0
рН 4,76 5,71 6,04 6,35 7,06 8,79 10,52 11,22 11,51
— ?,мВ. . 276 331 350 368 410 510 610 650 668
742. Построить кривые потенциометрического титро-
титрования в координатах Е — V и AE/AV— V и определить
175
концентрацию метиламина, если при титровании 20,0 мл
анализируемого раствора амина 0,2000 н. НС1 получили
следующие результаты:
VHCU мл . 10,0 12,0 14,0 14,5 14,9 15,0 15,1 15,5 16,0
рН . . . . 10,42 10,12 9,56 9,28 8,42 5,90 3,24 2,55 2,25
— Е, мВ . 605 586 554 538 488 342 188 148 130
743. Определить концентрацию NaCl в растворе (г/л),
если при потенциометрическом титровании 20,0 мл рас-
раствора 0,2000 н. AgNO3 получили следующие результаты:
^AgNOj, мл 15,0 20,0 22,0 24,0 24,5 24,9 25,0 25,1 25,5
Е, мв\ . 307 328 342 370 388 428 517 606 646
744. Навеску сплава 2,1574 г растворили и после со-
соответствующей обработки довели объем раствора до
100,0 мл. Определить процентное содержание серебра в
сплаве, если при потенциометрическом титровании
35,0 мл приготовленного раствора 0,1250 н. NaCl полу-
получили следующие результаты:
VNaa, мл . 16,0 18,0 19,0 19,5 19,9 20,0 20,1 20,5 21,0
Е, мВ . . • 689 670 652 634 594 518 441 401 383
745. Определить концентрацию NH4C1 в растворе
(г/л), если при потенциометрическом титровании 20,0 мл
раствора 0,0500 н. Hg2(N03h получили следующие ре-
результаты:
l^Hgi(NOa)j, мл . . 10,0 15,0 17,0 17,5 17,9 18,0 18,1 18,5 19,0
Е, MB."/ 382 411 442 457 498 613 679 700 709
746. Определить концентрацию KCN в растворе (г/л),
если при потенциометрическом титровании 20,0 мл рас-
раствора 0,1000 н. AgNO3 получили следующие результаты:
KAgNO,- мл ¦ 5>° 7-° 9-° 9>5 9'9 10>° 1О'! 10'5 И'°
?, мв' . . . -252 -216 -153 -116 24 376 340 340 340
747. Определить концентрацию NaCl в растворе (г/л),
если при потенциометрическом титровании 20,0 мл рас-
раствора 0,1000 н. Hg(NO3J получили следующие резуль-
результаты:
KHg(NOjb, мл . . 10,0 18,0 19,0 19,5 19,9 20,0 20,1 20,5
Е, мВ .' 501 552 570 589 629 704 737 757
748. Из навески сплава 1,2000 г железо перевели в
Fe (II) и оттитровали 1,0000 н. Ce(SO4J:
Се4+ + Fe2+ ^t Ce3+ + Fe3+
176
Вычислить процентное содержание железа в сплаве
по следующим результатам потенциометрического титро-
титрования:
ИСеE0<ь, мл. 2,0 10,0 18,0 19,8 20,0 20,2 22,0
Е, мВ* . . . . 712 771 830 889 1110 1332 1391
749. Из навески руды 0,0800 г уран перевели в U4+ и
оттитровали 0,0100 н. КМпО4:
2МпО" + 5U4+ + 2Н2О -$- 2Мп2+ + Ъ\30\+ + 4Н+
Вычислить процентное содержание урана в руде по
следующим результатам потенциометрического титро-
титрования:
VKMn(V мл. 2,0 10,0 18,0 19,8 20,0 20,2 22,0
Е, мВ* . . . 301 330 359 389 1173 1486 1498
750. Из навески образца 2,0400 г таллий перевели в
Т1 (I) и оттитровали 0,1000 н. КВЮ3 в солянокислой
среде:
ВгО- + 3 Т1+ + 6Н+ ^ Вг- + Зт13+ + ЗН2О
Вычислить процентное содержание таллия в сплаве
по следующим результатам потенциометрического тит-
титрования:
^КВгО,> MJI • • ¦ • 2,0 10,0 18,0 19,8 20,0 20,2 22,0
?, мВ . . . ... . 1251 1280 1309 1339 1407 1430 1451
751. Из навески 2,0000 г стали ванадий перевели в
раствор и оттитровали 0,1000 н. раствором сульфата же-
железа (II):
VO+ + Fe2+ + 2Н+ :? VO2+ + Fe3+ + Н2О
Вычислить процентное содержание ванадия в стали
по следующим результатам потенциометрического тит-
титрования:
KF.-SO,, мл • • • 2>° 10-° 18'° 19'8 20>° 20>2 22>°
?,^мВ 1058 999 940 901 885 841 830
752. Из навески 0,6000 г сплава титан перевели в
TiO2+ и оттитровали 0,1000 н. СгС12:
ТЮ2+ + Сг2+ + 2Н+ ¦+ Т13+ + Сг3+ + Н2О
177
Вычислить процентное содержание титана в сплаве
но следующим результатам потенциометрического тит-
титрования:
^crcu, "л ... 2.0 10,0 18,0 19,8 20,0 20,2 22,0
Е, мВ 159 100 41 —18 —155 -292 —351
Глава XVIII
ПОЛЯРОГРАФИЯ И АМПЕРОМЕТРИЧЕСКОЕ
ТИТРОВАНИЕ
Вопросы для самопроверки
I. В чем сущность полярографических методов ана-
анализа?
%, Начертить принципиальную схему полярографа.
3. Что называется потенциалом полуволны и предель-
предельным (диффузионным) током? Привести уравнение, свя-
связывающее эти величины.
4. На чем основан качественный полярографический
анализ?
5. Какова основа количественного полярографическо-
полярографического анализа?
6. Привести уравнение Ильковича и охарактеризо-
охарактеризовать входящие в него величины. Каково практическое
применение этого уравнения?
7. Какие аналитические приемы используются в ко-
количественной полярографии?
8. Привести примеры полярографических определе-
определений в неорганической и органической химии.
9. Что представляет собой полярография: а) пере-
меннотоковая; б) амальгамная с накоплением; в) осцил-
лографическая; г) со струйчатым электродом?
10. Назвать области применения, достоинства и не-
недостатки полярографического метода анализа.
II. В чем сущность амперометрического титрования?
12. Какова схема установки для амперометрического
титрования с вращающимся электродом?
13. Привести примеры реакций, используемых при
амперометрическом титровании.
14. Какой вид имеют кривые амперометрического
титрования?
15. Назвать области применения, достоинства и не-
недостатки метода амперометрического титрования.
178
Задачи
753. После соответствующей обработки четырех стан-
стандартных образцов стали, содержащих хром, сняли их
полярограммы и получили следующие результаты:
Образцы 1 2 3 4
ССг, % 0,30 0,42 0,96 1,40
А, мм . . 8,0 10,0 20,0 28,0
Построить калибровочный график и определить про-
процентное содержание хрома в анализируемом образце,
если при его полярографировании высота волны оказа-
оказалась hx:
Варианты I II III IV V
hx, мм 22,0 12,0 18,0 14,0 24,0
754. Для определения содержания примеси свинца в
металлическом алюминии навеску последнего а раство-
растворили, перенесли в мерную колбу на 50 мл и раствор до-
довели водой до метки. При снятии полярограммы высота
волны оказалась hx. При полярографированин стандарт-
стандартных растворов соли свинца получили следующие резуль-
результаты:
СРЬ-10б, г/мл. . . .0,5 1,0 1,5 2,0 2,5
Л, мм 4,0 8,0 12,0 16,0 20,0
Построить калибровочный график и определить про-
процентное содержание свинца в анализируемом образце
для следующих вариантов:
Варианты : I II III IV V
а, г 5,1340 2,5000 5,3000 5,8350 7,5860
hx, мм 9,0 6,0 11,0 14,0 17,0
755. Для определения содержания меди в латуни на-
навеску последней а растворили и после соответствующей
обработки довели объем раствора до 50,0 мл. При сня-
снятии полярограммы полученного раствора высота волны
оказалась равной hx. При полярографировании четырех
стандартных растворов меди получили следующие ре-
результаты:
ССи-10з, г/ыл 0,5 1,0 1,5 2,0
А, мм 5,0 15,0 25,0 35,0
Построить калибровочный график и определить про-
процентное содержание меди в анализируемом образце для
следующих вариантов:
179
IV
3,0730
3,5
29,0
V
3,1860
3,0
27,0
Варианты ... I II III IV V
а, г 0,1000 0,1435 0,1200 0,0690 0,1547
hx, мм . . . .18,0 28,0 23,0 11,0 31,0
756. Для определения содержания свинца в цинковой
руде методом добавок навеску руды а растворили и пос-
после соответствующей обработки объем раствора довели
до 200,0 мл. Для снятия полярограммы взяли 20,0 мл
' этого раствора. Высота волны оказалась равной 25,0 мм.
После добавки 0,08 М Pb(NO3J (Vct) высота волны уве-
увеличилась до h'. Определить процентное содержание
свинца в руде для следующих вариантов:
Варианты .... I II III
а, г 1,0000 2,2665 2,2680
Vcr, мл ... .5,0 4,5 4,0
А', мм 35,0 33,0 31,0
757. Для определения содержания кадмия в сплаве
методом добавок навеску сплава а растворили и после
соответствующей обработки объем раствора довели до
250,0 мл. Для снятия полярограммы взяли 18,0 мл этого
раствора. Высота волны оказалась 19,5 мм. После добав-
добавки 0,0430 н. CdSO4 (VCT) высота волны увеличилась до
h'. Определить процентное содержание кадмия в сплаве
для следующих вариантов:
Варианты .... I II III IV V
а, г 3,5420 3,1300 2,7460 2,5080 2,2940
Vcr, мл .... 2,0 2,5 3,0 4,0 5,0
А', мм 21,5 22,5 24,0 26,0 28,0
758. Для определения содержания марганца в стали
методом добавок навеску стали а растворили и после со-
соответствующей обработки объем раствора довели до
200,0 мл. Для снятия полярограмм взяли 15,5 мл этого
раствора. Высота волны оказалась 20,5 мм. После добав-
добавки 0,0500 н. MnSO4 (VCt) высота волны увеличилась до
h'. Определить процентное содержание марганца в стали
для следующих вариантов:
Варианты .... I II III IV V
а, г 1,5000 1,3050 1,1600 1,0160 0,5020
VQr, мл ... .2,5 3,0 3,5 4,0 5,0
А', мм 23,8 25,5 27,5 30,0 33,0
180
759. Определить концентрацию никеля (мг/мл) в ис-
исследуемом растворе, если при амперометрическом титро-
титровании 20,0 мл раствора спиртовым раствором диметил-
глиоксима (ДМГО) с титром по никелю 0,00203 при Е =
= —1,76 В получили следующие результаты:
ГДМГО'
мл
0
0,5
1,0
1,5
2,0
2,5
3,0
3,5
4,0
I
240
190
140
93
41
76
110
145
180
Диффузный
II
160
115
65
46
65
85
104
122
140
ток ld (мкА)
III
220
100
20
40
62
85
106
127
148
для вариантов
IV
260
235
191
158
124
100
148
171
240
V
279
250
218
186
153
122
90
80
100
760. Определить концентрацию цинка (мг/л) в иссле-
исследуемом растворе, если при амперометрическом титрова-
титровании 10,0 мл раствора свежеприготовленным раствором
K4Fe(CNN с титром по цинку 0,00244 при ? = — 1,46 В
получили следующие результаты:
^K.Fe (CN)e.
мл
0
0,2
0,4
0,5
1,0
1,5
2,0
2,5
3,0
I
30
30
31
40
94
146
200
и
20
20
31
40
94
146
200
Диффузный ток Irf (мкА) для вариантов
III
20
20
21
22
60
120
180
IV
, 30
31
30
32
80
200
310
V
30
29
31
32
32
60
137
220
300
VI
30
30
30
30
31
32
120
210
300
VII
44
45
45
45
46
46
46
175
300
VIII
60
60
60
61
61
120
176
230
285
IX
75
—
75
75
75
75
120
300
X
75
75
75
75
120
165
210
255
300
761. Определить концентрацию свинца (мг/л), если
при амперометрическом титровании 10,0 мл рабочим рас-
раствором Na2SO4 с титром по свинцу 0,00640 при ?=1,0 В
получили следующие данные;
161
vNa,sot>'
мл
0
0,5
1,0
1,5
2,0
2,5
Диффузный ток lj (мкА) для вариантов
I
215
163
113
60
40
39
и
151
106
57
31
31
30
ш
260
198
137
75
43
42
IV
105
72
40
30
30
29
V
308
240
172
102
42
42
Глава XIX
РАДИОМЕТРИЧЕСКИЕ МЕТОДЫ АНАЛИЗА
Вопросы для самопроверки
1. Назвать виды радиоактивных излучений и приве-
привести примеры радиоактивного распада.
2. Каковы основные характеристики а-, |3- и у-излуче-
ний: заряд, масса, скорость движения и энергия?
3. Сравнить проникающую способность а-, р- и у-из-
лучений в различных средах.
4. В каких единицах измеряется количество радиоак-
радиоактивного вещества?
5. Что такое постоянная радиоактивного распада?
Привести математическое уравнение, характеризующее
процесс распада.
6. Что называется периодом полураспада? Б каких
пределах должна находиться эта величина для изотопов,
используемых в аналитических целях?
7. Что происходит при взаимодействии радиоактивно-
радиоактивного излучения с воздухом?
8. В каких единицах измеряют ионизирующее дейст-
действие радиоактивного излучения? Сравнить ионизирующее
действие а-, |3- и ^-излучений.
9. Каковы правила техники безопасности при работе
с радиоактивными веществами? Какие дозы облучения
безопасны для человека?
10. Каковы устройство и принцип работы основных
счетчиков радиоактивных излучений: а) ионизационной
камеры; б) счетчика Гейгера — Мюллера; в) счетчика
Черенкова; г) сцинтилляционного счетчика?
182
11. Для каких целей в радиохимии используется фо-
фотопластинка (фотопленка)?
12. Что представляет собой радиометрическая уста-
установка типа Б-4?
13. Какие элементы можно определить количественно
по их естественной радиоактивности?
14. Какова методика радиометрического определения
калия в твердых образцах?
15. В чем сущность и каковы особенности активаци-
онного анализа? Привести примеры аналитических опре-
определений.
16. На чем основано радиометрическое определение
«возраста» органических материалов (древних рукопи-
рукописей, бытовых предметов и др.)?
17. Что представляет собой радиометрическое титро-
титрование? Какой вид имеют графики радиометрического
титрования?
18. Как можно количественно определить методом ра-
радиометрического титрования ионы Ва2+, Pba+, НРО*- ,
19. В чем сущность метода изотопного разбавления?
Привести примеры аналитических определений.
20. Каково значение радиохимических методов ана-
анализа? Указать достоинства и недостатки этих методов.
Решение типовых задач
Пример. Глицин в смеси аминокислот определяли методом изо-
изотопного разбавления. В анализируемый раствор аминокислот ввели
0,1000 г глицина, содержащего радиоактивный изотоп углерода 14С.
Затем из этого раствора выделили определенное количество глицина
и на радиометрической установке измерили его активность, получив
Лх = 800 имп/мин на 1 г вещества.
Определить количесто глицина в исследуемом растворе, если ак-
активность введенного глицина составляет 19 000 имп/мин на 1 г.
Решение. Так как активность глицина с меченым 14С состав-
составляет 19 000 имп/мин на 1,00 г, то 0,100 г этого препарата имеет ак-
активность 0,1 ¦ 19 000^= 1900 имп/мин. Такую же активность должно
иметь и все количество глицина @,100+*) г, находящееся в раство-
растворе, если х — количество глицина в смеси аминокислот до прибавле-
прибавления радиоактивного изотопа.
Глицин с радиоактивным i4C по химическим свойствам не отли-
отличается от обычного глицина, поэтому при выделении некоторого ко-
количества глицина из анализируемого раствора относительное содер-
содержание радиоактивного компонента не изменяется. Можно составить
пропорцию:
1,00 г 800 имп/мин
0,100 + х» 1900 >
1900—80
х — —г—— = 2,27 г глицина.
183
Примечание. Если количество радиоактивного препарата,
добавляемого к анализируемому раствору, пренебрежимо мало, то
расчеты упрощаются:
где аОс — масса вещества, выделенного из раствора, г; Аабщ — общая
активность анализируемого раствора с добавкой радиоактивного пре-
препарата, имп/мин; ЛОс — активность осадка, выделенного из р.аство-
ра, имп/мин.
Задачи
Метод естественной радиоактивности
762. Вычислить процентное содержание калия в ис-
исследуемом образце, если активность чистого КС!
1800 имп/мин, а активности исследуемых образцов (Ах)
следующие:
Образцы I ,11 III IV V
Ах, имп/мин .... 220 398 798 '616 480
763. Вычислить процентное содержание калия в ис-
исследуемом образце, если активность чистого КгСОз
800 имп/мин, а активности исследуемых образцов (Ах)
следующие:
Образцы I II III IV V
Ах, имп/мин .... 180 430 540 360 715
764. Для построения калибровочного графика при оп-
определении содержания калия взяли 5 образцов с извест-
известным содержанием калия и измерили их активность. При
этом получили такие данные:
СК, % 10,01 15,05 30,04 40,00 52,44
А, имп/мин . . .346 520 1030 1374 1800
Вычислить процентное содержание калия в исследуе-
исследуемом образце, если при измерении активности его получи-
получили следующие результаты:
Образцы ... I II III IV V VI VII VIII
Ах, имп/мин . 220 1160 930 400 620 1480 802 484
Метод изотопного разбавления
765. К 1 л исследуемого раствора прибавили навеску
Pb(NO3J, содержащую а радиоактивного свинца с удель-
184
ной активностью 432 ими/мин-Mr. Затем из раствора вы-
выделили навеску PbSO4, имеющего удельную активность
Ах. Определить содержание свинца в растворе (мг/л) по
следующим данным:
Варианты I П [II IV V
и, иг 10 20 30 40 50
Ах, имп/мин-мг . . 12 23 34 44 54
766. К образцу гидролизованного протеина добавили
а чистого глицина, содержащего радиоактивный изотоп
14С с удельной активностью 25 000 ими/мин-г. Выделен-
Выделенный из смеси глицин показывает удельную активность
Ах. Вычислить содержание глицина (г) в гидро-
лизованном протеине по следующим данным:
Варианты .... I II III IV V
а, г 0,1000 0,2000 0,3000 0,4000 0,5000
Ах, имп/мин-г .442 840 1240 1625 2000
767. Навеску а чистого пенициллина, содержащего
14С с активностью 4200 имп/мин • мг, прибавили к иссле-
исследуемому образцу. Из смеси удалось выделить часть чи-
чистого кристаллического пенициллина, удельная актив-
активность которого Ах. Рассчитать содержание пенициллина
в исходном образце (г) по следующим данным:
Варианты I II III IV V
а, мг 10,0 12,0 14,0 16,0 18,0
Ах, имп/мин-мг . . .405 354 312 277 252
768. К анализируемому раствору РЬAЧОзJ прибави-
прибавили пренебрежимо малое количество препарата, содер-
содержащего радиоактивный свинец, и измерили общую актив-
активность раствора (ЛОбщ). Затем из раствора осадили РЬСЦ,
отфильтровали его, промыли, взвесили (а) и измерили
его активность (Аос).
Вычислить содержание свинца (г) в анализируемом
растворе по следующим данным, имея в виду, что сви-
свинец в виде РЬС12 осаждался не полностью:
Варианты I II III IV V
Ао6щ, имп/мни . .2500 2700 2750 2980 2920
Аос, имп/мин . . . 2325 2410 2436 2500 2595
а, г 0,1674 0,1812 0,1945 0,2046 0,2184
769. Навеску известняка аОбр перевели в раствор, до-
добавили пренебрежимо малое количество радиоактивного
45Са (в виде раствора СаС12) и измерили общую актив-
активность раствора (ЛОбщ)- После этого кальций осадили в
7—4022 185
виде CaSO4 и взвесили (аас). Измерили его активность
(Аос). Определить процентное содержание СаСОз в изве-
известняке по следующим данным:
Варианты ...
Добр, Г ...
аос, г ....
Лсбщ, имп/мин
Аас, имп/мин
. I II III
.0,3023 0,3560 0,3410
,0,2546 0,2872 0,2905
. 870 914 950
. 816 868 846
IV
0,4105
0,3178
925
886
V
0,2636
0,2254
824
767
Метод радиометрического титрования
770. Для определения содержания цинка в растворе
использовали реакцию
В стакан полуавтоматической установки для радио-
радиометрического титрования вносили исследуемый раствор,
определенное количество соли цинка, содержащее
0,238 мг изотопа 63Zn, и разные объемы (от 0,2 до 1,6 мл)
0,0287 н. K.4Fe(CNN. После прибавления каждой порции
титранта и перемешивания отбирали пробу фильтрата,
измеряли его активность и возвращали пробу обратно
в стакан. Полученные результаты представлены в таб-
таблице.
"K.Fe (CN),-
мл
0,2
0,4
0,6
0,8
1,0
1,2
1,4
1,6
i
1000
860
710
570
420
280
150
0
Активность (имп/мин) для вариантов
II
1030
910
800
680
550
440
330
200
Ш
1005
880
740
610
480
350
210
80
IV
960
790
610
430
260
80
0
0
V
930
720
520
310
100
0
0
0
Построить график титрования в координатах: актив-
активность — объем титранта (активность раствора до начала
титрования составляла 1150 имп/мин), определить точку
эквивалентности и рассчитать количество цинка в рас-
растворе (мг/мл).
771. Для определения металла в растворе брали по
1,0 мл исследуемого раствора, содержащего радиоактив-
186
ный изотоп определяемого элемента, по 1,0 мл ацетатно-
ацетатного буферного раствора с рН 4,7, определенные объемы
@,25—1,5 мл) раствора дитизона (Dz) в хлороформе и
чистый хлороформ так, чтобы объем органической фазы
во всех пробирках был равен 2,0 мл. После достижения
равновесия измерили активность 1,0 мл водного слоя и
1,0 мл слоя хлороформа и получили следующие резуль-
результаты:
VDz, мл
Активность водного слоя,
имп/мин
Активность слоя хлоро-
хлороформа, имп/мин
0 0,25 0,50*0,75 1,00 1,25 1,50
Hg 1350 900 450 100 0 0 О
Zn 2150 1505 950 290 0 0 0
Hg 0 400 900 1250 1360 1340 1350
Zn 0 620 1240 1900 2140 2160 2150
Построить график радиометрического титрования,
определить точку эквивалентности и рассчитать содер-
содержание (мг/мл): 1) ртути, если титр дитизона по ртути
0,0000234; 2) цинка, если титр дитизона по цинку
0,000133.
772. Для определения содержания магния в растворе
методом радиометрического титрования использовали
реакцию
Mg2+ + NH+
¦ MgNH4s2PO4
К 4,0 мл исследуемого раствора прибавляли различ-
различные объемы (от 0,4 до 2,0 мл) 0,5000 М аммиачного рас-
твора Na2HPO4, меченного 32Р, и центрифугировали. Из
каждой пробирки брали одинаковые объемы раствора и,
измеряли его активность.
'у'
МЛ
0,4
0,5
0,6
0,7
0,8
1,0
1,2
1,4
1,6
1,8
2,0
I
20
18
18
154
445
719
968
-*-
Активность (имп/мин) лля вариантов
II
_
25
26
80
154
237
322
394
—
III
_
_
30
27
28
59
200
346
467
IV
_
27
26
25
185
371
552
748
V
28
25
_
23
128
230
414
603
7*
187
Построить график титрования с учетом увеличения
объема раствора в процессе титрования. Определить точ-
точку эквивалентности и рассчитать содержание магния в
растворе (в г-атом/л).
Глава XX
ХРОМАТОГРАФИЧЕСКИЕ МЕТОДЫ АНАЛИЗА
Вопросы для самопроверки
1. В чем сущность методов хроматографии?
2. Как классифицируются методы хроматографии по
агрегатному состоянию фаз и по методике проведения
эксперимента?
3. Назвать поглотители (адсорбенты) и растворите-
растворители, наиболее часто применяемые в хроматографии.
4. Каковы области применения, достоинства и недо-
недостатки методов адсорбционной хроматографии?
5. В чем сущность метода ионообменной хроматогра-
хроматографии?
6. Наззать основные типы ионитов. Что называется
обменной емкостью ионита?
7. Каковы области применения, достоинства и недо-
недостатки метода ионообменной хроматографии?
8. Пояснить сущность метода осадочной хроматогра-
хроматографии. Назвать варианты этого метода анализа.
9. На чем основан качественный анализ методами
осадочной и распределительной хроматографии на бу-
бумаге?
10. На чем основан количественный анализ метода-
методами осадочной и распределительной хроматографии на
бумаге?
11. Привести примеры аналитических определений
методами осадочной и распределительной хроматогра-
хроматографии на бумаге, указать основные способы измерений
при количественных определениях.
12. Пояснить сущность и назвать области применения,
достоинства и недостатки адсорбционной, газовой, газо-
газожидкостной и тонкослойной хроматографии.
13. Охарактеризовать методы проявителыюй, фрон-
фронтальной, и вытеснительной хроматографии.
188
Решение типовых задач
Пример 1. Определить процентный состав компонентов газовой
смеси по следующим данным, полученным с помощью газовой хрома-
хроматографии:
Компоненты смеси
S, мм"
Пропан . .
Бутан . . .
Пентан . .
Циклогексан
175
203
182
35
0,68
0,68
0,69
0,85
Решение. Расчеты проводят по методу внутренней нормали-
нормализации, согласно котосому
Pi =
100,
где Р; — весовой процент i-того компонента в смеси; S* — площадь
пика t-того компонента; k\ — поправочный коэффициент, определяе-
определяемый чувствительностью детектора хроматографа к t-тому компо-
компоненту.
Найдем приведенную суммарную площадь пиков:
= 175-0,68 + 203.0,68 + 182-0,69 + 35-0,85 = 412,9.
тев.
Отсюда процентное содержание пропана равно:
175-0,68
Л,ропана = 4129 ЮО = 28,8% .
Аналогичным образом находят содержание остальных компонен-
Примечание. В методе внутреннего стандарта расчет прово-
проводят по формуле
Я-100,
где Sot и Лот— соответственно площадь пика вещества, введен-
введенного в качестве внутреннего стандарта, и поправочный коэффициент;
R — отношение массы внутреннего стандарта к массе анализируемой
пробы,
Задачи
773. Для хроматографического определения никеля
на бумаге, пропитанной раствором диметилглиоксима,
приготовили три стандартных раствора. Для этого наве^
189
ску (a) NiCl2-6H2O растворили в мерной колбе на
50 мл. Затем из этой колбы взяли 5,0; 10,0 и 20,0 мл и
разбавили в колбах на 50 мл. Исследуемый раствор
также разбавили в мерной колбе на 50 мл.
Построить калибровочный график в координатах
h — CNi и определить содержание никеля (мг) в иссле-
исследуемом растворе, если высота пиков стандартных рас-
растворов равна hu /г2 и /г3, а высота пика исследуемого рас-
раствора равна hx.
Варианты
i
и
ш
IV
V
VI
VII
VIII
IX
X
а, г
0,2000
0,2040
0,2820
0,2946
0,2480
0,2284
0,1950
0,3720
0,2200
0,2780
Высота пиков, мм
Л,
20,5
21,0
29,0
30,0
25,5
23,5
20,0
38,0
22,5
28,5
л,
36,0
38,5
42,0
45,0
37,5
31,5
35,0
50,5
39,0
42,3
Л.
66,4
72,3
68,0
78,0
61,3
47,2
65,0
76,0
71,5
70,0
33,0
43,3
47,0
54,0
49,0
37,5
53,0
59,0
65,0
47,5
774. Рассчитать процентный состав смеси газдв по
следующим данным, полученным при газовой хромато-
хроматографии смеси:
Га»
Пропан , .
Бутян , , ,
Пентвн . .
Циклогексан
Пропилен .
Вариант I
S*
216
312
22
34
»*
1,13
1,11
1,11
1,08
Вариант II
5
155
216
198
28
к
0,68
0,68
0,69
0,85
Вариант III
.S
300
206
18
к
1,13
iTTi
1,08
Вариант I V
205
97
48
22
*
0,68
0,68
ole
0,65
* S— площадь пика, мм*; ft—поправочный коэффициент.
776. Рассчитать процентный состав смеси газов по
следующим данным, полученным при газовой хромато-
хроматографии смеси:
190
Вариант t
Газ
Бензол . .
Толуол . .
Этилбензол .
Кумол . . .
20,6
22,9
30,5
16,7
k
0,78
0,79
0,82
0,84
Вариант П
Газ
о-Ксилол . .
.и-Ксилол .
п-Ксилол
Этилбензол .
16,7
20,3
V8,5
30,4
k
0,840
0.812
0,812
0,820
Вариант III
Газ
Бензол . .
Гексан . .
Пропилен .
Этанол . .
85
27
34
11
к
1,00
1.11
1,08
1,77
776. Определить процентный состав смеси газов по
следующим данным, полученным при газовой хромато-
хроматографии:
Вариант I
Газ
Этанол
Метанол .....
s
3524,2
13,4
*
0,64
0,58
Вариант II
Газ
Метан
Этан
207
4
к
1,23
1,15
Вариант III
Газ
Динитробензол . .
Нитробензол . . .
5
305
12
к
1,22
1,07
Вариант I V
Газ
Этилацетат . . .
Этанол
"i
5
305,2
11,7
к
0,79
0,64
777. Реакционную массу после нитрования толуола
проанализировали методом газожидкостной хроматогра-
хроматографии с применением этилбензола в качестве внутреннего
стандарта. Определить процент непрореагировавшего
толуола по следующим экспериментальным данным:
Варианты ....
Взято толуола, г
Внесено этилбен-
зола, г ....
¦^толуола! мм • •
^толуола
¦^этилбензола"
^этилбенэола
ММ
I
12,7500
1,2530
307
1,01
352
1,02
II
15,2605
1,0865
108,5
0,794
157,7
0,822
III
8,5412
2,7522
55,3
1,01
80,1
1,02
IV
25,1639
1,2873
80,7
0,794
109,2
0,822
191
Глава XXI
ЭКСТРАКЦИЙ
Вопросы для самопроверки
1. В чем сущность методов экстракции? Какие зада-
задачи решаются с помощью этих методов?
2. Что представляют собой коэффициент распределе-
распределения и константа распределения?
3. Назвать органические растворители, наиболее ча-
часто используемые в методах экстракции.
4. Назвать основные типы соединений, в виде кото-
которых экстрагируются ионы металлов. Привести примеры.
5. Указать, какие элементы чаще всего экстрагируют-
экстрагируются в виде: а) дитизонатов; б) карбаминатов; в) оксихи-
нолятов; г) купферонатов; д) ацетнлацетонатов?
6. Охарактеризовать следующие методы экстракции:
а) периодической; б) непрерывной; в) из твердых ве-
веществ.
7. В чем сущность количественных экстракциогшо-
фотометрических определений?
8. Каковы достоинства и недостатки методов экстрак-
экстракции?
Задачи
778. Навеску руды а растворили. Из раствора экстра-
экстрагировали рений толуолом в присутствии метилового
фиолетового. Экстракты собрали в колбу на 50 мл, до-
довели объем до метки и определили оптическую плот-
плотность Dx. Оптическая плотность у четырех стандартных
растворов, содержащих 1,0; 6,0; 8,0 и 10,0 мг/л рения
и подвергнутых аналогичной обработке, оказалась 0,10;
0,50; 0,64; 0,81. Построить калибровочный график в ко-
координатах Ске — D. Определить процентное содержание
рения в руде по следующим данным:
Варианты I II III IV
а, г 1,0000 0,5000 0,7000 1,2300
Dx 0,54 0,25 0,87 0,70
779. Из 100 мл раствора, содержащего а меди, из-
извлекли ее дихлорэтаном в виде роданидпиридинового
комплекса. Рассчитать объем растворителя, необходи-
необходимый для однократной экстракции, чтобы уменьшить кон-
192
центрацию меди в водном растворе до Скоп, если коэффи-
коэффициент распределения ее 250:
Варианты I II III IV
д, мг 0,8 1,0 1,2 2,2
Скон, г-ион/л . . . . 1 -10—s 8-10-6 1,2-10-5 1,4-10-5
780. Из 10,0 мл раствора, содержащего 50 мкг ко-
кобальта, последний извлекли порциями по 5,0 мл раство-
раствора дитизона в хлороформе. Сколько экстракций следует
провести, чтобы понизить концентрацию кобальта в вод-
водной фазе до ЫО^6 г-ион/л, если коэффициент распреде-
распределения 4,5?
Глава XXII
МАТЕМАТИЧЕСКАЯ ОБРАБОТКА
РЕЗУЛЬТАТОВ АНАЛИЗА
Вопросы для самопроверки
1. Какими причинами вызываются систематические и
случайные ошибки анализа, грубые ошибки?
2. Какими способами можно уменьшить системати-
систематическую ошибку: а) при взвешивании; б) при калиброва-
калибровании мерной посуды; в) при осаждении и промывании
осадков; г) при титровании с индикаторами?
3. Как вычислить наиболее вероятную величину X,
если при п измерениях получены значения Х\, х2,
х3,. . ., х«?
4. Чем характеризуется случайная ошибка анализа?
5. Как вычислить стандартное отклонение отдельного
измерения? Что характеризует эта величина?
6. Что называется коэффициентом вариации? В ка-
каких случаях он используется для характеристики случай-
случайной ошибки?
7. Какие величины используются для оценки точно-
точности результата анализа?
8. Как вычислить стандартное отклонение среднего
результата?
9. Что характеризует коэффициент Стыодента ta,f- От
каких факторов зависит величина ^-коэффициента?
10. Чему равна статистическая надежность а для се-
серийных анализов?
И. Что такое точность измерений е«?
193
12. Чему равен доверительный интервал и что он ха-
характеризует?
13. Как используется доверительный интервал для
обнаружения систематической ошибки метода?
14. Как используется ^-критерий для проверки значи-
значимости различия двух средних значений X и (.i?
15. Как с помощью критерия t устанавливают число
параллельных измерений, необходимое для получения
среднего результата с заданной точностью га?
16. Какие методы обнаружения грубых ошибок (про-
(промахов) используются в математической статистике?
17. Что такое Q-критерий и от каких факторов он за-
зависит?
Решение типовых задач
При определении количества вещества в пробе обыч-
обычно выполняют несколько параллельных определений
(/1^2), которые характеризуются воспроизводимостью
полученных результатов вследствие случайных ошибок и
правильностью результатов, являющейся следствием си-
систематической ошибки. При обработке результатов ана-
анализа пользуются методами современной математической
статистики, разработанной для малого числа измерений.
Оценку воспроизводимости измерений и правильности
производят с помощью следующих величин:
1. Среднее арифметическое значение измеренных ве-
величин (выборочное среднее) вычисляют по формуле
1-п
где Хи х2, х3, . . ., Xi, х„ — результаты измерений величи-
величины, истинное значение которой равно ц (генеральное
среднее).
2. Стандартное отклонение, дисперсия, коэффициент
вариации — характеризуют случайную ошибку анализа.
Граница разброса отдельных измерений относительно X
характеризуется квадратичной ошибкой или стандарт-
стандартным отклонением отдельного измерения 5. Выборочное
стандартное отклонение определяется по формуле
Г—п
1/ S
г
^^- <2>
194
где (х{ — .X1) — единичное отклонение, т. е. отклонение
отдельного измерения от среднего арифметического;
п — 1 =/ — число степеней свободы.
Если имеется т проб и для каждой пробы проводит-
проводится П] параллельных измерений (/ — номер пробы), то
общее число измерений равно л= ^га;-,ачисло степеней
свободы / = я — т. В этом случае формула B) принима-
принимает вид
/J-m l-n
n — m
S= I/ '-' '-' C)
' п — т
где 5 — общее стандартное отклонение.
Относительная квадратичная ошибка, выраженная в
процентах от среднего значения X, называется коэффи-
коэффициентом вариации:
1/ = —100. D)
Величина S2— выборочная дисперсия и вычисляется
по формуле
1-п _
. E)
n—I
3. Стандартное отклонение среднего результата, вы-
выборочную дисперсию среднего значения, доверительный
интервал и точность определения используют для раз-
различных статистических расчетов. При оценке точности
полученных результатов вычисляют стандартное откло-
отклонение среднего результата (среднюю квадратичную
ошибку среднего арифметического):
— • F)
п(п— 1)
Значение S% — выборочная дисперсия среднего зна-
значения вычисляется по формуле
1-п _
S\ = — . G)
V 195
Точность измерений е, равна разности между сред-
средним выборочным значением X и средним генеральной со-
совокупности ц: ea=|.Y —(i|.
Точность измерений вычисляют по формуле
<j
z*=Lj -p=- = 4,/55, (8)
где ta>f — коэффициент нормированных отклонений (ко-
(коэффициент Стьюдента) принимается по табл. 4 (см. при-
приложение) в зависимости от надежности а и числа степе-
степеней свободы f=n — 1.
Для оценки неизвестной величины х имеется два
— t fs — t fs
значения X y=- и XA 7=- и можно утверждать,
У п У п
t s t fs
что X— "'/_ <Г х < X А- а'/- •
/и Vn
^ %=- и ^ + -^= доверительные 100A —
V п У п
— а)%-ные пределы, а интервал между ними— 100A —
— а)%-ный доверительней интервал, который равен
'Х ±ta.ifSR^=X ±га. (9)
Доверительный интервал с данной вероятностью а
указывает, с какой вероятностью следует ожидать ошиб-
tafs
ки вычисленной величины —^г- . Возможность, что от-
Уп
дельное значение несет более высокую ошибку, чем
tafs
—7^ , остается с риском A — и). Поэтому числовое зна-
V п
чение доверительного интервала всегда должно быть
дополнено указанием вероятности. Надежность а (дове-
(доверительную вероятность) принимают для серийных ана-
анализов равной 0,95. Точность измерения, выраженная в
процентах от среднего значения X, называется относи-
относительной ошибкой прямого определения:
д = -^100. A0)
Л.
Результаты анализа обычно представляют в виде
X ziz'a. или XztSx. Это эквивалентно указанию четырех
величин: X, S~x, n, а. Методы математической статистики
используют для проверки гипотезы, значимо ли отлича-
196
ются между собой два средних значения. Если сравни-
сравнивают среднее значение X из п измерений со средним ц
генеральной совокупности, имеющей нормальное распре-
распределение, то по формуле
вычисляют критерий /. Вычисленную величину / сравни-
сравнивают со значением, найденным в таблице коэффициентов
Стьюдента для выбранной доверительной вероятности а
и степеней свободы f=n— 1. Если вычисленное по фор-
формуле A1) значение t превышает табличную величину
4,/. т- е- ^^>^,/, то различие между X и ц является зна-
значимым.
Статистические методы позволяют установить число
параллельных измерений п, необходимое для получения
среднего результата с заданной точностью ?а- Для этого
предварительно находят стандартное отклонение S из
небольшого числа опытов. Задаются величиной п, вычис-
вычисляют по формуле A1) значение t и сравнивают его с таб-
табличным Lj при выбранной надежности а и / = п—1.
Если t^s-fa,/, то заданное число п обеспечивает точность
fa с вероятностью а. Если число измерений п получает-
получается не слишком большим (не более 8—10), то данный ме-
метод вполне оправдан для обеспечения заданной точно-
точности.
4. Критерий Q. При обработке результатов анализа
величины, являющиеся грубыми ошибками, отбрасыва-
отбрасывают. При небольшом числе анализов их устанавливают
при помощи критерия Q:
Хх
R
где R — размах варьирования; ^ = хтах — xmin (разница
между двумя крайними значениями в ряду величин Хи
расположенных в порядке возрастания); Х\ — подозри-
подозрительно выделяющееся значение; х2 — соседнее с ним зна-
значение. Вычисленную величину Q сопоставляют с таблич-
табличным значением Qa<n (см. табл. 5 приложения). Наличие
грубой ошибки доказано, если Q^>Qa,n, Другим спосо-
способом оценки является критерий 3S. Грубые ошибки отсут-
отсутствуют, если отклонение от среднего (л:; — X) не выхо-
выходит за пределы величины 35.
197
Результаты вычисления не могут быть точнее, чем
используемые измерения. Расчет результатов проводят
всегда с сохранением одной лишней цифры по сравнению
с числом цифр в конечном результате. В конечном ре-
результате эту лишнюю цифру опускают. Результат изме-
измерения и ошибка должны быть выражены числами с оди-
одинаковым количеством знаков после запятой. Поэтому их
округляют в одинаковой степени.
Пример 1. При определении содержания свинца в сплаве полу-
получили следующие результаты, %: 14,50; 14,43; 14,54; 14,45; 14,44;
14,52; 14,58; 14,40; 14,25; 14,49. Обработать эти данные по правилам
математической статистики. Сколько значащих цифр следует указать
в результате?
Решение. Перед статистической обработкой результатов ана-
анализа оцениваем наличие грубых ошибок по Q-критерию. Располага-
Располагаем экспериментальные данные в порядке возрастания величин: 14,25;
14,40; 14,43; 14,44; 14,45; 14,49; 14,50; 14,52; 14,54; 14,58. Предполага-
Предполагаем, что значения 14,25 и 14,58 являются результатами грубой ошиб-
ошибки. По формуле A2) рассчитываем критерий Q для этих величин:
14,40—14,25 0,15
^'~ 14,58—14,25 ~0,33
14,58+14,54 _0.04
V2 ' 14,58—14,25 0,33 ' "
Для а = 0,95 и п= 10 табличное значение Q = 0,42. Qi>0,42,
поэтому значение х.\ = 14,25 считаем недостоверным и исключаем из
числа статистически обрабатываемых величии. В измерении *т =
= 14,58 грубая ошибка отсутствует, так как <2к><0,42. По формуле
A) вычисляем среднее арифметическое значение из 9 определений'.
14,40+14,43+14,44+14,45 + 14,49+14,50+14,52+
Х== 9
+ 14,54+14,58 1М8
По формуле B) находим стандартное отклонение:
/
@,08J + @,05J + @,04J + @,03J + @,01J + @,02J .
9— 1
/+@,04J + @,06J + @,10J =
9-1
Стандартное отклонение среднего результата определяем по
формуле F):
5,82 10-2
°х /9
190
Точность определения fa вычисляем по формуле (8), принимая
по табл. 4 (см. приложение) taf = 2,3\ (а =0,95; /=9—1=8).
еа = 2,31 • 1,94-10-2 = 4,48-10-2.
Оцениваем еще раз наличие грубых ошибок по критерию:
35 = 3-5,82_-10-2 = 0,17.
Сравнивая величины (Xi — X) и 3S =0,17, видим, что ни одно
из отклонений от среднего не выходит за пределы 3S. Следователь-
Следовательно, величины х{ не содержат грубых ошибок. Среднее значение ре-
результата анализа свинца при а = 0,95 определяется доверительным
интервалом по формуле 9, т. е. A4,48±0,04) °/о РЬ. Результат опре-
определения должен быть представлен числом с двумя значащими циф-
цифрами после запятой, так как это соответствует полученной точности
анализа.
Пример 2. Вычислить стандартное отклонение единичного опре-
определения никеля в четырех пробах стали с различным содержанием
№. Результаты анализа Ni, %: 1) 1,22; 1,18; 1,22; 1,21; 2) 2,01;
1,98; 2,02; 1,99; 3) 3,25; 3,23; 3,22; .3,26; 4) 4,49; 4,47; 4,50; 4,46.
Как зависит коэффициент вариации от содержания Ni в образце?
Решение. По формуле A) находим среднее арифметическое
значение содержания № в каждой пробе:
1) Х =
2,01 + 1,98 + 2,02+1,99
2) Х= 4 =2,00,
Зс\ с I Q О О I О ОО 1 О Ой
4 j?O —т— О 1 ^О ~т~ О 1 ^л "~|- ij f ^^j
3) X — ¦ ¦ — = 3,24,
4
4,49 + 4,47 + 4,50 + 4,46
4) Х = = 4,48.
l-n _
Рассчитываем для каждой пробы величину 2 (xi — XJ:
i-i
1) 0,012+0,032+0,012+0,002=1ЫО-\
2) 0,012+0,022+0,022+0,012=10-10-4,
3) 0,012+0,012+0,022 + 0,022= 10- Ю-1,
4) 0,012+0,012 + 0,022+0,022= 10-10-'.
Стандартное отклонение единичного определения рассчитываем
по формуле C):
/01-10-4+ 10-10-4+ 10-10-4+ 10-10-4
\/ 4-4-4 =
= 1,85-10-2, S = 0,018.
Коэффициенты вариации вычисляем по формуле D):
0,018-100 0,018-100 „ е
^i = ~Y2l =1-49%- Уз = ^4~=0'56°/°1
1??
Видно, что коэффициент вариации уменьшается с увеличением
процентного содержания никеля в стали.
Пример 3. При анализе стандартного образца, содержащего
1,47% Ag, получили следующие результаты, %: 1,31; 1,45, 1,42; 1,32;
1,30. Определить S, ео,95 и сделать выводы о наличии систематиче-
систематической ошибки в использованном методе определения серебра.
Решение. По формуле A) находим среднее арифметическое
значение:
- 1,31 + 1,45+1,42+1,32+1,30
л = = 1,36.
5
По формуле B) вычисляем стандартное отклонение:
/@.
, ч_, 05J+@,09J+ @,06J+ @,04J +@,06J
О
5— 1
= 6,96-10-2.
По формуле (9) рассчитываем доверительный интервал значе-
значения X:
~Х ± ta ,-7=r = 1,36 ± 2,78- 6'96'|° = 1,36+0,09.
lJ у п у 5
/„,/ = 2,78 принимаем по табл. 4 для а = 0,95 и / = 5— 1=4. Истин-
Истинное значение содержания серебра не попадает в доверительный ин-
интервал. Следовательно, этот метод определения серебра имеет систе-
систематическую ошибку.
Пример 4. Определить, существует ли значимое различие между
выборочной средней величиной при определении процентного содер-
содержания серы в каменном угле-. 2,10-, 2,12', 2,13', 2,15; 2,15 н средней
генеральной совокупности (для л = 80) ц = 2,15%.
Решение. Среднее выборочное значение вычисляем по форму-
формуле A):
- 2,10 + 2,12 + 2,13 + 2,15 + 2,15 п 1П
л =
о
Стандартное отклонение отдельного определения вычисляем по
формуле B):
/0,032 + 0,012 + 0,002 + о,О22 + 0,022
= 1 /
= 2,12.10-2.
5— 1
По формуле A1) находим значение величины t:
B,15-2,13)/5
2,12-10-2 "" ' '
Из таблицы значений коэффициента Стьюдента (см. табл. 4, при-
приложения) для ге=4 и а = 0,95 taу-=2,78, что больше рассчитанного
по формуле A1). Следовательно, средняя величина X не отличается
значимо от средней ji генеральной совокупности.
Пример 5. При определении ванадия кинетическим методом
были получены результаты: 8,0-10~4 мкг; 8,4 • 10~4 мкг Чему равна
2Р0
точность анализа ett и Д? Сколько параллельных определений необ-
необходимо провести для достижения относительной точности 5%? Оп-
Оправдано ли будет применение этого способа для достижения такой
точности?
Решение. По формуле A) находим среднее арифметическое
значение:
_ 8,0-10-4 + 8,4-10-4
X =— +—!¦ = 8,2-10~4.
Стандартное отклонение единичного результата вычисляем по
формуле B):
3,2-10-4J+ @,2-10-4J
¦- — = 0,283-10-4.
2 i
По табл. 4 приложения находил для а = 0,95 и }= I ta < = 12,7
и по формуле (8) вычисляем точность анализа:
0,233-10-4
?а= 12,7-—^—-= = 2,54-10-4.
В относительных единицах точность составляет
2,54-10-4-100
Д = —: = 30,98 % .
8,2-10-4 "
Если необходимо получить Д = 5%. то
_ 5-8,2-10-4
еа=Д-^= ¦ = 0,41-10-4 ИЛ11 1^ — ^ = 0,41-10-4.
По формуле A1)
0,41-10-4 г- г-
t = — У п =г._ 1 ,45 Yn-
0,283-10-4 у г
Если принять п = 4, то ^ = 2,90, а по табл. 4 для а = 0,95 и f =
=;4—1=3 ta/~ 3,18, что не обеспечивает точность 5% с вероятно-
вероятностью а = 0,95. Если и = 5, то *=1,45 К" 5=3,24. По табл. 4 для а =
= 0,95 и f=5—1^4 ta f = 2,78, что меньше рассчитанного i=3,24.
Следовательно, при я = 5 величина i = 3,24 дает большую вероят-
вероятность, чем 0,95. Таким образом, для достижения относительной точ-
точности 5% необходимо провести 5 анализов. Так как я<8 (п = 5),
то можно считать, что данный метод вполне оправдан для достиже,-
пия точности 5,00%.
Задачи
781. При определении кальция весовым методом полу-
получили следующие результаты СаО, %: 12,86; 12,90; 12,93;
12,84. Вычислить стандартное отклонение в определении
содержания кальция.
201
782. В серебряной монете при анализе параллельных
проб получили следующее содержание серебра, %:
90,04; 90,12; 89,92; 89,94; 90,08; 90,02. Вычислить стан-
стандартное отклонение единичного определения и довери-
доверительный интервал среднего значения (для а=0,95).
783. При определении сурьмы в сплаве объемным ме-
методом получили следующие данные, %: 11,95 12,03; 11,98;
12,04. Вычислить стандартное отклонение единичного
определения и доверительный интервал среднего значе-
значения (для а=0,95).
784. При фотометрическом определении меди в рас-
растворе получили следующие данные (г/л): 5,1-10~3;
5,5-10-3; 5,4-10; 5,8-К)-3; 5,2- Ю. Вычислить стандарт-
стандартное отклонение единичного определения и доверительный
интервал среднего значения (для а=0,95).
785. При фотометрическом определении висмута по-
получили следующие значения концентраций (моль/л):
8,35-Ю-5; 8,00-10-s; 8,50- 10~5; 8,45-Ю-5; 8,05- Ю-5;
7,90-10~5; 8,17-10~5. Вычислить стандартное отклонение
и доверительный интервал среднего значения (для а=
=0,95).
786. При определении содержания марганца в почве
получили следующие результаты, %: 5,3• 10~2, 5,9-10~2,
7,3-Ю-2, 12,0-10-2, 6,9-10-2, 4,3-10-2, 3,8- i0~2, 6,3- 10~2,
10,0• 10~2, 4,8-10-2. Вычислить стандартное отклонение и
доверительный интервал среднего значения (для а =
=0,9,5).
787. При определении нормальности перманганата
калия тремя студентами получены следующие результа-
результаты (г-экв/л):
I студент 0,1013; 0,1012; 0,1012; 0,1014;
II студент 0,1015; 0,1012; 0,1012; 0,1013;
III студент 0,1013; 0,1015; 0,1015; 0,1013.
Вычислить стандартное отклонение единичного опре-
определения и доверительный интервал среднего значения
(дляа=0,95).
788. При анализе почв на содержание цинка в пяти
пробах одного образца получили следующие результа-
результаты, %: 1) 8,5-Ю-3; 9,2-10-3; 2) 10,4-1(Н; 10,9-10-»;
3) 7,2-Ю-3; 7,3-Ю-8; 4) 9,4- Ю; 8,9-10; 5) 7,3-10;
6,7-10-3.
Вычислить стандартное отклонение в определении со-
содержания цинка (дляа=0,95).
202
789. Содержание марганца в четырех образцах фер-
ферромарганца по результатам анализов составляет, %:
1) 21,34; 21,32; 21,31; 21,35; 2) 34,45; 34,41; 34,42; 34,43;
3) 50,17; 50,14; 50,13; 50,16; 4) 65,57; 65,56; 65,59; 65,60.
Вычислить стандартное отклонение в определении со-
содержания марганца.
790. При анализе топаза получили следующие данные
о содержании в нем А12О3, %: 53,96; 54,15; 54,05; 54,03;
54,32. Установить, является ли последний результат гру-
грубой ошибкой?
791. При анализе апатита получили следующие дан-
данные о содержании в нем Р2О5, %: 35,11; 35,14; 35,18;
35,21; 35,42. Установить, является ли последний резуль-
результат грубой ошибкой?
792. При определении сульфат-иона весовым методом
получили следующие данные о содержании SO3, %:
•15,51; 15,45; 15,48; 15,53; 16,21. Определить, является ли
последний результат грубой ошибкой?
793. При исследовании раствора получили следующие
значения рН: 5,48; 5,45; 5,30; 5,55. Определить, является
ли значение рН 5,30 грубой ошибкой?
794. Имеется ли систематическая ошибка в определе-
определении платины новым методом, если при анализе стандарт-
стандартного образца платиновой руды, содержащего 85,97% Pt,
были получены следующие результаты Pt, %: 85,97,
85,71,85,84,85,79.
795. При титровании 0,1285 н. стандартного раствора
серной кислоты раствором едкого натра получили следу-
следующие значения нормальности (г-экв/л): 0,1274; 0,1278;
0,1280; 0,1275. Определить, имеется ли систематическая
ошибка в определении нормальности серной кислоты.
796. При определении цинка методом амперометриче-
ского титрования два студента при титровании одной
пробы получили следующие значения Zn, мг: 1) 15,10;
15,05; 14,97; 2) 14,00; 13,50; 13,00 при истинном значении
15,00 мг цинка. Имеется ли систематическая ошибка в
полученных результатах?
797. При контрольном определении хрома по методу
трех эталонов в стандартном образце стали, содержащем
15,10% Сг, на двух фотопластинках получили следующее
содержание Сг, %: 1) 13,50; 14,00; 14,50; 2) 17,00; 16,00;
18,20. Найти, имеется ли систематическая ошибка в оп-
определении содержания хрома.
203
8. Содержание активного хлора в хлорной извести
составляет, %: 37,11; 37,18; 37,23; 37,15. Значение сред-
средней генеральной совокупности (га=50) 37,02. Устано-
Установить, существует ли значимое различие между выбороч-
выборочной средней и средней генеральной совокупности.
799. Содержание азота в аммиачной селитре равно
34,90%- При анализе этой селитры получили следующие
результаты параллельных определений, %: 34,52; 34,72;
34,68; 34,64. Установить, существует ли значимое разли-
различие между выборочной средней и средней генеральной
совокупности.
800. При определении содержания сульфида сурьмы
в различных образцах сурьмяного блеска получили сле-
следующие результаты, %: 1) 54,28; 54,52; 54,41; 54,35;
2) 67,59; 67,46; 67,66; 67,45; 3) 84,14; 83,93; 84,11; 83,98.
Вычислить S для отдельного измерения и установить,
как зависит коэффициент вариации от содержания опре-
определяемого компонента.
801. Найти число параллельных проб, необходимое
для определения олова в баббите с точностью 3%, если
известно, что при анализе двух проб получили содержа-
содержание олова 9,37 и 10,01 %.
802. Содержание молибдена в почве по результатам
трех параллельных определений составляет, %:
6,8-10~4; 7,0-10~4; 7,2-10~4. Какова точность метода и оп-
оправдано ли применение этого способа анализа для дости-
достижения точности 3%?
803. При определении марганца в стали получили
48,35 и 43,00%- Определить количество параллельных
проб, необходимое для определения марганца с точно-
точностью ± 1 %.
804. При определении цинка в почве получили Zn, %:
8,5-10~3; 10,4-10~3, 7,9• 10^3. Найти количество парал-
параллельных проб, необходимое для определения цинка с
точностью ±10%-
ОТВЕТЫ К ЗАДАЧАМ
Глава I
1.1) 1 и 2,88; 2) —0,14 и 2,92; 3) 0,72 и 2,85. 2. 1) [Н+] =
= [HCOO-] = 2,24-10-J; рН 2,65; 2) [Ii+] = [HCOOi = l,39-10-2;
рН 1,86. 3. 1) [ОН"] = 9,80-10-5; [Н+]= 1,02-10-10; рН 9,99;
2) [ОН-]=1,70-10-°; [Н+] = 5,90-10-10; рН 9,23. 4. —8,0. 5. —5,0.
6. -5,5. 7. [Н+] = 6,5310-3; рП 2,18. 8. [Н+] = 0,2108; []
204
= 0,1892; [SO^] =0,0108; 9. [H+] = 6,34- iO; [Sal2-] = 2,24¦ Ю4.
«0. [H+]=[HSOr] =5,04-10-2; [SO^-] =6,20-10-». II. [H+]=
= 2,40-10; pH 1,62. 12. [HPO^"] = 6,20-lO"8; [РО^~]=7,40-10-".
13.[H+]= [H2AsO^] = 2,17- 10~j; [HAsO^-]= 1,05-10-'. 14. [AsO^] =
=.1,43-10-". 15. 1,35- Ю-4 г-ион/л. 16. 3,6-10—* г-ион/л. 17. 5,75X
ХЮ-4 мол^л. 18. 6,55-Ю-3 моль/л. 19. 0,161 моль/л. 20. 0,017 моль/л.
21. 0,19 моль/л. 22. /С= 1,71 ¦ Ю; <х=1,3%. 23. 1,94-10"*.
24. 1,80-Ю. 25. 2,0-Ю. 26. 1,79-Ю-5. 27. 1,20-10-». 28. 9.80Х
ХЮ-7. 29. 1) 7,59; 2K,80;3) 4,75; 4) 2,29; 5) 5,18. 30. 1) 1.07Х
ХЮ-12 г-ион/л; 2) 1,60 • Ю-13 г-ион/л; 3) 9,0-10 г-ион/л,
4) 1,58-Ю-4 г-ион/л; 5) 3,38-10-' г-ион/л. 31. [СН3СОО"] =
= 1,0910-''; а = 0,011 %. 32. [НСОО"]= 1,9-10~5; а = 0,076%.
33. [NH|]=5,57-10-5; а = 0,056%. 34. 0,019%. 35. 0,029%. 36. рН 2,73;
а = 0,94% и рН 4,42, а = 0,025%. 37. рН 2,21, а = 2,84% и рН 3,55;
а = 0,43%. 38. рН 1,75, а = 8,4% и рН 2,75, а=1,38%. 39. 1) 3,47%,
красный; 2) 95,1%, желтый. 40. 1) 92,6%, синий; 2) 0,8%, желтый.
41. 1) О,02%, красный; 2) 92,1%, желтый. 42. 1) 99,4%, малиновый;
2) 95,6%, малиновый. 43. 1) 91,9%, синий; 2) 98,4%, синий. 44. 4,20.
45. [Н+] = 5,75-10; [ОН~]= 1,74-Ю-10; рН 4,24, 46. 4,76. 47. [Н+] =
= 1,12-10-4; [ОН-] =8,91 -10-П; рН.3,95. 4g 3,45. 4Р. 1) 6,91;
2) 10,62; 3) 4,09; 4) 2,82; 5) 10,44; 6) 1,64; 7) 12,98; 8) 6,73. 50. 2,67.
51. 6,27. 52. 1) 2,19; 2) 5,42. 53. 8,45 мл. 54. 27,7 мл. 55. 0,13 г.
56. 0,76 г. 57. 10 мл. 59. 5,3 г. 59. 5,8 г. 60. 28 мл. 61. 17,7 мл.
62. 1,53 г. 63. 2,2 г. 64.0,6 г. 6^.7,6 мл. *6. 117,8 мл. 67.23,4 мл.
68. 3,1 г. 69. 0,71 г. 70. 5,3 г. 71. 0,47 г. 72. 14,3 мд. 73. 1,47 г.
74. 9,0 мл. 75. 6,6 мл. 76. 0,82 г. 77. 0,70 г. 7S. 22,8 г. '9. 70 мл.
80. 15,1 мл. 81. 16,9 мл.
Глава !1
82. рН 8,88, А = 7,6-10-з%. 83. рН 10,95, А = 1,8%. 84. рН 8,46;
А = 6,8-10-4%. 8Я рН 11,50, А = 6,6%, 8". рН 11,51, А = 6,42%;
рН 11,16. 87. рН 8,48; А = 6,1-10-3%; рн 7,98. 8:'. рН 8,37; А =
= 2,35-10-3%. 89. рН 11,25; А = 0,9%, 90. рН 8,48; А ==--- 6,1 • 10—з%,
fl. 0,78 г. 9?. 0,78 г; А = 88%. 93. 0,067 г; А = 0,96-10-2%.
94. 6,5-10-2 г. 95. рН 12,7; А=1,11 • 10"?%. 96. рН 13,0; А =
=2,08-10-2%.97. 1N,27; 2) 14 ,87; 3) 4,57; 4) 11,63; 5) 13,89; 6I3,22;
7) 10,16; 8) 12,84. 98. 5,0-10-и. 9?. 5,0-10-4. 100. 1) рН 11,65, си-
синий; 2) рН 8,89, красный; 3) рН 8,37, синий; 4) рН 12,54, красный.
101. рН 5,13, А=7,45-Ю-з%; рН 5,63, А=2,36-10-2%. Ю2. рН5,32,
А=1,2-10-2%. 103. рН 3,99, А=1,02%. 104. рН5,84, А = 1,45-10-3%.
105. 1) рН 5,70, А= 1,58-10-2%; 2) рН 5,80, А = 1,58-10-2%;
3) рН 6,05, А = 8,9-10-3%; 4) рН4,0, А = 0,1%; 5) рН 1,77, А =
= 33,8%; 6) рН 2,72, А=9,5%; 7) рН 2,77, А = 5,6%; 8) рН 2,05,
А = 89%; 9) рН 5,57, Л = 5,44-10-3";,; Ю) рН 3,33, А = 2,34%; 11) рН
1,74, А=91,5%; 12) рН 5,22, А = 6,02-10-2%; 13) рН 2,34, Л=23,0%,
106. 0,23 г. 107. 0,011 моль/л. 103.5,7-10-4%. 109. 1) 3,60; 2) 7,83;
3) 0,04: 4) 5,00; 5) 4,60; 6) 7,11; 7) 7,56. ПО. 1) рН 2,35, красный;
2) рН 4,05, желтый; 3) рН 5,12, оранжеьыи. 111. 1) рН 8,78; Л =
= 87,5%; 2) рН 11,07, Л =98,5%; 3) рН 7,06, Л^5,7%; 4) РН 10,81,
А = 97,4%; 5) рН 9,31, А = 53,6%; 6) рН 11,82, Л = 99,2%; 7) рН
10,39, А = 93,3%; 8) рН 9,23, Л -=-49,0%; 9) рН 8,27, Л =¦-9,6%;
205
10) pH 6,21, А = 9,2-10-2%; И) РН 6,35, А= 1,28%; 12) рН 9,49;
А = 31,6%. 112. 6,2-10-ю. ИЗ. 1,810-4. 114. 1) рН 6,21, синий;
2) рН 7,0, желтый, 3) рН 7,21, желтый. 115. 1) 9,80; 2) 2,76; 3) 8,34.
4) 5,47; 5) 4,60; 6) 4,67; 7) 9,94; 8) 9,26; 9) 4,25; 10) 4,67; 11) 4,48;
12) 4,47; 13) 8,04; 14) 6,11; 15) 2,08; 16) 8,31. 11«. 1)9,80; 2L,67;
3) 8,04; 4) 4,67; 5) 2,33; 6) 8,61; 7) 3,95; 8) 5,58; 9) 3,71; 10) 2,08;
11) 8,04; 12) 4,26; 13) 7,30; 14) 4,08; 15) 7,13; 16) 7,69; 17) 3,71;
117. I) рН 4,60, синий; 2) рН 8,34, синий; 3) рН 4,67, синий; 4) рН
2,76, желтый.
Глава III
118. 1) 1,1-10-12; 2) 5,5-10-5; 3) 3-10-H;J4) 2,8-10-9; 5) 12,6-10-7;
6) 4010п 7) 481015 8) 301023 ^19 I) 22104|/100
) ; ) ; ) ;J) ,; ) ,;
6) 4,0-10-п; 7) 4,8-10-15; 8) 3,0-10-23. ^19. I) 2,2-10—4|г/100 мл;
2) 1,46-Ю-з г/100 мл; 3) 1,74-10-5 г/100 мл; 4I1,48-10—4 г/100 мл;
5) 2,6-10-8 г/100 мл; 6) 7,50-10-5 г/100 мл; 7),6,02-10-2 г/100 мл;
8) 9,82-10-2 г/100 мл; 9H,16 г/100 мл; 10I8,7.10-5 г/100 гмл;
11) 6,2-10-8 г/100 мл; 12) 0,132 г/100 мл; 13) 4,94-Ю-з г/юо мл;
14) 1,6110-2 г/ЮО мл; 15) 8,16-Ю-з г/100 мл. 120. 1) ВаСО3 в 6,9
раза; 2) Ba2Fe(CNNB 256 раз; 3) Са3 (РО4J в 2,2-105 раз; 4) РЬВг2
в 5,4.10s раз; 5) SrCrO4 в 550 раз; 6) Cd (CNJ в 34 раза; 7) Са (Ю3J
в 140 раз; 8) FeC2O4 в 2,6 раза; 9) CaSO4 в 290 раз; 10) № (Ю3)а
в 517 раз. I'M. 1) 1,3-10-5 моль/л; 2) 1,78-10-8 моль/л; 3) 4,8-10—ь
моль/л; 4) 2,3-10-7 моль/л; 5) 3,2-10-6 моль/л; 6) 5,6-10-4 моль/л;
7) 6,8-10-7 моль/л; 8) 1,8-10-9 моль/л; 9) 7,3-10-4 моль/л; 10) 3,0-10-7
моль/л; II) 1,5-10-7 моль/л. 122. 5,6-lQ-s г-ион 12_3. 6,0-10~6
г-ион РЬ2+. 124. 4,7-10—9__мг'. l'2b."ciU ИЛ. 1ШГЪ1(Г^ Др
127. 0,25 r/jL_' 128. 1) 1,7610-7, выпадет; 2) 3,01, не ыпадет.
l2ST776-T(Fi2, не произойдет. 120. 1,5-10-7, образуется. 131. 8,3 г,
132. 0,24 г-ион/л. 133. 1,8-10-13 г-ион/л. 134.6,7. 135. 1,2-10-5
осаждается. 136. [С1~] = 9,514-10-6. 137. AgCl. 138. 1,0-10-2 моля
КС0 [В2+] = 3,33107 139 РЬСО 140 Н
д [] , g ,
К2Сг04; [Ва2+] = 3,3310-7. 139. РЬСгО4, нельзя. 140. Нельз*.
141. РЬСгО4. 142. 1) 9,1-ДО—4 г-ион/л; 2) [Са2+] =0,01. W. Больше
0,2081 г-ион/л. 144. 6,48-10-2 г-ион/л. 145.37,7 мг. 146.1092 мг.
147. 1213 мг. 148. [СгО*-]=0,29; [СО*~] = 1,21. 149. [F-] = 0,44.
[М
= 1,28. 150. 65,5 мг. 151. 4,28-10-5 мг. 152. 41,2 мг.
153." 51,2¦ 10—s мг. 154. 0,14. 155. 1) 2,64; 2) 0,39; 3) 1,70.
156. 1) 2,29; 2) 0,90; 3) 6,14. 157. 5,0-10-28, не прои-
произойдет. 15Р. 1,81-10-18, выпадет. 159. 7,46-10-18, выпадет.
160.2,6-10-23, не выпадет. 161.7,22-10-20, не выпадет. 162.1,49-10-18,
выпадет. 163. 7,46-10-18, не выпадет. 164. 2,26-10—13, не выпадет.
165. 5,16-10-12, выпадет. 166. 1,07-10-14, выпадет. 1э7. 0,016 мг.
16^. 483 мг. 169. 1,43-10-5 мг. \jo. 7,27-10-4 мг. 171. 6, 36-10—з мг.
172. 1) 4,52-10-4 моль/л; 2) 1,86-10-6 моль/л-, 3) 0,91 моль/л1,
4) 3,35-10-9 моль/л; 5) 2,68-10—з моль/л; 6) 8,29-10-8 моль/л;
7) 1,64-10-3моль/л;8H,254моль/л;9) 1,47-10-4 моль/л; щ 8,7-10—з
моль/л. 173. 1) 1,00-10-6 моль/л; 2) 7,94-10-6 моль/л. 174. 0,18 моль/л.
175. 1) рН 2,2, [Cd2+]= 3,85-10-П; 2) рН 1,24, [Bi3+] = 1,2-10-9;
3) рН 0,41, [Сц2+] = 7,45-10-16; 4) рН 6,39, [Си2+] = 1,26-Ю-"-,
5) рН —1,11, [Сц2+] = 8,0-10-13; 6) рН 0,41, [Cd2+] = 9,3-10-7;
7) рН 1,90, [Си2 + ] = 7,9-10-19; 8) рН 1,24, [Сц2+] = 1,6-10-17;
9) рН 6,60. [Cd2+] = 9,45-10-19; 10) рН 2,44, [Cd2+] = 7.9-10-".
176. 1) 11,03; 2) 8,38; 3) 9,20; 4) 7,55; 5) 9,55; 6) 7,45; 7) 2,82;
8) 9,20; 9) 4,12; 10) 9,86; 11) 9,20; 12) 5,12. 177. 1) ПР 9, 6810-19;
206
pH 7,05; 2)ПР 2.3Ы0-49, PH 7,07; 3) ПР 8, 73-10-42, рн 7,33;
4) ПР 6,3-10-8, pH 7,33; 5) ПР 2,01 • 10-", pH8,ll; 6) ПР 9,73-10-6,
pH 9,91; 7) ПР 2,38-10-54, PH 7,00; 8) ПР9.6-10-15, pH 8,17;
9) ПР5,25 10-12, PH9,O; 10) ПР 1,02-10—is, pH 8,93; 11) ПР 1,5-10-8,
pH 7,24; 12) ПР 6,9-10-61; pH 7,00. 178. 1) a) pH 6,33; 6) pH 2,7.
2) a) pH 1,74; 6) pH 1,50. 179. 1) a) 7,9-10-as. не образуется;
б) 5-10-24, не образуется. 2) а) 1,55-10—36, образуется; б) 4,92-10-25,
образуется.
Глава IV
180. 1) [Cd2+] = 1,10-10-2; 2)[Cd2+] = 7,88-10-5. 181. 1) [Ag+]=
l,52-10-7;2)[Ag+]=8,98-10-9. 182. [Ag+]=2,30-10-8. 183. [Hg2+]=
= 5,78-10-27. 184. [Cd2+] = 7,68-10-9. 185. [Ni2+] = 2,62-10-8.
186. [Cu2+] = 5,83-10-is 187. [Hg2+] = 2,66-10-14. 188. [Cu2+] =
= 1,20-10-22. i?9. [Cd2+]=5,98-10-18, [CN-]=0,412, [Cd(CN)^~] =
.= 2,22-10-2. 190. [Co2+] = 8,51-10-7. 191. [Fe2+] = 5,78-10-5.
192. [Ag+]=6,07-10-П, [Cl-]=3,71-10-2, [NH3]=5,63. [Ag(NH3)]^=
= 3,71-10-2. 193. 1,054 моля. 194. 7,40-10-4 МОЛя. 195. 7,1274 г.
196. 4,62 мл. 197. [NOf[ = 0,2, [CN-] = 0,2, [Ag+] = 3,52-10-22.
[Ag(CN)f]=0,l. 198. 1,0710 r. 199. [HgCl^]=l ,74-10-i2,[Hg|+] =
= 1,48-10-27. [Hgl2,"] =0,1, [I—]=0,l, [Cl-] = 0,l. 200. 125,3 мл,
[F-] = 3,12-10-2. 201. 5,271-10-3 .моль/л. 202. 0,1006 г. 203. 56,84мг.
204. 0,99 мл. 205. Не растворится. 206. Не растворится. 207. 0,5 моль/л.
208.1,37 мл. 209. 9,62-10-4 моль/л. 210. 4,52-10-5 моль/л. 211.10 моль/л.
212. 4,20-10-2 моль/л. 213. 3,34-10-2 моль/л. 214. 4,88 моль, [1~] =
4,58. 215. 0,1 моль/л. 216. 0,16 моль/л. 217. 0,0106г. 218. 6,296 г/л AgCl,
7,839-Ю-з г/л Agj, разделение будет достигнуто. 219. Образуется.
220. Выпадает. 221. Осаждается CdS. 222. Образуется. 223. Не обра-
образуется. 224. Не образуется. 225. Образуется. 226. [Вг-] = 9,22-10-5.
227. 0,79 мл. 228. 0,344 моль/л. 229. 0,1 моль/л. 230. 0,463 моль/л.
231. 0,05 моль/л. 232. 0,3 моль/л. 233. 0,220 моль/л. 234. 0,1 моль/л.
235. 0,404 моль/л. 236. 0,1 моль/л. 237. 0,4 моль/л. 238. 0,104 моль/л.
239. 0,05 моль/л. 240. 0,6 моль/л. 241. [Hg2+]=2,05-10-i3, [HgCl+] =
= 1,21-10-7, [HgCl2]=0,039l, [HgCljf] =0,0294, [HgCl^~] = 0,0315,
[Cl-]=0,107. 242. [Hg2+]=4,97-10-25, [HgI+]=3,11-10-14, [HgI2] =
= 1,59-10-4, [Hglg-j = 0,0211, [HgI2~] = 0,0788, [I~] = 0,022.
243. [Cd2+] = 1,70-10-7, [CdI+] = 2,6210-s, [Cdl2] = 9,22-10-4,
[Cdl-] =0,00894 [Cdl2,-] =0,09096, [I-] = 0,807. 244. [Ag+] =
= 1,11-10-3, [AgNO2] = 9,46-10-3, [Ag (NO2)^ = 9,43-10-3,
[NO^]-=0,112. 245. [Ag+] = 3,05-10-4, [AgNH3+ = 1,92-Ю-з,
[Ag (NH3)+] = 0,Ы?8;- [NH3] = 0,003. 246. [Mg2+] = 1,62-10-4,
[MgC2O4] = 6,10-10-3, [Mg(C2O4)^] =4,37-10-2, [C2O^~] =0,106.
247. [Ag+]=7,96-10-14,[AgS2O^] =8,27-10-6,[Ag(S2O3)^~] =0,0565,
[Ag(S2O3)i~] =0,0435, [S2O2,-] =0,157. 248. [Fe2+] = 0,00620,
[FeC1+]= 0,02898, [FeCIo] = 6,06481, [Cl-] = 2,04,
• 207
Глава V
249. 1) 1,42 В, 2) 1,23 В, 3) 1,05 В, 4) 0,90 В, 5) 1,48 В, 6) 1,51 В,
7) 1,26 В. 250. 1,29 В. 251. 0,73 В. 252. 0,12 В. 253. 1) —0,25 В,
2) -0,71 В, 3) 0,125 В, 4) -0,254 В, 5) 0,576 В. 254. -0,065 В.
255. Первая. 256. —0,55 В. 257. —0,385 В. 258. —0,659 В. 259. 0,358В .
260. 0,235 В. 261. 0,577 В. 262. -0,754 В. 263. -0,124 В. 264. -0,274В.
265. —0,615 В. 266. -0,519 В. 267. -0,406 В. 268. —0,122 В.
269. —0,534 В. 270. -0,676 В. 271. —0,328 В. 272. —0,293 В.
273. -0,334 В. 274. -0,293 В. 275. —0,531 В. 276. I) 1,158 В,
2) 2,396 В, 3) 0,71 В, 4) 0,244В, 5) 0,896 В, 6) 0,35 В, 7) 0,69 В,
8) 0,36 В. 277. 1) 4,6-1015, 2) 4,0-10-16, 3) 4,5-1013, 4) 1,11061,
5) 1,5-10-58, 6) 2,4-10-13, 7) 1,9-1098, 8) 1,4-1082, 9) 4,9-10-ю,
10) 2,6.1021. 278. [МпО^] = 0,04, [Мп2+] = 0,01, [Fe3+] = 0,05,
[Fe2+] = 6,85-10-15 279. [Н2О2] = 2,07-10-15, [[-] = 4,14-10-15,
[12]=0,1. 280. [S9—] = 1,28-10-52, [NO~] =2,98. 281.0,1030 г Сг(ОНK,
[HOf] =5,10-10-36. 282. [Fe2+] = 0,l, [Fe3+] = 1,41-10—з, [I-] =
= 1,41-Ю-з, [I2] = 0,05. 283. [СгЗ+] = 9,78-10-12, [Сг2О^] = 0,1,
[Н2О2] = 1,47-10-п. 284. [Мп2+] = 5,0-10- 27, ГМпО^]=0,2,
[Bi3+] 05
Глаза VI
286. 1) а = 0,09, рН 2,05; 2) а = 1,0, рН 3,02; 3) си = 1,0,
а2 = 0,22, рН 0,61; 4) а = 0,268, рН 1,61; 5) а = 0,138,
рН 2,87, 6) а = 0,0441, рН 2,88; 7) а =1-10-з, РН 4,0.
287. 1) 6,89; 2) 6,85; 3) 6,84; 4) 6,85; 5) 6,87; 6) 6,84; 7) 6,85.
288. 1) а = 0,0170, рН 2,77; 2) а = 0,0186, рН 2,77; 3) а =
= 0,0174, рН 2,76; 4) а = 0,0191, рН 2,72; 5)а = 0,0186,
рН 2,73; 6) а = 0,0191, рН 2,72; 7)а = 0,0186, рН 2,73. 28°.
1) 4,54; 2) 4,44; 3) 4,46. 20. 1) 9,46; 2) 9,56; 3) 9,54.
291. 3,74. 292. 10,26. 2 3. 0,136 моль/л. 2L. 1) 2,85-10-5 моль/л;
2) 4,4-10-5 моль/л; 3) 2,85-10-5 моль/л; 4) 4,5-10-5 моль/л;
5) 9,5-10-9 моль/л; 6) 9,9-10—9 моль'л. 295. 1) 1,3-10-2 моль/л1,
2) 9,Ы0-з моль'л. 296. 2,0-10-6 моль/л.
Глава VII
257. 1) 0,2 дел, 2) 0,0 пел, 3) 0,5 дел. 2Ж 0,0, 0,5 дел. шкалы.
299. 1) 0,1 мг/дел; 2) 0,1 мг/дел; 3) 0,1 мг/дел; 4) 0,1 дел;
5) — 0,2 мг; 6) —0,3 мг. 300. 0,25 мг. 301. 5,3270г.302.
1) 31,7161 г; 2) 32,3187 г; 3) 17,0782 г; 4) 1,6244 г; 5) 0,8323 г.
303. 1) 0,3387; 2) 0,5884; 3) 0,5293; 4) 0,5203; 5) 0,7352; 6) 0,5603-,
7) 1,8437; 8) 0,8998; 9) 1,9026; 10) 0,8806- 11) 0,7536; 12) 0,9666;
13) 0,0631; 14) 0,6540; 15) 0,1938; 16) 0,8084; 17) 0,9206;
18) 0,0378; 19) 0,4488; 20) 0,3622. 304. 0,1746. 305. 0,2997.
300. 0,2236. 307. 0,4030. 303. 0,2940. 309. 1,8047. 310. 0,0161.
311. 0,14 г. 312. 0,14 г. 313. 0,97 г. 314. 0,96 г. 315. 0,12 г.
31в. 0,53 г; 1,05 г. 317. 0,47 г. 318. 2,8 г. 319. 0,32 г. 320. 0,74 г.
321. 37,0 мл. 322. 1,3 мл. 323. 5,5 мл. 324. 5,8 мл. 325. 24,9 мл.
326. 0,37 мл. 327. 126,5 мл. 328. 14,7 мл. 329. 11,5 мл. 330. 6,4 мл.
331. 5,0 мл. 332. 0,15 мл. 333. 14,0 мл. 334. 1,213-10-5 г;
2,00-10-3%. 335. 1,049-10-5 моль'л; 1,100-10-8 моль/л. 336.
8,108-10-7 г; 8,108-10-4%. 337. 1,734-Ю-з г; 0,58%. 338. 0,32%.
208 •
339. 2,619-10-7 r. 340. 16,2 мл. 341. 0,92 мл. 342. 6,8? мл.
343. 6,71-10-5%. 344. 37,78% S; 41,08% S. 345.98,98%.
346/5,80%. 347. 53,02%. 348. 5,08%. 349. 19,99%КС1; 12,63%
К2О. 350. 20,66%; 24,16%. 351.80,79% ЗСа, (PO4)o-CaF<-; 34,11 %
Р2О5- 352. 0,0223 г. 353. 47,52% СаО; 45,95% P2OS п 50,24%
СаО; 48,58% Р2О.. 354. 2,94% РЬ; 65,6% Zn; 4,98% Sn. 355.
0,31% Р; 3,07% Ni. 356. 1,44% Si; 5,65% VV. 357. 3,93% Al;
0,90% Si. 358. 24,89% FeO; 96,32% FeSO4-7H20. 359. 1,32% Zn;
0,55% Mp; 0,88% Sn. 360. 49,04% S\ 50,3'2°/0 S. 361. 35,38% Co.
362. 87,50% Na2SO4; 1,52% NaCl и 98,29% Na2SO4; 1,71% NaCl.
363. 81,64%. 364. 85,36% NaCl; 88,53% NaCl. 365. 16,10% P2O5;
18,20%P.O.. 366. 94,59% MgO. 367. 30,50% A12O3. 368. 1,51% FeO;
1,98% MgO; 50,30% CaO. 369. 77,12%. 370. 0,0619 r. 371. 0,0516 r.
372. 3,22% H2O: 3,48% S; 3,59% S. 373. 1,11% А!2Оч,- 58,52%
CaCO,; 33,95% MgCO3. 374. 39,81%. 375. 23,29% Ca, (PO4J;
12,63% CaO. 376. 2,0. 377. 7,0. 378. 18,0. 379. 7,0. 380. 18.
381. 12,0. 382. 5,0. 383. 6,0. 384. 8,0. 385. 6. 386. 49,46%
ZnSO4 6,16% K2SO4. 387. 76,24% NaCI; 23,76% KC1. 388. 2,06%
Na2O; 3,95% K2O. 389. 22,49% Br; 52,85% AgBr. 390. 26,56% I2;
31,37% Nal. 391. 2,73% Na2O; 2,32% K2O. 392. 50,88% Na2SO4;
49,12% K-.SO4. 393. 24,31% Ca: 59,09% Ba; 34,01% CaO. 394.
63,99% Sb; 1,71% Gd. 395. 93,10% Mg (NCbJ-6H.-.O; 6,90%
MgClo-6H20. 396. 10,82% ZnS; 89,18% CdS. 397. 19,55% Ca;
14,40% Mg. 398. 31,24% Fe2O3; 68,76% АШ3.
Глага VI11
399. 0,4988 r-экв/л. 4C0. 0,1005 г-экв/л. 401. 0,2501 г-экв/л.
402 0,1039 г-экв л. 403.0,5431 г-экв л. 404. 0,004943 г/мл. 405.
0,003992 г/мл. 406. 0,004615 г/мл. 407. 0,004087 г/мл: 408. 0,04906
г/мл 409. 0,005005 г/мл. 410. 0,004932 г/мл. 411. 0,003998 г/мл.
412. 0,0004474 г/мл. 413. 0,002313 г/мл. 414. МНС[ = 0,1046; УНС1 =
.-=0,003814; Гнс|/Са0 = 0,002933. 415. NHiSOi = 0,09894; A*HiSOi =
= 0,04947; TiUS0JCa0 = 0,002774. 416. 1) TNa2COj = 0,005316;
*Ка.соа = °.10°3; 7"NajCO,/HC1 = 0,03lDS7; 2) iVNaiCOj =
^Nco./Hci = °'0l82a 4l1 JVso4 = °.o9808;MH2SOi = o,o/90\
= 0,004812; 7"H.,SO4/NaOH = 0,003923. 418. 1,003 г-экв/л.
ДИИ^Об г-экв'л; 0,008408* rlMjt:; 420. 60 мл. 421. 136 мл. 422.
1?шгУ"':1'237~27,9 мл.' Ч2Т"СГ,5Ь(ГО г-экв/л. 425. 0,8160 г. 42Р.
0,1934 г-экв'л. 427. 0,1264 г-экв/л; 0,004607 г/мл. 428. 0,2120 г.
429 ОД 261 г. 430. 0,1188 г-экв'л. 431. 0,1039 г-экв (л-, 0 ,004677г/мл.
432. 0,05993 г/мл. 433. 0,09600 г-экв/л. 434. JVHC1 == 0,09446;
ГНС| = 0,003444; rHC1/Na0H = 0,003778. '35. JVH2SOi = 0,6214:
7VNa0|[ = 0,6068. 43л 0,09787 г-экв/л. 437.500 мл. 438.0,1735 г.
439° 6 387 i 440. 2,0. 442. 0,2%. 443. Нет. 444. 0,02%. 445.
0,2%. 446. 0,01%. 447. 0,015%. 448. Да. 449. 2%. 450. Нет.
451. Метиловый красный, метиловый оранжевый. 452. 85»/. 453.
Фенолфталеин, тимолфталенп. 454. Да. 455. 36%, 456. 0,02%. 457.
0 1060 г 458 0,08-М г. 459. 0,0998 г. 460. 0,1311 г. 461. 99,71%.
462 12 76% 463, 95,87%. 464. 68,44 г/л. 465. 0,07317 г-экв/л.
466 39,44% СаСОч; 60,56% ВаСО3. 467.46,16% Na.CO3, 53,84%
К'ССь 468 КОН. 469. 88,59%. 470. 88,91% NaoC03; 9,00%
NaHCOo, 471. 2,62%. 472 2,4 мг-экв/л. 473. 1,26 г HCI; 32,73 г
209
H3PO4. 474. 124,0 г H2SO4. 263,3 г Н3РО4. 475. 4% H2SO4; 7%
Н3РО4. 476. 0,1419 г. 477. 0,2325 г. 478. 86,82%. 479. 1,218 г.
480. 0,1763г. 481. 21,48%. 482. 3,766 мг-экв/л, 483. 1) 2,02мг-экв/л;
2) 4,94 мг-экв/л; 3) 6,96 мг-экв'л. 484. 45 мл. 485. 20%. 486.
5,86 мл. 487. 40,15% SrCO3; 59,85% Li2CO3. 488. 54,77% Na2CO3X
ХЮН2О; 45,23% NaHCO3. 489. 66,52%. 490.27,47%. 191.0,5850
г-экв/л. 492.33 мл. 493.11,0%. 494.12,65%, 495.5,0 г. 496.
10 мл. 497. 0,42%. 498. 0,25%. 499. 2-10-3 г/мл. 500. 0,0457 г.
501. 0,0991 г-экв/л. 502.1,4 мл. 503.35,2 мл. 504.2,56%. 505.
86,61%. 506. 99,14%. 597. 95,05%. 508. 16,94%. 509. 5,30%.
510. 0,0459 г. 511. 89,67%^! 514. N = 0,04908 г-экв/л; Т =
0,0О834Гг/мл~ГЭТ5. 0,1091 г-экв/л. 516. 0,05005 г-экв/л. 517. 7,017 г.
518. /V = 0,04264 г-экв/л; АГ = 0,8528; Т = 0,01196 г/мл. 519.
0,09310 г-экв/л. 520. 0,08983 г-экв/л. 521. N =0 ,08954 г -эк в/ л;
Г = 0,006816 г/мл. 522. N = 0,1001 г-экв/л. /С =1,1001; Г =
= 0,01624 г/мл. 523. // = 0,1075 г-экв/л; Т = 0,02001 г/мл. 524.
2,14 г. 525. 0,9319 г. 526. 2,6616 г. 527. 0,7729 г. 528. 263,88 г.
529. 437,61 г. 531 66,57 г. 531. 422,2 мг. 532. 0,3178 г. 533.
1,826 г. 534. 0,9958 г. 535. 0,1714 г. 536. 0,87 г. 537. 0,3129 г.
533. 1,4 г. 539. 10,46 мл. 540. 20,22 мл. 541. 23,51 мл. 542.
34,00 мл. 543. 12,55 мл. 544. 2,836 г/л. 545. 9,829 г/л. 546. 60,53%.
547. 59,08% 54S. 29,08%. 549. 67,88%. 550. 93,25%. 551. 84,01%.
552. 90,17%. 553. 97,55%. 554. 32,15%. 555. 5,00%. 556. 2,93%.
557. 9,79%. 55?. 0,32%. 559. 16,32 г/л. 560. 8,00%. 561. 0,26 г.
562. 30,76%. 563. 33,43% СаСО3; 3,56% MgCO3 564. 20,04%.
56 \ 29,98%. 566. 92,39%. 567. 47,52%. 568. 87,94%. 569. 65,38%.
570. 16,84%. 571. 14,40%. 572. 25,44%. 573. 73,42%. 574. 89,88%.
575. 0,2615 г. 576. 2,717 г. 577. 46,36%. 573. 83,42%. 579. 0,21%.
530. 90,93%. 531. 98,85%. 582. 128 мг. 583. N = 0,1198 г-экв/л;
Г = 0,01974 г/мл. 584. 0,0516 г. 585. 0,1488 моль/л. 586. 29,07 мг.
587.51,89%. 588. 26,93 г/л. 589. 18,64 г/л. 590.97,4%. 591.
39,56%. 592. 19,90%, 593. 9,37%. 594. 94,70%. 597. 1) «0,01%;
2) <0,01%; 3) —7-10-2%: 598. 1) <0,01%; 2) <0,01%;3) <0,01%.
599. 1) <0,01%; 2)—31,5%. 6Э0. 23,7 г. 601. 1N,20 г; 2) 2,9336 г.
602. 4,902 г. 603. 558,5 мл. 604. 26,85 мл. 615. 0,08656 г-экв/л;
0,002768 г/мл. 6N. 0,3978 г-экв/л. 617. 0,500 г-экв/л. 6)8. 0,2518 г.
609. 300,0 мл. 610. 19,06 г. 611. 0,1517 г-экв/л. 612. 0,009385 г/мл.
613. 99,45%. 614. 35,30%. 615. 0,27 г. 616. 2,672 г. 617. 0,03532г.
618. 28,61%. 619. 17,90мл. 620. 23,98мл. 621. 37,80%. 0,03161 г/мл.
622. 79,57%Л 623. 74,20^ Fe; 25,80% Fe2O3. 624.3,605%. 625.
Fe2O3. 626. 42,27%. 627. 25,67%. 628. 73,31%. 629. 0,5150 г.
63). 0,16 г. 631. 98,22%. 632. 6,87%. 633. 74,95%. 634. 0,7415 г.
635. 0,06843 г. 633. 1,17%. 637. 0,0001501 г/мл. 638. 3,90%.
639. 0,06161 г-экв/л. 640. 0,08749 г-экв/л. 641. 0,006338 г/мл.
642. 0,01382 г/мл. 643. 0,0159 г. 644. 0,0424 г-ион/л. 645. 0,0285 г.
646. 92,20%. 647. 0,09958 г-экв/л. 648. 3,59%. 649. 0,1257 моль/л.
650. 0,03576 моль/л. 651. W/, = 0,03328 г-экв/л. NK С( 0 =
= 0,03858 г-экв/л. 652. 5,67%. 653.0,03845 г. 654. V =
= 0,1413г--кв/л; Т = 0,01793 г/мл. 655. 0,005925 г/мл. 656. 0,2393 г.
657. 21,25 мл. 658. 5 мл. 659. 19,08%. 660. 98,28%. 661. 69,23%.
662. 24,07 мл. 663. 2,03%. 664. 48,03%. 665. 0,1303 г.
Глава IX
666. I. 1,23%; II. 0,21%; III. 0,23%. 667. 0,71%. 668. 1,42%.
669. 0,93%. 670.2,57%. 671. 3,31 %. 672. 0,66%. 673. 2,51 %. 674.
210
2,04%. 675. 1,70%. 676. 1,10%. 677. 7,08%. 678. 0,83%. 679. 0,36%.
680. 1,10%. 681. 1.0,18%; II. 0,25%; III. 0,56%; IV. 0,40%. V. 1,78%.
682. I. 6,92%; II. 7,67%; III. 10,96%; IV. 10,00%; V. 8,71%. 683. I.
3,16%; II. 3,63%; III. 3,98%; IV. 4,37%; V. 2,95%. 684. I. 3,75%;
II. 5,50%; III. 6,75%. 685. I. 10,00%; II. 14,40%; III. 16,25%. 686.
I. 20,0 мг/л; II. 48,0 мг/л; HI. 64,0 мг/л.
Глава X
687. I. 1,72 г/л; II. 0,93 г/л; III. 0,71 г/л; IV. 0,63 г/л. 688.
I. 1,07%, II. 1,00 %; III. 1,08%; IV. 1,01%. 689. I. 0,50%; II. 0,49%;
III. 0,50%: IV. 0,51%. 690. I. 85,62%; II. 85,61%; III. 85,53%.
691. I. 5,52%; II. 5,46%. III. 5,54%. 692.1. 6,28%; II. 6,38%; III. 6,50%;
IV. 6,42%; 693. 4-10-5 г.Ион/л. 694. 5,45-Ю-з г/л. 695. 3637. 696.
I. 0,33% Mn; 5,05% Cr; II. 0,51% Mn; 3,02% Cr; III. 0,38% Mn;
4,84% Cr; IV. 0,44% Mn; 4,24% Cr; V. 0,49% Mn; 3,63% Cr. 697.
I. 0,055 г V. 0,025 г Ti; II. 0,025r V; 0,040 r Ti; III. 0,045 r V;
0,085 r Ti; IV. 0,030 г V; 0,030 r Ti; V. 0,035 г V; 0,035 г Ti. 698.
I. 0,30 мг; II. 0,35 мг; III. 0,43мг; IV. 0,48 мг; V. 0,53 мг. 699. 1H,15%;
2I,45%; 3J,60%; 4K,80%; 5I,15%; 6N,20%; 7H,90%;
8) 5,17%; 9) 0,30%; 10) 0,70%; 11) 1,20%; 12) 0,93%; 13) 1,33%;
14) 1,50%; 15) 3,15%; 16J,05%; 17J,70%; 18L,80%; 19) 0,85%;
20) 0,28%. 700. 1) 83,7%; 2) 85,8%; 3) 82,2%; 4) 88,7%; 5) 85,0%;
6) 87,2%; 7) 85,4%; 8) 79,2%; 9) 83,7%-, 10) 82,7%. 701. 1) 6,3%;
2J,8%; 3I,0%; 4) 7,5%; 5) 1,7%; 6) 10,4%; 7) 20,4%;
8) 23,8%; 9) 17,5%; 10) 9,8%; 11) 6,1%.
Глава XI
702. I. 64,5 мг/л; П. 96,8 мг/л; III. 21,5 мг/л; IV. 43,0 мг/л;
703. I. 0,41%; II. 0,44%; IJI. 0,30%; IV. 0,37%. 704. I. 400 мг/л;
II. 240 мг/л; III. 560 мг/л; JV- 432 мг/л. 705. I. 1,6 г/л; II. 3,0 г/л;
Щ, 2,2 г/л; \у. 1,0 г/д,
Глава XII
708. I. 3,8-10—а мг/мл; II. 6.610—з МГ/ИЛ; Ш. 9,1 ¦ 10—э мг/м
JV. 5,7-Ю-а мг/мл; у. 7,8-10-а мг/мл. 707. 4,5%; И. 5,0%; III. 4,0
IV. 5,5%; V. 6,0%, 708. I, 0.75%; П. 0,50%; III. 1,00%; IV. 0,80%.
V. 1,25%. 709. I. 1,08.10-»%; И. 1,03.10-!%; HI, 1,04-10—8%}
IV. 1,08-10-J%| V, 1,00.10-3%,
Глава XIII
710. I. 3,9.10-? Г; II. 5,2-10-7 Г; III. 7,8-10-7 г. 711. 4,0-10-7 rj
II. 5,3-10-7 г; Ш. 3,110-7 г; IV. 6,2-10-' г; V. 7,1-10-7 г|
712. I. 4,2-10-7 г; II. 1,7-10-7 г; III. 3,7-10-7 г; р/. 6,310—7;
V. 2,6- .0-7 г. 713. I. 1,5 мкг/мл; II. 2,5*мкг/мл; III. 4,0^ мкг/мл,
714. I. 5,2-10-6 мкг/мл. П. 6,6-10-6 мкг/мл; III. 9,0-10-6 мкг/мл,
715. I. 3,4-Ю-з г-атом/л; II. 1,8-10-з г-атом/л; III. 5,2-Ю-з г-атом/л,
716. I. 0,022%; И. 0,024%; III. 0,026%, 717. I. 3,7 г/л; II. 4,3 г/л;
III. 5.1 г/л. 718. I. 0,52%; II. 0,55%; III. 0,51%.
211
Глава XIV
719. I. 1,2%; П. 0,8%; III. 0,5%. 720. I. 0,1045 г-экв/л; II.
0,0653 г-экв/л; III. 0,0445 г-экв/л. 721. I. 10,94%; II. 8,30%;
HI. 6,08%. 722. I. 20 мин. II. 30 мин; III. 35 мин. 723. I. 0,5 A.
U. 0,3 A; III. 0,2 A. 721. I. Al; II. Cr; III. Bi.
Глава XV
725. I. 0,63 мг; II. 0,74 мг; III. 0,86 мг; IV. 0,99 мг; V. 1,11 мг;
726. I. 6,45 мг; II. 5,05 мг; III. 4,15 мг. 727.1.0,170 мг;П. 0,196 мг;
III. 0,226 мг; IV. 0,253 мг; V. 0,282 мг. 728. I. 0,0933 г-экв/л;
П.0,1244г-гкв/л; III. 0,1812 г-экв/л. 729. 1.4,5-10-3%; Ц. 4,0-10-3%;
III. 4,25-10-3%; iv. 4,04-10-3%; V. 3,95-10-3%. 730.1. 2,32-10-2%;
II. 1,52-10-2%; III. 9,2-10-3%. 731. I. 6,93-10-4 моль/л;
II. 4,76-10-4 моль/л; III. 3,67-10-4 моль/л. IV. 2,43-10-4 моль/л;
V. 1,55-10-4 моль/л. 732. I. 49 мкг; II. 69 мкг; III. 83 мкг; IV. 102 мкг;
V. 137 мкг.
Глава XVI
733. I. 0,0064 моль/л; II. 0,034 моль/л; III. 0,066 моль/л;
IV. 0,112 моль/л; V. 0,190 моль/л. 731 I. 0,00098 г-экв/л;
II. 0,01036 г-экв/л;Ш. 0,0561 г-экв/л; IV. 0,0867г-экв/л;
V. 0,1420 г-экв/л. 735. I. 0,0280 г/л NaOH; 0,0281 г/л NH4OH;
II. 0,0230 г/л NaOH; 0,0347 г/л NH4OH; III. 0-0408 г/л NaOH;
0,0180 г/л NH4OH. 736. I. 0,1048 г; II. 0,1188 г;
III. 0,1323 г. 737. I. 99,07% п-нитроанилина; II. 23,99% диэтиламина;
47,57% дифениламина; III. 28,74% диэтиламина; 45,17% п-нитро-
п-нитроанилина, 21,07% мочевины, IV. 19,35% диэтиламина, 21,94% п-хлор-
анилина, 44,77% дифениламина, 13,28% ацетамида. 738. I. 58,22%
H2SO4 и 38,98% НС1; II. 77,55% H2SO4 и 17,31% НС1;
III. 71,95% H2SO4 и 26,76% НС1.
Глава XVII
739. I. 2,70; II. 7,83; III. 7,63; IV. 4,99; V. 9,21; VI. 8,93.
VII. —1,43; VIII. 6,06. IX. 7,91; X. 4,97. 740. 0,1000 г-экв/л;
741. 0,2000 г-экв/л. 742. 0,1500 г-экв/л. 743. 14,61 г/л. 744. 50,00%.
745. 2,41 г/л. 746. 6,51 г/л. 747. 5,84 г/л. 748. 93,08%. 749.'29,75%,
750. 10,02%. 751, 5,09%, 752. 15,97%,
Глава XVIII
/эв. 1. о,407о; 11- о,*и-/о; ш. о,ии-/о; iv. о,ои-/о; v. o.cjo/о.
759. I. 203 мг/л; II. 127 мг/л; III. 86гмг/л; IV. 254 мг/л; V. 335 мг/л.
760. I. 98 мг/л; II. 73 мг/л; III. 170 мг/л; IV. 183 мг/л; V. 318 мг/л;
VI. 366 мг/л; VII. 488 мг/л; VIII. 244 мг/л; IX. 585 мг/л; X. 122 мг/л.
761. I. 918 мг/л; П. 702 мг/л; III. 972 мг/л; IV.[62l мг/л; V. 1053 мг/л.
Глава IX
762. I. 6,4%; II. 11,6%; III. 23,2%; IV. 18,0%; V. 14,0%.
763. I. 5,0%; II. 12,0%; III. 15,0%; IV. 10,0%; V. 20,0%.
764. I. 6,4%; II. 34,0%; III. 27,0; IV. 11,6%; V. 18,0%; VI. 43,2%;
VII. 23,2%; VIII. 14,0%. 765. I. 350 мг/л; II. 356 мг/л; HI. 351 иг,я;
IV. 353 мг/л; V. 350 мг/л. 766. I. 5,56 г; II. 5,75 г; III. 5,75 г;
IV. 5,76 г; V. 5,75 г. 767. I. 0,0937 г; II. 0,1295 г; III. 0,1743 г;
IV. 0,2288 г; V. 0,2820 г. 768. I. 0,1126 г; II. 0,1270 г; III. 0,1374 г;
IV. 0,1446 г; V. 0,1534 г. 769. I. 90,0%; II. 85,0%; III. 95,5%;
IV. 87,2%: V. 91,7%. 770. I. 1,27 мг/мл; II. 1,59 мг/мл;
III. 1,37 мг/мл; IV. 0,98 мг/мл; V. 0,79 мг/мл. 771. 1) 0,176 мг/мл
Hg; 2) 115 мг/мл Zn. 772. I. 1,38 г-атом/л; II. 1,12 г-атом/л;
III. 1,63 г-атом/л. IV. 1,56 г-атом/л. V. 1,00 г-атом/л.
Глава XX
773. 1.8,9мг; И. 11,6мг; III. 16,7мг; IV. 18,9 мг; V.18,4 Mr;VI.15,8 мг;
VII. 15,4мг; VIII. 24,8 мг; IX. 19,6 мг; X. 16,5 мг. 774. I. 37,4%
пропана, 53,1% бутана. 3,8% пентанл, 5,7% циклогексана;
II. 25,5% пропана 35,6% бутана, 33,1% пентана, 5,8% циклогек-
циклогексана; III. 57,7% пропана, 39,0% пентана, 3,3% циклогексана;
IV. 53,5% пропана, 25,4% бутана, 15,6% циклогексана, 5,5% про-
пропилена. 775. I. 21,9% бензола, 24,7% толуола, 34,2% этилбензола,
19,2% кумола; П. 22,5% о-ксилола, 26,4% .м-ксилола, 11,1%л-кси-
лола, 40,0% этилбензола; III. 49,7% бензола, 17,5% гексана, 21,4%
пропилена, 11,4% этанола. 776. I. 99,65% этанола, 0,35% метанола;
II. 98,23% метана, 1,77% этана; III. 96,67% динитробензола, 3,33%
нитробензола; IV. 96,99% этилацетата, 3,01 % этанола. 777. I. 8,49%;
II. 4,44%; III. 22,02%; IV. 3,65%.
Глава XXI
778. I. 0,033%; II. 0,030%; III. 0,032%; IV. 0,035%. 779. J. -5 мл;
И. ~ 8 мл; Ш. ~ 6 мл; IV. ~ 10 мл; 780. 4 экстракции.
Глава XXII
781. 0,04. 782. S=_0,078; А* = 0,08. 783. 5 = 0,042; дЯ =» (ЦO.
784. S = 0,28-10-3; Д^ = 0,39-Ю-з. 785. S = 0,23-10-5; АХ =
=0,23-10-Е; 786. S = 2,6-10-2, Д^ = 2,0-10-2. 787. 5=1,2.10-*;
Д* = 0,3-10-4. 788. 0,37-Ю-з. 789. 0,02. 790. Нет. 791. Да. 792. Да.
793. Не является. 794. Нет. 795. Имеется. 7 6. Имеется у второго
студента. 797. Нет. 798. Различие значимо при а = 0,95. 799, Разли-
Различие значимо при а=0,95. 800. S = 0,1016; Vx = 0,187%; V2=0,150%;
V3== 0,121%. 801. 3 пробы. 802. 7,10%; да при л = 6. 803. 4 пробы.
804. 11 проб.
ПРИЛОЖЕНИЕ
Т а б л и ц а 1
КОНСТАНТЫ ДИССОЦИАЦИИ КИСЛОТ И ОСНОВАНИЙ ПРИ 25 °С
Название
Нитрилотриуксусная
лота
Салициловая кислота
Фенолфталеин
2 НСГ2О4 ZZ Сг2О^~Н
Триэтаноламин
кис-
2О
Формула
H3NTA
H2NTA-
H2NTA2-
HSal-
N(C2O4OHK+H2O
к
1,29-10-2
3,24-Ю-з
1,86-10-ю
2,2-10-H
1,7-10-14
34,5
5,6-10-7
1,89
2,49
9,73
13,65
9,77
-1,E4
6,23
Таблица 2
ПРОИЗВЕДЕНИЯ РАСТВОРИМОСТИ ПРИ 25 °С
Формула
Тетрафенил борат таллия
Т1[В(С6Н5L]
Фрсфат уранила и аммония
ПР
9,0-10-э
4,36-10-27
.рПР
8,05
26,36
Таблица 3
РАСТВОРИМОСТЬ
Формула
AgCN
Ag2VPO4 ....
Ba3(AsC>4J • ¦ •
Ва3(РО4J ....
Cd3(AsO4J • • •
СОС2О4
S, ноль/л
1,18-10-8
1,71-10-5
3,74-10-п
8,88-10-9 .
1,15-10-7
2,51.10-*
В ВОДЕ ПРИ 15 °С
Формула
СиСО3
NiSeO,
РЬ3(РО4J ....
SrCO,
Т12Сг04 . , . , .
ZnC2O4
S, моль/л
1,57-10-5
3,16-Ю-з
1,49- 10-9
1,05-10-5
6,32.10-5
3,88.10-6
214
Таблица 4
КОЭФФИЦИЕНТЫ НОРМИРОВАННЫХ ОТКЛОНЕНИЙ (КОЭФФИЦИЕНТЫ
СТЬЮДЕНТА) ПРИ 4=0,95
Число степеней
свободы /
1
2
3
4
5
12,706
4,303
3,182
2,7/6
2,571
Число степеней
свободы /
6
7
8
9
10
2,447
2,365
2,306
2,262
2,228
КРИТЕРИИ О ПРИ а=0,95
Таблица 5
Число
измерении п.
3
4
5
6
0,94
0,77
0,64
0,56
Число
измерений п
7
8
9
10
О -
0,51
0,48
0,44
0,42
Владимир Павлович Васильев, Вера Евгеньевна
Калинина, Людмила Александровна Кочергина,
Александр Николаевич Куракин, Павел Матвее-
Матвеевич Милюков, Галина Александровна Прик
СБОРНИК ВОПРОСОВ II ЗАДАЧ
ПО АНАЛИТИЧЕСКОЙ ХИМИИ
Редактор В. Н. Борапенкова. Переплет художника
Ю. Д. Федичкипа. Художественный редактор Т. М. Сквор-
цова. Технический редактор С. П. Передерни. Корректор
С. К.. Марченко.
Сдано в набор 17/IX—75 г. Подгт. к печати 16/11—76 г.
Формат 81хШ8'/з2. Бум. тип. № 2. Объем 6,75 печ. л.
Усл. печ. л. 11,34. Уч.-изд. л. 11,45. Изд. № Хим.—535.
Тираж 42 000 экз. Цена 40 коп.
План выпуска литературы издательства
«Высшая школа» (вузы и техникумы) па 1976 г.
Позиция № 73. Москва, К-51, Неглшшая ул., д. 29/14,
Издательство «Высшая школа»
Московская типография № 8 Союзполиграфпрома
при Государственном комитете Совета Министров СССР
по делам издательств, полиграфии и книжной торговли.
Хохловский пер., 7. Тип. зак. 4022.