Похожие
Текст
СБОРНИК ВОПРОСОВ
И ЗАДАЧ
ПО АНАЛИТИЧЕСКОЙ ХИМИИ
Под редакцией проф. В. П. Васильева
Допущено Министерством
высшего и среднего
специального образования СССР
в качестве учебного пособия —
для студентов
химико-технологических
специальностей вузов
МОСКВА «ВЫСШАЯ ШКОЛА» 1976 г.
543
С23
УДК 543(076)
Рецензенты: доц. 3. Е. Гольбрайх (ЛТИ им. Ленсовета) и кафедра
аналитической химии КХТИ им. С. М. Кирова
Авторы:
Васильев В. П., Калинина В. Е., Кочергина Л. А., Куракин А. Н.,
Милюков П. М., Прик Г. А.
Сборник вопросов и задач по аналитической химии.
С23 Под ред. В. П. Васильева. Учеб, пособие для вузов. М.,
«Высш, школа», 1976.
216 с. с ил.
На обороте тит. л. авт.: В. П. Васильев, В. Е. Калинина,
Л. А. Кочергина [и др.].
Сборник охватывает практически все разделы аналитической химии и со-
стоит из трех частей: ионного равновесия в растворе, количественного анали-
за и физико-химических методов анализа. Наиболее значительное место
отведено физико-химическим методам анализа. В этом разделе рассматри-
ваются эмиссионный спектральный анализ, абсорбционная спектроскопия,
нефелометрия и турбидиметрия, люминесцентный анализ, кинетические методы
анализа, электрогравиметрический анализ, кулонометрия, кондуктометрия, по-
тенцнометр|Ичесмие методы анализа, полярография и амперометрическое титро-
вание, радиометрические методы анализа, хроматографические методы анали-
за, экстракция.
В каждой главе даны примеры решения типовых задач.
20506—154 543
С ------------73—76
001(01)—76
© Издательство «Выошая школа», 1976 г.
ОГЛАВЛЕНИЕ
Стр.
Предисловие............................................... 5
Часть первая
ИОННЫЕ РАВНОВЕСИЯ В РАСТВОРЕ
Глава I. Равновесия в водных растворах кислот и ос-
нований .....................................'............. 6
Вопросы для самопроверки.................... 6
Решение типовых задач.................... 7
Задачи ....................................... Ю
Глава II. Равновесия в растворах гидролизующихся со-
лей ....................................................... 16
Вопросы для самопроверки .................. 16
Решение типовых задач ................... 17
Задачи....................................... 20
Глава III. Равновесия в растворах малорастворимых
соединений................................................ 23
Вопросы для самопроверки ................... 23
Решение типовых задач....................... 24
Задачи...................................... 28
Глава IV. Равновесия в растворах координационных
(комплексных) соединений.................................. 33
Вопросы для самопроверки.................... 33
Решение типовых задач....................... 35
Задачи ..................................... 39
Глава V. Равновесия при протекании окислительно-вос-
становительных процессов.................................. 44
Вопросы для самопроверки.................... 44
Решение типовых задач....................... 46
Задачи...................................... 49
Глава VI. Влияние ионной силы на равновесия в раст-
ворах электролитов ....................................... 55
Вопросы для самопроверки.................... 55
Решение типовых задач....................... 55
Задачи...................................... 59
Часть вторая
КОЛИЧЕСТВЕННЫЙ анализ
Глава VII. Гравиметрический (весовой) анализ .... 60
Аналитические весы и взвешивание .... 60
Решение типовых задач................. 60
Задачи................................ 63
Расчеты в гравиметрическом (весовом) ана-
лизе ...................................... 65
Вопросы для самопроверки ............... 65
Решение типовых задач ...................... 67
Задачи................................ 71
Глава VIII. Титриметрический (объемный) анализ ... 80
Вопросы для самопроверки ............... 80
Решение типовых задач................. 90
Задачи................................ 97
3
Часть третья
ФИЗИКО-ХИМИЧЕСКИЕ МЕТОДЫ АНАЛИЗА
Глава IX. Эмиссионный спектральный анализ ....
Вопросы для самопроверки ................
Решение типовых задач....................
Задачи ..................................
Глава X. Абсорбционная спектроскопия
Вопросы для самопроверки ................
Решение типовых задач....................
Задачи ..................................
Глава XI. Нефелометрия и турбидиметрия.................
Вопросы для самопроверки ................
Задачи ..................................
Глава XII. Люминесцентный анализ.......................
Вопросы для самопроверки ................
Задачи ..................................
Глава XIII. Кинетические методы анализа................
Вопросы для самопроверки ................
Решение типовых задач......................
Задачи ..................................
Глава XIV. Электрогравиметрический (электровесовой)
анализ ................................................
Вопросы для самопроверки ................
Решение типовых задач....................
Задачи ..................................
Глава XV. Кулонометрия.................................
Вопросы для самопроверки ................
Решение типовых задач....................
Задачи ..................................
Глава XVI. Кондуктометрия..............................
Вопросы для самопроверки ................
Задачи ..................................
Глава XVII. Потенциометрические методы анализа . . .
Вопросы для самопроверки ................
Задачи ..................................
Глава XVIII. Полярография и амперометрическое титрова-
ние ...................................................
Вопросы для самопроверки ................
Задачи ..................................
Глава XIX. Радиометрические методы анализа . . . .
Вопросы для самопроверки ............. •
Решение типовых задач....................
Задачи ..................................
Глава XX. Хроматографические методы анализа ....
Вопросы для самопроверки ................
Решение типовых задач....................
Задачи ..................................
Глава XXI. Экстракция..................................
Вопросы для самопроверки.................
Задачи ..................................
Глава XXII. Математическая обработка результатов ана-
лиза . . . ...... .....................................
Вопросы для самопроверки ................
Решение типовых задач....................
Задачи . . . . ..........................
Ответы к задачам.........................
Приложение . ......................
125
125
127
130
135
135
140
144
152
152
153
155
155
156
158
158
158
160
165
165
165
166
167
167
167
168
170
170
171
174
174
175
178
178
179
182
182
183
184
188
188
189
189
192
192
192
193
193
194
201
204
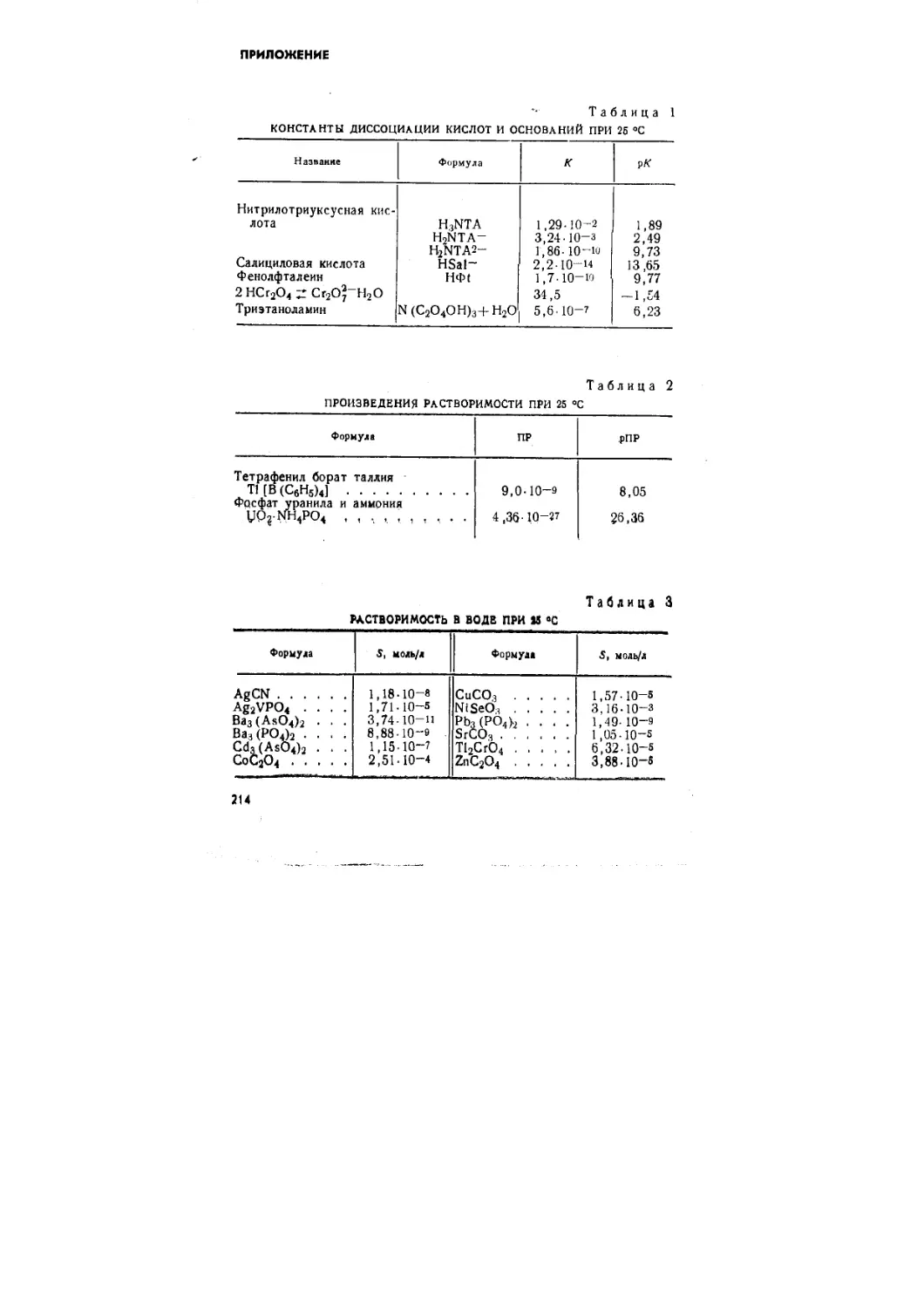
214
ПРЕДИСЛОВИЕ
Настоящий сборник вопросов и задач по аналитиче-
ской химии составлен в соответствии с программой для
химико-технологических высших учебных заведений.
Значения физико-химических констант, использован-
ных в сборнике, взяты, за небольшим исключением, по
справочнику *. Им же рекомендуется пользоваться при
решении задач. Величины, отсутствующие в справочнике,
приведены в приложении. Вопросы для самопроверки ох-
ватывают общетеоретический и специальный материал,
изучение которого в курсе аналитической химии является
обязательным. При разборе типовых задач даются крат-
кие пояснения теоретического характера и более подроб-
но рассматривается их решение. Дать решения задач всех
типов, встречающихся в сборнике, невозможно, так как
не все они достаточно «типичны». Однако в приведенных
примерах содержатся основные элементы решения прак-
тически любой задачи.
При подготовке сборника авторы опирались, главным
образом, на многолетний опыт и традиции преподавания
аналитической химии в Ивановском химико-технологиче-
ском институте. В составлении и решении задач помимо
авторов сборника принимали участие все преподаватели
кафедры аналитической химии, которым авторы выра-
жают глубокую благодарность. Авторы также глубоко
признательны рецензентам задачника: доц. 3. Е. Голь-
брайху (ЛТП им. Ленсовета) и сотрудникам кафедры
аналитической химии Казанского химико-технологическо-
го института им. С. М. Кирова за ценные советы.
* Лурье Ю. Ю Справочник по аналитической химии. Над. 4-е,
М., «Химия», 1971.
ЧАСТЬ ПЕРВАЯ
ИОННЫЕ РАВНОВЕСИЯ В РАСТВОРЕ
Большинство реакций аналитической химии протекает
в растворе. Глубокое изучение и понимание этих реакций
невозможно без выполнения многочисленных расчетов на
основе закона действия масс и других фундаментальных
соотношений. Поэтому первая часть сборника посвящена
задачам на расчет ионных равновесий, возникающих в
растворе при проведении химико-аналитических реакций.
За исключением специальной главы расчеты выполнялись
в предположении, что закон действия масс применим в
его классической форме, т. е. в терминах концентраций.
Вопрос об учете коэффициентов активности кратко рас-
сматривается в гл. VI. Это не означает, что эффект ион-
ной силы не следует изучать до проработки материала
первых пяти глав.
Глава I
РАВНОВЕСИЯ В ВОДНЫХ РАСТВОРАХ КИСЛОТ
И ОСНОВАНИЙ
Вопросы для самопроверки
I. Какие соединения являются в водном растворе кис-
лотами, а какие основаниями с точки зрения протолити-
ческой теории Бренстеда — Лаури:
НС1О4, NH3, СОзЛ нсог, н2со3, s2-, nh4+, сн3соо-?
2. Каково значение pH дистиллированной свежепере-
гнанной воды при 25° С? Как изменяется pH воды при
повышении температуры?
3. Чему равно ионное произведение воды (Кк) при
25° С? Как изменится Kw, если растворить в воде
1 моль/л NaNO3?
6
4. В каком водном растворе степень диссоциации наи-
большая:
а) 0,1М СН3СООН, 0,1М НСООН, 0,1М HCN;
б) O,1MNH3, 0,01MNH3?
5. Как зависит степень диссоциации слабого электро-
лита от константы диссоциации и концентрации его в
водном растворе? Вывести соответствующую формулу.
6. Как влияет добавление одноименных ионов и по-
стороннего электролита на степень диссоциации слабого
электролита?
7. Какие растворы называют буферными? Привести
примеры.
8. Что такое буферная емкость? Чем она характери-
зуется?
9. Вывести формулу для расчета pH: а) ацетатного
буферного раствора; б) аммонийного буферного рас-
твора.
10. Какие реагенты следует добавить к раствору,
pH которого 0, чтобы создать слабокислую среду: NH3,
NaOH, CH3COONa, НС1, CH3COOH, NH4C1?
11. Какие реагенты из указанных в задаче 10 следует
добавить к раствору, pH которого 12, чтобы создать сла-
бокислую среду?
12. Какой буферный раствор следует использовать,
чтобы поддерживать постоянную величину pH: а) 8—10;
б) 4—6; в) 3—5?
Решение типовых задач
При решении задач рекомендуется соблюдать следую-
щую последовательность:
1. Написать уравнение химической реакции (равнове-
сия) в ионной форме.
2. Записать выражение константы равновесия и найти
ее численное значение (например, по справочнику
Ю. Ю. Лурье).
3. Обозначить равновесные концентрации реагирую-
щих веществ, причем через х рекомендуется обозначить
наименьшую равновесную концентрацию, и записать их
под химическими формулами веществ в уравнении реак-
ции.
7
4. Подставить равновесные концентрации в выраже-
ние для константы равновесия и произвести возможные
упрощения.
5. Выполнить расчет.
Пример 1. Вычислить концентрацию продуктов ступенчатой
диссоциации в 0,1 М Н3РО4. Рассчитать степень диссоциации Н3РО4
в этом растворе.
Решение. Ступенчатая диссоциация фосфорной кислоты
(I ступень) Н3РО4 Н+ + Н2РО7
0,1-х х х
(II ступень) Н2РО7Н++ ^НРО^-
(III ступень) НРО4— 7*" Н+ + РО4~
характеризуется следующими константами диссоциации:
1ИЧ [Н,РОГ] _ 7 6 № , К2_ [Н+] [НРОГ] = 6 2 ю_,
)Н3РО4] [H2P<V]
1НЩРОГ]
[нро;-]
Значения А4 и К2 различаются примерно в Ю5 раз, поэтому
концентрацию ионов водорода можно вычислить с учетом диссоциа-
ции Н3РО4 только по первой ступени. Такое допущение не вызы-
вает существенных погрешностей, если Ki многоосновной кислоты
превышает примерно в 1000 и более раз. Равновесные концентра-
ции указаны под уравнением диссоциации фосфорной кислоты по
I ступени. Подставим равновесные концентрации в выражение Кр.
у 2
= -----= 7,6-10-з,
0,1 — х
или
х2 4-7,6-Ю-Зл—7,6-10-4 = 0.
Решая квадратное уравнение, получаем
7,6-Ю-з , f(7,6-10-3)2
х = [Н+] = —---------4-1/ —-------4-7,6-10-3-10-1 =
= 2,4-10-2 г-ион/л.
Если кислота очень слабая, то [Н+] « СНА и СНА—[Н+] СНА.
Равновесную концентрацию ионов Н+ в таких растворах следует
вычислять по формуле
[Н+] = V ХнаСна-
8
Такое допущение вполне оправдано для кислот с р К 5-4 (при
условии, что С^д'.-Кна)- Концентрация иона Н2РО7 практически
определяется диссоциацией НзРО-, по I ступени. Следовательно,
[Н2РО7] =[Н+] = 2,40-10-2 г-ион/л.
Значения К2 и Кз различаются п 105 раз, поэтому находим кон-
центрацию иона НРО^—, учитывая диссоциацию кислоты только по
II ступени:
Г 2 1 [Н2рс>г]
[НРО2~] = = К2 = 6,2-10-8 г-ион/л.
Концентрация аниона, образующегося в результате диссоциации
слабой кислоты Н2А по II ступени, численно равна Кз, т. е.
[А2-] = К^.
Это положение является общим для большинства многоосновных
кислот: H2S, Н2СО3, Н2С2О4, НзРО4 и др.
Зная равновесные концентрации ионов Н+ и НРО,( С вычис-
ляем концентрацию иона РО^—:
г а 1 [НРО|-1 4,2-10-13-6,2-10—«
[РОМ = Кл 1L '-----------------------’-------=1,1- Ю-18 г-пон/л.
L 4 J [Н+] 2,4-10-2
По равновесным концентрациям продуктов диссоциации Н3РО4
находим степень диссоциации («) Н3РО4 по всем трем ступеням:
[н2РО7]
«1 = -^------
сн3ро4
2,4-10-2
0,1
= 0,24, или 24%;
НРО*-]
«II — ' н2рог]
fP0M
ат = -т--=
[НРОГ]
--------= 2,58-10—6, или 2,58-10-1%;
2,4-10-2
1,1- 10-18
-1------= 1 ,77-10-и, или 1,77-10-9%.
6,2-10-8
В растворах, где [Н : ] ' %-нА’ величина а может быть опреде-
лена по уравнению
[Н+] на
«НА = 7^ = г°
°НА СНА
Отсюда
^НА — «НА^НА-
Пример 2 Сколько граммов твердого формиата натрия HCOONa
надо добавить к 100 мл 0.2 М НО. чтобы получить буферный рас-
твор с pH 4,3.
9
Решение. При добавлении достаточного количества формиата
натрия соляная кислота практически полностью замещается муравьи-
ной, так чтоСнсоон = СНС| =0,2 моль/л. Диссоциация муравьиной
кислоты
НСООН н+ + нсоо-
0,2-5-10-5 5-10-5 5• 10-5 + C°HC00Na
характеризуется константой диссоциации НСООН:
-[.н+инсоо7] = 10-4
[НСООН]
Равновесная концентрация ионов Н+ в растворе с pH 4,3 равна
5-10-5 г-ион/л.
При действии одноименного формиат-иона диссоциация муравьи-
ной кислоты резко уменьшится. Следовательно,
[НСООН] = 0,2—5 • 10_’~0,2 моль/л и [НСОО~] = 5 • 10~’ +
+ HCOONa ~ СHCOONa'
Подставляем равновесные концентрации в выражение Лнсоон:
I 8.10—4 — 5 10~5CHCOONa
’ 0,2
отсюда
^HCOONa = моль/л.
Общая концентрация добавленного формиата натрия, т. е. израс-
ходованного на реакцию с соляной кислотой и вошедшего в состав
буферной смеси, составляет
0,2 + 0,72 = 0,92 моль/л.
Масса добавленного HCOONa равна
0,92
-100-68,0 = 6,2 г/100 мл,
1000
где 68,0 — молекулярный вес HCOONa.
Задачи
1. Вычислить и сравнить pH растворов: 1) 0,1 М НС1
и 0,1 М СН3СООН; 2) 5%-ного раствора НС1 и 5%-ного
раствора СН3СООН; 3) растворов, содержащих 7 г/л
НС1 и 7 г/л СНзСООН соответственно.
2. Вычислить концентрацию ионов НСОО-, Н+ и
pH в: 1) 0,03 М НСООН; 2) 5 %-ном растворе НСООН;
3) в растворе, содержащем 4,6 г/л НСООН.
10
3. Вычислить концентрацию ионов ОН~, Н+ и pH в:
1) 0,01 М NH2OH; 2) 0,1%-ном растворе NH2OH.
4. Указать примерное значение pH, если в присутствии
фенолфталеина раствор бесцветен, а при добавлении ро-
золовой кислоты становится красным.
5. Указать примерное значение pH, если при введе-
нии бромкрезолового пурпурного раствор становится
желтым, а добавление конго красного приводит к окра-
шиванию раствора в красный цвет.
6. Указать примерное значение pH, если при введении
н-нитрофенола раствор бесцветен, а при добавлении
бромкрезолового синего окрашивается в синий цвет.
7. Вычислить концентрацию ионов Н+ и pH в 0,01 М
H2Se.
8. Вычислить концентрацию ионов. Н+, HSO? и SO4-
в 0,2М H2SO4.
9. Вычислить концентрацию ионов водорода и сали-
цилат-ионов в 0,001 М салициловой кислоте.
10. Вычислить концентрацию ионов Н+, HSO? и 80з~
0,2 М H2SO3.
11. Вычислить концентрацию ионов Н+ и pH в
0,1МН3РО4.
12. Вычислить концентрацию ионов НРО4- и РО4~
в 0,2М Н3РО4.
13. Вычислить концентрацию ионов Н+, Н2АзОГ и
HAsO4“ в 0,1MH3AsO4.
14. Вычислить концентрацию ионов ДзО4- в
0,1М H3AsO4.
15. При какой концентрации СН3СООН диссоцииро-
вана на 30% ?
16. При какой концентрации НСООН диссоциирована
на 50%?
17. Концентрация ионов Н+ в растворе СН3СООН
10-4 г-ион/л. Вычислить молярность этой кислоты.
18. Вычислить молярность раствора НСООН, имею-
щего pH 3,0.
19. Вычислить молярность раствора HCN, имеющего
pH 5,0.
20. Вычислить молярность раствора триэтаноламина,
имеющего pH 10, 0.
21. При какой концентрации N2H4 в растворе диссо-
циирован на 0,23%?
и
22. Концентрация ионов Н+ в 0,1 М СН3СООН
1,3-10-3 г-ион/л. Вычислить константу и степень диссо-
циации кислоты.
23. Вычислить константу диссоциации НСООН, если
pH 0,04 М раствора ее 2,57.
24. Вычислить константу диссоциации НСООН, если
в 0,46%-ном растворе она диссоциирована на 4,2%.
25. Рассчитать константу диссоциации HN3, если в
0,2 М растворе она диссоциирована на 1,0%?
26. Вычислить константу диссоциации NH3, если сте-
пень диссоциации его в 0,3 М растворе составляет 0,77%.
27. Вычислить константу диссоциации диметиламина,
если в 0,2 М растворе он диссоциирован на 7,42%.
28. Концентрация ионов ОН~ в 0,5М растворе гидра-
зина 7-10-4 г-ион/л. Вычислить его константу диссоциа-
ции.
29. При каком pH следует насыщать раствор серово-
дородом (Ch»s = 0,1 моль/л), чтобы концентрация иона
S2-составляла: 1) 2-10~16 г-ион/л; 2) 5-Ю-14 г-ион/л;
3) 4-10~12 г-ион/л; 4) 5-Ю-17 г-ион/л; 5) 3-10—9 г-ион/л?
30. Вычислить концентрацию иона S2- в насыщенном
растворе H2S (Ch2s =0,1 моль/л), содержащем: 1) 0,2 М
СН3СООН+0,1М CH3COONa; 2) 0,1 М НСООН+
+ 0,2 М HCOONa; 3) 0,5 М NaHCO3 + 0,2M Na2CO3;
4) 0,1М NH3+0,5M NH4C1; 5) 0,1 М NaHoPO4+
+0,1 М Na2HPO4.
31. Вычислить концентрацию ацетат-ионов и степень
диссоциации СН3СООН, если к 1 М. СН3СООН прибави-
ли НС1 до pH 0,8.
32. Вычислить концентрацию анионов и степень дис-
социации НСООН, если к 40 мл 0,2%-ного раствора
НСООН прибавили 30 мл 2%-ного раствора НС1.
33. Вычислить концентрацию ионов аммония и сте-
пень диссоциации NH3, если к 0,1 М. NH3 прибавили
NaOH до pH 12,5.
34. Вычислить степень диссоциации триэтаноламина,
если к 0,1 М раствору его прибавили NaOH до pH 11,5.
35. Вычислить степень диссоциации в растворе, полу-
ченном при смешении 70 мл 0,1%-ного раствора N2H4,
20 мл 0,1%-ного раствора его хлористоводородной соли
и 10 мл воды.
36. Как изменится pH и степень диссоциации
СН3СООН в 0,2 М растворе, если к 100 мл этого раство-
ра прибавили 30 мл 0,3 М CH3COONa?
12
37. Как изменится pH и степень диссоциации 1%-ного
раствора НСООН, если к 230 мл этого раствора приба-
вить 540 мл 0,5%-ного раствора НСООК?
38. Как изменится pH и степень диссоциации 2%-но-
го раствора СН2С1СООН, если к 80 мл этого раствора
прибавить 50 мл 3%-ного раствора CH2ClCOONa?
39. Определить степень диссоциации 10-5М метило-
вого оранжевого в растворе, содержащем: 1) 0,01 моль/л
НС1; 2) 0,1 моль/л СН3СООН%-0,1 моль/л CH3COONa.
Указать окраску каждого раствора.
40. Определить степень диссоциации 4-10-6М бром-
фенолового синего в растворе, содержащем: 1) 0,2 моль/л
НСООН+2 моль/л HCOONa; 2) 0,001 моль/л НС1О4.
Указать цвет каждого раствора.
41. Определить степень диссоциации 10~6М метило-
вого красного в растворе, содержащем: 1) 0,05 моль/л
НС1; 2) 0,001 моль/л HCN. Указать цвет каждого рас-
твора.
42. Определить степень диссоциации 5-10-6М фе-
нолфталеина в растворе, содержащем: 1) 0,01 моль/л
NaOH; 2) 0,1 моль/л NH3. Указать окраску каждого рас-
твора.
43. Определить степень диссоциации 10-6М тимолово-
го синего в растворе, содержащем: 1) 2 моль/л NH3+
+0,2 моль/л NH4C1; 2) 0,001 моль/л NaOH. Указать цвет
каждого раствора.
44. Рассчитать pH полученного раствора, если к
100 мл 0,0375 М СН3СООН прибавили 0,102 г
CH3COONa.
45. Вычислить концентрацию ионов Н+, ОН- и pH рас-
твора, полученного смешением 25 мл '0,2 М СН3СООН и
15 мл 0,1 MCH3COONa.
46. Вычислить pH полученного раствора, если в 1 л
воды содержится 60,05 г СН3СООН и 82,03 г CH3COONa.
47. Вычислить концентрацию ионов Н+, ОН- и pH
раствора, полученного смешением 15 мл 0,1 М НСООН и
12 мл 0,2 М HCOONa.
48. Вычислить pH раствора, если к 2 л воды приба-
вили 23 г НСООН и 21 г НСООК-
49. Вычислить pH раствора, полученного при сме-
шении:
13
1) 50 мл 0,1 М КН2РО4
2) 30 мл 0,1 М Na2CO3
3) 70 мл 0,2MKH2Cit*
4) 30 мл 0,2 М КН2РО4
5) 210 мл 0,1 М Na2CO3
6) 50 мл 0,15МКгНРО4
7) 30 мл 0,1 М КН2РО4
8) 40 мл 0,2 М КН2РО4
и 25 мл 0,2 М КгНРО4;
и 15 мл 0,lMNaHCO3
и 30 мл 0,1 М KaHCit;
и 10 мл 0,1 М НС1;
и 90 мл 0,1 МНС1;
и 45 мл 0,3 М НС1;
и 25 мл 0,2 М КОН;
и 10мл 0,2 М КОН.
50. В 100 мл воды растворили 0,34 г трилона Б
(Ыа2Н2ЭДТА-2Н2О) ** и добавили 10 мл 0,05 М HNO3.
Вычислить pH раствора.
51. В 100 мл воды растворили 0,34 г трилона Б и доба-
вили 10 мл 0,05 М. NaOH. Вычислить pH раствора.
52. Вычислить pH раствора, полученного смешением:
1) 20 мл 0,02 М трилона Б и 30 мл 0,01 М НС1; 2) 40 мл
0,02 М трилона Б и 10 мл 0,01 М NaOH.
53. Сколько миллилитров 0,2 М. NaOH надо прибавить
к 40 мл 0,1 М. H3Cit, чтобы получить .раствор с pH 3,0?
54. Сколько миллилитров 0,4%-ного раствора NaOH
надо прибавить к 23,0 мл 0,2 М. Н3РО4, чтобы получить
раствор с pH 2,3?
55. Сколько граммов NaOH надо растворить в 100 мл
0,1 М NaHCO3, чтобы получить раствор с pH 10,0?
56. Сколько граммов NaHCO3 надо растворить в 30 мл
1%-ного раствора NaOH, чтобы получить раствор с
pH 10,0?
57. Сколько миллилитров 0,2 М НС1 надо прибавить
к 50 мл 0,1 М Na2CO3, чтобы получить раствор с
pH 10,5?
58. Сколько граммов Na2CO3 надо растворить в 200 мл
0,1 М НС1, чтобы получить раствор с pH 10,5?
59. Сколько граммов Na3PO4 надо растворить в
250 мл 0,1 М НС1, чтобы получить раствор с pH 12,0?
60. Сколько миллилитров 0,1 М НС1 надо прибавить
к 40 мл 0,1 М К3РО4, чтобы получить раствор с pH 12,0?
61. Сколько миллилитров 0,2 М. НС1 надо добавить к
20 мл 0,2 М КН2РО4, чтобы получить раствор с pH 3,0?
62. Сколько граммов КН2РО4 надо растворить в
100 мл 0,1 М. НС1, чтобы получить раствор с pH 2,5?
63. Сколько граммов КН2РО4 надо растворить в 50 мл
0,2 М КгНРО4, чтобы получить раствор с pH 7,0?
* Cit3- — анион лимонной кислоты.
** ЭДТД4 — анион этилендиаминтетрауксусной кислоты.
14
64. Сколько граммов КОН надо растворить в 140 мл
0,2 М КН2РО4, чтобы получить раствор с pH 7,0?
65. Сколько миллилитров 0,2 М NaOH надо прибавить
к 40 мл 0,1 М NaH2PO4, чтобы получить раствор с
pH 7,0?
66. Сколько миллилитров 0,4 М НС1 надо добавить к
250 мл 0,2 М НагНРО4, чтобы получить раствор с
pH 6,0?
67. Сколько миллилитров 0,1 М КОН надо добавить к
100 мл 0,2 М КгНРО4, чтобы получить раствор с pH 11,5?
68. Сколько граммов К2НРО4 надо растворить в
100 мл 0,1 М КОН, чтобы получить раствор с pH 11,5?
69. Сколько граммов КгНРО4 надо растворить в 50 мл
0,05 М НС1, чтобы получить раствор с pH 7,0?
70. Сколько граммов КНгСИ надо растворить в
200 мл 0,2 М KaHCit, чтобы получить раствор с pH 4,0?
71. Сколько граммов K2HCit надо растворить в 100 мл
0,1 М KH2Cit, чтобы получить раствор с pH 4,0?
72. Сколько миллилитров 0,2 М НС1 надо прибавить
к 50 мл 0,1 М КНгСИ, чтобы получить раствор с pH 3,0?
73. Сколько граммов КОН надо растворить в 370 мл
0,02 М KH2Cit, чтобы получить раствор с pH 4,5?
74. Сколько миллилитров 0,1 М HNO3 надо добавить
к 30 мл 0,02 М №2Н2ЭДТА, чтобы получить раствор с
pH 2,0?
75. Сколько миллилитров 0,1 М NaOH надо добавить
к 30 мл 0,02 М №2Н2ЭДТА, чтобы получить раствор с
pH 10,0?
76. Сколько граммов На2Н2ЭДТА • 2Н2О надо раство-
рить в 70 мл 0,01 М HNO3, чтобы получить раствор с
pH 3,0?
77. Сколько граммов Na2H2 ЭДТА-2НгО надо раство-
рить в 40 мл 0,01 М NaOH, чтобы получить раствор с
pH 5,5?
78. Сколько граммов Na4P2O7 надо растворить в
300 мл 0,2 М НС1, чтобы получить раствор с pH 9,0?
79. Сколько миллилитров 0,1 М НС1 надо добавить к
раствору, 100 мл которого содержат 2,66 г Na4P2O7, что-
бы получить раствор с pH 9,0?
80. Сколько миллилитров 0,1 М NaOH надо добавить
к 20 мл 0,1 М Н4Р2О7, чтобы получить раствор с pH 2,0?
81. Сколько миллилитров 0,1 М. NaOH надо добавить
к 100 мл 0,1 М Н4Р2О7, чтобы получить раствор с pH 3,0?
15
Глава II
РАВНОВЕСИЯ В РАСТВОРАХ ГИДРОЛИЗУЮЩИХСЯ
СОЛЕИ
Вопросы для самопроверки
1. Написать уравнения реакций гидролиза следующих
ионов:
a) NH4+, СН3СОО~, СОз-; б) CN~, РОГ, Sn2+;
в) Sb3+, S2-, NOF; г) Bi3+, В4О?~ Ag+.
Указать, что является кислотой и основанием с точки
зрения протолитической теории.
2. Какую среду (кислую, нейтральную или щелочную)
имеют водные растворы солей: a) KNO3, Na2CO3,
(NH4)2SO4, NiCl2, Ba(NO3)2; б) CH3COONa, NaCl,
Pb(NO3)2, BiCl3, (NH4)2CO3; b) Na3PO4, A12(SO4)3,
Hg(NO3)2, CaCl2, NH4I?
3. Как влияют основные характеристики ионов (заряд,
радиус, строение электронной оболочки) на склонность к
гидролизу?
4. Что называется константой гидролиза? Зависит ли
ее величина от температуры, кислотности раствора, кон-
центрации постороннего электролита в растворе?
5. Вывести уравнение для расчета констант гидроли-
за: a) Na2S, СоС12; б) СН3СООК, (NH4)2CO3;
в) Bi(NO3)3, Na3PO4; г) AgNO3, Na3AsO4; д) ZnSO4,
Na2SiO3; e) CuCl2, Кг5О3; ж) MnCl2, NaNO2; 3) SbCl3,
NaF; и) Cr(CH3COO)3, KCN; к) SnSO4, Na3AsO3;
л) (NH4)2S, FeCl3; m) CdSO4, KCNO.
6. Вывести уравнение для расчета pH в растворе соли,
гидролизующейся: а) по катиону; б) по аниону; в) и по
катиону, и по аниону.
7. В растворе какой соли одинаковой концентрации
среда более щелочная: a) Na2CO3 или Na2SiO3; б) Na2S
или (NH4)2S; в) Na3PO4 или CH3COONa; г) (NH4)2CO3
или К2СО3?
8. В растворе какой соли одинаковой концентрации
среда более кислая: a) NH4C1 или NH4F; б) BiCl3 или
FeCl3; в) ZnSO4 или CuSO4; г) SnCl2 или SnCl4?
16
9. Что называется степенью гидролиза? Вывести урав-
нение, связывающее степень гидролиза с константой гид-
ролиза и с концентрацией гидролизующейся соли.
10. Вывести формулу для расчета степени гидролиза в
растворе: a) CH3COONa; б) CH3COONa + NaOH;
в) NH4C1; г) NH4CI + HCL
Решение типовых задач
Пример 1. Вычислить pH и степень гидролиза в 0,1 М РЬ(ПОз)2.
Решение. Соль Pb(NO3)2 в водном растворе практически на-
цело диссоциирована на ионы, т. е. Срь2+ = 0,1 гион/л. Катион РЬ2+
гидролизуется ступенчато:
(1 ступень) РЬ2+ 4- Н2О;±:РЬОН+ 4- Н+
0,1—х ~ х х
(II ступень) РЬОН+ 4- Н2О Pb (ОН)2 4- Н+
Запишем выражения ступенчатых констант гидролиза и вычис-
лим их численные значения:
Кгндр
[PbOH+] [Н+]
[РЬ2 + ]
[РЬОН+]
[РЬ2+] [ОН-]
.[Н+][ОН-] =
= ?рьон+/<«< = 7>94-106 1’0-10-ы==7,94-10-8,
= [РЬ(ОН)2ИН+] = [РЬ(ОН)2] _ =
11 [РЬОН+] [РЬОН+][ОН-]
= ХРЬ(ОН)Л® = 7-94’10311 ’°'10-14 = 7,94-Ю-п.
Величина константы гидролиза по второй ступени в 1000 раз
меньше, чем по первой ступени, поэтому гидролизом по второй сту-
пени можно пренебречь и вести расчет с учетом только первой сту-
пени. Подставим равновесные концентрации в выражение для /([и,₽:
ги,_ PbOH+ Н+
ЛТидр = --------14---- =---------=7,94-10-8
1 [РЬ2+] 0,1 -х
Видно, что Кр’Р <4 10—4 Следовательно, величина х мала и
0,1 —х ж 0,1. Тогда
х = [Н+] = /0,1-7,94-10-8 - . 8,9. 10 5 г-ион/л,
рН = —Ig 8,9-10-5 = 5 — 1g 8,9=4,05.
Степень гидролиза иона РЬ2+ вычисляем по уравнению
Лгндр = , ?.'?-10 5, = 8,9 10-4 или 8,9-10-2%,
17
8,9-10—4
то же самое значение йгидр получаем и по уравнению
/ ^™₽рЬОн +
"гидр - 1/
r cPb(NOa),
1,0-10—14-7,9-106
0,1
Покажем расчетом, что второй ступенью гидролиза РЬ2+ мож-
но пренебречь. Уравнение гидролиза по первой ступени показывает,
что равновесные концентрации ионов Н+ и РЬОН+ равны между со-
бой. Из выражения для второй константы гидролиза следует:
[РЬ (ОН)2] = А7(идр = 7,94' 10-и моль/л.
Такова же концентрация ионов водорода, связанная с гидроли-
зом по второй ступени. Следовательно, пренебрежение второй сту-
пенью гидролиза при расчете концентрации ионов Н+ заметно не
искажает результаты расчета.
Пример 2. Чему равен pH 0,1 М Na2HPO4?
Решение. Соль Na2HPO4 в водном растворе диссоциирована
практически полностью:
Na2HPO4->2Na+ + НРО^“
Ион НРО4^ гидролизуется по первой ступени:
нро*- + Н2О Н2РО^ + ОН- (1)
и далее по второй ступени:
Н2РО^ + Н2О Н3РО4 + о н- (2)
Запишем выражения констант гидролиза и найдем их численные
значения:
ГН2РОГ] [ОН-] К 1 О-Ю—14
^гидр = L 2 4В 1 = ---= 1U. = j ,б. 10—7
|НР°Г] К 6.2-10-»
4
„ = JH3PO4] [ОН_-]_ = = = 10_!2
[Н2РО4-] /<НаР04 7,6.10-3
/(™ДР в ~ 105 раз превышает А'™’11’, поэтому гидролизом по второй
ступени можно пренебречь.
Ион НРО4~, кроме того, диссоциирует:
НРО4~ Н+ + РО^ (3)
Для этого процесса
_[НН[РОГ]
“Р * [НРО;-]
Ионы водорода, появляющиеся в результате реакции (3),
[Н+] = [ро4_] , связываются ионами гидроксила, которые образу-
ются по реакции (l),i[OH_]= [H2PO;[“j. Поэтому равновесная
18
концентрация ионов водорода в растворе Na2HPOi определяется
разностью
[Н+] = [РОЗ-] - [Н2РО4~]
ИЛИ
(4)
[ОН ] = [н2РО4~] - [PQ3-]
Выразим концентрацию ионов Н2РО4 и РО4 через константы равно
весий (1) и (3):
[н2РО4-]=—
лн2ро4-
[HPQ2-]
[ОН-] ’
[нро;-]
[Н+]
следует, что
Из ионного произведения воды
поэтому соотношение (5) принимает вид
Гн РО-1 I"POi4 1Н+|
[н2РО4 ] =.-------------
Н2РО“
(5)
(6)
= [Н+],
[ОН-] L J
(7)
Подставляем в уравнение (4) концентрации РО4 и Н2РО4 из соот-
ношений (6) и (7):
|НП = К , [HP°S 1 IHP0M <Htl
1 J НРО2- ru+, — K
h2po-
[Н+]
После преобразований получаем
[Н+] =
(8)
9 К [HPO*-]
HP(>- 4 HiPO” L 4 -I
4 4_________
lHP0<1
где ><н po_, равная 6,2-IO-8, много меньше [HPO4'j, так как кон-
3 4
центрация ионов НРО4 практически равна начальной концентрации
соли Na2HPO4, т. е. 0,1 г-ион/л. Поэтому /< [НРО4~ 1 ®
Н arU . L J
4
|^НРО4 ] и уравнение (8) принимает вид
IH+1 =
[нр°м ___________________
[НРО*-] = 1/<А'н2ро-А'нро2-
19
я
pH=i/2;^_0_ + P/<HP0ty
По этой формуле рассчитываем pH в 0,1 М Na2HPO4:
pH = '/2 (7,21 + 12,38) = 9,80
Аналогично можно показать, что в растворе соли NaH2POi pH вы-
числяется по формуле
pH = 1/2 (р/<Нар04 + pKHjP0_j.
Расчет pH в растворе любой кислой соли состава М.НА производится
по формуле
рН = 1/2(рК1 + рК2),
состава М2НА — по формуле
pH = 1/2 (р/<2 + рКз) и т. д.
Задачи
82. В 0,5 л раствора содержится 4,1 г CHaCOONa.
Вычислить pH и степень гидролиза соли.
83. В 200 мл раствора содержится 0,65 г KCN. Опре-
делить pH и степень гидролиза соли.
84. К 30 мл воды прибавили 5 мл ЗМ KNO2. Вычис-
лить pH раствора и степень гидролиза соли.
85. В 500 мл раствора содержится 2,52 г Na2CO3. Оп-
ределить pH раствора и степень гидролиза соли.
86. Вычислить pH и степень гидролиза в 0,05 М
Na2CO3. Чему будет равен pH, если раствор разбавить
водой в 5 раз?
87. Вычислить pH и степень гидролиза соли в 0,05 М
Na2C2O4. Чему будет равен pH, если раствор разбавить
водой в 10 раз?
88. К 100 мл 0,2 М НСООН прибавили 100 мл 0,2 М
кон. Вычислить pH и степень гидролиза соли.
89. К 250 мл 0,4 М HCN прибавили 250 мл 0,4 М
NaOH. Вычислить pH и степень гидролиза соли.
90. Рассчитать pH раствора, полученного при слива-
нии разных объемов 0,1 М Н2С2О4 и 0,2М NaOH. Вычис-
лить степень гидролиза соли.
91. Сколько граммов CH3COONa нужно прибавить к
500 мл воды, чтобы получить раствор с pH 8,52?
92. Сколько граммов Na2S находится в 100 мл раство-
ра, если pH 12,94? Вычислить степень гидролиза соли.
93. Сколько граммов Na2C2O4 находится в 25 мл рас-
твора, если pH 8,28? Вычислить степень гидролиза соли.
20
94. Сколько граммов KCN находится в 10 мл раство-
ра, если pH 11,10?
95. Смешано 40 мл 0,3 М НСООК и 20 мл 0,15 М КОН.
Рассчитать pH и степень гидролиза соли.
96. Вычислить pH и степень гидролиза в 0,1 М Na2CO3,
содержащем 0,1 моль/л NaOH.
97. Вычислить pH раствора, если: 1) степень гидро-
лиза в 0,5 М CH3COONa будет равна 3%; 2) в 0,1 М
Na3VO4 25%; 3) в 0,05 М KNO2 5%; 4) в 0,2 М Na2CO3
5%; 5) в 0,1 М Na3PO4 3%; 6) в 0,1 М Na3AsO4 2%;
7) в 1 М KCN 10%; 8) в 0,1 М Na2S 10%.
98. Вычислить вторую константу диссоциации Н2СО3,
если.у 0,1 М Na2CO3 pH 11,65.
99. Вычислить константу диссоциации HNO2, если у
0,1 М NaNO2 pH 8,15.
100. Какой цвет имеют следующие растворы: 1) 0,1 М
Ыа2СО34-тимоловый синий; 2) 0,1 М. СН3СООЫа+фено-
ловый красный; 3) 0,2 М НСООК+бромтимоловый си-
ний; 4) 0,05 М Ыа3РО4-|-фенолфталеин?
101. Вычислить pH и степень гидролиза соли в 0,05 М.
NH4VO3. Чему будет равен pH, если раствор разбавить
водой в 10 раз?
102. В 250 мл раствора содержится 0,535 г NH4C1. Вы-
числить pH и степень гидролиза соли.
103. Вычислить pH и степень гидролиза соли в рас-
творе, полученном при сливании 250 мл 0,02 М NH2OH
и 250 мл 0,02 М НС1.
104. Вычислить pH раствора, полученного сливанием
500 мл 0,2 М этиламина и 500 мл 0,2 М НС1. Вычислить
степень гидролиза образовавшейся соли.
105. Вычислить pH растворов и степень гидролиза
соли в: 1) 0,01 М ZnCl2; 2) 0,01 М СоС12; 3) 0,01 М МпС12;
4) 0,1 М Cu(NO3)2; 5) 0,05М Fe(NO3)3; 6) 0,02М
Hg(NO3)2; 7) 0,03 М Th(NO3)4; 8) 0,01 М T1(NO3)3;
9) 0,05М Cd(NO3)2; 10) 0,02М A1(NO3)3; 11) 0,02М
Ce(NO3)4; 12) 0,01 М FeCl2; 13) 0,02 М SnCl2.
106. Сколько граммов NH4C1 содержится в 1 л рас-
твора, если pH его 5,8?
107. При какой концентрации (моль/л) NH4NO3 рас-
твор имеет pH 5,6?
108. В 1 л раствора содержится 0,1 моля NH4C1 и
10~4 моля НС1. Определить степень гидролиза соли.
109. Вычислить pH раствора, если: 1) степень гидро-
лиза в 0,2 М Co(NO3)2 будет равна 1-Ю-4 %; 2) в 0,02 М
21
Cd(NO3)2 1%; 3) в 0,05 M FeCl3 1%; 4) в 0,2М Cu(NO3)2
0,1%; 5) в 0,01 М Zn(NO3)2 1-1Q-3 %; 6) в 0,02М
Mn(NO3)2 1%; 7) в 0,1 М NH4NO3 2%?
110. Какой цвет имеют следующие растворы: 1) 0,1 М
Hg(NO3)2+метиловый оранжевый; 2) 0,1 М Pb(NO3)2+
+бромкрезоловый пурпуровый; 3) 0,1 М ЫН4С14-:метило-
вый красный.
111. Вычислить pH и степень гидролиза в: 1) 0,1 М
(NH4)2SeO3; 2) 0,01 М (NH4)2S; 3) 0,02 М CH3COONH4;
4) 0,03 М (NH4)3PO4; 5) 0,05 М (NH4)4P2O7; 6) 0,02 М
(NH4)3VO4; 7) 0,03 М (NH4)3AsO4; 8) 0,02 М NH4CN;
9) 0,05 М NH4C1O; 10) 0,1 М NH4F; 11) 0,02 М NH4CNO;
12) 0,05М (NH4)3NTA*.
112. Вычислить константу диссоциации HCN, если
0,2 М NH4CN имеет pH 9,23.
113. Вычислить константу диссоциации НСООН, если
0,1 М HCOONH4 имеет pH 6,50.
114. Какой цвет имеют следующие растворы: 1) 0,01 М
ННД'-рбромтимоловый синий; 2) 0,2 М. CH3COONH4-}-
+ тимоловый синий; 3) 0IM NH4F+метиловый красный?
115. Вычислить pH: 1) 0,2 М. Na2HPO4; 2) 0,5 М.
КНС2О4; 3) 0,1М NaHCO3; 4) 0,3 М NaHSeO3; 5) 0,05 М
NaH2AsO4; 6) 0,1 М NaH2PO4; 7) 0,03 М NaHS; 8) 0,3 М
Na2HAsO4; 9) 0,2 М NaH2PO3; 10) 0,1 М Na2H2P2O7;
И) 0,2 М KHSO3; 12) 0,2 М Ыа2Н2ЭДТА; 13) 0,3 М
Na3HP2O7; 14) 0,1 М Na2HNTA; 15) 0,5М NaH3P2O7;
16) 0,1 М NaHSal**.
116. Вычислить pH раствора, полученного при смеше-
нии: 1) 50 мл 0,1 М КН2РО4 с 50 мл 0,1 М КОН; 2) 25 мл
0,1 М К:гНРО4 с 25 мл 0,1 М НС1; 3) 20 мл 0,15М
NaH3P2O7 с 40 мл 0,15М NaOH; 4) 20 мл 0,15М
NaH3P^O7 с 20 мл 0,15М NaOH; 5) 15 мл0,1М
Иа2Н2ЭДТА с 15 мл 0,1 М НС1; 6) 15 мл 0,1 М
№2Н2ЭДТА с 15 мл 0,1 М NaOH; 7) 40 мл 0,2 М Кз-Cit с
30 мл 0,2 М НС1; 8) 40 мл 0,2 М K3Cit с 40 мл 0,2 М НС1;
9) 10 мл 0,01 М фумаровой кислоты с 1,0 мл 0,1 М NaOH;
10) 35 мл 0,4 М КгН2Р2О7 с 35 мл 0,4 М НС1; 11) 35 мл
0,4 М К2Н2Р2О7 с 35 мл 0,4 М КОН; 12) 25 мл 0,01 М
яблочной кислоты с 2,5 мл 0,1 М NaOH; 13) 30 мл 0,02М
сульфосалициловой кислоты с 3 мл 0,2 М NaOH;
14) 15 мл 0,02 М малеиновой кислоты с 3 мл 0,1 М NaOH;
15) 20 мл 0,015 М глутаминовой кислоты с 3 мл 0,1 М
* NTA3- — анион нитрилотриуксусной кислоты.
** Sal2- — аннон салициловой кислоты. . .
22
NaOH; 16) 25 мл 0,02 M аскорбиновой кислоты с 5 мл
0,1 М NaOH; 17) 20 мл 0,04 М винной кислоты с 3 мл
0,2 М NaOH.
117. Какой цвет имеют следующие растворы: 1) 0,1 М
НаН2АзО4-рбромфеноловый синий; 2) 0,3 М NaHCO3+
+бромтимоловый синий; 3) 0,2 М №Н2РО4+метиловый
оранжевый; 4) 0,2 М НаНС2О4+бромфеноловый синий?
Глава III
РАВНОВЕСИЯ В РАСТВОРАХ МАЛОРАСТВОРИМЫХ
СОЕДИНЕНИЙ
Вопросы для самопроверки
1. Как влияют температура, pH, добавление одноимен-
ных ионов и посторонних электролитов на растворимость
малорастворимых соединений?
2. Одинакова ли растворимость MgF2 и ВаСО3, если
известно, что их произведения растворимости близки
между собой?
3. Какой осадок будет выпадать первым при постепен-
ном прибавлении раствора AgNO3 к раствору, содержа-
щему хлорид- и бромид-ионы одинаковой концентрации?
4. В какой последовательности будут выпадать осад-
ки сульфатов, если к раствору, содержащему одинаковые
количества ионов Ва2+, Са2+ и Sr2+, постепенно добав-
лять H2SO4?
5. Растворимость каких соединений — BaSO4, СаСОз,
AgCl, ZnS, (MgOH)2CO3 — не зависит от кислотности
раствора? Почему?
6. В каком растворителе растворимость Mg(OH)2
максимальная и в каком минимальная в: а) воде; б) рас-
творе аммиака; в) растворе аммонийной соли; г) раство-
ре минеральной кислоты?
7. В каком растворе будет более полное осаждение
бария бихроматом в: а) 2М СН3СООН; б) 2М НС1;
в) 0,2 М CH3COONa?
8. В каком растворе растворимость гидроокиси магния
больше: с pH 7 или pH 10?
9. Какой из сульфатов — PbSO4, BaSO4 или SrSO4 —
полнее превращается в карбонат при нагревании с рас-
твором соды одной и той же концентрации?
23
10. Вывести формулы для расчета: а) концентрации
аниона в растворе слабой одноосновной кислоты при из-
вестном pH; б) концентрации анионов в растворе слабой
двухосновной кислоты; в) pH раствора, насыщенного
сероводородом при атмосферном давлении.
11. Какой из сульфидов — ZnS или MnS — осаждает-
ся сероводородом при более низком pH?
12. Почему катионы третьей аналитической группы
осаждают групповым реагентом в присутствии аммоний-
ной буферной смеси?
13. Какой из реактивов обеспечит наибольшую полно-
ту осаждения катионов третьей аналитической группы:
a) Na2S (pH 13,9); б) (NH4)2S (pH 9,3); в) смесь
(NH4)2S+NH4OH+NH4C1 (pH 9,0); г) NH4HS (pH 8,1);
д) насыщенный раствор H2S (pH 4,5); е) 0,3 н. НС1+
+ H2S (pH 0,5)?
14. Назвать продукты, образующиеся при растворении
сульфидов металлов в соляной и азотной кислотах и в
царской водке.
15. При каком pH (2,0; 8,0; 7,0; 9,0) растворимость
CoS наибольшая. При каком наименьшая?
16. Почему СаСО3 легко растворяется, а СаС2О4 не
растворяется в разбавленной уксусной кислоте, хотя оба
соединения имеют близкие ПР?
17. Вывести формулу для расчета константы равнове-
сия в реакциях взаимодействия: a) ZnS с НС1; б) Bi2S3
с НС1; в) СаС2О4 с НС1; г) ВаСО3 с СН3СООН; д) SrCO3
с НС1.
Решение типовых задач
Пример 1. Вычислить (без учета гидролиза) ПР фосфата сереб-
ра, если растворимость этой соли в воде при комнатной температуре,
равна 4,68 10~в моль/л. -Вычислить pH насыщенного раствора Ag-PO/,.
Чему равно nPAgjPOi с учетом гидролиза?
Решение. В насыщенном растворе AgaPOi существует равно-
весие
Ag3PO4(K)^3Ag+ +РО43-
3-4,68-10-6 4,68-10—6
Если растворимость солн 4,68-10-6 моль/л, то в соответствии с
записанным равновесием и без учета гидролиза
[РО^—] =4,68-10—6 г-ион/л,
[Ag+] = 3 [РО^] = 3-4,68-10-6 г-ион/л.
По этим данным вычисляем nPAgsPO4:
nPAg>p01 = [Ag+F [РО|-] = (3-4,68-10-6)3 (4,68 10-6) = 1,3-10-20
24
Образующийся при растворении ион РОд подвергается гидролизу:
РО^~ + Н2О^НРО^- + он
х 4,68-10-6—х 4,68* 10-6 — х
Запишем выражение константы гидролиза:
_[НРО?-][ОН-] [HPOt][OH-l [Н+] _
г"7" [Р0^-| [POV] [Н+]
. Гидролиз иона РО/[ по первой ступени при концентрации
4,68'10 с г-ион/л протекает практически полностью, поэтому за наи-
меньшую равновесную концентрацию х берем равновесную концен-
трацию ионов РО^—>т. е.
[РО^]=х и [НРО*-] = [ОН-] = 4,68 10 -6-х г-ион/л.
Подставим равновесные концентрации в выражение Кгидр: .
(4,68-10-6 —х)2
Л1ги1р = 2,38-10-2 = -4--------------— .
Допустим, 4,68-10 с — х«4,68- 10”в. Тогда
2,38-10-2-х = (4,68-10-6)2; х= 9,20-10-ю г-ион/л.
Следовательно,
[ОН-] =4,68- 10- 6-х = 4,68 10-6-9,20- 10-ю = 4,68-10-6 г-ион/л,
pH = 14 + 1g 4,68-10-6 = 8,67.
Гидролизом по катиону можно пренебречь, так как константа
гидролиза Ag+ очень мала (AAg+= 2-10—12). При [Ag+] =
= 3 • 4,68 • 10(,= 1,40 • 10-5 г-ион/л и [ОН ] = 4,68 • 10~6 г-ион/л кон-
центрация AgOH составляет
[AgOH] = fiAg0H [Ag+] [ОН-] = 2-102. 1,4-10 5-4,68-10-6 =
= 1,31-10~8 моль/л,
т. е. всего 0,1% от начальной концентрации ионов Ag+. Следователь-
но, поправка к pH, учитывающая гидролиз по катиону в насыщен-
ном растворе Ag3POj, несущественна. nPAgjPOi, вычисленное с уче-
том гидролиза, составит
nPAgaPOj = [Ag+]3 [РО®-] = (3-4,68-10-6)3(9,20-10-Ю) =
= 2,55-10—2<
Это значение nPAgaPOi значительно отличается от величины, найден-
ной без учета гидролиза.
Пример 2. К раствору, содержащему 0,1 моль/л Pb(NOj)2
и 0,01 моль/л Hg2 (МОз)2, постепенно добавляют раствор КС1. Какой
25
из катионов — РЬ2+ или Hg2+—начнет осаждаться первым и какой
процент его останется в растворе к началу осаждения второго?
Решение. Найдем, при каких концентрациях хлорид-ионов бу-
дут достигнуты величины nPpbclj и nPHg!Clj, пренебрегая изменением
концентраций Pb (NO3)2 и Hg2(NO3)2 при введении КС1 за счет разбав-
ления, т. е. принимая, что [РЬ2+]=0,1 г-ион/л, а [н?2+] =
= 0,01 г-ион/л:
ПРРЬС1, = [РЬ2+][С1-]2 = 1,6.10-5 и ПРНЙ1С11 =
= [Hg2+] [С1-]2= 1,3-10-18,
отсюда
ПРРЬС|.
[РЬ2+]
0,1
1,6-10-5
= 1,26-10—2 г-ион/л,
1,3-10-18
—— = 1,14- IO-8 г-ион/л.
Расчет показывает, что для достижения ПРнг5С1,требуется мень-
шая концентрация хлорид-ионов, следовательно, хлорид ртути (I)
будет осаждаться первым. Осаждение РЬС12 начнется при [С1_]=
= 1,26-10~г г-ион/л.
Концентрация ионов Hg2+ при этой концентрации хлорид-ионов
равна
г 2+1 nPHg2ci. 1,3-10-18
|Hg,| =------------=---------------= 8,2-10—15 г-ион/л.
I S2 J [Cl—]2 (1,26-10-2)2
8,2-10-15-100
Это составляет-------7-7^------= 8,2-10~110/о от исходной кон-
0,01
центрации Hg2(NO3)2-
Пример 3. Сколько миллиграммов BaSO4 можно превратить в
ВаСОз при обработке его 3 мл 2 М Na2COs?
Решение. Запишем уравнение реакции карбонизации
BaSO4 (к) + СО|_ ВаСО3 (к) + SO2-
2 — х х
и найдем константу равновесия этой реакции:
_ [SO4~] _ [S04~] [Ва2+] _ nPBaSO4 _ 1,1 IQ-Ю _
К== [СО2“] = [СО32-] ' [Ва2+] = ПРваСОа = 5,1-10-9“
= 2,16-10-2.
Подставим равновесные концентрации в выражение К:
------= 2,16-10-2,
2— х
отсюда
х = [SO4 ] = 4,23-10 2 г-ион/л.
26
Концентрация иона SO2 равна количеству сульфата бария, превра-
тившегося в карбонат бария под действием 1 л 2М Na2CO3. При
обработке BaSCh 3 мл того же раствора Па2СОз будет превращено
в ВаСОз:
4,23-10-2.233,40-3
= 0,0296 г = 29,6 мг BaSO4,
1000
где 233,40 — молекулярный вес BaSOs.
Пример 4. Рассчитать, при каком минимальном pH возможно
количественное разделение ионов Мп2+ и Си2+ в виде сульфидов
при насыщении раствора сероводородом (CHjS=0,l моль/л), если
концентрации их соответственно равны: 0^2+= 0,03 г-ион/л и
С°ц2+ =0,05 г-ион/л.
Решение. При насыщении сероводородом раствора, содержа-
щего ионы Мп2+ и Си2+, возможны реакции образования сульфидов:
Мп2+ 4- H2S iMnS + 2Н+
0,03 0,1 х
Cu2+ + H2S^CuS + 2Н+
Вычислим константы равновесия реакций (1) и (2):
[Н+]2 _ [Н+]2 [S2~] _ К1,2
[Mn2+] [H2S] - [Mn2+] [H2S] ' [S2-] npMnS
1,3-10-20
= —-----------------=5,20-10-11.
2,5-Ю-Ю
То же для реакции (2):
[Н+]2 Kl 2 1,310-20
=-----*-------= —=----------------= 2,06-1015.
2 [Cu2+] [H2S] ПРСи5 6,3-10-36
Численные значения Kt и К2 показывают, что более вероятно
осаждение сульфида меди.
Вычислим, при каком минимальном pH не будет осаждения суль-
фида марганца. Обозначим равновесную концентрацию
через х, тогда [Н+] = х г-ион/л, [Мп2+] = 0,03 г-ион/л
= 0,1 моль/л.
Подставим равновесные концентрации выражения в
К1 = 5,20-10-п = Х , отсюда
U,ио’и,I
Ki =
(1)
(2)
ионов H+
и [H2S] =
X = [н+] = /0,03-0,1-5,20-10-11 =3,95-10-7 г-ион/л
и рН = —1g 3,95.10~7 = 7—0,60 = 6,40.
Вычислим равновесную концентрацию ионов меди при этом pH,
используя А'2:
Н+ 2 3,95-10-7)2 п с ,_с
К2 =--------------= —------------ = 2,06-1015,
2 [Cu2+][H2S] [Cu2+]-0,1
27
отсюда
(3,95-10—7)2
[Cu2+] =-------------— = 7,57-10—28 г-ион/л.
J 0,1-2,06-1015 '
Концентрация меди в растворе значительно меньше 10-в г-ион/л,
характеризующей количественное осаждение данного иона.
Таким образом, при pH 6,40 и ниже сульфид марганца не обра-
зуется, а ионы меди количественно осаждаются в виде CuS. Это
можно показать также сравнением произведения концентрации ионов
[Cu2+] [S2-] с величиной FlPcus. При pH 6,40 в соответствии с урав-
нением
К1,2СН о 1,3-10-20.0,1
= [н+]2 = (3,95 10—7)2 = 8,33-10-9 г-ион/л.
Тогда
[Cu2+][S2-] = 0,05-8,33-10-9 = 4,17- 10-Ю,
что значительно превышает величину ПРсик=6,3 • 10'3e, следова-
тельно, осадок CuS образуется.
Если концентрация ионов водорода близка величине Ki или
меньше, то концентрация сульфид-ионов вычисляется по уравнению
1 J [H+J2 + Kj [H+] + К1,2
Задачи
118. Вычислить произведение растворимости: 1) хро-
мата серебра, если в 500 мл воды растворяется 0,011 г
Ag2CrO4; 2) бромата серебра, если в 200 мл воды раство-
ряется 0,35 г AgBrO3; 3) пирофосфата бария, если в
100 мл воды растворяется 8,78-10-3 г Ва2Р2О?; 4) PbCIF,
если в 250 мл воды растворяется 3,52- 10-4 моля этой со-
ли; 5) селенита цинка, если в 200 мл воды растворяется
1,95-10—2 г ZnSeO3; 6) фторида кальция, если раствори-
мость CaF2 2,16- 10"4 моль/л; 7) роданида меди (I), если
в 500 мл воды растворяется 4,21 • 10-6 г CuSCN; 8) циа-
нида никеля, если растворимость его 2,17-Ю-6 г/л.
119. Вычислить растворимость (г/100 мл) по данным
ПР: 1) Hg2Cl2; 2) AgVO3; 3) AgSCN; 4) BaSeO4;
5) Ba3(AsO4)2; 6) Ag3Fe(CN)fl; 7) CoHg(SCN)4; 8) CsBF4;
9) КзСо(ЫО2)6; 10) Cd2Fe(CN)6; 11) UO2NH4PO4;
12) KaSiF6; 13) NaSb(OH)6; 14) Rb2SiF6; 15) Tl2PtCl6.
. 120. Какая соль из двух сравниваемых более раство-
рима в воде и во сколько раз: 1) SrCO3 или ВаСОз;
2) Ba2Fe(CN)6 или Co2Fe(CN)6; 3) Са3(РО4)2 или BiPO4;
4) Hg2Br2 или РЬВг2; 5) ВаСгО4 или SrCrO4; 6) Zn(CN)2
или Cd(CN)2; 7) Са(Ю3)2 или РЬ(1О3)2’, 8) СиС2О4 или
28
FeC2O4; 9) BaSO4 или CaSO4; 10) Ni2Fe(CN)6 или
Ni (1О3)2?
121. Вычислить растворимость (моль/л): 1) AgCl в
воде; 2) AgCl в 0,01 М КС1; 3) СаС2О4 в воде; 4) СаС2О4
в 0,01 М (NH4)2C2O4; 5) SrSO4 в воде; 6) SrSO4 в 0,1 М
KaSO4; 7) Hg2Cl2 в воде; 8) Hg2Cl2 в 0,1 М КС1; 9) AgIO3
в воде; 10) AgIO3 в 0,1 М AgNO3; И) AgIO3 в 0,2 М
КЮ3.^
(^122хК 150 мл насыщенного раствора AgCl прибавле- /
но ТО мл 3%-ного раствора NaCl. Сколько грамм-ионов
серебра останется в растворе?
' 123^К 125 мл насыщенного раствора PbSO4 прибав- /
лево 5 мл 0,5% раствора H2SO4. Сколько грамм-ионов X
свинца останется в растворе?
(124^К 20 мл 0,08 М Na^AsO4 прилили 30 мл 0,12 М
AgNC% Сколько миллиграммов мышьяка останется в
растворе?
(j25yC кольцо миллилитров 0,1 М (NH4)2C2O4 следует
добавить в 1 л насыщенного водного раствора СаС2О4 ('
для понижения его растворимости до 0,1 мг/л?
\М2& Какова концентрация ионов магния в растворе J'
MlWh, если pH 11,0?
Д27^)К 50 мл 0,02 М СаС12 прибавили 50 мл 0,03 М
КгЗ^Сколько CaSO4 (г/л) останется в растворе?
щ28.ТВыпадет ли осадок Mg(OH)2 при действии на
0,2 М MgSO4 равным объемом: 1) 0,2 М NH3; 2) смеси
0,2M_NH3h2MNH4C1?
\29^Смешали равные объемы 0,2 М. MgSO4 и 0,2 М.
NH%r этой смеси добавили NH4C1 до концентрации
0,2 М. Произойдет ли в этом растворе осаждение
MgJQH)2?
Насыщенный раствор CaSO4 смешали с равным
объемом раствора, содержащего 0,0248 г (NH4)2C2O4 в
1 л. Произойдет ли образование осадка СаС2О4?
Vf31J К раствору, содержащему 50 г MgCl2, прилили
50 мл 6 М NH3. Сколько граммов NH4C1 необходимо до-
бавить к смеси, чтобы после разбавления ее водой до 1 л
осадак Mg(OH)2 не выпал? ‘
> При какой концентрации ионов магния начнется
выпадение осадка Mg(OH)2 из раствора, имеющего
pH 8,7.
ЗЗщПри какой концентрации ионов хромата начнется
выпЗДение осадка РЬСгО4 из 0,1 М Pb(NO?l2?
29
134. При каком pH начнется выпадение осадка
Со(ОН)2 из 0,1 М СоС12?
135. Будет ли осаждаться SrSO4 при добавлении 5 мл
насыщенного раствора CaSO4 к 20 мл раствора, содер-
жащего 0,5 мг-ион стронция?
136. В 200 мл раствора содержится по 0,02 г-экв хло-
рида и оксалата натрия. К раствору добавляют AgNO3.
Какова будет концентрация хлорид-иона, когда начнет-
ся осаждение Ag2C2O4?
137. Какое вещество начнет осаждаться первым при
постепенном приливании AgNO3 к раствору, в 1 л кото-
рого содержится 0,01 моля КС1 и 0,1 моля КгСгО4?
(138^В 100 мл раствора содержится по 0,01 г-экв ионов
Ва^и Sr2+. Сколько молей К2СгО4 следует ввести в рас-
твор, чтобы осадить барий, но избежать осаждения
стронция? Вычислить концентрацию бария, оставшегося в
растворе.
139. В 100 мл раствора содержится 200 мг-ионов Ва2+
и 1 мг-ион РЬ2+. Какое вещество будет осаждаться пер-
вым при постепенном приливании КгСгО4. Можно ли
количественно разделить указанные катионы в этом рас-
творе с помощью хромата калия?
140. Раствор содержит 0,02 г-ион/л Вго и 0,003 г-ион/л
I- Можно ли разделить эти ионы при помощи осаждения
солью свинца?
141. В 20 мл раствора содержится 20 мг КгСгО4 и
15 мг K2SO4. К раствору прибавляют малыми порциями
Pb(NO3)2. Какая соль будет осаждаться первой?
142. К раствору, в 1 л которого содержится по
0,01 г-ион/л Ва2+ и Са2+, постепенно прибавляют K2SO4.
1. Сколько грамм-ионов SO^- нужно прибавить
к 1 л раствора, чтобы начал выпадать осадок CaSO4?
2. Вычислить концентрацию кальция в растворе после
того, как 99,9% бария перейдет в осадок.
143. Какую концентрацию ионов Ю~ надо создать в
0,003М КгСгО4, чтобы при добавлении Pb(NO3)2 осадок
РЬ(Ю3)2 образовался прежде, чем РЬСгО4?
144. Избыток BaSO4 обработали 3MNa2CO3. Вычис-
лить концентрацию сульфат-иона в равновесном рас-
творе.
145. Сколько миллиграммов BaSO4 превратится в
ВаСО3 при взаимодействии его с 5 мл 1,5 М КгСО3?
30
146. Сколько миллиграммов SrSO4 превратится в
SrCO3 при взаимодействии его с 3 мл 2 М Na2CO3?
147. Сколько миллиграммов PbSO4 превратится в
РЬСО3 при взаимодействии его с 2 мл 2 М Na2CO3?
148. Вычислить концентрацию хромат- и карбокат-
ионов в равновесном растворе, полученном при обработ-
ке хромата свинца 1,5 М Na2CO3.
149. Вычислить концентрацию фторид- и карбокат-
ионов в равновесном растворе, полученном при обработке
фторида кальция 1,5 М Na2CO3.
150. Сколько миллиграммов CaF2 превратится в
СаСО3 при обработке его 3 мл 2,5 М Na2CO3?
151. Сколько миллиграммов AgBr превратится в
AgaCO3 при обработке AgBr 2 мл 1,5 М Na2CO3?
152. Сколько миллиграммов хромат-ионов перейдет в
раствор при обработке Ag2CrO4 2 мл 1,5 М Na2CO3?
153. Сколько миллиграммов бромид-ионов может
перейти в раствор при обработке AgBr 5 мл 2 М Na2CO3?
154*. Какой максимальный pH нужно поддерживать в
0,1 М Zn(NO3)2, чтобы предотвратить осаждение ZnS
при насыщении раствора сероводородом?
155*. При каком pH можно количественно осадить:
1) Zn24- в виде ZnS; 2) Cd2+ в виде CdS; 3) Ni2+ в виде
NiS, насыщая раствор сероводородом.
156*. При каком минимальном pH начнет выпадать
осадок: 1) FeS из 0,1 М FeSO4; 2) CoS из 0,05 М СоС12;
3) MnS из 0,1 М МпС12 при насыщении раствора серо-
водородом.
157*. Произойдет ли осаждение PbS при насыщении
сероводородом раствора, содержащего 2-Ю-3 моль/л
Pb(NO3)2, с pH 1,0?
158*. Выпадет ли осадок NiS, если раствор, содержа-
щий 0,2 моль/л НСООН и 0,05 моль/л NiCl2, насыщать
сероводородом?
. 159*. Выпадет ли осадок ZnS, если раствор, содержа-
щий 0,02 моль/л ZnCl2 и 0,2 моль/л СН3СООН, насыщать
сероводородом?
160*. Выпадет ли осадок MnS, если раствор, содержа-
щий 0,5 моль/л НС1 и 0,005 моль/л МпС12, насыщать се-
роводородом?
161*. Выпадет ли осадок FeS, если раствор, содержа-
щий 0,2 моль/л НСООН и 2-10~3 моль/л FeSO4, насыщать
сероводородом?
* В задачах 154—171, обозначенных звездочкой, концентрация
H2S в насыщенном растворе составляет 0,1 моль/л.
31
162*. Выпадет ли осадок PbS, если раствор, содержа-
щий 1 моль/л СНзСООН и 0,02 моль/л РЬ(МОз)2, насы-
щать сероводородом?
163*. Выпадет ли осадок MnS, если раствор, содержа-
щий 0,5 моль/л СНзСООН и 0,05 моль/л МпС12, насыщать
сероводородом?
164*. Выпадет ли осадок MnS, если раствор, содер-
жащий 0,02 моль/л МпС12 и 0,2 моль/л NH4C1, насыщать
сероводородом?
165*. Выпадет ли осадок CoS, если раствор, содержа-
щий 0,03 моль/л C0CI2, 0,1 моль/л СНзСООН и 0,2 моль/л
СНзСООЫа, насыщать сероводородом?
166*. Выпадет ли осадок NiS, если раствор, содержа-
щий 0,01 моль/л NiCl2, 0,2 моль/л СНзСООН и 0,1 моль/л
CH3COONa, насыщать сероводородом?
167*. Сколько миллиграммов NiCl2 должно содер-
жаться в 5 мл раствора с pH 3,5, чтобы при насыщении
его сероводородом образовался NiS?
168*. Сколько миллиграммов МпС12 должно содер-
жаться в 20 мл раствора с pH 6,0, чтобы при насыщении
его сероводородом образовался MnS?
169*. Сколько миллиграммов Cd(NO3)2 должно содер-
жаться в 10 мл раствора с pH 1,5, чтобы при насыще-
нии его сероводородом образовался CdS?
170*. Сколько миллиграммов Zn(NO3)2 должно содер-
жаться в 200 мл раствора с pH 3,5, чтобы при насыще-
нии его сероводородом образовался ZnS?
171*. Сколько миллиграммов Pb(NO3)2 должно содер-
жаться в 100 мл раствора с pH 0,5, чтобы при насыщении
его сероводородом образовался PbS?
172. Вычислить растворимость: 1) ZnS в 1 М
СНзСООН; 2) ZnS в растворе, содержащем по
0,5 моль/л СНзСООН и CH3COONa; 3) NiS в 2М НО;
4) Bi2S3 в растворе с pH 0,5; 5) NiS в 2М СН3СООН;
6) CoS в растворе с pH 1,5; 7) ВаСгО4 в 2 М СНзСООН;
8) SrCrO4 в 2М СНзСООН; 9) Ag2C2O4 в 2М
СНзСООН; 10) Ag2C2O4 в 1 М HNO3.
173. Вычислить растворимость РЬС2О4 в растворе с
pH: 1) 2,1,2) 3,2.
174. Сколько молей CH3COONa нужно прибавить к
1 л 1 М СНзСООН, чтобы обеспечить условия для от-
32
крытия иона Ва2+ в присутствии Sr2+ посредствомСгО2-
[Ba2+] = [Sr2+] = 0,2 г-ион/л.
175. При каком минимальном pH можно количест-
венно разделить смеси катионов при насыщении рас-
твора сероводородом (^<.3=0,1 моль/л) и какова кон-
центрация осаждаемого иона при этом pH: 1) 0,01 М
NiCl2 и 0.02М CdCl2; 2) 0,01 М СоС12 и 0,05М BiCl3;
3) 0,02 М ZnCl2 и 0,05 М СиС12; 4) 0,05 М МпС12 и 0,03 М
СиС12; 5) 0,001 М CdCl2 и 0,02 М СиС12; 6) 0,02 М ZnCl2 и
0,03 М CdCl2; 7) 0,04 М NiCl2 и 0,02 М СиС12; 8) 0,01 М
СоС12 и 0,03 М СиС12; 9) 0,03 М МпС12 и 0,02 М CdCl2;
10) 0,05 М FeCl2 и 0,01 М CdCI2?
176. Вычислить pH насыщенного раствора:
1) Mg(OH)2; 2) Zn(OH)2; 3) Со(ОН)2; 4) Cu(OH)2;
5) Cd(OH)2; 6) Pb(OH)2; 7) T1(OH)3; 8) Pu(OH)3;
9) Mo(OH)4; 10) Mn(OH)2; 11) Ni(OH)2; 12) Mn(OH)3.
177. Вычислить ПР с учетом гидролиза и pH насы-
щенного раствора: 1) AgCN*; 2) Ва3(РО4)2;
3) Cd3(AsO4)2; 4) СоС20* ; 5) СиСО* ; 6) NiSeO3;
7) РЬ3(РО4)7 ; 8) Т12СгО*; 9) SrSO3; 10) Ag2HVO4’;
11) ZnC2O*; 12) Ba3(AsO4)* ,
178. При каком pH начнет выпадать осадок***:
1)А1(ОН)3 из 0,1 М А1С13; 2) Fe(OH)3 из 0,2 М FeCh.
179. Образуется ли осадок***: 1) А1(ОН)3, если в
0,02 М А1С13 создать pH 3,2; 3) Fe(OH)3, если в 0,05 М
FeCl3 создать pH 2,5?
Глава IV
РАВНОВЕСИЯ В РАСТВОРАХ КООРДИНАЦИОННЫХ
(КОМПЛЕКСНЫХ) СОЕДИНЕНИИ
Вопросы для самопроверки
1. Назвать типы координационных соединений, наибо-
лее часто применяемых в качественном анализе.
2. Привести примеры применения комплексных соеди-
нений в анализе для: а) открытия ионов; б) маскировки
мешающего иона; в) растворения осадков; г) изменения
* При решении учесть равновесие Н2О Н++ОН”.
** Решить с учетом гидролиза по аниону (I ступень) и катио-
ну (I ступень).
*** Решить: 1) с учетом и 2) без учета образования гидроксо-
комплексов по первой ступени.
2 — 4022 33
окислительно-восстановительных свойств; д) изменения
кислотно-основных свойств.
3. Написать уравнения диссоциации следующих солей
в водном растворе: а) [Си (NH3)4]C12; б) K2[HgI4];
в) [Ni£NH3)4S04; г) K3[Fe(CN)e]; Д) К[ВП4];
е) KstCdlCN)*?'
4. Что называется константой устойчивости координа-
ционного соединения? Зависит ли она от ^темпер-атуры,
концентрации самого комплексного соединения и концен-
трации постороннего электролита?
5. В каком растворе концентрация ионов никеля наи-
меньшая и в каком-—наибольшая: а) 0,1 М NiSO4;
б) 0,1 М Ni (NH3)fiSO4; в) 0,1 М Ni (NH3)6SO4 —при со-
держании 1 моль/л NH3?
6. Вывести формулы для расчета констант равновесия
реакций растворения осадков в растворах: a) AgCl в
NH3; б) AgBr в Na2S2O3, в) Agl в KCN; г) Ag2CrO4 в
NH3; д) Ni(OH)2 в NH3; е) HgS в KI; ж) Ag3PO4 в NH3;
з) Zn(OH)2B NaOH.
7. Вычислить константу равновесия реакций взаимо-
действия в растворе: a) Fe(SCN)s и KF; б) K3Cu (CN)4 и
NH3; в) Cd(NH3)4SO4 и НС1; г) (NH4)2Hg(SCN)4 и КС1.
8. Почему HgS не растворяется в концентрированной
соляной или азотной кислоте, но растворяется в царской
водке?
9. Можно ли растворить сульфид ртути (II) в:
a) 3HC14~HNO3; б) HC1-J-KI; в) НО; г) HNO3? Напи-
сать уравнения реакций.
10. Образуются ли осадки, если на отдельные порции
раствора, содержащего Cd(CN)2-> подействовать:
a) H2S (pH 0,5); б) NaOH; в) Na2HPO4?
11. Образуются ли осадки при добавлении: а) К2СгО4;
б) KI; в) КС1; г) КгЗО4 к растворам AgNO3;
Ag(NH3)2NO3 и KAg(CN)2?
12. Образуется ли осадок сульфида меди при насыще-
нии сероводородом растворов, содержащих:
a) Cu(NH3)4+;6) Cu(CN)®-; в) CuCl4“?
13. Указать состав осадка, который образуется при
действии H2S на раствор, содержащий: a) Cd(CN^~ и
Си (CN)4_; б) Cd(NH3)|+ и Cu(NH3)2+.
14. Появится ли окраска роданида железа
(III) при добавлении NH4SCN к 0,01 М растворам:
a) (NH4)2Fe(SO4)a-12H2O; б) KaFe(CN)6; в) FeCIa;
г) K3FeF6; д) K3Fe(PO4)2?
34
Решение типовых задач
Пример 1. Вычислить концентрацию ионов Cd1* в растворе,
1 л которого содержит 0,1 моля Cd(NOj)a и 2 моля KI.
Решение. В указанных условиях практически весь нон Cd1*
связывается в комплексный ион Cdld~. Равновесие образования этого
комплекса
Cd2+ + 41- Cdl’“
характеризуется константой устойчивости:
[Cdlt]
р , = —-----------------------—-1,26 10«.
Cdi2- [Cd2*] [!-]*
При значительном избытке лиганда и достаточно большой вели-
чине константы устойчивости можно принять, 4To[Cdlt] = CC(j2+=
=0,1 г-ион/л, [I-]=CF— 4С^2+=2-4 0,1 = 1,6 г-ион/л. Равновесную
концентрацию аква-попов кадмия рассчитывают по формуле:
f °
ЬС(12+ 0 1
[Cd2* ] = —---------------------=--------!-------==
зИ12-(с;_-4с;12+г 1.26-1041.6)4
= 1,21-10 —8 г-ион/л.
Введение KI в раствор Cd(NO2)2 понизило концентрацию Cd2*
от 0,1 до 1,21 10-’ г-ион/л.
Пример 2. Вычислить растворимость HgS (моль/л) в 1 М НВг.
Решение. Исходя из уравнения реакции растворения
HgS + 2Н+ + 4Br- HgBrd- + H2S
1 — 2х 1 — Ах х х
найдем константу равновесия:
[HgBr^~] [HcS] [S2-] [Hg2 + 1 nf>H^S^HgBr2-
[H + ]2[Br-]4 ’[зЯ’ [Hg2 + ] == =
1,6- 10-52. 1,0- 1021
=--------------------1,23-10-11.
1,3-10—20
Подставим равновесные концентрации в выражение константы рав-
новесия:
К =
-------------------=-.= 1,23- 10-и.
(1 — 2х)2(1 — 4х)4
Значение К достаточно мало, поэтому 1— 2ха>1 и 1 —4хат
«1 г-ион/л. Отсюда хг= 1,23-10~и и х = 3,о1 10~в г-ион/л.
Пример 3. Вычислить начальную концентрацию раствора NH»,
обеспечивающую максимальную полноту осаждения Nl(OH)» из
0,02 М Ni(NO,)t.
2*
Решение. При добавлении аммиака к раствору нитрата никеля
образуется гидроокись Ni(OH)j и в растворе появляется 2-0,02
г-ион/л NH^:
Ni2+ + 2NH3+.2H8O^N1(OH)2|+2NH^ (1)
Ni(OH)a может растворяться вследствие комплексообразования:
Ni (ОН)2 + 4NH3 Ni (NH3)2+ + 2ОН~ (2)
Растворимость 5 осадка Ni(OH)2 равна
S = [№+]+ [Ni(NH3)2+] (3)
Начальная концентрация аммиака С^На определяется соотно-
си, = lNH3] + 4 [Ni(NH3)2+] + 2(C°N12+- [Ni2+]). (4)
Вычислим равновесную концентрацию NHa. Для этого выразим
концентрации Ni2+ и Ni (NH3)^+ через константы равновесий соглас-
но уравнениям (1) и (2):
[NH+]2 [NH+]2 [0Н-]2 _ Сн,
/C1-[Ni2+][NH3]2“[Ni2+][NH3]2'[ОН-]2 nPN1(0H)j ’
[Ni (NH3)2+] [ОН-]2 [Ni (NH3)2+] [ОН-]2 [Ni2+]
[NH3]4 ~ [NH3]4 ‘[Ni2+]-
= nPN!(OH),₽N1(NHs)2+-
Отсюда
[M;2+] __ nPN,oH). K+]2 _
Ch, (NH3]2
2,0-10-15 (2-0,02)2 1,03-10-8
= (1,76-10-5)2 ‘ [NH3]2 = [NH3]2
и так как в соответствии с уравнением (2) [Ni (NH3)2+j = 2[ОН“],
то
[Ni (NH3)2+] =Л- 1/4HPni(OH)2Pn j)2+ [NH3]4 =
= у 1/4-2,0-10-15.2,95-107-[NH3]4 = 2,45-10~3- [NH3]4^3.
Подставим эти значения в уравнение (3):
s = LW^8 + 2’45-10’3-[NHa]4/3- (5)
Чтобы найти минимум функции, приравняем нулю производную
S по [NHJ:
dS
д [NH3]
2-1’°3'10 8- + 4/3-2,45- Ю-з.[NH3]1/3 = о. (б)
[NH3]3 1 1 3J
36
Решая это уравнение относительно [NHi], находим: раствори-
мость Ni(OH)2 имеет минимальное значение при [NHa] =
= 1,10-10“2 моль/л. Отсюда по уравнению (4) находим:
Сын, = 1.10-10—2 + 4.2,45-10-3. (1,10 ю—2)-*/3 +
Г „ 1,03-10-8 1
+ 2- 0,02-------------— = 0,051 моль/л.
[ (1,10 -10—2)2 J
Пример 4. Вычислить равновесные концентрации продуктов сту-
пенчатой диссоциации в IM Zn(NH3)4(C104)2.
Решение. В водном растворе Zn(NH3)4(C104)2 практически
полностью диссоциирован на ионы Zn (NH3)^+ и СЮ^", причем
CZn(NH,)2+ ==CZn(NH,).(Cio1),= 1 г-ион/л,
4
^СЮ- ““ 2^Zn(NH,),(ClO1)1 — 2 Г-ион/л.
4
Диссоциация комплексного иона Zn (NH3)^+ происходит ступен-
чато.
Для расчета необходимы табличные данные о константах устой-
чивости аммиакатов цинка:
[Zn(NH3)2+] [Zn (NH3)1+]
[Zn2+] [NH3] H [Zn2+] [NH3]3
= 5,5-108,
[Zn(NH3)2+] [Zn(NH3)*+]
= 2,69-104, 84 =-
[Zn2+][NH3]2-----------------------------™ [Zn2+][NH3]4
Введем обозначения:
а пл., a n. , a n, , a Q, и a ,, —доля части-
Zn2+ ZnNH2+’ Zn(NH„)2+ Zn(NH,)2 + Zn(NH,)2 +
цы, состав которой указан нижним индексом у а.
И далее:
_ 1 _ 31 [NH3] _ 32 [NH3]2
aZn2+ ' £) ’ aZnNH2+ D ’ azn(NH„)2+ D
p3 [NH3]3 MNH3]<
“zn(NH,)3+ О " aZn(NH.)2+ D
где D = 1 + ₽! [NH3] + З2 [NH3]2 + 83 [NH3p + 34 [NH3]4.
Чтобы вычислить долю каждой частицы а., необходимо знать
равновесную концентрацию NH3 в данном растворе. Для ее расче-
та используем метод последовательных приближений. В первом при-
ближении оценим равновесную концентрацию NH3 на основании сум-
марной константы образования:
Zn2+ + 4NH3;£Zn (NH3)2 +
х 4х 1 — х
1-х
= X (4х)4
-=5,0-108.
37
Принимая 1—х»1 г-ион/л, получаем
// 1 Я/_______________________
|/ Т^^~ = >/7'8-10-,а = б'0'10-‘
Следовательно,
[NH3] = 4(6,0-10 3) = 2,4-10-2 Моль/л и 0 = 262,0.
Отсюда
а 2+= 1/262,0 = 3,82-10 а, а = 3,65/262,0 — 1,39-10—2,
Zn2+ ' Zu(NH,r+ ’ ‘ ’
“z,1(nhs)2+ = 15,5/262,0 = 5-91-Ю-2.
а 2, = 76,0/262,0 = 2,90-10-1,
Z.i(NII3)2+ ’
“z.i (NH.)2+ == 165,9/262,0 = 6,33-10-1.
Составим контрольный баланс по Nlh:
в комплекс Zn (NH3)^+ его вошло 6,33-10—1-1-4 = 2,532 г-ион/л
> > Zn (NH3)j+ » » 2,90-10-1-1-3 = 0,870 г-ион/л
» » Zu (NH3)2+ » » 5,92-10-2.1.2 = 0,118 г-ион/л
» > Zn(NH3)2+ » » 1,39-10—2-1 • 1 = 0,014 г-нон/л
Всего в комплекс связано NH3 3,534 моль/л
Следовательно, несвязанного аммиака будет 4,000—3,554 =
= 0,466 моль/л. Эта равновесная концентрация NH3 существенно
отличается от той, которой мы задались в расчете (2,4. 10-2 моль/л).
Дальнейшее решение задачи выполняем так, чтобы методом после-
довательных приближений найти, при какой концентрации лиганда
заданное и найденное по расчету значения ее совпадут. Задаемся
величиной [NH3] = 0,1 моль/л. При этом 72 = 55785 , a aZn2+ =
= 1,79-10-5, а „.=2,73-10-4, a „,=4,82-10-3,
’ Zr.(NH,)2+ ’ Zn(NH,f+
a = 0,099, a „, =0,896.
Zn(NHe)2+ Zn(NH,)2+
Концентрация NH3, связанного в комплекс, составляет
(0,896-1-4) + (0,099-1 3) + (0,005 • 1 2) =3,891 моль/л, а равновесная
концентрация NH3, равная 4,000— 3,891=0,109 моль/л, практически
совпадает с заданной. Пользуясь значениями а, последнего прибли-
жения, определим равновесные концентрации всех частиц в 1М
Zn(NH3)4(C104)2:
[NH3] = 1,09-10-1 моль/л,
[Zn2+] = aZu2+C°11(NHi)i(C1Oi)i= 1,79-10-5-1 = 1,79.10-5 г-ион/л,
[Zn (NH3)»+] = aZiiKHS+CL(NH,)1(C101). “ 2>73’10"4-1 -
8
38
= 2,73-10—1 г-ион/л,
[Zn(NH3)^+] “aZn(NHa)2+C'zP(-;i.3).(Cio1), ' 4,82.10-*.! =
= 4,52 10 -3 г-ион/л,
[Zn (NH3)2+] =aZn(NH!)2*C;il(NH>MC10i) =0,099-1=0,099 г-ион/л,
[Zn (NH3)4+] = azn(NHj)2+<^Zn(NH,)1(Cio,), ~ 0,896-1=0,896 г-ион/л
Примечание. Если концентрация лиганда намного превышает
концентрацию центрального иона, то, очевидно, равновесная и об-
щая концентрации лиганда близки между собой, поэтому необхо-
димость в методе последовательных приближений отпадает. В этом
случае в формулу для 0 подставляют общую концентрацию лиганда.
Задачи *
180. В каком растворе больше концентрация Cd2+:
в 0,1 М Cd(NH3)4Cl2 или в 0,1 .WK2Cd(CN)4?
181. Где больше концентрации Ag-i: в растворе, со-
держащем 1 моль/л AgNO3 и 2 моль/л KCN, или в ра-
створе, содержащем 0,1 моль/л AgNO3 и 1 моль/л NH3?
182. Вычислить концентрацию иона-комплексообразо-
вателя в растворе, содержащем 0,1 г-ион/л Ag (NHS)*
и 0,5 моль/л NH3.
183. Вычислить концентрацию Hg2+ в растворе, содер-
жащем 0,01 моль/л Hg(NO3)2 и 0,08 моль/л KI.
184. Вычислить концентрацию Cd2+ з растворе, содер-
жащем 0,02 моль/л Cd(NO3)2 и 1 моль/л NH3.
185. К 0,2 М NiSO4 добавили равный объем 2 М NH3.
Вычислить концентрацию Ni2+, если считать, что в ра»
створе образуются комплексные ионы Ni(NHt)4+.
186. В 1 л раствора содержится 0,1 моля CuSO4
и 2,4 моль NH3. Вычислить концентрацию свободных
ионов Си2+, если считать, что образуются комплексные
ионы Cu(NHs)4+.
187. Вычислить концентрацию Hg2+ в растворе, содер-
жащем 0,05 моль/л Hg(NO3)2 и 0,4 моль/л NaCl.
188. В 0,6 М. K2Cu(CN)3 ввели цианид-ион так, что
концентрация последнего получилась 0,005 г-ион/л.
Определить концентрацию Си+ в растворе.
• При решении задач 180—240 достаточно учитывать существо-
вание только одного, доминирующего соединения. В задачах 241—
248 следует учитывать ступенчатые равновесия комплексообразо-
вания.
39
189. К 1 мл раствора, содержащего 5 мг Cd2+, доба-
вили 1 мл 1 М KCN. Вычислить равновесные концентра-
ции ионов Cd2+, CN~ и Cd(CN)4~ в растворе.
190. К раствору, содержащему 25,96 г/л СоС12, доба-
вили равный объем раствора аммиака с концентрацией
2,8 моль/л. Вычислить концентрацию свободных ионов
Со2+, если считать, что в растворе образуются комплекс-
ные ионы Co(NH3)4+.
191. В 10 мл воды растворили 0,3684 г K4Fe(CN)6.
Чему равна концентрация Fe2+ в растворе?
192. Навеску 5,315 мг AgCl обработали 1 мл 6 М NH3,
в результате чего осадок растворился полностью. Вычис-
лить равновесные концентрации Ag+, NH3 и Ag(NH3)?.
193. Сколько молей аммиака необходимо ввести в 1 л
0,5 М AgNO3, чтобы снизить концентрацию Ag+ до
10~5 г-ион/л, если в растворе образуются комплексные
попы Ag (NH3)f?
194. Сколько молей NH4SCN необходимо ввести
в 1 л 5-10—5 М Hg(NO3)2, чтобы снизить концентрацию
Hg2+ до 10-11 г-ион/л за счет образования комплексных
ионов Hg(SCN)4-?
195. Сколько граммов NaOH необходимо для образо-
вания Zn(OH)4~ из 50 мл 0,8 М ZnCl2, если концентра-
ция Zn2+ в конечном растворе не должна превышать
10-13 г-ион/л?
196. Сколько миллилитров 1 М K.I нужно прибавить
к 10 мл 0,1 М Hg(NO3)2, чтобы получить в растворе ком-
плексную соль K2HgI4, а концентрация Hg2+ в нем
не превышала 10-26 г-ион/л?
197. Определить равновесные концентрации ионов
NOF, CN_, Ag+ и Ag (СЫ)Г в растворе, полученном
при добавлении 0,4 моля KCN к 1 л раствора, содержа-
щего 0,1 г-ион/л Ag(NO2)2".
198. Сколько граммов твердого KI надо внести в 5 мл
раствора, содержащего 0,1 г-ион/л CdCl4~ и 0,6 моль/л
NaCl, чтобы превратить 99,9% ионов CdCl4~ в Cdl4-?
199. Вычислить концентрацию ионов HgCl4~, Hg2+,
Hgl4~, I- и Cl- в растворе, полученном при добавлении
0,830 г KI к 10 мл раствора, содержащего 0,1 г-ион/л
HgCl24- и 0,6 моль/л КО.
200. К раствору, содержащему 0,1 моль/л Fe(SCN)«
и 2 моль/л KSCN, добавили 20%-ный раствор KF, Общин
40
объем смеси 1 л. Сколько миллилитров раствора KF при-
лили, если 99,99% Fe(SCN)3 превратилось в FeF~?
Чему равна равновесная концентрация F-?
201. Вычислить растворимость AgCl в 1 л 0,1 М NH3.
202. Сколько граммов AgCl растворится в 1 мл
25%-ного раствора NH3?
203. Сколько миллиграммов AgBr растворится
в 100 мл 1 М NH3?
204. Сколько миллилитров 25%-ного NH3 нужно для
растворения 0,1 г AgCl?
205. Растворится ли 0,1 г AgBr в 100 мл 1 М NH3?
206. Растворится ли 0,05 г Agl в 200 мл 1 М NH3?
207. Вычислить растворимость C112S в 1 л 3 М KCN,
если при растворении образуются только комплексные
ионы Си (CN)3~.
208. Сколько миллилитров 1 М NH3 необходимо для
растворения 0,1 г Ag2CrO4?
209. Вычислить растворимость 7п(ОН)2 в 1 л 1 М
NH3, если в растворе образуются только комплексные
ионы Zn(NH3)®+.
210. Вычислить растворимость Ni(OH)2 в 1 л 0,05 М
NH3, если в растворе образуются только комплексные
ионы Ni(NH3)4+.
211. Вычислить растворимость А1(ОН)з в 1 М NaOH.
212. Вычислить растворимость А1(ОН)3 в 1 М NH3.
213. Вычислить растворимость Ag3Fe(CN)3 в 1 л
0,2 М NH3.
214. Для получения комплексной соли K3AgI4 сме-
шали равные объемы 0,2 М растворов AgNO3 и KI.
Сколько молей KI нужно добавить к 1 л этой смеси,
чтобы осадок Agl растворился? Чему равна равновесная
концентрация Г- в растворе?
215. Какова начальная концентрация раствора KCN,
в 2 мл которого растворили 18,8 мг AgBr и при этом
образовался комплексный ион Ag(CN)2 ?
216. Вычислить начальную концентрацию \а2$20з,
необходимую для полного растворения в 1 л его 0,4 мо-
лей Ag2C2O4, если считать, что в растворе образуются
только ионы Ag(S2O3)2--
217. Сколько граммов AgBr растворится в 20 мл
0,1 М (NH4)2CO3?
218. Вычислить растворимость AgCl и Agl (г/л) в 1 М
(НН4)гСО3. Будет ли достигнуто разделение этих гало-
41
генидов, если смесь 0,05 г AgCl и 0,05 г Agl обработать
10 мл 1 М (NH4)2CO3?
219. Выпадет ли осадок AgCl, если в 1 л воды раство-
рили 0,1 моля AgNO3, 0,1 моля NaCl и 0,7 молей NH3?
220. В раствор, содержащий 0,1 моль/л СоС12 и
1,4 моль/л NH3, пропустили сероводород до начальной
концентрации иона S2-, равной 10~13 г-ион/л. Выпадет ли
в осадок CoS?
221. Раствор содержит 0,1 г-ион/л Cd (CN)4 ,
0,1 г-ион/л Си (CN)4~ и 0,05 моль/л KCN. При пропуска-
нии сероводорода создана концентрация сульфид-иона,
равная 10-13 г-ион/л. Будет ли происходить осаждение
Cu2S и CdS?
222. Образуется ли осадок РЫ2, если к 1 л 0,1 М
Pb(NO8)2 прибавить 1 мл раствора, содержащего
1,0 моль/л К! и 1,0 моль/л Cd(NO3)2?
223. Образуется ли осадок Ag3PO4, если в 1 л ра-
створа, содержащего 0,1 г-ион Ag (NHj)? и 1 моль NH3,
растворили 1 г Na3PO4?
224. К 1 л раствора, содержащего 0,1 моль Hg(NO3)2
и 0,1 моль KI, прибавили 1 г Pb(NO3)2. Образуется ли
осадок РЬ12?
225. Образуется ли осадок Fe(OH)3, если к 1 л ра-
створа, содержащего 0,1 моль Ni(NO3)2 и 0,1 моль NH3,
добавить 0,1 моля Fe(NO3)3?
226. К 1 л раствора, содержащего 0,1 моль AgNO3
и 1,2 моль NH3, добавляют по каплям раствор КВг. При
какой концентрации бромид-иона начнется образование
осадка AgBr?
227. Смешали 5 мл 0,1 М AgNO3 и 5 мл 25%-ного
раствора NH3. Сколько миллилитров 0,1 М КВг следует
прибавить к полученному раствору, чтобы началось вы-
деление осадка AgBr?
228. Вычислить начальную концентрацию раствора
NH3, обеспечивающую максимальную полноту осажде-
ния Cd(OH)2 из 0,1 М Cd(NO3)2.
229. Вычислить начальную концентрацию раствора
NaOH, обеспечивающую максимальную полноту осажде-
ния РЬ (ОН) 2 из 0,05 М Pb (NO3) 2.
230. Вычислить начальную концентрацию раствора
КС1, обеспечивающую максимальную полноту осажде-
ния РЬС12 из 0,1 М Pb(NO3)2.
42
231. Вычислить начальную концентрацию раствора
К1, обеспечивающую максимальную полноту осаждения
Agl из 0,05 М. AgNO3.
232. Вычислить начальную концентрацию раствора
KI, обеспечивающую максимальную полноту осаждения
Bil3 из 0,1 М Bi(NO3)3.
233. Вычислить начальную концентрацию раствора
Na2C2O4, обеспечивающую максимальную полноту осаж-
дения MgC2O4 из 0,2 М MgCl2.
234. Вычислить начальную концентрацию НС1, обес-
печивающую максимальную полноту осаждения AgCl
из 0,1 М AgNO3.
235. Вычислить начальную концентрацию NH3, обес-
печивающую максимальную полноту осаждения Си(ОН)2
из 0,2 М Си (NO3)2.
236. Вычислить начальную концентрацию KCN, обес-
печивающую максимальную полноту осаждения Ni(CN)2
из 0,05 М Ni(NO3)2.
237. Вычислить начальную концентрацию NaOH,
обеспечивающую максимальную полноту осаждения
Zn(OH)2 из 0,2 М Zn(NO3)2.
238. Вычислить начальную концентрацию Na2C2O4,
обеспечивающую максимальную полноту осаждения
МпС2О4 из 0,1 М МпС12.
239. Вычислить начальную концентрацию KCN, обес-
печивающую максимальную полноту осаждения AgCN
из 0,05 М AgNO3.
240. Вычислить начальную концентрацию NH3, обес-
печивающую максимальную полноту осаждения А1(ОН)3
из 0,2 М A1(NO3)3.
241. Навеску 2,7150 г HgCl2 растворяли в 100 мл
0,2 М НС1. Вычислить равнввесные концентрации Hg2+,
HgCl+, HgCl2, HgCir, HgCl4~ и Cl-в растворе.
242. В 1 л воды растворили 45,4 г Hgl2 и 33,2 г KI.
Вычислить равновесные концентрации Hg2+, Hgl+, Hgl2,
Hgir, Hgit и I в растворе.
243. Вычислить равновесные концентрации Cd2+,
Cdl+, Cdla, Cdir> Cdl}~ и I- в растворе, полученном
при растворении 0,3662 г Cdl2 в 10 мл 1 М KI.
244. Вычислить равновесные концентрации Ag+,
AgNOa, Ag(NO3)r и NOf в растворе, содержащем
0,02 моль/л K3Ag(NO2)2 и 0,1 моль/л KNO2.
43
245. Вычислить равновесные концентрации Ag+,
AgNH^, Ag (NH3)^ и NH3 в растворе, содержащем
0,05 моль/л Ag(NH3)2C104.
246. Вычислить равновесные концентрации Mg2+,
MgCzO^, Mg (С2О4)2- и С2О;“ в растворе, содержащем
0,05 моль/л Mg(NO3)2 и 0,2 моль/л КагС2О4.
247. Навеску 0,5793 г Ag2O растворили в 50 мл 0,4 М
NaoSsOa. Вычислить равновесные концентрации Ag4;
AgS2O?, Ag(S2O3)^, Ag(S2O3)3- и S2O1~.
248. В 10 мл 2 М НС1 растворили 0,1267 г FeCl2. Вы-
числить равновесные концентрации Fe2+, FeCl+, FeCl2
и Cl-
Глава V
РАВНОВЕСИЯ ПРИ ПРОТЕКАНИИ
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ ПРОЦЕССОВ
Вопросы для самопроверки
1. Привести примеры использования реакций окисле-
ния— восстановления в качественном анализе для:
а) растворения твердых соединений; б) разделения и
маскировки ионов; в) открытия ионов.
2. Что принято в качестве условного нуля отсчета
шкалы потенциалов? Как устроен водородный электрод?
3. Что называется стандартным окислительно-восста-
новительным потенциалом?
4. Написать уравнение Периста. Пояснить физический
смысл величин, входящих в это уравнение.
5. Как влияют на окислительно-восстановительный
потенциал температура, кислотность, соотношение кон-
центраций окисленной и восстановленной форм?
6. Что называется стандартным электродным потен-
циалом? Рядом напряжений? Какие выводы можно сде-
лать на основании этого ряда?
7. Пользуясь таблицей окислительно-восстановитель-
ных потенциалов, предложить реагенты для окисления;
а) I- до 12; б) Вг_ до Вг2; в) NOr до МОГ; г) S2- до SO1~1
д) Fe2+ до Fe3+; е) S2O1- до S4O1-; ж) AsOl- до AsC>4~:
з) SnCl4- до 5пС1б~; и) SO1~ до SOl-; к) Мп2+ до
44
МпО(ОН)1; л) Mn,+ до MnO<; м) Сг8+ до СгО< ; н) SbCl?
до SbCle".
8. Можно ли двуокисью свинца в кислой среде окис-
лить:
а) 1~ до 12; б) Мп2+ до МпОГ; в) Cl ’ до С12; г) NO?
до NOr?
9. Можно ли действием перманганата калия в щелоч-
ной среде окислить:
a) S3~ до S; б) 12 до Юз; в) Вг~ до ВгО~; г) Со2+ до
Со(ОН)3?
10. Можно ли действием нитрита натрия в кислой
среде восстановить:
а) МнОГ до Мп2+; б) Zn2+ до Zn; в) С10Г до С1_;
г) Сг2О^ до Сг3+?
11. Можно ли действием бпхромата калия в кислой
среде окислить:
a) Fe2+ до Fe3+; б) SO2~ до S2O2M в) Мп2+ до МпОГ;
г) 50з~ до SOi~?
12. Назвать соединения, наиболее часто используемые
в аналитической практике в качестве окислителей; в ка-
честве восстановителей.
13. В каких реакциях соединения: a) KNO2; б) Н2О2;
в) МпО2 являются окислителями и в каких восстанови-
телями?
14. Как влияет кислотность раствора на окислитель-
но-восстановительный потенциал систем:
а) Сг2О2ЛСг3+; б) МпОГ/Мп2+; в) SO2f7H2S; г) NO?/NO;
д) NO2~/NO; е) AsO^/AsOl-?
15. Почему реакцию окисления Сг3+ перекисью водо-
рода выполняют в щелочной среде, а не в кислой?
16. Почему ртуть не растворяется в H2SO4, но раство-
ряется в HI с выделением водорода?
17. Вывести уравнение для расчета константы равно-
весия окислительно-восстановительной реакции.
45
18. От каких факторов (температура, концентрация,
кислотность, ионная сила) и как зависит константа рав-
новесия окислительно-восстановительной реакции?
19. Как можно изменить направление окислительно-
восстановительных реакций:
а) 21-+ AsO3-4-2H+— 12| + AsO^4-HaO
б) 2I~ + 4H+ + SOr — 2H2O 4-I2| + SOaf
в) Вг--фВгО- + 2Н+-.Вг2 + Н2О
г) 2Mn2+4-5BrO~-4-6OH~—»2МпО--|-5Вг-+ЗН2О
Решение типовых задач
Пример 1. Вычислить потенциал водородного электрода в 0,5 М
растворе ацетата натрия.
Решение. Окислительно-восстановительный потенциал водо-
родного электрода в заданных условиях вычисляется по уравнению
п 0,059 л
£н1/2н+ = £н,/2н+ + 1g [Н+12 = £°н2/2н+ + °-059 1Н+1-
Концентрация ионов водорода в растворе определяется гидроли-
зом ацетат-иона:
сн3соо- + H2O^tCH3COOH + он—
Концентрацию гидроксил-ионов вычисляем по формуле
[ОН—] -
= 1,7-10-5.
Из ионного произведения воды получаем
[Н+] = ^-w =--------—— = 5,9- 10—Ю г-ион/л.
1 J [ОН-] 1,7-10-5
Подставляем найденную концентрацию ионов водорода в урав-
нение окислительно-восстановительного потенциала:
£Н1/2н+ = о + 0,059 1g (5,9-10-10) = -0,545В,
где £Н./2Н+ ~ °В-
Пример 2. Вычислить э. д. с. гальванического элемента:
Ni |№ (МО3)20,2моль/л, NH3 2моль/л || Hg2 С12 (к), КС1 0,1моль/л|Н£
Р ешение. В гальваническом элементе на электродах протека-
ют следующие реакции:
N12+ + 2ei:Nl, E°n|2+/n( =-0,23В
44
и
Hgr + 2е -2Hg, £^2+/2He--= +0.792B
Окислительно-восстановительные потенциалы этих электродов
вычисляем по следующим уравнениям:
П 0,059
£nP+/NI = £°12+/ni + — 1g [№+],
Е -Е> , 0,059 [g [не2+1.
Hg2+/2Hg Hg2*/511^ 2 ’
Для расчета необходимо знать равновесные концентрации ионов
Nl2+ и Hgj+. Равновесная концентрация ионов никеля определяет-
ся процессом комплексообразования, протекающим в избытке NHj.
Примем, что в растворе доминирует Ni(NH3)^n рассчитаем концсит-
трацию ионов никеля;
Cjji 0,2
[NiJ+l =------------2-----------».---------------------=
₽N«NH,b(CNH.-4C°N1)< 2,95-107(2 — 4-0.2)4
= 3,27*10'9 г-ион/л,
следовательно,
Е =-0,23 + —— 1g3,27-10-» =—0,48 В.
ni2+/ni 2
Равновесная концентрация ионов ртути (I) определяется как рас-
творимость HgsCh в 0,1 М КС1:
[нг»1 г.„н/л.
I 2 J [CI—]2 (0,1)2
Отсюда
0,059
Е 24.м = 0,792 + -—1g 1,310-18 = 0,323 В.
Hg2+/2Hg ' 2 к
Э. д. с. гальваническо! о элемента составляет
э.д.с. = Е 9.. --Е 2+ = 0,32.3—(—0,48) = 0,803 В.
Hg2 + /2Hg ni2+/ni v ’
Пример 3. Вычислить равновесные концентрации ионов NP+,
Н+, S2- и NO^~ в растворе, полученном при растворении 0,325 г
а-NiS в 10 мл 2 М HNOS.
Решение. Растворение сульфида никеля в азотной кислоте
3N1S + 2N(V + 8Н+ = 3Ni2+ + 3S + 2NO + 4Н2О
целесообразно рассматривать как сумму двух процессов:
a-NiS + 2Н+ :£Ni2+ + H2S (1)
47
3H2S + 2N<Y + 2H+ 3S + 2N0 + 4H2O
(2)
3 H2S^S + 2H+ + 2e, £°/HiS = 0,14B
2 N0~ + 4H+ + 3e NO + 2H2O,
° , = 0,96;B
NO—/NO
Для расчета K2 воспользуемся формулой
(£?-£2°)б _ (0,96-0,14)6 _
g/<2 0,059 0,059
Отсюда
K<1 [H2S]3 [NO']2 [Н+Р 2’5’1083'
Концентрация ионов никеля в конечном растворе определяется
количеством взятого для растворения NiS:
[Ni2+] = J^I000
L J 90,77-10
= 0,358 г-ион/л,
где 90,77 — молекулярный вес NiS.
На растворение NiS расходуется часть взятой азотной кислоты,
причем ионов водорода расходуется в 4 раза больше, чем ионов
NOJ", а именно:
„ 8 8 0,358
Сн+ = — [N12+] =-------------------= 0,96 г-ион/л
израсх **
2 2-0,358
и С = — [Ni2+] =-----------=0,24 г-ион/л.
израсх 3 3
Следовательно, в конечном растворе концентрации ионов Н+ и
NO^~ составляют
[H+] = Chno Сн+ =2 — 0,96 = 1,04 г-ион/л,
* израсх
[NO3~] = ChN01 - CNQ_ = 2 - 0,24 = 1,76 г-ион/л.
3 израсх
Равновесная концентрация H2S в растворе рассчитывается
по К2:
lH2S] |/ [Шз-]2[Н+]2 V 2,5(1,76)2(1,04)2
= 1,06-10-28
Концентрация сульфид-ионов в растворе H2S равна
^1.2CH,S 1,3-10-20.1 ,06-10-28
Is 1 = ~[Н+р = -------------------------------=1 ’27-10-48 Г’нон/Л1
(1,04)2
48
Задачи
249. Вычислить окислительно-восстановительный по-
тенциал в растворе, содержащем: 1) МпОГ =1 г-ион/л,
Мп2+=1 г-ион/л, Н+=10-1 г-ион/л; 2) МпОГ = 1 г-ион/л,
Мп2+=1 г-ион/л, pH 3,0; 3) МпОГ =1 г-ион/л, Мп2+ =
= 1 г-ион/л, pH 5,0; 4) МпО~ = 0,027 г-ион/л, Мп2+ =
= 0,013 г-ион/л, pH 6,59; 5) 0,2 моль/л КМпО4, 0,4 моль/л
MnSO4, 0,5 моль/л HNO3; 6) 0,1 моль/л КМпО4,
0,2 моль/л MnSO4, 0,5 моль/л H2SO4; 7) 15,8 г/л КМпО4,
0,1 моль/л MnSO4, pH 2,7.
250. Вычислить окислительно-восстановительный по-
тенциал в растворе, содержащем 0,2 моль/л К2СГ2О7,
0,3 моль/л Cr2(SO4)3 и 0,5 моль/л HNO3.
251. Вычислить окислительно-восстановительный по-
тенциал системы, содержащей 0,1 моль/л КМпО4,
0,01 моль/л NaOH и МпО2 (тв).
252. Рассчитать окислительно-восстановительный по-
тенциал в растворе, полученном смешением 20 мл 0,05М.
Na3AsO3 и 18 мл 0,05 М 12 при pH 8.
253. Рассчитать электродный потенциал в системе:
1) РЬ
РЬС12 (тв) 2) Cd CdCO3 (тв) 3) Ag AgBr (тв)
0,5М КС1 0,3M Na2CO3 0,22М КВг
4) РЬ РЬВг2 (тв) 5) Ag AgCl
50 г/л NaBr (нас. р-р)
254. Вычислить потенциал системы Спч^Си2++2е
в растворе, содержащем 0,1 моль/л CuSO4 и 2,0 моль/л
NH3.
255. Какая из систем имеет больший окислительно-
восстановительный потенциал:
Cu|Cu (NH3)4+ = 0,1 г-ион/л, NH3= 1,5 М или Cu|Cu(CN)3-
= 0,1 г-ион/л, KCN=1,5M?
256. Вычислить потенциал никелевого электрода в ра-
створе, содержащем 0,1 моль/л NiCl2 и 2, 7 моль/л NH3.
257. Вычислить потенциал серебряного электрода
в растворе, содержащем 0,1 моль/л AgNO3 и KCN, если
равновесная концентрация цианид-ионов 1 г-ион/л.
258. Вычислить потенциал кадмиевого электрода
в растворе, содержащем 0,02 моль/л CdCl2 и 1,5 моль/л
NH3.
4»
259. Вычислить потенциал ртутного электрода в ра-
створе, содержащем 0,05 моль/л Hg(NO3)2 и 1,6 моль/л
NaCl.
260. Вычислить потенциал серебряного электрода
в растворе, содержащем 3,4 г/л AgNO3 и 2,5 моль/л NH3.
261. Вычислить потенциал никелевого электрода в ра-
створе, 1 л которого содержит 7 г Ni(NOe)3 и 51 г NH3.
262. Вычислить потенциал водородного электрода
в растворе, 1 л которого содержит 5,61 г КОН.
263. Вычислить потенциал водородного электрода
в 0,3 М НСООН.
264. Вычислить потенциал водородного электрода
в 5%-ном растворе NH4C1.
265. Вычислить потенциал водородного электрода
в растворе, в 1 л которого содержится 0,65 г KCN.
266. Вычислить потенциал водородного электрода
в растворе, 1 л которого содержит 10,7 г NH4C1
и 0,1 моля NH3.
267. Рассчитать потенциал водородного электрода
в растворе, полученном смешением 10 мл 0,5 М НС1
и 20 мл 0,25 М КОН.
268. Вычислить потенциал водородного электрода
в растворе, полученном смешением 32 мл 0,25 М НС1О4
и 19 мл 0,4 М КОН.
269. Рассчитать потенциал водородного электрода
в растворе, полученном при смешении 250 мл 0,4 М HCN
и 250 мл 0,4 М KCN.
270. Рассчитать потенциал водородного электрода
в растворе, содержащем 0,1 моль/л Na2CO3.
271. Определить потенциал водородного электрода
в растворе, который получен прибавлением к 43 мл воды
2,5 мл 0,18 М НС1 и 4,5 мл 0,1 М NH3.
272. Вычислить потенциал водородного электрода в
растворе, 1 л которого содержит 0,5 моля СН3СООН и
0,5 моля Са(СН3СОО)2.
273. Вычислить потенциал водородного электрода в
растворе, полученном смешением 1 л 0,1 М. NaCH3COO
и 100 мл 0,1 М СНзСООН.
274. Вычислить потенциал водородного электрода в
растворе, 200 мл которого содержат 1,2 г СН3СООН и
3,3 г CHjCOONa.
275. Вычислить потенциал водородного электрода в
растворе, полученном смешением 20 мл 0,5 М НС1 и 30 мл
0,6 М NHj.
50
276. Вычислить э. д. с. гальванического элемента, по-
строенного из следующих пар:
1) Zn | Zn2+(0,001 г-ион/лj'||Cu2+ (0,1 г-ион/л)| Си
2) Al| Al,+ (0,05 г-ион/л)||Ag+ (0,03 г-ион/л)|Ая
3) Pt
Sn7 8 * * 11 (0,01 г-ион/л)
SnIV (0,001 г-ион/л)
Fe2+ (0,001 г-ион/л)
Fe3+ (0,01 г-ион/л)
4) Pt Sn” (0,01 г-ион/л)
SnIV (0,001 г-ион/л)
Fe(CN)fl (0,1 г-ион/л)
Fe(CN)e~(0,l г-ион/л)
Pt
5) Pt Fe2+(0,01 г-ион/л) СГ2О7 (0,1 г-ион/л)
Pt
Fe3+(10“e г-ион/л) Cr3+ (10 3 г-ион/л) pHO
6) Pt Mn2+ (0,05 г-ион л)
Fe2+ (0,05 г-ион/л)
MnO4 (0,03 г-ион/л)
CH3COOH (1моль/л)
Fe3+ (0,1 г-ион/л) Pt
7) H2(Pt)|HC104(5%4ibift p-p)||AgCl (нас. p-p)| Ag
8) Hg|Hg2Cl2 (тв), 2%-ный p-p I<C1||O,1 h. HCl|Ha(Pt)
В каком направлении пойдет соответствующая хими-
ческая реакция?
277. Вычислить константы равновесия окислительно-
восстановительных реакций:
1) 2HNO2+2I- + 2H+X2NOH-I2-|-2HaO
2) S40e 4-21“ ^2S2O3 44
3) h2S4-i2^2H+4- S4-2I“
4) hno24-nh4+^:n24-h+4-2h2o
5) 2Cr3+ + 6Fe8+ 4- 7H2OCr2O?~ -f- 6Fe2+ 4- 14H+
6) so2r+2i-4-4H+^:H2so3+i24-H2o
7) 2МпОГ 4- 5HNOa + H+ 2Mn2+ 4- 5NOr 4- 3H2O
51
8) Сга0?“ + 61~+ 14Н+ ^2Cr8++3I2 + 7H2O
9) 5Cra0?- + 6Mna+ + 22H+ 10Cr3+ + 6MnO?+11H2O
10) 2Fe8+4-SnC14~ + 2Cl-^: 2Fe2+ + SnC16~
В каком направлении пойдут реакции при смешении
эквимолярных количеств реагентов?
278. Вычислить равновесные концентрации ионов
МпО^-, Мп2+, Fe3* и Fe2+ в растворе, полученном смеше-
нием 20 мл 0,1 М КМпО4 и 20 мл 0,1 М FeSO4 при pH 0.
279. В 1 л раствора, содержащего 0,1 М Н2О2 и 1 М
НС1, растворили 33,2 г KI. Вычислить равновесные кон-
центрации Н2О2, I- и 12.
280. Вычислить равновесные концентрации ионов
S2- и NO~ в растворе, полученном растворением
0,0146 г ZnS в 5 мл ЗМ HNO3.
281. Сколько граммов Сг(ОН)з растворится в 5 мл
0,3 М Н2О2 при pH 14. Какова равновесная концентрация
НОГ в растворе?
282. Рассчитать равновесные концентрации ионов
Fe2+, Fe3+, I- и 12 в растворе, полученном растворением
16,60 г KI и 16,22 г FeCl3 в 1 л 1 н. кислоты.
283. Вычислить равновесные концентрации ионов
Сг8+, Сг2О?- и Н2О2 в растворе, содержащем 0,2 моль/л
СгС13 и 0,3 моль/л Н2О2 при pH 1.
284. К раствору 0,2 М MnSO4 добавили избыток
NaBiO3 при pH 0. Вычислить равновесные концентрации
ионов Мп2+, МпОГ и Bi3+.
285. Подобрать коэффициенты в следующих уравне-
ниях реакций:
1) МпОГ + 32- + Н2О — MnO(OH)a + S + OH~
2) MnOr + SO3- + H+-,Mn2+ + SOl_ + H2O
3) MnOr+NO2- + H+^Mn2+ + NO3~ + H2O
4) Cr3+NaBiO3+H+ - Cr2O72~ + Bi3+ H2O
5) Мпа+ + ВгО- + ОН-^МпОГ4-Вг- + Н2О
6) Co2+ + НОГ + K+ + H + —> K3Co (NO2)„ + NO + H2O
7) Cr2O7- + I“ + H+-Cr3+ + I2 + H2O
8) МпОГ4-С1- + Н+-^Мп2+ + С1а + Н2О
52
9) МпОГ-Н_4-Н+- Mna+ + IO3"+H2O
10) Cr3+ + Br2 + OH-^CrO4- + Br-+H2O
11) Mn2+4-S2O|- + H2O - M11O(OH)2+SO4“ + H+
12) cr3++s2Os~+h2o - cro2r+so2r+H+
13) H3AsO3 + М11ОГ + H+ — H3AsO4 + Mn2+ + H2O
14) SnCl2 + MiiOr + Cl--(-H+ — SnCl4 + Mn2+ + H2O
15) SbCir + BrO3~ + Cl- + H+-^ SbCir + Br~ + H2O
16) H3AsO4 + I~ + H+-.H3AsO3 + I3 + H2O
17) Fe3++ H2S —> Fe2+4-S-)-H+
18) NCV + H2S4-H+-^ no + s + h2o
19) ВгОГ-j-ВгГ Н+ --> Br24 H.,O
20) МпОГ + Cr3+ H2O - MnO (OH)2 + Cr2O2 ’ + H +
21) Mn2+ 4- PbO24 н + — MnO? + Pb2+ 4- H2O
22) Cr2O?“4-H2O2 + H+ — НгСгОв + Н2О
23) AgCl 4- Mn2+ + OH- Ag + MnO (OH)2 + Cl- + H2C
24) Cr (OH)7 + Na2O2 - CrO2~ + OH“ + Na+ + H2O
25) NOr4-Al + OH- + H2O-NH3+Al(OH)r
26) NiS-|-NOr + H+—> Ni2+4-S4-NO + H2O
27) Сг(ОН)Г4-Н2О2 + ОН- — СгОГ’ + Н2О
28) МпОГ + C2O.2 + H+ Mu3+ + CO24- H2O
29) Bi2S3 + NO3" + H+ Bi3+ + S + NO 4- H2O
30) i-+h2024-h+-i24-h20
31) SnCl2 + H2O2 + H+ + Ci- - > SnCl4 + H2O
32) Sb2S34- NOa- + H+ -> HSbO3 + HSO? + NO2 + H2O
33) SnS2 + NO3_ + H+ - H2SnO34-HSOr + NO2 + H2O
53
34) HaWO4+Zn + H+-.WaO8 + 2n,+ + HaO
35) As2S3 + NOF + H+ — H3 AsO4 + HSO? + NO + Ha°
36) Bis+ + Sn (OH)2- + OH — Bi + Sn (OH)1-
37) HgS 4-no? 4- h+ 4- ci- — Hgcil- 4- hso? 4- no4-h2o
38) SnS + H2O2 + ОН-— Sn (OH)i~ + so2- 4- H2O
39) As2S8 + NO? 4- H+ — H3AsO44- hsof 4- NO 4- HaO
40) AsOi“4-Al 4- H2O — AsH34- Al (ОН)Г+OH-
41) AsH34-Ag+4-H2O-> H3AsO34- Ag4*H+
42) SnCle-4-Zn + H+ — SnH44-Zn2+4-Cl~
43) NOr4-Mg4-H+—NH4+4-Mg2+4-H2O
44) H3AsO44-H2S-As2S34-S4-H2O
45) SO24-I2+H2O^SO4~+I-4-H+
46) Zn+NOr + OH- 4-HaO — Zn(OH)4-4-NH3
47) CO(NH2)2 + NOr4-H+-.CO24-Na + HaO
48) VO2+ 4- SnCl2 4- H+ 4- Cl" — VO2++SnCll-4- H2O
49) VO2+4-H2S4-H+- V2O2+4-S + H2O
50) Sbas64-H+4-ci--sbCi?~4-HaS4-s
51) Mo04"4-SnC!a4-Cl-4-H++SCN-^MoO(SCN)l~ +
4-SnCl4 + H2O
52) NO74-I- + H+ —NO4-Ia^HaO
53) SbCir4-Fe—Sb4-Fe2+4-Cl-
54) Sb4-NOr4-Cl-4-H+- SbC!6'4-NO+H2O
55) Br-4-PbOa4-H+-.Bra4-Pb’+4-HaO
56) Hg4-NOr4-Cl-4-H*^HgCl?“4-NO4-Ha0
57) H,AsO44- SnCl24-4-H+ + Cl- — As4-SnC13"4-HaO
54
Глава VI
ВЛИЯНИЕ ИОННОЙ СИЛЫ НА РАВНОВЕСИЯ
В РАСТВОРАХ ЭЛЕКТРОЛИТОВ
Вопросы для самопроверки
1. Что называют ионной силой раствора? Вычислить
ионную силу: а) 0,1 М НС1; б) 0,5 М НС1; в) 1,0М HNO3;
г) 0,05 М NaOH; д) 0,1 М СаС12; е) 0,5 М MgSO4;
ж) 1,0 М Na2SO4; з) 0,3 М А1С13; и) 0,5MScBr3;i<) 0,1 М
Al2(SOi)3.
2. Что называют активностью и коэффициентом ак-
тивности? Как связаны они между собой?
3. Привести уравнение- предельного закона Дебая
для коэффициента активности и уравнение Дэвиса.
4. Что называют солевым эффектом? С чем он свя-
зан?
5. Какое действие оказывает «индифферентный» элек-
тролит на растворимость малорастворимых солей?
6. Чем объясняется увеличение силы слабых кислот в
присутствии «индифферентных» электролитов?
7. Как влияет увеличение ионной силы на устойчи-
вость комплексных соединений?
8. Привести соотношение между концентрационной и
термодинамической константами: а) устойчивости комп-
лексных соединений; б) диссоциации слабых кислот.
9. В какую сторону изменится pH 0,1 М CHjCOOH
при введении 0,1 моля NaCl?
10. В какую сторону изменится pH 0,1 М NH3 при вве-
дении 0,1 моля КС1?
Решение типовых задач
Пример 1. С учетом коэффициентов активности рассчитать сте-
пень диссоциации и pH: 1) 0,1 М HF; 2) 0,1 М HF в присутствии
0,5 М NaClO*.
Решение. 1. Ионная сила раствора создается за счет диссо-
циации HF и Н2О
+ F-
Находим приближенно концентрацию ионов Н+ при диссоциа-
ции HF
[Н+] = - ]/б,8.10-4.0,1 = 0,825- 10-2 =,
= 8,25-10~3 г-ион/л.
S5
Следовательно, ионная сила раствора приближенно равна
'=+сг-4~) -
= -^-(8,25-10-3-1 + 8,25-10-3.1) = 8,25.10-3.
(Вклад в ионную силу за счет диссоциации воды пренебрежимо
мал.)
Находим константу диссоциации HF при этом значении ионной
силы по уравнению Дэвиса:
/ '1/2 \
рК = р№-Дг2.о,5 -------_ 0,2 / ,
\ 1 + /1/2 /
где Д-г*2 ^-^продуктов реакции ^исходных веществ*, /I, т—
стехиометрические коэффициенты; г — заряд иона.
В данном случае
Дг2 = г2н+ + г2_- z2hf = 1 + 1 - 0 = 2.
Подставив численные значения в ранее написанное уравнение,
получаем:
р/< =3,17—2-0,5 ( —^8'25,10 2----_ 0,2-8,25-10—3) =
\ 1 + /8,25-Ю-з /
= 3,09, /<HF = 8,12-10-4.
С помощью этой константы рассчитаем более точно концентра-
цию ионов Н+:
[Н+] = /8,12-10-4-ОД =0,90-10-2 = 9,0-Ю-з.
Следовательно, более точно / = 0,009. Константа диссоциации HF
при /=0,009 равна
/ /9-Ю-з \
рК = 3,17— 2-0,5 ------ —— 0.2 9-Ю-з =3,08.
\ 1+ /9-Ю-з /
Эта величина только на 0,01 логарифмической единицы отли-
чается от значения, полученного в предыдущем приближении, поэто-
му для расчета степени диссоциации а и pH оставляем Khf =
= 8,12-10_‘. В соответствии с этой константой [Н+]=9,0-10-3. Сле-
довательно, pH = 2,05. Отсюда
9,0- Ю-з
а = ——— = 9,0-10-2, или 9,0%.
56
2. Ионная сила раствора создается эа счет диссоциации HF и
П2О, а также за счет полностью диссоциированного NaClO.: '
1 / о 2 2 2 „ 2 \
/ =- — (CNa + 2Na+ + CC1O~*CIO- + СН+2Н+ + CF-*F~ j =
= ~ (0,5-1 + 0,0-1 + 0,01-1+0,01-1) = 0,51.
Константа диссоциации HF при / = 0,51 равна
p/<HF = 3,17— ^°’~1-----+ 0,2-0,51 =2,85, К = 1,4-10-3.
HF 1 + /(\5Т
Концентрацию ионов Н+ рассчитываем по формуле [Н+]=
= V KHFCHF
[Н+]= /1,4-10-3.0,1 = 1,19-10-2, pH =1,92.
Степень диссоциации
С 0,
ghf
Пример 2. По значениям ПР и констант устойчивости хлорид-
ных комплексов свинца рассчитать растворимость РЬС12 в
0,6 М КС1.
Решение. В насыщенном растворе РЬС12 существуют следу-
ющие равновесия:
РЬС12 (к);£РЬ2+ +2С1- (1)
РЬС12(к)^1РЬС1++ CI- (2)
РЬС12 (K)z£PbCI2 (р) (3)
PbCl2 (к) + Cl-^tPbCIf (4)
При этом
<=ПР-рьси = [Pb2+][Cl-]2YPb2+Y^_ = nPpbCI>Ypb2+Y^_ =
= 1,6-10-5,
К2= [PbCl +] [Cl~] VPbC1+ Vcr - = ПРрьс1,₽РьС1+ —
= 1,6-10-5-41,7 = 6,66-10-4,
К°3 = [PbCl2] уРЬС11 = ПР°РЬС11₽;ЬС11 = 1,6-10 -5.2,76-102 =
= 4.32-10-3,
о [РЬС13-] YPbCi-
^4 = "[ci-f ‘~7~Z-----------nPPbC!.3pbCl
= 1,6-10-5-1,1-102= 1 ,76-10-3.
В первом приближении принимаем, что ионная сила определяет-
57
ся только хлоридом калия (/=0,6), и рассчитываем константы рав-
новесия при этом значении ионной силы. В реакции (1)
= 2z^_ 4- 2^2+ — 4bCi. = 2 + 4—0 = 6,
' /’/2 \
рПР = рПР’—Дг2-0,5 --------— — 0,2/ =
\ 1 + /1/2 /
{ /оТб \
= 4,80 — 6.0,5 ——— 0,2-0,6 =3,85,
\1 + /0,6 /
тогда ПР=1,410-‘. В реакции (2)
Дг2 “ 4bCi+ + 'ci--г₽ьс1. = 1 + 1 - 0 = 2,
(5)
/ /О \
_ 1g/С2 = 3,18— 2-0,51 —0,2-0,6 =12,86,
\1 + /о,б /
/<2=1,4 10-3,
1g Кз = lg lg^4 = lgK4 (так как [Д^2 = 0).
Растворимость PbClj равна общей концентрации свинца в рас-
Spbci. = [РЬ2+] + [PbCl+] + [PbC12] + [PbCl^] -
riPphCi, ^2
= [Cl-]2 + [С1-] + *3 + /<4 [С1-].
Подставляем в уравнение (5) значения констант и [С1~] = 0,6:
1,4-10—4 1,4-10-8
Sphri = • / До" + -Нг;— + 4,32-10-3 + 1,76-10-3-0,6 =
РЬС1* (0,6)3 0,6
= 3,89-10-4 + 2,33- 10-з + 5,37- 10-з = 8,09- 10—з.
Рассчитываем более точно равновесную концентрацию хлорид-
нона:
[С1 -] = С’с1 + 2 [РЬ2+] + [РЬСI + ] - [РЬС1^]
[С1-] = 0,60 + 2-3,89-10-4 + 2,33-10-3— 1,05-10—з = 0,602 .
Эта величина незначительно отличается от использованной для рас-
чета растворимости, следовательно, нового приближения можно не де-
лать. Более точно ионную силу находим суммированием:
/ = 1/2 ( CNa+4.» + Cci-41- + СрьЗ+4ь'2+ + CPbCl+4bCl+ +
4- С г2 ,-^ = 1/2(0,6-1 + 0,602-1 + 4-10-4-4 +
rDGlg rDUlg y
+ 2,33-Ю-з. 1 + 1,05 10—8.1) = 0,606.
5S
Полученное значение ионной силы практически совпадает с задан-
ным при расчете констант равновесия, следовательно, необходимость
в новом приближении отпадает.
Задачи
286. С учетом коэффициентов активности рассчитать
степень диссоциации и pH растворов: 1) 0,1 М HF;
2) 10-3М НС1; 3) 0,2 М H2SO4; 4) 0,1 М Н3РО4; 5) ОД М
СНзСООН; 6) 0,1 М НСООН; 7) 0,1 М H2S.
287*. Учитывая солевой .эффект, рассчитать pH рас-
творов: 1) 0,1 М LiCl; 2) 0,3M NaBr;3) 0,7 М KI; 4) 0,1 М
СаВг2; 5) 0,05 М MgCl2; 6) 0,2 М SrCl2; 7) 0,1 У. MgSO4.
288*. Рассчитать степень диссоциации и pH 0,1 М
СНзСООН в присутствии: 1) 0,1 М NaCl; 2) 0,8 М NaCl;
3) 0,05 М СаС12; 4) 0,2 М СаС12; 5) 0,05 М А1С13; 6) 0,1 М
А1С13; 7) 0,02 М Al2 (SO4)3-
289. Рассчитать pH ацетатного буферного раствора,
содержащего уксусную кислоту и ацетат натрия одинако-
вой концентрации: 1) 0,1 М; 2) 0,5 М; 3) 1,0 М.
290. Рассчитать pH аммонийного буферного раствора,
содержащего хлорид аммония и аммиак одинаковой кон-
центрации: 1) 0,1 М; 2) 0,5 М; 3) 1,0 М.
291. Рассчитать pH ацетатного буферного раствора,
содержащего 0,5 М СНзСООН, 0,1 М CH3COONa и 0,5 М
NaCl.
292. Рассчитать pH аммонийного буферного раствора,
содержащего 0,5 М. NH3, 0,1 М NH4C1 и 0,5 М КС1.
293. По значению ПР рассчитать растворимость
КС1О4 с учетом коэффициентов активности.
294*. По значению ПР рассчитать растворимость
BaSO4 в присутствии: 1) 0,1 М. LiCl; 2) 0,5М NaBr;
3) 0,1 М НС1; 4) 0,2 М MgCL; 5) 0,2 М MgSO4; 6) 0,2 М
K2SO4.
295. По значению ПР и констант устойчивости хлорид-
ных комплексов свинца рассчитать растворимость РЬС12
в присутствии: 1) 0,2 М NaCl; 2) 0,25 М. СаС1;>.
296. По значению ПР и констант устойчивости иодид-
ных комплексов свинпа рассчитать растворимость РЫ2 в
0,1 М Lil.
* В задачах, обозначенных звездочкой, все соли считать диссо-
циированными нацело.
ЧАСТЬ ВТОРАЯ
КОЛИЧЕСТВЕННЫЙ АНАЛИЗ
Настоящий раздел содержит задачи на так называе-
мые классические методы количественного анализа —
гравиметрический (весовой) и титриметрические (объем-
ные). В этом разделе приведены задачи, в которых точка
эквивалентности фиксируется при помощи индикаторов
(т. е. по изменению цвета раствора или выпадению осад-
ка). Задачи на титриметрические методы, в которых точка
эквивалентности определяется с помощью физико-химиче-
ских измерений (потенциометрическое титрование, ампе-
рометрическое и т. д.), а также задачи на кулонометрию
и некоторые другие вынесены в раздел физико-химиче-
ских методов анализа.
Статистическая обработка результатов анализа, рас-
чет ошибок и т. д. вынесены в гл. XXII, задачи из кото-
рой рекомендуется использовать и при изучении настоя-
щего раздела.
Глава VII
ГРАВИМЕТРИЧЕСКИЙ (ВЕСОВОЙ] АНАЛИЗ
АНАЛИТИЧЕСКИЕ ВЕСЫ И ВЗВЕШИВАНИЕ
Решение типовых задач*
Пример 1. Определить пулевую точку весов АДВ-200, если по
оптической шкаЛб,- имеющей нуль в середине, были сделаны отсчеты:
0,0; +0,1; —0,1 (дел. шкалы).
Решение. Для определения нулевой точки в АДВ-200 делают
три отсчета по оптической шкале после полной остановки стрелки
и вычисляют среднее арифметическое по формуле
. _ ^1 + ^2 + С
* Здесь приведены примеры расчетов и задачи, связанные с ис-
пользованием автоматических демпферных весов, которые в настоя-
щее время широко применяются в аналитической практике.
60
„ 0,0 + 0,1 — 0,1
В данном случае /0 =----------------=0,0.
3
Пример 2. Определить постоянство показаний весов АДВ-200,
если при трехкратном определении нулевой точки были получены
результаты: 0,0; —0,5 —1,0 (дел. шкалы).
Решение. Постоянство показаний весов АДВ-200 определяет-
ся как среднее отклонение от средней точки из трех определений:
0,0— (—0,5) =0,5 дел.; —0,5—(—0,10) =0,5 дел.
Постоянство показаний весов АДВ-200 равно 0,5 дел. микро-
шкалы. По паспорту допускается вариация показаний не более одно-
го деления микрошкалы, т. е. не более 0,1 мг.
Пример 3. Определить цену деления весов АДВ-200 без нагруз-
ки, при 10 и 100%-ной нагрузке, если при проверке получены сле-
дующие результаты:
Нагрузка на чашки, г Положение равновесия (дел. шкалы) Нагрузка на чашки, г Положение равновесия (дел. шкалы)
левая правая левая правая
0 0 /-1 = 0,0 20 20 /•5 = 0,0
0 10* /.2= Ю0,0 20 20+10* L6 = 100,0
0 0 Л3 = 0,5 200 200 /-7 = 0,5
10* 0 /.4 = —99,5 200+10* 200 £8 = —99,5
• Масса выражена в миллиграммах.
Решение. Цена деления So микрошкалы без нагрузки вычис-
ляется по формуле
(£2-Z.1) + (Z.3-/4) ’
где г — образцовая гиря с номинальной массой 10 мг;
2-10
Sn =----------------------------------= 0,1 мг/дел.
0 (100,0 —0,0) + 0,5—( — 99,5)
Цена деления микрошкалы при 10 и 100%-ной нагрузке вычис-
ляется соответственно по формулам:
г ' 10
Slno. =---------=--------------= 0,1 мг/дел;
10'» Z6— L5 100,0 — 0,0
г 10
Slnno, =----------=-----------------= 0,1 мг/дел.
юо% L7-Ls 0,5— (-99,5)
Пример 4. Чему равна масса образца, если при взвешивании на
весах АДВ-200 он уравновешен гирьками 10 г + 2 г, на планке поме-
щены кольцевые разновесы 200 мг+ 20 мг, отсчет по мнкрошкале
+ 8,6?
Решение. Масса образца равна алгебраической сумме разно-
весов и отсчета по оптической шкале с учетом знака:
10,0000 + 2,0000 + 0,2000 + 0,0200 + 0,0086= 12,2286 г.
61
Пример 5. Определить погрешность из-за неравноплечности ве-
сов АДВ-200, если при проверке получены следующие данные:
К11*ру>ка на чашки, г Положение равновесия (дел. шкалы) Нагрузка на чашки, г Положение равновесия (дел. шкалы)
левая правая левая правая
0 0 £1==0 200(1) 200 (2) 2-5 = 3,0
20(1) 20 (2) ^2 = 2,0 200 (2) 200(1) /•6 = 4,0
20(2) 0 20(1) 0 LQ ~ о 11 Я 0 0 Z.7 = 0,5
Решение. Погрешность от неравноплечности весов при
10%-ной нагрузке вычисляется по формуле
/ Z-2 -4- Z-з / 1 + /-4 \ «
2 - 2
/2,0 4-1,5 \
Ую% ==(-------2-“°) 0,1 =0’18 ~ °’2 мг’
где 5 — цена одного деления микрошкалы, равна 0,1 мг.
Погрешность от неравноплечности при 100%-ной нагрузке вы-
числяется аналогично:
/ /-5 + Lf, Z-4 + L 7 \
&юо%—I 2 2 Р’
/3,0 4- 4,0 0 4- 0,5 \
У100% — 2 2 j 0,1 — 0,33 ~ 0,3 мг.
Для достижения равновесия необходимо прикладывать допол-
нительный груз на правую чашку, следовательно, правое плечо коро-
че левого. При взвешивании погрешность следует вычитать из мас-
сы гирек на правой чашке весов.
Пример 6. При двойном взвешивании тигля на весах АДВ-200
получены следующие результаты: 4,3552 г — на левой и 4,3556 г —
на правой чашке весов. Чему равна действительная масса тигля?
Решение. Действительная масса при способе двойного взве-
шивания равна среднему геометрическому из результатов обеих взве-
шиваний:
Р
Так как обычно и Рг различаются мало, что Р можно вычислить
как среднее арифметическое:
Р _ ZT + Р>
2
Следовательно, действительная масса тигля равна
————— 4 «3552 I 4 3556
Р-/4,3552 4,3556 » 4,3554 г, Р = —--------------= 4,3554 г.
Пример 7. Определить массу колбы с поправкой на массу гирь,
если она уравновешена разновесами 10 г+5 г+1 г+500 мг+
+ 200 мг+20 мг, а отсчет по микрошкале весов АДВ-200 равен
2,7 мг. Поправки к номинальной массе разновесов равны: 10 г
(+0,5 мг); 5 г (+0,3 мг); 1 г (+0,2 мг); 0,5000 г (—0,08 мг);
0,2000 г (—0,05 мг); 0,0200 г (+0,03 мг).
Решение. Масса колбы равна 10,0000+5,0000+1,0000+0,5000+
+0,2000+0,0200+0,0027+0,0005+0,0003+0,0002 — 0,00008 — 0,00005+
+0,00003=16,7236 г.
Задачи
297. Определить нулевую точку весов АДВ-200, если
по оптической шкале, имеющей нуль в середине, сделаны
отсчеты: 1) 0,2; 0,1; 0,3; 2) 0,0; —0,2; +0,3; 3) 0,5;
0,6; 0,4.
298. При определении нулевой точки весов АДВ-200
показания оптической микрошкалы были: 0,0;—0,5; +0,5.
Чему равны нулевая точка и вариация показаний весов?
299. При проверке весов АДВ-200 получены следую-
щие данные:
Нагрузка на чашки, г Положение равновесия (дел. шк.) Нагруака на чашки, г Положение равкомсин (дел, шк.)
левая правая левая правая
0 0 /i = 0 0 0 /7 =0,1
0 10* /2 = 100,1 200(1) 200 (2) Да =2,0
0 0 /3 = 0,2 200(1) 200(1)+Ю* Lt =101,5
10* (1) 0 /< = —99,5 20(2) 20(1) £ю = 4,0
20(1) 20(2) /5 = о 200 (2) 200(1) £ц = 4,5
20(1) 20 (2)+10* /•6=99,8
* Масса выражена в миллиграммах.
Определить: 1) цену деления микрошкалы без на-
грузки; 2) цену деления микрошкалы при 10 %-ной на-
грузке; 3) цену деления микрошкалы при предельной
нагрузке; 4) постоянство (вариацию) показаний нена-
груженных весов; 5) погрешность от неравноплечности
при 10%-ной нагрузке; 6) погрешность от неравноплеч-
ности при предельной нагрузке.
300. На обе чашки весов АДВ-200 поместили разно-
весы с номинальной массой 20 г. Отсчет по оптической
48
шкале —3,0 дел. Разновесы поменяли местами и получи-
ли отсчет —2,0 дел. Цена деления шкалы 0,1 мг/дел.
Нулевая точка равна 0,0. Определить погрешность (мг)
из-за неравноплечности весов.
301. При взвешивании бюкса на левой чашке весов
АДВ-200 его уравновесили гирями 5 г + 200 мг + 100 мг +
+ 20 мг, показания оптической шкалы+ 6,8 мг. При взве-
шивании бюкса на правой чашке на левую поместили
гири 5 г+1 г, на планке находились кольца 500 мг +
+ 100 мг + 50 мг + 20 мг, показания оптической шкалы
+ 2,8 мг. Какова действительная масса бюкса с учетом
неравноплечности весов?
302. В выпускном аттестате весов даны следующие по-
правки к номинальной массе гирь:
Номинальная масса гири, г Поправка, мг Номинальная масса гири, г Поправка, мг Номинальная масса гири, г Поправка, мг
100 +0,5 2(1) +0,2 100* (2) -0,04
50 +0,3 2(2) -0,4 50* -0,05
20 +0,7 1 -0,3 20* -0,02
Ю(1) +0,5 500* +0,01 10* (I) +0,04
Ю(2) +0,3 200* -0,01 10* (2) +0,01
5 +0,4 100*(1) 0,00
* Масса выражена в миллиграммах.
Определить массу образца с поправкой к номинальной
массе гирь, если при взвешивании образец уравновеси-
ли разновесами:
1) 20 г+10 г (1) +1 г + 500 мг + 200 мг+10 г (показа-
ние шкалы +5,2 мг);
2) 20 г+10 г (2) +2 г (1) +200 мг+100 мг (1) +
+ 20 мг (показание шкалы —2,5 мг);
3) 10 г (1)+5 г + 2 г (2)+50 мг + 20 мг (показание
шкалы +7,8 мг);
4) 1 г + 500 мг+ 100 мг (2) +20 мг (показание шкалы
+ 4,7 мг);
5) 500 мг + 200 мг+100 мг (1)+20 мг+Ю мг (1) +
+ 10 мг (2) (показание шкалы —7,7 мг).
64
РАСЧЕТЫ В ГРАВИМЕТРИЧЕСКОМ (ВЕСОВОМ)
АНАЛИЗЕ
Вопросы для самопроверки
1. Назвать основные операции гравиметрического ана-
лиза.
2. Что называется формой осаждения и какие требо-
вания к ней предъявляются?
3. Назвать наиболее пригодную форму осаждения при
определении: а) кальция; б) бария; в) свинца. Какое сое-
динение наиболее пригодно в качестве формы осаждения:
а) океихинолят алюминия или А1(0Н)3; б) диметилгли-
оксимат никеля или Ni(OH)2; в) океихинолят магния или
MgNH4PC>4? Объяснить выбор.
4. Какое соединение можно предложить в качестве
формы осаждения при весовом определении Mg, Са, Cd,
Си, Fe, Bi, Zn, Ba, Pb, К, P?
5. Что такое весовая форма и какие требования к ней
предъявляются?
6. Какое соединение наиболее пригодно в качестве ве-
совой формы при количественном определении Са, Pb, Sr,
Ni, Zn, Си?
7. Как влияют на полноту осаждения: а) температура
раствора; б) количество осадителя; в) присутствие по-
сторонних электролитов?
8. Какую цель преследуют, употребляя при осажде-
нии избыток осадителя? Почему нельзя брать слишком
большой избыток?
9. Что такое относительное пересыщение? Как оно
связано с числом центров кристаллизации, скоростью
кристаллизации, размером кристаллов?
10. Как влияют на размер кристаллов осадка: а) тем-
пература раствора; б) количество осадителя; в) присут-
ствие в растворе посторонних электролитов?
11. Как зависит растворимость осадка от размера
его частиц?
12. Какие процессы происходят при выстаивании рас-
творов и созревании кристаллических осадков?
13. Почему осаждение сульфата бария производится:
а) из разбавленных растворов; б) в кислой среде; в) при
нагревании растворов; г) в присутствии солей аммония?
14. Что такое соосаждение? Какие физико-химические
процессы в растворе приводят к соосаждению?
3-4022 М
15. В чем сущность осаждения с коллектором? При-
вести примеры.
16. Как влияют на чистоту осадка: а) присутствие в
растворе солей аммония; б) температура раствора;
в) скорость осаждения?
17. Что такое адсорбция? Указать факторы, влияющие
на адсорбцию ионным кристаллом. Что такое обменная
адсорбция?
18. Какие ионы будут адсорбироваться на поверхно-
сти осадка в начале осаждения: а) ВаС12 раствором
Na2SO4; б) СаС12 раствором (NH4)2C2O4; в) Na2SO4 рас-
твором ВаС12?
19. Какую соль бария — Ba (NO3)2, ВаВг2 или
ВаС12—целесообразно использовать в качестве осадите-
ля для получения наиболее чистого осадка BaSO4?
Объяснить, почему?
20. Какие соединения—КаС2О4, Na2C2O4, Н2С2О4,
(NH4)2C2O4 — следует использовать для осаждения
кальция?
21. Что такое окклюзия? Привести примеры.
22. Какие аналитические приемы применяются для
уменьшения адсорбции и какие — для уменьшения ок-
клюзии?
23. С какой целью используется переосаждение?
24. Каковы условия осаждения аморфных осадков?
Почему осаждение их проводят из концентрированных
растворов?
25. Как влияют количество промывной жидкости и
кратность промывания на эффективность промывания?
26. В чем сущность метода декантации?
27. Какие растворы используются в качестве промыв
ной жидкости при весовых определениях? Привести при-
меры.
28. В каком случае потери при промывании осадка
СаС2О4 будут наибольшими и в каком — наименьшими:
а) 100 мл воды; б) 100 мл 0,1 М- (NH4)2C2O4; в) 500 мл
воды?
29. Что такое фактор пересчета и каков его физиче-
ский смысл?
30. Составить расчетную формулу для определения
процентного содержания вещества по следующим дан-
ным: а —навеска образца; g — масса полученного
осадка; F — фактор пересчета.
31. Вычислить pH раствора, необходимый для количе-
ственного разделения: a) Fe3+ и Mg2+; б) Al34' и Mg24-.
32. Назвать наиболее распространенные органические
реактивы, которые используются в весовом анализе. Ка-
кие достоинства имеют эти реактивы?
33. Как при помощи оксихинолина провести разделе-
ние ионов: a) Al34- и Mg2+; б) А13+ и Cd2+: в) Fe34’
и А13+?
34. Привести примеры количественного разделения
ионов путем окисления или восстановления одного из
компонентов смеси.
35. Какие физико-химические методы используются
для разделения ионов?
36. Какие весовые способы применяются для опреде-
ления: а) магния, олова, сульфида; б) меди, кальция,
иодида; в) алюминия, молибдена, фосфата; г) цинка,
серебра, сульфата; д) железа, висмута, бромида;
е) свинца, ртути, хлорида; ж) бария, марганца, хромата.
37. Как проводится гравиметрическое определение:
a) SiO2 в силикате; б) Pb, Си, Fe, Zn в рудах; в) Р2О5 в
фосфоритах, суперфосфатах, преципитатах; г) S, Fe в
колчедане; д) S в каменном угле; е) Си, Pb, Zn в брон-
зе; ж) РЬ в латуни; з) СаО и MgO в цементах.
38. Указать преимущества и недостатки гравиметри-
ческого анализа.
Решение типовых задач
Пример 1. Вычислить фактор пересчета для определения калия,
если после осаждения его в виде KzPtCU получена весовая форма
платины.
Решение. Чтобы иметь 1 г-атом платины, необходим 1 моль
KjPtCle, на получение которого идут 2 г-иона К+. Фактор пересчета
равен
F =
2ЛК 2-39,102
= 0,4009,
ЛР( 195,09
где Л к — атомный вес калия; 4pt-—атомный вес платины.
Пример 2. Рассчитать навеску силикатной породы, содержащей
около 5% СаО, которая необходима для определения кальция в ви-
де CaSOt, если g — масса осадка CaSO4 0,3 г.
Решение. Если Мс»о — молекулярный вес определяемого ве-
щества, a -'Mc»so —молекулярный вес весовой формы, то
из Л1сэо г получается Afcgso г весовой формы
» X » » g » » »
3'
47
Из пропорции следует
^СаО
X S=---------Р.
^CaSO, •
Зная примерное содержание СаО в анализируемом веществе
(Ь %), рассчитаем навеску а для аналитического определения:
ле-100 ^сао
а —-------
b
При определении СаО
100 100
^CgSOt & Ь
виде CaSO4 фактор пересчета равен
Лй^_=+±_0.1|19.
^CaSO4 136,14
Навеска силикатной породы равна
100
а = 0,4119-0,3 —— = 2,5 г.
в
Вычисляют навеску приближенно, а взвешивают с обычной ана-
литической точностью (±0,0002).
Пример 3. Вычислить потери (г и %) за счет растворимости
осадка СаС2О4-Н2О, если к 20 мл 0,1 М СаС12 добавили: а) эквива-
лентное количество 0,1 М (NH4)2C2O4; б) полуторный избыток 0,1 М
(NH4)2C2O4.
Решение а) Масса осадка СаС2О4 Н2О (М = 146,12), образу-
ющегося при осаждении, равна
0,1'2° 146,12 = 0,2922 г СаС2О4• Н2О.
1000 2
Объем раствора после добавления эквивалентного количества
осадителя 20 + 20=40 мл; ПРСаС2О< = 2,3-10~э. Обозначим [Са2 + ] =
= [C2Ot] = х г-ион/л-
Отсюда
[Са2+] [С2О*-] =х2,
х =/2,3-10-9 = 4,80-10-5 г-ион/л.
Следовательно, потери за счет растворимости СаС2О4-Н2О со-
ставляют 4,80 - 10~5 моль/л. Вычислим, сколько граммов СаС2О4-Н2О
находится в 40 мл раствора:
4,80-IQ—5-146,12-40
1000
= 2,806-10-4 г СаС2О4-Н2О.
Потери за счет растворимости составляют
2,806-10-4-100
0,2922
= 0,096,
или'л 0,1%,
б) При использовании полуторного избытка осадителя масса
осадка остается практически неизменной — 0,2922 г CaCjOt-HjO.
Объем раствора после осаждения равен 20+20-1,5 — 50 мл. При до-
68
бавлении полуторного количества осадителя избыток его составляет
10 мл 0,1 М (NH4)2C2O4. Вычислим концентрацию ионов в по-
лученном растворе:
Г 2-1 0,1-10
[С2О4 ] = ——--------= 0,02 г-ион/л.
Обозначим через х моль/л растворимость СаС2О4. Тогда
[Са2+] = х г-ион/л, [С2О^~] = 0,02 4- х г-ион/л. Исходя из вели-
чины ПР, запишем
[Са2+] [С2О’_] = х (0,02 + х) = 2,3-10-9.
Так как х<0,02, то 0,2-Ь х ~ 0,02, следовательно, х-0,02=
=2,3 • 10_*. Отсюда
2,3-10-9
X=-L—--------=1,15-10-7
0,02
Растворимость СаС2О4 1,15-10-’ моль/л.
за счет растворимости в 50 мл составляют
1,15-10-7-146,12-50
= 8,40-10-7 г
г-ион/л.
Следовательно, потери
1000
СаСзСЦ- HjO,
или
8,40-10-7-100
0,2922
= 2,9-10-1%.
Пример 4. Сколько процентов составят потери за счет раство-
римости при промывании 0,2 г осадка Mg(OH)2 250 мл воды? Какова
должна быть концентрация аммиака в промывной жидкости, чтобы
потери при промывании осадка таким же объемом составляли не
более 0,1%?
Решение. На основании nP = [Mg2+][OH~]2 = 6,0-10~10 опре-
деляем концентрацию Mg2+ и равную ей концентрацию Mg(OH)2 в
водном насыщенном растворе.
Обозначим через х моль/л растворимость Mg(OH)2, тогда
[Mga+] = x г-ион'л. Отсюда [ОН~] = 2х г-ион/л. Исходя из величины
ПР, запишем
х-(2х)2 = 6,0-10-ю,
-ю
----= 5,31 10—1 г-ион/л.
Значит, потери за счет растворимости Mg(OH)2 (Af=58,320) в
250 мл составляют
5,31 -10—1-58,320-250 „ „
---- ---------= 7,74-10—3 г Mg(OH)2,
1000
или
7,74-10-3.100
При использовании в качестве промывной жидкости раствора
аммиака растворимость Mg (ОН), понижается за счет введения одно-
«9
жмеииих « осадком ионов ОН-. Зная, что потери должны составлять
*1%, ЖахедЖм растворимость Mg(OH)i в моль/л:
• ,2-0,1.1000
°1137-10-5 моль/л'
Следовательно, [Mg2+J—1,37-10-* г-ион/л.
Обозначив концентрацию [ОН-] через х, составляем на основа-
нии произведения растворимости уравнение
6,0-10—ю= [Mg2+] [ОН-]2= 1,37-Ю-s..Г2,
6,0-10-ю
1,37-10-5
= 6,62-10—3 г-ион/л.
На основании константы диссоциации NHS
[NH+] [ОН-]
[NH3]
начисляем кенцентрацню NHa в растворе, в котором [ОН-]=
•,8210-“ г-иои/л. Так как в водном растворе аммиака [NH^"]«
«•(ОН'*1], те же жеястанты диссоциации следует
гми , [NH4+] [°н~1 (6,62-10-3)2
s " ^NH, ~ 1,76-10-5
2,5 моль/л.
ржмвр 6. Йе навески каменного угля 2,6248 г после соответ-
ствуйте* ебработки получили осадок BaSO4 массой 0,3248 г. Вы-
числять процентное содержание серы в каменном угле. Пересчитать
пржцвитнее содержание серы на абсолютно сухое вещество, если со-
держание влаги в нем 2,58%.
Решение. Если Лэ — атомный вес серы, a AfBaS0 —молеку-
лярный вес весовой формы, то
из Л5 г получается Л4ВаЗО1 г
х •= g —------= gF-
* X * » g » Л1 Ba SO,
Если в а (г) образца содержится х (г) S, то процентное содержа-
ние (fe) равно:
х 100
4 =— 100 = Fg-------,
а а
32,064 100
b = -0.3248 —- - = 1,70%.
233,40 2,6248 /0
Зная процентное содержание исследуемого элемента и влажность
материала с % Н2О, найдем процентное содежание серы в абсолют-
но сухом веществе:
fe-lOp 1,70-100 о
100—с ~ 100 — 2,58 -1, % '
Яример 6. При епределении окислов щелочных металлов из об-
рдздв «ликатной породы 1,2505 г выделили смесь NaCl и КС1 мас-
сбйВ, 15(50 г.
fe' =
70
После многократной обработки этой смеси серной кислотой полу-
чили сульфаты NasSOt и KaSO* массой 0,1800 г. Вычислить процент-
ное содержание Na2O и КаО в силикатной породе.
Решение. Обозначим через х число граммов Ка4О в обраеже,
a КаО — через у. Следовательно,
2^NaCI
-------- г NaCl
^Na.o
2iMKCl
.и--------- > KC1
^K.O
2-74,56 E
, _ ——!— = 0,1501.
61,98 1 ’ 94,20
Масса Na>SO( и KaSOa, полученных из этой смеси, равна!
^Na.SO, , A1K,SO4
ас —------------------+ у ---------= 0,1800,
™Na,0 ^К.О
142,04 174,27
х --------4- у----------= 0,180®.
61,98 ” 94,20
Решаем полученные уравнения и находим:
х = 0,0533 г NaaO, у = 0,0313 К,О,
Na2O, % = 0.0533..100 д426%.
1,2505
из л г Na2O получится х
> у» К2О
2'58,44
4- У
г, ~ а, 0,0313-100 о гПо/
К»О, ----------——— = 2,50%.
1,2о05
Задачи
303. Вычислить фактор пересчета в следующих при-
мерах:
Вари- анты Определя- емое вещество Весовая форма Вари- анты Определя- емое вещество Весовая ферма
1 Na2S2O3 ВаЗО4 11 Pb3O4 PbSO4
2 Ва BaSO< 12 Fe3O4 Fe2O3
3 А1 AloOa 13 N (NH4)2 PtClg
4 Na2O NaCl 14 CuO CuSCN
5 СаСО3 CaSO4 15 K2O K2PiCI6
6 СаО CaCO3 16 Ag2O AgCl
7 СЭз(РО4^2 СаО 17 MoOj (NH4)3PO4'12MoOa
8 FeO Fe2O3 18 PA (NH4)3PO412MoO3
9 FeSO< Fe2O3 19 К k2so4
10 Н3РО4 Mg2₽A 20 MgO Mg2P2O?
304. Вычислить фактор пересчета Для определения
NH3 по хлорплатинатному методу, при котором весовой
формой является металлическая платина (NH3—►
-^(NH4)2PtCle^Pt).
305. Вычислить фактор пересчета, если при опреде-
лении мышьяка сначала осадили As2S3, затем окислили
серу до SO4-,осадили сульфат хлоридом бария и взве-
сили BaSO4?
306. Анализ карбида кальция выполняли по схеме:
СаС2—*Н2С2—>-Ag2C2—>-AgCl. Вычислить фактор пере-
счета для определения СаС2.
307. Определение содержания серы выполняют по
схеме: S—>H2S—>-CdS—*CuS—>-CuO. Вычислить фак-
тор пересчета для определения S по СиО.
308. Вычислить фактор пересчета для определения
HF, если анализ выполняли по схеме: HF—>CaF2—>•
—nCaSO4.
309. Для определения сульфата в растворе Fe2(SO4)3
осадили Fe(OH)3 и после прокаливания осадка получи-
ли весовую форму Fe2O3. Вычислить фактор пересчета.
310. Вычислить фактор пересчета для определения
Р2О3, если анализ выполняли по схеме: Р2О3—>РО^~—>
—HNH4)3PO4- 12Mo03—*-РЬМо04.
311. Какую навеску пирита, содержащего около 30%
серы, нужно взять для анализа, чтобы получить 0,3 г
осадка BaSO4?
312. Сколько вещества, содержащего около 50%
железа, следует взять для анализа, чтобы масса прока-
ленного осадка Fe2O3 была 0,1 г?
313. Какую навеску Fe3O4 следует взять для получе-
ния 1,0 г Fe2O3?
314. Рассчитать навеску фосфорита, содержащего
около 20% Р2О3, необходимую для получения
0,3 Mg2P2O7.
315. Какую навеску цемента, содержащего около 20%
магния, следует взять для анализа, чтобы получить 0,3 г
осадка оксихинолята магния Mg(C9H6ON)2?
316. Какие навески сплава, содержащего около 65%
РЬ и 15% Sn, потребуются для определения этих эле-
ментов, если свинец определяют в виде PbSO4 (масса
осадка 0,5 г), а олово в виде SnO2 (масса осадка 0,2 г)?
317. Какую навеску вещества, содержащего около
20% NaCl и 30% КС1, следует взять для определения
хлорида в виде AgCl (масса осадка 0,5 г)?
72
318. Рассчитать навеску вещества, содержащего око-
ло 1% K2SO4 и 3% КС1, необходимую для получения
0,2 г осадка КСЮ4.
319. Технический хлорид бария содержит около
97% ВаС12-2Н2О. Какую навеску следует взять для по-
лучения 0,3 г осадка BaSO4?
320. Сульфат алюминия содержит около 88%
AI2(SO4)3-I8H2O. Рассчитать навеску, необходимую для
определения алюминия в виде А12О3, если масса AI2O3
0,1 г.
321. Какой объем 0,5 М Na2HPO4 потребуется для
осаждения магния в виде MgNH4PO4 из 0,5 г сплава,
содержащего 90% Mg, при стехиометрическом соотноше-
нии реагирующих веществ?
322. Какой объем 2%-ного раствора NH3 потребуется
для осаждения железа из 0,2 г руды, содержащей 20%
Ре20з, если вещества берутся в стехиометрическом сдот-
ношении?
323. Какой объем 5%-ного раствора NH3 потребует-
ся для осаждения полуторных окислов из навески 1,5 г
силикатной породы, содержащей около 14% А12О3 и 6%
Fe2O3, если вещества берутся в стехиометрическом соот-
ношении?
324. Какой объем 3,5%-ного раствора
(NH4)2C2O4 Н2О потребуется для осаждения оксалата
кальция из навески 0,15 г апатита Саз(РО4)2СаС12 при
стехиометрическом соотношении реагирующих веществ?
325. Сколько миллилитров 0,1 М ВаС12 потребуется
для осаждения серы в виде BaSO4 из навески 2,0 г камен-
ного угля, содержащего около 4% S, если осадитель до-
бавлен в стехиометрическом соотношении?
326. Сколько миллилитров соляной кислоты (d=
= 1,17 г/см3) потребуется для осаждения серебра в виде
AgCl из 2,0 г сплава, содержащего 22% Ag, при стехио-
метрическом соотношении реагирующих веществ?
327. Какой объем 0,1 н. AgNO3 потребуется для осаж-
дения хлора на 1,0 г смеси, содержащей одинаковы; ко-
личества граммов ВаС12-2Н2О и NaCl, если осадитель
добавляется в стехиометрическом соотношении?
328. Сколько миллилитров 5%-ного раствора оксихи-
нолина C9H6NOH (d=l,07 г/см3) потребуется для осаж-
дения магния из 20 мл раствора, полученного при рас-
творении 5 г доломита СаСОз-MgCOj в 200 мл соляной
73
кислоты, если реагенты берутся в стехиометрических
количествах?
329. Какой объем 20%-ного раствора М^С12 (d=
»!. 17 г/смя) потребуется для осаждения фосфора в ви-
де MrNHiPO* из навески 5,0 г фосфорита, содержащего
около 25% PjOj, если реагенты берутся в стехиометри-
ческих количествах?
330. Навеску 5,0 г сплава, содержащего около 3% Ni,
вествопили в мепной колбе объемом 200 мл. Сколько
миллилитров 1%-ного раствора диметилглиоксима
CuHtN^Oi (J=0,93 г/см3) потребуется для осаждения
диметилглиоксимата никеля из 20 мл полученного раст-
вора при стехиометрическом соотношении реагирующих
веществ? л
331. Для определения серы навеску 2.0 г руды, со-
держащей около 20% S, сплавили с Na^O?. Плав раство-
рили в 200 мл воды. Сколько миллилитров 0.25 М BaClj
потребуется для осаждения серы в виде BaSO4 из 20 мл
полученного раствора при стехиометрическом соотноше-
нии реагирующих веществ?
332. Какой объем H?SO4 (rf=1,24 г/см3) потребуется
для превращения 0,35 г СаО в CaSO4?
333. Сколько миллилитров 0,1 М (NH4)?C?O4 необхо-
димо для осаждения кальция и стронция из 200 мл рас-
твора, содержащего в 1 л 0,555 г СаС12 и 0,317 г SrCh,
если осадитель добавляют в стехиометрическом количе-
стве?
334. Вычислить потери PbSO4 (г и %) за счет раство-
римости осадка, полученного при добавлении к 20 мл
0,1 М Pb(NOs)2 и полуторного избытка 0,1 М H2SO4.
335. Вычислить потери BaSO4 (моль/л) за счет рас-
творимости осадка при осаждении бария эквивалентным
количеством сульфата. Какова потеря от растворимости,
если концентрацию SO^- -ионов повысить до 0,01 г-ион/л?
336. Вычислить потери Са (г и %) за счет раствори-
мости осадка СаС2О4, если к 20 мл раствора, содепжа-
щего 0,1 г кальция, прибавили 35 мл 0,25 М
(NH4)3C3O4.
337. Сколько граммов СаСОз перейдет в раствор при
промывании 0,3 г осадка 250 мл воды? Какой процент
от маосы осадка составят потери вследствие растворимо-
сти СаСО3?
74
338. Сколько процентов составят потери за счет рав-
творимости AgCl при осаждении 0,15 г хлорида эквива-
лентным количеством нитрата серебра в 1 л раствора?
«139. Сколько граммов кальция составят потери за
счет растворимости осадка СаСгО* при промывании
3UU мл 1,5 %-ного раствора (NHtJjCaOi-HjO?
34и. Сколько миллилитров воды потребуется при про-
мывании 0,0 г осадка MglNH4P(j4-6H2O, чтобы потери
за счет растворимости не превышали 0,05%?
341. СКОЛЬКО миллилитров 0,1 Н. (NhijjSOi нужно
прибавить к 300 мл воды, чтобы при промывании осадка
0,5 г BaSO4 этим раствором потери за счет растворимо-
сти не превышали 0,01 % г
342. Сколько миллилитров 25%-ного NHa нужно до-
бавить к 130 мл промывной жидкости, чтобы при про-
мывании осадка MgNtHPO^ потери за счет раствори-
мости составили не оолее 0,0001 г MgO?
343. Сколько процентов составят потери при промы-
вании 3U0 мл воды осадка АЦОН)а, полученного и<
U, 1000 г А12Оа?
344. Из навески технического сульфида натрия
0,3000 г после окисления сульфида до сульфата получили
0,8250 г ВавО4. Определить процентное содержание се-
ры и сульфида натрия и сравнить его с теоретическим
содержанием.
345. Сколько процентов Na2S2Oa-5riaO содержится в
образце технического тиосульфата натрия, если из навес-
ки препарата 0,1852 г после окисления до
получили осадок BaSO4 0,3448 г?
346. При анализе технических алюмокалиевых квас-
цов навеску 2,07 10 г растворили в 200 мл воды и осадили
сульфат оария из 20 мл полученного раствора.
Сколько процентов алюминия содержится в препарате,
если масса прокаленного осадка ВаВО4 0,2Ь80 г?
347. Навеску технического хлорида натрия 0,2120 г
растворили в 200 мл воды и из 20 мл полученного рас-
твора осадили №2л(и04)з(С2Н3С)2)8 ЬНзО, масса кото-
рого оказалась 0,5578 г. Сколько процентов натрия в
пересчете на Na2O содержится в исследуемом продукте?
348. Из навески цемента 1,5000 г получили прокален-
ный осадок MgaPiO; 0,2105 г. Сколько процентов MgO
содержится в цементе?
349. Из навески 0,5000 г карналлита после раст-
ворения, осаждения KaPtCU и восстановления платины
75
получили 0,1308 г Pt. Вычислить процентное содержа-
ние КС1 в карналлите. Пересчитать это содержание на
К2О.
350. Из навески 0,5302 г суперфосфата, содержащего
14,50% влаги, получили 0,3240 прокаленного осадка
Mg2P2O7. Вычислить процентное содержание Р2О5 в су-
перфосфате при расчете на влажное и на абсолютно
сухое вещество.
351. Из навески 0,1000 г апатито-нефелиновой руды,
содержащей в основе кристаллический апатит
3Ca3(PO4)2-CaF2, получили 0,9017 г осадка
(NH4)3P(Mo3Ow)4. Вычислить процентное содержание
3Ca3(PO4)2-CaF2 в руде. Пересчитать это содержание
на Р2О5.
352. Из раствора хлорида магния получили осадок
оксихинолината магния Mg(CgH6ON)2 0,2872 г. Сколько
граммов Mg в исследуемом растворе?
353. Из навески 0,2350 г фосфорита получили 0,2711 г
CaSO4 и 0,1693 г Mg2P2O7. Вычислить процентное со-
держание СаО и Р2О5В фосфорите. Пересчитать резуль-
таты анализа на абсолютно сухое вещество, если фосфо-
рит содержит 5,42% влаги.
354. Каково процентное содержание Pb, Zn и Sn в
бронзе, если из образца 1,0000 г получили 0,0430 г
PbSO4, 0,1553 г 2пгР2О7 и 0,0632 г SnO2?
355. Из навески 1,2000 г специальной стали выдели-
ли фосфор в виде (NH4)3P(Mo3Oio)4 и после соответст-
вующей обработки получили 0,4450 г весовой формы
РЬМоО4. Для определения никеля из этой же навески
стали осадили диметилглиоксимат NiC8Hi4N4O4 массой
0,1812 г. Вычислить процентное содержание Р и Ni в
стали.
356. Из навески 1,0000 г стали получили осадок
SiO2 и WO3 общей массой 0,1021 г. После обработки
осадка HF и удаления SiO2 масса остатка WO3 стала
0,0712 г. Вычислить процентное содержание Si и W
в стали.
357. Из 2,7000 г сплава получили 0,2004 г А12О3 и
0,0518 г SiO2. Сколько процентов А1 и Si в сплаве?
358. Сколько процентов FeO содержится в образце
технического железного купороса, если из навески
0,9200 г в результате анализа получили 0,2545 г Fe2O3?
Вычислить процентное содержание FeSO4 • 7Н2О в иссле-
дуемом продукте.
76
359. Из навески алюминиевого сплава 5,0000 г полу-
чили 0,5022 г ZnHg(SCN)4, 0,1255 г Mg2P2O7 и 0,0560 г
SnO2. Сколько процентов Zn, Mg и Sn в сплаве?
360. Из навески 0,1500 г серного колчедана получили
осадок BaSO4 0,5155 г. Сколько процентов серы в кол-
чедане? Пересчитать содержание серы на абсолютно су-
хое вещество, если влажность колчедана 2,55%-
361. Вычислить процентное содержание Со в сплаве,
если из навески 0,2100 г после осаждения кобальта
а-нитрозо-р-нафтолом получили прокаленный осадок
Со3О4 0,1012 г?
362. Сколько процентов Na2SO4 и NaCi в техническом
сульфате натрия, если из навески 0,3500 г было получе-
но 0,5032 г BaSO4 и 0,1304 AgCl. Пересчитать содержа-
ние Na2SO4 и NaCl на абсолютно сухое вещество, если
влажность продукта 10,98%.
363. Вычислить процентное содержание Ag, если из
навески анализируемого сплава 0,2466 г после соответ-
ствующей обработки получили осадок AgCl 0,2675 г-
364. Вычислить процентное содержание NaCl в тех-
ническом хлориде натрия, если из навески 0,3000 г по-
лучили осадок AgCl 0,6280 г? Каково содержание NaCl
в абсолютно сухом веществе, если влажность техниче-
ского продукта 3,58%?
365. Из навески 0,4500 г суперфосфата с влажностью
11,52% получили 0,1136 г Mg2P2O7. Вычислить процент-
ное содержание Р2О5 во влажном и абсолютно сухом
суперфосфате.
366. Рассчитать процентное содержание MgO в иссле-
дуемом образце после прокаливания, если до прокали-
вания навеска состояла из 36,00% MgCO3, 51,00%
Mg(OH)2, 10,00% Н2О и 3,00% S1O2.
367. Из навески 0,8000 г силиката получили осадок
полуторных окислов (А120з+Ре20з+ТЮ2) 0,2566 г.
Сколько процентов А12О3 в силикате, если дополнитель-
ный анализ показал, что образец содержит 0,61% Fe и
0,42% Т1?
368. Из навески известняка 5,0000 г получили прока-
ленные осадки 0,1080 г Fe2O3 и 0,2660 г Mg2P2O7. Фильт-
рат, полученный после осаждения MgNH4PO4, разбави-
ли до 200 мл и из 20 мл раствора осадили СаС2О4. Окса-
лат кальция превратили в CaSO4 массой 0,6105 г.
Вычислить процентное содержание FeO, MgO и СаО в
известняке.
77
369. Вычислить процентное содержание Fe3O4 в маг-
нитном железняке, если из навески руды 0,5000 г полу-
чили 0,3989 г Fe2O3.
370. Из 25 мл раствора сульфата магния получили
осадок BaSO4 0,3247 г. Сколько граммов Mg2P2O7 полу-
чится из 10 мл этого же раствора MgSO4?
371. Из навески А1РО4 получили 0,1126 г Mg2P2O7.
Сколько граммов А12О3 получится из этой же навески?
372. Навеску каменного угля в 1,0000 г высушили до
постоянной массы 0,9678. Из этой навески после соответ-
ствующей обработки получили осадок 0,2531 г BaSO4.
Сколько процентов влаги содержал образец? Вычислить
процентное содержание серы во влажном и абсолютно
сухом веществе.
373. Из навески 0,5502 г доломита получили осадки:
0,0552 г A1(C9H6NO)3, 0,1650 г СаО и 0,2465 Mg2P2O7.
Вычислить процентное содержание А12О3, СаСО3 и
MgCO3 в образце доломита?
374. Из навески 0,4525 г криолита получили 0,0809 г
А12О3. Вычислить процентное содержание Na3AlF3 в кри-
олите?
375. Из навески 1,2250 г суперфосфата получили
прокаленный осадок CaSO4 0,3756 г. Вычислить процент-
ное содержание Са3(РО4)2 в суперфосфате. Чему равно
это содержание в пересчете на СаО?
376. Вычислить число молекул воды в молекуле кри-
сталлогидрата хлорида бария, если из его навески
0,3245 г получили 0,3100 г BaSO4.
377. Сколько молекул воды содержится в молекуле
кристаллогидрата сульфата магния, если из его навески
0,5520 г получили 0,2492 Mg2P2O7?
378. Сколько молекул воды содержится в молекуле
кристаллогидрата сульфата алюминия, если из его навес-
ки 0,7000 г получили 0,0535 г А12О3?
379. Вычислить число молекул воды в молекуле кри-
сталлогидрата сульфата кобальта, если из его навески
0,4800 г получили 0,3985 i BaSO4.
380. Вычислить число молекул воды в молекуле
кристаллогидрата сульфата хрома, если из его навески
0,8500 г получили 0,1803 г Сг2О3.
381. Вычислить число молекул воды в молекуле же-
лезоаммонийных квасцов, если из навески квасцов
0,5020 г получили 0,0891 г Fe2O3.
7«
382. Вычислить число молекул воды в молекуле кри-
сталлогидрата сульфата марганца, если из его навески
0,3240 г получили 0,3137 г BaSO4.
383. Сколько молекул воды в молекуле кристалло-
гидрата хлорида кальция, если из его навески 1,0000 г
получили 0,2560 г СаО?
384. Из навески частично выветрившегося сульфата
натрия 0,4000 г получили 0,3262 г BaSO4. Сколько моле-
кул воды содержится в молекуле кристаллогидрата?
385. Вычислить число молекул воды в молекуле кри-
сталлогидрата нитрата никеля, если из его навески
0,3000 г получили осадок диметилглиоксимата никеля
0,2980 г.
386. Из образца технического сульфата цинка 1,1350 г
получили осадки: 0,5298 г Zn2P2O? и 0,9052 г BaSO4. Вы-
числить процентное содержание основного компонента
ZnSOj и примеси K2SO4 в техническом продукте.
387. Из навески смеси х. ч. NaCl и КС1 общей массой
0,1225 г получили осадок AgCl 0,2850 г. Вычислить про-
центное содержание NaCl и КС1 в смеси.
388. Из навески 1,0000 г силикатной породы получили
смесь солей NaCl и КС1 общей массой 0,1015 г. Из этой
смеси получили осадок KgPtCle 0,2040 г. Вычислить про-
центное содержание Na2O и К2О в силикате.
389. Смесь х. ч. AgCl и AgBr содержит 65,85% Ag.
Вычислить процентное содержание брома и AgBr
в смеси.
390. Из навески 0,4500 г смеси х. ч. NaCl и Nal по-
лучили осадок, содержащий AgCl и Agl, обшей массой
0,9785 г. Вычислить процентное содержание 12 и Nal в
исходной смеси.
391. Из навески 1,5000 г силиката получили смесь
NaCl и КС1 общей массой 0,1322 г. Из этой смеси осади-
ли 0,1022 г КСЮ4. Вычислить процентное содержание
Na2O и К2О в силикате.
392. Из навески 0,7500 г смеси х. ч. Na2SO4 и K2SO4
получили осадок BaSO,( 0,1120 г. Вычислить процент-
ное содержание Na2SO.i и K2SO4 в исходной смеси.
393. Из навески 0,5000 г смеси х. ч. СаО и ВаО по-
лучили 0,9151 г смеси CaSO4 и BaSO4. Найти процентное
содержание Са, Ва и СаО в исходной смеси.
394. Из образца 0,5000 г цинковой руды получили
осадок Zn2P2O7 и Cd2P2O7 общей массой 0,7532 г. Из
этой смеси выделили сульфид цинка и прокалили его
7»
до ZnO, масса которого оказалась 0,3942 г. Вычислить
процентное содержание Zn и Cd в руде.
395. Кристаллогидрат магния Mg(NO3)2-6H2O со-
держит примесь хлори та магния MgCl2 • 6Н2О. Вычис-
лить процентное содержание компонентов в препарате,
если из навески 0,2812 г получили прокаленный осадок
Mg2P2O7 0,1242 г.
396. Из образца 0,4925 г смеси ZnS и CdS получили
осадок Zn2P2O7 и Cd2P2O7 общей массой 0,6895 г. Вычис-
лить процентное содержание ZnS и CdS в образце.
397. Из навески 0,9876 г смеси х. ч. СаСО3 и MgCO3
после прокаливания получили смесь СаО и MgO общей
массой 0,5123 г. Вычислить процентное содержание С а
и Mg в исходной смеси.
398. Навеску 0,7000 г х. ч. Fe2O3 и А12О3 восстановили
в токе водорода. Конечный продукт, содержащий Fe и
Л12О3, имеет общую массу 0,6350 г. Вычислить процент-
ное содержание Fe2O3 и А12О3 в исходной смеси.
Глава VIII
ТИТРИМЕТРИЧЕСКИЙ (ОБЪЕМНЫЙ) АНАЛИЗ
Вопросы для самопроверки
Метод нейтрализации
1. Какие требования предъявляются к реакциям, ис-
пользуемым в объемном анализе?
2. Что называется грамм-эквивалентом вещества?
Как определяется грамм-эквивалент в реакциях нейтра-
лизации?
3. Чему равны грамм-эквиваленты кислот, оснований
и солей в следующих реакциях:
a) H2SO4H-Ca(OH)2=CaSO4 + 2H2O
б) Са (ОН)24-НС1 =СаОНС1Н2О
в) H4P2O7 + NaOH = NaH8P2O,4-H2O
г) H4P2O7+2NaOH = Na2H2P2O, + 2H2O
д) H4P2O74-3NaOH = Na8HP2O7+3H2O
е) H4P2O,+4NaOH=Na4P2O7+4H2O
ж) 2Al (ОН)3+3H2SO4 - А12 (SO4)3 + 6Н2О
з) H2SO4+NaCl-NaHSO4+HCl
80
4. Что такое рабочий (стандартный, титрованный)
раствор? Какие концентрации рабочих растворов обыч-
но используют в методе нейтрализации?
5. Как выражают концентрацию растворов в титри-
метрическом анализе? Дать определение понятий: титр,
нормальность, нормальность с поправочным коэффици-
ентом, титр по определяемому веществу.
6. Написать формулу для расчета нормальности рабо-
чего раствора, если известен: а) титр раствора; б) титр
раствора по определяемому веществу.
7. Написать формулу для расчета результатов прямо-
го титрования, если концентрация рабочего раствора вы-
ражена в единицах: а) нормальности; б) титра; в) титра
по определяемому веществу.
8. Написать формулы для расчета результатов титро-
ваний: а) прямого; б) обратного; в) по методу замеще-
ния, если концентрация рабочего раствора выражена в
единицах нормальности.
9. Что называется кривой титрования?
10. Что такое точка эквивалентности? В какой области
pH (кислой, нейтральной, щелочной) лежит точка экви-
валентности при титровании раствора: а) сильной кисло-
ты сильным основанием; б) слабой кислоты сильным
основанием; в) слабого основания сильной кислотой?
И. В каком из перечисленных титрований точка эк-
вивалентности соответствует pH 7, рН>7 и рН<7:
a) HNOi+NaOH; б) НСООНф-NaOH; в) HICh+NaOH;
г) СН3СН.СООН+КОН; д) NH3+HC1; е) КОН+НС1;
ж) H2NC6H4SO4H + NaOH; з) CfiH5NH,+HCl;
и) C5H5N+HCI; к) C2H5NHo+HCl; л) KCN+HC1;
м) Na2CO3+HCl?
12. Что называется скачком титрования?
13. Какие факторы (константа диссоциации кислоты
или основания, температура, концентрация растворов,
объем титруемого раствора, скорость титрования) влия-
ют на: а) положение точки эквивалентности; б) величи-
ну и положение скачка титрования?
14. Как практически фиксируется точка эквивалент-
ности?
15. Какие вещества называются кислотно-основными
индикаторами?
16. Какие соединения используются в качестве кис-
лотно-основных индикаторов?
81
17. Как объясняется изменение окраски индикатора с
точки зрения ионной теории? Указать недостатки этой
теории.
18. Как объясняется изменение окраски индикатора
с точки зрения ионно-хромофорной теории?
19. Какие группы являются хромофорами и какие —
ауксохромами: —ОН, —СН3, O = N—, —NH2, —N=N—,
= N—NH—, —OCH3, —N(CH3)2? Как изменяются свой-
ства соединений при наличии этих групп в молекуле?
20. Назвать основные характеристики кислотно-ос-
новных индикаторов.
21. Что называют показателем титрования рТ" и интер-
валом перехода индикатора?
22. Какая связь существует между константой диссо-
циации и интервалом перехода индикатора?
23. Какими способами подбирают индикаторы при
титровании по методу нейтрализации?
24. Какой из индикаторов (метиловый оранжевый,
фенолфталеин, лакмус) пригоден для определения конпа
титрования: a) C4H5COOH4-NaOH; б) HCOOH4-NaOH;
в) HNOs+NaOH; г) NH3+HC1; д) CH3NH2+HC1;
е) CbH5NH,+HC1; ж) Na2CO.,+HCl; з) Na2CO3+2HCl;
и) KCN+HC1; к) Na3PO4+HCl; л) Na3PO4+2HCI?
25. Назвать типы индикаторных ошибок.
26. Какие индикаторные ошибки следует учитывать
при титровании с метиловым оранжевым и фенолфталеи-
ном: a) HCl+NaOH: б) CH3COOH+NaOH; в) NH3+
+НС1; г) Na2CO3+HCl?
27. При каком условии можно провести ступенчатое
титрование многоосновных кислот или смеси кислот?
28. Какие из следующих кислот: Н2С2О4, Н2СО3,
Н3РО4, Н4Р20т, Н2В4О7, Н2ТеО4 — можно оттитровать как
одно-, двух-, трех-, четырехосновные с погрешностью не
больше чем 1 % ?
29. Вычислить грамм-эквивалент Н3РО4 в методах,
основанных на осаждении: а) фосфоромолибдата аммо-
ния и последующем его растворении; б) Аосфата кальция
с последующим титрованием выделившейся соляной кис-
лоты.
30. Как приготовить рабочие растворы: а) 0,1 н. НС1;
б) 0,1 н. NaOH; в) 0,1 н. Na2CO3; г) 0,1 н. H2SO4. Как
установить их точную нормальность?
31. Назвать основные установочные вещества для оп-
ределения нормальности: а) кислоты; б) щелочи.
•2
32. Как определить содержание: а) КгСО3 и КНСО3;
б) NaOH и Na2CO3, если они присутствуют совместно?
33. Раствор, в котором может находиться одно из ве-
ществ: NaOH, N'aHCO3, Na2CO3— или одна из смесей:
NaOH+Na2CO3; Na2CO34-NaHCO3 — титруется раство-
ром НС1 с фенолфталеином (ф-ф) и метиловым оранже-
вым (м. о), применяемыми последовательно. Какое ве-
щество или какая смесь титруется, если объем израсхо-
дованной кислоты составляет:
Вариант ....абвгдежзик л
РНГ1/Ал,. мл. . . 10 7 18 13 - 20 9 10 - 25 23
п С 1/ф-ф
VHri/uo. ил. .. 10 15 б Г 16 - 9 23 15 8 .7
34. Привести примеры титрований: а) прямого;
б) обратного; в) по замещению — в методе нейтрализа-
ции.
35. Какими способами определяется содержание:
а) аммиака в солях аммония; б) карбонатов в щелочи;
в) СО2 в воде; г) азота в органических соединениях?
Записать уравнения реакций и расчетные формулы.
36. Что такое жесткость воды? Как определяется вре-
менная и постоянная жесткость воды?
Методы осаждения и комплексообразования
37. Привести примеры реакций титрования, основан-
ных на образовании осадка.
38. Какие требования предъявляются к реакциям в
методах осаждения? Образование каких осадков:
AgCl, Fe(OH)3, CaSO4, PbCi2, AgBr, А1(ОН)3 — исполь-
зуется при титровании по методу осаждения?
39. Вычислить грамм-эквиваленг определяемого ве-
щества (указано первым) в следующих реакциях:
NaCl + AgNO3=AgCl | ф NaNO3
Hg2 (NO3)2 + 2KBr - Hg2Br2 ;+2kno3
NH4SCN + AgNO3 = AgSCN |-j-NH4NO3
3ZnSO4 + 2K4 [Fe (CN ,e] = K2Zna [Fe (CN Ш+3K2SO4
MgCl2 -|- N H4OH + N a2HPO4=MgNH4PO4HH2O + 2NaCl
40. Как зависит величина скачка титрования в мето-
дах осаждения от температуры, произведения раствори-
мости, ионной силы раствора, концентрации растворов?
83
41. В каком случае скачок титрования будет наи-
больший и в каком — наименьший, если раствором
AgNO3 титруют: а) 0,1 н. растворы KI, KBr, КС1;
б) 0,01 н. KI, 0,1 н. KI, 1 н. KI?
42. В каком порядке будут выпадать осадки при ар-
гентометрическом определении смеси, содержащей ионы
С1~, Вг“, 1~, одинаковой концентрации? Какой вид будет
иметь кривая титрования?
43. Вывести формулы для вычисления рС1 при титро-
вании 0,1 н. NaCl 0,1 н. раствором: a) AgNOa;
б) Hg2(NO3)2, если определяемое вещество оттитровано
на 99,9; 100 и 100,1%?
44. Как приготовить рабочий раствор AgNO3 и уста-
новить его нормальность? Каковы условия хранения это-
го раствора?
45. Какие способы фиксирования точки эквивалент-
ности применяются при аргентометрическом определе-
нии галогенидов?
46. В чем сущность безындикаторного метода титро-
вания хлоридов раствором AgNO3?
47. В чем сущность титрования до «точки просветле-
ния»? Для определения каких ионов этот метод приме-
няется на практике?
48. Назвать индикаторы, которые применяются при
аргентометрическом определении галогенидов.
49. В чем сущность определения галогенидов по ме-
тоду: а) Мора; б) Фаянса; в) Фольгарда? Назвать рабо-
чие растворы, индикаторы. Записать основные уравне-
ния реакций.
50. Указать причины индикаторных ошибок при тит-
ровании по методу: а) Мора; б) Фольгарда?
51. В каких условиях применяют метод Мора? Какие
ионы мешают определению этим методом?
52. Какие ионы: С1_, Вг_, I-, SCN-, Ag+ — можно он
ределить титрованием по методу Мора? Дать обоснова-
ние вашему выбору.
53. Как определяется концентрация ионов Ag+ и С1_
роданометрическим методом? Записать соответствующие
расчетные формулы.
54. Сравнить преимущества и недостатки методов
Мора и Фольгарда при определении галогенидов.
55. При титровании какого раствора точность родано-
метрического определения будет выше: NaCl или NaBr
84
одинаковой концентрации? Какие меры принимаются для
более четкого фиксирования точки эквивалентности?
56. Каков механизм действия адсорбционных индика-
торов?
57. Что такое изоэлектрическая точка? Что происхо-
дит с осадком, находящимся в растворе, при переходе
через изоэлектрическую точку?
58. Какие требования предъявляются к адсорбцион-
ным индикаторам? Почему хлориды нельзя титровать с
эозином?
59. Какие адсорбционные индикаторы используются
при определении: а) хлоридов; б) бромидов; в) иодидов?
60. В чем сущность метода меркурометрии? Назвать
рабочие растворы, индикаторы. Записать основное урав-
нение реакции.
61. Как приготовить рабочий раствор Hg2(NO3)2 и
установить его нормальность? Каковы условия хранения
этого раствора?
62. При титровании какого раствора скачок титрова-
ния будет наибольший, если титруют раствором
Hga(NO3)2: а) 0,01 н. NaCl, 0,1 н. NaCl и 1 н. NaCl;
б) 0,1 н. растворы NaCl, NaBr, Nal?
63. Каков механизм действия железороданидного ин-
дикатора при меркурометрическом титровании галогени-
дов?
64. Какие вещества можно определить методом мер-
курометрии?
65. Сравнить достоинства и недостатки методов мер-
курометрии и аргентометрии.
66. Как фиксируется точка эквивалентности с помо-
щью внешних индикаторов? Привести примеры титрова-
ния с внешним индикатором.
67. В чем сущность гексацианоферроатометрии? На-
звать рабочие растворы, индикаторы. Записать основное
уравнение реакции определения цинка.
68. Как приготовить рабочий раствор K4Fe(CN)6 и
установить его нормальность?
69. В какой среде будет наименьшая ошибка при оп-
ределении цинка осаждением в; а) слабокислой среде;
б) нейтральной среде; в) щелочной среде?
70. Каков принцип действия индикатора — дифенил-
амина при определении цинка с ферроцианидом калия?
85
71. В чем сущность метода меркуриметрии? Назвать
рабочие растворы, индикаторы. Записать основное урав-
нение реакции определения Вг~.
72. Как приготовить рабочий раствор Hg(NO3)2 и
установить его нормальность? Каковы условия хранения
этого раствора?
73. Каков механизм действия индикаторов метода
меркуриметрии; а) нитропруссида натрия; б) дифенил-
карбазона?
74. При каких условиях выполняется титрование гало-
генидов по методу меркуриметрии?
75. Каковы преимущества и недостатки меркуримет-
рического метода анализа?
76. Что такое комплексоны? К какому классу соеди-
нений они относятся и каковы их свойства?
77. В чем сущность метода комплексонометрии? На-
звать рабочие растворы, индикаторы. Записать основное
уравнение реакции определения Mg2+.
78. Как приготовить рабочий раствор трилона Б и
установить его нормальность?
79. Какие металлохромные индикаторы вы знаете?
Каков механизм их действия?
80. Как зависит величина скачка титрования в ком-
плексонометрии от температуры, константы устойчивости
комплексного соединения, концентрации растворов, pH
среды?
81. В каком случае величина скачка титрования ока-
жется наибольшей и в каком — наименьшей, если титру-
ют раствором трилона Б; а) 0,01 М растворы MgSCh,
CoSOi, ZnSO4; б) 0,1 М и 0,01 М растворы ZnSO4?
82. Вывести формулы для вычисления рМе при титро-
вании 0,01 М CaCU 0,01 М трилоном Б, если определяе-
мое вещество оттитровано на 99,9; 100; 100,1%.
83. Почему комплексонометрическое определение
ионов Со2+, Zn2+, Gd2+ проводят в щелочной среде? Какой
аналитический прием используют для предупреждения
образования осадков гидроокисей металлов в этом слу-
чае?
84. Какие ионы определяются с помощью комплексо-
нометрического титрования в кислой среде?
85. Как определить жесткость воды с помощью три-
лона Б? Привести расчетную формулу. Укавать инди-
каторы.
86
86. Какие вещества определяются комплексонометри-
чески методами прямого и обратного титрований и по
•амещению?
87. Охарактеризовать особенности комплексономет-
рического определения: а) Со; б) Ni; в) РЬ; г) Cd;
д) Zn; е) Fe; ж) SO^~; з) РЬ из осадка PbSO4; и) Mg из
осадка Mg2P2O7.
Методы окисления — восстановления (оксидиметрия)
88. Какие требования предъявляются к окислительно-
восстановительным реакциям, используемым в объемном
анализе?
89. Перечислить основные окислительно-восстанови-
тельные методы объемного анализа. Какие рабочие рас-
творы и индикаторы применяются в каждом из этих ме-
тодов?
90. Дать краткую характеристику (основное уравне-
ние реакции, рабочие растворы, индикаторы, области
применения) методов окисления—восстановления:
а) перманганатометрии; б) хроматометрии; в) иодомет-
рии; г) броматометрии; д) ванадатометрии; е) перимет-
рии.
91. Как определяется грамм-эквивалент в реакциях
окисления — восстановления? Определить величину
грамм-эквивалента окислителя и восстановителя при ти-
тровании: a) I24-Na2S2O< б) НоС^+КМпО.);
в) FeSO;-FKMnO4; г) Н2О2+КМпО4; д) FeCl2+K2Cr2O7.
92. В каких координатах строятся кривые титрования
в методах окисления — восстановления?
93. От каких факторов зависит величина скачка тит-
рования в методе окисления — восстановления?
94. В каком случае величина скачка титрования будет
наибольшей ([Н+]— 1 г-ион/л): а) 0,1 и. FeSO4 титруется
0.1 н. КМпО« или 0,01 н. FeSO4 титруется 0,01 н. КМпО4;
б) 0,1 н. FeSO4 титпуется 0,1 н. КМпО. или 0,1 н. FeSO4
титруется 0,1 н. КяСгоО?: в) 0,1 н. FeSO4 титруется 0,1 н.
КгСггО/ или 0,01 н. FeSO4 титруется 0,01 н. К2Сг2О7?
95. Написать формулы для расчета окислительно-вос-
становительного потенциала Е при титровании 0,1 М
FeSO4 0,1 М раствором: а) КМпО4; б) КзСг?О7, если оп-
ределяемое вещество оттитровано на 99,9; 100,0: 100,1 %.
96. Как влияет введение в раствор ионов POJ- и F-
«7
на величину скачка титрования при перманганатометри-
ческом определении железа?
97. Указать способы фиксирования точки эквивалент-
ности в методах окисления — восстановления.
98. Какие индикаторы используются при оксидимет-
рических титрованиях?
99. Объяснить принцип действия редокс-индикаторов.
Указать наиболее распространенные из них.
100. Назвать основные характеристики редокс-инди-
каторов.
101. Что называется интервалом перехода редокс-ин-
дикаторов? Чему он равен?
102. Как подбираются редокс-индикаторы окислитель-
но-восстановительного титрования?
103. От каких факторов зависит скорость реакции
окисления — восстановления?
104. Какие реакции называются автокаталитическими?
105. Какие реакции называют индуцированными? Как
объясняются реакции сопряженного окисления?
106. Можно ли по точной навеске КМпО4 приготовить
его титрованный раствор?
107. Написать уравнения реакций возможного разло-
жения перманганата калия в водном растворе. Что спо-
собствует протеканию этих реакций?
108. Какие вещества используются для установления
титра перманганата калия?
109. Каковы условия (температура, pH, скорость до-
бавления титранта) титрования оксалата натрия перман-
ганатом калия?
110. Почему при титровании щавелевой кислоты пер-
манганатом калия первые капли обесцвечиваются мед-
ленно, но затем обесцвечивание происходит практически
мгновенно?
111. Чему равен грамм-эквивалент перманганата ка-
лия при проведении реакции в кислой и нейтральной сре-
дах. Записать соответствующие уравнения реакций.
112. Привести примеры титрований: прямого, обрат-
ного и по методу замещения — в методе перманганато-
метрии.
113. Как перманганатометрически определяют содер-
жание: а) железа в соли Мора; б) железа в рудах;
в) перекиси водорода; г) нитритов; д) кальция; е) МпОг
в пиролюзите; ж) К2СГ2О7?
88
114. Написать расчетные формулы для указанных в
п. 113 определений.
115. Каков механизм сопряженного окисления ионов
С1~ при титровании Fe (II) перманганатом калия в со-
лянокислой среде?
116. Указать назначение каждого из компонентов за-
щитной смеси в перманганатометрическом определении
Fe (II).
117. Как приготовить титрованный раствор бихромата
калия?
118. Указать преимущества и недостатки методов
перманганатометрии и хроматометрии.
119. Как проводят определение Fe (II) методом хро-
матометрии с внешним и внутренним индикаторами?
120. Написать формулы для расчета содержания
Fe (II) и Fe (III) при их совместном присутствии мето-
дом хроматометрии.
121. Для какой цели прибавляют фосфорную кислоту
при хроматометрическом определении Fe (II)?
122. Как приготовить рабочие растворы иода и тио-
сульфата натрия и установить их нормальность?
123. За счет каких процессов происходит изменение
титра растворов тиосульфата натрия и иода при их хра-
нении?
124. При каких условиях (температура, кислотность
раствора и т. д.) выполняются йодометрические титро-
вания?
125. Почему йодометрические определения нельзя
проводить в среде с pH ^8 и рН^О?
126. На чем основано йодометрическое определение:
а) окислителей; б) восстановителей; в) кислот;г) «актив-
ного» хлора в хлорной извести; д) сульфата; е) арсенита
и арсената; ж) меди; з) бихромата калия и Fe (III) при
их совместном присутствии; и) МпО2 в пиролюзите?
127. Записать расчетные формулы для указанных в
п. 126 определений.
128. Объяснить направление протекания реакции, ис-
пользуемой для йодометрического определения меди.
129. Чему равен грамм-эквивалент свинца при опре-
делении его методом иодометрии, основанном на следу-
ющих реакциях:
2РЬСгО4| +2Н+ =2РЬа+ + сгао27-+нао
61-+СгД- + 14Н+ = 312+2Сг’+ + 7Н2О
2S2O2-4-I|=S4O2-+2I-
89
130. Чему равен грамм-эквивалент Na2SOt при иодо-
метрическом его определении, основанном на следую-
щих реакциях:
SO*-+Ва2+(изб)=BaSO* |
Ваа+ + СгО2~ (изб)=ВаСгО4|
2CrO2~ + 2Н+=СгаО2~ + НаО
СгаО2~ + 61-+ 14H+=2Crs+ + 3Ia4-7HaQ
2SaO2- + Ia=S4O2-+2I-
131. Как приготовить основной рабочий раствор в ме-
тоде броматометрии и установить его нормальность?
132. Какие индикаторы используются в броматометри-
ческом методе анализа? На чем основано их действие?
133. Как броматометрически определяют содержание:
а) магния; б) алюминия; в) сурьмы?
134. Написать расчетные формулы для указанных в
п. 133 определений.
Решения типовых задач
Пример 1. Чему равен грамм-эквивалент КМиО4 в следующей
реакции:
Сг2 (SO4)3 + 2КМпО4 + 8КОН •= 2К2СгО4 + 2МпОа| +
+ 3K2SO4 + 4Н2О
Решение. Запишем уравнение соответствующей полуреакцни
MnOf + 2Н2О + Зй = МпО2+4ОН-
На восстановление одной молекулы перманганата калия до
МпО2 необходимо три электрона, следовательно,
МКМпО4 158,04 .2б3г
"-'КМлО4 3 ~ 3 £)2’0в г-
Пример 2. Определить грамм-эквивалент свинца при йодомет-
рическом определении его по схеме
РЬ2+ + СгО2~ = РЬСгО41
PbCrO4 + 31- + 8Н+ = Сг3+ + 4Н2О + 3/212 + РЬ2+
12 4- 2S2Oa и S4O2 +21
Решение. Согласно по л у реакция
СгО^- + 8Н+ + За - Cr3++4HgO
ио 1 г-иои хромата реагирует с 1 г-ионом РЬ3+, следовательно,
Пример 3. Сколько миллилитров концентрированной соляной
кислоты (пл. 1.17 г/см3) требуется для приготовления 500 мл 6,1 и.
раствора?
Решение. Молярная концентрация раствора НС1 с пл. 1,17
равна 10,97 моль/л. Очевидно, Mhci = A<hci= 10,97. Поскольку число
грамм-эквивалентов кислоты при разбавлении не меняется, можно за-
писать:
10,97-УНС1 = 500-0,1,
отсюда
500-0,1
VНГ1 = —-——- = 4,56 мл.
НС1 10,97
Пример 4, На титрование 2,025 f Na2C2O4 идет 24,10 мл рас-
твора КМпО4. Рассчитать: а) титр раствора КМпО4; б) титр КМпО4
по Na2C2O4; в) нормальность КМпО4.
Решение. Вычисления целесообразно вести в следующей по-
следовательности:
_ £Na,C,O4 2,025
^KMnO,/Na,C,O, — v ~ 94 10 =0,08403 г/МЛ,
уКМпО. 2,1
,, ^KMnO./Ne.CjO, 1000
™КМпО, — q •
JNa,CaO,
поскольку CzOj- = 2COj 4- 2е,
^КМпО,
0,08403-1000
67,00
1,254 г-экв/л.
Так как МпО4 4- 8Н+ + 5е = Мп2+ 4- 4HjO
„ ^кмпо, 158,038
эКМпО, =-------£----=------5----= 31,61 г,
_ ^КМпО.'-^КМпО,
КМпО. — 1000
1,254-31,61
1000
= 0,03964 г/мл.
Пример 5. Какую навеску негашеной извести, содержащей 90%
СаО и 10% индифферентных примесей, требуется взять для ана-
лиза, чтобы на ее нейтрализацию израсходовать 20,00 мл раствора
НС1 с титром по СаО 0,009000 *?
* Титр выражен всюду в г/мл.
91
Решение. Найдем число граммов СаО в навеске негашеной
извести:
^СаО = ^HCl/CaO^HCl-
Тогда навеска негашеной извести определится как
«СаО100 Т'на/СасЛ'нс1100 0,009000-20,00-100
ризв =----------=------'-----------=-------------------= 0,2 г.
90 90 90
Пример 6. Какую навеску вещества, содержащего 60% NaCl и
37% КС1 (остальное — индифферентные примеси), следует взять для
анализа, чтобы расход 0,1 н. AgNOs на титрование не превышал
20,00 мл?
Решение. Если для анализа взято х г вещества, то число
грамм-эквивалентов NaCl и КС1, содержащееся в навеске, равно
х-60 х-37
"NaC1 = йо^ и Лкс1 = юо-эКС1 •
Кроме того,
"NaCl + "КС1 = "AgNO,,
^AgNO.^AgNO,
где «AgNO, =---------------- — число грамм-эквивалентов раствора
AgNOs, затраченное на титрование.
Сочетание этих соотношений дает
Г-60 Х-37 _ ^AgNO.^AgNO,
100-Э NaCi + 100-ЭКС1 ~ 1000
Подставляя численные значения, получаем
х-60 х-37 0,1-20,00
------------4-------------=--------------, х = 0,1313 г.
100-58,443 100-74,555 1000
Пример 7. Навеска хлорида аммония обработана избытком ще-
лочи. Выделившийся аммиак поглощен 50,00 мл 0,5120 и. НС1 и по-
лученный раствор разбавлен до 250,0 мл. На титрование 50,00 мл
полученного раствора израсходовано 25,73 мл 0,05 и. КОН (К* =
= 0,9740). Сколько граммов NHs содержал хлорид аммония?
Решение. Число грамм-эквивалентов НС1, введенное с исход-
ным раствором кислоты, составит
, ^НсУнС!
С учетом разбавления этого раствора до 250 мл (Уовщ) найдем
число грамм-эквивалентов НС1, взятое для анализа (nj),
l^HCl^HCl Уалики
Л1 ” 1000 ‘ Уовщ ’
* К — поправочный коэффициент к нормальности,
92
где Р'аликв — объем разбавленного раствора HCI, взятый для ана-
лиза.
Число грамм-эквивалентов КОН (л2), израсходованное на тит-
рование избытка кислоты, определим из формулы
^КОН^ ^кон
Лп = ----------------.
1 1000
Очевидно, л,—n2 = n3, т. е. числу грамм-эквивалентов аммиа-
ка, содержащегося в аликвотной части раствора. Отсюда
_ / -^HCI^HCl Каликв__ ^КОН^КОН \ Коб.д
^NH« 1000 Кобщ 1000 /Уаликв NH’-
Подставляя численные значения, получаем
(0,5120-50,00-50,00/250—0,05-0,9740-25,73)250/50,00
£nh3 =-------------------------1555 17’03 =
(5,120— 1,253).17,03-5 3,867-17,03-5
= = 0, а 2Уо,
1000 1000
^NHj = 0,3293 г.
Пример 8. В мерной колбе емкостью 500 мл растворили
5,3600 г КС1. К 25,00 мл раствора прибавили 50,00 мл 0,1 н. AgNO3
(/(=0,8470). На титрование избытка Ag+ расходуется 23,88 мл рас-
твора роданида аммония (/"NH.stN/Ag:== 0.0Ю68), Вычислить про-
центное содержание КС1 в образце.
Решение. Определим число грамм-эквивалентов AgNO3 (л4),
введенное с раствором AgNO3:
^AgNO^^AgNO,
П\ = ----------------•
1000
Число грамм-эквивалентов (л2) NH4SCN, израсходованное на
титрование избытка иона Ag+, составит
7 NH.SCN/Ag17NH,SCN
Пл = ---------------------.
Тогда число грамм-эквивалентов (л3) КС1 определится как раз-
ность:
П3 = Л2 — Л] =
^gNO.^^AgNO
1000
^NH^CN/Ag^NH.SCN
5Ag
Процентное содержание КС1 в образце вычислим по формуле
/ ^AgNO.^AgNO, ^NH.SCN/Ag^NH.SCN \
KCI, % = ( • — _ IX
5Ag /
1000
_ И(,Я1ц 100
хэкс1 у------------• —
v А.1ИКВ "
93
52,04.
/ 0,1-0,8470-50,00 0,01068-23,88
КС1, % = I —:1----------------------------1—
к 1000 107,87
5°0 100
X 74,557 ——----------
25 5,3600
Пример 9. Для определения постоянной жесткости воды к
100 мл воды прибавили 30,00 мл раствора Na2CO3(7'NaiCO^CaO =
= 0,001025), полученную смесь выпарили досуха и сухой остаток
растворили в дистиллированной воде. На титрование фильтрата из-
расходовано 25,00 мл НС1 (7’НС1/,Са0 = 0,000812). Сколько милли-
граммов СаО в 1 л воды?
Реше н и е. Число миллиграммов СаО, содержащееся в 100 мл
воды, взятой для анализа, находим как разность:
(7’'NaJCO,/CaOlZNaaCO9 — ^HCI/CaO^HCl)1000’
Отсюда содержание СаО (мг) на 1 л воды составит
Ю00
£саО = (' Na,CO,/CaO^Na,CO, ~ ^HCl/CaO^HCl) Ю0°- v мгМ»
и а
1000
«"СаО “ (0,001025-30,00 — 0,000812-25,00) .1000 —
= (1,025.30,00 — 0,812.25,00) 10 = 104,5 мг.
Пример 10. Навеску 1,80 г сплава, содержащего 1,50% хрома,
растворили в H2SO4 и окислили ионы Сг3+ до С^О?-• К раствору
добавили 25,00 мл раствора FeSO4; на титрование избытка послед-
него израсходовали 5,00 мл раствора КМпО4. Предварительно опре-
делили, что на титрование 25,00 мл раствора FeSO4 расходуется
24,80 мл раствора КМпО4. Рассчитать: а) &) ^КМпО/,
в) ^FeSOt-
Решение. Для определения условного титра ^кМпО./Сг не‘
обходимо вычислить число граммов хрома, содержащееся в навеске:
%-1.50
?Сг ~ 100 ’
а также объем раствора КМпО4, соответствующий содержанию хро-
ма ger, г:
УКМп0, = 24,80 — 5,°0 = 19,SO мл,
следовательно,
~ £сг 1,80-1,50
Т^импл /гг = -= 0,001364 г/мл.
КМпО./Сг ZKMnOj 100-19,80
•^КМпО и ^FeSO рассчитываем по формулам
v ^KMnO./Cr ’1000
•/VKMnO. = о >
JCr
^KMriO.HcMnO.^FeSO,
FeS°‘“ ^FeSO. ’ 1000
Учитывая, что
Cr2Oj~ + 14Н+ + бе = 2Сг3+ + 7Н2О
Ре2+ = ре3+ + в
можно записать: ЭСг = ЛСг/3 = 17,332 и 3FeS0 = 44Fe.SO4 = 151,91.
Отсюда
^КМпО1 ~
0,001364-1000
17,332
- = 0,07870 г-экв/л,
TfeSO,
0,07870-24,80-151,91
25,00-1000
= 0,01186 г/мл.
Пример 11. Чему равна индикаторная ошибка титрования 0,1 н.
НС1 0,1 н. раствором NaOH с метиловым красным (р'Г=5)?
Решение. Поскольку титрование закончится при pH 5, то на-
личие в растворе сильной кислоты вызовет Н+-ошибку (со знаком
«—», так как раствор недотитрован).
10-рГУ2 10“ рг-2У1
Н+-ошибка =--------—--100 =-----——----- 100,
NVi NVt
где Vi — объем титруемой кислоты; Vi — общий объем раствора в
конце титрования.
Так как при титровании использовались растворы одинаковой
концентрации, то V'a=2VJ, Н+-ошибка равна
10-5-2^1
Н+-ошибка =----------- 100 = — 0,02%,
0,1 • V1
Ошибка мала, поэтому для титрования пригоден индикатор метило-
вый красный.
Пример 12. Можно ли оттитровать 0,02 н. NaOH 0,02н. раство-
ром НС1 с: а) фенолфталеином (рТ=9); б) метиловым оранжевым
(Р7=4)?
Решение, а) Точка эквивалентности достигается в этом слу-
чае при рН7. По окончании титрования (рН9) в растворе еще имеет-
ся неоттитрованная сильная щелочь, которая вызовет ОН-ошибку
IQ-n+pr.y 10~H+pr-2V4
ОН—-ошибка =----—----- 100 =-----------100,
Nv\ NVi
10-И+».21/, 10- 5
ОН—-ошибка ---------- -100 - ----100 = - 0,1 %.
0,02-10
Следовательно, индикатор вполне пригоден для титрования.
б) В этом случае титрование заканчивается при наличии в рас-
творе избытка сильной кислоты (pH 4), т. е. будет наблюдаться
Н+-ошибка (со знаком <+>, так как раствор перетитроаан):
10-4-2/)
Н+-ошибка = ~ •• ,, 100 = 1 %.
0,02-/)
Большая ошибка не позволяет использовать индикатор метиловый
еранжевый в данном титровании.
Пример 13. Вычислить ошибку титрования 0,1 н. этаиоЛамина
0,1 н. раствором НС1 с: а) метиловым красным (рТ=5); б) фенол-
фталеином (рТ=9).
Решение. Рассчитаем pH в точке эквивалентности. В этой
точке этаноламин нацело превращается в соль RNH3C1, которая под-
вергается гидролизу:
RNHj + HOH;rRNH3OH + Н+
0,05—х х X
[RNH3OH] [Н+1
^гидр — Г
[RNH+]
10-и
1,8-10-5
= 5,5-10-ю.
Поскольку объем раствора при титровании удваивается,
£rnh,ci ~ 0,05 моль/л. Подставляя равновесные концентрации в вы-
ражение для Лгидр, находим
х2
0,05— х
= 5,5-10-10.
Поскольку 0,05 — х » 0,05,
х = /5,5-10—10-5-10“2 = 5,24-10—6 г-ион/л,
pH = — lg [Н+]= —1g (5,24-10-6) = 6- 0,72 = 5,28.
а) При использовании метилового красного титрование заканчи-
вается не при pH 5,28, а при pH 5,0, т. е. в растворе имеем неболь-
шой избыток сильной кислоты, которая вызовет Н+-ошибку:
10-5.27,
Н+-ошибка =---------- 100 =
lO-i-^j
+ 0,02%.
Следовательно, индикатор метиловый красный пригоден для данно-
го титрования.
б) При титровании с фенолфталеином по окончании титрования
(pH 9) в растворе еще имеется неоттитрованное слабое основание
RNH3OH, которое вызовет щелочную ошибку титрования:
ROH-ошибка = юРАГ+Р7'-14= ю4’75+9—14= Ю-0’25,
отсюда
1g (ROH-ошибка) = —0,25 = 1,75, ROH-ошибка = 0,56.
Это значит, что из 1,56 первоначально взятого амина RNHaOH
остаются неоттитрованными 0,56 весовой части, т. е.
1,56— 100%
0,56— х%
ROH-ошибка =
0,56-100
1,56
= -36%.
Следовательно, индикатор фенолфталеин непригоден для данного
титрования.
Пример 14. Рассчитать индикаторную ошибку титрования 20 мл
0,1 н. VOSO4 0,1 н. раствором KMnOt при pH 0 с N-фенилантрани-
ловой кислотой в качестве индикатора (интервал перехода равен
^инд ± 0,03В)-
96
Решение. При расчете необходимо использовать Е° следую-
щих полуреакций:
VO+ + 2Н+ + 67VO2+ + Н2О, £° = 0,9994В, а=1
И
Л111О7 + 8Н+ + 5eZMi'2+ - 1:1 О,е!; 1,51В, 4 = 5
Отсюда в точке эквивалентности
лЕ?+АЕ2 (0,9994)-5 1,51
Е =-------------= 2-----------------= 1,4249 В,
а + b 6
где а и b — числа отданных и принятых электронов N-фенилантра-
ииловой кислоты. £®н,= 1,08В, поэтому интервал перехода ее ра-
вен Е°ид ± 0,03, т. е. 1,08±0,03= 1,114-1,05 В. Следовательно, при
использовании этого индикатора раствор будет недотитрован, а по-
тенциал в конце титрования будет равен 1,11 В. Отсюда
[vo+]
1,11 = 0,9994 + 0,059 lg L ,
[vo2] 1,11 — 0,9994 0,1106 , o
lg------:— =--------------=-------------- 1,87,
s [VO2+] 0,059 0,059
101’87 = 74 ’ "Л" [V°2+] =74fVO2+]
[V02+J-100
Ошибка —-----------------
[VO2+] + [VO2+]
_ 100
= 75
[VQ2+].1OO
[VO2+] + 74 [VO2+]
= 1,33%.
Следовательно, при титровании с N-фенилантраниловой кислотой
раствор VO2+ будет недотитрован на 1,33%. Для точных титрова-
ний индикатор рекомендовать нельзя.
Задачи
Метод нейтрализации
399. Вычислить нормальность раствора H2SO4, титр
которого равен 0,02446.
400. Вычислить нормальность раствора NaOH, титр
которого равен 0,004020.
401. Вычислить нормальность раствора, если 7'hci/koh =
= 0,01353.
402. Вычислить нормальность раствора, если
Т'.ХаОН/СаО = 0,002914.
4—4022
97
403. Вычислить нормальность раствора, если
Т NaOH/SO3 =0,02174.
404. Нормальность раствора H2SO4 равна 0,1008. Рас-
считать Гн^Ог
405. Нормальность раствора NaOH равна 0,09981.
Рассчитать Т^аон-
406. Нормальность раствора НС1 равна 0,09798. Рас-
считать Т'нс1/к2о-
407. Нормальность раствора NaOH равна 0,1021. Рас-
считать 7’NaOH/SO3-
408. Найти Т’нс1/к2о, если 7'hci = 0,03798.
409. Найти 7'koh/h2so4, если Укон —0,005727.
410. Найти 7'h2so4, если 7’h2so4/koh — 0,005643.
411. Н айти 7'ыяон, если 7'ыаон/нс1 = 0,003645.
412. Вычислить 7’h,So4, если для 0,01 н. раствора К=
= 0,9123.
413. Вычислить Ткон, если для 0,05 н. раствора К=
= 0,8549.
414. Имеется 0,1046 н. НС1. Определить моляр-
ность, T'hci и Т'нСГ/СаО-
415. Найти нормальность, молярность H2SO4 и
T"n2so,/cao, если 7'h2so1= 0,004852.
416. В 500 мл раствора содержится 2,6578 г Na2CO3.
Рассчитать Г^соз, Т'^ало3/пс\ и нормальность этого рас-
твора: 1) при нейтрализации до СО2; 2) при нейтрализа-
ции до NaHCO3.
417. Вычислить истинную нормальность, молярность,
7'h1so1 и ^HjSO./NaOH 0,1 и. H2SO4 (/(=0,9808).
418. В воде растворили 28,00 г х. ч. КОН и 40,20 г
х. ч. NaOH и разбавили раствор до 1500 мл. Рассчитать
нормальность полученного раствора.
419. К 550 мл 0,1925 н. НС1 прибавили 50,00 мл рас-
твора НС1 с титром 0,02370. Вычислить нормальность и
титр полученного раствора.
420. Сколько миллилитров воды надо добавить к 1 л
0,5300 н. НС1, чтобы получить 0,5000 н. раствор?
421. Сколько миллилитров 4 н. НС1 надо прибавить к
500 мл раствора НС1 с титром по СаО 0,08400, чтобы полу-
чить раствор с титром по СаО, равным 0,09000?
422. Сколько миллилитров соляной кислоты (d=
= 1,19 г/см3) необходимо для приготовления 1,0 л 0,1 н.
раствора?
98
423. Сколько миллилитров серной кислоты (d —
= 1,835 г/см3) требуется для приготовления 2,5 л 0,2 н.
раствора?
424. Для приготовления 500 мл раствора было взято
20,00 мл соляной кислоты (d= 1,19 г/см3). Вычислить
нормальность полученного раствора.
425. Сколько граммов щелочи, содержащей 98%
NaOH и 2% индифферентных примесей, необходимо для
приготовления 200 мл 0,1 н. раствора?
426. Из 8,5 г едкого натра, содержащего, кроме
NaOH, 4% Na2CO3 и 8% Н2О, приготовили 1 л раствора.
Определить нормальность полученного раствора, если
Na2CO3 нейтрализуется до Н2СО3.
427. Вычислить нормальность и титр раствора НС1,
если на титрование 0,4217 г буры израсходовано 17,50 мл
этой кислоты.
428. Какую навеску х. ч. безводной соды нужно взять,
чтобы на ее титрование израсходова'йт 20 мл 0,1 М
H2SO4?
429. Какую навеску щавелевой кислоты
Н2С2О4-2Н2О нужно взять, чтобы на ее титрование израс-
ходовать 20,00 мл 0,1 н. NaOH?
430. Вычислить нормальность H2SO;, если к 10 мл ее
добавили избыток ВаС12. Масса полученного осадка пос-
ле фильтрования, прокаливания и взвешивания оказа-
лась 0,2762 г.
431. Навеску 0,6000 г НгСгО.^НгО растворили в мер-
ной колбе емкостью 100 мл. На титрование 20,00 мл полу-
ченного раствора израсходовали 18,34 мл NaOH. Опре-
делить нормальность раствора NaOH и его титр по
Н2С2О4.
432. Определить ГКОн/р,о, раствора едкого кали, ис-
пользуемого при определении Р2О5 в суперфосфате
(Н3РО4 титруется до КН2РО4), если на титрование
18,00 мл 0,1 н. НС1 (.^=0,9064) израсходовано 19,32 мл
кон.
433. Вычислить нормальность раствора НС1, если на
титрование 20,00 мл его израсходовано 19,20 мл 0,10 н.
NaOH, приготовленного из фиксанала.
434. Навеску 0,5341 г щелочи, содержащей 92% NaOH
и 8% индифферентных примесей, растворили в мерной
колбе емкостью 100 мл. Определить нормальность и титр
НС1, Т’нс/маон, если на титрование 15,00 мл раствора
NaOH израсходовали 19.50 мл кислоты.
4*
99
435. Нормальность раствора H2SO4 была установлена
по карбонату кальция, содержащему 91,90% СаСО3 без
примеси других оснований. К навеске 0,6724 г добавили
29,87 мл кислоты и избыток ее оттитровали 10,27 мл рас-
твора NaOH (1 мл H2SO4 эквивалентен 1,024 мл NaOH).
Вычислить нормальность H2SO4 и NaOH.
436. Определить нормальность раствора КОН, если на
титрование 15,00 мл его израсходовали 18,70 мл раствора
НС1 (7’hci=0,002864) .
437. До какого объема нужно довести раствор, в ко-
тором содержится 1,530 г NaOH, чтобы на титрование
20,00 мл раствора израсходовать 14,70 мл НС1 17’hci =
=0,003800)?
438. Сколько граммов Na2CO3 содержится в растворе,
если на нейтрализацию до NaHCO3 израсходовали
21,40 мл раствора НС1 (Trci = 0,002789) ?
439. Вычислить число граммов N2O5 на 1 л раствора
HNO3, если на титрование 20,00 мл раствора кислоты из-
расходовано 21,12 мл 0,1120 н. NaOH.
440. На титрование раствора, полученного из 0,1370 г
щавелевой кислоты, израсходовано 22,10 мл 0,09840 н.
NaOH. Сколько молекул кристаллизационной воды со-
держала кислота?
441. Построить кривые титрования и подобрать инди-
каторы для титрования: 1) 0,2 н. НС1 0,2 н. раствором
NaOH; 2) 0,1 н. H2SO4 0,1 н. раствором КОН; 3) 0,3 н.
HNO3 0,2 н. раствором NaOH; 4) 0,2 н. СНзСООН 0,2 н.
раствором NaOH; 5) 0,1 н. НСООН 0,2 н. раствором
КОН; 6) 0,3 н. С6Н5СООН 0,3 и. раствором NaOH;
7) 0,2 н. NH3 0,2 н. раствором H2SO4; 8) 0,1 и. CH3NH2
0,1 н. раствором НС1; 9) 0,3 н. C2H5NH2 0,3 н. раствором
НС1; 10) 0,2 н. KCN 0,2 н. раствором НС1; 11) 0,2 М
NajCOj 0,2 н. раствором НС1; 12) 0,1 и. H2NCH2CH2OH
0,1 н. раствором НС1; 13) 0,1 и. HF 0,1 н. раствором
NaOH; 14) 0,1 М Н2С2О4 0,1 н. раствором NaOH; 15) 0,1 М
Н3РО4 0,1 н. раствором NaOH.
442. Рассчитать индикаторную ошибку титрования
0,01 н. НС1 0,01 н. раствором NaOH с фенолфталеином
(рТ=9).
443. Можно ли титровать 0,01 н. НС1 0,01 и раство-
ром NaOH с бромфеноловым синим (р7’=3,8) ?
444. Чему равна индикаторная ошибка титрования
0,1 н. NaOH 0,1 н. раствором НО с метиловым красным
(рТ=5)?
100
445. Рассчитать индикаторную ошибку титрования
0,1 н. NaOH 0,1 и. раствором НС1 с тимолфталеином
(рГ= 10).
446. Вычислить индикаторную ошибку титрования
0,2 н. НС1 0,2 н. раствором NaOH с метиловым красным
(р7’=5).
447. Вычислить индикаторную ошибку титрования
0,1 н. НС1 0,2 н. раствором NaOH с метиловым красным
(рГ=5).
448. Можно ли точно оттитровать 0,2 н. НС1 0,2 н.
раствором NaOH с о-крезолфталеином (рГ=9) ?
449. Рассчитать индикаторную ошибку титрования
0,01 н. NH3 0,01 н. раствором НС1 с метиловым оранже-
вым (рГ=4).
450. Можно ли оттитровать 0,01 н. NH3 0,01 н. раство-
ром НС1 с фенолфталеином (р7'=9)?
451. С каким индикатором можно оттитровать раствор
NH3, чтобы ROH-ошибка не превышала 0,1 %?
452. Вычислить индикаторную ошибку титрования
0,01 н. NH3 0,01 н раствором НС1 с тимолфталеином
(рТ^Ю).
453. С каким индикатором можно оттитровать рас-
твор СН3СООН, чтобы кислотная ошибка не превышала
0,1 %?
454. Можно ли оттитровать 0,01 н. СН3СООН 0,01 н.
раствором NaOH с нейтральным красным (р7’ = 7)?
455. Вычислить индикаторную ошибку титрования
0,1 н. НСООН 0,1 н. раствором NaOH с метиловым оран-
жевым (р7’“4).
456. Рассчитать индикаторную ошибку титрования
0,1 н. HF 0,1 н. раствором NaOH с фенолфталеином
(рГ=9).
457. Какую навеску х. ч. безводной соды нужно взять,
чтобы на ее титрование до СО2 израсходовать 20 мл 0,1 н.
НС1?
458. Какую навеску вещества, содержащего 40% СаО,
50% СаСО3 и 10% индифферентных примесей, нужно
взять, чтобы на ее титрование израсходовать 20 мл
0,1 н. НС1?
459. Какую навеску NaOH нужно взять, чтобы на тит-
рование ее израсходовать 22,00 мл раствора НС1
(7'нс1/№,о = 0,003514) ?
460. Какую навеску кальцита, содержащего 60%
СаСО3, нужно взять для анализа, чтобы на титрование ее
израсходовать 15,00 мл раствора НС1 (7hci=0,003820) ?
461. Навеску 2,0712 г технической буры растворили в
мерной колбе емкостью 100 мл. На титрование 20,00 мл
раствора израсходовали 21,80 мл НС1 (7'нс1/наон =
=0,003974). Вычислить процентное содержание х. ч.
NasBiOy- IOH2O.
462. Навеску 1,000 г суперфосфата обработали водой.
На титрование фильтрата до перехода Н3РО4 в NaH2PO4
израсходовали 17,60 мл раствора NaOH (7'маон/рщ,=
= 0,007251). Вычислить процентное содержание Р2О5 в
суперфосфате.
463. На титрование раствора, содержащего 3,1580 г
технического КОН, израсходовано 27,45 мл раствора НС1
(T’Hci/NaOH =0,07862). Вычислить процентное содержание
КОН в образце.
464. Для анализа взяли 50,00 мл раствора соляной
кислоты и разбавили водой до 1000 мл. На титрование
20,00 мл раствора NaOH (Тхаон/н,5о1=0,004189) израсхо-
довали 18,20 мл полученного раствора кислоты. Вычис-
лить концентрацию НС1 в исходном растворе (г/л).
465. Проба для анализа представляет собой смесь х. ч.
Na2CO3 и х. ч. К2СО3. Для нейтрализации 0,1000 г этой
смеси до СО2 израсходовали 22,00 мл раствора НО. Оп-
ределить нормальность кислоты, если содержание
NazCO3 в смеси 37,00%.
466. На нейтрализацию 0,2.140 г смеси, состоящей из
карбонатов кальция и бария, израсходовали 15,00 мл
0,2000 и. раствора кислоты. Вычислить процентное содер-
жание СаСО3 и ВаСО3 в смеси.
467. На нейтрализацию 0,4000 г смеси, состоящей из
х. ч. карбонатов натрия и калия, израсходовали 22,00 мл
0,3000 н. раствора кислоты. Вычислить процентное содер-
жание NajCOa и К2СО3 в смеси.
468. Навеску 2,0000 г неизвестного вещества раство-
рили в мерной колбе емкостью 100 мл. На титрование
25,00 мл раствора израсходовали 20,00 мл 0,4455 н. НС1,
Определить, что входило в состав анализируемого веще-
ства: КОН или NaOH.
469. Навеску 0,3251 г технической гидроокиси натрия
растворили в мерной колбе емкостью 100 мл. На титро-
вание 25,00 мл раствора с фенолфталеином израсходова-
ли 18,40 мл 0,1000 н. НС1, а с метиловым оранжевым
18,80 мл кислоты. Вычислить процентное содержание
NaOH в образце.
102
470. На титрование с фенолфталеином навески
0,4478 г, состоящей из Na2CO3, NaHCO3 и NaCl, потре-
бовалось 18,80 мл 0,1998 н. раствора кислоты. При тит-
ровании с метиловым оранжевым на ту же навеску из-
расходовали 40,00 мл раствора кислоты. Вычислить про-
центное содержание Na2CO3 и NaHCO3 в образце.
471. Навеску 0,4000 г технической гидроокиси натрия
растворили в мерной колбе емкостью 100 мл. На титро-
вание 20,00 мл раствора с метиловым оранжевым израс-
ходовали 19,20 мл раствора НС1 (Т’на^О,003600). Такую
же пробу раствора обработали 2 и. ВаС12 до полноты
осаждения карбонатов и при титровании с фенолфталеи-
ном израсходовали 18,80 мл раствора НО. Определить
процентное содержание карбонатных примесей в препа-
рате.
472. Определить временную жесткость воды, если на
титрование с метиловым оранжевым 200 мл исследуемой
воды израсходовали 10,00 мл раствора НС1 (7'nci=
= 0,0<Л760).
473. В мерной колбе емкостью 200 мл растворили
5,00 мл смеси соляной и фосфорной кислот. На титрова-
ние 20,00 мл полученного раствора с метиловым оранже-
вым израсходовали 18,20 мл 0,1012 н. NaOH; при титро-
вании такой же пробы раствора с фенолфталеином израс-
ходовали 34,70 мл раствора NaOH. Сколько граммов НС1
и Н3РО4 содержится в 100 мл смеси?
474. В мерной колбе емкостью 500 мл растворили
10,00 мл смеси технических серной и фосфорной кислот.
25,00 мл этого раствора оттитровали 26,40 мл раствора
NaOH (Гмаон/нс! = 0,003600) по метиловому оранжевому.
Такую же пробу оттитровали по фенолфталеину 40,00 мл
раствора NaOH. Сколько граммов Н28О4 и Н3РО4 содер-
жалось в 1 л смеси?
475. Навеску 2,000 г суперфосфата поместили в сухую
мерную колбу емкостью 100 мл. Объем раствора довели
ацетоном до метки. 50,00 мл фильтрата разбавили втрое
водой, прибавили несколько капель метилового красного
и оттитровали 15,00 мл 0,1020 н. КОН до желтой окрас-
ки. Затем прибавили фенолфталеин и оттитровали до ро-
зовой окраски, затратив 7,00 мл раствора КОН. Вычис-
лить процентное содержание H2SO4 и Н3РО4 в суперфос-
фате.
476. Какую навеску нашатыря, содержащего около
30% NH3, взяли для анализа, если после добавления к
103
ней 50,00 мл 0,1000 н. NaOH и нагревания до полного
удаления аммиака, избыток NaOH оттитровали 25,00 мл
0,1000 н. НС1?
477. Какую навеску х. ч. NaNO3 взяли для анализа по
методу восстановления NO^ до NH3, если выделивший-
ся аммиак был поглощен 40,00 мл 0,1245 и. НС1 и избы-
ток кислоты оттитрован 22,40 мл 0,1002 н. NaOH?
478. Пробу соли аммония в 1,000 г обработали избыт-
ком концентрированного раствора NaOH. Выделившийся
аммиак был поглощен 50,00 мл 1,0720 и. НС1. Избыток
кислоты был оттитрован 25,40 мл раствора NaOH
(Л?аон = 0,004120). Вычислить процентное содержание
NH3 в образце.
479. Навеску (NH4)2SO4 растворили в мерной колбе
емкостью 100 мл. К 20,00 мл раствора прибавили 50,00 мл
0,1122 н. NaOH и нагрели до полного удаления NH3.
Остаток щелочи оттитровали 18,00 мл раствора НС1
(20,00 мл раствора NaOH эквивалентны 21,00 мл раство-
ра НС1). Сколько граммов (NH4)2SO4 содержалось в рас-
творе?
480. Азот из навески органического вещества переве-
ли в соль аммония. Аммиак, выделившийся при кипяче-
нии с концентрированной щелочью, перегнали в
50,00 мл раствора ЙС1 (Гни=0,003905); избыток кисло-
ты оттитровали 22,40 мл раствора NaOH (7\гаон =
=0,004020). Какую навеску следует взять для анализа,
если содержание азота в веществе не превышало 30%?
481. Навеску 0,1032 г Na2CO3 обработали 50,00 мл
0,09496 и. НС1, избыток кислоты оттитровали 24,80 мл
0,1 и. NaOH (К= 1,298). Вычислить процентное содержа-
ние индифферентных примесей в образце.
482. Определить постоянную жесткость воды, если к
100 мл исследуемой воды прибавили 20,00 мл раствора
Na2CO3 0,003000) и после фильтрования
осадка карбонатов кальция и магния избыток Na2CO3
оттитровали 17,30 мл раствора НС1 (20,00 мл раствора
Na2CO3 эквивалентны 21,00 мл раствора НС1).
483. Определить: 1) временную; 2) постоянную и
3) общую жесткость воды, если на титрование 100,0 мл
воды израсходовали 2,00 мл 0,1010 н. НС1. После титро-
вания раствор обработали 50,00 мл щелочной смеси
(Na2CO3+NaOH), общая нормальность которой 0,09876
[при этом Са2+—>СаСО3 и Mg2+—>Л1ц(ОН)2]. Раствор с
осадком количественно перенесли в мерную колбу емко-
104
стью 200,0 мл и довели водой до метки. На титрование
избытка щелочной смеси в 50,00 мл с метиловым оранже-
вым израсходовали 11,00 мл раствора НС1.
484. В каком объеме соляной кислоты (7’иа=
=0,003814) нужно растворить навеску 0,1234 г СаСО3,
чтобы на титрование избытка кислоты израсходовать
19,50 мл раствора NaOH (Т’паон/сао =0,002910)?
485. Навеску 0,1938 г сплава, содержащего магний,
растворили в соляной кислоте, и магний осадили гидро-
фосфатом натрия в среде аммонийного буфера. Осадок
растворили в 50,00 мл 0,1 и. НС1 (/<=0,9981), на титро-
вание избытка кислоты израсходовали 18,00 мл раствора
NaOH (T’NaOH=0,004000). Определить процентное содер-
жание Mg в сплаве.
486. К 50,00 мл 0,1012 н. MgSO4 прибавили 25,00 мл
0,2514 н. NaOH и смесь разбавили водой в мерной колбе
емкостью 100 мл. Затем 50,00 мл фильтрата оттитровали
0,1046 н. НС1. Сколько миллилитров кислоты израсходо-
вали на титрование?
487. К 0,4789 г. смеси х. ч. SrCO3 и х. ч. Ы2СО3 доба-
вили 40,00 мл 0,5100 н. НС1. Избыток кислоты оттитро-
вали 20,00 йл NaOH (7\аОн/нс1=0,01825). Вычислить про-
центное содержание SrCO3 и Li2CO3.
488. К 1,000 г смеси х. ч. Na2CO3-10H2O и х. ч.
NaHCO3 добавили 50,00 мл 0,1000 н. НС1. Избыток кис-
лоты оттитровали 20,00 мл 0,1 н. NaOH (/<=1,543) по
фенолфталеину. Вычислить процентное содержание ком-
понентов в смеси.
489. К 0,5000 г смеси, содержащей Na2CO3 и NaHCO3,
прибавили 25,00 мл раствора НС1 (Тна=0,004000). На
титрование избытка кислоты израсходовали 15,00 мл рас-
твора NaOH (7\аон = 0,002000). Вычислить процентное
содержание Na2CO3.
490. Навеску 4,8215 г смеси х. ч. NaH2PO4 и х. ч.
Na2HPO4 растворили в 200 мл 0,1982 н. НС1. На титро-
вание 20,00 мл раствора с фенолфталеином израсходова-
ли 21,00 мл раствора NaOH (7’маон = 0,002000). Каково
процентное содержание Na2HPO4 в смеси?
491. К навеске 0,1000 г Na3PO4 прибавили 25,00 мл
0,2 М H2SO4. На обратное титрование избытка кислоты с
метиловым оранжевым израсходовали 15,00 мл раствора
NaOH. Определить нормальность раствора NaOH.
492. Какой объем 0,1012 н. НС1 прибавили к навеске
0,2000 г Na3PO4, если на титрование избытка кислоты с
105
фенолфталеином затратили 25,00 мл раствора NaOH
(7\аон=0,003400)?
493. Навеску 5,000 г суперфосфата растерли в ступке
с небольшим количеством воды. Фильтрат перенесли в
мерную колбу емкостью 250 мл, добавили 102,5 мл
0,1000 и. НС1 и довели водой до метки. На титрование
25,00 мл полученного раствора до перехода красной ок-
раски метилового оранжевого в желтую израсходовали
18,00 мл 0,1000 н. NaOH. Вычислить процентное содержа-
ние свободного Р2О5 в суперфосфате.
494. Навеску 5,000 г апатитовой муки после кипячения
с царской водкой перенесли в мерную колбу емкостью!
250 мл и довели водой до метки. Из мерной колбы взяли
5,00 мл исходной вытяжки и осадили РО|_ в виде фосфо-
ромолибдата аммония. Полученный осадок растворили в;
50,00 мл 0,2000 н. КОН, избыток которого оттитровали
30,00 мл 0,1971 н. H2SO4. Определить процентное содер-
жание Р2О5 в образце.
495. Какую минимальную навеску метилового спирта
нужно взять для определения в нем воды, чтобы на тит-
рование израсходовать 10,0 мл иодпиридинового раство-
ра с титром по воде 0,002000, если содержание влаги в
растворителе не превышает 0,4% ?
496. Какой объем этилового спирта, содержащего;
0,2% воды, нужно взять для анализа, чтобы на титрова-
ние израсходовать 8,00 мл иодпиридинового раствора с;
титром по воде 0,002500?
497. Вычислить процентное содержание влаги в орга-
ническом растворителе, если на титрование 5,00 мл его'
израсходовали 7,00 мл реактива Фишера с титром по во-
де 0,003000.
498. Вычислить процентное содержание воды в ацето-
не, если на титрование 4 г его израсходовали 5,00 мл!.
реактива Фишера с титром по воде 0,002000.
499. На титрование 4 г метанола, содержащего 0,1 %
воды, израсходовали 2,00 мл иодпиридинового раствора..
Определить титр реактива Фишера по воде.
500. Какую навеску фенола, содержащего около 3%
индифферентных примесей, нужно взять для анализа, что-
бы на титрование ее в среде метилэтилкетона с азофиоле-
товым израсходовать 5,00 ;мл 0,1 н. бензольно-метаноль-
ного раствора тетраэтиламмония?
501. На титрование 0,0200 г а-нафтола в среде метил-
этилкетона израсходовали 1,40 мл бензольно-метаноль-
106
ного раствора тетраэтиламмония. Определить нормаль-
ность титранта.
502. Определить объем 0,1 н. бензольно-метанольного
раствора тетрабензиламмония, израсходованный на тит-
рование 0,01560 г гидрохинона в среде метилэтилкетона.
503. Навеску 0,03274 г анилина растворили в 50,00 мл
безводной уксусной кислоты и оттитровали 0,1 н. НСЮ4
в безводной уксусной кислоте с кристаллическим фиоле-
товым. Определить объем титранта, израсходованный па
титрование.
504. Навеску 0,1300 г анилина растворили в 100,0 мл
безводной уксусной кислоты. На титрование 50,00 мл рас-
твора израсходовали 6,80 мл 0,1 н. НС1О4 в диоксане.
Вычислить процентное содержание индифферентных при-
месей в образце.
505. Определить процентное содержание толуидина в
образце, если на титрование 0,06928 г его в среде метил-
этилкетона с кристаллическим фиолетовым израсходова-
ли 6,00 мл 0,1 н. метилэтилкстонового раствора хлорной
кислоты.
506. Определить процентное содержание диметилапн-
лнна в пробе, если на титрование 0,04890 г ее в среде ме-
тилэтилкетона израсходовали 4,00 мл 0,1000 и. метил-
этилкетонового раствора хлорной кислоты.
507. Определить процентное содержание бензиланили-
на в пробе, если на титрование 0,0964 г в среде метил-
этилкетона израсходовали 5,00 мл 0,1000 н. метилэтилке-
тонового раствора хлорной кислоты.
508. К навеске 0,1000 г гидролизного сернокислотного
лигнина добавили 15,00 мл диметилформамида п оттит-
ровали 6,00 мл 0,03 М раствора метилата калия в бензо-
ле. Определить процентное содержание фенола в об-
разце.
509. К навеске 0,0500 г биохимического лигнина до-
бавили 15,00 мл диметилформамида и оттитровали
5,20 мл 0,03 М раствора .метилата калия в бензоле. Опре-
делить процентное содержание фенольных ОН-групп в
биохимическом лигнине.
510. Какую навеску биохимического лигнина, содер-
жащего 5% фенольных ОН-групп, нужно взять для ана-
лиза, чтобы на титрование ее в среде диметилформамида
израсходовать 4,50 мл 0,03 М раствора метилата калия
в бензоле?
107
511. В колбу с навеской 0,0997 г гвоздичного масла
добавили 30,00 мл этилендиамина и оттитровали 9,50 мл
0,1 и. бензольно-метанольного раствора метилата натрия.
Определить процентное содержание фенолов в навеске.
Методы осаждения и комплексообразования
512. Построить кривые титрования по методу осажде-
ния: 1) 0,1 н. AgNO3 0,1 н. раствором NH4SCN; 2) 0,05 и.
K.I 0,05 н. раствором AgNO3; 3) 0,05 н. NaBr 0,05 и. рас-
твором AgNO3; 4) 0,2 н. КгСгО4 0,2 и. раствором AgNO3;
5) 0,1 н. КС1 0,1 н. раствором Hg2(NO3)2; 6) 0,05 н. КВг
0,05 н. раствором Hg2(NO3)2; 7) 0,02 н. KI 0,02 н. раство-
ром Hg2(NO3)2; 8) 0,1 и. ВаС12 0,1 н. раствором Na2SO4;
9) 0,2 н. Ba(NO3)2 0,2 н. раствором К2СгО4; 10) 0,1 н.
Pb(NO3)2 0,1 н. раствором КЮ3; 11) 0,1 и. Pb(NO3)2
0,1 н. раствором Na2CrO4; 12) 0,05 н. NiSO4 0,05 н. раст-
вором диметилглиоксима (H2Dm).
513. Построить кривые титрования по методу комплек-
сообразования: 1) 0,05 н. КВг 0,05 н. раствором
Hg(NO3)2; 2) 0,03 н. К.С1 0,03 и. раствором Hg(NO3)2;
3) 0,1 н. NaCl 0,1 н. раствором Hg(NO3)2; 4) 0,1 н. FeCl3
0,1 н. раствором трилона Б; 5) 0,1 н. СаС12 0,1 н. раство-
ром трилона Б; 6) 0,1 н. NiCl2 0,1 н. раствором KCN;
7) 0,02 н. CdCl2 0,02 н. раствором трилона Б; 8) 0,03 и.
NiCl2 0,03 н. раствором трилона Б; 9) 0,04 н. МпС12
0,04 н. раствором трилона Б; 10) 0,03 и. MgCl2 0,03 н.
раствором трилона Б; 11) 0,02 н. Pb(NO3)2 0,02 и. раство-
ром трилона Б; 12) 0,02 н. ZnSO4 0,02 н. раствором три-
лона Б.
514. На титрование 20,00 мл 0,05 н. (/<=0,9640) NaCl
израсходовали 19,64 мл раствора AgNO3. Определить
нормальность и титр раствора AgNO3.
515. При анализе серебряного сплава, содержащего
85,00% Ag, взяли навеску 0,5000 г. Вычислить нормаль-
ность раствора KSCN, чтобы на титрование потребова-
лось 50,00 мл этого раствора.
516. Рассчитать нормальность раствора Hg2(NO3)2,
если на титрование навески NaCl 0,0585 г израсходовали
20,00 мл этого раствора.
517. Сколько граммов Hg2(NO3)2-2H2O требуется для
приготовления 500 мл 0,05 н. раствора?
518. На титрование 20,00 мл раствора NaCl (7\aci/ci =
108
= 0,001890) израсходовано 25,00 мл раствора Hg2(NO3)2.
Определить нормальность, поправочный коэффициент и
титр раствора Hg2(NO3)2.
519. Рассчитать нормальность раствора NaCl, 20,00 мл
которого оттитровываются 18,62 мл 0,1000 н. Hg(NO3)2.
520. Рассчитать нормальность раствора Hg2(NO3)2,
если на титрование 0,1050 г NaCl израсходовано 20,00 мл
раствора Hg2(NO3)2.
521. На титрование раствора, полученного растворе-
нием 0,2082 г NaBr, израсходовано 22,80 мл раствора
Hg2(NO3)2. На титрование 20,00 мл Hg2(NO3)2 затрачено
19,82 мл раствора NH4SCN. Определить нормальность и
титр раствора NH4SCN.
522. Навеску 4,856 г KSCN растворили в мерной кол-
бе емкостью 500 мл. На титрование 25,00 мл раствора
израсходовано 24,95 мл раствора Hg(NO3)2. Определить
нормальность, поправочный коэффициент и титр раствора
Hg(NO3)2.
523. Вычислить нормальность и титр раствора трило-
на Б, если на титрование 25,00 мл его израсходовано
24,45 мл 0,1100 и. ZnSO4.
524. Сколько граммов Hg(NO3)2-H2O требуется для
приготовления 250 мл 0,05 н. Hg(NO3)2?
525. Какую навеску КС1 следует взять для приготов-
ления 250 мл 0,05 н. раствора?
526. Сколько граммов KCI содержится в 250 мл рас-
твора, если на титрование 25,00 мл его израсходовано
34,00 мл 0,1050 н. AgNO3?
527. Сколько граммов NaCl содержится в 250 мл рас-
твора, если на титрование 25,00 мл его израсходовано
26,45 мл 0,05000 н. AgNO3.
528. Сколько граммов NaCl содержится в I л рассо-
ла, если после разбавления 10,00 мл его в мерной колбе
емкостью 500 мл на титрование 25,00 мл раствора потре-
бовалось 24,42 мл 0,1 н. AgNO3 ^=0,9245).
529. В мерную колбу емкостью 250 мл поместили
25,00 мл разбавленной НС! и довели водой до метки. На
титрование 20,00 мл раствора израсходовано 24,37 мл
0,9850 н. AgNO3. Сколько граммов НС1 содержится в 1 л
исследуемой кислоты?
530. Сколько граммов КС1 содержится в 250 мл рас-
твора, если на титрование 25,00 мл его израсходовано
17,00 мл 0,05252 н. Hg2(NO3)2?
109
531. Сколько миллиграммов бериллия содержится в
I л раствора ВеС12, 20,00 мл которого оттитровываются
18,16 мл 0,1032 н. Hg(NO3)2?
532. Сколько граммов KCN находится в растворе, на
титрование которого до появления неисчезающей мути
требуется 20,05 мл 0,1215 н. AgNO3?
533. Рассчитать навеску поваренной соли, содержа-
щей около 80% NaCl, необходимую для приготовления
500 мл 0,05 н. NaCl.
534. Сколько граммов чистой ртути следует раство-
рить в 25,00 мл азотной кислоты, чтобы на титрование
25,00 мл раствора расходовалось 20,00 мл раствора
NaCl (7’NaCi=0,002900)?
535. Какую навеску NaBr, содержащего около 10%
индифферентных примесей, следует взять для анализа,
чтобы на титрование ее потребовалось около 15 мл 0,1 н.
Hg(NO3)2?
536. Какую навеску цинковой руды, содержащей око-
ло 15% Zn, следует взять для анализа, чтобы после рас-
творения и отделения мешающих примесей Zn в ней отти-
тровывался 20 мл 0,1 М трилона Б?
537. Какую навеску Co(NO3)2-6H2O, содержащего
около 7% индифферентных примесей, следует взять для
анализа, чтобы на ее титрование потребовалось около
10 мл 0,1 М трилона Б?
538. Сколько граммов металлического цинка следует
растворить в 100,0 мл серной кислоты, чтобы на титрова-
ние 20,00 мл раствора расходовалось 20,00 мл 0,2000 М.
трилона Б?
539. Сколько миллилитров 0,1000 н. AgNO3 потребу-
ется на титрование 12,00 мл раствора, содержащего
6,50 г/л КС1?
540. Сколько миллилитров раствора Hg2(NO3)2
(^Hg,(NO3)a.2H3o = 0,01403) потребуется на титрование
25,00 мл раствора, полученного растворением 0,5910 г
NaCl в мерной колбе емкостью 250,0 мл?
541. Сколько миллилитров 0,05925 М. KiFe(CN)e по-
требуется на титрование 20,00 мл 0.1045М ZnSCU?
542. Рассчитать объем 0,05000 н. Hg(NO3)2, который
потребуется на титрование 0,2734 г образца, содержаще-
го 28,0% хлора.
543. Сколько миллилитров 0,1056 н. KCN потребуется
для титрования 20,00 мл AgNO3 (TAgNos =0,01126) ?
110
544, На титрование 20,00 мл раствора NiCl2 израсхо-
довано 21,22 мл 0,02065 М трилона Б. Определить кон-
центрацию раствора соли никеля (г/л).
545, Определить концентрацию (г/л) раствора MnCh,
если на титрование 20,00 мл его израсходовано 17,26 мл
0,6905 М трилона Б.
546. Навеску 0,8180 г смеси NaCl и NaNO3 растворили
в мерной колбе емкостью 200 мл. На титрование 20,00 мл
раствора израсходовали 18,35 мл раствора AgNO3
|'Саямо3/кс1 = 0,003442) . Вычислить процентное содер-
жание NaCl в смеси.
547. Навеску 2,4080 г технического NaCl растворили
в мерной колбе емкостью 500 мл. На титрование 25,00 мл
раствора израсходовали 20,35 мл 0,1 н. AgNO3 (К~
= 0,9860). Вычислить процентное содержание хлора в
исходной соли.
548. Навеску 6,7000 г технического ВаС12 растворили
в мерной колбе емкостью 1000 мл. На титрование
25,00 мл раствора израсходовали 28,95 мл раствора
AgNO3 (T’AgNOa =0,008048). Вычислить процентное содер-
жание хлора в образце.
549. Навеску 1,7450 г серебряного сплава растворили
в HNO3 и раствор разбавили водой до объема 200 мл. На
титрование 10,00 мл раствора потребовалось 11,75 мл
0,05 н. NH4SCN (А=0,9344). Вычислить процентное со-
держание Ag в сплаве.
550. Навеску 0,3838 г технического КВг растворили и
оттитровали 23,80 мл раствора AgNO; (^AgNO3/ci=0,003546).
Вычислить процентное содержание КВг в образце.
551. На титрование раствора, полученного из 0,2122 г
серебряного сплава, израсходовали 32,40 мл 0,05 н. KSCN
(Х= 1,0200). Вычислить процентное содержание Ag в
сплаве.
552. Определить процентное содержание Ag в сплаве,
если после растворения навески 0,2000 г на титрование
израсходовано 39,60 мл раствора, содержащего 0,4103 г
KSCN в 100 мл,
553. Навеску 10,0500 г Hg2(NO3)2 растворили в мер-
ной колбе емкостью 250 мл. На титрование 20,00 мл рас-
твора израсходовали 30,00 мл раствора NH4SCN
(5nNH4scN = 0,00709.2). Вычислить процентное содержание
Hg2(NO3)2 • 2Н2О в образце.
554. Навеску 2,2040 г карналлита растворили в мерной
колбе емкостью в 250 мл. На титрование 20,00 мл рас-
111
твора израсходовали 17,80 мл раствора 0,1 и. Hg2(NO3)2
(К—0,8975). Вычислить процентное содержание хлора в
образце.
С^555^Определить процентное содержание индиффе-
рентных примесей в ацетате свинца, если на титрование
раствора, полученного из 0,1000 г его, израсходовано
5,84 мл 0,05000 М трилона Б.
556. Определить процентное содержание Mg в алю-
миниевом сплаве, если после растворения 0,5000 г и уда-
ления мешающих элементов объем раствора довели до
100,0 мл и 20,00 мл его оттитровали 12,06 мл 0,01000 М
трилона Б.
557. Определить процентное содержание индиффе-
рентных примесей в MgSO4-7H2O, если после растворе-
ния навески 0,1000 г магний оттитровывается 7,32 мл
0,05000 М трилона Б.
558. После соответствующей обработки 3,0340 г стек-
ла перевели в раствор и объем раствора довели водой до
100,0 мл. 20,00 мл раствора оттитровали 7,06 мл
0,005000 М трилона Б. Определить процентное содержа-
ние Fe в стекле.
559. Определить процентное содержание Мп в медном
сплаве, если после растворения 0,2062 г пробы и маски-
ровки мешающих элементов Мп оттитрован 15,42 мл
0,05000 М трилона Б.
560. Определить процентное содержание Ni в стали,
если после растворения 1,0000 г пробы никель осадили
диметилглиоксимом и осадок растворили в НС1. Объем
раствора довели до 50,00 мл и 20,00 мл его оттитровали
5,45 мл 0,1000 М трилона Б.
561. Какую навеску силиката, содержащего около
20% А12О3, следует взять для анализа, чтобы после
сплавления и соответствующей обработки пробы А1 был
отделен и оттитрован 10 мл 0,1 М трилона Б.
562. Навеску соли магния 0,2000 г растворили в мер-
ной колбе емкостью 100 мл. На титрование 20,00 мл рас-
твора израсходовали 20,25 мл 0,02500 М трилона Б. Вы-
числить процентное содержание Mg в соли.
563. Вычислить процентное содержание СаСО3 и
MgCO3 в известняке, если после растворения 1,0000 г
пробы и соответствующей обработки объем раствора до-
вели водой до 100,0 мл и на титрование 20,00 мл его для
определения суммы Са и Mg затратили 19,25 мл
112
0,05140 М трилона Б, а на титрование Mg израсходовали
6,26 мл того же раствора трилона Б.
564. Образец 3,1540 цинковой руды растворили в мер-
ной колбе емкостью 250 мл. На титрование 20,00 мл рас-
твора израсходовали 4,90 мл раствора K«Fe(CN)6
(T’K<Fe(CN)t/znO-0,01285). Вычислить процентное содержание
Zn в руде.
565. Навеску 0,2775 г соли цинка растворили и после
соответствующей обработки оттитровали 6,48 мл раство-
ра, содержащего 0,03876 г/мл K4Fe(CN)6. Вычислить про-
центное содержание ZnO в образце.
566. Определить процентное содержание ВаС12-2Н2О
в образце соли, если на титрование раствора, полученно-
го из 0,2034 г ее, израсходовано 15,62 мл 0,09850 н.
Hg(NO3)2.
567. На титрование навески 0,0973 хлористой соли из-
расходовано 14,30 мл 0,1 и. Hg(NO3)2 (/(=0,9120). Вы-
числить процентное содержание хлора в образце.
568. Навеску 0,1506 г технического бромида калия
растворили в воде и оттитровали 22,02 мл 0,05 н.
Hg(NO3)2 (/(=1,0107). Вычислить процентное содержа-
ние КВг в образце.
569. Навеску 2,8530 г хлористой соли растворили в
мерной колбе емкостью 500 мл. На титрование 20,00 мл
раствора израсходовали 19,95 мл 0,1 н. Hg(NO3)2 (/(=
= 1,055). Вычислить процентное содержание хлора в об-
разце.
570. Вычислить процентное содержание брома в тех-
ническом бромиде натрия, если на титрование раствора,
полученного из навески 3,9856 г его, израсходовано
21,20 мл 0,2500 н. Hg(NO3)2.
571. Вычислить процентное содержание Ni в никеле-
вом сплаве, если на титрование раствора, полученного из
навески 0,2548 г его, израсходовано 25,00 мл 0,05000 н.
KCN.
572. К 0,2266 г. хлористой соли прилили 30,00 мл
0,1121 н. AgNO3, избыток которого оттитровали 15,00мл
0,1158 н. NH4SCN. Вычислить процентное содержание
хлорида в веществе.
573. В мерной колбе емкостью 250 мл растворили
3,0360 г технического КС1. К 25,00 мл раствора прибави-
ли 50,00 мл 0,1045 М AgNO3. На титрование раствора,
содержащего избыток ионов Ag+, израсходовали
113
20,68 мл раствора NH4SCN (7’NH1scN/Ag = 0,01166). Вы-
числить процентное содержание КС1 в образце.
574. Навеску 0,1160 г поваренной соли перевели в рас-
твор и обработали 40,00 мл 0,06540 н. AgNO3. На титро-
вание избытка AgNO3 израсходовали 9,05 мл 0,1 н. KSCN
(К= 1,0500). Вычислить процентное содержание NaCl в
поваренной соли.
575. К 25,00 мл раствора NaCl прибавили 50,00 мл
0,1100 н. AgNO3, разбавили водой до 100,0 мл, отобрали
50,00 мл и оттитровали их 5,23 мл 0,09800 н. KSCN.
Сколько граммов NaCl содержалось в первоначальном
растворе?
576. Сколько граммов ВаС12 содержится в 250,0 мл
раствора, если после прибавления к 25,00 мл этого рас-
твора 40,00 мл 0,1020 н. AgNO3 на обратное титрование
избытка AgNO3 израсходовано 15,00 мл 0,09800 н.
NH4SCN?
577. Навеску 1,4790 г смеси хлористых солей раство-
рили в мерной колбе емкостью 250 мл. К 25,00 мл полу-
ченного раствора прилили 50,00 мл 0,1 н. AgNO3 (К=
=0,9580). На титрование избытка AgNO3 израсходовали
25,50 мл 0,1 н. KSCN (К= 1,1200). Вычислить процент-
ное содержание хлора в образце.
578. Навеску 0,1130 г смеси хлористых солей раство-
рили и обработали 50,00 мл раствора AgNO3 (T’AgNoa=
= 0,01721). На титрование избытка AgNO3 израсходова-
ли 56,40 мл 0,05 н. KSCN (Л)=0,8532). Вычислить про-
центное содержание хлорида в смеси.
579. Навеску 0,2058 г технического NaBr растворили
в воде, к раствору добавили 40,00 мл 0,09980 н. AgNO3.
На титрование избытка AgNO3 израсходовали 21,20 мл
раствора KSCN. Вычислить процентное содержание при-
месей в рбразце, если 1,00 мл раствора AgNO3 эквива-
лентен 1,06 мл раствора KSCN.
580. В мерной колбе емкостью 250 мл растворили
2,0025 г технического КВг. К 25,00 мл раствора приба-
вили 50,00 мл 0,05560 и. Hg2(NO3)2. На титрование из-
бытка раствора Hg2(NO3)2 израсходовали 25,02 мл рас-
твора NaCl (rNaci = 0,002922). Вычислить процентное со-
держание КВг в образце.
581. К раствору, полученному после соответствующей
обработки 0,1624 г цинковых белил, прибавлено 22,40 мл
раствора K4Fe(CN)f„ на титрование избытка которого
израсходовано 2,82 мл раствора ZnSO4. Вычислить про-
114
центное содержание ZnO в образце (Т к4ге <cn)4 =
= 0,006517, а 1,00 мл его эквивалентен 1,08 мл раствора
ZnSO).
582. Сколько миллиграммов вещества, содержащего
60% NaCl и 37% КС1, следует взять для анализа, чтобы
после добавления 25,00 мл 0,1000 н. AgNO3 избыток его
оттитровался 5,00 мл раствора NH4SCN (1,00 мл раство-
ра NH4SCN эквивалентен 1,10 мл раствора AgNO3).
583. Определить нормальность и титр раствора
Pb(NO3)2, если после прибавления к 20,00 мл его
20,00 мл 0,09940 ДА трилона Б на обратное титрование по-
следнего израсходовано 15,24 мл 0,1036 н. ZnCh.
584. Сколько граммов сульфата содержится в пробе,
если после прибавления 20,00 мл 0,06315 М ВаС12 избы-
ток его оттитрован 15,64 мл 0,04640 М трилона Б.
585. К 20,00 мл 0.1000М NiSO4 прибавили 20,00 мл
исследуемого раствора NaCN. Определить молярную кон-
центрацию его, если на титрование избытка NiSO4 израс-
ходовали 10,24 мл 0,05000 М трилона Б.
586. Сколько миллиграммов ртути содержится в
50,00 мл раствора, если после прибавления 25,00 мл
0,01000 М трилона Б избыток его оттитровывается
10,50 мл 0,01000 М MgSO4?
587. В мерной колбе емкостью 100 мл растворили
0,5100 г технического MnSO4. К 10,00 мл раствора приба-
вили 25,00 мл 0,01036 М трилона Б. На титрование из-
бытка его израсходовали 15,94 мл 0,01049 н. Z11SO4. Вы-
числить процентное содержание MnSO4 в образце.
588. На титрование 20,00 мл раствора Hg(NO3)2 пос-
ле добавления избытка Na2Mg ЭДТА затрачено 19,85 мл
0,05 М раствора трилона Б \К = 1,055). Вычислить кон-
центрацию раствора Hg(NO3)2 (г/л).
589. К 25,00 М Ba(NO3)2 добавили избыток
Na2Mg ЭДТА. На титрование полученной смеси затраче-
но 18,05 мл 0,1 М. трилона Б (Д=0,9878). Вычислить
концентрацию раствора Ba(NO3)2 (г/л).
590. Навеску ВаС12-2Н2О 1,2515 г растворили в
100,0 мл воды. К 20,00 мл раствора добавили избыток
Ыа2А^ЭДТА. На титрование полученной смеси израсхо-
довали 17,65 мл 0,05085 М трилона Б. Вычислить про-
центное содержание ВаС12-2Н2О в образце.
591. Определить процентное содержание алюминия в
сплаве, если после растворения 0,6500 г его и удаления
мешающих элементов объем раствора довели до
250,0 мл и к 20,00 мл этого раствора добавили избыток
115
Na2Mg3flTA. На титрование полученной смеси затрати-
ли 15,18 мл 0,05023 М трилона Б.
592. В мерной колбе емкостью 100,0 мл растворили
0,5370 г NiSOi-nHsO. К 15,00 мл раствора прибавили
25,00 мл 0,01082 М трилона Б. На титрование избытка
трилона Б израсходовали 11,87 мл 0,01135 М ZnSOi. Вы-
числить процентное содержание Ni в образце.
593. В мерной колбе емкостью 200 мл растворили
1,1256 г MgSO4-/iH2O. К 20,00 мл раствора прибавили
25,00 мл 0,01238М трилона Б. На титрование избытка
трилона Б израсходовали 9,05 мл 0,01015 М ZnSCh. Вы-
числить процентное содержание Mg в образце.
594. В мерной колбе емкостью 250,0 мл растворили
0,7634 г Hg(NO3)2-/iH2O. К 25,00 мл раствора прибавили
50,00 мл 0,01007 М трилона Б. На титрование избытка
трилона Б израсходовали 23,83 мл 0,01178 М ZnSO4. Вы-
числить процентное содержание Hg(NO3)2 в образце.
Методы окисления — восстановления (оксидиметрия)
595. Построить кривые титрования и подобрать инди-
катор для титрования: 1) 0,1 н. FeSO4 0,1 н. раствором
КМпО4 при концентрации ионов водорода, равной
1,0 г-ион/л и 10~3 г-ион/л; 2) 0,1 н. H3AsO3 0,1 н. раство-
ром КМпО4 при pH 2; 3) 0,02 н. Na2S2O3 0,02 н. раство-
ром 12; 4) 0,1 н. Ce(SO4)2 0,1 н. раствором FeSO4;
5) 0,1 н. FeSO4 0,1 п. раствором NH4VO3 при [Н+]=
= 1,0 г-ион/л; 6) 0,1 н. SnCl2 0,1 н. раствором NH4VO3
при [Н+] = 1,0 г-ион/л; 7) 0,02 н. H2S 0,02 н. раствором
NaClO при pH 0 (H2S окисляется до SO^_).
596. Рассчитать область скачка титрования, окисли-
тельно-восстановительный потенциал в точке эквивалент-
ности и подобрать инициатор при титровании:
1) 0,05 н. FeSO4 0,05 н. раствором КС1О3, если [Н+]=
= 0,1 г-ион/л;
2) 0,1 и. FeSO4 0,1 н. раствором КВгО3, если [Н+]=
= 1,0 г-ион/л;
3) 0,1 н. Na2SO3 0,1 н. раствором КМ11О4, если [Н+] =
= 1,0 г-ион/л и 10~3 г-ион/л;
4) 0,01 н. FeSO4 0,01 н. раствором К2Сг2О7, если [Н+] =
= 0,1 г-ион/л;
116
5) 0,1 и. NaNO2 0,1 н. раствором КМпО4, если [Н+]=
= 10~2 г-ион/л и 0,1 г-ион/л;
6) 0,1 н. SnCl2 0,1 н. раствором КВгОз, если pH 0 и 3;
7) 0,02 н. Na2SO3 0,02 н. раствором 12, если pH 0 и 3;
8) 0,05 н. H3AsO3 0,05 н. раствором К1О3, если [Н+]=
= 3 г-ион/л;
9) 0,1 н. NaNO2 0,1 н. раствором КСЮ3, если [Н+]=
= 1,0 г-ион/л;
10) 0,1 н. H3AsO3 0,1 н. раствором 12, если [Н+]=
= 10 3 г-ион/л.
597. Вычислить индикаторную ошибку титрования
раствора V (Ш) раствором КзСггО? в сернокислой среде
при pH 0: 1) с ферроином (интервал перехода индикато-
ра равен £“ня + 0,06 В); 2) с о-дианнзидином (интервал
перехода + 0,06 В); 3) с дифениламином (интервал
перехода + 0,03 В).
598. Вычислить индикаторную ошибку титрования рас-
твора Mo (V) раствором NH4VO3 в сильнокислой среде:
1) с дифениламином (интервал перехода индикатора ра-
вен Е°нд + 0,03 В); 2) с дифениламинсульфонатом натрия
(интервал перехода Д°нд ± 0,03 В); 3) с N-фенилантра-
ниловой кислотой (интервал перехода £'°/д±0,03В).
599. Вычислить индикаторную ошибку титрования рас-
твора FeSO4 раствором КМпО4 в среде 2 М H2SO4:
1) с ферроином (интервал перехода индикатора равен
± 0’06 В); 2) с дифениламином (интервал перехода
± 0,03 В).
600. Сколько граммов КМпО4 надо взять, чтобы при-
готовить 1,5 л 0,05 н. раствора его для титрования в кис-
лой среде?
601. Сколько граммов Na2S2O3-5H2O следует взять
для приготовления: 1) 500,0 мл 0,1 н. раствора; 2) 200,0 мл
раствора с титром по иоду 0,01500?
602. Сколько граммов КаСьО? необходимо взять для
приготовления 2 л раствора с титром по железу 0,002792?
Какова нормальность раствора К2СГ2О7?
603. До какого объема следует разбавить 500,0 мл
0,1000 н. КаСг2О7 для получения раствора с титром по
железу 0,005000?
604. Сколько миллилитров 1,000 и. KzCr2O7 надо при-
бавить к 1000 мл раствора К2Сг2О7 с титром по железу
0,003500, чтобы получить раствор с титром по железу
0,004500?
117
605. На титрование 20,00 мл Н2С2О4 (71н1с1о.-2н1!о =
= 0,006900) израсходовали 25,00 мл раствора КМпО4.
Рассчитать нормальность и титр раствора КМпО4.
606. Анализ показал, что 1,00 мл раствора
КНС2О4-Н2С2О4-2Н2О эквивалентен 0,20 мл раствора
КМпО4, а 1,00 мл раствора КМпО4 эквивалентен 0,1117 г
Fe. Какова нормальность раствора КНС2О4-Н2С2О4Х
Х2Н2О?
607. Рассчитать нормальность раствора КМпО4, если
40,00 мл его окислили такую навеску КНС2О4-Н2С2О4Х
Х2Н2О, какая потребует для своей нейтрализации
30,00 мл 0,5000 н. NaOH.
608. Кальций осадили в виде СаС2О4-Н2О, осадок
отфильтровали, промыли и растворили в разбавленной
H2SO4. Образовавшуюся кислоту Н2С2О4 оттитровали
20,15 мл раствора КМпО4 с титром по СаО 0,01752.
Сколько граммов кальция содержалось в пробе?
609. На титрование 25,00 мл раствора FeSO4 в H2SO4
израсходовали 31,25 мл 0,1000 н. КгСсО?. Сколько воды
нужно добавить к 200,0 мл раствора соли железа, чтобы
сделать раствор точно 0,05000 н.?
610. Рассчитать навеску Н2С2О4-2Н2О, которую следу-
ет взять в мерную колбу емкостью 500 мл, чтобы на тит-
рование 25,00 мл раствора израсходовать 30,25 мл рас-
твора, содержащего 1,5800 г/л КМпО4.
611. Вычислить нормальность раствора 12, если на тит-
рование 0,3002 г As2O3 израсходовано 40,00 мл этого рас-
твора.
612. Чему равен титр раствора 12 по As2O3, если
1,00 мл его эквивалентен 0,03000 г Na2S2O3?
613. Вычислить процентное содержание Н2С2О4 в тех-
ническом препарате щавелевой кислоты, если 0,2003 г ее
оттитровали 29,30 мл раствора КМпО4, 1,00 мл которого
эквивалентен 0,006023 г Fe?
614. Из 1,4500 г технического Na2SO3 приготовили
200 мл раствора. На титрование 20,00 мл раствора израс-
ходовали 16,20 мл раствора 12, титр которого по As2O3
равен 0,002473. Определить процентное содержание
Na2SO3 в образце.
615. Какую навеску руды, содержащей около 60%
Fe2O3, взяли для анализа, если после соответствующей
обработки на титрование полученной соли железа (II)
израсходовали 20 мл 0,1 н. КМпО4?
118
616. Рассчитать навеску вещества (г), содержащего
0,3% серы, чтобы на титрование полученного из нее H2S
потребовалось 10,00 мл 0,05000 н. 12.
617. Сколько граммов Н2О2 содержится в пробе, если
при титровании израсходовано 14,50 мл раствора КМпО4,
1,00 мл которого эквиваленте.ч 0,08376 г Fe?
618. Навеску 5,0000 г пергидроля растворили в мерной
колбе емкостью 500 мл. На титрование 25,00 мл раствора
израсходовали 37,43 мл 0,1 н. КМпО4 (/(=1,1240). Вы-
числить процентное содержание Н2О2 в образце.
619. Навеску образца 0,1000 г, содержащего 99,98%
Fe, растворили в H2SO4 без доступа воздуха и- оттитро-
вали 0,1000 и. КМпО4. Сколько миллилитров КМпО4 из-
расходовали на титрование?
620. Сколько миллилитров раствора, содержащего
25,00 г/л К2Сг2О7, эквивалентны 3,4000 г FeSO4-7H2O в
кислой среде?
621. Вычислить процентное содержание железа в ру-
де, если после растворения 0,7100 г руды и восстановле-
ния железа до Fe2+ на титрование израсходовали
48,06 мл КМпО4 (1,00 мл КМпО4 эквивалентен 0,0067 г
Н2С2О4). Сколько граммов К.МпО4 содержится в 1 мл
раствора?
622. Железо в навеске 0,5000 г руды восстановили до
Fe2+ и оттитровали 35,15 мл раствора К2СГ2О7, 15,00 мл
которого по окисляющей способности эквивалентны
25,00 мл раствора КМпО4, а 1,00 мл КМпО4 эквивален-
тен 0,004750 г Fe. Рассчитать процентное содержание
Fe2O3 в руде.
623. Навеску в 0,2250 г пробы, состоящей только из
Fe и Fe2O3, растворили, восстановили железо до Fe2+ и
оттитровали 37,50 мл 0,09910 н. КМпО4. Вычислить про-
центное содержание Fe и Fe2O3 в пробе.
624. Определить процентное содежание Sn в бронзе,
если на титрование раствора, полученного из 0,9122 г
бронзы, израсходовано 15,73 мл 0,03523 н. 12.
625. После растворения навески 0,1000 г неизвестного
окисла железа и восстановления металла до Fe2+ на тит-
рование израсходовано 12,61 мл 0,09930 н. К2СГ2О7. Оп-
ределить, какую формулу имел анализируемый окисел:
FeO, Fe2O3 или Fe3O4?
626. Навеску 1,7950 г руды перевели в раствор, вос-
становили железо в Fe2+ и довели до 250,0 мл. На тит-
рование 20,00 мл раствора израсходовали 18,65 мл
119
К2СГ2О7 с титром 0,002857. Вычислить процентное содер-
жание Fe в образце.
627. Навеску технического Na2SO3 1,4680 г прибавили
к 100,0 мл 0,1000 н. 12. Избыток 12 оттитровали 42,40 мл
раствора Na2S2O3, 1,00 мл которого эквивалентен количе-
ству 12, выделяющемуся из 0,01574 г KI. Вычислить про-
центное содержание Na2SO3 в образце.
628. К навеске в 1,5000 г технического Na2SO3 после
растворения прибавили 100,0 мл 0,1000 н. 12. На титро-
вание избытка 12 израсходовали 40,00 мл раствора,
в 200,0 мл которого содержится 2,4820 г Na2S2O3. Опре-
делить процентное содержание Na2SO3 в образце.
629. К 25,00 мл раствора H2S прибавили 50,00 мл
0,01960 н. 12, избыток 12 оттитровали 11,00 мл 0,02040 н.
Na2S2O3. Сколько граммов H2S содержалось в 1 л иссле-
дуемого раствора?
630. Рассчитать навеску образца, содержащего около
65% МпО2, чтобы после взаимодействия с 50 мл 0,1 и.
Н2С2О4 избыток ее оттитровывался 25 мл раствора
КМпО4 (1,00 мл раствора КМпО4 эквивалентен 1,035 мл
раствора Н2С2О4).
631. К раствору, содержащему 0,1510 г технического
КС1О3, прилили 100,0 мл 0,09852 н. Na2C2O4, избыток ко-
торого оттитровали 48,60 мл 0,05320 и. КМпО4. Вычис-
лить процентное содержание КС1О3 в образце.
632. Навеску 0,2000 г руды, содержащей МпО2, обра-
ботали 24,00 мл Н2С2О4 в присутствии H2SO4 и на титро-
вание не вошедшего в реакцию избытка Н2С2О4 израсхо-
довали 20,00 мл 0,02000 н. КМпО4. Найти процентное со-
держание Мп в руде, если на 25,00 мл раствора Н2С2О4
израсходовали 45,00 мл раствора КМпО4.
633. Вычислить процентное содержание МпО2 в при-
родном пиролюзите, если образец 0,4000 г обработали
разбавленной H2SO4, содержащей 0,6000 г Н2С2О4-2Н2О,
и избыток Н2С2О4 оттитровали 26,26 мл 0,1000 н. КМпО4.
634. Сколько граммов кальция содержится в 250,0 мл
раствора СаС12, если после прибавления к 25,00 мл его
40,00 мл 0,1000 н. (NH4)2C2O4 и отделения образовавше-
гося осадка СаС2О4 на титрование не вошедшего в реак-
цию (NH4)2C2O4 израсходовали 15,00 мл 0,02000 н.
КМпО4?
635. К раствору КСЮ3 прибавили 50,00 мл 0,1048 н.
FeSO4, избыток которого оттитровали 20,00 мл 0,09450 н.
120
КМпО4. Сколько граммов КС1О3 содержалось в рас-
творе?
636. После растворения 1,2430 г стали хром окислили
до СгО2-. К раствору прибавили 35,00 мл раствора соли
Мора и избыток Fe2+ оттитровали 16,12 мл раствора
КМпО4 (СкмсО. --0,001510 25,00 мл раствора соли Мора
эквивалентны 24,10 мл раствора КМпО4). Рассчитать
процентное содержание Ст в стали.
637. Навеску стали 0,2548 г, содержащей 1,09% мар-
ганца, растворили, окислили до МиО~ и оттитровали
18,50 мл раствора Na3AsO3. Рассчитать титр Na3AsO3 по
марганцу.
638. Навеску руды в 2,000 г растворили в кислоте и
хром окислили до Сг2О2~. После разрушения избытка
окислителя раствор разбавили до 100,0 мл, 20,00 мл рас-
твора обработали 25,00 мл раствора FeSO4. На титрова-
ние избытка FeSO4 израсходовали 15,00 мл 0,04500 н.
К2СГ2О7 (25,00 мл FeSO4 эквивалентны 35,00 мл К2СГ2О7).
Вычислить процентное содержание Сг в руде.
639. Вычислить нормальность раствора Na2S2O3, если
1,00 мл раствора К2СГ2О7 эквивалентен 0,005584 г Fe, при
взаимодействии 20,00 мл раствора К2СГ2О7 с KI выде-
ляется такое количество 12, которое оттитровывается
32,46 мл раствора Na2S2O3.
640. К кислому раствору KI прибавили 20,00 мл
0,1133 н. КМпО4 и выделившийся 12 оттитровали 25,90 мл
раствора Na2S2O3. Рассчитать нормальность раствора
Na2S2O3.
641. К 40,00 мл раствора КМпО4 (1,00 мл КМпО4 эк-
вивалентен 0,0050 г железа) добавили KI и выделивший-
ся 12 оттитровали 35,90 мл раствора Na2S2O3. Рассчитать
титр раствора Na2S2O3 по меди.
642. К 25,00 мл раствора КМпО4 с титром по кисло-
роду 0,0008110 добавили KI. Выделившийся 12 оттитро-
вали 24,14 мл раствора Na2S2O3. Рассчитать титр Na2S2O3
по иоду.
643. Рассчитать навеску К2СГ2О7, чтобы на титрова-
ние 12, выделившегося после взаимодействия его с избыт-
ком KI, израсходовать 32,45 мл раствора Na2S2O3 с тит-
ром по 12 0,01270.
644. Из 25,00 мл раствора свинец осадили в виде
РЬСгО4, отфильтровали, промыли, растворили в кислоте
и добавили избыток KI. На титрование выделившегося
121
1г израсходовали 31,50 мл 0,1016 н . №2520з. Рассчитать
концентрацию свинца в растворе.
645. Сколько граммов Na2SO4 содержится в исследуе-
мом растворе, если эквивалентное количество СгО^ вы-
деляет из KI столько 12, что на его титрование расходу-
ется 30,40 мл 0,01880 н. Na2S2O3?
646. Навеску 0,2600 г технического CuCl растворили
в избытке солянокислого раствора NH4Fe(SO4)2. На тит-
рование образовавшегося Fe2+ израсходовали 20,18 мл
6,1200 н. КзСггО?. Найти процентное содержание CuCl в
образце.
647. Рассчитать нормальность раствора Na2S2O3, если
анализ выполнен по следующей схеме:
Cu->Cu2+; 2Cu2+ + 41-^2CuI + I2;
I2+2SaO2-^2I-+S4Oi-
Для этого взяли навеску меди 0,1530 г, а на титрование
выделившегося 12 израсходовали 24,18 мл раствора
Na2S20j.
648. Серу из навески 0,1906 г угля перевели в SO2,
который уловили разбавленным раствором крахмала и
оттитровали 20,45 мл 0,02088 н. 12. Рассчитать процент-
ное содержание серы в угле.
649. К 25,00 мл раствора KJ прибавили КЮз и кис-
лоту. На титрование выделившегося 12 израсходовали
30,00 мл 0,1048 н. Na2S2O3. Вычислить молярную концен-
трацию раствора KL
650. К 25,00 мл раствора KI прилили разбавленной
НС1 и 10,00 мл 0,05000 М КЮ3. Выделившийся 12 отогна-
ли, к охлажденному раствору прибавили избыток KI, ко-
торый вступил в реакцию с оставшимся КЮз. На титро-
вание выделившегося 12 израсходовали 21,14 мл 0,1008 н.
Na2S2O3. Вычислить молярную концентрацию первона-
чального раствора KI.
651. Установлено, что 50,00 мл раствора 12 по своей
окисляющей способности эквивалентны 49,47 мл раствора
К2СГ2О7, 1,00 мл которого выделяет из KI 0,004263 г 12.
Вычислить нормальность обоих растворов.
652. Рассчитать процентное содержание меди в ру-
де, если из навески 0,6215 г руды медь перевели в рас-
твор в виде Си2+, при добавлении к этому раствору KI
выделился 12, на титрование которого израсходовали
18,23 мл раствора Na2S2O3 (7’Na,s,Oa/cu = 0,006208).
122
653. К подкисленному раствору Н2О2 прибавили избы-
точное количество KI и несколько капель раствора
(NH4)2MoO4 как катализатора. Выделившийся 12 оттит-
ровали 22,40 мл 0,1010 н. Na2S2O3. Сколько граммов
Н2О2 содержалось в растворе?
654. К навеске 0,1500 г КгСггО? добавили избыточное
количество KI и соляной кислоты. Выделившийся 12 от-
титрован 21,65 мл раствора Na2S2O3. Рассчитать нормаль-
ность раствора Na2S2O3 и его титр по иоду.
655. Навеску 0,2940 г К2СГ2О7 растворили в мерной
колбе на 200,0 мл. На титрование иода, выделенного
25,00 мл полученного раствора из KI, израсходовали
20,00 мл раствора Na2S2O3. Рассчитать титр раствора
Na2S2O3 и грамм-эквиваленты окислителей и восстано-
вителей, участвующих в реакциях.
656. К раствору К2Сг2С>7 добавили избыток KI и выде-
лившийся 12 оттитровали 48,80 мл 0,1000 н. Na2S2O3.
Сколько граммов К2Сг2О7 содержалось в растворе?
657. Сколько миллилитров раствора Н2О2, приготов-
ленного разбавлением 25,00 мл 3%-ного раствора до
250,0 мл, следует взять, чтобы на титрование полученно-
го раствора после обработки его НС1 и KI израсходо-
вать 25,00 мл 0,1500 н. Na2S2O3?
658. Сколько миллилитров хлорной воды, содержащей
около 2% хлора, следует взять, чтобы на титрование ее
после соответствующей обработки израсходовать около
30 мл раствора Na2S2O3 (7’Na2s1oa-5Hso=:70,02500)?
659. В мерную колбу емкостью 250 мл поместили на-
веску 3,3590 г белильной извести и добавили воды до
метки. Для титрования 25,00 мл полученной суспензии
после соответствующей обработки потребовалось 18,29 мл
раствора NaaS<sOa(rNa,s.o,-5HJo = 0,02453). Вычислить
процентное содержание активного хлора в белильной из-
вести.
660. Навеску 4,8900 г технического FeCl3 растворили
в мерной колбе емкостью 250 мл. К 25,00 мл раствора
в кислой среде добавили KI. Выделившийся 12 оттитро-
вали 32,10 мл 0,09230 н. Na2S2O3. Вычислить процентное
содержание FeCl3 в образце.
661. Из навески 0,1862 г известняка, растворенной в
НС1, Са2+осадили в виде СаС2О4. Промытый осадок рас-
творили в разбавленной H2SO4 и оттитровали 22,15 мл
раствора КМпО4(7'кмпо,/сасо3 = 0,005820). Рассчитать про-
центное содержание СаСО3 в известняке.
123
662. На окисление 0,2000 г Na2C2O4 в кислой среде по-
требовалось 31,00 мл КМпО4. Сколько миллилитров
0,1000 и. Na2S2O3 израсходовали при йодометрическом
титровании 25,00 мл того же раствора КМпО4?
663. Из 3,2057 г сплава осадили свинец в виде РЬСгО4.
Действием на осадок кислоты и KI выделили 12, на тит-
рование которого израсходовали 9,15 мл 0,1028 н.
Na2S2O3. Рассчитать процентное содержание РЬ в сплаве.
664. Навеску 0,2000 г руды, содержащей МпО2, обра-
ботали концентрированной НС1. Образовавшийся при ре-
акции хлор отогнали и поглотили раствором KI. Выде-
лившийся 12 оттитровали 42,50 мл 0,05200 н. Na2S2O3.
Вычислить процентное содержание МпО2 в руде.
665. Сколько граммов НС1 содержится в 200,0 мл со-
ляной кислоты, если на титрование 12, выделенного из
20,00 мл избытком смеси (КЮ3+К1), израсходовали
18,25 мл 0,02 н. Na2S2O3 (7<=0,9825).
ЧАСТЬ ТРЕТЬЯ
ФИЗИКО-ХИМИЧЕСКИЕ МЕТОДЫ АНАЛИЗА
Глава IX
ЭМИССИОННЫЙ СПЕКТРАЛЬНЫЙ АНАЛИЗ
Вопросы для самопроверки
1. Какова природа спектров излучения?
2. Почему атомные спектры имеют линейчатый харак-
тер?
3. Какими квантовыми числами описывается энергети-
ческое состояние электрона в атоме?. Что характеризуют
квантовые числа п, I, mlt т8 и /?
4. Сформулировать правило Гунда.
5. Вывести термы следующих атомов и ионов в основ-
ном состоянии: a) Ni; б) Сг; в) Мп2+; г) Fe2+; д) Си2+;
е) Fe3+; ж) А1; з) Со; и) V2+.
6. Какие электронные переходы называются разре-
шенными, запрещенными, резонансными?
7. Назвать основные правила отбора.
8. Спектры каких частиц обозначаются символами
Na—I, Na—II, Na—III?
9. Назвать основные узлы спектральных приборов и
указать их назначение.
10. Каковы достоинства и недостатки следующих
средств возбуждения: а) пламени; б) электрической ду-
ги; в) конденсированной искры?
11. В каких случаях применяются в качестве средств
возбуждения микроискра, плазменная дуга (плазмотрон),
лазерный микрозонд?
12. Дать сравнительную характеристику призмы и ди-
фракционной решетки как диспергирующих устройств.
13. Что понимают под разрешающей способностью
спектрального прибора?
125
14. Каковы достоинства и недостатки призм, изготов-
ленных из стекла и кварца?
15. Какие приемники спектра (рецепторы) использу-
ются в эмиссионной спектроскопии?
16. Каковы особенности глаза человека как рецеп-
тора?
17. Как действует свет на фотопластинку (фото-
пленку) ?
18. Какие процессы происходят при проявлении и за-
креплении фотопластинки? Написать соответствующие
уравнения реакций.
19. Для какой области длин воли предназначены
спектральные фотопластинки? Что представляют собой
сенсибилизированные фотопластинки?
20. Чем характеризуется чувствительность фотопла-
стинки? Что такое экспозиция?
21. Что называется почернением фотопластинки, в ка-
ких пределах изменяется эта величина?
22. Что представляет собой характеристическая кри-
вая фотопластинки?
23. Что означают «вуаль», инерция и фактор контра-
стности фотопластинки?
24. Каковы достоинства и недостатки фотопластинки
как рецептора?
25. Вывести основное уравнение, связывающее почер-
нение фотопластинки с экспозицией.
26. Какие фотоэлементы используются как приемники
спектра излучения?
27. Привести оптическую схему спектрографа ИСП-28.
Каковы особенности этого прибора?
28. На чем основан качественный спектральный ана-
лиз? Какие приборы используются в этом анализе?
29. Вывести расчетную формулу для определения дли-
ны волны исследуемой линии по вторичному стандарту
(спектру железа или меди).
30. Как производится отождествление спектральных
линий?
31. Как выполняется качественный спектральный ана-
лиз: а) с помощью планшетов спектральных линий;
б) по «последним» линиям?
32. На чем основаны методы количественного спект-
рального анализа?
126
33. Как зависит интенсивность спектральных линий от
условий возбуждения? Что представляет собой относи-
тельная интенсивность спектральных линий?
34. Что называется гомологической парой линий?
35. Привести оптическую схему стилоскопа. Какие ос-
новные задачи решаются с помощью этого прибора?
36. В чем сущность следующих методов полуколичест-
венного спектрального анализа: а) появления чувстви-
тельных линий; б) спектров сравнения; в) гомологических
пар?
37. Привести уравнение Ломакина и дать характери-
стику входящих в него величин.
38. Вывести основное уравнение фотографических ме-
тодов количественного эмиссионного анализа.
39. В чем сущность следующих методов: а) трех эта-
лонов; б) одного эталона; в) постоянного графика;
г) фотометрического интерполирования?
40. Привести принципиальную оптическую схему и
объяснить принцип работы микрофотометра МФ-2.
41. Рассказать о фотоэлектрических методах эмисси-
онной спектроскопии и привести принципиальную схему
прибора типа ФЭСА-6.
42. Что представляет собой пламенная фотометрия?
Каковы достоинства и недостатки этого метода?
43. Привести принципиальную схему пламенного фо-
тометра.
44. Привести примеры определений методом спектро-
скопии пламен в неорганической химии, органической,
в биологии и медицине.
Решение типовых задач
Пример 1. При анализе стали на хром по методу трех эталонов
на микрофотометре МФ-2 измерено почернение (S) линий гомологи-
ческой пары в спектрах эталонов и исследуемого образца. Найти
процентное содержание хрома (Сцг) по следующим данным:
Эталон..............................
ССг,%...............................
SCr.................................
Spe................................
I II III
0,50 1,23 4,17
0,07 0,37 0,86
0,27 0,23 0,27
Анализируемый образец имеет SCr = 0,61 и 5Ре = 0,25.
Решение. В методе трех эталонов используется зависимость
разности (ДЗ) почернений линий гомологической пары от логариф-
ма концентрации определяемого элемента. При определенных усло-
виях эта зависимость близка к линейной. По показаниям измеритель-
127
ной шкалы микрофотометра находим Д5 (Д5=5сг — 5ре) для трех
эталонов: Д5](=0,07—0,27=—0,20; Д52=0,37 — 0,23=0,14; Д33 =
= 0,86 — 0,27=0,59.
Определяем по данным таблицы логарифмы концентраций:
1g С1 = —0,30; lgC2 = 0,09; lgC3 = 0,62 и строим калибровочный гра-
фик в координатах ДД — ]g С (рис. 1).
Находим Д5 для анализируемого образца: ДЗх = 0,61—0,25 =
= 0,36 и по калибровочному графику определяем 1g Осн lgCcr =
= 0,35, Ссг=2,24%.
Пример 2. При анализе алюминиевого сплава на кремний по ме-
тоду одного эталона получили почернение (S) линий гомологической
пары в спектрах эталона (SSi= 1,09 и Sai = 0,37 при Csi = 0,95%) и
анализируемого образца (SS1 = O,86 и Sai = 0,34).
Определить процентное содержание кремния в образце, если
ДЗ = 0 при Cgj = 0,45%•
Решение. В методе одного эталона калибровочный график в
координатах AS = lgC строим лишь по двум точкам, одна из кото-
рых известна заранее: ДД = 0 при 1g CS1 = 1g 0,45 = — 0,35.
По данным фотометрирования находим координаты второй точ-
ки и строим калибровочный график (рис. 2):
Д51 = Ssl — SA1 = 1,09— 0,37 = 0,72; lgCi = lgO,95 = —0,02.
Определяем ДДЖ для исследуемого образца: Д5х = 0,86— 0,34=
= 0,52 и с помощью графика находим содержание кремния: lgCx =
= —0,11, что соответствует Сз, = О,78°/о.
Пример 3. При определении олова в бронзе методом постоян-
ного графика сфотографировали на одной пластинке спектры четы-
рех эталонов и получили следующие результаты:
Эталон ....
Д5 = 5Sn — SCu
Csn, %
0,690 0,772 0,831
6,23 8,02 9,34
8,02 9,34
IV
0,910
11,63
Спектр одного из эталонов снят через трехступенчатый ослаби-
тель; при этом для выбранной линии Sn разность почернений двух
ступеней Д5ступ = 1,065.
Спектр анализируемого образца сняли на другой пластинке так-
же через трехступенчатый ослабитель и получили следующие резуль-
таты: Д5ступ = 0,925 —разность почернений двух ступеней выбран-
ной линии олова; ДД^ = 0,695 — разность почернений линий гомо-
логической пары Sn—Си.
Определить процентное содержание олова в образце.
Решение. Находим по значениям Csn логарифмы концентра-
ций для четырех эталонов (lgCt = 0,795; lgC2 = 0,904; 1g С3 = 0,970;
1g Сд= 1,068) и строим калибровочный график в координатах
Д5 — 1g С (рис. 3).
Определяем переводной множитель k, позволяющий использо-
вать этот график для анализа образцов, спектры которых получены
на разных фотопластинках;
1!*i лД5'туп
128
где у и у' — коэффициенты контрастности двух фотопластинок со
спектрами эталонов н анализируемого образца соответственно. Под-
ставляем численные значения Д5:
Находим значение разности почернении линий гомологической
пары в спектре анализируемого образца с учетом переводного мно-
жителя:
= = 1,151-0,695 = 0,800.
По калибровочному графику находим 1g С1 = 0,933, что соответ-
ствует Csn = 8,57%.
Примечание. Переводной множитель k можно определять,
не пользуясь трехступенчатым ослабителем. В этом случае необхо-
5—4022
129
димо знать разность почернений двух соседних линий основы на
основной пластинке и на пластинке, на которой снят спектр анализи-
руемогв образца. Отсюда k = Д50СН/Д50СН. Дальнейший ход ре-
шения задачи аналогичен описанному выше.
Задачи
Метод трех эталонов
666. Определить процентное содержание марганца в
стали по следующим значениям почернений S линий го-
мологической пары:
Варианты Параметры Эталоны Исследуемый образец
I II III
Смп, % 0,33 0,89 3,03
I SFe 1,33 1,24 1Д4 1,08
^*Мп 0,95 1,06 1,20 0,96
Смп, % 0,10 0,38 1,90 —
II Spe 0,98 0,94 0,99 0,75
^Мп 0,71 0,90 1,24 0,61
С’мш % 0,05 0,21 0,30 —
III Spe 0,72 0,74 0,78 0,73
*^Мп 0,53 0,90 1,03 0,91
667. Определить процентное содержание марганца в
стали, если при фотометрировании получены следующие
данные:
Эталон .............................. I II III
СМп. %............................. 1,20 0,94 0,48
Д5.................................. 0,47 0,39 0,17
Анализируемый образец имеет А5ж = 0,30.
668. Определить процентное содержание хрома в ста-
ли, если при фотометрировании получены следующие
данны'е:
Эталон............................... I II III
ССг, %................................. 0,93 1,97 2,34
ДЗ..................................... 0,23 0,60 0,71
Анализируемый образец имеет А5ж = 0,44.
669. Определить процентное содержание никеля в ста-
ли, если при фотометрировании получены следующие
данные:
Эталон................................. I II III
CN|, %................................ 0,56 1,42 1,97
AS................................... 0,054 0,44 0,60
130
Анализируемый образец имеет ASx=0,23.
670. Определить процентное содержание хрома в ста-
ли, если при фотометрировании получены следующие
данные:
Эталон................................. I II III
Qr, %.............................. 0,50 1,23 4,17
SCr................................... 0,07 0,29 0,86
SFe................................... 0,27 0,15 0,27
Анализируемый образец имеет Scr=O,73 и SF(.=0,33.
671. Определить процентное содержание никеля в ста-
ли, если при фотометрировании получены следующие
данные:
Эталон .......................... I II III
CN1, %........................ 1,86 3,80 10,23
SN1............................ 0,082 0,108 0,122
SFe............................ 0,062 0,066 0,047
Анализируемый образен имеет 5^=0,106 и Зре=
=0,067.
672. Определить процентное содержание меди в алю-
минии, если при фотометрировании получены следующие
данные:
Эталон ..................... I II III
CCu, %........................ 0,25 0,80 1,20
SCu........................... 0,25 0,54 0,61
SA1........................... 0,42 0,44 0,41
Анализируемый образец имеет Sc,i=0,41 и Sai=0,35.
673. Определить процентное содержание кремния в
сплаве, если при фотометрировании получены следующие
данные:
Эталон......................... I II III
CS1, %......................... 0,63 1,65 3,86
Ss(............................ 0,186 0,189 0,191
SAi............................ 0,184 0,184 0,184
Анализируемый образец имеет Ssi=0,190 и SA] =
=0,184.
674. Определить процентное содержание вольфрама в
стали, если при фотометрировании получены следующие
данные:
5’
131
Эталон.......................... I II III
Cw, %.......................... 0,78 1,37 2,19
Sw.............................. 0,388 0,472 0,494
SFe............................. 0,462 0,464 0,424
Анализируемый образец имеет Sw=0,516 и SFe=
=0,452.
675. Определить процентное содержание ванадия в
стали, если при фотометрировании получены следующие
данные:
Эталон...................... . I II Ш
Су, %......................... 0,11 0,97 2,79
Sv............................ 0,228 1,015 1,328
SFe ...................... 0,608 0,662 0,575
Анализируемый образец имеет Sy= 1,190 и SFe=
=0,640.
Метод одного эталона
676. При определении марганца в бронзе AS=0 соот-
ветствовала концентрации С°Мп= 1,77%, а для эталона с
концентрацией Ci = 0,83% AS\ =—0,54. Построить калиб-
ровочный график ц определить процентное содержание
марганца в исследуемом образце, если А5Ж = —0,33.
677. При определении олова в бронзе AS=O соответ-
ствовала концентрации С°п=10,2%, а для эталона с
концентрацией Ci = 5,2°/o AS] = —0,52. Построить калибро-
вочный график и определить процентное содержание оло-
ва в исследуемом образце, если ASX = —0,28.
678. При определении магния в алюминиевом сплаве
AS=0 соответствовала концентрации =0,57%,
а для эталона с концентрацией С] = 0,97% AS] = 0,27.
Построить калибровочный график и определить процент-
ное содержание магния в исследуемом образце, если
ASx = 0,19.
679. При определении железа в алюминиевом сплаве
AS = 0 соответствовала концентрации С°е = 0,23%,
а для эталона с концентрацией Ct = 0,54% ASj = 0,60.
Построить калибровочный график и определить про-
центное содержание железа в исследуемом образце,
если ASx = 0,32.
680. При определении кремния в алюминиевом спла-
ве AS = 0 соответствовала концентрации С^ = 1,70%,
а для эталона с концентрацией С1 = 0,72% ASi =—0,48.
132
Построить калибровочный график и определить про-
центное содержание кремния в исследуемом образце,
если Д£х= —0,24.
681. При определении марганца в алюминиевом спла-
ве Д5 = 0 соответствовала концентрации а для
эталона с концентрацией С{ получено ASi. Построить
калибровочный график и определить процентное содер-
жание марганца в исследуемом образце, если получе-
но AS.r:
Образцы................... I
Сип- %............... 0,14
Сь %................... 0,22
ASi.................... 0,26
ASa.................... 0,14
II III IV V
0,37 0,42 0,56 1,40
0,19 0,66 0,29 2,20
-0,44 0,39 -0,66 0,52
-0,25 0,25 -0,34 0,27
Метод постоянного графика
682. Для построения калибровочного графика при
определении олова в бронзе получены следующие дан-
ные:
Csn, %.................... 6,23 8,02 9,34 11,63
AS = SSn — SCu............ 0,690 0,772 0,831 0,910
Фотометрирование спектра, снятого через трехсту-
пенчатый ослабитель, показало, что для двух ступеней
выбранной линии Sn ASCTy-n= 1,055. При фотометрирэ-
вании спектра образца бронзы, сфотографированного на
другой пластинке, для двух ступеней той же линии Sn
получено iS'TVn, а для аналитической пары Sn—Си в
спектре образца на той же пластинке AS/. Определить
процентное содержание олова в образцах:
Образцы.......... I II III IV V
Д5'туп........... 0,930 0,920 0,890 0,900 0,910
bS'x............. 0,635 0,663 0,746 0,725 0,694
683. Для построения калибровочного графика при оп-
ределении никеля в бронзе были получены следующие
данные:
CNI, %....................... 3,00 3,42 3,84 4,24
AS = SN1—SCu....... 0,580 0,662 0,740 0,821
Для двух соседних линий меди, являющейся основой
сплава, ASOCH=0,828. При фотометрировании спектра
133
образца бронзы для той же пары линий меди получено
д£'сн, а для аналитической пары Ni—Си в спектре об-
разца на той же пластине &8'л. Определить процентное
содержание никеля в образце:
Образцы........... I II III IV V
Д5'сн............. 0,765 0,828 0,822 0,804 0,790
&S'X............. 0,566 0,708 0,764 0,820 0,538
Фотометрия пламени
684. Навеску стекла 0,1000 г растворили в смеси
H2SO4 и HF, раствор выпарили, остаток смочили соля-
ной кислотой и перенесли в мерную колбу на 250 мл.
Полученный раствор фотометрировали в пламени так
же, как и стандартные растворы, приготовленные из
NaCl.
Данные фотометрировании приведены в таблице
(/отн— относительная интенсивность излучения).
Стандартные растворы Образцы
Параметры 1 2 3 I II ш
С\а, МГ/л 10 20 30 — —. —
J отн 16,0 31,5 47,5 24,0 35,0 42,5
Построить калибровочный график в координатах
/отн — С и определить процентное содержание натрия в
образце.
685. Навеску удобрения 2,0000 г обработали при кипя-
чении насыщенным раствором оксалата аммония, после
охлаждения раствор разбавили в мерной колбе на
500 мл и профильтровали. Аликвоту фильтрата 5,00 мл
разбавили до 250,0 мл. Полученный раствор фотометри-
ровали в пламени так же, как и стандартные растворы,
приготовленные из КС1. Данные фотометрирования при-
ведены в таблице.
134
Стандартные растворы Образцы
Параметры 1 2 3 1 II III
, м г/л 5 10 15 — — —
^отн 8,0 15,0 24,2 12,7 18,4 20,8
Построить калибровочный график и определить про-
центное содержание калия в исследуемом образце.
686. Порцию исследуемой воды объемом 25,00 мл раз-
бавили дистиллированной водой в мерной колбе на
500,0 мл и фотометрировали в пламени так же, как и
стандартные растворы, приготовленные из СаСОз. Ре-
зультаты фотометрирования приведены в таблице.
Параметры Стандартные растворы Образцы
1 2 3 4 I 11 III
ССа» мг/л отн 10 1,6 30 47 ,0 50 80,2 70 111,0 32,0 76,9 101,8
Построить калибровочный график и определить кон-
центрацию (мг/л) кальция в исследуемой воде.
Глава X
АБСОРБЦИОННАЯ СПЕКТРОСКОПИЯ
Вопросы для самопроверки
1. Что называется коэффициентом пропускания Т и
оптической плотностью D? В каких пределах изменяют-
ся эти величины?
2. Какими уравнениями выражается основной закон
светопоглощения Бугера — Ламберта — Бера?
3. Что означает свойство аддитивности оптической
плотности?
4. Действие каких факторов может привести к нару-
шению линейной зависимости оптической плотности от
концентрации раствора?
135
5. Будет ли сохраняться линейная зависимость D от
С, если: а) состав анализируемого раствора с разбав-
лением не изменяется; б) при разбавлении раствора про-
исходит гидролиз определяемого вещества; в) при раз-
бавлении раствора происходит диссоциация определяе-
мого вещества, например:
Fe(SCN)3^Fe(SCN)+ + CNS-
г) с изменением кислотности раствора происходит сдвиг
равновесия, например:
2CrQ2- + 2Н+ Сг.Д~ + Н2О
д) коэффициент преломления раствора существенно из-
меняется с изменением концентрации определяемого ве-
щества.
6. Каков физический смысл молярного коэффициента
погашения е? Какие факторы влияют на е: а) темпера-
тура; б) длина волны проходящего света; в) концентра-
ция раствора; г) природа вещества?
7. Что называется спектром поглощения и в каких
координатах его можно представить?
8. Чем определяются число и положение полос в
спектре поглощения?
9. Чем характеризуется высота максимума в спектре
поглощения?
10. Какие электронные переходы обусловливают
большую высоту максимума в спектре поглощения:
а) внутри атома; б) от атома к атому?
11. Какой величиной характеризуют форму максиму-
ма в спектре поглощения и от каких факторов зависит
эта величина?
12. Какое математическое уравнение характеризует
полосу в электронном спектре поглощения?
13. Какова природа светопоглощения в ультрафиоле-
товом, видимом и инфракрасном участках спектра?
14. Вывести оптимальное значение Т и D, при кото-
рых обеспечивается наименьшая относительная ошибка
измерения.
15. В каком интервале значений оптической плотности
рекомендуется работать на приборах типа ФМ-56
и ФЭК-М?
16. Как можно рассчитать минимальную, оптималь-
ную и максимальную концентрации определяемого веще-
ства в исследуемом растворе при известном значении е?
136
17. Привести конкретные примеры использования в
фотометрическом анализе для получения окрашенных
веществ следующих типов химических реакций: а) комп-
лексообразования; б) образования малорастворимых
соединений; в) окисления — восстановления; г) синтеза
и разрушения органических соединений.
18. Привести примеры определений по собственному
светопоглощению вещества.
19. Какие факторы необходимо учитывать при выбо-
ре рабочей длины волны, если спектр поглощения ана-
лизируемого вещества имеет несколько максимумов?
20. Какие факторы необходимо учитывать при выбо-
ре толщины светопоглощающего слоя (кюветы)?
21. Как определяют концентрацию вещества фотомет-
рическим методом, используя среднее значение моляр-
ного коэффициента погашения?
22. Как определяют концентрацию вещества фотомет-
рическим методом с помощью одного стандартного рас-
твора? Указать недостатки и достоинства этого метода.
23. В чем сущность метода калибровочного графика
и каковы его особенности?
24. Какова сущность метода добавок? Вывести фор-
мулу для расчета концентрации определяемого вещества
этим методом.
25. В каких случаях используют метод дифференци-
альной спектроскопии и каковы особенности этого ме-
тода?
26. В чем сущность качественного анализа раство-
ров по светопоглощению?
27. На чем основано фотометрическое определение
смеси окрашенных веществ без их предварительного раз-
деления?
28. Каким образом решается задача определения
двух компонентов в их смеси, если спектры поглощения
обоих компонентов в значительной мере накладываются
друг на друга?
29. Что называют фотометрическим титрованием?
Назвать особенности этого метода и области примене-
ния.
30. Начертить кривые фотометрического титрования
в координатах D—V, мл, и привести конкретные при-
меры для следующих случаев: а) определяемый компо-
нент и титрант не поглощают, а продукт реакции погло-
щает свет; б) определяемый компонент поглощает,
137
а титрант и продукт реакции не поглощают свет; в) оп-
ределяемый компонент и продукт реакции не поглоща-
ют свет, а титрант поглощает; г) определяемый компо-
нент и титрант поглощают, а продукт реакции не погло-
щает свет.
31. Назвать особенности спектрофотометрии в ульт-
рафиолетовой области спектра.
32. Привести примеры количественных определений
по поглощению в ультрафиолетовой области спектра.
33. Каковы особенности инфракрасных спектров? Ка-
кова природа поглощения в инфракрасной области
спектра?
34. На чем основан качественный анализ по погло-
щению в инфракрасной области спектра?
35. Привести примеры количественных определений по
поглощению в инфракрасной области спектра в: а) неор-
ганической химии; б) органической химии.
36. Назвать достоинства и недостатки спектрофото-
метрии в инфракрасной области спектра.
37. Назвать основные узлы приборов для анализа по
светопоглощению. Каково назначение каждого из этих
узлов?
38. Назвать фотометрические приборы, предназначен-
ные для работы в: а) видимом участке; б) ультрафиоле-
товом участке; в) инфракрасном участке спектра.
39. Назвать источники света, используемые в: а) уни-
версальном фотометре типа ФМ-56; б) фотоэлектроколо-
риметре типа ФЭК-М; в) спектрофотометре СФ-5;
г) спектрофотометре СФ-4; д) инфракрасном спектро-
метре ИКС-12 или ИКС-14.
40. В каком спектральном интервале в качестве ис-
точника света используются лампа накаливания, водо-
родная лампа, штифт Нернста, силитовый глобар, ртчт-
ная лампа?
41. Какими устройствами для получения монохрома-
тического света снабжены перечисленные в п. 39 при-
боры?
42. Какой из светофильтров обладает наименьшей
шириной полосы пропускания: желатиновый, стеклянный
или интерференционный?
43. Сравнить достоинства и недостатки монохрома-
торов: светофильтров, призм и дифракционных решеток.
44. Из каких материалов изготовляют оптические де-
138
тали приборов абсорбционной спектроскопии? Чем обу-
словливают выбор материала?
45. Для каких областей спектра предназначены при-
боры, оптические детали которых выполнены из: а) стек-
ла; б) кварца; в) поваренной соли; г) флюорита?
46. В каких фотометрических приборах применяют
следующие приемники света: а) глаз человека; б) фото-
элементы с внешним фотоэффектом; в) фотоэлементы с
вентильным фотоэффектом; г) термоэлементы.
47. Назвать основные характеристики фотоэлементов.
48. Дать сравнительную оценку фотоэлементов с
внешним, вентильным и внутренним фотоэффектом.
49. Объяснить принцип действия фотоумножителей и
указать области их применения.
50. Начертить принципиальную оптическую схему:
а) фотометра ФМ-56; б) фотоэлектроколориметра
ФЭК-М; в) спектрофотометра СФ-4 или СФ-5; г) инфра-
красного спектрометра ИКС-12 или ИКС-14.
51. На каких принципах основывается работа фото-
метра, фотоэлектроколориметра, спектрофотометра?
52. Что представляют собой нулевые растворы или
растворы сравнения?
53. В чем состоит подготовка прибора к работе и ка-
ков порядок работы на: а) универсальном фотометре
М-56; б) фотоэлектроколориметре ФЭК-М?
54. В виде каких соединений определяют фотометри-
ческим методом следующие элементы: a) Fe, Cr, Zn;
б) Ni, Мп; А1; в) Со, Си, V; г) Bi, Ti, Sb.
55. Указать особенности фотометрического определе-
ния: а) железа в присутствии никеля; б) железа в при-
сутствии кобальта; в) хрома и марганца при совместном
присутствии; г) молибдена и ванадия при совместном
присутствии; д) двух красителей без их предварительного
разделения.
56. Каковы правила эксплуатации приборов ФМ-56
и ФЭК-М?
57. В чем сущность фотометрического определения
pH раствора с использованием цветных индикаторов?
58. Вывести расчетную формулу фотометрического
метода определения pH с: а) одноцветным индикатором;
б) двухцветным индикатором.
59. Как по поглощению в ультрафиолетовой области
спектра определяют: а) молибден в стали; бензол в цик-
логексане?
139
60. Какке способы приготовления образцов исполь-
зуются в ИК-спектроскопии в зависимости от агрегатно-
го состояния исследуемого вещества?
61. В чем сущность количественного анализа в
ИК-спектроокопии по методу базовой линии?
62. В чем сущность количественного анализа в ИК-
спектроскопии с помощью внутреннего стандарта?
63. В чем сущность дифференциального метода коли-
чественного анализа по ИК-спектрам?
64. Что такое характеристические частоты? Какова их
роль в анализе по ИК-спектрам?
65. Как выполняется качественный анализ по ИК-
спектрам с помощью диаграмм характеристических ча-
стот?
Решение типовых задач
Пример 1. При определении ванадия по методу добавок навеску
стали 0,5036 г перевели в раствор и его объем довели до 50,0 мл.
В две мерные колбы на 50 мл отобрали аликвоты раствора по
20,0 мл; в одну из этих колб добавили стандартный раствор, содер-
жащий 0,003 г V, затем в обе колбы — перекись водорода. Растворы
в колбах довели до метки, профотометрировали и получили: Dx=
= 0,20 и £>д:+ст = 0,48. Рассчитать процентное содержание ванадия
в стали.
Решение. Находим концентрацию стандартного раствора ва-
надия (Сст) с учетом разбавления:
где sv(ct) — количество ванадия в стандартном растворе, г; V —
объем раствора, мл.
Вычисляем концентрацию ванадия в растворе (Сх):
Определяем количество ванадия в навеске с учетом разбавления
растворов:
ои-ои
а . = 4,28- 10-5 —— = 5,35-10-з г.
v 20 ' 1
Процентное содержание ванадия в стали равно
ду-100 _ 5,35-IO-3-100
«стали 0,5036
где Детали — навеска стали.
Пример 2. Из навески стали 0,2542 г после соответствующей об-
работки получили 100,0 мл окрашенного раствора окисленного ди-
140
метилглиоксимина никеля. Относительная оптическая плотность этого
раствора D* (0Тв) оказалась 0,55. Для построения калибровочного гра-
фика взяли три стандартных раствора с содержанием никеля 8,0; 10,0 и
12,0 мг в 100 мл, профотометрировали их и получили относительные
оптические плотности (Z>0TB) соответственно 0,24; 0,46 и 0,70. Раствор
сравнения содержал 6 мг Ni в 100 мл. Определить процентное со-
держание никеля в стали.
Решение. Строим калибровочный график, откладывая на оси
ординат значения относительных оптических плотностей, а на оси
абсцисс — концентрации растворов никеля в мг/100 мл (рис. 4). Рас-
твор сравнения дает четвертую точку графика, лежащую непосред-
ственно на оси абсцисс.
Откладываем на графике Рх<отн)=0,55 и находим соответству-
ющую ей величину Сх=10,7 мг/100 мл. Следовательно, количество
никеля в анализируемом растворе с учетом разбавления составит
10,7-10 3 г. Отсюда находим процентное содержание никеля в стали;
л„,-Ю0 10,7-10-з.юо
—------= —---------------= 4’20%
Детали 0,2542
Пример 3. Навеску стали 0,2025 г растворили, отделили мешаю-
щие ионы, окислили Мп до МпО4~ и Сг до СгД-. Объем раство-
ра довели до 100,0 мл и измерили его оптическую плотность на
ФМ-56 при двух выбранных светофильтрах.
При построении калибровочных графиков использовали исход-
ные растворы марганца и хрома с TKMnOi/Mn =0,0001090 и
7'к]сг1О,/Сг =0,001210, 10,00, 15,00 и 20,00 мл каждого стандартного
раствора разбавляли водой до метки в колбах на 10Q0 мл и фото-
метрировалн с теми же светофильтрами. Определить процентное
содержание Мп и Сг в стали по следующим данным:
141
М светофильтра (с. ф.) Стандартные растворы, мл Исследуе- мый раст- вор (смесь Мл и Сг)
КМпО4 КаСг.О,
10,00 15,00 20,00 10,00 15,00 20,00
Оптическая плотность
5 (Xj = 533 нм) 0,23 0,35 0,47 — — — 0,32
8 (л2 = 432 нм) 0,10 0,14 0,18 0,43 0,60 0,78 0,72
Решение. Строим калибровочные графики I -я II (рис. 5) в
координатах D—С по данным
для растворов КМпО4. Концен-
трации стандартных растворов
рассчитываем следующим обра-
зом (в пересчете на марганец):
ТУ1 0,0001090-10
1 — 100 ~ 100 =
= 1,09-10— 5 г/мл;
ТУг 0,0001090-15
С2 100 “ 100 ~
= 1,64-10-5 г/мл;
TV3 0,0001090-20
С3 — —- =----------------=
3 100 100
= 2,18-10-5 г/мл.
Поскольку на с. ф. № 5 « Ь^а (раствор хрома при этой
длине волны свет практически не поглощает), то по прямой / нахо-
дим См о в анализируемой смеси:
С„ = 1,5-10“5 г/мл или аи = С • 100 = 1,5-10_3 г.
Мп ‘ Мп Мп
Процентное содержание марганца в стали равно
^МП-100 _ 1,5-10-3-100 _
«стали 0,2025 ’ /0‘
Строим калибровочный график III (см. рис. 5) по трем стан-
дартным растворам КгСг2О-7, используя данные по светопоглощению
на с. ф. № 8 и следующие значения концентраций растворов бихро-
мата калия (в пересчете на хром):
0,001210-10
100
100
1,21-10-4
г/мл;
ТУ \
,42
TV
с<1~
2 100
0,001210-15
100
1,82- 10—4
г/мл;
C3 =
ТУЯ
100
0,001210-20
100
= 2,42-10—4 г/мл.
При с. ф. № 8 (/.о) свет поглощают оба раствора, т. е.
= D^. +-О^П. Поэтому сначала с помощью прямой И (см.
рис. 5) находим величину D^n, используя значение С.мп, найденное
попрямей/: £>^п = 0,13.
Затем находим светопоглощенпе хрома в смеси:
4г = 4м - 4г. ==0,72-0,13 = 0,59.
Далее по прямой /// определяем
С =1,77-10—1 г/мл или а =1,77-10-1.Ю0= 1,77-10-2 г.
Процентное содержание хрома в стали равно
*100 1,77-10—2-100
—----- = —!------------= 8,74 % .
Детали 0,2025
Пример 4. В смеси углеводородов с помощью ИК-спектров сняли
кривые светопоглощенпя в области 11,6 мкм для исследуемого рас-
твора (Сх) и трех растворов с известными концентрациями цикло-
гексана (Сет). В кювету сравнения во всех случаях помещали рас-
твор с одинаковой концентрацией циклогексана. Методом базовой
линии получили следующие данные:
Интенсивность поглощения Стандартные растворы, % Исследуемый раствор
Сст.1“75'51 Си.'2 = 80’45 Сст.3 = 84’35
1а - 57,5 49,7 46,7 53,2
/д .... 65,2 62,6 64,7 64,6
Определить концентрацию циклогексана в исследуемом растворе.
Решение. На рис. 6 представлена часть ИК-спектра, содержа-
щего аналитическую линию циклогексана (Л). Общую энергию в об-
ласти полосы поглощения измеряют отрезком 1 Ву заключенным меж-
ду линией 100%-ного поглощения 2 и базовой линией 1, проведенной
в основании аналитической полосы поглощения. Пропускание Т
в методе базовой линии определяется отношением 7’^ = /^//^,
где /д—отрезок между 100%-ным пропусканием и максимумом
поглощения аналитической полосы А.
Удобнее пользоваться величиной оптической плотности
D= -lg7= -lg
в
143
так как
P = sCJ.
л
На основании этого соотношения достаточно определить опти-
ческие плотности нескольких растворов известных концентраций, по-
строить калибровочный график
•и, зная DXt найти искомую кон-
центрацию определяемого веще-
ства (е и I постоянны). Рассчи-
тываем оптические плотности
для каждого раствора:
'в 65,2
ОстЛ = 1§ —= 12^
А
= 1g 1,134 = 0,055;
'я 62,6
£>„0 = lg -- = lg —-
ё 47,9
Л
= lg 1,260 = 0,100;
64,7
= '8^ = '8 1-385 = 0,142;
4b, /
Лгт.з = 1g 7^
1А
г, I !в 64,6
Dx = \g— = 1g —!- = lg 1,214 = 0,084.
По £>ст и Сст строим калибровочный график (рис. 7), по кото-
рому находим Сх = 78,70%.
Рис. 7
Задачи
Метод добавок
687. В две мерные колбы на 100 мл влили одинако-
вые объемы V сточной воды, содержащей медь. Туда же
144
ввели необходимые количества аммиака и раствора ру-
беановодородной кислоты. В одну из колб добавили
10,00 мл стандартного раствора CuSO4 (7’cuso</cu = 0,001)>
содержимое обеих колб довели до метки. После фильт-
рования растворы фотометрировали, получив значения
оптической плотности Dx и £)х+ст. Определить концен-
трацию меди в сточной воде (г/л) по следующим дан-
ным:
Варианты................ I II III IV
V, мл.................... 10,00 20,00 30,00 40,00
Dx......................... 0,24 0,28 0,32 0,40
£\+ст...................... 0,38 0,43 0,47 0,56
688. При определении ванадия методом добавок на-
веску стали а растворили, объем раствора довели до
50,0 мл. Затем аликвоты раствора по 20,0 мл отобрали
в две мерные колбы на 50 мл. В одну из них добавили
навеску соли ванадия, содержащую 0,0030 г V. В обе
колбы добавили перекись водорода и объемы довели до
метки. Вычислить пропентное содержание ванадия в ста-
ли, если при фотометрировании растворов получили сле-
дующие результаты:
Варианты.......... I II III IV
а, г ............. 0,5000 0,7468 0,9580 0,6572
Dx................ 0,20 0,25 0,28 0,23
Dx+„.............. 0,48 0,50 0,48 0,49
689. При определении титана методом добавок на-
веску стали а растворили, объем раствора довели до
50,0 мл. Затем аликвоты раствора по 20,0 мл отобрали
в две мерные колбы по 50 мл. В одну из них добавили
навеску соли титана, содержащую 0,0010 г Ti. В обе
колбы добавили перекись водорода и объемы довели до
метки. Вычислить процентное содержание титана в ста-
ли, если при фотометрировании растворов получены сле-
дующие результаты:
Варианты............... I II III IV
а, г ............... 0,5000 0,4828 0,4600 0,6150
Dx.................. 0,22 0,19 0,20 0,25
£>.v+cl............. 0,44 0,39 0,42 0,45
14S
Дифференциальная спектрофотометрия
690. Навеску сплава а растворили в колбе на 100,0 мл.
В мерную колбу ла 50 мл отобрали 2,00 мл раствора,
добавили раствора цирконола и довели объем до метки
водой. Относительная оптическая плотность этого рас-
твора, измеренная по отношению к раствору сравнения,
содержащему 1 мг Zr в 50,0 мл, оказалась £>Х(Отн)-
Относительные оптические плотности четырех стан-
дартных растворов, содержащих в 50,0 мл 1,2; 1,5; 1,7
и 2,0 мл раствора с концентрацией 1 мг/мл Zr, оказа-
лись соответственно 0,28; 0,35; 0,40 и 0,47.
Построить калибровочный график в координатах
jDqth—Czr и определить процентное содержание цирко-
ния в сплаве для следующих вариантов:
Варианты...................... I II III
а, г..................................
0,0800 0,1092 0,0984
...................... 0,32 0,44 0,38
691. Из навески стали а после соответствующей об-
работки получили 50,0 мл раствора КМ11О4. Относитель-
ная оптическая плотность этого раствора, измеренная по
отношению к раствору сравнения, содержащему в
50,0 мл 10,00 мл раствора КМпО4(7’кмп0. =0,00126), ока-
залась 7-^;г(0ТН)‘
Относительные оптические плотности четырех стан-
дартных растворов, содержащих в 50,0 мл 5,00; 7,00;
8,00 и 9,00 мл раствора КМПО4 с тем же титром, изме-
ренные по отношению к тому же раствору сравнения,
оказались соответственно 1,19; 0,72; 0,49 и 0,24.
Построить калибровочный график в координатах
.Doth — Смп и определить процентное содержание мар-
ганца в стали для следующих вариантов:
Варианты....................... I II III
а, г ............................ 0,0500 0,0602 0,0680
Ох(тн}...................... 0,88 0,60 0,34
692. Из навески стали а после соответствующей обра-
ботки получили 1000 мл окрашенного раствора диметил-
глиоксимина никеля. Относительная оптическая плот-
ность этого раствора, измеренная по отношению к рас-
твору сравнения, содержащему 30 мг Ni в 1000 мл,
оказалась Dх(отн)*
146
Относительные оптические плотности четырех стан-
дартных растворов, содержащих 9,00; 15,0; 18,0 и 24,0 мг
Ni в 1000 мл, оказались соответственно 0,22; 0,48; 0,60
и 0,87.
Построить калибровочный график в координатах
Dat-ц—(Сср — Сст) и определить процентное содержа-
ние никеля в стали для следующих вариантов:
Варианты................... I II III IV
а, г .................. 0,1750 0,2162 0,3170 0,2555
Г>г,гтч,............... 0,78 0,66 0,37 0,55
Л(СТН;
693. При фотометрировании раствора сульфосалици-
латного комплекса железа получили относительную оп-
тическую плотность 0,29. Раствор сравнения содержал
0,0576 мг Fe в 50,0 мл, толщина кюветы 5 см.
Определить концентрацию железа в растворе, если
известно, что молярный коэффициент погашения комп-
лекса в этих условиях составлял 3000.
694. Молярный коэффициент погашения комплекса
индия с пирокатехиновым фиолетовым равен 35900 при
630 нм. Определить содержание индия в растворе (г/л),
если относительная оптическая плотность исследуемого
раствора, измеренная в кювете с /=1 см по отношению
к раствору сравнения, содержащему 6-Ю-5 г-ион/л In,
оказалась 0,45.
695. Определить молярный коэффициент погашения
хромата калия, если относительная оптическая плот-
ность 2,65 • 10-3 М КаСгОл, измеренная при^ = 372,5 нм в
кювете с 1 = 2,3 мм по отношению к раствору сравнения,
содержащему 1-Ю’3 моль/л КгСгОд, оказалась 1,38.
Определение смеси двух окрашенных веществ
696. Навеску стали 0,2000 г растворили, отделили ме-
шающие ионы, окислили Мп до МпО~, Сг до Сг3О^~ и
объем раствора довели до 100,0 мл.
Для построения калибровочных графиков использо-
вали раствор КМпО4 с титром по марганцу 0,0001090 и
раствор К2СГ2О7 с титром по хрому 0,001210. Брали
5,00; 8,00 и 10,00 мл каждого стандартного раствора,
разбавляли водой до метки в колбах на 100 мл и фо-
тометрировали, используя светофильтры 5 и 8.
Построить калибровочные графики и определить про-
центное содержание Мп и Сг в стали, если при измере-
147
нии оптической плотности стандартных растворов и ис-
следуемого получили следующие результаты (кювета
1 см):
Стандартные растворы, МЛ Исследуемый раствор
S _ Р А КМпО4 К aCf дО? Варианты
№ свет ра (с. < 5,00 8,00 10,00 5,00 8,00 10,00 I II ill IV V
Оптическая плотность
5 8 0,23 0,10 0,36 0,15 0,47 0,18 0,43 0,63 0,78 0,28 0,82 0,47 0,61 0,33 0,76 0,37 0,72 0,42 0,62
697. Перекисные комплексы титана и ванадия при
ЛЭфф=432 нм (с. ф. 8) интенсивно поглощают свет. При
л.,фф —619 нм (с. ф. 3) поглощает практически только
комплекс ванадия. Для построения калибровочного гра-
фика приготовили по четыре стандартных раствора пере-
кисных комплексов, содержащих по 0,2; 0,4; 0,5 и
0,6 мг/мл V и Ti. Исследуемый раствор довели водой до
объема 100,0 мл.
Построить калибровочный график и определить со-
держание V и Ti (г) в исследуемом растворе, если при
измерении оптической плотности стандартных растворов
и исследуемого получили следующие результаты (кюве-
698. При ХЭфф=496 нм (с. ф. 6) светопоглощение ро-
данидного комплекса железа намного превышает свето-
поглощение соответствующего комплекса никеля. Для
148
построения калибровочного графика в колбах на
50 мл приготовили три стандартных раствора, содержа-
щих 5,ОС; 8,00 и 10,00 мл исходного раствора
NH4Fe(SO4)2-12Н2О (Тре=0,00005). Исследуемый рас-
твор, содержащий железо и никель, довели до 100,0 мл,
взяли 20,0 мл в колбу на 50 мл, добавили 5 мл 2 н.
НС1, 5 мл 10%-ного KSCN и довели до метки водой.
Построить калибровочный график и определить со-
держание железа (мг) в исследуемом растворе, если при
измерении оптической плотности стандартных растворов
и исследуемого получили следующие результаты:
Стандартные растворы, мл Исследуемый раствор*
Варианты
5,00 | 8,00 | 10,00 I । и । ш । iv j V
Оптическая плотность
0,36 0,58 0,75 0,43 0,46 0,66 0,74 0,79
* Поправку оптической плотности на пцглпщение никеля bi веек ваоиштак бчать
0.08.
Количественный анализ по ИК-спектрам
699. Для анализа конечной газовой смеси при синте-
зе азотной кислоты в паровой фазе использовали метод
базовой линии. ИК-спектры снимали при помощи одно-
лучевого прибора в области 1,44 мкм. В зависимости от
температуры /°C, давления Р, соотношения концентра-
ций NO2 иНгОв исходной смеси (n=[NO2]: [Н2О]) полу-
чили следующие значения интенсивностей полос IА и 1 в-.
/, °C* л=2 л=4 /1=6 п =8
<4 'в 'а 'в % 1 в 'а 'в
25 67,6 68,2 61,4 62,3 64,7 65,2 57,8 58,4
50 65,4 68,5 60,2 63,1 61,3 74,6 54,5 57,8
75 62,5 67,4 56,4 61,3 58,8 64,2 54,2 58,8
100 63,5 67,8 57,4 61,6 59,7 63,7 54,3 58,6
150 65,7 68,1 59,4 61,8 61,3 63,9 55,3 58,2
200 67,7 67,6 61,2 62,2 63,0 64,2 5о,6 57,6
• Р-1 атм (1,03 • 10s Па).
149
/, °C* Р=2 атм Р = 4 атм Р=6 атм
'д ‘в 1В ]А
50 51,3 55,8 51,4 59,6 — —
75 50,2 56,5 49,2 58,9 51,1 67,2
100 47,8 55,2 48,3 59,8 50,5 67,8
150 51,2 55,7 51,6 60,2 47,8 68,2
200 53,6 56,2 55,3 59,2 60,1 67,5
На основании этих данных
жание азотной кислоты при:
найти процентное содер-
№ п/п t, °C п Р, атм № п/п 6 °C п Р, атм
1. 25 2 1 11. 200 2 4
2. 75 4 1 12. 50 6 1
3. 50 2 4 13. 100 8 I
4 100 2 4 14. 150 2 2
5. 100 6 1 15. 75 2 4
6. 150 2 6 16. 200 2 6
7. 150 8 1 17. 150 2 4
8. 100 2 6 18. 75 2 6
9. 200 4 1 19. 50 4 1
10. 150 4 1 20. 25 4 1
Для построения калибровочного графика использо-
вать следующие данные:
б’нМОз , % . 1,48 1,71 2,07 2,58 3,18 4,35 5,95
1а 64,8 64,2 62,0 60,1 58,7 55,6 49,8
I в . 70,5 71,0 69,8 69,5 70,8 71,2 70,2
700. При анализе циклогексана в смеси углеводоро-
дов в области 11,6 мкм сняли дифференциальные ИК-
спектры ряда смесей по отношению к одному и тому же
раствору сравнения. Методом базовой линии получили
следующие значения 1 к и /вдля смесей с известным и
неизвестным содержанием циклогексана:
150
С, % 'а 1 в № смеси 'а 'в
77,00 51,5 48,1 1 56,4 61,1
81,16 50,4 51,4 2 51,6 58,4
85,10 51,4 57,6 3 59,9 62,7
86,56 48,6 57,3 4 52,2 63,1
90,61 51,1 63,0 5 6 7 8 9 10 53,2 49,8 52,1 48,7 48,3 54,1 60,3 58,2 58,6 47,61 52,2’. 57,2-
Определить процентное содежание циклогексана в
смесях 1 —10 методом калибровочного графика.
701. Для определения поливинилацетата в смеси
полимеров сняли ИК-спектры в области 5,8 и
4,7 мкм смеси твердых образцов с КВг и KSCN...
выполняющим роль внутреннего стандарта. Аналитиче-
ская полоса поглощения поливинилацетата (ПВА) на-
ходится в области 5,8 мкм (группа >С=0), а полоса
поглощения KSCN — в области 4,7 мкм. Для приготов-
ления образцов с известным содержанием ПВА исполь-
зовали двойное последовательное разбавление броми-
стым калием, содержащим 0,2% KSCN; при этом каждый-
раз массу смеси доводили до 100 мг. Конечная смесь
превращалась в таблетки, для которых методом базовой
линии получили следующие значения IА и Iв. Данные
для смесей с известным содержанием ПВА приведены в
табл. 1.
Т а б’л и ц а I
Взятые навески Величина поглощения
первое разбавление (смесь 1), мг второе разбавление (смесь 2), мг при 5,8 мкм при 4,7 мкм-.
100% -ный ПВА КВг+0,2% KSCN смесь 1 КВг + 0,2% KSCN 'в ‘а ‘в ‘а
10 90 0,39 99,61 54,2 42,3 56,2 32,5
10 90 0,58 99,42 58,4 45,2 57,7 32,4
10 90 1,02 98,98 59,2 43,5 56,6 35,8
10 90 1,51 98,49 54,8 41,6 55,8 42,6-
10 90 2,55 97,45 57,0 40,9 53,2 43,9
15»
По данным табл. 1 построить калибровочный график
в координатах Л = 75,8/Л,7 — концентрация поливинила-
цетата (Спвд) и определить процентное содержание по-
ливинилацетата в образцах 1—11, используя данные
табл. 2.
Таблица 2
№ образ- ца Взятые навески Величина поглощения
первое разбавление (смесь 1), мг второе разбавление (смесь 2), мг при 5,8 мкм при 4,7 мкм
поли- мер КВг+0,2% KSCN смесь 1 КВг+0,2% KSCN ! Н 'а !в !а
1 40 60 2,5 97,5 63,8 49,1 65,7 37,6
2 30 70 15,0 85,0 61,2 44,8 63,2 44,2
3 50 50 5,0 95,0 58,3 43,4 62,5 47,3
4 25 75 10,0 90,0 62,2 44,6 58,7 45,2
5 35 65 3,5 96,5 56,3 42,0 58,6 48,0
6 55 45 2,5 97,5 61,3 46,4 59,6 34,6
7 45 55 1,0 99,0 58,3 44,5 61,2 40,5
8 30 70 1,5 98,5 62,7 47,0 60,8 41,3
9 35 65 4,0 96,0 59,8 43,7 58,2 48,1
10 40 60 5,0 95,0 61,6 46,3 62,3 50,2
11 50 50 6,0 94,0 62,5 43,7 60,8 48,7
Глава XI
НЕФЕЛОМЕТРИЯ И ТУРБИДИМЕТРИЯ
Вопросы для самопроверки
1. На чем основаны методы нефелометрии и турби-
диметрии?
2. Привести основной закон светорассеяния (уравне-
ние Релея) и характеризовать величины, входящие в это
уравнение.
3. Исходя из уравнения Релея, вывести зависимость
кажущейся оптической плотности от концентрации ве-
щества в анализируемой суспензии.
4. Построить графики зависимости Пкаж от С; Ткат от
С И Окаж ОТ 1g С.
5. Привести оптическую схему нефелометра (НФМ).
На каком принципе основана работа этого прибора?
6. Каков порядок работы на НФМ?
152
7. Какие условия необходимо соблюдать для обеспе-
чения достаточной точности нефелометрических опреде-
лений?
8. Почему основным приемом анализа в нефеломет-
рии является метод калибровочного графика?
9. Назвать примеры нефелометрических определений
и указать условия проведения анализа.
10. Как связана интенсивность света, прошедшего че-
рез суспензию, с концентрацией анализируемого вещест-
ва в методе турбидиметрии?
11. Какие условия необходимо соблюдать для обес-
печения достаточной точности турбидиметрических опре-
делений?
12. Какие приборы используют в методе турбидимет-
рии?
13. В чем сущность фотонефелометрического и фото-
турбидиметрического титрования?
14. Какой вид кривых нефелометрического и турби-
диметрического титрования?
15. Назвать достоинства и недостатки методов нефе-
лометрии и турбидиметрии.
Задачи
702. Для построения калибровочного графика при не-
фелометрическом определении сульфат-иона 25,0 мл рас-
твора H2SO4, содержащего 0,215 мг/мл SO3, поместили
в мерную колбу на 100 мл. Затем в мерных колбах на
100 мл, содержащих 20,0; 15,0; 10,0; 6,00 и 2,00 мл этого
раствора, приготовили суспензии BaSO4 и измерили их
кажущиеся оптические плотности:
^H,SO4’ мл..............2О’° 15>° 1О’° 6>° 2>°
Окаж................. 0,51 0,62 0,80 0,98 1,22
По этим данным построили калибровочный график.
Анализируемый раствор 50,0 мл разбавили в мерной
колбе на 100 мл. Затем 20,0 мл этого раствора перенес-
ли в мерную колбу емкостью 100 мл, приготовили в ней
суспензию BaSO4 и довели водой до метки. Кажущаяся
оптическая плотность этого раствора оказалась;
Варианты.................. I II III IV
^(каж) • ................. °-72 °'54 П08 0,90
6-4022
153
Определить содержание SO3 в анализируемом рас-
творе (мг/л).
703. Для нефелометрического определения серы в ка-
менном угле приготовили стандартный раствор, разба-
вив 2,5 мл 0,01000 н. H2SO4 водой до 1000 мл (раствор
1). Затем в мерные колбы емкостью 100 мл добавили
20,0; 15,0; 12,0; 8,0; 4,0 и 2,0 мл раствора 1, приготовили
в них суспензии BaSO4 и измерили их кажущиеся опти-
ческие плотности:
^H2SO4> мл • • 20-° 15-° 12>° 8-° 4-° 2-°
£)каж........ 0,21 0,33 0,42 0,60 0,80 0,92
По этим данным построили калибровочный график.
Навеску каменного угля а растворили, разбавили во-
дой до 1000 мл. Затем 20,0 мл этого раствора после со-
ответствующей обработки поместили в мерную колбу
емкостью 250 мл, приготовили в ней суспензию BaSO4 и
довели водой до метки. Кажущаяся оптическая плот-
ность раствора оказалась:
Варианты................ I II III IV
а, г ................ 0,1348 0,1832 0,1008 0,1212
............ 0,46 0,30 0,69 0,54
л ( КДЖ )
Определить процентное содержание серы в каменном
угле.
704. При нефелометрическом определении хлорид-
иона для построения калибровочного графика 20,0 мл
раствора КС1, содержащего 0,5 мг/мл С1, поместили в
мерную колбу емкостью 100 мл. Затем в мерных колбах
на 50 мл, содержащих 8,0; 6,0; 4,0 и 2,0 мл этого раство-
ра, приготовили суспензии AgCl и измерили их кажу-
щиеся оптические плотности:
VKCI, мл............................. 8,0 6,0 4,0 2,0
£)кяж................................ 0,12 0,22 0,39 0,66
*-'каж ’ » > •
По этим данным построили калибровочный график.
Анализируемый раствор 25,0 мл разбавили в мерной
колбе емкостью 100 мл. Затем 5,00 мл раствора поме-
стили в мерную колбу емкостью 50 мл, приготовили в
ней суспензию AgCl и довели водой до метки. Кажу-
щаяся оптическая плотность этого раствора оказалась:
Варианты......................... I II III IV
D , ....................... 0,29 0,50 0,16 0,26
^Лг(каж) t » 1 । ,
154
Определить содержание хлорид-иона в анализируе-
мом растворе (мг/л).
705. При нефелометрическом определении цинка для
построения калибровочного графика в мерные колбы ем-
костью 50 мл ввели 18,0; 14,0; 10,0; 6,0 и 2,0 мл стан-
дартного раствора соли цинка, содержащего 5 мг/мл Zn,
приготовили в них суспензии К22пз[Ре(СЫ)и измери-
ли их кажущиеся оптические плотности:
V, мл ........... 18,0 14,0 10,0 6,0 2,0
окаж............. 0,18 0,22 0,33 0,54 0,90
Анализируемый раствор 25,0 мл поместили в мерную
колбу емкостью 50 мл и приготовили в ней суспензию
K.2Zns[Fe(CN)(i]2. Кажущаяся оптическая плотность это-
го раствора оказалась:
Варианты.................... I II III IV
................... 0,42 0,20 0,29 0,59
Определить содержание цинка в анализируемом рас-
творе (г/л).
Глава XII
ЛЮМИНЕСЦЕНТНЫЙ АНАЛИЗ
Вопросы для самопроверки
1. Что называется люминесцентным излучением и ка-
кова его природа?
2. Какие виды люминесценции различают в зависи-
мости от способа возбуждения?
3. Что такое фосфоресценция и флуоресценция?
4. На чем основан качественный люминесцентный
анализ?
5. Привести примеры качественных определений ме-
тодом люминесценции в технике, сельском хозяйстве,
медицине и т. д.
6. Какая зависимость используется в количественном
люминесцентном анализе?
7. Назвать основные узлы приборов люминесцентно-
го анализа и привести принципиальную схему флуори-
метра.
6*
155
8. В чем сущность следующих приемов люминесцент-
ного анализа: а) метода шкалы; б) метода калибровоч-
ного графика; в) метода добавок?
9. Привести примеры количественных определений
элементов и веществ методом люминесценции.
10. Что представляют собой люминесцентные индика-
торы и в каких случаях они применяются?
11. Каковы достоинства и недостатки люминесцент-
ного анализа?
Задачи
706. Для построения калибровочного графика при
флуоресцентном определении магния с люмомагнезоном
ИРЕА 0,1054 г Mg(NO3)2-6H2O растворили в мерной
колбе емкостью 100 мл. Затем 1,0 мл раствора разба-
вили в колбе на 100 мл (раствор 1).
Для приготовления четырех стандартных растворов в
мерные колбы на 50 мл внесли 1,5; 2,5; 3,5 и 5,0 мл рас-
твора 1 и раствор люмомагнезона ИРЕА и довели объем
до метки. Интенсивность флуоресценции (/) стандарт-
ных растворов оказалась 0,37; 0,56; 0,75 и 1,03 соответ-
ственно.
10,0 мл исследуемого раствора разбавили в колбе на
100 мл. Затем 5,0 мл этого раствора внесли в колбу на
50 мл, добавили раствора люмомагнезона ИРЕА и дове-
ли объем до метки (раствор 2). Построить калибровоч-
ный график в координатах I—Си определить концент-
рацию магния (мг/мл) в анализируемом растворе, если
интенсивность флуоресценции раствора 2 равна 1Х;
Варианты................. I II III IV V
1Х .................... 0,45 0,71 0,95 0,63 0,83
707. Для люминесцентного определения бора в руде
навеску а растворили и после соответствующей обработ-
ки довели объем раствора до 100,0 мл. Затем к 1,00 мл
раствора добавили спиртовый раствор бензоила и изме-
рили интенсивность люминесценции полученного раство-
ра. Она оказалась 1Х.
Стандартные растворы содержали 4,00; 10,0 и 20,0 мг
бора в 100 мл. После прибавления к 1,00 мл каждого
стандартного раствора тех же реактивов и в тех же ко-
личествах, как и в случае исследуемого раствора, интен-
сивность люминесценции их оказалась 0,38; 0,65 и 1,08
соответственно,
156
Построить калибровочный график и определить про-
центное содержание бора в руде для следующих вариан-
тов:
Варианты . . I II III IV V
а, г ... . 0,2000 0,3600 0,1750 0,2182 0,2500
1Х.......... 0,60 1,00 0,52 0,74 0,86
708. Для люминесцентного определения алюминия в
латуни навеску а растворили и после соответствующей
обработки довели объем раствора до 500,0 мл. Затем
10,0 мл раствора перенесли в колбу емкостью 100 мл,
прибавили раствор кислотного хром-сине-черного и до-
вели объем до метки. Интенсивность люминесценции по-
лученного раствора оказалась 1Х.
Интенсивность четырех стандартных растворов, со-
держащих в 100 мл 10,0; 20,0; 30,0 и 40,0 мкг алюминия,
равна 0,60; 0,82; 1,04 и 1.26 соответственно. Построить
калибровочный график и определить процентное содер-
жание алюминия в латуни для следующих вариантов:
Варианты . . Ij II "III IV V
а, г........ 0,1000 0,0800 0,1600 0,1500 1,4400
1Х.......... 72 56 109 91 118
709. Для люминесцентного определения рибофлавина
(витамина В2) в пищевом продукте методом добавок
0,2000 г продукта растворили и после соответствующей
обработки измерили интенсивность люминесценции полу-
ченного раствора. Она оказалась 0,30. После добавления
стандартного раствора, содержащего а (мкг) витамина
Во, интенсивность люминесценции увеличилась до
Ах+СТ 1
Варианты............... I II III IV V
а, мкг................. 17 33 50 26 40
/t+.CT................ 0,50 0,70 0,90 0,60 0,80
Определить процентное содержание витамина В2 в
продукте *, если интенсивность люминесценции холо-
стого раствора /о=О,О5.
* Формула для расчета результатов люминесцентного анализа
по методу добавок имеет следующий вид:
«ст (/ж—/о) Ю-4
X =------------------° а ,
(G+ет- !x)g
где х — содержание определяемого вещества, %; ост— добавка
определяемого вещества, мкг; 1Х, Ar+ст и /> — интенсивность люми-
несценции исследуемого раствора, того же раствора с добавкой стан-
дарта и холостого раствора соответственно; g—навеска анализи-
руемого образца, г.
157
Глава XIII
КИНЕТИЧЕСКИЕ МЕТОДЫ АНАЛИЗА
Вопросы для самопроверки
1. В чем сущность кинетических методов анализа?
2. Что называют индикаторной реакцией и индика-
торным веществом? Какие требования предъявляются к
индикаторным реакциям?
3. Какие вещества называются катализаторами, акти-
ваторами (промоторами) и ингибиторами?
4. Назвать наиболее распространенные способы изме-
рения скорости химических реакций, используемые в ки-
нетических методах анализа.
5. Охарактеризовать основные приемы кинетических
методов анализа: а) метод тангенсов; б) фиксированной
концентрации; в) фиксированного времени; г) индукци-
онного периода.
6. Что представляют собой дифференциальный и ин-
тегральный варианты кинетических методов анализа?
7. Указать факторы, влияющие на точность опреде-
лений с помощью кинетических методов анализа.
8. Назвать индикаторную реакцию, способ измерения
скорости реакции и метод обработки данных при опре-
делении: a) Mo (VI); б) Со (II); в) W (VI); г) V (V);
Д) Си (II).
9. При каких условиях возможно раздельное опреде-
ление находящихся в смеси веществ (катализаторов)
кинетическими методами анализа?
10. В чем сущность каталиметрического титрования?
11. Какие приборы используются при выполнении
анализа кинетическими методами?
12. Назвать области применения, достоинства и не-
достатки кинетических методов анализа.
Решение типовых задач
Пример 1. Для определения молибдена кинетическим методом
использовали реакцию окисления иодид-ионов перекисью водорода,
катализируемую соединениями Мо. Применен дифференциальный
вариант метода тангенсов. В три колбы на 50 мл было прибавлено
1.0; 3,0 и 5,0 мл стандартного раствора молибдата аммония
И(НН,)1Мо01/Ми=^'^4- 10-8);в четвертую колбу помещен исследуемый
раствор. Поочередно в каждую колбу прибавлены необходимые реа-
генты (KI, НС1, НгО2 и крахмал) и после доведения объема раство-
158
ра до метки измерена зависимость оптической плотности D от вре-
мени т. Определить содержание Мо и растворе по нижеприведенным
экспериментальным данным.
мин Оптическая плотность, D
Стандартные растворы, мл Исследуемый раствор
1,0 3,0 5,0
2,0 0,025
2,5 — 0,020 0,073 —
3,0 — 0,052 0,135 0,020
3,5 — 0,094 0,198 0,050
4,0 0,012 0,140 0,248 0,090
4,5 0,030 0,181 0,300 0,119
5,0 0,057 0,225 0,365 0,164
5,5 0,090 0,265 0,408 0,192
6,0 0,120 0,304 0,446 0,234
6,5 0,145 0,340 0,477 0,270
7,0 0,175 0,374 0,509 0,301
7,5 0,205 0,402 — 0,335
8,0 0,232 0,428 — 0,356
Рис. 8
Решение. Строим графики зависимости оптической плотно-
сти раствора от времени (рис. 8). При этом необходимо учитывать,
что точки, соответствующие начальному и конечному периодам изме-
рений, могут не располагаться на прямой линии. В первом случае
это связано с недостаточной точностью измерений оптической плот-
ности при малых значениях D, во втором случае — с отклонением
зависимости D—т от линейной при достаточно глубоком протекании
индикаторной реакции. Поэтому эти точки практически отбрасы-
ваются.
Рассчитаем значения тангенсов угла наклона всех четырех Пря»
мых:
tgu1= 0,0583; tga3 = 0,1147;
tg a, = 0,0850; tg a r = 0,0725.
159
Определяем концентрации Мо в стандартных растворах:
г
1 50,0
TV2
С,= —-
50,0
4,454- 10-8.1 1Q3
50,0
= 0,891-10-6
мг/мл;
4,454- 10-8-3-1Q3
50,0
= 2,670-10-6
мг/мл;
TV?J 4,454-10-8-5-103
Сз=5О= 50 =4,454-10-6 мг/мл.
Строим калибровочный график в координатах tga—СМо
(рис. 9) по данным для стандартных растворов. С помощью калиб-
ровочного графика по значению tg ах находим концентрацию молиб-
дена в исследуемом растворе, а затем и его количество:
Сх = 1,8-10-6 мг/мл, лМо=Сл^ = 1,8-10-6-50,0 = 9-10-5 мг.
Задачи
710. Для определения вольфрама использовали реак-
цию окисления иодид-иона перекисью водорода, катали-
зируемую соединениями вольфрама. Был применен диф-
ференциальный вариант метода тангенсов. В три мерные
колбы емкостью 50 мл внесли 3,00; 5,50 и 8,00 мл рас-
твора Na2\VO4(7,Naawo1/w = 1,045-10-7). Исследуемый
раствор также поместили в мерную колбу на 50 мл. Пос-
ле добавления необходимых реагентов измерили оптиче-
скую плотность D в зависимости от времени т для всех
растворов. По приведенным в таблице данным постро-
ить графики в координатах D — т и tg a— Cw и опреде-
160
лить содержание вольфрама (г) в исследуемых раство-
рах.
Оптическая плотность, D
X, МИН Стандартные растворы, мл Исследуемые растворы
3,00 5,50 8,00 I II III
2,0 0,065 0,115 0,180 0,085 0,102 0,145
2,5 0,077 0,140 0,220 0,102 0,124 0,180
3,0 0,093 0,166 0,262 0,123 0,145 0,210
3,5 0,107 0,192 0,302 0,140 0,170 0,245
4,0 0,120 0,220 0,340 0,156 0,195 0,280
4,5 0,136 0,246 0,380 0,176 0,220 0,310
5,0 0,150 0,275 0,420 0,196 0,245 0,345
5,5 0,165 0,300 0,455 0,214 0,266 0,375
6,0 0,178 0,327 0,490 0,230 0,291 0,413
6,5 . 0,195 0,355 0,530 0,250 0,315 0,440
7,0 0,210 0,380 0,560 0,268 0,342 0,465
7,5 0,225 0,410 — 0,287 0,367 0,490
8,0 0,241 0,425 — 0,306 0,380 0,520
711. Для определения молибдена использовали реак-
цию окисления иодид-иона перекисью водорода, катали-
зируемую соединениями молибдена. В три мерные кол-
бы на 50 мл внесли 5,0; 10,0 и 15,0 мл раствора
(NH4)2MoO4 (7’(nii<),Moo,/mo =4,45-10-8). Исследуемый
раствор также поместили в мерную колбу на 50,0 мл.
После добавления необходимых реагентов измерили оп-
тическую плотность D в зависимости от времени т для
всех четырех растворов и построили график, по которо-
му определили тангенсы углов наклона прямых (tga),
приведенных в таблице.
Стандартные растворы Исследуемый раствор
Варианты
tg tg «2 tg "а Г II III IV V
0,75 1,00 1,25 0,95 1,10 0,85 1,21 1,31
Построить калибровочный график в координатах
tga—Смо и определить содержание молибдена (г) в
исследуемых растворах.
712. Для определения вольфрама использовали реак-
цию окисления иодид-иона перекисью водорода, катали-
зируемую соединениями W. В три мерные колбы на
161
50 мл внесли 1,0, 3,0 и 5,0 мл раствора Na2WO4
(ZNa,wo4/w = 1,045-10~7). Исследуемый раствор также по-
местили в мерную колбу на 50 мл. После добавления
необходимых реагентов измерили оптическую плотность
D в зависимости от времени т для всех четырех раство-
ров и построили график, по которому определили тан-
генсы углов наклона прямых (tga), приведенных в таб-
лице.
Стандартные растворы Исследуемый раствор
Варианты
tg «1 tg «1 tg «а I II III IV V
0,020 0,033 0,045 0,039 0,024 0,036 0,052 0,030
Построить калибровочный график в координатах
tg a — Cw и определить содержание вольфрама (г) в ис-
следуемых растворах.
713, Для определения содержания палладия в раство-
ре методом фиксированной концентрации использовали
реакцию окисления a-нафтиламина нитрат-ионами, ката-
лизируемую соединениями палладия. Определить кон-
центрацию палладия (мкг/мл) в исследуемом растворе,
если при измерении времени т, необходимого для дости-
жения оптической плотности, соответствующей оптиче-
ской плотности раствора с концентрацией палладия
2,8 мкг/мл, получили следующие результаты:
Параметры Стандартные растворы Исследуемые растворы
1 2 3 4 5 I п ill
Cpd, мкг/мл т, мин . . . 1,0 18,2 2,3 7,7 2,8 6,3 3,5 5,1 4,5 4,0 -> 12,0 7,1 ? 4,4
714. Для определения содержания серебра в растворе
методом фиксированной концентрации использовали ре-
акцию окисления n-фенитидина персульфат-ионами,
в которой соединения Мп (II) являются катализатором,
а соединения серебра — активатором.
Определить концентрацию серебра (мкг/мл) в иссле-
дуемом растворе, если при измерении времени т, необ-
ходимого для достижения оптической плотности,
соответствующей оптической плотности раствора с кон-
162
Цёнтрацией серебра f,0 • 1б~й мкг/мл, поручили сЛеДуЮ-
щие результаты:
Параметры Стандартные растворы Исследуемые растворы
1 2 3 5 6 I п in
Сде, мкг/мл т, мин . . . 2 13,3 4 6,3 6 4,2 7 3,6 8 3,1 10 2,5 ? 4,80 ? 3,85 ? 2,80
715. Для определения содержания тория в растворе
методом фиксированной концентрации .использовали ре-
акцию окисления иодид-иона перекисью водорода, ката-
лизируемую соединениями тория. 2,0 мл исследуемого
раствора разбавили до 100,0 мл в мерной колбе, и полу-
ченный раствор разбавили еще в 10 раз.
Определить концентрацию тория (г-атом/л) в иссле-
дуемом растворе, если при измерении времени т, необ-
ходимого для достижения оптической плотности, соот-
ветствующей оптической плотности раствора с концент-
рацией тория 8,2-10“° г-атом/л, получили следующие ре-
зультаты:
Параметры Стандартные растворы Исследуемые растворы
2 3 4 5 6 1 1 11 III
Сть-Ю6, г-атом/л 3,0 4,5 6,0 8,2 9,0 12,0 ? ?
т, мин 10,0 6,7 5,0 3,7 3,3 2,5 4,3 8,3 2,9
716. Для определения содержания рения в руде ме-
тодом фиксированного времени использовали реакцию
восстановления сульфосалицилатного комплекса железа
(III) хлоридом олова (II), катализируемую перренат-
ионами. Оптические плотности стандартных растворов,
измеренные через 30 мин после начала реакции, оказа-
лись равными:
CRe-102> мкг/мл .... 1,5 3,0 4,5 7,5
£>зо мин............ 0,42 0,39 0,36 0,30
Из навески руды а после соответствующей обработки
получили 100,0 мл раствора; 10,0 мл раствора разбавили
в мерной колбе на 50 мл. Определить процентное со-
держание рения в руде, если через 30 мин после начала
реакции получили следующие значения оптической плот-
ности исследуемых растворов:
163
Варианты..................... 1 II III
а, г ..................... 0,1280 0,0520 0,0674
£>30мик-.-................ 0.33 0,40 0,38
717. Для определения содержания палладия (II) в
растворе методом фиксированного времени использова-
ли реакцию восстановления мышьяковистой кислоты
хлоридом олова (II), катализируемую соединениями
палладия (II). Оптические плотности стандартных рас-
творов, измеренные через 3 мин после начала реакции,
оказались равными:
Cpd-107, г/мл ... 6,0 8,0 10,0 12,0 14,0
• - Дз мкн............ 0.22 0,29 Д),36 0,43 0,50
Для проведения реакции с исследуемым раствором
25,0 мл его разбавили водой до 1000 мл, затем 10,0 мл
полученного раствора вновь довели до объема 1000 мл.
Определить содержание палладия (г/л) в исследуемых
растворах, если получили следующие значения оптиче-
ской плотности, измеренной через 3 мин после начала
реакции:
Варианты.......................... I II III
£»3 мин • • • •........•........ 0,33 0,38 0,46
718. Для определения содержания ртути в фармацев-
тическом препарате методом фиксированного времени
использовали реакцию превращения гексацианоферрат
(II)-иона в аква-пентацианоферрат (II)-ион и далее в
присутствии нитрозобензола — в окрашенный ион
[Fe (CN) sCgHjNOp-. Эта реакция катализируется соеди-
нениями ртути. Оптические плотности стандартных рас-
творов, измеренные через 15 мин после начала реакции,
оказались равными:
<7цг-103, мкг/мл............. 10,0 16,0 21,0 26,0
£>15 мин.......................... 0,17 0,27 0,36 0,44
Из навески препарата а после соответствующей обра-
ботки получили 500 мл раствора. 10,0 мл раствора дове-
ли до объема 250 мл, из которого взяли 10,0 мл в мер-
ную колбу на 100 мл.
Определить процентное содержание ртути в препара-
те, если получили следующие значения оптической плот-
ности исследуемых растворов, измеренной через 15 мин
после начала реакции:
Варианты.......................... I II III
а, г......................... 0,4350 0,3140 0,1735
£>15 мии..................... 0,31 0,29 0,40
164
Глава XIV
ЭЛЕКТРОГРАВИМЕТРИЧЕСКИЙ
(ЭЛЕКТРОВЕСОВОЙ) АНАЛИЗ
Вопросы для самопроверки
1. В чем сущность электрогравиметрического ана-
лиза?
2. Что такое электрохимический эквивалент веще-
ства?
3. Что называется потенциалом разложения и пере-
напряжением?
4. Какое значение при электролизе имеют сила и
плотность тока?
5. Что представляет собой выход по току и каким об-
разом его учитывают в расчетах?
6. Какие аналитические цели достигаются с помощью
электролиза?
7. Какие металлы могут осаждаться на аноде?
8. Какими способами можно сократить время элек-
тролиза?
9. Каковы особенности электролиза на ртутном ка-
тоде?
10. Что представляет собой метод внутреннего элек-
тролиза? Каковы области применения, достоинства и не-
достатки этого метода анализа?
Решение типовых задач
Пример 1. Навеску сплава 0,6578 г растворили и через получен-
ный раствор в течение 20 мин пропускали ток силой 0,20 А, в резуль-
тате чего на катоде полностью выделилась медь. Определить про-
центное содержание меди в сплаве, если выход по току составлял
80%.
Решение. В соответствии с законом Фарадея
/тАт;
а = ЛлЮО’
где а — количество выделенного металла, г; / — сила тока, А; т —
время электролиза, с; А — атомный вес металла; F— постоянная
Фарадея; п—число электронов, участвующих в электрохимическом
процессе; р — выход по току, %.
Отсюда процентное содержание меди в сплаве равно
аСи100 /тАСит]100 0,20-20-60-63,55-80
CU’ °/о = ас..л ^с.ы'НОО " 96500-0,6578-2 ==9-5%-
165
Задачи
719. Определить процентное содержание индиффе-
рентных примесей в образце медного купороса, если
после растворения его навески а в азотной кислоте и
электролиза полученного раствора выделено на плати-
новом катоде х меди:
Варианты.....................
flCuSO4-5H;O, г..............
•*Си, г......................
I II III
0,4556 0,5237 0,6274
0,1145 0,1322 0,1586
720. При электролизе раствора нитрата свинца на
аноде выделилось х РЬО2. Определить нормальность рас-
твора РЬ(МОз)2, если для анализа взяли V мл раствора:
Варианты................... I II III
V, мл................... 20,0 30,0 40,0
хрьо2, Г .................. 0,2500 0,2345 0,2136
721. Навеску сплава а обработали соответствующим
образом и получили сульфатноаммиачный раствор, из ко-
торого электролизом при постоянной силе тока 0,5 А пол-
ностью выделили на платиновом катоде никель за вре-
мя т. Рассчитать процентное содержание никеля в спла-
ве по следующим данным:
Варианты.............. . • . . I II III
а, г........................ 1,0000 1,1000 1,2000
и, мин................ • . . 12 10 8
722. Определить время, теоретически необходимое
для полного выделения на катоде кадмия из V мл рас-
твора CdSO4 указанной нормальности, если электролиз
проводился при силе тока 0,1 А и выход по току соста-
вил 100%:
Варианты................. I II III
V, мл.................... 20,0 40,0 50,0
Arcjso< ................. 0,0622 0,0466 0,0435
723. Электролизом раствора ZnSO4 осаждено на ка-
тоде за время т 0,1200 г цинка. Какую силу тока необ-
ходимо поддерживать при электролизе, если выход по
току составил 90%:
Варианты.......................... I II III
и, с............................ 786 1310 1965
166
724. Из анализируемого раствора, содержащего ионы
трехвалентного металла, в результате электролиза при
силе тока 1 А за время т было выделено на катоде х ме-
талла и получены следующие данные:
Варианты.................... I II III
х, г ....................... 0,2800 0,3774 0,6510
и, мин...................... 50 35 15
Какой был металл?
Глава XV
КУЛОНОМЕТРИЯ
Вопросы для самопроверки
1. В чем сущность метода кулонометрии при контро-
лируемом потенциале? Привести примеры аналитических
определений.
2. Каковы особенности кулонометрического анализа
при контролируемой силе тока?
3. Привести примеры кулонометрического титрова-
ния: а) электрогенерированными окислителями; б) элек-
трогенерированными восстановителями; в) с использова-
нием реакций осаждения и комплексообразования; г) по
методу нейтрализации.
4. Назвать наиболее распространенные способы фик-
сирования точки эквивалентности в кулонометрическом
титровании.
5. В каких координатах строят кривые кулонометри-
ческого титрования?
6. На чем основывается кулонометрическое опреде-
ление воды?
7. Привести принципиальную схему установки для
выполнения кулонометрического анализа.
8. Указать достоинства и недостатки кулонометриче-
ских методов анализа.
Решение типовых задач
Пример 1. Навеску 0,6000 г вольфрамовой присадки перевели
в раствор и выделили алюминий в виде оксихинолята. Осадок после
очистки растворили в небольшом количестве концентрированной НС1,
раствор внесли в кулонометрическую ячейку и оттитровали выделив-
167
шийся 8-оксихинолин бромом, генерируемым в электролите. Точку
эквивалентности определили биамперометрически.
Вычислить процентное содержание алюминия в исследуемом об-
разце, если титрование велось при постоянной силе тока 8,0 мА в
течение 125 с.
Решение. Вычисления производят па основе закона Фарадея
(см. стр. 165):
а.,-100 /тМ.,-100
А1, о/о=2У-----= .
^обр * ЛЯобр
Величину п в данном случае находят из следующих соображе-
ний. Кулонометрическое титрование провели по методу замещения,
так как генерированный бром непосредственно реагировал не с алю-
минием, а с 8-оксихинолином. Последний был связан с алюминием
в стехиометрическом соотношении 3 . 1.
По уравнению реакции
Вг
I | + 2В'-в, +2Ю + 2В,-
YY YY
ОН он
на один моль 8-оксихинолина приходится 4 эквивалента брома. Сле-
довательно, число электронов, участвующих в электрохимическом
превращении в расчете на один атом алюминия, составляет п —
= 3-4=12.
Подставляем численные значения в формулу и находим процент-
ное содержание А1 в образце:
0,008-125-26,98-100
д 1 о; _____:----------:------
’ /0 96500-12-0,6000
= 3,9-10-=%.
Задачи
725, Титрование раствора, содержащего уран (IV),
провели кулонометрическим методом с помощью ионов
церия (IV), которые электрогенерируются в сернокис-
лом растворе при постоянной силе тока 5,0 мА. Точку
эквивалентности определили амперометрически, при
этом время электролиза т составило:
Варианты ...... I II III IV V
и, с................ 102 120 140 160 180
Сколько миллиграммов урана содержалось в рас-
творе?
726. Для определения иодид-ионов использовали ку-
лонометрический метод, титруя 1~ ионами МпО~, кото-
168
рые электрогенерируются в анодном пространстве в сер-
нокислой среде. Точку эквивалентности установили по-
тенциометрически.
Вычислить количество I- в растворе (мг), если тит-
рование продолжалось т, а сила тока равнялась I
и была постоянной
Варианты........................ I II III
т, с............................ 272 240 225
7, мА........................... 18,0 16,0 14,0
727. Для определения 8-оксихинолина исследуемый
раствор кулонометрически титровали бромом, электро-
генерируемым из КВг в присутствии H2SO4 при постоян-
ной силе тока 6,0 мА. Конец реакции определили биам-
перометрически.
Найти количество 8-оксихинолина (мг), если время
электролиза составило г, а для окисления 1 моля ок-
сихинолина требуется 4 мг-экв брома:
Варианты.............. I II III IV V
и, с.................. 75,5 (87 100 112 125
728. Раствор бихромата калия объемом V оттитрова-
ли электролитически генерируемыми ионами железа
(II) при силе тока I в течение времени т:
Варианты........................
V, мл...........................
I, А............................
и, мин .........................
I II III
20 25 30
0,20 0,25 0,25
15 20 35
Определить нормальность раствора бихромата ка-
лия.
729. Навеску сурьмы а перевели в раствор и содер-
жащийся в качестве примеси алюминий выделили в ви-
де оксихинолята. После очистки и растворения осадка в
соляной кислоте провели кулонометрическое титрование
раствора бромом, полученным в ходе электролиза из
КВг при постоянной силе тока 8,5 мА. Точка эквивалент-
ности, найденная биамперометрически, соответствовала
времени электролиза т. Рассчитать процентное содержа-
ние алюминия в сурьме по следующим данным:
Варианты . . I II III IV V
а, г .... 0,5000 0,5346 0,5824 0,6712 0,7015
и, с......... 114 108 125 137 140
730. Навеску алюминия а растворили и содержащие-
ся в виде примеси ионы Fe3+ кулонометрически оттитро-
169
вали электровосстанавливаемыми ионами Sn2+ при по-
стоянной силе тока 4,0 мА. Точка эквивалентности
фиксировалась потенциометрическим методом, время
электролиза т определялось с помощью хронометра.
Определить процентное содержание железа в алюми-
нии по следующим данным:
Варианты......................... I II III
а, г............................ 1,0000 1,2245 1,5136
т, с............................ 100 80 60
731. Для определения уксусной кислоты в ацетонит-
риле использовали метод кулонометрического титрова-
ния с помощью ОМ “-попов, образующихся при электро-
лизе воды в катодном пространстве. Точку эквивалентно-
сти установили потенциометрически. Какова молярность
СН3СООН, если сила тока составляла 25,0 мА, а время
электролиза — т и объемы исследованных растворов V
были следующими:
Варианты . . .
т, с..........
V, мл.........
I II III IV
107 92 85 75
40,0 50,0 60,0 80,0
V
60
100,0
732. Кальций в растворе оттитровали этилендиамин-
тетраацетатом, который генерировался из соответствую-
щего ртутного комплекса. Конец реакции установили
потенциометрически. Вычислить содержание кальция
(мкг) в растворе, если титрование велось при силе то-
ка 4 мА в течение времени т (в генерировании 1 иона
этилендиаминтетраацетата участвовало 2 электрона):
Варианты................. I II III IV V
т, с.................... 59 83 100 123 165
Глава XVI
КОНДУКТОМЕТРИЯ
Вопросы для самопроверки
1. В чем сущность кондуктометрического метода ана-
лиза?
2. Что называют удельной электропроводностью и эк-
вивалентной электропроводностью раствора?
3. Как влияет на электропроводность: а) природа
электролита и растворителя; б) концентрация электро-
лита (сильного, слабого); в) температура?
17Q
4. Назвать области применения метода прямой кон-
дуктометрии.
5. Что представляет собой кондуктометрическое тит-
рование и каковы особенности этого метода?
6. Какой вид имеют кривые кондуктометрического
титрования для реакций: а) кислотно-основного взаимо-
действия; б) осаждения; в) комплексообразования?
7. Как ведется кондуктометрическое титрование сме-
сей веществ?
8. Привести схему установки для измерения электро-
проводности растворов.
9. Что такое хронокондуктометрическое титрование?
10. В чем сущность высокочастотного титрования и
каковы особенности этого метода анализа?
Задачи
733. Для определения концентрации HF используют
зависимость удельной электропроводности и от содержа-
ния кислоты в растворе:
Chf,. моль/л...... 0,004 0,007 0,015 0,030 0,060 0,121 0,243
%.104, Om-1-cm-i ... 2,5 3,8 5,0 8,0 12,3 21,0 36,3
Построить по этим данным калибровочный график в
координатах 1g х— lg Chf и с его помощью определить
концентрацию фтористоводородной кислоты, если ее
удельная электропроводность равна:
Варианты.............. I II III IV V
Х-104, Om-1-cm- i ... 3,2 9,2 14,4 20,1 28,2
734. При титровании 50 мл соляной кислоты раство-
ром NaOH получили следующие данные:
Электропроводность раствора, со- О3 (Ом 1), для вариантов
VNaOH’ I II III IV V
МЛ ^аОН' ^аОН' %ОН= ЛМаОН” ^NaOH”
=0,0100 = 0,1000 =0,6230 = 1,012 -1,503
0 1,50 4,49 8,72
2 1,09 1,42 3,00 4,05
4 0,672 0,85 1,52 1,93 2,88
6 0,633 0,70 1,50 2,35 2,72
8 0,991 1,15 2,25 3,27
10 1,35 1,62 3,04 — 5,52
Построить график титрования в координатах
со — Умаон- Определить точку эквивалентности. Рассчи-
тать нормальность соляной кислоты.
171
735. При титровании 50 мл раствора, содержащего
NaOH и NH4OH, 0,01 н. НС! получили следующие дан-
ные:
VHC1’ мл Электропроводность, <о-103 (Ом 1), для вариантов
I II Ш
0 6,30 5,68 6,60
I 5,41 4,46 5,93
2 4,52 3,20 5,30
3 3,62 — 4,68
4 3,71 3,00 4,05
5 4,79 3,84 —
б 5,85 4,68 4,45
7 6,93 5,50 5,70
8 9,00 7,00 7,80
9 12,08 10,80 12,02
10 15,13 14,55 16,20
Построить график титрования, определить точки эк-
вивалентности и рассчитать концентрацию (г/л) NaOH и
NH4OH в исследуемом растворе (первая точка эквива-
лентности соответствует оттитровыванию NaOH, вто-
рая — сумме NaOH и NH4OH).
736. При титровании раствора ВаС12 0,2000 и. H2SO4
получили следующие данные по шкале высокочастотно-
го прибора:
l/HJSO1> мл Показавия прибора для вариантов
I II III
2,0 62,0 68,3 71,4
4,0 43,0 50,5 55,1
6,0 29,5 34,5 39,2
8,0 22,0 28,0 31,2
10,0 19,2 21,5 . 24,6
Построить график титрования и определить содержа-
ние ВаС12 (г) в исследуемом растворе.
737. Навеску а смеси слабых оснований растворили
в безводной уксусной кислоте и оттитровали кондукто-
метрическим методом 0,2000 М раствором хлорной кис-
лоты. Результаты титрования показаны на рис. 10, а и б.
Определить процентное содержание компонентов в
смеси.
172
Варианты
Состав смеси
I
II
III
IV
л-Нитроанилин
Диэтиламинч- дифенила мин
Диэтиламинч-л-нитроанилинЧ-мочевина
ДиэтиламинЧ-л-хлоранилинЧ-ДифениламинЧ-аце-
тамид
0,0920
0,2134
0,1425
0,1512
Рис. 10
738. Навеску а смеси соляной и серной кислот дове-
ли до 100,0 мл безводной уксусной кислотой. Результа-
ты кондуктометрического титрования полученного рас-
твора 0,2000М CH3GOOLi показаны на рис. И.
Определить процентное содержание H2SO4 и НС1 в ана-
лизируемой смеси *:
Варианты................... I II Щ
а, г . ..................... 0,1010 0,1390 0,0790
* Изломы на кривых соответствуют процессам нейтрализации в
следующей последовательности: 1-я ступень диссоциации H2SO4,
затем НО и, наконец, HSO".
173
При расчете содержания серной кислоты исйбльЗб-
вать оба скачка титрования.
Рис. 11
Глава XVII
ПОТЕНЦИОМЕТРИЧЕСКИЕ МЕТОДЫ АНАЛИЗА
Вопросы для самопроверки
I. На чем основаны потенциометрические методы
анализа?
2. Привести уравнение Нернста и пояснить смысл
входящих в него величин.
3. Какие электроды называют электродами I и
II рода?
4. Какой электрод называют индикаторным и какой
электродом сравнения?
5. В чем сущность потенциометрического определе-
ния pH раствора? Назвать основные индикаторные элек-
троды.
6. Какова сущность потенциометрического титрова-
ния? Указать его достоинства и недостатки.
7. Какие требования предъявляются к реакциям, ис-
пользуемым в потенциометрическом титровании?
8. Какой вид имеют кривые потенциометрического
титрования?
9. Привести принципиальную электрическую схему
установки для потенциометрического титрования.
174
10. Привести примеры потенциометрического титро-
вания с использованием реакций нейтрализации, осаж-
дения и окисления — восстановления.
Задачи
739. Рассчитать pH раствора по следующим экспери-
ментальным данным:
Вари- анты Элемент Э.л.с., В °C
I Pt (Н2)| СНзСООН I 0,1 н. КО, Hg2O2|Hg 0,498 30
II Хингидронный
электрод NH4OH нас. КО, Hg2Cl2 Hg 0,004 18
III Хингидронный NH4OH
электрод NH4O нас. КО, Hg2O2 Hg 0,016 18
IV Pt (Н2) НСООН 0,1 н. КО, AgCl | Ag 0,580 20
V Pt(H2)|N2H4 H,O| 1 н. КО, AgCllAg 0,772 20
VI Pt (Н2) | LiOH | HgO | Hg 0,626 25
VII Хингидронный 1 I I
электрод | H^SO4 | Hg2SO4 | Hg 0,104 20
VIII Pt (H2) | NH4CI10,1 н. KO, AgCl | Ag 0,642 20
IX Хингидронный I I I
электрод | HCOONa | 1 н. KO, AgCl | Ag 0,006 20
X Pt (H2) | HI, Agl | Ag 0,142 25
740. Построить кривые потенциометрического титро-
вания в координатах Е—V и AE/AV—V. Определить
концентрацию НС1, если при титровании 20,00 мл анали-
зируемого раствора кислоты 0,1000 н. NaOH получили
следующие результаты:
VNa0H, мл . . 10,0 18,0 19,0 19,9 20,0 20,1 21,0 22,0
pH........ 1,48 2,28 2,59 3,60 7,00 10,60 11,49 11,68
— Е, мВ . . 86 132 150 209 406 615 666 678
741. Построить кривые потенциометрического титро-
вания в координатах Е—V и ДЕ/ДК—V и определить
концентрацию СНзСООН, если при титровании 10,0 мл
анализируемого раствора кислоты 0,1000 н. КОН полу-
чили следующие результаты:
VK0H, мл . . 10,0 18,0 19,0 19,5 19,9 20,0 20,1 20,5 21,0
pH........ 4,76 5,71 6,04 6,35 7,06 8,79 10,52 11,22 11,51
— Е, мВ. . 276 331 350 368 410 510 610 650 668
742. Построить кривые потенциометрического титро-
вания в координатах Е — V и ЛЕ/SV— V и определить
175
концентрацию метиламина, если при титровании 20,0 мл
анализируемого раствора амина 0,2000 н. НС1 получили
следующие результаты:
VHC1. мл. 10,0 12,0 14,0 14,5 14,9 15,0 15,1 15,5 16,0
pH ... . 10,42 10,12 9,56 9,28 8,42 5,90 3,24 2,55 2,25
— Е, мВ. 605 586 554 538 488 342 188 148 130
743. Определить концентрацию NaCl в растворе (г/л),
если при потенциометрическом титровании 20,0 мл рас-
твора 0,2000 н. AgNO3 получили следующие результаты:
^AgNO,’ мл 15-0 2°.° 22,0 24,0 24,5 24,9 25,0 25,1 25,5
Е, мВ . . 307 328 342 370 388 428 517 606 646
744. Навеску сплава 2,1574 г растворили и после со-
ответствующей обработки довели объем раствора до
100,0 мл. Определить процентное содержание серебра в
сплаве, если при потенциометрическом титровании
215,0 мл приготовленного раствора 0,1250 н. NaCl полу-
чили следующие результаты:
VNaCI, мл . 16,0 18,0 19,0 19,5 19,9 20,0 20,1 20,5 21,0
Е, мВ . . • 689 670 652 634 594 518 441 401 383
745. Определить концентрацию NH4CI в растворе
(г/л), если при потенциометрическом титровании 20,0 мл
раствора 0,0500 н. Hg2(NO3)2 получили следующие ре-
зультаты:
^Hgl(NO3),’ мл 10>° 15’° 17>° 17>5 17’9 18-° 18-! 18-5 19’°
Е, мВ........... 382 411 442 457 498 613 679 700 709
746. Определить концентрацию KCN в растворе (г/л),
если при потенциометрическом титровании 20,0 мл рас-
твора 0,1000 н. AgNO3 получили следующие результаты:
ZAgN0>, мл 5,0 7-° 9-° 9>5 9-9 10>° 10>1 10’5 П.О
Е, мВ ... -252 -216 -153 -116 24 376 340 340 340
747. Определить концентрацию NaCl в растворе (г/л),
если при потенциометрическом титровании 20,0 мл рас-
твора 0,1000 н. Hg(NO3)2 получили следующие резуль-
таты:
^HgfNOs),- мл ' ' 10>° 18>° 19>° 19>5 19>9 20>° 20,1 20>5
Е, мВ......... 501 552 570 589 629 704 737 757
748. Из навески сплава 1,2000 г железо перевели в
Fe (II) и оттитровали 1,0000 н. Ce(SO4)2:
Се4++ Fe2+Се3++ Fe3+
176
Вычислить процентное содержание железа в сплаве
по следующим результатам потенциометрического титро-
вания:
Hce(so4h- мл • 2>° 10,0 18,0 19,8 20,0 20,2 22,0
£, мВ* . . . . 712 771 830 889 1110 1332 1391
749. Из навески руды 0,0800 г уран перевели в U4+ и
оттитровали 0,0100 н. КМпСХ:
2MnO- + 51Р+ + 2Н2О 2Мп2+ + 5UO2+ + 4Н+
Вычислить процентное содержание урана в руде по
следующим результатам потенциометрического титро-
вания:
VKMnO4> мл • 2’° 10>° 18’° 19>8 20>° 20-2 22-°
£, мВ . . . 301 330 359 389 1173 1486 1498
750. Из навески образца 2,0400 г таллий перевели в
Т1 (I) и оттитровали 0,1000 н. КВгО3 в солянокислой
среде:
ВгО- + 3 Т1+ + 6Н+ Вг~ + ЗТ13+ + ЗН2О
Вычислить процентное содержание таллия в сплаве
по следующим результатам потенциометрического тит-
рования:
УКВг0 , мл • • • 2,0 10,0 18,0 19,8 20,0 20,2 22,0
£, мВ . . . ... . 1251 1280 1309 1339 1407 1430 1451
751. Из навески 2,0000 г стали ванадий перевели в
раствор и оттитровали 0,1000 н. раствором сульфата же-
леза (II):
VO+ + Fe2+ -ф 2Н+ VO2+ + Fe3+ + Н2О
Вычислить процентное содержание ванадия в стали
по следующим результатам потенциометрического тит-
рования:
HF.SO мл • • • 2,° 10,0 18,0 19,8 20,0 20,2 22,0
£, мВ........ 1058 999 940 901 885 841 830
752. Из навески 0,0000 г сплава титан перевели в
TiO2+ и оттитровали 0,1000 н. СгСЬ:
TiO2+ + Cr3+ + 2Н+ Т13+ + Сг3+ + Н2О
177
Вычислить процентное содержание титана в сплаве
по следующим результатам потенциометрического тит-
рования:
усгсь, мл • • 2.0 Ю,0 18,0 19,8 20,0 20,2 22,0
Е, мВ........ 159 100 41 --18 -155 -292 -351
Глава XVIII
ПОЛЯРОГРАФИЯ И АМПЕРОМЕТРИЧЕСКОЕ
ТИТРОВАНИЕ
Вопросы для самопроверки
1. В чем сущность полярографических методов ана-
лиза?
2. Начертить принципиальную схему полярографа.
3. Что называется потенциалом полуволны и предель-
ным (диффузионным) током? Привести уравнение, свя-
зывающее эти величины.
4. На чем основан качественный полярографический
анализ?
5. Какова основа количественного полярографическо-
го анализа?
6. Привести уравнение Ильковича и охарактеризо-
вать входящие в него величины. Каково практическое
применение этого уравнения?
7. Какие аналитические приемы используются в ко-
личественной полярографии?
8. Привести примеры полярографических определе-
ний в неорганической и органической химии.
9. Что представляет собой полярография: а) пере-
меннотоковая; б) амальгамная с накоплением; в) осцил-
лографическая; г) со струйчатым электродом?
10. Назвать области применения, достоинства и не-
достатки полярографического метода анализа.
11. В чем сущность амперометрического титрования?
12. Какова схема установки для амперометрического
титрования с вращающимся электродом?
13. Привести примеры реакций, используемых при
амперометрическом титровании.
14. Какой вид имеют кривые амперометрического
титрования?
15. Назвать области применения, достоинства и не-
достатки метода амперометрического титрования.
178
Задачи
753. После соответствующей обработки четырех стан-
дартных образцов стали, содержащих хром, сняли их
полярограммы и получили следующие результаты:
Образцы.................1 2 3 4
ССг, %.................. 0,30 0,42 0,96 1,40
Л, мм . . .............. 8,0 10,0 20,0 28,0
Построить калибровочный график и определить про-
центное содержание хрома в анализируемом образце,
если при его полярографировании высота волны оказа-
лась hx:
Варианты.........I II III IV V
hx, мм........... 22,0 12,0 18,0 14,0 24,0
754. Для определения содержания примеси свинца в
металлическом алюминии навеску последнего а раство-
рили, перенесли в мерную колбу на 50 мл и раствор до-
вели водой до метки. При снятии полярограммы высота
волны оказалась hx. При полярографировании стандарт-
ных растворов соли свинца получили следующие резуль-
таты:
CPb'106, г/мл. . . .0,5 1,0 1,5
Л, мм..................4,0 8,0 12,0
2,0 2,5
16,0 20,0
Построить калибровочный график и определить про-
центное содержание свинца в анализируемом образце
для следующих вариантов:
Варианты.........: I II III IV V
а, г ............ 5,13402,50005,30005,83507,5860
Лд., мм...........9,0 6,0 11,0 14,0 17,0
755. Для определения содержания меди в латуни на-
веску последней а растворили и после соответствующей
обработки довели объем раствора до 50,0 мл. При сня-
тии полярограммы полученного раствора высота волны
оказалась равной 1гх. При полярографировании четырех
стандартных растворов меди получили следующие ре-
зультаты:
ССи-Ю3, г/ыл..............0,5 1,0 1,5 2,0
Л, мм.................... 5,0 15,0 25,0 35,0
Построить калибровочный график и определить про-
центное содержание меди в анализируемом образце для
следующих вариантов:
179
Варианты ... I II III IV V
a, v......... 0,1000 0,1435 0,1200 0,0690 0,1547
hx, мм . . . .18,0 28,0 23,0 11,0 31,0
756. Для определения содержания свинца в цинковой
руде методом добавок навеску руды а растворили и пос-
ле соответствующей обработки объем раствора довели
до 200,0 мл. Для снятия полярограммы взяли 20,0 мл
этого раствора. Высота волны оказалась равной 25,0 мм.
После добавки 0,08 М Pb(NO3)2 (Ист) высота волны уве-
личилась до h'. Определить процентное содержание
свинца в руде для следующих вариантов:
Варианты .... I II III IV V
а, г............ 1,0000 2,2665 2,2680 3,0730 3,1860
VCT, мл .... 5,0 4,5 4,0 3,5 3,0
Л', мм.......... 35,0 33,0 31,0 29,0 27,0
757. Для определения содержания кадмия в сплаве
методом добавок навеску сплава а растворили и после
соответствующей обработки объем раствора довели до
250,0 мл. Для снятия полярограммы взяли 18,0 мл этого
раствора. Высота волны оказалась 19,5 мм. После добав-
ки 0,0430 н. CdSO4 (ПСт) высота волны увеличилась до
h'. Определить процентное содержание кадмия в сплаве
для следующих вариантов:
Варианты .... I II III IV V
а, г.......... 3,5420 3,1300 2,7460 2,5080 2,2940
VCT, мл .... 2,0 2,5 3,0 4,0 5,0
Л', мм........ 21,5 22,5 24,0 26,0 28,0
758. Для определения содержания марганца в стали
методом добавок навеску стали а растворили и после со-
ответствующей обработки объем раствора довели до
200,0 мл. Для снятия полярограмм взяли 15,5 мл этого
раствора. Высота волны оказалась 20,5 мм. После добав-
ки 0,0500 н. MnSO4 (VCt) высота волны увеличилась до
h'. Определить процентное содержание марганца в стали
для следующих вариантов:
Варианты .... I II III IV V
а, г ..........1,5000 1,3050 1,1600 1,0160 0,5020
VCT, мл ... .2,5 3,0 3,5 4,0 5,0
Л', мм......... 23,8 25,5 27,5 30,0 33,0
180
759. Определить концентрацию никеля (мг/мл) в ис-
следуемом растворе, если при амперометрическом титро-
вании 20,0 мл раствора спиртовым раствором диметил-
глиоксима (ДМГО) с титром по никелю 0,00203 при Е =
= —1,76 В получили следующие результаты:
ГДМГ0’ мл Диффузный ток (мкА) для вариантов
I II ill IV V
0 240 160 220 260 279
0,5 190 115 100 235 250
1,0 140 65 20 191 218
1,5 93 46 40 158 186
2,0 41 65 62 124 153
2,5 76 85 85 100 122
3,0 110 104 106 148 90
3,5 145 122 127 171 80
4,0 180 140 148 240 100
760. Определить концентрацию цинка (мг/л) в иссле-
дуемом растворе, если при амперометрическом титрова-
нии 10,0 мл раствора свежеприготовленным раствором
K4Fe(CN)6 с титром по цинку 0,00244 при Е =— 1,46 В
получили следующие результаты:
vK4Pe (CN),> МЛ Диффузный ток I(мкА) для вариантов
I II III IV V VI VII VIII IX X
0 30 20 20 , 30 30 30 44 60 75 75
0,2 30 20 20 31 29 30 45 60 — 75
0,4 31 31 21 30 31 30 45 60 — 75
0,5 40 40 22 32 32 30 45 61 75 75
1,0 94 94 60 80 32 31 46 61 75 120
1,5 146 146 120 200 60 32 46 120 75 165
2,0 200 200 180 310 137 120 46 176 75 210
2,5 — — — — 220 210 175 230 120 255
3,0 — — — — 300 300 300 285 300 300
761. Определить концентрацию свинца (мг/л), если
при амперометрическом титровании 10,0 мл рабочим рас-
твором Na2SO4 с титром по свинцу 0,00640 при £=1,0 В
получили следующие данные:
181
vNa,SO4’ МЛ Диффузный ток Id (мкА) для вариантов
I II III I V V
0 215 151 260 105 308
0,5 163 106 198 72 240
1,0 113 57 137 40 172
1,5 60 31 75 30 102
2,0 40 31 43 30 42
2,5 39 30 42 29 42
Глава XIX
РАДИОМЕТРИЧЕСКИЕ МЕТОДЫ АНАЛИЗА
Вопросы для самопроверки
1. Назвать виды радиоактивных излучений и приве-
сти примеры радиоактивного распада.
2. Каковы основные характеристики а-, р- и у-излуче-
ний: заряд, масса, скорость движения и энергия?
3. Сравнить проникающую способность а-, р- и у-из-
лучений в различных средах.
4. В каких единицах измеряется количество радиоак-
тивного вещества?
5. Что такое постоянная радиоактивного распада?
Привести математическое уравнение, характеризующее
процесс распада.
6. Что называется периодом полураспада? В каких
пределах должна находиться эта величина для изотопов,
используемых в аналитических целях?
7. Что происходит при взаимодействии радиоактивно-
го излучения с воздухом?
8. В каких единицах измеряют ионизирующее дейст-
вие радиоактивного излучения? Сравнить ионизирующее
действие а-, р- и у-излучений.
9. Каковы правила техники безопасности при работе
с радиоактивными веществами? Какие дозы облучения
безопасны для человека?
10. Каковы устройство и принцип работы основных
счетчиков радиоактивных излучений: а) ионизационной
камеры; б) счетчика Гейгера — Мюллера; в) счетчика
Черенкова; г) сцинтилляционного счетчика?
182
11. Для каких целей в радиохимии используется фо-
топластинка (фотопленка)?
12. Что представляет собой радиометрическая уста-
новка типа Б-4?
13. Какие элементы можно определить количественно
по их естественной радиоактивности?
14. Какова методика радиометрического определения
калия в твердых образцах?
15. В чем сущность и каковы особенности активаци-
онного анализа? Привести примеры аналитических опре-
делений.
16. На чем основано радиометрическое определение
«возраста» органических материалов (древних рукопи-
сей, бытовых предметов и др.)?
17. Что представляет собой радиометрическое титро-
вание? Какой вид имеют графики радиометрического
титрования?
18. Как можно количественно определить методом ра-
диометрического титрования ионы Ва2+, РЬ2+, НРО^- ,
SO2-?
19. В чем сущность метода изотопного разбавления?
Привести примеры аналитических определений.
20. Каково значение радиохимических методов ана-
лиза? Указать достоинства и недостатки этих методов.
Решение типовых задач
Пример. Глицин в смеси аминокислот определяли методом изо-
топного разбавления. В анализируемый раствор аминокислот ввели
0,1000 г глицина, содержащего радиоактивный изотоп углерода 14С.
Затем из этого раствора выделили определенное количество глицина
и на радиометрической установке измерили его активность, получив
Дх = 800 имп/мин на 1 г вещества.
Определить количесто глицина в исследуемом растворе, если ак-
тивность введенного глицина составляет 19 000 имп/мин на 1 г.
Решение. Так как активность глицина с меченым 14С состав-
ляет 19 000 имп/мин на 1,00 г, то 0,100 г этого препарата имеет ак-
тивность 0,1'19 000=1900 имп/мин. Такую же активность должно
иметь и все количество глицина (0,100+х) г, находящееся в раство-
ре, если х — количество глицина в смеси аминокислот до прибавле-
ния радиоактивного изотопа.
Глицин с радиоактивным ,4С по химическим свойствам не отли- ,
чается от обычного глицина, поэтому при выделении некоторого ко-
личества глицина из анализируемого раствора относительное содер-
жание радиоактивного компонента не изменяется. Можно составить
пропорцию:
1,00 г
0,100 + х »
800 имп/мин
1900 >
1900— 80
х —-----------= 2,27 г глицина.
800
183
Примечание. Если количество радиоактивного препарата,
добавляемого к анализируемому раствору, пренебрежимо мало, то
расчеты упрощаются:
х = аос
ЛОс
где Дос — масса вещества, выделенного из раствора, г; ЛОбЩ — общая
активность анализируемого раствора с добавкой радиоактивного пре-
парата, и,мп/мин; ЛОс — активность осадка, выделенного из раство-
ра, имп/мин.
Задачи
Метод естественной радиоактивности
762. Вычислить процентное содержание калия в ис-
следуемом образце, если активность чистого КС1
1800 имп/мин, а активности исследуемых образцов (Дж)
следующие:
Образцы..........I ,11 III IV V
Л, имп/мин .... 220 398 798 '616 480
763. Вычислить процентное содержание калия в ис-
следуемом образце, если активность чистого К2СО3
800 имп/мин, а активности исследуемых образцов (Лх)
следующие:
Образцы..........I II III IV V
Ах, имп/мин .... 180 430 540 360 715
764. Для построения калибровочного графика при оп-
ределении содержания калия взяли 5 образцов с извест-
ным содержанием калия и измерили их активность. При
этом получили такие данные:
Ск, %........ 10,01 15,05 30,04 40,00 52,44
А, имп/мин . . .346 520 1030 1374 1800
Вычислить процентное содержание калия в исследуе-
мом образце, если при измерении активности его получи-
ли следующие результаты:
Образцы ... I II III IV V VI VII VIII
Ах, имп/мин . 220 1160 930 400 620 1480 802 484
Метод изотопного разбавления
765. К 1 л исследуемого раствора прибавили навеску
Pb(NO3)2, содержащую а радиоактивного свинца с удель-
184
ной активностью 432 имп/мин-мг. Затем из раствора вы-
делили навеску PbSO4, имеющего удельную активность
Ах. Определить содержание свинца в растворе (мг/л) по
следующим данным:
Варианты...........I
д, мг..............10
Ах, имп/мин-мг . . 12
II III IV V
20 30 40 50
23 34 44 54
766. К образцу гидролизованного протеина добавили
а чистого глицина, содержащего радиоактивный изотоп
14С с удельной активностью 25 000 ими/мин-г. Выделен-
ный из смеси глицин показывает удельную активность
Ах. Вычислить содержание глицина (г) в гидро-
лизованном протеине ио следующим данным:
Варианты .... I II III IV V
а, г........... 0,1000 0,2000 0,3000 0,4000 0,5000
Ах, имп/мин-г .442 840 1240 1625 2000
767. Навеску а чистого пенициллина, содержащего
14С с активностью 4200 имп/мин • мг, прибавили к иссле-
дуемому образцу. Из смеси удалось выделить часть чи-
стого кристаллического пенициллина, удельная актив-
ность которого Ах. Рассчитать содержание пенициллина
в исходном образце (г) по следующим данным:
Варианты ............ I
а, мг................10,0
Ах, имп/мин-мг . . .405
II III IV V
12,0 14,0 16,0 18,0
354 312 277 252
768. К анализируемому раствору РЬ(ЫОз)г прибави-
ли пренебрежимо малое количество препарата, содер-
жащего радиоактивный свинец, и измерили общую актив-
ность раствора (ЛОбщ)- Затем из раствора осадили РЬСЬ,
отфильтровали его, промыли, взвесили (а) и измерили
его активность (Лос).
Вычислить содержание свинца (г) в анализируемом
растворе по следующим данным, имея в виду, что сви-
нец в виде РЬС12 осаждался не полностью:
Варианты........I II
ЛобЩ, имп/мнн . . 2500 2700
Лос, имп/мин . . . 2325 2410
а, г............ 0,1674 0,1812
III IV V
2750 2980 2920
2436 2500 2595
0,1945 0,2046 0,2184
769. Навеску известняка аОбР перевели в раствор, до-
бавили пренебрежимо малое количество радиоактивного
45Са (в виде раствора СаС12) и измерили общую актив-
ность раствора (ЛОбщ)- После этого кальций осадили в
7—4022
185
виде CaSO4 и взвесили (аос). Измерили его активность
(Аос). Определить процентное содержание СаСОз в изве-
стняке по следующим данным:
Варианты .... I II III IV V
ао6р1 г . . . .0,3023 0,3560 0,3410 0,4105 0,2636
аос, г........ 0,2546 0,2872 0,2905 0,3178 0,2254
Лс6щ > имп/мин . 870 914 950 925 824
Лос, имп/мин .816 868 846 886 767
Метод радиометрического титрования
770. Для определения содержания цинка в растворе
использовали реакцию
266Zn2+ + Fe (CN)<- -> 65Zn2Fe (CN)e |
В стакан полуавтоматической установки для радио-
метрического титрования вносили исследуемый раствор,
определенное количество соли цинка, содержащее
0,238 мг изотопа 63Zn, и разные объемы (от 0,2 до 1,6 мл)
0,0287 н. K4Fe(CN)6. После прибавления каждой порции
титранта и перемешивания отбирали пробу фильтрата,
измеряли его активность и возвращали пробу обратно
в стакан. Полученные результаты представлены в таб-
лице.
vK.Fe (CN).> МЛ Активность (имп/мин) для вариантов
I II ill IV V
0,2 1000 1030 1005 960 930
0,4 860 910 880 790 720
0,6 710 800 740 610 520
0,8 570 680 610 430 310
1,0 420 550 480 260 100
1,2 280 440 350 80 0
1,4 150 330 210 0 0
1,6 0 200 80 0 0
Построить график титрования в координатах: актив-
ность— объем титранта (активность раствора до начала
титрования составляла 1150 имп/мин), определить точку
эквивалентности и рассчитать количество цинка в рас-
творе (мг/мл).
771. Для определения металла в растворе брали по
1,0 мл исследуемого раствора, содержащего радиоактив-
186
ный изотоп определяемого элемента, по 1,0 мл ацетатно-
го буферного раствора с pH 4,7, определенные объемы
(0,25—1,5 мл) раствора дитизона (Dz) в хлороформе и
чистый хлороформ так, чтобы объем органической фазы
во всех пробирках был равен 2,0 мл. После достижения
равновесия измерили активность 1,0 мл водного слоя и
1,0 мл слоя хлороформа
тэты:
VDz, мл
Активность водного слоя,
имп/мин
Активность слоя хлоро-
форма, имп/мин
и получили следующие резуль-
Hg
Zn
Hg
Zn
О
1350
2150
0
0
0,25 0,5020,75 1,00 1,25 1,50
900 450 100 0 0 0
1505 950 290 0 0 0
400 900 1250 1360 1340 1350
620 1240 1900 2140 2160 2150
титрования,
Построить график радиометрического
определить точку эквивалентности и рассчитать содер-
жание (мг/мл): 1) ртути, если титр дитизона по ртути
0,0000234; 2) цинка, если титр дитизона по цинку
0,000133.
772. Для определения содержания магния в растворе
методом
реакцию
радиометрического титрования использовали
Mg2+ + NH+ Д- 32РО3- MgNH4s2PO41
мл исследуемого раствора прибавляли различ-
К 4,0
ные объемы (от 0,4 до 2,0 мл) 0,5000 М. аммиачного рас-
твора Na2HPO4, меченного 32Р, и центрифугировали. Из
каждой пробирки брали одинаковые объемы раствора ц
измеряли его активность.
FNa,HPQ4> МЛ Активность (имп/мин) лля вариантов
I II III IV V
0,4 чти* 28
0,5 20 «а Ов*
0,6 — 25 м» «и 25
0,7 18 __
0,8 — 26 30 27 23
1,0 18 80 27 26 128
1,2 154 154 28 25 230
1,4 445 237 59 185 —
1,6 719 322 200 371 414
1,8 968 394 346 552 603
2,0 — — 467 748 —
7*
187
Построить график титрования с учетом увеличения
объема раствора в процессе титрования. Определить точ-
ку эквивалентности и рассчитать содержание магния в
растворе (в г-атом/л).
Глава XX
ХРОМАТОГРАФИЧЕСКИЕ МЕТОДЫ АНАЛИЗА
Вопросы для самопроверки
I. В чем сущность методов хроматографии?
2. Как классифицируются методы хроматографии по
агрегатному состоянию фаз и по методике проведения
эксперимента?
3. Назвать поглотители (адсорбенты) и растворите-
ли, наиболее часто применяемые в хроматографии.
4. Каковы области применения, достоинства и недо-
статки методов адсорбционной хроматографии?
5. В чем сущность метода ионообменной хроматогра-
фии?
6. Назвать основные типы ионитов. Что называется
обменной емкостью ионита?
7. Каковы области применения, достоинства и недо-
статки метода ионообменной хроматографии?
8. Пояснить сущность метода осадочной хроматогра-
фии. Назвать варианты этого метода анализа.
9. На чем основан качественный анализ методами
осадочной и распределительной хроматографии на бу-
маге?
10. На чем основан количественный анализ метода-
ми осадочной и распределительной хроматографии на
бумаге?
11. Привести примеры аналитических определений
методами осадочной и распределительной хроматогра-
фии на бумаге, указать основные способы измерений
при количественных определениях.
12. Пояснить сущность и назвать области применения,
достоинства и недостатки адсорбционной, газовой, газо-
жидкостной и тонкослойной хроматографии.
13. Охарактеризовать методы проявительной, фрон-
тальной и вытеснительной хроматографии.
188
Решение типовых задач
Пример 1. Определить процентный состав компонентов газовой
смеси по следующим данным, полученным с помощью газовой хрома-
тографии:______________________________________________________
Компоненты смеси S, мм* k
Пропан 175 0,68
Бутан 203 0,68
Пентан 182 0,69
Циклогексан 35 0,85
Решение. Расчеты проводят по методу внутренней нормали-
зации, согласно котовому
Р< = 4^~ 100,
2 s‘k‘
1
где Pi — весовой процент i-того компонента в смеси; -S, — площадь
пика i-того компонента; fe, — поправочный коэффициент, определяе-
мый чувствительностью детектора хроматографа к i-тому компо-
ненту.
Найдем приведенную суммарную площадь пиков;
л
Siki = 175-0,68 + 203-0,68 + 182-0,69 + 35-0,85 = 412,9.
Отсюда процентное содержание пропана равно;
175-0,68
^пропана == g ЮО — 28,8%.
Аналогичным образом находят содержание остальных компонен-
тев.
Примечание. В методе внутреннего стандарта расчет прово-
дят по формуле
= R-юо,
<Эст«ст
где $вт и т — соответственно площадь пика вещества, введен-
ного в качестве внутреннего стандарта, и поправочный коэффициент;
Я — отношение массы внутреннего стандарта к массе анализируемой
пробы.
Задачи
773. Для хроматографического определения никеля
на бумаге, пропитанной раствором диметилглиоксима,
приготовили три стандартных раствора. Для этого наве^
189
ску (a) NiC12-6HiO растворили в мерной колбе на
50 мл. Затем из этой колбы взяли 5,0; 10,0 и 20,0 мл и
разбавили в колбах на 50 мл. Исследуемый раствор
также разбавили в мерной колбе на 50 мл.
Построить калибровочный график в координатах
h — Cni и определить содержание никеля (мг) в иссле-
дуемом растворе, если высота пиков стандартных рас-
творов равна hi, /г2 и /г3, а высота пика исследуемого рас-
твора равна hx.
Варианты Л, г Высота пиков, мм
Л, Л, й, hx
I 0,2000 20,5 36,0 66,4 33,0
II 0,2040 21,0 38,5 72,3 43,3
III 0,2820 29,0 42,0 68,0 47,0
IV 0,2946 30,0 45,0 78,0 54,0
V 0,2480 25,5 37,5 61,3 49,0
VI 0,2284 23,5 31,5 47,2 37,5
VII 0,1950 20,0 35,0 65,0 53,0
VIII 0,3720 38,0 50,5 76,0 59,0
IX 0,2200 22,5 39,0 71,5 65,0
X 0,2780 28,5 42,3 70,0 47,5
ПЬ. Рассчитать процентный состав смеси газрв по
следующим данным, полученным при газовой хромато-
графии смеси:
Гаэ Вариант I Вариант Н Вариант III Вариант I V
S* Л* 5 к к 5 а
Пропан , . 216 1,13 155 0,68 300 1,13 205 0,68
Бутан , , . 312 1.11 216 0,68 <*• 97 0,68
Пентан . . 22 1.11 198 0,69 206 1.11
Циклогексан 34 1,08 28 0,85 18 1,08 48 0,85
Пропилен . — — — — — 22 0,65
* 5—площадь пикд| мм*; ft—поправочный коэффициент.
775. Рассчитать процентный состав смеси газов по
следующим данным, полученным при газовой хромато-
графии смеси:
190
Вариант I 1 Вариант II 1 Вариант III
Газ 5 А 1 Г аэ 5 k | Газ S к
Бензол . . 20,6 0,78 о-Ксилол . . 16,7 0,840 Бензол . . 85 1,00
Толуол . . 22,9 0,79 л/-Ксилол . 20,3 0,812 Гексан . . 27 1.11 1,08
Этилбензол . 30,5 0,82 п-Ксилол ч8,5 0,812 Пропилен . 34
Кумол . . . 16,7 0,84 Этилбензол . 30,4 0,820 Этанол . . 11 1,77
776. Определить процентный состав смеси газов по
следующим данным, полученным при газовой хромато-
графии:
Вариант I Вариант II
Газ 5 k Газ 5 к
Этанол Метанол ..... 3524,2 13,4 0,64 0,58 Метан Этан 207 4 1,23 1,15
Вариант III Вариант I V
Газ А Газ S А
Динитробензол . . Нитробензол . . . 305 12 1,22 1,07 Этилацетат . . . Этанол 1Й 305,2 И.7 0,79 0,64
777. Реакционную массу после нитрования толуола
проанализировали методом газожидкостной хроматогра-
фии с применением этилбензола в качестве внутреннего
стандарта. Определить процент непрореагировавшего
толуола по следующим экспериментальным данным:
Варианты .... I II III IV
Взято толуола, г 12,7500 15,2605 8,5412 25,1639
Внесено этилбен- зола, г . . . . 1,2530 1,0865 2,7522 1,2873
^толуола» . 307 108,5 55,3 80,7
^толуола 1,01 0,794 1,01 0,794
^этилбензола» мм^ • 352 157,7 80,1 109,2
^этилбензола • • • 1,02 0,822 1,02 0,822
191
Глава XXI
ЭКСТРАКЦИЯ
Вопросы для самопроверки
1. В чем сущность методов экстракции? Какие зада-
чи решаются с помощью этих методов?
2. Что представляют собой коэффициент распределе-
ния и константа распределения?
3. Назвать органические растворители, наиболее ча-
сто используемые в методах экстракции.
4. Назвать основные типы соединений, в виде кото-
рых экстрагируются ионы металлов. Привести примеры.
5. Указать, какие элементы чаще всего экстрагируют-
ся в виде: а) дитизонатов; б) карбаминатов; в) оксихи-
нолятов; г) купферонатов; д) ацетнлацетонатов?
6. Охарактеризовать следующие методы экстракции:
а) периодической-, б) непрерывной; в) из твердых ве-
ществ.
7. В чем сущность количественных экстракционно-
фотометрических определений?
8. Каковы достоинства и недостатки методов экстрак-
ции?
Задачи
778. Навеску руды а растворили. Из раствора экстра-
гировали рений толуолом в присутствии метилового
фиолетового. Экстракты собрали в колбу на 50 мл, до-
вели объем до метки и определили оптическую плот-
ность Dx. Оптическая плотность у четырех стандартных
растворов, содержащих 1,0; 6,0; 8,0 и 10,0 мг/л рения
и подвергнутых аналогичной обработке, оказалась 0,10;
0,50; 0,64; 0,81. Построить калибровочный график в ко-
ординатах CRe — D. Определить процентное содержание
рения в руде по следующим данным:
Варианты............... I II III IV
а, г................... 1,0000 (),.5000 0,7000 1,2300
ПА..................... 0,54 0,25 0,87 0,70
779. Из 100 мл раствора, содержащего а меди, из-
влекли ее дихлорэтаном в виде роданидпиридинового
комплекса. Рассчитать объем растворителя, необходи-
мый для однократной экстракции, чтобы уменьшить кон-
192
центрацию меди в водном растворе до Скоп, если коэффи-
циент распределения ее 250:
Варианты............ I II III IV
а, мг............... 0,8 1,0 1,2 2,2
Скон, г-ион/л. . . . 1-10-5 8-10-6 1,2-10-5 1,4-10-5
780. Из 10,0 мл раствора, содержащего 50 мкг ко-
бальта, последний извлекли порциями по 5,0 мл раство-
ра дитизона в хлороформе. Сколько экстракций следует
провести, чтобы понизить концентрацию кобальта в вод-
ной фазе до 1 • 10'G г-ион/л, если коэффициент распреде-
ления 4,5?
Глава XXII
МАТЕМАТИЧЕСКАЯ ОБРАБОТКА
РЕЗУЛЬТАТОВ АНАЛИЗА
Вопросы для самопроверки
1. Какими причинами вызываются систематические и
случайные ошибки анализа, грубые ошибки?
2. Какими способами можно уменьшить системати-
ческую ошибку: а) при взвешивании; б) при калиброва-
нии мерной посуды; в) при осаждении и промывании
осадков; г) при титровании с индикаторами?
3. Как вычислить наиболее вероятную величину А*,
если при п измерениях получены значения Xi, х2,
х3,. . ., х„?
4. Чем характеризуется случайная ошибка анализа?
5. Как вычислить стандартное отклонение отдельного
измерения? Что характеризует эта величина?
6. Что называется коэффициентом вариации? В ка-
ких случаях он используется для характеристики случай-
ной ошибки?
7. Какие величины используются для оценки точно-
сти результата анализа?
8. Как вычислить стандартное отклонение среднего
результата?
9. Что характеризует коэффициент Стыодента /а,у. От
каких факторов зависит величина /-коэффициента?
10. Чему равна статистическая надежность а для се-
рийных анализов?
11. Что такое точность измерений еа?
193
12. Чему равен доверительны!"! интервал и что он ха-
рактеризует?
13. Как используется доверительный интервал для
обнаружения систематической ошибки метода?
14. Как используется t-критерий для проверки значи-
мости различия двух средних значений X и р?
15. Как с помощью критерия t устанавливают число
параллельных измерений, необходимое для получения
среднего результата с заданной точностью еа?
16. Какие методы обнаружения грубых ошибок (про-
махов) используются в математической статистике?
17. Что такое Q-критерий и от каких факторов он за-
висит?
Решение типовых задач
При определении количества вещества в пробе обыч-
но выполняют несколько параллельных определений
(п^2), которые характеризуются воспроизводимостью
полученных результатов вследствие случайных ошибок и
правильностью результатов, являющейся следствием си-
стематической ошибки. При обработке результатов ана-
лиза пользуются методами современной математической
статистики, разработанной для малого числа измерений.
Оценку воспроизводимости измерений и правильности
производят с помощью следующих величин:
1. Среднее арифметическое значение измеренных ве-
личин (выборочное среднее) вычисляют по формуле
(1)
где х^ х2, х3, . . ., Xi, хп — результаты измерений величи-
ны, истинное значение которой равно ц (генеральное
среднее).
2. Стандартное отклонение, дисперсия, коэффициент
вариации — характеризуют случайную ошибку анализа.
Граница разброса отдельных измерений относительно X
характеризуется квадратичной ошибкой или стандарт-
ным отклонением отдельного измерения S. Выборочное
стандартное отклонение определяется по формуле
Л ___
{x-Х?
л— 1
(2)
194
где (Xi — .?) — единичное отклонение, т. е. отклонение
отдельного измерения от среднего арифметического;
п — 1 =f — число степеней свободы.
Если имеется т проб и для каждой пробы проводит-
ся tij параллельных измерений (j— номер пробы), то
j-m
общее число измерений равно а число степеней
свободы f=n — т. В этом случае формула (2) принима-
ет вид
j — m 1 — п
7-1 '-1
n — т
(3)
где S — общее стандартное отклонение.
Относительная квадратичная ошибка, выраженная в
процентах от среднего значения X, называется коэффи-
циентом вариации:
1/ = 4- 100.
(4)
Величина S2 — выборочная дисперсия и вычисляется
по формуле
S2
(5)
п—I
3. Стандартное отклонение среднего результата, вы-
борочную дисперсию среднего значения, доверительный
интервал и точность определения используют для раз-
личных статистических расчетов. При оценке точности
полученных результатов вычисляют стандартное откло-
нение среднего результата (среднюю квадратичную
ошибку среднего арифметического):
"(х,. - Л)2
Sy = -^-= -------. (6)
х У п п (п — 1)
Значение 5^ — выборочная дисперсия среднего зна-
чения вычисляется по формуле
1—п _
-------------
х п (п — I)
(7)
195
Точность измерений в« равна разности между сред-
ним выборочным значением X и средним генеральной со-
вокупности р,: еа = |Х — р|.
Точность измерений вычисляют по формуле
где ta<f— коэффициент нормированных отклонений (ко-
эффициент Стьюдента) принимается по табл. 4 (см. при-
ложение) в зависимости от надежности а и числа степе-
ней свободы f=n — 1.
Для оценки неизвестной величины х имеется два
— t.fS — t {s
значения X---и X ф- и можно утверждать,
_ / .S _ t ,S
что X — <ф х < X -I-.
/п Vn
— ,S — t„ fs
X —-—и X ---------------доверительные 100(1 —
У n У п
— а)%-ные пределы, а интервал между ними—100(1 —
— а)%-ный доверительцый интервал, который равен
X ± t.,fS^ = X + sa. (9)
Доверительный интервал с данной вероятностью а
указывает, с какой вероятностью следует ожидать ошиб-
fs
ки вычисленной величины —. Возможность, что от-
У п
дельное значение несет более высокую ошибку, чем
У
—, остается с риском (1 — а). Поэтому числовое зна-
У п
чение доверительного интервала всегда должно быть
дополнено указанием вероятности. Надежность а (дове-
рительную вероятность) принимают для серийных ана-
лизов равной 0,95. Точность измерения, выраженная в
процентах от среднего значения X, называется относи-
тельной ошибкой прямого определения:
д = 4ф100. (10)
Результаты анализа обычно представляют в виде
X или XztSx- Это эквивалентно указанию четырех
величин: X, Sx, п, а. Методы математической статистики
используют для проверки гипотезы, значимо ли отлича-
196
ются между собой два средних значения. Если сравни-
вают среднее значение X из п измерений со средним р
генеральной совокупности, имеющей нормальное распре-
деление, то по формуле
t = I* ~Я/..? (П)
вычисляют критерий I. Вычисленную величину t сравни-
вают со значением, найденным в таблице коэффициентов
Стьюдента для выбранной доверительной вероятности а
и степеней свободы f=n— 1. Если вычисленное по фор-
муле (11) значение t превышает табличную величину
Д/, т. е. то различие между X и ц является зна-
чимым.
Статистические методы позволяют установить число
параллельных измерений п, необходимое для получения
среднего результата с заданной точностью ея. Для этого
предварительно находят стандартное отклонение S из
небольшого числа опытов. Задаются величиной п, вычис-
ляют по формуле (11) значение t и сравнивают его с таб-
личным при выбранной надежности а и f = n— 1.
Если t'^Kh то заданное число п обеспечивает точность
с вероятностью а. Если число измерений п получает-
ся не слишком большим (не более 8—10), то данный ме-
тод вполне оправдан для обеспечения заданной точно-
сти.
4. Критерий Q. При обработке результатов анализа
величины, являющиеся грубыми ошибками, отбрасыва-
ют. При небольшом числе анализов их устанавливают
при помощи критерия Q:
(12)
где К— размах варьирования; Д = хтах— xmin (разница
между двумя крайними значениями в ряду величин х;,
расположенных в порядке возрастания); Xi— подозри-
тельно выделяющееся значение; х2 — соседнее с ним зна-
чение. Вычисленную величину Q сопоставляют с таблич-
ным значением (см. табл. 5 приложения). Наличие
грубой ошибки доказано, если Q>Qa,n, Другим спосо-
бом оценки является критерий 3S. Грубые ошибки отсут-
ствуют, если отклонение от среднего (лу — X) не выхо-
дит за пределы величины 35.
197
Результаты вычисления не могут быть точнее, чем
используемые измерения. Расчет результатов проводят
всегда с сохранением одной лишней цифры по сравнению
с числом цифр в конечном результате. В конечном ре-
зультате эту лишнюю цифру опускают. Результат изме-
рения и ошибка должны быть выражены числами с оди-
наковым количеством знаков после запятой. Поэтому их
округляют в одинаковой степени.
Пример 1. При определении содержания свинца в сплаве полу-
чили следующие результаты, %: 14,50; 14,43; 14,54; 14,45; 14,44;
14,52; 14,58; 14,40; 14,25; 14,49. Обработать эти данные по правилам
математической статистики. Сколько значащих цифр следует указать
в результате?
Решение. Перед статистической обработкой результатов ана-
лиза оцениваем наличие грубых ошибок по Q-критерию. Располага-
ем экспериментальные данные в порядке возрастания величин: 14,25;
14,40; 14,43; 14,44; 14,45; 14,49; 14,50; 14,52; 14,54; 14,58. Предполага-
ем, что значения 14,25 и 14,58 являются результатами грубой ошиб-
ки. По формуле (12) рассчитываем критерий Q для этих величин:
Л 14,40— 14,25 0,15
О, ==--------------= -1— = 0,45,
v 14,58— 14,25 0,33
14,58 + 14,54 0,04
Q2 =---------------= -2— = 0,12.
14,58—14,25 0,33
Для а = 0,95 и н=10 табличное значение Q = 0,42. Qi>0,42,
поэтому значение Xi = 14,25 считаем недостоверным и исключаем из
числа статистически обрабатываемых величин. В измерении Хю =
= 14,58 грубая ошибка отсутствует, так как Qio<;O,42. По формуле
(1) вычисляем среднее арифметическое значение из 9 определений-.
14,40+14,43+14,44+14,45 + 14,49+14,50+14,52+
+ 14,54+14,58
——11— =14,48.
9
По формуле (2) находим стандартное отклонение:
/(0,08)2 + (0,05)2 + (0,04)2 + (0,03)2 + (0,01)2 + (р,р2)2 ч-
9- 1
/+(0,04)2 + (0,06)2 + (0, IO)2
9- 1
Стандартное отклонение среднего результата определяем по
формуле (6):
_ 5.82-10-2
Sx~ /9
= 1,94-10—2.
1?@
Точность определения гв вычисляем по формуле (8), принимая
по табл. 4 (см. приложение) ta j = 2,31 (а — 0,95; / = 9—1=8).
еа = 2,31 1,94-10-2 = 4,48-10-2
Оцениваем еще раз наличие грубых ошибок по критерию:
35 = 3-5,82; 10-2 = 0,17.
Сравнивая величины (х,— X) и 35=0,17, видим, что ни одно
из отклонений от среднего не выходит за пределы 3S. Следователь-
но, величины Xi не содержат грубых ошибок. Среднее значение ре-
зультата анализа свинца при а = 0,95 определяется доверительным
интервалом по формуле 9, т. е. (14,48±0,04) % РЬ. Результат опре-
деления должен быть представлен числом с двумя значащими циф-
рами после запятой, так как это соответствует полученной точности
анализа.
Пример 2. Вычислить стандартное отклонение единичного опре-
деления никеля в четырех пробах стали с различным содержанием
Ni. Результаты анализа Ni, %: 1) 1,22; 1,18; 1,22; 1,21; 2) 2,01;
1,98; 2,02; 1,99; 3) 3,25; 3,23; 3,22; 3,26; 4) 4,49; 4,47; 4,50; 4,46.
Как зависит коэффициент вариации от содержания Ni в образце?
Решение. По формуле (1) находим среднее арифметическое
значение содержания Ni в каждой пробе:
1,22+ 1,18+ 1,22+ 1,21
2,01 + 1,98 + 2,02+ 1,99
2) X = —'—1—у-2-------------------=2,00,
3,25 + 3,23 + 3,22 + 3,26
О) А =: - = О , ,
_ 4,49 + 4,47+ 4,50 + 4,46
4) X —----------------------------= 4,48.
1—п _
Рассчитываем для каждой пробы величину 2 (х,-— X)2:
1-1
1) 0,012+0,ОЗ2+0,012+0,002 = 11 • ю-*,
2) 0,012+0,022+0,022+0,012=10-10-4,
3) 0,012+0,012+0,022+0,022 = 10-10- 4,
4) 0,012 + 0,012 + 0,022 + 0,022 = 10 10~4.
Стандартное отклонение единичного определения рассчитываем
по формуле (3):
/"11-10-4 + 1Q.1Q—4 + 1Q-10-4 + IQ. ю-4
= [/ 4-4—4 “
= 1,85-10-2, S = 0,018.
0,018-100
Vi = — = 1,49% ,
0,018-100
~ = °-90%
Коэффициенты вариации вычисляем по формуле (4);
г 0,018-100 „
^ = ~w=°’56%’
0,018-100
У4 = --------= 0,40%.
4 4,43
2;00
1??
Видно, что коэффициент вариации уменьшается с увеличением
процентного содержания никеля в стали.
Пример 3. При анализе стандартного образца, содержащего
1,47% Ag, получили следующие результаты, %: 1,31; 1,45, 1,42; 1,32;
1,30. Определить 5, е0,95 и сделать выводы о наличии систематиче-
ской ошибки в использованном методе определения серебра.
Решение. По формуле (1) находим среднее арифметическое
значение:
- 1,31 + 1,45 + 1,42+1,32+1,30
л =------------------------------= 1,36.
5
По формуле (2) вычисляем стандартное отклонение:
/ (0,05)2 + (0,09)2 + (0,06)2 + (0,04)2 + (0,0б)2~
~ ]/ 5—1 =
= 6,96-10-2.
По формуле (9) рассчитываем доверительный интервал значе-
ния Х-.
— S 6,96-10—2
X ± /а f~7= = 1,36 ±2,78—’ -----= 1,36±0,09.
17 у п у 5
/а,; = 2,78 принимаем по табл. 4 для а = 0,95 и [=5— 1=4. Истин-
ное значение содержания серебра не попадает в доверительный ин-
тервал. Следовательно, этот метод определения серебра имеет систе-
матическую ошибку.
Пример 4. Определить, существует ли значимое различие между
выборочной средней величиной при определении процентного содер-
жания серы в каменном угле: 2,10', 2,12; 2,13; 2,15; 2,15 и средней
генеральной совокупности (для /1 = 80) р = 2,15%.
Решение. Среднее выборочное значение вычисляем по форму-
ле (1):
- 2,10 + 2,12 + 2,13 + 2,15 + 2,15 „
Ji =---------------------------------= 2,10.
5
Стандартное отклонение отдельного определения вычисляем по
формуле (2):
/ 0,032 + 0,012 + 0,002 + 0,022 + 0,022
5=1/ -----------------— --------!----2—:----= 2,12-10-2.
\/ 5-1
По формуле (11) находим значение величины 1:
z (2,15-2,13)/5 __
2,12-10-2 ’ •
Из таблицы значений коэффициента Стьюдента (см. табл. 4, при-
ложения) для п=4 и а = 0,95 /ау=2,78, что больше рассчитанного
по формуле (11). Следовательно, средняя величина X не отличается
значимо от средней р генеральной совокупности.
Пример 5. При определении ванадия кинетическим методом
были получены результаты: 8,0-10-4 мкг; 8,4 10“4 мкг Чему равна
200
точность анализа еа и А? Сколько параллельных определений необ-
ходимо провести для достижения относительной точности 5°/о? Оп-
равдано ли будет применение этого способа для достижения такой
точности?
Решение. По формуле (1) находим среднее арифметическое
значение:
8,0-10-4 -f- 8,4- Ю -’
X =---------------------= 8,2-10-4.
Стандартное отклонение единичного результата вычисляем по
формуле (2):
/(0,2-10-4)2 + (0,2-10-4)2
11------------------— = 0,283-10-4.
По табл. 4 приложения находим для а = 0,95 и (= 1 ta у = 12,7
и по формуле (8) вычисляем точность анализа:
0,233-10-4
еа= 12,7- ----= 2,54-10-4.
В относительных единицах точность составляет
2,54-10-4-100
А =---------------= 30,98% .
8,2-10-4
Если необходимо получить Д=5%, то
_ 5-8,2-10-4
' ” =0,41-10-4
100
По формуле (11)
0,41-10-4
или |Х — = 0,41 • 10-4.
t — —---------1/ п - -
0,283-10-4
1 ,45 Vп.
Если принять п = 4, то / = 2,90, а
=4-1=3/, "
по табл. 4 для а = 0,95 и ( =
= 3,18, что не обеспечивает точность 5% с вероятно-
стью а = 0,95. Если п = 5, то /=1,45 5=3,24. По табл. 4 для а =
= 0,95 и (=5—1 = 4 ta f = 2,78, что меньше рассчитанного /=3,24.
Следовательно, при п=5 величина / = 3,24 дает большую вероят-
ность, чем 0,95. Таким
ности 5% необходимо
то можно считать, что
пия точности 5,00%.
образом, для достижения относительной точ-
провести 5 анализов. Так как п<8 (п = 5),
данный метод вполне оправдан для достиже-
Задачи
781. При определении кальция весовым методом полу-
чили следующие результаты СаО, %: 12,86; 12,90; 12,93;
12,84. Вычислить стандартное отклонение в определении
содержания кальция.
201
782. В серебряной монете при анализе параллельных
проб получили следующее содержание серебра, %:
90,04; 90,12; 89,92; 89,94; 90,08; 90,02. Вычислить стан-
дартное отклонение единичного определения и довери-
тельный интервал среднего значения (для а=0,95).
783. При определении сурьмы в сплаве объемным ме-
тодом получили следующие данные, %: 11,95 12,03; 11,98;
12,04. Вычислить стандартное отклонение единичного
определения и доверительный интервал среднего значе-
ния (для а=0,95).
784. При фотометрическом определении меди в рас-
творе получили следующие данные (г/л): 5,1 -10“3;
5,5-10-3; 5,4-10-3; 5,8-10“3; 5,2-10“3. Вычислить стандарт-
ное отклонение единичного определения и доверительный
интервал среднего значения (для а=0,95).
785. При фотометрическом определении висмута по-
лучили следующие значения концентраций (моль/л):
8,35-10—5; 8,00-10-5; 8,50 10~5; 8,45 -IO"5; 8,05-10~5;
7,90-10—5; 8,17-IQ—5. Вычислить стандартное отклонение
и доверительный интервал среднего значения (для а=
=0,95).
786. При определении содержания марганца в почве
получили следующие результаты, %: 5,3-10“2, 5,9-10“2,
7,3-10“2, 12,0-10“2, 6,9-10-2, 4,3-10-2, 3,8-10“2, 6,3-10“2,
10,0-10—2, 4,8-10“2. Вычислить стандартное отклонение и
доверительный интервал среднего значения (для а =
=0,9,5).
787. При определении нормальности перманганата
калия тремя студентами получены следующие результа-
ты (г-экв/л):
I студент 0,1013; 0,1012; 0,1012; 0,1014;
II студент 0,1015; 0,1012; 0,1012; 0,1013;
III студент 0,1013; 0,1015; 0,1015; 0,1013.
Вычислить стандартное отклонение единичного опре-
деления и доверительный интервал среднего значения
(для а=0,95).
788. При анализе почв на содержание цинка в пяти
пробах одного образца получили следующие результа-
ты, %: 1) 8,5-10“3; 9,2-10“3; 2) 10,4-10“3; 10,9-10“3;
3) 7,2-10—3; 7,3-10-3; 4) 9,4-10“3; 8,9-10“3; 5) 7,3-10“3;
6,7- 10“3.
Вычислить стандартное отклонение в определении со-
держания цинка (дляа=0,95).
202
789. Содержание марганца в четырех образцах фер-
ромарганца по результатам анализов составляет, %:
1) 21,34; 21,32; 21,31; 21,35; 2) 34,45; 34,41; 34,42; 34,43;
3) 50,17; 50,14; 50,13; 50,16; 4) 65,57; 65,56; 65,59; 65,60.
Вычислить стандартное отклонение в определении со-
держания марганца.
790. При анализе топаза получили следующие данные
о содержании в нем AI2O3, %: 53,96; 54,15; 54,05; 54,03;
54,32. Установить, является ли последний результат гру-
бой ошибкой?
791. При анализе апатита получили следующие дан-
ные о содержании в нем РйОд, %: 35,11; 35,14; 35,18;
35,21; 35,42. Установить, является ли последний резуль-
тат грубой ошибкой?
792. При определении сульфат-иона весовым методом
получили следующие данные о содержании SO3, %:
15,51; 15,45; 15,48; 15,53; 16,21. Определить, является ли
последний результат грубой ошибкой?
793. При исследовании раствора получили следующие
значения pH: 5,48; 5,45; 5,30; 5,55. Определить, является
ли значение pH 5,30 грубой ошибкой?
794. Имеется ли систематическая ошибка в определе-
нии платины новым методом, если при анализе стандарт-
ного образца платиновой руды, содержащего 85,97% Pt,
были получены следующие результаты Pt, %: 85,97,
85,71, 85,84, 85,79.
795. При титровании 0,1285 н. стандартного раствора
серной кислоты раствором едкого натра получили следу-
ющие значения нормальности (г-экв/л): 0,1274; 0,1278;
0,1280; 0,1275. Определить, имеется ли систематическая
ошибка в определении норма-льности серной кислоты.
796. При определении цинка методом амперометриче-
ского титрования два студента при титровании одной
пробы получили следующие значения Zn, мг: 1) 15,10;
15,05; 14,97; 2) 14,00; 13,50; 13,00 при истинном значении
15,00 мг цинка. Имеется ли систематическая ошибка в
полученных результатах?
797. При контрольном определении хрома по методу
трех эталонов в стандартном образце стали, содержащем
15,10% Сг, на двух фотопластинках получили следующее
содержание Сг, %: 1) 13,50; 14,00; 14,50; 2) 17,00; 16,00;
18,20. Найти, имеется ли систематическая ошибка в оп-
ределении содержания хрома.
203
798. Содержание активного хлора в хлорной извести
составляет, %: 37,11; 37,18; 37,23; 37,15. Значение сред-
ней генеральной совокупности (га=50) 37,02. Устано-
вить, существует ли значимое различие между выбороч-
ной средней и средней генеральной совокупности.
799. Содержание азота в аммиачной селитре равно
34,90%. При анализе этой селитры получили следующие
результаты параллельных определений, %: 34,52; 34,72;
34,68; 34,64. Установить, существует ли значимое разли-
чие между выборочной средней и средней генеральной
совокупности.
800. При определении содержания сульфида сурьмы
в различных образцах сурьмяного блеска получили сле-
дующие результаты, %: 1) 54,28; 54,52; 54,41; 54,35;
2) 67,59; 67,46; 67,66; 67,45; 3) 84,14; 83,93; 84,11; 83,98.
Вычислить S для отдельного измерения и установить,
как зависит коэффициент вариации от содержания опре-
деляемого компонента.
801. Найти число параллельных проб, необходимое
для определения олова в баббите с точностью 3%, если
известно, что при анализе двух проб получили содержа-
ние олова 9,87 и 10,01 %.
802. Содержание молибдена в почве по результатам
трех параллельных определений составляет, %:
6,8-10 4; 7,0-10~4; 7,2-10-4. Какова точность метода и оп-
равдано ли применение этого способа анализа для дости-
жения точности 3%?
803. При определении марганца в стали получили
48,35 и 48,00%. Определить количество параллельных
проб, необходимое для определения марганца с точно-
стью ± 1 %.
804. При определении цинка в почве получили Zn, %:
8,5• 10—3; 10,4-10-3, 7,9-10 3. Найти количество парал-
лельных проб, необходимое для определения цинка с
точностью ±10%.
ОТВЕТЫ К ЗАДАЧАМ
Глава I
1. I) 1 и 2,88; 2) —0,14 и 2,92; 3) 0,72 и 2,85. 2. 1) [Н+] =
= [НСОО-] = 2,24-10~3; pH 2,65; 2) [Н+]=4НСОС±] = 1,39-10±
pH 1,86. 3. 1) [ОН ] = 9,80-10-5; [11+] = 1,02 -10-10; pH 9,99;
2) [ОН-]= 1,70-10-°; [Н+] = 5,90-10-,0; pH 9,23. 4. —8,0. 5. -5,0.
6. -5,5. 7. [Н+] = 6,53-10-"; pH 2,18. 8. [Н+]=0,2108; [HSO^] =
204
= 0,1892; [SO^“] = 0,0108; 9. [H+] = 6,34-Ю"4; [Sal2-] = 2,24 10““.
10. [H+]=[HSOr] =5,04-10-2; [SO|~] =6,20-10-». 11. [H+]=
= 2,40-10-2; pH 1,62. 12. [HPO^“] = 6,20-10“»; [PO|~] =7,40-10-1’.
13.[H+]=[H2AsO^] = 2,17-IO-2; [HAsO^-]= 1,05-IO-7. 14. [AsO|“] =
= 1.43-10-17. 15. 1,35-10-‘ г-ион/л. 16. 3,6-10-4 г-ион/л. 17, 5,75*
X10~4 моль/л. 18. 6,55-10-» моль/л. 19. 0,161 моль/л. 20. 0,017 моль/л.
21, 0,19 моль/л. 22, /(= 1,71 • 10~5; а=1,3%. 23. 1,94-10"‘.
24. 1,80-10-*. 25. 2,0-10-». 26. 1,79-10“5. 27. 1,20- 10~3. 28. 9,80Х
ХЮ~7. 29. 1) 7,59; 2)3,80; 3) 4,75; 4) 2,29; 5) 5,18. 30. 1) 1.07Х
Х10-12 г-ион/л; 2) 1,60 10—13 г-ион/л; 3) 9,0-10—2 г-ион/л,
4) 1,58-10~4 г-ион/л; 5) 3,38-10-’ г-ион/л. 31. [СН3СОО_] =
= 1,09-10-4; а = 0,011%. 32. [НСОО~] = 1,9-10-»; а = 0,076%.
33. [NH + ] =5,57-10-»; а = 0,056%. 34. 0,019%. 35. 0,029%. 36. pH 2,73;
а = 0,94% и pH 4,42, а = 0,025%. 37. pH 2,21, а = 2,84% и pH 3,55;
а = 0,43%. 38. pH 1,75, а = 8,4% и pH 2,75, а=1,38%. 39. 1) 3,47%,
красный; 2) 95,1%, желтый. 40. 1) 92,6%, синий; 2) 0,8%, желтый.
41, 1) 0,02%, красный; 2) 92,1%, желтый. 42. 1) 99,4%, малиновый;
2) 95,6%, малиновый. 43. 1) 91,9%, синий; 2) 98,4%, синий. 44. 4,20.
45. [Н+]=5,75-10-5; [ОН—] = 1,74 —10—10; pH 4,24, 46. 4,76. 47. [Н+]=
= 1,12-10-4; [ОН-] = 8,91-10-И; pH 3,95. 48. 3, 45. 49.1) 6,91;
2) 10,62; 3) 4,09; 4) 2,82; 5) 10,44; 6) 1,64; 7) 12,98; 8) 6,73. 50. 2,67.
51. 6,27. 52. 1) 2,19; 2) 5,42. 53. 8,45 мл. 5А 27,7 мл. 55. 0,13 г.
56. 0,76 г. 57. 10 мл. 58. 5,3 г. 59. 5,8 г. 60. 28 мл. 61. 17,7 мл.
62. 1,53 г. 63. 2,2 г. 64.0,6 г. 65.7,6 мл. *6. 117,8 мл. 67.23,4 мл.
68. 3,1 г. 69. 0,71 г. 70. 5,3 г. 71. 0,47 г. 72. 14,3 мл. 73. 1,47 г.
74. 9,0 мл. 75. 6,6 мл. 76. 0,82 г. 77. 0,70 г. 78. 22,8 г. 19. 70 мл.
80. 15,1 мл. 81. 16,9 мл.
Глава II
82. pH 8,88, Л = 7,6-10-з%. 83. pH 10,95, А = 1,8%. 84. pH 8,46;
Л = 6,8-10-4%. 85. pH 11,50, h = 6,6%, 8". pH 11,51, h = 6,42%;
pH 11,16. 87. pH 8,48; h = 6,1 • 10-3%; рн 7,98. 8% pH 8,37; h =
= 2,35-10-3%. 89. pH 11,25; h = 0,9%, 90. pH 8,48; A = 6,1-10-3%,
Fl. 0,78 r. 92. 0,78 r; A = 88%. 93. 0,067 r; h = 0,96-10-2%.
94. 6,5-10-2 r. 95. pH 12,7; A=1,11 • 10-?%. 96. pH 13,0; h =
= 2,08-10-2%.97. 1) 6,27; 2) 14,87; 3)4,57; 4) 11,63; 5) 13,89; 6) 13,22;
7) 10,16; 8) 12,84. 98. 5,0-10-n. 99. 5,010-4. 109. 1) pH 11,65, си-
ний; 2) pH 8,89, красный; 3) pH 8,37, синий; 4) pH 12,54, красный.
101. pH 5,13, A=7,45-Ю-з%; pH 5,63, Л=2,36-10-2%. Ю2. pH 5,32,
A=1,2-10-2%. ЮЗ. pH 3,99, A=1,02%. 104. pH5,84, A=1,45-10-3%.
105. 1) pH 5,70, A = 1,58-10-2%; 2) pH 5,80, A = 1,58-10—2%;
3) pH 6,05, A = 8,9-10-3%; 4) pH4,0, A = 0,1 %; 5) pH 1,77, A =
= 33,8%; 6) pH 2,72, A=9,5%; 7) pH 2,77, A = 5,6%; 8) pH 2,05,
A = 89%; 9) pH 5,57, A = 5,44-10 ' ; 10) pH 3,33, A = 2,34%; 11) pH
1,74, A=91,5%; 12) pH 5,22, A=6,02-10-2%; 13) pH 2,34, A=23,0%,
106. 0,23 r. 107. 0,011 моль/л. 103.5,7-10-4%. Ю9. 1) 3,60; 2) 7,83;
3) 0,04: 4) 5,00; 5) 4,60; 6) 7,11; 7) 7,56. ПО. 1) pH 2,35, красный;
2) pH 4,05, желтый; 3) pH 5,12, оранжевый. 111. 1) pH 8,78; A =
= 87,5%; 2) pH 11,07, A=98,5%; 3) pH 7,00, A=5,7%; 4) pH 10,81,
A = 97,4%; 5) pH 9,31, A = 53,6%; 6) pH 11,82, A = 99,2%; 7) pH
10,39, A = 93,3%; 8) pH 9,23, A = 49,0%; 9) pH 8,27, A = 9,6%;
205
10) pH 6,21, Л = 9,2-10-2%; 11) pH 6,35, А = 1,28%; 12) pH 9,49;
А = 31,6%. 112. 6,2.10-ю. ИЗ. 1,8-10—4 114. 1) pH 6,21, синий;
2) pH 7,0, желтый, 3) pH 7,21, желтый. 115. 1) 9,80; 2) 2,76; 3) 8,34.
4) 5,47; 5) 4,60; 6) 4,67; 7) 9,94; 8) 9,26; 9) 4,25; 10) 4,67; 11) 4,48;
12) 4,47; 13) 8,04; 14) 6,11; 15) 2,08; 16) 8,31. 115. 1)9,80; 2)4,67;
3) 8,04; 4) 4,67; 5) 2,33; 6) 8,61; 7) 3,95; 8) 5,58; 9) 3,71; 10) 2,08;
II) 8,04; 12) 4,26; 13) 7,30; 14) 4,08; 15) 7,13; 16) 7,69; 17) 3,71;
117. 1) pH 4,60, синий; 2) pH 8,34, синий; 3) pH 4,67, синий; 4) pH
2,76, желтый.
Глава Ill
118. 1) 1,1-10-12; 2) 5,5-10-5; 3) 3-10—H;J4) 2,8-10-9; 5) 12,6-10-7;
6) 4,0-10-n; 7) 4,8-10-15; 8) 3,0-10-23. 0ig. ]) 2,2-10-4|г/100 мл;
2) 1,46-Ю-з г/100 мл; 3) 1,74-10-5 г/100 мл; 4)’1,48-10—4 г/100 мл;
5) 2,6-10—8 г/100 мл; 6) 7,50-10-5 г/100 мл; 7),6,02-10-2 г/100 мл;
8) 9,82-10-2 г/100 мл; 9)0,16 г/100 мл; 10)18,7-10-5 г/100 'мл;
11) 6,2-10-в г/100 мл; 12) 0,132 г/100 мл; 13) 4,94-10-3 г/100 мл;
14) 1,61-10-2 г/100 мл; 15) 8,16-Ю-з г/100 мл. 120. I) ВаСО3 в 6,9
раза; 2) Ва2Ве(СМ)6в 256 раз; 3) Саз(РО4)2 в 2,2-105 ра3; 4) РЬВг2
в 5,4-105 раз; 5) SrCrO4 в 550 раз; 6) Cd (CN)2 в 34 раза; 7) Са (Ю3)2
в 140 раз; 8) FeC2O4 в 2,6 раза; 9) CaSO4 в 290 раз; 10) Ni (Ю3)2
в 517 раз. 121. 1) 1,3-10-5 моль/л; 2) 1,78-10—8 моль/л; 3) 4,8-10—5
моль/л; 4) 2,3-10—7 моль/л; 5) 3,2-10—6 моль/л; 6) 5,6-10—4 моль/л;
7) 6,8 10—7 моль/л; 8) 1,8 -10—9 моль/л; 9) 7,3-10—4 моль/л; 10) 3,0-10—7
моль/л; II) 1,5-10—7 моль/л. 122. 5,6-10—9 г-иогы 12-3. 6,0-10—6
г-ион РЬ2+. 124. 4.7-10-9-МГ. 125. 30 МД. 12бГ75 1ДгГ"^г-ион7л"
127. 0,25 г/л. 128. 1) 1,76-10—7, выпадет; 2) 3,0 1 В"4-1не выпадет1.
1'29. /,6 10—12, не произойдет. 120. 1,5-10—7, образуется. 131. 8,3 г,
132. 0,24 г-ион/л. 133. 1,8-10-13 г-ион/л. 134.6,7. 135. 1,2-10—5
осаждается. 136. [С1—] = 9,514-10—6. 137. AgCl. 138. 1,0-10-2 моля
К2СгО4; [Ва2+] = 3,33-10—7. 139. РЬСгО4, нельзя. 140. Нельз*.
141. РЬСгО4. 142. 1) 9,1-.10—4 г-ион/л; 2) [Са2+] =0,01. 143. Больше
0,2081 г-ион/л. 144. 6,48-10—2 г-ион/л. 145. 37,7 мг. 146. 1092 мг.
147. 1213 мг. 148. [СгО4—]=0,29; [СО|“] = 1,21. 149. [F—] = 0,44.
[СО|-] = 1,28. 150. 65,5 мг. 151. 4,28-10-5 мг. 152. 41,2 мг.
153. 5,2-10-5 мг. 154. 0,14. 155. 1) 2,64; 2) 0,39; 3) 1,70.
156. 1) 2,29; 2) 0,90; 3) 6,14. 157. 5,0-10-28, Не прои-
зойдет. 158. 1,81-10—78, выпадет. 159. 7,46-10—>8, выпадет.
160.2,6-10-23, не выпадет. 161.7,22-10-20, не выпадет. 162.1,49-10—18,
выпадет. 163. 7,46-10—18, не выпадет. 164. 2,26-10—13, не выпадет.
165. 5,16-IO-’2, выпадет. 166. 1,07-10—14, выпадет. 167. 0,016 мг.
168. 483 мг. 16ft 1,43-10-5 мг. 17ft 7,27-10~4 мг. 171. 6, 36-10~з мг.
172. 1) 4,52-10-4 моль/л; 2) 1,86-10-6 моль/л; 3) 0,91 моль/л;
4) 3,35-10—9 моль/л; 5) 2,68-10—3 моль/л; 6) 8,29-10—8 моль/л;
7) 1,64-Ю-з моль/л; 8) 0,254 моль/л; 9) 1,47-10—4 моль/л; 10) 8,7-10—3
моль/л. 173. 1) 1,00 • 10—6 моль/л; 2) 7,94-10—6 моль/л. 174. 0,18 моль/л.
175. 1) pH 2,2, [Cd2+]= 3,85-10-П; 2) pH 1,24, [Bi3+] = 1,2-10—9;
3) pH 0,41, [Си2+] = 7,45-10-16; 4) pH 6,39, [Cu2+] = 1,26-10-27;
5) pH -1,11, [Си2+] = 8,0-10-13; 6) pH 0,41, [Cd2+] = 9,3-10-7;
7) pH 1,90, [Си2 + ] = 7,9-10-19; 8) pH 1,24, [Cu2+] = 1,6-10-17;
9) pH 6,60. [Cd2+] = 9,45-10-19; 10) pH 2,44, [Cd2+] = 7,9-10-П.
176. 1) 11,03; 2) 8,38; 3) 9,20; 4) 7,55; 5) 9,55; 6) 7,45; 7) 2,82;
8) 9,20; 9) 4,12; 10) 9,86; 11) 9,20; 12) 5,12. 177. 1) HP 9, 68-10-19;
206
pH 7,05; 2) ПР 2,31-10-49, pH 7,07; 3) ПР 8, 73-10-42, рн 7,33;
4) ПР 6,3-10-8, pH 7,33; 5) ПР 2,01 -10—И, pH 8,11; 6) ПР 9,73-10-6,
pH 9,91; 7) ПР 2,38-10-54, pH 7,00; 8) ПР 9,6-10— is, pH 8,17;
9) ПР5,25-10—12, pH 9,0; 10) ПР 1,02-10-15, pH 8,93; 11) ПР 1,5-10-9,
pH 7,24; 12) ПР6,9-10-61; pH 7,00. 178. 1) а) pH 6,33; б) pH 2,7.
2) а) pH 1,74; б) pH 1,50. 179. 1) а) 7,9-10—35. не образуется;
б) 5-10—24, не образуется. 2) а) 1,55-10—36, образуется; б) 4,92-10—25,
образуется.
Глава IV
180. 1) [Cd2+] = 1,10-10-2; 2) [Cd2+] = 7,88-10-5. 181. 1) [Ag+]=
1,52-10-7; 2) [Ag+]=8,98-10-9. 182. [Ag+]=2,30-10-8. 183. [Hg2+] =
= 5,78-10-27. 184. [Cd2+] = 7,68-10-9. 185. [Ni2+] = 2,62-10-8.
186. [Cu2+] = 5,83-10-15 187. [Hg2+] = 2,66-10-14. 188. [Cu2+] =
= 1,20-10-22. 159. [Cd2+]=5,98-10-18, [CN-]=0,412, Cd(CN)^“] =
.= 2,22-10-2. 190. [Co2+] = 8,51-10-7. 191. [Fe2+ = 5,78-10-5.
192. [Ag+]=6,07-10-и, [Cl-]=3,71-10-2, [NH3]=5,63. [Ag(NH3)]^=
= 3,71-10-2. 193. 1,054 моля. 194. 7,40-10-4 моля. 195. 7,1274 г.
196.4,62 мл. 197. [NOf [ = 0,2, [CN-] = 0,2, [Ag+] = 3,52-10-22.
[Ag(CN)f]=0,l. 198. 1,0710 r. 199. [HgCl^~] = 1,74-10-12,[Hg^+] =
= 1,48-10-27. [HgI2“]=0,l, [1-]=0,l, [Cl-] = 0,l. 200. 125,3 мл,
[F-]=3,12-10—2. 201. 5,271-Ю-злиоль/л. 202. 0,1006 г. 203. 56,84мг.
204. 0,99 мл. 205. Не растворится. 206. Не растворится. 207. 0,5 моль/л.
208.1,37 мл. 209. 9,62- 10—4 моль/л. 210. 4,52-10—5 моль/л. 211.10 моль/л.
212. 4,20-10—2 моль/л. 213. 3,34-10—2 моль/л. 214. 4,88 моль, [I-] =
4,58. 215. 0,1 моль/л. 216. 0,16 моль/л. 217. 0,0106г. 218. 6,296 г/л AgCl,
7,839-10-3 г/л Agl, разделение будет достигнуто. 219. Образуется.
220. Выпадает. 221. Осаждается CdS. 222. Образуется. 223. Не обра-
зуется. 224. Не образуется. 225. Образуется. 226. [Вг—] = 9,22-10—5.
227. 0,79 мл. 228. 0,344 моль/л. 229. 0,1 моль/л. 230. 0,463 моль/л.
231. 0,05 моль/л. 232. 0,3 моль/л. 233. 0,220 моль/л. 234. 0,1 моль/л.
235. 0,404 моль/л. 236. 0,1 моль/л. 237. 0,4 моль/л. 238. 0,104 моль/л.
239. 0,05 моль/л. 240. 0,6 моль/л. 241. [Hg2+]=2,05-10-13, [HgCl+] =
= 1,21-10-7, [HgCl2]=0,0391, [HgCl^] =0,0294, [HgCl2“] = 0,0315,
[Cl-]=0,107. 242. [Hg2+]=4,97-10-25, [Hgl+]=3,11 10—14, [Hgl2] =
= 1,59-10-4, [Hgl-] = 0,0211, [Hgl^J = 0,0788, [[-] = 0,022.
243. [Cd2+] = 1,70-10-7, [Cdl+] = 2,62-10-5, [Cd I2] = 9,22-10-4,
[Cdi“] = 0,00894 [Cdl2“] = 0,09096, [1-] = 0,807. 244. [Ag+] =
= 1,11-10—3, [AgNO2] = 9,46-10-3, [Ag(NO2)2-] = 9,43-10-3,
NO2’]= 0,112. 245. [Ag+] = 3,05-10-4, [AgNH3+] = 1,92-10-3,
Ag(NH3)+] = 0,Ы?8/- [NH3] = 0,003. 246. [Mg2+] = 1,62-10-4,
MgC2O4] = 6,10-10-3, [Mg (C2O4)2-] = 4,37-10-2, [C2O4-] =0,106.
247. [Ag+]=7,96-10-14,[AgS2O^] =8,27-10-6,[Ag(S2O3)|~] =0,0565,
[Ag(S2O3)f~] =0,0435, [S2O2-] =0,157. 248. [Fe2+] = 0,00620,
[FeCI+] = 0,02898, [FeCI-.] = 6,06481, [Cl-] = 2,04,
• 207
Глава V
249. 1) 1,42 В, 2) 1,23 В, 3) 1,05 В, 4) 0,90 В, 5) 1,48 В, 6) 1,51 В,
7) 1,26 В. 250. 1,29 В. 251. 0,73 В. 252. 0,12 В. 253. 1) —0,25 В,
2) -0,71 В, 3) 0,125 В, 4) -0,254 В, 5) 0,576 В. 254. -0,065 В.
255. Первая. 256. —0,55 В. 257. —0,385 В. 258. —0,659 В. 259. 0,358В .
260. 0,235 В. 261. 0,577 В. 262. -0,754 В. 263. -0,124 В. 264. -0,274В.
265. -0,615 В. 266. -0,519 В. 267. -0,406 В. 268. -0,122 В.
269. —0,534 В. 270. -0,676 В. 271. —0,328 В. 272. —0,293 В.
273. -0,334 В. 274. -0,293 В. 275. —0,531 В. 276. I) 1,158 В,
2) 2,396 В, 3) 0,71 В, 4) 0,244 В, 5) 0,896 В, 6) 0,35 В, 7) 0,69 В,
8) 0,36 В. 277. 1) 4,6-1015, 2) 4,0-10-16 , 3) 4,5-1013, 4) 1,1-1061,
5) 1,5-10-58, 6) 2,4-10-13, 7) 1,9-1098, 8) 1,4-1082, 9) 4,9-10-ю,
10) 2,6-1021. 278. [МпО^] = 0,04, [Мп2+] = 0,01, [ЕеЗ+] = 0,05,
[Fe2+] = 6,85-10-15. 279. [Н2О2] = 2,07-10-15, [[-] = 4,14-10-15,
[12]=0,1. 280. [S2—]= 1,28-10-52, [NO^]=2,98. 281.0,1030 г Сг(ОН)3,
[HOf] = 5,10-10-36. 282. [Fe2+] = 0,1, [Fe3+] = 1,41-10-3, [[-] =
= 1,41-Ю-з, [12] = 0,05. 283. [Сгз+] = 9,78-10-12, [CrjO^] = 0,1,
[Н2О2] = 1,47-10-и. 284. [Мп2+] = 5,0-10-27, ГМпО^“]=0,2,
[В13+] = 0,5.
Глаза VI
286. 1) а = 0,09, pH 2,05; 2) а = 1,0, pH 3,02; 3) <ц = 1,0,
а2 = 0,22, pH 0,61; 4) а = 0,268, pH 1,61; 5)а = 0,138,
pH 2,87, 6) а = 0,0441, pH 2,88; 7) а =1-10-3, pH 4,0.
287. 1) 6,89; 2) 6,85; 3) 6,84; 4) 6,85; 5) 6,87; 6) 6,84; 7) 6,85.
288. 1) а = 0,0170, pH 2,77; 2) а = 0,0186, pH 2,77; 3) а =
= 0,0174, pH 2,76; 4)а = 0,0191, pH 2,72; 5)а = 0,0186,
pH 2,73; 6)а = 0,0191, pH 2,72; 7)а = 0,0186, pH 2,73. 28<\
1) 4,54; 2) 4,44; 3) 4,46. 2 0. 1) 9,46 ; 2) 9,56; 3) 9,54.
291. 3,74. 292. 10,26. 2'3. 0,136 моль/л. 2)4. 1) 2,85-10-5 моль/л;
2) 4,4-10—5 моль/л; 3) 2,85-10—5 моль/л; 4) 4,5-10—5 моль/л;
5) 9,5-10—9 моль/л; 6) 9,9-10—9 моль/л. 295. 1) 1,3-10—2 моль/л;
2) 9,1-10—3 моль/л. 296. 2,0-10—6 моль/л.
Глава VII
297. 1) 0,2 дел, 2) 0,0 пел, 3) 0,5 дел. 298. 0,0, 0,5 дел. шкалы.
299. 1) 0,1 мг/дел; 2) 0,1 мг/дел; 3) 0,1 мг/дел; 4) 0,1 дел;
5) — 0,2 мг; 6) —0,3 мг. 300. 0,25 мг. 301. 5,3270 г.302.
1) 31,7161 г; 2) 32,3187 г; 3) 17,0782 г; 4) 1,6244 г; 5) 0,8323 г.
303. 1) 0,3387; 2) 0,5884; 3) 0,5293; 4) 0,5203; 5) 0,7352; 6) 0,5603;
7) 1,8437; 8) 0,8998; 9) 1,9026; 10) 0,8806- И) 0,7536; 12) 0,9666;
13) 0,0631; 14) 0,6540; 15) 0,1938; 16) 0,8084; 17) 0,9206;
18) 0,0378; 19) 0,4488; 20) 0,3622. 304. 0,1746. 305. 0,2997.
306. 0,2236. 397. 0,4030. 303. 0,2940. 309. 1,8047. 310. 0,0161.
311. 0,14 г. 312. 0,14 г. 313. 0,97 г. 314. 0,96 г. 315. 0,12 г.
316. 0,53 г; 1,05 г. 317. 0,47 г. 318. 2,8 г. 319. 0,32 г. 320. 0,74 г.
321. 37,0 мл. 322. 1,3 мл. 323. 5,5 мл. 324. 5,8 мл. 325. 24,9 мл.
326. 0,37 мл. 327. 126,5 мл. 328. 14,7 мл. 329. 11,5 мл. 330. 6,4 мл.
331. 5,0 мл.
2,00-10-3%.
8,108-10—7 г;
332. 0,15 мл. 333. 14,0 мл. 334. 1,213-10-5 г;
335. 1,049-10-5 моль/л; 1,100-10-8 моль/л. 336.
8,108-10-4%. 337. 1,734-Ю-з г; 0,58%. 338. 0,32%.
208 •
339. 2,61910-7 г. 340. 16,2 мл. 341. 0,92 мл. 342. 6,8? мл.
343. 6,71 10-5%. 344. 37,78% S; 41,08% S. 345.98,98%.
346/5,80%. 347. 53,02%. 348. 5,08%. 349. 19,99%КС1; 12,63%
К2О. 350. 20,66%; 24,16%. 351. 80,79% ЗСа,(PO4)oCaF-; 34,11%
Р2О5. 352. 0,0223 г. 353. 47,52% СаО; 45,95% Р%ОЧ п 50,24%
СаО; 48,58% Р2О5. 354. 2,94% Р0; 66,6% Zn; 4,98% Sn- 355.
0,31% Р; 3,07% Ni. 356. 1,44% Si; 5,65% W. 357. 3,93% Al;
0,90% Si. 358. 24,89% FeO; 96,32% FeS04-7H20. 359 1,32% Zn;
0,55% Mg; 0,88% Sn. 360. 49,04% S; 30,32% S. 361. 35,38% Co.
362. 87,50% Na2SO4; 1,52% NaCl и 98,29% Na2SO4; 1,71% NaCl.
363. 81,64%. 364. 85,36% NaCl; 88,53% NaCl. 365. 16,10% P2O5;
18,20°/oPo(%. 366. 94,59% MgO. 367. 30,50% Al2Oa. 368. 1,51 % FeO;
1,98% MgO; 50,30% CaO. 369. 77,12%. 370. 0,0619 r. 371.0,0516 r.
372. 3,22% H2O; 3,48% S; 3,59% S. 373. 1,11% A12O3; 58,52%
CaCO-4 33,95% MgCO3. 374. 36,81%. 375. 23,29% Ca3(PO4)2;
12,63% CaO. 376. 2,6. 377. 7,0. 378. 18,0, 379. 7,0. 380. 18.
381. 12,0. 382. 5,0. 383. 6,0. 384. 8,0. 385. 6. 386. 49,46%
ZnSO4 6,16% K2SO4. 387. 76,24% NaCl; 23,76% KC1. 388. 2,06%
Na2O; 3,95% K2O. 389. 22,49% Br; 52,85% AgBr. 390. 26,56% I2;
31,37% Nal. 391. 2,73% Na2O; 2,32% K2O. 392. 50,88% Na2SO4;
49,12% KoSO4. 393. 24,31% Ca: 59,09% Ba; 34,01% CaO. 394.
63,99% Sn; 1,71% Cd. 395. 93,10% Mg (NO3)2-6H,O; 6,90%
MgC19-6H2O. 396. 10,82% ZnS; 89,18% CoS. 397. 19,55% Ca;
14,40% Mg. 398. 31,24% Fe2O3; 68,76% Ab,03.
Гаага VIII
399. 0,4988 г-экв/л. 400. 0,1005 г-экв/л. 401. 0,2501 г-экв/л.
402 0,1039 r-экв л. 403. 0,5431 г-экв л. 404. 0,004943 г,мл. 405.
0,003992 г/мл. 406. 0,004615 г/мл. 407. 0,004087 г/мл. 408. 0,04906
г/мл. 409. 0,005005 г/мл 410. 0,004932 г/мл. 411. 0,003998 г/мл.
412. 0,0004474 г/мл. 413. 0,002313 г/мл. 414. А4НС1 = 0,1046; ГНС| =
— 0,003814; 7'НС|уСа0 = 0,002933. 415. A%[,so, = 0,09894; AlHjSOi =
— 0,04947; rH2S04/Ca0= 0,002774,- 416. 1) TNaaC0< = 0,005316;
^Na.coa = О.Ю03; T'NaJL0/HC1 = 0,03657; 2) /V^co, = OJJ500I;
TWos/HCi = 0,01823. 417. NH.iSOi = 0,09808; MH2SO1 = 0,0/901
rH2SO, = 0,004812; ^..SOJNaOH = 0,003923. 418. 1,003 г-экв/л.
A£9, -072306 г-экв/л; 0,008408_ г/м Л;/ 420. 60 мл. 421. 136 мл. 422.
8 мл/ '323ГТ7,9 мл. 424. 0,5000 г-экв/л. 425. 0,8160 г. 426.
0,1934 г-экв/л. 427. 0,1264 г-экв/л; 0,004607 г/мл. 428. 0,2120 г.
429. 0,4261 г. 430. 0,1188 г-экв/л. 431. 0,1039 г-экв/л; 0 ,004677г/мл.
432. 0,05993 г/мл. 433. 0,09600 г-экв/л. 434. jVhci = 0,09446;
ГНС1 = 0,003444; 7’HC|/Na0H = 0,003778. <15. MHjS0_ = 0,6214;
N ок = 0,6068. 43л 0,09787 г-экв/л. 437. 500 мл. 438. 0,1735 г.
439% 387 г. 440. 2,0. 442. 0,2%. 443. Нет. 444. 0,02%. 445.
0,2%. 446. 0,01%. 447. 0,015%. 448. Да. 449. 2%. 450. Нет.
451. Метиловый красный, метиловый оранжевый. 452. 85%. 453.
Фенолфталеин, тимолфталеин. 454. Да. 455. 36%, 456. 0,02%. 457.
0,1060 г. 458. 0,0824 г. 459. 0,0998 г. 460. 0,1311 г. 461. 99,71%.
462. 12,76%. 463, 95,87%. 464. 68,44 г/л. 465. 0,07317 г-экв/л.
466. 39,44% СаСО3; 60,56% ВаСО3. 467. 46,16% Na3CO3, 53,84%
К',СО.. 468. кон. 469. 88,59%. 470. 88,91% Na2CO3; 9,00%
NaHCO3. 471. 2,62%. 472 2,4 мг-экв/л. 473. 1,26 г НС1; 32,73 г
209
НаРО4. 474. 124,0 г H2SO4. 263,3 г Н3РО4. 475. 4% H2SO4; ?%
НаРО4. 476. 0,1419 г. 477. 0,2325 г. 478. 86,82%. 479. 1,218 г.
480. 0,1763г. 481. 21,48%. 482. 3,766 мг-экв/л, 483. 1) 2,02мг-экв/л;
2) 4,94 мг-экв/л; 3) 6,96 мг-экв/л. 484. 45 мл. 485. 20%. 486.
5,86 мл. 487. 40,15% SrCO3; 59,85% Li2CO3. 488. 54,77% Na2CO3X
Х10Н2О; 45,23% NaHCO3. 489. 66,52%. 490.27,47%. 491.0,5850
г-экв/л. 492. 33 мл. 493. 11,0%. 494. 12,65%, 495. 5,0 г. 496.
10 мл. 497. 0,42%. 498. 0,25%. 499. 2-10-3 г/мл. 500. 0,0457 г.
501. 0,0991 г-экв/л. 502. 1,4 мл. 503. 35,2 мл. 504. 2,56%. 505.
86,61%. 506. 99,14%. 597. 95,05%. 508. 16,94%. 509. 5,30%.
510. 0,0459 г. 511, 89,67%, t 514. У = 0,04908 г-экв/л; Т =
0,008341 г/мл. 5Г5. 0,1091 г-экв/л. 516. 0,05005 г-экв/л. 517. 7,017 г.
518. У = 0,04264 г-экв/л; /< = 0,8528; Т = 0,01196 г/мл. 519.
0,09310 г-экв/л. 520. 0,08983 г-экв/л. 521. N =0,08954 г-эке^л;
7’ = 0,006816 г/мл. 522. N = 0,1001 г-экв/л. /<=1,1001; Т =
= 0,01624 г/мл. 523. N = 0,1075 г-экв/л; Т = 0,02001 г/мл. 524.
2,14 г. 525. 0,9319 г. 526. 2,6616 г. 527. 0,7729 г. 528. 263,88 г.
529. 437,61 г. 539. 66,57 г. 531. 422,2 мг. 532. 0,3178 г. 533.
1,826 г. 534. 0,9958 г. 535. 0,1714 г. 536. 0,87 г. 537 . 0,3129 г.
538. 1,4 г. 539. 10,46 мл. 540. 20,22 мл. 541. 23,51 мл. 542.
34,00 мл. 543. 12,55 мл. 544. 2,836 г/л. 545. 9,829 г/л. 546. 60,53%.
547. 59,08% 548. 29,08%. 549. 67,88%. 550. 93,25%. 551. 84,01%.
552. 90,17%. 553. 97,55%. 554. 32,15%. 555. 5,00%. 556. 2,93%.
557. 9,79%. 553. 0,32%. 559. 16,32 г/л. 569. 8,00%. 561. 0,26 г.
562. 30,76%. 563. 33,43% СаСО3; 3,56% MgCO3 564. 20,04%.
56 х 29,98%. 566. 92,39%. 567. 47,52%. 568. 87,94%. 569. 65,38%.
570. 16,84%. 571. 14,40%. 572. 25,44%. 573. 73,42%. 574. 89,88%.
575. 0,2615 г. 576. 2,717 г. 577. 46,36%. 578. 83,42%. 579. 0,21%.
580. 90,93%. 581. 98,85%. 582. 128 мг. 583. W = 0,1198 г-экв/л;
Т = 0,01974 г/мл. 584. 0,0516 г. 585. 0,1488 моль/л. 586. 29,07 мг.
587.51,89%. 588. 26,93 г/л. 589. 18,64 г/л. 590. 97,4%. 591.
39,56%. 592. 19,90%, 593. 9,37%. 594. 94,70%. 597. 1) «0,01%;
2) <0,01%; 3) -7-10-2%! 598. 1) <0,01%; 2) <0,01%; 3) <0,01%.
599. 1) «0,01%; 2)—31,5%. 690. 23,7 г. 601. 1)6,20 г; 2) 2,9336 г.
602. 4,902 г. 603. 558,5 мл. 604. 26,85 мл. 675. 0,08656 г-экв/л;
0,002768 г/мл. 676. 0,3978 г-экв/л. 677. 0,590 г-экв/л. 6)8. 0,2518 г.
609. 300,0 мл. 610. 19,06 г. 611. 0,1517 г-экв/л. 612. 0,009385 г/мл.
613. 99,45%. 614. 35,30%. 615. 0,27 г. 616. 2,672 г. 617. 0,03532 г.
618. 28,61%. 619. 17,90мл. 620. 23,98мл. 621. 37,89%. 0,03161 г/мл.
622. 79,57%. 3 623. 74,20% Fe; 25,80% Fe2O3. 624.3,605%. 625.
Fe2O3. 626. 42,27%. 627. 25,67%. 628. 73,31%. 629. 0,5150 г.
63). 0,16 г. 631. 98,22%. 632. 6,87%. 633. 74,95%. 634. 0,7415 г.
635. 0,06843 г. 633. 1,17%. 637. 0,0001501 г/мл. 638. 3,90%.
639. 0,06161 г-экв/л. 649. 0,08749 г-экв/л. 641. 0,006338 г/мл.
642. 0,01382 г/мл. 643. 0,0159 г. 644. 0,0424 г-ион/л. 645. 0,0285 г.
646. 92,20%. 647. 0,09958 г-экв/л. 648. 3,59%. 649. 0,1257 моль/л.
650. 0,03576 моль/л. 651. = 0,03328 г-экв/л. ^кгСг,О, =
= 0,03858 г-экв/л. 652. 5,67%. 653. 0,03845 г. 654. V =
= 0,1413 г-1кв/л; Т = 0,01793 г/мл. 655. 0,005925 г/мл. 656. 0,2393 г.
657. 21,25 мл. 658. 5 мл. 659. 19,08%. 660. 98,28%. 661. 69,23%.
662. 24,07 мл. 663. 2,03%. 664. 48,03%. 665. 0,1303 г.
Глава IX
666. I. 1,23%; II. 0,21%; III. 0,23%. 667. 0,71 %. 668. 1,42%.
669. 0,93%. 670.2,57%. 671. 3,31 %. 672. 0,66%. 673. 2,51 %. 674.
210 ____
2,04%. 675. 1,70%. 676. 1,10%. 677. 7,08%. 678. 0,83%. 679. 0,36%.
680. 1,10%. 681. 1.0,18%; И. 0,25%; III. 0,56%; IV. 0,40%. V. 1,78%.
682. I. 6,92%; II. 7,67%; III. 10,96%; IV. 10,00%; V. 8,71%. 683. I.
3,16%; II. 3,63%; III. 3,98%; IV. 4,37%; V. 2,95%. 684. I. 3,75%;
II. 5,50%; III. 6,75%. 685. I. 10,00%; II. 14,40%; III. 16,25%. 686.
I. 20,0 мг/л; II. 48,0 мг/л; III. 64,0 мг/л.
Г лава X
687. I. 1,72 г/л; II. 0,93 г/л; III. 0,71 г/л; IV. 0,63 г/л. 688.
I. 1,07%, II. 1,00 %; III. 1,08%; IV. 1,01 %. 689. I. 0,50%; II. 0,49%;
III. 0,50%! IV. 0,51%. 690. I. 85,62%; II. 85,61%; III. 85,53%.
691. I. 5,52%; II. 5,46%. III. 5,54%. 692.1. 6,28%; II. 6,38%; III. 6,50%;
IV. 6,42%; 693. 4-10—5 г-ион/л. 694. 5,45-Ю-з г/л. 695. 3637. 696.
I. 0,33% Mn; 5,05% Сг; II. 0,51% Mn; 3,02% Cr; III. 0,38% Mn;
4,84% Cr; IV. 0,44% Mn; 4,24% Cr; V. 0,49% Mn; 3,63% Cr. 697.
I. 0,055 г V. 0,025 г Ti; II. 0,025г V; 0,040 г Ti; III. 0,045 г V;
0,085 г Ti; IV. 0,030 г V; 0,030 г Ti; V. 0,035 г V; 0,035 г Ti. 698.
I. 0,30 мг; II. 0,35 мг; III. 0,43мг; IV. 0,48 мг; V. 0,53 мг. 699. 1)0,15%;
2)1,45%; 3)2,60%; 4)3,80%; 5)1,15%; 6)6,20%; 7)0,90%;
8) 5,17%; 9) 0,30%; 10) 0,70%; 11) 1,20%; 12) 0,93%; 13) 1,33%;
14) 1,50%; 15) 3,15%; 16)2,05%; 17)2,70%; 18)4,80%; 19) 0,85%;
20) 0,28%. 700. 1) 83,7%; 2) 85,8%; 3) 82,2%; 4) 88,7%; 5) 85,0%;
6) 87,2%; 7) 85,4%; 8) 79,2%; 9) 83,7%; 10) 82,7%. 701. 1) 6,3%;
2)2,8%; 3)1,0%; 4) 7,5%; 5) 1,7%; 6) 10,4%; 7) 20,4%;
8) 23,8%; 9) 17,5%; 10) 9,8%; 11) 6,1%.
Глава XI
702. I. 64,5 мг/л; II. 96,8 мг/л; III. 21,5 мг/л; IV. 43,0 мг/л;
703. I. 0,41%; II. 0,44%; III. 0,30%; IV. 0,37%. 704. I. 400 мг/л;
II. 240 мг/л; III. 560 мг/л; IV- 432 мг/л. 705. I. 1,6 г/л; II. 3,0 г/л;
Щ. 2,2 г/л; IV- 1.0 г/л,
Глава XII
706. I. 3,8-10—3 мг/мл; II. 6,6-10-з мг/мл; III. 9,1 • 10-з мг/мл;
IV. 5,7-Ю-з мг/мл; V. 7,8-10-з Мг/мл. 707. 4,5%; II. 5,0%; III. 4,0%;
IV. 5.5%; V. 6,0%, 708. I, 0,75%; II. 0,50%; III. 1,00%; IV. 0,80%;
V. 1,25%, 709. I. 1,06-10-3%; П. 1,03.lO~s%; III, 1,04-10“!%;
IV. 1,08-10-!%; V, 1,00.10-!%,
Глава XIII
710. 1. 3,9-10—7 Г; П. 5,2-10—7 Г; III. 7,6-10-7 г. 711. 4,0-10—7 г;
И. 5,3-10—7 Г; III. 3,1-10-7 г; IV. 6,2-10—7 г; V. 7,1-10-7 г;
712. I. 4,2-10-7 г; II. 1,7-10-7 г; III. 3,7-10-7 г; iy. 6,3-10-7;
V. 2,6-.0—7 г. 713. I. 1,5 мкг/мл; II. 2,5Умкг/мл; III. 4,01 мкг/мл.
714. I. 5,2-10—6 мкг/мл. 11. 6,6-10-6 мкг/мл; III. 9,0-10-6 мкг/мл.
715. I. 3,4-10—з г-атом/л; II. 1,8-10—3 г-атом/л; III. 5,2-10-3 г-атом/л.
716. I. 0,022%; II. 0,024%; III. 0,026%. 717. I. 3,7 г/л; II. 4,3 г/л;
III. 5.1 г/л. 718. I. 0,52%; II. 0,55%; III. 0,51%.
211
Глава XIV
719. I. 1,2%; II. 0,8%; III. 0,5%. 720. I. 0,1045 г-экв/л; II.
0,0653 г-экв/л; III. 0,0445 г-экв/л. 721. I. 10,94%; II. 8,30%;
III. 6,08%. 722. I. 20 мин. II. 30 мин; III. 35 мин. 723. I. 0,5 A.
II. 0,3 A; III. 0,2 A. 724 I. Al; II. Cr; III. Bi.
Глава XV
725. I. 0,63 мг; II. 0,74 мг; III. 0,86 мг; IV. 0,99 мг; V. 1,11 мг;
726. I. 6,45 мг; II. 5,05 мг; III. 4,15 мг. 727. 1.0,170 мг;П. 0,196 мг;
III. 0,226 мг; IV. 0,253 мг; V. 0,282 мг. 728. I. 0,0933 г-экв/л;
II. 0,1244 г-экв/л; III. 0,1812 г-экв/л. 729. 1.4,5-10-3%; Ц. 4,0-10-3%;
III. 4,25-10-3%; IV. 4,04-10-3%; V. 3,95-10-3%. 730.1. 2,32-10-2%;
II. 1,52-10-2%; III. 9,2-10-3%. 731. I. 6,93-10-4 моль/л;
II. 4,76-10-4 моль/л; III. 3,67-10-4 моль/л. IV. 2,43-10—4 моль/л;
V. 1,55-10—4 моль/л. 732. I. 49 мкг; II. 69 мкг; III. 83 мкг; IV. 102 мкг;
V. 137 мкг.
Г лава XVI
733. I. 0,0064 моль/л; II. 0,034 моль/л; III. 0,066 моль/л;
IV. 0,112 моль/л; V. 0,190 моль/л. 734. I. 0,00098 г-экв/л;
II. 0,01036 г-экв/л;Ш. 0,0561 г-экв/л; IV. 0,0867г-экв/л;
V. 0,1420 г-экв/л. 735. I. 0,0280 г/л NaOH; 0,0281 г/л NH4OH;
II. 0,0230 г/л NaOH; 0,0347 г/л NH4OH; III. 0-0408 г/л NaOH;
0,0180 г/л NH4OH. 736. I. 0,1048 г; II. 0,1188 г;
III. 0,1323 г. 737. I. 99,07%, n-нитроанилина; II. 23,99% диэтиламина;
47,57% дифениламина; III. 28,74% диэтиламина; 45,17% и-нитро-
анилина, 21,07% мочевины; IV. 19,35% диэтиламина, 21,94% л-хлор-
анилина, 44,77% дифениламина, 13,28% ацетамида. 738. I. 58,22%
апплипа, ttj/i /о /о дцсюмпда. /ии, i. /о
H2SO4 и 38,98% НС1; II. 77,55% H2SO4 и 17,31% НС1;
III. 71,95% H2SO4 и 26,76% НС1.
Г лава XVII
739. I. 2,70; II. 7,83; III. 7,63; IV. 4,99; V. 9,21; VI. 8,93.
VII. —1,43; VIII. 6,06. IX. 7,91; X. 4,97. 740. 0,1000 г-экв/л;
741. 0,2000 г-экв/л. 742. 0,1500 г-экв/л. 743. 14,61 г/л. 744. 50,00%.
745. 2,41 г/л. 746. 6,51 г/л. 747. 5,84 г/л. 748. 93,08%. 749/29,75%,
750. 10,02%. 751, 5,09%, 752. 15,97%.
Глава XVIII
753.1.1,08%; II. 0,52%; III. 0,86%; IV. 0,64%; V. 1,18%.
754. I. 1,1-10-3%; п. 1,5-10-3%; щ. 1,3-10-3%; IV. 1,5-10-3%;
V. 1,4-10-3%. 755. I. 58,00%; II. 57,85%; III. 58,25%; IV. 58,001%;
V. 58,15%; 756. I. 1,83%; II. 2,00%; III. 2,24%; IV. 1,95%;
V. 2,42%. 757. I. 9,41%; II. 9,55%;ЧП. 9,45%; IV. 9,50%; V. 9,42%.
758. I. 8,48%; II. 8,40%; III. 8,60%; IV. 8,30%; V. 8,55%.
759. I. 203 мг/л; II. 127 мг/л; III. 86'мг/л; IV. 254 мг/л; V. 335 мг/л.
760. I. 98 мг/л; II. 73 мг/л; III. 170 мг/л; IV. 183 мг/л; V. 318 мг/л;
VI. 366 мг/л; VII. 488 мг/л; VIII. 244 мг/л; IX. 585 мг/л; X. 122 мг/л.
761. I. 918 мг/л; II. 702 мг/л; III. 972 мг/л; IV.[621 мг/л; V. 1053 мг/л.
212
Г лава IX
762. I. 6,4%; II. 11,6%; III. 23,2%; IV. 18,0%; V. 14,0%.
763. I. 5,0%; II. 12,0%; III. 15,0%; IV. 10,0%; V. 20,0%.
764. I. 6,4%; II. 34,0%; III. 27,0; IV. 11,6%; V. 18,0%; VI. 43,2%;
VII. 23,2%; VIII. 14,0%. 765. I. 350 мг/л; II. 356 мг/л; III. 351 мг/л;
IV. 353 мг/л; V. 350 мг/л. 766. I. 5,56 г; II. 5,75 г; III. 5,75 г;
IV. 5,76 г; V. 5,75 г. 767. I. 0,0937 г; II. 0,1295 г; III. 0,1743 г;
IV. 0,2288 г; V. 0,2820 г. 768. I. 0,1126 г; II. 0,1270 г; III. 0,1374 г;
IV. 0,1446 г; V. 0,1534 г. 769. I. 90,0%; II. 85,0%; III. 95,5%;
IV. 87,2%: V. 91,7%. 770. I. 1,27 мг/мл; II. 1,59 мг/мл;
III. 1,37 мг/мл; IV. 0,98 мг/мл; V. 0,79 мг/мл. 771. 1) 0,176 мг/мл
Hg; 2) 115 мг/мл Zn. 772. I. 1,38 г-атом/л; II. 1,12 г-атом/л;
III. 1,63 г-атом/л. IV. 1,56 г-атом/л. V. 1,00 г-атом/л.
Глава XX
773. 1.8,9мг; II. 11,6мг; III. 16,7мг; IV. 18,9 мг; V.18,4 мг;У1.15,8 мг;
VII. 15,4мг; VIII. 24,8 мг; IX. 19,6 мг; X. 16,5 мг. 774. I. 37,4%
пропана, 53,1% бутана. 3,8% пентана, 5,7% циклогексана;
II. 25,5% пропана 35,6% бутана, 33,1% пентана, 5,8% циклогек-
сана; III. 57,7% пропана, 39,0% пентана, 3,3% циклогексана;
IV. 53,5% пропана, 25,4% бутана, 15,6% циклогексана, 5,5% про-
пилена. 775. I. 21,9% бензола, 24,7% толуола, 34,2% этилбензола,
19,2% кумола; II. 22,5% о-ксилола, 26,4% лг-ксилола, 11,1%л-кси-
лола, 40,0% этилбензола; III. 49,7% бензола, 17,5% гексана, 21,4%
пропилена, 11,4% этанола. 776. I. 99,65% этанола, 0,35% метанола;
II. 98,23% метана, 1,77% этана; III. 96,67% динитробензола, 3,33%
нитробензола; IV. 96,99% этилацетата, 3,01 % этанола. 777. I. 8,49%;
II. 4,44%; III. 22,02%; IV. 3,65%.
Глава XXI
778. I. 0,033%; II. 0,030%; III. 0,032%; IV. 0,035%. 779. I. -,-5 мл;
II. — 8 мл; III. ~ 6 мл; IV. ~ 10 мл; 789. 4 экстракции.
Глава XXII
781. 0,04. 782. S=_0,078; Д2? = 0,08. 783. 5 = 0,042; Д^ = 0^07.
784. 5 = 0,28-10-3; ДХ = 0,39-10j3. 785. 5 = 0,23-10-5; дх =
=0,23-10-5; 786. 5 = 2,6-10-2, ДХ = 2,0-10-2. 787. 5= 1,2-10-4;
ДХ = 0,3-10-4. 788. 0,37-10-3. 789. 0,02. 790. Нет. 791. Да. 792. Да.
793. Не является. 794. Нет. 795. Имеется. 7 6. Имеется у второго
студента. 797. Нет. 798. Различие значимо при а = 0,95. 799. Разли-
чие значимо при а=0,95. 800. S — 0,1016; Vj = 0,187%; И2=0,150%;
V3 = 0,121%. 801. 3 пробы. 802. 7,10%; да при п = 6. 803. 4 пробы.
804. 11 проб.
ПРИЛОЖЕНИЕ
Таблица 1
КОНСТАНТЫ ДИССОЦИАЦИИ КИСЛОТ И ОСНОВАНИЙ ПРИ 25 °C
Название Формула к vK
Нитрилотриуксусная кис- лота Салициловая кислота Фенолфталеин 2НСг2О4 Сг2О^“Н2О Триэтаноламин H3NTA h2nta- H2NTA2- HSal- НФ1 N(C2O4OH)3+H2O 1,29-10-2 3,24-Ю-з 1,86- 10-Ю 2,2-10-14 1,7-10-ю 34,5 5,6-10-7 1,89 2,49 9,73 13,65 9,77 -1,54 6,23
Таблица 2
ПРОИЗВЕДЕНИЯ РАСТВОРИМОСТИ ПРИ 25 °C
Формула ПР рПР
Тетрафенил борат таллия Т1[В(С6Н5)4] Фрсфат уранила и аммония UO3NH4PO4 9,0-10-9 4,36-10-27 8,05 26,36
Таблица 3
РАСТВОРИМОСТЬ В ВОДЕ ПРИ 15 °C
Формула $, моль/л Формула S, моль/л
AgCN 1,18-10-8 СиСО.з 1,57-10-5
Ag2VPO4 .... 1,71-10-5 NiSeO, 3,16-Ю-з
Ba3(AsO4)2 . . . 3,74- 10-п РЬ3(РО4)2 .... 1,49- 10-9
ВазрОлЪ .... Cd3(AsO4)2 . . . 8,88-10-9 . SrCO3 1,05-10-5
1,15-10-7 Т12СгО4 ..... 6,32-10-5
CoC204 2,51-10-4 ZI1C2O4 3,88-10-5
214
Таблица 4
КОЭФФИЦИЕНТЫ НОРМИРОВАННЫХ ОТКЛОНЕНИЙ (КОЭФФИЦИЕНТЫ
СТЬЮДЕНТА) ПРИ а=0,95
Число степеней свободы / Ч/ Число степеней свободы / /
I 12,706 б 2,447
2 4,303 7 2,365
3 3,182 8 2,306
4 2,7/6 9 2,262
5 2,571 10 2,228
Таблица 5
КРИТЕРИИ <? ПРИ а=0,95
Число намерений п Фа,л Число измерений л Фа,л
3 0,94 7 0,51
4 0,77 8 0,48
5 0,64 9 0,44
6 0,56 10 0,42
Владимир Павлович Васильев, Вера Евгеньевна
Калинина, Людмила Александровна Кочергина,
Александр Николаевич Куракин, Павел Матвее-
вич Милюков, Галина Александровна Прик
СБОРНИК ВОПРОСОВ И ЗАДАЧ
по аналитической химии
Редактор В. Н. Борапеккова. Переплет художника
Ю. Д. Федичкина, Художественный редактор Т. М. Сквор-
цова. Технический редактор С. П. Передерий, Корректор
С. К. Марченко.
Сдано в набор 17/IX—75 г. Подп. к печати 16/II--76 г.
Формат 81Х108’/з2- Бум. тип. No 2. Объем 6,75 веч. л.
Усл. печ. л. 11,34, Уч.-изд. л, 11,45, Изд. № Хим,—535.
Тираж 42 000 зкз. Цена 40 коп.
План выпуска литературы издательства
«Высшая школа» (вузы и техникумы) па 1070 г.
Позиция № 73. Москва, К-51, Иеглпнная ул., д. 29/14,
Издательство «Высшая школа»
Московская типография № 8 Союзполиграфпрома
при Государственном комитете Совета Министров СССР
по делам издательств, полиграфии и книжной торговли.
Хохловский пер., 7. Тип. зак. 4022.