Текст
ТИТРИМЕТРИЧЕСКИЕ МЕТОДЫ АНАЛИЗА органических: СОЕДИНЕНИИ
М.Р.Ф. ЭШВОРТ
TITRIMETRIC ORGANIC ANALYSIS
PART 11. INDIRECT METHODS
By W. R. F. ASHWORTH, Professor of Applied and Analytical Organic Chemistry, University of the Saar, Saarbriicken
INTERSCIENCE PUBLISHERS
A DIVISION OF JOHN WILEY& SONS INC. NEW YORN — LONDON — SYDNEY
Л1. Р. Ф. ЭШВОРТ
ТИТРИМЕТРИЧЕСКИЕ МЕТОДЫ АНАЛИЗА ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
МЕТОДЫ КОСВЕННОГО ТИТРОВАНИЯ
Перевод с английского Д. Л. КреШКОва
Под редакцией и с дополнениями докт. хим. наук проф. А. П. Крешкова
КНИГА 1-я
МОСКВА ИЗДАТЕЛЬСТВО «ХИМИЯ»
1972
УДК 543.8 : 51^.24 ё 98
Эшворт М. Р. Ф.
Э 98 Титриметрические методы анализа органических соединений. Часть II. Методы косвенного титрования. (В двух книгах с единой нумерацией страниц и общим указателем). Пер. с англ, под общей ред. нроф. А. П. Крешкова. М., Химия, 1972.
Книга 1-я: 1—496 с.; 1—52 табл.
Книга 2-я: I—IV, 497—1108. с.; 53—121 табл.
Общий список литературы около 5 500 ссылок.
Книга является переводом с английского языка второй части монографии «Титриметрические методы анализа органических соединений». Перевод первой части — «Методы прямого титрования» — вышел в 1968 г. Вторая часть посвящена методу косвенного титрования органических соединений.
В ней изложены химические, физические и физико-химические (инструментальные) методы титрования водных и неводных растворов разнообразных классов органических веществ.
Излагаемые в книге методы широко применяются в различных Областях науки и промышленности. В ней приведен большой список монографий, обзорных статей и оригинальных работ, посвященных указанной проблеме.
Книга является монографией-справочником, предназначенной для широкого круга химиков-аналитиков, органиков и физико-химиков, занимающихся анализом, синтезом и исследованием органических соединений. Монография может служить настольной книгой работников научно-исследовательских и заводских лабораторий и справочником для преподавателей высших учебных заведений и студентов химических факультетов университетов и технических вузов.
2-5-5
10-БЗ-44-72
м. Р. Ф. ЭШВОРТ
ТИТРИМЕТРИЧЕСКИЕ МЕТОДЫ АНАЛИЗА ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Методы косвенного титрования
Книга 1-я
Редактор Л. Н, Овсянникова. Технический редактор Е. В. Макуни. Художник О. Н. Коняхин. Художественный редактор Ю. М. Сигов. Корректоры И. Д. Король, Г. Е. Потапова.
Сдано в набор 24/1 1972 г. Подп. в печ. 16/V 1972 г. Формат бумаги 60 x90*/,,. Бумага типогр. № 2. Уел. печ. л. 31. Уч.-изд. л. 39,63. Тираж 3500 экз. Заказ № 1488. Цена 2 р. 94 к.
Ивдательство «Химия». Москва, Б-76, ул. Стромынка, 23.
Ленивградская типография № 6 Главполиграфпрома Комитета по печати при Совете Министров СССР. 193144, Ленинград, ул. Моисеенко, 10
СОДЕРЖАНИЕ
Предисловие редактора ... V
Введение ..................... Ю
ЧАСТЬ 1
Косвенные методы титрования 11
Условия, обеспечивающие успешное применение методов титрования .................... 12
Физические методы разделения, предшествующие стадии титрования .................. 14
Особенности титрования ... 14
1. Измерение количества реагента X и исследуемого образца ................... 14
S. Измерение избытка реагента, продуктов реакции или не реагирующих с данным реагентом X компонентов . . 15
3. Смешивание реагирующих веществ ................... 15
4. Скорость реакции ... 15
Б. Определение конечной точки титрования................ 21
Реакции, применяемые в косвенных методах титрования органических соединений ... 22
1. Реакции окисления ... 24
2. Реакции восстановления . . 25
3. Реакции присоединения . 26
4. Гидролиз ................. 27
5. Реакции ионного и иономолекулярного обмена . . 27
6. Реакции обмена (замещения) водорода ... 29
7. Реакции конденсации • 30
8. Реакции этерификации и переэтерификации ... 30
9. Реакции комплексообразования ....................... 31
10. Реакции, сопровождающиеся образованием амидов . 31
11. Реакции деалкилирования (эфиров)..................... 32
12. Реакции дегидратации 32
13. Реакции окисления — восстановления 32
14. Реакции обмена галогенов 32
15 Реакции нитрозирования 33
16. Реакции декарбоксилирования ........................ 33
17. Реакции расщепления S—S-связей................... 33
18. Реакции расщепления С—S-связей .................. 33
19. Реакции образования ксантогенатов ............... 33
20. Другие реакции ... 34
Области применения косвенных методов титрования органических соединений.......... 35
ЧАСТЬ 2
Реагенты, используемые в косвенных методах титрования органических соединений ... 39
1. Кислоты .................. 39
2. Спирты ................... 41
Литература ....... 53
3. Щелочи.................... 54
Литература ...... 115
4. Алюминий- и боргидриды 124
Литература . . 127
5
5. Изопропилат алюминия . 128
Литература ................. 128
6. Амины и гетероциклические основания . . 128
Литература ................. 146
7. Аммиак и аммониевые соли 148
Литература ................. 152
8. Ангидриды .................. 152
Литература ................. 175
9. Соединения мышьяка (V) . 179
Литература ................. 179
10. Соединения мышьяка (III) . 180
Литература ................. 181
11. Соединения бария .... 181
Литература ................. 182
12. Бихромат и трехокись хрома.................... 182
Литература ................. 207
13. Соединения висмута (III) 213
Литература ................. 216
14. Бисульфат натрия или калия ....................... 216
Литература ................. 216
15. Бисульфит и сульфит . . . 217
Литература ................. 239
16. Реагенты, содержащие бром 243
Литература ................. 311
17. Соединения кадмия . . . 323
Литература ................. 326
18. Соединения кальция . . . 327
Литература ................. 333
19. Сероуглерод............. 334
Литература ...... 337
20. Карбонильные соединения 338
Литература ................. 343
21. Карбоновые кислоты и карбоксилаты .............. 344
Литература ...... 351
22. Соединения церия (IV) • • 351
Литература ................. 360
23. Хлорат калия............ 362
Литература ................. 363
24. Реагенты, содержащие хлор 363
Литература ................. 367
25. Хлорит натрия ............. 368
Литература ................. 369
26. Соединения хрома (II) . 370
Литература ................. 372
27. Соединения меди (I) • • 372
Литература ................. 374
28. Соединения меди (II) ... 374
Литература ................. 404
29. Соединения меди (III) . . - 408
Литература ................. 409
30. Цианид калия............... 409
Литература ...... 416
31. Соли диазония.............. 418
Литература ................. 419
32. Дигитонин.................. 419
Литература ................. 420
33. Диметилсульфат....... 420
Литература ...... 421
34. Дитиоиит натрия .... 421
Литература ...... 422
35. Красители.................. 422
Литература ...... 423
36. Электролитическое восстановление ................... 423
Литература ............ 424
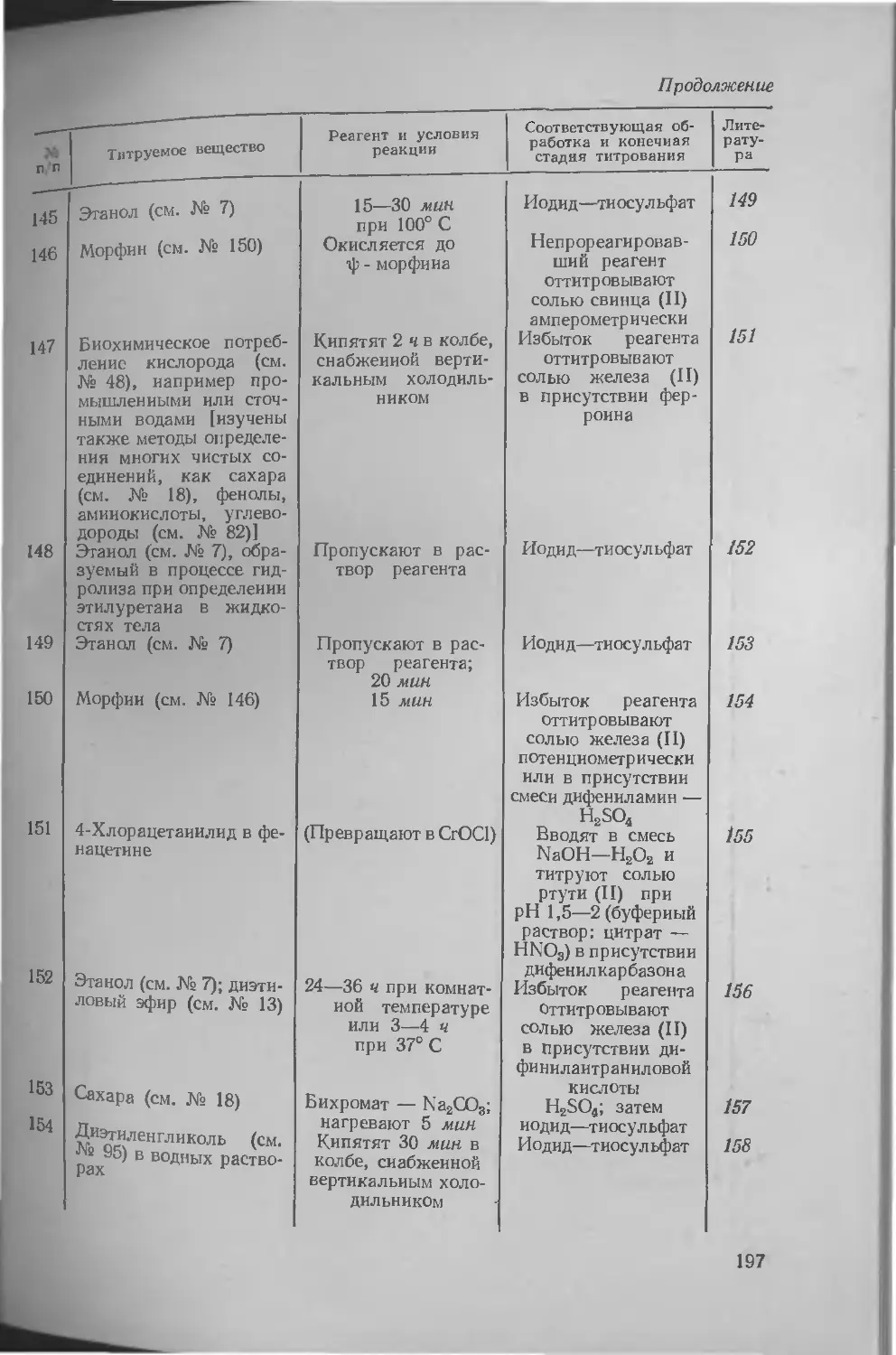
37. Гексациаиоферрат (III) калия ........................ 424
Литература ............ 436
38. Гексациаиоферрат (II) калия 438
Литература ...... 439
39. Желатин ................... 439
Литература ............ 440
40. Галогениды (активные) . . 440
Литература ............ 453
41. Галогенсодержащие реагенты, применяемые для определения ненасыщенности . 45а
Литература ...... 456
42. Гидразины........... 457
Литература .......... 464
43. Бромистоводородиая кислота ......................... 465
Литература .......... 468
44. Углеводороды............ 469
Литература .......... 470
45. Хлористоводородная кислота ......................... 470
Литература .... 494
^6. Фтористоводородная кислота ................. 497'
Литература .... 497
47. Газообразный водород . . . 497
Литература ...... 499
48. Перекись водорода .... 499
Литература .... 506
49. Гидроксиламин .... 507
Литература ...... 626
50. Иодат калия и пятиокись иода . . . . . 530
Литература .... 540
51. Йодиды и иоднстоводород-иая кислота............ 542
Литература .... 571
52. Реагенты, содержащие иод Литература
53. Хлориды, бромид н тиоцианат иода...............
Литература. ............
54. о-Иодозобензоат . . . • Литература ................
55. Ионообменники (ионообменные смолы) . • • •
Литература
56. Соединения железа (П) - Литература ................
57. Соединения железа (III) Литература ................
58. Изоцианат и изотиоцианат Литература.................
59. Определение азота но Кьельдалю .................
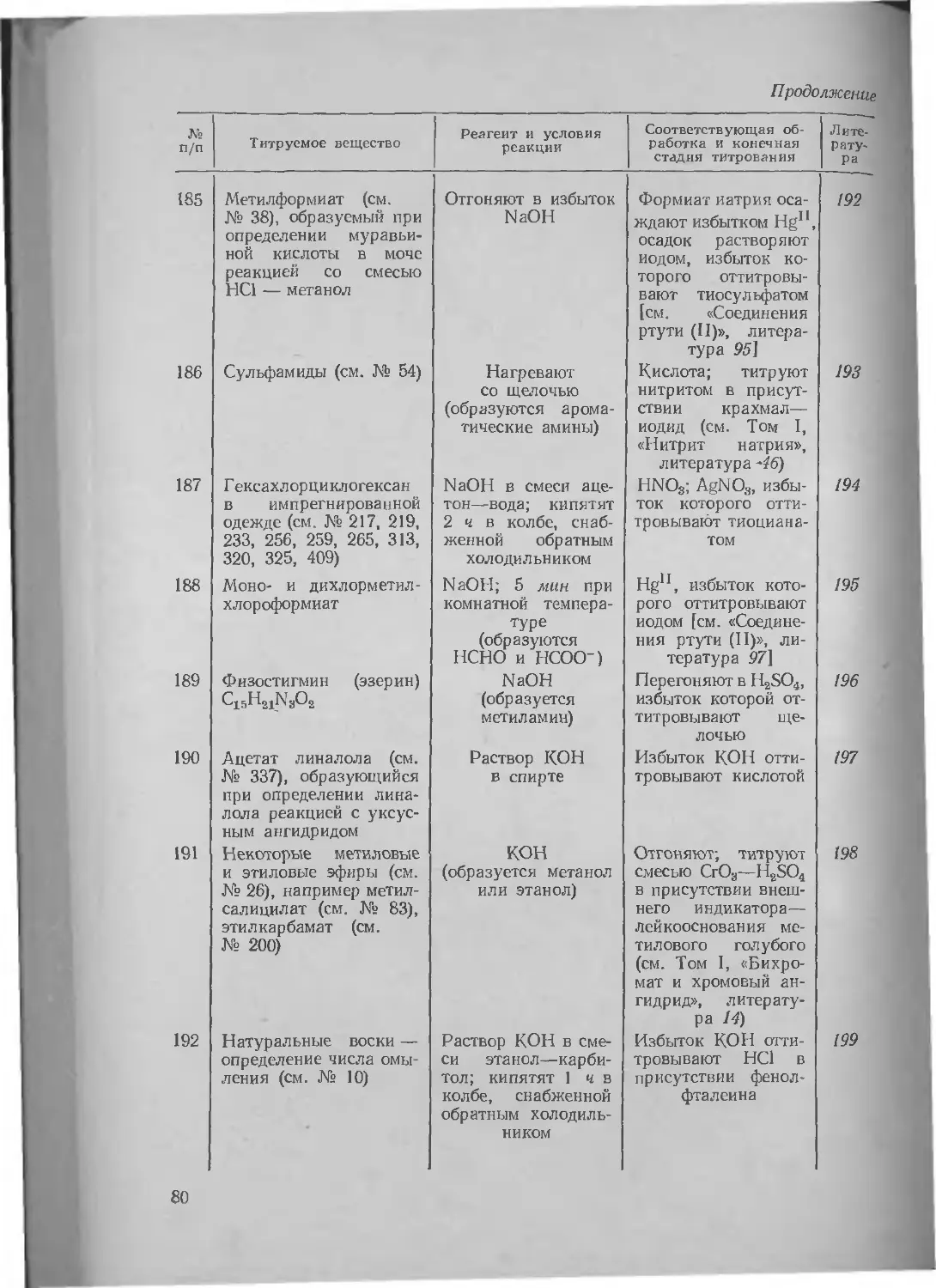
Литература ............
60. Соединения свинца (II) • Литература ................
61. Соединения свинца (IV) . Литература ................
62. Малеиновый (и хлормалеиновый) ангидрид............
Литература ...
63. Манганат калия ........
Литература . ... .
64. Соединения марганца (III) Литература ................
65. Соединения марганца (IV) Литература ................
66. Меркаптаны.............
Литература .............
67. Соединения ртути (I) ... Литература ......
68. Соединения ртути (II) • . Литература .....
69. Металлы ..............
Литература ............
70. Соединения молибдена (III) Литература ................
71. Соединения молибдена (VI) и вольфрама (VI)...........
Литература ............
72- Соединения никеля (II) Л итература ......
73. Нингидрин ...
Литература .... .
Азотная кислота .... Литература
75. Нитрилы..........
Литература
582
631
640
658
660
661
661
667
668
671
671
674
675
676
676
679
679
683
683
686
686
692
693
694
694
695
695
696
698
699
699
699
700
730
734
751
753
754
754
757
757
760
761
764
764
769
769
772
76. Нитрит..................... 772
Литература ................ 778
77. Нитрофенолы . • • • 778
Литература . ... . 7С9
78. Нитрозобензол........ 790
Литература .............. 790
79. Озон ...................... 790
Литература ................. 791
80. Перкарбоновые кислоты • 791
Литература ................. 794
81. Хлорная кислота . . . . 795
Литература ................. 798
82. Перйодаты и иодная кислота 798
Литература ................. 818
83. Перманганат калия . 821
Литература ................. 840
84. Персульфат ................ 844
Литература ................. 845
85. Фенолы ... 845
Литература ................. 847
86. Фосфорная кислота . 847
Литература ................. 851
87. Физические методы . - 851
Литература ................. 855
88. Соединения калия .... 856
Литература ................. 858
89. Пиролиз ..... 859
Литература ...... 867
90. Хиноны ... . 868
Литература 869
91. Двуокись селена • . 869
Литература .... 871
92. Соединения серебра (I) 871
Литература ................. 897
93. Амид натрия ............... 901
Литература ................. 902
94. Соединения натрия . . 902
Литература . - 902
95. Сульфиды . 902
Литература 906
96. Сульфокислоты ............. 906
Литература . 909
97. Серная кислота ............ 9’0
Литература '................ 933
98. Трехокись серы ............ 936
Литература ................. 936
99. Поверхностно-активные вещества .................... 936
Литература ................. 937
100. Тетрафенилборат натрия 938
Литература................. 943
101. Тетратионат натрия . . . 943
Литература................. 944
7
102. Соединения таллия (I) . . 944
Литература . ... . 944
103. Соединения таллия (III) 944
Литература............. 945
104. Тиоцианаты .............. 945
Литература............. 954
105. Родан (тиоцианоген) . . . 956
Литература............. 959
106. Тиосульфат натрия . . . 959
Литература ...... 964
107. Тиомочевина........... 965
Литература............. 965
108. Реагент Тильмана .... 966
Литература............. 966
109. Соединения олова (II) • • 966
Литература . ... , 970
ПО. Соединения титана (III) . 970
Л итература............ 981
111. Ванадаты.............. 982
Литература............. 985
112. Соединения ванадия (II) . 985
Литература ............... 987
113. Вода...................... ив*
Литература.................. 99
114. Ксант1 идрол (ксантанол) • . j
Литература .... 99
115. Соединения цинка ... 99
Литература ...... 9>
ЧАСТЬ 3
Указатель функциональных групп и классов соединений 99
А. П. К р е ш к о в. Современное состояние и перспективы дальнейшего развития титриметрических методов анализа органических соединений . • 107
Литература .... 708
Предметный указатель .... 10
ПРЕДИСЛОВИЕ РЕДАКТОРА
Значение выхода в свет книги М. Р. Ф. Эшворта, посвященной титриметриче-ским методам анализа органических соединений, трудно переоценить, так как в связи с бурным ростом химии и химической технологии органических веществ методы объемного анализа этих соединений, неоправданно забытые в начальный период развития инструментальных методов анализа, в настоящее время приобрели большое практическое значение. Этому в значительной степени способствовали общие усилия огромной армии ученых всех стран мира, и в том числе советских ученых, разработавших много новых перспективных титрнметрических методов анализа органических соединений, £ также предложивших много новых титрантов и способов определения точек эквивалентности. Особое развитие получили методы титрования невод-
ных растворов.
Эшворт цитирует многие работы советских ученых, имеющие известность ие только у нас в СССР, но и далеко за его пределами. Однако в этом отношении книга Эшворта не лишена, по нашему мнению, некоторых недостатков. Прежде всего следует отметить, что цитируемая автором литература охватывает работы, опубликованные лишь до 1961 г. В книгу Эшворта вошли не все фундаментальные
исследования советских авторов.
Перечисляя основные источники использованной литературы, Эшворт не называет такие известные журналы, как РЖХим, Журнал аналитической химии, «Заводская лаборатория» и другие советские издания. Цитируя отдельные работы советских ученых, автор монографии очень часто недооценивает принципиального значения этих исследований. Наконец, автор допускает ряд неточностей, а порой и не вскрывает с необходимой полнотой затрагиваемые им вопросы, разбирает рассматриваемые титриметрические методы анализа и не сравнивает их с другими существующими методами анализа. Одним из важнейших недостатков книги Эшворта является игнорирование теоретических аспектов аналитической химии органических соединений.
Несмотря на указанные недостатки, книга Эшворта ценна тем, что в ней собран и систематизирован огромный материал, относящийся к анализу органических соединении. В ней приводятся важнейшие литературные источники и ссылки на оригинальные работы, позволяющие читателю, если необходимо, использовать их для оолее подробного изучения интересующих его вопросов теории и практики. Эшворт называет свой труд «миниатюрным справочником Бейльштейна по методам титрования органических веществ».
Мы убеждены, что книга Эшворта окажется полезной для советских химиков. ангяи»ДаКТ°Р РУССКОГ° пеРевоДа пытался восполнить перечисленные выше пробелы иекггг^К0Т° издания книги Эшворта, дополнил списки литературы и снабдил книгу оепякт п'МИ пРимечаниями- отмеченными в тексте звездочками (*•). Кроме того, лпппп,°₽ написал специальную статью, материал которой в значительной мере дополняет данную книгу. г
никам™^?3 св^им приятным долгом выразить глубокую благодарность моим уче-к прият., отРУдникам за существенную помощь, оказанную мне при подготовке к печати русского издания книги Эшворта.
А. П. Крешков
ВВЕДЕНИЕ
Впервые метод титрования был введен в практику свыше 100 лет назад *. Вместе с весовым методом он является основой классического количественного химического анализа. Титриметрические химико-аналитические методы анализа всегда имели и имеют широкое практическое применение. За последнее время наиболее быстро развиваются современные микро- и субмикроколичествен-ные методы титрования.
Обычно различают прямые и косвенные методы титрования. Методы прямого титрования рассмотрены в первом томе данной книги **. Второй том книги посвящен косвенным методам титрования.
* if Основоположником титриметрического метода анализа является один из видных французских химиков и физиков Ж- Л. Гей-Люссак, предложивший метод объемного анализа в 1824— 1832 rr.-fr
** ★ Русский перевод вышел в 1968 г.^-
ЧАСТЬ 1
КОСВЕННЫЕ МЕТОДЫ ТИТРОВАНИЯ
★ Методы титрования, основанные не на непосредственном прямом титровании (см. Том I, стр. 13), называют косвенными методами. ★ Последней операцией в этих методах является титрование (чаще всего избытка реагента). В настоящем разделе не рассматриваются общие физические методы (фильтрование, дистилляция и т. п.), сопутствующие химическим методам анализа, но рассматриваются некоторые случаи, в которых титрование является завершающей стадией чисто физического метода разделения.
При определении содержания определяемого компонента А в смеси, содержащей наряду с А также компоненты В, С и т. п. в процессе взаимодействия А с реагентом X, сопровождаемом образованием продуктов реакции А', А" и т. д., протекает реакция, которую можно представить в виде следующего уравнения:
А + В+СЧ-------h X-------> А' +А" + В + СЧ-----h X'
Реагент Продукты Нереаги- Избыток
реакции рующие реагента компоненты
На этом равновесии основаны три метода титрования.
1. Метод титрования, в котором определяют избыток реагента X'. Этот метод обычно называют методом «обратного титрования»; он является наиболее широко применяемым методом косвенного титрования.
2. Метод определения количества продуктов реакции А', А" и т. д_, образовавшихся в результате взаимодействия определяемого компонента А с реактивом X.
и т 3. Метод определения нереагирующих с X компонентов В + С суммы предшествует контрольное определение содержания
А + В + С + • • • Количество определяемого компонента А находят по разности *.
11
УСЛОВИЯ, ОБЕСПЕЧИВАЮЩИЕ УСПЕШНОЕ ПРИМЕНЕНИЕ МЕТОДОВ ТИТРОВАНИЯ
Для всех трех указанных выше методов некоторые основные требования являются общими, а именно:
1) Реагент X следует приливать в избытке.
2) Время проведения реакции должно быть достаточным для завершения ее. Если определяют общее содержание функциональных групп, то для реакции должен быть отведен необходимый промежуток времени, в течение которого успеют прореагировать все группы, входящие в состав анализируемого вещества.
3) Реакция должна протекать в стехиометрическом отношении или по крайней мере быть воспроизводимой в случае изменения ее условий в достаточно широких пределах. Например, метод непригоден, если продолжительность реакции, температура и особенно избыток реагента X' оказывают сильное влияние на процесс взаимодействия.
Вместе с тем каждый из указанных методов в свою очередь требует соблюдения определенных условий.
Первый метод (метод обратного титрования), а) В этом случае количество добавляемого в избытке реагента X должно быть точно измерено.
б) В реакцию с реагентом X должен вступать только определяемый компонент А.
в) По окончании реакции А с X избыток реагента X' должен быть точно определен титрованием. При этом необходимо иметь в виду, что определению избытка реагента X' не должны мешать
* ★ Например, анализ смеси бензоилхлорид—нафталин основан на следующей реакции с морфолином:
/СН£ - СНа /СНа - сна
СаНаСОС1 + СюНе-J- HN /О—> CeHBCON /° +
^CHt-CH, \сна-сна
А В X А'
/СН, - СНа
+ НС1 С,„Нв + HN /О
\сна — сна
А" В X'
По первому методу избыток морфолина (X') обратно оттитровывают уксуснокислым раствором хлорной кислоты.
По второму методу хлористоводородную кислоту (А"), образующуюся в процессе указанной реакции, титруют едким натром или солями серебра (I).
По третьему методу осаждают пикриновой кислотой нафталин в виде пикрата восстанавливают образовавшийся пикрат титаном(III) и затем обратно оттитровываю избыток восстановителя солями железа
12
„.^иппшиеся компоненты анализируемого вещества (В, С НИ НЛ ни продукты взаимодействия А с X (А', А" и т. д.).
И Пр орой метод, а) В этом случае не обязательно знать точное количество реагента X, добавленного в титруемый раствор.
б) Другие компоненты, входящие в состав анализируемого вещества (В Сит. д.), могут вступать во взаимодействие с реагентом X, но в результате этих реакций не должны образовываться продукты, мешающие конечной стадии определения А' или А" и т. д. Кроме того, расход реагента X не должен быть настолько велик, чтобы нарушить нормальное течение реакции.
в) На точность определения А' или А" и т. д. не должны влиять другие компоненты реакционной смеси. Если это условие невыполнимо, то определению должно предшествовать частичное или полное разделение компонентов смеси. Обычно выделяют компоненты А' или А", но можно удалить и мешающие соединения. Для этой цели пригодны обычные методы выделения, например дистилляция, фильтрование, экстракция и т. п.
Третий метод, а) В этом случае, так же как и во втором методе, не обязательно знать точное количество реагента X.
б) Только определяемый компонент А не должен вступать во взаимодействие с реагентом, применяемым для определения В и С.
в) На результаты определения нереагирующих с X компонентов В+Сит.д. не должны влиять другие компоненты реакционной смеси.
Первый и третий методы титрования являются дифференциальными, поскольку количество израсходованного реагента, эквивалентное количеству определяемого компонента, находят по разности между объемом добавленного реагента и объемом избытка его. Этим первый и третий методы существенно отличаются от второго. В методах второго типа в случае необходимости для ускорения реакции можно добавлять большой избыток реагента X. Однако методы обратного титрования (первый и третий) имеют большое преимущество перед методами второго типа — количество вступающего в реакцию реагента эквивалентно содержанию реагирующих с ним компонентов. Для таких методов титрования широко применяются некоторые реагенты, отличающиеся многосторонним действием, например галогены, которые вступают в реакции различных типов, лагодаря этому, используя один и тот же реагент для стандартизации растворов и обратного титрования, можно проводить определение разнообразных функциональных групп и классов соединений, етоды второго типа применимы лишь к тем реакциям, в результате Z°PbIX образуются индивидуальные продукты, которые могут быть оттитрованы подходящим реагентом.
опепя>ЛН"Ь1^ анализ обычно включает несколько последовательных Р Ции, относящихся к методам указанных выше типов, например:
* Бутен-1-—-^ Дибромбутан
2-го типа
C2H8OK AgNO3
Метод^ Э™1 ацетилен -Ацетиленид серебра 2-го типа 1-го типа
13
Избыток Ag1 титруют тиоцианатом, осадок растворяют в H2SO4 и титруют перманганатом.
Метанол — Н, ВО4 Щелочь
II. Молочная кислота------------ ► Метиллактат----->
МпО4 — щелочь Са8Т
Лактат------------> Оксалат-----> Осадок оксалата кальция
(определяемый обычным способом)
Все четыре стадии этого определения основаны на применении методов второго типа. Уксусный Дистилляция н гидролиз
ангидрид избытком щелочи
III. Спирты—------->-Эфиры уксусной кислоты----------------------►
Метод Метод 2-го типа
2-го типа
—*Ацетат
Определение заканчивается титрованием избытка щелочи стандартным раствором кислоты.
ФИЗИЧЕСКИЕ МЕТОДЫ РАЗДЕЛЕНИЯ, ПРЕДШЕСТВУЮЩИЕ СТАДИИ ТИТРОВАНИЯ
Известно лишь немного методов титрования, основанных на I применении чисто физических методов разделения компонентов исследуемого вещества. При этом разделение может быть полным, например в ряде случаев дистилляции, или частичным — в ряде методов распределения вещества между двумя несмешивающимися растворителями. Ряд примеров подобного разделения приведен во , второй части книги в разделе «Физические методы».
ОСОБЕННОСТИ ТИТРОВАНИЯ
Сделанные здесь замечания, касающиеся различных аспектов методики титрования, большей частью весьма сходны с замечаниями, содержащимися в первом томе настоящей книги, посвященной методам прямого титрования.
1. ИЗМЕРЕНИЕ КОЛИЧЕСТВА РЕАГЕНТА X И ИССЛЕДУЕМОГО ОБРАЗЦА
Анализу подвергаются твердые, жидкие и газообразные пробы исследуемого вещества и используются твердые и жидкие реагенты (примеры использования газообразных реагентов, очевидно, не встречаются в методах первого типа). Исследователи применяют обычные способы измерений, т. е. измерения объемов и массы. В процессе выполнения косвенных методов титрования используются также реагенты, генерируемые электролитическим путем, но реже, чем в методах прямого титрования.
14
ичМЕРЕНИЕ ИЗБЫТКА РЕАГЕНТА, ПРОДУКТОВ РЕАКЦИИ
2- И ИЛИ НЕ РЕАГИРУЮЩИХ С ДАННЫМ РЕАГЕНТОМ X КОМПОНЕНТОВ
Измерение избытка реагента X в последней стадии определения бычно проводится методом титрования. Методика прямого титрова-ооь органических соединений была рассмотрена в первом томе на-НИояшей книги в части, посвященной соответствующим реагентам, где читатель может найти все интересующие его подробности. Титрование неорганических соединений X, А', В и т. д. осуществляется по стандартным методикам, применяемым при анализе неорганических веществ.
Основной альтернативой титрованию на последней стадии измерения является, вероятно, колориметрический метод. Избыток реагента X' редко определяют колориметрическим методом, равно как и методами, относящимися к третьему типу. Почти все примеры колориметрического метода представляют собой определения количества образующихся продуктов реакции.
3. СМЕШИВАНИЕ РЕАГИРУЮЩИХ ВЕЩЕСТВ
Тщательное смешивание реагирующих веществ не является важной процедурой при проведении косвенных методов титрования, при которых незначительное различие в скорости реакции не имеет большого значения. Более важным фактором является последовательность смешивания. Известны случаи, когда последовательность смешивания оказывает существенное влияние на результаты анализа, что обусловливается возникновением нежелательных побочных реакций, вызываемых одним из многих компонентов сложного реагента. Хорошим примером этого может служить определение альдоз окислением их смесью иод—щелочь. Что касается последовательности добавления щелочи и иодного раствора, то по этому вопросу нет единого мнения. Поэтому был предложен метод добавления этих веществ небольшими, последовательно чередующимися порциями.
4. СКОРОСТЬ РЕАКЦИИ
Все сказанное относительно роли скорости реакции в методах прямого титрования в соответствующем разделе первого тома настоящей книги (см. стр. 8) также верно и применительно к методам косвенного титрования. Как в косвенном, так и в прямом методе титрования используют катализаторы, хотя способы их применения катяпЧНЫ’ В большинстве случаев исследователи применяют те же исп ИЗат°ры окисления, восстановления и присоединения, которые агенть^У10™ В методах прямого титрования. Однако основные ре-ванием' пРименяемые в косвенных методах титрования с использо-тодах 2сатализатоР°в» очень редко или вовсе не встречаются в ме-рямого титрования. К числу используемых в методах обрат
15
ного титрования относятся главным образом реакции гидролиза, а также этерификации, дегидратирования, декарбоксилирования и деполимеризации. Указанные реакции обычно протекают очень медленно. Однако они могут быть успешно использованы по крайней мере в методах косвенного титрования в тех случаях, когда их скорость может быть повышена с помощью катализаторов.
Основные катализаторы, применяемые в косвенных методах титрования, перечислены в табл. 1, аналогичной таблице, приведенной в первом томе настоящей книги. В последней графе табл. 1 содержатся ссылки на работы, приведенные в разделах части 2, в которых описываются соответствующие реактивы. Слово «много», встречающееся в таблице, означает, что для данного реактива имеется около 10 или более литературных источников или что указанный катализатор настолько распространен, что в соответствующих таблицах части 2 даже нет сведений о его применении (например, Мп11 в методах окисления перманганатом, Вг“ в методах нитрозирования Сип или Hgn при определении азота по методу Кьельдаля).
Иногда даже очень медленные реакции можно использовать для аналитических целей, если прибегнуть к методу экстраполяции. При этом через определенные промежутки времени отбирают аликвотные части реакционной смеси, затем проводят титрование (или другую измерительную операцию). Полученные данные асимптотически экстраполируют к конечному объему. Этот способ был успешно применен для определения степени ненасыщенности смесей углеводородов типа каучуков или нефтяных фракций. Чрезмерно продолжительное время, необходимое для завершения реакции, свидетельствует о наличии побочных или последовательных реакций (например, реакция замещения в приведенном примере). В таком случае к интерпретации экстраполированных данных следует отнестись с осторожностью.
В последние годы особенно возрос интерес к методам анализа смесей соединений с одинаковыми функциональными группами, основанным на различии скоростей их реакций с соответствующими реагентами. Этот метод не может быть здесь подробно описан, так как он выходит за рамки косвенных методов титрования. Кратко сущность его в следующем: быстрее взаимодействующий компонент реагирует только в начале определения; затем, когда его концентрация заметно понизится, в реакцию вступает медленно реагирующий компонент. Результаты аналитического определения можно вычислить при помощи кривой титрования, соответствующей суммарной реакции, или же рассчитать на основании данных о скоростях реакций химически чистых соединений, реагирующих при тех же условиях. В тех случаях, когда содержание одного из компонентов удовлетворительно определяется каким-либо способом, второй компонент может быть определен по разности, если известно общее содержание компонентов, определенных ускоренным методом (например, при более высокой температуре) или в результате полностью завершившейся реакции. Изложение методики (в том числе основан-
16
Таблица 1. Катализаторы, применяемые в косвенных методах титрования
№ гг/п 1 катализатор Реагент Реакция Определяемое вещество Литература
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 Уксусная кислота Ацетат (калия) Щелочи Хлорид бария Бисульфат Трифторид бора Бромид Соединения кальция Церий (IV) Хром (Ш) Медь (II) Цианид Фторобор ная кислота Бромистоводородная кислота Хлористоводородная кис-лота Амины Свинец (IV) Вода (см. Часть 2, «Щелочи») Меркаптаны Нитрилы Хлористоводородная кислота Бисульфат Спирты Карбоновые КИСЛОТЫ Фенолы Вода Церий (IV) Нитрит Перманганат Бихромат Церий (IV) (Определение азота по Кьельдалю) Перманганат Щелочи Ангидриды Вода (см. Часть 2, «Бромистоводородная кислота») Спирты Спирты Присоединение Окисление Гидролиз Присоединение Присоединение Присоединение Дегидратация Этерификация Этерификация Конденсация Гидролиз Окисление Нитрозиро-вание Окисление Окисление Окисление Восстановление и окисление Окисление Гидролиз Этерификация Гидролиз Этерификация Переэтерификация <х,Р-Ненасыщен-ные нитрилы и карбонильные соединения Формиат Например, сложные эфиры, ангидриды, амиды, галогениды а,Р-Ненасыщен-ные нитрилы Меркаптаны, спирты Олефины-(С4) Оксисоединения Карбоновые кислоты Спирты Метилольные группы Ангидриды Муравьиная кислота Амины, аминокислоты, амиды, производные гидразина Некоторые оксикислоты Холестерин Муравьиная кислота Азотсодержащие соединения Оксисоединения Аллоксан Спирты Ацетали, кетали, виниловые эфиры, трибутилфосфат Карбоновые кислоты Эфиры 61 6 Много 3—5, 11 1—4, 6 46 1, 2 19 15 3 6 54 Много 112 86 39, 44, 45 Много 137 167 86 11, 15 33 21, 35, 53, 63
17
Продолжен!
№ тт/п Катализатор Реагент Реакция Определяемое вещество Литература
16 17 18 19 20 21 Фтористоводородная кислота Иодид Монохлорид иода Железо (III) Марганец (II) Ртуть (II) Вода (см. Часть 2, «Хлористоводородная кислота») Титан (III) Церий (IV) Вода Церий (IV) Вода (см. Часть 2, «Хлористоводородная кислота») Перекись водорода Иодид Церий (IV) Иод Марганец (IV) Перманганат Реагенты, содержащие бром Реагенты, содержащие иод Хлориды иода (Определение азота по Кьельдалю) Гидролиз Дегидратация Деполимеризация Декарбоксилирование Присоединение Восстановление Окисление Гидролиз Окисление Гидролиз Окисление Восстановление Окисление Окисление Окисление Окисление Присоединение Присоединение Присоединение Присоединение Окисление Присоединение Окисление Присоединение Окисление и восстановление Например, сложные эфиры, амиды, полисахариды, нитрилы и т. д. Пентозы Полиальдегиды Уроновые кислоты (главным образом галактуро-новая и глюкуроновая кислоты) Изоцианаты Азо-, нитро-, нитрозосоединения и т. д. Антабус Ангидриды Щавелевая кислота Глюкоза Масляная, изо-масляная кислоты Эфиры перкислот, перкислоты Полиспирты Ацетон Молочная кислота Молочная, щавелевая кислоты Олефины Ненасыщенные КИСЛОТЫ Ацетилены <%,Р-Ненасыщен-ные нитрилы Камфорхинон Олефины Вицинальные диоксимы Олефины Азотсодержащие соединения Много Много 4 1 15, 26, 29, 64, 81, 115, 124 104 Много 46 7, 9 7 43 1 10, 12 206, 2311 53 245 1, 6 | Много 1 235, 24 354, 36 503 1 483, 481, 498 145 426 1 360 258, 24 330, 35 373 Мног Много
Продолжение
№ п/п Катализатор Реагент Реакция Определяемое вещество Литература
22 23 24 25 Молибден (VI) (молибдат, МоО3) Никель Нитрат Азотная кислота Цианид Вода Реагенты, содержащие бром Перекись водорода йодид Железо (II) Газообразный водород Ртуть (II) Вода (см. Часть 2, «Азотная кислота») Церий (IV) Реагенты, содержащие хлор Гексацианоферрат (III) Галогениды («активные») Газообразный водород Ангидриды Присоединение Присоединение Присоединение Окисление Окисление Восстановление Восстановление Восстановление Присоединение Гидролиз Олефины Ацетилены Фурфурол Ненасыщенные соединения Мочевина Уксусный альдегид Перекиси, перкислоты Эфиры азотной кислоты Хлорпикрин Олефины Галогениды, мочевина 20 19 66, 203, 253, 265 503, 527, 533 508 25 218 10 3 107 Много
26 27 28 Тетраоксид осмия Палладий Хлорная кислота Окисление Окисление Окисление Окисление Окисление Окисление Восстановление Этерификация Дегидратация Щавелевая кислота Альдегиды Тиомочевина Формиат Ксантогенат Аминокислоты Феназины, карбобензилокси-группы Нитрилы Спирты Спирты, простые эфиры Олефины Сложные эфиры Пентозы Олефины Виниловые эфиры Нитрилы 7 25 103, 107 125 128 71 4, 5 6 114, 132, 137, 154, 162— 165, 168 12, 13
29 30 Фосфорная кислота Платина Ртуть (II) (См. «Спирты») (См. «Фосфорная кислота») Гидрид и боргидрид алюминия Газообразный водород Присоединение Переэтерификация Дегидратация Восстановление Восстановление 144, 150 2 10, 12 8 2 6
19
Продолжен
№ п/п Катализатор Реагент Реакция Определяемое вещество Литература
31 Полиоксисо- Перекись водорода Титан (III) Окисление Восстановле- Галогениды Азо-, нитро-, ни- 23 Много
32 единения Пиридин Вода ние Гидролиз трозосоединения и т. д. Ангидриды ю, и,
33 Двуокись се- Бихромат Окисление Хлорангидриды кислот Окисляемые ве- 20, 21, 22, 25 16 146
34 лена Серебро (I) (Определение азота по Кьельдалю) Бихромат Окисление и восстановление Окисление щества в сточных водах Азотсодержащие соединения Окисляемые ве- Много 198, 19
35 Сульфокисло- Церий (IV) Персульфат Спирты Окисление Окисление Этерификация щесгва в сточных водах и т. д. Жирные кислоты, липиды Полиспирты Органическое вещество Карбоновые 226 1 42 45, ПО, ,4й 163 16, 53 5—8 41, 50\
36 ты Серная кис- Ангидриды Карбоновые кислоты Фенолы Вода (см. Часть 2, «Сульфокислоты»; Спирты Переэтерификация Этерификация Этерификация Конденсация Гидролиз Дегидратация Этерификация кислоты Сложные эфиры Спирты Спирты Метилольные группы Сложные эфиры, амиды, особенно уксусной кислоты Спирты, особенно третичные Карбоновые 5, 7, М 13, 14, 29 101, 10 124, 14' 149, 152 160 25 3 Много 14—1б\ 37, 46
лота Спирты Ангидриды Карбоновые кислоты Карбоновые кислоты Переэтерификация Этерификация Этерификация Присоединение кислоты Сложные эфиры Спирты Спирты Олефины (образуются эфиры) 23, 54 114, 13i 162 27, 311 10, 14, 23, 31
20
Продолжение
№ п/п катализатор Реагент Реакция Определяемое вещество Литература
Вода (см. Часть 2, «Серная кислота») Гидролиз Присоединение Декарбоксилирование Деполимеризация Дегидратация Сложные эфиры, амиды, полисахариды, гидразины, нитрилы и т. д. а-Эпоксиды Полимеры альдегидов Спирты, эфиры Много 38, 91, 107, 124 123, 134, 135 31, 44, 48, 115, 122 128, 129
37 Винная кислота Карбоновые кислоты Гидролиз Гексаметилентетрамин 17
38 Олово (II) Изотиоцианаты и изоцианаты Присоединение Оксисоединения 6
39 Пентаоксид ванадия Перекись водорода (Определение азота по Кьельдалю) Окисление Окисление и восстановление Ацетальдегид Азотсодержащие соединения 25 14
40 Цинк (П) Перманганат Окисление Кумарин 18
ной на титровании и применяемой для анализа смесей органических соединений) содержится в следующих двух работах:
L a i t i n e n H. B., Reaction rates in chemical Analysis, Me Graw-Hill Book Co., New York, 1960, p. 452—460;
Mark H. B., Papa L. J., R e i 1 1 e у C. N., Reaction rate methods, Advances in Analytical Chemistry and Instrumentation, V. 2, Interscience Publishers, New York, 1963, p. 255—385, особенно p. 332—359.
5. ОПРЕДЕЛЕНИЕ КОНЕЧНОЙ ТОЧКИ ТИТРОВАНИЯ
Большинство методов прямого титрования, которыми заканчиваются косвенные методы определения, основано на использовании неорганических реагентов. В тех случаях, когда в конце определения титруют продукт реакции, то и он часто является неорганическим еществом (например, Fe11) в реакциях окисления железом (III). Детали таких процессов здесь не приводятся, так как они относятся (см° ласти неорганического анализа. Как уже указывалось ранее оПпеСТР' 15). если непосредственно титруемый в последней стадии описделения ПР°ДУКТ — органическое соединение, метод титрования ветстп В ПеРвом томе данной книги в разделе, где говорится о соот-
Ующем титранте, применяемом в этом случае титрования.
21
РЕАКЦИИ, применяемые в косвенных методах ТИТРОВАНИЯ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Большинство известных реакций, применяемых в методах прямого титрования, используется также в косвенных методах титрования, но в неодинаковой мере, что обусловлено различной скоростью реакции. Например, реакции нейтрализации в кислотно-основных методах титрования почти всегда протекают настолько быстро, что их можно использовать в методах прямого титрования, и нет особой необходимости применять косвенные методы титрования. С другой стороны, реакции, протекающие с малой скоростью (например, реакции конденсации), мало применяются в прямом титровании, но широко используются в косвенных методах титрования. Поскольку в косвенных методах титрования могут быть использованы реакции, протекающие с меньшей скоростью, перечень применяемых реакций и реагентов в этом случае сильно расширяется по сравнению с методами прямого титрования.
Реакции, подобные реакциям окисления, восстановления, гидролиза и конденсации, можно совершенно точно отличить от других реакций, в ряде же случаев возникают трудности в определении типа протекающей реакции. Вследствие этого возникает путаница в классификации таких реакций.
Несмотря на подобные неопределенности, в этой книге предпринята попытка классифицировать и объяснить реакции, на которых основаны косвенные методы титрования органических веществ (табл. 2).
Таблица 2. Некоторые типы реакций, применяемых в косвенных методах титрования органических соединений
Определяемые вещества и функциональные группы; реакции Возможные случаи классификация Классификация, принятая в данной книге
Соединения, содержащие -ОН-, SH-, >сн-, >ИН-группы, реагирующие с Agi и Hgn Осаждение оснований кислотами, например пикриновой кислотой Реакция ионного обмена: RS" + Ag+ -> RSAg или замещения атома водорода: RSH+Ag+ -> RSAg+Н+ Реакция присоединения: В + НХ -> [В н+] х- Реакция ионо-молекулярного обмена: В+Н++ X' ->[В-Н*] х-Реакция ионного обмена, если реакция протекает быстро: В + Н+ -> [В Н+ ] (сопровождается образованием соли) [В Н+1+ X- ->[В-Н+]Х" Ионный обмен в щелочных растворах; замещение — в кислых Классификация зависну от степени диссоциации кислоты и от сравнительных скоростей двух реакций, протекающих в третьем случае. Реакции ионного и ионо-молекулярного обмена классифицируются здесь вместе
22
Продолжение
*и Лункциоиальиые группы; реакции Возможные случаи классификации Классификация, принятая в данной книге
или образованием комплексного соединения, если стехиометрия последней реакции более сложна
Кислотно-основные титрования («нейтрализация» или «замещение») Реакция ионного или ионно-молекулярного обмена Классифицируются как одно и то же (в косвенных методах очень мало примеров таких реакций)
Нитрилы, реагирующие с водой: RCN + Н2О -> -» RCONH2 -» RCOOH + NH3 Присоединение или гидролиз (?) Гидролиз, так как в количественных методах анализа реакция не останавливается на стадии образования амида
Реакция Цейзеля: ROR' + HI -> -* ROH + R'l Восстановление, деалкилирование, гидролиз Деалкилирование
Галогениды, реагирующие с кислотами или щелочами: X — Hal + Н2О -» -» X — ОН + ННа! Гидролиз или замещение галогена (?) Гидролиз
ROH+ R'COCl -> -* R'COOR + НС] Образование сложного эфира или замещение галогена (?) Обе реакции
RNH2+ R'COCl -» -♦ R'CONHR + НС1 Образование амида или замещение галогена Обе реакции
= c< H2 -* >CH — CH< Присоединение или восстановление (?) Обе реакции
>c = c< + o3-> - >C - 0 - c< Присоединение или окисление (?) Обе реакции
Xo-O/
>c = C< + + RCOOOH -- >C - c<
0 Z.Nr± R -Hal --* (-N+r _) Hal-4’7 +R — Hal -> кЙХа™ + пи«Риновая талХ ПИКрат>) наФ-ни°н7епри"+диГиТо-единения» ДУКТ ™РИС°- Присоединение или образование комплекса (?) Присоединение для первых двух случаев; образование комплекса для остальных
23
В следующих ниже таблицах под их названиями, соответствующими принятым названиям реакций, приведены сведения о том, насколько часто применяются те или иные реагенты в методах прямого и косвенного титрования.
1. РЕАКЦИИ ОКИСЛЕНИЯ
Реакция окисления наиболее широко применяется в косвенных методах титрования органических веществ; поэтому в данной книге! содержится около 1500 литературных ссылок на работы в этой области химии.
Таблица 3. Реакции окисления
Реагенты в косвенных методах титрования Реагенты в прямых методах титрования Приблизительное число литературных ссылок
Реагенты, содержащие иод Бихромат Медь (11, Реагенты, содержащие бром; Медь (II) Свыше 250 200—250 150—200 100—150
гексациаиоферрат (III); перйодат и иодная кислота; перманганат Церий (IV); и о дат; ртуть (II) Реагенты, содержащие бром; 50—100
Перекись водорода; серебро (I) церий (IV); гексацианофер-рат (III); иодат; иод; перманганат Бихромат; реактив Тильмана 25—50
Галогениды («активные»); сви- Реагенты, содержащие хлор 10—25
нец (IV); молибден и вольфрам (VI); органические перкислоты; ванадат; нингидрин Хлорат; хлорит; хлор; краси- (включая гипохлорит); красители; галогениды («активные»); монохлорид иода; железо (III) Трихлорид золота; медь (III); 5—10
тели; железо (III); марганец (IV); персульфат; двуокись селена Мышьяк (V); медь (III); хлориды иода и т. п.; иодбензоат; манганат; марганец (III); озон; реактив Тильмана; тетратионат перйодат Меньше 5
Как и следовало ожидать, бихромат, реагенты, содержащие! бром и иод, церий (IV), медь (II), гексациаиоферрат (III), иодат и перманганат, широко применяют как в косвенных, так и в прямых методах титрования. Вместе с тем наблюдается заметная разница! в степени использования указанных реагентов в обоих методах. Так, перйодат, ртуть (II), перекись водорода и серебро (I) в косвенных методах титрования используют в качестве окислителей гораздо
чем в прямых (по-видимому, два последних окислителя больше,прИМеняют в прямых методах титрования). С другой сто-воооше акТИВ Тильмана и монохлорид иода применяют главным об-Км в методах прямого титрования.
Р Естественно, методами косвенного титрования по сравнению методами прямого титрования можно определять-гораздо большее число функциональных групп и классов соединений; косвенными методами определяют: спирты, полиспирты, полифенолы, карбоновые и поликарбоновые кислоты, оксикислоты, альдегиды (в том числе сахара), производные гидразина и многие серосодержащие соединения, подобные меркаптанам.
2. РЕАКЦИИ ВОССТАНОВЛЕНИЯ
Известно около 400 литературных ссылок, относящихся к методам определения, основанным на реакциях восстановления (табл. 4).
Таблица 4. Реакции восстановления
Реагенты в косвенных методах титрования
Реагенты в прямых методах титрования
Приблизительное число литературных ссылок
Йодиды и иодистоводородная кислота
Металлы
Титан (III) Олово (II) Железо (II); тиосульфат
Мышьяк (III); хром (III); газообразный водород; ванадий (II)
Алюминий-и боргидриды; карбоновые кислоты; дитионит; электролитическое восстановле-ние; меркаптаны; молибден (III); сульфиды
Титан (III) Дитионит; железо (II); тиосульфат; ванадий (II) Аскорбиновая кислота; хром (II); электролитическое восстановление; газообразный водород; литий-алюминий гидрид; сульфид; олово (II)
150—200
100—150 50—100 25—50
10—25
5—10
Меньше 5
наиболее ши-
В качестве титрантов в обоих методах титрования ле™ у,Е?м®няют соединения титана (III) и, в меньшей степени, же-а Олово (II), металлы и, кроме того, иодистоводородную ЛотУ Г0РазД° чаще применяют в косвенных методах титрования — в пп™ЧеСКИ послеДние Два реагента, очевидно, вообще не применяют тпп£^МЫХ мет°Дах титрования (металлы едва ли подходят для медов прямого титрования).
25
3. РЕАКЦИИ ПРИСОЕДИНЕНИЯ
Реакции присоединения (наряду с реакциями гидролиза) используются в косвенных методах титрования чаще, чем другие реакции (кроме реакции окисления). Методам с применением этих реакций посвящено 600—700 литературных ссылок (табл. 5).
Таблица 5. Реакции присоединения
Реагенты в косвенных методах титрования Реагенты в прямых методах титрования Приблизительное число литературных ссылок
Реагенты, содержащие бром, би- 150—200
сульфит и сульфит Хлориды иода и т. п. Реагенты, содержащие бром 50—100
Хлористоводородная кислота; Неорганические галогениды 25—50
малеиновый ангидрид; спирты (в неводных растворах) 10—25
Амины; цианид; иод; ртуть (II);
органические перкислоты; тиоцианат Аммиак; карбоновые кислоты; Реагенты, содержащие хлор 5—10
реагенты, содержащие хлор; бро-мистоводородная кислота;" иоди-ды и иодистоводородная кислота; меркаптаны; нитрилы; хиноны; тиосульфат Тиомочевина Меньше 5
Реагенты, содержащие бром, одинаково часто применяют как в косвенных, так и в прямых методах титрования (почти исключительно для титрования олефинов); большинство других реагентов используется преимущественно в косвенных методах титрования. Например, реагенты: бисульфит — сульфит (реакция присоединения, протекающая главным образом с соединениями, содержащими карбонильные группы), хлористоводородная кислота (взаимодействие с а-эпоксидами), малеиновый ангидрид и хиноны (взаимодействие с соединениями, содержащими цепи С=С—С=С), синильная кислота (взаимодействие с С=О-группами), спирты (взаимодействие с сероуглеродом), аммиак и амины (взаимодействие с С=О- и —N=C-группами в изоцианатах и изотиоцианатах), едва ли применяются в методах прямого титрования. Кроме того, следует отметить, что некоторые реагенты, используемые для определения олефинов, такие, как монохлорид иода, иод, соединения ртути (II), органические перкислоты и тиоцианат, чаще применяются в косвенных методах титрования.
Методы прямого титрования, основанные на использовании неводных растворов неорганических галогенидов, применялись главным образом в физико-химических исследованиях, поэтому неудивительно, что эти методы практически не применяются в косвенных методах титрования.
26
4. ГИДРОЛИЗ
Реакции гидролиза (наряду с реакциями присоединения) наиболее сто применяются в косвенных методах титрования (в этом отношении они уступают лишь реакциям окисления). В книге указывается свыше 600 работ, в которых описаны методы, основанные на реакциях гидролиза. Только в ограниченном числе случаев (когда имеют дело с весьма реакционноспособными веществами, подобными ангидридам кислот) гидролиз проводят в водной среде или в соответствующем нейтральном растворе (известно около 20 примеров таких реакций). В большинстве случаев гидролиз протекает в щелочных (около 500 ссылок, см. «Щелочи») или кислых средах в присутствии хлористоводородной, азотной, фосфорной и серной кислот (около 200 примеров) или сульфоновых кислот (около 15 примеров), оказывающих каталитическое действие.
В косвенных титриметрических методах подвергают гидролизу, в основном, следующие связи:
С—О — в сложных и некоторых простых эфирах, ангидридах, ацеталях и кеталях* полисахаридах;
С—N — в амидах;
С—Hal — во многих галогенидах;
С=Ь] — в продуктах конденсации карбонильных соединений с реагентами, содержащими —NHa-группы, подобных производным гидразина и гидроксиламина;
C = N — в нитрилах.
Менее часто гидролизуют следующие связи:
С—S — в некоторых сульфоновых кислотах;
С—Me (металл) — во многих элементоорганических соединениях, в состав которых входят мышьяк, висмут, германий, свинец, ртуть, а также кремний;
S—N — в сульфамидах;
S—CI — в сульфонилхлоридах.
Неожиданным является то, что практически неизвестно примеров прямого титрования, основанного на реакциях гидролиза (это было констатировано еще в первом томе данной книги). Естественно предположить, что реакционноспособные галогенангидриды, ангидриды или легкогидролизуемые сложные эфиры типа оксалатов могли бы служить определяемыми объектами методов прямого титрования. Во всяком случае этот факт, вероятно, наиболее ярко демонстрирует разницу между реакциями, применяемыми в прямых и косвенных методах титрования.
5. РЕАКЦИИ ИОННОГО И ИОНО-МОЛЕКУЛЯРНОГО ОБМЕНА
куляпК ^Ь1ло Указано выше (стр. 23), реакции ионного и ионо-моле-когоп °Г0 °^мена объединены вместе. Это позволяет избежать не-сравне16 их классификации. В табл. 6 приведены для
а первом5* Реакции <<нейтрализации» и «замещения», описанные ранее
27
Таблица 6. Реакции ионного и ионо-молекулярного обмена
Реагенты в косвенных методах титрования Реагенты в прямых методах титрования Приблизителен число литературных ссылок
Хлорная кислота Щелочи, серебро (I) Алкоксиды Свыше 300 150—200 100—150
Иод (Ig’); серебро (I) Кальций; нитрофенолы; тиоцианат Хлористоводородная кислота Ртуть (II); гидроокиси четвертичных аммониевых оснований; сульфоновые кислоты; поверхностно-активные вещества 50—100 25—50
Амины; бихромат; висмут (III); кадмий; медь (II); никель (II); хлорная кислота; калий; тетра-фенилборат Амины; карбоновые кислоты; медь (II); красители; галогениды в неводных растворах; свинец (II); пикриновая кислота; цинк 10—25
Аммиак; барий; карбоновые кислоты; гексацианоферрат (III); свинец (II); ртуть (II); фосфорная кислота; серная кислота; цинк Щелочи; гексацианоферрат (II); гидразины; бромистоводородная кислота; хлористоводородная кислота; иодат; железо (III); ртуть (I); перйодат; натрий; сульфид; поверхностно-активные вещества Аммиак; барий; электролитически генерируемые кислоты и основания; галогенидные комплексные анионы; иод (Ер; железо (Ш); никель (II); серная кислота; тетрафенилборат 5—10 Меньше 5 1
Реакции «нейтрализации» и «замещения», характеризующие^ большой скоростью и применяемые для определения кислот, осип авний и солей, образованных анионами слабых кислот и катионах слабых оснований или катионами сильных оснований и анионами ел: бых кислот, представляют собой идеальные примеры реакций, и пользуемых в методах прямого титрования.
Небольшое число известных примеров определений, осуществля мых косвенными методами титрования с применением этих реакта объясняется тем, что данные методы применяются лишь в тех сл чаях, когда анализируемые образцы отличаются малой раствор! мостью, т. е. когда анализируемое вещество приходится выдерж вать достаточное время в контакте с реагентом.
Большинство реакций ионного или ионо-молекулярного обмен сопровождается образованием продуктов, отделяемых от реакционно смеси путем фильтрования или дистилляции. Иногда некотор^ из этих продуктов самопроизвольно разлагаются (например, кса'4 тогеновые кислоты).
28
к видно из табл. 6, соединения серебра широко применяются методах прямого, так и косвенного титрования. Иод (точнее, КЭК одид-ионы) наиболее широко применяется в косвенных методах трИоования, в то время как соединения ртути (II) и поверхностноактивные вещества шире используются в методах прямого титро-БаНВыше уже было указано (стр. 28), что иногда трудно отличить реакции ионного и ионо-молекулярного обмена и замещения водорода и даже реакции присоединения от комплексообразования. Вследствие этого указанная классификация, по крайней мере частично, является неполноценной, в особенности применительно к реакциям висмута (III), ртути (II), серебра (I) и тиоцианата.
Известно приблизительно около 450 литературных ссылок, посвященных указанным типам реакций, т. е. приблизительно столько, сколько опубликовано работ по применению реакций восстановления.
6. РЕАКЦИИ ОБМЕНА (ЗАМЕЩЕНИЯ) ВОДОРОДА
Следует иметь в виду, что приводимая здесь классификация рассматриваемых реакций отличается известной условностью. Общее число косвенных титрований, основанных на применении этих реакций, составляет 350—400 примеров (табл. 7).
Таблица 7. Реакции обмена (замещения) водорода
Реагенты в косвенных методах титрования Реагенты в прямых методах титрования Приблизительное число литературных ссылок
Реагенты, содержащие бром 150—200
Реагенты, содержащие 50—100
Галогениды (активные); иод; серебро (I) бром 25—50
Медь (II); хлориды иода и т. д Ртуть (II) Серебро (I) 10—25
Арминий- и боргидриды; кальций; Иод 5—10
™сдь ц;, реагенты, содержащие хлор Амид натрия; тиоцианат Менее 5
ппг,^ П0м°Щью реакций обмена ^пределены следующие группы:
~ ос°бенно в ароматических и
__gpj__в спиртах и фенолах;
особенно в меркаптанах;
п ~ в аминах.
(замещения) водорода могут быть гетероциклических соединениях;
29
В косвенных методах титрования, основанных на реакциях с мена (замещения) водорода, возможно успешное использован активных галогенидов, подобных хлорангидридам и хлорамина
7. РЕАКЦИИ КОНДЕНСАЦИИ
(В этот раздел не включены методы прямого получения сложи] эфиров.)
Таблица 8. Реакции конденсации
Реагенты в косвенных методах титрования Реагенты в прямых методах титрования Приблизитель число литературны ссылок
Гидроксиламин Карбонильные соединения; гидразины Ксантгидрол Аммиак Амины; фенолы Гидразины Альдегиды; амины; гидроксиламин 150—200 25—50 10—25 5—10 До 5
Реакция конденсации, особенно соединений с карбонильньи группами (как в качестве определяемой группы, так и в качест реагента), наиболее широко используется в косвенных методах ти рования (цитируется около 250 литературных ссылок).
8. РЕАКЦИИ ЭТЕРИФИКАЦИИ И ПЕРЕЭТЕРИФИКАЦИИ
Реакции этого типа протекают слишком
медленно, поэтому
реже применяются в методах прямого титрования. Косвенные тит]
метрические определения основываются на следующих реакциях:
ROH + R'COOH -> R'COOR + Н2О
ROH + R'COCI R'COOR + HCI
или
ArOH + (R'CO)2O R'COOAr+ R'COOH
Каждый из партнеров указанных выше реакций использует как реагент для определения другого.
На реакциях этерификации основаны некоторые определен спиртов (большей частью низших представителей алифатическ: спиртов) с помощью бромистоводородной, хлористоводородной азотистой кислот.
В таблицах приведено около 200 литературных ссылок, из 5 торых около двух третей посвящены использованию в качестве I агентов ангидридов.
При переэтерификации (приблизительно 15 случаев) в случ взаимодействия высококипящего эфира с низкомолекулярным сп«1
30
ТОМ Б тучие
присутствии кислотного катализатора образуются легколе-сложные эфиры:
RCOOR' + R"OH RCOOR" + R'OH
(обычно метиловый или этиловый эфир)
Легколетучий эфир непрерывно отгоняют и затем определяют известными методами.
9. РЕАКЦИИ КОМПЛЕКСООБРАЗОВАНИЯ
Некоторые реагенты, представленные в табл. 9, описываются и в других разделах. Это объясняется тем, что часто природа реакции точно неизвестна.
Таблица 9. Реакции комплексообразования
Реагенты в косвенных методах титрования Реагенты в прямых методах титрования Приблизительное число литературных ссылок
Ртуть (II); нитрофенолы; тиоцианат Галогениды (неорганиче- 25—50
Висмут (III); кадмий; медь (II); серебро (1) ские) в неводных растворах. Гетерополикислоты молибдена (VI) и вольфрама (VI) Медь (II); ртуть (II) 10—25
Дитизон; молибден (VI) и воль- Иод; железо (III) 5—10
фрам (VI) Медь (I); гексацианоферрат (II); иод; Меньше 5
монохлорид иода и т. д.; железо (III) Об этих разнообразных рег тентах мало что мог кно сказать;
по поводу их известно около 200 спорных замечаний.
10. РЕАКЦИИ, СОПРОВОЖДАЮЩИЕСЯ ОБРАЗОВАНИЕМ АМИДОВ Подобно реакциям этерификации, эти реакции используют для определения любого паптнепа:
любого партнера:
RNH2 + R'COCl R'CONHR + НС1
(NH3) (R'CONHJ
RNH2 + (R'CO)2 О -> R'CONHR + R'COOH
посвяГ°Дам ПРЯМОГО титрования с использованием этих реакций ссылокНО всего лишь четыре литературные ссылки и около 50 Шинств косвенным методам, основанным на амидообразовании (боль-с аминам°)ПРеДеЛеНИЙ хлоРангиДРВДов и ангидридов, реагирующих
31
11. РЕАКЦИИ ДЕАЛКИЛИРОВАНИЯ (ЭФИРОВ)
Широко распространенные и имеющие важное значение метод определения эфиров, содержащих низшие алкильные группы (Cq метильной до бутильной групп), с использованием реакций деалк лирования иодистоводородной кислотой рассматриваются отдельнаI хотя их можно было бы описывать в разделе, например, «Реакщ,, восстановления» или «Гидролиз».
Всего приводится около 60 литературных ссылок, посвященньц этому типу реакций.
12. РЕАКЦИИ ДЕГИДРАТАЦИИ
Под этими реакциями подразумеваются реакции, связанны с отщеплением воды от исследуемого соединения. Реакции конде.
сации и этерификации сгруппированы отдельно. Известно около 3 литературных ссылок, в двух третях из них в качестве катализатор указывается хлористоводородная кислота, в остальных — други
кислоты и кислотные агенты. В большинстве случаев этими методам определяют пентозы, дегидратирующиеся с образованием фурфурол а также некоторые спирты, дегидратирующиеся с образованием ол финов.
В методах прямого титрования этого типа реакции не применяются.
13. РЕАКЦИИ ОКИСЛЕНИЯ—ВОССТАНОВЛЕНИЯ
Реакции окисления — восстановления используются в двух типах определений: определение азота по методу Кьельдаля, когда органическое вещество окисляется и при этом образуются NHM ионы (дается около 20 примеров), и определения, основанные на реакции Канниццаро, используемой в 10 случаях для определен! альдегидов в присутствии щелочных катализаторов.
14. РЕАКЦИИ ОБМЕНА ГАЛОГЕНОВ
Атомы галогенов в галогенидах вступают в реакции обмена, к торые используются для определения этих соединений. Такого ра реакции со щелочами или с водой, катализируемые кислотами, р» сматриваются в разделе «Гидролиз». Для отщепления атомов галог нов используются и некоторые другие реагенты: спирты, аммиа амины, бисульфит, соединения меди (I), меркаптаны и тиосульфа Приводится от 20 до 25 литературных ссылок, больше половин которых посвящено использованию для этих целей аминов.
Расщепление С—Hal-связи идет настолько медленно, что ] нельзя использовать в прямом титровании. В первом томе к ни приводится лишь четыре примера определения Si—Hal-или Нё На!-св язей.
32
15. РЕАКЦИИ НИТРОЗИРОВАНИЯ
в этом разделе рассматриваются реакции диазотирования, ди-инирования (например, аминокислот, алифатических первичных аминов, амидов и даже гидразинов) и нитрозирования, например, вторичных аминов и фенолов. Все эти реакции прямо зависят от атаки органического соединения NO; -группой и основаны на взаимодействии с участием смеси нитрит—кислота, поэтому они объединены под одним названием. Описано около 20 примеров косвенного и около 150 прямого титрования (особенно часто применяются сравнительно быстро протекающие реакции диазотирования).
16. РЕАКЦИИ ДЕКАРБОКСИЛИРОВАНИЯ
Дается около 15 примеров определения (почти все относятся к анализу галактуроновых и глюкуроновых производных) путем декарбоксилирования в присутствии кислых катализаторов (главным образом хлористоводородной кислоты).
17. РЕАКЦИИ РАСЩЕПЛЕНИЯ S-S-СВЯЗЕЙ
Дисульфиды, дитиокарбаматы и другие соединения, содержащие S—S-группы, определяют с помощью реакций, протекающих с цианидами или сульфитами согласно уравнениям:
R — S — S — RCN~RSR + SCN-
R — S— S— R + SO2--> RS- + RSSO~
Приводится около 20 примеров.
18. РЕАКЦИИ РАСЩЕПЛЕНИЯ C-S-СВЯЗЕЙ
Бисульфитные соединения, образующиеся в процессе взаимодействия карбонильных соединений с бисульфитом, определяют путем расщепления С—S-связей цианидом или гидроксиламином:
RCHOH + CN" RCHOH 4- SO2-
I I 3
SO~ CN
или
RCHOH + NH2OH RCH = NOH + HSO~ + H2O
SO^
19. РЕАКЦИИ ОБРАЗОВАНИЯ КСАНТОГЕНАТОВ
Роуглепппл этого типа пРотекают при взаимодействии спиртов с се-3 -чередом в щелочном растворе:
ROH + CS2 + он- ROCS- + Н2О II S 2 м. р * - Эшворт
33
Обратное определение, в котором сероуглерод определяется п тем взаимодействия со смесью спирт—щелочь, рассматривают ц реакции присоединения.
К этой группе реакций можно отнести и определение амине основанное на аналогичной реакции сероуглерода, сопровоя ющейся образованием дитиокарбамата.
20. ДРУГИЕ РЕАКЦИИ
Немногим более 10 литературных ссылок имеется на метод основанные на следующих реакциях.
Реакции алкилирования. Диметилсульфат используется в тр, реакциях алкилирования, одна из которых протекает с фенолами и д с замещенными пиридиновыми производными, у которых в ходе 1 акции происходит разрыв кольца.
Реакции сочетания. С солями диазония, для определения nj имущественно фенолов. В первом томе данной книги было приведен около 25 примеров прямого титрования, основанного на реакция сочетания.
Реакции деполимеризации. Реакции деполимеризации испоть зуются для определения альдегидных полимеров, деполимеризуема под влиянием неорганических кислот (соляной, фосфорной и серной|
Реакции галогенов. Некоторые хлориды и бромиды реагируют с ио дидом с образованием свободного иода, вследствие разложения полу чаемых при этом неустойчивых иодидов.
Реакции Мейервейна—Пондорфа—Берлея. Имеется один приме! применения этой реакции для определения ацетофенона и произво. ных бензальдегида с помощью изопропилата алюминия*.
Реакции нитрования. Смесь азотная кислота—серная кислсЯ как нитрующий реагент используется для определения только 6ei зола. Реакция нитрования применяется при определении нитроэдль ров путем обработки их смесью серной и салициловой кислот, ни реакция сопровождается вторичным процессом — гидролизом эфире! с образованием азотной кислоты.
Реакции сульфирования. В большинстве случаев сульфирована применяют для того, чтобы улучшить растворимость некоторые соединений, прежде чем они будут обработаны другими реагентами.
Некоторые литературные ссылки на методы, основанные на р акциях, которые не уточнены и сложны, опущены и не вошли
* -Д' Реакция Мейервейна—Понндорфа—Верлея основана на восстановлен, альдегидов и кетонов изопропиловым спиртом в присутствии катализате) («зо-С3Н7О)3А1. При этом изопропиловый спирт окисляется в ацетон:
(СН3)2 CHOH + О -> (СН„)а со + н2о
Ацетон по мере образования медленно отгоняют в раствор гидроксиламингидр1 хлорида, избыток которого обратно оттитровывают известными способами.
Этим методом можно определить не только ацетофенон н производные бенв альдегида, но и другие карбонильные соединения, например, кротоновый альдег> СН3СН=СНСНО, восстанавливающийся до СН3СН=СНСН2ОН кротилово! спирта, и нитропроизводные кетонов, восстанавливающиеся до нитроспиртов'
34
Ь указанной классификации. Большинство из них относится ПеРе педелей ням металлоорганических соединений, подобных тетра-К свинцу ртутьорганическим соединениям и литийалкилам. Рас-Г.отнен физический процесс образования рацематов при определении ? и 1-тартрата с помощью оптического антипода и Са2+ в качестве реагента для получения нерастворимого рацемата кальция*.
ОБЛАСТИ ПРИМЕНЕНИЯ КОСВЕННЫХ МЕТОДОВ ТИТРОВАНИЯ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Рассматриваемые вопросы и литература. В книге приведено максимальное число литературных источников, опубликованных до конца 1963 г.; для более широко распространенных журналов аналитической химии материалы были использованы до середины
1964 г.
Примеры, рассматриваемые во второй части, так же как и в первой, иллюстрируют, главным образом, определяемые функциональные группы, классификацию определяемых соединений и области применения описываемых методов (например, в медицине, фармакологии, промышленности, сельском хозяйстве и т. д.). При составлении библиографических сводок проявлена тенденция к объединению старых (до 1910 г.) и более современных методов анализа (позже 1945 г.). Это позволяет установить сходство (например, использование одних и тех же реакций и реагентов) и различие в применяемых методах (например, замена гравиметрических методов
анализа методами, основанными на предварительном растворении
осадка и последующего титриметрического его определения).
Естественно, использовать все ссылки, относящиеся к данному методу, особенно основанному на применении широко используемых реагентов, невозможно. Поэтому из большого числа публикаций было отдано преимущество публикациям, посвященным определениям не-
насыщенности с использованием галогенов, особенно брома; карбонильных соединений с использованием гидроксиламина; сложных эфиров путем омыления щелочами; многих соединений, окисляемых бихроматом. Подобные исключения были допущены и в первом томе при описании прямого титрования красителя титаном (III) или аскорбиновой кислоты реактивом Тильмана.
Следующий список сознательных исключений был сделан с целью ограничить число примеров в разумных пределах.
Не включены методы элементного анализа, за исключением небольшого перечня определений азота по Кьельдалю, применяемых матераНаЛИЗе азотсО|ДеРжащих соединений в присутствии других
неог^еСКОЛЬК° пРимеР0В Дают представление об анализе материалов ____Ределенного состава, таких, как органическое вещество почв,
нений "таю,кМИМ° пеРечисленных выше реакций для анализа органических соеди-Же применяют и многие другие реакции (см. «Приложение»).^-
35
сточных вод и т. д.; кетонов в биологических жидкостях; молоко и т. п.
Ссылки на дискуссионные статьи или опущены, или приводятся в очень редких случаях.
Опущены ссылки на методы, основанные на предварительной биологической обработке анализируемого вещества, такие, как разложение под влиянием ферментов.
Методы, основанные на хроматографическом разделении, как правило, не рассматриваются, так как имеется много монографий и книг, в которых излагаются эти методы. Сравнительно небольшое число методов этого типа заканчивается титрованием.
Классифицирование приводимых данных. Классифицирование основано на том же самом принципе, какой был использован в первом томе данной книги, а именно: все реагенты расположены в алфавитном порядке (английский алфавит). Для каждого реагента отдельно в хронологической последовательности представлены литературные данные. Для каждого календарного года ссылки подобраны по алфавиту в соответствии с первой упоминаемой фамилией автора. При составлении списка литературных ссылок 1961—1964 гг. этот порядок местами нарушен из-за необходимости вставки новейших' сведений, которые добавились в последнюю минуту. Это было сделано для того, чтобы данные были как можно более современйыми. Помимо основного заголовка, соответствующего названию реагента, в раз-| делах имеются подзаголовки: реагенты; определяемые вещества, реакции, на которых основаны определения; условия реакций; последующая обработка и конечная стадия титрования. Там, где последующая обработка состоит из нескольких стадий, проводимых' до заключительного титрования, литературные ссылки даются в разделе, в котором описывается использованный реагент, если, конечно, он был применен для определения органического соединения! Ниж. приведены два примера, поясняющие это положение:
HCI Тиомочевииа — КД
I. ROH —-> RC1----------------------
(вторич-
ный или третичный)
/zNH2 1 + 3,5-Динитробензоат R — S — С С СР----------------------------»]
xNH2.
z/NH2-1+ Till!
R— S — C" [C6H3 (NO2)2COO]-----------------^Соответствующий амин
XNH2J (избыток TiHI определяют
методом обратного титрования)
Последовательные стадии обработки анализируемого вещества рассматриваются в разделах «Хлористоводородная кислота», «Тиомо-чевина», «Йодиды и иодистоводородная кислота», «Карбоновые кислоты и карбоксилаты» и «Соединения титана (III)»;
HI Бром I- — кислота
II. ROCHS—* СН31----НО~-------------» 12
(Выделившийся иод отти-тровывают тиосульфатом)
36
топом случае последующие стадии описываются в разделах «Ио-в° и иодистоводородная кислота» и «Реагенты, содержащие бром», ДИДпоследняя стадия не представлена в разделе «Йодиды и иодисто-И°дородная кислота» потому, что определяемый иодат — неорганическое соединение. Последние две стадии лишь кратко описаны в разделе «Реагенты, содержащие бром».
Последний пример иллюстрирует также и другую особенность классификационных данных. В тех случаях, в которых используют реагент, состоящий из двух (или более, что встречается редко) непосредственно участвующих в реакции компонентов, данный пример рассматривается во всех соответствующих разделах. В дополнение к первому примеру, основанному на применении смеси тиомочевина — KI, могут быть упомянуты другие примеры: спирты — кислоты для определений, основанных на переэтерификации, медь (II) — тиоцианат и серебро (I) — пикриновая кислота для определения оснований путем осаждения. Многие методы окисления и восстановления не приводятся под рубрикой кислот или щелочей, используемых при выполнении этих методов.
Соответствующие реагенты, где это возможно, сгруппированы вместе. Так, в разделе «Реагенты, содержащие бром», рассматриваются бром, бромат—бромид, хлорид брома и гипобромит; «Галогениды (активные)» включают хлорангидриды, сульфанилхлориды, N-бром-сукцинимид и т. д.; бисульфит и сульфит включены в один раздел, и Т. д.
Во вторую часть включены также разделы «Электролитическое восстановление», «Определение азота по Кьельдалю», «Физические методы» и «Пиролиз». Хотя в указанных разделах не рассматривается действие отдельных реагентов, это позволяет сгруппировать вместе сходные методы анализа и указать области их применения. Далее, много примеров, основанных на использовании реакций гидролиза, дегидратации, декарбоксилирования и деполимеризации, объединены в разделы под названием «Щелочи» и различные «Кислоты», например «Хлористоводородная кислота», «Серная кислота» и т. д. В этом случае название этих разделов, посвященных катализаторам, более точно отражает их содержание, чем название разделов, посвященных реагентам, но, как упомянуто выше в этом параграфе, такого рода классификация более удобна.
Детали в таблицах сведены к минимуму в целях экономии места, редварительная обработка, такая, как, например, депротонизация те?аЗЦ0Б биологических жидкостей или селективная экстракция ма-черИаЛОВ’ не приводится (во второй части под заголовком «Физи-обоаб6 Ме\оды>> пРивеДено лишь несколько примеров предварительной тРац °ТКИ ' В графе таблицы «Реагент и условия реакции» концен-и темИ Реагентов> как правило, не приводятся, хотя время реакции ДелениеРЗТУРа Указываются. В последней графе таблиц детали опре-испольЯ К0Не?Н0Й точки титрования не излагаются, упоминается лишь туре ЗУеМЫЙ метод и индикатор, если он указан в литера-
37
Определение концентрации реагента (в методах обратного тит рования) или проведение холостого или контрольного определения в отсутствие анализируемого вещества считается само собой разум,«_ ющейся операцией, поэтому в каждом отдельном случае об этом н: говорится.
Так же как в первом томе, за данными, собранными в отдельны заголовки, следует «Указатель функциональных групп и классов соединений». Здесь группы и классы расположены в алфавитном порядке (английский алфавит) в соответствии с названиями исподы зуемых реагентов.
В конце книги дан «Предметный указатель».
ЧАСТЬ 2
РЕАГЕНТЫ, ИСПОЛЬЗУЕМЫЕ В КОСВЕННЫХ МЕТОДАХ ТИТРОВАНИЯ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
1. КИСЛОТЫ
В качестве реагентов и составных частей реактивов, применяемых в косвенных методах титрования, в настоящее время используют около 30 кислот (в терминах Аррениуса). В их число входят неорганические кислоты; органические карбоновые и сульфокислоты и некоторые фенолы. В данной книге указанные кислоты не сгруппированы все вместе, хотя при рассмотрении их в отдельности неизбежны некоторые повторения. Рассмотрение всех кислот вместе представило бы большие неудобства для читателя. Поэтому здесь приводятся лишь некоторые общие положения о кислотах, приме
няемых в качестве реагентов в косвенных методах титрования.
Кислоты принимают участие во многих, почти во всех, типах реакций, используемых в объемном анализе. Все реакции, в которых кислоты играют важную роль, можно разбить на две большие группы.
1. Каталитические реакции, обусловливаемые влиянием ионов водорода, в которых анионы кислот обычно оказывают только вторичный эффект (например, влияют на скорость реакции). В этом случае применяют сильные минеральные (и органические сульфо-) кислоты, которые могут быть взаимозаменяемы без сколько-нибудь заметного влияния на результат их действия. Кислота в этих реакциях не расходуется (за исключением ограниченного числа случаев, когда продукт реакции присоединяет кислоту), поэтому заключительная стадия определения не завершается обратным титрованием кислоты.
К таким катализируемым реакциям относятся следующие ре
йх ГидР°лиз большого числа органических соединений по месту ХаРактерных химических связей. Некоторые из этих реакций к Речисляются в разделах «Хлористоводородная кислота», «Серная ота», представляющих собой два принципиально важных кис
39
или спиртов, в особенности
уроновых кислот
к а-эпоксидам.
Восстановление, например иодистоводородной кислотой. Конденсация, например дибензиловых эфиров с НО. рассмотренных выше случаях анион может входить в моле определяемого соединения (как, например, в первых трех ти
лотных реагента. Ниже приведены важнейшие химические связи гидролизующиеся под влиянием ионов водорода кислот:
С—О — в эфирах, ацеталях, полисахаридах;
С—N — в амидах, полиамидах, гидразинах, гексаметилентетрамине;
C=N — в продуктах конденсации карбонильных соединений с гидроксиламином гидразином ит. п.;
CsN — в нитрилах;
С—Hal — в некоторых галогенпроизводных;
С—Me — (металл) — в металлоорганических соединениях.
2) Деполимеризация, например метальдегидов.
3) Дегидратация, например пентоз третичных спиртов.
4) Декарбоксилирование, например туроновой, глюкуроновой и др.).
5) Присоединение (воды), например
6) Этерификация и переэтерификация с участием спирта.
2. Реакции, в которых кислоты расходуются и в которых непо средственную роль обычно играют анионы или неионизированньи (слабые) кислоты. Примерами таких реакций являются:
1) Сульфирование.
2) Нитрование.
3) Реакции присоединения (молекул кислот, например HCI или НВг, к олефинам или к а-эпоксидам).
4) Реакции ионного и ионо-молекулярного обмена, включающие в себя реакции «нейтрализации» при определении оснований.
5) Образование сложных эфиров (реакции, сопровождающиеся образованием эфира, в состав которого входит анион кислотного реагента).
6) Гидратация, например при определении уксусного ангидриш в процессе взаимодействия его со щавелевой кислотой.
7) Окисление, например иодной кислотой или перкарбоновыми кислотами.
8)
9)
В кулу пах приведенных выше реакций); полностью или частично превраЬ щаться в продукт реакции (например, восстановление, сопровожда ющееся образованием иода).
Так как кислота или анион расходуются, то оказывается воз можным оттитровать избыток реагента (кислоты) или оттитровать продукт реакции, образующийся в процессе взаимодействия аниона кислоты (например, как было указано выше, элементарный иод, яв ляющийся продуктом окисления аниона иодистоводородной кислоты)
В некоторых случаях кислота может образовываться в процесс^ взаимодействия реагирующих веществ; например, если берут соль и подходящую минеральную кислоту в качестве реагента, примером может служить образование иодистоводородной и иодной кислот из их солей. Вследствие этого в книге рассматриваются в качестве
40
ентов йодиды и иодистоводородная кислота, йодаты и иодная РеЯлота которые описываются вместе в соответствующих разделах. Для удобства классификации выделен раздел «Карбоновые кислоты и карбоксилаты».
Кислоты часто используют вместе с другими реагентами (для стабилизации реактивов), в особенности с реагентами, применяемыми в методах окисления — восстановления, например СгаО?', МпОД, V11, Fe11, Ti111 и Celv. Такого рода реагенты рассматриваются в разделах, соответствующих названию катиона или аниона.
2. СПИРТЫ
Реагент. В качестве титрантов, применяемых в методах обратного титрования, обычно используют метанол или этанол, редко высшие спирты.
Реакции, титруемые вещества и соответствующая обработка
1. Реакции присоединения (образование ксантогената) при определении CS2 (также COS):
CS, + ROH + ОН" —> ROCS- + Н2О
II
S
Эти реакции протекают быстро и обычно завершаются в течение нескольких минут при комнатной температуре.
Ксантогенат определяют в слабокислом растворе методом прямого титрования соединениями меди (II) или иодом (см. соответствующие разделы в первом томе этой книги), или путем предварительной обработки ксантогената указанными реагентами, а также хлорамином Т и последующего титрования их избытка иодометрически (см. соответствующие разделы в данном томе):
2ROCS" + 12 —> ROCSSCOR + Sill II II
S S S
или
2ROCS- + Cu2+ (ROCSkCu II II
s S
Реже применяемым методом определения ксантогената является колориметрический метод, основанный на измерении интенсивности оурои окраски соответствующей соли меди.
2. Реакции этерификации, используемые при определении СОРУ011 (особенно ацетильной группы). Различают три типа реакций, нуждающихся образованием сложных эфиров.
) Реакции с хлорангидридами и ангидридами:
ИЛи RCOC1 + R 'ОН —> RCOOR' 4- НС1
(RCO)2 О -|- R'OH —* RCOOR' + RCOOH
RNCOCH3 + C2H5OH RNH + О^СООС,^
41
Эти реакции протекают очень быстро, в течение не более 30 мин при комнатной температуре. Выделяющуюся при этом в эквивалент’ ном количестве кислоту титруют стандартным раствором щелочу Вследствие того что хлористоводородная кислота может содержать! I в виде примеси в исходном хлор ангидриде, а соответствующая карбоновая кислота — в виде примеси в исходном ангидриде, прел варительно проводят холостой опыт прямого титрования их щелочьЛ или титрования после предварительного гидролитического расщепления их водой (см. раздел «Вода»), Получаемая разность межд-двумя значениями объемов щелочи, пошедшими на титрование,I эквивалентна содержанию хлорангидрида или ангидрида, проое-агировавших со спиртом:
RCOC1 + Н2О —> RCOOH + НС1
(RCO)2 О + Н2О —> 2RCOOH
2) Реакции с карбоновыми кислотами и их солями: RCOOH + R'OH —> RCOOR' Н2О
В качестве кислотного катализатора, катализирующего эту реакцию, используют хлористоводородную, серную, фосфор кую кислоты, а также сульфокислоты или трифторид бора; для смещения равновесия слева направо непрерывно отгоняют эфир или воду образующиеся в процессе этерификации. В тех случаях, когда реакция протекает очень медленно, предварительно в течение опреде-* ленного времени кипятят смесь реагирующих веществ в колбе, снаб женной обратным холодильником. В этом случае конечную стадию определения можно завершать несколькими способами.
а) Омыление перегнанного эфира избытком щелочи и последу-! ющее титрование избытка реагента. Этот метод является наиболее широко применяемым (см. раздел «Щелочи»).
б) Омыление перегнанного эфира и последующее его окисление.1 Например: лактат окисляют в щелочной среде перманганатом;] окисление сопровождается образованием оксалата, который оса ждают в виде кальциевой соли и затем оттитровывают пермангана-| том в кислой среде;
формиат окисляют Hg11; образующуюся при этом Hg1 оттитро-j Бывают иодометрически;
оксалат окисляют перманганатом;
ацетат и сопутствующие ему примеси подвергают дифференциаль' ному окислению двумя бихроматными реагентами, один из которых окисляет все окисляемые компоненты дистиллята, за исключением ацетата, другой — окисляет также уксусную кислоту.
в) Титрование образующейся воды реактивом Фишера.
г) Определение расхода кислоты путем титрования щелочью образца до реакции и образовавшейся смеси после этерификации.
д) Реакции переэтерификации ацетильных групп в сложных эфирах и амидах в процессе взаимодействия с легколетучим спиртом:]
ROCOCH3 + СН3ОН —> ROH + СН3СООСН3
42
Таблица 10. Примеры использования спиртов
/й Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
1 Сеооуглерод (см. № 3, 4 6, 7, 10, 14, 16, 17, 19, 24, 26, 29, 30, 38, 39, 42, 47, 48, 50, 51, 56—58, 61, 65, 67) Поглощают раствором КОН в этаноле Уксусная кислота, титруют иодом (см. Том I, «Иод», литература 3) 1
2 О- и N-Ацетильные группы (см. № 5, 9, 11 — 13, 15, 20, 22, 23, 27, 34, 53, 62) Медленно перегоняют в H2SO4, смешанную с избытком этанола; около 45 мин — О-аце-тильные, более продолжительно N-аце-тильные группы В дистиллят (этилацетат) добавляют избыток стандартного раствора КОН, который оттитровы-вают раствором H2SO4 (см. «Щелочи», литература 11, 12, /4) 2
3 Сероуглерод (см. № 1) в бензольном расгворе или в нефтяном газе КОН в этаноле; 30 мин Уксусная кислота; добавляют избыток ацетата меди; непрореагировавшие ионы медн (II) определяют иодометрически [см. «Соединения меди (II)», литература 16] 3
4 Сероуглерод (см. № 1) в четыреххлористом углероде КОН в этаноле; 5 мин Добавляют уксусную кислоту до тех пор, пока не покраснеет фенолфталеин, прибавляют NaHCO3 и титруют иодом (см. Том I, «Иод», литература 18) 4
5 О- и N-Ацетильные группы (см. № 2) Этанол — п-толуол-сульфокислота — п-толуолсульфонат серебра (если присутствуют ионы галогенов); кипятят в колбе, снабженной обратным холодильником, а затем отгоняют этилацетат В дистиллят (этил-ацетат) добавляют избыток стандартного раствора NaOH, который оттитровы-вают кислотой (см. «Щелочи», литература 35 и 42) 5, 7
6 Сероуглерод (см. № 1), получаемый при кислотном гидролизе дитиокарбаматов (см №42, 47, 50, 51, 61, 65) и при восстановлении тиурамдисульфидов (см. № 50, 61) (тетраалкил-™УРаВДИсульфидов — IR2NCS2] S2) в процессе их определения Пропускают в этанольный расгвор КОН Титруют иодом 6
43
Продолжу
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования
7- Сероуглерод (см. № 1) в газах Поглощают этанольным раствором КОН Уксусная кислота; добавляют избыток стандартного раствора ацетата меди; непрореагировавшие ионы меди (II) определяют иодометрически
8 Ангидриды (см. № 43, 46) (Контрольный о Метанол; 30 мин кипятят в колбе, снабженной обратным холодильником пыт с водой — также Титруют NaOH гитруют NaOH)
9 О-Ацетильные группы (см. № 2) Этанол и п-толуол-сульфокислота; 15 мин кипятят в колбе, снабженной обратным холодильником, затем перегоняют В дистиллят (этил-ацетат) добавляют избыток стандартного раствора NaOH, который оттитровы-вают кислотой (см. «Щелочи», литература 75)
10 Сероуглерод (см. № 1) КОН в этаноле Добавляют уксусную кислоту до тех пор, пока не покраснеет фенолфталеин; титруют иодом в присутствии крахмала (см. Том I, «Иод», литература 33)
11 Ацетильные группы (см. № 2) в нитроацетилцеллюлозе; формильные группы в формилцеллю-лозе Этанол — фосфорная кислота; кипятят в колбе, снабженной обратным холодильником, затем перегоняют Дистиллят (этилфор-миат или ацетат) омыляют стандартным раствором щелочи (см. «Щелочи», литература 86)
12 О-Ацетильные группы (см. № 2) Этанол — п-толуол-сульфокислота; кипятят 15 мин в колбе, снабженной обратным холодильником, затем перегоняют В дистиллят добавляют избыток стандартного раствора NaOH, который от-титровывают кислотой (см. «Щелочи», литература 94)
13 О-Ацетильные группы (см. № 2) в жирах Этанол — п-толуол-сульфокислота В дистиллят добавляют избыток стандартного раствора NaOH, который обратно оттитровы-вают кислотой
8
9
10
11
>2
13
14
Литд
Рат-Ра
44
Продолжение
№ П/П Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
14 Сероуглерод (см. № 1) КОН в этаноле Титруют иодом 15
15 О- и N-Ацетильные группы (см. № 2) в озазонах (Метод’описан выше6 — "см. № 5)
16 Сероуглерод (см. № 1) в крови КОН в этаноле Титруют иодом 17
17 Сероуглерод (см. № 1) КОН в этаноле; 30 мин H2SO4 в присутствии фенолфталеина; добавляют избыток иода, который отти-тровывают тиосульфатом (см. «Реагенты, содержащие иод», литература 176) 18
18 Карбоновые кислоты В диоксане; метанол и BF3 Титруют реактивом Фишера 19
19 Сероуглерод (см. № 1) в смесях КОН в метаноле или этаноле Добавляют уксусную кислоту в присутствии фенол(}уга-леина; титруют иодом в присутствии крахмала 20
20 Ацетильные группы (см. № 2) Этанол и НС1; перегоняют В дистиллят добавляют избыток NaOH, который оттитровы-вают кислотой (см. «Щелочи», литература 133) 21
21 Уксусная кислота (см. № 60) в консистентных жидкостях Метанол; перегоняют В дистиллят (метилацетат) добавляют NaOH, образуется ацетат натрия; проводят дифференцированное окисление смесью Ag2Cr2O7— H2SO4, а затем К2Сг2О7—H2SO4 Разность между двумя титрованиями методом обратного титрования избытка эквивалентна содержанию ацетата (см. «Щелочи», литература 140, и «Бихромат и трехокись хрома», литература ПО) 22
45
Продолжен
№ п,п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Лит рат' Ра
22 Ацетильные группы (см. № 2) Этанол и H2SO4; перегоняют Дистиллят гидролизуют NaOH, полученный раствор ацетата натрия пропускают через ионооб-менник и титруют в элюате уксусную кислоту (см. «Щелочи», литература 148, «Иоиообмеиники», литература 1) 23
23 Ацетильные группы (см. № 2) в эфирах целлюлозы и дру! их полиоксисоединениях В метаноле; метаноловый раствор CH3ONa; кипятят 3 ч в колбе, снабженной обратным холодильником Избыток п-толуол-сульфокислоты; метилацетат перегоняют в избыток стандартного раствора щелочи; непрореагировавшую щелочь обратно от-титровывают кислотой (см. «Щелочи», литература 151) 24
24 Сероуглерод (см. № 1) в бензоле Этаноловый раствор КОН Титруют иодом 25
25 Уксусный ангидрид (см. Ns 33, 43, 59, 60) Этанол Титруют этаноловым раствором CgHgONa в присутствии фенолфталеина (контрольный опыт титруют прямо щелочью) 26
26 Сероуглерод (см. № 1) и сероокись углерода (см. № 30) в каменноугольном газе Поглощают спиртовым раствором КОН Определяют иодометрически 27
27 Ацетильные группы (см. № 2) в эфирах углеводов В метаноле; метаноловый раствор CH3ONa; около 15 мин\ перегоняют Избыток H2SO4; метил ацетат отгоняют в избыток стандартного раствора щелочи; непрореагировавшую щелочь от-титровывают кислотой (см. «Щелочи», литература 156) 28
28 Ацетат натрия в красителях Этанол и п-толуол-сульфокислота; перегоняют В дистиллят (этил-ацетат) добавляют избыток раствора щелочи, который оттитровывают кислотой 29
46
Продолжение
Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
Сероуглерод (см. № 1) в четыреххлористом углероде КОН в этаноле; 30 мин Уксусная кислота в присутствии фенолфталеина; добав- ляют этанол, титруют иодом биамперометрически (см. Том I, <Иод», литература 53) 30
Сероуглерод (см. № 1) и сероокись углерода (см. № 26) в каменноугольном газе Поглощают спиртовым раствором КОН Определяют иодометрически 31
Ацетилсалициловая кислота NaOH в этаноле; перегоняют В дистиллят добавляют избыток стандартного раствора NaOH, который от-титровывают кислотой 32
Муравьиная кислота в вине Метанол в присутствии НС1; медленно отгоняют В дистиллят (метил-формиат) добавляют избыток NaOH; испаряют и формиат окисляют HgCI2 и иодомегрически титруют образующуюся HgCl [см. «Соединения ртути (II)», литература 95; «Щелочи», литература 192] 33
Уксусный ангидрид (см. № 25) Метанол (Холостой опыт с во; щело Титруют щелочью ЮЙ — также титруют чью) 34
О- и N-Ацетильные группы (см. № 2) Этанол и НС1, кипятят в колбе, снабженной обратным холодильником; при определении О-аце-тильных групп 2 ч, N-ацетильных — более продолжительное время; перегоняют В дистиллят добавляют избыток стандартного раствора щелочи, который оттитровывают кислотой (см. «Щелочи», литература 203) 35
Ацетилены (RC = СН и RC = CR) Метанол — BF3— HgO; 75—НО мин при 25°С (Образуются кетали) Кетали гидроли- зуют в кетоны, затем титруют гидроксиламином (см. «Гидроксиламин», литература 73) 36
47
Продолжение
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Лите-рату. ра
36 Молочная кислота в продуктах сахарной промышленности Метанол — H2SO4; перегоняют В дистилляте метил-лактат омыляют, окисляют в щелочном растворе перманганатом до оксалата, осаждаемого в виде кальциевой соли, и затем титруют перманганатом в кислом растворе (см. «Перманганат калия», литература 87 \ «Соединения кальция», литература 23\ «Щелочи», литература 22/) 37
37 Алкилроданидсиланы (C2H5hSi(SCN)4_n Этанол 95%-ный (Образуется HSCN) Титруют NaOH в присутствии фенолфталеина 38
38 Сероуглерод (см. № 1) в низкокипящих фракциях легких масел КОН—спирт—бензол; 3 ч Обрабатывают водным раствором, содержащим ксантоге-нат; добавляют избыток стандартного раствора иода и уксусную кислоту. Непрореагировавший иод оттитровывают тиосульфатом (см. «Реактивы, содержащие иод», литература 270} 39
39 Сероуглерод (см. № 1) в воде КОН в этаноле; 30 мин Подкисляют, добавляют избыток стандартного раствора иода, который оттитровывают тиосульфатом (см. «Реактивы, содержащие иод», литература 272) Ю
40 Жирные кислоты (см. № 49) в присутствии смоляных кислот н-Бутанол—бензол— бензосульфокислота; 60—90 мин при 125° С (Для сдвига равновесия образующуюся воду перегоняют в ловушку) Титруют КОН потенциометрически или индикаторным методом. Холостой опыт 41
41 Фталевый ангидрид (см. № 43) в глифталевых смолах В 5% -ном ацетоне; метанол Титруют спиртовым раствором КОН в присутствии фенолфталеина. Проводят холостое титрование 42
48
Продолжение
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
42 Сероуглерод (см. № 1), образуемый прн кислот ном гидролизе дитиокарбаматов (см. № 6) в процессе их определения Перегоняют в метаноловый раствор кон Добавляют уксусную кислоту в присутствии фенолфталеина, титруют иодом в присутствии крахмала (см. Том I, «Иод», литература 66) 43
43 Ангидриды (см. № 8), например уксусный (см. № 25), малеиновый, фталевый (см. Я» 41) в присутствии соответствующих кислот В ацетоне; метанол (при проведении контрольного опыта добавляют избыток водного раствора КОН) Титруют спиртовым раствором КОН (в контрольном опыте титруют НС1) 44
44 Хлорангидрид монокарбоновой кислоты (см. № 54), выделенной из цветов Chrysanthemum Sinense) Метанол; не более 5 мин Образующуюся НС1 титруют метаноловым раствором КОН в присутствии ди метилового желтого и метиленового голубого 45
45 46 47 Щавелевая кислота в растениях Ангидриды (см. № 8) Сероуглерод (см. № 1), образуемый при кислотном гидролизе дитиокарбаматов (см. № 6) в процессе их определения Спирт—H2SO4; перегоняют Безводный метанол и безводный пиридин; 30 мин, иногда Кипятят 15 мин в колбе, снабженной обратным холодильником (При проведении хо. ляют пиридин и вод (Метод описан вьи Эфир, перегоняют и омыляют; образующийся оксалат титруют в кислой среде перманганатом Титруют раствором NaOH в присутствии фенолфталеина тостого опыта добав-у — титруют NaOH) ле 43 — см. № 42) 46 47 48
48 Сероуглерод (см. № 1) КОН в этаноле Титруют ацетатом меди при pH 5,8—7 (предварительно прибавляют разбавленную уксусную кислоту) [см. Том I, «Соли меди (И)», литература /23] 49
49
Продолжрцц
№ п/п
Титруемое вещество
Реагент и условия реакции
Соответствующая обработка и конечная стадия титрования
Лит|„ Рату
Ра
49
50
51
52
53
54
55
Жирные кислоты (см. № 40) в присутствии смоляных кислот
Сероуглерод (см. № 1), образуемый при кислотном гидролизе дитиокарбаматов (см. № 6) и восстановлении тиурамдисульфида (см № 6) в процессе их определения Сероуглерод (см. № 1), образуемый при кислотном гидролизе дитиокарбаматов (см. № 6) в „процессе их определения Метилольные группы в аминоформальдегид-ных смолах
Ацетильные группы (см. № 2) в аспирине и других медикаментах
Хлорангидриды в диоксановом растворе (см. № 44, 55, 64)
Хлорангидриды чистых кислот (см. № 54)
Бутанол—бензол— H2SO4; 30 мин-, кипятят в колбе, снабженной обратным хо-
Титруют КОН
лодильником
(Модификация метода, описанного выше 41, — см. № 40)
КОН в спирте
КОН в спирте
Метанол—НС1; 10 мин
Этанол—H2SO4; 1 ч кипятят в колбе, снабженной обратным холодильником; перегоняют
Этанол; 5—10 мин при 80° С
Безводный этанол; 5 мин при 100° С
Титруют иодом в присутствии крахмала (см. Том I, «Иод», литература 103)
Титруют иодом
Безводный метанол; титруют реактивом Фишера
В дистиллят добавляют избыток стандартного раствора КОН, который оттг тровывают кислотой (см. «Щелочи», литература 370)
Титруют бензольно-метаноловым раствором CH3ONa в присутствии тимолового голубого
Охлаждают льдом и титруют выделившуюся НС1 в присутствии метилового красного, а свободную карбоновую кислоту в присутствии фенолфталеина. Добавляют избыток щелочи, нагревают. Непрореагировавшую щелочь оттитровы-вают кислотой (см. «Щелочи», литература 202, 424)-, таким путем определяют содержание эфиров, эквивалентное содержанию хлоран-гидридов
50
51
52
53
54
55
56,53
50
Продолжение
.м п/п Титруемое вещество Реагент н условия реакции Соответствующая обработка н конечная стадия титрования Литература
56 Сероуглерод (см. № 1) КОН в спирте; Экстрагируют водой, 57
57 в бензоле Сероуглерод (см. № 1) 10—15 мин КОН в этаноле добавляют уксусную кислоту в присутствии фенолфталеина; титруют иодом в присутствии крах-мала Избыток хлорами- 58
58 Сероуглерод (см. № 1) КОН в спирте на Т, который отти-тровывают иодом [см. «Галогениды (активные)», литература 65] Добавляют уксус- 60
59 Уксусный ангидрид н-Пропанол—пири- ную кислоту при pH 5 4—5,8. Титруют иодом в присутствии крахмала (см. Том I, «Иод», литература 123) Титруют раствором 61
60 (см. № 25) Уксусный ангидрид (см. дин (85 : 15) несколько минут (при проведении контрольного опыта добавляют воду и пиридин) Этанол; 1 мин (при NaOH в присутствии фенолфталеина (в контрольном опыте титруют раствором NaOH) Титруют потенцио- 61
61 № 25); уксусная кислота (см. № 21) и избыток триэтиламина в толуоле Сероуглерод (см. № 1), проведении контрольного опыта добавляют воду) КОН в метаноле метрически раствором H2SO4 (в контрольном опыте титруют H2SO4) Добавляют уксус- 62
62 образуемый при кислотном гидролизе дитиокарбаматов (см. № 6) и восстановлении тиурам-Дисульфидов (см. № 6) в процессе их определения в сырьевых продуктах Ацетильные группы (см. № 2) в ацетилированном полиформальдегиде Фосген в смеси с CHCL и т. п. Метанол и НС1 ную кислоту в присутствии фенолфталеина; титруют иодом в присутствии крахмала (см. Том I, «Иод», литература 125) Метилацетат отго- 63
63 Этанол (свободную НС1 предварительно от-титровывают этим же титрантом) няют и определяют омылением избытком NaOH Выделившуюся НС1 титруют бензольным раствором пирамидона 64
51
Продол wewJ
№ п/п Титруемое вещество Реагент н условия реакции Соответствующая обработка и конечная стадия титрования «Ш/т Рату Da
64 Хлорангидриды кислот (см. № 54) В бензоле; безводный метанол; 10 мин при 60—65° С Титруют бензольным раствором пирамидона в присутствии диметилового желтого 65
65 Сероуглерод (см. № 1), образуемый при кислотном гидролизе в процессе определения дитиокарбаматов (см. № 6) (Метод описан выше *а — см № 42) 66
66 2,4-Ди нитрофениловые тиоэфиры, образующиеся при определении меркаптанов в нефтепродуктах в процессе их взаимодействия с 2,4-динитрохлорбензолом Изопропанол (выделяются меркаптаны) Титруют Ag+ в аммиачной среде • 67
67 Сероуглерод (см. № 1) КОН в этаноле К аликвотной части (в 2 н. растворе КОН) добавляют избыток гексацианоферрата (III); 5 мин при 20° С; нейтрализуют до pH 7—10, титруют раствором FeSO4 в присутствии диметилглиоксима 68
В данном случае, так же как и в процессах этерификации карбо новых кислот и их солей, необходим кислотный катализатор; однако в некоторых случаях используют алкоголяты щелочных металлов. Продолжительность реакции зависит от природы реагирующих веществ. Для более полного проведения реакции многие авторы рекомендуют предварительное кипячение реакционной смеси в колбе, снабженной обратным холодильником, до начала перегонки уксусного эфира. N-Ацетильные группы устойчивы к действию гидролитических реагентов, поэтому нагревание в колбе, снабженной обратным холодильником, продолжают в течение 3 ч. Конечную стадию определения проводят, как описано гыше (см. п. 2, пп. а).
3. Реакции присоединения, протекающие при определении ацетиленов
RC э CR + 2СН8ОН —» RCH2C (OCH8)2R или
RC н CR + 2СН3ОН СН3С (OCH8)2R
Кетали в процессе гидролиза превращаются в кетоны, которь затем определяют с помощью гидроксиламина.
52
4 Алкоголиз алкилкремнийтиоцианатов:
(С2Н6)„ Si (SCN)4_„ + (4 - «) ROH (C2H6)„ Si (OR)4_„ + (4 - n) HSCN
Роданистоводородную кислоту затем оттитровывают щелочью.
5. Реакции дегидратации, протекающие при определении метилольных групп:
RCH2OH + R 'ОН —> RCH2OR' 4- Н2О
Образующуюся воду оттитровывают реактивом Фишера.
ЛИТЕРАТУРА
1. Gas tine М., Compt. rend., 98, 1588 (1884).
2. Perkin A. G., Proc. Roy. Soc., 20, 171 (1904); J. Chem. Soc., 85, 1462 (1904);
ibid., 87, 107 (1905). . „
3. H a r d i n g E. P., Doran J., J. Am. Chem. Soc., 29, 1476 (1907).
4. Radcliffe L. G., J. Soc. Chem. Ind., London, 28, 229 (1909).
5. Freudenberg R., Harder M., Ann., 433, 230 (1923).
6. C a 1 1 a n T., Strafford N., J. Soc. Chem. Ind., London, 43, IT (1924).
7. Freudenberg R., Weber E., Angew. Chem., 38, 280 (1925).
8. H u f f W. J„ J. Am. Chem. Soc., 48, 81 (1926).
9. Лукашевич В. О., Хим. пром., 8, 1086 (1931).
10. Bredereck Н., Angew. Chem., 45 241 (1932).
11. Matuszak M. P., Ind. Eng. Chem., Anal. Ed., 4, 98 (1932).
12. E з p и e л e в И. M., Соловейчик Л. С., Пласт, массы, № 3, 40; № 5,
27(1934).
13. Phillips
14. Г a u f e 1 K-, 156 (1934).
Damon W. A., 72nd Ann. Rept. Alkali Ets. Works 29 (1936).
WolfromM. L, Г ‘ ‘ - -
Soc., 58, 490 (1936). “ “
М., Ind. Eng. Chem., Anal. Ed., 6, 321 (1934).
Thaler H., de Men go M., Fettchem. Umschau, 41,
15.
16.
17.
18.
19.
20.
21.
22.
23.
24.
25.
26.
27.
28.
29.
30.
31.
32.
33.
34.
35.
36.
Konigsberg M., Saiz berg S., J. Am. Chem.
H a r r o'w e r'J. R„ Wiley F. H., J. Ind. Hyg. Toxicol., 19, 486 (1937). Магидова С. С., Дивинская E. К., Андреева E. Ф., Ивашкевич К- Д-, Зав. лаб., 6, 693 (1937).
Mitchell J., Smith D. M., Bryant W. M., J. Am. Chem. Soc., 62 4 (1940).
Bell R. T., A gruss M. S., Ind. Eng. Chem., Anal. Ed., 13, 297 (1941). Matchett J. R., Levine J., Ind. Eng. Chem., Anal. Ed., 13, 98 (1941). Casein P., Cearanfi E., Biochem. Z., 313, 11 (1942).
Wiesenberger E., Mikrochemie ver. Mikrochim. Acta, 30, 241 (1942). C r a m e r F. B., Gardner T. S., P u r v e s С. B., Ind. Eng. Chem., Anal. Ed., 15, 319 (1943).
Pieters H. A. J., Popelier C., Chem. Weekblad, 40, 2 (1943).
g t1 L., Lando E., Industrie у quim., 5, 79 (1943).
*'As z С- H., Wohlberg C„ Am. Gas. Assoc. Proc., 25, 259 (1943). Whistler R. L„ J e a n e s A., Ind. Eng. Chem., Anal. Ed., 15, 317 (1943). gel ar R. N„ Clark G. R„ J. Assoc. Offic. Agr. Chem., 27, 472(1944). H '= i ° p- F- L” Wallace E. L„ Ind. Eng. Chem., Anal. Ed., 17, 563 (1945). T л r r 'T • Rueck E. M„ Am. Gas. Assoc. Proc., 28, 529 (1946).
d 10 li C, Marzadco M., Ann. chim. applicata, 36, 370 (1946).
astrup T., Acta Pharmacol. Toxicol , 3, 303 (1947). onansen A., Svensk Paperstidn., 50. 527 (1947).
i/uart A. G., Analyst, 72, 235 (1947).
ll»£?.Sr C. D., Goldstein T., Peters E. D., Anal. Chem., 19, пи (I947y
53
37. Hummel V., Listy Cukrovar, 64, 229 (1948).
38. Anderson H. H., J. Am. Chem. Soc., 71, 1801 (1949).
39. Hansen H., Brennstoffchem., 30, 419 (1949).
40. Hofman-Bang N., S z у b a 1 s к i W., Acta Chem. Scand., 3, 926 (1949)
41. Linder A., Persson V., Svensk Papperstidn, 62, 331 (1949).
42, Школь ман E. E., Попова И. А., Ж. прикл. химии, 22, 135 (1949)
43. С 1 а г к е D. G., Baum Н., Stanley Е. L., Hester W. F., Anal Chem., 23, 1842 (1951).
44. N i с о 1 a s L., В u г е 1 R., Chim. anal., 33, 341 (1951).
45. H о g s e t t J. N., Racy H. W., Johnson J. B., Anal. Chem., 26, 120, (1953).
46. Lehmann E., G r ii t z W., Z. Pflanzernahr. Diing. u. Bodenk., 61, 77 (1953).
47. D a 1 Nogare S., Montague B. A., Mitchell J., Division Anal. Chem., 125th meeting A. C. S., Kansas City, U. S. A., March 30th (19541
48. I i j i m a T., J. Soc. Rubber Ind. Japan, 29, 14 (1956).
49. M a u r i с e M. J., Anal. Chim. Acta, 14, 583 (1956).
50. L i n d e r A., Persson V., J. Am. Oil Chemists' Soc., 34, 24 (19Ь7). I
51. Roth H., Beck W., Mikrochim. Acta, 6, 845 (1957).
52. C a r t о n i L., Ricerca Sci., 28, 1639 (1958).
53. Mora th J. C., Woods J. T., Anal. Chem., 30, 1437 (1958).
54. P i n g u e t, Pharm. Acta Helv., 33, 114 (1958).
55. Patchornik A., R о go z i n s к i S. E., Anal. Chem., 31, 985 (1959).
56. Burger K-. S c h u 1 e к E., Taianta, 4, 120 (1960).
57. И де ль co и E. M., Зав. лаб., 26, 947 (1960).
58. Sa ty anaray а па Rao V. R., Vasudeva Murthy A. R., Ta lanta, 4, 206 (1960).
59. Burger K., Schulek E., Magyar Kern. Folyoiurat, 67, 59 (1961).
60. E u s u f M., Khundkar M. H., Anal. Chim. Acta, 24, 419 (1961).
61. G б r 6 g S., T r i s c h 1 e r F., Acta Chim. Acad. Sci. Hung., 26, 437 (1961)
62. Roth H., Angew. Chem., 73, 167 (1961).
63. К о с и и с и а я В., Фейгин Е., Пласт, массы, Ks 6, 8(1961).
64. S с h u 1 е к Е., В а г с z a L., Acta Pharm. Hung., 32, 1 (1962).
65. В а г с z a L., Taianta, 10, 503 (1963).
66. В i g h i C., Penzo L., Ann. Chim. (Rome), 53, 1068 (1963).
67. D a h m e n E. A. M. F., D i j к s t r a R., Ve r j a a 1 A. J., Erdol. u. Kohle, 16, 768 (1963).
68. К i b о к u M., Bunseki Kagaku, 12, 797 (1963).
3. ЩЕЛОЧИ
Реагент. К щелочным реагентам здесь отнесены гидроокиси и карбонаты щелочных и щелочноземельных металлов, а также алкоксиды низших спиртов*. Указанные реагенты применяют в большинстве случаев в виде водных растворов или растворов в спиртовы? или полиспиртовых растворителях. Наиболее часто используют NaOH и КОН, на долю которых приходится 90% случаев титрования щелочными реагентами.
Примеры использования гидроокиси аммония (аммиака) рассматриваются в отдельном разделе (см. «Аммиак и аммониевые соли»)-
Иногда, в особенности для определения галогенидов, в качестве реагента применяют металлический натрий со спиртом. Этот реагент описан также в разделе «Металлы», поскольку действия его можно
* -fcB настоящее время наряду с указанными щелочными реагентами в титри-метрических методах анализа широко применяются гидроокиси четвертичных амыс ниевых оснований.
54
усматривать как реакцию металлического натрия или алкоксида ^трия. Щелочные реагенты широко применяются в сочетании с дру-ими реагирующими в условиях повышенных значений pH реагентами Например, с перманганатом, галогенами (образующими гипо-галогениты), спиртами (образующими с CS2 ксантогенаты), гидрохлоридом гидроксиламина (реагирующим в нейтральных или щелочных растворах). Случаи такого рода применения щелочных реагентов не рассматриваются в данном разделе, но в других местах книги щелочные реагенты приводятся как компоненты смесей с другими реагентами.
Реакции и титруемые вещества. 1. Реакции гидролитического расщепления химических связей в органических соединениях. Этого рода реакции наиболее широко применяются при анализе органических веществ. Ниже приводится несколько примеров, группируемых по характеру гидролизуемой химической связи.
С—О —в сложных эфирах (органических и неорганических), ангидридах и лактонах, определяемых этим путем, например:
RCOOR' 4- ОН- —* RCOO- + R'OH
(RCO)2 О + 2ОН- —* 2RCOO- + Н2О
На использовании реакции расщепления С—О-связи основаны наиболее широко применяемые методы анализа эфиров. Кроме того, эта же реакция используется при титровании соответствующих органических соединений растворами щелочных реагентов. Около 200, или приблизительно 50%, приводимых ниже примеров посвящены определению эфиров или чисел (или значений) омыления.
С—N — в амидах, определение основано на их гидролитическом расщеплении щелочами:
RCONH2 + ОН- —RCOO- + NH3
Примером использования реакции гидролиза (и также расщепление С—S-связи) является определение пенициллина путем обработки его щелочью и последующего йодометрического титрования.
C=N — в нитрилах, определение основано на реакции гидролитического расщепления щелочами; при этом, вероятно, сначала происходит присоединение к нитрилам воды, сопровождающееся образованием амидов, которые затем гидролизуются, как указано выше. Однако суммарную реакцию удобно рассматривать как гидролиз.
С Hal — в галогенидах; определение большинства галогенидов несомненно основано на их щелочном гидролизе:
X — Hal + ОН” —> X — ОН 4- НаГ
отноеР°ЯТН0, большая часть общеизвестных примеров такого рода налиСИТСЯ К опРеделениям в воздухе соединений, характеризующихся СНс1ИеГсВ ННХ ПОДВИЖНВ1Х атомов галогенов (например, СН3Вг,
г 2> CHCJ з, СОС12), галогенсодержащих инсектицидов (подобных
55
ДДТ и бензолгексахлориду) и некоторых специфических соединений таких, как хлораль и йодоформ. Свыше 100 примеров в табл, ij представляют собой методы определения галогенидов.
Другие связи. К числу других типов химических связей, гидр0. лизующихся щелочами, относятся: С—S в S-алкилтиомочевинах S—N (сульфонамиды), S—С1 (сульфурилхлориды) и связи атомов углерода с Si, As и Ge.
2. Реакции нейтрализации широко применяются в методах пря. мого титрования, а в методах обратного титрования они используются® в тех случаях, когда в результате их образуются малорастворимые продукты (например, с хлорной кислотой). Здесь приведены два примера такого титрования.
3. Реакция Канниццаро
2RCHO + ОН' —* RCOO- + RCH2OH используется при определении некоторых альдегидов.
4. Одно или два соединения определяют методами, основанными g на реакциях, отличающихся от указанных выше. Например, соли тетраметиламмония при нагревании с щелочами образуют триметил амин; трихлорацетат при декарбоксилировании в присутствии щелочей образует карбонат + хлороформ.
Условия реакций. Для 400—500 примеров, приведенных в табл. 11. практически невозможно сформулировать общие требования, предъявляемые к реакциям титрования. Можно лишь указать, что большинство реакций протекает в водной, спиртовой или гликолевой средах (или в среде смешанных растворителей), которые применяются в тех случаях, когда реакцию желательно проводить при повышенных температурах с целью ее ускорения.
Соответствующая обработка и конечная стадия титрования. В большинстве случаев определений, основанных на гидролизе, реакциях нейтрализации и реакции Канниццаро, применяют метод обратного титрования избытка щелочи кислотами. Почти всегда в качестве стандартных растворов кислот применяют НС1 или H2SO4. Этим путем наиболее широко определяют эфиры, ангидриды, амиды, галогениды и альдегиды. Около 40% методов, приводимых в табл. 11, осуществляется именно таким образом.
В остальных методах определяют один продукт реакции или некоторые из образующихся продуктов, как указано ниже.
1) Галоген-ионы, отщепляющиеся при определении галогенсодержащих органических соединений; в качестве титрантов при этом используют следующие соединения.
а) Соединения Ag1 прямым или обратным методом (обратное титрование проводят обычно 5С№-ионами).
б) Соединения Hg11 в присутствии нитропруссида натрия или дифенилкарбазона.
в) После предварительного окисления (ВС или К) хлором или гипохлоритом, сопровождающегося образованием бромата или
56
пата, вводят ионы иода (кислая среда) и затем титруют выделившийся ’ иод тиосульфатом.
2) Анионы карбоновых кислот (RCOO ), образующиеся при гидролиэе эфиров, амидов, нитрилов и главным образом галоген-ангидридов, определяют следующими способами.
а) Выделяют свободную кислоту путем подкисления и последующей дистилляции или экстракции подходящим растворителем, или пропусканием раствора ее соли через ионообменник. Выделившуюся кислоту титруют щелочью или определяют иодометрически, добавляя смесь иодат — иодид и затем титруя выделившийся иод тиосульфатом.
б) Осаждают анионы в виде малорастворимых солей, например при помощи Hg1 (фумараты), Са2+ (оксалаты) или К+ (фталаты), и затем определяют избыток осаждающего реагента (например, Са путем титрования ЭДТА) или титруют осажденную соль (например, гидрофталат калия хлорной кислотой).
в) В большинстве случаев анионы определяют непосредственно, минуя стадию выделения из реакционной смеси, методом осисле-ния. Так, салицилаты окисляют смесью щелочь — иод или щелочь — бром и IC1; формиаты — Hg11; оксалаты, лактаты и фталаты — МпСХГ; соли пенициллина — смесью щелочь—иод. Некоторые анионы, например ацетоацетат, разлагают в щелочном растворе с образованием СО2, которую определяют титриметрически. Карбоксилаты
также определяют в присутствии двух индикаторов титрованием от pH —40 (например, фенолфталеин) до pH —4 (например, бромфеноловый голубой).
3) Спирты, фенолы или тиофенолы, образующиеся при гидролизе эфиров, определяют бромированием (при этом получаются, например, бромзамещенные фенолов, продукты присоединения брома к аллиловому спирту); окислением CrVI (бихромат или трехокись хрома, обычно применяют при определении этанола); взаимодействием с иодом (например, тиофенолы) или с Hg11.
4) Аммиак или низшие алифатические амины, образующиеся главным образом при гидролизе азотсодержащих соединений, включая амиды (например, мочевина), нитрилы, уретаны, карбаматы, семикарбазоны, сульфонамиды, пирамидон и его производные и протеины, перегоняют в стандартный раствор кислоты, избыток которой затем оттитровывают щелочью.
Некоторые эфиры азотной кислоты и нитросоединения определяют таким же методом, предварительно восстановив их до аминосоединений.
5) Ароматические амины, образующиеся при гидролизе сульфонамидов, титруют стандартным раствором нитрита.
Ь) Некоторые карбонильные соединения (например, муравьиный ьдегид или ацетон), образующиеся главным образом при гидролизе Рунических соединений, определяют известными методами: ре-Нией с бисульфитом или гидроксиламином.
57
Таблица 11. Примеры использования гидроокисей щелочных и щелочноземельных металлов и алкоксидов низших спиртов
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Л in Par, Р.
1 Хлораль (см. № 14, 16, 34, 39, 46, 47, 64, 101, 173, 314) NaOH Избыток щелочи оттитровывают ИС1 в присутствии лакмуса /
2 Эфиры (см. № 26) В этаноле; КОН; кипятят 15 мин Избыток КОН оттитровывают НС1 в присутствии фенолфталеина 2
3 Формальдегид NaOH; выдерживают 2 дня на теплой бане, затем несколько часов при 80° С Избыток щелочи оттитровывают H2SO4 3
4 Ацетильные (см. № 8, 11, 17, 18, 32, 36, 41, 65, 69, 74, 78, 88, 93, 97, 108, 127, 142, 145, 150, 155, 163, 196, 199, 254, 281, 297, 303, 304, 349, 357, 363, 378, 384, 393, 407, 436) и-бензоиль-ные (см. № 8, 74, 108, 287, 303) группы в жирах В метаноле или этаноле; спиртовый раствор КОН; нагревают 30 мин — 1ч Избыток КОН оттитровывают НС1 в присутствии фенолфталеина 4
5 Мочевина (см. № 119) ВаСО3; нагревают в запаянной стеклянной трубке 1 ч при 180° С Экстрагируют НС1, добавляют Ва(ОН).2 и отгоняют NH3 в избыток стандартного раствора кислоты, который обратно оттитровывают щелочью 5
6 Темноокрашенные масла — определение числа омыления (см. № 21, 55, 60, 61, 82, 149, 152, 156, 174, 177, 183, 184, 209, 227, 242, 244, 302, 369, 377, 405, 428) Спиртовой раствор щелочи Избыток щелочи осаждают СО2; образовавшуюся соль щелочного металла органической кислоты нагревают с NH4C1, при этом образуется NH3. RCOONa + + NH4C1 -- NH3 + + NaCl + RCOOH; аммиак перегоняют в стандартный раствор НО, избыток которого оттитровывают щелочью (см. «Гидроокись аммония и соли аммония», литература 3) 1 6
58
Продолжение
, п Титруемое вещество Реагент н условия реакции Соответствующая обработка и конечная стадия титрования Литература
7 Эфиры в жирах и вос-сках (см. № 26) В петролейном эфире; спиртовый раствор КОН 12—24 ч при комнатной температуре Избыток КОН отти-тровывают НС1 7
8 Ацетильные (см. № 4) и бензоильные (см. № 4) группы КОН в метаноле; 1 ч кипятят в колбе, снабженной обратным холодильником фосфорная кислота; образующуюся уксусную или бензойную кислоту перегоняют и титруют NaOH в присутствии аурина 8, 13
9 Йодоформ, образующийся в процессе определения ацетона при взаимодействии его с иодом в щелочной среде (см. № 19) Раствор КОН в спирте; кипятят несколько минут Уксусная кислота; титруют AgNO3 в присутствии хромата 9
10 Воск — определение числа омыления (см. № 27, 192, 207, 236, 401) Раствор щелочи в амиловом спирте; нагревают 30 мин при 100° С Избыток щелочи от-титровывают НС1 в присутствии фенолфталеина 10
11 Этилацетат (см. № 26, КОН; несколько ми- Избыток КОН отти- 11, 12,
32, 69, 79, 88, 92, 95, 105, 109, 121, 127, 142, 153, 159, 181, 196, 326, 363, 410, 447) при определении ацетильных групп (см. № 4) методом перегонки со смесью этанол — H2SO4 нут тровывают H2SO4 14
12 Трихлоруксусная кислота КОН; кипятят (образуются СНС13 и СО2) Карбонат осаждают Ва2+, избыток щелочи оттитровывают кислотой 15
13 Хлороформ (см. № 72, 77, 193, 314, 408, 431) Раствор КОН; кипятят 1 ч в колбе, снабженной обратным ХОЛОДИЛЬНИКОМ Нейтрализуют и затем С1~ -ионы оттитровывают Ag+ в присутствии хромата 16
14 Хлораль (см. № 1) В этаноле; NaOH; кипятят 3 ч в колбе, снабженной обратным холодильником (образуется NaCl и HCOONa) Нейтрализуют H2SO4 и затем С1“ оттитровывают Ag+ 17
15 Эфир уксусной кислоты, образующийся при определении третич- ных терпеновых спиртов в процессе взаимодействия их со смесью Уксусный ангидрид — ацетат натрия (см. № 22, 26, 73, 80, 264, 270, 334) Избыток щелочи Избыток щелочи оттитровывают кислотой 18, 38
Продолжен^
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования •Пите-раТу. Ра
16 Хлораль (см. № 1) КОН в воде; 15— 20 мин при температуре не выше 15° С Избыток КОН отти-тровывают H2SO4 в присутствии фенолфталеина 19
17 Ацетильные группы (см. № 4) КОН в смеси вода — глицерин Избыток КОН отти-тровывают кислотой 20
18 Ацетильные группы (см. № 4) в ацетате целлюлозы (см. № 28, 52, 63, 125, 136, 145, 155, 281, 393, 398, 448, 456) В 75%-ном этаноле (подогретый раствор); NaOH; 15 мин при 50° С, затем 24— 48 ч при комнатной температуре Избыток NaOH от-титровывают НС1 в присутствии фенолфталеина 21
19 Йодоформ (см. № 9, 49, 57, 113, 429) Раствор КОН в этаноле; кипятят 2 ч в колбе, снабженной обратным холодильником Подкисляют HNO3, добавляют избыток AgNO3, который от-титровывают тиоцианатом 22 I
20 Жиры — определение числа омыления (см. №42, 149, 152, 156, 174, 177, 207, 242, 244, 369, 380, 428) КОН; в смеси вода — глицерин Избыток КОН отти-тровывают кислотой 23 1
21 Масла (см. № 6) — определение числа омыления Раствор щелочи — в н-пропаноле (высококипящие масла гидролизуются быстрее) Избыток щелочи от-титр овивают кислотой 24
22 Эфир уксусной кислоты, образующийся при определении ОН-групп (см. № 33, 80, 264, 450, 465) ацетилированием уксусным ангидридом Раствор КОН в спирте Избыток КОН отти-тровивают кислотой 25
23 Пентаацетат фруктозы NaOH; 2—3 ч при 0° С Избыток NaOH отти-тровывают H2SO4 в присутствии фенолфталеина 26
24 Эфиры в жирах, маслах и восках (см. № 26) Раствор КОН в бензиловом спирте; кипятят 5 мин Избыток КОН отти-тровывают НС1 в присутствии фенолфталеина 27
25 Ароматические сульфохлориды В водной среде; свободную кислоту титруют NaOH; затем добавляют избыток NaOH; кипятят 5— 15 мин в колбе, снабженной обратным холодильником Избыток NaOH от-титровывают НС1 28
60
Продолжение
— Реагент и условия Соответствующая об- Лите-
я» п/п Титруемое вещество реакции работка и конечная стадия титрования рату-ра
26 27 28 29 30 31 32 33 Эфиры (см. № 2, 7, 11, 15 24, 31, 33, 89, 99, 106, 111, 121, 129, 132, 178, 191, 216, 243, 252, 269, 272, 274, 284, 298, 309, 336, 356, 372, 375, 376, 395, 447, 455) Монтан-воск — определение числа омылеиия (см. № 10) Ацетат целлюлозы (см. № 18) Пирамидон (см. № 43, 333) Уксусный ангидрид (см. № 160) Эфиры, полученные из спиртов взаимодействием с уксусным ангидридом (см. № 26) Этилацетат (см. № 11), образующийся при определении ацетильных групп (см. № 4) методом перегонки со смесью этанол — п-толуол-сульфокислота Эфир, образую- щийся при определении ОН-групп (см. № 22) в эфирных маслах методом взаимодействия со смесью НСООН — Уфсусный ангидрид (см. Раствор щелочи в бутаноле; небольшое количество воды (высококипящие масла быстрее гидролизуются) Раствор КОН в смеси этанол — ксилол; кипятят 5 ч в колбе, снабженной обратным холодильником В ацетоне NaOH; 24 ч при комнатной температуре Кипятят со щелочью в атмосфере водорода (образуется диметиламин) Избыток щелочи; несколько минут при комнатной температуре Раствор КОН в спирте; 15—20 мин при 50—60° С или оставляют на ночь при комнатной температуре Отгоняют в избыток NaOH; в конце кипятят 10 мин Избыток NaOH Избыток щелочи оттитровывают кислотой Добавляют Ва2+ для осаждения жирных кислот, затем избыток КОН оттитровывают НС1 в присутствии фенолфталеина Вода; избыток NaOH оттитровывают кислотой в присутствии фенолфталеина Амин отгоняют в избыток стандартного раствора H2SO4 и обратно оттитровывают щелочью в присутствии метилового оранжевого Избыток кислоты, который оттитровывают щелочью Избыток КОН оттитровывают кислотой Избыток NaOH оттитровывают H2SO4 в присутствии фенолфталеина Избыток NaOH оттитровывают кислотой 29 30 31 32 33 34 35, 42 36
61
Продолжен
№ п/п Титруемое вещество Реагент н условия реакции Соответствующая обработка н конечная стадия титрования Лит,. Рату Ра
34 Хлоральгидрат (см. № 1, 115, 122) Раствор щелочи в этаноле; нагревают 2 ч при 90—100° С в запаянной стеклянной трубке Определяют СГ -ионы; с этой целью подкисляют, добавляют избыток AgNO3l который оттитровы-вают тиоцианатом 37
35 Фосген (см. № 37, 86) КОН (образуется КС1 и К2СО3) Избыток НС1, который обратно отти-тровывают Ва(ОН)2 39
36 Ацетильные группы (см. № 4) Раствор Ва(ОН)2 в воде; кипятят 30 мин — 2 ч в колбе, снабженной обратным холодильником Фосфорная кислота; уксусную кислоту перегоняют и тиг-руют NaOH в присутствии фенолфталеина 40
37 Фосген (см. № 35) Раствор NaOH в воде (образует NaCl и Na2CO3) Вода; избыток щелочи оттитровывают КИСЛОТОЙ 41
38 Метилформиат (см. № 185) или этилформиат (см. № 449), образующийся при определении метанола или этанола (см. № 95, 326) путем нагревания со смесью муравьиная кислота — H2SO4 NaOH Избыток NaOH оттитровывают кислотой 43
39 Хлораль в сиропе хлораля (см. № 1) Вода; раствор NaOH в воде; 10 мин при комнатной температуре Избыток NaOH оттитровывают H2SO4 в присутствии фенолфталеина 44,51
40 Ангидрид в молочной кислоте (см. № 53, 59, 81, 213, 279, 445) NaOH; нагревают 10 мин до 100° С (свободную кислоту определяют прямым титрованием NaOH) Избыток кислоты, который обратно оттитровывают NaOH в присутствии фенолфталеина 45
41 Ацетильные группы (см. № 4) в Р-октаацетате и сх-хлор ацетиле неолак-тозы В ацетоне; раствор КОН в воде; 2 ч, ниже 0° С Избыток КОН оттитровывают НС1 46
42 Жиры — микроопределение числа омыления (см. № 20) Раствор КОН в воде и несколько капель этанола Растворяют в спирте и титруют кислотой в присутствии фенолфталеина 47
43 Пирамидон (см. № 29) (Испытан метод, описанный выше 32, — см. № 29; найдено, что он неудовлетворителен) 48
44 Ароматические нитроамины, например нитроанилины, нитронафтилам ины Щелочь; кипятят (образуется NH3) NH3 отгоняют в кислоту, избыток которой оттитровывают щелочью в присутствии метилового оранжевого 49
62
Продолжение
Реагент н условия реакции Соответствующая обработка н конечная стадия титрования Литература
X ii Титруемое вещество
45 Ацетат (см. № 107, 159, Раствор КОН в спир- Избыток КОН отти- 50
46 47 240), образующийся при определении в маслах ацетилирующихся веществ при взаимодействии их со смесью уксусный ангидрид — ацетат натрия Хлораль (см. № 1) Хлораль в сиропе хло- те; кипятят 1 ч в колбе, снабженной обратным холодильником (Критическое исследс санных выше 41, 44 —с описанного ниже 63, — NaOH; 1 мин при тровывают H2SOa вание методов, опи-м. Ns 37, 39, и метода, см. Ns 47) Избыток NaOH отти- 52 53
48 раля (см. № 1) Метилбромид в воздухе комнатной температуре Пропускают через тровывают H2SOa Подкисляют, добав- 54
49 (см. № 104, 141, 167, 223, 286, 323) Йодоформ (см. № 19) раствор CH3ONa (Метод описан вы ляют избыток AgNO3, который обратно от-титровывают тиоцианатом ше 22 — см. Ns 19) 55
50 Сантонин в фармацевта- В этаноле; раствор Избыток КОН отти- 56
51 ческих препаратах (см. № 66, 133) Продукт присоединения КОН в этаноле; кипятят 45 мин в колбе, снабженной обратным холодильником КОН; 5 ч при 100е С тровывают НО в присутствии фенолфталеина Подкисляют, добав- 57
52 брома, образованный при определении смеси олеиновой (см. № 446) и линолевой кислот (в маслах, при взаимодействии этих кислот с эфирным раствором брома) Ацетаты целлюлозы (см. В пиридине; NaOH; ляют избыток AgNO3, который оттитровы-вают тиоцианатом (Результат рассчитывают методом интерполяции) Избыток NaOH отти- 58
53 № 18) Ангидрид в молочной встряхивают 30 мин NaOH; кипятят тровывают кислотой в присутствии фенолфталеина Избыток щелочи от- 59
54 кислоте (см. № 40) Сульфамиды 20 мин (свободную кислоту определяют прямым титрованием NaOH) Растворяют в избыт- титровывают кислотой в присутствии нейтрального красного Избыток NaOH отти- 60
ArS<J2NHAr (см. № 186) ке NaOH тровывают НС1 в присутствии фенолфталеина или до появления слабой мути в присутствии индикатора ВаС12
63
Продолжени
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Лит, Рат-, Ра
55 Масло — определение числа омыления (см. № 6) Раствор КОН в бензиловом спирте; кипятят 5 мин в колбе, снабженной обратным холодильником Избыток КОН оттитровывают кислотой 67
56 Органические эфиры азотной кислоты (см. № 129) В ацетоне; NaOH, перборат натрия, вода; оставляют иа ночь (образуются NO^"-ионы) NO^-ионы восстанавливают до NH3 сплавом Деварда; NH3 отгоняют в избыток H2SO4, который оттитровывают гидроокисью аммония в присутствии метилового красного 62
57 Йодоформ (см. № 19) Сплавляют с твердым КОН (образуется -иодид калия) Подкисляют, окисляют I- до Ю^“ хлорной водой, избыток хлора удаляют кипячением, добавляют 1“ и выделившийся иод титруют тиосульфатом 63
58 Дифенилхлорарсин (CgH5)2AsC1 NaOH в смеси этанол — вода (образуются С1_-иоиы) HNO3 и избыток AgNO3, который обратно оттитровывают тиоцианатом в присутствии Fe111 64
59 Ангидрид в молочной кислоте (см. № 40) NaOH; кипятят 30 мин при комнатной температуре (свободную кислоту отдельно титруют NaOH) Избыток NaOH оттитровывают кислотой 65
60 Растительные масла — определение числа омыления (полумикрометод) (см. № 6) Раствор в Hso-CgHyONa; кипятят 30 мин в колбе, снабженной обратным холодильником Избыток реагента' оттитровывают H2SO4 в присутствии фенолфталеина • 66
61 Смеси масла с асфальтом — определение числа омыления (см. № 6) В анизоле; раствор КОН в этаноле, кипятят 1 ч в колбе, снабженной обратным холодильником Избыток КОН оттитровывают НС1 потенциометрически 61
62 Метилен цитр ат уротропина в присутствии уротропина NaOH (уротропин не реагирует) (образуется НСНО) НСНО титруют иодометрически, окисляя его избытком иода в присутствии щелочи (см. «Реагенты, содержащие иод», литература 119) 68
64
Продолжение
П/П Титруемое вещество Реагент н условия реакции Соответствующая обработка н конечная стадия титрования Литература
63 Ацетат целлюлозы (см В 75%-ном этаноле; Избыток NaOH отти- 69
64 № 18) Хлораль (см. № 1) NaOH; 15 мин при 50° С, затем 24—48 ч при комнатной температуре (Незначительная мог описанного выше 21 В воде; NaOH; 1 мин тровывают кислотой в присутствии фенолфталеина ификация метода, , — см. № 18) Избыток щелочи от- 70
65 Замещенные ацетами- при комнатной температуре Раствор КОН в бен- титровывают H2SOa или НС1 в присутствии фенолфталеина Этанол; избыток 71
66 ды — определение ацетильных групп (см. № 4) Лактоны (см. № 366), зиловом спирте; кипятят 90 мин в колбе, снабженной обратным холодильником Раствор КОН в эта- КОН оттитровывают в присутствии фенолфталеина Вода; эфир; избыток 72
67 подобные наркотину, сантонину (см. № 50) Пиретрин ноле; спирт испаряют В керосине; раствор КОН оттитровывают НС1 в присутствии фенолфталеина или щелочного голубого Подкисляют спирто- 73
68 [CioH„CONHCH2CH(CH3)2] Сульфат или нитрат те- NaOH в метаноле; кипятят 3—4 ч в колбе, снабженной обратным холодильником (образуется соответствующая соль монокарбоновой кислоты) NaOH; нагревают вый слой H2SO4, отгоняют органиче скую кислоту с водяным паром и титруют NaOH в при-су гств ии фенолфталеина Перегоняют в стан- 74
69 траметиламмония Этилацетат (см. № 11), (образуется триметиламин) Перегоняют в избы- дартный раствор H2SOa; избыток кислоты оттитровывают NaOH Избыток NaOH отти- 75
70 образуемый при определении ацетильных групп (см. № 4) путем взаимодействия со смесью этанол — п-толуол-сульфокислота и последующей перегонки Бензилацетат, образую- ток NaOH; кипятят 10 мин NaOH в воде; 1 ч тровывают H2SO4 Избыток NaOH отти- 76
3 Щийся при определении бензилцеллюлозы в процессе взаимодействия ее со смесью уксусный ангидрид — H2SQ, М- ₽ Ф Эшворт, при 100 С тровывают кислотой в присутствии фенолфталеина 65
Продолженщ
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка н конечная стадия титрования >— Лите Рат у. Рь
71 Шеллак — определение Раствор КОН в спир- Избыток КОН отти- — 77
72 числа омыления Хлороформ (см. № 13) те; кипятят 2 ч в колбе, снабженной обратным холодильником Раствор КОН в спир- тровывают НС1 в присутствии тимолового голубого HNO3; AgNO3, избы- 78
73 Эфир уксусной кислоты, те; кипятят 4 ч в колбе, снабженной обратным холодильником Избыток щелочи ток которого отти-тровывают тиоцианатом в присутствии Fe111 Избыток щелочи от- 79
74 образующийся при определении сахаров (см. № 163) и углеводов в процессе взаимодействия их со смесью уксусный ангидрид — ацетат натрия в толуоле или ксилоле (см. № 15) О-Ацетильные (см. № 4) Раствор NaOH в сме- титровывают кислотой Подкисляют H2SO4, 80
75 и бензоильные (см. № 4) группы; N-ацетильные (см. № 4) группы Некоторые альдегиды си метанол — вода (1 : 1) или вода; обычно кипятят 15 мин в колбе, снабженной обратным холодильником; 3 ч для N-ацетильных групп Раствор КОН в бен- уксусную кислоту отгоняют и оттитро-вывают NaOH в присутствии фенолфталеина Избыток КОН отти- 81
76 (см. № 87, 308, 346), например изомасляный, изовалерьяновый, гептаналь (энантовый альдегид) Пектин (см. № 166, 205, зиловом спирте; кипятят 15 мин в колбе, снабженной обратным холодильником NaOH; 15 мин при тровывают кислотой Избыток H2SO4, ко- 82
77 254, 266, 297) — определение метоксильных групп (см. № 464) Хлороформ (см. № 13) комнатной температуре В толуоле; КОН торый оттитровыва-ют щелочью в присутствии фенолфталеина HNO3; AgNO3l избы- 83, 84
78 Ацетильные группы (см. в спирте; кипятят в колбе, снабженной обратным холодильником (образуются С1“ -ионы) NaOH; кипятят 12— ток которого отти-тровывают тиоцианатом Избыток NaOH от- 85
№ 4) 15 ч в колбе, снабженной обратным холодильником титровывают НС1 в присутствии фенолфталеина
66
Продолжение
К*1 п/п Титруемое вещество Реагент и условия реакции Соответству юща я обработка н конечная стадия титрования Литература
79 Этилацетат (см. № 11) Отгоняют в избыток Избыток щелочи от- 86
80 или формиат (см. №449), при определении ацетильных групп в нитроацетилцеллюлозе или формильных групп в формилцеллюлозе в процессе взаимодействия со смесью этанол — фосфорная кислота Эфир уксусной кислоты щелочи Раствор КОН в спир- титровывают кислотой Подкисляют п-толу- 87
81 (см. № 15), образующийся при определении гидроксильных групп (см. № 22) в жировых продуктах в процессе взаимодействия их с уксусным ангидридом Ангидрид в молочной те; кипятят 2 ч в колбе, снабженной обратным холодильником NaOH; 1 ч при ком- олсульфокислотой, уксусную кислоту перегоняют, обрабатывают смесью 107— I", выделившийся 12 оттитровывают тиосульфатом (см. «Йодат калия и пя-тиокись иода», лите- ратура 29) Избыток NaOH от- 88
82 кислоте (см. № 40) Масла — определение натной температуре Раствор КОН в спир- титровывают H2SO4 в присутствии метилового оранжевого Нейтрализуют НС1, 89
83 степени ненасыщенности (см. № 6) Метилсалицилат (см. те; кипятят в колбе, снабженной обратным холодильником Раствор КОН в ме- этанол испаряют, прибавляют NaOCl и H2SO>; избыток реагента определяют иодометрически (см. «Реагенты, содержащие хлор», литера- тура 7) Большую часть мета- 90
84 № 191, 250, 276, 338, 351) Ментолацетат, образующийся при определении ментола (см. № 123, 132, 164) в процессе взаимодействия его со смесью уксусный ангидрид — ацетат натрия таноле; кипятят 2 ч в колбе, снабженной обратным холодильником Раствор КОН в метаноле; кипятят 1 ч в колбе, снабженной обратным холодильником нола выпаривают, добавляют воду и титруют НС1 Вода; титруют НС1
67
Продолжение
№ п/п Титруемое вещество Реагент н условия реакции Соответствующая обработка и конечная стадия титрования Литература
85 Пентабромацетон, образующийся при определении лимонной кислоты (см. № 90) в процессе ее взаимодействия со смесью Вг——H2SO4 — МпО^ КОН в смеси спирт— вода (образуются Вг~-ноиы) HNOS; AgNOg, избыток которого отти-тровывают тиоцианатом 91
86 Фосген (см. № 35) — исследование влияния хлороформа на определение фосгена Пробы пропускают через 85%-ный этаноловый раствор NaOH HNO3; NaHCO3 до pH ~9; титруют AgNO3 в присутствии хромата (указывается на незначительные помехи хлороформа) 92
87 Альдегиды (см. № 75) в горькоминдальных маслах (Метод описан выше 81 — см. № 75) 93
88 Этилацетат (см. № 11), образуемый при определении ацетильных групп (см. № 4) перегонкой со смесью этанол — n-толуол сульфокислота Отгоняют в избыток спиртового раствора кон Избыток КОН отти-тровывают кислотой в присутствии фенолфталеина 94 1
89 Эфиры в разбавителях лака (см. № 26) Раствор NaOH в этаноле; кипятят 90 мин в колбе, снабженной обратным холодильником Избыток щелочи от-титровывают кислотой 95
90 Пентабромацетон, образуемый при определении лимонной кислоты (см. № 85) в процессе ее взаимодействия со смесью Вг~—МпО4~ — кислота Избыток NaOH; 30 мин при 85— 90° С Избыток NaOH отти-тровывают НС1 в присутствии метилового красного 96
91 Ароматические нитро-соединения Сплавляют в стальной трубке со смесью КОН — NaOH — пыль Zn или А1 (образуется аммиак) Переводят в избыток H2SO4, который от-титровывают щелочью 97
92 Этилацетат (см. № 11) Водный раствор кон Избыток КОН отти-тровывают НС1 в присутствии фенолфталеина 98
93 Ацетильные группы (см. № 4) КОН в этаноле; кипятят 4 мин в колбе, снабженной обратным холодильником. Для определения N-ацетильных групп применяют КОН в н-бутаноле; кипятят 1 ч Концентрированный раствор MgSO4; немного H2SO4; уксусную кислоту отгоняют и титруют NaOH в присутствии фенолового красного 99
68
Продолжение
№ п/П Титруемое вещество Реагент н условия реакции Соответствующая обработка и конечная стадия титрования Литература
94 Бензонафтол (2-нафтил-бензоат) в медикаментах (см. № 112, 399) Раствор КОН в спирте; кипятят 5 мин в колбе, снабженной обратным холодильником Вода; этанол отгоняют и избыток щелочи оттитровывают НС1 в присутствии фенолфталеина 100
95 Этилацетат (см. Ns 11), образующийся при определении этанола (см. № 38) в процессе его взаимодействия с уксусным ангидридом КОН; нагревают на водяной бане Избыток щелочи титруют кислотой 101
96 Хлорбутанол (СН3).2СОНСС13 (см. Ns 144, 215, 315) КОН; кипятят 30 мин в колбе, снабженной обратным холодильником HNO3; AgNO3, избыток которого оттитровывают тиоцианатом 102
97 О- и N-Ацетильные (Общее содержание ацетильных групп опре- 103
группы (см. № 4) деляют по методу, описанному выше 36,— см. № 32; О-ацетильные группы — также по методу, описанному выше46/— см. № 41, но реакция продолжается 1 ч)
98 Изатин Растворяют в избытке NaOH Избыток NaOH оттитровывают НС1 в присутствии фенолфталеина 104
99 Эфиры (см. Ns 26) КОН в диэтиленгликоле; 3 мин при 120—130° С Вода; титруют НС1 в присутствии фенолфталеина 105
100 Бензилбензоат (см. Ns 305) Щелочь—спирт; кипятят в колбе, снабженной обратным холодильником Спирт отгоняют, подкисляют H2SO4, бензойную кислоту экстрагируют СНС13 и титруют щелочью 106
101 Хлораль (см. Ns 1) NaOH; кипятят 10 мин (образуется формиат) Ацетат натрия; формиат оттитровывают перманганатом при 100° С 107
102 и-Дихлорбензол в коже (экстрагированный эфиром) СаО; сплавляют при ярко-красном калении (образуются СГ -ионы) HNOgj СГ -ионы определяют аргентометрически 108
103 Смола — определение числа омыления (см № 443) В спиртовом растворителе; щелочь в том же растворителе; кипятят 1 ч в колбе, снабженной обратным холодильником (Результаты зависят ниженные результать пользовании алифатг Избыток щелочи титруют НС1 от растворителя; за-наблюдаются при гаескими спиртами) 109
69
Продолжена,
№ Реагент и условия Соответствующая об- Лит
п/n . Титруемое вещество реакции работка и конечная стадия титрования рату ра
104 Метилбромид в воздухе (см. № 48) Поглощают раствором КОН в смеси спирт—эфир (образуются Вг~ -ионы) Окисляют до брома та смесью NaOCl— NaCl — борная кислота; 15 мин при 100° С; добавляют Г и молибдат аммония, выделившийся иод оттитровывают тиосульфатом по
105 Этилацетат (см. № 11) КОН; кипятят 3 ч в колбе, снабженной обратным холодильником Избыток КОН оттитровывают НС1 в присутствии фенолфталеина 111
106 Эфиры (см. № 26) Раствор КОН в этаноле, кипятят обычно 1 ч в колбе, снабженной обратным холодильником, но иногда кипятят до 50 ч Избыток КОН оттитровывают H2SO4 в присутствии а-нафтолфталеина 112
107 Ацетаты (см. № 45), образующиеся при определении гликоля или глицерина в табаке в процессе обработки его смесью уксусный ангидрид — ацетат натрия кон Избыток КОН оттитровывают НО 113 I
108 Ацетильные (см. № 4) и бензоильные (см. № 4) группы Раствор КОН в воде; кипятят 15—60 мин в колбе, снабженной обратным холодильником Подкисляют фосфорной КИСЛОТОЙ или п-толуолсульфокисло-той; уксусную или бензойную кислоты перегоняют и оттитровывают щелочью 114
109 Этилацетат в вине (см. № 11) NaOH; 2 ч при комнатной температуре H2SOa; уксусную кислоту отгоняют и оттитровывают NaOH 115
ПО Этил-п-оксибензоат NaOH; 15 мин при комнатной температуре Избыток ВгО^, который определяют путем добавления I" и последующего титрования выделившегося 1г тиосульфатом 116
111 Трудноомыляемые эфиры (см № 26), например метилабиетат или бор-пи лфталат CH3ONa в смеси циклогексанол — метанол; 16 ч при 150° С (также применяют mpem-C4H9ONa — mpem-C4H9OH) Избыток реагента оттитровывают H2SO4 в присутствии фенолфталеина или тимолового голубого 117
70
Продолжение
Титруемое вещество п/п 1 Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
112 Бензанафтол (2-нафтил-бснзоат) (см. № 94) Раствор КОН в этаноле; кипятят 5 мин в колбе, снабженной обратным холодильником Нейтрализуют НО; добавляют NaHCO3; нафтол определяют титрованием иодом в присутствии крахмала 118
113 Йодоформ (см. № 19) Раствор КОН в этаноле; кипятят 2 ч в колбе, снабженной обратным холодильником HNO3 и избыток AgNO3, который оттитровывают тиоцианатом 119
114 Диэтиламиды никотиновой и фталевой кислот NaOH; кипятят 20 мин в колбе, снабженной обратным холодильником (образуется диэтил-амин) Амин пропускают в НО, избыток которой обратно оттитровывают NaOH или тетраборатом натрия в присутствии метилового красного 120
115 Хлоральгидрат (см. № 34) NaOH Избыток NaOH оттитровывают НС1 в присутствии фенолфталеина 121
116 Аспирин (ацетилсалициловая кислота) (см. № 181, 363) NaOH; оставляют на ночь; немного нагревают Салицилат определяют путем добавления Na2CO3 и избытка иода, который оттитровывают тиосульфатом (см. «Ре агенты, содержащие иод», литература 196} 122
117 Дихлорэтан в воздухе (см. № 296, 318, 457) Поглощают раствором C2H^ONa в этаноле; кипятят 2 ч в колбе, снабженной обратным холодильником (образуются С1~ -ионы) Подкисляют HNO3; титруют в присутствии нитропруссида ртутью (II) до помутнения 123
118 Амиды (см. № 130, 147, 292 , 319, 342, 347, 357, 463, 466), нитрилы (см. № 319, 355, 371, 418, 466) КОН в спирте (лучше в бензиловом спирте); кипятят 1 ч в колбе, снабженной обратным холодильником Аммиак отгоняют и оттитровывают H2SO4 в присутствии метилового оранжевого 124
119 Мочевина (см. № 5), семикарбазоны, уретаны (см. № 239), аллофано-вая кислота и ее эфиры и т. д. КОН в глицерине, кипятят около 2 ч в колбе, снабженной обратным 'холодильником (образуется NHS) NH3 отгоняют с током азота и оттитровывают кислотой 125
71
П родолжение
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Лнт’и Рату, ра
120 Лобелины (C22H27NO2) Нагревают с NaOH (образуется ацетофенон) Ацетофенон отгоняют, добавляют NaOH и избыток иода, который оттитровывают тиосульфатом (см. «Реагенты, содержащие иод», литература 203) 126
121 Эфиры, например этилацетат (см. № 11) или лактат, в подвергшихся брожению спиртных напитках (см. № 26) NaOH, 20 мин при 60° С H2SO4, избыток которой оттитровывают NaOH; также подкисляют фосфорной кислотой, уксусную кислоту отгоняют и оттитровывают щелочью 127
122 Хлоральгидрат (см. № 34) В воде; NaOH; 1—3 мин Избыток NaOH оттитровывают НО 128
123 Ментол ацетат, образующийся при опре- делении ментола (см. № 84) при взаимодействии его со смесью уксусный ангидрид — ацетат натрия Раствор КОН в этаноле; кипятят 3 ч в колбе, снабженной обратным холодильником; или раствор КОН в диэтиленгликоле, кипятят 30 мин Избыток КОН оттитровывают НС1 129
124 Бензокаин, анестезин, этиловый эфир и-амидо-бензойной кислоты NaOH, кипятят 20 мин в колбе, снабженной обратным холодильником Избыток NaOH оттитровывают в присутствии фенолфталеина 130
125 Эфиры целлюлозы — определение общего содержания ацильных групп (см. № 18) Испытано несколько методов, включая два, основанных на омылении щелочью: а) незначительно модифицированный метод, описанный выше 21, — см. № 18; б) NaOH в 95%-ном этаноле; 16—24 ч не выше 30° С Избыток щелочи оттитровывают НО в присутствии фенолфталеина 131
126 Трихлорэтилен КОН; нагревают 1 ч при 150° С в запаянной стеклянной трубке HNO3; избыток AgNOa, который оттитровывают тиоцианатом 132
127 Этилацетат (см. № 11), образующийся при определении ацетильных групп (см. № 4) реакцией с этанолом и НС1 Отгоняют в щелочь; кипятят 30 мин в колбе, снабженной обратным холодильником Избыток щелочи оттитровывают кислотой в присутствии фенолфталеина 133
128 Эфиры п-оксибензойной кислоты (см. № 138, 339) (Метод описан выше118 — см № 110) 134
72
Продолжение
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
129 Эфиры, включая эфиры азотной кислоты (см. As 26, 56) NaOH в смеси спирт — вода; кипятят, а затем оставляют па холоду на ночь или на более продолжительное время Избыток NaOH от-титровывают НС1 135
130 Амиды (см. № 118) NaOH; кипятят Избыток NaOH отти-тровывают НС1 136
131 Этил хлор ид (см. № 263) Раствор КОН в спирте; 15 мин нагревают при 120° С в запаянной ампуле Избыток КОН отти-тровывают НС1 137
132 Эфиры в перечно-мятном масле; также ментол-ацетат при определении ментола (см. № 84) в процессе его взаимодействия со смесью уксусный ангидрид — ацетат натрия (см- № 26) Раствор КОН в спирте; кипятят I ч в колбе, снабженной обратным холодильником Избыток КОН отти-тровывают H2SO4 в присутствии фенолфталеина 133
133 Сантонин (см. № 50) Раствор Ва(ОН)2 в этаноле; 15 мин при 100° С Вода, титруют НС1 в присутствии фенолфталеина; нагревают 15 мин прн 100° С с избытком НС1, который отти-тровывают щелочью 139
134 Метилацетат (см. № 145, 150, 423), образуемый при определении в жидкостях уксусной кислоты (см. № 160) в процессе ее взаимодействия с метанолом Отгоняют в NaOH (образуется ацетат натрия) Дифференцированно окисляют смесью H2SO4 — Ag2Cr2O7, а затем H2SO4—К2Сг2О7; содержание ацетата определяют по разности между двумя титрованиями (см. «Бихромат и трехок ись хрома», литература 110) 140
135 Простигмин (неостиг-МИН, прозерин) (см. № 364) Щелочь; нагревают (образуется диэтил-амин) Диэтиламин перегоняют в избыток кислоты, который отти-тровывают щелочью в присутствии метилового красного 141
73
Продолжение
№ п/п
Титруемое вещество
Реагент и условия реакции
Соответствующая обработка и конечная стадия титрования
Литература
136 Смесь эфиров целлю- NaOH; 48—72 ч при
лозы (см. № 18) 40° С
137
138
139
Терпенилацетат
Эфиры (метиловый, этиловый, пропиловый) n-оксибензойной кислоты (см. № 128)
В метилцеллозольве; раствор КОН в этил-целлозольве; кипятят 30 мин в колбе, снабженной обратным холодильником NaOH; 15 яин при 100°С
Фосфорная кислота; образующуюся смесь уксусной, пропионовой и масляной кислот отгоняют и определяют путем распределения между бутилацетатом и водой и последующего титрования обоих слоев
Избыток КОН оттитровывают НС1 в присутствии фенолфталеина
142
143
1,2-Дибромбутан, образуемый при определении бутена-1 в присутствии бутена-2 реакцией с бромом
С2Н6ОК; 1 ч при 100—110° С (образуется С2Н5С^СН)
Хлорпикрин в воздухе
Метилбромид (в присутствии неорганических бромидов) в продуктах, окуренных метилброми-дом (см. № 48)
Этилацетат (см. Ns 11), образуемый при определении ацетильных групп (см. № 4) реакцией с этанолом и H2SO4
Пропускают через NaOH—Na2SO3— щелочь; раствор затем кипятят в колбе, снабженной обратным холодильником Раствор КОН в спирте. Выпаривают досуха после 1 ч кипячения в колбе, снабженной обратным холодильником; затем добавляют NaOH и нагревают до 600° С NaOH; кипятят 15 мин в колбе, снабженной обратным холодильником
n-Оксибензоат окисляют броматом, избыток которого определяют иодометрически (см. «Реагенты, содержащие бром», литература 215)
Этилапетилен определяют аргентометрически; избыток Ag+ -ионов оттитровывают тиоцианатом (см. «Соединения серебра», литература „ 75)
С1 осаждают серебром (I). избыток которого оттитровывают тиоцианатом
Вг~ окисляют NaOCl до BrOj~; добавляют Г и H2SO4; выделившийся иод оттитровывают тиосульфатом
Пропускают через ионообменник; уксусную кислоту в элюате оттитровывают щелочью в присутствии фенолфталеина
144
145
146
147
14 •
74
Продолжение
Титруемое вещество
Реагент и условия реакции
Соответствующая обработка и конечная стадия титрования
Литература
[43 Монохлоруксусная кислота (см. № 146, 170, 226) в напитках (экстрагированная эфиром)
144 Хлорбутанол (см. № 96)
145
146
147
148
149
Метилацетат (см. № 134), образующийся при определении ацетильных групп (см. № 4) в ацетате целлюлозы (см. № 18) переэтерификацией с метанолом при добавлении CH3ONa, а затем п-толуолсульфо-кислоты
Монохлоруксусная кислота в вине (см. № 143)
Амиды (см. № 118)
Натрийалкилсульфаты (от C2H5OSO3Na до
C14H26OSO3Na)
Жиры (см. № 20), масла (см. № 6) и т. п. — определение числа омыления
NaOH; кипятят не менее 2 ч в колбе, снабженной обратным холодильником Раствор КОН в метаноле; оставляют на ночь при комнатной температуре
NaOH; кипятят 1 ч в колбе
СГ осаждают серебром (I), избыток которого оттитровыва-ют тиоцианатом
HNO3; AgNO3, избыток которого от-титровывают тиоцианатом
Избыток NaOH отти-тровывают НС1 в присутствии фенолфталеина
Модификация метода, описанного выше149, — см. № 143)
Раствор КОН в этиленгликоле; кипятят 6 ч в колбе, снабженной обратным холодильником
Раствор КОИ в бензиловом спирте; кипятят 1 ч в колбе, снабженной обратным холодильником
Раствор КОН в этаноле
Эфир; титруют НС1 в присутствии бромфенолового голубого
Избыток КОН отти-тровывают НС1 в присутствии фенолового красного
Титруют НС1 до pH —10 (оттитровывает-ся избыток щелочи) и до pH -~4 (по разности между двумя титрованиями находят содержание соли органической кислоты, образующейся при омылении); так же титруют потенциометрически или в присутствии индикатора фенолфталеин — бромфеноловый голубой; для второго титрования добавляют бензол для растворения свободной органической кислоты
149
150
151
152
153
154
155
75
Продолжение
№ Титруемое вещество Реагент и условия Соответствующая об- «Лите-
п/п реакции работка и конечная стадия титрования рату-ра
150 Метилацетат (см.№ 134), образующийся при определении ацетильных групп (см. №4) в эфирах карбоновых кислот путем переэтерификации с метанолом и CHsONa Отгоняют в NaOH; кипятят 15 мин в колбе, снабженной обратным холодильником Избыток NaOH оттитровывают HCI в присутствии фенолфталеина 156
151 ДДТ в керосине (см. № 165, 168, 172, 175, 176, 194, 197, 198, 231, 234, 249, 251, 265, 273, 280, 383) Раствор КОН в 99%-ном этаноле; кипятят в колбе, снабженной обратным холодильником (образуются С1~ -ионы) HNO3; AgNO3, избыток которого оттитровывают тиоцианатом 157
152 Жиры (см. № 20) и масла (см. № 6) — определение числа омыления Раствор КОН в этаноле; 10 мин при 125° С Избыток КОН оттитровывают НС1 в присутствии щелочного голубого 158
153 Этилацетат (см. № 11) и ацетальдегид Щелочь — Н2О2 (для окисления альдегида); 15лшнпри80°С, затем 1 ч при комнатной температуре (Альдегид отдельно or бисульфита — см. «Б1 литерат Избыток NaOH оттитровывают НС1 в присутствии фенолфталеина гределяют с помощью гсульфит и сульфит», ура 74) 159
154 Трихлорацетонитрил NaOH; 7 ч (образуется аммиак) NH3 отгоняют в борную кислоту и титруют НО в присутствии метилового красного и бромкрезолового зеленого 160
155 Ацетильные группы (см. № 4) в эфирах целлюлозы (см. Ns 18) В смесях с различными растворителями: водой, пиридином, ацетоном и метанолом; добавляют избыток щелочи; 6— 16 ч при 20—55° С Избыток щелочи оттитровывают НС1 в присутствии фенолфталеина 161
156 Жиры (см. № 20) и масла (см. № 6) — определение числа омыления (микро) NaOH в смеси метанол — вода; 30 мин при 60° С Избыток NaOH оттитровывают НС1 в присутствии фенолфталеина 162
157 Пропионильные группы Метод описан выше 80 — см. № 74) 163
158 Акрилонитрил (см. № 418) в воздухе (поглощение концентрированной H2SO4) NaOH—Н2О2 — ацетат меди (II) (для предотвращения полимеризации); кипятят 30 мин в колбе, снабженной обратным холодильником (образуется аммиак) NH3 отгоняют в H2SO4, избыток которой оттитровывают NaOH в присутствии метилового красного 164
76
Продолжение
№ п/п
Титруемое вещество
Реагент и условия реакции
Соответствующая обработка и конечная стадия титрования
Литература
159
160
161
162
163
164
L65
Этилацетат (см. № 11), образующийся при определении ацетата натрия (см. •№ 45) реакцией с этанолом и п-толуолсульфокислотой Уксусный ангидрид (см. № 30) н уксусная кислота (см. № 134) Аллоксан
Щелочь Избыток щелочи от- 165
титровывают кисло-
той
Дихлоруксусная кислота (см. № 204) в пищевых продуктах
Ацетильные группы (см. № 4) в ацетатах сахаров (см. № 73) и глюкозидов
Ментолацетат, образующийся при определении ментола (см. № 84) в мятной эссенции путем его ацетилирования ДДТ (см. № 151)
166 Метиловый эфир, содержащийся в пектине (см. № 76)
167 Метилбромид в воздухе (см. № 48)
Избыток NaOH; нагревают до 100° С
KCN (CN“ — катализатор) — вода;
5 мин при комнатной температуре (образуется дилаурат, оксилаурат и СО2) Нагревают с этаноловым раствором КОН или сплавляют
с Na2CO3
В 95% -ном этаноле; раствор NaOH в этаноле; 4—24 ч при комнатной температуре
КОН в этаноле; кипятят 90 мин в колбе, снабженной обратным холодильником
Раствор КОН в спирте; кипятят 30 мин в колбе, снабженной обратным холодильником (образуются
СГ -ионы)
В воде при pH 7,5; NaOH; 30 мин при комнатной температуре
Поглощают раствором CHgONa в метаноле
Избыток щелочи оттитровывают кислотой
Дилаурат оттитровывают церием (IV)
СГ осаждают серебром (I), избыток которого оттитровывают тиоцианатом
Избыток NaOH оттитровывают H2SO4 в присутствии фенолфталеина
Избыток КОН оттитровывают H2SO4
HNO3; нитробензол; серебро (I), избыток которого оттитровывают тиоцианатом
168
ДДТ (см. № 151)
Раствор КОН в этаноле; кипятят
30 мин в колбе, снабженной обратным холодильником
H2SO4 эквивалентно первоначально прибавленному NaOH, затем титруют NaOH до pH 7,5 потенциометрически
Подкисляют и титруют серебром (I) в присутствии эозина или добавляют Ag1, избыток которого оттитровывают тиоцианатом
Нейтрализуют H2SO4; СГ оттитровывают серебром (I) в присутствии дихлорфлюоресцеина
166
167
168
169
170
171
172
173
174
Т1
Продолжение
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Лите рату-ра
169 Галогенсодержащие соединения (см. № 208, 220, 277, 353) Раствор КОН в диэтиленгликоле; при 150—160° С HNO3; AgNO3, избыток которого отти-тровывают тиоциана-! том 175, 188
170 Монохлоруксусная кислота (см. № 143) в промышленных консервирующих средствах NaOH; кипятят 30 мин в колбе, снабженной обратным холодильником, или 2 ч при 100° С HNO3, AgNOs, избыток которого от-титровывают тиоцианатом 176
171 Пенициллины (см. № 179, 212, 218, 221, 224, 230, 245, 248, 253, 257, 275, 300, 317, 335, 362, 381, 385, 386, 389, 400, 404, 413, 415, 421, 439) NaOH; 15 мин при комнатной температуре Нейтрализуют НС1, добавляют иод, избыток которого от-титровывают тиосульфатом (см. «Реагенты, содержащие иод», литература 237) 177
172 ДДТ (см. № 151) КОН в этаноле; кипятят 5 мин в колбе, снабженной обратным холодильником (образуются СГ -ионы) HNO3; AgNO3, избыток которого от-титровывают тиоцианатом 17g
173 Хлораль (см. № 1) Щелочь; 5 мин при комнатной температуре; или добавляют Са(ОН)2; кипятят 10 мин Избыток щелочи от-титровывают кислотой в присутствии фенолфталеина; непрореагировавшие вещества осаждают Na2CO3, добавляют MnOJ~, избыток которого оттитровыва-ют щавелевой кислотой в кислой среде (см. «Перманганат калия», литература 81) 179
174 Жиры (см. № 20) и масла (см. № 6) — определение числа омыления Раствор КОН в абсолютном или 95% -ном этаноле; кипятят от 30 мин до 3 ч в колбе, снабженной обратным холодильником Титруют НС1 в присутствии фенолфталеина, а затем бромфенолового голубого; разность эквивалентна содержанию соли органической кислоты, образуемой при омылении 180
175 ДДТ (см. № 151) Раствор КОН в этаноле; кипятят 30 мин в колбе, снабженной обратным холодиль-йиком (образуются СГ -ионы) HNO3; AgNO3, избыток которого отти-тровывают тиоцианатом 181
78
Продолжение
п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
176 ДДТ (см. № 151) NaOH в 95%-ном HNO3; AgNO3 — 182
177 Жиры (см. № 20) и этаноле; 15 мин при комнатной температуре Раствор КОН в эта- нитробензол; избыток Ag+ оттитровывают тиоцианатом Титруют НС1 в при- 183
178 масла (см. № 6) — определение числа омыления (микро) Высококипящие эфиры ноле; кипятят 30 мин в колбе, снабженной обратным холодильником Раствор КОН в ди- сутствии фенолфталеина, затем бромфенолового голубого в присутствии бензола (Сравнить с методом, описанным выше166,— см. № 149) Избыток NaOH отти- 184
179 (см. Ks 26) Пенициллин (см. № 171) этиленгликоле; 15 мин при 125° С NaOH тровывают НС1 в присутствии фенолфталеина Нейтрализуют НС1, 185
180 Фениловый эфир сали- Щелочь; выпари- добавляют иод, избыток которого оттитровывают тиосульфатом (см. «Реагенты, содержащие иод», литература 241) Растворяют в воде. 186
181 циловой кислоты (см. № 426) Этилацетат (см. № И), вают досуха Перегоняют в избы- добавляют щелочь и избыток иода; определяют, как описано выше (см. «Реагенты, содержащие иод», литература 244) Избыток щелочи от- 181
182 образуемый при определении аспирина (см. № 181) нагреванием со смесью этанол — NaOH Этнленхлоргидрин ток щелочи Раствор КОН в воде; титровывают кислотой HNO3; AgNO3, избы- 189
183 Нелетучие жидкие мае- кипятят 1 ч в колбе, снабженной обратным холодильником Раствор КОН в спир- ток которого оттитровывают тиоцианатом Избыток КОН отти- 190
184 ла (см. № 6), например оливковое, (см. № 227), льняное, —определение числа омыления Растительные и полимеризованные масла — определение числа омыления (см. № 6) те (испытаны различные низшие спирты, лучшим оказался пропанол); кипятят 30—120 мин в колбе, снабженной обратным холодильником (Метод описан выше 18 дено, что лучшим рас изопрог тровывают кислотой ° —см. № 183; най-творителем является ганол) 191
79
Продолжение
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
185 Метилформиат (см. № 38), образуемый при определении муравьиной кислоты в моче реакцией со смесью НС1 — метанол Отгоняют в избыток NaOH Формиат натрия осаждают избытком Hg11, осадок растворяют иодом, избыток которого оттитровы-вают тиосульфатом [см. «Соединения ртути (II)», литература 95] 192
186 Сульфамиды (см. № 54) Нагревают со щелочью (образуются ароматические амины) Кислота; титруют нитритом в присутствии крахмал— иодид (см. Том I, «Нитрит натрия», литература -46) 193
187 Г ексахлорциклогексан в импрегнированной одежде (см. № 217, 219, 233, 256, 259, 265, 313, 320, 325, 409) NaOH в смеси ацетон—вода; кипятят 2 ч в колбе, снабженной обратным холодильником HNO3; AgNO3, избыток которого оттитровывают тиоцианатом 194
188 Моно- и дихлорметил-хлороформиат NaOH; 5 мин при комнатной температуре (образуются НСНО и нсоо-) Hg11, избыток которого оттитровывают иодом [см. «Соединения ртути (II)», литература 97] 195
189 Физостигмин (эзерин) CisHbiIS 3O2 NaOH (образуется метиламин) Перегоняют в H2SO4, избыток которой оттитровывают щелочью 196
190 Ацетат линалола (см. № 337), образующийся при определении линалола реакцией с уксусным ангидридом Раствор КОН в спирте Избыток КОН оттитровывают кислотой 197
191 Некоторые метиловые и этиловые эфиры (см. № 26), например метил-салицилат (см. № 83), этилкарбамат (см. Ке 200) кон (образуется метанол или этанол) Отгоняют; титруют смесью СгОа—H2SO4 в присутствии внешнего индикатора— лейкооснования метилового голубого (см. Том I, «Бихромат и хромовый ангидрид», литература 14) 198
192 Натуральные воски — определение числа омыления (см. № 10) Раствор КОН в смеси этанол—карби-тол; кипятят 1 ч в колбе, снабженной обратным холодильником Избыток КОН оттитровывают HC1 в присутствии фенолфталеина 199
80
Продолжение
.—- Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
П/П Титруемое вещество
193 Хлороформ (см. № 13); бромоформ (см. № 278) Раствор КОН в смеси спирт—ацетон; ~1 ч при комнатной температуре (5 мин для бромоформа) Уравнение (СН3)2 СО + СНС13 -> -> (СН3)2СО + зкс Для определения СГ добавляют избыток серебра (I), который оттитровывают тиоцианатом реакции: 4К.ОН (СН,)2 С (ОН) СС13 -> +НСООК + 2Н2О 200
194 ДДТ (см. № 151) Раствор КОН в смеси спирт—ацетон; 30 мин при комнатной температуре HNO3; AgNO3, избыток которого оттитровывают тиоцианатом 201
195 Поливинилацетат в поливинилацеталях и по-ливинилкеталях (защитное стекло) Нагревают в среде метанол^бутанол и добавляют NaOH H2SO4, избыток которой оттитровывают NaOH в присутствии бромфенолового голубого 202
196 Этил ацетат (см. № 11), образующийся при определении ацетильных групп (см. № 4) переэтерификацией со смесью этанол—НС1 Перегоняют в избыток щелочи Избыток щелочи оттитровывают кислотой 203
197 ДДТ (см. № 151) Раствор КОН в диэтиленгликоле; при 150—160° С (образуются СГ -ионы) Добавляют AgNO3, избыток серебра (I) оттитровывают тиоцианатом 204
198 ДДТ (см. № 151) Щелочь; 30—60 мин с 0,1 н. раствором (Изучено влияние ще центр СК-ионы оттитровывают аргентометрически л очи различной кон-ации) 205
199 О-Ацетильные группы (см. № 4) в присутствии N-ацетильных групп NaOH в смеси вода— ацетон; 2 ч при комнатной температуре Избыток NaOH оттитровывают кислотой в присутствии фенолового красного 206
200 Этилкарбамат в крови (см. № 191) NaOH (образуются NH3, СО2 и этанол) Перегоняют в смесь Сг2Оу——H2SO4, избыток которой определяют иодометрически 207
201 5,6-Дици клопентилфор-миат, образующийся при определении ди-циклопентадиена реакцией с муравьиной кислотой В бензоле; КОН в 95% -ном этаноле; кипятят 6 ч в колбе, снабженной обратным холодильником Избыток КОН оттитровывают НС1 в присутствии фенолфталеина 208
81
Продолжение
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
202 203 204 205 206 207 208 209 1 -Бензоилглюкуроновая кислота в моче Диэтилфталат в бездымном порохе Дихлоруксусная кислота (см. № 162) Пектин (см. № 76) Тетр аэти л пи р офосфат (см. № 235, 414) Жиры (см. № 20) и воски (см. № 10) — определение числа омыления Галогенсодержащие органические соединения в воздухе (см. № 169) Хлопковое масло — определение числа омыления (см. № 6) NaOH; кипятят 2 ч КОН в воде; кипятят 1 ч в колбе, снабженной обратным холодильником, затем добавляют Н2О2 для окисления присутствующих альдегидов и далее снова дополнительно кипятят 1 ч NaOH; кипятят 1 ч в колбе, снабженной обратным холодильником Уравнения реакций: СНС12СОО~ -» СНОСОО- 4 2СНОСОО" -^СН2ОНСОС NaOH; 30 мин при комнатной температуре Экстрагируют бензолом; NaOH; встряхивают 1 ч при комнатной температуре Щелочь в спирте (лучше в этаноле или в пропаноле, поскольку растворяющая способность метанола меньше) В этаноле или пропаноле; КОН; оставляют на ночь при 50° С КОН в изопропаноле; кипятят 30 мин в колбе, снабженной обратным холодильником Подкисляют, бензойную кислоту экстрагируют толуолом и титруют C2H6ONa в присутствии фенолфталеина Вода; этанол отгоняют в смесь CrjOy-— H2SO3, избыток которой определяют иодометрически / Аммиак; ацетат кальция, образуется осадок оксалата кальция, который растворяют в H2SO4 и оттитровывают перманганатом + 2ОН- -> 2СГ + Н2О; + ОН- -> )- + (СОО)7 Избыток H2SO4, который оттитровывают NaOH Избыток NaOH оттитровывают НС1 в присутствии бромтимолового голубого Избыток щелочи оттитровывают кислотой Уксусная кислота, галогенид-ионы оттитровывают AgNOg по методу Либиха Этилен- или пропи-ленгликоль, титруют НС1 в среде гликоль—изопропанол в присутствии анилинового голубого - 209 210 211 212 213 214 215 216
8?
Продолжение
п’п Титруемое вещество Реагент н условия реакции Соответствующая обработка и конечная стадия титрования Литература
210 211 212 213 214 215 Дифенилкарбонат в тканях Дималон (репелент для насекомых) в тканях Пенициллин (см. № 171) Ангидрид в молочной кислоте (см. № 40) Метиллактат, образующийся при определении молочной кислоты реакцией со смесью метанол—H2SO4 (см. № 458) Хлорбутанол (см. № 96) Выпаривают эфирный экстракт; К2СО;1 в водном растворе; нагревают 20 -30 мин (образуется фенол) Раствор КОН в спирте; кипятят 90 мин в колбе, снабженной обратным холодильником НаОН; 15 мин при комнатной температуре Щелочь; кипятят 3 мин Гидролизуют щелочью Раствор КОН в спирте; или смесь КОН— Са (ОН)2—феллин-гова жидкость (при кипячении образуется ацетон) Обрабатывают бромид—броматом, избыток которого оттитровывают иодометрически (см. «Реагенты, содержащие бром», литература 275) Избыток КОН оттитровывают H2SO4 в присутствии фенолфталеина Нейтрализуют, добавляют избыток иода, который оттитровывают тиосульфатом (см. «Реагенты, содержащие иод», литература 259) Избыток щелочи оттитровывают кислотой Лактат окисляют МпО^" в щелочной среде до оксалата, который осаждают Са2+, затем оттитровывают образовавшийся оксалат кальция перманганатом (см. «Перманганат калия», литература 87 и «Соединения кальция», литература 23) Избыток КОН оттитровывают НС1 в присутствии метилового оранжевого Образующийся ацетон перегоняют и определяют иодометрически, добавляя избыток иода, который оттитровывают тиосульфатом (см. «Реагенты, содержащие иод», литература 262) 217 218 219 220 221 222
83
Продолжение
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Л и Герату ра
216 Фталевые эфиры в реактивном топливе (см. № 26, 290, 348) Раствор КОН в метаноле; кипятят в колбе, снабженной обратным холодильником Избыток КОН оттитровывают НС1 в присутствии фенолфталеина 223
217 Изомеры гексахлор -циклогексана (см. № 187) Раствор КОН в спирте; кипятят 20 мин в колбе, снабженной обратным холодильником (реагируют все изомеры) или 15 мин при 0° С и 50 мин при 0° С (разница эквивалентна содержанию •у-изомера) HNO3; нитробензол; AgNO3, избыток которого оттитровывают тиоцианатом 224
218 Пенициллина натриевая соль (см. № 171) NaOH; 20 мин при комнатной температуре Нейтрализуют и добавляют иод, избыток которого оттитровывают тиосульфатом 225
219 Гекса хлорциклогексан в промышленных продуктах (см. № 187) КОН в спирте HNO3; AgNO3, избыток которого оттитровывают тиоцианатом 226
220 Гидролизуемые органические галогениды (см. № 169), например хлоргидрины NaOH; кипятят I ч в колбе, снабженной обратным холодильником; или NaHCO3, кипятят 30 мин Нейтрализуют; галоген ид-ионы оттитровывают AgNCXj в присутствии хромата 227
221 Пенициллин (см. К» 171) В фосфатном буферном растворе, pH 7; NaOH; 30 мин при комнатной температуре Нейтрализуют, добавляют иод, избыток которого оттитровывают тиосульфатом (см. «Реагенты, содержащие иод», литература 266) 228
222 Алкил силиконизотиоци-анаты (см. № 237) Щелочь, в количестве, немного меньшем эквивалентного Дотитровывают щелочью в присутствии фенолфталеина 229
223 Метилбромид в воздухе (см. № 48) Пропускают через КОН в метаноле; 2 ч при комнатной температуре В ода—у ксусная кислота; Вг" оттитровывают Ag1 в присутствии эозина 230
224 Пенициллин (см. № 171) NaOH; 30 мин при 30° С Слабо подкисляют и добавляют избыток иода, который оттитровывают тиосульфатом (см. «Реагенты, содержащие иод», литература 267) 231
84
Продолжение
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
225 Глутамин в крови или в плазме (см. № 247, 292) КОН—тетраборат натрия; оставляют на ночь при 38° С Аммиак перегоняют в избыток H2SO4, который оттитровывают NaOH 232
226 Монохлор уксусная кислота (см № 143) в вине и т. п. NaOH; 2 ч при 80° С HNO3; AgNO3, избыток которого оттитровывают тиоцианатом 233
227 Оливковое масло — определение числа омыления (см. № 6, 184) Раствор КОН в эта-иоле (Изучаются ycj Избыток КОН потенциометрически оттитровывают НО или в присутствии фенолфталеина ювия реакции) 234
228 Винилацетат (см. № 327, 425) Раствор NaOH в этаноле; 30 мин при 45—50° С Избыток N аОН оттитровывают кислотой 235
229 Фенилтиоацетат (CcH6SCOCH3) Раствор КОН в этаноле; 20 мин при комнатной температуре (образуется тиофенол) Уксусная кислота; несколько капель пиридина, титруют иодом (см. Том I, «Иод», литература 63) 236
230 Пенициллин (см. № 171) NaOH; нагревают до кипения Слабо подкисляют и определяют, добавляя избыток иода (см. «Реагенты, содержащие иод», литература 273) 237
231 и,и'-ДДТ в препарате ДДТ (см. № 151) КОН; 1 ч при 1—5° С HNO3; AgNO3, избыток которого оттитровывают тиоцианатом 238
232 Яблочная кислота в зеленых листьях табака NaOH; Зч при 130° С (образуется фумаровая кислота) Вода; осаждают в виде соли ртути (I); окисляют Hg1 до Hgn и оттитровывают тиоцианатом [см. «Соединения ртути (I)», литература 2] 239
233 Гексахлорциклогексан в фармацевтических препаратах (см. № 187) Кипятят 1 ч с этаноловым раствором КОН в колбе, снабженной обратным холодильником HNO3; трихлорбензол экстрагируют эфиром, С1“ определяют аргентометрически 240
234 ДДТ (см. № 151) Раствор КОН в спирте, 40 мин при 40° С (образуются СР-ионы) СГ определяют, добавляя AgNO3, избыток которого оттитровывают тиоцианатом 241
85
Продолжение
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Л ил... рату-ря
235 Т етр аэти лпирофосфат (см. № 2С6) Раствор NaOH в воде; 30 мин при комнатной температуре Избыток NaOH оттитровывают в присутствии метилового красного или потенциометрически 242
236 Воски — определение числа омыления (см. № 10) Раствор КОН в этиленгликоле; немного ксилола; 2 ч при 130° С Титруют НС1 в присутствии тимолфталеина, а затем с бромфеноловым голубым, разница эквивалентна содержанию органической кислоты 243
237 Алкилсиликонизоци-анаты (см. № 222) и ал-килсиликонизотиоциа-наты Добавляют избыток NaOH (изоцианаты) или немного меньше, чем эквивалентное количество (изотиоцианаты) Избыток щелочи оттитровывают НО или титрование заканчивают щелочью 244
238 Эти л герм а ний фор ми ат, ацетат или меркаптоацетат NaOH в этаноле — 95% от предполагаемого количества; 5 мин при комнатной температуре Титрование заканчивают в присутствии бромфенолового 1рлубого, фенолфталеина или фенолового красного соответственно 245
239 Уретаны в жидкостях (см. № 119) NaOH (образуется этанол) Переносят в смесь бихромат—H2SO4 и избыток ее определяют иодометрически (см. «Бихромат и трехокись хрома», литература 152) 246
240 Ацетаты (см. № 45) в оксиэтил целлюлозе КОН—этанол—вода; 48—72 ч при комнатной температуре Избыток КОН оттитровывают кислотой 247
241 Моно- и диметилолмочевина В воде; NaOH— NaH»PO4; кипятят 15—60 мин в колбе, снабженной обратным холодильником (образуется НСНО) НСНО определяют бисульфитным методом (см. «Бисульфит и сульфит», литература 97) 248
242 Жиры (см. № 20) и масла (см. № 6) — определение числа омыления КОН—этиленцелло-зольв—ксилол (1 : 1); 10 мин при 90° С Избыток КОН оттитровывают НС1 в этилцеллозольве в присутствии тимолфталеина 249
243 Эфиры в талловом масле (см. № 26) Раствор КОН в метаноле; кипятят 3 ч в колбе, снабженной обратным холодильником Избыток КОН оттитровывают кислотой в присутствии тимоловый голубой—тимолфталеин 250
86
Продолжение
п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
241 Жиры (см. № 20) и масла (см. № 6) — определение числа омыления КОН—гликоль—немного бензола; 2 ч при 130° С Титруют НС1 в присутствии тимолфталеина, а затем бромфенолового голубого; разность эквивалентна содержанию органической кислоты 251
245 Пенициллинам №171), соль натриевая, кальциевая или новокаина NaOH; 20 мин при комнатной температуре Доводят до pH 2—6,5 и определяют, действуя избытком иода (см. «Реагенты, содержащие иод», литература 278} 252
246 Диметилсульфат NaOH; 90 мин при комнатной температуре (образуется CH3OSO3Na) Избыток NaOH оттитровывают НС1 в присутствии бромкрезолового зеленого 253
247 Протеины (см. № 293, 299, 382, 411, 433) в коровьем молоке [главным образом глутамин (см. № 225) и аспарагин (см. № 292)] NaOH; ВаС12; 10 мин перегоняют (образуется аммиак) NH3 отгоняют в избыток H2SO^, который оттитровывают NaOH в присутствии метиловый красный—метиленовый голубой 254
248 Пенициллин (см. № 171) NaOH; изучены различные условия, например 15 мин при 22° С или 10 мин при 100° С Определяют, действуя избытком иода (см. «Реагенты, содержащие иод», литература 279} 255
249 ДДТ в поверхностных обрызгиваниях и т. п. (см. № 151) Раствор КОН в воде; 30 мин при комнатной температуре или раствор КОН в спирте; кипятят 30 мин в колбе, снабженной обратным холодильником Избыток щелочи оттитровывают кислотой в присутствии метилового оранжевого 256
250 Метилсалицилат (см. № 83) Раствор КОН в этаноле; кипятят 30 мин в колбе, снабженной обратным холодильником Подкисляют; салициловую кислоту экстрагируют эфиром и оттитровывают NaOH в присутствии фенолового красного 257
251 ДДТ (см. № 151) Раствор КОН в этаноле; кипятят 25— 30 мин в колбе, снабженной обратным холодильником (образуются С1“ -ионы) Избыток КОН оттитровывают кислотой в присутствии фенолфталеина 258
87
Продолжение
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
252 Эфиры в присутствии альдегидов (см. № 26) Альдегиды реагируют с NH2OH, затем добавляют NaOH; 30 мин при 60° С Избыток NaOH оттитровывают НС1 в присутствии тимолфталеина 259
253 Пенициллины в промышленных культурах (см. № 171) Экстракт в бутаноне; NaOH; 10 мин при комнатной температуре Доводят до pH 4 и добавляют иод, избыток которого оттитровывают тиосульфатом (см. «Реагенты, содержащие иод», литература 281) 260
254 Ацетильные группы (см. № 4) в пектинах (см. № 76) NaOH; оставляют на время, требующееся для растворения, и дополнительно еще на 1 ч H2SO4—MgSO4; перегоняют и титруют NaOH в присутствии фенолового красного 261
255 Хлордан В петролейном эфире; раствор КОН в спирте; кипятят 30 мин в колбе, снабженной обратным холодильником СГ -ионы определяют, добавляя Ag1, избыток которого оттитровывают тиоцианатом 262
256 Изомеры гексахлорциклогексана в технических продуктах (см. № 187) Раствор КОН в метаноле. Изучены различные условия реакции, например при 20 мин и 100° С реагируют все изомеры; при 20 мин и 30° С реагируют а-, у- и 6-изомеры СГ-ионы оттитровывают HgSO4 в присутствии дифенил-карбазона 263
257 Пенициллин (см. № 151), выделяющийся при анализе новокаиновой соли пенициллина после осаждения новокаина молибдене- или вольфрамокремневой кислотой (Метод описан выше 228 — см. № 221) (См. «Реагенты, содержащие иод», литература 287) 264
258 Алкилсиланиодиды (R^SiU-J Раствор NaOH в этаноле Избыток NaOH оттитровывают кислотой 265
259 Изомеры гексахлорциклогексана после хроматографического разделения (см. № 187) Раствор КОН в спирте; кипятят 10 мин в колбе, снабженной обратным холодильником HNO3; титруют AgNO3 потенциометрически 266
260 Диацетоновый спирт и другие кетоспирты NaOH; 1—2 ч при комнатной температуре (образуется кетон) Перегоняют с паром в NHjOH -НС1 и оттитровывают выделяющуюся НС1 (см «Гидроксиламин», литература 96) 267
88
Прадо.1; жение
Ко п/п Гитрусмое вещество Реагент и условия реакции Соответствующая об работка и конечная стадия титрования Литература
261 2-Фенилсалицилат в медикаментах Раствор КОН в спирте; кипятят 2 ч в колбе, снабженной обратным холодильником или раствор КОН в воде; кипятят 30 мин в колбе, снабженной обратным холодильником Избыток КОН оттитровывают НС1 в при сутствии фенолфталеина, фенолфталеина—тимолового голубого пли потенциометрически Салициловую кислоту определяют, добавляя ВгО3—Вг~, избыток которого оттитровывают иодометрически (см. «Реагенты, содержащие бром», литература 325) 268
262 Резинаты кальция или цинка Избыток щелочи Титруют НС1 в присутствии тимолфталеина и бромфенолового голубого, как в методе, описанном выше 261 269
263 Этилхлорид (см. № 131) Раствор КОН в спирте, кипятят 2 ч в колбе, снабженной обратным холодильником Избыток КОН оттитровывают кислотой 270
264 Эфир уксусной кислоты (см. № 15), образующийся при определении гидроксильных групп (см. № 22) реакцией с уксусным ангидридом Раствор КОН в спирте; кипятят 30 мин в колбе, снабженной обратным холодильником Избыток КОН оттитровывают НС1 в присутствии фенолфталеина 271
265 ДДТ (см. № 151) и гек-сахлорцнклогексана (см. № 187) Ацетоновый экстракт; раствор КОН в спирте; кипятят 12 мин в колбе, снабженной обратным холодильником (Параллельно колор ЛЯЮТ ОД1 HNO3; AgNO3, избыток которого оттитровывают тиоцианатом иметрически опреде-1н ДДТ) 272
266 Диметилированный пектин (см. № 76) NaOH; 15 мин НС1, избыток которой оттитровывают NaOH в присутствии фенолфталеина 273
267 Сополимеры метил- и аллил метакрилатов Раствор КОН в спирте; кипятят 2 ч в колбе, снабженной обратным холодильником Спирт отгоняют с водяным паром, аллиловый спирт определяют действием избытка ВгО^ (см. «Реагенты, содержащие бром», литература 330) 274
89
П р одолжение
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
268 Бензилхлорид Метанол—вода; NaOH в 27%-ном этаноле; кипятят 30 мин в колбе, снабженной обратным холодильником Избыток NaOH оттитровывают кислотой 275
269 Трудноомыляемые эфиры (см. № 26), например канифоли Раствор КОН в смеси диэтиленгликоль—фенетол (92 : 8), последний повышает растворяющую способность и его пары предотвращают окисление; кипятят 2 ч в колбе, снабженной обратным холодильником Избыток КОН оттитровывают в присутствии тетрабромфенолового голубого или потенциометрически до pH 3,5 276
270 Эфиры уксусной кислоты (см. № 15), образующиеся при определении спиртов реакцией с уксусным ангидридом Нейтрализованный раствор; раствор NaOH в спирте; кипятят не менее 2 ч в колбе, снабженной обратным холодильником Избыток NaOH оттитровывают H2SO4 в присутствии крезоловый красный— тимоловый голубой 277
271 Метилнитрат CH3ONa; 1 ч при комнатной температуре, затем кипятят 1 ч в колбе, снабженной обратным холодильником Нитрат восстанавливают до аммиака сплавом Деварда; NH3 оттитровывают кислотой 278
272 Эфиры — определение числа омыления (микрометод) (см. № 26) Раствор КОН в воде, этаноле, этиленгликоле или диэтиленгликоле; нагревают 1 ч при 100° С в запаянной стеклянной трубке Избыток КОН оттитровывают НС1 в присутствии крезоловый красный—тимоловый голубой 279
273 ДДТ (см. К» 151) Применяя различные методики, можно разложить ДДТ с выделением 1, 2 или 5 ионов СГ , например Fe2O3— разбавленный раствор NaOH; 30 мин при 250° С; КОН в этиленгликоле; 3 ч при 180° С Избыток NaOH оттитровывают H2SO4 в присутствии метилового оранжевого или СГ -ионы оттитровывают AgNO3 потенциометрически 280
274 Эфиры (см. № 26), образуемые при ацетилировании кукурузного крахмала, амилозы и амилопектина (Метод описан выше 15 131, 161 _ см № 125> 5) 281
Продолжение
Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
v/n Титруемое вещество
275 Пенициллин (см. № 171) после предварительной экстракции амилацетатом NaOH; 5 мин при комнатной температуре Нейтрализуют НС1, добавляют иод, избыток которого оттитровывают тиосульфатом (см. «Реагенты, содержащие иод», литература 296) 282
276 Метилсалицилат (см. № 83) в жидкой мази Раствор КОН в этаноле Этанол выпаривают, подкисляют; салициловую кислоту экстрагируют эфиром и оттитровывают щелочью 283
277 Галогениды (полу микрометод) (см. Ns 169) КОН- диэтиленгликоль; нагревают 3 ч при 150—160° Св запаянной стеклянной трубке HNO3; нитробензол; AgNO3, избыток которого оттитровывают тиоцианатом 284
278 Бромоформ в сиропах и пилюлях (см. № 193) Нагревают с твердым NaOH Добавляют Ag1, избыток которого оттитровывают тиоцианатом 285
279 Ангидрид и кислота в молочной кислоте (см. № 40) NaOH; 20—30 мин при комнатной температуре Избыток NaOH оттитровывают кислотой в присутствии фенолфталеина 286
280 п,п'-ДДТ в эмульсии ДДТ (см. № 151) Раствор КОН в метаноле; 40 мин при 40° С HNO3; экстрагируют водой, добавляют Ag1, избыток которого оттитровывают тиоцианатом 287
281 Ацетильные группы (см. № 4) в ацетате целлюлозы (см. № 18) 75%-ный этанол (нагревают 30 мин при 50—60° С); NaOH; 15 лшн при 50° С, затем 48 ч при комнатной температуре Небольшой избыток HCI; оставляют на ночь и оттитровывают щелочью 288
282 Аралкилсульфонаты Сплавляют со щелочью при 350° С Растворяют в воде, нейтрализуют для определения фенолов, добавляют избыток брома, который обратно оттитровывают иодометрически (см. «Реагенты, содержащие бром», литература 339) 289
9)
Продолжение
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
283 3-(п-Х л орфенил) -1,1 -диметил мочевина КОН—вода—этанол—глицерин; кипятят 2,5 ч в колбе, снабженной обратным холодильником (образуется диметиламин) Дпметиламин перегоняют в избыток НС1 и оттитровывают щелочью потенциометрически 290
284 Эфиры (полумикрометод) (см. № 26) NaOH; нагревают 30 мин при 60° С в запаянной стеклянной трубке Избыток NaOH оттитровывают НС1 в присутствии фенолфталеина, тимолфталеина или тимолового голубого 291
285 Этиловый эфир фенилкарбаминовой кислоты Раствор КОН в этаноле (образуется анилин) Подкисляют и титруют нитритом 292
286 Метилбромид (см. № 48) Раствор КОН в метаноле; 15 мин при 0° С, затем 1 ч при 55° С Ag1, избыток которого оттитровывают тиоцианатом 293
287 Бензоильные группы (см. № 4) NaOH—вода—пиридин; 5 ч при 140— 150° С или CaHsONa—этанол— пиридин; 5 ч при 110—120° С Подкисляют; экстрагируют бензойную кислоту СНС13 и оттитровывают CH3ONa в присутствии тимолового голубого 294
288 1,1 -Бис-(п-этоксифенил)-2-(бромфенил)-этилен Нагревают с Na2CO3 Вг" -ионы определяют аргентометрически 295
289 Фталевый ангидрид Раствор КОН в этаноле; 15 мин при 70—75° С Эфир нейтрализуют по фенолфталеину олеиновой кислотой, образовавшийся гидрофталат натрия оттитровывают и определяют перманганатометрически (см. «Перманганат калия», литература Ш) 296
290 Фталевые эфиры в реактивных порохах (см. № 26, 216) Экстрагируют ме-тиленхлоридом и омыляют КОН Подкисляют фосфорной кислотой, фталевую кислоту экстрагируют эфиром и оттитровывают щелочью 297
291 Метиленсалициловая кислота NaOH (образуется салициловый альдегид) Добавляют ВгО^“, избыток которого оттитровывают иодометрически 298
92
Продолжение
№ и/л Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
292 Амиды (см. № 118) в Щелочь; нагревают NH3 поглощают бор- 299
293 промышленных экс- трактах [например, аспарагин (см. № 247), глутамин (см. № 225)] Протеины (см. № 247) 2—4 мин (образуется аммиак) Нагревают со смесью ной кислотой и оттитровывают H2SOa NH3 поглощают 300
294 Хлорамфеникол (см. NaOH—ацетат на- трия (образуется аммиак) Сплавляют со смесью H2SO4, избыток которой оттитровывают щелочью HNO3; AgNOg, избы- 301
№ 390, 434) (левомице- К2СО3—Na2CO3 ток которой оттитро- •
295 ТИН. Монобромуксусная кис- КОН—эфир—вода; вывают тиоцианатом Вг~ окисляют 302
296 лота в виноградном сусле, фруктовых соках Дихлорэтан (см. № 117) к водному слою добавляют MgO, выпаривают досуха и нагревают 2 ч при 475° С Поглощают этано- ОС1 -ионами при pH 6,5 до ВгСЩ, добавляют I" -ионы и оттитровывают выделившийся иод в кислой среде Добавляют Ag1, из- 303
297 или хлорбромэтан в воздухе Ацетильные группы лом; добавляют NaOH и нагревают NaOH; 3 ч при ком- быток которого оттитровывают тиоцианатом Подкисляют уксус- 304
298 (см. № 4) в пектиновых веществах (см. № 76) Эфиры в этаноле (см. натной температуре NaOH; 1 ч при ком- ной кислотой; экстрагируют и титруют щелочью Избыток NaOH отти- 305
299 № 26) Амидный азот (см. натной температуре Нагревают до 70° С тровывают H2SO4 NH3 поглощают бор- 306
300 № 467) в коллагене и других протеинах (см. № 247) N, N' -Д ибензилэтилен- с 2 н. раствором NaOH (образуется NH3) NaOH; 10 мин при ной кислотой и оттитровывают кислотой Нейтрализуют и 307
301 диаминднбензилпени-циллин (см. № 171) Алкалоиды белладонны комнатной температуре Щелочь; кипятят определяют иодометрически (см. «Реагенты, содержащие иод», литература 322) Избыток щелочи от- 308
302 Высыхающие масла — (образуется тропо-вая кислота) КОН—н-бутанол— титровывают кислотой в присутствии фенолфталеина Избыток КОН отти- 309
303 определение числа омыления (см. № 6); сополимеры со стиролом или циклопентадиеном Ацетильные (см. № 4) и 5% воды Раствор NaOH в эта- тровывают кислотой Пропускают через 310
бензоильные (см. № 4) группы ноле; нагревают ионообменник; NaOH оттитровывают органическую кислоту в элюате
93
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Лите-рату Ра
304 Ацетильные группы (см. № 4), например в производных углеводов Раствор NaOH в метаноле; 20 мин при 130—140° С, затем метанол отгоняют H2SO4, уксусную кислоту перегоняют и оттитровывают NaOH 311
305 Бензилбензоат (см. № 100) и дибутилфталат (см. № 310) Раствор NaOH в этаноле; кипятят 1 ч в колбе, снабженной обратным холодильником (Описанный метод ко ционным спектральн позволяет определять компо Избыток NaOH оттитровывают H2SOa потенциометрически мбинируют с абсорб-ым методом; метод содержание каждого нента) 312
306 Трихлорэтан в дихлорэтане Раствор Ва(ОН)2 в метаноле; 2—2,5 ч при 30—40° С (Метанол реагирует незначительно) Избыток щелочи оттитровывают НС1 в присутствии метилового оранжевого 313
307 Алкилфталаты, после их отделения от нитрокомпонентов, содержащихся в реактивном топливе Экстракция петро-лейным эфиром; отгонка эфира; раствор КОН в этаноле; кипятят 45 мин в колбе, снабженной обратным холодильником (Нитрокомпоненты восстанавливают Ti111) Избыток КОН оттитровывают НС1 в присутствии фенолфталеина 314
308 Диальдегид, (см. № 75), содержащийся в перйодате оксикрахмалов NaOH; 1 мин при 100° С H2SO4, избыток которой оттитровывают щелочью в присутствии фенолфталеина или потенциометрически 315
309 Смоляные эфиры (см. № 26) КОН—н-гексиловый спирт—гидрат ги- дразина (получаются бесцветные растворы) Этанол или изопропанол; титруют НС1 в присутствии фенолфталеина 316
310 Дибутилфталат в реактивном топливе (см. № 305) Эфирный экстракт выпаривают; раствор NaOH в этаноле; кипятят 45 мин в колбе, снабженной обратным холодильником Избыток NaOH оттитровывают НС1 в присутствии ТИМОЛОВОГО голубого 317
311 Дикетопиперазины в продуктах поликонденсации а-аминокислот NaOH; 1 ч при 40° С (образуются дипептиды) Титруют CuSOa до изменения цвета от красно-фиолетового до голубого (см. Том I, «Соли меди (II)», литератора 114) 318
94
Продолжение
До п/п
Титруемое вещество
Реагент и условия реакции
Соответствующая обработка и конечная стадия титрования
Литература
312
313
Глиоксаль (см. № 329, 391, 392) в присутствии глиоксалевой кислоты
у-Гекса хлорциклогексан в дустах и т. п. (см. № 187)
314
Хлороформ (см. № 13); хлораль (см. № 1)
315
Хлорбутанол (см. № 96)
316
317
Альтакс — ускоритель вулканизации (дибен-зотиазолдисульфид— CcH4NC(S)S]2) в воздухе промышленных предприятий
Гептилпенициллин (см. № 171)
318
319
320
321
Дихлорэтан (см. № 117)
Нитрилы (см. № 118); амиды (см. № 118)
Гексахлор циклогексан с поверхностей опыленных материалов (см. № 187)
Диалкилфосфиты
[ (R0)* рСо]
В воде; NaOH; 10 мин при комнатной температуре
В этаноле; раствор КОН в спирте.
Два определения: а) 13—17 мин\ б) 50 мин при комнатной температуре NaOH; кипятят в колбе, снабженной обратным холодильником, или соответственно на холоду NaOH—вода—этанол; кипятят 15 мин в колбе, снабженной обратным холодильником
NaOH
NaOH; 15 мин при комнатной температуре
КОН —вода—этанол; 2 ч при 125° С под давлением 40%-ный раствор NaOH (образуется аммиак)
В ацетоне; раствор КОН в спирте; кипятят 15 мин в колбе, снабженной обратным холодильником
В этаноле; NaOH (образуется моноал-килфосфит натрия)
Избыток NaOH оттитровывают H2SO4 в присутствии фенолфталеина
HNO3; AgNO3, избыток которого оттитровывают тиоцианатом; разность эквивалентна содержанию у-фор мы
Ag1, избыток которого оттитровывают тиоцианатом или избыток щелочи оттитровывают НС1
HNO3; СГ -ионы оттитровывают до помутнения нитропруссида натрия
Избыток NaOH оттитровывают кислотой в присутствии фенолфталеина
Определяют иодометрически при pH 6, применяя обратное титрование иода тиосульфатом (см. «Реагенты, содержащие иод», литература 331)
Ag1, избыток которого оттитровывают тиоцианатом
NH3 отгоняют в H2SO4, избыток которой оттитровывают щелочью HNO3; AgNO3;
15 мин при 100“ С, фильтруют и избыток Ag+ оттитровывают тиоцианатом
Избыток NaOH оттитровывают НС1 в присутствии фенолфталеина
319
320
321
322
323
324
325
326
327
328
95
П родолженце
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
322 Хромоны (см. № 417 Раствор NaOH в этаноле; расщепляется пироновое кольцо (образуется кислота и кетон) Избыток щелочи оттитровывают кислотой 329
323 Метилбромид в пище (см. № 48) Пропускают через NaOH—Н2О2 Вг~ -ионы оттитровывают Ag1 в присутствии бриллиантового желтого 330
324 3,5,5'-Триметилцикло-гексил-манделат («Цик-лоспасмол») В этаноле; раствор КОН в этаноле; кипятят 2 ч в колбе, снабженной обратным холодильником Избыток КОН оттитровывают НС1 331
325 Г ексахлорциклогексан с поверхностей опыленных материалов (см. № 187) Экстракт в метаноле; NaOH; кипятят 15 мин в колбе, снабженной обратным холодильником Избыток NaOH оттитровывают НС1 потенциометр ически 332
326 Этилацетат (см № 11), образующийся при определении этанола (см. № 38) реакцией с уксусным ангидридом NaOH Избыток NaOH оттитровывают кислотой 333
327 Винилацетат (см. № 228) в сополимере с винилхлоридом (см. № 425) В диоксане; C2H5ONa; кипятят 1 ч в колбе, снабженной обратным холодильником H2SO4; Ag2SO4; уксусную кислоту отгоняют и оттитровывают NaOH в присутствии фенолфталеина 334
328 Концевые карбоксильные группы в поликапролактаме (осажденном из фенолового раствора 96% -ным этанолом) КОН—КО или NaOH—NaO; 10— 20 мин при комнатной температуре Избыток щелочи оттитровывают кислотой 335
329 Глиоксаль (см. № 312) NaOH; 8 мин при комнатной температуре НС1 в количестве, эквивалентном первоначально добавленному NaOH, титруют NaOH в присутствии фенолового красного 336
330 Нефтяной пек — определение числа омыления Бензол—этанол (2 : 5); раствор КОН в этаноле; кипятят 1 ч в колбе, снабженной обратным холодильником Избыток КОН оттитровывают этаноловым раствором НС1 потенциометрически 337
96
Продолжение
№ п/п Титруемое вещество 1 Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
331 Мочевино-формальде-гидные смолы в смесях с меламино-формальде-гидными смолами КОН—этиленгликоль; кипятят 1 ч в колбе, снабженной обратным холодильником (образуется аммиак) Просасывают через избыток H2SO4, который оттитровывают NaOH в присутствии метилового пурпурового 338
332 Метиленхлорид в водных растворах NaOH; нагревают 5 мин в бомбе Парра H2SO4; титруют AgNO3 в присутствии хромата 339
333 Пирамидон (см. № 29) Нагревают со смесью NaOH—КМпО4 (образуется диметиламин) Перегоняют в избыток НС1 или H2SO4, который оттитровывают NaOH в присутствии фенолфталеина 340
334 Эфиры уксусной кислоты (см. № 15), образующиеся при определении этиленгликоля или метил целлозольва реакцией с уксусным ангидридом NaOH Избыток NaOH оттитровывают КИСЛОТОЙ 341
335 Пенициллин (см. № 171) NaOH; 30 мин при 50° С (Изучаются условия реакции) Тнтруют иодометрически (см. «Реагенты, содержащие иод», литература 344} S42
336 Эфирные группы в полиэфирах (см. № 26), например полиакрилатах (см. № 356) и полиметакрилатах (см. № 356) В смеси бензол—метанол; КОН; 3—4 ч при 120—180° С в запаянной стеклянной ампуле Избыток КОН оттитровывают НС] в присутствии фенолфталеина 343
337 Линалолацетат (см. № 190) при определении линалола реакцией со смесью уксусный ан гидр ид—а цетил хлорид NaOH Избыток NaOH оттитровывают кислотой 344
338 Метилсалицилат или этилсалицилат (см. № 83) Кипятят с КОН в колбе, снабженной обратным холодильником Нейтрализуют H2SO4, добавляют избыток IC1, который определяют иодометрически (см. «Хлориды, бромид и тиоцианат иода», литература 345
339 4 Эфиры и-оксибснзойной кислоты (см. № 128) М. Р. ф. Эшворт Гидролизуют NaOH Pz) Подкисляют и ароматическую кислоту окисляют избытком ВгОд', который оттитровывают иодометрически (см. «Реагенты, содержащие бром», литература 482) 346 97
Продолжение
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
340 Тиснильные группы КОН, кипятят 1 ч в колбе, снабженной обратным холодильником (образуется K2SO3) Фосфорная кислота, SO2 отгоняют в избыток иода, который оттитровывают тиосульфатом 347
341 Эфиры или хлорангидриды моноэфиров щавелевой кислоты Раствор NaOH в этаноле; кипятят 1 ч в колбе, снабженной обратным холодильником Уксусная кислота— ацетат натрия, осаждают избытком Са2+, который определяют титрованием ЭДТА в присутствии эриохром черного (см. «Соединения кальция», литература 33) 348
342 Амиды (см. № 118) Раствор КОН в спирте; кипятят 1,5—4 ч в колбе, снабженной обратным холодильником Избыток КОН оттитровывают уксусной кислотой в присутствии тимолфталеина или потенциометрически 349
343 Метилфениловый эфир малоновой кислоты в присутствии метилфе-нилэтилового эфира малоновой кислоты В этаноле; NaOH; 30 мин при комнат-' ной температуре (второй эфир практически не гидролизуется) Избыток NaOH оттитровывают H2SO4 в присутствии фенолфталеина 350
344 Дибромэтан в фруктах, окуренных его парами (см. № 437) Экстракт в бензоле; NaOH—бензол— этанол; кипятят в колбе, снабженной обратным холодильником Вг’ -ионы определяют путем окисления до ВгО^~ и последующего титрования иодометрически 351
345 Эфиры тиофосфор ной КИСЛОТЫ В ацетоне; NaOH; кипятят 90 мин в колбе, снабженной обратным холодильником Растворитель выпаривают, добавляют Вг“ —НС1—избыток ВгО^~, который оттитровывают иодометрически 352
346 Высшие альдегиды (см. № 75) в присутствии кетонов и жирных кислот NaOH—Н2О2; 30— 60 мин при 100° С Этанол; избыток NaOH оттитровывают НС1 в присутствии фенолфталеина 353
347 Амиды (см. № 118) NaOH; иногда кипятят в течение 30 мин — 2 ч в колбе, снабженной обратным холодильником Образующийся аммиак или амин отгоняют в НС1, избыток которого оттитровывают щелочью 354
98
Продолжение
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
348 Эфиры фталевой кислоты (см. № 26, 216) в реактивных топливах (после восстановления нитро- и нитратных групп Zn-пылью + уксусная кислота) Раствор КОН в этаноле Эфир; образующийся гидрофталат калия отфильтровывают и титруют уксуснокислым раствором НС1О4 (см. Том I, «Хлорная кислота», литература 194) 355
349 Ацетильные группы (см. № 4) в рыбьем жире Раствор КОН в этаноле; кипятят в колбе, снабженной обратным холодильником Пропускают через ионообменник, образующуюся уксусную кислоту в элюате оттитровывают щелочью (см. «Ионо-обменники», литература 22) 356
350 Бутилацетат в воде NaOH; кипятят 40 мин в колбе, снабженной обратным холодильником Избыток щелочи оттитровывают H2S0a 357
351 Метилсалицилат в медицинских препаратах (см. № 83) NaOH; кипятят 15 мин в колбе, снабженной обратным холодильником Салициловую кислоту определяют в солянокислой среде бромид-броматным методом, избыток ВгО~ оттитровывают иодометрически (см. «Реагенты, содержащие бром», литература 442) 358
352 Кумарин В этаноле; NaOH и некоторое количество HgO; встряхивают 15 мин при комнатной температуре Избыток NaOH оттитровывают кислотой 359
353 Некоторые алкилгало-гениды (см. № 169), фосфор- и серосодержащие эфиры (см. № 26) C3H7ONa—пропанол; КОН—пропанол или КОН—метанол; кипятят 1 ч при комнатной температуре Пропускают через ионообменник и оттитровывают кислоту в элюате NaOH (см. «Ионообменни-ки», литература 24) 360
354 Пиразинкарбоксиамид Нагревают с КОН (образуется аммиак) NH3 отгоняют в кислоту, избыток которой оттитровывают щелочью 361
355 * Нитрилы никотиновой и изоникотиновой кислот (см. Ns 118) Нагревают с NaOH (образуется аммиак) NH3 отгоняют в НС], избыток которой оттитровывают щелочью 362
99
Продолжение
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
356 Ненасыщенные полиэфиры (см. № 26), например полиакрилаты (см. № 336), полиметакрилаты (см. № 336) В ацетоне; NaOH; перемешивают до полного омыления эфиров Нейтрализуют НО; ацетон выпаривают и остаток окисляют избытком МпО^”; также определяют по методу, описанному выше 183 — см. № 178 (см. «Реагенты, содержащие бром») 363
357 Ацетильные группы (см. № 4) в углеводах; амиды (см. № 118), например ацетанилид Лучше с 4—5 н. раствором NaOH в 33% -ном метаноле; кипятят 30 мин в колбе, снабженной обратным холодильником Подкисляют; уксусную кислоту перегоняют и оттитровывают щелочью 364
358 1 -Нитрозометилмочеви-на NaOH до полного выделения диазометана Уравнения H2NCON (NO) С -> NaCNO + С Избыток NaOH оттитровывают H2SO4 в присутствии фенолфталеина реакции: Н3 + NaOH -> ,H2N2 + 2Н2О 365
359 Ди хлор ацетальдегид (см. № 360) КОН в этаноле; 3— 4 ч при 100° С в закупоренной склянке а) Избыток щелочи оттитровывают кислотой; б) СГ -ионы оттитровывают AgNOg 366
360 Дихлор ацетальдегид (см. № 359) и трихлорацетальдегид КОН. Условия, как описано выше 366, — см. № 359 (В комбинации с коле делением а) Избыток щелочи оттитровывают кислотой; б) СГ -ионы оттитровывают AgNOg риметрическим опре-CClgCHO) 367
361 Малахитовый зеленый В воде; NaOH; 20 мин при комнатной температуре (образуется осадок карбинольного основания) Продукт растворяют в H2SO4 и оттитровывают CeIV потенциометрически [см. Том I, «Соединения церия (IV)», литература 66} 368, 391
362 Пенициллин (см. № 171) NaOH; 20—30 мин при комнатной температуре Нейтрализуют H2SO4, добавляют ацетатный буферный раствор и избыток иода, который оттитровывают тиосульфатом (см. «Реагенты, содержащие иод», литер'атура 368) 369
100
Продолжение
Д' п/п 363 364 365 366 367 368 369 370 371 Титруемое вещество Этил ацетат (см. № 11), образующийся при определении ацетиль-них групп (см. № 4) в аспирине (см. № 18) и других медикаментах переэтерификацией в присутствии этанол— H2SO4 Бромид и метилсульфат неостигмина (см. № 135) Сапонины в конских каштанах Ангидриды; лактоны (см. № 66) 5-(Натрийацетилсуль-фонамид)-3,4-диметил-изооксазол Фтивазид (ванилингн-дразон изоникотиновой кислоты) Жиры (см. № 20) и масла (см. № 6) — определение числа омыления Диамокс (2-ацетилами-но-1,3,4-тиадиазол-5-сульфонамид) Нитрилы (см. № 118) Реагент и условия реакции Раствор КОН в этаноле; кипятят 30 мин в колбе, снабженной обратным холодильником В воде; NaOH (образуется диметиламин) Экстракт в метаноле; NaOH в метаноле; при выпаривании выпадает осадок соли эсцинола В метаноле или этаноле; NaOH; доводят до кипения Щелочь Растворяют в NaOH В бензоле; раствор КОН в этаноле; кипятят 2 ч в колбе, снабженной обратным холодильником NaOH; кипятят 30 мин в колбе, снабженной обратным холодильником КОН—Н2О2; 5 мин при комнатной температуре, затем нагревают и частично выпаривают Соответствующая обработка и конечная стадия титрования Избыток КОН оттитровывают H2SO4 Диметиламин отгоняют в НС1, избыток которой оттитровывают КОН в присутствии метилового красного Растворяют в воде; эсцинол осаждают НС1 (5 мин при 40° С); отфильтровывают и оттитровывают NaOH в присутствии фенолфталеина Избыток NaOH оттитровывают кислотой в присутствии фенолфталеина Избыток щелочи оттитровывают кислотой Избыток NaOH оттитровывают НС1 в присутствии тимолфталеина Пропускают через ионообменник и титруют элюат КОН потенциометрически Избыток ВгО^—Вг—• кислота; избыток реагента оттитровывают иодометрически (см. «Реагенты, содержащие бром», литература 465) Избыток КОН оттитровывают H2SO4 в присутствии фенолфталеина «Лите-рату-) Ра 370 371 372 373 374 375 376 377 378
101
Продолжение
№ п/n Титруемое вещество Реагент и условия реакции Соответствующая обработка к конечная стадия титрования Литература
372 Эфиры (см. № 26), образующиеся при определении камфена в процессе взаимодействия со смесью НСООН— H2SO4 КОН в этаноле; кипятят 1 ч в колбе, снабженной обратным холодильником Избыток КОН оттитровывают H2SO4 379
373 Первичный аминоалкилалкоксисилан, применяющийся для поверхностной обработки стекла Сплавляют с КОН (образуется аммиак) NH3 поглощают борной кислотой и оттитровывают НС1 в присутствии метилового красного 380
374 Карбомоильные группы [—NH2CO— NH = = С (ОН)—], например в уреколине (бетаиэхол-хлорид, холиновый эфир) В пиридине; CH3ONa— пиридин— бензол—метанол; кипятят I ч в колбе, снабженной обратным холодильником Избыток CH3ONa оттитровывают бензойной кислотой в присутствии тимолового голубого 381
375 а,Р-Ненасыщенные эфиры (см. № 26) КОН; 5—60 мин при комнатной температуре Нейтрализуют; соль определяют, добавляя бром—NaBr— метанол, избыток брома оттитровывают иодометрически (см. «Реагенты, содержащие бром», литература 469) 382
376 Эфиры аминоспиртов (см. № 2) NaOH; перегоняют Оттитровывают избыток NaOH и дистиллят кислотой 383
377 Масла — определение числа омыления (полумикрометод) (см. Ns 6) КОН в этаноле; кипятят 30 мин в колбе, снабженной обратным холодильником Титруют этаноловым раствором НС1 п стен ци ом етр ичсс к и; разность между двумя результатами титрования эквивалентна содержанию органической кислоты 384
378 Ацетильные группы (см. Ns 4) (Метод описан выше80, полуавтоматический — см. Ns 74) 385
379 Бромурал (а-брэмизо-валерилмочевина); кар-бромал (а-бромдиэтил-ацетилмочевина) (см. Ns 461) Кипятят с NaOH в колбе, снабженной обратным холодильником Нагревают с Н2О2, слегка подкисляют уксусной кислотой и титруют кулонометрически серебром (I) 386
380 Тем неокрашенные ацетилированные жиры (см. Ns 20) Раствор КОН в этаноле; кипятят в колбе, снабженной обратным холодильником Избыток НС1; петро-лейный эфир; кипятят в колбе, снабженной обратным холодильником, водный слой титруют NaOH 387
102
Продолжение
JV, п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Л мте-рату-ра
381 382 383 384 385 386 387 388 389 390 Феноксиметплпеницил' шн (см. № 171) Протеины в пищевых продуктах (см. № 247) ДДТ (экстрагирован-' ный с поверхности) (см. № 115) Ацетильные группы (см. № 4), например в ацетилированных сахарах Пенициллин (см. № 171) Пенициллин (см. № 171) в ферментированных бульонных образцах Толбутамид / СН3 СсН4—SO2—NH\ ' н-С4Н9—NH—СО / 4-Метилурацил Пенициллин (см. Ns 171) Хлорамфеникол (см № 294) (Метод описан выше 177 — см. № 171) NaOH—ацетат натрия; нагревают до 325° С (образуется аммиак) Раствор NaOH в этаноле; 15 мин при комнатной температуре для п.п'-соеди-нений; 10 мин для всех остальных Раствор или суспензия в безводном метаноле; КОСН3, реагирующий с RCOCH3 согласно уравнению: RCOCH3+ KOCHg-^ ->^>С(СН3)ОСН3 Промежуточный продукт затем реагирует с метаиолом, образуя RH, СН3СООСН3, косн3 NaOH NaOH Ацетон; NaOH; 2 мин при комнатной температуре Вода—ацетон; КОН (Обсуждение факторов щелочной Нагревают с NaOH— Na2CO3 (см. «PeaieHTbi, содержащие иод», литература 378) NH3 пропускают в H2SO4, избыток которой оттитровывают щелочью в присутствии метилового оранжевого Вода; H2SO4; AgNO3, избыток которого оттитровывают НС1 потенциометрически Вода, которая гидролизует метилацетат; избыток основания оттитровывают НС1 Титруют иодометрически (см. «Реагенты, содержащие иод», литература 415) Титруют иодометрически (см. «Реагенты, содержащие иод», литература 380, 416) Фильтруют; фильтрат нейтрализуют, добавляют Ag1, избыток которого оттитровывают тиоцианатом Избыток КОН оттитровывают НС1 влияющих на иодно-метод) Вода; HNO3; добавляют AgNOg, избыток которого оттитровывают тиоцианатом в присутствии нитробензола 388 389 390 392 393, 432 394, 433 395 396 397 398
103
Продолжение
№ D/П Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Лите рату-ра
391 Глиоксали (см. № 312) NaOH—вода—метанол; кипятят 90 мин в колбе, снабженной обратным холодильником Избыток NaOH оттитровывают НО потенциометрически 399
392 Бисульфитные соединения глиоксалей (см. 312) (Метод описан выше 399 см, До 39]) Небольшой избыток НО; добавляют H2Og для окисления SOg-до SO4— (способствует получению резкой конечной точки титрования) и титруют NaOH потенциометрически 399 •
393 Ацетильные (см. № 4) или бутирильные группы в ацетобутнрате целлюлозы (см. № 18) Раствор КОН в этаноле; 72 ч при комнатной температуре или 15 ч при 40° С Фосфорная кислота; органические кислоты ОТГОНЯЮТ водяным паром и оттитровывают КОН в присутствии фенолфталеина (комбинируют с методом окисления бихроматом) 400
394 Ихтиол в мазях и свечах Нагревают с 50%-ным NaOH (образуется аммиак) Образующийся NH3 отгоняют в H2SO4, избыток которой оттитровывают щелочью 401
395 Эфиры (см. № 26), образующиеся при определении хлорангидри-дов в процессе взаимодействия их с этанолом Нейтрализованный раствор; NaOH; кипятят 1 ч в колбе, снабженной обратным холодильником Избыток NaOH оттитровывают H2SO4 402, 424
396 Изофталевая и другие двуосновные кислоты в модифицированных алкидных смолах В бензоле; раствор КОН в метаноле или этаноле; кипятят 1—15 ч в колбе, снабженной обратным холодильником Добавляют бензол, оставляют на 30 мин при комнатной температуре, двузамещенную соль калия отфильтровывают; растворяют в гликоле, добавляют избыток НС1—этанол, который оттитровывают КОН в метано. е в присутствии л4-крезолового пурпурного (в расчет принимают объем, соответствующий интервалу между первым и вторым изменением цвета индикатора) 403
104
Продолжение
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
397 398 399 400 401 402 Хлорэндиковая кислота (см- № 452), содержащаяся в алкидных смолах, применяющихся в производстве огнеупорных красок Ацетобутират целлюлозы (см № 18) Бензонафтол (см. № 94) Пенициллин в моче (см. № 171) Воски — определение числа омыления (см. № 10) 4-Ацетамид-Ь1-лауроил-1 -нафталинсульфонамид (ПАНС) В бензоле; раствор КОН в изопропаноле; кипятят 1 ч в кедбе, снабженной обратным холодильником (образуется осадок двузамещенной калиевой соли) Щелочь—этанол; 72 ч при комнатной температуре Очыляют спиртовым раствором КОН Экстракт; щелочь; 30 мин при комнатной температуре (образуется пени-циллинамин) Ксилол—этанол или изопропанол (1 : 1); КОН в метаноле NaOH; кипятят 30 мин К осадку добавляют H2SO4—Н2О2 (1 : 1); свободную кислоту экстрагируют эфиром и оттитровывают метанол овым рас- твором КОН в присутствии л-крезоло-вого пурпурного Фильтруют; осадок растворяют в воде, пропускают через ионообменник; свободные жирные кислоты оттитровывают щелочью 0-Нафтол определяют титрованием IC1—НС1 в кислой среде амперометрически (см. Том I, «Монохлорид иода», литература 20) Подкисляют НС1, нагревают 1 ч, добавляют боратный буферный раствор (pH 9,23) и титруют амперометрически раствором HgCl2 1см. Том I, «Соединения ртути (II)», литература 75] Избыток КОН оттитровывают НС1 в присутствии флюоресцирующих индикаторов (например, Р-метилумбеллиферо-на) или в присутствии фенолфталеина (для сравнения) НС1; Вг“, добавляют избыток нитрита при 0“ С, который оттитровывают сульфаниловой кислотой с внешним индикатором; крахмал—иод (см. «Нитрит натрия», литература 27) 404 405 406 407 408 409
J 05
Продолжение
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая об работка и конечная стадия титрования Литература
403 2,4-Дихлор-6-(о-хлор-анилин)-5-триазин; хлорангидрид циануровой кислоты (CoNoCL) (см. № 454) NaOH; кипятят 10 мин в колбе, снабженной обратным холодильником (гидролизуются соответственно 2 и 3 атома хлора) СГ оттитровывают AgNO3 потенциометрически 410
404 Пенициллин или его натриевая соль (см. № 171) NaOH; 30 мин при комнатной температуре [образуется пенициллинам ин (с —SH-группой)] НС1; NaN3; иод, избыток которого оттитровывают арсенитом через 1 мин-, содержание меркаптосоединений находят по калибровочному графику (см. «Реагенты, содержащие под», литература 399) 411
405 Эфирные масла — определение числа омыления (см. № 6) Раствор КОН в спирте; кипятят 2 ч в колбе, снабженной обратным холодильником Избыток КОН оттитровывают НС1 в присутствии фенолфталеина 412
406 Продукт присоединения J-кислоты к мочевине NaOH; кипятят 3 ч в колбе, снабженной обратным холодильником [образуется натриевая соль J-кислоты (6-амино-1 -нафтол-3-сульфокислота)] НС1; .и-ксиленсуль-фонат натрия; титруют нитритом потенциометрически или в присутствии индикатора: крахмал—1“ (см. Том I, «Нитрит натрия», литература 138) 413
407 Ацетильные группы (см. № 4) в поливинилацетате КОН—н-пропанол; кипятят 5 мин в колбе, снабженной обратным холодильником, затем 2—3 ч прн комнатной температуре и в конце кипятят 30 мин Теплый раствор титруют НС1 в присутствии фенолфталеина 414
408 Хлороформ (в присутствии СС14 и СН2С12) (см № 13) Раствор КОН в воде; кипятят 6 ч в колбе, снабженной обратным холодильником, или оставляют на ночь при комнатной температуре Добавляют избыток AgNO3, который оттитровывают тиоцианатом 415
106
Продолжение
л» П/П Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
409 Гексахлор циклогексан в смеси с ДДТ (см № 187) К выпаренному эфирному экстракту добавляют КОН— этанол (образуется трихлорбензол) Экстрагируют петро-лейным эфиром; под действием раствора натрия в бутаноле образуются СП -ионы, которые оттитровывают AgNO3 (см. «Металлы», литература 99) 416
410 Этилацетат .(см- № П) Спирт—вода (Изучены условия гидролиза щелочью) Избыток щелочи оттитровывают кислотой в присутствии бромтимолового голубого 417
411 Протеины в молоке (см. № 247) Нагревают с NaOH (образуется аммиак) NHg отгоняют и оттитровывают кислотой 418
412 Диацетил NaOH—избыток Н2О2; 5 мин при 40° С Избыток NaOH оттитровывают H2SO4 в присутствии тимолового голубого 419
413 Пенициллины (натуральные или синтетические) (см. № 171) (Метод описан выше аз? — см № 230) (См. «Реагенты, содержащие иод», литература 408) 420
414 Некоторые фосфорорганические соединения, содержащие фтор и пи-роэфирные соединения, например GB-сарин— метилизопропоксифто-рофосфиноксид C3H7OCH3FPO, тетраэтил пирофосфа г (см. № 206) Быстро нейтрализованный раствор в присутствии метилового красного и тимолфталеина; NaOH; 2—5 мин при комнатной температуре; эфиры гидролизуются Избыток NaOH оттитровывают НС1 421
415 Пенициллин в ферментированной среде (см. № 171) Экстракт; NaOH; 5 мин при комнатной температуре Небольшой избыток НС1, затем добавляют иод, избыток которого оттитровывают тиосульфатом после 5 мин (см «Реагенты, содержащие иод», литерату- 422
416 4,7-Дихлорхинолин NaOCH3 в безводном метаноле (замещаются четыре Cl-атома на —ОСН3-группы ра 409) Добавляют AgNO3, избыток которого оттитровывают тиоцианатом 423
417 З-Метилхромон (см. № 322) NaOH; кипятят 2 ч в колбе, снабженной обратным холодильником Избыток NaOH оттитровывают кислотой в присутствии фенолфталеина 425
107
Продолжение
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Л нте-рату-ра
418 Нитрильные группы (см. № 118) сополимеров акрилонитрила (см. Ns 158) и 5-ВИНИЛ-2-ПИ-колина Гидролизуют 40% -ным раствором кон NH3 отгоняют в НС1, избыток которой оттитровывают щелочью 426
419 Крезолы В ацетоне; КОН в метаноле Избыток КОН оттитровывают метаноловым раствором HCI по методу высокочастотного титрования 427
420 И-(3,4,5-Триметоксибен-зоил)-морфолин (триоксазин) Добавляют 20% NaOH; кипятят 1 ч (образуется морфолин) Отгоняют и титруют НС1 в присутствии метилового красного 428
421 Пенициллины (см. № 171) NaOH; 15 мин при комнатной температуре Небольшой избыток НС1; ацетатный буферный раствор (pH 4,6); иод, избыток которого оттитровывают тиосульфатом (см. «Реагенты, содержащие иод», литература 410) 429
422 Первичные и вторичные нитросоединения, например метил-, этил-, изопропил- и другие производные КОН—спирт с водой; 10 мин при комнатной температуре HCI—1“ ; выделившийся иод оттитровывают тиосульфатом 430
423 Метилацетат (см. № 134), образующийся при определении ацетата в ацетилированном полиформальдегиде в процессе переэтерификации его смесью НС1— метанол NaOH; нагревают 2 ч на водяной бане Охлаждают до —5° С, добавляют НС1, избыток которой оттитровывают NaOH потенциометрически 431
424 Этилакрилат в смеси с акрилонитрилом и ди-метилформамидом Раствор КОН в этаноле 5 мин Избыток КОН оттитровывают НС1 в присутствии фенолфталеина 434
425 Винилацетат (см. № 228) и винилхлорид (см. № 327) в сополимерах В тетрагидрофуране; КОН в этаноле; 1—3 ч при 30° С Избыток КОН оттитровывают H2SO4 в присутствии тимолового голубого; затем добавляют избыток H2SO4 и СГ -ионы оттитровывают AgNO3 потенциометрически или в присутствии хромата 435
108
Продолжение
№ п/n Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
426 427 428 429 430 43! 432 1 Фенольные эфиры — определение числа омыления (см. № 180) S-Алкилтиомочевины Темноокрашенные жиры (см. № 20) и масла (см. № 6) — определение числа омыления Йодоформ (содержащий 1311) (см. № 19) Ксиленолы в технических смесях Хлороформ (см. № 13) Диметилформамид в растворах или в текстильных материалах (предварительная экстракция) 1 Раствор NaOH в диоксане; кипятят не менее 30 мин в колбе, снабженной обратным холодильником NaOH; метанол (в случае необходимости); нагревают до кипения (образуются меркаптаны) Раствор КОН в этаноле; кипятят 1 ч в колбе, снабженной обратным холодильником; экстрагируют эфиром, экстракт выпаривают досуха и остаток снова обрабатывают кон Раствор КОН в изопентиловом спирте; 10 мин при 125— 130° С, затем добавляют КОН—вода и нагревают до тех пор, пока спиртовой слой не сделается прозрачным В ацетоне; NaOH в метаноле КОН—спирт—толуол—ацетон; кипятят 30 мин в колбе, снабженной обратным холодильником NaOH; вода; перегоняют НС1, избыток которой оттитровывают NaOH в присутствии фенолового красного или тимолфталеина Титруют о-оксимер-курибензоатом до исчезновения голубого окрашивания тио-флуоресцеина Избыток КОН оттитровывают НС1 Вода; водную фазу отделяют и обрабатывают Ag1, избыток которого оттитровывают тиоцианатом Избыток NaOH оттитровывают метаноловым раствором НС1 по высокочастотному методу HNO3; AgNO3; осадок AgCl оттитровывают; в фильтрат добавляют K2Ni (CN)4 и NH4OH до pH 10; КЧ2+-ионы оттитровывают ЭДТА в присутствии муре-ксида Отгоняют диметиламин в борную кислоту и оттитровывают НС1 436 437 438 439 440 441 442
109
Продолжение
№ п/п Титруемое вещество PeaicHT и условия реакции Соответствующая обработка и конечная стадия титрования Литература
433 434 435 436 437 438 439 440 441 Протеины в сыре (эфирный экстракт) (см. № 247) Хлорамфеникол (см. № 294) Трихлорэтилфосфат в фармацевтических препаратах Ацетильные группы (см. № 4) 1,2-Дибромэтан в воздухе или как остаток во фруктах (см. № 344) Бензонитрил в побочных продуктах коксового производства (в техническом нафталине) Пенициллин, например в чистых водных растворах (см. № 171) Четвертичные амилга-логениды, образующиеся при определении mpem-амилснов в присутствии других амиленов при добавлении НС1 Алифатические амины кислоты Рейнеке Кипятят с NaOH (образуются аминокислоты) NaOH; кипятят 15 мин Аликвотная часть экстракта в пентиловом спирте; КОН в этаноле; нагревают 2 ч (Метод описан выш иногда используют б< ную щелочь; в Раствор NaOH в метаноле; кипятят 15 мин в колбе, снабженной обратным холодильником (как в методе, описанном выше 303, — см. Ns 296) NaOH, 45 мин при 140—145° С в ампуле (образуется NH3) NaOH; 30 мин (образуется пени-циллинамин) Раствор КОН в спирте; кипятят 90 мин в колбе, снабженной обратным холодильником NaOH; тартрат калия; нагревают 2— 3 мин (образуются SCN’ -ионы) НСНО при pH 8—8,5 и обратно титруют NaOH до этого же значения pH (см. «Карбонильные соединения», литература 30) HNO3; вода, фильтруют; к фильтрату добавляют Ag1, избыток которого оттитровывают тиоцианатом HNO3; Ag1, избыток которого оттитровывают тиоцианатом в присутствии FeIH е 206 — см. № 199; злее концентрирован-течение 24 ч) HNO3; Вг~; ти- труют кулонометрически (см. вы- ше 361 — № 344) NH3 поглощают H2SO4, избыток которой обратно оттитровывают NaOH Эквивалентное количество НС1; 1 ч при 100° С, добавляют боратный буферный раствор и титруют HgCl2 амперометрически Избыток КОН оттитровывают этаноловым раствором НС1 в присутствии фенолфталеина Уксусная кислота; SCN~-hohh оттитровывают AgNO3 в присутствии ди- хлорфлуоресцеина 443 444 445 446 447 j 449 450 451 452
ПО
Продолжение
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
442 Гексахлорфенолы; пен-гахлорфенол Сплавляют с твердым NaOH Растворяют в воде; добавляют HNO3 и титруют Ag1 в присутствии СгО4— 453
443 Индийские смолы (см. № 103) определение числа омыления Раствор КОН в этаноле; кипятят 30 мин в колбе, снаб- женной обратным холодильником Избыток КОН оттитровывают кислотой эл ектр ом етр и чес ки или в присутствии тимолового голубого или флюоресцентного индикатора 454
444 Мепробамат (2-метил-2-пропил-1,3-пропан-диолдикарбамат, C9H1SN2O4) Кипятят со спиртовым раствором КОН Избыток КОН оттитровывают НС1 в присутствии фенолфталеин—ализариновый желтый 455
445 Глицерид молочной кислоты — определение общего содержания связанной молочной кислоты (см. № 40) Раствор КОН в спирте; кипятят в колбе, снабженной обратным холодильником Вода; титруют НС1 в присутствии метилового красного; добавляют избыток НС1, экстрагируют гексаном и органический слой титруют КОН в присутствии фенолфталеина 456
446 Высшие жирные кисло- КОСН3 в среде Избыток реагента 457,
ты, например лауриновая, олеиновая (см № 51), стеариновая бензол—метанол обратно оттитровывают щавелевой кислотой в среде бензол—метанол в присутствии смеси индикаторов фенолового красного— крезолового красного—бромтимолового голубого (3 : 1 : 1). (Отмечают, что при обратном методе титрования лучше наблюдать конечную точку, чем при прямом 472
447 Этилацетат (см. № 11) и эфиры (см. № 26) энантовой кислоты в коньяке NaOH; 2,5 ч при 20° С (для гидролиза первого соединения); добавляют NaOH, кипятят 30 мин в колбе, снабженной обратным холодильником (гидролизуются все эфиры) титровании) Избыток NaOH оттитровывают H2SO4 в присутствии фенолфталеина 458
III
Продолжение
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
448 Оксамид в нитрате целлюлозы (см. № 18) реактивных топлив Экстракт в СН2С12; выпаривают; NaOH и отгоняют NH3 NH3 отгоняют в НС1, избыток которой оттитровывают NaOH в присутствии метилового красного 459
449 Формиат, образующийся при определении этил-ортоформиата (см. № 38) в процессе взаимодействия его с водой (см. № 22) NaOH Избыток NaOH оттитровывают кислотой 460
450 Хлорформиат, образующийся при определении —ОН-групп в полимерах в процессе их взаимодействия с фосгеном (см. № 22) В растворителе, использованном в предшествующих стадиях реакции (бензоле, дихлорэтане или диметиловом эфире этиленгликоля); NaOH в воде или в спирте или смесь 1(C4H9)4N] ОН— тетрагидрофуран для гидрофобных образцов; кипятят в колбе, снабженной обратным холодильником, или перемешивают до полного растворения Образующиеся С1~ -ионы оттитровывают AgNO3 потенциометрически 461
451 Этилмеркурихлорид в технических продуктах и фунгицидах В диметилформами-де; NaOH в присутствии тимолфталеина С1~ -ионы оттитровывают AgNO3 в присутствии хромата 462
452 Смеси хлорэндиковой (см. № 397) и малеиновой кислот и их ангидридов (Применяется также мете титрованием КОН и НСК ва КОН; 30—60 мин при 60° С )д с использованием ре Э4 — см. «Амины и гет ния», литература 108) Избыток НС1; ацетон; титруют КОН потенциометрически, наблюдается четыре скачка: избыток HCI, первый ион водорода малеиновой кислоты, хлорэндиковая кислота и второй ион водорода малеиновой кислоты акции с анилином и проциклические осно- 463
453 1,1-Бис (п-хлорфенил)- 2,2,2-трихлорэтанол Раствор КОН в метаноле; доводят до кипения в течение 45 мин HNO3; Ag1, избыток которого оттитровывают тиоцианатом 464
П2
Продолжение
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
454 Хлорангидрид циануровой кислоты (см. № 403) 20% КОН; кипятят 15—20 мин в колбе, снабженной обратным холодильником HNO3; Ag1, избыток которого оттитровывают тиоцианатом 465
455 Этилацетат (см. № 11); фе.шлэтплцианоуксусно-этиловый эфир (см. № 26); эфиры карбоновых кислот (см. № 26) Ва (ОН)2; 30— 60 мин при 100° С НС1; СО2 отгоняют в стандартный раствор Ва (ОН2), избыток которого оттитровывают НС1 в присутствии тимолового голубого 466
456 Ацетат целлюлозы (см. № 18) — определение общего содержания связанных ацетильных групп В 75%-ном этаноле; NaOH в атмосфере азота; 1 ч при 55— •60° С Избыток NaOH оттитровывают НС1, затем титруют NaOH в присутствии фенолфталеина 467
457 Дихлорэтан в воде (см. № 117) NaOH или КОСН3 в метаноле; 10— 20 мин в ампуле HNO3; AgNO3, избыток которого оттитровывают тиоцианатом 468 Г
458 Молочная кислота в лактилированных моноглицеридах (см. № 214) Щелочь НС1; жирную кислоту экстрагируют петролейным эфиром; молочную кислоту экстрагируют водой из экстракта петролейного эфира и оттитровывают щелочью 469
459 Сукцинилсульфатиазол 20% NaOH; кипятят 2 ч в колбе, снабженной обратным холодильником Подкисляют и титруют нитритодг 470
460 1-Фенилпропан-1,2-дион (ацетилбензоил) Н2О2; NaOH; 2 ч при 20° С, (образуются уксусная и бензойная кислоты) Избыток NaOH оттитровывают НС1 в присутствии фенолфталеина 471
461 Карбромал; бромурал (см. № 379) Кипятят со спиртовой щелочью HNO3; Вг“; оттитровывают радиометрически AgNOg, содержащим 110Ag 473
113
Продолжение
№ л/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
462 е-Капролактам в водных растворах NaOH; кипятят 30 мин в колбе, снабженной обратным холодильником Аминокислоту осаждают в виде бариевой соли, добавляют НС1, затем НСНО и титруют NaOH в присутствии фенолфталеина или потенциометрически (см. «Соединения бария», литература 7; «Карбонильные соединения», литература 35) 474
463 Амиды (см. № 118) Большой избыток NaOH; кипятят 15— 30 мин в колбе, снабженной обратным холодильником Вода; пропускают через ионообменник в кислой форме и элюат титруют NaOH потенциометрически [см. «Ионообменни-ки (ионообменные смолы)», литература 50] 475
464 Параформальдегид (см. № 465) определение концевых метоксильных групп (см. № 76) NaOH, 1 н. водный раствор; I мин (пока не растворится осадок, затем начинает протекать нежелательная реакция Канниццаро) Уксусная кислота; метанол переводят в метил нитрит, затем гидролизуют и определяют йодометрически (см. «Нитрит», литература 31} 476
465 Параформальдегид (см. № 464) — определение концевых гидроксильных групп (см. № 22) В метаноле; NaOCH3 в метаноле; 4 ч Уксусная кислота; выделенную воду оттитровывают реактивом Фишера 477
466 Бинарные смеси амидов (см. № 118) или нитрилов (см. № 118) Тетрагидрофуран; вода; NaOH Образующийся аммиак током азота отгоняют в борную кислоту при pH 5 и непрерывно титруют НС1, сохраняя указанное значение pH; таким путем определяют оба компонента 478
467 Амидный азот в промышленных экстрактах (см. № 299) Раствор КОН в воде; 30 мин при 90° С Образующийся аммиак отгоняют в борную кислоту и титруют КН (Ю3)2 в присутствии смешанного индикатора метиловый крас- ный—метиленовая синь 479
114
ЛИТЕРАТУРА
1 M₽ver V, Haff ter H., Ber., 6, 690 (1873).
o' VnPttstorfer J., Z. anal. Chem., 18, 199, 431 (1879).
q L₽ler L., Ber., 16, 1333 (1883).
4 Benedict R., Ulzer F., Monatsh., 8, 41 (1887).
5 Sc h m i ed, Archiv. f. Physiologie von Du Bois-Raymond, 552 (1892) [abstract in Z. anal. Chem., 34, 484 (1895)].
6 . M c I 1 h i n e У P- C., J. Am. Chem Soc., 16, 408 (1894).
7 Henriques R., Z. angew. Chem., 8, 721 (1895).
8 Meyer R, Meyer H., Ber., 28, 2965 (1895).
9 Argenson G., Bull. soc. chim., Paris (3), 15, 1055 (1896).
io" E i n h о r n О , Z. anal. Chem., 39, 640 (1900).
11 Per к i n A. G., Proc. Roy. Soc., 20, 171 (1904).
12. P e г к i n A. G., J. Chem., Soc., 85, 1462 (1904).
13. Meyer R., Hartmann E., Ber., 38, 3956 (1905).
14. P e г к i n A G., J. Chem. Soc., 87, 107 (1905).
15. P о о 1 J. F. A., Pharm. Weekblad, 42, 165 (1905).
16 N i с 1 о u x M„ Compt. rend., 142, 163 (1906;
17. W a 1 1 i s T. E., Pharm. J. (4), 22, 162 (1906).
18. В о u 1 e z V., Bull. soc. chim. France (4), 1, 117 (1907).
19. G a r n i e r J., Bull. sci. pharm. Nancy, 15, 77 (1908).
20. Siegfeld M., Chcm.-Ztg., 32, 1128 (1908).
21. Eberstadt O., Dissertation uber Acetylcellulose, Heidelberg, 1909.
22. G a n e E. H., Webster M. H., Pharm. J., (4), 28, 555 (1909).
23. К r e i s H , Chem.-Ztg., 35, 1053 (1911).
24. W i п к I e r L. W , Z. angew. Chem., 24, 636 (1911).
25. Norma nn W., Chem. Rev. Fett. u. Harz Ind., 19, 205 (1912).
26. H u d s о n C. S., Brauns D. H., J. Am. Chem., Soc., 37, 1283, 2736(1915).
27. S I а с к H. F., Chemist & Druggist, 87, 673 (1915).
28. N e i t z e 1 F., Chem Ztg., 43, 500 (1919).
29. P a r d e e A. M., Reid, E. E., Ind. Eng. Chem., 12, 129 (1920); ibid 481.
30. Salvaterra H., Chem.-Ztg , 44, 129 (1920).
31. В a г n e t t W. L., J. Soc. Chem. Ind., London, 40, 9T (1921).
32. О 1 i v i er i - Man d a la E., Calderaro E., Gazz. Chim. Ital., 51, 1, 324 (1921).
33. Sage С. E., Perfumery Essent. Oil Record, 13, 172 (1922).
34. Wolff H., Chem. Umschau, 29, 2, 10 (1922).
35. Freudenberg K-, Harder M., Ann., 433, 230 (1923).
36. G 1 i c h i t c h L. S., Bull. soc. chim. France (4), 33, 1284 (1923).
37. К о 1 t h о f f I. M., Pharm. Weekblad, 60, 2 (1923).
38. Boulez V., Bull. soc. chim. France, 35, 419 (1924).
39. Bred i g G., von G о 1 d b e r g e r A., Gas. u. Wasserfach, 67, 490 (1934).
40. К 6 g 1 F., P о s t о w s к у J. J., Ann., 440, 34 (1924).
41. Reeves H. G., J. Soc. Chem. Ind., London, 43, 279T (1924).
42- Freud cn ber g K-, Weber E., Angew. Chem., 38, 280 (1925).
43 W i m m e r J., Angew. Chem., 38, 721 (1925).
44. Andron P., Bull. soc. pharm., Bordeaux, 64, 199 (1926).
45. Eder R К ut ter F., Helv. Chim. Acta, 9, 557 (1926).
^и^50П c- s- J- Am- Chem. Soc., 48, 1982 (1926).
47. M a t th e s E Z i eg e n s p e с к H„ Botan. Archiv., 15, 187 (1926).
48. Borloz A., Helv. Chim. Acta, 10, 543 (1927).
cn Semiga nowski N., Z anal. Chem., 72, 27, 295 (1927).
50 . Allan J., Perfumery Essent. Oil Record, 19, 131 (1928).
51 . A n d г о n P.. J. pharm. chim. (8), 8, 453 (1928).
52 . Fleury P_, M a 1 m у M„ J. pharm. chim. (8), 8, 537 (1928).
53 . Franco is M., J pharm. chim. (8), 7, 54 (1928).
54 . Glaser E.. Deutsch. Z. ges. gerichtl’ Med., 12, 470 (1928).
55 . Jansky A., Casopis Ceskoslov. Lekarnietva, 8, 215 (1928).
56 . L a n g e r A , Apotheker-Ztg., 43, 815 (1928).
115
57 . V о 1 m a г Y, Sa m d ahi B,J pharm chim., 7, 106 (1928)
58 Battegay M , Penche J, Bull. soc. chim. France, 45, 132 (1929).
59 Gehrke M , Wi lira th H H.,Z physik. Chem . A 142, 301 (1929).
60 Heller К , Fleischhans Z,J prakt. Chem., 123, 146 (1929)
61 Kettle S., Chemist-Analyst, 18, 7 (1929)
62 Muraour H., Bull, soc chim France, 45, 1189 (1929)
63 Schulek E , Vastagh G., Magyar Gyogyszeresztud Tarsasag Ertesitoie 5, 43 (1929).
64 Frahm E D. G., Boogaert H L., Rec trav chim , 49, 623 (1930).
65 Brindle H , Quart J Pharm Pharmacol., 4, 394 (1931)
66 C h a r g a f f E, Z physio) Chem., 199, 221 (1931).
67 Demarest J. V., Rieman W, Ind. Eng Chem , Anal Ed , 3, 15 (1931).
68 Marotta D., Distefano F., Ann. chim applicata, 21, 150 (1931).
69 Murray T F., S t a u d C. J., Gray H. 1 e B., Ind Eng. Chem , Anal Ed., 3, 269 (1931).
70 R a mi rez C, Rev qui’m., 6, No 10, 6 (1931).
71 . S a b e t a у S., S i v a d j i a n J., J. pharm. chim., 13, 530 (1931).
72 Снесарев А. П., Хим. пром , 8, 161 (1931).
73 Vo 11 ma r R C., Ind Eng. Chem, Anal. Ed, 3, 110(1931).
74 Bickerman J J,Z anal Chem., 90, 335 (1932).
75 Bred er ec к H., Angew Chem , 45, 241 (1932).
76 . Meunier L., Gonfard M., Rev gen. mat. plastiques, 8, 427, 467 (1932).
77 Whitmore W F., Weinberger H.. Gardner W. H, Ind Eng Chem , Anal. Ed , 4, 48 (1932)
78 Beal G. D., S z a I к о w s к i C R , J. Am. Pharm. Assoc., 22, 540 (1933).
79 . Boulez V , Zymologie (2), 1, 170 (1933)
80 . К U h n R , Roth H., Ber., 66, 1274 (1933).
81 Pa 1 fray L., Sabetay S, Sontag D., Chimie et Industrie, spec. No 29, 1037 (1933).
82 . Romeo G., Ann. chim applicata, 23, 530 (1933).
83 . She hi go 1 M., Pharm Zentralhalle, 74, 529 (1933).
84 . S h c h i g о 1 M., Khim.—Prom Farm., 150 (1933).
85 . В a i 1 e у A. J., Robinson R. J , Mikrochemie, 15, 233 (1934).
86 . Езриелев И. M., Соловейчик Л. С., Пласт, массы, № 5, 27 (1934)
87 Furth О, Kaunitz Н., Stein М., Biochem Z., 26, 189 (1934)
88 . G 1 г a u 1 t F., Bull. sci. pharmacol., 41, 331 (1934)
89 . G о s w a m i M., Basu K. L., Analyst, 59, 533 (1934).
90 . H о s к i n g H. J., Snell F D., В i f f e n F. M , Ind. Eng. Chem., Anal.
Ed., 6, 254 (1934)
91 Котницкий А. И., Б о г а т ы p ч у к С. В., Укр хим. ж., 9, 317 (1934).
92 М a t u s z a k М Р., Ind. Eng. Chem., Anal. Ed., 6, 374 (1934)
93 Palfray L., Sabetay S., Sontag D., Chimie et Industrie, Spec. No 863 (1934).
94 . Phillips M., Ind Eng. Chem., Anal Ed., 6, 321 (1934).
95 . W a t t s С. E., Ind. Eng. Chem., Anal Ed., 6, 262 (1934).
96 . Кор ивановский Г А, Рекеда Я H, Зав. лаб , 4, 768 (1935).
97 . Алексеевский Е. В., Гольбрайх 3. Е., Ж прикл. хим., 9, 1535 (1936).
98 . В о h a n е s A., Chem. Obzor, 11, 71 (1936)
99 Clark Е. Р., Ind. Eng Chem, Anal Ed., 8, 487 (1936); 9, 539 (1937)
100 Генгринович А. И, Фармацевтический журнал, № 4, 26 (1936)
101 Сапгир И Н., Фролова Р. А., Синтетический каучук, № 11—12.
17 (1936).
102 Sinton F. С., J. Assoc Offic. Agr Chem., 19, 535 (1936)
103 Wo 1 fro m M L., Konigsberg M., Salzberg S., J Am. Chem Soc , 58, 490 (1936)
104 Андреевская Г. Д., Фармация и фармакология, № II—12, 57 (193/).
105 R е d е m a n С. Е., Lucas Н J., Ind. Eng. Chem., Anal Ed., 9, 521 (1937).
106 R e z n e k S., J Assoc. Offic Agr Chem , 20, 560 (1937).
107 Schwicker A., Z. anal. Chem., 110, 161 (1937).
116
108 109 ПО
111
112
113
114
115
116
117
118
119
120
121.
122
123
124.
125. 126
127
128
129
130
131 132.
133
134
135 136.
137
138
139
140
141 142.
143.
144
145 146.
147
148
149
150
151
152
153
154
155
156 157.
158
Шестаков И. С , Кожев обувная пром , 16, № 12, 54 (1937) crr,ith W С., Ind. Eng Chem., Anal Ed, 9, 469 (1937)
RnsbeV R- L , Drake N L, Ind Eng Chem Anal Ed., 10, 390 (1938). Rutbchewitz E , V 1 k A., Ann. chim anal chim appl., 20, 175 (1938). Fur ter M., Helv Chim Acta, 21, 601 (1938).
Lazar O., MeylingA. H,J S African Chem. Inst., 21, 8 (1938).
Merz К W , Krebs К G, Ber, 71, 302 (1938)
Peynaud E., Ann. fals., 31, 158 (1938).
Reimers F., Dansk lids Farm, 12, 203 (1938).
Shaefer W. E , Piccard J., Ind Eng. Chem., Anal. Ed , 10, 515 (1938) Беленицкая Д С., Фармацевтический журнал 12, № I, 19 (1939) Funck E., Suddeut Apotheker-Ztg., 79, 622 (1939)
Jac kero tt K A., Reimers F., Z anal. Chem., 117, 415 (1939) Хайт Г Я-, Укр roc. ин т эксперим. фармации (Харьков), № 3, 80 (1939). Кг О ger D., Z. anal Chem., 117, 318 (1939)
Мельников Ф Ф, Се и и лов Б. В., Лаб. практика, 14, № 9—10, 18 (1939)
Palfray L., Sabetay S., Rovira S, Compt rend., 209, 483 (1939). R о v i r a S., Compt. rend., 209, 754 (1939)
T p о п п M. Я., Укр гос ин-т эксперим фармации (Харьков), № 2, 40 (1939). Archinard Р, Ann fals , 33, 76 (1940)
Горецкий Л. М., Фармация, № 6, 31 (1940)
Hall R Т , Holcomb J. Н_, Griffin D. В., Ind. Eng Chem., Anal Ed , 12, 187 (1940).
С о л ь ц Л. М., Колик Е. М., Укр. гос ин т эксперим. фармации (Харь ков), № 5, 162 (1940)
Gen ung L. В, Mallatt R С., Ind Eng Chem , Anal. Ed., 13, 369 (1941) Kelly D F, O'Connor M., Reilley J, Analyst, 66, 489 (1941) Matchett J R , Levine J, Ind. Eng. Chem , Anal Ed , 13, 98 (1941) Reimers F,Z anal Chem., 122, 404 (1941).
Sc ho or 1 N . Pharm Weekblad, 78, 413 (1941)
S c h о о r 1 N., Pharm. Weekblad. 78, 433 (1941).
Thorsell P., Svensk Farm. Tidskr., 45, 341 (1941).
Baldinger L H., Ind. Eng Chem, Anal Ed., 14, 15 (1942).
Bohme H., Arch. Pharm., 280, 89 (1942).
Caselli P, Cearanfi E., Biochem , Z., 313, 11 (1942)
Me N a 1 1 F J , J Assoc Offic Agr Chem , 25, 814 (1942)
Malm C J., Nadeau G F, Genung L. В , Ind. Eng Chem , Anal Ed, 14, 292 (1942).
Perry H. M , West T. F., Analyst, 67, 159 (1942).
Poethke W., Pharm Zentralhalle, 83, I, 13 (1942).
Russo F., Ann chim applicata, 32, 216 (1942).
Silver S. D., Ferguson R. L., McGrath F P., S a 1 d i c k J., War Dept chem Warfare Service, Edgewood Arsenal, Md , EATR 374 April,
Shrader S A , Stenger V. A., В e s h g e t о о r A. W , Ind Eng.
Chem., Anal. Ed , 14, 1 (1942) Wiesenberger E, ............
Wilson ' "
Cowles . , ____. . . . ^ , c i w
Proc Am Pharm Mfrs Assoc., Mid-year proc., p 64 1943 GramerFB, Gardner TS Г '
Anal. Ed , 15, 319 (1943) ’ • “
П ГЛ1 n V П Er’bL °-V eKCRo™’/.Ind- Eng Chem ’ Anal Ed., 15. 207 (I943)
Olsen S, Die Chemie, 56, 202 (1943)
™ f! Lra y w rD/ Ve ‘A" e 4” (7ompt rend > 2,7> 213 П943)-
R ieman W., Ind. Eng. Chem, Anal. Ed., 15 325 (1943)
W h ‘ stler R. L., J eane s A. Ind Eng Chem , Anal. Ed 15, 317 (1943) r erruelrla ^nalS mC. fa™ odontol , Univ Sao Paulo 4, 218 (1944—5) Gorbach G., Anal Mikrochem., 31, 319 (1944)
г о т «' Mikrochemie ver. Mikrochim. Acta, 30, 241 (1942). J B., J Assoc Offic Agr Chem., 25, 145 (1942)
du A ’ иг a ‘ л 1 ‘ f f C< K ’ M 1 1 1 e r C °” К e 1 m m e C. J ,
15, 3B19 (1943) d Пе Г T S Ind. Eng Chem.,
117
159 L i n d е к е п С. LClayton J О., S к о о g D. А , Ind Eng Chem Anal. Ed , 16, 734 (1944)
160 Lubatti О F, Harrison A.,J Soc Chem Ind , London 63, 140 (1944).
161 Malm C J, Genu ng L В , Williams R F., Pile MA, Ind. Eng. Ch m., Anal Ed , 16, 501 (1944).
162 At itch ell J, Smith DM, Money F. S, Ind Eng Chem , Anal Ed., 16, 410 (1944)
163. de Mi ttelman D G., Anales asoc quim. arg., 32, 84 (1944)
161 Petersen G W, Radke H. H., Ind Eng. Chem., Anal. Ed., 16, 63 (1944).
165 Sclar R. N., Clark G. R., J. Assoc Offic. Agr Chem., 27, 472 (1944).
166. Vais O., Chem Listy, 38, 15 (1944).
167. Archibald R M,J. Biol. Chem., 158, 347 (1945)
168. Bruening C. F, J Assoc Offic Agr Chem., 28, 620 (1945)
169. Clarke R., Christensen В E, Ind Eng. Chem., Anal. Ed., 17 334 (1945).
170. Ferreira P. С, T itcc i W., Rev. quim farm (Rio de Janeiro), 10, No 89 (1945).
171. Gunther F. A., Ind. Eng. Chem., Anal. Ed., 17, 149 (1945).
172. Hills С. H , Ogg C L., S p e i s e r R., Ind. Eng. Chem., Anal. Ed., 17, 507 (1945)
173 Lewis S. E., J. Soc. Chem. Ind, London, 64, 57 (1945).
174 Powning R F,J Council Sci. Ind Research, 18, 121 (1945)
175. Ubeda F B, Puig P M. Anales fis у quim (Madrid), 41, 518 (1945)
176. Wilson J. B., J, Assoc. Offic Agr Chem., 28, 302 (1945)
177. Alicino J F, Ind. Eng Chem., Anal. Ed., 18, 619 (1946).
178. Carter R. H., Hubanks P E,J. Assoc Offic Agr Chem., 29, 112 (1946)
179. Harrington T., Boyd T H., Cherry G W., Analyst, 71, 97 (1946)
180. Ketchum D, Ind. Eng. Chem , Anal Ed , 18, 273 (1946).
181 Klein A. K-, Wichman H. J , J. Assoc. Offic Agr Chem., 29, 191 (1946)
182 Laclair J B., Ind. Eng Chem., Anal Ed., 18, 763 (1946).
183 M a г с a 1 i K-, R leman W., Ind. Eng. Chem , Anal. Ed., 18, 144 (1946)
184 Magi io M M., Chemist—Analyst, 35, 39 (1946)
185 Mundell M, Fischbach H., Eble T E , J Am Pharm. Assoc.
186.
187.
188
189
190.
191
192.
193.
194
195.
196
197.
35, 373 (1946)
Schuster G., Ann. chim. anal , 28, 146 (1946).
Toffoli C., Marzadro M., Ann. chim applicata. 36, 370 (1946).
Ubeda F. B., Puig P. M., Anales fis. у qui'm. (Madrid), 42, 1065 (1946)
Uhrig K-, Ind. Eng. Chem, Anal. Ed., 18, 469 (1946).
Andre E., Mai lie M., Bull, soc chim France, 14, 215 (1947).
Andre E, Mai lie M, Bull, soc chim France, 14, 725 (1947).
В a s t r u p T., Acta Pharm. Toxicol., 3, 303 (1947).
Chapman A M., Pierce J. S., Pharm. J , 159, 47 (1947)
GoldensonJ., Sass S, Anal. Chem, 19, 320 (1947).
Gros R , Ann. pharm franc., 5, 459 (1947)
H e 1 1 b e r g H., Svensk Farm. Tidskr., 51, 560 (1947).
Hoffmann A , Maffei F. J., Inst. pesq. tecnol (Sao Paulo), separate
No 196, 93 (1947)
198 lonescu Matiu A., Pop a I, Produits pharm., 2, 389 (1947).
199 . Knight В H., Anal Chem, 19, 359 (1947)
200 Pesez M, Ann pharm. franc., 5, 165 (1947)
201 . Pesez M., Ann pharm. franc., 5, 167 (1947).
202 Ryan J D., Shaw F. B., U S Patent № 2, 425, 568, Aug 12, 1947.
203 . Stuart R G., Analyst, 72, 235 (1947)
204 Ubeda F B., Puig M. M, Inform quim. anal. (Madrid), 1, 179 (1947)
205 Wain R. L., Martin A. E., Analyst, 72, 1 (1947).
206 Alicino J F , Anal Chem., 20, 590 (1948).
207 Archer H. E, Chapman L., Rhoden E., Warren F L., Biochem. J., 42, 58 (1948).
208 . Bergmann F, Japhe H., Anal. Chem., 20, 146 (1948).
209 Bergstrom B., Acta Physiol. Scand., 15, 338 (1948).
118
in R lifts P G, Prine G B., Kouba D L, Becker W W , Anal
2 Chem., 20, 1066 (1948)
on n я I i n G A., Haimsohn H J N , Anal Chem , 20, 470 (1948).
212 Deschrei der A, R., van den Driessche S, Food Manuf., 23, 77 (1948).
o|3 Dvorn i koff M. N , Morrill H. L, Anal Chem , 20, 935 (1948).
914 Elsner E., Pharmazie, 3, 401 (1948).
21б' Fahy J P-, J Ind. Hyg. Toxicol., 30, 205 (1948)
216 Frampton V. L., Martin G N , Anal. Chem , 20, 661 (1948)
217 . Goldenson J, Sass S., Anal Chem, 20, 730 (1948).
218 . Goldenson J., Sass S., Anal Chem., 20, 1118(1918).
219 . Gurmandi Robles G., Rev facultad farm у bioquim.. Univ nacl. mayor San Marcos (Lima), 10, 166 (1948).
220 Hickinbotham A. R, Analyst, 73, 509 (1948)
221 . Hummel V., Listy Cukrovar, 64, 229 (1948)
222 Jensen H., Jannke P., J. Am Pharm. Assoc , Sci. Ed 37, 37 (1948).
223 L a m о n d J., Analyst, 73, 674 (1948).
224 L a c 1 a i r J B., Anal Chem , 20, 241 (1943)
225 Pedersen V, Arch Pharm Chemi, 55, 625 (1948)
226 R a f f a e 1 1 i D , Ann chim applicata, 38, 552 (1948).
227 T г a f e 1 e t L , Anal. Chem , 20, 68 (1948)
228 Wild A. M , J Soc Chem Ind , London, 67, 90 (1948)
229 Anderson H H,J Am Chem. Soc., 71, 1801(1949)
230 Bl inn R. C., Gunther F A, Anal. Chem., 21, 1289 (1949)
231 Bond C. R., Analyst, 74, 550 (1949).
232 Boulanger P., Osteux R, Bull soc chim. biol., 31, 1290 (1949)
233 do Campo L. C., Copello M A., Jung W., Sernates M E, Anales direc. gen ofic. qui’m nacl. (Buenos Aires) 2, 9 (1949)
234 . Englis D. T, Reinschreiber J. F., Anal. Chem , 21, 602 (1949).
235 Гурвич С С, Мельникова П. А, Зав. лаб , 15, 672 (1949)
236 Harnish D P . Tarbell D S., Anal Chem 21, 968 (1949)
237
238
239
240
241.
242
243
244
245
246
247
248.
249.
250
251
252
479 (1950).
72, 3954 (1950).
256
257
258.
259.
Korzybski T., Bagdasarian G., Med Doswiadczal i MikrobioL, 1, 632(1949).
Pluchon J, Pille G., Med. trop., 9, 532 (1949).
Пятницкий M. П., Юрьева А. Ф., Биохимия, 14, 196 (1949). Shaw W. H. C., J. Pharm Pharmacol., 1, 813 (1949).
Takano T, Hamada M., Botyu Kagaku No 14, 26 (1949) Wreath A R., Zickefoose E J., Anal Chem , 21, 808 (1949). Zo liner W., Farben, Lacke, Anstrichstoffe, 3 385 (1949) Anderson H. H , J Am Chem Soc , 72, 196 (1950) Anderson H H., J Am Chem Soc , 72, 2089 (1950) Beickert A, Arch, exptl Path Pharmakoi., 210, Cohen S. G., Haas H. C.. J Am Chem Soc , D о n n a 1 1 у L H , Anal Chem , 22, 365 (1950). Hahn F L., Anal. Chim. Acta , 4, 577 (1950). Hezel E., Fette u Seifen, 52, 149 (1950) Hezel E., Farbe u. Lack. 56. 10 (1950) I 1 v a К , 253 (I960).
Jurecek M, Chem Listy, 44, 134 (1950) Kofrani E., Dm >'=•->--- - --
Korzybski T. 2, 468 (1950).
r •: т,..... __________
M e Ма nh ’f "rm ’ S тч \ W' C., Pharm’ J. “‘165^151 (1950) Mellini F., Chimica (Milan), 5, 335 (1950) ’
ЖП nM-‘ ‘C h M1 u’ S m ‘ ‘ h D M ’ AnaI Chem 260 Penau H., Hagemann G- Г
(1950).
Farbe u. Lack, 56, 10 (1950) Johansen O. L., Reimers F,
Dansk Fas
Farm., 24,
253
254.
255.
Die Milchwissenschaft, 5, 51 (1950)
Bagdasarian G., Med Doswiadczal. 1
M e Г 6 1 U Л’ Ат’ 'c Vei\eti? SCL’ ClaSSe SCi - mdt e nat- 108. 1 /И C I . Я Г И I а И T X rn t t k ЛТ7 Tn , . _ _ * __»
MikrobioL,
(1950)
----f 22f 746 (1950).
Saias E, Ann pharm. franc, 8, 100
П9
261 - Pippen E L., McCready R. M, Owens H. S., Ana! Chem 22
1457 (1950) ’ ’
262 Romano E., Ann. staz chim agrar sper , Roma, Ser 3, No 26 (1950)
263 Roth H, Z anal Chem., 131, 347 (1950)
261 Wild A M Nature. 165, 818 (1950)
265 Anderson H H,J Am Chem Soc , 73, 2351 (1951); Anderson H H., Seaton D L, Rudnicks R P. T , J. Am. Chem. Soc., 2144 (1951)’
266 Belie I, Strauh L, Battestin M, Arhiv Kem , 23, 269 (1951).
267 Chaney A., Astle M J, J Org Chem., 16, 57 (1951).
268 Goldenson J., Sass S. Anal Chem , 23, 1170 (1951).
269 Hezel E, Fette u Seifen, 53, 82 (1951)
270 Ka mes war a Rao G, Banerjee J. N , Bhattacharya N. N., Indian J Pharm, 13, 6 (1951)
271 Meier K., Farbe u Lack, 57, 437 (1951).
272 . Perkow W , Z anal Chem , 134, 267 (1951—2).
273 . Rispoli G , D i Giacomo A, Boll. Lab Chim. Provinciali (Bologna), 2, 55 (1951)
274 Рутовский Б H , Шур A, M , Ж прикл. хим , 24, 1074 (1951)
275 Schiessler R W, Speck R. M., Dixon J. A , J. Am Chem Soc,.
73, 3524 (1951).
276 S h a e f e r W. E , Balling W J., Anal. Chem , 23, 1126, 1452 (1951).
277 Siggia S., Kervenski LR, Anal Chem, 23, 117 (1951)
278 Vandoni R., Mem services chim etat (Paris), 36, No 1, 19(1951).
279 Vanetten С H., Anal Chem., 23, 1697 (1951).
280 Weber E , Z. anal. Chem, 132, 26 (1951).
281 Wolff I A., Olds D W., Hilbert G. E., J. Am Chem. Soc., 73, 346 (1951)
282 . Beloff Chain A., D'Accadia F. D., Analyst, 77, 423 (1952)
283 В hun vara N B, Vadodar i a D. J, Indian J Pharm , 14, 86 (1952).
284 В use ar о ns F, Mir P, Anal. Chim. Acta, 7, 185 (1952)
285 van E s p e n J., J. pharm Belg , 7, 456 (1952)
286 Fetzer W R, Jones R C., Anal Chem , 24, 835 (1952)
287 . Hamada M., Takano T., О h n о M_, Botyu Kagaku, 17, 27 (1952).
288 Interlab study, Anal Chem , 24, 400 (1952).
289 J о u s 1 i n D , Chim anal., 34, 34 (1952)
290 Lowen W K, Baker H M, Anal Chem., 24, 1475 (1952).
291 Smith D. M., Mitchell J , В i 1 1 in e у e r A- M., Anal Chem., 24,
1847 (1952)
292 Баскаков IO. А., Мельников H H, Ж- аналит. химии, 8, 119 (1953)
293 Sato R, Muta L, Ueshima T, Botyu Kagaku, 18, 57 (1953)
294 v Schivizhoffen E., D a n z H , Z anal Chem., 140, 81 (1953).
295 Sina A., Sallam M, Proc Pharm Soc Egypt, Sci Ed., 35, No 7, 53 (1953)
296 Struszy nski M., Bellen Z, Bel len N, Przemysl Chem., 9, 243 (1953)
297 Tranchant J., Mem poudres, 35, 108 (1953).
298 . Вайсман Г. А., Аптечное дело, 2, № 6, 25 (1953).
299 . Varner J. E., В u 1 e n W A., Vanecko S., Burrell R. C., Anal Chem , 25, 1528 (1953)
300 Бабин В, А., Музерский H H, Вопросы питания, 13, № 3, 34 (1954).
301 Boehm Т., Horse h, Pharm Zentralhalle, 93, 92 (1954).
302 Hansen A , Z. anal Chem., 143, 17 (1954).
303 Kennett В H,J Agr Food Chem , 2, 691 (1954)
304 Kertesz Z I, Lavin M I, Food Research, 19, 627 (1954).
305 Климовский Д H., Грязнов В П.. Ржехицкая Г. В, Спиртовая промышленность, 20, № 3, 17 (1954)
306 Mellon Е F., Viola S. J., Hoover S. Р., J Am Leather Chem. Ass., 49, 710 (1954)
120
307.
308.
309.
310
311
312.
313.
314
115.
316.
317
318
319 320.
321
322.
323
324
325
326
327
328
329
330
331
332
333
334
335 336.
337
338
339
340
341
342
343
344
345
346
347
348
349
350
351
352.
353.
Parker G., Donegan L., J. Pharm. Pharmacol., 6, 167 (1954)
Revol L, Nouvel G., Fosse G., Trans soc pharm. Montpellier, 14 284 (1954).
S h a w J N , F о m о M W , J Am. Oil Chemists’Soc , 31, 448 (1954) Tani H , Nara A, J Pharm Soc Japan, 74, 1309 (1954) Wiesenberger E, Mikrochim Acta, 127, (1954).
Davis P. L, Bowen С V , Anal Chem , 27, 1233 (1955).
Этлис В С, Артяхина Л М, Зав лаб 21, 919 (1955).
Grodzinsky J., Anal. Chem., 27, 1765 (1955).
Hofreiter В. T., Alexander В Н, Wolff I A., Anal Chem., 27, 1930 (1955).
Johnson A E., Lawrence R. V, Anal Chem., 27, 1345 (1955).
M u 1 1 a 1 у M A C., Analyst, 80, 237 (1955)
Порошин К. T., Козаренко Т Д., Хургин Я И., Изв. АН СССР, Отдел хим. наук, 773 (1955).
Salzer F , Z. anal Chem., 146, 260 (1955)
Ш о г а м С М., Фенькова Е И., Труды н. и. ин-та удобрений и ин сектофунгицидов им Я В. Самойлова, № 156, 30 (1955) Stainier С, GrosjeanL., Compt. rend , 27 congr intern chim ind., Brussels 1954, published in Ind. chim beige, 20, spec No 551 (1955). Vach S., Horak F., Pharmazie, 10, 596 (1955) Васкевич Д H, Хохлова P. В., Хим пром., 87 (1955).
Владимиров Г. Е, Климов А. Н, Жукова Е Н, Мед. пром СССР, № 1, 19 (1955).
Абдулла Заде Г. А., Азербайдж мед. журнал, № 10, 74 (1956)
Andrade J L., et al , Rev. sanidad у asistencia social (Venezuela), 21, 231
(1956) Ba mi H. L., Indian J Malariol , 10, 305 (1956). Bernhart D. N , Rattenbury К. H , Anal Chem , 28, 1765 (1956) DeLorenzi F, Da R e P., Boll, chim farm , 95, 235 (1956). DesbaumesP., DeshussesJ, Mitt. Lebensm u Hyg., 47, 550 (1956) Eijkel G., EmstingM J. E,, Rekker R F, Nauta WT, Pharm Weekblad, 91, 81 (1956).
Колякова Г E., Гигиена и санитария, 21, № 12, 46 (1956) Крешков А П.. " _ " "
Н е ш у м о в а А. М., Зав. лаб., 22, 660 (1956)
La г d е го М. R., Cernia Е , Mori A, Ann chim (Rome), 46, 194 (1956)
Мягков В. А., Па кшвер А. Б., Ж прикл. хим 29, 1703 (1956) Sa lorn а а Р, Acta Chem, Scand , 10, 306, 311(1956)
Сергиенко С. Р, Галич П Н Измайлов Н. А., Спивак Л. Л., Ж. анал. хим., 11, 731 (1956).
Swann М Н., Esposito G G., Anal. Chem., 28, 1984 (1956). Templeman В M., Juneau J, Anal Chem , 28, 1324 (1956) Я в орский H. П, Романюк Ю. Ф.. Аптечное дело, 5, № 5, 27 (1956) р и с т И М., Фирсова Ю Ф., Ж- анал Banfield JE.J"' ~ ---
Дринберг А. Я. 23, 26 (1957). Fujita Y , Г е и г р и н 68 (1957) Н е 1 о u J. Н е n n а г t Hennart _ гл а а г? г> А ’ ''“о| '-ИНН мсьа, II иоч \ivui).
Иоффе Б. В. С е р г е е в а 3 И., Ж анал. хим , 12, 540 (1957) J а п с i k F В u d е s 1 n s к у В , Ceskoslov Farm , 6, 590 (1957) Kennett В. Н Н u el i и F. E„ J Agr Food Chem , 5, 201 (1957) Meltzer H., Nachbrl deut. Pflanzenschutzdienst (Berlin), 11, 178 (1957) Metcalfe L. D., S c h m i r t z A. A., Anal. Chem , 29, 1676 (1957)
Сявцилло C B.L Шемятеикова В. И.,
Ue d a о в и ч A
_ , .... _ хим, 11, 205 (1956)
Chem Soc , 2578 (1957)
Яковлев А Д., Соколова 3 С., Зав лаб.,
Т., К u s u m о t о N , Когуо № 47, 42 (1957). И., Кадырова Я К Аптечное дело, 6, № 2, farm е quim , Sao Poulo, 8, 1 (1957)
Anal. Chim’ Acta, 17', 534 (1957).
H., Anais farm, e qurni , Sao Poulo, 8, 7 (1957) C.. Merlin E., Chim. anal., 39, 429 (1957) C , Merlin E , Anal Chim Acta, 17 534 (1957) .Сергеева ЗИ..Ж анал. хим , 12, 540 (1957) - н " Л S 1 n s. k У B > Ceskoslov Farm , 6, 590 (1957)
121
354.
355.
356.
357.
Roth Н., Schuster Р., Mikrochim. Acta. 6, 837 (1957).
° 1 ' ' ‘ ~ F„ Whitman C. L„ Anal. Chem., 29,
Zasshi, 60,
358.
359.
360.
361.
362.
363.
364.
365.
366.
367.
368.
369.
370.
371.
372.
373.
374.
375.
376.
377.
378.
379
380.
381.
382.
383.
384.
385
386.
387.
388.
389.
390.
391.
392.
393.
394.
395.
396.
397
398.
399.
400.
401.
402.
Stalcup H., McCollum 1479 (1957). Suzuki K., Kog\o Kagaku Турский Ю. И., Брик A. H., Кумин А М., Гальперин Е. М., Газовая промышленность, № 9, II (1957).
Вайсман Г. А., Бендерская С. Н., Аптечное дело, 6, № 2, 32 (1957). В ал я ш ко Н. А., Бердичевский Э. Г., Ж- общ. хим., 27, 2302 (1957). Baldwin W. Н., Higgins С. Е., Anal. Chem., 30, 446 (1958).
В 1 a i е k J., S t е j s к а 1 Z., Ceskoslov. Farm., 7, 578 (1958). Czerwinski W., Chem. Anal. (Warsaw), 3, 53 (1958). Fijolka P., Lenz J., ” Inglis J a n c i к Listy, 52, a 1 h о t a 1 h о t a t г к a
Miss A., Conu L, Rev. chim. (Bucharest), 9, 268 (1958). " i ngue t, Pharm. Acta Helv., 33, 114 (1958).
oethke W., Wigert R., Pharmazie, 13, 253 (1958). nm isc h H., Pharmazie, 13, 707 (1958).
о t h H., Mikrochim. Acta, 766 (1958).
S t i v i c L, M a r i n о v V., Acta Pharm. Jugoslav., 8, 93 (1958). Супрун П. П., Мед. пром. СССР, 12, 50 (1958).
Swann W. В., Z a h n e г R. J., Milner O. L., Anal. Chem , 30, 1830 (1958).
Varga E., Vastagh G., Acta Pharm. Hung., 28, 44 (1958). Whitehurst D. H., Johnson J. B., Anal. Chem., 30, 1332 (1958). BlaskowiczJ., Roczniakowa K., Wantuch S., BukalaM., Chem. Anal (Warsaw), 4, 719 (1959).
Bradley H. B., Neal D. J., Anal. Chem., 31, 1925 (1959).
C e r r i O., S p i a 1 t i n i A., Gallo U., Pharm. Acta Helv., 34, 13 (1959). Critchlield F. E., Anal. Chem., 31, 1406 (1959).
Gelebart F_, Ann. pharm. franc., 17, 278 (1959).
" u t ier r ez Amo P. A., Martin D., Grasas у Aceites, 10, 12 (1959).
a i nz G., Z. anal. Chem., 166, 32 (1959). a 1 i и о w s ' ~
a r t h a A. лайнер Г. 13, 42 (1949).
К о 1 ’ к о v s к i Полякова 1 М a t г к а М., 24, 1347 (1959). М a z о г L., М a z о г L., Narasimhachari dustan Antibiotics Bull., Parikh P. M., Mukherji S. P., Indian J. Pharm., 21, 110 (1959). Перельман Я. M., Красулина В. Н., Труды Ленинградск. хим. фарм. ин-та, № 6, 69 (1959).
Weiss Р. J., Antibiotics and Chemotherapy, 9, 660 (1959).
Andrey M., Mirimanoff A., Pharm. Acta Helv., 35, 276 (I960). В a 1 d i n u s J. G., R о t h b e r g I., Anal. Chem., 32, 1176 (1960).
Bartels U., Hoy me H., Faserforsch. u. Textilchem., 11, 503 (1960).
о химико-фармацевтического ин-та, 9, 103 (1960). Burger E., Schulek E., Taianta, 4, 120 (1960).
1128 (1957).
м м м
р р
R R
G К К К К
Б
Runge F., Makromol. Chem., A. S., Mikrochim. Acta, 228 (1958).
F., К а к a c ~ 909 (1958). г а О. P., г а О. P., M., Han
A A
Е.,
V
d d
n а п < n а п < о u s е к
а п
V.
V.
V.,
i с е
к
Z.
Z.
V., V г u b 1
anal. Chem., anal. Chem.,
о v s
26, 61 (1958).
к a М., Chem.
D„ D., Chem., Listy, 52, 755 (1958).
285 (1958).
159, 160,10 (1958).
к i R.
K., Acta Polon. Pharm., 16, 225 (1959).
S., J. Sci. Ind. Research (India), 18B, 217 (1959).
И., Дендзе-Плетман Б. Ю., Мед. пром. СССР,
i Р. G., М i t ко v a N., Khim. i Ind. (Sofia), 31, 55 (1959).
Г. E., Гигиена и санитария, 24, 72 (1959). Н а п о
use к V., Collection Czechoslov. Chem. Communs.,
М е i s е 1 Р а р а у
Т., Anal. Chim. Acta, 20, 130 (1959).
М. К., Acta Pharm. Hung., 29, 223 (1959).
N., Na у ar M. K-, Ramanarao G., Hin-I, 120 (1959).
Mirimanoff A., Pharm. Acta Helv., 35, 276 (I960).
стоганашвили Б. С., Сб. трудов Тбилисского научно-исслед.
122
лП„ р СП ns i to G. G., Swann M. H., Anal. Chem., 32, 49 (1960).
f cnnsito G. G., Swann M. H. Anal. Chem., 32, 680 (1960)
Inn’ f n nz J., Plaste u. Kautscbuk, 7, 493 (1960).
лпл г₽нгринович А. И , Кац А. Л., M у р т а з а е в А. М., ДАН 406’ Узбек. ССР, № 8, 44 (1960).
ил? г, rafnetterova, J., Casopis lekarii ceskych, 99, 182 (1960).
4ПЯ Hessler W., M a r s e n H., Fette u. Seifen, Anstricbmittel., 62, 579 (1960).
H s 1 а о C h. C h„ W u L. C h„ Yao Hsueh Pao, 8, 229 (1960).
410 Kane P. F.. Gillespie K. G., J. Agr. Food Chem., 8, 29 (1960).
411 Kurzawa Z., Suszka A., Chem. Anal (Warsaw), 5, 897 (I960).
412 Lal R- N., Lal J. B., J. Proc. Oil Technol. Assoc., India Kanpur, 15, Pt. 2,
15 (I960).
413. M a t r k a M., Navra t il F., Chem. prumysl, 10, 361 (1960).
414. Pristavka D., Chem. zvesti, 14, 472 (1960).
415. Robinson E. A., Anal. Chim. Acta, 23, 305 (1960).
416 S h i b a s a k i J., Bunseki Kagaku, 9, 544 (1960).
417. Шульман M. С., Гаврикова О. Ф., Труды центр, научно-исслед. ин-та спиртовой и ликеро-водочной пром., № 9, 74 (1960).
418. Stone W. К., Cremers L. F.. Thompson N. R-, J. Dairy Sci.,
43, 435 (1960).
419. Wolf F., Z. anal. Chem., 172, 413 (1960).
420. Alicino J. F., Anal. Chem., 33, 648 (1961).
421. Beach L. K-, Sass S., Anal. Chem., 33, 901 (1961).
422. Bethel M. M.. Bond C. R., Analyst, 86, 448 (1961).
423. Bose A., Cbaudhuri A. R., Ghosh T. N„ J. Proc. Inst. Chemists (India), 33, 16 (1961).
424. Burger E., S c h u 1 e k E., Magyar Kern. Folyoirat, 67, 59 (1961).
425. De Lorenzi F., Da Re P., Boll. chim. farm., 100, 23 (1961).
426. Емелин E. А., Свистунова Г. П., Царфин Я. А., Зав. лаб., 27, 283 (1961).
427. F р ш о в Б. FL, Покровская В. Л., Пласт, массы, № 7. 65 (1961).
428. F 1 о d е г е г I., D г о z d i k G., T о t h Z., Acta Pharm. Hung., 31, 145 (1961).
429. Kerenyi L, Magyar Kem. Folyoirat, 67, 313 (1961).
430 Климова В. А., Забродина К. С., Известия АН СССР, отд. хим. наук, № 1, 176 (1961).
431. Косинская В., Фейгин Ф., Пласт, массы, № 6, 8 (1961).
432. М a z о г L., Р а р а у М. К., Acta Chim. Acad. Sci. Hung , 26, 473 (1961).
433. Nayar M. K, Narasimhachari N., Hindustan Antibiotics Bull., 3, 101 (1961).
434. Philipp B., Bartels U.. H a у m e H., Faserforsch., Textilchem 12, 581 (1961).
435. So d о m k a J., Chem. pritmysl., 11, 333 (1961).
436. Tobey S. W., McGregor S. D., Cottrill S. L., J. Chem Educ 38, 611 (1961).
437. Wronski M., Chem. Anal. (Warsaw), 6, 859 (1961).
Ion’ ® a e 11 1 e r B-> Chams G., Cherbuliez, E., Pharm. Acta Helv., 36, 338 (1961).
439. Бухаров И. H., Хуснутдинова 3. С., Авт. свид. СССР 142 801 декаорь, 1961. ’ ’
44°’ №Р10 58 (?96П” П ° К Р ° В С К Э ” В’ Л” Д в у г л о в С. П., Пласт, массы, *"• вЛ,”' 42MN,AM277 0961)'. ° ' Е 1 ’ S ‘ ' 1 ‘ • У Л- М- eon РЬа™ 442. Urbanowicz S., Chem. Anal. (Warsaw), 6, 855 (1961)
443. A r m a n d о 1 a P., Latte, 36, 709 (1962).
444’ 49Wie7qYio^ ‘ e n e r 1 J- Arch- Pharm- 295, 1962; Mitt. Deut. Pharm. Ges., 04, J t О (
445. Boon P. F. G., J. Pharm. Pharmacol., 14, 116T(1962).
446. Brancone L. M., Microchem. J. Symp. Ser., 2, 605 (1962).
ило’ Su™as ,T7 A6r- Food Chem., 10, 476 (1962).
448. Dug insky G., Ту 1 leva M., Ceskoslov. Farm., 11, 359 (1962).
123
449. Горелов П. Н., Зав. лаб., 28, 668 (1962).
450. Or a [net ter ova Y., Antibiotiki, 7, 736 (1962).
451. Карпов О. H., Ж. аналит. химии, 17, 1029 (1962).
452. Kuffner F., Sattler-Dornbacher S., Humer C., Monatsh 93, 99 (1962).
453. Lor a nt B., Seifen Ole, Fette, Wachse, 88, 85 (1962).
454. Sharma S. K-, M a t h u r S., Paintindia, 12, 108 (1962).
455. So lomo n - lonescu I., Popescu D., Nicola M., Farmacia (Bucharest), 10, 627 (1962).
456. S t e t z 1 e r R. S., Andress T. B., J. Am. OilChemists’Soc., 39, 509 (1962).
457. T i war i R. D., S r 1 v a s t a v а К- C., Sharma J. P., Z. Anal Chem
187, 161 (1962); Proc. Natl. Acad. Sci. India, A32, 69 (1962).
458. Высоцкая Л. E., Виноделие и виноградарство СССР, 13 (1962).
459. А р a t о f f J. В., Cohen J., Norwitz G., Anal. Chem., 35, 800 (1963).
460. Barcza L., Burger K., Magyar Kern. Folyoirat, 69, 178 (1963).
461. Bush D. G., К u n z e 1 s a u e r L. J., Merrill S. H., Anal. Chem , 35, 1250 (1963).
462. Dragusin I., German A., Rev. Chim. (Bucharest), 14, 352 (1963).
463. Емелин E. А., Смыслова H. Ф., Царфин Я- А., Зав. лаб., 29, 1169 (1963).
464. Katz D„ Z Anal. Chem., 195, 258 (1963).
465. Л я н д e Ю. В., Черкасский А. А., Зав. лаб., 29, 1050 (1963).
466. Maros L., Molnar-Perl I., Vajda M., S c h u 1 e k E , Anal. Chim. Acta, 28, 179 (1963).
467. Murakami T., Ishii E., Bunseki Kagaku, 12, 657 (1963)
468. Николаева H. E., Изв. высш, учебн. зав., пищевая технол., 170 (1963).
469. Р о h 1 е W. D., Gregory R. L_, Van Giessen В., J. Am Oil Chemists’Soc., 40, 549 (1963).
470. Ray S. C., Ann. Biochem. Exptl. Med. (Calcutta), 23, 411 (1963).
471. Руженцева А. К., Ларина П. H., Мед. пром. СССР, 42 (1963).
472. Tiwari R. D., Sharma J. P., Z. Anal. Chem., 195, 267 (1963).
473. Tdlgyessy J., Sarsimova M., Z. Anal. Chem., 196, 192 (1963).
474. Ziolkowski Z., R e s po n d e k J., Przondo J., Chem. Anal. (Warsaw), 8, 273 (1963).
475. Bednarski T. M., Hume D. N., Anal. Chim. Acta, 30, 1 (1964).
476. P f 1 b у 1 M., Slovak Z., Z. Anal. Chem., 200, 23 (1964).
477. P f i b у 1 M., Slovak Z., Z. Amal. Chem., 202, 112 (1964).
478. Siggia S., Hanna J. G., Serencha N. M., Anal. Chem., 36,
227 (1964).
479. Barker A. V., Volk R. J., Anal. Chem., 36, 439 (1964).
4. АЛЮМИНИЙ- И БОРГИДРИДЫ
Реагент. Для приготовления стандартных растворов титранта применяют литийалюминийгидрид и натрийборгидрид.
В качестве растворителей для этих весьма реактивных агентов применяют эфиры.
Реакции и титруемые соединения. 1. Реакции восстановления, протекающие при определении главным образом СО-групп, а также С—N-, S—S- и С—С-групп
R2CO - R2CH2 rconh2 rch2nh2 RCH -> RCH .NH2 RSSR 2RSH
>C=C< -> >CH—CH<
124
Таблица 12- Примеры использования алюминий- и боргидридов
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
1 Соединения, содержащие гидроксильные (см. № 2, 4), аминные (см. № 3) и карбонильные группы (см. № 9) LiAlH4 в тетрагидрофуране; реакция протекает несколько минут Избыток реагента оттитровывают бензели роп анол овым раствором этанола потенциометрически 1
2 Соединения, содержащие гидроксильные группы (см. Ns 1) LiAlH4 в тетрагидрофуране, вносят навеску определяемого вещества; 15— 30 мин Избыток реагента оттитровывают бен-золпропаноловым раствором этанола потенциометрически 2
3 Фармацевтические препараты, например спирты, амины (см. № 1), кислоты (см. № 4), алкалоиды, альдегиды, эфиры (Метод описан выше 1 — см. № 1) 3
4 Соединения, в состав которых входят активные атомы водорода (см. № 5), главным образом гидроксилсодержащие соединения (см. № 1) и карбоновые (см. № 3) кислоты Навеску определяемого вещества растворяют в тетр а гидрофуране, добавляют LiAlH5 в том же растворителе Избыток реагента оттитровывают бензольным раствором бутанола в присутствии индикаторов (замещенных аминоазобензолов) 4
5 Соединения, содержащие активные атомы водорода (см. Ns 4), например бензойная кислота, трибромфенол LiAlH, в дипропиловом эфире (образуется газообразный водород) Водород пропускают над нагретой до 1100—1200° С СиО, при этом образуется вода, конвертируемая нагретым углеродом в СО; СО пропускают через 12О6 при 120° С; образующийся 12 улавливают NaOH и окисляют до йодата смесью бром — уксусная кислота; избыток брома восстанавливают муравьиной кислотой; добавляют I- — H2SO4 и титруют тио- 5
6 Амиды; некоторые нитрилы LiAlHj в диэтиловом эфире; 15 мин при комнатной температуре сульфатом Н2О; NaOH для разложения избытка реагента; амины перегоняют в H2SO4, избыток которой оттитровывают NaOH в присутствии метилового пурпурного 6
125
Продолжение табл. 12
№ п/п
Титруемое вещество
Реагент и условия реакции
Соответствующа я обработка и конечная стадия титрования
Литература
8
9
10
Дисульфиды (алифатические и ароматические)
Ненасыщенные кислоты — определение ненасыщенности
Целлюлоза (d-глюкоза или периодатцеллюло-за) — определение карбонильных групп (см. № 1)
Ацилферроцены (определение молекулярных весов)
NaBH4 в диэтиленгликоле; добавляют диметиловый эфир и А1С13; 30 мин при комнатной температуре
Безводный метанол; ЫА1Н4 в дибутиловом эфире; PtO (катализатор); нагревают 10 мин
При pH 12—12,3; NaBH4; 24—48 ч при комнатной температуре
LiAlH4—А1С13 (происходит восстановление до алкил-ферроценов)
Суспензия LiAlH4 в тетрагидрофуране; кипятят 5 мин в колбе, снабженной обратным холодильником (происходит восстановление до H2S и меркаптанов)
NaOH для разложения избытка реагента; добавляют HNO3 и NH4OH; титруют образовавшиеся меркаптаны AgNO3 потенциометрически (см. Том I, «Соединения серебра (1)», литература 125]
Избыток реагента окисляют кислородом до воды, которую титруют реактивом Фишера
Фильтруют; добавляют избыток Ю^~, затем NaOH и H2SO4; выделившийся иод оттитровывают тиосульфатом
Титруют уксуснокислым раствором потенциометрически
Избыток реагента разлагают водой; добавляют H2SO4—
Н2О — пиридин; нагревают 90 мин при 70—80° С; выделяющийся H2S током азота пропускают в раствор ацетата кадмия; осадок CdS титруют иодом; меркаптаны перегоняют в пиридиновый раствор AgNOg при —10° С и титруют NaOH в присутствии фенолфталеина; или осаждают меркаптиды, затем их отфильтровывают и фильтрат титруют (см. «Соединения серебра (1)», литература 207]
7
8
9
10
II
126
2 Реакции замещения активных атомов водорода при определении спиртов, карбоновых кислот, аминов и других органических соеди-ненпй, содержащих активные атомы водорода:
4Х—H+LiAlH4 LiAlX«+4H2
Условия реакций. Взаимодействие проводят в среде обезвоженных эфирных растворителей (в особенности в среде тетрагидрофурана). Реакции обычно протекают очень быстро и оканчиваются за несколько минут.
Соответствующая обработка и конечная стадия титрования. Помимо газоволюмометрического метода определения активных атомов водорода, основанного на измерении объема образующегося газообразного водорода, известно несколько титриметрических методов.
1. Определение избытка реагента, которое может быть выполнено двумя способами:
1) методом обратного титрования LiAlH4 титрантом, содержащим активные атомы водорода (обычно бензольным раствором низшего спирта); конечную точку титрования в этом случае определяют потенциометрически или визуально в присутствии замещенных аминоазобензолов в качестве цветных индикаторов;
2) окислением йодатом и последующим обратным титрованием его избытка
ЗВН4 +4Ю7^4|“+ЗН2ВО7+ЗН2О
2 Определение продукта реакции, как, например:
1) аминов путем дистилляции и последующего титрования кислотой;
2) меркаптанов титрованием AgNOs;
3) водорода окислением до воды и последующим ее титрованием реактивом Фишера; или путем комплекса реакций, а именно окислением до воды, конверсией в СО, реакцией СО с 12О5, сопровождающейся образованием 12, окислением иода в конечном счете до йодата и последующего титрования йодата тиосульфатом в присутствии смеси I — кислота.
I. Higuchi L i n t n e r (1950).
L i n t tie r 418 (1950).
H iguchi ... ------- J .... ^llcln
Sc ho n 1 ger W., Z. anal. Chem., 133 4 (1951) S i gg i a S., S * - ь 1 " • -- '
Stahl C. R. c.
Seaman W., Anal. Chem., 30, 1840 (19581 S u p 1 m a t s u A., Y a h a r a " " - ’ Pulp Paper Ind.), 14, 516 (1960).
P e t e r 1 i k M., S . „ c * ; Porter M„ Saville B„
2.
3.
4.
5.
6.
7.
8.
9.
10.
11.
T., L i n t n e r C J S c h 1 e i f R. H., Science, 111,63 (1950). C. J., S c h 1 e 1 f R. H., Higuchi T., Anal. Chem., 22, 534
C. J., Zuck D. A., Higuchi T„ J. Am Pharm. Assoc., 39,
T., Zuck D A., J. Am. Chem. Soc., 73, 2676 (1951).
Stahl C. R., Anal. Chem'., 21' 550 (1955).
’ ^S‘igKua So AnaI- Chem., 29, 154 (1957).
4ПЯ1 l.npm 1 ОЛП zinrrn ’ ' 1
Sls/jam S" Kami’Pa Gikyoshi (J. Jap. Tech. Assoc.
Schoeg! К Z. anal. Chem., 195, 113 (1963).
v ’ Watson A. A., J. Chem. Soc., 346 (1963).
L i n t n е г С. J., S с h 1 е i f R. Н., Science, 111,63 (1950).
Ч г* h I о ; + П ТЛ и i _ 1_ т-' « . л. 1 ' .. _
127
5, ИЗОПРОПИЛА Т АЛЮМИНИЯ
Рассматриваются случаи применения титриметрического метода основанного на реакции Меервейна—Понндорфа—Берлея.
Таблица 13. Примеры использования изопропилата алюминия
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования
1 Карбонильные соединения, например производные ацетофенона и бензальдегида Изопропанол и изопро-пилат алюминия; нагревают 15—60 мин в колбе, снабженной обратным холодильником. При этом устанавливается равновесие: Цн )С=О+ RZ снзч + )снонх± СН3Х сДч >СНОН+ Rz снзх + >с=о сн3/ (где R—Н или СН3) Ацетон как наиболее летучий продукт перегоняют в гидроксиламин гидрохлорид; титруют щелочью в присутствии бромфенолового голубого, потом — фенолфталеина; по разнице определяют содержание избытка гидроксиламина и, следовательно, содержание ацетона
1. S i m о п у j I., Tokar 217 (1956).
ЛИТЕРАТУРА
G., G а 1 G., Acta Chem. Acad. Sci. Hung., 16,
6. АМИНЫ И ГЕТЕРОЦИКЛИЧЕСКИЕ ОСНОВАНИЯ
Реагент. Обычно применяют алифатические и ароматические первичные, вторичные и третичные моно- и диамины. Для определения галогенидов предпочитают применять аминоспирты, проявляющие более сильные основные свойства.
Реакции, титруемые вещества и соответствующая обработка. Метод обратного титрования аминами основан на нескольких различных реакциях. Поэтому условия реакций и соответствующая обработка весьма разнообразны.
Конечной стадией определения является либо обратное титрование избытка амина (около приводимых ниже примеров, см. табл. 14), либо определение соответствующим методом продукта реакции. Для обратного титрования избытка оснований применяют реагенты, имеющие кислые свойства (хлористоводородную, хлорную и серную кислоты), для титрования ароматических первичных аминов — нитрит, бромат или соли диазония. Избыток амина почти всегда
128
определяют, не выделяя его из реакционной смеси, и только изредка амины предварительно отделяют от других продуктов реакции.
1 Образование амидов при взаимодействии аминов с хлоран-гидридами, ангидридами и иногда с эфирами:
RCOC1-|-R'NH2 RCONHR'-pHCl
(RCO)2O+R'NH2 -> RCONHR'+RCOOH
Эти реакции протекают в сравнительно умеренных условиях в течение 15 мин при комнатной температуре.
Заключительной стадией определения является титрование избытка амина или титрование щелочью образующихся в процессе реакции кислот (НС1 или R'COOH). Для определения содержания примесей свободных кислот во втором случае обычно проводят параллельное титрование продуктов гидролитического расщепления хлорангидридов или ангидридов в известных навесках. Разница между результатами двух титрований соответствует содержанию хлорангидрида или ангидрида. В нескольких случаях амины выделяют и затем содержание их определяют титриметрическим методом.
2. Реакции ионного или иономолекулярного взаимодействия, протекающие при определении сульфокислот и других сильных кислот с образованием продуктов, нерастворимых в воде и растворимых в органических растворителях (сюда же относятся реакции анионных поверхностно-активных веществ):
h++rso^ |-R'NH2^ (r'nh3)+ (RSO3)“
Приведенная реакция протекает быстро, но обычно реакционной смеси дают постоять долгое время для того, чтобы дать возможность продукту реакции количественно выпасть в осадок. В большинстве случаев осадок потом титруют щелочью, редко определяют содержание амина в фильтрате.
3. Реакции замещения или присоединения галоген-ионов при определении органических галогенидов:
RHal-|-2R'NH2 -> RNHR’-J-Hal-+R'NH^
Низшие алкилиодиды (образующиеся при определении алкоксиль-ных групп в процессе взаимодействия с HI) образуют с третичными основаниями иодиды четвертичных аммониевых оснований:
RI+R3N-> (RRgN)+r
Продолжительность реакции, очевидно, зависит от реакционной способности галогенида; для ее завершения требуется многочасовое нагревание смеси в колбе, снабженной обратным холодильником.
разующиеся гало1ен-ионы большей частью титруют солями се-Н° В нек0Т0Р^1Х случаях используют окисление, например мыппп В иода1°м> чт°бы затем оттитровать выделившийся иод, бро-галобромитом д0 аромата. Недавно было применено титро-пип* , 11ДР00КИСЬ1° четвертичного аммониевого основания92 метил-пиридиниииодида.
5
М. Р. ф. Эшворт
129
Таблица 14. Примеры использования аминов и гетероциклических оснований
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
1 Уксусный ангидрид (см. № 2, 4, 7—10, 12, 16, 18, 20, 25, 29, 49, 52, 57, 65, 69, 93) Анилин Титруют щелочью 1
2 Уксусный ангидрид (см. № 1) в большом избытке уксусной кислоты 2,4-Дихлоранилин; оставляют на ночь Экстрагированный хлороформом анилид превращают в устойчивый хлорамин путем взаимодействия с белильной известью в среде уксусной кислоты. Затем СН3С1 выпаривают и хлорамин определяют иодометрически. Для этого добавляют иодид калия и выделившийся иод оттитровывают тиосульфатом 2
3 Йодистый метил, образующийся при определении метоксильных групп в процессе взаимодействия их с иоди-стоводор одной кислотой Абсорбируют пиридином Титруют AgNOg в присутствии хромата; или добавляют небольшой избыток AgNO3, затем небольшой избыток NaCl и, наконец, титруют AgNOg 3
4 Уксусный ангидрид (см. Я» 1) Анилии Титруют раство- ром NaOH в присутствии фенолфталеина. Холостой опыт с водой 4
5 Алкилиодиды (см. № 11, 24, 91), образующиеся при определении алкоксильных групп (см. № 11) в процессе взаимодействия их с HI Абсорбируют пиридином Вода; титруют AgNOg в присутствии хромата 5
6 Диазотированный п-аминофеиол л-Фенилендиамин и ацетат натрия; при 25° С Титруют хлористым фенил ди азонием CcH6N2C1 (см. Том I, «Соли диазония», литература 5) 6
7 Уксусный ангидрид (см. № 1) Анилин Ацетанилид отфильтровывают, гидролизуют и анилин определяют броматометрически 7
8 У/сусный ангидрид (№ 1) Анилин — уксусная кислота (Холостой опыт с избытком NaOH) Титруют щелочью (NaOH в холостом растворе оттитровывают кислотой) 8
130
Продолжение
№ п/п Титруемое вещество Реагент н условия реакции Соответствующая обработка и конечная стадия титрования Литература
9 10 11 12 13 14 15 16 17 18 Уксусный ангидрид (см. № 1) Уксусный ангидрид (см. № 1) (Холостой опыт с избыт ти Алкилиодиды (см. № 5), образующиеся при определении алкоксильных (см. К° 5) групп в процессе их взаимодействия с HI Небольшие количесгва уксусного ангидрида (см. № 1) в уксусной кислоте Ацетат — сульфат (образующиеся при определении ацетата свинца путем осаждения измеренным избытком H2SO4) Алкилсульфаты (детергенты) Органический сульфат в технических сульфированных спиртах Уксусный ангидрид (см. № 1) в этерифици-рованной целлюлозе Нафталинсульфокислоты (см. № 45) У ксусный ангидрид (см № 1) 2, 4-Дихлоранилин в уксусной кислоте; при 25° С 2, 4-Дихлоранилин в СНС13; оставляют на ночь ком NaOH; оставляют груют кислотой) Абсорбируют пиридином 2, 4-Дихлоранилин в уксусной кислоте; оставляют на ночь Бензидин; 5 мин Бензидин гидрохлорид В воде; бензидин гидрохлорид; 10 мин Анилин в уксусной кислоте Бензидин, Р-нафтил-амин или замещенные анилины, подобные л/-нитроанилину Антраниловая кислота в уксусной кислоте Разбавленная НС1; титруют нитритом в присутствии крахмал — иодид (см. Том 1, «Нитрит натрия», литература //) Щелочь, избыток которой оттитровывают кислотой на ночь, затем также Пиридинийиодид окисляют йодатом до иода, который затем оттитровывают стандартным раствором тиосульфата (см. «Иодат калия и пя-тиокись иода», литература 15) НС1 в воде; избыток смеси бромат-бромид; избыток брома определяют иодометрически (см. «Реагенты, содержащие бром», литература 55) Бензидинсульфат отфильтровывают и фильтрат титруют NaOH в присутствии тимолового голубого или фенолфталеина Осадок растворяют в горячем этаноле и титруют щелочью Осадок растворяют в горячем этаноле и титруют NaOH в присутствии бромкрезолового пурпурового Избыток анилина оттитровывают сильной минеральной кислотой Осадок титруют NaOH в присутствии фенолфталеина Титруют уксуснокислым раствором хлорной кислоты 9 10, 13 11 12 14 15 16 17 18 19, 21
131
Продолжение
№ п/п Титруемое вещество Реагент в условия реакции Соответствующая обработка и конечная стадия титрования Литература
19 Бромистый метил (см. № 23, 26, 41, 86) в воздухе Абсорбируют моно-этаноламином; не менее 15 мин Добавляют избыток AgNOg, который оттитровывают тиоцианатом; или Вг“ окисляют гипохлоритом до бромата, добавляют KI — кислота и титруют тиосульфатом 20
20 Избыток уксусного ангидрида (см. № 1) при определении неосновного водорода в аминокислотах Антраниловая кислота; 3 ч Титруют уксуснокислым раствором хлорной кислоты в присутствии кристаллического фиолетового 22
21 Дихлорэтан Моноэтиламин — диоксан; нагревают 1 ч в колбе, снабженной обратным холодильником Азотная кислота; AgNOg, избыток которого оттитровывают тиоцианатом в присутствии FeIn 23
22 Формальдегид (см. № 51) в смеси с ацетальдегидом Глицин К остающемуся СНдСНО добавляют NaHSOg, затем проводят йодометрическое титрование связанного бисульфита. Далее определяют содержание обоих альдегидов Содержание НСНО находят по разности (см. «Бисульфит и сульфит», литература 71) 24
23 Бромистый метил (см. № 19) Абсорбируют смесью моноэтиламин — мокрый песок Вг“ -ионы определяют аргентометрически или окислением гипобромитом 25
24 Алкилиодиды (см. № 5), образующиеся при определении алкоксиль-иых (см. № 5) групп в процессе их взаимодействия с HI Абсорбируют пиридином Пиридин отгоняют; добавляют воду и Hg (ОН) CN; оттитровывают ОН- -ионы HaSOe 26
25 Уксусный ангидрид (см. № 1) Бензидин—нитробензол—бензол; при 0°С (Холостой опыт с во щел Избыток реагента оттитровывают щелочью гой — также титруют эчью) 27
132
П родолисение
X? п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
26 Бромистый метил (см. № 19) в воздухе Абсорбируют смесью этанол—диоксан Подкисляют; титруют стандартным раствором AgNO3 в присутствии эозина; или добавляют AgNO3, избыток которого оттитровывают тиоцианатом в присутствии Fe111 28
27 Хлорапгидриды (см. № 34, 63, 87, 103) алифатических кислот Анилин НС1; хлористоводородный анилин; избыток НС1 удаляют отмыванием; оставшуюся жирную кислоту оттитровывают щелочью 29
28 Алкил- и арилалкил-сульфонаты (см. № 35, 53, 104) n-Толуидингидрохло-рид—вода—СС14; встряхивают 5— 10 мин Сульфонат амина титруют в среде СС14 щелочью в присутствии .«-крезолового пурпурного (см. Том I, «Гидроокиси щелочных и щелочноземельных металлов», литература 45) 30
29 Уксусный ангидрид (см. № 1) при определении воды (см. № 100) в в пиридине Анилин: 10 мин (Холостой опыт с во щелс Воду; титруют NaOH в присутствии фенолфталеина цой — также титруют чью) 3J
30 Гексаметилен-, бензил-и циклогексилизоцианаты В ацетоне; пиперидин—ацетон Метанол и избыток стандартного раствора НС); избыток кислоты оттитровывают щелочью в присутствии метилового красного или метилового голубого (Холостой опыт) 32
31 Натриевая соль N-ме-тилкислоты,выделенной из таллового масла Кислота; бензидин гидрохлорид; 3 ч или оставляют на ночь Осадок растворяют в водном спирте и титруют NaOH в присутствии фенолфталеина. (Определяют также весовым методом.) (см. Том 1, «Гидроокиси щелоч ных и щелочноземельных металлов», литература 49] 33
133
Продолжение
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
32 Карбазол-З-сульфо-кислота в смеси с изомерными сульфокислотами В воде; бензидин гидрохлорид; кипятят и охлаждают льдом Осадок титруют NaOH в присутствии фенолфталеина (см. Том I, «Гидроокиси щелочных и щелочноземельных металлов», литература 54) 34
33 Ангидриды (см. № 42, 54, 55, 60, 72, 85, 87) двухосновных кислот, подобные ангидриду тетрахлорфталевой кислоты Анилин — ацетон; 30 мин, при комнатной температуре или нагревают в колбе, снабженной обратным холодильником Избыток реагента оттитровывают спиртовым раствором КОН в присутствии фенолфталеина 35, 36
34 Хлорангидриды (см. № 27) В диоксане; избыток анилина Вода; НС1 оттитровывают NaOH в присутствии бромтимолового голубого. Также определяют общее содержание С1_, добавляя AgNO3, избыток которого оттитровывают тиоцианатом. Содержание свободного хлор-ангидрида вычисляют по разности 37
35 Сульфонаты (детергенты) (см. № 28) (Подробности метода, описанного выше 33, — см. № 31, также см. Том I, «Гидроокиси щелочных и щелочноземельных металлов», литература 58) 38
36 Изоцианатные (см. № 38, 46, 71, 75, 96) и изотиоцианатные (см. № 71, 75, 99) группы Бутиламин—обезвоженный диоксан; при образовании ал-килсоединений — 45 мин при комнатной температуре; при образовании арилсоединений без выдерживания Вода; титруют H2SO4 в присутствии метилового красного 39
37 Сульфорицииолеаты Вода, беизидии гидрохлорид Осадок растворяют в горячем этаноле и титруют спиртовым раствором КОН в присутствии бромкрезолового пурпурного (см. Том I, «Гидроокиси щелочных и щелочноземельных металлов», литература 62) 40 I
134
Продолжение
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
38 39 40 41 42 43 44 45 Изоцианаты (см. № 36) Моногалогениды (см. № 67, 76, 80) и их смеси Соли 2-нитро-1, 3-индан-диона Бромистый метил (см. № 19) в фумигантах, содержащих хлор Ангидриды (см. № 33) Анионо-активные вещества (см. № 53, 84, 94, 95) Дибромметан (см. № 86) Нафталин-1,5- и 2, 5-дн-сульфокислоты (см № 17) Хлорбензол; избыток бутиламина в хлорбензоле; 5 мин Анилин или пиперидин без растворителя или в растворителях, подобных нитробензолу (компоненты смеси реагируют с разными скоростями) Бензидин гидрохлорид; оставляют на 24 ч Этаноламин Анилин; 5—90 мин при комнатной температуре (15 мин при 100° С для малеинового ангидрида) Вода; п-толуидинги-дрохлорнд—вода; СС1а или эфир; встряхивают 10 мин Этаиоламин; реакция протекает в течение 30 мин при 90° С (Изучены условия реакции) Нейтральный раствор, бензидин гидрохлорид; КИПЯТЯТ и охлаждают Метанол; титруют водным раствором НС1 в присутствии бромфенолового голубого Кислота и AgNO3, избыток которого оттитровывают тиоцианатом Осадок суспендируют в горячей воде и титруют NaOH в присутствии фенолфталеина Азотная кислота; СГ оттитровывают потенциометрически серебром (I) Изопропанол в этиленгликоле; титруют потенциометрически раствором HCIbtom же растворителе (см. Том I, «Хлористоводородная кислота», литература 76) В органический слой добавляют этанол и титруют NaOH в присутствии крезолового красного (см. Том I, «Гидроокиси щелочных и щелочноземельных металлов», литература 76) Ag+, избыток которого оттитровывают тиоцианатом в присутствии Fe111 Осадок титру ют NaOH в присутствии фенолфталеина (см. Том I, «Гидроокиси щелочных и щелочноземельных металлов», литература 86) 41 42 43 44 45 46 47 48
135
Продолжение
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая об работка и конечная Стадия титрования Л итература
46 Изоцианатные (см. № 36) группы в материалах, добавленных к резине Избыток изобутила-мин в хлорбензоле; 10 мин Титруют НС1 в среде хлорбензол—метанол (3: 10) потенциометрически (см. Том 1, «Хлористоводородная кислота», литература 29) 49
47 Аллетрин С1вН2(;О3 — инсектицид (эфир хри-зантеновой монокарбоновой кислоты) Этилендиамин; 2 ч при 25—30° С (выделяется аминная соль кислоты) Титруют пиридиновым раствором NaOCH3 в присутствии тимолфталеина 50
48 Хризантеновая монокарбоновая кислота или ее ангидрид Морфолин в метаноле; 5 мин при 25— 30° С Титруют метаноловым раствором НС1 в присутствии диметилового желтого — метилового голубого 50
49 Уксусный ангидрид (см. № 1) Анилин в бензоле; 5 мин при 0° С, затем 10 мин при комнатной температуре СС14; КВт; вода; избыток амина оттитровывают нитритом (см. Том 1, «Нитрит натрия», литература 76) 51
50 Лигнин сульфоновых кислот в сульфитных щелоках Полиаминоксиэтил-хитозан или полиметилами нохитозан Избыток реагента оттитровывают поливинилспиртовым раствором сульфата калия в присутствии пиридинового голубого 52
51 Альдегиды (см. № 77, 82, 101) например формальдегид (см. № 22), бензальдегид, фурфурол, коричный альдегид, салициловый альдегид Лауриламин — изопропанол — этиленгликоль; 1 ‘/при комнатной температуре Титруют потенциометрически раствором салициловой кислоты в том же растворителе (см. Том 1, «Карбоновые кислоты», литература 5) 53
52 Уксусный ангидрид (см. № 1) Анилин — хлорбензол Избыток анилина оттитровывают уксуснокислым раствором хлорной кислоты в присутствии кристаллического фиолетового (см. Том 1, «Хлорная кислота», литература 68) 54
53 Аиионо-активные (см. № 43) синтетические дубильные вещества (сульфонаты) (см. № 28) Вода, избыток п-то-луиди нгидр охлорида Избыток реагента оттитровывают нитритом (см. Том 1, «Нитрит натрия», литература 78) 55
136
Продолжение
№ п/п Титруемое вещество Реагент н условия реакции Соответствующа я обработка и конечная стадия титрования Литература
54 Избыток пропионового ангидрида (см. № 33, 56, 81, 98) при определении ОН-, (см. № 56, 92, 107) и —NH2-rpynn Анилин — уксусная кислота — бензол; 5 мин Избыток анилина оттитровывают уксуснокислым раствором хлорной кислоты в присутствии кристаллического фиолетового 56
55 Ангидриды (см. № 33) Морфолин — метанол; 5 —30 мин Титруют метаноловым раствором НО в присутствии диметилового желтого или метиленового голубого 57
56 Избыток пропионового ангидрида (см. № 54) при определении —ОН-групп (см. № 54) в по-лиэтиленгликоле Уксусная кислота; избыток анилин — бензол; 5 мин Титруют уксуснокислым раствором в присутствии кристаллического фиолетового (см. Том 1, «Хлорная кислота», литература 124) 58
57 Уксусный ангидрид (см. № 1) (Холостой опыт Анилин 3% -ный водный раствор с водой — также тит Титруют NaOH в присутствии фенолфталеина руют NaOH) 59
58 Серная кислота (см № 67), сульфокислоты в ненейтрализованных сульфированных смазочных маслах СНС13; анилин в СНС13 (образуется осадок су льфатани ли на) Фильтруют; сульфокислоту в фильтрате оттитровывают спиртовым раствором КОН потенциометрически 60
59 а, P-Ненасыщенные нитрил ьные и карбонильные соединения (см. № 77) Морфолин — вода — уксусная кислота (катализатор), 5— 240 мин при 25 или 98° С Ацетонитрил; уксусный ангидрид, реагирующий с избытком морфолина, образовавшееся соединение оттитровывают метанол овым рас- твором НС1 в присутствии метилового оранжевого или ксиленолцианола FF (см. Том 1, «Хлористоводородная кислота», литература 45) 61
13?
Продолжение
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
60 Ангидриды (см. № 33) Морфолин— ацетонитрил; 15 мин Нейтрализуют в присутствии фенолфталеина, добавляют CS2 для превращения амина в дитиокар-баминовую кислоту. Титруют NaOH в присутствии тимолфталеина (см. Том 1, «Гидроокиси щелочных и щелочноземельных металлов», литература 117) 62
6] Бензол-о- и л-дисульфо-кислоты (см. № 62) Р-Нафтиламин Осадок титруют в кипящем растворе NaOH в присутствии фенолфталеина 63 1
62 Бензол-п-дисульфокис-лота (см. Ке 61) Бензидин Определяют таким же методом, как описано выше63; — см. № 61 (см. Том 1, «Гидроокиси щелочных и щелочноземельных металлов», литература 127)
63 Хлорангидриды (см. № 27) и соответствующие карбоновые кислоты л<-Хлоранилии — ацетон; 5 мин при комнатной температуре Вода; титруют NaOH потенциометрически; скачок титрования при pH 5—6 соответствует гидрохлориду амина, при pH 8—9,5—карбоновой кислоте 64
64 Сероокись углерода в нефтяном газе Адсорбируют моно-этаноламином в этаноле или диамилами-ном при pH 10,6 CH3COONa; уксусная кислота —этанол (или изопропанол); титруют AgNO3 в 83 %-ном изопропаноле потенциометрически (см. Том 1, (Соединения серебра (1)»; литература (109) 65
65 Уксусный ангидрид (см. № 1) Анилин; 40—60 мин Избыток анилина оттитровывают уксуснокислым раствором хлорной кислоты в присутствии кристаллического фиолетового (см. Том 1, «Хлорная кислота», литература 170) 66
’38
Продолжение
№ n/п 66 67 68 69 70 71 72 73 Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
Первичные аллиловые хлориды в присутствии третичного изомера, например 1-хлор-З-метил-бутен-2 в присутствии 2-хлор-2-метил-бутен Алкилгалогениды (см. № 39), эфиры, фосфорной и серной кислот (см. № 58) (определение эквивалентных весов) Избыток фенилизоцианата (см. Хе 92, 107) при определении силановых групп Уксусный ангидрид (см. № 1) Сероуглерод (см. № 78, 97) Изоцианатные (см. № 36) и изотиоцианатные (см. № 36) группы Ангидриды (см. № 33) Сульфогруппы в синтетических детергентах Гексаметилентетрамин—KI (Образуется (RQHkNJ^-J Этаноламин; нагревают 1—2 ч в колбе, снабженной обратным холодильником Изобутиламии В уксусной кислоте; избыток анилина; 15 мин прй 100° С Морфолин или диэтаноламин в среде вода—пиридин— изопропанол В хлорбензол; дибу-тиламин—хлорбензол—метанол; встряхивают в течение нескольких минут Уксусная кислота; избыток 2,4-дихло-ранилин—уксусная кислота; 2 ч п-Толуидин Избыток основания оттитровывают НС1 в присутствии формалина Пропускают через ионообменник и элюент титруют NaOH (см. «Ионооб-менники», литература 24) Избыток реагента оттитровывают НС1 Избыток анилина оттитровывают уксуснокислым раствором НС1О4 в присутствии метилового фиолетового Образующуюся ди-тиокарбаминовую кислоту оттитровывают небольшим избытком NaOH; заканчивают определение титрованием раствором НС1 в присутствии тимолфта-леина Избыток дибутила-мина оттитровывают НС1 в присутствии бромфенолового голубого НС1 и смесь бромат-бромид, избыток которой определяют иодометрически (см. «Реагенты, содержащие бром», литература 459) Соль экстрагируют эфиром и титруют NaOH 67 68 69, 74 70 71 72 72 73
139
Продолжение
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
74 Димеры алкилкетена Эфир; этиламин—этанол Избыток реагента оттитровывают НС1 в присутствии бромкрезолового зеленого (см. Том 1, «Хлористоводородная кислота», литература 69) 75
75 Изоцианатные (см. № 36) и изотиоцианатные (см. № 36) группы Дибутиламин—диоксан; 15—45 мин Избыток дибутил-амина оттитровывают НС1 в присутствии метилового красного (см. Том 1, «Хлористоводородная кислота», литература 70) 76
76 Алкилгалогениды (реактивные) (см. № 39) Диоксан; анилин; нагревают 3—30 мин в колбе, снабженной обратным холодильником Избыток анилина от-титровывают CH3ONa—бензол— метанол в присутствии тимолового голубого 77
77 Карбонильные соединения (см. № 59), например ароматические альдегиды (см № 51) Анилин или о-толуи-дин—бензол Воду оттитровывают реактивом Фишера 78 I
78 Сероуглерод (см. № 70) Диэтиламин Дитиокарбамат оттитровывают пиридиновым раствором HgCl2 в присутствии медной соли этилен-диаминтетрауксусной кислоты [см. Том 1, «Соединения ртути (III)», литература 65] 79
79 Акрилонитрил (см. № 102) Пиперидин—диоксан и небольшое количество уксусной кислоты; 30 мин Уксусный ангидрид для ацетилирования избытка пиперидина; продукт реакции оттитровывают метаноловым раствором НС1 в присутствии метилового красного или метиленового голубого (см. Том 1, «Хлористоводородная кислота», литература 72) 80
140
Продолжение
№ п/п
Титруемое вещество
Реагент к условия реакции
Соответствующая обработка и конечная стадия титрования
Литература
80
81
82
83
84
85
Реактивные примеси галогенидов (см. № 39) в СНС13
Избыток пропионового ангидрида (см. № 54) при определении хлорамфеникола
Альдегиды (см. № 51), образующиеся при определении серина и треонина (а-амино-Р-оксимасляная кислота) в процессе окисления их перйодатом
N-Нитрозодифениламин
Анионо-активные (см. № 43) вещества, например додецилбензол-сульфонат натрия
Ангидриды (см. № 33)
Бромистый метил (см. 19), дибромметан (см. 44) и четыреххлори-*ыи углерод в воздухе
Пиперидин; 2 ч при 60° С в запаянной ампуле
Анилин—бензол
Глицин, реагирующий с альдегидом и препятствующий образованию альде-гидо-аммиачных производных
Уксусная кислота 70% -ная; избыток а-нафтиламина в уксусной кислоте;
30 мин при 60° С
Азотная кислота; AgNOs, избыток которого оттитровывают тиоцианатом в присутствии нитробензола и FeII(
Избыток анилина оттитровывают уксуснокислым раствором НСЮ4 в присутствии кристаллического фиолетового или потенциометрически (см. Том 1, «Хлорная кислота», литература 269)
Аммиак перегоняют и оттитровывают кислотой
81
82
Бензидин или «-толуидин (Методы описаны выше15,30—см. № 14 и 28)
Умеренный избыток гексаметиленимина или пиперидина в диоксане; 5 мин
Моиоэтаноламии (Реакция протекает при разных условиях)
Избыток реагента оттитровывают уксуснокислым раствором НСЮ4 (см. Том 1, «Хлорная кислота», литература 309, 339)
Избыток реагента оттитровывают нитритом (см. Том 1, «Нитрит натрия», литература 136)
Этанол; избыток реагента оттитровывают метаиоловым раствором НО в присутствии метилового’красного или метиленового голубого
ВГ и Cl-
оттитровывают серебром (1)
амперометрически
84, 89
85
86
141
Продолжение
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
87 Ангидриды (см. № 33); хлорангидриды (см. № 27) .и-Хлоранилин в смеси уксусная кислота— бензол или в нитробензоле; больше 1 ч при 65— 70° С Уксусная кислота, HCI и КВг оттитровывают нитритом потенциометрически (см. Том 1, «Нитрит иатрия», литература 142) 88
88 Бензоил- и пальмитоил-хлориды Морфолин в СС14; ацетат ртути—уксусная кислота; нагревают до кипения Избыток реагента оттитровывают уксуснокислым раствором НС1О4 в присутствии тропеоли-на 00 90
89 Бромистый бензил, образующийся при определении бензиловых групп в эфирах при взаимодействии их с НВг Бензол; анилин; нагревают в течение 5 мин Титруют стандартным бензол-метано-ловым раствором CHsONa в присутствии тимолового голубого 91
90 Фосген В толуоле; гексаме-тилеиамин в толуоле или диоксаие; несколько минут Подщелачивают; избыток амина перегоняют в избыток стандартного раствора кислоты и оттитровывают раствором щелочи в присутствии тимолового красного или метиленового голубого 92
91 Алкилиодиды (см. № 5), образующиеся при определении алкоксильиых (см. № 5) и S-метильиых групп в процессе взаимодействия их с HI Абсорбируют пиридином; кипятят 2 ч Титруют метанол-бензольным раствором гидроокиси тетрабутил аммония потенциометрически или в присутствии азофиолетового. Разность между скачками титрования или изменением цвета эквивалентна содержанию четвертичного иодида (см. Том 1, «Гидроокиси четвертичного аммония», литература 50) 93
92 Избыток фенилизоцианата (см. № 68) при определении гидроксильных групп (см. № 54) в ненасыщенных полиэфирных смолах Хлорбензол—ацетон (из предыдущей реакции); диизобу-тиламин—хлорбензол Избыток амина оттитровывают кислотой в присутствии бромфеиолового голубого 94
142
Продолжение
№ п/п 93 94 95 96 97 98 99 100 Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
Уксусный ангидрид (см. № 1) в ацетилирующих смесях Анионо-активные вещества (см. № 43) Аяиояо-активиые вещества (см. № 43), например сульфонаты Диизоцианаты (см. № 36) Сероуглерод (см. № 70) в органических растворителях Избыток пропионового ангидрида (см. № 64) при определении пропионового числа эфирных масел Изотиоцианаты (см. № 36) Избыток фталевого ангидрида при определении воды (см. № 29) в муравьиной кислоте Анилин; 10 мин при комнатной температуре В разбавленной НО (pH 1,5—2); избыток 4-амиио-4'-хлордифенилгидро-хлорида; 10 мин при комнатной температуре (образуется осадок соли) Вода; /7-толуидин гидрохлорид и СС14 В безводном хлорбензоле; гексаме-тиленамин—хлорбензол; 20 мин при комнатной температуре Этилендиамин—диме-тилформамин; 2—3 мин при комнатной температуре, затем в течение 30 сек при 100° С (образуется Р-ами-иоэтилдитиокарбамат) Анилин—бензол; уксусная кислота; 5 мин при комнатной температуре Пиперидин—диоксан N-Этиланилин— бензол; кипятят 5 мин Диэтилеигликоль; избыток анилина оттитровывают диоксановым раствором НС1О4 потенциометрически Осадок отфильтровывают и фильтрат титруют нитритом в присутствии внешнего индикатора крахмал—иодид (см. Том 1, «Нитрит натрия», литература 147) К слою СС14 добавляют этанол; титруют NaOH в присутствии бромфенолового голубого Избыток НО; этанол или изопропанол; титруют NaOH в присутствии бромфенолового голубого N аОН—метанол; титруют стандартным раствором о-окси-ртутьбензойной кислотой до исчезновения голубого цвета тиофлюоресце-ииа Избыток амина оттитровывают НС1О4 в присутствии кристаллического фиолетового Избыток основания оттитровывают кислотой Бензол—нитробензол; титруют уксуснокислым раствором НС1О4 потенциометрически 95 96 97 98 99 100, 102 101 103
43
Продолжение
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
101 Альдегиды (см. № 51) в смеси с ацеталями (Метод описан выше 78 — см. № 77) 104
102 Акрилонитрил (см. № 79) Метаиол; гексаметил ей амин—метанол и уксусная кислота; 4 ч Уксусный ангидрид для удаления избытка амина; титруют метаноловым раствором НС1 в присутствии метилового красного или метиленового голубого 105
ЮЗ Хлораигидриды кислот (см. № 27); хлористый сульфурил Г ексаметилеиамии метанол; 5—10 мин при комнатной температуре Титруют метаноловым раствором НС1О4 в присутствии метилового красного и метиленового голубого 106
104 Сульфонаты (см. Я» 28) (Модификация метода, описанного выше80, —см. № 28) 107 |
105 Хлорэндиковая кислота, хлорэндиковый ангидрид, малеиновая кислота, малеиновый ангидрид Анилии—СНС13; 90 мин Ацетон; аликвотную часть титруют КОН потен ци ом етр и ч еск и, первый скачок соответствует нейтрализации первого иона водорода малеиновой кислоты; второй— хлорэндиковой кислоты и анилидов и третий—второго Н+ -иона малеиновой кислоты. Избыток анилина также оттитровывают НС1О4 108
106 Трихлорид циануровой кислоты в присутствии С1~ Сульфанилат натрия—вода; нагревают 25—30 мин в колбе, снабженной обратным холодильником НС1 титруют нитритом в присутствии индикатора: крахмал—иоДИД 109
107 Избыток феи и л изоцианата (см. № 68) при определении эквивалентных весов полиоксиалкиленовых соединений по гидроксильным (см. № 54) группам Смеси диметилфор-мамид—толуол (из предыдущей реакции); дибутиламин— толуол; 15 мин при комнатной температуре Мети л целлозольв; титруют раствором НС1О4 в метилцеллозольве в присутствии бромкрезолового зеленого НО
144
Продолжение
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
108 Соли диазония, например толилдиазоний хлорид (см. 109) Гексаметилеиамии и Na2COs; 5 мин при комнатной температуре или ацетат натрия и л-толуидин; 15 мин при комнатной температуре Подщелачивают; избыток амина перегоняют в борную кислоту и оттитровывают НС1 в присутствии метилового красного н метиленового голубого Избыток амина выделяют, как указано выше, и определяют бромат-бромидным методом (см. «Реагенты, содержащие бром», литература 543) 111
109 Избыток п-толилдиазо-ний хлорида (см. № 108) при определении фенолов (Метод описан выше 111 — см. № 108) 112
4. Реакции присоединения аминов к изоцианатам и изотиоцианатам, а- и р-ненасыщенным карбонильным соединениям, к нитрилам, к сероуглероду и к сероокиси углерода:
RNCO J-R'nh RNHCONR'
CH2=CHCN+RjNH СН3—CHCN
nr;
CS2-PR2NH -> HS—c=s
I nr2
Содержание изоцианатов и изотиоцианатов определяют обратным титрованием избытка амина.
Во втором приведенном выше примере третичный амин, образующийся в процессе реакции присоединения к вторичному амину, титруют кислотой. Тиокарбаминовые кислоты, образующиеся в результате реакции с сероуглеродом или сероокисью углерода, титруют щелочью, ионами серебра или ртути(И).
5. Реакции конденсации с карбонил- или нитрозосоединениями: r2co fr'nh2 -> r2c=nr’+h2o RNO+R'nh2 -» RN=NR'+H2O
титп^п1?М слУчае встречаются различные варианты конечной стадии r,nnL,Hr/Hr’ например обратное титрование избытка амина или титрование образующейся воды реактивом Фишера.
145
6. Единственным примером других типов реакций аминов является сочетание с диазониевыми солями. Здесь можно упомянуть, что амины также используются как основания в некоторых случаях анализа, например при определении карбонильных соединений посредством гидроксиламина. Существенное значение имеет то, что реакции, протекающие между кетонами или альдегидами и гидроксиламином, сопровождаются уменьшением концентрации основания.
ЛИТЕРАТУРА
1. Мен шутки н Н., Васильев М., Ж- русского физико-хим. общества, 21, 190 (1889).
2. Ed wards М. G., Orton К. J. Р., Analyst, 36, 417 (1911); J. Chem. Soc., 99, 1181 (1911).
3. К 1 r p a 1 А., В й h n T., Ber., 47, 1084 (1914).
4. Radcliffe L. G., Me d о f s k i S., J. Soc Chem. Ind., London, 36, 628 (1917).
5. M e 1 a n d e г К- H. A., Svensk Paperstidn., 24, 277 (1921).
6. Er men W. F. A., Chem. and Ind. (London), 42, 538 (1923).
7. S p e n c e r G. C., J. Assoc. Offic. Agr. Chem., 6, 493 (1923).
8. P о r t e r R., Chem. Trade J., 75, 93 (1924).
9. С a 1 с о t t W. S., E n g 1 i s h F. L„ W i 1 b u г О. C„ Ind. Eng. Chem , 17,
942 (1925).
10. T e г 1 i n c k E., Ingenieur chimiste, 9, 140 (1925).
11. Eaton E. D., West E. S., J. Biol. Chem., 75, 283 (1927).
12. О r t о n K. J. P., Bradfield A. E., J. Chem. Soc., 983 (1927).
13. T e r 1 i n c k E., Chem.-Ztg., 53, 814, 850 (1929).
14. Han J. E. S., C h u T. L., Ind. Eng. Chem., Anal. Ed., 3, 379 (1931).
15. Kling W., P й s c h e 1 F., Melliand. Textilber, 15, 21 (1934).
16. В i f f e n F. M., Snell F. D., Ind Eng. Chem., Anal. Ed., 7, 234 (1935).
17. Malm C. J.. Nadeau G. F„ U. S. Patent 2, 063, 324, Dec. 8 (1936).
18. 3 и н к о в Е. И., Дамюшкевский Я. Л., Рейн штейн В., X о-мяковский Г. М., Ж- прикл. химии, 9, 1997 (1936).
19. К i 1 р i S., Suomen Kemistilehti, 11В, 7 (1938).
20. Stenger V. A., Shrader S. A., Beshgetoor A. W., Ind. Eng. Chem., Anal. Ed., 11, 121 (1939).
21. К i 1 p i S., Suomen Kemistilehti, 13B, 19 (1940).
22. T о e n n i e s G., К о 1 b J. J., J. Biol. Chem., 144, 219 (1942).
23. W i n t e г i n g h a m F. P. W., J. Soc. Chem. Ind., London, 61, 187 (1942).
24. Shupe I. S., J. Assoc. Offic. Agr. Chem., 26, 249 (1943).
25. C h i s h о 1 m R. D., К о b 1 i t s k у L., Ind. Eng. Chem., Anal. Ed., 16, 538 (1944).
26. Ingram G., Analyst, 69, 363 (1944).
27. Vais O., Chem. Listy, 38, 15 (1944).
28. Lewis S. E., J. Soc. Chem. Ind., London, 64, 57 (1945).
29. В a u e r S. T., Oil and Soap, 23, 1 (1946).
30. Marron T. U., S c h i f f e r 1 i J., Ind. Eng. Chem., Anal. Ed., 18, 49 (1946).
31. Pesez M., Ann. pharm. franc., 4, 98 (1946).
32. S t a g g H. E., Analyst, 71, 557 (1946).
33. S h i г a e f f D. A., Proc. Am. Assoc. Text. Chem. Colorists 313 (1947).
34. Бородкин В. Ф., Малькова Т. В., Ж. аналит. химии, 3, 186 (1948).
35. К а р р е 1 m е i е г С. Р. A., van G о о г W. R.. *Verfkroniek, 21, 136 0948). А.
36. К а р р е 1 m е i е г С. Р. A., van G о о г W. R., Anal. Chim. Acta, 2, 146 (1948).
146
г, „ _ „ 7 М Willemart R., Bull. soc. chim. France 479 (1948).
oo" с r, ; г я e f f D. A., Am. Dyestuff Reptr., 37, 411 (1948).
« c л n i я S. H anna J. G., Anal. Chem., 20, 1084 (1948).
39- ri1 hi net M, Chevron N., Bull. soc. chim. Beiges, 58, 324 (1949).
л?' SiefkU W, Ann., 562, 99 (1949).
^lomon G., U 1 t ё e A. J., Rec. trav. chim., 69, 95 (1950).
io v я n a es G Lipmanis M., Kim. Inst. Z. Raksti, Latvijas PSR Zinatnu Akad. Vestis, 1, 78 (1950).
ад Winteringham F. P. W., Bridges R. G., Harrison A., J. Sci.
' Food Agr., 1, 185 (1950).
45 SieeiaS., Hanna J. G., Anal. Chem., 23, 1717 (1951).
4K StOnel H.. v. Segesser A., Helv. Chim. Acta, 34, 1362 (1951).
47 Si nclair W. B„ Crandall P. R., J. Econ. Entomol., 45, 80 (1952).
43 Спрысков А. А., Караваев Б. И., Ж- общей химии, 22, 1620 (1952).
49 Will i amson A. G., Analyst, 77, 372 (1952).
50 H о gs e t t J. N., К а с у H. W., Johnson J. B., Anal. Chem., 25, 1207 ’ (1953).
51. P a r r a v a n о G., Chim. anal., 35, 13 (1953).
52. Sen j u R., Bull. Chem. Soc., Japan, 26, 143, 148 (1953).
53. S i g g i a S., Segal E., Anal. Chem., 25, 830 (1953).
54. C a p i t a n i С., I m p e r i a 1 e P., Chim. e Ind., Milan, 36, 606 (1954).
55. К i 1 c h 1 e r H., Osterr. Lederztg., Festivalnr., A 17 (1954).
56. Pesez M., Bull. soc. chim. France, 1237 (1954).
57. J о h n s о n J. B., Funk G. L., Anal. Chem., 27, 1464 (1955).
58. S e z e r a t A., Ann. pharm. franc., 13, 516 (1955).
59. 3 а в a p о в Г. В., Зав. лаб., 21, 791 (1955).
60. Cali L. J., Loveland J. W., Anal. Chem., 28, 224 (1956).
61. С r i t c h f i e 1 d F. E., Funk G. L., Johnson J. B., Anal. Chem., 28,
76 (1956).
62.
63.
64.
65.
66.
67.
68.
69.
70.
71.
72.
73.
74
75.
76.
77.
78.
79.
80.
81.
82.
С г i t c h f i e 1 d F. E., Johnson J. B., Anal. Chem., 28, 430 (1956). Спрысков А. А., Старков С. П., Ж- общей химии, 26, 2607 (1956). Stahl C. R„ S i g g i a S., Anal. Chem., 28, 1971 (1956).
В г u s s D. B., W у 1 d G. E. A., Peters E. D., Anal. Chem., 29 807 (1957).
E 1 1 e r i n g t о n T., Nicholls J. J., Analyst, 82, 233 (1957).
Лиц К. В., Пилевская А. И., Коровкина М. И., Авт. свид. СССР, 106, 985, август 25 (1957).
Baldwin W. Н., Н i g g i n s С. E., Anal. Chem., 30, 446 (1958). Damm W„ Noll K-, Kolloid. Z., 158, 97 (1958).
пост0'ew'ec'fa J"’ Jaworska J., Chem. Anal. (Warsaw), 3, 163 (1958).
Ротоуаёек J., Chem. Listy, 52, 1912 (1958).
Roth H., Mikrochim. Acta, 766 (1958).
n f ? Г T ° в M' П., Преображенская E. А., РицО. В., Ов ч a -18 (1959) ° ° ’ C T ° P и н с к и й Л. И., Маслобойне-жировая пром., 25, Рт W wN ? 1 I К” Krauss W., Farbe u. Lack, 65, 17 (1959).
Ur а К" TWTana m?LShir T- Yoshino M„ Komiya S., Котл J a* K-> J- Japan Oil Chem. Soc., 8, 279 (1959)
₽a tc h о гл i'k AM apT‘ S" Microchem- 3, 507 (1959).
Петр о в a JiV’h n° g 0 z 1 n s £ i S. E„ Anal. Chem., 31, 985 (1959). химищ 14, 347’(1959). K ° B a E- H., Скворцова А. Б., Ж- аналит. (1959)* VeC F 1 e k d"' Collection Czechoslov. Chem. Communs., 24, 3643 Ж* аиалитЬ химией, ЗД^ЭбЭ) ° в a № M- ° б т e м п e p а н с к а я С. И., Fran ch? г НЪ Fharm‘ and Pharmacol., 11, 400 (1959).
G., P e 1 1 e r a n о C., Ann. Chim. (Rome), 50, 134 (I960).
147
83. M a г о s L., М о 1 n а г - Р е г 1 I., S с h u 1 е к Е., Acta Chim. Acad Sci Hung., 24, 213 (1960).
84. Marvillet L, Tranchan t J., Mem. poudres, 42, 261 (1960).
85. N e m о t о M., Yukagaku, 9, 65 (1960).
86. T e p e н т ь e в А. П., Обтемперанская С. И., Бузлано-в a M. M., Власова T. E., Вестник Моск, уи-та, серия хим., П, № 4 71 (1960). ' ' ’
87. Be гс к В., Can. Dept. Agr. Publ. 1101 (1961).
88. Литвиненко Л. М., Александрова Д. М., Нападайло В. Г. Ж- аналит. химии, 16, 226 (1961).
89. М а г v i 1 1 е t L., Tranchant, J,, Chim. anal., 43, 169 (1961).
90. 6 m b б 1 у C., D e r z s i E., Z. anal. Chem., 183, 272 (1961).
91. Patchornik A., Ehrlich-Rogozinski S., Anal. Chem., 33 803 (1961).
92. Терентьев А. П., Бузланова M. И., Обтемперанская С. И., Ж- аналит. химии, 16, 743 (1961).
93. C u n d i f f R. H., M a r k u n a s P. C., Anal. Chem., 33, 1028 (1961).
94. Dreher B., Farbe u. Lack, 67, 703 (1961).
95. Емелин E. А., Свистунова Г. П., Зав. лаб., 27, 971 (1961).
96. I z a w a Y., Tokumasu К-, Kimura W., J. Jap. Oil Chem. Soc., 10, 205 (1961).
97. Подшибякина К- Д., Текстильная пром., 21, № 3, 63 (1961).
98. С т р о н г и н Г. М., Бодрова А. Н., Смирнов В. И., Вестник техн.
и экономия, ииформ., научно-исслед. ин-т технико-экономич. исследований гос.
комитета Совета министров СССР по химии, № 5, 30 (1961).
99. W г о n s k i М., Chem. Anal. (Warsaw), 6, 865 (1961).
100. F г a n с h i G., F r a n c h i R. R., Boll. chim. farm., 101, 127 (1962).
101. V e n к a t a r a g h a v a n R., Rao C. N. R., Chemist—Analyst, 51, 48 (1962).
102. Franc hi G., Francchi R. R., Congr. Sci. Farm., Conf. Commun., 21° Pisa 1961, 532 (1962).
103. К i c i a к S., Chem. Anal. (Warsaw), 7, 847 (1962).
104. Скворцова А. Б., П e т p о в а Л. H., Новикова E. H., Ж- аналит. химии, 17, 896 (1962).
105. Терентьев А. П., Бузланова М. И., Обтемперанская С. И., В о л о д з ь к о В. Е., Вестник моек, ун-та, серия хим., 83 (1962).
106. Терентьев А. П., Обтемперанская С. И., Бузланова М. Т., Власова Т. Е., Ж- аналит. химии, 17, 900 (1962).
107. Беспятов М. А., Липова Н. Ф., Дзюба Л. Я., Овчаренко В. Е., Маслобойно-жировая пром., 29, 29 (1963).
108. Емелин Е. А., Смыслова Н. Ф., Ц а р ф и н Я- А., Зав. лаб., 29,
1169 (1963).
109. Л я н д е Ю. И., Черкасски
110. Reed D. Н., Critchfield
571 (1963).
111. Терентьев А. П., Т у б и н а
112. Терентьев А. П., Т у б и н а
й А. А., Зав. лаб., 29, 1050 (1963).
F. Е., Elder D. К-, Anal. Chem., 35,
И. С., Ж- аналит. химии, 18, 113 (1963).
i И. С., Ж- аналит. химии, 18, 880 (1963).
7. АММИАК И АММОНИЕВЫЕ СОЛИ
Реагент. Большей частью применяют водные растворы аммиака, хлорида и сульфата аммония.
Реакции, титруемые вещества и соответствующая обработка. Используются три принципиально отличающихся друг от друга типа реакций.
1. Конденсация, например при определении формальдегида:
6НСНО + 4NH3 -> (CH2)6N4 + 6Н2О
148
В этом случае после завершения реакции, обычно протекающей в течение 1 «, содержание связанного аммиака определяют:
1) титрованием его избытка;
2) титрованием избытка щелочи, используемой в сочетании с аммониевой солью;
3) титрованием кислоты, освобождаемой из нейтральной аммониевой соли.
В одном случае образующийся гексаметилентетрамин был определен путем осаждения его пикрата.
2. Присоединение, например при определении аллилизотиоцианата: C3H6N = С = S + NH3 -» C3HbNHCSNH2
Тиозинамин (аллилтиомочевину) определяют титрованием раствором иода или йодатом или обрабатывают раствором серебра (1) — прямым или обратным титрованием:
C3H6NHCSNH2 C3H5NHC (SH) nh
C3H6NHC (SH) NH -I- Ag+ -» C3H5NHC (SAg) NH + H+
Bo многих случаях вначале добавляют заведомый избыток серебряной соли с аммиаком, две стадии реакции при этом протекают одновременно [см. «Соединения серебра (1)»].
Имеется много ссылок на этот способ определения, в особенности в старой литературе; в данном разделе приводится небольшое количество ссылок на работы такого рода.
3. Реакции ионного обмена, например при определении мочевой кислоты путем осаждения ее в виде нерастворимой соли. В ряде случаев, когда кислота регенерируется в кислом растворе, необходимо ее предварительно отделять и затем определять титрованием окислителями типа иода или перманганата.
В табл. 15 приведено только по одному примеру каждой из следующих реакций.
4. Образование амида при определении лауриновой кислоты в лаурилхлориде:
RCOC1 -f- RCOOH + 3NH3 RCONH2 + RCOONH4 + NH4C1
После подкисления амид и соль карбоновой кислоты экстрагируют органическим растворителем и кислоту оттитровывают щелочью.
5. Замещение атомов галогена, например в ДДТ:
RC1 + 2NH3 -» RNH2 + NH+ + Cl-
Выделившиеся Cl “-ионы определяют аргентометрически.
' 1 еакция замеЩения солей щелочных металлов слабых органических кислот. Например:
RCOOK + NH^ RCOOH + К+ 4- NH3 Образующийся аммиак отгоняют и затем титруют.
обр.? ювянир2ИЗ 0Са>кденньНс солей Рейнеке, сопровождающийся лонках Выпрп110ЦИаНаТаис^ДР0Лиз пРовоДЯт в ионообменных ко-делившуюся HSCN оттитровывают.
149
Таблица 15. Примеры использования гидроокиси аммония и аммониевых солей
п/п Титруемое вещество Реагент и условия титрования Соответствующая обработка и конечная стадия титрования Литература
1 Муравьиный альдегид (см. Ns 4, 6, 8, 9, 13, 15, 16, 21) NН4ОН; до 24 ч (найдено, что достаточно 1 «) Избыток реагента оттитровывают H2SO4 в присутствии розоловой кислоты 1, 8
2 Мочевая кислота (см. №7, И, 17, 20) в мочевине Избыток NH4C1; 2 ч при частом помешивании Образовавшуюся нерастворимую соль помещают в воду; мочевую кислоту осаждают и определяют обычным способом, например титрованием перманганатом (см. Том I, «Перманганат калия», литература 7) 2
3 Нейтральные соли карбоновых кислот NH4C1; вода Аммиак отгоняют в НС1, избыток которой оттитровывают щелочью в присутствии метилового оранжевого 3
4 Муравьиный альдегид (см. № 1) NH4C1; измеренный избыток NaOH; 30 мин Титруют кислотой в присутствии розоловой кислоты 4
5 Аллилизотиоцианат (см. № 10, 12, 14, 22, 24, 25, 26) Аммиак; избыток AgNO3; 24 ч при комнатной температуре HNO3; избыток Ag* оттитровывают тиоцианатом в присутствии Fein 5
6 Муравьиный альдегид (см. № 1) NH4C1 или (NH4)2 SO4 Титруют щелочью в присутствии лакмуса 6
7 Мочевая кислота (см. № 2) NH4OH—NH4C1; 15 мин Нерастворимую в воде соль растворяют в уксусной кислоте; добавляют Na2B4O,—KHCOg и титруют иодом (см. Том I, «Иод», литература 15) 7
8 Муравьиный альдегид (см. Ns 1) NH4OH; 30 мин Избыток NHS удаляют нагреванием и образовавшийся гексаметилентетрамин осаждаю! пикриновой кислотой в виде пикрата, определяемого обычным путем (см. «Нитрофенолы», литература 8) 9
0 Муравьиный альдегид (см. № 1) (Критикуется метод, описанный выше1, —см. № 4) 10
10 Аллилизотиоциават (см. № 5) в горчице Перегоняют в NH4OH H2SO4; иод, избыток которого оттитровывают тиосульфатом (см. «Реагенты, содержащие иод», литература 74) 11
11 Мочевая кислота (микрометод) (см. № 2) (Метод описан выше7 — см. № 7) Как описано выше ’, — см. № 7, но с NaHCOg вместо Na2B4O,—КНС03 (см. Том I, «Иод», литература 27 12
150
Продолжение
№ п/п 12 13 14 15 16 17 18 19 20 21 22 23 Титруемое вещество Реагент и условия титрования Соответствующая обработка и конечная стадия титрования Литература
Аллилизотиоцианат (см. № 5) Муравьиный альдегид (см. № 1) Аллилизотиоцианат (см. № 5) в горчичном масле Муравьиный альдегид (см. № 1) Муравьиный альдегид (см. № 1) в присутствии СН3СНО Мочевая кислота (см. № 2) и ее соли Свободная лауриновая кислота в лауро-илхлориде ДДТ в растениях и других материалах Мочевая кислота (см. № 2) в крови Муравьиный альдегид (см. № 1) Аллил изотиоцианат (см. № 5) Комплекс хлорпромазина и соли Рей-неке, осаждаемый при определении основания NH4OH; 15 мин Нейтрализованный NH4C1 и избыток NaOH NH4OH — спирт; нагревают 10 мин NH4OH; дают по- стоять несколько минут (NH4)2SO4; 15 мин Соли аммония 6%-ный раствор аммиака; 20 мин Экстракт; бензол; NH3 в метаноле; 16 ч при 45° С Соли аммония Нейтральный раствор; NH4C1; избыток NaOH NH^OH в этаноле; 10 мин при 50° С, затем 10 мин при 70° С В среде ацетон — вода; NH^OH; 10 мин при 100° С Фильтруют, добавляют H2SO4 и избыток иода; через 15 мин добавляют бензол и титруют тиосульфатом Титруют кислотой в присутствии бромфенолового голубого KBr, НС1 и АиВг3 нагревают до 45° С и титруют броматом до желтого окрашивания (см. Том I, «Бромат калия», литература 40) Избыток аммиака отгоняют в стандартный раствор H2SO4, избыток которой оттитровывают щелочью Титруют NaOH в присутствии розоловой кислоты Выпавший осадок растворяют в боратной буферной смеси и титруют перманганатом Добавляют НО в присутствии метилового оранжевого; амид и кислоту экстрагируют смесью эфир — этанол и титруют NaOH в присутствии фенолфталеина Выделившиеся СГ-ионы определяют аргентометрически; избыток Ag+ оттитровывают тиоцианатом Выделившийся осадок аммониевой соли мочевой кислоты оттитровывают иодом Титруют НС1 в присутствии метилового красного HCI; титруют йодатом потенциометрически (см. Том I, «Иодат калия», литература 50) Пропускают через иоио-обменник; образуется HSCN, которую оттитровывают щелочью 13 14 15 16 17 18 19 20 21 22 23 24
151
Продолжение
№ п/п Титруемое вещество Реагент и условия титрования Соответствующая обработка и конечная стадия титрования Лите рату Ра
24 Аллилизотиоцианат (см. № 5) NH4OH в этаноле; нагревают 20 мин HNO3 и AgNO3;. избыток Ag+-HOHOB после фильтрации раствора титруют тиоцианатом в присутствии Fe'n 25
25 Аллилизотиоцианат (см. № 5) Водный раствор NH3; 10 мин при 40° С NH4OH—NH4NO3 и титруют AgNO3 амперо- 26
26 Аллилизотиоцианат (см. № 5) в горчичных семенах и полупродуктах из них Перегоняют в раствор NH3 AgNO3; 1 ч при 80° С; фильтруют; фильтрат титруют тиоцианатом (см. «Соединения серебра (1)», литература 184) 27
ЛИТЕРАТУРА
1. Legler L., Вег., 16, 1333 (1883).
2. Hopkins F. G., Chemical News, 66, 106 (1892); Proc. Roy. Soc., 52, 96 (1892)
3. Me I 1 h i п e у P., J. Am. Chem. Soc., 16, 408 (1894).
4. Smith С. E., Am. J. Pharm., 86 (1898).
5. G a d a m e r J., Arch. Pharm., 237, 110, 372 (1899).
6. Schiff H., Chem.-Ztg., 27, 14 (1903).
7. R onchese A., J. pharm. chim., (6), 23, 336 (1906).
8. L e g 1 e r L., Z. anal. Chem., 44, 442 (1909).
9. К о 1 1 о C., Lascar О., Bull. soc. chim. Romania, 3, 3 (1921).
10 Mach F., Herrmann R., Z. anal. Chem., 62, 104 (1923).
11. Moivillez F., Meesemaecker R., J. pharm. chim., 30, 236 (1924)
12. D a ne t R., J. pharm. chim. (8), 6, 405 (1927).
13. Meesemaecker R., Boivin J., J. pharm. chim. (8), II, 478 (1930)
14. Biichi J., Pharm. Acta Helv., 6, 1 (1931).
15 M a d i s V., Pharmacia (Estonia), 18, 252 (1939).
16. Fo s c h i n i A., T a 1 e n t i M., Z. anal. Chem., 118, 94 (1939).
17. C a s t i g 1 1 о n i A., Z. anal. Chem., 119, 287 (1940).
18. M a 1 h a d a, Arquiv biol. (San Paolo), 27, 91 (1943).
19. А с к 1 e у R. R., T e s о г о G. C., Ind. Eng. Chem., Anal. Ed., 18, 444 (1946)
20. Baier W. E., Edmonds E. J., Wilson C. W., Elliot M. 11 Gunther F. A., Science, 104, 376 (1946).
21. D о b r e v a N., Ann. univ. Sofia, Fasc. med., 27, 801 (1947—8).
22. C a s i n i A., Ann. chim. applicata, 39, 600 (1949).
23. В e г к a A., Z у fc a J., Pharmazie, 13, 88 (1958).
24. H о w о г к a K-, Pharm. Zentralhalle, 97, 374 (1958).
25. F ti r s t W., P о e t h к e W., Pharm. Zentralhalle, 99, 674 (1960).
26. Fiirst W., Poe the W., Pharm. Zentralhalle, 100, 71 (1961). I
27. Керзн ер И. Л., Ершова M. С., Маслобойно-жировая пром., 27, № И 41 (1961).
8. АНГИДРИДЫ
Здесь рассматриваются только те ангидриды, ангидридная группа которых реагирует с определяемым компонентом. Например, приме нение малеинового ангидрида при определении сопряженных олефи
152
nR по методу присоединения по Дильсу—Альдеру здесь не приво-а рассматривается в разделе под названием этого реагента. д р*’. ,нт в 30% рассматриваемых случаев применяется уксусной а шидрчд Следующее место занимает „ фталевый ангидрид. Из других соединений применяют пропионовый, бензойный, 3-питро-Ат ыевый и пиромилптовый ангидриды.
Реакции и титруемые вещества. 1. Образование эфиров при определении гидроксилсодержащнх соединений, к которым относятся спирты, фенолы, полиспирты (гликоли и сахара и т. п.) и такие продукты, как эфирные масла, таннины и лигнины:
R'OH + (RCO)2O RCOOR’ + RCOOH
Термин «определение гидроксильных групп» иногда заменяют термином «определение ацетильного числа (индекса)».
Третичные спирты и фенолы трудно вступают в реакцию с ангидридами, и поэтому было затрачено много усилий, направленных на то, чтобы изыскать оптимальные условия их реакций с этими веществами. Фталевый ангидрид не реагирует с фенолами, и поэтому он успешно используется для определения спиртов в присутствии фенолов. Определение гидроксильных групп оксимов методом ацетилирования может быть также отнесено к этому типу реакций.
2. Образование амидов при определении первичных и вторичных амино-групп:
R'NH2 +- (RCO)2O RCONHR' + RCOOH
Эта реакция успешно применяется для ацетилирования аминогрупп в присутствии третичных аминов, которые не реагируют с уксусным ангидридом. В одном случае122 амины ацетилируют таким способом для того, чтобы устранить их влияние при определении олефинов.
3. В табл. 16 даны два примера ацетилирования SH-rpynn58-132 и один — дегидратации спирта в соответствующий олефин122.
Условия реакции. Обычно реакции проводят в растворе пиридина или другого третичного основания, а также в среде других неацети-лирующихся растворителей: ксилоле, этилацетате или ацетонитриле, или даже без растворителя. Очень часто добавляют ацетат гщтрия, особенно в тех случаях, когда не используют пиридин. Полная этерификация полиспиртов достигается при повышенной температур и [лительном нагревании, но при слишком высокой температуре Ин^-РЫе пРиР°дные вещества вступают в побочные реакции. Англ™. Р^акцни протекают в присутствии катализаторов, подобных сернои хлористоводородной и хлорной кислотам.
депжянпр сработка и конечная стадия титрования. 1. Со-ний оппрп?па’ °®Разованных из гидроксилсодержащих соедине-пос ••nvXiin HIST ОМЬ1лением измеренным количеством щелочи й лочи»). М °°Ратньш титрованием ее избытка (см. раздел «Ще-
153
Таблица 16. Примеры использования ангидридов
Ns п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Лите* рату* ра
1 Анилин; N-метил-анилин в присутствии N-диметиланилина Уксусный ангидрид; 30 мин при комнатной температуре Вода; титруют NaOH в присутствии фенолфталеина /
2 Алкиланилины, например моноэтил-анилин Уксусный анги- дрид—ксилол (1 : 14); 1 ч Вода; тируют Ва (ОН)2 в присутствии фенолфталеина 2
3 Цитронелловое масло (см. № 122) — определение гидроксильных групп (см. Кв 7) Фталевый анги- дрид—бензол; нагревают 2 ч в колбе, снабженной обратным холодильником Избыток КОН, который оттитровывают H2SO 3
4 Спирты (см. Кв 5,6,13, 28, 30, 36, 37, 44, 45, 58, 60, 64, 68, 73, 78, 88, 92, 95, 96, 100, 106, 111, 113, 115, 132, 135, 137, 146, 147, 149, 156), фенолы (см. Кв 5, 11, 16, 28, 30, 43, 58, 90, 91, 94, 99, 126, 146, 149, 156) Уксусный анги- дрид—пиридин (1 : 7); 15 мин при 100° С Вода; титруют стандартным раствором NaOH в присутствии фенолфталеина 4
5 Спирты (см. Кв 4); фенолы (см. № 4) (определение эквивалентного веса) Бензойный ангидрид; нагревают 2 ч при 100° С или выше Диэтиловый эфир, бензол или хлороформ и вода; титруют К2СО3 в присутствии фенолфталеина 5
6 Терпеновые третичные спирты (см. Кв 9) Уксусный анги- дрид—ацетат натрия—терпентинное масло; нагревают 3 ч в колбе, снабженной обратным холодильником Полученный эфир выделяют и определяют методом омыления 6
7 Г идрокси льные группы (см. № 3, 8, 10, 11, 14, 16—18, 20, 22, 23, 26—33, 35, 39, 42, 45, 47, 51, 54, 58, 62, 68, 70, 72, 79, 82, 83, 87, 89, 93, 94, 98, 107, 108, 109, 128, 133, 146, 148, 149, 151, 155 Уксусный ангидрид Уксусная кислота; избыток ангидрида отгоняют; оставшийся эфир определяют методом омыления 7
8 Гидроксильные группы в эфирных маслах (см. № 7) Уксусный анги- дрид—^муравьиная кислота (2 : 1); 72— 96 ч при комнатной температуре Эфирное масло выделяют и определяют методом омыления избытком КОН (см. «Щелочи», литература 36) 8
154
Продолжение
№ п/п
9
10
11
12
13
14
15
16
17
Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
Терпеновые третичные спирты (см. № 6) Эфирные масла (см. № 22, 26, 28, 48, 51, 58, 72, 95, 108, 112, 115, 143, 149)—определение гидроксильных групп (см. № 7) в гераниоле (см. № 111, 115, 122) и дигидрогер аниоле (цитронеллол) (см. № 123, 124) Гидроксильные группы (см. № 7), например в сахарозах, фенолах (см. Я» 4) Масла (см. № 103)— определение содержания ацетилирующихся компонентов Спирты (см. № 4) Гидроксильные группы (см. № 7) например в жирах Этанол (см. № 34, 61, 101) в промышленных газах после адсорбции его активированным углем Гидроксильные группы (см. № 7), например в фенолах (см. № 4) Гидроксильные группы (см. № 7), например в ванилине, 0-на-фтоле (см. № 43), касторовом масле Уксусный анги- дрид—ацетат натрия—л-ксилол; нагревают 9 ч в колбе, снабженной обратным холодильником Фталевый анги- дрид—пиридин; оставляют на ночь при комнатной температуре (применяют также метод, описанный выше4 , — см. № 4) Уксусный анги- дрид—пиридин (1:2); разные условия: 16—120 ч при 37— 90° С Уксусный анги- дрид—ацетат натрия; нагревают 2 ч в колбе, снабженной обратным холодильником Уксусный анги- дрид—пиридин (1:2); добавляют 5% аце-тилхлорида; нагревают 1—4 ч Уксусный ангидрид; 2 ч при 140° С Метод описан вь [Метод описан выше4 уксусного ангидрид, ацетил- и бензоилхлс (активные)», Уксусный ангидрид—пиридин (1 : 3), 15 мин при .100°С или 24 ч при комнатной температуре Полученный эфир выделяют и определяют методом омыления спиртовым раствором NaOH (см. «Щелочи», литература 38) Вода; титруют щелочью Лед—вода; титруют NaOH в присутствии фенолфталеина Эфирное масло выделяют и определяют методом омыления (см. «Щелочи», литература 50) Вода; титруют NaOH в присутствии фенолфталеина Избыток реагента оттитровывают анилином термометрически (см. Том I, «Амины и гетероциклические основания», литература 3) ;ше4 — см. № 4) — см. № 4; вместо также используют рид; см. «Галогениды литература б] Лед—вода; титруют щелочью 9 10 11 12 13, 14 15 16 17 18
155
Продолжение
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
18 Гидроксильные группы в жирах (см. № 7, 20, 24, 27, 31) Уксусный ангидрид—пиридин (1 : 2), нагревают 30—60 мин Титруют NaOH в присутствии фенолфталеина 19
19 Бензилцеллюлоза Уксусный ангидрид — несколько капель концентрированной H2SO4; нагревают 30—45 мин в колбе, снабженной обратным холодильником Вода; образующийся бензилацетат отгоняют и определяют методом омыления избытком NaOH (см. «Щелочи», литература 76) 20
20 Гидроксильные группы (см. Я» 7), например в жирах (см. № 18) Уксусный ангидрид; 1—2 ч при 120— 130° С в запаянной трубке Вода; титруют КОН в присутствии фенолфталеина 21 1
21 Сахара (см. № 33, 62, 113); углеводы (см. № 30, 58) Уксусный ангидр ид—ацетат натрия—ксилол (или толуол) Образующийся эфир выделяют и определяют методом омыления (см. «Щелочи», литература 79) 22
22 Гидроксильные группы (см. № 7) в эфирных маслах (см. № 10) Фталевый ангидрид—пиридин (1:4); 18 ч при комнатной температуре Вода; титруют КОН в присутствии фенолфталеина 23
23 Гидроксильные группы (см. № 7) Уксусный ангидрид—пиридин (1 : 2); 1 ч при 100° С Вода; титруют КОН в присутствии фенолфталеина 24 1
24 Гидроксильные группы в жирах (см. № 18) Уксусный ангидрид; в атмосфере азота Образующийся эфир экстрагируют петро-лейным эфиром и определяют методом омыления спиртовым раствором КОН (см. «Щелочи», литература 87) 25
25 Ментол (см. № 46, 48, 50, 52, 53, 63, 65, 84) Уксусный ангидрид—ацетат натрия; нагревают 1 ч в колбе, снабженной обратным холодильником Образующийся эфир выделяют и определяют методом омыления NaOH (см. «Щелочи», литература 90) 26 1
26 Гидроксильные группы (см. № 7) в эфирных маслах (см. № 10) Уксусный ан гидр ид—фосфор-ная кислота; 15 мин выше 50° С Вода; нагревают 10 мин в колбе, снабженной обратным холодильником, до разложения избытка ангидрида; эфир выделяют и определяют методом омыления 27
166
Продолжение
№ Ц 'll Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
27 28 29 30 31 32 33 Гидроксильные группы (см. № 7) в жирах (см. Xs 18), восках и стеринах (см. № 58) и т. п. Первичные и вторичные спирты (см. № 4); фенолы (см. № 4); гидроксильные группы (см. № 7) в эфирных маслах (см. № 10); амины (см. № 39, 49, 59, 77, 85, 93, 96, 103, 110, 119, 121, 126, 129, 130, 133, 140, 142, 160) Гидроксильные группы (см. № 7) Гидроксильные группы (см. № 7), например в оксикислотах (см. № 31, 32, 35), углеводах (см. № 21), спиртах (см. № 4), фенолах (см. 4) Гидроксильные группы (см. № 7) в жирах (см. № 18), оксикислотах (см. № 30) и т. п. I идроксильные груп-ni (см. № 7) в жир-। х оксикислотах (см. № 30) I идроксильные группа (см. ;<» 7) в саха. Г < (см. № 21), фла-ЕОНСХЛи* и т. п. Уксусный ангидрид—пиридин (1 : 7); 45—50 мин при 100° С или 24 ч или более при комнатной температуре Двух трехкратный избыток смеси уксусный ангидрид—пиридин (1 : 2); 30— 60 мин (Найдено, что бензойный ангидрид менее пригоден) Уксусный ангидрид—ацетонитрил или эфир—ацетонитрил; 2,4-дини-тробензол сульфокислота; 20 мин (с ацетонитрилом) или 1 день и более (с эфиром) Уксусный ангидрид—пиридин, приблизительно 20% для сахаров и 12% для фенолов, жиров и т. п. Нагревают до кипения 1 мин в колбе, снабженной обратным холодильником Уксусный ангидрид—пиридин (1 : 7); 75 мин при 100° С У ксусный ангидрид—пиридин (5 н.); 7 ч при 100° С Уксусный ангидрид—пиридин; 30 мин при 100° С Горячая вода и бутанол; титруют спиртовым раствором щелочи Вода; кипятят 15 мин и титруют спиртовым раствором КОН в присутствии фенолфталеина Вода—ацетонитрил; титруют метаноловым раствором CH(ONa в присутствии тимолового голубого Вода; титруют NaOH в присутствии фенолфталеина Вода; титруют щелочью Уксусную кислоту и ангидрид перегоняют при пониженном давлении в стандартный раствор КОН, затем его избыток оттитровывают НС1 Титруют NaOH в присутствии фенолфталеина 28 29 32 33 34 35 36
157
Продолжение
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка н конечная стадия титрования •Пите рату Ра
34 Этанол (см. № 15) Уксусный ангидрид; 1 ч при 100° С в запаянной трубке Вода; нагревают 30 мин при 50° С до разложения избытка ангидрида. Затем этилацетат определяют методом омыления избытком КОН (см. «Щелочи», литература 37
35 Гидроксильные группы (см. № 7) в алифатических оксикислотах (см. № 30) Уксусный ангидрид—пиридин; нагревают 7 ч в колбе, снабженной обратным холодильником 100) Вода; титруют NaOH в присутствии фенолфталеина 38
36 Первичные спирты (см. № 4) Фталевый ангидрид--бензол; 2 ч при 100° С Вода—пиридин; нагревают 10 мин, титруют КОН в присутствии фенолфталеина 39
37 Первичные и некоторые вторичные спирты (см. № 4) Фталевый ангидрид—пиридин, в двух-, четырехкратном количестве; 1 ч при комнатной Вода; титруют щелочью в присутствии фенол-фталена 40
38 Этиленгликоль (см. (№ 40, 41, 102); глицерин (см. № 40, 41, 57, 67, 86, 105) Уксусный ангидрид—пиридин (1 : 7); кипятят 15— 60 мин Вода; титруют NaOH в присутствии фенолфталеина 41
39 Гидроксильные (см. № 7) и аминные (см. № 28) группы в туберкулезных бациллах (микрометод) Уксусный ангидрид—пиридин (1 : 4); 1 чпри 100° С Титруют спиртовым раствором NaOH 42
40 Этиленгликоль (см. № 38) или глицерин (см. № 38) в табаке Уксусный а н гидрид— ацетат натрия; нагревают 90 мин в колбе, снабженной обратным холодильником КОН, избыток которого оттитровывают кислотой 43
41 42 Этиленгликоль (см. № 38); глицерин (см. № 38) Гидроксильные группы (см. № 7) Уксусный ангидрид—пиридин (12%), нагревают соответственно 10 или 60 мин в колбе, снабженной обратны холодильником Уксусный ангидрид—пиридин (1 : 7), нагревают 30 мин в колбе, снабженной обратным холодильником Титруют щелочью в присутствии крезолфта-леина Вода; титруют щелочью 44 45
158
Продолжение
П H
43
44
45
46
47
48
49
60
51
52
Титруемое вещество
Реагент и условия реакции
Соответствующая обработка и конечная стадия титрования
Литература
феНол (см. № 4); нафтол (см. № *')
Первичные спирты (см. № 4)
Гидроксильные группы (см. Я» 7), например в многоатомных спиртах (см. Я° 4) Ментол (см. № 25)
Гидроксильные группы (см. Я° 7) в гидрированном лигнине (см. Я» 94)
Ментол (см. Я° 25) в мятном масле (см.
Я° 10,50, 51, 53, 65)
Смеси первичных, вторичных и третичных аминов (см.
Я° 28)
Ментол (см. Я° 25) в мятном масле (см. Я° 48)
Гидроксильные группы (см. Я» 7) в эфирных маслах (см. Я« Ю), например в розмариновом, сандаловом, мятном (см Я» 48) ‘
Ментол (см. № 25) в смеси с камфорой
Бензойный ангидрид—пиридин (1 : 1); 1 ч при 100° С
Фталевый ангидрид—пиридин;
1 ч при 100° С
Уксусный ангидрид—пиридин (1 : 10); кипятят 3— 6 ч
Уксусный ангидрид—ацетат натрия; нагревают 2 ч в колбе, снабженной обратным холодильником Уксусный ангидрид—пиридин (1 : 7); 4 ч или ночь при 90—100° С
Уксусный ангидрид—пиридин (1 =2)
(Метод описан выше*
Уксусный ангидрид; 3 ч при 30° С
Уксусный ангидрид—ди-н-бу-тиловый эфир; нагревают 1 ч в колбе, снабженной обратным холодильником (Испытано несколько ше — см. Я» 4, наилучшим является в течение 60—90 мин
Уксусный ангидрид—пиридин (1 : 4); 30 мин при 100° С
Вода; нагревают 1 ч при 100° С; титруют КОН в присутствии фенолфталеина
Вода (гидролизуют 1 мин, чтобы избежать омыления эфира); титруют щелочью в присутствии фенолфталеина
Титруют щелочью
Вода; образующийся эфир выделяют и определяют методом омыления избытком КОН (см. «Щелочи», литература 129)
Титруют NaOH в присутствии фенолфталеина
Титруют NaOH
>2э — см. Я° 28) Нереагирующий с уксусным ангидридом третичный амин титруют стандартным раствором хлорной кислоты потенциометрически или в присутствии крезолового красного (см. Том I, «Хлорная кислота», литература 8) Нагревают 30 мин с водой; титруют КОН в присутствии фенолфталеина
методов, описанных вы-10, 44. Найдено, что метод ацетилирования смесью уксусный анги-
дрид—пиридин—ксилол)
Гидролизуют; титруют КОН в присутствии фенолфталеина
46
47
48
49
50
51
52
53
54
55
159
Продолжение
№ п/п Титруемое вещество Реагент н условия реакции Соответствующая обработка и конечная стадия титрования Литература
53 Ментол (см. № 25) в мятном масле (см. № 48) У ксусный ангидрид—ацетат натрия; кипятят 1 ч Вода; образующийся эфир выделяют и определяют методом омыления' (см. «Щелочи», литература 138) —- 56
54 Гидроксильные группы (см. № 7) в производных целлюлозы Уксусный ангидц ад—пиридин (1 : 19) в большом избытке; 24 ч при 75—80" С Титруют NaOH потенциометрически до pH 9 или в присутствии фенолфталеина 57
55 Не основный водород в аминокислотах, например — NH в триптофане или —SH в цистеине Уксусный ангидрид—уксусная кислота—хлорная кислота (основный водород дает соль хлорной кислоты и не ацетилируется) Избыток антраниловой кислоты, которая реагируете НСЮ4 и непрореагировавшим ангидридом; спустя 3 ч ее избыток оттитровывают уксуснокислым раствором НСЮ4 в присутствии кристаллического фиолетового 58
56 Глюкоза Уксусный ангидрид —пиридин 1(50%); кипятят 10мин Вода; титруют NaOH в присутствии фенолфталеина 59, 62
57 Глицерин (см. № 38) Уксусный ангидрид—пиридин (1 : 7), кипятят 15— 60 мин Гидролизуют и титруют щелочью 60
58 Гидроксильные группы (см. № 7), например в спиртах (см. № 4), фенолах (см. № 4), стеринах (см. № 27), углеводах (см. № 21), эфирных маслах (см. № 10) Уксусный ан гидр ид—пиридин (1 : 1); 24 ч при комнатной температуре в запаянной трубке Титруют щелочью
59 Первичные и вторичные амины (см. № 28) Уксусный ангидрид—пиридин; 30 мин при комнатной температуре, а затем 30 мин при 60° С (реагируют первичные амины) Избыток воды—Nal— пиридин; оттитровывают реактивом Фишера (см. «Вода», литература 9) 63
60 Спирты (см. № 4) Уксусный а н г и др ид—пиридин Титруют спиртовым раствором КОН 64
61 Зтанол (см. № 15) в смеси с водой, бензолом и эфиром (Метод описан выше 41 — см. № 38) 65
62 Гидроксильные группы (см. № 7) в сахарах (см. № 21) и глюкозидах Уксусный ангидрид—пиридин (1 : 12); 48 чпри комнатной температуре в запаянной трубке Титруют щелочью 66
160
Продолжение
№ п/п
63
64
65
66
67
68
69
70
6
Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
Ментол (см. № 25) в мятной эссенции У ксусный ангидрид—ацетат натрия; нагревают 2 ч в колбе, снабженной обратным холодильником Нейтрализуют и омы-ляют избытком КОН (см. «Щелочи», литература 170) 67
Первичные и вторичные спирты (см. № 4) Уксусный ангидрид—пиридин (1 : 3); 45 ч при 100° С Титруют спиртовым раствором NaOH потенциометрически или в присутствии смешанного индикатора, изменяющего окраску при pH 9,8 68
Ментол (см. № 25) в мятном масле (см. № 48) Уксусный ангидрид—пиридин (1 : 1); 48 ч при комнатной температуре Вода; титруют NaOH в присутствии фенолфталеина 69
Додециловый спирт (Метод описан выше 68 — см. № 64) 70
Глицерин (см. Ns 38) Уксусный ангидр ид—пир идин (1 : 6); 30—40 мин при 100е С. (Также исследовано влияние различных порций реагентной смеси и других растворителей) Вода; нагревают 1— 2 мин, добавляют бутанол и титруют КОН в присутствии фенолфталеина 71
Гидроксильные группы (см. № 7) в спиртах (см. Ns 4) и гликолях (см. № 113) Фталевый ангидрид—пиридин (10%); нагревают 1 ч при 100° С в запаянной трубке Титруют NaOH в присутствии фенолфталеина 72 ч
1, 2, 3, 4-Тетрагидро--Р-нафтол, экстрагированный из пропитанной ткани Уксусный ангидрид—пиридин (1 : 6); не менее 2 ч Титруют NaOH потенциометрически до pH 8,9 или в присутствии смешанного индикатора фенолфталеин—тимоловый синий 73
Гидроксильные группы (см. Ns 7) Уксусный ангидрид; нагревают 1 ч при 180° С в запаянной трубке Вода; кипятят и титруют NaOH в присутствии фенолфталеина 74
М. Р. ф_ Эшвор*
161
Продолжение
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
71 Линалоол (см. № 104) Уксусный ангидрид—хлоран-гидрид уксусной кислоты — N-диметил-анилин; 30 мин при комнатной температуре и 3 ч при 40° С Уксусный ангидрид—муравьиная кислота; 30 мин при 0° С и 72 ч при комнатной температуре Уксусный ангидр ид—ацетат натрия—ксилол; нагревают 9 ч в колбе, снабженной обратным холодильником Образующийся эфир выделяют и определяют методом омыления избытком щелочи (см. «Щелочи», литература 197) 75
72 Гидроксильные группы (см. № 7) в эфирных маслах (см. № 10) Уксусный ангидрид—пиридин (100 : 3); 1 ч при 100° С Титруют спиртовым раствором щелочи в присутствии тимолфталеина 76
73 Первичные и вторичные спирты (см. № 4) Уксусный а н гидр ид—п иридии (100 : 3); 15 мин при 100° С (для первичных аминов), 3 ч при 100° С или 15 мин при 140° С (для вторичных аминов) Титруют спиртовым раствором щелочи 77
74 Триметиленгликоль Уксусный ангидрид—пиридин (1 : 6); 30—40 мин при 100° С Вода—изобутанол; титруют КОН в присутствии фенолфталеина 78
75 Виниловый спирт (см № 76), содержащийся в поливинилацеталь-кеталевых смолах Уксусный ангидрид—пиридин Вода и дихлорэтан; титруют спиртовым раствором щелочи в присутствии фенолфталеина 79
76 Спирт (см. № 75) в виниловых эфирах и ацеталях Уксусный ангидр ид—пир идин (1 : 3); 45—60 мин при 100° С (фталевый ангидрид, если присутствуют альдегиды) Вода и бутанол; нагревают и титруют спиртовым раствором NaOH в присутствии крезоловый красный — тимоловый голубой или фенолфталеина (если используют фталевый ангидрид) Ю
77 Смеси первичных, вторичных и третичных аминов (см. № 28) (Метод описан выше 62 — см. № 49) Непрореагировавший третичный амин, титруют уксуснокислым раствором НС1О4 (см. Том I, «Хлорная кислота», литература 16) 81
162
Продолжение
№ п/п 78 79 80 81 82 83 84 85 Титруемое вещество Первичные и вторичные спирты (см. № 4) Гидроксильные группы (см. № 7) —ОСН2СН2ОН-груп-пы в оксиэтилцеллю-лозе (см. № 83) 9, Ю-Октадекандиол-дикарбоновая кислота Гидроксильные группы (см. № 7) Оксиэтилцеллюлоза (см. № 80) (определение эквивалентного веса по содержанию— ОН-групп (№ 7) Ментол (см. № 25) в листьях мяты Первичные, вторичные и третичные ами-Иы (см. № 28) Реагент и условия реакции З-Нитрофталевый ангидрид—бензол; нагревают 4 ч в колбе, снабженной обратным холодильником Уксусный ангидрид—пиридин (1 : 3); нагревают 2 ч в колбе, снабженной обратным холодильником Фталевый а нгидр ид—п иридии; 1 ч при комнатной температуре Уксусный ангидрид—ксилол (1 : 4); 1 ч при 100° С Уксусный ангидрид—диоксан; фторборная кислота (катализатор); 5 мин при 100° С Уксусный ангидрид—пиридин (1 : 20); при 75— 80° С; время реакции разное или уксусный ангидр ид—пир идин (1 : 1); 24—48 ч при 90° С Ксилол, добавляют смесь уксусный ангидрид—пиридин— ксилол (1:1: 10); 1 ч при 120° С Уксусный ангидрид; 15 мин при комнатной температуре Соответствующая обработка и конечная стадия титрования Титруют щелочью Вода и бутанол; титруют щелочью в присутствии крезоловый кр асный—тимоловый голубой Титруют NaOH Избыток ангидрида отгоняют с ксилолом; эфир определяют методом омыления избытком спиртового раствора кон Титруют NaOH в присутствии фенолфталеина Вода; титруют NaOH в присутствии фенолфталеина; эфир осаждают и определяют гидролизом избытком щелочи (см. «Щелочи», литерату- ра 247) Титруют NaOH в присутствии фенолфталеина Изопропанол—этиленгликоль; не реагирующий с уксусным ангидридом третичный амии титруют НС1 потенциометрически (см. «Хлористоводородная кислота», литература 25) Литература 82 83 84 85 86 87 88 89
163
Продолжение
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Л ите-рату-ра
86 Моноэфиры глицерина (см. № 38) Уксусный ангидрид—пиридин (15%); нагревают2 ч в колбе, снабженной обратным холодильником Вода; титруют NaOH в присутствии фенолфталеина 90
87 Гидроксильные группы (см. № 7) Уксусный ангидрид—сухой Na2SO4; нагревают 2 ч в колбе, снабженной обратным холодильником Вода; эфир экстрагируют петролейным эфиром и определяют методом омыления избытком КОН (см. «Щелочи», литература 271) 91 1
88 Спирты (см. № 4) Уксусный ангидрид—муравьиная кислота (2:1) Вода и пиридин; титруют спиртовым раствором NaOH 92
89 Гидроксильные группы (см. № 7) в присутствии аминов) Уксусный ангидрид—пиридин (1 : 3); 45 мин при 100° С Нейтрализуют; определяют эфир методом омыления избытком спиртового раствора КОН Вода и СС14; титруют NaOH в присутствии фенолфталеина 93
90 Фенолы (см. № 4) Уксусный ангидрид—пиридин (5 : 12); кипятят 5 мин при 118° С (некоторые более 1 ч) 95
91 Фенолы (см. № 4) (полумикрометод) Уксусный ангидрид—пиридин (1 : 10); 2 ч при 100° С Титруют КОН в присутствии фенолфталеина (i збыток ангидрида гидролизуют не более 3 мин, чтобы предотвратить распад фенольного эфира) 96
92 Первичные спирты (см. № 4) Уксусный ангидрид—пиридин (1 : 3); нагревают 1— 2 ч в колбе, снабженной обратным холодильником Вода; титруют щелочью в присутствии фенолфталеина 97
93 Спиртовые (см. № 7), фенольные и аминогруппы (см. № 28) в гидрированных продуктах угля (Метод описан выше 05 — см. № 90) 98
94 Гидроксильные группы (см. № 7) в танни-нах, лигнинах (см. № 47) и фенолах (см. № 4) Уксусный ангидрид—пиридин (1 : 3); 3—7 дней при комнатной температуре Вода и бутанол; при комнатной температуре (не при 70—100° С); титруют щелочью 99
95 Третичные спирты (см. № 4) в парфюмерных препаратах, например в эфирных маслах (см. № 10) Уксусный ангидрид—пиридин (3 : 1); нагревают 15—20 мин в колбе, снабженной обратным холодильником Вода; эфир отделяют и определяют методом омыления 100
164
Продолжение
Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
№ п/п Титруемое вещество
96 97 98 99 100 101 102 Первичные, вторичные и третичные спирты (см. № 4) и первичные и вторичные амины (см. № 28) Никотин — норникотин в табачных алкалоидах Гидроксильные группы (см. № 7) в полиэтиленгликолях Фенол (см. № 4) в метилметакрилате Первичные и вторичные спирты (см. № 4) Этанол (см. № 15) Этиленгликоль (см. № 38); метилцеллю-лоза Пропионовый ангидрид—уксусная кислота—п-толуолсуль-фокжжгса (катализатор); 2 ч при комнатной температуре или 30 мин при 100° С Трех хлористый углерод—бензол; уксусный ангидрид Пропионовый ангидрид—уксусная кислота—п-толуол-сулъфокислота (катализатор); оставляют при комнатной температуре или при 60° С Уксусный ангидрид—пиридин (1 : 1); 5 мин при 100° С Уксусный ангидрид—пиридин (1 : 10); 1 ч при 90— 100° С Уксусный ангидрид—пиридин (1 : 1); 2 ч при 100° С Уксусный ангидрид—ацетат натрия; нагревают 4,5—5 ч в колбе, снабженной обратным холодильником Избыток ангидрида определяют путем взаимодействия с анилином и последующим титрованием его избытка раствором НС1О4 (см. «Амины и гетероциклические основания», литера- тура 56) Непрореагировавший никотин титруют уксуснокислым раствором НС1О4 в присутствии кристаллического фиолетового (сумму обоих определяют при титровании без ацетилирования) (см. Том I, «Хлорная кислота», литература 106) Непрореагировавший ангидрид определяют путем взаимодействия с анилином, избыток которого затем оттитровывают НС1О4 (см. «Амины и гетероциклические основания», литература 58, Том 1, «Хлорная кислота», литература 124) Вода; титруют щелочью в присутствии крезоловый красный—тимоловый голубой Вода; титруют КОН в присутствии фенолфталеина Диэтиловый эфир уксусной кислоты отгоняют и определяют методом омыления избытком щелочи (см. «Щелочи», литература 333) Вода; нейтрализуют и эфир определяют методом омыления избытком NaOH (см. «Щелочи», литература 341) 101 102 103 104 105 106 107
165
Продолжение.
№ п/п
Титруемое вещество
Реагент и условия реакции
Соответствующая об работка и конечная стадия титрования
Л и Герату, ра
103
104
105
106
107
108
109
Амины (см. Ns 28) в продуктах нефти, неочищенном масле (см № 12), каменноугольном дегте и дистиллятах
Линалоол (полумикрометод) (см. № 71)
Глицерин (см. № 38) в медицинских препаратах
Спирты (см. № 4)
Гидроксильные группы (см. № 7)
Гидроксильные группы (см. № 7) в эфирных маслах (см. № 10)
Гидроксильные группы (см. № 7) в эпоксидных смолах
Уксусный ангидрид
Фталевый ангидрид
Уксусный ангидрид—ацетилхло-рид—N -диметилани-лин; 4 ч при 50° С
Уксусный ангидрид—ацетат натрия Фталевый ангидрид; нагревают 30—
120 мин в колбе, снабженной обратным холодильником
Уксусный ангидрид—пиридин;
24 ч
Уксусный ангидрид—диоксан (1:2) и несколько капель фосфорной кислоты; оставляют на 24 ч при комнатной температуре Испытано взаимодействие уксусного ангидрида со следующими реактивами: а) пиридин—НС1О4; нагревают 30 мин в колбе, снабженной обратным холодильником;
б) пиридин—НС1; иагре чают 30 мин в колбе, снабженной обратным холодильником;
в) уксусная кислота — небольшое количество H2SO4;
г) уксусная кислота—ацетат натрия— пиридин; 6 ч при комнатной температуре; д) уксусная кислота (2 : 1); 40—48 ч
Не реагирующие с ангидридом третичные амины титруют уксуснокислым раствором НСЮ4 потенциометрически Аналогичным путем титруют вторичные и третичные амины
Эфир выделяют и определяют методом омыления (см. «Щелочи», литература 344)
Кипятят с избытком раствора NaOH, который оттитровывают кислотой
Алкилгидрофталаты выделяют на целите 535 и титруют NaOH
Вода при 70—80° С; ацетон; титруют стандартным раствором NaOH Пиридин и вода; титруют стандартным раствором NaOH
Т итр уют р аствором
КОН в этаноле или метаноле
108
109
110
Ill
112
113
114
Нейтрализуют; добавляют H2SO4, уксусную кислоту отгоняют и титруют
166
Продолжение
Ав п/п Титруемос вещество Реагент п условия реакции Соответствующая обработка и конечная стадия титрования Л итература
но Амины (см. № 28) Уксусный ангидрид; нагревают в колбе, снабженной обратным холодильником Фталевый ангидрид Не реагирующие с ангидридом третичные амины титруют уксуснокислым раствором НС1О4 потенциометрически Как описано выше, титруют смесь непрореагировавших вторичных и третичных аминов (см. Том 1, «Хлорная кислота», литература 201) 115
111 Ароматические спирты (см. № 4), применяемые в парфюмерной промышленности, например бензиловый, фениловый спирты, гераниол (см. № 10) Уксусный ангидрид, ацетат натрия; ацетофенон (исследовано влияние ацетофенона при 80—140° С) 116
117
112
«Фосфорный ацетильный индекс» эфирных масел (см. № 10)
(Метод описан выше ,1'’ — см. № 108; основан на взаимодействии реагирующих веществ; 24 ч при комнатной температуре. Найдено, что данный метод приводит к более завышенным результатам, чем метод, основанный на применении смеси пиридин—уксусный ангидрид. Это объясняется тем, что происходит взаимодействие третичных спиртов, альдегидов, некото-
113
Первичные и вторичные спирты (№ 4); гликоли (см. № 68); (сахара (см. № 21)
рых олефиновых
Уксусный ангидрид—этилацетат или пиридин— НС 10 j не менее 5 мин при комнатной температуре
114
Гидроксильные группы в некоторых сырьевых материалах, применяемых для синтеза дифенолов
Уксусный ангидрид—пиридин (1 : 3); 45 мин при 100° С
соединений и .фиров)
Вода и пиридин; титруют NaOH в среде вода—метанол или в ме-тилцеллозольве в присутствии крезолового красного или тимолового голубого, или потенциометрически до pH 9,8
Вода; титруют спиртовым раствором NaOH в присутствии крезолового красного
118
119
115
Первичные спирты (см. № 4) в эфирных маслах (см. № 10), например гераниол (ем- № Ю), фенил-СПИРТ (см.
№ 138, 139, 158)
Уксусный ангидрид—пиридин (1 : 3); 2 ч
Титруют щелочью
120
167
Продолжение
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Лите рагу ра
116 Сульфафуразол (сульфаизоксазол) Уксусный ангидрид—пиридин; 10 мин при 0—2° С Вода, выпавшее в осадок N-ацетилпроизводное растворяют в ацетоне и титруют НС1 в присутствии нитрита в диметиламинобензальдегиде (см. Том I, «Нитрит натрия», литература 129) 121
117 1,1 -Дифенилэтанол; 1 -(п-бромфенил)-1 -фенилэтанол Уксусный ангидрид—пиридин (1 3); нагревают 90 мин в колбе, снабженной обратным холодильником Олефиновый продукт определяют путем взаимодействия с бромом в среде уксусной кислоты и последующим иодо-метрическим титрованием его избытка (см, «Реагенты, содержащие бром», литература 481) Избыток ангидрида определяют путем взаимодействия с анилином и последующим титрованием его избытка (см. «Амины и гетероциклические основания», литература 82; Том I, «Хлорная кислота», литература 269) 122
<18 Хлорамфеникол Пропионовый ангидрид—п-толуолсуль-фокислота; 30 мин при комнатной температуре 124
119 Ароматические амины (см. № 28) Уксусный ангидрид—пиридин (1 : 3); при 120° С Титруют щелочью в присутствии фенолфталеина или смеси крезоловый красный—тимоловый голубой 125
120 Ами нгидр охлор иды Уксусный ангидрид—уксусная кислота—ацетат ртути; 80—180 мин при комнатной температуре Не реагирующие с ангидридом третичные амины титруют уксуснокислым раствором НС1О4 в присутствии кристаллического фиолетового или крезолового красного (см. Том 1, «Хлорная кислота», литература 238) .26
121 Смеси аминов (см. Ns 28) В уксусной кислоте; уксусный анги- дрид—уксусная кислота (Исследована скорое вииных и вторичны; третичн Аликвотная часть и уксусная кислота; титруют уксуснокислым раствором НС1О4 в присутствии кристаллического фиолетового ть ацетилирования пер-< аминов и определение ых аминов) 127
168
Продолжение
№ г in 122 123 124 125 126 127 128 129 Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
Гераниол (см. Ns 10) в цитронелловом масле (см. Ns 3) Цитронеллол (см. № 10) Цитронеллол (после дегидратации гераниола п-толуол-сульфокислотой в ксилоле) (см. Ns 10) Ди- и тр и аллиламины Фенолы (см. № 4); тиолы; амины (см. № 28) Три-н-октиламии в керосине в присутствии первичных и вторичных аминов Гидроксильные группы (см. № 7) в полиэфирах (см. Ns 155) Аминогруппы (—NH2 или —NH) (см. № 28) в производных высокомолекулярных соединениях жирного ряда (определение ненасыщенности этих соединений) Уксусный ангндр ид—пир идин (1 : 3); 1 ч при 100° С Уксусный ангидрид—муравьиная кислота; 72 ч при 0° С (Метод описан вь Уксусный ангидрид (Метод описан выше 86 — см. Ns 85) Большей частью со смесью уксусный ангидрид—этилацетат или пиридин— НС1О4; 5 мин при комнатной температуре 1 (При выборе реагента что соединения могут сутствии других вещ ным выше 11 У ксусный ангидрид—уксусная кислота (10 : 1); 2 ч В этилацетате; уксусный ангидрид и H2SO4 (катализатор) Уксусный ангидрид; 5—60 мин при 100° С Вода; титруют этаноловым раствором КОН в присутствии фенолфталеина Вода и NaCl; эфир выделяют и определяют методом омыления избытком кон ше 128 — см, JJb 122) Гликоль и изопропанол; непрореагировавший триаллиламин титруют НС1 потенциометрически (см. Том 1, «Хлористоводородная кислота», литература 25) Вода и пиридин; титруют NaOH принимают во внимание, быть определены в при-гств. Ср. метод с описан-8 — см. Ns 113) Уксусная кислота; титруют уксуснокислым раствором НСЮ4 потенциометрически (см. Том I, «Хлорная кислота», литература 316) Титруют водно-метано-ловым раствором КОН потенциометрически Ненасыщенность, затем определяют иодометрически, действуя избытком IC1 (иначе определению мешают амины) (см. «Хлориды, бромид и тиоцианат иода», литература 120) 128 129 130 131 132 133 134 135
169
Продолжение
№ И, ГТ Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
130 Смеси аминов (см. № 28) Уксусный ангидрид; 30 мин при комнатной температуре Не реагирующий с ангидридом третичный амин титруют НСЮ4 в метил целлозол ьве потенциометрически /36
131 Кетоксимы; вицинальные диоксимы; некоторые альдоксимы Уксусный ангидрид—пиридин— НС1О4; 5—10 мин (для кетоксимов), 10—70 мин (для альдоксимов и вицинальных диоксимов) Вода; титруют NaOH в присутствии крезолового красного и тимолового голубого или мета-нол-бензоловым раствором CH3ONa в присутствии тимолового голубого, после добавления диметил формамида /.37
132 Смеси спиртов (например, изомеры) (см. № 4) Уксусный ангидрид—пиридин (1 : 24); время реакции различное Аликвотная часть и вода; титруют спиртовым раствором КОН в присутствии фенолфталеина и сульфата нильского голубого; строят кривую титрования двух-компонентнон смеси 138
133 Гидроксильные (см. № 7) и амино-(—NH2 и =NH) группы (см. № 28) Пиромеллитовый ангидрид—тетрагид-рофуран—пиридин; 2 мин при 100° С; затем тетрагидрофуран выпаривают Вода; титруют NaOH в присутствии фенолфталеина 139
134 Пиперазин и его N-оксиэтилпроизвод-ное В ацетонитриле; уксусный ангидрид— уксусная кислота (4 : 1); 100 мин Непрореагировавшее производное титруют НС1О4 в присутствии кр и сталл и ческого фиолетового 140
135 Остаточный спирт (см. № 4) в обезжиренных, промытых спиртом соевых хлопьях Ацетон; .и-фталевый ангидрид—пиридин в 5-кратном избытке; 2 ч Вода; нагревают 10 мин в колбе, снабженной обратным холодильником; титруют NaOH 141
136 З-Метилпентен-2-4-ин-1-ол в присутствии 3-метилпентен-2-4-ин-З-ола (третичного спирта) Уксусный ангидрид—безводный пиридин; при комнатной температуре Вода; титруют КОН 142
137 Первичные и вторичные спирты (см. № 4) — определение гидроксильного числа (см. № 141, 154) (Метод описан выше132 — см. № 126) 143
138 Фенилэтиловый спирт (см. № 115) Фталевый ан гидр ид—пир иди н; нагревают 1 ч в колбе, снабженной обратным холодильником Вода; оставляют на 15 мин-, титруют NaOH в присутствии фенолфталеина 144
170
Продолжение
№ п,п Титруемое вещество Реагент и условия ревкции Соответствующая обработка и конечная стадия титрования Литература
139 фенилэтиловый спирт (см. № 115) Фталевый ангидрид—бензол; нагревают 1—2 ч в колбе, снабженной обратным холодильником Пиридин—вода; ти- труют NaOH 145
140 Амины (см. № 28) Исследованы и обсуждены два метода: а) пиридин—уксусный ангидрид (3 : 1); 5 ч при комнатной температуре; б) уксусный ангидрид—диоксан (1 : 2) и несколько капель фосфорной кислоты Вода; титруют NaOH в присутствии фенолфталеина 146
141 Полиоксиалкиленовые полиолы (многоатомные спирты) — определение гидроксильного числа (см. № 137) У ксусный а н гидр ид—этил ацетат—-уксусная кислота—n-толуол сульфо кис лога; 30 мин при 60° С Вода—пиридин; 5 мин, затем титруют КОН в присутствии крезолового красного и тимолового голубого 147
142 Первичные амины (см. № 28) в полуцик-лических полиами- Уксусная кислота—муравьиная кислота; фталевый анги- Ацетон и ацетат ртути; непрореагировавшие первичные амины ти- 148
нах дрид; 1 ч при 90° С (Титрование анализи работки дает сумму аь труют уксуснокислым раствором НС1О4 потенциометрически >уемого вещества до об-лервичного и вторичного инов)
143 Эфирные масла (см. № 10) — определение пропионового числа Пропионовый ангидрид—п-толуол-сулъфокислота—уксусная кислота; 7— 8 ч при комнатной температуре Добавляют смесь анилин—бензол—уксусная кислота и оттитровывают избыток анилина НС1О4 (см. «Анилины и гетероциклические основания», литература 100 и 102} 149
14, Вода в муравьиной кислоте Фталевый ангидрид—диоксан; нагревают 10 мин N-Этиланилин; нагревают 5 мин\ добавляют нитробензол—бензол; избыток амина оттитровывают уксуснокислым раствором НС1О4 (см. «Амины и гетероциклические основания», литература 103) 150
171
Продолжение
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования •Литература
145 Теофиллин и 7-(2-ок-сиэтил)-теофиллин Уксусный ангидрид; нагревают 5 мин в колбе, снабженной обратным холодильником Титруют потенциометрически диоксановым раствором НС1О4; наблюдается два скачка титрования; первый для производного, получаемого из второго соединения, и второй — из теофиллина 151
146 Спирты (см. № 4) и фенолы (см. № 4) — определение гидроксильных групп (см. 7) Уксусный ангидрид—диоксан— n-тол уол сул ьфокис-лота (иногда добавляют фосфорную кислоту); 3 ч при комнатной температуре (до 24 ч в присутствии фосфорной кислоты) (Исследовано много соединений) Пиридин; титруют NaOH 152
147 Первичные спирты (см. № 4) У ксусный ангидрид—пиридин (1 : 3), 1—2 ч Вода; титруют NaOH потенциометрически до pH 7,6 153
148 Гидроксильные группы (см. № 7) Уксусный а н гидр ид—этил а це-тат—НС1О4; 10— 20 мин (Модификация реагента описана выше 132 — см. № 126) Титруют NaOH 154
149 Г идр оксильные гр уп-пы (см. № 7); спирты (см. № 4); фенолы (см. № 4); сложные эфиры; эфирные масла (см. № 10) Стеариновый ангидрид—jw-ксилол; нагревают 15—30 мин в колбе, снабженной обратным холодильником Пиридин или стеарат натрия; кипятят 15 мин и горячий раствор титруют NaOH в присутствии фенолфталеина 155
150 Мононатрийглутамат Уксусный ангидрид; нагревают 2 мин в колбе, снабженной обратным холодильником; ацетилируется NHa-rpynna Диоксан; титруют уксуснокислым раствором НС1О4 потенциометрически 156
151 Этиленоксидполи-эфиры — определение соотношения первичных и вторичных ОН-групп (см. № 7) [Взаимодействие фталевого ангидрида с фенил-нзоцианатом, сопровождаемое образованием эфира или уретана; исследуют через определенные интервалы времени (в случае фталиро-вания через определенные интервалы времени обратно оттитровывают щелочью реагент из аликвотных частей реакционной смеси] 157, 158
172
Продолжение
№ г п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
152 Нормальный и вторичный бутанол в смеси В пиридине; уксусный ангидрид—пиридин; при 25,5° С, время реакции различное Вода; титруют спиртовым раствором КОН в присутствии нильского голубого А и фенолфталеина (по кривой титрования проводят количественное определение обоих спиртов) 159
153 Полиоксиал килен-эфиры — определение гидроксильного числа (см. № 137) У ксусный ангидрид—этил ацетат—п-толуолсуль-фокислота; 15 мин при 50+1° С Вода—пиридин; ти- труют метаноловым раствором КОН в присутствии крезолового красного или тимолового голубого 160
154 Тетракаин и эфедрин гидрохлориды Уксусный ангидрид; ацетилируется эфедрин Тетракаин экстрагируют СН3С1 и титруют НС1О4 161
155 Свободные гидроксильные группы (см № 7) в полиэфирах (см. № 128) Уксусный ангидрид—ацетон—НСЮа или H,SO4; встряхивают 2 мин, затем оставляют на 5 мин при 5° С Титруют NaOH в присутствии фенолфталеина 162
156 Первичные и вторичные спирты (см. № 4); фенолы (см. № 4) (Незначительная модификация метода, описанного выше 132, — см. № 126) 163
157 Алкоксильные группы в алкоксисиланах Уксусный ангидрид—этилацетат— НС1О4; 5 мин Уравнени =SiOR + (СН3СО),О-> 4 sS Вода и пиридин; титруют мета половым раствором КОН в присутствии крезолового красного или тимолового голубого е реакции: = SiOCOCH3+ROCOCH3 гидролиз iOH+CH3COOH 164
158 ₽- Фенилэтиловый спирт (см. № 115) Уксусный ангидрид—пиридин— НС1О4; 10 мин при комнатной температуре Вода; титруют NaOH в Присутствии фенолфталеина 165
159 Гидразид никотиновой кислоты Уксусный ангидрид; 15 мин при 100° С Титруют диоксановым раствором НС1О4 в присутствии кристаллического фиолетового 166
173
Продолжение
№ п/п Титруемое вещество Реагент и условия реакция Соответствующая обработка и конечная стадия титрования Ли Герату ра
160 Смеси первичных, вторичных и третичных аминов (см. № 28) Аликвотная часть в уксусной кислоте; уксусный ангидрид и ацетат ртути; 1 ч при 80—90° С (Сочетают с определе аминов и суммы втор нов после реакции с с см. «Карбонильные со Ацетон; остаток третичного амина титруют потенциометрически уксуснокислым раствором НС1О4 нием общего содержания ичного и третичного ами-алициловим ангидридом; единения», литература 34) 167
161 Меркаптосиланы Уксусный ангидрид—этилацетат— НСЮ4; 5 мин Реакция протекает, дующему =S1SR+(CH3CO)2O- Пиридин—вода (3 1); оставляют стоять более 5 мин и титруют спиртовым раствором КОН в присутствии крезолового красного и тимолового голубого вероятно, согласно сле-уравнению* ► =SiOCOCH3+RSCOCH3 | гидролиз sSiOH+CH3COOH 168
162 Диметилгидразин в присутствии моно-метилового или незамещенного гидразина Уксусный ангидрид—уксусная кислота; 1 мин Титруют уксуснокислым раствором НС 1О4 в присутствии хинальдинового красного 169
Эфир почти всегда отделяют одним из следующих способов:
1) разделением при помощи делительной воронки, в особенности водонерастворимых эфиров высокомолекулярных веществ, таких, как ментол;
2) экстракцией растворителем, подобным петролейному эфиру;
3) отгонкой, если эфир летуч;
4) отгонкой образовавшейся уксусной кислоты и непрореагировавшего уксусного ангидрида; это, естественно, возможно осуществить лишь в случае образования эфиров высших спиртов. Инида реакционную смесь предварительно нейтрализуют и эфир затем определяют омылением определенным количеством щелочи, взятым в избытке.
2. Непрореагировавший ангидрид может быть определен:
1) прямым титрованием анилином;
2) взаимодействием с определенным избытком амина (например, с анилином или антраниловой кислотой) и последующим обратным титрованием избытка амина кислотой, например хлорной;
3) реакцией с определенным количеством воды, избыток которой определяют методом обратного титрования реактивом Фишера.
3. Образовавшуюся карбоновую кислоту, которая находится в смеси с избытком ангидрида, определяют титрованием щелочным
174
снтом (иногда этот метод используют для определения того количества ангидрида, который гидролизован водой):
X — Н + (RCO)2O -> X — COR + RCOOH + (RCO)2O амии или избыток
оксисоединение
Непрореагировавший ангидрид затем гидролизуется:
Н2О 4- (RCO)2O -» 2RCOOH
Свободную кислоту, содержащуюся в реагенте (который трудно получить совершенно чистым), оттитровывают перед каждым определением, и разница между результатами двух титрований щелочью эквивалента содержанию амино- или оксисоединения. Гидролиз ангидридов катализируется третичными аминами, например пиридином, а затем идет довольно быстро даже на холоду. Многие авторы предупреждают о нежелательности излишнего нагревания, которое может вызвать гидролиз образующихся эфиров (нагревание допустимо при реакциях, сопровождающихся образованием устойчивых амидов).
4. В тех случаях, когда ацетилирование служит для удаления некоторых компонентов, содержащихся в образце анализируемого вещества, титруют непрореагировавший остаток. Хорошо известным случаем является пример, указанный в пункте 2 («Реакции и титруемые вещества»), относящийся к анализу третичных аминов после ацетилирования первичных и вторичных. Для титрования оснований применяют хлористоводородную и хлорную кислоты. Другим примером является титрование олефинов хлоридом иода после ацетилирования потенциально мешающих аминов135.
5. Олефины, образующиеся вследствие дегидратации спиртов уксусным ангидридом, определяются бромометрически135. В некоторых приведенных работах,57'158'159 бинарные смеси спиртов определены по скорости реакции ацетилирования (или по образованию уретана при использовании в качестве реагента изоцианата). В работе94 приведен обзор методов определения «активного водорода», а также включено много методов ацетилирования, основанных на использовании в качестве реагента уксусного ангидрида.
1.
2.
3.
4.
5.
6.
7.
8.
9.
10.
ЛИТЕРАТУРА
Reverdin F., de la Harpe C., Ber., 22, 1004 (1889).
V a u b e 1 W., Chem. Ztg., 17, 465 (1893).
Schimmel and eth al, Berichte, Oct.—Nov., 1899.
X e r I e у А., В б 1 s i n g F., Ber., 34, 3354 (1901).
Oasca r d A., J. pharm chim. (6), 24, 97 (1906).
Boulez V., Bull. soc. chim. France (4), 1, 117 (1907).
Nermann w, Chem. Rev. Fett. u. Harz Ind., 19, 205 (1912).
177 9КЯЛоС93ч L' S’’ BU1L S0C’ chim’ France (4)> 88> 1284 <1923); ComPt- rend., F? i (ДУДэ).
Radi Bul1- ®°с- chim- France (4), 35, 419 (1924).
254 350 (1926) ° ’ Chaddert°n E., Perfumery Essent. Oil Record, 17,
175
11. P e t e r s о n V. L., West Е. S., J. Biol. Chem., 74, 379 (1927).
12. A 1 1 a n J. e t al., Perfumery Essent Oil Record, 19, 131 (1928).
13. V e r 1 e у A., Bull. soc. chim. France, 43, 469 (1928).
14. V e r 1 e у A., Am Perfumer, 24, 233 (1929).
15. S о m i у a T., J. Soc. Chem. Ind., Japan, Suppl. Bdg., 33, 140 (1930).
16. Connerade E, Chimie et Industrie, Spec. No. 696 (1931).
17. Huppmann Pharm. Ztg., 76, 113, 329 (1931).
18. Al a г к s S., Morrell R. S., Analyst, 56, 428 (1931).
19. D e 1 a b у R., В r e u g п о t Y., Bull. sci. pharm., 39, 354 (1932).
20. Meunier L., Gonfard M., Rev. gen. mat. plastiques, 8, 427, 467, 591 (1932).
21. R о b e r t s W. L., Schuette H. A., Ind. Eng. Chem., Anal. Ed., 4 257 (1932).
22. В о u 1 e z V., Ann. zymologie (2), 1, 170 (1933).
23. G lie hitch L. S., Naves Y. R., Chimie et Industrie, Spec. No. 1024 (1933).
24. Norma nn W., Sc hil dknecht E., Fettchem. Umschau, 40, 194 (1933).
25. F ti r t h O., Ka uni tz H., Stein H., Biochem. Z., 268, 189 (1934).
2b. Hosking H. J., Snell F. D., В i f f e n F. M., Ind. Eng. Chem., Anal. Ed., 6, 254 (1934).
27. S a b e t a у S., Compt. rend., 199, 1419 (1934).
28. W e s t E. S., Hoagland C. L., Curtis G. H., J. Biol. Chem., 104, 627 (1934).
29. D e 1 a b у R., Sabetay S., Bull. soc. chim. France (5), 2, 1716 (1935).
30. Roberts W. L., J. Assoc. Offic. Agr. Chem., 18, 434 (1935).
31. T a u f e 1 K-, de Mingo M., Thaler H., Fettchem. Umschau, 42, 141 ( 935).
32. Toennies G., E 1 1 i о t M., J. Am Chem. Soc., 57, 2136 (1935).
33. Freed M., Wynne A. M., Ind. Eng. Chem., Anal. Ed., 8, 278 (1936).
34. H a f п e r P. G., Swinney R. H., West E. S., J. Biol. Chem., 116, 691 (1936).
35. H i n s b e r g K-, Biochem. Z., 285, 125 (1936).
36. Rabate J., Bull. soc. chim. France (5), 3, 2112 (1936).
37. С a n г и p И. H., Фролова Р. А., Синтетич. каучук, № 11—12, 17 (1936).
38. Hinsberg К., Biochem. Z., 289, 294 (1937).
39. S a b е t а у S., Haves Y. R., Ann. chim. anal. chim. appl., 19, 35 (1937).
40. S a b e t a у S., Naves Y. R., Ann. chim. anal. chim. appl., 19, 285 (1937).
41. S h a e f e r W. E., Ind. Eng. Chem., Anal. Ed., 9, 449 (1937).
42. S t о d о 1 a F. H., Mikrochemie, 21, 180 (1937).
43. Lazar О., M e у 1 i n g A. H., J. S. African Chem. Inst., 21, 8 (1938).
44. О h m а п V., Laurent G.. Svensk Kem. Tidskr., 50, 35 (1938).
45. Bergstrom H., Trobeck K. G., IVA 10 (1939).
46. Leman A., Compt. rend., 208, 357 (1939).
47. S a b e t a у S., Ann. chim. anal. chim. appl., 21, 289 (1939).
48. Wilson H. N., Hughes W. C., J. Soc. Chem. Ind., London, 58, 74 (1939).
49. H a 1 1 R. T., Holcomb J. H., Griffin D. B., Ind. Eng. Chem , Anal. Ed., 12, 187 (1940).
50. Adkins H., Frank R. L., Bloom E. S., J. Am. Chem. Soc., 63, 554 (1941).
51. Angren A., Bengtsson E., Farm. Revy, 40, 57, 173 (1941).
52. В 1 u m r i c h К., В a n d e 1 G., Angew. Chem., 54, 374 (1941).
53. Brignail T. W., Ind. Eng. Chem., Anal. Ed., 13, 166 (1941).
54. G г о v e D. C., J. Assoc. Offic. Agr. Chem., 24, 465 (1941).
55. Wilson С. O., Bull. Natl. Formulary Comm., 9, 350 (1941).
56. В a 1 d i n g e r L. H., Ind. Eng. Chem., Anal. Ed., 14, 15 (1942).
57. M a 1 m C. J., G e n u n g L. B., Williams R. E., Ind. Eng. Chem,. Anal. Ed., 14, 935 (1942).
58. Toennies G., Kolb J. J., J. Biol. Chem., 144, 219 (1942).
59. Leman O., Bull. Soc. chim. France, 10, 235 (1943).
60. M о о r e J. C., Blank E. W., Oil and Soap, 20, 178 (1943).
Ind. Eng. Chem.. Anal. Ed., 17,
W., Rev. quim. farm. (Rio de Janeiro), 10, No. 8,
83.
„ » rcn и J W., Hedberg K. W., Christensen В. E., Ind. 61fP« Chem° Anai- Ed., 15, 225 (1943).
L.nB- „ПА Bull. soc. chim. France, 11, 354 (1944).
63 m1 tc h e 1 Г J-. Hawkins W., Smith D M., J. Am. Chem. Soc., 66, ^M^r’i H , Y a m a d e T., J. Soc. Chem. Ind. Japan, 47, 15 (1944).
nf Xefer W. E„ Ind. Eng. Chem., Anal. Ed., 16, 432 (1944).
t Christensen В. E., Cl ar ke R. A., Ind. Eng. Chem..
'265 (1945)
67. F e r r e i r a P. С., 1 u с c 1
кя 9O*₽ e^C L Pot ter W. L, Wi Hi ts G R., Ind Eng. Chem., Anal. Ed 17 394 (1945).
69 J о n e s J. S., FangS. C., Ind. Eng. Chem., Anal. Ed., 18, 130 (1946).
70 McFarlane S. B., Oil and Soap, 23, 237 (1946).
7j. P о h 1 e W. D., M e h 1 e n b a c h e г V. C., Oil and Soap, 23, 48 (1946).
72. E 1 v i n g P. J., W a r s h о w s к у В., Anal. Chem., 19, 1006 (1947).
73. G о 1 d e n s о n J., Sass S., Anal. Chem., 19, 322 (1947).
74 Hebrich K., Rieman W., Anal. Chem., 19, 69i (1947).
75 Hoffmann A., Maffei F. J., Inst. pesq. tecnol. (Sao Paulo), separate No. 196, 93 (1947).
76. Naves Y.-R., Helv. Chim. Acta, 30, 796 (1947).
77. Naves Y.-R., Helv. Chim. Acta, 30, 1613 (1947).
78. P о h 1 e W. D.. Meh 1 e n ba c her V. C., J. Am. Oil Chemists’Soc., 24, 155 (1947).
79. Ryan J. D„ Shaw F. B„ US Patent 2, 425, 568, Ang. 12th 1947.
80. S i g g i a S., Anal. Chem., 19, 1025 (1947).
81. Wagner C. D., Brown R. H., Peters E. D., J. Am. Chem. Soc., 69, 2609 (1947).
82. d e Graef H., P i e r r e t J., Bull. soc. chim. Beige, 57, 307 (1948).
83. H a w к e F.. J. S. African Chem. Inst. (N. S.), 1, 85 (1948).
84. Senju R., J. Agr. Chem. Soc. Japan, 22, 58 (1948).
85. С ё s a i r e G., Bull, soc chim. France, 16, 704 (1949).
86. V a 1 e n t i n F. H. H., J. S. African Chem. Inst. (N. S.), 2, 59 (1949).
87. С о h e n S. G., Haas H. C., J. Am. Chem. Soc., 72, 3954 (1950).
88. M i t s u i 'r XT ’ ” “ ' ~ ....
Chem. Soc.
89. S i g g i a (1950).
Stress
Meier К., 1
Sabetay S.
S i g g i a S., j\ e I v e n s к i i. к-, Anar, cnem., za 11/ (iyt>i).
oi leman E. D., Anal. Chem., 24, 1425 (1952).
He W a 1 t C. W., Glenn R. A., Anal. Chem., 24, 1789 (1952).
runner H., Thomas H. R., J. Appl. Chem. London, 3, 49 (1953).
Петрова Л. H., Ж- аналит. химии, 8, 61 (1953).
И I e n n R. A., О 1 1 e m a n E., Anal. Chem., 26, 350 (1954).
nl rrS V,’ E’’ J’ Soc- Leather Trades Chem., 38, 177 (1954).
p * t H„ Helv. Chim. Acta, 37, 786 (1954).
• psez M., Bull. soc. chim. France, 1237 (1954).
' c“ " d 1 f,f R- H-- M а г к u n a s P. C., Anal. Chem., 27, 1650 (1955).
T^, k Г a >,^’тАпп- Pharm. franc., 13, 516 (1955).
^68 (1955)Chl * ’ Eurasawa M- Takayama Y., Japan Analyst, 4, (1956)° s c E * t d R-> Singer K., Petit J., Bull. soc. chim. France hV^,?1 ,k 0 B \ LI-. Сявцилло С. В., Шемятенкова В.
107 Ю ДУЛ°ы ам А’ЛМ” Зав-лаб’ 22- 660 (1956).
И. М., Фирсова Ю. Ф., Ж- аиалит. химии, 11, 205 (1956).
T., Nakayama H., Tanaka J., Fujiwara H., J. Agr. Japan, 24, 82 (1950).
S., Hanna J. G., Kervenski I. R., Anal. Chem., 22, 1295
P., Stuckey R. E., J. Pharm. Pharmacol., 2 549 (1950).
Farbe u. Lack, 57, 437 (1951).
' , Intern. Perfumer, 1, No. 2, 11 (1951).
Kervenskj I. R., Anal. Chem., 23, 117 (1951).
Glenn R. A., ’Anal’. Chem., 24, 1789 (1952).
Thomas H. R., J. Appl. Chem. London, 3, 49 (1953).
90.
91.
92.
93.
94.
95.
96.
97.
98.
99.
100.
101.
102.
103.
104.
768
И.,
>77
108. Безингер Н. Н., Гальперн Г. Д., Савостьянова Т. Ц Хим. технология и применение производных пиридина и хинолина. Материале совещания, ин-т химии АН Латв. ССР, Рига, 53, 1957.
109. Fujita Y., U е d a Т., К usu mo to N., Koryo, 47, 42 (1957).
110. Gallo U„ Boll. Chim. farm., 96, 458 (1957).
Ill Shichiji S., Hayashi M., Kogyo Gijutsuin Hakko Kenyushko Kenkvu Hokoku No. 14, 19 (1957).
112. Шутер Л. M., Беркман Я. П., Укр. хим. журнал, 23, 669 (1957).
113. Bertucat М., М е s n а г d Р., Bull. soc. pharm. Bordeaux, 97, 117 (195?). '
114. Bring A., К a d 1 e c e k F., Plaste u. Kautschuk, 5, 43 (1958).
115. Гальперн Г. Д., Безингер Н. Н., Ж- аналит. химии, 13, 603 (1958).
116. Lal J. В., Math ur А. Р., Parwardhan V. М., J. Oil Technol j Ап., India, 4, 9 (1958).
117. Mesnard P., Bertucat M., Compt. rend., 246, 2793 (1958); Bull, soc. chim France 307 (1959).
118. Fritz J. S„ Schenk G. H„ Anal. Chem., 31, 1808 (1959).
119. L a n g m a i e r F., S у m о v s k У P., Kozarstvi, 9, 241 (1959).
120. Петрова Л. H., Новикова E. H., Маслобойно-жировая пром., 25, № 8, 21 (1959).
121 Uno T., Kono M., Miyai T., Yasuda H., Yakugaku Zasshi, 79, I 113 (1959).
122. Budeginsky B., Aixnerova M., Ceskoslov. Farm., 9, 312 (1960).
123. Cundiff J?. H., M ark ил as P. C., J. Assoc. Offic. Agr. Chem , 43, [ 519 (1960).
124. Franchi G., Pe Iler ano C., Ann. chim. (Rome), 50, 134 (1960).
125. G о и p i 1 R., Chim. anal., 42, 300 (1960).
126. G у e n e s I., Magyar Kem Folydirat, 65, 264 (1959).
127. Nic ksic S. W., Judd S. H., Anal. Chem., 32, 998 (1960).
128. van Os F. H. L., S i s s i n g J., Pharm. Weekblad, 95, 686 (I960).
129. vanOs F. H. L., de Boer G. D., Pharm. Weekblad, 95, 735 (1960).
130. vanOs F. H. L., E 1 e m a E. T., Pharm. Weekblad, 95, 761 (1960).
131. Parrish J. R., Stevenson R., Chem. a. Ind. (London), 531 (1960).
132. Schenk G. H., Fritz J. S., Anal. Chem., 32, 987 (1960).
133. Dep tul a C., Chem. Anal. (Warsaw), 6, 91 (1961).
134. Емелин E. А., Царфин Я- А., Пластические массы, № 3, 75 (1961).
135. M i I u n A. J., Anal. Chem., 33, 123 (1961).
136. Ruch J. E., C r i t c h f i e 1 d F. E., Anal. Chem., 33, 1569 (1961).
137. Schenk G. H., Anal. Chem.. 33, 299 (1961).
138. S i g g i a S., Hanna J. G., Anal. Chem., 33, 896 (1961).
139. S i g g i a S., Hanna J. G., C u 1 m о R., Anal. Chem., 33, 900 (1961).
140. Told у E., Csillog F., Bobak T., Gyenes L, Magyar Kem Folydirat 67, 180 (1961).
141. Black L. T., Kirk L. D„ Mu s t a k as G. C„ J. Am. Oil Chemists’Soc , 38, 483 (1961).
142. Сол у нин а И. А., Сорокина P. А., Девятин В. А., Мед. пром. СССР, 15, № 5, 60 (1961).
143. Ильина А. И., Недавняя В. Г., Маслобойно-жировая пром., 27, 10, 31 (1961).
144. К i s h о г е I., Lal J. В., Indian Oil and Soap J., 26, 255 (1961).
145. К i s h о r e L, Lal J. B., Riechstoffe u. Aromen, 11, 221 (1961).
146. Mesnard P., Bertucat M., Bull. soc. chim. France 611 (1961).
147. Madeline P., Debourg G., Mem. Poudres, 43, 143 (1961).
148. Емелин E. А., Царфин Я. А., Ж- аналит. химии, 17, 759 (1962).
149. Franchi G., Franchi R. R., Boll. Chim. Farm., 101, 127 (1962).
150. К i c i a k S., Chem. Anal. (Warsaw), 7, 847 (1962).
151. L i n e k K-, P e c i a r C., Chem. Zvesti, 16, 692 (1962).
152. Mesnard P., Bertucat M., Boll. Chim. Farm., 101, 519 (1962).
153. Quattrone J. J., Choy T., Microchem. J., 6, 259 (1962).
154. Schenk G. H., Santiago M., Microchem. J., 6, 77 (1962).
155. Sully B. D,, Analyst, 87, 940 (1962).
178
Anal. Chem., 34, 1668 (1962).
Anal. Chem., 34, 1343 (1962).
S i e e i a S., J. Polymer Sci., 56, 297 (1962).
“ v C N Pap a L. J., Anal. Chem., 34, 801 (1962).
' 'eyr i? S SmullinC. F., Anal. Chem., 34, 194 (1962).
t z 1 e r _R. ^elemen-Kuttel Acta Pharm. Hung., 33, 202
Полин-
Czechoslov.
156 Adler N., 57- В udd M. S.
158. Hanna J-?;
159. R e 1 1
160- s t e i _ rr
I61. Dupcza K..
Коша я E. С., Лыкова АН., Либерова Р. А., 162 С Л., Зав. лаб. 29, 549 (1963).
Rioucek В., Gasp ar ic J., Ob rub а К., Collection 63 Chem Communs., 28, 1606 (1963).
164 Mas'n u s о n J. A., Anal. Chem , 35, 1487 (1963) Моисеева H. В., Мерзликина M. H Зав. лаб., 29,
16б' S о 1 о m о п -I o_n^e scu^ 1., Popescu D., Е пас he S.,
Зал икин А. А., Чимишкян А. Л., Ж-
А?м”а е n\i son 'j. A., Anal. Chem., 36, 1156 (1964).
Н. Е., Biggers R. A., Anal. Chem., 36, 1037 (1964).
1437 (1963).
Rev. Chim.
(Bucharest), 14, 532 (1963). 167. Стрепихеев Ю. A., аналит. химии, 18, 1262 (1963); 168. Berger 169. Malone
9. СОЕДИНЕНИЯ МЫШЬЯКА (V)
Известно два метода определения органических соединений, основанных на окислении соединениями мышьяка (V): объемный метод определения фенилгидразина, основанный на реакции
C6HSNHNH2 + As2O5 -> С6Н5ОН + N2 + Н2О + As2O3
а также газоволюмометрическнй метод определения органических производных гидразина, основанный на измерении объема выделяющегося газообразного азота, образующегося при проведении описанной выше реакции.
Таблица 17. Примеры использования соединений мышьяка (V)
№ П/И Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
1 2 Фенилгидразин (см. № 2); фенил гидразоны некоторых альдегидов Фенилгидразин (см. № 1) Арсенат; НС1; уксусная кислота и Pt (в виде проволоки); нагревают до тех пор, пока замедлится выделение азота и затем еще кипятят 40 мин Нагревают с арсенатом Точно нейтрализуют, добавляют NaHCO3 и титруют образовавшийся арсенит иодом в присутствии крахмала Избыток реагента оттитровывают хлорамином Т 1 2
литература
J
2 AlU?Se Н- Compt. rend., 125, 712 (1897).
Фанасьев Б. Н„ Зав. лаб. 15, 1271 (1949).
179
10. СОЕДИНЕНИЯ МЫШЬЯКА (HI)
Обычно в качестве реагента применяют арсенит, но встречается указание на использование триэтиларсина As (СаН5)3 вместо арсе-нита.
Метод основан на восстановлении определяемого вещества ц применяется для определения перекисей.
Заключительной стадией определения обычно является обратное титрование избытка As111.
Таблица 18. Примеры использования соединений мышьяка (III)
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
1 Ксантат (ксантоге-нат) Арсенит; 15 мин Уксусная кислота, экстрагируют бензолом; к аликвотной части водного слоя добавляют NaHCO3 и иод, избыток которого оттитровывают тиосульфатом 1
2 Перекись бензола в органических средах (см. № 4) As,O3; раствор NaHCO3; этанол (если необходимо); кипятят до тех пор, пока органический растворитель не выкипит Подкисляют H2SO4; добавляют NaHCO3 и титруют иодом 2
3 Перекиси в нефтяных' продуктах (см. № 4) Арсенит натрия; NaOH; немного этанола; кипятят 45 мин в колбе, снабженной обратным холодильником, в атмосфере азота NaHCO3 титруют иодом в присутствии крахмала или потенциометрически 3
4 Перекиси (см. № 2, 3, 6) [Сравнивают метод, описанный выше 2 (см. № 2), с йодометрическим методом (см. «Йодиды и иодистоводородная кислота», литература 76)] 4 1
5 Диалкилпероксиды в присутствии диацил-и алкилпероксидов и перкислот As (С2Н5)3 в атмосфере азота, 10 мин\ последние три соединения реагируют с образованием арсино-ксида (RjAsO) Не реагирующие диалкил пероксиды определяют путем добавления 1“-ионов и уксусной кислоты и последующего титрования выделившегося иода тиосульфатом (см. «Йодиды и иодистоводородная кислота», литература /55) 5 1
6 Перекиси (в полимерном латексе) (см. № 4) Небольшой избыток As1 !I в щелочном растворе Избыток Asiri оттитровывают перекисью или иодом амперометрически 6
ЛИТЕРАТУРА
„; N Sorbini F., Boll. Chim Farm., 51, 361 (1912).
I- T a r ug c " Anal. Chem., 19, 872 (1947).
2- ^кег D C„ Conway H. S., Anal. Chem, 25, 923 (1953).
3’ n^fnrd A. J., Analyst, 79, 501 (1954).
t Horner L., Jurgen E., Angew. Chem., 70, 266 (1958)
c Knit hotf I- M., Meehan E. I., В r u с к e n s t e i n S., Mina to H., Microchem J-, 4, 53 (I960).
//. СОЕДИНЕНИЯ БАРИЯ
Некоторые органические поли карбоновые кислоты определяют путем осаждения в виде бариевых солей. В этих случаях обычно применяют весовой метод, однако опубликовано несколько титри-метрических методов.
Так как многие кислоты, часто сопутствующие друг другу, дают малорастворимые бариевые соли, условия реакции должны строго соблюдаться для того, чтобы обеспечить оптимальные условия осаждения определяемой кислоты. Это не всегда удается легко осуществить, и поэтому точность результатов анализа не очень высока.
Таблица 19. Примеры использования соединений бария
№ п/л Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
1 Лимонная кислота (см. № 2) в биологических смесях Раствор концентрируют; добавляют ВаС12; нагревают 5 мин Цитрат бария отцентрн-фуговывают, окисляют МпО^" до ацетона, который определяют иодометрически в щелочном растворе (см. «Реагенты, содержание иод», литература 232 и «Перманганат калия», литература 79) 1
2 Лимонная кислота (см. № 1) в портвейнах Ва2+ -ионы Как описано выше — см. № 1 2
3 Сульфонаты в смесях, получаемых в процессе реакции сульфирования В а (ОН)2 для осаждения сульфатов; 30 мин при 100° С Отфильтровывают; фильтрат пропускают через ионообменник; элюент титруют NaOH (см. «Ионообменники», литература 21) 3
4 Винная кислота в вине Ва2+ при pH 4,7 или 7 Тартрат бария определяют окислением перйодатом 4
181
Продолжение
№ п/л Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Л итература
5 Янтарная кислота в винах Нейтральный раствор; ВаС12; этанол (до тех пор, пока содержание его не достигнет 66%); 2 ч при 10° С; затем то же самое, но с доведением содержания этанола до 76%; 4 ч Отфильтровывают; фильтрат титруют NaOH. Разница между двумя титрованиями (после 2 и 4 ч реакции) соответствует содержание янтарной кислоты 5
6 Сульфаты алкалоидов, например атропина, стрихнина н хинина ВаС12; Сип-ЭДТА Оттитровывают ЭДТА в присутствии 1-(2-ПИ-ридилазо)-2-нафтола 6
7 е-Аминокапроновая кислота, образующаяся при определении е-капролактама путем гидролиза NaOH ВаС12; Ва (ОН)2; 15 мин (образуется осадок бариевой соли) Нейтрализуют НС1; добавляют нейтрализованный НСНО; титруют NaOH в присутствии фенолфталеина или потенциометрически (см. «Карбонильные соединения», литература 35) 7
ЛИТЕРАТУРА
1. d е S a i n t - R a t L., Н a t е у J., Bull, assoc, chim., 61, 285 (1944).
2. R a m о s M. da C., Gu i maraes A. F., Anais inst. vinho Porto 9 (1953).
3. H о u f f W. H., Christie D. R., Beaumont R. H., Anal. Chem., 29, 1866 (1957).
4. Mar ec a Cortes I., de Bethancourt C. D., Inds. aliment, et agr (Paris), 75, 563 (1958).
5. Procopio M., A n t о n a M., Vini. Ital., 3, 217 (1961).
6. F u I о p L., V e r e p h I., Martonfi L., Farmacia (Bucharest), 11, 301 (1963).
7. Ziolkowski Z., Respondek J., Przondo J., Chem. Anal. (Warsaw), 8, 273 (1963).
12. БИХРОМА T И ТРЕХОКИСЬ ХРОМА [(хром (VI)]
Реагент. Обычно в качестве реагента используют водные растворы бихромата щелочного металла; иногда для этой цели применяют трехокись хрома.
Реакции и титруемые вещества. 1. Окисление различных функциональных групп и классов соединений по уравнению:
Cr20f" + 14Н+ + бе -> 2Сг3+ + 7Н2О или
CrVI + Зг-» Сг1Н
182
п Углеводороды и С-метильные группы, включая углеводороды, ятпие в состав каучука. Окисление С-метильных групп (с образованием уксусной кислоты) в различных типах соединений усиленно изучается.
Л 2) Гидроксилсодержащие соединения. Реакция рассматриваемого типа протекает при окислении низших спиртов, таких, как метанол и этанол; полиоксисоединений от гликоля и глицерина до маннита; сахаров, целлюлоз и крахмалов; фенолов; стеринов, например холестерина; лигнина.
Описано много примеров определения этанола в биологических жидкостях; в этом разделе приведены лишь выборочные материалы, а дискуссионные вопросы не рассматриваются. В работах218-250 приведены данные по окислению спиртов, а в работе 244 исследована кинетика окисления циклогексанона.
3) Карбоновые кислоты, в основном алифатические от муравьиной до масляной (кроме уксусной кислоты, которая относительно устойчива к окислению), включая окси- и поликарбоновые кислоты, такие, как молочная, адипиновая, винная, салициловая и Р-окси-масляная.
4) Эфиры, например диэтиловый эфир, диоксан, целлозольвы и полиэтиленгликоли. Наиболее часто встречается описание определения диэтилового эфира в биологических жидкостях.
5) Альдегиды, например бензальдегид (сахара также могут быть отнесены сюда).
6) Различные соединения, обычно имеющие относительно большой молекулярный вес. Например, индиго, протеины, карбазолы, нафталинсульфокислоты, тринитротолуол, дифениламин. Сюда относятся нерастворимые продукты реакции, образующиеся в процессе первой стадии анализа, например при определении холестерина после предварительного осаждения «дигитонида» или мочевины после осаждения диксантидрила.
Определение «химически потребляемого кислорода» в объектах типа сточных вод часто проводится путем обработки анализируемого образца стандартным раствором бихромата. Здесь эти вопросы подробно не рассматриваются, но приводится несколько литературных ссылок. Конечным продуктом окисления обычно является относительно устойчивая уксусная кислота, получаемая из этанола или при окислении С-метильных групп.
2. Реакции ионного обмена, сопровождающиеся образованием нерастворимых бихроматов и хроматов при определении «больших» катионов таких соединений, как атебрин, риванол, метиленовая синь, четвертичные аммониевые соли в антисептиках, стрихнин и т. д.
Условия реакции. Окисление проводят в кислой среде (чаще всего в сернокислой, но также и в среде других кислот, например ^зотной) И °бычно ПРИ повышенной температуре. Иногда в качестве лениЛИЗаТ°Ра пРименяют серебро (I) для обеспечения полного окис-Углеп’ ЭТ°М даже Уксусная кислота окисляется до двуокиси
рода. В работе194 сравниваются различные методы определения
183
Таблица 20. Примеры использования соединений церия (VI)
В данной таблице приняты два типа сокращений:
1. В тех случаях, когда в качестве реагента применяют смесь серной кислоты с бихроматом или трехокисью хрома, состав реагента не указывается, если не встречаются некоторые специальные особенности, требующие пояснения.
2. Определение не вошедшего в реакцию избытка реагента обычно основано на принципе, описанном в п. 1, пп. (I) и кратко обозначается «Иодид — тиосульфат».
м п/п Титрyelifoe вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
1 Смесь муравьиной (см. № 244) и уксусной кислот Кипячение в колбе, снабженной обратным холодильником Нереагирующую уксусную кислоту перегоняют и титруют обычным способом /
2 Спирты (см. № 143, 157, 181, 183); альдегиды (см. № 239) Нагревают 2—3 ч в запаянной трубке Иодид—тиосул ьфат 2
3 Глицерин (см. № 6, 12, 32, 43, 49, 83, 84, 95, 107, 117, 126, 128) Реакция протекает в течение 2 ч при 100° С Избыток реагента оттитровывают солью , Мора с внешним индикатором [Fe (CN)6]8- 3
4 Метанол (см. № 40, 49, 65, 81, 158, 165, 224, 227, 241, 244) в растворе формалина Оставляют на 12 ч Иодид—тиосульфат (этим путем определяют содержание всего формальдегида, содержание отдельных компонентов определяют по разности) 4
5 Молочная кислота (см. № 20, 44, 58, 200, 203) Кипятят 1 ч (образуется уксусная кислота и двуокись углерода) 2 ч при 100° С Иодид—тиосул ьфат 5
6 Глицерин (см. № 3) Иодид—тиосул ьфат 6
7 Этанол (см. № 9, 10, 15, 17, 19, 21, 24, 27, 37, 38, 41, 46, 49—53, 56, 57, 61, 64—66, 69—71, 73, 74, 76, 81, 86, 87, 91, 92, 94, 97, 98, 102—104, 111, 112, 114, 122, 129 131, 133, 139, 140, 144, 145, 148, 149, 152, 155, 158, 162, 171, 185, 188, 195, 196, 198, 202, 211, 212, 223, 225, 233, 234, 237, 240, 246) в эссенциях, настойках и т. п. 2—3 ч Иодид—тиосул ьфат 7
8 Р-Оксимасляная кислота (см. № 67, 115) Окисляется до ацетона Ацетон перегоняют в щелочной раствор иода (см. «Реагенты, содержащие иод», литература 58) 8
Продолжение
п/п 9 10 11 12 13 14 15 16 17 18 19 20 21 22 | Титруе^°е вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
Этанол (см. № 7) в воздухе Этанол (см. № 7) в крови Целлюлоза (см. № 80, 88, ИО, 132, 169, 235) Глицерин (см. № 3) Диэтиловый эфир (см. № 24 , 36, 49 , 54 , 59, 89, 96, 102, 133, 143, 152, 155) Жирные кислоты (см. № 45, 201, 242) Этанол (см. № 7) в крови Пропионовая (см. № 25), масляная кислоты Этанол (см. № 7) Сахар (см. Ns 79, 147, 153, 208) в крови Этанол (см. № 7) в пиве Молочная кислота (см. Ns 5) и ее соли или эфиры Этанол (см. Ns 7) Винная (см. 197, 200, 216), фталевая, салициловая (см. Ns 75, 125) кислоты; сахароза (см. № 68, 75); Р-нафтол Абсорбируют реагентом; затем нагревают 15 мин в колбе, снабженной обратным холодильником Перегоняют в раствор реагента; нагревают в течение 9 ч Кипятят 5 ч (образуется двуокись углерода и вода) 2—3 ч при 100° С Абсорбируют 50%-ной HaSO4, разбавляют до 40%, добавляют Cr2Oj—; нагревают 30 мин при 100° С 30 мин при 100° С (Метод описан выше 10 — см. № 10) Кипятят I ч Окисляют до уксусной кислоты 30 мин при 90° С Перегоняют в реагент; нагревают I ч при 80° С Нагревают 1 ч при 70° С Перегоняют в раствор реагента, разогревающийся при смешении с определяемым веществом Приблизительно двухкратный избыток реагента, концентрированная H2SO4; нагревают 15 мин при 100° С (образуется СО2) Иодид—тиосульфат Иодид—тиосульфат Избыток реагента оттитровывают солью Мора с внешним индикатором Иодид—тиосу л ьфат Иоднд—тиосульфат Иодид—тиосульфат Иодид—тиосульфат Избыток реагента оттитровывают раствором соли железа (II) Иодид—тиосу л ьфат Иодид—тиосульфат Иодид—тиосул ьфат Иодид—тиосульфат Иодид—тиосул ьфат 9 10 11 12 13 14 15 16 17 18 19 20 21 22
185
№ njn Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Л ите. Р<1Ту-Ре
23 Органические вещества в воде (см. № 48) 2 ч при 106—110° С (образуется СО2) Избыток реагента оттитровывают раствором солн железа (II) 23
24 Этанол (см. № 7); диэтиловый эфир (см. № 13) 6 ч при комнатной температуре или 2 ч при 60° С (для этанола; эфир реагирует с более концентрированным реагентом) Нагревают 3 ч в колбе, снабженной обратным холодильником (пропионовая кис до уксусно Иодид—тиосульфат 24
25 Пропионовая кислота (см. № 16) в уксусной кислоте Иодид—тиосульфат лота окисляется й кислоты) 25
26 Изопропанол (см. № 29, 60, 72, 93, 127, 174, 193, 194); 2-бутанол (см. №51,52,64,76,99, 188, 193, 234) (Окисляются до ацетона и бутанона соответственно) Кетоны определяют с реагентами, содержащими иод (см. «Реагенты, содержащие иод», литература 88) 26
27 Этанол (см. № 7) в тканях (Окисляется до уксусной кислоты) Перегоняют; титруют раствором NaOH в присутствии фенолфталеина 27
28 Бензальдегид в лавровишневом водном настое 90 мин (окисляется до бензойной кислоты) Экстрагируют СНС13; титруют щелочью 28
29 Изопропанол (см. № 26) в присутствии этанола (Окисляется до ацетона) Определяют с помощью гидроксиламина (см. «Гидроксиламин», литература 10) Абсорбируют раствором Ва (ОЙ)2, избыток которого оттитровывают кислотой 29
ЗС Дикса нтидр ил мочевина (см. № 31, 106), образующаяся при определении мочевины (Окисляется до СО2) 30
31 Диксантидрилмочевина (см. № 30), образующаяся при определении мочевины (Окисляется до СО2) Избыток реагента оттитровывают раствором соли железа (II) с внешним индикатором [Fe (CN)6]S“ 31
32 Глицерин (см. № 3) в винах и ликерах Перегоняют в раствор реагента; кипятят 2 ч Соль Мора, избыток которой оттитровывают перманганатом 32
33 Гексаметиленнитрамин Нагревают 1 ч при 100° С Иодид—тиосульфат 33
34 Стрихнин (см. № 62) Бихромат и разбавленная H2SO4; 30 мин (образуется нерастворимая соль) Фильтруют, добавляют НС1—KI, титруют тиосульфатом 34
186
Продолжение
№ Титруемое вещество п/Л Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
_— 35 Карбазол в технических материалах 36 Диэтиловый эфир (см. № 13) в смеси с этанолом 37 Этанол (см. № 7) в присутствии изопропанола и ацетона 38 Этанол (см. № 7) в моче, крови и т. п. 39 Нитросоединения (см. № 232) и амины (см. № 183), подобные дифениламину и тринитротолуолу 40 Метанол (см. № 4) в этаноле 41 Этанол (см. № 7) 42 Холестерин «дигитонид» (см. №85), осаждаемый при определении холестерина 43 Глицерин (см. № 3) в винах и‘в напитках, подвергшихся брожению 44 Молочная кислота fe1' № 5) в кР°ви о Жирные кислоты (см. № 14) в крови (после предварительной экстракции) Уксусная кислота; СгО3 и вода; кипятят 1 ч Модификация метода, описанного выше 24 — см. № 24 (Различная техника абсорбции) 30 мин при комнатной температуре (этанол окисляется до уксусной кислоты, изопропанол — до ацетона) Кипятят 20 мин с реагентом, взятым в 20% -иом избытке (Метанол окисляется до СО2, этанол—до уксусной кислоты) 5—10 мин (образуется уксусная кислота и не образуется ацетальдегид) Бихромат калия— H2SO4; AggCfgO?; 15 мин при 124° С или 90 мин при 100° С Перегоняют в реагент; 3 ч 1 ч при 100° С Реагент и бихромат серебра (катализатор); 90 мин при 100° С Уксусную кислоту перегоняют, затем добавляют Zn—NaOH; образующийся аммиак перегоняют в стандартный раствор НС1, избыток которой оттитровывают NaOH в присутствии метилового красного Избыток FeSO4; перегоняют и титруют щелочью в присутствии фенолфталеина Иодид—тиосул ьфат Иодид—тиосульфат СО2 абсорбируют раствором ВаС12— NH4OH; осадок ВаСОз отфильтровывают и титруют рас- твором НС1 Избыток реагента титруют солью Мора с внешним индикатором [Fe (CN)eJ3- Иодид—тиосул ьфат Избыток реагента оттитровывают раствором соли железа (II) Иодид—тиосульфат Иодид—тиосул ьфат 35 36 37 38 39 40 41 42 43 44 45
187
Продолжение
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая об-работка и конечная стадия титрования Литература
46 Этанол (см. W° 7) в крови Выпаривают 15 мин Иодид—тиосульфат ““ —-—. 46
47 И т. п. C-Метильные группы или более (Окисляют до уксус- Избыток реагента 47,59
48 (см. № 119, 120, 138, 161, 163, 173, 176, 178, 183, 190, 218, 219, 231) Определение биохими- ной кислоты) Cr3O3—H2SO4—Н3РО4; восстанавливают гидразином, раствор частично нейтрализуют; уксусную кислоту перегоняют и титруют щелочью в присутствии фенол- фталеина СО2 абсорбируют 48
49 ческого потребления кислорода сточными водами и промышленными отбросами (см. We 23, 90, 137, 142, 147, 159, 182, 191, 192, 217) Метанол (см. № 4); эта- кипятят 2 ч (образуется СО») Нагревают 1 ч при раствором Ва (ОН)2, избыток которого оттитровывают раствором НС1 в присутствии фенолфталеина Добавляют соль же- 49
50 нол (см. № 7); эфир (см. № 13); глицерин (см. № 3) Этанол (см. № 7) в крови 85° С (этанол окисляется до уксусной кислоты, другие — до СО2) Модификация метода, леза (II), избыток которой оттитровывают перманганатом Иодид—тиосул ьфат 50
51 или в выдыхаемом воздухе Смеси этанола (см. We 7) описанного выше10,— см. We 10 (образуется уксусная кислота) Б и х р омат—Н3РО4 Смесь перегоняют 51
52 и н-бутанола (см. We 26) Смеси этанола (см. We 7) (образуется уксусная и масляная кислоты) Этанол окисляется и разделяют между водой и изопропиловым эфиром; титруют щелочью Смесь перегоняют 52 1
53 и бутаиола (см. We 26) Этанол (см. We 7) в барде до уксусной кислоты, а бутанол до масляной кислоты Перегоняют в рас- в соответствии с методом Дюкло и титруют В а (ОН)2 в присутствии фенолового красного Иодид—тиосул ьфат 53
54 Диэтиловый эфир (см. твор реагента. (Метод описан выше21 — см. We 21) Абсорбируют Иодид—тиосульфат 54
55 We 13) после отделения от этанола и альдегидов перманганатом Нафталинсульфокис- реагентом; 3 « Нагревают 45 мин Иодид—тиосул ьфат 55
56 лоты (моио-, ди,- три- и тетра-) Этанол (см. We 7) при 100° С, (образуются СО2 и SO3) Бнхромат—Н3РО4 Иодид—тиосул ьфат 56
(окисляется до уксусной кислоты)
188
Продолжение
№ /п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
57 58 59 60 61 62 63 64 Этанол (см. № 7) в молоке Молочная кислота (см. № 5) в вине и фруктовых соках Диэтиловый эфир (см. № 13) Изопропаиол (см. № 26) Этанол (см. № 7) в хлороформе Стрихнин (см. № 34), бруцин Органические вещества в отходах и иле Смесь этанола (см. We 7) и н-бутаиола (см. № 26) Перегоняют в раствор реагента; 30 мин при 50° С под пониженным давлением Нагревают 1 ч в колбе, снабженной вертикальным холодильником (образуется уксусная кислота) Абсорбируют реагентом; 5 ч 4 ч (образуется ацетон) 1 ч при 85° С Бихромат—разбавленная кислота (образуется нерастворимая соль) Реакцию лучше проводить с 50% -ной H2SO4 Нагревают 10 мин при 100° С Два определения: с двумя реагентами, отличающимися разными концентрациями кислот, или до и после экстракции четыреххлористым углеродом Иодид—тиосульфат Перегоняют и титруют Иодид—тиосульфат FeSO4; ацетон перегоняют в гидрохлорид гидроксиламина; выделяющуюся НС1 оттитровывают едким натром (см. «Гидроксиламин», литература 27) Добавляют соль Мора, избыток которой оттитровывают перманганатом Осадок растворяют в смеси FeSO4—H2SO4, избыток которой оттитровывают бихроматом в присутствии дифениламин— H2SO4 Избыток реагента оттитровывают раствором соли железа (II) Иодид—тиосул ьфат 57 58 60 61 62 63 64 65
189
Продол.
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титроваипя
65 Метанол (см. Хе 4) или Перегоняют в рас- Избыток реагента
этанол (см. № 7) в биологических материалах твор реагента оттитровывают раствором соли железа (III) в присутствии метилового оранжевого
66 Этанол (см. № 7) 1 ч при 40° С Иодид—тиос ул ьфат
67 Р-Оксимасляная кис- (окисляется до Определяют
лота (см. № 8) в крови, моче и т. л. ацетона) иодометрически (см. «Реагенты, содержащие иод», литература 137)
68 Многие соединения, ха- Нагревают 15 мин Частично нейтрали-
растеризующиеся наличием гидроксильных (см. № 209) и карбоксильных групп, например маннит (см. № 75), сахароза (см. 22), адипиновая (см. № 75), бензойная (см. № 75, 125) и янтарная (см. № 75, 79) кислоты или более при 100° С зуют; затем и оди д—тиосу л ьфат
69 Этанол (см. № 7) Кипятят 5 мин Иодид—тиосу льфат
70 Этанол (см. № 7) в ректифицированном бутадиене Кипятят 1 ч
71 Этанол (см. № 7) в пиве Перегоняют в раствор реагента; 24 ч при Иодид—тиосульфат Нейтрализуют; аце-
72 Изопропанол (см. № 26 комнатной температуре (образуется ацетон) тон перегоняют и определяют иодометрически (см. «Реагенты, содержащие иод», литература 166)
73 Этанол (см. № 7) в мышечных жидкостях 5 при комнат- ной температуре Иодид—тиосул ьфат
74 Этанол (см. № 7) 1 ч при 85° С (образуется уксусная кислота) Добавляют соль Мора, избыток которой оттитровывают перманганатом
75 Бинарные смеси, например бензойная, янтарная или адипиновая (см. № 68) кислота — маннит (см. № 68), сахароза (см. № 22) или салициловая (см. № 22) кислота (Два определения с реагентами, содержащими 40%-ную и 80%-ную кислоту) Иодид—тиосул ьфат
76 Этанол (см. № 7); бутанол (см. № 26); гексанол в сивушном масле Иодид—тиосульфат 1
190
Продолжение
№ n/Ч
77
78
79
80
81
82
83
84
85
86
87
88
_ — —
Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
Соечинения, окисляемые Ацетон перегоняют 78
до ацетона (см. № 188, 194) и определяют иодометрически (см. «Реа-
генты, содержащие
иод», литература
170)
Дигидрохлорид атебрин; Ацетатный буферный Фильтруют; в филь- 79
риваноллактат раствор и избыток трат добавляют
бихромата НС1 и титруют
(образуются нерас- тиосульфатом
творимые соли) Иодид—тиосульфат
Многие соединения, 20 мин при 165° С; 80
например сахар (см. добавляют кислоты
№ 18), янтарная (см. № 68) кислота, ацет- и затем 5 мин кипятят
анилид, хинолин а-Целлюлоза (отделен- Кипятят 10 мин Иодид—тиосул ьфат 81
ная от Р- и у-целлюлозы) (см. № 11) Метанол (см. № 4) и эта- 1) 25 мин при 100° С 1) Добавляют соль 82
нол (см. № 7) (образуются муравь- Мора и избыток ее
иная и уксусная опитровывают
кислоты соответ- бихроьатом;
ственно);
2) 15 мин с более 2) Иодид—тиосульфат
концентрированным
реагентом
Углеводороды в резине (образуется СО2) Окисление проводят Перегоняют; титруют 83
(см. № ИЗ, 124, 147) по методу, описанному щелочью
выше47,59— см. № 47 (образуется уксусная
Глицерин (см. № 3) кислота)
2 ч при 90—100° С Избыток реагента 84
оттитровывают солью железа (II)
Глицерин (см. № 3) в мы- 90 мин при 100° С потенциометрически Титруют солью 85
лах и т. п. (после пред- Мора в присутствии
варительного отделения) смеси фениламин—
Холестерин (см. № 42) H2SO4
Реагент и CeIV Иоднд—тиосульфат 86
в крови Этанол (см. № 7) в при- (катализатор) (Окисляют в присут- Перегоняют и титру- 87
сутствии метанола, изопропанола ствии солей Hg" до ют раствором NaOH
уксусной кислоты) в присутствии
Этанол (см. № 7) «-Целлюлоза (см. № 11) Бихромат—HNO3 Кипятят 5 мин фенолфталеина Иодид—тиосул ьфат Иодид—тиосульфат 88 89
(Модификация мето-
да, описанного вы-
ше 81— см. № 80)
191
ПРодолКенщ
№ п/п
89
90
91
92
93
94
Титруемое вещество
Диэтиловый эфир (см.
№ 13) (С2О5)2О
Вода, определение биохимического потребления кислорода (см. № 48)
Этанол (см. № 7)
Этанол (см. № 7)
Изопропанол (см. № 26) во вкусовых веществах
Этанол (см. № 7)
95
96
97
98
99
100
101
Глицерин (см. № 3), этиленгликоль (см. № 167, 226) и диэтиленгликоль (см. № 154, 167, 222)
Диэтиловый эфир (см. № 13) в крови
Следы этанола (не более 0,6%) (см. № 7) в присутствии ацетона и бензола
Этанол (см. № 7) в крови или моче
я-Бутанол (см. № 26), образующийся при гидролизе в присутствии фосфорной кислоты смол, разлагающихся с образованием смесей формальдегид—мочевина— бутанол
Паральдегид в биологических жидкостях Метиленовая синь (см. № 134)
Реагент и условия реакции
Соответствующая обработка и конечная стадия титрования
(Метод описан выше 10 — см. № 10) 15—20 мин при 100° С
Иодид—ти осул ьфат
100 мин при 100° С (Окисляется до уксусной кислоты) (Окисляется до ацетона)
Иодид—тиосул ьфат Иодид—тиосульфат
Иодид—тиосул ьфат
52
53
94, 102, ИЗ
95
Кипятят 20—30 мин в колбе, снабженной
Избыток реагента оттитровывают гексацианоферратом (II) в присутствии дифениламина
Иодид—тиосульфат
96
вертикальным холодильником
[В комбинации с перйодатным методом окисления можно определить первые два компонента (см. «Перйодаты и иодная кислота», литература 14\ Продувают в раствор Иодид—тиосульфат
реагента и окисляют до уксусной кислоты
10 мин Иодид—тиосульфат
(Метод описан вышеее — см. № 65; образуется уксусная кислота)
Перегоняют в раствор реагента; кипятят 45 мин в колбе, снабженной вертикальным холодильником (образуется уксусная кислота) (Окисляется до уксусной кислоты) В воде; бихромат (образуется нерастворимая соль)
Избыток реагента оттитровывают солью железа (II) в присутствии метилового оранжевого
Перегоняют; титруют раствором NaOH в присутствии фенолфталеина
Иодид—тиосул ьфат
Избыток реагента оттитровывают в фильтрате; иодид—тиосульфат
97
98
99
100
101
103
192
Продолжение
Xt н/п
102
103
104
105
106
107
108
109
110
7
Титруемое вещество
Реагент и условия реакции
Соответствующая обработка и конечная стадия титрования
Литература
Этанол (см. № 7), ди-этиловый эфир (см. № 13) в воздухе
Этанол (см. № 7)
Этанол (см № 7)
Глюкоза (см. № 116, 160)
Пропускают через раствор реагента;
1—2 ч при 100° С или 1—18 ч при комнатной температуре (в зависимости от концентрации реагента; концентрация H2SO4 должна быть выше при определении эфира) Перегоняют в раствор реагента; 20 мин при 100° С
(Окисляют до уксусной кислоты) (Модификация метода, описанного выше Б3, — см. № 53)
60—80 мин при 100° С
Иодид—тиосульфат
Иодид—тиосульфат
Диксантидрилмочевина (см. № 30), образующаяся при определении мочевины
Глицерин (микрометод) (см. № 3)
Бихромат—HNO3; 20 мин при 100° С
Ацетат натрия (см. № 175) в присутствии солей других органических кислот (при анализе смеси кислот методом этерификации метанолом и последующим омылением щелочью)
Некоторые четвертичные аммониевые соли (см. № 245) в антисептиках
Целлюлоза (см. № 11) в сырой фибре (после предварительной экстракции)
1) Бихромат и 50%-ная H2SO4 (окисляются все компоненты, исключая ацетат);
2) Бихромат серебра и 60% -ная кислота (окисляется также ацетат) Бихромат—разбавленная кислота; 24 ч
Кипятят 1 ч
Добавляют соль Мора; избыток Fe11 оттитровывают перманганатом Иодид—тиосульфат; или добавляют железо (II), избыток которого оттитровывают перманганатом Избыток реагента оттитровывают гексацианоферратом (II) в присутствии дифениламина Избыток реагента оттитровывают гексацианоферратом (II) в присутствии дифениламина Иодид—тиосульфат; разность эквивалентна содержанию ацетата
Избыток реагента оттитровывают в фильтрате тиосульфатом
Избыток реагента оттитровывают солью Мора в присутствии ферроина
104
105
106
107
108
109, 114
ПО
111
112
М. Р. ф, Эшворт
193
№ П/П Титруемое вещество Реагент и условия реакции
111 Этанол (см. № 7) в вине Кипятят 5 мин
112 Этанол (см. № 7) в крови или моче Пропускают в раствор реагента; 2 ч при 50° С; 6 ч при 37° С или 10 ч при 25° С
113 Углеводороды в резине (см. № 82) 1 ч при 100° С (1 моль изопрена соответствует 1 моль кислоты; выход СНдСООН—75%)
114 Этанол (см. № 7) в крови Бихромат—HNO3; 1 ч (образуется уксусная кислота)
115 (j-Оксимасляная кислота (см. № 8) Кипятят 45 мин (образуется ацетон)
116 Глюкоза (см. № 105) 30 мин при 100° С (образуется СО2)
117 Глицерин (см. № 3)
118
_______ nP°doAwt, |;
Соответствующая об- п работка и конечная J"’1 стадия титрования :
Алкилцеллозольвы, HOCH2CH2OR в паровой фазе или в разбавленном водном растворе
119
Некоторые концевые метильные группы (см. № 47), например в кротоновой кислоте или 1-метилциклогексан-3-он
120
C-Метильные группы (см. № 47)
Бихромат—HNO3; 20 мин при 100° С (образуется СО2)
15 мин при 100° С (для R = СН3 или С2НЬ)
120 мин при 100° С (для R = С4Н9)
240 мин при 100° С (для R = С3Н,) Кипятят 90 мин в колбе с вертикальным холодильником (образуется уксусная кислота)
(Модифицированный метод окисления, описанный выше47.® — см. №47;
выход уксусной кислоты—75—85% от теоретического)
Иодид—тиосульфат Иодид—тиосульфат
Перегоняют; титруют раствором NaOH в присутствии фенолфталеина
Иодид—тиосул ьфат
Ацетон определяют иодол-етрически (см. «Реагенты, содержащие иод», литература 223)
Избыток реагента оттитровывают раствором соли Мора с внешним индикатором гексацианоферратом (III)
Избыток реагента оттитровываюг гексацианоферратом (II) в присутствии дифенилбензи-дина
Иодид—тиосульфат
117
118
119
120
121
122
Перегоняют; титруют раствором Ва(ОН)2 в присутствии фенолфталеина или определяют иодометрически смесью иодат— иодид
Перегоняют; титруют щелочью
123
124
194
Продолжение
К» Титруемое вещество •'п Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
[2[ Гидрохлорид хииакрина 122 Этанол (см. № 7) в хло-реформе 123 Общее содержание флавинов в трипафлавине 124 Углеводороды в резине (см. № 82) 125 Салициловая (см. № 22) и бензойная (см. № 68) кислоты 126 Глицерин (после разделения путем осаждения с вольфраматом натрия) (см. № 3) 127 Изопропанол (см. № 26) 128 Глицерин (см. № 3) в су-позитории 129 Этавол (см. № 7) в желудочном соке 130 Диоксан 131 Этанол (см. № 7) в крови 132 р. и у-Целлюлоза в измельченной древесной пульпе после удаления “-формы (см. № 11) 133 Этанол (см. № 7); ди-этиловый эфир (см. № 13) Ацетатный буферный раствор; бихромат (образуется нерастворимая соль) Бихромат—HNO3; встряхивают 3 мин (образуется уксусная кислота) Ацетатный буферный раствор; бихромат; 1 ч при комнатной температуре (Метод описан выше ден удовлет! 1) Бихромат -40% -на я H2SO4 (окисляется только первая кислота) 2) Бихромат—80% -иая кислота (окисляются обе кислоты) 20 мин при 100° С (Окисляется до ацетона) 1 ч при 100° С 30 мин при 100° С Нагревают 1 ч в запаянной трубке при 100° С 25—30 сек (Модификация метода, описанного выше 76 — см. № 74) Пропускают через раствор реагента в течение 5 ч Избыток реагента оттитровывают в фильтрате иодид— тиосульфатом Иодид—тиосульфат Избыток реагента оттитровывают в фильтрате иодид— тиосульфатом 17 — см. № 113; най-зорительным) Иодид—тиосульфат или непрореагировавший реагент оттитровывают солью железа (II) Избыток реагента оттитровывают солью Мора в присутствии дифенилами- на—H2SO4 Определяют иодометрически Иодид—тиосульфат Избыток реагента оттитровывают солью Мора в присутствии конго красного до светло-фиолетового окрашивания Иодид—тиосульфат Соль Мора, избыток которой оттитровывают перманганатом Избыток реагента оттитровывают солью Мора в присутствии дифениламина — H2SO4 Иодид—тиосульфат 125 126 127 128 129 130 131 132 133 134 135 136 137
195
Предо.
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования
134 Метиленовая синь (см. № 101) Нейтральный раствор; бихромат Избыток реагента оттитровывают в фильтрате иодид— тиосульфатом
135 —ОС2НБ-, —СНСН3-и —СН2СН2ОН-группы До 155° С (образуется уксусная кислота) (Модификация метода, описанного выше47,59, — см. № 47) Перегонку начинают при 135° С н дистиллят титруют NaOH в присутствии фенолфталеина
136 Липиды в крови Реагент, используемый в методе, описанном выше 7В, — см. № 74; добавляют AgNO3; 2 ч при 130° С Иодид—тиосульфат
137 Биохимическое потребление кислорода сточными водами (см. № 48) Бихромат — H2SO4— Н3РО4; кипятят и частично выпаривают Иодид—тиосул ьфат
138 C-Метильные группы (см. № 47) Окисляют, как в методе, описанном выше47,59, — см. № 47 (образуется уксусная кислота) Уксусную кислоту перегоняют без предварительного восстановления непрореагировавшего бихромата гидразином
139 Этанол (см. № 7) в вине Перегоняют в раствор реагента; 15 мин. (Модификация метода, описанного выше12, — см. № 12) Перегоняют в раствор реагента; 75 мин при 100° С Fe11, избыток которого обратно оттитровывают бихроматом в присутствии фенил-амина — H2SO4
140 Этанол (см. № 7), образуемый в процессе гидролиза в присутствии щелочей при определении диэтилфталата Иодид—тиосульфат
141 Протеин в инсулине 15 мин при 100° С Иодид—тиосульфат
142 Биохимическое потребление кислорода сточными водами (см. № 48) Бихромат — H2SO4 — Н3РО4; селеновый катализатор; 60 мин при 145° С Иодид—тиосульфат
143 Низшие спирты (см. № 2), диэтиловый эфир (см. № 13); ацетальдегид (см. № 198, 239) Варьируют концентрацию H2SO4 (при анализе бинарных смесей) (окисление главным образом протекает до уксусной кислоты) Соль Мора, избыток которой оттитровывают бихроматом
144 Этанол (см. № 7) Кипятят 5 мин в колбе, снабженной вертикальным холодильником (образуется ацетальдегид) Иодид—тиосул ьфат
196
Продолжение
м л и 145 146 147 148 149 150 151 152 153 154 Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
Этанол (см. № 7) Морфин (см. № 150) Биохимическое потребление кислорода (см. № 48), например промышленными или сточными водами [изучены также методы определения многих чистых соединений, как сахара (см. № 18), фенолы, аминокислоты, углеводороды (см. № 82)] Этанол (см. № 7), образуемый в процессе гидролиза при определении этилуретаиа в жидкостях тела Этанол (см. № 7) Морфии (см. № 146) 4-Хлорацетаиилид в фенацетине Этанол (см. № 7); диэтиловый эфир (см. № 13) Сахара (см. № 18) Днэтиленгликоль (см. „ Н5) в водных растворах F 15—30 мин при 100° С Окисляется до ф - морфина Кипятят 2 ч в колбе, снабженной вертикальным холодильником Пропускают в раствор реагента Пропускают в раствор реагента; 20 мин 15 мин (Превращают в CrOCl) 24—36 ч при комнатной температуре или 3—4 ч при 37° С Бихромат — Na2CO3; нагревают 5 мин Кипятят 30 мин в колбе, снабженной вертикальным холодильником Иодид—ти осу л ьфат Непрореагировавший реагент оттитровывают солью свинца (II) амперометрически Избыток реагента оттитровывают солью железа (II) в присутствии ферроина Иодид—тиосульфат Иодид—тиосульфат Избыток реагента оттитровывают солью железа (II) потенциометр ически или в присутствии смеси дифениламин — H2SO4 Вводят в смесь NaOH—Н2О2 и титруют солью ртути (II) при pH 1,5—2 (буферный раствор: цитрат — HNO3) в присутствии дифенил карбазона Избыток реагента Оттитровывают солью железа (II) в присутствии ди-финилаитраниловой кислоты H2SO4; затем иодид—тиосульфат Иодид—тиосульфат 149 150 151 152 153 154 155 156 157 158
197
Предо
№ n/п Титруемое вещество Реагент н условия реакции Соответствующая обработка и конечная стадия титрования
155 Этанол (см. № 7) и ди-этиловыйэфир (см. № 13) в воздухе или биологической среде Пропускают через смесь бихромат—HNO3 (этанол окисляется до уксусной кислоты); затем через бихромат—H2SO4 и HNO3 30 мин при комнатной температуре (окисляется эфир) Иодид—тиосульфат
156 Метониевые соединения соли Рейнеке Избыток бихромата (образуются нерастворимые соли) Избыток реагента оттитровывают в фильтрате
157 Низшие спирты (см. № 2), разделенные методом распределительной хроматографии 30 мин при 22—24° С Иодид—тиосульфат
158 Метанол (см. № 4) и этанол (см. № 7), например в настойках 1) Метанол окисляют до СО2 и этанол — до уксусной кислоты; затем добавляют Ag2SO4, окисляют оба спирта до СО2 Избыток реагента оттитровывают солью железа (II) потенциометрически
159 Биохимическое потребление кислорода сточными водами коксовых заводов (см. № 48) Би хромат — H2SO4 — Н3РО4; 5 мин при 100° С Соль Мора, избыток которой оттитровывают бихроматом в присутствии дифе-ииламиисульфо-ната бария
160 Глюкоза (см. № 105) Кипятят 10—12 мин Иодид—ти осул ьфат
161 C-Метильные группы (см. № 47) (изучение процесса окисления) Окисление проводят по методу, описанному выше 124, — см. № 120 (Выход уксусной кислоты 62—99%) Перегоняют и титруют щелочью
162 Этанол (см. № 7) в крови (Окисляют до уксусной кислоты) Избыток реагента оттитровывают солью железа (II) в присутствии фер-роииа или диметила-минсульфоната бария
163 С-Метильиые группы (см. № 47), присоединенные к длинным углеводородным цепям (Методика окисления описана выше47, 59— см. № 47, температуру поднимают до 135° С; выход уксусной кислоты 70— 97%) Перегоняют; титруют щелочью в присутствии фенолфталеина
164 Г ексадецилтриметил-бромид аммония Бихромат и немного НС1 Избыток реагента определяют в фильтрате иодид—тиосульфатом
198
Продолжение
X" п’п
ТитрУеМое
вещество
165
166
167
168
Метанол (см.„ № 4) растительный стерин, осажденный в виде ди-гитонида при их определении
Этиленгликоль (см.
95) и диэтиленгликоль (см. № 95) (изучение процесса окисления) Углеводы; многие карбоновые кислоты (см. № 183) и полиоксисоединения
169
Целлюлоза (см. № 11)
170 Изониазид
171 Этанол (см. № 7)
172 Крахмал и крахмалистые продукты; лау-риламинацетат
173
C-Метильные группы (см. № 47)
174 Изопропаиол (см. Ns 26) в декстране и растворе декстрана
175 Ацетат бария (см. № 108), образующийся из уксусной кислоты, которая получается в процессе определения ацетатов перегонкой
176 г кислот°й C-Метильные группы (см. № 47)
177
Лигнин пульпе H2SO4 ’Кения
в отбеленной после обработки с целью разло-ДРугих веществ
Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
6 ч при 60° С Иодид—тиосульфат 170
4 ч при 100° С Избыток реагента оттитровывают Felll в присутствии ферроина 171
Реагенты смеши- Иоди д—ти осул ьфат 173
вают с 12,5%, 25%-ной и 50% -ной H.2SO4; 2 ч при 100° С
10 мин смешивают с раствором реагента; при смешении происходит разогре- Избыток реагента оттитровывают солью Мора потенциометрически 174
ванне
(Метод описан вы- 175
ше174 — см. Ns 168)
Ьихромат — H2SO4 — KI (действует эффективнее иода); слегка подогревают Н епрор еа ги р ова в -ший иод оттитровывают тиосульфатом 176
Перегоняют в раствор Иодид—тиосульфат 177
реагента; 12 ч
30 мин при 120° С или 2 ч при 100° С (для крахмала); 1 ч при 120е С (для ацетата) Соль Мора, избыток которой оттитровывают перманганатом; или избыток реагента определяют колометрически 178
90 мин при 130° С (образуется уксусная кислота) MgSO4, перегоняют и титруют раствором NaOH в присутствии фенолфталеина 179
5 мин при 100° С (образуется ацетон) Перегоняют и определяют иодометрически (см. «Реагенты, содержащие иод», литература 316) 180
Избыток бихромата (образуется осадок хромата бария) В фильтрат добавляют смесь кислоты — Г; титруют тиосульфатом 181
Окисляют до уксусной кислоты Насыщенный раствор Na2SO4; 182
К осадку добавляют перегоняют; титруют раствором NaOH в присутствии фенолфталеина Избыток реагента 183
реагент; 1 ч при 100° С оттитровывают солью Мора в присутствии ферроина
199
Продолу
№ п/п
178
179
180
181
182
'83
184
185
186
187
188
189
Титруемое вещество
С-Метильиые группы (см. № 47) (микрометод)
Г емицеллюлоза
Индиго; индигосульфо-кислота
Низшие спирты (см № 2)
Биохимическое потребление кислорода поверхностными водами (см. № 48) C-Метильные группы (см. № 47) например в аминах (см. № 39), кетонах, кислотах (см. № 168), спиртах (см. № 2) (изучение окисления) Глюконовая кислота Этанол (см. № 7) в крови
Гидрохинон (см. № 213, 243), полученный в процессе гидролиза при определении арбутина (см № 213)
2,2,6,6-Тетрабисок-симетилцнклогексан-1 -он и 2,2,6,6-тетра-бис-оксиметилциклогексан-1-ол
Ацетон (см. № 77), бутанол (см. № 26), этанол (см. № 7)
Соли холина
Реагент н условия реакции Соответствующая обработка и конечная стадия титрования Л’(|„ Р;
60—90 мин при 165— 175°С (образуется уксусная кислота) Перегоняют; титруют раствором NaOH в присутствии фенолфталеина 184
В горячий раствор добавляют реагент Соль Мора, избыток которой оттитровывают перманганатом 18и
1—30 мин при комнатной темпера- туре; используют различные концентрации H2SO4 (окисляют до изатина) Иодид—тиосульфат или избыток реагента оттитровывают солью железа (II) 186
5 мин\ температура при смешении образца и реагента повышается Избыток реагента оттитровывают солью Мора потенциометрически 187
(Метод описан выше 161 — см. № 147) 188
15 мин — 4 ч при 120° С (образуется уксусная кислота)
Иодид—тиосульфат (Модификация метода, описанного выше88,—см. № 87)
(Окисляется до хинона)
4 ч при 95—100° С (образуется глутаровая кислота и СО2)
1) 5 мин при 100° С; 2) 15 мин при 100° С (Применяют H2SO4 различной концентрации)
3,5—4 ч при 100° С (—СН2ОН-группы окисляются до -СООН)
Перегоняют; титруют раствором NaOH в присутствии бромтимолового голубого
!89
Перегоняют с паром в смесь I-—кислота и титруют тиосульфатом
Арсенит, избыток которого оттитровывают бромом или иодом
Иодид—тиосульфат
Избыток реагента оттитровывают солью Мора в присутствии дифеиил-амииосульфоната
/Л 191
192
193
195, 2"'
19
200
Продолжение
№ n/n
190
191
192
193
194
195
196
197
198
199
Титруемое вещество
Реагент и условия реакции
Соответствующая обработка и конечная стадия титрования
Литература
г-Метильные группы
(см. № 47)
Сточные воды, изучение биохимического потребления кислорода (см. № 48)
Биохимическое потреб-ление кислорода водами нефтехимических заво-дов (см. № 48)
Изопропанол (см. № 26) и 2-бутанол (см. № 26) в вине и других фермен-татативных жидкостях
Ацетон (см. № 77) и изопропанол (см. № 26)
Этанол (см. № 7) в фармацевтических препаратах
Этанол (см. № 7) в крови
Тартраты, винная кислота (см. № 22)
Этанол (см. № 7) и ацетальдегид (см. № 143) в растительных тканях
Этоксильные группы в некоторых кремний- и алюминийорганических соединениях
(Окисляются до уксусной кислоты)
Ag2SO4 и H2SO4;
1 ч, затем добавляют реагент и кипятят 15 мин в колбе, снабженной вертикальным холодильником Кипятят 1 ч в колбе, снабженной вертикальным холодильником; затем добавляют Ag2SO4 и кипятят 1 ч
2 ч (окисляется до ацетона и бутанона соответственно)
2
ч при комнатной температуре, (изопропанол окисляется до ацетона)
(В сочетании с гипобромитным методом применяется для определения обоих
компонентов)
Кипятят 15 мин в колбе, снабженной обратным холодильником
Перегоняют в раствор реагента;
25—30 мин
45 мин при 100° С
Перегоняют в раствор реагента
Кипятят 30 мин в колбе, снабженной обратным холоднль-
ником
Избыток реагента восстанавливают
Н20.2; кислоту перегоняют и титруют Соль Мора, избыток которой оттитровывают перманганатом
Избыток реагента оттитровывают солью Мора в присутствии ферроина
Общее содержание кетонов определяют иодометрически (см. «Реагенты, содержащие иод», литература 361); ацетон определяют колориметрически
Оттитровывают избыток щелочного раствора иода
Избыток реагента оттитровывают солью Мора в присутствии фенилантраниловой кислоты Иодид—тиосульфат
Избыток реагента оттитровывают гидрохиноном потенциометр ически Иодид—тиосул ьфат (ацетальдегид отдел ь-
но определяют колориметрически) Иодид—тиосул ьфат
197
198
199
200
201
202
203
204
206
207
201
^Родолллр, —
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования «Пн-!,,, Рату Ра
200 Молочная (см. № 5), винная (см. № 22) кислоты При 100° С Избыток реагента оттитровывают солью железа (И) в присутствии ферроина 20t
201 Жирные (см. № 14), смоляные и нафтеновые кислоты в жирах и мылах (для характеристики кислот) (Методи ка окисЛенин описана вы-ше47, 59 _ см № 47. образуется уксусная кислота) Перегоняют с паром и титруют раствором кон 209
202 Этанол (см. № 7) в крови Перегоняют в раствор реагента под давлением 1 мм pm. ст.\ 1 мин Иодид—тиосульфат 210
203 Молочная кислота (см. № 5), образуемая при гидролизе а-хлорпропи-оновой кислоты в присутствии солей ртути (II) и HNO3 Бихромат; 5 мин Избыток реагента восстанавливают солью железа (II); кипятят 15 мин в колбе, снабженной обратным холодильником. Окисление сопровождается образованием пировиноградной кислоты, которая реагирует с Hg11, образуя zHg4 /СОСООН °х XHgz xHgNO3 добавляют KI, выделившийся КОН оттитровывают раствором НС1 в присутствии фенолфталеина (см. «Соединения ртути (II)», литература 145) 211
204 «Акаприн» — N, N-бис-(N-метилхинолинмоче-вина)-метилсульфат Избыток бихромата; 15 мин при комнатной температуре Избыток реагента оттитровывают в фильтрате иодид — тиосульфатом 212 213 214
205 1-Фенил-2, З-диметил-4-пирролидинил-5-пиразо-лон в медицинских препаратах Кипятят 1 ч в колбе, снабженной обратным холодильником Иоднд—тиосульфат
206 Продукты омыления ацетобутирата целлюлозы Кипятят 1 ч в колбе, снабженной обратным холодильником Иодид—тиосул ьфат; или образующуюся кислоту перегоняют и титруют щелочью
202
Продолжение
ТЛ титруемое вещество п,'П Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
207 1,4-Дигидразинфталазин 908 Сахара (см. № 18), раз-z [елейные методом бумажной хроматографии 909 Поверхностно-активные полимеры, получен- ные на основе эти-леноксида [определение числа эпоксидных связей в комбинации со спектрофотометрическим определением — ОН-групп (см. № 68) посредством (NH4)2 Се (NO3)e] 210 Трихлорбензол в воде, экстрагированный эфиром 211 Этанол (см. № 7) в жидкостях организма 212 Этанол (см. № 7) в целлозольве и т. п. 213 Гидрохинон (см. Ns 186), образуемый при гидролизе арбутина (см. № 186) в процессе его определения в присутствии кислот 214 Гексахлорид бензола 21^ Пентахлорфенол в продуктах Винная кислота (см. 22) (.изучение процесса окисления) Разбавленная H2SO4 и бихромат (образуется нерастворимая соль) 1 ч при 95° С Кипятят 60—90 мин Окисляют до хлора Перегоняют в раствор реагента; 8 ч Переносят потоком азота в раствор реагента; 30 мин Окисляют до хинона 20 мин при 130— 135° С (реакция сопровождается образованием хлора) Нагревают с СгО3 (образуется хлор) 28—29° С (Очевидно, первонач реакцией являе тартроновой кислот изменение ее до мез Избыток реагента оттитровывают в фильтрате иодид— тиосульфатом Иодид—тиосул ьфат Иодид—тиосул ьфат Переносят с воздухом в раствор Cdl2 и тнтруют тиосульфатом или определяют колориметрически Иодид—тиосульфат Иодид—тиосульфат Перегоняют с паром, восстанавливают Zn—H,SO4, таким образом получается гидрохинон, который титруют Се (SO4) 2 [см. «Металлы», литература 98 и Том 1, «Соединения церия (IV)»; литература 80] Хлор с воздухом перегоняют и определяют иодометрически Пропускают через раствор и титруют тиосульфатом Иодид—тиосульфат альной быстрой тся образование ы, затем медленное оксалиевой кислоты) 215 216 217 219 220 221 222 223 224 225
203
№ п/п
217
218
219
220
221
222
223
224
225
226
204
Продолиь^
Титруемое вещество Реагент н условия реакции Соответствующая обработка и конечная стадия титрования •Яит „ Рат, Ра
Биохимическое потребление кислорода сточными водами (см. № 48) C-Метильные группы (см. № 47) в алкилбен-золах С-Метнльные группы (см. № 47) Этиленокси- и пропи-леноксн-группы в по-лиалкилепгликолях Реагент и Ag2SO4 (катализатор); кипятят 1 мин 3 ч при 130° С (образуется уксусная кислота) Предварительно нагревают от 125 до 170° С в колбе, снабженной вертикальным холодильником, или сразу же перегоняют (Исследованы различ влияние различных вость выходов у Окисление проводят, как описано выше47’59, _ см № 47 (образуется 2СО2 и СО2 с уксусной кислотой соответственно) 20 мин при 115° С (образуется СО2) Описано два определения с H2SO4 различной концентрации; 2 ч при 100° С Пропускают в бихромат—HNO3 (Метод описан выше ве — см ggj Не слишком концентрированная H2SO4 (50% -ная лучше, чем концентрированная) В водный экстракт добавляют реагент (образуется уксусная кислота) 90 мин при 100° С Избыток реагента оттитровывают солью Мора в присутствии ферроина Перегоняют и титруют раствором NaOH в присутствии фенолфталеина Перегоняют и титруют раствором NaOH в присутствии фенолфталеина -те методики; изучено факторов на устойчи-ксусной кислоты) Уксусную кислоту перегоняют и титруют (СО2 определяют в абсорбционных трубках) 226 227 228 229
Тетрафенилбораты Днэтиленгликоль (см. № 95) и триэтнленгли-коль в водных растворах Этанол (см. № 7) в крови Метанол (см. № 34) Этанол (см. № 7) в смесях, содержащих ароматические растворители Различные вещества, например этиленгликоль (см. № 95) Избыток реагента оттитровывают раствором соли железа (II) в присутствии ферроина Иодид—тиосульфат Иодид—тиосульфат Иодид—тиосульфат Иодид—тиосул ьфат в аликвотных частях Избыток реагента оттитровывают солью Мора амперометрически 230, 238 231 232 233 234 235
Продолжение
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
227 Метанол (см. № 4) Реагент в двукратном избытке; кипятят 10 мин в колбе, снабженной обратным холодильником Избыток реагента оттитровывают солью Мора в присутствии фенил-антр аниловой кислоты 236
228 Оценка эфирных масел и специй Перегоняются в раствор реагента Иодид—тносул ьфат 237
229 Органические вещества в глине СгО3 и H2SO4; кипятят Б мин Вода; титруют раствором соли железа (II) амперометрически 239
230 Индигокармин Оставляют в темном месте до исчезновения голубого окрашивания Иодид—тиосул ьфат . 240
231 С-Метнльные группы (см. № 47) например в фенобарбитале, пирамидоне (Метод описанный вышелв, — см. № 47, но используется модифицированная аппаратура142,189 — см. № 138, 183) 241
232 Нитрозо- и нитросоединения (см. № 39) СгО3 и H2SO4; 30 мин при 150° С (образуется HNO3) Разбавляют, подщелачивают и восстанавливают сплавом Деварда до аммиака; перегоняют в токе азота в НС1 и обратно оттитровывают в присутствии метилового красного или метиленового голубого 242
233 Этанол (см. № 7) в крови (после разделения дистилляцией) Перегоняют в смесь бихромат—HNO3 Иодид—тиосульфат 243
234 Этанол (см. № 7); пропанол; н-бутанол (см. № 26) Различные реагенты, отличающиеся различной концентрацией кислоты и бихромата; 1 ч при 100° С (30 мин цля изопропанола) (Изучен процесс окисления и возмож- Соль Мора, избыток которой оттитровывают бихроматом в присутствии дифенила-минсульфоната бария 245
235 Целлюлоза (см. Кв 11) (предварительно удаляют протеин и лигнин) ности анализа продуктов реакции) 90 мин при 100° С Сульфат железа, избыток которого оттитровывают перманганатом 246
205
Продолжение
№ п/п Титруемое вещество Реагент и условия реакций Соответствующая обработка и конечная стадия титрования — Литература
236 Различные органические В реакции с 50% -иой СО2 пропускают ——. 247
237 соединения Этанол (см. № 7) в инъ- H2SO4 или НС1О4 наблюдается полное окисление анализируемых веществ до со2 2 ч при 55—60° С в раствор В а (ОН), покрытый слоем пентана для предохранения от влияния атмосферного СО2; избыток Ва(ОН)2 оттитровывают кислотой Иодид—тиосульфат 248
238 екционных растворах 2,2'-Сульфонил- и 15 мин при 100° С Иодид—тиосульфат 249
239 2,2'-сульфиннлдиэтанол, образующиеся при окислении 2,2'-тиодиэтанола Альдегиды (см. № 2), на- (образуется сульфо-нилдиуксусная кислота) 10 мин при 100° С; Обратное титрова- 251
240 пример формальдегид (см. № 244), ацетальдегид (см. № 145), парахлор альдегид Этанол (см. № 7) в раз- (15 мин для СН3СНО) Перегоняют; добав- ние солями железа (II) в присутствии фенилантраннловой кислоты Иодид—тиосульфат 252
241 личных ферментах Метанол (см. № 4) в сме- ляют СгО3; 1—2 мин 30 мин при 100° С Иодид—тиосульфат 253
242 сях с формальдегидом (удаляемым окислением до НСООН и абсорбцией в ионообмен-нике) Жирные кислоты (см. 1 ч при 100° С Иодид—тиосул ьфат 254
243 244 № 14) (экстрагированные раствором КОН) Гидрохинон (см. № 186) Формальдегид (см. Нагревают 45— Иодид—тиосульфат Иоднд—тиосульфат 255 256
24Б № 239); муравьиная кислота (см. № 1); метанол (см. № 4) (все окисляются до СО2) Четвертичные аммоние- 60 мин в колбе, снабженной обратным холодильником (В случае необходимс определяют отдельно делить содержание Бихромат >стн НСНО и НСООН что позволяет опре-2Н3ОН по разности) Избыток реагента 257
246 вые (соли см. № 109) Этанол (см. № 7) в кис- (образуется осадок) 20 мин в фильтрате оттитровывают смесью нодид—тиосульфат Иодид—тиосул ьфат 258
247 лом молоке и моче (после разделения перегонкой) Лимонная и щавелевая кислоты, осажденные солями кальция при анализе ферментативных смесей Иодид—тиосульфат 259
206
содержащегося в крови. Один пример 1Б7 дается по окислению сППР полной 'среде. Образование нерастворимых бихроматов в основ-в ш происходит в слабокислой или нейтральных средах. ^^Соответствующая обработка и конечная стадия титрования. j в большинстве случаев избыток бихромата определяют одним ИЗ следующих способов.
И 1) Добавление иодида и кислоты, когда среда нейтральная или лабокислая, последующее титрование выделившегося иода тио-С„Льфатом обычно в присутствии крахмала.
СУ 2) Прямое титрование солями железа (II).
3) Добавление определенного количества Fe11 и обратное титрование избытка реагента перманганатом.
4) Прямое титрование гексацианоферратом (II).
5) Титрование соединениями свинца (II) или гидрохиноном.
2. Определение продуктов реакции. 1) Двуокись углерода, обра
зующуюся при полном окислении анализируемого вещества, определяют поглощением раствором Ва (ОН)а и последующим титрованием его избытка.
2) Ацетон, образующийся при окислении изопропанола или р-оксимасляной кислоты, а также кетоны из других вторичных спиртов определяют путем взаимодействия с избытком иода (в щелочной среде) или гидроксиламина.
3) Уксусную кислоту, которую обычно отгоняют из окисляемой смеси, титруют щелочью в присутствии фенолфталеина.
4) Хлор, образующийся при окислении хлоридов, определяют
иодометр ически.
ЛИТЕРАТУРА
I. McN a i г D. S., Chem. News, 55, 229 (1887).
2. Bourcart Е., Bull. soc. ind. de Mulhouse, 558 (1889).
3. H e h п e r O., J. Soc. Chem. Ind. (London), 8, 4 (1889).
4. Blank O., Finkenbeiner H., Ber., 39, 1326 (1906).
5. P a s s 1 e r J., abstract in Z. anal. Chem., 47, 321 (1908).
6- Steinfels W., •Seifensieder—Ztg., 37, 793 (1910).
7. Hoepner K., Z. Nahr. Genussmittel, 41, 193 (1921).
8- L u b 1 i n A., Klin. Wochschr., 1, 894 (1922).
9. Spatz R., Arch. Hyg., 91, 315 (1922).
0- Widmark E. M. P., Biochem. Z., 131, 473 (1922).
11. В г а у M. W., Andrews T. M., Ind. Eng. Chem., 15, 377 (1923). Fachini S„ Chem. Trade, J., 73, 127 (1923).
3. S h a f f e r P. A., R о n z о n i E., J. Biol. Chem., 57, 741 (1923).
’• V a s i 1 e w s k a j., Trav. inst. M. Hencki No. 28 (1923).
°- В i 1 d s t e n N. V., Biochem. Z„ 146, 361 (1924).
“• Fyleman E„ J. Soc. Chem. Ind. (London), 43, 142T (1924).
1Я т °°s L-i Ann. fals. et fraudes, 17, 410 (1924).
IQ v a e r I D. G. C., Arch, neerland. physiol., 9, 132 (1924).
20 u a b 0 f G- Bull. sOc- chim. Belg., 34, 328 (1925).
91' fl a n s.e n F-, Tidskr. Kjemi og Bergvesen, 5, 172, 187 (1925).
22* t - r t * n * M., Nourisson A., Ann. fals. et fraudes, 18, 235 (1925).
2з" a 5 u e 1 K., Wagner C., Z. anal. Chem., 67, 16 (1925).
(1926)П 6 У W. E., Dawson В. B., Sci. Proc. Royal Dublin Soc., 18, 199
207
24. v. S о m о g v i E., Z. angew. Chem., 39, 280 (1926).
25. Baum F., Chem. Ztg., 51, 517, 538 (1927).
26. C a s s a r H. A., Ind. Eng. Chem., 19, 1061 (1927).
27. G e t t 1 e r A. O., Tiber A., Arch. Path. Lab. Med., 3, 75 (1927).
28. Morvillez F., Defossez M., J. pharm. chim., 6, 204 (1927).
29. N о e t z e 1 O., Z. Untersuch. Lebensm., 53, 388 (1927).
30. В о i v i n A., Bull. soc. chim. biol., 10, 684 (1928).
31. Cordebard H., Bull. soc. chim. biol., 10, 461 (1928).
32. F e г г e L., Bourges J., Chimie et Industrie, Special Ns 775, April (19281
33. Rae J., Pharm. J., 120, 71 (1928). л
34. R ae J., Pharm. J., 120, 270 (1928).
35. S c h w e п к E., W a n к о L., Z. anal. Chem., 74, 168 (1928).
36. S p e n c e r G. C., J. Assoc. Offic. Agr. Chem., 11, 360 (1928).
37. A d a m s C. A., Nicholls J. R., Analyst, 54, 2 (1929).
38. Evans J., Jones A. O., Analyst, 54, 134 (1929).
39. F r i e d e m a n n F., Z. ges. Schiess. u. Sprengstoffw., 24, 208 (1929).
40. К e 11 1 e S., Chemist—Analyst, 18, 7 (1929).
41. S e m i c h о n L., F 1 a n z у M., Ann. fals. et fraudes, 22, 139 (1929).
42. О к e у R„ J. Biol. Chem., 88, 367 (1930).
43. Semichon L., F 1 a n z у M., Ann. fals. et fraudes, 23, 583 (1930).
44. К e r v e 1 1 O., Biochem. Z., 235, 101 (1931).
45. Katsura S., H a t а к e у a m a T., Biochem. Z., 234, 462 (1931).
46. К 1 a u e r H., Deut. Z. ges. gerichtl. Med., 17, 89 (1931).
47. Kuhn R., L’ О r s a F., Z. angew. Chem., 44, 847 (1931).
48. M о h 1 m a n F. W., Edwards G. P., Ind. Eng. Chem., Anal. Ed., 3, 119 (1931).
49. N i с 1 о u x M., Compt. rend., 192, 985 (1931).
50. S tn i t h L., Svensk Kem. Tidskr., 43, 83 (1931).
51. W e г к m a n С. H., Osburn O. L., Ind. Eng. Chem., Anal. Ed., 3, 387 (1931).
52. J о h n s о п M. J., Ind. Eng. Chem., Anal. Ed., 4, 20 (1932).
53. Labourasse G., Bull, assoc, chim. suer. dist., 49, 56 (1932).
54. L a 1 a n d e A., Bull. soc. chim. France, 51, 916 (1932).
55. Lantz R., Chimie et Industrie, 27, 775 (1932).
56. Mayer R. M., Deut. Z. ges. gerichtl. Med., 18, 638 (1932).
57. Sato M., M u r a t a K., J- Agr. Chem. Soc., Japan, 8, 1303 (1932).
58. S e m i c h о n L., F 1 a n z v M., Ann. fals. et fraudes, 25, 414 (1932).
59. Kuhn R., Roth H., Ber., 66, 1274 (1933).
60. К u n к e W. F., J. Assoc, offic. Agr. Chem., 16, 348 (1933).
61. A 1 e s s a n d r i n i E., Ann. brasserie dist., 32, 104 (1934); Analyst, 59, 630
(1934).
62. F a b r e R., В r a r d D., J. pharm. chim., 19, 5 (1934).
63. К о 1 t h о f f I. M., L i n g a n e J. J., J. Am. Pharm. Assoc., 23, 404 (1934).
64. Prochizka R., Plyn a Voda, 14, 115, 302, 319, 342 (1934).
65. Christensen L. M., Fulmer E. I., Ind. Eng. Chem., Anal. Ed., 7, 180 (1935).
66. Harger R. N., J. Lab. Clin. Med., 20, 746 (1935).
67. J a n к e А., К г о p a c s у S., Biochem. Z., 278, 30 (1935).
68. Schmidt-Hebbel H., Rev. estud. farm, bioquim. (Buenos Aires), 25, 526 (1935).
69. S n e t h 1 a g о H. C. S., Z. anal. Chem., 102, 321 (1935).
70. V u c e t i c h D. C., Rev. fac. cienc. quim. (La Plata), 10, 37 (1935).
71. В e 1 e t z к i i Yu. A., M i 1 ’ c h о E. M., Sintet. Kautschuk, Ns 2, 27 (1936).
72. Deux Y., Petit. J. brass., 44, 790 (1936).
73. Kemal H., Z. anal. Chem., 107, 33 (1936).
74. Newman H., J. Pharmacol., 56, 278 (1936).
75. N i с 1 0 u x M., Anni fermentations, 1, 449, 513, 596 (1936).
76. S n e t h 1 a g о H. C. S., Rec. trav. chim., 55, 58 (1936). fi.
77. Ill а т а л о в В. П., Лапши нов И. И., Синтетич. каучук, Ns 1, 38 (1934
78. Троцкий Й, Мендельсон Р., Укр. бнохим. журнал, 9, 157 (193ВД
208
prhach M. E., J. Am. Pharm. Assoc., 26, 231 (1937).
79-Au istensen В. E., Williams R. J., King A. E„ J. Am. Chem. 8°' 59, 293 (1937).
Г о н ч a P ° в С. В., Б у p в а с с e p Ф. Г., Орг. хим. пром., 3, 423 (1937).
Каучук и резина, № 7—8, 39
Ind. Eng. Chem., Anal. Ed., 9, 514 (1937).
8b ° r r is E. J., Analyst, 62, 729 (1937).
Ч Хераскова E., Корсунская E., (1937)- . r . . r
proctor and Gamble Co,
8*- panda E., Oil and Soap, 14, 7 (1937).
S' R an P °P or * F., Engelberg H., Klin. Wochschr., 16, 610 (1937).
о? Boorman E. J., Analyst, 64, 791 (1939).
88 Cordebar d H., J. pharm. chim., 30, 263 (1939).
m Гон ча p св С. В., Бурвассер Ф. Г., Бумажная пром., 17, № 10, 27 (1939).
90 Hansen K-, Dybing O., Biochem. Z., 301, 225 (1939).
| Островская P. E., Лаб. практика, 84 (1939).
09 R a p i n A., Helv. Chim. Acta, 22, 72 (1939).
93^ S c h u 1 e k E., R 6 z s a P., Z. anal. Chem., 117, 400 (1939).
94' S t a n 1 e у R. D., J. Assoc. Offic. Agr. Chem., 22, 594 (1939).
95. T h i v о 1 1 e L., Sonntag G., Bull. soc. chim. biol., 21, 1369 (1939).
96 Allen N., Charbonnier H. Y., Coleman R. M., Ind. Eng. Chem., Anal. Ed., 12, 384 (1940).
97 Andrews E., Potter R. M., Friedemann T. E., Livingston H. M., J. Lab. Clin. Med., 25, 966 (1940).
98. В a у 1 у W. A., Soc. Chem. Ind. Victoria, Proc., 40, 267 (1940).
99. Johnson G. W., Gibson R. E., J. Lab. Clin. Med., 26, 399 (1940).
100. L e v e n s e n J. J., Ind. Eng. Chem., Anal. Ed., 12, 332 (1940).
101. Levine H., Bodansky M., J. Biol. Chem., 133, 193 (1940).
102. Stanley R. D., J. Assoc. Offic. Agr. Chem., 23, 576 (1940).
103. Dister A., J. pharm. Belg., 23, 25 (1941).
104. " ' - - - - - — ----
105.
106.
107.
108.
109.
ПО.
111.
112.
113.
114.
115.
116.
117.
118.
119.
120
121.
122.
123,
Raveux R., Trav. memb. soc. chim. biol., 23, 1445
С е а г a n f i Е., Biochem. Z., 313, 11 (1942).
Pharm. Zentralhalle, 83, 181 (1942).
J. H., Conrad С. M., Ind. Eng. Chem., Anal. Ed., 14,
124.
125.
126.
12/ h
Гинзбург С. Л., Бокова Г. Б., Ж- хим. пром., 18, № 12, 33 (1941).
К о z е 1 k a F. L., Hine С. Н., Ind. Eng. Chem., Anal. Ed., 13, 905 (1941).
Labourasse G., Bull, assoc, chim., 58, 161 (1941).
Орловский С. T., Ж. прнкл. химии, 14, 671 (1941).
T h i v о 1 1 e L., Sonntag G., Trav. memb. soc. chim. biol., 23, 1302 (1041).
T h i v о 1 1 e L., (1941).
C a s e 1 1 i P., F 1 о t о w E., Kettering 432 (1942).
Stanley R. D., J. Assoc. Offic. Agr. Chem., 25, 693 (1942).
Thivolle L., Raveux R., Trav. memb. soc. chim. biol., 24, 1066 (1942).
T о m a g h e 1 1 i A. A., Anales asoc. quim. arg., 30, 30 (1942).
Winnick T„ Ind. Eng. Chem., Anal. Ed., 14, 523 (1942).
Burgess V. L., Donaldson W. E, Batty J. A., ASTM Bulletin, 120, 23 (1943); Rubber Chem. Tech., 19, 792 (1943).
Griffon H., Compt. rend., 217, 404 (1943).
ju a 1 a n J. R., Onderstepoort J. Vet. Sci. Animal Ind., 18, 311 (1943).
N iculescu M., Cip 1 escu N., Z. anal. Chem., 125, 416 (1943).
Raveux R„ Ann. chim. anal., 25, 70, 95 (1943).
(1943Г) " 6 Г H- W” M 1 t c h e 1 1 J- L-, Ind. Eng. Chem., Anal. Ed., 15, 375
* h e 1 W. F., L a f о r g e F. B., Ind. Eng. Chem., Anal. Ed., 16, 434 U944).
G'nger L. G„ J. Biol. Chem., 156, 453 (1944).
" e 1 m H. C., J. Assoc. Offic. Agr. Chem., 27, 354 (1944).
"°uvenin R., Ann. chim. anal., 26, 72 (1944).
a с k e г о t t K. A,, Dansk Tids. Farm., 16, 154 (1945).
209
128. Pucci J. R., Maffei F. J., Anais asoc. quim. Brasil, 4, 65 (1945).
129. de Saint-Rat L., Hatey J., Ann. pharm. franc., 3, 166 (1945)
130. Wessel C. J., D r i g о t S. M., Beach G. W., Ind. Eng. Chem An i Ed., 17, 440 (1945). nal
131. Bizzozero C. D., Bol. inform, petrol. (Buenos Aires), 23, 451 (1946).
132. Blum C., Kaser mann H., Pharm. Helv. Acta, 21, 233 (1946).
133. C h a i к e 1 i s A. S., F 1 о e r s h e i m R. D., Am. J. Clin. Path Terr, Sect., 10, 189 (1946).
134. Lindenberg A. B., Bull. soc. chim. bioL, 28, 451 (1946).
135. R о c h a t J., Helv. Chim. Acta, 29, 819 (1946).
136. Becker H. E., Pulp Paper Ind., 21, № 1, 54 , 56, 58 (1947).
137. В о n п о r T. G., Analyst, 72, 47 (1947).
138. Davidson G. F., Shirley Inst. Mem., 21, 29 (1947).
139. Lemieux R. U., P u r v e s С. B., Can. J. Res., 25B, 485 (1947).
140. Monas ter io G., Gigli G., Rass. fisiop. clin. e terap. (Pisa), 19 во (1947). ’ z
141. Rhame G. A., Water and Sewage Works, 94, 192 (1947).
142. W i esenber ger E., Mikrochemie ver. Mikrochim. Acta, 33, 51 (1947)
143. Barini-Banchi G., Ann. chim. applicata, 38, 423 (1948).
144. Butts P. G., Prine G. B., Kouka D. L., Becker W. W., Anal Chem., 20, 1066 (1948).
145. Cordebard H., Schneider J., Ann. pharm. franc., 6, 542 (1948).
146. I n g о 1 s R. S., Murray P. E., Water and Sewage Works, 95, 113 (1948).
147. П удов н к A. H., Синайский Г. M., Ж- прикл. химии, 21, 862 (1948).
148. В а с i 1 а М., F е г е n с z G., Arquiv. biol. е tecnol., inst. biol. e pesquisas tecnol., 4, 25 (1949).
149. Ferrari P. V., Ann. sper. agrar. (Rome), (N. S.), 3, 927 (1949).
150. К a 1 v о d a R., Z у k a J., Casopis ceskeho Lekarnictvo, 62, 134 (1949).
151. Moore W. A., Kroner R. C., R u c h h о f t С. C., Anal. Chem., 21, 953 (1949).
152. В e i c k e r t A., Arch, exptl. Path. Pharmakoi., 210, 479 (1950).
153. В h a t tach ar у a A., Bose I. B., Indian Pharmacist, 5, 263, 276 (1950).
154. В 1 a i e k А., К a 1 v о d a R., Z У k a J., Casopis ceskeho Lekarnictva, 63, 69 (1950).
155. H a 1 d J., Dansk Tids. Farm., 24, 195 (1950).
156. Knox K. D., Pask E. A., Brit. J. Anaes, 22, 102 (1950).
157. Тульчинский M. H., Ж- прикл. химии, 23, 176 (1950).
158. А м л и н с к а я М. А., Эрих Ю. Н., Труды научно-исслед. нн-та хил переработки газов, 6, 213 (1951).
159. Fabre R., Truhaut R., Ch tr a my P., Ann. pharm. franc , 9, 408 (1951).
160. Fabre R., Truhaut R., Cheramy P., Compt. rend., 232, 2266 (1951). , I
161. Heyrovsky A., Sbornik Celostatni Pracovni Konf. Anal. Chemikti, L 221 (1951).
162. N e i s h A. C., Can. J. Chem., 29, 552 (1951).
163. S e d i v e с V, Chem. Listy, 45, 32 (1951).
164. Shaw J. A., Anal. Chem., 23, 1764 (1951).
165. Szeberenyi P., Magyar Kem. Folyoirat, 57, 47 (1951).
166. Campbell A. D., Morton J. E., J. Chem. Soc., 1693 (1952). fi.
167. Gottwald E., Voigt G. E., Deut. Z. ges. u gerichtl. Med., 41, Iм (1952).
168. Kirsten W., Stenhagen E., Acta Chem. Scand., 6, 682 (1952).
169. Renard I., J. pharm. Belg., 7, 403 (1952).
170. Seifert P., Leyers H., Arch. Exp. Path. Pharm., 214, 124 (1952).
171. Waghorne D., Ball C. D., Anal. Chem., 24, 560 (1952).
172. Campbell A. D., C h e t 11 e b u r g h V. J., J. Chem. Soc., 1942 (19^
173. Cardone M. J., Compton J. W., Anal. Chem., 25, 1869 (1953).
174. Launer H. F., TOmimatsu Y., Anal. Chem., 25, 1767 (1953).
210
. n e r H. F., T о m i m a t s u Y., Anal. Chem., 25, 1769 (1953).
м n t e q u i F., Farm, nueve (Madrid), 18, 10 (1953).
mp w man E. J., Newman H. W„ Stanford Med. Bull., 11, 96 (1953).
ccliulz N’ F- AnaL Chem-- 25. >762 (1953).
p.-cenbraun J., McElvain S. M., Aycock B. F., J. Am. Chem.
Soc 76, 607 (1954).
Frisone G. J., Anal. Chem., 26, 924 (1954).
Koszegi D., S i m о n у i J., Acta Chim. Acad. Sci. Hung., 5, 33 (1954).
Schoniger W., Lieb H., E 1 - I b r a h i m M. G., Mikrochim. Acta,
, r’/oitsch H., Assoc, tech. ind. papetiere, Bull., 134 (1954).
lea W,esenberger E., Mikrochim. Acta, 127 (1954).
gc’ To marl Y., Sen-i-Gakkaishi, 11, 727 (1955).
1Я6 Go p a 1 a Rao, Venkateswara Rao N., Z. anal. Chem., 151, 347 ' (1956).
ir7 Griffiths V. S., S t о с к D. 1., J. Chem. Soc., 1633 (1956).
йЯ Moore W. A., Walker W. W., Anal. Chem., 28, 164 (1956).
ig9 T a s h i n i a n V. H., Baker M. J., К о c h C. W., Anal. Chem., 28, 1304 ' (1956).
190. van den Buleke I. A., Pharm. Tijds, Belg., 34, 126 (1957).
19L Cordebard H., Bull. soc. pharm. Nancy, № 33, 14 (1957).
192. Fried R., Arch. Pharm., 290, 73 (1957).
193. Kamphenkel L., v. Hintzenstern G., Chem. Tech. (Berlin), 9,
E., Chim. Chronika (Athens), 22A,
никова H. А., Зав. лаб., 23, 165
175.
176-
177
178.
179-
180
181
182' 96 (1954).
704 (1957).
194 Melissinos I., Stylakakis ' 83 (1957).
195. Нахманович Б. M., Пряниш
(1957).
196. Sa ye C., Compt. rend., 245, 427 (1957).
197. Sudo T., S h i m о e D., T s u j i i Y., Japan Analyst, 6, 494, 498 (1957).
198. Бар В. П., Вестник техн, и экономич. информации. Научно-исслед. физикохим. ин-т им. Л. Я. Карпова, № 6, 46 (1958).
199. Bertram F. W., Carlisle О. Т., М и г г а у J. Е., W а г г е n G. W., Connell С. Н., Anal. Chem., 30, 1482 (1958).
200. Ge nevois L., Lafon M., Chim. anal., 40, 156 (1958).
201 Grover К. C„ M e h г о t r a R. C„ Z. anal. Chem., 160, 274 (1958).
202. Карпов О. H., Аптечное дело, 7, 58 (1958).
203. Kirk Р. L., Gibor A.. Parker К. Р., Anal. Chem., 30, 1418 (1958).
204. К г е j z о v а Е., S i m о n V., Z k a J., Ceskoslov. Farm., 7, 82 (1958).
205. Нахманович Б. М., Щ е б л и к и н а Н. А., Труды Всесоюзного научно-исслед. ин-та спиртовой и ликеро-водочной пром., № 6, 58 (1958).
206. Wager Н. G., Analyst, 83, 291 (1958).
207. Бон даревска я Е. А., Сявцилло С. В., Поцепкина Б. Н., Q Ж. аналит. химии, 14, 501 (1959).
опл С° u r t о i s i е г A. J., Ann. ecole natl. agr. Alger, 1, 1 (1959).
209. JureCek M., К a z a k P„ Z. anal. Chem., 167, 32 (1959).
2 0. Mahal H. S., Anal. Chem., 31, 1908 (1959).
Marquardt R. P., L u с e E. N., Anal. Chem., 31, 418 (1959).
о!?' S p i n k о v a V., Z у k a J., Ceskoslov. Farm., 8, 551 (1959).
2 / ptrunz W., Sci. Pharm., 27, 145 (1959).
• Bartels U., H о у m e H., Faserforsch. u. Textiltech., 11, 503 (1960).
'S' ' k F., Budesinsky В., К 6 r b 1 J., Ceskoslov. Farm., 9, 304
217 ia. У m e G., H a h n G., Angew. Chem., 72, 520 (1960).
2lR j 1 r h e f f e г J.V., Jungermann E., Anal. Chem., 32, 1178 (1960).
219 Maf0n M’’ Baraud J., Bull. soc. chim. France, 943 (1960).
Г >0 x, ? л e Щ e н к о К. Ф., Гигиена и санитария, 25, № 5, 54 (1960).
1 1 с к о 1 1 s L. С., Analyst, 85, 840 (1960).
211
221. П е р е п л е т ч и к о в а И. М., Этлис В. С., Калугин А д ч лаб., 26, 154 (1960). ” 'Зав-
222. R а с z G., F u z i J., F и 1 о р L., Acta Pharm. Hung., 30, 212 (I960)- f macia (Bucharest), 8, 377 (I960).
223. Szucki B., Soczewinska Z., Med. Pracy, 11, 463 (1960).
224. Теплякова 3. M., Тимбеков E. X., Сб. научн. трудов Ташкеи, ского мед. ин-та, 16, 229 (1960).
225. V а i d у a L. S., D a t а г D. S., J. Sci. Ind. Research (India), 20В, 35 (19gn
226. Zdybiewska M., Gas. Woda i Tech. Sanit., 34, 254 (1960).
227 Brandenberger S. G., Ma as L. W., Dvoretzky I., Anal. Chem 33, 453 (1961).
228. Gore T. S., G u p t e S. S., Mikrochim. Acta, 654 (1961).
229 Kotschmar A., Z. anal. Chem., 181, 30 (1961).
230. Schneer A., Hartmann H., Acta Chim. Acad. Sci. Hung., 28 27t (1961).
231 Whitman C. L., R о e c k e r G. W., M c N e r n e у C. F., Anal. Chem 33, 781 (1961).
232. Boucherle A., Serusclat F., Eynaud M., Rev. Alcoolisme 7 87(1961).
233. Dynakowski R., Kubalski J., Acta Polon. Pharm., 18, 21 (1961).
234. Гамбарделла E. И., Лакокрасочные материалы и их применение, № 3, 60 (1961).
235. Гинзбург В. И., Зав. лаб., 27, 1337 (1961).
236. Карпов О. Н., Изв. высш. уч. заведений. Химия и хим. технология, 4 1039 (1961).
237. М i s г a R. С., К г i s h п a Rao G. S., J. Sci. Ind. Research, India, 20D, 331 (1961).
238. Schneer A., Hartmann H., Magyar Kern. Folyoirat, 67, 309 (1961).
239. Кондрахина E. Г., Труды Казахского фил. академии строительства и архитектуры, 367 (1961).
240. Suzuki М., Nakamura Е., К а па у a Y., Nagase Y., Tokyo Yakka Daigaku Kenkyu Nempo, No 11, 120 (1961).
241. Brancone L. M., Microchem. J. Symp. Sec., 2, 605 (1962).
242 Novak V., Kozak P., Matousek P., Jurefek M., Mikrochim. Acta, 1101 (1962).
243. Truhaut R., Boudene U., Ann. Med. Legale Criminol. Police Sci et Toxicol., 42, 455 (1962).
244. timed а К., T a r a m a K., Nippon Kagaku Zasshi, 83, 1216 (1962).
245. Barnard J. A., Karayannis N., Anal. Chim. Acta, 26, 253 (1962).
246. M e b i u s L. J., Analyst, 87, 821 (1962). I
247. Maros L., Sz aka cs-Pi n ter M., S c h u 1 e k E., Magyar Kern-Folyoirat, 68, 213 (1962).
248. P a u 1 s s e n R. B., W a a 1 e r T., Pharm. Acta Helv., 37, 125 (1962).
249. Stahl C. R., Anal. Chem., 34, 1001 (1962). . . ,
250. C h a t t e r j i A. C., S h u k 1 a S. N., L a 1 J., Z. Physik, Chem. (Leipzig).
222, 305 (1963).
251. Карпов О. H„ Труды комиссии по аналит. химии АН СССР. Ин т геохими и аналит. химии, 13, 132 (1963).
252. К u b i с е k R., Kvasny Prfimsyl, 9, 173 (1963).
253. Lfegradi L., Magyar Kern. Folyoirat, 69, 117 (1963). .Л
254. Левицкий А. П., Булацкий M. П., Укр. биохим. журнал, 35, 1 v
255. Priestley P. T., Analyst, 88, 194 (1963).
256. S z e k e г e s L., К a r d о s E., Z. Anal. Chem., 193, 271 (1963).
257. Thoma K., U 1 1 m a n n E., L о о s P., Pharmazie, 18, 414 (1963).
258. Andrews R. E. S.,Cooper P. J., Analyst, 89, 272 (1964).
259. В й г t f a у J., Varga M., Magyar Kern. Lapya, 17, 430 (1962).
212
13. СОЕДИНЕНИЯ ВИСМУТА (HI)
реагент. В качестве реагента обычно применяют ВР+-ионы виде нитрата или реже хлорида) и [Bi 14] “-ионы [реагент Драген-оофа, обычно приготовляемого путем смешения Bi (NO3)3, HNO3 к I]'. Недавно был применен реагент, содержащий эквивалентные количества Bi (NO3)3 и ЭДТА.
реакции и титруемые вещества. Все методы титрования основаны на образовании осадков в результате реакций ионного обмена Bi3+-йли [Bi U'-ионов. Простейшие уравнения реакций могут быть представлены в следующем виде (где В — основание):
3RCOO- + Bi3+ -> Bi (RCOO)S
В+Н++ [BiI4]~->(B-H+)BiIf
[R4N]+ + [BilJ--> R4NBiI4
Вероятно, указанные реакции не всегда протекают так просто. Образующиеся осадки имеют более сложный состав, например
(B.H+)sn+[Bii7]4„i7 или [в-н+]Г»“ [вп^]2„1~
Возможно образование комплексных соединений, например про-пилгаллатом12. В число оснований и солей, определяемых таким методом, входит много алкалоидов, пуринов, изониазид, оксин, капролактам, соли четвертичных аммониевых оснований и соли фосфония; винная кислота была определена осаждением в виде соли Bi111.
Соответствующая обработка и конечная стадия титрования. 1. Около половины примеров определений основано на методе обратного титрования избытка Bi111 раствором ЭДТА до исчезновения желтого окрашивания, вызываемого [Bi 14]“-ионами, или в присутствии индикаторов, подобных ксиленоловому оранжевому или пирокатехиновому фиолетовому.
2- В других случаях образующийся осадок растворяют и затем титруют;
1) Bini — раствором ЭДТА;
2) 1_-ионы — йодатом в солянокислом растворе;
3) органические соединения (винная кислота) окисляют МпО~, избыток которого затем оттитровывают оксалатом;
При использовании реагента, содержащего эквивалентные личества Bi (NO3)3 и ЭДТА, образующийся избыток ЭДТА отти-Р°вывают солями цинка (П) или тория (IV).
213
Таблица 21. Примеры использования соединений висмута (III)
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования «Пите-Рату. Ра
———
1 Винная кислота Нейтрализуют водный раствор, добавляют при температуре кипения избыток (50%) смеси Bi (NO3)3—уксусная кислота; перемешивают 5 мин Осадок отфильтровывают и растворяют в H2SO4, добавляют MnOj~ в небольшом избытке, который оттитровывают щавелевой кислотой /
2 Никотин (В) НВП4 [образуется осадок [bh2]2+ (вп4)г] Осадок растворяют в НС1 и титруют йодатом 2
3 Алкалоиды (см. Ns 6, 11, 13); оксин В разбавленной H2SO4; KBiI4 Осадок отфильтровывают; 1~- ионы, входящие в состав осадка, титруют йодатом 3
4 Органические основания (см. № 10) и соли BiClg—KI (образуется осадок иодовисмутата) Осадок отфильтровывают, к фильтрату добавляют Na2S2O3 и ацетат натрия; избыток Bi111 оттитровывают ЭДТА до исчезновения желтооранжевой окраски 4 I
5 Теофиллин; теобромин; хинин; некоторые имидазолины КВП4; при pH 1,2— 1,5 Определение проводят, как указано выше4—см. Ns 4, при pH 4,5 5
6 Алкалоиды (см.№ 3), например наркотин, папаверин, стрихнин, кодеин, бруцин НС1; BiCl3 — эквивалентное количество ЭДТА — —KI-Na2SO3; 5 мин при комнатной температуре (выделяется ЭДТА) Центрифугируют; к аликвотной части фильтрата добавляют N а2В4О 7 и титруют выделившийся ЭДТА Zn2+ или ThIV в присутствии эр и о хром черного Т 6
7 Витамин В2 (тиамин) Тиамин гидрохлорид растворяют в воде; НС1; КД; КВП4 Осадок отфильтровывают; избыток Bi111 определяют, как указано выше 4, — см. № 4 7
8 е-Капролактам KBiI4; НС1; 3 ч при 20° С (образуется осадок Осадок отфильтровывают и избыток Bi111 определяют, как указано выше 4, — см. № 4 8
9 Атропин [(CeHuON) Н]а Bil4— KBiI4 (образуется осадок) Осадок растворяют в НС1, добавляют боратную буферную смесь и тиомочевину, титруют Bi111—ЭДТА в присутствии метиленовой сини 9
214
Продолжение
X? п/п ТиТрУемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
10 Третичные амины; четвертичные аммониевые основания и соли (см. № 4); суль-фониевые соединения HCI; Bi (NO3)3 (или BiCl3) и ЭДТА в эквивалентных количествах; NaOH, Na2SO3, KI, КС1 (все при pH 4—5); 5 мин при комнатной температуре Центрифугируют; фильтрат титруют при pH 2—3 ThIV в присутствии метилтимолового голубого 10
11 Хелидонин гидрохлорид (C20HieNO5 • НС1) и родственные алкалоиды (см. № 3) В разбавленной уксусной кислоте; квп4 Отфильтровывают, добавляют к фильтрату CH3COONa и Na2S2O3; титруютЭДТА в присутствии ксиленолового оранжевого 11
12 Пропилгаллат Bi (NO3)3 (образуется осадок) Избыток Bi111 в фильтрате оттитровывают ЭДТА в присутствии ксиленолового оранжевого или пирокатехинового фиолетового 12
13 Алкалоиды (см. № 3) В разбавленной уксусной кислоте; разбавленная H2SO4; KBiI4; 10 мин при комнатной температуре Избыток Bi111 в фильтрате оттитровывают ЭДТА в присутствии ксиленолового оранжевого 13
14 15 ЭДТА в присутствии металлокомплексов Некоторые антигистамины, например феназолин, бензгид-рамин, пирибенза-мин, аллерган S 50%-ная НС1О4; избыток Bi (NO3)3; аскорбиновая кислота4 (для восстановления FenI; нагревают почти до кипения, затем дают постоять смеси 10 мин Вода; НС1; КВП4 Вода; титруют ЭДТА Zn2+ или ThIV в присутствии ксиленолового оранжевого Отфильтровывают; в аликвотную часть раствора добавляют Na2S2O3, ацетатную буферную смесь (pH 4,5) и титруют ЭДТА до исчезновения желтого окрашивания 14 15
16 Пиперазиновые соли В лимоннокислом растворе; KI; KBiI4; 10 мин Отфи л ьтровывают; фильтрат титруют ЭДТА амперометрически 16
215
ЛИТЕРАТУРА
1. Chapman A. C., Wtitteridge P., Analyst, 32, 163 (1907).
2. Men nel I i G., Ann. Chim. applicata, 31, 68 (1941).
3. Poethke W., ”
4. В u d ё s i ns ky
5. В tides i ns ky
6. В u d ё s i n s к у
7. BudSsinsky
8. F r a n c J„ Kn
9. Krowczriski
9, 189 (1957).
10. Budesinsky
11. Ochynska J., Krdwczyiiski L., Chem. Anal. (Warsaw), 4, 309 (19591
12. M a 1 к u s Z., Horacek J., Prfim. Potravin, 11, 43 (1960).
13. Ochynska J., Chem. Anal. (Warsaw), 6, 261 (1961).
14. Старостин В. В., Ж- анал. хим., 16, 620 (1961).
15. С е g 1 а г s к i R., Roman J., Farm. Polska, 18, № 14, 327 (1962).
16. We ng Y. K-, Lan С. T., Yao Hsueh Pao, 10, 303 (1963).
Trabert Н., Pharm. Zentralhalle, 91, 284 (1952)
В., Chem. Listy, 49, 1524 (1955).
В., Van ic ко va E., Chem. Listy, 50, 1241 (1956).
B., Ceskoslov. Farm., 5, 579 (1956).
В., V a n i с к о v a E., Ceskoslov. Farm., 6, 308 (19б7г izek J., Chem. Listy, 51, 72 (1957).
L., Weremczuk-Krose F., Dissertationes Pharm
B., Korbl J., Chem. Listy, 52, 1513 (1958).
14. БИСУЛЬФАТ НАТРИЯ ИЛИ КАЛИЯ
Известно два примера применения бисульфата натрия (или калия) для определения гидроксилсодержащих соединений. Метод основан на дегидратации анализируемых соединений.
Таблица 22. Примеры использования бисульфатов натрия или калия
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
1 Глицерин глицериды 20-кратный избыток KHSO4; нагревают 30 мин (образуется акролеин) Перегоняют с паром в токе СО2 в щелочной раствор соли меди (II), образуется Си2О; добавляют Feln и титруют МпО^" образующиеся Ееп-ионы (см. «Соединения меди (II)», литература 84] 1
2 Фенилдиметил-карбинол Кипятят с NaHSO4 в колбе, снабженной обратным холодильником, в среде изопропилбензола Выделяющуюся воду оттитровывают реактивом Фишера 2
ЛИТЕРАТУРА
1. Kataoka Е., J. Biochem. (Japan), 19, 15 (1934).
2. Соколов А. В., Михайлин Н. К., Коротаева Г. Ф-. Ж-хим., 13, 369 (1958).
216
15. БИСУЛЬФИТ И СУЛЬФИТ
Реагент. Для приготовления реагента применяют соли натрия калия. Растворы готовят с различными значениями pH. Соотношение между сульфитом и бисульфитом обусловлено равновесием
SO5- + Н+ HSOg”
илп
SO*- + Н2О 7 - HSO.7 + Bl ’
Подкисленный раствор сульфита представляет собой бисульфит, поэтому оба эти реагента рассматриваются вместе.
реакции и титруемые вещества. 1. Реакции присоединения к карбонильным группам (главным образом к альдегидным); к олефиновым группам в а, 0-ненасыщенных карбонильных соединениях и нитрилах, к а-эпоксидным смолам, например:
/ОН
RCHO + HSO7 -> RCHC xso-
или
RCHO + S0^ + H2O-^
/ОН
RCH< ОН-xso3-
он
I
RCH = CHCN + SO*- + НгО -> R — CH — CHCN + ОН-
ОН SO7
2 1 1
Н2С — СН2 + sop+ н2о сн2 — сн2 + он-
о
Такой метод определений карбонильных соединений главным образом применяют при анализе низших альдегидов, например формальдегида, ацетальдегида, фурфурола. Этот метод часто является завершающей стадией определения молочной кислоты (окисляемой Се или МпОГ в ацетальдегид), пентоз или пентозанов (гидролизующихся водой до фурфурола), полиоксисоединений и аминокислот (окисляющихся до альдегидов перйодатом, а также нингидрином в последнем случае).
К другим классам соединений, определяемых этим методом, относятся акрилонитрил, производные масляной кислоты и окись
2- Разрыв дисульфидной связи при определении соединений типа цистеина:
RS — SR' + SO*- -> RS- + R'SSO^
217
3. Дегалогенирование в некоторых случаях, например, хлорпикрина и пентабромацетона:
R — Hal -I- SO|~ -> RSO^ + Hal-
Условия реакции. Большинство реакций протекает в водном растворе или в среде смешанных с водой некоторых органических растворителей, например низших спиртов. Реакции предпочтительно проводят при комнатной температуре во избежание разложения реагента.
Соответствующая обработка и конечная стадия титрования. 1. В одной пятой примеров, приведенных ниже, избыток реагента оттитровывают соответствующим раствором. В качестве основного титранта применяют иод, им титруют реагент непосредственно или применяя избыток иода, который оттитровывают тиосульфатом; иногда также титруют арсенитом или гидразином. В двух случаях вместо иода применяют хлорамин Т92-130.
2. При определении альдегидов наиболее часто разлагают сначала избыток реагента (обычно титрованием иодом), а затем полученный продукт присоединения разрушают с образованием альдегида и бисульфита путем повышения pH раствора до 8 (добавление карбоната, бикарбоната, бората или фосфата щелочного металла). Бисуль-фитный продукт присоединения разлагают также добавлением цианида или гидроксиламина:
RCH (ОН) SO3 RCHO 4- HSO^
RCH (ОН) SO3 — RCH (ОН) CN + SO|—
RCH (ОН) SO3 - RCH = NOH + H2O + HSO^
Выделившийся сульфит или бисульфит, как правило, титруют иодом или хлорамином Т. При определении ацетальдегида в присутствии кротонового альдегида110 бисульфитное соединение разлагают аналогично, а выделившийся альдегид отгоняют и таким образом отделяют от кротонового альдегида.
3. ОН--ионы, которые образуются в результате реакции присоединения к альдегидам сульфита, титруют кислотой, обычно в присутствии фенолфталеина или другого индикатора, изменяющего окраску в пределах pH 9. Кроме того, для проведения реакции нейтрализации используют избыток кислоты, который оттитровывают основанием.
4. Определение бисульфидов согласно реакциям, представленным выше (см. п. 2), сопровождается титрованием растворами солеи серебра (I) или ртути (II). Конечную точку титрования в большинстве случаев устанавливают амперометрически (см. Том I).
5. Титрование растворами солей серебра (I) применяют как конечную стадию определения галоген-ионов, образующихся при обработке растворов соляной кислотой.
218
Таблиц11 23. Примеры использования бисульфита и сульфита
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
1 Ацетальдегид (см. № 5, 8 9, 11, 12, 14, 17-19, 22 23, 25, 26, 28—30, 32’ 36, 41—44, 46, 49, 50 52, 53, 57, 60, 66, 67, 69 72, 74, 75, 78, 81, 84, 87’ 94—96, 100, 102, 105, 108—111, 113, 115, 121, 122, 124, 127, 131, 134, 135, 139, 140, 152, 153, 159, 164, 168) В 50% -ном этаноле; Na2SO3 — H2SO4 — 50%-ный этанол; оставляют на ночь при 50—60° С Избыток реагента оттитровывают иодом 1
2 Альдегиды (см. № 21, 38, 40, 55, 63, 79, 83, 91 95, 107, 114, 115, 132, 137, 148, 159, 163) некоторые кетоны (см. № 6, 21) Водный раствор; KHSO3; 15 мин при комнатной температуре Избыток реагента оттитровывают иодом 2
3 Формальдегид (см. № 4, 10, 13—16, 20, 24, 31, 34, 39, 58, 59, 62, 64, 68—72, 85, 86, 88, 89, 93, 96, 97, 101, 103, 1п4. 115, 118, 120, 138, 139, 145, 146, 150—152, 156, 159, 160, 167 Na2SO3, нейтрализованный несколькими каплями NaHSOg в присутствии фенолфталеина Титруют раствором H2SO4 в присутствии фенолфталеина 3
4 Формальдегид (см. № 3); полимеры, например триоксиметилен Na2SO3, нейтрализованный H2SO4 в присутствии фенолфталеина Титруют кислотой в присутствии того же индикатора 4
б Ацетальдегид (см. № 1) (Метод описан выше 4 — см. № 4) 5
6 Кетоны (см. № 2) В 20%-ном этаноле; эквивалентное количество NaHSO3; время и температура реакции различные (Исследовано влияние групп на продолжительность реакции) б
7 Фурфурол (см. № 27, 33, 45, 51, 76, 77, 80) KHSO4; 2 ч при комнатной температуре Избыток реагента оттитровывают иодом 7
8 Ацетальдегид (см. № 1), образуемый из молочной кислоты при ее определении путем окисления перманганатом в сернокислом растворе Перегоняют в раствор, содержащий HSO; Избыток реагента оттитровывают иодом 8
215
Продолжение
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Лит Рат Ра
9 Свободный ацетальдегид (см. № 1) в паральдегиде Нейтральный водный раствор; нейтрализованный Na2SO3 Титруют раствором НС1 в присутствии тимолфталеина 9
10 Формальдегид (см. Ns 3); бензальдегид (см. № 21, 35, 159) Нейтральный водный раствор; нейтрализованный Na2SO3; 30 мин при комнатной температуре Титруют раствором H2SO4 в присутствии фенолфталеина 10
11 Ацетальдегид (см. № 1), образуемый в процессе гидролиза в присутствии кислоты при определении ацеталей (см. № 82; 84) и паральдегида (Метод описан выше 2 — см. № 2) 11
12 Ацетальдегид (см. № 1), образуемый из молочной кислоты при ее определении путем нагревания в присутствии H2SO4 Перегоняют в раствор NaHS03 Непрореагировавший реагент окисляют иодом; добавляют NaHCO3 и оттитровывают иодом HSO^" — образующийся из бисульфитного соединения 12
13 Формальдегид (см. № 3) Na2SO3 (Сравнение с другими методами) Титруют кислотой 13
14 Формальдегид (см. № 3); ацетальдегид (см. № 1) (Метод описан выше2 — см. № 2) 14
15 Формальдегид (см. № 3) в параформальдегиде Na2SO3, оттитрованный кислотой в присутствии розоловой кислоты Титруют кислотой (с тем же индикатором) 15
16 Формальдегид (см. № 3) Na2SO3; 10 мин при комнатной температуре Титр у ют р аствором H2SO4 в присутствии розоловой кислоты 16
17 Ацетальдегид (см. № 1), образуемый при определении молочной кислоты в крови путем нагревания с перманганатом в сернокислом растворе Перегоняют в раствор KHSO3 Избыток реагента оттитровывают иодом 17
18 Ацетальдегид (см. № 1), образуемый при определении молочной кислоты в органах животных путем нагревания с перманганатом в сернокислом растворе Перегоняют в охлаждаемый льдом раствор KHSO3 Избыток реагента оттитровывают иодом 18
220
Продолжение
Ks п/п 19 20 21 22 23 24 25 26 Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
Ацетальдегид (см. № 1), образуемый при определении молочной кислоты нагреванием с перманганатом в сернокислом растворе Формальдегид (см. № 3) Альдегиды (см. № 2), кетоны (см. № 2), например бензальдегид (см. № 10), коричный Ацетальдегид (см. № 1), образуемый при определении молочной кислоты путем нагревания с перманганатом в сернокислом растворе Ацетальдегид (см. Ns 1), образуемый при определении молочной кислоты путем нагревания с H2SO4 Формальдегид (см.№3) Ацетальдегид (см. Ns 1), образуемый при определении молочной кислоты путем нагревания с МпО^, MnSO4 и H2SO4 Ацетальдегид (см. Ns 1), образуемый при определении молочной кислоты путем нагревания с перманганатом в серно-ислом растворе Перегоняют в раствор KHSO3 KHSO3—Na2SO3 (катализатор); 15 лшн при комнатной температуре KHSO3—Na2SO3; 45 мин (для альдегидов); 4—5 ч (для кетонов) при комнатной температуре Перегоняют в раствор KHSO3 Перегоняют в раствор KHSO3 Na2SO3 ч Перегоняют в раствор NaHSO3 Перегоняют в раствор KHSO3 Избыток реагента оттитровывают иодом Титруют раствором NaOH в присутствии розоловой кислоты Титруют раствором NaOH в присутствии розоловой кислоты Избыток реагента оттитровывают иодом Избыток HSO^~ — окисляют иодом; добавляют NaHCO3 и оттитровывают иодом HSO^“, образуемый из бисульфитного соединения Титруют кислотой в присутствии фенолфталеина или тимолфталеина (добавление NaCl улучшает определение конца титрования в присутствии первого индикатора) Избыток реагента окисляют иодом; добавляют NaHCO3 и оттитровывают иодом HSO^, образуемый из бисульфитного соединения Избыток реагента окисляют иодом; добавляют NaHCO3 или Na2HPO4 и титруют иодом 19 20 21 22 23 24 25 26
221
Прадо.
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования
27 Фурфурол (см. № 7), образуемый при нагревании глюкуроновой кислоты с НС1 Перегоняют в раствор NaHSOg Избыток реагента оттитровывают иодом
28 Ацетальдегид (см. Ns 1), образуемый при определении молочной кислоты в экстрактах тан-нина путем нагревания с МпО^~, MnSO4 и H2SO4 Перегоняют в раствор NaHSOg Избыток реагента окисляют, титруя иодом; добавляют NaHCOg и титруют иодом
29 Ацетальдегид (см. Ns 1) NaHSO3 или KHSOg Избыток реагента окисляют, титруя иодом; доводят pH до 8 с ПОМОЩЬЮ NaHCOg и титруют иодом
30 Ацетальдегид (см. № I), образуемый при определении молочной кислоты в молоке и молочных продуктах путем нагревания с перманганатом в сернокислой среде Перегоняют в раствор NaHSOg Избыток реагента оттитровывают иодом
31 Формальдегид (ст. Ns 3) Нейтральный водный раствор (с тимолфталеином); Na2SO3, оттитрованный в присутствии тимолфталеина Титруют НС1
32 Ацетальдегид (см. № 1), образуемый при определении молочной кислоты в растительных дубильных соках путем нагревания с перманганатом в сернокислом растворе Перегоняют в раствор NaHSOg Избыток реагента окисляют, титруя иодом; добавляют NaHCO3 и титруют иодом
33 Фурфурол (см. Ns 7) HSO^"; 10—15 лшн в темноте при комнатной температуре Избыток реагента оттитровывают иодом
34 Формальдегид (см. Ns 3) Небольшой избыток NaHSOg; немного NaHCO3; 15 лшн при комнатной температуре Подкисляют уксусной кислотой в присутствии метилового оранжевого, непрореагировавший HSO^ окисляют, титруя иодом; добавляют Na2CO3 и титруют иодом
222
Продолжение
п/п 35 36 37 38 39 40 41 42 43 Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
Бензальдегид (см. № 10) Ацетальдегид (см. № 1), образуемый при определении молочной кислоты в крови путем нагревания с перманганатом в сернокислом растворе Окись этилена Альдегиды (см. № 2) из прогорклого жира; гептальдегид (см. № 148) Формальдегид (см. № 3) Альдегиды (см. № 2) Ацетальдегид (см. № 1) Ацетальдегид (см. We 1) в биологических субстратах Ацетальдегид (см. № 1) в винах и т. п. Небольшой избыток NaHSO3, немного NaHCO3; 15 мин при комнатной температуре Перегоняют в раствор, содержащий HSOg“ Пропускают через раствор Na2SO3, насыщенный H2S В бензоле; NaHSO3; 60—90 мин при комнатной температуре (30 мин для гептальдегида) Нейтральный раствор; нейтрализованный Na2SO3 (оба в присутствии тимолфталеина) NaHSO3; некоторое количество этанола; обычно 30—00 мин при комнатной температуре HSO3~ HSOg~; 20 мин при комнатной температуре HSO^~ — фосфатный буферный раствор (pH 7), 20 мин при комнатной температуре Подкисляют фосфорной кислотой, непрореагировавший реагент оттитровывают иодом; добавляют NaHCO3 и титруют иодом 1\'а2НРО4; добавляют стандартный раствор иода, избыток которого оттитровывают арсенитом Титруют раствором НС1 Непрореагировавший HSO3' окисляют, титруя иодом, добавляют NaHCO3 и титруют иодом Титруют кислотой Иод, избыток которого быстро оттитровывают тиосульфатом; некоторые альдегиды прямо титруют иодом, но этот метод менее удовл етвор ителен Иод, избыток которого оттитровывают тиосульфатом или окисляют избыток реагента иодом, добавляют NaHCO3 и титруют иодом Непрореагировавший HSOg окисляют, титруя иодом; добавляют NaHCO3 и титруют иодом НС1; непрореагировавший HSO3~ окисляют, титруя иодом, добавляют NaOH— Н3ВО3 и титруют иодом 35 36 37 38 39 40 41 42
223
№ п/п
44
45
46
47
48
49
50
51
52
" родолэ^ещ
Титруемое вещество Реагент и условия реакции Соответствующая об- п работка и конечная вят ' стадия титрования
Ацетальдегид (см. № 1), образуемый при определении молочной кислоты путем нагревания сМпОд~, MnSO4 и H2SO4 Фурфурол (см. № 7), образуемый при перегонке пентозанов в присутствии кислот Ацетальдегид (см. № 1), образуемый при гидролизе ацеталей при определении pH вина Трихлорнитрометан в протравленном зерне Изовалериановый альдегид, образуемый при определении лейцина (см. № 55, 79) реакцией с нингидрином Ацетальдегид (см. № 1) в винах Ацетальдегид (см. № 1), образуемый при определении молочной кислоты путем нагревания с МпО^-, MnSO4 и H2SO4 Фурфурол (см. № 7) в смеси с фурфуриловым спиртом Ацетальдегид (см. №.1), образуемый при определении молочной кислоты путем окисления раствором Се (SO4) 2 Перегоняют под пониженным давлением в раствор NaHSO3; 60 мин Перегоняют в раствор NaHSO3 (Утверждают, что этот метод лучше, чем метод, основанный на прямом титровании иодом) Перегоняют в NaHSO3 — фосфатный буферный раствор (pH 7) Переносят потоком воздуха в щелочной раствор Na2SO3, [образуются NO2CH(SO3Na)2 и 2NaCl[ Перегоняют в раствор NaHSO3 1) NaHSOg—10% -ный этанол; 30 мин при комнатной температуре; 2) NaHSO3 — фосфатный буферный раствор (pH 7) Перегоняют в раствор, содержащий HSOJ" NaHSO3; 15 мин при комнатной температуре Перегоняют в раствор NaHSO3 Титруют иодом; до- 43 бавляют NaHCO3 и титруют иодом Титруют стандарт- 44 ным раствором иода Содержание 45 связанного HSO^~ определяют методом, описанным выше 42, —см. № 43 С1~ определяют, 46 используя избыток Ag+, который оттитровывают тиоцианатом Непрореагировавший 47 HSOf оттитровывают иодом 1) Добавляют иод, 48 избыток которого оттитровывают тиосульфатом; 2) непрореагировавший реагент оттитровывают иодом; добавляют NaOH, борную кислоту и титруют иодом Избыток реагента 49 оттитровывают иодом Избыток реагента 50 оттитровывают иодом Титруют иодом; 51 добавляют NaHCOg и титруют иодом
924
Продолжение
Д’ П/11 Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
53 54 55 56 57 58 59 60 61 Ацетальдегид (см. № 1), образуемый при определении (микрометодом) молочной кислоты путем нагревания с МпО4 , MnSO4 и H2SO4 Пировиноградная кислота Альдегиды (см. № 2), образуемые при определении аминокислот (см. № 79, 137), подобных аланину (см. № 79, 81), валину (см. № 79), лейцину (см. № 48), изолейцину, в процессе их взаимодействия с нингидрином Карбонильные соединения (см. № 92, 141) Ацетальдегид (см. № 1), образуемый при определении метилпентоза-нов путем окисления перйодатом Формальдегид (см. № 3) в смолах Формальдегид (см. № 3) Ацетальдегид (см. № 1), образуемый при определении а-амино-(3-окси-масляиой кислоты (треонина) (см. № 67, 152) путем окисления перйодатом Ацетон (см. № 98) 1 Перегоняют в раствор NaHSOg Перегоняют в раствор NaHSOg NaHSOg—НО или NaOH; 1 ч при комнатной температуре Перегоняют потоком СО2 в раствор NaHSOg Перегоняют в раствор NaHSO3 Na2SO3 Перегоняют потоком СО3 в раствор NaHSO3 Перегоняют в раствор NaHSOg 5— 6 ч при комнатной температуре или 3 ч при 40—50° С Титруют иодом; добавляют и титруют иодом Титруют иодом; добавляют NaHCO3 и титруют иодом Избыток HSO^“ оттитровывают иодом Избыток реагента оттитровывают иодом; добавляют NaHCOg н титруют иодом Связанный HSO3~ определяют методом, описанным выше 12 — см. № 12 Избыток реагента оттитровывают иодом; добавляют Na2CO3 и титруют иодом Титруют раствором НС1 в присутствии фенолфталеина— а-нафтолфталеина Связанный HSO3‘ определяют по методу, описанному выше 5С — см. № 57 Избыток реагента оттитровывают иодом; добавляют Na2HPO3 и титруют иодом 52 53 54, 78 55 56 57 58 59 60
8 м
Р. Ф. Эшворт 225
Продолжение
№ п/п Титруемое вещество Реагент и условия реакции Соогветствующая обработка и конечная стадия титрования Лит, Рату. Ра
62 Формальдегид (см. № 3) и ацетальдегид (см. № 1), образуемые при анализе смесей глицерин (см. № 69, 72, 86, 88, 145) — этиленгликоль (см. № 72, 96) — пропиленгликоль (см. № 72, 78) путем окисления перйодатом Na2SO3, 12,5%-ный раствор (в 200-кратном избытке) Титруют раствором НС1 в присутствии фенолфталеина 61
63 Альдегиды (см. № 2) в синтетической уксусной кислоте (Метод описан выше 48 — см. № 49) 62
64 Формальдегид (см. № 3), образуемый при определении гексаметилентетрамин (см. № 71, 85, 157) путем нагревания с винной кислотой Перегоняют в раствор NaHSO3 Избыток реагента оттитровывают иодом; добавляют NaHSO3 и титруют иодом 63
65 Некоторые соединения, характеризующиеся наличием —С—С—СО= групп, например соли малеиновой кислоты (см. № 90) Нейтральный раствор; Na2SO3; кипятят 8 ч Титруют раствором НС1 64
66 Ацетальдегид (см. № 1), образуемый при определении молочной кислоты в процессе взаимодействия ее с соединениями CeIV Пропускают в раствор NaHSO3 Связанный HSO^ определяют методом, описанным выше 60, — см. № 61 65
67 Ацетальдегид (см. № 1), образуемый при определении треонина (см. № 60) в процессе взаимодействия его с перйодатом (Метод описан выше 66 — см. № 66) 66
68 Формальдегид (см. № 3) в воздухе Пропускают в 1%-ный раствор NaHSO3 Титруют иодом; добавляют СОд“, ацетат натрия и титруют иодом 67
69 Формальдегид (см. № 3) и ацетальдегид (см. № 1), образуемые при анализе смеси глицерин (см. № 62) — 2,3-бути-ленгликоль (см. № 74) путем окисления перйодатом (Метод описан выше 61 — см. № 62) 68 яд
70 Формальдегид (см. № 3) в молоке Добавляют избыток Na2SO3; NaOH; 15 мин при комнатной температуре Уксусная кислота; титруют хлорамином Т в присутствии I" -ионов
226
Продолжение
№ я/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
71 Формальдегид (см. № 3), образуемый при определении гексаметилентетрамин (см. № 64) путем нагревания с H2SO4 Перегоняют в нейтральный раствор Na2SO3 Титруют раствором H2SO4 в присутствии розоловой кислоты 70
72 формальдегид (см. № 2), ацетальдегид (см. № 1), образуемые при определении этилен-гликоля (см. № 62) и пропилен-гликоля (см. № 62), а также глицерина (см. № 62) путем окисления перйодатом NaHSO3 Титруют иодом; добавляют Na2CO3 и тетраборат и титруют иодом 71
73 Пента бром ацетон, образуемый при определении лимонной кислоты путем окисления смесью MnOj'—Вг“—H2SO4 или NaHSO3; пентабромацетон реагирует с образованием 5Вг_ -ионов; 3 мин при 100° С Вг_ -ионы определяют титрованием солями серебра 72
МпО2—ВгО~—Вг~—H2SO4
74 Ацетальдегид (см. № 1), образуемый при определении 2,3-бутиленгли-коля (см. № 69) путем окисления перйодатом Перегоняют в раствор NaHSOg Титруют иодом; добавляют NaHCOg и титруют иодом 73
75 Ацетальдегид (см. № 1) в смеси с этил ацетатом NaHSO3; 30 мин при комнатной температуре, периодически встряхивают Иод, избыток которого оттитровывают тиосульфатом 74
76 Фурфурол (см. № 7), образуемый при определении пентозанов (см. № 77) путем нагревания с фосфорной кислотой Перегоняют в раствор NaHSO3 Тнтруют нодом; добавляют N аНСОд и титруют иодом 75
77 Фурфурол (см. № 7), образуемый при определении пентозанов (см. № 76) путем нагревания с 85% -ной фосфорной кислотой Перегоняют в раствор NaHSO3 Тнтруют иодом; добавляют NaHCOg и титруют иодом 76
78 Ацетальдегид (см. № 1), образуемый при определении пропиленглико-ля (см. Ко 62) путем окисления перйодатом Перегоняют с потоком СОг в раствор NaHSO3 Титруют иодом; добавляют смесь NaHCOg—Na2CO3— Na2B4O7 и титруют иодом 77
*
227
Продолжение
\ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
— —
79 Альдегиды (см. № 2), образуемые при определении некоторых аминокислот (см. № 55), например аланина (см. № 55), валина (см. № 55), лейцина (см. № 48) путем окисления гипохлоритом Пропускают в раствор NaHSOg Избыток реагента оттитровывают иодом 79, 86
80 Фурфурол (см. № 7) NaHSO3 при pH 4; 5 мин при комнатной температуре НС1 до pH 1; избыток реагента оттитровывают хлорамином Т; добавляют MgCO3 и HSO~ образующийся из би-сульфитного соединения, оттитровывают хлорамином Т 80
81 Ацетальдегид (см. № 1), образуемый при определении а-аланина (см. № 55) в процессе взаимодействия его с нингидрином Перегоняют в раствор NaHSO3 Титруют иодом; добавляют NaHCO3 и титруют иодом 81
82 Кеталь и ацеталь (см. № 11), образуемые при гидролизе подивипильных ацеталь—кетальных смол в присутствии кислот NaHSO3; 1 ч при комнатной температуре Добавляют избыток смеси иод—уксус- ная кислота и немедленно обратно оттитровывают тиосульфатом 82 1
83 Альдегиды (см. № 2) Избыток Na2SO3 и избыток стандартного раствора H2SO4; 2—3 мин встряхивают при комнатной температуре Титруют щелочью потенциометрически 83
84 Ацетальдегид (см. № 1), а также ацетальдегид, образуемый из ацеталей (см. № 11); винильные эфиры (гидролизованные в присутствии кислот) Na2SO3; избыток H2SO4; несколько минут встряхивают Титруют раствором NaOH потенциометрически 84
85 Формальдегид (см. № 3), образуемый при определении гексаметилентетрамин (см. № 64) путем нагревания с H2SO4 Перегоняют в нейтральный раствор Na2SO3 Титруют раствором H2SO4 в присутствии фенолфталеина 85
228
Продолжение
X? п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
86 формальдегид (см. № 3), образуемый при определении в бродильных остатках глицерина (см. № 62) путем окисления перйодатом Прн pH 9,3; 12%-ный раствор Обратно оттитровывают НС1 до pH 9,3 потенциометрически 87
87 Ацетальдегид (см. № 1) в промышленных спиртах В фосфатном буферном растворе; Na2SO3—H3SO4; 20 мин при комнатной температуре НС1; титруют иодом; добавляют NaOH— борную кислоту и титруют иодом 88
88 формальдегид (см. № 3), образуемый при определении глицерина (см. № 62) путем окисления перйодатом Перегоняют в раствор NaHSO3; (Метод описан выше 42 — см. № 43) 89
89 Формальдегид (см. № 3) Na2SO3; лучше при 0°С Титруют раствором НС1 или H2SO4 в присутствии тимолфталеина 90
90 Малеиновая кислота (см. № 65) в присутствии других кислот, например а) Нейтрализуют; избыток NaHSO3; кипятят 5 мин-, а) Титруют раствором NaOH; 91
бензойной, фталевой б) Нейтрализуют; добавляют также нейтрализованный Na2SQ3 (тимолфталеин); кипятят 1 ч; в) Как в п. «б», но добавляют избыток H2SO4; кипятят 30 мин б) Титруют раствором H2SO4; в) Титруют раствором NaOH 91 91
91 Альдегиды (см. № 2) N a2SO3, нейтр ал и- зуют; 5 мин при комнатной температуре Титруют раствором H2SO4 91
92 Карбонильные соединения (см. № 56) NaHSO3 Избыток реагента оттитровывают хлорамином Т 92, 130
93 Формальдегид (см. № 3) в водных растворах в присутствии своих полимеров N aHSO3—ацетатный буферный раствор (PH 4-5) (полимеры не гидролизуются) Избыток реагента определяют иодометрически 93
У4 Ацетальдегид (см. № 1), образуемый при определении молочной кислоты в процессе взаимодействия ее с соединениями CeIV Перегоняют в раствор NaHSO3; 30 сек при 100° С Титруют иодом; добавляют фосфат и титруют иодом 94
229
Продолжение
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Лита-рату Ра
95 Ацетальдегид (см. № 1), образуемый при определении молочной кислоты путем окисления перманганатом в сернокислом растворе Перегоняют в раствор NaHSO3; 30 мин при комнатной температуре NaCl; титруют иодом, добавляют NaHCO3 и титруют иодом 95
96 Ацетальдегид (см. Ns 1), образуемый при гидролизе этиленгалогидри-нов, также формальдегид (см. № 3), образуемый при окислении перйодатом этиленгликоля (см. № 62) NaHSO3; 30 мин при комнатной температуре Титруют иодом; добавляют Na»CO3— Na2B4O7 и титруют иодом 96
97 Формальдегид (см. № 3), образуемый из моно- и диметилолмочевины после гидролиза в присутствии щелочи NaHSO3; 15 мин при комнатной температуре Подкисляют, ти- труют иодом; добавляют Na2CO3 и титруют иодом 97
98 Ацетон (см. № 61) NaHSO3; pH 5; 30 мин при 0° С (Указанные условия считаются наилучшими в результате изучения процесса взаимодействия) Иод, избыток которого оттитровывают тиосульфатом 98
99 Цистеин (см. Ns 116, 123, 125) В аммонийном буферном растворе; Na2SO3; в атмосфере азота Титруют раствором серебряной соли амперометрически [см. Том I, «Соединения серебра (I)», литература 47] 99
100 Ацетальдегид (см. № 1), образуемый при определении молочной кислоты в растворе путем окисления смесью Перегоняют в раствор, содержащий HSO^“ при pH 7 Связанный HSO3 определяют методом, описанным выше 42, — см. № 43 100
101 Формальдегид (см. Ns 3) HSO^" —фосфатный буферный раствор (pH 7,3) НС1; доводят pH до 4 и избыток реагента оттитровывают иодом 101
102 Ацетальдегид (см. Ns 1), образуемый при определении молочной кислоты в вине; соке грейпфрута и т. п. путем окисления смесью МпО^“— MnSO4—фосфорная кислота Перегоняют в фосфатный буферный раствор NaHSO3 НС1; доводят pH до 2—3; титруют иодом; добавляют NaHCOg и титруют иодом 102
230
Продолжение
№ п/п 103 104 105 106 107 108 109 110 Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
формальдегид (см. № 3) при изучении кинетики реакции с анилином и замещенным анилином в среде разбавленной НС1 формальдегид (см. № 3) при изучении реакции с мочевиной Ацетальдегид (см. № 1) в винилацетате л-Оксокамфора Альдегидные группы (см. № 2) в оксикрахмале, получаемом при окислении крахмала хромовой кислотой Ацетальдегид (см. № 1) в спиртах Ацетальдегид (см. № 1), Образуемый при определении молочной кислоты^ в процессе взаимодействия с соединениями Celv Ацетальдегид (см. № 1) в присутствии кротонового альдегида Na2SO3; умеренный избыток NaOH SO|~; pH 8,5 (в основном за счет прибавления НС1 во время реакции); 7 мин при комнатной температуре; или добавляют избыток so3 NaHSOs—NaCl NaHSO3 (приблизительно 10-кратное эквивалентное количество); 1 ч при 10° С Na„SO3; избыток H2SO4; 3 ч при комнатной температуре NaHSOs в нейтральной среде Перегоняют в буферный раствор; NaHSO3; pH 7; 20 мин при комнатной температуре NaHSO3; оставляют на ночь при 70— 80° С Титруют раствором НС1 в присутствии розоловой кислоты Титруют иодом; добавляют Na2CO3 и титруют иодом титруют раствором НС1 Водный слой титруют иодом; добавляют NaHCO3 и титруют иодом Иод, избыток которого оттитровывают тиосульфатом Титруют раствором N аОН потен циоме-трически до pH 9,5 (правильнее до образования СООН-групп) Подкисляют, титруют иодом, добавляют NaOH—Н3ВО3, чтобы довести pH до 9,5, и титруют иодом НС1 и избыток реагента оттитровывают иодом NaHCO3, выделившийся ацетальдегид из его бисульфитно-го соединения перегоняют в раствор N aHSO3 и определяют методом, описанным выше 40, — см. № 41 103 104 105 106 107 108, 113 109 ПО
231
Продолжение
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования •Пить Рату. Ра
111 Ацетальдегид (см. № 1), образуемый при определении молочной кислоты путем окисления смесью МпО^~—MnSO4— Лосфорная кислота Перегоняют в раствор NaHSO3 Титруют иодом при 0° С; добавляют NaHCO3 и титруют иодом 111
112 Протеиновые — S—S- Пропускают в бу- Образующиеся 112,
группы ферный раствор (NH4OH—NH4NO3); Na2SO3 группы титруют солями серебра амперометрически [см. том I, «Соединения серебра (I)», литература 73 и 145] 146
ИЗ Ацетальдегид (см. № 1); также образуемый при определении молочной кислоты в процессе окисления соединениями церия (IV) Перегоняют в фосфатный буферный раствор; NaHSO3; этанол; при pH 7; 20 мин при комнатной температуре НС1; доводят pH до 0,7—3,0 добавляют иод, избыток которого оттитровывают тиосульфатом, или НС1 до pH 2,5; титруют иодом; добавляют NaHCO и титруют иодом 114
114 Альдегиды (см. № 2) в винах, фруктовых соках Перегоняют в фосфатный буферный раствор; Na.2SO3— H2SOd; при pH 7; 10 мин НС1; титруют иодом; добавляют боратный буферный раствор и титруют иодом 115
115 Альдегиды (см. № 2), например формальдегид (см. № 3), ацетальдегид (см. № 1), пропионовый альдегид, бензойный альдегид N aHSO3—фосфатный буферный раствор; слой толуола для предотвращения действия кислорода воздуха НС1; непрореагировавший реагент оттитровывают иодом 116
116 Цистеин (см. № 99) в гидролизатах протеина В аммонийном или боратном буферном растворе при pH 9,2; Na2SO3; в атмосфере азота Титруют Hg11 амперометрически [см. Том I, «Соединения ртути (II)», литература 32] 117
117 а-Эпоксиды Na2SO3; 30 мин— 3 ч при комнатной температуре; периодически встряхивают Титруют раствором НС1 в присутствии ализаринового желтого Р и ксиленолового цианола ФФ, или потенциометрически до pH 9,5 118
118 Формальдегид (см. № 3) в водных растворах мочевины Экстракт в изоамиловом спирте; Na2SO3; 10—15 мин при комнатной температуре Титруют раствором H2SOd в присутствии тимолфталеина 119
232
Продолжение
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
119 Соединения, содержащие —С=С—СО- или —С=С—CN-группы Изопропанол; Na2SO3; избыток H2SO4; в атмосфере азота; 5—120 мин при 25—28° С Титруют раствором NaOH в присутствии ализаринового желтого Р и ксиленолового цианола ФФ 120
120 Свободный формальдегид (см. № 3) в смоляных растворах, содержащих оксиметилмоче-вину или меламнн Анализируемый раствор; Na2SO3; избыток НС1 Титруют раствором NaOH в присутствии тимолфталеина или фенолфталеина 121
121 Ацетальдегид (см. № 1) в винилацетате NaHSOg Иод, избыток которого оттитровывают тиосульфатом 122
122 Ацетальдегид (см. № 1) в замерзших овощах Перегоняется с паром в раствор NaHSO3; 30 мин при комнатной температуре Иод, избыток которого оттитровывают тиосульфатом 123
123 Цистеин (см. № 99) в протеиновых гидролизатах В щелочном растворе; Na2SO3 (Метод описан выше117 — см. № 116) Титруют Hgn амперометрически [см. Том I, «Соединения ртути (II)», литература 36] 124
124 Небольшие количества ацетальдегида (см. № 1) в водных растворах NaHSO3; при pH 2; 90 мин при комнатной температуре Титруют иодом; доводят pH до 8 посредством НСО3" и титруют иодом 125
125 Цистеин (см. № 99) В буферном растворе (NH4OH—NH4NO3); Na2SO3 Титруют солями серебра амперометрически [см. Том I, «Соединение серебра (I)», литература 105] 126
126 Глиоксаль (см. № 144) N aHSO3—фосфатный буферный раствор, pH 7,3; 3 мин при комнатной температуре Доводят НС1 pH до 4,5 и титруют иодом 127
127 Ацетальдегид (см. № 1), образуемый при определении молочной кислоты в вине путем окисления в сернокислой среде Перегоняют в раствор NaHSO3 Титруют иодом; добавляют Na2CO3 и титруют иодом 128
128 Акрилонитрил (см. № 133, 158) В среде диоксана Na2SO3 60—90 мин при комнатной тем1' пературе Титруют раствором НС1 в присутствии тимолфталеина или ализаринового желтого 129
233
Продолжение
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Лите-рату Ра
129 Дисульфиды (см. № 130, В щелочном раство- Титруют Hg11 при 132
130 136, 142, 143, 155, 166, 169, 170) Дисульфиды (см. № 129) ре; Na2SO8 В щелочном раство- pH 2 потенциометрически [см. Том I, «Соединения ртути (II)», литература 40] Титруют Hg11 ампе- 133
131 Ацетальдегид (см. № 1), ре; Na2SOs Перегоняют в рас- рометрически [см. Том I, «Соединения ртути (II)», литература 41] Титруют иодом; до- 134
132 образуемый при определении молочной кислоты в крови путем окисления смесью МпО^, MnSO4 и H2SO4 Альдегиды (см. № 2) твор NaHSO3 Перегоняют в фос- *бавляют Na2CO3 и титруют иодом НС1; титруют иодом; 135
133 в вине и коньяке Акрилонитрил (см. фатный буферный раствор; NaHSO3; pH 7; 1 ч при комнатной температуре Na2SO3; 15 мин при 100° С Перегоняют в рас- добавляют борат— щелочь и титруют иодом Титруют кислотой 136
134 Ns 128) Ацетальдегид (см. № 1), в присутствии тимолфталеина Иод, избыток кото- 137
135 образуемый при определении молочной кислоты в свежем мясе путем окисления МпО4“ в сернокислом растворе Ацетальдегид (см. № 1) твор NaHSO3 NaHSO3; 4 ч при 75° С В щелочном раство- рого оттитровывают тиосульфатом NaHCO3; образую- 138
136 в техническом кротоновом альдегиде Дисульфиды (см. № 129) щийся ацетальдегид пропускают через раствор гидроксил-амина гидрохлорида и титруют щелочью Титруют Hgu ампе- 139
137 Альдегиды (см. № 2), ре; NajjSOg Переносят с потоком рометрически [см. Том I, «Соединения ртути (II)», литература 48] Избыток реагента 140
образуемые при определении аминокислот (№ 55) окислением нингидрином азота в раствор NaHSO3 окисляют иодом, альдегиды определяют добавлением Na2CO3 и иода; избыток непрореагировавшего иода оттитровывают тиосульфатом
234
Продолжение
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования
Литература
138 139 Свободный формальдегид (см. № 3) в мочеви-но-формальдегидных и меламино-формальдегид-ных смолах Формальдегид (см. № 3); ацетальдегид (см. № 1) В воде; Na2SO3 и НС1 В воде; Na2SO3 уксусная кислота и пентан для предотвращения действия кислорода и потери SO2; 10—20 мин при комнатной темпера-
туре
Титруют раствором NaOH
141
140 Ацетальдегид (см. № 1), образуемый при определении молочной кислоты в пиве путем окисления перманганатом в сернокислой среде Перегоняют в раствор NaHSO3
141 Карбонильные соединения (см. № 56) в атмосфере Пропускают воздух через NaHSO3; при 0° С
142 Дисульфиды (см. № 129), например цистин (см. № 155, 162) В боратном буферном растворе; КС1; Na2SO3
143 Дисульфиды (см. № 129) При pH 9; Na2SO3
144 Глиоксаль (см. № 126) (Как в методах, описанных выше 142-143, — см. № 139, ио реакция протекает 30 мин)
Непрореагировавший SO|” окисляют, титруя иодом, добавляют NaOH—KCN, при этом образуется цианогидрин альдегида и освобождается эквивалентное количество SO^-;
подкисляют и снова титруют иодом (см. «Цианид калия», литература 30, 31, 44) Титруют иодом; добавляют NaHCOg и титруют иодом
142, 143,
164
144
Титруют иодом; добавляют Na2CO3—
уксусная кислота и титруют иодом
Титруют Hgn амперометрически [см. Том I, «Соединения ртути (II)», литература 61]
Титруют Hgn амперометрическим методом [см. Том I, «Соединения ртути (П)», литература 62]
Непрореагировавший SOg” окисляют иодом; добавляют NaOH и гидрохлорид гидроксиламина, при этом в течение 5 мин образуется оксим и освобождается эквивалентное количество SOj~, подкисляют и титруют иодом (см. «Гидроксиламин», литература 145)
145
147
148
149,
154, 164
235
ПРОдолженц.
№ п/п
145
146
147
148
149
150
151
152
153
154
Титруемое вещество
Формальдегид (см. № 3), образуемый при определении 1,2-гликолей например глицерина (см. № 62), маннита, окислением перйодатом Формальдегид (см.№ 3), образуемый при определении глюкозы путем окисления перйодатом Глиоксиловая кислота (см. № 149), образуемая при определении винной кислоты путем окисления перйодатом Гептальдегид (см. № 38) и другие альдегиды (см. № 2), образуемые при окислении жиров коровьего масла Глиоксиловая кислота (см. № 147) или ее соли
Формальдегид (см.
№ 3), образуемый при определении фруктозы окислением перйодатом Формальдегид (см. № 3), образуемый при определении глицеральдегида окислением перйодатом Формальдегид (см. № 3) или ацетальдегид (см. № 1), образуемые при определении серина или треонина (см. № 60), соответственно, окислением перйодатом Ацетальдегид (см. № 1)
Дитиогликолевая кислота; дисульфид 2-мер-каптоэтанола
Реагент и условия реакции
Соответствующая обработка и конечная стадия титрования
[Как в методах, описанных выше 142,143, — см. № 139; SOg- также окисляют и IO4* (см. «Цианид калия», литература 52 и 55)]
(Как в методе, описанном выше 150,151 — см. № 145; см. также «Цианид калия», литература 54)
(Как в методе, описанном выше 150,151 — см. № 145; см. также «Цианид калия», литература 55, 36, 46)
Лит? Рату. Ра
150
15
152
153,
155
166
(Метод описан выше 37 — см. № 38) 156
Na2SO3
Титруют раствором H2SO4 до pH 9,5
157
потенциометрически (Как в методе, описанном выше 150,151, — см. № 145; см. также «Цианид калия», литература 38 и 41)
(Как в методе, описанном выше150,151,— см. № 145; см. также «Цианид калия», литература 39 и 42)
158, 161
159,
162
(Как в методе, описанном выше 150,151, — 160,
см. № 145; см. также «Цианид калия», 163 литература 40, 43 и 45)
В фосфатном буферном растворе; NaHSO3, pH 7;
20 мин при комнатной температуре
В буферном растворе (NH4OH— NH4NO3), pH 9; Na2SO3
Доводят кислотой pH до 1—2 и титруют иодом, затем pH доводят до 8 боратом и щелочью и титруют иодом
Т итр уют соедине-
ниями серебра амперометрически [см. Том I, «Соединения серебра (I)», литература 183]
167
168
236
Продолжение
п'п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Лите-рагу ра
155 Некоторые дисульфиды (см. № 129), например цистин (см. № 142) В боратно-аммиач-ном буферном растворе; Na2SO3; немного нитрата или ацетата ртути (II) HNO3 доводят до pH 2 и титруют Hg** амперомегрически [см. Том I, «Соелине ния ртути (II)», литература 91] 169
156 Формальдегид (см.№3), (Как в методе, описанном выше 1ьи,1° , — 170,
образуемый при определении этаноламинов. (см. № 167) и этилендиаминов (см. № 167) окислением перйодатом см. № 145; см. также «Цианид калия», литература 47, 48) 171
157 Гексаметилентетрамин, изолированный из биологических материалов посредством ионного обмена (см. № 64) NaHSO3; 5 мин Титруют соедине-нениями серебра амперометрически при pH 7,4 [см. Том I, «Соединения се- ребра (I)», литература 177] 172
158 Акрилонитрил (см. № 128) N a2SO3 Титруют раствором НС1 в присутствии тимолфталеина или ализаринового желтого 173
159 Альдегиды (см. № 2), например формальдегид (см. № 3), ацетальдегид (см. № 1), бензальдегид (см. № 10) NaHSO3—5% -ный этанол; 30 мин прн комнатной температуре Иод, избыток которого оттитровывают гидразином в присутствии крахмала или биамперометрически (см. «Реагенты, содержащие иод», литература 417) 174
160 Формальдегид (см.№ 3), также формальдегид в фенольных смолах, спиртах и т. п. В воде; Na2SO3; титруют H2SO4 в присутствии метилового красного; 7—10 мин при комнатной температуре Добавляют уксусную кислоту и титруют иодом; добавляют NaOH или NaHCO3 и титруют иодом 175
161 Диэтилдитиобис-(тио-формиат) (диксанто-ген) В среде метанола или этанола; Na2SO3; 30 мин при комнатной температуре Избыток реагента отмывают смесью формальдегид— уксусная кислота и титруют иодом 176
162 Цистин (см. № 142) В фосфатном (pH 8) или боратном (pH 9,2) буферном растворе или NaOH (pH 12); Na2SO3 Титруют раствором C2H5HgCl ампе- рометрически [см. Том I, «Соединения ртути (II)», литера- 177
163 Содержание альдегидов (см. № 2) в хлебе NaHSO3 тура 92] Титруют иодом; добавляют Na2CO3 и титруют иодом 178
237
Продолжение
.№> Tl/П Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Лите-Рату. Ра
164 165 166 167 168 169 170 Ацетальдегид (см. № 1) в вине Мономер из полиакриловых волокон Дисульфиды (см. № 129) в сыворотке кроличьей крови и т. п. Формальдегид (см. № 3), образуемый при определении этаноламина (см. № 156) и этилендиамина (см. № 156) окислением перйодатом Ацетальдегид (см. № 1), образуемый при определении молочной кислоты окислением смесью МпО^- — MnSO4 — фосфорная кислота Дисульфиды (см. № 129) Дисульфиды (см. №129) в муке K2S2O5; НО; 15 мин при комнатной температуре Na2SO3; H2SO4; 10—90 мин при 35— 38° С Na2SO3; nh4oh—NH4NO3 (Как в методе, опис см. Ns 139; см. так литерат Перегоняют в раствор NaHSO3 Na2SO3 Na2SO3 в буферном растворе NH4OH— NH4C1 при pH 9; 5 мин при комнатной температуре Добавляют 1<Н2РО4— NaOH доводят pH до 7; оставляют на 15 мин-, затем добавляют НС1 и титруют иодом в присутствии крахмала, добавляя борат— NaOH, делают раствор щелочным и образующийся из би-сульфитного соединения альдегида сульфит оттитровывают иодом Избыток кислоты оттитровывают раствором NaOH в присутствии ализаринового желтого Титруют соединениями серебра амперометрически [см. Том I, «Соединения серебра (I)», литература 180] 149 143 энном выше * , — же «Цианид калия», ура 50) Избыток реагента оттитровывают иодом Образующийся меркаптан оттитровывают раствором AgNO3 при pH 7,4 амперометрически Титруют раствором AgNO3 потенциометрически •—. 179 180 181 182 I 183 184 185
238
6. В тех случаях, когда сульфит или бисульфит применяют для того, чтобы отделить компонент или исключить вредное его влияние, определение завершают титрованием другого компонента. В качестве примера можно привести определение некоторых аминокислот окислением перйодатом до альдегидов и аммиака, завершающееся добавлением бисульфита, отгонкой аммиака и титрованием его кислотой.
В работе11,1 приводится обзор методов обратного титрования карбонильных соединений, включая бисульфитный и сульфитный методы.
ЛИТЕРАТУРА
]. Rocques X., Compt. rend., 127, 524, 764 (1898).
2. Ripper M„ Monatsh., 21, 1079 (1900).
3. L e m m e G., Chem.—Ztg., 27, 896 (1903).
4, Seyewitz A., G i b e 1 1 o, Bull. soc. chim. France (3), 31, 691 (1904).
5. Seyewitz A., Bardin, Bull. soc. chim. France, 33, 1000 (1905).
6. Stewart A. W., J. Chem. Soc., 87, 185 (1905).
7. Jolies A., Ber., 39, 96 (1906); 2. anal. Chem., 45, 196 (1906).
8, v. F 6 r t h O., Charnass D., Biochem. 2., 26, 199 (1910).
9. R i c h t e r R., Pharm. Ztg., 57, 125 (1912).
10. F e i n b e r g B. G., Am. Chem. J., 49, 87 (1913).
11. Orton K.J.P.,m. McKie P. V., J. Chem. Soc., 109,184 (1916).
12. С 1 a u s e n S. W., J. Biol. Chem., 52, 263 (1922).
13. К ii h 1 F., Collegium 133 (1922).
14. В 1 a i r E. W., Wheeler T. S., Analyst, 48, 110 (1923).
15. Borgstrom P., Hors ch W. G., J. Am. Chem. Soc., 45, 1496 (1923).
16. Herrmann R., 2. anal. Chem., 62, 104 (1923).
17. M a с 1 e о d J. J., A r m о u г M. E., J Lab. Clin. Med., 7, 635 (1923).
18. Hi rsch - Kau ff mann H., Z. physiol. Chem., 140, 25 (1924).
19. С о 1 1 a z о J., Supniewski J., Compt. rend. soc. biol., 92, 370 (1925).
20. Romeo G., Ann. chim. applicata, 15, 300 (1925).
21. Romeo G., D’Amico E., Ann. chim. applicata, 15, 320 (1925).
22. Tsukasaki R., Tohoku J. Exptl. Med., 5, 429 (1925).
23. The Brehme and Brahdy, B., Biochem. Z., 175, 348 (1926).
24. Ta ufel K., W a g n e r C., 2. anal. Chem., 68, 25 (1926).
25. Friedemann T. E., Cotonio M., S h a 11 e r P. A., J. Biol. Chem., 73, 335 (1927).
26. L e h n a r t z E., Z. physiol. Chem., 179, 1 (1928).
27. H a e n d e 1 M., Rev. asoc. med. Argentina, 42, 215 (1929).
28. С и м с к а я А., Вестник кожевенной пром, торговли, 700 (1929).
29. Т о m a d a Y., J. Sac. Chem. Ind., London, 48, 76 (1929).
30. L a m p i 11 L. H., В о go d M., Chim. et ind., Special № 510, March, 1930.
31 В fl c h i J., Pharm. Helv. Acta, 6, 1 (1931).
32. Highberger J. H., Y о u e 1 D. L., J. Am. Leather Chem. Assoc., 27, 343 (1932).
С e p ч e л JL, Вестник кожевенной пром, торговли, 51 (1932).
3| Donnally L Н„ Ind. Eng. Chem., Anal. Ed., 5, 91 (1933).
35 M ii 1 1 e r - P a r c h a m W„ Z. physiol. Chem., 218, 209 (1933). „Киреев В. А., Попов А. А., Ж- прикл. химии, 7, 489 (1934). Qe » a Ind. Eng. Chem., Anal. Ed., 6, 241 (1934).
3«- M a 1 a p r a d e L„ Compt. rend., 198, 1037 (1934).
y Parkinson A. E., Wagner E. C., Ind. Eng. Chem., Anal. Ed., 6, 40 H3-l1934
Hahn el S., Svensk Kern. Tidskr., 47, 275 (1935).
49 Janke А., К гора cs у S., Biochem. Z„ 278, 30 (1935).
’ J a u 1 m e s P., E s p e z a 1 R., Ann. fals., 28, 325 (1935).
239
43. H i n s b e r g K-, A m m о n R., Biochem. Z., 284, 343 (1936).
44. Г о p о к о л и и с к а я М. С., Зав. лаб., 6, 188 (1937).
45. Peynaud Е., Ann. fals., 30, 390 (1937).
46. Grub S., Mukomol’e, 13, № 3, 15 (1938).
47. Laine T., Suomen Kemistilehti, 11B, 28 (1938).
48. Joslyn M. А., С о m a r C. L., Ind. Eng. Chem., Anal. Ed., 10, 364 (193«\
49. У p и неон А. П., Ж. физиологии, 25, 748 (1938). I
50. Dunl'op A. P., T r i m b 1 e F., Ind. Eng. Chem., Anal. Ed., 11, 602 (193m
51. Gordon J. J., Quastel J. H., Biochem. J., 33, 1332 (1939). 1
52. M с C r e a d у R. M., Mitchell H. K-, К i r k P. L., Mikrochemie 28
23 (1939). ’ ’
53. S c h r a d e r G. A., J. Lab. Clin. Med., 25, 520 (1940).
54. V i r t a n e n A. L., L a i n e T., T о i v о n e n T., Z. physiol. Chem. 266
193 (1940).
55. Hahnel S., Lenners t r a nd M., Svensk Kern. Tidskr., 53, 336 (1941).
56. N i с о 1 e t В. H., Shinn L. A., J. Am. Chem. Soc., 63, 1456 (1941).
57. Nitschmann H., H a d о r n H., Helv. Chim. Acta, 24, 237 (1941).
58. Poethke W., Pharm. Zentralhalle, 82, 529 (1941).
59. S h i n n L. A., N i с о 1 e t В. H., j. Biol. Chem., 138, 91 (1941).
60. Winnick T., J. Biol. Chem., 141, 115(1941).
61. H о e p e G., Treadwell W. D., Helv. Chim. Acta, 25, 353 (1942).
62. L a z z a r i G., Ann. chim. applicata, 32, 78 (1942).
63. P a u 1 a i s R., Bull. sci. pharm., 49, 191 (1942).
64. Rosenthaler L., Pharm. Acta Helv., 17, 196 (1942).
65. W i n n i c k T., J. Biol. Chem., 142, 451 (1942).
66. Winnick T., J. Biol. Chem., 142, 461 (1942).
67. G о 1 d m a n F. H., Y a g о d a H., Ind. Eng. Chem., Anal. Ed., 15, 378 (1943).
68. H о e p e G., Helv. Chim. Acta, 26, 1931 (1943).
69. M a c d о n a 1 d F. J., Analyst, 68, 171 (1943).
70. Rapine M., Ann. chim. anal., 25, 113 (1943).
71. S h u p e 1. S., J. Assoc. Offic. Agr. Chem., 26, 249 (1943).
72. G о I d b e r g A. S., В e r n h e i m A. R., J. Biol. Chem , 156, 33 (1944).
73. Johnson M. J., Ind. Eng. Chem., Anal. Ed., 16, 626 (1944).
74. L i n d e k e n C. L, Cl a у ton J. O., Skoog D A., Ind. Eng. Chem., Anal. Ed., 16, 734 (1944).
75. Meissner R., Biochem. Z., 317, 17 (1944).
76. Heines V., Arch. Biochem., 11, 531 (1946).
77. R e i n c k e R. C., Luce E. N., Ind. Eng. Chem., Anal. Ed., 18, 244 (1946).
78. V i r t a n e n A. L, Rautanen N., Suomen Kemistilehti, 19B, 50 (1946).
79. A u b e 1 E., A s s e 1 i n e a u J., Bull. soc. chim. France, 689 (1947).
80. H о p n e r T., Das Papier, 1, 102 (1947).
81. Roine P., Rautanen N., Acta Chem. Scand., 1, 854 (1947).
82. R у a n J. D., Shaw F. B., US Patent No. 2, 425, 568, Aug, 12, 1947.
83. S i g g i a S., Maxey W., Anal. Chem., 19, 1023 (1947).
84. Siggia S., Anal. Chem., 19, 1025 (1947).
85. d e Souze A. H., Pubs. farm. (Sao Paulo), 12, No. 48, 5, 9 (1947).
86. A u b e 1 E., A s s e 1 i n e a u J., Biochim. et Biophys. Acta, 2, 198 (1948).
87. Elving P. J..Warshowsky B.,Shoemaker E.,Margolit J-, Anal. Chem., 20, 25 (1948).
88. Martra ire M., Inds. agr. et aliment, 65, 123 (1948).
89. Peynaud E., Ann. fals. et fraudes, 41, 384 (1948).
90. R e у n о 1 d s J. G., Irwin M., Chem. and Ind. (London), 419 (1948).
91. Wurtzschmitt B., Z. anal. Chem., 128, 549 (1948).
92. Афанасьев Б. H., Зав. лаб., 15, 1271 (1949).
93. I lice to A., Ann. chim. (Rome), 39, 703 (1949); 40, 711 (1950).
94. M с C a r v i 1 1 M., Conway E. J., Biochem. Abstracts of Comms., ls< Intern.
Congress, Cambridge, 301 (1949).
95. A r k a w a T., Hirosaki Med., J., 1, 33 (1950).
96. С о w a n H. D., McCa be C, L, Warner J. C., J. Am. Chem. Soc., 7Д
1194 (1950).
240
п о n n a 1 1 у L., Anal. Chem., 22, 364 (1950).
о I 1 i c e t о A., M a 1 a t e s t a A., Ann. chim. (Rome), 40, 494 (1950).
л К о 1 t h о f f I. M., Stricks W., J. Am. Chem. Soc., 72, 1952 (1950).
on peynaud A., Charpentie Y., Ann. fals et fraudes, 43, 246 (1950).
Joi Sa lorn a a P., Nord. Kemistmotet, Helsingfors, 7, 20 (1950).
,n? Koch J., В r e t t h a u e r G., Z. anal. Chem., 132, 346 (1951).
in3 Ogata Y., Okano M., Sugawara M., J. Am. Chem. Soc., 73, 1715
1 ' (1951).
,04 de Jong J. J., d e J о n g e J., Rec. trav. chim., 71, 890 (1952).
,п5 A r i к a wa Y., Japan Analyst, 2, 436 (1953).
{on Asahi Y., Ann. Repts. Takeda Research Lab., 12, 75 (1953).
iq7 Ellington A. С., P urves С. B., Can. J. Chem., 31, 801 (1953).
108 J a u 1 m e s P., D ieuzede J. C., Trav. soc. pharm. Montpellier, 13, 182 (1953).
109 . Lucas J. F. C., Rev. cienc. apl. (Madrid), 7, 526 (1953).
110 Sj os from E., Acta Chem. Scand., 7, 1392(1953).
HL Smith R. J., Anal. Chem., 25, 505 (1953).
112. Carter J. R., Science, 120, 89b (1954).
113. Jaulmes P., Dieuzede J. C., Ann. fals. et fraudes, 47, 9 (1954).
114. Lucas J. F. C., Rev. cienc. apl. (Madrid), 8, 103 (1954).
115. P a u 1 F., Mitt. Klosterneuburg, Ser. A, Rebe u. Wein, 4, 225 (1954).
116. S a 1 о m a a P., Suomen Kemistilehti, 27B, No. 2, 12 (1954).
117. Stricks W„ К о 1 t h о f f I. M., Tanaka N., Anal. Chem., 26, 299
(1954).
118. Swan J. D., Anal. Chem., 26, 878(1954).
119. P e t z A., Cherubini M., Holz, Roh.-, u. Werkstoff, 13, 70 (1955).
120. Critchfield F. E., J о h n s о n J. B., Anal. Chem., 28, 73 (1956).
121. Endo A., Japanese Patent № 1750, March 10, 1956.
122. Frehden O., Ecsichof T., Rev. chim. (Bucharest), 7, 304 (1956).
123. Gutterman В. M., J. Assoc. Offic. Agr. Chem., 39, 282 (1956).
124. Human J. P. E., L e a c h S. J., Chem. and Ind. (London), 149 (1956).
125. Impey N. R. M., V e r d i e r E. T., J. S. African Chem. Inst., 9, 51 (1956).
126. Ray Sarkar B. C.Swaraman R., Analyst, 81, 668 (1956).
127. S a 1 о m a a P., Acta Chem. Scand., 10, 306 (1956).
128Сапонджян С. О., Геворкян К. С., Виноделие и виноградарство СССР, 16, № 8, 10 (1956).
129. Терентьев А. П., О бте м п ер а нс к а я С. И., Ж- аналит. химии, 11, 638 (1956).
130. Афанасьев Б. Н., Тр. Свердловск, сельскохозяйственного ин-та, 1, 361 (1957).
131. Berka А., Chemie (Prague), 9, 528 (1957).
132. Cecil R._ McPhee J. R., Biochem. J., 66, 538 (1957).
133. Csagoly E., Acta Pharm. Hung., 27, 267 (1957).
134. Држевецкая И. А., Лабораторное дело, 3, № 4, 21 (1957).
135. Духовный А. И., Садоводство, виноградарство и виноделие Молдавии, 12, № 3, 46 (1957).
36- 1957° т и н Л- Д, Виданова В. А., Авт. свид. СССР № 104, 643, январь 25, '37. Trawinska J., Ann. Univ. Mariae Curie—Sklodowska, Lublin, Polonia, 138 nect; ,DD 12- 41 <1957)-
Ho 1 1 e n Z., Bellen N., Chem. Anal. (Warsaw), 4, 19 (1958).
Un u u m a n J- P- s-- Textile Research J., 28, 647 (1958).
141 v U n 1 e r I- R-. P о t t e r E. F., Anal. Chem., 30, 293 (1958).
(19*58) елев В., Зарубицкий А., Строит, материалы, 4, № 7, 32
143 | c J} u 1 e k E., M а г о s L., Magyar Kem. Folyoirat, 64, 480 (1958).
144 E-, Maros L., Acta Chim. Acad. Sci. Hung., 17, 369 (1958).
145 ш1., ereisen K, Kremkow C., Brauerei Wiss. Beil., 11, 128 (1958).
1 'Ulson K. W„ Anal. Chem., 30, 1127 (1958).
•Larter J. R., J. Biol. Chem., 234, 1705 (1959).
241
r R. C., Z. anal. Chem., 166, 1 (1959).
S. J., Biochim. et Biophys. Acta, 33, 264 (1959).
L., S c h u 1 e к E., Magyar Kem. Folyoirat, 65, 195 (1959).
L., S c h u 1 e к E., Magyar Kem. Folyoirat, 65, 361 (1959).
L., Schulek E., Acta Chim. Acad. Sci. Hung., 20, 359 (1959)
L., Schulek E., Acta Chim. Acad. Sci. Hung., 21 9]
147. К а р о о
148. Leach
149. Maros
150. Maros
151. Maros
152. Maros
(1959).
153. Schulek E., Molnar-Perl I., Maros L., Magyar Kem. Folvoir=*
65, 363 (1959). * at'
154. Schulek E., Maros L., Acta Chim. Acad. Sci. Hung., 19, 473 (19591
155. Schulek E., Maros L., Acta Chim. Acad. Sci. Hung., 20, 143 (19501
156. T a m s о n a A., Powel 1 R. D., J. Agr. Food Chem., 7, 643 (1959). '
157. McFadden B. A., Howes W. V., Anal. Biochem., 1, 240 (I960).
158. Maros L., S c h u 1 e к E., Magyar Kem. Folyoirat, 66, 197 (1960).
159. Maros L., Molnar-Perl I., Schulek, E., Magyar Kem. Folyoirat 66
319 (1960). ’ ’
160. Maros L., Molnar-Perl I., Schulek E., Magyar Kem. Folyoirat 66, 321 (1960).
161. Maros L., Schulek E., Acta Chim. Acad. Sci. Hung., 22, 359 (1960).
162. Maros L., Molnar-Perl I., Schulek E., Acta Chim. Acad. Sci Hung., 24, 67 (1960).
163. Maros L., Molnar-Perl I., Schulek E., Acta Chim. Acad. Sci Hung., 24, 213 (1960).
164. Maros L., S c h u 1 e к E., Ann. Univ. Sci. Budapest Rolando Eotvos nomi-natae, Sect. Chim., 2, 227, 231 (1960).
165. Maros L., Molnar-Perl I., Schulek E., Ann. Univ. Sci. Budapest Rolando Eotvos nominatae, Sect. Chim., 2, 237 (1960).
166. Schulek E., Maros L., Ann. Univ. Sci. Budapest Rolando Eotvos nomi-
natae, Sect. Chim., 2, 243 (I960).
167. Burroughs L. F., Sparks A. H., Analyst, 86, 381 (1961).
168. Kolthoff I. M., Eisenstadter J., Anal. Chim. Acta, 24, 83 (1961).
169. Kolthoff I. M., Eisenstadter J., Anal. Chim. Acta, 24, 280 (1961).
170. Maros L., Mo In ar-Perl I., Schulek E., Magyar Kem. Folyoirat,
67, 203 (1961).
171. Maros L., Molnar-Perl I., Schulek E., Acta Chim. Acad. Sci. Hung., 26, 467 (1961).
172. Mondovi B., Costa M. T., Ferro-Luzzi G., Ital. J. Biochem.,
10, 42 (1961).
173. Обтемперанская С. И.,Терентьев А. П., Бузланова M. M., Ж- анал. хнм., 16, 372 (1961).
174. P a n w a r K. S., R a о S. P., G a u r J. N., Anal. Chim. Acta, 25, 218 (1961)-
175. P г о b s t h a i n K-, Z. anal. Chem., 182, 409 (1961).
176. Satyanarayana Rao V. R., Vasudeva Murthy A. R., Chemist—Analyst, 50, 30 (1961).
177. Stricks W., Chakravarti S. K., Anal. Chem., 33, 194 (1961).
178. Токарева P. P., Кретович В. Л., Хлебопекарная и кондитерская пром., 5, № 6, 11 (1961).
179. Jaulmes Р., Hamelle G., Ann. fals., 54, 338 (1961).
180. Philipp В., В a r t e 1 s U., H a у m e H., Faserforsch., Textiltech , 12, 581 (1961).
181. Schwartz А., Рога E. A., К i s Z., M a d a r I., F a b i a n N., Comun. acad. rep. populare Romine, 11, 45 (1961). .
182. Maros L., Molnar-Perl I., Schulek E., Acta Chem. Acad. 5ci. Hung., 30, 119 (1962).
183. Sepitka A., Zradulova E., Listy Cukvovar, 77, 16 (1961).
184. Nedic M., Berkes I., Acta Pharm. Jugoslav, 13, 13 (1963).
185. Tsen С. C., Anderson J. A., Cereal Chem., 40, 314 (1963).
242
16. РЕАГЕНТЫ, СОДЕРЖАЩИЕ БРОМ
ГТоД этим названием объединено несколько реагентов.
1. Элементарный бром в среде различных органических раство-птелей, таких, как уксусная кислота, СС14,_ СНС13. Отмечают37, что в среде СНС13 образуются пербромиды водорода:
5Вг2 + 2СНС13 НВг3 + НВг6 + 2СВгС13
Запах брома после окончания реакции не ощущается.
2. Бром и Вг~ в воде; реагент, вероятно, находится главным образом в форме Вг~-ионов.
3. Бром и Вг_ в метаноле. В так называемом реагенте Кауфмана раствор дополнительно насыщают NaCl, благодаря этому, как утверждают, устойчивость реагента превосходит устойчивость всех других реагентов, приготовленных на основе брома.
4. Бром в смеси уксусная кислота—пиридин—H2SO4. В растворе образуется дибромпиридинсульфат C5H5N-H2SO4-Вг2, который, как утверждают, не принимает участия в побочных реакциях.
5. Метилпиридиний трибромид (С5Н5 NCH3)+ Вг-Г в смеси уксусная кислота — безводный ацетат натрия.
6. Бром в щелочном растворе, реагирующий как гипобромит. При этом может быть непосредственно использован элементарный бром или бром, образующийся в кислой бромид-броматной смеси при добавлении щелочи. В некоторых случаях бром получают из гипохлорит-бромидной смеси.
7. Бромат, обычно в присутствии Вг_-ионов, в водном растворе. Этот реагент по сравнению со всеми упомянутыми выше титрантами имеет то преимущество, что он устойчив в течение долгого времени; но для выделения свободного брома его необходимо применять только в кислой среде:
ВгО“ + 5Вг~ + 6Н+ -> ЗВг2 + ЗН2О
Реагент может содержать только бромат, но к реакционной смеси Добавляют достаточное количество бромида. В некоторых случаях бромат (как реагент-окислитель) употребляют и без бромида.
Этот реагент не содержит свободного брома, но он подходит под классификацию, принятую здесь, так как в присутствии бромида протекают те же самые окислительные реакции. Во всяком случае окисление—восстановление сопровождается образованием бромида (ВгОг— Вг~ 4- 30).
8. Бром, генерируемый электролитическим путем. Этот реагент Все более широко применяется, так как при использовании его отпадает необходимость в получении устойчивого реагента, и количество Реагента может быть измерено с большой точностью кулонометриче-скип. методом.
9- Хлорид брома ВгС1, образующийся в смеси бромид—бромат— °нцентрированная соляная кислота.
243
Реакции и титруемые вещества. 1. Реакции присоединен^ в основном к олефинам, но в некоторых случаях также и к ацетил Я нам:
)С = С( + Вг2 -> )СВг — СВг( ИЛИ
)С = Q + ВгС1 -> )СВг — СС1(
К олефинам, определяемым таким способом, относятся углево дороды, например инден, стирол, терпены; ненасыщенные барби" тураты, такие, как аллил- и циклогексенилпроизводные; фурфурол (особенно получаемый из пентоз и пентозанов); виниловые эфиры-кетоны; коричная и кротоновая кислоты; аллилизотиоцианат' Наиболее важным примером является широко распространенное определение ненасыщенных, особенно нефтяных, фракций, жиров и масел, часто называемое определением «бромного числа» или «иодного числа» (в таблице употребляется исключительно первое название даже тогда, когда авторы употребляют второе).
При определении енолов присоединение сопровождается быстрым выделением НВг:
(— СО — СН2 —) — С (ОН) = СН— — С (ОН) — СН — ——i
Вг Вг
I I
- ► — с (ОН) — СВг — (— СО — СВгН —)
То же самое, вероятно, происходит с аци-формой нитросоединений, например:
СН3 —CH = N(T° —iCH3 —СНВг—NBr^0 — \он 4 ОН
СН3 — СНВг — NO2
2. Реакции, протекающие почти всегда за счет замещения атомов водорода циклов:
— СН — -- Вг2 (или ВгС1) -> — СВг = НВг (или HCI)
Наиболее широко эти реакции применяют для определения фенолов и ароматических аминов. Так определяют фенол, крезолы, нафтолы и нафтолсульфоновые кислоты, салициловую кислоту и салициламид, фенолфталеин, n-оксибензойную кислоту (образуемую при гидролизе ее эфиров), оксин и диэтилстильбэстрол. Среди ароматических аминов, определяемых этим методом, можно упомянуть аминофенолы и и-аминосалициловую кислоту, сульфаниламиды, и-аминобензойную кислоту, образуемую при гидролизе ее эфиров, сульфаниловую кислоту, дифениламин и соединения, подобные «централиту»; восстановленный хлорамфеникол; N-метиламин анилы.
Замещение бромом атомов водорода в бензольном кольце леж также в основе определения антрацена, фенотиазинов, индола и ег
244
поизводных, сульфамидов и карбазола. Ниже приведены уравнения некоторых реакций:
ОН
ОН
ОН ОН
Н3С'/':у/Х'ОН
Вг
I I
so2nh2 so2nh2
С1 (или —NO2)C1 (или —NO2)
соон
он он
он
ОВг СООН Вг I ,Вг 8Вг Х| II
он он
I Вг
SO3H Вг
Вг
3. Реакции окисления, протекающие в процессе определения различных классов соединений. Главными примерами такого рода соединений являются: гидразины (например, изониазид); серосодержащие соединения (меркаптаны, например 6-меркаптопурин и глю-татион; сульфиды, как метионин и тиофен; дисульфиды, как цистин, а также тиомочевины, тиоурацилы и тиобарбитураты); полиоксисоединения (например, гидрохинон, глицерин и сахара); альдегиды (например, формальдегид, а также формиаты); некоторые амиды и аминокислоты (например, мочевина и глицин).
В табл. 25 представлено около 50 примеров окисления бромом алкилиодидов, образуемых при определении содержания низших алкоксильных групп в процессе нагревания анализируемых объектов с иодистоводородной кислотой. Ниже приводится несколько уравнений типичных реакций окисления бромом:
C6H4NCONHNH2 -J- Н2О + 2Вг2 -> C5H4NCOOH + N2 + 4HBr
RSR' + H2O + Br2 -> RSR' + 2HBr
I
О
245
RSSR + 4H2O + 5Br2 -> 2RSO2Br + 8HBr
CS (NH2)2 - 7OB1- + 20H~ C02 + N, + SO^ j- 7Br~ + ЗЯо CH2OHCHOHCH2OH + OBr- -> CH2OHCOCH2OH + Br + H2O
HO —OH + Br2 -> О =/ О + 2HBr
CO (NH2)2 + ЗОВГ -> CO2 + N2 + 3Br- + 2H2O
— CO —CO—+H2O + Br2~> —CO—О —CO—+2HBr 3HCHO + 2BrOf 3CO2 + 3H2O + 2Br~
5HCOOH + 2HBrO3 -» 5CO2 + 6H2O + Br2 (литература 16)
CHSI + Br2 -> CH3Br + IBr и далее
IBr + 2Br2 -J- 3H2O -> HIO3 + 5HBr
В некоторых случаях могут протекать одновременно несколько реакций, а не одна из указанных выше. Так, диэтилстильбэстрол, содержащий ненасыщенную связь и гидроксилзамещенные ароматические соединения, реагируют с 10 атомами брома, из которых два присоединяются, а два замещают атомы водорода в каждом бензольном ядре. Окисление изопропанола до ацетона обычно происходит путем частичного замещения метильных групп (см., например, работу48). Конечным продуктом при определении оксима циклогексанона является бромнитроциклогексан CeH10NO2 (Вг), который получается в результате окисления и замещения (или присоединения, сопровождаемого выделением НВг)®05.
4. К трем описанным группам реакций не могут быть отнесены реакции определения тетраэтилсвинца и силанфенильных групп:
РЬ (С2НБ)4-> РЬВг2
= Si — С6Н5 = SiBr +С6НвВг
Примеры реакций ионного обмена, сопровождающихся образованием пербромидов органических оснований, аналогичных тем, которые образуют иод-иодидные реагенты, неизвестны.
Условия реакции. pH реакционной смеси меняется в широких пределах; среда может изменяться от сильнокислой (особенно с бромид-броматным реагентом для достаточно быстрого выделения брома), создаваемой НС1 или H2SO4 (как растворитель может применяться уксусная кислота), до щелочной, как например, с гипобромитом. Очень часто берут минимальный избыток реагента, чтобы избежать побочных реакций. Величину его устанавливают с помощью предварительного определения или титруют до появления светло-желтого или коричневого окрашивания, затем иногда добавляют еще небольшую порцию реагента. С другой стороны, очень редко (для ускорения реакции) приливают большие избытки реагента из-за возможности побочных реакций. Например, при проведении реакций присоединения могут протекать также реакции замещения. Реакции почти всегда проводят при комнатной или меньшей температуре. В этих условиях, главным образом, предотвращается потеря летучего бром
246
ного реагента и подавляются реакции замещения, наблюдающиеся при определениях, основанных на реакциях присоединения. При проведении реакций присоединения применяют катализаторы. В качестве основных катализаторов можно указать сульфат ртути (II) и молибдат аммония. Реакционная среда в большинстве случаев бывает гомогенной, но имеются случаи, особенно при использовании бромид-броматных реагентов, когда образуются два несмешива-ющихся слоя. Реакции часто выполняются в темноте.
Соответствующая обработка а конечная стадия титрования. 1. В большей части примеров, приведенных ниже, при выполнении конечной стадии титрования определяют избыток брома. Это делают различными путями.
1) Непосредственно методом обратного титрования с применением, например, тиосульфата в щелочной среде в присутствии индикатора крахмал—иодид38.
с применением Р-нафтола (титруют до обесцвечивания); титана (III) (титруют до обесцвечивания метиленовой сини); анетола (титруют до обесцвечивания); электролитически генерируемых ионов Си11 амперометрически; сульфата гидразина (потенциометрически);
2) Косвенным методом обратного титрования, основанным на применении избытка арсенита. Непрореагировавший арсенит затем оттитровывают броматом или бромом в присутствии индикатора типа метиленового красного, метилового оранжевого, п-этоксихризоидина, индигокармина или бриллиантового кармоизина; иодом в присутствии крахмала; или гипогалогенитом в присутствии индигокармина.
Другим видом косвенного метода обратного титрования является введение избытка Sn11 и последующее обратное титрование иодом, избытка SCN- с последующим кулонометрическим окислением его (до CN- + SO1') и известная реакция с фенолами, сопровождающаяся образованием Вг-, который затем превращают в BrCN и титруют иодометрически125.
В настоящее время большинство наиболее применяемых методов обратного титрования избытка брома основано на добавлении иодида и последующем титровании выделившегося иода,- обычно тиосульфатом, до исчезновения желтого окрашивания иода или в присутствии крахмала, или с применением инструментального метода, например биамперометрического. Перед добавлением иодида раствор щелочного гипобромита нейтрализуют или подкисляют, а к смесям, содержащим ртуть (II) в качестве катализатора, добавляют хлорид натрия; при этом выделяется бром, образующий с ртутью комплекс. Очень редко добавляют избыток тиосульфата и завершают определение титрованием иодом. Имеются две ссылки на титрование выделившегося иода сульфитом вместо тиосульфата. Кроме того, в двух статьях описана техника поглощения непрореагировавшего брома раствором иодида калия и последующего титрования этого Раствора тиосульфатом.
2. Определение продуктов реакции. В большинстве этих определений используется титриметрическое определение органически
247
связанного брома в продуктах реакции (обычно реакции присоединения или замещения); титрование бромистоводородной кислоты или бромид-иодидов, образующихся в процессе реакции замещения, а иногда при окислении. Во всех случаях избыток брома должен быть удален, для этой цели применяют такие вещества, как тиосульфат фенол, |3-нафтол, анилин (при таких реакциях выделяется НВг’ и они непригодны, если в основе определения лежит титрование этой кислоты), Hgi, сульфит, 1“ в смеси тиосульфатом, диизобути-лен, органические растворители, такие, как СС14 или СНС13; также применяют отдувку током воздуха и кипячение.
1) Бром в некоторых органических соединениях, в таких, как бромированные енолы (при определении енолов), гипобромит три-бромфенила (при определении, например, фенола или п-оксибензой-ной кислоты) или а, p-дибромкоричная кислота (при определении коричной кислоты), отличается большой активностью. Его определяют путем предварительной обработки иодидом в течение 15 мин и последующего титрования выделившегося иода тиосульфатом:
C6H2Br3OBr -J- Н+ + 21- С6Н2Вг3ОН + Вг' + 12
С6Н6СНВгСНВгСООН + 21- С^СН = СНСООН + 2Вг" + 12
— СОСНВг — + Н+ Н-2Г — СО — СН2— С (ОН) = СН — + Вг + 12
Для превращения брома, содержащегося в продуктах реакции (ковалентная связь), в Вг_-ионы требуется воздействие сильнодействующих агентов, например щелочей или окислителей (см. работы26’ 63 ’ 525). Вг~ титруют растворами Ag+ или Hg2+.
Таблица 24. Примеры определения бромид-ионов, образующихся при бромировании некоторых органических веществ
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования
1 Трибромфенол Феиол Растворяют в избытке щелочи и обратно оттитровывают кислотой
2 Бронированный фенол Фенол Титруют щелочью
3 Хинон Г идрохинон Добавляют Г—кислота; титруют тиосульфатом
4 1,2-Дибромбутан Бутен-1 Превращают действием КОС2НВ в этилацетилен, затем добавляют Ag+ и оттитровывают избыток Ag+ тиоцианатом
5 Иодат Иод в органическом основании Добавляют Г —кислота; ти- труют тиосульфатом
6 Соединения свинца (II) Тетраэтилсвинец Титруют молибдатом, добавляют избыток Сг2Оу“ и обратно оттитровывают иодометрически или ЭДТА
7 Аммиак Аминофенол Перегоняют и титруют кислотой
248
Таблица 25. Примеры использования реагентов, содержащих бром
Выражение «иодид—тиосульфат» в четвертой графе таблицы употребляется как удобное сокращение для обозначения широко используемого метода определения непрореагировавшего брома путем добавления I"-ионов и последующего титрования тиосульфатом выделившегося иода
№ /П Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
1 Жиры (см. № 6, 19, 39, 44, 55, 59, 66, 146, 168, 185, 229, 232, 304, 353, 416, 501) и масла (см. № 8, 17, 19, 35, 39, 44, 55, 56, 60, 66, 67, 91, 146, 230, 304, 347, 356, 362, 501, 515) — определение бромного числа НВг; избыток ВгО^; лучше в среде СНС1а Иодид—тиосульфат 1
2 Орсин Титруют бромной водой до желтого окрашивания Иодид—тиосульфат 2
3 Фенол (см. № 13, 27, 39, 46, 48, 51, 54, 58, 65, 76, 86, 88, 93, 95, 106, 107, 113, 120, 124, 129, 164, 189, 193, 197, 204, 233, 240, 242, 243, 254, 272, 279, 298, 299, 302, 313, 337, 339, 344, 359, 370, 383, 386, 387, 397—399, 409, 410, 418, 433, 438, 439, 451, 460, 463, 475, 488, 489, 504, 508, 537, 538, Избыток бромной воды или ВгО^— Вг—H2SO4; 10— 15 мин при комнатной температуре Иодид—тиосульфат 3
4 Углеводороды (см. № 68, 142, 186, 198, 247, 394, 501, 530) — определение бромного числа ОВг- —Вг; НС1; встряхивают, затем оставляют на несколько минут У глеводородный слой экстрагируют NaOH, неводный слой подкисляют и определяют посредством иодид—тио- сульфата 4
5 Мочевина (см. № 7, 28, 36, 74, 287, 301, 388, 404, 450, 493, 506, 516) Избыток ОВг- AsO|~; избыток арсенита оттитровывают ОВг- в присутствии индигокармина 5
6 Жиры (см. № 1) — определение бромного числа СС14; бром—СС14 (ссылка 8) или CS2 (ссылка 6) 15 мин при комнатной температуре Обратное титрование Р-нафтолом (ссылка 8) или иодид—тиосул ьфатом (ссылка 6) 6, 8
7 Мочевина (см. № 5) Избыток ОВг- AsO^-; избыток арсенита оттитровывают иодом 1
249
Продолжение
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования «Литература
8 Масла (см. № 1) и т. п. — определение бромного числа СС14; бром—СС14; 18 ч в темноте И одид—тиосул ьфат; затем добавляют Ю^~ и снова титруют иодид—тиосульфатом 9
9 Салициловая кислота (см. № 25, 30, 83, 84, 87, 113, 115, 160, 171, 280, 299, 324, 375, 383, 442, 461) ВгО^~—В г- (по крайней мере в 100% -ном избытке)—НС1; 5 мин при комнатной температуре Иодид—тиосул ьфат 10
10 jw-Крезол (см. № 29) в смеси с о- и крезолами В воде; ВгО^—Вг~; НС1; встряхивают 1 мин при комнатной температуре Иодид—тиосульфат 11
11 Тимол (см. № 63, 299, 302) ВгО^—Вг~; НС1; 5 мин при комнатной температуре Иодид—тиосульфат 12
12 Аллиловый спирт (см. № 170, 316, 329, 379) ВгО3~—Вг~; разбавленная H2SO4 Иодид—тиосульфат 13
13 Фенол (см. № 3) НС1 титруют смесью бром—КОН до желтого окрашивания и затем добавляют 10—20% избытка Вг2 Иодид—тиосульфат 14
14 Муравьиная кислота (см. № 15, 18, 26, 52, 74, 98, 101, 196, 201, 220, 259, 357, 505, 518) Бром—NaOH при- близительно в 100%-ном избытке, затем добавляют НС1 до постоянного желтого цвета Иодид—тиосульфат 15
15 Муравьиная кислота (см. № 14) BrO~—Br-; H2SO4; 1 ч при 100° С (пока не перестанет выделяться бром) Иодид—тиосульфат 16
16 Бромные числа (см. № 4, 266, 267, 322, 336) В среде СНС13 или СС14; НВг; ОС1— вода; 20 мин при комнатной температуре AsO|", избыток которого оттитровывают ОСН до желтого окрашивания 17
17 Эфирные масла (см. № 1) — определение бромных чисел В среде СС14; ВгО^-— Br_; H2SO4; 6 ч при комнатной температуре SnCl2, избыток которого оттитровывают иодом 18
18 Соли или эфиры муравьиной кислоты (см. № 14) Бром—вода до постоянного желтого цвета Избыток брома удаляют кипячением; добавляют Ag+, избыток которого оттитровывают тиоцианатом 19
250
Продолжение
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
19 Жиры (см. № 1) и масла (см. № 1) — определение ненасыщенности В среде СС14; Вг" — вода; НС1; избыток Вг~; 1 мин при комнатной температуре Непрореагировавший бром титруют сульфитом в присутствии иода как индикатора (образующегося после добавления кристалла KI) 20
20 Коричная кислота (см. № 68, 122, 224, 445) Титруют бромной водой до желтого цвета, устойчивого в течение 5 мин Иодид—тиосульфат 21
21 Терпены (см. № 307, 374) В среде СНС13; ВгО^~—Br~; H2SO4 Иодид—тиосульфат 22
22 Енолы (см. № 23, 31, 33, 153, 349, 502) В метаноле или без растворителя; бром— метанол; при —10° С P-Нафтол немедленно (для удаления; избытка брома) и Г -титруют тиосульфатом после выдерживания в течение 10 мин при 35° С (см. «Йодиды и иоди-стоводородная кислота», литература /0) 23
23 Енолы (см. № 22) В среде 96% -кого этанола при —10° С; бром—спирт (до серо-желтого цвета) Избыток брома немедленно восстанавливают тиосульфатом, добавляют I- и титруют тиосульфатом (см. «Йодиды и иоди стоводородная кислота», литература 9) 24
24 Резорцин (см. № 191, 299, 383, 538) В водной среде; бром—вода; НС1; 1 мин при комнатной температуре Иодид—тиосул ьфат 25
25 Салициловая кислота (см. № 9) Бром—вода (образуется осадок трибромфенола) Фильтруют; окисляют МпО^ получают Вт-, который обрабатывают избытком Ag+, определяемым затем обратным титрованием (см. «Перманганат калия», литература 17) 26
26 Муравьиная кислота (см. № 14) Избыток ВгО^~— Вг-; Н3РО4; 12— 15 ч при комнатной температуре Иодид—тиосульфат 27
251
П родолжение
№ п/п Титруемое вещество Реагент н условия реакции Соответствующая обработка и конечная стадия титрования Литература
27 Фенол (см. № 3) Изучено влияние концентрации кислоты, избытка Вг“, времени и температуры 28
28 Мочевина (см. № 5) Избыток ОВг~; 1 мин при комнатной температуре Уксусная кислота; иодид—тиосульфат 29, 43
29 Крезол (см. № 10, 57, 87, 88, 113, 193, 314, 370, 399, 475) Избыток ВгО^“— Вг“; НС1; 1 мин встряхивают при комнатной температуре Иодид—тиосульфат (конец титрования лучше устанавливать в присутствии СС14) 30
30 Салициловая кислота (см. № 9) BrO~—Br~; НС1; 5—10 мин при комнатной температуре Иодид—тиосульфат 31
31 Енолы (см. № 22) Избыток брома— спирт (Исследован также п ше 22,—см. № 21, брома удаляют с noi анилина, но следуе этом реакция с Г также «Йодиды и ио лота», лит Иодид—тиосульфат ютод, описанный вы-в котором избыток мощью р-нафтола или г заметить, что при идет медленно; см. ди стоводородная кис-гратура 18) 32
32 Нефтяные продукты (см. № 43, 371, 415, 452) — определение бромного числа В среде СС14; бром—СС14; 30 мин при комнатной температуре Иодид—тиосульфат; затем добавляют 10^" и снова иодид—тиосульфат 33
33 Енолы (см. № 22), например в ди а цетил янтарной кислоте или ее диэтиловом эфире В среде спирта; бром—метанол до желтого окрашивания и затем добавляют избыток реактива Избыток реагента немедленно удаляют с помощью а-нафто-ла; затем добавляют иодид—тиосул ьфат (реакция протекает в течение 5 мин, при 60° С) или Вода; НСО^~, избыток которого оттитровывают НС1 в присутствии метилового оранжевого 34
34 л-Дифенолы (см. № 193) или амины (см. № 58, 80, 162, 277, 413, 423, 488), получаемые из динитросоединений восстановлением соединениями ТИП В водной среде; этанол или разбавленная H2SO4; избыток ВгО^—Вг~ Иодид—тиосульфат 35
252
Продолжение
Хр П/п Титруемое вещество Реагент и условия реакции Соответствующая обработка н конечная стадия титрования Литература
35 Растительные масла (см. № 1) — определение ненасыщенности В среде CHC1S; бром—уксусная кислота или бром— 20%-ная НС1 AsO^, избыток которого оттитровывают уксуснокислым раствором брома в присутствии индигокармина или тринитрорезорцина 36
36 Мочевина (см. № 5) ОВг-; подогревают и снова добавляют ОВг-; затем смесь оставляют на 10 мин при комнатной температуре Избыток НС1; непрореагировавший бром удаляют нагреванием, затем обратно оттитровывают раствором NaOH; добавляют уксусную кислоту; иодид— тиосульфат 3J
37 Эритрен (бутадиен) (см. № 40) В среде этанола; бром—СС14; 5 мин при комнатной температуре; реакция протекает с образованием дибромпро-изводных; через 12 ч образуются тетра-бромпроизводные Избыток реагента оттитровывают NaOH—тиосульфатом в щелочной среде в присутствии крахмал—иодид 38
38 Фурфурол (см. № 64, 75, 96, 104, 116, 118, 135, 145, 161, 175, 176, 187, 199, 250, 262, 288, 297, 427, 447, 448) Избыток ВгО“— Вг”; НС1; 1 ч при комнатной температуре в темноте Иодид—тиосульфат 39
39 Жиры (см. № 1) и масла (см. № 1) — определение ненасыщенности; фенол (см. № 3) В среде СНС13; бром—уксусная кислота—пиридин— H2SO4; 5 мин при комнатной температуре Иодид—тиосульфат 40
40 Эритрен (бутадиен) (см. № 37) Избыток ВгО^“— Вг; H2SO4 (образуются дибром-производные) Иодид—тиосульфат 41
41 Протеины (например, желатин, казеин); гип-пуровая кислота и т. п. В водной среде; NaOH; бром—NaOH; при 0° С (при исследовании процесса разложения периодически отбирают пробы) Кислота; иодид— тиосульфат 42
263
Продо.1/нсецие
№ п/п Титруемое вещество Реагент н условия реакции Соответствующая обработка и конечная стадия титрования Литс. Гату ра
42 Анилин (см. № 80, 121, 147, 156, 169, 202, 261, 302, 332, 333), образующийся при определении нитробензола (см. № 156) путем восстановления его соединениями Тг Избыток ВгО" — Вг"; кислота; 5 мин при комнатной температуре Иодид—тиосул ьфат 14
43 Нефтяные продукты (см. № 32) — определение ненасыщенности Небольшой избыток BrOZT—Br~; H2SO4; 1 мин встряхивают при комнатной температуре Иодид—тиосульфат 45
44 Жиры (см. № 1) и масла (см. № 1) — определение ненасыщенности В среде СНС13; бром—метанол; насыщают NaBr и оставляют на 30— 60 мин при комнатной температуре Иодид—тиос ул ьфат 46
45 Дифениламин (см. № 80, 126, 246) (Ar2NCONR2) Избыток BrO^j— Br; НС1 (образуются дибром-замещенные продукты) Иодид—тиосульфат 47
46 Фенолы (см. № 3) в неочищенной аммиачной воде газовых и коксовых заводов Избыток ВгО3 — Br”; H2SO4; 1 ч при комнатной температуре И одид—тиосульфат 48
47 Производные аминокислот (см. № 178) В водной среде; бром—NaOH при 0°С (В процессе разложения периодически отбирают пробы) Кислота; иодид— тиосульфат 49
48 Фенолы (см. № 3) Избыток — Вг“; НС1; 30 мин при комнатной температуре для определения крезола в лизоле И одид—тиосул ьфат; СНС13 добавляют в конечной точке для освобождения иода, оккл юди ров а нного осадком 50
49 Смеси изомерных ненасыщенных соединений (см. № 62), например циклогексенилуксусных кислот В среде СС14 или СНС13; бром в том же растворителе. При определении различных кислот требуется разное время для завершения реакции Иодид—тиосульфат 51
50 Итаконовая (см. № 237) и мезаконовая кислоты В водной среде; бром—Вг- —вода; 10 мин при комнатной температуре Иодид—тиосульфат; методом интерполяции определяют состав смеси 52
25-1
Продолжение
— п/п Титруемое вещество Реагент и условия реакции Соответствующая об работка н конечная стадия титрования Литература
51 Фенол (см. № 3) Избыток ВгО^“— Вг; Н3РО4 Иодид—тиосульфат 53
52 Муравьиная кислота (см. Ns 14) NaHCO3 или ацетат натрия; бром—Вг" до желтого окрашивания; 15 мин при комнатной температуре AsC^-\ избыток которого оттитровывают смесью бром— Вг-—вода в присутствии индигокармина или тринитрорезорцина 54
53 2,4-Динитроанилин, неизрасходованный в реакции при определении уксусного ангидрида В уксусной кислоте (из предыдущей реакции); вода; ВгО~—Вг~; НС1; 5 мин при комнатной температуре Иодид—тиосульфат 55
54 Фенол (см. Ns 3), получаемый в процессе щелочного плавления бен-золсульфоната натрия Бром (образуется трибромфенол) Осадок растворяют в едком натре и избыток NaOH оттитровывают 56
55 Масла (см. № 1) и жиры (см. Ns 1) — определение бромного и иодного чисел ВгО^-—Вг~; кислота; 2 ч при комнатной температуре (определяют «вторичное» иодное число) или 2 дня при комнатной температуре (определяют «третичное» число) Иодид—тиосульфат 57
56 Смазочные масла (см. Ns 1) — определение ненасыщенности В среде бензола или бензина; H2SO4; ВгО^"—Вг- до желтого окрашивания Добавляют I- и избыток тиосульфата; водный слой обратно оттитровывают иодом 58
57 Бронированные крезолы (см. Ns 29) Уксусная кислота— вода; ВгО^-—Вг- до небольшого избытка (желтое окрашивание); 1 мин при комнатной температуре Иодид—тиосульфат 59
58 Фенолы (см. Ns 3); ароматические амины (см. Ns 34) Избыток ВгО^"— Вг" ; НС1; 5—30 мин при комнатной температуре И оди д—тносул ьфат 60
255
Продолжение
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
59 60 61 62 63 64 65 66 Жиры (см. № 1) — определение бромного числа Масла (см. № 1) и т. п. — определение ненасыщенности Смесь олеиновой (см. № 122, 298) и линоленовой кислот в маслах Ненасыщенные соединения (см. № 49, 130, 198, 225, 228, 251, 256, 275, 318, 392) Тимол (см. № 11) Фурфурол (см. № 38), получаемый при перегонке пентоз и пентозанов (см. № 96, 118, 135, 161, 175, 176, 199, 250, 262, 297, 447, 448) в присутствии кислоты Фенолы (см. Ns 3) в сточных водах Жиры (см. № 1) и масла (см. № 1) — определение ненасыщенности Метод описан вы (Метод считается у Избыток ВгО^“— Вг"; вода; СС14; НС1; выдерживают 20 ч при комнатной температуре В эфире при —10° С; бром до коричневой окраски; 2 ч при —10° С В среде СС14; небольшой избыток ВгО~—Br"“; H2SO4; встряхивают 3 мин при комнатной температуре Избыток ВгО3~— Вг"; НС1; подогревают (образуется дибром-производное) Избыток ВгО^”— Вг-; кислота; молибдат аммония; 4 мин при комнатной температуре Бензольно-хиполп-новый экстракт; избыток BrOjf—Вг-; HsSOj \ 2 ч при комнатной температуре [Метод описан выше завершения реакции больше времен ше40 — см. Ns 39 довлетворительным) Иодид—тиосульфат Непрореагировавший бром удаляют с помощью тиосульфата, эфир перегоняют и бронированный продукт кипятят с КОН в колбе, снабженной обратным холодильником; Вг- определяют с помощью Ag+. Затем путем интерполяции определяют состав смеси (см. «Щелочи», литература 57) Иодид—тиосульфат Иодид—тиосул ьфат Иодид—тиосул ьфат Иодид—тиосульфат 40 — см. № 39. Для требуется намного и (10—15 мин)] 61 62- 63 64 65, 85 66 67 68
256
Продолжение
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
67 68 69 70 71 72 Омыляемые масла (см. № 1), например оливковое масло определение бромного числа Ненасыщенные углеводороды (см. № 4), кислоты (см. № 122, 469, 501), эфиры (см. № 165) и т. п„ например кротоновая (см. № 181) и коричная (см. № 20) кислоты Тетраэтилсвинец (см. № 140, 214, 490, 527) в бензине Смесь бутен-1 и бутен-2 (см. № 212) Фенолсульфонаты цинка или натрия (см. № 82) Р,у-Ненасыщенные нитрилы (Метод описан bi В среде ССЦ; бром—СС14; 18 ч при температуре от 0 до 75° С Бром—СС14; 5 мин при комнатной температуре (образуется РЬВг.2) Бром [образуется смесь трех дибромбутанов (1,2-, мезо-2,3- и рацемат-2,3)] Избыток ВгО^"— Вг~; H2SO4; 2 ч при комнатной температуре в темноте В среде СНС13; 200% -ный избыток брома—Вг- —вода; 10 сек встряхивают при комнатной тем- дше40 — см. № 39) Непрореагировавший бром и образующийся НВг перегоняют с азотом в раствор KI; титруют тиосульфатом. добавляют 10^ и оттитровывают тиосульфатом Смесь фильтруют, осадок растворяют в HNO3 выпаривают с H2SO4, при этом образуется PbSO4, который растворяют в ацетате аммония; раствор титруют молибдатом аммония в присутствии внеш- i него индикатора таннина I"—метанол; выделяется иод; иод по мере его выделения титруют тиосульфатом через определенные интервалы (см. «Йодиды и иодистоводородная кислота», литература 27) Иодид—тиосул ьфат Иодид—тиосульфат 69 70 71 72 73 74
73 74 Центр ал ит (см. № 80) |(СвН6ХС2Нь)2СО] в нитроцеллюлозонитроглицериновых порохах Мочевина (см. № 5); соли или эфиры муравьиной кислоты (см. № 14) (формиаты) В среде этанола; избыток ВгО^"—Вг~; НС1; 30 сек при комнатной температуре Борат или КНСО3; бром; 30 мин при комнатной температуре Иодид—тиосульфат Иодид—тиосульфат 75 76
9 М. р. ф. Эшворт
257
Продолжение
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
75 Фурфурол (см. № 38) НС1; избыток ВгО^; 2 ч при комнатной температуре Иодид—тиосул ьфат 77
76 Фенолы (см. Яс 3) в сточных водах коксохимических заводов H2SO4; BrOj'—Вг-до появления запаха брома Иодид—тиосульфат 78
77 Алкилиодиды (см. № 78, 159, 174, 194, 213, 227, 384, 424, 457, 471, 526), образуемые при определении низших алко-ксильных (см. Ks 78, 159, 174, 194, 213, 227, 384, 424, 457, 526) групп реакцией с HI (по Цей-зелю) Пропускают в смесь бром—уксусная кислота; реакция сопровождается образованием IBr; добавляют ацетат натрия; IBr окисляется До 10^ Избыток брома восстанавливают муравьиной КИСЛОТОЙ, затем добавляют H2SO4, иодид—тиосульфат 79
78 Алкилиодиды (см. № 77), образуемые при определении низших алко-ксильных (см. № 77) групп реакцией с HI (по Цейзелю) (Микрометод, описанный выше78, — см. № 77) 80
79 Газообразные олефины (см. № 133) и ацетилен (см. № 141, 163, 326) Избыток ВгО^-— Вг“; H2SO4; встряхивают 60—90 мин при комнатной тем- Иодид—тиосульфат 81
80 Ароматические амины (см. № 34) и их производные, например анилин (см. № 42), п-то-луидин (см. № 136, 195, 541), дифениламин (см. •Ns 45), централит (см. № 73) (Модификация мете ше75, — см. № 73, п СС14 вместо менее ин этан да, описанного вы-ри этом используют ертного растворителя ола) 82
81 n-Хлорфенол (см. № 158) Избыток ВгО^"— Вг"; НС1 (образуется дибром-производное) Иодид—тиосульфат 83
82 Фенолсульфонаты (см. № 7) Избыток ВгО^— Вг’; HgCl2; НС] или H2SO4; изучено влияние концентрации Вг-, избытка брома и продолжительности реакции; рекомендуемое время реакции 3 ч при комнатной температуре Иодид—тиосульфат; добавление нескольких капель СНС13 позволяет легче наблюдать конечную точку титрования 84
258
Продолжение
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая об* работка и конечная стадия титрования Литература
83 Салициловая кислота (см. № 9) Избыток ВгО“— Бг“; НС1; 1 мин при комнатной температуре Иодид—тиосульфат 86
84 Салициловая кислота (см. № 9) Избыток ВгО^— Вг“; НС1; 10 мин при комнатной температуре Иодид—тиосульфат 87
85 Природные и нефтяные битумы — определение бромного числа (Метод описан выше70 — см. № 68) 88
86 Фенолы (см. Ns 3) Избыток бром—вода (образуются трибромфенол и НВг) Фильтруют; непрореагировавший бром удаляют током воздуха; НВг титруют NaOH в присутствии метилового красного 89
87 Салициловая кислота (см. Ns 9); м-крезол (см. Ns 29) (Метод описан вь 1ше89 — см. Ns 86) 90
88 Фенолы (см. № 3); крезолы (см. Ns 29) Вг-, НС1; избыток ВгО^"; 1 ч при комнатной температуре Иодид—тиосульфат 91
89 Метилиодид (см. Ns 92, 100, 112, 119, 128, 138, 155, 173, 180, 206, 222, 223, 236, 273, 292, 308, 315, 381, 403, 414, 446, 474, 478, 513, 528), об- разуемый при определении метоксильных (см. Ns 92, 100, 119, 128, 138, 155, 173, 180, 206, 381, 403, 414, 446, 471, 474, 478, 513, 528) групп реакцией с HI (по Цей-зелю) (Метод описан вь ше79 — см. Ns 77) 92
90 р,у-Гексен онитр илы и бутенонитрилы в присутствии а, Р-нитрилов (Метод описан выше74 — см. № 72) 93
91 Смазочные масла (см. № 1) — определение бромного числа (Метод описан выше9 — см. Ns 8; берут 50—70%-ный раствор брома; время реакции 15—30 мин) 94, 128
259
Продолжение
№ п/п
Титруемое вещество
Реагент и условия реакции
Соответствующая обработка н конечная стадия титрования
Литература
93
94
Метилиодид (см. № 89) или этилиодид (см. № 119, 173, 184, 209, 222, 252, 292, 315, 381, 412, 420, 474), образуемый при определении метоксильных (см. №89) или этоксильных (см. № 119, 173, 184, 305, 381, 412, 420, 471, 474) групп реакцией с HI (по Цейзелю)
Фенол (см. № 3) в различных медицинских препаратах, например в таблетках
Эфиры п-аминобензой-ной кислоты (см. № 183, 218, 374), например новокаин (см. № 383), анестезин
Фенол (см. № 3)
(Метод описан выше79 — см. № 77)
[Метод описан выше 8 — см. № 3 (после предварительного разделения)]
НС1; избыток
BrOg'—Вг~;
15 мин при комнатной температуре
Бром—вода (образуется три-бромфенил гипохлорит)
96
97
98
Фурфурол (см. № 38), образуемый при определении пентозанов (см. № 64) нагреванием с НС1
Гидрохинон (см. № 234, 437, 496)
Муравьиная (см. №14), щавелевая кислоты
Избыток ВгО3 —Вг“; кислота; 1ч при комнатной температуре
(Метод описан выше89 — см № 86) Избыток бромной воды; 15—20 мин и 1—2 ч соответственно при комнатной температуре
AsO^~, избыток которого оттитровывают ВгО^ в присутствии метилового красного а) Непрореагировавший бром удаляют действием HgCl или экстракцией СНС13 или СС14; НВг титруют в присутствии метилового красного или бромкрезолового зеленого и т. п.;
б) на осадок действуют I-, освобождающийся иод титруют тиосульфатом (см. «Йодиды и иодистоводородная кислота», литература 39) Иодид—тиосульфат
Непрореагировавший бром удаляют током воздуха и оттитровывают НВг щелочью
96
97
98
99
100
101
260
Продолжение
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
99 Сульфиды (см. № 192, 352, 458, 542) В среде смешанного растворителя; бензол—вода; бром—вода до устойчивой окраски, не более 15 сек при комнатной температуре Непрореагировавший бром удаляют добавлением I- и титруют тиосульфатом; затем НВг в водном слое оттитровывают NaOH в присутствии бромкрезолового пурпурового или лакмуса 102
100 Метилиодид (см. № 89), образуемый при определении метоксильных (см. № 89) или N-ме-тильных (см. № 155, 236, 446) групп реакцией с HI (Метод описан выше78 — см. № 77) 103
101 Муравьиная кислота (см. № 14) NaCl; бром—уксусная кислота; 30 мин при комнатной температуре Иодид—тиосульфат 104
102 Тирозин НО, ВгО^—Вг“ до отчетливого желтого окрашивания; 2 ч при комнатной температуре Иодид—тиосул ьфат 105
103 Гексилрезорцин Избыток ВгОц"—Вг~; кислота; оставляют на ночь при 70° С Иодид—тиосульфат 106
104 Фурфурол (см. № 38), образуемый при обработке твердой древесины НС1 Избыток ВгО^~—Вг~; НС1; 1 ч при комнатной температуре в темноте ИодиД—тиосульфат 107
105 Симпатол Избыток ВгО~—Вг~; НС1; 15 мин при комнатной температуре в темноте Иодид—тиосульфат 108
106 Фенол (см. № 3) в присутствии 2,4-динитро-резорцина Избыток ВгО^"—Вг~; НС1; 15 мин при 0° С Иодид—тиосульфат 109
107 Фенол (см. № 3), получаемый в процессе щелочного плава сульфонатов натрия Бром—вода; при 0° С (смесь насыщают NaCl) (образуется осадок трибромфенола) Непрореагировавший бром удаляют тиосульфатом, осадок растворяют в избытке NaOH и оттитровывают НС1 в присутствии метилового оранжевого ПО
2 61
Продолжение
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
108 Формальдегид (см. № 196, 454, 539) Избыток ВгО~—Вг~; НС1, затем подщелачивают; 30 мин при комнатной температуре Кислота; иодид—тиосульфат 111
109 Метанол; полиоксисоединения, подобные глИр церину (см. № 154, 157, 321), сахарам (см. № 123, 422) Избыток ОВг’; концентрированная щелочь; на свету Кислота; иодид—тиосульфат 112
110 Моно- и дисахариды В водной среде; избыток ОВг' на свету; 15 мин (моно-) или 20 мин (ди-) при 16—17° С (образуется щавелевая кислота) HC1; иодид—тиосульфат 113
111 Апиол (4-аллил-3,6-ди-метокси -1,2-метилен-диоксибензол) ВгО^—Вг-; кислота; 5 мин при комнатной температуре, затем добавляют тетраборат натрия; 15—20 мин Иодид—тиосульфат 114
112 Метилиодид (см. № 89), образуемый при определении метионина (см. № 444) реакцией с HI (Метод описан выше’8 — см. Ns 77) 115
113 Фенол (см. № 3); крезолы (см. № 29); салициловая кислота (см. № 9) (Метод описан выше88— см. № 86) 116
114 Оксин (см. Ns 125, 258, 263, 323, 331, 402) НС1, ВгО^~—Вг-до обнаружения избытка (проба на иодо-крахмальную бумагу); 5 мин при комнатной температуре CSgJ иодид—тиосул ьфат 117
115 Салициловая кислота (см. № 9) Избыток ВгО^“—Вг~; НС1; 30 мин при комнатной температуре Иодид—тиосульфат 118
116 Фурфурол (см. № 38) Избыток ВгО~—Вг—; кислота; различная продолжительность реакции при 0° С; рекомендуется 5 мин (реакция сопровождается присоединением двух атомов брома) Иодид—тиосульфат 119, 187
262
Продолжение
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
117 5-Бром-2-фуранкарбо-новая кислота Избыток ВгО^~—Вг-; НС1; 10 мин при 2ГС; (реакция сопровождается присоединением четырех атомов брома) Иодид—тиосул ьфат 120
118 Фурфурол (см. № 38), образуемый при кислотном гидролизе пентозанов (см. № 64) Избыток BrOj"—Вг-; НС1 Иодид—тиосульфат 121
119 Метилиодид (см. № 89) или этилиодид (см. 92), образуемый при определении метоксильных (см. № 89) или этоксильных (см. № 92) групп [например, в ванилине (см. № 299), пектине] реакцией с HI Окисляют бромной водой до 10^" Непрор еагировав-ший бром удаляют фенолом; затем добавляют H2SO4; далее иодид—тиосульфат 122
120 Фенол (см. № 3) Избыток ВгО^"—Вг~; кислота; 20—30 мин при комнатной температуре Иодид—тиосул ьфат 123
121 Анилин (см. № 42) в аминоазобензоле Избыток ВгО^“—Вг~; НС1; 5—10 мин при комнатной температуре Иодид—тиосульфат 124
122 Ненасыщенные кислоты (см. № 68) [например, олеиновая (см. № 61), коричная (см. № 20)] В среде СС14; бром— СС14; 10—15 мин при комнатной температуре Вода и фенол для превращения непрореагировавшего брома в Вг~; Вг- обрабатывают хлором, при этом образуется ВгС1, затем KCN— получают BrCN и, наконец, I, реакция сопровождается образованием иода: BrCN + 21- -* -* 1г + Вг- + С№ Далее титруют тиосульфатом 125
123 Общее содержание сахара (см. № 109) в меде В водном растворе; избыток ОВг-; на свету Иодид—тиосульфат 126
124 Фенолы (см. № 3) из щелочных плавов (Метод описан выше 3 — см. № 3) 127
263
Продолжение
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
125 Оксин (см. № 114) В солянокислом растворе; бром—вода (образуется 5,7-ди-бромхинолил-8-ги-побромит) Непрореагировавший бром удаляют током воздуха н образующийся НВг оттитровывают NaOH (при этом учитывают первоначальное содержание НС1) 129
126 Дифениламин (см. № 45) Нитроцеллюлоза; этанол; избыток BrOf—Вг-; НС1; 2 мин при 0° С Иодид—тиосульфат . 130
127 Ксилидины (см. № 132, 188) Избыток ВгО^"—Вг~; НС1; 5 мин при комнатной температуре Иодид—тиосульфат 131
128 Метилиоднд (см. № 89), (Несколько модифицированный метод,
образуемый при определении метоксильных (см. № 89) групп реакцией с HI описанный выше78, — см. № 77) 132
129 Фенол (см. № 3) в специальных препаратах Избыток ВгО3 —Вг ; H2SO4; встряхивают 5—10 мин при комнатной температуре Иодид—тиосульфат 133 |
130 Ненасыщенные соединения (см. № 62) в алифатических углеводородах (особенно моноолефины) Избыток BrOjT—Вг~; H2SO4 (до устойчивой желтой окраски, (не исчезающей в течение 2 мин) Иодид—тиосульфат 134
131 Аллильные группы (см. № 249) (Рекомендуется метод, описанный выше40, — см. № 39) 135
132 Ксилидины (см. № 127) (Немного улучшенный метод, описанный выше131, — см. № 127) 136
133 Олефины (см. № 79, 163, 167, 216, 255, 283, 298, 379, 405, 441, 481, 511, 512) — определение ненасыщенности Бром—СНС13 в 60— 70%-ном избытке; 1—10 мин при комнатной температуре. (Утверждается, что при этом не наблюдается реакция замещения) Иодид—тиосульфат 137
134 Серебряные или кадмиевые производные глутатиона, выпавшие в осадок при его определении в биологических материалах Избыток ВгО^—Вг-; НС1; 8 мин при комнатной температуре Na2HPO4; затем иодид—тиосульфат 138
264
Продолжение
Ns п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
135 136 137 138 139 140 141 142 Фурфурол (см. № 38), образуемый при определении пентозанов (см. № 64) нагреванием с НС1 Толуидин (см. № 80), образуемый при определении нитротолуола путем восстановления смесью Zn—НС1— уксусная кислота Нитроанилины Метилиодид (см. № 89), образуемый при определении метоксильных (см. № 89) групп реакцией с HI Антрацен (см. Ns 491) и карбазол в сырье; также продуктов взаимодействия антрацена с малеиновым ангидридом Тетраэтилсвинец (см. Ns 69) в бензине Ацетилен (см. Ns 79) в водных растворах при изучении его гидратации Углеводороды (см. Ns 4) — определение ненасыщенности Избыток ВгО^—Вг~; HCI; 1 ч при комнатной температуре (Метод описан выше86 — см. Ns 34) Избыток ВгО^"—Вг-кислота; 30 мин при 0°С (Метод описан выше78 — см. Ns 77) В среде уксусной кислоты; НС1; титруют смесью ВгО^Т— Вг* до устойчивого синего окрашивания, не исчезающего в течение 10 мин, в присутствии крахмал—иодид В среде керосина; бром — СС14; (образуется осадок РЬВг2) Избыток ВгО^~—Вг-; H2SO4; оставляют на 2—3 мин\ затем добавляют H2SO4 и пробу снова оставляют на 5—7 мин\ реакция проводится под пониженным давлением Бром — метанол; насыщают NaBr по методу, описанному выше46, — см. Ns 44 Установлено, что мет стым, рекомендуется 10—15 мин с 60%-ны Иодид—тиосульфат Иодид—тиосульфат Иоднд—тиосульфат РЬп осаждают бихроматом, избыток Сг2Оу— оттитровывают иодометрически NaCl; иодид—тиосульфат Иодид—тиосульфат знол должен быть чи-реакцию проводить м избытком реактива) 139 140 141 142 143 144 145 146
265
Продолэгение
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая об-, работка и конечная стадия титрования Литература
143 Инден (см. № 200, 311) Бром — СС14 (двойное от теоретического количество); не более 30 сек при комнатной температуре Вода; иодид—тиосульфат 147
144 Циклопентадиен Бром — СС14 (двойное от теоретического количество), затем немедленно оттитровывают избыток брома Иодид—тиосульфат 147
145 Смесь фурфурола (см. № 38) и метилфурфу-рола Избыток BrOg-—Вг-; НС1; 5, 10 или 30 мин при 0° С Иодид—тиосул ьфат; расчет ведут по двум уравнениям 148
146 Жиры (см. № 1) и масла (см. № 1) — определение микробромного числа В среде СНС13; бром—метанол— NaBr как в методе, описанном выше46 — см. № 43; 1—60 мин при комнатной температуре Иодид—тиосульфат 149
147 Анилин (см. № 42), образуемый при определении ацетанилида гидролизом с НС1 Избыток ВгО^“—Вг~“; НС1; 20 мин при комнатной температуре Иодид—тиосульфат 150
148 Сульфаниламид (см. № 177, 219) Избыток BrOg"—Вг-; НС1; 5 мин при комнатной температуре Иодид—тиосульфат 151
149 Хлораль Избыток ВгО^-—Вт-; кислота; 5 мин при комнатной температуре, затем добавляют тетраборат натрия н оставляют стоять 15—20 мин Избыток AsO|—, который оттитровывают броматом 152
150 Ненасыщенные соединения в бензоле ВгО^—Br-; H2SO4; 7—30 сек при комнатной температуре Иодид—тиосульфат 153
151 Фумаровая кислота (см. № 483) При pH 8,4; бром — Вг" — вода; 2 ч при комнатной температуре в темноте Иодид—тиосульфат 154
152 Аллильные соединения (см. № 251) HCI; BrCXj"—В г- до желтого окрашивания Иодид—тиосульфат 155
266
Продолжение
№ п/п
-----
153
154
155
156
157
158
159
160
161
Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
Енолы (см. № 22), например в (СвН5СО)2 СН2 В среде метанола; бром—безводный метанол; при —5° С Непрореагировавший бром немедленно удаляют при помощи диизобутилена, добавляют 1~ и через 10 мин титруют тиосульфатом (см. «Йодиды и иодисто-водородная кислота», литература 59) 156
Глицерин (см. № 109) ОВг"; кипятят 90 мин Иодид—тиосульфат 157
Метилиодид (см. № 89), образуемый при определении метоксильных (см. № 89) и N-метил ь-ных (см. № 100) групп реакций с Н1 (Метод описан выш дится сравнение с д| пример с методом, см. № 3, см. «Аминь основания» и гравиг Цей е70 — см. № 77; провозу гимн методами, надписанным выше 3, — и гетероциклические метрическим методом зеля) 158
Анилин (см. № 42), образуемый при определении нитробензола (см. № 42) путем восстановления его цинковой амальгамой в солянокислом растворе ВгО^—Вг“; НС1 Иодид—тиосул ьфат 159
Глицерин (см. № 109) в водных растворах Бром; вода; 15 мин при комнатной температуре Иодид—тиосульфат 160
n-Хлорфенол (см. № 81) В NaOH; ВгО^-—Вг-; НС1; СНС13; иодид—тиосульфат 161
15 мин при комнатной температуре; (образуется дибром-производное)
Алкилиодиды (см. № 77), образуемые при определении низших алко-ксильных (см. № 77) групп реакцией с HI (по Цейзелю) (Техника метода описана выше’9) 162
Салициловая кислота (см. № 9) ВгО~—Вг~; 0,4 н, НС1 не встряхивают Иодид—тиосул ьфат 163
Фурфурол (см. Ns 38), образуемый при определении пентозанов (см. № 64) перегонкой с НС1 Дистиллят; ВгО^—Вг"| кислота Иодид—тиосул ьфат 164
267
Продолжение
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
162 Ароматические амины (см. № 34), образуемые при определении ароматических нитросоединений путем восстановления металлическим кадмием в редукторе Джонса (Метод описан вышев0 — см. Ns 58) 165
163 Олефины (см. № 133) и ацетилены (см. № 79) ВгОГ—Br~; H9SO4; о ’ Z Ч’ HgSO4 и проба, растворенная в СС14; уксусная кислота с нерастворимой в воде пробой; встряхивают 7 мин при комнатной темпера- туре в темноте NaCl; иодид—тио- сульфат 166
164 Фенолы (см. № 3) в крови после осаждения протеинов ВгО~—Вг“; НС1; 15 мин при комнатной температуре в темноте Иодид—тиосульфат 167
165 п-Оксибензойная кислота (см. № 210, 428, 462), образуемая при определении эфиров (см. № 68) омылением ВгО~—Вт-; НС1; 15 мин при комнатной температуре (в реакции вступают 6 атомов брома) Иодид—тиосульфат 168, 206
166 Прокаин (см. № 183, 300, 507) BrO^-—Br“; НС1; 10 мин при комнатной температуре Этанол; иодид—тиосульфат 169
167 Олефины (см. № 133) в бензине СС14—разбавленная H2SO4; при 0° С; титруют смесью ВгСХГ— Вг-, пока слой СС14 будет устойчиво сохранять желтое окрашивание Иодид—тиосульфат 170
168 Жиры (см. № 1) — определение ненасыщенности (Метод описан выше46 — см. Ns 44; в микроварианте реакция протекает 2—4 ч) 171
169 Анилин (см. № 42) в пищевых красителях и пищевых настойках ВгО^—Br~; HCI; 30 мин при комнатной температуре Иодид—тиосульфат 172
170 Следы аллилового спирта (см. № 12) в воздухе Водный раствор, полученный пропусканием воздуха через воду; ВгОД—Вг ; H2SO4; 15 мин при комнатной температуре Иодид—тиосульфат 173
268
Продолжение
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Л ите-рату-ра
171 Салициловая кислота (см. № 9), образуемая при определении салола (фенилсалицилата) (см. № 299, 453) гидролизом его в присутствии едко го натра В смешанном растворителе этанол— вода; ВгО^-—Вг-; H2SO4; 15 мин при комнатной температуре Иодид—тиосульфат 174
172 Этилен (см. № 241, 282, 296, 305, 310, 412) в воздухе заводских помещений Воздух пропускают через раствор, содержащий BrOjF— H2SO4, добавляют Вг~; 15 мин при комнатной температуре при встряхивании Иодид—тиосульфат 175
173 Метилиодид (см. № 89) или этилиодид (см. № 92), образуемый при определении метоксильных (см. № 89) и этоксильных (см. № 92) групп реакцией с HI (Несколько модифицированный метод, описанный выше79, — см. № 77) 176
174 Алкилиодиды (см. № 77), образуемые при определении низших ал-коксильных (см. № 77) групп реакцией с HI (Модификация аппаратуры метода, описанного выше78, — см. № 77) 177
175 Фурфурол (см. № 38), образуемый при определении пентозанов (см. № 64) нагреванием с НС1 (Метод описан выше38 — см. № 38) 178
176 Фурфурол (см. № 38), образуемый при определении пентозанов (см. № 64) нагреванием с НС1 ВгО3 —Вг ; кислота; 1 «при комнатной температуре Иодид—тиосульфат 179
177 Сульфаниламид (см. № 148) В воде ВгО^“—Вг~; НС1; 5 мин при комнатной температуре в темноте (образуется дибром-производное) Иодид—тиосу льфат 180
178 Ароматические аминокислоты (см. № 47) и альдегиды (см. № 482, 501), образуемые при определении нитрокислот и альдегидов путем восстановления их цинковой амальгамой ВгО^-—Вг~; кислота Иодид—тиосульфат 181
269
Продолжение
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
179 Камфен В среде спирта; ВгО^-—Br-; НС1; 10 мин при комнатной температуре в темноте Иодид—тиосульфат 182
180 Метилиодид (см. № 89), образуемый при определении метоксильных (см. № 89) групп при анализе целлюлозной пульпы и бумажных материалов (Метод описан bi □иле79 — см. № 77) 183
181 Кротоновая кислота (см. № 68) при изучении кинетики ее гидратации 50—100%-ный избыток ВгО^—Вг-; H2SO4; 5 мин при комнатной температуре Иодид—тиосульфат 184
182 5-Сульфоантраниловая кислота BrO-f—Вг—; НС1 (образуется трибром-анилин и H2SO4) H2SO4 оттитровывают раствором ВаС12 185
183 Эфиры п-аминобензой-ной кислоты (см. № 94), например бензокаина (см. № 190, 205, 221, 294, 299, 383), прокаина (см. № 166) Бром; 1 ч при 0° С Иодид—тиосульфат 186
184 Этилиодид (см. № 92), образуемый при определении этоксильных (см. № 92) групп в кетенацеталях (Метод описан вь 1ше79 — см. № 77) 188
185 Жиры (см № 1) — определение бромного числа В среде СНС13; бром—метанол— NaBr; 30—120 мин при комнатной температуре НС1; обратно оттитровывают арсенитом в присутствии метилового красного 189
186 Смеси алифатических углеводородов (см. № 4)— определение ненасыщенное та H2SO4—Вг-—«-гептан; титруют смесью ВгОа'—Вг- до светло-желтого окрашивания и затем добавляют небольшой избыток реагента; 2 мин при комнатной температуре Вода; иодид—тио- сульфат 190
187 Фурфурол (см № 38) ВгО^—Вг—; НС1; 30 мин при 0° С Иодид—тиосульфат 191
210
Продолжение
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
188 Ксилидины (см. № 127) В смешанном растворителе вода—спирт; BrOf—Вг“; НС1; 10 мин при —4° С до —8° С (Титрование, комбин нитрита, позволяет о отдельны. Иодид—тиосульфат лрованное с действием пределить содержание к веществ) 192
189 Фенол (см. № 3) в мыле ВгО^~—Вг-; HCI; 15 мин при комнатной температуре Иодид—тиосульфат 193
190 Бензокаин (см. № 183) ВгО~—Вг“; НС1; 10—15 мин при комнатной температуре Иодид—тиосульфат 194
191 Резорцин (см. № 24) ВгО^—Вг-; НС1; 10—15 мин при комнатной температуре Иодид—тиосульфат 195
192 Сульфиды (см. № 99) Бром—вода; встряхивают 10 мин (образуются сульфоксиды и НВг) Непрореагировавший бром восстанавливает иодид—тио- сульфатом, НВг оттитровывают раствором КОН в присутствии метилового красного 196
193 Фенолы (см. № 3); крезолы (см. № 29); дифенолы (см. № 34); флороглюцин BrOjj"—Вг"; кислота (Изучена кинетика реакции) Иодид—тиосульфат или обратно титруют арсенитом 197
194 Алкилиодиды (см. № 77), образуемые при определении низших алко-ксильных (см. № 77) групп реакцией с HI [Небольшое изменение метода, описанного выше79, — см. № 77 (описывается аппаратура и приготовление HI)] 198
195 о-Толуидин (см. № 80) в красителях для кожи (отделенный путем перегонки) BrCtf—Вг-; НС1 (реакция сопровождается присоединением 4 атомов брома) Иодид—тиосульфат 199
196 Формальдегид (см. № 108) или муравьиная кислота (см. № 14), образуемые при определении поли-спиртов методом окисления перйодатом Бром—вода; 1 ч при комнатной температуре (окисление сопровождается образованием СО») AsO|“ избыток которого оттитровывают хиодом 200
197 Фенолы (см. № 3) (Обсуждаются методы35, 209 — см. № 34 и 204) 201
271
Продолжение
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
198 199 Ненасыщечны" соединения (см Ws 62), главным образом углеводороды (см. № 4) Фурфурол (см. № 38), образуемый при определении пентоз и пентоза нов (см. № 69) нагреванием с 40%-ной НВг H2SO4 титруют смесью ВгО^~—Вг-до устойчивой желтой окраски; добавляют небольшой избыток реагента, встряхивают 3 мин при комнатной температуре ВгО“—Вг“; НС1; молибдат аммония; после появления желтой окраски оставляют на 4 мин при комнатной тем- Иодид—тиосульфат Иодид—тиосульфат 202 203
200 201 Стирол; инден (см. № 143) Муравьиная кислота (см. № 14) в уксусной кислоте В среде СНС13; бром—СС14 или бром—метанол— NaBr; 2 ч при комнатной температуре (Исследована реакция) Бром—ацетат натрия; 30 мин при комнатной темпера- Иодид—тиосульфат; затем титруют щелочью или добавляют и титруют снова тиосульфатом Иодид—тиосульфат 204 205
202 203 204 205 Оксалат анилина (см. № 42), выпавший в осадок при определении анилина в дифениламине Формальанилин (CeH6N=CH2) Фенолы (см. № 3) Бензокаин (см. № 183) туре В теплом водном растворе титруют смесью BrOJ"—Вг-до светло-желтого окрашивания; оставляют на 5—10 мин при комнатной температуре Бром—метанол— NaBr; 2 ч при комнатной температуре (образуется трибром-производное) В щелочном растворе; ВгО^—Вг-; затем подкисляют НС1; 10 мин при комнатной температуре (некоторые при —5° С) (Небольшое изменени выше 186, — Иодид—тиосульфат Иодид—тиосульфат Иодид—тиосульфат е метода, описанного см. № 183) 207 208 209 210
272
Продолжение
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
206 Метилиодид (см. № 89), образуемый при определении метоксильных (см. № 89) групп, например В ЛИГНИНОВЫХ препаратах (Небольшое изменение аппаратуры в методе, описанном выше76, — см. № 77) 211
207 Пиперазин Нейтральный раствор; бром—вода; несколько минут при комнатной температуре (образуется осадок тетрабромпроизвод-ного) ВгОу—Вг“ (10— 20% -ный избыток); НС1; 5 мин при комнатной температуре Фильтруют; непрореагировавший бром удаляют током воздуха; образуются НВг; оттитровывают NaOH в присутствии фенолфталеина 212
208 Сульфатиазол (см. № 226, 319) Иодид—тиосульфат 213
209 Этилиодид (см. № 92), образуемый при определении этанола (см. № 296) в крови путем нагревания с HI (Принцип метода описан выше76 — см. № 77) 214
210 n-Оксибензойная кислота (см. № 165), образуемая при определении ее эфиров путем гидролиза в присутствии едкого натра ВтО3 —Вт ; НС1 (образуется 2,4,6-трибромфенол) Иодид—тиосульфат 215
211 Акролеин (см. № 482) и акриловая (см. № 303, 348) кислота (изучение процесса их гидрата- (Метод описан выше184 — см. № 184) 216
212 Бутен-1 в присутствии бутена-2 (см. № 70) Бром добавляют при —70° С до тех пор, пока раствор не станет красным. Затем смесь оставляют стоять 30 мин при комнатной температуре Непрореагировавший бром восстанавливают сульфитом, 1,2-бромбутан превращается при действии этоксида калия в этилацетилен, который определяют аргентометрически (см. «Щелочи», литература 145\ «Соединения серебра», литература 75) е метода, описанного см. № 77) 217
213 Алкилиодиды (см. № 77), образуемые при определении низших алко-ксильных (см. № 77) групп путем нагревания (Небольшое изменен! выше76, — 218
273
Продолжение
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
214 Тетраэтилсвинец (см. № 69) В среде СС14; бром— СС14; 30—60 мин при комнатной температуре в темноте Иодид- -тиосульфат 219
215 Диэтилстильбэстрол . (см. № 407, 473, 494, 495) NaOH; ВгО^—Вг-; НС1; 30 мин при 25—30 С Иодид—тиосульфат 220
216 Олефины (см. № 133) в газообразных углеводородах В среде СНС13; бром—уксусная кислота в небольшом избытке; 30 мин или более при комнатной температуре Иодид—тиосульфат 221
217 P-Нафтол (см. № 299, 383) в косметических препаратах ВгО“—Вг~; НС1; 15 мин при комнатной температуре Иодид—тиосульфат 222
218 Производные п-амино-бензойной кислоты (см. № 94) (Метод описан выше186 — см. № 183) 223
219 п-Аминобензолсульфо-новая кислота, образуемая при определении сульфаниламидов (см. № 148) путем гидролиза в присутствии НС1 ВгО3 —Вг ; кислота Иодид—тиосульфат 224
220 Муравьиная кислота (см. № 14), также образуемая при определении формильных групп перегонкой с п-толуол-сульфоновой кислотой Бром'—вода; 5 мин при комнатной температуре Иодид—тиосульфат 225
221 Бензокаин (см. № 183) Метаноловый экстракт бром—НС1; 1 ч при комнатной температуре Иодид—тиосульфат 226
222 Метилиодид (см. № 89) или этилиодид (см. № 92), образуемые при определении метоксильных и этоксильных групп путем нагревания с Н1 (Метод описан выше70 — см. № 77) 227
223 Иодид тетраметиламмо-ни я, образуемый при реакции триметиламина с метилиодидом, который получается при определении метоксильных (см. № 89) групп путем нагревания с HI (Метод описан выше?® — см. № 77) • 227
274
Продолжение
№ п/п 224 225 226 227 228 229 230 231 Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
Коричная кислота (см. № 20) Ненасыщенные соединения (см. № 62) — определение бромных чисел Сульфатиазол (см. № 208) Алкилиодиды (см. № 77), образуемые при определении низших алко-ксильных (см. № 77) групп реакцией с HI Ненасыщенные соединения (см. № 62) (изучение процесса замещения, происходящего во время реакции присоединения) Жир (см. № 1) женского молока — определение бромного числа Масла (см. № 1) — определение бромного числа Таллово масло — определение бромного числа Бром (образуется а-, Р-дибромкоричная кислота) В среде СНВг3; бром—метанол— NaBr (в СНВг3 разделение слоев в конце реакции происходит быстрее, чем в СНС13) НС1; титруют^ смесью ВгО^"—Вг— до избытка реагента (Метод описан bi (Техника метода описана выше180 — см. № 186, но берут измеренное количе- ство H2SO4) В среде СНС13; бром—уксусная кислота—пиридин— H2SO4 В среде СНС13; бром—метанол— NaBr; 2 ч при комнатной температуре В среде СС14; бром— уксусная кислота— пиридин—HaSO4; ацетат ртути; 90 мин при комнатной температуре; (Изучался эффект влг та и продолжительн мендуют 70%-ный Nal—этанол; кипятят и получают коричную кислоту; добавляют NaBr и иод; титруют тиосульфатом (см. «Йодиды и иодисто-водородная кислота», литература 88) Вода—метанол; титруют водно-мета-ноловым раствором арсенита в присутствии индигокармина Иодид—тиосульфат иле76 — см. № 77) Иодид—тиосульфат; добавляют Ю^“ к водному слою и титруют тиосульфатом, при этом образуется НВг — продукт реакции замещения Иодид—тиосульфат Сначала титруют водным раствором арсенита до полного исчезновения окраски, затем иодид— тиосульфат Вода; иодид—тио- сульфат яния избытка реаген-ости реакции; реко-избыток реактива) 228 229 230 231 232 233 234 235
275
Продолжение
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
232 Жиры (см. № 1) — определение бромного числа (микрометод) В среде целлозольва; бром—метанол— NaBr; 5 мин при комнатной температуре Иодид—тиосульфат 236
233 Фенол (см. № 3) в моче в присутствии гидрохинона ВгО^"—Вг“; H2SO4 (высокой концентрации, в этом случае гидрохинон не реагирует); 30 мин при комнатной температуре 1“, избыток которого оттитровывают сульфитом; конечную точку титрования устанавливают потен ци ометр и чески 237
234 Гидрохинон (см. № 97) в том же образце Сначала как указано выше, затем добавляют NaHCO3 (для уменьшения концентрации кислоты); пиридин; ВгО^-— Вг-; 1 ч при комнатной температуре (в реакцию вступают 10 атомов брома) 1“, избыток которого оттитровывают сульфитом 237
235 Сульфонамиды (см. № 374) В 50—70%-ной уксусной кислоте; ВгО~— Вг~; НО; 90 сек при комнатной температуре Обратное титрование арсенитом 238
236 Метилиодид (см. № 89), образуемый при определении N-метильных (см. № 100) групп реакцией с HI (Метод описан выпи70 — см. № 77) 239
237 Итаконовая кислота (см. № 50) в бродильной жидкости Бром—KBr—КС1— НС1—вода; pH 1,2; 10 мин при комнатной температуре, затем 5 мин при 0° С Иодид—тиосульфат 240
238 n-Нитрофенол в процессе отделки хромовой кожи ВгО“—Вг"; кислота (реакция сопровождается присоеди нением 4 атомов брома) Иодид—тиосульфат 241
239 Г ваяколсульфокислота (тиокол) и хинозол (су-ноксол—оксинсульфат) (Метод описан bi дше 3 — см. № 3) 242
240 Фенолы (см. № 3) в мыле ВгО~—Вг-; НС1; 1 ч при 15—17° С Иодид—тиосульфат 243
276
Продолжение
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
241 Этилен (см. № 172) и этилиодид (образующиеся при определении простых или сложных эфироь этиленгликоля реакцией с Н1); пропилен (и изопропилиодид), образующиеся из производных пропиленглико ля (см. № 321) Перегоняют током СО2 в бром—метанол или уксусную кислоту Иодид—тиосульфат алкилиодиды определяют с помощью Ag1 (см. «Соединения серебра», литература 82) 244
242 Фенол (см. № 3) BrO-—Br~; H2SO4 Избыток брома восстанавливают сульфитом и Вг" обрабатывают Ag+, избыток которого оттитровывают тиоцианатом 245
243 Фенолы (см. № 3) BrO~—Вг—; НС1 (Изучение эффекта пример избытка рег кислоты, времени и Иодид—тиосульфат многих факторов, на-шента, концентрации температуры реакции) 246
244 Аллил-, циклогексенил,-и другие ненасыщенные барбитураты (см. Хе 268, 383, 430) В среде СНС13 или СНС13—метанол; Вг(Д~—Вг—; H2SO4; перемешивают 1 ч при комнатной температуре Иодид—тиосульфат 247
245 4-Винил-1-циклогексен в тетрагидрофталевом ангидриде Дифениламин (см. № 45) и его производные, подобные (CSH5)2NCONH2 и (C0H6NC2H6)2CO (Метод описан выше 134 — см. № 130) 248
246 В среде СС14 или уксусной кислоте; BrO~—Br~; НС1; 15 сек—5 мин при комнатной темпера- Иодид—тиосульфат 249
247 Ненасыщенные углеводороды (см. № 4) в бензине туре (Принцип метода см. описан выше40 — й 39) 250
248 Фуран; сильван; фурфуриловый спирт (см. № 392) Бром—уксусная кислота—пиридин— H2SO4; 1 ч при комнатной температуре в темноте (в реакцию вступают 4 атома брома; реакция замещения наблюдается в незначительной степени) Иодид—тиосульфат 251
277
Продолжение
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
249 250 251 252 253 254 255 256 257 Аллильные группы (см. № 131) в простых и сложных эфирах Фурфурол (см. № 38), образуемый при определении пентозанов (см. № 64) в заводской пульпе путем нагревания с НС1 Ненасыщенные, например аллильные (см. № 152), соединения (см. № 62) Этилиодид (см. № 92), образуемый при определении фенетидина нагреванием с HI Этилцентралит (C6H5NCaH5)2CO в порохах ракетного топлива Фенолы (см. Хе 3), экстрагированные едким натром из авиационного бензина Олефины (см. № 133) — определение бромного числа Ненасыщенные соединения (см. № 62) — определение бромного числа Жирные кислоты (см. № 354, 515) определение микробромного числа (микрометод) В среде СНС13; бром—СНС13; 1, 2 или 3 ч при 4° С (Метод такой же, ше40 - 45, — см. № г случае результаты з Частично нейтрализуют, затем добавляют ВгО^~—Вг- и молибдат аммония; 5 мин при комнатной температуре ВгО^~—Вг-; пиридин; уксусная кислота (Метод описан вь Экстракт в уксусной кислоте; ВгО^~— Вг-; НС1; 1 мин при комнатной температуре ВгОз“—Br~; НС1 В среде ССЦ; уксусная кислота; ВгО^"— Вг-; при 25° С до желтого окрашивания, устойчивого 5 сек; затем добавляют небольшой избыток реагента (Даны замечания по выше40, — В среде СНС13; бром—уксусная кислота—пиридин— H2SO4; 15 мин при комнатной температуре Иодид—тиосульфат как описанные вы-9 и 43; в последнем знижаются на— 10%) Иодид—тиосульфат Иодид—тиосульфат ше70 — см. № 77) Иодид—тиосульфат Иодид—тиосульфат Иодид—тиосульфат методу, описанному см. № 39) Иодид—тиосульфат 252 253 254 255 256 257 258 259 260
278
Продолжение
№ п/п Титруемое вещество Реагент н условия реакции Соответствующая обработка и конечиай стадия титрования Литература
258 259 260 Оксины (см. № 114) и их металлические производные (например, Си, А1) Соли или эфиры муравьиной кислоты (см. № 14) Трифениларсин (при анализе смеси фенил-хлорарсинов после реакции с NaOH—Н2О2) В среде метанола; НС1; КВг; титруют ВгО^- до обесцвечивания метилового красного; добавляют небольшой избыток реагента ВгО^-—Вг-; НС1; 2 мин для выделения брома; затем добавляют ацетат натрия; 30 мин при комнатной температуре в темноте Экстракт в СС14; избыток BrOjP Иодид—тиосульфат или обратно титруют арсенитом в присутствии этоксихризоидина или бриллиантового кармоизина НС1; иодид—тио- сульфат Титруют арсенитом 261 262 263
261 Анилин (см. № 42), образуемый при определении ацетанилина путем гидролиза в присутствии H2SO4 ВгС)——Вг— Иодид—тиосульфат 264
262 263 264 265 266 Фурфурол (см. № 38), образуемый при определении пентозанов (см. № 64) реакцией с кислотой Оксин (см. № 114) Бутилиодид (см. Хе 355, 385, 420), образуемый при определении бу-токсильных (см. Хе 355, 385, 420) групп в мочевине формальдегидных смолах Альдозы (см. Хе 378) Бромное число (микрометод) (см. Хе 16) ВгО^~—Вг-; молибдат аммония; 4 мин при 14—18°С В 20%-ной НС1; избыток электролитически генерируемого брома (Метод описан bi ВгО^~—Вг-; H2SO4; 10 мин при комнатной температуре, затем добавляют избыток NaOH и дают постоять 20 мин при 30° С (Метод описан вьн Иодид—тиосульфат Обратно титруют арсенитом пне76 — см. Х° 77) Иодид—тиосульфат ге 140 — см. Xs 146) 255 266 267 268 269
279
Продолжение
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
267 268 269 270 271 272 273 274 275 Бромное число (см. № 16) Ненасыщенные барбитураты (см. № 244), например аллилциклопен-тенилбарбитурат, диал-лилбарбитурат Аллилизотиоцианат Аммонийуранилурат, выпадающий в осадок при определении мочевой кислоты Кофеин (см. № 289, 487, 535) в медицинских смесях Фенол (см. № 3), образуемый при определении дифенилкарбоната путем гидролиза со щелочью Метилиодид (см. № 89), образуемый при определении инсектицида дималона (см. № 274) реакцией с HI Дималон (см. № 273) на ткани Ненасыщенные соединения (см. № 62) — определение бромного числа В среде СС14; BrO~—Br- НО; 5—15 мин при комнатной температуре ВгО^~—Вг~; НС1; несколько минут при комнатной температуре (в реакцию вступают 2 или 4 атома брома) BrO-f—Вг-; НС1; 10—12 мин при комнатной температуре В горячей H2SO4; BrO“—Br-; НС1; 2 ч при комнатной температуре в темноте ВгО^-—Вг~; НС1; 2 ч при комнатной температуре в темноте ВгО-—Вг-; НС1; встряхивают 5 мин при комнатной температуре (Метод описан вы Экстракт в СС14 или уксусной кислоте; ВгО^—Br-; НС1; встряхивают 10 мин при комнатной температуре Бром—метанол— NaBr; 20 мин при комнатной температуре Иодид—тиосульфат или добавляют из быток арсенита, который оттитровывают раствором бромата Иодид—тиосульфат Избыток арсенита, который оттитровывают раствором бромата Иодид—тиосульфат или обратное титрование арсенитом Иодид—тиосульфат или обратное титрование арсенитом Иодид—тиосульфат не70 — см. № 77) Иодид—тиосульфат Обратно титруют соединениями титана (III) в присутствии метиленовой сини или арсенитом в присутствии метилового красного (после подкисления) 270 271 272 273 274 275 276 276 277
280
Продолжение
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
276 Хинин (см. № 299, 350, 383) ВгО^"—Вг-; кислота Иодид—тиосульфат 278
277 Ароматические амины (см. № 34), образуемые при определении нитро-соединеиий восстановлением смесью Zn—Hg— НС1 ВгО^—Вг“; НС1; 10—60 мин при комнатной температуре Иодид—тиосульфат 279
278 Каучук в латексе (раствор в СС14) Дисперсия в воде (бентонит как стабилизатор); ВгО^~— Вг-; НС1; 15 мин при комнатной температуре Иодид—тиосульфат 280
279 Фенол (см. № 3) ВгО“—Вг”; НС1; 5—10 мин при комнатной температуре AsO|—, избыток которого оттитровывают ВгО^~ в присутствии этоксихри-зо иди и а или бриллиантового кармои-зина 281
280 Салициловая кислота (см. № 9) ВгО~—Вг—; H2SO4; 10 мин при 15° С NaHCO3 и Na2SO3 до превращения непрореагировавшего брома в Вг~; HNO3; AgNO3, избыток которого оттитровывают тиоцианатом 282
281 Металла лхлорид [СН2=С (СН3) СН2С1] (Метод описан выше40, 46 — см. № 39, 44 с небольшими изменениями) 283
282 Этилен (см. № 172) в газах Отбирают в вакуумированный сосуд, содержащий ВгО^-— Вг- —H2SO4; встряхивают 5 мин при комнатной температуре NaOH; через 3— 5 мин добавляют H2SO4 и титруют тиосульфатом 284
283 Олефины (см. № 133) в углеводородных (С4) газах (Метод описан выше221 — см. № 216) 285
284 Сульфамиды ВгО3 —Вг ; уксусная кислота и НС1 или H2SO4 от 10 сек до 1 ч при комнатной температуре Иодид—тиосульфат 286
281
Продолжение
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
285 Паитокаин и пантезин ВгО^—Вг~; кислота (реакция сопровождается присоединением 2 и 4 атомов брома соответственно) Иодид—тиосульфат 287
286 п- Аминосалициловая кислота (см. № 306, 335, 536); n-аминофенол (см. № 536, 543) ВгО~—Вг-; уксусная кислота; НС1; 5 мин при комнатной температуре Иодид—тиосульфат 288
287 Диксаитгидрилмочеви-иа, образуемая при определении мочевины (см. № 5) в моче путем осаждения ксантгидролом Гипобромит кальция; 5 мин (Холостой опыт проводят с мочой без предварительного осаждения) НС1; иодид—тио- сульфат 289
288 Фурфурол (см. № 38), образуемый при определении целлюлозных материалов гидролизом их H2SO4 (Метод описан выше118 — см. № 116) 290
289 Кофеин (см. № 271) в кофе и т. п. (после предварительной экстракции) (Метод описан выше г7<| — см. № 271) 291
290 4-Винил-1 -циклогексан (димер бутадиена) Экстракт в СНС1Э; уксусная кислота; титруют смесью ВгО^-—Вг-" до желтого окрашивания, затем добавляют небольшой избыток реагента. Встряхивают несколько минут при комнатной температуре Иодид—тиосульфат 292
291 Фенилбензилсульфид Бром—вода; трет-бутаиол; 5—10 мин при комнатной температуре Иодид—тиосульфат 293
292 Метилиодид (см. № 89) и этилиодид (см. № 92), образуемые при определении алкоксисилаиов Si (0СН?)4 и Si (ОС2Н6)4 реакцией с HI (Принцип метода описан выше7У — см. № 77) 294
293 Некоторые ненасыщенные карбонильные соединения, такие, как а- и ф-ионоиы, коричный альдегид (см. № 482) Бром—безводный метанол—NaBr; продолжительность реакции различна; при комнатной температуре, например, 10 мин для -ф-ионона и 12 ч для а -ионон а Обратное титрование смесью анетол— метанол до исчезновения желтой окра-* ски 295
282
Продолжение
Ns п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
294 Фенацетин (см. № 383); бензокаин (см. № 183) В 80% -ной уксусной кислоте; ВгО“— Br; НС1; 10— 30 мин при комнатной температуре Иодид—тиосульфат 296
295 Фенолфталеин В щелочном растворе; ВгО“— Вг-; уксусная кислота и НС1; встряхивают 1 мин при комнатной температуре Иодид—тиосульфат 297
296 Этилен (см. № 172), образуемый при определении этанола (см. № 209) в крови, путем пропускания его через пемзу, пропитанную Н3РО4, при — 300° С Выделяющийся этилен абсорбируют смесью Вг2—СС14 Иодид—тиосульфат 298
297 Фурфурол (см. № 38), образуемый при определении пентозанов (см. № 64) в целлюлозе гидролизом ее НС1 ВгО^~—Вг-; кислота (Проведено сравнение барЗит Иодид—тиосульфат с методом осаждения уратов) 299
298 Фенолы (см. № 3); оле-"фины (см. № 133) и другие соединения [например, лимоиен, олеиновая кислота (см. Ks 61); нафталин; холестерин (см. 377, 533, 540)] Бром—уксусная кислота Избыток брома оттитровывают арсенитом 300
299 Некоторые фармацевтические препараты, главным образом фенолы (см. № 3) [например, салициловая кислота (см. № 9), резорцин (см. № 24), Р-нафтол (см. № 217), тимол (см. № 11), ванилин (см. Ks 119), салол (см. № 171)] и основания (см. Ns 383) [например, хинин (см. № 276), стрихнин (см. № 383), кодеин (см. № 383), бензокаин (см. № 183)] В уксусной кислоте или в смеси уксусная кислота—вода; бром—уксусная кислота; иногда добавляют ацетат натрия; 10—30 мин при комнатной температуре в темноте (Изучены условия реакции) Иодид—тиосульфат 301
283
Продолжение
№ TI/П Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
300 Прокаин (см. № 166) ВгО^—Вг-; кислота (образуется дибром-производное) Иодид—тиосульфат или обратно титруют арсенитом, или добавляют AsO|, избыток которого оттитровывают BrOjp в присутствии индигокармина 302
301 Мочевина (см. № 5) ОВг- Избыток реагента оттитровывают арсенитом ’ 303
302 Фенол (см. № 3); анилин (см. Ns 42); тимол (см. № 11); сульфаниловая кислота (см. № 317) Бром—вода Избыток брома оттитровывают нитритом 303
303 Мономер в частично полимеризованной акриловой кислоте (см. № 211) и аллиловых эфирах Пиридиновый раствор; ВгО^"—Вг-; H2SO4; 20 мин при комнатной температуре или 10—15 мин при 0° С соответственно СС14; иодид—тио- сульфат 304
304 Ненасыщенные масла (см. № 1) и жиры (см. Ns 1) — определение бромных чисел В среде СС14; бром— уксусная кислота— пиридин—H2SO4; ацетат ртути (II); 1 мин при комнатной температуре Иодид—тиосульфат 305
305 Этилен (см. Ns 172) и этилиодид, образуемые при определении этоксильных (см. Ns 92) групп в целлюлозе путем нагревания с HI (Метод описан выше244 — см. № 241) 306
306 п -Аминосалициловая кислота (см. Ns 286) в моче (экстрагированная эфиром) ВгО3 —Вг ; уксусная кислота и НС1 (в реакцию вступают 6 атомов брома) Иодид—тиосульфат ЗОЛ
307 Терпены (см. Ns 21) H2SO4; ВгО^“—Вг~ до появления окраски, устойчивой в течение 30 сек Иодид—тиосу льфат 308
308 Метилиодид (см. Ns 89), образуемый при определении диметилсульфата реакцией со смесью I"—вода (Принцип метода описан выше79 — см. Ns 77) 309
309 Бромные числа [например, тунгового (см. Ns 361) и ойтикового масел] (Метод описан выше реакции протекают в 306 — см. Ns 304, но течение 30 мин—2 ч) 310
284
Продолжение
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
310 Этилен (см. № 172) в га- Встряхивают со Иодид—тиосульфат 311
зовых смесях смесью бром—у к-
сусная кислота 312
311 Инден (см. № 143) в при- (Метод описан выше 147 — см. № 143)
сутствии гидриндена 313
312 Кислотная форма нитро- Бром—вода Иодид—тиосульфат
этана и его анион
313 Фенол (см. № 3) в био- BrO“—Br~; НС1; Иодид—тиосульфат 314
логических и других 10 мин при комнат-
протеинсодержащих растворах (отделенный дистилляцией) ной температуре
314 Крезол (см. № 29) ВгО^—Br~; НС1; 1—2 ч при комнат- Иодид—тиосульфат 315
ной температуре 316
315 Метилиодид (см. № 89) (Метод описан выше79 — см. № 77)
или этилиодид (см. № 92), образуемый при
определении я-нитро-
фенилдиэтил (или метил) моноэтилфосфата
путем реакции с HI
316 Аллиловый спирт (см. ВгО3 —Вг ; кислота Иодид—тиосульфат 317
№ 12) ИЛИ
бром—вода (очевид- Образующуюся НВг 317
но, при добавлении оттитровывают
брома продукт гидролизуется, давая СН2ВгСНОНСН2ОН щелочью
и НВг)
317 Сульфаниловая кислота (см. № 302) ВгО^~—Вг-; кислота; 5 мин при комнатной Иодид—тиосульфат 318
318 Ненасыщенные соединения (см. № 62) в моторном топливе температуре (Испытаны метод ше40, 46, — с ы, описанные Bbl-м. № 39, 44) 319
319 Сульфатиазол (см. ВгСХГ—Вт-; кислота Иодид—тиосульфат 320
№ 208); сукцинилсуль- (Изучено влияние различных факторов,
фатиазол и фталилсуль- таких, как избыток реагента, концентрация
фатиазол бром-ионов и кислот, продолжительность реакции и др. Предлагаемое время 2 мин
при комнатной температуре)
320 321 Тиофен ВгО^—Вг~; НС1; 5—30 мин при комнатной температуре Иодид—тиосульфат 321
Изопропилиодид (см. (Метод описан выше78 — см. № 77) 322
№ 241), образуемый при определении глицерина (см. № 109) путем на-
гревания с HI
285
Продолжение
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
322 Бромное число (см. № 16) (Метод описан выше 310 — см. № 309) 323
323 Оксин (см. № 114) БгО3 Избыток реагента оттитровывают арсенитом амперометрически 324
324 Тениловый спирт и салициловая кислота (см. № 9), образуемые при определении митицид-2-тенилсалицилата гидролизом в присутствии щелочей (где тенил—радикал C4H3SCH2—) ВгО^~—Br~; НС1; 20 мин при комнатной температуре. Компоненты (в реакцию вступают 6 или 8 атомов брома соответственно) Иодид—тиосульфат 325
325 3,3-Диэтил-2,4-диоксо-тетрагидпопиридин (перседон) В воде; ВгО^“—Вг-; НС1; не более 30 сек при комнатной температуре Иодид—тиосульфат 326
326 Ацетилен (см. № 79) в крови Бром—вода Иодид—тиосульфат 327
327 Ацетилацетон (изучена кинетика его алкоголиза) Добавляют к разбавленному раствору кислоты; бром—вода; 4 мин при комнатной температуре Непрореагировавший бром удаляют при помощи фенола; добавляют Г и через 5—10 мин титруют тиосульфатом 328
328 Салициламид ВгО^”; НС1; 10 мин при комнатной температуре Иодид—тиосульфат 329
329 Аллиловый спирт (см. № 12), образуемый при определении сополимеров метилметакрилатов и аллилметакрилатов при их гидролизе в присутствии щелочи ВгО^"—Вг-; кислота; 1 мин при комнатной температуре Иодид—тиосульфат 330
330 Тиосемикарбазон п-аце-тиламинобензальдегида ВгО3"—Br"; НС1; нагревают 5—10 мин Иодид—тиосульфат 331
331 Цинковые производные оксина (см. № 114), образуемые при его определении методом осаждения Солянокислый раствор; ВгО^“—Вг-; 1 мин при комнатной температуре Иодид—тиосульфат 332
332 Анилин (см. № 42) Электролитически генерируемый бром, из раствора НС1— NaBr—CuSO4 Меняют полярность электродов и избыток реагента оттитровывают кулонометрически Си1 333
286
Продолжение
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
333 Анилин (стандартизация) (см. № 42) ВгО-—Вг”; НС1; 3 мин при комнатной температуре Иодид—тиосульфат 333
334 Изониазид (см. № 338. 351, 393, 395) В водном растворе; ВгО^—Вг“; НС1; 5 мин при комнатной температуре Иодид—тиосульфат 334
335 п-Аминосалициловая кислота (см. № 286) (Метод описан выше288 , 307 — см. № 286, 306) 335
336 Бромное число (см. № 16) (Метод описан выше310 — см. № 309 с биамперометрическим способом определения конца титрования иода тиосульфатом) 336
337 Летучие фенолы (см. № 3) в сточных водах (микрометод) Дистиллят; небольшой избыток брома; 15—20 мин при комнатной температуре Иодид—тиосульфат 337
338 Изониазид (см. № 334) В водном растворе; ВгО-—Вг-; НС1; 10—15 мин при комнатной температуре Иодид—тиосульфат 338
339 Фенолы (см. № 3), образуемые при определении ар алкилсульфон атов путем сплавления их со щелочами Водный раствор нейтрализуют бром—СС14; встряхивают 2 мин при комнатной температуре Иодид—тиосульфат 339
340 Гексабарбитал (см. № 468) и его натриевая соль ВгО~—Вг~; H2SO4 (Модификация метод деле «Перманганат к Иодид—тиосульфат а, описанного в раз-алия», литература 82) 340
341 2,3-Дигидропиран В среде бензола при 0° С; HgCl2; НС1; 100%-ный избыток BrOjp—Вг-; 5 мин при комнатной температуре Иодид—тиосульфат 341
342 Метантелинбромид ВгО~—В,-; НС1; 1 ч при комнатной температуре Иодид—тиосульфат 342
343 Резацетофенон ВгО^~—Вг-; кислота (образуется дибром-производное, используют различные количества избытка реагента) Иодид—тиосульфат 343
287
Продолжение
№ п/п Титруемое вещество Реагент и условия реакции е Соответствующая обработка и конечная стадия титрования Л ите-ра ту» ра
344 345 346 347 348 349 350 351 Фенолы (см. Ns 3) 8-Оксихинальдии Винилацетилен и этил-ацетилен, образующиеся при реакции с насыщенным раствором КВт из их серебряных производных, выделенных при их определении в газовых смесях Парафиновые масла (см. Ns 1) — определение бромного числа Акриловая кислота (см. Ns 211) в Р-пропиолак-тоне Содержание енолов (см. Ns 22) в формильных соединениях Хинин (см. Ns 276) в таблетках Изониазид (см. Ns 334) В водном растворе; ВгО~—Br~; НС1 (образуются бромза-мещенные фенолов) BrO~—Br~; НС1; 5 мин при комнатной температуре Ацетатный буферный раствор; бром— вода—KBr; HgCl2; встряхивают 10 мин при комнатной температуре (Метод описан выше40 — см. Ns 39) ВгО~—Вг-; H2SO4; 5 мин при комнатной температуре; затем добавляют HgSO4; 5 мин при комнатной температуре (Критическое изучен! выше23’ 24, — см. № «ИОДИДЫ И ИОДИСТО! литер аг Бром—уксусная кислота—пиридин— H2SO4; 15 мин при комнатной температуре (реакция сопровождается присоединением 4 атомов брома) BrO^~; НС1 нли H2SO4 (с Вг” или без него; разницы не наблюдается) Растворяют в этаноле и титруют щелочами термометрически или кондуктометрически (см. том I, «Гидроокиси щелочных и щелочноземельных металлов», литература 84) Иодид—тиосульфат Иодид—тиосульфат П р едпочтительно применяют иодид— тиосульфат вместо обратного титрования арсенитом NaCl; иодид—тио- сульфат е методов, описанных 22, 23; см. также юдородная кислота», ура 457) Иодид—тиосульфат Иодид—тиосульфат 344 345 346 347 348 349 350 351
288
Продолжение
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
352 Ароматические или гетероциклические сульфиды (см. № 99) В среде уксусной кислоты; немного воды; НС1; ВгО^-— Вг-; 5 мин при 45° С Иодид—тиосульфат 352
353 Жиры (см. № 1) — определение ненасыщенности В среде СС14, СНС13 или метанол—NaBr; бром—СС14; 1 ч при комнатной температуре в темноте Иодид—тиосульфат; добавляют 10“ и водный слой титруют тиосульфатом 353
354 Жирные кислоты (см. № 257) в фекальных жирах — определение нен асыщен н ости ВгО-—Br-; НС1; Hgl2; СС14; вода (непрореагировавший бром определяют немедленно) Иодид—тиосульфат 354
355 Бутилиодид (см. № 264), образуемый при определении бутоксильных (см. Ks 264) групп в полупродуктах фенольно-формальдегидных смол путем нагревания с HI (Принцип метода описан выше78 — см. Ks 77) 355
356 Полимеризованные масла (см. Ks 1), например льняное масло — определение бромного числа (Критикуется метод, описанный выше 30Б, — см. Ks 304; указывается, что результаты анализа зависят от количества реагента, добавляемого в избытке) 356
357 Муравьиная кислота (см. Ks 14) В среде смешанного растворителя; пиридин—вода; бром; 3 мин при комнатной температуре Иодид—тиосульфат 357
358 Ундециленовая кислота и ее соли ВгО~—Вг“; НС1; 5 мин при комнатной температуре Иодид—тиосульфат 358
359 Фенолы (см. № 3) в воде или дегте Бром (Изучено влияние количество избытка тельность и температ; дуется проводить ре 1 ч пр эазличных факторов; реагента, продолжила реакции; рекомен-акцию при pH 6—9, и 0°С) 359
360 Камфахинои В среде метанола, этанола или уксусной кислоты; ВгО^"— Br”;H2SO4h HgSO4; 7—10 мин при комнатной температуре (образуется камфарный ангидрид и НВг) Концентрированный раствор NaCl; затем иодид—тиосульфат 360
Ю М. Р. ф. Эшворт
289
Продолжение
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
361 Некоторые вещества, содержащие сопряженные двойные связи, например тунговое масло (см. № 309), — определение бромного числа Ацетат ртути (II), затем бром; уксусная кислота—пиридин — —H2SO4; 1 ч при комнатной температуре в темноте Иодид—тиосульфат 361
362 Эфирные масла (см. № 1) — определение ненасыщенности Метилпиридинтри-бромид—уксусная кислота; безводный ацетат натрия; 2— 12 ч при комнатной температуре Иодид—тиосульфат 362
363 Некоторые тиобарбитураты BrO^; НС1; 10— 15 мин при комнатной температуре Вг'; иодид—тиосульфат 363
364 Диметилсульфид Насыщенный водный раствор брома; 10 мин при комнатной температуре 1“; иод восстанавливают тиосульфатом, а НВг, которая образуется в результате реакции, оттитровывают раствором КОН в присутствии метилового красного 364
365 Витамин Вв В воде; ВгО^"—Вг~; НС1; 45 мин при комнатной температуре в темноте Иодид—тиосульфат 365
366 Метиленсалициловая кислота В щелочной среде; ВгО”—Вг”; H2SO4; 15 мин при комнатной температуре в темноте Иодид—тиосульфат 366
367 Растворы натриевой соли пенициллина ВгО^~—Вг-; H2SO4; 30 мин при комнатной температуре в темноте Иодид—тиосульфат 367
368 Сквален Экстракт в СС14; бром—уксусная кислота—пиридин— H2SO4; 15 мин при комнатной температуре Иодид—тиосульфат 368
369 Тиоурацилы В растворе NaOH; ВгО”; НС1; 30— 60 мин при комнатной температуре AsO|'“> избыток которого оттитровывают ВгО^ в присутствии и-этоксихризоидина 369
290
Продолжение
№ п/п Титруемое вещество Реагент н условия реакции Соответствующая обработка и конечная стадия титрования Литература
370 Фенолы (см. № 3), например о-крезол (см. № 29), 4-хлор-2- метилфенол, 2-метил-фенокснуксусная кислота В растворе NaOH; НС1; тнтруют смесью ВгО^—Вг- до желтого окрашивания, затем добавляют небольшой избыток реагента; 30 сек при комнатной темпера Иодид—т иосульфат 370
371 Нефтяные фракции (см. № 32), очищенный бензин и т. п. —определение ненасыщен- ности туре В среде СНС13; бром—метанол— NaBr; 20 мин при комнатной температуре Иодид—тиосульфат 371
372 Винилхлорид в воздухе Абсорбирует СНС13; добавляют бром; 40 мин при комнатной температуре Иодид—тиосульфат 372
373 Атоксил (л-аминофенил-арсонат натрия, H2NC6H4AsO3HNa) В воде; ВгО^—Вг"~; НС1; 10 мин при комнатной температуре в темноте AsO|~, избыток которого оттитровывают ВгО^- в присутствии метилового оранжевого 373
374 Различные медицинские препараты, например пурин (см. № 487), сульфонамиды (см. № 235), терпены (см. № 21), эфиры н-амино-бензойной кислоты (см. № 94) Бром—метанол— NaBr; продолжительность реакции различна; комнатная температура; в темноте Иодид—тиосульфат 374
375 Салициловая кислота (см. № 9) Электролитически генерируемый бром из НС1—КВг—CuSO4 раствора; 2 мин при комнатной темпера- туре Меняют полярность электродов и реагент оттитровывают кулонометрически посредством Си1; конечную точку титрования устанавливают амперометрически 375
376 а- и Р-Дикетоны ВгО^~—Вг-; H2SO4; HgSO4 NaCl; иодид—тиосульфат 376
377 Осадок, образующийся при взаимодействии дигитонина с холестерином (см. № 298), при его определении В среде метанола; бром—метанол— NaBr Иодид—тиосульфат 377
378 Смесь альдоз (см. № 265) и кетоз Бром- вода, кислота при 100° С; альдозы окисляются Общий сахар определяют до и после окисления бромом, титрованием соединениями меди (II) 378
291
Продолжение
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
379 Примеси олефинов (см. № 133) в органических растворителях, таких, как аллиловый спирт (см. № 12), кротоновый альдегид (см. Ns 466, 482) Бром—уксусная кислота; 3 мин при 0° С Иодид—тиосульфат 379
380 rz-Оксигидрокоричная кислота В воде; ВгО^~—Вт-; H2SO4; 3 мин при 0°С Иодид—тиосульфат 380
381 Метилиодид (см. Ns 89) и этилиодид (см. Ns 92), образуемые при определении метоксильных (см. Ns 89) и этоксильных (см. Ns 92) групп реакцией с HI (Метод описан выше 79 — см. № 77) 381, 399
382 Бутин-2-диол-1, 4 и другие алкинолы (Метод описан выше 46 — см. Ns 44) 382
383 Фенолы (см. № 3) (например, салициловая кислота (см. Ns 9); Р-нафтол (см. Ns 217), резорцин (см. Ns 24)]; алкалоиды и другие органические основания (см. Ns 299) [стрихнин (см. Ns 299), хинин (см. № 276), кодеин (см. Ns 299), новокаин (см. № 94), бензокаин (см. Ns 183); фенацетин (см. Ns 294)]; барбитураты (см. № 244); аскорбиновая кислота (см. № 501) В среде уксусной кислоты; бром— уксусная кислота; иногда добавляют воду; 10—80 мин при комнатной температуре Иодид—тиосульфат 383
384 Алкилиолиды (см. Ns 77), образуемые при определении низших алкокси льных (см. Ns 77) групп реакцией с HI (полумикро- и микрометодами) (Метод описан выше 79 — см. Ns 77) 384
385 Бутилиодид (см. Ns 264), образуемый при определении бутоксильных (см. Ns 264) групп путем нагревания с HI (Метод описан выше 79 — см. Ns 77) 385
292
Продолжение
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
386 Фенолы (см. № 3) и их смеси в водных растворах BrO-j"—Вг-; H2SO4 Иодид—тиосульфат 386
387 Мопофенолы (см. № 3) ВгО^—Вг-; НС1 или H2SO4; 45 мин при комнатной температуре Иодид—тиосульфат 387
388 Мочевина (см. № 5) ВгО~— Вг-; НС1; 10 мин при комнатной температуре; затем добавляют NaOH и оставляют стоять 15 мин при 100° С Кислота; иодид—тиосульфат 388
389 Хлоропрокаин ВгО“—Вг-; НС1; 5 мин при комнатной температуре Иодид—тиосульфат 389
390 N-Метиланилин (в процессе изучения реакции с 2, 4-динитрофлюоро-бензолом в 99,9% -ном этаноле) Бензол—концентрированная НС1; в водный слой добавляют небольшой избыток ВгО^~—В г-; 12 мин при комнатной тем- Иодид—тиосульфат 390
391 2, 4-Динитрофенол в присутствии пикриновой кислоты 100%-ный избыток ВгО“—Вг-; НС1; 30 мин при 20— 25° С в темноте Иодид—тиосульфат 391
392 Остаточные ненасыщенные соединения (см. № 62) в синтетических смолах, получаемых на основе аллиловых эфиров, а также фурфурилового спирта (см. № 248) В среде СС14; бром— уксусная кислота— пиридин — H2SO4; ацетат ртути (II) Иодид—тиосульфат 392
393 Изониазид (см. № 334) ВгО-—Вг-; НС1 (лучше 0,7—0,86 н. раствор); 30 мин при комнатной температуре Иодид—тиосульфат 393
394 Некоторые ненасыщенные углеводороды (см. № 4) в воздухе Барботируют через этанол; бром—NaBr; 30 мин при комнатной температуре в темноте Иодид—тиосульфат 394
395 Изониазид (см. № 334) Бром—вода (образуются изоникотиновая кислота и НВг) Кислоту оттитровывают щелочью в присутствии фенол фталеина 395
293
Продолжение
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
396 397 398 399 400 401 402 403 404 Производные фенотиа зина Фенол (см. Ns 3) в присутствии восстановителей Смеси алкилированных фенолов (см. № 3) Фенолы (см. Ns 3); крезолы (см. Ns 29) Индол; индол-3-уксус-ная кислота; индол-3-а-масляная кислота 1 -Метил-2—меркаптоимидазол (метимазол, та-разол, метотирин) Оксинат меди (см. Ns 114) Метилиодид (см. Ns 89), образуемый при определении метоксильных (см. Ns 89) групп реакцией с HI Мочевина (см. Ns 5) ВгО“—Вг~; НС1 Бромная вода до появления краснокоричневой окраски раствора (образуется трибром-фенилгипобромит) ВгО“—Вг”; НС1; 5 сек—4 мин (Взаимодействие протекает в различных стехиометрических отношениях) BrOj“—Вг~; 4—5Л4 раствор НС1; 4—5 мин при комнатной температуре (Метод описан выше 4оо — см дь 399) В воде; ВгО^—Вг-; НС1; 15 мин при комнатной температуре H2SO4; ВгО~— Вг~; 10 мин при комнат ной температуре (Метод описан выше 78 — см. Ns 77) КВг; борная кисло та; ОСГ; 2 мин при 50—60° С Иодид—тиосульфат Непрореагировавший бром восстанавливают SO2—, затем добавляют фенол, НС1 и Г; через 10— 15 мин титруют тиосульфатом (см. «Йодиды и иодисто-водородная кислота», литература 175) Иодид—тиосульфат Непрореагировавший бром удаляют с помощью тиоцианата, избыток которого оттитровывают кулонометрически (окисляют до CN- и so2-) Иодид—тиосульфат Тартрат; доводят значение pH до 6,2; затем иодид—тио сульфат NaOH; тиосульфат в количестве, эквивалентном начальному содержанию ОСГ; 1 капля раствора KI; гитруют гипохлоритом в присутствии брази-лина С1СН14О6 (красное окрашивание и чеходнт в желго зеленое) 396 397 398 400 401 402 403 404 405
294
Продэгжение
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
405 Олефины (см. № 133) В воде, метаноле или другом растворителе; NaBr; ВгО.^—Br~—НС1— метанол—вода; 1 мин — 3 ч при комнатной темпера- Метанол; иодид- -тиосульфат 406
406 Декаметиленбис-(иодид триметиламмония) туре Бром—вода— H2SO4; кипятят 10 мин; 1“ окисляется До Ю~ Непрореагировавший бром удаляют с помощью фенола; затем добавляют 1“ и титруют тиосульфатом 407
407 Диэтилстильбэстрол (см. № 215) ВгО"—Вг~; НС1 25 мин при 25—30° С в темноте Иодид—тиосульфат 408
408 Синестрол (см. № 417, 495)(диэтилстильбэстрол дипропионат) В среде уксусной кислоты; ВгОд-—Вг-; H2SO4; 80—83 мин при 25—35° С Иодид—тиосульфат 408
409 Фенол (см. № 3) (Метод описан выше 3 — см. № 3; проведено сравнение с весовым и колориметрическим методами) 409
410 Фенол (см. № 3) в фенолятах H2SO4; ВгО3 —Вг ; 15—20 мин при комнатной температуре в темноте Иодид—тиосульфат 410
411 Трифлюороэтилвинило-вый эфир (флюоромар) в крови Пропускают через смесь Вг2 — метанол),) Иодид—тиосульфат 411
412 Этилен (см. № 172), образованный с этилиоди-дом (см. № 92) при определении этоксильных (см. № 92) групп в низших замещенных эфирах крахмала путем нагревания с HI Пропускают через смесь Вг2 — уксусная кислота—КВг Иодид—тиосульфат 412
413 Амины (см. № 34) ОВг-(образуются бромоамины) Пропускают через смесь КД—вода— H2SO4; выделяется иод, который оттитровывают тиосульфатом (см. «Йодиды и иодистоводородная кислота», литература 183) 413
295
Продолжение
№ П/П Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
414 Метилиодид (см. № 89), образуемый при опреде лении метоксильных (см. № 89) групп в эфирных маслах путем нагревания с HI (Метод описан выше 79 — см. Кв 77) 414
415 Отдельные фракции крекированных нефтяных продуктов (см. № 32) — определение ненасыщенности В среде СС14; 60—70% -ный избыток брома—СС14; 10, 20 и 30 мин при 0° С Иодид—тиосульфат 415
416 Жиры (см. № 1) — определение бромного числа В среде СНС13; бром—метанол— NaBr; от 30 мин до 2 ч при комнатной температуре в темноте (Предпочитают метод с использованием IC1) 416
417 Синестрол (см. № 408) В среде спирта; ВгО^"—Вг”'; кислота; 15 мин при 8—10° С Иодид—тиосульфат 417
418 Фенолы (см. Ks 3) В среде уксусной кислоты в присутствии небольшого или 100% -ного избытка ВгО^-—Вг~; 3 мин при комнатной тем пературе Иодид—тиосульфат 418
419 Нитродихлорбензол ВгО^-—Вг-; кислота Иодид—тиосульфат 419
420 Этилиодид (см. № 92) и бутилиодид (см. Ks 264), образуемые при определении этоксильных (см. Ks 92) и бутоксильных (см. Кв 264) групп в кремнийорганических соединениях путем нагревания с HI (Модификация метода, описанного выше гм, — см. Кв 292) 420
421 л-Кумаровая кислота (см. Кв 445) Трехкратный избыток ВгО^-—Вг-; 0,5—0,6 н. раствор НС1; 30 мин при 40° С (реакция сопровождг 12 атом 1ется присоединением ов брома) 421
296
Продолжение
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
422 423 424 425 Сахар (см. № 109) Амины (см. № 34), образующиеся при определении хлорамфеникола восстановлением Zn— НС1 Алкилиодиды (см. № 77), образуемые при микроопределении низших алкоксильных (см. № 77) групп путем нагревания с HI Винилметилкетон Концентрированный раствор NaOH; ОВг" ; 4 мин при комнатной температуре или при кипении (реакция сопровожда или 6 атомов бро ВгО^~—Вг-; кислота; 2 мин (Принцип метода описан выше 78 — см № 77) В воде; ВгО^—Вг~; НС1; ется присоединением 2 ма соответственно) Иодид—тиосульфат Иодид—тиосульфат 422 423 424 425
426 427 цис- р-Метокси-а эток-симетилакрилонитрил Фурфурол (см. № 38) в воздухе 5 мин при комнатной температуре В среде уксусной кислоты; немного пиридина; ацетат ртути (II); бром — уксусная кислота; 2 мин при комнатной температуре Пропускают в смесь BrO“—Вг~; НС1; Иодид—тиосульфат Иодид—тиосульфат 426 427, 450
428 429 430 л-Оксибензойная кисло та (см. № 165), образуемая при определении ее эфиров гидролизом в присутствии щелочей н-Хлорфенил-н-хлорбен-зилсульфид Ненасыщенные барбитураты (см. № 244), например этилкротонил-барбитуровая кислота 1 ч при комнатной температуре ВгОз"—Вг-; кислота В среде уксусной кислоты; бром—уксусная кислота; 10 мин при 10° С (окисление до сульфоксида) В среде СНС13; ВгО~—Br~; НС1; встряхивают, затем оставляют на 30 мин при комнатной температуре в темноте Иодид—тиосульфат H2SO4; иодид—тиосульфат Иодид—тиосульфат 428 429 430
297
Продолжение
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
431 4-Бутил-1,2-дифенилпи-разолидин-3, 5-дион В среде уксусной кислоты; ВгО^-—Вг- Непрореагировавший бром удаляют анилином; добавляют 1~ и образующийся под оттитровывают через 5 мин тиосульфатом 431
432 6-Меркаптопурин В сернокислом растворе; ВгО^-; 15 мин при комнатной температуре Иодид—тиосульфат 432
433 Фенол (см. № 3) в фармацевтических продуктах В воде; бром—вода; НС1; встряхивают 30 мин, затем оставляют на 15 мин при комнатной темпера туре СНС13; иодид—тиосульфат 433
434 2-Нитродифениламин В среде уксусной кислоты; СС14; BrOg-—Вг~ Иодид—тиосульфат 434
435 Тиофэсфорная кислота, образуемая при определении ее эфиров гидролизом в присутствии щелочей ВгО~—Вг“; НС1; 15 мин при комнатной температуре Иодид—тиосульфат 435
436 Альдрин; изодрин В среде уксусной кислоты; ВгО^-—Вг-; НС1; 45 мин при комнатной температуре в темноте Иодид—тиосульфат 436
437 Гидрохинон (см. № 97), хингидрон Бром—вода до желтого окрашивания; 30 сек при комнатной температуре Недопр среагировавший бром удаляют фенолом, добавляют I-—НС1 и через 15—20 мин титруют тиосульфатом (см. «Йодиды и иодис-товодородная кислота», литература 193) 437
438 Арилоксисиланы; также фенолы (см № 3), образуемые при гидролизе в присутствии кислот арилоксисиланов, содержащих третичные бутоксильные группы В среде уксусной кислоты; ВгО^"—Вг-; НС1 Иодид—тиосульфат 438
298
Продолжение
Ke п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
439 Фенолы (см. № 3) — определение свободных орто- и параположений В среде уксусной кислоты; НС1; титруют BrQ——Вт- до желтого окрашивания, избыток не должен превышать 10% Иодид—тиосульфат 439
440 Высшие алкилкетоно вые димеры В среде СС14; бром — СС14; 30 сек при 20° С Иодид—тиосульфат 440
441 Некоторые С5-и С6-оле-фины (см. № 133) и диены В среде СНС13; бром— метанол—NaBr; 20 мин при комнатной температуре Иодид—тиосульфат 441
442 Салициловая кислота (см. № 9), образуемая при определении ее метилового эфира путем гидролиза в присутствии NaOH ВгО~—Вг~; НС1; 15 мин при комнатной температуре в темноте Иодид—тиосульфат 442
443 п-Оксифеиилалкилами ны, например веритол. передрин (пилсотон) BrOy; H2SO4 Иодид—тиосульфат 443
444 Цистин; метионин (см № 112) ВгО^~—Вт-; НС1; 10 мин при комнатной температуре Иоднд—тиосульфат 444
445 Коричная (см. № 20), л-кумаровая (см № 421) кислоты (Метод описан выше 421 — см j\fo 421) 445
446 Метилиодид (см № 89). образуемый при микро определении метоксиль ных (см № 89) или N-метильных (см. № 100) групп путем нагревания с HI (Принцип метода описан выше 78 — см. № 77) 446
447 Фурфурол (см. № 38), образуемый при определении пентозанов(см. № 64) путем нагревания с НС1 ВгОр—Вг~; кислота; 2 мин при 15— 30° С Ацетат натрия; иодид—тиосульфат 447
448 Фурфурол (см. № 38) и 5-оксиметилфурфурол, образуемые при определении пентозанов (см. № 64) обработкой кислотой (разделяют при помощи СНС13 и разбавленной НС1) (Метод описан выше 447 — см. № 447) 448
449 1 -(4-Оксифенил)-2-бутил-амино-этанолсульфат (васкулат) ВгО~—Вг“; НС1; 2 мин при комнатной температуре Иодид—тиосульфат 449
299
Продолжение
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
450 451 452 453 454 455 456 457 458 Мочевина (см. № 5); тиомочевина (см. № 497, 524) Фенолы (см. № 3) Нефть (см. № 32) — определение бромных чисел Салол (см. № 171); нипагин А Формальдегид (см. 108); гексаметилентетрамин (см. № 485) Р-Н афто лсульфокислота, например R-кислота, кислота Шеффера Дихлордиэтилсульфид Алкилиодиды (см. №77), образуемые прн определении низших ал-коксильных (см. № 77) групп в кремнийорга-нических соединениях Дисульфиды; сульфиды (см. № 99) (микрометод) ВгО^—Вг“; НС1; 10 мин при комнатной температуре; затем добавляют NaOH и кипятят 20 мин (образуются СО2, Г тиомочеви Бром — уксусная кислота; пиридин (как катализатор); 2—20 мин при комнатной температуре (Определено число J брс н-Гептан; разбавленная H2SO4; титруют смесью ВгО^~—Вг-до отчетливого желтого окрашивания верхнего слоя Электролитически генерируемый бром из раствора НС1—КВг—CuSO4 ВгО-; НС1; 20 мин при 100° С ВгО^“—Вг~; кислота; не более 1—2 мин при комнатной температуре ВгО^~—Вг-; кислота (Метод описан выше 78 — см. № 77) В уксусной кислоте; ВгО^“--Вг~; Н2О и НС1; 5 мин при комнатной температуре (реакция сопровождается присоединением 10 и 4 атомов брома соответственно) Иодид—тиосульфат <2; при определении ны — SO4—) Иодид—тиосульфат (визуально или амперометрически) >еагирующих атомов >ма) И одид—тиосульфат Меняют полярность электродов и обратно титруют Си1 кулонометрически Иодид—тиосульфат Иодид—тиосульфат Иодид—тиосульфат Иодид—тиосульфат 451 452 453 454 455 456 457 458 459
SCO
Продолжение
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литера гура
459 4 2,4-Дихлоранилин, не вступивший в реакцию при микроопределении ангидридов В уксусной кислоте; ВгОд~—Вг”; НС1; 5 мин при комнатной температуре Иодид—тиосульфат 459
460 Фенол (см. № 3) в при сутствии восстановителей Большой избыток бром—вода; 20— 30 мин при комнатной температуре (образуется трибромфен илгипобромит) Избыток брома восстанавливают so|~ затем фенолом; НС1 и Г и после 15— 20 мин титруют тиосульфатом (см. «Йодиды и иодисто-водородная кислота», литература 203) 460
461 Салициловая (см. № 9); ацетилсалициловая кислоты Избыток ВгС1 (ВгО”—Вг- и концентрированная НС1); НС1; 2 мин при комнатной температуре Иодид—тиосульфат 461
462 n-Оксибензойная кислота (см. № 165) (также образуемая при определении ее метилового эфира путем гидролиза в присутствии щелочи) Бром—вода до ко«-ричневого цвета Избыток брома удаляют при помощи SO|— и фенола; НС1 и I" через 20 мин титруют тиосульфатом 462
463 Антипирин; фенол (см. № 3) ВгС1 (BrOJ^—Вг~—ко (образуются 4-бромаг фенол или трибро (Предполагается, что нег нцентрированная НС1) 1типирин и трибромо-мфенилгипохлорит) метод найдет приме-ше) 463
464 Оксалат ВгО”—Вг“; кислота; ацетат натрия НС1; титруют арсенитом в присутствии Г —крахмал 464
465 Продукт, образуемый при определении диа-мокса путем гидролиза в присутствии щелочей ВгО^—Вг~; НС1; 5 мин при комнатной температуре Иодид—тиосульфат 465
466 Кротоновый альдегид (см. № 379) В воде; ВгО^"—Вг-; НС1; 3 мин при 0° С Иодид—тиосульфат 466
467 Салицилат натрия В воде; ВгО.р-Вг-; НС1; 10 мин в темноте Титруют гидразинсульфатом потенциометрически 467
301
Продолжение
№ п/п Титруемое вещество Реа1ент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
468 Гексабарбитал (см. № 340) ВгО (из ВгО~—Вг' концентрированная НО); НС1; 5 мин при комнатной температуре (Реакция присоединения галогенов по месту двойной связи) Иодид—тиосульфат 468
469 а, f-Ненасыщенные кислоты (см. № 68) и соли (также образуемые при определении эфиров путем гидролиза в присутствии щелочей) Нейтрализованная аликвотная часть; NaBr; бром—метанол—NaBr в большом избытке; 5— 10 мин при комнатной температуре Метанол; иодид— thoCj гьфат 469
470 Пропилен гликоль — определение ненасыщенности Бром—СС14; 1 мин при 0° С Иодид—тиосульфат; Ю^“ и оттитровывают тиосульфатом 470
471 Алкилиодиды (см. №77), образуемые при определении метоксильных (см. № 89), этоксильных (см. № 92) и изопро-поксильных групп в эфирах, кеталях и крем-нийорганических соединениях путем нагревания с HI (Принцип метода о № писан выше 79 — см. 77) 471
472 Цианацетгидразид НС1; Вг~; титруют ВгО^~ до появления желтого окрашивания; добавляют 20%-ный избыток реагента Иодид—тиосульфат 472
473 Диэтилсильбэстрол (см. № 215) В среде уксусной кислоты; ВгО^—Вг— • HCI; 20± 1 мин при комнатной температуре Иодид— тиосульфат 473
474 Метилиодид (см. № 89) иэтилиодид (см. №92), образуемые при определении метоксильных (см. № 89) и этоксильных (см. № 92) групп реакцией с HI (Метод описан выше 78 — см. № 77) 474
302
Продолжение
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
475 Фенолы (см. № 3); крезолы (см. № 29) НС1; титруют смесью ВгО^~—Вг- до желтого окрашивания; затем добавляют 20—25%-ный избыток реактива; 2 мин при комнатной тем- Иодид—тиосульфат 475
476 177 478 479 480 481 482 4-Метилурацил Соласодин Метилиодид (см. № 89), образуемый при определении метоксильных (см. № 89) групп в гуминовой кислоте и ее продуктах окисления путем нагревания с HI Мономер винилацетата (см. № 532) Изопропанол в смеси с метанолом, этанолом, ацетоном и н-пропано-лом Олефины (см. № 133), образуемые при определении дифенилэтанола (см. № 512) и 1-фенил-1-(п-бромфенил)-этанола дегидратацией уксусным ангидридом Ненасыщенные альдегиды (см. № 178), например акролеин (см. № 211), кротоновый альдегид (см. № 379), коричный (см. № 293) альдегид В воде; бром—вода; 15 мин при комнатной температуре В среде СНС13; бром—уксусная кислота—пиридин— H2SO4—СНС13 (Метод описан вь В разбавленной уксусной кислоте; титруют смесью бром— уксусная кислота до желтого окрашивания, затем добавляют небольшой избыток реактива ВЮ--ВГ-; Н3РО4; 1 ч при 40° С (образуется броми-рованный ацетон) Бром—уксусная кислота; 5 мин при комнатной температуре в темноте В среде этанола; ВгС1 (ВгО~—Вг~— концентрированная НС1) до появления желтого окрашивания; 5 мин при комнатной температуре Избыток брома уда ляют кипячением, добавляют избыток КОН и оттитровывают раствором НС1 Иодид—тиосульфат [ше7в — см. № 77) Иодид—тиосульфа г Г; оставляют на 15 мин при 90° С (для того, чтобы завершилась реакция бромирования ацетона) и затем титруют тиосульфатом Иодид—тиосульфат Иодид—тиосульфат 476 477 478 479 480 481 482
303
Продолжение
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
483 Малеиновая, фумаровая (см. № 151) кислоты [также после осаждения первой солями ртути (II)] ВгС1 в 20%-ном избытке; HgSO4; 15 мин при комнатной температуре (2 или 6 ч соответственно в отсутствии HgSO4) Иодид—тиосульфат 483, 484, 498
484 Омыленные ненасыщенные полиэфиры — определение ненасыщенности BrCl; 6 ч Иодид—тиосульфат 485
485 Г ексаметилентетрамин (см № 454) BrO“; НС1; 20— 35 мин при 100° С (образуется СО2, Н2О и N2) Иодид—тиосульфат 486
486 Изопрен в воздухе промышленных предприятий Абсорбируют спиртом и добавляют небольшой избыток ВгО”—Вг~—НС1 Иодид—тиосульфат 487
487 Пурины (см. № 374); кофеин (см. № 271); 1 -диоксипроп и лтеобро-мин и 7-диоксипропил-теофиллин ВгО^"—Вг—; H2SO4; 30 мин и 5 ч соответственно Иодид—тиосульфат 488
488 Фенолы (см. № 3); ароматические амины (см. № 34) ВгО^-—Вг-; кислота Иодид—тиосульфат; потенциометрически 489
489 Фенол (см. № 3) в воде в присутствии восстановителей Раствор нейтрализуют по метиловому красному; бромная вода; 20 мин Na.zSO3 до желтого окрашивания, фенол, чтобы удалить избыток брома; I" — НС1 титруют через 15 мин тиосульфатом 490
490 Тетраэтилсвинец (см. № 69) в бензоле Бром—СС14 до ко ричневой окраски, устойчивой в течение 5 мин-, метанол для растворения осадка; кипятят; добавляют КОН, чтобы удалить бром, затем добавляют небольшой избыток воды и кипятят 5 мин Избыток ЭДТА; nh4oh—nh4ci (буферный раствор); оттитровывают раствором ZnSO4 в присутствии эриохром черного Т 491
491 Антрацен (см. № 139) В среде уксусной кислоты; бром— уксусная кислота; 30 мин при комнатной температуре в темноте; (образуется 9,10-ди-бромантрацен) Иодид—тиосульфат 492
304
Продолжение
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
492 Пиррол В смеси уксусная кислота—вода (1 : 1); бром—уксусная кислота; 40— 60 мин при комнатной температуре Иодид—тиосульфат 493
493 Мочевина (см. № 5); биурет ВгО“—Вг~; НС1; через 5 мин и доводят пробу; 30 мин при комнатной температуре (образуются СО2, Н2О и N2) Иодид—тиосульфат 494
494 Диэтилстильбэстрол (см. № 215); диенэстрол В щелочном растворе; ВгО^-—Вт-; H2SO4; 25± 2 мин или 15± 1 мин соответственно прн комнатной температуре в темноте Иодид—тиосульфат 495
495 Синестрол (см. № 408) В среде уксусной кислоты; ВгО^“—Вг~; H2SO4; 80—83 мин в темноте; (образуется дибром-производное) Иодид—тиосульфат 496
496 Гидрохинон (см. № 97) в присутствии хинона В солянокислой среде; метанол; раствор брома; 10 мин при 20° С в темноте Метанол; иодид— тиосульфат 497
497 Тиомочевина (см. №450) Избыток ОВг~; NaOH; 1 ч при комнатной температуре H2SO4; иодид—тиосульфат 499
498 Тиоацетамид (Метод описан выше499 — см. № 497) Уравнение реакции: CH3CSNH2 + 4ОВ1- + 2ОН~ -> -> СН3СОО” -j- SO^“ + 4Вг— 4- NH+ 500
499 1 -Нафтиламин-5-суль-фокислота BrO“—Br“; НС1; 15—20 мин Иодид—тиосульфат 501
500 Эскулозид ВгОд-—Вг-; кислота (образуется дибромид) Иодид—тиосульфат 502
305
П родолжение
№ п/п Титруемое вещество Реагент я условия реакции Соответствующая обработка и конечная стадия титрования Лите-рату-ра
501 Ненасыщенные углеводороды (см. № 4), альдегиды (см. № 178), кетоны; кислоты (см. № 68), спирты (см. № 511), масла (см. Ns 1) и жиры (см. № 1), аскорбиновая кислота (см. № 383) — определение иодных чисел ВгОр—Вг-; НО; СС14; иногда добавляют молибдат аммония или ацетат ртути (II) — как катализатор; выдерживать 20 мин при комнатной температуре Иодид—тиосульфат 503
502 Енолы (см. № 22) в ацетоуксусных эфирах Добавляют до 5% смеси бром—метанол при —50° С (применяют также и другие растворители) Немедленно добавляют 10% f-нафтол— метанол; затем иодид—тиосульфат (см. «Йодиды и иодистоводородная кислота», литература 238) 504
503 Оксим циклогексанона Фосфорная кислота; H2SO4; ВгОр; затем вводят пробу в уксусную кислоту; 5 мин (превращение происходит через бромнитрозо- в бромнитроциклогексан) Иодид—тиосульфат; биамперометрически 505
504 Продукты конденсации фенолов (см. № 3) с формальдегидом (определение бромного числа для установления степени полимеризации) BrOp—Br~; НС1; 40 мин Иодид—тиосульфат 506
505 Соли или эфиры муравьиной кислоты (см. № 14) BrCI—НС1 (ВгО~ — Вг' —концентрированная HCI); 1 мин\ затем добавляют NaOH—ацетатный буферный раствор (оптимальный pH 4,2—6); 5 мин при комнатной температуре Уравнени НСОО- + Bi -> Н2О 4- СО (недиссоциированная медл Иодид—тиосульфат г реакции: С1 + он- -> 2 + Вг- + СГ НСООН реагирует енно) 507
506 Мочевина (см. № 5) BrOp—Br~; H2SO4; молибдат аммония; 5 мин при комнатной температуре Иодид—тиосульфат 508
306
Продолжение
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
507 Прокаин (см. № 166) в частично гидролизованной форме H2SO4; ВгО-—Вг"; 5 мин при комнатной температуре Иодид—тиосульфат 509
508 Фенолы (см № 3), например сульфосалициловая кислота Электролитически генерируемый бром в присутствии Си11 Меняют полярность и обратно оттитровывают кулонометрически Си1 510
509 = Si—Н- и =Si—CfiH5-группы Бром—уксусная кислота; при комнатной температуре для определения первой группы, нагревают для второй Уравнени = Si - - С6Н5 4- Вг2 Иодид—тиосульфат г реакции: -> = SiBr + С6Н6Вг 511
510 Ацетнафтилен в присутствии стирола и аценафтена В хлороформе; бром—метанол— NaBr; 10 мин в темноте Иодид—тиосульфат 512
511 Олефины (см. № 133), образуемые при определении третичных спиртов (см. № 501) в процессе реакции со смесью уксусная кислота—H2SO4 BrOg“—Вг-; 5 мин Иодид—тиосульфат 513
512 Олефины (см. № 133), образуемые при определении эфиров 1,1-дифе-нилэтанола (см. № 481) и его производных в процессе реакции со смесью уксусная кислота—H2SO4 BrOg*—Вг-; 5 мин Иодид—тиосульфат 514
513 Метилиодид (см. № 89), образуемый при определении метоксильных (см. № 89) групп в полимерах и сополимерах (Метод описан выше’9 — см. № 77) 515
514 Соли Рейнеке, осаждаемые при определении резерпина и камами-цина Горячий раствор Фелинга; Вг”; концентрированная НС1; титруют раствором ВгО~ до появления желтого окрашивания; 15 сек Иодид—тиосульфат 516
515 Масла (см. № 1) и жирные кислоты (см. № 257) — определение ненасыщенности (Метод описан выше40 — см. № 39; реагент берут в 2—2,5-кратном избытке) 517
307
Продолжение
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Лите» рату-ра
516 Мочевина (см. № 5) В водном растворе; бром, насыщенный раствором тетрабората натрия; 1 ч Г и НС1; тиосульфат 518
517 2-Этил-З-метилбутен-2-1-аль в присутствии 2-метилвалерианового альдегида В среде метанола или этанола; ВгС1 ( BrOg“—Вг-—концентрированная НС1) до желтого окрашивания; 5 мин Иодид—тиосульфат 519
518 Соли и эфиры муравьиной кислоты (см. № 14) Нейтральный раствор; избыток ВгО^; кипятят, добавляют Вг2—КВг до желтого окрашивания, затем добавляют избыток реагента; кипятят 3—5 мин (очевидно, для удаления избыточного свободного брома) Г и H2SO4; тиосульфат 520
519 Ртутьуксусная кислота и ацетат ртути НС1; бром—вода Избыток брома удаляют нагреванием; охлаждают; добавляют NH4OH и SO|~ и титруют мер каптоацетатом натрия в присутствии тиофлюоресцеина 521 j
520 1-(5-Тетразолил)-4-гуанилтетразингидрат (C2H8N10O) BrO3; H2SO4, вода; 30 мин при комнатной температуре, затем кипятят 15 мин Охлаждают и титруют окончательно раствором ВгО^ 522 i
521 Этилформиат, образуемый при определении этилортоформиата в процессе реакции с уксусной кислотой (Метод описан вы не607 — см_ До 505) 523
522 и-Оксипропиофенон в таблетках френантола Н-305 (Метод описан выше607 — см. № 505) 524
523 Резина — определение ненасыщенности В среде СС14, СНС13 или бензола; жидкий бром; 2 ч в темноте NaOH до исчезновения окраски брома; осаждают дибромид-гексаиом; озоляют; Вг- определяют титрованием раствором Hg (NO3)2 525
308
Продолжение
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
524 Ароматические тиомочевины (см. № 450) В воде или в смеси уксусная кислота— вода; НС1; ВгОз~— Вг—; 20—30 мин\ окисляют до мочевины и добавляют H2SO4 (Результаты не всегда соответствуют теоретическим) Иодид—тиосульфат 526
525 Дигидрохлортиазид В присутствии NaOH; BrO~—Вг“; НС1; 10 мин Иодид—тиосульфат 527
526 Алкилиодиды (см. № 77), образуемые при определении алкоксильных (см. № 77) групп реакцией с HI (Метод описан выше70 — см. № 77) 528
527 Тетраэтилсвинец (см. № 69) в бензине Бром—СС14 до появления устойчивого желтого окрашивания; 2 мин HNO3; водный слой освобождают от избытка брома; РЬ2+-ионы немедленно оттитровывают ЭДТА в присутствии эриохром черного Т 529
528 Метилиодид (см. № 89), образуемый при определении метоксильных (см. № 89) групп в по-лифункциональных производных ксилитола или сорбитола (Метод описан выше78 — см. № 77) 530
529 Моногидразин; дигидразин В смеси соляная кислота—вода; Вг- — ВгО|Г; 10 мин (1 молекула гидразина реагирует с 4 атомами брома) Иодид—тиосульфат 531
530 Углеводороды (см. № 4) каучука (см. № 531) В среде бензола; Na2MoO4—НС1— уксусная кислота; ВгО^~—Вг-; 100 лшн в темноте I* и тетраборат натрия; через 5 мин добавляют избыток тиосульфата, затем через 5 мин оттитровывают иодом 532
531 Каучук (см. № 530) в вегетативной части бразильской гевеи (Метод описан вьп пе5за — см. № 530) 533
309
Продолжение
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
532 533 534 535 536 537 538 539 540 541 Мономер в сополимерах винилацетата (см. № 479) с 2-этилгексаакрилатом Холестерин (см. № 298); р-ситостэрол Сорбиновая кислота Теофиллин; кофеин (см. № 271); теобромин Аминофенол (см. № 286), образуемый из аминосалициловой кислоты (см. № 286) декарбоксилированием разбавленной H2SO4 Фенол (см. № 3) после отделения резорцина перегонкой с паром Фенол (см. № 3); резорцин (см. № 24) Формальдегид (см. № 108) и муравьиная кислота (см. № 14) в присутствии метанола Холестерин (см. № 298) Непрореагировавший n-толуидин (см. A''j 80), отогнанный из реакционной смеси при определении солей диазония В 70%-ной уксусной кислоте; ацетат натрия; бром—уксусная кислота; 40— 48 ч при комнатной температуре (Метод вообще приме ния мономеров; винг прямым титро В среде СНС13; бром—уксусная кислота; 30 мин Нейтр а лизо ванный раствор; бром—СС14 Вг“—ВгО^"—H2SO4; 30 мин в темноте (Вводят эмпирически щий рассчитать с Вг-—ВгО^“—H2SO4; 20 мин ВгО“—Вг-; НС1; 15 мин в темноте В воде; ВгО^-—Вг~; НС1; 15 мин при 0° С (резорцин определяют избытком иода) BrOg-—Br—; H2SO4; через 30 мин добавляют NaOH и вводят пробу; 15 мин В среде СНС13; BrOg - Вг-; 20%-ная НС1; 3— 5 мин ВгО~—Вг-—НС1 Иодид—тиосульфат нителен для определе-лацетат определяется занием бромом) Иодид—тиосульфа г Иодид—тиосульфат Иодид—тиосульфат й фактор, позволяю бщее содержание) Иодид—тиосульфат; избыток брома вое станавливают SOg—, перегоняют NH3 в избыток НС1, кото рый оттитровывают NaOH в присутствии метилового красного Г; затем титруют тиосульфатом Вода; Г; H2SO4; титруют тиосульфатом Иодид—тиосульфат Иодид—тиосульфат 534 535 536 537 538 539 540 541 542 543
310
Продолжение
Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная •Пите-рату-
n/n стадия титрования ра
542
543
Иодид—тиосульфат
544
545
Ароматические или гетероциклические сульфиды (см. № 99) п-Амипофенол (см. № 286); метол (метил-n-аминофенол сульфат)
В среде уксусной кислоты; НС1;
ВгО~—Вг~
В разбавленной H2SO4; бром до желтого окрашивания; 10—20 мин (образуются хинон и
Избыток брома удаляют фенолом, затем добавляют I" и через 15 мин титруют тиосульфатом или
добавляют избыток SO3 , кипятят, уда ляют SO2, подщелачивают; NHS перегоняют в НС1, избыток которой оттитровывают NaOH в присутствии метилового красного
2) К веществам, определяемым путем титрования бромистоводородной кислоты, образующейся в качестве продукта реакции, относятся сульфиды, фенол, оксин, пиперазин, 4-метилурацил, муравьиная и щавелевая кислоты и изониазид (изоникотиновую кислоту титруют одновременно). Титрование обычно осуществляют растворами NaOH или КОН в присутствии индикаторов, подобных метиловому красному, изменяющему окраску в пределах pH от 3 до 6. В присутствии изоникотиновой кислоты применяют фенолфталеин. НВг, образующийся в результате побочных реакций замещения, определяют путем прибавления йодата и титрования выделившегося иода тиосульфатом и вносят исправления в результаты определения.
3) Определение бромид-ионов, образованных в результате реакции бромирования, проводят по Фольгарду, добавляя избыток Ag1 и обратно оттитровывая SCN--ионами. Этот метод применим для определения фенолов и формиатов. Некоторые другие случаи титри-метрических определений продуктов реакции приведены в табл. 24
3. В единственном случае бром используется для разрушения альдозы- в смеси кетоза—альдоза. Конечной стадией анализа является титрование Си11 сахара до и после воздействия брома.
ЛИТЕРАТУРА
1. Knop W., Zentralblatt, 321, 403, 499 (1854).
2. Reymann S., Ber., 8, 790 (1875).
3. Koppeschaar W. F., Z. anal. Chem., 15, 233 (1876).
4. A 1 1 en A. H., Analyst, 6, 177 (1881).
311
5. Quinquand E., Moniteur scientifique, 23, 641, abstract in Z. anal. Chem., 21, 607 (1882).
6. M i 1 1 s E., S n о d g r a s s, J. Soc. Chem. Ind. (London), 2, 435 (1883).
7. Hamburger H. T., Rec. trav. chim., 2, 181 (1883).
8. M i 1 1 s E., A к i t t, J. Soc. Chem. Ind. (London), 3, 366 (1884)
9. Me I I h i ney P. C., J. Am. Chem. Soc., 16, 275 (1894).
10. F г e у e r F., Chem.—Ztg., 20, 820 (1896).
11. D i t z FL, Z. angew. Chem., 13, 1051 (1900).
12. Z d a г e к E„ Z. anal. Chem.. 41, 288 (1902).
13. S t r i t a r M. J., Zeidler, FL, Z. anal. Chem., 43, 396 (1904).
14. L 1 о у d S. J., J. Am. Chem. Soc., 27, 16 (1905).
It?. Rupp E., Arch. Pharm., 243, 69 (1905).
16. Rupp E., Arch. Pharm., 243, 98 (1905).
17. Telle F., J. pharm. chim., 21, 111 (1905).
18. Mossier, Z. allgem. osterr. Apoth.—Verein, 45, 223, 235, 251, 267, 283, 299 (1907).
19. J о s e p h A. F., J. Soc. Chem. Ind. (London), 29, 1189 (1910).
20. V a u b e 1 W., Z. angew. Chem., 23, 2078 (1910).
21. de Jong A. W K., Rec. trav. chim., 30, 223 (1911).
22. К 1 i m о n t I. J., N e u m a n n W., Pharm. Post, 44, 587 (1911).
23. M e у e r K. FL, Kappel meier P., Ber., 44, 2718 (1911).
24. Meyer K. FL, Ann., 380, 212 (1911).
25. Pence С. M., J. Ind. Eng. Chem., 3, 820 (1911).
26. Lagrange A., abstract in Z. anal. Chem., 51, 264 (1912).
27. Mader H., Deut. Apotheker—Ztg., 27, 746 (1912).
28. R e d m a n L. V., Werth A. J., В u с к F. P., Ind. Eng. Chem., 5, 389 (1913).
29. Go Ise J., Bull. soc. pharm., Bordeaux, 56, 186 (1919); J. pharm. chim. (7), 19, 20 (1919).
30. F о x J. J., Barker M. F., J. Soc. Chem. Ind. (London), 39, 169T (1920).
31. Ko It holt I. M.. Pharm. Weekblad, 58, 699 (1921).
32. D i e с к m a n n W., Ber., 55, 2470 (1922).
33. J о h a n s e n E. M., Ind. Eng. Chem., 14, 288 (1922).
34. К a u f m a n n FL P., Ann., 429, 247 (1922).
35. F r a n c i s A. W., Hill A. J., J. Am. Chem. Soc., 46, 2498 (1924).
36. M a n c h о t W., О ber h a user F., Z. Untersuch. Nahr. u. Genussm., 47, 261 (1924).
37. Pohorecka-Lelesz B., Bull. soc. chim. biol., 6, 773 (1924).
38. Поварнин Г. Г., Б е л и к о в а А. В., Ж- русского физико-химического общества, 55, 226 (1924).
39. Р о w е 1 1 W. J., W h i t t a k e r FL, J. Soc. Chem Ind. (London), 43, 35T (1924).
40. R о s e n m u n d K. W., Z. angew. Chem., 37, 58 (1924).
41. Dobryanski A. F., Petroleum Domain, 574 (1925).
42. Goldschmidt S., Steigenwald C., Ber., 58, 1350 (1925).
43. Go Ise J., Bull. soc. chim. biol., 7, 167 (1925).
44. К о I t h о 11 I. M., Chem. Weekblad, 22, 558 (1925).
45. Francis A. W., Ind. Eng. Chem., 18, 821, 1095 (1926).
46. К a и f m a n n FL P., Z. Untersuch. Lebensm., 51, 3 (1926).
47. T и г e k 0., Chem. Obzor, 1, 295 (1926).
48. U 1 r i c h F., Kather K-, Z. angew. Chem., 39, 229 (1926).
49. G r a n a c h e r C., W о I f G., Helv. Chim. Acta, 10, 815 (1927).
50. J a r v i n e n К- K-, Z. anal. Chem., 71, 108 (1927); 73, 446 (1928).
51. L i n s t e a d R. P., J. Chem. Soc., 355 (1927).
52. L i n s t e a d R. P., M a n n J. T. W., J. Chem. Soc. 723 (1927).
53. d e 1 Mundo S., Phillipine J. Sci., 33, 363 (1927).
54. Oberhauser F., Heusinger W., Z. anorg. u. allgem. Chem., 160, 366 (1927).
55. О r t о n K. J. P-, В r a d f i e 1 d A. E., J. Chem. Soc. 983 (1927).
312
56 Rhodes G. F. H., J a у m e D. W., Bivins F. H., Ind. Ene. Chem., 19, ‘ 804 (1927).
57. V a u b e 1 W., Z. angew. Chem., 40, 1143 (1927).
58. В а с о n F. S., Ind. Eng. Chem., 20, 970 (1928).
59. В u x t о n J , L u c a s H. J., J. Am. Chem. Soc., 50, 249 (1928).
60 Day A. R., T a g g а г t W. T., Ind. Eng. Chem., 20, 545 (1928).
61 Furia A., Boll. soc. chim., Sao Paulo, 1, 15 (1928).
62. Hansen A., Dansk Tids. Farm., 12, 89, 112 (1928).
63. V о 1 m a r Y., S a m d a h 1 B., J. pharm. chim., 7, 106 (1928).
64. С о r t e s e F., Rec. trav. chim., 48, 564 (1929).
65. Hart L., J. Assoc. Offic. Agr. Chem., 12, 296 (1929).
66. К u 1 1 g r e n С., T у d e n FL, Ing. Vetenskaps Akad. Handl., No. 94, 3 (1929).
67. R о s i n P., J u s t FL, Z. angew. Chem., 42, 965, 984, 1002 (1929).
68. Ю ш к e в и ч С., Маслобойно-жировое дело, 45, 39 (1929).
69. В о 1 t о n Е. R., W i 1 1 i a m s К. A., Analyst, 55, 5 (1930).
70. В u с k w а 1 t е г FI. М., Wagner Е. С., J. Am. Chem. Soc., 52, 5241 (1930).
71. С a 11 i n L. J., S t а г г е 11 J. E., Refiner Natural Gasoline Mfr., 9, No. 7, 155 (1930).
72. Dillon R. T., Y о u n g W. G., L u c a s H. J., J. Am. Chem. Soc., 52, 1953 (1930).
73. Harris M., J. Assoc. Offic. Agr. Chem., 13, 364 (1930).
74. Heim G„ Bull. soc. chim. Belg., 39, 458 (1930).
75. Levenson H., Ind. Eng. Chem., Anal. Ed., 2, 246 (1930).
76. van der Meulen J. FL, Chem. Weekblad, 27, 550 (1930).
77. Sasaki K., J. Agr. Chem. Soc., Japan, 6, 538 (1930).
78. Travers A., A v e n e t, Compt. rend., 190, 875 (1930).
79. V i e b о c k F., S c h w a p p a c h A., Ber., 63, 2818 (1930)
80. V i e b о c k F„ В г e c h e r C., Ber., 63, 3207 (1930).
81. Davis H. S., G r a n d a 1 1 G. S., H i g b e e W. E., Ind. Eng. Chem., Anal. Ed., 3, 108 (1931).
82. Ellington О. C., Beard H. G., J. Soc. Chem. (London), 50, 151T (1931).
83. Feist K-, Klatt F., Pharm. Ztg., 76, 112 (1931).
84. G r a n t E. H., J. Assoc. Offic. Agr. Chem., 14, 351 (1931).
85. Hart L., J. Assoc. Offic. Agr. Chem., 14, 330 (1931).
86. Кульская О. А., Укр. хим. журнал, 6, 1 (1931).
87. М у u n g С. W., Folio Pharm. Jap., 12, No. 3, 417(1931).
88. Poll FL, Petroleum Z., 27, 817 (1931).
89. R о s e n t h a 1 e r L., Pharm. Acta Helv., 6, 179 (1931).
90. R о s e n t h a 1 e r L., Pharm. Acta Helv., 6, 209 (1931).
91. Scott R. D., Ind. Eng. Chem., Anal. Ed., 3, 67 (1931).
92. Bruckner V., Mikrochemie, 12, 153 (1932).
93. Bruylants P., Bull. soc. chim. Belg., 41, 309 (1932).
94. C a s i m i r E. E., D i m i t r i u M., Inst. Geol. Roumanie, Compt. rend., 21,
241 (1932—3).
95. С 1 a r k E. P., J. Assoc. Offic. Agr. Chem., 15, 136 (1932).
96. С о r f i e 1 d С. E., M u n d у С. M., Quart. J. Pharm. and Pharmacol., 5, 504
(1932).
97. Ф и а л к о в Я., Ямпольская М., Фарм. журнал, 13 (1932).
98. К о 1 t h о f f I. M., Lingane J. J., Pharm. Weekblad, 69, 1147 (1932).
99. P о з e н б e p г e p H. А., Рабинович P. В., Ф p e н к e л ь К- Я., Тр. Всесоюзного научно-исследовательского ин-та бумажной целлюлозы, № 1, 109 (1932).
100. Rosenthaler L., Pharm. Acta Helv., 7, 45 (1932).
101. Rosenthaler L., Pharm. Acta Helv., 7, 223 (1932).
1021 S a m p e у J. R., S 1 a g 1 e К H., R e i d E. E.. J. Am. Chem. Soc., 54, 3401 (1932).
103. S I о 11 a K- FL, H a b e r 1 a n d G., Ber., 65, 127 (1932).
104. v. S z e 1 e n у i G., Z. Untersuch. Lebensm., 63, 534 (1932).
105. В о n i c a t t i M., Boll, ufficiale. staz. sper. seta, 3, 66 (1933).
106. Carol J., J. Assoc. Offic. Agr. Chem.. 16, 384 (1933).
313
107. Г d d 1 e s H. A., Robbins P. J., Ind. Eng. Chem., Anal. Ed., 5, 55 (1933).
108. К a I 1 s t r 6 m E., Pharm. Zentralhalle, 74, 269 (1933).
109. Ростовцева E., Гофман E., Анилинокрасочная пром., 3, 457 (1933).
НО. Ш e м я к и н М. М., Апилипокрасочная пром., 3, 403 (1933).
ill. Spitzer L., Chem.—Ztg., 57, 224 (1933).
112. Szahlender К., Magyar Gyogyszeresztud. Tarsasag Ertesitoie, 9. 135 (1933).
113. Szahlender K-, Pharm. Monatsh., 14, 281 (1933).
114. V i g n о 1 i L., Bull. soc. pharmacol., 40, 344 (1933).
115. В a e r n s t e i n H. D., J. Biol. Chem., 106, 451 (1934).
116. Beukema-Goudsmit M., Pharm. Weekblad, 71, 380 (1934).
117. F 1 e c k H. R., G r e e n a n e F. J., W a r d A. M., Analyst, 59, 325 (1934).
118. H о s h a 1 1 E. M., Grove D. C., J enkins G. L., J. Am. Pharm. Assoc., 23, 118 (1934).
119. H u g h e s E. E., Acree S. F., Ind. Eng. Chem., Anal. Ed., 6, 123 (1934).
120. Hughes E. E., A c r e e S. F., Ind. Eng. Chem., Anal. Ed., 6, 292 (1934).
121. К г i s h n a n T. S., J. Indian Chem. Soc., 11, 651 (1934).
122. N a n j i H. R., Analyst, 59, 96 (1934).
123. Щербачев К. Д-, Химико-фармацевтич. пром., 5, 37 (1934).
124. Щербачев К. Д-, Анилинокрасочная пром., 4, 562 (1934).
125. С х о д ц е в С. Т., Ж. прикл. химии, 7, 605 (1934).
126. Szahlender К., Magyar Gyogyszeresztud. Tarsasag Iirtesitoje, 10, 52 (1934).
127. Ворожцов H. Н., Анилинокрасочная пром., 4, 166 (1934).
128. Casimir Е. Е., Dimitriu М., Petroleum Z., 31, No. 33, 1 (1935).
129. С a s t i g 1 i о n i A., Ann. chim. applicata, 25, 236 (1935).
130. Cook S. G., Ind. Eng. Chem., Anal. Ed., 7, 250 (1935).
131. Федоров Б. П., С п p ы с к о в А. А., Анилинокрасочная пром., 5, 143 (1935).
132. Gibson D. T., С a u 1 f i e 1 d T. H., J. Chem. Soc., 1419 (1935).
133. Jenkins G. L., D u n k e r M. F. W., J. Am. Pharm. Assoc., 24, 840 (1935).
134. Mulliken S. P., Wakeman R. L., Ind. Eng. Chem., Anal. Ed., 7, 59 (193b).
135. Березова M. К., Гигиена труда, 14, № 3, 72 (1936).
136. Федоров Б. П., Спрысков А. А., Орг. хим. пром., 2, 101 (1936).
137. Гальперн Г. Д., Виноградова Е. В., Нефтяное хозяйство, 1, 59 (1936).
138. Hart пег F., S с h 1 е i s s Е., Mikrochemie, 20, 163 (1936).
139. Литвак И. М., Советский сахар, 14, № 11, 40 (1936).
140. Меламед Ф., Гофман Е., Орг. хим. пром., 1, 616 (1936).
141. Сквирская В. М., Орг. хим. пром., 1, 163 (1936).
142. White Е. V., W г i g h t G. F., Can. J. Research, 14, 427 (1936).
143. Ардашев Б. И., Ж. прикл. химии, 10, 1032 (1937); Тр. Уральского ин-дустр. ин-та им. С. М. Кирова, № 6, 70 (1938).
144. Е р 1 er W. N., Refiner Natural Gasoline Mfr., 16, 83 (1937).
145. F r i e m a n R. H., Kennedy E. R., Lucas H. J., J. Am. Chem. Soc., 59, 723 (1937).
146. Гальперн Г. Д., Виноградова Е. В., Химия твердого топлива, 8, 384 (1937).
147. Н a m m i с k D. LI., L a n g r i s h D., J. Chem. Soc. 797 (1937).
148. Hughes E. E., A c r e e S. F., Ind. Eng. Chem., Anal. Ed., 9, 318 (1937).
149. Kaufmann H. P., H a r t w e g L., Ber., 70, 2554 (1937).
150. Халецкий A. M., Микрюкова H. С., Фармация и фармакология, № 8, 21 (1937).
151. -S c h u 1 e k E., В о 1 d i z a r I., Z. anal. Chem., 108, 396 (1937).
152. Schwicker A., Z. anal. Chem., 110, 161 (1937).
153. S 1 i v a V., Plyn. Voda, zdravotni tech., 17, 9 (1937).
154. Szeged у E., Z. anal. Chem., 109, 95, 316 (1937).
155. Wessel F. W., Keszl er M. R., Ber. ungar. pharm. Ges., 13, 161 (1937).
156. Cooper S. R., В a r n e s R. P., Ind. Eng. Chem., Anal. Ed., 10, 379 (1938).
314
j57 Gut hill R., Atkins C., J. Soc. Chem. Ind. (London), 57, 89 (1938).
158: Fur ter M„ Helv. Chim. Acta, 21, 1144, 1151 (1938).
159. Гордон Б., Д a x и о в В., Нефтяное хозяйство, 19, № 9, 53 (1938).
160. J u h 1 i п О., Z. anal. Chem., ИЗ, 339 (1938).
161 X а л е ц к и й А. М., Я новицка я А. М., Фармация и фармакология, № 1, 17 (1938).
162. Kinsman S., N о 1 1 е г С. R., Ind. Eng. Chem., Anal. Ed., 10, 424 (1938).
163. Kalin A., Pharm. Acta Helv., 13, 488 (1938).
164. Литвак И., Спирто-водочная пром., 15, Ns 2, 7 (1938).
165. Л о б у н е ц Н. Н., Зав. лаб., 7, 872 (1938).
166. Lucas Н. J., Pressman D., Ind. Eng. Chem., Anal. Ed., 10, 140 (1938).
167. N a ss i L., Diagnostica tec. lab. (Napoli), Riv. mens., 9, 161 (1938).
168. Reimers F., Dansk Tids. Farm., 12, 203 (1938).
169. Rossi O. A., Rev. centre estud. farm, bioquim., 28, 60 (1938).
170. Thomas C. L., В 1 a c k H. S., H oekst r a J., Ind. Eng. Chem., Anal. Ed., 10, 153 (1938).
171. Trappe W„ Biochem. Z„ 296, 174, 180 (1938).
172. V alencien C., Deshusses J., Mitt. Lebensm. Hyg., 29, 119 (1938).
173. Баранов H. Б., Зав. лаб., 8, 931 (1939).
174. Беленицкая Д. С., Укр. гос. ин-т эксперим. фармации (Харьков), консультационные материалы Ns 2, 44 (1939).
175. Christensen В. Е., Hansen Е., Cheldelin J. Н., Ind. Eng. Chem., Anal. Ed., 11, 114 (1939).
176. Clark E. P., J. Assoc. Offic. Agr. Chem., 22, 109, 622 (1939).
177. Elek A., Ind. Eng. Chem., Anal. Ed., 11, 174 (1939).
178. Ф e p т м а н Г., P о д з e в и ч В., Спирто-водочиая пром., 16, Ns 7, 40 (1939).
179. Hallsworth Е. G., J. Soc. Chem. Ind. (London), 58, 357 (1939).
180. H о s h a 1 1 E. M., J. Assoc. Offic. Agr. Chem., 22, 748 (1939).
181. Л о б у н e ц M. M., Научный бюллетень Киевского гос. ун-та, серия химия, Ns 4, 23, 41 (1939).
182. Осанов Б. П., Зараковская И., Лесохимическая пром., Ns 12, 27 (1939).
183. Peniston Q. Р., Hibbert FL, Paper Trade J., 109, No. 17, 46 (1939).
184. Pressman D., L u c a s H. J., J. Am. Chem. Soc., 61, 2271 (1939).
185. P e з н и ц к а я T. В., Орг. хим. пром., 6, 666 (1939).
186. Valencien С., Deshusses J., Mitt. Lebensm. Hyg., 30, 246 (1939).
187. Hughes E. E., Acree S. F., J. Research Natl. Bur. Standards, 24, 175 (1940).
188. Johnson P. R., В a r n e s H. M., M с E 1 v a i n S. M., J. Am. Chem. Soc., 62, 969 (1940).
189. Kaufmann H. P., Fette u. Seifen, 47, 4 (1940).
190. Lewis J. В., В r a d s t r e e t R. B., Ind. Eng. Chem., Anal. Ed., 12, 387 (1940).
191. P e d i n e 1 1 i M., P e s s a r e 1 1 i V., Boll. sci. fac. chim. ind., Bologna, 99 (1940).
192. Seaman J. W., Norton A. R., Mason R. W., Ind. Eng. Chem., Anal. Ed., 12, 345 (1940).
193. Семенов C. FL, 3 а л и о п а М., Маслобойно-жировое дело, 16, Ns 3, 20 (1940).
194. С о л ь ц Л. М., Колик Е. М., Укр. гос. ин-т эксперим. фармации (Харьков), консультационные материалы, Ns 5, 162 (1940).
195. Сонгина О. А., Научно-информационный бюллетень центрального научно-исследов. аптечного ин-та ГАПУ, Наркомздрава РСФСР, 4, Ns 12, 10 (1940).
196. Bell R. Т., A gruss М. S., Ind. Eng. Chem., Anal. Ed., 13, 297 (1941).
197. Bielenberg W., Go I dh a hn H., Z о f f A., 61 u. Kohle, 37, 496 (1941).
198. Christensen В. E., F r i e d m a n L., S a t о Y., Ind. Eng. Chem., Anal. Ed., 13, 276 (1941).
'99 Deshusses J., Mitt. Lebensm Hyg., 32, 176 (1941).
200. Fleury P., Courtois J ..Ann chim anal chim appl., 23, 117 (1941).
315
201. F r a n c i s A. W., H i 1 1 A. J., Ind. Eng. Chem., Anal. Ed., 13, 357 (1941).
202. Green S. J., J. Inst. Petroleum, 27, 66 (1941).
203. J ayme G., Sarten P., Biochem. Z., 308, 109 (1941).
204. Jordan C. W., J. Am. Chem. Soc., 63, 2687 (1941).
205. L a z z a r i G., Ann. chim. applicata, 31, 266 (1941).
206. Reimers F., Z. anal. Chem., 122, 404 (1941).
207. S c h r e t t e r O., Z. anal. Chem., 122, 24 (1941).
208. Соловейчик Л., Ал ексеев П., Ж. прикл. химии, 18, № 21, 26 (1941).
209. Sprung М. М., Ind. Eng. Chem., Anal. Ed., 13, 35 (1941).
210. Wells E. FL, J. Assoc. Offic. Agr. Chem., 24, 736 (1941).
211. Ba iley A. J., Ind. Eng. Chem., Anal. Ed., 14, 181 (1942).
212. C a s t i g 1 i о n i A., Z. anal. Chem., 123, 405 (1942).
213. Conway H. S., J. Assoc. Offic. Agr. Chem., 25, 791 (1942).
214. G e t t 1 e r A. O., Umberger, C. J., J. Biol. Chem., 143, 633 (1942).
215. Poet hke W., Pharm. Zentralhalle, 83, 1, 13 (1942).
216. Pressman D., L u c a s H. J., J. Am. Chem. Soc., 64, 1953 (1942).
217. Russo F., Ann. chim. applicata, 32, 216 (1942).
218. S a m s e 1 E. P., M c FI a r d J. A., Ind. Eng. Chem., Anal. Ed., 14, 750 (1942).
219. Sanchez J. V., Ciencia, 3, 18 (1942).
220. Sondern C. W., В a r s о n C., Ind. Eng. Chem., Anal. Ed., 14, 358 (1942).
221. Stanerson B. R., Levin FL, Ind. Eng. Chem., Anal. Ed., 14, 782 (1942).
222. Weiss L. C., J. Assoc. Offic. Agr. Chem., 25, 896 (1942).
223. Wells E. FL, J. Assoc. Offic. Agr. Chem., 25, 537 (1942).
224. Wells E. H., J. Assoc. Offic. Agr. Chem., 25, 747 (1942).
225. Alicino J. F., Ind. Eng. Chem., Anal. Ed., 15, 764 (1943).
226. Burson C., Sondern C. W., Pharm. Arch., 14, 17 (1943).
227. Cooke L. M., FI i b b e r t H„ Ind. Eng. Chem., Anal. Ed., 15, 24 (1943).
228. Lespagnol A., M e r v i 1 1 e R., Ann. chim. anal., 25, 53 (1943).
229. Korpaczy I., Kem. Lapya, 4, 106 (1943).
230. Wojahn H., Arch. Pharm., 281, 289 (1943).
231. Houghton A. A., W i 1 s о n H., Analyst, 69, 363 (1944).
232. Lewis J. В., В r a d s t r e e t R. B., Ind. Eng. Chem., Anal. Ed., 16, 617 (1944).
233. M о r i w a k i Y., Tohoku J. Exptl. Med., 47, 34 (1944).
234. Muller A., Feher L„ Fette u. Seifen, 51, 171 (1944).
235. Rowe R. G., Furnas С. C., Bliss FL, Ind. Eng. Chem., Anal. Ed., 16, 371 (1944).
236. Schtn i d t-N ielsen K., Compt. rend. trav. lab. Carlsberg., Ser. chim., 25, 87 (1944).
237. Baernstein FI. D., J. Biol. Chem., 161, 685 (1945).
238. Conway H. S., J. Am. Pharm. Assoc., 34, 236 (1945).
239. Fierz-David H. E., P f a n n e r E., О p p 1 i g e r F., Helv Chim. Acta, 28, 1463 (1945).
240. F r i e d k i n M., Ind. Eng. Chem., Anal. Ed., 17, 637 (1945).
241. Gan da у R., J. Intern. Soc. Leather Trades, Chem., 29, 143 (1945).
242. C h a m b о n M., Rochebillard R., Lyon pharm., 5/6, 2 (1946).
243. Cox H. E„ Analyst, 71, 301 (1936).
244. Morgan P. W., Ind. Eng. Chem., Anal. Ed., 18, 500 (1946).
245. R iemschneider R., Pharmazie, 1, 161 (1946).
246. Ruderman I. W., Ind. Eng. Chem., Anal. Ed., 18, 753 (1936).
247. Schill G„ Svensk Farm. Tid., 50, 385 (1946).
248. W a r s h о w s k у В., Elving P. J., Ind. Eng. Chem., Anal. Ed., 18, 276 (1946).
249. Waugh T. D., Harbottle G., Noyes R. M., Ind. Eng. Chem., Anal. Ed., 18, 636 (1946).
250. Wilson G. E„ Nisbet FI. B„ Analyst, 71, 183 (1946).
251. A n g e 1 1 F. G„ Analyst, 72, 178 (1947).
252. Boyd FI. M., Roach J. R., Anal. Chem., 19, 158 (1947).
253. Brissaud L., Mem. services chim etat. (Paris), 33, 75 (1947).
316
254. C’a ccia-Bava А. М., Ateneo parmense, 18, 467, 477 (1947).
255. Green N., Green M. W., J. Am. Pharm. Assoc., 36, 235 (1947).
256. H i r s c h h о r n I. S., Anal. Chem., 19, 880 (1947).
257 J i r s a F., Chemie (Prague), 3, 130 (1947).
258' Johnson H. L., Clark R. A., Anal. Chem., 19, 861 (1947); correction ibid., 20, 490 (1948).
259 Montequi R., Alvares A., Anales fis. у quim. (Madrid), 43, 1159 (1947).
260. N i e m i e г к о W., Acta Biol. Exptl. (Warsaw), 14, 199 (1947).
261. Poethke W., Pharm. Zentralhalle, 86, 2 (1947).
262. Poethke W., Pharm. Zentralhalle, 86, 357 (1947).
263. Prat J., V a g a n a у J., Mem. services chim. etat. (Paris), 33, 391 (1947).
264 Robinson E. D., W e r c h S. C., J. Am. Pharm. Assoc., Sci. Ed., 36, 185 (1947).
265. S a v a r d J., L ecl erg A., Reygrobellet J., Agron. trop., 2, 170 (1947).
266. S a v i о 1 i F., Chimica e industria (Milan), 29, 206 (1947).
267. Shaw В. M., J. Soc. Chem. Ind. (London), 66, 147 (1947).
268 S h r i к h a n d e J. G., D e v R., J. Indian Chem. Soc., Ind. & News Ed., 10, 125 (1947).
269. Thayer L., Glase B., Proc. Louisiana Acad. Sci., 10, 213 (1947).
270. Awe W., S к г о c h B., D e r e 1 i u s F., Suddeutsch. Apotheker-Ztg., 88, 155 (1948).
271. Bar D., Bull. soc. pharm., Lille, No. 2, 16 (1948).
272. C a v i с c h i G., Riv. ilal. essenze profumi, piante offic. olii vegetali, saponi, 30, 473 (1948).
273. Fungairino L. V., Puertas P. G., Anales real soc. espan. fis. у quim., 44, 459 (1948).
274. Fungairino L. V., Anales real acad. farm., 14, 707 (1948).
275. G о 1 d e n s о n J., Sass S., Anal. Chem., 20, 730 (1948).
276. G о 1 d e n s о n J., Sass S., Anal. Chem., 20, 1118 (1948).
277 К a 1 1 e r A., Angew. Chem., 60, 334 (1948).
278. Lespagnol A., Bar D., Ann. pharm. franc., 6, 515 (1948).
279. L о b u n e t s N., Z. anal. Chem., 128, 279 (1948).
280. M a f f e i F. J., О u t a M., Anais asoc. quim. Brasil, 7, 195 (1948).
281. Poethke W., Pharmazie, 3, 69 (1948).
282. Riemschneider R., Pharmazie, 3, 207 (1948).
283. Shafik Ali Khishen, Anal. Chem., 20, 1078 (1948).
284. Soos I., Z. Anal. Chem., 128, 110 (1948).
285. Thomas P. R., D о n n L., Becker H. C., Anal. Chem., 20, 209 (1948).
286. Wojahn H., Siiddeutsch. Apotheker-Ztg., 88, 395 (1948).
287. Z a n e t t i G. C., Atti accad. sci. Ferrara, 26, No. 1 (1948—9).
288. С о p p i n i D., Farm, sci e. tec. (Pavia), 4, 526 (1949).
289. Ran S., Braun M., О r v о s i Hetilap, 90, 283 (1949).
290. Dunning J. W., Dallas D. E., Anal. Chem., 21, 727 (1949).
291. Fungairino L. V., Garcia-Puertas P., Anales bromatol (Madrid), 1, 219 (1949).
292. H а Ы i t z e 1 С. P., J e z 1 J. L., Anal. Chem., 21, 1049 (1949).
293. Harnish D. P„ T a r b e 1 1 D. S., Anal. Chem., 21, 968 (1949)
294. К p e in к о в А. П., H e с с о н о в а Г. Д., Ж- аналит. химии, 4, 220 (1949).
295. Петрова Н. Л., Ж. прикл. химии, 22, 122 (1949).
296. Попов С. Ф., Мед. пром. СССР, № 3, 31 (1949).
297. Попов С. Ф., Мед. пром. СССР, № 6, 25 (1949).
298. S с h i f f e r 1 i E., Folia Med. (Naples), 32, 562 (1949).
299. Teinissen P. H., Anal. Chem., 21, 620 (1949).
300. Tom ft ek O., Dolezal J., Chem. Listy, 43, 193 (1949).
301. Tomicek O., Zyka J., Casopis teskeho Lfekarnictva, 62, 49 (1949).
302. Wankmuller A., Pharmazie, 4, 510 (1949).
303. Z e t h e 1 i u s P. S., Rev. colomb, quim., 3, No. 1, 5 (1949)
317
304. Albertson С. E., Macgregor I. R., Anal. Chem., 22, 806 (1950).
305. Benham G. FI., Klee L., J. Am. Oil Chemists' Soc., 27, 127 (1950).
306. Cohen S. G„ Haas FL C„ J. Am. Chem. Soc., 72, 3954 (1950).
307. С о p p i n i D., Costa E., Farm. sci. e tec. (Pavia), 5, 411 (1950).
308. Esch inazi H. E., Bergmann E. D., J. Am. Chem. Soc., 72, 5651 (1950).
309. J ur etek M., Chem. Listy, 44, 134 (1950).
310. Klee L., Benham G. H., J. Am. Oil Chemists' Soc., 27, 130 (1950).
311. M i 11 e r S. A., Pearman F. H., Analyst, 75, 492 (1950).
312. N a i dus E. S., Meu 1 ler M. B., J. Am. Chem. Soc., 72, 1829 (1950).
313. Pearson R. G., Dillon R. L., J. Am. Chem. Soc., 72, 3574 (1950).
314. P о t n e r P. C., Anal. Chem., 22, 570 (1950).
315. Ray N., Indian Pharm., 5, 148 (1950).
316. Reckendorfer P., Pflanzenschutzber, 5, 287 (1950).
317. Schulek E., Bayer I., Acta Pharm. Intern., 1, 177 (1950).
318. Schulek E., R 6 z s a P., Acta Pharm. Intern., 1, 127 (1950).
319. Wilson G. E., J. Inst. Petroleum, 36, 25 (1950).
320. Aasness FL, Medd. Norsk Farm. Selskap, 12, 115, 125, 139 (1951); 13, 2 (1951).
321. Bar D., Bull. soc. pharm., Lille, No. 1, 29 (1951).
322. Bradbury R. B., Mikrochemie ver. Mikrochim. Acta, 38, 114 (1951).
323. D u p i n S., Bull, mens ITERG, 5, 469 (19511.
324. Duyckaerts G., Pitance T., Sbornix Mezinarod. Polorograf. Sjezdu v Praze, 1st Congress Pt. 1, 51 (1951).
325. Goldenson J., Sass S., Anal. Chem., 23, 1170 (1951).
326. J a m i n e t F., Compt. rend. 1. Symposium intern, controle specialite tes pharm., Brussels, 325 (1951).
327. Ludes H., Z. ges. exptl. Med., 118, 1 (1951).
328. Pearson R. G., Sandy A. C., J. Am. Chem. Soc., 73, 931 (1951).
329. Pulido-Cuchi F., Hernandez-Gutierrez' F., Anales real soc. espan., fis. у quim., 47B, 351 (1951).
330. Рутовск и й Б. FL, Шур А. М., Ж. прикл. химии, 24, 1074 (1951).
331. S a n d г i G., Ann. chim. (Rome), 41, 135 (1951).
332. Bontemps R., J. pharm. Belg., 7, 553 (1952).
333. Buck R. P., Swift E. FL, Anal. Chem., 24, 499 (1952).
334. С о p p i n i D., Cameroni R., Monzani A., Ricerca sci., 22, 1783 (1952).
335. Costa E., G r a s s i G., Boll. chim. farm., 91, 227 (1952).
336. Duke J. A., M a s e 1 1 i J. A., J. Am. Oil Chemists'Soc., 29, 126 (1952).
337. Gorbach G., Rohner K., Mikrochemie ver. Microchim. Acta, 39, 299 (1952).
338. FI a u g a s E. A., Mitchell B. W., J. Pharm. Pharmacol., 4, 687 (1952).
339. J о u s 1 i n D., Chim. anal., 34, 34 (1952).
340. Kalinowski K-> Farm. Polska, 8, 408 (1952).
341. McCul lough R. L„ Stone K. G., Anal. Chem., 24, 1206 (1952).
342. Matta G., Nunes M. L., Anais azevedos (Lisbon), 4, 161 (1952).
343. Neelakantam K-, Viswanath G., Proc. Indian Acad. Sci., 35A, 72 (1952).
344. Paris R. A., Vial J., Chim. anal., 34, 3 (1952).
345. Phillips J. P., Emery J. F., Price H. P., Anal. Chem., 24, 1033 (1952).
346. Robey R. F., FI u d s о n В. E., Wiese FL K-, Anal. Chem., 24, 1080 (1952).
347. Rosenmund K. W., G r a n d j e a n FL H., Erdol u Kohle, 5, 348 (1952).
348. Tyler W. P., В e e s i n g D. W., Anal. Chem., 24, 1511 (1952).
349. В о k a d i a M. M., Agra Univ. J. Research., 2, Pt. I, 9 (1953).
318
450. Fen ec h G., Tommasine A., Boll. chim. farm., 92, 327 (1953).
451 Horn D., Pharmazie, 8, 646 (1953).
452 Houff W. H., Schuetz R. D., Anal. Chem., 25, 1258 (1953).
353. К a m a t h N. R., Oils and Oilseeds J. (India), 5, No. 10/12, 82 (1953).
354^ Ramer J. H. van de, Scand. J. Clin, and Lab. Invest., 5, 30 (1953).
355^ Канторович С. А., Алегина О. H., Бюллетень обмена опытом в лакокрасочной пром., № 4, 70 (1953).
356. Lips Н. J., J. Am. Oil Chemists'Soc., 30, 399 (1953).
357. L о п g s t a f f J. V. L., Singer K-, Analyst, 78, 491 (1953).
358. Masotti M., Atti accad. sci., Ferrara, 30, 23 (1953).
359. Meissner B., Chem. Tech. (Berlin), 5, 381 (1953).
360. M о d i a n о J., P a r i a u d J. C., Compt. rend., 236, 1897 (1953).
361 Planck R. W., Park F. C., Goldblatt L. A., J. Am. Oil Chemists' Soc., 30, 417 (1953).
362. Rosenmund K. W., Grand jean H. H., Arch. Pharm., 286, 531 (1953).
363. S a n d r i G., L a m b a r d i F., Atti. acad. sci., Ferrara, 30, 27 (1953).
364. Segal W., Starkey R. L., Anal. Chem., 25, 1645 (1953).
365. Szab о les L., Magyar Kem. Folyoirat, 59, 218 (1953).
366. Вайсман Г. А., Аптечное дело, 2, № 6, 25 (1953).
367. Vogt H., Arch. Pharm., 286, 389 (1953).
368. Wheatley V. R., Biochem. J., 55, 637 (1953).
369. Wojahn H., Wempe E., Pharm. Zentralhalle, 92, 124 (1953).
370. A i c h e n e g g P., Haynes H. G., J. Appl. Chem., 4, 137 (1954).
371. Г альперн Г. Д., Труды ин-та нефти АН СССР, 4, 116 (1954).
372. Гронсберг Е. С., Гигиена и санитария, № 11, 43 (1954).
373. Гвоздик В. А., Троценко М. А., Потапова В. П., Аптечное дело, 3, № 3, 33 (1954).
374. Kaufmann Н. Р., Arends W., Arch. Pharm., 287, 590 (1954).
375. Kawamura F., Momoki K-, Suzuki S., Bunseki Kagaku (Japan) Analyst), 3, 29 (1954).
376. Mod ian о J., P a r i a u d J. C., Bull. soc. chim. France 189 (1954).
377. О r 1 о w s k i M., Simon J., Acta Biochim. Polon., 1, 231(1954).
378. Rastelli A., Chimica (Milan), 9, 75 (1954).
379. Reid V. W., Beddard J. D., Analyst, 79, 456 (1954).
380. P у ж e н ц e в а А. К., Горячева H. С., Аптечное дело, 3, № 5, 7 (1954).
381. Steyermark A., Loeschauer E. E., J. Assoc. Offic. Agr. Chem., 37, 433 (1954).
382. T a m a t e E., К i n о s h i t a S., J. Chem. Soc., Japan, Ind. Chem., Sect. 57, 322, 922 (1954).
383. Z у k a J., Pharmazie, 9, 812 (1954).
384. Belcher R., Fildes J. E., N u 11 e n A. J., Anal. Chim. Acta, 13, 16 (1955).
385. Ditrych Z., Rejkova H., U I b r i c h V., Chem. Listy, 49, 869 (1955).
386. v. Erichsen L., Rudolphi N., Erdol. u. Kohle, 8, 16 (1955).
387. Ettre L., Heredy L., Kovacs M., Magyar Kem. Lapya, 10, 23 (1955).
388. Grover К. C., Agra Univ. J. Research, 4, 627 (1955).
389. H a d i c k e M , Pharm. Zentralhalle, 94, 384 (1955).
390. Hammond G. S., Parks L. R., J. Am. Chem. Soc., 77, 340 (1955).
391. J о h n s о n L. D., McNabb W. M., Wagner E. C., Anal. Chem., 27, 1494 (1955).
392. Кастерина Т.Н., Федотова E. H., Шевченко О. С., Зав. лаб., 21, 408 (1955).
393. Kochi Z., Yakugaku Zasshi (J. Pharm. Soc. Japan), 75, 748 (1955).
394. Морозов В. А., Гигиена и санитария, № 7, 47 (1955).
395. Rosenthaler L., Pharm. Acta Helv., 30, 69 (1955).
396. S a n d r i G., Il Farmaco (Pavia), Ed. Sci., 10, 444 (1955).
319
397. Schulek E., Burger K-, Magyar Kem. Folyoirat, 61, 359 (195o)
398. S p I i e i h о f f W. L., Hart H., Anal. Chem., 27, 1492 (1955).
399. Steyermark A., J. Assoc. Offic. Agr. Chem., 38, 367 (1955).
400. S у к u t K-, Ann. Univ. Marie Curie—Sklodowska, Lublin, Polonia. Sect AA 10, No. 3, 25 (1955).
401. Sykut K-, Ann. Univ. Marie Curie—Sklodowska, Lublin, Polonia Sect.
AA 10, No. 6, 53 (1955).
402. Varga E., Z о 1 1 n e r E., Acta Pharm. Hung., 25, 150 (1955).
403. Verma M. R., В h u c h a г V. M., J. Sci. Ind. Research (India), 14B, 419 (1955).
404. Bethge P. O., Carlson О. T., Anal. Chim. Acta, 15, 279 (1956).
405. В i t s к e i J., Magyar Kem. Folyoirat, 62, 71 (1956).
406. Byrne R. E., Johnson J. B., Anal. Chem., 28, 126 (1956).
407. Dmowska W., Pech M., Acta Polon. Pharm., 13, 219 (1956).
408. G у e n e s I., Magyar Kem. Folyoirat, 62, 242 (1956)..
409. I о a n i d N., В о r s G., P о p a 1., L о r e n t L., Farmacia (Bucharest) 4, 303 (1956).
410. Котлик Б. E., С м ы с л о в а А. И., Кокс и химия, № 7, 41 (1956).
411. L i n d е Н. W., Anesthesiology, 17, 777 (1956).
412. Lortz Н. J., Anal. Chem., 28, 892 (1956).
413. Рейс H. В., Сборник научи, трудов Самарканд, мед. ин-та, 11, 117 (1956).
414. v. Schantz М., Farm. Aikakauslehti, 65, 265 (1956).
415. Shell Method Series, Designation 221/50, from «Organic Analysis», Vol. 3, Interscience, New York, 1956.
416. S h t e i n d e H., Biul. Inst. Roslin Leczniczych, 2, 160 (1956).
417. Шуб M. E., Василенко А. С., Аптечное дело, 5, № 3, 25 (1956).
418. Smith В., Acta Chem. Scand., 10, 1589 (1956).
419. Спрысков A. A., E p ы к а л о в Ю. Г., Ж- аналит. химии, 11, 492 (1956).
420. СявциллоС. В., Бондаревская Е. А., Ж. аналит. химии, И, 613 (1956).
421. Verma М. R., A g г a w а 1 К. С., Paul S. D., J. Sci. Ind. Research (India), 15B, 589 (1956).
422. Yoshimura C., Kiboku M., Nippon Kagaku Zasshi (J. Chem. Soc., Japan, Pure Chem. Sect.), 77, 1547 (1956).
423. Awe M., Stohlmann H., Arzneimittelforschung, 7, 495 (1957).
424. Belcher R., R h a t ty M. K., West T. S„ J. Chem. Soc. 4480 (1957).
425. Budesinsky В., M ri о u с e k K., J a n c i' k F., Kraus E., Chem. Listy, 51, 1819 (1957).
426. Budesinsky B., Vani’ckova E., Ceskoslov. Farm., 6, 305 (1957).
427. Дьячков Г. С., Гидролизная и лесохим. пром., 10, № 5, 16 (1957).
428. Н е 1 о u J. Н., Anais farm. е. quim. Sao Paulo, 8, 7 (1957).
429. Higgins D. J., Stephenson W. H., Analyst, 82, 435 (1957).
430. Hor sch W., Pharmazie, 12, 124 (1957).
431. J a n c 1 k F., Kraus E., В u d ё s i n s k У В., C inkov aO., Ceskoslov. Farm., 6, 105 (1957).
432. J a n c i k F., В u des in sky В., C inkova O., Ceskoslov. Farm., 6, 108 (1957).
433. К о k о s k i R. J., Allen B. F., Drug Standards, 25, 17 (1957).
434. Marvillet L., Tranchant J., Mem. poudres, 39, 329 (1957).
435. M e 11 z e r H., Nachbrl. deut. Pflanzenschutzdienst (Berlin), 11, 178 (1957).
436. Prat J., Colas A., Chim. anal., 39, 298 (1957).
437. Schulek E., Burger K., Acta Pharnj. Hung., 27, 51 (1957).
438. Smith B., Acta Chem. Scand., 11, 558 (1957).
439. Smith B., Acta Chem. Scand., 11, 839 (1957).
440. Takel F., Murai K., A k a z a m e G., Kogyd Kagaku Zasshi, 60, 1271 (1957).
441. Тимофеева E. А., К л ейм анов а В. М., Добрынина Т. II., Изв. АН СССР, отделение хим. наук, 122 (1957).
320
442 Вайсман Г. А., Бендерская С. Н., Аптечное дело, 6, № 2, 32 (1957).
443. Varga Е., Vastagh G., Pharm. Zentralhalle, 96, 149 (1957).
444 V a s t a g h G., Varga E., Pharm. Zentralhalle, 96, 99 (1957).
445' Verma M. R., Agrawal К. C., Paul S. D., J. Sci. Ind. Research ’ (India), 16B, 213 (1957).
446. Belcher R., Bhatt у M. K-, West T. S., J. Chem. Soc., 2393 (1958).
447. В e t h g e P. O., Svensk Papperstidm, 61, 267 (1958).
448 В e t h g e P. O., Svensk Papperstidm, 61, 565, 856 (1958).
449. Blazek J., Ceskoslov. Farm., 7, 25 (1958).
450. Дьячков Г. С., Гидролизная и лесохим. пром., 11, № 2, 19 (1958).
451. Grover К- С., М е h о t г a R. С., Z. anal. Chem., 166, 267 (1958).
452. I п g b е г m а п А. К., Anal. Chem., 30, 1003 (1958).
453. J a v е s A. R., Liddell C., Anal. Chem., 30, 1570 (1958).
454. Kalinowski K., Piotrowska A., Acta Polon. Pharm., 15, 321 (1958).
455. К о s z e g i D., S a 1 g 6 E., Z. anal. Chem., 164, 320 (1958).
456. Laszlovsky J., Magyar Kem. Folyoirat, 64, 5 (1958).
457. Malatesta P., Lorenzini A., Ricerca sci., 28, 1874 (1958).
458. H ессонов а Г. Д., П о г о с я н ц Е. К., Зав. лаб. 24, 953 (1958).
459. Roth Н„ Mikrochim. Acta 766 (1958).
460. Schulek Е., Burger К-, Z. anal. Chem., 161, 184 (1958).
461. Schulek E., Burger K-, Acta Pharm. Hung., 28, 96 (1958).
462. Schulek E., Burger K., Acta Pharm. Hung., 28, 100 (1958).
463. Schulek E., Burger K-, Taianta, 1, 147 (1958).
464. S z e k e r e s L., Zergenyi-Balazsfalvy M., Molnar L. G.,
Magyar Kem. Folyoirat, 64, 96 (1958).
465. Varga E., Vastagh G., Acta Pharm. Hung., 28, 44 (1958).
466. В e 1 1 e n Z., В el len N., Chem. Anal. (Warsaw), 4, 19 (1959).
467. Berka A., Z^ka J., Ceskoslov. Farm., 8, 17 (1959).
468. В u r g e r K., Schulek E., L’a d a n у i L., Acta Pharm. Hung., 29,
241 (1959).
469. С r i t c h f i e 1 d F. E., Anal. Chem., 31, 1406 (1959).
470. Dege G. J., Harris R. L., Mackenzie J. S., J. Am. Chem. Soc., 18, 3374 (1959).
471. Фаворская И. А., Аувинен E. M., Вестник Ленингр. ун-та, 14, серия физики и химии, № 3, 119 (1959).
472. Jane i k F., Cinkova О., К о г b 1 J., Collection Czechoslov. Chem. Communs., 24, 2695 (1959).
473. Kraft I., Arch. Pharm., 292/64, 306 (1959).
474. Mak ens R. F., Lothringer R. L., Donia R. A., Anal. Chem., 31, 265 (1959).
475. Mlodecka J., Rev. chim. (Bucharest), 10, 343 (1959).
476. Перельман Я. M., Красулина В. Н., Тр. Ленингр. химико-фармацевтического ин-та, № 6, 69 (1959).
477. Руженцева А. К., Т у б и н а И. С., Мед. пром. СССР, 13, Ke 1, 40, (1959).
478. S a g i М., Veszpremi Vegyipari Egyetem Kozlemenyei, 3, 47 (1959).
479. S о d о m k a J., Chem. Prfimysl, 9, 363 (1959).
480. W e h 1 e H., Z. anal. Chem., 169, 241 (1959).
481. В u d e s i n s k У В., Aixnerova M., Ceskoslov. Farm., 9, 312 (1960).
482. Burger K., Schulek E., Taianta, 7, 46 (1960).
483. Burger E., Schulek E., Z. anal. Chem., 172, 98 (1960).
484. Schulek E., Burger K., Ann. Univ. Sci. Budapest Rolando Eotvos
nominatae, Sect. Chim., 2, 145 (1960).
485 Greger К- M., Szmrecsanyi I. V., BodiE. M., Magyar Kem. Lapya, 15, 72 (1960).
486, К 6 s z e g i D., S a 1 g 6 E., Magyar Kem. Folyoirat, 66, 142 (1960).
487. Немировский H. Л., Меерович Г. И., Тр. Ленингр. сан.-гигиен, мед. ин-та, 62, 66 (1960).
11 М. Р. ф. Эшворт
321
488. Ott R„ Raber H„ Sci. Pharm., 28, 206 (1960).
489. Prasad В В.. Das В.. J. Sci. Research Banares Hindu Univ.. 11, 22
490.
491.
492.
493.
494.
495.
496.
497.
498.
499.
500.
501.
502.
503.
504.
505.
(1960—1).
Schulek E., Burger K-, Ann. Univ. Sci. Budapest Rolando Eotvos nominatae, Sect. Chim., 2, 537 (I960).
Уваров E. И., Ваняркина H. M., Зав. лаб., 26, 1097 (1960). «Die Organische Analyse» — Bauer—Moll, 4th Edition, Leipzig, 1960, p. 38. «Die Organische Analyse» — Bauer—Moll, 4th Edition, Leipzig, 1960, p 203.
«Die Organische Analyse» — Bauer—Atoll, 4th Edition, Leipzig, 1960, p. 446.
«Die Organische Analyse» — Bauer—Moll, 4th Edition, Leipzig, 1960, p 571.
«Die Organische Analyse» — Bauer—Moll, 4th Edition, Leipzig, 1960, p. 573.
Bohme H., N eidlein R., Tauber E., Arch. Pharm.. 294, 315 (1961).
Burger K-, Schulek E., Magyar Kem. Folyoirat, 67, 33 (1961) Claeys A., Sion H., Campe A., Bull. soc. chim. Beiges, 70, 455 (1961).
Claeys A., Sion H., Campe A., Thun H., Bull. soc. chim. Beiges, 70, 576 (1961).
Драницкая P. M., Научный ежегодник Одесского гос. ун-та, хим фак., № 2, 70 (1961).
Faure М., Peyrieux R., Bull. trav. soc. pharm., Lyon, 5, 53 (1961). Hamann V., Herrmann A., Mikrochim. Acta 105 (1961).
Korte F., W ii s t e n F., Ann., 647, 18 (1961).
Подуровская О. M., Кутулина Р. А., Ефимова Н. И., Зав. лаб., 27, 403 (1961).
506. Probsthain К-, Z. anal. Chem., 182, 409 (1961).
507. Schulek E., Burger K., Gaizer F., Acta Pharm. Hung., 31, 241 (1961).
508. T а п a у L, Acta Pharm. Hung., 31, 247 (1961).
509. W i sn i ewsk i W., Furmanczyk Z., Acta Polon. Pharm., 18, 415 (1961).
510. Delgado O. A., Rev. fac. ing. quim., Argentina, 30, 85 (1961).
511. Fritz G., Burdt H., Z. anorg. u. allgem. Chem., 317, 35 (1962).
512. Безуглый В. Д., Дмитриева, В. Н., Батовская Т. А.,
Ж. аналит. химии, 17, 169 (1962).
513. Korbl J., Jancik F., Czechoslovak Patent No. 105, 606, Nov. 15, 1962.
514. Korbl J., Jancik F., Czechoslovak Patent No. 105, 608, Nov. 15, 1962.
515. Лебедева А. И., Писаренко E. С., Ж- аналит. химии, 17, 636 (1962).
516. M о n t e q u i R., de Valderrama F., Anales Real Acad. Farm., 28, 133 (1962).
517. S p a g n о 1 о F., Mater. Res. & Stand., 2, 899 (1962).
518. Student J., Uhrova D., Chem. Prumysl, 12, 553 (1962).
519. Tokar G., S о m i п у i L, Magyar Kem. Folyoirat, 68, 338 (1962).
520. Verma R. M., Bose S., J. Indian Chem. Soc., 39, 329 (1962).
521. W г о n sk i M., Chem. Anal. (Warsaw), 7, 1011 (1962).
522. В a 1 1 r e i c h K., Z. anal. Chem., 195, 274 (1963).
523. Barcza L., Burger K-, Magyar Kem. Folyoirat, 69, 178 (1963).
524. В e r a 1 H., Constantinescu, T., Rev. Chim. (Bucharest), 14, 235 (1963).
525. Даровск и x Г. T., Трофимов Г. А., Каучук и резина, 22, 49 (1963).
526. Gupta Р. С., Analyst, 88, 896 (1963).
527. Kertesz Р., Acta Pharm. Hung., 33, 150 (1963).
528. Климова В. А., Забродина К- С., Ж- аналит. химии, 18, 109 (1963).
529. К о у ат а К., Taguchi Y., Е g u с hi S., Bunseki Kagaku, 12, 435 (1963).
530. Л еб ед ей а А. И., Писаренко Е. С., Ж. аналит. химии, 18, 892 (1963).
531. Marz a dr о М., De Carolis A., Mikrochim. Acta 726 (1963).
532. М i d d 1 е t о п К. R., Analyst, 88, 368 (1963).
533. Middleton К. R., Westgarth D. R., Analyst, 88, 544 (1963).
534. M i n t z e r L, Mont zoi L, Z. anal. Chem., 196, 27 (1963).
322
535. Перельман Я. А., Гаврилин Г. Ф., Ж- аналит. химии, 18, 529 11
536 Полянский Н. Г., Ц е х м и с т е р Е. Ф., Ж. аналит. химии, 18, 888 ’ (1963).
537 Raber Н., О t t R., Sci. Pharm., 31, 10 (1963).
538 Schulek E., Maros L., Molnar — Peril., Taianta, 10, 561 (1963).
539. S о b c z a k N., Chem. Anal. (Warsaw) 8, 801 (1963).
540. S о b c z a k N., Chem. Anal. (Warsaw), 8, 613 (1963).
541. S z e k e r e s L., К a r d о s E., Z. anal. Chem., 193, 271 (1963).
542' Tan а у I., Magyar Kem. Folyoirat, 69, 226 (1963).
543. Терентьев А. П., T у б и и а И. С., Ж. аналит. химии, 18, ИЗ (1963).
544. Забродина К. С., Изв. АН СССР, Отд. хим. наук, 941 (1963).
545 Schulek Е., Maros L., Molnar-Perl I., Mikrochim. Acta 336 ' (1964).
17. СОЕДИНЕНИЯ КАДМИЯ
Реагент. В качестве реагентов используют различные соли кадмия: галогениды, сульфат, ацетат, тиоцианат. Применяют также комплексные соединения кадмия с ЭДТА, а также комплексные ионы, содержащие кадмий, например иодиды кадмия [Cdl4]2“.
Реакция и титруемые вещества. 1. Реакции ионного обмена Cd2+ с маркаптидами, типа глутатиона, и [Cdl4] 2“ с органическими катионами, типа четвертичных аммониевых катионов, а также образованных из мепакрина, хинина, риванола и т. д.:
2RS- + Cd2+ (RS)2 Cd
2NR+ + Cdl2-->(NR4)2CdI4
2Б + 2Н+ + Cdl4— [В. Н]2 Cdl4
Продукты этих реакций мало растворимы в воде и поэтому осаждаются в процессе взаимодействия.
2. Образование комплекса с основаниями, например пирамидоном, изониазидом, пиридином, пиперазином и метразолом:
2В - - Cd2+ -j- 2Ап~ [Cd (B)2J (Ап)2
где анионом может быть галоген- или SCN “-ион. В реакциях, протекающих по типу (1), продукты реакции осаждаются.
3. Расщепление С—S-связей в некоторых серосодержащих моле
кулах, которые разрушаются с образованием осадка CdS. Этим ме-
тодом могут быть определены тиомочевина и тиосгмикарбазоны.
Соответствующая обработка и конечная стадия титрования. 1. В большинстве случаев определяют избыток Cd11 в фильтрате титрованием ЭДТА. В одном случае после осаждения определяемого вещества непрореагировавшие SCN~-hohh реагента, состоящего из Cd11 и SCN“, обратно оттитровывают Ag1.
2. Продукты реакции определяют одним из следующих методов:
1) осадок растворяют и Cd11 титруют ЭДТА;
2) осадок CdS обрабатывают смесью кислота—иод, избыток иода
оттитровывают тиосульфатом;
р) органическое соединение, полученное путем взаимодействия Cd , определяют титриметрическим методом; например Cd-произ-
323
Таблица 26. Примеры использования соединений кадмия
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
1 Глутатион CdSO4 и NaOH, (образуется Cd-npo изводное меркап тана) ВгО^“—Вг- — кислота; избыток окислителя оттитровывают иодометрически (см. «Реагенты, содержащие бром», литература 138) 1
2 Меркаптаны в газах Пропускают через смесь CdCl2—NaaCOs НС1 и иод, избыток которого оттитровывают тиосульфатом 2
3 Тиомочевина (см. № 19) в смесях Уксусная кислота, ацетат кадмия; NaOH; нагревают до 80° С и оставляют на 1 ч Уксусная кислота; филь труют; затем добавляют НС1 и иод, избыток которого оттитровывают тиосульфатом 3
4 Цистеин в протеиновых гидролизатах CdSO4 и щелочь (образуется Cd-производное меркаптана) Обрабатывают щелочью; образуется CdS, который растворяют в H2SO4; добавляют иод, избыток которого оттитровывают тиосульфатом через 20 мин 4
5 Пирамидон (см. № 6, 8, 24); изониазид (см. № 7) В воде; Cdl2 или Cd(SCN)2 [обра- зуется осадок комплексного соединения Cd (В)212 или Cd(B)2 (SCN)2, где В — основание] Избыток Cd2+ в фильтрате определяют титрованием ЭДТА в аммиачном буферном растворе (pH 10) в присутствии эриохром черного Т 5
6 Пирамидон (см. № 5) В воде; Cd (SCN)2 в буферном растворе (pH Ю) (образуется комплексное соединение) Как указано выше, — см. № 5 6
7 Изониазид (см. №5); ге кс а метилентетр а-мин В воде; Cd (SCN)2; 10 мин или 2 ч соответственно Как указано выше, — см. № 5 7
8 Пирамидон (см. № 5) в фармацевтических препаратах Кипятят водный раствор; Cd (SCN)2 (получаемый при взаимодействии CdCl2 и NH4SCN); нейтрализуют в присутствии метилового красного едким натром и оставляют на 90—120 мин Как указано выше, — см. Ns 5 8
е Соли четвертичных аммониевых оснований K2CdI4 (образуется комплексное «соединение иодид кадмия) Как указано выше6, — см. № 5 или осадок растворяют и определяют содержание Cd2+ в растворе 9
324
Продолжение
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
10 Пиридин в этаноле CdCl2 в 90% -ном этаноле оставляют на несколько минут [образуется осадок Cd (C5H5N) 2+ С12] Как указано выше, — см. № 9 10
11 Хинин гидрохлорид (см. № 13, 18) В воде; Cdl2—KI; оставляют на 15 мин (образуется осадок комплексного соединения) Как указано выше, — см. № 9 11
12 Тиосемикарбазон никотинового альдегида (см. № 19) в присутствии изониазида В воде; ацетат кадмия и NaOH; кипятят 15 мин (образуется CdS) Осадок отфильтровывают; CdS растворяют в НС1, добавляют иод, избыток которого оттитровывают через 5 мин тиосульфатом 12
13 Хинин (см. № И) K2CdI4 (образуется осадок комплексного соединения) Осадок отфильтровывают и избыток Cd2+ оттитровывают рас- твором ЭДТА 13
14 Пахикарпин KI—Cdl2; 15 мин (образуется осадок комплексного соединения) Осадок отфильтровывают; к фильтрату добавляют аммиачный буферный раствор и избыток Cd2+ оттитровывают ЭДТА в присутствии кислого хромового темно-голубого 14
15 Риванол В воде; Cdl2—KI (образуется осадок комплексного соединения) В фильтрате определяют избыток Cd2+ титрованием ЭДТА в присутствии смеси ксиленоловый оранжевый — гексамин 15
16 Хлорпромазин (см. № 18) (Метод описан иы-ше 16 — см. № 15) 16
17 Метразол (кардизол, лептазол CeH10N4) Смесь вода — изопропанол (2 : 3); CdCl2 — вода — изопропанол; 10 мин (образуется осадок CBH10N4CdCl2.3H2O) Осадок отфильтровывают, растворяют в горячей воде; добавляют аммиачный буферный раствор н Cd2+ оттитровывают ЭДТА в присутствии эриохром черного Т 17
18 Органические основания, например хинин (см. № 11), хлорпромазин (см. № 16), пиперидин бромид, галламинтритиоиодид H2SO4; CdSO4—Na2COs — ЭДТА—KI; 5 мин (образуется осадок Cd2+-комплекса) Осадок отфильтровывают и в фильтрате оттитровывают ЭДТА раствором СаС12 в присутствии метилтимолового голубого 18
325
Продолжение
№ n/n Титруемое вещество Реагент и условия реакции Последующая обработка и конечная стадия титрования Литература
19 Тиомочевина (см. № 3) и некоторые ее производные, подобные ацетилмочевине; 1 иосеми карбазоны никотинового альдегида (см. № 12) или п-ацетамидобензаль-дегида В разбавленном растворе NaOH и гидразина; CdSO4 — Na2CO3 — ЭДТА; нагревают от 30 мин до 3 ч (образуется осадок CdS) Осадок отфильтровы вают; добавляют к фильтрату буферную смесь NH4OH—NHjCI (pH 10) и титруют ЭДТА раствором СаС12, как указано выше 18 — см № 18 /9
20 Мепакрин (атебрин) В воде; K2CdI4 (образуется осадок комплексной соли кадмийиодида) В фильтрате избыток Cd2+ оттитровывают в среде аммиачного буферного раствора ЭДТА в присутствии эриохром черного Т 20
21 Пиперазин В воде; NH4SCN и CdCl2; или CdSO4 10 мин (образуется осадок [Cd (C4H10N2)][SCNJ2) В фильтрате титруют тиоцианат раствором соли серебра (I) 21
22 2-(Фурфурилиден-1-метилэтилиден) гидразид (Ларусан) В среде ацетон — вода; ацетат кадмия (образуется осадок комплексного соединения) Осадок отфильтровы вают; к фильтрату добавляют гексамин и титруют ЭДТА в присутствии ксиленолового оранжевого 22
23 Тофраиил (имипра-мин); Ь1-(3-диметил-аминопропил)-имино-дибензил гидрохлорид В воде; Cdl2—К1 (образуется осадок Cd2+ -производного) Гексамин; титруют избыток Cd2+ в фильтрате ЭДТА в присутствии ксиленолового оранжевого 23 ’
24 Пирамидон (см. № 5) (NH4)2 Cd (SCN)4 -вода; 10 мин Осадок отфильтровывают и растворяют в NH4OH, доводят pH до 10; титруют ЭДТА в при сутствии эриохром черного Т 24
водное глутатиона обрабатывают бромом, избыток которого оттитровывают йодометрически; другие меркаптаны обрабатывают избытком иода, непрореагировавший иод оттитровывают тиосульфатом;
4) ЭДТА, выделяющуюся из соединения Cd11—ЭДТА, оттитровывают солями кальция.
ЛИТЕРАТУРА
1. Н a t n е г F., S с h 1 е i s s Е., Mikrochemie, 20, 163 (1936).
2. Hakewill H., Rueck E. M., Proc. Am. Gas Assoc., 28, 529 (1946).
3. Коринфский А. А., Зав. лаб., 12, 418 (1946).
4. Ghiglione С., В ozz i-T ich a d ou M., Bull, soc chim. biol., 36, 659 (1954).
5. Budesinsky B., Pharmazie, 10, 597 (1955).
326
6 в u d ё s i n sky B., Ceskoslov. Farm., 4, 71 (1955).
7 Budesinsky
8 . G г о e b e 1 W.,
9 . В u d ii i n s к ”
10 C a s t i g j о и i --- , , ,
11 Зайцев В. А., Аптечное дело, 6, № 4, 48 (1957).
io Budesinsky В., VachekJ. Ceskoslov. Farm., 7, 241 (1958).
13Chou Y.—Y„ Hsu J.—Ch., Yao Hsueh Hsueh Pao (Acta Pharm. Sinica), ’ 6, 7 (1958).
14. 3 а й ц e в В. А., Аптечное дело, 7, № 5, 78 (1958).
15. P r z у b о г о w s к i ' * " ' ” /,nen'
16 Przyborowski
59 (1959).
17. A n d e r s s о п E.,
В., Ceskoslov. Farm., 4, 181 (1955).
Schneider E., Z. anal. Chem., 146, 191 (1955).
B, Vanickova E., Chem. listy, 50, 1241 (1956).
Л , Z. anal. Chem., 156, 426 (1957).
L., Acta Polon. Pharm., 16, 31 (1959).
L„ К r owczy li sk i L., Chem. Anal. (Warsaw), 4,
F о r s M., Lindgren J. E., Acta Chem. Scand., 14,
1957 (1960).
18 Budesinsky B., Korbl J., Collection Czechoslow. Chem. Communs., 25, 76 (1960).
19. Budesinsky В., V a n i t к о v a E., Korbl J., Collection Czechoslov. Chem. Communs, 25, 456 (1960).
20. C h о u Y. Y., Ch'eng Ch.—L., H s u J. Ch., Yao Hsueh Hshueh Pao (Acta Pharm. Sinica), 8, 61 (1960).
21. Grecu I., Farmacia (Bucharest), 8, 261 (1960); Rev. chim. (Bucharest), 11, 714 (1960).
22. К о м a p и ц к а я И. Д., Фарм. журнал (Киев), 16, № 6, 31 (1961).
23. Domagalina Е., Przyborowski L., Chem. Anal. (Warsaw), 7, 1153 (1962).
24. V a s i 1 i e v R., S c i n t e e V., Chialda I., Sisman E., F r u eh -ter J., J ecu M., Rev. Chim. (Bucharest), 13, 759 (1962).
18. СОЕДИНЕНИЯ КАЛЬЦИЯ
Реагент. Почти во всех случаях в качестве реагента применяют ацетат или хлорид кальция, кроме того, применяют также нерастворимые соли (карбонат) и гидроокись кальция (см. ниже).
Реакции и титруемые вещества. Все определения основаны на реакциях ионного обмена или замещения водорода, сопровождающихся образованием солей кальция или соответствующих производных. Во всех известных случаях (кроме одного) карбоксильные группы определяют непосредственно, также определяют, например, крезолы:
2RCOO- + Са2+ (RCOO)2 Са
2RCOOH + Са2+ (RCOO)2 Са + 2Н+
2АгОН + Са2+ (АгО)2 Са + 2Н+
Наиболее часто встречаются два определения: определение оксалатов и щавелевой кислоты путем осаждения в виде оксалата кальция и определение карбоксильных групп в окисленной целлюлозе путем замещения Н1 -ионов и образования солей кальция. На два этих метода и естся ного ссылок в медицинской и технической (целлюлозно-бумажная промышленность) литературе, некоторые выборочные работы приведены в табл. 27.
327
Таблица 27 Примеры использования соединений кальция
№ п/п Титруемое вещество Реагент и условия реакции Последующая обработка и конечная стадия титрования Литература
1 Оксалат (см. № 8, 9, 13, 14, 22, 24, 25), образующийся при определении лактата в процессе нагревания его с МпО4 — кон Избыток Мг.О^ восстанавливают Н2О2, добавляют уксусную кислоту и ацетат кальция (образуется осадок оксалата кальция) Осадок отфильтровывают, добавляют H2SO4 и титруют перманганатом 1
2 Левулиновая кислота СаСО3 (образуется кальциевая соль) К осадку добавляют избыток иода в щелочной среде, который обратно оттитровывают в нейтральной среде тиосульфатом (см. «Реагенты, содержащие иод», литература 27)
3 d-Виниая кислота (см № 4) Избыток 1-тартрата и ацетата кальция (образуется осадок рацемата кальция) Образовавшийся оса док титруют перман ганатом 3, 5
4 d-Винная кислота (см. № 3) (Критикуется метод, описанный выше ь, — см. № 3) 4
5 Щавелевая кислота (см № 7, 12, 16, 29, 32, 34, 37, 38), образующаяся при определении пропионовой кислоты окислением перманганатом в щелочной среде Са2+ (образуется осадок оксалата кальция) Образующийся осадок титруют перманганатом (см. «Перманганат калия», литература 42) 6
6 Молочная кислота (см. № 22) Уксуснокислый раствор ацетата кальция (образуется осадок лактата кальция) Титруют перманганатом 7
7 Щавелевая кислота (см.-№ 5) в депротеинизированной крови СаС12; 30—60 мин Осадок отцентрифу-говывают, растворяют в H2SO4 и титруют перманганатом 8
8 Оксалат (см. № 1) в депротеинизированной моче Ацетат натрия и СаС12; 12 ч при 0° С Образовавшийся осадок растворяют в H2SO4; добавляют MnSO4 и избыток МпО^; через 3 мин добавляют 1“ -ионы и выделившийся 12 оттитровывают тиосульфатом (см «Перманганат калия», литература 50)
328
Продолжение
№ п/п Титруемое вещество Реагент и условия реакции Последующая обработка н конечная стадия титрования Литература
9 10 11 12 13 14 15 Оксалат (см. № 1) в ра стительных тканях Полисахариды, искусственный шелк и т. п. — определение содержания карбоксильных групп (см. № 15, 19, 27, 39) Крезолы Щавелевая кислота (см. Ks 5) в моче Оксалат (см. Ks 1) в моче Оксалат (см. Ks 1) Целлюлоза (см. Ks 18, 19, 21, 31, 35), окисленная NO2 — определение карбоксильных групп (см. Ks 10) Экстракт; разбавлен ная СН3СООН и СаС12; кипятят 3 мин, затем оставляют на 12—16 ч при комнатной температуре Ацетат кальция; 30 мин Са (ОН)2 и СаСО8; встряхивают 1 ч и оставляют на ночь Щавелевая кислота, ацетат натрия и ацетат кальция; оставляют на ночь Разбавленный раствор NaOH; СаС12; 1 ч при комнатной температуре Ацетатный буферный раствор (pH 5,6) и ацетат кальция; не менее 2 ч Ацетат кальция; 2 « при 25° С (Видоизменение мето, те и, — с Осадок растворяют в H2SO4 и титруют перманганатом Фильтрат титруют NaOH в присутствии фенолфталеина В фильтрат добавляют NH4C1 и оксалат; образуется оксалат кальция, который растворяют в H2SO4 и титруют перманганатом (см «Карбоновые кислоты и карбоксилаты», литература 13) К осадку добавляют H2SO4, избыток МпО^" и I-; выде лившийся иод оттитровывают тиосульфатом Осадок отцентрифу говывают, добавля ют к нему H2SO4, MnSO4 и избыток МпО^-; через 3 мин добавляют 1“ -ионы и выделившийся 12 оттитровывают тиосульфатом Осадок отфиль тровывают, растворяют в H2SO4 и ти труют перманганатом Выделившуюся уксусную кислоту оттитровывают NaOH ;а, описанного в рабо м. Ks 10) 10 11 12 13 14 /5 16
329
Продолжение
№ п/п Титруемое вещество Реагент и условия реакции Последующая обработка и конечная стадия титрования Литература
16 Щавелевая кислота (см. № 5) в моче Эфирный экстракт; уксусная кислота и этанол; эфир выпаривают; затем добавляют СаС12; оставляют на ночь Осадок отцентрифу-говывают; добавляют кислоту и МпО^", избыток которого определяют через 8—10 мин иодоме- 17
17 Тартрат (см. № 23) Са2+; 10 ч (образуется осадок тартрата кальция) Осадок отфильтровывают, растворяют в H2SO4 и титруют перманганатом 18
18 Целлюлоза (см. № 15), окисленная СгО3 или гипохлоритом, — определение карбоксильных групп pH не ниже 6,3; ацетат кальция; 24 ч при 25° С (Метод сравнивают с на применении Ag1, если определяемое в своем составе отри гру Титруют щелочью методом, основанным и предпочитают его, соединение содержит цательно заряженные ппы) 19
19 Хлопковые целлюлозы № 15) и оксицеллюлозы — определение карбоксильных групп (см. № 10) pH 6,5—6,7; ацетат кальция; 17 ч Титруют NaOH при pH 8,4—8,6 в присутствии крезолового красного и тимолового голубого 20
20 Аминокислоты и белки — с пределение основных групп Са (NO3)2 и Са (ОН)2; встряхивают 2 ч Фильтрат титруют НС1 21
21 Целлюлоза (см. № 15), окисленная NO2, — определение карбоксильных групп; целлуроно-вая и альгиновая кислоты (Метод, аналогичный описанному выше 16, но титрование проводят с NaOH потенциометрически) 22
22 Оксалат (см. № 1), образующийся при определении молочной кислоты (см. № 6), в процессе нагревания ее с перманганатом в щелочном растворе Са2+ Осадок оксалата кальция растворяют в H2SO4 и титруют МпО4' (см. «Перманганат калия», литература 87) 23
23 d-Тартрат (см. № 17) в виноградном сусле 1-Тартрат аммония и ацетат кальция (образуется рацемат кальция) Осадок отфильтровывают, растворяют в H2SO4 и определяют посредством (см? «Перйодаты и иодная кислота», литература 50). 24
24 Оксалат (см. № 1) в ферментативной среде (микро) pH 4—5,6; ацетат кальция К осадку оксалата кальция добавляют H2SO4 и MnSO4; гитруют перманганатом 25
330
Продолжение
п/п 25 26 27 28 29 30 31 32 33 34 Титруемое вещество Реагент п условия реакции Последующая обработка и конечная стадия титрования Литература
Оксалат (см № I) в свежих растительных материалах Окисленные крахмалы (см. № 27) — определение карбоксильных групп, позволяющее судить о степени окисления Крахмалы (см № 26), окисленные СгО3, — определение карбокси льпых групп (см. № 10) Пектин Щавелевая кислота (см № 5) в кровяной плазме, сыворотке и красных клетках Жирные кислоты (см № 36) в мыльных про дуктах Целлюлозные материалы (см. № 15) — определение карбоксильных групп Омыленные щелочью (NaOH) моноэфиры и хлор-нгидриды щаве левой кислоты (см № 5) Олеат и ол- иновая кислота в жирах и мылах Щавелевая кислота (см. № 5) (малые коли чества) в лактоне паю .-.огептоновой КИС ТОТЫ Солянокислый экстракт; NH4OH и СаС12 оставляют на ночь при 5—7° С Ацетат кальция; 30 мин встряхивают При pH 8,2; ацетат кальция; 24 ч при комнатной температуре Щелочной экстракт; уксусная кислота и СаС12; 10 мин (образуется осадок пектата кальция) Са2+ (образуется осадок оксалата кальция) Водный раствор и избыток СаС12 нагре вают до кипения pH 6,5—7; ацетат кальция Ацетат натрия; к кипящему раствору добавляют СаС12 СаС12—КОН; встряхивают Кипящий раствор; СаС12; оставляют на ночь Осадок отцентри фуговывают, растворяют в H2SOj и титруют перманга патом Свободную уксусную кислоту потенцио метрически огтитро вывают NaOH до pH 8,3 Уксусную кислоту оттитровывают NaOH при pH хо лостого опыта Осадок отфильтровывают, добавляют буферную смесь Na2B4O7—NaOH— Na2S и ЭДТА, избы ток которого оттитровывают СаС12 в присутствии эр ио-хром черного Т Титруют перманганатом Охлаждают, фильтруют; к фильтрату добавляют NaOH и избыток реагента оттитровывают ЭДТА в присутствии мурексида Избыток реагента в фильтрате оттитровывают ЭДТА в присутствии эриохром черного Т Избыток реагента в фильтрате оттитровывают ЭДТА в присутствии эриохром черного Т Избыток Са2+ оттитровывают ЭДТА в присутствии мурексида Осадок отфильтровывают, растворяют в H2SO4 и титруют перманганатом 26 27 28 29 30 31 32 33 34 35
331
П родолжение
№ п/п Титруемое вещество Реагент и условия реакции Последующая обработка и конечная стадия титрования Литература
35 Целлюлозы (см. № 15) — определение карбоксильных групп (Метод, описанный выше 32, — см. № 31) 36
36 Жирные кислоты (см. № 30) в туалетных мылах Водный раствор; избыток СаС12; нагревают до полной коагуляции осадка В фильтрате избыток Са2+ оттитровывают ЭДТА в присутствии хромоген черного 37
37 Лимонная и щавелевая (см. № 5) кислоты в ферментационных смесях Са (ОН)2иСаСО3; pH 8 Осадок растворяют в H2SO4 и определяемые кислоты окисляют Сг2О?~, избыток которого оттитровывают иодометрически; щавелевую кислоту отдельно определяют первое аж дени ем СаС12 и титрованием перманганатом (см. «Бихромат и трехокись хрома», литература 259) ?<$
38 Щавелевая кислота (см. № 5) в шпинате (водный экстракт) Раствор, содержащий ССЦСООН; Na2B4O, и NH4C1; кипятят, добавляют ацетат кальция; 2 мин взбалтывают при температуре кипения Осадок отцентри-фуговывают, растворяют в H2SO4 и титруют перманганатом при 80° С 39
39 Нерастворимые углеродистые материалы — определение карбоксильных групп (см. № 10) Вода; ацетат кальция—вода; нагревают Уксусную кислоту непрерывно отгоняют и титруют NaOH в присутствии о-крезолфталеина 40
К числу соединений, определяемых посредством солей кальция, относятся кислоты винная, молочная, левулиновая, олеиновая, аминокислоты и другие, а также крезолы. Следует отметить, что этим путем определяют оптически активные изомеры винной кислоты. Определение основано на взаимодействии оптического антипода и Са2+, сопровождающемся образованием осадка рацемата кальция.
Условия реакции. В большинстве случаев реакции протекают в водном, почти нейтральном растворе, иногда реагирующую смесь выдерживают продолжительное время для достижения полноты осаждения.
Соответствующая обработка и конечная стадия титрования 1. Титрование (прямое или обратное) избытка Са2+ раствором ЭДТА (после отфильтровывания нерастворимой соли кальция).
2. Титрование кислотой аминогрупп в аминокислотах после превращения последних в соли кальция.
332
3 Определение продуктов реакции.
1) Кислоты, образованной из СООН-групп окисленной целлюлозы, титрованием щелочами.
2)' Осажденных солей кальция поликарбоновых и оксикислот, в особенности оксалата (а также тартрата, цитрата и лактата). Эти определения почти всегда выполняют путем добавления H2SO4, в которой растворяются нерастворимые соли кальция, и последующим прямым или обратным титрованием перманганатом. В одном случае, вместо МпО~, применяют перйодат, и, кроме того, левулинаты определяют, используя смесь щелочь—иод, а цитраты определяют при помощи смеси оксалат—бихромат. При определении крезолов растворимый крезолат кальция осаждают в виде оксалата кальция, а затем титруют, как обычно, перманганатом.
ЛИТЕРА ТУРА
1. Ulzer F„ Seidel H„ Monatsh., 18, 138 (1897).
2 Savare B., Gazz Chim. Ital., 36, 11 344 (1906).
3. Kling A., Arm fals., 4, 186(1911).
4. Francois M, Lormand C., Ann. fals., 16, 602 (1923); Ann. chim anal, chim appl., 5, 33 (1924).
5. Kling A., Lassieur A., Ann. fals., 17, 162 (1924); Ann. chim. anal, chim. appl., 6, 103 (1924).
6. McN air J. B„ J. Am. Chem. Soc., 54, 3249 (1932).
7. H a r t m a n n B. G., H i 1 1 i g F., J. Assoc. Off. Agr. Chem., 16, 435 (1933).
8. Iznmi S., Japan J. Med. Sci. II, Biochem., 2, 195 (1933).
9. Mau ger i S., Z. physiol. Chem , 217, 138 (1933).
10. С о т н и к о в Е. И., ДАН СССР, № 6, 83 (1933А).
Il Liidtke М., Biochem. Z., 268, 372 (1933); Angew. Chem., 48, 650 (1935).
12. Munch W., Z. anal. Chem., 98, 107 (1934).
13. Koch K-, Biochem., Z., 283, 422 (1936).
14. О i k a w a "
15. Pucher
Anal. Ed.,
16. Y a c k e 1
17 P о w e r s
18. T ou r a t i er M., Ann. chim. ___, ___,____
M e e s о о k В., P u r v e s С. В., Paper Trade J., 123, No 18, 35 (1946); Tech.
Assoc. Papers Ser., 29, 508 (1946).
Davidson G. F., N e v e 1 1 T. P., Shirley
G r e t t i e D. P., Science, 106, 277 (1947).
McGee D. A., Fowler W. F., Kenyon
69, 347 (1947).
Hummel V., Listy Cukrovar, 64, 229 (1948);
Poux C., Ann. fals., 42, 439 (1949).
H a 1 1 i w e 1 1 G., Anal. Chem., 22, 1184 (1950).
Baker C. J., Analyst, 77, 340 (1952).
Mattisson M. F_, Legendre K. A., Anal. Chem., 24, 1942 (1952).
Ellington A C Purves С. В Can. J. Chem., 31, 801 (1953).
Holt R., Analyst, 79, 623 (1954).
Grott J. V., Acta Gastro-Enterol. Belg., 18, 772 (1955).
^e.bste,r Ц Robinson A., Analyst, 80, 616 (1955).
Sobue H„ Okubo M., Tappi, 39, 415 (1956).
H e n n a r t C., Merlin E., Anal. Chim. Acta, 17, 534 (1957).
A n t on a с c i M., Chim. e ind (Milan), 42, 375 (1960).
I r a 1 t e r M., Chem Zvesti, 14, 623 (1960).
S., Japan J. Med. Sci. II Biochem., 3, 211 (1937).
G. W., Wakema
13, 244 (1941).
E. C., Kenyon
H. H., L e v a t i
19
20
21
22
23
24
25
26
27.
28.
29.
30.
31.
32.
33
34.
35
n A. J., Vickery H. B., Ind. Eng. Chem.,
W. O., J. Am Chem. Soc., 64, 121 (1942).
n P., J. Biol. Chem., 154, 207 (1944).
anal., 27, 112 (1945).
Inst. Mem., 21, 85 (1947).
W. О., J. Am. Chem. Soc., Chem. Obzor, 23, 42 (1948).
333
36. Samuelson О., Torneli В., Svensk Papperstidn., 64, 198 (1961).
37. Барташевич E И., К о п ы с e в В. А., Маслобойно-жировая пром., 28, № 9, 34 (1962)
38. В art fay J., Varga M., Magyar Kem. Lapya, 17, 430 (1962).
39. К о v a c s A. S., Denker P., Ind. Obst-Gemuseverwert., 47, 250 (1962).
40. F e s t e r J. I., Robinson W. E., Anal. Chem., 36, 1392 (1964).
19. СЕРОУГЛЕРОД
Реагент и условия реакций. Большинство определений, основанных на использовании сероуглерода в качестве реагента, проводят в щелочных растворах (в присутствии гидроокисей щелочных металлов или аммония). Иногда реакции проводят в присутствии соединений никеля (II), в этом случае реакции сопровождаются мгновенным образованием производных никеля (II) (см. ниже).
Реакции, титруемые вещества и соответствующая методика определения. Сероуглерод, очевидно, вступает в 3 типа реакций.
1. Образование дитиокарбамата при определении —NH2 и —NH-rpynn:
RNH2 + CS3 -> RNH—CS—SH
R2NH + CS2 -> R3N— CS—SH
Предложено несколько методов титрования, применимых для определения дитиокарбаматов.
1) Титрование NaOH в присутствии фенол- и тимолфталеина.
2) Образование нерастворимых солей металлов, например:
а) титрование соединениями меди(Н);
б) кулонометрическое титрование соединениями ртути (I) или (И);
в) осаждение в виде солей никеля(П), которые затем определяют путем разложения HNO3 и немедленного титрования ЭДТА или путем введения избытка ЭДТА и последующего титрования избытка реагента солью никеля(Н), или путем превращения в серебряную соль дитиокарбамата и последующего титрования высвободившихся Ni 2+-ионов ЭДТА. Как указано выше, соединения никеля(П) могут входить в состав реагента или быть добавлены при последующей стадии определения.
3) Титрование дитиокарбаматов НС1О4 в неводных растворах.
2. Образование ксантогената в процессе определения первичных и вторичных спиртов. Реакция аналогична той, которая протекает с аминами (см. выше):
ROH + CS2 + ОН’ -> RO—CS—S- ф- Н2О
Реакцию проводят в щелочном растворе, потому что кислоты типа RO—CS—SH неустойчивы и разлагаются в процессе образования.
Ксантогенаты определяют подобно дитиокарбаматам путем осаждения их никелевых солей, которые затем оттитровывают ЭДТА.
334
Таблица 28. Примеры использования сероуглерода
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
1 Диметиламин (см № 4) В воде; NH4OH и CS2; 15 мин при 25° С Титруют CuSQj до тех пор, пока капельная реакция па дитиокарбамат с Си11 не будет отрицатель ной /
2 Дифен и лгу ан и дин CS2—этанол — небольшое количество СаО; кипятят в колбе, снабженной обратным холодильником Выпаривают досуха и титруют SCN~-ионы AgNO3 в присутствии индика-ГГ III тора Fe 2
3 Первичные и вторичные спирты (определение молекулярных весов) Спирт; твердый КОН (нагревают до полного растворения); эфир и CS2 Ксантат калия отфильтровывают и титруют иодом (см. Том 1, «Иод», литература 40) 3
4 Вторичные амины в присутствии первичных и третичных (см. 1, 6, 7, 9, 10, 12) В бензоле или изопентаноле; CSg и NiSO4 Никелевую соль, образующуюся из первичного амина, экстрагируют NaOH— NH4OH; никелевую соль, образующуюся из вторичного амина, разлагают HNO3 или малую навеску ее обрабатывают AgNO3; затем выделившиеся Ni2+-ионы оттитровывают ЭДТА в присутствии мурексида 4
5 Этанол в разбавленном водном растворе CS2; КОН; диоксан; 80—90 мин при 40— 45° С (при этом 73% этанола превращается в ксантат; этот эмпирический фактор используют при расчете содержания спирта) Немного уксусной кислоты; 40 мин через смесь пропускают СО2; затем добавляют ацетат никеля; образуется ксантат никеля; через 10— 15 мин осадок отфильтровывают, растворяют в NH4OH. ионы никеля титруют ЭДТА в присутствии мурексида [см. «Соединения никеля) (II)», лите ратура 2] 5
335
Продолжение
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
6 Монометиламин в присутствии других метиламинов (см. № 4) CS2 и NaOH (образуются дитиокарбаматы) Дитиокарбамат, об разующийся из первичного амина, осаждают из нейтрального раствора ни-келем(П), добавляют ЭДТА, избыток которого оттитровывают NiSO4 в присутствии мурексида [см. «Соединения ни-келя(П)», литература 2] 6
7 Первичные и вторичные амины (см. № 4); вторичные амины определяют после удаления первичных с помощью 2-этилгексальдегида; избыток морфолина (см. № 9) при определении уксусного ангидрида В смеси пиридин — изопропанол—вода (в зависимости от амина); CS2 Титруют NaOH в присутствии фенолфталеина или тимолфталеина (ниже 0° С в присутствии большого количества NH4OH) 7
8 Гексаметилен имин в присутствии гексаметилен-диамииа В воде; CSj — бензол; соль никеля(П) Бензоловый раствор встряхивают с AgNO8—NH4OH; выделившиеся Ni2+-ионы оттитровывают ЭДТА в присутствии мурексида [см. «Соединения серебра(1)», литература 152] 8
9 Вторичные амины (см. № 4), например диэтил-, дипропил-, дибутилами-ны, морфолин (см. № 7); также в присутствии первичных аминов после их отделения при помощи салицилового альдегида Ацетон—CS2 (3 : 1); NaClO4H2O; 10 мин в атмосфере азота Дитиокарбамат оттитровывают кулонометрически Hg11 (с ртутным анодом) [см. Том 1, «Соединения ртути(П)», литература 52] 9
10 Первичные и вторичные амины (см. № 4) Фильтрат, получаемый при определении аммиака; н-бутанол, пиридин; нейтрализуют NaOH; CS2 Титруют NaOH потенциометр ически 10
336
П родолжение
П/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Л ите-рату-ра
11 Пиперазин; N-окси-этилпиперидин и N-ди-оксиэтилпиперидин В СНС13; CS2; нагревают 40—80 мин в колбе, снабженной обратным холодильником (Реакция протекает с первыми двумя аминами) Осадки дитиокарбаматов растворяют в ацетонитриле и титруют НС1О4 в присутствии кристаллического фиолетового; третье основание (не реагирующее с CSJ титруют в фильтрате 11
12 Высшие алифатические амины (первичные и вторичные) (см. № 4) CS2—СНС13 — изопропанол Титруют NaOH в присутствии фенолфталеина 12
Кроме того, применяют йодометрическое титрование, основанное
на окислении ксантогената иодом:
2RO—CS—S- 4-12 -» (RO—CS—S—)2 + 21"
(сМ. «Реагенты, содержащие иод» в этом томе и в томе I).
3. Замещение = NH-групп атомами S в процессе определения производных гуанидина (дифенилгуанидина):
C6H5NH—С—NHC6H5 + CS2 -> CfiHjNH—С—NHC6HS + HSCN
II II
NH S
Определение завершается титрованием SCN -ионов солями се-ребра(1) в присутствии соединений железа(Ш) как индикатора.
ЛИТЕРА ТУРА
1.
2.
3.
4.
5.
6.
7.
8.
9.
10. И
12.
Катчер Э., Ворошилова М., Анилинокрасочная пром., 4, 39 (1934). гч1 *? У т К о j i m а К., Аое I., Ebe Т., N a g a i I., Researches Lab' (T°kyo) N° 385: see also J' Soc' Rubber Ind. (Japan), 8, 328
Whitmore W. F., Lieber E., Ind. Eng. Chem., Anal. Ed., 7, 127 (1935).
Nebbia L Guerrieri F., Chim. e Ind. (Milan), 35, 896 (1953).
Ar'kawa Y., Kato T., Tech. Reports Tohoku Univ., 19, 104 (1954)-as0 Arilrawa Y., Bunseki Kagaku (Japan Analyst), 4, 94 (1955).
N ebb i a L. Gu er r i e r i F., Chim. e Ind. (Milan), 37, 198 (1955).
ЫК1,С- ‘i r F.E., Johnson J. B., Anal. Chem., 28, 430 (1956).
Nebbia L., Guerrieri F„ Chim. e Ind. (Milan), 39, 672 (1957).
Pr zy b у low ic z E. p., Rogers L. B., Anal. Chim. Acta, 18,596 (1958).
To denpN? ?,e> enc ZA’ -^naL (Warsaw), 6, 63 (1961).
rat 67 У180 (1961) 3 8 F ’ B ° b a k T’’ G У e n e s I., Magyar Kem. Folyoi-
Oktawiec C., Prace Inst. Hutn., 14, 203 (1962).
337
20. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
Реагент. В качестве реагента главным образом применяют формальдегид, иногда используют и другие альдегиды, подобные бензальдегиду и салициловому альдегиду. Известны примеры использования также димедона и 2,4-пентандиона.
Реакции и титруемые вещества. Все методы титрования основаны на использовании реакций конденсации.
1. Конденсация карбонильных групп реагента с ИН2-группами первичных аминов, аминокислот и родственных им соединений или гидразинов:
RNH2 + ArCHO -> ArCH=NR + Н2О
RNH2 + СН3СОСН2СОСН3 -> СН3С (=NR) СН2СОСН3
СН3С (=NR) СН=ССН3 + Н2О I ОН
НООС—X—NH2 + НСНО -* НООС—X—N=CH2 + Н2О
В случае определения карбазола наблюдается конденсация с СН-группами бензольного кольца, возможно также дополнительное введение оксиметильной группы.
Последняя реакция используется в так называемом титровании ам! нокислот по Серенсену, широко описанном в медицинских, биохимических, сельскохозяйственных и других специальных источниках литературы. В данном разделе приведено лишь небольшое число примеров этого способа титрования.
2. Конденсация активных =СН2-групп реагента (димедона) с альдегидами, сопровождающаяся образованием слаборастворимых продуктов:
/СН2—СО.
2(СН3)2С< >СН2 + RCHO-*
ХСН2—COZ
,СН2—СО.
|сн,)-с<сн -сс>
CHR + Н2О
Этим путем определяют формальдегид и ацетальдегид.
Условия реакции. Как правило, аминокислоты определяют в водных растворах, а первичные амины — в среде органических растворителей. Большинство реакций протекает весьма быстро.
Соответствующая обработка и конечная стадия титрования. Можно отметить три способа определения.
1. Обратное титрование избытка реагента (димедона, пентадиона-2,4 и салицилового альдегида) с использованием для этой цели стандартных растворов щелочи или алкоксида.
2. Определение непрореагировавших функциональных групп или соединений. Это наиболее широко используемая конечная стадия титрования; имеется два типа определения такого рода.
338
Таблица 29. Примеры использования карбонильных соединений
№ Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
1 2 3 4 5 6 7 8 9 10 Аминокислоты (см. № 2, 3—5, 7, 8, 10, Н, 23, 25, 26, 31) Аминокислоты (см. № 1) Аминокислоты (см. № 1), например цистеин или гиппуровая кислота Аминокислоты (см. № 1) Аминокислоты (см. Ns 1) в гидролизатах протеина Муравьиный альдегид; ацетальдегид Аминокислоты (см. Ns 1) в продуктах сахарной промышленности Аминокислоты (см. Ns 1), например глицин (см. Ns 17), dl-аланин (см. Ns 31) Карбазол Аминокислоты (см. Ns 1) НСНО—50% -ный этанол при pH 9—9,5; избыток Ва (ОН)2 Раствор нейтрализуют по лакмусу; нейтральный НСНО Избыток NaOH; НСНО Раствор нейтрализуют по нейтральному красному; НСНО Нейтральный спиртовый раствор; НСНО Избыток димедона; 12 ч при 50° С, затем 12—16 ч при комнатной температуре (образуется осадок продукта конденсации) Нейтральный раствор; НСНО В воде; НСНО (предварительно обработанный MgCOg для нейтрализации муравьиной кислоты) Кипятят 20 мин в колбе, снабженной обратным холодильником, с НСНО— К2СО3 (образуется осадок N-оксиметилпроиз-водного) (Метод описан вь НС1; титруют Ва (ОН)» в присутствии фенол- или тимолфталеина Титруют NaOH в присутствии раствора-свидетеля Титруют НС1 Титруют NaOH до pH 8,5 (фенолфталеин) Титруют NaOH в в присутствии фенолфталеина 1) Фильтруют; избыток димедона оттитровывают щелочью; 2) осадок растворяют в этаноле и титруют NaOH в присутствии фенолфталеина; 3) избыток реагента вместе с НСНО оттитровывают щелочью Тнтруют NaOH до pH 9 Титруют NaOH потенциометрически Осадок отфильтровывают, нагревают с водой с целью выделения свободного НСНО, определяемого затем щелочно-пероксидным методом (см. «Перекись водорода», литература 11) ше 1 — см. № 1) 1 2 3 4 5 6 7 8 9 10
339
Продолжение
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Лите-рату. ра
11 Аминокислоты (см № 1); пептоны Нейтрализуют по бромфеноловому голубому, затем добавляют НСНО, нейтрализованный по фенолфталеину Титруют щелочью в присутствии фенолфталеина 11
12 Первичные амины (см. № 13—15, 19, 20, 22, 23, 33) В безводном пиридине; бензальдегид; 30 мин при 60° С NaCN—HCN— пиридин для того, чтобы разложить избыток альдегида, через 45 мин выделившуюся воду от титровывают реактивом Фишера 12
13 Первичные амины (см. № 12) в смеси с вторичными и третичными Салициловый альдегид—метанол; 30 мин при комнатной температуре Нереагирующие с альдегидом вторичные и третичные амины титрую г изопропаноловым раствором НС1 потенциометрически 13 1
14 Соли некоторых синтетических аминов, (см. № 12), например эфедрин гидрохлорид, синеф-рин тартрат (Принцип метода описан выше 1 — см. № 1) 14
15 Первичные амины (см. № 12) в смеси с вторичными и третичными В среде изопропанол—этиленгликоль; салициловый альдегид; 30 мин при комнатной температуре Нереагирующие с альдегидом вторичные и третичные амины титруют раствором НС1 в смеси изопропанол—этиленгликоль потенциометрически (см Том I, «Хлористоводородная кислота», литература 25) 15
16 Аминный азот в гидролизатах протеина При pH 6; НСНО при pH 7,5 Титруют NaOH до pH 9 16
17 Глицин (см. № 8); гистидин гидрохлорид (см. № 21) Нейтральный НСНО Титруют NaOH до pH 9,4 потенциометрически 17
18 Этилендиамин Раствор нейтрализуют по метиловому оранжевому; НСНО; 10 мин при комнатной температуре Титруют NaOH 18
340
Продолжение
№ п/п 19 20 21 22 23 24 Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
Первичные, вторичные и третичные амины (см. № 12) в смеси Алифатические первичные амины (см. № 12) Гистидин гидрохлорид (см. № 17) Смесь первичных, вторичных и третичных аминов (см. № 12) Первичные алифатические амины (см. № 12) [включая аминокислоты (см. № 1), аминоспирты и алкиленамины} Формальдегид в присутствии полимеров 2-Этил гексал ьдегид (в некоторых случаях добавляют изопропанол); 5 мин при комнатной температуре (первичные амины превращаются в основания Шиффа) Салициловый альдегид—пиридин; 15 мин при комнатной температуре В воде; НСНО СНС13; салициловый альдегид; 15 мин при комнатной температуре Пентандион-2,4— пиридин; 15 мин— 2 ч при нагревании до 98° С или при комнатной температуре Ацетатный буферный раствор; pH 4,6; димедон—вода; 3 ч при комнатной температуре (образуется осадок продукта конденсации) Пиридин—вода—изопропанол; добавляют CS2 при —10° С, вторичные амины превращаются в ди-тиокарбаминовые кислоты, которые оттитровывают в присутствии фенолфталеина (см. «Сероуглерод», литература 7) Избыток альдегида оттитровывают раствором CH3ONa в смеси метанол— пиридин в присутствии фенол- или тимолфталеина (см. Том I, «Алкоголяты», литература 66) Титруют NaOH в присутствии фенолфталеина Вторичные и третичные амины титруют диоксановым раствором НС1О4 в присутствии бромкрезолового зеленого; добавляют конго красное и титруют основания Шиффа, полученные из первичных аминов, хлорной кислотой (см. Том I, «Хлорная кислота», литература 167) Избыток диона оттитровывают раствором CH3ONa в смеси метанол—пиридин в присутствии тимолфталеина (см. «Алкоголяты», литература 78) Осадок растворяют в этаноле и титруют NaOH в присутствии фенолфталеина или потенциометрически 19 20 21 22 23 24, 26
341
П родолжение
№ п/п
25
26
27
28
29
30
31
32
33
342
Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
Аминокислоты (см. № 1), образуемые при кислотном гидролизе полиамидов, например полиаминоундекановой кислоты Нейтрализованный раствор; НСНО Титруют КОН 25
Аминокислота (см. № 1), образуемая при кислотном гидролизе D-панто-тенола Нейтрализованный раствор; НСНО Титруют NaOH 27
Апельсиновый сок — определение формальдегидного числа При pH 8; НСНО при pH 8 Титруют NaOH до pH 8 28 |
Смеси гексаметилендиамина и гексамети-ленимина В спирте, содержащем воду; салициловый альдегид Нереагирующий с альдегидом имин титруют НС1 29
Протеины в сыре после нагревания с NaOH При pH 8—8,5; НСНО при том же значении pH Титруют NaOH электрометрически 30
Смеси гидразина, 1,1-диметил гидразина и диэтилентриамина В метаноле; салициловый альдегид (образуется азнн, диме-тилгидразон и анил) или в уксусной кислоте; салициловый альдегид (образуются те же продукты) (В уксусной кислоте определяемых Вторичные —NH-группы в аниле оттитровывают кислотой Титруют кислотой гидразон и все группы анпла, содержащие азот титруют также сумму компонентов) 31
Аминокислоты (см. № 1) в вине; например аланины (см. № 8), фенилаланин, лизин, пролин, тирозин е-Аминокапроновая кислота в ее лактаме (см. № 34) ВаС12; NaOH до pH 9 (по фенолфталеину); НСНО Немедленно титруют NaOH до ярко-красного окрашивания, затем НС1 до обесцвечивания 32
В воде; нейтрали-З'тот по фенолфталеину; НСНО; 10 мин NaOH; титруют НС1 в присутствии фенолфталеина 33
Смеси первичных, вторичных и третичных аминов (см. № 12) Аликвотная часть уксуснокислого раствора; ацетат ртути (II) и салициловый альдегид; 1 ч при 80—90° С (Метод сочетают с ти1 жимого кислотой и тр ацетилирования сме ангид Ацетон, вторичные и третичные амины титруют уксуснокислым раствором НС1О4 потенциометрически рованием всего содер-етичных аминов после :и аминов уксусным зидом) 34
Продолжение
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
34 s-Ам инока проновая кислота (см. № 32), образуемая при определении капролактама путем щелочного гидролиза с последующим осаждением ее в виде бариевой соли Раствор нейтрализуют (бариевая соль—НС1); 30%-ный НСНО; 10 мин Титруют NaOH потенциометрически или в присутствии фенолфталеина 35
1) Титрование щелочью —СООН-групп аминокислот после конденсации —NHг-групп с формальдегидом, сопровождающейся образованием азометиновых групп —N=CH2, которые проявляют более слабые основные свойства, чем исходные —NH2-rpynnbi, и поэтому не мешают титрованию щелочью.
2) Титрование нереагирующих вторичных и третичных аминов после конденсации первичных аминов с-основаниями Шиффа. Титрование такого рода обычно проводят неводными растворами НС1 или НС1О4. Примером титрования нереагирующего с НСНО вторичного амина может служить определение, основанное на реакции с CS2 и сопровождающееся образованием дитиокарбаминовой кислоты, которую затем оттитровывают щелочью.
3. Определение различных продуктов реакции, которое включает:
титрование воды реагентом Фишера;
титрование избытка щелочи, использованной для растворения осадков, образуемых димедоном;
титрование кислотой анилов и гидразонов;
отщепление связанного НСНО из продукта реакции с карбазолом и последующего его определения щелочно-пероксидным методом.
ЛИТЕРАТУРА
1. Sorensen S. Р. L., Biochem. Z., 7, 45 (1908); Z. physiol. Chem., 63, 27 (1909); 64, 120 (1910) (with Henriques, V.).
2. К о n i g J., Grossfeld J., Z. Untersuch. Nahr. u. Genussm., 27, 508 (1914).
3. I о d i d i S. L., J. Am. Chem. Soc., 48, 751 (1926).
4. Northrop J. H., J. Gen. Physiol., 9, 767 (1926).
5. D a v i e s W. L., Biochem. J., 21, 815 (1927)
6’ 0929)’® " d e Г D” Ihle C’ Volkholz H„ Z. anal. Chem., 77, 321
7. R iehm H., Z. Wirtschaftsgruppe Zuckerind., 85, 381 (1935).
e. Dunn M. S„ Loshakoff A., J. Biol. Chem., 113, 359 (1936).
«Ильинский M., Рошаль P. Б., ДАН СССР, 17, 117 (1937).
№2Ь 61е(?94П Л L 4 е П С К а я Б‘ Я- Немова С. В., Лаб. практика, 16,
1- uronsseau L., J. pharm. chim. (9), 1, 329 (1941).
343
12. Hawkins W., Smith D. M., Mitchell J., J. Am. Chem. Soc 66 1662 (1944).
13. W agner C. D., Brown R. H., Peters E. D., J. Am. Chem. Soc., 69, 2611 (1947).
14. S t em p el B., Ber., 81. 80 (1948).
15. S i g g i a S., Hanna J. G., Kervensk i I. R., Anal. Chem., 22, 1295 (1950).
16. G a n g u 1 у S. K-, J- Proc. Inst. Chemists (India), 24, 48 (1952).
17. G о 1 s t e i n S. W., Drug Standards, 20, 223 (1952).
18. D e Lorenzi F., Boll. chim. farm., 94, 343 (1955).
19. С r i t c h f i e 1 d F E., Johnson J. B., Anal. Chem., 28, 430 (1956).
20. J о h n s о n J. B., Funk G. L., Anal. Chem., 28, 1977 (1956).
21. X а й т Г. Я-, Аптечное дело, 5, 5, 59 (1956).
22. Critchfield F. E., Johnson J. B., Anal. Chem., 29, 957 (1957).
23. C r i t c h f i e 1 d F. E., Johnson J. B., Anal. Chem., 29, 1174 (1957).
24. В e 1 1 en Z„ Chim. anal., 40, 250 (1958).
25. S c h r 6 d e r E., Plaste u. Kautschuk, 5, 103 (1958).
26. В e 1 1 e n Z., Chem. Anal. (Warsaw), 4, 13 (1959).
27. H e 1 о u J. H., Anais farm, e quim., Sao Paulo, 10, 73 (1959).
28. Intouli R., RamuzinoF. C., Stacchini A., Ind. conserve (Parma), 34, 222 (1959).
29. X у д я к о в а Т. А., Немцева Л. И., Белоусова 3. С., Тр. по химии и хим. технологии (Горький), 4, 772 (1961).
30. А г m а и d о 1 а Р., Latte, 36, 709 (1962).
31. М а 1 о n е Н. Е., Barron R. Е., US Dept. Com. Office Tech. Serv. AD 278, 499 (1962).
32. Пол итов а-Сюзенк о T. К., Виноделие и виноградарство СССР, 22 № 8, 18 (1962).
33. М a j ewsk a J., Chem. Anal. (Warsaw), 8, 589 (1963).
34. Стрепихеев Ю. А., Заликин А. А., Ч им иш к ян А. Л., Ж. анал. хим., 18, 1262 (1963).
35. Ziotkowski Z., Respondek J., Przondo J., Chem. Anal. (Warsaw), 8, 273 (1963).
21. КАРБОНОВЫЕ КИСЛОТЫ И КАРБОКСИЛАТЫ
Реагент. В табл. 30 представлены восемь различных реагентов, относящихся к алифатическим и ароматическим моно- и дикарбоновым кислотам. Наиболее широко применяемыми реагентами являются муравьиная, уксусная и щавелевая кислоты (салициловая кислота рассматривается в разделе «Фенолы», так как ее свойства обусловливаются наличием в составе ее молекулы фенольной группы).
Реакции и титруемые вещества. Титрование основано на использовании разнообразных реакций.
1. Реакции ионного обмена, сопровождающиеся образованием нерастворимых в воде продуктов. Так, анилин, замещенные анилина, меламин и эфедрин определяют осаждением их щавелевой кислотой в виде оксалатов. Этот же реагент оказался пригодным для определения кальциевых солей методом осаждения (метод определения Са 2+ применяют и при анализе некоторых образцов, содержащих кальциевые соли органических соединений). Соли алкилтиомочевины определяют осаждением 3,5-динитробензоатом.
2. Реакции образования сложного эфира, используемые при определении гидроксилсодержащих соединений, особенно низших спиртов, и при анализе эфирных масел. За исключением единствен-344
п примера применения лауриновой кислоты, в таких случаях ппименяют муравьиную и уксусную кислоты. Катализаторами этерификации служат BF3> HaSO4 и n-толуолсульфокислота. Чистую муравьиную кислоту или в смеси с уксусным ангидридом применяют для этерификации в отсутствие катализатора.
3. Реакции присоединения, применяемые обычно для определения олефинов, например камфена, и сопровождающиеся образованием сложного эфира:
I
> С=С < -J- RCOOH -> > СН—С—OCOR
Для этой цели наиболее часто применяют муравьиную и уксусную кислоты, при определении камфена образуется изоборнилфор-миат или ацетат дициклопентадиена — дициклопентенилформиат.
Сюда же может быть отнесен метод определения диазометана, основанный на присоединении бензойной кислоты, сопровождающемся образованием метилового эфира и газообразного азота.
4. Реакция гидратации, например в случае определения уксусного ангидрида и карбодиимида путем взаимодействия их с щавелевой кислотой:
(СН3СО)2 О -J- НООССООН -> 2СН3СООН + СО + С02
RN=C=NR' + НООССООН -» RNH —СО -.\HR'4-CO-(-CO2
5. Реакция восстановления, например в случае определения mpem-бутилгипохлорита щавелевой кислотой:
QHgOCI + НООССООН -> С4Н9ОН + НС1 -( 2СО2
6. Реакция образования рацемата, используемая для определения одного оптического изомера винной кислоты путем добавления другого оптического изомера и осаждения рацемата кальция.
7. Реакции гидролиза, например уротропина, до НСНО и NH3; дитиокарбамата до CS2, новобиоцина до О-карбамоилновиоза; или реакции декарбоксилирования, например аконитовой кислоты.
Условия титрования. Здесь можно сделать лишь несколько общих замечаний. Как упоминалось выше, для протекания реакций типа 2 и 3 обычно требуется присутствие сильнокислотных катализаторов. Температурные условия и время течения реакции варьируют в широких пределах: от нескольких минут при комнатной температуре в случае осаждения до 1 ч и более при повышенной температуре в случае этерификации или декарбоксилирования.
Соответствующая обработка и конечная стадия титрования.
В шести из каждых двенадцати случаев проводят титрование избытка реагента (избыток кислоты оттитровывают щелочью или непрореагировавший анион кислоты — кислотным титрантом) или, как в двух случаях применения в качестве реагента щавелевой кислоты, ее избыток определяют методом оксидиметрии путем окисления перманганатом или солями церия (IV).
345
Таблица 30. Примеры использования карбоновых кислот и карбоксилатов
№ п/п Титруемое вещество PcaieHT и условия титрования Соответствующая обработка и конечная стадия титрования Л >и е-рату-ра
1 n-Толуидин, полученный восстановлением n-нитротолуола при определении его в смеси с другими изомерами нитротолуола В эфире; щавелевая кислота—эфир (образуется осадок аминной соли щавелевой кислоты) Выпавший осадок растворяют в воде и титруют NaOH в присутствии фенолфталеина 1
2 Диазометан в эфирном растворе Бензойная кислота (или м- или п-нитро-бензойная кислота)— эфир; охлаждают, затем нагревают Избыток кислоты оттитровывают Ва (ОН)2 в присутствии фенолфталеина 2
3 d-Винная кислота (см № 4, 20) Избыток 1-тартрата; ацетат кальция (образуется осадок рацемата кальция) Осадок растворяют в горячей H2SO4 и титруют перманганатом 3, 6 8
4 d-Винная кислота (см. № 3) (Критикуется метод, см. описанный выше 3, — № 3) 4
5 Эфирные масла — определение гидроксильных групп (см № 13) Муравьиная кислота—уксусный ангидрид (1 2); 3— 4 дня при комнатной температуре Образующиеся эфиры отделяют и определяют содержание их путем гидролиза избытком КОН (см. «Щелочи», литература 36) 5
6 Метанол, этанол Большой избыток муравьиной кислоты (400—800%); H2SO4 Полученный эфир муравьиной кислоты перегоняют, обрабатывают стандартный раствор щелочи, избыток которой оттитровывают кислотой (см. «Щелочи», литература 43) 7
7 Уксусный ангидрид Избыток безводной щавелевой кислоты; осушенный пиридин; 10 мин при 50° С (выделяются СО и СО2) Вода; избыток кислоты оттитровывают перманганатом 9
8 Камфен (см. № 12, 29, в хвойном масле Уксусная кислота— вода—H2SO4, нагревают (образуется изоборнилацетат) Избыток кислоты оттитровывают кон в прису тствии фенолфталеина; затем титруют кислотой в присутствии тетра-бромсульфонафта-леина 10
9 Цитронеллол (см. № 32) в розовом масле 90% -ная муравьиная кислота; 1 ч при 100° С Избыток кислоты оттитровывают щелочью 11
346
Продолжение
дь
Титруемое вещество
Реагент и условия титрования
Соответствующая обработка и конечная стадия титрования
Литература
Ю n-Хлоранилин, содержащийся в смеси хлор-анилинов, а также образующийся при определении п-нитрохлорбеи-зола после восстановления его цинковой пылью в солянокислой среде
11 Крезоляты кальция, образующиеся при определении крезолов в процессе взаимодействия с СаСО3—Са(ОН)2
12 Камфен (см. № 8)
13 Гидроксильные группы
(см. № 5, 25)
14 Анилин в дифенилани-
лине
Гексаметилентетрамин
16
17
Аконитовая кислота (см. № 17, 18) в продуктах сахарного производства
Аконитовая кислота (см. № 16) в смеси с лимонной кислотой
В эфире; щавелевая кислота—эфир (образуется осадок аминной соли щавелевой кислоты)
Оксалат (образуется осадок оксалата кальция)
Муравьиная кислота— H2SO4; 2,5—
3,5 ч при комнатной температуре (образуется изобор-нилформиат)
В диоксане; уксусная кислота—BF3, 2 ч при 67±2°С
В абсолютном эфире; щавелевая кислота—эфир (образуется осадок оксалата анилина)
Нагревают в колбе, снабженной обратным холодильником, с водным раствором винной кислоты (гексамин гидролизуется с образованием формальдегида) (По методу, № 18; SO
(По методу, описанному ниже 20, — см. № 18; к реагенту добавляют борную кислоту для предотвращения декарбоксилирования лимонной кислоты)
Осадок отфильтровывают, растворяют в горячей воде и титруют броматом
Осадок растворяют в H2SO4 и титруют перманганатом
Насыщают NaCl для того, чтобы высолить эфир, и затем избыток кислоты оттитровывают раствором NaOH, насыщенным NaCl. Холостой опыт
Пиридин; образующуюся воду оттитровывают реактивом Фишера
Осадок растворяют в воде, обрабатывают смесью бромат—бромид, избыток которой оттитровывают иодометрически (см. «Реагенты, содержащие бром», литература 207)
Формальдегид поглощают бисульфитом натрия и би-сульфитное производное формальдегида определяют путем титрования иодом
описанному ниже 20, — см. 2 поглощают сначала раствором бихромата)
12
13
14
15
16
17
18
19
347
Продолжение
№ п/п Титруемое вещество Реагент и условия титрования Соответствующая обработка и конечная стадия титрования Литература
18 Аконитовая кислота (см. № 16); аконитаты Уксусная кислота— ацетат калия (с минимальным содержанием воды); нагревают примерно в течение 1 ч, при этом выделяется СО2 Адсорбируют СО2 избытком NaOH, добавляют ВаС12 и оттитровывают избыток NaOH соляной кислотой в присутствии фенолфталеина 20
19 Дициклопентадиен Избыток НСООН; нагревают в колбе, снабженной обратным холодильником, в течение 5 ч при 135—140° С (образуется дицикло-пентилформиат) Образовавшийся эфир гидролизуют щелочью, избыток которой оттитровывают кислотой (см. «Щелочи», литература 208) 21
20 d-Винная кислота (см. № 3) в виноградном сусле 1-Тартрат аммония; ацетат кальция (образуется осадок рацемата кальция) Осадок отфильтровывают, растворяют в H2SO4 и проводят определение перйодатным методом (см. «Перйодаты и иодная кислота», литература 50) 22
21 Смесь пинен—камфора Уксусная кислота— H2SO4; 10 мин при 50° С Избыток кислоты оттитровывают NaOH в присутствии фенолфталеина. Результаты оценивают по шкале стандартных растворов 23
22 Спирты (см. № 23) Муравьиная кислота—уксусный анги-дрид (1 : 2) Вода; пиридин; затем титруют спиртовым раствором NaOH. Холостой опыт 24
23 Спирты (см. № 22) Избыток лауриновой кислоты; п-то-луолсульфокислота (катализатор); 20 мин при 80° С (для спиртов до С4) или при 100° С Растворяют в этаноле и титруют NaOH в присутствии фенолфталеина; лаурат натрия затем оттитровывают кислотой в присутствии метилового красного 25
24 Меламин В воде; щавелевая кислота—этанол; 30 мин при температуре ниже 4° С; (образуется осадок гемиоксалата) Осадок растворяют в H2SO4 и титруют при 70° С перманганатом 26
25 Гидроксильные группы (см. № 13) Уксусная кислота— H2SO4; 1 ч при 60° С Образующуюся воду оттитровывают реактивом Фишера 27
348
Продолжение.
№ п/п Титруемое вещество Реагент и условия титрования Соответствующая обработка н конечная стадия титрования Литература
26 Пантотенат кальция Горячий водный раствор; NH4OH; оксалат аммония; нагревают и оставляют на 2 ч (образуется оксалат кальция) Осадок растворяют в H2SO4 и затем титруют перманганатом 28
27 йодиды алкилтиомочевины, образующиеся при определении вторичных и третичных спиртов методом переведения их в галогениды реакцией с НС1— ZnCl2 и последующей обработки смесью тиомочевина—KI При pH 5—6 в ацетатной буферной смеси; 3,5-динитро-бензоат натрия— вода; нагревают 2 ч в запаянной ампуле (образуется осадок динитробензоата) Осадок растворяют в этаноле; добавляют цитрат натрия и TiIH, избыток которого затем оттитровывают соединениями Fe111 [см. «Титан (III)», литература 57] 29
28 трет-Б утил гипохлор ит (стандартизация раствора в уксусной кислоте) I Тзбыток оксалата натрия; уксусная кислота; образец встряхивают в течение 1 ч при комнатной температуре (образуется СО2 и mpem-бутитиловый спирт) Вода; НС1 и немного IC1; избыток оксалата титруют CeIV при 50° С в присутствии ферроина 30
29 Камфен (см. № 8) НСООН—H2SO4; 3 мин при комнатной температуре (образуется изобор-нилформиат) Насыщенный раствор NaCl; эфирный слой отделяют, гидролизуют КОН, избыток которого оттитровывают H2SO4 (см. «Щелочи», литература 379) 31
30 Изоборнеол НСООН—H2SO4; 15 мин при комнатной температуре (образуется сложный эфир) Эфирный слой отделяют и титруют NaOH. Холостой опыт
31 Новобиоцин в присутствии изоновобиоцина Безводная трифторуксусная кислота; 2 ч при комнатной температуре в тем- ноте (образуется З-О-карб-амилновиоза) Окисляют иодной кислотой, избыток которой оттитровывают арсенитом (см. «Перйодаты и иодная кислота», литература 97) 32
349
Продолжение
п/п Титруемое вещество Реагент и условия титрования Соответствующая обработка и конечная стадия титрования Литература
32 Цитронеллол (см. № 9) Уксусный ангидрид—муравьиная кислота; 72 ч при 0°С Вода; NaCl; эфир отделяют и гидролизуют избытком КОН 33
33 Аскорбиногены Уксусная кислота 2%-ная; 10 мин при 100° С в атмосфере со2 (образуется аскорбиновая кислота) Титруют реактивом Тильмана 34
34 Карбодиимид Щавелевая кислота—диоксан; нагревают 45 мин в колбе, снабженной обратным холодильником, без доступа воздуха и воды Титруют бензольно-метаноловым раствором CH3ONa в присутствии тимолового голубого 35
35 Этилортоформиат Уксусная кислота (образуется этил-формиат) Добавляют ВгС1, избыток которого оттитровывают иодометрически (см. «Реагенты, содержащие бром», литература 525) 36
2. В других случаях определяют продукты взаимодействия, образующиеся согласно следующим двум уравнениям реакций:
А + X -> АХ (а)
Опреде- Реагент Соль или раце-ляемое мат, или нестой-
вещество кий продукт
присоед и ненн я
Заключение о содержании определяемого вещества в этом случае может быть основано на одном из трех типов определений:
а) определение реагента X, входящего в состав АХ, например, действием щелочи, окислителем, таким, как МпО~ в случае оксалатов, или солями титана (III) в случае 3,5-динитробензоатов;
б) определение компонента А, связанного с X, например анилина или /г-хлоранилина, титрованием броматом; в этом случае метод основан на отделении определяемого компонента при помощи соответствующего реагента;
в) определение рацемата кальция в реакции типа 6 титрованием МпО^ или перйодатом
AyX^ByC+D и т. д.......... (б)
В этом случае наиболее часто продуктом реакции, в процессе которой образуются и (или) рвутся ковалентные связи, является эфир, который определяют омылением после предварительного отде-
350
В табл. 30 приведены также два примера определения, основанных на титровании реактивом Фишера воды, образующейся ^процессе этерификации.
ЛИТЕРАТУРА
, G 1 a s т а п В., Вег., 36, 4260 (1903).
9 Marshall Е. К., Acree S. F., Вег., 43, 2323 (1910).
ч Kline A., Ann fals., 4, 186 (1911).
4 Francois М., Lormand С., Ann. fals., 16, 602 (1923); Ann. chim. anal. chim. appl., 6, 33 (1924).
5 G 1 i c h i t c h L. S., Bull. soc. chim. France (4), 33, 1284 (1923); Compt. rend., ’ 177, 268 (1923).
6 Kling A., Lassieur A., Ann. fals., 17, 162 (1924); Ann. chim. anal. ' chim. appl., 6, 103 (1924).
7. Wimmer J., Z. angew. Chem., 38, 721 (1925).
8. Kling A., Lassieur A., Z. anal. Chem., 68, 471 (1926).
9. ’Rosenbaum С. K., Walton J. K., J. Am. Chem. Soc., 52, 3366 (1930).
10 E з p и e л e в И. M., M а г и д о в а С. С., Пластические массы, № 2—4, 11 (1932).
11 . Glichitch L. S., Naves Y. R., Parfums de France, 11, 154 (1933). |2. Мизух К. Г., Савченко А. Я., Анилинокрасочная пром., 4, 204 (1934). 13. Miinch W., Z. anal. Chem., 98, 107 (1934).
14. Л ю б и м о в В. И., Орг. хим. пром., 6, 167 (1939).
15. В г у а п t W. М. D., Mitchell J., Smith D. М., J. Am. Chem. Soc., 62, 1 (1940).
16. Schretter O., Z. anal. Chem., 122, 24 (1941).
17. P a u 1 a i s R., Bull. sci. pharm., 49, 191 (1942).
18. A m b 1 e r J. A., Roberts E. J., Anal. Chem., 19, 877 (1947).
19. A m b 1 e r J. A., Roberts E. J., Anal. Chem., 19, 879 (1947).
20. Roberts E. J., Ambler J. A., Anal. Chem., 19, 118 (1947).
21. Bergmann F., J a p he H., Anal. Chem., 20, 146 (1948).
22. Poux C., Ann. fals., 42, 439 (1949).
23. Fortunato A. D., Hourqueb ie H., Rep. Argentina Ministerio ind. у com. nacion, Direc. gen. ind. manuf., Inst, technol., Ser. A, No 4, 3 (1950).
24. Sabetay S., Intern. Perfumer, 1, No 2, 11 (1951).
25. Perron R., Petit J., Bull. soc. chim. France 1072 (1952).
26. S t e e 1 J. R., Glover J. H., Hodgson H. W., J. Appl. Chem. (London), 2, 296 (1952).
27. M 1 e j n e k O., Chem. Zvesti, 9, 27 (1955).
28. G r e u 1 i c h J., M e i n e r K., Pharmazie, 12, 643 (1957).
29. J u r e c e k M., C h 1 a d e k O., Chladkova R., Soucek M., S г p о -
v a B„ Chem. Listy, 51, 448 (1957).
30. Van Hall С. E., Stone K. G., Anal. Chem., 30, 1416 (1958).
31. Blaskowicz J., RoczniakowaK., Wantuch S., BukalaM., Chem. Anal. (Warsaw), 4, 719, 725 (1959).
32- Fori st A A., Theal S., S t r u c k W. A., Anal. Chem., 31, 100 (1959).
33. V a n Os F. H. L., de В о e r G. D., Pharm. Weekblad, 95, 735 (1960)
34. Bogdanski K., Czajka G., Chem. Anal. (Warsaw), 7, 1149 (1962).
35. Z a r e m b ° J. E., Watts M. M., Microchem. J. Symp. Ser. 2, 591 (1962).
36. В a r c z a L., Burger K., Magyar Kem. Folyoirat, 69, 178 (1963).
22. СОЕДИНЕНИЯ ЦЕРИЯ (IV)
Реагент. В качестве реагента используют главным образом сульфат церия. Кроме того, для этой же цели применяют также другие соединения церия (IV), перхлорат, сульфатоцерат аммония и диэтилентетрааммоний сульфатоцерат, гексанитратоцерат аммония.
351
Все указанные реагенты применяются в виде кислых и очень кислых водных растворов.
Реакция и титруемые вещества. Соединения церия (IV) отличаются высокими окислительными свойствами:
Се4+ + е -> Се3+
Окисление ими органических веществ большей частью сопровождается образованием двуокиси углерода и воды. Иногда окисление останавливается на промежуточной стадии (см. ниже).
Соединениями церия (IV) окисляются следующие соединения:
1) Поли- и оксикарбоновые кислоты (например, щавелевая, малоновая, гликолевая, винная, яблочная, лимонная). Муравьиная кислота при определенных условиях является стабильным конечным продуктом окисления органических соединений. Молочная кислота окисляется соединениями CeIV до ацетальдегида.
2) Моно- и полиоксисоединения (спирты, гликоли, фенолы, сахара и т. д.) окисляются CeIV до СО2 и муравьиной кислоты.
3) Разнообразные группы и классы органических соединений, включая кетоны и кетокислоты (например, пировиноградная кислота), альдегиды (например, формальдегид), ароматические амины, а также органические вещества в почвах, сточных водах и т. д. (ниже приводится лишь один пример такого рода анализа).
Условия реакций. Реакции протекают, как правило, в кислых, часто горячих, водных растворах. Иногда используются катализаторы:
га, OsO4, Сг1П, Ag1— Мп11, Вг- и I"
для ускорения реакции окисления также применяют облучение анализируемой смеси видимым и ультрафиолетовым светом.
Некоторые бинарные смеси анализируют, используя окисление при различных условиях (без участия и с участием катализатора).
Соответствующая обработка и конечная стадия титрования.
1. Почти во всех случаях определяют избыток реагента, применяя следующие методы.
1) Титрование Ре2+-ионами (обычно сульфат железа Fe11 или соль Мора; известен пример обратного кулонометрического титрования Ре2+-ионами).
2) Титрование оксалатом; в этом случае применяют как прямой, так и обратный методы титрования. В случае обратного метода титрования избыток оксалата оттитровывают перманганатом или соединениями церия (IV).
3) Титрование арсенитом в присутствии катализатора OsO4. Как и в случае титрования оксалатом, применяют как прямой, так и обратный методы титрования [в случае обратного метода титрования используют соединения церия (IV)].
4) Добавление иодида и последующее титрование выделившегося иода тиосульфатом.
5) Титрование гидрохиноном.
352
Таблица 31. Примеры использования соединений церия (IV)
№ п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
1 2 3 4 5 6 7 8 Оксикислоты (см. № 49), например винная (см. № 31, 48, 49, 52), яблочная (см. № 31, 49, 55), малоновая, лимонная (см. № 2, 11, 49, 52), гликолевая (см. We 31) Лимонная кислота (см. № 31) Пировиноградная кислота см. № 41) Глицерин (см. We 6, 8, 12, 37, 51) Молочная кислота (см. № 9, 15, 24, 29, 47, 49, 55) в биологических материалах Глицерин (см. № 4) и декстроза [глюкоза (см. We 50), виноградный сахар] Оксалат (микрометод) (см. We 41) Глицерин (см. We 4) Се (SO4)2; 10— 120 мин при 90— 95° С (образуется СО2 и муравьиная кислота) Се (SO4)2—H2SO4; 1 ч при 90—95° С (образуется СО2) Се (SO4)2-H2SO4; 5 мин (образуется СО2 и уксусная кислота) Се (SO4)2; нагревают 1 ч в колбе, снабженной обратным холодильником (образуется тартро-новая кислота) Се (SO4)„; 50° С (образуется СН3СНО) Се (SO4)2—H2SO4; 1 ч при 100° С Се (SO4)2—H2SO4; IC1 или OsO4 (катализатор); 30 мин при 100° С в отсутствие катализатора (NH4)4 [Се (SOJJ-HnSO4; 90 мин при 90—100° С; или (NH4)2 [Се (NO3)61— НСЮ4; 15 мин при 50° С Избыток реагента оттитровывают Fe11 потенциометр и чески Избыток реагента оттитровывают в горячем растворе щавелевой кислотой потенциометрически Избыток реагента оттитровывают Fe11 Избыток реагента оттитровывают Fe11 в присутствии ксиленолового цианола Альдегид определяют бисульфитным методом (см. «Бисульфит и сульфит», литература 51} Избыток реагента оттитровывают Fe11 в присутствии ферроина или эриоглау-цина Избыток реагента оттитровывают Fe11 в присутствии сето-палина С Избыток реагента оттитровывают щавелевой кислотой в присутствии нитроферроина 1 2 3 4 5 6 7 8
9 Молочная кислота (см. We 5) (окисляется до муравьиной кислоты) Се (SO4)2; 5 ч при 25° С или 2 ч при 150° С (образуется ацетальдегид) Ацетальдегид определяют бисульфитным методом (см. «Бисульфит и сульфит, литература 65) 9
12
М Р. ф Эшворт
353
Продолжение
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Лите рату ра
10 Полиоксисоединения (см. № 20), дикетоны, некоторые карбоксильные кислоты (см. № 26) Н2Се (С1О4)6—НО04; 10—120 мин при 10—45° С (Метод сравнивался перйодатом при изуч Щ Избыток реагента оттитровывают оксалатом в присутствии нитроферроина с методом окисления ении механизма реак-и) ю
11 Лимонная кислота (см. № 1) в молочных продуктах (выделенная в виде свинцовой соли) Се (С1О4)4—НС1О4 Избыток реагента оттитровывают оксалатом в присутствии нитроферроина и
12 Глицерин (см. № 4) в мыле Се (С1О4)4—НС1О4; 12—13 мин при 50° С Избыток реагента оттитровывают оксалатом в присутствии нитроферроина 12
13 Пентаэритрит (см. № 20, 51) Се (С1О4)4 Избыток реагента оттитровывают оксалатом 13
14 Тетрагидрофур иловый спирт Се (SO4)2—H2SO4; нагревают 1 ч в колбе, снабженной обратным холодильником Избыток реагента оттитровывают Fe" 14
15 Молочная кислота (см. We 5) Се (SO4)2; 90 мин (образуется CHSCHO) Альдегид определяют бисульфитным методом (см. «Бисульфит и сульфит», литература 94) 15
16 Альгинат натрия (см. № 20) Се (SO4)2; сульфаты серебра и калия; кипятят 2 мин Фильтруют и избыток реагента оттитровывают Fe11 в присутствии ферроина 16
17 Почва — определение общего содержания органического вещества Предварительно нагревают с H2SO4— HNO3, затем добавляют (NH4)4Ce (SO4)4 (кипятят 60 мин) или (NH4)2Ce (NOS)6 (кипятят 5—10 мин) Вода; KI; выделившийся иод оттитровывают тиосульфатом 18
18 а-Токоферол (витамин Е), образующийся при щелочном гидролизе сыворотки в присутствии ацетата Се (SO4)2—НС1— H2SO4 К избытку реагента прибавляют щавелевую кислоту, избыток которой оттитровывают перманганатом 19 ।
19 Моно- и полиспирты; моно-, ди- и трифенолы; ариламины Се (SO4)2 (Условия реакций различные) Избыток реагента оттитровывают Fe" 20
354
Продолжение
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
20 Полиоксисоединения Се (SO4)2; нагревают Избыток реагента от- 21
(см. № 10), например титровывают Fenno-
маннит (см. № 54), сорбит (см. We 54), пента- тен ци ометр и чески
эритрит (см. We 13), инозит, альгиновая кислота (см. We 16)
21 Одноатомные спирты, Се (SO4)2-H2SO4; 2—3 ч при 100° С Избыток реагента от- 22
например метанол (см. титровывают Fenno-
We 25, 34), этанол, бу- тенциометрически
танол
22 Фенолы (см. We 27, 30, 53) Се (SO4)2; нагревают Избыток реагента от-т- II титровывают Fe по- 23
тенциометрически
23 Щавелевая кислота (см. Се (SO4)2; нагревают 15 мин Избыток реагента от- 24
We 36, 38, 39, 42, 54, 57, титровывают Fenno-
58), образовавшаяся тенциометрически
при определении глутаминовой кислоты (см.
№ 54) при взаимодействии с нитритом
24 Молочная кислота (см. Се (SO4)2 Перегоняют в рас- 25
We 5) в вине (образуется СН3СНО) твор бисульфита и титруют иодометрически (см. «Бисульфит и сульфит», ли-
тература 109)
25 Метанол (см. We 21) Разбавленная HNOS; Разбавленная 26
в воде ЩНЩСе (NOS)6; H2SO4; UsU4; избыток
10 мин при 100° С реагента оттитровы-
(образуется вают арсенитом в
муравьиная кислота) присутствии фер-
ровна
26 Карбоксильные кисло- Се (SO4)2; нагревают 15 мин См. выше21,22 — 27
ты (см. We 10), образующиеся при определении см. W° 20, 21
аминокислот при взаимодействии с нитритом
27 Фенол (см. We 22); пирогаллол; флороглюцин Се (SO4)2; кипятят 50, 5 и 5 мин соот- См. выше21,22 — см. Wo 20, 21 28
ветственно
28 Ароматические амины; о- и п-аминофенолы; п-фенил ендиаминосуль- Се (SO4)2; 5 мин См. выше21,22 — 29
при 20° С (1 ч при 100° С для п-фени- см. № 20, 21
фонат натрия лендиаминосульфо-
ната натрия) 1
*
355
Продолжение
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
29 Молочная кислота (см. № 5) в винах и т. п. Кипящий раствор; Се (SO4)2-H2SO4 по каплям, образующийся СН3СНО перегоняют 12 мин Образовавшийся альдегид перегоняют в раствор бисульфита и оттитровывают иодометрически (см «Бисульфит и сульфит», литература 114) 30
30 Фенолы (см. № 22) В H2SO4 (pH ~1); Се (SO4)2; 1—3 мин при комнатной температуре Избыток реагента оттитровывают Fe11 биамперометрически 31
31 Муравьиная (см. № 42, 43, 52), винная (см. № 1), яблочная (см. № 1), гликолевая (см. № 1), малеиновая (см. We 58), фумаровая, бензойная, фталевая, салициловая и другие кислоты Се (SO4)2-H2SO4; кипятят 5 мин в колбе, снабженной обратным холодильником; концентрацию кислоты затем повышают до 66%; затем кипятят 1—3 ч • (определяемые кислоты окисляются до СО,) Избыток кислоты оттитровывают Fe11 в присутствии N-фенилантраниловой кислоты 32, 33
32 Миндальная кислота (см. № 45, 49, 55) Се (SO4)2; кипятят 20 мин Избыток реагента оттитровывают Fe11 в присутствии ферроина 34
33 Дикальциевая соль 2-метил-1,4-нафтахинон-дифосфорной кислоты В воде; Се (SO4)2; H2SO4; 10 мин прн комнатной температуре Избыток реагента оттитровывают гидрохиноном в присутствии ферроина 35
34 Метанол (см. № 21), образующийся при гидролизе в присутствии HNO3 при определении метокси групп в мет-о кси бор огидр и да х (NH4)2 [Се (NO3)6[; 10 мин при 100° С H2SO4 — OsO4 (катализатор); избыток реагента оттитровывают арсенитом в присутствии фер-роииа 36
35 Сахара Се (СЮ4)4—НСЮ4; 1 ч при 25° С Добавляют избыток оксалата, который оттитровывают CeIV в присутствии нитроферроина, или добавляют OsO4 (катализатор) и арсенит, избыток которого оттитровывают CeIV 37
356
Продолжение
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
36 37 38 39 40 41 42 Щавелевая кислота (см. № 23) Глицерин (см. № 4) и гликоль Щавелевая кислота (см. № 23) Щавелевая кислота (см. № 23); гидрохинон (см. № 41) n-Кумаровая кислота Восстановители, например оксалат (см. № 7), гидрохинон (см. 39), пировиноградная кислота (см. № 3) Щавелевая (см. № 23) и муравьиная (см. № 31) кислоты Се (SO4)2—H2SO4; 5—15 мин при ярком освещении Се (SO4)2; кипятят 30 мин в колбе, снабженной обратным холодил ьни ком (образуется муравьиная кислота); затем добавляют катализатор Сг1"; при дальнейшем нагревании образуется со2 Се (SO4)2; 80 мин при 100° С Сульфатоцерат диэтилентетр ааммо-ния—H2SO4; гидрохинон окисляется при комнатной температуре, щавелевая кислота — при нагревании Се (SO4)2—50%-пая H2SO4; нагревают 2 ч Се (SO4)2-H2SO4; нагревают до 60° С Се (SO4)2; кипятят 5 мин в колбе, снабженной обратным холодильником (окисляется только щавелевая кислота), затем прибавляют катализатор Сг1" и кипятят 50—80 мин (образуется СО2) Избыток реагента оттитровывают Fe11 в присутствии фер-роииа Избыток реагента оттитровывают Fe11 в присутствии N-фе-нилантраииловой кислоты Избыток реагента оттитровывают Fe" кулонометрически Избыток реагента оттитровывают Fe" потенциометрически или визуально в присутствии ферроина Избыток реагента оттитровывают Fe" в присутствии ферроина Избыток реагента оттитровывают Fe" потенциометрически Избыток реагента оттитровывают Fe" в присутствии N-фе-нилантраниловой кислоты 38 39 40 41 42 43 44
357
Продолжение
№ п/n Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
43 Формальдегид и муравьиная (см. № 31) кислота Ce(SO4)2; кипятят 5 мин (альдегид окисляется до кислоты); затем добавляют катализатор— Сг1" и H2SO4 и кипятят 75—90 мин (образуется СО2) Избыток реагента оттитровывают Fe11 в присутствии N-фе-нилантр аниловой кислоты 45
44 Антабус В уксусной кислоте; Се (SO4)2; KI (катализатор); 5 мин при 21—23° С Избыток реагента оттитровывают Fe11 в присутствии ферроина 46
45 Миндальная кислота (см. № 32) в фармацевтических препаратах В воде; Се (SO4)2— H2SO4; кипятят 20 мин в колбе, снабженной обратным холодильником Избыток реагента оттитровывают Fe11 в присутствии ферроина 41 |
46 Тартрат; цитрат Се (С1О4)4—НС1О4; 10 мин Избыток реагента оттитровывают оксалатом амперометрически 48
47 Молочная кислота (см. We 5) в вине (после предварительного отделения) Се (SO4)2 (образующийся СН3СНО) Образующийся альдегид отгоняют 15 мин в раствор бисульфита и титруют иодометрически 49
48 Винная кислота (см. We 1) Се (SO4)2-H2SO4; кипятят 15 мин в колбе, снабженной обратным холодильником (Изучалась НООССНОНСНО +НСОО в качестве промежут зуется тартронс Избыток реагента от-т- II титровывают Fe в присутствии ферроина реакция: 40 нсоои—>зсо2+ Н+2Щ0 очного продукта обращая кислота) 50
49 Оксикислоты (см. We 1), например яблочная (см. We 1), молочная (см We 5), лимонная (см. We 1), винная (см. We 1), миндальная (см. We 32), гликолевая (см. We 1) Се (SO4)2—H2SO4; 15—30 мин при излучении 575 нм Избыток реагента от- I- II титровывают ге в присутствии ферроина 51
358
Продолжение
п/п Титруемое вещество 1 Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
50 Глюкоза (см. № 6); фруктоза; сахароза Се (С1О4)4—НС1О4; 35—40 мин при 60° С (образуется муравьиная кислота и СО2) Избыток реагента оттитровывают оксалатом амперометрически 52
51 Многоатомные спирты, например глицерин (см. We 1), эритрит, пентаэритрит (см. № 13); оксин, оксинаты Се (SO4)2—НС1О4; Ag1—Мп11 (катализатор); нагревают при 95° С до тех пор, пока не появится розовый цвет перманганата (3—5 мин) Избыток реагента от- I- II титровывают ге в присутствии ферроина 53
52 Муравьиная кислота (см. We 31) и другие кислоты, которые образуются в результате некаталитического окисления Celv [например, винная (см. We 1), лимонная (см. We 1)] Се (SO4)2-H2SO4; Вт- (катализатор) 45—100 мин (очевидно, образуется бром) Г; выделившийся иод оттитровывают тиосульфатом 54
53 Анилин; фенол (см. We 22); Р-нафтиламин В разбавленной H2SO4; электролитически генерируемые Се1У-ионы; при комнатной температуре Избыток CeIV оттитровывают электролитически генерируемыми Регионами 55
54 Щавелевая кислота (см. We 23), сорбит (см. We 54), маннит (см. We 20), окси-глутаровая кислота, образующаяся при определении глутаминовой кислоты (см. We 23) в результате взаимодействия с HNO2 Электролитически генерируемые CeIV-noHbi; 3 мин при 80—100° С Избыток CeIV оттитровывают электролитически генерируемыми Fe11-ионами
55 Молочная (см. We 5), миндальная (см.. We 32), DL-яблочная кислоты (см. We 1) Избыток Се (SO4)2; несколько дней при 25° С Избыток реагента оттитровывают солью Мора в присутствии N-фенилантранило-вой кислоты 56
56 Жиры и масла — определение иодного числа Масло; этанол; Се (SO4)2; KI; вода; 5 мин при комнатной температуре в темноте Выделившийся иод оттитровывают тиосульфатом 59
359
Продолжение
№ n/n Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
57 Щавелевая кислота (см. № 23) В уксусной кислоте; (NH4)2 [Се (NOsJel-ацетонитрил; 5— 10 мин при комнатной температуре. [Изучалось окисление, проходящее, вероятно, через образование промежуточного соединения—оксалат церия (IV)] Избыток реагента оттитровывают гидрохиноном в среде уксусной кислоты или ацетонитрила в присутствии дифениламина 60
58 Щавелевая (см. № 23) и малеиновая (см. № 31) КИСЛОТЫ Кипятят в колбе, снабженной обратным холодильником, с Се (SO4)2 Избыток реагента от-I- 11 титровывают ге (щавелевая кислота определяется в отдельной навеске прямым титрованием) 62
Конечную точку титрования определяют инструментальными (главным образом потенциометрическим) или индикаторным методами для индикации CeIV и других окислителей (например, в качестве индикаторов применяют ферроин, нитроферроин, N-фенилантра-ниловую кислоту).
2. Определение продукта реакции — ацетальдегида, получаемого при окислении молочной кислоты. Ацетальдегид абсорбируют бисульфитом, а затем избыток бисульфита или бисульфит, связанный с альдегидом, определяют иодометрически.
Обзор применения соединений церия (IV) в анализе приведен в работе17. Изучение кинетики окисления CeIV молочной кислоты и глицерина представлено в работах 57- 58 соответственно. Помехи, вызываемые присутствием оксалата, описаны в работе 61.
ЛИТЕРА ТУРА
1. Willard H. H„ Young Р., J. Am. Chem. Soc., 52, 132 (1930).
2. Wilkinson J. A., Sipherd I. R., Fulmer E. 1., Christensen L. M., Ind. Eng. Chem., Anal. Ed., 6, 161 (1934).
3. Fromageot C., Desnuelle P., Biochem. Z., 279, 174 (1935).
4. Cu t h i 1 1 R., Atkins C., J. Soc. Chem. Ind. (London), 57, 89 (1938).
5. G о r d о n J. J., Qu astel J. H., Biochem. J., 33, 1332 (1939).
6. Fulmer E. I., Hickey R. J., Underkofl er L. A., Ind. Eng. Chem., Anal. Ed., 12, 729 (1940).
7. К i r k P L., Tompkins P. C., Ind. Eng. Chem., Anal. Ed., 13, 277 (1941).
8. S m i t h G. F., Duke F. R., Ind. Eng. Chem., Anal. Ed., 13, 558 (1941)-
9. W i n n i c k T„ J. Biol. Chem., 142, 451 (1942).
10. S m i t h G. F., Duke F. R., Ind. Eng. Chem., Anal. Ed., 15, 120(1943'-
11. H e i n e m a n n B., J. Dairy Science, 27, 377 (1944).
12. Silverman L., J. Am. Oil Chemists' Soc., 24, 410 (1947).
360
.. ,„rman L J. Am. Oil Chemists' Soc., 25, 359 (1948).
I3‘ н'ДТа mJ-, Ruddle L.H., Analyst, 74, 559 (1949).
u с яг v i 11 M Conway E. J., Intern. Congr. Biochem., Abstracts of 15‘ Comms 1st Congress, Cambridge 301 (1949).
G a d e к e A., Z. anal. Chem., 131, 428 (1950).
, G n a r d i a С. C„ Afinidad, 27, 289, 454 (1950).
«Pacheco J., de la R., Lopez - Ru b i о F. В., Trans. 44 Intern. Congr.
Soil Sci., Amsterdam, 2, 101; 4, 79 (1950).
to Schulz H. G., Z. physiol. Chem., 288, 31 (1951).
90 K i mot о K-, Repts. Inst. Ind. Sci. Tokyo Univ., 3, 20(1952).
21 Takahashi T., К i m о t о К., M inatn i S., J. Chem. Soc. Japan, ' Ind Chem. Sect., 55, 115, 168 (1952).
22 Takahashi T., Hay as e C., J. Chem. Soc. Japan, Ind. Chem. Sect.,
55, 205 (1952).
23 Takahashi T., Kimoto K., Kimoto M., J. Chem. Soc. Japan, Ind. ' Chem. Sect., 55, 283 (1952).
24 Takahashi T., Ki,,, v I » Ind. Chem. Sect., 55, 805 (1952).
25 Lucas J. F. C., Rev. cienc. apl. (Madrid), 7, 26^ S к о о g D. A., В u d d e M. M., Anal. Chem., 27. T a к a h a s h i T., Ind. Chem. Sect., 56,
28. T a к a h a s h i T., Ind. Chem. Sect., 56,
29. T a к a h a s h i T., Ind. Chem. Sect., 56,
283 (1952).
Kimoto K., Minam i S., J. Chem. Soc.
К i m о t о 417 (1953).
К i m о t о 491 (1953).
К i m о t о 591 (1953).
K-, Minam i
К., M i n a m i
K., Takano
Japan,
526 (1953).
25, 822 (1953).
S., ' ~
J. Chem. Soc.
Japan,
S„
Y.,
J. Chem. Soc.
J. Chem. Soc.
Japan,
J apan,
30. L u c a s J. F., Anales real. soc. espan. fis. у quim. (Madrid), 50B, 535 (1954).
31. Spencer W. R., Duke F. R., Anal. Chem., 26, 919 (1954).
32. S h a r m a N. N., M e h о t r a R. C., Anal. Chim. Acta, 11, 417 (1954).
33. S h a r m a N. N., Mehotra R.C., Anal. Chem. Acta, 11, 507 (1954).
34. V e r m a M. R., Paul S. D., J. Sci. Ind. Research, India, 13B, 346 (1954).
35. Y a m a g i s h i M., Fujiwara H., S h i г a к i S., Ann. Repts. Takamine Research Lab., 13, 25 (1954).
36. A 1 e x a n d e r A. P., Bourne P. G., L i 111 e h a 1 e D. S., Anal. Chem., 27, 105 (1955).
37. F о r i s t A. A., Speck J. C., Anal. Chem., 27, 1166 (1955).
38. Gopala Rao G., Ar avamu dan G., Z. anal. Chem., 145, 426 (1955).
39. S h a r m a N. N., Mehotra R. C., Anal. Chim. Acta, 13, 419 (1955).
40.
Speck J. C., Anal. Chem., 27, 1166 (1955).
. Mehotra R. C., Anal. Chim. Acta, 13, 419 (1955).’ Takahashi T., Kimoto K-, S a к u r a i H., Rept. of Inst, of Ind. Sci., Univ. Tokyo № 6, Nov. (1955). Balwant Singh, Surjit Chim. Acta, 15, 320 (1956).
Verma M. R., Agr aw al K. India, 15B, 636(1956).
Balwant Singh, Sarwan Ind. Research, India, 16B, 173 (1957).
44. S h a r m a N. N., Z. anal. Chem., 157, 110 (1957).
45. S h a r m a N. N., Z. anal. Chem., 162, 321 (1958).
46. Varga E., Acta Pharm. Hung., 28, 38 (1958).
48. '
49.
50.
51.
52.
41.
42.
43.
53.
54.
Singh, C„ Paul
Singh,
Harbans Singh, Anal. S. D., J. Sci. Ind. Research, Harbans Singh, J. Sci.
Helmstaedter G., Deut. Apotheker Ztg., 99, 589 (1959).
Michalski E., Czarnecki K., Chem. Anal. (Warsaw), 4, 83 (1959) E * m °r Qk r ,K ° U та tS° v V'bЛПк- fals‘ et expert. chim-> 53, 569 I960). Hsu L. S., Chou T. H., Yao Hsueh Hsueh Pao, 8, 141 (I960).
Mathur N. K., Rao S. P., Current Sci. (India), 29, 92 (1960).
Hormhalskl E” Czarnecki K., Ignaczak M„ Taianta. 127 \ lyuUy.
Guilbault G G. Г' "
Mathur n к Pon /ша‘- ’-пет., за, эви (1961).
24, 533 (1961).’ K” R ’’ Chowdhary D. R„ Anal. Chim. Acta,
Tai anta, 5, 137
G. G., McCurdy W. H., Anal. Chem., 33, 580 (1961).
361
55. Takahashi T., Sakurai H., J. Chem. Soc. Japan, Ind. Chem. Sect 63, 608 (1960).
56. Krishna B., Tew ar i К. C., J. Chem. Soc., 3097 (1961).
57. Bhargava К. P., S h a n к e r R., Joshi S. N., J. Sci. Ind. Res. (India) 21B, 573 (1962).
58. G u i 1 b a u 1 t G. G., M с C u r d у jr. W. H., J. Phys. Chem., 67, 283 (1963).
59. J u n g n i с к e 1 H. E., Klinger W., Pharmazie, 18, 130 (1963).
60. Prabhakar Rao G., Vasudeva Murthy A. R., Z. anal. Chem 195, 406 (1963).
61. R echnitz G. A., E l-Tantawy Y., Z. anal. Chem., 193, 434 (1963).
62. S u m a t h i S. C., Leather Sci. (Madras), 10, 351 (1963).
23. ХЛОРАТ КАЛИЯ
Хлорат калия, применяемый в солянокислом или азотнокислом растворе, реагирует как окислитель:
С1О“ + 6Н+ + бе -> С1“ + ЗН2О
Определение завершается аргентометрическим титрованием образующихся при этом СЬ-ионов или, в случае определения тетраэтилсвинца, РЬ1’-ионов.
Таблица 32. Примеры использования хлората калия
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
1 Формальдегид Нагревают со смесью КС1О3—HNO3, AgNO3 (образуются муравьиная кислота _ и AgCl) Избыток Ag+ оттитровывают SCN-или СГ 1
2 Амилнитрит (см. № 3) КС1О3 и HNO3; встряхивают 1 ч при нагревании AgNO3; выделившийся осадок отфильтровывают п избыток Ag+ в фильтрате оттитровывают тиоцианатом 2
3 Амилнитрит (см. № 2) КС1О3 и HNO3; 15 мин Как указано выше — см. № 2 3
4 Тетраэтилсвинец в бензине (см. № 5) HNO3 40%-ная и КС1О3 6%-ный водный раствор; встряхивают 3 мин РЬ2+ из кислого водного раствора осаждают в виде хромата, растворяют в НС1, добавляют 1“; выделившийся иод оттитровывают тиосульфатом 4
5 Тетраэтилсвинец в бензине (см. № 5) Концентрированная НС1 и ксю3 Вода; добавляют к водному слою NH4OH—NH4C1 и титруют РЬ2+ раствором ЭДТА в присутствии эриохром черного Т 5
362
ЛИТЕРАТУРА
r r ii t z n e r B., Arch. Pharm., 234, 634 (1896).
1 xJ t Л < T T Л Л л ** ** “ “
2 Andrews M. J.,
3 Krantz J. U., L-- . . _. ._
i Cr h war t z L., „ .
5 Blumenthal A., Mitt. Lebensm. Hyg., 51, 159 (1960).
.J. Am. Pharm. Assoc., 21, 799, 886 (1932).
Carr C. J., Pharm. Weekblad, 69, 101 (1932).
L., Ind. Eng. Chem., Anal. Ed., 15, 499 (1943).
24. РЕАГЕНТЫ, СОДЕРЖАЩИЕ ХЛОР
Реагенты. К рассматриваемым в данном разделе реагентам относятся: свободный хлор (в виде газа или раствора); СвН51С12, который ведет себя как смесь иодбензола и хлора; и, в особенности, гипохлорит, применяемый обычно в виде натриевой или кальциевой солей.
Реакции и титруемые вещества. 1. Реакция присоединения к олефинам, обычно применяемая при определении ненасыщенности масел, жиров и других природных продуктов:
=С=С= + С12 -» =СС1—СС1 = =С=С= + HOCI -> =С (ОН)—СС1=
2. Реакция окисления, например альдегидов, мочевины, аминокислот и гидразинов, с использованием гипохлорита. Окисление может быть представлено следующим образом:
ОС1- + Н2О + 2е -» С1-+2ОН-
или
ОС1- -> С1~+О
Ниже приводятся некоторые уравнения типичных реакций:
НСНО + 2ОС1- -> СО2 + 2СГ + Ир
СО (NH2)2 + ЗОС1- -> СО2 + N2 + 2Н2О + за-
RCH (NH2) СООН + ОС1- -> RCHO + СО2 + NHS + С1"
NH2NH2 + 2ОС1- -> N2 + 2Н2О + 2С1-
CH8NHNH2 + 4ОСГ -> СО + N2 + ЗН2О + 4С1-
3. Реакции замещения водорода хлором, обычно присоединяемым к азоту (эта реакция, разумеется, может быть рассматриваема как реакция окисления, но ее удобно классифицировать отдельно). Например:
H2N—у —NH2 -> C1N=/ \=NC1
ОС—NH ОС—NCI
II ^11
HN CO C1N CO
C(CeHB)2 C(CeH5)2
ArSO2NH2 -> ArSO2NCl2
RCH2NO2 — RCC12NO2
R2CHNO2 -> R2CQNO2
363
Таблица 33. Примеры использования элементарного хлора и некоторых других хлорных реагентов
№ п/л Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Лите рату ра
1 Ацетон KI—щелочь; избыток NaOCl; встряхивают 1 мин НС1; тиосульфат, избыток которого через несколько мипут оттитровывают NaOCl 1
2 Амины; нитрилы; имиды Са (ОС1) С1 и NaOH; 12—15 ч в темноте Избыток арсенита и H2SO4, затем добавляют NaHCO3; избыток арсенита оттитровывают иодом 2
3 Триолеин [глицерил-триолеат— (Cj 7 Н33СОО)3С3Н 5 ]— определение ненасыщенности СвНБ1С12—СС14; 4 ч при комнатной температуре Тиоционат, избыток которого оттитровывают AgNOg в присутствии РеП1-ионов 3
4 n-Фенилендиамин (см. № 9, 22) NaOCl (окисление исходного продукта до N.N'-дихлорхинон-диимина) Избыток реагента оттитровывают арсенитом в присутствии внешнего индикатора (иодид—крахмал) 4
5 Муравьиный альдегид (см. № 24) В воде; NaOCl; встряхивают 1“ и НС1; выделившийся иод оттитровывают тиосульфатом 5
6 Масла (см. № 7, 15, 16, 20) — определение ненасыщенности Насыщенный раствор СвНБ1С12 в СС14 СВ -ионы оттитровывают AgNOg 6
7 Масла (см. № 6) и жиры (см. № 16, 20) — определение ненасыщенности (после омыления) Нейтрализованный раствор; NaOCl и H2SO4 KI, через 5—15 мин добавляют II2SO4, затем титруют тиосульфатом Z
8 Олеиновая кислота — определение ненасыщенности С12—СС14; 30 мин в темноте I ; выделившийся иод оттитровывают тиосульфатом 8
9 n-Фенилендиамин (см. № 4) и п-толуиленди-амин В воде; NaOCl (образуется N.N'-ДИ-хлорхинондиимин) т- Избыток реагента восстанавливают арсенитом; диимин экстрагируют CHClg и определяют путем взаимодействия с I*—НС1; выделившийся иод оттитровывают тиосульфатом (см «Йодиды и иодистоводородная кислота», литература 68) 9
10 5,5-Дифенилгидантоин в биологических мате- риалах В разбавленной NaOH; хлорный реагент (образуется 1,3-ди-хлорпроизводное) Растворяют в уксусной кислоте, добавляют 1“, выделившийся иод оттитровывают тиосульфатом 10
364
Продолжение
'ft Г1/П Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
11 Аминокислоты (см. № 13) (аланин, валин, лейцин) NaOCl; 12 мин при 0° С (аминокислоты окисляются до альдегидов) Избыток реагента разлагают мочевиной; добавляют фосфатный буферный раствор (pH 8,5) и альдегиды перегоняют в раствор бисульфита; избыток бисульфита оттитровывают иодом (см. «Бисульфит и сульфит», литература 79 и 86) 11, 12
12 Сульфонамиды в ни-кель-гальванических ваннах Хлор барботируют через анализируемый раствор 10— 15 мин Продукт реакции экстрагируют СНС18, растворитель выпаривают, добавляют Г— СН3СООН; выделившийся иод оттитровывают тиосульфатом 13
13 Аминокислоты (см. № 11) В кипящий щелочной раствор добавляют NaOCl и NaOH; 1 мин (образуется аммиак) Выделяющийся аммиак пропускают в НС1, избыток которого оттитровывают щелочью в присутствии метилового красного и метиленовой сини 14
14 Жирные кислоты — определение ненасыщенности Хлорноватистая кислота в трехкратном избытке; 15 мин при 37° С 1“ —кислота; выделившийся иод оттитровывают тиосульфатом 15
15 Масла (см. № 6) — определение иодных чисел (даже для соединений с „ конъюгированными ДВОЙНЫМИ связями) 0,3 н. раствор хлорноватистой кислоты в трех- или четырехкратном избытке; ацетат ртути; I ч I"; выделившийся иод оттитровывают тиосульфатом 16
16 Жиры (см. № 7) и масла (см. № 6) — определение ненасыщенности Раствор или суспензия в уксусной кислоте и NaOCl; 4— 5 мин в темноте I-; выделившийся иод оттитровывают тиосульфатом 17
17 Циклизованный каучук — определение ненасыщенности В СС14; СвН51С12; нагревают 2 ч в колбе, снабженной обратным холодильником Продукт реакции осаждают спиртом, количественно растворяют в бензоле и снова осаждают метанолом; в полученном осадке определяют С1" путем сжи-I ания и последующего титрования Ag+-ионами 18
365
Продолжение
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
18 Мочевина (см № 21) КВг; борная кислота; нагревают до 50—60° С и добавляют раствор NaOCl, нагретый до той же температуры; 2 мин NaOH; тиосульфат в эквивалентном количестве по отношению к исходному количеству NaOCl; избыток тиосульфата оттитровывают NaOCl в присутствии индикатора—брази-лин (CjcHjaOj) и 1 капля раствора KI 19
19 Первичные и вторичные нитропарафины NaOCl и NaOH; 15 мин при комнатной температуре (образуется хлорнитропарафин) Уксусная кислота; раствор KI; выделившийся иод оттитровывают тиосульфатом 20 |
20 Жиры (см. № 7) и масла (см. № 6) — определение ненасыщенности Уксусная кислота; раствор белильной извести; 10 мин Ba (ОС1)2; НС1; 10 мин (образуется СО2) I-; выделившийся иод оттитровывают тиосульфатом 21
21 Мочевина (см. № 18) в воде плавательных бассейнов (раствор концентрируют и прибавляют дополнительное количество мочевины) Ва (ОН)2; образуется ВаСО3, осадок отфильтровывают, растворяют в НС1, избыток которой оттитровывают NaOH в присутствии фенолфталеина (при расчете учитывают добавленное количество мочевины) 22
22 n-Фенилендиамин (см. We 4) в красках для волос Добавляют образец к NaOCl—NaHCO31 (образуется дихлордиимин) Экстрагируют СНС13; добавляют I-—НС1; встряхивают 1 мин и титруют тиосульфатом (см. «йодиды и иодистоводородная кислота», литература 226) 23
23 Метил гидр азин н гидразин В буферном растворе Na2HPO4—Na3PO4; КВг и NaOCl; 15 мин при 60° С (на окисление расходуется соответственно 4 н 2 моль реагента) (Метод сочетают с хлорами I-; уксусная кислота; титруют тиосульфатом методом титрования ном Т) 24
24 Муравьиный альдегид (см. We 5), бензальдегид Избыток NaOCl; щелочь и OsO4 (катализатор) Избыток реагента оттитровывают арсенитом потенциометрически 25
366
Усаовия реакции. Реакции присоединения большей частью про-в среде органических растворителей. Для реакций окисления В°1амешения обычно применяют водно-щелочные растворы.
И Соответствующая обработка и конечная стадия титрования.
1 Избыток реагента определяют несколькими способами.
1) Добавляют иодид (с кислотой) и титруют тиосульфатом выделившийся иод.
2) Добавляют раствор арсенита, избыток которого затем оттитро
вывают иодом.
3) Добавляют раствор тиосульфата, избыток которого оттитровывают гипохлоритом (метод 2 и 3 применим только к случаю обратного титрования гипохлоритом).
4) Добавляют раствор тиоцианата, избыток которого оттитровывают А§+-ионами.
2. Продукты реакции могут быть определены следующими спо-
собами.
1) N-Хлориды — путем добавления иодида и последующего титрования выделившегося иода тиосульфатом:
=NC1 + 2Г + Н+ -> =NH + Cl- + I2
2) Альдегиды, образуемые из аминокислот,— путем взаимодействия с избытком бисульфита и последующего обратного его титрования иодом.
3) Аммиак, образующийся из аминокислот,— путем поглощения раствором кислоты и последующим титрованием ее избытка щелочью.
4) СО2, выделяющаяся при окислении мочевины,— путем поглощения Ва (ОН)2 и титрования кислотой образующегося осадка карбоната бария.
ЛИТЕРАТУРА
1.
2
3.
4.
5.
6.
7.
8.
9.
10.
11.
12.
13.
14.
15.
16.
17.
18.
19.
20.
К e b 1 e г L. F., J. Am. Chem. Soc., 19, 316 (1897).
E f f г о n t J., Ber., 37, 4290 (1904).
Zlatarow A., Z. Untersuch. Nahr. u. Genussm., 26, 348 (1913).
Callan T., Henderson J. A. R., J. Soc. Chem. Ind. (London), 38, 408T (1919).
Bicskei J., Z. anorg. u. allgem. Chem., 161, 309 (1927).
Kettle S., Chemist-Analyst, 18, 7 (1929).
Goswami M., Basu K. L., Analyst, 59, 533 (1934).
u , a У L-, S a b e t a у S., Ann. chim. anal. chim. appl., 20, 288 (1938).
Herd R. L., J. Assoc. Off. Agr. Chem., 22, 158 (1939).
д ° к e i k a F. L., Hine C. H„ J. Pharmacol., 72, 276 (1941).
E’’ Asselineau J., Bull. soc. chim. France, 689 (1947).
AUbei E., Asselineau J., Biochim. et Biophys. Acta, 2, 198 (1948).
?'ro,ta J-- Metal Finishing, 46, No 9, 68(1948).
Wieland T„ Yogelbach C. -..........
С ьА л [J e e Altl- c"' bnemisrs ooc., zb, у/(lytjzj.
4Я4 nocn u г У К- В., Mukherjee S., J. Am. Oil Chemists' Soc., 32,
L“nkhNrjer J. Am‘ Oil Chemists' Soc., 32, 351 (1955).
В ft А У С-, Makromol. Chem., 16, 198 (1955).
J on Aer‘ JA’ Ма§уаг Kem- Folyoirat, 62, 71 (1956).
nes L. R., Riddick J. A., Anal. Chem., 28, 1137 (1956).
^., В i е 1 ig Н. J., Ann., 561, 116 (1948).
J. Am. Oil Chemists’ Soc., 29, 97 (1952).
367
21. Chowdhury R. В. R., J. Am. Oil Chemists' Soc., 37, 198 (1960).
22. Fuchs J., Chem. Ztg., 84, 805 (1960).
23. v a n d e P о 1 A., Chem. Weekblad, 56, 21 (1960).
24. Clark J. D., Smith J. R., Anal. Chem., 33, 1186 (1961).
25. Norkus P., Zhur. Anal. Khim., 18, 650 (1963).
25. ХЛОРИТ НАТРИЯ
Хлорит натрия в слабокислом растворе (pH — 3) применяют для определения альдегидов, в особенности альдоз; при этом происходит реакция окисления—восстановления:
RCHO + ЗНС1О2 -> RCOOH + Н2О + НС1 + 2С1О2
Хлорит натрия применен также для определения некоторых азотсодержащих соединений, как изониазид, оксин и анилины.
Избыток реагента определяют путем прибавления смеси I- — кислота и последующего титрования выделившегося иода тиосульфатом. Некоторые приводимые ниже (табл. 34) примеры связаны с изучением реакции и возможностью применения ее для количественного определения некоторых органических соединений.
Таблица 34' Примеры использования хлорита натрия
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
1 Глюкоза (см. № 2, 3) В ацетатном буферном растворе (pH 3,5); 20 ч при 40° С 1“—кислота; выделившийся иод оттитровывают тиосульфатом 1
2 Глюкоза (см. № 1) В фосфатном буферном растворе (pH 2,4—3,4); в токе азота (очевидно, для удаления С1О2) в темноте при 50° С (Изучено влияние р концентраций, избыт должительности peai реакция протекает отношении при указа pf- 1“—H2SO4; выделившийся иод оттитровывают тиосульфатом потенциометрически азличных факторов-ка реагента и про-щии; найдено, что стехиометрическом ином выше значении i) 2
3 Глюкоза (см № I) В фосфатном буферном растворе (pH 2,4—3,4) при 50° С (Изучена кинетика реакции) Как указано выше 2, — см. № 2 3
4 Альдозы, например ксилоза, арабиноза, ликсо-за, рибоза, рамноза Изучение реакции при pH 3,5 и при 40° С 4
368
Продолжение
№ Титруемое вещество ц/п Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
_ Окисленная целлюло- ь за — определение фор- мильных групп 6 Альдегиды (например, бензальдегид); сахара 7 Полисахариды (см. № 9) — определение формильных групп 8 Изониазид 9 Полисахариды (см. № 7) — определение формильных групп Ю Анилин; N-метиламин; N-этиламин И Оксин; оксинаты металлов При pH 3,5 (ацетат-нооксалатная буферная смесь); NaC102; оставляют на ночь В фосфатном буферном растворе при различных концентрациях (pH 2—4); в токе азота для удаления С1О2 (Изучена стехиометрия) В фосфатном буферном растворе, при различных концентрациях (pH 2,4— 3,2); при 25—50° С (Изучение кинетики реакции) В разбавленной НС1; избыток NaC102 5 мин Сравнивается ’хло-ритный метод с другими методами, например с гипоиодит-ным, щелочным с использованием Си11 и щелочным с использованием [Fe (CN)0F- В разбавленной НС1; избыток NaC102 и снова НС1; не менее чем 5 мин NaC102—НС1 (образуется 5,7-ди-хлороксин) СЮ2 удаляют током азота, добавляют смесь Г—кислота и титруют тиосульфатом I-—кислота; титруют тиосульфатом Как указано выше 2, — см. № 2 I"; титруют тиосульфатом Г; титруют тиосульфатом Г; титруют тиосульфатом потенциометрически или визуальным методом 5 6 7 8 9 10 11
1.
2.
3.
4.
L au пег H. F., Wils standards, 51, 237 (1953).
Fanner H F banner H. F ’
Wilson W. к
ЛИТЕРА ТУРА
on W. К., Flynn
J. H., J. Research Nat.
Tomimatsu YAnal. Chem., 26, 382 (1954).
T о m i m a t s u Y., J. Am. Chem. Soc., 76, 2591 (1954).
Padgett A. A., Tappi, 38, 292 (1955).
Bur
369
5. S t г о 1 e U., Das Leder, 11, 453 (1957).
6. L a u п е г Н. F., Т о m i m a t s u YAnal. Chem., 31, 1385 (1959).
7. L a u n e r H. F., T о m i m a t s u Y., Anal. Chem., 31 1569 (1959).
8. Spacu P., Dumitrescu H., Analele Univ.' С. I. Parhon', Ser. Stiint Nat., 9, 79 (1960).
9. L a u n e r H. F., T о m i m a t s u Y., Anal. Chem., 33, 79 (1961).
10. Pop a G., Albert F. M., Grig ore E., Z. Anal. Chem., 199, 210 (1963).
II. Spacu P., Gheorghiu C., Paralescu I., Z. Anal. Chem., 195' 321 (1963).
26. СОЕДИНЕНИЯ ХРОМА (II)
Реагент. Хлорид или сульфат хрома (II) в кислом растворе.
Реакция и титруемые вещества. Все методы основаны на восстановлении определяемого вещества. Этим методом определяют преимущественно нитро-, нитрозо- и азосоединения, к числу других определяемых соединений относятся: соли диазония, оксимы, дикетоны, хиноны, ацетилены, галогениды и красители.
Реакции протекают согласно следующим уравнениям:
Сг2+ -> Сг3+ + е
RNO2 + 6Cr2+ + 6Н+ -> RNH2 4- 2Н2О + 6Сгз+
RNO + 4Cr2+ + 4Н+ -> RNH2 + Н2О + 4Сгз+
(AgN sN)+ + 3Cr2+ + ЗН+ -> (AgNHNH8)+ + 3Cr3+
C6H5N (NO) ONH4, очевидно, первоначально восстанавливается до C6H6N (NH2) ONH4, который затем расщепляется на C6H6ONH4 и NH3.
Условия реакции. Большинство реакций протекают весьма быстро, в течение нескольких минут при комнатной температуре. Реакции проводят в атмосфере инертного газа, чтобы предотвратить нежелательное окисление реагента атмосферным кислородом.
Конечная стадия титрования. Во всех случаях избыток Сг11 оттитровывают окислителем. Наиболее часто применяемыми окислителями являются соединения железа (HI), но встречаются также случаи использования в качестве окислителя бихромата.
Таблица 35. Примеры использования соединений хрома (И)
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература^
1 п-Нитроанилин; пикриновая кислота; п-нитро-фенол СгС12; 2—5 мин Избыток реагента оттитровывают Fe”1 (квасцами) 1
2 Метиленовый голубой CrSO4—H2SO4; при 50° С в атмосфере СО2 Избыток реагента оттитровывают Сг2О|— потенциометрически 2
3 Ацетоксим; диметил-глиоксим Сг”; при pH 7—12,4 и 0,8—11,7 соответственно НС1; титруют Fe1” (квасцами) в присутствии SCN"-ионов 3
370
Продолжение
г.'*1 Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
4 Хлороформ; четыреххлористый углерод 1 СгС12—НС1; 20 мин при 80° С и при комнатной температуре соответственно Как указано выше 3, — см. № 3 4
5 Нитросоединения (см. Ns 8, 9); нитрозосоединения (см. № 7, 8); азосоединения; антрахиноны и ацетиленовые соединения, подобные НООС—СнС—СООН CrCl2—НС1; 1—2 мин Как указано выше 3, — см. № 3 5
6 Соли диазония В воде или разбавленной НС1; СгС12— НС1 в атмосфере СО2 не менее 1 мин Титруют Fe111 (квасцами) потенциометрически 6
7 8 9 Некоторые нитрозосоединения (см. № 5), например п-нитрозодиме-тиланилин, аммоний-купферон, N-нитрозо-фенилбензиламин Нитросоединения (см. № 5) и нитрозосоединения (см. № 5), хиноны, хингидрон; бензил (см. № 11) Ароматические нитросоединения (см. № 5); нитрат целлюлозы; циклические нитроамины В разбавленной НО; этанол—НС1 или СН3СООН—НС1; СгС12; 1 мин В некоторых случаях в концентрированной НС1; CrSO4; в атмосфере СО2 В диметилформами-де; НС1 СгС12—НС1; при 70° С Как указано выше6, — см. № 6 Титруют соединениями железа (III) в присутствии SCN~ -ионов Избыток реагента оттитровывают Fe111 (квасцами) в присутствии феносафранина 7 8 9
10 11 Пикролоновая кислота и пикролонаты Красители (такие, как оранжевый II, тартра-зин); азооксибензол; пропиолиновая кислота; диацетил; бензил (см. № 8) В разбавленной H2SO4; CrSO4 в 10% -ном избытке; 2 мин при 55—60° С Обычно реакция протекает в воде, в уксусной кислоте или 95% -н ом этаноле, свободных от содержания растворенного кислорода; НС1; избыток СгС12; 1—2 мин Избыток реагента оттитровывают FeCl3 в присутствии сафранина Т или нейтрального красного Избыток реагента оттитровывают Fe111 10 11
371
ЛИТЕРА ТУРА
1. Someya К., Z. anorg. u. allgem. Chem., 161, 293 (1928).
2. Davidson G. F., Shirley Inst. Mem., 21, 29 (1947).
3. Kiba T., Yamazaki Y., J. Chem. Soc. Japan, Pure Chem. Sect. 74
808 (1953). ’
4. К i b a T., T e r a d a K., J. Chem. Soc. Japan, Pure Chem. Sect., 75, 10c (1954).
5. В о 11 e i R. S., Furman N. H., Anal. Chem., 27, 1182 (1955).
6. В о t t e i R. S., Furman N. H., Anal. Chem., 29, 119 (1957).
7. Bottei R. S., Furman N. H., Anal. Chem., 29, 121 (1957).
8. Tan don J. P., Z. anal. Chem., 167, 184 (1959).
9. Selig W., U. S. At. Energy Comm., UCRL, 6639, 20 (1961).
10. Dworzak R., Krause H., Friedrich P., Ann., 653, 12 (1962). 11. Bottei R. S., Anal. Chim. Acta, 30, 6 (1964).
27. СОЕДИНЕНИЯ МЕДИ (I)
Реагент. В качестве реагента применяют CuCl и Си’-ионы, образующиеся в процессе восстановления ионов Си11. В качестве восстановителей в этом случае используют сульфит и гидроксиламин. Смесь Си”—NH2OH—NH4OH представляет собой хорошо известный реагент Илосвая (используемый для обнаружения ацетиленового водорода).
Реакции и титруемые вещества. 1. Реакция замещения атомов водорода при определении содержания ацетиленов и мочевой кислоты (эту реакцию вполне можно рассматривать как реакцию ионного обмена):
RChCH -j- Cu+ -> RC-CCu 4- Н+
C5H4N4O3 + Cu+ -> C5H3N4O3Cu 4- H+
Полученные производные отделяют в виде осадков.
2. Реакция замещения ионов брома при определении содержания бромацетиленов:
RCsCBr 4- 3Cu+ -> RC=CCu 4- 2Cu2+ 4- Br~
и затем
RC=CCu 4- RC=CBr -> (RC=C—)2 4- Cu+ 4- Вг-
S. Реакция комплексообразования, например с метразолом, в результате которого образуется нерастворимое вещество, отвечающее формуле C6H10N4-2CuC1.
Соответствующая обработка и конечная стадия титрования-1. В большинстве случаев растворяют осадок, образующиеся при этом Си’-ионы окисляют до Си”, например:
а) с помощью Fe”1 и последующего титрования образующихся Ре2+-ионов перманганатом (обычная методика, используемая для определения ацетиленидов); И
б) с помощью таких окислителей, как HNO3 или Н2О2, и п0’ следующего определения содержания Си” титрованием этилен диаминтетрауксусной кислотой или путем добавления иодида (ил
372
Таблица 36. Примеры использования соединений меди (I)
м п/п —— Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Л итература
—— 1 Мочевая кислота (см. № 2) в моче У ксусная кислота; Си11—(NH4)2SO3; отстаивают 30 мин [образуется урат меди (I)] Фильтруют; нагревают аликвотную часть фильтрата с H2SO4 и определяют содержание Си11 с помощью смеси Г —уксусная кис лота; выделившийся иод оттитровывают тиосульфатом 1
2 Мочевая кислота (см. № 1) CuSO4—щелочь— тартрат—N aHSO3; отстаивают 5 мин [образуется урат меди (I)] Фильтруют; осадок растворяют в H2SO4 и титруют перманганатом 2
3 Ацетилен (см. № 5, 7) CuCl—NH4C1— NH2OH; встряхивают несколько минут Фильтруют; растворяют осадок в смеси Fein—H2SO4 и оттитровывают Fe2+ -ионы перманганатом [см. «Соединения железа (III), литература 1] 3
4 Фенилацетилен В спирте; CuCl— NH4OH—NH20H; встряхивают несколько минут Растворяют осадок в смеси Fe111 — H2SO4 и титруют перманганатом 4
5 Ацетилен (см. № 3) В воде; CuSO4— NH4OH—NH2OH; встряхивают 2—3 мин Фильтруют; растворяют образовавшийся осадок Си2С2 в HN03 и определяют содержание Си11 путем добавления смеси I- —SCN- и последующего титрования выделившегося иода тиосульфатом 5
6 Метразол (QH10N4) (кардиазол, лептазол) (см. № 8) В воде; CuCl; встряхивают 3 ч (образуется осадок комплексного соединения CeH10N4 2CuCl) Фильтруют; добавляют к фильтрату Н2О2, кипятят 10 мин и определяют содержание Си11 путем добавления 1~ и последующего титрования выделившегося иода тиосульфатом 6
373
Продолжение
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования —'——-Лите-рату-ра
7 Ацетилен (см. № 3), полученный из Cu2Cs при обработке его KCN Переводят с помощью азота в смесь Си (NO3)2—nh4oh— nh2oh Фильтруют; осадок растворяют в НС1 и в конечном итоге определяют содержание Си11 путем добавления 1“ и последующего титрования выделившегося иода тиосульфатом 7
8 Метразол (см. № 6) В воде; CuCl; 1 ч при комнатной температуре (образуется осадок комплексного соединения) Фильтруют; осадок растворяют в НС1, окисляют Н2О2 и в конечном итоге оттитровывают Си11 этилендиаминтетра-уксусной кислотой в присутствии мурексида Добавляют HNO3; Вг' -ионы оттитровывают раствором AgNO3 8
9 Бромацетилены RC=CBr • CuSO4—NH2OH— этиламин—метанол— водный раствор реагента; 5 мин 9
I"—SCN-) и последующего титрования выделившегося иода тиосульфатом.
2. После реакций замещения брома проводят титрование Вг“-ионов AgNOg.
3. Содержание непрореагировавших Си+ -ионов в фильтрате определяют с помощью методов, описанных выше (см. п. 1).
ЛИТЕРАТУРА
1. Repiton F., Revue generale de chim. pure et appl., 11, 285 (1908).
2. Pegu r i er G., Repert. pharm., 32, 65 (1920).
3. Willstatter R., Maschmann E., Ber., 53, 939 (1920).
4. H e i n F., Meyer A., Z. anal. Chem., 72, 30 (1927).
5. В о p о н к о в М. Г., Ж. аналит. химии, 1, 285 (1946).
6, S h а г р L. К., J. Pharm. Pharmacol., 4, 52 (1952).
7, Поляков Н. Н., Ж. аналит. химии, 8, 302 (1953).
8. Paulsen A., Medd. Norsk Farm. Selskap, 18, 139 (1956).
9. Chodkiewicz W., C a d i о t P., Bull. soc. chim. France, 298 (1959).
28. СОЕДИНЕНИЯ МЕДИ (П)
Реагент. Большинство реагентов двухвалентной меди готовят на основе сульфата меди(П), изредка применяют ацетат и хло| рид меди(П).
374
Реагенты двухвалентной меди, обладающие окислительными -Ствами и используемые для определения содержания редуци-СБ° щих сахаров, в большинстве своем имеют щелочную реакцию. W приготовления такого рода реактивов применяют главным боазом гидроокиси или карбонаты щелочных металлов. При иссле-°ованиях реакции проводили при различных значениях pH, для этого использовали щелочные буферные растворы; в качестве компонентов буферных смесей чаще всего используют СО1--, НСОГ-, а также фосфат-ионы. Устойчивость Си11 в растворе обеспечивают добавлением полиокси соединений, оксикислот или других комплексообразующих агентов; например, для этой цели были использованы: глицерин, маннит, тартрат, цитрат, лактат, триоксиглютарат, салицилат, сульфосалицилат, триэтаноламин и этиленди-аминтетрауксусная кислота (при этом поддерживалась высокая концентрация щелочи). Обычно составные части реактива хранят в отдельных склянках и смешивают вместе лишь непосредственно перед использованием.
Помимо реагента могут быть добавлены и другие вещества, участвующие в последующих стадиях определения [например, иодид, иодат, сульфаты щелочных металлов, используемые для уменьшения растворимости кислорода воздуха в растворе; тиоцианат или гексацианоферрат (II), используемые для предотвращения образования красного осадка Си2О1, однако указанные вещества можно добавлять лишь после стадии окисления.
Для ряда реакций окисления и большинства реакций осаждения предпочтительнее использовать нейтральные или слабокислые растворы реагента.
В тех случаях, когда компонент, подлежащий определению, реагирует с образованием растворимого в воде производного, в качестве исходного реагента используют суспензию гидроокиси меди(П) или, чаще, фосфат ее.
Реакции и титруемые вещества. 1. Окисление — восстановление, сопровождающееся образованием Си1, обычно в виде Си2О. Часть примеров, на которые даются ссылки, представляют собой определения гексоз; продукты реакции при таком окислении зависят °т условий реакции, и хотя основную реакцию можно представить как реакцию окисления альдегидной группы до карбоновой кислоты, стехиометрия реакции обычно более сложна. По этой причине определения проводят при стандартных значениях pH, температуры продолжительности реакции, путем сравнения с контрольным трованием, осуществляемым в аналогичных условиях.
так дРУг°й группе определений относятся определения альдегидов, Их> как муравьиный альдегид, акролеин, хлораль и фурфурол:
RCHO + 2Cu2+ + Н2О -> RCOOH + 2Cu+ + 2Н+
°киспД Различных соединений также может быть определен путем лота еНИЯ (напРимеР> некоторые аминокетоны, аскорбиновая кис-
> мочевая кислота, ацетат и пенициллин). Могут быть также
375
проведены титриметрические измерения «восстанавливающей способности» или «восстановительного числа» растворов (главным образом полисахаридного происхождения).
2. Реакция ионного обмена, в результате которой образуются либо нерастворимые производные меди(Н) из растворимого реагента, либо растворимые производные из нерастворимого реагента. Ниже приведены примеры реакций ионного обмена со следующими ионами или группами:
RCOO“ — манделат, n-аминобензоат, глюконат, цитрат, карб-оксиметилцеллюлоза, окисленный крахмал, антранилат, образующие нерастворимые соли меди(П);
NH 2-группа а-аминокислот, реакции сопровождаются образованием хелатных растворимых солей меди (II):
/ООО- /СОО^ h2n
2RCH +Cu2+->RHC Си CHR
\nH2 4NH2/rX'OOC/
RSO? — ряд сульфокислот;
ArO- — пикриновая кислота (в присутствии аммиака), реагирующая с образованием нерастворимой медноаммиачной соли Си (NH3)4 [ОС6Н2 (NO2)31;
RS — ксантаты и меркаптаны (в последнем случае происходит также окисление): 4RSH + 2Cu2+ —» RSSR + 2RSCu + 4Н+; RR'N~ — барбитал.
3. Реакция замещения подвижных атомов водорода, сопровождающаяся образованием растворимых или нерастворимых в воде производных меди. Отличие этих реакций от описанных выше (п. 2) весьма незначительно. К реакциям замещения относятся отдельные реакции таких полиокси соединений, как маннит, глицерин, сорбит и т. д., когда едва ли можно предположить существование органического соединения в качестве аниона. Сюда можно также отнести определение содержания енолов, таких, например, как |3-дикарбо-нильные соединения, а также тартраты:
4. Реакции комплексообразования с основаниями (В) сопровождаются образованием гетероциклических соединений. Определение содержания пиридина, изоанизида и анилина проводится в присутствии SCN--ионов, при этом образуются нерастворимые в воде комплексные соединения CuB2 (SCN)a. Хинин и пиперазин осажда1ОТ
376
исутствии других анионов, но катион снова представляет собой ® „р.пекс Си2+ —В (где В — основание).
"° условия реакций. Определение содержания редуцирующих саха-и ряда других восстанавливающих веществ, как правило, пропят при относительно высоких температурах, при этом продол-Б^1тельность реакции может колебаться от 2 до 30 мин при кипении ^яствора и в течение 2,5 ч при температуре около 50° С.
Р как правило, реакции типа 2, 3 и 4 проводят при комнатной температуре, иногда в присутствии органических растворителей. Сообщение об исследовании кинетики окисления сахаров щелочными растворами солей меди(П) содержится в работе188, а о влиянии концентрации Си11 и сегнетовой соли на определение редуцирующих сахаров в работе 189.
Соответствующая обработка и конечная стадия титрования. Почти во всех анализах заключительной стадией определения является титрование Си+- или Си2+ -ионов.
1. Определение содержания непрореагировавшей Си” проводят обычно после отфильтровывания осажденного производного меди. При этом используют два основных метода.
1) Метод прямого титрования Си” с использованием таких реагентов как:
Sn” (до исчезновения голубой окраски);
Сг” (в присутствии нейтрального красного индикатора или феносафранина);
CN- (до исчезновения голубой окраски);
NH2OH (до исчезновения голубой окраски);
ЭДТА, этилендиаминтетрауксусная кислота [в присутствии мурексида или 1-(2-пиридилазо)-нафтола];
Гидрохинон (потенциометрический метод).
2) Метод обратного титрования, в большинстве случаев путем добавления смеси (~ — кислота и последующего титрования выделившегося иода тиосульфатом
2Cu2+ + 41- | 2CuI + 12
Указанный метод применяют наиболее часто для определения содержания Си”. В одной из работ иод был оттитрован Эп2+-ионами.
Иногда вместо (--ионов применяют ЭСЬД-ионы; получаемое преимущество в том, что тиоцианаты стоят дешевле и, кроме того, oiSCN приблизительно в 10 раз менее растворим, чем Cui (см. например, литературную ссылку 31).
одной из описываемых работ была использована смесь I"— тиосульфат, избыток тиосульфата оттитровывают иодом.
Определение продукта реакции, содержащего медь. Таким РоДуктом может являться либо производное органического соединение) eg I1™0 РаствоРимое или нерастворимое хелатное соеди-обыч (“)пР.еделение содержания органического производного меди(П) но осуществляют с помощью указанных выше методов (п. 1),
377
в большинстве из которых предусматривается прямое титрование ЭДТА или же косвенное титрование смесью I- — кислота.
2)- Определение содержания меди(1), образующейся по реак-ции типа (1). Для такого определения используют следующие четыре основных метода.
а) Метод прямого титрования в небольшом числе случаев, например, иодом или СггО?-;
б) Добавление измеренного избытка окисляющего агента и обратное титрование непрореагирова'вшей его части. В качестве окисляющих реагентов используют следующие вещества (во второй колонке указаны реагенты, применяемые для обратного титрования избытка исходного реагента):
CeIV Иод Ю? —
AgN03
Fe11 в присутствии ферроина
Тиосульфат
Тиосульфат [в ряде случаев Ю^~ и (или) 1“ содержатся в первоначальном реагенте] SCN-
в) Окисление Си1 до Си11 с последующим определением образующейся Си11. В качестве окисляющих агентов используют бром, гипохлорит, перманганат и азотную кислоту. Заключительное титрование Си11 основывается на ряде методов, уже описанных выше, в пункте 1, т. е. на методах прямого титрования CN--ионами или ЭДТА или на методах обратного титрования, основанных на добавлении смеси 1“ — кислота и последующем титровании выделившегося иода тиосульфатом;
г) Окисление Си1 до Си” и последующее определение содержания восстановленной части реагента. Ниже приведен ряд примеров:
~ „ Продукт восстановления,
Окисляющий агент - f
образующимся при окислении Си*
Fe111 Fe11
CeIV Сеш
Vv (ванадат) Vlv
CrVI (бихромат) Cr111
MoVI (молибденофосфат или ар- Mo111 сенат)
(обратное титрование стандартными растворами реагентов типа МпО^-, Cr2Oj—, BrOJ" или CeIV)
д) Один из примеров определения, не рассмотренный выше, основан на растворении Си2О в смеси H2SO4—Н2О2:
Cu2O + Н2О2 + 2H2SO4 -> 2CuSO4 + ЗН2О
и обратном титровании избытка кислоты.
При проведении указанных выше определений Си’ почти всегда содержится в виде Сп2О.
Более чем в половине примеров Си2О отделяют путем фильтро-вания или центрифугирования, а затем проводят определение, однако это не всегда необходимо.
378
Таблица 37. Примеры использования соединений меди(П)
№ п'п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
1 Сахар (см. № 3, 22, 26, 28 36, 40, 47, 49, 51, 52’ 55, 64, 76, 129, 141, а также № 4, 12, 25) CuSO4 — щелочь — тартрат; нагревают Осадок Си2О растворяют в растворе FeCl3 и образовавшееся Fe11 оттитровывают перманганатом I
2 Мочевая кислота (см. № 8) CuSO4 — щелочь; кипятят Избыток Си11 определяют путем прибавления смеси Г — НС1 и последующего титрования образовавшегося иода SnCl2 2
3 Сахар (см. № 1) CuSO4 — щелочь — тартрат; нагревают Сп2О растворяют в растворе Fe2 (SO4)3 и образовавшееся Feii оттитровывают перманганатом 3
4 Сахара (см. Ns 1, 5—7, 9—11, 14, 15, 21, 27, 29, 39, 42, 48, 59, 62, 69, 80, 84, 86, 88, 89, 93, 96, 98, 100, 102, 104, 108, 119, 124, 126, 147, 155, 160, 161, 164, 172, 177, 196, 202, а также № 1, 12, 25) Щелочной раствор меди(П); нагревают Сп2О растворяют в HNO3 и образовавшуюся Си11 оттитровывают цианидом до исчезновения голубой окраски 4
5 Глюкоза (см. № 31) и другие сахара (см. № 4) Щелочной раствор меди (II); нагревают Сп2О кипятят со смесью НС1—NaCl и титруют перманганатом 5
6 Сахара (см. № 4) (Испытан метод, предложенный выше 4, — см. № 4) 6
7 Сахара (см. Ns 4) CuSO4 — щелочь — тартрат; нагревают Си2О растворяют в HNO3; образовавшуюся Си11 восстанавливают SO2 до Си1, которую осаждают в виде CuSCN избытком NH4SCN, который оттитровывают Ag*; не вошедшую в реакцию Си11 в фильтрате, после отделения Си2О, определяют таким же способом 7
379
Пpoi?O43^eW(ie 1
№ Титруемое вещество Реагент и условия Соответствующая об- Лите-
п/п реакции работка и конечная стадия титрования рату. Ра
8 Мочевая кислота (см. № 2) CuSO4 — щелочь — тартрат; кипятят 5 мин Сп2О растворяют в HNO3; частично HNO3 нейтрализуют Na2CO3, затем добавляют I- — H2SO4 и титруют тиосульфатом -— 8
9 Сахара (см. № 4) в сладких винах Щелочной раствор меди(П) Сп2О растворяют в HNO3, добавляют NH4OH и титруют цианидом до исчезновения голубой окраски 9 I
10 Сахара (см. Ns 4) CuSO4 — щелочь — тартрат Сц2О растворяют в HN03, образовавшуюся Си11 восстанавливают so|“ до Си1, затем добавляют избыток SCN- , который оттитровывают Ag+ 10 1
И Сахара (см. Ns 4) CuSO4 — щелочь — тартрат; кипятят 2 мин К фильтрату добавляют Г" — H2SO4 и титруют тиосульфатом 11
12 Инвертный сахар (см. Ns 19, 33, 43, 45, 46, 92, 109, 128, 149, 200, 205, а также Ns 1,4, 25) CuSO4 — щечочь — тартрат; кипятят Избыток Си11 оттитровывают SnCl2 до исчезновения голубой окраски 12 I
13 Декстроза (см. Ns 91, 110); фруктоза (см. Ns 44, 67, 71, 94, 137, 153, 180, 195) CuSO4 — глицерин — цитрат—избыток щелочи; кипятят 5 мин В фильтрате избыток щелочи оттитровывают НС1 или H2SO4 в присутствии фенолфталеина 13 1
14 Сахара (см. № 4) CuSO4—КНСОз— К2СО3—KSCN; кипятят 3 мин Избыток Си11 оттитровывают гидроксиламином до исчезновения голубой окраски
15 Сахара (см. Ns 4) CuSO4—NaOH —тартрат; кипятят 3 мин Осадок Си2О растворяют в растворе соли железа(Ш) и образовавшееся Fe11 оттитровывают перманганатом /5 1 /6 I
16 Ксантогенат, образующийся из CS2 при его определении в присутствии щелочь—спирт Игбьток ацетата меди (II); уксусная кислота; 15 мин при комнатной температуре Избыток Си11 определяют иодометрически
380
Продолжение
Титруемое вещество !'" ____________________
7 фурфУРол (см- № 20> 79> *' 95), обраэуёмый при ки-
слотном гидролизе при определении пентоз
о Глицерин (см. № 78, 101, Ю6, 112, 144)
19
Глюкоза (см. № 31); лактоза (см. № 34, 37, 53, 65, 66, 72, 165); маль-гоза (см. № 34, 91); инвертный сахар (см. № 12)
20 Фурфурол (см. № 17)
21 Сахара (см. № 4)
22 Сахар (см. № 1), например в крови
23
24
25
Аминокислоты (см.
№ 105, 115, 122, 134, 140, 148, 167, 175, 207) в крови, моче, протеиновых гидролизатах
Маннит (см. № 83, 101, 154)
Редуцирующие сахара (см. №35, 58, 61, 73, 74, 90, 97, 111, ИЗ, Ц4 Н6, 120, 121, 125, 130, 132, 133, 139, 143, 146, 152, 169, 170, 187, 188, 212, 214, а также № 1, 4, 12)
26
Сахар (см. № 1) в кро-ви и моче
Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
Дистиллят; CuSO4 — щелочь—тартрат; кипятят 35 мин Как указано выше,— см. № 16 17
CuSO4—NaOH; выдерживают 12 ч [образуется растворимое соединение меди (II)] К аликвотной части прозрачного раствора добавляют Г —H2SO4; титруют тиосульфатом 18
CuSO4—К2СО3 — салициловая кислота; 20 мин при 100° С Осадок Си2О растворяют в HNO3, нитрит окисляют NaOCl, избыток реактива разлагают фенолом, добавляют I" и титруют тиосульфатом 19
(Комментируется метод, описанный выше17,— см. № 17. Указывается, что восстановительная способность зависит от концентрации) 20
CuSO4—NaOH — Избыток Си11 опре- 21,
тартрат; кипятят 10 мин деляют иодометрически 25
CuSO4—КНСО3— К2СО3—КС1; кипятят 3 мин Си1 (находящаяся в растворе в виде CuCl) оттитровывают иодом в присутствии крахмала 22
Нейтральный рас- В фильтрате Си11 23,
твор; боратная буферная смесь, при pH 7—9; Си (ОН)2; встряхивают 2— 3 мин (Метод описан выше 18 — см. № 18) определяют иодометрически в уксусной среде 26 24
CuSO4—NaOH — тартрат; кипятят 2 мин Си2О растворяют в растворе соли железа (III) и образовавшееся Fe11 оттитровывают перманганатом или к фильтрату добавляют Г —H2SO4 и титруют тиосульфатом 27
CuSO4 — щелочь — тартрат; нагревают Си2О растворяют в растворе соли желе-за(Ш) и титруют перманганатом 28
381
Продолжен^
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Лите-Рату. Ра
27 Сахара (см. № 4) CuSO4— NaHCOg— N а2СО3—цитрат; кипятят 3 лшн НС1; уксусная кислота; иод, избыток которого оттитровывают тиосульфатом 29
28 Сахар (см. № 1) в крови CuSO4— KHCOg— К2СО3—КС1; кипятят 3 мин Си1 титруют в атмосфере СО2 иодом в присутствии крахмала 30
29 Сахара (см. № 4) CuSO4 — щелочь — тартрат; кипятят 2 мин Г—SCN~; НС1 или H2SO4; выделившийся иод оттитровывают тиосульфатом 31, 32
30 Енолы (см. № 32, 138) (Указывается, что метод, описанный ниже ЗБ, — см. № 32, применим только к ^ис-енолам) 33 |
31 Глюкоза (см. № 5, 19, 41, 50 , 54, 56, 57, 63, 68, 70, 81, 82, 127, 136, 142, 151, 156, 171, 176, 181, 186, 201, 210) CuSO4—Na2CO3 — тартрат; 6 мин при 100° С, затем добавляют MgSO4— Na2CO3 и еще 1 мин при 100° С Мол и бденофосфор-ная кислота, которая восстанавливается до Мо111 синего цвета; титруют перманганатом 34
32 Енолы (см. № 30), например бензоилацетон, ацетоуксусный эфир В спирте; ацетат меди—этанол— СНС13; при —10° С Вода; енолхелат меди, экстрагируемый неводным растворителем, смешивают с 1“ —HjSC^ и титруют тиосульфатом 35
33 Инвертный сахар (см. № 12) К раствору, доведенному ДО ТОЧКИ кипения, прибавляют кипящую смесь CuSO4—Na2CO3 — тартрат; кипятят 10 мин НСГ, иод, прибавляемый для окисления Сн2О; избыток иода оттитровывают тиосульфатом 36
34 Мальтоза (см. № 19), лактоза (см. № 19) в присутствии других сахаров Ацетат меди—ацетат натрия—NaOH; или ацетат меди— CuSO4—NaOH — тартрат (отличаются различной окислительной силой) Си2О растворяют в растворе соли железа(Ш) и титруют перманганатом 37
35 Редуцирующие сахара (см. № 25) CuSO4—NaOH — тартрат; 30 мин при 80° С Си2О определяют по методу, описанному выше 19 — см. № 19 38
382
J
Продолжение
Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
36 37 38 39 40 41 42 43 44 45 Сахар (см. № 1) в крови, моче и др. Лактоза (см. № 19) в молоке Пиридин (см. № 162) Сахара (см. № 4) Сахар (см. № 1) в крови Глюкоза (см. № 31) Сахара (см. № 4) в биологических жидкостях Инвертный сахар (см. № 12) в присутствии сахарозы Фруктоза (см. № 13) (в присутствии альдоз) Иивертиый сахар (см. CuSO4—NaOH — тартрат (и другие реагенты) (Метод описан выше за — см № 3Q Избыток Си11 и SCN-, [образуется осадок Си (C5H5N)2 (SCN)2] CuSO4—NaOH — тартрат; нагревают 5 мин CuSO4—НСО^— СО|——тартрат— 1-—10Г; кипятят 90 сек CuSO4—NaOH — тартрат; 6 мин при 100° С CuSO4 — щелочь — тартрат CuSO4—NaOH — тартрат; кипятят 2 мин CuSO4—К2СО3— КНСО3; 2,5 ч при 48,5—49G С или 20 мин при 100° С, или 5 мин при кипячении CuSO4—Na2CO3 — тартрат Си2О определяют путем прибавления смеси —I-— H2SO4 — оксалат; выделившийся иод оттитровывают тиосульфатом; или избыток Си11 определяют иодометрически Избыток Си11 в фильтрате определяют иодометрически Щавелевая кислота — иод, избыток которого оттитровывают тиосульфатом НО; титруют тиосульфатом Си2О растворяют в молибденофосфор-ной кислоте, которая восстанавливается до Мо111, и титруют перманганатом Си2О растворяют в растворе Fe2 (SO4)3 и титруют перманганатом Избыток Си11 определяют путем прибавления Г —H2SO4 и последующего титрования выделившегося иода тиосульфатом Си2О растворяют в растворе соли железа(Ш) и оттитровывают образовавшееся Fe11 перманганатом Щавелевая кислота; иод, избыток которого оттитровывают тиосульфатом 39 40 41 42 43 44 45 46 47 48
383
Р‘’5олясрН,
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Ли,, Р PJ
46 Инвертный сахар (см. № 12) в присутствии сахарозы CuSO4—Na2CO3 — цитрат; кипятят 5 мин Избыток Си11 определяют путем прибавления 1“ H2SO4 и последующею титрования тиосульфатом 49
47 Сахар (см. № 1) в крови CuSO4—Na2CO3 — тартрат—1——Ю3, 15 мин при 100° С H2SO4; выделившийся иод оттитровывают тиосульфатом 50
48 Сахара (см. № 4) CuSQj—NaOH — тартрат Сн2О растворяют в IOIf—со|~—НС1 (образуется СО2), затем • добавляют оксалат — Г, выделившийся иод оттитровывают тиосульфатом 51
49 Сахар (см. № 1), например в крови CuSO4—NaOH — цитрат Си2О растворяют в растворе железа (!!!) и образовавшееся Fe11 оттитровывают броматом потенциометрически 52
50 Глюкоза (см. № 31), например в крови CuSO4—со|~— тартрат—оксалат— НСО^—!“—!О~ при pH 9,4—9,55; 15 мин при 100° С H2SO4; выделившийся иод оттитровывают тиосульфатом 53
51 Сахар (см. № 1) в моче CuSO4—NaOH — тартрат; кипятят 2 мин Г —SCN- —НС1; выделившийся иод оттитровывают тиосульфатом 54
52 Сахар (см. № 1) в крови (Метод описан выше 34 — см. № 32) 55
53 Лактоза (см. № 19) CuSO4 — щелочь — тартрат; нагревают Си2О растворяют в молибденофосфор-ной кислоте и образующийся Мо111 оттитровывают перманганатом 56
54 Глюкоза (см. № 31) CuSO4 — концентрированная NaOH; 15 мин при 100° С Как указано выше — см. № 53 i)l
384
Продолжение
Xs п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
55 Сахар (см. № 1) в разбавленных растворах CuSO4—NaOH — тартрат; кипятят 2 мин Сп2О растворяют в Na2SO4—NH4OH добавляют избыток AgNO3, при этом образуется Си111; избыток Ag+ оттитровывают тиоцианатом 58
56 Глюкоза (см. № 31) CuSO4—NaOH — тартрат; нагревают Си2О растворяют в Н2О2; избыток ^80,(61^0 + + Н2О2-|- 2Г48О4-* -> 2CuSO4 + ЗН2О); избыток кислоты оттитровывают NaHCO3 в присутствии метилового оранжевого 59
57 Глюкоза (см. № 31) Щелочной раствор соли меди (II); нагревают Избыток Си11 в фильтрате оттитровывают цианидом до исчезновения голубой окраски 60
58 Редуцирующие сахара (см. № 25) CuSO4—NaOH — тартрат; нагревают Си2О растворяют в НС1— NaCl—MnSO4 и окисляют перманганатом до Си11, которую определяют иодометрически 61
59 Сахара (см. № 4) CuSO4—Na2CO3— Na2HPO4 -тартрат; нагревают I- _ SCN" —НС1: выделившийся иод оттитровывают тиосульфатом 62, 66
60 Формальдегид (см. № 118), образующийся при кислотном гидролизе уротропина в процессе его определения CuSO4—NaOH — тартрат; нагревают Си2О растворяют в растворе Fea (SO4)3; образующееся Fe11 оттитровывают перманганатом 63
61 Редуцирующие сахара (см. № 25) CuSO4—NaOH — тартрат; нагревают Си2О растворяют в молибденофосфор-ной кислоте, образующийся Мо111 оттитровывают перманганатом 64
62 Сахара (см. № 4) CuSO4—Na2CO3 — цитрат; кипятят 10 мин Избыток Си11 определяют путем прибавления Г —H2SO4 и последующего титрования тиосульфатом 65
Р. Ф. Эшворт
385
13
продолжение
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования •Пит^. рагу. Ра
63 Моносахариды (см. № 77) CuSO4 — ацетат Си2О растворяют 67
64 [например, глюкоза (см. № 31), галактоза] в присутствии лактозы Сахар (см. № 1) в кро- натрия—уксусная кислота; 6,5 мин при 100° С CuSO4—NaaCO3 — в растворе Fes (SO4)3; образовавшееся Fe11 оттитровывают перманганатом Си2О растворяют 68
65 ВИ и т. п. Лактоза (см. № 19) в мо- тартрат; 15 мин при 100° С CuSO4—NaOH - в 1“—Ю^“— оксалат — HaSO4, выделившийся иод оттитровывают тиосульфатом Си2О растворяют 69
66 локе Лактоза (см. № 19) в мо- тартрат; кипятят 6 мин CuSO4—NaOH - в HNO3, нитрит окисляют смесью бромат—бромид, добавляют аммиак, кипятят; Си11 определяют йодометрическим методом НС1—NaCl для рас- 70
67 локе и шоколаде, сахароза гидролизованная в кислом растворе (см. № 92) Фруктоза (см. Ns 13) тартрат; кипятят 5 мин CuSO4—N^COj — творения Си2О; добавляют NaHCO3 и иод, избыток которого оттитровывают тиосульфатом 1~—Ю~—H2SO4; 71
68 Глюкоза (см. № 31) цитрат; кипятят 10 мин CuSO4—КОН— тар- выделившийся иод оттитровывают тиосульфатом Си2О растворяют 72 1
69 Сахара (см. № 4) трат (Изучался эффект от различной концентрации щелочи) CuSO4—N а2СО3— в растворе соли железа(Ш) (квасцах); титруют перманганатом НС1 и иод, избыток 73,
70 Глюкоза (см. Ns 31) Na2HPO4— тартрат; кипятят 5 мин CuSO4—NaOH - которого оттитровывают тиосульфа- том Титруют гидроксил- 78, 79 74
71 Фруктоза (см. № 13) тартрат— К4 [Fe (CN)e]; ки пятят 2 мин (1 молекула глюкозы эквивалентна 4 атомам кислорода) CuSO4—К2СО3— аминсульфатом до исчезновения голу бой окраски или в присутствии внешнего индикатора реактива Несслера Си2О растворяют 75
КНСО3; 75 мин при 55° С в НС1; Си1 определяют титрованием бихроматом
Продолжение
к« п/п 72 73 74 75 76 77 78 79 80 Титруемое вещество Реагент н условия реакции Соответствующая об* работка и конечная стадия титрования Литература
Лактоза (см. № 19) в молоке и молочных продуктах Редуцирующие сахара (см. № 25) Редуцирующие сахара (см. № 25) Ацетат Сахар (см. № 1) в крови и т. п. Моносахариды (см. № 63) в присутствии дисахаридов Акролеин, образуемый из глицерина (см. № 18) при его определении нагреванием с большим избытком Фурфурол (см. № 17), образующийся при кислотном гидролизе пентозанов (см. № 132) Сахара (см. № 4) CuSO4—NaOH — тартрат; кипятят 6 мин (Изучался метод, oni см. № 36; фактор в и т. CuSO4—NaOH — тартрат; 20 мин при 62—63° С КОН—СиО; 10— 15 мин при 220— 240° С (образуется оксалат) Уравнение реакции: СН3СОО- + 6CuO + + он-->с2О4— + + 3Cu2O + 2Н2О CuSO4—Na2CO3 — тартрат — IO^; немного NaHCOg и I"; 15 мин при 100° С (Изучались факторы, опреде. CuSOa — ацетат; 20 мин при 100° С Перегоняют током С02 в CuSO4—NaOH — тартрат CuSO4—NaOH — тартрат CuSO4—NaOH — тартрат Щавелевая кислота и иод, избыток которого оттитровывают тиосульфатом иаиный выше зв, — эемени, температуры Д) Избыток Си11 определяют иодометрически в декантированном от Сн2О растворе Осадок растворяют в воде, подкисляют и оттитровывают перманганатом H2SO4 или H2SO4 — оксалат; выделившийся иод оттитровывают тиосульфатом влияющие на процесс пения) В горячий раствор добавляют H2SO4 и иод, избыток которого оттитровывают тиосульфатом Си2О растворяют в растворе соли железа(Ш) и образовавшееся Fe11 оттитровывают перманганатом Как указано выше, — см. № 78 Си2О растворяют в растворе Се (SO4)2, избыток которого оттитровывают FeSO4 в присутствии ферроина 76 77 80 81 82 83 84 85 86
2g*
387
Продолжение
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка н конечная стадии титрования Лите, Рату. Ра
81 Глюкоза (см, № 31) CuSO4—NaOH — тартрат Си2О растворяют в растворе соли железа (III), образовавшееся Fe11 оттитровывают бихроматом в присутствии дифениламина в кислой среде 87
82 Глюкоза (см. № 31) CuSO4 — ацетат — уксусная кислота — тартрат; кипятят 5 мин (Изучались факторы, определения, — врем и д Си2О растворяют в NaCl — кислота — тартрат; нейтрализуют NaHCOg и титруют иодом влияющие на процесс я, концентрация Си11 Р-) 88
83 Маннит (см. № 24) (Метод, описанный выше 24, — см. № 24) 89
84 Сахара (см. № 4) CuSO4—NaOH — тартрат Большой избыток KI—НС1, прибавляемый до pH 2—3,2; выделившийся иод оттитровывают тиосульфатом 90
85 Пикриновая кислота CuSO4—NH4OH (образуется нерастворимый медно-ам-мойный пикрат) Избыток Си11 определяют иодометрически 91
86 Сахара (см. № 4) Щелочной раствор соли меди(П) Уравнение реакции: 2Cu2+ + 2SCN- + + 2S2O^ ->2CuSCN + S4O|- Избыток Си11 определяют путем добавления смеси аце-цат—уксусная кислота — избыток тиосульфата — I" —SCN' непрореагировавший тиосульфат оттитровывают иодом 92
87 б-Сульфоиовые кислоты, образующиеся при расщеплении жиров В воде; избыток CuSO4 [образуется нерастворимая соль меди(П); у-кислоты дают растворимые соли] Избыток Си11 в фильтрате определяют иодометрически 93
88 Сахара (см. № 4) CuSO4—NaOH — тартрат Си2О растворяют в HNO3; AgNOg, избыток которого оттитровывают тиоцианатом 94
388
Продолжение
Jw П/п
89
90
91
92
93
94
95
96
97
Титруемое вещество
Сахара (см. № 4) в био-л0П" еских жидкостях
Редуцирующие сахара (см. № 25)
Декстроза (см. № 13); декстроза и мальтоза (см. № 19), подвергшиеся кислотному гидролизу
Инвертный сахар (см. № 12); сахароза (см. № 66)
Сахара (см. № 4)
Фруктоза (см. № 13)
Фурфурол (см. № 17), образующийся при кислотном гидролизе пентозанов
Сахара (см № 4)
Редуцирующие (см. № 25)
сахара
Реагент н условия реакции
CuSO4—СО3 — тартрат — K2SO4; 20 мин при 100° С
Соответствующая обработка и конечная стадия титрования
Си2О растворяют в молибденофосфор-ной кислоте и образовавшийся Мо1н оттитровывают перманганатом
Избыток Си11 определяют иодометрически
Си2О растворяют в растворе соли же-леза(Ш), образовавшееся Fe11 оттитровывают перманганатом
Си2О определяют путем добавления иода и кислоты; избыток иода оттитровывают тиосульфатом pH, концентрации, времени и температуры на течение реакции)
CuSO4—NaOH — ~ "
тартрат
CuSO4 — КОН — глицерин или маннит; кипятят 2 мин
CuSO4—NaOH — тартрат—ацетат;
20 мин при 100° С
CuSO4—N а2СО3— Na2HPO4 — тартрат
(Изучалось влияние
CuSO4—К2СО3—
КНСО3; 2,5 ч при 48,5—49° С CuSO4—NaOH—тартрат
Щелочной раствор соли меди(П)
CuSO4—КОН—салициловая кислота; кипятят 2 мин
Cu2O растворяют в различных окислителях [например, в растворе соли же-леза(Ш)], образующееся Fe11 оттитровывают перманганатом, соединениями церия(1¥) или бихроматом
Избыток Си11 определяют в фильтрате иодометрически
Сн2О растворяют в растворе соли железа(Ш), образующееся Fe11 оттитровывают перманганатом
Си2О окисляют до Си11 бромом в среде уксусной кислоты и определяют иодометрически
Избыток Си11 определяют иодометрически
Литература
95
96
97
98
99
100
101
102
103
389
Ирододнсе^
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования 1ит( Рату Ра
98 Сахара (см. № 4) CuSO4—со|~— Подкисляют И ти- '04
99 Анилин нсо^— г — ю^— сульфат щелочного металла (последний уменьшает растворимость кислорода и тем самым предотвращается окисление Си2О) CuSO4; избыток SCN" труют тиосульфатом Избыток SCN" в 105
100 Сахара (см. № 4) [образуется нерастворимый осадок Си <C,H6NH2)2(SCN)£] CuSO4—N аОН— фильтрате оттитровывают AgNO3 1“ —SCN" —кислота; 106
101 Глицерин (см. № 18), тартрат; 2 мин при 100° С СиС12—NaOH—эта- выделившийся иод оттитровывают тиосульфатом I"—H2SO4; вы де- КП
102 маннит (см. № 24), сорбит, винная кислота Сахара (см. № 4) нол [образуются растворимые производные меди (II) — глицерин и винная кислота — с одним, остальные — с двумя атомами меди] CuSO4—NaOH—гл и- лившийся иод оттитровывают тиосульфатом I" —SCN" —кислота, 108
103 Сахара (см. № 4) церин CuSO4—NaOH— выделившийся иод оттитровывают тиосульфатом Си2О растворяют 109
104 105 Смеси сахаров (см. № 4) Аминокислоты (см. № 23) тартрат; кипятят 3 мин [Используют различи большей частью щелс меди Си11 в фосфатно- в растворе соли железа (III), образовавшееся Fe11 от- титровывают перманганатом ые методы, применяя чные растворы солей (II)] Си11 в фильтрате 110 111
106 Глицерин (см. № 18) боратном буферном растворе [образуются растворимые соли меди (11)] СиС12—N аОН—метанол, (образуется растворимое производное Си) определяют путем добавления смеси 1" — кислота, вьщелившийся иод оттитровывают тиосульфатом Си11 после центрифугирования определяют в растворе иодометрически !1
390
Продолжение
Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
формальдегидсульфо-ксилат натрия К (HOCH2SO2Na) Сахара (см. № 4) в тро-стниКОВОМ соке Инвертный сахар (см. № 12) в пищевых продуктах Декстроза (см. № 13) в присутствии гликоля Редуцирующие сахара (см. № 25) Глицерин (см. № 18) РедуцируЮщИе сахара (см. № 25) ?едуЦирующие сахара (см. № 25) F CuSO4—H2SO4 (окисление до HOCH2SO3Na; реакция протекает весьма быстро) CuSO4—N а2СО3— Na2HPO4—тартрат; кипятят 3 мин CuSO4—N аОН—тар-трат; 5 мин при 100° С CuSO4—со|—— HCCXf—1-—ю^-— i сульфат щелочного "металла; 35 мин при 100° С CuSO4—N аОН—тартрат; нагревают до 80° С В воде; NaOH— этанол и СиС12 (образуется растворимое производное меди—глицерат меди) CuSO4—нсо^-— СОз——тартрат; 15 мин при 100° С CuSO4—NaOH-тартрат Избыток Си11 определяют иодометрически НС1 и иод, избыток которого оттитровывают тиосульфатом Си2О растворяют в растворе соли же-леза(Ш), образовавшееся Fe11 оттитровывают перманганатом Подкисляют и титруют тиосульфатом Си2О растворяют в растворе соли железа (Ш), образовавшееся Fe11 оттитровывают бихроматом в присутствии дифениламина в кислой среде Си11 определяют в растворе после центрифугирования путем прибавления уксусной кислоты и I-и последующего титрования тиосульфатом Си2О растворяют в растворе соли же-леза(Ш), образую-щееся Ге оттитровывают перманганатом в присутствии ферроина Си2О растворяют в растворе соли же-леза(Ш), образующееся Fe11 оттитровывают бихроматом в присутствии дифениламина в кислой среде 113 114 115 116 117 118 119 120
391
Продо,
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования
115 Аминокислоты (см. № 23) Фосфат меди(П)— суспендированный NaOH; 10 мин при комнатной температуре (образуются растворимые соли) Си11 в фильтрате определяют путем добавления 1“— уксусная кислота и последующего титрования выделившегося иода тиосульфатом
116 Редуцирующие сахара (см. № 25) в тунговом дереве CuSO4—NaOH-тартрат; кипятят 2 мин Си2О растворяют в растворе соли же-леза(Ш), образующееся Fe11 оттитровывают при 50—60 С Се (ЗО4).2 в присутствии ферроина
117 Карбоксильные группы в продажном крахмале, модифицированном путем окисления Ацетат меди; 18 ч при комнатной температуре [образуется нерастворимая соль меди (II)] Избыток Си11 определяют в фильтрате иодометрически
118 Многие редуцирующие соединения, например формальдегид (см. № 60), хлораль, гексаметилентетрамин Щелочной раствор соли меди (II) Си2О растворяют в молибденофосфор-ной кислоте, образующийся Мо11 оттитровывают перманганатом
119 Сахара (см. № 4) в яблочной массе Щелочной раствор соли меди(П), например NaOH—тартрат или СО?~— HCOJ- Си2О растворяют в растворе Fe2 (SO4)3, образующееся Fe11 оттитровывают бихроматом в присутствии дифениламина в кислой среде
120 Редуцирующие сахара (см. № 25) CuSO4—NaOH-тартрат; слой петролейного эфира; кипятят 3 мин Охлаждают; Си2О растворяют в уксусной кислоте, добавляют иод, избыток которого оттитровывают тиосульфатом
121 Редуцирующие сахара (см. № 25) в продуктах брожения CuSO4—Na2CO3— тартрат (pH 9,48); I-—Ю“—Na-jSO^ 30 мин при 100° С Оксалат—Г— _ H2SO4; выделившийся иод оттитровывают тиосульфатом
122 Аминокислоты (см. № 23) в моче СиС12—N а3РО4— Na2B4O7; 5 мин при комнатной температуре [образуются растворимые соли меди(П)] Си11 в фильтрате определяют иодометрически
392
Продолисенич
Vj е п ТитрУемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
123 124 125 126 127 128 129 130 Левулиновая кислота Сахара (см. № 4) Редуцирующие сахара (см. № 25), образующиеся при кислотном гидролизе древесины Сахара (см. № 4) Метилированные глюкозы (см. № 31) Инвертный сахар (см. № 12) Сахар (см.№1), например в моче Редуцирующие сахара (см. № 25) Кипящая смесь CuSO4—NaOH-тартрат CuSO4—NaOH-тартрат; 7 мин при 100° С (Метод описан выше 82 — см. № 76) CuSO4—NaOH— Na2HPO4—тартрат (pH 10,2); 10 мин при 100° С CuSO4—N аОН— тартрат; кипятят 3, 5, 10 и 15 мин CuSO4—N а2СО3+ +Na2HPO4— тартрат; кипятят 5 мин CuSO4—NaOH-триэтаноламин CuSO4—К2СО3— КНСО3; 45 мин при 100° С [Проводилось сравнен торых в качестве тит гексацианоферрат(Ш) феррат(Ш) калия», л (см. «Реагенты, содер тура Си2О растворяют в растворе соли же-леза(Ш), образующееся Fe11 оттитровывают перманганатом Си2О в атмосфере СО2 растворяют в НС1—NaCl; добавляют NaHCO3— тартрат и иод, избыток которого оттитровывают тиосульфатом 10^—1-—H2SO4; выделившийся иод оттитровывают тиосульфатом Сн2О растворяют в растворе соли железа (III), образующееся Fe11 оттитровывают перманганатом НС1; уксусная кислота; 1~; иод, избыток которого оттитровывают тиосульфатом I- —SCN- —кислота; выделившийся иод оттитровывают тиосульфатом 1——СО|—; НС1 уксусная кислота—ацетат свинца; встряхивают, добавляют KSCN и оттитровывают тиосульфатом ие с методами, в ко-) антов используются (см. «Гексациано-итература 77) и иод жащие иод», литера-249)] 129 130 131 132 133 134, 137 135 136
393
“Родоллсе
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Лит( Рат у. Ра
131 Р-Дикарбонильные соединения Ацетат меди(П) — ацетат натрия; встряхивают 5 мин (образуются нерастворимые хелатные производные) Избыток Си11 определяют иодометрически в водном слое после фильтрования и экстракции СНС13 138
132 Редуцирующие сахара (см. № 25), образуемые при кислотном гидролизе пентозанов (см. № 79) (Метод описан выше 132 — см. № 126, но для определения арабинозы нагревают 15 мин при 100° С) 139
133 Редуцирующие сахара (см. № 25) после разделения методом бумажной хроматографии Реагент, описанный выше 132, — см. № 126; 25 мин при 100° С; затем 10 мин при 35° С Избыток Си11 определяют иодометрически путем прибавления 1“—H2SO4 и последующего титрования выделившегося иода тиосульфатом 140
134 Аминокислоты (см. № 23) после разделения методом бумажной хроматографии В фосфатно-борат-ном буферном растворе; суспензия фосфата меди(II) (образуются растворимые соли меди) Си11 в фильтрате определяют иодометрически 141
135 Теофиллин (см. № 174, 197, 211) в крови, моче В безводном метаноле; ацетат меди— метанол [образуются нерастворимые производные меди (II)] Осадок растворяют в H2SO4, прибавляют Г и титруют тиосульфатом 142
136 Глюкоза (см. № 31), образуемая при кислотном гидролизе крахмала CuSO4—N аОН— Na2HPO4—тартрат—Ю^~; 15 мин при 100° С Г —H2SO4; выделившийся иод оттитровывают тиосульфатом 143
137 Фруктоза (см. № 13) в присутствии глюкозы CuSO4-K8CO3— КНСО3; 2,5 ч при 48—48,5° С или CuSO4—N аОН— тартрат, при этом реагируют оба сахара Си2О растворяют в растворе железа (III), образовавшееся Fe11 оттитровывают перманганатом 144
138 Енол (см. № 30), содержащийся в оксимети-ленкетонах Си" (образуются соединен римые в СНС13; раств определяют и ия меди(П), раство-оримое производного эдометрически) 145 14»
139 Редуцирующие сахара (см. № 25) — определение восстанавливающей способности CuSO4—N а2СО3— тартрат—I-—IO,,-— NaHCO3; при pH 8,9—9,4 (Изучалось влияние р трации тип Оксалат—Г —H2SO4; выделившийся иод оттитровывают тиосульфатом 4, времени, концен-эв сахаров)
394
Продолжение
№ п/я
140
141
142
143
144
145
146
147
Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
Аминокислоты (см. № 23) в сахарной свекле и в продуктах сахарного производства Сахар (см. № 1) в фуражных культурах (после кислотного гидролиза) В щелочном растворе; суспензия фосфата меди (II); при pH 10 (образуются растворимые производные) CuSO4—щелочь— "артрат Си11 в фильтрате определяют иодометрически в уксуснокислой среде Си2О растворяют в растворе соли же-леза(1И), образующееся Fe11 оттитровывают бихроматом в присутствии дифениламина в кислой среде 147 148
Глюкоза (см. № 31) б крови CuSO4—СОц-— НСО3; 6 мин при 100° С Молибденоарсенат— H2SO4; образующийся Мо111 оттитр овы-вают перманганатом 149
Редуцирующие сахара (см. № 25) CuSO4—NaOH-тартрат Си2О растворяют в смеси ванадат— H2SO4, бихромат— H2SO4 или в молибденомышья ковой кислоте и титруют перманганатом или железными квасцами 150
Глицерин (см. № 18) в мыле Карбоксиметнлцелл го-лоза (см. № 218) Редуцирующие сахара (см. № 25) Растительные сахара (см. № 4) CuCl2—метанол— этанол—NaOH [образуется растворимое производное меди(П)] CuSO4 при pH 4 [образуется нерастворимое производное меди(П)] CuSO4—Na2CO3— NaHCO3—Г — Ю^-—тартрат; pH 8,6—9,3 (Изучени CuSO4—NaOH— тартрат; кипятят 2 мин Си11 в фильтрате определяют иодометрически Осадок растворяют в HNO3—H2SO4 Си11 определяют иодометрически Оксалат—I- —H2SO4; выделившийся иод оттитр овывают тиосульфатом в метода) Си2О растворяют в растворе железа(Ш); образующееся Fe11 оттитровывают перманганатом 151 152 153 154
395
пРодоЛэ1сени/1
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Ра Ра
148 Аминокислоты (см. CuSO4 в фосфатно- Си11 определяют би- 15д
149 № 23) Инвертный сахар (см. боратной буферной смеси при pH 9,1; встряхивают 5 мин [образуется растворимое производное меди (II)] CuSO4—Na2CO3 — амп ер ометр ическим титрованием тиосульфатом вфастворе, полученном после центрифугирования; прибавляют смесь Г—уксусная кислота I'—SON"—H2SO4; 156
150 № 12) Меркаптаны (см. № 185) цитрат; кипятят 10 мин Пропускают в смесь титруют тиосульфатом Г; выделившийся 157
151 в газообразных углеводородах Глюкоза (см. № 31) в ацетат меди—уксусная кислота (образуются RSCu и RSSR) CuSO4—ацетат на- иод оттитровывают тиосульфатом I-—10^—оксалат— 158
152 присутствии мальтозы Редуцирующие сахара трия; 20 мин при 100° С CuSO4—щелочь— H2SO4; через 30 мин титруют тиосульфатом 12—уксусная кисло- 159
153 (см. № 25) Фруктоза (см. № 13) тартрат при pH 10,4; 10 мин при 100° С CuSO4—N а2СО3— та; избыток иода оттитровывают тиосульфатом NaCl; нейтрализуют; 160
154 Маннит (см. № 24) в мор- N аНСО3—тартрат; 2 ч при 50° С CuSO4—NaOH; затем добавляют Г —H2SO4; выделившийся иод оттитровывают тиосульфатом Си11 в фильтрате 161
155 ских водорослях Сахара (см. № 4) встряхивают 5 мин CuSO4—NaOH— определяют йодометрически Си2О растворяют в 162
156 Глюкоза (см. № 31) в тартрат; 2 мин при 100° С CuSO4—Na2CO3— молибденофосфорной кислоте; образующийся Мо111 оттитровывают перманганатом Си2О растворяют 163
157 биологических материалах Некоторые аминокетоны тартрат; 20 мин при 100° С CuSO4—NaOH-тартрат; кипятят (образуется производное амина— RR'NH) в HNO3, добавляют NH4OH и титруют ЭДТА в присутствии мурексида Перегоняют в стандартный раствор кислоты, избыток которой оттитровывают щелочью 164
366
Продолжение
X» n/n Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
—-— 158 Пектины в хлопке и Раствоо в щелочи; Осадок растворяют 165
159 льне п-Аминосалицил ат на- уксусная кислота; CuSO4 (образуется нераствс В воде; избыток в NH4OH; Си11 определяют иодометрически римый пектат меди) Избыток Си11 в 166
160 трия Сахара (см. № 4) в дне- CuSO4 [образуется нерастворимая соль меди(П)] Щелочной раствор фильтрате определяют иодометрически Си2О растворяют 167
161 тической пище Сахара (см. № 4) меди(П) CuSO4—NaOH— в HNO3; титруют ЭДТА в присутствии мурексида Осадок Си2О рас- 168
162 Пиридин (см. № 38) тартрат (Обзор методов) Си (NO3)2; избыток SCN'; pH 5,2—5,7; 1 ч при комнатной температуре [образуется нераст Си (C5H5N Избыток Си11; нзме- творяют в растворе соли железа (III); образующееся Fe111 оттитровывают перманганатом Избыток SCN- опре- 169
163 или его перхлорат Жирные кислоты в мыль- деляют в фильтрате путем добавления Ag1 и титрования его избытка тиоцианатом воримое соединение )2(scn)2] Си11 в фильтрат 170
164 ном маточном растворе Сахара (см. № 4) ренное количество натр ий карбоксиме- тил целлюлозы (образуется осадок медь-карбоксиметил целлюлозы, с которым соосаждаются медные соли жирных кислот) CuSO4—NaOH— определяют путем добавления 1“— уксусная кислота и титрованием выде- лившегося иода тиосульфатом (при расчете учитывают количество добавленного натрийкарбок-симетилцеллюлозы) Си2О растворяют 171
165 Лактоза (см. Яв 19) в лактат Щелочной раствор в растворе соли железа(Ш), образующееся Fe11 оттитровывают перманганатом Си2О растворяют 172
шоколаде соли меди (II) в HNO3; титруют в аммиачном растворе ЭДТА в присутствии мурексида
397
Продолжение
№ n/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования - Л ите-ра ту. Ра
166 Пенициллин CuSO4—NaOH-тартрат; нагревают (образуется NH3) Выделившийся аммиак перегоняют в стандартный раствор кислоты, избыток которой оттитровывают щелочью 173
167 Аминокислоты (см. № 23), пептиды Си11 в фосфатно-боратном буферном растворе, pH 9,1 Си11 определяют в фильтрате путем добавления НС1 и последующего титрования ЭДТА в присутствии 1- (2-пири-дилазо)-нафтола 174
168 Хинин гидрохлорид В среде ацетон— бензол или толуол; СиС12—ацетон [образуется нерастворимое соединение Си (C20H25N2O2) ( Осадок растворяют в NH4OH; титруют ЭДТА в присутствии мурексида :12.(СН3СОСН3Д] 175
169 Редуцирующие сахара (см. № 25) CuSO4—N а2СО3— ЭДТА; кипятят 10 мин Cu2O растворяют в HNO3; титруют ЭДТА в присутствии мурексида 176
170 Редуцирующие сахара (см. № 25) CuSO4—NaOH-тартрат (Рассматриваются ме Си2 тодики определения О) т
171 Глюкоза (см. № 31) Си11—NaOH— сульфосалициловая кислота Избыток Си11 определяют иодометрически 1781
172 Сахара (см. № 4) (Метод описан выше 178— см. № 171) 179
173 Изониазид (см. № 198, 213) Избыток CuSO4; 30 мин [образуются нерастворимые производные меди (II)] Си11 в фильтрате определяют иодометрически 180
174 Теофиллин (см. № 135) Избыток ацетата меди; 30 мин при комнатной температуре [образуется нерастворимое производное меди (II)] Избыток Си11 в растворе, полученном после центрифугирования, определяют иодометрически 181
175 Аминокислоты (см. № 23) Суспензия фосфата меди (II) [образуются растворимые соли меди (II)] (Критикуется метод, о см. № Си11 в фильтрате определяют иодометрически писанный выше147 ,— 140) 182
398
Продолжение
№ в/0 Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
176 Глюкоза (см. № 31) CuSO4—NaOH—тар- Сц2О растворяют 183
177 Сахара (см. № 4) в фар- трат CuSO4—щелочь— в HNO3; титруют ЭДТА Си2О растворяют 184
178 мацевтических сиропах Редуцирующие веще- ЭДТА CuSO4—NaOH— в HNO3; добавляют NH4OH и титруют ЭДТА в присутствии мурексида Си2О растворяют 185
179 ства в шерсти, хлопке и т. п. — определение «медного числа» Аскорбиновая кислота тартрат; кипятят 3 мин (Метод описан вы- в растворе соли железа (III), образую щееся Fe11 оттитровывают перманганатом 186
180 Фруктоза (см. № 13) ше 178 — см. № 171) (Метод описан вы- 187
181 Глюкоза (см. № 31) в те 178 — см. № 171) Ацетат меди—ацетат Сн2О растворяют 190
182 присутствии большого количества лактозы Натрийкарбоксиметил- натрия—молочная кислота; кипятят 5 мин Вода—этанол— в растворе соли железа (III), образующееся Fe11 оттитровывают перманганатом Избыток Си11 опре- 191
183 целлюлоза Глюконат H2SO4; CuSO4 pH 3,35; подогревают до 50—55° С [образуется нерастворимая соль меди (II)] Суспензия фосфата деляют в фильтрате иодометрически Си11 в фильтрате 192,
184 Лимонная кислота меди (II) [образуется растворимая соль меди (II)] (Метод описаи выш определяют путем прибавления Г— SCN"—НС1 и последующего титрования тиосульфатом е юг _ см. № 183) 200 193,
185 Меркаптаны (см. № 150) Бутилфтал ат меди— 1“; титруют тиосуль- 200 194
186 (микрометод) Глюкоза (см. № 31) в у гл еводор од—мета -нол или углеводород—амиловый спирт; 5% уксусной кислоты; встряхивают 5 мин CuSO4—щелочь— фатом Избыток Си11 от- 195
биологических жидкостях тартрат; 2 мин при 100° С титровывают ЭДТА в присутствии мурексида
399
Продолжение
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
187 Редуцирующие сахара (см. № 25) CuSO4—NaOH-тартрат; кипятят 2 мин Фильтрат; H2SO4— ацетат натрия; NH4C1; NH4SCN; тнтруют гидрохиноном потенциометрически /96
188 Редуцирующие сахара (см. Кр 25) в дубильных экстрактах CuSO4—N аОН— тартрат; кипятят 2 мин Си2О растворяют в НС1, добавляют NH4OH до pH 8 и титруют ЭДТА в присутствии мурексида /97
189 а-Аминный азот (Метод описан выше 111 — см. № 105; изучались композиции производных меди) 198
190 Миндальная кислота и ее смеси, применяемые в медицине Си” (образуется нерастворимая соль) Си11 в осадке определяют титрованием ЭДТА 199
191 Пиперазин (см. № 199) в этилендиамине Вода; CuSO4 [образуется нерастворимое производное меди (II) Осадок растворяют в НС1 или H2SO4, прибавляют NH4OH и титруют ЭДТА в присутствии мурексида 201
192 Глицин в смеси глипин-триоксалатохромат калия Суспензия фосфата меди (II) в боратном буферном растворе, pH 9,1; встряхивают 5 мин [образуется растворимая соль меди (II)] Центрифугируют, кальциевую соль удаляют на ионообменной колонке; Си11 определяют путем добавления 1“ — уксусная кислота и последующего биамперометрического титрования тиосульфатом 202
193 Углеводы CuSO4—NaOH-тартрат (пробу прибавляют к кипящему реактиву) Фильтруют; фильтрат подкисляют НС1 и титруют Си11 в атмосфере СО2 в присутствии нейтрального красного или феносафранина 203
194 Барбитал Пиридин—вода— КН2РО4; pH 8,5; CuSO4—25% -ный раствор пиридина; 1—2 ч при комнатной температуре [образуется нерастворимое производное меди (II)] Избыток Си11 в фильтрате определяют при pH 8 путем титрования ЭДТА в присутствии мурексида и NH4C1 204 1
400
Продолжение
к? п/п Титруемое вещество Реагент и условия реакции Соответствующая об работка и конечная стадия титрования Литература
195 фруктоза (см. № 13) CuSO4—кгсо3— КНСО3; 135 мин при 50° С Сц,О растворяют в растворе соли железа (III), образующееся Fe11 оттитровывают перманганатом 205
196 Сахара (см. № 4) CuSO4—NaOH— триоксиглутаровая кислота; 6 мин при 100° С Как указано выше,— см. № 195 206
197 Теофиллин (см. № 135) В метаноле; ацетат меди—метанол; 3 ч при комнатной температуре [образуется нерастворимое производное меди(П)] Осадок растворяют в смеси уксусная кислота—ацетат натрия, Си11 оттитровывают ЭДТА в присутствии 1-(2-пиридилазо)- Р-нафтола 207
198 Изониазид (см. № 173) В воде; избыток SCN“; небольшой избыток CuSO4; 30 мин при комнатной температуре [образуется нерастворимое производное меди (II)] Избыток SCN-определяют в фильтрате титрованием Ag+ в присутствии Fe111 208
199 Пиперазин (см. № 191) (Метод описан выше 208 — см. № 198) 209
200 Инвертный сахар (см. № 12) в рафинированных сахарах CuSO4—NaOH— N а2СО3—тартр ат; 5 мин при 100° С Избыток Си11 оттитровывают ЭДТА в присутствии мурексида 210
201 Глюкоза (см. № 31), образуемая при кислотном гидролизе крахмала Нейтрализованный раствор; CuSO4— NaOH—тартрат; кипятят 2 мин I- —H2SO4; титруют тиосульфатом 211
202 Сахара (см. № 4) в силосе и фураже (после предварительного отделения и инверсии) CuSO4—NaOH— Na2HPO4— lOjf; кипятят 15 мин Как указано выше,— см. № 201 212
203 Высокомолекулярные полисахариды (после кислотного гидролиза)— определение восстано-пительной способности (Метод описан выше 132 — см. № 126) 213
401
Предо.
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования
204 Протеины N аОН—вода—ацетат меди (II); 1—2 ч Центр ифу гир у ют; добавляют к раствору избыток ЭДТА; кипятят, прибавляют ацетатный бу- ферный раствор и ЭДТА оттитровывают ацетатом цинка в присутствии 1-(2-ПИ-ридилазо)-Р-нафгола
205 Инвертный сахар (см. № 12) CuSO4—N а2СО3— лимонная кислота; кипятят 10 мин I"—H2SO4; титруют тиосульфатом
206 Таннины Ацетат меди; 15лшн при 100° С Центрифугируют; определяют избыток Си11 иодометрически
207 Аминокислоты (см. № 23) Суспензия фосфата меди (II); встряхивают 1 мин Фильтруют; фильтрат титруют в аммиачной среде ЭДТА в присутствии мурексида или н солянокислой среде в присутствии 1 -(2-пиридилазо)-Р-нафтола
208 Сульфамиды В NaOH; раствор Na2B4O7; CuSO4 [образуется осадок производного меди (11)1 Фильтрую;; избыток Си11 в фильтрате оттитровывают ЭДТА в присутствии 1- (2-лири-дилазо)-2-нафтола
209 Барбитураты (X), например веронал CuSO4—NH4OH— пиридин; 10—15 мин [образуется осадок меднопиридинового производного Cu(C5H5N)2(X)2-] Фильтруют; в фильтрате создают pH 8 и титруют ЭДТА в присутствии мурексида Си2О отфильтровы-
210 Глюкоза (см. № 31) CuSO4—NaOH-тартрат; кипятят 2 мин вают; избыток Си11 в фильтрате оттитровывают KCN при температуре кипения до обесцвечивания Фильтруют; к алик-
211 Теофиллин (см. № 135) В воде; NH4OH— CuSO4; 5 мин вотной части фильтрата добавляют уксусную кислоту и KI; титруют тиосульфатом
212 Редуцирующие сахара (см. № 25) в продуктах сахарной промышленности CuSO4—NaOH— NajCOg — тартрат; 5 лин при 100° С Избыток Си11 оттитровывают ЭДТА в присутствии мурексида
402
Продолжение
К! Пр1 Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
213 Изониазид (см. № 173) NH4SCN—CuSO4— nh4oh—nh4ci [образуется осадок производного меди (II)] Центрифугируют; избытой Си11 в цен-трифугате оттитровывают ЭДТА в присутствии мурексида 223
214 редуцирующие сахара (см. № 25) в продуктах сахарной промышлен- ности CuSO4—N а2СО3— Na2HPO4—тартрат натрия; нагревают 4—5 мин Доводят до pH 8 (уксусной кислотой), добавляют иод, избыток которого оттитровывают тиосульфатом 225
215 Сорбоза в смесях с аце-тоном, МОНО- и диизо-пропилиденсорбозой Нагревают со смесью CuSO4—NaOH-тартрат Избыток Си11 определяют иодометрически 226
216 Каптакс (главным образом 2-меркаптобензотиазол) В этаноле; CuSO4; нагревают [образуется осадок производного меди (II)] Фильтруют; в фильтрате создают pH 8 и титруют ЭДТА в присутствии мурексида 227
217 D-Глюкозамин гидрохлорид и родственные соединения CuSO4—NaOH-тартрат; 10 мин при 100' С Осадок Сц2О растворяют в HNO3, добавляют NH4OH и титруют ЭДТА в присутствии мурексида 228
218 Эфиры карбоксиметил-целлюлозы (см. № 145) В смеси этанол — разбавленная H2SO4 (pH 2,2—2,5); CuSO4—NH4OH, (pH 4—4,1) [образуется осадок производного меди (II)] Я Фильтрат; уксусная кислота—Г; выделившийся иод оттитровывают тиосульфатом или к осадку добавляют смесь вода—эта- нол—NH4OH, затем уксусная кислота—Г и титруют указанным выше способом — см. № 217 229
окисления воздухом Си+-ионов необхо-
Для предотвращения ---- — —..— ..--------
Д мо применять значительные меры предосторожности, например, Роеодить анализ в атмосфере индифферентного газа (СО2 или Дорода) или же под слоем несмешивающегося органического СдВоРителя (например, толуола).
Ос ' В небольшом числе случаев конечная стадия определения <а«а на определении продукта реакции, не содержащего медь, ирнведен ряд таких примеров:
«епмоСалат (ПРИ определении ацетата путем окисления СиО) титруют ^манганатом;
403
амины (при определении некоторых аминокетонов) перегоняю в стандартный раствор кислоты и затем избыток кислоты оттитп Т вывают щелочью;
аммиак (при определении содержания пенициллина) также пеп гоняют в кислоту, избыток которой оттитровывают.
4. Определение других реагентов, присутствующих в растворе путем обратного титрования. Основным примером является опреде’ ление избытка SCN--ионов после осаждения, основанного на реакциях типа (4); непрореагировавшие SCN_-hohh оттитровывают соединениями серебра (I). В одном из определений редуцирующих сахаров, основанном на использовании реакции окисления, оттитровывают непрореагировавшую щелочь вместо определения меди.
ЛИТЕРАТУРА
1. Schwarz Н., Ann., 84, 84 (1853).
2. v. В а b о С. Н. L., J. prakt. Chem., 74, 120 (1858).
3. М о h г F., Z. anal. Chem., 12, 296 (1873).
4. Р е г г о t F., Вег., 9, 1939 (1876).
5. Pillitz W., Z. anal. Chem., 15, 262 (1876).
6. U 1 1 b г i с h t R„ Ber., 10, 128 (1877).
7. А г п о 1 d C., Z. anal. Chem., 20, 331 (1881).
8. Riegler E., Z. anal. Chem., 35, 31 (1896).
9. P i n e t t e J., Chem. Ztg., 21, 395 (1897).
10. Pf 1Й ger Archiv fiir physiol. Chem., 69, 409 (1898).
11. Schoorl N., Z, angew. Chem., 12, 633 (1899).
12. Weil F., Compt. rend., 134, 115 (1902).
13. R о s e n t h a 1 e r L., Z. anal. Chem., 43, 282 (1904).
14. Bang I., Biochem. Z., 2, 271 (1906); 11, 538 (1908).
15. Bertrand G., Bull. soc. chim. France, 35, 1285 (1906).
16. Har d ingE. P., D or an J., J. Am. Chem. Soc., 29, 1476 (1907).
17. F 1 о h i 1 J. T., Chem. Weekblad, 7, 1057 (1910).
18. Wagenaar M., Pharm. Weekblad, 48, 947 (1911).
19. К e n d a 1 1 E. G., J. Am. Chem. Soc., 34, 317 (1912).
20. E у и о n L., L a n e J. H., Analyst, 37, 41 (1912).
21. Schoorl N., Chem. Weekblad, 9, 678 (1912).
22. Bang I., Biochem. Z., 49, 1 (1913).
23. К о b e r P. A., S u g i u г a K., J. Am. Chem. Soc., 35, 1546 (1913).
24. Smit J., Chem. Weekblad, 10, 894 (1913).
25. Schoorl N., Chem. Weekblad, 12, 481 (1915).
26. Kober P. A., J. Ind. Eng. Chem., 9, 501 (1917).
27. Schoorl N., Regenbogen A., Z. anal. Chem., 56, 191 (1917).
28. К о w a r s k у A., Deut. med. Wochschr., 45, 188 (1919).
29. S с a 1 e s F., J. Ind. Eng. Chem., 11, 747 (1919).
30. V i g e v a n i G., Boll. chim. farm., 58, 436 (1919).
31. Bruhns G., Z. anal. Chem., 59, 337 (1920).
32. Bruhns G., Chemiker — Ztg., 45, 486 (1921).
33. D i e c k m a n n A., Ber., 54, 2251 (1921).
34. Fontes G., T h i v о 1 1 e L., Bull. soc. chim. biol., 3, 226 (1921).
35. H i e b e r W., Ber., 54, 902 (1921).
36. К r e i s у A., Z. Verein Deut. Zuckerind., 71, 123 (1921).
37. Legrand, Compt. rend., 172, 600 (1921).
38. QuisumbingF. A., Thomas A. W., J. Am. Chem. Soc., 43, 1503 (1
39. S h a f f e r P. A., H a r t m a n n A. F„ J. Biol. Chem., 45, 365 (1921).
40. Fontes G., Thivolle L., Bull. soc. chim. biol., 4, 23 (1922).
41. Spacu, G., G r e a n g a C., Bull. soc. Stiinte, Cluj, 2, 105 (1923).
404
. Rlanchetiere A., Bull. soc. chim. biol., 6, 509 (1924).
fa С о p P e n s P. A., Nederland. Tydschr. Geneeskunde, 68, 1, 153 (1924).
fi Speh 1 P-. Compt, rend. soc. biol., 90, 638 (1924).
ff'Csapo J., Biochem. Z„ 157, 350 (1925).
m v a n den Hout M. A. H., Neeteson P. A., van Scher p e n -
4 berg A. L„ Chem. Weekblad, 22, 126 (1925).
,7 N i j n s L., Bull, assoc, ecole sup. brasserie Louvain, 25, 36 (1925).
лк Pick L., Listy Cukrovar, 43, 185 (1925).
до S c h о о r 1 N., Chem. Weekblad, 22, 132 (1925).
ко T e r v a e r t D. G. C., Biochem. J., 19, 541 (1925).
ki К о 1 t h о f f I. M., Chem. Weekblad, 23, 61 (1926).
ко" M i s 1 о w i t z e r E., Schaefer W., Biochem. Z., 168, 217 (1926).
ка" S о m о g у i M., J. Biol. Chem., 70, 599 (1926).
54, Stoffella C. G., Boll. chim. farm., 65, 225 (1926).
55' F о n t e s G., T h i v о 1 1 e L., Bull. soc. chim. biol., 9, 353 (1927).
56. F о n t e s G., T h i v о 1 1 e L., Lait, 7, 547 (1927).
57. A m i c k C. A., Chemist — Analyst, 17, 10 (1928).
58. Biazzo R., Ann. chim. applicata, 18, 447 (1928).
59. H a d j e f f M. D., Z. Untersuch. Lebensm., 55, 615 (1928).
60. H о r n e W. D., Planter Sugar Mfr., 81, 1 (1928).
61. Семигановский H., Tp. научно-исследовательского химикофармацевтического ин-та (Москва), 33 (1926)
62. Of пег R., Listy Cukrovar, 47, 737 (1929).
63. R e b a g 1 i a t t i E. E., Rev. farm. (Buenos Aires), 2, 340 (1929).
64. R о s s J. H„ Research Notes, 2, 11 (1929).
65. Schoor1 N., Chem. Weekblad, 26, 130 (1929).
66. О f n e r R., Z. Zuckerind. Czech. Rep., 53, 733 (1930).
67. Svanberg O., Z. physiol. Chem., 188, 219 (1930).
68. T о m p s e t t S. L., Biochem. J., 24, 1148 (1930).
69. D e m о n t P., Mitt. Lebensm. Hyg., 22, 48 (1931).
70. v. F e 1 1 e n b e r g T., Mitt. Lebensm. Hyg., 22, 9 (1931).
71. H i n t о и C. L., M а с a r a T., Analyst, 56, 286 (1931).
72. К h a d z h i e v M. D., Ann. univ. Sofia, 9, 163 (1931).
73. Ofner R., Z. Zuckerind. Czech. Rep., 56, 249 (1931—2).
74. Heiduschka A., Bietham W., J. prakt. Chem., 133, 273 (1932).
75. J a c k s о n R. F., M a t t e w s J. A., Bur. Stads. J. Research, 8, 403 (1932);
J. Assoc. Offic. Agr. Chemists, 15, 198 (1932).
76. К о m e t i a n i P. A., Z. Untersuch. Lebensm.,63, 194 (1932).
77. M a r s h G. L., Joslyn M. A., Ind. Eng. Chem., Anal. Ed., 4, 368 (1932).
78. О f и e r R., G г a с k о I., Listy Cukrovar., 50, 148 (1932); Z. Zuckerind. Czech.
Rep., 57, 125 (1932—3).
79. Ofner R., Listy Cukrovar., 50, 270 , 278 (1932).
°0. Labourasse G., Bull, assoc, chim. suer, dist., 50, 447 (1933).
81. M u g d a n M„ Wimmer J., Angew. Chem., 46, 117 (1933).
82. S h a f f e r P. A., S о m о g у i M., J. Biol. Chem., 100, 695 (1933).
«3- S t e i n h о f f G., Z. Spiritusind., 56, 64 (1933).
о*- К a t a о k a E., J. Biochem. (Japan), 19, 15 (1934).
co- Ошмян Г., Бродильная пром., 11, No. 5, 26 (1934).
* Stegeman R. A., E n g 1 i s D. T., Trans. Illinois State Acad. Sci., 27,
87 t(1934)-
„•Таран E. H., Ж. прикл. химии, 7, 213 (1934).
89 v F e 1 1 e n b e r 6 T- Mitt Lebensm. Hyg., 26, 182 (1935).
ло*1 зеветтеР И. В. Рыбное хозяйство Дальнего Востока, 13, № 1, 123
90 У935)-
91 v°senblii h Е., Vavrinecz G., Listy Cukrovar., 53, 157 (1935).
92 n F н я’4 e B H. Я., Рихтер Д. А., Зав. лаб., 4, 1062 (1935).
93' ° ! t s k e i J., Angew. Chem., 49, 310 (1936).
94' 1,1 s e n S t e i n P., Przemysl Naftowy, 11, 322 (1936).
95' т a r 1 а у V., J. pharm. chim., 23, 589 (1936).
’ e Berre M., Bull. sci. pharmacol., 43, 507 (1936).
405
96. Платковская В. М., В е х отк о Т. И., Ж- прикл. химии 9, 177
97. S i с h е г t К-, В 1 е у е г В., Z. anal. Chem., 107, 328 (1936). I
98. Spengler О., Todt F., Scheuerer M., Z. Wirtschaftsgruppe Zuckp rind, 86, 130, 322 (1936).
99. Stegeman R. A., E n g 1 i s D. T., J. Assoc. Offic. Agr. Chemists, 19 4«n (1936). ’ u
100. Strep kov S. M., Ann. chim. anal. chim. appl., 18, 231 (1936).
101. Христич К. И., Завод, лаб., 6, 558 (1937).
102. Pall D. В., Intern. Sugar J., 39, 153 (1937).
103. Платковская В. M., Вехотко Т. И., Ж. прикл. химии, 10. 219 (1937).
104. Somogyi М., J. Biol. Chem., 117, 771 (1937).
105. S р а с u G., Dima L., Z. anal. Chem., 110, 25 (1937).
106. С о т о и и н К., Спирто-водочная пром., 14, № 6, 30 (1937).
107. Bertram S. H., Rutgers R., Rec. trav. chim., 57, 681 (1938).
108. Сотонин К., Евдокимова В., Спирто-водочн. пром., № 1, 27 (1938).
109. S z a k а с s О., Kisferletugyi Kozlemenyek, 41, 143 (1938).
110. Z e r b a n F. W., Sattler L., Ind. Eng. Chem., Anal. Ed., 10, 669 (1938).
111. Pope C. G., Stevens M. F., Biochem. J., 33, 1070 (1939).
112. S c h о 0 r 1 N., Pharm. Weekblad, 76, 777 (1939).
113. S p i t z e r L., Ann. chim. applicata, 29, 184 (1939).
114. Y 0 s i d a T., T a n a b e T., Y a m a h и z i K-, Bull. Agr. Chem. Soc., Japan, 15, 49 (1939).
115. A p у т ю н я и Л. А., Акопд анян В. И., Вопросы питания, 9, № 4,
44 (1940).
116. Fulmer Е. I., Н i с к е у R. J., U n d е г к о f 1 е г L. A., Ind. Eng. Chem., Anal. Ed., 12, 729 (1940).
117. W i 1 d m a n S. G., Hansen E., Plant Physiology, 15, 719 (1940).
118. Andrews J. T. R., Oil and Soap, 18, 14(1941).
119. P h i 1 1 i p s T. G., J. Assoc. Offic. Agr. Chemists, 24, 181 (1941).
120. Свертков И. В., Лаб. практика, 16, № 6, 27 (1941).
121. Abel in I., Verhandl. Verein schweiz. Physiol., 7 (1942).
122. Best A. H., Peterson A. H., Sell H. M., Ind. Eng. Chem., Anal. Ed.,
14, 145 (1942).
123. Elizer L. H., Ind. Eng. Chem., Anal. Ed., 14, 635 (1942).
124. I о n e s c u-M atlu A., Popescu A., Petrescu E., Bull. acad. med. Roumanie, 14, 598 (1943).
125. Leonard R. H., Meade R. C., D u s t m a n R. B., Ind. Eng. Chem.,
Anal. Ed., 15, 579 (1943).
126. P h i 1 1 1 p s о n T., Arkiv Kemi Min. Geol. Ser. A 16, No. 22, 1 (1943).
127. U n d er k of 1 er L. A., Guyman J. F., Rayman M. M., Fulmer E. I., Iowa State College J. Sci., 17, 251 (1943).
128. Albanese A. A., I r b у V., J. Biol. Chem., 153, 583 (1944).
129. В 0 i n 0 n R., Ing. chim., 27, No. 161, 8 (1945).
130. H a d о r n IL, v. Fellenberg T., Mitt. Lebensm. Hyg., 36, 359 (1945).
131. S a e m a n J. F., В u b 1. J. L., H a n n a E. G., Ind. Eng. Chem., Anal. Ed., 17, 35, 95 (1945).
132. Somogyi M., J. Biol. Chem., 160, 61,69 (1945).
133. J e a n 1 0 z R., Helv. Chim. Acta, 29, 57 (1946).
134. McDonald E. J., T u г г о 11 e A. L., J. Research Natl. Bur. Standards, 37, 429 (1946).
135. Tsch i rch E., Pharmazie, 1, 230 (1946).
136. Blom J., R 0 s t e d C. O., Acta Chem. Scand., 1, 32 (1947).
137. McDonald E. J., T u г г о t t e A. L., J. Assoc. Offic. Agr. Chemists, 30,
124 (1947). zin._
138. Seaman W., W о о d s J. T., M a s s a d E. A., Anal. Chem., 19, 250 (194'F
139. Auernheimer A. H., Wicker ham L. J., S c h n i e p p L.
Anal. Chem., 20, 876 (1948). K,
140. Flood A. E„ H i r s t E. L., J ones J. K. N„ J. Chem. Joe., 1679 (194W-141. Martin A. J. P., Mittelman R., Biochem. J., 43, 353 (1948).
406
142. Plummer A. J., J. Pharm. Exp. Therap., 93, 142 (1948).
143 Pucher G. W., Leavenworth C. S., V i с к e г у H. В., Anal. Chem., 20, 850 (1948).
144. Besson S., Petot M., Bull. soc. sci. Nancy, 8, 36 (1949—50).
<45. В о к a d i a M. M., Seshapande S. S.,J. Indian Chem. Soc., 26, 455 (1949).
146 H e i d t L. J., S о u t h a m F. W., Benedict J. D., Smith M. E., ' J. Am. Chem. Soc., 71, 2190 (1949).
147. S 1 a v i с к о v a A., Listy Cukrovar., 66, 185 (1949—50).
118 Thomas J. W., M e 1 i n C. G., M о о r e L. A., Anal. Chem., 21, 1363 ’ (1949).
149. (Anonymous), Ann. biol. chim., 8, 516 (1950).
150. Bev ill ar d P., Bull. soc. chim. France 1298 (1950).
151. Bore P., Bull. mens. ITERG, 4, 168 (1950).
152. Conner A. Z., E у 1 e r R. W., Anal. Chem., 22, 1129 (1950).
153. H e i d t L. J., S о и t h a m F. W., J. Am. Chem. Soc., 72, 589 (1950).
154. Лисицын Д. И., Биохимия, 15, 165 (1950).
155. Schroeder W. A., Kay L. M., Mills R. S., Anal. Chem., 22, 760 (1950).
156. В о r g h i M„ M а и r a n d i V., Ind. sacc. ital., 44, 158 (1951).
157. Ellis E. W., Barker T., Anal. Chem., 23, 1777 (1951).
158. Phillips L. L., С a 1 d w e 1 1 M. L., Anal. Chem., 23, 1172 (1951).
15Э. Schneider F., Emmerich A., Zucker-Beihefte, No. 2, 17 (1951).
160. Prillinger F., Mitt. Hoherer Bundeslehr — u. Versuchsanstalt, Wein u. Obstbau, Klosterneuburg; hoherer Bundeslehr — u. Versuchsanstalt Bienenkunde, Wien—Grinzing, 2, 20 (1952).
161. Suzuki N., Bull. Fac. Fisheries Hokkaido Univ., 3, 59 (1952).
162. Carles J., Bull. soc. chim. biol., 35, 365 (1953).
163. В и 1 t a s о v a H., Horakova E., Chem. Listy, 48, 1698 (1954).
164. S i m о n у i L, GaL G., Tokar G., Magyar Kem. Folyoirat, 60, 289 (1954).
165. Соболев M. А., Красивская А. А., Текстильная пром., 14, № 7, 39 (1954).
166. Барон M. С., Аптечное дело, 4, № 5, 17 (1955).
167.
168.
169.
170.
171.
172.
173.
174.
175.
176.
177.
178.
179.
180.
181.
18
183.
184.
185.
186.
187.
>88. Si
148 (1955).
Н a d о г n Н., Suter Н., Mitt. Lebensm. Hyg., 46, 341 (1955). Marotta C. R., Pena C., pR (Montevideo), 5, Nos. 1—3 D9 (1955). Musha S., Munemori M., J. Chem. Soc. Japan, Ind. Chem. Sect., 58, 393 (1955).
Павлович В. А., Абуладзе Л. M., Текстильная пром., 15, № 10, 56 (1955).
Pijanowski Е., Zebrowska М., Przem. Spozywczy, 9, 282 (1955). Raymond Р., Mitt. Lebensm. Hyg., 46, 246 (1955).
Tokar G., S i m о n у i L, G a 1 G., Magyar Kem. Folyoirat, 61, Budesinsky B., Chem. Listy, 50, 1236 (1956).
Budesinsky B., Vanickova E., Ceskoslov, Farm., 5, 277 (1956). Eschmann H., Chemist — Analyst, 45, 5 (1956).
Klautschnigg P., Ann. sper. agrar. (Rome), 10, 1405 (1956).
R abega C., Analele Univ. «С. I. Parhon», Bucuresti, Ser. stiinte nat. N. 12, 57 (1956).
Rabega C., Stanescu R., Rabega M., Osorhan T., Analele Univ. «С. I. Parhon», Bacuresti, Ser. stiinte nat. No. 12, 65 (1956).
Ruggieri R., Boil. chim. farm., 95, 467 (1956).
Runti С., П Farmaco (Pavia), Ed. prat., 11, 218 (1956).
Vavrinecz G., Cukroripar., 9, 49 (1956).
T'(1957a k 3 W a H’’ Kobe Daigaku Kyoikugakubu Kenkyu ShOroku № 15, Kleflin Z., Sumanovic K., Farm. Glasnik, 13, 95 (1957).
В a a p e W., Gebert P., Pharmazie, 12, 475 (1957).
Rabega C., Stanescu R., Rabega M., Analele Univ «С. I. Parhon», Bucuresti, Ser. stiinte nat. No. 16, 107 (1957).
К a b e g a C., Rabega M., Stanescu R., Analele Univ. «С. I. Parhon», Bucuresti, Ser. stiinte nat. No. 16, 111 (1957).
- 1 n g h M. P., G h о s h S., Z. physik. Chemie (Leipzig), 207, 187 (1957).
407
189. Arnoux M. J., Pastor J., Morel B., Bull. soc. pharm. Marseille, 7, 190. Евстратова К- И., Биохимия, 23, 181(1958).
231 (1958).
191. Финкельштейн М. 3., Тимохин И. М., М ухамедов X. у Изв. высших учебн. заведений, нефть и газ, № 12, 45 (1958).
192. Leopold Н., V а 1 t г Z., Nahrung, 2, 464 (1958).
193. Leopold Н., V а 1 t г Z„ Nahrung, 2, 532 (1958).
194. Roth Н., Mikrochim. Acta 767 (1958).
195. Street H. V., Analyst, 83, 628 (1958).
196. Berka A., Z У k a J., Ceskoslov. Farm., 8, 576 (1959).
197. BlaEej A., Mladek M., Kozafstvi, 9, 131 (1959).
198. В о t t i n i E., S t r i g i n i P., A n t о g n о n i G., Boll. soc. ital. biol sper., 35, 772 (1959).
199. Hel mstaed t er G., Deut. Apotheker — Ztg., 99, 589 (1959).
200. Leopold H., V a 1 t r Z., Ceskoslov. Farm., 8, 486 (1959).
201. N e b b i a L., P a g a n i B., Chim. e ind. (Milan), 41, 870 (1959).
202. Spaulding G. H., Anal. Chem., 31, 1109 (1959).
203. T a n d о n J. P., Z. anal. Chem., 167, 184 (1959).
204. T a tsuzawa M., Eisie Shikenjo Hokoku, 77, 109 (1959).
205. W u С. C., Formosan Sci., 13, 37, 45 (1959).
206. А б л о в А. В., Б а т ы p Д. Г., Ж. аналит. химии, 15, 112 (1960).
207. Blagajevic Z., Bradlc Р., Bunovic М., Schweiz. Apotheker— Ztg., 98, 654 (1960).
208. G r e c u I., G и r e a E., Farmacia (Bucharest), 8, 503 (1960).
209. G г e с и I., С и r e a E., Farmacia (Bucharest), 8, 625 (1960).
210. Knight J., A 1 1 e n С. H., Intern. Sugar J., 16, 344 (1960).
211. S i m k о v a A., H a 1 1 e r A., Pharm. Zentralhalle, 99, 113 (1960).
212. Wiseman H. G., M a 1 1 a c k J. C., J а с о b s о n W. C., J. Agr. Food Chem., 8, 78 (1960).
213. Casier J. P. J., H e n d r i x R., Agricultura (Louvain) (2), 8, 741 (1960).
214. Holasek A., Dugandzic M., Arztl. Lab., 6, 1 (1960).
215. Tanner H., Fruchtsaft. Ind., 5, No. 1, 13 (1960).
216. S t a n c i и N., I о n i с a V., Farmacia (Bucharest), 9, 49 (1961).
217. Gauthier B., Mar ech al M. C., Ann. pharm. franc., 20, 156 (1962).
218. A b d i n e H., Abdel S a у a d W. S., J. Pharm. Pharmacol., 14, 761 (1962).
219. C i о g о 1 e a G., M о r a i t G., Baloescu C., Teodorescu N, Creanga, S., Tudor, M., P e t г о n i u, L., lonescu, G., Farmacia
(Bucharest), 10, 257 (1962).
220. M а н о л о в К- P., Ж- аналит. химии, 17, 898 (1962).
221. Р 1 u m е 1 М., Ann. Pharm. Franc., 20, 34 (1962).
222. Roche M., Ind. Aliment. Agr. (Paris), 79, 647 (1962).
223. Tatsuzawa M., Bunseki Kagaku, 11, 1055 (1962).
224. Ciogolea C., Creanga S., Mihai T., Petroniu L., Ann. Pharm.
Franc., 21, 681 (1963).
225. F r i m 1 M., Vcelakova D., Listy Cukrovar, 79, 241 (1963).
226. Kvapil J., Копир c i k M., L i | k a M., Tech. Publ. Stfedisko Tech. Inform Potravinar Prtimyslu No. 139, 334 (1963).
227. Parushev M., Khim. Ind. (Sofia), 35, 49 (1963).
228. Tamura Z., Miyazaki M., Bunseki Kagaku, 12, 470 (1963).
229. Тимохин И. M., Финкельштейн М. 3., Ж- прикл. химии, 36,
415 (1963).
29. СОЕДИНЕНИЯ МЕДИ (III)
В большинстве случаев соединения меди (III) применяют в качестве окислителя в методах прямого титрования. Известен один слУ' чай использования указанного реагента в методах косвенного титр0' вания — для определения винной кислоты.
408
Винную кислоту смешивают в течение 5—10 мин при комнатной температуре с К7Си (Ю6)2 в щелочном растворе. Избыток реагента оттитровывают арсенитом до изменения синей окраски титруемого раствора в зеленую.
ЛИТЕРАТУРА
у е 1 i к ° n j а N.> Arkiv. Kem., 27, 161 (1955).
30. ЦИАНИД КАЛИЯ
Реагент. В качестве реагента можно использовать цианид какого-либо щелочного металла. Почти всегда применяют один реагент — цианид калия. В большинстве случаев для титрования применяют водные растворы цианида калия.
Реакции и титруемые вещества. 1. Реакции присоединения к карбонильным соединениям, главным образом к альдегидам:
ОН
I
RCHO + CN" + Н2О RCH + ОН"
I
CN
Большинство примеров реакций этого типа связано в первую очередь с определением формальдегида и во вторую — с определением сахаров.
Определение формальдегида иногда представляет собой заключительную стадию анализа его продуктов конденсации или полимеров: гексамина, феноло-формальдегидных смол, параформальдегида или триоксиметилена. Определение может быть связано с предварительной отгонкой альдегидов или может не сопровождаться их отделением от других компонентов реакции. Кинетика реакций образования циангидринов была изучена некоторыми авторами. В работе 25 указывается, что ацетальдегид и пропионовый альдегид реагируют с KCN количественно, а кетоны, например ацетон, не реагируют.
2. Реакции образования циангидринов путем замещения сульфита в бисульфитных соединениях альдегидов:
ОН ОН
I I
RCH + CN” -> RCH + SO‘~ + Na+
I I
SO3Na CN
Эти реакции применяются главным образом для определения сНО и СН3СНО, образующихся при окислении некоторых органических соединений; сначала получаемые альдегиды превращаются бисульфитные соединения (см. «Бисульфит и сульфит») и затем ввергаются действию цианида калия.
409
По существу такой же принцип лежит в основе определения некоторых производных метансульфокислот, подобных новальгину и мелубрину. Уравнение реакции может быть представлено в следующем виде (где X является NH-группой, очевидно, превращающейся в NH2-rpynny):
X — CH2SO^ + CN- + Н2О X — Н + СН2 (ОН) CN + SO^~
Формальдегидциангидрин гидролизуется в гликолят при определенных условиях.
3. Реакции расцепления S—S-связей, сопровождающиеся образованием SCN--ионов. Эти реакции применяют для определения соединений, подобных тиосульфонатам, тиурамдисульфидам и дибутил ксантогенату:
RSO2S- + CN~ -> RSO7 4- SCN“
R2N — CS — S — S — CS — NR2 4- CN" R2N 4- CS — S — CS — NR2 4- SCN'
C4H9O —CS — S—S — CS — OC4H9 + CN' ->
-> C4H9O — CS — S — CS — OC4H9 + SCN-
Условия реакции. В процессе выполнения указанных реакций редко используются органические растворители. Большое число определений основано на реакциях типа 3.
Реакции с сахарами и другими карбонильными соединениями обычно протекают в слабощелочном растворе (pH 8—9).
Реакции типа 2 проводятся под слоем пентана, чтобы свести к минимуму окисление кислородом воздуха выделяющегося в свободном виде сульфита.
Соответствующая обработка и конечная стадия титрования. 1. Избыток реагента CN- может быть определен одним из трех указанных ниже способов.
1) Титрование А§+-ионами. Этот способ титрования может быть выполнен прямым методом в присутствии I--ионов, играющих роль индикатора (конечную точку титрования определяют по появлению помутнения), или косвенным методом путем добавления избытка реагента и последующего титрования его тиоцианатом (т. е. по Фольгарту). Обычно титруют реакционную смесь, не прибегая к предварительному разделению ее компонентов; но в одном случае избыток CN- отгоняют в виде HCN, которую затем оттитровывают.
2) Титрование Н§а+-ионами. Подобно титрованию ионами серебра, этот способ может быть осуществлен путем прямого титрования [раствором Hg (NO3)2 в присутствии дифенилкарбазона] или косвенным методом (избыток реагента оттитровывают SCN • ионами или добавляют избыток С1_-ионов и заканчивают титрование Hg2+-HOHaMH в присутствии нитропруссида натрия).
3) Связывание CN- в BrCN избытком брома, который удаляют с помощью фенола, и затем добавляют 1_-ионы, реагирующие согласно уравнению:
BrCN + 21“ Br + CN' + 12
410
Таблица 38. Примеры использования цианида калия
—- № п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
1 формальдегид (см. № 3, 4 6, 8—14, 17, 20, 21, 24, 30, 39, 41) Избыток KCN—вода HNO3; избыток AgNO3; отфильтровывают; оттитровывают Ag1 тиоцианатом в присутствии Fe111 1
2 Тиосульфонаты Избыток KCN—щелочь; 30 мин при 100° С Избыток CN” оттитровывают AgNO3; затем добавляют AgNO3 и HNO3, избыток Ag1 оттитровывают тиоцианатом 2
3 Формальдегид (см. № 1) KCN; MgSO4 (катализатор); 1—2 мин при комнатной температуре NHjOH—NH4C1; немного Г; избыток CN- оттитровывают AgNO3 до пояилеиия мути 3
4 Формальдегид (см. № 1) (микрометод) KCN; 3 мин НС1; бромная вода; избыток брома удаляют с помощью фенола; добавляют Г и титруют тиосульфатом 3
5 Т иооксиметилен Избыток KCN; метаноловый раствор кон MgSO4; осадок растворяют в NH4C1, прибавляют немного Г и титруют AgNO3 4
6 Формальдегид (см. № 1) KCN; 5 мин при комнатной температуре Винная кислота; HCN, образующуюся из избытка CN- , перегоняют и отти-троиывают AgNO3 в присутствии С1_ в качестве индикатора) 5
7 Сахара (см. № 16), например лактоза, глюкоза (см. № 18, 31) В воде; KCN; 10 мин при комнатной температуре Как указано иы-ше — см. № 6; отдельные сахара образуют свои характерные соединения, отличающиеся HCN-числом 6
8 Формальдегид (см. № 1), образуемый при определении параформальдегида путем прибавления H2SO4 и перегонки с паром KCN; перевешивают (Холосто)< опыт) AgNO3 и HNO3; фильтруют; избыток Ag+ оттитровывают SCN- в присутствии Fe111 7
411
Продолжение
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
9 Формальдегид (см. №1), образуемый при определении гексамина путем добавления H2SO4 и последующей перегонки KCN; 30 мин Фосфорная кислота; бромная вода до по-явления желтого окрашивания; избыток брома удаляют с помощью фенола; прибавляют I- и через 30 мин титруют тиосульфатом 8
10 Формальдегид (см. № 1) (Метод описан выше 3 — см. № 3) 9
11 Формальдегид (см. № 1) Водный раствор KCN AgNO3; капля HNO3; избыток Ag+ оттитровывают тиоцианатом в присутствии Fe111 10
12 Формальдегид (см. № 1), образуемый при анализе смеси глицерин (см. № 13) — гликоль (см. № 30) путем окисления перйодатом KCN AgNO3, избыток которого оттитровывают тиоцианатом (при расчете учитывают образование AgIO3 и AglOJ и
13 Формальдегид (см. № 1), образуемый при определении глицерина (см. № 12, 30) и бутан-2,3-диола путем окисления перйодатом (Метод описан выше 11 — см. № 12) 12
14 Формальдегид (см. № 1) KCN Избыток CN" определяют прибавлением избытка Hg (NO3)2 {образуется недиссоцииро-ванная соль Hg (CN)2], затем вводят избыток NaCl (образуется HgCl2); избыток С1_ оттитровывают раствором Hg (NO3)2 в присутствии нитропруссида натрия 13
15 Альдегиды (см. № 29); кетоны; полуацетали; полукетали В разбавленной уксусной кислоте; KCN; 24 ч при комнатной температуре NH4OH; 1“; избыток CN- оттитровывают AgNO3 до появления мути i4
16 Сахара (см. № 7) (При pH 9,1 метод № описан выше 14 — см. 15) 13
17 Формальдегид (см. № 1) KCN Избыток CN' определяют действием Hg (NO3)2, избыток которого оттитровывают тиоцианатом 16
412
Продолжение
1* п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
18 Глюкоза (см. № 7) KCN; уксусная кислота; pH 8,5; 3 ч при 39°С Подкисляют в присутствии метилового красного и затем избыток CN- отгоняют в виде HCN; добавляют NaOH; NH3 отгоняют в НС1, избыток которой оттитровывают щелочью в присутствии метилового красного 17
19 Концевые группы в альдозе KCN; NH4NO3; pH 8,3 Избыток CN~ оттитровывают Hg (NO3)2 18
20 формальдегид (см. № 1) KCN Фосфорная кислота; бромная вода; избыток брома удаляют с помощью фенола, прибаиляют 1“ и выделившийся иод оттитровывают тиосульфатом 19
21 Формальдегид (см. № 1) KCN; дифенилкарб-азон; HNO3 (до тех пор, пока не исчезнет окраска) Немедленно проводят обратное титрование Hg (NO3)3 до появления фиолетовой окраски, не исчезающей в течение 1 мин 20
22 Фруктоза (см. № 34) KCN; при pH 8 (добавляют уксусную кислоту); 48 ч при 45° С Доводят pH до 11,5, добавляя NaOH; образующийся при гидролизе цианги- дрина NH3 перегоняют в H2SO4, избыток которой оттитровывают щелочью в присутствии метилового красного или пурпурного 21
23 24 Карбонильные группы (см. № 38) в окисленных хромовой кислотой крахмалах NaCN; уксусная кислота, при pH 9,5; 24 ч при комнатной температуре NaOH; образующийся NH3 перегоняют в борную кислоту; титруют НО в присутствии метилового красного и бромкрезолового зеленого 22
Формальдегид (см. № 1) в присутствии фенолов и фенолспиртов KCN, при pH 7 или выше Избыток CN” -ионов оттитровывают Hg (NO3)2 в присутствии дифенилкарб-азона 23
413
ПРодолм#^
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Лите. Рату. Ра
25 26 27 28 29 30 31 32 Метилольные группы (см, 40) в мочевино-формальдегидных смолах Тиурамидисульфид (см. № 33) Производные метансульфокислоты, подобные мелубрину или но-вальгину (метилмелуб-рин) Бисульфитное соединение формальдегида (см. № 29—31, 34—37) Бисульфитные соединения формальдегид (см. № 28) и ацетальдегид (см. № 36), образующиеся при определении альдегидов (см. № 15) путем взаимодействия их с Na2SO3 — уксусная кислота под слоем пентана Бисульфитное соединение формальдегида (см. № 28), образуемое при определении НСНО (см. № 1), получаемого в процессе окисления 1,2-гли-колей (например, глицерина (см. № 13) маннита) перйодатом (см. № 12) Бисульфитное соединение формальдегида (см. № 28), полученное из НСНО при определении глюкозы (см. № 7) путем окисления перйодатом Бисульфитное соединение глиоксиловой кислоты, получаемой из глиоксиловой кислоты при определении винной кислоты путем окисления перйодатом KCN—щелочь KCN—ацетон (образуется моносульфид и KSCN) KCN; NaOH; под слоем пентана; 2 мин (образуется сульфит и гликолевая кислота) KCN; NaOH под слоем пентана (образуется сульфит) Избыток сульфита окисляют иодом, затем поступают так, как описано выше 28, — см. № 28 (Метод описан выше 2 (Метод описан выше 2 (Метод описан иыше 2 Как указано выше, — см. № 24 SCN- оттитровывают AgNO3 Подкисляют H2SO4 в присутствии метилового красного и титруют иодом в присутствии крахмала Выделившийся сульфит определяют иодо-метрическим титрованием, как в методе, описанном выше 27, — см. № 27 Как указано вы- ше, — см. Ns 28 28, 30, 31 _ см № 28> 9) 28, 30, 31 _ см. № 28, 9) 28, 30, 31 _ см> № 28, 9) 24 26 27, 29 28 30. 31,44 32,33 34 35 36. *
414
Продолжение
Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
ТиуРамДисУльФиды (см-Xs 26) В ацетоне; KCN— NH4NO3; встряхивают 30 мин Продукты реакции экстрагируют бензолом; к иодному слою прибавляют уксусную кислоту; HCN перегоняют; SCN-оттитровывают AgNO3 амперометрически 37
Бисульфитное соединение формальдегида (см. № 28), полученное из НСНО при определении фруктозы (см. Xs 22) путем окисления перйодатом (Метод описан выше 23 ’ 30 • 31 — см. Xs 28 29) 38, 41
Бисульфитное соединение формальдегида (см. Xs 28), полученное из НСНО при определении глицеринового альдегида путем окисления перйодатом (Метод описан выше 28, 30> 31 — см. Xs 28 29) 39, 42
Бисульфитные соединения формальдегида (см. № 28) или ацетальдегида (см. № 29), образующиеся при определении серина или треонина путем окисления перйодатом (Метод описан выше 30, 31 — см. Хе 28, 29) 40, 43, 45
Бисульфитное соединение формальдегида (см. Xs 28), образующееся из НСНО при определении этилендиамина и эта-ноламина путем окисления перйодатом (Метод описан выше 30, 31 — см. Xs 28, 29) 47, 48, 50
Карбонильные группы (см. № 23) в крахмале Буферный раствор: СО2-—НСО", pH 9,5; NaCN (по крайней мере в двойном количестве по сравнению с теоре- Фильтруют; фильтрат титруют AgNO3 в присутствии KI (в качестве индикатора) до помутнения 49
Формальдегид (см. Xs 1) в формальдегид-тиомо-чевинных смолах (см. Xs 40) тическим); 2—24 дня KCN; титруют H2SO4 при 0—4° С в присутствии тимолфталеина; оставляют на 5 мин при комнатной температуре НС1; бромная вода; избыток брома удаляют с помощью фенола; добавляют I-и через 30 мин титруют тиосульфатом 51
^РодолясеНие
№ п/п
40
41
Титруемое вещество
Реагент и условия реакции
Соответствующая обработка и конечная стадия титрования
Литература
Метилольные группы (см. № 25) в формальде-гид-тиомочевинных смолах (см. № 39) Формальдегид (см. Ns 1) в нерастворимых протеинах кожи
KCN; NaOH; 30 мин при комнатной температуре
Перегоняют из фосфорнокислого раствора; KCN; 30 мин при комнатной температуре
Дибутилксантогенат
KCN—NH4NO3— ацетон; около
25 мин при 40—50° С (образуется KSCN и C4H,O—CS—S—CS—ОС4Не)
НС1; в заключение поступают так, как описано выше, — см. № 39
Концентрированная НС1; бромная вода; избыток брома удаляют с помощью фенола; добавляют KI и титруют тиосульфатом после выдерживания в течение 30 мин в темноте Моносульфид ксантогената экстрагируют бензолом; к водному слою приливают Н3РО4; затем раствор кипятят для удаления С№ в виде HCN; окисляют SCN" бромом до BrCN и SO|~; добавляют Г и
NaHCO3; через 10 мин выделивший-
51
52
ся иод оттитровывают тиосульфатом
Выделившийся иод оттитровывают тиосульфатом.
2. В ряде случаев также применяют способы, основанные на титровании какого-либо продукта реакции; ниже приводятся некоторые примеры такого рода.
1) Циангидрид, образующийся в процессе реакции типа 1, гидролизуется в щелочном растворе с образованием NH3 (при этом иногда удаляют избыток CN”, а в ряде случаев его не отделяют), который | отгоняют и определяют методом кислотно-основного титрования.
2) 5Оз--ионы, образующиеся в процессе реакции типа 2, от-титровывают стандартным раствором иода.
3) SCN_-HOHbi, образующиеся ц процессе реакции типа 3, оттитровывают Ag1 или определяют окислением бромом до BrCN, который реагирует с I- с образованием элементарного иода, которо оттитровывают тиосульфатом [см. п. 1 (3)1.
ЛИТЕРАТУРА
1. R о m i j n G., Z. anal. Chem., 36, 18 (1897).
2. G u t m а п n A., Z. anal. Chem., 47, 294 (1908).
3. S c h u 1 e k E., Ber., 58, 732 (1925).
J
416
л 1 e s s a n d г i n i M. E., Atti II congresso naz. chim. pura applicata 1356 (1926). npich F., Z. anal. Chem., 76, 241, 255 (1929).
5- i p p i c h F., Z. anal. Chem., 76, 401 (1929).
Weinberger W., Ind. Eng. Chem., Anal. Ed., 3, 357 (1931).
' c c h u 1 e к E., G e r v а у V., Magyar Gyogyszeresztud. Tarsasag Ertesitoje, 8‘ a 26 (1933); Z. anal. Chem., 92, 406 (1933).
nMutschin A., Z. anal. Chem., 99, 335 (1934).
,n Thompson F., Chemist and Druggist, 121, 523 (1934).
i H о e p e G., T r ead wel 1 W. D., Helv. Chim. Acta, 25, 353 (1942).
9 H о e p e G„ Helv. Chim. Acta, 26, 1931 (1943).
o' L a s к a F., P г о t i v a M., Chem. Listy, 37, 76 (1943).
14 M i 1 i t z e r W. E., Arch. Biochem., 9, 91 (1946).
15 M i 1 > t z e r W. E., Arch. Biochem., 21, 143 (1949).
16 Bring A., Chem. Prftmysl., 1, (26), 272 (1951).
17'Frampton V. L., F о 1 e у L. P., S m i t h L. L., M a 1 о n e J. G., Anal. ' Chem., 23, 1244 (1951).
18. Y u n d t A., TAPPI, 34, 95 (1951).
19 Коппо K., Kageyama M., U e d a T., J. Pharm. Soc. Japan, 72, 1153 ' (1952).
go. P f e i 1 E., S c h г о t h G., Z. anal. Chem., 134, 333 (1952).
21. С о о m b s R. D., R e i a A. R., P u r v e s С. B., Anal. Chem., 25, 511 (1953).
22. E 11 i n g t о n А. С., P u r v e s С. B., Can. J. Chem., 31, 801 (1953).
23. D e J о n g. J. I. Rec. trav. chim., 72, 356 (1953).
24. D e Jong J. I., Rec. trav. chim., 72, 653 (1953).
25. S v i г b e 1 у W. J., R о t h J. F., J. Am. Chem. Soc., 75, 3106 (1953).
26. Scheele W., G e n s c h C., Kautschuk u. Gummi, 7, WT 122 (1954).
27. S c h u 1 e к E., M а г о s L., Acta Pharm. Hung., 27, 237 (1957).
28. Maros L., Magyar Kem Folyoirat, 64, 41 (1958).
29. S c h u 1 e к E., M а г о s L., Anal. Chim. Acta, 19, 4 (1958).
30. S c h u 1 e к E., M а г о s L., Magyar Kem. Folyoirat, 64, 480 (1958).
31. S c h u 1 e к E., M а г о s L., Acta Chim. Acad. Sci. Hung., 17, 369 (1958).
32. M а г о s L., S c h u 1 e к E., Magyar Kem. Folyoirat, 65, 361 (1959).
33. M а г о s L., S c h u 1 e к E., Acta Chim. Acad. Sci. Hung., 20, 359 (1959).
34. M а г о s L., S c h u 1 e к E., Acta Chim. Acad. Sci. Hung., 21, 91 (1959).
35. S c h u 1 e к E., M о 1 n a r - P e r 1 I., M а г о s L., Magyar Kem. Folyoirat, 65,363 (1959).
36. S c h u 1 e к E., M о 1 n а г - P e r 1 I., M a г о s L., Acta Chim. Acad. Sci. Hung., 20, 443 (1959).
37. Chatterjee P. K-, Banerjee D., Sircar A. K., J. Sci. Ind. Research (India), 19B, 1-C, 118 (1960).
38. M а г о s L., S c h u 1 e к E., Magyar Kem. Folyoirat, 66, 197 (1960).
3»- Maros L., M о 1 n a r - P e r 1 I., S c h u 1 e к E., Magyar Kem. Folyoirat, 66, 319 (1960).
Maros L., M о 1 n a r - P e r 1 I., S c h u 1 e к E., Magyar Kem. Folyoirat, 66, 321 (i960).
ros L., Schulek E., Acta Chim. Acad. Sci. Hung., 22, 359 (1960).
•Maros L., Molnar-Perl I., Schulek E., Acta Chim. Acad. Sci.
44 MUng'’ 24’ 67(1960).
Maros L., Molnar-Perl I., Schulek E., Acta Chim. Acad. Sci.
44 м g'’ 24’ 213 (1960)‘
Maros L., S c h u 1 e к E., Ann. Univ. Sci. Budapest Rolando Eotvos nomina-
45 м ’ Sect Chim., 2, 227, also 231 (ln60,
оЛ r ° s !-, Mol nar-Per 1 I., S c h u 1 e к E., Ann. Univ. Sci. Budapest 46. c an<^° Eotvos nominatae, Sect. Chim., 2, 237 (1960).
' c h u 1 e к E., M а г о s L., Ann. Univ. Sci. Budapest Rolando Eotvos nomi-47. мtae Sect- Chim., 2, 243 (1960).
fi7a I ° s L., M о 1 n a r - P e r 1 I., S c h u 1 e к E., Magyar Kem. Folyoirat,
48. m’ ?°3(1961)-
° s L-, M о 1 n аг - P er 1 I., S c h u 1 e к E., Acta Chim. Acad, Sci. Hung-, 26, 467 (1961).
4 M' P- Ф. Эшворт 417
49. Schmorak J., Lewin M., Anal. Chem., 33, 1403 (1961).
50 Maros L., Mol nar - Perl I., S c h u 1 e к E., Acta Chim <-• Hung., 30, 119 (1962). acl' Sci.
51 Prob st ha in K., Z. anal. Chem., 187, 104 (1962).
52. Rosmus J., D e у 1 Z., KoEafstvi, 11, 111 (1961).
53. S h a n к a r a n а г а у a n a M. L., P a t e 1 С. C., Analyst, 86, 98 (196П
1 Маслов И. Г., Пахомова О. И., Изв. центрального н.-и. ин-та кожи ной пром., № 5, 18 (1932).
2. М е н дл и н а Н. Г., Изв. центрального н.-и. ин-та кожевенной пром м, 0 41, № 9, 28 (1932). "
3. Holtzman Н., Graham Н., J. Assoc. Off. Agr. Chem., 32, 617 (19494
4. Holtzman H., Graham H., J. Assoc. Off. Agr. Chem., 34, 393 (I95n
5. D e M a 1 d e M., Ann. chim. (Rome), 42, 431 (1952).
6. Кухаренко T. А., Екатерина Л. H., Тр. ин-та горючих ископя₽ мых, АН СССР, 8, 142 (1959).
7. Терентьев А. П., Т у б и н а И. С., Ж- анал. хим. , 18, 880, (1963)
31. СОЛИ ДИАЗОНИЯ
По сравнению с методами прямого титрования известно меньше примеров косвенного титрования, основанного на применении солей диазония. Это несомненно объясняется сравнительно малой стойкостью реагента.
Примеры, приведенные здесь, основаны на использовании реакций сочетания, применяемых, как правило, для определения фенолов. Определение завершается титрованием избытка реагента [3-наф-толом или продукта реакции соединениями титана (III) или путем прибавления амина и последующего определения его избытка.
Метод колориметрического определения содержания продуктов, получаемых путем азосочетания, является наиболее обычной заключительной стадией анализа посредством диазониевых солей.
Таблица 39. Примеры использования солей диазония
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литературу
1 Танниды (см. № 2) Ацетат натрия; Избыток реагента от- 1
п-нитробензолдиазо- титровывают (3-наф-
ниевая соль; 40— толом с помощью
45 мин внешнего ипдикато-
ра — R-соли 2
2 Танниды (см. № 1) в иве, Метод описан выше 1 — см. № 1
сосне, дубовой пульпе •
3 и т. Д. fi-Нафтол в красителях Диазотированная Продукт азосочета- 3.
сульфаниловая ния титруют 1 1С13
кислота [см. Том I, «Соединения титана (III)»,литератур а 37]
4 1-Цианбутадиен-1,3 В среде уксусная Избыток реагента от-
в техническом акр ил о- кислота—ацетат на- титровывают fi-наф-
нитриле трия; п-нитробен- золдиазониевая соль; толом
15 ч в темноте
418
Продолжение
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Л те рату ра
5 фенольные соединения (см. № 6) в каменноугольной смоле и гуминовых кислотах В NaOH; ацетат натрия; диазониевая соль; 1 ч при охлаждении Избыток реагента оттитровывают Р-нафтолом с помощью внешнего индикатора—5%-ного рас- твора резорцина 6
6 фенолы (см. № 5) Избыток п-толуол-диазонийхлорид; Na2CO3 Гексаметиленимин; 5 мин; затем добавляют NaOH; избыток имина отгоняют в борную кислоту и титруют НС1 (см. «Амины и гетероциклические основания», литература 112) 7
ЛИТЕРАТУРА
1. Маслов И. Г., Пахомова О. И., Известия Центральн. НИИ Кожевенной пром., № 5, 18 (1932).
2. Мендл и н а Н. Г., Известия Центральн. НИИ Кожевенной пром., № 8, 41; № 9, 28 (1932).
3. Holtzman Н., Graham Н., J. Assoc. Of Agr. Chem., 32, 617 (1949).
4 Holtzman H., Craham H., J. Assoc. Of Agr. Chem., 34, 393 (1951).
5. De M a 1 d e M., Ann. chim. (Rome), 42, 431 (1952).
6. Кухаренко T. А., Екатеринина Л. H., Труды Ин-та горючих ископаемых, АН СССР, 8, 142 (1959).
^Терентьев А. П., Т у б и н а И. С., ЖАХ, 18, 880 (1963).
32. ДИГИТОНИН
Дигитонин образует малорастворимые комплексные Со стеринами. Осаждение продукта присоединения
соединения
________________________ _ . __ _ дигитонина является общеизвестным стандартным методом определения холе-
Определение, как правило, завершается гравиметрически, некоторых случаях, цитируемых ниже, содержание холесте-
стерина *. ЙО PJ ТТ~_. —
Рина в осадке комплекса определяется титриметрически.
коПро* ^[)0ДУкты присоединения с дигитонином образуют также холестанол, Г1Ргдс5ганол’ эргостерин, стигмастерин и некоторые другие. Поэтому дигитонин г>эИнаВЛЯет со6ой важный аналитический реагент, применяемый для определения в> представляющих собой кристаллические спирты.★
419
Таблица 40. Примеры использования дигитонииа
№ п/п
Реагент и условия реакции
Соответствующая обработка и* конечная стадия титрования
Литератур.,
Спирто-эфирный экстракт (см. № 2, 3)
2 Спирто-эфирный экс-
тракт (см. № 1)
3 Спирто-эфирный экс-
тракт (см. Ns 1)
Избыток 1%-ного раствора дигито- j нина в 50%-ном этаноле выпаривают досуха и экстрагируют эфиром; осадок комплексного соединения окисляют бихроматом, избыток которого оттитровывают иодометрически (см. «Бихромат и трехокись хрома», литература 42)
Некоторая модификация метода, опи- 2
санного выше х, — см. № 1
Спиртовой раствор дигитонина; вы- 3
паривают досуха; добавляют воду; нагревают для того, чтобы извлечь избыток растворителя; добавляют ацетон; продукт реакции определяют путем окисления избытком бихро-
В этаноле (растительные стер ины)
мата
Раствор дигитонина в 80% -ном этаноле оставляют на ночь; центрифугируют; осадок окисляют бихроматом, избыток которого оттитровывают Fe11 (см. «Бихромат и трехокись хрома», литература 171) или
5
осадок растворяют в метаноле и анализируют, действуя избытком бром— NaBr—метанол (см. «Реагенты, содержащие бром», литература 377)
ЛИТЕРАТУРА
1. Okey R., J. Biol. Chem., 88, 367(1930).
2. Т и г п е г М. Е., J. Biol. Chem., 92, 495 (1931).
3. Y a s и d а М., J. Biol. Chem., 92, 303 (1931).
4. W a g h о г n e D., В a 11 C. D., Anal. Chem., 24, 560 (1952).
5. Orl a wsk i M., Simon J., Acta Biochim. Polon, 1, 231 (1954).
33. ДИ МЕТИЛСУЛЬФ AT
Ниже приводится три примера определения, основанных на алкилировании анализируемого вещества диметилсульфатом *.
* Диметилсульфат наряду с хлористым или бромистым метилом, метанол! и диазометаном является прекрасным метилирующим агентом. „
При действии ди метилсульфата иа гидроксилсодержащие соединения получа1°. ( летучие эфиры, легко подвергающиеся дистилляции. Поэтому диметилсульч». применяют не только для определения метилирующихся органических соедчне _ но и для разделения их от нелетучих продуктов, например для отделения оксики от смолистых продуктов4,5.
420
Таблица 41. Примеры использования диметилсульфата
-/п Титруемое вещество Реагент н условия реакции Соответствующая обработка и конечная стадия титрования Литература
1 2 Некоторые гетероциклические соединения (0. или у-замещенные пиридина; некоторые алкалоиды) Лигнин — определение ОН-групп Щелочь; (CH3)2SO4 (или С2Н61); нагревают в запаянной трубке при 120° С (Для расщепления гетероциклического кольца разных соединений требуется различное время) NaOH; (CH3)2SO4; 6 ч при 60° С (Происходит метилирование ОН-групп; требуется повторная обработка) MnOj- и метиламин; продукт реакции отгоняют и оттитровывают H2SO4 Немного H2SO4; отфильтровывают и высушивают; дважды обрабатывают реагентом и затем определяют содержание метоксигрупп при помощи HI, взаимодействие сопровождается образованием СН31, который немедленно окисляют йодатом и затем определяют иодометрически 1, 2 3
ЛИТЕРАТУРА
1. Sa скит О., Bull. soc. chim. France, 16, 270 (1949).
2. Kahane E., Sackur O., Ann. pharm. franc., 11, 175 (1953).
3 Farkas, J., Chem. zvesti, 13, 536 (1959).
4. П. П. Шор ыги н, А. П. К p e ш к о в, Ж. общ. хим., 3, 825 (1933).
5. П. П. Шорыги н , А. П. К р е ш к о в, Ж. общ. хим., 4, 988 (1934).
34. ДИТИОНИТ НА ТРИН
Ниже приводится четыре примера анализа, основанного на восстановлении дитионитом. В трех из этих примеров используют метод обратного титрования избытка реагента в заключительной стадии определения.
Таблица 42. Примеры использования дитионита
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
1 2 Бензолдиазонийхлорид Азосоединения (см. 3), например красители метиловый крас-ныи и конго красный В НС1 при 0° С; S О2-(образуется фенилгидразин) NaHSO3 и Zn (очевидно, реакция протекает с образованием S2O2~ ) Избыток реагента оттитровывают красителем кислым зеленым Уксусная кислота; через 10 мин добавляют NaHCO3; избыток реагента отти- 1 2
421
ПРодолисенш
№ п/п Титруемое вещество Реагент н условия реакции Соответствующая обработка и конечная стадия титрования Лит*. Рату, ра
3 Нитро- и азосоединения Уравнение реакции: 4NaHSO3 + Zn -> -> ZnSO3+ Na,SO3 + + 2H2O + Na2S2O4 реакция 3RN = NR' + + 2S2O4—+ 8H2O 3RNH2 + + 3R'NH2 + 4HSO^~ протекает в течение 5 мин Восстанавливают тровывают иодометрически Определяют содер- 3
4 (см. № 2) Хлорпикрин в зерно- с помощью S2O|— до аминов Абсорбируют в эта- жание азота по методу Кьельдаля Избыток реагента от- 4
вых продуктах, обработанных фумигантами ноле и добавляют S О2~ а2и4 титровывают иодом
ЛИТЕРАТУРА
1. К n е с h t Е., Thompson L., J. Soc. Dyers Colourists, 36, 215 (1920).
2. Z a r a u s V. J., Boll. soc. quim. Peru, 5, 124 (1939).
3. Sh aef er W. E., Becker W. W., Anal. Chem., 19, 307 (1947).
35. КРАСИТЕЛИ
Известно несколько примеров использования красителей в ти-триметрических методах анализа. Обычно для этих целей применяют в качестве окислителя метиленовый голубой. Определение обычно завершается титрованием титаном (III) избытка красителя.
В отличие от метода прямого титрования красителями для методов обратного титрования неизвестно примеров определения, основанных на реакциях ионного обмена, сопровождающихся образованием нерастворимых в воде продуктов.
Таблица 43. Примеры использования красителей
Ns п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
1 Фенилгидразин В разбавленной НС1; Избыток реагента от- 1
2 Глюкоза метиленовый голубой; кипятят 1 мин в атмосфере СО2 В воде; метиленовый голубой; NaOH; нагревают до кипения, кипятят 5 сек в атмосфере СО2 титровывают TiCl3 Избыток реагента оттитровывают TiCl3 [см. Том I, «Соединения титана (III)», литература 13] 2
422
Продолжение
№ ,/п Титруемое вещество Реагент н условия реакции Соответствующая обработка и конечная стадия титрования Литература
3 Аскорбиновая кислота Метиленовый голубой; 30—50 сек на солнечном свету Избыток реагента оттитровывают TiClg [см. Том I, «Соединения титана (III)», литература 24] 3
4 Гидразосоединения (образующиеся в процессе изучения бензидиновой перегруппировки) Биндшедлера зелень Избыток реактива оттитровывают Ti2(SO4)s [см. Том I, «Соединения титана (III)», литература 36] 4
5 Г идр азобензол (изучение бензидиновой перегруппировки) Этанол—вода; Биндшедлера зелень Избыток реагента оттитровывают TiCl3 в атмосфере азота [см. Том I, «Соединения титана (III)», литература 33] 5
ЛИТЕРАТУРА
1. Н a t а Т„ Bull. Research Inst. Food Sci., Kyoto Univ., No. 3, 63 (1950).
2 Малеев a E. Г., Научные доклады Высшей Школы, Химия и хим. технология, № 3, 505 (1958).
3. Brenner М. W., О wedes J. Н., Schapiro G. J., hauler S., Am. Brewer, 93, 28, 38 (1960).
36. ЭЛЕКТРОЛИТИЧЕСКОЕ ВОССТАНОВЛЕНИЕ
Ниже приводится три примера электролитического восстановления некоторых органических соединений.
Таблица 44. Примеры использования электролитического восстановления
№ п/п Титруемое вещество Реагент н условия реакции Соответствующая обработка и конечная стадия титрования Литература
1 Цистин Восстанавливают до Титруют иодометри- 1
2 Эти лбр ОМИД цистеина чески
В этаноле; спирто- Титруют аргеноме- 2
вой раствор КОН; трически
восстанавливают на
Pt или Ni электро-
3 Пиво — определение ди- дах Восстанавливают до Меркаптаны опреде- 3
сульфидных групп меркаптанов ляют путем взаимодействия с иодоацетамидом; добавляют
щелочь и оттитровывают ее избыток [см.
«Галогениды (активные)», литература
64]
423
ЛИТЕРАТУРА
1. Unger Р., Analyst, 80, 820 (1955).
2. N е b b i a L., Gu er r i er i F., Chim. e ind. (Milan), 39, 17
3. Kund u К. K., D as M. N-, Science and Culture, 23, 660 (1958) 31, 1358 (1959).
37. ГЕКСАЦИАИОФЕРРАТ (III) КАЛИЯ
Реагент. Почти всегда в качестве реагента применяют водные растворы гексацианоферрата (III) калия; реакции часто проводят в щелочном растворе и иногда в присутствии сульфата цинка.
Реакции и титруемые вещества. 1. Реакции окисления (используются почти во всех примерах, приводимых в этом разделе):
[Fe (CN)e]s- + e-[Fe (СЫТ-
ИЛИ в щелочном растворе:
2 [Fe (CN)6]3-2HZ-> 2 [Fe (CN)6]«~
Более 80% примеров реакций окисления с применением этого реактива относятся к определению сахаров. К числу других определяемых этим реактивом веществ, на которые имеется по крайней мере две литературные ссылки, относятся таннин, глюкуроновая и аскорбиновая кислоты, морфин и тиамин (витамин BJ.
Как и в случае реакций окисления сахаров щелочными растворами солей меди (II), реакции окисления посредством К3 (Fe (CN)61 протекают в нестехиометрических соотношениях, но являются воспроизводимыми при постоянно поддерживаемых условиях, которые соблюдаются также при установке титра раствора реагента.
2. Реакции ионного обмена, протекающие при определении некоторых высокомолекулярных оснований, таких, как акридин- и фе-нантридинпроизводные, и некоторых солей четвертичных аммониевых оснований. При этом взаимодействие веществ может протекать в различных стехиометрических соотношениях:
[В-Н]+ + Н2 [Fe (CN)6]_ -> осадок
2 [В-Н]+ + Н [Fe (CN)6]2- -> осадок
3 [В-Н]+ + [Fe (CN)e]3- осадок
(где В — основание).
Условия реакций. Большинство реакций окисления проводят в щелочных средах, добавляя в реакционную смесь гидроокиси, карбонаты, фосфаты или бораты щелочных металлов.
Очень часто добавляют также сульфат цинка, для того чтои осадить в виде нерастворимой в воде соли цинка гексацианофеР рат (II), образующийся в процессе реакции окисления—восстав0
вления. „
Окисление может быть проведено при различных условиях (вг мени и температуры). Например, при определении сахаров тем ч ратура варьрует от температуры кипения (—100° С) до 40 | продолжительность реакции колеблется от 1 до 20 мин.
424
Таблица 45. Примеры использования гексацианоферрата (III) калия
!»
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
Титруемое вещество
Глюкоза в крови и т. д. (см. № 5)
Сахар в крови (см.
№ 16)
Сахар в крови (см. № 16)
Сахар в крови (микрометод) (см. № 16) Глюкоза (см. № 1, 8, 11, 23, 25, 32, 34, 40, 41, 43, 48, 52, 53, 59, 61, 73, 75, 81, 84, 85, 87, 95, 99, 101, 109, 114) Сахар в крови (микрометод) (см. № 16) Сахар в крови (см. Ns 16)
Глюкоза (см. № 5) Сахар в крови (см. Ns 16)
Сахар в моче (см. Ns 16)
Глюкоза в крови (см. Ns 5)
Сахар (микрометод) (см. № Ю)
Сахар в крови (см. № 16) мочевая кислота
Глютатион; тиазин
Редуцирующие сахара (микрометод) (см. Ns 16, 18-20, 32, 36, 49, 55, 66, 76, 78, 80, 92, 103, 106, 1Ц, Ц6, 123)
Реагент и условия реакции
K3[Fe (CN)6I-щелочь; кипятят 1 мин
K3[Fe (CN)6J-
Na2CO3; нагревают 3 мин при 75—85° С
K3[Fe (CN)6J-Na2CO3; 15 мин при 100° С
(Метод описан выше 3 — см. Ns 3)
K3[Fe (CN)6]— щелочь; кипятят 1 мин
(Улучшенный вариант метода, описанного выше 3, — см. Ns 3)
KI—уксусная кислота; титруют тиосульфатом
K3[Fe (CN)6I— Na2CO3—ZnSO4;
5 мин при 100° С
(Метод описан выше 3 — см. № 3) [Метод, описанный выше3 (см. Ns 3), сравнивают с методом, в котором используют окисление медью (II) по методу Шафера—Хартманна, — см. «Соединения меди (II)», литература 59] (Изучалось применение метода, описанного выше 3, — см.
K3[Fe (CN)6]- ]
Na2CO3; кипятят ] 15 мин 1
K3[Fe (CN)e]— Na2CO3; 20 мин при 100° С
K3[Fe (CN)6]— Na2CO3; 15 мин при 100° С KstFe (CN) 0]—КОН
K3[Fe (CN)J-КОН
Соответствующая обработка и конечная стадия титрования
H2SO4; титруют перманганатом до изменения зеленой
окраски в розовую KI— ZnSO4—NaCl— уксусная кислота; титруют тиосульфа-
том в присутствии
крахмала
Как указано ше, — см. Ns
вы-2
Кислота; титруют перманганатом, как указано выше 1, — см. Ns 1
t. Ns 3)
Избыток бихромата; НС1; избыток арсенита; КВг; избыток арсенита оттитровывают броматом в присутствии метилового оранжевого KI— ZnSO4—NaCl— уксусная кислота; титруют тиосульфатом в присутствии крахмала
Избыток реагента оттитровывают ипди-госул ьфоки сл отой
Как указано выше, — см. Ns 13
Кислота; титруют перманганатом, как указано выше \ — см. № 1
Литература
/
2
3
4
5
6
7
8
9
10
11
12
13
14
14
425
№ п/п
16
17
18
19
20
21
22
23
24
25
26
27
28
29
30
31
Титруемое вещество
Сахара (см. № 2—4, 6, 7, 9, 10, 12, 13, 22, 24, 31—33, 35, 38, 42, 45, 46, 50, 51, 65, 67, 86, 88, 107, а также № 15) Диоксиацетон в крови
Редуцирующие сахара в крови (см. № 15)
Редуцирующие сахара в крови (см. № 15)
Редуцирующие сахара (см. № 15)
Лактоза в молоке (см. № 27, 30, 37, 83, 90)
Сахар в крови (см. № 16)
Глюкоза (см. № 5)
Сахара (см. № 16)
Глюкоза (микрометод) (см. № 5)
Мальтоза в муке и хлебных продуктах
Лактоза (см. № 21) Глюкуроновая кислота в крови (см. К° 68, 72)
Флавиновые красители, например акрифлавин
Лактоза в молоке (см. № 21)
Сахар в крови (см. № 16)
Реагент и условия Соответствующая об-реакции работка и конечная
стадия титрования
[Метод, описанный выше 3 (см. № 3)f сравнивают с другими методами определения углеводов]
K3[Fe (CN)eI— Na2CO3; на холоду, чтобы исключить влияние глюкозы
K3[Fe (CN)el-щелочь
Как в санном
методе, опи-выше 8, — см. № 3
KI—ZnSO4—NaCl-кислота; титруют тиосульфатом
ZnSO4, затем добавляют KI—кислота; титруют тиосульфатом (Модификация метода, описанного ше 3, — см. Ks 3)
K3[Fe (CN)eI— Na2CO3
KstFe (CN)el-Na2CO3 20 мин при 100° С
K3[Fe (CN)el-к2нро4-к3ро4
ВЫ-
опи-
3 ___
Как в методе, санном выше см. № 3
KI— ZnSO4—NaCl—
кислота; титруют тиосульфатом
(Модификация метода, описанного ше 1в, — см. № 3)
K3[Fe (CN)eJ— N аОН; 15 мин при 100° С
Как в методе, санном выше см. № 3
вы-
опи-
3 ___
Л nt Рату
Fa
16
17
18
19
20
21
22
23
24
25
з
количество гексацианоферрата (1П)[, см- № 3[
описанный выше 3, — см. № 3)
Модификация метода, описанного выше [двойное
(Метод,
(Метод, описанный K3[Fe (CN)el-NaOH; 15 мин при 100° С
В воде; избыток K3[Fe (CN)el; ацетат натрия и НС1; 10 мин при комнатной температуре
KstFe (CN)el-Na2CO3; 15 мин при 100° С
(Метод, описанный
выше 3, — см. № 3) KI—ZnSO4—NaCl, затем добавляют НС1; титруют тиосульфатом
Избыток реагента определяют в фильтрате, добавляя
I-—кислота и отти-тровывая образовавшийся иод тиосульфатом
Kl—ZnSO4—NaCl-уксусная кислота; титруют тиосульфатом в присутствии крахмала выше 3, — см. № 3)
26
27
28
23
за
426
Продолжение
Соответствующая об- Лите-
Титруемое вещество реакции работка н конечная рату-
стадия титрования ра
редуцирующие сахара K3[Fe (CN)6]~ H2SO4; титруют це- 31
(см. № 15), например Na2CO3; около рием (IV) в присут-
глюкоза (см. № 5), 30 мин при 80° С ствии альфазурина
фруктоза (см. № 39), до изменения желто-
тростниковый сахар зеленой окраски
(см. № 15) K3[Fe (CN)eI— в зеленую
Сахар в крови (см. KI—лимонная кис- 32
№ 16) щелочь; 5 мин лота—ZnSO4; титруют тиосульфатом
Глюкоза (см. № 5) при 100° С
K3[Fe (CN)6I-Na2CO3; 10 мин при 100°С H2SO4; титруют церием (IV) в присут- 33
ствии метилового
Сахар в крови (см. K3[Fe (CN)J- фиолетового
H2SO4; титруют це- 34
№ 16) Na2CO3; 5 мин при 100° С рием (IV) в присутствии ферроина или
Экстракт; K3[Fe (CN)eJ— альфазурина
Редуцирующие сахара HaSOj; титруют це- 35
(см. № 15) в растениях (микрометод) рием (IV) в присутствии ферроина
Na2CO3; 10 мин при 100° С
Лактоза в молоке (см. K3[Fe (CN)6]— KI—ZnSO4—NaCl, 36
№ 21) К2НРО4-КзРО4; затем НС1; титруют
Сахар в крови (см. 15 мин при 100° С тиосульфатом
K3[Fe (CN)6]— Na2CO3; 15 мин при 100° С H2SO4; титруют церием (IV) в присут- 37
№ 16)
ствии сетопалина С
до перехода от золотисто-желтой окра-
ск и до золоти сто-ко-
Фруктоза в присутствии ричневой
K3[Fe (CN)J- Уксусная кислота; 38
глюкозы (см. № 32, 56, Na2HPO4; нагре- иод, избыток кото-
62) вают 2,5 ч при 60° С рого оттитровывают
Глюкоза (образуемая тиосульфатом
K3[Fe (CN)eI— KI—ZnSO4—уксус- 39
из мальтозы путем окисления иодом и взаимо- Na2CO3; 15 мин при 100° С на я кислота; титруют тиосульфатом
действия с НС1) (см. К» 5)
Глюкоза в крови (ми- K3[Fe (CN)e]— H2SO4; титруют це- 40
крометод) (см. № 5) Na2CO3; 5 мин при 100° С рием (IV) в присут-
ствии метилового
Сахар в растениях (см. № 15) фиолетового
Экстракт; K3[Fe (CN)6j— H2SO4; титруют церием (IV) в присут- 41
Na2CO3; 15 мин ствии сетопалина С
Глюкоза в крови (суб- при 100° С K3tFe (CN)J- H2SO4; титруют це- 42
Микрометод) (см. № 5) Na2CO3; 5 мин рием (IV) в присут-
Таннины (см. № 120) при 100° С K3[Fe (CN)B]- ствии ферроина H,S04; титруют пер- 43
КОН; 5 мин при манганатом
кипении
427
Продолжен^
№ п/л Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования «Л 11TQ-рату Ра
45 Инвертный сахар (см. № 16) KstFe (CN)6I— Na2CO3; 20 мин при 100° С KI— ZnSO4—NaCl, затем добавляют уксусную кислоту; титруют тиосульфатом 44
46 Сахар в крови (см. № 16) K3[Fe (CN)6]— NaOH; 6 мин при 100°С H2SO4; титруют индигокармином 45
47 Сахароза (см. № 59, 83) в муке (после кислотного гидролиза) KstFe (CN)e]— Na2CO3; 20 мин при 100° С КС1—ZnSO4—уксусная кислота, затем KI; титруют тиосульфатом в присутствии крахмала 46
48 Глюкоза (субмикрометод) (см. № 5) (Метод, описанный выше 3, — см. № 3) 47
49 Редуцирующие сахара (см. № 15), образующиеся при кислотном гидролизе гексозанов KstFe (CN)6]— KjFe (CN)6]— Na2CO3; 15 мин при 100° С К1—ZnSO4, затем добавляют уксусную кислоту; титруют тиосульфатом 48
50 Сахара (см. № 16) K3[Fe (CN)e]-Na,CO3; 15 мин при 100° С Титруют бихроматом в присутствии дифениламин— h2so4 49, 50
51 Сахара (см. № 16) KstFe (CN)6]— Na2CO3; 20 мин при 100° С H2SO4; титруют церием (IV) в присутствии сетопалина С 51
52 Глюкоза (микрометод) (см. № 5) [Модификация метода, описанного выше 21 (15 мин при 100° С), —см. № 21] 52
53 Глюкоза в крови (см. № 5) KstFe (CN)6]— Na2CO3; 15 мин при 100°С Уксусная кислота; титруют реактивом Тильмана до появления розового окрашивания 53
54 Углеводы (см. № 115) в экстрактах из корней (Метод, описанный выше и, — см. № 41) 54
55 Редуцирующие сахара (см. № 15) в экстрактах растений (Метод, описанный выше 21, — см. № 21) 55
56 Фруктоза (см. № 39) в присутствии декстрозы KstFe (CN)eJ— Na2CO3—Na2HPO4; [Изучалось влияние в на течение реакции H2SO4; титруют церием (IV) в присут ствии ферроина эемени и температуры (обычно при 50° С) ОО
57 Галактоза в кровн (Метод, описанный выше 3, — см. № 3) 58
58 Инозит, сорбит, маннит (Метод, описанный выше 3, — см. № 3) 5Q
59 Глюкоза (см. № 5), образующаяся при кислотном гидролизе сахарозы в процессе ее определения (см. № 47) (Метод, описанный выше 3, — см. № 3)
428
Продолжение
X? п/л Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
60 редуцирующие сахара (см. №15), образующиеся при гидролизе крахмала под действием слюны (Метод, описанный выше ", — см. № 41) 60
61 Глюкоза (см. № 5) в биологических жидкостях и тканях (Изучался метод, описанный выше 3, — см. № 3) 61
62 Фруктоза (см. № 39) в присутствии декстрозы и сахара K3[Fe (CN)6J-Na2CO3—Na2HPO4; 1 ч при 50° С H2SO4; титруют церием (IV) в присутствии дифениламин— H2SO4 62
63 Сорбоза (Метод, описанный выше ", — см. Ns 50) H2SO4; титруют церием (IV) в присутствии сетопалина С редуцирующей сло-шые результаты, если ть глюкозы) 63
64 Крахмалы и декстри ны (см. Ns 101) — определение редуцирующей способности KJFe (CN)eJ-Na2CO3; добавляют измеренное количество глюкозы; 15 мин при 100° С (Вещества со слабой собностью дают пето1 не добавля 64
65 Сахар в крови (см. Ns 16) K3[Fe (CN)J-Na2CO3; 15 мин при 100° С H2SO4; титруют перманганатом в при сутствии сетопалина С, эриозеленого или эриоглауцина 65, 70
66 Редуцирующие сахара (см. № 15) KJFe (CN)e]-Na2CO3—Na2HPO4; 1 ч при 100° С Слабо подкисляют, прибавляют избыток иода (около 60—70% избытка) и обратно оттитровывают через 15 мин тиосульфатом 66
67 Сахар в крови (см. № 16) (Метод, описанный выше 37, — см. № 37) 67
68 Глюкуроновая кислота (см. № 28), образующаяся при кислотном гидролизе ментолглюкуроновой кислоты в процессе ее определения KJFe (CN)6]-щелочь; 15 мин при 100° С KI —ZnSO4—уксусная кислота; титруют тиосульфатом 68
69 70 5-Аминоакридин Некоторые соли, являющиеся производными фенантрена Ацетат натрия— K3[Fe (CN)e] образуется нерастворимая соль; 5 мин при комнатной температуре Ацетат натрия— K3[Fe (CN)oJ; 5 мин при комнатной температуре (образуется нерастворимая соль) Избыток реагента определяют в фильтрате, для этого прибавляют KI— НС1—ZnSO4 и титруют тиосульфатом Как указывалось вы- ше, — см. Ns 69 69 71
429
родолжет
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования •Hiiti . Рату, Ра
— - _
71 Четвертичные аммониевые основания в пищевых продуктах (см. № 74, 118, 126) [Метод, описанный ниже 7Б, — см. № 73 (отличается предварительной экстракцией анализируемого продукта)] 72
72 Глюкуроновая кислота (см. № 28) KslFe (CN)el-Na2CO3; 15 мин при 100° С H2SO4; титруют церием (IV) в присутствии сетопалина С 73
73 Глюкоза в крови (см. № 5) Кз[Ге (CN)eJ— Na2CO3; 15 мин при 100° С H2SO4; титруют церием (IV) в присутствии сетопалина С 74
74 Четвертичные аммониевые основания (см. № 71) в пищевых продуктах, напитках и т. п В ацетатном буферном растворе; KJFe (CNeJ (образуется нерастворимая соль) К избытку реагента в фильтрате прибавляют смесь KI— НС1—ZnSO4 и титруют тиосульфатом 75,81
75 Глюкоза в крови (см. № 5) (Метод, описанный выше 3, — см. № 3) 76 1
76 Редуцирующие сахара (см. № 15) [Сравнение гексациа описанного выше 3, -в котором применяете ским, — см. также «С литература 136 и «Г иод», лите] ноферратного метода, - см. № 3, с методом, :я Си11 и иодометриче-оединения меди (II)», еагенты, содержащие эатура 249] 77 '
77 Тиамин — витамин Вх (см. № 89) В воде; KjFe (CN)6]— Na2CO3; 2 мин Образованный гексацианоферрат (II) или избыток реактива определяют: 1) титрованием индигокармином до появления слабо-зеленого окрашивания; 2) путем добавления смеси ZnSO4—KI— NaCl—уксусная кислота и последующим титрованием тиосульфатом; 3) путем прибавления H2SO4 и последующим титрова-нйем церием (IV) в присутствии ферроина 78
78 Редуцирующие сахара (см. Ks 15) (Метод, описанный выше 3, — см. Кв 3. Изучалось влияние температуры и времени на процесс взаимодействия; рекомендуется 45 мин при 85° С)
79 Морфин (см. № 113, 117, 119) K3[Fe (CN)6J— щелочь KI—ZnSO4—NaCl— кислота; титруют тиосульфатом 82
80 Редуцирующие сахара (см. Ks 15) в растительных материалах (Метод, описанный выше, 41 — см. .№ 41)
430
Продолжение
Я п/п
81
82
83
84
85
86
87
88
89
90
91
92
93
Титруемое вещество
Глюкоза в слезах (см. № 5)
Кристаллические пенициллины, например прокаиновая соль пенициллина
Лактоза (см. Ns 21), гидролизованная сахароза (см. Ns 47) в молочных продуктах
Глюкоза в крови (см.
Ns 5)
Глюкоза (субмикроме год) (см. Ns 5)
Сахар в крови (см. Ns 16)
Глюкоза в растительных материалах (см.
Ns 5,.
Сахар в крови (см.
Ns 16)
Тиамин — витамин В4 (см. Ns 77)
Лактоза в молоке (см. № 21)
Диэтилиодид гуанидина
Редуцирующие сахара (см. № 15) в цитрусовых отбросах Галлотаннины
Реагент и условия реакции
Соответствующая обработка и конечная стадия титрования
(Метод, описанный выше 3, — см. № 3)
K3[Fe (CN)e]— NaOH; 15—20 мин при 100° С
(Холостой опыт проводят с нейтральным раствором KjFe (CN)6] при одних и тех же условиях)
H2SO4; титруют церием (IV) в присутствии сетопалина.
Литература
K3[Fe (CN)el— Na2CO3; 20 мин при 100° С
Уксусная кислота—
ZnSO4—КС1; затем добавляют KI; титруют тиосульфатом метода, описанного вы-
3, — см. Ns 3) метода, описанного вы-
(Модификация ше
[Модификация
ше 42, — см. Ns 42; используют различные концентрации реагента]
KJFe (CN)eJ— Na2CO3; 10 мин при 100° С [Метод, описанный
Титруют индиго до появления синего окрашивания выше 1е, — см. № 19;
для сравнения приведено определение глюкозы методом, основанным на использовании цианида, — см. «Цианид калия», литература /7]
(Метод, описанный выше 3, — см. Ns 3)
KJFe (CN)e]— фосфатный буферный раствор, pH 10; 5 мин при 100° С
H2SO4; титруют церием (IV) в присутствии ферроина
(Модификация метода, описанного выше 35, 41, — см. Ns 35, 41)
Прибавляют к K3[Fe (CN)eJ— КОН; при 50—55° С
(Метод, описанный
Титруют иодидом п-нитроэтилизохино-линия в среде КОН при 50—60° С визуально или потенциометрически [см. Том I, «Гексациано феррат (III) калия», литература 34] выше 2В, — см. Ns 25)
KJFe (CN)6]-Na2CO3; 20 мин при 40°С
ZnSO4—NaCl, затем добавляют уксусную кислоту—KI; титруют тиосульфатом
83
84
85
86
87
88
89
90, 91
92
93
94
95
96
431
nродолэкенц?
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Лите-рату. Ра
94 Некоторые производные тиобарбитуровой кислоты KJFe (CN)eJ-щелочь; 15—20 мин Титруют парманга-натом в сернокислой среде 97
95 Глюкоза в крови (см. № 5) K3[Fe (CN)eJ; при pH 10 H2SO4; титруют церием (IV) в присутствии ферроина 98
96 Метантелинбромид В водном ацетатном буферном растворе; избыток K.-jFe (CN)6J; 1 ч при комнатной температуре (образуется нерастворимая соль) Осадок отфильтровывают и избыток реагента определяют в фильтрате путем добавления смеси KI—ZnSO4—НС1 и последующего титрования тиосульфатом 99
97 о-Дифенолы KJFe (CN)6J-ZnSO4—ацетатный буферный раствор; 5 мин при комнатной температуре KI; выделившийся иод титруют, затем подкисляют H2SOd и титруют иод, количество которого эквивалентно содержанию хинона 100
98 Аскорбиновая кислота (см. № ПО, 116) K.3[Fe (CN)6J— ZnSO4; 3—5 мин при комнатной температуре H2SO4—KI; титруют тиосульфатом 101
99 Глюкоза в крови (см. № 5) [Метод, описанный выше 3, — см. № 3. Обсуждаются возможные ошибки, рекомендуется быстрое окончание титрования, чтобы свести к минимуму потери иода] 102
100 Тиомочевина (см. № 104) K3[Fe (CN)e]—OsO4 (катализатор) Избыток реагента оттитровывают арсенитом или образовавшийся гексацианоферрат (II) оттитровывают церием (IV) 103
101 Глюкоза (см. № 5), образующаяся при кислотном гидролизе декстрина (см. № 64) K3[Fe (CN)eJ-NaOH—ZnSO4; 20 мин при 100° C KI—уксусная кислота; титруют тиосульфатом 104
102 Изониазид K3[Fe (CN)6]-NaOfi; реакция протекает быстро НС1—KI—ZnSO4; титруют через 5 мин тиосульфатом 105
103 Редуцирующие сахара (см. № 15) (Проведено сравнение различных методов, описанных выше *’ Б’14, а, — см. № 1, Б, 14, 21) Титруют перманганатом 106
432
Продолжение
к?
л/п
104
105
106
107
108
109
ПО
111
112
ИЗ
114
Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
Тиомочевина (см. Ns 100) K3[Fe (CN)e]— щелочь; 20—30 мин при 100° С или 30 мин при комнатной температуре в присутствии OsO4 (катализатор) KI— ZnSO4—НС1 или H2SO4; титруют тиосульфатом или церием (IV) в присутствии ферроина 107
Моногидразинофталази ны, дигидразинофтала- KstFe (CN)e]—NaOH H2SO4; титруют перманганатом 108
ЗИНЫ
Редуцирующие сахара (Метод, описанный выше 3, — см. Ns 3) 109
(см. № 15) в крови K3[Fe (CN)6J-NaOH—ZnSO4 Уксусная кислота— I"; титруют тиосульфатом
Сахар в крови (см. № 16) ПО
Дитиокарбаматы KstFe (CN)6]-H2SO4 (выделяется CS2) CS2 абсорбируют спиртовым раствором и образовавшийся ксантогенат титруют иодом (см. «Спирты», литература 52) 111
Глюкоза (см. № 5) KstFe (CN)e]-KOH—HPO4-; 10 мин при 100° C H2SO4; титруют ZnSO4 биамперометрически 112
Аскорбиновая кислота (см. № 98) NaHCOg и слегка перетитровывают гексацианоферратом (III) биамперометрически H2SO4; титруют ZnSO4 113
Редуцирующие сахара (см. № 15), разделенные (Применяют метод, описанный выше 37, — см. № 37) 114
бумажной хроматографией H2SO4; титруют Zn2+ биамперометрически
Адреналин (после 10 мин нагревания с H2SO4) Нейтрализованный раствор; KstFe (CN)eJ-Na2B4O7; 5 мин Экстракт; KstFe (CN)6J—фос-фатно-карбонатный буферный раствор; 5 мин 115
Морфин в маковых зернах (см. Ns 79) НС1; титруют церием (IV) в присутствии ферроина 116
Глюкоза (см. Ns 5) KstFe (CN)6J— К2СО3; 15 мин при 100° С, затем 5 мин при 23—24° С Избыток реагента титруют церием (III) в атмосфере СО2 потенциометрически, амперометрически или биамперометрически 117
433
родолэк^ц{
№ п/п
Титруемое вещество Реагент и условия реакции
115
116
Углеводы (см. № 54) в техническом пентаэритрите KJFe (CN)6J-Na2CO3; 15 мин при 100° С
Аскорбиновая кислота (см. К° 98), цистеин, редуцирующие сахара (см. № 15) и т. д. (Приведен обзор
Морфин (см. № 79)
117
118
119
Четвертичные аммониевые основания (см. № 71)
Морфин (см. № 79)
применении Эквивалентные количества KJFe (CN)6J и KJFe (CN)6] при pH 9 (боратный буферный раствор); 12—15 мин (морфин окисляется до псевдоморфина) В апетатном буферном растворе;
Kg[Fe (CN)6J; встряхивают 1 ч
120
121
Таннины (см. № 44) и красители в сухих винах
Гидрохинон
(Метод, описанный выше 120, — см. № 116; указывают, что определение возможно проводить в присутствии лактозы, атропина, гиосцина, фенапетина и аспирина)
KJFe (CN)e]-N а2СО3—ZnSO4; нагревают способом ствляют после удаления тан-нинов и красителей активированным углем)
H2SO4; K3[Fe(CN)6] в большом избытке
122
Эфиры кислоты
муравьиной
(таким осуще-контроль
Избыток KJFe(CN)el; КОН; OsO4 (катализатор); 30—40 мин при комнатной температуре; (анализируемый продукт окисляется до СО2)
Соответствующая обработка и конечная стадия титрования
Рат-, Ра
KI—ZnSO4—NaCl-уксусная титруют фатом
Избыток реагента определяют иодометрически или обра зовавшийся
KJFe (CN)6J определяют титрованием церием (IV) методов, основанных на
Kg[Fe (CN)„])
Несколько капель вольфрамовокрем-ниевой кислоты; титруют ZnSO4 потенциометрически или биамперометрически
кислота; тиосуль-
118
119
120
Фильтруют; избыток реагента титруют AgNO3 потенциометрически
121
122
Избыток реагента определяют прибавлением смеси I-— уксусная кислота и последующим титрованием тиосульфатом
123
KJFe (CN)6J оттитровывают цинком (II) в присутствии дифениламина и H2SO4
Избыток реагента титруют арсенитом биамперометрически
124
25
434
Продолжение
Титруемое вещество PeaieiiT и условия реакции Соответствующая обработка и конечная стадия титрования Литература
123 124 Редуцирующие сахара (см. № 15) Семикарбазиды KJFe (CN)G]-Na2CO3; 30 мин при 80° С К3 [Fe (CN)„] - Na„CO3 или Na2B4O7— карбонат; 25— 30 мин 1“ —ZnSO4—уксусная кислота; титруют тиосульфатом НС1; избыток реагента титруют аскорбиновой кислотой до исчезновения окраски в присутствии 2-оксивариаминово-го голубого 126 127
125 Ксантогенаты, обра зуемые при определении CS2 реакцией с КОН— спирт КОН (2 н. раствор); избыток KstFe (CN)61; OsO4 (катализатор); 15 мин при 20° С H2so4, pH 7—10; диметил глиоксим; титруют FeSO4 до появления красного окрашивания 128
126 Четвертичные аммониевые основания (см. № 71) K3[Fe (CN)e] (образуется осадок соли четвертичного аммониевого основания) Избыток реагента определяют путем прибавления I- и последующего титрования тиосульфатом 129
Реакции осаждения, как правило, проводят в ацетатном буферном растворе.
Соответствующая обработка и конечная стадия титрования. Применяют три метода определения.
1. Метод обратного титрования избытка реагента. В этом случае прибегают как к прямым, так и к косвенным способам определения.
1) Прямое титрование избытка реагента восстановителем, например аскорбиновой кислотой, соединениями церия (III), арсенитом, щелочным раствором иодида п-нитроэтилизохинолиния или индигосульфокислотой, а также осаждение реагента А§+-ионами.
2) Косвенное титрование, часто наиболее легко осуществляется путем добавления иодида и кислоты и последующего титрования выделившегося иода тиосульфатом.
2. В равной мере применяют метод титрования гексацианофер-Рата (II), образующегося в процессе восстановления гексациано-Феррата (III):
окислителями — соединениями церия (IV), бихроматом, перманганатом и реагентом Тильмана;
соединениями цинка, образующими с гексацианоферратом (II) ерэстворимую соль цинка. В этом случае титрование проводят амперометрически или потенциометрически.
б 3. Методы определения органических продуктов реакции. Среди ф Лее сотни примеров определений с использованием гексациано-н РРата (III), известно только два примера титрования, основан-ча определении органических продуктов реакции. В одном слу-
435
чае 100 хинон, образующийся при окислении дифенолов, реагина со смесью I- — кислота и затем выделившийся в эквивалент^! количестве по отношению к хинону иод оттитровывают тиосульфато В другом случае 111 сероуглерод, образующийся при определени дитиокарбаматов [в процессе кислотного гидролиза в присутстви гексацианоферрата (III)], превращается в ксантогенат, который затем оттитровывают иодометрически.
ЛИТЕРАТУРА
10, 252 (1928).
1. lonescu А., V а г g о 1 i с i V., Bull. soc. chim. Romania, 2, 102 (1920
2. R о s e n t h a 1 A., Biochem. Z., 133, 469 (1922). 'j
3. Hagedorn H. C., J ensen B. N., Biochem. Z., 135, 46 (1923).
4. D in gem anse E., Biochem. Z., 154, 483 (1924).
5. lonescu A., S p i r e s c u E., Bull. soc. chim. Romania, 6, 101 (1924).
6. К a u f m a n n E., В i о c h e m. Z., 166, 207 (1925).
7. Van Fazekas E., Biochem. Z., 168, 175 (1926).
8. H о 1 d e п H. F., Biochem. J., 20, 263 (1926).
9. J onsell S.,J orpes E.,S i ks t r 6 m N., Acta Med. Scand., 63, 446 (1926).
10. Power M. H., Wilder R. M., J. Pharmacol., 27, Proc. 255 (1926).
11. Hansen A., Dansk Tids. Farm., 1, 195 (1927).
12. V. I s s e k u t z B., v. R о t h J., Biochem. Z„ 183, 298 (1927).
13. F 1 a t о w L., Biochem. Z., 194, 132 (1928).
14. lonescu-Mat iu A., Bull. soc. chim. biol., ____
15. Pucher G. W„ Finch M. W., J. Biol. Chem., 76, 331 (1928).'
16. S i 1 b e r s t e i n F., Rapp a port F., Biochem. Z., 194, 105 (1928).
17. T о s с a n i V. A., Chemist - Analyst, 18, 7 (1929).
18. В г у a n t H. L„ J. Lab. Clin. Med., 14, 1082 (1929).
19. H a n e s C. S., Biochem. J., 23, 99 (1929).
20. G о h r H., Z. Untersuch. Lebensm., 59, 90 (1930).
21. F u j i t a A., I w a t a k e D., Biochem. Z., 242, 43 (1931).
22. H u 1 m e A. C., Narain R., Biochem. J., 25, 1051 (1931).
23. M о s о п у i L., Biochem. Z., 238, 95 (1931).
24. Carrasco-Farmiguera R., Comp. rend. soc. biol., 110, 730 (1932).
25. В 1 i s h M. J., S a n d s t e d t R. M., Cereal Chem., 10, 189 (1933).
26. Fromageot С., Mo u 1 i п M., Bull. soc. chim., 53, 266 (1933).
27. Masamune H., J. Biochem. (Japan), 18, 259 (1933).
28. P о w e 1 1 A. D., Hall G. F., Quart. J. Pharm. Pharmacol., 6, 389 (1933).
29. В 1 a c k w о о d J. H., J. Dairy Research, 5, 245 (1934).
30. M а с с о G. D., Boll. soc. ital. biol. sper., 9, 1008 (1934).
31. W h i t m о у e r R. B., Ind. Eng. Chem., Anal. Ed., 6, 268 (1934).
32. Hagedorn H. С., H a 1 s t г о m F., J e n s e n B. N., Hospitalstidende, 78, 1193 (1935). ,
33. V a n о s s i R., F e r r a m о 1 a R., Anales asoc. quim. arg., 23, 162 U9-^’
34. G i r a g о s s i n t z G., Davidson C., Kirk P. L., Mikrochemie, * > 21 (1936).
35. H a s s i d W. Z., Ind. Eng. Chem., Anal. Ed., 8, 138 (1936).
36. Kern A., Biochem. Z., 288, 375 (1936).
37. M i 1 1 er B. F„ v. S 1 у k e D. D., J. Biol. Chem., 114, 583 (1936).
38. S t r e p k о v S. M., Biochem. Z., 287, 33 (1936).
39. S t r e p k о v S. M., Biochem. Z., 289, 38 (1936).
40. Van ossi R., Ferranola R., Biochem. Z., 288, 369 (1936).
41. H a s s i d W. Z., Ind. Eng. Chem., Anal. Ed., 9, 228 (1937).
42. Heck K., Brown W. H., Kirk P. L., Mikrochem., 22, 306 (1937)- .ft
43. I onescu - Mat i u A., Popescu C., Bull. soc. Stiinte Farm. Rom >
2, No 3—4, 38 (1937). {193
44. Лыновский О. П.,С p or ив А. А., Вопросы питания, 6, № 5, 14U 1
436
, Patterson J., Biochem. J., 31, 244 (1937).
^Sandstedt R. M„ Cereal Chem., 14, 767 (1937).
,7 S c li r a d e r G. A., Chemist - Analyst, 26, 52 (1937).
S t г e p к о v S. M„ Biochem. Z., 289, 295 (1937).
[q S t г e p к о v S. M., Biochem. Z., 290, 91 (1937).
кп Стрелков С. M„ Укр. хим. журнал, 12, 105(1937).
?j' Hildebrand F. С., M с С 1 e 1 1 а п В. A., Cereal Chem., 15, 107 (1938).
in' j\ji emi er ко W., Acta Biol. Expt. (Warsaw), 12, 178 (1938).
A Abrahamson E. M., Am. J. Clin. Path. Tech. Suppl., 3, 60 (1939).
и В arr C. G., Plant Physiology, 14, 285 (1939).
eg’ D о а к В. W., New Zealand J. Sci. Tech., 218, 90 (1939).
56^ E n g 1 i s D. T., В e с к e r H. C., Ind. Eng. Chem., Anal. Ed., 11, 145 (1939).
5A Larsson P. A., S v e i n s s о n S. L., Skand. Arch. Physiol., 83, 58 (1939). «’Todd W. R., V r e e 1 a n d J., Myers J., W e s t E. S., J. Biol. Chem., 127, 269 (1939).
59. Z e 1 1 e r A., Biochem. Z., 303, 92 (1939).
60 Hassid W. Z.,McCready R. M., R о s e n f e 1 s R. S., Ind. Eng. Chem., ’ Anal. Ed., 12, 142 (1940).
61. Ш e p г и н H. FL, Лаб. практика, 15, № 12, 17 (1940).
62. В e c k e г H. С., E n g 1 i s D. T., Ind. Eng. Chem., Anal. Ed., 13, 15 (1941).
63. В г о о m e F. K-, S a n d s t г о m W. M., Ind. Eng. Chem., Anal. Ed., 13,
142 (1941).
64. F a r 1 e у F. F., H i x о n R. M., Ind. Eng. Chem., Anal. Ed., 13, 616 (1941).
65. Fiorentino M., Boni P., Biochem. Z., 307, 245 (1941).
66. E n g 1 i s D. T., В e c k e r H. C., Ind. Eng. Chem., Anal. Ed., 15, 262 (1943).
67. MacFa dy en D. A., v. S 1 у k e D. D., J. Biol. Chem., 149, 527 (1943).
68. S h i m о s a w a T., J. Pharm. Soc. Japan, 63, 462 (1943).
69. A m о r G., Foster G. E., Analyst, 70, 174 (1945).
70. F iorent i по M., В о n i P., Diagn. tec. lab. (Napoli), Riv. mens., 11, 449 (1945).
71. F о s t e r G. E., Grove W. F., Analyst, 71, 287 (1946).
72. H a r r i s T. H., J. Assoc. Offic. Agr. Chem., 29, 310 (1946).
73. L e v v у G. A., Biochem. J., 40, 396 (1946).
74. N i m m о - S m i t h R. H., Biochem. J., 40, 414 (1946).
75. W i 1 s о n J. В , J. Assoc. Offic. Agr. Chem., 29, 311 (1946).
76. Accoyer P., Camelin A., Garnung H., Bernard M., J. Med., Lyon, 28, 301 (1947).
77. В 1 о m J., R о s t e d C. O., Acta Chem. Scand., 1, 32 (1947).
78. Wachsmuth H., Bull. soc. chim. Beiges, 56, 261 (1947).
79. Schaffeler K-, Helv. Physiol, et Pharm. Acta, 6, 584 (1948).
80. W a c h s m u t h H., M e у t e n E., J. pharm. Beige (N. S.), 3, 163 (1948).
81. W i 1 s о n J. B., J. Assoc. Offic. Agr. Chem., 31, 480 (1948).
82. В e v e n u e A., Anal. Chem., 21, 586 (1949).
83. G i a r d i n i A., Atti 37 Cong. sez. regional! soc. oftalmol. ital., 10, 392 (1949).
84. H i s с о x D. J., Anal. Chem., 21, 658 (1949).
85. H i t e s B. D., Ackerson C. W., Volkmer G. H., Anal. Chem., 21, 993 (1949).
°6. Pruner G., Ann. chim. applicata, 39, 181 (1949).
“'Stern H„ К i r k P. L., J. Biol. Chem., 177, 37 (1949).
S’Rappaport F., E i clihor n E., Am. J. Clin. Path., 20, 834 (1950).
y- F r a m p t о и V. L., F о 1 e у L. P., S m i t h L. L., M a 1 о n e J. G., Anal.
on Chem., 23, 1244 (1951).
ХУ' К i r b e r g e r E., F r a n k H., Klin. Wochschr., 29, 297 (1951).
„ Merkel H., Ausbuttel F., Deut. Z. ges. u. gericht. Med., 40, 485 (1951).
93 n r u n e r G-> RentB ist. super sanitfi (Rome), 14, 222 (1951).
Й Ttanc's F. J., S m i t h M. D., J. Dairy Research, 19, 83 (1952).
95 A.0 m i c e k 0., Simon J., Ceskoslov. Farm., 1, 25 (1952).
2; e 1 1 s W. N., Rohrbaugh P. W., Doty G. A., Sewage and Ind. Wastes,
96 24. 212 (1952).
Nimura K-, Ku wane S., Hikino H., I i d a S., Ued a M., M a-n a b e T., I d a Y., J. Pharm. Soc. Japan, 73, 1200 (1953).
437
97. S a n d r i G., Lambardi F., Attiaccad. sci. Ferrara, 30, 27 (1953)
98. Pruner G., Rend. ist. super sanita, 17, 123 (1954.)
99. S a n g r a C. S., P a г г e п о R., Rev. asoc. bioqui., agr., 19, 87 (1954).
100. Михельсон В. Я-, Tp. Таллинского политехнического ин-та А тл ко 127(1955). ’ ' Ь3-
101. Абрамов М. К., К а д ы р о в Я- К-, Аптечное дело. 5, № 2 28 (
102. D'А г с a n g е 1 о Р., Giorn. Biochim., 5, 465 (1956). ’
103. В а р a t М. G., Sharma В., J. Sci. Research Banaras Hindu Univ 7 (1956—7). ’’ ’ 2
104. Солодовников П., Tp. Казанского авиац. ин-та, 31, 127 (1956)
105. Akiyama T., Fujiwara M., 1 c h i d a H., Kyoto Yakka Daipakn Gakuho, 5, 42 (1957). 6
106. lonescu-Matiu A., Produifs Pharm., 12, 247 (1957).
107. Joshi M. K-, Naturwissenschaften, 44, 537 (1957).
108. S a n d r i G. C., Boll. chim. farm., 96, 431 (1957).
109. D' A r c a n g e 1 о P., Arch. sci. biol. (Bologna), 42, 459 (1958).
110. Brahmachari H. D., Kumar M., Current Sci (India), 27, 486 (1958).
111. С a r t о n i L., Ricerca sci., 28, 1639 (1958).
112. v. P i n x t e r e n J. A. C., Pharm. Weekblad, 93, 753 (1958).
113. v. P i n x t e r e n J. А. С., V e r 1 о о p E., Pharm. Weekblad, 93, 982 (1958).
114. Thaler N., Nahrung, 2, 111 (1958).
115. v. P i n x t e r e n J. А. С., V e r 1 о о p M. E., Pharm. Weekblad, 94, 169 (1959).
116. Pruner G., Rend. ist. super, sanita, 22, 710 (1959).
117. F u r m a n N. H., Fenton A. J., Anal. Chem., 32, 754 (1960).
118. С ал о в а А. С., Антонова-Антипова И. П., Лакокрасочные материалы и их применение № 6, 55 (1960).
119. S а п t В. R., Sant S. В., Taianta, 3, 261 (1960).
120. V. Р i и х t е г е п J. А. С„ V е г 1 о о р М. Е., Pharm. Weekblad, 96, 545 (1961).
121. Hefferren J. J., Dietz C., J. Pharm., Sci., 50, 535 (1961).
122. V. P i nx ter en J. A. C., Ver 1 oo p M. E., Pharm. Weekblad, 97, 1 (1962)
123. Короблев А. И., Трофименко Б. С., Садоводство, виноградарство и виноделие Молдавии, 37, № 1 (1962).
124. Brinkman D. А. Т., S n е 1 d е г s Н. А. М„ Z. Anal. Chem., 199, 432 (1963).
125. D е s m u k h G. S., R a о A. L. J., Z. Anal. Chem., 194, 110 (1963).
126. Friedmann T. E., Weber C. W., Witt N. F., Anal. Biochem., 4, 358 (1963).
127. К a s a I., E r d e у L., Acta Chim. Acad. Sci. Hung., 39, 21 (1963).
128. К i b о k u M., Bunseki Kagaku, 12, 797 (1963).
129. Thoma K-, U 1 1 m a n п E., L о о s P., Pharmazie, 18, 414 (1963).
38. ГЕКСАЦИАНОФЕРРАТ(П) КАЛИЯ
Гексацианоферрат(П) калия применяют для осаждения некоторых оснований или полимеров, получаемых на основе окиси этилена. Осаждение соответственно основано на реакциях ионного обмена или комплексообразования.
Таблица 46. Примеры использования гексацианоферрата (II) калия
№ п/п Титруемое вещество Реагент н условия реакции Соответствующая обработка и конечная стадия титрования Литература
1 Антипирин в присутствии пирамидона В разбавленной НС1; Ki [Fe (CN) 6]; 30 мин (образуется осадок C1,H12N2O)2H4[Fe(CN)e] Фильтруют; осадок взмучивают в воде и титруют NaOH в присутствии фенолфталеина 1
438
Продолженг
№ п/П Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
2 Продукты присоедине- НС1; NaCl; избыток Фильтруют; избы- 2, 3
3 ния этиленоксида, например неионогенные детергенты Неи но генные поверх- KJFe (CN) в]; вода KJFe (CN)e] ток реагента оттитровывают ZnSO4 в присутствии дифениламина Избыток реагента от- 4
4 ностно-активные вещества, получаемые на основе окиси этилена (см. № 4) Неиногенные поверх- (Метод, описанный в титровывают ZnSO4 потенциометрически ыше 21 3 — см. Ns 2) 5
5 ностно-активные вещества (полиоксиэтилен-нонилфеноловые эфиры) после отделения катион-активных и амфотерных веществ (см. № 3) Полиэтиленгликоль в В водном растворе; Отфильтровывают, 6
вискозе НС1; K4[Fe(CN)6]; перемешивают 5 мин к фильтрату добавляют (NH4)2SO4 и несколько капель KJFe (CN)g]; титруют ZnSO4 в присутствии дифениламина
ЛИТЕРАТУРА
1. Kolthoff I. М., J. Am. Pharm. Assoc., 22, 947 (1933).
2. Schon f eld t N„ Nature, 172, 820 (1953).
3. S c h 6 n f e 1 d t N., J. Am. Oil Chemists' Assoc., 32, 77 (1955).
4. Roussos M., Passed ouet H., Cariou J., Rev. franc, corps gras, 5, 13 (1958).
5 1 z a w a Y., Nakogawa O., Kimura W., J. Jap. Oil Chem. Soc., 11, 174 (1961).
6. Zimmermann K-, Faserforsch. u. Textiltech., 14, 180 (1963).
39. ЖЕЛАТИН
Известен один пример использования желатина для осаждения таннина из его смеси с галловой кислотой 1. Метод основан на взаимодействии анализируемой смеси с водным раствором желатина в присутствии раствора NaCl. Образующийся осадок отфильтровывают; к аликвотной части раствора добавляют избыток иода и Щелочь; через 15 мин выдерживания полученной смеси в темноте Добавляют H2SO4 и избыток иода оттитровывают тиосульфатом ЩМ. «Реагенты, содержащие иод», литература 400). Параллельно проводят йодометрическое определение (не прибегая к предварительному осаждению) общего содержания таннина и галловой кислоты.
ЛИТЕРАТУРА
^Уджир и К- С., Ж У к и. М., Сборник трудов Тбилисского научно-исследовательского химико-фармацевтического института, 9, 29 (1960).
439
40. ГАЛОГЕНИДЫ (АКТИВНЫЕ)
Реагенты. В качестве реагентов применяют все органическ соединения, содержащие сравнительно активные (подвижные) атом 6 галогенов, связанные с атомами С, N или S. Не известны случаи обратного титрования, основанные на применении органических соединений со связями О—Hal, т. е. органических гипохлоритов в то время как известен случай прямого титрования трещ-бутилгипо* хлоритом, описанный в первом томе этой книги. Активация атомов галогенов в большинстве случаев обусловлена наличием — СО- и SO2-rpynn, а также ароматических ядер, иногда с нитрогруппами в орто- или пара-положениях.
К применяемым реагентам относятся органические соединения характеризующиеся наличием связей:
С—Hal: ацилгалогениды, в особенности ацетилхлорид; некоторые алкилгалогениды, включая бензилгалогенид, трифенилметил и тритилгалогенид (трифенилметилгалогенид), нитрохлор- и нитро-фторбензолы и т. п.
N—Hal: хлорамины и N-бромсукцинимид;
S—Hal: сульфонилгалогениды и хлорсульфоновая кислота, которая является, конечно, неорганическим реагентом, но ее удобно отнести к этой группе реагентов.
Реакции и условия реакций. Во всех случаях реакция зависит от подвижности атома галогена.
I. Реакции, сопровождающиеся выделением галогенводородных кислот при определениях некоторых типов органических соединений, содержащих активные атомы водорода, например ОН-групп в спиртах и фенолах; —NH2 или =NH-rpynn в анилине, морфине и других аминах; SH-групп в тиофенолах и ксантогенатах. В основном в таких случаях применяют в качестве реагента ацил- или сульфонилгалогениды. Для этих целей также применяют тритилгалогенид и нитрохлорбензол, например, пикрилхлорид; хлорсульфоновую кислоту и иодацетамид:
ROH + R'COCl -> R'COOR + НС1
RNH2 + ArSO2Cl -> ArSO2NHR + HC1
RSH + ICH3CONH2 -» RSCH2CONH2 + HI
Часто образующиеся при этом продукты нерастворимы в данной среде или могут быть экстрагированы подходящим растворителем-
2. Реакции присоединения или ионо-молекулярное взаимодействие, в результате которого активный атом галогена становится анионом четвертичного аммониевого основания или сульфония при определении соответственно третичных аминов или сульфидов:
R3N + RI->(R4N)+1-
R2S + R'COBr -» (R2SCOR')+Br-
440
3. Реакция дегидрирования, например при определении ацетамидов, основанная на реакции:
RCONH2 -J- R'COCl -> RCN + R'COOH + HC1
4. Реакции образования галогенидов металлов при определении металлоорганических соединений, таких, как литий- или калий-адкилы:
3RK + 3R'Hal -> 3KHal + R — R + R' — R' + R — R'
(В этом случае нет необходимости в строгой стехиометрии, но все три типа углеводородов обычно образуются и, во всяком случае, каждый атом металла эквивалентен одному атому галогена).
В других приводимых ниже реакциях в качестве реагентов применяют хлорамины или N-бромсукцинимид. Они эффективно функционируют как гипохлорит или гипобромит и применяются обычно в водных растворах:
(ArSO2NCl)" + Н2О -> ArSO2NH2 + ОС1"
СН2—СО СН2—СО
| ^NBr + H2O-> | ^NH -j- HOBr
СН2—СО СН2—СО
5. Реакции окисления различных соединений, включая альдегиды (формальдегид, фурфурол, бензальдегид, а также альдозы), производные гидразина (изониазид и метилгидразин), серосодержащие соединения (тиомочевина, фосген, ксантогенаты и диксан-тоген), полиоксисоединения, подобные гликолю, глицерину и альдозам (упомянутым выше), аминокислоты, четвертичные аммониевые нитрилы и аскорбиновую кислоту. Например:
RCHO + О -» RCOOH
НОСН2СН2ОН + 50 -> 2СО2 + ЗН2О
C2H6OSC — S — S — CSOC2H5 + 130 + 7Н2О ->
2С2Н5ОН + 4H2SO4 + 2НС00Н
6. Реакции замещения, протекающие в присутствии смеси I" (или Вг-) — кислота, при определении фенолов (таких, как С6Н5ОН, •«-крезол или салициловая кислота) или ароматических аминов (подобных анилину или антраниловой кислоте).
7. Реакции присоединения при определении иодных чисел и ненасыщенности, например жиров. Как и реакция замещения, эта Реакция протекает в присутствии Вг" или I-; в результате бром или И°Д присоединяются к молекуле органического вещества.
Условия реакций. Здесь невозможно дать исчерпывающие указания. Реакции типа 1—4 обычно выполняют в неводных растворах, ® типа 5—7 в водной среде. Продолжительность реакции и темпера-УРа варьируют в слишком широких пределах.
441
Бромиды или иодиды, принимающие участие в реакциях заме щения и присоединения, часто применяются также в реакциях окисления.
Для проведения реакций типа 1 необходимо участие оснований в особенности при ацилировании, а в таких случаях большей частью применяют пиридин, N-диметиланилин и NaHCO3.
Соответствующая обработка и конечная стадия титрования 1. Определение избытка реагента в реакциях типа 5, 6 и 7 путем добавления иодида (и, если необходимо, кислоты) и последующего титрования выделившегося иода тиосульфатом.
2. Определение избытка реагента, применяемого при реакциях ацилирования (1) и также при реакциях дегидрирования (3) или кислых продуктов реакции. В качестве контрольного определения проводят холостой опыт с реагентом. Например:
X — Н + RCOC1 RCOX + НС1
Н2О + RCOC1 -> RCOOH + НС1
Разница между результатами двух титрований щелочью соответствует содержанию X—Н соединения (обычно гидроксилсодержащего соединения).
3. Определение продуктов реакции. 1) Галогенводородные кислоты или галоген-ионы, образующиеся в процессе взаимодействия активных атомов галогенов с определяемыми веществами в реакциях типа 1, 2 и 4. Конечной стадией определения являются:
а) титрование кислоты щелочью (часто после отделения ее током газа); также применяют добавление избытка щелочи и последующее его титрование кислотой;
б) прямое титрование А§+-ионами или обратное титрование избытка реагента SCN--ионами;
в) в одном случае был применен метод ионообменной хроматографии с ионитом в ОН-форме и последующее титрование образовавшегося основания кислотой.
2) Эфиры, образующиеся при ацилировании (1), отделяют и определяют путем омыления щелочью и последующим титрованием ее избытка кислотой; в одном случае эфиры определяют с помощью динитробензойной кислоты, избыток которой восстанавливают избытком Vй. Сульфонамидные продукты реакции, образующиеся при определении первичных и вторичных аминов в процессе их взаимодействия с сульфонилхлоридом (хлористым сульфурилом), определяют также путем гидролиза (но в присутствии кислоты) и последующего титрования восстановленных аминов.
3) Содержание СО2, образующейся при окислении некоторый полиоксисоединений или аминокислот, определяют путем адсорбций ее Ва (ОН) 2 и последующего титрования его избытка НО или путе абсорбции смесью бензиламин—диоксан—этанол и прямого титро вания CH3ONa. м
4) Катионы сульфонила, образующиеся при определениях пу реакции 2, осаждают в виде пикрата и в конце концов титрУ
442
Таблица 47. Примеры использования галогенидов (активных)
№ п/г
Титруемое вещество
Реагент и условия реакции
Соответствующая обработка и конечная стадия титрования
Сивушные масла — определение ОН-групп
о Фенол (см. № 6, 11, 45, 47, 48, 55, 65, 75, 81, 85) салициловая кислота
3 Альдозные сахара, особенно в молоке
4 Калийфенилизопропил С6Н5С (CHS)2K
5 Литийалкилы (см. № 28)
6 Фенолы (см. № 2) — определение ОН-групп
7 Анилин (см. № 9, 31, 34, 45)
Ненасыщенные соединения — определение иодных чисел
Ацетил хлорид— СНС13; 5—10 мин
В воде; KI и избыток «Халамина Т» *;
5 мин при 60° С
Депротеинизированный раствор; NaOH; KI; хлорамин Т; 90 мин при 17,5° С В безводном эфире; бутнлбромид (Вн), который не реагирует с алкоголятами и КОН
Уравнение реакции: 3RK + ЗВиВг ->
ЗКВГ + Ви2 + + R2+ RBu
Избыток бутилбро-мида (как описано выше 4, — см. № 4); затем добавляют дибензилртуть, которая реагирует с образованием литий-бензила, способного быстрее реагировать с бутилбромидом, чем литийалкил
Ацетнлхлорид или бензоилхлорид (или уксусный ангидрид) В этилацетате; пи-крилхлорнд—этил -ацетат; твердый
N аНСО3 15 мин при комнатной температуре; затем 15 мин кипятят в колбе, снабженной обратным холодильником; оставляют на 3 ч
Дихлорамии Т— уксусная кислота—
К1
Вода; титруют NaOH в присутствии фенолфталеина. Холостой опыт
H2SO4; отфильтровывают; фильтрат титруют тиосульфатом
НС1; титруют тиосульфатом
Образующиеся Вг_-ионы связывают избытком Ag1, который затем оттитровывают тиоцианатом
Как указано выше, — см. № 4
Литература
1
2
3
4
Вода; ’ титруют ще- 6 лочью. Холостой
опыт
Отфильтровывают; 7 образовавшийся NaCl титруют Ag1 (или определяют весовым методом)
Титруют тиосульфатом
X
= СИ,—CeH4S02Nx (Me—К или Na; X—CI, Вт или I).
ХМе
443
Продолжение
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
9 Анилин (см. № 7) в при- (Метод, описанный выше 7, — см. № 7) . 9
10 сутствии N-метил- и N-диметиланилинов Ксантогенат целлюлозы Нейтральный рас- Осадок отфильтро- 10
11 (см. № 30) в вискозе Спирты (см. № 13, 14, твор; хлорацетил-диэтиламид C1CH2CON (С2Н5)2; 1 ч (образуется нерастворимый продукт) Бензоил или п-ни- вывают и определяют в нем содержание азота по Кьельдалю Образовавшийся НС1 11
12 27, 40, 46, 47, 75, 78, 85) и фенолы (см. № 2) — определение ОН-группы Морфин (см. № 16, 26, тробензоил хл ор ид в кипящем тетралине В мета половом рас- перегоняют с воздухом, азотом или водородом в воду и титр уют NaOH в присутствии метилового красного Осадок отфильтро- 12
13 42, 70) в опиуме Спирты (см. № 11) — творе щелочи; 2,4-ди-нитрохлорбензол оставляют на ночь (образуется осадок динитрохлорфенилового эфира) В среде толуола; по- вывают, обрабатывают избытком НС1— NaCl; избыток НС1 в фильтрате оттитровывают NaOH в присутствии метилового красного Вода; титруют ще- 13
14 определение ОН-групп Первичные спирты (см. луторакратный избыток ацетилхлори-да—пиридин; при 0° С; затем 20 мин при 60° С Трифенилметанхло- лочью в присутствии фенолфталеина. Холостой опыт Образующийся НС1 14
15 № 11) в присутствии вторичных и третичных Формальдегид, бензаль- рид—толуол; кипятят 40—60 мин Хлорамин Т; NaOH; пропускают в спиртовый раствор AgNO3, избыток которого оттитровывают тиоцианатом Т- III в присутствии Fe НС1; титруют тио- 15
16 дегид Морфин (см. № 12) KI; 30 мин при комнатной температуре (Указывается, что м сульфатом етод, описанный вы- 16
17 Жиры (см. № 29, 38, 40, ше 12, — см. № В среде пиридина; 12, не подходит) Вода; нагревают и 17
18 78) и масла (см. № 25, 40) — определение ОН-групп Тиофенол по крайней мере двухкратный избыток смеси ацетилхло-рид—толуол; 5 мин, при 65—70° С (Метод, описанный титруют КОН в присутствии фенолфталеина. Холостой опыт ыше 13, — см. Ns 13; 18
найдено, что этот метод неудовлетворителен для определения аминов и особенно алифатических)
444
Продолжение
п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
19 Амииы (см. № 33, 45, Ацетил хлорид—ди- Вода; титруют ще- 18
20 79) Г идроксилсодержащие бутиловый эфир; 20 мин при 70° С В среде бензола или лочью по фенолфталеину. Холостой опыт Отогнанный НС1 ти- 19
21 соединения (см. № 23) — определение ОН-групп Амиловый спирт (в си- СС14; стеар ил хлорид; кипятят; одновременно пропускают сухой воздух Ацетил хлор ид—то- труют NaOH Вода; NaOH, избы- 20
22 вушном масле, отделенном предварительно экстракцией СС1й) Фурфурол (см. № 44, луол—пиридин; 30 мин при 60° С Хлорамин Т; NaOH; ток которого оттитровывают H2SO4 в присутствии фенолфталеина. Холостой опыт НС1; титруют тио- 21
23 57) Г идроксилсодержащие KI; 90 мин при комнатной температуре Ацетилхлорид (без сульфатом В ода; титр уют N аО Н 22
24 соединения (см. № 20) — определение ОН-групп 1-Аскорбиновая кисло- растворителя); 20 мин при 40° С Хлорамин Т; KI; в присутствии фенолфталеина. Холостой опыт Избыток реагента от- 23
25 та Мятное масло (см. НС1 Ацетилхлорид (без титровывают тиосульфатом Вода; титруют рас- 24
26 № 17) — определение ОН-групп Морфин (см. № 12) растворителя); 20— 30 мин при 50° С Экстракт; 2,4-дини- твором NaOH в присутствии фенолфталеина. (Некоторое количество НС1, реагирующее с пиненами, оттитровывают AgNO3 в присутствии хромата). Холостой опыт Растворяют в НС1— 25
27 в опиуме Спирты (см. № 11); спир- трохлорбензол в ацетоне; NH4OH; 24 ч при комнатной температуре (образуется осадок эфира) Ацетилхлорид (без NaCl и обратно оттитровывают кон в присутствии метилового красного Вода; титруют ще- 26
28 то-эфиры — определение ОН-групп Литийалкилы (см. № 5), например литий-н-бу-тил растворителя); 10— 15 мин для первичных спиртов, 20 мин для вторичных, 30 мин для гликолей В среде эфира; бен-зилхлорид (реакция протекает, как указано выше 4, — см. № 4) лочью Вода; титруют кислотой в присутствии фенолфталеина. Холостой опыт 27
445
продолжение
№ п/п
Титруемое вещество
Реагент и условия реакции
Соответствующая обработка и конечная стадия титрования
Лит,., рагу
Ра
29 Жиры (см. К» 17) — определение ОН-групп
30 Ксантогенат целлюлозы (см. № 10) в вискозе
31 Анилин (см. № 7) в присутствии N -метил- и N -диметиланилинов
Ацетилхлорид—толуол—пиридин;
15 мин при 65° С
Вода—этанол; HCI титруют спиртовым раствором КОН. Холостой опыт
(Сравнивают метод, описанный выше 10,_
см. № 10, с йодометрическим методом) Пикрилхлорид— Образующийся КаС1 этилацетат; NaHCO3; экстрагируют водой
29
30
32 Амиды
15 мин (определение основано на методе, описанном выше 7, — см № 7)
2,4-Динитробензоил-хлор ид—диокса н;
пиридин, 30 мин при 60е С; 1 ч при 70° С для амидов двухосновных кислот
33
Смеси первичных, вторичных и третичных аминов (см. № 19)
Анилин (см. № 7) в N -а лкиланилинах
Триметиламин
В бензоле (при 0° С); п-толуолсульфонил-хлор ид—безводный пиридин; 30 лнн при 0° С
Бензол; пикрилхлорид—бензол; 20 мин при комнатной температуре
Пропускают в этаноловый раствор метилиодида (образуется нерастворимый тетраме-тиламмония иодид)
и титруют Ag1 потенциометрически
Избыток реагента разлагают метанолом и кислоту титруют метаноловым раствором NaOCH3 в присутствии фенолфталеина или этил-бис-2,4-дини-трофенилацетата.
Холостой опыт Отделяют сульфонамиды вторичных аминов; подкисляют и отделяют сульфонамиды первичных аминов; амнны регенерируют путем гидролиза сульфонамидов концентрированной НС1; образующиеся основания экстрагируют бензолом и из бен-
зола водным раствором кислоты, избыток которой обратно оттитровывают щелочью (см. «Хлористоводородная кислота», литература 63) НС1, экстрагируют водой и титруют
NaOH
Избыток метилноди-да; отгоняют I" и оттитровывают Ag1
31
Зо
34
446
Продолжение
Титруемое вещество
фосген
Лииалол (см № 54)
Жиры (см. № 17) — определение иодного числа
Аминотиазол
Жиры (см. № 17), масла (см. № 17), низшие алифатические спирты (см. № 11) и полиспирты (см. № 75) — определение
ОН-групп
Некоторые (3- и у-заме-щенные производные пиридина и алкалоиды
Морфин (см. № 12) в опиуме
Жирные кислоты (см. № 60, 78) — определение ненасыщенности
Фурфурол (см. № 22) Фенолы (см. № 2) (например, л-крезол); ароматические амины (см. № 19) [например, анилин (см. No 7), антраниловая кислота]
Реагент и условия Соответствующая об- Лите-
реакции работка и конечная рату-
стадия титрования ра
В керосине или циклогексане; дихлор-амип Т—СС14; 20 мин при 27° С KI—уксусная кислота; титруют тиосульфатом 35
Ацетилхлорид—ук- Эфир отделяют и 36
сусный ангидрид— определяют омыле-
N -диметиланилин; нием избытком КОН
30 мин при комнат- (см. «Щелочи», лите-
ной температуре, за- ратура 197)
тем 3 ч при 40° С В СНС13 или СС14; I-; оттитровывают 37
хлорамин Т—уксусная кислота; экви- тиосульфатом
валентное количе-
ство I" или Вг"; 1 ч при комнатной
температуре Пикрилхлорид— NaCl; определяют 38
этанол ар генометр ичес ки
Ацетилхлорид—то- Вода; титруют рас- 39
луол; кипятят 2 ч твором NaOH в при-
в колбе, снабженной сутствии фенолфта-
обратным холодиль- леина
НИКОМ
(холостой опыт) Этилиодид—щелочь При перегонке с во- 40
(также с диметил- дяным паром в при-
сульфатом); различ- сутствии МпО^~
ное время кипятят в колбе, снабженной образуется метил-
обратным холодильником (образуются алкил- амин, который титруют H2SO4
иодиды пиридина) Экстракт; 2,4-дини- Осадок растворяют 41
трохлорбензол— в избытке НС1—
ацетон; 3 ч NaCl; избыток кис-
(образуется нерас- лоты оттитровывают
творимый эфир) NaOH в присутствии метилового красного
Хлорамин Т; H2SO4 (чтобы избежать побочные реакции замещения добавляют НС1—I"; титруют тиосульфатом 42
ацетат натрия)
(Метод, описанный выше21, —см. № 21) 43
В воде; хлорамин В, I ; титруют тиосуль- 44
КВг—НС1 встряхивают 1 мин, затем фатом
охлаждают н снова встряхивают 20—
30 мин
447
Продолжение
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Лите. Рату-Ра
46 Спирты (см. № И) с Хлор сульфоновая NaOH; эфир выпари- 45
47 длинной углеводородной цепью Спирты (см. № 11) и фе- кислота—безводный эфир Ацетилхлорид—то- вают, в остатке—-натрийалкилсульфа-ты; доводят pH до 8 и титруют цетилтриметиламмонием бромидом в среде СНС13—вода в присутствии метиленового голубого до одинаковой интенсивности окраски водного и хлороформного слоев (см. Том I, «Поверхностно-активные вещества», литература 26) Вода; титруют NaOH 46
48 иолы (см. № 2) — определение «Ацетильного числа» Метанол, этанол, бен- луол; для определения спиртов кипятят 30—40 мин в колбе, снабженной обратным холодильником, для определения фенолов кипятят 90— 120 мин 3,5-Динитробензоил- в присутствии фенолфталеина. Холостой опыт Эфиры определяют 47
49 зиловый спирт, фенол (см. № 2) — определение ОН-групп Глицин (см. № 73) хлорид (образуются эфиры) 2,4-Динитрохлорбен- путем взаимодействия с VSO4 и последующего обратного титрования его избытка К2Сг2О7 (см. «Соединения ванадия (II)», литература 3) Нитросоединение 47
50 51 Изониазид Диалкилсульфиды (идентификация) зол [образуется ^OOCCH2NHC.H3(NO2)2 Хлорамин Т; KI; щелочь Метаноловый раствор п-бромфенацил-бромида; кипятят 10 мин в колбе, снабженной обратным холодильником; добавляют эфир (образуется осадок сульфониевой соли) определяют путем взаимодействия с V11, как указано выше 47, — см. № 48 H2SO4; титруют тиосульфатом Осадок растворяют в воде, осаждают в виде пикрата и титруют НС1О4 (см. «Нитрофенолы», литература 60 и Том I, «Хлорная кислота», литература 161) 48 49
443
Продолжение
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
.—• 52 Глицерин, этиленгликоль Твердый N-бром-сукцинимид; 15 мин при 100° С (образуется СО2) СО2 пропускают в Ва (ОН)2; избыток которого оттитровывают НС1 в присутствии фенолфталеина 50
53 Сер у содержащие соединения — определение мер калтогрул пы Иодоацетамид в двух—пятикратном избытке при pH 5,5; доводят pH до 9 щелочью; 2 мин при комнатной температуре Титруют кислотой до pH 5,5 51
54 Линалол (см. № 37) (полумикрометод) Ацетилхлорид—уксусный ангидрид— диметиланилин; 4 ч при 55° С Эфир определяют омылением избытком щелочи (см. «Щелочи», литература 344) 52
55 Фенолы (см. № 2) — определение ОН-групп .и-Н итр обензои л суль-фонилхлорид—ацетон; NaOH; 5 мин при комнатной температуре NaOH, избыток которого оттитровывают раствором кислоты. Холостой опыт 53
56 Органические сульфиды Метилиодид—метанол; нагревают 2— 3 ч при 100° С в запаянной трубке (образуются сульфо-нийиодиды) Избыток метилиоди-да отгоняют и суль-фонийиодид определяют, добавляя HNO3—AgNO3; избыток Ag1 оттитровывают тиоцианатом (см. «Соединения серебра», литература 154) 54
57 Альдегиды [например, ванилин, салицилальдегид, фурфурол (см. № 22)], тиопентабарбитал NaOH—50% -ный этанол; хлорамин Т; до 10 мин (1 ч ДЛЯ тиопентабарбитала) НС1—KI; титруют тиосульфатом 55
58 Эпоксидные смолы — определение ОН-групп Стеарилхлорид— СНС13 НС1 отгоняют током азота и оттитровывают раствором 56
59 Алкидные смолы — определение ОН-групп В смеси толуол— пиридин; ацетилхлорид—толуол; 30 мин при 100° С Вода—этанол; ти- труют КОН в присутствии фенолфталеина. Холостой опыт 57
ЬО Жирные кислоты (см. № 43) — определение иодного числа N-Бромсукцин-имид—уксусная кислота; оставляют на 1 ч в темноте Вода—KI; титруют тиосульфатом 58
15
М. Р. ф. Эшворт
449
Продолжение
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Лите рату-ра
61 Нитриты четвертичных В среде диметил- Г; титруют тиосуль- 59
62 аммониевых оснований с длинной углеводородной цепью Полиэтилентерефта - формамида (в некоторых случаях добавляют эфир); немного уксусной кислоты; хлорамин Т— диметилформамид; оставляют на 15 мин в темноте В нитробензоле; фатом Полимер осаждают 60
63 лат — определение концевых ОН-групп Ментол в мятном масле бромацетилбромид; 1 ч при 80° С С1СН2СОС1—толуол; ацетоном, обрабатывают раствором КОН; затем добавляют HNO3—AgNO3; избыток Ag+ -ионов оттитровывают тиоцианатом в присут- ствии Fe111 НС1 отдувают током 61
64 Фруктовые соки, сиро- при 100° С Хлорамин Т; остав- сухого азота в AgNO3, избыток которого оттитровывают тиоцианатом I"—H2SO4; титруют 62
65 пы и напитки — определение «хлор аминного» числа Фенолы (см. № 2) в при- ляют на 15 мин в темноте м-Нитробензолсуль- тиосульфатом Основание (выдер- 63
66 сутствии спиртов Меркаптаны (см. № 83), фонил хлорид—ацетон—вода—щелочь (образуется осадок эфира сульфоновой кислоты) (Метод, описанный г жива ют 20—30 мин). избыток которого затем оттитровывают кислотой в присутствии метилового красного ыше 51, — см. № 53) 64
67 образующиеся при определении дисульфидов в пиве путем электролитического восстановления Ксантат, образующий- f Хлорамин Т—НС1; 1~; титруют тиосуль- 65
68 ся при определении сероуглерода в процессе его взаимодействия с КОН—спирт Кератин волос — определение — SH-rpynn, образующихся при его восстановлении этанол; 30 мин при комнатной температуре Иодацетамид; боратный буферный раствор (pH 10); 45 мин при комнатной температуре фатом Аликвотная часть; HNO3 при pH 7; титруют AgNO3 потенциометрически 66
450
Продолжение
———" № п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Лите рат>-ра
69 Альдрин В среде уксусной кислоты; хлорамин Т; КВг; концентрированная НС1; 45 мин при комнатной температуре Г; титруют тиосульфатом 67
70 Морфин (см. № 12) в опиуме Экстракт; NH4OH; 2,4-динитрофторбен-зол—ацетон; встряхивают 1 мин\ затем 30 мин при комнатной температуре и 15 мин при 5° С (образуется осадок производного морфина) Осадок р аствор яют в уксусной кислоте, добавляют уксусный ангидрид и титруют в присутствии кристаллического фиолетового 68
71 Метилгидразин Вода; хлорамин Т; 10 мин при комнатной температуре (В комбинации с титрованием гипохлоритом — см. «Реагенты, содержащие хлор», литература 24} I"—уксусная кис- лота; титруют тиосульфатом 69
72 Металлкремнийоргани-ческие соединения, например трифениллитий-силан, дифенилметил-литийсилан, фенилди-метиллитийсилан В тетрагидрофуране; бутилбромид; в атмосфере азота; 2 мин при комнатной температуре (образуется LiBr) Разбавленная H2SO4; нейтрализуют в присутствии фенолфталеина; Вт- -ионы определяют, добавляя Ag+, избыток которого затем оттитровывают тиосульфатом 70
73 Аминокислоты, например аланин, глицин (см. № 49), аспарагин При pH 4,7; PdCl2; N-бромосукцинимид (окисление сопровождается образованием СО2) СО2 пропускают в смесь бензиламин— диоксан—этанол и титруют метаноловым раствором NaOCH3 в присутствии тимолового синего 71
74 Диксантогенаты Хлорамин Т—НО; 1 ч при комнатной температуре Г; титруют тиосульфатом 72
461
Продолжение
Титруемое вещество
Реагент и условия реакции
Соответствующая обработка и конечная стадия титрования
Литература
75
Первичные, вторичные, некоторые третичные спирты (см. № 11), полиспирты (см. № 40), фенолы (см. № 2) и ацето: оксим— определение ОН-групп; бензиламин
3,5-Динитробензоил-хлорид—пиридин;
большей частью 5— 15 мин при комнатной температуре, но
иногда до 96 ч
76 Оксин и оксинаты ме-
таллов
НС1; КВг; хлорамин Т—в 15%-ном избытке; 5 мин при комнатной температуре
77
78
79
80
81
82
Моноглицериды и диглицериды — определение ОН-групп Жирные кислоты (см. № 43), жиры (см. № 11), глицериды, высшие спирты (см. № 11) — определение ОН-групп
Окиси аминов (см. № 19) с длинной цепью углеводородных атомов в присутствии третичных аминов с длинной цепью углеводородных атомов
Лигнин — определение ОН-групп
Фенолы (см. № 2)
Полимеры — определение ОН-групп
(Метод, описанный выше
Несколько капель воды; пиридин; титруют бензольно-метаноловым раствором (7 : 1) гидроокиси тетрабу-тиламмония потенциометрически или визуально до перехода желтой окраски в красную
I"; титруют тиосульфатом или добавляют избыток As111 и НС1 и оттитровывают хлорамином Т в присутствии а-нафтаф-лавона или п-эток-кснхризоидина
73, — см. № 75)
73
74
75
В среде пиридина; ацетил хлорид—толуол (до двухкратного избытка);
20 мин при 60° С
Вода; нагревают 15 мин при 60° С и титруют спиртовым раствором КОН в присутствии фенолфталеина. Холостой опыт Окиси титруют спиртовым раствором НС1 потенциометрически
76
В среде изопропанола; метилиодид;
15 мин при 50°С (образуются соли четвертичных аммониевых оснований с аминами)
(Испытаны различные методы, например метод, описанный выше rs, — см. № 75,
а также методы, основанные на применении 2,4-динитрохлор- и фторбензола; получены
заниженные В N-диметиланили-не; хлорсульфоновая кислота; 1 ч при комнатной температуре
В бензоле, дихлор-этаноле, этиленгликоле, диметиловом эфире или других растворителях;
СОС12; 1 ч при 80° С
результаты)
NaOH, избыток которого оттитровывают кислотой
Избыток СОС12 удаляют выпариванием; продукты реакции гидролизуют щелочью и СГ -ионы оттитровывают AgNO8 в уксуснокислой среде
77
78
79
80
452
Продолжение
№ n/n Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования «Литература
83 Меркаптаны (см. № 66), 2,4-Динитрохлорбен- Отделяют тиоэфир 81
84 содержащиеся в нефтяных продуктах Элеостеариновая кис- зол—этанол; КОН— спирт (образуются тиоэфиры) N-Бромосукцин- и добавляют к нему изопропанол, при этом получаются меркаптаны, которые оттитровывают аммиачным раствором соли серебра (I) I" ; титруют тиосуль- 82
85 лота и тунговое масло — определение иодного числа Спирты (см. № И) и фе- имид—уксусная кислота (тунговое масло в СНС13); 24 ч при комнатной температуре n-Т олуолсульфонил- фатом Пиридин—вода; ти- 83, 84
86 нолы (см. № 2) е-Капролактам хлорид—пиридин; 5, 30, 60, 90, 120 и 180 мин (Изучалась продолжительность реакции) Ацетилхлорид—то- тру ют NaOH Вода; титруют рас- 85
87 Тиомочевина луол—пиридин; 30 мин при 60° С При pH 10; избыток твором NaOH в присутствии фенолфталеина I_ —НС1; титр уют 86
хлорамина Т; 2 мин Уравнение NH2CSNH2 * NH2CONH2 +“ 5 тиосульфатом реакции: 1- 10ОН~ -> >О|- + 5Н2О 4- 8е
НС104; катионы четвертичных аммониевых оснований, образующихся в процессе подобного определения, расщепляют с образованием метиламина, титруемого затем кислотой.
5) Эфиры морфина, образующиеся при его определении путем взаимодействия с динитрохлорбензолом, обрабатывают избытком НС1, который обратно оттитровывают щелочью.
6) К некоторым частным определениям, встречающимся в табл. 47, относятся: определение азота по Кьельдалю [после применения в качестве реагента C1CH2CON (C2N6)2]; титрование петилтриметил-аммонийбромидом алкилсульфатов, получающихся при взаимодействии высших спиртов с C1SO3H; отделение исходных меркаптанов и титрование их А§+-ионами.
ЛИТЕРА ТУРА
'•Adam F., Osterr. Chem. Ztg., 2, 241 (1899).
< Roberts E„ J. Chem. Soc., 2707 (1923).
“Hinton C. L., Macar a T., Analyst, 52, 668 (1927).
4- Ziegier K., - Grossmann F., Kleiner H., Schafer O., Ann., 473, 21 (1929).
453
5. Ziegler К., Grossmann F., Kleiner H., Schafer О Лиг 473, 31 (1929). ” nn-
6. Huppmann, Pharm. Ztg., 76, 113, 329 (1931).
7. Linke B., Preissecker H., Stadler J., Ber., 65, 1280 (1939»
8. H unt er L., H у d e F. F„ Analyst, 58, 523 (1933). 1 ’
9. Нелюбина А., Анилинокрасочная пром., 3, 355 (1933).
10. Fink H., S t a h n R., Matthes A., Angew. Chem., 47, 429, 602 f 1934ч
11. M e у e r T. M., Rec. trav. chim., 53, 387 (1934).
12. M a n n i c h C., Arch. Pharm., 273, 97 (1935).
13. S m i t h D. M., Bryant W. M. D., J. Am. Chem. Soc., 57, 61 (1935).
14. S a b e t a у S., Compt. rend., 203, 1164 (1936).
15. С a r 1 i B., A i г о 1 d i R., Ann. chim. applicata, 27, 56 (1937).
16. Eder R., Wackerlin, Quart. J. Pharm. Pharmacol., 10, 680 (1937)
17. Kaufmann H. P., Funke S„ Ber., 70, 2549 (1937). ’’
18. О 1 s о n V. R., Feldman H. B., J. Am. Chem. Soc., 59, 2003 (1937).
19. Raymond E., Bouvetier E., Compt. rend., 209, 439 (1939).
20. S c h i c k t a n z S. T., Etienne A. D., Ind. Eng. Chem., Anal. Ed 1] 390 (1939).
2]. В i on d a G., Ann. chim. applicata, 31, 31 (1941).
22. Christensen В. E., Pennington L., Dimick К. P., Ind. Eng Chem., Anal. Ed., 13, 821 (1941).
23. Leonhardt FL, Moes er W., Z. anal. Chem., 122, 3 (1941).
24. C h r i s t e n s e п В. E., Pennington L., Ind. Eng. Chem., Anal. Ed., 14, 54 (1942).
25. M an n ich C., Arch. Pharm., 280, 386 (1942).
26. M о n t e s A. L., Anales asoc. quim. argentine, 31, 109 (1943).
27. Gilman FL, H a u b e i n A. H., J. Am. Chem. Soc., 66, 1515 (1944).
28. H о u g e t J., Bull. soc. chim., 11, 139 (1944).
29. J u n g К. P., Kolloid. Z., 108, 120 (1944).
30. H a s 1 a m J., Sweeney F., Analyst, 70, 413 (1945).
31. M i t c h e I 1 J., Ashby С. E., J. Am. Chem. Soc., 67, 161 (1945).
32. Seaman W., Norton A. R., Woods J. T., Bank H. N., J. Am.
Chem. Soc., 67, 1571 (1945).
33. Spencer G., В r i m I e у J. E., J. Soc. Chem. Ind. (London), 64, 53 (1945).
34. Wilson FL N., Heron A. E., Analyst, 70, 38 (1945).
35. Kinsey V. E., Grant W. M., Ind. Eng. Chem., Anal. Ed., 18, 794 (1946).
36. H о f f m a n n A., Maffei F. J., Inst. pesq. tecnol. (Sao Paulo), No 196, 93 (1947).
37. К a c 1 K., Fink F., Chem. Listy, 41, 34 (1947).
38. Aubry G., Bull. soc. pharm. Lille No 2, 22 (1948).
39. J о h n s о n B. L., Anal. Chem., 20, 777 (1948).
40. Sackur O., Bull. soc. chim. France, 16, 270 (1949).
41. Van Pinxteren J. A. C., S m e e t s M. A. G., Pharm. Weekblad, 85, 1, 48 (1950).
42. В a s u K. L., Indian Soap J., 18, 259 (1953).
43. В ion da G., Atti accad. sci. Torino, Classe sci. fis. mat. e nat., 88, 3 (1953—4).
44. A p а г Singh, J. Indian Chem. Soc., 31, 605 (1954).
45. Bl ic ken staff R.T., Schaeffer J. R., К a t h m a n G. G., Anal.
Chem., 26, 746 (1954).
46. К e p n e r R. E., Webb A. D., Anal. Chem., 26, 925 (1954).
47. Witry-Schwachtgen G., Inst. Grand-Ducal Luxembourg, Sect. lX-nat. phys. et math., Arch., 22, 87 (1955).
48. Spacu R., Teodorescu G., Gavanescu D., Bui. inst. politen., Bucuresti, 18, 51 (1956).
49. V e i b e 1 S., Nielsen B. J., Acta Chem. Scand., 10, 1488 (1956).
50. A b d e 1 - W a h a b M. F., Barakat M. Z., Monatsh., 88, 692 (1957).
51. Benesch R., Benesch R., Biochim. et Biophys. Acta, 23, 643 (1&Э )
52. Fujita ¥., Ueda T., Kusumoto N., Koryo (Aromatics), No > 42 (1957).
454
53. Ш у т е р Л. М., Беркман Я. П., Укр. хим. журнал, 23, 669 (1957) 54’ Д а р н а А. Я., Силланд X. А., Ж. аналит. химии, 13, 473 (1958).
55. Berka A., Zyka J., Pharmazie, 13, 90 (1958).
56. В г i n g A., Kadlacek F., Plaste u. Kautschuk, 5, 43 (1958).
57. К a p p e 1 m e i e г С. P. A., M os tert J., Verfkroniek, 31, 61 (1958).
58. J ovtscheff A., Nahrung, 3, 153 (1959).
59. К i 1 h e f f e r J. V., J unger m ann E., Anal. Chem., 31, 581 (1959)
60. Матвеева С. П., Мягков В. А., Хим. волокна, № 5, 8 (1959).
61. Blake M. I., J. Am. Pharm. Assoc., Sci. Ed., 49, 175 (I960).
62. В e n k E., Riechstoffe u. Aromen, 10,'122 (1960).
63 Беркман Я. П., Шутер Л. М., Докл. Львовского политехи, ин-та, 4, № 1, 2, 33 (1960).
64. В г е п n е г М. W., О w a d е s J. L., S с h а р i г о G. J., L a u f е г S.,
Am. Brewer, 93, 28, 38 (1960).
65. S a t у а п а г а у a n a Rao V. R., Vasudeva Murthy A. R., Taianta, 4, 206 (I960).
66. S t e i n H. H., Guarnaccio J., Anal. Chim. Acta, 23, 89 (1960).
67. V e 1 n i c e r i и A., lonescu E., Rev. chim. (Bucharest), 11, 533 (1960).
68. В ii c h i J., Huber R., Pharm. Acta Helv., 36, 313 (1961).
69. С I a r k J. D., Smith J. R., Anal. Chem., 33, 1186 (1961).
70. Gilman H., Klein R. A., Winkler H. J. S., J. Org. Chem., 26, 2474 (1961).
71. Patchornik A., S h a 1 i t i n Y. Anal. Chem., 33, 1887 (1961).
72. Ramachandra Rao S., Taianta, 8, 747 (1961).
73. R о b i n s о n W. T. Cundiff R. H., M a r k и n a s P. C., Anal. Chem., 33, 1030 (1961).
74. В i s h о p E., J e n n i n g s V. J., Taianta, 9, 679 (1962).
75. Jensen R.G., Sampugna J., J. Am. Oil Chemists' Soc., 39, 309 (1962).
76. К a и f m a n n H. P., S c h m и e 1 1 i n g E., Fette u. Seifen, Anstrichmittel, 64, 319 (1962).
77. M e t с a 1 f e L. D., Anal. Chem., 34, 1849 (1962).
78. W i 1 d e n h a i n W., Heinichen G., Henseke G., J. prakt. Chem., 20, 35 (1963).
79. R and sep p H., M i k k a 1 M., Tallinsk. Politekhn. Inst., Ser. A No 198, 101 (1962).
80. В и s h D. G., Kunzelsauer L. J., Merrill S. H., Anal. Chem., 35, 1250 (1963).
81. D a h m e n E. A. M. F., D i j k s t r a R., V e r j a a 1 A. J., Erdol, Kohle, 16, 768(1963).
82. J ovtscheff A., Bontscheff N., Jonkow D., Nahrung, 7, 375 (1963).
83. Mesnard P., Gibirila B., Bertucat M., Compt. Rend., 257, 2999 (1963).
84. Mesnard P., Gibirila B., Bertucat M., Chim. Anal., 45, 491 (1963).
85. Polaczek L., Grzezkiewicz A., Chem. Anal. (Warsaw), 8, 961 (1963).
86. Ar a v am и nd an G., Satyanarayana Rao V. R., Taianta, 11, 55 (1964).
41. ГАЛОГЕНСОДЕРЖАЩИЕ РЕАГЕНТЫ, ПРИМЕНЯЕМЫЕ ДЛЯ ОПРЕДЕЛЕНИЯ НЕНАСЫЩЕННОСТИ
Наиболее широко применяются методы определения ненасыщенности, основанные на реакциях присоединения галогенов или некоторых их соединений. В качестве реагентов используют следующие вещества: хлор, бром, иод, тиоциан, хлорид брома, хлорид иода, бромид иода, тиоцианат иода и кислородгалогенсодержащие кислоты, образующие галогены в процессе взаимодействия. Методы прямого
455
титрования бромными реагентами широко применяются для определения многих органических соединений, однако подавляющее число примеров определений ненасыщенности органических соединений основано на косвенных методах (обратного) титрования. В косвенных методах разные реагенты, в особенности применяемые для анализа сложных смесей, таких, как масла и жиры, часто приводят к различным результатам. Некоторые работы, посвященные сравнению различных реагентов, приведены ниже.
В табл. 48 приняты следующие обозначения: знак «+» указывает, что был изучен один метод, основанный на применении данного реагента, знак «++» указывает, что изучено более одного метода.
Таблица 48. Примеры использования галогенов и некоторых их соединений для определения ненасыщенности
ЛИТЕРАТУРА
1. Юшкевич С., Маслобойно-жировое дело, № 2, 9 (1930).
2. S е t t i m j M., Ann. chim. applicata, 21, 507 (1931).
3. Ю ш к e в и ч С., Тр. ВНИИЖ, № 2, 9 (1934).
4. С a s i m i г Е. Е., D i m i t r i u M., Petroleum Z., 31, No 33, 1 (1935).
5. C a s 1 m i r E. E., D i m i t r i u M., Inst. Geol. Roumanie, Compt. rend.,
21, 241 (1932—3), published 1937.
6. Grosse-Oetringhaus H., Brennstoff-Chemie, 19, 417 (1938).
7. E a r 1 e F. R., M i 1 n e r R. T., Oil and Soap, 16, 69 (1939).
8. Richter M., 61, Kohle, Erdol, Teer, 15, 69 (1939).
9. Riemenschneider R. W., Wheeler D. H., Oil and Soap, 16, 219 (1939).
10. Schloemer A. L., Eckardt H. H., Vorratspflege u. Lebens-mittelforsch. 2, 710(1939).
11. Schoorl N., Pharm. Weekblad, 76, 1295 (1939).
12. Сендерихииа Д. П., Тр. Московского санитарного ин-та им. Эрисмаиа, 86 (1939).
13. Koch Н., Н i 1 b е г a t h F., Brennstoffchemie, 21, 185 (1940).
14. В о у d Н. М., Roach J. R., Anal. Chem., 19, 158 (1947).
456
Thayer L., Glass В., Proc. Louisiana Acad. Sci., 10, 213 (1947).
S a v a г у P., Bull. soc. chim. France, 635 (1949).
17 Cerdeiras Alonso J. J., pR (Montevideo), 1, No 2, 39 (1951).
1й. D u к e J. A., Mas ell i J. A., J. Am. Oil Chemists' Soc., 29, 126 (1952).
19. В о d 1 e у D. S., J. Am. Oil Chemists' Soc., 32, 235 (1955).
on. S t a h 1 i H., Mitt. Lebensm. Hyg., 46, 121 (1955).
21. Shi e in del H., Biul. Inst. Roslin Leczniczych, 2, 160 (1956).
22. Seher A., Arends W., Mitt. Gebiete Lebensm. u. Hyg., 48, 1 (1957).
23. M e s n a r d P., Raby C., Chim. anal., 44, 463 (1962).
42. ГИДРАЗИНЫ
Реагент. В качестве реагента главным образом применяют фенилгидразин и его нитрозамещенные производные.
Реакции и титруемые вещества *. 1. Реакции конденсации (сопровождающиеся образованием нерастворимых продуктов), применяемые для определения альдегидов и кетонов:
RR'CO + H2NNHR" -> RR'C = NNHR" + H2O
2. Реакции ионного и иономолекулярного обмена, применяемые для определения сульфокислот; эти реакции сопровождаются образованием нерастворимых в воде солей:
н+ + RSO7 + r'nhnh2 -> (r'nhnh3)+ (rso3)~
Условия реакций. В некоторых случаях для полного завершения реакции образования продукта конденсации требуется до 24 ч. Соли, образующиеся по второму типу реакций, обычно осаждаются быстро.
Соответствующая обработка и конечная стадия титрования. Метод обратного титрования избытка реагента и определение продукта реакции применяются примерно в одинаковой мере.
1. Избыток реагента титруют:
а) кислотами;
б) окислителями, например иодом, хлорамином Т, йодатом и соединениями меди (II);
в) восстановителями, например соединениями титана (III), в тех случаях, когда используются нитрозамещенные фенилгидразины.
2. Осаждаемые и отделяемые продукты реакции определяют путем титрования, основанного на свойствах их функциональных групп:
а) восстановителями ‘ (как в п. 1, в), например Ti111, Sn11 или V11, в тех случаях, когда образуются нитрозамещенные продукты;
б) щелочами сульфонатов, образующихся по 2-му типу реакций, и продуктов конденсации кетокисло! с и-карбоксифенилгидразином;
в) кислотами аммиака, образующегося при гидролизе семикарбазонов.
3. Образующиеся кислоты титруют щелочами:
КарбонильноеГидразин гидрохлорид->• Гидразон (или H2SO4)
соединение или сульфат (заме- (замещенный) ________ щенный)
вИте* ^" ^идРазин в аналитической химии применяют также в качестве восстано-
457
Таблица 49. Примеры использования гидразинов
№ Е/П Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Л ите-ра ту. Ра
1 Карбонильные соеди- Избыток спиртового Вода; фильтруют и 1
2 нения (см. № 5, 10, 15, 20, 23—27, 30—32, 34, 36, 39, 43) а-Дикетоны раствора фенилгидр-азина; выдерживают в темноте 15 ч В 80% -ном этаноле; для определения избытка реагента добавляют иод, избыток которого оттитровывают тиосульфатом (см. «Реагенты, содержащие иода, литература 3) Избыток реагента 2
3 Кетоны и циклические приблизительно эквивалентное количество фенилгидра-зина; 4 ч при 15— 17° С [Исследовано течение кето (Метод и исследование оттитровывают реакций с различными нами) , описанные выше 2, — 3
4 кетоны (см. № 12, 42) Формальдегид (см. № 30) см. Избыток гидразин- № 2) Избыток реагента 4
5 Карбонильные соеди- гидрата; обрабатывают при нагревании в закрытом сосуде в течение 1 ч Избыток фенилги- оттитровывают H2SO4 в присутствии метилового оранжевого Избыток реагента 5
6 нения (см. № 1) Ароматические альде- дразина Избыток гидра- оттитровывают кислотой Фильтруют; к алик- 6
7 гиды (см. № 18, 21, 29), а также альдегиды, образующиеся при кислотном гидролизе в процессе определения оксимов, азинов, гидразонов и т. д. Фурфурол (см. № 18), зинсульфата; встряхивают несколько часов Избыток фенилги- вотной части филь-рата добавляют избыток иода и NaOH; после прекращения выделения азота прибавляют H2SO4 и титруют тиосульфатом К избытку реагента 7
8 образующийся при гидролизе пентоз и пентозанов Глюкоза (см. № 30), дразина Фенилгидразин— добавляют избыток иода, который затем оттитровывают тиосульфатом (см. «Реагенты, содержащие иод», литература 53) Озазон определяют 8
лактоза, фруктоза и другие сахара уксусная кислота; тартрат натрия; 10 мин при 100° С путем добавления к нему избытка TiCl3 и обратного титрования раствором соли железа 111 [см. «Соединения титана (III)», литература 18)
458
Продолжение
——— № п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
9 Пировиноградная кислота Фенилгидразин или n-бромфен ил гидразин гидрохлорид; 3—4 ч Фильтруют; титруют NaOH в присутствии фенолфталеина 9
10 Карбонильные соединил (см. № 1) Фенилгидразин гидрохлорид; динатрийфосфат; более 30 мин при 100° С Фенилгидразон экстрагируют петро-лейным эфиром и к избытку реагента добавляют иод, избыток которого оттитровывают тиосульфатом 10
11 Цитраль Фенилгидразин гидрохлорид;30 мин при комнатной температуре Выделившуюся кислоту титруют Na2CO3 11
12 Кетоны (см. № 3) Семикарбазид Семикарбазоны гидролизуют смесью НС!—HgCI2, образующийся аммиак отгоняют и титруют (см. «Хлористоводородная кислота», литература 11) 12
13 Нафта лин-2-сульфо кислота Фенилгидразин гидрохлорид; 1 ч при 0° С Осадок кипятят с водой и титруют NaOH в присутствии фенолфталеина 13
14 Дегидроаскор би новая кислота 2,4-Динитрофенил-гидразин — (24 ч, если присутствует аскорбиновая кислота, которая должна быть окислена реагентом) Осадок; метанол; избыток TiCl3—НС1, который оттитровывают Fe111 [см. «Соединение ти-тана(Ш)», литература 50] 14, 15
15 Карбонильные соединения (см. № 1) — определение эквивалентного веса Если необходимо в этаноле; п-карб-оксифенилгидразин— вода — НС1; в течение нескольких минут Осадок; этанол, титруют NaOH или Ва (ОН)2 в присутствии фенолфталеина или потенциометрически (см. Том 1, «Гидроокиси щелочных и щелочноземельных металлов», литература 31 и 51) 16, 20
16 Коричный альдегид (см. № 19) в коричном масле Гидразин сульфат Титруют NaOH в присутствии метилового красного 17
459
Продолжение
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Лите-рату. Ра
17 Левулиновая кислота Фенилгидразин Осадок растворяют в избытке НС1 и титруют NaOH в присутствии метилового красного, затем фенолфталеина Разность объемов титранта эквивалентна содержанию левулиновой кислоты 18
18 Альдегиды (см. № 6), например фурфурол (см. № 7) Г идр азинсульфат Титруют NaOH в присутствии метилового красного или прибавляют избыток щелочи, который оттитровывают кислотой 19
19 Коричный альдегид (см. № 16) в коричном масле В смеси вода—метанол или этанол; гидразинсульфат; иейтр ализоваи ный NaOH; 6 ч при комнатной температуре Фильтруют; фильтрат титруют NaOH в присутствии метилового красного 21
20 Карбонильные соединения (см. № 1) В воде или в смеси вода—этанол; и-нитрофенилгидразин—уксусная кислота Осадок растворяют в 50%-ной H2SO4, добавляют Sn н, избыток которого оттитровывают иодом или осадок растворяют в щелочи и определяют посредством избытка станнита [см. «Соединения олова(II)», литература 20] 22
21 Ароматические альдегиды (см. № 6), например бензальдегид (см. № 37, 42), пиперонал Нейтрализованный гидразинсульфат; выдерживают до 6 ч при комнатной температуре Фильтруют; фильтрат титруют иодом 23
22 Метилглиоксаль 20-кратный избыток горячего 20%-ного раствора л-нитро-бензгидразина в 10%-ной уксусной кислоте К осадку добавляют TiCI3, избыток которого оттитровы-г- III вают Fe [см. «Соединения титана(Ш)», литература 40] 24
460
Продолжение
№ п/л Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
23 Карбонильные соедине- В воде; избыток Фильтруют; избыток 25,
24 ния (см. № 1) Карбонильные соеди- 2,4-динитрофенил-гидразина—НС1; в зависимости от исходного карбонильного соединения для завершения реакции требуется различное время Фенилгидразин, реагента определяют путем добавления TiCl3, избыток которого оттитровывают Fe111 [см. «Соединения тита-на(Ш)», литература 41 и 42] Титруют щелочью 26 21
25 нения (см. № 1) Карбонильные соеди- семикарбазидгидрохлорид или тиосемикарбазид гидрохлорид n-Нитро-, 2,4-дини- потенциометр и чески до первоначального значения pH 4,2; 3,15 и 2,6 соответственно Избыток реагента 28
26 нения (см. № 1) Карбонильные соеди- тро- или 2, 4, 6- тринитрофенил гидразин Избыток фенилги- определяют посред-ством Tiln [см. «Соединения титана (III)», литература 45] Избыток реагента 29
27 нения (см. № 1) Карбонильные соеди- др азин гидрохлорида в смеси пиридин—вода 2,4-Динитрофенил- оттитровывают ацетатом меди до изменения цвета от желто-коричневого до зелено-коричневого [см. Том 1, «Солн меди (П)», литература 107] Фильтруют; избыток 30
28 нения (см. № 1) Глиоксаль, глиоксалевая кислота гидразин—НС1; 1 ч при 0° С или 2— 24 ч при комнатной температуре Избыток семикарбазид гидрохлорид — вода; 4 ч при 60° С реагента оттитровывают йодатом или добавляют иодат, избыток которого оттитровывают иодом [см. Том 11, «Иодат калия и пятиокись иода», литература 60 и Том I, «Иодат калия», литература 43] Уксусная кислота; избыток IOJ*, который вместе с образующимся иодом оттитр овывают тиосульфатом [см. «Иодат калия и пятиокись иода», литература 621 31
461
Продолжения
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Лите, рату. ра
29 Альдегиды (см. Ks 6) 1,1-Диметилгидра-зин в метаноле или этиленгликоле; 15 мин —2 ч при комнатной температуре Метанол; избыток реагента оттитровывают метаноловым раствором НС1 потенциометрически (см. Том I, «Хлористоводородная кислота», литература 44) 32
30 Карбонильные соединения (см. Ks 1,) например формальдегид (см. № 4), глюкоза (см. № 8), антрахинон 2,4-Динитрофенил-гидразин Осадки отфильтровывают, добавляют избыток VSO4, который затем оттитровывают бихроматом [см. «Соединения ванадия (I I)», литература 3] 33
31 Карбонильные соединения (см. Ks 1) Избыток фен и л гидразина Избыток реагента оттнтр овывают ацетатом меди потенциометрически [см. Том I, «Соли меди(П)», литература 118} 34
32 Карбонильные соединения (см. Кв 1) В 96% -ном этаноле; 2,4-динитрофенил-гидразин; 12 ч при комнатной температуре Фильтруют; избыток реагента оттитровывают хлорамином Т в присутствии КВг [см. Том I, «Хлорамины В и Т», литература 15, 16 и 20) 35, 36, 41
33 Мезоксалевая кислота Избыток фенилгидразин гидрохлорида; 15 мин при 95° С Избыток реагента определяют путем добавления иода, избыток которого оттитровывают тиосульфатом (см. «Реагенты, содержащие иод», литература 334] 37
34 Карбонильные соединения (см. Ks 1) Избыток п-нитро-фенилгидразина в среде диоксан— уксусная кислота; 10 мин ниже 20° С Избыток реагента оттитровывают уксуснокислым раствором НСЮ4 по-тенци ометрически. Холостой опыт (см. Том 1, «Хлорная кислота», литература 152) 38
462
Продолжение
№ n/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
35 Б ензолди сульфокислота Фенилгидразин гидрохлорид Осадок титруют в кипящем растворе NaOH в присутствии фенолфталеина (см. Том 1, «Гидроокиси щелочных и щелочноземельных металлов», литература 127) 39
36 Карбонильные соединения (см. № 1) В пиридине; избыток фенилгидр азинги-дрохлорида; 15 мин при температуре около 100° С Избыток реагента оттитровывают ацетатом меди в среде этанол—пиридин (1 : 1) потенциометрически [см. Том 1, «Соли меди (II)», литература 128] 42
37 Бензальдегид (см. № 21), образующийся при кислотном гидролизе в процессе определения бензольных групп Отгоняют в солянокислый раствор 2,4-динитрофенилгидр-азина; выдерживают 1 ч; или перегоняют в солянокислый раствор нитрофенил-г.щразина; выдерживают 6—8 ч Добавляют TiCl3, избыток оттитровывают Fe111 [см. «Соединения тита-на(Ш)», литература 56] 43
38 Карбонильные соединения (см. № 1) 2,4-Динитрофенил-гидразин Отделяют бумажной хроматогр афией; экстрагируют ацетатным буферным раствором, добавляют TiClj, избыток которого оттитровывают Fe111 [см. «Соединения титана (III)», литература 59] 44
39 Карбонильные соединения (см We 1) в пищевых продуктах В этаноле или этанол—вода; 2,4-ди-нитрофенил гидр азин в НС1; 1 ч при комнатной температуре, затем нагревают 1 ч в колбе, снабженной обратным холодильником Фильтруют; добавляют иод, избыток которого оттитровывают тиосульфатом (см. «Реагенты, содержащие иод», литература 395) 45’
40 Монохлорацетальдегид В воде; избыток гидразинсульфата; 10 мин HNO3; добавляют AgNO3, избыток которого оттитровывают тиоцианатом 46
463
Продолжение
№ П/П Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
41 З-Метил хромой Гидразингидрат; 3 ч Избыток реагента титруют НС1, в присутствии метилового красного и метиленового голубого 47
42 Циклические кетоны (см. № 3); замещенные бензальдегиды (см. № 21) Гидразидкарбокси-метилтриметил-ам-монийхлорид (Исследование ci Избыток реагента определяют иодометрически сор ости реакций) 48
43 Карбонильные соединения (см. № 1) В этаноле; 2, 4-дини-трофенилгидр азин— НС1; 10 мин—2 ч 12; через 20 мин оттитровывают избыток иода тиосульфатом (см. «Реагенты, содержащие иод», литература 442) 49
ЛИТЕРАТУРА
1. v. Meyer Е., J. prakt. Chem. (2), 36, 115 (1887).
2. Pefrenko-Kritschenko Р., Eltschaninoff Е., Ber., 34, 1699 (1901).
3. Petrenko-Kritschenko P., L ordk i pan i d z e S., Ber., 34, 1702 (1901).
4. P f a f f A., Chem. Ztg., 26, 701 (1902).
5. К 1 e b e r C., Am. Perfumer, 6, 284 (1912).
6. L au tensch lager L., Arch. Pharm., 256, 81 (1918).
7. Ling A., N a n j i D., Biochem. J., 15, 466 (1921).
8. К п e c h t E., Hibbert E., J. Chem. Soc., 2009 (1924).
9. S i m о n L. J., P i a u x L., Bull. soc. chim. biol., 6, 477 (1924).
10. A r d a g h E. G. R., W i 1 1 i a m s J. G., J. Am. Chem. Soc., 47, 2983 (1925).
11. Fernandez О., M osar d 6 A., Anales soc. espan. fis. у quim , 27, 265
(1929).
12. H obson R. P., J. Chem. Soc., 1384 (1929).
[З.Зиньков 3. E., Данюшевский Я. Л., Рейнштейн В., X о-мяковский Г. М., Ж. прикл. химии, 9, 1997 (1936).
14. Е s р i 1 L.,xGenevois L., Bull. soc. chim. France (5), 5, 1532 (1938).
15. E s p i 1 L., Mand il Ion G., Compt. rend. soc. biol., 129, 1187 (1938)-
16. V e i b e 1 S., Hauge N., Bull. soc. chim. France, 5, 1506 (1938).
17. S t e m p e 1 B., Fette u. Seifen, 49, 42 (1942).
18. В о i n о n R., Ing. Chim., 27, No 161, 8 (1945).
19. M о n t i L., M a sser i z i M. T., Ann. chim. applicata, 37, 101 (1947).
20. V e i b e 1 S., Acta Chem. Scand., 1, 54 (1947).
21. F u c h s L., Scientiae Pharm., 16, 50 (1948).
22. P e t i t G., Bull. soc. chim. France, 15, 141 (1948).
23. F u c h s L., M a t z k e O., Scientiae Pharm. 17, 1 (1949).
24. Prey V., Waldmann E., Ludwig F., Monatsh., 82, 1022 (1951)-
25. Schoniger W., Lieb H., Mikrochemie ver. Mikrochim. Acta, 38, loo (1951). , 1йЯ
26. Schoniger W., Lieb H., Gassner K., Z. anal. Chem., 134, 166
27. Dvorak K., Trekoval J., Buzkova V., Treybal K-, Sbornik Celostatni Pracovni Konf. Anal. Chemikfl, 1, 313 (1952).
28. Schoniger W., Mikrochim. Acta 434 (1953).
464
29. Т е р е н т ь е в А. П., Забродина К. С., ДАН СССР, 95, 85 (1954).
30. В а г к е D. J., Cole Е. Р., J. Appl. Chem. (London), 5, 477 (1955).
31. S а 1 z е г F., Z. anal. Chem., 146, 260 (1955).
32. S i g g i a S., Stahl C. R., Anal. Chem., 27, 1975 (1955).
33. W itry-Schwachtgen G., Inst. Grand-Ducal, Luxembourg, Sect. Sci. nat. phys. et meth. Arch., 22, 87 (1955).
34. Barro-Raffel M., J a c i n i G., 01 ii minerali, grassi e saponi, colori e vernici, 33, 381 (1956).
35. Berka A., Z У к a J., Chem. Listy, 50, 831 <1956).
36. Berka A., zyka J., Ceskoslov. Farm., 5, 30 (1956).
37. H i г a у a m a H., Amano T., Ann. Rept. Shionagi Research Lab., 6, 55 (1956).
38. N a к a m u r a N., Bunseki Kagaku, 5, 459 (1956).
39. С п p ы с к о в А. А., Старков С. А., Ж- общей химии, 26, 2607 (1956).
40. Berka А., Chemie (Prague), 9, 528 (1957).
41. В е г к a A., Z $ к a J., Pharmazie, 13, 89 (1958).
42. Budesinsky В., Chem. Listy, 52, 2292 (1958).
43. J и г е с е к М., О b г u b а К., Chem. Listy, 52, 2066 (1958).
44. В 1 о m L., С а г i s J., Nature, 184, Suppl. No 17, 1313 (1959).
45. Hamann V., H e r r m a n A., Deut. Lebensm. Rundschau, 56, 95, 133 (i960)”
46. Я с н и ц к и й Б. Г., С а т а н о в с к а я Т., Мед. пром. СССР, 14, 36 (I960).
47. D е Lorenzi F., Dare Р., Boll. chim. farm., 100, 23 (1961).
48. W h e el er О. H., G a i n d V. S., R os a d о О., J. Org. Chem., 26, 3537 (1961).
49. H о z u m i К., H az am a K., Bunseki Kagaku, 10, 1240 (1961).
★50. Б p и к у н И. К., Козловский М. Т., Никитина Л. В., Гидразин и гидроксиламин и их применение в аналитической химии, Изд. «Наука», Казахской ССР, Алма-Ата, 1967.★
43. БРОМИСТОВОДОРОДНАЯ КИСЛОТА
Реагент. В качестве реагента обычно применяют концентрированные водные или уксуснокислые растворы бромистоводородной кислоты. В некоторых случаях применяют смесь бромида (MgBr2) с серной кислотой (рассматривается в разделе «Серная кислота»).
Реакции и титруемые вещества. 1. Реакция присоединения к эпоксидам и олефинам. Реакции такого рода, вероятно, имеют место при определении аскаридола и эвкалиптола (цинеола), а также присоединение НВг при размыкании эпоксидного цикла:
>С—С< +НВг-> = С — С = \/ I I
О НО Вг
I
>С = С< +НВг-> =СН — СВг I
2. Образование эфира при взаимодействии с третичными спиртами R3COH + НВг -> R3CBr + Н2О
3. Разрушение С—О-связи при определении бензилокси-групп в бензиловых эфирах. Реакция сопровождается образованием бромидов бензила или его производных:
RCOOCH2C6Hb + НВг — RCOOH + CeH6CH2Br
Определение эфирных групп бензила и его производных основано на следующей реакции:
(СвН6СН2),О + 2НВг-> 2С6Н6СН2Вг + Н2О
16 м. Р. Ф. Эшворт
465
Таблица 50. Примеры использования бромистоводородной кислоты
№ п/п 1 итруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
1 Окись этилена (см. № 8, 14) 50% MgBr2; HsSOj Избыток кислоты оттитровывают NaOH в присутствии метилового оранжевого 1
2 Смеси олефинов С4, С6 и С7 Концентрированная НВг Избыток кислоты оттитровывают щелочью 2
3 Пентозы; пентозаны (см. № 12) Перегоняют с 40% -ной НВг Образовавшийся фурфурол определяют в дистилляте с помощью бромного реагента 3
4 а, п-Диметилстирол в присутствии п-метилсти-рола, стирола и л-цимола В СС14; НВг; барботируют в течение 30 мин Избыток НВг удаляют током азота; добавляют 90% -ный этанол при 0° С; свободную НВг оттитровывают КОН в присутствии метилового красного 4
5 Дибензиловый эфир; окснбензиловые эфиры; эфирные группы в фенольных смолах В СНС13; НВг; 12— 24 ч Образовавшуюся воду оттитровывают реактивом Фишера 5
6 Третичные спирты Концентрированная НВг; встряхивают в течение 5 мин (образуются бромиды третичных спиртов) Превращают в пикрат тиомочевины и оттитровывают его НС1О4 (см. «Тиомочевина», литература 1; «Нитрофенолы», литература 55; Том 1, «Хлорная кислота», литература 62) 6
7 Соли эпоксикислот В уксусной кислоте; избыток НВг—уксус-на я кислота Ацетат натрия; избыток Вг"-ионов оттитровывают AgNO3 в присутствии эозина 7
8 Окись этилена (см. № 1) в окуривающих смесях Пропускают в насыщенный раствор MgCl2; H2SO4; 15 мин при комнатной температуре Избыток кислоты оттитр овывают N аОН 8
9 Аскаридол в цитварном масле Уксусная кислота; избыток НВг—уксусная кислота; 24 ч при комнатной температуре Избыток НВг оттитровывают потенциометрически уксуснокислым раствором ацетата натрия
466
Продолжение
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
10 Эвкалиптол в смесях с тимолом, ментолом или камфорой Уксусная кислота; избыток НВг—уксусная кислота; 48 ч при комнатной температуре Избыток НВг быстро оттитровывают уксуснокислым раствором ацетата натрия в присутствии метилового фиолетового 10
11 Ацетали; кетали; виниловые эфиры НВг; 30 мин при 100° С Измеренное количество гидрохлорида гидроксиламина; НВг; затем 30 мин при 100° С, добавляют КОН и титруют потенциометрически раствором соли 11
12 Пентозаны (см. № 3) в древесной пульпе Перегоняют с 20% -ной НВг Образовавшийся фурфурол определяют в дистилляте бромометрически 12
13 Бензилокси-группы в бензиловых эфирах и в производных карбоксибензила 30% -ная НВг— уксусная кислота; 5—15 мин при 80— 100° С Бензол; нейтрализуют, бензольный слой обрабатывают анилином, при этом происходит экстрагирование бензил-бромида и образуется НВг, которую оттитровывают NaOCH3 в присутствии тимолового синего (см. «Амины и гетероциклические основания», литература 91) Избыток кислоты оттитр овывают едким натром в присутствии бромкрезолового зеленого 13
14 Окись этилена (см. № 1) в малых концентрациях Поглощают 60% -ным раствором MgBr2—H2SO4 14
16 Трибутилфосфат Гидролизуют смесью НВг—уксусная кислота НВг и уксусную кислоту выпаривают, а образовавшуюся фосфорную кислоту оттитровывают щелочью 15
16 З.З-Бис-(хлорметил)-оксациклобутан В органическом растворителе; НВг— ацетон Избыток кислоты оттитровывают щелочью 16
17 Карбоксибензильные группы в высокомолекулярных пептидах НВг—уксусная кислота; дихлоруксусная кислота; 15—45 мин при комнатной температуре, затем нагрорают до 80° С СО2 абсорбируют смесью бензиламин— —диоксан—этанол и титруют NaOCH3 в присутствии тимолового синего 17
467
4. Кислотный катализ в некоторых реакциях гидролиза (например, ацеталей, кеталей или виниловых эфиров) или в реакциях дегидратации пентоз, сопровождающихся образованием фурфурола. Высокая стоимость бромистоводородной кислоты по сравнению со стоимостью хлористоводородной или серной кислот в известной мере ограничивает широкое ее применение в качестве катализатора, несмотря на некоторые значительные достоинства этого реагента. Например, бромис^оводородная кислота (или бромид в кислом растворе) является исключительно эффективным катализатором в реакциях диазотирования и некоторых реакциях нитрозирования (здесь соответствующие примеры не приводятся, но они указываются в первом томе книги в разделе «Нитрит натрия»).
Условия реакций. Большинство реакций проводят при комнатной температуре, время реакции составляет от нескольких минут до 48 ч.
Соответствующая обработка и конечная стадия титрования. Около половины приведенных в табл. 50 примеров определений основано на обратном титровании избытка кислоты или бромида. Бромистоводородную кислоту титруют щелочью (в случае проведения реакции в водном растворе), ацетатом натрия (при проведении реакции в уксусной кислоте) или раствором соли серебра.
2. Наиболее часто заключительная стадия анализа основана на определении продуктов реакции, образуемых при введении атома брома в молекулу определяемого вещества. В двух таких случаях выделившуюся свободную бромистоводородную кислоту титруют щелочью; в третьем случае, который целесообразно рассмотреть здесь, бромиды третичных спиртов превращают в пикраты тиомочевины, которые оттитровывают хлорной кислотой:
R3CBr + CS (NH2)2 -> (R3CSC = NH2)+Br_ -> нерастворимый пикрат
NH2
3. Фурфурол, образующийся при анализе пентоз и пентозанов определяют бромометрическим методом.
ЛИТЕРАТУРА
1. L u b a t t i О. F., J. Soc. Chem. Ind. (London), 54, 424T (1935).
2. Stern G., Reichsamt. Wirtschaftsausbau Priif. Nr. 43, (PB 52003) 15 (1940).
3. Jayme G., S ar ten P., Biochem. Z., 308, 109 (1941).
4. E 1 1 i о 11 J. H., Cook E. V., Ind. Eng. Chem., Anal. Ed., 16, 20 (1944).
5. L 11 1 e у H. S., Osmond D. W. J., J. Soc. Chem. Ind. (London), 66, 425 (1947).
6. Schotte L., V e i b e I S., Acta Chem. Scand., 7, 1357 (1953).
7. D u r b e t a k i A. J., Anal. Chem., 30, 2024 (1958).
8. Affens W. A., H aenni E. V., Fulton R. A., Anal. Chem., 31, 1565(1959).
9. Blake M., O'Neill R. E., Anal. Chem., 32, 1370 (1960).
10. В 1 a k e M. L, R a b j о h n E., J. Am. Pharm. Assoc., Sci. Ed., 49, 650 (1960).
11. В u d e s i n s k У В., KorH J., Mikrochim. Acta, 697 (1960).
12. G r ob e 1 n у L, Illukowicz W„ TAPPI, 43, 244A (1960).
13. Patchornik A., Ehrlich-Rogozinsky S., Anal. Chem., 33, 803 (1961).
468
14. S a 11 z m an В. E., Anal. Chem., 33, 1100 (1961).
15. U. К. A. E. A., Report PG 255 (S), 1962.
16. БаланДииа В. А., Зинченко В. А., Авт. свид. СССР, № 154, 430, июль 24, 1963.
17. Y а г о n А., Е h г 1 i с h - R о g о z i n s k i S., Berger A., Anal. Chem., 36, 1387 (1964).
44. УГЛЕВОДОРОДЫ
Три случая использования ненасыщенных углеводородов для титрования некоторых органических соединений, основанного на реакции присоединения, приведены в табл. 51.
Таблица 51. Примеры использования углеводородов
№ П/П Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
1 Малеиновый ангидрид В бензоле; циклопентадиен—бензол; 10 мин при 35° С (образуется продукт присоединения по реакции Дильса— Альдера) Продукт присоединения экстрагируют КОН и определяют титрованием бромат—бромидной смесью (см. Том 1, «Бромат калия», литература 112) 1
2 Малеиновая кислота или ангидрид в присутствии многих других кислот и ангидридов, например винной, янтарной, фумаровой и фталевой кислот В хлорбензоле; антрацен; кипятят в колбе, снабженной обратным холодильником (образуется продукт присоединения по реакции Дильса— Альдера) Горячая вода; титруют едким натром (при наличии малеиновой кислоты или малеинового ангидрида титрование резко отличается от титрования едким натром холостой пробы, без предварительного добавления антрацена) 2
3 Бинарные смеси ацетатов металлов, одним из компонентов которых является ацетат ртути В смеси пропилен-гликоль—метанол; несколько капель стирола (при этом происходит взаимодействие с ацетатом ртути) Второй ацетат титруют бутаноловым раствором НС1 в присутствии тимолового синего; аналогичным титрованием, без предварительного добавления стирола, определяют также суммарное количество ацетатов в образце (см. Том 1, «Хлористоводородная кислота», литература 60 и 71) 3
ЛИТЕРАТУРА
1- и П g е г Р., Analyst, 80, 820 (1955).
2. N е b b i a L., G u е г г i е г i F., Chim. е ind. (Milan), 39, 17 (1957). Kundu К. К., Das М N., Science and Culture, 23, 660 (1958); Anal. Chem., 31, 1358 (1959).
469
45. ХЛОРИСТОВОДОРОДНАЯ КИСЛОТА (Общие замечания см. в разделе „Кислоты")
Реагент. Обычно применяют водные растворы НС1, концентрации которых варьируют в широких пределах: от разбавленных до 20%-ных, а иногда и более концентрированных растворов. В ряде случаев используют органические растворители, из которых наиболее часто применяют эфиры.
Хлористоводородную кислоту применяют также в виде ее солей, образованных слабыми третичными основаниями, например пиридином, коллидином или триметиламином.
Реакции и титруемые вещества. 1. Реакции присоединения, используемые при определении а-эпоксидов, оксэтанов" A ZCH2 \
I /Сб /О и некоторых олефинов; в первых двух случаях V \сн/ J
наблюдается размыкание кольца:
>С — С< +НС1 -> = С — С = \/ I I
О НО С1
>с=с< +НС1-» =СН —СС1 =
Наиболее частыми примерами анализа, основанными на этой реакции (стандартный метод), являются определения окиси этилена.
2. Реакции этерификации, примерами которых являются два специальных определения вторичных и третичных спиртов и метиловых или этиловых эфиров некоторых ароматических соединений (в последнем случае взаимодействие можно рассматривать как реакцию деалкилирования):
R3COH + НС1 -» R3CC1 + Н2О
АгОСНз + НС1 АгОН + СН3С1
3. Реакции ионного обмена, сопровождающиеся образованием слабых органических кислот, которые обычно отделяют фильтрованием или другими методами. Эти реакции используются при определении ксантогенатов, меркаптидов ртути, нафтенатов многих металлов, например кобальта, и меркаптобензтиазолцинка:
ROCS- + Н+ -» ROH + CS2
II
S
RS- + H+ -> RSH
RCOO- + H+ RCOOH
4. Реакции иономолекулярного обмена при определении некоторых оснований:
В + Н+->(В-Н)+
(обычно выпадает
в осадок)
где В — основание.
470
Некоторые органические основания, 2,4-динитрофеноловый эфир морфина, концевые группы поликапролактама и некоторые ненасыщенные амины определяют, основываясь на использовании таких реакций в начальной стадии определения.
К этому типу реакций можно отнести определения аминов, образующихся при гидролизе или в процессе других реакций, основанных на применении хлористоводородной кислоты. Одной из стадий этого рода химико-аналитического определения является образование соли. Амиды и изоцианаты определяют таким же методом.
5. Реакции кислотного катализа, которые делят на пять типов.
1) Гидролиз самых разнообразных связей:
С—О — эфиров, ацеталей и полисахаридов (инверсия дисахаридов, например сахарозы, и гидролиз пентозанов, широко применяемых в пищевой промышленности и сельском хозяйстве; для того, чтобы ограничить число примеров, приводятся только один или два типа такого рода реакций).
С—N — амидов и полиамидов; гидразидов, подобных изониазиду; гексаметилентетрамина; семикарбазида и гидроксамовых кислот:
RCONH2 + Н2О RCOOH + NH3
(CH2)6N4 + 6Н2О -> 6НСНО + 4NH3
RCONHNH2 + H2O -> RCOOH + NH2NH2 RCO(NHOH) + H2O RCOOH + NH2OH
к этой группе определений преимущественно относятся определения амидов и ароматических аминов.
C=N — продуктов конденсации карбонильных соединений, таких, как оксимы, озазоны, гидразоны, фенилгидразины и семикарбазоны:
R2C — NX + Н2О R2CO + xnh2
C=N — нитрилов.
С—С — при определении СН2ОН-групп в формальдегидных смолах;
АгСН2ОН + Н2О -т АгН + СН2 (ОН)2
НСНО + Н2О
С—I — йодоформа, а также тетраиодопиррола, гидролизующихся с образованием иода или иодида.
С—Me — основным примером этого рода гидролитического расщепления является расщепление тетраэтилсвинца, превращающегося в РЬС12; некоторые ртутные соединения также определяют путем их разложения хлористоводородной кислотой и превращения в HgCl2; гриньяровский реагент разлагается при этом с образованием Mg2+ -ионов.
S—N — сульфонамидов, определяемых путем гидролитического разложения:
ArSO2NH2 -f- Н2О ArSO3H + NH3
Si—О — некоторых арилоксисиланов, их гидролиз в начальной стадии сопровождается разрывом Si—О-связи.
471
2) Дегидратация пентоз с образованием фурфурола используется в стандартном методе определений их, а также пентозанов. Метил-пентозы, реагирующие подобным образом, образуют метилфурфурол а гексозы — оксиметилфурфурол; известно несколько примеров использования следующей реакции:
ноне — СНОН НС—СН
II II II
н2с снсно~ЗНг%нс ссно I I \/
но он о
3) Декарбоксилирование при определении уроновых кислот и ангидридов, а также N-карбоксиаминокислот:
RCOOH RH + СО2
,СО — О ,СООН
RHC< | + Н2О -> RHC( + СО2 XNH—СО xNH2
4) Деполимеризация, например паральдегида, сопровождающаяся образованием ацетальдегида.
5) Реакции присоединения (воды), например при определении изоцианатов. Начальной стадией является реакция присоединения, за которой следует декарбоксилирование:
RN = С = О + Н2О -> RNHCOOH
(Взаимодействие нитрилов с водой рассматривается как гидролиз, хотя начальной реакцией, вероятно, является присоединение воды).
Условия реакций. В тех случаях, когда нерастворимые продукты реакции (соли) очень чувствительны к действию воды, реакции проводят в ее отсутствие. Определение эпоксидов (реакция присоединения НС1) проводят также в отсутствие воды, чтобы избежать конкурирующую реакцию присоединения воды:
>С —С< +Н2О-г- >С —С< X/ I I
О но он
Нередко реакцию проводят в среде органического растворителя, например в среде безводной уксусной кислоты, чтобы облегчить процесс конечной стадии обратного титрования.
Очень часто применяют хлориды металлов в виде концентрированных растворов (наиболее высокая концентрация достигается в случае использования насыщенных растворов сильно растворимых хлоридов кальция и магния), для того чтобы:
благоприятствовать образованию хлоргидринов при определении эпоксидов;
окислить нежелательные продукты реакции (HgCl2 применяют для разложения гидразина, которое обусловливается в действительности влиянием Hg11);
катализировать реакции образования эфиров вторичных спиртов (ZnCl2), присоединения НО к олефинам (ВаС12), декарбоксили
472
рования (NaCl или ZnCl2), дегидратации пентоз (NaCl); разложения целлюлозы (FeCl3, очевидно, для уменьшения растворимости солей).
Продолжительность реакций и температура, естественно, варьируют в широких пределах: от нескольких минут при комнатной температуре до нескольких дней кипячения в колбе, снабженной обратным холодильником, в случае взаимодействия с НС1 трудногидролизуемых продуктов, таких, как некоторые сульфонамиды.
Соответствующая обработка и конечная стадия титрования. Используются три методики титрования.
1. Обратное титрование избытка реагента. Этот способ титрования, разумеется, применим только в методах, основанных на использовании первых 4 типов реакций, в которых кислота расходуется в процессе взаимодействия с определяемым веществом. Действительно этот способ титрования применяется в заключительной фазе определения при использовании реакций типов 1 и 4; при определении третичного бутанола и метиловых или этиловых эфиров ароматических соединений с использованием реакций типа 2; при определении ксантогенатов (реакции типа 3).
Обычно избыток кислоты оттитровывают водными растворами гидроокисей щелочных металлов. К числу других титрантов относятся ацетат натрия (в среде безводной кислоты), нитрат серебра или ртути (II).
2. Титрование избытка реагента и кислого продукта реакции (образующихся в процессе гидролиза). Основными примерами такого титрования являются определения эфиров серной и сульфоновой кислот:
(RO)2SO2 -f- 2Н2О -> H2SO4 + 2ROH
На этом принципе также основано определение сульфонамидов и полиамидов 61>121, но практическое значение имеют только те определения, когда образующиеся амины могут быть отделены (например, на ионообменной колонке) или когда по крайней мере их влияние устраняется путем выбора подходящего индикатора. В приводимых ниже примерах в качестве титранта в таких определениях используют гидроокиси щелочных металлов.
3. В большинстве случаев титруют продукт реакции.
1) Титрование фурфурола, образующегося при реакциях типа 5, б, связанное с использованием следующих реагентов: бисульфита, брома, меди (II), гидроксиламина, иод—щелочь или серебра (I).
2) Титрование других карбонильных соединений, получаемых в процессе гидролиза ацеталей или СН2ОН-групп формальдегидных смол или образующихся при деполимеризации в реакциях типа 5, г, основанных на применении тех же титрантов, которые используются при определении фурфурола [бисульфит, гидроксиламин, иод—щелочь или ртути (II)].
3) Определение содержания двуокиси углерода, образующейся при декарбоксилировании в процессе протекания реакций типа 5, в, путем адсорбции ее щелочью и последующего титрования избытка реагента.
473
Таблица 52. Примеры использования хлористоводородной кислоты
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
1 2 3 4 5 6 7 8 Сложные эфиры глицерина (см. № 9) и декстрозы или глюкоз-амина — определение бензоильных групп Пентозы (см. № 3, 13, 15, 28, 32, 39, 53); пентозаны (см. № 3, 13, 15, 19—21, 24, 26, 28, 31, 53, 68, 73) Пентозы (см. № 2); пентозаны (см. № 2) Ацеталь (см. № 55) в присутствии паральдегида Паральдегид Озазоны Тетраэтилсвинец (см. № 43, 61, 91, 116, 129) в бензине Ксантогенаты (см. № 35) НС1—н асыщеп н ый раствор бензойной кислоты (на холоду); выдерживают в течение 1—2 дней Нагревают с 10%-ной НС1 (образуется фурфурол) Нагревают с концентрированной НС1, образующийся фурфурол отгоняют Очень разбавленная НС1 (около 0,001 н.) (образуется ацетальдегид) Более концентрированная, чем указано выше — см. № 4 НС1; 1 ч при 100° С (образуется фенилгидразин) Нагревают с концентрированной НС1 в колбе, снабженной обратным холодильником (образуется РЬС12) Нейтральный раствор; избыток НС1; 10 мин при комнатной температуре Бензойную кислоту отфильтровывают и титруют NaOH в присутствии фенолфталеина Дистиллят нейтрализуют, концентрируют и альдегид определяют, действуя избытком Ag 1 (см. «Соединения серебра», литература 9) Фурфурол в дистилляте определяют, действуя бисульфитом, избыток которого затем оттитровывают иодом (см. «Бисульфит и сульфит», литература 7) Альдегид отгоняют, затем определяют по бисульфитному или сульфитному методу (см. «Бисульфит и сульфит», литература 11) Как указано выше, см. № 4 Нейтрализуют NaOH, прибавляют NaHC'O3 и определяют иодометрически (см. «Реагенты, содержащие иод», литература 69) Смесь выпаривают досуха, органические вещества окисляют HNO3; РЬП, оттитровывают молибдатом аммония с помощью внешнего индикатора таннина Избыток кислоты оттитровывают щелочью в присутствии метилового красного 1 2 3 4 4 5 6 7
’474
Продолжение
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
9 Производные ацетона полиоксисоединений, как глицерин (см. № 1) или глицериды НО; от 15 мин до 1 ч Ацетон определяют иодометрически (см. «Реагенты, содержащие иод», литература 83) 8
10 Сахарин НС1; нагревают 2 ч в колбе, снабженной обратным холодильником Избыток NaOH; аммиак отгоняют в кислоту, избыток которой оттитровывают щелочью 9
11 Глюкуронат свинца, образующийся при определении в моче глюкуроновой кислоты путем осаждения свинцом (II) Нагревают с концентрированной НС1 (образуется фурфурол) К дистилляту добавляют бисульфит, избыток которого оттитровывают иодом (см. «Бисульфит и сульфит», литература 27) Создают щелочную среду; NH3 отгоняют и оттитровывают обычным способом 10
12 Семикарбазид (см. № 38); семикарбазоны (см. № 38, 133) НО 15%-ная и HgCl2; нагревают 7—8 ч в колбе, снабженной обратным холодильником (образуется аммиак; Hg11 окисляет гидразин до азота) 11
13 Пентозы (см. № 2); пентозаны (см. № 2); метил-пентозы и мети л пентозаны Перегоняют с концентрированной НС1; NaCl (образуется фурфурол или метил фурфурол) Альдегиды в дистилляте определяют броматным методом (см. «Реагенты, содержащие бром», литература 66) 12
14 Окись этилена (см. № 23, 36, 41, 75, 79, 81, 113, 135, 142) Пропускают через смесь НС1—25%-ный раствор NaCl Избыток кислоты оттитровывают NaOH в присутствии метилового оранжевого 13, 40
15 Пентозы (см. № 2); пентозаны (см. № 2) Нагревают с 12% -ной НС1 и перегоняют Фурфурол окисляют бромом, избыток которого определяют иодометрически 14
16 Уроновые кислоты (см. № 27,30,54,63,80, 114, 123) Нагревают с 12% -ной НС1 (образуется СО2) СО2 пропускают в избыток Ва (ОН)2, который оттитровывают НС1 в присутствии фенолфталеина или тимолфталеина Этанол; избыток кислоты оттитровывают в присутствии фенолфталеина 15
17 а-Эпоксиды (см. № 69, 71, 74 , 78, 90, 95, 104, 105, 112, 122), например 9,10-эпоксистеариновая кислота НС1—200%-ный избыток безводного эфира; 2 ч при комнатной температуре 16
475
Продолжение
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
18 Органические сульфаты (см. № 34) НС1; нагревают 2 ч в колбе, снабженной обратным холодильником Титруют NaOH по метиловому оранжевому 17
19 Пентозаны (см. № 2) Нагревают с концентрированной НС1 (не выше 11%-ной) Фурфурол в дистилляте титруют броматом, после прибавления смеси бромид — кислота, п отен ци ометр и чески 18
20 Пентозаны (см. № 2) НС1, 2,5%-ная; нагревают 4 ч в колбе, снабженной обратным ХОЛОДИЛЬНИКОМ (образуются редуцирующие сахара) Действуют медью (II), окисляют осадок Си2О железом (III) и оттитровывают образующееся Fe11 перманганатом 19
21 Пентозаны (см. № 2) Нагревают с 13%-ной НС1 Дистиллят нейтрализуют и содержание фурфурола определяют по гидроксиламиновому методу (см, «Гидроксиламин», литература 21) 20
22 Пектиновые вещества — определение ангидридов уроновых кислот Нагревают с 12%-ной НС1 (образуется СО2) СО2 пропускают в Ва (ОН)2, избыток которой оттитровывают щавелевой кислотой в присутствии фенолфталеина 21
23 Окись этилена (см. № 14) в воздухе и пищевых продуктах Пропускают в раствор НС1, ненасыщенный MgCl2 Избыток кислоты оттитровывают NaOH в присутствии метилового оранжевого 22
24 Пентозаны (см. № 2) Нагревают с 12% -ной НС1 Фурфурол определяют в дистилляте действием смеси бромат—бромид, избыток которой затем оттитровывают иодометрически (см. «Реагенты, содержащие бром», литература 99) 23
476
Продолжение
№ п/fl Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
25 Ацетильные группы в ацетатах целлюлозы Концентрированная НС1; до прекращения изменения вязкости Вода; оставляют на ночь и титруют по-потенциометрически (наблюдается два скачка титрования' первый скачок соответствует НС1, второй — выделившейся уксусной кислоте) 24
26 Пентозаны (см. № 2) в твердой древесине ^Нагреваютс 12%-ной НС1 Фурфурол в дистилляте определяют бромат-бромидным методом (см. «Реагенты, содержащие бром», литература 107) 25
27 Уроновые кислоты (см. № 16) (Метод, описанный выше1В, — см. № 16) 26
28 Пентозы (см. № 2); пентозаны (см. № 2) (Метод, описанный выше 12, — см. № 13) 27
29 Фенацетин (см. № 92, 121, 145); ацетилсалициловая кислота (аспирин); ацетанилид (см. № 42, 83, 145) Избыток НС1; гидролизуют в течение 1 ч Избыток кислоты оттитровывают NaOH в присутствии фенолфталеина 28
30 Уроновые кислоты (см. № 16) 12%-ная НС1 — насыщенный раствор NaCl; нагревают 2 ч при 133—136° С СО2 пропускают в Ва (ОН)2, избыток которой оттитровывают H2SO4 в присутствии фенолфталеина 29
31 Пентозаны (см. № 2) Нагревают с концентрированной НС1 Фурфурол в дистилляте определяют бромат-бромидным методом (см. «Реагенты, содержащие бром», литература 121) 30
32 Пентозы (см. № 2) Нагревают с 12%-ной НС1 Фурфурол в дистилляте определяют с помощью меди (II), образующийся Си2О окисляют железом (III) и Fe11 оттитровывают перманганатом [см. «Соединения меди (II)», литература 851 31
477
Продолжение
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
33 Уротропин Разбавленная НС1; нагревают 15 мин в колбе, снабженной обратным холодильником (образуется формальдегид) Hgn; образовавшуюся Hg1 определяют иодометрически [см. «Соединения ртути (II)», литература 57] 32
34 Органические сульфаты (см. № 18) в промышленных спиртах, обработанных серной кислотой НС1; нагревают 2 ч в колбе, снабженной обратным холодильником Эфир для растворения свободного спирта; общее содержание кислоты затем определяется титрованием NaOH в присутствии метилового оранжевого 33
35 Ксантогенат (см. № 8) целлюлозы Разбавленная НС1 (образуется CS2) CS2 просасывается через спиртовый раствор КОН, образующийся ксантогенат оттитровывают иодометрически 34
36 Окись этилена (см. № 14) в промышленных фумигантах НС1 — раствор MgCl,l Избыток кислоты оттитровывают NaOH в присутствии метилового оранжевого 35
37 Слабые ароматические основания В эфире; НС1 — эфир Выпаривают досуха; соль растворяют в воде и титруют NaOH в присутствии фенолфталеина 36
38 Семикарбазоны (см. № 12); семикарбазиды (см. № 12) Нагревают с НС1 в запаянной трубке, образуется NH3, СО.2 и гидразин Ацетат натрия; гидразин определяют иодометрически 37
39 Пентозы (см. № 2) Нагревают с концентрированной НС1 Образующийся фурфурол отгоняют, добавляют избыток брома, который оттитровывают иодометрически (см. «Реагенты, содержащие бром», литература 139 и 164) 38, 43
40 Мальтобиониевая кислота, образующаяся в процессе определения мальтозы при реакции ее с иодом в щелочном растворе Нагревают с НС1 (образуется глюкоза) Глюкозу определяют действием избытка Кз [Fe (CN)e] и последующего его титрования иодометрически [см. «Гексацианоферрат (III) калия», литература 39] 39
478
Продолжение
N? п/п Титруемое вещество Реагент и условии реакции Соответствующая обработка и конечная стадия титрования Литература
41 Окись этилена (см. № 14) НС1—СаС12; встряхивают 3 мин в закрытом сосуде Разбавляют избыток кислоты и оттитровывают NaOH в присутствии фенолфталеина 41
42 Ацетанилид (см. № 29) Кипятят с НО Анилин определяют бромат-бромидным методом в присутствии НС1 (см. «Реагенты, содержащие бром», литература 150) 42
43 Тетраэтилсвинец (см. № 7) в бензине Нагревают с концентрированной НС1 в колбе, снабженной обратным холодильником Выпаривают досуха, органические вещества окисляют HNO3, Pb11 оттитровывают молибдатом аммония, применяя внешний индикатор— таннин 44
44 Йодоформ (см. № 56), образующийся при определении ацетона в процессе взаимодействия его с иодом в щелочном растворе Нагревают с концентрированной НС1 (образуется иод) Выделившийся иод оттитровывают тиосульфатом 45
45 Олефины С4, например изобутилен НС1; ВаС12 Избыток кислоты оттитровывают щелочью 46
46 Ди нитрозопентаметилентетрамин в циклометилентри нитроамине Кипятят с разбавленной НС1 (образуется НСНО и NH3) НСНО окисляют Н2О2, a NH3 отгоняют в избыток кислоты, который затем оттитровывают щелочью 47
47 Глюкоза, целлюлоза и другие вещества, образующие глюкозу при обработке их кислотой Кипятят с 9%-ной НС1, добавив FeCl3 (катализатор) (образуется СО2) Выделяющуюся СО2 поглощают Ва (ОН)2, избыток которого затем оттитровывают кислотой 48
48 Формальдегидные смолы — определение СН2ОН-групп Нагревают с НС1 (также с H2SO4 или Н3РО4) Перегоняют в NaHSO3; образующееся бисульфитное соединение определяют йодометрически (см. «Бисульфит и сульфит», литература 57) 49
479
Продолжение
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
49 Осадок, получающийся при реакции морфина с 2, 4-динитрохлорбен-золом Избыток НС1; NaCl образуется осадок эфира морфина гидрохлорида Осадок отфильтровывают; НС1 в фильтрате оттитровывают КОН в присутствии метилового красного 50
50 Ароматические соединения — определение метоксильных и этоксильных групп Пиридин гидрохлорид; 3—4 ч при 220° С (более длительное нагревание при определении этоксильных групп) Избыток НС1 оттитровывают NaOH в присутствии фенолфталеина или потенциометрически 51
51 Сульфаниламиды Нагревают с НО в колбе, снабженной обратным холодильником Ароматические аминосульфокислоты определяют действием избытка брома (см. «Реагенты, содержащие бром», литература 224) 52
52 Формальдегид в волокнах НС1; 15 мин при 55—60° С, затем 1 ч при 110° С в толстостенной склянке для реакций под давлением НСНО определяют гидроксиламиновым методом (см. «Гидроксиламин», литература 58) 53
53 Пентозы (см. № 2); пентозаны (см. № 2) Нагревают с 12% -ной, 18,5%-ной или 24%-ной НС1 (исследованы различные реагенты) Образующийся фурфурол определяют, действуя избытком брома 54
54 Ментолглюкуроновая кислота (см. № 16) НС1; 50 мин при 100° С (образуется глюкуроновая кислота) Образующуюся кислоту определяют, действуя Кз [Fe (CN)el, избыток которого оттитровывают иодометрически 55
55 Ацеталь (см. № 4); метилаль НС1; нагревают 1 ч в колбе, снабженной обратным холодильником Альдегиды определяют йодометрически (см. «Реагенты, содержащие иод», литература 225) 56
56 Йодоформ (см. № 44); тетра иодпиррол НС1—HNO3 (2 : 1); кипятят 3 мин (образуются Г-ионы) Agl осаждают AgNO3—NH^OH; осадок растворяют в избытке KCN и титруют AgNO3 до появления опалесценции 57
480
Продолжение
№ п/п Титруемое вещество Реагент н условия реакции Соответствующая обработка и конечная стадия титрования Литература
57 а, n-Диметилстирол в присутствии «-метилстирола, стирола и п-цимола В бензоле; пропускают газообразный НС1 в течение 30 мин (образуется третичный хлорид) Избыток НС1 удаляют продуванием воздухом; галогенид гидролизуют прибавлением 80% -ного этанола; НС1 титруют КОН — эта-иол в присутствии метилового красного 58
58 Алкалоиды типа атропина НС1; нагревают и частично выпаривают (образуется тропо-вая кислота) Кислоту экстрагируют смесью СНС13— изопропанол (3 : 1), экстракт выпаривают и остаток титруют NaOH в присутствии фенолфталеина 59
59 Ксилоза Нагревают с 12% -ной НС1 в колбе, снабженной обратным холодильником Фурфурол перегоняют и определяют иодометрически (см. «Реагенты, содержащие иод», литература 231) 60
60 Сульфопиридин НС1; нагревают 30 мин в колбе, снабженной обратным холодильником (образуются сульфаниловая кислота и а-аминоп иридии гидрохлорид) Выпаривают досуха и титруют в присутствии фенолфталеина 61
61 Тетраэтилсвинец (см. № 7) в бензине Перемешивают с холодной НС1 Выпаривают досуха; органические вещества окисляют HNO3 или НС1О4; РЬ11 осаждают избытком Сг2О|— и в фильтрате оттитровывают избыток реагента 62
62 Сульфонамиды первичных и вторичных аминов после отделения по Гинзбергу (реакция с ароматическими суль-фонилхлоридами) (см. № 76, 126) НС1; кипятят 75— 100 ч (образуются органические амины) Создают щелочную среду, амины экстрагируют бензолом, бензольный слой экстрагируют избытком НС1 и избыток кислоты титруют потенциометрически 63
481
Продолжение
№ п/п Титруемое вещество Реагент н условия реакции Соответствующая обработка н конечная стадия титрования Литература
63 Уроновые кислоты (см. № 16) 19%-ная НС1; 1,5— 2 ч при 145° С Образующуюся СО2 пропускают в избыток NaOH, прибавляют ВаС12 и оттитровывают НС1 в присутствии фенолфталеина 64
64 Колхицин НС1; 50 мин при 100° С Избыток щелочи; иод, избыток которого оттитровывают тиосульфатом (см. «Реагенты, содержащие иод», литература 247) 65
65 Сахароза (см. № 72, 127) в шоколаде НС1; нагревают 30 мин в колбе, снабженной обратным холодильником (образуются глюкоза и фруктоза) Моносахариды, определяют иодометрически (см. «Реагенты, содержащие иод», литература 248) 66
66 Пентозаны (см. № 2) в растительной пульпе Перегоняют с 13,2%-ной НС1 Образующийся фурфурол обрабатывают бромом, избыток которого оттитровывают иодометрически (см. «Реагенты, содержащие бром», литература 253) 67
67 Сульфосолуцин (двунатриевая соль 1-фенил-3-сульфамоиланилин--1,3-пропандисульфокислоты) НС1; в атмосфере СО2; кипятят 45 мин Амины титруют NaNO2, применяя индикатор: крахмал — Г (см. Том 1, «Нитрит натрия», литература 46) 68
68 Пентозаны (см. № 2) НС1, 13%-ная, NaCl; нагревают 140 мин Образующийся фурфурол определяют иодометрически (см. «Реагенты, содержащие бром», литература 265) 69
69 Эпоксиды (см. № 17) НС1—эфир; 3 ч при комнатной температуре Этанол; избыток кислоты титруют NaOH в присутствии фенолфталеина 70
70 Крахмал (см. № 132), отделенный в виде иодного комплекса Разбавленная НС1; 2,5 ч при 100° С (образуется глюкоза) Глюкозу определяют с помощью меди (II), избыток которой затем оттитровывают иодометрически [см. «Соединения меди (II)», литература 143] 71
482
Продолжение
л° п/п Т итруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
71 Эпоксиды (см. № 17) НС1—диоксан (не полностью обезвоженный); 10 мин при комнатной темпера- Этанол; избыток НС1 оттитровывают NaOH в присутствии фенолфталеина 72
72 Сахароза (субмикрометод) (см. № 65) туре НС1; 10 мин при 69 С (образуются глюкоза и фруктоза) Моносахариды определяют, добавляя К3 [Fe (CN)e], избыток которого Угтитровывают затем иодометрически [см. «Гексацианоферрат (III) калия», литература 87] 78
73 Пентозаны (см. № 12) НС1, 12%-пая; Фурфурол опреде-
в целлюлозе нагревают около 75 мин ляют бромометрически (см. «Реагенты, содержащие бром», литература 299) НС1 титруют NaOH в присутствии фенолфталеина 74
74 а-Эпоксиды (см. № 17) в полиэпоксидах и смолах Пиридин гидрохлорид—пиридин; нагревают 20 мин в колбе, снабженной обратным холодильником 75
75 Окись этилена (см. № 14) Пропускают в НС1— насыщенный MgCl2 Избыток кислоты оттитровывают NaOH 76
76 Сульфонамиды (см. № 62) Нагревают до 100— 120° С с НС1 в запаянной трубке (образуются сульфаниловая кислота и гидрохлорид амина) Продукты реакции отделяют на амберлите ИР-100, сульфаниловую кислоту элюируют и титруют КОН потенциометрически 77
77 Гидроксамовые кислоты с длинной цепью, а также в присутствии гидроксамовых кислот с числом углеродных атомов менее 10 Этанол; избыток НС1; нагревают 2—4 ч в колбе, снабженной обратным холодильником Избыток кислоты оттитровывают NaOH до рН4 и титруют до рН8; разность между этими титрованиями эквивалентна содержанию NH2OH-HC1 78
78 а-Эпоксиды (см. № 17), образующиеся в процессе изучения самоокисления НС1—диоксан; 10—15 мин при комнатной температуре Этанол; избыток кислоты оттитровывают щелочью 79
79 Окись этилена (см. № 14) НС1—СаС12 или MgCl2 HCI оттитровывают NaOH в присутствии метилового красного 80
483
Продолжение
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
80 Уроновые кислоты (см. № 16) 3,3 н. НС1; нагревают 5 ч при 110° С в запаянной трубке СО2 пропускают в Ва (ОН)2, избыток которой оттитровывают НС1 в присутствии фенолфталеина 81
81 Окись этилена (см. № 14) в тетрахлорэтане Сухой НС1—безводный эфир; 3 ч при комнатной температуре Вода—бензол или толуол; титруют NaOH в присутствии фенолфталеина 82
82 Алкилсульфаты НС1 (образуются кислоты) Экстрагируют эфиром и титруют NaOH в присутствии метилового красного (вводят поправку на содержание НС1, определяемую титрованием AgNOg) 83
83 Ацетанилид (см. № 29) НС1, 4 н. раствор, нагревают 30 мин в колбе, снабженной обратным холодильником IC1—НС1; образуется трииодид анилина; избыток реагента определяют путем прибавления I” и последующего титрования тиосульфатом (см. «Хлориды, бромид и тиоцианат иода», литература 73) 84
84 Изопроп илфенилкарба-мат Кислота, например концентрированная НС1 (образуется анилин) Титруют нитритом в присутствии внешнего индикатора: крахмал — Г (см. Том 1, «Нитрит натрия», литература 73) 85
85 Изониазид в присутствии п-аминосалицилата кальция НС1; нагревают 10— 12 мин в колбе, снабженной обратным холодильником (образуется гидразин) СНС13 или СС^; титруют йодатом до исчезновения окраски иода в органическом слое 86
86 Диэтил мер каптал и сахара — определение тиоэтоксигрупп НС1; нагревают 2 ч в токе СО2 (образуется этилмер-каптан) Пропускают в смесь иод—I"—этанол и обратно оттитровывают тиосульфатом 87
87 Третичные спирты (см. № 107) Концентрированная НС1; встряхивают 5 мин (образуются третичные хлориды) Переводят в тиоуро-ниевые пикраты и титруют НС1О4 (см. Том 1, «Хлорная кислота», литература 62) 88
484
Продолжение
№ п/п Титруемое вещество Реагент и условия реакции / Соответствующая обработка н конечная стадия титрования Литература
88 Диметилмеркаптид ртути, образующийся при реакции Hg" с метил-мер каптаном НС1; 30 мин при комнатной температуре Пропускают в раствор иод, избыток которого оттитровывают тиосульфатом (см. «Реагенты, содержащие иод», литература 313) 89
89 Декстрины НС1 (или H2SO4) 4 н.; нагревают 50 мин — 3 ч в колбе, снабженной обратным холодильником. (Изучены условия гидролиза) Глюкозу определяют с помощью меди (П) 90
90 Эпоксиды (см. № 17) в жирах Сухой НС1—эфир; 3 ч при комнатной температуре Этанол, 96%-ный; избыток кислоты оттитровывают NaOH 'в присутствии фенолфталеина 91
91 Тетраэтилсвинец (см. № 7) в бензине Концентрированная НС1; нагревают 30 мин в колбе, снабженной обратным холодильником; затем добавляют воду и снова нагревают 5 мин К полученному водному слою прибавляют MgCJ2 и NH4OH; Pbs+ и Mg2+ оттитровывают ЭДТА в присутствии эриохром черного Т 92
92 Фенацетин (см. № 29) Разбавленная НС1; нагревают 90 мин в колбе, снабженной обратным холодильником Создают щелочную среду, амины экстрагируют СНС13 и титруют диоксановым раствором НС1О4 потенциометрически (см. Том I, «Хлорная кислота», литература 97) 93
93 Альгиновая кислота НС1, 19%-пая; нагревают 10 ч при 100е С в запаянной трубке СО2 пропускают в Ва (ОН)2, избыток которой оттитровывают кислотой потенциометрически 94
94 Нафтенаты кальция, свинца, цинка и кобальта НС1 (образуются осадки соответствующих органических кислот) Осадок отфильтровывают; катионы титруют ЭДТА в присутствии эриохром черного Т или мурексида 95
95 Эпоксиды (см. № 17) в перегретых жирах Триметиламин гидрохлор ид—уксусная кислота; 36 ч при комнатной температуре Избыток НС1 определяют аргентометрически 96
485
Продолжение
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
96 Ненасыщенные амины НС1—этанол (образуются соли) Определяют иодное число методом присоединения галогена (аминная группа замещается галогеном, но атомы водорода замещенных аммониевых катионов не замещаются) 97
97 Полисахариды в древесных тканях HCJ; нагревают 3 ч в колбе, снабженной обратным холодильником Редуцирующие сахара определяют с помощью меди (II); Си.2О восстанавливают Fe111; образовавшийся Fe11 оттитровывают перманганатом 98
98 Нитрилы; амиды НС1, 50%; нагревают 1 ч в колбе, снабженной обратным холодильником Создают щелочную среду и i\Hs перегоняют в кислоту, избыток которой оттитровывают NaOH в присутствии метилового красного 99
99 Диалкилфосфиты, три-алкилфосфиты В этаноле; избыток НС1; 10 мин при комнатной температуре (тр и алкил пр ои зво д-ное гидролизуется до сложного диэфира) Избыток NaOH (гидролиз диалкилпро-изводного до сложного моноэфира), который затем оттитровывают НС1 в присутствии фенолфталеина (сумма обоих эфиров эквивалентна количеству использованной щелочи) 100
100 Этил-п-аминобензоат Концентрированная НС1; при 0° С (образуется амино-бензойная кислота) Титруют нитритом при 0° С, применяя внешний индикатор: крахмал—I" (см. Том I, «Нитрит натрия», литература 90) 101
101 Меркаптобензтиазол-цинк Концентрированная НС1 (образуется свободный меркаптан) Титруют AgNO3 кондуктометрически или иодом визуально [см. том I, «Соединения серебра (I)»; литература 101] 102
102 Поликапролактам (осажденный из раствора фенола 96%-ным этанолом)— определение концевых NHs-rpynn Избыток НС1—К.С1; 10—20 мин при комнатной температуре Фильтруют и избыток кислоты оттитровывают NaOH 103
486
Продолжение
Хе п/п Титруемое вещество Реагент н условия реакции Соответствующая обработка и конечная стадия титрования Литература
103 Полиуретановые смолы и покрытия — определение непрорearир опавших —NCO-rpynn В циклогексаноне; избыток НС1 и немного хингидрона Избыток кислоты оттитровывают потенциометр и чески 104
104 Эпоксиды (см. № 17) НС1—диметилформ-амид; 30 мин при 98° С (холостой опыт) Вода—ацетон; HNO3; титруют AgNO3 потенциометрически 105
105 Эпоксиды (см. № 17), например эпихлоргидрин (см. № 147) или фенилглицид НС1—СС14—изопропиловый эфир; 6 ч при комнатной температуре Избыток кислоты оттитровывают уксуснокислым раствором ацетата натрия в присутствии метилового фиолетового 106
106 Некоторые органические соединения ртути, например ртутьфенил-ацетат, этилмеркурий-салицилат натрия, салицилат ртути Нагревают с НС1 или НС1—HNO3 Hg11 оттитровывают ЭДТА 107
107 Вторичные, третичные спирты (для идентификации) (см. № 87) Концентрированная НС1—ZnCl2 (образуются хлориды) Растворяют в этаноле; тиомочевина— I", образуется иодидалкилтиомо-чевины, добавляют 3,5-динитробензоат, получается осадок динитробензоата алкилтиомочевины, к которому добавляют -r-Ш /Г Т1 , избыток которого оттитровывают [см. «Тиомочевина», литература 2; «Карбоновые кислоты и карбоксилаты», литература 29; «Соединения титана (III)», литература 51] 108
108 Оксэтаны НС1—безводный пиридин; нагревают 3 ч в колбе, снабженной обратным холодильником, или 30 мин при 170° С в запаянной трубке Избыток кислоты оттитровывают водным раствором гце-лочи в присутствии фенолфталеина 109
109 Метоксиэти лмер кур и-хлорид Нагревают со смесью НС1—HNO3 в колбе, снабженной обратным холодильником Ж. NH4OH; избыток K.CN; Г (индикатор); титруют AgNOg до появления опалесценции ПО
487
Продолжение
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
по Тетраэтилсвинец (см. № 7) в бензине Концентрированная НС1; нагревают 30 мин в колбе, снабженной обратным холодильником РЬП осаждают в виде сульфата, растворяют в тартрате и после прибавления Mg11 оттитровывают ЭДТА (см. № 91) 111
111 Арилоксисиланы, характеризующиеся наличием третичных бутокси групп НС1; нагревают 30 мин в колбе, снабженной обратным холодильником Фенол определяют, добавляя смесь бро-мат-бромида, избыток которой затем оттитровывают (см. «Реагенты, содержащие бром», литература 438) 112
112 а-Эпоксиды (см. № 17) НС1—диоксан; 15 мин при комнатной температуре Разбавленная HNO3; избыток НС1 оттитровывают аргентометрически ИЗ
ИЗ Окись этилена (см. № 14) (Методы, описанные выше 13, 22, — см. № 14 и 23) 114
114 Уроновые кислоты (см. № 16) НС1, 19%-ная; затем кипятят 2,5 ч СО2 адсорбируют щелочью, избыток которой оттитровывают кислотой 115
115 мрат-Бутанол Концентрированная НС1; 2,5 мин при 50° С Охлаждают; СС14; встряхивают и титруют NaOH в присутствии метилового оранжевого 116
116 4-Г идрокси-3-ацетамидо-фен иларсинат НС1; нагревают 30 мин в колбе, снабженной обратным холодильником Амин титруют NaNO3 потенциометрически (см. Том I, «Нитрит натрия», литература 108) 117
117 1-Пропил-М-(3-хлорфе-нил)-карбамат Кипятят с НС1 (образуется п-хлор-анилин) КВг; титруют нитритом (см. Том I, «Нитрит натрия», литература 106) 118
118 Циклогексаноноксим Нагревают с НС1 в колбе, снабженной обратным холодильником (образуется гидроксиламин) Циклогексанон отгоняют с паром; гидроксиламин в остатке определяют путем действия избытком Fe111 и последующего обратного титрования перманганатом 119
488
Продолжение
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка н конечная стадия титрования Литература
119 Хлорамфеникол и его пальмитат Амидную связь гидролизуют нагреванием с НС1 Выпаривают досуха, образующийся амингидрохлорид растворяют в уксусной кислоте, прибавляют ацетат ртути и титруют НС1О4 в присутствии кристаллического фиолетового (см. Том I, «Хлорная кислота», литература 221) 120
120 Полиамиды Концентрированная НС1; нагревают (гидролиз завершается образованием карбоновой кислоты и соответствующего амингидрохлорида) Пропускают через ионообменную колонку с вофатитом и в элюате кислоту оттитровывают КОН в присутствии фенолфталеина; или добавляют НСНО и оттитровывают щелочью 121
121 Фенацетин (см. № 29) НС1; нагревают 60—90 мин в колбе, снабженной обратным холодильником Титруют нитритом потенциометрически (см. Том I, «Нитрит натрия», литература 120) 122
122 а-Эпоксиды (см. № 17) в маслах и жирах В изопропаноле или хлоробеизоле; коллидин гидрохлорид—изопропанол; нагревают 1 ч в колбе, снабженной обратным холодильником | Вода; HNO3 до pH от 3 до 5; избыток НС1 оттитровывают в присутствии конго красного и декстрина (розовая -> голубовато-серая) 123
123 Уроновые кислоты (см. № 16) НС1—ZnCl2; нагревают до 160° С в токе азота СО2 пропускают в Ва (ОН)2, избыток которого оттитровывают НС1 по методу высокочастотного титрования 124
124 Мепробамат Концентрированная НС1; нагревают 45 мин в колбе, снабженной обратным холодильником, затем выпаривают почти досуха (образуется хлорид аммония) Уксусная кислота и ацетат ртути; титруют уксуснокислым раствором НС1О4 в присутствии кр истал л ического фиолетового 125 489
Продолжение
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
125 126 127 128 129 130 131 М,1Ч'-Бис-(Ь1-метилхи-нолинилмочевина)-ме-тилсульфат («Акаприн») Некоторые сульфонамиды (см. № 62) Сахароза (см. № 65) п-Оксиацетанилид Тетраэтилсвинец (см. № 7) в бензине 1 -Имино-2-цианоцикло-пентан в нитриле адипиновой кислоты е-Капролактам НС1, 25%-ная; нагревают 6 ч в колбе, снабженной обратным холодильником Этиленгликоль; концентрированная НС1; 30 мин при 120— 130° С НС1, 10%-ная; 30 мин при 100° С В водном растворе; НС1; нагревают 90 мин в колбе, снабженной обратным холодильником Концентрированная НС1; КС1О3 (образуется РЬ11) В среде изопропанол—вода; избыток НС1 Избыток НС1; нагревают 4 ч в колбе, снабженной обратным холодильником (образуется капроновая кислота) Титруют NaNO2 потенциометрически (см. Том I, «Нитрит натрия», литература 127) NaOH; NH3 перегоняют в НС1, избыток которой оттитровывают NaOH в присутствии метилового красного Глюкозу опреде- ляют при помощи меди (II), осадок Сп2О окисляют железом (III), Fe11 оттитровывают перманганатом [см. «Соединения меди (II)», литература 206] Еще НС1; КВг; титруют нитритом потенциометрически (см. Том I, «Нитрит натрия», литература 143) Вода; к водному слою прибавляют буферный раствор NH4OH—NH4C1; ЭДТА; РЬ11 оттитровывают в присутствии эриохром черного Т НС1 оттитровывают NaOH в присутствии бромтимолового синего Титруют NaOH потенциометрически (наблюдается два скачка титрования, интервал между которыми соответствует содержанию капроновой кислоты) 126 127 128 129 130 131 132
490
Продолжение
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
132 Крахмал (см. № 70) в перевязочных материалах Разбавленная НС1; нагревают 90 ч в колбе, снабженной обратным холодильником (образуется глюкоза) Нейтрализуют; глюкозу определяют, действуя Си11 и титруя избыток реагента иодометрически (см. «Соединения меди (II)», литература 211) 133
133 Семикарбазон (см. № 12) 5-нитро-2-фур-фурола («Нитрофур-азон») НО—уксусная кислота—вода (1:1: 1); нагревают до 70— 80° С (образуются фурфурол, СО2, NH4C1 и гидразин гидрохлорид) Гидразин титруют хлорамином Т в присутствии метилового красного и метиленового голубого 134
134 Сахар в силосах и кормах Разбавленная НС1; оставляют на ночь (образуются редуцирующие моносахариды) Моносахариды определяют, действуя Си11, затем оттитровывают избыток ее иодометрически [см. «Соединения меди (II)», литература 212] 135
135 Окись этилена (см. № 14) в газовых смесях НС1; насыщенный раствор MgCl2; смачивающий агент (нонилфенолполи-этиленгликоль); встряхивают несколько минут Избыток кислоты оттитровывают щелочью 136
136 Желатин — определение содержания амида НС1, 2 и.; кипятят 1 ч (образуется хлорид аммония) NaOH до pH 5,2; NH3 перегоняют в борную кислоту и титруют НС1 137
137 Алкоксиды алюминия [Al (OR)31 В абсолютном этаноле; разбавленная HCI; нагревают до кипения (образуется А18+) ЭДТА; пиридин, избыток ЭДТА оттитровывают Си11 в присутствии пирокатехинового фиолетового 138
138 Эпоксидные смолы — определение эпоксидных групп i В бутаноле; НС1— бутанон; 5—30 мин при комнатной температуре Вода и избыток кислоты оттитровывают NaOH в присутствии крезолового красного 139
139 Ангидрид N-карбокси-а минокисл оты НС1 или H2SO4 (разрывается кольцо и происходит выделение СО2) СО2 отгоняют азотом в смесь бензиламин—диоксан— этанол; титруют NaOCH3 в присутствии тимолового синего 140
491
Продолжение
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
140 Алкилмагнийгалогенид В эфире; разбавленная НС1 Эфир выпаривают; доводят pH до 10, прибавляя NH4OH— NH4C1 и титруют Mg11 раствором ЭДТА в присутствии эрио- хром черного Т 141
141 Третичные амилены (2-метил-бутен-1 и 2-ме-тилбутен-2) в смесях с амиленами Концентрированная НС1; 6 ч при комнатной температуре (образуются третичные хлориды) Избыток КОН— спирт; нагревают около 90 мин при 100° С и оттитровывают НС1 в присутствии фенолфталеина 142
142 Окись этилена (см. № 14) в присутствии солей железа (III) и метакриловой кислоты НС1—этанол—вода; 45 мин при комнатной температуре Кислоту оттитровывают ацетатом натрия 143
143 Органические соединения ртути Нагревают с концен-^ трированной НС1 (образуется Hg11) Добавляют ацетат натрия до pH 6; Hgn оттитровывают тиогликолятом кулонометрически 144
144 Гидразоны изоникоти-ноила Концентрированная НС1—уксусная кислота; нагревают 15 мин (образуются карбонильные соединения и гидразид изоникотиновой кислоты) Гидразид титруют нитритом потенциометрически или в присутствии крахмал—иодид 145
145 Ацетанилид (см. № 29); фенацетин (см. № 29) Гидролизуют НС1; 30—40 мин В г”; свободный амин оттитровывают нитритом потенциометрически 146
146 Динатриевая соль алкенилянтарной кислоты В ацетоне; избыток НС1 Избыток кислоты оттитровывают спиртовым раствором щелочи потенциометрически (первый скачок соответствует содержанию непрореагировавшей НС1, второй — органической кислоты) 147
147 Эпихлоргидрин (см. № 105) В диоксаие; НС1; 1 ч при комнатной температуре Избыток НС1 титруют NaOH в присутствии фенолфталеина 148
492
Продолжение
№ п/п Титруемое вещество Реагент и условия реакции Соответствующая обработка и конечная стадия титрования Литература
148 Модифицированные смолы — определение эпоксидных групп НС1—диоксан; 15 мин при комнатной температуре Избыток СГ титруют Hg (NO3)2—метанол в присутствии дифе-нилкарбазона 149
149 Аминоалкильные эфиры, например (СвН8)2СНСООСН2- —CH2N (CeH8)2 (в виде гидрохлоридов) НС1; нагревают от 30 мин р.о2чъ колбе, снабженной обратным холодильником Амнноспнртовые продукты немедленно отгоняют и титруют обычным способом 150
В качестве поглотителя СО2 наиболее часто применяют гидроокись бария и иногда гидроокись натрия, которую обрабатывают ВаС12 перед титрованием избытка щелочи кислотой.
4) Амины, обычно ароматические, образующиеся в процессе гидролитического расщепления амидов и сульфонамидов, определяют методом, основанным на титровании их кислотами (НС1, НС1О4), а также диазотированием нитритом или реакции замещения бромом или IC1. Последние два метода, конечно, применимы лишь к ароматическим аминам.
5) Другие азотсодержащие продукты, получающиеся при гидролизе С—N-, S—N-, С=Ы- или С = М-связей, определяют следующим образом: аммиак обычно отгоняют в избыток стандартного раствора кислоты, который затем оттитровывают щелочью; гидразины определяют титрованием иодом, йодатом или хлорамином Т или путем титрования нитритом, а гидроксиламин титруют, применяя избыток Fe111.
6) Кислые продукты реакции гидролиза эфиров, амидов или сульфонамидов титруют щелочами.
7) Гексозы, образующиеся при определении целлюлозы, пентозанов и т. п., определяют методами, основанными на восстановительных свойствах этих соединений. В качестве окислителей наиболее часто применяют щелочные растворы меди (II), а также гексацианоферраты (III) щелочных металлов.
8) Серосодержащие соединения, такие, как меркаптаны, образующиеся при обработке кислотами их производных, определяют путем титрования иодом или Ag1; сероуглерод, получаемый из ксан-тогенатов в процессе их гидролиза, определяют путем обратной конверсии в ксантогенат при действии КОН — спирт.
9) Катионы металлов, подобные Hg11, РЬП и т. д., выделяющиеся при обработке соответствующих металлоорганических соединений кислотой, определяют стандартными методами, применяемыми при анализе неорганических соединений, например титрованием ЭДТА.
10) Галогенидные эфиры, образующиеся при реакциях типа 2, превращают в тиоурониевые пикраты или в тиоуроний-3,5-динитро-бензоаты, которые определяют соответственно титрованием НС1О4 или восстановлением нитрогрупп титаном (III).
493
ЛИТЕРАТУРА
1. Pu m G., Monatsh., 12, 438 (1891).
2. Cormack W., J. Chem. Soc., 77, 990 (1900).
3. J о I 1 e s A., Ber., 39, 96 (1906); Z. anal. Chem., 45, 196 (1906).
4. О r t о п К. J. P., McKie P. V., J. Chem. Soc., 109, 184 (1916).
5. N an j i D. R., Biochem. J., 17, 761 (1923).
6. F e г r e r i G., Giorn. chim. ind. applicata, 7, 625 (1925).
7. Hirschkind W., Eng. Mining J.-Press, 119, 908 (1925).
8. G r ii n A., L im p ac h er R., Ber., 59, 695 (1926).
9. L e r r i g о A. F., W ill iams A. L., Analyst, 52, 377 (1927).
10. H a en d el M., Rev. asoc. med. Argent., 42, 215 (1929).
11. Hobson R. P., J. Chem. Soc., 1384 (1929).
12. К u 1 1 g r e n С., T у d ё n H., Ing. Vetenskaps. Akad. Handl., No. 94, 3 (1929).
13. D e с к e r t W., Z. anal. Chem., 82, 297 (1930).
14. D e s h p a n d e D. D., J. Indian Inst. Sci., 13A, 110 (1930).
15. D i с к s о n A. D., О t t e r s о n H., Link К. P., J. Am. Chem. Soc., 52,
775 (1930).
16. N i с о 1 e t В. H., Poulter T. C., J. Am. Chem. Soc., 52, 1186 (1930).
17. Grimshaw A. H., Textile World, 79, 1212,1245 (1931).
18. M a 1 h о t г a R. C., J. Indian Chem. Soc., 8, 51 (1931).
19. M a 1 h о t r a R. C., Ind. Eng. Chem., Anal. Ed., 3, 161 (1931).
20. Noll A., Belz W., Papier-Fabr., 29, Tech. Wiss. Teil, 33 (1931).
21. Buston H. W., Analyst, 57, 220 (1932).
22. L u b a 11 i O. F., J. Soc. Chem. Ind. (London), 51, 361T (1932).
23 .,R ozenb erger N. A., Rebinovich R. V., Frenkel K. Ya., Trans. All-Union Sci. Research Inst. Paper Cellulose No. 1, 109 (1932).
24» Ab rib at Ann. chim. anal. chim. appl., 15, 147 (1933).
25. I d d 1 e s H. A., Robbins P. J., Ind. Eng. Chem., Anal. Ed., 5, 55 (1933).
26. .Phillips M., Goss M. J., Browne C. A., J. Assoc. OIL Arg. Chem., 16, 289 (1933).
27. С а д и к о в В. С., Беликова К. С., Тр. центрального н.-и. биохимического ин-та пищевой промышленности, 3, 299 (1933).
28. В а й с м а н Г. А., Фарм. журнал, 3, 109 (1933).
29. В u г k h а г t В., В a u г L., Link К. Р., J. Biol. Chem., 104, 171 (1934).
30. К г i s h n a n T. S., J. Jndian Chem. Soc., 11, 651 (1934).
31. Ошмян Г., Бродильная пром., 11, № 5, 26 (1934).
32. М i п a t о у a S., N a g a i I., J. Soc. Rubber Ind., Japan, 7, 337 (1934).
33. В i f f e n F. M., Snell F. D., Ind. Eng. Chem., Anal. Ed., 7, 234 (1935).
34. Fock W. H„ Kunstseide, 17, 117 (1935).
35. Brown W. B., J. Soc. Chem. Ind. (London), 55, 321T (1936).
36. Федоров Б. IL, Спрысков А. А., Орг. хим. пром., I, 620 (1936).
37. H a r 1 а у V., J. pharm. chim., 23, 199 (1936).
38. Л и tb а к И. M., Советский сахар, 14, № 11, 40 (1936).
39. S t г е р к о v S. М., Biochem. Z., 289, 38 (1936).
40. D е с к е г t W., Z. anal. Chem., 109, 166 (1937).
41. Kerckow F. W., Z. anal. Chem., 108, 249 (1937).
42. X а л e ц к и й A. M., Микрюкова H. С., Фармация и фармакология, № 8, 21 (1937).
43. Л и т в а к И. М., Спирто-водочная пром., 15, № 2, 7 (1938).
44. С а 1 i n g а е г t G., G a m b г i И С. М., Ind. Eng. Chem., Anal. Ed, 11, 324 (1939).
45. D u 1 i a n F., Klin. Wochschr., 18, 1224 (1939).
46. Stern G., Reichsamt. Wirtschaftsausbau Pruf., Nr. 43 (PB 52003) 15 (1940).
47. В e 11 i n i L., Ann. chim. applicata, 31, 125 (1941).
48. N ickerson R. F., Ind. Eng. Chem., Anal. Ed., 13, 423 (1941).
49. N itschm ann H., H a d о r n H., Helv. Chim. Acta, 24, 237 (1941).
50. M a n n i c h C., Arch. Pharm., 280, 386 (1942).
51. P г e у V., Ber., 75, 350, 445 (1942).
52. W e 11 s E. H., J. Assoc. Off. Agr. Chem., 25, 747 (1942).
494
53. W е 1 t z i 1 n W., Zellwolle, Kunstseide, Seide, 47, 197 (1942).
54. Duncan F. J., Ind. Eng. Chem., Anal. Ed., 15, 162 (1943).
55. Sh im os aw a T., J. Pharm. Soc. Japan, 63, 462 (1943).
56. Z e i d 1 e r G., Pogranitzky, N., Lack. u. Farbenztg., 140 (1943).
57. D о u r i s R. G., Ann. pharm. franc., 2, 56 (1944).
58. E 1 1 i о t t J. H., Cook E. V., Ind. Eng. Chem., Anal. Ed., 16, 20 (1944).
59. R e i m e r s F., Dansk. Tids. Farm., 18, 217 (1944).
60. R о g e r s H. R., Ind. Eng. Chem., Anal. Ed., 16, 319 (1944).
61. Хромов-Борисов H. В., Фармация, 8, № 6, 31 (1945).
62. Lykken L., Treseder R.S., Tuemmler F. D., Zahn V., Ind. Eng. Chem., Anal. Ed., 17, 353 (1945).
63. S e a m a n W., Norton A. R., Woods J. T., Bank H. N., J. Am. Chem. Soc., 67, 1571 (1945).
64. McCready R. M., Swenson H.A. Maclay W. D., Ind. Eng. Chem., Anal. Ed., 18, 290 (1946).
65. U f f e 1 i e О. E., Pharm. Weekblad, 81, 426 (1946).
66. V a e с к S. V., Mededeel Vlaam. Chem. Ver., 8, 179 (1946).
67. В r i s s a u d L., Mem. services chim. etat (Paris), 33, 75 (1947).
68. C h a p m a п A. M., Pierce J. S., Pharm. J., 159, 47 (1947).
69. Savard J., Leclercq A., Reygrobeilet J., Agron. trop., 2, 170 (1947).
70. S w e г и D., Findley T. W., Billen G. N., Scanlan J. T., Anal. Chem., 19, 414 (1947).
71. P u c h e r G. W., Leavenworth C. S., Vickery H.B., Anal. Chem., 20, 850 (1948).
72. King G., Nature, 164, 706 (1949).
73. Stern H Kirk P. L., J. Biol. Chem., 177, 37 (1949).
74. T e u n i s s e n P. H., Anal. Chem., 21, 620 (1949).
75. В r a d 1 e у T. F., U. S. Patent № 2, 500, 600, March 14, 1950.
76. E 1 Kh ishen S. A., J. Sci. Food Agr., 1, 71 (1950).
77. J i n d r a A., ё i p о S F., Chem. Listy, 44, 235 (1950).
78. R о e E. T., Swern D., Anal. Chem., 22, 1160 (1950).
79. King G„ J. Chem. Soc., 1980 (1951).
80. M i 1 1 e r S. A., Williams N. E., Analyst, 76, 224 (1951).
81. О g s t о n A. G., S t a n i e r J. E., Biochem. J., 49, 591 (1951).
82. T о m i s e к A. J., Mahler H. R., J. Am., Chem. Soc., 73, 4685 (1951).
83. Etienne H., Ind. chim. beige, 17, 373 (1952).
84. Генгринович А. И., Кадыро" Я. К., Аптечное дело, I, 46 (1952). 85. Баскаков Ю. А., Мельников Н. Н., Ж. аналит. химии, 8, 119 (1953). 86. Biffoli R., Boll. lab. chim. prov. (Bologna), 4, 83 (1953).
87. H i r a s e S., A r a k i C., Bull. Chem. Soc. Japan, 28, 481 (1953).
88. S c h о t t e L., V e i b e 1 S., Acta Chem. Scand., 7, 1357 (1953).
89. Segal W., Starkey R. L., Anal. Chem., 25, 1645 (1953).
90. D i m 1 e r R. J., Davis H. A., Gill G. J., Rist С. E., Anal. Chem., 26, 1142 (1954).
91. Дроздов H. С., Материнская H. П., Мясная пром., 25, № 3, 50 (1954).
92. M i 1 и e г О. I., Shipman G. F., Anal. Chem., 26, 1222 (1954).
93. W о 1 1 i s h E. G., Colarusso R. J., P i f e r C. W., S c h m a 1 1 M., Anal. Chem., 26, 1753 (1954).
94. Jensen A., Sunde I., 2nd Intern. Seaweed Symposium, Trondheim, 125 (1955).
95. Leggier! G., Chimica (Milan), 10, 287 (1955).
96. S e e 1 k о p f C., Fette, Seife, Anstrichsmittel, 57, Ill (1955).
97. Смирнов О. К., Беженцева В. М., Зав. лаб., 21, 414 (1955)
98. Т г е с с a n i С. Р., Т е n t о г i о G., Ann. sper. agrar (Roma), 9, No 6, Suppl., 27 (1955).
99. A n d r a d e L. J., et al., Rev. sanidad у asistencia solial (Venezuela), 21, 231 (1956). 100. В er nh art D. N., Rattenbury К. H., Anal. Chem., 28, 1765 (1956). 101. Kleflin Z., ё umanov ic K., Acta Pharm. Jugoslav., 6, 191 (1956). 102. Lorenz О., E c h t e E., Kautschuk u. Gummi, 9, WT 300 (1956).
495
103. Мягков В. А., П а к ш в е р А. Б., Ж. прикл. химии, 29, 1703 (1956).
104. Навяжская Ф. А., Хим. пром., 432 (1956).
105. Shechter L., Wynstra J., Kurkjy R.P., Ind. Eng. Chem., 48, 94 (1956).
106. H e n n a r t C., Merlin E., Chim. anal., 39, 269 (1957).
107. I r i t a и i N., Tanaka T., J. Pharm. Soc. Japan, 77, 106 (1957).
108. Jurecek M., Chladek O., Chladkova R., Soucek M.,
S г p о v a B., Chem. Listy, 51, 448 (1957).
109. Keen R. T., Anal. Chem., 29, 1041 (1957).
110. Laub i e H., Bull. soc. pharm., Bordeaux, 96, 65 (1957).
111. Russ J. J., Reeder W., Anal. Chem., 29, 1331 (1957).
112. S m i t h B„ Acta Chem. Scand., 11, 558 (1957).
113. St enm ark G. A., Anal. Chem., 29, 1367 (1957).
114. Афанасьева Л. Г., Рабо икая H. С., Э т л и с В. С., Тр. по химии и хим. технологии, 1, 611 (1958).
115. А п d е г s о п D. М. W., Taianta, 1, 283 (1958).
116. Ashworth М. R. F., Ann. Univ. Saraviensis, Nat. Sci., 7 (2), 98 (1958).
117. Blalek J., Pharmazie, 13, 529 (1958).
118. Баскаков Ю. А., Мельников H. H., Органические инсектофунгициды и гербициды, 279 (1958).
119. Goszyriski S., Chem. Anal. (Warsaw), 3, 117 (1958).
120. S a 1 v e s e n B., Medd. Norsk Farm. Selskap, 20, 65 (1958).
121. Schroder E., Plaste u. Kautschuk, 5, 49, 101 (1958).
122. Baldinas J. G., Rothberg I. J., Am. Pharm. Assoc., Sci. Ed., 48, 318 (1959).
123. Krull L., Farben-Chemiker, 61, 23 (1959).
124. Мозхейко Л. H., Я у н з е м с В., Гидролизная лесохимическая пром., 12, № 3, 7 (1959).
125. S а 1 v е s е п В., Sol 1 i О., Medd. Norsk Farm. Selskap, 21, 85 (1959).
126. S p in k ova V., Z У k a J., Ceskoslov. Farm., 8, 551 (1959).
127. S i m i о и о v i c i R., Conu 1., Rev. chim. (Bucharest), 10, 107 (1959).
128. Аблов А. В., Батыр Д. Г., Ж. аналит. химии, 15, 112 (1960).
129. A f t а 1 i о п Н., Keim N., Sterescu М., Rev. chim. (Bucharest), 11,
49 (1960).
130. Blumenthal A., Mitt. Geb. Lebensm. u. Hyg., 51, 159 (1960).
131. Калугин А.А., Переплетчикова E.M., Зильберман E.H. Водзинский Ю. В., Куликов А. Е., Ж. анал. хим., 15, 739 (1960).
132. Markus L., Kayser A., Magyar Kem. Lapya, 15, 86 (I960).
133. S i m k о v a A., Haller A., Pharm. Zentralhalle, 99, 113 (1960).
134. Spacu P., Teodorescu G., Z. anal. Chem., 174, 321 (1960).
135. Wiseman H. G., Mai lack J. C., Jacobson W. C., J. Agr. Food Chem., 8, 78 (1960).
136. Blouri B., Rafi M., Bull. soc. chim. France, 1170 (1961).
137. E a s t о e J. E., Long J. E., W i 1 1 a n A. L. D., Biochem. J., 78, 51 (1961).
138. H e n n a r t C., Chim. anal., 43, 283 (1961).
139. Jung G., Kleeberg W., Kunststoffe, 51, 714 (1961).
140. P at chornik A., Shalitin Y., Anal. Chem., 33, 1887 (1961).
141. H enn art C., Chim. anal., 44, 7 (1962).
142. Карпов О. H., Ж. анал. хим., 17, 1029 (1962).
143. Худякова Т.А., Немцева Л. И., Баландина М. А., Ж- прикл. химии, 35, 824 (1962).
144. Merkle A. A., Di sc her С. A., J. Pharm. Sci., 51, 117 (1962).
145. N i n' о N., Farmatsiya (Sofia), 12, No 2, 27 (1962).
146. Д з о т т с о т и С. X., Азерб. хим. ж., № 1,143 (1962).
147. Малышев А. И., Смирнов О. К., Зав. лаб., 29, 1173 (1963).
148. Никитин В. М., Скачков В. М., Зав. лаб., 29, 1309 (1963).
149. V о г о b j о v V., Chem. PrumysL, 13, 381 (1963).
150. Михайлова Т. А., Хромов-Борисов Н. В., Ж- анал. хим.
19, 648 (1964).