Текст
ХИЩТИЯ НЕОТЛОЖНЫХ
ЗАБОЛЕВАНИЙ
Ш
бГПТ?
А Э О I • •
ИЗДАТЕЛЬСТВО
КАЗАНСКОГО УНИВЕРСИТЕТА
1981
Печатается по постановлению
Редакционно-издательского совета
Казанского государственного института
усовершенствования врачей им. В. И. Ленина
Цель монографии —в кратком виде представить современные
основы патогенеза основных неотложных хирургических заболеваний и на основе их сформулировать принципы выбора метода оперативного и медикаментозного лечения. В книге излагаются также в
сжатой форме основы дооперационной диагностики и подготовки к
операциям. В отличие от монографических работ на подобную тему
в данной книге указываются наиболее оптимальные варианты оперативных вмешательств и ход их выполнения с учетом 20-летнего
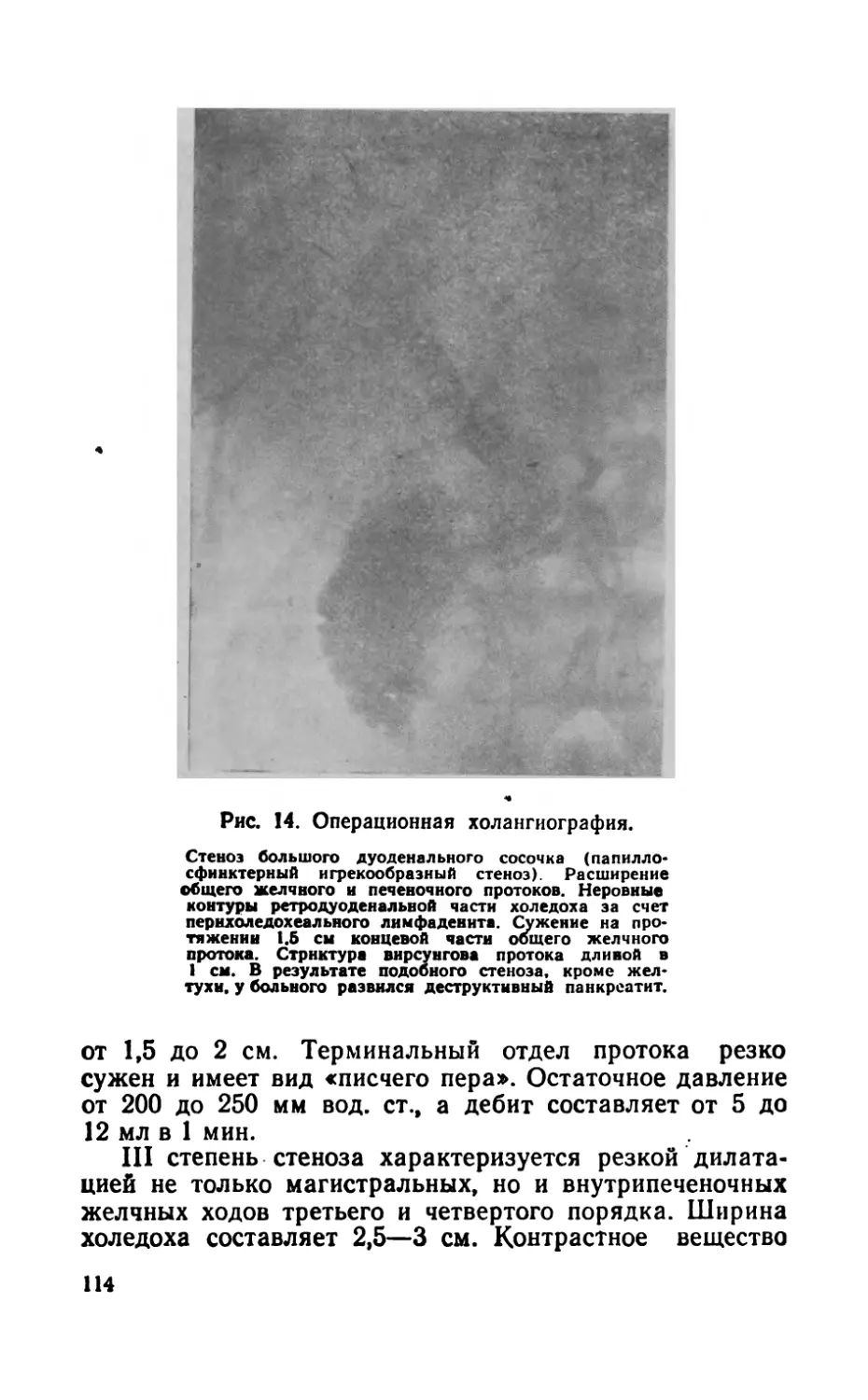
опыта работы автора в этой области, а также оригинальные методики операций, применяемые в клинике (электрохирургические методы операций, на грудном лимфатическом протоке, большом дуоденальном сосочке и т. д ).
Книга рассчитана на широкий круг практических врачей — хирургов, гинекологов и анестезиологов.
К
51100—034
075(02)--81
52—81 4113000000
© Издательство Казанского университета, 1981 г*
Парадоксально, но остается фактом, что 65% всех операций
составляют экстренные хирургические вмешательства. Поэтому хирургия экстренных заболеваний и состояний была и остается не
только наиболее распространенной областью хирургии, но и захватывает значительные контингенты населения. Однако неповторимость этого раздела хирургии определяется не только количественной стороной дела. Непохожая особенность неотложной хирургии состоит в необходимости срочной постановки диагноза, принятия решений в минуты и даже секунды, выполнения операций в
условиях неизвестности в отношении окончательного диагноза и
функционального состояния больного. Поскольку на сегодняшним
день хирургия в целом — это не ремесло или искусство, а наука,
то она должна мериться четкой обоснованностью действий хирурга, предвидением результатов и ответственностью за исход. При
такой постановке вопроса даже в экстренных случаях нельзя допустить произвольного толкования в отборе способа лечения, а при
осуществлении того или иного метода — непоследовательности, пренебрежения или невыполнения основных принципов хирургии в
целом и неотложной, в частности. Кроме того, как и любая наука,
хирургия требует от врача в настоящее время предвидеть не только исход операции, но и добиться возможно полноценного восстановления функции организма на отдаленных сроках после операции.
Цель этой книги — помочь врачу в условиях жесткого дефицита времени быстрее сориентироваться в выборе и способе применения наиболее оптимального варианта диагностики, метода подготовки к операции и проведения самого оперативного вмешательства. Причем мы поставили перед собой задачу информировать
врача не о том, что можно делать или вообще делают при данной
патологии, а как лучше поступить в данной сложившейся ситуации, т. е. помочь избежать врачу неопределенности в решении важнейших вопросов неотложной хирургии. Основанием для такого выбора явилось не только изучение богатого клинического опыта в
этом разделе хирургии, представленного в специальной литературе.
Такие рекомендации явились результатом более чем 20-летнего личного опыта и работы сотрудников руководимой' клиники неотложной хирургии, за что автор и приносит им свою глубокую благодарность. Конечно, автор отчетливо сознает, что любая, даже самая
лучшая схема остается лишь схемой, требующей творчества и индивидуального подхода к больному. Однако творческий и индивидуальный подход к диагностическим и хирургическим проблемам
тогда оказывается плодотворным и целесообразным, когда соблюдаются основополагающие принципы хирургического и консервативного лечения и учитываются современные достижения науки.
ГЛАВА I
ТРАВМАТИЧЕСКИЙ ШОК
Травматический шок—критическое состояние организма, развившееся в ответ на механическое повреждение и характеризующееся функциональной декомпенсацией в ряде важнейших систем жизнеобеспечения
(центральной нервной системе, кровообращении, дыхании, эндокринной системе и обмене веществ).
Нарушение кровообращения и микроциркуляции
Основой гемодинамических нарушений при шоке является острый кризис кровообращения на уровне микроциркуляции (М. Вейль, Г. Шубин, 1971; И. Теодореску
Ексарку, 1972; Г. Н. Цыбуляк, 1975; А. П. Зильбер, 1977;
Е. А. Вагнер, В. М. Тавровский, 1977). В ответ на повреждение в организме происходит массивный выброс
катехоламинов. Под их влиянием наступает спазм как
прекапиллярных, так и посткапиллярных сфинктеров,
что ведет к открытию артериовенозных шунтов и к сбросу «артериализированной крови» в венозную систему
(фаза централизации кровообращения). Ценою ухудшения местной тканевой перфузии создается временная
возможность увеличить наполнение кровью емкостной
системы, повысить венозный возврат и ударный объем
сердца. Это позволяет на короткое время улучшить
кровообращение в «центральных органах» (головной
мозг, сердце). Однако уже в этой фазе сердце работает
в неблагоприятных условиях, осуществляя свою деятельность против сокращенных сосудов.
Далее под действием местной ишемии, развивающейся в результате неадекватной перфузии тканей, и
ацидоза наступает расслабление прекапиллярного сфин-
4
ктера, теряющего в условиях ацидоза чувствительность к воздействию даже высоких
доз адреналина. В этом
периоде нарушения
кровообращения наступают серьезные качественные изменения в
характере самого капиллярного кровотока
(фаза децентрализации). Под влиянием
прогрессирующей местной гистаминемии
повышается капиллярная проницаемость и
жидкая часть крови
выходит из сосудистого русла в ткани, что
ведет к изменению реологических свойств
крови и повышению ее
вязкости. В то же время наступают существенные изменения
механических свойств
эритроцитов, снижение их деформабельности и приобретение значительной жесткости (Д. Е. Банков, 1977) (см.
рис. 1).
Вследствие развития местной биогенной ноксинемии
(увеличения содержания гистамина, серотонина и кина-
нов) и замедления скорости кровотока приводит к развитию феномена Сладжа. При этом эритроциты выходят из аксильного тока крови и начинают складываться
в «монетные» столбики- Этот же процесс касается и
тромбоцитов. В связи с этим наступает депонирование
крови на уровне микроциркуляторного русла, а далее
секвестрация кровообращения, характеризующаяся
уменьшением числа эритроцитов и тромбоцитов, резким
падением объема крови, потерей воды и электролитов
(Wiggers, 1950; Grant, Reeve, 1951; Fischer, 1958, и др.).
Даже в условиях ацидоза и оеротонинемии продолжает
Рис. 1. По данным высокоскоростной
кинематографии. В нормальных условиях эритроциты могут чрезвычайно сильно деформироваться в самых
малых капиллярах (по А. Эрли,
1977).
5
прогрессировать микроагрегация эритроцитов и тромбоцитов. «Монетные столбики» соединяются в микроагрегаты, состоящие из сотен элементов. Из разрушенных
тромбоцитов освобождается тромбопластин, способствующий превращению фибриногена в фибрин и осаждению
его на агрегатах, что приводит к склеиванию форменных
элементов крови и обтурации капилляра. Следствием
этого процесса является полное выключение тканевой
зоны капилляра из перфузии и местный некроз ткани.
Следующим этапом этой фазы является стимуляция
фибринолитических процессов вследствие образования
осаждения на агрегатах фибрина, что создает условия
для развития тромбо-геморрагического синдрома, коа-
гулопатии потребления, а далее и фибринолиза. Конечным этапом нарушения кровообращения является нарушение всех видов метаболизма и деятельности ферментных систем.
Изменения в легких
Развитие острой гиповолемии при шоке сказывается
на многих органах и, в частности, на легких. Она ведет
к снижению легочного кровотока, раскрытию артериовенозных шунтов малого круга кровообращения и к
увеличению в два раза физиологического мертвого пространства. Кроме того, большое значение приобретает
констрикция сосудов легких, имеющих, как и сосуды
печени, почек, кишечника, а-рецепторную иннервацию.
Установлено, что в а-рецепторных сосудистых зонах тонус артериол и венул повышен. Причем тонус венул сохраняется дольше, чем ведет к развитию после ишемии
Стадии отека, сопровождающейся явлениями агрегации,
микротромбоза и тканевого отека (Lillehei, 1974; А. В. Об-
лывач, 1978). Кроме того, аноксия легочных капилляров
уменьшает синтез поверхностно-активного вещества
капилляров — сурфактанта, что создает дополнительные
условия для спадения альвеол, развития ателектазов и
пневмоний.
Указанные факторы являются основой для развития
при шоке синдрома острой дыхательной недостаточности.
Этот синдром получил название «синдрома респираторного дистресса» или «шокового легкого». Считается
даже, что 50% пациентов с обширными травмами поги¬
6
бает от острой дыхательной недостаточности. В клинике
синдрома «шокового легкого» выделяют 4 периода
(А. В. Облывач, 1978). Первый, ранний период, характеризующийся в основном нарушением кровообращения
и умеренными изменениями в дыхании- Второй период —
появление благоприятных клинических признаков. Третей период развивается через 18—24 часа и выражается
в нарастании признаков дыхательной недостаточности и
появлении легочной инфильтрйции. Четвертый период
охватывает несколько часов перед смертью. Он характеризуется гипоксемией, снижением pH, гиперкапнией,
увеличением физиологического мертвого пространства.
Таким образом, гипоксемия является результатом в
основном трех факторов: дефекта диффузии, гиповен-
тиляции, нарушения вентиляционно-перфузионных взаимоотношений (Me Laughlin, 19б9).
Нарушение кислотно-щелочного состояния
Гипоксия тканей вследствие преобладания анаэробного обмена ведет к накоплению в крови большого количества органических кислот (молочной, пировиноград-
ной и др.). Нарушение выделительной функции почек и
метаболизирующей функции печени увеличивает их содержание в крови и тканях, вызывая развитие метаболического ацидоза. Нарушение дыхания и гиперкапния усугубляют его за счет дыхательного ацидоза
(Г. М. Соловьев, Г. Г. Радзивил, 1973)- Установлено,
что метаболический ацидоз сопровождается клеточной
гипокалиемией и гипернатриемией, а также плазменной
гиперкалиемией. Клеточная гипернатриемия еще больше
нарушает внутриклеточный обмен и усиливает ацидоз.
Ацидоз существенно снижает способность гемоглобина
поглощать кислород из альвеолярного пространства и
потому усиливает гипоксию. Основным результатом изменения кислотно-щелочного состояния и развития ацидоза является нарушение сократительной функции миокарда, стойкая вазодилатация, снижение выделительной
функции почек и нарушение высшей нервной деятельности.
7
Изменения функции почек
Важная роль почек в нарушении кровообращения при
шоке зависит от ряда факторов. Во-первых, почечный
кровоток составляет около 25% сердечного выброса.
Поэтому снижение объема циркулирующей крови приводит к резкому нарушению внутрипочечного кровотока,
Во-вторых, почечный эпителий стоит на втором месте по
ранимости под влиянием гипоксии и недостаточного
кровотока. И, в-третьих, капиллярное давление, обеспе-
чивающее фильтрацию в почках, зависит в основном не
от аортального, а в большей степени от соотношения
просвета входной и выходной артериол клубочка
(А. П. Зильбер, 1977). Поэтому при массивном выбросе
норадреналина и наступающем одинаковом сокращении
входных и выходных артериол фильтрация уменьшается.
Причем спазм почечных сосудов дополняется раскрытием
артериовенозных шунтов, что еще более углубляет гипоксию почки.
Все эти факторы ведут к резкому снижению диуреза,
нарушению выделительной функции почек, задержке воды и натрия в тканях, углублению ацидоза. Несомненно,
что в нарушении фильтрационной функции почек играют роль и токсические факторы, образующиеся при
гипоксии, и активация кининовой системы в результате
воздействия гормонов коры надпочечника и гипофиза
(АДГ).
Изменения свертывающей системы крови
Поражения тканей и разрушение эритроцитов освобождают тромбопластиновые факторы, стимулирующие
склеивание тромбоцитов. На агрегатах тромбоцитов далее оседают фибрин и форменные элементы крови, образующие тромб. Этот процесс усиливается под влиянием
высокого содержания катехоламинов (Д. М. Зубаиров,
1966). Кроме того, медиаторы (ацетилхолин, андрена-
лин) и вазоактивные полипептиды (серотонин, бради-
кинин) способны менять величину электрического потенциала сосудистой стенки, эритроцитов и тромбоцитов,
способствуя тромбообразованию. Под влиянием этих
факторов в результате гиперкоагуляции развивается
диссеминированное внутрисосудистое свертывание, яв-
в
ляющееся началом тромбо-геморрагического сйндрома
(М. С.Мачабели, 1970; К-Раби, 1974). Процесс рассеянного внутрисосудистого свертывания носит генерализованный характер и резко ухудшает кровообращение на
уровне микроциркуляторного русла. Процесс внутрисосудистой коагуляции способствует активации фибринолитической системы. Образование новых тромбов на
смену растворенных ведет к истощению фибриногена,
развитию состояния гипокоагуляции и возникновению
ёторой стадии тромбогёморрагического синдрома —
цоагулопатии потребления. В условиях шока даже при
нарушенном тромбообразовании иногда не только сохраняется высокая фибринолитическая активность, но и
возрастает, что свидетельствует о начале третьей стадии
тромбО-геморрагического синдрома — стадии фибриноли-
ва. Причем клинически между второй и третьей стадией
нет различия, они проявляются непрекращающимся кровотечением из любого поврежденного сосуда.
Диагностика шока
Диагностика нарушения кровообращения. Диагностика нарушения кровообращения при шоке включает определение тяжести шока, объема кровопотери и диагностику повреждения.
Согласно четырехстепенной классификации тяжести
шока различают (А. Н. Беркутов, 1973): шок I степени —
легкий шок. Общее состояние больного не внушает опасений. Сознание сохранено, больной правильно отвечает
на вопросы, но неохотно вступает в контакт. Кожа и
видимые слизистые бледные. Температура нормальная
или слегка понижена. Пульс ритмичный, но учащенный
до 100 ударов в 1'. АД—90—100 мм. рт. ст. Объем
циркулирующей крови снижен на 20%, или на 1000 мл.
Тоны сердца глуховатые. Дыхание ровное, но учащенное. Гипорефлексия выражена слабо.
Особенностью легкой степени шока является способность к обратному развитию при проведении самой
простой и недлительной по времени противошоковой
терапии.
Шок II степени—средней тяжести шок. Кожные покровы с сероватым оттенком, холодные наощупь, Боль¬
9
ного мучает жажда. Пульс учащен до 110 ударов в Г, но
ритмичный. АД —80 мм рт. ст. Объем циркулирующей
крови снижен на 30%, или на 1500 мл. Дыхание — учащенное и поверхностное. Клинически определяемая гипорефлексия.
Шок III степени — тяжелой степени шок. Кожные
покровы серовато-синюшного цвета, покрытые холодным
липким потом. Больной безучастен и резко адинамичен.
АД — 70 мм рт. ст. Пульс — 120—130 ударов в Г. Объем циркулирующей крови снижен на 45%, или на 2000
мл.
Шок IV степени — терминальное состояние. Сознание
отсутствует, зрачки широкие, слабо реагируют на свет,
АД ниже 70 мм рт. ст. Пульс слабый, плохо сосчитывается. Дыхание поверхностное, неравномерное, с задержками. В результате гипоксии мозга часто появляются судороги. Электрокардиографически выявляется недостаточность коронарного кровообращения. Объем циркулирующей крови снижен на 50%, или на 2500 мл.
Терминальное состояние, которое характеризуется
крайней степенью угнетения жизненных функций, подразделяется на 3 категории:
а) предагональное состояние — пульс на периферических артериях отсутствует и не определяется артериальное давление; имеется пульсация крупных сосудов
(бедренной, сонной артерий);
б) агональное состояние. К вышеуказанным расстройствам кровообращения присоединяются дыхательные нарушения и появляются аритмичное дыхание типа
Чайн-Стокса и выраженный цианоз;
в) клиническая смерть, начинающаяся с момента
прекращения дыхания и остановки сердца. Обменные
процессы в тканях головного мозга продолжаются еще в
течение 5—7 минут. Выделение периода клинической
смерти целесообразно, поскольку это состояние может
быть обратимым, если нет несовместимых с жизнью
повреждений.
Для диагностики расстройства кровообращения следует использовать артериальное давление, частоту пульса, показатели гематокрита и гемоглобина, удельного
веса крови, объема циркулирующей крови, определение
фибриногена, тромбоцитов, протромбина, фибринолитической активности и свертываемости крови,
10
Важной диагностической процедурой следует считать
определение центрального венозного давления. Под центральным вецозным давлением подразумевают давление
в устье полых вен или правого предсердия. Уровень
центрального венозного давления отражает не только
сократительную способность миокарда, но и приток крови к правому сердцу. Таким образом, по изменению
центрального венозного давления в динамике можно
судить об изменении и объема циркулирующей крови
(Wilson, 1962; Borow, 1965).
Полихлорвиниловый катетер длиной в 30 см проводится путем чрезкожной пункции правой подключич-
*ой вены на глубину в 15 см и закрывается «гепариновым
замком» (5000 ед. гепарина на 5 мл физиологического
раствора). Измерение ЦВД производится с помощью аппарата Вальдмана. В норме ЦВД колеблется в пределах от 50 до 100 мм вод. ст. Показатели центрального
венозного давления от 0 до 50 мм вод. ст. указывают на
гиповолемию и являются определенным показанием к
введению жидкости. Повышение ЦВД до 150 мм вод. ст.
является признаком слабости правого сердца и служит
сигналом к резкому ограничению интравенозной инфузии.
Установлено, что на основании измерения артериального давления и «подсчета» пульса, используя «шоковый
индекс» Аллговера (1967), можно получить приблизительное представление о тяжести шока и кровопотере.
«Шоковый индекс» равен отношению частоты пульса к
величине систолического артериального давления. Используя «Индекс Аллговера», бескровным методом можно получить представление о величине острой кровопо-
тери (таблица 1).
Конечно, эти данные должны рассматриваться как
сугубо ориентировочные, так как на уровень кровяного
давления влияет не только объем и скорость кровопо-
тери, но и индивидуальная чувствительность организма,
возраст больного и ряд других обстоятельств.
В динамике внутренних кровотечений большое значение имеют и методы лабораторных исследований крови.
Так, с помощью определения гемоглобина, числа эритроцитов и удельного веса крови можно установить
факт кровопотери, определить приблизительное количество потерянной крови и ответить на вопрос, прекра-
11
Таблица 1
Определение величины острой кровопотери бескровным
методом (из работы Б. Г. Апанасенко с соавт., 1976)
Кровопотеря в % к объему циркулирующей крови
и в мл
Частота
пульса
Величина
максимального АД
Формула
Аллговера
норма
60—70
120—140
0,5
10% — 500 мл
80
120
0,7
20% —1000 мл
100
100
0,8
30% —1500 мл
100—120
80—100
1.0
50% —2500 мл
120
70
1,2-1,4
тилось кровотечение или нет. Большим достоинством
этого метода является его широкая доступность и простота.
Метод Филипса ван-Слайка основан на сравнении
удельного веса «плавающей капли» крови и стандартного раствора медного купороса. Заранее заготавливается
серия стандартных растворов химически чистого медного
купороса возрастающего удельного веса в пределах от
1030 до 1060. Считается, что удельный вес капли гепаринизированной крови равен удельному весу того стандарта, в растворе которого капля находится в центре
пузырька в течение 4—6 секунд. Используя сугубо ориентировочную таблицу, разработанную Г. А. Барашковым
(1953), можно вычислить объем острой кровопотери
(см. табл. 2).
Таблица 2
Величина кровопотери в зависимости от показателей Нв, Ht,
удельного веса крови (Г. А. Барашков)
Объем кровопотери
в мл
Удельный
вес
крови
Нв по Сали
Гематокрит
в % по
эритроцитам
в ед.
В г%
500
1000
1500
Более 1500
1057—1054
1053—1040
1049—1044
1044 и менее
65-62
61—50
53-38
менее 43
10,9-10,3
10,1-8,3
8,9—6,3
менее 7,2
44—40
38—32
30—23
менее 23
12
Следует учитывать, что вскоре после кровотечения
начинается процесс гемодилюции, который достигает
максимума через 1,5—2 суток и продолжается 3—5
суток.
Следует также помнить, что после массивных трансфузий крови и жидкости показатели * удельного веса
крови уже не столь информативны.
Одновременно проводится диагностика повреждений с использованием рентгеновского исследования.
При подозрении на повреждение органов живота целесообразно произвести диагностический лапароцентез и
применить «шарящий катетер».
Диагностика нарушения дыхания. Она состоит в
определении проходимости дыхательных путей, частоты
и ритма дыхания, состояния грудной стенки и целости
плевральной полости.
1. Вначале следует обратить внимание на звуки, возникающие при дыхании больного. Хрипящее дыхание
указывает на обструкции в гортани или может быть обусловлено наличием слизи в дыхательных путях. Следует
помнить, что при нормальном дыхании и сохранном сознании грудная клетка при вдохе увеличивается несколько
раньше, чем живот. При нарушении проходимости дыхательных путей развивается также парадоксальный
тип дыхания, когда при попытке вдоха вначале выпячивается брюшная стенка, а затем с большим затруднением увеличивается грудная клетка.
2. Особое внимание при травмах грудной клетки
должно быть обращено на характер дыхательных экскурсий с целью выявления парадоксальных экскурсий грудной клетки при множественных двойных переломах ребер.
Такие переломы приводят к западению ребер при вдохе,
резко нарушают вентиляцию легких и внешнее дыхание.
3. Большое значение в нарушении дыхания при травмах грудной клетки имеет накопление в плевральной
полости крови и воздуха в количествах, препятствующих дыханию. Кроме рентгенологического метода исследования целесообразно срочно пунктировать плевральную полость, а в неясных случаях измерить и вну-
триплевральное давление для исключения клапанного
пневмоторакса.
4. Источником дыхательных нарушений является также «шоковое легкое», основной сущностью которого яв¬
18
ляется «опеченение» легкого, скопление жидкости в интерстициальном пространстве, образование внутрисосудистых тромбов и возникновение ателектазов. Рентгенологически выявляется легочная инфильтрация, усиливается дыхательная недостаточность и нарастает ацидоз.
5. Достоверным показателем функции внешнего дыхания является уровень насыщения артериальной крови
кислородом. Наиболее простым методом оценки насыщения артериальной крови кислородом является прямое
определение процентного содержания в ней оксигемогло-
бина (Ю. Н. Цибин, Г. Д. Шушков, 1974), для чего используется метод кюветной оксигемометрии. Снижение
этого показателя ниже нормы свидетельствует о нарушении внешнего дыхания или о шунтировании кровотока в
легких. Окончательно вопрос решается при определении
уровня оксигемоглобина в центральных венах. Если содержание оксигемоглобина в венозной крови невелико,
в то время как артерио-венозная разница по оксигемо-
глобину значительна, более вероятным является расстройство внешнего дыхания.
Менее ценную информацию о функции дыхания при
шоке дает определение кислотно-щелочного равновесия.
Недостаточное выделение СОг за счет расстройств внешнего дыхания и ее накопление приводит к изменению
pH крови и сопровождается развитием ацидоза (pH
ниже 7,35).
Диагностика нарушения функции почек. Расстройство
деятельности почек имеет большое значение для судьбы
больного. Снижение скорости диуреза характерно для
шока, отражает уровень системного артериального давления (Ю. Н. Цибин и Г. Д. Шушков, 1974), и прекращается при показателях артериального давления в 50—
60 мм рт. ст. Подозрение на острую почечную недостаточность при шоке должно вызывать неадекватное
восстановление мочеотделения после стабилизации системного артериального давления. Критической величиной почасового диуреза является величина в 40 мл/час.
Повышение остаточного азота и мочевины, снижение
удельного веса мочи, появление в осадке цилиндров
и альбуминурии подтверждают диагноз развития острой
почечной недостаточности.
Диагностика обменных нарушений. При шоке наблюдаются значительные метаболические нарушения, свя¬
14
занные с изменением обмена углеводов, белков, жиров,
электролитов и др. В крови рано и резко возрастает гипергликемия. Известно, что углеводы являются наиболее
важным и доступным источником энергии в организме.
В результате сдвига обмена при шоке в анаэробную фазу
в крови и тканях возрастает уровень молочной и пиро-
виноградной кислот и молочно-кислый ацидоз. При этом
содержание молочной кислоты возрастает больше, чем
пировиноградной, то есть возникает «избыток лактата»
(Huckabee, 1958). Считается, что этот показатель коррелирует с тяжестью шока и выживаемостью людей при
шоке. Высказывается мнение, что определение одного
уровня лактата достаточно для суждения о тяжести шока (М. Вейль, Г. Шубин, 1971). Метаболический ацидоз
сменяется через 2—3 дня алкалозом, сопровождается
гиперкалиемией и гипонатриемией. Активизируется распад белков, нарастает гипопротеинемия с повышением
остаточного азота и мочевины крови.
Диагностика нарушений свертывания крови (тромбо-
геморрагического синдрома). Высказывается мнение, Что
надежная диагностика тромбо-геморрагического синдрома достигается с помощью тромбоэластографии. Однако
в экстренных условиях для первичной ориентации могут быть применены параметры (А. П. Зильбер, 1977).
Наибольшее значение имеет определение, времени свертываемости крови и фибриногена. Во-первых, если
кровь свертывается за 8—10 минут, то источник кровотечения не в тромбо-геморрагическом синдроме. Во-вторых,
при свертывании крови менее 3 минут следует заподозрить I стадию этого синдрома. В-третьих, если кровь
исследуемого больного в пробирке не свертывается, но
и не растворяет помещенный в нее тромб в течение 30—
60 минут, то нарушения свертываемости дошли до II
стадии тромбо-геморрагического синдрома. И, наконец,
если несвернувшаяся кровь растворяет густой тромб, то
это III стадия тромбо-геморрагического синдрома.
Программа лечения
Показания к операции
С целью выбора оптимальных сроков для оперативных вмешательств при травматическом шоке целесообразно разделить больных на 3 группы (Г. Н. Цыбу-
15
ляк, 1975). В то же время следует придерживаться
правила: по возможности не начинать операцию до того
времени, пока не удастся улучшить показатели гемодинамики, подняв систолическое давление до 90—100 мм
рт. ст., и показатели состояния жизненно важных органов (дыхания, мочеотделения и др.). Это правило имеет
относительное значение для первой группы больных, у
которых операция практически является решающей мерой устранения критического состояния. Сюда относятся
пострадавшие с продолжающимся кровотечением, повреждением жизненно важных органов (сердца, размозжение печени) и расстройством дыхания в результате
нарастающего гемопневмоторакса. Промедление с операцией у подобных больных недопустимо. Поэтому реанимационные мероприятия у этой категории больных
проводятся перед началом оперативного вмешательства,
в операционной и по ходу оперативного вмешательства.
, Ко второй группе относятся пострадавшие, у которых
степень экстренности операции не столь значительна, как
у пациентов первой группы. К ним можно, в частности,
отнести шок при перфорации полого органа в результате травмы, шок при травме поджелудочной железы и
др. Те 30—60 минут, которые хирурги тратят на установление диагноза, используются для проведения реанимационных мероприятий. Они заключаются в энергичной инфузионно-трансфузионной терапии, коррекции
кислотно-щелочного равновесия и восстановлении газообмена.
Третью по срочности группу операций составляют
раненые с повреждением опорно-двигательного аппарата и наложенным жгутом. В условиях временного гемостаза допустимо затратить более длительное время (2—
3 часа) для поднятия артериального давления до индивидуальной нормы или до 90—100 мм рт. ст. К этой же
группе относятся больные с повреждением магистральных сосудов и нуждающиеся в восстановлении кровотока.
Этапы консервативного лечения
1. Производят канюляцию не менее двух вен. Один
из полихлорвиниловых катетеров вводится путем подключичной пункции в верхнюю полую вену, Введение
1«
такого катетера позволяет избежать флебитов, осуществлять динамический контроль за центральным венозным давлением и проводить энергичную инфузионно-
трансфузионную . терапию. Расположение катетера в
верхней полой вене позволяет избежать веноспазма и
ограничения скорости введения растворов.
2. В случаях тяжелого шока необходимо обнажить и
взять на держалку одну из легкодоступных для выде-
ления периферических артерий: заднюю большеберцовую позади медиальной лодыжки или лучевую артерию.
3. При множественных повреждениях конечностей
или при тромбозах вен вследствие многократных трансфузий можно использовать внутрикостный путь введения крови. Для введения крови в губчатое вещество
кости могут быть использованы гребень подвздошной
кости, мыщелки бедра и голени, пяточной кости и грудины. Игла для костной пункции должна быть достаточно толстой, иметь мандрен и ограничительную муфту,
которую может заменить фиксированный к игле кровоостанавливающий зажим. Кожа в области предлагаемой
пункции сначала анестезируется, а затем надсекаемся.
После прокола компактного вещества кости возникает
ощущение «провала», что свидетельствует о попадании
иглы в костный мозг. Полученная при аспирации шприцем кровь свидетельствует о правильном положении иглы. Для снятия боли перед трансфузией через иглу вводят 5—10 мл 0,5% раствора новокаина. Трансфузия в
подобных случаях проводится под повышенным давлением или шприцами.
4. Произвести катетеризацию мочевого пузыря я
оставить в нем катетер для измерения почасового диуреза (при нормальном диурезе выделение 40—50 мл в час).
Следует рассматривать показатель почасового диуреза
как важный параметр системной гемодинамики.
5. Инфузионно-трансфузионная терапия должна, как
правило, начинаться и проводиться внутривенным способом с использованием не менее двух вен, одна из которых должна быть центральной. Внутриартериальным
методом следует пользоваться при наличии тяжелого
шока или при отсутствии эффекта от реанимационных
мероприятий, начатых внутривенным способом.
2 М-843
17
Коррекция гемодинамических нарушений
Основными принципами устранения гемодинамических нарушений является экстренное ■восполнение поте*
рянного объема циркулирующей крови (устранение гипо-
волемии) и улучшение кислородно-транспортной функции крови. Средует особо подчеркнуть, что решающее
значение для судьбы пациента имеет своевременность
восстановления центрального кровообращения и нор-
моволемии. Улучшение микроциркуляции и устранение
анемии стоят на втором плане и не являются столь безотлагательной задачей, как восполнение волемии. При
этом нужно помнить о том, что гемоглобин человека
обладает 3—4-кратным запасом прочности по кислороду.
Отсюда остро возникшая анемия со снижением уровня
гемоглобина на 3—5 г%, а гематокритного числа на 10—
15% не представляет серьезной опасности для организма.
Сейчас даже считается, что нормолемическая гемодилпо-
ция со снижением гемоглобина до 10 г% и гематокрита
до 30% полностью обеспечивают кислородно-транспортную функцию крови (В. А. Климанский, Я. А. Рудаев,
Ю. Л. Степаньков, 1978). Поэтому срочный гемостаз при
продолжающемся кровотечении является важнейшей и
безотлагательной мерой в реанимации шоковых больных. В связи с этим среди хирургов, оказывающих помощь больным с травматическим шоком, большую популярность приобрела формула: «Первостепенно — количество и темп, качество — второстепенно» (Ф. В. Бал-
мозек, 1975). Отсюда следует, что особенно на первом,,
доклиническом этапе с ограниченными возможностями
контроля инфузионно-трансфузионная программа должна
быть предельно простой, стандартизированной, не требующей сложного оборудования и направленной, в первую очередь, на ликвидацию волемических нарушений
или их профилактику.
Выбор и проведение инфузионно-транефузионной
программы. Несмотря на имеющуюся при шоке значительную кровопотерю, переливание цельной донорской
крови не отвечает сформулированным выше задачам.
Причиной этого являются следующие факторы:
1. В консервированной крови происходят изменения
функциональных свойств под влиянием хранения. В ней
18
значительно возрастает концентрация калия, снижается
pH, появляется свободный гемоглобин.
2. Эритроциты даже свежезаготовленной крови не
включаются в достаточной мере в газообмен реципиента,
а через 3 суток хранения они способны лишь наполовину
отдавать тканям поглощенный в легких кислород
(В. А. Климанский и соавт., 1978).
3. Массивное переливание холодной крови может
привести к опасной гипотермии сердца и развитию гак
называемого «холодового кардиоваскулярного шока».
Основой его является снижение температуры правой половины сердца по сравнению с левой, вследствие чего
возникает фибрилляция желудочков и остановка сердца
(Dripps, 1961; Б. В. Петровский, Ч. С. Гусейнов, 1971).
4. Массивные переливания чужеродной крови могут
вызвать синдром «гомологичной крови», заключающийся в секвестрации (выключении) из кровотока более 50%
эритроцитов перелитой крови и развитии гиповолемии,
гипотонии и ацидоза, не поддающегося лечению
(В. И. Бураковский и соавт., 1968). Предполагается иммунобиологическая природа этого конфликта.
5. Переливание крови нередко осложняется сывороточным гепатитом, частота которого после массивных
трансфузий составляет в среднем 5% (Miller, 1973).
Однако все сказанное не означает отказа от примене-
ния крови при травматическом шоке. Целесообразность
включения переливания крови в число противошоковых
мероприятий очевидна. Однако кровь (в идеальном случае — теплая донорская) должна вводиться в ограниченных количествах (не более 40—42% от общего объема трансфузионной терапии) (Ю. Н. Цибин. И. В. Гальцова, Н. К. Разумова, 1977).
Поскольку проведение инфузионно-трансфузионной
программы должно осуществляться срочно, а также
нужно, чтобы растворы можно было вводить в больших
количествах, струйно и без специальных подготовительных мер, то указанным задачам более отвечает введение
коллоидных кровезаменителей или электролитных растворов.
Лучшей инфузионной средой для быстрого возмещения утерянного объема крови являются коллоидные
растворы (полиглюкин, реополиглюкин, желатиноль)
и коллоидные растворы белкового происхождения (аль-
2*
19
бумин, протеин, эритем). Полиглюкин является наилучшим средством, позволяющим быстро и стойко возместить объем циркулирующей крови. Благодаря высокому
молекулярному весу полиглюкина (70000) 50% его
удерживается в крови в течение 12 часов, а полностью
выводится из организма через 3 суток. Под влиянием
полиглюкина наступает умеренная гемодилюция, улучшающая реологические свойства крови за счет снижения ее вязкости. Кроме того, полиглюкин сравнительно безопасно переливать при сопутствующих шоку явлениях гипокоагуляции ввиду незначительного его
влияния на процессы свертывания крови. Использование препаратов желатины (желатиноль) при шоке должно быть ограничено в связи с тем, что этот препарат
оказывает выраженное агрегационное действие на форменные элементы крови и вызывает выброс гистамина
(Gruber, Rittman, 1974).
Декстраны меньшего молекулярного веса типа рео-
полиглюкина (40000) обладают не только плазмозамещающим действием, но и выраженными реологическими свойствами. Обладая дезагрегирующей способностью, они улучшают кровообращение в капиллярном
русле, снижают вязкость крови и улучшают ее другие
реологические свойства. Однако они быстро покидают
сосудистое русло (4—6 часов после введения)* и влияют на свертываемость крови, вызывая гипокоагуляцию,
что не позволяет рекомендовать этот препарат при неостановленном кровотечении.
Синтетические кровезамещающне препараты в виде
поливинолпираллидона и его производных (неокомпен-
сан, гемодез), имея низкий молекулярный вес (10000),
обладают способностью связывать вещества с различной
структурой и молекулярным весом (токсины, билирубин, краски и т. д.). Эти препараты также повышают
диурез за счет усиления почечного кровотока и клубочковой фильтрации. Они очень широко применяются при
различных инфекционных осложнениях, массивном разрушении тканей, ожогах, сепсисе. Сфера применения гемодеза несколько ограничена из-за его способности вызывать гипотензию и потому следует применять этот
препарат после стабилизации артериального давления.
Из коллоидных растворов белкового происхождения
наиболее популярны альбумин и протеин. Лечебный эф¬
20
фект альбумина связан с его высокими коллоидно-осмотическими свойствами, способностью длительно удерживаться в сосудистом русле пациента и улучшать реологические свойства крови. Протеин же по своим коллоидно-осмотическим свойствам уступает альбумину, и
'Переливание его нередко сопровождается пирогенными
реакциями. При тяжелой гиповолемии альбумин вливают в зависимости от концентрации до 1—1,5 л, а протеин даже до 2—2,5 л.
Не следует забывать о высоком гемодинамическом и
диуретическом эффекте электролитных растворов—физиологического раствора, раствора Рингера, раствора
Хартмана, лактасола, гельвисола (Е. А. Вагнер,
В. М. Тавровский, 1977). Они безопасны для пациента,
совместимы с кровью, доступны и могут вводиться любым путем. Ввиду их быстрого распределения во всем
внеклеточном пространстве, электролитные растворы
вводят в дозах, превышающих кровопотерю в 3—4 раза.
Некоторые из них (лактасол) уменьшают метаболический ацидоз и служат энергетическим субстратом. По
своей эффективности в отношении воздействия на гемодинамику при введении в достаточных дозах они не
уступают коллоидным кровезаменителям.
Поэтому срочная инфузионно-трансфузионная программа при шоке (особенно тяжелом) должна начинаться с введения коллоидных растворов, эффективно устраняющих гиповолемию, но в объеме не более 100—150 мл,
чтобы не вызвать нарушения свертывания крови.
Далее следует перейти на введение многокомпонентного солевого кровезаменителя типа рингер-лактата,
позволяющего быстро восстановить нарушенное электролитное равновесие и улучшить реологические свойства крови.
Отсюда инфузионно-трансфузионная программа должна строиться на введении плазмозаменителей и крови
в следующих отношениях (Лундсгаард—Хансен, 1969):
1) при кровопотере в 1—1,5 л только плазмозамени-
тель;
2) при кровопотере в 1,5—3 л плазмозаменители и
кровь в соотношении 1:1;
3) при кровопотере свыше 3 л на 2 объема крови
вводится 1 объем коллоидного плазмозаменители и дополнительно солевой раствор.
21
Кроме ориентировочного правила Лундсгаард-Хан-
сена можно воспользоваться таблицей, определяющей
объем и характер трансфузионной терапии в зависимости от тяжести травматического шока (см. табл. 3).
Таблица 3
Объем и характер трансфузионной терапии у пострадавших
с травматическим шоком (Ю. Н. Цибин, И. В. Гальцева,
Н. К. Разумова, 1977)
Вводимая
жидкость
в мл
Шок
1 степени
Шок
II степени
Шок III
степени
выжившие
умершие
Общий объем
Кровь ....
Кристаллоиды
Коллоиды . .
Доля крови в %
1357+92,6
369+14,2
623 + 20,8
290+9,9
27
2464 + 163,8
894 + 74,3
948 + 83,0
496+72,9
36
4400 + 312,8
1879+128,3
1487 + 163,4
1028+94,2
42
5367+322,3
1687 ±84,0
1922+138,8
1494 ±84,8
31
Таким образом, во всех случаях целесообразно комбинировать введение крови вместе с кровезаменителем,
что позволяет избежать возникновения синдрома «гомологичной крови» и «холодового кардиоваскулярного
шока».
Далее следует соблюдать четыре правила при возмещении кровопотери с помощью гемотрансфузий:
1) переливать по возможности одногруппную кровь;
2) переливать кровь не более 3 суток хранения;
3) избегать массивных вливаний крови, как бы ни
были велики запасы донорской крови;
4) сочетать введение крови с плазмозаменителями,
устраняющими побочное и неблагоприятное действие
консервированной крови.
Инфузионно-трансфузионная программа должна осуществляться при высокой объемной скорости инфузии,
а при неопределяемом артериальном давлении составлять 250—500 мл за 1 минуту. Определяемый уровень
АД должен быть достигнут за 10 мин. (избегать медленных капельных вливаний). Переходить к медленному
капельному вливанию можно только тогда, когда частота
пульса не превышает 100 ударов в минуту, полностью
нормализуется артериальное давление и гематокрит достигает 30%.
22
Необходимо шире пользоваться аутотрансфузиями
излившейся крови при травме брюшной и грудной полостей без повреждения полых органов. Кровь следует
собрать в стерильный сосуд с добавлением 5000 ед- гепарина на 1 литр крови, профильтровать через 8 слоев
марли и перелить больному. Можно воспользоваться
излившейся кровью и при открытом повреждении этих
полостей, но после добавления к собранной крови
антибиотиков (Г. Н. Цыбуляк, 1975).
Коррекция нарушений в центральной нервной системе
Генерализованное возбуждение, наблюдающееся в
эректильной фазе шока, встречается в клинике нечасто
(у 15% больных). Оно сменяется торможением в тор-
пидной фазе в различных отделах нервной системы неодновременно, в связи с чем наряду с очагами торможения продолжают существовать очаги возбуждения.
Причем функциональное состояние различных отделов
нервной системы меняется по-разному: в большей степени происходит угнетение периферических звеньев
центральной нервной системы (рецепторов, периферических нервов, вегетативных нервов) и в меньшей степени страдает функция подкорковых образований и
коры головного мозга. Ослабление болей в торпидной
фазе свидетельствует о том, что болевые импульсы не
достигают коры головного мозга, поскольку болевая
импульсация, видимо, блокируется в восходящих путях
в результате образования очагов парабиоза на различных уровнях нервной системы (в синапсах, спинном
мозгу, ретикулярной формации и т. д.). Таким образом,
в торпидной фазе имеется своеобразное состояние нервной системы, когда периферические образования находятся в состоянии торможения, а кора и подкорка активны, но из-за блокады не в состоянии оказывать регулирующее действие на жизнедеятельность органов
пострадавшего. Однако сказанное не должно вести к
недооценке нервноболевых влияний и отрицательных
психоэмоциональных воздействий на течение шока. Известно, что неустраненные нервноболевые влияния на
фоне кровопотери, расстройств дыхания и инфекции
значительно отягощают состояние шока и углубляют
23
его. Борьба с болью складывается из следующих элементов:
1. Ликвидации «болевого тормоза» с помощью блокады места перелома введением 20—30 мл 1% раствора
новокаина.
2. Назначения анальгетиков: внутривенное введение
1 мл промедола и 0,5—1,0 мл атропина или внутримышечное введение реопирина или анальгина в комбинации с антигистаминным препаратом (Ю. Н. Шанин,
1973).
3. Применения нейролептанальгезии в случаях тяжелой травмы. Следует учитывать благоприятное влияние этого вида анестезии на гемодинамику за счет
предотвращения централизации кровообращения, но требующей надежной коррекции гиповолемии перед
анестезией. Не следует вводить дроперидол до поднятия и стабилизации систолического артериального
давления до 80—90 мм рт. ст. На фоне инфузионно-
трансфузионной терапии вводят небольшие дозы дро-
перидола (0,5—3 мг), как противошоковое средство, и
малые дозы фентанила (1—2 мл 0,005% раствора). Выключение сознания может быть достигнуто с помощью
введения небольших доз таламонала (3—4 мл). Анестезия дальше поддерживается за счет дробного введения
небольших доз указанных препаратов и закиси азота
(М. И. Кузин с соавт., 1976).
4. Масочного «самонаркоза» дачей закиси азота Q
кислородом в соотношении 1:1. Особенно показан при
повреждениях груди и в пожилом возрасте.
5. Продленной перидуральной анестезии при систолическом артериальном давлении не ниже 100 мм рт,
ст. дробным введением каждые 4 часа 1,5% раствора
тримекаина через пластиковый катетер.
Коррекция газообмена
Основными причинами нарушения дыхания являются]
1) нарушение проходимости верхних дыхательных путей вследствие обструкции их кровью, слизью, рвотными
массами, инородными телами; 2) нарушение биомеханики внешнего дыхания вследствие образования гемопневмоторакса, клапанного пневмоторакса или западе-
ния грудной клетки при множественных двойных
24
переломах ребер; 3) повреждение легочной паренхимы;
4) нарушение центральной регуляции дыхания при тяжелых травмах мозга (И- В. Гальцева с соавт., 1974);
5) развитие синдрома «шокового легкого».
Лечебные мероприятия
1. Проверка проходимости верхних дыхательных путей, тщательный туалет ротовой полости и глотки, отсасывание застойного секрета. Для этих целей катетер
проводится за голосовую щель или проводится чрез-
кожная пункция трахеи и введение полихлорвинилового
катетера. Через последний вводится 5—10 мл физиологического раствора с антибиотиками и трипсином для
разжижения секрета и лучшего еш удаления.
2. Снятие «болевых тормозов дыхания» достигается
новокаиновой блокадой места (9,0 мл 0,5% раствора
новокаина с добавлением 1 мл ректифицированного
спирта).
3. При резком угнетении дыхания, когда имеется
одышка более 40 дыхательных движений в 1 минуту,
концентрация НЬОг снижается до 80%, исследование
кислотно-щелочного равновесия указывает на респираторный или метаболический ацидоз и намечается гипотония, показана интубация и искусственная вентиляция
легких. Перед интубацией следует убедиться в отсутствии клапанного пневмоторакса.
4. При наличии «шокового легкого» показана искусственная вентиляция легких, нормализация реологических свойств крови и фибринолитическая терапия.
5. Пункция плевры и отсасывание крови и воздуха
при гемопневмотораксе, ликвидация клапанного пневмоторакса, восстановление каркасности грудной стенки при
«реберных клапанах».
6. Трахеостомия при необходимости в длительной
санации дыхательных путей, при невозможности произвести интубацию, при тяжелых травмах черепа, шейного
отдела позвоночника, гортани, шеи.
7. Для улучшения легочной вентиляции ввести 20 мл
1,5% этимизола в 100 мл 5% раствора глюкозы.
8. Борьба с парезом желудочно-кишечного тракта
для устранения высокого стояния диафрагмы и ограничивающего ее экскурсии.
25
Коррекция эндокринных нарушений
Высокое содержание стероидов в крови при шоке не
определяет и не отражает функциональной активности
гипофизарно-надпочечниковой системы. Повышенное содержание кЬртикоиДОВ связано с пониженной их утилизацией тканями, а й£и тяжелЫЭс степенях шока секреция
кортикоидов прогрессивно снижается. Применение их
дает благоприятные результаты в дозах, значительно
превышающих физиологические.
В связи с вышеуказанными рекомендациями введение
гидрокортизона в дозе 1000—1500 мг имеет в виду фармакологический, а не заместительный эффект гидрокортизона (Т. М. Дарбинян, 1974). Глюкокортикоиды снимают спазм периферических сосудов, улучшают сократительную функцию миокарда, стабилизируют мембрану
лизосом, препятствуют накоплению в крови вазоактивных полипептидов.
Отсутствие после адекватного кровезамещения повышения артериального давления говорит об увеличении
общего объема сосудистого русла за счет вазодилатации. У таких больных показано применение вазопрессора
норадреналина, который в таких случаях является средством оптимального распределения имеющегося объема
крови. Норадреналин, таким образом, следует вводить
тем пострадавшим, у которых артериальное давление
имеет прогрессирующую тенденцию к снижению, несмотря на интенсивную терапию и восполненную крово-
потерю. Доза вводимого препарата может колебаться в
широких пределах—от 2 мг до 10 мг в физиологическом растворе, или 5% глюкозе. Раннее введение норадреналина при тяжелом шоке улучшает циркуляцию в
жизненно важных органах, увеличивает объем циркулирующей крови за счет мобилизации депонированной
крови, улучшает кровообращение в терминально-сосудистом русле (И. В. Гальцева, 1974).
Коррекция обменных нарушений
Известно, что развивающаяся при шоке циркуляторная гипоксия вызывает значительные обменные нарушения, которые характеризуются преобладанием катабо-
26
лических процессов. Поэтому терапевтические мероприятия этого звена шока должны быть направлены на ликвидацию гипопротеинемии, молочно-кислого ацидоза,
нарушений углеводного обмена, электролитного баланса.
1. Применение сухой нативной плазмы, альбумина,
протеина.
2. Введение с инсулином 200—300 мл 40% глюкозы,
которая необходима для восполнения энергетических
потребностей организма, связанных с гликолизом и образованием аденозин-трифосфата, являющегося основным источником энергии в организме. С этой же целью
вводится 50—100 мг кокарбоксилазы. Для уменьшения
проницаемости клеточных мембран — введение 5% раствора аскорбиновой кислоты 15—20 мл.
3. Для компенсации молочно-кислого ацидоза вводится 300—400 мл 4% раствора бикарбоната натрия.
4. Введение 1000—1500 мл физиологического раствора и 10—20 мл 10% раствора хлористого кальция,
5. Антигистаминные препараты.
Коррекция острых нарушений свертываемости
1. При установлении 1 стадии тромбогеморрагического синдрома, проявляющегося диссеминированным
внутрисосудистым свертыванием, показано введение гепарина (20000 ед.) и реополиглюкина (А. П. Зильбер,
1977).
2. Во 2 стадии тромбо-геморрагического синдрома
показано введение гепарина, фибриногена от 3 до 8 г и
прямое переливание крови.
3. При наличии стадии фибринолиза дополнительно
к указанным мероприятиям рекомендуется введение
ингибиторов фибринолиза. С этой целью применяется
контрикал (25000 ед.) и эпсилонаминокапроновая кислота. Сначала вводится 5% раствор внутривенно, а
затем по 50 мл каждые 2 часа (А. К. Кабанов, 1967).
Однако ингибиторы фибринолиза следует применять с
осторожностью из-за опасности развития генерализованных тромбозов и почечной недостаточности. Поэтому их
введение должно сочетаться с применением гепарина.
27
Профилактика почечной недостаточности
Почечные расстройства при шоке вначале носят
функциональный характер, но при тяжелом шоке без
своевременного лечения ведут к необратимым морфо-
логическим изменениям. Поскольку нарушение функции
почек при шоке связано с неполноценностью-канальце-
вого аппарата, показано применение средств, норма*
лизующих тубулярные процессы и, в частности, осмодиуретиков.
1. Ртутные диуретики при шоке не показаны из-за
наличия почечной вазоконстрикции. Применение манни-
тола даже в тяжелом периоде торпидной фазы шока
приводит к нормализации функционального состояния
почек. Маннитол увеличивает скорость почечного кровотока, уменьшает реабсорбцию в проксимальных канальцах и увеличивает диурез. Кроме того, маннитол
снижает вязкость крови и гематокрит более чем на
10%, уменьшает размеры эритроцитов. Маннитол вводится струйно, внутривенно в дозе 1,0—1,5 г на кг веса
больного. Вначале маннитол повышает артериальное
давление, а через 30—40 минут от начала введения осмодиуретика наступает его снижение. Поэтому он может
применяться при шоке II и III степени, а при IV степени его вводить не следует. Особенно показан маннитол с целью профилактики почечной недостаточности у
больных с массивным размозжением мягких тканей, при
начинающейся олигурии и после массивных гемотрансфузий консервированной крови. Для этих целей может
быть использован и сорбитол, но его диуретическое
действие слабее маинитола.
2. Диурез хорошо стимулируется и с помощью
введения электролитных натриевых растворов. Изотонический раствор поваренной соли легко проникает через
сосудистую стенку, восстанавливает нормальный объем
интерстициального пространства и усиливает выделительную функцию почек при кровопотере (Е. А. Вагнер,
В. М. Тавровский, 1977).
3. Паранефральная околопочечная новокаиновая
блокада.
4. Борьба .с ацидозом является также профилактикой олигурии.
28
ГЛАВА II
СЕПТИЧЕСКИЙ ШОК
Гнойные заболевания у хирургических больных могут осложняться развитием фатальных нарушений в
кровообращении и других жизненно важных системах
и органах. Это состояние, не связанное с кровопотерей
и сердечной слабостью, называют септическим или бактериальным шоком (Waisbren и Borden, 1951). Этиологическим фактором септического шока является различная инфекция и чаще всего грамотрицательная форма,
которая в условиях измененной иммунологической реактивности приводит к острому нарушению перфузии тканей, что является основой любого шока (Вейль и Шубин. 1971).
Основными патогенетическими факторами развития
септического шока считаются распространенная внутрисосудистая коагуляция и нарушение перфузии тканей.
Под влиянием бактериальных токсинов наступает стимуляция эффекторных альфа-рецепторов внутренних органов, что ведет к периферической вазоконстрикции,
ухудшающей перфузию тканей (Good и Thomas, 1953;
Lillehei, McLean, 1958).
Септический шок должен определяться следующими
критериями: 1) состоянием больного; 2) понижением
систолического артериального давления ниже 80 мм
рт. ст.; 3) выделением возбудителя из крови в течение
периода гипотензии; 4) полным исключением других видов шока (Martin, 1969).
Ведущее место в клинической картине септического
шока занимают нарушения в сердечно-сосудистой системе. Отличительной его чертой от других видов шока
является скорость развития нарушений в системном и
органном кровообращении, которые могут принимать
необратимый характер в течение нескольких минут.
Имеются отличия в механизмах развития септического
шока при грамотрицательной и грамположительной флоре (Д. М. Суровикин, В. И. Немченко, 1973; Б. Д. Беляков, А. П. Колесов и др., 1976).
Эндотоксины, выделяющиеся грамотрицательной
флорой (кишечная, синегнойная палочка, протей и др.),
соединяясь с форменными элементами крови, образуют
29
мукополисахаридные комплексы, обладающие высокой
симпатомиметической активностью и стимулирующие
секрецию эндогенных катехоламинов. Это приводит к
стимуляции альфа-рецепторов и спазму прекапилляров
и венул, в то время как гидростатическое давление крови не обеспечивает открытие артерио венозных шунтов.
Отражением подобной трансформации микроциркуляции
является повышение периферического сопротивления и
падение сердечного выброса (гиподинамический синдром). Под влиянием аноксии тонус периферических артериальных сфинктеров теряется, однако тонус посткапиллярных венозных сфинктеров даже в этих условиях
сохраняется, так как венулярные сфинктеры функционируют при более низком pH крови. В результате этого
наступает депонирование крови, резко снижается венозный ее возврат, развивается интракапиллярная коагуляция. При этом виде шока наблюдается также ослабление сократительной функции миокарда, повышение
сродства гемоглобина к кислороду, что на фоне усиленной потребности в кислороде быстро ведет к глубокой
кислородной задолженности тканей.
Септический шок при грамположительной флоре (гемолитический, золотистый стафилококк) развивается на
фоне достаточного сердечного выброса и значительного
снижения периферического сопротивления (гипердинамический синдром). Экзотоксины, выделяемые грампо-
ложительными бактериями, действуют на ткани и вызывают клеточный протеолиз. Следствием этого процесса
является образование плазмокининов, которые вызывают спазм артериол и открытие артерио-венозных
шунтов, что приводит к снижению периферического
сопротивления и временному увеличению сердечного
выброса. Периферическая вазодилатация ведет к гипо-
волемии и гипотензии вследствие застоя крови в зоне
микроциркуляции и снижению венозного возврата.
Большую роль в развитии клиники септического
шока имеют дыхательные расстройства. Причинами дыхательных нарушений является ряд патогенетических
механизмов:
1) внутрисосудистое микротромбообразование в результате агрегации форменных элементов крови и эмболизация в систему малого круга;
2) деструкция поверхностно-активных веществ (сур¬
30
фактантов), результатом чего является снижение поверхностного натяжения в альвеолах и появление микроателектазов;
3) повышенная проницаемость сосудистых стенок и
отсюда интерстициальный отек ткани легкого;
4) ухудшение сократимости дыхательных мышц
вследствие гипоперфузии;
5) повышение требования к вентиляции вследствие
лихорадки, озноба, избытка углекислоты.
В результате этого клинически наблюдается тахип-
ноэ, дыхательный алкалоз, гипоксемия, интерстициальный отек легких (у 33% больных).
Коагулопатические нарушения являются следующей
особенностью септического шока. Под влиянием экзоэндотоксинов развивается спазм печеночных вен, портальный застой и гипертензия. Перфузионная недостаточность печени ведет к нарушению синтеза компонентов коагуляции и фибринолиза. На этом фоне развивается гиперкоагуляция за счет высокого содержания
фибриногена и уменьшения активности эндогенного гепарина. Это и определяет развитие в конечном итоге
диссеминированной внутрисосудистой коагуляций у
больных септическим шоком (Hardaway, 1965).
Ишемическое повреждение поджелудочной железы
при септическом шоке наблюдается у половины больных
и бывает различной степени. В легких случаях повреждения наблюдается «уклонение» протеолитических ферментов и калликреина в кровь и выброс значительного
количества их в просвет кишечника. В тяжелых случаях
острая ишемия поджелудочной железы ведет к асептическому панкреонекрозу. Развитие портальной гипертензии, нарушение кровообращения и выброс протеолитических ферментов являются причиной возникновения
острого язвенного гастроэнтерита.
Септический шок часто осложняется развитием тяжелых морфологических изменений в почках, некрозом
тубулярного аппарата почек, олигурией. Олиго-анурия
быстро приводит к гиперазотемии и гиперкреатинине-
мии.
При септическом шоке можно различить две фазы.
Первая фаза (в течение 6—12 часов) характеризуется
возбуждением, гипертермией, умеренной гипотензией,
тахикардией, Для второй фазы характерна значитель-
31
ная заторможенность, часто бессознательное состояние,
выраженная гипотензия, олигурия или анурия, тяжелая
сердечная и дыхательная недостаточность, брадикардия.
Если суммировать клинические признаки септического шока, то их можно объединить в группы
(В. С, Савельев, В. А. Гологорский, Б. Р. Гельфанд,
1976):
I. Симптомы инфекции:
Гипертермия, озноб.
Бактериемия.
Изменения белой и красной крови.
II. Нервно-психические расстройства:
Возбуждение.
Судороги.
Кома.
III. Сердечно-сосудистые расстройства:
Артериальная гипотензия.
Нарушение ритма, ишемия миокарда,
Нарушение микроциркуляции.
IV. Дыхательные расстройства:
(Тахипноэ, дыхательный алкалоз.
Гипоксемия.
V. Нарушение функции паренхиматозных органов:
Олигурия, азотемия, гиперкреатининемия.
Желтуха (гипербилирубинемия).
Повышение активности альдолазы и трансаминаз.
Диастазурия, гиперамилаземия, гипертрипсинемия, ги-
перлипаземия.
VI. Лабораторные данные:
Коагулопатия.
Нарушение кислотно-щелочного равновесия.
Нарушение водно-электролитного баланса,
Диспротеинемия,
82
Лечебная программа
Интенсивная терапия септического шока предусматривает: 1) проведение активной инфузионной терапии,
направленной на нормализацию объема циркулирующей
крови и ее реологических свойств; 2) адекватную вентиляцию легких; 3) улучшение деятельности сердечнососудистой системы; 4) устранение гемокоагуляционных
нарушений; 5) рациональной антибиотикотерапии.
Важное место в лечении септического шока занимают и хирургические мероприятия. Их целью является
полноценная хирургическая санация септических очагов,
устранение источника инфекции или хорошее дренирование очагов инфекции.
Коррекция гемодинамических нарушений
при септическом шоке
Основными элементами терапии расстройств кровообращения является восстановление или улучшение
кровотока в зоне микроциркуляции, восстановление объема циркулирующей крови, улучшение сократимости миокарда и реологических свойств крови. Этим целям отвечают следующие мероприятия:
1. При грамотрицательном бактериальном шоке
назначение малых доз гликозидов,' не увеличивающих
потребности сердечной мышцы в кислороде (дигоксин,
изоланид).
2. Компенсация дефицита объема циркулирующей
крови проводится в зависимости от показателей ЦВД
и ОЦК. При низком или нормальном ЦВД лучшим остается применение низкомолекулярного декстрана, а
при гематокрите ниже 30% и гемоглобине менее 10 г% —
гемотрансфузии свежегепаринизированной крови.
При выборе противошокового раствора следует учитывать не только волемические, но и реологические
свойства препаратов и их влияние на агрегацию эритроцитов. Поэтому наиболее рациональной является комбинация декстранов (полиглюкина, реополиглюкина,
гемодеза) с альбумином и белковыми гидролизатами
(В. Д. Беляков, А. П. Колесов и др., 1976). Такая комбинация обеспечивает поддержание объема циркули¬
3 М-843
33
рующей крови, улучшает микроциркуляцию и является
терапией гипопротеинемии. При значительном снижении
гематокрита и гемоглобина необходимо дополнительное
включение в эту смесь крови.
К применению вазопрессоров или вазодилататоров
при септическом шоке следует относиться крайне осторожно.
Объем инфузионной терапии определяется по диурезу и центральному венозному давлению. Исчезновение цианотических пятен, восстановление диуреза и повышение центрального венозного давления до 100—
150 мм вод. ст. говорят о нормализации объема циркулирующей крови.
Кортикостероидная терапия при септическом шоке
целесообразна как при гипердинамическом, так и при
гиподинамическом синдроме. Назначение кортикостероидов (гидрокортизона до 20 мг/кг или преднизолона до
10 мг/кг) способствует блокаде симпатомиметического
действия эндотоксинов, нормализует периферическое
сопротивление. Кортикостероиды не только восстанавливают сосудистый тонус, но защищают капиллярную стен-
ку и предупреждают агрегацию эритроцитов и развитие
«шокового легкого».
Таким образом, определяющими показателями при
коррекции гемодинамических нарушений является центральное венозное давление, гематокрит. При этом ЦВД
помогает контролировать объем перфузии, а гематокрит
и ионограмма помогают в выборе инфузионно-трансфу*
зионной программы.
Коррекция дыхательных нарушений
Нормализация газообмена часто может быть достигнута лишь при использовании длительной ИВЛ. Применение ИВЛ рассчитано не только на улучшение газообмена, но и на предотвращение больших затрат энергии при спонтанном дыхании и показано при тяжелых
формах септического шока.
Коррекция гемокоагуляционных нарушений
Антикоагулянтная терапия при септическом шоке
должна начинаться срочно, поскольку целью ее является профилактика тромбообразования. Этим задачам
34
отвечает экстренное назначение гепарина до 30000 ед.
в.сутки. Целесообразно и капельное длительное вливание смеси реополиглюкина с гепарином (В. С. Савельев
й соавт., 1976).
Антибактериальная терапия
Наиболее целесообразно применять антибиотики бактерицидного типа действия (пенициллин, полусинтети-
ческие пенициллйны, канамицин, гарамицин, цефало-
спорин) и комбинированным способом (канамицин и
пенициллин, ампициллин и оксациллин), что является
эффективным как в отношении грамположительной,
так и грамотрицательной флоры.
Наиболее активными препаратами при грамотрица-
тельном шоке являются полимиксин, гентамицин, канамицин, карбенициллин.
При грамположительном септическом шоке эффективными оказались пенициллин и полусинтетические
пенициллйны (оксациллин, метациллин), цефалотин,
ванкомицин.
Следует применять высокие дозы антибиотиков,
превышающие значительно обычные. Так, пенициллин
(калиевая соль) вводится внутривенно в дозе от 60 млн
до 120 млн ед. Дозы полусинтетических пенициллинов
и цефалоспоринов колеблются в пределах от 6 до 12 г
в сутки, гентамицина — до 400 мг, канамицина — до
6,0 в сутки.
Следует помнить, что массивная инфузионная терапия при нормальном мочеотделении приводит к снижению эффективной концентрации антибиотика в крови.
Длительная антибиотикотерапия ведет к активации
кпниновой системы (Г. А. Ивашкевич, 1974). Кроме
того, микробную клетку окружает кольцо протеиназ,
снижающих эффективность действия антибиотиков. Поэтому целесообразно для повышения эффективности
антибиотиков применять естественные ингибиторы протеолитических ферментов (трасилол, цалол, контрикал)
и синтетические— парааминометилбензойная кислота
(амбен), аминокапроновая кислота и др. Доза естественных ингибиторов составляет 1000—1500 ед. на кг веса
больного и вводится внутривенно в течение 5—7 дней.
3*
35
Для профилактики суперинфекции не следует забы-
вать о назначении антимикотических средств (нистатин,
леворин), сульфаниламидов.
Иммунотерапия
1. Стафилококковый анатоксин в дозе 0,5—1,0—2 мл
с интервалами в 7 дней под кожу лопатки с новокаином.
2. Противостафилококковый гамма-глобулин по 5 мл
внутримышечно через день в 4—5 раз повышает специфическую реактивность больного и неспецифический
иммунитет (пассивная иммунизация).
3. Антистафилококковая гипериммунная плазма в
наиболее тяжелых случаях вводится из расчета 5 мл
на кг веса больного ежедневно от 4 до 7 раз (пассивная
иммунизация).
Компенсация электролитного баланса и кислотнощелочного равновесия проводится по общим правилам,
как и профилактика и лечение почечной недостаточности.
ГЛАВА III
СИНДРОМ ДЛИТЕЛЬНОГО РАЗДАВЛИВАНИЯ
(СДР)
Этот синдром развивается у больных при многочасовом сдавливании мягких тканей и после освобождения
их от сдавления. Синдром СДР возникает при различных стихийных катастрофах (землетрясение, наводнение), авариях на подземных работах, лесозаготовках,
железнодорожном и автомобильном транспорте. Причиной развития синдрома СДР может быть длительное,
бесконтрольное применение кровоостанавливающего
жгута, а так же позднее восстановление естественного
кровотока при повреждениях сосудов. В клинической
практике нередко встречается разновидность этого синдрома, так называемый синдром позиционного сдавливания. Он развивается у лиц, находящихся в состоянии
36
тяжелого алкогольного опьянения или длительном бессознательном состоянии, у которых конечность в течение
длительного времени была сдавлена тяжестью собственного тела (самосдавление). или свисала, перекидываясь
через твердый предмет.
Следует сказать, что ввиду сравнительной редкости
этой патологии и недостаточной информированности
врачей в диагностике и лечении этого синдрома допускается немало ошибок. Литературные данные говорят о
том, что правильный диагноз устанавливается рано или
вовремя лишь у половины пациентов.
В развитии патогенеза и клиники синдрома длительного раздавливания тканей имеют значение следующие
факторы (М. И. Кузин и соавт., 1959—1969; И. Н. Крук,
1964—1968; А. Н. Беркутов, 1973; Е. С. Карашуров,
1975; Bywaters, 1941; Trueta, 1946—1947):
1. Длительное сдавление и травматизация нервных
стволов обусловливает целую цепь патологических нервно-рефлекторных влияний на центральную нервную
и эндокринную систему, кровообращение, функцию почек и тяжелые психо-эмоциональные нарушения. Таким
образом, боль является пусковым фактором многих
патофизиологических сдвигов при этом поражении.
2. Массивная плазмопотеря в поврежденных тканях
достигает нередко катастрофических размеров. Объем
циркулирующей крови в зависимости от времени сдавления может снижаться до 52—27% от исходного
(Ю. М. Максимов, 1972). Так, при отеке одной верхней
конечности депонируется до 2—3 л, а нижней — до 3—
5 л жидкости, в основном плазмы (С. А. Симбирцев,
М. О. Стернин, 1973). При этом одновременно резко нарастает гемоконцентрация, что проявляется в катастрофическом возрастании гематокрита. Таким образом, бурно развивается состояние, связанное с драматической
плазмопотерей, которое трудно переносится организмом
и называется «белым кровотечением» (М. И. Кузин).
3. Фактор токсемии. Выраженная интоксикация при
синдроме длительного раздавливания в начальных стадиях болезни определяется не микробным агентом, а
веществами, образующимися в тканях при их повреждении (ноксинами). При массивном повреждении мышечной ткани высвобождается до 75% миоглобина, 75%
фосфора, 66% калия, 70% креатинина и 95% кислых
37
продуктов (Bywaters, 1942). Причем их содержание резко возрастает в венозной крови. Вначале выделение их
с мочой резко увеличивается, что в свою очередь ведет
к уменьшению экскреции калия и фосфора. Таким образом, факторами ноксинемии являются следующие:
а) гиперкалиемия, поражающая сердце, почки, гладкие мышцы;
б) выделение миоглобина, являющегося механическим препятствием для эвакуации вредных для организма веществ через почки;
в) увеличенное образование биогенных аминов я
вазоактивных полипептидов (гистамина и кининовых
агентов). Ведущую роль в ноксинемии играют внутриклеточные протеолитические ферменты, освобождающиеся при разрушении лизосом;
г) аутоантигены, образующиеся в поврежденных
тканях и ведущие к появлению аутоантител (В. Г. Дей*
нега, 1964, 1965);
д) «ишемический токсин», образующийся в первую
очередь в поврежденной коже и мышцах из собственных
белков организма под влиянием протеолитических ферментов (И. Н. Крук).
Указанные факторы ведут к проявлению следующих
патогенетических механизмов:
1. Установлено, что уже на ранних сроках компрессии в первую очередь поражаются почки, что выражается в деструкции клубочкового и канальцевого эпителия, развитии стаза и тромбоза как в корковом, так в
мозговом веществе. Почечные канальцы претерпевают
значительные дистрофические изменения, целость отдельных канальцев нарушена, их просвет заполнен продуктами распада клеток. Причем эти рано возникающие и быстро прогрессирующие изменения существуют
до развития признаков почечной недостаточности. Мио-
глобин и образующийся при гемолизе эритроцитов
гемоглобин усиливают ишемию коркового слоя почек, делают ее длительной и более выраженной, что способствует прогрессированию грубых морфологических изменений в клубочковом и канальцевом аппарате почек и
развитию острой почечной недостаточности.
2. В результате длительного сдавления, развития в
тканях кислородного голодания и гипотермии возникает
выраженный тканевой ацидоз. После устранения сдав-
лення и восстановления кровотока из поврежденной конечности током крови удаляются недоокисленные продукта обмена: молочная, пировиноградная, ацетоуксус-
ная и другие кислоты. Молочная кислота является тем
метаболитом, который вызывает резкое падение pH
крови и сосудистого тонуса, приводит к снижению сердечного выброса и необратимому шоку (Л. Б'. Канцали-
ев, 1975). Развивающаяся гипоксия отрицательно влияет на функцию целого ряда жизненно важных систем
(почек, печени, кишечника). Так, дефицит кислорода
ведет к повышению проницаемости кишечной стенки и
нарушению ее барьерной функции. Поэтому вазотоксические вещества бактериальной природы свободно
проникают в портальную систему и блокируют ретику-
лоэндотелиальную систему печени. Нарушение антитоксической функции печени и ее аноксия способствуют
освобождению вазодепрессивного фактора — ферритина.
3. Нарушения гемодинамики при этом состоянии
связаны не только с образованием вазодепрессивных
факторов, но и с массивным разрушением эритроцитов,
ведущим к гиперкоагуляции и внутрисосудистому тромбозу.
Клинически течение синдрома длительного раздавливания укладывается в три периода: начальный, промежуточный и период восстановления (М. И. Кузин.)
Начальный период продолжается 2—3 суток и развивается бурно. Сразу после устранения сдавления пациента беспокоит сильная боль в поврежденной конечности.
Гемодинамические показатели в пределах нормы. Поврежденная конечность бледная, с цианозом пальцев и
ногтей. Быстро нарастает отек конечности. Причем кожа
приобретает деревянистую плотность. На коже появляются пузыри с прозрачным или геморрагическим содержимым. Пульсация периферических сосудов не
определяется из-за плотного отека. С развитием и углублением местных явлений ухудшается общее состояние
больных. У них развивается адинамия, появляется головокружение, тошнота и рвота, падает артериальное
давление, развивается олиго-анурия. Моча уже на ранних сроках поражения конечностей имеет высокий удельный вес, приобретает лаковую окраску, в ней появляется
значительное количество белка и эритроцитов. В крови
в этот период резко повышается гематокрит и умень¬
30
шается гемоглобин, возрастает концентрация фибриногена, повышается толерантность плазмы к гепарину,
снижается активность фибринолитической системы,
Все это указывает на повышение функции свертывающей
системы крови, ведущей к тромбозам.
Промежуточный период характеризуется симптомами
нарастающей почечной недостаточности. Появляются
боли в пояснице. Повышается температура до 38,5°,
Количество мочи остается низким. Удельный вес ее
снижается, появляются гиалиновые, зернистые, эпителиальные цилиндры. В крови нарастает уровень остаточного азота мочевины, креатинина. Состояние больных
резко ухудшается. Усиливается вялость и заторможенность больных, появляется частая рвота и жажда, икте-
ричность склер и кожных покровов, что говорит о вовлечении в патологический процесс печени. Продолжительность периода составляет 10—12 дней.
В периоде восстановления преобладают местные изменения над общими. Температура тела нормализуется,
отек конечности к концу месяца и боли в ней проходят.
Время восстановления движений и чувствительности
зависит от степени повреждения мышц и нервных стволов. В результате гибели мышечных элементов происходит их замещение соединительной тканью и развитие
атрофии конечности. Однако нужно помнить, что инфицирование ран после лампасных разрезов и некрэк-
томии приводит к развитию флегмоны и даже сепсиса.
В связи с поражением при этом синдроме почек, печени и
некоторых других органов восстановительный период
затягивается, он продолжается и после ликвидации
клинических проявлений заболевания.
Диагностическая программа
Ввиду недостаточной информированности врачей
позиционный синдром часто путают с 'тромбофлебитом
глубоких вен. Такую ошибку нетрудно совершить, учитывая, что между указанными патологиями часто имеется много общего при проверке симптомов Хоманса, Мозеса, Ловенберга (А. М. Скворцов и соавт., 1978).
Имеются следующие отличительные признаки позиционного синдрома от тромбофлебита глубоких вен по
А. М. Скворцову (1978):
1. При синдроме позиционного сдавления наблю¬
40
дается снижение чувствительности, свисание стоп, ишемический неврит, чего почти не бывает при тромбофлебите.
2. Резкая болезненность инфильтрированных мышц
при синдроме сдавления, выявляемая пальпацией.
3. При синдроме позиционного сдавления отсутствует рисунок компенсаторно расширенных вен, наблюдающийся при тромбофлебите.
4. Нарушение функции почек на 2—3 день заболевания является характерной особенностью позиционного синдрома и проявляется снижением суточного диуреза, микрогематурией, протеинурией.
5. Восстановление диуреза, как правило, сопровождается уменьшением отека конечности, что не бывает
при тромбофлебите.
6. Тщательное собирание анамнеза и выявление
алкогольной интоксикации.
II. Срочное проведение лабораторных исследований:
определение гемоглобина, эритроцитов и гематокрита
В динамике, свертываемости крови, протромбина, тромбоцитов, фибриногена, электролитов, pH крови, остаточного азота и креатинина крови, общий анализ мочи.
III. В сомнительных'случаях окончательный диагноз
помогает установить флебография. Однако следует
помнить, что острая почечная недостаточность является
противопоказанием к проведению ангиографии.
С целью рационализации диагностики позиционного
синдрома приводим дифференциально-диагностическую
таблицу (табл. 4).
Консервативное лечение
Консервативное лечение является ведущим при синдроме длительного раздавливания. В зависимости от
того, насколько рано оно начато, энергично и полно
проводится, зависит судьба больного. Хирургическое
лечение, как правило, бывает вынужденным и проводится лишь в тяжелых случаях. Поэтому очень важно
своевременно и рано диагностировать данное заболевание и как можно раньше начать лечение., Оно складывается из мер по лечению и профилактике шока, борьбы с болью, интоксикацией, ацидозом, электролитными
41
Таблица 4
Дифференциальная диагностика синдрома позиционного
сдавления и тромбофлебита глубоких вен
Признак
Синдром позиционного сдавления
Тромбофлебит
глубоких вен
Отек конечности
Деревянистый
Тестоватый
Чувствительность
Снижена
Не нарушена
Ишемический нев-
Резко выражен
Отсутствует
рит
Резко выражено
Не выражено
Расширение под¬
кожных вен
Нарушение диуреза
Олигурия, вплоть
до анурии
Нормальный
Патологические
элементы в моче
.Лаковая моча",
эритроциты, белок,
циликдрурия
Отсутствуют
Пузыри на коже
Имеются, часто заполнены прозрачной
или кровянистой
жидкостью
Отсутствуют
Электролиты крови
Гиперкалиемия
Без изменений
Движения в суста¬
Резко ограничены
Болезненны, но
вах поврежденной
или отсутствуют
возможны
конечности
Флебография
Глубокие вены
Непроходимость
проходимы
глубоких вен
нарушениями. Врачебная помощь начинается уже на
месте травмы. Она состоит из следующих элементов)
1. Введение анальгетиков (промедол, анальгин, паи*
топон).
2. Наложение жгута на проксимальную часть ко»
вечности до освобождения из-под завала.
3. После освобождения из-под завала футлярная
новокаиновая блокада 0,25% раствором новокаина выше
жгута и после производства блокады снятие жгута.
4. Тугое бинтование конечности эластичным или
марлевым бинтом в течение 3—4 дней. Если возможно его применить с самого начала оказания помощи, то жгут накладывать не нужно.
Б. Местная гипотермия в виде обкладывания поврежденной конечности иузырямя со льдом. Эти две
42
процедуры являются очень важными, поскольку они
предотвращают критическое повышение гематокрита
и гиперкалиемию. Кроме того, местная гипотермия
снижает токсичность оттекающей от поврежденной конечности крови за счет торможения активности гидролитических ферментов, освобождающихся из разрушенных лизосом.
6- Транспортная иммобилизация является обязательной и важной процедурой, поскольку она замедляет
движение токсических веществ из поврежденной конечности в общее сосудистое русло (Trueta, 1947).
7. Борьба с гиповолемическим шоком. Как уже говорилось, его развитие связано с колоссальной, а иногда и катастрофической плазмопотерей. Поэтому необходимо как можно раньше начать введение средне- и
высокомолекулярных синтетических заменителей плазмы. Введение солевых эквилибрированных растворов не
достигает поставленных задач по борьбе с шоком, так
как солевые растворы из повышенной капиллярной
проницаемости быстро покидают сосудистое русло, способствуют нарастанию отека и опасны из-за гиперка-
лиемии.
8. Одной из причин ранней гибели больных с синдромом раздавливания является острая дыхательная
недостаточность. Она связана с острым интерстициальным отеком и накоплением жидкости в альвеолах. Поэтому следует помнить о необходимости экстренной
санации дыхательных путей с помощью отсасывания
жидкого отделяемого из трахео-бронхиального дерева
и насыщении организма кислородом.
9. Введение щелочных растворов внутривенно (4—
5% раствора бикарбоната натрия), щелочное питье,
дача лимоннокислого натрия peros для ощелачивания
мочи (15—20,0 г в сутки).
10. Введение 150—200 мл 0,25% раствора новокаина
внутривенно.
11. Паранефральная новокаиновая блокада.
12. Профилактическое введение антибиотиков.
13. Введение противостолбнячной сыворотки.
14. При возможности осуществить контроль за свертывающей системой целесообразно введение антикоагулянтов.
43
Оперативное лечение
При отсутствии эффекта от проводимого консервативного лечения, усилении явлений интоксикации или
ори бурном нарастании отека конечности показано хирургическое лечение. На первом этапе оно заключается
в выполнении радиальной фасциотомии, снимающей
напряженный отек тканей. Для увеличения площади
разрезов целесообразно рассекать фасцию z-образным
разрезом. Необходимо проводить операцию в строго
асептических условиях и следить за профилактикой вторичного инфицирования ран. В последующем нередко
приходится иссекать нежизнеспособную мышцу, то есть
производить парциальную миоэктомию. В случае
отсутствия улучшения состояния больных после проводимого энергичного консервативного лечения или разрезов, нарастания явлений интоксикации и особенно
почечной недостаточности показана срочная ампутация.
ГЛАВА IV
ПРИНЦИПЫ ДИАГНОСТИЧЕСКОЙ И ЛЕЧЕБНОЙ
ПРОГРАММЫ В НЕОТЛОЖНОЙ ХИРУРГИИ
ОРГАНОВ БРЮШНОЙ ПОЛОСТИ
Лечение больных с острыми хирургическими заболе*
паниями брюшной полости часто является сложной задачей. Трудности в лечении этого контингента больных
зависят от целого ряда причин. К ним относятся критическое состояние многих пациентов при поступлении,
невозможность проведения полноценного обследования
больного, затруднительный контакт с пациентами пожилого и старческого возраста, наличие у них сопутствующих заболеваний, маскирующих основную патологию,
необходимость принятия срочного решения о выборе
метода лечения и т. д- Эти трудности усугубляются
недостаточной разработкой экспресс-методов лабораторной диагностики многих экстренных хирургических
заболеваний (ишемическая болезнь кишечника, пери¬
44
тонит, непроходимость кишечника и др.). Методы экстренной инструментальной диагностики (фиброгастродуо-
деноскопия, лапароскопия, колоноскопия) чрезвычайно
обогатили хирургическую практику и расширили возможности установления точного диагноза. Однако эти методы требуют дорогостоящей аппаратуры, специально
подготовленных кадров, имеют определенную разрешающую способность и противопоказания. Следовательно, как лаборат<?рная, так и инструментальная диагностика не могут быть конкурентами с обычным клиническим методом обследования, а являются лишь одними
из элементов в построении диагноза. Анализ самого
метода постановки диагноза в неотложной хирургии, ме-
юдом выбора того или иного способа лечения, методик проведения операций и их окончания, проведения послеоперационного периода показывает, что в неотложной
хирургии брюшной полости, несмотря на имеющуюся
пестроту объединяемых ею заболеваний, можно сформулировать ряд общих принципиальных установок. Мы
попытались выделить основополагающие принципы при
решении трех основных вопросов неотложной хирургии:
постановки диагноза, выбора метода лечения, методики
проведения операции. Конечно, предлагаемое деление
является условным, но может быть основой последовательности действий в неотложной хирургии и выглядит
следующим образом:
I. Постановка диагноза (анатомического и функционального)-
II. Определение функционального состояния больного
и риска оперативного вмешательства.
III. Выбор лечения:
а) консервативного;
б) эндоскопические операции;
в) оперативного.
IV. Операционная диагностика.
1. Визуальный осмотр, пальпация.
2. Инструментальная:
а) рентгеноконтрастная (вазография, холангиогра-
фия, спленопортография);
б) бесконтрастная (трансиллюминация);
в) функциональная — измерение портального давления, давления в желчном и панкреатическом протоках,
термометрия, определение кровотока в сосудах и т. д.
45
г) морфологическая (пункционная, эксцизионная биопсия и т. д.);
д) операционная диагностика, связанная с бескровной мобилизацией пораженного органа (бескровная
мобилизация толстого кишечника, желудка, панкреатодуоденального комплекса и т. д.).
V. Устранение патологического очага, а при невозможности его удаления — отграничение.
VI. Санация области патологии, а в показанных
случаях и всей брюшной полости (удаление крови,
желчи, кишечного содержимого, экссудата, фибрина,
сгустков и т. д.).
VII. Декомпрессия полого органа, являющегося источником патологии:
1) механическая;
2) лекарственная.
VIII. Борьба с инфекцией местно, за пределами очага, профилактика гнойных осложнений.
IX. Адекватная коррекция гомеостаза с помощью
интенсивной терапии до, во время и после операции.
Проведение специфической и неспецифической дезинтоксикации (форсированный диурез, дренирование грудного лимфатического протока, лнмфо- и гемосорбция).
Постановка диагноза. Постановка диагноза
в клинической практике проводится с помощью трех общих методов исследования: клинического, инструментального и биохимического. В неотложной хирургии
за последние годы большое развитие получили разработка и применение инструментальных методов диагностики. Среди них наибольшее распространение получили рентгеновские, рентгеноконтрастные и эндоскопические методы исследования больных. Учитывая их
высокие диагностические возможности, эти методы стали нередко выходить на первый план в постановке диагноза, часто даже в ущерб чисто клиническим способам обследования больных. Высоко оценивая результаты применения этих методов в неотложной хирургии,
следует все же сказать, что даже современные инструментальные способы являются лишь одним из элементов
построения диагноза, но далеко не единственным. В
связи с этим стоит вспомнить высказывание Р. Хегглина
(1965) о том, «что диагноз устанавливается по данным
анамнеза приблизительно более чем на 50^ случаев, на
4в
основании клинического исследования приблизительно в
30% и по лабораторным данным—приблизительно в 20% ».
Таким образом, диагностическая гипотеза может
быть создана у значительного числа больных с помощью
обычного сбора анамнеза и осмотра больного, а уже
проверена и уточнена путем использования инструментальных методов. Имеющаяся же сейчас тенденция к
технизации диагностики часто, несомненно, идет за
счет уменьшения применения обычных клинических методов исследования. Эти обстоятельства усложняют
диагностический процесс и идут не на пользу больным.
Поэтому нам бы хотелось кратко остановиться на основах структуры диагностического процесса в неотложной хирургии, поскольку в хирургической литературе
этот вопрос освещался недостаточно.
Принципы проведения диагностического процесса в
неотложной хирургии отличаются тем, что проводятся
в условиях жесткого дефицита времени. Чисто условно
структура диагностического процесса предполагает
наличие в нем трех основных этапов: 1) собирание
фактов (обследование больного), 2) анализ полученных фактов, 3) синтез (А. С. Попов, В. Г. Кондратьев,
1972). За этим следует применение диагноза на практике, его проверка лечением и прогнозирование исхода
заболевания. Исследование больного в неотложной хирургии начинается с выявления симптомов заболевания.
Следует сказать, что принятое в терапии условное деление симптомов на основные и второстепенные, «большие» и «малые» в неотложной' хирургии
часто имеет большое значение. Именно в этой области
хирургии такие «большие» симптомы, как рвота кровью,
сильнейшая эпигастральная боль, разлитое напряжение
брюшной стенки, бывают ведущими при обследованик
больного и потому полностью занимают внимание врача. Однако оци могут увести далеко в сторону от основного диагноза ввиду их относительной специфичности. Поэтому, определяя симптом как основной и второстепенный, нужно, прежде всего, иметь в
виду их диагностический «вес», а главное патогенетическое значение и специфичность (И. Н. Осипов,
П. В. Копнин, 1962). Причем ведущее значение в диагностической значимости симптомов следует рассматривать по их специфичности. Однако лишь небольшое
4J
количество симптомов абсолютно специфично, то есть
имеет патогномоничный характер. Большинство же симп-
томов относительно специфично или вообще малоспецифично. Поэтому для проведения диагностического процесса и получения нужной информации нужны несколько
симптомов с установленной между ними патогенетической
связью. Так начинается формирование специфических
для конкретного заболевания синдромов. По определению В. X. Василенко, синдром — это «устойчиво наблюдаемая совокупность симптомов, объединенных общим патогенезом».
Диагностические трудности в неотложной хирургии
определяются еще и тем, что многие симптомы, наиболее часто встречающиеся при абдоминальной катастрофе, не поддаются количественной оценке. К ним относятся такие симптомы, как боль, рвота, тошнота, слабость и др. До сих пор оценка этих симптомов проводится примитивно, определяется их количественная мера
по принципу «больше — меньше». В то же время большая или меньшая выраженность многих симптомов
часто совсем не пропорциональна их диагностической
значимости. Нередко более специфичные и важные для
диагностики ’ симптомы могут быть выражены слабо
н потому ускользают от внимания врача. Однако количественная оценка многих симптомов в принципе все
же возможна- Так, совместно с сотрудником нашей
клиники Р. Ш. Шаймардановым мы провели электро-
миографический анализ защитного напряжения брюшной
стенки при аппендицитах, холециститах и перитонитах.
Известно, что оценка защитного напряжения *до сих
пор производилась чисто субъективно на основе данных пальпации. Для объективизации данного симптома
мы применили электромиографическую оценку напряжения мышц брюшной стенки. Эти исследования показали, что в норме фоновая электрическая активность
мышц брюшной стенки у здоровых людей в положении
лежа отсутствует. При наличии воспалительного процесса в брюшной полости ЭМГ исследование обнаружило наибольшую электрическую активность при остром
аппендиците в подвздошной области справа, при остром
холецистите — в правом подреберье. Проведение функциональных нагрузок (кратковременный подъем головы
49
или ног) ведет к усилению электрической активности
над областью патологии.
Таким образом, с помощью электромиографического
метода стала возможной объективная оценка такого
общего симптома, как защитного напряжения мышц
брюшной стенки.
В принципе возможна и объективная оценка болевого симптома. Так, установлено, что степень снижения
электрокожного сопротивления при острых аппендицитах прямо пропорциональна степени болевых ощущений (Б. М. Ворошилов, 1978).
Несомненно также, что большое .значение имеет и
установление постоянства проявления данного симптома
при диагностируемом заболевании, полученное при статистической обработке. Известно, что в литературе нет
единого представления о логической структуре диагностического процесса, хотя ему посвящено немало
работ (М. П. Кончаловский, 1939; Г. А. Рейнберг, 1951}
В, И. Катеров, 1960; И. Н. Осипов и П. В Копнин,
1962; А. С. Воронов, 1969, и др.). Наиболее полно методологические основы структуры диагностического процесса представлены в работе А. С Попова и В. Г. Кондратьева (1972), в которой подробно излагаются приемы анализа и синтеза как двух основ единого диагностического процесса.
Анализ включает в себя ряд этапов:
1. Перечисление сведений, полученных врачом в
результате сбора анамнеза и осмотра.
2. Группировка полученных данных, то есть объединение симптомов, связанных патогенезом, сведений об
индивидуальных особенностях пациента, функциональном состоянии различных систем организма.
3. Выделение из полученных сведений главного и
второстепенного, то есть выделение симптомов твердо
установленных и сомнительных.
4. Классификация симптомов по их информативности и диагностической значимости, попытка найти и
выделить патогномоничный симптом.
.5- Классификация симптомов на основе отражения
ими жизненно важных функций организма, что особенно важно в неотложной ИЬрургии.
6. Анализ каждого симптома, включающий локализацию, иррадиацию, количественную характеристику,
4 М-843
49
периодичность, связь с возрастом, внешней средой и т. д.
Итогом аналитического этапа является заключение
о возможном патогенезе симптомов. Таким образом,
задачей анализа является объективное установление,
симптома, выделение симптомов, важных для диагноза
и связанных с возможными этиологическими факторами
болезни, анатомическими и функциональными сдвигами
в организме.
Следующим, более сложным этапом диагностического процесса является синтез, то есть воссоединение
полученных данных в единое целое. Этот процесс состоит из трех этапов.
1. Объединение симптомов и данных по различным
системам на основе их патогенетической связи, то есть
построение из отдельных симптомов специфических синдромов (панкреатического, желудочного, геморрагического, печеночного, печеночно-обтурационного, кишечно-обтурационного, интоксикационного, васкулярного
и т. д.). Понятно, что каждое из заболеваний включает
в себя несколько синдромов. Так, язвенное кровотечение состоит из васкулярного, геморрагического и язвенного синдромов, острый панкреатит — из панкреатического, васкулярного и интоксикационного синдромов
и т. д.
2. Установление различных сторон диагноза или
«частных диагнозов» — функционального и анатомического. Здесь особенно важно избежать догматического
подхода и стремления обязательно уложить симптомы
в известные и наиболее распространенные синдромы,
что является частой основой диагностических ошибок
(В. И. Катеров, 1960).
3. Синтез «частных диагнозов» в целостную картину,
то есть конкретный диагноз с предполагаемой топологией и патогенезом заболевания- Здесь особенно важно
избежать насилия над фактами при невозможности создания единой картины заболевания и высказать предположение о других сопутствующих болезнях.
Таким образом, ведущее значение в постановке диагноза имеет объединение симптомов по их патогенетической связи в тот или иной синдром, то есть патогенетический подход к построению диагноза. Далее
Б0
полученные при синтезе симптомов синдромы объ-
единяются в конкретную нозологическую форму болезни.
Другой особенностью постановки диагноза в неотложной хирургии является необходимость, помимо установления нозологической формы заболевания — холецистит, аппендицит, панкреатит и др., определения и
морфологической стадии болезни или фазы заболевания.
Без сомнения, динамика клинической картины может много сказать о степени морфологических изменений в пораженном органе. Однако проводимое лечение
нередко резко меняет клиническую картину заболевания, существенно не влияя на возникшие в органе морфологические изменения. Так, антибиотики и инфузионная терапия существенно ослабляют явления интоксикации при остром холецистите, но часто не влияют на
возникшие в органе деструктивные изменения. В то
же время надежность многих лабораторных тестов
снижена из-за отсутствия строгой специфичности целого ряда показателей. Поэтому 'часто возникает необходимость в применении более объективных методов
инструментальной диагностики. Ценность и достоверность их зависят от правильно установленного и выбранного клинического синдрома. Так, термография
брюшной стенки может помочь при наличии воспалительного синдрома в брюшной полости и не дает никакого результата при обтурационном или дискинетиче-
ском синдроме.
Применяющиеся в неотложной хирургии инструментальные методы можно чисто условно разделить на
две группы. Первая группа методов не связана с «агрессией» против организма, не приносит никакого вреда
пациенту и не имеет противопоказаний. К этой группе
относятся рентгенография, термографическая, ультразвуковая, радиоизотопная диагностика, электромиография, исследование электропроводности кожи и некоторые другие. Вторая группа методов связана с необходимостью проведения манипуляций в исследуемом органе
или полости. Эта группа методов имеет свои ограничения и противопоказания. К этой группе относятся фиб-
рогастроскопия, лапароскопия, колоноскопия, селективная артериография'. Таким образом, опираясь на синдромные проявления заболевания, выбирается метод
исследования. При этом целесообразно начинать с при¬
4*
51
менения более простых методов исследования, то есть
с методов первой группы, не связанных с «агрессией»
против организма и лишь при отсутствии четких данных
и необходимости уточнения полученной информации
перейти к более сложным методам второй группы. Следует подчеркнуть, что такие простые методы, как цветная термография (Ю. М. Герусов, И. Г. Чистяков,. 1970;
Н. С. Орлов, 1974; Р. Г. Панченков, И. Г. Чистяков,
1976), электромиография (Р. Ш. Шаймарданов. 1978),
исследование электрического сопротивления кожи
(С. С. Федотов, 1977; Б. М. Ворошилов, 1978), позволяют довольно точно определить локализацию воспалительного процесса в брюшной полости и даже вероятную
степень морфологических изменений в некоторых органах (червеобразный отросток, желчный пузырь). Однако для выяснения точной локализации патологического
процесса и уточнения морфологических изменений нередко необходимо применение эндоскопических и ар-
териографических методов исследования. Отсюда следует говорить не о конкуренции методов той или иной
группы, а о целесообразном их сочетании в показанных
случаях. При этом одни методы годны для первичной
ориентации и экспресс-диагностики, а другие — для
уточнения локализации и морфологии патологического
процесса.
Оценка функциональных возможностей органа является важной задачей предоперационного периода.
Однако в неотложной хирургии это еще недостаточно
разработанная глава. Справедливо признается, что
установление диагноза экстренного хирургического заболевания является показанием для срочной операции,
В то же время часто хирург испытывает чувство неудовлетворенности от срочно сделанной, но фатально
закончившейся операции. Принцип оценки функциональных возможностей организма не говорит об отказе
от операции в показанных случаях. Он лишь
напоминает о необходимости тщательно выбирать метод подготовки к операции, время ее выполнения и
наиболее щадящий оперативный вариант. Оценка функциональных возможностей легких, сердечно-сосудистой
системы, печени, почек и других органов и систем часто коренным образом заставляет менять время и объ*
62
ем операции, особенно у лиц пожилого и старческого
возраста.
• Операционная диагностика. Известно, что операция
является не только средством лечения, но и продолжением диагностического этапа. Операционная визуальная и пальпаторная диагностика для определения вида
и распространенности процесса и в настоящее время
имеет часто решающее значение. Визуализация операционной диагностики имеет большое значение в неясных диагностических случаях. Так, гастротомия и дуо-
денотомия с тщательным осмотром слизистой двенадцатиперстной кишки и желудка позволяют выявить источник кровотечения в виде плоской язвы, артериовенозного свища или трещин слизистой. Пальпация
также позволяет установить источник патологии в виде
полипа, внутристеночной опухоли, камня, инородного
тела и т. д. С помощью осмотра и пальпации выявля-
’ются измененные лимфатические узлы и зоны их распространения, что позволяет условно определить объем
и целесообразность предстоящей операции.
Однако, каким бы опытом ни располагал хирург,
осмотр и пальпация не могут быть окончательными критериями постановки диагноза. Ошибки, связанные с
такой диагностикой, зависят от методичности проводимого обследования, индивидуальных особенностей течения заболевания, опыта хирурга и многих других факторов. Эти ошибки можно4 исключить с помощью объективных методов субоперационной диагностики. К ним
следует отнести, в первую очередь, контрастные и бес*
.контрастные методы исследования (артериография,
порто- и спленопортография, холангиография), которые
завоевали широкую и заслуженную популярность среди
хирургов. В целом ряде областей хирургии, как, например, в хирургии внепеченочных желчных путей, контрастные методы занимают ведущее место в субоперационной диагностике. В последнее время все большее
распространение получает метод бесконтрастной диагностики состояния и морфологической структуры различных органов (желудка, желчного пузыря и внепеченочных желчных путей, кишечника и др.) с помощью
метода трансиллюминации, разработанного в Казани
И
йроф. М. 3. Сигалом и его сотрудниками, начиная С
1961 года. Метод основан на изучении морфологических
особенностей структуры органов в проходящем свете от
зонда-трансиллюминатора, находящегося в просвете ор-
гана или вне его. Он позволяет установить невидимые
при холангиографии камни в общем желчном протоке,
выявить полип в желудке, границы распространения
опухоли.
Верификация диагноза в неотложной хирургии часто
невозможна без применения методов субоперационной
функциональной диагностики. К ним следует отнести
динамическое определение давления в желчных путях,
портального давления, кровотока в экстраорганных и
внутриорганных сосудах-
Не менее важное значение в операционном диаг»
ностическом процессе имеет и морфологическая диагностика. Следует подчеркнуть, что при оценке операбельности обнаруженного опухолевого процесса следует
исходить из полученных объективных патоморфологических данных, а не на основании установления факта
обнаружения лимфатических узлов и таких критериев,
как их величина, плотность, подвижность и т. д. Известно, что увеличенные лимфоузлы при злокачественных
опухолях часто являются реакцией лимфоаппарата на
инфекцию, а не результатом метастазирования. Эксци-
зионная же биопсия имеет нередко решающее значение
не только при опухолях, но и при язвах желудка, циррозах печени и ряде других заболеваний. Нарушение
принципа морфологической верификации процесса нередко ведет к диагностическим и тактическим ошибкам.
Однако нередко окончательная операционная диагностика невозможна без обследования органа после предварительной анатомической мобилизации органа. Такая
-мобилизация носит бескровный характер, так как не
должна сопровождаться пересечением и перевязкой сосудов обследуемого органа. Так, очень сложно, а иногда
невозможно определить характер обтурации в терминальном отделе холедоха при пальпации немобилиэо-
ваниой двенадцатиперстной кишки. Бескровная мобилизация двенадцатиперстной кишки и головки поджелудочной железы делает доступной эту область для
М
точной визуальной и пальпаторной диагностики и поз*
воляет определить вероятную причину желчной непроходимости. Без мобилизации желудка иногда невозможно выявить множественные язвы желудка, полипы,
степень распространения опухолевого процесса. При
такой мобилизации желудка проводится его «скелети-
зация» по малой и большой кривизнам без пересечения
магистральных сосудов. Таким образом, часто анатомические особенности органа, его связочного аппарата
или расположение мешают объективно оценить патологический процесс и его распространенность. В этих случаях мобилизация обследуемого органа, без нарушения
кровообращения и лимфатического аппарата, является
важным и нужным этапом операционной диагностики.
Принцип возможно полного и раннего хирургического
устранения патологического очага был сформулирован
еще тогда, когда возникала и развивалась хирургия
острых воспалительных заболеваний брюшной полости
(В. М. Зыков, 1900; А. Гагман, 1901; И. И. Греков и
др., 1912; Н- И. Напалков, 1927: В. Н. Шамов, 1937).
Не потерял своего значения этот принцип и в настоящее
время. Однако при осуществлении этого принципа
должно соблюдаться главное правило: сначала спасти
жизнь больного, а затем думать о радикальности. Отсюда резекция желудка при перфоративной язве во многих случаях представляется сомнительной из-за вероятности развития послеоперационных осложнений или
утяжеления состояния больного. То же самое касается
и кровоточащей язвы желудка и двенадцатиперстной
кишки. Нередко удалить патологический очаг из-за
выраженного перипроцесса невозможно или рискованно.
В таких случаях применяется метод отграничения воспалительного процесса с помощью сальника, марсупи*
лизации органа, тампонады. Применяется тампонада
остаточной гнойной полости и после удаления гнойного
очага. При этом рационально выбранный метод тампонады, кратчайший путь выведения тампонов, а главное
правильно выбранное время смены и удаления тампонов играют нередко решающую роль в исходах оперативного лечения.
Известно, что удаление патологического очага при
острой катастрофе в брюшной полости не является окон-
66
чательной процедурой в хирургическом лечении. Не
менее важным является тщательный туалет брюшной
полости или ее санация. Она заключается в тщательном
удалении экссудата, сгустков крови, кишечного содержимого, желчи и фибрина. Фибрин, оставшийся в брюшной полости, является источником формирования остаточных гнойных полостей в брюшной полости и дополнительным фактором интоксикации за счет фиксированного на нем. токсина (Н. М. Баклыкова, 1964j
К. С. Симонян, 1971). Однако удаление фибрина нужно
производить очень осторожно, не нарушая мезотелиаль-
ный покров брюшины. Это легче достигнуть с помощью
многократных прополаскиваний брюшной полости антисептиком при наличии разлитого воспаления брюшины.
После такого орошения брюшины фибрин легко удаляется с ее поверхности. При локальных фибринозных наслоениях заинтересованная область многократно
смачивается влажными салфетками, после чего фибрин возможно удалить. В остальных случаях жидкий
патологический экссудат лучше удалить с помощью
электрического отсоса. С целью санации брюшной
полости при распространенных воспалительных процессах брюшины показано промывание брюшной полости
и в послеоперационном периоде. Такая процедура способствует удалению из брюшной полости продуктов
белкового распада, токсических веществ, бактерий и
фибрина. С этой же целью в неотложной хирургии
должно строго соблюдаться правило дренирования
области воспалительного процесса даже после удаления
основного очага. Воспалительный экссудат, лимфа,
токсические вещества и бактерии продолжают накапливаться в зоне операционного вмешательства и после
удаления пораженного органа. Поэтому в большинстве случаев показано рациональное дренирование
трубками из инертных синтетических материалов анатомической области удаленного патологического очага
и активная аспирация экссудата по Редону. Такая
местная активная послеоперационная санация является
более существенной, чем рутинное назначение антибиотиков.
Декомпрессия полых органов после операции на них
была и остается ведущей в лечении неотложных хи¬
56
рургических больных. Она начинается до операции о
лечебной и диагностической целью- Опорожнение желудка перед операцией является профилактикой многих
осложнений во время проведенияшаркоза. Декомпрессия
желудочно-кишечного тракта является важной составной
частью оперативного вмешательства при перитоните,
непроходимости, ишемической болезни кишечника
(Н. И. Напалков, 1927; Л. А. Беляев, 1962; Ю. М. Деде-
рер с соавт., 1971; Ю. М. Гальперин, 1975; П. Е. Нечитай-
ло, 1978, и др.). Она необходима при желчной гипертензии, сопровождающей острый холецистит и панкреатит. Декомпрессия нужна после операции на полых
органах и при невоспалительных заболеваниях, нЛри-
мер, при операциях на желудке по поводу кровоточащей
язвы или портальной гипертензии, кишечной непроходимости. Практически принцип декомпрессии полых
органов и систем является в неотложной хирургии универсальным, только область ее применения меняется в зависимости от патологии. Причем декомпрессия может быть
предоперационной, операционной и послеоперационной.
При этом необходимо строго придерживаться правила —
не оставлять полый орган на операции и в ближайшие
дни после операции переполненным. В каждом конкретном случае эта задача решается индивидуально, но
желательно без вскрытия просвета полого органа. Поэтому более перспективной является «закрытая» транс-
назогастральная, трансдуоденоеюнальная или трансректальная интубация. Декомпрессивная терапия может
быть механической (с помощью зондов различной конструкции и катетеров), лекарственной (с помощью
различных кишечных стимуляторов) и физической
(электростимуляция). Декомпрессия уменьшает интоксикацию, улучшает кровоснабжение и лимфообращение
пораженного органа, устраняет патологические рефлексы, способствует заживлению швов и анастомозов.
Многолетнюю дискуссию по вопросу борьбы с инфекцией в брюшной полости можно считать закончившейся. Большинство хирургов считает целесообразным
после удаления гнойного очага закрытие брюшной
полости наглухо. При наличии в брюшной полости воспалительных изменений, выходящих за пределы пораженного органа, применяется после удаления патологи¬
5?
ческого очага введение трубок или микроирригаторов
для местного подведения антибиотиков, то есть местная
борьба с инфекцией. Это правило сейчас используется
при остром деструктивном аппендиците, холецистите,
панкреатите, сопровождающихся изменениями в брюшине. Исследования последних лет показали,что при
воспалительных процессах брюшины часто развивается
и бактериемия (В. Д. Федоров, 1971; П. Н. Зубарев,
1974: Б. Д. Савчук, 1975; Me Lean, 1962, и др.). Это
говорит о том, что при осложненных формах воспалительных процессов в брюшной полости необходима борьба с инфекцией и в сосудистом русле, что является
профилактикой или лечением септического шока. Появление септического шока при распространенных процессах в брюшной полости предусмотреть невозможно.
Поэтому целесообразно- с лечебной целью внутривенное введение антисептиков, антибиотиков и ингибиторов
протеолиза, усиливающих действие антибактериальной
терапии (А. Н. Ревин, 1977). Показания к тампонаде
за последние годы резко ограничены. Однако в целом
ряде случаев рациональная тампонада просто необходима. Она показана в случаях наличия сформировавшейся гнойной полости, неполного удаления пораженного воспалением органа, при сомнении в надежности
наложенных швов.
Принцип адекватной и интенсивной коррекции гомеостаза получил широкое распространение последние
15—20 лет в связи со становлением реаниматологии
как самостоятельной науки. Он является предметом
всестороннего обсуждения во многих специальных руководствах по анестезиологии и реаниматологии
(Т. М. Дарбинян, Г. Н. Цыбуляк, Ю. Н. Шанин,
Э. В. Элин, Л. Вестермарк, А. Ван дер-Влиит и др.).
Здесь же хотелось бы подчеркнуть, что лечение больного
с острой хирургической патологией в животе должно
проходить при активном участии реаниматологов и
анестезиологов с самого начала их поступления. Уепех
в лечении этого контингента больных зависит не только
от своевременно и правильно выбранного оперативного
вмешательства, но и от адекватной и интенсивной коррекции гомеостаза до, во время и после операции. Следовательно, неотложная хирургия —это еще и неотложная интенсивная терапия. Ее задача не ограничи*
68
вается только пассивной коррекцией гомеостаза, но
заключается и в активной борьбе с интоксикацией, ответственной за тяжелые нарушения постоянства внутренней среды организма. В настоящее время возможности дезинтоксикационной терапии расширились и
вышли далеко за пределы инфузионно-трансфузионной
терапии. Сюда относятся, кроме указанных ранее, методы неспецифической дезинтоксикационной терапии с
помощью форсированного диуреза, лимфо- и гемосорб-
ции.
В заключение хотелось бы сказать, что в задачу
данной главы не входила оценка того или иного метода
лабораторной, инструментальной диагностики и метода
лечения. Ее целью является систематизация диагностической и операционной программ в неотложной хирургии. С нашей точки зрения, создание последовательной
и единой программы лечебно-диагностического процесса,
хотя и носит условный характер, может помочь в последовательном проведении лечения у очень тяжелого контингента больных в условиях экстренного дежурства.
Мы хотели бы при этом подчеркнуть, что преимущественное выделение того или иного принципа этой программы и пренебрежение другим часто обрекают все
усилия врача на неудачу. Поэтому результаты лечения
больных в неотложной хирургии определяются умелым
выполнением с учетов индивидуальных особенностей
течения болезни основополагающих принципов лечения
неотложных хирургических заболеваний.
ГЛАВА V
ОСТРЫЙ АППЕНДИЦИТ
Проблема острого аппендицита продолжает оставаться наиболее актуальной в неотложной хирургии.
Это определяется большой распространенностью заболевания, необходимостью выполнения очень значительного количества операций (от 900 тыс. до 1,5 млн. в
год —А. Н. Поляков, 1973), нередким развитием тяжелых послеоперационных осложнений,
Характерный анамнез, боль и локальная болезненность в правой подвздошной области, местное раздражение брюшины и повышение температуры — вот основные и наиболее постоянные признаки острого аппендицита. При установлении симптома перемещения болн
из эпигастральной области в правую подвздошную
диагноз аппендицита не. вызывает сомнений. Клиническая формула, что «анамнез и боль в отдельности и тем
более в сочетании с другими признаками — острый аппендицит без сомнений, анамнез в сочетании с любым
другим признаком — острый аппендицит вероятен»
(Г. Н. Захарова, В. П. Шехов, 1974), подтверждается
опытом неотложной хирургии аппендицита. При этом
следует помнить, что указанные признаки позволяют поставить диагноз острого аппендицита, но не дают возможности установить морфологическую формулу заболевания. Клинику деструктивного аппендицита может симулировать даже баугиноспазм в силу общности нервно-рецепторного аппарата плеоцекального отдела кишечника.
Отсюда следует, что во многих неясных случаях не следует ограничиваться простым наблюдением, а применять мероприятия и методы по исключению диагноза
недеструктивного аппендицита.
Примерный план диагностической программы прв
остром аппендиците следующий:
1. Тщательно собрать анамнестические данные.
2. Исключить соматическое заболевание, симулирующее острую патологию в брюшной "полости (диабет,
почечная недостаточность, цирроз, гепатит и др.).
3. Исследовать состояние дыхательной системы, а
при необходимости произвести и рентгеноскопию грудной клетки.
4. Исследовать функцию сердечно-сосудистой системы.. Для этого определяется частота и характер пульса,
измеряется артериальное давление, а у лиц пожилого
возраста при необходимости делается и ЭКГ.
5. При подозрении на урологическое заболевание
необходимо сделать обзорный снимок почек, урографию
и выполнить хлорэтиловую пробу по Борисову, которая снимает на короткое время боли при колике мочеточника.
6. Путем пальпации, перкуссии живота и изменения
60
положения больного выявить симптомы, характерные
для острого аппендицита.
7. Сделать анализ крови и общий анализ мочи.
8. При сомнительных данных произвести:
A. Ректальное исследование, а у женщин и вагинальное обследование.
Б. Обзорный снимок брюшной полости.
B. Измерение ректальной и подмышечной температуры (увеличение этой разницы больше 1° говорит о
воспалительном процессе в брюшине).
Г. Применение цветной термографии с помощью
жидких кристаллов. В медицинской практике в качестве жидких кристаллов используются производные
холестерина. В жидком состоянии они дают различную
гамму цветов, реагируя на минимальные изменения температуры в пределах 0,1—0,001° С, образуя своеобразную цветную карту распределения температур на поверхности кожи человека. Термотропные композиции
жидких кристаллов использовались в диагностических
целях впервые Ю. М. Герусовым и И. Г. Чистяковым
(1972), а затем А. Г. Баировым и соавт. (1973),
И. Г. Чистяковым и Р. Т. Панченксвым с соавт. (1976).
Причем указанные авторы применяли экспериментально
приготовленные композиции. В нашей клинике С. С. Федотов провел термографическое обследование передней
брюшной стенки с помощью жидких кристаллов холестерического типа в температурных пределах от 36 до
41° С, выпускаемых в серийном производстве Всесоюзны^ НИИ монокристаллов (директор — С. Е. Ковалев).
Им проведено хромотермографическое обследование
20 здоровых людей, 115 больных острым аппендицитом
н 19 пациентов с коликами различной этиологии. Термографические данные сопоставлялись с клинико-лабораторными исследованиями и операционными находками. При обследовании применялась следующая методика. После адаптации кожных покровов больного к
температуре окружающей среды в течение 10—15 минут наносился экран черной тушью без предварительной обработки кожи. После высыхания туши мягкой
кистью наносился слой жидких кристаллов, предварительно расплавленных в водяной бане при температуре
50° С. Через 5—10 минут читалась хромотермограмма
распределения температуры в исследуемой области. По
61
данным С. С. Федотова, при остром простом аппендиците хромотермографическая картина выражалась в
появлении пятен и полос зелено-голубого цвета как в
правой, так и левой подвздошной областях. Однако в
правой подвздошной области интенсивность окраски
бывает более значительной, чем в симметричном участке
слева.
У больных с деструктивным аппендицитом температура в подвздошных областях повышалась от 37,8 до
41,0° С. При флегмонозном аппендиците появлялась
общая зеленая окраска правой подвздошной области с
участками синего или фиолетового цвета над очагом
деструкции. При гангренозном аппендиците кожная температура в правой подвздошной области повышалась до
41,0° С. Термографически это проявлялось в виде участка черного цвета на общем фиолетовом фоне. При диффузных аппендикулярных перитонитах термографическая
картина была полиморфной. Обычно область повышенной температуры соответствовала скоплению выпота в
правом боковом канале живота или над лоном. Термографически появлялись зоны сине-голубого или сине-
фиолетового цвета, причем фиолетовый цвет над очагом деструкции был наиболее насыщенным. При почечных и аппендикулярных коликах температура в нижних
отделах не менялась, что термографически проявлялось
в появлении пятен и полос красного цвета. Проведенная
клиническая оценка жидкокристаллической термографии дает возможность использования этого метода с
целью экспресс-диагностики в неясных случаях. Причем метод отличается простотой, дешевизной, быстротой
получения информации и возможностью использования
для экстренной диагностики.
Д. Измерение электрокожного сопротивления (ЭКС)
применяется в клинической практике как метод диагностики различных хирургических заболеваний и, в частности, аппендицита. При остром аппендиците отмечаемся максимальное уменьшение электрокожного сопротивления в правой подвздошной области (М. Б. Дунаевский, 1956; Н. Э. Татарский, 1957; Л. В. Ложкова,
Н. А. Смирнова, 1960 и др.). И имеются сведения, что
степень снижения ЭКГ при остром аппендиците прямо
пропорциональна степени болевых ощущений (Б. М. Ворошилов, 1978),
Показания ЭКС могут быть использованы и для
оценки морфологических изменений в отростке при
остром аппендиците. Так, при гиперемии червеобразного
отростка наблюдается снижение электрокожного сопротивления, а при развитии деструктивных изменений в
отростке показатели ЭКС, наоборот, возрастают
(С. С. Федотов, 1977; Б. М. Ворошилов, 1978). Можно
считать измерение электрокожного сопротивления простым и доступным вспомогательным методом диагностики
острого аппендицита.
Ж. Электромиография брюшной стенки. Сотрудник
нашей клиники Р. Ш. Шаймарданов провел изучение
электромиографической картины всей передней брюшной
стенки у 38 больных различными клиническими формами острого аппендицита. Для усиления и регистрации биопотенциалов использовался двухканальный венгерский электромиограф «Медикор». Установлено, что
при остром аппендиците наблюдается «феномен электромиографической асимметрии», заключающийся в
преобладании электрической активности мышц на стороне, противоположной патологическому процессу. При
развитии местного перитонита отмечается слабая фоновая электрическая активность над местом патологического очага и более выраженное усиление ее при фи-
аиологических нагрузках (кратковременный подъем ног
или головы). Полученные при ЭМГ исследовании брюшной стенки данные показывают, что этот метод позволяет определить локализацию воспалительного процесса в брюшной полости, а также его степень и распространенность.
3. Лапароскопия. В последнее время с целью уточнения диагноза острого аппендицита и для исключения
ненужной операции стали применять лапароскопию
(В. М. Буянов, 1977; Э. Н. Айтаков, П. И. Острин, 1977
и др.). Сотрудник нашей клиники И. А. Ким выполнил
лапароскопию у 29 больных с подозрением на аппендицит с дифференциально-диагностической целью. На
основании полученных данных различают прямые и косвенные лапароскопические признаки острого аппендицита (В. С. Савельев, В. М. Буянов и соавт., 1978),
К прямым лапароскопическим признакам острого аппендицита относятся изменения, обнаруживаемые при осмотре и инструментальной «пальпации» червеобразного
63
отростка. Косвенные признаки заключаются в различных проявлениях местного перитонита в правой подвздошной ямке (изменение брюшины, выпот, фибрин
и т. д.). Несомненно, что эндоскопическая диагностика
острого аппендицита, проводимая в сомнительных случаях и особенно у пожилых больных, дает возможность
избежать многих ненужных и опасных в пожилом воз»~
расте операций.
Особенности клинической картины острого аппендицита
Острый аппендицит в детском возрасте. Когда говорят об особенностях клинического течения острого аппендицита в детском возрасте, то, в первую очередь,
имеют в виду клинические проявления аппендицита у
детей первых 3 лет жизни. Именно в этой возрастной
группе клиническая картина заболевания отличается полиморфизмом и потому бывает наиболее сложной и
запутанной. Ведущей особенностью клиники при этой
патологии является то, что общие явления превалируют
над местными. Это проявляется в беспокойном поведении детей, нарушении сна, нарастающих болях без определенной локализации, частой рвоте и тошноте, высокой температуре до 38,5—39° С, тахикардии, появлении
жидкого стула (В. И. Колесов, 1972; Ю. Ф. Исаков,
С. Я. Долецкий, 1978). При этом локализация болей
наблюдается не в правой подвздошной области, а вокруг пупка. Выявить локализацию напряжения брюшной
стенки и его истинный характер при беспокойном поведении ребенка без проведения дополнительных мер
невозможно. Поэтому рекомендуется начинать пальпацию живота со здорового места, проводить одновременную сравнительную пальпацию в обеих подвздошных областях, а главное исследовать ребенка во время
сна. Пальпация во время сна позволяет выявить «симптом отталкивания». Для ускорения проведения осмотра
рекомендуется применение у детей медикаментозного
сна (А. Ф. Дронов, Н. Я. Романенко). С этой целью
после очистительной клизмы вводится. 3% раствор хло-
рангидрата из расчета 10 мл на год жизни. Сон наступает через 15—20 минут; в это время проводится обследование живота для выявления локальной болезненности
и истинного напряжения брюшной стенки, сохраняющихся во время сна,
64
Острый аппендицит в пожилом и старческом возрасте
характеризуется ранним развитием деструктивных изменений в отростке и склонностью к тромбообразованию
(А. В. Смольянников, 1963; Н. С. Утешев с соавт.,
1975). Другой характерной особенностью аппендицита в
этом возрасте является слабая выраженность таких основных симптомов острого аппендицита, как боль, болезненность при пальпации и выраженность напряжения брюшной стенки. Часто боли при аппендиците у стариков в начале заболевания отличаются неопроделенной
локализацией и малой интенсивностью. По мере прогрессирования заболевания боли локализуются в правой
подвздошной области. Температура остается значительный промежуток времени нормальной или слегка повышенной, а количество лейкоцитов в крови — без изменения. При этом большее значение больные придает
общему недомоганию, задержке стула, сухости языка.
Видимо, все же следует говорить не столько об атипич-
ности клинической картины заболевания в этой группе, сколько о недостаточной выраженности клинических
признаков болезни.
Острый аппендицит у беременных в первые 3 месяца беременности не имеет существенных клинических
особенностей. После этого периода с увеличением сроков
беременности возрастают и трудности»диагностики аппендицита. Для острого аппендицита беременных наиболее характерным является наличие внезапно появившихся и постоянных болей без иррадиации, локализующихся в нижних отделах правой половины живота
(Г. Д. Шушков, 1968; В. И. Колесов, 1972). Для выявления локализации болезненности целесообразна пальпация больной на левом боку. Установить другие симц-
томы заболевания часто сложно, а иногда и невозможцр.
Поэтому ранняя госпитализация и динамическое наблюдение за этим контингентом больных просто необходимы.
Хирургическая тактика
1. Острый аппендицит является абсолютным показанием к срочному оперативному вмешательству.
2. Продленное динамическое клиническое наблюдение (до 24-часов) возможно у молодых женщин и деау-
5 М-843
65
шек при не совсем ясной клинической картине заболевания. У них при этом целесообразно выполнить с диф- 1
ференциально-диагностической целью внутритазовую
новокаиновую блокаду по Л. Г. Школьникову —
В. П. Селиванову. Если после блокады боли в правой
подвздошной области при пальпации и вагинальном
обследовании сохраняются, то речь идет об аппендиците. При воспалительных заболеваниях гениталий боли
после блокады утихают (Н. Я. Романенко, 1978).
3. Противопоказанием к срочной операции является
наличие плотного, неподвижного аппендикулярного
инфильтрата.
4. При неясном диагнозе ближайшие 12—24 часа
должны быть использованы для его уточнения и проведения дополнительных методов диагностики. К ним относятся: применение для установления диагноза жидких
кристаллов, измерение электрокожного сопротивления,
электротермометрии, электромиографии, лапароцентеза, лапароскопии, в зависимости от метода, наиболее
разработанного в данном медицинском учреждении.
5. Если по каким-то причинам эти методы невозможно применить или они дают неясные результаты,
а диагноз острого аппендицита исключить невозможно,
показана операция с диагностической целью.
6. Отказ от госпитализации больного с диагнозом
«острый аппендицит» должен быть строго обоснован и
сделан лишь после тщательного осмотра больного и
проведения необходимых анализов.
7. Больные с осложненной формой острого аппендицита (перитонит, выраженная интоксикация)* должны быть для операции подготовлены, но в кратчайшие
сроки. При этом необходимо помнить о компенсации не
только водно-электролитных расстройств, кислотно-щелочного состояния, но и сердечно-сосудистой системы
и почек.
8. При наличии у больного аппендицитом заболевания, серьезно отягощающего его общее состояние (инфаркт миокарда, кровоизлияние в мозг, декомпенсация
кровообращения) и делающего высоким риск оперативного‘вмешательства, допустимо в исключительных случаях короткое время применять консервативный метод
лечения (холод, антигистамннные препараты, спазмолитики, антибиотики). Основным условием такой те¬
66
рапии является короткий период времени с начала заболевания, а главное возможность осуществления квалифицированного врачебного и лабораторного контроля.
9. Беременность является не противопоказанием к
операции при остром аппендиците, а, напротив, настоятельной необходимостью, особенно во второй половине
беременности, когда клиническая картина заболевания
является стертой.
10. Частой причиной ошибок при остром аппендиците является не излишек, а недостаток применения
всего арсенала диагностических методов и приемов и
отсюда запоздалая диагностика (Г, Д. Шушков, 1968).
Обезболивание
У большинства больных при наличии неосложненного
острого аппендицита операция может быть выполнена
под местной анестезией, и лишь в 20—25% случаев следует прибегать к наркозу. В таких случаях эндотрахе-
альный наркоз является «самым лучшим, удобным и
безопасным методом» (В. И. Колесов, 1972). Этот
вид обезболивания следует применять у детей, у крепких, физически развитых мужчин, у лиц с обильной
подкожной клетчаткой, при осложненном остром аппендиците. При необходимости ревизии брюшной полости
вовремя операции лучше воспользоваться масочным наркозом с нейролептаналгегиками. Не следует забывать,
что переход от местной анестезии к наркозу всегда хуже,
чем наркоз, примененный с самого начала операции.
Операционный доступ
Вид операционного доступа и его объем должны
определяться в зависимости от характера воспалительного процесса в брюшной полости, диагностированного
до операции, найденных во время операции патологоанатомических изменений, а также от вида и объема экссудата. У большей части больных аппендэктомия мажет
быть произведена из косого переменного разреза Вол-
ковича — Дьяконова. Длина разреза должна составлять
не менее 6—8 см, т. е. достаточной с самого начала
операции. Применение маленьких операционных разрезов является грубейшей ошибкой оперативной техники.
5*
67
Нужно всегда помнить» «маленький рубец украшает
больного, но маленький разрез не украшает хирурга.
Лучше, когда ошибками хирурга занимается косметолог, чем патологоанатом» (Г. Л. Ратнер, 1976).
В ряде случаев этот разрез не дает полноценного
доступа, сопровождается сильной травматизацией и загрязнением тканей, что ведет к нагноению раны. Наиболее частой ошибкой здесь является не выбор метода
расширения, а позднее его применение. Пересечение
травмированных мышц после многократных и безуспешных попыток удалить находящийся в обширных
спайках отросток создает дополнительные благоприятные условия для развития гнойной инфекций. Кроме
того, из типичного аппендэктального разреза при операции, проходящей под местной анестезией,- сложно
произвести визуальную ревизию соседних отделов
брюшной полости для решения вопроса о распространенности воспалительного процесса, а затем произвести
санацию брюшной полости.
В подобных случаях необходимо до попыток удаления отростка расширить операционную рану. В нашей
клинике анатомически, обоснованным и более «физиологичным» считается расширение раны по Богуславскому медиально с пересечением передней и задней
стенок влагалища прямой мышцы и • последующим отведением ее кнутри. При крайней необходимости прямую мышцу посл.е предварительного прошивания можно пересечь.
При наличии признаков перитонита аппендэктального
происхождения операцию с самого начала следует проводить из лапаротомного разреза под наркозом.
Операционная диагностика
Операционная диагностика острого аппендицита
может быть визуальной, пальпаторной и инструментальной. Визуальная и пальпаторная операционная диагностика включает обнаружение отростка, оценку изменений в нем и характера воспалительных изменений в
соседних отделах кишечника, состояния висцеральной
и париентальной брюшины, вид и объем экссудата. Для
этого после производства ретроцекальной новокаиновой*
блокады необходимо найти на слепой кишке место слия¬
ния продольных лент толстой кишки или одну переднюю
свободную ленту слепой кишки. Иногда для обнаружения отростка необходимо мобилизовать слепую и восходящую кишку, так как отросток нередко располагается
ретроцекально, забрюшинно или замурован в спайки.
При отсутствии макроскопических изменений в отростке необходима ревизия терминального отдела тонкого кишечника на расстоянии 1 см от слепой кишки
для исключения воспаления Меккелева дивертикула, терминального илеита и определения состояния органов
правой половины живота. В первую очередь следует
обратить внимание на состояние правых.придатков, восходящей и печеночного угла толстой кишки, двенадцатиперстной кишки и желчного пузыря.
Поводом для осмотра указанных органов является
вид и характер обнаруженного экссудата. Так, экссудат зеленовато-серого цвета характерен для прободной
язвы желудка, с примесью желчи — для патологии желчного пузыря и поджелудочной железы, геморрагический — для панкреонекроза, ишемической болезни кишечника и непроходимости.
Следует обратить внимание и на возможность развития первично-гангренозной формы аппендицита
(А. М. Абрикосов, А. И. Струков, 1950, 1954). В этих
случаях речь идет об отсутствии воспалительного процесса в отростке и развитии гангрены ишемического
генеза, т. е. ишемического аппендицита. Такие формы
аппендицита имеют «коварную» клиническую картину
и являются, вероятно, следствием эмболизации артерии червеобразного отростка, особенно у лиц пожилого
и старческого возраста, и даже в результате нарушения общей гемоциркуляции (3. М. Сигал, 1978).
Ишемический характер деструктивных аппендицитов
объясняет и частое появление кишечных свищей после
этих форм аппендицита, поскольку в таких случаях дополнительно нарушается кровоток в сосудистой ветви,
идущей к куполу слепой кишки. С целью профилактики
подобных осложнений предлагается в сомнительных
случаях проверка кровотока в слепой кишке путем
трансиллюминационной вазоскопии или с помощью спет
циального аппарата для определения внутристеночного
давления в кишке (Ш.З. Аджиев, 1978).
69
Удаление червеобразного отростка
1. Перед перевязкой брыжейки отростка в нее вводят 5—10 мл '/<% раствора новокаина. Брыжейку отростка при остром аппендиците следует пересечь по
частям путем парциального прошивания и перевязывания.
2. Основание червеобразного отростка пережимается и перевязывается обязательно только кетгутом при
отсутствии инфильтрации у основания. При наличии
инфильтрата у основания для избежания прорезывания
лигатуры целесообразно продольно рассечь серозу, изолированно перевязать слизистую кетгутом и ^атем прикрыть это место за счет оставшегося участка серозы
по типу «двубортного пиджака».
3. Культя червеобразного отростка после смазывания йодной настойкой погружается в кисет при помощи
серо-серозного кисетного шва. Кисет не должен быть
большим и обязательно прикрыт сверху z-образным
швом. При тонкостенной или раздутой слепой кишке
кисет лучше наложить атравматической иглой. При
инфильтрированной слепой кишке отросток лучше погрузить за счет отдельных серо-серозных швов и это
место зафиксировать к париетальной брюшине.
4. При наличии значительных сращений в дистальной части червеобразного отростка не следует прибегать
к стандартной методике, а удалять отросток ретроградно. Для этого отросток вначале пересекается у основания, перевязывается и погружается в кисет, прикрытый
z-образным швом. Затем рассекают спайки, по частям
перевязывают и пересекают брыжейку и производят
удаление отростка. Необходимо после выделения и удаления тщательно проверить, полностью ли удален отросток и особенно его верхушка.
‘5. Обязательным этапом операции является полное
удаление экссудата и промывание области операции
раствором антисептика.
6. У больных с аппендицитом, сочетающимся с подвижной слепой кишкой, ориентация ведется по большому сальнику и поперечноободочной кишке. У подобных
больных после аппендэктомии необходимо фиксировать
подвижную слепую кишку, подшивая ее к париетальной брюшине и мышцам правой подвздошной ямки
(А. И. Чалганов, 1978),
70
Показана ли аппендэктомия при не подтвердившемся
во время операции диагнозе острого аппендицита?
Существует много противоречивых суждений о целесообразности «попутных» аппендэктомий при неподтвер-
дившемся диагнозе острого аппендицита. Анализ ближайших и отдаленных результатов говорит о том, что
аппендэктомия при неподтвердившемся диагнозе острого
аппендицита является целесообразной и оправданной,
а отказ от нее следует рассматривать как тактическую
ошибку (А. М. Карякин, Г. П. Шипунов, 1978). Гистологические исследования показали, что визуальная,
макроскопическая диагностика часто оказывается обманчивой. Даже при наличии флегмонозных изменений в
отростке хирург может расценить его как неизмененный.
Не следует при этом забывать о возможности сочетанных воспалительных заболеваний в двух органах.
Показания к тампонаде. Тампонада брюшной полости после аппендэктомии производится по особым показаниям:
1. При невозможности полного удаления источника
инфекции.
2. При вскрытии периаппендикулярного абсцесса.
3. При сомнениях в надежности гемостаза или при
паренхиматозном кровотечении из ложа червеобразного отростка.
4. При возможности несостоятельности швов, погружающих культю червеобразного отростка, вследствие
инфильтрации купола слепой кцшки.
5. При наличии ретроцекального аппендицита, осложненного нагноением забрюшинной клечатки.
Показания к дренированию. 1. При деструктивном
аппендиците и местном перитоните показано подведение к области патологических изменений полихлорвини-
лового дренажа для внутрибрюшной инфузии антибиотиков.
2. При аппендиците, осложненном диффузным перитонитом, показано введение 2—3 полихлорвиниловых
дренажей проколом брюшной стенки на разных уровнях для внутриперитонеальной инфузии антибиотиков.
3. При аппендиците, осложненном перитонитом, после санации иногда показано введение через отдельный
разрез в малый таз резиновой трубки и марлево-перчаточного «сигарного» дренажа.
71
4. Наличие разлитого перитонита является показанием для проведения метода интраперитонеальной анти-
биотиковой перфузии.
Ушивание послеоперационной раны. 1. Для достижения герметичности раны брюшину и мышцы после
аппендэктомии следует зашивать не послойно, а
вместе.
2. Дренирование брюшной полости для лучшего заживления раны следует производить отдельным проколом рядом с основной раной.
3. При значительном загрязнении операционной
раны следует чаще прибегать к наложению первично
отсроченных швов. При этом в подкожную клетчатку
поверх редко ушитого апоневроза укладывается тампон,
смоченный антисептиком. Затягивание швов кожной
раны производится на 4—5 день при отсутствии признаков воспаления в ране.
4. При тампонаде брюшной полости брюшная стенка
ушивается до тампона так, чтобы не сдавить его и не
нарушить кровообращения в тканях.
~ Послеоперационный период
- 1. Сроки окончания дренирования и тампонады:
а) тампоны должны подтягиваться, начиная с 4—
5 дня, и удаляться не ранее 8—9 дня в зависимости от
состояния больного;
б) не следует вводить в брюшную полость тампоны,
смоченные мазью Вишневского;
в) не следует торопиться закрывать свищевой ход
при наличии температуры, даже при отсутствии болей в
области операционной раны;
г) удалять микроирригаторы из брюшной полости
лишь после ликвидации воспалительных явлений в
брюшной полости, но не ранее 4—5 дня.
2. Выбор антибиотика. Известно, что у подавляющего числа больных воспалительный процесс при остром осложненном аппендиците вызывается в основном
кишечной палочкой (44% случаев), кишечной палочкой
в ассоциации (14,3%) или стафилококком (32%). Кишечная палочка оказалась наиболее чувствительной к
канамицину *(92%), неомицину (88%), ампициллину
(68%), левомицетину, олеоморфоциклину (43%), ста¬
72
филококк же—к ампициллину (74%), канамицину
(70%), эритромицину (68%), неомицину (63%), тетрациклину (61%). При этом 95% высеваемой при
остром аппендиците флоры не чувствительно к пенициллину и стрептомицину (Н. А. Мизуров, 1978).
Поэтому однократного введения антибиотика при осложненном аппендиците явно недостаточно. Отсюда и
должна строиться при остром аппендиците рациональная антибиотикотерапия.
A. При простом и флегмонозном аппендиците у пациентов молодого и среднего возраста можно в боль-'
шинстве случаев обойтись без антибиотика, если нет
сопутствующих заболеваний. У лиц старше 60 лет
целесообразно назначить внутримышечно неомицин,
мономицин или ампициллин.
Б. При деструктивном аппендиците, осложненном
местным перитонитом, эти антибиотики следует вводить через микроирригатор в брюшную полость 2—3
раза в день и дополнительно внутримышечно.
B. При деструктивном аппендиците, осложненном
диффузным перитонитом, целесообразнее применить
комбинацию антибиотиков. При этом в брюшную полость через микроирригаторы вводится мономицин или
неомицин по 1 г 2 раза в сутки в 150—200 мл 1/4%
раствора^ новокаина, а внутримышечно ампициллин или
метициллин по 0,5 г 4—6 раз в сутки или пенициллин
по 2—3 млн. ед. 6 раз в сутки.
Г. При деструктивном аппендиците, осложненном
перитонитом, лечение проводится путем антибиотиковой
перфузии брюшной полости канамицином до 6 г в сутки.
Кроме того, внутривенно вводится другой антибиотик:
ампициллин, оксациллин, метациллин по 0,5 г 4—6 раз
в день или пенициллин до 40—60 млн. ед. в сутки.
Аппендикулярный инфильтрат
Одним из частых осложнений острого аппендицита
является инфильтрат и абсцесс. Частота этого осложнения колеблется от 0,3 до 3,4% (Н. И. Блинов, 1970;
В. И. Колесов, 1972; Н. М; Хачатурян, 1977; М. В. Портной, 1978, и др.). Клиническими признаками инфильтрата является обнаружение при пальпации болезненной воспалительной опухоли и наличие в анамнезе
73
предшествующего приступа болей в правой подвздошной
области. Примерно у половины больных ' инфильтрат
спускается в полость таза и четко определяется при паль*
цевом исследовании прямой кишки. Этот симптом является достоверным признаком инфильтрата, позволяющим проследить и стадии его развития (абсцедирование
и рассасывание). Следует помнить при обнаружении
опухоли в правой подвздошной области у больных пожилого возраста о 'возможности опухолевого процесса.
Известно, что 30% больных раком толстой кишки
экстренно госпитализируется с подозрением на острый
аппендицит и инфильтрат аппендикулярного происхождения (Н. М. Хачатурян, 1977).
Тактика хирурга при аппендикулярном инфильтрате
Больные с инфильтратами аппендикулярного ‘происхождения подлежат консервативному лечению, если
нет признаков абсцедирования. Оно заключается в
следующем:
а) местное применение холода до нормализации
температуры;
б) через 1,5—2 недели назначается УВЧ, теплые клизмы, солюкс, алоэ, лидаза;
в) производство внутритазовой новокаиновой блокады 100—150 мл 1/4% раствора новокаина с добавлением 10 мг трипсина;
г) внутримышечное введение антибиотиков амино-
гликозидов (мономицина, канамицина, гентамицина),
а в тяжелых случаях в сочетании с пенициллином или
синтетическими пенициллинами внутривенно;
д) строгий постельный режим;
е) диета, не вызывающая усиления перистальтики и
процессов брожения.
Оперативное лечение. Сохранение высокой температуры тела, возрастание лейкоцитоза, появление симптомов раздражения брюшины, напряжения мышц брюшной стенки, инфильтрация стенок прямой кишки при
ректальном исследовании свидетельствуют об абсцедировании аппендикулярного инфильтрата. Это является
показанием к немедленной операции, так как отсрочка
с операцией может привести к таким тяжелым осложнениям, как прорыву гнойника в свободную брюшную
74
полость, забрюшинной флегмоне и т. д. Вскрытие гнойника производится через обычный операционный разрез
Волковича — Дьяконова, а также внебрюшинным доступом ближе к гребешку подвздошной кости. После
вскрытия абсцесса производится, если возможно, ап-
пендэктомия, а затем дренирование полости абсцесса
тампоном и резиновой трубкой для введения антибиотиков. При наличии плотного, малоподвижного инфильтрата без признаков абсцедирования не следует пытаться разъединить ткани инфильтрата, а ограничиться ограничивающей тампонадой этой области. Лишь при
рыхлом свежем инфильтрате можно осторожно попытаться разъединить его и удалить отросток. Таким образом, при абсцедирующем аппендикулярном инфильтрате одной тампонады и дренирования брюшной полости
недостаточно, а показано вскрытие абсцесса; при сформировавшемся же плотном инфильтрате, наоборот, все
манипуляции, кроме тампонады, противопоказаны.
Г Л А В А VI
ОСТРЫЕ ЗАБОЛЕВАНИЯ В НЕПЕЧЕНОЧНЫХ'
ЖЕЛЧНЫХ ПУТЕЙ
Острый холецистит
Острый холецистит в настоящее время занимает по
частоте второе место после аппендицита, составляя
17—18% от больных поступающих по неотложной хирургии. Этиология и патогенез острого холецистита и
желчнокаменной болезни имеют много общих черт, что
позволяет рассматривать их вместе.
Анализ проведенных в нашей клинике 490 оперативных вмешательств при остром холецистите показывает, что наиболее важное значение из трех этиологических факторов (застой, инфекция, дисхолия) имеет
фактор застоя.
Фактор застоя. Он определяется анатомическими, функциональными, нейрогуморальнымщ эндокринными, воспалительными и другими факторами.
Анатомические условия, способствующие застою желчи, могут быть на различных уровнях (см. рис. 2).
1. На уровне пузырното протока за счет сдавления
75
Рис. 2. Схема строения внепеченоч-
ных желчных путей (У. А. Арипов
с соавт., 1969).
1 — сфинктер Лиоткенса, II — сфинктер
Мнриццн; I — желчный пузырь, 2 — шейка
пузыря, 3 — общий печеночный проток.
4 — пузырный проток, 5 — общий желчный
проток, 6 — главный панкреатический вир-
супгов проток. 7 — ампула Фатера, 8 —
фатеров сосок, 9 — гейстеровы клапаны,
10 — правый печеночный проток, 11 — левый печеночный проток, 12 — поджелудочная железа. 13 — двенадцатиперстная
кишка.
его карманом Гартмана, содержащим камень. Другой,
наиболее постоянной причиной застоя является анатомическая особенность хода пузырного протока и его
взаимоотношений с общим желчным протоком. Ruge
выделил 3 типа впадения пузырного протока в холедох.
Первый тип состоит во впадении пузырного протока в
холедох под острым углом (33—80%). Второй тип заключается в параллельном ходе пузырного протока на
протяжении от 1 до 5 см и больше (12—49%). Третий
тип характеризуется спиралеобразным ходом его и
впадением в печеночный проток. Анализ операционного
76
материала показывает,
что у больных острым
холециститом наиболее
часто встречается второй тип по Ruge. Среди наших оперированных он составлял 78%
(рис. 3). Мы объясняем это обстоятельство
следующим образом.
Ёероятно, при параллельном ходе пузырного протока он отделяется от общего желчного протока лишь
слизистой оболочкой
(И. Литман, 1970). Поэтому любое повышение давления в общем
желчном протоке прежде всего направлено в
сторону слабой стенки,
состоящей лишь из
слизистой, что приводит к сдавлению пузырного протока и нарушению оттока желчи
(боковой гидродинамический эффект).
Можно предположить,
что люди со вторым
типом пузырного протока имеют анатомическую предрасположенность к развитию холецистита.
2. Следующим анатомическим уровнем, на котором
происходит нарушение оттока желчи, является дуоденальный сосочек. Различные первичные заболевания
большого дуоденального сосочка (папилдоспазм, сте-
нозирующий папиллит, возрастная гипертрофия и склероз и др.) являются важнейшими факторами, нарушаю-'
щими естественный пассаж желчи и вызывающими
холестаз.
Рис. 3.
Операционная
графия.
холангио-
Пузырный проток длиной в 8 см спирале-
образно огибает общий желчный прото»
проток
и впадает в него на уровне интрапан-
креатического отдела. Такой анатомический вариант хода пузырного протока
создает условия для сдавления его и нарушения оттока желчи из пузыря и для
рефлюкса панкреатического сока в желчный пузырь
77
3. Не менее важным является и нарушение оттока
желчи, связанное с повышенным внутридуоденадьным
давлением. Одной из причин повышения внутридуоде-
нального давления является нарушение пассажа дуоденального содержимого в области дуоденоеюнального
перехода. Иногда действительно в области дуоденоеюнального перехода имеется острый изгиб врожденного
или приобретенного характера, который вызывает нарушение пассажа кишечного содержимого и повышение
внутридуоденального давления (Я. Д. Витебский, 1976).
Это состояние наблюдается нечасто и выявляется с
помощью дуоденографии и поэтажной манометрии (см,
рис. 4). Средние показатели давления (в мм вод. столба)
в двенадцатиперстной кишке составляют 80—120, а в
начальной части тощей кишки — 40—60 мм (А. Д. Сло-
божаикин). Поэтажные манометрические исследования,
проведенные в нащей клинике у больных, перенесших
Рис. 4. Рентгенологическое исследование дуоденоеюнального угла при холецистопанкреатите!
имеется острый дуоденоеюнальный угол («двустволка»), вызывающий дуоденостаз и потребовавший оперативного низведения дуоденоеюнального угла.
78
холецистит, выявили при наличии нарушенной дуоде-
ноеюнальной проходимости и возрастание градиента давления почти в 2 раза по Сравнению с нормой. После
хирургической коррекции и низведения острого дуоденального угла наступали нормализация градиента и
устранение клинических проявлений сопутствующего холециститу дуоденостаза.
Дисфункция вегетативной нервной системы. Известно,
что секреция желчи увеличивается при возбуждении
парасимпатических и уменьшается при раздражении
симпатических нервов. Кроме того, при раздражении
средней силы блуждающих нервов- открываются сфинктеры Люткенса и Одди, происходит сокращение желчного пузыря и опорожнение его. При сильном же раздражении вагуса сфинктеры замыкаются. Возбуждение
сфинктера Одди и его спастические сокращения возникают под влиянием различных висцеро-висцеральных
рефлексов с других органов желудочно-кишечного тракта, почек, брюшины, придатков, аппендикса. Усиленное
раздражение симпатических нервов ведет к расслаблению мышц желчного пузыря, что способствует его атонии и застою желчи.
Дефицит интенсинальных гормонов. Установлено, что
в слизистой двенадцатиперстной кишки образуется гормон холецистокининопанкреозимин, обладающий сильным холекинетическим и холеретическим действием, а
также способностью открывать сфинктер Одди (Sun,
Shay, 1960; Plessier с соавт., 1973; Ю. И. Рафес, 1974,
1975). Слизистой оболочкой тонкого кишечника освобождается другой гормон — секретин, увеличивающий
щелочные компоненты желчи и снимающий спазм сфинктера Одди. Предполагается, что при дефиците интестинальных гормонов развивается атония желчных путей,
застой желчи в результате эндокринной патологи!
(Ю. И. Рафес).
Другими причинами затруднения оттока желчи ■
застоя являются перихоледохеальный лимфаденит, повышение внутрибрюшного давления, гиподинамия, редкие приемы пищи.
При застое желчь резко сгущается, в ней уменьшается концентрация желчных кислот' за счет всасывания стенкой желчного пузыря и вследствие разрушения
их бактериями. В этих условиях ослабляются раство¬
79
римость не только холестерина, но и жирных кислот и
солей кальция. В результате образуется эмульсия холестерина, капельки которой постепенно сливаются, кристаллизуются и образуют сферолиты, к которым присоединяются новые кристаллы.
При воспалении же камни носят неоднородный характер. Основой таких камней (ядром) являются белок
разрушенных клеток эпителия и адсорбированные им
соли кальция, вокруг которых позднее и кристаллизуется холестерин.
Инфекция. Инфекция попадает в желчную систему тремя путями: 1) энтерогенным (восходящим путем из кишечника); 2) гематогенным (через пузырную
артерию и воротную вену); 3) лимфатическим. Микрофлора в пузырной желчи выявляется примерно у 60%'
больных. При посеве желчи чаще всего обнаруживают
кишечную палочку, затем стрептококки, стафилококки,-
энтерококки (С. М. Рысс, 1956; Т. А. Глазкова, 1963, и
др.).
Дисхолия. Нарушение состава желчи является
важнейшим фактором камнеобразования и холецистита.
Желчь представляет собой сложное вещеетво с высокой
концентрацией холестерина, желчных пигментов и электролитов. Факторами, удерживающими эти вещества в
растворенном состоянии, являются так называемые защитные коллоиды — желчные кислоты и лецитин. Для
стабильности составных частей желчи имеет значение
определенное соотношение между холестерином и желчными кислотами (холангио-холестериновый коэффициент), которое в норме равно 1:25. Желчные кислоты,
фосфолипиды (лецитин) и холестерин образуют смешанный липидный комплекс, мицеллу (В. А. Максимов, 1971; Ф. И. Комаров, 1974, и др.). Липидный комплекс обеспечивает коллоидальную устойчивость желчи
и препятствует образованию камней. При калькулез-
ных холециститах липидные комплексы отсутствуют, а
при хронических некалькулезных холециститах их количество резко снижается. Стабильность желчи обеспечивается также и щелочной реакцией желчи. При снижении pH ниже 6,0 наступает выпадение холестерина,
Ацидоз желчи является следствием предпочтительного
употребления в пищу продуктов с кислой валентностью
80
(рыба, мясо, мучные изделия, крупяные блюда и т. д.)
или воспалительного процесса в желчных путях.
Поражение желчного пузыря может быть местным
проявлением аллергических реакций сен*
сибилизированного организма. Симптомы поражения
желчных путей наблюдаются при сывороточной болезни,
бронхиальной астме, полинозах, крапивнице, лекарствен*
ной аллергии и т. д. (Т. Б. Толпегина, Р. X. Бурнашева,
1969; А. М. Ногаллер, 1975). В таких условиях желчный
пузырь выступает как «шоковый орган», в котором развивается реакция антиген — антитело. Известно, что
микробная аллергизация имеет место у 72% больных
острым холециститом в основном на гемолитический
стрепто-стафилококк и кишечную палочку. Микробный
фактор может быть источником аутоиммунизации и образования аутоантител к желчному пузырю и печени.
В выявлении аллергического компонента холецистита
помогают анамнез, кожные пробы, реакции лейколи-
зиса и бластотрансформации с тканевыми аллергенами.
Ферментный фактор. Развитие острого холецистита может вызвать попадание панкреатических ферментов в желчные пути (Seifert, 1923; Popper, 1936).
У 44% мужчин в поджелудочной железе имеется предохранительный клапан в виде добавочного Санторинова
протока, по которому может оттекать панкреатический сок
в случае острого повышения внутрипротокового давления
при ущемленном в папилле камне или стенозе (у женщин
он встречается в 3 раза реже — Hyorth, 1947). Попадающий в желчные пути панкреатический сок вызывает
деструкцию слизистой желчного пузыря и повышение
проницаемости его стенки. Это приводит- к имбьбиции
желчью печеночно-двенадцатиперстной связки, забрю-
шинного пространства и пропотеванию желчи в свободную брюшную полость. Серозный покров желчного
пузыря в таких случаях мало изменен. Однако подобные холециститы отличаются тяжелой интоксикацией и
ранним развитием пропотного желчного перитонита
(Т В. Шаак, 1974). При ферментативных формах острого холецистита недостаточно удаления измененного
желчного пузыря, а необходимо восстановить пассаж
панкреатического сока естественным путем или временно разгрузить внепеченочиые желчные пути с по¬
6 М-843
81
мощью их дренирования. Следует помнить, что основой
ферментных холециститов является и другая анатомическая ситуация, встречающаяся у 65% людей. Она
заключается в наличии общего сообщения между панкреатическим и общим желчным протоком.
Сосудистый фактор. Значительную роль в
развитии деструктивных изменений в желчном пузыре
играют сосудистые изменения в его стенке, связанные
с общим поражением сосудов в организме при атероскле»
розе, гипертонической болезни или в результате постоянной желчной гипертензии (В. В. Виноградов, С. И. Левина, 1970). Кроме того, после 60 лет наблюдаются существенные изменения в артериях желчного пузыря и
мышечной оболочке. В этом возрасте наступает истончение мышечной оболочки в области дна желчного пузыря.
Изменения в артериях желчного пузыря заключается
в эластофиброзе интимы, склерозе мышечного слоя и
истончении адвентиция, нарушающих кровоток по сосуду и способствующих тромбозу. Вначале эти изменения
развиваются в- основном стволе пузырной артерии, а
затем в ее ветвях (А. В. Бельский с соавт., 1975). Мы
наблюдали холециститы чисто сосудистого генеза, которые протекали с самого начала в виде гангрены стенки
желчного пузыря. Такие формы острого поражения
желчного пузыря можно назвать «ишемическим холециститом». Причем с самого начала процесс носит деструктивный необратимый характер.
%
Диагностическая программа
Известно, что лишь примерно у 50% больных холециститом имеется типичная клиническая картина заболевания, хорошо описанная и в хирургической литературе. Однако следует помнить и об атипичных проявлениях желчнокаменной болезни и холецистита, атипичных синдромах этого заболевания. К ним следует
отнести следующие:
Гастритический синдром. При этом синдроме ведущая роль принадлежит диспепсическим расстройствам.
Они характеризуются изжогой, тяжестью в подложечной
области после еды, тошнотой и рвотой после жирной
нищи, вздутием живота. Эти больные отмечают также
непереносимость отдельных видов пищи, неприятный
82
горький вкус во рту натощак. Явления желудочного дискомфорта обычно развиваются через 2—3 часа после
приема острых, жареных и жирных блюд. Указанные
симптомы часто уводят врача в сторону от правильного
диагноза и приводят к мысли о наличии у пациента язвенной болезни или гастрита.
Холецисто-кардиальный синдром (синдром С. П. Боткина). Этот синдром характеризуется появлением во
время колики загрудинных болей или болей в области
сердца. Эти боли сопровождаются затрудненным дыханием или одышкой и аритмией. Причем болевой синдром в области сердца или грудины часто превалирует
в клинической картине заболевания. Трудности увеличиваются в связи с тем, что в ЭКГ наблюдаются изменения,
характерные для инфаркта, что приводит к ошибочному
диагнозу инфаркта миокарда. Основой этого синдрома
являются рефлекторно-токсические воздействия и метаболические нарушения (гиперкалиемия, гипергликемия), сопутствующий панкреатит (В. В. Виноградов
с соавт., 1973).
Гепатитно-цирротический синдром. При этом синдроме отмечаются тупые, ноющие боли в правом подреберье и правой половине живота, субиктеричность.
Печень увеличена и болезненна. Больные жалуются на
различные нервные расстройства: головокружение, головные боли по типу мигрени, невралгию тройничного
нерва. Нередко отмечаются ревматоидные боли в суставах. Этот синдром чаще наблюдается у мужчин, злоупотребляющих алкоголем (А. И. Краковский, Г. П. Петров, 1978).
Холангитический синдром. Развивается при наличии
затрудненного оттока желчи из холедоха в результате
чаще всего стеноза большого дуоденального сосочка или
вентильного камня холедоха. При холангитическом
синдроме боли меняют свой характер и иррадиацию.
Обычно в результате многолетнего течения заболевания
стенка желчного пузыря склерозируется, утолщается, а
слизистая — атрофируется. Вследствие склероза стенки
и гибели нервных элементов постоянное растяжение желчного пузыря не вызывает острых болей по типу печеночной колики, а проявляется тупыми распирающими
болями в правом подреберье. Вследствие растяжения
общего желчного протока боли иррадиируют в поясницу.
6*
63
Нередко у больных наблюдаются вспышки повышения
температуры по вечерам или упорный субфебрилитет.
Печень постепенно увеличивается, появляется кожный
зуд. Больные теряют в весе. При этом даже при значительном нарушении оттока желчи желтуха часто отсутствует, живот остается мягким, а желчный пузырь прощупывается непостоянно.
Для определения тактики и выбора метода лечения
определенное значение имеют лабораторные исследования. Среди них большое значение имеет динамическое
исследование формулы крови и лейкоцитоза, билирубина, печеночных проб, остаточного азота, сахара крови,
свертываемости крови и протромбина, тромбоцитов,
фибринолитической активности, фибриногена, трансами-
наз и щелочной фосфатазы, диастазы мочи и ЭКГ.
В диагностике острого холецистита, кроме клинических признаков и лабораторных тестов, большое значе-
ние приобрели инструментальные методы исследования.
В нашей клинике разработаны и применяются комбинированная лапароскопия и электромиография брюшной
стенки (О. С. Кочнев, И. А. Ким, 1977, 1978; Р.Ш. Шай-
марданов, 1978).
Показанием для проведения экстренного лапароскопического исследования' являются случаи холецистита:
1) не поддающиеся консервативному лечению в течение
10—12 часов (сохранение сильного болевого синдрома)}
2) при неясной клинической картине заболевания у пациентов старше 60 лет; 3) при наличии острого холеци-
стопанкреатита с целью уточнения основной локализации патологического процесса.
Нами совместно с сотрудником нашей клиники
И. А. Кимом, начиная с 1975 года, разработана и применена у 132 больных холециститом и панкреатитом
лапароскопическая диагностическо-лечебная программа.
Она состоит из следующих элементов: 1) обзорной лапароскопии, 2) экстренной холецистохолангиографии,
3) лечебного промывания желчного пузыря и протоков,
4) лапароскопической канюляции круглой связки печени.
Обзорная лапароскопия при остром холецистите помогает определить морфологические изменения в органе, но не дает представления о характере патологического процесса в желчных путях (Л. И. Горохов, 19G8;
И. И. Зарицкий, 1968; Ю. Е. Березов, М. Д. Лапин и др.,
84
1971; Р. X. Васильев, 1976, и др.). В связи с этим специалисты вынуждены применять способы прямого введения контрастного вещества в желчный пузырь и протоки. В настоящее время наиболее широко используется
чрезкожная гепатохолангиография и лапароскопическая
холецистохолангиография (В. В. Виноградов, В. И. Ко-
чиашвили, 1967; О. Б. Милонов с соавт., 1970; В. Н. Сотников, Э. В. Луцевич с соавт., 1975, и др.). Мы стали
применять лапароскопическую хрлецистохолангиографию
в ургентной хирургии холецистита. Техника исполнения
прямой лапароскопической холецистохолангиографии
заключалась в пункции желчного пузыря длинной тонкой
иглой диаметром до 0,1 см, надетой на шприц типа «Рекорд», наполовину заполненный 0,25% раствором новокаина, аспирации желчи и введении контрастного вещества в объеме, на 8—10 мл превышающем количество
аспнрированной желчи. Рентгенографию осуществляли через 2—2,5 минуты. После выполнения рентгеноскопических снимков желчный пузырь промывали теплым 0,25% раствором новокаина с антибиотиками до
получения чистого промывного раствора, а затем в
желчные пути вводили антибиотики (канамицин, мономи-
цин) с новокаином (2—3 мл). Такое исследование проведено у 26 больных. У 6 из них был острый холецистит
с явлениями билирубинемии, у 16 — острый флегмонозный холецистит, у 4 — отключенный желчный пузырь.
При выборе места пункции на передней брюшной стенке
мы учитывали данные лапароскопии, локализацию и
размер желчного пузыря, толщину края печени и топографические взаимоотношения органов: Со стороны пристеночной брюшины место пункции проецировали на кожу светом лапароскопа. Пункцию желчного пузыря проводили у его дна под контролем лапароскопа и через
паренхиму печени. Для профилактики желчеистечения
из места прокола многократно промывали желчный пузырь раствором антибиотиков с последующей максимальной аспирацией желчи и контрастного вещества.
Контроль осуществляли посредством дренажной трубки,
подведенной к желчному пузырю при лапароскопии;
Экстренная лапароскопическая прямая холецистохолангиография дает возможность, наряду с обнаружением
морфологических изменений в желчном пузыре, с высокой степенью достоверности определить состояние
85
Рис. 5. Лапароскопическая холецистохолангиография.
Ущемленный камень большою дуоденального сосочка, вы*
звавший полное нарушение оттока желчи и панкреатического сока в двенадцатиперстную кишку. Имеется резкое
расширение вне- и внутрипеченочных желчных ходов, рефлюкс конзрастного вещества в расширенный главный панкреатический проток. В желчном пузыре камень, занимающий */4 объема желчного пузыря Пузырный проток спиралеобразно извит, конечная часть его расположена параллельно холедоху.
Рис. б. Лапароскопическая холецистохолангиография.
Резко выраженный папиллостеноэ. Общий желчный протон
шириной в 2.3 см. Расширенные внутрнпеченочные желчные ходы. Контрастное вещество в двенадцатиперстную
кишку не попадает. Желчный пузырь дилатнровая, опре*
деляется больших размеров гартмановский карман, подпаянный к холедоху.
желчевыводящих путей, выбрать метод лечения и оптимальный вариант хирургического вмешательства (рис. 5
и 6).
Для лечения больных острым холециститом в 1976 году мы разработали и внедрили метод лапароскопической
канюляции круглой связки печени (О. С. Кочиев,
И. А. Ким, Ф. А. Давлеткильдеев, 1977, 1978). Для этого
под контролем лапароскопа чрезкожно иглой диаметром
87
0.2—0,3 см пунктируем круглую связку печени и вводим
иглу в толщу связки на 4—5 см по направлению к печени, а затем через нее проводим металлический проводник.
После извлечения иглы по проводнику проводим поли-
хлорвиниловый катетер. Место рункции на брюшной
стенке проецируется светом лапароскопа. После каню-
ляции круглой связки печени делаем блокаду связки
теплым раствором 0,25% новокаина в смеси с антибиотиком. Длительность нахождения катетера в круглой
связке зависела от того, как скоро удавалось ликвидировать воспалительный процесс. Инфузию лечебной смеси в дозе 200—250 мл проводили 2—3 раза в сутки в зависимости от морфологических изменений в органе. Метод канюляции круглой связки печени был применен в
нашей клинике у 50 больных, в том числе у 10 — с катаральным, у 30 — с флегмонозным холециститом, а у
10 — с инфильтратом в зоне желчного пузыря. Лишь 3
больных были оперированы в сроки от 16 до 48 часов.
Таким образом, с помощью лапароскопической канюляции круглой связки печени и ее пролонгированной ново-
каин-антибиотиковой блокады удается не только устранить болевой синдром, но и добиться разрешения острого воспалительного процесса в желчном пузыре, если он
носит катаральный и даже флегмонозный характер и
отсутствуют явления перитонита. Возможность купировать воспалительный процесс в желчном пузыре с помощью этого метода говорит о том, что истинная и необратимая обтурация пузырного протока при остром холецистите возникает нечасто. С нашей точки зрения,
указанный метод особенно целесообразно применять у
лиц пожилого и старческого возраста, у которых риск
экстренной операции особенно велик.
Общие показания к операции
Для осуществления срочной программы лечения острого холецистита большое значение имеет определение
показаний к операции. Во всех случаях даже при срочно
показанной операции целесообразно подготовить больного к оперативному вмешательству в минимально короткое время. Причем следует рассматривать проводимое
до операции консервативное лечение и как средство
подготовки к операции, и как метод лечения холецисти¬
68
та, который позволяет при отсутствии эффекта рекомендовать операцию.
Показания к операции ставятся с учетом обнаруженных клинических, лабораторных и инструментальных
данных.
На основании клинического анализа и результатов
лечения 726 больных острым холециститом мы разделили этих больных на 3 группы.
К группе лиц, подлежащих срочной операции, 16,3%
относятся больные с перитонитом, с сильным и некупи-
руемым болевым синдромом, нарастающей желтухой и
прогрессирующим холангитом, длительно не сокращающимся желчным пузырем. Проводимое энергичное консервативное лечение, как правило, улучшает до некоторой степени состояние этих больных за счет снятия
интоксикации. Однако повышенная температура, несок-
ращающийся желчный пузырь и несннжающийся лейкоцитоз являются показанием для операции в ближайшие
12—36 часов. Следует считать целесообразным сокращение сроков наблюдения при остром холецистите, поскольку пациент некоторое время, как правило, находится дома до поступления в стационар. Кроме того, при
наличии обструктивного холецистита консервативное
лечение практически оказывается неэффективным в отношении далеко зашедшего воспаления и восстановления оттока из желчного пузыря, хотя и дает субъективное улучшение за счет временного снятия интоксикации.
Второй группе больных в связи с более легким клиническим течением заболевания и за счет своевременного применения энергичных консервативных мер удается снять острые явления. Однако большая часть этих
пациентов нуждается после обследования без выписки
из стационара в активном хирургическом лечении. Результаты оперативного лечения показывают, что наибо*
лее оптимальным сроком для подобной отсроченной операции является не 10—12 день после приступа, как считалось раньше, а 3—4 недели.
Третью группу составляют больные с желчной коликой, дискинезией желчного пузыря и двенадцатиперстной' кишки, а также с заболеваниями верхнего отдела
желудочно-кишечного тракта симулирующими поражение желчевыводящей системы. Сюда не относятся и
больные с заболеванием желчевыводящей системы,
трудно выявляемым клиническими методами исследования.
Следовательно, срочной операции подлежит сравнительно небольшая часть пациентов первой группы,
которых целесообразно оперировать до перехода деструктивного процесса на печень, печеночно-двенадцатиперстную связку и поджелудочную железу, делающего операцию технически трудной, а послеоперационный период — полным опасных для жизни больного осложнений.
Большая часть больных второй группы нуждается
в активной санации гепатобилиарной зоны после купирования приступа без выписки из стационара. Значительная часть больных третьей группы подлежит консервативному лечению и наблюдению, что позволяет
выбрать пациентов, нуждающихся в операции.
Из 726 наших больных острым холециститом 260
(35,8%) были в возрасте 61 года и старше и только
99 (13,6%) — моложе 40 лет. С первым приступом острого холецистита поступило лишь 22% больных, а остальные перенесли в течение последних трех лет от 1 до
3 приступов. Причем 33,5% из этих пациентов страдало
холециститом более 5 лет. Как видно из таблицы 5,
Таблица 5
Результаты лечения в зависимости от сроков
оперативного вмешательства
Сроки до операции
Количество
операций
Число умерших
До 3 дней
64
3
До 7 дней
12
7
До 14 дней
25
2
Свыше 14 дней
49
0
Итого
150
1 12
летальность бывает наименьшей при ранних сроках (в'
пределах первых трех суток) и при операциях, проведенных через 2—3 недели после приступа острого холецистита. В первом случае операция выполняется до развития тяжелой интоксикации, вызывающей поражение пе-
90
чени и почек, а также до возникновения выраженного
воспалительного процесса в окружающих желчный пузырь тканях, делающего операцию технически трудной.
Во втором случае операция осуществляется после ликвидации воспалительных явлений, рассасывания инфильтрата, что позволяет произвести тщательную ревизию,
а если необходимо, и оперативную коррекцию желчевыводящей системы.
Активная хирургическая тактика не исключает интенсивного консервативного лечения больных острым
холециститом и является естественным продолжением
энергичных терапевтических мер. Консервативная терапия при остром холецистите направлена на улучшение
или восстановление оттока из желчного пузыря и внепе-
ченочных желчных путей, снятие воспалительных явлений и интоксикации, коррекции симптоматических нарушений (диабет, гипертоническая болезнь, нарушение
сердечного ритма, выделительной функции почек и
т. д.). Поэтому целесообразно провести следующие мероприятия:
1. Опорожнение желудка с помощью назогастрально-
го зонда, поскольку парез желудка усугубляет застой
в желчном пузыре и желчных путях.
2. Паранефральная новокаиновая блокада, а спустя
14—16 часов общая новокаиновая блокада. Она состоит
из введения 600—800 мл */4% раствора новокаина внутривенно капельно (медленно!) и рассчитана на использование его антиаллергического, антнгистаминного влияния, способности нормализовать тонус гладкой мускулатуры и улучшать кровообращение, т. е. оказывать гем
самым и противовоспалительное действие. Если воспалительный процесс в желчном пузыре обратим, а болевой синдром связан с дискинезией желчных путей, подобная новокаиновая терапия в течение 1—2 суток дает
общее и местное улучшение и сокращение желчного пузыря. При осложненном холецистите результат подобного воздействия незначителен. Таким образом, новокаи-
новые блокады являются как лечебным средством, так
и диагностическим тестом, позволяющим подтвердить
или отвергнуть необходимость оперативного лечения.
3. Спазмолитики. Обязательно назначать нитроглицерин '/г таблетки под язык 2 раза в день ввиду избирательного его спазмолитического действия на сфинк¬
91
тер Одди. Такое же расслабляющее действие на сфинктерный аппарат шейки желчного пузыря и папиллы оказывают атропин, но-шпа, галидор.
4. Инфузионная терапия состоит из введения 5%
раствора глюкозы и раствора Рингера (до 2000 мл).
5. Антибиотики вначале не назначаются. Они показаны в случаях, когда острый процесс имеет тенденцию
к разрешению,и при явной возможности обойтись терапевтическими методами лечения.
Не следует забывать, что антибиотики, хотя часто и
ограничивают распространение воспалительного процесса, но также часто не останавливают развитие деструктивных изменений в стенке желчного пузыря. Их назначение дает возможность смягчить явления интоксикации,
снизить температуру и сгладить другие острые проявления холецистита, но не ликвидировать гнойный процесс,
а придать ему торпидное течение. Наступающее субъективное улучшение создает иллюзию благополучия, хотя
деструктивные изменения в желчных путях и пузыре
продолжают прогрессировать. Поэтому назначение антибиотиков должно быть строго обоснованным, индивидуализированным и требует тщательного наблюдения
за больным. В процессе предоперационного лечения
можно пользоваться комбинацией пенициллина и стрептомицина ввиду их высокой концентрации в выделяемой
печенью желчи. Лучшей комбинацией считается применение тетрациклиновых препаратов, в частности, морфо-
циклина в комбинации с сульфаниламидами или ампициллин и сульфаниламиды (В. И. Стручков, А. В. Григорян и др., 1973).
6. Симптоматическая и кардиальная терапия.
Показания к операции при остром холецистопанкреатите
Клинически и лабораторно очень трудно установить
переход отечной формы панкреатита в некроз. Кроме
того, снятие острых явлений со стороны поджелудочной
железы не дает гарантии стойкого улучшения, поскольку
холецистопанкреатнт часто сочетается с камнем д общем
желчном протоке или стенозом сосочка. Таким образом,
у этих больных часто развивается желчная гипертензия,
которую необходимо устранить. Поэтому наличие желчной гипертензии и особенно перитонита является пока¬
92
занием к экстренному вмешательству. В остальных случаях показана консервативная терапия, но без, длительного выжидания.
Показания к операции при поражении сердца
Боли в области сердца при остром холецистите могут
превалировать над абдоминальными болями, что дезориентирует врача и затрудняет постановку правильного
диагноза. На электрокардиограмме имеются признаки
ишемии миокарда, но, как правило, истинная стенокардия с расстройством венечного кровообращения имеет
место лишь при тяжелых нарушениях желчеоттока, связанных с ущемленным камнем в желчном пузыре или
общем желчном протоке. Своевременно выполненная
операция при хорошем обезболивании снимает рефлекторные нарушения со стороны сердца и является лучшей
профилактикой тяжелых нарушений коронарного кровообращения (Б. А. Королев, Д. Л. Пиковский, 1971),
Показания к операции при холангите
При остром холецистите, осложненном холангитом,
консервативная терапия не должна занимать более 3
суток (Б. А. Петров, Э. И. Гальперин, 1971). Консервативная терапия и подготовка к операции должны включать следующие мероприятия:
1. Борьба с воспалительным процессом в желчных путях назначением антибиотиков бактерицидного действия.
Следует отдать предпочтение аминогликозидам в комбинации с пенициллином. Для этих целей можно применять канамицин в дозе до 4,0 г в сутки и пенициллин в
дозе до 20—30 млн. ед. в сутки внутривенно.
2. Спазмолитическая (нитроглицерин, атропин, но-
шпа, галидор) и десенсибилизирующая терапия, направленная на восстановление оттока желчи.
3. Дренирование желудка и двенадцатиперстной
кишки с целью аспирации дуоденального содержимого,
так как спазмолитическая терапия вызывает релаксацию
двенадцатиперстной кишки и застой дуоденального содержимого, что, естественно, ухудшает дренаж желчных
путей.
Показания к операции при механической желтухе
Анализ нашего клинического материала показывает,
что операдия при механической желтухе не должна откладываться на длительное время. Даже за 10—12 дней,
срок/который многие авторы рекомендуют для проведения раннего оперативного вмешательства, развиваются
тяжелые поражения в печени, почках и других органах,
что делает операцию запоздалой. Единственным противопоказанием для ранней операции является неуверенность в истинной природе желтухи. Поэтому необходимо проводить обследование больных в кратчайшие сроки — 3—5 дней, после чего, не откладывая, оперировать.
Следует подчеркнуть особую роль в диагностике желтух
лапароскопического обследования.
В нашей клинике подобным больным, как правило, проводится лапароскопическая холецистохол ангиография.
Эта диагностическая процедура, по нашим наблюдениям,
отличается.высокой разрешающей способностью. Визуальная лапароскопия позволяет установить опухоль поджелудочной железы или внепеченочных желчных путей,
цирроз печени, опухоль печени. В' последующем лапароскопическая холангиография дает возможность установить уровень нарушения оттока желчи: пузырный проток, общий желчный проток, большой дуоденальный сосочек, холедохолитиаз. Несомненно, что лабораторная
диагностика дает немало для дифференциальной диагностики желтух, но в целом ряде случаев из-за недостаточно высокой специфичности лабораторных тестов она
оказывается неэффективной и потому требует применения инструментальных методов диагностики или, наконец, диагностической лапаротомии (Ситенко В. М.,
Нсчай А. И. 1975; А. Я. Яковлев с соавт., 1978).
Время, нужное для установки диагноза, должно использоваться для проведения интенсивной терапии, являющейся и средством подготовки больного к операции.
Терапия у подобных больных должна быть направлена
на снятие интоксикации, лечение и профилактику печеночной недостаточности, коррекцию гемокоагуляционных
нарушений:
1. Инфузионная терапия с введением раствора Рин-
гера, глюкозы, белковых препаратов.
2. Введение 60—80 мл 40% раствора глюкозы с ин-
94
сулином, витаминами группы В (Bt, Вб, В)2) и витамина
С до 1000 мг в сутки.
3. Преднизолон до 20 мг в сутки. Назначение гред-
низолона имеет дифференциально-диагностическое значение при наличии паренхиматозной желтухи и снижает
билирубинемию.
4. Липотропные средства: лнпокаин по 0,1 3 раза в
день, метионин по 0,5 3 раза в день.
5. Оротат калия 0,75 в сутки. Играет роль анаболического вещества при нарушениях белкового обмена и
улучшает действие сердечных гликозидов. Противопоказан при истинных циррозах с явлениями асцита.
6. При снижении протромбинового индекса ^свертываемости крови назначение викасола, эпсилонаминока-
проновой кислоты за 3—4 дня до операции.
7. При наличии выраженной желтухи и интоксикации показан управляемый дренаж грудного лимфатического протока с лимфосорбцией.
Операционная программа
Операция при остром холецистите на внепеченочных
желчных путях состоит в выборе обезболивания, доступа,
операционной диагностике, в удалении патологически
измененного органа.
Наиболее предпочтительным при остром холецистите,
особенно тяжелых его формах, является эндотрахеаль-
ный наркоз с применением нейролептиков и управляемого дыхания.
Операционный доступ. Из многочисленных операционных разрезов, предлагаемых для операций на внепеченочных желчных путях, мы отдаем предпочтение срединной лапаротомии с аппаратной коррекцией доступа
крючками РСК-10, крепящимися к операционному столу.
Этот вид доступа позволяет избежать пересечения больших мышечных массивов, уменьшает число послеоперационных нагноений и грыж. Нам ни в одном из собственных случаев не приходилось пользоваться дополнительным рассечением брюшной стенки вправо от разреза.
Преимуществом данного доступа является и то, что дренирование и тампонада подпеченочного пространства
в этих случаях проводится обязательно вне основного
операционного доступа.
95
Операционная диагностика. Операционная диагностика состояния внепеченочных желчных путей включает визуальный осмотр их и поджелудочной железы, пальпацию, трансиллюминацию, холангиографию и холангио-
манометрию, зондирование протоков и папиллы, диагностическую холедохотомию и холедохоскопию.
1. Операционное обследование панкреато-билиарной
зоны при остром холецистите следует начать с осмотра
поджелудочной железы. Оно проводится через отверстие
в желудочно-ободочной связке. При осмотре поджелудочной железы после введения в отверстие печеночных
зеркал и пальпации можно получить представление о
размерах железы, ее плотности, наличии в ней инфильтративных изменений, кист. Большое значение имеет
установление цвета железы, выявление «стеариновых
бляшек», жидкости в сальниковой сумке и ее характер.
Однако пальпация железы со стороны сальниковой сумки недостаточно информативна в отношении определения состояния головки поджелудочной железы. Нам нередко при дальнейшей последовательной ревизии поджелудочной железы удавалось обнаруживать изолированный индуративный процесс в головке железы по ходу
терминального отдела холедоха, недоступный пальпации
со стороны сальниковой сумки. Поэтому в неясных
случаях пальпацию этой области следует произвести
после мобилизации головки поджелудочной железы.
2. Перед дальнейшим обследованием внепеченочных
желчных путей производится ретродуоденальная ново-
каиновая блокада из трех точек. Первой точкой является корень брыжейки поперечно-ободочной кишки справа
от связки Трейца. Второй точкой является угол слияния
между супрадуоденальной частью холедоха и двенадцатиперстной кишкой. Третьей точкой — введение новокаина в круглую связку.
3. После выполнения панкреатодуоденальной блокады проводится осмотр и пальпация желчного пузыря,
холедоха и головки поджелудочной железы. При этом
следует обратить внимание не только на наличие в них
камней, но и на степень дилатации желчного пузыря,
холедоха, инфильтративные изменения по ходу общего
желчного протока, наличие и выраженность перихоледо-
хеального лимфаденита, ход пузырного протока. Пузырный проток, идущий параллельно холедоху, очень часто
96
сопровождается не только изменениями в желчном пузыре, но и концевой части общего желчного протока.
При наличии механической желтухи пальпацию концевой части общего желчного протока нужно делать обязательно после бескровной мобилизации всего панкреатодуоденального комплекса, включающего не только
двенадцатиперстную кишку, но и головку поджелудочной железы. Предварительная новокаиновая блокада
этой зоны облегчает проведение этой манипуляции.
Пальпация ретродуоденальной части холедоха, где чаще
всего находятся камни, после подобной мобилизации
практически позволяет исключить возможность оставления камней даже при отрицательных данных холан-
гиографии. Пальпация в условиях мобилизованного
комплекса помогает не только определить предполагаемый вид обструкции (камень, опухоль, индуративный
панкреатит), но и позволяет точно локализовать проекцию папиллы на переднюю стенку двенадцатиперстной
кишки, что облегчает дальнейшее проведение операции.
4. Рентгенохолангиоманометрия имеет в операционной диагностике состояния внепеченочных желчных
путей неравнозначную достоверность.
Наиболее информативным среди всех показателей
манометрии являются остаточное давление и дебитомет-
рия, ценность которых проверена у 180 больных с патологией во внепеченочных желчных путях. Остаточное
давление измерялось нами по методу Малле—Ги—Виноградова. Для этих целей можно пользоваться как специальным аппаратом для холангиоманометрии, так и
аппаратом Вальдмана для измерения венозного давления. Колба аппарата устанавливается на уровне 300 мм
вод. ст. Под этим повышенным давлением начинают перфузию физиологического раствора в желчные пути, повышая давление в трубке манометра до 300 мм вод. ст.
Достигнув этого показателя, перфузию прекращают и в
течение 30 сек наблюдают за падением давления в манометре до его стабилизации. Уровень стабилизации
давления в пределах от 100 до 150 мм вод. ст. свидетельствует о нормальной проходимости дуоденального
сосочка. Однако повышение остаточного давления не
может служить единственным критерием нарушения
проходимости дуоденального сосочка. Мы наблюдали
повышенное остаточное давление и при нормальной
7 М-843
97
проходимости в терминальном отделе холедоха. Оно
зависело от ошибок в интубации протока и от недостатков самой холангиоманометрии по этой методике. В
ответ на гиперпрессию в желчных путях нередко возникает длительный спазм сфинктера Одди, продолжающийся более длительное, чем в норме, время. В результате сокращения также и времени раскрытия
сфинктера нормализация остаточного давления происходит более длительное время, хотя никакого органического препятствия в области папиллы не имеется.
Поэтому градиент остаточного давления как изолированный показатель не может использоваться для оценки
степени проходимости концевой части протока (К. В. Новиков, 1973; М. А. Трунин, Н. А. Пострелов, 1977). Оно
обязательно должно сочетаться с проведением дебито-
метрии, измерением ширины протока и холангиогра-
фией. Нами проводилась дебитометрия по методу
Besanson (1965). Для проведения этого исследования
мерная колба аппарата для холангиоманометрии устанавливалась на высоте 300 мм вод. ст. и проводилась
перфузия протока в течение 60 секунд. Прохождение в
течение указанного времени 20—25 мл раствора свидетельствовало о хорошей проходимости дуоденального
сосочка. Следует отметить, что длительная гиперпрессия
в протоках приводит к насильственному расширению
сосочка и значительному пассажу жидкости даже при
'наличии имеющегося препятствия в этой области. Поэтому при использовании одного этого показателя возможна гиподиагностика.
Анализ сделанных нами 180 манометрических исследований показывает следующее. Наличие повышенного
остаточного давления при нормальном дебите еще не
говорит о нарушении проходимости, но заставляет ее
подозревать. Окончательное суждение можно вынести
после холангиографии и измерении ширины протока.
Повышение же остаточного давления и снижение дебита
жидкости уже позволяет высказаться об органическом
нарушении проходимости сосочка. К сожалению, ни тот,
ни другой метод не позволяет придти к окончательному
выводу о характере препятствия в терминальном отделе
холедоха, его степени и протяженности. Все сказанное
не должно приводить хирурга к отрицанию целесообразности проведения манометрического исследования
желчных путей. Это лишь должно означать, что необходимы критический анализ полученных манометрических показателей и применение дополнительных методов, позволяющих в совокупности более или менее
точно оценить состояние этой области.
5. Операционная холангиография. Этот метод, предложенный еще в 1931 году аргентинским хирургом Мйг-
рици, в последнее десятилетие пережил свое второе
рождение. Теперь уже ни у кого не вызывает сомнений,
что он является ведущим при выявлении патологии во
внепеченочных желчных путях и терминальном отделе
холедоха. Для проведения этого метода операцию на
желчных путях начинаем с выделения пузырного протока. После надсечения его стенки проводится канюляция
протока полихлорвиниловым катетером соответствующего диаметра. Катетер предварительно должен быть
заполнен новокаином, чтобы воздух из него не попал
в проток при введении контраста. В качестве контрастных веществ мы пользовались водорастворимыми органическими йодсодержащими веществами • (кардиотраст
(диодон), триомбрин (уротраст) и др.) в концентрации
не более 50%. Нужно помнить, что препараты более
высокой концентрации оказывают раздражающее действие на желчные пути и ведут к возникновению артефактов. Для холангиографии достаточно ввести 15—
18 мл контрастного вещества, сделать снимок в конце
введения и через 3—5 минут после введения. Оценку
холангиограмм проводили по следующим параметрам:
1) ширине общего желчного и печеночного протоков;
2) выявлению расширенных сегментарных протоков
печени III и IV порядка;
3) обнаружению камней во внепеченочных желчных
путях;
4) выявлению сужения концевой части протока, характеру и протяженности этого сужения, наличии в этой области ущемленных камней, опухоли;
5) обнаружению рефлюкса контрастного вещества
в панкреатический проток;
6) времени поступления контрастного вещества в
двенадцатиперстную кишку.
Расширение протока более 1 см всегда говорит в
пользу наличия органического препятствия в области
фатерова канала. Однако постоянной прямой зависи¬
7*
99
мости между степенью расширения общего желчного '
протока и размерами сужения большого дуоденального
сосочка, вероятно, не существует. Нередко рано развившийся холедохит и перихоледохит не позволяет протоку
расширяться даже при наличии стойкой и значительной
обструкции в концевой части протока. Поэтому при
оценке холангиограмм следует обратить особое внимание на наличие расширенных субсегментарных внутри*
печеночных протоков и вид дистальной части холедоха.
Для стенозирующего паниллита характерен вид протока
по типу «писчего пера» или «кончика сигары» (рис. 7).
Для хронического индуративного панкреатита характерно стреловидное сужение протока (рис. 8). При
'/щемленном камне в области дуоденального сосоч-
Рис 7. Оперзционная кодангиография,
Ровно выраженный етемоэ большого дуоденального сосочрв (етеноэ III степени). Терминальвый
отдел протона конусовидно сужен и подобен
•кончику сигары». Выраженное расширение еле*
н внутрипеченочных желчных протоков. Контрастное вещество в двенадцатиперстную кишку не
■вступает. В терминальной части оротока «замазка», имитирующая камень.
100
ка появляется дефект наполнения сферической формы,
обращенный выпуклостью кверху (рис. 9.) При раке
большого дуоденального сосочка или головки поджелудочной железы проявляется изъеденность контуров
терминального отдела холедоха с полным отсутствием
поступления контраста в двенадцатиперстную кишку
или резкий обрыв тени холедоха (рис. 10). Камни при
холангиографии не обнаружены в 20% случаев. По нашему мнению, это не влияет существенно на ценность
метода. Поскольку камни в холедохе, как правило,
имеются *при стенозах фатерова канала II и III степени, когда возникают настоятельные показания к холе-
Рис. 8. Операционная холангиография.
Хронический нндуративыыЛ панкреатит Резкое расширение вне- к внутрипеченочных
желчных путей. Холедох имеет выраженный
изгиб. Стреловидное сужение терминального
отдела общего* желчного протока. Контраст
в двенадцатиперстную кишку не попадает
101
Рис. 0. Операционная холангиогряфкя.
Утепленный камень большого дуоденального сосочка, аса*
•вавшнй оолное нарушение оттока желчи н резкую днла-
тению вне' и ваутрнпеченочных желчных путей у больного,
■еревесшего ранее холецистэктомию В терминальной отделе холедоха имеется дефект наполнения сферической формы, обращенный выпуклостью кверху. Определяется также
рефлюкс контрастного вещества в резко расширенный главный оавкреатнческнй ароток.
Рис. 10. Операционная холангиография.
Рак большого дуоденального сосочка. Выраженное оасширснне вне*
печеночных желчных протоков. S * образный изгиб печеночного и
общего желчного протоков. Терминальный отдел холедоха конусо*
видно сужен и заканчивается слепо. Контуры его неровные и изъеденные. Контрастное вещество в двенадцатиперстную кишку не поступает*
дохотомии и ревизии холедоха, отсутствие камня на
рентгенограмме не должно влиять на действия хирурга.
Хирург должен соблюдать правило: при расширении
общего желчного протока нужны холедохотомия и зондирование папиллы, если это невозможно сделать через
пузырный проток, для окончательного установления
степени сужения дуоденального сосочка. Поступление
контрастного вещества в двенадцатиперстную кишку
может быть и при выраженных стенозах большого дуоденального сосочка. Форсированное введение контраста в ригидные желчные пути ведет к проталкиванию
его в двенадцатиперстную кишку, поэтому наличие
контрастного вещества в двенадцатиперстной кишке не
должно создавать иллюзию благополучия и не является
тестом полноценной проходимости холедоха. Решающее
значение в нарушении проходимости терминального
отдела холедоха имеет расширение вне- и внутрипече-
ночных желчных путей и вид концевой части протока*.
Выявление камней на рентгенограммах служит дополнительным доказательством нарушения пассажа желчи.
Зондирование протока и папиллы. После установления рентгеноманометрически нарушения оттока желчи
или выявления конкрементов необходимы в большинстве
случаев холедохотомия и инструментальное исследование протоков и папиллы. В ряде случаев это обследование можно провести через пузырный проток достаточной ширины. Холедохотомический разрез не должен
быть стандартным. Его можно делать как вдоль протока, так и в поперечном направлении. При выборе
направления разреза холедоха нужно ориентироваться
на возможность в дальнейшем того или иного варианта
билиодигестивного анастомоза. При холедохе шириной
более 2 см и короткой верхней горизонтальной ветви
двенадцатиперстной кишки общий желчный проток
лучше рассекать в поперечном направлении, чтобы далее наложить холедоходуоденоанастомоз по Роуленду —
Мирици. После холедохотомии целесообразно проверить
протоки вначале с помощью ложечки даже при «отрицательной» на выявление конкрементов холангиограм-
ме. Причем ложечка вводится вначале в печеночные
протоки, а затем в терминальный отдел холедоха. Ощущение «скребка» при движении ложечкой помогает-
обнаружить камень, невидимый на холангиограмме, или
104
удалить замазкообразную массу. Лишь после проводится последовательное зондирование папиллы мягкими
металлическими или пластмассовыми бужами диаметром от 1 до 4 мм. Предварительная бескровная мобилизация панкреатодуоденального комплекса повышает
диагностическую ценность этого способа. Далее 4
пальца левой руки располагаются сзади двенадцатиперстной кишки и обхватывают головку поджелудочной
железы, а большой палец располагается в области папиллы. Такое расположение пальцев помогает направить движение кончика зонда, изменять своевременно
его направление и исключает движение зонда по ложному ходу и травму протока. Отсутствие прохождения
1 мм зонда является достоверным признаком тотального стеноза фатерова канала. Следует также помнить,
что форсированное'проведение 2 и 3 мм зонда может
привести к разрыву стеноза большого дуоденального
сосочка и прохождению кончика зонда в двенадцатиперстную кишку. Поэтому зондирование папиллы должно быть нежным, шадящим и под контролем пальцев
левой руки. Мы также убедились, что зондирование
папиллы при немобилизованном панкреатодуоденальном комплексе потенциально опасно серьезными ошибками, поскольку выпяченную стенку ретродуоденальной
части протока легко принять за свободно прошедший
зонд. Такая методика позволяет избежать ошибки и
при очень низком расположении папиллы на границе
перехода нисходящей ветви двенадцатиперстной кишки
в нижнегоризонтальную ее ветвь.
Трансиллюминация протоков. В 1968 году М. 3. Сигал предложил бесконтрастную вазоскопию желчного
пузыря и протоков с помощью трансиллюминации.
Объектом исследования в основном служили различные
формы холецистита. Было обнаружено, что при гангренозном холецистите большое значение имеют эмболический компонент и нарушение кровотока по ветвям
пузырной артерии (Г. И. Дряженков, 1970). Кроме
диагностики холедохолитиаза, для чего в основном
применяли авторы эту методику, целесообразно использование ее и для определения локализации папиллы и состояния стенок желчного пузыря при бес-
каменном холецистите.
Холедохоскопия. Холедохоскопия проводится через
105
холедохотомическое отверстие или через широкий пузырный проток. При холедохоскопии можно осмотреть
общий печеночный проток, внутрипеченочные протоки,
общий желчный проток и фатеров сосочек. При этом
можно увидеть в них конкременты, замазкообразную
массу, воспалительные изменения в слизистой протока,
рубцовый процесс в области сосочка и даже новообразования. Этот метод может помочь и в распознавании
различных форм холангита и рубцовых изменений в
области большого дуоденального сосочка (В. Р. Пур-
малис, 1970; С. Я. Кнубовец, 1976; В. В. Виноградов о
соавт., 1977).
Важнейшие этапы операции холецистэктомии:
1. Введение новокаина под серозу желчного пузыря
с целью гидравлической препаровки тканей.
2. Отсасывание содержимого желчного пузыря а
взятие желчи на посев для определения чувствительности к антибиотикам.
3. Надсечение брюшины, покрывающей разрез желчного пузыря, отступя на 1,5 см от печени для сохранения ее при катаральном и флегмонозном холецистите.
При гангренозном холецистите желчный пузырь удаляется вместе с измененной брюшиной.
4. Выделение шейки желчного пузыря и протока. В
трудных случаях при наличии инфильтрата в этой области целесообразнее начать выделение пузыря от дна.
5. Изолированная перевязка и прошивание пузырной артерии, ориентируясь на лимфатический узел
Масканьи,
6. Тщательное выделение кармана Гартмана, лежащего у 50% больных на общем желчном протоке и нередко симулирующего «ложный» пузырной проток.
7. Интубация пузырного протока и операционная
холангиоманометрия с целью определения состояния
общего желчного протока и большого дуоденального
сосочка.
8. При наличии свободного оттока желчи в двенадцатиперстную кишку и интактного общего желчного
протока операция заканчивается перевязкой пузырного
протока на расстоянии 2—3 мм от стенки холедоха
капроновой лигатурой и последующим ее прошиванием.
9. При наличии сопутствующего отечного панкреатита или явлении длительного спазма со стороны
106
сфинктера Одди - целесообразно оставить катетер, проведенный ранее в общий желчный проток, для декомпрессии желчных путей. Предварительно нужно оценить
ход пузырного протока. В 5 случаях из 24 мы не наблюдали в послеоперационном периоде выделения
желчи из катетера в связи с. резким изгибом пузырного
протока или низким его впадением в общий желчный
проток. Не следует прибегать к такой методике дренирования желчных путей и при наличии гнойной желчи.
10. Ложе желчного пузыря должно быть по возможности ушито за счет оставшейся брюшины не только для лучшего гемостаза, но и для профилактики
желчеистечения из добавочных желчных путей. С этой
же целью к области Винстова отверстия через отдельный разрез по средней подмышечной линии вводится
резиновая трубка. Показания к тампонаде подпеченочной области должны быть ограничены случаями пери-
везикулярных абсцессов, при сомнениях в гемостазе и
неполном удалении деструктивно измененной стенки
желчного пузыря. В ряде случаев возникают показания
к холедохотомии. На основании данных анамнеза клиники и операционного обследования различают показания к холедохотомии операционные и дооперационные
(Б. А. Петров и Э. И. Гальперин, 1971).
Дооперационные показания к холедохотомии
а) механическая желтуха;
б) холангит.
Операционные показания к холедохотомии
а) расширение общего желчного протока;
б) пальпируемые камни,
в) мутная или гнойная желчь при пункции протока;
г) плохая проходимость желчных путей в условиях
их нагрузки.
1. При отсутствии патологии в магистральных желчных путях после холедохотомии при остром холецистите
можно прибегнуть к первичному шву холедоха. Ушивать
разрез холедоха лучше с помощью атравматических игл
двухрядным швом. Все же в подобных случаях целесообразно, если возможно, произвести дополнительную
декомпрессию желчных путей через пузырный проток*с
контролем надежности наложенных на холедох швов.
10/
2. В значительной части случаев после холедохото-
мии следует применить наружное дренирование (рис.II).
Наиболее простым способом является дренирование по
способу А. В. Вишневского или Стерлинга. Недо-
статном способа А. В. Вишневского является большая
потеря желчи и возможность перекрытия правого пе*
ченочного протока при коротком общем печеночном
протоке и низком его делении. Поэтому более предпочтительным в таком случае является применение расщепленного дренажа Стерлинга. Оба дренажа должны
фиксироваться к холедоху двумя швами, чтобы избежать поворота дренажа вокруг оси и истечения желчи
в свободную брюшную полость. Отверстие в холедохе
ушивается до трубки слегка инвагинируюшими швами,
что создает дополнительную фиксацию трубки и предупреждает желчеистечение. Дренажная трубка выводится вдали от операционной раны через отдельный разрез.
Дополнительно обязательно дренируется подпеченочное
пространство.
3. При наличии холангита, перивезикулярного абсцесса и перитонита необходимо произвести канюляцию
ветвей воротной вены для инфузии лекарственных препаратов (О. С. Кочнев с соавт., 1974). Для этих целей
лучше использовать правую желудочно-сальниковую
вену. В дистальный конец ее в 8—10 см от привратника
вводится полихлорвиниловый катетер на глубину в VРис И. Метод» наружного дренирования
общего желчного аротока.
V - образная дреннжная трубка по Керу (а),
расщепленный дренаж по Стерлингу (б), дренажная трубка но Мейо — Вишневскому (в),
Каттелю (г),
108
5—6 см. Участок введения катетера после перевязки
фиксируется к брюшине. Используя гепариновый замок, можно пользоваться веной для лечебной инфузии
длительный срок.
4. В послеоперационном периоде холангиоманомет-
рия является лучшим средством контроля восстановления свободного пассажа желчи в двенадцатиперстную
кишку. Нормальные цифры дебита и остаточного давления сигнализируют о возможности прекращения дренирования. Окончательное суждение о прекращении
дренирования выносится после фистулохолангиографии.
При нормальном пассаже контраста и отсутствии конкрементов в протоке дренаж перекрывают на 10 — 12
часов в течение 2—3 дней, а затем удаляют.
Таким образом, сроки прекращения дренирования
желчных путей должны определяться не эмпирически
в течение 2—3 недель, а временем восстановления хорошего пассажа желчи, то есть на 7—10 день после
операции, что позволяет уменьшить потерю желчи и
сократить послеоперационный период.
5. При обнаружении в протоке остаточных камней
следует попытаться применить метод петролиза. Для
этого вначале определяют функцию печени и при отсутствии серьезных ее нарушений следует попытаться
растворить камни. Вначале общий желчный проток
промывается раствором новокаина, вводится спазмолитик и анальгетик внутримышечно. Затем в холедох
вводится 5 мл подогретого хлороформа. После этого
нельзя закрывать дренажную трубку, так как это усиливает боли. Иногда, кроме болей, появляются тошнота
и рвота. При отсутствии эффекта процедуру повторяют
через 5—6 дней.
6. Для растворения оставленных камней применяются и другие медикаментозные средства. Для этих целей можно использовать хенодеоксихолевую кислоту
по 0,5x3 раза в день (Danzibger, 1972). Большей популярностью пользуется промывание общего желчного
протока гепарином (Gardner, 1975), а также физиологическим раствором или раствором Рингер — Лактата
с добавлением спазмолитика по 500 мл 2—3 раза в
день (Lahana, 1974; Holub, 1977). По мнению многих
авторов, благоприятные результаты после промывания
желчных путей связаны в основном с механическими
109
факторами. Под давлением промывной жидкости про*
исходит проталкивание вместе с жидкостью мелких
камней через папиллу или вымывание их наружу.
В ряде случаев наружное дренирование не является
методом адекватного восстановления пассажа желчи в
двенадцатиперстную кишку. В связи с этим приходится
прибегать к реконструктивным операциям в виде создания билиодигестивных анастомозов.
Непроходимость большого дуоденального сосочка (БДС)
Непроходимость дистального отдела общего желчного протока в течение последнего десятилетия стала
серьезной хирургической проблемой. Это связано с
тем, что число пациентов с патологией доброкачественного характера этого отдела составляет от 15 до 30%'
всех заболеваний внепеченочных желчных путей
(В. В. Виноградов, А.. В. Вишневский, В. И. Кочиаш-
вили, 1972; А. В. Гуляев, А. М. Джавадян, Л. Б. Крылов и др., 1973; О. Б. Милонов, 1973; А. Ф. Греджев,
Г. Г. Мысник, Г. Г. Попов и др., 1974; М. И. Кузин,
М. В. Данилов, Э. А. Грабой, 1977, и др.). По нашим
данным, больные с непроходимостью БДС доброкачественной природы составляют 32,6% от пациентов о
хирургической патологией желчевыводящей системы.
Вид оперативных вмешательств при доброкачественных заболеваниях БДС, выполненных в клинике неотложной хирургии, представлен в табл. 6.
В связи с наличием множества зачастую противоречивых суждений о заболеваниях большого дуоденального сосочка доброкачественной природы приводим наиболее приемлемую с практической точки зрения класси-
фикацию патологии БДС.
1. Первичные заболевания БДС.
1. Стенозирующий папиллит.
2. Спастической стеноз БДС, переходящий в папил-
лосклероз.
3. Возрастные изменения БДС — возрастные гипертрофии и склероз.
4. Доброкачественные опухоли БДС — липомы, меланомы, фибромы, шваномы, аденомы, полипы, папилломы, карциноиды и др.
5. Врожденные аномалии БДС.
110
Таблица 6
Оперативные вмешательства при стенозах и спазмах
большого дуоденального сосочка
Характер операций
Число больных
всего |
умерло
Бужирование фатерова соска ....
3
Неврогенная сфинктеротомия . . .
13
—
Холецистэктомия, супрадуоденальная
холедоходуоденостомия
53
3
Холецистэктомия, трансдуоденальная папиллосфинктеротомия .....
52
4
Холецистэктомия, трансдуоденальная
папиллосфинктеротомия, вирсунгопла-
стика
4
1
Комбинированная холедоходуоденостомия и папиллосфинктеротомия . .
21
2
Холецистэктомия, холедохоеюносто-
мия
7
—
Итого. .
153
10
II. Вторичные заболевания БДС.
1. Вторичный стеноз при наличии желчекаменной
болезни.
2. Вторичный комбинированный стеноз — недостаточность.
3. Стенозы БДС на почве дуоденита.
Большое значение в выборе метода лечения заболеваний БДС имеет протяженность стеноза по длине и
вовлечение в патологический процесс различных элементов БДС. Наиболее часто в хирургической практике
встречаются (до 42% всех случаев) так называемые
остиум — стенозы. Этот вид стеноза характеризуется
сужением верхушки БДС, т. е. сужением только выходной части общесосочкового канала. Хотя этот вид сужения короток по протяжению, он наиболее опасен для
больного, так как он создает общий канал, а отсюда и
условия для рефлюкса желчи в панкреатический проток
и развитие панкреатита (Niedner, 1975) (см. рис.. 12).
Поражение склеротическим или воспалительным процессом всей ампулы.БДС и собственного сфинктера ампу-
111
Ряс. 12. Операционная жолангиографня.
Стевоэ большого дуоденального сосочка (остиумстеноэ),
Ввепеченочвые желчные пути цилиндрически расти*
ревы. В терминальной части мледоха имеется свободное сообщение в расширенным внреувговым протоком.
Ниже располагается стриктура ва ограниченном участке, вызвавшая нарушение оттока желчи я контраста
в двенадцатиперстную квшву я рефлюкс в главный
панкреатический проток.
лы рассматривают как ампулярный или папиллостеноэ
(рис. 13) (Hess. 1966; Е. А. Почечуев, 1977). Этот вид
стеноза протекает клинически более благоприятно, так
как при нем меньше условий для рефлюкса желчи а
панкреатические протоки, чем при остиумстенозах. И,
наконец, если стеноз захватил весь собственный сфинктер холедоха, то его называют папиллосфинктерным
стенозом. Протяженность такого стеноза составляет не
более 2 см. Разновидностью его является дополнительный стенозирующий процесс вирсунгова протока (см.
рис. 14). Эта разновидность стеноза получила название
игрекообразного стеноза (Hess, 1966). Другим немало*
112
Рис. 13. Операционная холангиогрзфия
Стеноп большого дуоденального сосочка (папиллосто*
воз). Реэчайшее расширение вне* и внутрипеченочныя
желчных путей, связанное е хроническим нарушением
оттока желчи. Конусовидное сужение концевой части
яоледоха и наличие рубцовой стриктуры на протяжении
4 мм. Контрастное вещество поступает в двенадцатиперстную кишку в незначительном количестве.
важным фактором в хирургии БДС является установление степени стеноза.
На основании данных холангиорентгеноманометрии
различают 3 степени стеноза БДС (В. В. Виноградов,
Э В. Гришкевич, 1962).
I степень стеноза. Общий желчный проток расширен
до 1,5 см. Остаточное давление составляет не более 200
мм вод. столба, а дебит снижен до 15 мл в 1 мин.
II степень стеноза. Общий желчный проток расширен
8 М-843
113
Рис. 14. Операционная холангиография.
Стеноз большого дуоденального сосочка (папилло-
сфинктерный игрекообразный стеноз). Расширение
общего желчного и печеночного протоков. Неровные
контуры ретродуоденальной части холедоха за счет
пернхоледохеального лимфаденита. Сужение на протяжении 1.5 см концевой части общего желчного
протока. Стриктура вирсунгова протока длиной в
I см. В результате подобного стеноза, кроме желтухи, у больного развился деструктивный панкреатит.
от 1,5 до 2 см. Терминальный отдел протока резко
сужен и имеет вид «писчего пера». Остаточное давление
от 200 до 250 мм вод. ст., а дебит составляет от 5 до
12 мл в 1 мин.
III степень стеноза характеризуется резкой дилатацией не только магистральных, но и внутрипеченочных
желчных ходов третьего и четвертого порядка. Ширина
холедоха составляет 2,5—3 см. Контрастное вещество
114
попадает в двенадцатиперстную кишку в незначительном
количестве. Дебит снижен до 3—5 мл в 1 мин.
Подобная классификация непроходимости БДС доброкачественной природы позволяет правильно выбрать
метод оперативного лечения и снизить количество ненужных операций на БДС.
Одной из серьезных проблем в патологии БДС является дооперационная диагностика. Анализ результатов дооперационной диагностики непроходимости БДС
показывает, что многие традиционные дооперационные
методы диагностики часто оказываются недостаточно
информативными. Так, число неудачных пероральных'
холецистографий составляет в среднем 45, а внутривенных холангиографий — до 25%. Обращает внимание и
тот факт, что даже при значительном нарушении оттока
желчи, развивающемся хронически, у 60% больных
билирубинемия отсутствует. В то же время в результате
хронического нарушения оттока желчи и желчной гипертензии развивается латентно протекающий хронический холангит. Указанные обстоятельства побуждают
шире применять в показанных случаях более объективные и информативные методы диагностики. К ним мы
относим лапароскопический метод обследования внепе-
ченочных желчных путей, во время которого визуальный
осмотр дополняется чрезкожной холецистохолангиогра-
фией.
В настоящее время в хирургии заболеваний большого дуоденального сосочка практически используются 3 группы операций. К первой группе относятся органосохраняющие операции — «идеальная» холедохоли-
тотомия с наложением глухого шва холедоха (В. В. Виноградов, 1962, 1970; П. И. Зима, 1967; А. Ф. Греджев,
1972) или сочетание глухого шва холедоха с наружным
дренированием через культю пузырного протока
(Д. Л. Пиковский, 1964—1974; Л. М. Шор, 1966; А. И. Не-
чай, .1966; Л. Б. Дуберман, 1974). Во вторую группу
входят различные варианты билиодигестивных анастомозов (С. П. Федоров, 1934; И. М. Тальман, 1937;
Ю. И. Морозов, 1964; Е. В. Смирнов с соавт., 1966;
А. Н. Шабанов и С. М. Микиртумов, 1967; В. С. Савельев, 1968; В. А. Вишневский, 1969; В. В. Виноградов
с соавт., 1972; О. Б. Милонов, 1973; А. Г. Островский,
1974; Jurasz, 1923; Florken, 1923; Finsterer, 1932). Третью
8*
US
группу составляют операции внутреннего дренажа билиарного тракта — папиллосфинктеротомия различного
объема (В. В. Виноградов, 1954; А. А. Шалимов, 1958;
А. В. Бельский, 1963; Д. Л. Пиковский, 1969; А. В. Смирнов, 1972; С. Я. Кнубовец, 1976; Doubilet, 1937; Malle-
Guy, 1944; Hess, 1961).
Для производства идеальной холедохотомии нужно
ряд условий. К ним относятся:
1. Свободная, проходимость общего желчного протока
при диагностической холедохотомии.
2. Уверенность в проходимости дистального отдела
холедоха.
3. Отсутствие инфекции в протоках.
4. После удаления из протоков одного или двух камней.
К противопоказаниям глухого шва холедоха следует
отнести: ,
1. Наличие воспалительно-инфильтративных изменений в стенке холедоха.
2. Гнойный холангит.
3. Узкий общий желчный проток.
4. Замазкообразные массы в общем желчном протоке.
В ряде случаев после ревизии протоков возникает
необходимость в адекватном восстановлении пассажа в
желчи в двенадцатиперстную кишку. В связи с этим
приходится прибегать к реконструктивным операциям
в виде создания билиодигествных анастомозов или
внутреннего отведения желчи с помощью папиллосфинк-
теротомии.
Показания к холедоходуоденоанастомозу
Абсолютные:
а) холангит с расширением общего желчного протока более 2 см;
б) мелкие камни общего желчного протока при наличии механической желтухи;
в) неудалимые камни в области фатерова канала;
г) копьевидное сужение терминального отдела холедоха длиной в 2 см и более.
№
Относительные:
а) неуверенность в полном удалении камней;
б) опухоль головки поджелудочной железы в не*
операбельных случаях.
Противопоказания:
а) ширина холедоха менее 5—6 мм;
б) обширный спаечный процесс в области двенадцатиперстной кишки;
в) дуоденостаз.
Недостатками холедоходуоденоанастомозов является
образование «слепого мешка» желчного протока, опасность развития «восходящего» холангита и Дискинети*
ческие нарушения в двенадцатиперстной кишке, являющиеся причиной рецидива болевого синдрома и холангита.
Этапы операции
Чтобы избежать указанных выше недостатков при
выполнении холедоходуоденоанастомозов, следует придерживаться ряда правил и технических приемов.
1. Накладывать анастомозы шириной не менее 2,0—
2,5 см с целью предупреждения развития структур в послеоперационный период.
2. С целью предупреждения сужения соустья предпочтительней пользоваться однорядным узловым швом,
3. Не применять этот вид соустья при рубцовых, воспалительных и функциональных нарушениях двенадцатиперстной кишки.
4. Исходя из этих задач, наиболее подходящим типом билиодигестивного анастомоза является холедохо-
дуоденоанастомоз по Юрашу (см. рис. 15).
5. Вскрытие общего желчного протока производится
в продольном направлении на протяжении 2—2,5 см,
не приближаясь вплотную к стенке двенадцатиперстной
кишки.
6. Двенадцатиперстная кишка вскрывается электроножом в поперечном направлении на уровне разреза
холедоха, причем разрез в кишке должен быть несколько меньше разреза холедоха.
117
7. Анастомоз выполняется однорядным шнюм с помощью атравма-
тических игл. Швы при этом следует
накладывать, начиная со стенки
кишки, вкалывая иглу через все
слои кишки снаружи внутрь, а затем
проводя ее через стенку протока
изнутри кнаружи.
8. Для облегчения сшивания
краев соустья лучше сразу наложить все швы, а уже затем произвести затягивание отдельных лигатур.
9. При такой технике наложения
анастомоза все узлы располагаются
снаружи от соустья, при этом происходит хорошая адаптация слизистой
протока и двенадцатиперстной кишки. Подпеченочное пространство
обязательно дренируется трубкой,
один конец которой располагается
вблизи от анастомоза. Брюшная
рана зашивается наглухо.
10. Применять препапиллярное дренирование через
культю пузырного протока при создании холедоходуо-
деноанастомоза нецелесообразно. Мы применили его
у 7 больных без особого успеха, так как создание широкою соустья предусматривает снятие желчной гипертензии, что и подтвердили наши дебитометрические исследования.
11. Следует подчеркнуть, что показания к холедохо-
дуоденоанастомозу в экстренной хирургии должны быть
01раничены по сравнению с плановой хирургией заболеваний БД С. Так, нецелесообразно накладывать холедо-
кодуоденоанастомоз при выраженных воспалительно-инфильтративных изменениях гепатодуоденальной связки
и двенадцатиперстной кишки. В подобных случаях для
декомпрессии внепеченочных желчных путей применяется один из известных дренажей холедоха или чрезшееч-
ное дренирование. Эта мера, безусловно, показана при
холецистопанкреатите.
Рис. 15. Холедо\одуо-
деностомия по Юра-
шу (а, б).
118
Показания к холедохоеюноанастомозд
Показания к этому виду анастомоза те же, что и к
холедоходуоденоанастомозу. Основным достоинством его
является отсутствие рефлюкса пищевых масс в желчные пути, а отсюда и меньшая возможность развития
холангитов. Однако в отечественной хирургической
практике этот вид билиодигестивного анастомоза применяется реже (Э. И. Гальперин, В. А. Лобачев, 1969;
Н. И. Краковский, В. И. Тарабрин, Ю. К. Дунаев и
.др., 1972). Его выполнение технически сложнее, в то
время как данному варианту операции свойственны недостатки, характерные для всех супрадуоденальных
анастомозов. Кроме того, после него в послеоперационном периоде часто наблюдается развитие дуоденальных язв. Тем не менее в хирургии внепеченочных желчных путей есть ситуации, когда холедохоеюноанастомоз
является методом выбора.
Абсолютными показаниями к наложению холедохоею-
ноанастомоза являются:
1. Высокая непроходимость желчных путей;
2. Наличие обширного спаечного процесса в области
двенадцатиперстной кишки;
3. Наличие выраженного дуоденостаза.
Показания к папиллосфинктеротомии .
В целом ряде случаев в хирургии внепеченочных
желчных путей более предпочтительным является трансдуоденальное рассечение большого дуоденального сосочка и формирование внутреннего холедоходуоденального анастомоза. Достоинством подобной операции
внутреннего дренирования является: 1) исключение
образования «слепого мешка», 2) сохранение естественного тока желчи; 3) декомпрессия билиарного тракта и
панкреатического протока; 4) уменьшение возможности
развития «восходящего» холангита благодаря сохранению части собственного сфинктера общего желчного
протока. Кроме того, визуальная биопсия позволяет
выявлять небольшие опухоли.
Абсолютным показанием к папиллосфинктеротомии
являются:
1. Рубцовые стенозы большого дуоденального сосочка
II—III степени;
Ш
2. Ущемленные камни ампулы и периампулярной
воны;
3. Кольцевидные стенозы терминального отдела холедоха на протяжении до 2 см, осложненные панкреатитом.
Имеются следующие противопоказания для папилло-
сфинктеротомии:
1. Распространенный стеноз терминального отдела
холедоха протяженностью более 2 см;
2. Острый панкреатит;
3. Множественные камни и «замазка» в холедохе.
По объему рассечения большого дуоденального сосочка различают: папиллотомию или парциальную па-
пиллосфинктеротомию на протяжении 5—6 мм, субтотальную папиллосфинктеротомию на протяжении 1,5—
2 см и тотальную папиллосфинктеротомию на протяжении 2,5—3 см (см. рис. 16, 17, 18).
Производить парциальную папиллотомию в большинстве случаев нецелесообразно, так как после нее очень
часто развиваются рестенозы.. Однако для удаления
вклинившегося камня достаточно и минимального рассечения папнллы. Операция тотальной сфинктеротомни,
с нашей точки зрения, также не является оптимальной,
так как полное рассечение мышечного жома ведет к
постоянному зиянию папиллы и рефлюксу кишечного
содержимого в общий желчный проток. Более оптимальной является субтотальная папиллосфинктеротомия,
Рис. 16. Операция иа большом
дуоденальном сосочке (П. Н. Напалков, Н. И Артемьева, 1978).
• — термнвалъвая паииллотомия; б —
парциальная папиллосфинктеротомия.
v
120
Рис. 17. Операция на большом
дуоденальном сосочке (П. Н. Напалков, Н Н. Артемьева, 1978).
• — папиллохоледохопластика; б —
продленная папиллохоледохопластика
обеспечивающая хороший отток желчи и сохранение
части мышечного аппарата сфинктера Одди, обеслечи*
вающего порционное освобождение желчных путей
Важнейшими этапами операции являются:
1. Обширная мобилизация нисходящего сегмента две*
надцатиперстной кишки и головки поджелудочной железы после ретродуоденальной новокаиновой блокады.
2. Холедохотомия, инструментальная ревизия состояния протоков и проходимости большого дуоденального
сосочка. •Рис. 18. Операция на большом
дуоденальном сосочке (П. Н. Напалков, Н. Н. Артемьева, 1978).
• — папилловирсунгопластнка; б — па-
пнллохоледохо- я вирсувгопластика.
121
3. С помощью оливчатого зонда, проведенного через
разрез холедоха, определяется расположение папиллы и
место предстоящего разреза двенадцатиперстной кишки.
4. Двенадцатиперстная кишка рассекается электро*
ножом в продольном направлении. Такой разрез позво-
ляет расширить его в нужном направлении на значи-
тельном протяжении.
5. Папилла выводится в разрез кишки с помощью
оливчатого зонда, и края папиллы берутся на капроновые
держалки. С помощью электроножа на 11 часах производится рассечение слизистой и мышечной части сфинктера на протяжении до 1,5—2 см, что определяется выходом на расширенную часть протока, и проводится
идентификация устья панкреатического протока.
6. Вырезается треугольной формы лоскут из стенки
сфинктера основанием в 2—3 мм и направляется на
гистологическое исследование. Тонким гетгутом двумя-
тремя швами сшивается слизистая кишки и протока
с наружной стороны. Швы с внутренней стороны накладывать не следует, чтобы не перекрыть отток из вирсун-
гова протока и не вызвать острый панкреатит.
7. Кишка ушивается в поперечном направлении двухрядным швом. Для разгрузки двенадцатиперстной кишки
и предупреждения желчной гипертензии целесообразно
использовать холедохотомическое отверстие для наружного дренирования. Дренировать проток транспапиллярно
дренажом типа Долиотти ошибочно, так как этот дренаж, перекрывая проток, способствует развитию панкреатита. Можно воспользоваться для этих целей дренажом
холедоха типа А. В. Вишневского или Стерлинга, помня
о том, что при коротком гепатикохоледохе более предпочтителен второй способ.
8. Наружный дренаж используется в послеоперационном периоде для декомпрессии желчных путей и для
контроля за восстановлением нормальной гидродинамики
желчи. Он дополняется холангиографией через трубку.
Нормальные показатели гидродинамики и холангиограм-
мы являются тестом, позволяющим определить время
удаления трубки из общего желчного протока.
Операция, как правило, должна заканчиваться дренированием подпеченочного и ретродуоденального пространства трубкой. Она служат контролем при возникаю-
122
Шей недостаточности дуоденальных швов или швов на
холедохе или путем оттока лимфы, скапливающейся
после мобилизации двенадцатиперстной кишки и головки
панкреас. Мы наблюдали обильную лимфоррею у 5 больных после операций на внепеченочных желчных путях,
связанных с мобилизацией указанных органов. При
излиянии скопившейся лимфы в брюшную полость появляются умеренные боли в животе и слабое мышечное
напряжение, более выраженное в правой половине живота. Одновременно повышается температура и возрастает лейкоцитоз. Так возникает картина слабо выраженного и вяло текущего хилезного перитонита. В одном
случае этот диагноз был подтвержден на релапаротомии,
во время которой было удалено около литра мутной лимфы. В другом же случае была произведена лапароскопия.
При лапароскопии было удалено из брюшной полости
около литра прозрачной лимфы и были поставлены
трубки в брюшную полость для эвакуации вновь накапливающейся лимфы. Через 5 дней после этого истечение
лимфы из брюшной полости прекратилось. Видимо,
лимфоррея после обширной мобилизации двенадцати-
1ерстной кишки и головки поджелудочной железы наблюдается нередко. Клинически это проявляется тяжестью,
тупыми болями в правом подреберье, субфебрильной
температурой и пальпаторной болезненностью. Обычно
расширения канала для дренирования подпеченочного
пространства бывает достаточно, чтобы опорожнить это
жопленве лимфы. Поэтому при операциях, связанных с
мобилизацией панкреатодуоденального комплекса, сле-
тует помнить о возможности развития подобного ослож-
тения и предупреждении его.
Показания к операциям «двойного дренирования»
При непроходимости большого дуоденального сосочка
юзникают ситуации, когда ни один из методов внутрен-
iero дренирования не является достаточным для деком-
рессии билиарного тракта и панкреатических протоков,
ак, при стенозах большого дуоденального сосочка и
ниженной перистальтике желчных протоков создаются
словия для затрудненного оттока как желчи, так и
анкреатического сока. Трудности в выборе адекватной
нерации возникают и при множественном холедохо-
123
литиазе на фоне резкого расширения протоков и ущемлении одного из камней в папилле.
В таких случаях оказывается целесообразным двойное дренирование гепатикохоледоха — холедоходуодено-
стомия и сфинктеротомия (Э. В. Гришкевич, М. В. Данилов, П. И. Зима и др., 1974; О. Б. Милонов, А. А. Мов-
чун, 1975; В. В. Виноградов, П. И. Зима, Ф. В. Базилевич, 1976; Д. Ф. Благовидов, М. В. Данилов, А. В. Вишневский, 1976). Таким образом, показанием к операции
«двойного дренирования» являются сегментарные или
комбинированные обтурирующие поражения гепатикохоледоха и дуоденального сосочка в различных сочетаниях. Кроме одномоментной операции «внутреннего дренирования», могут применяться и двухмоментные операции. Так, органическое сужение большого дуоденального
сосочка, выявленное после операции холедоходуодено-
анастомоза. и сопровождающееся холангитом, может быть
дополнено папнллосфинктеротомией. Явления билиарной
гипертензии и холангита после рестеноза оперированного
ранее большого дуоденального сосочка могут дополняться холедоходуоденоанастомозом.
Важнейшие этапы операции:
1. Мобилизация двенадцатиперстной кишки и головки
поджелудочной железы после ретродуоденальной новокаиновой блокады.
2. Холедохотомия, проверка проходимости большого
дуоденального сосочка и установление степени стеноза
с помощью зондовой пробы.
3. Дуоденотомия и рассечение папиллы на зонде с
пластикой сфинктера по наружному контуру.
4. Если дуоденотомическое отверстие располагается
вблизи от холедохотомного отверстия, то оно может
быть использовано для создания холедоходуоденоанасто-
моза. В других случаях холедохотомное отверстие ушивается поперечно однорядным швом по Матушеку или
двухрядным. После этого накладывается типичный холе-
доходуоденоанастомоз по Юрашу в постбульбарном отделе двенадцатиперстной кишки.
5. Дренирование подпеченочного и ретродуоденаль-
ного пространства трубкой.
124
ГЛАВА VII
ОСТРЫЙ ПАНКРЕАТИТ
Острый панкреатит — заболевание со сложным патогенезом, в котором ферментный фактор имеет «пусковое» значение, а панкреатическая ферментная токсемия
ведет к поражению ряда органов и систем. Пусковым
элементом ферментативного патогенеза острого панкреатита является повреждение ацинозных клеток поджелудочной железы различной природы (алиментарной,
аллергической, токсической, ишемической, травматнче-i
ской, обструктивной и т. д.). Освобождающиеся
лизосомные ферменты активируют трипсиноген и превращают его в трипсин (Forell с соавт., 1961; О. С. Кеч*
нев, 1970). Последний активирует калликреиноген и другие протеазы. При наличии достаточного количества ингибитора происходит дезактивация ферментных систем, в
результате чего наступает равновесие в организме
и панкреатит не развивается. В случае дефицита ингибитора аутокаталитический процесс прогрессирует и
развивается острый панкреатит. Его дальнейшие патогенетические механизмы развертываются с участием
вазоактивных полипептидов — брадикинина и каллиди-
на (см, рис. 19). Последние усиливают транссудацию
крови, нарушают микроциркуляцию и вызывают коллапс (В. С. Савельев с соавт., 1973, 1978; Ю. В. Огнев
с соавт., 1974). Таким образом, острый панкреатит
представляет собой «токсическую энзимопатию» поли-
висцерального характера. Это объясняет полиморфизм
клинического течения острого панкреатита и существование при этом заболевании целого ряда клинических
синдромов.
Таких синдромов при остром панкреатите может
быть несколько: 1) абдоминальный, 2) панкреато-кар-
диоваскулярный, 3) панкреато-плевральный, 4) панкре-
ато-супраренальный, 5) панкреато-ренальный, 6) пан*
креато-церебральный (В. В. Чаплинский. А. И. Гнаты-
шак, 1972; В. И. Филин, 1973).
Абдоминальный синдром включает ряд общих и
местных симптомов. К ним относятся сильная эпигастральная боль, динамическая кишечная непроходимость, рвота. К другим постоянным признакам абдоми- '
125
Рис 19 Схема образования и распада кинииов при
остром панкреатите.
нального синдрома относятся тошнота, сухость во рту,
мучительная икота, отрыжка горечью и воздухом, икте-
ричность кожных покровов. Иктеричность кожных
покровов может быть следствием не только нарушения
оттока желчи в двенадцатиперстную кишку, но и результатом токсического повреждения печеночной паренхимы
вплоть до развития острой желтой атрофии печени.
Нередко при абдоминальном синдроме наблюдается
рвота «кофейной гущей» за счет кровотечения из остро
образовавшихся язв и эрозий. Следует подчеркнуть, что
местная картина при осмотре живота может быть, очень
полиморфной: от абсолютно мягкого живота, наличия
поперечной ригидности в подложечной области и вплоть
до признаков перитонита в виде напряжения и других
признаков раздражения брюшины.
126
Панкреато-кардиоваскулярный синдром. Он может
проявляться жалобами на сильные загрудинные боли,
резким ослаблением сердечных тонов, тахикардией,
расширением границ сердечной тупости и изменениями
в электрокардиограмме, характерными для острой ишемии миокарда (панкреато-кардиальный или «инфарктоподобный» синдром). Основные изменения в ЭКР
заключаются в снижении вольтажа желудочкового
комплекса, смещении сегмента ST и значительном изменении зубца Т (инверсия зубца Т, изменение вольтажа,
расщепление и др.), что указывает на очаговую гипоксию и обменные нарушения в миокарде (О. С. Кочнев;
1965). Изменения в электрокардиограмме при остром
панкреатите носят рефлекторный характер, они быстро
проходят после купирования болевого синдрома и приступа панкреатита, что имеет дифференциально-диагностическое значение.
Панкреато-васкулярный синдром более характерен
для тяжелых, деструктивных форм острого панкреатита.
Изменение артериального давления носит фазный характер. В начальных стадиях заболевания (отека) нередко наблюдается повышение артериального давления,
сопровождающееся гиперемией лица. Далее гипертония
при прогрессировании морфологических изменений в
поджелудочной железе и развитии некроза сменяется
прогрессирующей гипотонией.
Пульс в начале заболевания не имеет особенностей,
но при развитии васкулярного синдрома, кроме тахикардии, появляется, аритмия и экстрасистол и я. Главными причинами развития сосудистой недостаточности
являются нарушение состояния сосудистого тонуса, ги*
поволемия и патологическое депонирование крови в
системе сосудов воротной вены, что и определяет специфичность лечебных мероприятий при возникновении
этого синдрома.
Панкреато-плевральный синдром, характеризующийся различной степени реактивными изменениями со стороны легких и плевры, обнаруживается практически у
половины больных. Изменения в грудной полости выражаются в ограниченной подвижности диафрагмы и высоком ее стоянии, наличии дисковидных ателектазов в
нижних отделах легких, плеврального выпота и пневмо-
127
нии, причем значительное количество изменений в грудной полости выявляется в первые три дня болезни.
Панкреато-супраренальный синдром тесно связан с
сосудистыми нарушениями при остром панкреатите. Их
основой является нарушение функции надпочечников.
Причем имеет место как понижение, так и повышение
функции коры надпочечников. Понижение функции надпочечников выражается в развитии гипотензии и коллапса, резкой слабости и адинамии, гипотермии и гипер-
калиемии, лимфопении и нейтрофилеза.
Панкреато-ренальный синдром характеризуется лабораторными и клиническими признаками поражения
почек. Нарушения функции почек условно делятся на 3
формы: легкая, средняя и тяжелая форма. Для легкой
или функциональной формы характерны альбуминурия
и незначительно выраженная олигурия в течение 2—3
дней. При средней тяжести нарушения функции почек
появляются микрогематурия, цилиндрурия, снижение
удельного веса мочи и более выраженная олигурия. Тяжелые нарушения функции почек проявляются анурией
и азотемией длительностью до 10 суток, которую часто
вызывает сосудистый коллапс. В результате некроза
кортикального слоя почки анурия и уремия может стать
необратимой.
Панкреато-церебральный синдром характеризуется
различной степени нарушением психики. Это может проявляться в начале заболевания резким возбуждением,
страхом и обморочным состоянием вплоть до кратковременной потери сознания, которые быстро проходят
при ликвидации болевого приступа (В. М. Воскресенский, 1951; С. В. Лобачев, 1953). Чаще, особенно при
деструктивном панкреатите, наблюдаются другие мозговые нарушения. Они проявляются довольно разнообразно в виде психомоторного возбуждения, бредовых дели-
риозных состояний, депрессий, заторможенностью, затемнением сознания.
Указанные клинические и синдромные проявления
острого панкреатита, лабораторные тесты являются основой для определения тяжести острого панкреатита.
А. 1. Боли.
2. Тошнота и рвота.
3. Метеоризм,
12»
4. Уклонение ферментов.
5. Температура.
6. Изменения со стороны крови.
7. Изменения со стороны легких и плевры.
8. Рефлекторные признаки (расширение зрачка
слева, болезненность в зонах Геда).
5. 1. Гипергликемия.
2. Протеинурия.
3. Ригидность и болезненность при пальпации живота.
4. Изменения ЭКГ.
5. Желтуха.
6. Расстройство электролитного баланса.
7. Красное «калликреиновое» лицо.
8 Флеботромбозы.
В. 1. Шок.
2. Паралитический илеус, атония желудка.
3. Геморрагический асцит.
4. Свежий диабет.
5. Почечная недостаточность.
6. Кровь в содержимом желудка.
Т: Цианоз.
8. Психоз.
9. Пальпируемый инфильтрат.
Клинические тесты первой группы относятся к легкой форме острого панкреатита, первой и второй групп —
средней тяжести, а комбинация признаков третьей группы — к тяжелой форме панкреатита.
В клиническом течении прогрессирующего панкреатита можно выделить три периода: 1 период — общих, в
основном гемодинамических расстройств (1—3 сутки);
2 период — органных нарушений в виде функциональной недостаточности или токсической дистрофии паренхиматозных органов (3—7 сутки); 3 период — преимущественно местных (абдоминальных) асептических или
гнойных осложнений (В. М. Буянов*. Ю. В. Огнев,
В. А. Кубышкин, 1978).
Немаловажное значение для постановки диагноза
острого панкреатита и выбора метода лечения имеет
определение ряда лабораторных показателей: амилазы
9 .И-843
129
(диастазы) мочи или крови, билирубина, остаточного
азота, сахара, кальция крови и других электролитов,
кислотно-щелочного равновесия, гематокрита, протромбина и свертываемости крови, геминовых соединений,
общего анализа крови и мочи. В последнее время дифференциально-диагностическое значение приобретает
определение общей лактатдегидрогеназы и ее изоферментов (Р. Г. Амбарцумян с соавт., 1977; Э. Ф. Казинец
с соавт., 1977). Установлено, что активность общей ЛДГ
и содержание ЛДГ-3 повышаются при различных формах панкреатита. Увеличение ЛДГ-4 и ЛДГ-5 наблюдается при острых холециститах и повреждении печеночной паренхимы.
Инструментальные методы обследования включают
ряд исследований:
A. Рентгеноскопия и рентгенография брюшной полости, а при необходимости и грудной клетки для выявления косвенных признаков панкреатита. В брюшной полости к ним относятся вздутие поперечноободочной кишки, увеличение расстояния между большой кривизной
желудка и поперечноободочной кишкой, сглаженность
тени ш. iliopsoas и др.
Б. В сомнительных случаях или при отсутствии эффекта от консервативной терапии применяется диагностическая лапароскопия (В. С. Савельев с соавт., 1973;
B. И. Юхтин с соавт., 1978; Ю. Е. Березов с соавт., 1978;
О. С. Кочиев и И. А. Ким, 1978).
B. Определенную диагностическую ценность начинают приобретать ультразвуковое обследование поджелудочной железы и цветная термография (Э. Я. Дубров,
C. А. Игнатенко, 1977; Р. Т. Панченков с соавт., 1977).
Лечебная программа
Большинство больных острым панкреатитом при отсутствии угрожающих для жизни признаков ухудшения
заболевания должно лечиться консервативно. Показания
к хирургическому лечению должны быть строго определены в зависимости от сроков и клинического течения
заболевания (В. С. Савельев, 1978; Ю. Е. Березов с соавт., 1978; А. В. Гуляев с соавт., 1978; Б. А. Королев с
с соавт., 1978, и др.),
Консервативное лечение
1. Торможение панкреатической секреции:
а) голод в течение 3—7 суток;
б) отсасывание желудочного содержимого;
в) атропинизация по 0,5 мг 2—3 раза в день или
введение эфедрина;
г) внутрижелудочная гипотермия.
2. Борьба с болью:
а) блокада чревных нервов или паранефральная
блокада;
б) нитроглицерин под язык, спазмолитики (папаверин, но-шпа, галидор);
в) новокаиновая терапия. Введение 1/4% раствора новокаина в больших дозах, до 600,0—800,0 мл,
медленно — 20—30 капель в минуту;
г) промедол, анальгин, нельзя морфий из-за его
способности вызывать спазм сфинктера Одди.
3. Антиферментная терапия:
а) тразилол вводится внутривенно из расчета
5000 ед. на кг веса в сутки, т. е. 350000—400000 ед. в сутки (О. С. Кочиев, 1971). Суточная доза делится пополам
и вводится медленно капельно в течение многих часов
в физиологическом растворе. При наличии шока показано ввести сначала 50000 ед. тразилола одномоментно,
а затем перейти на капельное вливание;
б) контрикал (1 ед. контрикала =3 ед. тразилола) —суточная доза от 80000 до 120000 ед. в физиологическом растворе. Вначале следует ввести одномоментно 10000—20000 ед. контрикала, а затем перейти на
медленное капельное вливание контрикала в физиологическом растворе;
в) пантрипин—суточная доза 300ед.; 100—120ед.
пантрипина в 10 мл физиологического раствора вводят
одномоментно внутривенно. Остальная доза вводится
дробно внутривенно капельно по 30—50 ед. каждые
4 часа;
г) эпсилонаминокапроновая кислота 5% раствор
300—400 мл внутривенно, капельно;
д) амидопирин 10 мл — 4% раствора внутримышечно;
е) пентоксил по 0,2 г 3 р. в день.
9*
131
4. Коррекция водно-&лектролитного баланса. Конкретное определение объема инфузионной терапии представляет трудную задачу. Наиболее полно можно решить этот вопрос с помощью определения ОЦК и ее
компонентов. В экстренной хирургии при трудностях
определения ОЦК ее можно заменить формулой
Л. Г. Завгороднего с соавт. (1973):
Дефицит ОЦК = Д°^ный ^
fit,
где Ш\ — нормальный показатель гематокрита (для
мужчин — 43, для женщин — 41%), Ша — показатель
гематокрита у данного больного; должный ОЦК для
мужчин равен весу тела, умноженному на 76, а для
женщин — весу тела, умноженному на 71. Введение
жидкости в больших количествах должно проводиться
под контролем ЦВД, диуреза и содержания электролитов. Резко ограничивается введение жидкости при повышении ЦВД до 150 мм вод. ст. и выше и применяется
кардиальная терапия:
а) раствор Рингера — Локка до 2000 мл в сутки;
б) 5% раствор глюкозы 1500 мл4-инсулин из расчета 1 ед. на 3 г сахара;
в) 10 мл 10% раствора хлористого кальция с 5—
6 суток болезни;
г) сухая плазма или альбумин 10% — 100 мл;
д) гемодез — 400 мл медленно, капельно, внутривенно.
5. Противошоковая терапия:
а) реополиглюкин или полиглюкин до 1000 мл
внутривенно;
б) 10% раствор альбумина 200—300 мл;
в) 125 мл гидрокортизона струйно в вену (суточная доза — 300—600 мг);
г) норадреналин 2—3 мг в сутки.
6. Антиаллергическая терапия: пипольфен, димедрол,
супрастин.
7. Противовоспалительная терапия: препараты ге-
трациклинового ряда, можно применять пенициллин и
стрептомицин в высоких дозах (до 10—15 млн. ед. пенициллина).
8. Неспецифическая дезинтоксикационная терапия —
форсированный диурез (В. И. Ковальчук, 1972);
132 '
а) предварительная водная нагрузка раствором
Рингер — Локка от 750 до 1500 мл и 500 мл 3% раствора
бикарбоната натрия;
б) введение маниитола из расчета 1,0 г на кг веса
больного струйно или частыми каплями. Если позволит
давление, сочетать с 20 мл 2,4% раствора эуфиллина;
в) коррекция электролитного и белкового баланса:
1000 мл 5% раствора глюкозы -f- 50 мл. 10% раствора
хлористого натрия 4- 20 мл 10% раствора хлористого
калия -+- 200 мл 1 % раствора хлористого кальция.
9. Симптоматическая кардиальная терапия.
С целью рационализации консервативного лечения
больных острым панкреатитом приводим схему лечебных мероприятий в таблице 7.
Эндоскопическое лечение
В случае безуспешности консервативной терапии,
проводимой в течение 12—24 часов, показана диагностическая и лечебная лапароскопия (В. С. Савельев с
соавт., 1973; Ю. Е. Березов, 1976; В. И. Юхтин, 1977;
О. С. Кочнев, И. А. Ким, 1978). При установлении во
время лапароскопии отечного или деструктивного панкреатита без признаков нагноения, но с наличием токсического ферментного выпота, т. е. химического перитонита, в нашей клинике у 28 больных из 59, экстренно
лапароскопированных по поводу острого панкреатита,
произведено лапароскопическое дренирование брюшной
полости для проведения перитонеального диализа
(И. А. Ким). Для этого под контролем лапароскопа
производилась пункция брюшной стенки--в подреберьях
и подвздошных областях с помощью троакара и в отлогие места устанавливали полихлорвиниловые дренажные
трубки. Верхние трубки притока диаметром в 0,2 cml
нижние трубки оттока — в 0,5 см. Через них проводили
фракционное промывание брюшной полости раствором
следующего состава: раствор Рингер-Локка (1000—
1500 мл), 0,25% раствор новокаина (500 мл), сульфат
канамицина (2,0 г), гепарин (1000 ед.), контрикал
(20000 ед.), гидрокортизон (50 мг). За сутки осуществляли 2—3 сеанса промывания брюшной полости, продолжительность диализа составляла 3—4 суток. К этому
времени у ряда больных наступило клинически опреде-
133
Таблица 7
£
Характеристика
Легкий панкреатит
Панкреатит средней
тяжести
Тяжелый панкреатит
Общее состояние
Постоянные боли вверху
живота в течение нескольких часов, тошнота, редко
рвота. Субфебрильная температура.
Пальпаторно мягкий, болезнен в надчревье или
левом подреберье, умеренное вздутие.
Сильные и продолжительные боли вверху живота,
часто опоясывающие. Рвота. Температура 38°С.
Сильные и продолжительные
боли в надчревье, часто опоясывающие. Неукротимая рвота. Температура 38 — 39* С.
Желтуха.
Живот
Пальпаторно значительная болезненность в надчревье, часто ригидность
брюшной стенки в верхнем
этаже, локальный метео¬
Вздутие, больше в надчревье. Пальпаторно разлитая болезненность, симптомы раздражения брюшины.
Кровообращение
АД — норма, небольшое
учащение пульса.
ризм.
Умеренная гипотензия.
Лицо розовое, пульс учащенный.
Шок — синдром с артериальной гипотонией. Выраженная
тахикардия, стенокардитиче-
ские боли, симулирующие
инфаркт миокарда.
Кровь
Лейкоциты—норма или
повышение до 10000, сдвиг
в картине крови отсутствует.
Лейкоцитоз — 10000 —
—20000, сдвиг в лейкофор-
муле (лимфопения). Повышение амилазы. Легкая
гипергликемия.
Гиперлейкоцитоз — 15000 —
—25000. Резкий сдвиг влево,
гипергликемия, гипокальци-
емия, гипопротеинемия, ги-
попротромбинемия, гипоан-
титромбинемия.
Моча
Диастазурия непостоянная с тенденцией к большим колебаниям. Диурез-
норма.
Стойкая диастазурия,
снижение суточного диуреза.
Олигурия или анурия, длительная диастазурия, альбуминурия, цилиндрурия.
Патогенетическая терапия
Тразилол — 2 инфузии по
50 000 ед. внутривенно в
растворе Рингера или 5%
растворе глюкозы. Перорально пентоксил по 0,2
о—4 раза в день.
Тразилол — 25000 ед.
одномоментно, по 75000 ед.
капельно внутривенно в
растворе Рингера или 5%
глюкозы 2 раза в день.
Тразилол— 50 000 ед. одномоментна внутривенно, затем
по 150 000 ед. 2 раза в день.
Торможение
панкреатической
секреции
Атропин, эфедрин п/к.
Отсасывание из желудка,
Атропин, эфедрин п/к.
Фонурит 0,25 г. 1 раз в
день.
Носожелудочный зонд.
Атропин, эфедрин. Фонурит
0,25 г 1 раз в день.
Режим питания
Голод на 1—3 дня, пить
Боржом 1—1,5 л.
Полный голод 3—5 дней.
Полный голод 5—7 дней.
Кардиальная и
сосудистая терапия
Только у больных с заболеваниями сердца по показаниям.
Строфантин 0,5 мл капельно внутривенно в растворе глюкозы. Камфора,
кордиамин, гидрокортизон
(75—100 мг) при артериальной гипотензии.
Строфантин по 0,5—1,0 мл
внутривенно в глюкозе. Камфора, кордиамин, АТФ, Гидрокортизон по 125 — 200 мг
внутривенно при артериальной гипотонии. Норадреналин
по 0,5—1,0 мл внутривенно
при стойком коллапсе, кровь
или плазма внутривенно.
Продолжение таблицы 7
Характеристика .
Легкий панкреатит
.Панкреатит средней
тяжести
Тяжелый панкреатит
Борьба с болью
Паранефральная новокаи-
новая блокада. Внутривенно по 200—400 мл 0,25%
раствора новокаина. Про-
медол. Спазмолитики (нитроглицерин, папаверин,
атропин).
Паранефральная новокаи-
новая блокада или блокада
чревных нервов! Внутривенно 400 мл 0,25% раствора новокаина. Проме-
дол, спазмолитики.
Паранефральная новокаино-
вая блокада или блокада чревных нервов. Внутривенно
0,25% раствор новокаина, если
нет гипотонии. Промедол,
спазмолитики, атропин.
Антиаллергиче-
ская терапия
Димедрол, супрастин или
пипольфен. Э-АКК 5%
раствор по 15 мл 6 раз в
день.
Димедрол или пипольфен Э-АКК 5% раствор
внутривенно или перорально.
Димедрол или пипольфен.
5% раствор Э-АКК внутривенно или перорально
Водно-электролитная корреляция
Физиологический раствор
или раствор Рингера
1000 мл, 5% раствор глюкозы внутривенно. Плазма
200 — 300 мл. Хлористый
кальций (10% раствор)
10 мл внутривенно. Инсулин.
Физиологический раствор
1000 мл, раствор Рингера
1000 мл, 5% раствор глюкозы
1500 мл внутривенно. Плазма
'250—500 мл или кровь. Хлористый кальций 10% раствор
10 мл внутривенно. Инсулин.
Борьба с инфекцией
•
Препараты тетрацикли-
нового ряда.
Пенициллин и стрептомицин, препараты тетра-
циклинового ряда.
Пенициллин и стрептомицин; препараты тетрацикли-
нового ряда.
Ияемое обратное развитие или торможение патологического процесса в поджелудочной железе. Лапароскони-
ческое дренирование брюшной полости дополнялось
канюляцией и пролонгированной блокадой круглой связки печени по нашей методике (О. С. Кочнев, И. А. Ким,
Ф. А. Давлеткильдеев, 1978). В результате проведенного
лапароскопического лечения у 26 больных из 28 воспалительные явления в поджелудочной железе были купированы. По нашим наблюдениям, лапароскопическое
дренирование брюшной полости и проведение интрапе-
ритонеальной перфузии являются мощным средством
дезинтоксикации организма и ликвидации явлений «химического» перитонита. Он позволяет также уменьшить
число экстренных операций или проводить их в более
благоприятных условиях после проведенного лечения.
Оперативное лечение
Определение_показаний к хирургическому лечению
до сих пор остается сложной и не до конца решенной
проблемой. Эти трудности определяются тем, что состояние больных на ранних сроках заболевания отягощается выраженной интоксикацией, сердечно-сосудистыми нарушениями и печеночно-почечной недостаточностью. Кроме того, на ранних сроках заболевания
трудно определить объем операции из-за отсутствия
четкой зоны демаркации в области некроза. Спустя 2—3
недели после начала заболевания развиваются септиче'
ские осложнения как в поджелудочной железе, так и
ретроперитонеалыюй клетчатки. Таким образом, задачи
хирургического лечения в различные периоды течения
панкреатита не могут быть однотипными и решаться с
помощью единой хирургической методики. Задачи хирургического лечения острого панкреатита можно сформулировать так: каждой фазе панкреатита — свой комплекс хирургических мероприятий (табл. 8). В связи с
этим целесообразно придерживаться классификации
операций при панкреатите на ранние — в первые 2—3
суток заболевания, отсроченные — через 2—3 недели
после начала брлезни и поздние — через 1—2 месяца
после купирования воспалительных явлений в поджелудочной железе (В. И. Филин с соавт., 1973),
137
Таблица 8
Вид оперативных вмешательств при остром
панкреатите и их исходы
Виды операции
К-во
больных
Умершие
„Закрытый метод44 в сочетании с за-
брюшпнной блокадой
34
„Закрытый метод44 в сочетании с
канюляцией правой желудочно-сальниковой артерии
13
2
Холецистэктомия в сочетании с хо-
ледоходуодепоанастомозом
18
2
Холецистэктомия в сочетании с па*
пиллосфинктеротомией
11
2
Секвестрэктомия и тампонада . . .
17
9
Тампонада в сочетании с холецисто-
стомией
4
2
Резекция тела и хвоста поджелудочной железы
2
2
Внутренний дренаж кисты .
8
—
Наружный дренаж кисты
2 -
~
Всего*
109
19 (17,4%)
Ранние операции
Ранние операции производятся:
1. При неуверенности в диагнозе и подозрении на
острое заболевание в брюшной полости, отличить которое ог панкреатита не представляется возможным
2. При нарастании симптомов перитонита.
3. При сопутствующем поражение желчных путей и
признаках деструкции желчного пузыря.
4. При отсутствии эффекта от проводимого комплексного интенсивного консервативного лечения в течение
24—48 часов. Критериями неэффективности лечения являются: симптомы неустранимого шока, .снижение диуреза ниже 1000 мл за сутки, снижение кальция крови
ниже 7,5 мг%, возрастание гипергликемии выше
200 мг%.
138
Этапы операции
1. Наркоз, верхняя срединная лапаротомия. Забрю-
шинная новокаиновая блокада путем инфильтрации корня брыжейки поперечноободочной кишки справа и слева
от связки Трейца, блокада круглой связки печени и
ретродуоденальной клетчатки.*
2. Тщательная ревизия поджелудочной железы после
вскрытия желудочно-ободочной связки, осмотр желчевыводящих путей и нижних этажей брюшной полости
для выявления экссудата. Особое внимание при ревизии
нужно обратить на установление свободной проходимости в терминальном отделе холедоха, т. е. выявление
стриктуры большого дуоденального сосочка, ущемленного камня.
3. Если установлено наличие ущемленного камня
большого дуоденального сосочка, то при отечном панкреатите показана трансдуоденальная папиллосфинкте-
ротомия с дополнительной декомпрессий общего желчного протока. При наличии деструктивного панкреатита
вмешательство на большом дуоденальном сосочке противопоказано, но обязательна декомпрессия желчных
путей.
4. При отечном и геморрагическом панкреатите брюшина над поджелудочной железой не рассекается. Производится обкалывание поджелудочной^ железы по ее
периметру раствором, содержащим 50 мл 0,5% раствора
новокаина с добавлением 125 мг гидрокортизона, 20000
ед. контрикала и 1 млн. ед. пенициллина.
5. При наличии ферментативного холецистита делается холецистэктомия с обязательным дренированием
общего желчного протока через культю пузырного протока. Декомпрессия также необходима при явлениях
билиарной гипертензии в случае интактных внепеченоч-
ных желчных путей с помощью холецистостомии.
6. Тщательное удаление из брюшной полости и особенно ее нижних этажей экссудата, обладающего токсическим действием.
7. При отечной и геморрагической форме панкреатита тампонаду сальниковой сумки проводить не следует.
В сальниковую сумку лишь вводится многодырчатый
ирригатор для подведения антибиотиков и антиферментов,
139
8. При отечном или отечно-геморрагическом панкреатите нами хороший эффект получен от пролонгированной блокады круглой связки печени. Для этого чрез-
кожно и внебрюшинно производится канюляция круглой
связки печени по Сельдингеру тонкой полихлорвинило-
вой трубкой. Через установленный катетер ежедневно
в течение 4—5 дней вводится капельно 150—200 мл
*/«% раствора новокаина с добавлением 20000—30000 ед.
контрикала и спазмолитиков — галидора или но-шпы.
9. При деструктивном панкреатите показана регионарная перфузия поджелудочной железы. Для этих целей используется постоянный катетер, введенный а
правую желудочно-сальниковую артерию. После выделения этой артерии в 5—6 см от привратника в ее просвет вводится соответствующего диаметра катетер в
сторону головки поджелудочной железы на глубину
в 5—7 см. Место введения катетера фиксируется к брюшине лапаротомной раны, что позволяет изолировать
место канюляции от
свободной брюшной
полости, затем без риска получить кровотечение, удалить катетер
через 7—10 дней. В катетер ежедневно вводится 20000—30000 ед.
контрикала в 150—200
мл новокаина с добавлением антибиотиков.
10. При наличии чисто ферментативного
перитонита необходимо произвести дренирование как верхнего, так
и нижнего этажа брюшной полости трубками.
При наличии гнойнофибринозного септического перитонита пока-
Рдс. 20. Схема перфузии зано проведение промы-
сальниковой сумки я вания брЮШНОЙ ПОЛО-
брюшной полости при п Г[ГЯ,И .. „еобхо-
остром деструктивном сти- ^ связи с неоохо
панкреатите. димостью промывания
140
не только брюшной полости, но и сальниковой сумки
целесообразно воспользоваться модификацией Wasner’a
(1973) %(см. рис. 20).
11. При панкреатите, осложненном желтухой, почечной недостаточностью, перитонитом, показано дополнительно дренирование грудного лимфатического протока.
12. В послеоперационном периоде нередко наблюдается развитие постнекротического инфильтрата. Он
поддается лечению антибиотиками и, в частности, полу-
синтетическими пенициллинами в сочетании с гепари-
нотерапией (15000—30000 ед. в сутки), амидопирином,
глюконатом кальция и анаболическими гормонами
(В. С. Савельев, 1978).
Отсроченные операции
Показаниями к отсроченной операции являются:
1. Отсутствие эффекта от консервативного лечения —
сохраняющиеся боли, явления частичной кишечной непроходимости, наличие повышенной температуры, лейкоцитоз со сдвигом формулы влево, нарастание явлений
почечной недостаточности.
2. Клинические и рентгенологические признаки септической деструкции поджелудочной железы.
Объем операций
В настоящее время нет единого мнения об оптимальном варианте хирургического вмешательства спустя
7—14 дней после начала заболевания и при наличии
панкреонекроза. Спектр применяемых в подобных случаях операций варьирует в широких пределах: от
широкого дренирования сальниковой сумки и забрюшин-
ного пространства до тотальной дуоденопанкреатэк-
томии. Принято считать дренирующие операции паллиативными, а секвестрэктомию и различные варианты
резекции поджелудочной жеЛезы — радикальными. Известно, что просто дренирующие операции при остром
панкреатите дают очень высокую летальность—до
56,2% (В. М. Лащевкер, М. В. Данилов, 1978). Поэтому р клинической практике невольно приходится обращаться к другим, более сложным, но и более рискован¬
141
ным оперативным вмешательствам, заключающимся в
удалении части или всей поджелудочной железы. Из
всех этих операций более доступной и простой является
секвестрэктомия, которую некоторые хирурги считают
операцией выбора (Boutlier, Edelman, 1972). В таких
случаях при обнаружении очага некроза во время операции над ним надсекается брюшина, после чего нежизнеспособные ткани удаляются пальцем или кюреткой.
Фиксированные участки тканей при этом не удаляют
Рис. 21. Схема дренирования ретро-
панкреатического пространства и
сальниковой сумки при остром панкреатите.
а — через желудочно-ободочную связку
(сагиттальный распил); 6 — через люмбо-
томическую и лапаротомную раны (горизонтальный распил на уровне XII груд*
■ого позвонка).
142
из-за опасности возникновения кровотечения. Секвест-
рэктомию заканчивают дренированием очага деструкции
и забрюшинного пространства. Для этих целей лучше
использовать люмботомический доступ справа или слева
в зависимости от локализации очага деструкции или
перипанкреатита. При необходимости дренирования патологического очага в области хвоста или тела производится мобилизация селезеночного угла толстой
кишки. Затем толстую, кишку отдавливают книзу и
в пространство между верхним полюсом почки
и нижним селезенки делают надрез брюшины, а затем
рассекают ткани вместе с кожей. Разрез обычно приходится на десятое межреберье по задней подмышечной
линии. Его делают достаточной ширины, до 8—10 см,
и через него проводят марлевые тампоны и трубку к
санированному очагу деструкции или гнойнику. Отверстие в желудочно-ободочной связке ушивается наглухо.
При подобной методике дренирования создается прямой
и короткий* раневой канал, способствующий стеканию
экссудата, панкреатического сока и лучшему выделению
некротических тканей (см. рис. 21). Некоторые авторы
рекомендуют после такой операции проводить активную
аспирацию панкреатического экссудата.
В настоящее время все большую популярность завоевывает более радикальная операция — резекция хвоста
и тела поджелудочной железы вплоть до тотальной
дуоденопанкреатэктомии (В. И. Серга, 1964; Б. А. Королев с соавт., 1974, 1978; А. А. Шалимов с соавт., 1976,
1978; Hollender, 1970; Grozingcr, 1971). Приводим эту
операцию по описанию В. И. Филина с соавторами.
' ' Этапы операции
Ф
1. Продолженная верхняя срединная лапаротомия.
Для удаления геморрагического перитонеального выпота
из забрюшинной клетчатки делаются продольные разрезы париетальной брюшины по наружному краю восходящего и нисходящего отделов толстой кишки. При этом
брюшину вместе с частью клетчатки отслаивают к средней линии живота и с помощью отсоса удаляют токсический экссудат. После удаления жидкости в забрюшин-
ное пространство вводят марлевые салфетки до конца
операции (рис. 22),
143
2. Производится широкое вскрытие сальниковой сумки путем мобилизации желудочно-ободочной связки от
пилорического отдела желудка до его дна.
3. После рассечения париетальной брюшины по нижнему краю железы и вдоль нее производится бескровное
пальцевое отделение задней поверхности тела и хвоста
* железы от забрюшинной клетчатки.
4. Низко делается окно в париетальной брюшине
по верхнему краю тела железь* и под железу подводится
резиновый катетер, которым сдавливают ткань^железы
и селезеночные сосуды (рис. 23).
5. Ткань железы в области перешейка рассекается
снизу наверх на половину ее толщины до селезеночных
сосудов, которые перевязываются путем прошивания
вместе с тканью железы.
6. После перевязки сосудов и пересечения всей железы производится окончательная мобилизация хвоста
поджелудочной железы и селезенки. Панкреатический
проток оставшейся части железы перевязывается или
Рис. 22. Доступ к поджелудочной железе для
левосторонней резекции
и схема разрезов париетальной брюшины для
удаления геморрагической жидкости из забрюшинной клетчатки.
Рис. 23. Схема резекции
тела и хвоста поджелудочной железы4 совместно с селезенкой при
некротическом панкреатите (а). Прием подтягивания поджелудочной
железы в рану с помощью резиновой трубки (б).
144
дренируется тонкой полихлорвиниловой трубкой (Б. А. Королев с соавт., 1978).
7. К культе поджелудочной железы и ложу удаленной железы подводится 4—6 марлевых тампонов и
дренаж, которые выводятся через широкое отверстие
в желудочно-ободочной связке. Дополнительно дренируется левое поддиафрагмальное пространство и левый
боковой канал живота.
8. Дренаж из-под левого поддиафрагмального пространства и бокового канала живота удаляется на 2—3
день, а смена тампонов в области ложа удаленной железы — на 7—8 день после операции.
9. Дополнительно в конце операции производится
дренирование внепеченочных желчных путей-
Поздние операции
Показаниями к поздним операциям являются:
1. Клинические и рентгенологические признаки кисты
поджелудочной железы.
2. Калькулез внепеченочных желчных путей.
3. Нарушения проходимости большого дуоденального
сосочка.
Объем операций
1. Методы обследования во время операций на этом
сроке включают холангиоманометрию, холангиоскопию,
панкреатографию. Большое значение имеет субоперационное выявление-дуоденостаза и определение состояния желудка.
2. При наличии стеноза в области большого дуоденального сосочка 111 степени наиболее обоснованной
является папиллосфинктеротомия с пластикой, если
протяженность стеноза не превышает 2 см. Если при
этом выявляется сужение устья панкреатического протока, дополнительно необходимо произвести вирсун-
гопластику (А. А. Шалимов с соавт., 1978, рис. 24).
После подобных операций целесообразно дренирование
общего желчного протока через холедохотомическов
отверстие или через культю пузырного протока.
3. До сих пор остается неясным выбор метода операции при невыраженных стенозах большого дуоденаль-
10 М-843
145
Рис. 24. Методика папиллосфинктеро- и
вирсунропластики.
а—д — элементы сфинктеропластики; е—ж —
элементы вирсунгопластикн (А. А. Шалимов,
1978)
ного сосочка, сопровождающихся панкреатитом. В таких случаях очень сложно ответить на вопрос, что первично и что вторично: стеноз ли способствует развитию
панкреатита или сам панкреатит вызывает нарушение
оттока желчи и панкреатического сока? Наши наблюдения показывают, что разгрузка и декомпрессия желчных путей с помощью холедоходуоденостомии способствует, хотя и очень замедленно, купированию явлений
панкреатита и постепенному улучшению оттока желчи и
панкреатического сока естественным путем. Поэтому при
подобных стенозах папиллы с сопутствующими явлениями панкреатита целесообразно ограничиться холедо-
ходуоденостомией по одному из вариантов.
4. При множественных стриктурах по ходу вирсун-
гова протока или стриктуре его в области головки, где
имеется резкий изгиб протока, показана операция бокового панкреатоеюноанастомоза по Пьюстау (А. А. Шалимов, 1975; О. Б. Милонов, В. И. Соколов, 1977). Для
этого расширенный панкреатический проток вскрывается продольно на всем протяжении со вскрытием всех
карманов. Тощая кишка пересекается отступя на 30 см
146
Рис 25 Методика панкреатоеюносто-
мии по Puestow
а — вскрытие расширенного панкреатического
протока; б—в — формирование анастомоза;
г — формирование «заглушки» приводящей
петли тонкой кишки; ,д — вид после формирования панкреатоеюиоэнтероанастомоэа и ’ «заглушки»; е— методика формирования искусственного панкреатического протока ио
А. А. Шалимову (1378).
от связки Трейца. Дистальный конец тощей кишки проводится* через окно в брыжейке поперечно-ободочной
кишки. Далее накладывается двухрядный плоскостной
шов между кишкой и поджелудочной железой бок в бок
на всем протяжении рассеченного протока- Проксимальный конец кишки анастомозируют с тощей кишкой
(рис. 25).
5. При отсутствии патологии в желчных путях и
вирсунговом протоке (идиопатический панкреатит) показаны различные варианты операций на вегетативной
нервной системе и, в частности, маргинальная невротомия по М. А, Трунину,
10*
147
Хирургическое лечение псевдокист поджелудочной
железы
Хирургическая тактика при псевдоТгистах зависит
от стадии формирования кисты. В течении их различают 4 стадии (Р. Г. Карагюлян, 1974).
В первой стадии, когда киста не сформирована,
операция не показана.
Во второй стадии стенка псевдокисты состоит из
рыхлой, легко рвущейся грануляционной ткани. Операция не показана, если нет признаков абсцедирования.
При вынужденной операции целесообразна инфильтрация забрюшинной клетчатки новокаином с антиферментами, гидрокортизоном и антибиотиками.
В третьей стадии стенки псевдокисты становятся
прочными, но иссечь ее без опасности повреждейия жизненно важных органов невозможно. В этой стадии
показано в зависимости от данных исследования содержимого кисты на диастазу и цистографию внутреннее
или наружное дренирование кисты. Если киста является «активной», т. е. соединяется свищом с вирсунговым
протоком, то единственно правильной операцией является внутреннее дренирование кисты, способствующее
декомпрессии главного панкреатического протока. При
наличии «неактивной;» панкреатической кисты, не связанной с панкреатическим протоком (Низкие цифры
диастазы в содержимом кисты, отрицательная цистогра-
фия), показано простое наружное дренирование кисты,
ведущее к ее облитерации. Наружное дренирование может проводиться двумя методами; марсупилизацией и
простым дренированием.
Марсупилизация кисты (т. е. вскрытие и вшивание
стенки кисты в брюшную рану — операция Гуссенбауе-
ра) в настоящее время применяется редко, в Основном
при тяжелом состоянии больного или нагноении кисты.
Для этого после рассечения желудочно-ободочной связки вскрывают переднюю стенку кисты. Удаляют содержимое кисты и секвестры. Стенку кисты на протяжении 5—8 см фиксируют к брюшине лапаротомной раны.
Брюшина предварительно подшивается к коже. В полость кисты вводится резиновая трубка и два марлевых
тампона. Однако после этих операций остаются дли¬
не
тельно не заживающие свищи и наступает истощение
больного.
Простое дренирование проводится вскрытием кисты
по возможности в самой нижней ее точке, т. е. лучше
через брыжейку поперечноободочной кишки. После
этого в полость кисты после удаления ее содержимого
проводится головчатый дренаж типа катетера Петцера,
который фиксируется к стенке кисты и брюшной стенке.
Внутреннее дренирование заключается в анастомозировании кисты с каким-либо полым органом (желудком, двенадцатиперстной кишкой, тощей кишкой). Среди многих методов внутреннего дренирования наибольшее предпочтение отдается операции цистоеюностомии
на изолированной петле. Именно при этой операции
наряду с разгрузкой кисты исключается забрасывание
пищевых масс в полость кисты, что является основной задачей данной операции. Для этого брыжейка поперечноободочной кишки рассекается в бессосудистом месте. Обнажается стенка кисты. Далее берется петля тощей кишки
на расстоянии в 30 см от связки Трейца и накладывается анастомоз между кишкой и кистой на протяжении
5—б см. Требуется хорошая адаптация слизистой кишки и внутренней поверхности кисты. Приводящая петля
прошивается аппаратом УО, и прошитое место погружается за счет узловых серо-серозных швов. Это необходимо для выключения приводящей петли и предупреждения попадания кишечного содержимого в полость
кисты.
В четвертой стадии формирование кисты заканчивается. Киста становится подвижной, ее сращения с
окружающими органами становятся менее плотными
и грубыми. Это позволяет ставить вопрос о возможном
иссечении кисты, если она не сообщается с крупным
панкреатическим протоком.
Таким образом, для больных с псевдокистами поджелудочной железы показаны поздние операции спустя
4—6 месяцев после перенесенного приступа острого
панкреатита, обеспечивающие более высокую радикальность оперативного вмешательства и лучшие отдаленные результаты.
149
ГЛАВА VIII
ПРОБОДНЫЕ ГАСТРОДУОДЕНАЛЬНЫЕ ЯЗВЫ
Прободная язва желудка и двенадцатиперстной
кишки чаще развивается у мужчин в возрасте от 21 до
40 лет (71,4%).
1. Основным фактором, ведущим к развитию прободения является обострение язвенной болезни, когда
прогрессируют процессы деструкции или некроза в
стенке желудка. Тогда больных на фоне общего благополучия начинают беспокоить боли в эпигастральной
области, отрыжка, изжога, тошнота и рвота. Таким образом, сбор анамнестических данных нередко позволяет
выявить «предперфоративное состояние». Подтверждением тому является наибольшее количество прободных
язв весной и осенью (55,6%), т. е. в периоды обострения
течения язвенного процесса (Д. П. Чухриенко, 1968).
Другимй этиологическими факторами, способствующими прободению язв, являются физическое перенапряжение, переполнение желудка пищей, злоупотребление
спиртными напитками (В. ,А. Баскаков, 1973).
2. Патогенез перфорации до сих пор остается неясным. Существует обоснованная точка зрения об аутоиммунном механизме язвенного процесса (О. Я. Гриншпун,
1965; К. И. Мышкин, Л. А. Франкфурт, 1971). Отсюда
прободение рассматривается как манифестация местного
аутоиммунного конфликта. Доказательством тому являются иммунноморфологические изменения в области
язвы и характеризующиеся фибриноидными'изменениями стенок сосудов с накоплением кислых мукополиса-
харидов по периферии язвы, высоким коэффициентом
плазматизации слизистой оболочки, большим количеством тучных клеток в состоянии дегрануляции (К. И. Мышкин).
3. Анамнестические данные указывают на возникновение перфорации в интервале между 12 и 20 часами,
т. е. на протяжении рабочего дня и вскоре после его
окончания. Чаще всего перфорируют язва двенадцатиперстной KtAiiKH (50,7%), препилорического и пилорического отделов желудка (42,8%). сравнительно редко
язва малой кривизны (4,8%) и еще реже кардиального
отдела желудка (0,7%)*
150
4. Наиболее рациональным является деление * клинического течения прободной язвы на 3 фазы: фазу
шока, фазу «мнимого благополучия», фазу перитонита
(Мондор, 193S).
Фаза шока (продолжительность 6 часов) характеризуется кинжальной, мучительной болью, заставляющей
больного лечь. Боли локализуются, в подложечной области или правом подреберье, иррадиируют в правое
плечо и ключицу. Иногда наблюдаются явления шока,
брадикардия. Лицо бледное, губы цианотичные^ Доскообразное напряжение живота и ^кожная гиперестезия.
Фаза «мнимого благополучия» (6—12 часов). Следует xopotno помнить об этой фазе,' так как здесь легко
совершить тактическую ошибку. В этой фазе состояние
больных улучшается, боли ослабевают. Появляется в
верхних отделах живота вздутие. На смену напряжению
приходит разлитая ригидность в правой половине живота,
распространенный симптом Щеткина. Таким образом,
для этого периода характерно перемещение кардинальных симптомов и изменение клинической картины.
Фаза перитонита (12—24 часа и более). Симптом
острой боли уступает место постоянным мучительным
болям и общему^ тяжелому состоянию больного. Появляется выраженное вздутие. Положительный симптом
Щеткина сохраняется на фоне умеренного напряжения.
В то же время развиваются прогрессирующая гипотония, малый частый пульс, явления тяжелой общей
интоксикации. Однако следует помнить, что клиническая картина прободения может варьировать в зависимости от вида перфорации в свободную брюшную
полость, сальниковую сумку, забрюшинное пространство,
прикрытой перфорацией и .др.
Диагностическая программа
1. Для постановки диагноза большое значение имеет
пальпация живота, перкуссия для выявления симптома исчезновения печеночной тупости, шума плеска в
области мечевидного отростка, аускультация для выявления шума трения брюшины у реберного края или в
эпигастральной области.
151
2. Объем инструментальной диагностики зависит от
трудности постановки диагноза. В ряде случаев при
наличии типичной клинической картины, анамнеза и
лабораторных данных этого бывает достаточно для
установления диагноза. Без необходимости не следует
расширять показания к применению инструментальных
методов диагностики, что требует дополнительного времени и может утяжелить состояние больного. Этапность
аппаратной и инструментальной диагностики при перфоративной язве следующая:
Рентгеноскопия и рентгенография брюшной полости
для выявления свободного газа в брюшной полости
под диафрагмой справа или слева (С. В. Иванова-Подо-
бед, 1935; Н. Е. Дуденко, 1945; С. В. Лобачев с соавт.,
1962, и др.). Пневмоперитонеум при прободениях обна-'
руживают в 42—80%. Следует помнить, что гйз под
диафрагмой может симулировать интеррозиция толстой
кишки (симптом Челаидити). Для исключения подобной
ошибки следует изменить положение больного. При
наличии свободного газа под диафрагмой посЛЬ изменения положения полоска газа соответственно смещается,
что не наблюдается при интерпозиции кишки.
Определение синдрома «переполненного желудка»
(Л. М. Рысин, 1966).'Он заключается в обнаружении
при рентгеноскопии брюшной полости желудка, заполненного жидкостью с широким уровнем и большим
газовым пузырем желудка.
Пневмогастрография (Henelt, 1963; В. А. Милославский, 1969) заключается во введении по зонду в желудок 400—500 мл кислорода. Кислород проходит через
перфорационное отверстие в свободную. брюшную полость и обнаруживается под диафрагмой. -
Лапароцентез. При абдоминальной пункции, выполняемой ниже пупка, стилет троакара направляется в
правое подреберье. После этого вводится 30-сантимст-
ровая хлорвиниловая трубка, из которой при потягивании аспирируется из брюшной полости экссудат. При
сомнении в характере экссудата может быть применена диагностическая проба И. И. Неймарка. Для выполнения этой пробы к 2—3 мл экссудата, обнаруженного
в брюшной полости, добавляют 4—5 капель 10% йодной
настойки. Если в жидкости имеется примесь желудочного содержимого, то под воздействием йодной настойки
152
она приобретает темное грязновато-синее окрашивание
(из-за остатков крахмала).
При отсутствии положительных данных применяется
диагностическая лапароскопия.
Лечение
Консервативное лечение может быть осуществлено
в очень редких случаях у тяжелых, ослабленных больных или при других безусловных противопоказаниях к
операции. Применяемый в таких случаях метод активной
аспирации из желудка рассчитан на спонтанное закрытие перфорационного отверстия (Taylor, 1946). Метод
заключается в назогастральной интубации, постоянной
активной аспирации желудочного содержимого, введении средств, подавляющих желудочную секрецию
(атропин), введении в желудок и внутримышечно антибиотиков широкого спектра действия и инфузионной
терапии.
Оперативное лечение
Хирургическое лечение должно начинаться активной
предоперационной подготовкой.
Предоперационная подготовка зависит от клинической фазы перфорации. В первой фазе противошоковые
мероприятия должны сочетаться с диагностикой и не
должны отодвигать время операции. Введение анальгетиков и простейшая инфузионная терапия бывают
вполне достаточными для осуществления оперативного
лечения. Во второй и третьей фазах реаниматологическое пособие должно быть более фундаментальным.
Наряду с диагностическими мероприятиями должна
осуществляться активная инфузионно-трансфузионная
программа, изложенная в разделе «шок» и «перитонит».
Причем большее значение имеет высокий темп инфузионной терапии, осуществляемой через кавакатетер и две
периферические вены дополнительно.
Несмотря на значительные успехи желудочной хирургии, проблема хирургического лечения прободных язв
еще далека от своего разрешения. В настоящее время
среди хирургов наибольшей популярностью пользуются
при лечении прободных язв три вида операций:
153
1) ушивание прободного отверстия;
2) первичная резекция желудка;
3) стволовая или селективная ваготомия в сочетании
с дренирующими операциями (пилоропластикой или
антрумэктомией).
И в настоящее время ушивание прободного отверстия является .самой распространенной операцией, *
имеющей до сих пор много сторонников (Н. Е. Дудко,
1945; Е. Л. Березов, 1952; В. И. Стручков, 1953;
Н. Е. Епифанов, 1959; Л. Д. Решетов, 1963; В. В. Кула-
/ га с соавт., 1974). Однако сейчас уже хорошо известно,
что эта простая операция дает хорошие результаты лишь
у 60—65% больных (Р. Г. Квачадзе, 1976). Остальные
же больные нуждаются в повторном вмешательстве.
В связи с успехами желудочной хирургии и внедрением в практику первичных резекций желудка появилась и более радикальная точка зрения, призывающая
в случае отсутствия противопоказаний производить
иссечение желудка вместе с прободной язвой (С. С. Юдин,
1935; Б. А. Петров, 1938; М. К. Чачава, 1951;
A. Т. Лидский, 1969; Б. С. Розанов, 1970 и др.). Однако
изучение отдаленных результатов после первичных резекций желудка при осложненных язвах показало развитие тяжелых постгастрорезекционных осложнений
в среднем от 10—15 до 30—60% случаев (А. А. Шалимов с соав., 1970; В. И. Стручков с соавт., 1971;
Ю. М. Панцирев, 1971). Эти обстоятельства и привели
к поискам и внедрению в практику неотложной хирургии более «физиологических» методов лечения осложненной язвы. В связи с этим в неотложной хирургии
стали разрабатываться и применяться органосохраняющие операции на желудке. К ним относятся стволовая,
и селективная, или селективная проксимальная, ваготомия с иссечением язвы и дополнительной дренирующей
операцией в виде пилоропластики или экономной резекции желудка (Harbrecht, 1967; Tolley, 1967; Karageoris,
Malignos, 1968; В. С. Маят с соавт., 1970; Ю. М. Пан-
цырев, 1971; М. И. Кузин, П. М. Постолов, 1974, 1978;
B. С, Маят, А. А. Шалимов, 1974; А. А. Шалимов,
1972, 1978; П. И. Норкунас, В. С. Лаписканс, 1978 и др.).
Все же хирургическая объективность заставляет
сказать, что при выборе метода лечения перфоративной
язвы нельзя придерживаться догматически одного спо-
154
соба лечения. Скорее следует говорить о необходимости
гибкого индивидуального подхода при выборе метода
лечения в зависимости от условий, вида и размеров
перфорации, изменений в брюшной полости, состояния
больного и опыта хирурга. Суммируя сказанное, можно
сделать заключение, что для каждой из операций при
прободной язве имеются ориентировочные показания
и противопоказания.
^Показаниями к операции стволовой ваготомии с
пилоропластикой при прободной язве являются:
1) перфорации язвы передней стенки двенадцатиперстной кишки или пилорического отдела желудка;
2) наличие большого язвенного инфильтрата, переходящего на окружающие ткани;
3) молодой и средний возраст больных;
4) отсутствие распространенных форм перитонита
(И. С. Белый, Н. Н. Хорошенко, 1978).
Этапы операции
1. Лапаротомия, ревизия двенадцатиперстной кишки
и желудка, удаление экссудата из брюшной полости
электроотсосом, забрюшинная новокаиновая блокада.
2. Вначале производится пилоропластика по одному
из принятых в таких случаях методов: Финнея, Гей-
неке—Микулича, Джадда и т. д. Техника пилоропласти-
ки по Гейнеке — Микуличу проста и позволяет одновременно иссечь -перфорационное отверстие. Для ее ’
осуществления-область привратника извлекают в операционную рану. Продольным разрезом по передней
поверхности привратника длиной в 5—8 см вскрывают
желудок и двенадцатиперстную кишку. Следует помнить, что маленькие разрезы ведут к рубцовому сужению привратника. Середина краев раны расширяется
в поперечном направлении. Рана зашивается в поперечном направлении двухрядным швом. Причем первый
ряд непрерывного кетгутового шва необходимо накладывать на слизистую двенадцатиперстной кишки и желудка, а второй ряд — узловатые шелковые серозномышечные швы (рис. 2б).
3. Далее проводится стволовая ваготомия. Ее начинают с мобилизации левой доли печени и над(£че-
иия брюшины над пищеводом, Желудок оттягивается
155
Рис. 26. Пилоропластика по Гейнеке — Микуличу
(Ю. М. Панцырев, А. А Гринберг, 1977).
а — продольное рассечение передней стенки желудка две*
надцатиперстной кишки; б — швы на слизистой желудка;
в — серозно-мышечные узловые шелковые швы.
справа налево за малую кривизну. Натяжение за большую кривизну желудка опасно из-за повреждения коротких желудочных сосудов и надрыва капсулы селезенки. Натяжение пищевода позволяет обнаружить
натянутый ствол левого блуждающего нерва на передне-
боковой поверхности пищевода. Нерв выделяется и
иссекается на протяжении 1,5—2 см. Оба конца пересеченного нерва лигируются. После этого желудок снова натягивают и перемещают задний ствол (правый
нерв) на боковую, правую поверхность пищевода, и также резецируют (рис. 27).
4. Если позволяет состояние больного, лучше произвести проксимальную селективную ваготомию, не сопровождающуюся денервацией внутренних органов, кроме
желудка. Ее начинают с установления локализации
нерва Латарже, который необходимо сохранить. Отступя от места его вхождения в антральный отдел желудка,
производят отсечение вначале переднего листка сальника в направлении к пищеводу. При этом нужно точно
держаться ребра желудка, чтобы не повредить печеночную ветвь и нерв Латарже. Необходимо также дополнительно сделать мобилизацию 4—6 см абдоминального
отдела пищевода. Затем производят отсечение заднего
листка малого сальника от желудка и пищевода на таком же протяжении. Целесообразно дополнить операцию
скелетизацией абдоминального отдела пищевода и кар-
дии с латеральной стороны до верхнего полюса селезен-
156
Рис. 27. Стволовая ваготомия (10. М. Панцырев,
А. А. Гринберг, 1977).
а — операционный доступ; б — рассечение брюшины над пищеводом; в— выделение и резекция ствола левого блуждающего нерве; г — перевязка проксимального отрезка блуждающего нерва;
д — выделение правого блуждающего нерва; е — ушивание брюшины над пищеводом.
ки. Результат операции можно считать, достигнутым,
если при внутрижелудочной pH-метрии достигают pH = 7.
Примерная схема операции представлена на рис. 28.
5. В желудок вводится зонд на 3 суток для откачивания желудочного содержимого. Очень целесообразно
осуществить временную экстрамуральную десимпати-
заиию желудка после ваготомии путем открытой бло-
157
Рис. 28. Проксимальная селективная ваготомия (10. М. Пан-
цырев, А. А. Гринберг, 1977).
а — пунктирное обозначение линии послойной скелетизацни малой
кривизны желудка, рассечение брюшины над пищеводом вместе с
желудочными ветвями блуждающих нервов; б — отсечение переднего
листка малого сальника с передним нервом Латарже; в — отсечение
заднего листка малого сальника вместе с задним нервом Латарже;
г— ушивание десерозированной малой кривизны желудка.
кады чревного сплетения через круглую связку печени
(Р. М. Нурмухаметов, Е. Е. Яругский, 1977). Блокада
чревного сплетения достигается введением в круглую
связку печени по направлению к ее воротам полиэтиленового микроирригатора длиной в 10 см, через который
каждые 4—6 часов медленно вводится 40—60 мл 0,5%
раствора новокаина. Подобная блокада позволяет сократить длительность послеоперационного дренирования
желудка или даже избежать его.
158
6. В случае наличия большого язвенного инфильтрата вокруг перфорации или низко расположенной язвы
показаны* ушивание прободного отверстия, стволовая
ваготомия и дренирующая операция типа гастродуоде-
ностомии по Джабулею.
Показания к ушиванию прободного отверстия:
1) наличие выраженного перитонита,
2) наличие тяжелых сопутствующих заболеваний,
особенно у лиц пожилого и старческого возраста.
Обычно ушивание перфорационного отверстия сочетается с его оментопластикой по Оппелю — Поликарпову.
1. Для ее осуществления сначала на край выкроенной чожки сальника накладывается обвивной кетгу-
товый шов. Свободные концы кетгутовой лигатуры проводят через все слои желудочной стенки или двенадцатиперстной кишки, отступя на 1 —1,5 см от края
перфорационного отверстия, начиная прокол со стороны слизистой. Сальник затем погружается в перфорационное отверстие и шов затягивается. Вокруг перфорационного отверстия на расстоянии 1,5—2,0 см производится дополнительная фиксация распластанного по
стенке желудка сальника.
2. На ранних сроках перфорации (в первые 6 часов)
при отсутствии большого количества желудочного содержимого после промывания брюшной полости лапаро-
томная рана ушивается наглухо. При наличии диффузного перитонита, развивающегося через 6—8 часов
после перфорации, целесообразно ввести микроирригаторы в подпеченочное пространство, в мезогастрин и
через отдельный прокол в подвздошной области задре-
нировать более толстой трубкой малый таз для предупреждения развития тазового абсцесса. При наличии
разлитого перитонита следует обязательно прибегнуть
к методу интраперитонеальной перфузии. Приточные
трубки при этом устанавливаются под диафрагмой справа и слева, а трубки оттока — проколом через подвздошные области в малый таз. Лучше в основном
пользоваться методикой фракционного промывания
брюшной полости. Опыт нашей клиники показывает,
что перфузия брюшной полвсти не препятствует приживлению сальника.
159
В случаях очень тяжелого перитонита целесообразно, как показывает опыт нашей клиники, прибегнуть
к комбинированной терапии перитонита, состоящей из
интраперитонеальной перфузии и дренирования грудного протока с целью дезинтоксикации,
Следует избегать при перфоративной язве дополнительной операции после ушивания в виде гастроэнтероанастомоза. Последняя утяжеляет состояние больного и повышает летальность.
В ряде случаев при прободной язве желудка и двенадцатиперстной кишки все же показана резекция
желудка, хотя показания к ее производству сейчас
ограничены. Резекция желудка показана: 1) при подозрении на раковое повреждение язвы; 2) при сочетании перфорации с кровотечением; 3) при декомпенси-
рованном стенозе привратника. Однако нужны условия
для ее осуществления: время перфорации не более 6
часов, отсутствие разлитого перитонита, хорошо подготовленная операционная бригада.
Послеоперационная терапия должна быть направлена на профилактику гнойны^ осложнений со стороны
операционной раны, брюшной полости, со стороны легких и сердечно-сосудистой системы.
ГЛАВА !Х
ОСТРЫЕ ГАСТРОДУОДЕНАЛЬНЫЕ
КРОВОТЕЧЕНИЯ
Язвенные кровотечения
Из ста наиболее вероятных причин острых гастродуоденальных кровотечений наиболее частой является
язвенная болезнь желудка и двенадцатиперстной кишки
(В. Д. Братусь, 1972; А. И. Горбашко, 1974). Так, по
нашим данным, кровотечения из язв двенадцатиперстной
кишки и желудка составляли 60,4%, вследствие геморрагического гастрита—.10,5, цирроза печени—7,4, рака
желудка—6,9, прочих заболеваний (дивертикулез, по-
липоз и др.) — 5,8. Причина кровотечения не была установлена в 9% случаев. Следовательно, язвенные крово¬
160
течения составляют почти 2/3 среди всех причин острых
гастродуоденальных кровотечений. Кровотечения чаще
возникают при наличии омозолелых, каллезных язв.
Причем с возрастом возможность развития кровотечения при наличии язвы значительно возрастаем У
пациентов старше 60 лет язвенная болезнь осложняется
кровотечением в 50% случаев (Б. И. Альперович,
М. М. Соловьев, 1975).
Что же является причиной развития этого драматического осложнения язвенной болезни? Видимо, их
несколько. Наиболее ясно определяемым фактором
является обострение язвенной болезни, выражающееся
в усилении некробиотического процесса в области язвенного кратера и распространения его на сосуды. При этом
фибриноидный некроз и расплавление сосудистой стенки сопровождаются выраженной лейкоцитарной инфильтрацией. Отсюда язвенное кровотечение может быть из
аррозированного сосуда или диапедезным из множества разрушенных капилляров. Другим пусковым моментом язвенных кровотечений является усиление фибринолитической активности в тканях желудка и двенадцатиперстной кишки (И. М. Матяшин с соавт., 1973),
т. е. резкое возрастание локального фибринолиза. Немаловажное значение имеет также и возникновение при
подобных геморрагиях состояния гипокоагуляции и повышенной фибринолитической активности крови (И. И.
Кальченко, П. В. Лыс, Г1. А. Рябый, 1974). Эти патогенетические механизмы язвенных кровотечений и являются обоснованием применения того или иного лекарственного препарата при язвенных кровотечениях.
Срочная диагностическая программа
Диагностическая программа при этом осложнении
язвенной болезни заключается 6 установлении факта,
источника и тяжести кровопотери. Для решения этих
задач большое значение имеет сбор анамнеза. При
сборе анамнеза нужно выделить, по крайней мере, следующие вопросы:
1. Болел ли больной ранее язвенной болезнью желудка и двенадцатиперстной кишки?
2. Переносил ли больной в анамнезе инфекционную
желтуху?
И М-843
161
3. Принимал ли больной ульцерогенные препараты
и особенно аспирин?
4. Не страдает ли больной гипертонической болезнью
и склонностью к гипертоническим кризам?
5:' Не имелась ли склонность к различного рода кровотечениям ранее?
После сбора анамнеза и осмотра проводятся следующие мероприятия:
1. Вводится назогастральный зонд с целью установления источника кровотечения и опорожнения желудка.
Желудок после этого промывается ледяной водой в
количестве 3—4 л.
2. Производится фиброгастроскопия, если имеется
апдрскопическая аппаратура, или экстренная рентгено-
фгопия желудка и двенадцатиперстной кишки (А. И. Гор-
башко, 1974). При этом различают:
а) экстренную рентгеноскопию (вскоре после поступления) в случае отсутствия коллапса и подтвержденной в анамнезе язвы;
б) раннюю срочную рентгеноскопию (утром после
поступления);
в) раннюю рентгеноскопию (в течение 2—10 дней
после поступлений).
3. Определение тяжести кровопотери до сих пор
представляет трудную задачу- Известно, что использование для этих целей ряда таких общепринятых клинических и лабораторных тестов, как пульс, артериальное
давление, уровень гемоглобина и эритроцитов, имеет
определенную ценность при динамическом наблюдении,
но не отличается надежностью. Поэтому целесообразно
дополнять указанные тесты определением удельного
веса крови, гематокрита, объема циркулирующей крови
и центрального венозного давления. Используя данные
Г. А. Барашкова (1956) и А. И. Горбашко (1974), мы
применили указанные тесты для комплексного определения степени кровопотери. Следует сказать, что пока
■е существует общепринятой классификации определения тяжести кровопотери при гастродуоденальных кровотечениях. Определение тяжести кровотечения мы
производили по комплексу клинических и лабораторных
данвыд, взяв за основу классификацию В. И. Струч-
кова и 9. В. Луцевича (1961), выделяя при этом не
4, а 3 степени кровопотери: легкую, среднюю и тяжёлую
162
(О. С. Кочнев, И. А. Ким, Ф. А. Давлеткильдеев с
соавт., 1978).
Кровопотеря легкой степени. Сравнительно удов*
летворительное состояние больного без потери сознания,
легкая бледность кожных покровов, АД в норме или
снижено до 100 мм рт. ст., частота пульса увеличена до
100 в минуту, НЬ снижен до 60 г%, эр. 3500000, Ш
35 г%, удельный вес крови в пределах 1053—1040,
дефицит глобулярного объема до 20%.
Кровопотеря средней тяжести. Заметная бледность
кожных покровов, однократная потеря сознания, повторная рвота, жидкий дегТеобразный стул. АД снижено
до 90 мм рт. ст., пульс 120 в минуту, НЬ 50 г%, эр.
2500000, Ш 25—30%, удельный вес крови 1050—1045,
дефицит глобулярного объема 30%.
Кровопотеря тяжелой степени. Потеря сознания,
обильная повторяющаяся рвота или обильный стул с
кровью, резкая бледность кожных покровов и слизистых
оболочек, холодный пот, жажда, НЬ 40 ед., Ш ниже
25%, эк. 1000000—1500000, удельный вес крови ниже
1044, дефицит глобулярного объема больше 30%.
По нашим данным, у 78% больных было кровотечение легкой и средней степени и у 22% — тяжелое кровотечение.
4. Пальцевое ректальное исследование.
5. Срочное проведение лабораторных исследований:
определение гемоглобина и эритроцитов в динамике,
определение удельного веса крови по Филипсу ван
Слайку (купросульфатным методом), лейкоцитоза и
лейкоформулы, остаточного азота и /билирубина крови,
диастазы мочи. При коагулогическом исследовании
крови следует обратить внимание на определение времени свертывания, уровня фибриногена, протромбино-
арго индекса, фибринолитической активности крови и
толерантности плазмы к гепарину.
Лечебная программа
Наиболее целесообразным у больного с гастродуоденальным кровотечением следует считать проведение
активного консервативного лечения с целью остановки
кровотечения и операции в «холодном периоде» после
обследования. Такая тактика возможна при кровотече¬
11*
163
ниях легкой и средней степени. При кровотечениях
тяжелой степени показана операция. Проводимое вначале активное консервативное лечение, осуществляемое нередко в предоперационной, служит и целям подготовки к срочной операции.
Консервативное лечение
1. Катетеризация двух вен, одна из них в центральную вену путем подключичной пункции. В тяжелых случаях обнажение лучевой или задней большеберцовой
артерии.
2. Динамический контроль артериального давления,
пульса, центрального венозного давления, диуреза,
гематокрита и удельного веса крови (каждые 6 часов).
3. Переливание теплой крови (прямое) или свеже-
цитратной крови (не более двух суток хранения) в
объеме 250—500 мл и 250 мл плазмы.
4. При тяжелых кровотечениях допустимо начать
инфузионную терапию с полиглюкина для поднятия
артериального давления, но обязательно на фоне предварительного введения гемостатических средств.
5. Введение гемостатических средств: 10 мл 10%
раствора хлористого кальция, 1% раствора викасола,
1,0 мл 2—3 раза в день внутримышечно, внутривенно
10% раствор подогретой желатины из расчета 1 мл на
кг веса больного, гемофобина, 200,0—300,0 мл 5% раствора эпсилонаминокапроновой кислоты, 3—4 г фибриногена.
6. В тяжелых случаях внутривенное введение тра-
зилола 100000 ед. или контрикала 25000—30000 ед.
7. Введение назогастрального зонда для опорожнения желудка, проведения местной гемостатической
терапии и контроля за эффективностью проводимой
терапии.
8. Инфузионная терапия: медленное капельное введение 1000—1500 мл 5% раствора глюкозы с витаминами
группы В и С.
9. Строгий постельный режим, холод на живот,
глотать мелкие кусочки льда.
» 10. В остром периоде кровотечения голод. При оста¬
новленном кровотечении раннее применение диеты Мей-
ленграхта,
164
11. Местная гемостатическая терапия.
А. В нашей клинике с успехом применяется метод
локальной лекарственной терапии норадреналином
(О. С. Кочнев, И. А. Ким, Ф. А. Давлеткильдеев с
соавт., 1978). Для его осуществления через назогастрэл!}-
ной зонд с целью местного гемостаза вводят 4 мл норадреналина, растворенного в 150 мл физиологического
раствора, после чего зонд перекрывается на 2 часа.
При продолжающемся кровотечении через 2 часа повторное введение норадреналина в половинной дозе
(Ле-Вейн, 1972). Патогенетическими основами метода
местной норадреналиновой терапии является способность норадреналина раскрывать артерио-венозные шунты в подслизистом слое, что приводит к местному обескровливанию слизистой желудка и гемостазу. Вторым
патогенетическим механизмом является способность
норадреналина активировать XII фактор крови и тем
самым повышать местно коагулирующие свойства
крови, нарушенные при гастродуоденальных кровотечениях. Метод локальной норадреналиновой терапии был
применен в нашей клинике у 75 больных с острыми
гастродуоденальными кровотечениями различной этиологии (см. табл. 9).
Внутрижелудочное введение норадреналина может
быть использовано в качестве диагностического теста.
При отсутствии эффекта от норадреналина показана
операция. Проведенные оперативные Вхмешательства
выявили кровотечения из аррозированных крупных сосудов. В этих ситуациях характер желудочного содержимого может свидетельствовать о продолжающемся
кровотечении, несмотря на удовлетворительные лабораторные показатели или нормальное артериальное давление. Мы считаем, что этот метод целесообразно применять у пожилых и ослабленных больных, у которых
кровотечение сочетается с другими тяжелыми соматическими заболеваниями (сердечно-сосудистой системы,
легких, диабетом и др.)
Таким образом, ограничивающим возможности'этого
метода фактором является не возраст и тяжесть состояния больного, а наличие каллезной язвы в области
крупных артериальных стволов. Следует обратить внимание и на другое обстоятельство. Использование
Таблица 9
Результаты лечения острых желудочно-кишечных кровотечений с местным применением
норадреналинового раствора
Источник кровотечения
Кровопотеря
Результат лечения
легкая
средняя
тяжелая
кровотечение остановлено
оперирова¬
но
Язва двенадцатиперстной кишки
16
4
1
19
2
Язва желудка
8
3
3
11
3
Геморрагический гастрит
12
5
2
19
—
Варикозное расширение вен пищевода . . .
3
1
2
* 6
—
Опухоль желудка
2
2
1
4
1
Кровотечение из культи желудка
2
2
—
4
—
Дивертикул пищевода
’ —
—
1
1
—
Не установлен .
3
1
1
5
И т о I о н
46
18
11
69
I 6
ворадреналиновой терапии позволило уменьшить число
операций на высоте кровотечения, что создает более
благоприятные условия для хирургического лечения
очень тяжелого контингента больных. Так, если до применения норадреналина было экстренно оперировано
20% больных на высоте кровотечения, то после его внедрения в практику число операций снизилось на 12%.
Б. Применение для угнетения усиленной фибринолитической активности на фоне повышенной кислотности желудочного сока местной антифибринолити ческой терапии... Для этого 10,0 г эпсилонаминокапроно-
вой кислоты и 200 мг тромбина растворяют в 100 мл
воды и' дают пить по 1 столовой ложке через каждые
15 минут-в течение 2 часов, в последующем по 1 столовой ложке 3 раза в день (А. М. Уманский).
Эндоскопическое лечение. В последние
годы благодаря появлению фиброгастроскопов расширились возможности не только экстренной диагностики,
но и эндоскопического лечения. При кровотечениях
такое лечение заключается в следующем: 1) прицельном
орошении источника кровотечения гемостатическими
средствами; 2) инъекции в область очага кровотечения
ингибиторов фибринолиза; 3) введении склерозирующих
веществ в расширенные вены пищевода, аппликация
аэрозольных пленкообразующих препаратов (лифу-
оль) на кровоточащий участок; 5) диатермокоагуляции
источника кровоточения; 6) криовоздействии на источник ' кровотечения; 7) электроэксцизии кровоточащего
полипа или злокачественной опухоли; 8) использовании
лазерного облучения (Р. Т. Панченков с соавт., 1975,
1976; В. И. Кукош, А. Ф. Ефремов, 1975; Э. В. Луцевич,
И.Н. Белов, Ю. В. Стручков, 1977; В. Д. Галустов, 1978).
Опыт этих авторов показывает, что эндоскопическое
лечение не заменяет оперативное. Оно эффективно лишь
при поверхностном поражении слизистой оболочки,
т. е. когда кровотечение носит капиллярный характер.
Лечебная эндоскопия при желудочно-кишечном кровотечении является процедурой ответственной и сложной,
а вероятность ошибок при ней больше, чем при обычной
эндоскопии. Осложнения при экстренной эндоскопии
связаны с продолжающимся кровотечением, проведением анестезии и выполнением эндоскопических лечеб¬
167
ных мероприятий. Поэтому экстренная внутрижелудоч*
ная эндоскопия предполагает наличие хорошо подготовленного специалиста именно в этой области.
Оперативное лечение
При отсутствии эффекта от проводимого консервативного лечения в ближайшие 4—6 часов показано
оперативное лечение. Оно тем более настоятельно необходимо, если кровотечение повторилось. Значительную
помощь в оценке эффективности проводимой терапии
дает назогастральная интубация. Продолжающееся
кровотечение сопровождается выделением крови через
зонд даже при отсутствии рвоты. Причем применяемая
консервативная терапия является и методом предоперационной подготовки. В тяжелых случаях инфузионно-
трансфузионная программа должна проводиться не
только внутривенно, но и внутриартериально, чтобы
сократить время подготовки до операции.
Операция при гастродуоденальном кровотечении
должна проводиться под наркозом и прикрытием переливания крови.
1. Лапаротомия, осмотр желудка и кишечника для
определения в них крови. При осмотре желудка особое
внимание следует обратить на участки гиперемированной
серозы, локальной инъекции сосудов, наличие белесоватых втянутых рубцов, указывающих на язвенный
процесс в органе со стороны слизистой. Очень много
дает для диагноза бимануальная пальпация стенки
желудка и двенадцатиперстной кишки, позволяющая
определить участок уплотнения, инфильтрации.
2. При отсутствии ясного диагноза следует произвести
продольную гастротомию, начинающуюся несколько
отступя от привратника. После отсасывания желудочного содержимого и крови в желудок следует ввести
зонд-иллюминатор для визуального тщательного осмотра
слизистой. При наличии отрицательных данных после
отсасывания содержимого из двенадцатиперстной кишки в нее следует ввести марлевый тампон. Изменение
окраски тампона может помочь более точно локализовать источник кровотечения. Особенно тщательно следует осмотреть и прощупать кардиальный отдел
желудка.
168
3. После установления источника до выбора оптимального варианта операции нужно принять меры для
остановки кровотечения. Для этого во время гастротомии следует прошить и перевязать видимый кровоточащий сосуд или наложить восьмиобразный шов на язву.
Можно наложить и завязать тесемку проксимальнее
места кровотечения (С. М. Бова). Мы как временную
меру применяем внутриполостную электрокоагуляцию
кровоточащего места. Все эти меры осуществляются
при- наличии продолжающегося кровотечения.
4. Объем оперативного вмешательства при язвенной
болезни определяется состоянием больного, тяжестью
кровотечения, сопутствующими заболеваниями, анатомической локализацией и характером язвы. Наиболее
предпочтительным на современном этапе при кровоточащей язве двенадцатиперстной кишки является ушивание язвы после широкой гастродуоденотомии, стволовая ваготомия, дополненная дренирующей операцией — пилоропластикой по Финнею или гастродуодено-
стомией по Джабулею (Ю. М. Панцырев, 1969; А. А.
Шалимов, 1972; П. М. Постолов, 1973; М. И. Кузин,
П. М. Постолов, 1975, 1978; В. С. Маят, Ю. М. Панцырев, А. А. Гринберг, 1978; Г. Н. Захарова, В. Н. Кац,
1978, и др.) (рис. 29). Эта операция может быть выполнена и при язве желудка у ослабленных больных или
пациентов, имеющих серьезные сопутствующие заболевания. Однако при язве желудка более целесообразной
является резекция желудка. Опыт работы нашей клиники показывает, что более надежной является электрохирургическая резекция желудка по Бильрот-П на
предельно короткой петле. Лишь в случае производства
ранних операций и у не очень обескровленных больных
оправданно выполнение электрохирургической резекции
желудка по Бильрот-I. При язве кардиального отдела
желудка с большой инфильтрацией вокруг нее показана
проксиальная резекция желудка или гастрэктомия.
5. У крайне тяжелых больных оправдано выполнение только паллиативной операции. Сюда относится
прошивание кровоточащего сосуда со стороны слизистой после гастротомии, тампонада язвы свободным
сальником, прошивание стенки желудка насквозь
П-образными швами по периметру язвы с последующим
169
Рис. 29. Органосохраняющие операции при кровоточащей
пилородугодуоденальной язве (Ю. М. Панцырев, А. А. Гринберг, 1977).
ш — стволовая ваготомия; б — прошивание кровоточащей дуоденальной
язвы; в — пилоропластика.
укрытием сквозных швов серо-серозными швами (метод
В. А. Картавина).
В связи с недостаточным знакомством хирургов с
влектрохирургическими резекциями желудка при язвенной болезни приводим их описание.
Электрохнрургическую асептическую резекцию по
Бильтрот-Н при язвенной болезни обязательно выполняем на предельно короткой петле. Обоснованием для
такого выбора являются два обстоятельства. Во-первых,
данные о наличии электрического «водителя ритма» —•
расетасег — в стенке тонкой кишки (Milton, Smith,
1956; П. Г. Богач, 1957). «Водитель ритма», являющийся источником, задающим частоту сокращений остальным сегментам кишки, расположен у места впадения
желчного протока в двенадцатиперстную кишку, Обра-
170
ч
зование соединительнотканного кольца в области дополнительного анастомоза при резекции желудка на
длинной петле снижает влияние датчика ритма на
дистальные отделы кишечника. Кроме того, его влияние наиболее активно проявляется яа расстоянии 15—
20 см от места расположения «водителя ритма». Другим
обстоятельством является нередко наблюдающееся при
стенозирующих язвах двенадцатиперстной кишки явление различной степени выраженности дуоденостаза.
Ревизия начального отдела тонкой кишки часто выявляет избыточную фунйцию «дуоденоеюнального клапана» (Я. Д. Витебский, 1976). Она вызывается интенсивным рубцовым подтягиванием вверх зоны дуоденоеюнального перехода, обширной спаечной фиксацией кишки в результате перидуоденита, формированием дуоде-
ноеюнальной «двустволки» и т. д. Поэтому нередко
возникает необходимость не только в дополнительной
бессосудистой мобилизации этой зоны, но и в наложении анастомоза вблизи от релаксированной части двенадцатиперстной кишки. Причем наложение дополнительного межкишечного анастомоза при резекции желудка на длинной петле не способствует лучшему
опорожнению двенадцатиперстной кишки, так как отводящий отдел тонкой кишки значительно удален от
датчика ритма.
С другой стороны, электрохирургическая методика
позволяет оперировать тяжелых, обескровленных больных асептично, избегать загрязнения операционного
поля и наложения травмирующих слизистую кишечных
жомов.
Методика, применяемая в клинике неотложной
хирургии, является видоизменением способов и усовершенствований, ранее описанных С. А. Холдиным (1941),
М. С. Шульманом (1948), М. 3. Сигалом (1964) и
Р. К. Харитоновым (1973).
Техника электрохирургической резекции по Биль-
рот-Н, которую мы выполняем, заключается в следующем:
1. Мобилизация желудка и обработка культи двенадцатиперстной кишки не представляют особенностей.
2. Мобилизованный желудок отбрасывается вверх
и влево и растягивается в стороны по большой и малой кривизнам с помощью держалок,
171
'3. Берется предельно короткая петля тощей кишки
по возможности ближе к месту перехода ее в забрю-
шинную часть двенадцатиперстной кишки. Для осу*
ществления этого нередко приходится проводить
дополнительно бессосудистую мобилизацию связки Трей-
ца на протяжении 8—10 см. Петля проводится в отверстие брыжейки поперечноободочной кишки.
4. Наложение гастроеюнального анастомоза начинается с фиксации тонкой кишки вблизи от связки
Трейца к задней стенке желудка со стороны малой и
большой кривизны двумя швами на ширину будущего
анастомоза. В середине между ними накладывается
дополнительный узловой шов. Растягивая эти нити
держалки, накладывается непрерывный серозно-мышечный шов между стенкой желудка и кишкой. Поверх
него накладывается второй этаж непрерывного шва.
5. Поверх сформированного двухэтажного серозномышечного шва на желудок со стороны большой кривизны накладывается удлиненный зажим Бильрота
без зубчиков (длина бранш 5,5 см).
6. После этого желудок со стороны малой кривизны
подтягивается, и на него навстречу зажиму и вплотную
к нему накладывается аппарат УО. Прошив желудок,
производится отсечение его дистальной части с помощью электроножа. Особое внимание обращают на
тщательную коагуляцию подслизистого слоя желудка
в области будущего анастомоза.
7. При снятии аппарата УО обращает на себя внимание сокращение стенки желудка по малой кривизне.
Следовательно, при такой методике происходит дополнительная резекция малой кривизны. После этого
производится погружение части культи в серозно-мышечный полукисет, а остальная часть желудка до анастомоза погружается отдельными швами.
8. Под зажим, лежащий у устья будущего анастомоза, проводится сквозная «страховочная» прошивная
лигатура, после чего зажим снижается, а просвет желудка остается закрытым.
9. Вдоль линии будущего анастомоза и параллельно
ему электроножом рассекают серозно-мышечный слой
кишки. {1ри этом тщательно коагулируют соединительнотканные перемычки между циркулярными складками
слизистой.
172
10. После этого приступают к наложению непрерывного серозно-мышечного шва на переднюю стенку желудка поверх «страховочной» прошивной лигатуры и
дефекта в тонкой кишке. В начало серозно-мышечного
шва включают и преданастомозную часть культи желудка. Поверх накладывается второй этаж непрерывного
серозно-мышечного шва, и производят пальцами раздавливание коагулянта со стороны тонкой кишки.
11. Анастомоз извлекается через отверстие в брыжейке, и края брыжейки фиксируются к культе желудка.
В послеоперационном периоде обращает внимание
быстрое наступление эвакуации из культи желудка,
наступающее, как правило, через сутки после операции.
Это избавляет от тягостной для больного необходимости долго держать назогастральный зонд и рано
приступать к приему жидкости и пищи.
В послеоперационном периоде следует обратить
особое внимание на компенсацию кровопотери, очищение кишечника от крови и профилактику гнойных
осложнений. Здесь целесообразно вспомнить предложение В. И. Стручкова, Э. В. Луцевича и соавт. (1977)
выделять в постгеморрагическом состоянии 3 периода:
I период (первые 2 суток) характеризуется дефицитом и плазмы и эритроцитов. Поэтому показано переливание цельной крови. Лишь при отсутствии крови для
восполнения объема плазмы можно воспользоваться
кровезаменителями;
II период (3—5 сутки) отличается восстановлением
объема плазмы и сохранением дефицита эритроцитов.
Поэтому показано переливание эритроцитарной массы;
III период (начиная с 6 суток) характеризуется
постепенным увеличением объема эритроцитов и требует чаще всего переливания эритроцитарной массы и
реже цельной крови при наличии гипопротеинемии.
Неязвенные кровотечения
Причинами неязвенных кровотечений наиболее часто
являются геморрагический гастрит, опухоли желудочно-кишечного тракта и портальная гипертензия. К более
редким причинам относится синдром Меллори — Вейсса,
травматическая и воспалительная гемобилия, дивертикулы желудочно-кишечного тракта, грыжи пищевод-
173
кого отверстия диафрагмы, свищи между крупными
сосудами и пищеварительным трактом и др.
Геморрагический гастрит. При геморрагическом гастрите на слизистой желудка обнаруживаются одиночные или множественные эрозивно-язвенные
участки, значительные участки «плачут кровью», а в
толще слизистой обнаруживаются кровоизлияния. Представляется, что этот процесс имеет стадийный характер: кровоизлияния — эрозии — язвы (Н. М. Белоусова,
1976). Такой процесс нередко является следствием местного повреждающего фактора — действия токсических
или лекарственных веществ на неполноценные сосуды
слизистой. В связи с этим большое значение приобретает употребление больным ульцерогенных лекарств
(аспирин, бутадион, резерпин, атофан, соли калия
и др.). Определенное значение в возникновении геморрагического гастрита имеют анатомические особенности' в
кровоснабжении желудка в кардиальном отделе по малой кривизне (Barlow, 1951). Ввиду отсутствия подслизистого сосудистого сплетения конечные сосуды по малой
кривизне располагаются тангенциально по отношению
к слизистой. Поэтому слущивание эпителия ведет к эрозии, в первую очередь, вены, что приводит сначала
к кровоизлиянию, а затем и к кровотечению. Этот анатомический вариант диктует необходимость тщательного осмотра слизистой в кардиальном отделе и по малой
кривизне.
Портальная гипертензия. Пусковым механизмом кровотечений при портальной гипертензии
являются гипертонические кризы в портальной системе, вызывающие нарушение целости декомпенсирован-
ных вен. Поэтому подобные кровотечения часто начинаются после обильного приема пищи или во - время
сна, когда приток крови к органам пищеварения значительно увеличивается. У подавляющего числа больных
с портальной гипертензией имеются различного рода
нарушения в системе свертывания крови (тромбоцито-
пения, гипофибриногенемия, усиление фибринолитической активности и т. д.), но они не являются пусковыми в возникновении кровотечений у этих больных.
Эти больные отмечают приступообразные боли в области печени, нередко сочетающиеся с кровавой рвотой
и желтухой. При осмотре обнаруживаются увеличенная
174
печень и селезенка, асцит, атрофия мышц плечевого пояса, похудание.
Кроме лабораторных данных, указанных в разделе, посвященном язвенным кровотечениям, необходимо исследовать активность трансаминаз,
щелочной фосфатазы и
альдолазы, содержание
белка и белковых фракций. В объективной диагностике кровотечения при
синдроме портальной гипертензии имеют большое значение рентгенологическое исследование
пищевода для выявления
варикозно расширенных
вен (рис. 30), эзофагоскопия, силенопортог рафия, внутривенная и вну-
триселезеночная радио-
портография, реогепато*
графия.
Опухоли желудка. Желудочные
кровотечения при опухолях, как правило, развиваются на поздних стадиях заболевания при
распаде опухоли. Кровотечение может быть из
крупного аррозированно-
го сосуда, а чаще из мелких сосудов, открывающихся в опухоль. Это
определяет клиническую особенность подобных кровотечений, заключающихся в медленности развития,
смазанности клинических проявлений, осложнения. Профузные желудочные кровотечения могут быть первым
клиническим проявлением опухоли желудка, У ряда
Рис. 30. Рентгенограмма пищевода больного циррозом печени. Варикозное расширение вен пищевода на всем протяжении.
175
больных наблюдается сочетание кровотечения с прободением опухоли. При этом часто имеет место атипизм
клинической картины и стертость симптоматики. Поэтому даже незначительное усиление болей в подложечной области должно настораживать хирурга и побудить его к использованию для диагностики ранней
рентгеноскопии желудка или экстренной эндоскопии.
Синдром Меллори — Вейсса в основном
встречается у мужчин в возрасте от 30 до 50 лет. Он
характеризуется образованием трещин на слизистой
оболочке кардио-пищеводной области. Трещины образуются вдоль оси пищевода или желудка. При этом повреждаются и сосуды, от вида которых зависит интен*
сивность кровотечения. Артерии в этой области в основном являются ветвями левой желудочной артерии. Предрасполагающим фактором является также истончение
подслизистого слоя субкардиального отдела желудка
в пожилом возрасте (Bellman с соавт., 1974). Возникновение кровотечения обычно следует за рвотой, которая -ведет к повышению внутрижелудочного давления,
изменению кровообращения в растянутом желудке за
счет обескровливания слизистого слоя при сохранной
циркуляции в мышечном слое и возникновению разрывов слизистой.
Таким образом, начало этого заболевания связывают с приступами повторной сильной рвоты после приема
большого количества пищи и алкоголя, Иногда развитию этого синдрома предшествует продолжительная
икота, приступы кашля и бронхиальной астмы, физическое перенапряжение после еды или заболевания желудка (гастрит, язвенная болезнь двенадцатиперстной
кишки, стеноз привратника и др.). Причем рвота может
быть как «кофейной гущей», так и алой кровью. Боли
в эпигастральной области обычно носят слабый характер или отсутствуют. Иногда наблюдается умеренное
напряжение передней брюшной стенки в этой области
без других симптомов раздражения брюшины (Б. Д. Комаров, В. В. Кушунин, В. Г. Теряев, 1974). Диагностика-
неязвенных кровотечений не может ограничиваться
использованием только рентгенологического метода
исследования и указанных ранее лабораторных тестов.
У этой категории больных применение гастрофиброско-
176
пии имеет решающее значение. Причем гастрофиброско-
пия может быть использована не только с диагностической, но и лечебной целью.
Г емобилия — кровотечение из желчных путей.
Наиболее частой причиной, гемобилии является травма печени. Среди других причин гемобилии следует
указать на воспалительные заболевания печени и желчных путей (абсцессы, холангиты, язвенный холецистит),
сосудистые аномалии в виде аневризм печеночной артерии и ветвей воротной вены. Клиническая картина гемобилии характеризуется кровотечением, приступообразными болями в правом подреберьи и желтухой. Наибольшую диагностическую ценность имеют ангио- и
холангиография, позволяющие выявить затек контрастного вещества в ткань печени (В. С. Шапкин>вЖ. А. Гри-
ненко, 1974).
Консервативное лечение
Для определения тяжести неязвенных кровотечений
применяется та же схема, что и в диагностике кровотечений язвенных. Как правило, сначала должно применяться активное, энергичное и продолжительное консервативное лечение. Причем консервативный метод лечения является у этой категории больных ведущим. Лишь
при кровотечениях тяжелой степени после короткого
пробного лечения предпринимается .операция с обязательным проведением энергичной предоперационной
подгоуовки.
В зависимости от диагноза спектр консервативных
мероприятий несколько меняется. Так, при опухоли
желудка и геморрагическом гастрите консервативные
мероприятия в основном такие же, как и при язвенной
болезни. Дополнительно следует рекомендовать при геморрагическом гастрите: а) атропинизацию; б) введение
витамина С внутривенно до 10—15 мл.
При портальной гипертензии имеются некоторые
особенности консервативной терапии. Они состоят в
следующем.
1. Выполнение пунктов 1—8, указанных в разделе
о лечении язвенных кровотечений.
2. Введение капельно внутривенно 20 ед. питуитрина в 200 мл 5% раствора глюкозы медленно, в течение
20 минут. При отсутствии эффекта введение питуитрина
12 М 843
177
в половинной дозе через 40—60 минут после первого
введения (М. Д. Пациора).
3. Дробное и многократное введение сухой или на»
тивной плазмы в небольших дозах (20—30 мл).
4. Введение зонда Блекмор — Сенгстакена, если
кровотечение не останавливается после проведения ме-
дикаментозной терапии. Перед введением зонд-баллон
смачивают в 2% растворе новокаина, баллоны сворачивают вокруг зонда и в таком виде проводят через нос
в желудок. Затем в дистальный (шаровидный) баллон
вводят 100 мл воздуха и весь зонд подтягивают кверху,
что приводит к обтурации кардии. После этого в пищеводный баллон вводят около 200 мл воздуха. В таком
положении зонд оставляется на 1—2 суток в зависимости от тяжести состояния больного. Через просвет
зонда производят отсасывание желудочного содержимого, т. е. осуществляют динамический контроль за
эффективностью процедуры и осуществляют дробное
кормление. Каждые 5—6 часов воздух из пищеводного
баллона выпускается и проводится контроль местного
гемостаза. При удалении зонда следует соблюдать следующие рекомендации. Сначала из баллонов шприцем
удаляется воздух, но зонд оставляется на месте на
1—1,5 часа со спущенными баллонами. Затем больному
дают ложку вазелинового масла и лишь после этого
зонд извлекают (см. рис. 31).
Рис. 31. Пищеводный зонд с пневмоба июнями.
178
5. Ликвидация печеночной недостаточности внутривенным введением до 100 мл 40% раствора глюкозы
с инсулином, витаминами В|, Вв, В|2, никотиновой и
аскорбиновой кислотами до 5 мл 5% раствора с добавлением в этот раствор гемостатиков.
6. Внутримышечное введение антибиотиков типа
неомицина или канамицина.
7. Питание больных после прекращения кровавой
рвоты малыми порциями 4—5 раз в день. В пищевой
рацион включаются сырые яйца, молоко, жидкий творог, протертые фрукты и овощи, соки.
8. Опорожнение кишечника с помощью послабляющих продуктов питания и очистительных клизм.
Оперативное лечение
Однако даже самое интенсивное консервативное лечение в ряде случаев ые приводит к остановке кровотечения. Особенно неблагоприятным течением отличаются кровотечения при портальной гипертензии, резко
ухудшающие функцию печени, почек и приводящие к
обострению и декомпенсации цирротического процесса.
Поэтому операции у подобных больных должны быть
минимальными по объему и не травматичными. Следует
помнить, что операция на фоне желтухи и асцита, т. е.
при декомпенсированном течении цирроза печени, даже
небольшого плана бесперспективны.
Этапы операции
1. После лапаротомии необходимо внимательно
осмотреть серозную оболочку круглой и печеночно-двенадцатиперстной связки, кардиоэзофагальной зоны,
малого сальника для выявления не только порто-ка-
вальных, но и порто-портальных анастомозов, т. е. для
установления диагноза портальной гипертензии.
2. Осмотреть и пропальпировать печень, селезенку
и поджелудочную железу для выявления цирротического процесса в печени или синдрома портальной гипертензии на почве опухоли поджелудочной железы.
3. При отсутствии положительных диагностических
данных произвести широкую продольную гастротомию,
развести стенки желудка, отсосать желудочное содер¬
12*
179
жимое, ввести зонд-иллюминатор с лампочкой и внимательно осмотреть слизистую для выявления кровоизлияний, эрозий, плоских язв, полипов, трещин. Особое
внимание обратить на малую кривизну и кардиальный
отдел желудка. При неясном источнике кровотечения
затампонировать сомнительный участок комком из марлевых салфеток. Пятно на салфетке можер помочь в
установлении источника кровотечения.
При кровотечении на почве портальной гипертензии
из варикозно расширенных вен должна быть применена
минимально травматичная операция, направленная на
спасение жизни больного. Этим требованиям отвечает
гастротомия с лрошиванием вен желудка и пищевода
или операции Таннера (пересечение желудка в субкардиальном отделе) в различных модификациях.
Операция гастротомия с прошиванием кровоточащих вен пищевода и желудка и перевязкой селезеночной артерии по М. Д. Пациора с соавт. (1974) проводится следующим образом. После лапаротомии желудок на протяжении 10—12 см вскрывают от дна к
малой кривизне. Удаляются кровь и желудочное содержимое, после чего вводят зеркало, приподнимающее
верхнюю часть передней стенки желудка. Пальцами
левой руки хирурги выводят расправленную слизистую
желудка в рану. Этот прием позволяет обнаружить
расширенные вены малой кривизны в виде резко утолщенных, не меняющих свою форму складок слизистой
оболочки. Иногда видны кровоточащие вены. Расширенные вены прошивают кетгутом через слизистую оболочку узловыми швами. Подтягивая за лигатуры и
отдавливая слизистую оболочку малой кривизны, прошивают выбухающие в просвет вены нижнего отдела
пищевода. После прошивания ушивают послойно рану
желудка (см. рис. 32). Если позволяет состояние больного, то перед гастротомией перевязывают селезеночную артерию ближе к чревной артерии.
При геморрагическом гастрите наиболее
оптимальными следует считать также минимальные вмешательства, направленные на спасение жизни больного. Ушивание и обшивание кровоточащих участков, селективная ваготомия с пилоропластикой в большинстве
случаев оказываются достаточно эффективными
180
Рис. 32. Гастротомия с прошиванием
расширенных вен пищевода и желудка.
а — 1 этап (желудок взят на держалки ■
вскрыт в продольном направлении); б —
2 этап (прошивание вев кардиального..отдела желудка); в—3 этап (прошивание вея
пищевода).
"(А. А. Шалимов, 1972; Веллер, 1972; Bartiet, 1966;
Nagel с соавт., 1967, и др.).
Лишь при кровотечениях, возникших из острых эрозий и язв, развившихся на почве подслизистых телеангиэктазий, показана резекция желудка. При этом следует помнить, что дополнительные источники кровотечения могут находиться в фундальном или кардиальном
отделе желудка, что требует их обшивания и гемостаза, без чего операция не может быть радикальной. При
поражении желудка эрозивным процессом на значительном протяжении иногда показана субтотальная резекция желудка или даже гастрэктомия.
При синдроме Меллори — Вейсса в большинстве
случаев бывает достаточно обшивания трещин кетгу-
181
товым швом, начинающимся с ее нижнего края, и дополнительной перевязки левой желудочной артерии
(Stoica, 1959). При продолжающемся кровотечении
можно дополнить ушивание трещины и перевязку ле«
вой желудочной артерии ваготомией (А. А. Шалимов),
При кровоточащей опухоли желудка или полипе методом выбора следует считать резекцию желудка. Лишь
в неоперабельных случаях могут быть использованы
ушивание и тампонада кровоточащего кратера, элек-.
трокоагуляция или перевязка сосудов на протяжении.
При гемобилии вскрытие, дренирование и тампонада
полости гематомы считаются наиболее простым и щадящим методом операции. При этом необходимо обязательно дренировать общий желчный проток для декомпрессии желчных путей. Наиболее рациональным
некоторые хирурги считают вскрытие гематомы с перевязкой кровоточащего сосуда и желчного протока или
резекцию печени (В. С. Шапкин, Ж. А. Гриненко, 1977),
Лишь в редких случаях рекомендуется перевязка печеночной артерии после ангиографически установленного
диагноза заинтересованности внутриорганных артериальных сосудов (Т. Т. Тунг, 1973). Желательно при
этом перевязывать ту ветвь печеночной артерии, из
ветвей которой наблюдается кровотечение.
«Слепая» резекция может быть применена лишь в
крайних случаях продолжающегося кровотечения после
тщательного осмотра слизистой желудка и двенадцатиперстной кишки.
В послеоперационном периоде серьезное внимание
должно быть обращено на предупреждение развития
перитонита, так как у обескровленных больных репаративные процессы и заживление ран резко ослаблены.
ГЛАВА X
УЩЕМЛЕННЫЕ НАРУЖНЫЕ ГРЫЖИ ЖИВОТА
Проблема хирургического лечения больных с ущемленными грыжами живота не потеряла актуальности до
последнего времени. Это определяется значительной
182
частотой поступления больных с этой патологией, большим процентом пациентов пожилого и старческого возраста (до 40%), высокой послеоперационной летальностью (Г. Д. Шушков, 1970; М. И. Шалаев, 3. В. Тишинская, Т. Ф. Илатовская и др., 1978).
Больных с ущемленными грыжами следует рассматривать как пациентов с острой кишечной непроходимостью. В результате возникновения кишечной непроходимости наступают сначала функциональные,
а затем органические изменения в проксимальном и-
дистальном отрезках ущемленного кишечника. Нарастающее внутрикишечное давление приводит, в первую очередь, к сдавлению, а затем и к тромбозу венозных сосудов и нарушению кровообращения. Повышенная проницаемость кровеносных и лимфатических
сосудов в результате местной ишемии и «биогенной
токсемии» ведет к обильной транссудации крови в
стенку кишки.
Таким образом, в стенке ущемленной кишки развиваются геморрагический инфаркт и процессы воспаления. В.результате ишемии и слущивания эндотелиального покрова стенка кишки становится проницаемой
для микробов и токсинов. Отсюда инфицированный
экссудат появляется как в содержимом грыжевого мешка, так и в брюшной полости при самопроизвольном
вправлении мешка. Изучение пробы Ривальта показало, что в 90% случаев грыжевые воды являются экссудатом, причем в 15% случаев они инфицированы за
счет гемолитического стрептококка или смешанной
микрофлоры (В. Вашкялис, 1971). Нам приходилось
видеть, как инфицированный экссудат, оставленный в
брюшной полости после грыжесечения, явился в послеоперационном периоде источником перитонита. Кроме
того, фибринозные наслоения, появившиеся на поверхности ущемленных органов, могут быть причиной развития после операции спаечного процесса. В престарелом
же возрасте деструктивные изменения в сосудистой
стенке вследствие склероза развиваются быстрее и могут
в короткое время привести к перфорации ущемленного
органа. Кроме того, следует помнить, что при ишемии
кишечника изменения сначала развиваются в слизистой
и подслизистом слое кишки. Брюшинный же покров тонкой кишки более длительное время сохраняется неиз¬
183
мененным (Lester, Williams, 1971). Эта патогенетическая
особенность при ущемленных грыжах является причиной неверной оценки жизнеспособности кишки, а_ далее
и тактической хирургической ошибки.
Диагностическая программа
Она остается традиционной и стабильной уже многие десятилетия. Приходится все же признать, что нередкие ошибки в диагностике этой патологии (до 26%)
зависят часто от недостаточно собранного анамнеза и
не всегда тщательно и поверхностно проведенного
осмотра больных больше, чем от недостатка диагностических методов. Обращает внимание то обстоятельство,
что такой классический признак ущемления, как боль,
может быть невыраженным или менять свою локализацию. Так, только в 47,8% наблюдений боль локализовалась в области грыжевого выпячивания, в 10 —
случаев она начиналась в подложечной области, а в
42,2 — по всему животу (М. И. Шалаев с соавт., 1978).
Причем у лиц пожилого и старческого возраста первыми признаками ущемления могут быть различного вида
диспептические расстройства: от задержки стула
(у 9% больных) до тошноты (38%) и рвоты (31%).
В клинически неясных случаях существенную помощь хирургу может оказать рентгенологический метод
исследования (С. В. Пружанский, 1947; И. М. Либер-
ман, 1953, и др.). При этом нужно помнить, что в своевременной диагностике грыж решающее значение имеет
выявление кишечной непроходимости, так как в 85%
случаев ущемленной является тонкая кишка. Методика
рентгенологического обследования состоит в следующем (Н. А. Лесникова, 1976). При пупочных и послеоперационных грыжах рентгенография брюшной полости в вертикальном положении больного в двух проекциях с выведением на контур грыжевого выпячивания
и прицельный снимок области грыжевых ворот. При
паховых и бедренных грыжах достаточно одного снимка
брюшной полости в вертикальном положении больного
от диафрагмы до таза. Особенность рентгенологической
картины состоит в появлении признака сторонности
при локализации горизонтальных уровней жидкости,
наличии газа в толстой кишке при тонкокишечной не¬
184
проходимости вследствие ущемления в ранние сроки
заболевания (до 6 часов). Поэтому при осмотре больного с клиникой кишечной непроходимости следует
строго соблюдать ряд рекомендаций (Н. В. Воскресенский, С. Л. Горелик, 1965; Г. Д. Шушков, 1970):
1. У каждого больного, предъявляющего жалобы на
боли в животе, и при явлениях кишечной непроходимости должны быть тщательно осмотрены места обычного возникновения грыж.
2. При подозрении на ущемление паховых или
бедренных грыж должны быть внимательно осмотрены нижние конечности, промежность и прямая кишка.
Подобный осмотр нужен для исключения симулирующего ущемления регионарного лимфаденита, острого
тромбофлебита и метастазов опухоли прямой кишки
в лимфатические железы.
3. При обнаружении невправимой грыжи и малейшем подозрении на ущемление лечить больного как
пациента с ущемленной грыжей.
4. При обследовании больного с ущемленной грыжей необходимо выявлять сопутствующие ущемленной
грыже заболевания со стороны других органов и систем,
утяжеляющих послеоперационный период и влияющих
на исход заболевания.
5. У больного с ущемленной грыжей, кроме проведения обычных методов исследования (анамнез, осмотр,
пальпация), необходимо сделать анализ крови, мочи,
рентгенологическое исследование грудной клетки и
брюшной полости, определение протромбинового показателя, свертываемости" крови и электрокардиографическое исследование по показаниям.
Лечение
Установленный диагноз ущемленной грыжи является
показанием к срочной операции. В большинстве случаев
применение таких мероприятий, как ванны и местное
тепло, недопустимо. Особенно опасным для больного
является насильственное ручное вправление ущемленной грыжи. Этот метод ведет к возникновению кровоизлияний в мягкие ткани и увеличивает сосудистые
нарушения в ущемленной кишке. Иногда он заканчивается мнимым вправлением, когда грыжевой мешок
185
перемещается вместе с содержимым под мышцы, но
остается ущемленным во внутреннем кольце. Это приводит к наружному исчезновению грыжи, но сохранег
нию ущемления и непроходимости. Нередко грыжевой
мешок в результате самопроизвольного вправления перемещается в промежутки между различными слоями
брюшной стенки (интерстициальное ущемление) или
полностью вправляется в брюшную полость. При подобной форме мнимого вправления наружное паховое
кольцо и канал свободны, а над пупартовой связкой
прощупывается резко болезненное образование, причем
сохраняются явления кишечной непроходимости.
В исключительных случаях на ранних сроках ущемления, т. е. когда с момента ущемления прошло не
более 1,5—2 часов, допустимо применение консервативных мероприятий, особенно если больной категорически отказывается от операции или имеются заболевания, делающие прогноз при операции сомнительным
(острые нарушения кровообращения, астматический статус и др.). В таких ситуациях вводится промедол, атропин и другие спазмолитики, делается хлорэтиловое орошение зоны грыжевых ворот и даже местная анестезия
0,5% раствором новокаина (Г. Д. Шушков, 1970).
В случае безуспешности применения указанных мер
необходимо прибегнуть, несмотря на тяжелые функциональные показатели, к операции.
Оперативное лечение
Операции при ущемленной грыже должна предшествовать подготовка.
1. При отсутствии явлений интоксикации и нару¬
шения функционального состояния жизненно важных
систем подготовка должна быть предельно короткой и
состоит в опорожнении мочевого пузыря и введении
назогастрального зонда, если операция будеть проходить под наркозом. Введение обезболивающих средств
нужно избегать, чтобы не создать условия для само-
вправления ущемленных органов (И. 3. Козлов,
Т. П. Андросова, 1975.)
2. При наличии тяжелого состояния,- связанного о
интоксикацией на почве перитонита, кишечной непроходимости, сердечно-сосудистой недостаточности, под¬
.186
готовка больного к операции должна проводиться соответственно с новым, возникшим в результате ущемления заболеванием. Это требует определенный промежуток времени, но не более 2—3 часов. Больной с возникшим осложнением готовится по рекомендациям, указанным в соответствующих разделах.
Этапы операции
1. При проведении местной анестезии нельзя пользоваться проводниковой и иифильтрационной анестезией, рекомендуемой для грыжесечения по поводу впра-
вимых грыж, так как она способствует самопроизвольному вправлению ущемленных органов в брюшную
полость, состояние кровообращения которых неизвестно (И. 3. Козлов, Т. П. Андросова, 1975). Наиболее
пригодна в этих ситуациях местная анестезия по методу тугого ползучего инфильтрата по А. В. Вишневскому.
2. Разрез должен быть с самого начала операции
достаточных размеров и проводиться при ущемленной
паховой грыже параллельно пупартовой связке, при
бедренной — перпендикулярно пупартовой связке, а при
пупочной грыже — окаймляющий поперечный разрез
сверху и снизу.
3. Вначале вскрывается грыжевой мешок, а затем
рассекается ущемляющее кольцо, при паховых грыжах
ущемляющее наружное кольцо рассекается кверху и
кнаружи. При бедренных грыжах ущемляющее кольцо
расширяется медиально и кверху (нельзя латерально
из-за наличия бедренных сосудов) и дополнительно пересекается пупартова связка. При пупочной грыже
ущемляющее кольцо расширяется в поперечном направлении с обеих сторон.
4. Если после анестезии грыжевых ворот во время
операции произошло вправление ущемленного органа,
то необходимо принять меры для его осмотра. Для
этого необходимо произвести герниолапаротомию или
даже лапаротомию. При герниолапаротомии косые и
поперечные мышцы живота, а также брюшина расслаиваются и рассекаются по ходу кожного разреза кнаружи
и вверх. Этот прием, как правило, обеспечивает достаточно хороший доступ для того, чтобы извлечь ущемленный орган, хорошо его осмотреть и решить вопрос
187
о степени деструктивных изменений и дальнейшей тактике. Лапаротомия более предпочтительна при дальнейшей необходимости производства резекции кишечника и санации брюшной полости. Причем удаление
экссудата из брюшной полости является не менее важной задачей, чем резекция нежизнеспособного участка
кишки.
5. Для оценки жизнеспособности кишечника применяются методы клинической и функциональной оценки
сохранения адекватного кровотока.
Безусловными признаками нежизнеспособности кишки являются темная окраска, тусклость серозного покрова кишки, отсутствие перистальтики и пульсации
сосудов брыжейки, явления некроза в области странгу-
ляционной борозды. .
Решение о жизнеспособности кишки принимается
после согревания освобожденной кишки теплым физиологическим раствором и новокаиновой блокады брыжейки выше места ущемления. Для оценки жизнеспособности кишки могут быть применены и функциональные методы. К ним следует отнести наложение кристалла поваренной соли. Появление перистальтики в сомнительном участке кишки свидетельствует о жизнеспособности ущемленного отдела кишечника (Е. А. Норенберг-
Чарквиани, 1969). Можно заменить поваренную соль
смачиванием кишки эфиром. Достаточно демонстративный эффект дает и введение в брыжейку кишки 0,2—
0,3 мл ацетилхолина в разведении 1:10-4. Такая инъекция при жизнеспособной кишке, приводит к появлению бурной перистальтики (В. В. Иванов, 1966). Недостатком этих методик является трудность определения границ нежизнеспособного участка.
Эффективным методом определения жизнеспособности кишки и границ адекватной перфузии кищечной
стенки является трансиллюминационная вазоскопия
(М. 3. Сигал, 1964, 1974). Определение жизнеспособности кишки проводится с помощью «трансиллюминационной окклюзионной методики». Она заключается в
следующем. Над лампочкой зонда-трансиллюминатора
распластывается исследуемый участок кишечной стенки.
Причем лампочку прижимают к стенке так, чтобы полностью исчезло теневое изображение артерии и вены.
При постепенном ослаблении давления на лампочку
Ш
наблюдают пульсирующую струю при сохраненном в
артерии кровотоке. При нарушении кровотока после
ослабления давления на трансиллюминатор наблюдается
медленное заполнение артерии и вены с проксимального
и дистального концов (пассивный кровоток). При сниженном, но сохраненном кровотоке пульсация артерии
не видна, но артерия заполняется быстрее вены, что
говорит о наличии редуцированного кровотока
(Б. К. Дружков).
Определение кровотока по указанным параметрам
может проводиться и без подсветки с помощью сдавления исследуемого сосуда пальцами и наблюдения
пульсирующего активного кровотока в проходящем свете.
Проводя последовательное исследование интрамурального кровотока сомнительного участка кишечника с
помощью окклюзионной методики, можно ориентировочно высказаться о жизнеспособности ущемленного участка кишки и пределах распространения внутристеночной
ишемии, т. е. выбрать границы резекции не схематически, а исходя из реальных условий кровообращения.
Однако отек, кровоизлияния в стенку кишки и брыжейки зачастую не дают возможности эффективно применить указанную методику и снижают ее достоверность.
6. А. При малейших сомнениях в жизнеспособности
ущемленной кишки следует прибегнуть к резекции
кишки особенно у лиц пожилого и старческого возраста,
поскольку у них особенно затруднена объективная оценка достаточности кровообращения в измененном участке кишечника (Г. Л. Феофилов с соавт., 1978). Кроме
нежизнеспособного участка, резецируется участок приводящего отдела кишки согласно данным вазоскопии
(или около 30 см) и отводящего отдела кишки (примерно около 15—20 см).
Б. Такая же тактика должна применяться в случаях
пристеночного ущемления кишки и при сомнениях в
жизнеспособности этого участка. Не следует погружать
измененный участок в просвет кишки, так как это создает механическое препятствие и нередко способствует
возникновению недостаточности погружающих швов.
В. Следует помнить, что ущемление жирового привеска ведет к нарушению кровообращения в стенке
толстой кишки и некрозу. Поэтому в подобных случаях
следует тщательно осмотреть соответствующий участок
189
*
толстой кишки и применить методы объективной оценки
внутристеночного кровотока.
7. После резекции кишки необходимо осмотреть
состояние слизистой на границе с резецируемой частью.
Наличие выраженного отека, изменение цвета слизистой
до сине-багрового или черного цвета говорит о том, что
границы резекции недостаточны и необходимо продолжить мобилизацию до нормальной слизистой.
8. При сильном растяжении приводящего отдела
кишки перед наложением анастомоза необходимо его
опорожнить. Можно произвести это с помощью электрического отсоса, на металлический наконечник которого нанизывается кишка. «Выдаивание» кишечного
содержимого не должно допускаться.
9. После резекции кишки, учитывая нарушения местного кровообращения, предпочтительно наложение
анастомоза «бок в бок», особенно при резекции кишки
в терминальном отделе или в условиях перитонита.
В нашей клинике наложение анастомоза мы производили электрохирургическим асептическим методом. Для
этого на боковые поверхности приводящего и отводящего отрезков кишки вблизи от ушитых концов накладываются на расстоянии 6 см друг от друга две нити-
держалки и дополнительная в середине будущего
анастомоза. Растягивая эти нити-держалки, накладывается первый этаж непрерывного серозно-мышечного
шва. Поверх него проводится второй этаж непрерывного шва. После этого вдоль линии будущего анастомоза
и параллельно ему электроножом рассекаются серозномышечные слои кишки. Особое внимание обращают на
тщательную коагуляцию соединительнотканных перемычек между циркулярными складками слизистой.
После этого приступают к наложению двухэтажного
непрерывного серозно-мышечного шва на переднюю
губу анастомоза. Далее производят пальцами раздавливание коагулята. Такая методика позволяет оперировать асептично, избегая загрязнения операционного
поля и применения кишечных жомов, ухудшающих и
без того нарушенное кровообращение кишки.
10. Обработка грыжевого мешка зависит от возраста
пациента и ширины грыжевых ворот. При наличии широких грыжевых ворот лучше наложить у его основания
кисетный шов. У престарелых пациентов или при очень
190
большой грыже грыжевой мешок не следует выделять
на всем протяжении и стремиться весь его резецировать.
При этом выделяется только шейка грыжевого мешка
со всех сторон, полностью пересекается и на шейку
накладывается кисетный шов. Дистальная часть грыжевого мешка лишь рассекается в продольном направлении для предупреждения скопления жидкости и оставляется на месте.
При производстве экстренного грыжесечения следует помнить о клинических аномалиях в виде:
1. Ретроградного ущемления кишки, когда в ущемляющем грыжевом мешке располагаются две петли,
а третья, соединяющая их кишечная петля и наиболее
измененная, находится в брюшной полости. Об этом
нужно помнить при осмотре кишечных петель в грыжевом мешке и, заподозрив ретроградное ущемление, после
рассечения грыжевого кольца следует вывести соединяющие ущемленные участки кишечника петли, чтобы
их внимательно осмотреть и оценить в них состояние
кровообращения.
2. Скользящей паховой грыжи. Уплощение грыжевого мышка может быть за счет выхождения по наружной стенке грыжевого мешка слепой кишки или мочевого пузыря по внутренней стенке. Чтобы избежать ранения этих органов, грыжевой мешок следует вскрывать
по передней поверхности и на участке наибольшего
истончения. После вскрытия такой грыжи избыток грыжевого мешка иссекается, орган вправляется в брюшную
полость и затем восстанавливается целость брюшины
непрерывным швом.
При подозрении на ранение мочевого пузыря в него
следует ввести катетер и разведенную метиленовую
синьку на физиологическом растворе (100—150 мл).
Такое заполнение поможет не только установить факт
повреждения, но и место повреждения. Поврежденное
место ушивается двухрядным швом без захватывания
слизистой. Катетер в мочевом пузыре оставляется на
4—5 суток.
3. Интерстициального ущемления. При этом виде
ущемления кишечные петли располагаются между париетальной брюшиной и остальным слоем брюшной стенки. Интерстициальное ущемление чаще всего наступает
после насильственного правления грыжи. При этой форме
191
ущемления в значительной части грыжевого мешка
ущемленные кишечные петли отсутствуют. Для их выявления и ликвидации ущемления необходимо сделать
герниолапаротомию.
Оперативное лечение ущемленной грыжи,
осложненной флегмоной грыжевого мешка или
перитонитом
При грыже, осложненной флегмоной грыжевого мешка, этапы оперативного вмешательства следующие:
1. Лапаротомия с выключением ущемленной кишечной петли. Для этого пересекаются в пределах здоровых участков приводящий и отводящий отделы кишок,
концы кишок, подлежащих удалению, зашиваются наглухо и погружаются в кисет. Целость кишечника восстанавливается путем наложения анастомоза «бок в
бок», лучше всего с помощью электрохирургической
асептической методики.
Брюшная полость после хорошей забрюшинной новокаиновой блокады в области корня брыжейки зашивается наглухо с введением двух полихлорвиниловых
микроирригаторов в подвздошных областях для введения антибиотиков.
2. Разрез над областью грыжевого выпячивания и
вскрытие грыжевого мешка. Далее после рассечения
ущемляющего кольца выключенная петля кишки удаляется и брюшина зашивается. Операционная рана
после промывания антисептиком и обкалывания антибиотиком тампонируется и оставляется открытой.
3. Пластика грыжевого канала и ушивание раны
производятся через 4—5 дней при отсутствии воспалительных явлений в области операции.
При грыже, осложненной перитонитом, операция
проводится по следующим этапам:
Если состояние больного позволяет, следует произвести лапаротомию. Брюшная полость осушивается и
промывается раствором антисептика. Производится резекция нежизнеспособной кишки до участков с нормальной васкуляризацией и слизистой. Электрохирургический
анастомоз «бок в бок». При наличии разлитого перитонита вводятся трубки для проведения интраперито-
неальной перфузии в послеоперационном периоде.
192
При очень тяжелом состоянии больного или у престарелых больных целесообразно расчленение операции на 2 этапа. На первом этапе делается герниола-
паротомия, резекция измененного участка кишки. Через
отдельный разрез в подвздошной области выводятся
приводящий й отводящий отделы тонкого кишечника и
подшиваются к брюшине, апоневрозу и коже. Просвет
приводящего отдела кишки вскрывают на следующий
день, так как Кишечник перед выведением предварительно опоражнивают. Производится пластика соответствующего канала и ушивание раны наглухо. Второй
этап операции — восстановление кишечной трубки —*
делается после выведения больного из тяжелого состояния и ликвидации воспалительных явлений в брюшной
полости.
Послеоперационный период
Задачи послеоперационного периода у больных с
ущемленной грыжей определяются возрастом больных,
сроками ущемления, видом операции, наличием осложненного ущемления. Основными принципами являются:
1) борьба с интоксикацией; 2) подавление инфекции
местно и в брюшной полости; 3) восстановление моторики желудочно-кишечного тракта; 4) профилактика
тромбоэмболических осложнений; 5) лечение и профилактика нарушений со стороны сердечно-сосудистой , и
дыхательной систем.
Назначения при осложненной ущемленной грыже
(перитонит, кишечная непроходимости) приведены в
соответствующих разделах. При неосложненной ущемленной грыже у лиц пожилого возраста:
1. Полусидячее положение в постели, дыхательная
гимнастика;
2. Анальгетики (промедол 2—3 раза в день);
3. Круговые банки и отхаркивающая .микстура;
4. Прокол трахеи и введение антибиотиков при плохом кашлевом рефлексе и задержке мокроты;
5. Антибиотики (пенициллин, стрептомицин, морфо-
циклин);
6. Антикоагулянты, начиная со вторых суток после
операции (фенилин 0,03 г 3—4 раза в день; синкумар
0,002 г 4—6 раз в день; пелентан 0,1 г 2 раза в день
и др.).
13 м-843
193
ГЛАВА XI
ОСТРАЯ КИШЕЧНАЯ НЕПРОХОДИМОСТЬ
Проблема острого илеуса до сих пор остается одной
из актуальных в неотложной хирургии. Нерешенность
ряда вопросов патогенеза, диагностики и лечения этого
синдрома находит отражение, в частности, в высокой
послеоперационной летальности, достигающей в сред*
нем 14% (Б. Д. Комаров, 1976). Тяжесть больных при
острой кишечной непроходимости и неудовлетворитель*
ные результаты оперативного лечения во многом зави*
сят от особенностей патогенеза илеуса. Среди основ*
ных патогенетических факторов выделяются следую*
щиё:
1. Расстройство водно-электролитного обмена и
кислотно-щелочного состояния вследствие прекращения
всасывания излившихся в просвет кишечника и потери
со рвотой пищеварительных соков. Причем их характер
в большей степени зависит от уровня непроходимости,
чем от ее вида.
2. Развитие шока вследствие боли я гиповолемии
на почве секвестрации кишечного сока и транссудации
плазмы в стенку кишки и ее просвет (до 2 литров).
3. Интоксикация, связанная с некротическими из*
менениями в кишечной стенке, образованием токсических продуктов под влиянием застоя и бактериальной трансформации.
4. Нарушение углеводного в белкового обмена
б. Нарушение портального кровообращения вследствие прекращения притока жидкости из кйшечннка в
воротную вену в результате блокады ветвей воротной
вены.
Более чем полувековой путь развития проблемы
илеуса, которая активно разрабатывалась многими отечественными хирургами, начиная с А. Г. Цеге-Мантей-
феля, Э. Валя, А. А. Кадьяка, И. И. Грекова, Н. Н. Самарина и др„ подробно изложен в работе А. П. Юри*
хина (1967).
При оценке клинического течения непроходимости
следует помнить о фазном течении заболевания, делающим проявления в клинике непроходимости полиморф¬
194
ными и расплывчатыми, зависящими от времени возникновения заболевания и от вида непроходимости.
Ведущими клиническими признаками кишечной непроходимости являются боли в животе, задержка стула
и газов, вздутие живота, усиленная перистальтика,
рвота и частый пульс (А. Е. Норенберг-Чарквиани,
1969). Следует помнить, что в клиническом течении
непроходимости можно выделить три фазы: 1) фазу
«илеусного крика»; 2) фазу интоксикации; 3) фазу
перитонита.
Фаза «илеусного крика? продолжается 12—16 часов. Она характеризуется острыми, приступообразными,
периодически повторяющимися болями. Эти боли иногда
бывают настолько сильными и значительными, что
вызывают явления шока. В «светлые» промежутки при
отсутствии болей состояние больных значительно не
страдает. Эти «светлые» промежутки и могут быть причиной диагностической ошибки во время осмотра больного в этот период.
Фаза интоксикации находится в интервале от 12 до
36 часов. В этот период боли теряют приступообразный
характер и становятся постоянными. Появляются вздутие и асимметрия живота. Ранее оживленная перистальтика исчезает. Появляется частая рвота или срыгива-
ние. Пульс учащается, артериальное давление нормальное или несколько сниженное. Задержка стула и газов
полная, появляется шум плеска. Именно в этот период
я появляются четкие рентгенологические признаки непроходимости.
Терминальная фаза непроходимости развивается
спустя 36 часов после начала заболевания. Для этого
периода характерно выраженное нарушение общего
состояния и функций целого ряда органов и систем.
Живот резко вздут, перистальтика не выслушивается
совсем. В свободной брюшной полости отчетливо определяется свободная жидкость. Язык сухой, обложен коричневым налетом. Периодически появляется каловая
рвота. Артериальное давление низкое, пульс частый и
малый. Вви^у глубокого нарушения обменных процессов, бурного развития инфекции в брюшной полости
и тяжелой интоксикации этот период непроходимости
называют еще терминальным.
13*
195
Диагностическая программа
Острая кишечная непроходимость и в настоящее
время представляет трудности для диагностики.#В тол
время как для других видов'острой патологии арсенал
диагностических приемов значительно расширился,
объем диагностических тестов при острой кишечной
непроходимости остался по-прежнему довольно ограниченным. Наличие послеоперационных рубцов, вздутие'
живота резко ограничивают возможности современной
эндоскопической диагностики. Поэтому в диагностике
острой кишечной непроходимости большое значение имеют тщательно собранный анамнез, скрупулезное выявление клинических признаков болезни, анализ рентгеновских и лабораторных данных.
При осмотре живота особое внимание следует обращать на конфигурацию живота, состояние грыжевых
ворот, наличие видимой перистальтики, послеоперационных рубцов. Таким образом, большое значение в ранней диагностике кишечной непроходимости занимает
выявление синдрома Э. Валя (В. Ф. Матохин, 1973). Он
включает четыре местных признака: 1) видимую асимметрию живота; 2) видимую перистальтику кишечника;
3) прощупываемую кишечную выпуклость; 4) слышимый при перкуссии высокий тимпанит. Причем симптом
высокого тимпанита наблюдается наиболее постоянно,
у 71% больных с непроходимостью (В. Ф. Матохин,
1973). При сотрясении брюшной стенки в растянутой, переполненной жидкостью кишке определяется шум
плеска (симптом Склярова). Перкуссия живота обнаруживает приглушение перкуторного звука соответственно расположению опухоли, инфильтрата или переполненной петли и скоплению жидкости в отлогих местах
брюшной полости. При аускультации в начале кишечной непроходимости выслушиваются многочисленные,
различные по высоте и звуку кишечные шумы. При развитии пареза, а. затем и паралича кишечника в терминальной стадии кишечные* шумы исчезают и наступает
«мертвая тишина». Осмотр живота заканчивается обязательным ректальным исследованием, позволяющим
выявить обтурирующую просвет толстой кишки опухоль,
каловый завал или баллонообразное вздутие прямой
кишки (симптом Обуховской больницы^.
106
Рентгенологическое исследование при кишечной не*
проходимости нередко является основным методом диагностики и потому обязательным. Оно должно проводиться строго последовательно._ На первом этапе проводится обзорная рентгеноскопия грудной и брюшной
полости, а затем делаются рентгенограммы и латеро-
граммы брюшной полости. Если при повторном рентгенологическом обследовании больного в течение 1—2 часов не выявляются характерные признаки заболевания,
то переходят к контрастным методам исследования
(М. К. Щербатенко, Э. А. Береснева, 1977). К ним
относятся полстаканная пероральная бариевая проба
Шварца при тонкокишечной непроходимости и экстренная ирригоскопия при подозрении на непроходимость
толстого кишечника (В. И. Петров, 1964; А. П. Юри-
хин, 1970, и др.).
Рентгенологическая картина тонкокишечной непроходимости имеет прямые и косвенные симптомы
(В. И. Петров, 1964). К прямым симптомам относятся
чаши и арки, поперечная исчерченность кишки, отсутствие газа в тонкой кишке. Косвенные признаки являются следствием давления переполненных жидкостью
петель на соседние органы. Сюда относятся деформации желудка, мочевого пузыря, затемнения в тазу и
боковых отделах живота. Одиночные «чаши Клойбера»
появляются уже через 2 часа после начала непроходимости и их количество возрастает через 3—4 часа
(рис. 33). Располагаются они во всех отделах живота,
ро преимущественно ближе к центральным отделам живота. Ширина уровня жидкости при этом обычно больше высоты газового пузыря. Арки возникают в случае,
когда петли кишки содержат больше газа, чем жидкости.
Расположение жидкости в арке на разных уровнях говорит в пользу механической непроходимости.
Обзорная рентгенография брюшной полости выявляет и другой ценный симптом — поперечную исчерченность тонкой кишки (симптом Кейси). Этот симптом
возникает в результате отека керкринговых складок,
которые выявляются на фоне газа в виде поперечно
идущих полосок затенения, закругляющихся у края
кишки, что создает иллюзию «селедочного скелета».
В подвздошной кишке эти поперечные складки более
редкие, прямые и толстые.
197
Рис. 33. Обзорная рентгенограмма брюшной
полости больного со спаечной тонкокишечной
непроходимостью. Видны широкие чаши Клой-
бера на разных уровнях.
Рентгенологическая картина непроходимости толстой
кишки более бедная. Она характеризуется просветлением периферии брюшной полости за счет раздутой газом толстой кишки и небольшим содержанием «чаш
Клойбера». Они располагаются в периферических отделах живота и характеризуются высоким газовым пузырем над узким уровнем жидкости. Резкое вздутие
сигмовидной кишки делает «светлым» весь живот.
Рельеф слизистой весьма своеобразен. Своеобразие заключается в том, что полулунные складки, выявляющиеся в виде толстых полос затенения, прерываются.
При неясной клинической картине тонкокишечной
непроходимости целесообразно применить для исследования рентгеноконтрастную пробу. Для этого пациенту дается 100 мл жидкой бариевой взвеси. Обзорный
снимок брюшной полости делается через 2, 4 и 6 часов.
У здорового человека контрастное вещество проходит в
тонкий кишечник и попадает в слепую кишку за 4 часа.
Задержка контрастной массы в тонкой кишке более
4 пасов говорит о наличии механической непроходимости. Следует подчеркнуть, что контрастная масса
помогает выявить неопределяемый до этого рельеф
отечных складок, т. е. помогает «проявить» симптом
поперечной исчерчепности (см. рис. 34).
198
Рис. 34. Рентгенография брюшной полости больного через 6 часов после приема бария (проба
Шварца). Контрастная масса полностью остается
в гонком кишечнике. Видны отечные, растянутые
складки слизистой, скопление бария в перегибах
и на дне растянутых кишечных петель
Для диагностики механической кишечной непроходимости стала применяться так называемая «водяная
проба» (Е. А. Пчелина, 1960; А. П. Хомутова, 1969).
Способ заключается в приеме стакана холодной воды,
после чего рентгенологически устанавливается-, увеличение количества горизонтальных уровней жидкости.
При подозрении на толстокишечную непроходимость
необходимо применить исследование толстой кишки контрастной клизмой. При завороте сигмы бариевая смесь
туго заполняет ампулу прямой кишки и дистальную
часть сигмовидной до места перекрута, где образуется
сужение в виде «клюва» или тени «сидящей птицы».
Контрастная клизма позволяет уточнить локализацию,
вид и протяженность обтурации, «дефект» наполнения
и супрастенотйческое расширение. Следует помнить,
что в неясных случаях и при этих видах непроходимости можно пользоваться рентгеноконтрастной пероральной пробой, которая должна дополняться через
8—10 часов «встречной» контрастной клизмой, что
199
позволяет выявить опухолевую непроходимость на ран»
них сроках.
Эндоскопическое обследование в последние годы
стало использоваться при кишечной непроходимости
неясного генеза (Ю. Е. Березов, В. Н. Сотников, 1977).
Поскольку при динамическом наблюдении можно
упустить благоприятное для операции время, то для
разрешения возникших диагностических трудностей при
симптомокомплексе кишечной непроходимости применяется лапароскопия. Ее рекомендуется выполнять под
местной анестезией при небольшом газовом пузыре (не
более 1,5—2 литра закиси ai30Ta).
Лабораторная диагностика предполагает проведе»
ние общих анализов крови и мочи, мочи на амилазу
(диастазу), определение содержания белка и белковых
фракций, электролитов (калия, натрия, кальция), кис»
лотно-щелочного состояния, хлоридов крови, остаточного азота и гематокрита.
Следует обратить внимание у .подобных больных на
состояние гемокоагуляции и предрасположенности их к
гиперкоагуляционному синдрому, связанному с понижением' антикоагулянтной активности крови и торможением фибринолитической системы (Д. П. Павловский,
1973). Поэтому целесообразно определение фибриногена, свертываемости крови, толерантности плазмы к гепарину, фибринолитической активности крови.
Консервативное лечение и предоперационная
подготовка
Больного с острой кишечной непроходимостью следует рассматривать как пациента с нлеус-болезнью.
Наиболее существенными элементами этой болезни
являются перерастяжение кишки выше места препятствия, потеря плазмы и эрыроцитов через стенку
ущемленного сегмента кишки, появление в ней некро-
биотических изменений, быстрое размножение микрофлоры с последующей бактериальной, интоксикацией и
длительное голодание. Для больных с механической кишечной непроходимостью типичным является повышение
гематокрита, содержания остаточного азота, гипонат-
риемия, гипохлоремия и появление респираторного
алкалоза (X. Э. Кокк, 1969). Определения гематокрита
200
и содержания белка позволяют выявить два вида ге-
моконцентрации. При странгуляционной кишечной не*
проходимости значительному повышению гематокрита
сопутствует нормальное содержание общего белка, т. е.
наблюдается гемоконцентрация по эритроцитам, характерная для потери плазмы. При обтурационной кйшеч,-
ной непроходимости наблюдается повышение не только
гематокрита, но и увеличение содержания общего белка,
что свидетельствует о дефиците внеклеточной жидкости.
Следует помнить, что изменение содержания натрия и
хлора зависит не от вида непроходимости, а от ее продолжительности. Так, в первые сутки заболевания практически гипонатриемии не наблюдается. Гипонатриемия,
гипохлоремия и повышение остаточного азота развиваются на 2—3 день болезни. Исходя из этих предпосылок и строится предоперационная терапия.
1. Введение назогастрального зонда и опорожнение
желудка.
2. Назначение антибиотиков широкого спектра действия для уменьшения возможности развития некроза
кишечной стенки под влиянием активно размножающейся в обтурированной петле микробной флора.
3; Катетеризация центральной вены для парентеральной коррекции расстройств гомеостаза и быстрого
восстановления объема циркулирующей крови. Поскольку потере воды при непроходимости сопутствует потеря
Натрия, считается целесообразным переливание жидкости, содержащей изотоническую концентрацию натрия.
'При странгуляционной кишечной непроходимости показана инфузия плазмы, консервированной крови, плаз-
мозаменителей, раствора Рингера или физиологического
раствора в соотношении 1 : 1.
При обтурационной кишечной непроходимости для
возмещения потерь внеклеточной жидкости основным
раствором может быть раствор Рингера. Причем добавление плазмы или крови проводят при соотношении
коллоидных и кристаллических растворов 1:2 и 1:3.
Темп инфузии определяется видом непроходимости. При
странгуляционной непроходимости вливается 1000 мл/час,
обтурационной — 500—700 мл/час. За время подготовки в течение 1—4 часов вливается от 1000 до 3000 мл
жидкости.
201
4. Паранефральная двусторонняя новокаиновая 6ло*
када.
5. В ряде случаев, особенно при спаечной кишечной
непроходимости и каловых завалах, с лечебной целью
необходимо освободить толстый кишечник от кала и
газов с помощью сифонной клизмы.
' 6. Введение антиспастических средств (атропина,
папаверина, но-шпы и др.).
7. Для расчета суточной потребности организма в
жидкости можно прибегнуть к формуле Рандала:
Дефицит (в литрах) — 1—— • аес <в кг)
г 5
где г — показатель гематокрита, или к рекомендациям
Ю. М. Дедерера (1971), согласно которым пациент ве-
сом в 70 кг должен получать 3,5 литра жидкости и
дополнительно количество жидкости, потерянное через'
дренаж или со рвотой.
8. Отсутствие эффекта от проводимого лечения в
течение 2—4 часов является показанием к оперативному лечению.
Оперативное лечение
Задачами хирургического лечения при острой кишечной недостаточности являются:
1. Установление локализации и вида непроходимости.
2. Блокирование болевой импульсации.
3. Устранение непроходимости.
4. Декомпрессия желудочно-кишечного тракта.
5 Выбор оптимального метода окончания операции
Этапы операции
Ревизия брюшной полости. 1. Под наркозом производится средне-срединная лапаротомия. Разрез далее
удлиняется вверх или вниз в зависимости от места непроходимости. При наличии послеоперационного рубца
лапаротомия производится после иссечения кожного
рубца выше или ниже окончания рубца, что позволяет
довольно свободно войти в брюшную полость и расширить операционную рану под визуальным контролем.
202
Перед ревизией кишечника необходимо удалить транссудат из брюшной полости, обладающий токсическими
свойствами. После этого производится новокаиновая
блокада корня брыжейки тонкой кишки, лучше всего
ближе и по направлению к связке Трейца для блокады
верхнебрыжеечного и солнечного сплетений.
2. При тонкокишечной непроходимости ревизия тонкого кишечника начинается последовательно от связки
Трейца, постепенно приближаясь к- месту препятствия
и области илеоцекального угла, где чаще всего локализуется препятствие или спаечный процесс. Этот прием
позволяет выявить нередко наличие не одного, а ряда
препятствий, вызывающих нарушение пассажа кишечного содержимого, в виде спаек, стриктур, желчных
камней, воспалительных инфильтратов.
3. При вздутии всего тонкого кишечника возникает
предположение о локализации непроходимости в толстом
кишечнике. Следует внимательно осмотреть и пропаль-
пировать особенно печеночный, селезеночный и ректо-
сигмоидный отделы, труднодоступные для осмотра. Необходимо исключить не тблько наличие опухоли, но и
Воспалительного инфильтрата, обтурирующих просвет
кишечника полипов и каловых камней.
4. При отсутствии в э+их «типичных» для возникно¬
вения непроходимости местах патологических процессов
нужно внимательно осмо+реть возможные места образования и ущемления внутренних грыж: внутренние
паховые и бедренные кольца, область запирательных
отверстий, связки Трейца и Винслова отверстия, поверхность диафрагмы и околопищеводное отверстие.
5. На ранних сроках непроходимости для осмотра
кишечник не выводится наружу. При сильном вздутии
и переполнении его после новокаиновой блокады петли
кишечника эвентерируются и покрываются влажной
салфеткой, пропитанной горячим физиологическим
раствором.
Устранение непроходимости. После установления
причины острой кишечной. непроходимости приступают
к устранению непроходимости. Причем единбго метода
устранения непроходимости не существует, тйк как причины обструктивного кишечного синдрома различны.
Поэтому и методы дезобструкции варьирую"* в зависимости об этиологии синдрома непроходимости.
203
1. При странгуляционной непроходимости причиной
обструкции могут быть тяж сальника,, дивертикул Мек-
келя, фаллопиева труба, рубцовый тяж. Поэтому нужно
проявлять большую осторожность при их пересечении,
поскольку это может привести к вскрытию просвета
полого органа и инфицированию брюшины. При деструкции этих органов показано их удаление.
2. При завороте тонкого кишечника при отсутствии
спаек и сращений кишечник разворачивается без особого труда в направлении, обратном завороту. Особое
внимание нужно обратить на места пересечения спаек
и тяжей, где легко возникает десерозирование. Эти
места должны быть тщательно ушиты.
3. При завороте слепой кишки и установлении ее
гангрены показана резекция слепой кишки с наложением илеотрансверзоанастомоза. При наличии жизнеспособной слепой кишки, имеющей общую с тонкой
кишкой брыжейку или собственную брыжейку, показана цекопекспя. Для.этого рассекается брюшина по
латеральному каналу живота. Слепая кишка помешается забрюшинно, а латеральный отслоенный листок
брюшины фиксируется к линии тении слепой кишки.
4- Заворот поперечноободочной кишки наступает
вследствие ненормально длинной брыжейки. В случае
сохранения Жизнеспособности кишки после устранения
ааворота необходимо произвести укорочение ее брыжейки и желудочно-ободочной связки. При нежизнеспособной кишке производится ее резекция с выведением обоих концов кишки наружу, т. е. двуствольного
ануса.. Первичное наложение анастомоза, как правило,
не показано, так как часто ведет к несостоятельности
анастомоза.
5. Заворот сигмовидной кишки возникает при наличии длинной сигмовидной кишки, широкой брыжейки я
узкого корня брыжейки. Самый простой вид лечения —
это раскручивание заворота сигмовидной кишки (де-
торзия) и опорожнение ее с помощью трансанально
проведенного зонда. Часто этого бывает недостаточно,
потому что нарушение кровообращения ведет к некрозу
сначала слизистой, а затем и остальных слоев толстой
кишки. Укорочение и пликация брыжейки сигмовидной
кишки, как правило, не дают результатов и сопровождаются рецидивами. Поэтому в ряде случаев даже при
204
жизнеспособной кипите показана первичная резекция
удлиненной и сверхподвижной сигмы с наложением
анастомоза конец в конец или конец в бок. При нежиз-
неспособной сигмовидной кишке ее резекция обязательна, причем не следует прибегать к простому выведению
омертвевшей кишки на кожу, так как это ведет к большой летальности. После резекции кишки лучше периферический и центральный концы кишки вшить в операционную рану. В ряде случаев дистальный конец
толстой кишки можно после пересечения -ушить и
леритонизировать (операция Гартмана). Однако это
создает дополнительные трудности для восстановления
непрерывности сигмовидной кишки в послеоперационном периоде.
6. В узлообразовании обычно участвуют два отдела
кишечника и чаще всего сигмовидная и тонкая кишки.
Причем ущемляющее кольцо образуется тонкой киш-
• кой, а ущемляется сигмовидная кишка. Кровообращение в тонкой кишке нарушается раньше и значительнее,
чем в толстой. Установив вид узлообразовании при ревизии, следует поступить следующим образом. Вначале произвести новокаиновую блокаду корня брыжейки кишки,
участвующей в узлообразовании. Если в узлообразо-
ванни участвует тонкий кишечник и кишки жизнеспособны, нужно прибегнуть к развязыванию узла. Если
кишечник нежизнеспособен, развязывать узел нельзя н
следует сразу прибегнуть к резекции кишечника, составляющего узел. Если узел .состоит из сигмовидной и
тонкой кишок, перед развязыванием узла вначале необходимо опорожнить сигмовидную кишку, что облегчает в дальнейшем развязывание узла. Опорожнение
кишки проводят с помощью грансанально проведенного
зонда или пункции кишки.. В ряде случаев можно попытаться опорожнить сигмовидную кишку, растянув
ущемляющее кольцо указательным пальцем правой руки
и медленно выдавливая содержимое кишки в вышележащие отделы. Если установлена нежизнеспособность
тонкой и толстой кишок, производится их первичная резекция. Причем целость тонкого кишечника восстанавливается сразу, а проксимальный и дистальный концы
толстой кишки выводятся наружу.
7. Обтурационная непроходимость вызывается инородным телом, желчным или каловым камнем, а также
205
расположенной вне кишки кистой, спайкой и чаще всего
опухолью.
v При обтурации тонкой кишки желчным камнем еле-
дует передвинуть камень в кишку несколько ниже, чтобы рассечь ее стенку на нормальном участке и через
это отверстие удалить камень. Это же отверстие должно
быть использовано для удаления содержимого из тонкого кйшечника.
При операбельной опухоли правой половины толстой
кишки целесообразно наложить на высоте кишечной
непроходимости обходной илеотрансвероанастомоз. Через
2—3 недели после ликвидации непроходимости больной подлежит повторной радикальной операции. При
неоперабельной опухоли илеотрансверзоанастомоз становится окончательным этапом разрешения непроходимости.
При опухоли селезеночного угла на высоте непроходимости лучше наложить цекостому, через которую
произродится разгрузка кишечника в послеоперационном периоде. Через 2—3 недели производится радикальная операция — левосторонняя гемиколэктомия, а спустя
некоторое время — закрытие цекостомы (операция
Пойдлер — Шлоффера).
При опухоли сигмовидной кишки или ее перфорации наиболее целесообразно произвести резекцию сигмы, отступя на 6—8 см от опухоли. Проксимальный
конец сигмы выводится на кожу, а дистальный ушивается наглухо (операция Гартмана), восстановление
непрерывности толстого кишечника предпринимается
через 4—6 месяцев при отсутствии метастазов.
При опухоли прямой кишки на высоте неироходи-
мости наиболее оптимальным является образование
противоестественного ануса с обязательным вьгеЪДением
обоих концов кишки на кожу.
8. В случаях ранней инвагинации следует попытаться произвести дезинвагинацию. Для этого после анестезии брыжейки весь инвагинат берут в левую руку, а
правой, осторожно надавливая на головку, пытаются
расправить инвагинат. Недопустимо потягивание кишки
за ее внутренний конец. После дезинвагинации определяется жизнеспособность кишки и показания к резекции. В поздних случаях инвагинации при наличии нежизнеспособной кишки показана резекция всего инва-
206
гината, поскольку его расправление может привести к
перфорации кишки и перитониту.
При любом виде непроходимости после ее .устранения , необходимо произвести оценку жизнеспособности
кишки с помощью тестов, представленных в разделе
*Ущемленные грыжи».
Трансиллюминация полых органов по М. 3. Сигалу
может быть использована не только для изучения полноценности внутристеночного кровотока. Она имеет
значение для исследований в проходящем свете подлежащих рассечению структур, границ опухоли, дифференциации элементов узла и т. д.
Декомпрессия кишечника во вр^мя и после операций
имеет решающее значение для сохранение целости анастомоза, жизнеспособности .дишки, устранения интоксикации и исхода всей операции.
Способы декомпрессии можно условно разделить на
8акрытые и открытые. Закрытая декомпрессия с помощью проведения назогастроеюнального зонда или
трансректальной интубации более благоприятна для
больного, поскольку она не сопровождается вскрытием
кишечника и потенциально не опасна последующим раз*
ви1ием недостаточности швов. Существенными недостатками трансназальной интубации являются длительность
и гравматичность интубации, а также неудобство, связанное с длительным пребыванием зонда в носоглотке.
Открытая декомпрессия осуществляется с помощью
энтеротомии и различного вида энтеростомий. Отрицательной стороной этих методов является реальная возможность развития недостаточности швов в послеоперационном периоде и развитие перитонита. К тому же
они показаны при выраженном вздутии кишечника или
запушенном заболевании.
Таким образом, вид декомпрессии зависит от характера непроходимости, степени растяжения кишечника
н наличия воспалительного процесса в брюшной полости.
При верхней тонкокишечной непроходимости можно
опорожнить кишечные петли через назогастральный
вонд, поскольку привратник зияет. Поэтому, осторожно перебирая кишечные петли, можно эвакуировать
кишечное содержимое в желудок, а затем отсосать его
через зонд. При выраженной нижней тонкокишечной
20?
непроходимости опорожнение кишечника проводится о
помощью энтеротомии (И. М. Перельман, 1937;
Е. Н. Никонова, 1953; В. М. Пронин, 1955, и др.). Это
наименее благоприятный вид декомпрессии. Для этого
вблизи препятствия на здоровый участок кишки после
его ограничения салфетками накладывается кисет и
после рассечения стенки вводится трубка или зонды-
отсасыватели -различных конструкций, на которые нанизывается кишка. Одним из удобных является зонд
Эйземана (1960).
В случаях значительного растяжения петель кишечника и необходимости длительной декомпрессии можно
воспользоваться предложением Дедбрера (1971) про-
« водить многодцрчатый зонд в кишечник через микрогастростому или через терминальный отдел тонйой кишки в проксимальном направлении на расстоянии от
1 до 1,5 м (И. Д. Житнюк, 1965). Место введения трубки на желудке или кишке фиксируется к париетальной
брюшине.
Д1ри толстокишечной непроходимости опорожнение
кишечника производится путем трансанально проведенного зонда после растяжения сфинктера. Зонд проводится и после резекции толстой кишки выше анастомоза. Через него в послеоперационном периоде вводится
небольшими порциями вазелиновое масло (30,0) или
фурациллин (50 мл) и производится откачивание газа
и каловых масс.
При невозможности проведения зонда необходимо
воспользоваться простой и часто- эффективной процедурой — растянуть в конце операции анальный сфинктер.
Метод окончания операции. При выражетюм вздутии кишечных петель или после резекции кишечника
необходима длительная послеоперационная декомпрессия кишечника по одному из приведенных методов. Нередко кишечная непроходимость осложняется перитонитом на почве перфорации или некроза кишки. Поэтому
после удаления воспалительного экссудата или устранения каловой загрязненности брюшины промыванием показано проведение метода интраперитонеальной антибио-
тиковой перфузии. При сомнении в жизнеспособности
кишки и тяжелом состоянии больного не следует торо-
• питься с резекцией. Для ее изоляции в стороне от лапа-
ротомной раны нужно сделать дополнительный разрез и
9ПА
кишку подшить до уровня брыжейки к брюшине и сшить
над кишкой кожу. Через 3—4 суток в случае жизнеспособности кишки ее погружают в брюшную полость.
Послеоперационное ведение
1. Постоянное дренирование и отсасывание из желудка. ■
2. Декомпрессия тонкого или толстого кишечника
через зонд.
3. Ранняя стимуляция кишечника назначением про-
зерина и карбохолина 6—8 раз в сутки.
4. Инфузионная терапия должна строиться на основании строгого учета потерянной жидкости из желудочно-кишечного тракта и почасового диуреза. Ориентировочные данные дефицита внеклеточной жидкости
при таких многообразных ее потерях можно получить,
в частности, с помощью формулы Seifart’a (1971),
основанной на определении уровня гематокрита (Ht)
и гемоглобина (В. М. Буянов, 1977):
Дефицит воды в литрах = —и-т'—/^лОЛЖИ' ■.
■ Одолжи.
вес. больного, кг ... .гп)
. прИ норме Ht в 45%.
5
В качестве инфузионных сред используются растворы Рингер — Локка, Гартмана, Дарроу до 2000 мл,
10% раствор глюкозы от 500 до 1000 мл, плазма или
цельная кровь (1000 мл).
5. Введение синтетических кровезамещающих растворов типа поливинолпиролидона и его производных
(гемодеза или неокомпенсана 400 мл), обладающих способностью связывать токсические вещества и усиливать
диурез.
Таким образом, пациент должен в среднем получать
около 4 л жидкости и белков, причем это количество
увеличивается соответственно потерям жидкости с желудочным и кишечным соком (Б. Д. Савчук, В. А. Ку-
бышкин, 1973).
6. При выраженной интоксикации и сниженном диурезе необходимы срочные меры по восстановлению
функции почек. Для этого вводится сорбитол или ман-
нитол из расчета 1—1,5 г/кг веса тела в виде 15% раст¬
14 М-843
209
вора. Лучше вводить маннитол, чередуя с небольшими
порциями 10% раствора глюкозы. Диуретическая терапия всегда предполагает активную * инфузионную заместительную терапию. Вначале для этих целей могут
применяться плазмозаменители (полиглюкин, желати-
ноль), а затем плазма или альбумин не менее 50% от
общего объема инфузии (И. В. Егоров, Ю. Е. Березов
С соавт., 1973).
7. Назначение антибиотиков-неомицинового ряда.
8. Введение гидрокортизона до 200—300 мл в сутки
при тяжелом состоянии больного.
9. Оксигено- и кардиальная терапия.
10. Профилактика или лечение легочных осложнении.
11. Проведение интраперитонеальной антибиотико-
вой перфузии при разлитом перитоните.
12. Назначение антикоагулянтов по показаниям.
Особенности операций
при спаечной кишечной непроходимости
Спаечная непроходимость занимает особое место в
хирургии илеуса в связи со своеобразным и не до
конца выясненным патогенезом этого заболевания. Причины образования спаек в брюшной полости многообразны. Среди них определенное значение имеют: 1) предшествующие операции, сопровождающиеся значительной травматизацией тканей; 2) длительный послеоперационный парез кишечника; 3) кровоизлияния в брюшную полость; 4) инородные тела в брюшной полости;
5) физические повреждения (охлаждение, перегревание,
высушивание брюшины); 6) хронические воспалительные заболевания органов брюшной полости; 7) ишемические изменения в тканях и т. д. Однако указанные этиологические факторы, являясь причинами образования
спаек, еще не могут рассматриваться как этиологические
причины самой спаечной болезни. Необоснованность
взгляда на спайки брюшной полости как на причину
спаечной болезни доказывается и тем, что спайки после
операций наблюдаются у 90% оперированных больных,
а истинная спаечная болезнь встречается у них во много раз реже (К. С. Симонян, 1966).
За последние годы высказывается все чаще точка
зрения на спаечную болезнь как на гиперергическую
210
реакцию соединительной ткани в результате гетеро- или
аутосенсибилизации, близкой по своей природе к коллагеновым заболеваниям (Р. А. Женчевский, 1971,
1975; А. Н. Дубяга, 1971, 1978, и др.). Этиологическая
и патогенетическая близость спаечной болезни к кол-
лагенозам подтверждается и общими чертами клинического течения, морфологических и биохимических изменений в крови и эффективностью применения кортикостероидов. Отсюда суть этого процесса заключается
не только в сращениях кишечных петель и сальника,
но и в характерных морфологических изменениях всей
брюшины, брыжейки и кишечной стенки, называемых
даже «брюшинным фиброзом» (П. Н. Напалков, 1975).
Эти обстоятельства и определяют особенности операций при спаечной кишечной непроходимости, которая
нередко протекает как острая атака спаечной болезни
с механической непроходимостью.
Показания к операции
Наличие очевидной полной спаечной кишечной непроходимости, проявляющейся схваткообразными болями в животе, тошнотой и рвотой, задержкой стула и
газов, вздутием живота и нарушением пассажа бария
по тонкому кишечнику, является показанием к экстренной операции после интенсивной предоперационной
подготовки. Срочному оперативному вмешательству
подлежат также больные, не имеющие явных признаков
непроходимости, у которых комплексное консервативное
лечение в течение 5—6 часов не устраняет приступа
острой непроходимости кишечника (Н. Г. Гатауллин,
1978). Комплексное консервативное лечение традиционно
и состоит в производстве паранефральной новокаиновой
блокады, введении спазмолитиков, производстве очистительных и сифонных клизм, промывании желудка.
Для консервативного лечения острой атаки спаечной болезни иногда можно рекомендовать выполнение
следующего комплекса: 1) внутривенное капельное введение 125 мг гидрокортизона в 500 мл 0,5% хлористого
калия на 5% раствора глюкозы; 2) струйное вливание
от 50 до 100 мл 10% раствора хлористого натрия и
инъекция 1 мл прозерина или питуитрина и последующая очистительная клизма (А. Н. Дубяга, Б. К. Ги-
14*
211
берт, 1977). Усиление болей и нарастание рентгенологических признаков непроходимости после данного
комплекса рассматриваются как показание к операции.
В случае ликвидации .острого приступа спаечной кишечной непроходимости больные подлежат в дальнейшем
обследованию для уточнения диагноза и локализации
брюшинных спаек. Следует точно соблюдать и другое
правило: после купирования приступа спаечной кишечной непроходимости не отпускать больного домой, а
продолжать в течение 1—2 суток динамическое наблюдение в условиях стационара.
*
Этапы операции
1. Наиболее оптимальным считается средне-срединный доступ с проведением забрюшинной новокаиновой
блокады с добавлением гидрокортизона.
2. Освобождение по возможности кишечника и большого сальника от деформирующих спаек. Оставление
деформированных участков кишечника в условиях его
пареза может явиться причиной развития послеоперационной спаечной кишечной непроходимости. В отношении плоскостных межкишечных спаек, не нарушающих пассаж по кишечнику, поступают индивидуально в
зависимости от их плотности.
3. При повреждении серозной оболочки кишки, которое может произойти при самом осторожном разъединении брюшинных спаек, небольшие и единичные десе-
розированные участки ушиваются в поперечном направлении. Если наступает после этого деформация кишки
или десерозирование произошло на значительном протяжении, лучше произвести резекцию кишки.
4. Травмированный и десерозированный после освобождения от спаек сальник лучше резецировать. Перед
зашиванием операционной раны сальник нужно расположить так, чтобы в ближайшие часы после операции
ой не мог войти в контакт с травмированными участками кишечника.
5. Тяжистые спайки нередко хорошо васкуляризиро-
ваны и в послеоперационном периоде могут быть источ-
ником кровотечений. Поэтому после рассечения эти спайки нужно лигировать и произвести их перитонизацию.
В случае массивных сращений, спаивающих петли ки«
212
шечника в единый конгломерат, и при отсутствии некроза участвующих в конгломерате петель кишки иногда
целесообразно пойти на выключение ряда петель кишечника из пассажа путем наложения обходного анастомоза. К операции энтеропликации (операция Нобля)
в остром периоде прибегать не следует.
6. Растянутые петли кишечника необходимо обязательно освободить от токсического застойного содержимого. Лучше вначале освободить кишечник от спаек,
а затем приступить к эвакуации кишечного содержимого. Показания к подвесной энтеростомии при спаечной болезни ограничены.
7. Показания к введению трубок в брюшную полость
должны быть предельно сужены. Резиновые трубки
после подобных операций в брюшную полость не следует вводить, а применять только полихлорвиниловые
дренажи. Вводить их нужно в нижнце этажи брюшной
полости для соприкосновения с наиболее подвижными
отделами кишечника, что предупреждает развитие грануляционного ~вала вокруг трубки (Н. Г. Гатауллин,
1978).
Особенности ведения послеоперационного периода
1. С целью лечения спаечного процесса показано
введение через микроирригатор 100 мл 0,25% раствора
новокаина с гидрокортизоном (125 мг) в течение 4—
5 дней. Этот метод допустим при отсутствии первичного
инфицирования брюшины.
2. При наличии противопоказаний для введения
кортикостероидов в брюшную подость рекомендуется
с профилактической целью введение в брюшную полость кислорода (до 1 литра), новокаина и местная
гипотермия продолжительностью по 30—40 минут 3—
4 раза в день (Н. Г. Гатауллин, 1978).
3. Предупреждение или лечение атонии, желудка.
Для этого в желудке после операции оставляется на-
зогастральный зонд и производится постоянное его
опорожнение.
4. Ранняя борьба с атонией кишечника назначением
прозерина (2 мл) и карбохолина (2 мл) 6—8 раз в
сутки, начиная со второго дня после операции до появления стула. При затянувшейся атонии кишечника применяются масляные или солевые слабительные.
213
5. Инфузионно-трансфузионная терапия с илнвани-
ем изотонических солевых растворов, глюкозы, белков.
Введение антигистаминных препаратов.
6. Питание через рот начиная с 1—2 суток после
операции при отсутствии выраженных моторных нарушений кишечника.
7. Раннее вставание и активное ведение больных.
ГЛАВА XII
фт
ОСТРАЯ АРТЕРИАЛЬНАЯ НЕПРОХОДИМОСТЬ
Острая артериальная непроходимость
магистральных артерий конечности
В настоящее время имеется отчетливая тенденция к
увеличению, числа больных с острой непроходимостью
магистральных артерий конечностей. Хирургия этой
области добилась ббльших успехов, восстанавливая кровообращение при данной патологии в 80—94% случаев
(Fogarti, 1971; Б. В. Петровский, 1975). Однако послеоперационная летальность остается очень высокой, составляя 29,7% (И. И. Затевахин, 1975). Все это говорит о серьезности данной проблемы в целом, вопросов
диагностики и лечения, в частности.
Острая непроходимость магистральных артерий вызывается эмболом или местно образовавшимся тромбом
в результате изменений в сосудистой стенке.
Основной причиной эмболий артерий являются различные формы поражения сердца вследствие атеросклероза. К ним относятся инфаркт миокарда, постинфарктные изменения в сердце и чаще всего острые или хронические аневризмы левого желудочка. Другой, наиболее частой причиной развития эмбологенных кризисов
являются ревматические пороки сердца, сопровождающиеся нарушениями ритма сердечных сокращений. Сравнительно редко источники артериальной эмболии находятся вне сердца. Такими источниками являются аневризмы аорты и ее крупных ветвей, пневмонии, опухоли
214
легких, а также тромбоз вен большого круга кровообращения. Опасность эмболии увеличивается с возрастом, особенно при нарастании явлений легочной и сердечной недостаточности. Одной из важных причин эмболий являются операции на крупных сосудах, легких
и сердце, а также обширные и продолжительные хирургические интервенции по поводу опухолевых процессов. Послеоперационные эмболии возникают ;на 5—
7 сутки после операции. Предполагается, что опасность
операционных тромбоэмболий можно предсказать на
основе ряда признаков и схем, в частности, схемы Д<>-
манига (табл. 10).
Таблица 10
Факторы, влияющие на свертывающую систему
Балл
Возраст в годах: 20 — 50
‘2*
51 -90
\ .
Пол: мужской
1
женский .....
2
Конституция: астеническая
1
нормостеническая
2
адипозная
3
Тяжесть заболевания: легкая степень
1
средняя степень
2
тяжелая степень ......
3
Варикозное расширение
2
Вид операции: абдоминальная
1
торакальная . ...
2
Когда сумма баллов, рассчитанная по схеме Дома-
ннга, равна И или превышает эту цифру, у больного
имеется 'опасность развития острой тромбоэмболии.
Механизм отторжения эмбола от источника его образования остается не совсем ясным. Считается, что
причиной мобилизации эмбола являются лекарственная
кардиальная терапия и следующее за ней усиление
сердечной деятельности, применение антикоагулянтов,
дефибрилляция, перепады атмосферного давления и др.
После отрыва тромба от места возникновения его
дальнейшая миграция может произойти в любую магистральную артерию. При этом наиболее часто пора-
215
жаются висцеральные ветви брюшной аорты (40%),
сосуды головного мозга и горазДо реже магистральные
артерии конечностей. Среди магистральных артерий
следует выделить поражение общей подвздошной артерии в области бифуркации, бедренную артерию в месте бифуркации, подключичную и затем подмышечную
(В. с. Савельев с соавт., 1974). Таким образом, артерии
нижних конечностей чаще перекрываются эмболом, чем
'сосуды верхних конечностей. Это объясняется анатомическими особенностями строения магистральных артерий
конечности, которые отходят под более острым углом
от основных стволов, чем верхние. Так, отхождение левой подвздошной артерии от аорты под более острым
углом по сравнению с правой способствует более частой
эмболии слева.
В патогенезе артериальных эмболий большое значение имеет кислородное голодание тканей, ведущее к
нарушению всех видов обмена и развитию выраженного ацидоза. Гибель клеточных элементов и повышенная
тканевая проницаемость способствуют прогрессирующей
гиперкалиемии и накоплению активных кининов в тканях (И. И. Затевахин, 1975). Под влиянием нарушенной
клеточной проницаемости развивается субфасциальный
отек мышц, еще более ухудшающий нарушенный кровоток.
Стаз крови, ацидоз и местная ноксинемия являются
основными факторами дополнительного сосудистого
тромбообразования (Hardaway, Mackay, 1963). Кроме
того, эмболизация артерий вызывает резкий спазм не
только самого сосуда ниже закупорки, но и коллатеральных ветвей. Следствием указанных причин является образование продолженного тромба, который характеризуется увеличением длины тромба от его нижнего
полюса в дистальном направлении. Причем длина продолженного тромба может достигать 40—50 мм. Спустя
8—1б часов в месте окклюзии развивается воспалительный процесс, захватывающий соседние вены.
Основными * причинами для местного тромбообразования являются три фактора: 1) повреждение эндотелия
сосудистой стенки; 2) замедление кровотока; 3) изменение состава крови (Т. Ексарку, 1972)'.
Эндотелиальное поражение сосудистой стенки является следствием прямого воздействия некоторых фи¬
216
зических факторов (случайная или хирургическая травма, механическое сдавление, наличие катетера и др.)>
действия химических факторов (внутрисосудистое введение лекарственных веществ), биологических факторов
(инфекционные аллергены, продукты тканевого расщепления, протеинового рассасывания). Эндотелиальное
поражение может наступить в результате острой системной гипоксии при шоке различного характера, так
как питание сосудистой интимы осуществляется путем
пропитывания. Поражение эндотелия может быть представлено изъязвлением на почве атероматозной бляшки, узелкового периартериита, красной волчанки и т. д.
Снижение скорости кровотока приводит к нарушению
структуры кровотока. Известно, что кровоток имеет
слоистое строение: а) центральная колонка состоит из
лейкоцитов; б) снаружи располагаются эритроциты;
в) на периферии находятся красные кровяные пластинки; г) ближе всего к эндотелию располагается плазматический слой.
Снижение скорости кровотока приводит к нарушению
слоистого тока крови, появлению завихрений, что создает для тромбоцитов возможность прямого контакта с
эндотелием сосудистых стенок. В условиях измененного
состояния эндотелий утрачивает способность отталкивать
тромбоциты, что ведет к осаждению на пораженном
участке сначала тромбоцитов, которые затем покрываются фибринозным слоем. Нормальный кровоток смывает с поверхности этих агломератов тромбин и предупреждает оседание новых фибринозных слоев. При наличии же застоя появляется чрезмерное накопление
факторов коагуляции, что стимулирует образование
тромба.
Изменения в крови при тромбоэмболиях представлены тремя факторами:
а) физико-химическим изменением в плазме (повышенная вязкость, ацидоз, увеличение глобулинов, ги-
перлипемия);
б) качественными, и количественными изменениями
некоторых форменных элементов крови (повышенная
адгезия тромбоцитов, внутрисосудистое склеивание эритроцитов и т. д.);
в) изменениями коагуляционной и фибринолитиче*
ской систем крови.
217
Следует отметить, что при тромбозах некротические
процессы в пораженной конечности развиваются медленнее по сравнению с эмболией, а спастический компонент менее выражен.
Клиника острой артериальной непроходимости характеризуется внезапно возникшими, острыми, как
«удар кнута», болями в конечности, интенсивность которых уменьшается спустя 2—4 часа после окклюзии
в связи с постепенным устранением спазма. Однако через некоторое время наступает повторное нарастание
болей в связи с прогрессирующей ишемией тканей. При
этом больные отмечают чувство онемения, похолодания
в пораженной конечности, отсутствие сначала активных,
а затем и пассивных движений в суставах.
Для клинициста очень важно оценить степень нарушения кровообращения в конечности и глубину развившихся некротических изменений в тканях. Эго можно
сделать, проанализировав клинические признаки заболевания на основе классификации ишемии тканей
В. С. Савельева, И. И. Затсвахина, Н. В. Блинова
(1974). Согласно этой классификации выделяются:
Ишемия напряжения — клинические проявления заболевания отсутствуют в покое и появляются при нагрузке.
1 А степень ишемии — появляется чувство онемения,
похолодания, парестезии в пораженной конечности при
отсутствии боли.
I Б степень ишемии — умеренное чувство онемения,
похолодания, незначительное снижение чувствительности и нерезкая боль.
II А степень — умеренная боль и онемение, выраженное похолодание и снижение поверхностной чувствительности при сохранении глубокой; резкое ограничение
активных движений в суставах конечности.
II Б степень — выраженные боли и похолодание с
отсутствием поверхностной чувствительности в дистальных отделах конечности. Активные движения в Суставах конечности отсутствуют, пассивные — сохранены.
Небольшая падьпаторная болезненность мышц.
III А степень — резко выраженные боли, похолодание с отсутствием поверхностной и глубокой чувствительности. Активные движения отсутствуют, а пассивные — ограничены. Умеренный субфасциальпый отек
мышц, резкая пальпаторная болезненность.
218
Ill Б степень ишемии — при наличии резко выраженных болей и похолодания конечности имеется значительный субфасдиальный отек мышц, а главное — выраженная пальпаторная болезненность и контрактура
мышц.
Диагностическая программа
Основой диагностической программы является анамнез, осмотр больного, проведение инструментальных и
биохимических методов исследования.
1. Выявление источника эмболии. Оно невозможно
без тщательной оценки сердечно-сосудистой системы,
исключения опухоли легких, пневмонии, аневризмы сердца или крупных магистральных сосудов.
2. Установление уровня артериальной окклюзии и
степени ишемии достигается с помощью:
а) пальпации конечности в проекции сосудистого
пучка для выявления ослабления пульсации ниже места
окклюзии и усиленной пульсации выше эмбола;
б) определение границы болевой чувствительности
(рис. 35);
в) кожной термометрии. Причем разница кожной
температуры на пораженной и здоровой конечности может составлять 6—8° С.
г) реографии и капилляроскопии;
д) экстренной ангиографии, которая является решающей в установлении уровня окклюзии, а также состояния артериального сосуда.
3) Определенное значение для диагноза, лечеция и
прогноза при тромбоэмболиях имеют исследования свертывающей и антисвертывающей систем крови (А. И. Тре-
губенко, 1972; Т. П. Макаренко с соавт., 1976):
а) общие коагулирующие свойства крови, определяемые на основании времени свертывания крови по Лн-
Уайту (норма 8—10 минут), времени кровотечения по
Дуке (норма 2—3 минуты), количества тромбоцитов
(в норме 50—60 тромбоцитов на каждые 1000 эритроцитов) и тромботеста;
б) нарушения в первой фазе * свертывания крови
оцениваются по времени рекальцификации и толерантности плазмы к гепарину. Время рекальцификации в
норме равно 110—180 сек., и его увеличение свидетель-
219
Рис. 35. Схема верхней границы понижения (или погери)
болевой чувствительности (по Птипьеру).
а — при эмболия на уровне бифуркации аорты; б — при эмболии
на уровне подвздошой артерии и дистального конца плечевой
артерии; н — на уровне подколенной артерии; г — на утюнне бед
ренной и подкрыльцовой аотермй
ствует о склонности к кровотечениям, а укорочение—*
об изменении коагуляции в сторону тромбообразовання.
Толерантность плазмы к гепарину составляет в норме
7—11 мин. Увеличение времени указывает на склонность
к тромбообразованию, а уменьшение — на кровоточивость;
в) нарушения во второй фазе могут выявляться на
основании исследования протромбинового индекса, тромбинового времени и свободного гепарина. Средняя величина протромбинового индекса равна 85%. Этот показатель может быть использован для контроля за эффективностью антикоагулянтной терапии, когда его
целесообразно довести до 30—40%. Тромбиновое время
в норме составляет 17—24 сек. и его увеличение свидетельствует о гипокоагуляции;
г) для характеристики нарушения в третьей фазе
свертывания крови используются показатели фибриногена и фибринолитической активности. В норме содержание фибриногена по методу Куллена составляет
325 мг%, а фибринолитическая активность по методу
Бидвелла равна 20%.
220
Лечение
Лечебная тактика
В современных условиях считается, что время, прошедшее с начала эмболии, хотя и имеет определенное
значение для судьбы больного, но не может быть основанием для отказа от активной хирургической тактики.
При этом следует помнить, что надежды хирургов па
лизис эмбола лекарственным путем в большинстве случаев иллюзорны. Кроме того, даже хорошо развитое
коллатеральное кровообращение не в состоянии обеспечить полноценную функцию конечности. Отсюда единственно возможным методом лечения эмболий является
в большинстве случаев активная хирургическая тактика.
В зависимости от степени ишемии различают
(В. С. Савельев с соавт., 1974):
1) экстренную эмболэктомию, которая показана при
ишемии II и III степени;
2) отсроченную эмболэктомию, которая (через 24—
48 часов) показана при ишемии IA и 1Б степени;
3) позднюю эмболэктомию (в течение 7 суток) при
ишемии напряжения.
Противопоказаниями к эмболэктомии являются:
1) агональное состояние больного;
2) гангрена нижней конечности.
Консервативное лечение
Консервативное лечение применяется по ограничен-
ным‘ показаниям и в основном у больных с тяжелым
общим Состоянием или преклонного старческого возраста. Основной задачей консервативного лечения является снятие артериального спазма, уменьшение последствий ишемии, предупреждение дальнейшего тромбооб-
разования, торможение роста продолженного тромба,
улучшение деятельности сердечно-сосудистой системы.
1. Для борьбы с болью и снятия спазма вводится
внутривенно 1—2 мл промедола или пантопона одновременно со спазмолитиками (папаверин по 2—4 мл
2% раствора 3—4 раза в сутки, но-шпа 2—4 мл 2%
раствора 3—4 р*аза в день, галидор по 2 мл 3 раза в
221
сутки). Дополнительно для снятия спазма в пораженную артерию пункцией вводят 20 мл 1% раствора новокаина и производят периартериальную блокаду.
2. Тромболизирующая терапия проводится несколькими средствами. Наиболее распространенными из них
являются:
а) внутривенное введение гепарина по 5000 ед. каждые 4 часа, добиваясь удлинения свертывания крови в
2,5 раза по сравнению с нормой, или снижение протромбина до 50%. Через 4—5 дней начинают уменьшать
дозу гепарина, сохраняя прежние интервалы введения
(2500 ед. сначала каждые 4 часа и 6 часов). На 7—
10 сутки назначаются антикоагулянты непрямого действия, которые даются не менее 3 недель. В последние
годы в течение 2—3 дней применяют смесь, состоящую
из 1000 мл реополиглюкина и 35 000 ед. гепарина
(В. С. Савельев с соавт., 1974; О. И. Виноградова,
В. А. Шестаков, 1978), которая вызывает не только ги-
покоагуДяцию, но и снижение адгезии и агрегации форменных элементов крови;
б) введение фибринолизина 2 раза в сутки ^ по
20 000 ед. с добавлением 10 000 ед. гепарина в 300—
400 мл изотонического раствора хлористого натрия в
течение 4—5 часов;
в) применение стрептазы, действующей на тромб
снаружи и проникающей внутрь его. Ее вводят по схеме, рекомендованной фирмой «Берингверке» (ФРГ),
выпускающей этот препарат. Сначала в течение 30 минут вливают внутривенно 250 000 ед. стрептазы в 50 мл
физиологического раствора. При отсутствии реакции непереносимости, проявляющейся в виде сильных головных
болей, гипертермии, болей в пояснице и аллергических
явлений, лечение препаратом продолжают. Тогда вводит
750 000 ед. стрептазы, растворенной в 500 мл физиологического раствора в течение 4 часов. В последующие
8 часов вводят такую же дозу препарата, но гораздо
медленнее. После улучшения состояния переходят на
внутривенное введение гепарина. Сначала внутривенно
в первые 12'часов вливают 10 000 ед. гепарина, а^затем
по 5000 ед. каждые 4 часа (Р. А. Стегайлов, 1976).
3. Коррекция сердечных нарушений пррводится с
помощью коргликоиа или строфантина и назначения
антиаритмических средств (индерал, новокаинамид).
222
4. Местная терапия. С целью замедления обменных
процессов в пораженной конечности и снижения потребности тканей в кислороде рекомендуется местное применение холода. Следует помнить, что применение тепла якобы с целью ликвидации спазма является ошибкой, так как это нередко ведет к возникновению ожогов
в результате пониженной чувствительности.
Оперативное лечение
Предварительно проводится полный комплекс консервативных мероприятий, включая противошоковые.
Они не исключают оперативное лечение, а служат подготовкой больного к операции.
Этапы операции
1. 'У большинства больных с острой артериальной
ркклюзией операция может быть выполнена под местной
Анестезией. Эндотрахеальный наркоз показан при сочетанных острых окклюзиях и необходимости удаления
не только эмбола, но и проведения реконструктивной
операции.
2. Разрез делается в типичных местах анатомического обнажения артерий. После взятия артерии и коллатеральных сосудов на турникеты производится попе-
Рнс. 36. Катетер Фогарти.
223
речная артериотомия над областью
бифуркации сосуда с целью ревизии коллатералей. Удаление основного и продолженного тромба в дистальных отделах магистрального
сосуда производится с помощью
баллонного катетера Фогарти (см.
рис. 36). На одном конце его находится баллончик из тонкой резины,
а на другом — штуцер, закрытый
мембраной. Сначала катетер осторожно проводится в центральном
направлений, и баллончик заполняется физиологическим раствором в
количестве 1—3 мл. При извлечении катетера из сосуда баллончик
увлекает за собой тромботические
массы. Иногда процедуру повторяют несколько раз как в проксимальном, так и дистальном направлении, добиваясь появления сильной струи крови, с которой удаляются остатки тромботических масс
(рис. 37).
3. После удаления тромботических масс в дистальную часть артерии вводят 50—100 мл 0,25% раствора новокаина с 5000 ед. гепарина * и артериотоушческое отверстие ушивается непрерывным швом.
4. При сегментарном атеросклеротическом сужении
сосуда делается продольная артериотомия, С помощью
лопаточки измененную интиму вместе с тромботическими массами отделяют от средней оболочки и удаляют.
Для предотвращения заворачивания свободного конца
интимы, ведущего к ретромбозу, производится фиксация
ее в дистальною части сосуда П-образными швами.
При этом отверстие в артерии ушивается с помощью
аутовенозной заплаты, заготовленной из большой подкожной вены.
5. Одновременно при ишемии III степени проводится
ревизия одноименной вены, во время которой удаляют
150—200 мл застойной крови.
Рис. 37. Схема эм-
‘‘болэктомни из подколенной артерии
с помощью катетера Фогарти.
224
б. При ишемии III степени операция должна заканчиваться широкой продольной фасциотомией с помощью
двух разрезов длиной 15—20 см. Рассекается не только
фасция, но и тупо разводятся до межкостной перегородки и мышцы. Раны при этом не ушиваются, а закрываются стерильными салфетками.
Послеоперационный период
В послеоперационном периоде особое внимание следует обратить на стабильность гемодинамики, профилактику ретромбоза и функциональное состояние почек.
Практически в этот период в полном объеме и активно осуществляют комплекс консервативного лечения
артериальных тромбоэмболий. Для контроля за постишемическим почечным синдромом, являющимся одной
из частых причин гибели этих больных, рекомендуется
наблюдение не только за почасовым диурезом, но азотемией и цветом мочи. Резкое снижение диуреза, появление темновишневого цвета мочи и значительное
возрастание остаточного азота (более 120 мг%) свидетельствуют о развитии посткомпрессионного миоглобино-
урийного почечного синдрома и почечной недостаточности, являющихся показанием к ампутации конечности.
Ишемическая болезнь кишечника
Ишемическая болезнь желудочно-кишечного тракта
проявляется клинически в виде 3 состояний: 1) синдрома брюшной жабы; 2) инфаркта кишечника; 3) ишемического энтероколита (Friedman Sloan, 1972)..
Возникновение синдрома «брашной жабы» связано с
нарушением кровотока по чревному стволу и верхнебрыжеечной артерии. Оно может быть связано с аномалией развития чревного ствола и высоким его отхождением от аорты, иногда в грудной полости, сдавлением —
гипертрофированной ножкой диафрагмы, инфильтратом
в результате хронического воспалительного процесса
или опухолью, облитерацией сосуДа вследствие неспецифического артериита (В. С. Савельев с соавт., 1975).
Основные клинические проявления «брюшной жабы» —
тетрада симптомов: 1) боль на высоте пищеварения;
2) дисфункция кишечника в виде поносов; 3) прогресси-
16 М-843
225
рующее похудание; 4) систолический шум в эпигастральной области.
Инфаркт кишечника развивается в результате острой
окклюзии на различном уровне, поэтому различают инфаркты: а) артериальные (55%); б) венозные (33%);
в) неокклюзивные (12%).
Острая артериальная окклюзия верхней брыжеечной
артерии протекает в 3 стадии (В. С. Волкоедои,
О. М. Смирнова, 1977):
1. Стадия ишемии характеризуется обратимостью
изменений в стенке кишки при восстановлении брыжеечного кровообращения. Кишечник выглядит бледным,
стенка его утолщена, на слизистой имеются кровоизлияния и даже изъязвления.
2. Стадия инфаркта характеризуется развитием деструктивных, необратимых изменений в стенке кишки
даже после восстановления брыжеечного кровообращения. Стенка кишки синюшна, отечна, с кровоизлияниями,
распространяющимися до серозной оболочки. В просвете кишечника появляется геморрагическая жидкость;
3. Стадия перитонита характеризуется некрозом
всех слоев кишки, развитием воспалительного процесса
в брюшине, наличием геморрагической жидкости не
только в просвете кишки, но и в брюшной полости.
Острое нарушение брыжеечного кровообращения характеризуется сильными постоянными болями, диспеп-
тическими расстройствами, повышением температуры,
вздутием живота и гйперлейкоцитозом (Friedman, Sloan,
1972). У 3/< больных вначале отмечается подъем артериального давления независимо от вида окклюзии
(В. С. Волкоедов, О. М. Смирнова, 1977).
Диагностическая программа
1. Сбор анамнеза, осмотр и выявление эмбологенного
заболевания.
2. Экстренная лапароскопия при подозрении на острую ишемическую болезнь кишечника с дифференциально-диагностической целью и для исключения другой
патологии (инфаркт миокарда, почки, острый панкреатит и т. д.).
3. Экстренная селективная ангиография (В. И. Про-
кубовский, 1977).
226
Лечение
У большинства больных единственной мерой спасения жизни является ранняя операция, осуществляемая
после предоперационной подготовки. Она должна быть
направлена на экстренную коррекцию сердечно-сосудистых нарушений, ацидоза, болевого и бактерийного
шока.
Этапы операции
1. Ревизия кишечника и анализ полученных данных
с целью установления стадии развития ишемии.
2. Определение пульсации крупных артериальных
стволов брюшной полости и вида инфаркта. Обследование чревного ствола, ствола воротной вены и брыжеечных сосудов. Для артериального инфаркта характерно
изменение в брыжейке по типу треугольника, обращенного основанием к кишке, а при венозном тромбозе поражение брыжейки носит лентовидный характер.
3. Обследование брюшной полости для исключения
гнойного очага или опухолевого процесса.
4. При отсутствии инфаркта осмотр кишечника с
целью выявления ненормальной бледности кишечных
петель и потери блеска брюшины. Для определения состоятельности кровотока в подобных случаях может
быть использована окклюзионная методика с трансиллюминатором или без него. С этой же целью можно
использовать и рассечение околокишечного еосуда для
выявления кровотечения из него.
5. Операция на сосудах в чистом виде может быть
выполнена лишь в стадии ишемии. В стадии инфаркта
или перитонита операция на сосуде должна дополняться резекцией кишечника (В. И. Спиридонов, 1977).
Эмболэктомия из брыжеечных сосудов делается из
поперечного разреза с помощью баллонного катетера
Фогарти или методом «выдаивания», который заключается в последовательном сдавлении пальцами или инструментами стенки артерий. В ряде случаев эмбол
можноудалить и с помощью вакуум-отсоса.
6. При наличии атеросклеротического процесса и
необходимости удаления не только эмбола, но и изме¬
15* 227
ненной интимы показана продольная артериотомия и
эмболинтимоэктомия.
7. При отсутствии обструкции в сосуде и при клинике неокклюзивного инфаркта показана десимпатизацчя
верхней брыжеечной артерии.
8. После эмболэктомии и реваскуляризации кишечника границы резекции значительно уменьшаются.
В случае необходимости в таких ситуациях возможно и
оставление участков кишечника «сомнительной жизнеспособности» с повторной контрольной операцией «второго осмотра» (second look).
9. Операция «второго осмотра», т. е. релапаротомия,
делается через 12—36 часов после эмболэктомии, когда
имеются сомнения в жизнеспособности реваскуляризо-
ванного кишечника или явления ретромбоза.
Резекция кишечника при инфаркте
1. В тех случаях, когда не производится сосудистая
операция, резекция должна быть выполнена в пределах
окклюзии.
2. Резекция кишки проводится вместе с пораженной
брыжейкой. При этом • важным является определение
границ жизнеспособности кишки. Для этих целей используются осмотр, пальпация сосудов, трансиллюминационная окклюзионная методика, прокол серозы кишки.
При жизнеспособной кишке вытекает красная кровь, при
некрозе — темная.
3. Ценным параметром, характеризующим состояние
жизнеспособности кишки, является определение индекса жизнеспособности с помощью сравнительной термометрии заведомо здоровых и пораженных участков кишечника (М. 3. Сигал, М. Ю. Розенгартен). Индекс
жизнеспособности — это соотношение температуры сомнительного и интактного участка кишки. Он определяется формулой
! 7и Тж
Тн-т п
где (v — индекс жизнеспособности, Г„—локальная
температура в момент эвентерации кишки (исходная),
*Т — температура жизнеспособной кишки, Тп — температура пораженной кишечной петли спустя 5—6 минут
после эвентерации. Индекс, равный 1, соответствует
полноценному кровотоку в кишке, ниже 1—нарушенному.
4. Перед принятием окончательного решения о границах резекции кишечника необходимо осмотреть слизистую кишки и произвести мобилизацию в пределах
нормальной визуально слизистой.
5. Наложение анастомозов при ишемической болезни кишечника должно проводиться без зажимов и с
предварительной инстилляцией антибиотиков в просвет кишки.
6. При венозном инфаркте реваскуляризация кишечника не показана и единственным методом лечения остается резекция кишечника.
7. В стадии инфаркта и перитонита брюшная полость обязательно дренируется .
Послеоперационное ведение
1. Проведение назогастрального зонда в двенадцатиперстную кишку.
2. Продолжение реанимационных мероприятий с
целью стабилизации гемодинамики, что предупреждает
ретромбоз артериального сосуда или распространение
тромбоза.
3. Назначение антибиотиков широкого спектра действия (левомицетин, тетрациклин) как в просвет кишки, так и парентерально.
4. Антикоагулянты через 10—12 часов после хирургического вмешательства в течение 2—3 недель.
5. Применение в послеоперационном периоде препаратов дезагрегирующего действия (реополиглюкин).
6. Новокаинозая блокада чревных нервов.
7. Местная гипотермия.
8. Диета с достаточным содержанием 1 белков и углеводов и уменьшенным содержанием жиров.
229
ГЛАВА XIII
ПЕРИТОНИТЫ
Перитониты занимают важное место в структуре
ургентной хирургической заболеваемости. Частота их
составляет 15—20% среди больных, поступающих в хирургические стационары с острыми заболеваниями и
. повреждениями органов брюшной полости (В. С. Савельев, 1970; Н. П. Медведев, В. А. Кузнецов, 1970; В. Д. Федоров, 1974).
Перитонит является одним из видов хирургической
инфекции, имеющей своеобразные патогенетические механизмы. Это своеобразие определяется массивным
раздражением обширнейшего рецепторного аппарата
брюшины, колоссальной ее всасывательной способности
и громадной поверхностью брюшинного покрова.
Патогенез перитонита складывается из цепи взаимосвязанных функциональных и органических изменений
в ряде систем организма и патологических синдромов:
1. Нарушений нейро-гуморальной регуляции, характеризующихся изменением соотношения биогенных аминов — катехоламинов, серотонина, гистамина, плазматических протеаз, кининов, а также тканевых метаболитов — молочной, пировиноградной, адениловой, ино-
зиновой и других кислот.
2. Изменений в сердечно-сосудистой системе, возникающих в результате нарушений сосудистого тонуса,
сократительной функции миокарда и массы циркулирующей крови.
3. Изменений в микроциркуляции и лимфомикро-
циркуляции, развивающихся вследствие диспротеинемии
(гипоальбуминемии, гиперглобулинемии), гиповолемии и
гемоконцентрации, замедления скорости кровотока, изменения формы и объема эритроцитов.
4. Нарушений в эндокринной системе и обменных
процессах (белковом, углеводном, жиро-липидном,
электролитном и др.).
5. Динамического илеуса, связанного с интоксикацией, нарушением нейрогуморальной регуляции, микроциркуляции и кровообращения.
6. Интоксикацией: а) аутокаталитической (гистамин,
серотонин, кинины); б) метаболической (аммиак, мо¬
230
лочная, приовимоградная, адениловая кислота); в) микробной.
Большое значение для лечения и исхода перитонита
имеет определение распространенности и глубины развития воспалительного процесса.
По распространенности воспалительного процесса
целесообразно, с практической точки зрения, выделить
местный, диффузный и разлитой перитониты. Под местным перитонитом мы понимаем развитие воспалительного процесса в одной-двух анатомических областях
(подвздошной, подреберной, подложечной и т. д.) при
наличии в этих зонах не только воспалительного экссудата, но и изменений париетальной и висцеральной
брюшины. К диффузным перитонитам относится воспаление брюшины, захватывающее более 2, но менее 5
анатомических областей с соответствующими изменениями брюшины. Под разлитым Перитонитом понимается наличие воспалительных изменений со стороны брюшины и значительного количества экссудата, находящегося на протяжении не менее двух этажей брюшной
полости (верхнего и среднего, среднего и нижнего
и т. д.).
Необходимо также при определении тяжести перитонита учитывать его стадийность, выделяя соответственно реактивную (12—24 часа), токсическую (24—72 часа)
и терминальную (свыше 72 часов) стадии по терминологии К. С. С'имоняна. Эта классификация важна для
оценки клинической картины заболевания и послеоперационного лечения перитонита.
Диагностическая программа
Диагностика перитонита является многоплановой
проблемой и основывается на данных анамнеза, клинического и инструментального обследования, результатов лабораторных исследований. При оценке клинической картины перитонита следует исходить из стадийности этого заболевания, а отсюда и фазового проявления
клинических симптомов (И. И. Греков, Б. А. Петров,
, А. А. Беляев, В. Я. Шлакоберский, К. С. Симонян).
В первой, начальной или реактивной, стадии заболевания (по К. С. Симоняну), охватывающей 12—24
часа, максимально проявляются защитные силы орга¬
2о1
низма. Вначале появляются боли, являющиеся первым
и наиболее постоянным признаком перитонита. Они отличаются постоянством и вначале бывают локализованы в области основной патологии, а затем становятся
разлитыми. Больных охватывает беспокойство, появляется частая рвота. Температура тела повышается, пульс
становится более частым.
Вторая, токсическая, стадия характеризуется нарастанием интоксикации. Больной занимает вынужденное
положение, неохотно и осторожно его меняет. Кожные
покровы приобретают серовато-синюшный оттенок.
Живот умеренно вздут, резко болезненный во всех отделах и напряжен. Симптом Щеткина отчетливо выражен. Температура тела повышена, учащенный пульс не
соответствует температуре. Рвота учащается, язык суховат и обложен. В картине крови отмечается нарастание
лейкоцитоза и усиливается сдвиг в формуле белой крови.
Третья, терминальная, стадия характеризуется выраженными нарушениями гомеостаза и тяжелой интоксикацией. Объективно состояние больного тяжелое.
Кожные покровы землистые, черты лица заострены
(лицо Гиппократа). Пульс частый,* мягкий, артериальное давление снижено. Живот резко вздут, напряжение
брюшной стенки исчезает, шишечные шумы редкие.
Перкуторно в брюшной полости определяется свободная
жидкость. У больного появляется «черная рвота», снижается температура. —
Таким образом, в начале заболевания задача хирурга практически сводится к выявлению основного патологического очага:'аппендицита, холецистита, перфоративной язвы и т. д. Однако по мере течения перитонита
такая задана становится крайне сложной и требуется
применение дополнительных инструментальных методов
обследования.
Ориентировочно программа обследования больного
перитонитом следующая:
1. Общеклиническое обследование больного.
2. Обзорная рентгенография брюшной полости, а в
неясных случаях и грудной клетки.
3. В показанных случаях целёнаправленные исследования мочеполовой системы.
4. Применение инструментальных биофизических методов обследования: жидкокристаллической термогра¬
232
фии, определение электрокожного сопротивления, элек-
троэнтерография, электромиографии брюшной стенки
и т. д.
Так, в нашей клинике была разработана и применена электромиография брюшной стенки с целью диагностики острого воспалительного процесса в брюшной полости у 29 больных перитонитом различной этиологии.
Известно, что пальпация относится к субъективным
методам исследования, так как она сопровождается болезненными ощущениями и ответной реакцией организма в виде защитного напряжения мышц живота. Метод
электромиографической регистрации (ЭМГ) напряжения мышц брюшной стенки свободен от этих недостатков, поскольку он позволяет оценивать истинное сокращение и защитную реакцию при применении функциональных нагрузок. Основы электромиографии при перитоните в эксперименте разработаны в Казани
(Л. Н. Зефиров, Г. И. Полетаев, 1956; Л. Н. Зефиров,
В. И. Алатырев, 1971).
ЭМГ записывается на аппарате «Медикор» в эпигастральной, подреберных, подвздошных и надлонной областях. Вначале фиксируется фон, а затем электрическая активность мышц при функциональных нагрузках
(кратковременный подъем головы или ног). Фоновая
электрическая активность мышц брюшной стенки у здоровых людей в положении лежа отсутствует. Воспалительный процесс органа с переходом на париетальную
брюшину вызывает вначале локальное постоянное напряжение мышц. Соответственно этому ЭМГ исследование обнаруживает наибольшую фоновую электрическую
активность при остром аппендиците в подвздошной
области справа, при остром холецистите — в правом
подреберье.
Проведение функциональных нагрузок дает следующее. При местных перитонитах аппендикулярного происхождения нагрузки ведут^к наиболее выраженному
усилению электрической активности в правой подвздошной области по сравнению с другими зонами, при местном желчном перитоните нагрузка выявляет преобладание электрической активности в подреберье справа.
При разлитых перитонитах ЭМГ исследование с применением функциональной нагрузки позволяет отчетливо
наблюдать сохранение преобладания электрической ак¬
233
тивности в зоне локализации первичного очага. Следовательно, истинное воспаление в брюшной полости
рано проявляется веноменом ЭМГ асимметрии, а функциональная нагрузка позволяет при разлитом воспалении уточнить расположение патологического очага
(О. С. Кочнев, Р. Ш. Шаймарданов, В. И. Алатырев,
1975)t
5. Дапароцентез. При необходимости в срочной диагностике и подозрении на травму или острый воспалительный процесс в брюшной полости целесообразно
применять лапароцентез (А. Ф. Жлоба, 1965; А. Н. Беркутов, В. Е. Закурдаев, 1972). По целям лапароцентез
делится на четыре группы:
а) лапароцентез диагностический;
б) лапароцентез с целью выбора рационального оперативного доступа;
в) лапароцентез с целью наблюдения за состоянием
брюшной полости («следящий» лапароцентез);
г) лапароцентез лечебный.
Приводим технику лапароцентеза, которую считаем
наиболее рациональной. Под местной анестезией на
2 см ниже пупка по средней линии делаем разрез кожи
длиной в 1,5—2 см. Апоневроз прошивается двумя лигатурами— держалками и приподнимается. Длинным
троакаром под углом в 45° в направлении пупка прокалывается брюшная стенка, после удаления стилета
длинная трубка троакара направляется в исследуемое
место. Внутри нее проводится эластичная полихлорви-
ииловая трубка диаметром в 0,5—0,8 см, через которую
отсасывается содержимое брюшной полости шприцем.
Во время отсасывания катетер .вытягивается из брюшной
полости, чтобы избежать его присасывания к стенке
кишки. Далее меняем положение трубки с тем, чтобы
достигнуть боковых каналов живота и малый таз. Только с помощью катетера достигнуть этой области трудно,
так как катетер часто сворачивается. Поэтому при отрицательном результате в брюшную полость вводится
500 мл физиологического раствора. Больной после эго-
го несколько раз ^меняет положение, после чего жидкость вновь отсасывается. Далее производится макро-
и микроскопическое исследование полученной жидкости
и определение наличия в ней панкреатических ферментов. В неясных случаях оставляем в брюшной полости
234
на 1—2 дня тонкую полихлорвиниловую трубку. Трубку
в брюшной полости следует оставить и для контроля за
течением патологического процесса, поскольку иногда
трудно решить вопрос о течении, например, острого
панкреатита, морфологической форме этого заболевания, виде перитонита. По характеру и объему выпота
в брюшной полости можно до некоторой степени судить
о выраженности морфологических изменений в поджелудочной железе. Кроме того, экссудат при остром панкреатите содержит значительное количество панкреатических ферментов, вызывающих «химический перитонит».
Поэтому оставленный катетер может быть использован
не только для динамического контроля за составом
и характером экссудата, но и использован с лечебной
целью для введения новокаина и контрикала.
Противопоказанием к проведению лапароцентеза являются наличие послеоперационных рубцов, вздутие
живота и обильная подкожная клетчатка.
6. В случаях неясного лапароцентеза и невозможности исключения острой ургентной хирургической патологии проводится лапароскопия (Ю. Е. Березов, 1971,
1976; В. М. Буянов, 1976).
Опыт нашей клиники показывает, что опасность генерализации воспалительного процесс преувеличена.
Учитывая высокую разрешающую способность лапароскопии, целесообразно применять ее в следующих случаях:
а) при подозрении на острый аппендицит, когда невозможно исключить острое гинекологическое или урологическое заболевание;
б) при подозрении на некроз кишечника в случаях
самостоятельного вправления ущемленной грыжи;
в) при подозрении на мезентериальный тромбоз;
г) при подозрении на повреждение органов брюшной
полости в случае закрытых травм живота при сомнительном и «сухом» лапароцентезе;
д) при неясной клинической картине острого холецистита и холецисто-панкреатита для дифференциальной диагностики;
е) для установления формы острого панкреатита и
проведения лечебных процедур.
Лапароскопия должна проводиться с обязательным
рентгенологическим контролем до лапароскопии, кон¬
235
тролем гемодинамики и легочной вентиляции при ла-
нароскопических манипуляциях.
7. Проведение лабораторных анализов: определение
лейкоцитоза и формулы крови, общего анализа мочи и
определение в ней сахара, ацетона, диастазы, исследование крови на холестерин, содержание белка и белковых
фракций, остаточного азота и сахара крови, определе-'
ние электролитов и кислотно-щелочного состояния,
объема циркулирующей крови и выполнение простейшей коагулограммы.
Лечение перитонита
Лечение перитонита должно быть комплексным,
включающим в себя элементы консервативной терапии
и применение оперативных методов. Причем консервативная терапия должна применяться перед операцией,
когда она носит черты реанимационного пособия и занимает важное место в послеоперационном лечении
больных. Поэтому неотложная хирургия перитонита
складывается из следующих элементов: 1) предопера¬
ционной подготовки, продолжительность которой зависит от тяжести состояния больного и фазы перитонита;
2) оперативного метода, преследующего цель удаления
патологического очага и предупреждающего дальнейшее
распространение инфекции; 3) послеоперационного лечения, направленного на коррекцию возникших при перитоните нарушений гомеостаза.
Предоперационная подготовка
Время и продолжительность предоперационной подготовки определяется состоянием больного и фазой перитонита. В реактивной фазе перитонита, когда нарушения, гомеостаза нерезко выражены и достаточно хорошо компенсированы, нет необходимости в интенсивной
предоперационной подготовке. Время до операции должно быть использовано для уточнения состояния жизненно важных систем (сердечно-сосудистой, печени, почек и легких). Исключение составляют пациенты старше
60 лет, у которых течение перитонита отягощается другим, существовавшим до него серьезным заболеванием
236
(гипертоническая болезнь, коронаросклероз, инфаркт
миокарда, диабет, хронические почечные болезни и др.).
При этом следует помнить о синдроме взаимного отягощения, когда не только указанные заболевания ухудшают течение перитонита и делают операцию опасной,
но и сам перитонит способствует обострению этих болезней. В подобных случаях и в реактивной фазе необходимо позаботиться о возможной в экстренных ситуациях коррекции обнаруженных дополнительных патологических синдромов, что создает благоприятные условия
для выполнения полнбценной операции. Спешка А подобных ситуациях приводит из-за тяжелого состояния
больного к сокращению радикальности операции и далее ведет в послеоперационном периоде к развитию
смертельных осложнений. В токсической и терминальной фазах перитонита необходимость в предоперационной подготовке становится настоятельной. Предоперационная подготовка в этих фазах слагается из следующих
элементов: 1) борьбы с нарушениями сердечно-со¬
судистой системы и шоком; 2) борьбы с интоксикацией и нарушением обменных процессов; 3) применения
системы контроля за эффективностью реанимационных
мероприятий.
Срочная лечебная программа пр» перитонитах в
предоперационном периоде должна состоять из ряда
.следующих мероприятий: 1) введения постоянного гастроназального зонда с активной аспирацией; 2) катетеризации двух вен, одна из которых должна быть обязательно центральной (кавакатетеризация); 3) установления постоянного катетера в мочевом пузыре для
почасового контроля за диурезом; 4) трансфузионной терапии.
Возникает вопрос о характере и объеме трансфузионной терапии в предоперационном периоде. Чем раньше и энергичнее применяется трансфузионная терапия
с целью устранения гиповолемиет, расстройства микроциркуляции, электролитных нарушений и других сдвигов гомеостаза, тем быстрее создаются возможности для
ранней операции и эффективного ее проведения. Таким
образом, принципы современной трансфузионной терапии вполне отвечают желанию хирурга быстрее оперировать больного перитонитом. Подобным задачам отвечает вливание сложного солевого кровезаменителя типа
• 237
раствора Рингера и ощелачивающих растворов, устраняющих метаболический ацидоз.
В терминальной фазе перитонита, когда на первый
план выступает клиническая картина шока, задачи ин-
фузионно-трансфузионной терапии несколько иные.
Известно, что одной из главных причин срыва компенсации является нарушение сосудистого тонуса, развитие
флебопаретического процесса в сосудах портального
бассейна, критическое падение плазменного и глобулярного объема (О. С. Кочнев, 1967; В. А. Кузнецов, 1971).
В этом случае можно воспользоваться вливанием значительных количеств (2000—2500 мл) солевых поли-
ионных растворов, содержащих ощелачивающие
ингредиенты. Однако более целесообразно в подобных
случаях быстро восполнить объем циркулирующей
крови введением реологически оптимальных кровезаменителей типа полиглюкина, реополиглюкина или альбумина. Для улучшения микроциркуляции и достижения
антиагрегационного эффекта нужно не менее 1000—1500
мл раствора. При недостаточной эффективности подобной терапии целесообразно ввести кротикостероиды в
дозе 500—600 мг гидрокортизона в кровь. В настоящее
время получены данные, что введение гидрокортизона
повышает выносливость сердца к форсированным плеторическим инфузиям изотонических солевых растворов
и способствует нормализации показателей гемодинамики. Подобная терапия в предоперационном периоде
должна осуществляться форсированно, в сжатые сроки
(не более 3—4 часов) под контролем АД, пульса, ЦВД
и диуреза.
Хирургическое лечение
Задачи хирургического лечения, которые хирург выполняет в настоящее время, сформулированы еще в
1912 г. И. И. Грековым. Основными принципами неотложной хирургии перитонита являются ранняя операция, устранение источника инфекции, очищение брюшной полости и предупреждение дальнейшего развития
инфекции в брюшной полости. Принцип проведения
этого этапа лечения на практике должен сводиться к
реализации следующих требований;
238
1. Применения наркоза, особенно при явлениях распространенного перитонита.
2. Использования адекватного тяжести процесса
оперативного доступа, позволяющего провести полноценную санацию брюшной полости.
3. Устранения источника перитонита.
4. Декомпрессии кишечника.
5. Выбора метода местного лечения перитонита —
инфузия или антибиотиковая перфузия брюшной полости.
6. Правильного выбора метода тампонады или дренирования брюшной полости и сроков их окончания.
7. Активного общего лечения перитонита в послеоперационном периоде.
Этапы операции
1. Большое значение имеет выбор обезболивания.
Местная анестезия при перитонитах не дает возможности не только произвести полноценную санацию брюшной полости, но и оценить распространенность процесса,
чтобы выбрать оптимальный метод окончания операции.
Поэтому целесообразно операции при разлитом и диффузном перитоните производить под общим обезболиванием.
2. Максимальные задачи, которые стоят в таких
случаях перед хирургом, должны быть выполнены с
помощью наиболее простых, коротких по времени и
щадящих хирургических приемов. Недопустимо в погоне за радикальностью удлинять время оперативного
вмешательства при перитоните и осуществлять сложные
хирургические интервенции, приводящие к необратимому срыву компенсации, достигнутой в ходе предоперационной подготовки.
3. После вскрытия брюшной полости до производ-
в ства ревизии необходимо произвести тщательную ново-
*каиновую блокаду забрюшинного пространства. Для
этого справа и слева от связки Трейца в корень брыжейки поперечноободочной кишки вводится 200—250 мл
0,25% раствора новокаина. Анестезирующий . раствор,
как правило, распространяется и омывает солнечное и
верхнебрыжеечное симпатические сплетения. Поэтому
такая блокада хорошо устраняет патологические вис¬
239
церальные рефлексы и способствует быстрому устранению пареза кишечника в послеоперационном периоде.
4. Важным этапом операции является тщательное
удаление экссудата из свободной брюшной полости и
карманов брюшины с помощью электроотсоса и тщательное промывание ее при каловом загрязнении.
5. Исключительно ответственным этапом операции
является выбор метода лечения в послеоперационном
периоде:
а) при местном перитоните, особенно неограниченном, показано после удаления патологического очага
и экссудата введение микроирригатора для последующего введения антибиотиков;
б) при диффузном перитоните после удаления патологического очага целесообразно воспользоваться
предложением вводить 4—6 микроирригаторов «веерным» способом для массированной инфузии антибиотиков (В. С. Савельев с соавт., 1974; Б. Д. Савчук, 1975);
в) при наличии разлитого перитонита в токсической
и особенно терминальной стадии показано проведение
метода интраперитонеальной антибиотиковой перфузии;
г) при изолированных скоплениях выпота в тазу
без признаков разлитого перитонита целесообразно
после тщательной санации закончить операцию дренированием и тампонадой таза. Для этих целей используется резиновая трубка и «сигарный» марлево-перчаточный дренаж. Следует помнить, что раннее удаление их
ведет к закрытию раневого канала и к формированию
остаточного гнойника;
д) при разлитых перитонитах у больных, госпитализированных в поздние сроки заболевания, можно
воспользоваться предложением вводить антибиотики и
спазмолитики в верхнюю брыжеечную артерию пункцией во время операции или путем ее селективной ка*
тетеризации по Сельдингеру (Ю. Л. Шальков, В. М. Ревин, 1976). Метод основан на установленном факте
уменьшения линейной и объемной скорости брыжеечного кровотока при перитоните более чем в 4 раза в
токсической и в 18 раз в терминальной стадиях (В. М.
Ревин, 1978). В состав инфузата входит физиологический раствор, реополиглюкин, 0,25% раствор новокаина,
антибиотики, гепарин,
240
Интраперитонеальная антибиотиковая перфузия
f
В клинике неотложной хирургии Казанского
ГИДУВа в течение 5 лет лечилось 689 больных перитонитом. У 179 имел место разлитой перитонит. Метод
интраперитонеальной перфузии применен у 102 больных
разлитым перитонитом различной этиологии с летальностью в 11,7%. Совместно с сотрудниками нашей
клиники И. А. Кимом и Б. X. Кимом мы провели анализ достоинств и недостатков данного метода (см.
табл. 11).
В нашей стране' перитонеальный диализ в лечении
разлитых перитонитов’ стал применяться с 1964 г.
Однако до сих пор нет единодушия в оценке значения
этого метода в комплексном лечении перитонита. Если
одни хирурги (Б. С. Данилова, 1968; К. С. Симоняи,
1971; И. И. Дерябин и М. Н. Лизанец, 1972; В. Д. Федоров, 1974, и др.) высоко оценивают эффективность
перитонеального диализа при перитонитах, то другие
(Н. П. Медведев и В. А. Кузнецов, 1970; Н. С. Утешев
с соавт., 1975; В. А. Кубышкин, 1977) призывают к
предельной сдержанности и осторожности при использовании этого метода. Такая противоречивость в оценке
перитонеального диализа, как и любого метода, зависит от ряда обстоятельств. Во-первых, трудно создать
лечебный метод, который бы давал стопроцентные положительные результаты. Во-вторых, различная эффективность метода у разных авторов зависит от применения его в различные фазы заболевания. Несомненно, что применение этого метода только в терминальной
стадии перитонита даст более худшие результаты, чем
в фазе токсической. Если же неоправданно расширить
показания к диализу за счет больных в реактивной
стадии, то улучшение результатов лечения отнюдь не
говорит в пользу эффективности данного метода.
В-третьих, как и у любого другого метода, у перитонеального диализа имеются свои достоинства, особенности и недостатки. Недоучет и пренебрежение этими
особенностями ведут к ухудшению результатов приме-
менения этого метода.
Показания и задачи перфузии. Показанием к проведению интраперитонеальной перфузии служило
наличие разлитого перитонита или калового загрязнения
16 М-843
241
242
Та б и л ца 11
Структура заболеваемости и результаты лечения разлитых перитонитов
методом интраперитонеальной перфузии
Причина
перитонита
Пол
Возраст (лет)
Срок заболевания
Умер¬
ло
м.
ж.
15—20
21—30
31—40
41-50
51—60
61-70
6—24
часов
24—48
часов
2—3
сутки
свыше
3 сут.
Деструктивный аппенди-
цит
22
16
8
16
4
4
6
14
15
4
5
Перфорация гастродуоде-
12
нальных язв
—
—
2
3
5
2
—
6
3
2
1
1
Травмы кишечника . . .
25
1
—
4
11
8
3
—
17
4
1
4
1
Кишечная непроходи-
'
мость:
а) опухолевая обтурацион¬
ная
3
2
—
—
—
—
2
3
—
—
2
3
3
б) странгуляционная . . .
3
1
—
1
1
1
1
—
3
—
—
1
—
в) на почве заворота ки¬
шечника
2
—
—
—
—
—
1
1
—
1
1
—
г) тромбоз сосудов брыжейки
3
_
_
_
_
1
2
3
2
д) ущемленная грыжа . .
3
—
—
—
—
—
3
—
—
—
1
~2
3
Острый панкреатит, хо¬
1
1
лецистит
2
—
1
—
—
1
1
1
—
1
1
Всего
74
22
Воспаление придатков
1ИТКИ
—
3
—
1
1
1
—
—
—
—
2
1
1
Прочие
1
2
—
—
—
—
1
2
—
—
3
—
—
Итого ..
75
27
8
25
20
20
20
9
41
22
20
19
12
брюшины при травме или перфорации полого органа в токсической и терминальной стадии. После хирургической санации брюшной полости и ликвидации
источника перитонита брюшную полость многократно
промывали раствором антисептика до полного удаления экссудата и особенно фибрина. Последний играет
важную роль в усилении интоксикации и ухудшения
течения перитонита за счет фиксированного на нем
токсина (Ю. М. Гальперин, Н. М. Баклыкова, 1964).
Мы считаем, что промывание брюшной полости должно
отличаться от неврологического диализа. Учитывая
особенности патогенеза перитонита (гипопротеинемию,
гиповолемию, дегидратацию и электролитный дисбаланс), не следует извлекать белки, электролиты и воду
из интерстициального пространства, применяя гиперосмотические диализирующие растворы. Отсюда ясно,
что за редким исключением не нужно стремиться при
проведении перфузии к истинному диализирующему
влиянию, чтобы не усугублять нарушения гомеостаза
(Schmitt, Pietsch, Troeger, 1977).
Таким образом, задачей этого метода является в
первую очередь промывание (перфузия) брюшной полости. Кроме того, как мы убедились, интраперитоне-
альная перфузия может быть быстрым и надежным
источником инфузии сбалансированного солевого
раствора в организм, что позволяет нормализовать
водно-электролитное равновесие и объем циркулирующей крови. Поэтому для перфузии мы применяли раствор
Рингер — Локка. Чтобы избежать массивного и быстрого
поступления жидкости в сосудистое русло, на 1 литр
раствора Рингера добавляли 250 0,25% раствора новокаина. Для предупреждения образования сгустков
фибрина и спаек к перфузионному раствору добавляли
1000 ед. гепарина и 200 мл полиглюкина, а для борьбы
с инфекцией—1,0 канамицина.
Особенности техники проведения интраперитонеаль-
ной перфузии. Эффективность интраперитонеальной
перфузии в первую очередь зависит от правильно выполненной санации брюшной полости. Оставление сгустков фибрина чаще всего является источником неэффективной перфузии, так как быстро выводят из строя
трубки оттока. Это обстоятельство явилось причиной
неудачи перфузии в трех случаях, когда через сутки
16*
243
наступило прекращение оттока жидкости из брюшной
полости. Далее оставшаяся жидкость, плохо рассасываясь, осумковывается, затем реинфицируется и является источником остаточных гнойников. *
До сих пор является дискутабельным вопрос о методике брюшной перфузии, так как одни авторы рекомендуют проводить диализ через 4 трубки (К. С. Си-
монян, 1971; В. Д. Федоров, 1974), а другие — через
одну (И. И. Дерябин, М. Н. Лизанец, 1977). С нашей
точки зрения, более целесообразно проводить перфузию
с помощью четырех трубок, две из которых служат
для введения жидкости, а две другие—для оттока. Мы
наблюдали, что при задержке жидкости в брюшной
полости открытие трубок притока после перфузии ведет к эвакуации остаточной жидкости. При этом поли-
хлорвиниловые многодырчатые трубки притока (диаметром в 3 мм) лучше укладывать не под печенью, а
под диагфрагмой. В случаях неэффективной перфузии
они сами в, силу капиллярности могут служить путем
оттока скопившейся или осумкованной жидкости под
диафрагмой. Нарушение этого принципа привело в
одном случае к образованию поддиафрагмального абсцесса. Поэтому нельзя также вводить и один сквозной
многодырчатый катетер для вливания жидкости, хотя
вначале нам представлялось это выгодным с точки
зрения равномерного орошения брюшной полости антисептиком. Трубки из полихлорвинила для оттока
должны проводиться проколами в подвздошных областях. Ошибочно их делать многодырчатыми, так как
это приводит к неполному удалению жидкости из
малого таза. Как правило, правую трубку оттока укладывали .на дно дугласова пространства полукольцом так, чтобы ее свободный конец был направлен немного кверху, а дополнительное отверстие дренировало самую низкую точку , тазового пространства.
Левую же трубку оттока укладывали в боковой канал
живота, пространство которого, как правило, трудно
дренируется. Использование для оттока кольпотомиче-
ского отверстия у женщин не оставило у нас хорошего
впечатления. Наступает или быстрая обтурация его
фибрином* или раствор начинал подтекать помимо
трубки.
244
До сих пор не имеется и общепризнанной .единой
методики перитонеального леважа при перитонитах.
Как известно, существуют методы проточного и фракционного диализа. Мы не задавались целью, специально
сравнивать эти два метода, но избрали и в основном
пользовались методом фракционного промывания
брюшной полости. С нашей точки зрения, проточный
леваж имеет существенные недостатки. Вот некоторые
из них. Во-первых, при проточном диализе невозможно
создать высокую концентрацию антибиотика в брюшной полости и крови. Во-вторых, при этом методе имеется большая и трудно, контролируемая потеря белка.
В-третьих, при проточном диализе легко образуются
осумкованные каналы, что не позволяет добиться полного орошения брюшины.
После тщательного ушивания лапаротомной раны
начиналась интраперитонеальная перфузия. Перфузи-
онный раствор вливался через две капельные системы,
установленные на высоте 1 м над постелью больного. На
введение 2 литров раствора затрачивалось около 1,5
часов. Затем трубки перекрывались на 2 часа. Через
2 часа экспозиции антибиотика все трубки открывались,
и брюшная полость опорожнялась в течение 0,5 часа.
Таким образом, весь сеанс занимал в среднем 4 часа.
За сутки в первые два дня проводилось четыре сеанса
перфузии с перерывами во время сна больных.. Дополнительно в зависимости от тяжести перитонита вводили
внутривенно 20—40 млн. ед. пенициллина. Для точного
контроля за эффективностью перфузии приток и отток
должны проводиться без тройников, в раздельные системы. Это позволяет определить, с какой стороны перфузия остается эффективной, а где ее нужно прекратить. Чтобы избежать перегрузки сердца, нарушений
электролитного баланса и задержки жидкости в организме, интраперитонеальную перфузию нужно проводить под контролем диуреза, ЦВД, определения белка
и электролитов в крови. Усилить эффективность интра-
перитонеальной перфузии можно с помощью дополнительного применения форсированного диуреза. Такая
комбинация позволяет избежать одного из чартых осложнений метода перфузии, каким является появление
отеков (В. С. Савельев с соавт., 1974).
245
Как правило, после 2-, 3-часовой экспозиции всасывается около 500 мл раствора, поэтому такой дефицит
жидкости не говорит о ее задержке в брюшной полоски
и является естественным. Чтобы избежать большей
задержки жидкости, отеков и быстро снять интоксикацию и азотемию, мы применяем с самого начала ин-
тра перитонеальной перфузии форсированный диурез
(Scifart, Burkhardt, 1974). Известно, что при быстром
и обильном выделении мочи сосудистое русло освобождается от высокотоксичных гуморальных агентов
(В. И. Филин, Б. Н. Соломатин, 1974). Кроме того, уже
с первых дней после операции добивались увеличения
диуреза до 2000—2500 мл в сутки. Форсированный
диурез осуществлялся комбинированным введением
маннитола (из расчета 1,0 на 1 кг веса больного) и
последующим введением 40—60 мг лазикса. Вначале
внутривенно перед введением маннитола вливали
1000—1500 мл раствора Рингера, а затем вводили
1000 мл 5% раствора глюкозы, 10% раствор хлористого натрия и хлористого кальция, панангин, 200—300 мл
4% раствора бикарбоната натрия. Показанием к проведению форсированного диуреза являлось наличие выраженной интоксикации и функциональной почечной
недостаточности. Противопоказанием к применению
форсированного диуреза мы считали снижение артериального давления до 80 мм рт. ст., наличие органических изменений в почках, сердечную недостаточность.
Интраперитонеальная перфузия, как правило, позволяла стабилизировать артериальное давление и
улучшить сердечную деятельность, что, в частности,
проявлялось урежением пульса через сутки после начала лечения. Эффект перфузии проявлялся также в
улучшении общего состояния больных, уменьшении
явлений интоксикации, более быстрой нормализации
температуры и лабораторных показателей (лейкоцитоза, формулы крови, остаточного азота и аммиака.) Особенно значительно влияние перфузии на моторику желудочно-кишечною тракта. Уже через сутки вздутие
живота уменьшалось, как и количество эвакуированного через зонд желудочного содержимого. Это позволяло
на 2—3 суток убрать назогастральный зонд и раньше
приступить к кормлению больных.
Ошибки и неудачи. Эффективность интранеритоне-
246
альной перфузии зависит от целого ряда факторов и
выполнения многих требований, несоблюдение и недоучет которых ведет к осложнениям и неудачам.
1. Наиболее частым осложнением перфузии является
нарушение оттока жидкости из брюшной полости (оно
наблюдалось у пяти наших больных). Этчт зависит:
а) от недостаточного наполнении брюшной полости
жидкостью; б) от неправильного расположения трубок
притока и оттока; в) от использования для оттока резиновых трубок, способствующих выпадению фибрина
и закупорке катетеров; г) от неполной санации брюшной полости и оставления больших количеств фибрина.
2. Причиной неэффективности перфузии является
применение этого метода в непоказанных случаях. К
таким мы относим резкое вздутие кишечных петель,
недостаточно устраненное в ходе операции. Не показано промывание и при очень дряблой брюшной стенке у
больных старческого возраста. Добиться адекватного
наполнения брюшной полости в таких случаях очень
сложно и потому перфузия становится малоэффективной. Не наблюдали мы хороших результатов от перфузии и при перитонитах с выраженными фибринозными
наложениями. Вводимая жидкость в таких случаях плохо эвакуируется и легко осумковывается в виде остаточных полостей.
- 3. Эффективность перфузии снижается при запоздалом заполнении брюшной полости жидкостью и редких
сеансах промывания, особенно в первые сутки. Поэтому
перфузия должна начинаться сразу после ушивания
лапаротомной раны и проводиться в первые сутки особенно интенсивно.
4. Ошибкой является продолжение перфузии при
дебите выделенной жидкости более 500 мл после первых 2—3 сеансов и появлении отеков.
Декомпрессия кишечника
Функциональная кишечная непроходимость при пери юните является важнейшим патогенетическим фактором этого заболевания, требующим соответствующей
коррекции до, во время и после операции (Н. И. Напалков, 1927; А. А. Беляев, 1962; Ю. М. Дедерер, 1971;
Ю. М. Гальперин, 1975, и др.).
247
Следует подчеркнуть, что большинство хирургов в
настоящее время отказались от применения классического варианта энтеростомии по С. С. Юдину, поскольку опорожнение близлежащих отделов кишечника дает
кратковременный эффект. Все меньшей популярностью
пользуются другие «открытые» методы декомпрессии
кишечника как через еюностому по И. Д. Житняку, так
и через цеко-аппендикостому в связи с возможностью
прорезывания швов (Б. Д. Савчук, 1975; П. Е. Нечи-
тайло, 1978). Правда, в начальных стадиях пареза энтеротомия или энтеростомйя при условии одномоментной и полной эвакуации кишечного содержимого могут
быть полезны (Hollender с соавт., 1974; О. Б. Поремб-
ский, 1976). Поэтому методом выбора декомпрессии
кишечника в послеоперационном периоде является
трансназальная интубация одним из специальных зондов (Эббот — Миллера и др.). Для этих целей, в частности, может быть использован упругий полихлорвини-
ловый зонд с металлическим наконечником и множеством перфораций (10. Л. Шальков, А. А. Кипенский,
1973). Таким образом, метод декомпрессии выбирают
индивидуально, с учетом тяжести воспалительного процесса в брюшной полости, давности заболевания, степени пареза и состояния кишечной стенки.
^ Послеоперационное ведение
1. Рациональная и целенаправленная антибиотика
терапия. Антибиотикотерапия должна строиться с учетом высеянной из воспалительного экссудата микрофлоры. Известно, что чаще всего высевается кишечная
палочка (63,4%), паракишечная палочка (7,1%), энтерококк (16,1%), стафилококк (7,0%), протей (7,4%)*
Бактериальный рост отсутствует в 22,5% (Б. Д. Сав¬
чук, 1975).
Высеянная перитонеальная флора оказывается высокочувствительной к полусинтетическим пенициллинам,
аминогликозидам и тетрациклинам (Б. Д. Савчук,
В. Е. Родоман, 1977). Отсюда лечение антибиотиками
перитонита следует начинать с назначения канамицина
(от 3 до 6 г в сутки) внутрибрюшинно и пенициллина
до 40—60 млн. ед. внутривенно. Через 5—6 дней переходят на лечение тетрациклинами (тетраолеан, сигма-
248
мицин, морфоциклин) или полусинтетическими пеницил*
линами (ампициллин, оксациллин, метициллин).
Действие антибиотикотерапии усиливается при дополнительном назначении трасилола, цалола, контрика-
ла и других ингибиторов кинин-калликреиновой системы,
способствующих улучшению микроциркуляции как в
очаге воспаления, так и вокруг него (М. И. Кузин,
О. С. Шкроб, 1976).
2. Инфузионно-трансфузионная терапия проводится
под контролем АД, ЦВД и диуреза. Она включает:
а) введение средств, уменьшающих дефицит воды и
электролитов (раствор Рингер — Локка, Дарроу, Гартмана, 10% раствор глюкозы);
б) введение препаратов, повышающих коллоидноосмотическое давление крови (кровь, альбумин, плазма,
протеин);
в) введение средств, улучшающих 'реологические
свойства крови (реополиглюкин, полиглюкин, гемодез).
Больной должен получать в . сутки в среднем 40—
60 мл/кг жидкости, т. е. 3—3,5 л.
3. При перитонитах с тяжелой интоксикацией или у
ослабленных больных целесообразна коррекция возникающих эндокринных нарушений назначением гидрокортизона (300—400 мг в сутки) или преднизолона
4. Ослабление патологических нейрорефлекторных
влияний на сердце и сосуды (анальгетики, блокады,
дроперидол).
5. Нормализация функции миокарда:
а) назначением средств, улучшающих обмен в сердечной мышце (кокарбоксилаза, АТФ);
б) введением препаратов, влияющих на контрак-
тильные свойства сердечной мышцы (строфантин,
коргликон — В. А. Кузнецов, Р. К Джорджикия, 1976) •
6. Улучшение функциональною ^ состояния печени
проведением глюкозо-витамино-инсулиновой терапии.
7. С целью лечения и предупреждения внутрисосудистой агрегации эритроцитов и микротромбообразо-
вания использование антикоагулянтов — гепарина
20000—30000 ед. в сутки.
8. Неспецифическая дезинтоксикация с помощью
форсированного диуреза или дренирования грудного
лимфатического протока.
9. Борьба с легочными осложнениями должна вестись по пути профилактики. С этой целью показаны
ранняя дыхательная гимнастика, банки, вызывание
кашлевого рефлекса. При плохом откашливании мокроты целесообразно введение протеолитических ферментов чрезкожной пункцией трахеи.
10. Успеха в лечении перитонита нельзя добиться
без эффективного разрешения пареза кишечника.
Борьбу с ним следует начать через сутки после операции, не дожидаясь его развития. С этой точки зрения
целесообразно раннее введение холиномиметиков (про-
зерина, карбохолина), гипертонических растворов поваренной соли, питуитрина, внутривенного введения новокаина в больших дозах, применение блокады
чревных нервов при упорных парезах кишечника, механическое раздражение кишечника с помощью использования многокомпонентных микроклизм и электростимуляции диадинамическими токами.
В заключение следует сказать, что лечение перитонита является комплексным. Оперативное пособие
должно быть простым и щадящим, проводиться после
подготовки и заключаться интенсивным послеоперационным лечением.
ГЛАВА XIV
ДРЕНИРОВАНИЕ ГРУДНОГО ЛИМФАТИЧЕСКОГО
ПРОТОКА В НЕОТЛОЖНОЙ ХИРУРГИИ
Функциональными исследованиями отечественных и
зарубежных авторов доказано, что лимфатическая система является важным и неотъемлемым фактором гемодинамического гомеостаза (Д. А. Жданов, 1934—1945;
Б. В. Огнев, 1936—1972; Е. Я. Выренков, 1957, 1967;
Л. В. Чернышенко и А. А. Сушко, 1973; Д. Д. Зербино,
1974; Starling, 1909; Эппингер с соавт., 1938; Русньяк,
Фельди, Сабо. 1969, и др ). Установлено, что она выполняет ряд важных функций в организме. К ним следует
отнести:
250
1. Всасывание из тканей организма коллоидных рас¬
творов, белковых веществ и эмульсий липидов, не всасывающихся в кровеносные капилляры, а также взвесей
инородных частиц и гормонов. 1
2. Транспортную функцию, заключающуюся в транспортировке этих веществ в кровеносную систему.
3. Кроветворную и защитную функцию за счет переноса лимфоцитов и антител.
4. Дренажную функцию. При возникновении воспалительного процесса в органе по лимфатической системе
удаляются токсины и бактерии, что способствует купированию и ликвидации данной патологии. Кроме этого,
в лимфе рано появляются токсические продукты воспаления (аммиак, кинины, бактерии, билирубин, мочевина
и другие вещества). Такое «лимфатическое уклонение»
токсических продуктов, токсинов и бактерий стало использоваться в хирургии с целью дезинтоксикации. С этой
целью стали производить дренирование грудного протока
при остром панкреатите (О. С. Кочнев, Ф. Ш. Шарафис-
ламов, 1970; О. С. Кочнев, Ф. А. Давлеткильдеев,
Б. X. Ким, 1977; В. С. Савельев с соавт., 1977), механической желтухе и отравлениях (Д. Л. Пиковский,
Б. В. Алексеев, 1971, 1975), циррозах печени (М. Д. Па-
циора с соавт., 1976, 1977), печеночной недостаточности
(Э. И. Гальперин с соавт., 1975), перитоните (П. Н. Зубарев, 1974; Р. Т. Панченков с соавт., 1976, 1977), острой
непроходимости брыжеечных сосудов (С. С. Долгот,
1978), ожогах (Г. Д.Малясов, 1978), уремии (В. А.Мал-
хасян, И. В. Таткало, 1966).
Клиника неотложной хирургии Казанского ГИДУВа
начала применять операции на грудном лимфатическом
протоке (ГЛП) с 1973 г. и в настоящее время располагает опытом 73 операций на ГЛП, из которых 67 сделаны
с целью наружного отведения лимфы, а 6 — для внутреннего дренирования (О. С. Кочнев, Ф. А. Давлеткильдеев,
Б. X. Ким, 1976, 1977, 1978). Операции наружного дренирования ГЛП проводились наиболее тяжелому контингенту больных с выраженной интоксикацией в комплексе
дезинтоксикационных мероприятий. Наружное дренирование ГЛП проведено следующему контингенту больных с острой патологией брюшной полости: при перитоните (18 больных), механической желтухе (31), панкреа¬
251
тите (17), кровотечении при циррозе печени (1 больной).
Мы считаем целесообразным выделить следующие патогенетические факторы для наружного лимфодренажа.
Механическая желтуха
1. Установлено, что имеется тесная связь между желчной й лимфатической системами печени. Электронно-
микроскопические исследования показали наличие прямого сообщения между желчными капиллярами и пери-
синусоидальными пространствами Диссе. При различных
патологических процессах в печени (механическая желтуха, острый или токсический гепатит, холангит и т. д.)
обнаруживается значительное расширение крупных лимфатических сосудов и истончение их стенок. Поэтому
обструкция в желчевыводящей системе как острого, так
и хронического характера ведет к увеличению билирубина сначала в лимфе, а затем в крови (Э. И. Гальперин
с соавт., 1975).
2. Ведущим компонентом развития патоморфологи-
ческих.изменений в печени после развития-желчной гипертензии является нарушение внутриорганного кровообращения (Т. Ш. Магдиев, 1960; В. И. Витлин, 1966).
Оно проявляется сбросом крови, минуя синусоиды, сосудистыми спазмами, значительным ухудшением показателей реогепатографии (Б. Б. Мосихин, 1974). Желчная
гипертензия, как правило, сопровождается резким повышением портального давления, усиленной лимфопро-
дукцйей, в 4—5 раз превышающей норму. Нарушение
печеночного крово-лимфообращения, сосудисто-тканевой
проницаемости ведет к формированию очагов желчного
стаза, появлению в капиллярах желчных тромбов, дистрофическим изменениям гепатоцитов. Однако быстрая
желчная декомпрессия при холестазе еще более ухудшает функциональное состояние печеночных клеток, ведет к нарушению внутрипеченочного кровотока и углубляет органную гипоксию (Н. Н. Артемьева, 1968;
А. И. Краковский, 1974). Быстрое опорожнение желчных
путей при длительной механической желтухе также способствует уменьшению объема функционально активной
печеночной ткани и прогрессированию печеночной недостаточности.
3. В условиях усиленной при нарушении оттока жел-
253
чи лимфопродукции возникает функциональная недостаточность грудного протока. Она заключается в том, что
«герез естественное лимфовенозное соустье в условиях
лимфатической гиперпродукции транспорт лимфы в венозную систему затруднен (Dumont, 1973), что увеличивает застой лимфы в печени, способствует ухудшению
органного кровообращения и возникновению асцита.
Острый панкреатит
Считается, что лимфодренаж через грудной лимфатический проток играет роль предохранительного клапана при изменениях внутрипротокового давления в поджелудочной железе (О. С. Кочнев, 1970; О. С. Кочнев,
ф. III. Шарафисламов, 1971). Установлено, что при остром панкреатите имеется предпочтительное «уклонение
ферментов» в лимфу по сравнению с кровью. В разгар
острых воспалительных изменений в поджелудочной железе активность амилазы и липазы в лимфе значительно
превосходит их активность в крови. Это дало основание
нам рекомендовать операцию на грудном протоке и его
дренирование с целью отведения «энзимного удара» и
дезинтоксикации организма. Дренаж грудного лимфатического протока, проводимый не менее 6—8 часов, ведет к. снижению панкреатических ферментов сначала в
лимфе, а затем в крови. Визуальное наблюдение за состоянием поджелудочной.железы при лимфостомии показывает, что отек и кровоизлияние в поджелудочной железе развиваются более медленно, а стеариновые бляшки
появляются позднее, чем в контроле.
Показанием к дренированию грудного протока являются случаи острого панкреатита, сопровождающиеся
тяжелой интоксикацией, стойкой амилазурией, желтухой
и олиго-анурией (О. С. Кочнев, 1970; Д. Л. Пиковский и
Б. В. Алексеев, 1971).
Перитонит
Электронно- и биомикроскопические исследования при
перитоните микролимфоциркуляции выявили ряд особенностей (Р. Т. Панченков с соавт., 1978). В начальном периоде перитонита происходит замедление кровотока в
микроциркуляторном русле вследствие расширения
253
артериол, капилляров и венул. Замедление кровотока сопровождается повышением сосудистой проницаемости и
выхождением жидкой части крови в воспаленную ткань.
Несмотря на значительный отек воспаленной ткани,
сдавления лимфатических, капилляров не происходит
ввиду своеобразного их строения. Оно определяется тем,
что эндотелиальные клетки лимфатических капилляров
связаны с интерстициальной соединительной тканью при
помощи пучков фибронитей, располагающихся под
прямым и острым углом к поверхности капилляра (см,
рис. 38). Поэтому при отеке межуточной ткани происходит расширение лимфатических капилляров и уменьшение в нем гидростатического давления (В. А. Шах-
ламов, 1971). В результате аутолиза в воспаленных тканях повышается содержание протеолитических фермии- I 11Рис. 38. Схема м икрой и р куля торной
единицы.
I — артериола, 2 — прекапиллирный сфинктер,
8 — прекапилляр, 4 — капилляр, 5 — посткапиллярная венула, 6 — посткапиллярный
сфинктер. 7 — артериоловенулярный шунт.
8 — коллекторная вена, 9 — лимфатический
капилляр, 10 — лимфатический посткапилляр,
11 — лимфатический микрососуд.
254
тов и гистамина. Под их действием между эндотелиальными клетками лимфатических капилляров появляются
щели. За счет этого механизма и снижения гидростатического давления наступает не только усиленный приток
межклеточной жидкости в капилляры и усиление общего
лимфотока, но и проникновение в них клеточных элементов и микроорганизмов. Поэтому при перитонитах
отчетливо выявляется бактериальная загрязненность^
лимфы (П. Н. Зубарев, 1974, 1976; М. М. Минебаев,
Б. К. Брудная, 1975). В связи с этим можно предположить, что усилёние интоксикации в токсическую фазу
перитонита связано с попаданием микробов сначала в
систему грудного протока, а затем в кровь. При дренированном грудном протоке возможность проникновения
бактерий из брюшной полости в кровь снижена. Однако
это не исключает попадания бактерий в кровь через правый лимфатический проток или через лимфо-венозные
анастомозы. Отсюда становится ясным, что исчезновение
бактериемии при повторных исследованиях лимфы следует рассматривать при перитоните как благоприятный
прогностический признак.
Таким образом, при указанных заболеваниях дренирование грудного лимфатического протока позволяет
освободить организм от бактерийной, метаболической и
аутокаталитической интоксикации, обеспечивает декомпрессию органа в случаях серозного отека и предупреждает переход процесса в деструкцию.
Анатомические варианты строения и впадения шейного
отдела ГЛП
При операциях по дренированию ГЛП встречается
целый ряд трудностей, которые делают высоким процент
неудачных вмешательств в этой области, когда проток
не удается найти или его заканюлировать (9,6%). По
нашим наблюдениям, основой таких неудач являются
анатомические варианты в строении шейного отдела
ГЛП. Строение этого отдела грудного лимфатического
протока представлено в анатомических исследованиях
Д. А. Жданова (1945), И. А. Ибатуллина (1974),.
М. Д. Пациоры с соавт. (1977), Р. Т. Панченкова с соавт.
(1977),
255
Мы провели совместно с сотрудниками нашей клиники Ф. А. Давлеткильдеевым и Б. X. Кимом анатомический анализ этого сегмента грудного протока с целью
повышения эффективности поисков и дренирования ГЛП.
Полученные в результате проведенных операций анатомические данные показывают, что целесообразно, с
точки зрения известной классификации Д. А. Жданова и
оперативной хирургии, выделить 4 типа шейного отдела
грудного лимфатического протока: ^
1) магистральный — 47,9% (рис. 39 а);
2) древовидный— 21,9% (рис. б);
Рис. 39. Типы строения терминального
отдела грудного лимфатического протока.
а — магистральный. б — древовидный. а —
рассыпной, г — прерывистый (крупным планом
дана схема лимфоузла о протоками).
3) рассыпной — 12,3% (рис. в);
4) прерывистый — 8,2% (рис. г).
Магистральный тип представлен лимфатическим гро*
током, идущим единым стволом диаметром от 2 до
14 мм. Древовидный тип состоит из 2—3 стволов, кото-
рые у места впадения в венозное русло соединяются в
единое устье. Рассыпной тип представлен множеством
мелких протоков, впадающих в венозное русло каждый
в отдельности. Прерывистый тип, хотя и встречается,
более редко создает наибольшие технические трудности
при выделении и канюляции элементов протока. Он за*
256
ключается в том, что один или несколько лимфатических протоков прерываются в лимфоузле у неполного
угла, а затем уже из лимфоузла впадают в петиций
угол Пирогова.
Наиболее часто (в 50,7%) грудной лимфатический
проток впадает в венозный угол. Впадение грудного протока в подключичную вену наблюдается у 24,7% случаев, а в яремную вену — в 11%. В 4% случаен наблюдалось впадение ГЛП в безымянную Вену
Методика дренирования грудного лимфатического
протока
Операцию можно выполнять под местной анестезией
или под наркозом. Последнее, с нашей точки зрения, более предпочтительно, так как новокаин затрудняет ориентировку в тканях, а беспокойство больных во время
операции ухудшает обзор операционного поля. Разрез
делается выше и параллельно ключице. Затем пересекается платизма. Наружная ножка кивательной мышцы
обычно прикрывает венозный угол Пирогова, поэтому
целесообразно парциально илд полностью пересечь эту
часть- кивательной мышцы. После этого следует обязательно вскрыть влагалище внутренней яремной вены и
обнажить ее на протяжении не менее 3—4 см, так как
ГЛП может впадать в заднюю поверхность яремной вены на 2—3 см. Очень помогает в поиске протока взятие
внутренней яремной вены на турникет, особенно когда
проток впадает в заднюю поверхность этой вены. Этот
прием ведет к гипертензии в протоке, его увеличению в
диаметре и четкому контурированию. Далее проток не
следует выделять на значительном протяжении (не более 1,5 см), так как это приводит в дальнейшем к его
облитерации. Перед канюляцией дистальную часть протока следует взять на держалку. Это позволяет, во-пер*
вых, предупредить попадание воздуха в подключичную
вену и воздушную эмболию и, во-вторых, способствуя
наполнению протока, облегчает его канюляцию.
Дистальную часть протока не следует перевязывать,
имея в виду последующее восстановление естественного
лимфатического оттока после удаления катетера. После
интубации протока полихлорвиниловой трубкой на края
отверстия в протоке атравматической иглой накладывали
17. М-843
257
П-образный шов, восстанавливающий его герметичность
и фиксирующий трубку. Таким образом, трубка в грудном протоке размещается по типу дренажа Мейо в
желчных путях, что позволяет в случае необходимости
восстановить естественный ток лимфы при ее полном
перекрытии. Уже на глубине 1—2 см нередко встречается
препятствие при продвижении трубки в виде клапана.
В- этих случаях не следует форсировать продвижение катетера, так как это может вызвать деформацию протока
или повреждение его стенки.
При древовидном типе ГЛП производилась канюля-
ция наиболее широкого ствола по методу Мейо, если
позволял диаметр протока. Когда диаметр ствола оказывался недостаточным для введения катетера типа
Мейо, ствол протока пересекался, центральная часть
его каиюлировалась с фиксацией катетера в протоке, а
периферическая часть перевязывалась. Такой же методики канюляции мы придерживались и при рассыпном
типе ГЛП.
Управляемое дренирование грудного лимфатического
протока
Одной из важнейших задач дренажа грудного лимфатического протока является максимальный сброс лимфы
в первые часы и дни после операции для получения выраженного дезинтоксикационного эффекта. Однако,
кроме обычного дренирования, для увеличения коэффициента полезного действия лимфодренажа нужны дополнительные меры. Сотрудники нашей клиники
Ф А. Давлеткильдеев и Б. X. Ким разработали и применили на практике методику дозированного дренажа
грудного протока. Дозированный лимфодренаж достигается: 1) вышеуказанным расположением трубок в
зависимости от типа протока; 2) изменением высоты
расположения катетера над постелью больного; 3) медикаментозной стимуляцией лимфотока; 4) наложением
турникета на концевую часть протока; 5) лимфосорб-
цией.
Нами установлено, что лимфоток можно значительно
увеличить лекарственным путем. Для этих целей мы
применили маннитол, используя его способность ловы-
258
шать осмотическое давление плазмы (А. Н. Шанская,
1975). Это приводит к усиленному притоку интерстициальной жидкости в сосудистое русло, увеличивает объем циркулирующей крови, улучшает гемодинамику и
снижает гематокрит. Введение маннитола из расчета 1,0 г
на кг веса приводит через 10—15 минут после его*
введения к увеличению лимфотока на 100% и более в
течение 4—5 часов. Особенно эффективен этот способ
при несколько пониженной лимфопродукции, наблюдающейся в токсической фазе перитонита.
Следовательно, используя маннитол, можно усилить
дезинтоксикационный эффект дренирования грудного
протока, ускоряя лимфоток и увеличивая объем выводимой Лимфы. Это позволяет более интенсивно проводить предоперационную подготсьлу а 'ок^агить время
до операции. Этим методом целесообразно пользоваться
в случаях, когда естественный лимфоток снижен, выделяется густая и вязкая лимфа, что имеет место при
холангитах, или содержит большое количество эритроцитов, как это бывает при панкреатитах и перитонитах.
При ранее описанном методе канюляции различных
типоб ГЛП лимфодренаж часто бывает недостаточным
за счет сохранения естественного тока лимфы при магистральном типе и по дополнительным путям при древовидном и рассыпном типах, что снижает дезинтоксикационный эффект операции. Поэтому мы разработали методику усиления лимфотока с помощью наложения временного турникета на устье протока при магистральном
и древовидном типах ГЛП, а также на дополнительные
ветви'при рассыпном типе. Нами установлено, что лишь
одно перекрытие протока с помощью турникета ведет к
увеличению лимфотока по катетеру на 30% по отношению к исходному уровню. Для этого турникет, наложенный на проток, подтягивается к кожной ране и фикси1
руется на коже к марлевому шарику. При сочетании
турникетного метода с медикаментозной стимуляцией
лимфотока выделение лимфы можно увеличить в 2,5
раза (см. рис. 40).
В последующем, когда необходимость в лимфосто-
мии отпадает, турникет удаляется я восстанавливается
естественный ток лимфы. Однако в связи с массивной
потерей белка вместе с лимфой возникает опасность нарушения гемодинамики и угнетения за счет гипопрот-н-
17*
259
Рис, 40. Методы использования анатомических
типов строения терминального отдела ГЛП для
поиска протока, канюляции и усиления лимфо-
гока.
а — слияние ГЛП и шейно лимфатического протока
используется для поисков грудною протока, если пользоваться шейным протоком как ориентиром; б — при магистральном типе ГЛП и достаточном диаметре протока
предпочтительнее производить канюляцию его по типу
дренажа Мейо в сочетании с превентивным турникетом:
в — при древовидном типе ГЛП канюлируется наиболее
крупный ствол ГПЛ в сочетании с превентивным турникетом. наложенным также на устье протока; г — при
рассыпнсй* типе ГЛП наиболее крупный ствол протока
пересекается, дистальный отрезок его лигируется, а
проксимальный канюлируется с фиксацией катетера в
протоке узловой лигатурой по периметру. На устье
накладывается единый превентивный турникет.
нсмии антитоксической функции печени. Чтобы устранить
эти побочные явления, мы стали комбинировать дренирование с очищением лимфы (лимфосорбцией) и реинфузией очищенной лимфы (Р. Т. Панченков с соавт.,
1976). Лимфосорбция произведена у 16 больных: 10—
с механической желтухой, 3 — с перитонитом, 3 — с панкреатитом. Для очищения лимфы от токсических продуктов применялась ионообменная смола КУ-2-8 и активированные угли СКТ-6 и БАУ. 500 мл лимфы очищали с
помощью 50 г увлажненного стерильного катионита в
натриевой форме. К очищенной лимфе добавляли
1 000 000 млн. ед. пенициллина. Очищенную лимфу вводили в подключичную вену со скоростью 30 капель в минуту. Однократное проведение лимфы через катионат почти
полностью устраняет аммиак и в меньшей степени билирубин. Очищение от билирубина больше достигается от
260
применения активированных углей. Белка в ходе лимфо-
сорбции теряется сравнительно мало — от 0,3 до 0,5 г %.
Таким образом, лимфосорбция позволяет не только очистить лимфу от токсических продуктов, но и сохранить
для организма и возвратить ему собственный белок, т. е,
предупредить гипопротеинемию и нарушение онкотиче-
ского давления крови.
Результаты лимфодренажа
Наружное дренирование грудного лимфатического
протока является эффективным средством дезинтоксикации в основном при желтухах доброкачественной природы. У этой категории больных грудной лимфатический
проток расширен до 4—5 . мм и стенка его утолщена.
Торзионное давление было предельно высоким, поднимаясь до 500 мм вод. ст., а скорость лимфотока возрастала до 60—80 мл/час. В лимфе наблюдались высокие
цифры остаточного азота, повышение активности транс-
аминаз, аммиака и билирубина. Причем содержание
аммиака в лимфе бывает в 2—3 раза выше по сравнению с кровью, что говорит о'предпочтительном выделении этого токсического агента с лимфой. Лимфодренаж
быстро улучшал общее состояние больных, устраняя
зуд, снижал содержание остаточного азота и аммиака.
Однако снижение билирубинемии наблюдается не во
всех случаях. В трех случаях имело место только замедление темпа роста билирубинемии, но не снижение
этого показателя, несмотря на интенсивный лимфодренаж. Это нужно иметь в виду при дренировании грудного
лимфатического протока у больных механической желтухой, поскольку отсутствие эффекта от лимфодренажа
является показанием ж операции.
Известно, что за сутки через, грудной проток выделяется 40% плазменных белков (Dumont, 1975), обеспечивающих коллоидно-осмотическое давление крови.
Поэтому сброс лимфы наружу до некоторой степени
подобен кровотечению и может привести к гипотонии,
что наблюдалось нами у 2 больных даже при проведении
интенсивной водно-электролитной коррекции. Кроме того,
с лимфой при дренированном грудном протоке теряются
не только белки, но и лимфоциты, ответственные за иммунологическое равновесие в организме. Поэтому длительное (более 3—4 суток) дренирование протока часто
261
нецелесообразно, так как может привести к критическому уменьшению количества лимфоцитов (с 2400 до 1400
в 1 мм3 лимфы).
Несколько особое положение занимают больные с
механической желтухой на почве опухоли поджелудочной железы и желчевыводящих путей. Несмотря на интенсивную желтуху, у этих больных проток не расширен,
давление в нем повышено нерезко. У этих больных имеется тенденция к быстрой закупорке дренажа в связи с
выделением лимфы с большой примесью эритроцитов.
Это связано, видимо, с распадом опухоли и раковым
лимфангоитом, затрудняющим транспорт лимфы в грудной проток. Поэтому при отсутствии эффекта, от дренирования в первые часы после операции не следует надеяться уменьшить билирубинемию этим методом.
Этот метод может быть полезным при холангитах. У
некоторых больных действительно можно снизить температуру и добиться улучшения состояния с помощью
лимфодренажа. Однако при отсутствии эффекта в первые
двое суток надеяться на улучшение состояния не приходится и потому радикальную операцию на более длительный срок откладывать не следует.
Таким образом, мы считаем нецелесообразным при
механических желтухах проводить предоперационную
^декомпрессию протока более 3—4 суток. Показателем
возможности осуществления радикальной операции па
желчных путях является улучшение общего состояния
больных, снижение остаточного азота и аммиака крови,
улучшение показателей общего состояния.
Лимфодренаж продолжается и в послеоперационном
периоде, что позволяет предупредить у этой тяжелой категории больных развитие печеночной недостаточности.
Потери с лимфой жидкости и белка должны строго контролироваться и своевременно восполняться введением
адекватного количества электролитов и белка. Надежным методом контроля эффективности лимфодренажа
является подсчет лимфограммы и общего количества
лимфоцитов.
Правила дренирования грудного протока при панкреатитах те же. Обращает внимание, что лимфодренаж
при остром панкреатите, проведенный у 17 пациентов,
бистро устранил болевой синдром в животе, снизил лейкоцитоз и температуру, уменьшил воспалительный и и-
фильтрат в области поджелудочной железы. Это свойство
дренирования грудного лимфатического протока может
быть использовано в лечении появляющихся после пан-
креатита псевдокист. Поскольку лимфа при острых панкреатитах содержит большое количество белка и эритроцитов, способствующих тромбированию катетера, целесообразно в таких случаях для сохранения лимфотока
применять гепарин и маннитол.
Результаты дренирования грудною лимфатического
протока в комплексном лечении разлитых перитонитов
ободряющие. Наружный лимфодренаж при перитонитах
снижает явления интоксикации, печеночной недостаточности, а главное способствует более быстрому разрешению пареза кишечника. Создается впечатление, что наружный лимфодренаж, примененный в сочетании с ан-
тибиотиковой иитраперитонеальной перфузией, предупреждает патологическое депонирование жидкости в
брюшной полости.
Следовательно, дренирование грудного лимфатического протока и его лимфодренаж позволяют уменьшить
'явления интоксикации при ряде острых заболеваний
брюшной полости. Требуется тщательное наблюдение за
состоянием больных в ходе декомпрессии, лабораторными показателями и адекватное возмещение электролитов
и белка, а также реинфузия очищенной лимфы. Лимфодренаж является лишь одним из элементов дезингокси-
кационной терапии и с помощью его не всегда удается
добиться желаемого эффекта. Отсутствие эффекта от
декомпрессии грудного протока является настоятельной
рекомендацией к операции. Дозированный лимфодренаж
должен продолжаться и после операции.
ЛИТЕРАТУРА
Алексеев Б. В. Дренирование грудного лимфатического протока при панкреонекрозе и тяжелом отравлении уксусной кислотой.
Автореф. канд. дис. Волгоград, 1976.
Альперович Б. И., Соловьев М. М Очерки неотложной
хирургии живота Томск, 1975.
Апанасенко Б. Г., Корнев В. В., Воробьев В. Нп
Куницын А. И., Ходырев Л. П. Методы определения крово¬
263
потери и возможности применения их на этапах медицинской эвакуации.— «Военно-мед. журнал», 1976, № 7, 22—25.
АриповУ. А., МазаевП. Н., Гришкевич Э. В. Рентгенологическое исследование в хирургии желчных путей. Ташкент,
1969.
Баклыкова Н. М. О природе токсических факторов при
перитоните.— Матер, к 4 съезду хирургов Алтайского края. Барнаул, 1971, 134—135.
Баскаков В. А. О выборе метода операции при прободной
язве желудка и двенадцатиперстной кишки. Автореф. канд. дис.
Казань, 1973.
Белоусова Н. М. Редкие причины желудочно-кишечных
кровотечений. М., «Медицина», 1976.
Беляков В. Д., Колесов А П., Остроумов Б. П.,
Немченко В. И. Госпитальная инфекция. Лм «Медицина», 1976.
Березов Ю. Е., Лапин М. Д., Мусабеко в Т., Сотников В. Н. Лапароскопия в ургентной хирургии.— «Клин, хир.»,
1971, ЛЬ 10, 39—42.
Березов Ю. Е., Со т н и к о в В. Н., Б о т в и н о в А. М. и др.
Остановка гастродуоденального кровотечения комбинированным методом.—«Хирургия», 1972, № 1, 85—89.
Вагнер Е. А., Та в ровен и и В. М. Трансфузионная терапия при острой кровопотере. М., «Медицина», 1977.
Васильев Р. X. Лапароскопическая холецистохолангиогра-
фия.— «Вести, хир.», 1968, № 4, 129—130.
Витебский Я. Д. Хронические нарушении дуоденальной проходимости и язвенная болезнь желудка и двенадцатиперстной кишки. Челябинск, 1976.
Ваньков Д. Е. Нарушение реологических свойств крови при
травматическом шоке.— В кн.: Травматический шок. Ред. М. П. Гвоздев. Л., 1977, 36—38.
Виноградов В. В., Зима П. И., Кочнашвяли В И.
Непроходимость желчных путей. М., «Медицина», 1977.
Вишневский В. А. Обходные желчевыводящие анастомозы
в хирургии воспалительных заболеваний желчных путей. Автореф.
канд. дис. М., 1969.
Гальперин Э. И., С т е ц ю к А. Г., Волкова Н. В. и др.
Дренирование грудного лимфатического протока в комплексном лечении печеночной недостаточности.— «Хирургия», 1972, № 11.90—94.
Гальперин Ю. М. Парезы, параличи и функциональная
непроходимость кишечника. М., «Медицина», 1975.
Гальцева И. В., Кусто б В. М., Шушков Г. Д., Ершова И. Н. Лечение травматического шока.— В кн : Травматический
шок. Труды Ленингр. института скорой помощи им. И. И. Джанелидзе, 1974, 75—112.
Гатауллин Н Г Послеоперационная спаечная болезнь
брюшины. Уфа, 1978
Герусов Ю. М. Жидкие кристаллы и перспектива их применения в хирургии — «Хирургия», 1978, № 5, 100—104.
Горячев А. Н., Туршева Г. И. Позиционное сдавление
конечностей.— «Вести, хир.», 1976, № 12, 93—97.
Гр а нов А М.,~ Лащевкер В. М. Содержание и обьем
трансфузнонной терапии при остром панкреатите.— «Весгн, хир.»,
1978. 12, 93—95.
264
Дарбинян Т. М. (ред.). Руководство по клинической анестезиологии. М., «Медицина», 1974.
Дед.ерер Ю. М. Патогенез и лечение острой кишечной непроходимости. М., «Медицина», 1971.
Дерябин И. И., Лизанец М. Н. Перитонеальный диализ.
Л., «Медицина», 1977.
Д у б я г а А. Н. Еще раз о спайках брюшной полости и спаечной болезни.— «Вести, хир.», 1978, № 11,31—36.
Жданов Д. А. Общая анатомия и физиология лимфатической системы. Л., 1952.
Жлоба А. Ф. Диагностическое значение пункции брюшной
полости при закрытых повреждениях живота.—«Хирургия», 1965,
№ 6, 81—82.
Затевахин И. И. Хирургия острой эмбологенной артериальной непроходимости. Автореф. докт. дис. М., 1975.
Захарова Г. Н., Шехов В. П. К проблеме острого аппендицита.— «Хирургия», 1974, № 2, 70—75.
Захарова Г. Н., Скатин Л. И. Некоторые вопросы хирургии перитонита.— «Хирургия», 1974, № 6, 90—96.
Зефиров Л. Н., Ал а т ы рев В. И., Ко чн ев О. С., LLI а й-
карданов Р. Ш. Электромиография брюшной стенки в диагностике острых заболеваний живота. Изд-во Казанск. университета,
1978.
Зильбер А. П. Клиническая физиология для анестезиолога.
М., «Медицина», 1977.
Зубарев П. Н. Пути резорбции токсических веществ из
брюшной полости при раневом перитоните.— «Вести хир.», 1974,
№ 1, 14—19.
Ивашкевич Г. А. Сепсис и септические состояния — «Вести,
хир », 1974, № 1, 5—9.
Ивашкевич Г. А., В у л ь Г. П., Химка А. С. Происхождение интоксикации при гнойном перитоните.— «Хирургия», 1977,
№ 11,74—77.
Карагюлян Р. Г. Хронический панкреатит и eFO осложнения. Учебное пособие. М., 1974.
Катеров В: И. Введение во врачебно-клиническую практику.
Казань, 1960.
Квача дзе Р. Г. Сравнительные результаты хирургического
лечения прободных гастродуоденальных язв. Автореф. докт. дис.
М., 1976.
К л и м а н с к и й А. В., Рудаев А. Я., Степаньков Ю. Л.
Место донорской крови и возмещение умеренной кровопотерн —
«Хирургия», 1978, № 9, 149—150.
Кнубовец С. Я. Клинико-экспериментальное обоснование
оперативных вмешательств на терминальном отделе желчного протока при осложненном холецистите. Автореф. докт. дис. Казань,
1976.
К о в а л ь ч у к В И. Форсированный диурез при остром панкреатите. Автореф. канд. дис., Л., 1972.
Козлов И. 3., Андросова Т. П. Ошибки и опасности в
диагностике и лечении больных с ущемленными грыжами живота.—
«Хирургия», 1975, № 6, 106—110.
Кокк X. Э. О расстройствах водно-электролитного обмен я и
265
их коррекция при механической кишечноА непроходимости. Авто-
реф. канд. дис. Тарту, 1969.
Колесов В. И. Клиника я лечение острого аппендицита.
М., «Медицина», 1972. ;
Комаров Б. Д., К У ш у н и н В. В., Те р я е в В. Г. Синдром Маллори — Вейсса.— «Хирургия», 1974. /Ч» 11, 127—031.
Комаров Б. Д., Зайцев В. Г. Состояние и перспектива
организации неотложной хирургической помощи в РСФСР.—«Сов.
мед», 1976, № 9, 7—14.
Королев Б. А., П и к о в с к и й Д. Л. Осложненный холецистит. М., «Медицина», 1971.
Кочнев О. С. Гемодинамика н лимфообращение при остром
панкреатите в эксперименте и клинике. Автореф. докт. дис. Казань,
1970.
К о ч н е в О. С., К и м И. А., Ш а й м а р д а и о в Р. 111. Интра-
оеритонеальная перфузии при лечении разлитых перитонитов.—
«Казанский мед. журн.», 1975, № 4, 31—34.
Кочнев О. С., Д а в л е т к и л ь д и е в Ф. А., Ким Б. X.
Дренирование грудного лимфатического протока в неотложной хирургии органов брюшной полости.— «Казанский мед. журн.». 1977,
№ 3, 47—51.
Кочнев О. С, Ким И. А., Д а в л е т к и л ь д и е в Ф. А.
Лапароскопическая канюляция круглой связки печени при остром
холецистите и" панкреатите.—«Сов. мед.», 1978, № 3, 62—67.
Кочнев О. С., Ким И. А., Давлеткил ьдиев Ф. А. н
др Применение норадреналина при лечении гастродуоденальных
кровотечений.— «Хирургия», 1978, № 9, 39—45.
Кочнев О. С. Консервативная и операционная программа в
неотложной хирургии. Изд-во Казанск. университета, 1978.
Кузин М. И. (ред.). Синдром длительного раздавливании М.,
1969
Кузин М. И , Ш к р о б О. С., С о р о к и н а М. И., Ц и д е-
нов М. М. Лечёние разлитых гнойных иеритонитов.— «Хирургия»,
1973, № 10, 125—131.
Кузин М. И., ПостоловП. М. Выбор метода хирургического лечения язвенной болезни.— Труды XXIX Всесоюзн. съезда
хирургов. Киев, «Здоровье», 1975, 132—136.
Кузин М. И., Данилов М. В., Гр а бой Э. А. Внутреннее дренирование общего желчного протока ири его неопухолевой
непроходимости —«Сов. мед.», 1977, JNTsp 10, 99—105.
Кузин М. И. (ред.). Материалы Всесоюзной конференции по
органосохраняющим операциям (ваготомии) при язвенной болезни
желудка и двенадцатиперстной кишки М., 1977.
Кара шуров Е. С. (ред). Гурникетный шок в синдром
длительного сдавления. Петрозаводск, 1975.
Кузнецов В. А. Перитонит и сердечно-сосудистая система.
Автореф. докт дне Казань, 1971.
Кулагин В. К. Патологическая физиология травмы и шока,
М.. «Медицина», 1975.
Луцевич Э; В., Белов Н. Н., Стручков Ю. В. Тактика хирурга при кровотечениях из варикозных вен пищевода.—
Тезисы XV объели ценного пленума Правлений Всесоюзного и Молдавского общее! в хирурюв. Кишинев, 1976, 123—124.
Луцевич Э. В,, Белов И. 11., Стручков Ю. В. Эндо-
266
сколия в диагностике и лечении желудочно-кишечных кровотечений.— «Вести, хир.», 1977, № 7, 11—14.
Лыткин М. И., Карякин А. М., Б е л ы й В. Я., Зубарев П. Н. Лечение острого перитонита. Непосредственные результаты и перспективы их улучшения.— «Вести, хир.», 1977, № в,
10-16.
Макаренко Т. П., Харитонов Л. Г., Богданов А. В.
Ведение послеоперационного периода у больных общехирургического профиля. М., «Медицина», 1976.
Малиновский Н. Н., Козлов В. А. Антикоагулянтная
и тромболитическая терапия в хирургии. М., «Медицина», 1976.
М а л х а с я н В. А., ТаткалоИ. В. О дренаже грудного
лимфатического протока.— «Хирургия», 1966, № 4, 99—104.
М а я т В. С., Панцырев Ю. М., Г р и н б е р г А. А. Ваготомия в хирургии язвенной болезни.— «Хирургия», 1970, № 6,
28—34.
Милонов О. Б., М о в ч у н А. А. Сочетанное применение
холедоходуоденостомии и сфннктеротомии.—«Хирургия», 1975, № 10,
18—“24.
Миннебаев М. М. Роль и функция лимфатической системы
в патогенезе острого воспаления брюшины в эксперименте. Авто-
реф. докт. дис. Казань, 1975.
Морозов Ю. И. Холедоходуоденостомия. Автореф. канд.
дис. М., 1964.
Напалков П. Н. Принципы хирургического лечения разлитого гнойного перитонита.—«Сов. мед », 1971, № 9, 29—31.
Напалков П. Н., Артемьева Н. Н. О единой терминологии пластических операций на большом дуоденальном соске.—
«Вести, хир.», 1978, № И, 3—8.
Новиков К. В. Клиническая оценка манометрии и дебито-
метрии при операциях на желчной системе. Автореф. канд. дис.
Л., 1973.
Норенберг-Чарквиани А. £. Острая непроходимость
кишечника. М., «Медицина», 1969.
Неймарк И. М. Прободная язва желудка и двенадцатиперстной кишки. М., «Медицина», 1972.
Облывач А. В. Шоковое легкое.— «Хирургия», 1978, № 9,
149—150.
Панченков Р. Т., Ярема И. В., П е н и н В. А. и др.
Реинфузия очищенной лимфы.— «Хирургия», 1976, № 7, 96—102.
Панченков Р. Т., С е м е н о в В. В., П о п о в Ю. П. и др.
Современные возможности диагностики и лечения острых кровотечений из верхних отделов пищеварительного тракта.— «Хирургия»,
1976, М>-5, 85—89.
Панченков Р. Т., В ы р е н к о в Ю. £., Ярема И. В.,
У р т а е в Б. М. Нарушение микролимфоциркуляции у больных
перитонитом.— «Хирургия», 1978, № 7, 147—151.
Пациора М. Д., Цацаниди К. Н., Шерцингер А. Г.,
Семенов В. С. Хирургическое лечение больных с кровотечением
из расширенных вен пищевода и желудка.—«Хирургия», 1974, №2,
3—8.
Пациора М. Д., £ р ш о в Ю. А., Шерцингер А. Г.
Хирургия портальной гипертензии.—Тезисы XV объединенного пле-
26?
s
нума Правлений Всесоюзного и Молдавского обществ хирургов.
Кишинев, 1976, 111—112.
Петров В. И. Клинико-рентгенологическая диагностика кишечной непроходимости. М:, «Медицина», 1964.
Петров Б. А., Гальперин Э. И. Хирургия внепеченочных
желчных протоков. М., «Медицина», 1971.
Петровский Б. В. Наш опыт в экстренной хирургии сосудов — «Хирургия», 1975, № 4, 9—13.
Пиковский Д. Л., Алексеев Б. В. Дренирование грудного лимфатического протока в лечении деструктивного панкреатита—«Хирургия», 1976, № 1, 107—113.
Попов А. С., Кондратьев В. Г. Очерки методологии
клинического мышления. Л., «Медицина», 1972.
Портной М. В., Царев Н. Б р а т а н ч у к Б. Ф.,
ШендриковЮ. М. О лечении аппендикулярного инфильтрата.—
«Вести, хир.», 1978, № 7, 23—26.
Постолов П. М. Применение ваготомии в лечении профузных язвенных кровотечений.— «Хирургия», 1973, № 7, 108—ИЗ.
Почечуев Е. А. Доброкачественные заболевания большого
дуоденального сосочка.— «Сов. мед.», 1977, № 10, 105—ПО.
Р а б к и н И. X., Милонов О. Б., П и щ и н Э. М., Сухомлина Р. А. Значение вариантов пузырного протока в хирургии
желчного пузыря.— «Хирургия», 1976, № 5, 103—108.
Р а ф е с Ю. И., К р Ь1 ш е н ь И. Ф. Клиническое применение
гормонов пищеварительного тракта. Киев, «Здоровье», 1974.
Рейнберг Г. А. Методика диагноза. М., 1951.
Рокицкий М. Р. Анализ врачебных ошибок.— «Казанский
мед. журн.», 1978, № 4, 1—5.
Савельев В. С., Савчук Б. Д., К У б ы ш к и н В. А.,
Л (? м и ш Г. Т. Перфузия и инфузия в лечении гнойного перитонита—«Хирургия», 1974, № 4, 3—9.
Савельев В. С., Спиридонов И. В. Тактика хирурга
и методика оперативного вмешательства при инфаркте кишечника.*— «Клин, хир.», 1974, № 2, 1—7.
СавельевВ. С., ЗатевахинИ. И., Степановы. В.
Принцип лечения больных с эмболиями бифуркации аорты и магистральных артерий конечностей. Метод, рекомендации. М., 1974.
Савельев В. С., Буянов В. М., Б а л.а л ы к и н А. С.
Эндоскопия органов брюшной полости. М., «Медицина», 1977.
Савельев В. С. (ред.). Руководство по неотложной хирургии органов брюшной полости. М., «Медицина», 1976.
Савельев В. С. (ред.). Экстренная хирургия органов
брюшной полости. М., 1977. >
Савельев В. С. (ред.). Тезисы V Всероссийского съезда
хирургов. Свердловск, 1978.
Савельев В. С., Гологорский В. А., Гельфанд Б. Р.
Септический шок у хирургических больных.— «Хирургия», 1976.
№ 6, 45-52.
Савчук Б. Д. Патогенетические основы хирургии и интенсивной терапии гнойного перитонита. Автореф. докт. дис. М., 1975г
С а л и х о в И. А. Некоторые патогенетические механизмы перитонита в организме с неизмененной и измененной иммуно-биологи ческой реактивностью. Автореф. докт. дис. Казань, 1970.
268
Сигал М. 3. Трансиллюминация при операциях на полых
органах. М., «Медицина», 1974.
Сигал М. 3., Розен га р ген М. Ю. Тактика хирурга
при острой кишечной непроходимости. Изд-во Казанского университета, Казань, 1976.
Сигал 3. М. Исследование кровяного давления и кровотока
в интрамуральных сосудах кишечника и други-х полых органов во‘
время операции. Автореф. докт. дис. Казань, 1977.
Симбирцев С. А., С т е р н и н М. О. Реанимация и интенсивная терапия при синдроме инцизионного сдавления.— «Вести,
хир.», 1973, N° 11, 97—101.
Симонян К. С. Перитониты. М., «Медицина», 1971.
Соколов А. М., Червяков И. В., Кофман Б. Л., Вере й н о в А. А. Дифференциальная диагностика синдрома позиционного сдавления и острого тромбофлебита конечностей.— «Хирургия», 1978, Лр9 8, 80—82.
Сотников В. Н., Багдасаров Г. А., Острин П. И.
др. Прямая холецистохолангиография под контролем лапароскопа
при хроническом холецистите.— «Хирургия», 1975, ЛГ« 10, 72—76.
Стручков В. И., Григорян А. В. Принципиальные вопросы хирургии острого холецистита.— Тезисы XV объединенного
пленума Правления Всесоюзного и Молдавского обществ хирургов.
Кишинев, 1976, 3—6.
Стручков В. И., Гостищев В. К. Трансфузионная терапия у больных с гнойной хирургической инфекцией.— «Хирургия», 1978, № 6, 118—123. ‘
Суровикин Д. М., Немченко В. И. Септический шок в
хирургической клинике.— «Вести, хир.», 1973, № 3, 126—129.
У теш ев Н. С., Богницкая М. Н., Сорокин В. А,
Летальность при прободном аппендиците.— «Казанский мед. жури»,
1975, N° 6, 42—44.
Феофилов Г. Л., Шишкина Т. Я, Муартов В. Д.
Анализ летальных исходов при ущемленных грыжах живота.—
«Вести, хир.», 1978, N° 11, 36—39.
Филатов А. Н. (ред). Кровезаменители. Л., Медицина,
1975.
Федоров В. Д. Лечение перитонита. М., «Медицина», 1974.
Филин В. И., Саламатин Б. Н. Постоянное промывание брюшной полости в сочетании с форсированным диурезом.—
«Вести, хир.», 1974, N° 1, 10—13.
Ф и л и н В. И., Шушков Г. Д., С т р а ш н и н а Н. К. Рабочая классификация и основные компоненты острого панкреатита.— Сборник трудов Ленинградского института скорой помощи
им. И. И. Джанелидзе. Л., 1973, 25—30.
Харитонов Р. К. Усовершенствование методики наложения
асептических элекгрохирургическнх концевых анастомозов на желудочно-кишечном тракте.— Материалы IV Всероссийского съезда
хирургов. Пермь, 1973, 215—216.
Ц ы б и н 10. Н., Гальцева И. В., Р а з у м о в а Н. К. Особенности трансфузионной терапии травматического шока.— В кн,:
Травматический шок, ред. М. П. Гвоздев. Л., 1977, 76—79.
Цыбуляк Г. Н. (ред.). Реаниматология. Л., «Медицина»,
1975.
269
Чаплинский В. В., Гнатышак А. И. Острый панкреатит. М., «Медицина», 1972.
Ч е п к и й Л. П., Ц е р т и й В. П. Кислотно-щелочной баланс
и газообмен при интенсивной терапии больных перитонитом.—
«Вести, хир.», 1977, № 5, 107—114.
Ш а а к Т. В. Ферментативный холецистит. Л., «Медицина»,
1974.
Шалаев М. И., Тишинская 3. В., Илатовская Т.Ф.
и др. Результаты лечения ущемленных наружных грыж живота.—
«Вести, хир.», 1978, № 10, 21—24.
Шалимов А. А., Саенко В. Ф. Хирургия желудка и двенадцатиперстной кишки. Киев, «Здоровье», 1972.
Шалимов А. А. Хирургия печени и желчных протоков. Киев,
«Здорцвье», 1975.
Шальков Ю. Л., Левендюк А. М., Р е в и н В. М.,
Нечитайло П. Е. Нарушение регионарного брыжеечного кровотока как причина функциональной кишечной непроходимости.—
«Вести, хир. нм. Грекова», 1976, т. 116, № 4, 55—60.
Шанин Ю. Н., Волков Ю. Н., К о с т ю ч е н к о А. Л. и
др> Послеоперационная интенсивная терапия. Л., «Медицина», 1978.
Шапкин В. С., Гриненко Ж. А. Закрытые и открьпые
повреждения печени. М., «Медицина», 1977.
Шкроб О. С., Кузин М. И. и др. Бактериальный шок.—
«Хирургия», 1976, № 6, 52—58. 4
Шушков Г. Д. Острый аппендицит. Методич. письмо. Л.,
1968.
Шушков Г. Д. Ущемленные грыжи. Методич. письмо. Л.,
1970.
Щербатенко М. К., Береснева Э. А. Неотложная
рентгенодиагностика острых заболеваний и повреждений органов
брюшной полости. М., «Медицина», 1977.
Эрли М. Микрореологические нарушения при хронической
окклюзии артерий: размышления в связи с новой терапевтической
концепцией.— Материалы симпозиума. М., 1977, 21—24.
Barnett W., Oliver R., Elliott R. Elimination of the lethal
properties of gangrenous bowel segments. — .Ann. Surg“., 1968,
v. 167, No. 6, 912— 919.
Borow M., Aquilisan L., KrauseA., StefanidisA.
The use of central venous pressure as an accurate guide for body
fluid replacement. — „Surg. Gynec. Obstet.-. 1965, v. 120, No. 3/
545 — 552.
Blair B., Wise A., Mackay A. Gram-negative bacteriemic
shock. — .JAMA-, 1969, v. 207, No. 2, 333 — 336.
Friedman G., Sloan W. Ishemic enteropathy.— .Surg. Clin.
N. Amer.\ 1972, v. 52, No. 4, 1001 — 1012.
Gay B., Hocht B., Bruch H., Arbogast R. Erste Erfah-
rungen mit der Endotoxin-bestimmung bei Patienten mil Per itonitis.
— „Chirurg*. 1976, Bd. 47,H. 6, 326 — 327.
G u l z о w M., Herzog K., Zastrov R. Diagnostik und The-
rapie der akuten Pankreatitis. — „Zbi. f. Chir.\ 1972, Bd. 97, H. 35.
1222 — 1234.
Hardaway R. Basis concepts in the management of shock* —
.Med. Bull. US Army-, Europe, 1968, v. 25, No. 9, 339 — 340.
Harrison L. H., H i n s h a w L. В., С о a l s о n J. J., G r e e n*
270
fild L. Effects of E. coli septic shock on pulmonary hemodynamics
and capillary permeability. — .J. Thorac. Cardiovasc. Surg* 1971,
v. 61. No. 5, 803
Hinkel M., Hoffman Ch., Teutsch W. Appendizitis 1965
bis 1971 eine Standortbestimmung. — .Zbl. f. Chir.*, 1974, Bd. 98, H.
47,1683— 1688.
(Hloucal L.) Глоуцал Л. Заболевания желчного пузыря и
желчных путей. Прага, 1967.
Holub К. Das Problem ber Gallenstenauflosung. — .Zbl. f.
Chir*., 1977, Bd. 102, H. 14, 833 — 838.
Irving M. H. Folia traumatologica Geigy. Traumatc shock.
Lonqon, 1973, 16.
KieneS., Troger H. Jntraperitoneale Antibiotikspuldrainage
bei diffuser Peritonitis. —,Zbl. f. Chir.*, 1974, Bd. 92, H. 27, 833 —
641.
Koch W. Die Dinamik bes Lymphflusses beim Hochdruck der
Pfortader. —.Zbl. f. Chir.-, 1967, Bd. 92, H. 15, 529 — 532.
Lebeen H. H., Diaz C., Falk O. A proposed method t*
interrupt gastrointestinal bleeding; preliminary report. — .Ann. Surg.*,
1977, v. 175, 459 — 463.
Lees N. W. The diagnosis and treatment of endotoxin shock.—
.Anaesthesia*, 1976, v. 31, No. 7, 897 — 909.
Lester W. Vascular insufficiency of intestine. — .Gastroenterology*, 1971, v. 61, No. 5, 757 — 777.
Marc hand M. Cholecystite aique, urgence chirurgicale.—
•Montpellier Chir.*, 1973, v. 19, No. 1, 71—74.
Miller R. Complications of massive blood transfusion. — Anaesthesiology*, 1973, v. 39, No 1, 824—93.
Nilsson I., Ber ge u t z S., Hedner U., К u 11 e n be r g K.
Gastric fibrinolysis. — .Thrombos. Diathes. haemorrh. (Stuttg.), 1975,
v. 34, 409 — 418.
(Raby С.) Pa б и К. Локализованная и рассеянная внутрисосудистая коагуляция, М., .Медицина*, 1974.
R о s о f f L., R о b b i n s F. Operative treatment of acute cholecystitis.— .Surg. Clin. N. Amer.*, 1973, v. 53, No 5, 1079— 1088.
(Ruczhjak J., Fdldi M., Szabo D) Русньяк И., Фельди M.,
Сабо Д. Физиология и патология лимфообращения. Будапешт.
1957.
Schmauss A. Akute, massive, obere Magen-Darmblutung. —
.Zbl. f. Chir.*, 1973, Bd. 98, H. 43, 1521 — 1531.
S e i i a r t W. Bedeutung der Diurese fiir den Verlauf der Peritonitis. — .Zbl. f. Chir.*, 1973, Bd. 98, H. 32, 1148 — 1151.
S e i f a г t W., Burkhardt G. Forsierte Osmodialise bei Peritonitis. — .Zbl. f. Chir.*, 1974, Bd. 99, H. 50, 1390—1393.
Sokhi G., Lang lad C. Early and delayed operation in acute
gallstone disease. — .Brit. J. Surg.*, 1973, v. 60, No 12, 937 — 939.
Wilson J. et al. Central venous pressure in optimal blood volume
maintainence. — .Arch. Surg.*, 1962, v. 85, 563 — 570.
(Weil M., Shubin H) Вейль M., Шубин Г. Диагностика
и лечение шока. М., .Медицина41, 1971.
Wassner U. Die Spill — Saugdrainage der nekrotisierenden
Pankreatitis. — .Der Chirurg.*, 1973, Bd. 44, H. 3, 139—140.
ОГЛАВЛЕНИЕ
Предисловие ........ 3
Глава I. Травматический шок . . . , , . 4
Глава II. Септический шок 29
Глава III. Синдром длительного раздавливания (СДР) . 36
Глада IV. Принципы диагностической и лечебной программы
в неотложной хирургии органов брюшной полости 44
Глава V. Острый аппендицит ....... 59
Глава VI. Острые заболевания внепеченочных желчных
путей ... ...... 75
Глава VII. Острый панкреатит . 125
Глава VIII. Прободные гастродуоденальные язвы . • . 150
Глава IX. Острые гастродуоденальные кровотечения • . 150
Глава X. Ущемленные наружные грыжи живота . . 182
Глава XI. Острая кишечная непроходимость .... 104
Глава XII. Острая артериальная непроходимость . . . 214
Глава XIII. Перитониты 230
Глава XIV. Дренирование грудного лимфатического протока
в неотложной хирургии 250
Литература . т . . . 263
Олег Сергеевич Кочнев
ХИРУРГИЯ НЕОТЛОЖНЫХ ЗАБОЛЕВАНИЯ
Редактор Л. Л. Биктимиров
Техн. редактор Г. М. Семенова
Обложка художника Б. А. Чукомина
Корректоры Э. А. Кузнецова, И. Г. Кондратьева. С. А. Петрова
ИБ № 510
Сдано в набор 11/XII-80 г. Подписано к печати 29/VII-81 г. ПФ 05072.
Формат бумаги 84хЮ8|/з2- Печ. л. 8,5 (14,28). Уч.-изд. л. 14,3.
Заказ М-843. Тираж 36 000 экз. Цена 1 р. 80 к.
Издательство Казанского университета
г. Казань, ул. Ленина, 2.
Полиграфический комбинат им. Камиля Якуба Государственного
комитета Татарской АССР по делам издательств, полиграфии
и книжной торговли. Казань, ул. Баумана, д. 19.