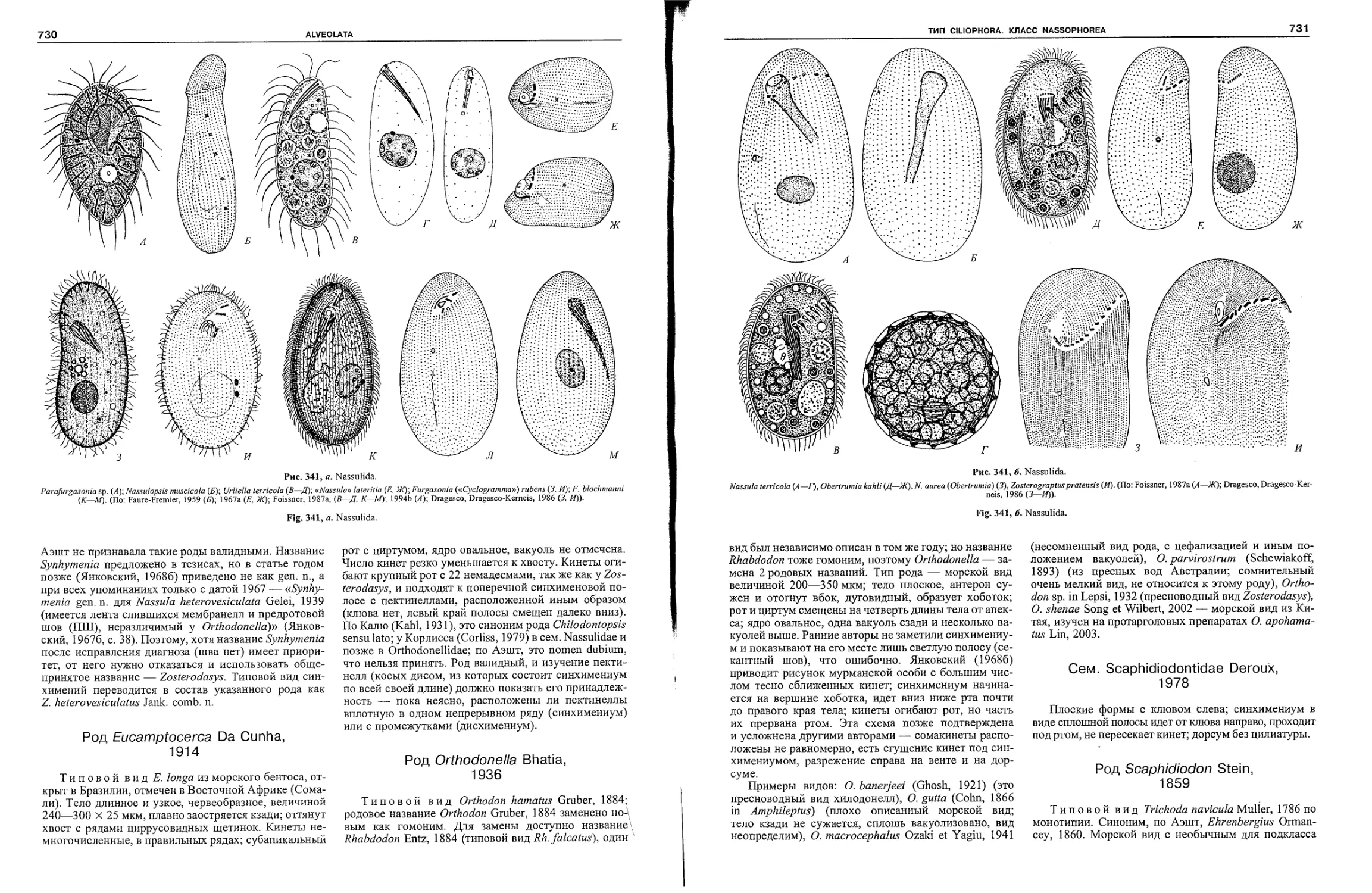
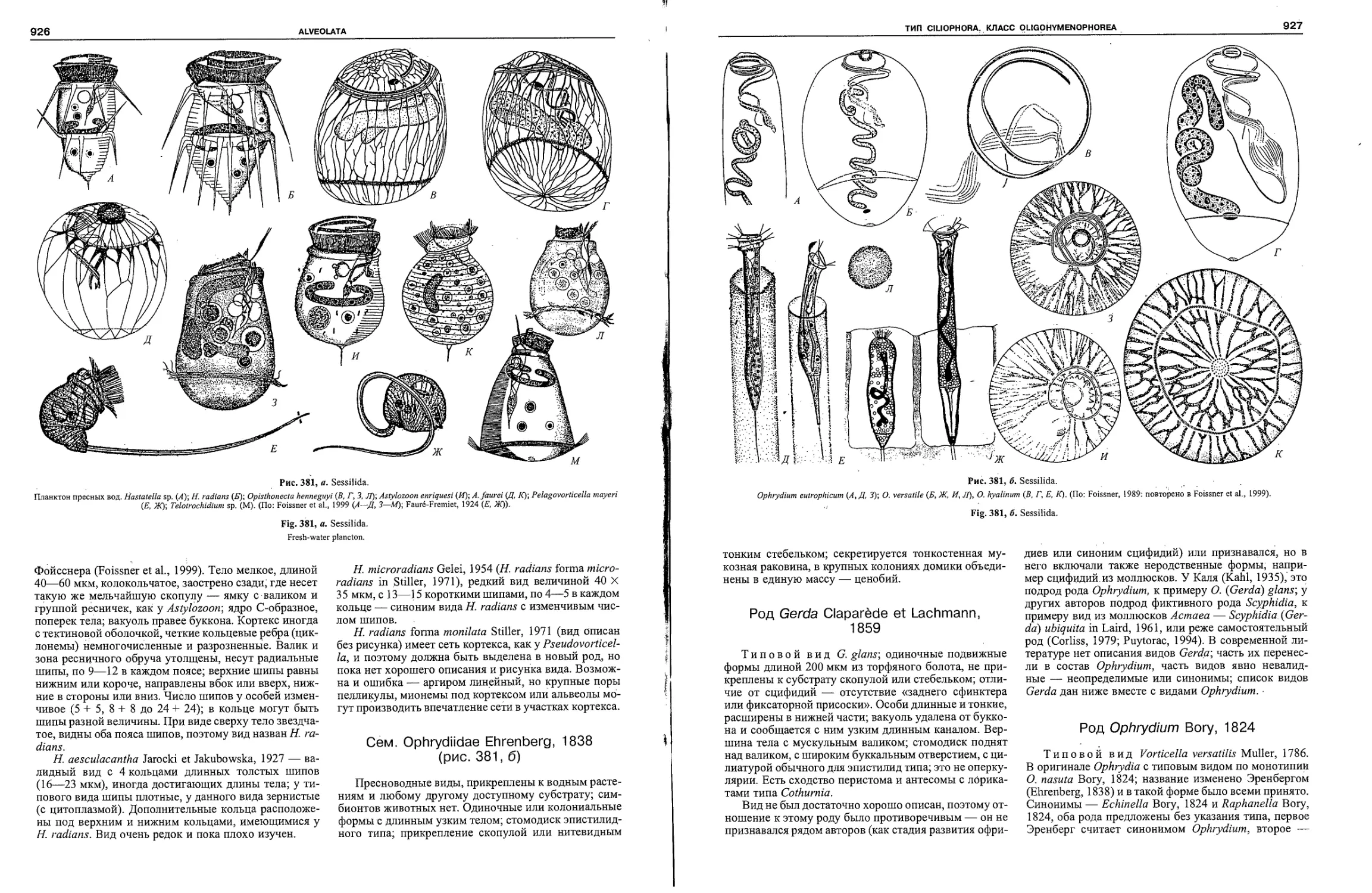
Автор: Пугачев О.Н.
Теги: биология зоология российская академия наук руководство по зоологии протисты анатомия эукариотов
ISBN: 978-5-02-026224-9
Год: 2007
Текст
1MI.‘.‘>1AN ACADEMY OF SCIENCES
Zoological Institute
PROTISTA
PART 2
HANDBOOK ON ZOOLOGY
в
ST. PETERSBURG
«NAUKA»
2007
РОССИЙСКАЯ АКАДЕМИЯ НАУК
Зоологический институт
ПРОТИСТЫ
ЧАСТЬ 2
РУКОВОДСТВО по зоологии
в
САНКТ-ПЕТЕРБУРГ
«НАУКА»
2007
\ ул v/i /
1.ы< ।
ПК '
11|н> । nt । i.i Г\мшо/к । но по зоологии. — СПб.: Наука,
ми»/ 'I ’ I 11-1 с
l.'.HN ')/Я > ().’ 026224-9 (Ч. 2)
IMIN К II.’
lliopaii часи. Руководства по зоологии «Протесты»
предо lanuiier собой фундаментальную сводку современных
.....ах данных ио четырем типам низших эукариот: спо-
ровикам, инфузориям, миксоспородиям и микроспоридиям.
В написании глав приняли участие ведущие российские
протозоологи. Материал изложен по единой схеме, позволя-
ющей получить исчерпывающую информацию по любому
из представленных таксонов от истории его изучения до но-
вейших представлений об эволюции и филогении. Система-
тическая часть каждой из глав содержит сведения по всем
входящим таксонам до рода включительно. Библиогр. 2485
назв. Ил. 428. Табл. 4.
Для зоологов всех специальностей, преподавателей ву-
зов и студентов.
Protista: Handbook on zoology. — St. Petersburg: Nauka,
2007. — Pt 2. — 1144 p.
ISBN 978-5-02-026224-9 (Pt 2)
ISBN 5-02-026258-7
The second part of the Handbook on Zoology entitled «Pro-
tista» is a fundamental review of the recent scientific data on
four phyla of the lower eucaryotes: Sporozoa, Ciliophora, My-
xozoa and Microsporida. The leading Russian protozoologists
participated in writing the chapters. The material is presented
according to a single scheme allowing the reader to obtain exha-
ustive information on any of the taxa represented, from the histo-
ry of its study to the latest conceptions of the evolution and phy-
logeny. The systematic part of each chapter contains information
on every taxon to a genus, inclusive. The references include
2485 titles. 111. 428. Plates 4.
The monograph is intended for zoologists of all specialties,
higher school teachers and students.
Главный редактор
директор Зоологического института РАН
академик РАН, проф. А. Ф. АЛИМОВ
Editor-in-Chicf
Director of Zoological Institute (Russian Academy of Science)
Prof. A. F. ALIMOV, Member of Russian Academy of Science
Редакционная коллегия:
M. В. КРЫЛОВ, О. Н. ПУГАЧЕВ, Л. Н. СЕРАВИН,
\Я. И. СТАРОБОГАТОВ |
Editorial Board:
М. V. KRYLOV, О. N. PUGACHEV. L. N. SERAVIN,
I Ya, I. STAROBOGATOV j
Научные редакторы:
M. В. КРЫЛОВ, А. О. ФРОЛОВ
Ответственный редактор
М. Н. МАЛЫШЕВА
Рецензенты:
Д. В. ОСИПОВ, С. О. СКАРЛАТО
S с i с n t i fi с Ed 11 о rs:
M. V. KRYLOV, A. O. FROLOV
Demanding Editor
M. N. MALYSHEVA
Reviewers:
D. V. OSIPOV, S. O. SKARLATO
Издание осуществлено при поддержке РФФИ по проекту № 04-04-62036
ISBN 978-5-02-026224-9 (Ч. 2)
ISBN 5-02-026258-7
© Российская академия наук, 2007
©Зоологический институт РАН, 2007
© Коллектив авторов, 2007
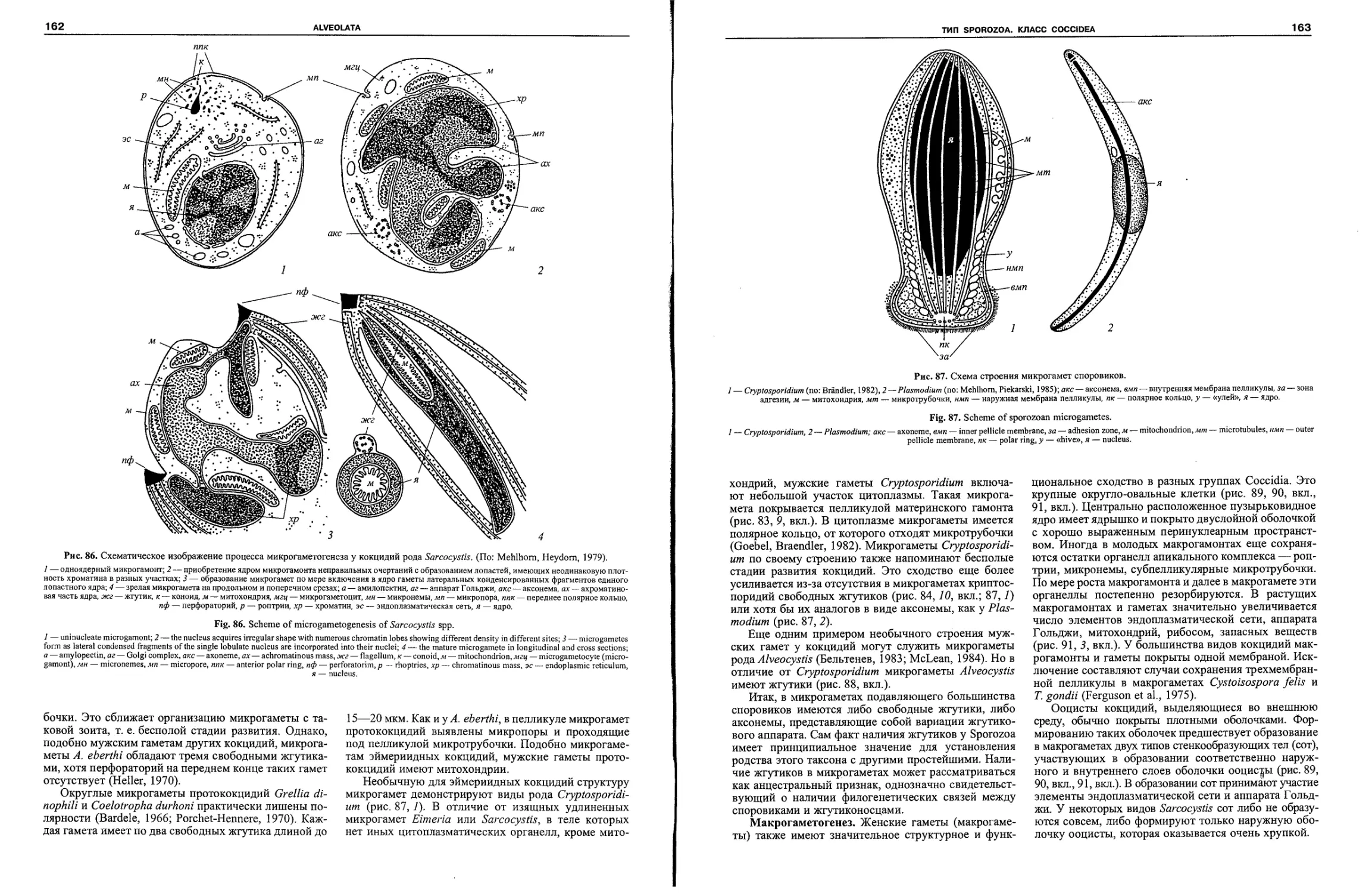
ALVEOLATA Cavalier-Smith, 1991
Протесты, покровы которых представлены пелликулой, вклю-
чающей плазмалемму и кортикальные альвеолы.
Альвеоляты объединяют три типа простейших:
споровиков (Sporozoa), динофлагеллят (Dinozoa) и ин-
фузорий (Ciliophora) (рис. 1). Своим возникновением
’>та группировка протистов обязана синтезу резуль-
татов ультраструктурных и молекулярно-биологиче-
ских исследований, ставшему возможным лишь в кон-
це XX в. Необходимо отметить, что в эпоху световой
микроскопии для объединения споровиков, динофла-
геллят и инфузорий не существовало никаких объек-
тивных предпосылок. Представители каждого из этих
макротаксонов характеризуются набором уникальных
признаков, доступных на световом уровне (Wenyon,
1926), которые в равной степени не позволят сближать
их как друг с другом, так и с любыми другими группа-
ми протистов. Для инфузорий к числу таких признаков
в первую очередь относятся ядерный дуализм и разви-
тая, сложно организованная цилиатура. Динофлагел-
ляты отличаются особой организацией ядерного аппа-
рата (динокарион), уникальной формой митоза (дино-
митоз) и особым набором пигментов. Для споровиков
наиболее характерным признаком считалось наличие в
жизненном цикле особых расселительнЫх стадий —
«спор». Представители этих трех типов протистов зна-
чительно отличаются и по образу жизни. Инфузории в
большинстве своем, являются свободноживущими фа-
готрофами, динофлагелляты преимущественно сво-
бодноживущие автотрофы, а споровики, как правило,
облигатно-паразитические организмы. Однако с конца
80-х гг. XX в. в литературе все чаще стали появлять-
ся результаты молекулярно-биологических исследо-
ваний, на итоговых схемах которых представители
трех типов протистов: споровики, динофлагелляты и
инфузории, с удивительным постоянством формиро-
вали устойчивые сестринские клады (рис. 1). Моле-
кулярно-биологические исследования инициировали
сравнительно-морфологический анализ этих на пер-
вый взгляд столь непохожих друг на друга групп про-
тистов (Cavalier-Smith, 1993). Выяснилось, что все они
обладают особым типом покровов — пелликулой.
Пелликула инфузорий, динофлагеллят и споровиков
формируется за счет плазмалеммы и расположен-
ных под ней альвеол — мешковидных структур,
стенки которых образованы гладким ретикулумом.
Альвеолы могут иметь разную форму и размер, они
могут быть представлены пузырьками или цистер-
нами, у споровиков альвеолы, например, сильно упло-
щены, что в свое время трактовалось как наличие у
них «внутреннего мембранного комплекса», подстила-
ющего плазмалемму. Наличие альвеолярного слоя
единственный морфологический признак, объединяю-
щий споровиков, динофлагеллят и инфузорий. Однако
новейшие молекулярно-биологические данные, осно-
ванные на исследовании различных генов (митохонд-
риальных, рибосомальных РНК, белков hsp, актина,
тубулина и т. д.), не оставляют сомнений в обоснован-
ности такого объединения (Leander, Keeling, 2003,2004).
Во втором томе «Руководства» будут рассмотрены два
из трех входящих в Alveolata типов протистов — спо-
ровики (Sporozoa) и инфузории (Ciliophora).
Тип SPOROZOA Leuckart, 1879 — СПОРОВИКИ
Гомоксенные и гетероксенные паразитические и свободно-
живугцие простейшие со сложным жизненным циклом развития.
Наличие в жизненном цикле спорогонии, мерогонии и гамогонии
характерно для большинства представителей типа. Общность пла-
на строения споровиков наиболее отчетливо проявляется на ста-
дии зоита. Покровы представлены пелликулой, под которой распо-
лагаются продольные (субпелликулярные) микротрубочки. Пелли-
кула формирует одну или множество микропор. На переднем
конце зоита локализованы органеллы так называемого «апикальио-
I о комплекса»; полярное крльцо (у некоторых споровиков иногда
имеется второе кольцо на дистальном полюсе), коноид, выводные
протоки роптрий и микронемы. Часть этих органелл у некоторых
групп споровиков может быть редуцирована, либо претерпевает
ряд морфологических и функциональных изменений. Ядро везику-
лярного типа. Митохондрии с трубчатыми или ампуловидными
кристами. У большинства споровиков, за исключением Colpodellea
и Agamococcidiida, в жизненном цикле обнаружен половой про-
цесс. Все стадии жизненного цикла, кроме зиготы, гаплоидны. Ре-
дукция хромосом происходит при первом зиготическом делении.
В настоящее время известно около 5000 видов и около 300 родов
6
ALVEOLATA
Slranienopila
Sporozoa
(включая Colpodella)
(включая Perkinsus,
Parvilucifera, Rastrimonas)
Dinozoa
Ciliophora
Рис. 1. Родственные отношения основных групп Alveolata. (По:
Kuvardina et al., 2002; Leander, Keeling, 2003, 2004).
Fig. 1. Phylogenetic relations between the main groups of Alveolata.
споровиков. Ряд представителей типа Sporozoa способны вызывать
тяжелые заболевания человека и животных. Особенно опасны ток-
соплазмоз и малярия человека, а также кокцидиозы и пироплазмо-
зы домашних животных.
История изучения
Впервые представителя споровиков, по всей види-
мости, увидел и описал Левенгук в 1674 г. В желчном
пузыре кролика он обнаружил ооцисты Eimeria stiedai.
Однако основные открытия, связанные с изучением
этой группы протистов, безусловно, приходятся на
вторую половину XIX в. В 1828 г. Дюфур (Dufour,
1828) опубликовал сообщение о грегаринах из кишеч-
ника уховерток. Множество различных видов кокци-
дий из разных групп животных было описано Эймером
(Eimer, 1870). В 1871 г. Ланкастер (Lankester, 1871) на-
шел в эритроцитах лягушки простейших, которых он
принял первоначально за инфузорий и назвал Undulina
ranaгит. Позже он отказался от своей первоначальной
точки зрения и поместил найденного им паразита в род
Drepanidium (=Dactylosoma) класса Sporozoa. В 1879 г.
Лейкарт (Leuckart, 1879) объединил кокцидий и грега-
рин в группу Sporozoa, не придав, однако, ей никакого
таксономического ранга. К споровикам Лейкарт отнес
одноклеточных, в жизненном цикле которых форми-
руются споры.
Одно из важнейших открытий в протозоологии
было сделано 6 ноября 1880 г. врачом французской ар-
мии Альфонсом Лавераном (Laveran, 1880). В Африке
он изучал происхождение малярийного пигмента и об-
наружил в крови пациента, больного малярией, эритро-
цитарные стадии развития Plasmodium falciparum. Си-
стематическое положение открытого им организма Ла-
веран определить не смог, семь лет спустя это сделал
И. И. Мечников (1887). Мечников отнес возбудителя
малярии к группе кокцидий и назвал его Haemophylium
malariae. Одним из важных событий в истории изуче-
ния споровиков явилась опубликованная в журнале
«Русская медицина» работа В. Я. Данилевского (1884)
«О паразитах крови (Haematozoa)». Открытие пиро-
плазм было сделано румынским исследователем Бабе-
шем (Babes, 1888). Правда, систематическое положе-
ние открытых им паразитов Бабеш определил неверно,
отнеся их к бактериям. Позднее Смит и Килборн
(Smith, Kilborn, 1893), обследуя животных, больных
«техасской лихорадкой», нашли у них в эритроцитах
организмы грушевидной формы, часто соединенные
попарно цитоплазматическими мостиками. Исследова-
тели назвали этих паразитов Pyrosoma bigemina (^Ba-
besia bigemina). Они доказали участие клещей в транс-
миссии этого заболевания и правильно определили
природу возбудителя, поместив его в тип Protozoa.
Следует особо подчеркнуть, что Смит и Килборн пер-
выми открыли способность кровососущих членисто-
ногих переносить простейших, паразитирующих в
клетках крови млекопитающих.
В 1890 г. Д. Л. Романовский предложил новый спо-
соб окраски простейших, стимулировавший дальней-
шие морфологические и фаунистические исследова-
ния споровиков. В различных модификациях этот ме-
тод успешно применяется до сих пор. Шаудин и
Сидлецкий (Schaudinn, Siedlecki, 1897) изучили гаме-
тогенез у кокцидий и показали формирование зиготы.
В это время в Индии военный врач Рональд Росс (Rose,
1895) изучал жизненный цикл возбудителя птичьей
малярии Plasmodium relictum (=Р. ргаесох) и блестяще
доказал перенос этого паразита комаром Culex fati-
gans. За эти исследования Росс был впоследствии удо-
стоен Нобелевской премии и получил дворянский ти-
тул в Англии. Практически одновременно с этим от-
крытием итальянский ученый Баттиста Грасси с соавт.
(Grassi et al., 1898) доказали передачу возбудителя ма-
лярии человека комарами из рода Anopheles.
В начале XX в. разными исследователями одновре-
менно и независимо друг от друга был описан возбуди-
тель токсоплазмоза — Toxoplasma gondii', в Африке —
у грызуна Ctenodactylus gondi (Nicolle, Manceaux,
1908) и в Бразилии — у кролика (Splendore, 1908). Ин-
тересно, что жизненные циклы саркоспоридий и ток-
соплазм были расшифрованы значительно позже опи-
сания самих паразитов: саркоспоридий — через 129
лет (Fayer, 1972), а токсоплазм — через 61 год (Hutchi-
son et al., 1969). Все перечисленные даты и события —
это лишь отдельные вехи в истории изучения спорови-
ков. Исчерпывающую информацию по этому вопросу
читатель найдет в главах, посвященных их конкрет-
ным группам.
Жизненные циклы
По разнообразию и сложности жизненных циклов
споровики, безусловно, занимают лидирующее поло-
жение среди всех протистов. В этом разделе мы огра-
ничимся характеристикой наиболее общей, «базовой»
модели жизненного цикла споровиков и рассмотрим
основные принципы ее модификации, реализующиеся
у различных представителей Sporozoa.
Схема базовой модели жизненного цикла спорови-
ков представлена на рис. 2. Заражение потенциального
ТИП SPOROZOA
7
Минина в большинстве случаев происходит при попа-
ДП1111П в его организм экзогенных стадий жизненного
цикла паразитов — ооцист (у большинства грега-
рип) или спороцист (у многих кокцидий). В ооци-
стах и спороцистах находятся инвазионные стадии
споровиков — спорозоиты. Под влиянием опреде-
ленных условий в кишечнике хозяина происходит вы-
ход спорозоитов из ооцист или спороцист (эксцисти-
рование). Свободные спорозоиты либо сразу проника-
ют в клетки хозяина, что характерно, например, для
кишечных кокцидий, либо совершают миграцию, под-
час значительную по протяженности, к месту своей
окончательной локализации, как это происходит у
ряда полостных грегарин. В циклах развития спорови-
ков реализуются как пассивный, так и активные спосо-
бы инвазии клеток хозяина. В первом случае паразиты
попадают внутрь определенных клеток хозяина в ре-
зультате их фагоцитарной активности. В случае актив-
ного проникновения зоиты либо пенитрируют плазма-
лемму клетки-мишени, либо индуцируют ее инвагина-
цию. В последнем случае спорозоит оказывается в
клетке хозяина внутри особой паразитофорной вакуо-
ли (Sam-Yelow, 1996; Бейер и др., 2003). Механизм
проникновения зонтов в клетки хозяев сопряжен со
сложными процессами, протекающими на биохими-
ческом уровне. В них задействован целый ряд мо-
лекулярных комплексов, ассоциированных с поверх-
ностными мембранами паразита и хозяина и осущест-
вляющих рецепторные, сигнальные и иные функции.
Внутри клетки хозяина спорозоит начинает актив-
но питаться и расти. Эта стадия получила название
трофозоита. Трофозоит по мере роста вступает в
следующую фазу жизненного цикла и трансформиру-
ется в меронта, чему предшествует серия ядерных де-
лений. Многоядерный меронт дает начало одноклеточ-
ным стадиям — мерозоитам. Бесполое размноже-
ние споровиков, связанное с эндогенной агломерацией
паразитов, получило название мерогонии. Часто в
зависимости от числа продуцируемых мерозоитов и
характера их закладки в меронте выделяют несколько
типов мерогонии: эндодиогению, когда внутри меро-
нта формируются два мерозоита, и эндополигению,
когда внутри меронта формируется множество (иногда
тысячи) мерозоитов. Некоторые авторы выделяют ши-
зогонию как особую форму мерогонии, при которой
будущие мерозоиты закладываются по периферии ме-
ронта (в этом случае его называют шизонтом), а их
обособление напоминает процесс почкования. Суще-
ствуют и другие, более частные варианты бесполого
размножения споровиков. В любом случае важно то,
что в процессе мерогонии одна особь паразита способ-
на дать начало целому поколению дочерних мерозои-
тов. Мерозоиты могут вновь проникать в клетки хозяи-
на и снова превращаться в многоядерные стадии —
меронты — с последующим образованием мерозоитов.
Циклы мерогонии могут повторяться несколько раз,
способствуя накоплению паразитов в организме хозяи-
на. Следующая фаза жизненного цикла споровиков
связана с подготовкой к половому процессу и его реа-
лизации. Мерозоиты превращаются в макро- и мик-
рогамонты. Микрогамонты продуцируют обычно
много микрогамет, макрогамонты — одну макрогаме-
ту (у кокцидий) или равное число гамет (у грегарин).
Рис. 2. Схема «базовой» модели жизненного цикла споровиков.
Fig. 2. Schema of a «basic» model of a life cycle of the Sporozoa.
Для большинства споровиков характерна анизогамная
копуляция, хотя известны примеры и изогамной, и
оогамной копуляции. Процесс слияния гамет заверша-
ется образованием инцистированной зиготы, которая
называется ооцистой. У всех споровиков зигота пре-
терпевает метагамное развитие или спорогонию, за-
канчивающуюся формированием спорозоитов. Число
спорозоитов в одной ооцисте в зависимости от вида
споровиков может варьировать от 1 до 3 тыс. и более.
При первом метагамном делении ядра зиготы происхо-
дит редукция хромосом. Таким образом, все стадии
развития споровиков, кроме зиготы, гаплоидны. Фор-
мированием ооцист завершается эндогенное развитие
споровиков. У многих представителей Sporozoa про-
цессы спорогонии протекают во внешней среде и час-
то очень растянуты во времени.
Приведенная модель жизненного цикла реализует-
ся у многих споровиков, особенно у кокцидий. Разли-
чия в числе генераций меронтов и репродуцируемых
ими мерозоитов (эндогенная продуктивность) и числе
формирующихся в ооцистах спорозоитов (экзогенная
продуктивность) носят более или менее частный ха-
рактер, хотя и широко используются в систематике
группы. Однако часто можно наблюдать и существен-
ные отклонения от этой схемы. Упрощение базовой
модели цикла у ряда групп Sporozoa связано с отсутст-
вием в нем одной из трех фаз размножения — обычно
мерогонии. Жизненный цикл, в котором отсутствует
фаза агамного размножения, характерен для Protococ-
cidiida и Eugregarinida. При этом у эугрегарин, напри-
мер, задача эндогенной агломерации паразитов пере-
кладывается с агамной на половую фазу их жизненно-
го цикла. Этого удается достичь благодаря трем
главным особенностям, отличающим грегарин от дру-
гих споровиков: наличию в их жизненном цикле ста-
дии гипертрофированного трофозоита, способного
впоследствии продуцировать большое количество га-
мет, раннее объединение будущих гамонтов в парные
ассоциации — сизигии и осуществление гамогонии и
8
ALVEOLATA
копуляция гамет и замкнуюм пространстве гаметоци-
сты. Усложнение жизненных циклов споровиков свя-
зано с включением в них не одного, а двух или более
хозяев.' )iо явление, получившее название гетероксен-
НОС1Н, особенно широко распространено среди крове-
наразнтов (Крылов, 1992). При включении в жизнен-
ный цикл паразита второго хозяина происходит про-
странственное разобщение его отдельных фаз, как
правило, это касается агамной и половой фаз цикла
(Крылов, 1992). Многочисленные примеры различных
модификаций базовой модели жизненного цикла спо-
ровиков будут подробно рассмотрены далее в главах,
посвященных конкретным группам этих протистов.
Морфофункциональная
организация зоита
Многообразие типов и форм сложных жизненных
циклов, присущих Sporozoa, сопряжено с удивитель-
ным разнообразием, наблюдаемым в организации ста-
дий их развития. Приспособление даже однопотент-
ных стадий, в том числе и у близких групп споровиков,
к одним и тем же условиям обитания в хозяине носят у
них зачастую уникальный характер. На этом фоне оче-
видным консерватизмом отличается организация рас-
селительных стадий споровиков — зонтов. Вероят-
но, это отчасти можно объяснить двумя причинами:
ограниченным кругом задач, решаемых на данной ста-
дии паразитом, главная из которых проникновение в
клетку хозяина, и относительной кратковременностью
существования данной стадии в организме хозяина, не
требующей сколько-нибудь существенных адаптивных
изменений в ее организации. Зоиты споровиков по сра-
внению с другими стадиями их жизненного цикла об-
ладают наиболее полным набором характерных для
этих протистов органелл, при этом организация последу-
ющих стадий развития связана с теми или иными пре-
образованиями исходного «зоитного» плана их строения.
Такие примеры будут подробно разобраны ниже, в гла-
вах, посвященных конкретным группам Sporozoa. Здесь
же мы рассмотрим обобщенную модель морфофунк-
циональной организации зоита споровиков (рис. 3).
Покровы зоита образованы пелликулой. Пел-
ликула включает плазмалемму, граничащую с
внешней средой, и внутренний мембранный
комплекс (субпелликулярные альвеолы), который
представлен уплощенными цистернами гладкого рети-
кулума. Внутренний мембранный комплекс подстила-
ет плазмалемму на всем ее протяжении, прерываясь
лишь на апикальном полюсе зоита, в местах формиро-
вания микропор и на дистальном полюсе, обычно
при наличии там второго полярного кольца.
Микропора представляет собой ампуловидное впя-
чивание плазмалеммы. Шейка такой ампулы с цито-
плазматической стороны обычно окружена двумя
кольцами электронно-плотного материала, а у ее дна
происходит активный эндоцитоз. Пузырьки, отшнуро-
вывающиеся в цитоплазму от дна микропоры, имеют
шиповатую поверхность за счет расположенного на их
поверхности белка клатрина. Микропора была впер-
вые описана Гарнемом с соавт. (Garnham et al., 1961) у
спорозоитов Plasmodium falciparam и названа ими
«микропиле». Термин «микропора» предложили поз-
же Вивье и Эннере (Vivier, Hennere, 1964). Сейчас
уже не вызывает сомнения тот факт, что микропора яв-
ляется специализированной органеллой питания пара-
зитических споровиков,своеобразным ультрацитосто-
мом. Однако обнаружение Крыловым и Мыльниковым
(1986) микропоры у представителей рода Colpodella,
ведущих свободный образ жизни, заставляет думать о
том, что она может выполнять и какие-то иные функ-
ции. Дело в том, что представители рода Colpodella —
хищники. Нападая на других жгутиконосцев, они при
помощи специальной органеллы — рострума —
перфорируют покровы своей жертвы и высасывают
содержимое ее клетки. Предположение о том, что на-
ряду с рострумом у Colpodella есть еще один «рот» —
микропора, кажется маловероятным.
Непосредственно под субпелликулярными альвео-
лами в цитоплазме зоита по направлению от переднего
конца клетки к заднему проходят субпелликулярные
микротрубочки. Они берут начало от переднего по-
лярного кольца и заканчиваются на уровне середины
клетки или чуть далее, никогда, однако, не достигая ди-
стального полюса зоита. Субпелликулярные микро-
трубочки выполняют, вероятно, структурно-опорные
функции, участие же их в обеспечении подвижности
зоитов споровиков не подтверждается пока экспери-
ментальными данными (Joiner, Dubremetz, 1993).
На апикальном и реже дистальном полюсах у зои-
тов располагаются электронно-плотные кольцеобраз-
ные структуры — полярные кольца. У зоитов не-
которых видов Sporozoa на апикальном полюсе имеет-
ся два полярных кольца, лежащих одно за другим.
Апикальное полярное кольцо, вероятно, является цен-
тром организации субпелликулярных микротрубочек
(Dyson et al., 1994). В плотный тонко фибриллярный
материал на его поверхности погружены их основа-
ния. Кроме того, многие исследователи отводят этим
структурам и опорную функцию.
Внутрь апикального полярного кольца входит пе-
редний конец конусообразной структуры, сформиро-
ванной спирально закрученными микротрубочками,
получившей название коноид (Gustafson et al., 1954).
Форма коноида у различных групп споровиков может
варьировать. Это — либо усеченный конус, либо
структура, по форме близкая к цилиндру. Толщина
стенки коноида определяется диаметром микротрубо-
чек, его внутренний диаметр может достигать 80, а
длина 120 нм. У многих видов споровиков коноид име-
ет два преконоидальных кольца. Преконоида-
льные кольца не следует путать с полярными. В ряде
случаев коноид и преконоидальные кольца покрыты
пологообразной мембраной с отверстием на вершине
коноида (Scholtyseck, Mehlhom, 1970). Иногда в про-
свете коноида обнаруживаются дополнительные пар-
ные микротрубочки. Коноид является мобильной ор-
ганеллой, способной к выворачиванию и обратному
втягиванию внутрь клетки. Этот процесс может быть
связан с выведением из клетки секрета роптрий, по-
скольку протоки последних открываются в общий ка-
нал, который формируется в просвете коноида. Однако
в целом функция коноида пока мало понятна. Считает-
ся, что коноид играет важную роль в стимулировании
ТИП SPOROZOA
9
инвагинации плазмалеммы клеток хозяина. Однако зо-
нты ряда видов споровиков проникают в них, не ори-
ентируясь к их поверхности своим передним концом,
несущим коноид. В то же время зонты некоторых пи-
роплазмид, лишенные коноида, при проникновении в
клетку хозяина строго ориентированы к ее поверхно-
сти своими передними концами.
Как уже отмечалось, с коноидом тесно связана еще
одна группа органелл «апикального комплекса» —
роптрии. Еще Густавсон с соавт. (Gustafson et al.,
1954) на заре электронно-микроскопических исследо-
ваний обнаружили на апикальном полюсе у зоитов To-
xoplasma gondii электронно-плотные тела, назвав их
«токсонемы». Позднее Гарнем с коллегами нашли у
Haemamoeba (—Plasmodium) gallinaceum аналогичные
образования и назвали их «парные органеллы». Даль-
нейшие исследования показали, что подобные струк-
туры встречаются у всех Sporozoa, а форма, количест-
во и пространственное расположение их варьируют.
Сено (Senaud, 1967) предложил для этих органелл но-
вый термин — роптрии, которым в настоящее время
пользуется большинство исследователей. Роптрии в
виде извилистых, булавовидных структур локализуют-
ся обычно в передней половине тела зоита. На попе-
речных срезах видно, что роптрии окружены одной
мембраной, а их профили выглядят как электрон-
но-плотные структуры различной формы, от округлой
до эллипсоидальной. Продольные срезы показывают,
что роптрии сужаются по направлению к апикальному
полюсу зоита.
Вокруг роптрий, в средней части клетки паразита и
даже на дистальном полюсе (Mehlhom, Schein, 1977),
располагаются мелкие электронно-плотные осмио-
фильные образования — микронемы (Jacobs, 1967).
Диаметр их варьирует, а количество непостоянно и мо-
жет достигать большого числа. Происхождение и фун-
кции роптрий и микройем требуют дальнейшего изу-
чения. По мнению Шолтизека и Мелхорна (Scholty-
seck, Mehlhom, 1970), роптрии и мИкронемы имеют
функциональную и структурную общность. Эта точка
зрения получила косвенное подтверждение благодаря
тому, что была установлена цитохимическая общность
секрета, обнаруженного в роптриях и микронемах цис-
тозоитов Toxoplasma gondii (Vivier, Petitprez, 1972).
Шолтизек и Мелхорн (Scholtyseck, Mehlhom, 1970) по-
лагают, что роптрии и микронемы — единый комп-
лекс. Секрет, который синтезируется в микронемах, по
их протокам доставляется к накопительным резервуа-
рам “ роптриям. Из роптрий по узким протокам,
открывающимся в районе полярного кольца, секрет
поступает в специальный канал, откуда выводится во
внешнюю среду. Предполагается, что фермент, проду-
цируемый комплексом роптрии—микронемы, способ-
ствует проникновению паразита в клетку хозяина.
Рудзинска (Rudzinska, 1976) обнаружила, что форми-
рование роптрий и микронем у зоитов Nicollia colesi
(=Babesia microti) связано с деятельностью аппарата
Гольджи. Таким образом, весьма вероятно, что в схе-
му, предложенную Шолтизеком и Мелхорном (Schol-
tyseck, Mehlhom, 1970), следует включить помимо
микронем и роптрий также и комплекс Гольджи. В по-
следнее время было показано, что секрет роптрий вы-
деляется и после проникновения паразита в клетку хо-
Рис. 3. Схема ультратонкой организации зоита споровиков.
аг — аппарат Гольджи, апк — апикальное Полярное кйльцо, апп — апико-
пласт, вмк — внутренний мембранный комплекс, дпк —- дистальное поляр-
ное кольцо, кн — коноид, ми — митохондрия, мн — микронемы, мп — мик-
ропора, пм — плазмаЛеМма, рпт — роптрии, смт — субпелликулярные
микротрубочки, я — ядро, яд — ядрышко.
Fig- 3. Schema of fine structure of a zooite of the Sporozoa.
аг — Golgi apparatus, апк — apical polar ring, вмк — inner membrane complex,
дпк — posterior polar ring, кн — conoid, mu — mitochondria, мн — microne-
mes, mn — micropore, пм —plasmalemma, pnm — rhoptry, смт — subpellicu-
lar microtubules, я — nucleus, Яд — nucleolus.
зяина, вероятно обеспечивая ему выживание в новых
условиях (Sam-Yellow, 1996).
Ядро зоита обычно располагается в средней части
клетки. Ядерная оболочка имеет выраженное перинук-
леарное пространство. Одно крупное ядрышко занима-
ет центральное положение. Кпереди от ядра локализу-
ется диктиосома аппарата Гольджи. Митохондрия, как
правило, одна, иногда слабо ветвящаяся. Кристы труб-
чатого типа — везикулярные или ампуловидные. В ци-
топлазме присутствует ретикулум обоих типов, много-
численные рибосомы, липидные капли, различные
включения.
10
ALVEOLATA
Одним из важных открытий конца прошлого—на-
чала нынешнего столетий стало доказательство при-
сутствия в клечках паразитических споровиков плас-
тид. Эти органеллы неоднократно обнаруживались
ранее и клетках различных споровиков в процессе
электронно-микроскопических исследований, однако
определить их природу не удавалось (McFadden, Wal-
ler, 1997). Органеллы, получившие сначала название
Гольджи-адъюнкта из-за локализации вблизи диктио-
сомы аппарата Гольджи, на ультраструктурном уровне
выглядят как мешковидные структуры, оболочка кото-
рых включает 4 концентрически расположенные мемб-
раны. В середине 70-х гг. в зонтах Plasmodium lophu-
гае возбудителе птичьей малярии — была обна-
ружена кольцевая ДНК (Kilejian, 1975), интуитивно
отнесенная ав тором к митохондриальному типу. Однако
последующие исследования показали, что митохонд-
риальная ДНК этих паразитов представлена линейной
молекулой размером 6 килобаз, тогда как обнаружен-
ная кольцевая молекула имела размер 35 килобаз. По-
следующий анализ нуклеотидных последовательно-
стей этой ДНК доказал ее прокариотную природу и
установил ее несомненное сходство с геномом пластид
автотрофных организмов (однако в сильно редуциро-
ванном виде) (Wilson et al., 1996). Было также доказа-
но, что этот геном приурочен к мультимембранной ор-
ганелле — Гольджи-адъюнкту (McFadden, Waller,
1997). Новая ДНК-содержащая органелла получила
название апикопласт. Показано, что апикопласт у
споровиков наследуется через макрогаметы (Marechai,
Ccsbron-Delauw, 2001). Установлена по крайней мере
часть функций апикопласта. Как и в пластидах расти-
тельных клеток, здесь вырабатываются ферменты,
контролирующие биосинтез изопренов и жирных кис-
лот (Jomaa, 1999). В русле популярной концепции сим-
биогенного происхождения пластид эукариотных
клеток апикопласт, учитывая наличие 4 мембран в его
оболочке, обычно рассматривают как продукт вто-
ричного эндобиоза (Vogel, 1997). Открытие гомолога
пластид автотрофных организмов у зоитов Sporozoa
открывает большие перспективы для изучения филоге-
нии этой уникальной группы протистов. Уже сейчас,
например, получены доказательства того, что апико-
пласт споровиков по своему происхождению наиболее
близок к пластидам динофлагеллят, страменопилов и
гаптофитов (Fast et al., 2001).
Классификация
Развитие представлений о ранге и названии таксо-
на, объединяющего споровиков, требует специального
рассмотрения: Sporozoa или Apicomplexa? Этот вопрос
уже давно вышел за рамки проблем синонимии и на-
прямую связан с определением качественного состава
таксона. Ранг таксона, объединяющего споровиков,
постоянно повышался от класса (Wenyon, 1926) до
подтипа (Grasse, 1953) и типа (Dobell, O'Connor, 1921;
Крылов, Добровольский, 1980). Уже ранние исследо-
вания но изучению ультраструктуры простейших по-
казали, что споровики имеют общий план строения,
центральным признаком которого является наличие
органелл «апикального комплекса». В той или иной
степени полно этот план строения реализуется у раз-
ных стадий жизненного цикла споровиков в различ-
ных их группах. На основании этих данных известный
американский протозоолог Норман Ливайн (Levine,
1970) присвоил группе протистов, обладающих орга-
неллами «апикального комплекса» (т. е. споровикам),
название Apicomplexa, придав этому таксону ранг под-
типа. После того как Перкинс (Perkins, 1976) нашел ха-
рактерные для споровиков органеллы у свободных
жгутиковых стадий Dermocystidium marinum — пара-
зита устриц Crassostera virginica, Ливайн (Levine,
1978) поместил эти организмы в отдельный класс Per-
kinsea, в подтипе Apicomplexa, повысив затем (Levine
et al., 1980) ранг последнего до типа.
На основании очевидного морфологического
сходства свободноживущих жгутиковых стадий пер-
кинсей со споровиками им сразу была отведена роль
анцестральной группы, связывающей облигатно-пара-
зитических Sporozoa с их гипотетическими свободно-
живугцими предками (Levine, 1978; Крылов, Добро-
вольский, 1980). Вскоре, однако, были обнаружены
свободноживущие организмы — кольподеллы (=спи-
ромонасы), подобно перкинсидам обладающие вполне
развитым набором характерных органелл «апикально-
го комплекса» и двумя жгутиками (Brugerolle, Mignot,
1979; Foissner, Foissner, 1984). Таким образом, выстро-
илась довольно стройная гипотеза филогении большой
группы организмов (Apicomplexa), обладающих еди-
ным планом строения и демонстрирующих практи-
чески полный эволюционный ряд переходов от сво-
бодноживущих форм к паразитическим (Крылов,
Добровольский, 1980; Крылов, Мыльников, 1986, Ca-
valier-Smith, 1993). В последующие 10 лет, однако,
произошли события, которые существенно изменили
эти взгляды. Наряду с углубленным изучением ультра-
структуры различных кольподеллид (Мыльников,
1991, 2000; Simpson, Patterson, 1996; Мыльников и др.,
1998; Brugerolle, 2002) появились описания новых ви-
дов жгутиконосцев, обладающих достаточно разви-
тым «апикальным комплексом», но при этом несущих
целый ряд признаков, которые сближают их с дино-
флагеллятами в большей степени, чем с кольподелла-
ми. Речь идет в первую очередь о жгутиконосцах из
родов Parvilucifera и Rastrimonas (=Cryptophagus) (No-
ren et al., 1999; Brugerolle, 2001). Наряду с некоторыми
различиями в организации жгутикового аппарата, ме-
ханизмах питания и строении органелл «апикального
комплекса» было показано, например, что если у коль-
поделл митоз протекает по характерному для спорови-
ков полузакрытому внутриядерному типу, то у Rastri-
monas он реализуется по типу диномитоза, т. с. как за-
крытый митоз с внеядерным митотическим веретеном
(Brugerolle, 2001, 2002). Результаты молекулярно-
биологических исследований однозначно указали на
сборный характер таксона Apicomplexa (рис. 1). Еще
в 1993 г. Кавалье-Смит (Cavalier-Smith, 1993) обратил
внимание на то, что по данным сиквенса генов малой
субъединицы 18S рибосомальной РНК Perkinsus за-
частую оказывался ближе к динофлагеллятам, чем к
морфологически более близкой нм группе Sporozoa.
Последующие исследования подтвердили этот фено-
мен. Причем включение в анализ кольподелл привело
к окончательному расхождению двух групп жгутико-
ТИП SPOROZOA. ЛИТЕРАТУРА
11
носцев, обладающих органеллами «апикального комп-
лекса». Perkinsus, Parvilucifera и позднее Rastrimonas
отошли в качестве сестринских групп к кладе, объеди-
няющей динофлагеллят, тогда как Colpodella, очевид-
но, тяготела к кладе, объединяющей споровиков (Sid-
dall et aL, 1997; Kuvardina et aL, 2002; Leander, Keeling
2003; Leander et al., 2003). Таким образом, в филогении
(а как следствие и в систематике) всех затронутых
групп на данный момент создалась следующая ситуа-
ция. Совершенно ясно, что тип Apicomplexa Levine,
1970 в его прежнем понимании должен прекратить
свое существование, поскольку часть организмов, об-
ладающих «апикальным комплексом», оказывается за
его пределами, в типе Dinozoa. В настоящее время не-
возможно сформулировать диагноз, который позволил
бы объединить динофлагеллят и споровиков в одном
таксоне, оперируя принятыми морфологическими тер-
минами. Однако именно между этими двумя группами
и распределены по современным данным свободно-
живущие организмы, обладающие «апикальным комп-
лексом» органелл. По всей вероятности наличие
«апикального комплекса» следует рассматривать как
плезиоморфный признак, отражающий уровень орга-
низации, который был присущ общим предкам дино-
флагеллят и споровиков (рис. 1). На этом фоне вполне
обоснованным выглядит возврат в настоящее время к
первоначальному названию типа Sporozoa для таксона,
объединяющего наряду с грегаринами и кокцидиями
свободноживущих хищных жгутиконосцев, — кольпо-
делл.
В этом издании принята следующая классификация
споровиков:
Тип Sporozoa Leuckart, 1879
Класс Colpodellea (Kussakin, Drozdov, 1998)
Отряд Colpodellida Cavalier-Smith, 1993 (=Spiromona-
dida Krylov, Mylnikov, 1986)
Класс Gregarinea Grasse, 1953
Отряд Schizogregarimda Leger, 1900
Отряд Eugregarinida Leger, 1900
Gregarinea incerta sedis
Отряд Blastogregarinida Chatton et Villeneuve, 1936
Класс Coccidea Leuckart, 1879
Подкласс Coccidia Leuckart, 1879
Отряд Agamococcidiida Levine, 1979
Отряд Ixorheida Levine, 1984
Отряд Protococcidiida Cheisin, 1956
Отряд Adeleida Leger, 1911
Отряд Eimeriida Leger, 1911
Отряд Haemosporida Danilewsky, 1885
Подкласс Piroplasmia Levine, 1961
Отряд Piroplasmida Wenyon, 1926
ЛИТЕРАТУРА
Бейер T. В., Свежова Н. В., Радченко А. И., Сидоренко
Н. В. Пути формирования и разнообразие паразитофорных вакуо-
лей у паразитических простейших. Кокцидии (Sporozoa, Apicomp-
lexa) // Цитология. 2003. Т. 45. С. 339—357.
Данилевский В. Я. О паразитах крови (Haematozoa) // Русск.
мед. 1884. № 46. С. 948—949.
Крылов М. В. Происхождение гетероксенности у Sporozoa //
Паразитология. 1992. Т. 26. С. 361—368.
Крылов М. В., Добровольский А. А. Макросистема и фи-
логения споровиков // Тр. ЗИН АН СССР. Л., 1980. Т. 94. С. 62—74.
Крылов М. В., Мыльников А. П. Новые таксоны в типе Spo-
rozoa, Spiromorphina subcl. n., Spiromonadida ordo n. // Паразитоло-
гия. 1986. T. 20, вып. 6. C. 425—430.
Мечников И. И. К изучению малярии // Русск. мед. 1887.
№ 12. С. 207—210.
Мыльников А. П. Ультраструктура и биология некоторых
представителей отряда Spiromonadida (Protozoa) И Зоол. журн.
1991. Т. 70, вып. 7. С. 5—15.
Мыльников А. П. Новый морской хищный жгутиконосец
Colpodella pontica (Colpodellida, Protozoa) // Зоол. журн. 2000. Т. 79,
вып. 2. С. 261—266.
Мыльников А. П., Мыльникова 3. М., Цветков А. И. Ульт-
раструктура хищного жгутиконосца Colpodella edax П Биология
внутренних вод. СПб., 1998. Т. 3. С. 55—62.
Романовский Д. Л. К вопросу о строении чужеядных маля-
рий//Врач. 1890. №52. С. 1171—1173.
Babes V. Sur I'hemoglobinurie bacterienne du Boeuf // Comp.
Rend. Acad. Sci. Paris. 1888. T. 107. P. 692—694.
Brugerolle G. Cryptophagus subtilis: a new parasite of cryptophy-
tes affiliated with the Perkinsozoa lineage // Europ. J. Protistol. 2001.
Vol. 37. P. 379—390.
Brugerolle G. Colpodella vorax: ultrastructure, predation, li-
fe-cycle, and phylogenetic relationships // Europ. J. Protistol. 2002. Vol.
38. P. 113—125.
Brugerolle G., Mignot J. P. Observations sur le cycle 1'ultrastruc-
ture et la position systematique de Spiromonas perforans (Bodo perfo-
rans Hollande, 1938), flagella parasite de Chilomonas paramaecium:
ses relation avec les dinoflagelles et sporozoaires // Protistologica. 1979.
T. 15. P. 183—196.
Cavalier-Smith T. Kingdom Protozoa and its 18 Phyla // Microbi-
ol. Rev. 1993. Vol. 57. N 4. P. 953—994.
Dobell C., O'Connor F. W. The intestinal Protozoa of man. L., 1921.
Dyson J., Grahame J., Evennett P. J. The apical complex of the
gregarine Digyatum oweni (Protozoa, Apicomplexa) II J. Nat. Hist.
1994. Vol. 28. P. 1—7.
Dufour L. Note sur la Gregarine, nouveau genre de Ver qui vit en
troupeau dans les intestines de divers Insectes U Annales des Sciences
naturelies. 1828. Vol. 13. P. 366—368.
Eimer T. Uber dieei-und Kugelborinigen Sogenanuten Psorosper-
mien der Wirbelthieri // Wurzburg. 1870.
Fast N. M., Kissinger J. C., Roos D. S., Keeling P. J. Nuclear-en-
coded, plastid-targeted genes suggest a single common origin for api-
complexan and dinoflagellate plastids // Mol. Biol. Evol. 2001. Vol. 18.
P. 418—426.
Fayer R. Gametogony of Sarcocystis in cell culture // Science.
1972. Vol. 175. P. 65—67.
Foissner W., Foissner I. First record of an ectoparasitic flagellate
on ciliates: an ultrastructural investigation of the morphology and
the mode of attachment of Spiromonas gonderi nov. spec. (Zoomasti-
gophora, Spiromonadidae) invading the pellicle of ciliates of the genus
Colpoda (Ciliophora, Colpodidae) // Protistologica. 1984. T. 20.
P. 635—648.
Garnham P., Baker I., Birf R., Bray R. Electron microscope stu-
dies of motile stages of malaria parasites. II. The fine structure of the
sporozoites of Laverania (Plasmodium) falcipara // Trans. Roy. Soc.
Trop. Med. Hyg.. 1961. Vol. 55. P. 98—102.
Grasse P.-P. Classe des Gregarinomorphes // Traitc de Zoologie.
Vol. 1, Fasc. 2 / Ed. P.-P. Grasse. Paris, 1953. P. 550—690.
Grassi G., Bigmani A., Bastianelii G. Ulteriori riccrche sul ciclo
dei parasiti malarici umani nel corpo del zanzaronc. (Nota prelimina-
re) 1/ Atti. R. Accad. Lincei. Rendic. 1898.
Gustafson P. V., Agar H. D., Cramer D. J. An electron microsco-
pe study of Toxoplasma // Amer. J. Trop. Med. Hyg. 1954. Vol. 3.
P. 1008—1021.
Hutchison W. M., Dunachie J. F., Slim J. Chr., Work K. Life
cycle of Toxoplasma gondii // Brit. Med. J. 1969. Vol. 4. P. 806.
Jacobs L. Toxoplasma and toxoplasmosis // Advs. ParasitoL Lon-
don, 1967. Vol. 5. P. 1—45.
Joiner K. A., Dubremetz. J. F. Toxoplasma gondii: a protozoon
for nineties // Infect. Immunol. 1993. Vol. 61. P. 1169—1172.
Jomaa H. Inhibitors of the nonmcvalonatc pathway of isoprenoid
biosynthesis as antimalarial drugs // Science. 1999. Vol. 285. P. 1573—
1576
Kilejian A. Circular mitochondrial DNA from the avian malarial
parasite Plasmodium lopliuroe // Biochim. Biophys. Acta. 1975.
Vol. 390. P. 276 -284.
ALVEOLATA
К и i hi iIIiih ll.l iiinili'i II., A les hiii V., Mylnikov A., Keeling P.,
‘ilinih niiiii I. Ilu I'liyliii'eiiy nl (olpodellids (Alveolata) Using Small
‘ lul и и 111 I It NA < iriii' Si'i|iiences Suggests They are the Free-living Sister
< lump In Aplrmnplr.xims II J. Eukaryot. Microbiol. 2002. Vol. 49(6).
Г -I'lH Mil.
I uinkesler E. On Undulina the type of a new group of infusoria //
i.linnI. .1. Microscop. Sci. 1871. Vol. 11. P. 387—389.
Laveran A. Note sur un noveau parasite trouve dans le sang de plu-
sicurs malades atteints de fievre palustre // Bull. Acad. Med. Paris. 1880.
T. 9. S. 1235—1296.
Leuckart R. Die Parasiten des Mcnschen und die von ihnen her-
ruhrenden Krankheiten // Leizig—Heidelberg, 1879. S. 336.
Leander B. S., Keeling P. J. Morphostasis in alveolate evolution //
Trends Ecol. Evol. 2003. Vol. 18. P. 395—402.
Leander B. S., Clopton R. E., Keeling P. J. Phylogeny of gregari-
nes (Apicomplexa) as inferred from SSU rDNA and beta-tubulin // Int.
J. Syst. Evol. Microbiol. 2003(a). Vol. 53. P. 345—354.
Leander B. S., Kuvardina O. N., Aleshin V. V., Mylnikov A. P.,
Keeling P. J. Molecular Phylogeny and Surface Morphology of Col-
podella edax (Alveolata): Insights into the Phagotrophic Ancestry
of Apicomplexans // J. Eukaryot. Microbiol. 2003. Vol. 50. P. 334—
340.
Leander B. S., Keeling P. J. Early evolutionary histoiy of Dinofla-
gellates and apicomplexans (Alveolata) as inferred from hsp90 and ac-
tin phylogenies // J. Phycol. 2004. Vol. 40. P. 341—350.
Levine N. D. Taxonomy of the Sporozoa II J. Parasitol. 1970.
Vol. 56. P. 208—209.
Levine N. D. Perkinsus gen. n. and other new taxa in the Protozoan
phylum Apicomplexa // J. Parasitol. 1978. Vol. 64. P. 549.
Levine N. D., Corliss J. О., Cox E. F., Deroux G., Grain J., Ho-
nigberg S. M., Leedale G. F., Loeblich A. R., Lorn J., Lunn D., Me-
rinfeld E. G., Page F. C., Poljansky G., Sprague V., Vavra J., Walla-
ce F. G. A newly revised classification of the Protozoa // J. Protozool.
1980. Vol. 27. P. 37—58.
Marechai E., Cesbron Delauw MF. The apicoplast: a new mem-
ber of the plastid family//Trends Plant Sci. 2001. Vol. 6. P. 200—205.
McFadden G. I., Reith M., Munholland J., Lang-Unnasch N.
Plastid in human parasites // Nature. 1996. Vol. 381. P. 482.
McFadden G. I., Waller R. F. Plastids in parasites of humans //
BioEssays. 1997. Vol. 19. P. 1033—1040.
Mehlhorn H., Schein E. Electron microscopic studies of the deve-
lopment of kinetes in Theleria annulata Dschunkowsky et Luhs, 1904
(Sporozoa, Piroplasmea)//J. Protozool. 1977. Vol. 24. P. 249—257.
Nicolle C., Manceaux L. Sur une infection a corps de Leishman
(on organismes voisins) du gondi // Compt. Rend. Acad. Sci. Paris.
1908. T. 147. S. 763—766.
Noren F., Moestrup O., Rehnstam-Holm A.-S. Parvilucifera in-
fectans Noren et Moestrup gen. et sp. nov. (Perkinsozoa phylum nov.): a
parasitic flagellate capable of killing toxic microalgae // Europ. J. Protis-
tol. 1999. Vol. 35. P. 233—254.
Perkins F. O. Zoopores of the oyster pathogen, Dermocystidium
marinum. I. Fine structure of the conoid and other sporozoan-like orga-
nelles // J. Parasitol. 1976. Vol. 62. P. 959—974.
Ross R. The crescent-sphere flagella metamorphoses of the malaric
parasite in the mosquito // Trans. Soc. Indian. Branch. Brit. Med. Assoc.
1895. Vol. 6. P. 334.
Rudzinska M. A. Ultrastructure of intraerythrocytic Babesia mic-
roti with emphasis on the feeding mechanism // J. Protozool. 1976. Vol.
23. P. 224—233.
Sam-Yellow T. Y. Rhoptry organelles of the Apicomplexa: their
role in host cell invasion and intracellular survival // Parasitol. Today.
1996. Vol. 12. P. 308—316.
Schaudinn F., Siedlecki M. Beitrage zur Kentnis der Coccidien H
Verh. Dtsch. Zool. Ges. 1897. S. 192.
Scholtyseck E., Mehlhorn H. Ultrastructural study of characteris-
tic organelles (paired organelles, micronemes, micropores) of Sporozoa
and related organisms // Z. Parasitenk. 1970. Bd 34, H. 2. S. 97—127.
Senaud J. Contribution a 1'etude des sarcosporidies et des toxoplas-
mes (Toxoplasmea) // Protistologica. 1967. T. 3. P. 170—232.
Siddall M. E., Reece K. S., Graves J. E., Burreson E. M. «Total
evidence» refutes the inclusion of Perkinsus species in the phylum Api-
complexa//Parasitol. 1997. Vol. 115. P. 165—176.
Simpson A. G. B., Patterson D. J. Ultrastructure and identificati-
on of the predatory flagellate Colpodella pugnax Cienkowski (Apicom-
plexa) with a description of Colpodella turpis n. sp. and a review of the
genus// Systematic Parasitology. 1996. Vol. 33. P. 187—198.
Smith T., Kilborn F. Investigations into the nature causation and
preventation of Texas or southern cattle fever // U. S. Dep. Agr. Bur.
Anim. Indus. Bull. 1893. N 1. 01P.
Splendore A. Un nuovo protozoa parassita de'sonigli incontrato
nelle lesioni anatomiche d'uno malattia ehe ricorda in molti punti il kala
azar dell'uomo // Rev. Soc. Sci. S. Paulo. 1908. T. 3. S. 109—112.
Vivier E., Hennere E. Etude a'laide du microscope electronique
des trophozoites de la coccidie Coeltropha durchoni // J. Microscopie.
1964. T. 3. P. 57—58.
Vivier E., Petitprez A. Etude du systeme vacuolaire de 1'hemato-
zoaire Anthemosoma garnhami a 1'aide des coupes series et de reconstri-
tutions tradimensionnelles U J. Ultrastr. Res. 1972. T. 41. P. 219—237.
Vogel G. Parasites shed light on cellular evolution // Science. 1997.
275. P. 1422.
Wenyon С. M. Protozoology. L., 1926. Vol. 2.
Wilson R. J. M., Denny P. W., Preiser P. R., Rangachari K.,
Roberts K., Roy A., Whyte A., Strath M., Moore D. J., Moo-
re P. W., Williamson D. H. Complete gene map of the plastid-like
DNA of the malaria parasite Plasmodium falciparum // J. Mol. Biol.
1996. Vol. 261. P. 155—172.
Класс Co I pod el lea (Kussakin, Drozdov, 1998)
Свободноживущие, хищные споровики, трофические стадии
обладают двумя жгутиками, размножаются в цистах.
Класс объединяет небольшую группу хищных жгутиконосцев,
обитающих в почве, в пресной и в морской воде с различными
уровнями солености, в очистных сооружениях. Характерной чер-
той кольподелл являются способ их питания и размножения: напа-
дая на жертву (мелких жгутиконосцев или инфузорий), они при-
крепляются к ее плазмалемме клювовидным рострумом и букваль-
но высасывают содержимое клетки, оставляя, как правило, лишь
фрагменты покровов со жгутиками или ресничками. После пита-
ния жгутиконосцы инцистируются и дважды делятся, формируя
четыре дочерние особи.
Свое место в системе протистов кольподеллиды обрели отно-
сительно недавно. Впервые идею о возможной близости этих жгу-
тиконосцев к споровикам или паразитическим динофлагеллятам
высказали Бружероль и Миньо (Brugerollc, Mignot, 1979), основы-
ваясь на анализе ультраструктуры Colpodella perforans (=Spiromo-
nas perforans). Годом позже Крылов и Добровольский, обсуждая
филогению и макросистему споровиков, напишут: «Систематиче-
ское положение Spiromonas perforans пока остается недостаточно
ясным, возможно это представитель большой самостоятельной
группы ранга класса...» (Крылов, Добровольский, 1980), а еще
Heel |> лет спустя Крылов и Мыльников впервые оформят статус
колкиолеллид (--еппромонадид) в ранге самостоятельного подклас-
са Spiromorphina (Крылов, Мыльников, 1986) в типе Sporozoa.
В дальнейшем ранг этого таксона будет меняться в зависимости от
взглядов того или иного исследователя на макросистему в целом:
отряд Colpodellida у (Cavalier-Smith, 1993); семейство Colpodelli-
dae у (Simpson, Patterson 1996, 2000); класс Colpodelliodes у Куса-
кина и Дроздова (1998). Однако сама идея выделения кольподел-
лид в ранге крупного самостоятельного таксона в рамках типа Spo-
rozoa останется неизменной.
История изучения
История изучения кольподеллид, хотя и насчиты-
вает без малого полтора столетия, не отмечена сколь-
ко-нибудь яркими событиями и динамичностью. По-
жалуй, наибольший интерес в этом аспекте представ-
ляет проблема синонимии родовых названий
организмов, на разных этапах включавшихся в состав
ныне признанного рода Colpodella Cienkowski, 1865.
Центральное место в этом ряду принадлежит, безу-
ТИП SPOROZOA. КЛАСС COLPODELLEA
13
словно, роду Spiromonas Perty, 1852. Именно к нему на
протяжении многих десятилетий относили большую
чисть тех жгутиконосцев, которых сегодня мы называ-
ем кольподеллами. Паттерсону и Золффелу пришлось
провести настоящее расследование, чтобы восстано-
вить цепь событий, приведшую к этой путанице (Pat-
terson, Zolffel, 1991). Выяснилось, в частности, что ро-
довое название Spiromonas Perty, 1852 было использо-
вано независимо многими авторами для самых разных
жгутиконосцев. Самое интересное, что типовой вид
рода ,5. volubilis Perty, 1852, судя по оригинальному ри-
сунку и крайне скудному описанию, оказался при этом
не жгутиконосцем, а по всей вероятности, даже и не
протистом. Следовательно, использование родового
названия Spiromonas для любых жгутиконосцев было
ошибочным с самого начала. Для хищного жгутико-
носца, высасывающего свою жертву, название Spiro-
monas впервые было предложено Алексеевым. Этот
организм был сначала описан им под названием Alpha-
monas edax Alexeieff, 1924. Алексеев полагал, что это
разновидность Bodo edax (Klebs, 1892), хотя и не обна-
ружил у него вентральную бороздку, описанную Клеб-
сом. Позже Алексеев без объяснения упомянул тот же
самый организм как Spiromonas angusta (Alexeieff,
1929). С этого момента в род Spiromonas Perty, 1852
стали помещать жгутиконосцев, обладающих сход-
ным пищевым поведением. Впрочем, наряду с ними в
этот таксон попадали и другие организмы. Дюжардин
(Dujardin, 1841) описал слегка извитого жгутиконосца,
обладающего двумя жгутиками, как Heteromita angus-
ta. Алексеев (1929) использовал данное название как
базионим Spiromonas angusta, позднее этот организм
был переведен в род Dingensia (Patterson, Zolffel,
1991). Скуя (Skuja, 1939) предложил название Spiromo-
nas для ригидного организма с отчетливой вентраль-
ной бороздкой, в которой проходит рекуррентный
жгутик, а позднее сам предложил родовое название
Cryptaulax для этих организмов (Skuja, 1948). Сквор-
цов описал неидентифицируемого жгутиконосца, с
двумя апикальными жгутиками и округлым телом, как
Spiromonas spirogyrae (Skvortzow, 1957), указав при
этом, что им предложено новое родовое название, чем
еще более усугубил путаницу. В разное время к спи-
ромонадам относили представителей таких родов,
как Dimastigella, Bodo, Cyclidium и др. Вместе с тем
часть хищных жгутиконосцев, высасывающих свою
жертву и размножающихся делением внутри цист,
оставались в других таксонах, как например Bodo са-
udatus sensu Stein 1878, Bodo edax sensu Hanel 1979,
Bodo celer, Dinomonas vorax sensu Kent 1881, Nephro-
monas hyalina (Droop, 1953, Mylnikov 1983, 1986b; Жу-
ков, Мыльников, 1983). Разрешение столь запутанной
ситуации стало возможным лишь после того, как род
Spiromonas Perty, 1852 был признан невалидным (Pat-
terson, Zolffel, 1991), а ревизия ранее входивших в его
состав протистов позволила объединить хищных жгу-
тиконосцев с характерным пищевым поведением и
размножением в рамках рода Colpodella Cienkowsky,
1865. Типовой вид Colpodellapugnax был описан Цен-
ковским (Cienkowski, 1865) как пожиратель Chlamydo-
monas с ошибочным указанием на наличие у него
единственного жгутика. Организм был повторно ис-
следован Штейном (Stein 1878), который описал у него
два жгутика и деление в цистах. Ревизия рода Colpo-
della на основании современных данных с учетом всех
особенностей биологии, жизненных циклов и уль-
траструктурной организации кольподелл была выпол-
нена Симпсоном и Паттерсоном (Simpson, Patterson,
1996).
Классификация
В настоящее время классификация кольподеллид
выглядит следующим образом:
Класс Colpodellea (Kussakin, Drozdov, 1998)
Отряд Colpodellida Cavalier-Smith, 1993 (=Spiromonadida Kry-
lov, Mylnikov, 1986)
Сем. Colpodellidae Simpson, Patterson, 1996
В семействе единственный типовой род Colpodella
Cienkowsky, 1865.
Морфофункциональная
организация
В световом микроскопе клетки кольподеллид име-
ют обычно удлиненно-овальную или яйцевидную фор-
му тела, с характерным заостренным передним кон-
цом — рострумом (рис. 4, А). Длина тела у разных ви-
дов жгутиконосцев варьирует обычно от 7—10 до
18—25 мкм (Simpson, Patterson, 1996). Размеры и фор-
ма тела кольподелл в пределах одного вида существен-
но различается у голодных, сытых, молодых и зрелых
особей. У основания рострума и несколько сбоку от
него находятся два неглубоких впячивания, обычно
располагающихся одно за другим, — жгутиковые кар-
маны, из которых выходят два жгутика. В культуре
Colpodella edax недавно были обнаружены особи, об-
ладающие тремя жгутиками (Leander et aL, 2003). Эти
данные получены при исследовании поверхности жгу-
тиконосцев в сканирующем электронном микроскопе.
Происхождение и судьба таких трехжгутиковых кле-
ток пока остаются неясными, как собственно и приро-
да их третьего жгутика. У большинства кольподелл
оба жгутика имеют примерно одинаковую длину, од-
нако у Colpodella edax, например, жгутики различают-
ся по длине почти в 2 раза (Мыльников и др., 1998).
Чаще жгутики кольподелл гетеродинамные, однако у
Colpodella vorax равные по длине жгутики направлены
к заднему концу клетки (рис. 4, A) (Brugerolle, 2002).
Ядро имеет более или менее сферическую форму и ле-
жит в середине клетки или несколько сдвинуто к ее пе-
реднему концу (рис. 4, А). У пресноводных и почвен-
ных видов в переднем конце клетки заметна сократи-
тельная вакуоль. Расширенная задняя часть тела
жгутиконосцев обычно занята одной крупной пищева-
рительной вакуолью (редко несколькими более мелки-
ми). Характерная вентральная бороздка обнаружена
только у одного вида.у Colpodella edax (Мыльников
и др., 1998). Тонкостенные цисты кольподелл имеют
сферическую форму, их диаметр варьирует от 5 до
12—15 мкм. Внутри цисты в зависимости от степени
ее зрелости можно наблюдать от 1 до 4 ядер (редко 2
14
ALVEOLATA
Рис. 4. Морфология кольподсллид.
/1 — некоторые представители рода Colpodellcr. а — С. pontica, б —
С. angusta. в — С. edax, г — С. pugnax. с) — С. vorax, в — С. turpis; Б,
В — ультраструктурная организация колыюделлид: Б — схема строе-
ния жгутиконосца В. edux\ В — схема строения рострума В. vorax на
поперечных срезах; бр — вентральная бороздка, зж — задний жгу-
тик. кек — кииетосомальньш корешок, ко — коноид, ми — митохонд-
рии. мн - мпкронемы, мп — микропора, нж — передний жгутик.
не — пищеварительная вакуоль, р — рострум, ро — роптрии, св — со-
кратительная вакуоль, тр — трихоцисты, я — ядро, емт — субиел-
ликулярные трубочки. (А, Б— по: Мыльников и др., 1998; Мыльни-
ков. 2000. с изменениями: В — по: Brugerollc. 2002, с изменениями).
Fig. 4. The morpology of colpodellids.
A — some colpodellids. light microscopy; Б, В — the schemes of the ult-
rastructure organization of colpodellids; op — ventral groove, зж — po-
sterior flagellum, кек — kinetosomal rootlet, ко conoid, mu — mitoc-
hondrion, мн — microneme. мп — micropore, пж — anterior flagellum,
ne — digestive vacuole, p — rostrum, po — rhoptry, ce — contractile va-
cuole, (-мт — - subpcllicu lar microtubules, mp — trichocysts, я — nucleus.
ТИП SPOROZOA. КЛАСС COLPODELLEA
15
или более 4) или уже сформировавшихся жгутико-
носцев.
На электронно-микроскопическом уровне (рис. 4, Б, В)
морфология кольподелл, как неоднократно отмечалось
многими исследователями, демонстрирует высокую
степень сходства с морфологией паразитических спо-
ровиков (Brugerolle, Mignot, 1979; Foissner, Foissner,
1984; Крылов, Мыльников, 1986; Simpson, Patterson,
1996, Brugerolle, 2002). Покровы кольподелл представ-
лены типичной пелликулой с различной степенью
развитости альвеолярных структур. Продольные суб-
пелликулярные микротрубочки хорошо развиты на
переднем конце клетки, но практически полностью
отсутствуют в задней половине тела жгутиконосцев.
Пелликула пронизана микропорами, которые пред-
ставляют собой инвагинацию плазмалеммы, окружен-
ную цилиндром электронно-плотного материала. В ба-
зальной части микропор альвеолярные мембраны от-
сутствуют. В этой области осуществляется эндоцитоз
(Мыльников, 1991). Два жгутика расположены суб-
апикально и выходят из разделенных жгутиковых кар-
манов (рис. 4, Б), в стенке которых также расположе-
ны микропоры. Данные о тонком строении жгутиково-
го аппарата кольподелл довольно противоречивы, что
в значительной степени объясняется разной степенью
изученности отдельных их видов. Кинетосомы имеют
типичное строение, они залегают под значительным
углом друг к другу. Основания кинетосом сближены и
соединяются, по данным разных авторов, тяжами элек-
тронно-плотного материала, фибриллами или мульти-
ламеллярными структурами (Brugerolle, Mignot, 1979;
Мыльников, 1991; Мыльников и др., 1998, Simpson,
Patterson, 1996, 2000, Brugerolle, 2002).
Корешковая система жгутиков кольподелл изуче-
на очень слабо. Наиболее полное ее описание дано
Бружероллем для Colpodella vorax (Brugerolle, 2002).
У этих жгутиконосцев обнаружены три микротрубоч-
ковых корешка. Один из них принадлежит передней
кинетосоме, содержит 3 микротрубочки и проходит
под плазмалеммой соответствующего жгутикового
кармана по направлению к переднему концу клетки.
Два других корешка отходят от задней кинетосомы.
Относительно короткий корешок из 2—3 микротрубо-
чек направлен к заднему концу клетки, другой, назван-
ный Бружероллем «наклонным», представлен лентой
из 6—7 микротрубочек. Этот корешок направлен к пе-
реднему концу жгутиконосцев и залегает в субпелли-
кулярной зоне. Минуя передний жгутиковый карман,
«наклонный корешок» проходит в рострум, не дости-
гая, однако, его вершины. Мыльников описал наличие
2—3 лент микротрубочек с похожей топологией у изу-
ченных им видов кольподелл, однако их связь с ки-
нетосомами не обнаружил (Мыльников, 1991, 2000;
Мыльников и др., 1998). Переходная зона жгутиков
относительно длинная, характеризуется наличием ци-
линдра. Центральные микротрубочки аксонемы ба-
зальной частью упираются в небольшую, но хорошо
выраженную аксосому. Для ряда видов, таких как Col-
podella perforans и Colpodella vorax, описано наличие в
жгутиках настоящих параксиальных тяжей (Brugerolle,
Mignot, 1979; Brugerolle, 2002). У С. angusta в базаль-
ной части ундулиподии переднего жгутика имеется
утолщение. В этом месте на поперечных срезах замет-
но наличие плотного материала в пространстве между
аксонемой и плазмалеммой жгутика (Мыльников,
1991), который также может соответствовать паракси-
альной структуре. У большинства изученных видов
кольподелл жгутики гладкие, однако у Colpodella edax
плазмалемма переднего жгутика несет на своей поверх-
ности простые нетрубчатые мастигонемы (рис. 4, Б)
(Мыльников, 1991), подобные мастигонемы обнаруже-
ны в базальной части переднего жгутика С. pontica
(Мыльников, 1991).
Органеллы апикального комплекса представлены у
кольподелл коноидом, полярным кольцом, роптриями
и микронемами (рис. 4, Б, В). Полярное кольцо в виде
аморфного, электронно-плотного материала, подсти-
лающего плазмалемму вершины рострума, найдено у
единственного вида С. pugnax (Simpson, Patterson, 1996).
Коноид также расположен в роструме (рис. 4, Б, В).
Его микротрубочки формируют конусовидную фигу-
ру, обращенную основанием к заднему концу клетки.
На поперечных срезах видно (рис. 4,В), что микротру-
бочки коноида не образуют замкнутого кольца. Их ко-
личество у разных видов варьирует от 4 до 30. Каждая
микротрубочка коноида имеет 2 «ручки», которые сое-
диняют соседние синглеты с наружной стороны коль-
ца. Вершина коноида располагается субапикально, но
не упирается в поверхность рострума, которая в этой
зоне представлена одной плазмалеммой. Внутри коно-
ида расположены секреторные органеллы — роптрии
и микронемы. Их количество у разных видов кольпо-
делл варьирует от нескольких до 30—50.
При прикреплении вершины рострума С. vorax к
телу жгутиконосцев Bodo spp.. в его апикальной зоне
появляются дополнительные кольцевые микротрубоч-
ки, располагающиеся под плазмалеммой. В зоне кон-
такта плазмалемма жертвы резорбируется, а плазма-
лемма хищника контактирует непосредственно с цито-
плазмой пожираемого жгутиконосца. Роптрии в этой
зоне отсутствуют, однако выявляются пучки микро-
нем, упирающиеся непосредственно в плазмалемму.
В зоне контакта формируются каналы, по которым ци-
топлазма жертвы поступает в пищеварительную ваку-
оль, расположенную в задней части клетки.
Митохондрии кольподелл имеют трубчатые или
визикулярные кристы (рис. 4, Б). Их профили много-
численны и создается впечатление, что у этих жгути-
коносцев имеется единая митохондриальная сеть (Bru-
gerolle, 2002). Непосредственно под пелликулой у ряда
видов кольподелл обнаруживаются стрекательные ор-
ганеллы — трихоцисты (рис. 4, Б). Они состоят из
аморфной головки и кристаллоида. Выстрелянные
трихоцисты демонстрируют поперечную исчерчен-
ность (Мыльников, 1991). Комплекс Гольджи имеет
типичную организацию, одна или несколько его дик-
тиосом располагаются вблизи ядра, которое обычно
расположено в центре клетки. Ядра кольподелл вези-
кулярного типа, с крупным центральным ядрышком
(рис. 4, Б).
После завершения питания жгутиконосцы инци-
стируются. Этот процесс связан с округлением клетки,
формированием стенки цисты и серией ядерных деле-
ний, завершающейся формированием 4 дочерних осо-
бей. На ультраструктурном уровне морфогенез ин-
цистированных особей подробно изучен у С. vorax
16
ALVEOLATA
(Brugerolle, 2002). В центре округленной клетки жгу-
тиконосца располагается крупная пищеварительная
вакуоль. Ядро дважды делится путем полузакрытого
внутриядерного митоза. ЦОМТы веретена расположе-
ны у основания кинетосом. Микротрубочки веретена
подходят к ядерной оболочке с двух полюсов, заметно
ипвагипируя ее, и проникают внутрь ядра, вероятнее
всего через ядерные поры. Таким образом, формирует-
ся центральное митотическое веретено. По заверше-
нии ядерных делений проходит цитокинез, приводя-
щий к появлению четырех молодых особей, которые
имеют полный набор клеточных органелл, характер-
ных для кольподелл. По данным Бружеролля (Bruge-
rolle, 2002), коноид дочерних особей имеет вдвое
меньшее число микротрубочек. На светооптическом
уровне Бружеролль, как и некоторые другие авторы
(Simpson, Patterson, 1996), описывает последователь-
ное формирование сначала двух, а затем четырех осо-
бей в цисте, однако на электроннограмме (fig. 6а, Bru-
gerolle, 2002) показана четырехъядерная материнская
особь с отпочковывающимися зонтами.
Жизненные циклы
Жизненные циклы различных видов кольподелл
протекают в целом по единой схеме (рис. 5, А), вклю-
чающей две фазы: питание и размножение. Питающие-
ся зоиты активно перемещаются в водной среде в
поисках жертвы. Движение осуществляется по спи-
ралевидной траектории. Сам механизм обнаружения
жертвы пока неизвестен, однако то, что этот процесс
носит случайный характер, маловероятно. С одной сто-
роны, на это указывает узкая пищевая специфичность
ряда видов кольподелл (Brugerolle, Mignot, 1979; Fois-
sner, Foissner, 1984; Simpson, Patterson, 1996). В естест-
венных условиях при относительно низкой плотности
организмов в окружающей среде хищник тем не менее
обнаруживает именно тот вид простейших или водо-
рослей, который способен удовлетворить его пищевые
потребности. Наблюдения за поведением кольподелл,
атакующих мелких инфузорий, также подтверждают
это предположение. Если в момент начала питания
отогнать хищника от его жертвы, то он довольно скоро
вновь обнаруживает ее и вновь начинает пожирать до-
бычу. Более того, если поблизости есть другие особи,
занятые поиском добычи, они также вскоре соберутся
около поедаемой инфузории. Возможно, однако, что у
разных видов кольподелл способность к целенаправ-
ленному поиску и узнаванию добычи развита неодина-
ково. Так, Мыльников установил, что С. angusta в ку-
льтуре без видимого предпочтения удовлетворяет свои
пищевые потребности за счет различных видов мелких
кинетопластид и хризомонад, а С. edax, хотя и атакует
всех этих жгутиконосцев, но питается только на хризо-
монадах (Мыльников, 1991). Интересно поведение
морской кольподеллы С. pontica в насыщенной куль-
туре Bodo sorokini (Kinetoplastida). Кольподеллы ак-
тивно плавают среди бодонид, атакуют их, а также
друг друга. Контакты носят кратковременный харак-
тер. «Укушенные» бодониды вскоре перестают дви-
гаться и округляются, тогда как на самих хищников
нападение сородичей не оказывает видимого воздейст-
вия. Погибающие, обездвиженные бодониды стано-
вятся объектом нападения кольподелл, которые при-
крепляются к телу жертвы рострумом и в считаные ми-
нуты высасывают содержимое клетки, оставляя от нее
лишь небольшой фрагмент плазмалеммы с двумя жгу-
тиками.
Обычно, кольподеллы питаются несколько раз,
прежде чем вступить в следующую фазу жизненного
цикла. Исключение составляют виды, питающиеся на
крупных инфузориях. В последнем случае кольподел-
лы могут насыщаться даже не вызывая гибели «хозяи-
на», в силу чего в литературе за ними утвердилась ре-
путация эктопаразитов. Сытые особи инцистируются
(рис. 5, А). Оболочка цисты тонкая, лишенная каких-
либо дополнительных структур. В цисте жгутиконос-
цы округляются, теряют способность к движению.
Подготовка к размножению связана с перевариванием
заглоченной пищи и занимает несколько часов. Обыч-
но у кольподелл описывают двукратное деление мате-
ринской особи и формирование 4 дочерних клеток
(рис. 5, а). Однако иногда описывают выход из цисты
2 жгутиконосцев (Simpson, Patterson, 1996; Мыльни-
ков и др., 2000). В цисте С. performs изначально было
описано формирование тетрады дочерних особей (Bru-
gerolle, Mignot, 1979), однако в работе, посвященной
изучению С. vorax, Бружеролль сообщает о формиро-
вании большего чем 4 числа зоитов в цистах С. perfo-
rms (Brugerolle, 2002). Две из описанных в литературе
стадий развития кольподелл не укладываются в приве-
денную обобщающую схему. У двух морских кольпо-
делл С. pugnax и С. pontica в световом микроскопе
описаны «цисты покоя», более мелкие и плотные, чем
те, в которых происходит размножение жгутиконосцев
(Simpson, Patterson, 1996; Мыльников, 2000). Мыльни-
ков сообщает, что такие цисты устойчивы к высыха-
нию. Однако морфогенез жгутиконосцев, связанный
как с формированием таких цист, так и с выходом из
них, пока не изучен. Другим неясным моментом био-
логии кольподелл является объединение особей по-
парно, часто описываемое различными авторами. Сое-
динение происходит передними концами клеток. Сим-
псон и Паттерсон проводили эксперимент, помещая
морских кольподелл С. pugnax и С. turpis в одну чашку
Петри, после чего наблюдали попарное объединение
передними концами только у особей одного вида и
Рис. 5. Жизненный цикл и филогения кольподеллид.
А — схема жизненного цикла Colpodella edax\ Б -— филогения кольподеллид по данным сиквенса гена рибосомальной РНК малой субъединицы; рж — ре-
куррентный жгутик, р — рострум, ж — жертва, остальные обозначения, как на рис. 4 (А — по: Мыльников и др., 1998; Мыльников, 2000, с изменениями;
Б — по: Leander et al., 2003).
Fig. 5. The life cycle and phylogeny of colpodellids.
A — the scheme of the life cycle of Colpodella edax\ Б — the phylogeny of Colpodellids using small subunit rRNA gene sequences; рж — recurrent flagellum, p —
rostrum, ж — victim. For other designations see fig. 4.
ТИП SPOROZOA. КЛАСС COLPODELLEA
17
2 Зак. №4163
39 '
45
28
36
61
32
96
94
96
68
73
77 L
26 r
56
81Ti-
iJ-i
84
58
52
51 57 24 31
32
30
32
loo ।------Theileria buffeli
100 I------Bebesia gibsoni
100 I— Caryospora bigenetica
_ 100 I—Eimeria alabamensis
—^2— Toxoplasma gondii
-----------Selenidium terebellae
100 I---------------------------Monocystis agilis
10° I----------Ophryocystis elektroscirrha
-----Cryptosporidium serpentis
।-----------Marine parasite from Tridacna crocea
I--------------------------------------Marine clone from Ammonia beccarii
-------Environmental sequence (AF372772)
----Environmental sequence (AF372785)
I Colpodella edaxl
100 ।-----------Environmental sequence (AF372786)
Юб I------------Colpodella sp. (ATCC 50594)
%— Colpodella pontica
------------Perkinsus marinus
--------------Noctiluca scintillans
------«Cryptoperidiniopsis brodyi»
_ r—Amphidinium semilunatum
1----------------Prorocentrum emarginatum
--------Gyrodinium dorsum
I--Dinophysis norvegica
4j--------------Kryptoperidinium foliaceum
----Durinskia baltica
----------Eukaryote clone OLIII005
------------------------------------Amoebophrya sp.
Parvilucifera infectans
Hematodinium sp.
Б
18
ALVEOLATA
даже использовали такой термин, как «репродуктив-
ная изоляция» (Simpson, Patlerson, 1996). Бружеролль
сообщает о том, что в таких парах происходит слияние
цитоплазмы, и, вероя тно, справедливо предполагает на-
личие еще одной! сексуальной фазы развития в жизнен-
ном цикле этих жгутиконосцев (Brugerolle, 2002).
Филогения и эволюция
Вопрос о филогении и эволюции кольподеллид
остается пока одним из самых сложных и запутанных в
протистологии. Объективно это связано с все еще сла-
бой изученностью самих кольподелл и тех организмов,
сравнение с которыми необходимо в первую очередь
при разработке филогении группы: перкинсид, низших
и паразитических динофлагеллят, архигрегарин и про-
тококцидий. Безусловно, довольно сложно на данном
этапе преодолеть инерцию концепции «Apicomplexa»,
еще недавно считавшейся бесспорной и до сих пор
очень влиятельной (по крайней мере в терминологии).
Нельзя, однако, забывать, что эта концепция целиком
и полностью базировалась на сравнительно-морфо-
логических данных. Действительно, если рассматри-
вать филогению «Apicomplexa» без учета результатов
современных молекулярно-биологических исследова-
ний, то мы получим очень простую и логичную схему,
структуру которой будут определять главным образом
два параметра: образ жизни организмов и степень раз-
витости у них «апикального комплекса». В основании
такого древа окажутся свободноживущие жгутиконос-
цы из родов Colpodella и Rastrimonas, обладающие
слабо развитым апикальным комплексом. Следующую
позицию займут паразитические организмы, имеющие
свободноживущие жгутиковые стадии. Это представи-
тели родов Parvilucifera и Perkinsus, апикальный комп-
лекс которых также недостаточно развит. Крону тако-
го гипотетического древа образуют грегарины и кок-
цидии — облигатные паразиты, зоиты которых имеют
полный набор органелл апикального комплекса (изве-
стные примеры вторичной утраты тех или иных орга-
нелл у «высших» споровиков, естественно, в расчет не
принимаются).
С точки зрения сравнительной морфологии в этом
ряду пока обнаруживается только одно противоречие.
Совсем недавно был изучен митоз у жгутиконрецев,
располагающихся в основании такого древа (Brugerol-
le, 2001, 2002). Оказалось, что для Colpodella vorax ха-
рактерен полуоткрытый внутриядерный плевромитоз,
широко распространенный среди паразитических Spo-
rozoa. В то же время, как выяснилось, у Rastrimonas
subtilis митоз протекает по типу диномитоза (закрыто-
го с внеядерным митотическим веретеном), который
является уникальным признаком динофлагеллят. Если
бы речь шла не о диномитозе, сам по себе этот факт
вряд ли привлек бы к себе особое внимание. Известно,
что для паразитических споровиков тип митоза не яв-
ляется консервативным признаком (Raikov, 1982). Од-
нако этого нельзя сказать о динофлагеллятах, у кото-
рых данный признак фигурирует в диагнозе типа. (По-
хожая форма митоза реализуется лишь у парабазалий,
но включать их в наши рассуждения пока нет никаких
оснований).
Теперь обратимся к филогенетическому древу аль-
веолят, построенному по данным молекулярно-биоло-
гических исследований (рис. 5, Б). В качестве примера
мы взяли фрагмент «рибосомального» древа (Leander
et al., 2003), однако в настоящее время с высокой сте-
пенью подобия, во всяком случае в той их части, кото-
рая касается интересующих нас групп, получены и
аналогичные «белковые» деревья (по генам актина, ту-
булина и hsp90) (Leander et al., 2003, 2004). На всех из-
вестных нам схемах молекулярных филогений, опуб-
ликованных до настоящего времени, «апикомплекс-
ные» жгутиконосцы распадаются на две группы. При
этом Colpodella spp. всегда формируют сестринскую
кладу (внешнюю) по отношению к паразитическим
Sporozoa. В то же время Parvilucifera и Perkinsus все-
гда формируют разделенную кладу, сестринскую по
отношению к динофлагеллятам.
Несмотря на явную противоречивость обеих схем,
важно отметить, что «конфликт филогений» никоим
образом не затрагивает очевидную связь кольподел-
лид с группой паразитических споровиков, родствен-
ные отношения между которыми подтверждаются
и молекулярно-биологическими, и морфологически-
ми фактами. Это позволяет утверждать, что хищные
жгутиконосцы кольподеллы являются ближайшими
свободноживущими родственниками грегарин и кок-
цидий. Учитывая вторичный характер паразитизма в
эволюции эукариот, можно также предполагать, что
кольподеллы в большей степени сохранили черты ги-
потетических предковых форм споровиков, чем высо-
ко специализированные, облигатные паразиты грега-
рины и кокцидии. Гораздо сложнее выглядит попытка
объяснить, почему ряд «Apicomplexa» {Rastrimonas,
Parvilucifera и Perkinsus) на схемах молекулярных фи-
логений позиционируется вместе с динофлагеллятами,
а не со споровиками. Существуют ли родственные от-
ношения между этими жгутиконосцами и морфологи-
чески очень близкими к ним кольподеллидами? Ко-
нечно, морфологическое сходство можно объяснить
параллелизмами в эволюции обеих групп. Однако боль-
шое количество сложных признаков, определяющих
степень этого сходства, делает такое предположение
крайне сомнительным. В качестве наиболее приемле-
мой на сегодняшний день гипотезы, способной объяс-
нить «конфликт филогений» внутри группы «Apicom-
plexa», мы рассматриваем гипотезу «общего предка»
динофлагеллят и споровиков. Можно предположить,
что все жгутиконосцы, обладающие апикальным ком-
плексом (т. е. Colpodella, Rastrimonas, Parvilucifera и
Perkinsus), являются потомками гипотетической груп-
пы альвеолят, которую условно можно назвать «ргоа-
picomplexa». По всей видимости, «proapicomplexa» об-
ладали некоторыми органеллами апикального комп-
лекса, по образу жизни и организации клеток мало чем
отличаясь от современных кольподелл. В этой группе
и могли обособиться две линии жгутиконосцев, реали-
зовавших в конечном счете две противоположные эво-
люционные тенденции, касающиеся судьбы комплекса
апикальных органелл. Одна из этих линий дивергиро-
вала на фоне совершенствования их организации и
функций и представлена в настоящее время типом
Sporozoa. Другая линия, напротив, постепенно утрати-
ла органеллы «апикального комплекса» — это совре-
ТИП SPOROZOA. КЛАСС COLPODELLEA
19
мснные динофлагелляты. Однако в обеих группах со-
хранились и организмы, несущие черты общих пред-
ковых форм: Colpodella в типе Sporozoa, а Rastrimonas,
Parvilucifera и Perkinsus в типе Dinozoa. Именно с
ними в настоящее время и связана проблема «конф-
ликта филогений».
Есть все основания полагать, что количество ныне
известных видов кольподеллид отражает лишь незна-
чительную часть истинного разнообразия «низших»
споровиков. На это, в частности, указывает, например,
недавнее обнаружение в морских илах нескольких
сиквенсов «кольподеллидной» ДНК, не принадлежа-
щей известным видам кольподелл (Leander et al.,
2003). Фаунистические исследования в этой области
безусловно очень перспективны. Расширение круга
изучаемых объектов, их комплексное исследование со-
временными методами, несомненно, будут способст-
вовать развитию наших взглядов на филогению и эво-
люцию как собственно кольподеллид, так и всей груп-
пы споровиков в целом.
Систематический обзор
Класс Col pod el lea (Kussakin, Drozdov, 1998)
Свободноживущие, хищные споровики, трофиче-
ские стадии обладают рострумом и двумя жгутика-
ми, размножаются в цистах с формированием 4 зонтов.
Отряд Colpodellida Cavalier-Smith, 1993
(= Spiromonadida Krylov, Mylnikov, 1986)
Сем. Colpodellidae Simpson, Patterson, 1996
В семействе единственный типовой род Colpodella
Cienkowsky, 1865
Род Colpodella Cienkowsky, 1865
Типовой вид Colpodella pugnax (Cienkowski,
1865) (рис. 4, А, г).
Длина зоитов 12 мкм, обладают длинным ростру-
мом, жгутики появляются за основанием рострума.
Вентральной бороздки нет. С. pugnax питается только
морскими хлорофитовыми водорослями (Simpson,
Patterson, 1996). Обитает в морской воде.
Colpodella perforans (Holland, 1938) Patterson et
Zolffel, 1991.
(=Spiromonas perforans Holland, 1938).
Длина зоитов 7—9 мкм. Вентральной бороздки нет.
Рострум длинный и тонкий, жгутики выходят у осно-
вания рострума. Пожирают криптомонад Chilomonas
paramecium Ehrenberg, 1831 (Brugerolle, Mignot, 1979).
Обитает в пресных водоемах.
Colpodella gonderi (Foissner, Foissner, 1984).
(-Spiromonas gonderi Foissner, Foissner, 1984).
Голодные жгутиконосцы очень мелкие (до 5 мкм),
без видимого рострума, а жгуты — в два или больше
раз длиннее, чем тело. Вентральной бороздки нет.
С. gonderi питается исключительно на инфузориях
Cotpoda (Gonder, 1910; Foissner, Foissner 1984). Обита-
ет в пресных водоемах.
Colpodella edax (Klebs, 1892). (Рис. 4, А, в).
(=Bodo edax Klebs, 1892; Spiromonas edax sensu Mylnikov,
1991).
Зоиты достигают 11—14 мкм, тело часто сжато, с
вентральной бороздкой, рострум средней длины. Пе-
редний жгутик существенно короче, чем задний, и не-
сет простые мастигонемы. Имеются трихоцисты. Пи-
тается в основном мелкими бесцветными жгутиконос-
цами (Мыльников, 1991; Мыльников и др., 1998).
Обитает в пресных водоемах.
Colpodella vorax (Kent, 1880). (Рис. 4, А, д').
(=Dinomonas vorax Kent, 1880, не Dinomonas vorax sensu Mylni-
kov, 1991).
Длина 8—12 мкм. Вентральной бороздки нет. Жгу-
тики выходят слегка субапикально, передний содер-
жит параксиальный тяж, рострум маленький. Охотно
питаются бодонидами и другими бесцветными жгути-
коносцами (Brugerolle, 2002). Обитает в пресных водо-
емах.
Colpodella angusta (Dujardin, 1841). (Рис. 4, А, б).
(=ffeteromita angusta Dujardin, 1841).
Зоиты 12—15 мкм, рострум маленький, жгутики
выходят субапикально, тело цилиндрическое со спи-
ральной бороздкой. Встречается в почве богатой орга-
никой, в очистных сооружениях.
Colpodella turpis Simpson, Patterson, 1996. (Рис. 4, А, ё).
Зоиты длиной 14—22 мкм. Рострум большой, вент-
ральной бороздки нет. Питаются хлорофитовыми во-
дорослями, обитают в морской воде.
Colpodella pontica Mylnikov, 2000. (Рис. 4, A, a).
(=Dinomonas vorax sensu Mylnikov, 1991).
Зоиты удлиненно-овальные, реже яйцевидные.
Длина 8—10 мкм, иногда до 18 мкм. На переднем кон-
це тела небольшая ямка. Жгутики гетеродинамные, пе-
редний чуть больше длины тела, задний длиннее в пол-
тора-два раза. Есть трихоцисты. Имеются цисты по-
коя.
20
ALVEOLATA
THE CLASS COLPODELLEA (KUSSAKIN, DROZDOV, 1998)
SUMMARY
Class Colpodellea (Kussakin, Drozdov. 1998), Order Colpodellida
Cavalier-Smith. 1993 ( Spiromonadida Krylov, Mylnikov, 1986), Fa-
mily Colpodellidae Simpson, Patterson, 1996, type and only genus Col-
podella ( icakowsky. 1865, type species Colpodella pugnax (Cienkow-
ski, 1865).
The 8 named species: C. pontica. C. angusta, C. edax, C. pugnax,
C. vorax, C. turpis, C. perforans, C. gonderi. Free-living, predatory fla-
gellates has two flagella, rostrum with apicomplexa-like organization,
division is exclusively within a cyst, with 4 daughter cells being pro-
duced.
ЛИТЕРАТУРА
Жуков Б. Ф., Мыльников А. П. Фауна зоофлагеллят очист-
ных сооружений // Простейшие активного ила. Л., 1983. С. 27—42.
Крылов М. В., Добровольский А. А. Макросистема и филоге-
ния споровиков // Принципы построения макросистемы однокле-
точных животных. Л., 1980. Т. 94. С. 62—74.
Крылов М. В., Мыльников А. П. Новые таксоны в типе Spo-
rozoa, Spiromorphina subcl. n., Spiromonadida ordo n. // Паразитоло-
гия. 1986. T. 20, N 6. C. 425—430.
Кусакин О. Г., Дроздов А. Л. Филема органического мира.
Ч. 2. Прокариоты и низшие эвкариоты. СПб., 1988.
Мыльников А. П. Ультраструктура и биология некоторых
представителей отряда Spiromonadida (Protozoa) И Зоол. журн.
1991. Т. 70, вып. 7. С. 5—15.
Мыльников А. П. Новый морской хищный жгутиконосец Col-
podella pontica (Colpodellida,Protozoa) И Зоол. журн. 2000. Т. 79.
С. 261—266.
Мыльников А. П., Мыльникова 3. М., Цветков А. И. Ульт-
раструктура хищного жгутиконосца Colpodella edax // Биология
внутренних вод. СПб., 1998. Т. 3. 7. С. 55—62.
Alexeieff A. Materiaux pour servir a 1'etude des protistes coprozoi-
tes // Arch. ZooL exp. et gen. 1929. Vol. 68. P. 609—698.
Brugerolle G. Cryptophagus subtilis: a new parasite of cryptophy-
tes affiliated with the Perkinsozoa lineage // Europ. J. Protistol. 2001.
Vol. 37. P. 379—390.
Brugerolle G. Colpodella vorax: ultrastructure, predation, li-
fe-cycle, and phylogenetic relationships // Europ. J. Protistol. 2002.
Vol. 38. P. 113—125.
Brugerolle G., Mignot J. P. Observations sur le cycle I'ultrastruc-
ture et al position systematique de Spiromonas perforans (Bodo perfo-
rans Hoolande 1938), flagelle parasite de Chilomonas paramecium: ses
relations avec les dinoflagelles et sporozoaires // Protistologica. 1979.
Vol. 15. P. 183—196.
Cavalier-Smith T. Kingdom Protozoa and its 18 Phyla // Microbi-
ol. Rev. 1993. Vol. 57, N 4. P. 953 -994.
Cienkowski L. Beitra ge zur kenntnis der Monaden // Arch. Mikr.
Anat. 1865. Bd 1. S. 203—232.
Dujardin F. Histoire naturelle des Zoophytes infusoires // Paris. 1841.
Foissner W., Foissner I. First record of an ectoparasitic flagellate
of ciliates:An ultrastructural investigation of the morphology and the
mode of attachment of Spiromonas gonderi nov. spec. (Zoomastigopho-
ra. Spiromonadidae)invading the pellicle of ciliatcs of the genus Colpo-
da (Ciliophora,Colpodidae) // Protistologica, 1984. Vol. 20. P. 635—648.
Leander B. S., Keeling P. J. Early evolutionary history of Dinofla-
gellates and apicomplexans (Alveolata) as inferred from hsp90 and ac-
tin phylogenies // J. Phycol. 2004. Vol. 40. P. 341—350.
Leander B. S., Kuvardina O., Aleshin V., Mylnikov A., Kee-
ling P. J. Molecular Phylogeny and Surface Morphology of Colpodella
edax (Alveolata): Insights into the Phagotrophic Ancestry of Apicomp-
lexans II J. Eukaryot. Microbiol. 2003. Vol. 50. P. 334—340.
Patterson D. J., Zolffel M. Heterotrophic flagellates of uncertain
taxonomic position // The biology of free-living heterotrophic flagella-
tes. Oxford, 1991. P. 427—476.
Raikov I. B. The protozoan nucleus. Morphology and evolution //
Cell Biology Monographs. Wien: New York, 1982. Vol. 9.
Simpson A. G. B., Patterson D. J. Ultrastructure and identificati-
on of the predatory flagellate Colpodella pugnax Cienkowski (Apicom-
plexa) with a description of Colpodella turpis n. sp. and a review of the
genus // Systematic Parasitology. 1996. Vol. 33. P. 187—198.
Skvortzov В. V. New and rare flagellatae from Manchuria, Eastern
Asia // Philippine J. Sci. 1957. Vol. 86. P. 139—202.
Skuja H. Beitrag zur Algenflora Lettlands II // Acta Horti botanici
Universitatis latviensis. 1939. Vol. 11/12. P. 41—169.
Skuja H. Taxonomic des Phytoplanktons einiger Seen in Uppland
Sweden // Symb. Bot. Upsala. 1948. Bd 9 (3). 386 p.
Stein F. R. Der Organismus der Infusionsthiere. III. Abt. der Orga-
nismus der Flagellaten. Leipzig, 1878.
Класс Gregarinea Dufour, 1828 — Грег ар ины
Крупные формы — до 15 мм длиной (сизигий Porospora gigan-
tea), обычно 300—500 мкм. Паразиты водных и наземных беспоз-
воночных и низших хордовых (Tunicata). Локализация — кишеч-
ник, реже целом и его производные (семенные мешки олигохет),
гонады, гемоцель и жировое тело насекомых. Большинство грега-
рин (эугрегарины) утратило мерогонию, хотя у некоторых она все
же есть (архигрсгарины, неогрегарины). В жизненном цикле при-
сутствует характерная для споровиков стадия инвазионного зоита
(споро- и иногда мсрозоита), имеющая сходный план строения у
грегарин и кокцидий. Жгутиком снабжены только мужские гаме-
ты. Покровы на протяжении большей части жизненного цикла
представлены типичной для споровиков трехмембранной пелли-
кулой, состоящей из плазмалеммы и внутреннего мембранного
комплекса, сформированного слившимися мембранными пузырь-
ками — альвеолами, в образовании которых принимают участие
цистерны ЭПР и, возможно, аппарат Гольджи. Пелликула проявля-
ет тенденцию к усложнению путем формирования простых продо-
льных складок либо эпицита — совокупности продольных пелли-
кулярных гребней особого строения. В кортикальной зоне обычны
микротрубочки — либо продольные, либо кольцевые. Митохонд-
рии обычно мелкие, с небольшим числом трубчатых (ампуловид-
ных) крист. Запасное вещество — углевод амилопектин, в боль-
шом количестве накапливающийся в цитоплазме. Вегетативные
стадии грегарин имеют обычно одно крупное пузырьковидное
ядро, содержащее одно, реже несколько хорошо заметных ядры-
шек. Самые ранние стадии роста у многих грегарин внутриклеточ-
ные; по мере увеличения размеров паразита клетка хозяина
претерпевает прогрессирующую гипертрофию и в итоге разруша-
ется. Развивающиеся трофозоиты обычно паразитируют внекле-
точно, внедряясь в ткани хозяина передним конном, на котором,
как правило, формируются специальные прикрепительные приспо-
собления (мукрон, эпимерит). Небольшая часть грегарин перешла
к полностью внутриклеточному паразитизму (некоторые неогрега-
рины). Зрелые гамонты внеклеточных паразитов, как правило, по-
движные. Движение гамонтов скользящее (большинство эугрега-
рин), посредством изгибаний тела (архигрсгарины) или, редко, --
перистальтическое. У части видов подвижны только инвазионные
стадии (зоиты) и гаметы. Характерной для жизненных циклов гре-
гарин является стадия сизигия — соединение гамонтов, предшест-
вующее гаметогонии. Гаметогенез протекает внутри гаметоцпеты.
Гамонты после равного числа прогамных ядерных делений (мито-
зов) формируют одинаковое количество гамет, как правило, мор-
фологически различающихся (морфологическая анизогамия) либо,
реже, сходных (изогамия). В пределах класса встречаются основ-
ные типы митоза — открытый и полузакрытый ортомитоз, полуза-
крытый плевромитоз. Мсйоз, как и у всех споровиков, одноступен-
чатый. редукция числа хромосом зиготическая. В ооцисте чаще
всего формируется 8 свободных спорозоитов, хотя изредка встре-
чаются и другие варианты (4, 16 и более).
На сегодняшний день описано более 1700 видов грегарин.
ТИП SPOROZOA. КЛАСС GREGARINEA
21
История изучения
Первые работы по грегаринам относятся к началу
XIX столетия. Организмы, давшие имя всей группе,
были впервые описаны в 1828 г. энтомологом Дюфу-
ром (Dufour, 1828) из кишечника уховертки Forficula
auricularia и названы им Gregarina ovata. После этого
довольно долгое время всех подобных существ отно-
сили к роду Gregarina, и в результате название «грега-
рина» стало также и нарицательным. В то время толь-
ко создавалась клеточная теория и едва намечалось
воззрение, по которому кроме многоклеточных су-
ществуют еще и одноклеточные организмы. Поэтому
большинство исследователей вслед за Дюфуром в те-
чение долгого времени считало грегарин паразитиче-
скими червями.
Впервые высказал верный взгляд на природу гре-
гарин Кёлликер (Kolliker, 1848): подобно Зибольду
(Siebold) и Дюжардену (Dujardin) настаивавшим на
одноклеточности инфузорий, он старался показать,
что и грегарины являются одноклеточными организ-
мами. С развитием техники исследований и накопле-
нием данных по другим группам одноклеточных
взгляды Кёлликера приобретали все большее значе-
ние. Во второй половине XIX в. одноклеточная приро-
да грегарин была признана большинством исследова-
телей.
Относительно родственных связей грегарин в кон-
це XIX—начале XX в. существовали различные точки
зрения. Их выводили из амеб (Lieberkiihn, 1855; van
Beneden, 1871), из эвгленоподобных жгутиконосцев,
снабженных плотной «кутикулой» и утративших жгу-
тик (Biitschli, 1880—1882), отмечали сходство стадии
сизигия грегарин с конъюгацией инфузорий (Stein,
1848; Wolters, 1891; Hartmann, 1907).
В 1875 г. французский исследователь А. Шнейдер,
автор многих подробных работ, посвященных грегари-
нам, открыл у этих организмов спорозоит — серповид-
ный, а не амебоидный (Schneider, 1875). В 1899 г. Сед-
лецкий, изучив образование гамет и зигот у Lankesteria
ascidiae, показал, что половой процесс грегарин пред-
ставляет собой копуляцию гамет, а не конъюгацию (Si-
edlecki, 1899). Эти факты в соответствии с существо-
вавшими в то время представлениями о путях эволю-
ции протистов поставили гипотезы о происхождении
грегарин от амеб и инфузорий под сомнение.
Крупные размеры и необычное для одноклеточных
организмов расчленение тела грегарин привлекали к
их изучению внимание многих крупных исследовате-
лей конца XIX—начала XX в., таких как Бразиль, Дю-
боск, Коллери, Мениль, Леже и многих других. Грега-
ринам посвящены и ранние исследования В. А. Доге-
ля, который опубликовал в 1906—1910 гг. серию
статей по их морфологии (Dogiel, 1906, 1907, 1909,
1910а). В. Т. Шевяков выдвинул гипотезу, объясняю-
щую скользящее движение грегарин выделением сли-
чи (Schewiakoff, 1894). Работы этих ученых значитель-
но увеличили число известных науке видов и внесли
огромный вклад в изучение морфологии, биологии и
жизненных циклов грегарин, подтвердив, в частности,
открытия Шнейдера и Седлецкого. Это позволило
сблизить грегарин с кокцидиями и противопоставить
их микро- и миксоспоридиям в пределах класса Sporo-
zoa, установленного Лейкартом (Leuckart) в 1879 г. для
одноклеточных организмов, имеющих в жизненном
цикле стадию споры.
Искусственность объединения «настоящих споро-
виков» с «книдоспоридиями» была ясна с самого на-
чала, поэтому сразу стали появляться варианты внут-
реннего подразделения класса Sporozoa. При этом
авторы использовали разные признаки — внутрикле-
точное или внеклеточное развитие (подклассы Cytos-
poridia и Histospordia Labbe, 1894), строение «заро-
дыша» (подклассы Rhabdogeniae — организмы с ти-
пичными спорозоитами — и Amoebogeniae Delage et
Herouard, 1896 — организмы с амебоидными «споро-
зоитами»), способ образования спор (подклассы Ecto-
spora и Endospora Mesnil, 1899), время образования
спор (подклассы Telosporidia и Neosporidia Schaudinn,
1900).
В 1898 г. Леже и Василевский независимо друг от
друга делают важное открытие — у микрогамет кокци-
дий были найдены жгутики (Leger, 1898; Wasielewski,
1898). Позднее они были обнаружены и у мужских га-
мет грегарин (Leger, 1904а). Эти факты наряду с от-
крытиями Шнейдера и Седлецкого послужили под-
тверждением гипотезы Бючли о происхождении грега-
рин и кокцидий от жгутиконосцев.
Быстрое накопление данных по грегаринам повлек-
ло за собой детализацию их системы. В конце XIX в.
Леже (Leger, 1892) и Лаббе (Labbe, 1899) выделяют
основные семейства грегарин. В 1900 г. Леже устанав-
ливает принадлежность к грегаринам описанного ра-
нее Шнейдером организма Ophryocystis biitschlii, обла-
дающего бесполым размножением (Leger, 1900с). В те
времена не были известны сложные морфогенети-
ческие процессы, протекающие во время мерогонии
споровиков и приводящие в итоге к формированию ха-
рактерной ультраструктуры мерозоитов, да и само по-
нятие мерогония отсутствовало: бесполое размно-
жение любых «Sporozoa» традиционно, по примеру
кокцидий, называли шизогонией — независимо от
способа деления материнской особи. Поэтому откры-
тие Леже было интерпретировано им как обнаружение
шизогонии у грегарин. Вскоре была найдена «шизого-
ния» и у некоторых других представителей этой груп-
пы (Selenidium, Merogregarina, Schizocystis), что по-
влекло за собой разделение грегарин на Schizogregari-
па и Eugrerarina (Leger, 1900а, 1900b, 1900с). В 1902 г.
появляется система Дофляйна (Doflein), который в
основном перенял подходы и номенклатуру Шаудин-
на, но более резко подчеркнул разнохарактерность
групп, входящих в состав класса Sporozoa. В пределах
подкласса Telosporidia Дофляйн рассматривает отряды
Coccidiomorpha, куда относятся кокцидии и гемоспо-
ридии, и Gregarinae, заключающие в себе только грега-
рин. Система грегарин, которой придерживалось боль-
шинство исследователей в начале XX в., имеет следу-
ющий вид: •
Класс Sporozoa Leuckart, 1879
Подкласс Telosporidia Schaudinn, 1900
Отряд Gregarinae Du four, 1828
Подотряд Schizogregarinaria Doflein, 1901
Подотряд Eugregarinaria Doflein, 1901
Легион Acephalina Kolliker, 1848 (= Monocystidea)
Легион Ccphalina Delage et Herouard, 1896 (=Poly-
cystidca)
22
ALVEOLATA
Подотряды в этой системе, как видно уже из самих
названий, выделены на основе различий в ходе жиз-
ненных циклов их представителей, а именно по при-
знаку наличия или отсутствия бесполого размно-
жения «шизогонии». Легионы (или трибы у других
исследователей) объединяют грегарин по признакам
внешней морфологии трофозоитов. Представители
Ccphalina имеют специальное прикрепительное при-
способление -- эпимерит, отсутствующий у предста-
вителей Accphalina. Деление же на Monocystidea и Ро-
lycystidea отражает хорошо заметные в световом мик-
роскопе особенности расчленения клетки грегарин: у
полицистидных форм она поделена септами или пере-
тяжками на две (дицистидные), три (трицистидные)
или более частей, тогда как у моноцистидных форм
расчленение тела отсутствует.
Такая система грегарин с небольшими изменения-
ми просуществовала до 50-х гг. XX столетия. Все это
время шло активное накопление информации по фауне,
морфологии, цитологии и биологии грегарин. К пер-
вой половине XX в. относятся основные исследования
хромосомных циклов (Dobell, Jameson, 1915; Bastin, 1919;
Calkins, Bowling, 1926; Naville, 1927; Grell, 1940; Sprague,
1941) и немногочисленные работы по физиологии гре-
гарин (Roskin, Lewinson, 1929; Gohre, 1943). В это же
время большой размах получили региональные иссле-
дования фауны грегарин — паразитов морских, пре-
сноводных и наземных беспозвоночных. В первой по-
ловине XX в. их вели такие ученые, как В. А. Догель в
России, Маккиннон, Рэй, Бхатиа, Сетна, Ганапати,
Чакраварти в Британской Индии; Тюзе во Франции,
Райхенов в Германии, X. Хосиде в Японии. По мере
увеличения числа описанных видов составлялись сводки
и проводились ревизии отдельных таксонов (Watson,
1916; Watson Kamm, 1922; Kamm, 1922; Chakravarty, 1959).
Ко второй половине XX в. из состава Sporozoa бы-
ли окончательно выведены миксоспоридии и микро-
споридии, чье сходство с грегаринами и кокцидиями
чисто поверхностно и ограничивается наличием в жиз-
ненном цикле «спор», не гомологичных спороцистам и
ооцистам настоящих споровиков. В результате в суще-
ствовании таксона Telosporidia отпала необходимость
и таксономический ранг отрядов Gregarinae и Coccidi-
omorpha был повышен до ранга подклассов либо даже
классов, в зависимости от ранга (класс или подтип)
всей группы Sporozoa.
К 50-м гг. XX в. было накоплено достаточно большое
количество данных по морфологии, биологии и разно-
образию грегарин. Это время можно охарактеризовать
как период достижения качественного предела инфор-
мации, которую способны предоставить исследования
с использованием только светооптических методов.
Поток новых данных не уменьшился, но поступающие
сведения практически перестали привносить значимый
вклад в уже сложившуюся к тому времени общую кар-
тину знаний о грегаринах, которая нуждалась не столь-
ко в дополнении, сколько в крупных обобщениях.
Такие обобщения были проведены выдающим-
ся французским ученым, академиком Пьером-Полем
Грассе (Grasse, 1953) в рамках издававшегося во Фран-
ции фундаментального многотомного руководства по
зоологии «Traite de Zoologie». В главе, посвященной
грсгаринам (тип Protozoa, подтип Sporozoa, класс Gre-
garinomorpha), подробно изложены основные данные,
касающиеся жизненных циклов, морфологии различ-
ных стадий развития, физиологии и биологии грега-
рин. Особого упоминания заслуживает раздел, посвя-
щенный систематике. Тщательный анализ накоплен-
ных к тому моменту сведений позволил Грассе
выдвинуть собственный подход к эволюции и филоге-
нии грегарин, который и был положен в основу пред-
ложенной им системы. Грассе, исходя из концепции
сопряженной эволюции паразитов и их хозяев, прида-
вал большое значение приуроченности различных так-
сонов грегарин к определенным группам хозяев. В со-
ответствии с этим подходом, а также на основании не-
которых других особенностей, таких как морфология
ооцист, он разделил группу Schizogregarina на два са-
мостоятельных таксона — Archigregarina (шизогрега-
рины морских беспозвоночных, преимущественно по-
лихет) и Neogregarina (шизогрегарины насекомых).
Жизненный цикл Archigregarina при этом считается
исходно примитивным — в нем закономерно череду-
ются «шизогония», гаметогония и спорогония. Neogre-
garina, по мнению Грассе, произошли от высших Eug-
regarinida — паразитов насекомых. Жизненный цикл
Neogregarina считается вторично усложненным, а име-
ющие в нем место «шизогонии» — вторично приобре-
тенными. Формы, первоначально отнесенные к грега-
ринам, но обладающие аберрантными жизненными
циклами (Siedleckia, Schaudinnella), идут дополнением
к классу Gregarinomorpha. Таким образом, вместо двух
основных таксонов грегарин — Schizogregarina и Eug-
regarina, Грассе рассматривает три — отряды Archigre-
garina, Eugregarina и Neogregarina. Несмотря на неко-
торую умозрительность, эта точка зрения получила
поддержку большинства исследователей. Значение
труда Грассе трудно переоценить. Прекрасно иллюст-
рированная, содержащая исчерпывающие сведения (за
исключением, естественно, ультраструктурных дан-
ных) глава по грегаринам в «Trait ё de Zoologie» остает-
ся актуальной и по сей день. Она смело может быть ре-
комендована для ознакомления с группой наряду и
даже взамен многих современных аналогов.
В конце 60-х гг. XX в. началось интенсивное разви-
тие электронно-микроскопических исследований про-
тистов, которые продолжились и достигли наибольше-
го расцвета в 70-е гг. Электронная микроскопия позво-
лила выявить глубокие различия в планах строения
различных групп «Protozoa». В это время была изучена
ультраструктура многих представителей самых раз-
ных таксонов, в том числе и грегарин. Особенно боль-
шой вклад в изучение ультраструктуры грегарин вне-
сли французские исследователи — представители
школы Грассе: Вивье, Винкье, Депорт, Девошелль,
Ормье, Шревель и другие. Существенный вклад в изу-
чение тонкой морфологии грегарин внес также рабо-
тавший в США чешский исследователь Иржи Вавра.
Этими и другими учеными были, в частности, выявле-
ны основные типы строения покровов трофозоитов,
изучены прикрепительные приспособления предста-
вителей наиболее крупных семейств грегарин (Lecudi-
nidae, Gregarinidae, Dactylophoridae, Stylocephalidae,
Actinocephalidae и др.), исследованы процессы гамето-
генеза и спорогонии у некоторых видов. Были показа-
ны также глубокие ультраструктурные различия меж-
ТИП SPOROZOA. КЛАСС GREGARINEA
23
ду архигрегаринами и эугрегаринами (Schrevel, 1968а,
1971а, 1971b), заключающиеся в том, что трофозоиты
архигрегарин сохраняют особенности строения, свой-
с таенные инвазионным стадиям (споро- и мерозоитам)
споровиков, тогда как строение трофозоитов эугрега-
рип сильно модифицировано. Таким образом, исследо-
пиния Шревеля подтвердили идею Грассе о примитив-
ности архигрегарин и позволили дополнить диагноз
>той группы, сделав основной акцент на признаки уль-
траструктуры (Schrevel, 1971b).
Наряду с бурным расцветом электронно-микроско-
пических исследований в 70-е гг. продолжался про-
цесс изучения фауны грегарин, Описания новых видов
и составления сводок. В этом русле работали такие ис-
следователи, как Гойе в Восточной Германии (ГДР);
Теодорид во Франции, Алжире и странах Юго-Восточ-
ной Азии; Липа в Польше; Кодряну-Бальческу в Румы-
нии и др.
В 80-е и особенно 90-е гг. исследования ультра-
структуры грегарин, к сожалению, пошли на убыль,
хотя целостная картина тонкого строения грегарин так
и не успела полностью сложиться. В то же время го-
раздо большее развитие получили физиологические и
цитохимические изыскания. Так, изучение механизма
скользящего движения эугрегарин принимало порой
характер поединка между двумя научными группами,
в котором вслед за очередной публикацией одной
из сторон немедленно следовал «ответный удар» про-
тивоположной. Главная суть разногласий состояла
в том, принимает ли актин участие в скользящем дви-
жении (группа К. А. Кинга) или не принимает (груп-
па К. Маккензи). В это же время под руководством
Ж. Шревеля развернулись работы по цитохимии кор-
тикальной зоны трофозоитов грегарин. Важнейшим
результатом этих работ стало обнаружение у грегарин
основных белков двигательной системы: актина, а так-
же мйозино- и спектриноподобных белков, ассоцииро-
ванных с покровами грегарин (Ghazali et al., 1989; Gha-
zali, Schrevel, 1993, 1995). Однако, несмотря на про-
гресс в этой области, вопрос о механизме скользящего
движения грегарин остается до сих пор открытым.
Изменения в систематике грегарин в конце XX в.
тесно связаны с бурными процессами, происходив-
шими в это время в систематике протистов вообще.
К концу 1970-х гг. стало невозможным более рассмат-
ривать Protozoa как единый тип. В 1980 г. Комитетом
по эволюции и систематике Международного обще-
ства протозбологов под председательством авторитет-
ного американского протистолога И. Д. Левайна (Levi-
ne et al., 1980) была проведена большая фундаменталь-
ная ревизия всей системы «простейших», в результате
которой тип Protozoa был разбит на 7 типов. Место
грегарин в этой системе определяется так:
Подцарство Protozoa
Тип Apicomplexa Levine, 1970
Класс Sporozoasida Leuckart, 1879
Подкласс Gregarinasina Dufour, 1828
Отряд Archigregarinorida Grasse, 1953
Отряд Eugregarinorida Leger, 1900
Подотряд Blastogregarinorina C(iatton et Ville-
neuve, 1936
Подотряд Aseptatorina Chakravarty, 1960
Подотряд Septatorina Lankester, 1885
Отряд Neogregarinorida Grasse, 1953
Реально основные принципы классификации грега-
рин, использованные в этой системе, были постепенно
внедрены самим Левайном в течение 70-х гг., а ее при-
нятие Комитетом по эвблюции и систематике можно
рассматривать в какой-то степени как официальное
утверждение. Деление эугрегарин на Aseptata и Septata
(в написании Левайна — Aseptatorina и Septatorina) по
наличию или отсутствию протОдейтомеритной септы
пришло на смену более размытым Acephalina и Cepha-
lina или Monocystidea и Polycystidea. Последние два
термина, правда, часто применяются До сих пор при
описании морфологии трофозоитов в вйде определе-
ний «моноцистиДНый» и «полицистидный» (ди-, три-
Цистидный). Включение же бластогрегарин й состав
Eugregarinorida являемся одним из следствий чисто
утилитарного подхода Левайна к систематике грега-
рин. Не будучи, строго гойоря, специалистом по грега-
ринам, Левайн взял на себя Нелегкий труд по инвента-
ризации этой группы. Он составил подробные сводки
архигрегарин и основных семейств асептатных грега-
рин, но, не ограничиваясь этой "трудоемкой и, безу-
словно, очень полезной работой, Параллельно еще и
осуществил ряд не всегда обоснованных таксономиче-
ских перестановок (Levine, 1971b, 1976, 1977а, 1977b,
1977с, 1977d, 1979, 1984, 1985). Формально следуя
диагнозам основных отрядой грегарин, предложенных
Грассе, Левайн автоматически причисляет всё виды, у
которых мерогония отсутствует или неизвестна, к от-
ряду Eugregarinorida, полностью игнорируя степень
изученности жизненных циклов и особенности ультра»
структуры. В частности, к эугрегаринйМ была отнесена
большая часть видов рода Selenidium, доставлявшего
ядро группы Archigregarinida, а также «бласГогрегарина»
Siedleckia, жизненный цикл которой сильно отличает-
ся не только от жизненного цикла эугрегарин, но и от
такового грегарин вообще — отсутствием сизигйя, га-
метоцисты и некоторыми другими особенностями. Кро-
ме Siedleckia Левайн в своей системе нашел места И
для других групп неясного положения, так что таких
таксонов не осталось вовсе. Стремясь втиснуть все
многообразие грегарин и сходных с ними организмов в
жесткие рамки трех отрядов, Левайн лишил таксоны
Грассе филогенетического и эволюционного наполне-
ния, чему придавал такое большое значение сам Грас-
се. Справедливости ради следует заметить, что некоторые
авторы, принимающие систему Левайна, и сами отме-
чают отсутствие в ней связной эволюционной концеп-
ции, но считают, что эта система тем не менее «облегча-
ет накопление и поиск информации» (Clopton, 2000). По-
следнее утверждение, впрочем, кажется сомнительным.
Если оценивать систему Левайна с позиции адек-
ватного отображения современного состояния науки о
грегаринах, то по сравнению с системой Грассе она,
несмотря на кажущуюся преемственность, Представля-
ет собой скорее шаг назад, чем вперед. В ней полно-
стью игнорируются данные, полученные с помощью
электронно-микроскопических методов, и отсутствует
ясность в понимании основных путей эволюции грега-
рин -— напротив, в это понимание вносится дополни-
тельная путаница, для борьбы с которой система, соб-
ственно говоря, и нужна.
Все это цдюс неудобоваримые громоздкие оконча-
ния названий таксонов, часто противоречащие латин-
24
ALVEOLATA
ской грамматике, вызывает несогласие ряда исследо-
вателей. Особенное неприятие этот подход встречает у
французских ученых, принадлежащих к научной шко-
ле Грассе (Puytorac et al., 1987; Vivier, Desportes, 1990;
Schrevel, Philippe, 1993), которые в своих работах час-
то попросту игнорируют построения Левайна.
Не встретил подход Левайна поддержки и у отече-
ственных протистологов (Крылов, Добровольский,
1980). Работа Крылова и Добровольского «Макроси-
стема и филогения споровиков» вышла почти одновре-
менно с системой Комитета по эволюции и системати-
ке. Авторы согласны с объединением обладающих
апикальным комплексом простейших в одну группу,
как это сделал ранее Левайн, и также придают ей ранг
типа, но используют старое название Sporozoa вместо
Apicomplexa и более традиционные написания назва-
ний основных таксонов. Однако, признавая существо-
вание отрядов грегарин, предложенных Грассе, авто-
ры, вслед за Шревелем (Schrevel, 1971а, 1971b), прида-
ют основное систематическое значение особенностям
ультраструктуры — таким как строение переднего
конца и покровов трофозоитов. Крылов и Доброволь-
ский включают их во все диагнозы отрядов, возражая,
таким образом, против разбиения архигрегарин и при-
числения семейства Selenidiidae к эугрегаринам. Деле-
ние Eugregarinida на подотряды авторами не рассмат-
ривается, а принадлежность Blastogregarinida к споро-
викам вообще ставится под сомнение. Предлагаемая
Крыловым и Добровольским система имеет следую-
щий вид:
Тип Sporozoa Leuckart, 1879
Класс Gregarinomorpha Dufour, 1828
Отряд Archigregarinida Grasse, 1953
Отряд Eugregarinida Doflein, 1901
Отряд Neogregarinida Grasse, 1953
Несмотря на существование альтернативных точек
зрения, часто более обоснованных, система Левайна
продолжала применяться и применяется до сих пор во
многих обзорных статьях, крупных монографиях и их
разделах, посвященных споровикам, а также в учебни-
ках (Levine, 1985, 1988; Сох, 1994; Hausmann, Hiilsmann,
1996). В частности, эта система взята за основу в вы-
шедшем в 2000 г. втором издании «Ап illustrated guide
to tire Protozoa» (Lee et al., 2000), хотя авторы-составители
и сами отмечают существующие в ней противоречия.
В настоящее время интерес к грегаринам заметно
ослаб, что связано, видимо, с их небольшим практи-
ческим значением и, как следствие, невеликим финан-
сированием исследований в условиях современной
«грантовой» науки. Так, начавшийся в 80-х гг. бум мо-
лекулярной филогении обошел грегарин стороной, и
лишь совсем недавно появились первые филогенети-
ческие деревья, построенные на основе нуклеотидных
последовательностей генов 18S рРНК и р-тубулина не-
скольких видов (Carreno et al., 1999; Leander et al.,
2003a, 2003b). Стоит отметить также, что не прекраща-
ется процесс описания новых видов грегарин, правда
преимущественно на светооптическом уровне. В этом
отношении следует упомянуть многочисленные рабо-
ты американского исследователя Клоптона (Clopton) и
индийских ученых (Амоджи, Хальдар, Джанарданан,
Кунду, Рамачандран, Саркар и др.).
В заключение этого раздела будет полезным приве-
сти ссылки на основную обзорную литературу по гре-
гаринам, касающуюся общих вопросов (Grasse, 1953;
Vivier, Desportes, 1990; Schrevel, Philippe, 1993) и так-
сономии группы (Watson, 1916; Kamm, 1922; Watson,
Kamm, 1922; Grasse, 1953; Reichenow, 1953; Chakravar-
ty, 1959; Kudo, 1966; Lipa, 1967; Geus, 1969; Corbel,
1971; Levine, 1971b; Levine, 1976, 1977a, 1977b, 1977c,
1977d, 1979, 1984, 1985, 1988a; Schrevel, 1971b; Perkins
et al., 2000).
Классификация
Большинство современных вариантов системы гре-
гарин базируется на выделении трех основных группи-
ровок, предложенных Грассе (Grasse, 1953), — отря-
дов Archigregarina, Eugregarina и Neogregarina (воз-
можны варианты в написании окончаний). Однако в
настоящее время нет единой точки зрения на состав
этих таксонов и, как следствие, существуют значи-
тельные трудности с их диагностированием. Главной
из них является то, что по совокупности всех рассмат-
риваемых признаков, за исключением приуроченности
к определенным группам хозяев, формальные разли-
чия между архигрегаринами и неогрегаринами оказы-
ваются относительно небольшими. Во всяком случае
они гораздо меньше, чем различия между обеими эти-
ми группами, вместе взятыми, с одной стороны, и эуг-
регаринами — с другой. Поэтому в настоящем изда-
нии будет использована система, где за внешнюю
основу взяты таксономические категории Леже, — от-
ряды Schizogregarinida и Eugregarinida (см. раздел «Во-
просы систематики»). Однако сохранены и таксоны,
предложенные Грассе, правда в качестве подотрядов.
Предлагаемая система является компромиссной, пред-
ставляет собой компиляцию из уже существующих си-
стем (Leger, 1900а, 1900b, 1900с; Grasse, 1953; Levine,
1985; Perkins et al., 2000) и, как следствие, содержит
некоторые явно сборные группы и группы неясного
положения.
Класс Gregarinea Dufour, 1828
Отряд Schizogregarinida Leger, 1900
Подотряд Archigregarinina Grasse, 1953
Сем. Selenidiidae Brasil, 1907
Archigregarinina incertae sedis
Сем. Exoschizonidae Levine, 1971
Подотряд Neogregarinina Grasse, 1953
Сем. Schizocystidae Leger et Duboscq, 1908
Сем. Caulleryellidae Keilin, 1914
Сем. Ophryocystidae Leger et Duboscq, 1908
Сем. Lipotrophidae Grasse, 1953
Сем. Syncystidae Schneider, 1886
Neogregarinina incertae sedis
Род Tipulocystis Kratnar, 1950
Род Coelogregarina Ghelelovitch, 1948
Род Apicystis Lipa et Triggiani, 1996
Отряд Eugregarinida Leger, 1900
Подотряд Aseptata Chakravarty, 1960
Сем. Lecudinidae Kamm, 1922
Сем. Urosporidae Leger, 1892
Сем. Monocystidae Biitschli, 1882
Сем. Ganymedidae Huxley, 1910
Сем. Enterocystidae Codreanu, 1940
Сем. Diplocystidae Bhatia, 1930
Сем. Allantocystidae Bhatia, 1930
Подотряд Septata Lankester, 1885
ТИП SPOROZOA. КЛАСС GREGARINEA
25
Надсем. Porosporicae Chakravarty, 1960
Сем. Porosporidae Labbe, 1899
Надсем. Gregarinicae Chakravarty, 1960
Сем. Cephaloidophoridae Kamm, 1922
Сем. Cephalolobidae Theodorides et Desportes, 1975
Сем. Uradiophoridae Grasse, 1953
Сем. Gregarinidae Labbe, 1899
Сем. Gigaductidae Filipponi, 1948
Сем. Metameridae Levine, 1980
Сем. Didymophyidae Leger, 1892
Сем. Hirmocystidae Grasse, 1953
Надсем. Stenophoricae Levine, 1984
Сем. Stenophoridae Leger Duboscq, 1904
Сем. Leidyanidae Kudo, 1954
Сем. Cnemidosporidae Grasse, 1953
Сем. Monoductidae Ray et Chakravarty, 1933
Сем. Sphaerocystidae Chakravarty, 1960
Сем. Trichorhynchidae Ormieres, Marques et Puisse-
gur, 1977
Сей. Dactylophoridae Leger, 1892
Сем. Stylocephalidae Ellis, 1912
Сем. Actinocephalidae Leger, 1892
Сем. Brustiosporidae Kundu et Haidar, 1981
Сем. Acutidae Stejskal, 1965
Сем. Monoicidae Geus, 1969
Надсем. Fusionicae Stejskal, 1965
Сем. Fusionidae Stejskal, 1965
Gregarinea incertae sedis
Род Filipodium Hukui, 1939
Род Heterospora de Saint Joseph, 1907
Сем. Schaudinnellidae Poche, 1913
Отряд Blastogregarinida Chatton et Villeneuve, 1936
Все перечисленные семейства грегарин (за исклю-
чением сем. Selenidiidae), а также надсемейства сеп-
татных грегарин в основном соответствуют таковым,
принятым в системе Левайна (вариант, представ-
ленный во втором издании «Ап illustrated guide to the
Protozoa» (Lee et al., 2000)). Род Selenidioides вновь
объединен с родом Selenidium, а сем. Selenidioididae,
таким образом, исключено из рассмотрения как nomen
nudum. Сем. Selenidiidae возвращено в состав архи-
грегарин, сем. Aikinetocystidae объединено с сем. Мо-
nocystidae. Сем. Gigaductidae, обладающее несомнен-
ным близким родством с сем. Gregarinidae, исходя из
филогенетических соображений, перемещено (возвра-
щено) из состава Schizogregarinida (Neogregarinina) в
состав Eugregarinida. В пределах подотрядов отряда
Schizogregarinida некоторые роды и семейства рас-
сматриваются в качестве таксонов неясного положе-
ния в основном в силу недостаточной изученности.
Кроме того, на основе особенностей ультраструктуры
род Filipodium убран из состава сем. Lecudinidae и пе-
реведен в состав Gregarinea incertae sedis, поскольку
сумма признаков недостаточна для помещения его в
какое-либо известное семейство и даже отряд. Сем.
Schaudinnellidae (род Schaudinnella) и таксон Blastogre-
garinida (род Siedleckia) удалены из отряда Eugregarini-
da и также рассматриваются в качестве Gregarinea in-
certae sedis.
Причины предпринятых таксономических опера-
ций станут более понятными после ознакомления с
жизненными циклами и морфофункциональной орга-
низацией грегарин, а также разделами «Эволюция и
филогения» и «Вопросы систематики».
Жизненные циклы
Рассмотрение грегарин удобно начинать с жизнен-
ных циклов, а не с морфологии, поскольку грегарины,
как и все споровики, обладают сложными жизненны-
ми циклами, организация отдельных стадий которых
сильно различается.
Общие замечания. Грегарины паразитируют толь-
ко в беспозвоночных животных. Их хозяева — полихеты,
олигохеты, членистоногие, турбеллярии, немертины, си-
пункулиды, эхиуриды, моллюски, иглокожие, полухор-
довые, низшие хордовые: оболочники (Tunicata) и, воз-
можно, бесчерепные (Acrania). Отсутствуют, по всей
видимости, грегарины в кишечнополостных, первичнопо-
лостных червях, форонидах, мшанках и брахиоподах.
Большинство грегарин паразитируют в кишечнике
хозяев. Таковы, например, все архигрегарины, боль-
шинство эугрегарин, часть неогрегарин (Schizocysti-
dae, Caulleryellidae, Ophryocystidae). В некоторых се-
мействах эугрегарин, преимущественно асептатных,
наблюдается переход от кишечного паразитизма к па-
разитизму в полости тела хозяина и находящихся там
органах, например, многие Urosporidae, живущие в по-
лихетах, моллюсках и иглокожих. Некоторые из них
прикрепляются к стенкам целома (Urospora travisiae
из полихеты Travisia forbesii, Urospora chiridotae из го-
лотурии Chiridota laevis), другие развиваются в нефри-
диях (Gonospora arenicolae из пескожила Arenicola
ecaudata), кровеносной системе (Gonospora irregularis
из Holothuria forskalii), стенках водных легких голоту-
рий (Lithocystis minchini, Urospora pulmonalis из Сиси-
maria spp.), гонадах (Urospora gonadipertha из Сиси-
maria frondosa) и даже ооцитах (Gonospora minchini)
хозяина. Представители обширного сем. Monocystidae
целиком перешли к паразитизму в целоме и семенных
мешках олигохет.
Подавляющее большинство грегарин паразитирует
внеклеточно, прикрепляясь передним концом к эпите-
лию хозяина, хотя самые ранние стадии развития мо-
гут быть внутриклеточными. Они характерны для мно-
гих Eugregarinida — в основном для примитивных
Aseptata (Lankesteria ascidiae из асцидии Ciona intesti-
nalis, грегарины сем. Monocystidae и др.), но также и
для некоторых Septata (например, грегарины рода
Schneideria из двукрылых насекомых семейств Bibioni-
dae и Sciaridae, Cephaloidophora из кишечника рако-
образных). В некоторых случаях (Ascogregarina culicis
из кишечника личинок кровососущих комаров рода
Aedes, Schneideria schneiderae из двукрылого Trichosia
или Gigaductus steropi из жука Steropus) гамонты даже
дорастают внутри клеток хозяина до зрелого состоя-
ния и вскоре по выходе из них приступают к размно-
жению, объединяясь в сизигии (Ray, 1933b; da Cunha,
Jurand, 1978; Massot, Ormieres, 1979). Среди грегарин
иногда встречаются и настоящие внутриклеточные па-
разиты, такие как неогрегарины семейств Syncystidae и
Lipotrophidae из ткани жирового тела насекомых, у ко-
торых, так же как и у большинства кокцидий, единст-
венными внеклеточными стадиями являются ооцисты
и инвазионные зоиты — мсрозоиты и спорозоиты.
Почти все грегарины гомоксенны, т. е. проходят
развитие в единственном хозяине. Исключением явля-
26
ALVEOLATA
кт я представители сем. Porosporidae, основная часть
жп шепного цикла которых проходит в кишечнике раз-
личных представителей десятиногих ракообразных
(Decapoda), а промежуточными хозяевами служат раз-
нообразные двустворчатые моллюски (Bivalvia), в
чьей кровеносной! сис теме происходит созревание спо-
розоитов (см. характеристику сем. Porosporidae в раз-
деае «('пстематический обзор»).
Исходным для грегарин считается характерный для
споровиков трехзвенный жизненный цикл, в котором
закономерно чередуются мерогония, гамогония
(iaмстогония) и спорогония (Grasse, 1953).
Учитывая недостаточную изученность морфогенеза
процессов бесполого размножения у грегарин (см. раз-
дел «Мерогония и мерозоиты»), мы считаем возмож-
ным употреблять в отношении грегарин термин «меро-
гония» в широком, почти буквальном смысле — для
обозначения любого бесполого размножения путем
деления клеток. Термин «шизогония», употребляв-
шийся ранее для этой цели, будет, по аналогии с кок-
цидиями, применяться исключительно в качестве обо-
значения одного из способов репродукции — одновре-
менного отпочковывания множества мелких дочерних
особей от крупного временно многоядерного материн-
ского организма, независимо от того, происходит ли
это во время бесполого размножения или связано с по-
ловым процессом. У огромного большинства грегарин
мерогония выпадает из жизненного цикла (почти все
Eugregarinida). У ряда форм, таких как грегарины рода
Gigaductus, а также у Neogregarinina, мерогония появ-
ляется, согласно общепринятому мнению, вторично.
Характерной для жизненных циклов грегарин явля-
ется стадия сизигия — объединение гамонтов перед
началом гаметогенеза. При этом уникальной особен-
ностью является не сама гамонтогамия, известная
также для аделеидных кокцидий и некоторых других
протистов (пластогамные фораминиферы, инфузории),
а совместное инцистирование гамонтов и
формирование стадии гаметоцисты, под покро-
вом которой происходит гаметогенез.
Для всех Gregarinea характерна изо- или анизога-
мия различной степени выраженности. Следует под-
черкнуть, что анизогамия грегарин носит чисто мор-
фологический характер, поскольку число прогамных
ядерных делений гамонтов всегда одинаково и одина-
ково число формируемых ими гамет. У грегарин ни-
когда не встречается оогамия «кокцидийного» типа,
когда прогамные деления ядра макрогамонта отсутст-
вуют и он целиком превращается в макрогамету —
т. е. макрогамета формируется гологамно. Образова-
нию гамет грегарин всегда предшествуют прогамные
деления ядра гамонта, даже если гамонт дает начало
единственной гамете (неогрегарина Ophiyocystis). Та-
ким образом, еще одно важное отличие грегарин от
кокцидий, наряду с присутствием в жизненном цикле
стадии гаметоцисты, — это отсутствие оогамии. Кажу-
щееся исключение составляют грегарины сем. Dacty-
lophoridae, об «оогамии» которых будет рассказано в
разделе «Стадии гаметогонии».
Мерогония у грегарин, если есть, протекает внутри
хозяина, спорогония — обычно во внешней среде, а га-
метогония по-разному, в зависимости от таксономиче-
ской принадлежности.
Жизненные циклы без мерогонии. Этот наиболее
распространенный тип жизненных циклов характерен
для представителей отряда Eugregarinida. Рассмотрим
его на примере грегарин рода Stylocephalus (рис. 6), па-
разитирующих в имаго жуков-чернотелок (Tenebrioni-
dae). В кишечнике хозяев чаще всего обнаруживают
трофозоиты (гамонты) (рис. 6, /). Молодые грега-
рины прикреплены к эпителию кишечника, активно
питаются и растут. Достигнув определенных размеров,
они отделяются и начинают свободно перемещаться в
кишечнике. Зрелые гамонты объединяются попарно в
сизигии (рис. 6, 2). Иногда, правда, сизигии образу-
ются довольно рано, еще на стадиях роста (характерно
для многих представителй сем. Urosporidae и некото-
рых других грегарин — см. также раздел «Морфо-
функциональная организация» о сизигиях), таких гре-
гарин иногда называют неогамными, или «ран-
небрачными» (Woodcock, 1904, 1906). В этом случае
фаза одиночного трофозоита фактически выпадает из
жизненного цикла.
Партнеры в сизигиях округляются, теряя свою пер-
воначальную форму, и выделяют вокруг себя толстую
прозрачную оболочку — цисту. Это — стадия г а м о н -
т о ц и с т ы или гаметоцисты (рис. 6, 3). У эугрега-
рин ядерные трансформации начинаются только после
образования цистной оболочки. Ядро каждой особи
многократно делится митотически (прогамные деле-
ния). В результате образуется множество вторичных
ядер (рис. 6, 4), которые мигрируют к периферии тела
каждой особи. Затем на поверхности гамонтов образу-
ется множество содержащих эти ядра мелких бугор-
ков, которые отпочковываются с образованием га-
мет (рис. 6, 5, 6). Часть цитоплазмы гамонтов остает-
ся неиспользованной, образуя остаточное тело
(residuum), которое в дальнейшем либо дегенерирует,
либо играет определенную роль при вскрытии зрелых
гаметоцист. В ряде случаев остаточное тело может со-
вершать активные движения, перемешивая гаметы в
цисте. У эугрегарин наблюдается как изо-, так и анизо-
гамия. На рис. 6 (6, 7) показан как раз последний слу-
чай: мужские гаметы обладают жгутиком и отличают-
ся от женских продолговатой формой. Каждый гамонт
дает начало гаметам только одного пола. Мужские и
женские гаметы попарно копулируют (рис. 6, 7) и об-
разуют зиготу, которая, покрываясь плотной оболоч-
кой, превращается вооцисту (рис. 6, 8), которую ра-
нее также часто называли спорой.
Гаметоцисты вместе с экскрементами хозяина вы-
деляются наружу. Под покровом ооцист происходит
формирование спорозоитов — спорогония (рис. 6,
9—14), в результате которой в ооцисте оказывается 8
мелких червеобразных тел — спорозоитов. Первое
деление зиготы (рис. 6, 9) представляет собой харак-
терный для споровиков одноступенчатый мейоз (Рай-
ков, 1978). Таким образом, грегарины, как и другие
споровики, гаплоидны и обладают зиготической ре-
дукцией числа хромосом. Процесс созревания ооцист
называется споруляцией. Помимо собственно спо-
рогонии споруляция может включать в себя формиро-
вание дополнительных слоев оболочки ооцист и их
выход из гаметоцисты, который у разных грегарин
происходит по-разному (см. раздел «Морфофункцио-
нальная организация», подраздел «Гаметоцисты»).
ТИП SPOROZOA. КЛАСС GREGARINEA
27
Рис. 6. Жизненный цикл грегарины Stylocephalus (Eugregarinida). (По: Догель, 1981).
1 — трофозоит; 2 — сизигий; 3 — гаметоциста; 4 — прогамные ядерные деления; 5,6 — формирование гамет; 7 — копуляция гамет; 8 — сформированная
ооциста; 9 — мейоз; 10—13 — митозы спорогонии (метагамные); 14 — вскрытие ооцисты в кишечнике хозяина; 15 — спорозоит; Я! — место мейоза.
Fig. 6. The life cycle of a gregarine Stylocephalus (Eugregarinida).
1 — trophozoite; 2 — syzygy; 3 — gametocyst; 4 — progamic nuclear divisions; 5, 6 — formation of gametes; 7 — fecundation; 8 — oocyst formation; 9 — meiosis;
10—13 — sporogonic mitoses; 14 — oocyst dehiscence; 15 — sporozoite.
Для дальнейшего развития ооцисты должны быть
проглочены хозяином. В этом случае под действием
пищеварительных соков ооциста вскрывается и спо-
розоиты выходят в просвет кишечника (рис. 6, 14, 15).
В кишечнике спорозоит прикрепляется своим перед-
ним концом к клетке эпителия, постепенно увеличива-
ется в размерах и превращается в молодого трофозои-
та, приобретая все его характерные черты. На этом
жизненный цикл замыкается.
У грегарин, ранние фазы роста которых проходят
внутриклеточно (рис. 7), спорозоит проникает в клетку
эпителия хозяина целиком (возможно, путем эндоци-
тоза, индуцированного секретом роптрий), где оказы-
вается заключенным в паразитофорную вакуоль. По
мере роста молодой грегарины цитоплазма и ядро
клетки эпителия дегенерируют, затем ее мембрана ло-
пается и грегарина оказывается в просвете кишечника,
где прикрепляется и начинает расти (Siedlecki, 1901;
Ganapati, Aiyar, 1937; Hoshide, 1956). Спорозоиты гре-
гарин, паразитирующих в органах полости тела, попа-
дают к своему окончательному месту паразитирова-
ния, по всей видимости активно проникая сквозь стен-
ку кишечника.
У некоторых грегарин зафиксированы случаи оди-
ночного инцистирования гамонтов. Чаше всего это от-
клонения от нормального хода гаметогонии, не имею-
28
ALVEOLATA
Рис. 7. Внутриклеточное развитие Lankesteria ascidiae в асцидии Ciona intestinalis. (По: Siedlecki, 1901).
1 — кишечный эпителий Ciona в начале инвазии; 2 — гипертрофия зараженной клетки и начало атрофии ядра; 3 — окончание фазы внутриклеточного разви-
тия; 4 — внеклеточный трофозоит, прикрепленный к эпителиальной клетке.
Fig- 7. The intracellular development of Lankesteria ascidiae in the ascidian host Ciona intestinalis.
1 — the intestinal epithelium of Ciona at the beginning of infestation; 2 — hypertrophy of the infected cell and the beginning of the nucleus atrophy; 3 — ending of the
phase of the intracellular development; 4 — an extracellular trophozoite attached to the epithelial cell.
щие продолжения. Однако для некоторых грегарин, в
частности для ряда форм из сем. Urosporidae (Gonospo-
ra te.sticuli, Ceratospora mirabilis и некоторые другие),
довольно обычно одиночное инцистирование с после-
дующим развитием. При этом происходит образование
многочисленных вторичных ядер, которые становятся
ядрами споробластов. Процесс заканчивается форми-
рованием нормальных ооцист, содержащих споро-
зоиты. Подобное явление трактуется как партено-
генез (Grasse, 1953).
Для многих грегарин никакие другие стадии жиз-
ненного цикла, кроме трофозоитов, неизвестны — та-
ково, например, большинство представителей сем. Le-
cudinidae, паразитирующих в разных группах морских
беспозвоночных.
Жизненные циклы с мерогонией. Жизненные
циклы грегарин, включающие бесполое размноже-
ние — мерогонию, довольно разнообразны.
Жизненный цикл Archigregarinina (рис. 8)
считается исходным для грегарин и, видимо, близок к
исходному для споровиков вообще. Грассе (Grasse,
1953) в предложенном им для этого отряда диагнозе
указывает, что для архигрегарин характерны «три ши-
зогонии — агамная, прогамная и постгамная», под ко-
торыми подразумеваются соответственно бесполое
размножение путем множественного деления (мерого-
ния), образование гамет (гаметогония) и образование
спорозоитов из зиготы (спорогония). Ядро группы со-
ставляет обширный род Selenidium, представители ко-
торого, как уже указывалось, паразитируют в средней
Рис. 8. Предполагаемый жизненный цикл грегарин рода Selenidium (Archigregarinida).
1—7 — гаметогония; 8—/7 - спорогония; 13—18 — мерогония, 7?! — место мейоза; пунктирными линиями указаны процессы, точно не прослеженные: 1 —
трофозоит; 2 — сизигий; 3 — сизигий, первые прогамные ядерные деления; 4 — гаметоциста; 5 — формирование гамет; 6 мужская гамета: 7 — женская
гамета; 8 — зигота; 9 — сформированная ооциста после мейоза (с двумя ядрами); 10 — метагамный митоз (митоз спорогонии); 11 — зрелая ооциста с четы-
рьмя сформированными спорозоитами; 12 — спорозоит; 13 — проникновение спорозоитов в клетки кишечного эпителия хозяина; 14,15 — фазы роста меро-
нта в клетке хозяина; 16, 17 — фазы мерогонии; 18 — мерозоит (7—12, 18 — по: Schrevel, 1970а, 1971b: 13—17— по: Brasil, 1907).
Fig. 8. The presumable scheme of the life cycle of an archigregarine Selenidium (Archigregarinida).
1—7 — gametogony; 8—11 — sporogony; 13—18 — merogony; R\ — place of meiosis; Dotted lines — processes having no true evidences: / — trophozoite; 2 — sy-
zygy; 3 — syzygy showing first nuclear transformation; 4 — gametocyst; 5 — formation of gametes; 6 — male gamete; 7 — female gamete; 8— zygote; 9— oocyst af-
ter meiosis (with two nuclei); 10 — sporogonic mitosis; 11 — mature oocyst with four sporozoites; 12 — sporozoite; 13 — penetration of sporozoites in the host intesti-
nal epithelium cells; 14, 15 — development of meront in the host cell; 16, 17 — phases of the merogony; 18 merozoite.
I
ТИП SPOROZOA. КЛАСС GREGARINEA
29
30
ALVEOLATA
кишке седсптарных полихет, а также отмечены в си-
пункулидах и кишсчнодышащих.
11а рис. 8 представлена предполагаемая обобщен-
ная схема жизненного цикла представителей рода Sele-
nidium, обладающих мерогонией. Мерогония Seleni-
dium протекает интраэпителиально и, по всей види-
мости, внутриклеточно, хотя ультраструктурных
исследований, которые могли бы это подтвердить, не
было. Вначале в эпителий кишечника или, в случае ки-
шечнодышащих, печени хозяина внедряется вы-
шедший из ооцисты спорозоит (рис. 8, 12, 13). Он уве-
личивается в размерах и приобретает округлую форму,
оставаясь одноядерным (стадия трофозоита-меро-
нта — рис. 8, 14, 15). Достигнув определенных разме-
ров, меронт претерпевает множественные деления
ядра (рис. 8, 16), в результате чего образуется множе-
ство (от 50 до 200—300) мелких ядер, вокруг которых
обособляется цитоплазма, и формируются мелкие чер-
веобразные мерозоиты. Мерозоиты свободно лежат
в округлом образовании, называемом цистой м е р о -
зоитов (рис. 8,17), однако наличие плотной цистной
оболочки не доказано. Относительно возможных по-
вторных циклов мерогонии данных нет. Так или иначе,
в конце всего процесса мерогонии освободившиеся из
«цисты» мерозоиты попадают в просвет кишечника
хозяина, где прикрепляются к его стенкам, превраща-
ясь в растущих трофозоитов-гамонтов. Дальнейшие
стадии жизненного цикла и процессы гаметогонии и
спорогонии сходны с таковыми у Eugregarinida. Из
особенностей следует особо отметить, во-первых, то,
что прогамные деления у Selenidium начинаются еще
на стадии сизигия — до образования оболочки гамето-
цисты (рис. 8, 3). Во-вторых, в ооцистах многих пред-
ставителей этого рода формируется всего 4 спорозоита
(рис. 8, 11), что считается для споровиков примитив-
ным признаком.
Следует отметить плохую изученность жизненных
циклов архигрегарин и слабую достоверность имею-
щихся результатов. Приведем пример. Впервые меро-
гония Selenidium была описана Коллери и Менилем
(Caullery, Mesnil, 1901) для S. spionis из кишечника
полихеты Scolelepis fuliginosa (Spionidae). Тем не ме-
нее когда Рэй (Ray, 1930) искал мерогонию S. spionis в
эпителии кишки Scolelepis fuliginosa, он вскрыл около
250 полихет, просмотрел около 5000 срезов, но не
встретил ни одной шизогонии 5. spionis, хотя зараже-
ны грегаринами были 97 % червей. Оказалось, что ме-
рогония, описанная Коллери и Менилем как мерого-
ния S. spionis, на самом деле принадлежит кокцидии
Dorisiella. Проблематичность мерогонии у Selenidium
отмечает и Шревель в своих работах, посвященных жиз-
ненным циклам Selenidiidae (Schrevel, 1970а, 1971b).
Лишь у одного из 18 изученных этим автором видов —
S. hollandei — обнаружены «цисты мерозоитов», по
всей видимости принадлежащие именно этой грегари-
не, что косвенно подтверждают и ультраструктурные
данные. Во многих других случаях, в том числе и у ти-
пового вида Selenidium pendula, никаких признаков ме-
рогонии в жизненном цикле не обнаружено. Вообще, к
настоящему времени мерогония отмечена всего у 11 из
44 известных видов Selenidium (Levine, 1971b), причем
доказанным можно считать лишь единичные случаи —
S. hollandei и, вероятно, S. caulleryi (Brasil, 1907).
Другие грегарины, обычно включаемые в группу
архигрегарин, могут отличаться от Selenidium особен-
ностями некоторых стадий жизненного цикла. Так, у
Meroselenidium описано прохождение мерогонии в
два этапа — образованию мерозоитов предшествует
распад меронта на несколько многоядерных отдельно-
стей; ооцисты этой грегарины содержат более 16 спо-
розоитов. У необычного организма Exoschizon sipho-
nosomae из кишечника сипункулиды Siphonosoma
kumanense меронты внешне сходны с гамонтами Sele-
nidium и обитают в просвете кишечника хозяина. Ме-
розоиты отпочковываются от переднего конца меро-
нта. Гамонты у Exoschizon неизвестны.
Жизненные циклы Neogregarinina. В эту,
очевидно, сборную группу объединены своеобразные
организмы, обладающие мерогонией и паразитирую-
щие исключительно в насекомых.
Разнообразие жизненных циклов неогрегарин, бо-
лее подробно рассмотренных в «Систематическом
обзоре», представляет собой результат различных ком-
бинаций двух основных параметров. Прежде всего ме-
рогония у неогрегарин может протекать, в зависимо-
сти от семейства, либо внеклеточно, либо внутрикле-
точно. Другая особенность — наличие у некоторых из
них в жизненном цикле «разнохарактерных мерого-
ний», продукты которых не всегда представляют со-
бой типичные мерозоиты (см. раздел «Морфофункци-
ональная организация», подраздел «Мерогония и ме-
розоиты»). У представителей семейств Schizocystidae,
Caulleryellidae и Ophryocystidae мерогония внеклеточ-
ная. При этом для Schizocystidae и Caulleryellidae ха-
рактерно образование мелких червеобразных или кап-
левидных мерозоитов. У Ophryocystis существует два
сильно различающихся морфологических типа ме-
ронтов — мицетоидные с многочисленными мелкими
ядрами, образующие длинные выросты и часто не име-
ющие определенной формы, и грегариноидные, купо-
лообразной или конической формы, содержащие в ци-
топлазме немногочисленные более крупные ядра. Ми-
цетоидные меронты могут продуцировать в большом
количестве мелкие «микронуклеарные» мерозоиты.
Грегариноидные меронты претерпевают мерогонию,
которая напоминает продольное деление. Образовав-
шиеся в результате немногочисленные крупные «ме-
розоиты» дифференцируются в гамонтов, формирую-
щих сизигии и приступающих к гаметогонии.
Неогрегарины семейств Syncystidae и Lipotrophidae
паразитируют внутриклеточно в жировом теле насеко-
мых и соответственно претерпевают внутриклеточные
мерогонии — микро- и макронуклеарную (у некото-
рых представителей, впрочем, только один тип меро-
гонии). Внедрившиеся в клетку хозяина спорозоиты
вырастают вмикронуклеарных меронтов, ко-
торые по мере роста становятся многоядерными и рас-
падаются на микронуклеарные мерозоиты.
Микронуклеарные мерозоиты в свою очередь внедря-
ются в клетки хозяина и вырастают вмакронукле-
арных меронтов, продуцирующих макронук-
леарные мерозоиты. Макронуклеарные меронты
отличаются от микронуклеарных большим размером и
меньшим количеством ядер. Макронуклеарные меро-
зоиты в свою очередь дифференцируются либо снова
в макронуклеарных меронтов, либо в гамонтов. Для
ТИП SPOROZOA. КЛАСС GREGARINEA
31
этих грегарин характерны неогамные сизигии, факти-
чески образующиеся только что внедрившимися в
клетку мерозоитами-гамонтами. Стадия одиночного
трофозоита-гамонта при этом выпадает из жизненного
цикла.
Для грегарин родов Mattesia (Lipotrophidae) и Oph-
ryocystis (Ophryocystidae) характерно небольшое число
гамет: в первом случае каждый гамонт продуцирует 2,
во втором — 1 гамету.
Две внутриклеточные разнохарактерные мерого-
нии присутствуют и в жизненных циклах эугрегарин
рода Gigaductus (см. раздел «Морфофункциональная
организация», подраздел «Мерогония и мерозоиты», а
также характеристику сем. Gigaductidae в «Системати-
ческом обзоре»). Эти грегарины вначале были выделе-
ны из сем. Gregarinidae в отдельное сем. Gigaductidae
(Filipponi, 1948), а затем и вовсе переведены в Neogre-
garina (Ormieres, 1971). В настоящей главе они возвра-
щены в отряд Eugregarinida на основании морфологи-
ческих и ультраструктурных данных (см. разделы
«Эволюция и филогения» и «Воросы систематики»).
Наконец, с классом Gregarinea традиционно сбли-
жают некоторые организмы, которые обладают абер-
рантными жизненными циклами. Это Schaudinnella
enchytraei из олигохеты Henlea leptodera и «бластогре-
гарины» рода Siedleckia из кишечника морских поли-
хет. В их жизненных циклах отсутствуют стадии сизи-
гия и гаметоцисты (см. характеристику этих организ-
мов в разделе «Систематический обзор»).
Морфофункциональная
организация
Общие замечания
Большинство материалов по морфологии грегарин
представляют собой светооптические описания трофо-
зоитов новых или предположительно новых для науки
видов. Количество видов, у которых подробно изуче-
ны другие стадии жизненного цикла, относительно не-
велико. Ультраструктурные исследования грегарин,
хотя и представляют много интересной информации,
носят в целом неравномерный и разрозненный харак-
тер — разные таксоны изучены с неодинаковой степе-
нью подробности. Основная масса данных относится к
представителям отряда Eugregarinida. Существенный
вклад в проблему изучения различных стадий жизнен-
ных циклов могли бы внести методы культивирования
грегарин in vitro, разработка которых находится пока в
зачаточном состоянии (Collins, 1972; Abe, Aoyama,
1979; Abe, Tsuchiya, 1980).
Морфофункциональная организация разных ста-
дий жизненного цикла у грегарин в большинстве слу-
чаев существенно различается. Однако у некоторых
грегарин может происходить «наложение» некоторых
стадий развития друг на друга. Речь идет в первую оче-
редь о стадиях трофозоита и сизигия у неогамных
грегарин, таких как Zygocystis (Monocystidae) из се-
менных мешков олигохет, Enterocystis (Enterocystidae)
из кишечника личинок поденок, многих представите-
лей сем. Urosporidae (например, Urospora chiridotae из
кровеносного сосуда и целома голотурии Chiridota lae-
vis, Diplauxis из полости тела полихет), внутриклеточ-
ных неогрегарин сем. Lipotrophidae (Mattesia,
Farinocystis) — паразитов жирового тела различных
насекомых. В этих случаях, как уже отмечалось в раз-
деле «Жизненные циклы», объединение партнеров
происходит, по-видимому, еще на стадии недавно вы-
шедших из ооцисты спорозоитов, либо — в случае
внутриклеточных неогрегарин — слегка подросших
мерозоитов. Стадия, на которой идут основные про-
цессы роста и развития, совмещает в себе, таким обра-
зом, как функции трофозоита и сизигия, так и основ-
ные черты их организации. Поэтому часть особенно-
стей строения таких неогамных сизигиев будет
рассмотрена в разделе, посвященном трофозоитам
(ультраструктура покровов и цитоплазмы), а другая
часть — в разделе, посвященном сизигиям (способы
объединения партнеров и строение зоны контакта).
Методы изучения грегарин
При исследовании грегарин на светооптическом
уровне применяются фиксации сулемовым спиртом по
Шаудину, жидкостью Германа, жидкостью Флеммин-
га, смесью Буэна, смесью Бразиль, смесью Карнуа;
окраска — борный кармин, гематоксилин Гейденгайна,
Делафильда, Караччи, гемалаун, сафранин, пикрокар-
мин. Для срезов особенно хороша окраска по Малло-
ри. Наблюдение грегарин в живом состоянии произво-
дится в окрашенных кармином или тушью жидкостях,
физиологическом растворе, профильтрованной слюне.
Паразиты морских животных прекрасно чувствуют
себя в морской воде и могут жить там многие часы и
даже, иногда, до нескольких суток.
Для получения ультратонких срезов грегарин испо-
льзуют стандартные электронно-микроскопические
методики. Хорошие результаты дает следующий спо-
соб: грегарин фиксируют 1.5%-ным или 2.5%-ным
глютаровым альдегидом на 0.1 М какодилатном буфе-
ре (pH 7.2—7.4) — две смены по 1 ч (на льду и в темно-
те), промывают в трех сменах такого же буфера при
комнатной температуре (в случае морских организ-
мов — в профильтрованной морской воде), постфик-
сируют в течение 2 ч 2%-ным раствором OsO4 на 0.1 М
какодилатном буфере (pH 7.2—7.4) в тех же условиях,
что и при фиксации глютаральдегидом, а затем, после
восходящей проводки, заливают в Ероп-812 или дру-
гую подходящую среду по стандартной методике. Уль-
тратонкие срезы окрашивают уранил-ацетатом и цит-
ратом свинца по Рейнольдсу.
Для исследования трофозоитов в сканирующем
электронном микроскопе применяется такая же фикса-
ция (глютаровый альдегид — тетраоксид осмия). Хо-
рошие результаты дает также использование вместо
глютаральдегида 4%-ного раствора формальдегида в
морской воде (для морских форм). После восходящей
спиртовой проводки объекты переводят в смесь 96°
спирта и ацетона 1:1, далее следуют три смены чистого
ацетона по 1 часу и сушка в критической точке. Вслед
за этим объекты монтируют на столики, подвергают
напылению металлом и изучают собственно в скани-
рующем электронном микроскопе.
32
ALVEOLATA
Спорозоиты
Спорозоиты грегарин имеют типичное для споро-
виков строение (Porchet-Hennere, Vivier, 1971). Это
мелкие червеобразные клетки, передний конец кото-
рых обычно заострен, а задний притуплен. Спорозои-
ты подвижны — они способны изгибать, скручивать и
раскручивать тело, а также скользить по субстрату.
Тело спорозоитов покрыто трехмембранной пелли-
кулой, образованной плазмалеммой и внутренним
мембранным комплексом (более подробно о пеллику-
ле и процессах ее формирования рассказано в подраз-
делах «Трофозоиты» и «Стадии спорогонии»). Под
пелликулой располагаются в один слой продольные
субпелликулярные микротрубочки. Основные компо-
ненты апикального комплекса — коноид, полярные
кольца, роптрие-микронемальный комплекс — пред-
ставлены у большинства изученных в этом отношении
спорозоитов грегарин (Desportes, 1967, 1969; Prensier,
1970а, 1970b; Porchet-Hennere, Fischer, 1973; Tronchin,
Schrevel, 1977; Crespi et al., 1981). У спорозоитов Dip-
lauxis, правда, не найден коноид, а у развивающихся
внутриклеточно спорозоитов Ascogregarina («Lankes-
teria») culicis из личинок комара Addes aegypti и недав-
но прикрепившихся к эпителию кишечника хозяина
спорозоитов Gregarina blaberae из тропического тара-
кана Blaberus craniifer обнаружена «осевая органел-
ла» — округлая вакуоль с фибриллярным содержимым
и протоком, проходящим через коноид, что сильно на-
поминает мукрональный комплекс трофозоитов архи-
грегарин Selenidium (Sheffield et al., 1971; Tronchin,
Schrevel, 1977). Эта структура исчезает на начальных
этапах развития спорозоита в организме хозяина
(у спорозоита A. culicis — при переходе к внутрикле-
точному паразитизму). Следует заметить, что «осевая
органелла» описана лишь у спорозоитов, уже вступив-
ших в контакт с хозяином, тогда как у спорозоитов,
находящихся внутри ооцист, она не отмечена. О пред-
полагаемой функции этой органеллы будет сказано в
разделе «Эволюция и филогения».
Процессы превращения спорозоита в трофозоит
подробно изучены только у септатных эугрегарин Sty-
locephalus и Gregarina blaberae (Desportes, 1967, 1969;
Tronchin, Schrevel, 1977) и будут рассмотрены в следу-
ющем разделе.
Трофозоиты
Для обозначения вегетативных стадий грегарин в
литературе применяют такие термины, как «трофозо-
ит» («трофонт»), «цефалина» («цефалонт»), «споради-
на» («споронт»), «гамонт» («гаметоцит»), «меронт»
(«шизонт»). В основу этих терминов заложены разно-
плановые критерии — возрастные, морфологические,
а также способность к определенному типу размноже-
ния. Это часто вызывает путаницу и потому требует
некоторых пояснений.
Термин тро ф озо ит («питающийся зоит») приме-
няется в протозоологической литературе для обозначе-
ния активно питающихся и растущих неразмножаю-
щихся стадий. Он отражает определенную возрастную
и функциональную характеристику и в этом смысле
полностью подходит для обозначения вегетативных
стадий грегарин. Цефалинами (т. е. «головастика-
ми») называют прикрепленных трофозоитов — как
видно из названия, часто обладающих хорошо разви-
тыми прикрепительными приспособлениями (эпиме-
рит). Этот термин не совсем удачен в отношении гре-
гарин, у которых прикрепительные приспособления
выражены плохо. Спорадинами называют свобод-
ных, неприкрепленных трофозоитов, но название, ко-
торое переводится как «рассеивающаяся» или «рассе-
ляющаяся», не совсем верно отражает суть дела и, ско-
рее, даже вводит в заблуждение, поскольку за этой
стадией следует образование сизигия и, далее, гамет, а
не «спор» или спорозоитов, которые и являются насто-
ящими расселительными стадиями.
Термины гамонт и меронт, напротив, отража-
ют мультипликативные (репродуктивные) потенции
данной особи. Гамонт, согласно унифицированной
терминологии, предложенной Левайном (Levine,
1971а) для типа Apicomplexa, это особь, которая будет
продуцировать одну или более гамет. Меронт —
бесполая особь, размножающаяся путем деления
(чаще всего множественного), обычно продуцирую-
щая мерозоиты. Очевидно, что и гамонт, и меронт дол-
жны проходить в своем развитии разные стадии —
спорозоит или мерозоит, трофозоит, зрелый гамонт
(меронт). Кроме того, гамонтами являются и партнеры
в сизигиях. Исходя из этого, мы полагаем термины
«гамонт» и «меронт» неподходящими для обозначения
стадий жизненного цикла грегарин, поскольку они яв-
ляются названиями различных поколений, а не ста-
дий развития как таковых. Это в особенности касается
ситуаций, когда жизненный цикл не изучен, что имеет
место у очень многих видов грегарин. Термины «ме-
ронт» и «гамонт» следует применять в этом случае с
большой осторожностью. Так, крупные меронты Exos-
chizon siphonosomae из кишечника сипункулиды Sipho-
nosoma kumanense внешне похожи на гамонтов других
грегарин и вполне могли бы быть описаны как тако-
вые, если б не была обнаружена их мерогония (Hukui,
1939). В литературе также имеются указания на воз-
можность существования мерогонии у ряда эугрега-
рин — Ancora prolifera (Clausen, 1993), некоторых
Urosporidae (Мавродиади, 1914). В случае подтвержде-
ния этих фактов, как, в частности, произошло с други-
ми эугрегаринами из рода Gigaductus (Ormieres, 1971;
Massot, Ormieres, 1979), теоретически вполне может
оказаться, что стадии, описанные как «гамонты», на
самом деле являются меронтами, или даже «гамонты»,
описанные как разные виды, — это разные поколения
одного и того же вида.
Исходя из всего вышесказанного, для обозначения
вегетативных стадий грегарин лучше всего подходит
термин «трофозоит», которым мы и будем пользовать-
ся в дальнейшем. Термины «гамонт» и «меронт» будут
употребляться в случае необходимости подчеркнуть
принадлежность стадий развития к тому или иному по-
колению. Взамен терминов «цефалина» и «спорадина»
будут использоваться «прикрепленный трофозоит» и
«свободный» или «взрослый трофозоит».
Общее строение. Клетки трофозоитов большинст-
ва грегарин резко гетерополярны, что связано с обо-
соблением переднего конца, выполняющего прикрепи-
ТИП SPOROZOA. КЛАСС GREGARINEA
33
тельную функцию. Трофозоиты грегарин чаще всего
имеют овоидную или удлиненную форму и крупные
размеры. Так, Grebnickiella gracilis из кишечника Sco-
lopendra cingulata достигает 5 мм в длину, Cystocepha-
lus algerianus из жука-чернотелки Pimelia — 4 мм, не-
которые Stylocephalidae — до 1—2 мм. Многочислен-
ны грегарины размером 400—500 мкм, но наиболее
обычные размеры их клеток от 150 до 300 мкм. Разме-
ры, близкие к минимальным, — около 10 мкм — имеет
внутриклеточная неогрегарина Lipotropha, паразити-
рующая в жировом теле насекомых. Форма тела тро-
фозоитов более или менее определенная и постоянная,
за исключением представителей сем. Monocystidae, об-
ладающих способностью к перистальтическому мета-
болирующему движению, а также мицетоидных мерон-
тов некоторых неогрегарин (Ophryocystis), имеющих
разнообразную разветвленную форму. Свободные тро-
фозоиты подавляющего большинства грегарин по-
движны, что необходимо для поиска полового партне-
ра. Не обладают подвижностью или малоподвижны,
помимо неогамных трофозоитов-сизигиев, лишь не-
многие — например, трофозоиты эугрегарины Trichor-
hynchus pulcher, гамонты и меронты неогрегарин рода
Ophryocystis.
Тело трофозоитов может быть несегментирован-
ным — таких грегарин называют моноцистидны-
ми, либо поделено на отделы перетяжками и внут-
ренними перегородками (септами) — это поли-
цистидные формы (рис. 9). Моноцистидное тело
характерно для Archigregarinina и Neogregarinina (т. е.
для отряда Schizogregarinida), а также для представите-
лей подотряда Aseptata отряда Eugregarinida. Полицис-
тидные или септатные формы — это представители
подотряда Septata отряда Eugregarinida. Они в свою
очередь подразделяются на дицистидных, трицистид-
ных и многосегментных. У трицистидных грегарин от-
четливо различаются три отдела: позади переднего
сегмента — эпимерита, служащего для прикрепле-
ния, находится протомерит, а позади него — дей-
томерит, в котором лежит ядро. Протомерит и дей-
томерит отделены друг от друга внутренней перего-
родкой — с е п т о й. Эпимерит обычно отграничен от
протомерита перетяжкой и отличается структурой ци-
топлазмы. Термин «дицистидный» применяется как к
грегаринам, имеющим эпимерит и нерасчлененный
протодейтомерит, так и к грегаринам, лишенным эпи-
мерита, но имеющим протомерит и дейтомерит. Такое
двоякое толкование вносит определенную путаницу,
поэтому, на наш взгляд, дицистидными лучше назы-
вать лишь септатных грегарин, тело которых состоит
только из прото- и дейтомерита. У некоторых эугрега-
рин, таких как Cognettiella legeri, Gregarina segmenta-
ta, Neoschneideria douxi, Taeniocystis mira, форми-
руется несколько септ. Этих и подобных им грегарин
называют метамерными, или многосегментными
(рис. 9, 3, 4, 5).
Трофозоиты подавляющего большинства грегарин
прикрепляются к клеткам хозяина передним концом,
где для этой цели развиваются особые приспособления
и структуры. Наиболее употребительные обозначения
для основных типов прикрепительных приспособле-
ний — это мукрон и эпимерит. Прикрепление к
клеткам эпителия хозяина архигрегарин рода Selenidi-
um осуществляется мукроном — вздутой терми-
нальной частью клетки с заостренным кончиком.
В мукроне взрослых трофозоитов Selenidium, подобно
спорозоитам, располагаются органеллы апикального
(мукронального) комплекса органелл и, по всей види-
мости, формируется подобие цитостома, при помощи
которого поглощается цитоплазма клетки хозяина (по-
дробнее о строении архигрегарин см. ниже). Мукрон
трофозоитов архигрегарин полностью гомологичен
переднему концу инвазионных стадий споровиков —
спорозоитов и мерозоитов.
У эугрегарин мукрональный комплекс на переднем
конце отсутствует. Септатные грегарины, как уже ука-
зывалось выше, часто снабжены особым прикрепи-
тельным приспособлением — эпимеритом, кото-
рый формируется как новообразование впереди исче-
зающего в процессе развития апикального комплекса
спорозоита, и, таким образом, негомологичен мукрону
архигрегарин и переднему концу инвазионных зоитов.
У некоторых грегарин эпимерит достигает большого
развития и бывает вооружен крючьями или другими
придатками, с помощью которых паразиты заякорива-
ются в эпителии кишечника хозяина. Зрелые гамонты,
переходя к подвижному образу жизни, по всей види-
мости, отбрасывают эпимерит, который остается в тка-
нях хозяина. Утрата эпимерита является необратимой.
Трофозоиты некоторых грегарин (Amphoroides circi,
Cnemidospora lutea, Porosporidae) способны к неод-
нократному откреплению и прикреплению к эпите-
лию хозяина. В подобных случаях главную роль, по-
видимому, играют поверхностные структуры протоме-
рита.
Прикрепление к кишечной стенке хозяина асептат-
ных Eugregarinida (подотряд Aseptata) осуществляется
передним концом, который обычно, по мнению ряда
исследователей, функционирует как присоска (Schre-
vel, Vivier, 1966; Ouassi, Porchet-Hennere, 1978) и пред-
ставляет собой в этом случае небольшой вырост на пе-
реднем конце тела. По аналогии с архигрегаринами его
также принято обозначать как «мукрон» на основании
сходства светооптической морфологии. Некоторые
асептатные эугрегарины, однако, могут иметь при-
крепительные приспособления, подобные эпимериту
Septata, т. е. структурно дифференцированные отделы
тела, отбрасываемые при созревании. Дифференци-
ровка может выражаться, например, в существовании
перетяжки и (или) в отсутствии зернистости цитоплаз-
мы (Cygnicollum lankesteri, Sycia inopinata). Такие при-
крепительные приспособления в старой литературе
(например, Kamm, 1922), по аналогии с септатными
формами, также назывались эпимеритами. В совре-
менной литературе и эти структуры тоже обозначают
термином «мукрон», оставляя термин «эпимерит»
только для септатных грегарин. Свободные, открепив-
шиеся трофозоиты имеют обычно прозрачный, лишен-
ный зернистости передний конец тела. В современной
литературе его часто называют опять-таки «мукрон»
(Levine, 1971а).
Таким образом, термин мукрон используется для
обозначения следующих образований:
• прикрепительное приспособление архигрегарин;
• неотбрасываемое прикрепительное приспособле-
ние асептатных грегарин;
3 Зак. № 4163
34
ALVEOLATA
3 4
Рис. 9. Морфология трофозоитов грегарин: моноцистидные (7), ди- и трицистидные (2), метамерные (3—5).
7 — моноцистидная грегарина Lecudina elongata (а — фазы развития, б — свободный трофозоит); 2 — грегарина Ancyrophora uncinata {а — трицистидный
трофозоит с эпимеритом: эп — эпимерит, п — протомерит, d — дейтомсрит; б — дицистидный трофозоит, отбросивший эпимерит; в — эпимерит); 3 — Cog-
nettiella legeri\ 4 — Neoschneideria douxi', 5 — Taeniocystis mira {a — молодой трицистидный трофозоит, б — полностью сформированный многосегментный
трофозоит). (7 — по: Brasil, 1908а; 2 — по: Baudoin, 1971; 3 — по: Cognetti de Martiis, 1911; 4 — по: Ormieres et al., 1965; 5 — no: Leger, 1906).
Fig. 9. Morphology of the gregarines' trophozoites: monocystid (7), di- and tricystid (2), metameric (3—5).
7 — monocystid gregarine Lecudina elongata (a — developmental stages, o — free trophozoite); 2 — gregarine Ancyrophora uncinata (a — tricystid trophozoite with
an epimerit: on— epimerit, n — protomerit, d— deutomerit; 6— dicystid adult trophozoite without epimerit; в — epimerit); 3 — Cognettiella legeri', 4 — Neoschneide-
ria douxi-, 5 — Taeniocystis mira (a — young tricystid trophozoite; 6 — fully shaped metameric trophozoite).
• отбрасываемое прикрепительное приспособление
асептатных грегарин;
• передний конец взрослых, свободных трофозоитов
асептатных грегарин — независимо от его гене-
зиса.
Употребление одного и того же термина по отно-
шению к имеющим совершено различное строение и в
ряде случаев, видимо, даже не гомологичным структу-
рам грегарин является, на наш взгляд, не вполне кор-
ректным, особенно когда речь идет об одной группе
организмов. Поэтому в дальнейшем во избежание пу-
таницы мукроном мы будем называть структуры,
несущие элементы апикального комплекса орга-
нелл — прикрепительное приспособление архигрега-
рин и передний конец внутриклеточных неогрегарин.
Термин эпимерит оставим за септатными грега-
ринами, а в отношении асептатных эугрегарин будут
применяться понятия «передний конец», «прикрепи-
ТИП SPOROZOA. КЛАСС GREGARINEA
35
тельное приспособление» и «мукрон» в кавычках. Тем
не менее следует подчеркнуть еще раз, что в современ-
ной литературе термин мукрон, перекочевав из эпо-
хи световой микроскопии, продолжает употребляться
равным образом по отношению как к архигрегари-
нам, так и ко всем асептатным эугрегаринам. Он явля-
ется общепринятым и постоянно присутствует в диа-
гнозах (Schrevel, 1969; Levine, 1971а, 1974, 1976,
1977а, 1977b, 1977с, 1977d, 1980, 1981, 1985, 1988; Per-
kins et al., 2000). При прочтении диагнозов следует, та-
ким образом, иметь в виду, что под «мукроном» часто
понимается просто передний конец тела трофозоитов
моноцистидных грегарин.
Ряд грегарин имеет множественные прикрепитель-
ные приспособления. Таковы крупные выросты тела у
Pterospora petaloprocti (Urosporidae) и Ophryocystis,
которыми они прикрепляются соответственно к цело-
мической стенке хозяина или к эпителию кишечника, а
также многочисленные нитевидные ризоиды, харак-
терные для крупных грегарин сем. Dactylophoridae, па-
разитирующих в средней кишке губоногих многоно-
жек (Chilopoda).
Трофозоиты некоторых грегарин полностью лише-
ны прикрепительных приспособлений. Таковы некото-
рые паразиты целомической полости полихет и игло-
кожих — грегарины из сем. Urosporidae: Gonospora varia,
Urospora longissima, Lithocystis spp., Diplauxis spp., внут-
риклеточные паразиты жирового тела насекомых —
неогрегарины семейств Syncystidae и Lipotrophidae.
Общая ультраструктура (рис. 10). Покровы боль-
шинства изученных внеклеточных трофозоитов грега-
рин представлены трехмембранной пелликулой, ха-
рактерной для всех споровиков на тех или иных стади-
ях развития (Vivier et al., 1970; Porchet-Hennere, Vivier,
1971). Внешняя — плазматическая — мембрана по-
крыта гликокаликсом (Schrevel, 1972; Philippe, Schre-
vel, 1982), который может быть различной толщины и
плотности. Средняя и внутренняя мембраны пеллику-
лы имеют внутриклеточное (в филогенетическом пла-
не — альвеолярное) происхождение и соответствуют
таковым спорозоита. Они обычно тесно сближены и
формируют внутренний мембранный комп-
лекс (ВМК), отделенный от плазмалеммы промежут-
ком 6—10 нм. Общая толщина пелликулы порядка
25—30 нм. Следует сразу заметить, что в работах кон-
ца 60—начала 70-х гг. XX в. (начало «электронно-мик-
роскопической» революции в протистологии) часто
сообщается о двух, четырех и даже пяти мембранных
образованиях в покровах грегарин. Такая интерпрета-
ция по большей части, скорее всего, связана с невер-
ным прочтением фотографий (за мембрану принима-
лись ее отдельные листки и т. п.) либо с плохой фикса-
цией. В любом случае, все подобные сообщения
нуждаются в дополнительной проверке.
Пелликулу на всем ее протяжении подстилает элек-
тронно-плотный слой толщиной до 30 нм, который в
настоящее время называют internal lamina (Schrevel
et al., 1983) (другие варианты: lame basale, formation so-
on лип
1 2
Рис. 10. Схема ультратонкой организации архигрегарин (?) и эугрегарин (2) на поперечных срезах. (По: Фролов, 1991).
иг — аппарат Гольджи, ап — амилопектиновые зерна, вмк— внутренний мембранный комплекс пелликулы, гли — гликокаликс, иг — иитрацистернальные
грпиулы, лип — липидные капли, мп — микропора, мт — микротрубочки, мтх — митохондрии, пм — плазматическая мембрана (плазмалемма), пс — под-
г I нлающий слой, ппс — перемычки подстилающего слоя, рп — роптрии, эпр — эндоплазматический ретикулум, экт — эктоплазма, энд — эндоплазма, я —
ядро, яо — ядерная оболочка.
Fig. 10. Diagram of the ultra-thin organization of archigregarines (7) and eugregarines (2) at the cross-sections.
i/г dyctiosomes, an — amylopectin, вмк — cortical cytomembranes, гли — cell coat, иг — intracistemal granules, лип — lipid droplets, мп — micropore, мт —
llllcrotubules, мтх — mitochondria, пм—plasma membrane, nc—internal lamina, nnc — internal lamina links at the bases of epicytic folds, pn — dense bodies (rhop-
tries), эпр — endoplasmic reticulum, экт — ectoplasma, энд — endoplasma, я — nucleus, яо — nuclear envelop.
36
ALVEOLATA
iis-j.icciih', «подстилающий слой» и даже «базальная
мсморапа»). На наш взгляд, наиболее подходящим
русским названием для этой структуры будет под-
ст илающий слой. Показано, что у эугрегарины Di-
dymophyes gigantea из личинок жука-носорога (Orycies
nasicornis) он состоит из тонких фибрилл толщиной
2.5 нм, которые расположены продольно (Hildebrand,
1981). У архигрегарин гликокаликс и подстилающий
слой выражены слабо. Непрерывность пелликулы час-
тично нарушается многочисленными микропорами,
устроенными так же, как у зоитов других спорови-
ков, — внешняя мембрана инвагинирует внутрь цито-
плазмы через «разрыв» внутреннего мембранного ком-
плекса и подстилающего слоя, последний образует во-
круг устья микропоры электронно-плотную муфту.
Под пелликулой в кортикальной зоне обычно распола-
гаются различным образом ориентированные суб-
пелликулярные микротрубочки.
Поверхность тела трофозоитов устроена у предста-
вителей разных таксонов неодинаково.
• Для архигрегарин характерны регулярные широкие
продольные складки пелликулы, непосредственно
под которой упорядоченно расположены, часто в
2—3 слоя, продольные субпелликулярные микро-
трубочки (рис. 10, 7; рис. 11, Л, вкл.).
• Поверхность большинства неогрегарин, по-види-
мому, лишена гребней и борозд.
• Для эугрегарин характерен особый тип строения
поверхности — эпицит. Он представляет собой
совокупность узких продольных гребней, образо-
ванных пелликулой и несущих в своих вершинах
два типа особых структур — апикальные арки и
апикальные филаменты (подробнее о тонком стро-
ении трофозоитов эугрегарин см. ниже). Для эугре-
гарин характерны также не продольные, а кольце-
вые кортикальные микротрубочки, лежащие не
сразу под пелликулой, а на некотором от нее удале-
нии (рис. 10, 2; рис. 11, В—Г\ 12, В—Е, вкл.).
Термин «эпицит» иногда применяют и для обозначе-
ния складок пелликулы архигрегарин. Однако во избежа-
ние путаницы мы будем употреблять его только в отноше-
нии уникальной структуры поверхности Eugregarinida.
Цитоплазма трофозоитов грегарин обычно подраз-
делена на наружную прозрачную эктоплазму (экто-
ц и т) и внутреннюю эндоплазму (э н д о ц и т), у живых
экземпляров часто сильно зернистую. Эта зернистость
обусловлена большим количеством зерен запасного
углевода — амилопектина, иногда не совсем верно на-
зываемого парагликогеном (Vivier, 1968; Mercier et al.,
1973). Концентрация амилопектиновых зерен может
быть столь высока, что при наблюдении в световом
микроскопе цитоплазма кажется темной, а у крупных
форм — почти черной. В области переднего конца, вы-
полняющего прикрепительную функцию, зернистость
исчезает — это область утолщенной эктоплазмы, тогда
как на протяжении всего остального тела слой экто-
плазмы очень тонок и часто трудно различим. У неко-
торых грегарин деление на экто- и эндоплазму отсут-
ствует вовсе, так как зерна амилопектина равномерно
распределены по всей цитоплазме, в том числе и по
кортикальной зоне. В цитоплазме грегарин помимо зе-
рен амилопектина находятся основные клеточные ор-
ганеллы: диктиосомы, гладкий и шероховатый ЭПР,
различные вакуоли и включения (белковые и липид-
ные капли, имеющие гомогенную структуру и особен-
но многочисленные в области переднего конца, а
также окруженные мембраной электронно-плотные
тела различной формы и размеров). Последние имеют
совершенно разную природу у представителей разных
таксонов: у архигрегарин это в основном компоненты
роптрие-микронемальной системы (рис. 12, А, вкл.), а
у эугрегарин округлой формы плотные тела, по всей
видимости, содержат гликопротеиды (см. ниже раздел,
посвященный дифференцировке тела септатных грега-
рин) и по сути представляют собой мукоцисты, вы-
деляющие на поверхность либо слизь, либо компонен-
ты гликокаликса (Philippe et al., 1982). Во всяком слу-
чае плотные тела у эугрегарин часто контактируют с
пелликулой, а на срезах иногда наблюдается картина,
похожая на экструзию содержимого плотного тела, ве-
роятно слизи, во внешнюю среду (Симдянов, 1995а)
(рис. 12, Е). Возможно также участие этих образова-
ний в формировании стенки гаметоцисты, наподобие
стенкообразующих тел макрогамонтов кокцидий.
Цистерны ЭПР иногда содержат кристаллоиды, ха-
рактеризующиеся периодической структурой в виде
чередующихся темных и светлых полос шириной око-
ло 10 нм, которые имеют, вероятно, белковую природу
и, возможно, представляют собой запасные вещества
(Schrevel et al., 1974b). Митохондрии у грегарин чаще
всего немногочисленны (за исключением эпимерита
септатных грегарин), что, вероятно, связано с анаэроб-
ными условиями существования. Они располагаются в
эктоплазме, обычно имеют округлую форму и неболь-
шое число ампуловидных (в грубом приближении —
трубчатых) крист.
Большинство грегарин имеет единственное ядро.
Оно крупное и содержит обычно одно, реже два и бо-
лее хорошо заметных ядрышка различных размеров и
формы. У моноцистидных форм ядро лежит в проме-
жутке от одной трети до середины длины клетки. Ядро
септатных грегарин находится в середине дейтомерита
или сдвинуто в его переднюю часть. У некоторых сеп-
татных эугрегарин, кроме того, в цитоплазме протоме-
рита трофозоитов поздних возрастов наблюдается
компактная структура, окрашиваемая ядерными кра-
сителями и называемая поэтому «протомеритным яд-
ром». Подробнее об этом образовании будет рассказа-
но в разделе, посвященном особенностям строения
трофозоитов Eugregarinida.
Многочисленные ядра характерны для меронтов
шизогрегарин в начале процесса мерогонии — это вре-
менная многоядерность, предшествующая образова-
нию мерозоитов. Однако у части неогрегарин наблю-
дается длительная прогрессирующая многоядерность
на протяжении всей стадии роста меронтов (Machado-
ella, Mattesia, Schizocystis, Ophryocystis). Среди эугре-
гарин многоядерность — чрезвычайно редкое явление,
отмеченное лишь у трофозоитов Didymophyes gigantea
(Hildebrand, 1976). Многочисленные ядра характерны
и для трофозоитов («гамонтов») бластогрсгарины Sied-
leckia. Во всех этих случаях количество ядер увеличи-
вается с возрастом трофозоита. У взрослых трофозои-
тов (гамонтов) Didymophyes gigantea их количество
достигает нескольких сотен, но ядра мелкие и собраны
в компактную группу, поэтому при наблюдении в све-
ТИП SPOROZOA. КЛАСС GREGARINEA
37
тобой микроскоп создается впечатление, что у этой
грегарины, как и у большинства других, всего одно
крупное ядро.
Ядра трофозоитов грегарин пузырьковидные (по
классификации И. Б. Райкова, 1978). Их ядерная обо-
лочка имеет в основе то же строение, что и у большин-
ства эукариот, т. е. состоит из двух параллельных мем-
бран, разделенных перинуклеарным пространством и
переходящими друг в друга в местах образования
ядерных пор. Такое классическое строение ядерной
оболочки описано, например, для трофозоитов Мопо-
cystidae (Warner, 1968; Vinckier, 1969; Sathananthan,
1977; Martinucci, Crespi, 1979), представителей рода
Ascogregarina (pLankesteria) (Vavra, 1969; Walsh, Cal-
laway, 1969) и др. Интересным является то, что, соглас-
но Вивье, ядерные поры грегарин имеют особое строе-
ние (Vivier, 1967). Поровый комплекс у Selenidium hol-
landei и Lecudina pellucida, по данным этого автора,
представляет собой усеченный конус или цилиндр,
вставленный внутрь просвета поры. В его стенку вмон-
тированы 8 субъединиц, представляющих собой отрезки
трубочек толщиной 12—15 нм и высотой 80—90 нм.
Следует заметить, правда, что эти данные противоре-
чат современным представлениям о консервативной
структуре ядерных пор эукариот и поэтому нуждаются
в проверке.
У части грегарин строение ядерной оболочки ста-
новится более сложным. Так, на внутренней ее стороне
может развиваться неструктурированный фиброзный
слой, иногда значительной толщины. Он имеется у ар-
хигрегарин рода Selenidium (Schrevel, 1971а), многих
эугрегарин —Lecudina pellucida (Vivier, 1967), пред-
ставителей рода Gregarina, паразитирующих в мучных
червях (Devauchelle, 1968а). У других грегарин отме-
чен сотовый слой — таковы Gregarina melanophi (Be-
ams et al., 1957) и некоторые виды рода Stylocephalus
(Grasse, 1957; Desportes, 1970). Внешняя мембрана
ядерной оболочки грегарин, как и у других эукариот,
способна переходить в мембраны ЭПР, а также отпоч-
ковывать диктиосомы аппарата Гольджи (Tronchin,
Schrevel, 1977; Hildebrand, 1978).
Некоторые грегарины имеют выросты ядра, затра-
гивающие обе мембраны оболочки. У Callynthrochla-
mys phronimae от поверхности ядра отходят многочис-
ленные трубчатые выпячивания, образующие по мере
роста трофозоита корону из канальцев вокруг ядра
(Dogiel, 1910; Desportes, Theodorides, 1969). У Entero-
cystis fungoides ядерные отростки, лишенные пор, вет-
вятся, заполняя всю околоядерную цитоплазму (Des-
portes, 1974). Подобные же, но снабженные порами вы-
росты у Didymophyes chaudefouri анастомозируют друг
с другом. В результате вокруг ядра образуется мощная
канальцевая зона (Baudoin J., Ormieres, 1973). Значе-
ние этих выростов, очевидно, заключается в резком
увеличении поверхности ядра и, как следствие, силь-
ной интенсификации ядерно-цитоплазматических об-
менов (Райков, 1978).
Ядра взрослых трофозоитов грегарин заполнены
ядерным соком — кариолимфой, содержащей сильно
деконденсированный хроматин в виде тонких фибрилл
толщиной 10—30 нм. На световом уровне хроматин в
ядрах грегарин совершенно не виден, а концентрация
ДНК столь невелика, что реакция Фёльгена дает отри-
цательный результат. Обнаружение каких-либо кон-
денсированных плотных ДНК-содержащих структур
(гетерохроматин) в ядрах грегарин довольно редкий
случай. Так, в ядре Stylocephalus имеются клубки плот-
ных тяжей (Desportes, 1970), однако возможно, что это
тяжи рибонуклеопротеида (РНП), а не ДНК (ДНП)
(Райков, 1978).
Ядрышки грегарин чаще всего сферической фор-
мы. Их ультраструктура обычна для большинства
эукариот: характерно наличие двух зон — фибрилляр-
ной (в центре) и гранулярной-(на периферии). Грану-
лярный слой может сильно разрыхляться — в этом
случае образуется сеть тяжей, состоящих из грануляр-
ного материала, которая называется нуклеолонемой.
Такое строение ядрышка характерно для Enterocystis
fungoides (Desportes, 1974). Нуклеолонема Enterocystis
легко фрагментируется, и часть этих фрагментов сво-
бодно лежит в кариолимфе, заходя в выросты ядерной
оболочки.
Особенности строения трофозоитов
у представителей разных таксонов
Отряд Schizogregarinida
Все изученные представители этого отряда, не-
смотря на разнообразие особенностей строения, име-
ют общую черту — отсутствие эпицита.
Архигрсгарины. Большинство данных по архигре-
гаринам относятся к представителям центрального
рода Selenidium. Изучена ультраструктура вегетатив-
ных стадий только полового поколения — гамонтов.
По своему тонкому строению они напоминают гигант-
ских, гипертрофированно развитых спорозоитов.
Трофозоиты-гамонты Selenidium благодаря своему
облику и характеру движения могут быть легко узна-
ны среди других паразитов полихет (см. раздел «Дви-
жение грегарин»). Тело трофозоита моноцистидное,
имеет лентовидную либо листовидную форму, часто
согнуто в полумесяц. В цитоплазме передней части
грегарины находятся палочковидные хорошо окраши-
ваемые тельца. Крупное ядро обладает сферической
или овальной формой и содержит одно крупное яд-
рышко. Трофозоитам архигрегарин свойственна спо-
собность к оживленным изгибаниям тела, у некоторых
видов — вплоть до скручивания в пружину с последу-
ющим раскручиванием. Для Selenidium vivax отмечена,
кроме того, способность к сильному сокращению тела
(Gunderson, Small, 1986). В отличие от большинства
представителей отряда Eugregarinida скользящим дви-
жением трофозоиты архигрегарин не обладают.
Покровы трофозоитов Selenidium представлены ти-
пичной трехмембранной пелликулой. Сверху она по-
крыта тонким слоем гликокаликса (Schrevel, 1972).
Под пелликулой тянутся продольные микротрубочки,
расположенные в несколько слоев. Каждая микротру-
бочка на поперечном срезе окружена областью гиало-
плазмы грубо гексагональной формы. Вдоль всего тела
трофозоита, как правило, тянутся более или менее ши-
рокие складки пелликулы, разделенные глубокими бо-
роздами — их наличием обусловлена характерная про-
дольная исчерченность, которую можно наблюдать у
38
ALVEOLATA
Рис. 13. Схема ультратонкого строения переднего конца архигре-
гарины Selenidium. (По: Schrevel, 1968а).
в — вакуоля, вмк — внутренний мембранный комплекс пелликулы, ко —
коноид, кх — клетка хозяина, мв — мукрональная вакуоль, мт — субпелли-
кулярные микротрубочки, мтх— митохондрии, пв — пищеварительная ва-
куоль, пм — плазматическая мембрана (плазмалемма), пине — пииоцитоз-
ные вакуоли,/;/? — роптрии.
Fig. 13. Diagram of the ultra-thin organization of the anterior region of
Selenidium.
в — vacuoles, вмк — cortical cytomembranes, ко — conoid, кх — host cell,
мв — niucronal vacuole, мт — subpellicular microtubules, мтх — mitochond-
ria, ne — food vacuoles, пм — plasma membrane, пине — pinocytosis vesicles.
pn — dense bodies (rhoptries).
трофозоитов архигрегарин в световом микроскопе. Ра-
нее эту особенность объясняли наличием либо про-
дольных мионем (Grasse, 1953), либо групп микротру-
бочек (Levine, 1971b, 1985). По ходу борозд располага-
ются микропоры. Такая структура поверхности
характерна почти для всех исследованных архигрега-
рин родов Selenidium и Ditrypanocystis (Mac Gregor,
Thomasson, 1965; Schrevel, 1971а, 1971b), за исключе-
нием Selenidium pennatum, у трофозоитов которых по-
верхность гладкая, а слабая складчатость наблюдается
лишь в «шейной» области (Симдянов, 1992).
У архигрегарин нет четкого разделения на экто- и
эндоплазму, поскольку амилопективые зерна заходят в
кортикальную зону. В цитоплазме отмечены хорошо
развитые комплексы Гольджи, часто связанные с цис-
тернами ЭПР, которые содержат интрацистернальные
гранулы, по всей видимости белковой природы. Эти гра-
нулы имеют среднюю электронную плотность и распола-
гаются внутри цистерн гладкого ЭПР. Вивье и Шревель
отмечают, что внешне сходные образования присутст-
вуют в клетках Metazoa с высокой метаболической ак-
тивностью — например, клетки, осуществляющие син-
тез пищеварительных ферментов, желтка и т. п. (Vivi-
er, Schrevel, 1966; Schrevel, 1971а; Schrevel et al., 1974b).
В целом, ультраструктура цитоплазмы (кроме кор-
тикальной зоны) и ядра трофозоитов архигрегарин
сходны с таковой эугрегарин и лишены отличитель-
ных особенностей, за исключением обилия электрон-
но-плотных образований, представляющих собой
роптрии — органеллы, относящиеся к апикальному
комплексу, который у архигрегарин называется также
мукрональным.
Наличие органелл апикального комплекса у взрос-
лых трофозоитов — главная черта строения архигрега-
рин (рис. 13). В переднем конце тела — мукроне — на-
ходятся хорошо развитый коноид и полярные кольца.
Имеются многочисленные роптрии. Они выглядят на
срезах как плотные овальные и вытянутые тела, рассе-
янные по всей цитоплазме вплоть до заднего конца.
Роль этих органелл у трофозоитов архигрегарин не со-
всем ясна, однако Шревель (Schrevel, 1968а) нашел в
них гидролитический фермент — кислую фосфата-
зу — и высказал предположение об их литической
функции — участии в проникновении в клетку хозяи-
на и питании. Мукрон Selenidium hollandei содержит
особые крупные вакуоли, заполненные рыхлым фиб-
риллярным содержимым. От их дна отшнуровываются
мелкие пузырьки, сходные с пиноцитозными. Самая
передняя из вакуолей — мукрональная ваку-
оль — открывается наружу широким протоком, про-
ходящим сквозь коноид. Все это позволило Шревелю
(Schrevel, 1968а, 1971а, 1971b) предположить, чтомук-
рональный комплекс у архигрегарин выполняет функ-
цию клеточного рта, роптрии служат резервуарами ли-
тических ферментов, а крупные вакуоли предположи-
тельно выполняют пищеварительную функцию.
Коноид, мукрональную вакуоль и роптрии автор
данной главы обнаружил и у прикрепленных трофозо-
итов другой архигрегарины — Selenidium orientate,
хотя проток мукрональной вакуоли в этом случае от-
сутствовал (рис. 12, А). Возможные причины такого
отличия обсуждаются в разделе «Питание грегарин».
Неогрегарины. Форма тела трофозоитов неогрега-
рин крайне разнообразна. Все они моноцистидные.
Внеклеточные паразиты имеют червеобразную (Schi-
zocystis, Machadoella), колбовидную (Caulleryella), ко-
ническую, или куполообразную (грегариноидные ме-
ронты Ophryocystis), или разветвленную форму (мице-
тоидные меронты Ophryocystis). Прикрепительные
приспособления внеклеточных неогрегарин довольно
разнообразны: передний конец Machadoella (Schizo-
cystidae) сходен с «мукроном» асептатных эугрегарин;
трофозоиты Caulleryella формируют «псевдоэпиме-
рит» — удлиненный вырост на переднем конце тела,
проникающий в клетку хозяина; для особей Ophryocys-
tis характерны многочисленные корневидные отроет-
ТИП SPOROZOA. КЛАСС GREGARINEA
39
ки клетки, которыми они прикрепляются к кишечному
эпителию. Молодые меронты Schizocystis вначале об-
разуют на переднем конце псевдоподиеподобные вы-
росты, которые по мере развития исчезают, и вместо
них формируется прикрепительное приспособление в
виде присоски. /
Внутриклеточные неогрегарины (Syncystidae, Li-
potrophidae) лишены прикрепительных приспособле-
ний. Их мелкие (10—40 мкм) вегетативные стадии
имеют округлую либо слегка удлиненную форму тела.
У части представителей семейств Lipotrophidae и Syn-
cystidae, паразитирующих в жировом теле насекомых,
существует несколько поколений, морфологически от-
личающихся друг от друга. Это «микронуклеарные
шизонты» (меронты первой генерации), «макронукле-
арные шизонты» (меронты последующих генераций) и
гамонты. Макронуклеарные шизонты мельче микро-
нуклеарных и имеют меньшее количество более круп-
ных ядер. У Farinocystis tribolii отмечено 53 и 175 ядра
соответственно. Ядра макронуклеарных стадий обыч-
но в два раза крупнее, чем у микронуклеарных, а у Api-
cystis (=Mattesia) bombi их размеры различаются почти
в восемь раз (Liu et al., 1974) — 10 и 1.3 мкм. Стадия
одиночного гамонта у внутриклеточных паразитов
скоротечна и практически выпадает из жизненного
цикла по причине неогамии. Гамонты, приступающие
к образованию сизигия, по своему строению и по сути
представляют собой слегка подросшие макронуклеар-
ные мерозоиты, в цитоплазме которых к этому момен-
ту начинает откладываться амилопектин.
Характерной чертой строения трофозоитов разных
генераций неогрегарин является отсутствие каких-ли-
бо усложнений пелликулы — складок, гребней, цито-
пилей и других выростов. Правда, у гамонтов и моло-
дых меронтов представителей сем. Schizocystidae в
световой микроскоп видна некоторая продольная ис-
черченность, напоминающая таковую у архигрегарин
Selenidiidae, однако ее природа пока не изучена.
Данные по ультраструктуре вегетативных стадий
неогрегарин настолько отрывочны и разрознены, что
почти не представляют возможности для крупных
обобщений. Лучше всего изучены трофозоиты внекле-
точной неогрегарины Ophryocystis schneideri — пара-
зита мальпигиевых сосудов жука-чернотелки Blaps из
Алжира (Ormieres et al., 1978) и некоторые стадии
внутриклеточных паразитов жирового тела насеко-
мых: Syncystis (Syncystydae) (Larsson, 1991), Mattesia
(y&Nr&j McLaughlin, 1970) и Farinocystis (Lipotrophi-
dae) (Zizka, 1971; Canning, Sinden, 1975; Zizka, 1977,
1978a, 1978b, 1978c).
Куполообразные трофозоиты (грегариноидные
меронты) Ophryocystis schneideri из кишечника Blaps
покрыты гладкой трехмембранной пелликулой, фор-
мирующей в некоторых местах микропоры. В цито-
плазме отмечены зерна амилопектина, однако не об-
наружено диктиосом и митохондрий. Особи дают по
нескольку отростков — корешков, которыми прикреп-
ляются к микровиллям мальпигиевых сосудов хозяи-
на, но не проникают внутрь клеток. Корешки тесно пе-
реплетены с микровиллями. Внутри корешков в про-
дольном направлении проходят толстые продольные
электронно-плотные тяжи неясной природы и микро-
трубочки.
А
Неогрегарины, паразитирующие внутриклеточно,
обычно лежат в цитоплазме внутри паразитофорных
вакуолей. Степень их изученности неодинакова. Об
ультраструктуре микронуклеарных меронтов, напри-
мер, известно очень мало и данные противоречивы.
Так, Ормье с соавт. (Ormieres et aL, 1972) утверждают,
что меронт Mattesia oryzaephili к началу мерогонии по-
крыт единственной мембраной, тогда как для Farino-
cystis tribolii указано, что поверхностных мембран две
(Zizka, 1978b). Следует отметить, что наличие двух-
мембранных покровов нетипично для споровиков —-
возможно, за внешнюю мембрану была принята при-
легающая к трофозоиту мембрана паразитофорной ва-
куоли клетки хозяина либо за одну внутреннюю мемб-
рану — две тесно сближенные мембраны внутреннего
мембранного комплекса. В любом случае, окончатель-
ное прояснение этого вопроса требует дополнитель-
ных исследований. Цитоплазма микронуклеарных ме-
ронтов богата митохондриями, свободными рибосома-
ми, плотными гранулами — возможно, липидными
каплями, но лишена амилопектиновых зерен.
Данные относительно строения макронуклеарных
меронтов также довольно противоречивы. Так, макро-
нуклеарные меронты Mattesia grandis, по данным Вав-
ры и Мак-Лафлина (Vavra, McLaughlin, 1970), покры-
ты тремя раздельными мембранами, а у Farinocystis
tribolii мембрана всего одна (Canning, Sinden, 1975). У
молодых, имеющих всего 1—4 ядра меронтов Mattesia
grandis, обнаружен мукрональный комплекс, который,
вероятно, является остатком апикального комплекса
мерозоита, подвергающегося резорбции (Vavra, McLa-
ughlin, 1970). Мукрональный комплекс состоит из по-
лярного кольца, от которого расходятся радиальные
(продольные) субпелликулярные микротрубочки, и
тесно прилегающей к поверхности «мукрональной
вакуоли». Она выглядит как фибриллярная сеть в ци-
топлазме, отходящая от электронно-плотного слоя, ко-
торый подстилает покровы в зоне «мукрона», и огра-
ниченную мембраной, которая образует множество
впячиваний. Коноид отсутствует. Рядом с мукроном
отмечены неправильной формы цистерны с аморфным
содержимым умеренной электронной плотности и
многочисленные электронно-плотные тела, возможно
гомологичные структурам роптрие-микронемального
комплекса других споровиков. В цитоплазме меронта
присутствуют ядра и митохондрии с ампуловидными
кристами. ЭПР развит плохо и представлен короткими
сегментами, покрытыми рибосомами. Много свобод-
ных рибосом разбросано в цитоплазме. Зерна амило-
пектина в цитоплазме отсутствуют. В отличие от Mat-
tesia grandis у макронуклеарных меронтов Farinocystis
tribolii мукрональный комплекс не обнаружен (Can-
ning, Sinden, 1975). Микропоры у вегетативных стадий
внутриклеточных неогрегарин не отмечены.
Отряд Eugregarinida
Эугрегарины — самая многочисленная и разнооб-
разная группа грегарин. Среди них есть как моноцис-
тидные (подотряд Aseptata), так и полицистидныё фор-
мы (подотряд Septata). Наиболее яркими чертами стро-
ения трофозоитов эугрегарин являются: во-первых,
40
ALVEOLATA
Рис. 14. Схема ультратонкой организации эпицитарного гребня
эугрегарины Lecudina pellucida на поперечном срезе. (По: Фролов,
1991).
аа — апикальные арки, аф — апикальные филаменты, вм — внутренняя
мембрана пелликулы, вмк — внутренний мембранный комплекс пеллику-
лы, гли — гликокаликс; пм — плазматическая мембрана (плазмалемма),
пс — подстилающий слой, ппс — перемычки подстилающего слоя, см —
средняя мембрана пелликулы.
Fig. 14. Diagram of the ultra-thin organization of the epicytic fold
of Lecudina pellucida (cross-section).
aa — rippled dense structures, аф — apical filaments, вм — internal memb-
rane of pellicle, вмк — cortical cytomembranes, гли — cell coat, пм — plas-
ma membrane (external membrane of pellicle), nc — internal lamina, nnc —
internal lamina links at the bases of epicytic folds, cm — middle membrane
of pellicle.
приобретение в процессе эволюции уникальной струк-
туры поверхности — эпицита, обеспечивающего спо-
собность к скользящему движению, и во-вторых —
многоообразие формы и строения прикрепительного
аппарата. Высшие эугрегарины из подотряда Septata,
кроме того, достигают высокой степени внутриклеточ-
ной дифференцировки, что делает их одними из наибо-
лее сложно устроенных протистов.
Ультраструктура кортикальной зоны Eugregari-
nida (рис. 12, В—Е) существенно отличается от тако-
вой Archigregarinida. Представители этого отряда, как
уже было указано, обладают так называемым эпици-
том, представляющим собой совокупность многочис-
ленных узких продольных гребней, которые можно на-
блюдать и в световой микроскоп при фазовом контра-
сте на больших увеличениях. Эпицитарные гребни
тянутся вдоль всего тела грегарины и представляют
собой особым образом устроенные пелликулярные об-
разования. Внешняя мембрана пелликулы (плазмалем-
ма) в отличие от архигрегарин покрыта хорошо раз-
витым гликокаликсом (cell coat) — углеводным
чехлом, который, в частности, предохраняет грегарин
в кишечнике хозяина от разрушающего воздействия
пищеварительных ферментов пептидаз (Philippe,
Schrevel, 1982). Изучение состава покровов Gregarina
blaberae при помощи биохимических методов выявило
около 30 полипептидов (15—260 кДа) и 4 гликопроте-
ида (Philippe et al., 1982). Последние, по всей видимо-
сти, представляют собой составляющие гликокаликса.
Их основные компоненты — глюкоза, манноза, галак-
тоза, глюкозамин и галактозамин (Philippe et al., 1979;
Philippe, Schrevel, 1982). Гликокаликс может быть раз-
личной толщины и плотности. Наибольшего развития
он достигает на вершинах гребней.
Снизу к пелликуле примыкает хорошо развитый у
эугрегарин подстилающий слой. У большинства изу-
ченных трофозоитов он образует перемычки в основа-
нии гребней («lame basale» у Вивье), отделяя их внут-
ренние пространства от эктоплазмы.
Вдоль вершин гребней проходят две системы про-
дольных филаментов (рис. 12, Д, вкл.; рис. 14). Первая
из них находится между плазмалеммой и внутренним
мембранным комплексом и, видимо, связана со сред-
ней мембраной. На поперечном срезе эта структура
имеет вид узких электронно-плотных дуг, основания
которых покоятся на средней мембране, а вершины
устремлены ко внешней, поэтому она получила назва-
ние «апикальных арок» (фр. — arceaux apicaux, совре-
менный англоязычный вариант: rippled dense structu-
res) (Vivier, 1968). Вторая система — «апикальные фи-
ламенты» толщиной 10—12 нм — находится под
пелликулой верхушки гребня и прилегает к внутрен-
ней мембране пелликулы. Апикальные арки и фила-
менты обычно располагаются друг напротив друга.
Описанное выше строение эпицита встречается
наиболее часто. У грегарин, имеющих такой «класси-
ческий эпицит», по ходу борозд между эпицитарными
гребнями расположены многочисленные микропоры.
Микропоры, вероятно, служат для питания грегарин,
хотя картины, похожие на пиноцитоз, наблюдаются в
районе микропор крайне редко.
Эпицитарные гребни являются достаточно прочны-
ми образованиями — они сохраняются даже при ис-
кусственном разрушении клеток (Schrevel et al., 1983).
Считается, что изменение их формы обеспечивает
скользящее движение трофозоитов эугрегарин. Кроме
того, эпицит может нести и некоторые другие функ-
ции. Так, ундуляция эпицитарных гребней может спо-
собствовать притоку питательных веществ, содержа-
щихся в кишечнике хозяина, к микропорам (Vivier,
1968). За счет видоизменений эпицитарных гребней
могут формироваться некоторые виды прикрепитель-
ных приспособлений, например апикальные папиллы
некоторых Monocystidae, ризоиды Dactylophoridae.
Еще одна функция гребней эпицита — соединение
партнеров в сизигии. В начале электронно-микроско-
пического изучения грегарин некоторые авторы (Kum-
mel, 1957) приписывали эпициту только эту роль.
Таким образом, эпицит, по-видимому, выполняет
следующие функции:
1) обеспечение скользящего движения;
2) участие в процессе питания;
ТИП SPOROZOA. КЛАСС GREGARINEA
41
3) участие в формировании прикрепительных при-
способлений;
4) скрепление партнеров в сизигии.
Перемычки подстилающего слоя в основании греб-
ней маркируют границу между эпицитом и эктоцитом
(эктоплазмой). В эктоплазме находятся основные кле-
точные органеллы, в то время как в цитоплазме эпици-
тарных гребней клеточные органеллы, как правило, от-
сутствуют. В кортикальной зоне большинства Eugre-
garinida часто встречаются кольцевые микротрубочки
(рис. 12, В). Эти структуры бывают довольно много-
численны — 10—15 микротрубочек на микрон длины
тела у Lecudina pellucida (Vivier, 1968). В некоторых
случаях к ним добавляются кольцевые мионемы, со-
стоящие из пучков фибрилл различного строения. Мио-
немам приписывается сократительная функция. Так, у
молодых трофозоитов грегарины Didymophyes gigantea,
способных к перистальтическим сокращениям, коль-
цевые элементы цитоскелета состоят из микротру-
бочек (18 нм) и фибрилл (5 нм). У взрослых!), gigantea
кольцевые микротрубочки исчезают (Hildebrand, 1981).
Продольные субпелликулярные микротрубочки, харак-
терные для Archigregarinina, у Eugregarinida отсутствуют.
Вся цитоплазма трофозоитов эугрегарин, в том
числе и цитоплазма эпицита, пронизана редкой сетью,
состоящей, по видимому, из рыхлых фибрилл непосто-
янной толщины, примерно от 10 до 20 нм (рис. 12,
В—Е). Густота сети возрастает ближе к поверхности,
где составляющие фибриллы вливаются в постилаю-
щий слой.
Модификации строения кортекса. У ряда эугре-
гарин описанная выше классическая структура эпици-
та и кортикальной зоны подвергается различным мо-
дификациям. В наиболее простом случае — у грегарин
Kamptocephalus mobilis и Mastigorhynchus bradae из
кишечника морских полихет — это выражается в от-
сутствии перемычек подстилающего слоя в основани-
ях гребней (Симдянов, 1995b). Для Gregarina blaberae
показано, что в гребнях, покрывающих протомерит,
перемычек нет, тогда как в гребнях на дейтомерите
они всегда есть (Tronchin, Schrevel, 1977). Нет перемы-
чек и в гребнях протомерита грегарин рода Stylocepha-
lus (Desportes, 1970). В тех случаях, когда перемычки
подстилающего слоя в основаниях гребней отсутству-
ют (Stylocephalus, Kamptocephalus mobilis, Mastigor-
hynchus bradae), микропоры обычно располагаются не
между гребнями, а на их боковых поверхностях.
У некоторых грегарин видоизменения в строении
эпицита заходят дальше. Так, у Trichorhynchus pulcher
отсутствуют гребни, вместо них — выросты и бугорки.
На поперечном срезе, однако, видны уплощенные об-
разования — «пеньки», в которых сохраняются типич-
ные апикальные арки и филаменты (Ormieres et aL,
1977; Marques et al., 1978). Авторы трактуют эти обра-
зования двояко — либо как развивающиеся эпицитар-
ные гребни, либо, наоборот, как результат их редук-
ции. У неподвижных во взрослом состоянии неогам-
ных грегарин рода Diplauxis (D. hatti, D. schreveli) и у
Urospora chiridotae гребни полностью отсутствуют, но
имеются многочисленные волосовидные выросты —
цитопил и, образованные всеми тремя мембранами
пелликулы и укрепленные у Urospora chiridotae мно-
гочисленными микротрубочками (Vivier, Petitprez, 1968;
Porchet-Hennere, Fischer, 1973; Dyakin, Simdyanov,
2005).
Особенно интересны в рассматриваемом отноше-
нии грегарины сем. Monocystidae, все представители
которого утратили скользящее движение и либо имеют
метаболирующее (перистальтическое) движение, либо
неподвижны. Строение эпицита у моноцистид претер-
певает изменения различной степени сложности
(рис. 15). Так, у грегарин Nematocystis magna еще име-
ются гребни вполне типичного строения (рис. 15,1,а).
В местах сужения тела, при прохождении волны пери-
стальтического сжатия, формируются «супергребни»
(рис. 15,1, б) — складки пелликулы, от которых отхо-
дят собственно гребни (Miles, 1968; MacMillan, 1973а).
У других Monocystidae (Monocystis agilis, М. herculea,
М. sp.) гребни срастаются вершинами (рис. 15, 2, 3),
так что формируется система продольных туннелей,
внутри которых могут образовываться дополнитель-
ные горизонтальные перегородки (Vinckier, Vivier,
1968; Vinckier, 1969). В итоге кортикальная зона у Mo-
nocystis sp. на поперечном срезе выглядит как слож-
ный лабиринт. Массивные гребни малоподвижной
неогамной моноцистиды Zygocystis cometa содержат в
своем верхнем расширенном участке мощный фибрил-
лярный тяж и цитоплазматические органеллы — мито-
хондрии и диктиосомы (Фролов, 1991), чего никогда
не бывает в случае классического эпицита (рис. 15, 4).
Для всех этих грегарин характерно развитие контрак-
тильной системы, состоящих из различным образом
устроенных кольцевых мионем, которые залегают у
основания гребней.
У некоторых Monocystidae модификация кортекса
приводит к практически полной редукции эпицита.
Так обстоит дело, например, у грегарин Rhynchocystis
pilosa и Zeylanocystis burti, покрытых цитопилями и
формирущих в кортикальной зоне сложную систему
микрофибрилл. Согласно данным Уорнера (Warner,
1968), пелликула Rhynchocystis pilosa двухмембран-
ная, по-видимому, хотя это и кажется сомнительным,
отсутствует одна из мембран внутреннего мембранно-
го комплекса (рис. 15, 5, б). Отсутствуют также клас-
сические апикальные структуры (арки и филаменты).
Большая часть поверхности образует невысокие про-
дольные складки — первичные и вторичные. Первич-
ные несколько массивнее, на их вершинах пелликула
формирует волосовидные цитопили (рис. 15, 5, а). В
кортикальной зоне Rhynchocystis pilosa залегают коль-
цевые, размером 15 нм, микрофиламенты («микрофиб-
риллы») и пучки приуроченных к основаниям первич-
ных складок продольных фибрилл, размером 15 нм,
которые ветвятся и заходят в цитопили. У Zeylanocystis
burti пелликула формирует выступы либо невысокие
складки, на вершинах которых находятся длинные ци-
топили, армированные не микрофиламентами, а мик-
ротрубочками (Sathananthan, 1977).
Ультраструктура переднего конца Eugregarini-
da существенно отличается от таковой архигрегарин и
сильно варьирует в пределах отряда. Здесь нет мукро-
нального комплекса, хотя у отдельных представителей
могут сохраняться некоторые мембранные и микро-
трубочковые образования, которые трактуются авто-
рами соответствующих исследований как его остат-
ки — «мукрональная вакуоль» у Ascogregarina («Lan-
42
ALVEOLATA
ТИП SPOROZOA. КЛАСС GREGARINEA
43
kesteria») culicis (Vavra, 1969; Walsh, Callaway, 1969),
«микронемы» у Ancyrophora puytoraci (Baudoin J.,
1969), остатки коноида и базальных колец в основании
эпимерита Pyxinia firmus (Ormieres, 1977а). Тем не ме-
нее в большинстве известных (и, что особенно важно,
тщательно исследованных) случаев все эти компонен-
ты полностью редуцируются.
Прикрепительные приспособления эугрегарин ни-
когда, по всей видимости, не перфорируют мембрану
клетки хозяина, но обычно залегают в ее инвагинации,
формируемой трофозоитом в процессе роста, — ино-
гда довольно глубокой. В зоне контакта с клеткой хо-
зяина внутренний мембранный комплекс пелликулы
обычно отсутствует, так что покровы трофозоита
представлены здесь только одной мембраной — плаз-
малеммой. Непосредственно под поверхностью кон-
такта у многих эугрегарин формируется новообразова-
ние, так называемая «кортикальная зона» или, точнее,
кортикальная вакуоль (см. ниже).
Отсутствие мукронального комплекса означает для
эугрегарин невозможность заглатывания содержимого
клетки хозяина. Поэтому их «мукроны» и эпимериты
часто трактуются как структуры, выполняющие иск-
лючительно прикрепительную функцию. Тем не менее
нельзя исключить и возможность мембранного транс-
порта молекул из клетки хозяина в клетку паразита
(см. также разделы, посвященные питанию грегарин и
паразито-хозяинным отношениям). Строение прикре-
пительных приспособлений Eugregarinida чрезвычай-
но разнообразно. Их рассмотрение удобно начать с
эпимеритов септатных грегарин, так как здесь все же
можно усмотреть некоторые общие черты организа-
ции в отличие от недостаточно изученных в этом отно-
шении асептатных грегарин.
Строение эпимерита септатных грегарин (рис. 16,
1—3; 19, 6). У многих грегарин подотряда Septata, как
уже указывалось, впереди резорбирующегося в про-
цессе развития апикального комплекса спорозоита
формируется эпи мер ит (Desportes, 1967; Ormieres,
Daumal, 1970; Tronchin, Schrevel, 1977; Ormieres, 1977a)
(рис. 16, 1). Он может быть различной формы и разме-
ров. Функциональное значение разнообразия морфо-
логии эпимеритов неясно. Бодуэн с соавт. предполага-
ют тесную связь между типами прикрепительных от-
ростков и рационом хозяев (Baudoin J., Maillard, 1972;
Baudoin J., Mouthon, 1976; Baudoin J., 1978). Эти ис-
следователи обращают внимание на тот факт, что эпи-
мериты грегарин растительноядных животных часто
имеют вид простой головки, тогда как эпимериты
паразитов плотоядных хозяев снабжены мощными
крючьями или многочисленными филаментами.
Эпимерит септатных эугрегарин может внедряться
в клетку либо целиком, либо только передней частью.
В основании эпимерита, в том месте, где начинается
зона контакта, формируется кольцевая борозда. Здесь
же заканчивается внутренний мембранный комплекс
пелликулы. Таким образом, весь эпимерит или та
его часть, которая контактирует с клеткой хозяина, по-
крыты единственной мембраной — плазмалеммой.
Зона контакта обычно имеет высокую электронную
плотность, что сильно затрудняет ее изучение. У Didy-
mophyes gigantea здесь имеется узкое пространство,
разделяющее мембраны паразита и хозяина, причем
плазматическая мембрана эпимерита формирует мно-
гочисленные мелкие выросты (Hildebrand, 1976). В
других же случаях выросты не обнаружены. Иногда
зона высокой электронной плотности в области кон-
такта может иметь значительную толщину — у Ancy-
rophora puytoraci, из веснянки Trichostegia minor по-
рядка 250 нм — и напоминать своим видом гигант-
скую десмосому (Baudoin J., 1969).
По всей поверхности контакта к плазмалемме тро-
фозоита со стороны его цитоплазмы тесно примыкает
кортикальная вакуоль, которая представляет со-
бой гигантскую уплощенную мембранную цистерну,
заполненную рыхлым тонкофибриллярным содержи-
мым (рис. 16, 2, б, 3; 19, 4—6). Следует заметить, что в
работах 70-х гг. ее обычно называли не кортикальной
вакуолью, а «кортикальной зоной». Эта структура
формируется в онтогенезе как новообразование — уже
после полной редукции органелл апикального комп-
лекса (Tronchin, Schrevel, 1977) (см. ниже раздел о пре-
вращении спорозоита в трофозоит). Под кортикальной
вакуолью располагаются митохондрии, часто столь
многочисленные, что образуют некое подобие слоя. У
Gregarina blaberae митохондрии эпимерита могут
быть в несколько раз крупнее таковых из других отде-
лов тела. Кроме того, они имеют удлиненную форму и
многочисленные хорошо развитые трубчатые, а не
ампуловидные, как обычно у грегарин, кристы. Все
эти признаки указывают на высокую активность мито-
хондрий в эпимерите (Tronchin, Schrevel, 1977). Следу-
ет еще раз подчеркнуть (см. описание общей ультра-
структуры грегарин), что, за исключением эпимерита,
митохондрии у грегарин развиты слабо.
Согласно данным электронной микроскопии, эпи-
мерит не отделен от остальной части клетки трофозои-
та какими-либо мембранными или фибриллярными
перегородками. В его основании, в районе перехода в
протомерит, часто развивается кортикальное фибрил-
лярное кольцо, которое, вероятно, может играть роль
сфинктера, предотвращающего вытекание цитоплаз-
Рис. 15. Ультраструктура кортекса грегарин семейства Monocystidae. (По: Фролов, 1991).
I —Nematocystis magna (а — одиночный гребень на поверхности несокращенного участка тела.трофозоита, б — «супергребеш.» и зоне сокращения тела),
2 — Monocystis herculea, 3 — Monocystis agilis, 4 — Zygocystis cometa, 5 — Rhynchocyslis pilosa (o — трехмерная реконструкция кортекса, б — ультратонкая
организация участка кортекса на поперечном срезе); аа — апикальные арки, аф— апикальные филаменты, аг — аппарат Гольджи, пм •- внутренняя мембра-
на пелликулы, вмк — внутренний мембранный комплекс пелликулы, мтх— митохондрии, мф, мф\,мфг,мф3 — микрофибриллы, пм плазматическая мем-
брана (плазмалемма), см — средняя мембрана пелликулы, цп — цитопили.
Fig. 15. Fine structure of cortex of gregarines from the family Monocystidiic ,
I —Nematocystis magna (a — single fold on the non-contracted area of the trophozoite body, 6 — «superfold» on the conlritcled area of the body), 2 —Monocystis her-
eulea, 3 —Monocystis agilis, 4 — Zygocystis cometa, 5 — Rhynchocyslis pilosa (a — 3D-reconstruction of the cortex, 6 ultra-thin organization of the fragment of the
cortex at the cross-section); aa — rippled dense structures, аф— apical filaments, аг — dyctiosomes, вм — internal membrane of pellicle, вмк — cortical cytomembra-
nes.Mmx — mitochondria, мф, мф\, мф2, мф3 — microfibrils, пм — plasma membrane, см — middle membrane of pellicle, ijn — hair-like projections.
44
ALVEOLATA
3 4
Рис. 16. Прикрепительные приспособления септатных грегарин.
I — формирование эпимерита в развитии Stylocephalus africanus, 2 — Pyxinia firmus (a — общий вид трофозоита, б — ультраструктура эпимерита), 3 — уль-
траструктура эпимерита Epicavus araeoceri, 4 — ультраструктура переднего конца Uradiophora maetzi: кх — клетка хозяина; цс — центральный стержень;
бо — боковые отростки; в — вакуоли; вв — волосовидные выросты протомерята; во — воротничок с микрофибриллярным кольцом в основании эпимерита;
кв, кз — кортикальная вакуоль («кортикальная зона»); ко — коноид; лз — ламеллярная зона; мкв — мембрана кортикальной вакуоли; мт — микротрубочки;
мтх — митохондрии; мф — микрофибриллы; н — ножка эпимерита; ос — «осевая структура»; сп — складки поверхности; эп — эпимерит; эг — эпицитар-
ные гребни; эс — «эпимеритная септа»; эц — эпицит; «з— центральная зона; цу— центральное углубление. (/ — по: Desportes, 1969; 2 — по: Leger, 1892 (о)
и Ormieres, 1977а (б); 3 — по: Ormieres, Daumal, 1970; 4 — по: Desportes, Theodorides, 1985).
Fig. 16. Attachment devices of septate gregarines.
1 — formation of epimerit in development of Stylocephalus africanus: 2 — Pyxinia firmus (a — trophozoite, 6 — fine structure of epimerit), 3 — fine structure of epi-
merit of Epicavus araeoceri: 4 — fine structure of anterior part of Uradiophora maetzi: кх — host cell; цс — central mucro; 6o— lateral hooks; в— vacuoles; вв— ha-
ir-like projections of protomerit; во — collar containing the microfibrillar ring at the base of epimerit; кв, кз — cortical vacuole («cortical zone»); ко — conoid; лз —
lamellar zone; мкв — membrane of cortical vacuole; лип — microtubules', мтх — mitochondria; мф — microfibrils; n — neck of epimerit; oc — «axial structure»;
cn — folds of surface; on — epimerit; эг — epicytic folds; эс — «epimerit's septum»; эц — epicyte; цз — central zone; цу — central cavity.
ТИП SPOROZOA. КЛАСС GREGARINEA
45
мы из клетки при отбрасывании эпимерита. Во всяком
случае, в этой области обнаружена высокая концентра-
ция актино- и миозиноподобных белков, что говорит
в пользу такого предположения (Ghazali et al., 1989;
Ghazali, Schrevel, 1993). Состав органелл и включений,
содержащихся в цитоплазме эпимерита, несколько ва-
рьирует у разных видов. Помимо митохондрий здесь
присутствуют многочисленные рибосомы, диктиосо-
мы, цистерны ЭПР и различного рода вакуоли. У Gre-
garina blaberae, G. polymorpha, G. cuneata и G. steini в
эпимерите могут встречаться зерна амилопектина, а у
Ancyrophora puytoraci и Actinocephalus dujardini —
многочисленные липидные глобулы (Baudoin J., 1969;
Marques, 1979). Большое количество органелл и вклю-
чений в цитоплазме эпимерита свидетельствует о его
высокой метаболической активности.
У некоторых грегарин эпимерит находится на кон-
це ножки или шейки, как например у Trichorhynchus
pulcher. В шейке Т. pulcher обособляется центральная
зона, содержащая продольные микротрубочки и окру-
женная митохондриями (Ormieres et al., 1977). Эпи-
мерит у этой грегарины покрыт не одной, а тремя мем-
бранами.
Эпимериты многих грегарин из сем. Actinocephali-
dae снабжены крючьями. Эти крючья у Ancyrophora
puytoraci, Pyxinia firmus и Actinocephalus dujardini
представляют собой простые выросты эпимерита, не
заключающие внутри себя никаких особых структур,
за исключением микрофибрилл у Pyxinia (рис. 16, 2,6)
(Baudoin J., 1969; Ormieres, 1977а; Marques, 1979).
Эпимерит Epicavus araeoceri (рис. 16, 3) имеет фор-
му чаши и содержит в цитоплазме многочисленные ла-
меллы (Ormieres, Daumal, 1970). Он располагается на
короткой ножке, центральная часть которой содержит
многочисленные продольные фибриллы. Эти фибрил-
лы заканчиваются на одном уровне — в основании
эпимерита, что создает видимость «эпимеритной сеп-
ты». В области этой «септы» у Epicavus araeoceri, а
также в основании эпимерита Pyxinia firmus обнаруже-
ны структуры, интерпретируемые как остатки коноида
с расходящимися от него микротрубочками (Ormieres,
Daumal, 1970; Ormieres, 1977а). Предположение о пер-
систировании коноида у трофозоитов этих видов про-
тиворечат данным, полученным при подробном изуче-
нии хронологии развития грегарин родов Stylocephalus
и Gregarina другими авторами (Desportes, 1967, 1969;
Devauchelle, 1968а; Tronchin, Schrevel, 1977). Согласно
им, все элементы апикального комплекса исчезают
еще на стадии трансформации спорозоита в трофозоит
(см. ниже посвященный этому процессу раздел). Сле-
дует заметить, что хронологическое ультраструктур-
ное изучение развития Epicavus и Pyxinia не проводи-
лось, поэтому гомология обнаруженных у этих грега-
рин коноидо-подобных структур с компонентами
апикального комплекса строго не доказана. В любом
случае, вопрос о судьбе апикального комплекса у эу-
грегарин, как септатных, так и в особенности асептат-
ных, требует дополнительных исследований.
Прикрепительные аппараты асептатных грега-
рин исследованы очень отрывочно. Как уже было от-
мечено выше, терминология, относящаяся к прикрепи-
тельным аппаратам асептатных грегарин, крайне запу-
тана. В современных обзорных работах (Schrevel,
Philippe, 1993; Perkins et al., 2000) по отношению к
прикрепительным приспособлениям асептатных форм
употребляется термин мукрон. Некоторые исследо-
ватели настаивают на том, что мукрон как архи-, так и
эугрегарин — это прикрепительное приспособление
на основе «простой трансформации» органелл апика-
льного комплекса, тогда как эпимерит септатных эуг-
регарин представляет собой новообразование, воз-
никающее впереди коноида (Ormieres, Daumal, 1970).
К сожалению, эта точка зрения достаточно умозрите-
льна, так как трансформация апикального комплекса в
мукрон асептатных эугрегарин не прослежена, а сле-
довательно, и не доказана. Следует еще раз подчерк-
нуть, что мукрон асептатных эугрегарин сильно отли-
чается от мукрона архигрегарин. Эти различия состоят
в следующем:
• Мукрон асептатных эугрегарин в отличие от архи-
грегарин не содержит в себе элементов собственно
мукронального комплекса: органелл апикального
комплекса и мукрональной пищевой вакуоли с про-
током, играющим роль цитостома. Вопреки обще-
му мнению, мукрон асептатных грегарин по своему
тонкому строению больше напоминает эпимерит
септатных грегарин наличием примыкающей к
зоне контакта с клеткой хозяина обширной струк-
туры, сходной с кортикальной вакуолью (см. выше
раздел о строении эпимерита).
• Мукрон архигрегарин — структура персистирую-
щая: он не отбрасывается при откреплении трофо-
зоита и наблюдается даже у гамонтов в сизигии по
крайней мере при наступлении первых прогамных
ядерных делений. Прикрепительные приспособле-
ния асептатных эугрегарин по крайней мере в части
случаев могут отбрасываться (рис. 17,2, а; 44, 3, 6).
Судьба «неотбрасываемых мукронов» у эугрегарин
подробно не прослежена.
Отбрасываемыми прикрепительными аппаратами,
в частности, обладают грегарины рода Ascogregarina
(=Ascocystis, Lankesteria in part) из кишечника личинок
кровососущих комаров сем. Culicidae (Vavra, 1969;
Walsh, Callaway, 1969; Chen et al., 1997). В связи с этим
авторы исследований, кроме Вавры, так и пишут —
«эпимерит». Вавра употребляет термин «мукрон», од-
нако также отмечает, что он в конце развития трофозо-
ита отбрасывается. Вообще, существование отбрасы-
ваемого прикрепительного аппарата у «комариных
Lankesteria» (настоящие Lankesteria паразитируют в
кишечнике асцидий (Tunicata)) было отмечено еще
Рэем в 30-х гг. XX в. (Ray, 1933b). Рэй полагал, кроме
того, что у A. culicis существует разделение тела на
протомерит и дейтомерит. Протомеритом Рэй считал
небольшую область на переднем конце тела, сразу за
эпимеритом, довольно четко выделяющуюся меньшей,
чем в «дейтомерите», зернистостью цитоплазмы. Забе-
гая вперед, сразу заметим, что у видов рода Ascogrega-
rina на ультраструктурном уровне показано отсутст-
вие прото-дейтомеритной септы (Vavra, 1969; Walsh,
Callaway, 1969; Chen et al., 1997). Данные по ультра-
структуре прикрепительных приспособлений изучен-
ных в этом отношении видов A. culicis, A. barretti и
A. taiwanensis достаточно противоречивы. По данным
Вавры (Vavra, 1969), для «мукрона» внутриклеточных
трофозоитов A. barretti характерна сильная вакуолиза-
46
ALVEOLATA
1
ТИП SPOROZOA. КЛАСС GREGARINEA
47
ция цитоплазмы. Вакуоли довольно крупные, сообща-
ются между собой и тесно примыкают к ограниченному
единственной мембраной небольшому (около 2 мкм)
участку «мукрона». В этом месте внутрь системы ва-
куолей отходят тонкие ветвящиеся фибриллы. Вавра
сравнивает эту систему с пищевой мукрональной ваку-
олью архигрегарин, однако при этом указывает, что он
ни разу не наблюдал мелких вторичных вакуолей, опи-
санных Шревелем у Selenidium. Следует добавить, что
отсутствие таких важных элементов мукронального
комплекса, как роптрие-микронемальная система и ко-
ноид, также говорит не в пользу предлагаемой гомоло-
гии. На наш взгляд, строение переднего конца А. Ьаг-
retti более всего напоминает таковое у септатной гре-
гарины Uradiophora maetzi (см. ниже).
У внеклеточных трофозоитов A. culicis и A. taiwa-
nensis, обладающих хорошо развитым прикрепитель-
ным приспособлением, зона контакта с клеткой хозяи-
на, как и у септатных грегарин, покрыта только плаз-
малеммой и имеет высокую электронную плотность.
У A. taiwanensis изнутри к этой зоне примыкает об-
ласть, очень похожая на «кортикальную зону» (корти-
кальную вакуоль) эпимеритов многих септатных гре-
гарин. В отличие от последних здесь нет митохондрий
(но их много на границе «прото-» и «дейтомерита»!),
цитоплазма зернистая, почти не содержит органелл и
включений. У A. culicis «кортикальной зоны» в «мук-
роне» (эпимерите) не отмечено, хотя и здесь наблюда-
ется большое количество фибриллярного материала.
Перед отбрасыванием содержимое эпимерита A. culicis
и A. taiwanensis сильно вакуолизируется (Vavra, 1969;
Chen et al., 1997). Эпимерит («мукрон») A. culicis, по
данным Вавры, сходен по строению с предположи-
тельно неотбрасываемым «мукроном» Lecudina pellu-
cida (Schrevel, Vivier, 1966) из кишечника Perinereis
cultrifera (рис. 12, Б). И тот и другой имеют грибовид-
ную форму и высокое содержание фибриллярных эле-
ментов в передней части. У L. pellucida существует
мембрана, ограничивающая фибриллярную зону, что
также напоминает кортикальную вакуоль эпимеритов
септатных грегарин. Еще сильнее сходство с ней у
огромной фронтальной дольчатой вакуоли в «мук-
роне» Lecudina sp. из кишечника полихеты Audouinia
(= Cirriformia) tentaculata, заполненная рыхлым фиб-
риллярным содержимым (Ouassi, Porchet-Hennere,
1978) (рис. 17, /). По всей поверхности контакта с
клеткой хозяина мембрану вакуоли покрывает изнутри
слой многочисленных микротрубочек, расположен-
ных перпендикулярно плоскости контакта. Сам «мук-
рон» в области прикрепления одет только плазмалем-
мой. Между ним и клеткой хозяина находится узкое,
почти непрерывное пространство. По краям зоны кон-
такта образуется «кольцо прикрепления», где мембра-
на паразита «защипывает» мембрану клетки хозяина.
В основании «мукрона» находится циркулярный пу-
чок эктоплазматических микротрубочек. Судьба «мук-
ронов» грегарин рода Lecudina на ультраструктурном
уровне не прослежена. Считается, что они выступают
в роли присоски и не отбрасываются.
Оригинальным прикрепительным аппаратом об-
ладают грегарины Cygnicollum lankesteri (Desportes,
Theodorides, 1986) из кишечника полихет рода Laetmo-
nice (рис. 17,2). Он представляет собой коническое об-
разование, окруженное в основании воротничком и по-
груженное в клетку хозяина. Эта структура в свою оче-
редь расположена на хоботке, представляющем собой
узкую вытянутую переднюю часть тела трофозоита.
Вдоль поверхности контакта с клеткой хозяина распо-
лагается зона повышенной электронной плотности,
опять же сходная с «кортикальной зоной» в эпимери-
тах септатных грегарин. В базальном воротничке рас-
полагается кольцо из 6—12 трубчатых образований
толщиной 750 нм каждое. Эти трубки обособляются
из субстанции кортикальной зоны путем ее заключе-
ния в двухмембранную оболочку. На уровне базально-
го воротничка находится занимающий центральное
положение массивный электронно-плотный цилиндр,
играющий, по-видимому, роль ЦОМТ для многочис-
ленных продольных микротрубочек, которые арми-
руют цитоплазму хоботка. Взрослые трофозоиты от-
брасывают прикрепительное приспособление вместе с
хоботком.
Грегарина Sycia inopinata (Lecudinidae) также обла-
дает отбрасываемым прикрепительным приспособле-
нием, которое авторы ультраструктурного исследова-
ния (Schrevel, Vivier, 1966) справедливо называют эпи-
меритом, невзирая на систематическое положение
объекта изучения. У молодого трофозоита (26 мкм) из
кишечника полихеты Audouinia tentaculata цитоплазма
эпимерита лишена фибриллярных структур. Зона кон-
такта с клеткой хозяина здесь светлая и подостлана
плоскими цистернами ЭПР. По границе основания ап-
парата прикрепления проходит кольцевая складка, в
основании которой залегает кольцо фибрилл. Эпиме-
рит богат рибосомами, встречаются диктиосомы аппа-
рата Гольджи, разнообразные везикулы по периферии.
Отмечено прогрессивное развитие вакуолярной систе-
мы, наличие зерен амилопектина и липидных включе-
ний. Все это говорит о большой метаболической ак-
тивности эпимерита. В отличие от многих эпимеритов
Рис. 17. Прикрепительные приспособления асептатных грегарин.
1— ультраструктура переднего конца Lecudina sp. из полихеты Audouinia tentaculata, 2 — Cygnicollum lankesteri (a — трофозоиты на ратных этапах утраты
прикрепительного приспособления, б — ультраструктура прикрепительного приспособления); вмк — внутренний мембранный комплекс пелликулы; вфв —
выросты фронтальной вакуоли; к — кольцо из трубчатых образований в основании прикрепительного приспособления; клип кольцо микротрубочек; кп —
«кольцо прикрепления», образованное в результате защипывания грегариной мембраны клетки хозяина; кх— клетка хозяина; мп микропора; мт — мик-
ротрубочки; мтх — митохондрии; пм — плазматическая мембрана (плазмалемма); фв — фронтальная вакуоль с фибриллярным содержимым; ц — элект-
ронно-плотный цилиндр; эц — эпицит. (/ — по: Ouassi, Porchet-Hennere, 1978; 2 — по: Desportes, Tlidodot Ide's, 1986).
Fig. 17. Attachment devices of aseptate gregarines.
I — ultrastructural organization of the anterior part of Lecudina sp. from polychaete Audoinia tentaculata, 2 —• Cygnicollum lankesteri (a trophozoites at different
stages of the loss of attachment device, 6— ultrastructural organization of the attachment device); вмк — cortical cylomonibrimcn; ифп - lobes of frontal vacuole; к —
ring of tubular structures at the base of Cygnicollum attachment device; клип — ring of microtubules; кп--ring of nllliclmicnl formed by plasma membrane of the host
cell nipped by plasma membrane of the gregarine; кх — host cell; jin — micropore;.йот — microtubules; мтх • inlloohondllii; им plasma membrane; фв — frontal
vacuole with fibrillar content; ц — electron-dense cylinder; nil oplcyle.
48
ALVEOLATA
септатных грегарин здесь нет «кортикальной зоны» и
не отмечены митохондрии. Возможно, правда, что это
связано со слишком молодым возрастом исследован-
ного трофозита и, как следствие, неполным развитием
прикрепительного приспособления.
Особое место среди асептатных грегарин в отноше-
нии строения прикрепительных приспособлений зани-
мают представители сем. Monocystidae. У этих грега-
рин, паразитирующих в целоме олигохет, прикрепле-
ние к эпителию хозяина осуществляется при помощи
гипертрофированных эпицитарных гребней и складок
поверхности на переднем конце (Warner, 1968; Mac-
Millan, 1973b). В местах контакта клеточных мембран
паразита и хозяина формируются контакты типа полу-
десмосом. В цитоплазме переднего конца находится
большое количество неупорядоченных фибрилл, а у
Rhynchocystis pilosa, кроме того, электронно-плотные
структуры неясной природы.
Таким образом, ультраструктурные данные под-
тверждают, что ни прикрепительный аппарат молодых
трофозоитов асептатных грегарин, ни передний конец
взрослых, свободных трофозоитов не могут приравни-
ваться к мукрону архигрегарин. Следует отметить еще
раз, что у свободных трофозоитов асептатных эугрега-
рин «мукрон» может иметь двоякую природу. В случае
отбрасываемого прикрепительного приспособления
«мукрон» свободного трофозоита, скорее, гомологи-
чен протомериту септатных грегарин, чем мукрону ар-
хигрегарин.
Прикрепительные приспособления на основе
протомерита. Некоторые септатные грегарины при-
крепляются к клеткам хозяина при помощи образова-
ний, находящихся на протомерите. Так, заякоривание
в эпителии хозяина грегарины Uradiophora maetzi, па-
разитирующей в кишечнике Gnathophausia zoea (Crus-
tacea: Mysidacea), осуществляется при помощи узких
волосовидных выростов протомерита (рис. 17, 4). Зо-
на, покрытая одной мембраной и соответствующая
собственно эпимериту, здесь очень невелика. Изнутри
к ней прилегает гигантская вытянутая «осевая струк-
тура» с фибриллярным содержимым, возможно, гомо-
лог кортикальной вакуоли, но напоминающая и мукро-
нальную вакуоль архигрегарин (Desportes, Theodori-
des, 1985).
Представители сем. Dactylophoridae, паразитирую-
щие в губоногих многоножках (Chilopoda), имеют осо-
бые прикрепительные приспособления — ризоиды,
глубоко внедряющиеся в эпителий кишечника хозяина
(рис. 18). Первичная фиксация паразита осуществляет-
ся передней частью спорозоита. Затем по мере роста
образуются многочисленные ризоиды, представляю-
щие собой выросты протомерита. Ризоиды в большом
числе формируются на особой площадке, лежащей
вначале латерально недалеко от переднего конца гре-
гарины, но по мере развития занимающей терминаль-
ное положение (рис. 18,1, а—д). Бывший передний ко-
нец тела при этом часто оказывается сбоку в виде не-
большого пальцевидного выроста тела. Отсюда, в
частности, и название типового рода семейства —
Dactylophorus. Ризоиды формируются как разрастания
плазмалеммы на вершинах уплощенных и расширен-
ных эпицитарных гребней (рис. 18, II). Как и в случае
эпимерита, перфорации клетки хозяина не происхо-
дит, а зона контакта представляет собой комплекс двух
тесно сближенных плазмалемм — грегарины и хозяи-
на. Внутренний мембранный комплекс пелликулы от-
граничивает ризоиды от цитоплазмы протомерита и
в сами ризоиды не заходит. Содержимое ризоидов в
отличие от протомерита однородное, мелкозернистое,
органеллы и включения отсутствуют, за исключением
так называемого «неоформного комплекса», представ-
ляющего собой, по всей видимости, разрастание рыхлой
субстанции, заполняющей в норме промежуток меж-
ду плазмалеммой и внутренним мембранным комп-
лексом. Каждый ризоид проникает в одну клетку и
окружен циркумцеллюлярной бороздой, образованной
внешней мембраной пелликулы и проходящей вдоль
границ между клетками хозяина (Ormieres, Marques,
1976). Ризоиды, по всей видимости, выполняют толь-
ко прикрепительную функцию, так как в их цитоплаз-
ме нет признаков метаболической активности. Такой
мощный прикрепительный аппарат может быть обу-
словлен, по крайней мере отчасти, крупными разме-
рами этих грегарин: округлая массивная Echinomera
достигает 500 мкм в длину, вытянутые Dactylophorus
и Grebnickiella — до 800 мкм и 5 мм соответственно.
Трофозоиты некоторых грегарин способны к неод-
нократному прикреплению и откреплению. Две из та-
ких грегарин — Amphoroides circi (Actinocephalidae) и
Cnemidospora lutea (Cnemidosporidae) из кишечника
двупарноногих многоножек (Diplopoda) изучены ульт-
раструктурно (Baudoin, 1978). Для «вторичного при-
крепления» они используют протомерит, который у
обоих видов имеет чашевидную форму. Механизм
прикрепления как таковой остался неизученным, но
Бодуэн полагает, что это каким то образом связано с
частичной модификацией эпицита: у обеих грегарин
на фронтальной поверхности протомерита наблюда-
ются эпицитарные гребни двух типов — обычного
строения и уплощенные, тогда как для области пере-
хвата, отделяющего протомерит от эпимерита, харак-
терны гребни двух других типов — с расширенной и с
раздвоенной верхушкой.
Дифференцировка клетки трофозоитов септат-
ных грегарин на отделы происходит на ранних эта-
пах их развития в прикрепленном состоянии. Отделы
появляются неодновременно, а их формирование и
обособление связано с тем, что в разных частях тела
трофозоита, по всей видимости, протекают различные
физиологические и биохимические процессы (Devauc-
helle, 1968а; Tronchin, Schrevel, 1977). Предполагается,
что эпимерит извлекает питательные вещества из клет-
ки хозяина; протомерит, согласно гипотезе Девошел-
ля, осуществляет синтез амилопектина и транспорт
его, а также других питательных веществ в остальное
тело; в дейтомерите же происходит накопление запас-
ных питательных веществ — в первую очередь амило-
пектина. Троншен и Шревель предполагают, что син-
тез амилопектиновых зерен происходит в эпимерите, а
затем они перераспределяются в другие отделы. В про-
томерите происходит, кроме того, синтез мукополиса-
харидов, оформленных в виде небольших электрон-
но-плотных телец, покрытых одной мембраной, — по-
хожих на роптрии, но шаровидных (Schrevel, 1972;
Philippe et al., 1982). Они представляют собой продук-
ты созревания везикул аппарата Гольджи и многочис-
ТИП SPOROZOA. КЛАСС GREGARINEA
49
I
Рис. 18. Прикрепительные приспособления грегарин семейства Dactylophoridae.
I— Grebnickiella gracilis: развитие (а—d) и общий вид переднего конца взрослого трофозоита (е); II— ризоиды Echinomera lithobii в разрезе (а) и в реконст-
рукции (б) с указанием расположения восьми клеток хозяина (J—8); кх — клетка хозяина; ни — внутренняя мембрана пелликулы; нк — «неоформный комп-
лекс»; пм — плазматическая мембрана (плазмалемма); пя — «протомеритное ядро»; р — рострум, соответствующий эпимериту других грегарин; ри — ризо-
иды; см — средняя мембрана пелликулы; ццж — циркумцеллюлярный желобок, образованный пелликулой; эг — эпицитарные гребни. (7 — по: Grasse,
1953, 2 — по: Ormieres, Marques, 1976).
Fig. 18. Attachment facilities of gregarines of the family Dactylophoridae.
I— developmental stages (a—d) and anterior part of the adult trophzoite (e) of Grebnickiella gracilis; II— rhizoids of Echinomera lithobii in section (a) and in recons-
truction (6) with indication of positions of eight intestinal cells (7—8); кх — host cell; вм — internal membrane of pellicle; нк — «neoform complex»; пм — plasma
membrane (external membrane of pellicle); пя — «protomeritic nucleus»; p — rostrum corresponding to epimerit of other gregarines; pu — rhizoids; cm — middle
membrane of pellicle; ццж — circumcellular gutter; эг — epicytic folds.
ленны в эктоплазме протомерита, часто располагаясь
группами под эпицитом. В связи с этим в протомерите
сильно развиты диктиосомы в виде стопок мешочков,
иногда связанных с цистернами гладкого ЭПР (эрга-
стоплазмы). Эндоплазма протомерита трофозоитов
старших возрастов сильно вакуолизирована и содер-
жит единичные амилопектиновые зерна. В дейтомери-
те соотношение углеводных включений обратное:
эндоплазма богата амилопектином, тогда как зона
эктоплазмы, содержащая мукополисахариды, очень
узкая, а диктиосомы немногочисленны и состоят всего
из двух-трех мешочков.
4 Зак. №4163
50
ALVEOLATA
I IpoioMepuT и дейтомерит разделяет перегород-
ка септа, представляющая собой рыхлое сплете-
ние тонких фибрилл (Beams et al., 1959; Grasse, Theo-
dor ides, 1959; Devauchelle, 1968a; Baudoin J., Ormieres,
1973; Hoshide, 1975; Hildebrand, 1976). Она, по всей ви-
димости, не является непреодолимым барьером для
внутриклеточных процессов транспорта, так как внут-
ри нее иногда можно наблюдать отдельные вакуоли,
идентичные таковым в других отделах тела (Tronchin,
Schrevel, 1977).
Превращение спорозоита в трофозоит. Хроноло-
гическая последовательность изменений ультраструк-
туры в ходе развития трофозоитов изучена у очень
немногих видов. Это Didymophyes gigantea (Hildebrand,
Vinckier, 1975; Hildebrand, 1976, 1978, 1981) и предста-
вители родов Stylocephalus и Gregarina (Desportes,
1967, 1969; Devauchelle, 1968a; Tronchin, Schrevel, 1977).
Наиболее подробно исследовано раннее развитие Gre-
garina blaberae (Tronchin, Schrevel, 1977) (рис. 19).
Вначале спорозоиты прикрепляются к клетке эпи-
телия кишечника апикальным полюсом. Затем проис-
ходит образование перед коноидом куполообразного
выроста — зачатка эпимерита — и его последующее
прогрессивное разрастание (рис. 19, 1, 2). Внеклеточ-
ная часть спорозоита одета типичной трехмембранной
пелликулой, тогда как эпимеритный бугорок покрыт
только плазмалеммой. Элементы апикального комп-
лекса исчезают на самых первых этапах развития: ко-
ноид и «осевая органелла» (см. раздел о строении спо-
розоитов) через 24 ч после заражения, роптрии —
через 48 ч. К концу второго дня начинается формиро-
вание «кортикальной вакуоли». Она образуется в ре-
зультате слияния многочисленных мелких везикул,
распределенных по периферии эпимерита ювенильно-
го трофозоита (рис. 19, 3). Везикулы, возможно, про-
исходят от ЭПР. Параллельно этим процессам идет
деконденсация хроматина в ядре. На третий день раз-
вития в эпимерите уже сформирована кортикальная
вакуоль, происходит интенсивное отпочковывание
диктиосом и цистерн ЭПР от внешней мембраны ядер-
ной оболочки (рис. 19, 4). Ядро становится Фёльген-
отрицательным, на заднем конце трофозоита появля-
ются зачатки эпицитарных гребней.
Далее преимущественное развитие эпимерита
сменяется быстрым развитием задней, экстрацел-
люлярной части тела. У четырехдневного трофозоита
(рис. 19, 5) в эпимерите находятся вакуоли с плотной
окантовкой, напоминающие пищеварительные, появ-
ляются липидные включения и первые зерна амило-
пектина, мигрирующие в протодейтомерит. Немно-
гочисленные пока митохондрии располагаются под
кортикальной вакуолью эпимерита. На поверхности
протодейтомерита идет прогрессирующее образова-
ние эпицитарных гребней.
На 5-й день развития митохондрии в эпимерите
становятся многочисленными. В экстрацеллюлярном
отделе пояляется пока еще слабо развитая септа, по-
дразделяющая тело на прото- и дейтомерит. Она за-
рождается в середине тела и распространяется в пери-
ферическом направлении. Прото- и дейтомерит содер-
жат многочисленные вакуоли, зерна амилопектина,
заключенные в цистернах ЭПР, липидные включения
и несколько мелких митохондрий. Амилопектиновые
зерна скапливаются в протомерите рядом с септой и
проникают в дейтомерит. Количество вакуолей, не-
многочисленных в заднем отделе, возрастает по на-
правлению к переднему. Это, возможно, указывает на
активное участие эпимерита в питании клетки.
Начиная с шестых суток развития молодые тро-
фозоиты уже морфологически сходны с взрослыми
(рис. 19, 6). В эпимерите хорошо развита кортикаль-
ная вакуоль, на периферии эпимерита расположены
крупные митохондрии, а в срединной (медуллярной)
зоне — большие вакуоли с зернистым в середине и
плотным по краям содержимым. Развивается септа,
разделяющая прото- и дейтомерит. Ее толщина дости-
гает 0.4—0.6 мкм. В кортикальной зоне септа расщеп-
ляется на два слоя, которые загибаются в разные
стороны и проникают на некоторое расстояние внутрь
протомерита и дейтомерита соответственно, следуя
непосредственно под поверхностью. Распределение
полисахаридных включений и подразделение на экто-
и эндоплазму сходно с таковым у трофозоитов старших
возрастов: мукополисахариды содержатся в основном
в протомерите, амилопектин же, наоборот, в основном
в дейтомерите. Продолжается увеличение числа эпи-
цитарных складок. Они достигают 0.6—0.9 мкм в вы-
соту и имеют развитый гликокаликс.
Большой интерес представляет процесс развития
трофозоита у эугрегарин, имеющих внутриклеточные
стадии роста, в частности вопрос о формировании при-
крепительных приспособлений в этом случае. Согласно
литературным данным, некоторые грегарины, такие как
асептатная Lankesteria ascidiae из асцидии Ciona intes-
tinalis, по всей видимости, прикрепляются к кишечному
эпителию хозяина уже после окончания периода внут-
риклеточного развития, т. е. имея морфологию вполне
сформировавшегося трофозоита (Siedlecki, 1901).
Другие грегарины с преимущественно внутрикле-
точным развитием, такие как, например, Schneideria и
Gigaductus, находясь внутри клетки хозяина, тем не
менее обязательно формируют эпимерит, который от-
брасывается почти сразу после выхода взрослого тро-
фозоита в просвет кишечника. В случае Ascogregarina
culicis из личинок комара Aedes прослежено, что в за-
висимости от участка кишечника часть трофозоитов
паразитирует внутриклеточно, а часть — с самого начала
внеклеточно, причем и те и другие формируют эпиме-
рит (Ray, 1933b). С наступлением стадии куколки тро-
фозоиты мигрируют в мальпигиевы сосуды, где обра-
зуют сизигии. И в этом случае не только внеклеточные
особи, но и особи, развивавшиеся внутри клеток хозя-
ина, при переходе к стадии свободного трофозоита от-
брасывают эпимерит, хотя в последнем случае он явно
не мешает перемещению грегарины, поскольку не был
ни к чему прикреплен. В связи с этим встает еще один
вопрос — о функциональной значимости эпимерита
при внутриклеточном паразитизме, поскольку здесь он
явно несет не прикрепительную, а какую-то иную фун-
кцию — возможно, функцию питания. К сожалению,
эти вопросы далеки от своего разрешения, поскольку
соответствующих исследований с привлечением со-
временных методов практически не проводилось.
Процессы, происходящие в эпимерите перед его
утратой, изучены мало. Согласно данным Девошелля
(Devauchelle, 1968а) по развитию Gregarina polymorp-
ТИП SPOROZOA. КЛАСС GREGARINEA
51
О
мтх
мтх
фк
Рис. 19. Ранние стадии развития Gregarina blaberae. (По: Tronchin, Schrevel,
1977).
/ — 0.5 дня после заражения; 2 — 2-й день после заражения; 3 — 2, 3 дня после зараже-
ния; 4 — 3 дня после заражения; 5 — 4 дня после заражения; 6 — 8 дней после заражения;
кх — клетка хозяина, эп — эпимерит, nd — протодейтомерит, п — протомерит, д — дей-
томерит, аг — аппарат Гольджи, ап — амилопектиновые зерна, в — вакуоли, вмк —
внутренний мембранный комплекс пелликулы, зэ — зачаток эпимерита, кв — кортика-
льная вакуоль, ко — коноид, лип — липидные капли, мтх — митохондрии, ос — осевая
структура, пм — плазматическая мембрана (плазмалемма), рп — роптрии, с — септа,
фк — фибриллярное кольцо в основании эпимерита, эпр — эндоплазматический ретику-
лум, ЭЦ — эпицит, я — ядро.
Fig. 19. Early developmental stages of Gregarina blaberae.
I — day 0.5 after infestation; 2 — day 2; 3 — day 2,3; 4 —day 3;5 —day 4; 6 —day 8; кх—host cell; эп — epimerit; nd — protodeutomerit; n— protomerit; d— deu-
loincrit; аг — dyctiosomes; an — amylopectin granules; в — vacuoles; вмк — cortical cytomembranes; зэ — зачаток эпимерита; кв — кортикальная вакуоль; ко —
I’onoid; лип — lipid droplets; мтх — mitochondria; ос — axial structure; пм — plasma membrane; рп — dense bodies (rhoptries); c — septum; фк — fibrillar ring at
the base of epimerit; эпр — endoplasmic reticulum; я — nucleus.
52
ALVEOLATA
ha из мучных червей, эпимерит постепенно дегенери-
рует и уменьшается в размерах, кортикальная вакуоль
сжимается, между эпи- и протомеритом образуется об-
ширная аморфная зона, не содержащая никаких вклю-
чений, кроме тонких рыхлых фибрилл. К моменту от-
крепления эпимерит представляет собой довольно
узкую зону выше кольцевой борозды. Процесс откреп-
ления трофозоита ультраструктурно не исследован.
«Протомеритное ядро». У некоторых грегарин в
области протомерита существует особое образование,
называемое протомеритным ядром (рис. 18, I,
д—е). Впервые оно было обнаружено у Grebnickiella
giardi (Dactylophoridae) (Leger, 1899). Протомеритное
ядро Grebnickiella на световом уровне представляет
собой пузырек в протомерите взрослых грегарин око-
ло 3 мкм в диаметре, который окрашивается гораздо
сильнее цитоплазмы и содержит мелкие удлиненные
гранулы, иногда образующие сеть, а также две или три
более крупные гранулы, которые можно выявить толь-
ко окраской. Оно сохраняется у инцистированных гре-
гарин и исчезает лишь в процессе развития гаметоци-
сты. Позже подобные образования были описаны у
Gregarina socialis (Leger, 1906), Cephaloidophora таси-
lata (Leger, Duboscq, 1910b), C. talitri (Mercier, L.,
1912), Porospora nephropis (Hatt, 1931; Tuzet, Ormieres,
1963) и некоторых других видов. В эпоху световой
микроскопии считалось, что это дегенерирующее ядро
либо скопление «хромидиев». Такая трактовка иногда
приводила к курьезам — например, в начале XX в.
В. А. Догель рассматривал протомерит и дейтомерит
как клетки (соматическую и половую соответственно),
а самих грегарин — как простейших, переходящих к
многоклеточности (Dogiel, 1908). Позже появилась и
альтернативная точка зрения, согласно которой прото-
меритное ядро представляет собой скопление пузырь-
ков, содержащих оксидазы (Gohre, 1943).
Ультраструктурные исследования (Marques, Ormie-
res, 1981) показали, что протомеритное ядро Grebnicki-
ella по своему строению ничем не напоминает настоя-
щее ядро. Оно не покрыто ядерной оболочкой, а в самом
«ядре» морфологически различаются две зоны: пери-
ферическая зона состоит из большого числа фибрилл,
а центральная представляет собой скопление белков
паракристаллической структуры, окруженное мембра-
нами шЭПР. Сходные образования меньшего размера,
но более многочисленные есть в протомерите Echino-
тега. Роль этих образований неясна. Возможно, они
представляют собой запасы питательных веществ. Де-
вошелль (Devauchelle, 1968а), исследуя ультраструктуру
стадий роста паразитов мучных червей из рода Grega-
rina (G. cuneata, G. polymorpha, G. steini), указывает,
что «протомеритное ядро» в этом случае представляет
собой компактное скопление рибонуклеопротеидов.
В протомерите прикрепленных трофозоитов Didymo-
phyes gigantea также отмечены скопления рибосом,
окруженные цистернами ЭПР (Hildebrand, 1976).
Сизигии
Сизигий (syzygy, association) — это стадия жиз-
ненного цикла грегарин, предшествующая образова-
нию гаметоцисты. Традиционно сизигий трактуется
как чисто механическое объединение двух зрелых га-
монтов, не сопровождающееся слиянием их цитоплазм
(рис. 20). В некоторых случаях сизигием называют уже
инцистированных гамонтов, а для неинцистированных,
но уже соединившихся оставляют термин «ассоциа-
ция». В данной главе термин «сизигий» будет употреб-
ляться в основном для обозначения свободных, а не
инцистированных ассоциаций гамонтов грегарин.
Стадия сизигия может быть довольно длительной.
В этом случае говорят о «ранних» сизигиях, характерных,
например, для септатных грегарин надсем. Gregarini-
сае (Gregarina, Hirmocystis и др.). Обычно в этом слу-
чае рост и, вероятно, питание гамонтов продолжаются.
В еще большей степени это относится к так называе-
мым «неогамным» сизигиям (Diplauxis, Urospora chiri-
dotae, Zygocystis cometa и др.), о которых уже упоми-
налось в разделе «Жизненные циклы» (рис. 20, з—к).
Напротив, если сизигии образуются непосредственно
перед образованием цисты, то говорят о «поздних» си-
зигиях. Поздние сизигии очень трудно обнаружить из-за
кратковременности их существования. Они известны у
представителей сем. Lecudinidae — родов Lecudina,
Lankesteria, у многих грегарин сем. Monocystidae, септат-
ных грегарин надсем. Stenophoricae и некоторых других.
Основное разнообразие внешней морфологии сизи-
гиев составляют различные конфигурации соединения
партнеров. По этому признаку выделяют четыре
основных типа:
каудальные сизигии — партнеры соединяются зад-
ними концами (рис. 20, а);
фронтальные сизигии — партнеры соединяются пе-
редними концами (рис. 20, б);
латеральные сизигии — партнеры соединяются бо-
ковыми сторонами (рис. 20, в);
каудо-фронтальные сизигии — к заднему концу од-
ного из партнеров, так называемого примита,
прикрепляется своим передним концом другой —
сателлит (рис. 20, г).
Каудальные сизигии характерны для многих архи-
грегарин, например для Selenidium pendula; у эугрега-
рин они не описаны (за исключением, по-видимому,
Diplauxis). Еще одна отличительная черта сизигиев ар-
хигрегарин, о которой уже упоминалось, это начало
прогамных ядерных делений еще до начала образова-
ния стенки гамонтоцисты. И наконец, элементы апика-
льного комплекса (коноид, роптрии) сохраняются у ар-
хигрегарин и на этой стадии.
Латеральные и фронтальные сизигии характерны
также для некоторых архигрегарин (Selenidium sabella-
riae) и многих Eugregarinida с поздними сизигиями —
большинства асептатных и ряда септатных грегарин
(например, Stylocephalus). Для многих высших Eugre-
garinida — представителей подотряда Septata — харак-
терны каудо-фронтальные сизигии. Примит при этом
всегда один, тогда как сателлитов может быть несколь-
ко. Они прикрепляются либо к общему примиту, либо
друг к другу (рис. 20, д—ж). Чаще всего это отклоне-
ния в ходе подготовки к инцистированию, своего рода
«ошибки». Для некоторых грегарин тем не менее обра-
зование множественных сизигиев является характер-
ной чертой жизненного цикла (Hirmocystis). Соедине-
ние в каудо-фронтальные сизигии в отличие от других
типов строения не ограничивает подвижности партне-
ТИП SPOROZOA. КЛАСС GREGARINEA
53
Рис. 20. Сизигии грегарин.
а — каудальный сизигий Selenidium pendula, б—фронтальный сизигий Lecudinaplatynereidis, в — латеральный сизигий Lecudina tuzetae, г — каудо-фронта-
льный сизигий Pyxinioides balani (п — примит, с — сателлит); д—ж — множественные сизигии (д — Hirmocystis polyinorpha, е — Gregarina socialis, ж —
Uradiophora sp.); з—к — неогамные грегарины (з — Urospora chiridotae, и — Diplauxis hatti, к — Zygocystis cometa). (a — no: Schrevel, 1970a; 6, e — no;
Schrevel, 1969; г — no: Tregouboff, 1912; d, e — no: Leger, 1892,1896; ж — no: Grasse, 1953; з— no: Pixell-Goodrich, 1915; и — no: Vivier, Petitprez, 1968; к —
no: Hesse, 1909).
Fig. 20. Syzygy of gregarines.
a — caudal syzygy, 6— frontal syzygy, e — lateral syzygy, г — caudo-frontal syzygy (n — primite, c — satellite); d—ж— multiple syzygy; з—к — neogamous gre-
garines.
ров. Некоторые авторы предполагают, что это может
быть важно для питания и роста гамонтов в ранних си-
зигиях (Gohre, 1943; Фролов, 1991). Другие же счита-
ют, что питание на этой стадии прекращается и рост
осуществляется за счет использования запасов амило-
пектина (Tronchin et al., 1986).
Для гамонтов в сизигиях грегарин характерна поло-
вая дифференциация, что может выражаться, напри-
мер, в меньших размерах сателлита, различной спо-
собности цитоплазм партнеров к окраске витальными
красителями (нейтральный красный, бромтимоловый
синий и др.). В каудо-фронтальных сизигиях многих
54
ALVEOLATA
септатных грегарин {Gregarina, Cephaloidophora, Ura-
diophora и др.) примит, по всей видимости, является
женским гамонтом (Leger, Duboscq, 1909; Joyet-La-
vergne, 1926; Gohre, 1943). Мужские и женские гамон-
ты в последующем дают начало гаметам только свое-
го пола.
Общая ультраструктура сизигиев (рис. 21) в ос-
новном сходна с таковой трофозоитов-гамонтов. Спе-
цифические для этой стадии черты относятся, главным
образом, к строению зоны контакта между партнера-
ми, а у архи- и неогрегарин, кроме того, к судьбе эле-
ментов апикального комплекса. К сожалению, сведе-
ния здесь довольно отрывочные. У эугрегарин можно
выделить два типа сизигиев, различающихся по степе-
ни объединенности гамонтов: «закрытые» и «откры-
тые» (Фролов, 1991). В первом случае целостность
пелликул партнеров не нарушается и их цитоплазмы
не контактируют. В «открытых» сизигиях непрерыв-
ность покровов в зоне контакта нарушается и цито-
плазмы партнеров так или иначе сообщаются друг с
другом. Степень объединенности партнеров, по всей
видимости, тесно связана с длительностью стадии си-
зигия. Так, в поздних сизигиях Stylocephalus зона кон-
такта устроена просто — она представлена щелевид-
ным пространством между пелликулами двух особей,
заполненным гомогенным мелкозернистым матрик-
сом, материал которого доставляется сюда в мелких
мембранных пузырьках, которые экскретируются га-
монтами (Desportes, 1970) (рис. 21, 3). В случае ранних
сизигиев контакт между партнерами становится более
тесным. Важную роль в скреплении партнеров при
этом играют эпицитарные гребни. Так, у Gregarina
blattarum, G. blaberae, G. polymorpha и G. rigida в зоне
контакта примитом и сателлита гребни располагаются
наподобие зубьев в сопряженных шестернях (Beams et
aL, 1959; Desportes, 1966a; Devauchelle, 1968b; Philippe,
1983). У G. polymorpha между плазмалеммами греб-
ней партнеров отмечены септированные десмосомы
(рис. 21, 4'у Сквозь них не проходят молекулы флуо-
ресцентного красителя, что заставляет предположить в
данном случае чисто механическую, скрепляющую
функцию этих клеточных контактов (Снигиревская,
1974; Dallai, Vegni Talluri, 1988; Vegni Talluri, Dallai,
1991). Наконец, для неогамных эугрегарин характерны
«открытые» сизигии. У представителей рода Diplauxis
в области границы между гамонтами две внутренние
мембраны пелликулы исчезают. Сквозь границу, обра-
зованную двумя плотно сближенными плазмалемма-
ми, проходят многочисленные цитоплазматические
мостики (рис. 21, 5). Однако при подготовке к гамето-
генезу контакт становится менее тесным, поры и
мостики исчезают. Между гамонтами появляется про-
странство, в котором формируются многочисленные
выросты, сцепляющиеся наподобие элементов картин-
ки-головоломки «puzzle» (Vivier, Petitprez, 1968; Po-
rchet-Hennere, Fischer, 1973). У Enterocystis fungoides
из кишечника личинок подёнок сем. Baetidae граница
между гамонтами, наоборот, образована внутренними
мембранными комплексами и подстилающим слоем,
тогда как плазмалемма общая. ВМК партнеров в одних
местах тесно сближены, а в других между ними фор-
мируются расширения, заполненные цитоплазмой с
цистернами ЭПР и диктиосомами (рис. 21, 7). Таким
образом, можно говорить об очень высокой степени
объединения гамонтов в сизигиях этой грегарины
(Desportes, 1974). У близкого вида Enterocystis racovit-
zai, имеющего сходное строение, при подготовке к га-
метогенезу тем не менее происходит обособление
партнеров, сходное с грегаринами рода Diplauxis.
Соединение гамонтов в сизигиях архигрегарин
очень непрочное — фиксированные для электронной
микроскопии, они обычно распадаются на отдельные
особи во время проводки. Это, с одной стороны, за-
трудняет изучение зоны контакта, а с другой — застав-
ляет предположить принадлежность к «открытому»
типу. У партнеров сизигия архигрегарины Selenidium
pennatum из кишечника полихеты Flabelligera affinis
сохраняются основные элементы мукронального ком-
плекса, за исключением мукрональной вакуоли и ее
протока. Из этого можно заключить, что сизигии архи-
грегарин либо не питаются, либо питание осуществля-
ется не через мукроны партнеров, а каким-то иным об-
разом (Kuvardina, Simdyanov, 2002).
Для внутриклеточных неогрегарин семейств Lipot-
rophidae и Syncystidae характерно персистирование
(длительное существование) мукронального комплек-
са на стадии сизигия, что сближает их с архигрегари-
нами. Неогамные сизигии Mattesia grandis и Farino-
cystis tribolii можно интерпретировать как фронталь-
ные, поскольку гамонты в них располагаются «коноид
к коноиду» (рис. 21, 2). Несмотря на неогамность,
эти сизигии существуют относительно недолго и га-
монты в них в отличие от неогамных эугрегарин хоро-
шо обособлены. Они полностью покрыты трехмемб-
ранной пелликулой, на свободной, не участвующей
в контакте поверхности которой отмечены микропо-
ры. Цитоплазма партнеров более дифференцирована,
чем у мерозоитов. Каждый гамонт имеет крупное ядро
с крупным, хорошо развитым ядрышком, большое ко-
личество шЭПР и свободных рибосом, многочислен-
Рис. 21. Ультраструктура сизигиев грегарин.
1 — неогамная эугрегарина Enterocystis fungoides, 2 — внутриклеточная неогрегарина Farinocystis tribolii; 3—5 — ультраструктура зоны контакта между га-
монтами в сизигиях эугрегарин (3 — сизигий позднего формирования Stylocephalus, 4 — сизигий раннего формирования Gregarina, 5 — неогамный сизигий
Diplauxis на ранних фазах развития); аг — аппарат Гольджи, ап — амилопектиновые зерна, в — вакуоли, вмк — внутренний мембранный комплекс пеллику-
лы, ко — коноид, лк — липидные капли, мтх — митохондрии, пк — полярное кольцо, пм — плазматическая мембрана (плазмалемма), рп — роптрии, эг —
эпицитарные гребни; эпр — эндоплазматический ретикулум, я — ядро. (7 — по: Desportes, 1974; 2 — по: Zizka, 1978а; 3, 5 — по: Фролов, 1991, с изменения-
ми; 4 — по: Снигиревская, 1974, ориг.; Desportes, 1966а; Dallai, Vegni Talluri, 1988).
Fig. 21. Fine structure of gregarines syzygy.
1 — a neogamous eugregarine Enterocystis fungoides, 2 — an intracellular neogregarine Farinocystis tribolii, 3—5 — fine structure of the border between gamonts
(3 — a «late» syzygy of Stylocephalus, 4 — an «early» syzygy of Gregarina, 5 — a neogamous syzygy ofDiplauxis early in the development); аг — dyctiosomes, an —
amylopectin granules, в — vacuoles, вмк — cortical cytomembranes, ко — conoid, лк — lipid droplets, мтх— mitochondria, пк — polar ring, пм — plasma membra-
ne, pn — dense bodies (rhoptries), эг — epicytic folds, эпр — endoplasmic reticulum, я — nucleus.
ТИП SPOROZOA. КЛАСС GREGARINEA
55
56
ALVEOLATA
ные митохондрии с пузырьковидными кристами и
крупные вакуоли. Встречаются немногочисленные
электронно-плотные тела, однако не наблюдается
включений запасных веществ — зерен амилопектина
или липидных капель. Коноид, полярные кольца, ропт-
рии, субпелликулярные МТ и микропоры сохраняются
в гамонтах длительное время, но исчезают с формиро-
ванием оболочки гаметоцисты вокруг сизигия (Vavra,
McLaughlin, 1970;.Canning, Sinden, 1975). Здесь мы
имеем дело с необычным сочетанием конфигурации
соединения гамонтов и времени возникновения сизи-
гия, поскольку, как уже указывалось, фронтальные си-
зигии обычно поздние. Мукрональный комплекс этих
неогрегарин, по всей видимости, не принимает учас-
тия в процессах питания и роста. В отличие от Mattesia
и Farinocystis в сизигиях Syncystis aeschnae мукрональ-
ные комплексы остаются свободными, а их цитоплаз-
ма богата амилопектиновыми зернами (Larsson, 1991).
Обилие амилопектиновых зерен в цитоплазме харак-
терно и для шаровидных сизигиев внеклеточных нео-
грегарин рода Ophryocystis. Кроме амилопектина здесь
отмечены и липидные капли (Ormieres et al., 1978; Pur-
rini, Ormieres, 1982; Purrini, Kohring, 1987).
У немногих грегарин (Ganymedes anaspidis, Fusiona
geusi, Diplocystis, некоторые Urosporidae) на светооп-
тическом уровне описано полное слияние гамонтов в
сизигиях (Grasse, 1953; Stejskal, 1965 (цит.: по Perkins
et al., 2000)). К сожалению, во всех этих случаях ульт-
раструктура не изучена.
Стадии гаметогонии
Образование гаметоцисты. Переход к собственно
гаметогонии знаменуется образованием вокруг сизи-
гия цистной оболочки. Эта стадия носит название га-
метоцисты. Впрочем, для ее обозначения в литера-
туре часто используются и другие термины, такие как
гамонтоциста, спороциста, зигоциста и си-
зигий — последний термин в противовес термину
«ассоциация» (см. предыдущий раздел). Разнообразие
этих терминов носит, с одной стороны, исторический
характер, а с другой — связано со стремлением отра-
зить те или иные процессы, проходящие в данный мо-
мент внутри этих образований. Процессы, проходящие
в цисте, представляют собой последовательную смену
стадий гаметогонии и спорогонии, плавно перетекаю-
щих друг в друга. Во избежание путаницы мы будем в
дальнейшем использовать термин «гаметоциста», или
просто «циста», имея ввиду не конкретную стадию
жизненного цикла, а само образование как таковое.
Возможно, правильнее было бы использовать термин
«гамонтоциста», поскольку она образуется гамонтами,
однако название «гаметоциста» является наиболее рас-
пространенным.
Перед образованием гаметоцисты партнеры в сизи-
гии округляются и утрачивают подвижность. Затем в
каждом из них одновременно начинается круговое
движение цитоплазмы, причем обычно в одном и том
же направлении. Оно завершается с образованием про-
зрачной оболочки, окружающей обоих гамонтов. Фор-
мирование гаметоцисты длится несколько часов — у
Lecudina tuzetae, например, 3—4 ч (Schrevel, 1969).
Стенка гаметоцисты довольно эластична и хорошо
проницаема для воды, фиксаторов и красителей.
Строение гаметоцисты. Разнообразие морфоло-
гии гаметоцист связано в основном с их формой, раз-
мерами и наличием или отсутствием специальных
приспособлений для распространения ооцист. Гамето-
цисты грегарин обычно имеют округлую (эллипсоида-
льную или сферическую) форму. Реже встречаются
полусферические или удлиненные цисты. В подавляю-
щем большинстве случаев поверхность гаметоцист со-
вершенно однородна, но у Trichorhynchus pulcher га-
метоцисты формируют кольцевой экваториальный
шов, по которому в дальнейшем происходит их вскры-
тие. Размеры гаметоцист сопоставимы с размерами
сизигиев и трофозоитов. Так, сферические цисты Lecu-
dina legeri могут достигать 120 мкм в диаметре при
длине трофозоитов 200 мкм (Schrevel, 1969), цисты
архигрегарины Selenidium pendula достигают пример-
но 190 мкм при длине взрослых трофозоитов около
180 мкм (Schrevel, 1966).
Стенка гаметоцисты может иметь различную тол-
щину. У архигрегарин она чаще всего тонкая — 1—
2 мкм (Schrevel, 1970а). Очень тонкую стенку имеют и
гаметоцисты неогрегарин (Mattesia grandis, Farinocys-
tis tribolii, Syncystis aeschnae, Ophryocystis spp.). У внут-
риклеточных неогрегарин ее толщина сравнима с
толщиной покровов гамонтов (10—20 нм) (Vavra,
McLaughlin, 1970; Canning, Sinden, 1975; Ormieres et
al., 1978; Purrini, Ormieres, 1982; Purrini, Kohring, 1987;
Larsson, 1991). Наблюдения в световой микроскоп по-
казывают, что большинство эугрегарин имеют тол-
стую (около 20 мкм) стенку гаметоцисты, состоящую
из трех слоев — внутреннего (толщиной около 1 мкм),
среднего светопреломляющего (толщиной порядка
7—10 мкм) и наружного гомогенного (около 10 мкм).
Электронная микроскопия немногих изученных видов
показывает не трех-, а двухслойное строение оболочки
гаметоцисты (Desportes, 1970; Martinucci et al., 1981;
Фролов, 1991). Это происходит по той причине, что
внешний и средний слои практически сливаются в
один в процессе подготовки препарата: при пропитке
эпоксидными смолами их толщина уменьшается в
10—20 раз. Внешний слой состоит из концентрически
расположенных фибрилл или тонких слоев, тогда как
внутренний слой — мелкозернистый, гомогенный
(Desportes, 1970). О химическом составе стенки гаме-
тоцисты известно только то, что в ее состав входят уг-
леводы (Philippe et al., 1975). Формирование стенки га-
метоцисты, вероятно, связано с экструзией содержи-
мого плотных тел, содержащих полисахариды. Эти
тела, которые, как уже упоминалось выше, скаплива-
ются в протомерите зрелых трофозоитов, в большом
количестве содержатся в кортикальной зоне гамонтов
перед инцистированием и не обнаруживаются после
окончания формирования цисты (Desportes, 1970).
Вопрос о степени обособленности гамонтов внутри
гаметоцисты не ясен. С одной стороны, как уже упоми-
налось в предыдущем разделе, степень обособления
гамонтов может возрастать по мере подготовки к ин-
цистированию. С другой стороны, показано, что в га-
метоцистах Gregarina введенный в одну из клеток
флуоресцентный краситель (lucifer yellow) свободно
проникает в другую, тогда как ранее, на стадии сизи-
ТИП SPOROZOA. КЛАСС GREGARINEA
гия, граница между гамонтами была для него непро-
ницаемой (Vegni Talluri, Dallai, 1991). В гаметоцистах
неогрегарин Mattesia grandis и Farinocystis tribolii раз-
рушение мембран, формирующих границу между
партнерами и слияние гамонтов показано на электрон-
но-микроскопическом уровне (Vavra, McLaughlin,
1970; Zizka, 1978а).
Формирование гамет (рис. 22) у грегарин проис-
ходит обычно путем множественного почкования, час-
то называемого «шизогонией». Вначале внутри каждо-
го гамонта происходят серии не сопровождающихся
цитокинезом прогамных ядерных делений, число ко-
торых одинаково для каждого из партнеров. Это при-
водит к тому, что у грегарин в отличие от кокцидий
формируются равные количества мужских и женских
гамет, независимо от их размеров. Деления протека-
ют по типу открытого ортомитоза (Stylocephalus,
рис. 22, 4), полузакрытого ортомитоза (Diplauxis, Lecu-
dina) или полузакрытого плевромитоза (Grebnickiella,
рис. 22, 4) (Grell, 1940; Desportes, 1970; Molon-Noblot,
Desportes, 1980; Schrevel, Philippe, 1993). Для прогам-
ных делений характерны крупные, хорошие митотиче-
ские фигуры с четким разделением на фазы. Это, в ча-
стности, дает возможность определить количество
хромосом у грегарин: отл = 2дол = 11 (Grasse, 1953).
На светооптическом уровне для некоторых грегарин
(Diplocystis schneideri, Gonospora testiculi и др.) перед
началом прогамных делений отмечено обособление от
крупного ядра гамонта небольшого хроматинсодержа-
щего «микронуклеуса», который и дает начало ядрам
гамет (Tregouboff, 1916; Jameson, 1920). У большинст-
ва грегарин, однако, такого не происходит.
На ультраструктурном уровне показано, что к нача-
лу гаметогонии поверхность гамонтов, до того приле-
гавшая к оболочке гаметоцисты, отходит от нее, так
что появляется свободное пространство. Одновремен-
но начинается резорбция внутреннего мембранного
комплекса пелликулы вкупе с подстилающим слоем
(Desportes, 1970). У внутриклеточных неогрегарин
(Farinocystis, Syncystis, Mattesia'} с началом гамето-
гонии исчезает мукрональный комплекс (Vavra, McLa-
ughlin, 1970; Canning, Sinden, 1975; Larsson, 1991).
Хроматин в первичном ядре конденсируется, ядрышко
исчезает. В дальнейшем хроматин остается конденси-
рованным, в том числе и в интерфазах прогамных ми-
тозов, где он занимает пристеночное положение. Ядер-
ные деления гаметогонии следуют друг за другом
очень быстро. У Grebnickiella даже наблюдается опе-
режение: новые митотические веретена начинают об-
разовываться до полного окончания предыдущего де-
ления ядра. Центры организации микротрубочек
(ЦОМТы) митотических веретен в делящихся ядрах
представляют собой либо электронно-плотные зерни-
стые массы с отходящими от них микротрубочками
(«полярные шапочки» или «центроконусы»), либо цен-
триоли (Desportes, 1966b, 1970; Molon-Noblot, 1976,
1977, 1978; Molon-Noblot, Desportes, 1980; Martinucci
et al., 1981; Schrevel, Philippe, 1993). У Apolocystis sp. и
Diplauxis hatti ЦОМТами являются только «полярные
шапочки». У Stylocephalus longicollis и Lecudina tuzetae
роль кинетических центров прогамных делений вна-
чале также играют полярные шапочки, но на послед-
них этапах мужской гаметогонии дифференцируются
центриоли, которые в дальнейшем становятся кинето-
сомами жгутиков. У Grebnickiella центриоли сущест-
вуют на всех этапах прогамных делений, независимо
от пола.
Параллельно с ядерными делениями идет реорга-
низация цитоплазмы. В ее поверхностной зоне концен-
трируются органеллы и включения, которые затем по-
падут в цитоплазму гамет: митохондрии, диктиосомы,
цистерны шЭПР и свободные рибосомы, липидные
капли. Туда же мигрируют и ядра будущих гамет.
В центральной части цитоплазмы гамонта содержится
практически весь запас амилопектина и «соматиче-
ские» ядра. У моноцистиды Apolocystis sp. в централь-
ной зоне обнаружены упорядоченные микрофибриллы
и микротрубочки (Martinucci et al., 1981). Такие эле-
менты цитоскелета, возможно, могут обеспечивать ак-
тивные движения остаточных тел (см. ниже) в гамето-
цистах некоторых грегарин.
К концу гаметогонии герминативная (образующая
гаметы) поверхность гамонта покрыта только плазма-
леммой. Делящиеся ядра распределяются по перифе-
рии, и в конечном итоге происходит массовое отделе-
ние от тела гамонта небольших участков цитоплазмы,
содержащих основные клеточные органеллы и получа-
ющих по одному ядру (рис. 22, 1, 3, 5). Отпочковыва-
ние гамет часто сопряжено с последним прогамным
митозом — в этом случае гаметы отделяются от мате-
ринского организма не поодиночке, а парами (Schre-
vel, Philippe, 1993). Кинетические центры (ЦОМТы)
последнего митоза становятся кинетосомами жгутиков
мужских гамет (рис. 22, 3, 5). Количество гамет в га-
метоцистах большинства эугрегарин исчисляется сот-
нями.
Оставшаяся неиспользованной цитоплазма — ос-
таточное тело (residuum) — может содержать не-
сколько «соматических» ядер, которые в дальнейшем
обеспечивают его функции и непосредственно в гаме-
тогенезе не участвуют. Остаточное тело часто облада-
ет значительной подвижностью и играет важную роль
в процессах копуляции гамет и вывода ооцист из гаме-
тоцисты (см. ниже пункты «Гаметы» и «Вскрытие
ооцист»). Следует подчеркнуть, таким образом, что в
ходе гаметогенеза грегарин дифференцируются два
типа ядер — соматические и генеративные, и образует-
ся не один, а два разных типа организмов: гаметы и
остаточное тело.
Описанная выше типичная картина гаметогенеза
может в ряде случаев нарушаться. Так, прогамные
ядерные деления у архигрегарин Selenidium начинают-
ся, как уже упоминалось, еще на стадии сизигия, и к
началу формирования гаметоцисты каждый гамонт со-
держит уже около 20 вторичных ядер. Это примерно
десятая часть от общего количества гаметических
ядер. Для эугрегарин ранние прогамные деления ядер
нетипичны, хотя у Didymophyes gigantea они отмечены
еще на стадии прикрепленных (!) трофозоитов (Hilde-
brand, 1976,’1978). Зрелые гамонты этой грегарины со-
держат до 200 мелких ядер, собранных в компактную
группу, которая располагается на месте первичного
ядра. У неогрегарин Mattesia и Ophryocystis количест-
во прогамных митозов сильно сокращено — их всего
два. При этом у Mattesia dispora ко второму, собствен-
но гаметическому, делению приступает лишь одно из
58
ALVEOLATA
5
ТИП SPOROZOA. КЛАСС GREGARINEA
59
дочерних ядер гамонта, образовавшихся в результате
первого деления, а другое остается в остаточном теле.
Таким образом, в гаметоцисте этой грегарины образу-
ется всего 4 гаметы и соответственно 2 ооцисты. У Ор-
hryocystis ядерные трансформации протекают сход-
ным образом, но каждый гамонт формирует единст-
венную гамету, ядром которой становится лишь одно
из дочерних ядер второго поколения. Гаметоциста этой
грегарины в итоге содержит единственную ооцисту.
Так или иначе, но у большинства грегарин муж-
ская и женская гаметогонии протекают сходно, за иск-
лючением представителей сем. Dactylophoridae (см.
ниже).
Гаметы (рис. 23). Гаметы грегарин могут быть
морфологически сходными (изогамия) или различны-
ми (анизогамия). Размеры гамет малы — большей ча-
стью от 3 до 5 мкм.
Для большинства грегарин характерна морфологи-
ческая анизогамия (рис. 23,1, 2). Мужские гаметы при
этом имеют один жгутик и более или менее вытянутую
форму, часто с заостренным передним концом, а женские
гаметы округлые и жгутика лишены. Размеры женских
и мужских гамет мало отличаются у большинства гре-
гарин, за исключением Dactylophoridae (рис. 23, 3).
Изогамия характерна для эугрегарин сем. Monocys-
tidae (рис. 23, 4), а также для большей части неогрега-
рин, например для представителей семейств Ophryo-
cystidae, Syncystidae, Lipotrophidae. Во всех этих слу-
чаях гаметы имеют округлую форму и лишены
жгутиков.
Гаметы грегарин в одних случаях покрыты только
плазматической мембраной, в других случаях под ней
могут находиться одна или две дополнительных цито-
мембраны. В отличие от кокцидий у большинства гре-
гарин (кроме Dactylophoridae) и мужские, и женские, и
изогамные гаметы одинаково богаты цитоплазмой, в
которой содержатся основные клеточные органеллы:
митохондрии, диктиосомы, цистерны шЭПР и свобод-
ные рибосомы, липидные капли (рис. 23, 1, б, в, 2, б,
4,6) (Desportes, 1966b, 1970; Martinucci et al., 1981;
Schrevel, Philippe, 1993). Цитоплазма мужских гамет
Stylocephalus spp., Lecudina tuzetae, а также гамет нео-
грегарин Ophryocystis и Syncystis содержит, кроме
того, зерна амилопектина (Desportes, 1966b, 1970; Pur-
rini, Ormieres, 1982; Purrini, Kohring, 1987; Larsson,
1991; Schrevel, Philippe, 1993). Ядро гамет не спер-
мального типа, пузырьковидное с большим количест-
вом кариолимфы. Хроматин в ядре в значительной сте-
пени конденсирован и занимает пристеночное положе-
ние, однако иногда может присутствовать ядрышко. У
мужских гамет ядро смещено вперед.
В самой апикальной части гаметы находится кине-
тосома жгутика, от которой к поверхности ядра могут
отходить микротрубочки, образуя конус. Кинетосома
представляет собой одну из центриолей веретена деле-
ния последнего прогамного митоза. Жгутик тянется от
верхушки сквозь всю гамету и только на заднем ее
конце выходит наружу. В отличие от большинства
эукариот аксонема жгутика мужских гамет грегарин
часто имеет разное и во всех известных случаях абер-
рантное строение. Это выражается в отсутствии цент-
рального дуплета микротрубочек и вариациях в коли-
честве периферических дуплетов. Так, жгутик Stylo-
cephalus longicollis имеет структуру (9X2 + 0) (рис. 23,
1, г—ж), Lecudina tuzetae — (6x2 + 0) (рис. 23, 2, г),
Dipliluxis hatti — (3x2 + 0) (Desportes, 1966b; 1970;
Schrevel, Besse, 1975; Prensier et al., 1980). Биение этих
жгутиков замедленное — 1.5—2 уд./с. Этого тем не
менее достаточно для эффективного равномерного пе-
ремешивания мужских и женских гамет, которое осу-
ществляется в небольшом объеме гаметоцисты в тече-
ние нескольких часов. Кинетосомы таких жгутиков
устроены также нетипично. Так, у Lecudina tuzetae
(рис. 23, 2, в) здесь имеется единственная центральная
микротрубочка, а взамен периферических микротру-
бочек присутствует кольцевидная структура, выпол-
ненная из рыхлой электронно-плотной субстанции
(Schrevel, Besse, 1975).
Встреча разнополых гамет в гаметоцистах грегарин
обеспечивается за счет собственной подвижности или
(и) за счет активных пульсирующих или размешиваю-
щих движений остаточного тела, как это происходит,
например, у Actinocephalidae и Dactylophoridae. В га-
метоцистах Stylocephalus, кроме того, всегда присутст-
вуют аномальные крупные стерильные гаметы, снаб-
женные двумя жгутиковыми аксонемами, окруженны-
ми общей мембраной. Эти гаметы очень подвижны, и
им также приписывается перемешивающая функция.
Строение аксонем жгутиков у них несколько варьиру-
ет, но обычно такое же, как у типичных мужских гамет
(9x2 + 0) (Desportes, 1970).
«Оогамия» у Dactylophoridae. В отличие от дру-
гих грегарин у представителей сем. Dactylophoridae
анизогамия выражена очень резко и по многим призна-
кам похожа на оогамию. Женские гаметы Grebnickiella
цилиндрические, размером 20x4.5 мкм, покрыты, по
данным Молон-Нобло (Molon-Noblot, 1977,1978), дву-
мя мембранами, что крайне необычно (рис. 23, 3, д).
Их цитоплазма богата рибосомами, митохондриями,
цистернами ЭПР, диктиосомами, липидными включе-
ниями, зерна амилопектина отсутствуют. Ядро распо-
ложено на одном из концов гаметы, крупное, содержит
Рис. 22. Формирование гамет у грегарин.
I—3 — Stylocephalus longicollis'. 1 — общий вид гаметоцисты на различных этапах (а, б) формирования гамет, 2 — последние прогамные митозы и формиро-
вание цитоплазматических лопастей за счет слияния крупных вакуолей, 3 — этапы формирования.мужской гаметы; 4—5 — Grebnickiella gracilis: 4 — фазы
прогамного митоза; 5 — этапы формирования мужской гаметы; аг — аппарат Гольджи, в — вакуоли, г — гаметы, жг — жгутик, лип — липидные капли,
мтх — митохондрии, огц — оболочка гаметоцисты, от — остаточное тело; ц, 41, Ц2 — центриоли, эпр — эндоплазматический ретикулум; я, яь я2 — ядра
(/ — по: Leger, 1904а; 2, 3 — по: Desportes, 1970; 4 — по: Molon-Noblot, Desportes, 1980; 5 — по: Molon-Noblot, 1978).
Fig. 22. Gametes formation by gregarines.
/—3 — Stylocephalus longicollis: I — gametocyst at the different stages (a, 6) of gametes formation, 2 — the last progamic mitoses and formation of cytoplasmic lobes
following a fusion of large vacuoles, 3 — formation phases of a male gamete; 4—5 — Grebnickiella gracilis: 4 — phases of a progamic mitosis, 5 — formation phases
of a male gamete; аг — dyctiosomes, в — vacuoles, г — gametes, жг — flagellum, лип — lipid droplets, мтх — mitochondria, огц — gametocyst envelop, от — resi-
dual body, ц, 4i, 42 — centriole, эпр — endoplasmic reticulum, я, я2 — nucleus.
60
ALVEOLATA
Рис» 23. Гаметы грегарин.
7 — Stylocephalus longicollis: а — общий вид гамет, б — ультраструктура женской гаметы, в — ультраструктура мужской гаметы, г, д, е, ж — срезы мужской
гаметы на разных уровнях; 2 — Lecudina tuzetae: а — копуляция гамет, б — ультраструктура мужской гаметы, в — поперечный срез кинетосомы жгутика,
г — поперечный срез жгутика; 3 — Grebnickiella gracilis: а — копуляция гамет, б — ультраструктура мужской гаметы, в, г — срезы мужской гаметы на раз-
ных уровнях, d — ультраструктура женской гаметы; 4 — изогаметы грегарин семейства Monocystidae: а — гаметы Monocystis sp., б — ультраструктура гаме-
ты Apolocystis sp.; аг — аппарат Гольджи, ап — амилопектиновые зерна, жг — жгутик, лип — липидные капли, мп — микропора, мтх — митохондрии,
цомт — центр организации микротрубочек митотического веретена, эпр — эндоплазматический ретикулум, я — ядро, (la — по: Leger, 1904а; 16—1ж — по:
Desportes, 1970; 2а — по: Schrevel, 1969; 26— по: Schrevel, Philippe, 1993; 2в, г— по: Schrevel, Philippe, 1993, ориг.; За — по: Leger, Duboscq, 1903; 26--2д —
по: Molon-Noblot, 1978; 4а — по: Brasil, 1905а; 4б— по: Фролов, 1991).
Fig. 23. Gametes of gregarines.
I — Stylocephalus longicollis: a — general view of gametes, 6 — fine structure of female gamete, в — fine structure of male gamete, г, д, e, ж — sections of the male
gamete at the different levels; 2 — Lecudina tuzetae: a — fecundation, 6 — fine structure of male gamete, в — cross-section of the basal body of the gamete's flagellum,
г — cross-section of the flagellum; 3 — Grebnickiella gracilis: a — fecundation, 6 — fine structure of male gamete, в. г — sections of the male gamete at the different
levels, d — fine structure of female gamete; 4 — isogametes of gregarines from the family Monocystidae: a — gametes Monocystis sp., 6 — fine structure of the Apolo-
cystis sp. gamete; аг — dyctiosomes, an —amylopectin granules, жг — flagellum,.™?? — lipid droplets,мп — micropore, мтх— mitochondria, эпр — endoplasmic
reticulum, цомт — mitotic MTOC, я — nucleus.
ТИП SPOROZOA. КЛАСС GREGARINEA
61
1 ядрышко. Мужские гаметы веретеновидные, 10 мкм
в длину, одножгутиковые (9x2 + 0), покрытые одной
мембраной (рис. 23, 3, а). Микрогаметы сильно напо-
минают таковые кокцидий и сперматозоиды многокле-
точных: в них почти полностью отсутствует цитоплазма,
ядро повторяет форму гаметы, хроматин в ядре сильно
конденсирован, а в передней части гаметы находится
единственная крупная удлиненная митохондрия (Mo-
lon-Noblot, 1978; Molon-Noblot, Desportes, 1980).
Женская гаметогония Dactylophoridae отличает-
ся от мужской. В то время как мужские ядра, как и у
других грегарин, мигрируют на периферию гамонта
(рис. 22, 5), женские распределяются равномерно в
толще цитоплазмы. Покровы женских гамет Grebnicki-
ella образуются в результате слияния мембранных пу-
зырьков. Цитоплазма женского гамонта при этом рас-
ходуется полностью, а остаточное тело образуется
только за счет мужского гамонта и занимает в гамето-
цисте латеральное положение (Molon-Noblot, 1978).
Необходимо подчеркнуть, что, несмотря на столь
резко выраженный диморфизм гамет, у Dactylophori-
dae, как и у других грегарин, образуются равные коли-
чества гамет обеих полов — образованию женских,
так же как и мужских, обязательно предшествуют
прогамные митозы гамонта в отличие от оогамных
кокцидий. Поэтому во избежание путаницы «оога-
мию» дактилофорид следует трактовать как резко вы-
раженную анизогамию.
Стадии спорогонии
Зигота и ооциста. В течение нескольких часов по-
сле окончания гаметогенеза происходит копуляция га-
мет, которая завершается образованием зигот, иногда
не совсем верно называемых споробластами
(рис. 24). Внутри зиготы происходит кариогамия с об-
разованием диплоидного синкариона. При выделе-
нии зиготой плотной защитной оболочки образуется
ооциста. Эту стадию, особенно в старой литературе,
часто называют также спороциста или с п о р а. Тем
не менее, поскольку оболочка «споры» грегарин фор-
мируется зиготой, она соответствует не споре, а ооци-
сте кокцидий. Под покровом ооцисты проходит спо-
рогония — формирование спорозоитов. В результа-
те этого процесса сначала из диплоидного ядра зиготы
образуются гаплоидные ядра спорозоитов, а затем во-
круг них обособляется цитоплазма. Как и в процессе
гаметогонии, цитоплазма на построение дочерних кле-
ток расходуется не вся — зрелые ооцисты, кроме спо-
розоитов, обычно содержат также и остаточное тело.
Размеры ооцист обычно невелики. Так, в сем. Lecudini-
dae они не превышают 9—10 мкм.
Форма ооцист (рис. 25) довольно разнообразна.
Грассе (Grasse, 1953) выделяет здесь четыре основные
категории:
• сферические ооцисты характерны для многих архи-
грегарин из рода Selenidium (рис. 25, 7), но иногда
встречаются и у других грегарин, например Uradi-
ophora, у которой снабжены экваториальным швом
(рис. 25, 10).
• гомополярные ооцисты — имеют одинаковые
полюса и в свою очередь подразделяются на «пра-
Рис. 24. Копуляция гамет (а) и последовательные стадии формиро-
вания зиготы (б—д) у грегарины Stylocephalus longicollis. (По:
Leger, 1904а).
Fig. 24. Fecundation (a) and successive formation stages of zygote
(4—d) by Stylocephalus longicollis.
вильные» (рис. 25,2, 4, 5, И, 12, 15—21, 23), имею-
щие две взаимно перпендикулярные оси
симметрии, и «неправильные» (рис. 25, 14, 22).
«Правильные» ооцисты с гладкой поверхностью
могут быть овоидные или эллипсоидальные (неко-
торые Archigregarinina, Lecudinidae, Stenophoridae),
бочонковидные (Gregarinidae) (рис. 25, 12), цилин-
дрические (Dactylophoridae), биконические или на-
викулярные, т. е. лодочковидные (рис. 25, 4, 5, 15)
(многие Actinocephalidae, Monocystidae); у некото-
рых Actinocephalidae (подсем. Acanthosporinae)
ооцисты могут нести на своей поверхности иглы
или шипы (рис. 25, 19, 21). «Неправильные» ооци-
сты могут иметь искривленную продольную ось,
принимая форму банана, рогалика или полумесяца
(Actinocephalidae: Menosporinae) (рис. 25, 22); для
представителей сем. Stylocephalidae характерны
уплощенные ооцисты в форме кошелька или варе-
ника (рис. 25, 14).
• гетерополярные ооцисты (рис. 25, 3, 6—9, 13) — ха-
рактерны для многих асептатных грегарин: у Dipla-
uxis они овоидные с бугорком на одном конце; у
представителей сем. Urosporidae (рис. 25, 6—9) на
одном из полюсов образуется бугорок или воротни-
чок, а на другом — более или менее длинный вы-
рост, иногда выросты парные (Ceratospora mirabi-
lis).
• сложные или сросшиеся ооцисты (рис. 25, 20,
24) — по всей видимости представляют собой
уродства и часто встречаются в гаметоцистах мно-
гих грегарин наряду с нормальными; их жизнеспо-
собность не установлена (Фролов, 1991).
Оболочка ооцисты принимает на себя основную
функцию по защите спорозоитов от воздействий внеш-
ней среды, поэтому процесс спорогонии сопровожда-
ется ее прогрессивным утолщением и укреплением. На
светооптическом уровне в оболочке ооцисты обычно
различают два слоя: внешний носит название эпи-
спора, а внутренний — эндоспора. Иногда эпи-
спора отслаивается от эндоспоры, как это имеет место
у многих Stenophoridae, у Pyxinia (Actinocephalidae).
Во многих случаях ооцисты покрыты лишь одной обо-
лочкой — либо эписпора резорбируется, либо сливает-
62
ALVEOLATA
14 16 17 18 20 24
Рис. 25. Ооцисты грегарин.
1 — Selenidium potamillae; 2 — Meroselenidium keilini (a — внешний вид, б — оптический срез); 3 — Lecudina brasili; 4 — Nematocystis magna; 5 — Monocystis
sp. (выход спорозоитов); 6 — Lithocystis schneideri; 7— Ceratospora mirabilis; 8 — Gonospora varia; 9 — Urospora sipunculi; 10 — Uradiophora cuenoti; 11 —
Hirmocystis gryllotalpae; 12 — Gregarina acuta; 13 — Monoductus lunatus (a — аифас, 6 — профиль); 14 — Lepismatophila parva; 15 — Amphoroides polydesmi;
16—18 — Pyxinia spp. (16— общий вид, 17 — цепочка вскрывающихся ооцист, 18— выход спорозоитов); 19, 20 — Ancyrophora gracilis (19 — нормальная
форма, 20 — аномальная форма); 21 — Cometoides capitata; 22 — Menospora polyacantha; 23 — Ophryocystis duboscqui (вскрытие); 24 — Monocystis agilis
(аномальная форма). (/—3, 5—23 из: Grasse, 1953 (no разным авторам); 4 и 24 из: Фролов, 1991 (по: Meier, 1956)).
Fig. 25. Oocysts of gregarines.
2 — Meroselenidium keilini (a — outward appearance, 6 — optical section); 5 — Monocystis sp. (sporozoite release); 13 — Monoductus lunatus (a — full face, 6 —
half face); 16—18 — Pyxinia spp. (16— appearance, 17 — chain of dehiscent oocysts, 18 — sporozoite release); 19, 20 — Ancyrophora gracilis (19 — normal shape,
20 — abnormal shape); 23 — Ophryocystis duboscqui (dehiscence); 24 — Monocystis agilis (abnormal shape).
ТИП SPOROZOA. КЛАСС GREGARINEA
63
1 2
Рис. 26. Ультраструктура ооцист грегарин.
1 — Diplauxis schreveli, 2 — Apolocystis sp.; аг — аппарат Гольджи, ап — амилопектиновые зерна, апк — апикальное полярное кольцо, в — вакуоли, гс — губ-
чатая субстанция, лип — липидные капли, мт — микротрубочки, мтх — митохондрии, от — остаточное тело, рп — роптрии, соц — стенка ооцисты, эпр —
эндоплазматический ретикулум, элс — эписпора, энс — эндоспора, я — ядро. (/ — по: Porchet-Hennere, Fischer, 1973; 2 — по: Фролов, 1991).
Fig. 26. Fine structure of gregarines oocysts.
аг — dyctiosomes, an — amylopectin, апк — apical polar ring, e—vacuoles, гс — spongious substance, лип — lipid droplets, мт — microtubules, мтх — mitochond-
ria, от — residual body, pn — dense bodies (rhoptries), соц — oocyst wall, эпр — endoplasmic reticulum, эпс — epispore, энс — endospore, я — nucleus.
ся с эндоспорй, либо ее вообще не удается обнару-
жить. На одном (Lankesteria, Nematopsis) или двух по-
люсах ооцисты (Pyxinia, Farinocystis, Ophryocystis)
могут находиться отверстия для выхода спорозоитов,
плртно закрытые пробочками.
Электронно-микроскопическое исследование зре-
лых ооцист во многих случаях затруднено из-за пло-
хой проницаемости их стенок для фиксаторов и про-
питочных смесей. Поэтому сведения об их строении
довольно отрывочны. Наиболее соответствует свето-
оптическим данным устройство стенки ооцисты грега-
рин рода Diplauxis (рис. 26,1), которая состоит из двух
сближенных слоев. Толщина стенки около 65 нм. На
концах ооцисты слои расходятся, формируя простран-
ство, которое заполнено на апикальном полюсе губча-
той субстанцией. Снаружи ооциста покрыта материа-
лом, напоминающим гликокаликс (Prensier, 1970b; Po-
rchet-Hennere, Fischer, 1973). Двухслойное строение
имеют и стенки ооцист Mattesia grandis и Nematopsis
sp. (Vavra, McLaughlin, 1970; Azevedo, Cachola, 1992).
У Apolocystis sp. (рис. 26, 2) зрелые ооцисты имеют
толстую (до 350 нм) стенку, состоящую из трех слоев
(Crespi et al., 1981). Два внешних слоя — толстые (при-
мерно 150 — 170 нм) и гетерогенные, внутренний слой
относительно тонкий — около 20 нм. В некоторых слу-
чаях, однако, оболочка гомогенная, однослойная. Та-
кое строение имеют ооцисты Farinocystis tribolii и Gre-
garina korogi (140 нм) (Zizka, 1972; Canning, Sinden,
1975; Hoshide, Todd, 1993). У Nematopsis sp. на одном,
a у Farinocystis tribolii на обоих полюсах ооцисты есть
отверстия, закрытые пробочкой. В первом случае ее
материал, по-видимому, тот же, что и у стенки, а во
втором электронная плотность материала пробочек
ниже. Толщина стенки ооцист варьирует от 35 (Matte-
sia grandis ) до 560 нм (Farinocystis tribolii), В целом
никаких общих закономерностей в ультраструктуре
оболочки ооцист пока не усматривается, что, безусловно,
является следствием недостаточной изученности.
Стенка ооцисты строится, по всей видимости, из
материала вакуолей с плотным содержимым, которые
формируются содержащимися в цитоплазме зиготы
диктиосомами. Кроме них зигота имеет и другие орга-
неллы, унаследованные от гамет, — многочисленные
рибосомы, которые придают цитоплазме повышенную
64
ALVEOLATA
электронную плотность, митохондрии, очень сильно
развитую систему цистерн ЭПР. Из включений харак-
терны липидные капли и зерна амилопектина (Prensier,
1970а, 1970b; Crespi et al., 1981). Последние, по-види-
мому, могут вырабатываться внутри самой зиготы, по-
скольку далеко не всегда содержатся в гаметах. Покро-
вы зиготы тесно прилегают к цистной оболочке.
Формирование спорозоитов. В ходе спорогонии
в ооцисте происходит 2 или 3 ядерных деления (мета-
гамные деления). В первом случае зрелая ооциста
будет содержать 4 спорозоита, что характерно для
большинства архигрегарин рода Selenidium. Во втором
случае в ооцисте формируется 8 спорозоитов, что ха-
рактерно для подавляющего большинства остальных
грегарин. Исключения из этого правила редки — на-
пример ооцисты Meroselenidium могут содержать бо-
лее 16 спорозоитов. «Монозоитные ооцисты» гетеро-
ксенных грегарин сем. Porosporidae в сущности ооци-
стами не являются, поскольку такая «ооциста»
Рис. 27. Формирование спорозоита в ооцисте Diplauxis hatti. (По:
Schrevel, Philippe, 1993).
аг — аппарат Гольджи, вмк— внутренний мембранный комплекс пеллику-
лы, кц — кинетический центр последнего спорогонического митоза, мн —
закладка микронем, мт — микротрубочки, мтх — митохондрии, пм —
плазматическая мембрана (плазмалемма), рп — закладка роптрий, эпр —
эндоплазматический ретикулум, я — ядро; стрелкой обозначено направле-
ние прогрессирующего впячивания плазмалеммы зиготы.
Fig. 27. Sporozoite formation in an oocyst of Diplauxis hatti.
аг — dyctiosomes, вмк — cortical cytomembranes, кц — kinetic center oh the
last sporogonic mitosis, мн — future micronemes, мт — microtubules, мтх —
mitochondria, пм — plasma membrane, pn — future dense bodies (rhoptries),
эпр — endoplasmic reticulum, я — nucleus; arrow — direction of propagation of
the zygote plasma membrane invagination.
сформирована не зиготой, а единственным заключен-
ным в ней спорозоитом.
Первое деление ядра зиготы представляет собой
одноступенчатый мейоз, характерный для споровиков
(Райков, 1978), а последующие — митозы тех же ти-
пов, что и в ходе гаметогонии. Мейоз у грегарин, по
всей видимости, ахиазматический, хотя у Grebnickiella
gracilis обнаружен редуцированный синаптонемаль-
ный комплекс (Molon-Noblot, Desportes, 1977). С по-
мощью электронной микроскопии наиболее подробно
прослежено формирование спорозоитов Diplauxis hatti
(Prensier, 1970а, 1970b) (рис. 27). Последние ядерные
деления спорогонии проходят по типу полузакрытого
ортомитоза. После образования дочерних ядер начина-
ется формирование покровов. Если образование гамет
можно сравнить с процессом наружного почкования,
то образование спорозоитов — с процессом внутрен-
него почкования, как это, например, происходит у со-
сущих инфузорий (Suctoria) или в ходе эндодиогении
токсоплазмоподобных кокцидий. Внешняя мембрана
спорозоита образуется за счет плазматической мемб-
раны зиготы, прогрессивно инвагинирующей внутрь
цитоплазмы. Внутренний мембранный комплекс фор-
мируется из цистерн ЭПР, кроме того, в него допол-
нительно встраиваются пузырьки, продуцируемые ап-
паратом Гольджи. Апикальный комплекс начинает
формироваться в непосредственной близости от кине-
тического центра последнего митоза. Роптрии обра-
зуются из электронно-плотных пузырьков, продуци-
руемых аппаратом Гольджи. В финале спорогонии в
ооцисте формируются восемь спорозоитов и остаточ-
ное тело. У Apolocystis sp. остаточное тело представля-
ет собой окруженный мембраной фрагмент цитоплаз-
мы, содержащий крупную вакуоль, липидные капли и
основные клеточные органеллы, за исключением ядер
и диктиосом (Crespi et al., 1981).
Вскрытие гаметоцист и рассеивание ооцист
(рис. 28). Созревание гаметоцист у большинства грега-
рин длится обычно не более двух недель. Его темпы
прямо зависят от температуры, а при развитии в воз-
душной среде — еще и от влажности. Так, у Gregarina
blaberae при оптимальных условиях (температура
25—28 °C, влажность воздуха 80 %) созревание гаме-
тоцист занимает всего 3 дня. При понижении темпе-
ратуры до 20 °C сроки созревания увеличиваются до
7 дней. При понижении температуры до 15 °C разви-
тие останавливается, а при длительном многодневном
повышении до 40 °C развивающиеся ооцисты погиба-
ют (Tronchin et al., 1986).
Рис. 28. Некоторые способы вскрытия гаметоцист у грегарин.
I — Trichorhynchus pulcher, 2 — Echinomera hispida (Dactylophoridae), 3 —
Gregarina munieri (общий вид гаметоцисты с вывернутыми спородуктами),
4 — Gregarina ovata (детали строения спородукта до (а) и во время (б) вы-
давливания ооцист); огц — оболочка гаметоцисты, от — остаточное тело,
оц — ооцисты, спд — спородукт, спм — спородуктовый мешок. (7 — по:
Schneider, 1882; 2 — по: Schellack, 1907; 3 — по: Schneider, 1875; 4 — по:
Schnitzler, 1905).
Fig. 28. Some modes of gregarines’ gametocysts dehiscence.
7 — Trichorhynchus pulcher, 2 — Echinomera hispida (Dactylophoridae), 3 —
Gregarina munieri (general view of gametocyst with turned out sporoducts),
4 — Gregarina ovata (details of the sporoduct structure before (a) and during (6)
expulsion of oocysts); огц — gametocyst envelop, от — residual body, оц —
oocysts, end — sporoduct, спм — sporoduct sac.
ТИП SPOROZOA. КЛАСС GREGARINEA
В5
5 Зак. №4163
66
ALVEOLATA
У большинства грегарин гаметоцисты созревают
вне хозяина, будучи выведены вместе с экскрементами
во внешнюю среду. Внутри хозяина развитие в этих
случаях не происходит. Более того, по всей видимости,
у многих Lecudinidae, таких как Lecudina brasili, даже
гаметогенез начинается только при попадании во
внешнюю среду — морскую воду. Свое крайнее выра-
жение эта тенденция находит у Lecythion и Hentschelia
из эхиуриды Thalassema neptuni, у которых в морскую
воду выводятся неинцистированные сизигии (Mackin-
non, Ray, 1931). У грегарин, паразитирующих в поло-
сти тела хозяина или полостных органах, гаметоцисты,
напротив, созревают внутри хозяина (Monocystidae,
многие неогрегарины — Lipotrophidae и др.).
В процессе созревания происходит не только спо-
руляция ооцист, но и изменения в тонком строении
оболочки самой гаметоцисты. На ультраструктурном
уровне показано, что в гаметоцистах Stylocephalus в
это время появляется дополнительный внутренний
слой низкой электронной плотности, а самый внешний
меняет свое строение — из слоистого он становится
исчерченным в перпендикулярном к поверхности обо-
лочки направлении (Desportes, 1970).
Вскрытие гаметоцист и рассеивание ооцист может
происходить различным образом. Часто активную роль в
этом процессе играет остаточное тело. Вслед за Грассе
(Grasse, 1953) можно выделить следующие случаи:
1) простой разрыв оболочки гаметоцисты. Этот спо-
соб встречается у грегарин наиболее часто. Он ха-
рактерен для архи- и неогрегарин, многих эугрега-
рин, таких как представители семейств Lecudinidae,
Monocystidae, многие Actinocephalidae и др.
2) вскрытие гаметоцисты с участием остаточного тела
так называемой «псевдоцисты» характерно для
представителей семейств Stylocephalidae, Dactylo-
phoridae и некоторых других. Псевдоциста форми-
руется в результате слияния цитоплазм гамонтов уже
после прохождения спорогонии (Schrevel, Philippe,
1993). Во влажной атмосфере псевдоциста набуха-
ет и, увеличиваясь в размерах, как бы «взрывает»
гаметоцисту изнутри. Гаметоцисты Trichorhynchus
pulcher, имеющие экваториальный шов, раскрыва-
ются вдоль него (рис. 28, 7). У Dactylophoridae
псевдоциста, образованная только мужским гамон-
том, занимает асимметричное, пристеночное поло-
жение. Ее набухание приводит к прорыву отвер-
стия, как бы продавленного компактной массой
ооцист, для которых больше не остается места
внутри гаметоцисты (рис. 28, 2). Этот процесс об-
легчается параллельным разрушением внешнего
гиалинового покрова, так что к моменту прорыва
оболочка гаметоцисты состоит только из тонкого
внутреннего слоя.
3) рассеивание ооцист с помощью спородуктов. Гаме-
тоцисты грегарин семейств Gregarinidae, Gigaducti-
dae, Monoductidae и некоторых других снабжены
полыми выворачивающимися трубками — споро-
дуктами, через которые ооцисты выводятся нару-
жу (рис. 28, 5). Они образуются остаточным телом,
которое за счет собственных активных движений
вскоре после копуляции гамет превращается из
центрального в периферическое, формируя не-
прерывный пристеночный слой внутри цисты —
«спородуктовый мешок». Эта субстанция конденси-
руется, и в ее толще закладываются ввернутые спо-
родукты, контактирующие своими расширенными
основаниями со стенкой гаметоцисты, а суженными
концами обращенные в ее полость (рис. 28, 4, а).
Увеличение внутреннего давления в результате на-
сасывания гаметоцистой молекул воды приводит к
выворачиванию спородуктов и выдавливанию из
них ооцист, часто соединенных в цепочки (Grasse,
1953; Hoshide, Todd, 1993) (рис. 28, 4, б).
Образование цепочек ооцист может происходить
не только в третьем, но и во втором случае. Как показа-
но на ультраструктурном уровне у Stylocephalus, одно-
временно с началом образования оболочки на буду-
щих полюсах ооцист формируются особые трехслой-
ные лигаменты, связывающие зиготы между собой
(Desportes, 1970).
Особый интерес представляют случаи, когда гаме-
тоцисты созревают внутри хозяина — в его целоме или
полостных органах. Вскрытие гаметоцист при этом
происходит на месте, обычно простым разрывом обо-
лочки. Пути попадания ооцист во внешнюю среду и
способы заражения хозяев в некоторых подобных слу-
чаях рассмотрены в разделе, посвященном парази-
то-хозяинным взаимоотношениям.
Вскрытие ооцист обычно происходит в кишечни-
ке хозяина под действием пищеварительных соков.
Оболочка ооцисты при этом растрескивается (Watson,
1916), по всей видимости, вдоль уже намеченных
«надломов», наподобие обнаруженных на ультра-
структурном уровне у Gregarina korogi (Hoshide, Todd,
1993). В тех случаях, когда имеется специальный шов
(Cephaloidophora, Uradiophora), вскрытие происходит
по нему (рис. 25, 10; 48, 2). Ооцисты Stylocephalidae,
имеющие форму кошелька или вареника, вскрываются
по выпуклому краю. У ооцист, снабженных полярными
пробочками, эти пробочки выпадают или растворяют-
ся, и спорозоиты выходят наружу через образовавшие-
ся отверстия (рис. 25, 25). Иногда сочетаются оба этих
способа — у Pyxinia эписпора, свободно облегающая
ооцисту, раскрывается по средней линии на две створки,
а затем происходит выпадение пробочек из полярных
отверстий в эндоспоре (Grasse, 1953) (рис. 25, 17, 18).
У Gregarina blaberae при инкубации ооцист в гомоге-
нате из тканей кишечника хозяина эписпора в течение
нескольких минут переваривается — остается только
эндоспора. Спорозоиты покидают ооцисту через «кла-
пан» на одном из полюсов (Tronchin et al., 1986).
Мерогонии и мерозоиты
В соответствии со стандартной терминологией,
предложенной Левайном (Levine, 1971а) для типа Api-
complexa, особи, которые формируются в результате
мерогонии, следует называть мерозоитами. Известно,
что мерозоиты споровиков в большинстве случаев
имеют характерное строение, сходное с таковым спо-
розоитов (Porchet-Hennere, Vivier, 1971). Однако у гре-
гарин, по-видимому, это не всегда так. Напомним, что
у неогрегарин в жизненном цикле, как правило, при-
сутствуют две разнохарактерные мерогонии (см. раз-
дел «Жизненные циклы»), продукты которых могут
ТИП SPOROZOA. КЛАСС GREGARINEA
67
Рис. 29. Мерозоиты грегарин.
7 — архигрегарина Selenidium hollandei (а — общий вид меро-
зоитов, б — ультраструктура), 2 — формирование мерозоита
неогрегарины Mattesia grandis', ме — меронт, мз — мерозоит-
ная почка, аг — аппарат Гольджи, ап — амилопектиновые
зерна, вмк — внутренний мембранный комплекс пелликулы,
ко — коноид, кр — кристаллоид, мт — микротрубочки,
мтх — митохондрии, пм — плазматическая мембрана (плаз-
малемма), рп — роптрии, фк — электронноплотное фибрил-
лярное кольцо в основании мерозоитной почки, эпр — эндоп-
лазматический ретикулум, я — ядро; стрелками обозначено
направление распространения образующегося внутреннего
мембранного комплекса, наконечниками стрелок — направ-
ление прогрессирующей инвагинации плазмалеммы меронта
(1, а — по: Schrevel, 1970а; 7, б — по: Schrevel, 1971b; 2 — по:
Vavra, McLaughlin, 1970, ориг.).
Fig. 29. Merozoites of gregarines.
7 — archigregarine Selenidium hollandei (a — general view of
merozoites, 6 — diagram of those fine structure), 2 — formation
of merozoit of a neogregarine Mattesia grandis\ ме — meront,
мз — merozoite bud, аг — dyctiosomes, an — amylopectin,
вмк — cortical cytomembranes, ко — conoid, кр — crystalloid,
мт — microtubules, мтх — mitochondria, пм — plasma memb-
rane, pn — dense bodies (rhoptries), фк — electrondense fibrillar
ring at the base of the merozoite bud, эпр — endoplasmic reticu-
lum, я — nucleus; arrows — direction of propagation of new-for-
ming cortical cytomembranes, arrowheads — direction of propa-
gation of the meront plasma membrane invagination.
5 MKM
।-----1
a
иметь различную морфологию. В одних случаях при
этом образуются мелкие червеобразные клетки, в дру-
гих же могут формироваться крупные организмы,
сходные с материнским, — например, грегариноидные
особи Ophryocystis. Таким образом, следует иметь в
виду, что, хотя формально и те и другие должны назы-
ваться мерозоитами, во взором случае эти «мерозои-
ты» явно атипичны.
Мерозоиты типичного строения описаны для ар-
хигрегарины Seleiridiniii hollandei (рис. 29, /), неогрега-
68
ALVEOLATA
Рис. 30. Жизненный цикл Gigaductus steropi (объяснения в тексте). (По: Massot, Ormieres, 1979).
А — меронт первой генерации; Б, В — стадии первой мерогонии; Г— мерозоит первой генерации; Д~Ж— меронт второй генерации; 3—Й—стадии второй
мерогонии; К— мерозоит второй генерации; Л, М— гамонт: фазы внутриклеточного развития; Н — образование сизигия в кишечном просвете хозяина;
О — гаметоциста; П — зрелая гаметоциста с вывернутым спородуктом; Р — ооцисты; С — выход спорозоитов.
Fig. 30. Life cycle of Gigaductus steropi.
A — rneront of Is1 generation; Б, В — stages of Is1 merogony; Г— merozoite of 1st generation; Д—Ж — meront of 2nd generation; 3—Й — stages of 2nd merogony;
К— merozoite of 2n<i generation; Л, M— gamont: intracellular developmental phases; H— formation of syzygy in the intestinal lumen of the host; О — gametocyst;
П — mature gametocyst with turned out sporoduct; P — oocysts; C — sporozoites releasing.
ТИП SPOROZOA. КЛАСС GREGARINEA
69
рин Mattesia, Farinocystis и Syncystis, эугрегарин рода
Gigaductus (Schrevel, 1968b; Vavra, McLaughlin, 1970;
Ormieres, 1971; Schrevel, 1971b; Ormieres et al., 1972;
Canning, Sinden, 1975; Zizka, 1978b; Massot, Ormieres,
1979; Larsson, 1991). Они покрыты трехмембранной
пелликулой, формирующей микропору и подостлан-
ной продольными субпелликулярными микротру-
бочками. Органеллы апикального комплекса обычно
представлены в полном объеме: есть коноид, поляр-
ные кольца, присутствуют (за исключением Gigaduc-
tus} роптрии и микронемы.
Формирование мерозоитов у архигрегарин на
ультраструктурном уровне не прослежено. У неогрега-
рин Mattesia и Farinocystis микро- и макронуклеарная
мерогония протекает сходно с мерогонией Eimeria-no-
добных кокцидий — способом, традиционно называе-
мым шизогонией (см. главу, посвященную коккциди-
ям). Меронты к моменту мерогонии становится много-
ядерными, вторичные ядра мигрируют к периферии
меронта и мерозоиты образуются путем почкования.
Вначале формируется апикальный комплекс органелл,
затем в почку мигрирует ядро. Плазмалемма меронта
переходит в плазмалемму мерозоитов, а формирова-
ние внутреннего мембранного комплекса связано не с
мембранами цитоплазмы, как у спорозоитов Diplauxis,
а с кольцом электронно-плотного материала, по всей
видимости фибриллярной или гранулярной природы,
расположенным в основании растущей мерозоитной
почки (рис. 29, 2).
У грегарин Gigaductus — единственного рода мо-
нотипического сем. Gigaductidae, близкого к Gregarini-
dae, в жизненном цикле, как уже указывалось, присут-
ствует мерогония двух типов, которые различаются
строением меронтов и способом формирования меро-
зоитов (Ormieres, 1971; Massot, Ormieres, 1979). Она
протекает внутриклеточно в клетках регенерационных
крипт средней кишки хозяина (обычно жужелицы) и
(или) в его мальпигиевых сосудах (рис. 30). Меронты
обоих поколений, как и гамонты, утрачивают апикаль-
ный комплекс и формируют эпимерит, что в корне от-
личает их от меронтов и гамонтов неогрегарин. Ме-
ронты первой генерации покрыты только плазмалем-
мой (рис. 30, А). Согласно Ормье, они и их потомство
лежат непосредственно в цитоплазме, без паразито-
форной вакуоли, что крайне необычно. У Gigaductus
anchi меронт первой генерации продуцирует непо-
средственно мерозоиты. У Gigaductus steropi каждый
меронт распадается вначале на несколько отдельно-
стей — «островков» (меробластов), содержащих по
1—3 ядра (рис. 30,5); эпимерит при этом отбрасывает-
ся. Многоядерные меробласты делятся на одноядер-
ные клетки (рис. 30, В), которые превращаются в меро-
зоиты первой генерации (рис. 30, Г). Эти мерозоиты
имеют грушевидную форму. В их широкой базальной
части содержится ядро. Пелликула формируется толь-
ко в узкой передней части. Из элементов апикального
комплекса есть коноид, тогда как роптрии и микроне-
мы отсутствуют. Мерозоиты проникают в клетки, фор-
мируют эпимерит и превращаются в меронтов второй
генерации, покрытых пелликулой и лежащих в парази-
тофорных вакуолях (рис. 30, Д, Е, Ж). Эти меронты де-
лятся надвое (рис. 30, 3—Й), продуцируя по два меро-
зоита второй генерации, которые, так же как и мерозо-
иты первой генерации, имеют коноид и лишены ропт-
рие-микронемальной системы, но в отличие от них
целиком одеты пелликулой (рис. 30, К). Мерозоиты
мигрируют из выростов в основную кишку, где внед-
ряются в клетки эпителия. Там они вырастают в дефи-
нитивных грегарин — гамонтов (рис. 30, Л, М), кото-
рые выпадают из клеток в просвет кишечника, образу-
ют сизигии (рис. 30, Н) и приступают к гамогонии.
Зрелые гамонты Gigaductus обладают всеми основны-
ми чертами строения септатных эугрегарин — у них
есть эпицит, тело поделено септой на прото- и дейто-
мерит.
Атипичные мерозоиты образуются при мерого-
нии грегариноидных меронтов Ophryocystis. На ульт-
раструктурном уровне изучена мерогония Ophryocystis
schneideri (Ormieres et al., 1978). Строение особей это-
го вида, имеющих куполообразную форму и прикреп-
ленных несколькими выростами к выстилке мальпиги-
евых сосудов хозяина (жука-чернотелки Blaps), уже
было описано в разделе, посвященном трофозоитам. В
процессе мерогонии сначала делятся ядра меронта, а
затем происходит образование борозд по направле-
нию от базы к вершине. В результате образуется не-
сколько дочерних особей, уже прикрепленных к по-
верхности мальпигиевого сосуда. Их строение точно
такое же, как и материнской особи. Типичные мерозо-
иты у Ophryocystis schneideri не обнаружены.
Ультраструктура мерозоитов неогрегарин Schizo-
cystidae, Caulleryellidae и мерозоитов первой («микро-
нуклеарной») мерогонии Ophryocystidae не изучена.
Поэтому вопрос об их типичности или атипичности
остается открытым.
Движение грегарин
Подвижностью обладают гаметы, инвазионные зо-
иты (споро- и мерозоиты) и трофозоиты грегарин. О
движении гамет уже было рассказано выше. Зоиты
грегарин обладают теми же типами движений, что и
зоиты кокцидий — изгибательным и скользящим. Оче-
видно, механизмы этих движений те же, что предпола-
гаются и для кокцидий (Russell, Sinden, 1981; Blood-
good, 1988). Тем не менее, поскольку движение зоитов
грегарин специально не изучалось, данный раздел бу-
дет целиком посвящен движению трофозоитов.
Грегарины — единственная группа споровиков,
большинство представителей которой имеют подвиж-
ную стадию свободного трофозоита-гамонта. Подвиж-
ность может выражаться в пространственном переме-
щении грегарины (локомоции), либо иметь характер
отдельных сокращений или сгибаний тела, не носящих
локомоторный характер. Локомоция необходима гре-
гаринам в первую очередь для образования сизигия,
т. е. для поиска полового партнера. Способ локомоции
трофозоитов-может быть различным. Можно выделить
метаболирующее движение — ундулирующее и пери-
стальтическое (Серавин, Фролов, 1983) — и скользя-
щее движение.
Ундулирующее движение за счет активных пери-
одических изгибаний тела свойственно в первую1 оче-
редь трофозоитам архигрегарин Selenidiidae — это
единственный вид подвижности, которым они облада-
70
ALVEOLATA
(промежуточный ф-т/микротрубочка)
2 3
Рис. 31. Движение грегарин.
1 — основные типы движения (а, б — перистальтическое движение Monocystis, в — ундулирующее движение Selenidium, г — скользящее движение Gregari-
na в суспензии частичек туши); 2 — конформации эпицитарных гребней Eugregarinida в процессе скользящего движения (а — ундуляпня гребней Lecudina
pellucida, б — временные вздутия, перемещающиеся вдоль гребней Gregarina garnhami)', 3 — схема, иллюстрирующая гипотезу Кинга о возможном меха-
низме скользящего движения: рецепторы субстрата (ре), плавающие в плазмалемме (пм) взаимодействуют с молекулами миозина (л*), которые прикрепля-
ются к актиновым филаментам (акф), ассоциированным с внешней поверхностью внутреннего мембранного комплекса пелликулы (вмк). Возможно сущест-
вование трансмембранных связок (тс), соединяющих актиновые филаменты с внутренними фибриллярными образованиями (апикальными филаментами
или микротрубочками), что придает всей структуре дополнительную жесткость. В результате АТФ-зависимой конформации молекул миозина (как при мы-
шечном сокращении) происходит перемещение связанных с рецепторами частичек субстрата (пунктирная линия). Стрелкой обозначено направление дви-
жущей силы. (I, а, б, в — по: Roskin, Lewinson, 1929; I, г — по: Schewiakoff, 1894; 2, а— по: Vivier, 1968; 2, б — по: Mackenzie, Walker, 1983; 3 — по: King,
1988).
Fig. 31. Movement of gregarines.
I — main types of movement (a, 6—peristaltic movement of Monocystis, в — binding movement of Selenidium, г — gliding movement of Gregarina in the slip of Chi-
naink particles); 2 — conformations of epicytic folds in Eugregarinida (a — undulation of epicytic folds of Lecudina pellucida, 6 — temporary vesicles moving along
epicytic folds of Gregarina garnhami); 3 —diagram illustrating a hypothesis about presumable mechanism of gliding movement (King, 1988): embedded in the plasma
membrane (пм) substrate’s receptors (pc) interact with myosin molecules (ai) that are attaching to actin filaments (акф), probably associated with outer surface of the
cortical cytomembranes (вмк). it is possible there is existence of transmembrane components (me) connecting actin filaments with intracellular fibrils (e. g. apical
12 nm filament or microtubule). This makes the entire structure more rigid. The result of ATP-depended conformational changes of myosin molecules (as in case of
muscle contraction) is relocation of substrate particules linked to receptors (dotted line). Drawing force is marked by arrow.
ТИП SPOROZOA. КЛАСС GREGARINEA
71
ют (рис. 31,/, в). Движения Selenidiidae описываются в
литературе как раскачивание (маятникоообразное или
пендулярное движение), скручивание—раскручивание
и «нематоидное» движение. Шревель с соавт. (Schrevel
et al., 1974а) при помощи обработки грегарин раство-
рами деполимеризующего микротрубочки реагента
(мочевины) показали, что способность к ундулиру-
ющему движению прямо связана с количеством про-
дольных субпелликулярных микротрубочек — чем ме-
ньше в клетке остается микротрубочек, тем слабее и
медленнее изгибания тела. Однако на основании этих
данных нельзя утверждать, что микротрубочки непо-
средственно генерируют движущую силу, — вполне
вероятно, что они по аналогии с кутикулой немйТод,
являющейся антагонистом продольных мышечных
лент, лишь обусловливают выпрямление тела. Способ-
ность к изгибаниям тела возможно связана с присутст-
вием в кортексе архигрегарин актино- и миозинопо-
добных белков, которые обнаружены при помощи
иммунофлуоресцентных методов (Ghazali et al., 1989;
Ghazali, Schrevel, 1995).
Трофозоиты некоторых эугрегарин также иногда
способны к сгибанию тела, подчас довольно резкому.
Эти движения, однако, нерегулярные и представляют
собой пример подвижности, не приводящей к переме-
щению грегарины.
Перистальтическое движение, иногда не совсем
верно называемое также «эвгленоидным» (Grasse,
1953; Серавин, Фролов, 1983), свойственно в основном
эугрегаринам, обитающим в целоме и его производ-
ных. Таковы, например, некоторые Urosporidae — па-
разиты полихет и иглокожих (LJrospora longissima, Li-
thocystis schneideri й др.). Наиболее характерен этот
тип движения для представителей сем. Monocystidae
(Фролов, 1991). У крупных удлиненных Nematocystis
й Monocystis, обладающих червеобразной формой
тела, локомоция сопровождается прохождением по
телу перистальтических волн в направлении, проти-
воположном вектору (рис. 31, 1, а, б). Для округлых
трофозоитов Apolocystis и Zeylanocystis характерно
возникновение циклических волн. У блюдцевидных
трофозоитов Zeylanocystis быстрое прохождение цик-
лйческих волн по телу вызывает биение расположен-
ных по краю цитопилей, в результате чего движущаяся
грегарина становится похожа на вращающуюся шес-
теренку (Sathananthan, 1977). Наконец, у некоторых
Monocystidae вся подвижность заключается в способ-
ности время от времени медленно менять форму тела.
У части моноцистид описано также изгибание или рас-
качивание тела. Метаболирующее движение моно-
цистид обеспечивается, по-видимому, системой кор-
тикальных мионем, описанной в разделе, посвящен-
ном морфофункциональной организации трофозоитов.
Утрата моноцистидами скользящего движения и пе-
реход к метаболии, вероятно, связаны с их парази-
тизмом в семенных мешках олигохет, заполненных
вязким содержимым (Серавин, Фролов, 1983; Фролов,
1991).
Скользящее движение грегарин. Большинство
представителей отряда Eugregarinida обладают особым
типом локомоции — так называемым «скользящим
движением». Скольжение грегарин представляет со-
бой однонаправленное движение без изменения фор-
мы клетки по отношению к ее передне-задней оси.
Скорость передвижения при этом невелика — так, у
представителей рода Gregarina она составляет порядка
1—10 мкм/с (King, 1981; King et al., 1986).
В то время исследователи придерживались выска-
занной В. Т. Шевяковым (Schewiakoff, 1894) гипотезы
о том, что грегарина движется за счет выделяемой на-
зад слизи, образующей колонну. Слизь застывает и вы-
талкивает грегарину вперед, наподобие того как стре-
ляют вишневой косточкой, сдавливая ее пальцами.
Данное предположение основывалось на том, что тро-
фозоит, движущийся в жидкости с добавлением туши,
оставляет за собой след, свободный от ее частичек
(рис. 31, /, г). Другой русский исследователь, Соколов
(Sokolow, 1912), также связывает движение грегарин с
выделением слизи, но считает его реактивным. Экспе-
рименты по изучению разрезанных трофозоитов круп-
ных грегарин показали, впрочем, что их отдельные
фрагменты также способны к скольжению, а следова-
тельно, в генерировании движения участвует вся по-
верхность клетки, а не только ее задняя часть (Leger,
Duboscq, 1909; Dembowski, 1913).
С развитием электронно-микроскопических мето-
дов исследования большинство исследователей начало
склоняться к мысли о главенствующей роли корти-
кальных структур в механизме скользящего движения
грегарин. Кюммель (Kummel, 1957), изучив движение
мелких частичек по поверхности грегарин, считал ло-
комоцию грегарин не связанной ни с выделением сли-
зи, ни с действием каких-либо глубоко лежащих струк-
тур (мионем). Движение, по мнению этого автора, ана-
логично таковому у брюхоногих моллюсков и связано
с сокращениями тонкого фибриллярного материала,
подстилающего внутренюю мембрану.
Вивье (Vivier, 1968) на основании изучения в элект-
ронном микроскопе поперечных срезов Lecudina pellu-
cida высказал предположение о существовании унду-
ляции эпицитарных гребней и их локомоторной функ-
ции (рис. 31, 2, а). Он предположил существование
трех возможных вариантов движения — плавание
без контакта с субстратом, ползание по субстрату на
извивающихся гребнях и скольжение по субстрату
на прямых гребнях, между которыми находятся более
короткие ундулирующие — они генерируют усилие,
выталкивая жидкость назад. Слизь при этом играет
роль смазки. Вивье также предположил, что унду-
ляцию вызывают обнаруженные им в вершинах греб-
ней апикальные арки и апикальные филаменты. Поз-
же, с помощью сканирующего электронного микро-
скопа, было показано, что гребни грегарин в самом
деле часто волнообразно изогнуты (Vavra, Small, 1969;
Walker et al., 1979, и др.) (рис. 11, Г). Выяснилось так-
же, что для скольжения обязателен контакт поверх-
ности грегарины с субстратом — во взвешенном со-
стоянии движение отсутствует (Mackenzie, Walker,
1983).
Объяснение скользящего движения грегарин дина-
мическими изменениями конформации эпицитарных
гребней в настоящее время является наиболее рас-
пространенным. Такая точка зрения в общем согласу-
ется с прижизненными наблюдениями над Gregarina
garnhami, показавшими, что скольжение грегарины по
стеклу сопровождается продольным перемещением
72
ALVEOLATA
мелких периодических вздутий гребней в зоне контак-
та с субстратом (рис. 29, 2, б) (Mackenzie, Walker,
1983). Волнообразные изгибания гребней при этом,
однако, не выявлены. Причины, вызывающие измене-
ния конформации гребней, точно неизвестны. До сих
пор одним из наиболее вероятных предположений яв-
ляется следующее: существует взаимодействие между
апикальными арками, апикальными филаментами и
внутренним мембранным комплексом пелликулы,
приводящее к сдвигу последнего относительно плаз-
малеммы в продольном направлении и, как следствие,
к временной деформации гребня (Mackenzie, Walker,
1983; Puytorac et al., 1987). Механизм предполагаемого
взаимодействия, однако, неясен. Возможно, в этом
процессе каким-то образом участвуют белки акти-
но-миозинового комплекса, ассоциированные у эугре-
гарин в том числе и с кортикальными структурами
(Baines, King, 1989; Ghazali et al., 1989; Ghazali,
Schrevel, 1993, 1995).
Существуют и альтернативные объяснения движу-
щей силы скользящей локомоции, в основе которых
лежит гипотеза о существовании белков-транслокато-
ров, связанных, с одной стороны, с какой-либо корти-
кальной фибриллярной структурой в клетке, а с другой
стороны — с трансмембранным белком-рецептором
субстрата (Bloodgood, 1988; King, 1988). Бладгуд, изу-
чив скользящее движение Chlamydomonas reinhardtii,
предлагает универсальный для всех протистов меха-
низм на основе подвижного транслокатора типа дине-
ина или кинезина, ассоциированного с продольными
микротрубочками, которые лежат под плазмалеммой.
Кинг в своей теоретической модели предлагает в каче-
стве транслокатора миозин, а в качестве фибриллярно-
го «основания» — актиновый филамент, возможно
входящий в состав апикальной арки и связанный до-
полнительными трансмембранными сшивками с апи-
кальным (12 нм) филаментом либо с продольной мик-
ротрубочкой (рис. 31, 3). Обе эти гипотезы сходны по
своей сути и претендуют на универсальное объяснение
скользящего движения как у трофозоитов грегарин,
так и у инфекционных стадий (спорозоитов и мерозои-
тов) всех споровиков. Гипотеза Бладгуда, однако, не
подходит для трофозоитов эугрегарин, поскольку они
покрыты сплошной трехмембранной пелликулой, и
вдобавок контактирующие с субстратом вершины
гребней лишены микротрубочек.
Из гипотез Кинга и Бладгуда следует, в частности,
что структура поверхности не должна играть большой
роли в способности к скользящему движению. В ре-
альности же способ движения грегарин находится в
тесной связи с организацией эпицита. Так, архигрега-
рины, лишенные эпицитарных гребней, способны к
ундулирующему движению, но не к скользящему. На-
против, у эугрегарин, обладающих скользящим движе-
нием, эпицит хорошо развит и имеет более или менее
одинаковое строение. Важная роль эпицитарных греб-
ней в движении грегарин косвенно подтверждается
и тем, что у эугрегарин, приобретших взамен сколь-
зящего иной тип движения либо вовсе неподвиж-
ных, строение эпицита подвергается сильным моди-
фикациям. Примерами могут служить обладающие
метаболирующим движением представители сем. Mo-
nocystidae, а также грегарины Diplauxis и Trichorhync-
hus, об особенностях строения которых говорилось
в разделе, посвященном морфофункциональной орга-
низации трофозоитов.
Питание грегарин
Способы питания грегарин точно не установлены, а
механизмы не изучены. Косвенные данные указывают
на то, что важную роль в поглощении питательных ве-
ществ играют прикрепительные приспособления. Так,
мукрону Selenidium, как уже говорилось, на основании
особенностей ультраструктуры приписывается функ-
ция, сходная с таковой цитостом-цитофарингеального
комплекса других протистов. Предполагается, что гре-
гарина втягивает через окруженный коноидом проток
мукрональной вакуоли цитоплазму клетки хозяина, а
на поверхности самой мукрональной вакуоли про-
исходит процесс пиноцитоза (Schrevel, 1968а, 1971а).
Согласно нашим собственным данным, полученным
при исследовании трофозоитов Selenidium orientate,
проток мукрональной вакуоли может отсутствовать
(рис. 12, А). Если исходить из верности гипотезы Шре-
веля, то это можно объяснить лишь периодичностью
процесса питания трофозоита, т. е. тем, что цитоплаз-
ма хозяина заглатывается порциями. По всей видимо-
сти, каждая из крупных пищеварительных вакуолей в
переднем конце Selenidium hollandei заключает в себе
такую порцию. Таким образом, судя по всему, каждый
раз во время очередного «приема пищи» проток и мук-
рональная вакуоль формируются заново. Способ пита-
ния Selenidium можно охарактеризовать как периоди-
ческий мизоцитоз при постоянном прикреплении к ис-
точнику пищи. Помимо мизоцитоза для архигрегарин
предполагается и питание через микропоры, также как
у эугрегарин (см. ниже).
Питание большинства эугрегарин, согласно наибо-
лее распространенному мнению, происходит в основ-
ном через поверхность клетки, несмотря на наличие
трех мембран. Предполагается, что этот способ реали-
зуется благодаря многочисленным микропорам (Vivi-
er, 1968). Действительно, эксперименты по инкубации
грегарин в растворах меченых аминокислот, углеводов
и нуклеотидов выявили определенные места, в кото-
рых, по-видимому, происходит проникновение этих
веществ в клетку (Schrevel, Dhainaut, 1968; Schrevel,
Fouquet, 1968; Vivares, Van Wormhoudt, 1976). Тем не ме-
нее этот вопрос требует дальнейших исследований.
Ряд исследователей приписывает функцию пита-
ния прикрепительным приспособлениям эугрега-
рин — «мукронам» и эпимеритам (Devauchelle, 1968а;
Schrevel, 1968а; Tronchin, Schrevel, 1977). В пользу
этого предположения говорят такие факты, как при-
сутствие большого количества рибосом и митохонд-
рий в прикрепительных приспособлениях эугрегарин,
что свидетельствует об их высокой метаболической
активности, а также то, что эти структуры покрыты
только одной мембраной — это делает принципиально
возможным питание путем мембранного транспорта.
Показано, кроме того, что у трофозоитов Gregarina
blaberae преждевременная утрата эпимерита, вызван-
ная процессами, которые связаны с линькой хозяина,
приводит к стойкой задержке роста — такие особи ни-
ТИП SPOROZOA. КЛАСС GREGARINEA
>4
когда не достигают размеров, нормальных для грега-
рин этого вида (Tronchin et aL, 1986). По мнению Трон-
шена и Шревеля, питание через эпимерит происходит
за счет мембранного транспорта, а необходимую для
этого энергию обеспечивают многочисленные здесь
митохондрии. Также путем мембранного транспорта
питаются, по-видимому, внутриклеточные неогрега-
рины и внутриклеточные стадии развития многих эуг-
регарин, лежащие в паразитофорных вакуолях. Неко-
торые такие эугрегарины (Ascogregarina, Schneideria,
Gigaductus), как уже говорилось, будучи ни к чему не
прикрепленными, тем не менее формируют эпимерит,
который, как приходится предположить, играет здесь
настолько существенную роль в питании трофозоитов,
что без него нельзя обойтись. Следует заметить, что
инвагинацию клетки хозяина, в которой находится
эпимерит внеклеточного трофозоита, можно также
рассматривать как не до конца сформированную па-
разитофорную вакуоль, изолированную от внешней
среды «кольцом прикрепления» в основании эпиме-
рита.
О важной роли зоны контакта паразита и хозяина в
процессе питания говорят эксперименты МакМиллана
(MacMillan, 1973b) с грегариной Nematocystis magna
(Monocystidae), паразитом дождевого червя Lumbricus
terrestris. Оказалось, что при впрыскивании меченой
[3Н] глюкозы в кишечник хозяина через 10 мин метка
появляется как в грегарине, так и в клетках семенного
мешка, к которым она прикреплена выростами эпици-
тарных гребней, тогда как в омывающей паразита жид-
кости метка отсутствует.
Как показано на примере Gregarina blaberae, рост
гамонтов тем не менее не прекращается после утраты
эпимерита и продолжается некоторое время даже по-
сле образования сизигиев (Tronchin et al., 1986). Авто-
ры по не очень понятным причинам предполагают, что
это происходит в основном за счет расходования части
запасенного амилопектина, хотя вероятнее, что как раз
здесь основное значение приобретает питание через
микропоры.
Наконец, для некоторых грегарин указан фагоци-
тоз, хотя эти данные, по определенным причинам, не
кажутся абсолютно достоверными. Так, Тюзе и Лю-
батье отмечают (на светооптическом уровне), что не-
которые Monocystidae способны заглатывать амебоци-
ты хозяина (Tuzet, Loubatieres, 1946, 1948; Loubatieres,
1955), несмотря на трехмембранную пелликулу.
У своеобразной грегарины Filipodium ozakii, паразити-
рующей в кишечнике сипункулиды Siphonosoma кита-
nense, на ультраструктурном уровне показан фагоци-
тоз цитоплазмы хозяина в зоне контакта (Hoshide,
Todd, 1992). По данным Хосиде и Тодда, в процессе
фагоцитоза происходит инвагинация всех трех мемб-
ран пелликулы, что по современным представлениям
является крайне необычным (см. также характеристи-
ку рода Filipodium).
Большинство грегарин живет в условиях недостат-
ка кислорода, и по этой причине они являются в боль-
шей или меньшей степени анаэробами. С этим, в част-
ности, вероятно, связано слабое развитие митохондрий
(за исключением митохондрий эпимерита септатных
грегарин). Метаболизм грегарин, по всей видимости,
основан на гликолитическом расщеплении амилопек-
тина, накапливающегося в цитоплазме в огромном ко-
личестве, хотя в эпимеритах септатных грегарин на
стадии прикрепленного трофозоита, возможно, замет-
ную роль играет и окислительное фосфорилирование
(Tronchin, Schrevel, 1977).
Паразито-хозяинные отношения
Пути заражения хозяев. Основной путь попада-
ния грегарин в организм хозяина — алиментарный. За-
ражение наступает при поедании'хозяевами пищи, за-
грязненной зрелыми (спорулированными) ооцистами.
Выход спорозоитов из ооцисты инициируется дейст-
вием кишечных соков. Дальнейшее поведение спо-
розоитов зависит от дефинитивной локализации па-
разита. Соответственно в большинстве случаев они
продолжают свое развитие в кишечнике или его произ-
водных (дивертикулы, печеночные выросты, мальпи-
гиевы сосуды, регенерационные крипты). У грегарин,
паразитирующих в полости тела и внутренних органах
и не имеющих отношения к пищеварительной систе-
ме, спорозоиты, по видимому, совершают миграцию
сквозь стенку кишечника в полость тела. Оттуда они
попадают в место своего окончательного паразитиро-
вания (стенки полости тела, кровеносная система, го-
нады, семенные мешки олигохет, жировое тело насе-
комых и т. п.). Пути и механизмы миграции спорозои-
тов не изучены.
В случае внекишечной локализации у грегарин воз-
никают также трудности с выводом ооцист во внеш-
нюю среду. Они преодолеваются различными путями.
Большинство из этих способов связаны с нарушением
целостности покровов хозяина в. результате его трав-
мы или гибели. Так, один из возможных путей распро-
странения грегарин сем. Monocystidae — частые по-
вреждения их хозяев, олигохет, в результате нападе-
ний хищников. В результате во внешнюю среду
попадает часть целомической жидкости, содержащей
ооцисты (Фролов, 1991). Другой возможный путь рас-
пространения — прохождение сквозь кишечник хищ-
ника (Pfeiffer, 1891; Хейсин, 1948). Действительно, в
помете некоторых мелких млекопитающих, поедаю-
щих олигохет, в частности таких как землеройки-бу-
розубки (Sorex) и полевки (Clethrionomys), обнаружи-
ваются ооцисты этих грегарин (Bull et al., 1998). Пока-
зано также, что отдельные ооцисты могут выводиться
с полостной жидкостью через целомические и нефри-
диальные поры олигохет. Гипотеза о выводе ооцист из
организма хозяина вместе с семенной жидкостью во
время копуляции не находит своего подтверждения,
поскольку ооцисты никогда не обнаруживаются в се-
мяприемниках червей (Фролов, 1985).
Одним из возможных вариантов заражения внеки-
шечными грегаринами может быть каннибализм, час-
то наблюдающийся, например, у насекомых: личинок
стрекоз, тараканов и др.
В некоторых достаточно редких случаях гибель хо-
зяина может вызываться самими грегаринами. Это
имеет место, как правило, у неогрегарин — паразитов
жирового тела и некоторых других органов насеко-
мых, которые способны резко увеличивать интенсив-
ность инвазии с помощью мерогонии (см. ниже о вли-
74
ALVEOLATA
янии грегарин на хозяев). У неогрегарины Farinocystis
tribolii вдобавок к мерогонии отмечен еще один способ
увеличения инвазии — аутоинфекция. При этом спо-
рогония протекает внутри хозяина и часть ооцист
вскрывается на месте (Zizka, 1972).
Специфичность по отношению к хозяину. Мно-
гие таксоны грегарин Приурочены к определенным
группам хозяев. Таковы, например, Monocystidae, па-
разитирующие исключительно в малощетинковых
червях (Oligochaeta), Enterocystidae из личинок поде-
нок (Ephetheroptera). Представители сем. Cephaloido-
phoridae паразитируют в кишеЧнике ракообразных, а
Dactylophoridae — в губоногих многоножках (Chilopo-
da). Многие семейства септатных грегарин и все нео-
грегарины паразитируют в насекомых.
Однако в некоторых других случаях такая стро-
гая привязанность не наблюдается. Так, в сем. LecUdi-
nidae есть паразиты полихет (Lecudina), турбеллярий
(Monocystella), асцидий (Lankesteria), личинок кома-
ров (Ascogregarina) и некоторых других групп бес-
позвоночных. Правда, в данном конкретном случае та-
кой разброс можно объяснить явно сборным характе-
ром этого семейства. Для некоторых же других групп,
например сем. Urosporidae, представители которого
паразитируют в полихетах, иглокожих и моллюсках,
подобное объяснение не подходит. Еще более не-
обычным выглядит распределение по хозяевам у архи-
грегарин: представители рода Selenidium паразити-
руют преимущественно в «седентарных» полихетах
и никогда не встречаются в полихетах «эррантных»
(отряды Phyllodocida и Eunicida), но При этом несколь-
ко видов описано из сипункулид и даже кишечноды-
шащих.
Рис. 32. Распределение трех видов Gregarina в кишечнике мучного
червя (Tenebrio molitor) в зависимости от pH. (По: Gohre, 1943;
Clopton et al., 1991).
Fig. 32. Distribution of three Gregarina species in the gut of meal worm
(Tenebrio molitor) depending on intestinal pH.
Видовая специфичность большинства грегарин по
отношению к своим хозяевам, согласно общепринято-
му мнению, довольно узкая. Это находит свое отраже-
ние, в Частности, и в диагнозах видов. Действительно,
грегарины Gonospora arenicolae из полихет рода Areni-
cola (пескожилы) никогда не обнаруживаются в широ-
ко распространенном виде Arenicola marina, но, напро-
тив, паразитируют в A. ecaudata, имеющем довольно
ограниченное распространение (Schrevel, Philippe,
1993). В двух близких видах полихет из рода Capitella
паразитируют разные виды грегарин — один из них
принадлежит к роду Апсога, а другой — к роду Lecudi-
na (Wagenbach et al., 1983). Эксперименты по зараже-
нию грегариной Metamera sillasenorum трех разных
видов пиявок показали ее узкую специфичность по от-
ношенью лишь к одному из них — Helobdella triseria-
lis (Wise et al., 2000). Исследование специфичности
9 видов септатных грегарин по отношению к 8 видам
жуков-чернотелок (Tenebrionidae) также показало, что
дна довольно высока (Patil et al., 1985). При этом оказа-
лось, что у 5 видов паразитов наблюдается выход спо-
розоитов из ооцист в кишечниках всех 8 видов насеко-
мых, но дальнейшее развитие наступает лишь в естест-
венном хозяине.
Различные виды и даже роды грегарин могут пара-
зитировать в Одном и том же хозяине. Так, в мучных
червях — личйкаХ Мучного хрущака Tenebrio molitor
живут 3 вида рода Gregarina: Gregarina polymorpha, G.
cuneata и G. steini. Их локализация приурочена к опре-
делённым участкам кишечника (рис. 32), что связано,
вероятно, с различиями в кислотности (Gohre, 1943).
Во взрослых жуках эти грегарины не встречаются, но
там Паразитирует еще один вид этого рода — G. nip-
handrodes. Эксперименты Но перекрестному зара-
жению показали строгую специфичность паразитов
Tenebrio molitor к стадйй развития хозяина (Clopton
et al., 1992). Сходным образом в хищных личинках
жуков-водолюбов (Hydrophylidae) живут грегарины из
родов AcanthOspora, Ancyrophora и Cometoides (сем.
Actinocephalidae)-, тогда как в растительноядных имаго
паразитируют Enterocystis (EnterOcystidae) и Gregarina
(Gregarinidae) (Baudoin J., M'aillard, 1972). Во всех этих
случаях мы сталкиваемся со специфичностью йо отно-
шению к стадии развития хозяина.
Однако не все грегарины проявляют столь строгую
специфичность По отйоШейию к своим хозяевам. На-
пример, Gregarina garnhami паразитирует в двух видах
саранчи перелетной (Locusta migratoria) и пустын-
ной (Schistocerca gregaria). При помощи анализа дан-
ных, полученных Методом гель-электрофореза белков
пелликулы, показано полное сходство обеих Популя-
ций (Philippe et al., 1982). Существуют й другие виды
грегарин, описанные из нескольких хозяев. Таковы Le-
cudina pellucida, Gregarina blattarum. В последнем
случае, правда, речь может идти о комплексе видов-
двойников, поскольку, например, ооцисты из тарака-
на-пруссака Blatella germanica не являются инвази-
онными для остальных четырех видов Тараканов, в ко-
торых отмечена эта грегарина (Clopton, Gold, 1996).
Напротив, Ascogregarina («Lankesteria») culicis из маль-
пигиевых сосудов личинок комаров Aedes aegypti в
условиях лабораторного заражения способна парази-
тировать и в личинках других видов комаров сем. Culi-
ТИП SPOROZOA. КЛАСС GREGARINEA
75
cidae — A. epactius, A. solicitans, A. stimulans, A. vexans,
Culiseta ornata и Psorophora columbiae (Walsh, Olson,
1976). Однако в природе эти насекомые не заражены
грегаринами, что может быть связано с условиями
обитания личинок, не способствующими заражению
грегаринами данного вида (слишком большой объем
воды, экстремальные для грегарин температуры). Тем
не менее эти данные ставят под сомнение сложившую-
ся практику описания новых видов грегарин из рода
Ascogregarina и из некоторых других родов по принци-
пу «новый хозяин — новый вид». Таким образом, во-
прос о строгой видоспецифичности паразитизма грега-
рин требует дальнейших исследований.
Согласованность жизненных циклов грегарин и
их хозяев. Грегарины являются высокоспециализи-
рованными паразитами. Это выражается, в частности,
в тесной корреляции их жизненных циклов и жизнен-
ных циклов хозяев, а также, как правило, в отсутствии
ярко выраженного негативного воздействия на орга-
низм хозяина. В развитии грегарин и их хозяев обычно
наблюдаются согласованность и синхронизм, помо-
гающие паразиту в прохождении своего жизненного
цикла.
Уже длительное время известны корреляции между
жизненными циклами целомических грегарин и их хо-
зяев — морских многощетинковых червей (Polychae-
ta). На протяжении большей части времени грегарины
представлены вегетативными формами и приступают
к гамо- и спорогонии лишь в период размножения хо-
зяина, одновременно с началом формирования его га-
мет. Во внешнюю среду ооцисты попадают во время
нереста, вместе с половыми продуктами червя. Такие
взаимоотношения описаны у многих грегарин из поли-
хет и их хозяев: Urospora longissima из Dodecaceria са-
ulleryi (Caullery, Mesnil, 1898b), Gonospora varia из
Audoinia (-Cirriformia) tentaculata, G. arenicolae из
Arenicola ecaudata (Hentschel, 1926, 1930). Грегарины
Diplauxis hatti из Perinereis cultrifera, заражение кото-
рыми происходит еще на стадии личинки, почти не
растут в течение 2 лет и 8 мес — до наступления пери-
ода полового созревания хозяина. С наступлением на-
чала сексуализации грегарины резко увеличиваются в
размерах и приступают к образованию гаметоцист.
Зрелые ооцисты готовы к выходу во внешнюю среду к
тому моменту, когда хозяин выметывает свои гаметы
во время брачного танца (Durchon, Vivier, 1961, 1964;
Schrevel, Philippe, 1993).
Длительность жизненного цикла кишечных грега-
рин насекомых может зависеть от продолжительности
периода между линьками хозяина. Так, было показано,
что утрата эпимеритов трофозоитами Gregarina blabe-
rae из кишечника таракана Blaberus craniifer связана с
процессами новообразования кишечного эпителия,
предшествующими линьке. В случае эксперименталь-
ного заражения грегаринами новорожденных личинок
(длительность стадии до первой линьки в лаборатор-
ных условиях — 21 день) свободные трофозоиты появ-
лялись за 1 или 2 дня до линьки, а первые сизигии —
через день после нее, уже на второй личиночной ста-
дии, длительность которой — 22 дня. Первые гамето-
цисты регистрировались на 32-й день после заражения,
и еще три дня требовалось на споруляцию. Весь цикл
Gregarina blaberae, таким образом, занимает 35 дней
(Tronchin et al., 1986). Gregarina garnhami из саранчи
Locusta migratoria проходит весь цикл за 12 дней, в то
время как хозяину требуется для развития 40 дней. За
это время насекомое проходит через 4 личиночные
стадии (Corbel, 1964), т. е. в нем может смениться 4 по-
коления грегарин. Как уже говорилось, у насекомых с
полным превращением грегарины, паразитирующие в
личинках, не переходят в имаго. Завершение жизнен-
ного цикла паразитов наступает на последней личиноч-
ной стадии или на стадии куколки (Grasse, 1953).
Высокая степень корреляции жизненных циклов
паразита и хозяина объясняется, вероятно, воздействи-
ем гормонов хозяина на грегарин. Это влияние было
показано в ходе экспериментов По изучению стимули-
рующего действия церебрального гормона, вызыва-
ющего сексуализацию полихеты Perinereis cultrifera,
на развитие паразитирующей в ней грегарины Diplau-
xis hatti (Durchon, Vivier, 1961, 1964). В случае кишеч-
ных грегарин насекомых определенную роль, вероят-
но, играет гормон линьки — экдизон. Так, инъекция
экдизона в хозяина (Trichosia pubescens) вызывает вы-
ход внутриклеточных трофозоитов грегарины Schnei-
deria schneiderae из клеток в просвет кишечника с по-
следующим образованием сизигиев (Malavasi et al.,
1976). Однако сходные эксперименты с G. blaberae в
Blaberus craniifer не позволяют сделать столь одно-
значные выводы (Schrevel, Philippe, 1993).
Воздействие грегарин на своих хозяев может
проявляться различным образом. В случае внутрикле-
точного развития трофозоиты грегарин лежат в клетке
хозяина, как правило, внутри паразитофорной вакуо-
ли, хотя меронты первой генерации Gigaductus steropi
и их потомство развиваются непосредственно в цито-
плазме. Внутриклеточные стадии развития эугрегарин
вызывают по мере своего роста гипертрофию клетки
хозяина. В дальнейшем клетка дегенерирует и гибнет.
Гипертрофия клетки хозяина сопровождается измене-
ниями в строении ее цитоплазмы и ядра. Так, цито-
плазма клетки кишечного эпителия асцидии Ciona in-
testinalis, содержащей трофозоит Lankesteria ascidiae,
по мере роста паразита становится прозрачной, а ядро
уплощенным, принимая форму шапочки (Siedlecki,
1901). В цитоплазме клеток, содержащих ранние ста-
дии развития моноцистид рода Nematocystis, напротив,
развиваются многочисленные фибриллы (Hesse, 1909;
Loubatieres, 1955).
На ультраструктурном уровне показано, что внут-
риклеточные трофозоиты эугрегарины Schneideria
schneiderae вызывают существенные изменения в
строении и относительном количестве цитоплазмати-
ческих органелл в клетке хозяина Trichosia pubescens
(Diptera: Sciaridae). Различия в строении цитоплазмы
нормальных и зараженных клеток увеличиваются по
мере роста и развития паразита. Цистерны ЭПР прини-
мают форму пузырьков, матрикс митохондрий стано-
вится более электронно-плотным, увеличивается чис-
ло рибосом. Одновременно происходит гипертрофия
хромосом в ядре клетки хозяина — хромосомы, в нор-
ме политенные, разрастаются до гигантских размеров,
а затем расслаиваются на отдельные фибриллы. Га-
монты Schneideria schneiderae дорастают внутри кле-
ток хозяина до зрелого состояния и, выходя наружу,
сразу образуют сизигии (da Cunha, Jurand, 1978).
76
ALVEOLATA
В случае внеклеточного паразитизма гипертрофии
клетки хозяина, к которой прикрепился трофозоит
грегарины, не происходит. Реакция хозяина на присут-
ствие паразита выражается в изменении структуры ци-
топлазмы клетки, причем эта реакция гораздо более
сильная на прикрепительные приспособления асептат-
ных грегарин, чем на эпимериты септатных. В первом
случае цитоплазма хозяина становится более элект-
ронноплотной, она сильно вакуолизирована и может
содержать большое количество фибриллярных струк-
тур, тянущихся через всю клетку от зоны контакта до
базальной мембраны эпителия (Schrevel, Vivier, 1966;
Ouassi, Porchet-Hennere, 1978). Эпимериты септатных
грегарин, напротив, обычно не оказывают столь замет-
ного воздействия на клетку хозяина. Изменения в
структуре цитоплазмы выражаются чаще всего в появ-
лении небольшого количества миелиноподобных
структур (Devauchelle, 1968а; Baudoin J., 1969; Tron-
chin, Schrevel, 1977).
На организменном уровне реакция хозяина на при-
сутствие паразита не всегда отчетливо выражена. Так,
гаметоцисты целомических грегарин — Urosporidae и
Monocystidae, как правило, подвергаются атаке амебо-
цитов, которые в итоге формируют непрерывный слой
на их поверхности (Leger, 1897; Hesse, 1909; Martinucci
et al., 1981; Фролов, 1991). Такая дополнительная обо-
лочка, однако, вовсе не препятствует вскрытию гаме-
тоцист, поэтому подобную реакцию можно назвать за-
щитной лишь условно.
Присутствие грегарин в организме хозяина обычно
не вызывает серьезных последствий, за исключением
очень сильной инвазии. В этих случаях у хозяев могут
наблюдаться кишечные расстройства различной степе-
ни тяжести, вплоть до воспаления кишечника (Leger,
1899; Lipa, 1967; Ball et al., 1995). Разрушение стенки
кишечника в свою очередь может приводить к сепсису
и гибели хозяина, как это происходит у личинок и ку-
колок комаров сем. Culicidae, зараженных Ascogregari-
па culicis (Mourya, Soman, 1985). Следует заметить, что
массовая гибель личинок и куколок (до 86 %) наблю-
дается лишь у неспецифических хозяев в условиях экс-
периментального заражения, тогда как гибель молоди
естественного хозяина Aedes aegypti не превышает 3 %
(Walsh, Olson, 1976).
Грегарины рода Nematopsis (сем. Porosporidae) при
очень сильной инвазии промежуточных хозяев — дву-
створчатых моллюсков могут вызывать их ослабление
(нематопсиоз) в результате поражения жабр и даже
приводить к гибели молоди (Найденова, 1990).
Присутствие грегарин в организме хозяина может
отражаться и на его репродуктивных способностях.
Как показано в результате исследований поведения
разных видов сверчков (Zuk, 1987а, 1987b, 1987с; Sim-
mons, 1990; Cade, Cade, 1992; Simmons, Zuk, 1992; Zuk,
1992), грегарины в зависимости от силы инвазии могут
в той или иной степени ослаблять организм самцов.
Это в свою очередь приводит к снижению продукции
сперматофоров и уменьшению длительности и час-
тоты звука брачной песни. В результате самцы, сильно
зараженные грегаринами, имеют меньше шансов на
успешное размножение, чем здоровые или слабо зара-
женные. В отличие от сверчков мощное заражение ан-
тарктического криля (Euphausia superba) кишечными
грегаринами рода Cephaloidophora может приводить к
паразитарной кастрации хозяина (Авдеев, 1985,1987).
Все же в большинстве случаев грегарины в отличие
от кокцидий не вызывают сильной патологии, что свя-
зано в том числе с неспособностью большинства из
них к увеличению интенсивности инвазии путем меро-
гонии. Исключение составляют неогрегарины, особен-
но внутриклеточные. Многие из них вызывают гибель
хозяев из-за обширного лизиса зараженной ткани или
органа. Так, Mattesia geminata поражает гиподерму ли-
чинок муравьев Solenopsis geminata, вызывает урод-
ства при формировании глаз у куколок и их гибель.
В связи с этим данный вид рассматривается как воз-
можное средство биологического контроля над чис-
ленностью интродуцированных на юг США огненных
муравьев Solenopsis richteri и Solenopsis invicta (Jouve-
naz et al., 1981). Возможно также использование нео-
грегарин, таких как Mattesia trogodermae, М. oryzaephi-
li, Farinocystis tribolii и др., для борьбы с амбарными
вредителями. С другой стороны, неогрегарины рода
Apicystis (^Mattesia in part), а также другие грегарины,
паразитирующие в пчелах и шмелях, в принципе могут
наносить некоторый урон сельскому хозяйству (Lipa,
Triggiani, 1992; Гробов, Сотников, 1999).
Симбионты и гиперпаразиты грегарин. В цито-
плазме грегарин иногда содержатся эндосимбиотиче-
ские бактерии и паразиты. Эндосимбиотические бак-
терии были обнаружены с помощью электронного
микроскопа в эндоплазме Gregarina polymorpha (De-
vauchelle, 1967), Schneideria schneiderae (da Cunha, Ju-
rand, 1978) и Gregarina garnhami (Mackenzie, Walker,
1979).
Кроме бактерий в цитоплазме грегарин встречают-
ся микроспоридии. В первую очередь это представите-
ли сем. Metchnikovellidae — специфические паразиты
грегарин (Caullery, Mesnil, 1897,1919; Dogiel, 1922; Vi-
vier, 1965, 1973; Desportes, Theodorides, 1979). Кроме
них в грегаринах отмечены и другие микроспоридии,
такие как Nosema viveri (Vinckier et al., 1970).
Эволюция и филогения
Филогенетические отношения внутри класса Gre-
garinea долгое время оставались неясными, да и сейчас
многие проблемы далеки от своего разрешения. Грега-
рины представляют собой обширную, хорошо очер-
ченную группу, оформившуюся в результате первич-
ной дивергенции общих предков Sporozoa. Их распро-
странение ограничено беспозвоночными хозяевами и
низшими хордовыми, тогда как кокцидии — сестрин-
ская группа грегарин — проникли и в позвоночных,
где дали мощный эволюционный всплеск.
Общие предки грегарин и кокцидий имели, судя по
всему, план строения, сходный с инвазионными зонта-
ми — стадиями жизненного цикла, одинаково устроен-
ными у обеих групп. Такая точка зрения подтвержда-
ется строением гамонтов примитивных архигрегарин
Selenidium и существованием хищных жгутиконосцев
Colpodella (=Spiromonas), вегетативные стадии кото-
рых обладают набором органелл апикального ком-
плекса и трехмембранной пелликулой, образующей
микропоры. Однако в отличие от свободноживущих
ТИП SPOROZOA. КЛАСС GREGARINEA
77
Colpodella происхождение и дальнейшая эволюция
собственно споровиков связаны с переходом к парази-
тическому образу жизни. Колыбелью Sporozoa, по-ви-
димому, следует считать кишечник морских многоще-
тинковых червей (Polychaeta), где можно встретить
представителей, в том числе и примитивных, всех
основных групп споровиков, за исключением сильно
специализированных (неогрегарины, гемоспоридии,
пироплазмы).
В отличие от кокцидий, в большинстве своем внут-
риклеточных, эволюция грегарин пошла по пути при-
способления к внеклеточному паразитизму, что позво-
лило им достигать крупных размеров. Это в свою оче-
редь дало возможность каждой особи продуцировать
большое количество гамет, исчисляемых сотнями, а
наличие в жизненном цикле стадии инцистированного
сизигия — гаметоцисты — обеспечило успешную ко-
пуляцию гамет обоего пола при численно равном их
производстве. В результате всего лишь два гамонта
дают начало достаточному для успешного заражения
нового хозяина количеству спорозоитов. У кокцидий
же внутриклеточный паразитизм наложил ограниче-
ния на формирование крупных особей. Число макрога-
мет, которым определяется количество инвазионных
стадий «на выходе», возрастает у них в процессе меро-
гонии. Пространственная разобщенность гамонтов,
кроме того, требует избыточного количества микрога-
мет, что достигается как умножением числа микрога-
монтов путем мерогонии, так и «сперматизацией» са-
мих гамет, что позволяет микрогамонту увеличить их
продукцию без увеличения собственных размеров. Та-
ким образом, у грегарин в отличие от кокцидий до-
статочная численность будущих инвазионных стадий
достигается в процессе гаметогенеза, а не посредством
мерогонии, что повлекло за собой утрату последней в
большинстве случаев. Следует заметить, правда, что
для эффективного функционирования такого механиз-
ма воспроизводства необходима определенная степень
подвижности гамонтов либо их высокая концентра-
ция. Так, у малоподвижных и неподвижных неогрега-
рин мерогония из жизненного цикла не исчезает. Кро-
ме того, мерогония у многих неогрегарин компенсиру-
ет относительно небольшое количество формируемых
ооцист. Следует отметить также значительное кон-
вергентное сходство внутриклеточных неогрегарин с
кокцидиями (Larsson, 1991), что можно объяснить
сходной эволюционной специализацией.
В закреплении стадии сизигия и уменьшении роли
мерогонии в жизненном цикле грегарин кроется, воз-
можно, и основная причина «запрета» на паразитизм в
позвоночных хозяевах, обладающих в большинстве
случаев крупными размерами. Действительно, можно
предположить, что вероятность встречи двух гамонтов
при малой степени зараженности в относительно боль-
шом объеме кишечника позвоночного животного
очень невелика. В то же время в случае мелкого бес-
позвоночного хозяина, просвет кишечника которого
сопоставим по величине с размерами гамонтов грега-
рин, вероятность встречи резко возрастает, даже если
там находится всего несколько паразитов.
Неясно, связано ли появление стадии сизигия в
жизненном цикле грегарин только с их крупными раз-
мерами, обусловленными внеклеточным паразитиз-
мом, или такой вариант гаметогонии был унаследован
ими от предков. Этот вопрос далек от своего разреше-
ния. С одной стороны, стремление к объединению га-
монтов перед началом гаметогенеза ярко выражено
еще в одной группе споровиков — аделеидные кок-
цидии (Eucoccidiida: Adeleina). Сходство особенно
бросается в глаза при сравнении грегарин с одним из
семейств этих своеобразных организмов — так назы-
ваемыми гемогрегаринами (Haemogregarinidae), у ко-
торых сизигии образуются в просвете кишечника
окончательного хозяина (членистоногого или пиявки),
хотя общая гаметоциста при этом не формируется.
С другой стороны, гамонтогамия — спаривание гамон-
тов, предшествующее собственно половому процес-
су — встречается не только среди Sporozoa, но и у не-
которых Foraminifera (пластогамия), не говоря уже об
инфузориях (конъюгация).
Вопрос о первичности или вторичности внеклеточ-
ного паразитизма грегарин является дискуссионным.
Существует мнение, что внеклеточный паразитизм у
грегарин первичен и свидетельствует, таким образом,
об их примитивности (Бейер, 1989). Действительно,
подавляющее большинство грегарин — внеклеточные
паразиты, однако не следует забывать, что у части гре-
гарин, в том числе и у многих примитивных Aseptata,
ранние стадии развития трофозоитов — внутриклеточ-
ные — это в ряде случаев подтверждено и электрон-
но-микроскопическими данными (Sheffield et al., 1971;
da Cunha, Jurand, 1978; Chen et al., 1997). У архигрега-
рин на светооптическом уровне описано внутрикле-
точное развитие меронта (Brasil, 1907), хотя в развитии
их гамонтов внутриклеточные стадии, казалось бы, от-
сутствуют. Последнее обстоятельство, правда, скорее
говорит о слабой изученности жизненных циклов, чем
о том, что таких стадий нет вовсе. Таким образом, име-
ет право на существование и альтернативная точка
зрения — предки грегарин были внутриклеточными
паразитами, а переход к внеклеточному паразитизму
вторичен и выражает собой определенный вектор спе-
циализации этой группы.
Так или иначе, но основным направлением эво-
люции грегарин действительно стал внеклеточный па-
разитизм, позволивший достичь крупных размеров.
В дальнейшем это дало им возможность отказаться от
мерогонии и создало почву для фантастического раз-
нообразия организации, связанного со сложной диф-
ференцировкой клеточных структур. Подобные сооб-
ражения неоднократно высказывались еще в начале
XX в. (Аверинцев, 1908; Awerinzew, 1910; Leger, Du-
boscq, 1910а) и легли в основу современных представ-
лений о филогенезе грегарин. Так, согласно Леже и
Дюбоску, наиболее примитивными формами следу-
ет считать Schizogregarina, от которых путем утра-
ты мерогонии произошли просто устроенные асептат-
ные (моноцистидные) эугрегарины. Далее в процессе
эволюции их строение усложнялось, и в результа-
те возникли септатные (дицистидные) грегарины
(рис. 33,7).
В 50-х гг. XX в. на смену взглядам Леже и Дюбо-
ска на эволюцию и филогению грегарин пришла кон-
цепция Грассе (Grassi, 1953) (рис. 33, 77), основанная
главным образом на теории сопряженной эволюции
хозяев и паразитов и касающаяся прежде всего фило-
78
ALVEOLATA
SPOROZOA
sensu stricto
Greg. Dicystidea
Monocystidea
целомические
Aggregatidae
Haemogregarinae
Hepatozoon
Greg. Monocystidea
кишечные
Schizogregarinae
целомические Eucoccidia
кишечные Eucoccidia
Prococcidia
Selenoccidium
Selenidium '
Schizocysiis
FLAGELLATA
1
ТИП SPOROZOA. КЛАСС GREGARINEA
79
генетических отношений внутри класса (см. раздел
«История изучения»). Согласно Грассе, наиболее при-
митивной группой грегарин являются архигрега-
рины — сохранившие исходное состояние шизогрега-
рины морских беспозвоночных, преимущественно
«сидячих» полихет. Они дали начало эугрегаринам,
утратившим мерогонию и давшим мощную адаптив-
ную радиацию. Неогрегарины (шизогрегарины насеко-
мых), по мнению Грассе, произошли от высших сеп-
татных Eugregarina и приобрели мерогонию вторично.
При этом, вероятно, разные семейства неогрегарин
приобрели ее независимо, таким образом, эта группа,
по всей видимости, является сборной. В подтвержде-
ние своей гипотезы о происхождении неогрегарин
Грассе указывает на то, что гаметоцисты и ооцисты не-
которых из них напоминают таковые Actinocephalidae.
Концепция филогенеза грегарин, предложенная Грас-,
се, в дальнейшем не претерпела существенных измене-
ний и в настоящее время является общепринятой (Le-
vine, 1985, 1988; Сох, 1994; Perkins et al., 2000). Основ-
ные разногласия касаются в основном трактовки
таксонов архигрегарин и бластогрегарин (см. раздел
«История изучения»). Следует отметить, что некото-
рые исследователи предлагают в качестве предковой
группы именно бластогрегарин, а архигрегарин счита-
ют их потомками (Theodorides, 1984; Vivier, Desportes,
1990). Действительно, бластогрегарины, паразитирую-
щие в кишечнике полихет, не образуют сизигиев, что,
возможно, является плезиоморфным признаком. Одна-
ко в отсутствие ультраструктурных и молекуляр-
но-филогенетических данных сама принадлежность
этих организмов к грегаринам остается недоказанной,
а их рассмотрение в качестве исходной группы кажет-
ся преждевременным.
Все накопленные к настоящему моменту данные, в
том числе ультраструктурные (Schrevel, 1968а, 1971а,
1971b) и молекулярно-филогенетические (Leander et
al., 2003b), подтверждают точку зрения Грассе лишь в
отношении архи- и эугрегарин, тогда как относительно
неогрегарин ясности нет. Действительно, из ныне жи-
вущих грегарин Archigregarina, по всей видимости,
наиболее близки к исходному состоянию. Для их
взрослых трофозоитов (гамонтов) характерно сохране-
ние плана строения и отчасти способа движения, свой-
ственных инвазионным стадиям споровиков вообще.
Кроме того, архигрегарины — единственная группа
«настоящих» споровиков, сохранившая первичную
трофическую функцию апикального комплекса. Сле-
дует подчеркнуть, что все уникальные органеллы, ха-
рактерные для инвазионных зонтов (коноид, роптрии,
продольные субпелликулярные микротрубочки и опи-
санная для некоторых спорозоитов «осевая структу-
ра» — вакуоль с протоком, проходящим сквозь коно-
ид), не являются «атавизмом» у взрослых трофозоитов
архигрегарин, но активно функционируют, о чем гово-
рит их гипертрофированное развитие. Наконец, хозяе-
ва большинства архигрегарин и их паразитарная лока-
лизация — кишечник полихет — являются, по всей ви-
димости, исходными для всех Sporozoa. Есе эти
признаки безусловно плезиоморфные и говорят о бли-
зости архигрегарин к основанию филогенетического
древа споровиков.
Предками Eugregarina, по всей видимости, были
архигрегрины или близкие к ним организмы. Станов-
ление эугрегарин связано с двумя крупными аромор-
фозами: возникновением эпицита и скользящего дви-
жения с одной стороны, и утратой апикального (мук-
ронального) комплекса в связи с переходом от
фаготррфного к иным способам питания — с другой.
Считающиеся наиболее примитивными Lecudinidae
уже имеют классическое строение эпицита, который
развился, возможно, из образований, подобных по-
верхностным складкам архигрегарин. В ходе дальней-
шей эволюции структура эпицита эугрегарин остается
довольно консервативной, за исключением случаев
утраты скользящего движения (Monocystidae, Diplau-
xis и др.).
О фаготрофном питании предков эугрегарин гово-
рит, возможно, наличие «осевой структуры» у только
что вошедших в контакт с хозяином спорозоитов как у
видов с внутриклеточным, так и с внеклеточным раз-
витием. Поскольку эта структура, сходная, как уже
Рис. 33. Схемы, иллюстрирующие различные точки зрения на эволюцию и филогенез грегарин.
/—точка зрения Леже и Дюбоска на филогенез Sporozoa (no: (Leger, Duboscq, 1910а)); II—точка зрения Грассе (Grasse, 1953) на филогенез грегарин (ориг.);
III — авторская точка зрения на пути эволюции грегарин: «Anepicytaria» и «Epicytaria» — уровни морфологической организации, характеризующиеся опре-
деленными чертами строения покровов и наличие^ или отсутствием апикального комплекса (для обоих уровней приведены основные типы строения кор-
текса в виде схем поперечных срезов). Для «Anepicytaria» обычна мерогония, для «Epicytaria» — ее отсутствие; 1 — зоитоподобный предок с гладкой пелли-
кулой претерпевает гипертрофию, приводящую к возникновению архигрегарин (Selenidium)', 2 — приобретение «классического» эпицита и скользящего
движения, отказ от мизоцитоза, сопровождающийся утратой апикального комплекса и формированием спереди от апикального конца спорозоита (насто-
ящего мукрона) новых прикрепительных приспособлений, содержащих фронтальную вакуолярную систему (иллюстрируется стадией развития Eugregarini-
da); 3 и 4 — эволюция Eugregarinida, связанная с усложнением новоприобретенных прикрепительных приспособлений, а в дальнейшем — с дифференциров-
кой тела на отделы (3 — Aseptata: формиррвание прикрепительного приспособления типа «мукрон» Lecudina, содержащего большую фронтальную вакуоль
и мнргочисленные микротрубочки; 4 — Septata: формирование эпимерита с крупной «кортикальной» вакуолью и хорошо развитыми митохондриями, появ-
ление протодейтомеритной септы (Gregarina)-, 1 — процессы, приведшие к возникновению неогрегарин, неясны, вероятно независимое происхождение раз-
ных семейств (изображены две особи Mattesia: слева — макронуклеарный шизонт с полярным кольцом, мукрональной вакуолью и роптриями, справа — ме-
розоитоподобный гамонт).
Fig. 33. Different points of view on the evolution and phylogenesis of gregarines.
1 — Leger’s and Duboscq’s view on the phylogenesis of Sporozoa; II— Grasse’s view on the phylogenesis of gregarines; III—author’s point of view on the pathways
of gregarine evolution: «Anepicytaria» and «Epicytaria» — levels of morphological organization distinguished by structure of cortex and by the presence or absence of
the apical complex (basic types of cortical structure are given for both of them as cross sections). For «Anepicytaria» merogony is ordinary, for «Epicytaria» — no. 1 —
hypertrophy of zoite-like ancestor gives rise to Archigregarines (Selenidium); 2 — acquiring of «classical» epicyte and gliding movement, loss of mysocytosis accom-
panied by loss of apical comlex and formation of new vacuolated attachment devices in front of sporozoite fore end (genuine mucron of ancestor) which contain a fron-
tal system (illustrated by the developmental stage of Eugregarinida); 3 and 4 — evolution of Eugregarinida through complication of reacquired attachment devicesand
subsequent segmentation of the body: 3 — Aseptata: formation of a «mucron» Lecudina containing a large frontal vacuole and numerous microtubules; 4 — Septata:
formation of an epimerite containing a large «cortical» vacuole and well-developed mitochondria, and appearance of a proto-deutomerite septum (Gregarina); ?'— the
processes underlying the origin of Neogregarines remain unclear; independent origin of different families is probably (two individuals of Mattesia are shown: at the — a
macronuclear schizont with polar ring, mucronal vacuole, and rhoptries (left), and a merozoite-like gamont (right)).
80
ALVEOLATA
говорилось. и мукрональной вакуолью архигрегарин,
отсутствует у спорозоитов, находящихся внутри ООЦИ-
СТЫ. можно предположить, что «новорожденная» гре-
гприна вначале использует предковый тип питания,
т. е. в первую очередь заглатывает определенный объ-
ем цитоплазмы хозяина, который служит ей источни-
ком пищи иа начальных этапах развития. В дальней-
шем происходит переход к питанию через микропоры
и, предположительно, к мембранному транспорту пи-
тательных веществ из клетки хозяина, который, воз-
можно, связан с прогрессивным врастанием переднего
конца в клетку, формированием обширных фронталь-
ных («кортикальных») вакуолей и резорбцией апи-
кального комплекса органелл. Утратив вместе с мук-
роном апикальный комплекс, трофозоиты эугрегарин
демонстрируют огромное разнообразие строения воз-
никших взамен прикрепительных аппаратов. Дальней-
шая эволюция Eugregarina пошла по пути еще боль-
шего усложнения морфологии, связанного с диффе-
ренциацией тела на отделы — прото- и дейтомерит,
разделенные септой.
Таким образом, эугрегарины представляют собой
морфологически четко очерченную группу, которая по
сравнению с возможными предками — архигрегари-
нами — демонстрирует переход на более высокий
эволюционный уровень благодаря приобретению уни-
кального локомоторного аппарата и качественно ино-
го типа прикрепительных приспособлений. В ходе
обширной адаптивной радиации эугрегарины, пред-
ставляющие собой ядро класса Gregarinea, освоили в
качестве хозяев широчайший круг водных, почвенных
и наземных беспозвоночных.
Наибольшее количество вопросов возникает в свя-
зи с происхождением и систематическим положением
Neogregarina. Прежде всего требует особого рассмот-
рения утверждение Грассе, к сожалению никак им
не аргументированное, о вторичности происхождения
мерогонии у неогрегарин. В пользу этой гипотезы го-
ворит то, что ход жизненного цикла некоторых, хотя и
не всех, неогрегарин характеризуется присутствием
морфологически различающихся поколений меронтов,
которые часто осуществляют мерогонию неодинако-
вым способом. Поскольку грегарины, обладающие та-
кими особенностями жизненного цикла, встречаются
только в насекомых, где кроме них паразитируют
лишь высшие, септатные эугрегарины, то действитель-
но напрашивается предположение о происхождении
первых от вторых в результате вторичного приобрете-
ния мерогонии. Несходство процессов мерогонии в
разных семействах неогрегарин можно объяснить их
независимым происхождением.
Однако более подробное рассмотрение хода меро-
гонии у неогрегарин, в том числе и с привлечением
немногочисленных ультраструктурных данных, не по-
зволяет сделать столь однозначные выводы. Мерого-
ния, наблюдаемая у грегариноидных меронтов Ophry-
ocystis, скорее всего, действительно вторична — она
представляет собой по сути простое деление материн-
ских многоядерных особей, не сопровождающееся
специфическими морфогенетическими процессами
формирования типичных мерозоитов. Следует заме-
тить однако, что мерогония первичных мицетоидных
особей, протекающая по иной схеме (см. «Системати-
ческий обзор»), у этих грегарин на ультраструктурном
уровне не изучена. В отличие от Ophryocystis, внутри-
клеточные Syncystidae и Lipotrophidae всегда, по всей
видимости, продуцируют мерозоиты классического
для споровиков строения, а сам ход мерогонии у них
обнаруживает большое сходство с кокцидиями (Vavra,
McLaughlin, 1970; Canning, Sinden, 1975; Larsson,
1991), что отнюдь не свидетельствует в пользу вторич-
ности ее происхождения по крайней мере у этих се-
мейств. Следует подчеркнуть, кроме того, что и другие
данные по строению Neogregarina плохо укладывают-
ся в рамки гипотезы Грассе об их происхождении от
септатных эугрегарин и от эугрегарин вообще. Трофо-
зоиты всех неогрегарин, как гамонты, так и меро-
нты — моноцистидные, у них нет септы и эпимерита, а
у изученных на ультраструктурном уровне представи-
телей покровы гладкие и не формируют никаких обра-
зований, которые напоминают эпицит эугрегарин. Эти
признаки вкупе с персистированием апикального ком-
плекса у Mattesia, Farinocystis и Syncystis сближают
Neogregarina скорее с Archigregarina, чем с Eugregari-
na. Следует заметить, правда, что элементы апикаль-
ного комплекса найдены только у внутриклеточных
неогрегарин, тогда как внеклеточные трофозоиты
Ophryocystis, по всей видимости, полностью их лише-
ны. К сожалению, другие внеклеточные неогрегарины
(Schizocystidae, Caulleryellidae) не изучены ультра-
структурно, так что этот вопрос требует дальнейших
исследований.
Особого упоминания заслуживают грегарины рода
Gigaductus, которые иногда рассматриваются как воз-
можные переходные формы от эу- к неогрегаринам
(Schrevel, Philippe, 1993). Гамонты Gigaductus имеют
строение, типичное для септатных эугрегарин, в том
числе обладают и эпицитом. Внутриклеточные мерон-
ты Gigaductus хотя и лишены эпицита, но в отличие от
неогрегарин Syncystidae и Lipotrophidae не содержат
органелл апикального комплекса и формируют эпиме-
рит. Способы формирования мерозоитов также отли-
чаются от таковых у внутриклеточных неогрегарин.
Таким образом, грегарины Gigaductus, несмотря на
вторичное приобретение мерогонии, все же сохраняют
все основные признаки эугрегарин, чем в корне отли-
чаются от «настоящих» неогрегарин. В то же время
пример Gigaductus показывает, что утрата эугрегари-
нами мерогонии действительно не оказалась необра-
тимой, а типичное строение мерозоитов отражает
тот факт, что потенция к воспроизводству подобных
стадий развития заложена в геноме грегарин на очень
глубоком уровне. Это, впрочем, неудивительно, по-
скольку такое же строение имеют спорозоиты, форми-
рование которых является неотъемлемой чертой жиз-
ненных циклов как грегарин, так и споровиков во-
обще.
Отсутствие фактов, однозначно подтверждаю-
щих или опровергающих концепцию Грассе в той
ее части, которая касается происхождения неогре-
гарин, заставляет нас допустить теоретическую воз-
можность независимого происхождения Neogregarina
от каких-то древних, близких к Archigregarina предков
несколькими параллельными линиями, которым, ве-
роятно, соответствуют традиционно выделяемые се-
мейства.
ТИП SPOROZOA. КЛАСС GREGARINEA
8¥
Высказанные выше соображения относительно пу-
тей эволюции различных групп грегарин суммирова-
ны в виде схемы, представленной на рис. 33, III. Выде-
лены два четко различающихся уровня морфологиче-
ской организации грегарин, которым даны названия
«Anepicytaria» и «Epicytaria». Anepicytaria — это фор-
мы, изначально лишенные эпицита, многие из которых
сохраняют на протяжении большей части жизненного
цикла черты строения зоитоподобных предков — мук-
рональный комплекс и покровы с регулярно располо-
женными продольными субпелликулярными микро-
трубочками, лишеные апикальных арок и филаментов.
На этом уровне находятся архигрегарины и неогрега-
рины, причем если проводить аналогии с Metazoa, то
архигрегарины — это формы гипертрофированные, а
внутриклеточные неогрегарины — «неотенические».
Многие Anepycitaria имеют в своем жизненном цикле
мерогонию в отличие от Epicytaria, в подавляющем
большинстве ее утративших. Epicytaria — это более
высокий уровень, на котором находятся асептатные и
септатные эугрегарины. Помимо приобретения клас-
сической структуры эпицита и способности к скользя-
щему движению эугрегарины выработали качественно
иной тип прикрепительных приспособлений — эпиме-
рит, который, являясь новообразованием, не соответ-
ствует истинному (анцестральному) переднему концу
тела Anepicytaria — мукрону, а представляет собой
надстройку над ним. В отличие от традиционных
взглядов мы считаем возможным гомологизировать
«мукроны» асептатных эугрегарин типа Lecudina с
эпимеритами септатных форм на основании морфоло-
гического сходства, выражающегося в сильном разви-
тии крупной фронтальной вакуоли, тесно прилегаю-
щей к зоне контакта с клеткой хозяина. К сожалению,
отсутствие подробных данных по развитию асептат-
ных грегарин не позволяет ни надежно подтвердить,
ни убедительно опровергнуть высказанную точку зре-
ния. В качестве косвенного подтверждения можно,
правда, рассматривать наличие отбрасываемых при-
крепительных приспособлений у таких грегарин, как
Cygnicollum и Ascogregarina. Однако в последнем слу-
чае, возможно, более правильной является точка зре-
ния Грассе (Grasse, 1953), который на основе исследо-
вания Рэя (Ray, 1933b), а также в связи с паразитизмом
не в морских беспозвоночных, а в насекомых считал
Ascocystis (=Ascogregarina) culicis вторично асептат-
ной формой.
Большой вклад в филогенетику грегарин, наряду с
дальнейшим изучением ультраструктуры, могли бы
внести молекулярно-биологические данные. На сегод-
няшний день прочитаны последовательности гена 18S
рРНК только 9 видов грегарин (2 вида архигрегарин из
рода Selenidium, 6 видов эугрегарин и 1 неогрегарина
из рода Ophryocystis) (Carreno et al., 1999; Leander et al.,
20Q3a, 2003b). К сожалению, эти данные ввиду своей
скудности не дают возможности для каких-либо одно-
значных выводов (рис. 34). Тем не менее можно отме-
тить четыре заслуживающих внимания обстоятельст-
ва. Во-первых, обращает на себя внимание большая
длина ветвей многих грегарин. С одной стороны, это
затрудняет филогенетический анализ в силу феномена
LBA (преимущественное взаимное притяжение длин-
ных ветвей). С другой стороны, высокая вариабель-
ность, возможно, позволит в будущем использовать
последовательность гена 18S рРНК для выяснения фи-
логенетических отношений внутри клады грегарин с
большей разрешающей способностью, чем для многих
других таксонов. Во-вторых, все исследованные грега-
рины образуют монофилетическую группу. При этом
самые ранние ответвления дают две исследованные
архигрегарины — Selenidium vivax и S. terebellae.
Вслед за ними общей ветвью отходят близкие последо-
вательности двух морфотипов асептатной эугрегари-
ны Lecudina polymorpha из морской полихеты Lumbri-
neris sp. Септатные эугрегарины (Leidyana migrator из
мадагаскарского таракана Gromphadorhina portentosa
и Gregarina niphandrodes из имаго мучного хрущака
Tenebrio molitor) всегда формируют монофилети-
ческую группу. В-третьих, последовательность нео-
грегарины Ophryocystis elektroscirrha, поражающей ги-
подерму некоторых чешуекрылых, ответвляется от
основания древа эугрегарин, а не от его кроны, т. е. не-
огрегарина не образует с септатными грегаринами мо-
нофилетической группы, как это можно было бы ожи-
дать исходя из гипотезы Грассе. В четвертых, при при- ,
менении различных методов анализа получаются не
всегда сопоставимые результаты, часть из которых
пока не поддается объяснению. Так, на дереве, постро-
енном методом «maximal likelihood» (рис. 34, А), грега-
рины из сухопутных хозяев (неогрегарина Ophryocys-
tis elektroscirrha, эугрегарины Monocystis agilis (Asep-
tata) из дождевого червя Lumbricus terrestris, Leidyana
migrator и Gregarina niphandrodes (Septata)), проявля-
ют тенденцию к формированию монофилетической
группы, которая, однако, нарушается последователь-
ностью Lecudina tuzetae из полихеты Nereis vexillosa.
Авторы исследований (Leander et al., 2003а, 2003b)
объясняют подобные «несуразности» влиянием LBA,
однако попытка убрать из анализа длинные ветви
(рис. 34, В) не дает конструктивного результата, по-
скольку оставляет на дереве только три грегаринные
ветви, расположение которых указывает лишь на уста-
новленный ранее морфологическим путем факт при-
митивного состояния архигрегарин.
Любопытным, с точки зрения филогении грегарин
является и то, что по молекулярно-биологическим дан-
ным организмы рода Cryptosporidium, обладающие
внеклеточной локализацией и вызывающие дизенте-
рию оппортунистического характера при снижении
иммунитета у многих позвоночных животных, в том
числе и у человека, оказываются ближе к грегаринам,
чем к кокцидиям, куда их до сих пор относили (Carreno
et al., 1999; Zhu et al., 2000; Leander et aL, 2003b). Крип-
тоспоридии всегда группируются вместе с грегари-
нами, причем с достаточно высокой степенью ста-
тистической подержки (рис. 34). Гипотезе о филоге-
нетической близости криптоспоридий и гергарин не
противоречит также факт обнаружения положитель-
ной реакции С/урГокрог/бУшги-ооцистспецифических
моноклональных антител на ооцисты грегарин сем.
Monocystidae (Bull et al., 1998). Тем не менее для более
достоверного решения этого вопроса требуются даль-
нейшие исследования.
Будущие исследования несомненно прояснят мно-
гие вопросы, связанные с филогенией грегарин, в том
числе и вопрос о происхождении неогрегарин. В связи
6 Зак. №4163
82
ALVEOLATA
A
Phylogeny of alveolates
— Thraustochytrium multirudimentale |
loo i— Mallomonas stariata Stramenopiles
100 1-- Costaria costata —•
Furgasonia blochmanni
- Urocentrum turbo
----- Didinium nasutum ...
„----. , ciliates
Oxytricha nova
87
100
97 «
96 -------- Protocruzia sp.
100
100
100
dinoflagellates
(including Perkinsus)
67
65
59
43
50
60
100
93
96
------ Blepharisma americanum
r Amphidinium semilunatum
----- Prorocentrum emarginatum
j---- Cryptoperidinium foliaceum
I— Durinskia baltica
I- Dinophysis norvegica
— Gyrodinium dorsum
— Cryptoperidiniopsis brodyi
----- Noctiluca scintillans
--------Amoebophrya sp.
Hematodinium sp.
Eukaryote clone OLI11001
Perkinsus marinus
82 —
751---- Colpodella pontica
‘------- Colpodella sp. (ATCC 50594)
Marine clone rom Ammonia Est. 0.05
л. m - j substitutions/site
from Tridacnc
77
95
------- Marine parasite
jgg.— Theileria buffeli
100'— Babesia gibsoni
I— Toxoplasma gondii
П юр [~ Caryospora bigenetica
*- Eimeria alabamensis
В
Phylogeny of alveolates excluding long branches
Thaustochytrium multirudimentale ~
- Mallomonas striata
— Costaria costata __
---—---------------------------Hepatozoon sp. ~
r 'oo I---Theileria buffeli
iojp---Babesia gibsoni
z i oo I-Toxoplasma gondii
tool loo t— Caryospora bigenetica
100 }°° *- Eimeria alabamensis
I------------Marine parasite from Tridacna
1 I-----Cryptosporidium serpentis
— Selendium terebellae
-------------------Mono, agilis
---Ophryocystis electroscirrha
Colpodella sp. (ATCC 50594)
S
100
70
80
90
94
A
75 ML
88 WNJ
91 ME “
90 MP
97
99
86
97
100
100
100
100
94
Perkinsus marinus
— Noctiluca scintillans
I-------Noctiluca scintill
J------Hematodinium sp.
Amvhidinium semilunat
6i
78
59
Amphidinium semilunatum
---Gyrodinium dorsum
— Dinophysis norvegica
D
73
66
54
52
100 —
100
об
A? O*
94
~-------Cryptoperidinium foliaceum
------Prorocentrum emarginatum
Cryptoperidiniopsis brodyi
।-------------------Amoebophrya sp.
'----Eukaryote clone OLIllOOl
-----Blepharisma americanum
-----Didinium nasutum
Protocruzia sp.
Oxytricha nova
— Urocentrum turbo
Furgasonia blochmanni
93
84
58
C
other apicomplexans
(inicluding Colpodella)
100
100
98
— Cryptosporidium serpentis
47ML J
61 WNJ^
62MP
23 /
52>
65
Selenidium terebellae
37----------------- — ' -
63i-----Ophryocystis electroscirrha
64
18
Est. 0.1
substitutions/site
75 —
76
27
55
61L
22
93
80
83
Selenidium vivax
100
100
100
Monocystis agilis
Lecudina polymorpha morphotype 1
Lecudina polymorpha morphotype 2
gregarine clade
(including Cryptosporidium)
- Lecudina tuzetae
Leidyana migrator
Gregarina niphandrodes
Рис. 34. Филогенетические деревья, построенные по результатам анализа последовательности гена 18S рРНК, на которых показано поло-
жение грегарин внутри группы Alveolata. (По: Leander et al., 2003b). Числами показаны гамма-скорректированные проценты бутстрэп-под-
держки при использовании следующих методов анализа (сверху вниз): «maximal likelihood» (ML), «weighted neighbor joining» (WNJ) и «mi-
nimum evolution» (ME) с использованием GTR; самые нижние числа (только на дереве «5») относятся к методу «maximum parsimony»
(MP).
А — гамма-скорректированное филогенетическое дерево 40 таксонов (метод ML). Большинство грегарин образуют чрезвычайно длинные ветви и группиру-
ются с Cryptosporidium с умеренной статистической поддержкой; В — гамма-скорректированное филогенетическое дерево 34 таксонов (метод ML); исклю-
чены из анализа 6 наиболее длинных ветвей: грегарины Selenidium vivax, Lecudinapolymorpha — морфотип 1, Lecudinapolymorpha — морфотип 2, Lecudina
tuzetae, Leidyana migrator и Gregarina niphandrodes. В отсутствие длинных ветвей группировка грегарин с Cryptosporidium получает статистическую под-
держку от умеренной до высокой — в зависимости от метода анализа. А — споровики («Apicomplexa») и Colpodella, С — инфузории (Ciliata); D —динофла-
гелляты (Dinoflagellata) и Perkinsus', S —• хромисты (Stramenopiles).
Fig. 34. Phylogenetic trees showing the relationship of gregarines to other alveolates as inferred from SSU rDNA sequences. Numbers at the bran-
ches denote gamma-corrected bootstrap percentages using the following methods (from top to bottom): maximal likelihood (ML); weighted neighbor
joining (WNJ); and minimum evolution (ME), using GTR; the lowermost numbers (tree «В» only) refer to the maximum parsimony method (MP).
A — gamma-corrected ML tree of the 40 taxa. Most gregarine sequences are extremely divergent and cluster with Cryptosporidium serpentis with moderate statistical
support; В — gamma-corrected ML tree of the 34 taxa; the 6 longest branches have been removed: Selenidium vivax, Lecudina polymorpha — morphotype 1, Lecudina
polymorpha — morphotype 2, Lecudina tuzetae, Leidyana migrator, and Gregarina niphandrodes. In the absence of long branches, Cryptosporidium clusters withSe/e-
nidium terebellae, Monocystis agils, and Ophryocystis elektroscirrha with moderate to high statistical support — depending on the analysis method. A — apicomple-
xans and Colpodella', C — ciliates; D — dinoflagellates and Perkinsus', S — stramenopiles.
ТИП SPOROZOA. КЛАСС GREGARINEA
83
с этим большой интерес могли бы представлять ульт-
раструктурные и молекулярно-филогенетические ис-
следования представителей как можно большего числа
таксонов грегарин, в особенности внеклеточных нео-
грегарин, таких как, например, Schizocystis, обладаю-
щих определенным внешним сходством с Selenidium.
В свое время это обстоятельство ввело в заблуждение
В. А. Догеля, описавшего один из видов рода Selenidium,
который паразитирует в сипункулиде Sipunculus nudus
под названием Schizocystis sipunculi (Dogiel, 1907).
Вопросы систематики
Систематические признаки. Построение естест-
венной системы грегарин в настоящее время представ-
ляет собой трудную задачу. Большинство таксонов
диагностируются при помощи неравнозначных комби-
наций довольно расплывчатых критериев, многие из
которых к тому же используются далеко не всегда в
силу неравномерной изученности группы в целом.
Таксономическое деление грегарин основано в на-
стоящее время на следующих признаках:
1) наличие или отсутствие мерогонии в жизненном
цикле, особенности ее протекания — на уровне от-
рядов;
2) светооптическая морфология трофозоитов и сизи-
гиев — на уровнях от вида до подотряда включи-
тельно;
3) особенности ультраструктуры поверхности и пе-
реднего конца трофозоитов — на уровне отрядов
(используется не всегда);
4) светооптическая морфология ооцист — на уровне
семейств и родов (используется не всегда);
5) светооптическая морфология гаметоцист, отсутст-
вие или наличие спородуктов, их количество — на
уровне семейств;
6) приуроченность к определенным видам хозяев —
на уровне видов либо к определенным таксономи-
ческим группировкам хозяев — на уровне родов,
семейств, отрядов (используется не всегда).
Признак наличия или отсутствия мерогонии в жиз-
ненном цикле, как уже говорилось, широко использу-
ется в макросистематике грегарин. Тем не менее сле-
дует напомнить, что жизненные циклы многих видов
грегарин до сих пор неизвестны, а сами виды описаны
исключительно по стадии прикрепленного либо сво-
бодного трофозоита. Светооптическая же морфология
этих стадий сводится в основном к форме и размерам
тела и прикрепительных приспособлений, а также на-
личию или отсутствию септы. У грегарин, лишенных
септы и эпимерита, таких как, например, многие Lecu-
dinidae из морских беспозвоночных, светооптическая
морфология трофозоитов настолько бедна, что с ее по-
мощью невозможно с уверенностью различить разные
виды.
Признак наличия или отсутствия прото-дейтоме-
ритиой септы, на котором, в частности, основано деле-
ние отряда Eugregarinida на подотряды, также не всегда
отчетливо выражен (примеры: Sycia, Ulivina). Иногда
септа, хорошо оформленная на ранних стадиях разви-
тия трофозоита, в конце исчезает, так что грегарина
принимает моноцистидное строение (Schneideria).
В случае хорошо развитого эпимерита особенности
его строения обычно используются для целей система-
тики. Так, в сем. Actinocephalidae морфология эпиме-
рита, часто вместе с морфологией ооцист, успешно
применяется для диагностирования некоторых родов и
видов (рис. 35) (Tuzet et aL, 1968; Baudoin, 1971).
Данные по ультраструктуре трофозоитов нерав-
номерны и разрозненны, а потому недостаточны для
применения их в качестве критериев систематики,
за исключением различий в ультраструктуре между
представителями крупных таксонов, таких как Archig-
regarina и Eugregarina.
Форме ооцист в систематике споровиков традици-
онно придается большое значение. В случае грегарин
использование этого критерия также иногда дает хоро-
шие результаты. Многим семействам грегарин прису-
ща, хотя и не всегда, специфическая морфология
ооцист. Прежде всего это относится к тем случаям,
когда они несут на своей поверхности различные вы-
росты, как это имеет место у представителей семейств
Urosporidae (рис. 25, 6—9) и Actinocephalidae (подсем.
Acanthosporinae) (рис. 25,19, 20; 33). Более того, внут-
ри сем. Urosporidae, в частности, этот признак исполь-
зуется в качестве основного для выделения родов и
даже видов (Dogiel, 1909). Такой подход, однако, пло-
хо подходит для некоторых других семейств, ооцисты
представителей которых часто довольно однообразны
по своей морфологии, например для семейств Lecudi-
nidae, Monocystidae и др. Следует еще раз подчерк-
нуть, что для многих грегарин, особенно морских,
ооцисты и гаметоцисты неизвестны.
В систематике септатных эугрегарин иногда на-
ходят применение такие признаки, как длительность
стадии сизигия и некоторые особенности гаметоцист.
Так, грегарин, образующих ранние сизигии, иногда
объединяют в надсем. Gregarinicae, а образующих позд-
ние — в надсем. Stenophoricae (= Solitaricae) (Chakra-
varty, 1959; Levine, 1985; Clopton, 2000). Грегарины се-
мейств Gregarinidae, Gigaductidae, Hirmocystidae, Didy-
mophyidae обладают гаметоцистами co спородуктами.
Резко выраженная анизогамия и вскрытие гаметоцист
при помощи латеральной > «псевдоцисты» являются
специфическими признаками сем. Dactylophoridae.
По причине нехватки хороших морфологических
критериев при описании и идентификации видов боль-
шое развитие получил подход, основанный на мнении
о строгой видоспецифичности грегарин как паразитов
и вытекающий из гипотезы сопряженной эволюции
хозяев и паразитов. Действительно, в некоторых слу-
чаях, в особенности если речь идет о крупных таксо-
нах ранга семейства и выше, этот «хозяинный» подход
может быть оправданным (Grasse, 1953). Однако ис-
пользование рассматриваемого критерия на родовом и
видовом уровне, иногда имеющее место, кажется не
всегда убедительным, поскольку даже немногочислен-
ные эксперименты по искусственному заражению гре-
гаринами различных хозяев дают неоднозначные ре-
зультаты (см. раздел «Паразито-хозяинные отноше-
ния»).
Все вышесказанное приводит к тому, что единого
взгляда на систему грегарин в настоящее время нет.
Решению существующих проблем могут помочь толь-
ко дополнительные исследования, в том числе ультра-
84
ALVEOLATA
Рис. 35. Эпимериты и ооцисты грегарин родов Ancyrophora (7—4) и Rhizionella (5).
1 — Ancyrophora octacantha, 2 — A. uncinata, 3 — A. puytoraci, 4 — A. umbelliformis, 5 — Rhizionella tenuis. (По: Baudoin, 1971). 1—3: a — эпимерит, 6 —
ооциста; 5: a, 6 — эпимериты различной морфологии, в — ооцист.
Fig. 35. Epimerits and oocysts of the gregarines of genera Ancyrophora (7—4) and Rhizionella (5).
1—3: a — epimerit, 6 — oocyst; 5: a, 6 — epimerits of different morphology, в — oocyst.
структурные и молекулярно-филогенетические. Инте-
ресные результаты дает также применение метода
гель-электрофореза кортикальных белков грегарин
(Philippe et al., 1982). Так, в результате сравнительного
анализа 30 белков, выделенных из пелликул Gregarina
blaberae и G. garnhami, и 20 белков из пелликулы
G. rhyparobiae оказалось, что каждый вид характери-
зуется своим собственным электрофоретическим узо-
ром, и, более того, у всех трех видов грегарин имеется
только один общий белок (52 кД). С другой стороны,
две разные популяции G. garnhami — из перелетной
саранчи (Locusta migratoria) и пустынной саранчи
(Schistocerca gregaria) имели одинаковый набор бел-
ков. Таким образом, гель-электрофорез белков позво-
лил в данном случае выявить сильные межвидовые
различия и отсутствие внутривидовых. К сожалению,
этот метод не получил дальнейшего развития.
Макросистема грегарин. В настоящее время в
основу большинства систем грегарин положена точка
зрения Грассе (Grasse, 1953), согласно которой выде-
ляются три основных отряда — Archigregarinida, Eu-
gregarinida и Neogregarinida (Крылов, Добровольский,
1980; Vivier, Desportes, 1990; Perkins et aL, 2000). Одна-
ко существуют определенные трудности, касающиеся
четкого разграничения архи-, нео- и эугрегарин. Это
связано, во-первых, с тем, что Грассе, устанавливая
диагнозы для выделяемых им группировок (отрядов),
сделал упор на особенности жизненных циклов, по-
скольку ультраструктурных данных в то время еще не
было. Во-вторых, хотя с появлением ультраструктур-
ных данных и появились попытки привлечь их к реше-
нию вопросов макросистематики грегарин, однако не
все исследователи придают этим признакам таксоно-
мическое значение. В результате на сегодняшний день
существуют разногласия в трактовке отрядов, предло-
женных Грассе. Здесь можно выделить два подхода.
Французские исследователи, представляющие шко-
лу Грассе (Schrevel, 1971b; Puytorac et aL, 1987; Vi-
vier, Desportes, 1990; Schrevel, Philippe, 1993; Vivier,
Schrevel, 1995) наряду с традиционными признаками
используют и признаки ультраструктуры трофозоитов,
которым придают приоритетное значение, справед-
ливо указывая на их важность в условиях слабой изу-
ченности жизненных циклов. Уникальные особенно-
сти ультраструктуры трофозоитов, в частности, были
включены Шревелем в диагноз отряда Archigregarini-
da. По мнению этого исследователя, которое мы здесь
полностью разделяем, особенности ультраструктуры в
данном случае гораздо более значимы, чем наличие
или предполагаемое отсутствие мерогонии. Поскольку
эволюция грегарин шла главным образом по пути
усложнения организации трофозоитов, с правомерно-
стью такого подхода нельзя не согласиться. Однако
при использовании ультраструктурных признаков
главное затруднение состоит в далеко не полной изу-
ченности грегарин электронно-микроскопическими
методами.
Другой подход к макросистеме грегарин, предло-
женный Левайном и заключающийся в формальном
применении диагнозов Грассе, в основных чертах из-
ложен в разделе «История изучения». Вслед за уче-
ными французской школы его приходится признать
ТИП SPOROZOA. КЛАСС GREGARINEA
85
Диагностические признаки грегарин Таблица 1
Предлагаемые диагностические признаки Возражения против предлагаемых признаков, оговорки и исключения
Archigregarina
В жизненном цикле присутствует мерогонии, унаследованная от
предков (Grasse, 1953)
Паразитируют в морских беспозвоночных, преимущественно в по-
лихетах (Grasse, 1953)
Гамонты сохраняют черты строения зоитов: имеют хорошо разви-
тый апикальный (мукрональный) комплекс, покровы формиру-
ют продольные широкие складки, хорошо развиты продольные
субпелликулярные микотрубочки (Schrevel, 1971b)
Обладают ундулирующим движением (Schrevel, 1971b)
Прогамные ядерные деления начинаются до инцистирования сизи-
гия (Schrevel, 1971b)
Ооцисты в отличие от других грегарин содержат 4 спорозоита
(Schrevel, 1971b)
Мерогония архигрегарин доказана лишь для очень немногих ви-
дов (см. раздел «Жизненные циклы»)
Элементы мукронального комплекса сохраняются не только у ар-
хигрегарин, но и у некоторых неогрегарин (Mattesia, Farinocys-
tis, Syncystis), в том числе и на стадии сизигия (Vavra, McLaugh-
lin, 1970; Zizka, 1978а; Larsson, 1991)
Не у всех архигрегарин покровы формируют складки — есть виды
и с гладкой поверхностью, например Selenidium pennatum (Сим-
дянов, 1992)
Способностью к изгибанию тела обладают и трофозоиты многих
эугрегарин, хотя характер движений при этом и отличается от
архигрегарин
Раннее, еще на стадии прикрепленных трофозоитов, начало про-
гамных делений ядра отмечено у эугрегарины Didymophyes gi-
gantea (Hildebrand, 1978)
Неверно. Не у всех архигрегарин ооцисты содержат 4 спорозоита
(см. раздел «Систематический обзор»)
Eugregarina
Мерогония отсутствует (Grasse, 1953)
Имеют эпицит, состоящий из многочисленных узких гребней, ко-
торые содержат в вершинах комплекс 10—12 нм филаментов,
ассоциированных с внутренней мембраной пелликулы (Крылов,
Добровольский, 1980)
Обладают скользящим движением
Доказана мерогония у Gigaductus, в литературе есть указания на
мерогонию и у некоторых других эугрегарин (Мавродиади,
1914; Clausen, 1993)
Не все эугрегарины обладают классическим эпицитом и скользя-
щим движением (Monocystidae и др.) (см. раздел «Морфофунк-
циональная организация»)
См. выше
Neogregarina
В жизненном цикле присутствует вторично приобретенная меро-
гония (Grasse, 1953)
Паразитируют в насекомых (Grasse, 1953)
Покровы гладкие, лишены выростов, складок и т. п. (Schrevel, Phi-
lippe, 1993)
Обладают внутриклеточным развитием (Viver, Desportes, 1990)
Нет доказательств вторичного происхождения мерогонии у нео-
грегарин, в особенности у внутриклеточных (см. разделы «Мор-
фофункциональная организация» и «Эволюция и филогения»)
Тонкое строение покровов изучено не у всех неогрегарин (извест-
но для Farinocystis, Mattesia, Ophryocystis, Syncystis), что важно
в связи с неоднородностью группы. Гладкие покровы встреча-
ются и у архигрегарин (см. выше)'
Неверно. Далеко не все неогрегарины внутриклеточные и, кроме
того, внутриклеточные стадии развития встречаются во всех
трех группах грегарин
неприемлемым, поскольку он не отражает основные
тенденции н эволюции грегарин и существующие раз-
личия в их морфологической организации.
Все современные системы, основанные на выделе-
нии трех отрядов грегарин, сталкиваются при диагно-
стировании этих таксонов с существенными затрудне-
ниями формального характера, поскольку почти все
признаки, предлпгнемые в качестве диагностических
на основании самых разных подходов, не являются аб-
солютными. Для оценки надежности основных таксо-
номических критериев, используемых в настоящее
время в макросистеме грегарин, их удобно предста-
вить в виде таблицы вместе с существующими возра-
жениями и оговорками ( гибл. I).
Нетрудно замеI игв, что помимо многочисленных
оговорок к диагноитинеоким кри териям сами наборы
признаков, характерных для каждой из трех группиро-
вок грегарин, неконгруэнтны — например, паразитизм
в насекомых отличает неогрегарин от архигрегарин,
но не от эугрегарин, в диагнозе которых хозяева не
рассматриваются.
Используемая в данном издании макросистема час-
тично избавлена от противоречий общепринятой, хотя
это во многом достигается за счет ее предварительного
характера. В ситуации, когда гипотеза Грассе о проис-
хождении неогрегарин от эугрегарин не получает ни
морфологической, ни убедительной молекулярно-фи-
логенетической поддержки (см. раздел «Эволюция и
филогения»), кажется оправданным отказаться от рез-
кого противопоставления архи- и неогрегарин, так как
с формальной точки зрения единственным четким
критерием, по которому их можно разделить, остается
86
ALVEOLATA
характеристики хозяев морские беспозвоночные в
первом случае и насекомые во втором. Все остальные
критерии ненадежны ввиду слабой и неравномерной
изученности этих групп. Поэтому выделять их в каче-
стве отдельных отрядов кажется преждевременным,
но крайней мере до появления дополнительных дан-
ных, которые помогли бы прояснить этот вопрос. В ре-
зультате предпринятого объединения получаются не
три, а две крупные группировки грегарин — в одну из
них входят архигрегарины и неогрегарины, в дру-
гую — эугрегарины. Эти группировки соответствуют
двум уровням морфологической эволюции грегарин,
рассмотренным в разделе «Эволюция и филогения» —
«Anepicytaria» и «Epicytaria», и характеризуются соот-
ветствующими морфологическими признаками. Кроме
того, также нетрудно заметить, что выделенные групи-
ровки в основном соответствуют отрядам Schizogrega-
rina и Eugregarina Леже. Следует подчеркнуть, однако,
что в отличие от макросистемы грегарин Леже, в осно-
ву которой положен признак наличия или отсутствия
мерогонии («шизогонии») в жизненном цикле, что и
отражено в названиях отрядов, наша макросистема
опирается в первую очередь на различия в морфологии
трофозоитов. Тем не менее, поскольку статус справоч-
ного издания не дает возможности использовать в сис-
тематической части новые, не опубликованные До того
названия таксонов, основные группировки грегарин
далее будут рассматриваться как отряды Schizogregari-
nida и Eugregarinida, хотя эти названия и неверно отра-
жают суть дела — к примеру, как уже упоминалось,
многие «шизогрегарины» Selenidium не имеют меро-
гонии, тогда как у эугрегарин Gigaductus она есть
(см. разделы «Жизненные циклы», «Морфофункцио-
нальная организация» — о мерогонии и мерозоитах, и
«Систематический обзор» — характеристики соответ-
ствующих семейств и родов). В рамках отряда Schizog-
regarinida, противопоставляя хорошо морфологически
очерченную группу архигрегарин неогрегаринам, мы вы-
делям два подотряда Archigregarinina и Neogregarinina.
Сложным является вопрос о системе отряда Eugre-
garinida — самой многочисленной группы грегарин.
Так, Грассе, отмечая, что система этого отряда на-
ходится «в болезненном состоянии», указывает на не-
возможность выделения каких-либо естественных
таксономических группировок крупнее семейства.
Отказываясь от выделения подотрядов, основанного
на наличии или отсутствии у трофозоитов септы, под-
разделяющей тело на протомерит и дейтомерит, Грас-
се тем не менее считает важным расположить семейст-
ва грегарин в порядке, отражающем их эволюцию.
Наиболее правильной, с его точки зрения, является
классификация на основе систематического положе-
ния хозяев, поскольку грегарины эволюционировали
вместе с ними. Поэтому семейства эугрегарин рас-
сматриваются в направлении от паразитов морских ан-
нелид к паразитам насекомых. Следует заметить, что
такая последовательность неплохо коррелирует и с
усложнением морфологии трофозоитов, хотя при по-
добном подходе в состав семейства, включающего
преимущественно моноцистидные формы, могут попа-
дать и полицистидные (например, Sycia и Metamera в
составе сем. Lecudinidae). Грегарин, для которых не-
возможно точно указать место в его системе (Diplocys-
tis, Lankesteria (= Ascogregarina) culicis и др.), Грассе
рассматривает отдельно как грегарин неясного поло-
жения.
В системе эугрегарин, предлагаемой Левайном, на-
против, выделяются подотряды Blastogregarinorina,
Aseptatorina и Septatorina. Последние два таксона вы-
делены на основании признака наличия или отсутст-
вия септы, хотя этот признак не всегда является посто-
янным и может изменяться в обе стороны в процессе
развития трофозоита (см. выше). Внутри подотряда
Septatorina выделены четыре надсемейства, одно из ко-
торых — гетероксенные Porosporicae, а три других —
моноксенные и различаются по особенностям сизиги-
ев. Надсем. Gregarinicae включает в себя грегарин с
ранними сизигиями, надсем. Stenophoricae — с позд-
ними, а надсем. Fusionicae выделено на основе слия-
ния гамонтов в сизигии с полным объединением цито-
плазмы.
К сожалению со времени выхода в свет обзора
Грассе сам подход и основанная на нем система, кото-
рая кажется более естественной, чем система Левайна,
не применялись в крупных сводках и соответственно
не имели развития. С тех пор было описано и выделено
множество новых родов и семейств грегарин, которые
затруднительно привести в полное соответствие с сис-
темой Грассе без дополнительных данных. Поэтому в
настоящем издании принято деление Eugregarinida на
подотряды Aseptata и Septata, а в подотряде Septata
рассматриваются те же надсемейства, что и в системе
Левайна.
В соответствии с принятым подходом произведены
соответствующие таксономические операции, указан-
ные в разделе «Классификация».
В отношении предлагаемых ниже в разделе «Сис-
тематический обзор» диагнозов отрядов и подотрядов
грегарин необходимо подчеркнуть, что, поскольку при
нынешнем уровне изученности дать исчерпывающие
характеристики этих таксонов невозможно, мы не пы-
таемся полностью охарактеризовать всю группу, а ха-
рактеризуем только ее ядро—для этой цели многие из
критериев, перечисленных в табл. 1, вполне пригодны.
Наиболее существенные оговорки включены в состав
диагнозов, хотя это и делает их несколько расплывча-
тыми. Несовпадающие конгруэнтные наборы призна-
ков позволяют достаточно хорошо различать таксоны
одного ранга, что частично компенсирует нечеткость
отдельных критериев.
ТИП SPOROZOA. КЛАСС GREGARINEA
87
Систематический обзор
Класс Gregarinea Dufour, 1828
(= Gregarinae Haeckel, 1866; Gregarinomorpha Grasse, 1953;
Gregarinasina Dufour, 1828 in: Levine et aL, 1980)
Паразиты беспозвоночных и низших хордовых.
Мужские и женские гамонты объединяются в сизигий,
образуется гаметоциста. Гаметогенез протекает сход-
но у обоих полов; образованию гамет обоих полов
предшествуют Прогамные ядерные деления; обычна
анизогамия или изогамия; гамонты продуцируют рав-
ные количества мужских и женских гамет. Зиготы
формируют ооцисты внутри гаметоцист.
Отряд Schizogregarinida L6ger, 1900
Трофозоиты моноцистидные. Эпицит и скользящее
движение отсутствуют. Часто сохраняется мукрональный
(апикальный) комплекс — целиком или большая часть
элементов. В жизненном цикле обычна мерогония.
Подотряд Archigregarinina Grass6, 1953
Гамонты имеют план строения инвазионных ста-
дий (зоитов) в гипертрофированном варианте. Хорошо
развит мукрональный комплекс, играющий роль цито-
стома. Пелликула лишена эпицитарных гребней, часто
формирует широкие продольные складки, обусловли-
вающие продольную исчерченность; хорошо развиты
продольные субпелликулярные микротрубочки, рас-
положённые регулярно, обычно в несколько слоев.
Прогамные ядерные деления начинаются до инцисти-
рования сизигия. Характерно ундулирующее движе-
ние. Мерогония есть либо отсутствует. Кишечные па-
разиты полихет и других морских беспозвоночных.
Примечание. Поскольку ультраструктура изучена в той или
иной мере только у представителей родов Selenidium и Ditrypano-
cystis, остальные представители архигрегарин включены сюда на
основании «обоснованных предположений» (Schrevel, 1971b).
Все архигрегарины — исключительно паразиты пищева-
рительного тракта морских беспозвоночных: в основном полихет
(около 40 видов), но встречаются также и в сипункулидах (6 ви-
дов), иглокожих (1 вид), кишечнодышащих (1 вид), асцидиях
(2 вида).
Сем. Selenidiidae Brasil, 1907
Трофозоиты листовидные или цилиндрические с
продольной исчерченностью; тело часто изогнуто или
в форме полумесяца. Передний конец содержит палоч-
ковидные окрашиваемые тельца, возможно являющи-
еся роптриями. Мерогония, если есть, в эпителиаль-
ных клетках кишечника хозяина. Гамонт развивается
внеклеточно. Сизигии обычно каудальные. Ооцисты
сферические или эллипсоидальные, содержат от 4 до
множества спорозоитов.
Примечание. Таксономические перестановки, предприня-
тые Левайном (Levine, 1971b) в отношении сем. Selenidiidae и рода
Selenidium, кажутся малообоснованными. Таксономическая пози-
ция и состав сем. Selenidiidae в настоящем издании рассматривают-
ся в понимании Грассе и в соответствии с подходом Шревеля
(Grasse, 1953; Schrdvel, 1971b).
Род Selenidium Giard, 1884 (рис. 8; 11, А, Б;
12, A; 20, a; 25, 7; 29, 7; 36, 7-4)
(= Selenidioides Levine, 1971)
Гамонты с признаками отряда и семейства. Движе-
ние ундулирующее или скручивающееся. Сизигии ка-
удальные; прогамные ядерные деления начинаются до
инцистирования сизигия. Ооцисты, как правило, с
4 спорозоитами. Мерогония, если есть, — путем пря-
мого распада меронта на множество мерозоитов.
В кишечнике полихет сипункулид, полухордовых и
асцидий. Описано около 55 видов.
Типовой вид Selenidium pendula Giard, 1884.
Типовой хозяин: Nerine cirraiulus (Polychaeta:
Spionidae).
Примечание. 1. Ооцисты S. potamillae могут содержать 4,
6, 8 или 10 спорозоитов. 2. Один из видов — S. vivax Gunderson et
Small, 1986 — способен к сильной метаболии, что резко отличает
его от остальных представителей рода, а структура поверхности
сближает этот вид с Digyalum oweni (см. ниже).
Род Meroselenidium Mackinnon et Ray,
1933 (рис. 25, 2)
Мерогония с формированием многоядерных от-
дельностей — цитомеров, распадающихся на мерозои-
ты. Ооцисты с поперечными гребнями, содержат более
16 спорозоитов.
Описан 1 вид из кишечника полихет.
Типовой вид Meroselenidium keilini Mackinnon
et Ray, 1933.
Типовой хозяин: Potamilla reniformis (Poly-
chaeta: Sabellidae).
Род Selenocystis Dibb, 1938 (рис. 34, 5)
Трофозоиты листовидные. Сизигии каудальные,
один из гамонтов прикреплен к стенке кишечника. Га-
метоцисты удлиненные, грушевидные, прикреплены к
кишечной клетке хозяина раздвоенной или разветв-
ленной ножкой, сформированной модифицированным
мукроном. Ооцисты сферические с 4 или 8 спорозоита-
ми. Мерогония отсутствует.
Описан 1 вид из кишечника полихет.
Типовой вид Selenocystis foliata (Ray, 1930)
Dibb 1938 (= Selenidium sp. Caullery et Mesnil, 1899; Ha-
plozoon sp. Mesnil, 1917; Selenidium foliatum Ray, 1930).
Типовой хозяин: Scolelepis fuliginosa (Poly-
chaeta: Spionidae).
88
ALVEOLATA
Рис. 36. Архигрегарины.
I — Selenidium terebellae, 2 — S. hollandei, 3 — 5. penna-
tum, 4 — S. pendula (сизигий), 5 — Selenocystis foliata
(a — сизигий; 6—d — стадии созревания гаметоцисты).
(/, 2, 4, 5 — no: Schrevel, 1970а; 3 — по: Симдянов,
1992).
Fig. 36. Archigregarines.
Род Мегодгедаппа Porter, 1908
Трофозоиты моноцистидные. Продольная исчер-
ченность ограничена передней областью тела — от
мукрона до ядра. Ооцисты овоидные, содержат 8 спо-
розоитов.
Описан 1 вид из кишечника колониальных асцидий.
Типовой вид Merogregarina amaroucii Porter,
1908.
Типовой хозяин: Amaroucium sp. (Tunicata: As-
cidiacea).
Род Ditrypanocystis Burt, Denny
et Thomasson, 1963
Гамонты червеобразные, расширяющиеся кпереди;
с продольными пелликулярными складками, 2—4 из
которых увеличены и вытянуты в виде ундулирующих
ТИП SPOROZOA. КЛАСС GREGARINEA
В9
мембран, которые начинаются сразу позади мукрона и
тянутся назад вдоль тела. По бокам каждой ундулиру-
ющей мембраны имеются менее выраженные складки,
по размеру промежуточные между ундулирующей
мембраной и остальными складками.
Описано 2 вида.
Типовой вид Ditrypanocystis cirratuli Burt,
Denny et Thomasson, 1963.
Типовой хозяин: Cirriformia (= Audoinia) ten-
taculata (Polychaeta: Cirratulidae).
Род Digyalum Koura, Grahame,
Owen et Kamel, 1990
Грегарины Digyalum oweni паразитируют в средней
кишке брюхоногого моллюска Littorina obtusata. Опи-
саны только трофозоиты, имеющие грушевидную фор-
му тела. Передняя, расширенная часть несет два кар-
мановидных впячивания и короткий хоботок, с по-
мощью которого грегарины прикрепляются к стенке
кишечника хозяина. Поверхность трофозоитов покры-
та чередующимися бороздами и складками, напоми-
нающими таковые у многих архигрегарин, но распо-
ложенными не в продольном, а в поперечном направ-
лении. Следует заметить, что сходное строение
поверхности имеют также трофозоиты одного из ви-
дов рода Selenidium — Selenidium vivax (см. приме-
чание 2 к роду Selenidium), способные к сильной ме-
таболии (Leander et al., 2003b).
Исследования ультраструктуры выявили ряд осо-
бенностей, также сближающих Digyalum с архигрега-
ринами (Dyson et al., 1993, 1994, 1995). В мукрональ-
ной области Digyalum oweni найдены некоторые орга-
неллы апикального комплекса — полярное кольцо, к
основанию которого примыкает конус из фибрилляр-
ного материала, в цитоплазме — многочисленные об-
разования, похожие на роптрии, протоки которых про-
ходят через полярное кольцо и, по-видимому, откры-
ваются наружу (рис. 37). В отличие от архигрегарин
рода Selenidium у Digyalum не найден коноид, нет мук-
рональной вакуоли, а в цитоплазме не обнаружено ни-
какой фосфатазной активности.
Специальных исследований тонкого строения по-
верхности Digyalum oweni не проводилось, но на опуб-
ликованных микрофотографиях полностью отсутствует
характерная для эугрегарин структура эпицита, хотя
вследствие мелкого масштаба не удается идентифициро-
вать и характерные для архигрегарин субпелликулярные
микротрубочки, подстилающие складки покровов.
Авторы первоописания Digyalum oweni не указали
его принадлежность к какому-либо таксону грегарин.
Клоптон (Clopton, 2000) на основании особенностей
уш.траструктуры предварительно помещает род Digy-
alum В сем. Selenidiidae (правда, в соответствии с под-
ходом Левайна — т. е. в отряд Eugregarinida), указы-
iiiiii, что необходимы дополнительные исследования.
11с возражай против самой сути сближения Digyalum с
Scletiidiidae, мы гем не менее считаем неприемлемым
включать в отряд Eugregarinida как род Digyalum, так и
сем. Selenidiidae в целом, о чем уже неоднократно упо-
миналось. При этом следует признать, что определен-
ная близость в строении Selenidium и Digyalum служит
Рис. 37. Схема строения переднего конца Digyalum oweni. (По: Dy-
son et al., 1993).
кфм — конус из фибриллярного материала, мт — субпелликулярные мик-
ротрубочки, пк — полярное кольцо, рп — роптрии, фм — фибриллярный
материал.
Fig. 37. Diagram of ultra-thin organization of the anterior part of Digy-
alum oweni.
кфм — conical «polar ring extensions» formed by fibrillar matter, мт — subpel-
licular microtubules, пк — polar ring, pn — rhoptries, фм — fibrillar matter.
действительно веским доводом в пользу их сближе-
ния. Однако отсутствие коноида в мукрональном ком-
плексе и мукрональной вакуоли заставляет думать, что
мукрон Digyalum в отличие от Selenidium не выполняет
функцию клеточного рта. Возможно, более корректным
было бы выделение рода Digyalum в отдельное се-
мейство (может быть, вместе с «Selenidium» vivax) по
крайней мере до появления сколько-нибудь полной
информации по ультраструктуре других родов архи-
грегарин. Поскольку подобные таксономические опе-
рации невозможны в рамках справочного издания,
мы ограничиваемся этим замечанием и уточнением
диагноза.
Трофозоиты грушевидные; передний конец расши-
ренный, с двумя кармановидными впячиваниями и
мукроном в форме короткого хоботка; мукрональный
комплекс состоит из полярного кольца и роптрий с
протоками, проходящими через него; эпицит отсутст-
вует; поверхность покрыта поперечными складками
пелликулы; трофозоиты способны к несильной мета-
болии (пульсация, скручивание), поступательное дви-
жение отсутствует. Другие стадии жизненного цикла
неизвестны.
Монотипический род.
Типовой вид Digyalum oweni Koura, Grahame,
Owen et Kamel, 1990.
Типовой хозяин: Littorina obtusata (Gastropo-
da: Monotocardia).
Archigregarinina incertae sedis
Сем. Exoschizonidae Levine, 1971
Мерогония экстрацеллюлярная, мерозоиты фор-
мируются как связка на переднем конце меронта. Га-
монты, сизигии, гаметоцисты, гаметы и ооцисты не-
известны.
Семейство монотипическое.
90
ALVEOLATA
Рис. 38. Exoschizon siphonosomae Hukui, 1939. (По: Hukui, 1939).
a — общий вид, б, в — стадии мерогонии.
Fig. 38. Exoschizon siphonosomae Hukui, 1939.
a — general view, б, в — stages of merogony.
Род Exoschizon Hukui, 1939 (рис. 38)
С признаками семейства.
Монотипический род, описанный из кишечника си-
пункулиды.
Типовой вид Exoschizon siphonosomae Hukui, 1939.
Типовой хозяин: Siphonosoma kumanense (Si-
punculida).
Примечание. Этот род включен Левайном (Levine, 1971) в
состав архигрегарин на основании внешнего сходства трофозоитов
Exoschizon и Selenidium и наличия хотя и довольно своеобразно
протекающей, но все же мерогонии в жизненном цикле. В литера-
туре существуют и другие точки зрения на этот вопрос. Так, Грассе
рассматривает эти организмы как Sporozoa incertae sedis, отмечая,
что их принадлежность к какой-либо определенной Группе споро-
виков можно точно установить только изучив половой процесс
(Grasse, 1953). Боголепова (Боголепова, 1953), напротив, считает
Exoschizon siphonosomae еще одним видом рода Selenidium. Хотя В
данном случае мы присоединяемся к точке зрения Левайна, все же
следует иметь ввиду, что сближение Exoschizon с архигрегаринами
носит сугубо предварительный характер, а для уточнения система-
тического положения этих протистов требуются дополнительные
исследования — в первую очередь ультраструктурные и исследо-
вания жизненного цикла.
Подотряд Neogregarinina Grass6, 1953
Мукрональный комплекс трофозоитов, если есть,
сохраняется не полностью и не выполняет функцию
цитостома. Покровы гладкие; субпелликулярные мик-
ротрубочки, если есть, никогда не располагаются не-
сколькими слоями. Прогамные ядерные деления начи-
наются после инцистирования сизигия. Обычно непо-
движны. В жизненном цикле всегда есть мерогония,
иногда разных типов. Паразиты насекомых.
Подотряд включает в себя 5 семейств.
Часть семейств неогрегарин (Schizocystidae, Caulle-
ryellidae, Ophryocystidae) паразитирует в кишечнике
хозяев, как и большинство других грегарин. Два дру-
гих семейства — Syncystidae и Lipotrophidae целиком
перешли к внутриклеточному паразитизму в ткани жи-
рового тела хозяина.
Неогрегарины представляют собой, по всей видимости,
сборную группу (см. раздел «Эволюция и филогения»).
Сем. Schizocystidae L6ger et Duboscq, 1908
Развитие внеклеточное; трофозоиты крупные с
продольной исчерченностью. Ядерные деления проис-
ходят в процессе роста меронта, затем наступает цито-
кинез, в результате которого формируются одноядер-
ные мерозоиты. Молодые гамонты червеобразные. Си-
зигии поздние — образуются непосредственно перед
инцистированием. Гаметоцисты и ооцисты — актино-
цефалидного типа (?). Гаметоцисты сферические;
ооцисты веретеновидные с 8 спорозоитами.
Семейство включает в себя 3 рода с 6 видами, пара-
зитирующих в мальпигиевых сосудах и гемоцеле насе-
комых; один вид отмечен в олигохетах (?).
Род Schizocystis L6ger, 1900 (рис. 39)
Прикрепительный аппарат трофозоитов — неболь-
шие псевдоподии на переднем конце, затем формиру-
ется «присоска». Зрелые меронты червеобразные с
продольной исчерченностью. В результате мерогонии
образуется скопление мерозоитов в виде удлиненной
грозди; молодые мерозоиты каплевидные. Гамонты с
продольной исчерченностью. Сизигии фронтальные.
Анизогамия. Ооцисты биконические с незначительны-
ми утолщёййями на полюсах.
Описано 3 вида из личинок двукрылых и олигохет (?).
Типовой вид SchizocystisgregarinoidesLeger, 1900.
Типовой хозяин: Ceratopogon solstitialis (Di-
ptera: Ceratopogonidae), личинкй.
Род Machadoella Reichenow, 1935
Прикрепительный аппарат трофозОитов в виде
«мукрона». Зрелые меронты и гамонты червеобразные
с продольной исчерченностью. МёрОГбйия в 2 этапа—
вначале меронт распадается на неправильной формы
плазмодии, образующие в Свою очередь неправильной
формы связки мерозоитов; мерозоиты округлые. Сизи-
гии фронтальные. Изогамия. Ооцисты йавикулярные с
утолщениями на полюсах.
Известно 2 вида.
Типовой вид Machadoella triatomae Reiche-
now, 1935.
Типовой Хозяин: Triatoma dimidiata (Hemipte-
ra: Triatomatidae).
Род Lymphotropha Ashford, 1965
Паразиты гемоцеля. Меронты овоидные, с папил-
лой на переднем конце и продольной исчерченностью.
В результате мерогонии формируется до 8 сфериче-
ТИП SPOROZOA. КЛАСС GREGARINEA
91
Рис. 39. Жизненный цикл Schizocystis gregarinoides. (Из: Grasse, 1953; по: Leger, 1910).
а—г: выход спорозоитов из ооцисты, прикрепление и рост меронтов, сопровождающийся увеличением количества ядер; д—ж: мерогония; з—р: гаметого-
ния, в результате которой образуются жгутиковые мужские (о, п) и безжгутиковые женские (р) гаметы, впоследствии копулирующие; с—т — спорогония.
Fig. 39. Life cycle of Schizocystis gregarinoides.
а—-г: releasing of sporozoites, attachment and growth of meronts; д—ж: merogony; з—р: gametogony, in which as result flagellated male (о, n) and flagellum-less fe-
male (p) gametes are formed; c—m — sporogony.
92
ALVEOLATA
ских мерозоитов, лишенных папиллы и исчерченно-
сти. Гаметоцисты с тонкой оболочкой. Изогамия.
Ооцисты в форме лимона, с незначительными поляр-
ными утолщениями.
Род монотипический.
Типовой вид LymphotrophatriboliiAshford, 1965.
Типовой хозяин: Tribolium castaneum (Coleo-
ptera: Tenebrionidae).
ронты округлые. Мерогония проходит по типу шизо-
гонии. Гамонты более или менее бутылевидной фор-
мы. Изогамия. Гаметоцисты продуцируют 8 ооцист.
Ооцисты лишены утолщений и выростов оболочки.
Семейство включает в себя 1 род Caulleryella Kei-
lin, 1914. Большинство представителей паразитирует в
кишечнике личинок двукрылых насекомых (Diptera),
но иногда встречаются в куколках и имаго (Caulleryel-
la maligna Godoy et Pinto, 1922).
Сем. Caulleryellidae Keilin,1914
Развитие внеклеточное; прикрепительный аппарат
трофозоитов — «псевдоэпимерит» — хоботок на пе-
реднем конце, погруженный в эпителий хозяина. Ме-
Род Caulleryella Keilin, 1914 (рис. 40)
Признаки семейства. Ооцисты с 8 спорозоитами.
Описано 5 видов.
Рис. 40. Жизненный цикл Caulleryella pipientis.
а, б — трофозоиты; в—е — мерогония; ж—й — гаметогония; к — образование зигот; л—и: спорогония. (Из; Grasse, 1953; по: Buschkiel, 1921).
Fig. 40. Life cycle of Caulleryella pipientis.
a, 6— trophozoites; e—e — merogony; ж—й — gametogony; к — fecundation; л—н: sporogony.
ТИП SPOROZOA. КЛАСС GREGARINEA
93
Типовой вид Caulleryella aphiochaetae Keilin,
1914.
Типовой хозяин: Aphiochaeta rufipes (Diptera:
Phoridae), личинки.
Сем. Ophryocystidae L6ger et Duboscq,
1908
Развитие обычно внеклеточное. Мукрональный
комплекс у трофозоитов отсутствует. Две разнохарак-
терные мерогонии в жизненном цикле и два типа мерон-
тов — неправильной формы мицетоидные и куполо-
видные или конические грегариноидные. Мицетоид-
ные меронты распадаются на многочисленные мелкие
мерозоиты. Грегариноидные делятся продольно на две
или более дочерние клетки. Прикрепительные приспо-
собления — корневидные выросты трофозоитов, при-
крепляющиеся к микровиллям хозяина. Гамонты полу-
сферические или червеобразные. Прогамных ядерных
делений — два; второе деление претерпевает лишь
одно из дочерних ядер, образовавшихся после первого
деления. Каждый гамонт в сизигии формирует лишь
одну гамету — только одно из трех ядер становится га-
метическим. Изогамные. Гаметоциста содержит одну
ооцисту с 8 спорозоитами и остаточное тело.
Семейство включает в себя единственный род Oph-
ryocystis с примерно 14 известными видами, паразити-
рующими в мальпигиевых сосудах жуков, за исключе-
нием Ophryocystis elektroscirrha, поражающего гипо-
дерму бабочек (у этого вида, кроме того, описана
внутриклеточная мерогония).
Род Ophryocystis Schneider, 1883
(рис. 25, 23; 41)
Диагноз семейства.
Типовой вид OphryocystisbiitschliiSchneider, 1883.
Типовой хозяин: Blaps sp. (Coleoptera: Tene-
brionidae).
Сем. Lipotrophidae Grass6, 1953
Внутриклеточные паразиты; преимущественно в
ткани жирового тела насекомых, но иногда встречают-
ся в гиподерме, мальпигиевых сосудах и кишечнике.
В жизненном цикле часто два разнокачественных типа
мерогонии — микронуклеарная и макронуклеарная;
мерогония обычно по типу шизогонии; мерозоиты
типичного строения. Гамонты сохраняют упрощенный
мукрональный комплекс, сизигии ранние, «коноид
к коноиду» (фронтальные). Оболочка гаметоцисты
гонкая. Изогамные. Ооцисты веретеновидные, бико-
нические, навикулярные, лишенные игл и шипов, ино-
гда с утолщениями на полюсах, обычно с 8 спорозои-
тами.
Семейство включает в себя 19 видов, относящихся
к 6 родам.
Род Lipotropha Keilin, 1923 (рис. 42, 1)
Мерогония только одного типа. В гамегоцисте форми-
руется примерно 16 ооцист. Ооцисты веретеновидные, без
полярных утолщений, содержат по 8 спорозоитов.
Описано 5 видов. Паразиты жирового тела жуков и
двукрылых.
Типовой вид LipotrophamacrosporaKeilin, 1923.
Типовой хозяин: Systenus adpropinquans (Dip-
tera: Dolichopodidae).
Род Lipocystis Grell, 1938
Два типа мерогонии в жизненном цикле — мик-
ронуклеарная (повторяется несколько раз) и макронук-
леарная. Микронуклеарные меронты амебоидные,
мерозоиты банановидные; макронуклеарные меронты
округлые, мерозоиты грушевидные или каплевид-
ные. Гамонты округлые. В гаметоцисте формируется
порядка 200 навикулярных ооцист с утолщениями
на полюсах, каждая из которых содержит 8 спорозо-
итов.
Род монотипический.
Типовой вид Lipocystispolyspora Grell, 1938.
Типовой хозяин: Panorpa communis (Insecta:
Mecoptera).
Род Farinocystis Weiser, 1953 (рис. 21, 2)
(= Triboliocystis Dissanaike, 1955)
Два типа мерогонии в жизненном цикле — микро-
нуклеарная и макронуклеарная. Микронуклеарные ме-
ронты удлиненные или округлые; макронуклеарные
меронты грушевидные, веретеновидные или овоид-
ные. Гамонты в сизигии полусферические. В гамето-
цисте формируется 16 ооцист. Ооцисты имеют форму
лимона, с пробочками на полюсах, содержат по 8 спо-
розоитов.
Описано 2 вида из жирового тела личинок жуков.
Типовой вид Farinocystis tribolii Weiser, 1953
(= Triboliocystis garnhami Dissanaike, 1955).
Типовой хозяин: Tribolium castaneum, T. con-
fusum (Coleoptera: Tenebrionidae).
Род Mattesia Naville, 1930 (рис. 42, 2)
Два типа мерогонии в жизненном цикле — микро-
нуклеарная и макронуклеарная. Мерогония внутрикле-
точная. Гамогония внутриклеточная либо внеклеточ-
ная (вследствие обширного лизиса ткани хозяина).
Каждый гамонт формирует по 2 гаметы. Гаметоциста
содержит одно или два остаточных тела и 2 ооцисты.
Ооцисты имеют форму лимона, с пробочками на по-
люсах, содержат по 8 спорозоитов.
Описано 7 видов. Паразиты жирового тела пере-
пончатокрылых, чешуекрылых, жуков и блох; найде-
ны также в гиподерме личинок муравьев, мальпигие-
94
ALVEOLATA
Рис.
41. Грегарины сем. Ophryocystidae. (По:
Leger, 1907).
1 — жизненный цикл Ophryocystis'. а — спорозоит в
просвете кишечника, миграция в мальпигиев сосуд и
прикрепление к эпителию; б — фазы развития мицето-
идного меронта: прикрепление к эпителию корневид-
ными отростками и формирование большого количест-
ва ядер; в — мицетоидная мерогония; г — молодой од-
ноядерный меронт; д, е — грегариноидная мерогония;
ж — гамонты; з — сизигий; и, й — гаметоциста, в кото-
рой каждое из ядер гамонтов претерпевает первый прогамный митоз, а затем лишь одно из дочерних ядер претерпевает второй прогамный митоз, так что в
каждой клетке образуется по три ядра; к — формирование в каждой клетке единственной гаметы (г) вокруг одного из дочерних ядер второго прогамного ми-
тоза — остальные ядра остаются соматическими (ся); л — образование зиготы (зн); м — развивающаяся ооциста (рц); н — выход спорозоитов из ооцисты в
новом хозяине; 2 — мицетоидные (а—г) и грегариноидные меронты (б, е) Ophryocystis hagenmiilleri в мальпигиевом сосуде Olocrates gibbus (поперечный
срез).
Fig. 41. Gregarines of family Ophryocystidae.
1 — life cycle of Ophryocystis'. a — sporozoite in gut lumen, migration to malpighian tubule and attachment to epithelium; 6 — developmental stages of mycetoid me-
ront: attachment to epithelium with rhizoidal processes and yielding of great number of nuclei; e — mycetoid merogony; г — young mononucleate meront; d, e — gre-
garinoid merogony; ж — gamonts; з — syzygy; и, й — gametocyst in which one nucleus of each gamont divides followed by division of only one daughter nucleus to
yield three nuclei in each cell; к — gametes (a) formation, somatic nuclei (ся); л — zygote (зи); м — developing oocyst (оц); и — sporozoite release in new host; 2 —
Mycetoid (a—г) and gregarinoid meronts (d, e) Ophryocystis hagenmiilleri in the malpighian tubule of Olocrates gibbus (cross-section).
ТИП SPOROZOA. КЛАСС GREGARINEA
95
Рис. 42. Жизненные циклы грегарин сем. Lipotrophidae.
1 — жизненный цикл Lipotropha macrospora — внутриклеточно-
го паразита жирового тела личинок Systenus sp. (Diptera); а, б —
молодые трофозоиты; в—е — мерогония; ж—и — гаметогонии;
й — зиготы; к, л — спорогония, путь заражения хозяев ооцистами
не исследован; 2 — жизненный цикл Mattesia dispora — внутри-
клеточного паразита жирового тела гусениц Anagosta (=Ephestia)
ktihniella (Lepidoptera): a — выход спорозоитов из ооцисты; б —
спорозоит; в—е— первая (микронуклеаряая) мерогония; ж—з —
вторая (макронуклеарная) мерогония; и — молодые гамонты;
й—и — гаметогонии; о — формирование зигот; п—у — спорого-
ния. (/ — по: Keilin, 1923; 2 — по: Naville, 1930).
Fig. 42. Life cycles of Lipotrophidae.
I — life cycle of Lipotropha macrospora — intracellular parasite of fat body of dipteran larva of Systenus sp.: a, 6 — young trophozoites; в—e — merogony; ж—и —
gamogony; it — zygotes; к, л — sporogony, the pathway for infection via oocysts is unknown. 2 — life cycle of Mattesia dispora — intracellular parasite of fat body of
caterpillars of Anagosta (=Ephestia) kiihniella (Lepidoptera): a — sporozoites release from oocyst; 6 — sporozoite; e—e — first (micronuclear) merogony; ж—з —
second (macronuclear) merogony; и — young gamonts; ii—n — gamogony; о zygotes formation; n—у — sporogony.
96
ALVEOLATA
вых сосудах блох и чешуекрылых, в кишечнике че-
шуекрылых.
Типовой вид Mattesia dispora Naville, 1930.
Типовой хозяин: личинки и имаго Anagosta
(= Ephestia) kiihniella, Plodia interpunctella (Lepidopte-
ra: Pyralidae).
Род Menzbieria Bogoyavlensky, 1922
Паразиты кишечного эпителия. Два типа мерого-
нии в жизненном цикле. Мерогония первого типа —
путем шизогонии; мерозоиты удлиненные, один конец
закругленный, другой заостренный. При мерогонии
второго типа амебоидные мерозоиты формируются эн-
догенно в теле меронта и затем превращаются в гамон-
тов. Гаметоцисты с остаточным телом, содержат мно-
гочисленные ооцисты. Ооцисты овоидные с обрублен-
ными утолщенными полюсами.
Описано 2 вида из жуков и водяных клещей.
Типовой вид Menzbieria hydrachnae Bogoyav-
lensky, 1922.
Типовой хозяин: Hydrachna sp. (Acariformes:
Hydracarina).
Примечание. Грассе (Grasse, 1953) рассматривает род Men-
zbieria среди Neogregarina incertae sedis, отмечая при этом сходство
гамогонии с таковой у Lipotropha. Левайн (Levine, 1985, 1988) от-
носит этот род к сем. Lipotrophidae.
Сем. Syncystidae Schneider, 1886
Развитие в основном внутриклеточное. В результа-
те мерогонии, протекающей по типу шизогонии, фор-
мируется более 100 мерозоитов типичного строения.
Гамонты сохраняют упрощенный мукрональный ком-
плекс, объединяются в сизигии на стадии слегка по-
дросших мерозоитов, не «коноид к коноиду». Изогам-
ные. В гаметоцисте от 30 до 150 ооцист с 8 спорозои-
тами каждая. Ооцисты навикулярные, вооружены 3—
4 полярными иглами и иногда экваториальными иг-
лами.
Семейство включает в себя единственный род Syn-
cystis с 2 известными видами, паразитирующими в жи-
ровом теле клопа — водяного скорпиона (Nepa cine-
геа) и жировом теле, гемоцеле и кишечных жабрах ли-
чинок стрекозы Aeschna.
На основании сходства морфологии ооцист Грассе
(Grasse, 1953) предполагает происхождение Syncystis
от представителей подсем. Acanthosporinae (Eugregari-
nida: Actinocephalidae). Моноцистидное тело и нали-
чие мерогонии в жизненном цикле трактуются как вто-
ричные изменения.
Род Syncystis Schneider, 1883
(рис. 43)
Признаки семейства.
Типовой вид Syncystis mirabilis Schneider,
1883.
Типовой хозяин: Nepa cinerea (Hemiptera: Ne-
pidae).
Рис. 43. Стадии жизненного цикла неогрегарины Syncystis mirabi-
lis. (По: Steopoe, 1928).
а—в — стадии мерогонии, г — гамонт, д — сизигий, е — гаметоци-
ста с ооцистами.
Fig. 43. Stages of life cycle of a neogregarine Syncystis mirabilis.
a—в — stages of merogony, г — gamont, d — syzygy, e — gametocyst contai-
ning oocysts.
Neogregarinina incertae sedis
Род Tipulocystis Kramar, 1950
Зрелые меронты бесформенные («мицетоидные»),
мерогония проходит эндогенно (мерозоиты формиру-
ются внутри меронта). Гаметоциста формирует 1 ооцис-
ту с 8 спорозоитами.
Монотипический род. В кишечнике комаров-дол-
гоножек (Tipulidae).
Типовой вид Tipulocystis maximaeKramar, 1950.
Типовой хозяин: Tipulamaxima(Diptera:Tipulidae).
Примечание. Таксономическое положение этого рода
спорно. Грассе (Grasse, 1953) относит его к Neogregarina incertae se-
dis, указывая на сомнительность данных, касающихся «мицетоид-
ных шизонтов», и необходимость дальнейших, более тщательных
исследований. Левайн (Levine, 1985, 1988) тем не менее помещает
его в сем. Caulleryellidae. Сходство весьма поверхностное и заклю-
чается главным образом в существовании прикрепительного хо-
ботка («псевдомерита») у трофозоитов.
Род Coelogregarina Ghelelovitch, 1948
К этому роду относится единственный вид — Coe-
logregarina ephestiae Ghelelovitch, 1948, паразитирую-
щий в гемоцеле гусениц Ephestia kiihniella и Galleria
mellonella (Lepidoptera: Pyralidae).
рис. и. морфология грегарин
А, Б-архигрегарины; эУг₽егаРИНЬ1’]^т^£р°^д0”ейис/Х^ г”—этицитарные гребни Lecudina pelludda.
^1’^o'Thology^gg^^^ij^fj^n^mpennafum,^ —anterior part oftrophozoite of Леси-
А, Б - archigregarines; В, Г— eugregarines; А - d™^^foids of Lecudina pellucida.
Рис. 12. Ультраструктура грегарин.
А — строение переднего конца архигрегарины Selenidium orientale (продольный срез): кх — клетка хозяина, ап — амилопектиновые зерна, ко — коноид,
мв — мукрональная вакуоль, мт — микротрубочки, прп — проток роптрии, рп — роптрии, смт — субпелликулярные микротрубочки; Б — строение перед-
него конца молодого трофозоита эугрегарины Lecudinapellucida (продольный срез): кх — клетка хозяина, зк — зона контакта между паразитом и клеткой хо-
зяина, м — мембрана фибриллярной зоны, фз — фибриллярная зона. (По: Schrevel, Vivier, 1966, с изменениями); В—ультраструктура асептатной эугрегари-
ны Gen. sp. из кишечника полихеты Phyllodoce citrina (поперечный срез): аг — аппарат Гольджи, ап — амилопектиновые зерна, в — вакуоли, мт — кольце-
вые кортикальные микротрубочки, эг — эпицитарные гребни; Г— ультраструктура покровов той же грегарины (поперечный срез): пе — пелликула, пс —
подстилающий слой; Д— строение вершины эпицитарного гребня той же грегарины (поперечный срез): аа — апикальные арки, аф — апикальные филамен-
ты, вмк — внутренний мембранный комплекс пелликулы, гли — гликокаликс, пм — плазматическая мембрана (плазмалемма); Е — ультраструктура корти-
кальной зоны Lankesteria cyrtocephala (поперечный срез): мп — микропора, мц — мукоцисты (?), эг — эпицитарные гребни, эс — экструзия слизи (?).
Fig. 12. Fine structure of gregarines.
A — organization of the anterior part of an archigregarine Selenidium orientale (longitudinal section); кх — host cell, an — amylopectin granules, ко — conoid, мв —
mucronal vacuole, мт — microtubules, npn — rhoptry ductule, pn — rhoptry, смт — subpellicular microtubules; Б — organization of the anterior part of young trop-
hozoite of an eugregarine Lecudina pellucida (longitudinal section): кх — host cell, зк—zone of contact between the parasite and the host cell, м — membrane of fibril-
lar zone, фз — fibrillar zone; В — fine structure of an aseptate eugregarine Gen. sp. from intestine of polychaete Phyllodoce citrina (cross-section): аг — dyctiosomes,
an — amylopectin granules, в — vacuoles, мт — circular cortical microtubules, эг — epicytic folds; Г— fine structure of cortex of the same gregarine (cross-section):
ne — pellicle, nc — internal lamina; Д— organization of an epicytic fold apex of the same gregarine (cross-section): aa — rippled dense structures, аф — apical fila-
ments, вмк — cortical cytomembranes, гли — cell coat, пм — plasma membrane; E — fine structure of cortical zone of Lankesteria cyrtocephala (cross-section): мп —
micropore, мц — mucocysts (?), эг — epicytic folds, эс — extrusion of mucus (?).
f
Рис. 55. Строение ооцист кокцидий.
1,2 — начало споруляции в ооцистах рода Eimeria; 3—5 — спорулированные ооцисты Eimeria intestinalis (3), Е. coecicola (4), Е. magna (5); 6— Cystoisospora
felis (фото И. И. Вершинина); 7 — Sarfocystis disperse в кишечнике кошки (препарат Z. Cerna); 8, 9 — Hepatozoonfusifex в полости тела комара Culex tarsalis
(препарат G. Ball). 1—6 — нативные препараты; 7—9 — окраска гематоксилином и эозином; мк — микропиле, оо — ооциста, от — остаточное тело, сп — спо-
розоит, спр — сгторонт, сц — спороциста, я — ядро.
Fig. 55. Coccidian oocysts.
1, 2 — early sporulation in oocysts of Eimeria; 3—5 — sporulated oocysts of Eimeria intestinalis (3), E. coecicola (4), E. magna (5); 6 — Cystoisospora felis', 7—Sar-
cocystis dispersa in the cat intestine; 8,9 — Hepatozoon fusifex in the body cavity of Culex tarsalis. I—6 — native preparations; 7—9 — eosin and haematoxylin stai-
ning; мк — micropyle, oo — oocyst, от — residual body, cn — sporozoite, cup — sporont, сц — sporocyst, я — nucleus.
Рис. 56. Строение ооцист кокцидий (продолжение).
10 — ооцисты Klossia из лисицы (фото В. Големанского); II — ооциста Klossia из кошки (фото И. Г. Галузо); 12,13 — ооцисты и спороцисты Sarcocystis bo-
vicanis из кишечника собаки (фото И. И. Вершинина). 10 а 11 X 1600.
Fig. 56. Coccidian oocysts (continuation).
10 — oocysts of Klossia from the fox; 11 — oocyst of Klossia from the cat; 12, 13 — oocysts and sporocysts of Sarcocystis bovicanis from the dog intestine.
Рис. 59. Ультраструктурная организация зоитов кокцидий.
/ — спорозоит Eimeria nocens (фото А. К. Понизовского); 2, 3 — цистозоиты (брадизоиты) Toxoplasma gondii на продольном (2) и поперечном (3) срезах
(фото Е. Scholtyseck); 4 — мерозоит Т. gondii в эпителии кишечника кошки (по: Ferguson et al., 1975); 5 — фрагмент кристаллоида в цитоплазме эритроцитар-
ного мерозоита/Сядуо/уугм' sp. (по: Beyer et al., 1983); а — амилопектин, аг — аппарат Гольджи, к — коноид, м — митохондрии, мн — микронемы, мп — микро-
нора, мпфв — мембрана паразитофорной вакуоли, пе — пелликула, пнт — парануклеарное тело, ппк — переднее полярное кольцо, пфв — паразитофорная ва-
куоль, р — роптрии, смт — субпелликулярные микротрубочки, я — ядро, яд — ядрышко.
Fig. 59. Ultrastructural organization of coccidian-zoites.
/ - sporozoites of Eimeria nocens; 2, 3 — cystozoites (bradyzoites) of Toxoplasma gondii on longitudinal (2) and cross (3) sections; 4 — merozoite of T gondii in the
cut cnterocyte; 5 — a fragment of crystalline body (crystalloid) in the cytoplasm of erythrocytic merozoite of Karyolysus sp.; a — amylopectin, аг — Golgi complex,
Л' conoid, м — mitochondrion, мн — micronemes, мп — micropore, мпфв — membrane of parasitophorous vacuole, не — pellicle, пнт — paranuclear body, ппк —
anterior polar ring, пфв — parasitophorous vacuole, p — rhoptries, смт — subpellicular microtubules, я — nucleus, яд — nucleolus.
Рис. 60. Ультраструктурная организация зоитов кокцидий (продолжение). (По: Beyer et al., 1983).
6— 8 — зоиты Karyolysus sp. из семенников скальных ящериц Lacerta nairensis: 6 — передний конец зоита; 7 — средняя часть тела зоита; 7а — микропора;
8 — продольный срез зоита; а — амилопектин, вмк — внутренний мембранный комплекс, кр — кристаллоид, мн — микронемы, мп — микропора, нмп — на-
ружная мембрана пелликулы, пкк — преконоидальные кольца, ппк — переднее полярное кольцо, р — роптрии, смт — субпелликулярные микротрубочки,
я — ядро, яд — ядрышко.
Fig. 60. Ultrastructural organization of coccidian zoites (continuation).
6—8 — zoites of Karyolysus sp. from testis of the rock-lizard Lacerta nairensis: the apical end (6); middle part (7); longitudinal section (S); a — amylopectin, вмк — in-
ner membrane complex, кр — crystalloid, мн — micronemes, мп — micropore, нмп — outer pellicle membrane, пкк — preconoidal rings, ппк — anterior polar ring, p —
rhoptries, смт — subpellicular microtubules, я — nucleus, яд — nucleolus.
Рис. 61. Ультрасгрук।урпая организация зоитов кокцидий {продолжение).
- о Hlivtidocmtisi sthenelais (По' Porchet-Hennere, 1972), 10 — Karyolysus sp. (По: Beyer
9, 10 - кристаллоид в цитоплазме зоитов KOK.onan^^^/hfe « ?пелликула. \>0 - роптрии. X 30 000.
Fig. 61. infrastructural organization of coccidian zoites {continuation).
9 10- crystalline body in the cytoplasm of coccidian zoites: 9 - Dehonua (- Rhytidocystis) sthenelais, 10 - Karyolysus sp.; к - conoid, мн - micronemes, ne -
' } pellicle, po — rhoptnes.
Рис. 62. Ультраструктурная организация зонтов кокцидий (продолжение).
11, 12 — молодые трофозоиты Coelotropha durchoni (фото Е. Неппегё, 1965): 11 — в мышечной клетке, 12 — в клетке целома; м — митохондрии, мн — мик-
ронемы, пе — пелликула, яо — ядерная оболочка, я — ядро, яд — ядрышко. X 8800.
Fig. 62. Ultrastructural organization of coccidian zoites (continuation).
11, 12 — young trophozoites of Coelotropha durchoni: in muscle cell (11), in coelomic cell (72); м — mitochondrion, мн — micronemes, ne — pellicle, яо — nuclear
envelope, я — nucleus, яд — nucleolus.
ТИП SPOROZOA. КЛАСС GREGARINEA
97
Согласно интерпретации автора (Ghelelovitch, 1948),
спорозоиты выходят из ооцисты в кишечнике хозяина
и проникают сквозь его стенку в гемоцель; сам про-
цесс миграции не наблюдался. Меронты двух типов:
одни развиваются внутриклеточно в клетках жирового
тела, имеют вид плазмодиев и содержат порядка 40 и
более ядер; другие плавают в гемолимфе, число ядер у
них не превышает 8. Внутриклеточные меронты про-
дуцируют веретеновидных гамонтов, выпадающих в
гемолимфу. Гамонты объединяются попарно боковы-
ми сторонами друг к другу. Их ядра сливаются без ка-
ких либо видимых трансформаций. Получившаяся зи-
гота выделяет оболочку и превращается в ооцисту,
внутри которой формируется 8 спорозоитов.
Необычность этого жизненного цикла заключается
в отсутствии прогамных ядерных делений и гологам-
ной копуляции гамонтов. Грассе (Grasse, 1953), лично
просматривавший препараты Гелеловича, предполага-
ет также, что ооцисты и меронты могут принадлежать
различным протестам, паразитирующим в гусеницах.
То же можно сказать и о «гамонтах».
В изданном в 2000 г. «Ап illustrated guide to the Pro-
tozoa», в главе о споровиках (Perkins et al., 2000), род
Coelogregarina объединен с родом Mattesia, по всей
видимости, на основании сходства мерогонии. В на-
стоящем издании, опираясь на изложенные выше сооб-
ражения, мы считаем это преждевременным и вслед
за Грассе рассматриваем Coelogregarina как Neogrega-
rinina incertae sedis.
Род Apicystis Lipa et Triggiani, 1996
Внутриклеточные паразиты жирового тела и, воз-
можно, эпителия средней кишки. В ходе мерогонии
формируются микро- и макронуклеарные меронты.
Ооцисты формируются поодиночке (?). Ооцисты нави-
кулярные, с полярными пробочками, содержат 4 одно-
ядерных спорозоита.
Род монотипический. Паразиты шмелей и пчел.
Типовой вид Apicystis bombi (Liu, Macfarlane,
Pengelly, 1974) Lipa et Triggiani, 1996 (= Mattesia bombi
Liu, Macfarlane, Pengelly, 1974).
Типовые хозяева: Bombus affinis, B. bimacula-
tus, B. fervidus, B. griseocollis, B. hortorum, B. impatiens,
B. perplexus, B. terrestris, B. terricola, B. vagans, Apis
mellifera (Hymenoptera: Apoidea).
Примечание. Ангоры первоописания (Liu et al., 1974) от-
несли открытый ими организм, Mattesia bombi, к сем. Ophryocysti-
dae, что представляет собой таксономическую ошибку. Липа и
Триггиани (Lipa, Triggiani, 1996) переносят Mattesia bombi в сем.
Lipotrophidae и совершенно оправданно выделяют в отдельный род
Apicystis. Мы, однако, считаем преждевременным включение Api-
cystis в сем. Lipotrophidae по тем же соображениям, что и в случае
рода Coelogregarina.
Отряд Eugregarinida Leger, 1900
Трофозоиты моно- и полицистидные. Мукрональный
комплекс редуцирован. Характерно наличие эпицита и
скользящего движения. Характерно отсутствие мерогонии.
Отряд включает в себя более 1600 видов грегарин,
распределенных между двумя подотрядами. Подотряд
Aseptata объединяет монцистидные формы, а подотряд
Septata — полицистидные формы.
Подотряд Aseptata Chakravarty, 1960
Трофозоиты моноцистидные.
Большинство асептатных грегарин паразитирует в
морских беспозвоночных, олигохетах и водных личин-
ках насекомых.
В современных диагнозах для обозначения перед-
него конца асептатных грегарин часто употребляется
термин «мукрон» — в противопоставление эпимериту
септатных грегарин. По причинам, подробно изложен-
ным в разделе «Морфофункциональная организация
грегарин», в настоящем издании этот термин в диагно-
зах эугрегарин по возможности применяться не будет.
Взамен него использованы термины «прикрепитель-
ное приспособление» и «передний конец» в зависимо-
сти от того, идет ли речь о прикрепленных или свобод-
ных трофозоитах соответственно.
В сводках, основаных на системе Левайна, в подо-
тряд Aseptata обычно включают 10 семейств (Levine,
1979, 1985, 1988; Perkins et al., 2000). Из них три — Le-
cudinidae, Urosporidae и Monocystidae достаточно об-
ширны, тогда как остальные — монотипические. Сем.
Selenidioididae исключено из рассмотрения как nomen
nudum (см. раздел «Классификация»),
В настоящем издании сем. Aikinetocystidae объеди-
нено с сем. Monocystidae, а сем. Schaudinnellidae рассмат-
ривается как дополнение к классу Gregarinea. Таким об-
разом, в составе подотряда рассматривается 7 семейств.
Сем. Lecudinidae Kamm, 1922
Трофозоиты удлиненные, движение скользящее;
начальные стадии развития обычно внутриклеточные.
Сизигии латеральные или фронтальные. Ооцисты эл-
липсоидальные или овоидные со слабым утолщением
стенки на одном конце.
Это семейство, по всей видимости, сборное. Оно
включает в себя кишечных паразитов морских беспо-
звоночных (за исключением членистоногих) с ооци-
стами, лишенными ярких особенностей (выросты, не-
обычная форма и т. п.). Однако сюда же относят ряд
грегарин из насекомых и некоторых других членисто-
ногих, таких, например, как Ascogregarina из личинок
комаров, а также, в нарушение диагноза подотряда, не-
которые трицистидные формы (Syria и др.).
Сем. Lecudinidae — одно из самых обширных среди
асептатных грегарин — оно насчитывает около 30 ро-
дов с более чем 160 видами.
Род Lecudina Mingazzini, 1891
(рис. 9: 1; 11, В-Г; 12, Б; 20, б-в; 25, 3)
(= Dolyocystis Leger, 1893)
Передний конец лишен крючьев или выростов.
Трофозоиты без продольной исчерченности. Ооцисты
овоидные, утолщенные на одном конце.
7 Зак. №4163
98
ALVEOLATA
Паразиты полихет и других морских беспозвоноч-
ных. Около ИО известных видов.
Типовой вид Lecudina pellucida (Kolliker,
1849) Mingazzini, 1891 (= Gregarinapellucida Kolliker,
1849; Gregarina nereidis Leidy, 1856; Monocystis pellu-
cida (Kolliker, 1849) Lankester, 1863; Monocystis nerei-
dis (Leidy, 1856) Lankester, 1863; Dolyocystis pellucida
(Kolliker, 1849) Leger, 1893).
Типовой хозяин: Nereis beaucoudrayi (Poly-
chaeta: Nereidae).
Примечание. Границы рода Lecudina очерчены нечетко.
Так, Шревель (Schrevel, 1969) указывает, что представителей этого
рода можно разбить на две группы: формы с удлиненными трофо-
зоитами и формы с «массивными», округлыми трофозоитами. В раз-
ное время в род Lecudina включались и из него выводились пред-
ставители рода Cygnicollum, обладающие отбрасываемым прикре-
пительным приспособлением (Theodorides, 1969; Desportes, Theo-
dorides, 1986). Прикрепительное приспособление собственно Lecu-
dina считается втяжным (Grasse, 1953), однако в действительности
судьба его на ультраструктурном уровне не прослежена. Таким об-
разом, вопрос о систематике pouaLecudina, а также родов Cygnicol-
lum и Loxomorpha является дискуссионным и требует дальнейших
исследований с применением современных методов.
Род Cygnicollum Bogolepova, 1953
(рис. 16, 2)
(= Lecudina Mingazzini, 1891, in part)
Прикрепительное приспособление отбрасываемое,
в виде хоботка, на вершине которого — конус, окру-
женный ободком в основании. Передний конец сво-
бодных трофозоитов, отбросивших хоботок, закруг-
ленный, не отделенный от тела. Сизигии фронтальные
и фронтолатеральные. Гаметоцисты сферические.
Ооцисты овоидные с небольшим утолщением на од-
ном из полюсов.
Кишечные паразиты полихет. Описано 6 видов.
Типовой вид Cygnicollum attenuatum Bogole-
pova, 1953.
Типовой хозяин: Lumbrineris japonica (Poly-
chaeta: Lumbrineridae).
Примечание. См. примечание к роду Lecudina.
Род Loxomorpha К. Hoshide, 1988
(рис. 44, 3)
Сходен с Cygnicollum, но сизигии каудо-фронто-ла-
теральные (почти каудофронтальные, поверхность
контакта сформирована не терминальными, а боковы-
ми поверхностями примита и сателлита на соот-
ветствующих концах тела). Гаметоцисты и ооцисты
неизвестны.
Род монотипический. Кишечные паразиты поли-
хет.
Типовой вид Loxomorpha harmothoe К. Hoshi-
de, 1988.
Типовой хозяин: Harmothoe imbricata (Poly-
chaeta: Polynoidae).
Примечание. См. примечание к роду Lecudina.
Род Kamptocephalus Simdyanov, 1995
(рис. 44, 7)
Прикрепительное приспособление в виде хоботка,
отбрасываемое. Передний конец свободных трофозо-
итов не отграничен от тела, без крючьев, отростков и
папилл, несет гладкую апикальную площадку, образо-
ванную слиянием вершин эпицитарных гребней — при
этом образуется система радиальных тоннелей, вы-
стланных пелликулой. Структура эпицита аберрант-
ная: цитоплазма гребней не отделена от эктоплазмы
перемычками подстилающего слоя, микропоры распо-
ложены на боковых поверхностях эпицитарных греб-
ней, вершины гребней плоские. Апикальные арки вы-
ражены; апикальных филаментов нет — сходные с
ними образования залегают в нижней части подстила-
ющего слоя.
Монотипический род. Кишечные паразиты по-
лихет.
Типовой вид Kamptocephalus mobilis Simdya-
nov, 1995.
Типовой хозяин: Flabelligera affinis (Polycha-
eta: Flabelligeridae).
Род Mastigorhynchus Simdyanov, 1995
(рис. 44, 6)
Трофозоиты вытянутые, цилиндрические, по внеш-
нему виду напоминают септатные формы: передний
конец отделен бороздой от остальной части тела и пре-
образован в прикрепительный аппарат, состоящий из
двух частей — конической базальной и апикальной,
имеющей вид длинного тонкого хоботка. Прикрепи-
тельный аппарат может отбрасываться — в этом слу-
чае трофозоиты моноцистидные, передний конец не
отграничен от тела. Эпицитарные гребни покрыты
Рис. 44. Грегарины сем. Lecudinidae.
1 —Ancora sagittate (прикрепленный трофозоит, продольный срез); 2 — Zygosoma globosum; 3 — Loxomorpha harmothoe {a — трофозоит с прикрепительным
приспособлением, б — трофозоит без прикрепительного приспособления, в — сизигий); 4 — Sycia inopinata; 5 — Sycia polydorae (продольный срез); 6 —
Mastigorhynchus bradae: трофозоиты с прикрепительным приспособлением (а) и без него (0; 7 — Kamptocephalus mobilis; 8 — Lankesteria cyrtocephala-, 9 —
Ascogregarina culicis (a — внутриклеточные трофозоиты, б— внеклеточный трофозоит, в — ооциста); 10 — Lecythion thalassemae (а — прикрепленный тро-
фозоит; б — детали строения переднего конца, в — сизигий). (7, 2, 4, 5, 9, 10 -— Из: Grasse, 1953 (по разным авторам); 3 — по: Симдянов, 1996; 6, 7 — по:
Симдянов, 19956; 8 •— по: Симдянов, 1995а).
Fig. 44. Gregarines of family Lecudinidae.
1 — Ancora sagittata (attached trophozoite, longitudinal section); 3 — Loxomorpha harmothoe (a — trophozoite with attachment device, 6 — trophozoite without at-
tachment device, в — syzygy); 5 — Sycia polydorae (longitudinal section); 6 — Mastigorhynchus bradae {a — trophozoite with attachment device, 6 — trophozoite
without attachment device); 9 — Ascogregarina culicis (a — intracellular trophozoites, 6 — extracellular trophozoit, в — oocyst); 10 — Lecythion thalassemae (a —
attachment trophozoite, 6 — details end morphology, в — syzygy).
ТИП SPOROZOA. КЛАСС GREGARINEA
99
100
ALVEOLATA
плотным глшсокаликсом. Структура эпицита абер-
piiirniiiH цитоплазма гребней не отделена от экто-
НИ1ПМЫ перемычками подстилающего слоя, микропо-
pi,i располагаются на боковых поверхностях гребней,
нет четко выраженных апикальных арок и филамен-
тов.
Монотипический род. Кишечные паразиты полихет.
Типовой вид Mastigorhynchus bradae Simdya-
nov, 1995.
'Г И и о в ой хозяин: Brada villosa (Polychaeta:
I’lnbcIHgeridae).
Род Polyrhabdina Mingazzini, 1891
Передний конец с крючьями. Трофозоиты с про-
дольной исчерченностью.
Описано 4 вида из кишечника полихет.
Типовой вид Polyrhabdina spionis (Kolliker,
1849) Mingazzini, 1891.
Типовой хозяин: Scolelepis fuliginosa (Poly-
chaeta: Spionidae).
Примечание. Грассе хотя и относит этих грегарин к сем.
Lecudinidae, тем не менее считает их трицистидными (Grasse,
1953). Левайн (Levine, 1977а, 1985) придерживается в отношении
систематического положения этого рода такой же позиции, хотя и
упоминает при этом о «неполной септе».
Род Ulivina Mingazzini, 1891
Передний конец без крючьев или выростов. Трофо-
зоиты подразделены неполной септой (?) на «псевдо-
протомерит» с прозрачным содержимым и «псевдо-
дейтомерит» с гранулярным содержимым. Сизигии,
гаметоцисты и ооцисты неизвестны.
Известно около 6 видов из кишечника полихет.
Типовой вид UlivinaellipticaMingazzini, 1891.
Типовой хозяин: Cirratulus filigerus (Polycha-
eta: Cirratulidae).
Примечание. См. ниже примечание к роду Sycia.
Род Sycia L6ger, 1892 (рис. 44, 4, 5)
Прикрепительное приспособление отбрасываемое,
имеет форму купола с мощным кольцевым валиком в
его основании. Трофозоиты подразделены неполной
септой (?) на «псевдопротомерит» с прозрачным со-
держимым и «псевдодейтомерит» с гранулярным со-
держимым. Сизигии, гаметоцисты и ооцисты неиз-
вестны.
Описано 4 вида из кишечника полихет.
Типовой вид Sycia inopinata Leger, 1892.
Типовой хозяин: Cirriformia (= Atidoinia) ten-
taculata (Polychaeta: Cirratulidae).
Примечание. По мнению Грассе (Grasse, 1953), Ulivina и
Sycia — синонимы, хотя представители этих родов и различаются
отсутствием или наличием кольца в основании прикрепительного
приспособления. Грассе, хотя и относит на основании таксономи-
ческой принадлежности хозяев всех этих грегарин к сем. Lecudini-
dae, тем не менее считает их трицистидными, а имеющееся у них
прикрепительное приспособление называет эпимеритом. Левайн
(Levine, 1977а, 1985) разделяет эти два рода, но также причисляет
их к сем. Lecudinidae, хотя и с оговорками. Ранее грегарины, отно-
сящиеся к родам Polyrhabdina, Ulivina и Sycia, выделялись в сем.
Polyrhabdinidae Kamm, 1922.
Род Pontesia Hasselmann, 1926
Трофозиты описаны как септатные, удлиненно-ци-
линдрические, суживающиеся к «тупо заточенному»
заднему концу. Прикрепительное приспособление —
ряд коротких шипов на свободной верхней оконечно-
сти «протомерита».
Монотипический род, описанный из кишечника
полихет.
Типовой вид Pontesia kelschiHasselmann, 1926.
Типовой хозяин: Nereissp.(Polychaeta:Nereidae).
Примечание. Принадлежность этого рода к сем. Lecudini-
dae еще более сомнительна, чем Polyrhabdina, Ulivina и Sycia. Тем
не менее в сводках Левайна и др. (Levine, 1977а, 1985; Perkins et al.,
2000) род Pontesia включен в состав рассматриваемого семейства.
Это типичный пример «хозяинного» подхода, требующий допол-
нительных исследований.
Род Bhatiella Setna, 1931
Прикрепительное приспособление в виде длинной
тонкой иглы с маленьким вздутием на вершине. Тро-
фозоиты обычно грушевидные. Сизигии неизвестны.
Гаметоцисты без спородуктов.
В кишечнике полихет. Описано 2 вида.
Типовой вид Bhatiella marphysae Setna, 1931
emend. Levine, 1977 (= Bhatiella marphysae Setna, 1931
lapsus calami-, Ferraria cornucephala Setna, 1931).
Типовой хозяин: Marphysa sanguinea (Poly-
chaeta: Eunicidae).
Род Viviera Schrdvel, 1963
Прикрепительное приспособление в виде малень-
кого шарика. Трофозоит подразделен на широкую бу-
лавовидную переднюю часть и длинную, узкую, в виде
равнобедренного треугольника, заднюю часть. Другие
стадии неизвестны.
В кишечнике полихет. Монотипический род.
Типовой вид Viviera marphysae Schrevel, 1963.
Типовой хозяин: Marphysa sanguinea (Polyc-
haeta: Eunicidae).
Род Cochleomeritus H. Hoshide, 1944
Прикрепительное приспособление разнообразно по
форме, но обычно в виде удлиненного выроста с воло-
совидными придатками или без них. Трофозоит спере-
ди расширенный, сплющенный в поперечнике, более
или менее поперечно складчатый со спины. Гаметоци-
сты или ооцисты неизвестны.
В кишечнике полихет. Описано 2 вида.
Типовой вид Cochleomeritus lysidici Н. Hoshi-
de, 1944.
Типовой хозяин: Lysidice punctata (Polychae-
ta-. Eunicidae).
ТИП SPOROZOA. КЛАСС GREGARINEA
101
Род Ancora Labbe, 1899 (рис. 44, 1)
Прикрепительное приспособление в виде неболь-
шого апикппьпого выроста. Трофозоиты с 2 боковыми
отростками, придающими им сходство с якорем.
В кишечнике полихет. Описано 3—4 вида.
Тип о и о б вид Апсога sagittata (Leuckart, 1861)
Labbe, 1899 ( Gregarina sagittata Leuckart, 1861; Mo-
nocystis sagittata (Leuckart, 1861) Lankester, 1863;
Anc(h)orina sagittata (Leuckart, 1861) Mingazzini, 1891).
Типовой хозяин: Capitella capitata (Polychae-
ta: Capitelliilae).
П p И м e 'I и в и с. Для Ancora prolifera указано бесполое раз-
множение (меротония?) путем отпочковывания боковых отрост-
ков, содержащих ядра (?) (Clausen, 1993).
Род Hentschelia Mackinnon et Ray, 1931
Прикрепительное приспособление в виде зонтика,
с краем, поделенным на 4 или 5 рифленых долей. Тро-
фозоиты с тонкой, слабо заметной продольной исчер-
ченпоетыо. Сизигии обычно латеральные, гамонты
расположены «валетом».
В кишечнике эхиурид. Монотипический род.
Типовой вид Hentschelia thalassemae Mackin-
non et Ray, 1931.
Типовой хозяин: Thalassema neptuni (Echiurida).
Род Lecythion Mackinnon et Ray, 1931
(рис. 44, 10)
Прикрепительное приспособление — длинный, ци-
линдрический хоботок с 14—15 лепестковидными до-
лями на конце. Трофозоит спирально исчерчен, по-
крыт косыми рядами очень мелких зубчиков. Сизигии
латеральные, гамонты расположены «валетом». Гаме-
тоцисты покидают хозяина с фекалиями.
В кишечнике эхиурид. Монотипический род.
Типовой вид Lecythion thalassemae Mackinnon
et Ray, 1931.
Типовой хозяин: Thalassemaneptuni(Echiurida).
Род Hyperidion Mackinnon et Ray, 1931
Передний конец широкий, закругленный. Ранние
стадии Biiyi риклсточные, без видимого рострума. Тро-
фозоиты с продольными полосами, способны к сокра-
щению; либо удлиненные, либо сферические.
В кишечнике эхиурид. Монотипический род.
Типовой в и д Hyperidion thalassemae Mackin-
non et Ray, 1931 (;= Hyperidion neptuni Reichenow, 1932).
Типовой хозяин: Thalassemaneptuni(Echiurida).
Род Zygosoma Labb6, 1899 (рис. 44, 2)
Трофозоиты более или менее грушевидные, покры-
тые многочисленными выступами, с широким округ-
лым передним концом. Сизигии ранние, латеральные.
Гаметоцисты сферические или овоидные с примерно
1250 ооцистами. Гаметы от сферических до грушевид-
ных, изогамные. Ооцисты с 4 спорозоитами.
В кишечнике эхиурид. 2 вида.
Типовой вид Zygosomagibbosum (Greef, 1880)
Labbe, 1899.
Типовой хозяин: Echiuruspallasi (Echiurida).
Род Chlamydocystis Dogiel, 1910
Трофозоиты удлиненные, внутри амебоцитов хозя-
ина; движение скользящее. Гаметоцисты и ооцисты
неизвестны.
В полихетах. 1 вид.
Типовой вид Chlamydocystis captiva Dogiel, 1910.
Типовой хозяин: Thelepus cincinnatus (Poly-
chaeta:Terebellidae).
Род Contortiocorpa Bhatia et Setna, 1938
Трофозоиты одиночные, тело спирально перекручено.
В кишечнике полихет. Монотипический род.
Типовой вид Contortiocorpa prashadi Bhatia et
Setna, 1938.
Типовой хозяин: Eunicesiciliensis(Polychaeta:
Eunicidae).
Род Lankesteria Mingazzini, 1891
(рис. 7; 12, E; 44, 3)
Трофозоиты более или менее булавовидные; на
переднем конце свободных трофозоитов — прозрач-
ный широкий округлый либо слегка заостренный рост-
рум. Сизигии фронтальные или латеральные в виде нож-
ниц. Гаметоцисты сферические. Анизогамные. Ооцис-
ты эллипсоидальные, часто с пробочкой на одном
конце.
Описано примерно 37 видов. Паразиты кишечника
асцидий.
Типовой вид Lankesteria ascidiae (Lankester,
1872) Mingazzini, 1891 (= Monocystis ascidiae Lankester,
1872; Gregarina cionae Frenzel, 1885; Urospora cionae
Parana, 1886; Urospora cionae Gruber, 1886).
Типовой хозяин: Ciona intestinalis (Tunicata:
Ascidiacea).
Примечание. Грассе (Grasse, 1953) относит роды Lankeste-
ria и Monocystella к сем. Urosporidae, несмотря на отсутствие выро-
стов оболочки ооцист.
Род Monocystella Valkanov, 1935
Сходны с Lankesteria, но в турбелляриях.
Около 10 видов.
Типовой вид Monocystellaarndti Valkanov, 1935.
Типовой хозяин: Planaria albissima (Turbella-
ria: Tricladida).
Примечание. См. примечание к роду Lankesteria.
102
ALVEOLATA
Род Ascogregarina Ward, Levine et Craig,
1982 (рис. 44, 9)
(“ Lankesteria Mingazzini, 1891 in part;
Ascocystis Grasse, 1953)
Сходны c Lankesteria, но в насекомых.
Известно около 17 видов.
Типовой вид Ascogregarina culicis (Ross, 1898)
Ward, Levine et Craig, 1982 (= Gregarina culicidis Ross,
1898 lapsus calami', G. culicis Ross, 1898; Lankesteria cu-
licis (Ross, 1898) Wenyon, 1911; Ascocystis culicis Gras-
se, 1953).
Типовой хозяин: Aedes aegypti (Diptera: Culi-
cidae).
Примечание. Ранее этих грегарин причисляли к роду Lan-
kesteria, несмотря на столь различных хозяев. Рэй (Ray, 1933b) ука-
зывает, что трофозоиты Lankesteria culicis не моноцистидные, а ди-
цистидные и обладают отбрасываемым эпимеритом, что подтверж-
дается ультраструктурно (Walsh, Callaway, 1969) (см. раздел
«Морфофункциональная организация»). Грассе (Grasse, 1953) на-
зывает этих грегарин «псевдомоноцистидными», выделяет в от-
дельный род Ascocystis и сближает с сем. Actinocephalidae. Левайн,
напротив, относит их к тому же семейству, что и Lankesteria (Levi-
ne, 1977а; Ward et al., 1982; Levine, 1985).
Род Kofoidina Henry, 1933
Трофозоиты в сизигиях в цепочке от 2 до 14, в насе-
комых.
Монотипический род. Описаны из кишечника тер-
митов.
Типовой вид Kofoidina оvata Henry, 1933.
Типовой хозяин: Zootermopsis angusticollis,
Z. nevadensis (Insecta: Isoptera).
Примечание. Автор первоописания (Henry, 1933) выделил
Kofoidina ovata в отдельное сем. Kofoidinidae. Ку до (Kudo, 1966)
переместил этот вид (и род) в сем. Lecudinidae, тогда как Грассе
(Grasse, 1953), напротив, сближает его с сем. Hirmocystidae и со-
мневается в валидности сем. Kofoidinidae. Гойе (Geus, 1969) при-
нимает сем. Kofoidinidae. Левайн с последователями, как и Кудо,
помещают род Kofoidina в сем. Lecudinidae (Levine, 1977а, 1985,
1988; Perkins et al., 2000).
Род Chakravartiella Misra et Raychaudhury,
1973
Трофозоиты одиночные, удлиненные и цилиндри-
ческие, передний конец вооружен неподвижной круг-
лой присосковидной органеллой, несущей зубчики и
сидящей на короткой ножке; развиты мионемы.
В кишечнике многоножек. Монотипический род.
Типовой вид Chakravartiella sugereiformes Mis-
ra et Raychaudhury, 1973 (= Chakravartiella suckerifor-
mes Misra et Raychaudhury, 1973, lapsus calami).
Типовой хозяин: Trigoniulus goesii (Myriapoda).
Примечание. Левайн (Levine, 1977c, 1985, 1988) относит
этот род к сем. Monocystidae, несмотря на то что большинство
представителей этого семейства — специфические паразиты цело-
ма олигохет. В настоящей главе принята точка зрения Фролова
(Фролов, 1991) на систему Monocystidae, поэтому род Chakravarti-
ella и некоторые другие роды грегарин перемещены нами из сем.
Monocystidae в сем. Lecudinidae.
Род Echiurocystis Levine, 1977
Трофозоиты веретеновидные, с вздутой средней
частью; сизигии латеральные.
В кишечнике эхиурид. Описано 3 вида.
Типовой вид Echiurocystis yumushii (litsuka,
1933) Levine, 1977 (= Enterocystis yumushii litsu-
ka, 1933; Enterocystis umushii litsuka, 1933, lapsus ca-
lami).
Типовой хозяин: Urechis unicinctus (Echiurida).
Примечание. См. примечание к роду Chakravartiella.
Род Neomonocystis Geus, 1969
Трофозоиты веретеновидные, всегда одиночные;
ооцисты с уплощенными полюсами.
В губоногих многоножках (Chilopoda). Монотипи-
ческий род.
Типовой вид Neomonocystis lithobii Rauchalles
in Geus, 1969.
Типовой хозяин: Lithobius mutabilis, L. muti-
cus, L. piceus (Arthropoda: Chilopoda).
Примечание. См. примечание к роду Chakravartiella.
Род Асагодгедаппа Levine, 1977
Трофозоиты несут на переднем конце корону из
шипиков; гаметоцисты и ооцисты неизвестны.
В клещах. Монотипический род.
Типовой вид Acarogregarina corolla (Erhardo-
va, 1955) Levine, 1977 (= Gregarina corolla Erhardova,
1955).
Типовой хозяин: Scutovertexminutus (Arachni-
da, Acariformes).
Примечание. См. примечание к роду Chakravartiella.
Род Ophioidina Mingazzini, 1891
Тело трофозоита сильно вытянуто в длину, цилинд-
рическое, одинаковой толщины на всем протяжении;
передний конец более или менее обрубленный. Гаме-
тоцисты и ооцисты неизвестны.
В кишечнике эхиурид. Монотипический род.
Типовой вид Ophioidina bonelliae (Frenzel, 1885)
Labbe, 1899 (= Gregarina bonelliae Frenzel, 1885).
Типовой хозяин: Boneilia viridis (Echiurida).
Род Paraophioidina Levine, 1977
Тело трофозоита сильно вытянуто в длину, цилинд-
рическое, одинаковой толщины на всем протяжении,
за исключением переднего конца, который вздут у зре-
лых особей, но не у молодых. Гаметоцисты и ооцисты
неизвестны.
Описано около 11 видов из ракообразных.
Типовой вид Paraophioidina haeckeli (Mingaz-
zini, 1891) Levine, 1977 (= Ophioidina haeckelii Mingaz-
ТИП SPOROZOA. КЛАСС GREGARINEA
103
zini, 1891; Ganymedes haeckeli (Mingazzini, 1891) Theo-
dorides et Desportes, 1972).
Типовой хозяин: Sapphirina sp. (Crustacea:
Copepoda).
Род Lateroprotomeritus Th6odoridfes
et Desportes, 1975
Трофозоиты с латеральным «мукроном» («протомери-
том»); развитие одиночное; сизигии фронтолатеральные.
Монотипичесикй род.
Типовой вид Lateroprotomeritus conicus Theo-
dorides et Desportes, 1975.
Типовой хозяин: Nematoscelis megalops (Crus-
tacea: Euphausiacea).
Род Extremocystis Setna, 1931
Трофозоит цилиндрический, напоминающий нема-
тоду; сизигий каудофронтальный: заостренный конец
одной особи входит в постоянное полусферическое
углубление другой, но не формирует соединение типа
«сустав», как у Ganymedes. Гаметоцисты не обнаруже-
ны. Ооцисты веретеновидные с тонко заостренными
обоими концами; спорозоиты не наблюдались.
Монотипический род, описан из сипункулид.
Типовой вид Extremocystis dendrostomiSetna, 1931.
Типовой хозяин: Dendrostoma signifer (Sipun-
culida).
Примечание. Грассе (Grasse, 1953) относит этот род к
сем. Urosporidae и сравнивает с Gonospora, отмечая, что разница
заключается в наличии у ооцист выростов не на одном, а на обоих
Полюсах.
Сем. Urosporidae Ldger, 1892
Передний конец образует более или менее хорошо
выраженное прикрепительное приспособление. Сизи-
гии фронтальные или латеральные. Слабо выраженная
анизогамия. Вскрытие гаметоцист путем простого раз-
рыва оболочки. Ооцисты гетерополярные — передний
полюс несет воротничок (иногда утолщение), а зад-
ний — более или менее выраженный хвостовой вы-
рост; стенка ооцисты хорошо дифференцирована (эпи-
спора и эндоспора); содержат 8 спорозоитов.
Паразиты полости тела и редко кишечника поли-
хет, олигохет, немертин, моллюсков, иглокожих, веро-
ятно, оболочников и, возможно, нематод.
Система сем. Urosporidae довольно запутана. В на-
стоящее время она строится на признаках строения
ооцист, а именно на форме и количестве выростов обо-
лочки (эписпоры). Основы этого подхода были за-
ложены В. А. Догелем (Dogiel, 1909), и в настоящее
врёмя он разделяется большинством исследователей
(Levine, 1977b, 1985; Perkins et al., 2000). Однако в ли-
тературе высказываются и другие взгляды на принци-
пы построения системы уроспорид. Так, Боголепова
(1953) указывает, что одного лишь признака длины и
формы хвостового отростка ооцисты недостаточно,
поскольку он достаточно пластичен в пределах основ-
ных родов этого семейства — Urospora, Gonospora и
Lithocystis. С другой стороны, существуют и другие
признаки, такие как неогамия, подвижность трофозои-
тов и приуроченность к определенным группам хозя-
ев. Неогамные формы паразитируют преимуществен-
но в голотуриях и ведут неподвижный, прикреплен-
ный образ жизни, тогда как большинство видов
Urospora, Gonospora и Lithocystis из других групп жи-
вотных обладают хорошо выраженной подвижностью.
По мнению Боголеповой, неогамия есть существенный
признак жизненного цикла, и было бы естественным
объединить все неогамные виды уроспорид в один род
Cystobia, как это делали Калкинс (Calkins, 1926) и
позднее Шанжё (Changeux, 1961). С другой стороны,
Боголепова отмечает, что различные признаки, в част-
ности неогамия и строение ооцист, в пределах родов
Urospora, Gonospora и Lithocystis перекрещиваются,
т. е. не коррелируют друг с другом. В связи с этим вы-
сказывается предположение, что все формы, распреде-
ляемые между этими тремя родами, составляют на са-
мом деле один крупный полиморфный род с несколь-
кими группами видов, слабо отграниченными друг от
друга по форме ооцист, неогамии и другим признакам.
Для построения естественной системы семейства, оче-
видно, требуются дополнительные исследования с
применением современных методов.
Семейство включает в себя 7 родов с приблизи-
тельно 55—60 описанными видами.
Род Urospora Schneider, 1875
(рис. 20, з; 25, 9)
(= Cystobia Mingazzini, 1891 in part; Pachysoma
Mingazzini, 1891; Syncystis Cuenot, 1891)
Трофозоиты крупные (до 1 мм), продольно исчер-
ченные; некоторые виды покрыты цитопилями. Сизи-
гии латеральные, партнеры часто неравного размера.
Анизогамия присутствует, но слабо выражена. Ооци-
сты овоидные с длинным отростком на одном конце
содержат 6 (?}—8 спорозоитов.
В аннелидах, сипункулидах, немертинах и иглоко-
жих. Описан примерно 21 вид.
Типовой вид Urospora nemertis (Kolliker, 1845)
Schneider, 1875 (= Gregarina nemertis Kolliker, 1845;
Monocystis nemertis (Kolliker, 1845) Lankester, 1863).
Типовой хозяин: Nemertesdelineatus(Nemertini).
Примечание. Для Urospora ovalis и U. travisiae описаны
стадии мерогонии (Мавродиади, 1914). Эти данные весьма необыч-
ны и нуждаются в уточнении. По всей видимости, паразитические
динофлагелляты Haplozoon были интерпретированы как стадии
мерогонии грегарин.
Род -Gonospora Schneider, 1875
(рис. 25, 8)
(= Cystobia Mingazzini, 1891 in part; Diplodina
Woodcock, 1906; Kalpidorhynchus Cunningham, 1907)
Трофозоиты полиморфные: овоидные, грушевид-
ные или червеобразные. Гаметоцисты сферические.
104
ALVEOLATA
Ооцисты овоидные с неодинаковыми концами, закруг-
ленные на одном полюсе и с простым или зазубрен-
ным выступом или воронкой на другом.
В целоме или редко в кишечнике полихет, семенни-
ках переднежаберных моллюсков, целоме, водных лег-
ких и кровеносных сосудах голотурий. Известно около
17 видов.
Типовой вид Gonospora variaLeger, 1892 (= Go-
nospora terebellae (Kolliker, 1848) Schneider, 1875).
Типовой хозяин: Terebella sp. (Polychaeta: Te-
rebellidae).
Род Lithocystis Giard, 1876 (рис. 25, 6)
Трофозоиты крупные — овоидные или цилиндри-
ческие, длительное время прикреплены к тканям хозя-
ина. Сизигии Х-образные. Гаметоцисты содержат сфе-
ру из оксалата кальция — продукт эндоплазмы гамон-
тов. Ооцисты уплощенные на одном конце, с более или
менее длинным отростком на другом.
В иглокожих и сипункулидах. Описано 8 видов.
Типовой вид LithocystisschneideriGiard, 1876.
Типовой хозяин: Echinocardium cordatum (Echi-
nodermata: Echinoidea).
Род Ceratospora L6ger, 1892 (рис. 25, 7)
Трофозоиты удлиненно-конические. Сизигии
фронтальные, неинцистирущиеся. Ооцисты овоидные,
с неодинаковыми полюсами, с маленьким воротнич-
ком на одном конце и 2 расходящимися филаментами
на другом.
В полихетах. Монотипический род.
Типовой вид Ceratospora mirabilisLeger, 1892.
Типовой хозяин: Glycera sp. (Polychaeta: Gly-
ceridae).
Род Pterospora Labbd et Racovitza, 1897
Трофозоиты в сизигиях или одиночные; задний
конец вытянут в 4 раздвоенных отростка. Сизигии
фронтальные. Гаметоцисты сферические или овоид-
ные. Ооцисты овоидные, стенка образует 3 латераль-
ных ребра.
В целоме полихет. 6 описанных видов.
Типовой вид Pterospora maldaneorum Labbe et
Racovitza, 1897.
Типовой хозяин: Leiochone leiopygos, L. clype-
ata (Polychaeta: Maldanidae).
Род Paragonospora Lang, 1954
Трофозоиты с редкими, слабо развитыми мионемами,
с эллипсоидными зернами амилопектина; движение
скользящее; ядро трофозоитов с одной или более эндо-
сомой. Сизигии фронтальные. Ооцисты с неодинако-
выми полюсами: воронковидное образование на одном
и 6 небольших трубчатых образований на другом; с 8 спо-
розоитами и очень маленьким остаточным телом.
В полихетах. Монотипический род.
Типовой вид Paragonospora typica Lang, 1954.
Типовой хозяин: Terebellides stromi (Polycha-
eta: Trichobranchiidae).
Род Diplauxis Vivier, Ormieres et Tuzet,
1964 (рис. 20, и; 26, 1)
Неогамные; сизигии каудальные. Гамонты удли-
ненные, более или менее заостренные к свободному
(переднему?) концу; поверхность густо ворсистая. Га-
метоцисты удлиненные, сохраняют форму сизигия.
Ооцисты овоидные с утолщением на одном конце, вы-
свобождаются цепочками.
Описано 2 вида из кишечника полихет.
Типовой вид Diplauxis hatti Vivier, Ormieres et
Tuzet 1964.
Типовой хозяин: Perinereis cultrifera (Poly-
chaeta: Nereidae).
Примечание. Часть исследователей относит этот род к сем.
Urosporidae, несмотря на отсутствие выростов оболочки ооцист
(Porchet-Hennere, Fischer, 1973; Theodorides, 1978), другие, по этой
же причине, — к сем. Lecudinidae (Levine, 1977а, 1985; Perkins
et al., 2000). Как и целый ряд уроспорид (например, Urospora chiri-
dotae), грегарины рода Diplauxis образуют неогамные сизигии; их
поверхность лишена эпицита и покрыта цитопилями (см. раздел
«Морфофункциональная организация») сходно с Urospora chirido-
tae (собств. иссл.). В данном издании поддержана точка зрения
французских исследователей; форму ооцист мы при этом трактуем
как уроспоридную с редуцированным отростком.
Сем. Monocystidae Butschli,
1882
Внекишечные паразиты Oligochaeta. Большинство
видов осуществляет свое развитие в целоме или семен-
ных мешках хозяев. Тело трофозоитов не подразделя-
ется на отделы. Передний конец тела слабо дифферен-
цирован или не дифференцирован вовсе. Движение
метаболирующее. Сизигии фронтальные или латераль-
ные. Ооцисты биконические или в форме лодочки (на-
викулярные).
Система семейства неоднократно подвергалась пе-
ресмотру (Bhatia, 1929, 1930; Levine, 1977с; Фролов,
1991). В настоящем издании принята точка зрения
Фролова, согласно которой дробление Monocystidae на
подсемейства и выделение из его состава самостоя-
тельных семейств являются искусственными. Исходя
из этого представители родов Aikinetocystis и Nellocys-
tis рассматриваются как представители Monocystidae, а
сем. Aikinetocystidae исключается из рассмотрения как
nomen nudum. Также в соответствии с диагнозом в со-
став семейства не включены паразиты Echiurida и Art-
hropoda — роды Echiurocystis, Neomonocystis, Acaro-
gregarina, Chakravartiella, которые рассмотрены в со-
ставе сем. Lecudinidae.
Сем. Monocystidae — самое многочисленное среди
асептатных грегарин по количеству видов. Оно вклю-
чает в себя 25 родов с приблизительно 196 видами.
Наиболее богат видами (около 74) типовой род Mono-
cystis.
ТИП SPOROZOA. КЛАСС GREGARINEA
105
Род Monocystis von Stein, 1848
(рис. 25; 45, 7)
Трофозоиты эллипсоидальной или червеобразной
формы, передний конец не дифференцирован. Сизигии
поздние.
74 описанных вида.
Типовой вид Monocystis agilis Stein, 1848.
Типовой хозяин: Lumbricus terrestris.
Род Nematocystis Hesse, 1909
(рис. 25, 4; 45, 2)
Трофозоиты очень крупных размеров, червеобраз-
ной формы, передний конец часто дифференцирован в
прикрепительную папиллу. Сизигии поздние.
28 описанных видов.
Типовой вид Nematocystis magna (Schmidt,
1854) Hesse, 1909 (= Monocystis magna Schmidt, 1854;
Gregarina magna Diesing, 1859; Nematocystis caudata
Loubatieres, 1955).
Типовой хозяин: Lumbricus terrestris.
Род Rhabdocystis Boldt, 1910
(рис. 45, 3)
Трофозоиты булавовидной формы, в расширенной
апикальной части тела цитоплазма часто выглядит пе-
нистой. Гаметоцисты гантелевидные.
Описано 3 вида.
Типовой вид Rhabdocystis claviformis Boldt,
1910.
Типовой хозяин: Octolasium complanatum.
Род Apolocystis Cognetti de Marti is,
1923
Трофозоиты сферические или слегка эллипсои-
дальной формы. Сизигии поздние. Ооцисты бикониче-
ские.
26 описанных видов.
Типовой вид Apolocystis lumbriciolidi (Schmidt,
1854) Cognetti de Martiis, 1923 (= Monocystis lumbrici
olidi Schmidt, 1854; Apolocystis elongata Phillips et Mac-
kinnon).
Типовой хозяин: Eisenia foetida.
Род Cephalocystis Rees, 1962
Форма тела трофозоитов цилиндрическая, перед-
ний конец формирует прикрепительное приспособле-
ние Т-образной формы; одиночные.
Монотипический род.
Типовой вид Cephalocystis singularis Rees,
1962.
Типовой хозяин: Eiseniafoetida.
Род Trigonepimerus Sciacchitano, 1932
(= Trigonocephalus Sciacchitano, 1931)
Трофозоиты червеобразной формы, передний ко-
нец преобразован в подобие эпимерита треугольной
формы и отделен от тела филаментом (?).
Монотипический род.
Типовой вид Trigonepimerus criodrilii (Sciac-
chitano, 1931) Sciacchitano, 1932 (= Trigonocephalus
criodrilii Sciacchitano, 1931).
Типовой хозяин: Criodrilus laccum.
Род Mastocystis Boisson, 1957
Форма тела трофозоитов куполообразная, поверх-
ность несет мелкие папиллы с цитопилями.
В семенных мешках. Описано 2 вида.
Типовой вид Mastocystis denticulata Boisson,
1957.
Типовой хозяин: Pheretimapeguana.
Род Zygocystis von Stein, 1848
(рис. 20, к)
Сизигии очень ранние (неогамные), фронтальные;
форма гамонтов от сферической до цилиндрической.
Ооцисты биконические.
В целоме и семенных мешках.
Описано 15 видов.
Типовой вид Zygocystis cometa von Stein, 1848.
Типовой хозяин: Lumbricus terrestris.
Род Adelphocystis Сох, 1967
Моноцистиды объединены во фронтальные сизи-
гии; гамонты очень крупные (до 1.5 мм), форма тела
червеобразная. В целоме.
Монотипический род.
Типовой вид Adelphocystisaeikineta Сои, 1961.
Типовой хозяин: Keffia variabilis.
Род Pleurocystis Hesse, 1909
Форма тела гамонтов удлиненно-цилиндрическая,
всегда в латеральных сизигиях.
Описано 2 вида.
Типовой вид Pleurocystis cuenoti Hesse, 1909.
Типовой хозяин: Allolobophora longa terrestris.
Род Rhynchocystis Hesse, 1909
(рис. 45, 5)
Форма тела эллипсоидальная; на переднем кон-
це — подвижная прикрепительная папилла в виде ко-
нического или цилиндро-конического хоботка. Ооци-
сты биконические.
ALVEOLATA
106
ТИП SPOROZOA. КЛАСС GREGARINEA
107
Описано 11 видов.
Типовой вид Rhynchocystis pilosa (Cuenot,
1901) Hesse, 1909 (= Monocystis cuneiformis Ruschhaupt,
1885; Monocystispilosa Cuenot, 1901; Monocystis minuta
Ruschaupt, 1885; Monocystis tenax var. cuneiformis Ru-
schaupt, 1885 in Labbe (1899); Rhynchocystis oculata
Berlin, 1924 emend. Levine, 1977, Rhynchocystis pilosa
var oculata Berlin, 1924; Rhynchocystis cuneiformis (Rus-
chhaupt, 1885) Levine, 1977). '
Типовой хозяин: Lumbricus terrestris.
Род Dirhynchocystis Cognetti de Martiis,
1921
Трофозоиты с отростками на обоих концах тела; на
переднем конце — сократимая прикрепительная па-
пилла. Ооцисты биконические.
Описано 7 видов.
Типовой вид Dirhynchocystis brasiliensis Cog-
netti de Martiis, 1921.
Типовой хозяин: Fimoscolex inurus.
Род Grayallia Setna, 1927
(рис. 45, 6)
Форма тела удлиненно-цилиндрическая, на перед-
нем и заднем концах — крючковидные отростки.
Монотипический род.
Типовой вид Grayallia quadrispina Setna, 1927.
Типовой хозяин: Pheretima heterochaeta.
Род Stomatophora Drzhevetskiy, 1907
(рис. 45, 7)
Трофозоиты сферические или овоидные; на перед-
нем конце тела находится прикрепительная папилла,
уплощенная в виде присоски. Ооцисты биконические,
с уплощенными концами, вне гаметоцист — в длин-
ных цепочках.
В семенных мешках Pheretima. Описано 5 видов.
Типовой вид Stomatophora coronata (Hesse,
1904) Drzhevetskiy, 1907 (= Monocystis coronata Hesse,
1904).
Типовой хозяин: Pheretima hawayana.
Род Craterocystis Cognetti de Martiis, 1918
(рис. 45, 8)
Трофозоиты сферические или каплевидные; силь-
но развит «миоцит»: мионемы расходятся радиаль-
но от прикрепительной папиллы, имеющей вид при-
соски.
Описано 2 вида.
Типовой вид Craterocystis рариа Cognetti de
Martiis, 1918.
Типовой хозяин: Pheretima wendessiana.
Род Astrocystella Cognetti de Martiis,
1918
Трофозоиты уплощенные, имеют звездообразную
форму тела с 5—9 лучами, центральная часть содер-
жит ядро и формирует присоску; одиночные.
Описано 2 вида.
Типовой вид Craterocystis рариа Cognetti de
Martiis, 1918.
Типовой хозяин: Pheretima wendessiana.
Род Albertisella Cognetti de Martiis, 1918
(рис. 45, 9)
Форма тела чашеобразная с центральной присос-
кой, от которой расходятся мионемы (?).
Типовой вид Albertisella crater Cognetti de
Martiis, 1918.
Типовой хозяин: Pheretima sermowaiana.
Род Beccaricystis Cognetti de Martiis,
1918
Трофозоиты цилиндрические, поверхность тела
формирует многочисленные вздутия, передний конец
вооружен присосковидной органеллой; в централь-
ной части эндоплазмы залегает пучок продольных
мионем.
Типовой вид Beccaricystis loriai Cognetti de
Martiis, 1918.
Типовой хозяин: Pheretima sermowaiana.
Рис. 45. Грегарины сем. Monocystidae.
I — Monocystis agilis (две наиболее обычные формы трофозоитов); 2 — Nematocystis tuzetae (трофозоит, прикрепленный к клетке хозяина); 3 — Rhabdocystis
gyriniformis; 4 — Pleurocystis cuenoti, прикрепленный к гипертрофированным клеткам семенного мешка хозяина; 5 — Rhynchocystis pilosa (а — трофозоит,
прикрепленный к эпителию семенного мешка хозяина, б — передний конец трофозоита); 6 — Grayallia quadrispina; 7 — Stomatophora coronata; 8 — Cratero-
cystis рариа; 9—Albertisella crater; 10 — Nellocystis birmanica; 11 — Parachoanocystoides tentaculata; 12 — Choanocystoides costaricensis; 13 — Aikinetocystis
singularis. (Из: Grasse, 1953; по: разным авторам).
Fig. 45. Gregarines of family Monocystidae.
/ — Monocystis agilis (trophozoites of two most ordinary body shapes); 2 — Nematocystis tuzetae (trophozoite attached to the host cell); 4 — Pleurocystis cuenoti at-
tached to the hypertrophied cells of the host seminal vesicle; 5 — Rhynchocystis pilosa (a — trophozoite attached to the epithelium of the host seminal vesicle, 6 — tro-
phozoite anterior end).
108
ALVEOLATA
Род Parachoanocystoides de Saedeleer,
1930 (рис. 45, 11)
(= Choanocystis Cognetti de Martiis, 1918;
Choanocystella de Melo, 1931)
Форма тела эллипсоидальная, на переднем кон-
це — сократимая папилла, окруженная сократимым же
цитоплазматическим воротничком.
Монотипический род.
Типовой вид Parachoanocystoides tentaculata
(Cognetti de Martiis, 1918) de Saedeleer, 1930 (= Choano-
cystis tentaculata Cognetti de Martiis, 1918; Choanocystella
tentaculata (Cognetti de Martiis, 1918) de Melo, 1931).
Типовой хозяин: Pheretima beaufortii.
Род Choanocystoides Cognetti de Martiis,
1925 (рис. 45, 12)
Сходен c Parachoanocystoides, но имеет на перед-
нем полюсе глубокое впячивание, стенки которого не-
сут цитопили.
Монотипический род.
Типовой вид Choanocystoides costaricensis
Cognetti de Martiis, 1925.
Типовой хозяин: Pheretima heterochaeta, Ph.
indica.
Род Zeylanocystis Dissanaike, 1953
Трофозоиты блюдцевидной формы, поверхность
несет папиллы, приуроченные к краю клетки и закан-
чивающиеся цитопилями.
Описано 2 вида.
Типовой вид Zeylanocystis burti Dissanaike,
1953.
Типовой хозяин: Pheretimapeguana.
Pop, Arborocystis Rees et Howell, 1966
Форма тела грушевидная, передний конец окружен
кольцом сократимых папилл.
2 вида.
Типовой вид Arborocystispiriformis (Rees, 1962)
Rees et Howell, 1966 (= Dendrocystis piriformis Rees, 1962).
Типовой хозяин: Allolobophora caliginosa.
Род Oligochaetocystis Meier, 1956
Форма тела булавовидная, гамонты одиночные или
в сизигиях.
Описано 3 вида.
Типовой вид Oligochaetocystispachydrilii Mei-
er, 1956 (= Monocystis pachidrilii Lankester, 1863; Mono-
cystis pachidrilii (Claparede, 1861) Labbe, 1899; Gono-
spora pachidrilii Vejdovsky, 1879; Gregarina saenuridis
Kolliker, 1848 in Delphy (1922)).
Типовой хозяин: Lumbricillus semifuscus.
Pop Aikinetocystis Gates, 1926
(рис. 45, 13)
(= Pessoaella Righi, 1988)
Задний конец тела расширен, передний формиру-
ется за счет дихотомического ветвления тела трофо-
зоита.
Описано 3 вида.
Типовой вид AildnetocystissingularisGates, 1926.
Типовой хозяин: Eutyphaeus foveatus, Е. pegu-
anus, E. rarus, E. spinulosus.
Примечание. Последние отростки с присосками.
Род Nellocystis Gates, 1933 (рис. 45, 10)
Задний конец тела вздут, передний — дендрито-
видный.
Монотипический род.
Типовой вид Nellocystisbirmanica Gates, 1933.
Типовой хозяин: Pheretima compta.
Примечание. Возможно, имеют 2 ядра (?).
Сем. Ganymedidae Huxley, 1910
Сизигии каудофронтальные; на заднем конце прими-
та — чашевидное углубление, куда входит передний ко-
нец сателлита; цитоплазмы гамонтов смешиваются. Гаме-
тоцисты сферические. Ооцисты неизвестны.
Семейство содержит единственный род.
Род Ganymedes Huxley, 1910 (рис. 46, 1)
Признаки семейства.
Монотипический род. Обнаружены в кишечнике
ракообразных.
Типовой вид GanymedesanaspidisHuxley, 1910.
Типовой хозяин: Anaspides tasmaniae (Crusta-
cea: Anaspidacea).
Сем. Enterocystidae Codreanu, 1940
Развитие вначале внутриклеточное; сизигии нео-
гамные, примит расширен в основании, а сателлит бо-
лее или менее цилиндрический, так что две клетки
вместе имеют форму меча или кинжала. Гаметоцисты
без спородуктов, вскрываются простым разрывом обо-
лочки. Ооцисты эллипсоидальные.
Все представители этого семейства паразитируют
в кишечнике личинок поденок.
Семейство содержит единственный род.
Род Enterocystis Tsvetkov, 1926 (рис. 46, 2)
Признаки семейства.
Известно порядка 8 видов.
ТИП SPOROZOA. КЛАСС GREGARINEA
109
Рис. 46. Грегарины семейств Ganymedidae (7), Enterocystidae (2) и Allantocystidae (3).
I — Ganymedes anaspidis, сизигий; 2 — Enterocystis fungoides; 3 —Allantocystis dasyhelei (a — молодой трофозоит, б— взрослый трофозоит, в — гаметоци-
ста, г — ооцисты). (/ — по: Huxley, 1910; 2 — по: Desportes, 1974; 3 — по: Keilin, 1920).
Fig. 46. Gregarines of families Ganymedidae (7), Enterocystidae (2) and Allantocystidae (3).
/ — Ganymedes anaspidis, syzygy; 3 — Allantocystis dasyhelei (a — young trophozoite, 6 — adult trophozoite, в — gametocyst, г — oocysts).
Типовой вид Enterocystis ensis Tsvetkov, 1926.
Типовой хозяин: Caenis sp. (Insecta: Epheme-
roptera).
Примечание. Грассе (Огаияб, 1953) сближает этот род с
сем. Hirmocystidae.
Сем. Diplocystidae Bhatia, 1930
Сизигии ранние с полным слиянием гамонтов.
Ооцисты эллипсоидальные, сферические или овоид-
ные с 8 спорозоитами.
Паразиты насекомых. Семейство содержит единст-
венный род.
Род Diplocystis Kiinstler, 1887
Признаки семейства. Гаметоцисты в гемоцеле.
Ооцисты эллипсоидальные, вскрываются в средней
кишке хозяина.
Спорозоиты, вышедшие из ооцисты в кишечнике
хозяина (сверчок, таракан), проникают между столбча-
тыми клетками эпителия в его основание или в соеди-
нительнотканно-мускульную оболочку, где образуют
сизигии и приступают к первому этапу роста и разви-
тия. Затем натянутая оболочка не выдерживает и моло-
дые грегарины (сизигии) выпадают в гемоцель, где
продолжают расти. Слияние цитоплазм гамонтов на-
ступает по достижении окончательных размеров. Га-
метоцисты развиваются в гемоцеле. Заражение хозяев
происходит вследствие каннибализма.
Известно 10 видов.
Типовой вид Diplocystis schneideri Kiinstler,
1887.
Типовой хозяин: Periplaneta americana, Blatta
orientalis (Insecta: Blattoidea).
Примечание. По мнению Грассе (Grasse, 1953), ранние си-
зигии и эллипсоидальные ооцисты говорят о возможном родстве
Diplocystis и Hirmocystidae.
Сем. Allantocystidae Bhatia, 1930
Гамонты удлиненные. Гаметоцисты удлиненные,
колбасовидные. Ооцисты веретеновидные с неодина-
ково выпуклыми боковыми сторонами.
Семейство содержит единственный род.
110
ALVEOLATA
Род Allantocystis Keilin, 1920
(рис. 46, 3)
Признаки семейства. Сизигии фронтальные.
Монотипический род. Описаны из кишечника ли-
чинок мокрецов.
Типовой вид Allantocystis dasyhelei Keilin,
1920.
Типовой хозяин: Dasyhelea obscura (Diptera:
Ceratopogonidae), личинки.
Примечание. Грассе (Grasse, 1953) на основании формы
ооцист сближает Allantocystis с сем. Stylocephalidae.
Подотряд Septata Lankester,
1885
Трофозоиты полицистидные: тело подразделено
как минимум одной септой на протомерит и дейтоме-
рит, характерно наличие эпимерита.
Преимущественно паразиты членистоногих.
В качестве основы для рассмотрения эугрегарин
подотряда Septata взята система, использованная в 1-м
и 2-м изданиях «Ап illustrated guide to the Protozoa»
(Levine, 1985; Perkins et al., 2000).
Надоем. Porosporicae Chakravarty,
1960
Гетероксенные, двуххозяинные; один хозяин — ра-
кообразное, другой — моллюск.
Надсемейство включает единственное семейство с
3 родами и 37 видами.
Сем. Porosporidae Labbd, 1899
Представители сем. Porosporidae отличаются ot
других грегарин дигенетическим или двуххозяинным
жизненным циклом. Типичным примером может слу-
жить жизненный цикл Nematopsis ostrearum (Prytherch,
1940) (рис. 47). Особи хозяина (краб Panopeus herbsti)
заражаются грегаринами, поедая инвазионные споро-
цисты (рис. 47, а), содержащиеся в тканях устрицы
Crassostrea virginica (жабры, мантия). Свободные спо-
розоиты прикрепляются к клеткам кишечного эпите-
лия при помощи округлого эпимерита, принимают
округлую форму и растут (рис. 47, в, г). Через 15—20 ч
после заражения трофозоиты отделяются от эпителия
и формируют пре-рецродуктивные ассоциации в виде
прямых или разветвленных цепочек (рис. 47, д). Эти
ассоциации вскоре распадаются на одиночные трофо-
зоиты, которые опять прикрепляются к кишечной
стенке (рис. 47, е). После короткого периода прикреп-
ления и роста грегарины приобретают цилиндри-
ческую форму и вновь отделяются от кишечной стен-
ки (рис. 47, ж). Начиная с этого момента трофозоиты
свободно перемещаются в просвете кишечника и
быстро растут, вероятно, адсорбируя питательные ве-
щества из кишечника краба. Для них характерны рез-
кие изгибания и внезапные сокращения тела. Период
роста в свободном состоянии продолжается 2—3 нед.
Затем образуются парные каудофронтальные сизигии
(рис. 47, з), которые мигрируют в прямую кишку хозя-
ина, и примит прикрепляется к ее стенке передним
концом (рис. 47, и). Здесь происходит формирование
гаметоцисты (рис. 47, й), гаметогенез и образование
зигот, которые покрываются тонкой оболочкой. Каж-
дая зигота делится на 8, иногда 16 спорозоитов, кото-
рые группируются радиально вокруг несколько более
крупной центральной клетки. Тонкая оболочка ооци-
сты разрушается, и «голые» связки спорозоитов —
гимноспоры (рис. 47, л) — попадают в морскую воду
через разрыв оболочки гаметоцисты (рис. 47, к), вы-
брошенной во внешнюю среду с фекалиями краба.
Гимноспоры попадают в мантийную полость устрицы
с пищевым током воды и прилипают к жабрам и ман-
тии. Далее гимноспоры каким-то образом (по разным
источникам — фагоцитозная активность жабр или же
собственная активность гимноспоры) проникают
сквозь покровный эпителий в кровеносные сосуды, где
их поглощают фагоциты. Внутри лейкоцитов спорозо-
иты претерпевают период роста, который сопровожда-
ется увеличением размеров фагоцита (рис. 47, м, н).
Зараженные клетки образуют скопления в сосудах
жабр и мантии. В конце жизненного цикла каждый
спорозоит покрывается толстой двуслойной оболоч-
кой (рис. 47, о—р), формируя спору или спороцисту
(рис. 47, а). Образование спор сопровождается гибе-
лью и разрушением зараженных клеток. Споры Nema-
topsis некоторые авторы (Levine, 1985; Clopton, 2000)
также называют ооцистами, что неверно, так как обо-
лочка ооцисты, по определению, формируется зиго-
той, а не спорозоитом.
Признаки надсемейства. Вегетативные стадии в пи-
щеварительном тракте десятиногих ракообразных, а
спорогония в соединительной ткани пластинчатожа-
берных моллюсков и гастропод.
Примечание. 1.Клоптон (Clopton, 2000) указывает, что
хотя Porosporidae и характеризуются дигенетическим жизненным
циклом, но ни один жизненный цикл пороспорид не исследован
полностью корректным экспериментальным способом. Что касает-
ся исследования Prytherch, то все животные, использованные в его
работе, были собраны в полевых условиях. Поэтому, по мнению
Клоптона, нет никаких доказательств того, что чистота данного ис-
следования не нарушена никакими посторонними инвазиями, на-
пример кокцидийной природы.
2. Клоптон (Clopton, 2000) отмечает, что валидность таксонов
и таксономические отношения внутри Porosporidae не до конца вы-
яснены. К этому замечанию следует добавить, что имеет место
некоторое несоответствие родовых названий и диагнозов, которое
вызывает мысли о таксономической путанице и потому требует
тщательного расследования. Так, название Porospora предполагает
наличие споры, в оболочке которой имеется отверстие (пора). Между
тем к этому роду относятся грегарины, у которых, согласно диа-
гнозу, оболочка споры не образуется. В то же время споры с откры-
вающимся отверстием формируют грегарины рода Nematopsis.
Род Porospora Schneider, 1875
Спороцисты отсутствуют, спорозоиты в лейкоци-
тах моллюска. Взрослые трофозоиты относительно
длинные, с тенденцией к изолированному существова-
нию.
ТИП SPOROZOA. КЛАСС GREGARINEA
111
Рис. 47. Жизненный цикл Nematopsis ostrea-
rum (PoroHporidac, объяснение в тексте).
(По: Prytherch, 1940).
Fig. 47. Life cycle of Nematopsis ostrearum
(1’oronporidac, explication in the text).
Описано 2—4 вида (по разным источникам).
Тицовой вид Porospora gigantea. (van Beneden,
1869) Schneider, 1875 (= Gregarina gigantea van Bene-
den, 1869).
Типовые хозяева: омары Hommarus gamma-
rus, H. americanus (Crustacea: Decapoda); моллюск
Trochocochlea mutabilis (Mollusca; Gastropoda).
Род Nematopsis Schneider, 1892
(*= Carcinoecetes Ball, 1938 in part)
Развитие гимноспор в промежуточном хозяине
(моллюске) заканчивается формированием спороцист.
Спороцисты с единственным спорозоитом покры-
ты толстой двойной оболочкой. Пре-репродуктивные
ассоциации обычно из нескольких особей в прямой
или раздвоенной цепочке. В репродуктивных ассо-
циациях (сизигиях) примит и сателлит могут быть
покрыты общим эпицитом; септа в сателлите (сател-
литах) может отсутствовать; сателлиты могут сливать-
ся друг с другом, формируя многоядерное образо-
вание; протомерит примита с «мускульным» ворот-
ничком.
Описано около 32 видов.
Типовой вид Nematopsis legeri Hatt, 1931.
Типовые хозяева: краб Eriphia spinifrons
(Crustacea: Decapoda); мидия Mytilus galloprovincialis
(Mollusca; Bivalvia).
112
ALVEOLATA
Род Pachyporospora Th6odoridfes,
1961
Особи в сизигиях (?) многоядерные, но без ка-
ких-либо перегородок; с многочисленными попереч-
ными складками, глубоко вдающимися в цитоплазму.
Описано 3 вида из кишечника крабов.
Примечание к диагнозу. Предположительно известны
только особи в сизигии — они имеют 2—3 ядра и лишены септы.
Теодоридес (Theodorides, 1961) полагает, что септа исчезает после
объединения в сизигии. Другие стадии жизненного цикла не изуче-
ны. Клоптон (Clopton, 2000) указывает, что положение этого рода в
сем. Porosporidae спорное.
Типовой вид Pachyporospora laubieri Theodo-
rides, 1961.
Типовые хозяева: Atelecyclus septemdentatus,
A. rotundatus (Crustacea: Decapoda).
Надсем. Gregarinicae Chakravarty,
1960
Жизненный цикл гомоксенный, сизигии ранние.
Это надсемейство включает в себя 7 семейств, объ-
единяющих примерно 45 родов с приблизительно 560
описанными видами. Его представители отличаются
от Porosporidae моногенетическим жизненным цик-
лом, в котором спорогония полностью проходит в га-
метоцисте. Грегарины надсем. Gregarinicae обычно
формируют ранние сизигии, чем отличаются от Ste-
nophoricae, у которых объединение в сизигии происхо-
дит непосредственно перед инцистированием.
Сем. Cephaloidophoridae Kamm, 1922
Эпимерит присутствует. Раннее развитие внутри-
клеточное. Сизигии каудофронтальные, ранние; при-
мит отличается от сателлита. Выраженная анизогамия.
Гаметоцисты вскрываются простым разрывом оболоч-
ки. Ооцисты овоидные или сферические с выступаю-
щим экваториальным гребнем; эписпора не выражена.
В кишечнике ракообразных и других относительно
примитивных членистоногих.
Семейство включает в себя 3 рода и около 70 видов,
главным образом кишечных паразитов десятиногих
раков, бокоплавов и усоногих.
Род Cephaloidophora Mavrodiadi, 1908
(рис. 48, 1, 2)
Эпимерит небольшой, линзовидный. Ооцисты эл-
липсоидальные или сферические, с небольшим эквато-
риальным кольцом, высвобождаются из гаметоцисты
цепочками или поодиночке.
В кишечнике усоногих, десятиногих раков и боко-
плавов. Примерно 62 вида.
Типовой вид Cephaloidophora communis Mav-
rodiadi, 1908 (= Pyxinioides chthamali Tuzet et Ormieres,
1956).
Типовой хозяин: Balanus improvisus, B. ebur-
neus, B. amphitrite (Crustacea: Cirripedia).
Род Caridohabitans Ball, 1959
(рис. 48, 3)
Эпимерит отчетливо выражен, прозрачный, полу-
лунный, вогнут спереди; эпицит толстый; ядро с гра-
нулами, нерегулярно распределенными вдоль ядерной
оболочки, без эндосомы. Гаметоцисты и ооцисты неиз-
вестны.
В пищеварительном тракте ракообразных. Описано
4 вида.
Типовой вид Caridohabitans setnai Ball, 1959.
Типовой хозяин: Penaeus semisulcatus (Crus-
tacea: Decapoda).
Род Rotundula Goodrich, 1949
(рис. 48, 4)
Эпимерит в виде пуговицы, персистирующий;
трофозоиты округлые. Ооцисты маленькие, сфе-
рические или субсферические, с экваториальным
швом.
В бокоплавах. Описано 4 вида.
Типовой вид Rotundula gammari (Diesing, 1859)
Goodrich, 1949 (= Gregarina gammari von Siebold, 1839;
G. gammari Diesing, 1859; Cephaloidophora echinogam-
mari Poisson, 1921, C. gammari (von Frantzius, 1848)
Theodorides, 1967).
Типовой хозяин: Gammarus pulex (Crustacea:
Amphipoda).
Рис» 48» Грегарины семейств Cephaloidophoridae (7—4), Uradiophoridae (5, 6), Gregarinidae (7—72), Metameridae (73, 14), Hirmocystidae (75,
76) и Didymophyidae (77). (Из разных источников).
7 — Cephaloidophora duboscqui (a — взрослый трофозоит, б—молодые трофозоиты в клетках хозяина); 2 — Cephaloidophora communis (ооцисты); 3 — Cari-
dohabitans setnai', 4 — Rotundula gammari; 5 —Heliospora longissima (a — сизигий, 6 —ооциста); 6 — Pyxinioides balani (a — прикрепленный трофозоит, б —
ооцисты); 7— Gregarina ovata;8 — Gamocystis francisci; 9—Anisolobus dacnecola; 10 — Bolivia vellardi; 11 — Garnhamia aciculata (сизигий, прикрепленный
кэпителию — срез); 12— Torogregarina stammeri; 13 — Metamera schubergi; 14— Gopaliella marphysae; 15—Hirmocystis ventricosa (a— молодой трофозо-
ит, б — ооциста); 16 — Quadruhyalodiscus gallerucidae; 17 — сизигий Didymophyes gigantea.
Fig. 48. Gregarines of families Cephaloidophoridae (7—4), Uradiophoridae (5, 6), Gregarinidae (7—72), Metameridae (73, 14), Hirmocystidae (75,
76) and Didymophyidae (77).
7 — Cephaloidophora duboscqui (a — adult trophozoite, 6—young trophozoites in the host cells); 2 — Cephaloidophora communis (oocysts); 5 — Heliospora longis-
sima (a — syzygy, 6 — oocysts); 6 — Pyxinioides balani (a — attached trophozoite, 6 — oocysts); 77 — Garnhamia aciculata (section of syzygy attached to the host
epithelium); 15 — Hirmocystis ventricosa (a — young trophozoite, 6 — oocysts); 17 — syzygy of Didymophyes gigantea.
ТИП SPOROZOA. КЛАСС GREGARINEA
113
II |и|. 'i I 11, I
114
ALVEOLATA
Сем. Cephalolobidae Theodorides
et Desportes, 1975
Взрослые трофозоиты прикреплены к эпителию
желудка видоизмененной передней частью прото-
мерита; этот «прото-эпимерит» расширен в виде при-
соски и формирует доли, которые плотно прикреплены
к микровиллям желудочного эпителия. Сизигии ран-
ние, состоящие из примита и одного или двух-трех са-
теллитов, располагающихся в последнем случае бок
о бок.
Семейство включает в себя 2 рода и 5 видов, глав-
ным образом кишечных паразитов ракообразных —
бокоплавов и десятиногих раков.
Род Uradiophora Mercier, 1912
(рис. 20, ж; 25, 1)
Эпимерит простой. Развитие внеклеточное. Сател-
лит с отростком на заднем конце. Гаметоцисты овоид-
ные, открываются простым разрывом стенки. Ооцисты
сферические или почти сферические, изолированные,
с тонким экваториальным ребром.
В ракообразных. Описано 6 видов.
Типовой вид Uradiophora cuenoti (Mercier,
1911) Mercier, 1912 (= Cephaloidophora cuenoti Mercier,
1911).
Типовой хозяин: Atyaephyra desmaresti (Crus-
tacea: Decapoda, Caridea).
Род Cephalolobus Kruse, 1959
Развитие внеклеточное; сизигии каудофронталь-
ные, прикрепленные к кишечной стенке, с 1, 2 или
3 сателлитами; сателлиты меньше примита; протоме-
рит сателлита без специальных прикрепительных при-
способлений.
Описано 6 видов из кишечника ракообразных.
Типовой вид Cephalolobus penaeus Kruse,
1959.
Типовой хозяин: Penaeusaztecus, Р. duorarum
(Crustacea: Decapoda).
Род Callynthrochlamys Frenzel,
1885
Ядро трофозоитов с многочисленными радиальны-
ми трубчатыми выростами; сизигии каудофронталь-
ные; гаметоцисты овальные; ооцисты сферические,
склеены в цепочки при освобождении.
Описан 1 вид из кишечника амфипод.
Типовой вид Callynthrochlamys phronimae Fren-
zel, 1885.
Типовой хозяин: Phronima sedentaria (Crusta-
cea: Amphipoda).
Примечание. Систематическое положение этого рода неяс-
но. Несмотря на гистологические (Dogiel, 1910) и ультраструктур-
ные исследования (Desportes, Theodorides, 1969), в литературе нет
точного описания формы тела этой грегарины.
Сем. Uradiophoridae Grass6,
1953
Эпимерит простой, цилиндрический. Развитие вне-
клеточное. Сизигии каудофронтальные, ранние; про-
томерит сателлита вдавлен в дейтомерит примита.
Анизогамные. Гаметоцисты вскрываются простым
разрывом стенки. Ооцисты сферические, изолирован-
ные (не образуют цепочек при высвобождении из га-
метоцисты), с тонким экваториальным гребнем или ра-
диальными отростками.
Семейство включает в себя 5 родов и 21 вид. Глав-
ным образом кишечные паразиты ракообразных.
Род Heliospora Goodrich, 1949
(рис. 48, 5)
Эпимерит простой. Взрослые трофозоиты удлинен-
ные. Ооцисты почти сферические, с экваториальными
лучевидными отростками, сформированными эписпо-
рой. В амфиподах. Описано 3 вида.
Типовой вид Heliospora longissima (von Siebold
in Kolliker, 1848) Goodrich, 1949 (= Gregarina gammari
Kolliker, 1847; Didymophyes longissima (von Siebold, 1839)
von Frantzius, 1848; Gregarina longissima von Siebold in
Kolliker, 1848; Gregarina millaria (Zenker) Diesing, 1851;
Gregarina pediepiscopalis (von Wasielewski, 1896); Ura-
diophora longissima (von Siebold in Kolliker, 1848) Pois-
son, 1921; Uradiophora gammari (Kolliker, 1847) Poisson,
1924; Monocystis gammari Georgevitch, 1951).
Типовой хозяин: Gammarus pulex (Crustacea:
Amphipoda).
Род Pyxinioides Tregouboff, 1912
(рис. 48, 6)
Эпимерит в виде ребристой головки с 16 продоль-
ными бороздами и маленьким апикальным конусом
или куполом. Гаметоцисты открываются простым раз-
рывом стенки. Ооцисты неизвестны или эллипсои-
дальные с длинным отростком на одном из концов, ча-
сто объединены в пакеты.
В морских желудях. Описано 10 видов.
Типовой вид Pyxinioides balani (Kolliker, 1848)
Tregouboff, 1912 (= Gregarina balani Kolliker, 1848).
Типовой хозяин: Balanus eburneus (Crustacea:
Cirripedia).
Род Nematoides Mingazzini,
1891
Взрослые трофозоиты червеобразные, без септы.
Эпимерит в форме вилки или щипцов на удлиненной
шейке.
Монотипический род.
Типовой вид Nematoides fusiformis Mingazzini,
1891.
ТИП SPOROZOA. КЛАСС GREGARINEA
115
Типовой хозяин: Balanusperforatus (Crustacea:
Cirripedia).
Примечание. Клоптон (Clopton, 2000) указывает, что этот
вид очень бедно описан и ни разу не отмечен со времени описания
чп прошедшие более чем сто лет. Его систематическое положение в
значительной степени определено положением типового хозяина.
Для установления его валидности требуются дополнительные ис-
следования.
Род Bifilida Tuzet et Ormieres, 1964
Эпимерит неизвестен. Ооцисты цилиндрические с
длинными филаментами на каждом конце, высвобож-
даются цепочками.
В морских желудях. Монотипический род.
Типовой вид Bifilida гага Tuzet et Ormieres,
1964.
Типовой хозяин: Chthamalus stellatus (Crusta-
cea: Cirripedia).
Сем. Gregarinidae Labbe, 1899
Эпимерит простой. Сизигии каудофронтальные,
обычно ранние, иногда очень ранние. Анизогамия вы-
ражена средне. Гаметоцисты со спородуктами. Ооци-
сты отчетливо удлиненные или цилиндрические, сим-
метричные.
Примечание. В диагнозе этого семейства, приведенном во
птором издании «Ап illustrated guide to the protozoa» (Clopton, 2000)
укп'шно: «раннее развитие внутриклеточное». Поскольку исследо-
nniiiiH раннего развития грегарин из рода Gregarina показали, что
что не так (Devauchelle, 1968а; Tronchin, Schrevel, 1977), мы сочли
более корректным убрать данный критерий из диагноза.
Семейство включает в себя 15 родов и 352 вида, главным обра-
том, кишечных паразитов насекомых. Несколько родов специально
учреждены Левайном (Levine, 1979) для различных представите-
лей семейства, которые паразитируют не в насекомых.
Род Gregarina Dufour, 1828
(рис. 20, е; 25, 12; 28, 3, 4; 32; 48, 7)
(= Deguistina Levine, 1979 (in part);
Erhardovina Levine, 1985 (in part))
Эпимерит конический, бутоноообразный (в виде
НуГОНИЦы), шаровидный или цилиндрический. Сизи-
HIII ptllllllie, Ооцисты бочонковидные, лодочковидные
(1ИИИИулир11ЫС) или сферические.
И МИШвЧИИКС насекомых. Описано около 317 видов.
ТНИПНОЙ пид Gregarina ovata Dufour, 1828
( (t'tiHOldca Hammerschmidt, 1838; Clepsid-
I'lHlI DWM (Puftnir, 1826) Schneider, 1873).
ТИПОВОЙ ХОЗЯИН! Forficula auricularia (Insecta:
I )₽i IIWPIWB),
Типовой вид Gymnospora nigra Moniez, 1886.
Типовой хозяин: Vanessa urticae (Insecta: Lepi-
doptera).
Род Triseptata H. Hoshide, 1958
Трофозоиты в сизигиях попарно цилиндрические,
с телом, состоящим из трех сегментов, разделенных
септами; эпимерит — маленький овоидный бугорок.
Ооцисты эллипсоидальные, выделяются цепочками.
Монотипический род.
Типовой вид Triseptata fungicola Н. Hoshide,
1958.
Типовой хозяин: Erotylidae Gen. sp. (Insecta:
Coleoptera).
Род Gamocystis Schneider, 1875
(рис. 48, 8)
Эпимерит отсутствует; протомерит временный —
отсутствует у взрослых трофозоитов. Сизигии ранние.
Гамонты цилиндрические, округлые или языковидные.
В кишечнике насекомых. Описано 7 видов.
Типовой вид Gamocystis tenax Schneider, 1875.
Типовой хозяин: Ectobius lapponicus (Insecta:
Blattoidea).
Род Anisolobus Vincent, 1924 (рис. 48, 9)
Эпимерит, видимо, отсутствует даже у самых мо-
лодых стадий. Передние края протомерита формируют
прикрепительный диск. Сизигии очень ранние. Гаме-
тоцисты эллипсоидальные, с толстой оболочкой и 6—
8 спородуктами. Ооцисты бочонковидные, выделяют-
ся цепочками.
В насекомых. Описано 4 вида.
Типовой вид Anisolobus dacnecola Vincent, 1924.
Типовой хозяин: Dacne rufifrons (Coleoptera:
Erotylidae).
Род Anisoloboides Theodorides, 1992
Сходен c Anisolobus. Эугрегарины с трофозоитами
округлой формы в ранних двучленных сизигиях,
округлая форма особенно выражена у примита; прото-
мерит с 15—20 хорошо выраженными долями. Гамето-
цисты сферические. Ооцисты неизвестны.
Описано 4 вида.
Типовой вид Anisoloboides joliveti Theodorides,
1992.
Типовой хозяин: Brachyomus histrio (Coleopte-
ra: Curculionidae).
Род Gymnospora Moniez, 1886
Гаметоцисты имеют до 8 спородуктов. Ооцисты
сферические. Трофозоиты неизвестны.
Монотипический род.
Род Garnhamia Crusz, 1957 (рис. 48, 11)
Форма эпимерита от сосочковидной до игольчатой.
Септа отсутствует (малозаметная?). Сизигии образу-
ются пока примит еще прикреплен к эпителию средней
116
ALVEOLATA
кишки. Гаметоцисты со спородуктами. Ооцисты ово-
идпые, выделяются цепочками.
В чешуйницах (первичнобескрылые насекомые).
Монотипический род.
Типовой вид Garnhamia aciculata Crusz, 1957
(= Gregarina aciculata Bhatia, 1938; Gregarina ctenole-
pismae Lindsay, 1939).
Типовой хозяин: Lepisma saccharina (Insecta:
Thysanura).
Род Тогодгедаппа Geus, 1969 (рис. 48, 12)
Эпимерит сохраняется у гамонтов в сизигиях; эпи-
мерит большой, овоидный; протомерит формирует
широкое тороидальное вздутие в основании эпимери-
та. Сизигии ранние, каудофронтальные. Гаметоцисты
округлые, вскрываются простым разрывом оболочки.
Ооцисты бочонковидные, не образуют цепочек.
Описано 2 вида.
Типовой вид Torogregarina stammeri Rauchalles
in Geus (1969).
Типовой хозяин: Nosodendron fasciculare (Co-
leoptera: Nosodendridae).
Род Faucispora Baudoin, 1967
Ооцисты с эллипсоидальной эндоспорой; эписпора
на обоих полюсах с полыми выростами, закрытыми
маленькими колпачками (cap-valve).
Монотипический род.
Типовой вид Faucispora phryganeae (Berge-
von-Emme, 1912) Baudoin, 1967 (= Diplocystis phryga-
neae Berge-von-Emme, 1912).
Типовой хозяин: Phryganea striata, Agrypnia
pagetana, A. obsolete (Trichoptera: Phryganeidae).
Род Spinispora Baudoin, 1967
Ооцисты веретеновидные, покрытые шипами по
всей поверхности.
Монотипический род.
Типовой вид Spinispora dytisci Baudoin, 1967.
Типовой хозяин: Dytiscus marginalis (Coleop-
tera: Dytiscidae), целом.
Род Bolivia Corbel, 1968 (рис. 48, 10)
Трофозоиты листовидные; протомерит с сужением
на конце и, часто, со вздутием в основании; дейтоме-
рит цилиндрический с тонкой продольной исчерчен-
ностью. Гаметоцисты сферические, со слизистым чех-
лом, с единственным коротким широким спородуктом
и крупным остаточным телом. Ооцисты бочонковид-
ные, высвобождаются не цепочками, а в виде слип-
шейся массы.
Монотипический род.
Типовой вид ВоНvia vellardi Corbel, 1968.
Типовой хозяин: Gryllus sp. (Orthoptera: Grylli-
dae).
Род Cirrigregarina Levine, 1979
Сходно c Gregarina (эпимерит конический, в виде
кнопки, шаровидный или цилиндрический; сизигии ран-
ние; ооцисты бочонковидные, лодочковидные (нави-
кулярные) или сферические). Найдены в усоногих.
Описано 2 вида.
Типовой вид Cirrigregarinaspissa (Henry, 1938)
Levine, 1979 (= Gregarina spissa Henry, 1938).
Типовой хозяин: Balanus cariosus, B. glandula
(Crustacea: Cirripedia).
Род Molluskocystis Levine, 1979
Сходно c Gregarina (эпимерит конический, в виде
кнопки, шаровидный или цилиндрический; сизигии
ранние; ооцисты бочонковидные, лодочковидные (на-
викулярные) или сферические). Найдены в моллюсках.
Монотипический род.
Типовой вид Molluskocystis pterotracheae (Stu-
art, 1871) Levine, 1979 (= Zygocystis pterotracheae Stu-
art, 1871; Gregarina pterotracheae (Stuart, 1871) Labbe,
1899).
Типовой хозяин: Pterotrachea sp. (Gastropoda:
Heteropoda).
Примечание. Клоптон (Clopton, 2000) поддерживает мне-
ние Теодорида и Депорт (Theodorides, Desportes, 1975), согласно
которому Molluskocystis pterotracheae — младший синоним Cepha-
loidophora clausii (Frenzel, 1885), Kamm, 1922.
Сем. Gigaductidae Fillipponi, 1948
В жизненном цикле присутствует мерогония. Все
фазы развития меронтов и фазы роста гамонтов —
внутриклеточные. Зрелые гамонты и последующие
стадии гамогонии и спорогонии — внеклеточные.
Эпимерит формируется и у меронтов, и у гамонтов.
Зрелые гамонты подразделены септой на протомерит и
дейтомерит. Сизигии каудофронтальные. Гаметоци-
сты с толстой гиалиновой оболочкой, формируют
один крупный спородукт. Ооцисты, как у Gregarinidae,
бочонковидные или цилиндрические, склеенные в це-
почки.
В регенерационных криптах кишечника и мальпи-
гиевых сосудах насекомых: Collembola (ногохвостки);
Coleoptera, надсем. Caraboidea (жужелицы); Orthoptera,
надсем. Grylloidea (сверчки).
Это семейство включает в себя единственный род
Gigaductus, ранее относимый к сем. Gregarinidae на
основании общности признаков светооптической мор-
фологии. В 1948 г. Филиппони предложил выделить
этот род в отдельное сем. Gigaductidae (Filipponi, 1948)
по причине внутриклеточного развития. Грассе (Gras-
se, 1953), не соглашаясь с мнением Филиппони, на-
стаивает на том, что Gigaductus — типичный пред-
ставитель сем. Gregarinidae, а внутриклеточное разви-
тие само по себе достаточно широко распространено
среди грегарин и не является достаточной причиной
для выделения этого рода в отдельное семейство.
Ультраструктурные исследования, предпринятые
для проверки гипотезы, высказанной вначале Филип-
ТИП SPOROZOA. КЛАСС GREGARINEA
117
пони (Filipponi, 1953), а затем поддержанной Тюзе
и Ормье (Tuzet, Ormieres, 1966), — о наличии меро-
гонии в жизненном цикле Gigaductus anchi из жука Ап-
chus ruficornis (Coleoptera: Caraboidea Harpalomorpha),
полностью подтвердили ее верность (Ormieres, 1971;
Massot, Ormieres, 1979). Было показано, что в жизнен-
ном цикле грегарин Gigaductus anchi и Gigaductus ste-
ropi действительно существует мерогония, причем
двух типов, протекающая внутриклеточно в регене-
рационных криптах кишечника (см. раздел «Меро-
гония и мерозоиты»). На основании этих исследо-
ваний род Gigaductus был окончательно выделен в от-
дельное семейство и переведен в состав неогрегарин
в соответствии с концепцией Грассе о происхождении
этой группы от септатных грегарин. Ормье с соавт.
тем не менее подчеркивают при этом, что Gigaductidae
все же произошли от Gregarinidae, от которых уна-
следовали каудофронтальный сизигий, гаметоцисту со
спородукгом и бочонковидные ооцисты, склеенные в
цепочки.
В соответствии с принятым подходом (см. разделы
«Эволюция и филогения» и «Вопросы систематики»)
мы считаем более обоснованным с филогенетической
и эволюционной точек зрения рассматривать это се-
мейство в непосредственной связи с его ближайшими
родичами, т. е. в составе отряда Eugregarinida, так как
его представители обладают всеми достаточными для
этого морфологическими признаками.
Род Gigaductus Crawley, 1903
(рис. 30)
(= Endocryptella Morrigi, 1943)
11ризпаки семейства.
11 описанных видов.
Т и попой вид Gigaductus parvus Crawley, 1903.
THIIOIU.IC хозяева: Harpalus caliginosus, H.penn-
fiylvtltllewt (Coleoptera: Caraboidea).
Сем. Metameridae Levine, 1979
Эпимерит простой; трофозоиты с вторичной сег-
ментацией прото-и дейтомерита. В аннелидах.
('смсйстпо включает в себя 4 рода и 5 видов.
Род Metamera Duke, 1910
(рис. 48, 73)
J111ИМ1j)HI ПОЧТИ конический, его вершина с множе-
нном UltrUMUihlK inuibHaiiiiAiibix отростков. Гаметоци-
ты иии|шнш<гам П|нюшм разрывом оболочки. Ооци-
Г1ы Ппкопичагкна, пциикулириыс.
В НИЦЦКИХ (lllllUIHIO 3 ЙИДЙ.
Типовой вид nehuhei^l Duke, 1910.
In ионы с хочмени: (ihitediiluiida coiHpluiiata,
1 /eiiiiclepsis margliKitti (Annelida; 1 llrudlnen).
Примечание. Грассе (Cirassi, 1953) относит чтот род К ССМ.
I i-i tiilinidae.
Род Gopaliella Ganapati et al., 1974
(рис. 48, 74)
Эпимерит зонтиковидный, с центральным хорошо
окрашивающимся стержнем; тело со многими сегмен-
тами (обычно 8, иногда 12). Изогамные гаметоцисты
вскрываются простым разрывом оболочки. Ооцисты
сферические, с 8 спорозоитами.
Монотипический род. В полихетах.
Типовой вид Gopaliella marphysae Ganapati
etal., 1974.
Типовой хозяин: Marphysa gravelyi (Polychae-
ta: Eunicidae).
Род Deuteromera Bhatia et Setna, 1938
Эпимерит почти конический с вершиной в виде
чаши; прото- и дейтомерит трофозоитов с неполной
вторичной сегментацией. Сизигии, гаметоцисты и
ооцисты неизвестны.
Монотипический род. В полихетах.
Типовой вид Deuteromera cleava Bhatia et Setna,
1938.
Типовой хозяин: Eunice siciliensis (Polychaeta:
Eunicidae).
Род Cognettiella Pizl, Chalupsky et Levine,
1983 (рис. 9, 3)
Эпимерит простой; прото- и дейтомерит трофозои-
та с полной вторичной сегментацией. Сизигии, гамето-
цисты и ооцисты неизвестны.
Монотипический род. В целоме аннелид.
Типовой вид Cognettiella legeri Pizl, Chalupsky
et Levine, 1983 (= Taeniocystis legeri Cognetti de Martiis,
1911; Cognettia legeri (Cognetti de Martiis, 1911) Levine,
1979).
Типовой хозяин: Kynotus pitarelli (Annelida:
Oligochaeta (?)).
Сем. Didymophyidae Leger, 1982
Септа сателлита более или менее постепенно ре-
зорбируется в течение стадии сизигия. Гаметоцисты
сферические или слегка удлиненные. Ооцисты без
эписпоры, с эллипсоидальной эндоспорой; высвобож-
даются пакетами, окруженными тонкой оболочкой
(вторичная циста) посредством единственного очень
длинного тонкостенного спородукта.
Семейство включает в себя 4 рода и 5 видов.
Род Didymophyes von Stein, 1848
(рис. 48, 17)
Эпимерит цилиндро-конический, уменьшенный до
маленькой заостренной папиллы; дейтомерит с иголь-
чатыми кристаллоидами неизвестной природы в эн-
118
ALVEOLATA
доплазме. Гаметоцисты обычно сферические. Ооци-
сты сгруппированы в сферические пакеты внутри га-
метоцист.
Описан 41 вид.
Почти все виды этого рода — кишечные паразиты
личинок жуков-копрофагов из семейств Scarabaeidae и
Hydrophilidae.
Типовой вид Didymophyes gigantea von Stein,
1848 (= Gregarina gigantea Diesing, 1859; Gregarina gi-
gantea Lankester, 1863).
Типовой хозяин: Oryctes nasicornis (Coleopte-
ra: Scarabaeidae).
Сем. Hirmocystidae Grasse, 1953
Эпимерит обычно в виде папиллы или простого бу-
горка. Гаметоцисты вскрываются простым разрывом
оболочки. Ооцисты эллипсоидальные, призматиче-
ские, веретеновидные, овоидные или сферические.
Семейство включает в себя 16 родов и 69 видов.
Род Hirmocystis Labbe, 1899
(рис. 20, д\ 25, //; 48, 15)
Эпимерит — коническое вздутие или папилла, из-
менчивый. Трофозоиты часто собраны в цепочки (мно-
жественные сизигии). Ооцисты овоидные, эллипсои-
дальные или цилиндроидные.
В насекомых. Описано около 37 видов.
Типовой вид Hirmocystis ventricosa (Leger,
1892) Labbe, 1899 (= Eirmocystis ventricosa Leger,
1892).
Типовой хозяин: Tipula oleracea (Diptera: Ti-
pulidae), личинки.
Род Tettigonospora L. M. Smith, 1930
Сходен c Hirmocystis. Эпимерит сферический. При-
мит сходен с сателлитом. Гаметоцисты вскрываются
простым разрывом оболочки. Ооцисты прозрачные ги-
алиновые, сферические.
Монотипический род.
Типовой вид TettigonosporastenopelmatiL.М. Smith,
1930 (= Coccospora stenopelmati L. M. Smith, 1929; Hir-
mocystis stenopelmati (L. M. Smith, 1929) Corbel, 1968).
Типовые хозяева: Stenopelmatusfuscus, Steno-
pelmatus pictus (Orthoptera: Tettigoniidae).
Род Dumbbellicephalus Bala et Kaur, 1988
Эпимерит в форме гантели. Сателлит с отчетливой
широкой «подушечкой» спереди, формирующей сое-
динение с примитом. Гаметоцисты вскрываются про-
стым разрывом оболочки. Ооцисты сферические или
овоидные.
Монотипический род.
Типовой вид Dumbbellicephalus haldari Bala et
Kaur, 1988.
Типовой хозяин: Aulacophora foveicollis (Co-
leoptera: Chrysomelidae).
Род Euspora Schneider, 1875
Трофозоиты одиночные. Сизигии каудофронталь-
ные. Гаметоцисты вскрываются простым разрывом обо-
лочки, без спородуктов. Ооцисты призматические.
Описано 4 вида.
Типовой вид Eusporafallax Schneider, 1875.
Типовой хозяин: Rhizotrogus aestivus (Coleo-
ptera: Scarabaeidae).
Род Neohirmocystis Ghose et al., 1986
Эпимерит отсутствует или рудиментарный. Сизи-
гии каудофронтальные, ранние (хотя некоторые особи
могут оставаться одиночными); протодейтомеритная
септа присутствует у сателлита. Гаметоцисты вскры-
ваются простым разрывом оболочки. Ооцисты сфери-
ческие.
Описано 2 вида.
Типовой вид Neohirmocystis grassei Ghose, Ray
et Haidar, 1896.
Типовой хозяин: Tribolium castaneum (Coleo-
ptera: Tenebrionidae).
Род Hyalospora Schneider, 1875
Эпимерит — округлый бутон; эндоплазма молодых
трофозоитов оранжево-желтая. Ооцисты эллипсо-
идальные или веретеновидные. Описано 9 видов.
Типовой вид Hyalospora roscoviana Schneider,
1875.
Типовой хозяин: Holomachilis maritimus (In-
secta: Thysanura).
Род Tintinospora H. Hoshide, 1959
Трофозоиты в сизигиях по 2 или 3; эпимерит — ма-
ленькая глобулярная папилла. Гаметоцисты вскрыва-
ются простым разрывом оболочки. Ооцисты высво-
бождаются цепочками.
Монотипический род.
Типовой вид TintinosporasoroniaeН.Hoshide, 1959.
Типовой хозяин: Soroniajaponica (Coleoptera:
Nitidulidae).
Род Arachnocystis Levine, 1979
Эпимерит простой, сферический. Гаметоцисты
сферические, вскрываются простым разрывом оболоч-
ки, без остаточного тела. Ооцисты биконические с усе-
ченными концами.
Описано 3 вида.
Типовой вид Arachnocystis arachnoidea (Devd-
har et Gourishankar, 1971) Levine, 1979 (= Sycia arach-
noidea Devdhar et Gourishankar, 1971).
Типовой хозяин: Opalnia sp. (Arachnida: Opili-
ones).
ТИП SPOROZOA. КЛАСС GREGARINEA
119
Род Acanthogregarina Kalavati et al., 1988
Эпимерит — диск приблизительно 14 перифериче-
скими зубцами, собранными в две группы, по 7 зубцов
в каждой. Сизигии парные. Гаметоцисты без споро-
дуктов. Форма ооцист от цилиндрической до бочонко-
видной, с утолщенными полюсами; высвобождаются
группами, окруженными общей оболочкой через раз-
рыв стенки гаметоцисты.
Монотипический род.
Типовой вид Acanthogregarina hoshidei Kalava-
ti, Narasimhamurti et Vnidyullatadevi, 1988.
Типовой хозяин: Liogryllus sp. (Orthoptera: Gry-
lloidea).
Род Protomagalhaensia Pinto, 1918
Развитие внутриклеточное. Молодые трофозоиты
всегда удлиненные. Сизигии каудофронтальные, с
языковидной сцепкой. Ооцисты бочонковидные с ко-
ническими шипами, высвобождаются через разрыв
стенки гаметоцисты.
Описано 3 вида.
Типовой вид Protomagalhaensia serpentula
(de Magalhaes, 1900) Pinto, 1918 (= Gregarina serpentula
de Magalhaes, 1900).
Типовой хозяин: Periplaneta orientalis (Insecta:
Blattoidea).
Род Elliptocystis Sengupta et al., 1991
Раннее развитие внеклеточное. Молодые трофозои-
ты удлиненные. Сизигии каудофронтальные (с зубча-
той смычкой). Ооцисты сферические, высвобождают-
ся из эллиптической гаметоцисты через разрыв стенки.
Монотипический род.
Типовой вид Elliptocystis tribolii Sengupta et al.,
1991.
Типовой хозяин: Tribolium castaneum (Coleo-
ptera: Tenebrionidae).
Род Pintospora Carini, 1944
Трофозоиты вначале внутри-, а потом внеклеточ-
ные. Гаметоцисты с гладкой стенкой. Ооцисты объе-
динены попарно, каждая с утолщенными, несколько
приостренными концами, с гладкими стенками; обыч-
ны в свободном состоянии в целомической полости
ХОМИНИ.
Монотипический род.
ТИПОВОЙ вид Pintospora bigemina Carini, 1944.
Типовой Хозяин: Astylus atromaculatus (Coleo-
р|0ги: Melyridtie),
Род Endomycoln Thdodorld6s et al., 1972
Трофозоиты одиночные, округлые, с эпимеритом в
виде пуговицы и сферическим ядром; эндоцит и экто-
цит очень хромофильные. Гаметоцисты и ооцисты не-
известны. Амилопектинсодержащие вакуоли в эпиме-
рите. Эпицитарный покров окружает как прото-, так и
эпимерит от верхнего края эпимерита до нижней кром-
ки протомерита.
Описано 2 вида.
Типовой вид Endomycola baiyeri Theodorides
et al., 1972.
Типовой хозяин: Encymon ruficollis (Coleopte-
ra: Endomychidae).
Род Retractocephalus Haidar
et Chakraborty, 1976
Эпимерит округлый, втягивающийся в протомерит.
Раннее развитие внутриклеточное. Сизигии каудо-
фронтальные. Ооцисты бочонковидные, высвобожда-
ются из гаметоцисты цепочками через простой разрыв
оболочки.
Описано 6 видов.
Типовой вид Retractocephalus raphidopalpae (Hai-
dar et Chakraborty, 1976) Haidar et al., 1982 (= Retracto-
cephalus raphidopalpii Haidar et Chakraborty, 1976).
Типовой хозяин: Raphidopalpa (=Aulacophora)
foveicollis (Coleoptera: Chrysomelidae).
Род Liposcelisus Sarkar et Haidar, 1980
Эпимерит сферический, гиалиновый, с короной из
14—16 гребней. Гаметоцисты простые, вскрываются
простым разрывом оболочки. Ооцисты веретеновид-
ные.
Монотипический род; из кишечника сеноедов.
Типовой вид Liposcelisuscoronata Sarkar etHai-
dar, 1980.
Типовой хозяин: Liposcelis sp. (Insecta: Psoco-
ptera).
Род Quadruhyalodiscus Kundu et Haidar,
1984 (рис' 48, 16)
Эпимерит сферический, спереди с короной из 4
присоскообразных гиалиновых дисков, с короткой
шейкой. Гаметоцисты вскрываются простым разры-
вом оболочки. ОоЦисты веретеновидные с полярными
утолщениями. Развитие внеклеточное.
Монотипический род.
Типовой вид Quadruhyalodiscusgallerucidae Kun-
du et Haidar, 1984.
Типовой хозяин: Gallerucidabicolor(Coleopte-
ra: Chrysomelidae).
Надсем. Stenophoricae Levine, 1984
(= Solitaricae Chakravarty, 1960)
Гомоксенные. Трофозоиты одиночные. Развитие
внутриклеточное или внеклеточное. Эпимерит про-
стой или сложный. Сизигии поздние, образуются не-
120
ALVEOLATA
посредственно ПврвД инцистированием. Гаметоцисты
со СП продуктами или без них.
ЭТО падеемейство включает в себя 14 семейств с
примерно ЮЗ родами и приблизительно 570 видами. В
ОТЛИЧИв от надсем. Gregarinicae представители Stenop-
llOflcae остаются одиночными почти до самого образо-
вания гаметоцисты, т. е. из жизненного цикла практи-
чески выпадает стадия свободного, неинцистирован-
ного сизигия.
Сем, Stenophoridae Leger et Duboscq,
1904
Раннее развитие внутриклеточное. Эпимерит от-
сутствует или редуцирован до вогнутой формы. Сизи-
гии каудофронтальные, поздние (непосредственно пе-
ред инцистированием). Отчетливо выражена анизога-
мия. Гаметоцисты открываются простым разрывом
оболочки; выход ооцист поодиночке. Ооцисты овоид-
ные или эллипсоидальные, с очень развитой эписпо-
рой, с экваториальным швом или без него.
Это семейство включает в себя 3 рода и 93 вида.
Все они — кишечные паразиты двупарноногих много-
ножек (Diplopoda). Наиболее обширный род — Steno-
phora — насчитывает около 88 видов.
Род Stenophora Labbe, 1899 (рис. 49, 1)
Развитие внутриклеточное. Ооцисты овоидные с
выраженным экваториальным швом.
Описано 88 видов.
Типовой вид Stenophora juli (von Frantzius,
1846) Labbe, 1899 (= Gregarinajuli von Frantzius, 1846).
Типовой хозяин: Schizophyllum sabulosum
(= Julus sabulosus) (Myriapoda: Diplopoda).
Род Fonsecaia Pinto, 1918
Развитие внутриклеточное. Ооцисты удлиненно-
овоидные без экваториального шва.
Монотипический род.
Типовой вид Fonsecaia polymorpha Pinto, 1918.
Типовой хозяин: Orthomorpha gracilis (Myria-
poda: Diplopoda).
Род Hyalosporina Chakravarty, 1935
Эпимерит — дисковидный воротничок (окаймлен-
ный тонкими пролиферирующими корешками у взрос-
лых трофозоитов), с центральной языковидной папил-
лой, без шейки. .Ядро прикреплено к задней части дей-
томерита двумя латеральными пучками мионем.
Анизогамные. Ооцисты овоидные с мощной полярной
эписпорой.
Описано 4 вида.
Типовой вид Hyalosporina cambolopsis Chakra-
varty, 1935.
Типовой хозяин: Cambolopsis sp. (Myriapoda:
Diplopoda).
Сем. Leidyanidae Kudo, 1954
Сходны c Gregarinidae (эпимерит простой; раннее
развитие внутриклеточное; сизигии каудофронталь-
ные; анизогамия выражена средне; гаметоцисты со
спородуктами), но одиночные. Эпимерит в виде бугор-
ка. Гаметоцисты с несколькими спородуктами. Ооци-
сты бочонковидные.
Это семейство включает в себя единственный род,
Leidyana, с 29 описанными видами. Все они кишечные па-
разиты насекомых в основном бабочек и прямокрылых.
Род Leidyana Watson, 1915 (рис. 49, 2)
Сизигии поздние. Эпимерит — простой округлый
бугорок. Ооцисты высвобождаются из гаметоцист че-
рез спородукты. Ооцисты бочонковидные.
Около 29 описанных видов.
Типовой вид Leidyana erratica (Crawley, 1907)
Watson, 1915 (= Gregarina achaetaeabbreviatae Leidy in
Crawley, 1907; Stenophora erratica Crawley, 1907; Lei-
dyana solitaria Watson, 1915).
Типовой хозяин: Gryllus abbreviatus (Orthopte-
ra: Gryllidae).
Сем. Cnemidosporidae Grasse, 1953
Молодые трофозоиты сперва прикреплены к клет-
ке кишечника объемистым эпимеритом, который в
процессе развития регрессирует и редуцируется до
Рис. 49. Грегарины семейств Stenophoridae (7), Leidyanidae (2), Cnemidosporidae (3), Monoductidae (4), Sphaerocystidae (5, 6), Dactylophori-
dae (7—11), Trichorhynchidae (72) и Stylocephalidae (73—18). (Из разных источников).
7 — Stenophora larvata; 2—Leidyana erratica; 3 — Cnemidospora lutea; 4—Monoductus lunatus; 5 — Sphaerocystis simplex; 6—Schneideria mucronata (a — тро-
фозоит с эпимеритом, 6—трофозоит, отбросивший эпимерит, в — ооциста); 7—Dactylophorus robuslus (а — молодой прикрепленный трофозоит, б — взрос-
лый трофозоит, в — ооцисты); 8 — Echinomera hispida; 9 — Grebnickiella gracilis (a — взрослый трофозоит, б — молодой прикрепленный трофозоит); 10 —
Seticephalus elegans; 11 — Rhopalonia geophili; 12 — Trichorhynchus pulcher {a — трофозоит, 6 — ооцисты); 13 — Stylocephalus longicollis: трофозоиты с эпи-
меритом (а) и без него (б); 14—Xiphocephalus gladiator; 15 — Bulbocephalus wardi; 16— Clavicephalus madagascariensis; 17—эпимерит Cystocephalus algeri-
anus; 18 — Lophocephalus insignis; p — рострум дактилофорид, соответствующий эпимериту других грегарин, пя — «протомеритное ядро».
Fig. 49. Gregarines of families Stenophoridae (7), Leidyanidae (2), Cnemidosporidae (3), Monoductidae (4), Sphaerocystidae (5, 6), Dactylophori-
dae (7—/7), Trichorhynchidae (72) and Stylocephalidae (73—78).
6 — Schneideria mucronata (a — trophozoite with epimerit, 6 — trophozoite without epimerit, в — oocyst); 7 — Dactylophorus robustus (a — young attached trophozo-
ite, 6 — adult trophozoite, в — oocyst); 9 — Grebnickiella gracilis (a — adult trophozoite, 6—young attached trophozoite); 12 — Trichorhynchuspulcher (a — tropho-
zoite, 6— oocyst); 13 — Stylocephalus longicollis: trophozoite with epimerit (a) and without one (6); 17—epimerit of Cystocephalus algerianus; p — rostrum ofDac-
tylophorids corresponding to epimerit of other gregarines, пя — «protomeritic nucleus».
121
ТИП SPOROZOA. КЛАСС GREGARINEA
122
ALVEOLATA
маленького колпачка или шарика на протомерите.
Ооцисты эллипсоидальные.
Это семейство включает в себя единственный
род, Cnemidospora, с 4 описанными видами. Все они
кишечные паразиты многоножек. Гаметоцисты не-
известны, поэтому неизвестно, имеют ли они споро-
дукты.
Род Cnemidospora Schneider, 1882
(рис. 49, 3)
Диагноз семейства.
4 описанных вида.
Типовой вид Cnemidospora lutea Schneider,
1882.
Типовые хозяева: Glomerismarginata, G. cons-
persa (Myriapoda: Diplopoda).
Сем. Monoductidae Ray et Chakravarty,
1933
Начальное развитие внутриклеточное. Эпимерит с
зубчатыми выростами или отсутствует. Гаметоциста с
одним спородуктом. Ооцисты эллипсоидальные или
овоидные, с 8 спорозоитами.
Это семейство включает в себя 3 рода и 19 ви-
дов, преимущественно кишечных паразитов много-
ножек.
Род Monoductus Ray et Chakravarty, 1933
(рис. 25, 13-, 49, 4)
Эпимерит — маленький выступ с прикрепленными
в основании зубчатыми отростками, с двумя уходящи-
ми глубоко в клетку пучками мионем, которые могут
втягивать эпимерит. Анизогамные. Ооцисты эллипсо-
идальные или веретеновидные, с медиодорсальным
гребнем, выводятся наружу из гаметоцисты цепочкой
через единственный спородукт.
Известно 5 видов. В многоножках.
Типовой вид Monoductus lunatus Ray et Chakra-
varty, 1933.
Типовой хозяин: Strongylosoma contortipes
(Myriapoda: Diplopoda).
Род Stenoductus Ramachandran,
1976
Эпимерит отсутствует у взрослых трофозоитов.
Ооцисты эллипсоидальные, с гиалиновой эписпорой,
без медиодорсального гребня, выводятся наружу через
спородукт цепочкой. Ядро без мионем.
В многоножках. 12 описанных видов.
Типовой вид Stenoductus penneri Ramachandran,
1976.
Типовой хозяин: Floridobolus penneri (Myria-
poda: Diplopoda).
Род Phleobum Haidar et Chakraborty, 1974
Эпимерит отсутствует. Гаметоциста с эктоцистой,
эндоцистой и единственным спородуктом. Ооцисты
овальные, не склеены в цепочки.
В насекомых. 2 описанных вида.
Типовой вид Phleobum gigantinum Haidar et
Chakraborty, 1974.
Типовой хозяин: Phleoba antennata.
Сем. Sphaerocystidae Chakravarty, 1960
Эпимерит сидячий, в виде толстого горизонталь-
ного диска с рифленым краем или отсутствует. Про-
томерит только у молодых трофозоитов, атрофирован
у взрослых. Гаметоцисты вскрываются простым раз-
рывом оболочки. Ооцисты овоидные или бикони-
ческие.
Это семейство включает в себя 4 рода и 12 видов,
преимущественно кишечных паразитов насекомых.
Примечание. Г рассе (Grasse, 1953) относит род Sphaerocys-
tis к сем. Hirmocystidae (на основании сходства морфологии
ооцист — ср. рис. 48,15, б и рис. 49, 5, б), а род Schneideria (вклю-
чая Paraschneideria) к Actinocephalidae.
Род Sphaerocystis Leger, 1892
(рис. 49, 5)
Эпимерит изменчивый. Трофозоиты выглядят мо-
ноцистидными, одиночные, партеногенетические (?).
Ооцисты эллипсоидальные, с эписпорой.
В насекомых. 4 описанных вида.
Типовой вид Sphaerocystis simplex Leger, 1892.
Типовой хозяин: Cyphon pallidus (Coleoptera:
Scirtidae).
Род Schneideria Leger, 1892 (рис. 49, 6)
Эпимерит в виде толстого горизонтального диска
с рифленым краем, с или без центрального стержня.
Протомерито-дейтомеритная септа рано исчезает (ре-
зорбируется). Ооцисты биконические, гладкие вздутые.
В кишечнике личинок двукрылых. 5 описанных видов.
Типовой вид Schneideria mucronata Leger, 1892.
Типовой хозяин: Bibio marci (Diptera: Bibio-
nidae).
Род Paraschneideria Nieschulz, 1924
Эпимерит простой, в виде пуговицы. Развитие
внутриклеточное. Взрослые трофозоиты без протоме-
рито-дейтомеритной септы. Ооцисты биконическИе.
Монотипический род.
Типовой вид Paraschneideria metamorphosa
(Nowlin, 1922) Nieschulz, 1924 (= Schneideria metamor-
phosa Nowlin, 1922).
Типовой хозяин: Sciara coprophila (Diptera:
Sciaridae).
ТИП SPOROZOA. КЛАСС GREGARINEA
123
Род Neoschneideria Ormieres et al., 1965
(рис. 9, 4)
Эпимерит состоит из дольчатой подушечки, в цент-
ре которой заостренная папилла. Эпицит продольно
исчерчен. Трофозоиты подразделены на сегменты
(обычно 6). Внешняя стенка гаметоцисты формирует
на противоположных сторонах два длинных выроста.
Ооцисты биконические, с очень неплотной эписпорой,
высвобождаются цепочками.
Описано 2 вида.
Типовой вид Neoschneideria douxi (Hesse, 1926)
Ormieres, Manier et Mathiez, 1965 (= Asterophora douxi
Hesse, 1926).
Типовой хозяин: Dixa autumnalis (Diptera: Di-
xidae).
Сем. Trichorhynchidae Ormieres, Marques,
Puissegur, 1977
Эпимерит слабо дольчатый, продолжается в длин-
ную шейку, окружен 3 мембранами. Эпицит орнамен-
тирован многочисленными выростами, формирующи-
ми плотную «шерсть». Эпицитарные складки отсутст-
вуют, но апикальные арки и филаменты в мембранах
располагаются регулярно. Двустворчатые гаметоци-
сты усеяны бугорками; бугорки, как правило, отсутст-
вуют на экваториальном шве; гаметоцисты вскрыва-
ются по экваториальному шву — необходимое для
этого давление обеспечивается крупным остаточным
телом («псевдоцистой»). Ооцисты цилиндрические,
высвобождаются цепочками.
В губоногих многоножках.
Это семейство включает в себя 1 род с 2 видами.
Семейство установлено на основании ультраструктур-
ных исследований (Ormieres et al., 1977).
Род Trichorhynchus Schneider, 1882
(рис. 28, /; 49, 12)
Диагноз семейства. 2 вида.
Типовой вид Trichorhynchus pulcher Schneider,
1882 (= Trichorhynchus insignis Schneider, 1882; Grega-
rina megacephala Leidy, 1889).
Типовой хозяин: Scutigera coleopterata (Myria-
poda: Chilopoda).
Сем. Dactylophoridae Leger, 1892
Прикрепительный аппарат — многочисленные ри-
зоиды, врастающие в клетки хозяина; формирование
ризоидов — за счет эпицитарных гребней на особой
площадке протомерита; эпимерит редуцирован до не-
большого выроста; характерно «протомеритное ядро».
Сизигии поздние, латеральные «голова к хвосту»,
инцистируются сразу после образования. Анизогамия
выражена очень резко. Гаметоцисты с одним остаточ-
ным телом («псевдоциста»), происходящим из муж-
ского гамонта и обеспечивающим выход ооцист
(рис. 28, 2). Ооцисты цилиндрические, с закругленны-
ми концами.
Примечание. Диагноз изменен по сравнению с таковым в
«Ап illustrated guide to the Protozoa» (Lee et al., 2000): приведены в
соответствие с современными представлениями позиции, касаю-
щиеся прикрепительного аппарата, эпимерита и «протомеритного
ядра» (см. раздел «Морфофункциональная организация»).
Это семейство включает в себя 7 родов и примерно
27 видов, паразитирующих преимущественно в ки-
шечнике губоногих многоножек, иногда диплопод и
насекомых.
Род Dactylophorus Balbiani, 1899
(рис. 49, 7)
Протомерит расширен, с огромным числом мощ-
ных папиллообразных ризоидов. Гаметоцисты сфери-
ческие, ооцисты в более или менее длинных цепочках.
Описано 2 вида.
Типовой вид Dactylophorusrobustus(Leger, 1892)
Labbe 1899 (= Dactylophora robusta Leger, 1892).
Типовой хозяин: Cryptops hortensis (Myriapo-
da: Chilopoda).
Род Echinomera Labbe, 1899
(рис. 28, 2; 49, 8)
Прикрепительный аппарат в виде неправильного ко-
нуса с эксцентрической вершиной, несущего много ко-
ротких пальцевидных ризоидов. Гаметоцисты сфериче-
ские, с одним остаточным телом, происходящим из муж-
ского гамонта. Ооцисты цилиндрические, в цепочках.
Описано 8 видов.
Типовой вид Echinomera hispida (Schneider,
1875) Labbe, 1899 (= Echinocephalus hispidus Schneider,
1875).
Типовой хозяин: Lithobius forficulatus (Myria-
poda: Chilopoda).
Род Grebnickiella Bhatia, 1938
(рис. 18, /; 49, 9)
Протомерит растянут в поперечном направлении, с
многочисленными тонкими ризоидами. Ооцисты
длинные, овоидные, обычно в цепочках.
Описано 9 видов.
Типовой вид Grebnickiella gracilis (Grebnicki,
1873) Bhatia, 1938 (= Nina gracilis Grebnicki, 1873; Pte-
rocephalus nobilis Schneider, 1887).
Типовой хозяин: Scolopendra cingulata, S. mor-
sitans (Myriapoda: Chilopoda).
Род Rhopalonia Leger, 1894 (рис. 49, 11)
Прикрепительный аппарат в виде почти сфериче-
ского бутона с 10 или более пальцевидными ризоида-
ми. Гаметоцисты с остаточным телом («псевдоциста»).
Ооцисты цилиндрические.
124
ALVEOLATA
Описано 3 вида.
Типовой вид Rhopalonia geophili Leger, 1894.
Типовой хозяин: Geophilus sp., G. gabrielis (My-
riapoda: Chilopoda).
Род Acutispora Crawley, 1903
Прикрепительный аппарат — головка на конце
длинной шейки. Гаметоцисты с остаточным телом или
без него. Ооцисты биконические с толстым притуп-
ленным стержнем на каждом конце.
Описано 3 вида.
Типовой вид Acutispora macrocephala Crawley,
1903.
Типовой хозяин: Lithobius forficulatus (Myria-
poda: Chilopoda).
Примечание. Принадлежность этого рода к данному семей-
ству кажется сомнительной, так как строение прикрепительного
аппарата не соответствует диагнозу Dactylophoridae. Грассе
(Grasse, 1953) предполагает, что строение прикрепительного аппа-
рата в данном случае было плохо изучено.
Род Seticephalus Kamm, 1922
(рис. 49, 10)
Прикрепительный аппарат в виде толстого пучка
коротких, направленных вперед «щетинок». Протоме-
рит широкий и плоский.
Монотипический род.
Типовой вид Seticephalus elegans (Pinto, 1918)
Kamm, 1922 (= Gregarina elegans Pinto, 1918).
Типовой хозяин: Scolopendra sp. (Myriapoda:
Chilopoda).
Род Mecistophora Ganapati
et Narasimhamurti, 1960
Прикрепительный аппарат чашевидный с много-
численными нитевидными отростками по краям, вне-
дряющимися в клетку хозяина. Протодейтомеритная
септа есть. Анизогамия. Гаметоцисты с остаточным
телом. Ооцисты простые (?), с 8 спорозоитами.
Монотипический род.
Типовой вид Mecistophora legeri Ganapati et Na-
simhamurti, 1960.
Типовой хозяин: Mecistocephalus punctifrons
(Myriapoda: Chilopoda).
Сем. Amphiplatysporidae Kundu et Haidar,
1984
Эпимерит отсутствует. Трофозоиты одиночные. Си-
зигии поздние, латеральные. Гаметоцисты овоидные с
выдающейся (prominent) эктоцистой, вскрываются про-
стым разрывом оболочки. Ооцисты цилиндрические, с
полярными уплощениями, выделяются цепочками.
Семейство включает в себя единственный род Ат-
phiplatyspora.
Род Amphiplatyspora Kundu et Haidar,
1984
Признаки семейства.
Типовой вид Amphiplatyspora striata Kundu et
Haidar, 1984.
Типовой хозяин: Pteronemobius concolor (Ort-
hoptera: Grylloidea).
Сем. Stylocephalidae Ellis,
1912
(= Stylorhynchidae Schneider, 1875)
Эпимерит удлиненный, с отростками или без них.
Развитие внеклеточное. Сизигии фронтальные, позд-
ние. Остаточное тело в гаметоцисте присутствует.
Ооцисты в форме вареника (кошелька, шляпы), выпук-
лые с одной стороны, выделяются цепочками, с одно-
слойной коричневой или темноватой оболочкой, с ли-
нией вскрытия по выпуклому краю.
Это семейство включает в себя 15 родов и 91 вид.
Все они — кишечные паразиты насекомых, преимуще-
ственно взрослых жуков сем. Tenebrionidae, но описа-
ны также из первичнобескрылых насекомых Diplura и
Thysanura.
Род Stylocephalus Ellis, 1912
(рис. 6; 23, 7; 24; 49, 13)
(= Stylorhynchus Schneider, 1875)
Эпимерит вытянут в хоботок, с субапикальным
вздутием. Гаметоцисты покрыты папиллами, с оста-
точным телом («псевдоцистой»). Ооцисты в форме ко-
шелька, обычно выделяются длинными цепочками.
Описано 37 видов.
Типовой вид Stylocephalus oblongatus (Ham-
merschmidt, 1838) Watson, 1916 (= Rhizinia oblongata
Hammerschmidt, 1838; Sporadina oblongata (Hammers-
chmidt, 1838) von Frantzius, 1848; Gregarina oblon-
gata (Hammerschmidt, 1838) Diesing, 1851; Stylorhyn-
chus oblongatus (Hammerschmidt, 1838) Schneider,
1875).
Типовой хозяин: Asida grisea (Coleoptera: Te-
nebrionidae).
Род Stylocephaloides Theodorides et al.,
1965
Эпимерит в виде головки. Трофозоиты старших
возрастов с эпицитными ребрами (?). Протомерит час-
то с тонкой осью. Ооцисты в форме кошелька.
Описано 2 вида.
Типовой вид Stylocephaloides monodi Theodo-
rides, Desportes et Jolivet, 1965.
Типовой хозяин: Ademsmia antiqua, Pimelia
grandis, Prionotheca coronata (Coleoptera: Tenebrioni-
dae).
ТИП SPOROZOA. КЛАСС GREGARINEA
125
Род Cystocephalus Schneider, 1886
(рис. 49, 17)
Эпимерит с короткой шейкой, широкий в основа-
нии, вздутый в виде луковицы и переходящий кпереди
в небольшой вырост. Трофозоиты старших возрастов с
ребрами, образованными эпицитом. Протомерит часто
с тонкой осью. Ооцисты по очертаниям напоминают
шляпу.
Описано 10 видов.
Типовой вид Cystocephalus algerianus Schnei-
der, 1886.
Типовой хозяин: Pimelia sp. (Coleoptera: Te-
nebrionidae).
Род Bulbocephalus Watson, 1916
(рис. 49, 15)
Эпимерит состоит из толстого столбика с широким
основанием, переходящего в длинную шейку с цент-
ральным вздутием в виде луковицы. Ооцисты извест-
ных видов каплевидной формы.
Описано 3 вида.
Типовой вид Bulbocephalus wardiWatson, 1916.
Типовойхозяин: Cleridae gen. sp. (Coleoptera).
Род Xiphocephalus Theodorides, 1964
emend. Corbel, 1971 (рис. 49, 14)
Эпимеритный комплекс вытянут в цилиндриче-
ский, часто нитевидный «диамерит», расширяющийся
терминально, где и формирует собственно эпимерит;
эпимерит вытянут в мечевидный отросток (включая
дельтовидную, ланцетовидную и гладиусоподобную
формы), заканчивающийся острием или округлой вер-
шиной. Гаметоцисты покрыты папиллами, содержат
остаточное тело («псевдоцисту»). Ооцисты асиммет-
ричны относительно продольной оси, широкодельто-
видные, выпуклые по бокам, слегка килеватые со
«спинной» стороны (включая «шапко-», «кошелько-»
и «семявидные» у разных авторов), выводятся цепоч-
ками.
Описано 3 вида.
Типовой вид Xiphocephalus gladiator (Blan-
chard, 1905) Corbel, 1971 (= Stylorhynchus gladiator
Blanchard, 1905; Stylocephalus gladiator (Blanchard,
1905) Watson, 1916).
Типовой хозяин: Helenophorus collaris (Cole-
optcrn: Tcnebrionidae).
Род Lophocephalus Labbe, 1899
(рис. 49, 18)
(« Lophorhynchus Schneider, 1882)
Эпимерит n виде обширной чаши с зазубренными
краями, может бы ть окружен в основании короной из
мелких пузырьковидных выростов; ядрышко колбасо-
видное, длинное и изогнутое. Ооцисты по очертаниям
напоминают шапку, асимметричные.
Описано 2 вида.
Типовой вид Lophocephalus insignis (Schneider,
1882) Labbe, 1899 (= Lophorhynchus insignis Schneider,
1882).
Типовой хозяин: Helops striatus (Coleoptera:
Tenebrionidae).
Род Lophocephaloides Theodorides,
Desportes et Jolivet, 1965
Молодые трофозоиты с длинным головчатым эпи-
меритом на короткой ножке. Эпимерит более старших
трофозоитов и зрелых гамонтов в виде более или ме-
нее дряблого венчика, несколько напоминающим та-
ковой Lophocephalus. Гаметоцисты обычного цистоце-
фалидного типа. Ооцисты выводятся в виде цепочек
(четковидные).
Описано 2 вида.
Типовой вид Lophocephaloides thripterae Theo-
dorides, Desportes et Jolivet, 1965.
Типовой хозяин: Thriptera crinita (Coleoptera:
Tenebrionidae).
Род Sphaerorhynchus Labbe, 1899
(= Sphaerocephalus Schneider, 1886)
Эпимерит в виде маленькой сферы на конце длин-
ной или иногда короткой шейки.
Описано 4 вида.
Типовой вид Sphaerorhynchus ophioides (Schnei-
der, 1886) Labbe, 1899 (= Sphaerocephalus ophioides
Schneider, 1886; Stylocephalus ophioides (Schneider,
1886) Corbel, 1971).
Типовойхозяин: Akis sp. (Coleoptera: Tenebrio-
nidae).
Род Oocephalus Schneider, 1886
Эпимерит в виде округлого бутона на короткой ко-
нической шейке, ее длина почти равна ширине. Описа-
но 2 вида.
Типовой вид Oocephalus hispanus Schneider,
1886 (= Stylocephalus hispanus (Schneider, 1886) Corbel,
1971).
Типовой хозяин: Morica sp. (Coleoptera: Te-
nebrionidae).
Род Campanacephalus Theodorides, 1955
Эпимерит без шейки, в форме четырехугольного
или усеченного бутона. Ооцисты в цепочках.
Описано 2 вида.
Типовой вид Campanacephalus villiersi Theodo-
rides, 1955.
Типовой хозяин: Macropodia variolaris (Coleo-
ptera: Tenebrionidae).
126
ALVEOLATA
Род Clavicephalus Theodorides, 1959
(рис. 49, 16)
Эпимерит в виде четырехугольного бугорка, про-
должающего протомерит, зернистый на вершине, с
тонко зернистым островком, отделяющим цитоплазму
эпимерита от таковой протомерита. Гаметоцисты и
ооцисты неизвестны.
Описано 3 вида.
Типовой вид Clavicephalus madagascarensis
Theodorides, 1959 (= Cystocephalus madagascarensis
(Theodorides, 1959) Corbel, 1971).
Типовой хозяин: Melanocratus sp. (Coleoptera:
Tenebrionidae).
Род Cystocephaloides Theodorides
et Jolivet, 1963
Эпимерит с короткой шейкой, состоит из бутона,
окруженного эпицитным воротничком. По мере разви-
тия воротничок исчезает и эпимерит приобретает фор-
му четырехугольного бутона, сидящего на короткой
шейке.
Монотипический род.
Типовой вид Cystocephaloides prionothecae
Theodorides et Jolivet, 1963.
Типовой хозяин: Prionotheca coronata (Cole-
optera: Tenebrionidae).
Род Colepismatophila Adams et Travis,
1935
Эпимерит в виде простого симметричного бугорка,
округлый. Контуры ооцист в виде шляпы, с полярны-
ми филаментами, ооцисты изогнутые, выходят из га-
метоцисты волнистыми цепочками через разрыв обо-
лочки.
Описано 3 вида.
Типовой вид Colepismatophila burti Crusz, 1960.
Типовой хозяин: Peliolepisma calvum (Insecta:
Thysanura).
Сем. Actinocephalidae Leger, 1892
Эпимерит симметричный, с отростками или без
них. Сизигии поздние, фронтальные. Гаметоцисты без
спородуктов, обычно вскрываются простым разрывом
оболочки. Ооцисты биконичесие, цилиндро-бикониче-
ские, или неправильные, иногда покрыты иглами.
Это семейство самое богатое по числу родов. Оно
включает в себя 3 подсемейства (Actinocephalinae,
Acanthosporinae и Menosporinae) с приблизительно
60 родами, объединяющими около 280 видов. Хотя
большинство представителей — кишечные паразиты
насекомых и многоножек, некоторые из них описаны
в щетинкочелюстных и пелагических оболочниках —
сальпах.
Род Orbocephalus Nelson,
1970
Эпимерит на длинной шейке, в виде расширенной
папиллы, окруженной плоским диском. Гаметоцисты
и ооцисты неизвестны.
Описано 2 вида.
Типовой вид Orbocephalus bulbusNelson, 1970.
Типовой хозяин: Eleodes sp. (Coleoptera: Te-
nebrionidae).
Род Lepismatophila Adams et Travis, 1935
(рис. 25, 14)
Эпимерит сначала вытянут в шейку, но с возрастом
превращается в простой симметричный бугорок.
Взрослые трофозоиты с широким протомеритом. Га-
метоцисты с остаточным телом; стенки гаметоцист ор-
наментированы канавками, ограниченными неболь-
шими гранулярными областями. Ооцисты овоидные
или эллипсоидальные, асимметричные (контуры в
виде шляпы), выходят из гаметоцисты развернутыми
цепочками через разрыв оболочки.
Описано 10 видов. Паразиты первичнобескрылых
насекомых из отрядов Thysanura и Diplura.
Типовой вид Lepismatophila thermobiae Adams
et Travis, 1935.
Типовой хозяин: Thermobia domestica (Insecta:
Thysanura).
Подсем. Actinocephalinae Leger, 1892
Ооцисты без игл или утолщений на полюсах. В на-
секомых, диплоподах, губоногих, сенокосцах и обо-
лочниках.
Род Actinocephalus von Stein, 1848
(рис. 50, 1)
(= Stephanophora Leger, 1892)
Эпимерит на короткой, но заметной шейке, в виде
полусферического вздутия с 8—10 направленными
вверх пальцевидными отростками; шейка более или
менее сохраняется у трофозоитов старших возрастов,
но пальцевидные отростки исчезают. Гаметоцисты
вскрываются отверстием в стенке, через которое ооци-
сты выходят единственной цепочкой. Ооцисты бико-
нические или лимоновидные.
В насекомых. Описано около 40 видов.
Типовой вид Actinocephalus conicus (Dufour,
1837) von Frantzius, 1848 (= Gregarina conica Dufour,
1837; Actinocephalus lucani von Stein, 1848; Actinoce-
phalus lucanus (von Stein, 1848) von Frantzius, 1848;
Gregarina lucani (von Stein, 1848) Diesing, 1851; Stepha-
nophora radiosa Leger, 1892; Stephanophora lucani
(von Stein, 1848) Labbe, 1894; Actinocephalus conicus
var. magna Theodorides, 1955).
Типовой хозяин: Dorcus parallelopipedus (Co-
leoptera: Lucanidae).
ТИП SPOROZOA. КЛАСС GREGARINEA
127
Род Caulocephalus Bhatia et Setna, 1924
Передняя часть эпимерита походит на цветную ка-
пусту; эпимерит сужен в основании, персистирующий.
Протомерит со специализированной цитоплазматиче-
ской зоной. Ооцисты овоидные или сферические.
В жуках. Описано 3 вида.
Типовой вид Caulocephalus bhatiasetnai Theo-
dorides et al., 1964 (= Caulocephalus crenatus Bhatia et
Setna, 1924, in part).
Типовой хозяин: Aulacophorafoveicollis (Cole-
optera: Chrysomelidae).
Примечание. Грассе (Grasse, 1953) причисляет этот род к
сем. Hirmocystidae.
Род Cornimeritus Н. Hoshide, 1959
Трофозоиты одиночные. Эпимерит в форме остро-
го зубца на длинной, широкой, гибкой ножке. Гамето-
цисты сферические, вскрываются простым разрывом.
Ооцисты биконические, выводятся цепочками.
Монотипический род.
Типовой вид Cornimeritus ovalis Н. Hoshide,
1959.
Типовой хозяин: Nitidulidae gen. sp. (Insecta:
Coleoptera).
Род Umbracephalus H. Hoshide, 1959
Трофозоиты одиночные, удлиненно-цилиндриче-
ские, с удлиненным эллипсоидальным ядром. Эпиме-
рит с очень длинной шейкой, несущей на конце корону
из примерно 20 загнутых назад крючьев. Гаметоцисты
сферические. Ооцисты неизвестны.
Монотипический род.
Типовой вид Umbracephalus longicollis Н. Ho-
shide, 1959.
Типовой хозяин: Lithobius sp. (Myriapoda: Chi-
lopoda).
Род Urnaepimeritus H. Hoshide, 1959
Трофозоиты одиночные, удлиненные, со сфериче-
ским ядром. Эпимерит с короткой шейкой и чашевид-
ной короной из примерно 30 или более загнутых назад
крючьев. Гаметоцисты сферические, вскрываются
простым разрывом. Ооцисты веретеновидные.
Монотипический род.
Типовой вид Urnaepimeritus spatiformis Н. Ho-
shide, 1959.
Типовой хозяин: Prolamnonyx holstii (Myriapo-
da: Chilopoda).
Род Asterophora L6ger, 1892 (рис. 50, 2)
Эпимерит в виде толстого горизонтального диска с
рифленым краем и толстым палочковидным выростом
в центре. Ооцисты цилиндро-биконические.
Описано около 14 видов.
Типовой вид Asterophora mucronata Leger,
1892.
Типовой хозяин: Rhyacophila sp. (Trichoptera),
личинки.
Род Pileocephalus Schneider, 1875
(рис. 50, 14)
Эпимерит — заостренная головка на короткой шей-
ке. Ооцисты биконические.
В личинках насекомых. Описано около 18 видов.
Типовой вид Pileocephalus chinensis Schneider,
1875 (= Cardiocephalus sororculae Tsvetkov, 1929).
Типовой хозяин: Anabolia sororcula (Tricho-
ptera: Limnephilidae), личинки.
Род Gemmicephalus Baudoin, 1967
Эпимерит в форме овальной почки. Ооцисты слабо
биконические.
Описано 2 вида.
Типовой вид Gemmicephalus mutabilis Baudoin,
1967.
Типовой хозяин: Athripsodes cinereus (Trichop-
tera: Leptoceridae), личинки.
Род Pilidophora Baudoin, 1967
Эпимерит лишен длинной дифференцированной
шейки и описан как «имеющий форму небольшого
колпачка, состоящего из купола, продолженного впе-
ред маленькими язычками, окружающими эпимерит-
ный стержень».
Монотипический род.
Типовой вид PilidophorafragilisBaudoin, 1967.
Типовой хозяин: Agrypniapaginata (Trichopte-
ra: Phryganeidae), личинки.
Род Geneiorhynchus Schneider, 1875
Эпимерит — длинный стебелек, заканчивающийся
пучком коротких щетинок. Ооцисты цилиндро-кони-
ческие.
Описано 2 вида.
Типовой вид Geneiorhynchus monnieri Schnei-
der, 1875 (^Gregarina monieri Schneider, 1875 in Geus,
1969, lapsus calami).
Типовой хозяин: личинки Libellula sp. (Insecta:
Odonata).
Род Phialoides Labbe, 1899 (рис. 50, 3)
(= Phialis Leger, 1892)
Эпимерит на длинной шейке, состоит из втяжной
папиллы, окруженной подушечкой, которая усажена
по периферии толстыми зубцами, окруженными более
128
ALVEOLATA
широким воротничком. Гаметоцисты сферические, без
спородуктов. Ооцисты биконические, вздутые.
В личинках жуков. Монотипический род.
Типовой вид Phialoides ornata (Leger, 1892)
Labbe, 1899 (=Phialis ornata Leger, 1892).
Типовой хозяин: Hydrous piceus (Coleoptera:
Hydrophilidae), личинки.
Род Legeria Labbe, 1899 (рис. 50, 4)
{—Dufouria Schneider, 1875)
Эпимерит стебельчатый с неправильно дольчатым
и бороздчатым участком цитоплазмы на конце. Прото-
мерит окружен обширным воротничком. Гаметоцисты
без спородуктов. Ооцисты цилиндро-биконические
или субнавикулярные, с толстой стенкой.
В личинках жуков. Монотипический род.
Типовой вид Legeria agilis (Schneider, 1875)
Labbe, 1899 (= Sporadina dityscorum von Frantzius,
1848; Dufouria agilis Schneider, 1875).
Типовой хозяин: Colymbetes sp. (Coleoptera:
Dytiscidae), личинки.
Род Pyxinia Hammerschmidt, 1838
(рис. 17, 2; 25, 16-18)
(= Xiphorhynchus Leger, 1892; Beloides Labbe, 1899)
Эпимерит в виде мелко зазубренного кратеро-
образного диска, с крючьями по периферии или без
них, с центральным коническим выростом. Гамето-
цисты сферические, без спородуктов; вскрываются
отверстием в стенке, через которое ооцисты вы-
ходят единственной цепочкой. Ооцисты бикониче-
ские.
В личинках жуков. Описано около 13 видов.
Типовой вид Pyxinia rubecola Hammerschmidt,
1838.
Типовой хозяин: Dermestes lardarius, D. vulpi-
nus (Coleoptera: Dermestidae), личинки.
Род Discorhynchus Labbe, 1899
(= Discocephalus Leger, 1892)
Эпимерит — сферическая папилла с воротничком и
короткой шейкой; не персистирующий. Ооцисты би-
конические, слегка изогнутые, немного вздутые с од-
ной стороны.
В личинках ручейников. Монотипический род.
Типовой вид Discorhynchus truncates (Leger,
1892) Labbe, 1899 (= Discocephalus truncatus Leger,
1892).
Типовой хозяин: Sericostoma (?) sp. (Insecta:
Trichoptera), личинки.
Род Steinina Leger et Duboscq,
1904
Эпимерит — короткий подвижный пальцевидный
вырост, позднее превращающийся в уплощенное обра-
зование в форме пуговицы на короткой ножке. Ооци-
сты биконические, вздутые с одной стороны.
В насекомых. Описано около 23 видов.
Типовой вид Steinina ovalis (von Stein, 1848) Le-
ger et Duboscq, 1904 (= Clepsidrina polytnorpha Ham-
merschmidt, 1838 (in part); Stylorhynchus ovalis von Stein,
1848; Gregarina ovalis (von Stein, 1848) Diesing, 1851;
Gregarina polytnorpha (Hammerschmidt, 1838) Lankes-
ter, 1863 (in part)).
Типовой хозяин: Tenebrio molitor (Coleoptera:
Tenebrionidae), личинки.
Род Bothriopsides Strand, 1928
(рис. 50, 5)
(= Bothriopsis Schneider, 1875)
Эпимерит без стебелька, линзовидный, маленький,
сидячий, овальный, с 6 или более длинными тонкими
филаментами, отрастающими от него вперед. Прото-
мерит очень крупный, подвижный. Протомерито-дей-
Рис. 50. Грегарины сем. Actinocephalidae. (Из разных источников).
1 —Actinocephalus conicus; 2 — Asterophora elegans; 3 — Phialoides ornata (a — внешний вид, б—детали строения эпимерита); 4 — Legeria agilis; 5 — Both-
riopsides histrio; 6 — Stictosporaprovincialis (a — внешний вид, б — детали строения эпимерита); 7 — Amphoroidespolydesmi (а — трофозоит, б — ооциста);
8 — Dendrorhynchus systeni (а — передний конец трофозоита с эпимеритом, б — взрослый трофозоит, отбросивший эпимерит); 9 — Sciadiophora phalangii
(а — взрослый трофозоит, отбросивший эпимерит, б—молодой трофозоит с эпимеритом, в — ооциста); 10 —Acanthosporapileata (а — молодой трофозоит с
эпимеритом, б — ооциста); 11 — Ancyrophora gracilis (а — трофозоит, б — ооциста); 12 — Cometoides capitatus'. трофозоит с эпимеритом, погруженным в
клетку хозяина (кх); 13 — Corycella armata (а — трофозоит, б — ооциста); 14 — Pileocephalus chinensis (молодой трофозоит); 15 — Prismatospora evansi (а —
внешний вид, б — детали строения эпимерита, в — ооцисты, г — ооциста при большом увеличении); 16 — Menospora polyacantha.
Fig. 50. Gregarines of family Actinocephalidae.
3 — Phialoides ornata (a — appearance of trophozoite, 6 — details of epimerit morphology); 6—Stictospora provincialis (a — appearance of trophozoite, 6 — details
of epimerit morphology); 7 — Amphoroides polydesmi (a — trophozoite, 6 — oocyst); 8 — Dendrorhynchus systeni (a — anterior end of trophozoite with epimerit,
6 — adult trophozoit without epimerit); 9 — Sciadiophora phalangii (a — adult trophozoit without epimerit, 6 — young trophozoite with epimerit, в — oocyst); 10 —
Acanthospora pileata (a — young trophozoite with epimerit, 6 — oocyst); 11 — Ancyrophora gracilis (a — trophozoite, 6 — oocyst); 12 — Cometoides capitatus:
trophozoite with the embedded in the host cell epimerit; 13 — Corycella armata {a — trophozoite, 6 — oocyst); 14 — Pileocephalus chinensis (young trophozoite);
15 — Prismatospora evansi (a — appearance of trophozoite, 6 — details of epimerit morphology, в — oocyst, г — oocyst under high magnification).
129
ТИП SPOROZOA. КЛАСС GREGARINEA
9 Зак. №4163
130
ALVEOLATA
томеритная септа выгнута вперед. Гаметоцисты сфе-
рические. Ооцисты биконические.
Описано около 8 видов.
Типовой вид Bothriopsides histrio (Schneider,
1875) Strand, 1928 (= Bothriopsis histrio Schneider, 1875;
lorella wegorecki Lipa, 1967).
Типовой хозяин: Graphoderes (= Hydacticus)
cinereus, Colymbetes fuscus, Acilius sulcatus (Coleoptera:
Dytiscidae), личинки.
Род Romania Baudoin, 1967
Эпимерит состоит из острия, которое может транс-
формироваться в присоску или колпачок, покрываю-
щий эпимерит.
Монотипический род.
Типовой вид Pomania hovassei Baudoin, 1967.
Типовой хозяин: Potamophylax nigricornis (Tri-
choptera: Limnephilidae), личинки.
Род Stictospora Leger, 1893 (рис. 50, 6)
Эпимерит на коротком стебельке в виде вогнутого
спереди шарика с 9 —12 направленными назад листка-
ми, тесно прижатыми к стебельку.
Монотипический род.
Типовой вид Stictosporaprovincialis Leger, 1893
(= Stictospora provincialis var. anomalae Theodorides,
1955).
Типовой хозяин: Melolontha sp. (Coleoptera:
Scarabaeidae), личинки.
Род Coleorhynchus Labbe, 1899
(= Coleophora Schneider, 1885)
Эпимерит дисковидный, плохо развитый. Протоме-
рит широкий, формирует воротничок или присоску,
служащую для прикрепления. Трофозоиты одиноч-
ные. Развитие партеногенетическое. Ооцисты бикони-
ческие или навикулярные, с 8 спорозоитами.
Монотипический род, описан из кишечника водно-
го скорпиона.
Типовой вид Coleorhynchus heros (Schneider,
1885) Labbe, 1899 (= Coleophora heros Schneider, 1885).
Типовой хозяин: Nepa cinerea (Hemiptera:
Nepidae).
Род Amphoroides Labbe, 1899
(рис. 50, 7)
(= Amphorella Leger, 1892)
Эпимерит — глобулярная сидячая папилла, рано
исчезающая. Протомерит округлый чашевидно вогну-
тый спереди. Ооцисты биконические или навикуляр-
ные, изогнутые, без эписпоры.
В кишечнике двупарноногих многоножек (Diplopo-
da). Описано 4 вида.
Типовой вид Amphoroidespolydesmi(Leger, 1892)
Labbe, 1899 (= Amphorella polydesmi Leger, 1892).
Типовой хозяин: Polydesmus complanatus,
P. denticulatus (Myriapoda: Diplopoda).
Род Stylocystis Leger, 1899
Эпимерит простой, резко заостренный вырост, в
виде длинной гиалиновой иглы, как правило, изогну-
той назад, с очень острой вершиной. Гаметоцисты пол-
ностью созревают внутри хозяина и не содержат оста-
точного тела. Ооцисты биконические.
В кишечнике насекомых. Описано 4 вида.
Типовой вид Stylocystis praecox Leger, 1899.
Типовой хозяин: Tanypus sp. (Diptera: Chirono-
midae), личинки.
Род Taeniocystis Leger, 1905 (рис. 9, 5)
Эпимерит сидячий или с коротким стебельком, со-
стоящий из апикального вздутия с 6—8 крючьями.
Дейтомерит подразделен перегородками на многие
сегменты. Гаметоцисты сферические, открывающиеся
простым разрывом. Ооцисты биконические.
В кишечнике насекомых.
Описано 3 вида.
Типовой вид Taeniocystis mira Leger, 1904.
Типовой хозяин: Ceratopogon solstitialis (Dip-
tera: Ceratopogonidae), личинки.
Род Sciadiophora Labbe, 1899 (рис. 50, 9)
(= Lycosella Leger, 1896)
Эпимерит — широкий сидячий диск с зазубренны-
ми краями, рано утрачивается. Протомерит с много-
численными вертикальными пластинками, расширен-
ными и формирующими зонтик у взрослого трофо-
зоита, каждая «спица» зонтика формирует с краю
загнутый назад заостренный шип. Ооцисты бикони-
ческие.
В сенокосцах. Описано 6 видов.
Типовой вид Sciadiophoraphalangii (Leger, 1896)
Labbe, 1899 (= Lycosa phalangii Leger, 1896 (in part)).
Типовой хозяин: Phalangium opilio (Arachnida:
Opiliones).
Род Anthocephalus Labbe, 1899
(= Anthorhynchus Schneider, 1887)
Эпимерит — широкий уплощенный рифленый
диск. Ооцисты биконические или овоидные, скреплен-
ные боками в цепочки.
В сенокосцах. Описано 3 вида.
Типовой вид Anthocephalus sophiae (Schneider,
1887) Labbe, 1899 (= Anthorhynchus sophiae Schneider,
1887).
Типовой хозяин: Phalangium opilio (Arachnida:
Opiliones).
ТИП SPOROZOA. КЛАСС GREGARINEA
131
Род Agrippina Strickland, 1912
Эпимерит — круглый диск с периферическими
пальцевидными выростами. Ооцисты симметричные,
эллипсоидные, без шипов.
В личинках блох. Монотипический род.
Типовой вид Agrippina bona Strickland, 1912.
Типовой хозяин: Ceratophyllusfasciatus(Insec-
la: Aphaniptera).
Род Tricystis Hamon, 1951
Известны только трофозоиты — внутриклеточные
или между клетками пищеварительного эпителия.
Эпимерит, протомерит и дейтомерит присутствуют.
В щетинкочелюстных. Описано 2 вида.
Типовой вид Tricystisplanctonis Hamon, 1951.
Типовой хозяин: Sagitta lyra, S. bipunctata
(Chaetognatha).
Род Giobuiocephatus Baudoin, 1965
Молодые трофозоиты с шаровидным эпимеритом с
перманентной септой. Сизигии поздние, кратковре-
менные; промежуточные между фронтальными и лате-
ральными. Вскрытие гаметоцист — простым разрывом
оболочки. Ооцисты биконические.
В кишечнике личинок ручейников. Монотипиче-
ский род.
Типовой вид Globulocephalus hydropsyches
Baudoin, 1965.
Типовой хозяин: Hydropsyche sp. (Insecta: Tri-
clioptera), личинки.
Род Alaspora Obata, 1953
Эпимерит сидячий в виде присоски с глубоко вдав-
ленным передним краем. Трофозоиты одиночные, уд-
линенные. Гаметоцисты вскрываются простым разры-
Иом оболочки. Ооцисты цилиндро-биконические с 3
ТОНКИМИ треугольными удлиненными пластинками,
отходящими радиально от корпуса.
В кишечнике жуков. Монотипический род.
Типовой вид Alaspora depressa Obata, 1953.
Типовой хозяин: Anoplogenius cyanescens (Со-
leoplciu: Caraboidea).
Род Ascocephalus Obata, 1955
Эпимерит сидячий, в виде присоски с толстым во-
ротничком по периферии, спереди глубоко вдавленный,
е полостью, расширенной на дне, окруженной кольцом
тубопидных выростов. Трофозоиты одиночные, удли-
1111111 ыс, овоидные. Гаметоцисты сферические. Способ
МИПМ ГИН гаметоцист и ооцисты неизвестны.
И кишечнике жуков. Монотипический род.
Т ИНОКОЙ вид Ascocephalus armatus Obata, 1955.
ТиПО НОЙ хозяин: Chlaenius nigricans (Coleop-
Iviki linboldott).
РОД Amphorocephalus Ellis, 1913
' >1 IHMf|1HT И МИДе КНОПКИ с волнистыми краями, си-
ДИН(Р|| на иерШИИе коро ткого расширенного стебелька.
I IpoioMcpilT и поперечной поверхностной перетяжкой.
В губоИОГИХ МИОГОИОЖКИХ. Описано 7 видов.
Типовой вид Ainphoroeephalus amphorellus El-
lin, 1913.
Типовой хозяин: Scolopendra heros (Myriapo-
dir < liilopoda).
Род Thalicola Ormieres, 1965
Трофозоиты с продольной исчерченностью или без
нее. Эпимерит простой. Сизигии каудофронтальные.
Гаметоцисты сферические. Ооцисты и способ вскры-
тия гаметоцист неизвестны.
В сальпах. Описано 4 вида.
Типовой вид Thalicola salpae (Frenzel, 1885) Or-
mieres, 1965 (= Gregarina salpae Frenzel, 1885).
Типовой хозяин: Salpa maxima, S. fusiformis
(Tunicata).
Род Epicavus Ormieres et Daumal,
1970
Эпимерит стебельчатый, в форме глубокой чаши с
толстыми стенками, покрытыми легкой продольной
исчерченностью с внутренней стороны. Ядро с одним
крупным ядрышком. Гаметоцисты сферические,
вскрываются простым разрывом оболочки. Ооцисты
почти сферические с закругленными эписпоральными
полярными пробочками.
В насекомых. Описано 2 вида.
Типовой вид Epicavus araeoceri Ormieres et Dau-
mal, 1970.
Типовой хозяин: Araeocerusfasciculatus (Coleo-
ptera: Staphylinidae).
Род Gryllotalpia Hasselmann, 1926
Эпимерит — крупный бугорок на длинном стебле.
Гаметоцисты вскрываются простым разрывом. Ооци-
сты биконические.
Монотипический род, описан из медведок.
Типовой вид Gryllotalpia magalhaesi Hassel-
mann, 1926.
Типовой хозяин: Gryllotalpa sp. (Orthoptera:
Grylloidea).
Род Chilogregarina Levine, 1979
Эпимерит простой или с недолговечными пальце-
видными выростами на вершине. Гаметоцисты и ооци-
сты неизвестны.
В губоногих многоножках. Описано 5 видов.
Типовой вид Chilogregarinastriata (LegeretDu-
boscq, 1903) Levine, 1979 (= Actinocephalus striatus Le-
ger et Duboscq, 1903).
Типовой хозяин: Scolopendra cingulata (Myria-
poda: Chilopoda).
132
ALVEOLATA
Род Crucocephalus Sarkar, 1984
Молодые трофозоиты овоидные, затем цилиндри-
ческие. Эпимерит на коротком толстостенном стебель-
ке, утолщенном в основании, состоит из шаровидного
корпуса с 6—8 широкими вертикальными перифери-
ческими гребнями. Взрослые трофозоиты от веретено-
видных до цилиндро-конических, одиночные. Гамето-
цисты сферические, вскрываются простым разрывом
оболочки. Ооцисты биконические, с резко заостренны-
ми концами.
Монотипический род.
Типовой вид Crucocephalus dufouri Sarkar, 1984.
Типовой хозяин: Dermestes sp. (Coleoptera: Der-
mestidae), личинки.
Род Harendraria Sarkar, 1984
Трофозоиты от овоидных до веретеновидных. Эпи-
мерит на узком удлиненном стебельке, состоит из
очень сложной, длинной кеглевидной структуры с лу-
ковицеобразным округлым основанием, на обрублен-
ной вершине которой — 4 коротких тонких симмет-
ричных филамента или шипа. Взрослые трофозоиты
одиночные. Гаметоцисты сферические, вскрываются
простым разрывом облочки. Ооцисты эллипсоидаль-
ные, соединенные боковыми сторонами в цепочки.
Монотипический род.
Типовой вид Idarendrariaintricata Sarkar, 1984.
Типовой хозяин: Ptinus sp. (Coleoptera: Ptini-
dae).
Род Levinea Kori, 1985
Молодые трофозоиты одиночные. Эпимерит чаше-
видный на коротком стебельке, с многочисленными
периферическими пальцевидными выростами. Вскры-
тие гаметоцист — простым разрывом оболочки. Ооци-
сты цилиндро-биконические.
В стрекозах. Монотипический род.
Типовой вид Levinea agriocnemidis Kori, 1985.
Типовой хозяин: Agriocnemis pygmaea (Insec-
ta: Odonata).
Род Dendrorhynchus Keilin, 1920
(рис. 50, 8)
Прикрепительный аппарат — диск или присоска с
каймой из разветвленных папилл; трофозоиты сеп-
татные, но протодейтомеритная септа часто плохо
различима; поверхность трофозоитов поперечно ис-
черчена, что внешне придает прото- и дейтомериту ме-
тамерный характер. Гаметоцисты эллипсоидальные,
неправильные. Ооцисты веретеновидные.
Описано 2 вида.
Типовой вид Dendrorhynchus systeni Keilin,
1920.
Типовой хозяин: Systenus sp. (Diptera: Dolicho-
podidae), личинки.
Примечание. Клоптон (Clopton, 2000) помещает этот род в
сем. Dactylophoridae. Грассе (Grasse, 1953) отмечает, что, несмотря
на внешнее сходство трофозоитов этих грегарин с дактилофорида-
ми, по характеру гаметогенеза и ооцист Dendrorhynchus следует
отнести к Actinocephalidae.
Подсем. Acanthosporinae Leger,
1892
Ооцисты с иглами или утолщениями на полюсах,
иногда также на экваторе и вдоль кромки.
Паразиты кишечника хищных насекомых (особен-
но водных), губоногих многоножек и сенокосцев.
Подсемейство включает 25 родов и 75 видов.
Род Acanthospora Leger, 1892
(рис. 50, 10)
Эпимерит — коническая папилла со вздутым кон-
чиком или простой, в виде бугорка или папиллы, или
кратерообразный с неполной септой вокруг него.
Ооцисты биконические или эллипсоидные, с полярны-
ми и экваториальными иглами, освобождаются из га-
метоцист через простой разрыв оболочки.
В насекомых. Описано 6 видов.
Типовой вид Acanthosporapileata Leger, 1892.
Типовые хозяева: Cistelides sp., Omoplus sp.
(Coleoptera: Hydrophilidae), личинки.
Род Grenoblia Hasselmann, 1927
Эпимерит маленький, простой; протомерит кони-
ческий. Гаметоцисты и ооцисты неизвестны.
Монотипический род.
Типовой вид Grenoblia legeri Hasselmann, 1927.
Типовой хозяин: Hydrophilus sp. (Coleoptera:
Hydrophilidae), личинки.
Род Corycella Leger, 1892
(рис. 50, 13)
Эпимерит с центральной головкой, несущей коро-
ну мощных загнутых назад крючьев с острыми конца-
ми. Ооцисты биконические с пучком тонких волосков
на каждом полюсе.
Описано 2 вида.
Типовой вид Corycella armata Leger, 1892.
Типовой хозяин: Gyrinus natator (Coleoptera:
Gyrinidae), личинки.
Род Ancyrophora Leger, 1892
(рис. 9, 2; 35, 1-4; 50, 11)
Эпимерит состоит из глобулярной папиллы с гиб-
кими или жесткими выростами в форме крючьев, кото-
рые могут быть загнуты назад. Ооцисты биконические
с полярными пучками и 6 экваториальными одиноч-
ными щетинками или иглами.
ТИП SPOROZOA. КЛАСС GREGARINEA
133
Кишечные паразиты жуков (личинки и имаго Сага-
bidae, личинки Silphidae, Dytiscidae) и личинок ручей-
ников (Trichoptera). Описано 22 вида.
Типовой вид Ancyrophora gracilis (von Stein,
1848) Leger, 1892 (= Gregarina acus von Stein, 1848; Ac-
tinocephalus acus von Stein, 1848).
Типовые хозяева: Carabus sp. (C. auratus,
C. violaceus, C. arcensis, C. auronitens, C. cancellatus,
C. glabratus, C. hortensis, C. insulicola, C. intricatus,
C. nemoralis, C. nitens, C. ullrichi).
Род Rhizionella Baudoin, 1971 (рис. 35, 5)
Эпимерит состоит из центральной головки, несу-
щей длинные восходящие филаментозные корневид-
ные выросты. Ооцисты биконические с полярными бу-
горками экваториальными иглами.
Монотипический род.
Типовой вид Rhizionella tenuis Baudoin, 1971.
Типовые хозяева: Procrustespurpurescens, Sil-
pha atrata (Coleoptera: Silphidae), личинки.
игл или пальцевидных выростов. Ооцисты додекаэд-
рические, удлиненные, усеченные терминально, гекса-
гональные в поперечнике без экваториальных граней,
с экваториальными и терминальными иглами.
Монотипический род.
Типовой вид Nubenocephalus nebraskensis Clop-
ton, Percival, Janovy 1993.
Типовой хозяин: Argia bipunctulata (Insecta:
Odonata), имаго,
Род Tetraedrospora Ts'chudovskaia, 1928
Эпимерит состоит из плоского диска, окаймленно-
го 14—16 крючьями. Развитие гаметоцисты и выход
ооцист — в кишечнике хозяина. Ооцисты удлинен-
но-тетраэдрические, покрытые шипиками.
Монотипический род.
Типовой вид Tetraedrospora sciarae Tschudovs-
kaia, 1928.
Типовой хозяин: Sciara militaris (Diptera: Scia-
ridae), личинки.
Род Cometoides Labbe, 1899
(рис. 25, 21; 50, 12)
(= Pogonites Leger, 1892)
Эпимерит на стебельке или ножке, состоит из сфе-
рической или уплощенной папиллы, окруженной
длинными тонкими гибкими филаментами. Гаметоци-
сты вскрываются простым разрывом оболочки. Ооци-
сты цилиндро-конические с полярными иглами и 2 ря-
дами экваториальных игл.
В кишечнике жуков. Описано 4 вида.
Типовой вид Cometoides crinitus (Leger, 1892)
Llibb6, 1899 (= Pogonites crinitus Leger, 1892).
Типовой хозяин: Hydrobius sp. (Coleoptera:
Hydrophilidae), личинки.
Род Prismatospora Ellis, 1914
(рис. 50, 15)
Эпимерит почти сферический с латеральными уко-
роченными крючьями. Ооцисты призматические, со-
иттшщис из центральной правильной гексагональной
lipillMhl, на обоих основаниях переходящей в две усе-
Ч#Н11ЫС пирамиды, окруженные коронами из 6 ДЛИН-
НЫХ ИГЛ, отходящих от их базальных углов.
II JIIIHIIHKIIX стрекоз. Монотипический род.
Тип о йо II вид Prismatospora evansi Ellis, 1914.
Til IIО II ОII хозяин: Tramea lacerata, Sympetrum
riiblrtiHdllllim (Insecta: Odonata), личинки.
Род Nubenocephalus Clopton, Percival
et Janovy 1993
Эпимерит па длинной тонкой ножке, широко ово-
идпый, усеченный сзади, с широкими гибкими эквато-
риаиьпыми вздутиями, не формирующими крючьев,
Род Ramicephalus Obata, 1953
Эпимерит блюдцевидный, со многими направлен-
ными вперед древовидными отростками по перифе-
рии. Ооцисты биконические, с одним рядом полярных
и одним рядом из 6 экваториальных игл.
Примечание. Древовидные отростки эпимерита у Ramice-
phalus более толстые, чем у Cometoides (Tuzet et al., 1968).
Описано 13 видов.
Типовой вид Ramicephalus ozakii Obata, 1953.
Типовой хозяин: Chlaenius inops (Coleoptera:
Caraboidea).
Род Coronoepimeritus H. Hoshide, 1959
(= Quadruspinospora Sarkar and Chakravarty, 1969)
Трофозоиты одиночные. Эпимерит на коротком
стебельке, представленный шаровидным вздутием, по-
крытым многочисленными пальцевидными выроста-
ми, которые иногда могут ветвиться. Ооцисты эллип-
соидальные или овоидные, с длинными нитевидными
полярными иглами, высвобождающиеся из гаметоцист
через простой разрыв стенки.
Описано 13 видов.
Типовой вид Coronoepimeritus japonicus Н. Ho-
shide, 1959.
Типовой хозяин: Locusta migratoria, Oedaleus
infernalis, Oxya japonicus, Oxya velox (Orthoptera: Acri-
didae).
Род Dinematospora Tuzet et Ormieres,
1954
Развитие внеклеточное. Эпимерит полусфериче-
ский, уплощенный, становящийся пуговицеобразным
у взрослых трофозоитов, прикреплен коротким тол-
134
ALVEOLATA
стым i-TVOi’HhKoM к протомериту, который имеет в мес-
те переходи и стебелек хромофильное кольцо, перси-
стирующее иилоть до стадии сизигия; дейтомерит с
। олс roll оболочкой; продольные мионемы хорошо раз-
ни u,i; черна амилопектина и «черные гранулы» пред-’
отпилены ядро сферическое или слегка овоидное с
единственным ядрышком. Молодые трофозоиты оди-
ночные. Гаметоцисты вскрываются простым разры-
вом. Ооцисты с двумя длинными полярными филамен-
тами.
Монотипический род.
Типовой вид Dinematospora grassei Tuzet et Or-
mieres, 1954.
Типовой хозяин: Machilis tenuis (Insecta: Thy-
sanura).
Род Doliospora Ormieres et Baudoin,
1969
Эпимерит без орнаментации. Ооцисты асиммет-
ричные, без терминальных пучков, с двумя экватори-
альными утолщениями на продольных каемках.
В сенокосцах. 2 описанных вида.
Типовой вид Doliospora repelini (Leger, 1897)
Ormieres et Baudoin, 1969 (= Acanthospora repelini Le-
ger, 1897).
Типовой хозяин: Phalangium opilio (Arachnida:
Opiliones).
Род Acanthosporidium Georgevitch,
1951
Средняя часть переднего конца эпимерита в форме
конического хоботка; эпимерит и протомерит разделе-
ны короткой шейкой. Гаметоцисты и ооцисты неизве-
стны.
Описано 2 вида.
Типовой вид Acanthosporidium gammari Geor-
gevitch, 1951.
Типовой хозяин: Trichoptera (?) gen. spp.
Род Cosmetophilus Cockendolpher, 1991
Эпимерит симметричный, без крючьев, филамен-
тов, исчерченности или орнаментации. Трофозоиты
подразделены на протомерит и дейтомерит септой.
Движение поступательное — скользящее или ундули-
рующее. Гаметоцисты выводятся с фекалиями хозяи-
на, вскрываются простым разрывом оболочки. Ооци-
сты биконические с утолщениями на полюсах и эква-
торе, с рядом шипов на полюсах и вдоль ребер,
высвобождаются тысячами, но не в цепочках. Трофо-
зоиты, гамонты и гаметоцисты развиваются в кишеч-
нике и слепой кишке сенокосцев сем. Cosmetidae.
Монотипический род.
Типовой вид Cosmetophilus vonones Cockendol-
pher, 1991.
Типовой хозяин: Vonones sayi (Arachnida: Opi-
liones).
Род Contospora Devdhar et Amoji, 1978
Эпимерит без стебелька, состоит из конического
вздутия с базальной зубчатостью и приблизительно 20
вертикальными пластинками. Ооцисты цилиндриче-
ские, с заостренными коническими полюсами, каждый
из которых снабжен пучком игл.
Монотипический род.
Типовой вид Contospora opalniae Devdhar et
Amoji, 1978.
Типовойхозяин: Opalnia sp. (Arachnida: Opiliones).
Род Tetractinospora Sarkar et Haidar,
1981
Эпимерит — сферическое образование на короткой
ножке с более чем 8 (~16) слоистыми вертикальными
пластинками в виде арок, направленных назад. Трофо-
зоиты одиночные. Ооцисты биконические, изогнутые
в середине, с двумя острыми толстыми иглами на каж-
дом полюсе.
Монотипический род.
Типовой вид Tetractinospora victoris Sarkar et
Haidar, 1981.
Типовой хозяин: Ceriagrion coromandelianum
(Insecta: Odonata).
Род Echinoocysta Levine, 1984
Эпимерит — простой шаровидный или сфериче-
ский бугорок. Протомерит куполовидный или полу-
сферический, с исчерченным ободком по базальному
краю, расположенным на небольшом цилиндрическом
воротничке, ооцисты биконические, с рядом из 8—
10 тонких иголочек на полюсах. Ооцисты выходят из
гаметоцист цепочками по 2—3 или более через про-
стой разрыв стенки.
Монотипический род.
Типовой вид Echinoocysta phalangii (Amoji et
Devdhar, 1979) Levine, 1984 (= Echinospora phalangii
Amoji et Devdhar, 1979).
Типовой хозяин: Opalnia sp. (Arachnida: Opili-
ones).
Род Mukundaella Sarkar, 1981
Эпимерит состоит из очень короткой ножки, закан-
чивающейся чашечкой, покрытой исчерченностью или
вертикальными складками. Ооцисты додекаэдриче-
ские, с полярными и меридиональными иглами.
В насекомых. 3 описанных вида.
Типовой вид Mukundaella undulatus Sarkar, 1981.
Типовой хозяин: Enallagma sp. (Insecta: Odo-
nata).
Род Tetrameridionospinospora Kori
et Amoji, 1985
Эпимерит состоит из короткой, но отчетливой нож-
ки, заканчивающейся округлым или дисковидным
вздутием с многочисленными периферическими тен-
ТИП SPOROZOA. КЛАСС GREGARINEA
135
такулами или пальцевидными отростками. Ооцисты
биконические, с 4 полярными (по 2 на каждом полюсе)
и 4 меридиональными (по 2 на каждой стороне) иг-
лами.
В насекомых. 2 описанных вида.
Типовой вид Tetrameridionospinospora karnata-
ki Kori et Amoji, 1985.
Типовой хозяин: Agriocnemis sp. (Insecta: Odo-
nata).
Подсем. Menosporinae Leger, 1892
Ооцисты полулунные или серповидные, гладкие.
Подсемейство включает 5 родов и 24 вида.
Род Menospora Leger, 1892
(рис. 25, 22; 50, 16)
Эпимерит очень долговечный, состоящий из длин-
ной шейки, заканчивающейся чашечкой, ограничен-
ной крючьями. Ооцисты изогнутые, банановидные
(полулунные).
В личинках стрекоз. Описано 2 вида.
Типовой вид Menospora polyacantha Leger,
1892.
Типовойхозяин: Agrionpuella(Insecta:Odonata).
Род Hoplorhynchus Carus, 1893
Эпимерит состоит из длинной шейки, заканчиваю-
щейся уплощенным диском, окаймленным крючьями
или иглами. Ооцисты полулунные или эллипсоидаль-
ные и изогнутые.
В личинках стрекоз. Описано 12 видов.
Типовой вид Hoplorhynchus oligacanthus (von
Siebold, 1839) Carus, 1863 (« Gregarina ollgacantha von
Siebold, 1839; Gregarina sieboldl KiJlliker, 1848; Stylor-
hynchus oligacanthus (von Siebold, 1839) von Stein,
1848; Acanthocephalus sieboldl VOn FruntzillS, 1848; Acti-
nocephalus sieboldi (Kfilliker, 1848) von Frantzius, 1848;
Actinocephalus oligacantha (von Siebold, 1839) BUtschli,
1882).
Типовой хозяин: Calopleryx sp. (Insecta: Odo-
nata).
Род Odonaticola Sarkar et Haidar, 1981
Эпимерит состоит Из длинной шейки, заканчиваю-
щейся расширением в виде зонтика с краевыми лепест-
ковидными выступами. Трофозоиты одиночные. Гаме-
тоцнеты вскрываются простым разрывом оболочки.
Развитие внеклеточное. Ооцисты гладкие, навикуляр-
пые.
Описано 8 видов.
Типовой вид Odonaticola hexacantha Sarkar et
Haidar, 1981.
Типовой хозяин: Brachythemis contaminate (In-
secta: Odonata).
Род Domadracunculus Clopton, 1995
Эпимерит расположен на узкой ножке, в виде
складчатой чашечки или присоски, очень широко ово-
идной в профиль и круглой анфас, с отчетливыми
складками, поднимающимися изнутри чашечки, обра-
зуя розетку или корону. Гаметоцисты сферические; ги-
алиновая оболочка непостоянная (присутствует не у
всех гаметоцист); вскрытие — простым разрывом обо-
лочки; никаких спородуктов или пакетных мембран не
обнаружено. Ооцисты полулунные. Развитие одиноч-
ное. Сизигии латеральные, поздние.
Монотипический род.
Типовой вид Domadracunculus janovy Clopton,
1995.
Типовой хозяин: Ischnura verticalis (Insecta:
Odonata), имаго.
Род Steganorhynchus Percival, Clopton
et Janovy 1995
Эпимерит расположен на длинной червеобразной
ножке, в виде овоидной папиллы, заключенной в со-
кратимое округлое влагалище. Гаметоцисты сфериче-
ские; гиалиновая оболочка присутствует; вскрытие —
простым разрывом; никаких спородуктов или пакет-
ных мембран не обнаружено. Ооцисты полулунные.
Развитие одиночное. Сизигии латеральные, поздние.
Монотипический род.
Типовой вид Steganorhynchus dunwoodyi Perci-
val, Clopton et Janovy, 1995.
Типовой хозяин: Ischnura verticalis (Insecta:
Odonata).
Сем. Brustiosporidae Kundu et Haidar,
1981
(= Brustiophoridae in Clopton, 2000, lapsus calami)
Трофозоиты одиночные. Эпимерит маленький, раз-
личной формы, со щетинковйдными выростами, с ко-
роткой, но хорошо выраженной ножкой. Гаметоцисты
вскрываются простым разрывом оболочки. Ооцисты
сферические, с ворсистой поверхностью, соединенные
в цепочки тонкими нитчатыми выростами.
Это семейство включает в себя один монотипиче-
ский род, описанный из кишечника жука.
Род Brustiospora Kundu et Haidar, 1981
Эпимерит состоит из короткой, но хорошо различи-
мой шейки, заканчивающейся пучком тонких «щети-
нок». Гаметоцисты вскрываются простым разрывом.
Ооцисты сферические, с ворсистой поверхностью, со-
единенные в цепочки тонкими нитчатыми выростами.
Монотипический род.
Типовой вид Brustiospora indicola Kundu etHai-
dar, 1981.
Типовой хозяин: Stethorus sp. (Coleoptera:
Coccinellidae).
136
ALVEOLATA
Сом, Acutidae Stejskal, 1965
Трофозоиты одиночные. Эпимерит простой, меня-
ющий форму в ходе развития. Гаметоцисты без споро-
дуктов или остаточного тела, вскрываются отверстием
в стенке. Ооцисты эллипсоидальные.
В насекомых.
Это семейство включает в себя два монотипиче-
ских рода, описанные из домашних медоносных пчел.
Род Acuta Stejskal, 1965
Эпимерит простой, постоянно растущий, вначале
сферический, затем цилиндрический и каплевидный;
при отбрасывании оставляет рубец. Гаметоцисты
вскрываются путем разрыва стенки с образованием не-
правильной формы щели.
В кишечнике пчел. Монотипический род.
Типовой вид Acuta rousseaui Stejskal, 1965.
Типовой хозяин: Apis mellifera.
Род Apigregarina Stejskal, 1965
Эпимерит простой, вначале обширный, становя-
щийся овоидным, затем сферическим и, наконец, ко-
ноидальным в ходе развития. Гаметоцисты вскрыва-
ются с образованием округлого отверстия в стенке.
В кишечнике пчел. Монотипический род.
Типовой вид Apigregarina stammeri Stejskal,
1965.
Типовой хозяин: Apis mellifera.
Сем. Monoicidae Geus, 1969
Аутогамные (т. е. каждый гамонт образует гаметы
обоих полов).
Это семейство включает в себя один монотипиче-
ский род, описанный из кишечника домашних медо-
носных пчел.
Род Monoica Stejskal, 1964
Эпимерит простой. Молодые трофозоиты одиноч-
ные. Каждый гамонт формирует гаметы обоих полов.
Гаметы анизогамные. Вскрытие гаметоцист — прос-
тым разрывом; остаточное тело в гаметоцисте присут-
ствует. Ооцисты эллипсоидальные.
В пчелах. Монотипический род.
Типовой вид Monoica apis Stejskal, 1964.
Типовой хозяин: Apis mellifera.
Надсем. Fusionicae Stejskal, 1965
Гомоксенные. На стадии сизигия ядро и эндоплаз-
ма сателлита переходят в примит, где перемешива-
ются. Анизогамные. Гаметоцисты и ооцисты неиз-
вестны.
Надсемейство монотипическое.
Сем. Fusionidae Stejskal, 1965.
> Признаки надсемейства.
Род Fusiona Stejskal, 1965
Признаки семейства.
Монотипический род, паразиты насекомых.
Типовой вид Fusiona geusi Stejskal, 1965.
Типовой хозяин: Pycnoscelus surinamensis (In-
secta: Blattoidea).
Gregarinea incertae sedis
В настоящем издании мы рассматриваем некото-
рые таксоны грегарин и сходных с грегаринами орга-
низмов как группы неясного таксономического поло-
жения. Особенности жизненного цикла, либо особен-
ности ультраструктуры не позволяют с уверенностью
отнести эти организмы к какому-либо из существую-
щих семейств или отрядов грегарин, или же их принад-
лежность к грегаринам вообще сомнительна.
Род Filipodium Hukui, 1839 (рис. 51)
Грегарины Filipodium ozakii были впервые обнару-
жены в кишечнике сипункулиды Siphonosoma кита-
nense (Hukui, 1939). Описаны трофозоиты (гамонты),
сизигии, гаметоцисты и ооцисты. Согласно наблю-
дениям Хукуи, гамонты Filipodium проникают через
стенку кишечника в целом, где принимают форму,
сходную с Monocystis, образуют сизигии и проходят
гамогонию. Способ образования сизигиев напомина-
ет таковой у Dactylophoridae — мужские гамонты как
бы «обнимают» женские. Гаметы анизогамные, но
у мужских гамет не обнаружено жгутика, что, правда,
можно отнести за счет несовершенства светоопти-
ческих наблюдений. Ооцисты, содержащие 8 споро-
зоитов, выводятся во внешнюю среду через нефридии
хозяина. Грассе предполагает, что описанный Ху-
куи жизненный цикл объединяет двух разных грега-
рин, одна из которых кишечная, а другая — целоми-
ческая.
Особенности строения кишечных трофозоитов Fili-
podium ozakii были сравнительно недавно исследованы
с помощью сканирующего и просвечивающего элект-
ронных микроскопов (Hoshide, Todd, 1992; Hoshide,
Todd, 1996). Оказалось, что эти грегарины имеют не ци-
линдрическую, а уплощенную, листовидную форму тела.
Структура их поверхности (рис. 51, 2) сходна с тако-
вой архигрегарин Selenidium и Ditrypanocystis'. пелли-
кула формирует не эпицит, а продольные борозды и
складки, лишенные апикальных арок и филаментов.
Под пелликулой складок регулярно располагаются в
один слой продольные микротрубочки. От дна каждой
второй или четвертой борозды отходят трубчатые во-
лосовидные выросты диаметром 130—160 нм, которые
образованы всеми тремя слоями пелликулы. Эти вырос-
ты напоминают цитопили эугрегарины Diplauxis, но в
отличие от нее мембраны внутреннего мембранного
ТИП SPOROZOA. КЛАСС GREGARINEA INCERTAE SEDIS
137
1 2
Рис. 51. Грегарина Filipodium ozakii Hukui, 1839.
1 — общий вид трофозоита, 2 — схема ультратонкой организации покровов, вмк — внутренний мембранный комплекс пелликулы, мт — микротрубочки,
пм — плазматическая мембрана (плазмалемма), цп — цитопили. (/ — по: Hukui, 1939; 2 — по: Hoshide, Todd, 1996).
Fig. 51. Gregarine Filipodium ozakii Hukui, 1839.
1 — general view of a trophozoite, 2 — diagram of ultra-thin organization of cortex; вмк — cortical cytomembranes, мт — microtubules, пм — plasma membrane,
цп — hair-like projections.
комплекса здесь всегда тесно сближены и не контакти-
руют с плазмалеммой.
Крайне своеобразно строение прикрепительного ап-
парата Filipodium — оно отличается от такового и у архи-
и у эугрегарин (Hoshide, Todd, 1992). Передняя часть
трофозоита подразделяется на несколько долей, которые
контактируют выростами с многочисленными клетками
хозяина. В зонах контакта идет поглощение цитоплазмы
хозяина, которая затем переваривается. При этом, судя
по всему, формируются впячивания всей пелликулы, а
не только внешней мембраны, как это имеет место в
микропорах. Иногда грегарины поглощают реснички
хозяина, но нс переваривают их. К. Хосидс предпола-
гает, что это один из механизмов прикрепления. Кроме
того, часть выростов переднего конца трофозоита на-
ходится между клет ками кишечника и контактирует с
ними, формируя волосковидныо отростки. Элементы му-
кроналыгого комплекса у Filipodium не обнаружены.
Автор первоописапия, Т. Хукуи, на основании не-
которого сходит Till формы тела и способа образования
С1ГН1ГИСИ первоначально отпсс обнаруженных им гре-
nipiiil к сем. Ductyloplioridae. Однако Грассе (Grasse,
1953) рассматривает род Filipodium уже в составе сем.
Lcciidinidae, дактилофориды паразитируют в много-
ножках, а не в сипункулидах или других морских жи-
вотных. До последнего времени род Filipodium про-
должали относить к сем. Lecudinidae отряда Eugregari-
nida (Grasse, 1953; Levine, 1985; Clopton, 2000). Однако
выявленные особенности тонкого строения покровов
этих грегарин, особенно с учетом предположения
Грассе о неверной интерпретации стадий жизненного
цикла, заставляют усомниться в принадлежности рода
Filipodium к отряду Eugregarinida. Вместе с тем отсут-
ствие элементов мукронального комплекса, своеобраз-
ный способ питания и видимое отсутствие мерогонии,
наряду со слабой изученностью ультраструктуры ши-
зогрегарин, не позволяют включить Filipodium ни в одно
из известных сем. Schizogregarinida, тем более что случаи
полной утраты эпицита известны и для эугрегарин. У
них, правда, никогда не наблюдались поверхностные
структуры, сходные с таковыми архигрегарин. В любом
случае, на наш взгляд, род Filipodium, безусловно, за-
служивает учреждения нового семейства. Однако, по-
скольку рамки справочного издания не позволяют это-
го сделать, мы ограничимся лишь уточнением диагноза
рода в соответствии с ультраструктурными данными.
Гамонты удлиненные, листовидные; эпицит отсут-
ствует, структура поверхности как у Selenidium, за иск-
лючением отходящих от дна борозд многочисленных
цитопилей, образованных пелликулой; передний ко-
нец в виде широкой присоски с выростами. Анизогам-
ные, но мужские гаметы без жгутиков (?). Гаметоци-
сты со многими ооцистами. Ооцисты эллипсоидаль-
ные или овоидные, с 8 спорозоитами.
Описано 2 вида.
Типовой вид Filipodium ozakii Hukui, 1839
(== Lithocystis parquerae Jones, 1971).
Типовой хозяин: Siphonosoma kumanense (Si-
punculida).
Род Heterospora de Saint Joseph, 1907
Этот род описан только по ооцистам (спорам?), об-
наруженным в целоме полихеты Eulalia parva (Poly-
chaeta: Phyllodocidae). Левайн (Levine, 1985), по-види-
138
ALVEOLATA
momv. uhii.iu) пи основании присутствия в цисте 4 спо-
poToinon и отсутствия остаточного тела причисляет
hoi род к сем. Selenidiidae. На наш взгляд, это не со-
всем оправдано, поскольку из-за отсутствия данных по
другим стадиям жизненного цикла, «грегаринная»
принадлежность «ооцист» Heterospora сомнительна.
Кроме того, наличие волосовидных выростов нехарак-
терно для ооцист архигрегарин.
Ооцисты эллипсоидальные, без утолщений на кон-
цах, но с короткими волосовидными выростами на
каждом конце и 4 волосовидными выростами от сере-
дины сторон, с 4 спорозоитами, без остаточного тела.
Другие стадии жизненного цикла неизвестны.
Монотипический род.
Типовой вид Heterospora eulaliae de Saint Jo-
seph, 1907.
Типовой хозяин: Eulalia parva (Polychaeta:
Phyllodocidae).
Сем. Schaudinnellidae Poche, 1913
К этому семейству относится единственный вид —
Schaudinnella enchytraei (= Schaudinnella henleae) из
кишечника олигохет сем. Enchytraeidae. Жизненному
циклу присущ ряд особенностей (Nussbaum, 1903). Га-
монты объединяются в сизигии как с особями проти-
воположного, так и своего пола, но не инцистируются;
многие гамонты остаются одиночными. Независимо от
этого, женские гамонты формируют сферические мак-
рогаметы, а мужские — банановидные микрогаметы.
Зиготы покрыты двумя оболочками. Некоторые из них
выводятся наружу с экскрементами, другие же остают-
ся в кишке и осуществляют эндогенное размножение.
В последнем случае зиготы внедряются в эпителиаль-
ные клетки кишечника, вырастают и продуцируют
большое количество округлых спорозоитов, которые
выпадают в просвет кишечника и превращаются в тро-
фозоитов.
Грассе (Grasse, 1953) рассматривает Schaudinnella
как дополнение к классу Gregarinomorpha, отмечая, что
жизненный цикл этой грегарины аберрантный и не на-
ходит себе аналогов. Грассе высказывает также предпо-
ложение, что Нуссбаум интерпретировал как единый
цикл стадии развития двух разных споровиков.
В сводках, основанных на системе Левайна (Levine,
1977d, 1985, 1988; Perkins et al., 2000), сем. Schaudin-
nellidae включено в состав отряда Eugregarinida, подо-
тряд Aseptata.
Гаметоцисты не образуются; мужские гамонты
продуцируют микрогаметы, женские — макрогаметы.
Ооцисты сферические.
Род Schaudinnella Nussbaum, 1903
Микрогаметы веретеновидные, макрогаметы сфе-
рические; в пищеварительном тракте олигохет.
Монотипический род.
Типовой вид Schaudinnella enchytraei (Kolliker,
1848) Meier, 1956 (= Gregarina enchytraei Kolliker,
1848; Gregarina pachydrili Claparede, 1861; Monocystis
mitis Leidy, 1882; Monocystis enchytraei (Kolliker,
1848) Labbe, 1863; Schaudinnella henleae Nussbaum,
l§03).
Типовой хозяин: Henlea leptodera (Oligochae-
ta: Enchytraeidae).
Отряд Blastogregarinida Chatton
et Villeneuve, 1936
Термин Blastogregarina был введен Шаттоном и
Вилленевом (Chatton, Villeneuve, 1936а) для таксона,
включающего себя протистов рода Siedleckia — нео-
бычных организмов, впервые описанных из кишечни-
ка полихеты Scoloplos armiger Коллери и Менилем
(Caullery, Mesnil, 1898а).
Жизненный цикл бластогрегарин (рис. 52) абер-
рантный — в нем отсутствуют мерогония, стадии сизи-
гия и гаметоцисты (Chatton, Villeneuve, 1936а, 1936b).
Молодые трофозоиты Siedleckia (рис. 52, а; 53) при-
креплены к кишечному эпителию хозяина. Своим
внешним видом и характером движений они напоми-
нают молодых трофозоитов Selenidium. Затем, по мере
роста, они становятся многоядерными (рис. 52, б, в).
Далее наблюдается фрагментация тела остающихся
прикрепленными трофозоитов, которая ведет к образо-
ванию округлых отдельностей — одноядерных или
многоядерных (рис. 52, г, Ь). Шаттон и Вилленев счи-
тают этот процесс начальным этапом гаметогонии, ко-
торая завершается образованием макрогамет и очень
мелких микрогамет (рис. 52, е). Далее следует копуля-
ция гамет (рис. 52, з) и образование ооцист (рис. 52, и).
В ходе споруляции в каждой ооцисте формируется
10— 16 спорозоитов (рис. 52, й).
В литературе существуют и иные, часто совершен-
но противоположные трактовки жизненного цикла
Siedleckia. Так, Коллери и Мениль (Caullery, Mesnil,
1898а) рассматривают фрагментацию многоядерных
особей как почкование. В. А. Догель (Догель, 1910)
считает этот процесс патологическим, предшествую-
щим гибели организма, попавшего в неблагоприятные
для него условия прижизненного препарата. По пред-
положению В. А. Догеля, Siedleckia следует рассмат-
ривать как своеобразных грегарин, у которых деление
ядра предшествует образованию сизигия. Действи-
тельно, так обстоит дело, например у Didymophyes gi-
gantea (Eugregarinida, Didymophyidae) (Hildebrand,
1978). Однако образование сизигиев у Siedleckia нико-
му из исследователей наблюдать не удалось.
Противоречия во взглядах на природу жизненного
цикла Siedleckia естественным образом отразились на
систематическом положении этих организмов. Грассе
(Grasse, 1953) рассматривал бластогрегарин как допол-
нение к классу Gregarinomorpha, отмечая своеобразие
их строения и биологии. Пюйторак с соавт. (Puytorac
et al., 1987) выделяют бластогрегарин в отдельный
класс — наравне с грегаринами, кокцидиями и гемо-
споридиями. Напротив, Левайн с соавт. и последовате-
лями (Levine et al., 1980; Levine, 1985, 1988; Perkins et
al., 2000) считает бластогрегарин подотрядом в составе
отряда Eugregarinorida — как следует из диагноза, на
основании только отсутствия мерогонии (!). Между
тем по совокупности всех признаков жизненного цик-
ла, а также по некоторым предварительным ультра-
ТИП SPOROZOA. КЛАСС GREGARINEA INCERTAE SEDIS
139
Рис. 52. Жизненный цикл Siedleckia. (По:
Chatton, Villeneuve, 1936a). (Поясйения в
тексте).
Fig. 52. Life cycle of Siedleckia. (Explica-
tion in the text).
Рис. 53. Молодой трофозоит Siedleckia с прикрепительным аппаратом и делящимися яд-
рами. (По: Chatton, Dehome, 1929b).
Fig. 53. Young trophozoite of Siedleckia showing attachment organelle and dividing nuclei.
140
ALVEOLATA
структурным и молекулярно-филогенетическим дан-
ным (собств. исследования), сама принадлежность бла-
стогрегарин к грегаринам кажется сомнительной. Одна-
ко в силу сложившихся традиций Blastogregarinida поме-
щены в конец главы, посвященной классу Gregarinea.
Мерогония отсутствует (?). Сизигии отсутствуют;
гаметы (?) отпочковываются от заднего конца одиноч-
ных особей. Резко выраженная анизогамия (?). Гамето-
цисты отсутствуют. Ооцисты с Ю — 16 спорозоитами.
Сюда относится единственное монотипическое се-
мейство с 4 видами, описанными из кишечника полихет.
Сем. Siedleckiidae Chatton et Villeneuve,
1936
С признаками отряда.
Род Siedleckia Caullery et Mesnil, 1898
С признаками семейства. Трофозоиты удлиненные,
с продольной исчерченностью.
Типовой вид Siedleckia nematoides Caullery et
Mesnil, 1898.
Типовой хозяин: Scoloplos armiger (Polychae-
ta: Ariciidae).
Автор с удовольствием благодарит своих дру-
зей и коллег: А. О. Фролова (ЗИН РАН) за инициа-
цию и курирование этого проекта, [О. Н. Леонтович|
(Mayo Clinic, Rochester, USA), Г. А. Колбасова (ББС
МГУ) и С. О. Скарлато (ИНЦ РАН) за неоценимую
помощь, оказанную ими в процессе сбора лите-
ратуры, проф. А. В. Чесунова (кафедра зоологии бес-
позвоночных МГУ) за тестирование первого варианта
рукописи, А. Б. Поповкину (МГУ) и Н. С. Васецко-
го (ИМБ РАН) за помощь в переводе. Особую при-
знательность автор выражает Андрею Александро-
вичу Добровольскому (кафедра зоологии беспозво-
ночных СПбГУ) за плодотворные дискуссии, важные
замечания и пожелания, во многом благодаря ко-
торым данная глава приобрела свой окончатель-
ный вид.
THE CLASS GREGARINEA DUFOUR, 1828
SUMMARY
Gregarines are obligatory parasites of invertebrates. Their hosts are
found among Polychaeta, Oligochaeta, Arthropoda, Turbellaria, Ne-
mertini, Sipunculida, Echiurida, Mollusca, Echinodermata, Hemichor-
data, Tunicata, and, possibly, Acrania. No reliable findings of gregari-
nes in Cnidaria, Ctenophora, Nemathelminthes, Phoronidea, Bryozoa,
and Brachiopoda were described. Most of the gregarines are found in
the guts of their hosts, though in some families transition from the intes-
tine parasitism to parasitism in the body cavity and organs located there
(seminal vesicles of Oligochaeta, gonads, hemocoel, and adipous tissue
of insects as well) is observed. Gregarines are large protists, usually ran-
ging in size from 300 to 500 pm; the largest of them (syzygy Porospora
gigantea) are up to 15 mm long. More than 1700 gregarine species have
been described by now.
Tree-stage life cycle typical for Sporozoa with regularly alternating
merogony, gamogony, and sporogony is original for gregarines. The
stage of invasive zoite (sporozoite and sometimes merozoite) characte-
ristic of Sporozoa is present in the life cylce of gregarines. Morphology
of this stage is similar in gregarines and coccidia. Most of the gregarines
(Eugregarines) have lost merogony, though it is still found in some of
them (Archigregarines and Neogregarines). Two different types of me-
rogony, e. g., micronuclear and macronuclear ones, are present in the
life cycle of some Neogregarines.
Gregarines are usually extracellular parasites; they anchor in the
host tissues with their anterior part, posessing specific structures. In
some gregarines, the earliest growth stages are intracellular; the host
cells undergo hypertrophy during the growth of the parasite. Emergence
of trophozoite is accompanied with destruction of the cell. A small num-
ber of gregarines (Neogregarines of the Lipotrophidae and Syncystidae
families) has completely shifted to the intracellular parasitism. Mature
gamonts of extracellular parasites are usually mobile. Their movements
are gliding (most of Eugregarines), pendular or rolling (Archigregari-
nes) and, more seldom, peristaltic (Monocystidae). In some species,
only zoites and gametes are mobile. The life cycles of gregarines are
characterised by the presence of syzygy stage — conjugation of gamonts
which is usually paired and preceds gametogony. Gametogenesis occurs
inside gametocysts; in contrast to coccidias, formation of gametes is al-
ways preceded by progamous replications of the nuclei of each of the
gamonts. More or less expressed isogamy or anisogamy are common.
Gamonts produce approximately equal number of gametes. Male game-
te is the sole stage of the life cycle which may posess flagellum. The fla-
gella are often aberrant (9+0, 6+0, and 3+0). In the Class members, the
main types of mitosis, such as open and semiclosed orthomitosis and se-
miclosed pleuromitosis are found. Meiosis is single-stage as in all Spo-
rozoa; the reduction of chromosome number is zygotic. Eight free spo-
rozoits are usually formed in the oocyst, though in few cases their
number is different (4, 16 or more).
Evolution of gregarines followed the way of specialization for ext-
racellular parasitism. That is why their trophozoites are the most com-
plex and variable stages of development. The cells of trophozoites are
usually distinctly heteropolar, that is associated with segregation of the
anterior part, with the attachment function. The bodies of trophozoites
may have no segments (such gregarines are called monocystid) or may
be divided into segments by comissures and inner septa (polycystid
forms). Monocystid body is characterisic of Archigregarines and Neo-
gregarines as well as of the lower Eugregarines (Aseptata suborder).
The members of Septata suborder (Eugregarinida order) are polycystid,
or septate forms. They may be dicystid, tricystid, and multisegmented.
Most of the septate gregarines are tricystid forms. They have three dis-
tinct sections. Protomerit is located behind epimerit used for the ancho-
ring and is followed by deutomerit containing nucleus. Protomerit and
deutomerit are separated by the inner fibrillar septum.
Integuments of trophozoites are represented by three-membrane
pellicle typical for Sporozoa. It consists of plasmalemma and the inner
membrane complex of the merged membrane vesicles (alveoles) formed
by the cisterns of endoplasmic reticulum and probably Golgi apparatus.
In some intracellular Neogregarines, the integument structure is simpli-
fied up to the presence of a single membrane. The structure of the cell
surface of the gregarine trophozoites is different in various taxa. In Archi-
gregarines, it is characterised by the regular wide longitudinal folds of
pellicle with 2—3 regular layers of longitudinal subpellicular microtu-
bes beneath it. The surface of the most Neogregarines must be lacking
crests and fissures. Epicyte, a specific type of the surface structure, is
characteristic of Eugregarines. It is represented by a combination of the
narrow longitudinal ridges formed by pellicle and bearing peculiar fila-
mentous formations — apical archs and apical filaments — on their
tops. Eugregarines are also noted for the circular (not longitudinal) cor-
tical microtubes laying not immediately under the pellicule, but some
distance off it. The term «epicyte» is sometimes used for the pellicule
folds in Archigregarines. However, in this chapter it is used only for the
unique structure of the surface of Eugregarinida. Epicyte ensures the
abilities of Eugregarines for the gliding movements. In gregarines una-
ble for such movements, epicytes are modified or lost, being replaced
with hair-like protections.
Cytoplasm of gregarine trophozoites is usually divided into the
transparent ectoplasm and endoplasm; the latter is often distinctly gra-
nular in the living specimens. This granularity is determined by the high
content of the grains of amylopectin (=paraglycogen), the reserve car-
bohydrate. Mitochondria are located at the periphery of the cytoplasm.
ТИП SPOROZOA. ЛИТЕРАТУРА
141
They are not large and have a small number of poorly developed ampu-
le-shaped (tubular) cristas. Well-developed Golgi complexes (dyctioso-
mes), the cisterns of the smooth and rough endoplasmic reticulum, and
electron-dense bodies with carbohydrate content (mucocysts) were also
found. Mucocysts must provide for the excretion of mucus and, possib-
ly, the coat of gametocyst. Vegetative stages of gregarines usually have
a single large vesicle-like nucleus containing one and, more rarely, a
few distinct nucleoli.
Trophozoites have very diverse attachment structures. Archigrega-
rines of Selenidium genus anchor in the hosts' cells by mucron, a swol-
len terminal part of the cell. Mucronal (apical) complex of organelles,
consisting of the conoid, the polar ring, numerous rhoptries, and the lar-
ge mucron vacuole is located in the mucron of Selenidium. The outside
opening of the mucron vacuole is represented by a wide canal running
inside the conoid; small vacuoles similar to the pinocytose ones are for-
med on the bottom of this large vacuole. According to Schrevel's hypo-
thesis (Schrevel, 1968a, 1971a, 1971b), the mucronal complex in Archi-
gregarines has a function of the cell mouth (cytostome), whereas the
rhoptries are the reservoirs of the digestive enzymes. If the fine structure
of the trophozoites of Selenidium is considered, they resemble giant
overgrown sporozoits.
Among few Neogregarines with studied fine structure, particular
elements of the mucron complex were found in the intracellular parasi-
tes. The complex does not have a function of the cell mouth in them, but
is preserved for a long time, including the syzygy stage.
Eugregarines are lacking the cell mouth and the mucron complex in
their anterior part. Septate gregarines usually posess epimerit, a specific
anchoring structure bearing giant «cortical» vacuole with fibrillar con-
tent beneath the zone of contact with host cell. Epimerit is newly deve-
loped in front of the apical complex of sporozoit which is being lost in
the course of development. In some gregarines it is well-developed and
has hooks and other appendages used for anchoring in the epithelium of
the host's intestine. Mature mobile gamonts lose their epimerits leaving
them in the hosts' tissues. The loss of epimerit is irreversible. Aseptate
gregarines have diverse anchoring structures, but, contrary to the wide-
spread opinion, they also contain no elements of the mucron complex.
Data on the «mucron vacuolar system» of Ascogregarina (= Lankeste-
ria) culicis (Vavra, 1969) must refer to the vacuolized cytoplasm of the
discharged anchoring structure of the «epimerit» type at the stages of
degradation. «Mucron» of aseptate gregarine Lecudina is in our opinion
more similar to epimerit of Septata because of presence of large frontal
vacuole with fibrillar content.
The taxonomic status of gregarines ranges from subclass to class in
various modem classifications of Protista. Following Grasse's system
(1953), the three orders of gregarines have been distinguished: Ar-
chigregarinida (merogony is present; parasites of marine invertebrates,
primarily polychetes), Eugregarinida (merogony is absent), andNe-
ogregarinida (merogony is present; parasites of insects). The life cycle
of Archigregarines is considered to be initially primitive. According to
this point of view, Neogregarines originated from septate Eugregarines
and their merogony is secondary.
The structure of Archigregarine trophozoites is primitive and simi-
lar to that of the ivasive stages (sporozoites and merozoites). The origin
of Eugregarines is associated in our opinion with the loss of the mucron
complex and development of specific surface structures and called epi-
cytic folds. These folds are delivered by peculiar filamentous system,
and ensure characterisic gliding movements of trophozoites. Neogrega-
rines are poorly studied; however, the amount of facts supporting Gras-
se's hypothesis of Neogregarines origin is still not sufficient. Available
data on their ultrastructure (complete absence of epicyte and persisiting
of apical complex of some forms), indicate that they are more close to
Archigregarines than to Eugregarines (Vavra, McLaughlin, 1970;
Zizka, 1971; Canning, Sinden, 1975; Zizka, 1977,1978a, 1978b, 1978c;
Ormieres et al., 1978; Larsson, 1991). Studied merozoites of Neogrega-
rines are typical for Sporozoa, which also opposes the concept of the se-
condary development of merogony in those organisms. It is also note-
worthy, that Neogregarines are likely a complex group and various fa-
milies in it must have independent origin from a similar to
Archigregarines or common with them ancestor.
Archigregarines and Neogregarines have relatively little differen-
ces indicated in their formal diagnoses if the whole complex of their
known characterisics, except for association with particular groups of
the hosts, is taken into consideration. In any case, they are much closer
to each other than both of them to Eugregarines. That is why we retur-
ned in this chapter to the old classification by Leger and distinguish
two orders, Schizogregarinida Leger, 1900 and Eugregarinida Leger,
1900 within Gregarinea class. Archigregarines and Neogregarines are
included in Schizogregarinida order as suborders. In our opinion, ultra-
structure of trophozoites rather than the presence of merogony in the life
cycle has priority value for systematics. Since the epicyte is the most
important evolutionary acquisition of Eugregarines, the name «Epicyta-
ria» is most appropriate for them in contrast to Schizogregarinida lac-
king epicytes and gliding movements. The latter would be better called
«Anepicytaria». In addition, Schizogregarinida retain the apical (muc-
ron) complex either in its original or hyrertrophic state (Archigregari-
nes), or in slightly reduced state (Neogregarines), whereas Eugregarine
trophozoites lose it completely.
A system used in the present chapter is a trade-off and represents a
compilation of existing systems (Leger, 1900a, 1900b, 1900c; Grasse,
1953; Levine, 1985; Perkins et al., 2000) and, hence, contains some evi-
dently combined and incertae sedis groups. A list of the basic families
and genera with their diagnoses is presented.
ЛИТЕ1
Авдеев В. В. Новые виды грегарин рода Cephaloidophora, па-
разиты Euphausia superba // Паразитология. 1985. Т. 19. С. 72—75.
Авдеев В. В. Некоторые особенности развития грегарины Ce-
phaloidophora pacifica, паразита Euphausia superba // Паразитология.
1987. Т. 21. С. 580—582.
Аверинцев С. А. Исследования над паразитическими простей-
шими И Тр. И. С.-Пб. Общ. Естеств. 1908. Т. 38.
Белофастова И. П. Грегарины рода Nematopsis (Eugregarinida,
Porosporidae) — паразиты черноморских беспозвоночных И Пара-
зитология. 1996. Т. 30. С. 159—173.
Бейер Т. В. Клеточная биология споровиков — возбудителей
протозойных болезней животных и человека. Л., 1989. 184 с.
Боголепова И. И. Грегарины из залива Петра Великого И Тр.
ЗИН АН СССР. 1953. Т. 13. С. 38—56.
Гробов О. Ф., Сотников А. Н. Критидиоз и грегариноз у шме-
лей // Ветеринария. 1999. № 11. С. 30—32.
Догель В. A. Catenata. Организация рода Haplozoon и некото-
рых сходных с ним форм. СПб., 1910.
Догель В. А. Зоология беспозвоночных. М., 1981. 606 с.
Крылов М. В., Добровольский А. А. Макросистема и филоге-
ния споровиков // Принципы построения макросистемы однокле-
точных животных. Л., 1980. С. 62—74. (Тр. ЗИН АН СССР; Т. 94).
Мавродиади П. П. Наблюдения над строением и развитием
грегарин (Работы из Зоотомической лаборатории Варшавского
университета; Т. XLIII). Варшава, 1914. 164 с., ил.
Найдёнова Н. Н. Грегарины — причина нематопсиоза у чер-
номорских мидий И Рыб. хоз-во. 1990. № 10. С. 27—29.
Райков И. Б. Ядро простейших: морфология и эволюция. Л.,
1978. 328 с.
Серавин Л. Н., Фролов А. О. Метаболирующее движение как
одна из основных форм клеточного движения И Цитология. 1983.
Т. 25. С. 1343—1352.
Симдяиов Т. Г. Selenidium pennatum sp. n. — новый вид архи-
грегарин из Flabelligera affinis (Polychaeta: Flabelligeridae) // Пара-
зитология. 1992. T. 29. С. 344—347.
Симдянов Т. Г. Ультраструктура двух видов грегарин рода
Lankesteria (Eugregarinida: Lecudinidae) // Паразитология. 1995а.
Т. 29. С. 424—432.
Симдянов Т. Г. Два новых вида грегарин с аберрантным стро-
ением эпицита из полихет Белого моря // Паразитология. 19956.
Т. 29. С. 305—315.
Симдянов Т. Г. Морфология и ультраструктура грегарины
Loxomorpha harmothoe из Белого моря // Паразитология. 1996.
Т. 30. С. 174—177.
1 К этой главе приводится цитируемая и рекомендуемая литература.
142
ALVEOLATA
Спшкреискпи Ki С. Септированные контакты в сизигии Gre-
garinn polyniorplut (Protozoa) // ДАН СССР. 1974. T. 214. С. 1187—
1188,
Фролоп А. О. Фауна и особенности жизненных циклов моно-
цистпд Северо-Запада СССР. (Sporozoa, Gregarinomorpha). Жизненные
циклы простейших И Тр. ЗИН АН СССР. 1985. Т. 129. С. 67—73.
Фролов А. О. Мировая фауна грегарин. Семейство Monocysti-
dac. Л., 1991. 126 с. (Тр. ЗИН АН СССР; Т. 229).
Хейсии Е. М. Роль кротов в распространениии Monocystidae
земляных червей И Ученые записки ЛГПИ. 1948. Т. 70. С. 171—
173.
Abe Н., Aoyama М. In vitro culture of the Gregarina blattarum //
Bull. Fac. Educ. Univ. Kagoshima (Nat. Sci.). 1979. Vol. 29. P. 1—9.
Abe H., Tsuchiya M. Growth and cyst formation during the culture
of the Gregarina blattarum in vitro // Bull. Fac. Educ. Univ. Kagoshima
(Nat. Sci.). 1980. Vol. 30. P. 27—33.
Awerinzew S. A. Uber die Stellung im System und die klassifizie-
rung der Protozoa II Biol. Zbl. 1910. Vol. 30.
Azevedo C., Cachola R. Fine structure of the apicomplexa oocyst
of Nematopsis sp. of two marine bivalve molluscs // Diseases Aquatic
Organisms. 1992. Vol. 14. P. 69—73.
Baines I., King C. A. Demonstration of actin in the protozoan Gre-
garina // Cell Biol. Int. Rep. 1989. Vol. 13. P. 679—686.
Ball S. J., Cunningham A. A., Clarke D., Daszak P. Septate gre-
garines associated with a disease of the hissing cockroach Grotnphador-
hina portentosa // J. Invertebr. Pathology. 1995. Vol. 65. P. 311—312.
Bastin A. Contribution a I’etude des Gregarines monocystidees //
Bull. Biol. France et Belgique. 1919. Vol. 53. P. 325—373.
Bandoin A.-M. Contribution a I’etude des Gregarines des Tri-
choptcres Litnnophilidae et Sericosmidae // Protistologica. 1966. Vol. 2.
P. 97—108.
Baudoin J. Contribution a I’etude des Gregarines des Dytiscides
(Insectes, Coleopteres) // Bull. Biol. France et Belgique. 1961. Vol. 95.
P. 389—408.
Baudoin J. Sur quelques Gregarines Actinocephalidae des Tri-
chopteres // Arch. zool. exp. et gen. 1965. Vol. 105. P. 245—258.
Baudoin J. Contribution a I’etude morphologique, biologique et
ecologique des Gregarines d’lnsectes a larves aquatiques II Ann. St.
Biol. Besse-en-Chandesse. 1967. Vol. 2. P. 13—160.
Baudoin J. Sur 1’ultrastructure de la region anterieure de la Grega-
rine Ancyrophora puytoraci B. //Protistologica. 1969. Vol. 5. P. 431—433.
Baudoin J. Etude comparee de quelques Gregarines Acanthospori-
nae // J. Protozool. 1971. Vol. 18. P. 654—660.
Baudoin J. Particularites cytologiques de protomerite des Gregari-
nes des Diplopodes // Protistologica. 1978. Vol. 14. P. 261—268.
Baudoin J., Maillard Y. P. Recherches sur les Gregarines des
Coleopteres hydrophilides // Protistologica. 1972. Vol. 2. P. 53—63.
Baudoin J., Mouthon J. Nouvel exemple de correlation entre la
presence d'une Gregarina du genre Ancyrophora Leger, 1892 et le regi-
me alimentaire de 1'hdte // C. R. Acad. Sci. Paris. 1976. Vol. 282.
P. 1285—1287.
Baudoin J., Ormieres R. Sur quelques particularites de 1’ultrast-
ructure de Didymophyes chaudefouri Ormieres, Eugregarine, Didy-
mophyidae // C. R. Acad. Sci. Paris. Ser. D. 1973. Vol. 277. P. 73—75.
Beams H. W., Tahmisian T. N., Devine R. L., Anderson E. Ult-
rastructure of the nuclear membrane of a gregarine parasitic in gras-
shoppers // Exp. Cell Res. 1957. Vol. 18. P. 200—204.
Beams H. W., Tahmisian T. N., Devine R. L., Anderson E. Stu-
dies on the fine structure of a gregarine parasitic in the gut of the gras-
shopper, Melanophis differentialis // J. Protozool. 1959. Vol. 6. P. 136—
146.
Bhatia B. L. Preliminary note of the mode of infection of earth-
worms by monocystid parasites // J. R. microsc. Soc. London. 1924a.
Vol. 2. P. 187—189.
Bhatia B. L. The genus Stomatophora Drzewecki // Quart. J. Mic-
rosc. Sci. 1924b. Vol. 68. P. 481—512.
Bhatia B. L. On the distribution of gregarines in oligochaetes II Pa-
rasitology. 1929. Vol. 21. P. 120—131.
Bhatia B. L. Synopsis of the genera and classification of haplocyte
gregarines // Parasitology. 1930. Vol. 22. P. 156—167.
Bhatia B. L., Chatterjee G. B. On some gregarines parasites of In-
dian earthworms // Arch. Protistenk. 1925. Vol. 52. P. 189—206.
Bhatia B. L., Setna S. B. On some new cephaline gregarines // Pa-
rasitology. 1924. Vol. 16. P. 279—288.
Bhatia B. L., Setna S. B. On some more gregarines parasites of In-
dian earthworms // Arch. Protistenk. 1926. Vol. 53. P. 361—377.
Bhatia B. L., Setna S. B. On some gregarines parasites from certa-
in polychaete worms from Andaman Islands // Proc. Indian Acad. Sci.
Sec. B. 1938. Vol. 8. P. 231—242.
Bloodgood R. A. Gliding motility and the dynamics of flagellar
membrane glycoproteins in Chlamydomonas reinhardtii // J. Protozoo-
logy. 1988. Vol. 35. P. 552—558.
Brasil L. Recherches sur la reproduction des Gregarines monocys-
tidees II Arch. zool. exp. et gen. Ser. 4. 1905a. Vol. 3. P. 17—38.
Brasil L. Nouvelles recherches sur la reproduction des Gregarines
monocystidees // Arch. zool. exp. et gen. Ser. 4. 1905b. Vol. 4. P. 69—
99.
Brasil L. Recherces sur le cycle evolutif des Selenidiidae, Gregari-
nes parasites d'Annelides polychetes. I. La schizogonie et la croissance
des gametocytes chez Selenidium caulleryi n. sp. // Arch. Protistenk.
1907. Bd8. S. 371—397.
Brasil L. La croissance de Doliocystis elongata dans Г intestin de
Lumbriconereis impatiens Clap. // C. r. Soc. biol. Paris. 1908a. Vol. 64.
P. 355—356.
Brasil L. Le genre Doliocystis Leger U C. R. Acad. Sci. Paris.
1908b. Vol. 146. P. 425—427.
Brasil L. Documents sur quelques Sporozoaires d'Annelides //
Arch. Protistenk. 1909. Bd 16. S. 106—148.
Brasil L., Fantham H. B. Sur 1'existence chez les Sipunculides de
Schizogregarines appartenant a la famille des Selenidiidae // C. R. Acad.
Sci. Paris. 1907. Vol. 144. P. 518—520.
Bull S., Chalmers R., Sturdee A. P., Curry A., Kennaugh J.
Cross-reaction of an anti-Cryptosporidium monoclonal antibody with
sporocysts of Monocystis species // Veterinary Parasitology. 1998.
Vol. 77. P. 195—197.
Buschkiel M. Caulleryella pipientis n. sp. Eine neue Schizogregari-
ne aus den Larven der Culex pipiens // Zool. J. Abt. Anat. Ontog. Tiere.
1921. Bd 43. S. 97—147, Pls. 4, 5.
Biitschli O. Protozoa. I. Sarcodina und Sporozoa. Leipzig; Heidel-
berg. 1880—1882. Vol. 1.
Cade W. H., Cade E. S. Male mating success, calling and sear-
ching behavior at high and low densities in the field cricket, Gryllus in-
teger// Anim. Behav. 1992. Vol. 43. P. 49—56.
Calkins G. N. The Biology of the Protozoa. Philadelphia, 1926.
Calkins G. N., Bowling R. C. Gametic meiosis in Monocystis //
Biol. Bull. 1926. Vol. 51. P. 385—399.
Canning E. U., Sinden R. E. Development of Farinocystis tribolii
Weiser (Sporozoa, Neogregarinida) in Palembus ocularis Casey (Cole-
optera, Tenebrionidae) and some observations on its fine structure //
Protistologica. 1975. Vol. 11. P. 221—231.
Carreno R. A., Martin D. S., Barta J. R. Cryptosporidium is
more closely related to the gregarines than to coccidia as shown by phy-
logenetic analysis of apicomplexan parasites inferred using small-subu-
nit ribosomal RNA gene sequences // Parasitology Res. 1999. Vol. 85.
P. 899—904.
Caullery M., Mesnil F. Sur un type nouveau (Metchnikovella n.
g.) d'organismes parasites des Gregarines // C. r. Soc. biol. Paris, Ser. 4.
1897. Vol. 4. P. 960—962.
Caullery M., Mesnil F. Sur un Sporozoaire aberrant (Siedleckia
n. g.) // C. r. Soc. biol. 1898a. Vol. 5. P. 1093—1095.
Caullery M., Mesnil F. Sur une Gregarine coelomique presentant
dans son cycle evolutif un phase de multiplication asporulee // C. r. Soc.
biol. 1898b. Vol. 5. P. 65—68.
Caullery M., Mesnil F. Sur quelques parasites internes des Anneli-
des. I. Gregarines nematoides des Annelides: g. Selenidium Giard //
Trav. Stat. Zool. Wimereux. 1899. Vol. 7. P. 80—99.
Caullery M., Mesnil F. Sur un mode particulier de division
nucleaire chez les Gregarines // Arch. anat. microsc. 1900. Vol. 3.
P. 146.
Caullery M., Mesnil F. Le parasitisme intracellulaire et la multi-
plication asexuee des Gregarines // C. r. Soc. biol. 1901. Vol. 53. P. 84—
87.
Caullery M., Mesnil F. Sur 1'existence de Gregarines dicystidees
chez les Annelides polychetes // C. r. Seanc. Soc. biol. 1914. Vol. 77.
P. 316—320.
Caullery M., Mesnil F. Metschnikovellidae et autres Protistes pa-
rasites des Gregarines d' Annelides // Ann. Inst. Pasteur. 1919. Vol. 33.
P. 209—240.
Chakravarty M. M. Systematic position of some genera and clas-
sification of the suborder Cephalina Delage and Herouard // Proc. Zool.
Soc. 1959. Vol. 12. P. 71—81.
Changeux J.-P. Contribution a I’etude des animaux associes aux
Holothurides // Actualites Scientique de 1'Industrie N 1284 (Vie et Mi-
lieu, Suppl. N 10). 1961. P. 124.
ТИП SPOROZOA. ЛИТЕРАТУРА
143
Chatton Е., Dehorne L. Sporozoaires du genre Siedleckia, S. dogi-
eli, n. sp. et S. mesnili n. sp. // Bull. Soc. zool. France. 1929a. Vol. 54.
P. 28—32.
Chatton E., Dehorne L. Observations sur les Sporozoaires du gen-
re Siedleckia // Arch. anat. microsc. 1929b. Vol. 25. P. 530—543.
Chatton E., Villeneuve F. La sexualite et le cycle evolutif des Si-
edleckia d'aprcs I’etude de S. caulleryi, n. sp. hologregarines et blas-
togregarines. Sporozoaires hologamctogcnes et blastogametogenes //
C. R. Acad. Sci. Paris (Ser. D). 1936a. Vol. 203. P. 833—836.
Chatton E., Villeneuve F. Le cycle evolutif de 1' Eleutheroschizon
duboscqui Brasil. Prevue experimentale de 1'absence de schizogonie
chez la Siedleckia caulleryi Ch. et Vill. // C. R. Acad. Sci. Paris. 1936b.
Vol. 203. P. 833—836.
Chen W. J., Chow C. Y., Wn S. T. Ultrastructure of infection, de-
velopment and gametocyst formation of Ascogregarina taiwanensis
(Apicomplexa, Lecudinidae) in its mosquito host, Aedes albopictus
(Diptera, Culicidae) // J. Euk. Microbiol. 1997. Vol. 44. P. 101—108.
Clausen C. Ancora prolifera sp. n., a gregarine parasite of Micro-
phthalmus ephippiophorus Clausen (Polychaeta, Hesionidae) // Zool.
Scripta. 1993. Vol. 22. P. 111—115.
Clopton R. E. Domadracunculus janovy n. gen., n. sp. (Apicom-
plexa: Actinocephalidae) from adults of Ischnura verticalis (Odonata:
Zygoptera) in Texas // J. Parasitol. 1995. Vol. 81. P. 256—260.
Clopton R. E. Revision of the genus Torogregarina and description
of Torogregarina sphinx n. sp. (Apicomplexa, Eugregarinida) from a
Missouri-river bank beetle, Bembidion laevigatum (Coleoptera, Carabi-
dae), in southeastern nebraska // J. Parasitol. 1998. Vol. 84. P. 823—827.
Clopton R. E. Revision of the genus Xiphocephalus and descrip-
tion of Xiphocephalus ellisi n. sp. (Apicomplexa: Eugregarinida: Stylo-
cephailidae) from Eleodes opacus (Coleoptera: Tenebrionidae) in the
western Nebraska sandhills // J. Parasitol. 1999. Vol. 85. P. 84—89.
Clopton R. E. Order Eugregarinorida Leger, 1900II An Illustrated
Guide to the Protozoa. Vol. 1 / Eds J. J. Lee, G. F. Leedale, P. Bradbu-
ry. Lawrence, KS (USA). 2000. P. 205—288.
Clopton R. E., Gold R. E. Host specificity of Gregarina blattarum
von Siebold, 1839 (Apicomplexa: Eugregarinida) among five species of
domiciliary cockroaches // J. Invertebr. Pathol. 1996. Vol. 67. P. 219—
223.
Clopton R. E., Janovy J., jr. Developmental niche structure in the
gregarine assemblage parasitizing Tenebrio molitor// J. Parasitol. 1993.
Vol. 79. P. 701—709.
Clopton R. E., Janovy J., jr., Percival T. J. Host stadium specifi-
city in the gregarine assemblage parasitizing Tenebrio molitor// J. Para-
sitol. 1992. Vol. 78. P. 334—337.
Clopton R. E., Percival T. J., Janovy J., jr. Gregarina niphandro-
des, new species (Apicomplexa: Eugregarinorida) from adult Tenebrio
molitor (L.) with oocyst descriptions of other gregarine parasites of the
yellow mealworm // J. Protozool. 1991. Vol. 38. P. 472—479.
Clopton R. E., Percival T. J., Janovy J., jr. Gregarina coronata,
new species (Apicomplexa: Eugregarinida) described from adults of the
southern com rootworm, Diabrotica undecimpunctata howardi (Coleop-
tera: Chrysomelidae) // J. Protozool. 1992. Vol. 39. P. 417—420.
Clopton R. E., Percival T. J., Janovy J., jr. Nubenocephalus ne-
braskensis, new genus new species (Apicomplexa: Actinocephalidae)
from adults of Argia bipunctulata (Odonata: Zygoptera) // J. Parasitol.
1993. Vol. 79. P. 533—537.
Cognetti de Martiis L. Descrizione d'una nuova gregarina Policis-
tideaparassita d'un oligochete // Arch. Protistenk. 1911. Bd 23. S. 247—
252.
Collins R. L. In vitro maintenance of the trophonts an sporozoites
of Pyxinia crystalligera // J. Protozool. 1972. Vol. 19. P. 355—362.
Corbel J.-C. Infestation experimentales de Locusta migratoria L.
(Insecte, Orthoptere) par Gregarina gamhami Canning (Sporozoaire,
Gregarinomorphe): Relation entre le cycle de 1'hote et celui du parasite //
C. R. Acad. Sci. Paris. 1964. Vol. 253. P. 318—320.
Corbel J.-C. Les Stylocephalidae (Sporozoa, Gregarinida) // Natur.
can. 1971. Vol. 98. P. 1—39.
Coulon P., Jangoux M. Gregarine species (Apicomplexa) parasitic
in the burrowing echinoid Echinocardium cordatum: occurence and host
reaction II Diseases Aquatic Organisms. 1987. Vol. 2. P. 135—145.
Coulon P., Jangoux M. Cyclic occurrence of gregarine trophozoi-
tes (Apicomplexa) in the burrowing echinoid Echinocardium cordatum
(Echinodcrmata, Spatangoidea) // Diseases Aquatic Organisms. 1991.
Vol. 12. P. 71—73.
Coulon P., Jedwab J., Jangoux M. Les cristaux intrakystiques des
gregarines (Apicomplexa) parasites du Spatangue Echinocardium cor-
datum (Echinodermata) // Ann. Soc. Roy. Zool. Belgique. 1988.
Vol. 118. P. 177—182.
Cox F. E. G. The evolutionary expansion of the Sporozoa // Int. J.
Parasitol. 1994. Vol. 24. P. 1301—1316.
Crespi P., Martinucci G. B., Ferragosti E. Contributions to the
study of monocystid gregarines parasites of Octolasium transpadanum.
II. The fine organization of Apolocystis sp. oocysts // Boll. zool. 1981.
Vol. 48. P. 143—156.
Da Cunha A. B., Jurand A. Ultrastructural study of (he relation-
ships between the gregarine Schneideria schneiderae da Cunha et al.
1975 and the cells of the host Trichosia pubescens Morgante 1969 (Sci-
aridae, Diptera) // Arch. Protistenk. 1978. Bd 120. S. 233—254.
Dallai R., Vegni Talluri M. Evidence for septate junctions in the
syzygy of the protozoon Gregarina polymorpha (Protozoa, Apicomple-
xa) // J. Cell Sci. 1988. Vol. 89. P. 217—224.
Dembowski J. Versuche fiber Merotomie der Gregarinen // Arch.
Protistenk. 1913. Bd 29. S. 1—21,
Desportes I. L'ultrastructure de la jonction entre le primite et le sa-
tellite des associations de Gregarina blattarum Sieb. (Eugregarines,
Gregarinidae) // C. R. Acad. Sci. Paris. Ser. D. 1966a. Vol. 262.
P. 1869—1870 (errata 263 : 311).
Desportes I. L'ultrastructure du gamete male de Г Eugregarine Sty-
locephalus longicollis F. St. (Stylocephalidae) // C. R. Acad. Sci. Paris.
Ser. D. 1966b. Vol. 263 (errata: 263D). P. 517—520.
Desportes I. Ultrastructure et evolution du sporozoite de Stylocephalus
africanus // C. R. Acad. Sci. Paris. Ser. D. 1967. Vol. 265. P. 423—426.
Desportes I. Ultrastructure et developpement des Gregarines du
genre Stylocephalus//Ann. sci. natur. Zool. etbiol. anim. Ser. 12.1969.
Vol. 11. P. 31—96.
Desportes I. Ultrastructure des Gregarines du genre Stylocephalus;
la phase enkystee // Ann. sci. natur. Zool. et biol. anim. Ser. 12. 1970.
Vol. 12. P. 73—170.
Desportes I. Ultrastructure et evolution nucleaire des trophozoites
d' une Gregarine d'Ephemeroptere: Enterocystis fungoides M. Codrea-
nu II J. Protozool. 1974. Vol. 21. P. 83—94.
Desportes I. Etude au microscope electronique a balayage du cycle
evolutif de la Gregarine Stylocephalus longicollis F. Stein (Sporozoai-
re) // Ann. sci. natur. Zool. et biol. anim. 1975. Vol. 17. P. 215—228.
Desportes I., Theodorides J. Ultrastructures de la Gregarine Cal-
lynthrochlamys phronimae Frenzel: etude comparee de son noyau avec
celui de Thalicola salpae Frenzel (Eugregarina) // J. Protozool. 1969.
Vol. 16. P. 449—460.
Desportes I., Theodorides J. Etude ultrastructurale d' Amphiamb-
lys laubieri n. sp. (Microsporidia, Metchnikovellidae) parasite d'une
Gregarine (Lecudina sp.) d'un Echiurien abyssal // Protistologica. 1979.
Vol. 15. P. 435—457.
Desportes I., Theodorides J. Particularites cytologiques d' Uradi-
ophora maetzi Theod. et Desp. (Eugregarina, Uradiophoridae) parasite
du Mysidace bathypelagique Gnathophausia zoea WS // Ann. sci. natur.
Zool. et biol. anim. Ser. 13. 1985. Vol. 7. P. 199—213.
Desportes I., Theodorides J. Cygnicollum lankesteri n. sp.,
Gregarine (Apicomplexa, Lecudinidae) parasite des Annelides Polychc-
tes Laetmonice hystrix et L. producta; particularites de Г appareil de fi-
xation et implications taxonomiques // Protistologica. 1986. Vol. 22.
P. 47—60.
Desportes I., Theodorides J., Vivares С. P. Association entre la
Gregarine Porospora portunidarum (Frenzel) et des bacteries intestina-
les de son hote Carcinus mediterraneus Czer. (Crustace, Decapode) //
Protistologica. 1977. Vol. 13. P. 607—610.
Desportes I., Vivares С. P., Theodorides J. Interet taxinomique
de l'ultrastructure epicytaire chez Ganymedes Huxley, Porospora
Schneider et Thiriotia n. g. Euregarines parasites de Crustaces // Ann.
sci. natur. Zool. et biol. anim. Ser. 12. 1977. Vol. 19. P. 261—277.
Devauchelle G. Presence revelee par microscopie electronique
d'inclusions particulieres chez deux Gregarines Tricystidees // C. r. Soc.
biol. 1967. Vol. 161. P. 2188—2190.
Devauchelle G. Etude ultrastructurale du developpement des
Gregarines du Tenebrio molitor L. // Protistologica. 1968a. Vol. 4.
P. 313—332.
Devauchelle G. Etude ultrastructurale de Gregarina polymorpha
(Hamm.) en syzygie // J. Protozool. 1968b. Vol. 15. P. 629—636.
Dobell C.,’ Jameson A. P. The chromosome cycle in coccidians
and gregarines // Proceedings of the Royal Society. London (ser. B).
1915. Vol. 89. P. 83—94.
Dogiel V. Beitrage zur Kenntnis der Gregarinen. I. Cystobia chiri-
dotae nov. sp. //Arch. Protistenk. 1906. Bd 7. S. 106—130.
Dogiel V. Beitrage zur Kenntnis der Gregarinen. II. Schizocystis si-
punculi n. sp. // Arch. Protistenk. 1907. Bd 8. S. 203—215.
Dogiel V. Catenata, eine neue Mesozoengruppe // Ztschr. wiss.
Zool. 1908. Bd 89.
144
ALVEOLATA
Dogiel V. Beitrage zur Kenntnis der Gregarinen. III. Uber die Spo-
rocysten der Colom-Monocystideae // Arch. Protistenk. 1909. Bd 16.
S. 194—208.
Dogiel V. Beitrage zur Kenntnis der Gregarinen. IV. Callynthroch-
lamys phronimae Frenz. u. a. m. // Arch. Protistenk. 1910a. Bd20.
S. 60—78.
Dogiel V. Surune genre nouveau de Metchnikovellidae // Ann. Inst.
Pasteur. 1922. Vol. 36. P. 574—576.
Dufour L. Note sur la Gregarine, nouveau genre de Ver qui vit en
troupeau dans les intestines de divers Insectes // Ann. Sci. natur. 1828.
Vol. 13. P. 366—368.'
Durchon ML, Vivier E. Determinisme de la gamogonie chez une
Gregarine parasite de P. cultrifera // C. R. Acad. Sci. Paris. 1961.
Vol. 253. P. 318—320.
Durchon M., Vivier E. Influence des secretions sur le cycle des
Gregarines chez les Nereidiens (Annelides Polychctes) // Ann. endocri-
nol. 1964. Vol. 25. P. 43—48.
Dyakin A. Y., Simdyanov T. G. The cortical zone of skittle-like
cells of Urospora chiridotae, a gregarine from an apode holothuria Chi-
ridota laevis // Protistology. 2005. Vol. 4. P. 97—105.
Dyson J., Evennett P. J., Grahame J. Histochemical studies of
some hydrolytic enzymes in the gregarine Digyalum oweni (Protozoa:
Apicomplexa) // Arch. Protistenk. 1995. Vol. 145. P. 94—99.
Dyson J., Grahame J., Evennett P. J. The mucron of the gregari-
ne Digyalum oweni (Protozoa: Apicomplexa), parasitic in Littorina sp.
(Mollusca: Gastropoda) // J. Natur. Hist. 1993. Vol. 27. P. 557—564.
Dyson J., Grahame J., Evennett P. J. The apical complex of the
gregarine Digyalum oweni (Protozoa: Apicomplexa) // J. Natur. Hist.
1994. Vol. 28. P. 1—7.
Filipponi A. Gigaductus macrospora, n. sp. Revisione del genre Gi-
gaductus. Instituzione della nuova famiglia Gigaductidae (Gregarini-
da) II Arch. zool. Ital. 1948. Vol. 33. P. 293—331.
Filipponi A. Sviluppo trophico, estensione e posizione sistemati-
ca del genere Gigaductus // Riv. Parassitologica. 1953. Vol. 14. P. 69—
84.
Ganapati P. N., Aiyar R. G. Life history of a dicystid gregarine,
Lecudina brasili n. sp. parasitic in the gut of Lumbriconereis // Arch.
Protistenk. 1937. Bd 89. S. 113—132.
Geus A. Sporentierchen. Sporozoa. Die Gregarinida der land- und
siisswasserbewohnenden Arthropoden Mitteleuropas. Jena, 1969.
608 S. (Die Tierwelt Deutschlands und der angrenzenden Meeresteile
nach ihren Merkmalen und nach ihren Lebensweise; Vol. 57).
Ghazali M., Philippe ML, Deguercy A., Gounon P., Gallo J. ML,
Schrevel J. Actin and spectrin-like (Mr = 260—240 000) proteins in
gregarines // Biol. Cell. 1989. Vol. 67. P. 173—184.
Ghazali Ml., Schrevel J. Myosin-like protein (Mr 175,000) in Gre-
garina blaberae II J. Euk. Microbiol. 1993. Vol. 40. P. 345—354.
Ghazali Ml., Schrevel J. Identification and localization of proteins
in gregarines that are immunologically related to smooth-muscle alp-
ha-actinin II Eur. J. Protistol. 1995. Vol. 31. P. 292—301.
Ghelelovitch S. Coelogregarina ephestiae, Schizogregarine parasi-
te d1 Ephestia Kiihniella Z. (Lepidoptere) // Arch, zoologie Exp. et gen.
1948. Vol. 85. P. 155—168.
Gohre E. Untersuchungen fiber den plasmatischen Feinbau der
Gregarinen mit besonderer Berucksichtigung der Sexulitat-verhaltnis-
se // Arch. Protistenk. 1943. Bd 96.
Grasse P.-P. Classe des Gregarinomorphes // Traite de Zoologie.
Vol. 1, Fasc. 2 / Ed. P.-P. Grasse. Paris, 1953. P. 550—690.
Grasse P.-P., Theodorides J. L’ultrastructure de la membrane
nucleaire des Gregarines // C. R. Acad. Ski. Paris. 1957. Vol. 245.
P. 1985—1986.
Grasse P.-P., Theodorides J. Recherches sur Г ultrastructure de
quelques Gregarines // Ann. Sci. natur. (Zoologie et Biologie animale,
Ser. 12). 1959. Vol. 1. P. 296—305.
Grell K. G. Der Kernphasenwechsel von Stylocephalus (Stylor-
hynchus) longicollis P. Stein // Arch. Protistenk. 1940. Bd 94. S. 161—
200.
Gunderson J., Small E. B. Selenidium vivax n. sp. (Protozoa, Api-
complexa) from the sipunculid Phascolosoma agassizii Keferstein,
1867 // J. Parasitol. 1986. Vol. 72. P. 107—110.
Hartmann M. Das System der Protozoen // Arch. Protistenk. 1907.
Bd 10.
Hatt P. L'evolution des Porosporides chez les Mollusques // Arch,
zool. exp. et gen. 1931. Vol. 31. P. 341—415.
Hausmann K., Hiilsmann N. Protozoology. Stuttgart; New York,
1996.
Henry D. P. Hirmocystis termitis (Leidy) and Kofoidina ovata gen.
nov., spec. nov. H Arch. Protistenk. 1933. Bd 80. S. 101—115.
Hentschel С. C. On the correlation of the life-history of the acep-
haline gregarine, Gonospora, with the sexual cycle of its host // Parasito-
logy. 1926. Vol. 18. P. 137—143.
Hentschel С. C. On the correlation of the life-history of the acep-
haline gregarine, Gonospora, with the sexual cycle of its host. II. Gonos-
pora (Kalpidorhynchus) arenicolae // Parasitology. 1930. Vol. 22.
P. 505—509.
Hesse E. Contribution a I'etude des monocystidees des Oligochc-
tes II Arch. zool. exp. et gen. 1909. Vol. 43. P. 27—301.
Hildebrand H. F. Elektronenmikroskopische Untersuchungen an
den Entwicklungstadien des Trophozoiten von Didymophyes gigantea
(Sporozoa, Gregarinida). 1. Die Feinstruktur des Proto- und Epimeriten
und die Beziehung zwischen Wirt und Parasit // Ztschr. Parasitenk.
1976. Bd 49. S. 193—215.
Hildebrand H. F. Elektronenmikroskopische Untersuchungen an
den Entwicklungsstadien des Trophozoiten von Didymophyes gigantea
(Sporozoa, Gregarinida). 2. Die Feinstruktur des Deutomeriten mit be-
sonderer Berucksichtigung der Kemteilung und des Golgi- Apparates //
Ztschr. Parasitenk. 1978. Bd 55. S. 9—27.
Hildebrand H. F. Elektronenmikroskopische Untersuchungen an
den Entwicklungsstadien des Trophozoiten von Didymophyes gigantea
(Sporozoa, Gregarinida). 3. Die Feinstruktur des Epizyten mit besonde-
rer Berucksichtigung der kontraktilen Elemente // Ztschr. Parasitenk.
1981. Bd 64. S. 29—46.
Hildebrand H. F., Vinckier D. Nouvelles observations sur la
Gregarine Didymophyes gigantea Stein // J. Protozool. 1975. Vol. 22.
P. 200—213.
Hoshide H. Studies on the cephaline gregarines of Japan (1). Rela-
tion between cephaline gregarines in their early stage of growth and the
host cells // Mem. Bull, of the Faculty of Education, Y amaguchi Univer-
sity. 1956. P. 1—43.
Hoshide K. Studies on the gregarines in Japan (Part 1). The fine
structure of some gregarines. // Bull, of the Faculty of Education, Yama-
guchi University. 1975. Vol. 25. P. 71—106.
Hoshide K., Todd K. S. Structure and function of the mucron of
Filipodium ozakii Hukui 1939 (Apicomplexa, Gregarina) // Proceedings
of the Zoological Society. 1992. Vol. 45. P. 53—59.
Hoshide K., Todd K. S. Morphology of the gametocysts and
oocysts of Gregarina korogi Hoshide (Apicomplexa, Eugregarinorida) //
Acta Protozoologica. 1993. Vol. 32. P. 17—26.
Hoshide K., Todd K. S. The fine structure of cell surface and ha-
ir-like projections of Filipodium ozakii Hukui 1939 gamonts // Acta
Protozoologica. 1996. Vol. 35. P. 309—315.
Hukui T. On the gregarines from Siphonosoma kumanense (Kefer-
stein) // J. Sci. Hiroshima Univ. 1939. Vol. 7. P. 1—23.
Huxley J. S. On Ganymedes anaspidis (nov. gen., nov. sp.), a gre-
garine from the digestive tract of Anaspides tasmaniae (Thompson) //
Quart. J. Microsc. Sci. 1910. Vol. 64. P. 207—266.
Jameson A. P. The chromosome-cycle of gregarines with special
reference to Diplocystis schneideri // Quart. J. Microscop. Sci. 1920.
Vol. 64/P. 207—266.
Jouvenaz D. P., Lofgren C. S., Banks W. A. Biological control of
imported fire ants: a review of current knowledge // Bull. Entomol. Soc.
Amer. 1981. Vol. 27. P. 203—208.
Joyet-Lavergne P. Les colorations vitales des Gregarines et les
characteres de sexualisation du cytoplasme И C. R. Acad. Sci. Paris.
1926. Vol. 182. P. 1295—1297.
Kamm M. W. A list of new gregarines described from 1911 to
1920//Trans. Amer. Microsc. Soc. 1922. Vol. 41. P. 122—152.
Keilin D. On two gregarines, Allantocystis dasyhelei n. g., n. sp.,
and Dendrorhynchus systeni n. g., n. sp., parasitic in the alimentary ca-
nal of the dipterous larvae, Dasyhelea obscura and Systenus sp. // Parasi-
tology. 1920. Vol. 12. P. 154—158.
Keilin D. The structure and life history of Lipotropha n. g., a new
type of schizogregarine parasitic in the fat-body of a dipterous larva
(Systenus) // Proc. Cambridge Phil. Soc. (Biol. Sci.). 1923. Vol. 1.
P. 18—29.
King C. A. Cell surface interaction of the protozoan Gregarina
with Concanavalin A beads — implications for models of gregarine gli-
ding // Cell Biol. Int. Reports. 1981. Vol. 5. P. 297—305.
King C. A. Cell motility of sporozoan protozoa // Parasitology To-
day. 1988. Vol. 4. P. 315—319.
King C. A., Baines I. C., Cooper L., Pringle N., Whitehead C.
Motility of protozoan gregarines — a model for studying mechanoche-
mical force transduction at the cell-surface // Cell Motility and the Cy-
toskeleton. 1986. Vol. 6. P. 243.
KoIIiker A. Beitrage zur Kenntniss niederer Thiere // Ztschr. wiss.
Zool. 1848. Bd 1. S. 1—37.
ТИП SPOROZOA. ЛИТЕРАТУРА
145
Kudo R. R. Protozoology. Illinois, 1966.
Kiimmel G. Die Gleitbewegung der Gregarinen. Elektronenmik-
roskopische und experimentelle Untersuchungen // Arch. Protistenk.
1957. Bd 102. S. 501—522.
Kuvardina O. N., Simdyanov T. G. Fine structure of syzygy in
Selenidium pennatum (Sporozoa, Archigregarinida) // Protistology.
2002. Vol. 2. P. 169—177.
Labbe A. Sporozoa // Das Tierreich. Vol. 5 I Eds F. E. Schulze,
O. Butschli. Berlin, 1899. 180 S.
Larsson J. I. R. On the cytology and fine structure of the Neogre-
garine Syncystis aeshnae Tuzet, Mainier, 1953 (Apicomplexa, Syncys-
tidae) // J. Protozool. 1991. Vol. 38. P. 383—392.
Leander B. S., Clopton R. E., Keeling P. G. Phylogeny of grega-
rines (Apicomplexa) as inferred from SSU rDNA and beta-tubulin // Int.
J. Syst. Evol. Microbiol. 2003a. Vol. 53. P. 345—354.
Leander B. S., Harper J. T., Keeling P. G. Molecular phylogeny
and surface morphology of marine aseptate gregarines (Apicomplexa):
Selenidium spp. and Lecudina spp. // J. Parasitol. 2003b. Vol. 89.
P. 1191—1205.
Lee J. J., Leedale G. F., Bradbnry P. [Eds) An illustrated guide
to the Protozoa. Vol. 1. Lawrence (Kansas, USA), 2000. 689 p.
Leger L. Recherches sur les Gregarines // Tablettes Zoologiques.
1892. Vol. 3. P. 1—183.
Leger L. L'evolution des Gregarines intestinales des Vers marins //
C. R. Acad. Sci. Paris. 1893. Vol. 116. P. 204—206.
Leger L. Nouvelles recherches sur les Polycystidees parasites des
Arthropodes terrestres // Ann. Fac. Sci. Marceille. 1896. Vol. 6.
P. 1—54.
Leger L. Contribution a la connaissance des Sporozoaires. Etudes
sur le Lithocystis schneideri // Bull. Sci. France et Belg. 1897. Vol. 30.
P. 240—264.
Leger L. Sur la morphologie et le developpement des microgame-
tes des Coccidies // Arch. zool. exp. et gen. Ser. 3.1898. Vol. 6 (Notes et
Revues). P. 20—26.
Leger L. Quelques types nouveaux de Dactylophorides de la region
mediterraneenne // Trav. St. Zool. Wimereux. 1899. Vol. 7. P. 390—
395.
Leger L. Sur un nouveau Sporozoaire des larves de Dipteres (Schi-
zocystis) U C. R. Acad. Sci. Paris. 1900a. Vol. 131. P. 722.
Leger L. Sur un nouveau Sporozoaire des larves de Dipteres // C. r.
Soc. Biol. 1900b. Vol. 52. P. 868—870.
Leger L. La reproduction sexuee chez les Ophryocystis // C. r. Soc.
Biol. 1900c. Vol. 52. P. 927—930.
Leger L. La reproduction sexuee chez les Stylorhynchus // Arch.
Protistenk. 1904a. Bd 3. S. 303—357.
Leger L. Sporozoaires parasites de 1'Embia solieri Rambur. // Arch.
Protistenk. 1904b. Bd 3. S. 358—366.
Leger L. fcude surTaeniocystis mira Leger, Gregarine metameri-
que // Arch. Protistenk. 1906. Bd 7. S. 307—327.
Liger L. Les Schizogregarines des Tracheates. I. Le genre Ophryo-
cystis // Arch. Protistenk. 1907. Bd 8. S. 159—202.
Liger L. Les Schizogregarines des Tracheates. II. Le genre Schizo-
eystis // Arch. Protistenk. 1910. Bd 18. S. 5—15.
Liger L., Duboscq O. Les Gregarines et I'epithelium intesti-
nal chez les Tracheates // Arch. Parasitologie. 1902. Vol. 6. S. 377—
472.
Liger L., Duboscq O. La reproduction sexuee chez Pterocepha-
lllN II Arch. zool. exp. et gin. Ser. 4 (Notes et Revues). 1903. Vol. 1.
P. 141 -147.
Liger L., Duboscq O. Nouvelles recherches les Gregarines et
I'ipithilium intestinal chez les Tracheates // Arch. Protistenk. 1904.
H<l 4. S. 335—383.
Liger L., Duboscq O. Etudes sur la sexualite chez les Gregarines //
Arch. Protistenk. 1909. Bd 17. S. 19—134.
Liger L., Dnboscq O. Selenococcidium intermedium Leg. et Dub.
cl In systimatique des Sporozoaires // Arch. zool. exp. et gin. Ser. 5.
19111a. Vol. 5. P. 187—238.
Liger L., Duboscq O. Deux Grigarines de Crustacis. Porospora
poilunidarum Frenz. et Cephaloidophora maculata n. sp. // Arch. zool.
exp. et gin. Ser. 5 (Notes et Revues). 1910b. Vol. 6. P. LIX.
Liger L., Duboscq O. Deux nouvelles especes de Grigarines ap-
paitcnait nu genre Porospora // Ann. Univ. Grenoble. 1911. Vol. 23.
P. 399—404.
Liger L., Duboscq O. Sporozoaires de Glossobalanus minutus
Kow.: Selenidium metchnikovi n. sp. // Ann. Inst. Pasteur. 1917.
Vol. 31. P. 60—74.
Liger L., Duboscq O. Les Porosporides et leur ivolution // Trav.
Stat. Zool. de Wimereux. 1925. Vol. 9. P. 126—139.
Levine N. D. Uniform terminology for the protozoan subphylum
Apicomplexa // J. Protozool. 1971a. Vol. 18. P. 352—355.
Levine N. D. Taxonomy of the Archigregarinorida and Selenidii-
dae (Protozoa, Apicomplexa) // J. Protozool. 1971b. Vol. 18. P. 704—
717.
Levine N. D. Gregarines of the genus Lecudina (Protozoa, Api-
complexa) from Pacific Ocean polychaetes // J. Protozool. 1974.
Vol. 21. P. 10—12.
Levine N. D. Revision and checklist of the species of the aseptate
gregarine genus Lecudina // Trans. Amer. Microsc. Soc. 1976. Vol. 95.
P. 695—702.
Levine N. D. Revision and checklist of the species (other than Le-
cudina) of the aseptate gregarine family Lecudinidae // J. Protozool.
1977a. Vol. 24. P. 41—52.
Levine N. D. Checklist of the species of the aseptate gregarine fa-
mily Urosporidae // Int. J. Parasitol. 1977b. Vol. 7. P. 101—108.
Levine N. D. Revision and the check-list of the species of aseptate
gregarine family Monocystidae // Folia Parasitologica. 1977c. Vol. 24.
P. 1—24.
Levine N. D. Checklist of the species of the aseptate gregarine fa-
milies Aikinetocystidae, Diplocystidae, Allantocystidae, Schaudinnelli-
dae, Ganymedidae, and Enterocystidae // J. Invertebr. Pathol. 1977d.
Vol. 29. P. 175—181.
Levine N. D. New genera and higher taxa of septate gregarines
(Protozoa, Apicomplexa)//!. Protozool. 1979. Vol. 26(4). P. 532—536.
Levine N. D. Three new species of Ascocystis (Apicomplexa, Le-
cudinidae) from mosquitoes//J. Protozool. 1980. Vol. 27. P. 147—151.
Levine N. D. New species of Lankesteria (Apicomplexa, Eugrega-
rinida) from the Ascidians of the Central California coast // J. Protozool.
1981. Vol. 28. P. 363—370.
Levine N. D. Nomenclatural corrections and new taxa in the api-
complexan Protozoa // Trans. Amer. Microsc. Soc. 1984. Vol. 103.
P. 195—204.
Levine N. D. Phylum 2. Apicomplexa Levine, 1970 // An illustra-
ted guide to the Protozoa / Eds J. J. Lee, S. H. Hutner, E. C. Bovee. La-
wrence (Kansas, USA), Society of Protozoologists. 1985. P. 322—374.
Levine N. D. The protozoan phylum Apicomlexa. Boca Raton,
USA, 1988. Vol. 1, 2.
Levine N. D., Corliss J. O., Cox F. E. G., Deronx G., Grain J.,
Honigberg В. M., Leedale G. F., Loeblich A. R., Lorn J., Lynn D.,
Merinfeld E. G., Page F. C., Poljansky G., Sprague V., Vavra J.,
Wallace F. G. A newly revised classification of the Protozoa // J. Proto-
zool. 1980. Vol. 27. P. 37—58.
Lieberkuhn N. Evolution des Gregarines // Mem. cour. et mem. d.
Sav. etrang. Ac. de Belgique. 1855. Vol. 26.
Lipa J. J. Studies on gregarines (Gregarinomorpha) of arthropods
in Poland // Acta Protozoologica. 1967. Vol. 5. P. 1—179.
Lipa J. J., Triggiani O. A newly recorded neogregarine (Protozoa,
Apicomplexa), parasite in honey bees (Apis mellifera) and bumble bees
(Bombus spp) II Apidologie. 1992. Vol. 23. P. 533—536.
Lipa J. J., Triggiani O. Apicystis gen. nov. and Apicystis bombi
(Liu, MacFarane, Pengelly) comb. nov. (Protozoa: Neogregarinida), a
cosmopolitan parasite of Bombus and Apis (Hymenoptera: Apidae) //
Apidologie. 1996. Vol. 27. P. 29—34.
Liu H. J., Macfarlane R. P., Pengelly D. H. Mattesia bombi n. sp.
(Neogregarinida, Ophryocystidae), a parasite of Bombus (Hymenopte-
ra: Apidae) // J. Invertebr. Pathol. 1974. Vol. 23. P. 225—231.
Loubatieres R. Contribution a 1'etude des Monocystidees des Oli-
gochetes du Languedoc-Roussillon // Ann. Sci. natur. (Zoologie et Bio-
logie animale Ser. 11). 1955. Vol. 17. P. 73—205.
MacGregor H. C., Thomasson P. A. The fine structure of two arc-
higregarines Selenidium fallax and Ditrypanocystis cirratuli // J. Proto-
zool. 1965. Vol. 12. P. 438—443.
Mackenzie C., Walker M. H. Bacteria-like structures in the en-
doplasm of Gregarina gamhami (Eugregarinida, Protozoa) // Cell and
Tissue Res. 1979. Vol. 202. P. 33—39.
Mackenzie C., Walker M. Substrate contact, mucus, and Eugrega-
rine gliding // J. Protozool. 1983. Vol. 30. P. 3—8.
Mackinnon D. L., Ray H. N. Observations on dicystid gregarines
from marine worms // Quart. J. Microsc. Sci. 1931. Vol. 74. P. 439—466.
MacMillan W. G. Conformation changes in the cortical region du-
ring peristaltic movements of a gregarine trophozoite // J. Protozool.
1973a. Vol. 20. P. 267—274.
MacMillan W. G. Gregarine attachement organelles: structure and
permeability of an interspecific cell junction // Parasitology. 1973b.
Vol. 66. P. 207—214.
Malavasi A., da Cunha A. B., Morgante J. S., Marqnes J. Relati-
onships between the gregarine Schneideria schneiderae and its host
III Irth. №4163
ALVEOLATA
TriehM
vol. 16
Il НЙМИИН (Diptera, Sciaridae) // J. Invertebr. Pathol. 1976.
, к lil-ri.
Mirouh A, Actinocephalus dujardini Schneider 1875. Eugregari-
III Mffllli* de Lithobius (Myriapoda, Chilopoda): ultrastructure de
VMlmirlte # Ann. Sci. natur. (Zoologie et Biologie animate, Ser. 13).
IITO. Vol. 1. P. 161—168.
Marques A., Ormieres R. Le «noyau protomeritique» et les struc-
tures periodiques chez les Eugregarines Dactylophoridae, Leger 1892.
Etude Ultrastructurale // Ann. Sci. natur. (Zoologie et Biologie animate,
Ser. 13). 1981. Vol. 3. P. 231—239.
Marqites A., Ormieres R., Puissegur C. Observations en micros-
copic electronique a balayage de quelques stades de Trichorhynchus
pulcher Schneider, 1882, Eugregarine parasite de Scutigera (Myriapo-
des, Chilopodes) // Ann. Sci. natur. (Zoologie et Biologie animate, Ser.
13). 1978. Vol. 20. P. 27—36.
Martinucci G. B., Crespi P. Contributions to the study of mono-
cystid gregarines parasites of Octolasium transpadanum. I — The fine
organization of Apolocystis sp. trophozoite // Boll. Zool. 1979. Vol. 46.
P. 23—29.
Martinucci G. B., Crespi P., Ferragosti E. Contributions to the
study of monocystid gregarines parasites of Octolasium transpadanum.
III. Ultrastructural features of Apolocystis sp. gamonts, gametes and zy-
gotes // Boll. Zool. 1981. Vol. 48. P. 243—253.
Massot M., Ormieres R. Gigaductus steropi n. sp., Neogregari-
ne parasite de Steropus madius Fabr. (Coleopt. Caraboidea). Ultrastruc-
ture des stades intracellulaires // Protistologica. 1979. Vol. 15.
P. 495—505.
Meier M. Die Monocystideen Fauna der Oligochaten von Erlangen
und Umgebung // Arch. Protistenk. 1956. Bd 101. S. 335—400.
Mercier L. Cephaloidophora talitri n. sp. Gregarine parasite du Ta-
litre II C. R. Soc. biol. 1912. Vol. 72. P. 38—39.
Mercier C., Schrevel J., Stark J. R. The storage polysaccharide
(paraglycogen) of the gregarine (Gregarina blaberae): cytology and bi-
ochemistry // Comp. Biochem. and Physiol. B. 1973. Vol. 44. P. 1001—
1010.
Miles H. B. The fine structure of the epicyte of the acephaline gre-
garines Monocystis lumbrici-olidi, and Nematocystis magna: observati-
ons by electron microscope // Rev. iberica Parasitologia. 1968. Vol. 28.
P. 455—465.
Molon-Noblot S. Ultrastructure du centriole chez la Gregarine
Grebnickiella gracilis (Sporozoaire) // Protistologica. 1976. Vol. 12.
P. 431—434.
Molon-Noblot S. Les gametes de la Gregarine Grebnickiella
(=Nina) gracilis (Grebnicki) (Sporozoaire) parasite de la Scolopendre
Scolopendra cingulata L.; premieres donnees ultrastructurales // C. R.
Acad. Sci. Paris (Ser. D.). 1977. Vol. 284. P. 1179—1182.
Molon-Noblot S. Etude ultrastructurale de la gamctogenese chez la
Gregarine Grebnickiella (=Nina) gracilis (Grebnicki) (Sporozoaire) pa-
rasite de la Scolopendre Scolopendra cingulata L. // Ann. sci. natur.
Zool. et biol. anim., Ser. 13. 1978. Vol. 20. P. 79—97.
Molon-Noblot S., Desportes I. Mise en evidence de complexes sy-
naptonematiques dans le noyau meiotique d'un sporozoaire, la Gregari-
ne Grebnickiella gracilis (Grebnicki) parasite de la scolopendre Scolo-
pendra cingulata L. // C. R. Acad. Sci. Paris (Ser. D.). 1977. Vol. 285.
P. 217—219.
Molon-Noblot S., Desportes I. Etude ultrastructurale des mitoses
gamogoniques de la Gregarine Grebnickiella gracilis Gr. parasite de la
scolopendre Scolopendra cingulata L. Considerations sur les mitoses
schizogoniques des Sporozoaires (Apicomplexa) // Protistologica. 1980.
Vol. 16. P. 395—411.
Mourya D. T., Soman R. S. Effect of gregarine parasite, Asco-
gregarina culicis and tetracycline on the susceptibility of Culex bita-
eniorhynchus to JE virus // Ind. J. Med. Res. 1985. Vol. 81.
P. 247—250.
Naville A. Le cycle chromosomique d'Urospora lagidis (de Saint
Joseph) // Parasitology. 1927. Vol. 19. P. 100—138.
Naville A. Recherches cytologiques sur les Schizogregarines. I. Le
cycle evolutif de Mattesia dispora n. g., n. sp. // Z. Zellforsch. 1930.
Bd 11. S. 375—396.
Nussbaum J. Uber die geschlechtliche heterogame Fortpflanzung
einer in Darmkanale von Henlea leptodera Vejd. schmarotzenden Gre-
garine Schaudinnella henleae mihi I/ Ztschr. wiss. Zool. 1903. Bd 175.
S. 281—307.
Ormieres R. Recherches sur les Sporozoaires parasites des Tunici-
ers // Vie et Milieu. 1965. Vol. 15. P. 823—946.
Ormieres R. Gregarines parasites de Myriapodes Chilopodes: ob-
servations sur les genres Echinomera Labbe, 1899, et Acutispora Craw-
ley, 1903 // Protistologica. 1966a. Vol. 2. P. 15—21.
Ormieres R. Eugregarines nouvelles ou peu connues parasites de
Coleoptcres // Vie et milieu. 1966b. Vol. 17C. P. 765—774.
Ormieres R. Pachyporospora retorta n. sp. Gregarine parasite de
Macropipus holstatus F. Crustace — Decapode. Donnees nouvelles sur
le genre Pachyporospora Theo3?4961 // Ann. parasitol. hum. et comp.
1968. Vol. 43, P. 413—419.
Ormteres R. Une Gregarine paradoxale, Gigaductus anchi Tuz. et
Orm., 1966: Ultrastructure de la schizogonie et position systematique
des Gigaductidae Filipponi 1948 // Protistologica. 1971. Vol. 7.
P. 261—271.
Ormieres R. Etudes experimentales sur Gregarina ovata Dufour
1828: macro- et microsporocystes, specifite parasitaire, duree du cycle //
Ann. parasitol. hum. et comp. 1975. Vol. 50. P. 521—529.
Ormieres R. Pyxinia firmus (Leger, 1892), Eugregarine parasite du
Coleoptcre Dermestes frischi Kugel. Etude ultrastructurale // Ztschr. Pa-
rasitenk. 1977a. Vol. 53. P. 13—22.
Ormieres R. Deux nouvelles espcces de Gregarines parasites
d'Annelides: Pleurocystis eiseniellae d' Eiseniella tetraedra Sav. (Oli-
gochcte), Pterospora petaloprocti de Petaloproctus terricola Quatr. (Po-
lychete) // Ann. parasitol. hum. et comp. 1977b. Vol. 52. P. 109—116.
Ormteres R. Eugregarines parasites de Cirripedes. Revision syste-
matique basee sur des donnees et espcces nouvelles II Protistologica.
1983. Vol. 19. P. 187—191.
Ormteres R., Daumal J. Etude ultrastructurale de la partie anterie-
ure d1 Epicavus araeoceri Ormieres et Daumal, Eugregarine parasite du
Coteoptcre Anthribidae Araeocerus fasciculatus de Geer// Protistologi-
ca. 1970. Vol. 6. P. 97—111.
Ormteres R., Daumal J. Ultrastructure de la partie anterieure de
Pyxinia anobii Vincent, 1922, Eugregarine parasite du Coleoptere Ano-
biidae, Stegobium paniceum // Ann. Stat. biol. Besse-en-Chandesse.
1975. Vol. 9. P. 157—176.
Ormieres R., Louis C., Kuhl G. La schizogonie de premiere
generation chez Mattesia oryzaephili Ormieres, Louis et Kuhl (Sporo-
zoa — Neogregarinida) etude ultrastructurale // Protistologica. 1972.
Vol. 8. P. 287—294.
Ormieres R., Manier J. F., Mathiez F. Proposition de Neoschnei-
deria n. g. pour les Gregarines metamerisees, parasites des larves des
Dixa (Diptera-Culicidae) // Ann. parasitol. hum. et comp. 1965. Vol. 40.
P. 359—368.
Ormieres R., Marques A. Fixation a leurs hStes de quelques Dac-
tylophoridae Eugregarines parasites de Myriapodes Chilopodes // Pro-
tistologica. 1976. Vol. 12. P. 415—424.
Ormieres R., Marques A., Puissegur C. Trichorhynchus pulcher
Schneider, 1882, Eugregarine parasite du Scutigera coleopterata L.
Cycle, ultrastructure, systematique // Protistologica. 1977. Vol. 13.
P. 407—417.
Ormteres R., Massot M., Massot N. Ophryocystis schneideri Leg.
Hagenm., 1900 Neogregarine parasite de Blaps d' Algerie. Cycle et etu-
de ultrastructurale // Protistologica. 1978. Vol. 14. P. 483—492.
Ouassi M. A., Porchet-Hennere E. Etude ultrastructurale de muc-
ron d'une Gregarine du genre Lecudina, parasite intestinal d' Audoinia
tentaculata (Annelide Polychcte) et de ses rapports avec la cellule hote //
Protistologica. 1978. Vol. 14. P. 39—52.
Patil С. C., Amoji S. D., Neelgund Y. F. Studies on cross infecti-
on of cephaline gregarines of tenebrionid insects // Arch. Protistenk.
1985. Vol. 129. P. 179—182.
Perkins F. O., Barta J. R., Clopton R. E., Peirce M. A., Up-
ton S. J. Phylum Apicomplexa // An Illustrated Guide to the Protozoa.
Vol. 1 / Eds J. J. Lee, G. F. Leedale, P. Bradbury. Lawrence (Kanzas,
USA), 2000. P. 190—370.
Pfeiffer L. Infectio im Hoden des Regenwurmes durch Monocysti-
den // Die Protozoen als Krankheitserreger. Jena, 1891. P. 37—44.
Philippe M. Differentiation and cellular arrangement of Gregarina
blaberae gamonts // J. Protozool. 1983. Vol. 30. P. A72.
Philippe M., Fournet B., Schrevel J. Determination de la compo-
sition en glucides macromoteculaires du Protozoaire parasite Gregarina
blaberae aux stades vegetatif et sexue et de I'hemolymphe de I'hote Bla-
beruscraniifer//C.R. Acad. Sci. Paris. 1975. Vol. 280. P. 1801—1804.
Philippe M., Fournet B., Caigneaux E., Schrevel J. Les polysac-
charides associes a la surface cellulaire d' une Gregarine (Protozoaire
parasite). 2. Caracterisation cytochimique et analyse biochimique des
«ghosts» // Biol. Cellulaire. 1979. Vol. 35. P. 165—174.
Philippe M., Schrevel J. The three cortical membranes of the gre-
garines (parasitic Protozoa). Characterization of the membrane proteins
of Gregarina blaberae // Biochem. J. 1982. Vol. 201. P. 455—464.
Philippe M., Vinckier D., Dubremetz J. F., Schrevel J. The three
cortical membranes of the gregarines (parasitic Protozoa). III. Compa-
rative studies of the membrane proteins among different sporozoan spe-
ТИП SPOROZOA. ЛИТЕРАТУРА
147
cies during their vegetative phase // J. Protozool. 1982. Vol. 29.
P. 424—430.
Pixell-Goodrich H. L. M. On the life history of the Sporozoa of
Spatangoids, with observations on some allied forms II Quart. J. Mic-
rosc. Sci. 1915. Vol. 61. P. 81—104.
Porchet-Неппегё E., Fischer A. Diplauxis schreveli, n. sp.,
Grdgarinc parasite du coelome de Г Annelide Polychete Platynereis du-
merilli: cycle et etude ultrastructurale preliminaire // Protistologica.
1973. Vol. 9. P. 437—454.
Porchet-Hennere E., Vivier E. Ultrastructure comparee des ger-
mcs infectieux (sporozoites, merozoites, schizozoites, endozoites, etc.)
chezles Sporozoaires// Ann. biol. (Ser. 4). 1971. Vol. 10. P. 77—113.
Prensier G. Premieres observations ultrastructurales sur la formati-
on des sporozoites a partir du sporoblaste chez Diplauxis hatti // C. R.
Acad. Sci. Paris. (Ser. D). 1970a. Vol. 270. P. 100—103.
Prensier G. Structure de la paroi du sporoblaste et origine du com-
plexe membranaire interne du sporozoite de Diplauxis hatti (gregarine
monocystidee), demontrees par la microscopie electronique // C. R.
Acad. Sci. Paris. (Ser. D). 1970b. Vol. 271. P. 2329—2331.
Prensier G., Vivier E., Goldstein S., Schrevel J. Motile flagel-
lum with a '3+0' ultrastructure // Science. 1980. Vol. 207. P. 1493—1494.
Prytherch H. F. The life cycle and morphology ofNematopsis ost-
rearum sp. nov., a gregarine parasite of the mud crab and oyster // J.
Morphology, Philadelphia. 1940. Vol. 66. P. 39—65.
Purrini K., Kohring G.-W. Ophryocystis oryctesi n. sp. (Ophryo-
cystidae, Neogregarinida), a new gregarine parasitizing the rhinoceros
beetle, Oryctes monoceros Oliv (Scarabaeidae, Coleoptera) II Zool.
Anz. 1987. Vol. 218. P. 237—245.
Purrini K., Ormieres R. Gregarina hylobii and Ophryocystis hylo-
bii n. sp. (Ophryocystidae, Neogregarinida) parasitizing Hylobius abie-
tis (Curculionidae, Coleoptera) // J. Invertebr. Pathol. 1982. Vol. 39.
P. 164—173.
Puytorac P., De Grain J., Mignot J.-P. Precis de Protistologie.
Paris, 1987.
Ray H. N. Studies on some Sporozoa in polychaete worms. I. Gre-
garines of the genus Selenidium//Parasitology. 1930. Vol. 22. P. 370—
398.
Ray H. N. Studies on Sporozoa from Indian millipedes. I. Stenop-
hora kharendrae n. sp., with a note on its metod of progression // Arch.
Protistenk. 1933a. Bd 81. S. 343—351.
Ray H. N. On the gregarine Lankesteria culicis (Ross) in the mos-
quito Aedes (Stegomyia) albopictus Skuse П Parasitology. 1933b.
Vol. 25. P. 392—396.
Ray H. N., Chakravarty M. M. Studies on Sporozoa from Indian
Millipedes. II. The life history of a cephaline gregarine, Monoductus lu-
natus n. gen., n. sp. // Arch. Protistenk. 1933. Bd 81. S. 352—360.
Reichenow E. Lehrbuch der Protozoenkunde. Vol. 3. Jena, 1953.
Roskin Gr., Lewinson L. B. Die Kontraktilen und Skelettelemente
der Protozoen. I. Der Kontraktile und der Skelettapparat der Gregarinen
(Monocystidae) II Arch. Protistenk. 1929. Bd 66. S. 355 — 401.
Russell D. G., Sinden R. E. The role of the cytoskeleton in the
motility of coccidian sporozoites II J. Cell Sci. 1981. Vol. 50. P. 345—359.
Sathananthan A. H. Cytochemical nature and fine structure of the
gregarine Zeylanocystis burti Dissanaike, with special reference to mic-
rofilaments, microtubules and movement // J. Protozool. 1977. Vol. 24.
P. 233—243.
Schellack C. Uber die Entwicklung und Fortpflanzung von Echino-
mera hispida // Arch. Protistenk. 1907. Bd 9. S. 297—345.
Schewiakoff W. Uber die Ursache der fortschreitenden Bewegung
der Gregarinen // Ztschr. wiss. zool. 1894. Bd 58. S. 197—293.
Schneider A. Contributions a I'histoire des Gregarines des In-
vertebres de Paris et de Roscoff // Arch. zool. exp. et gen. 1875. Vol. 4.
P. 493—604.
Schneider A. Seconde contribution a 1'etude des Gregarines // Arch,
zool. exp. et gen. 1882. Vol. 10. P. 423—450.
Schneider A. Sur le developpement du Stylorhynchus longicollis II
Arch. zool. exp. etgen. Ser. 2. 1884. Vol. 2. P. 1—36.
Schneider A. Etudes sur le developpement des Gregarines. Grega-
rines nouvelles ou peu connues // Tablettes Zoologiques. 1885. Vol. 1.
P. 10—24, 25—30.
Schneider A. Gregarines nouvelles ou peu connues U Tablettes
Zoologiques. 1886. Vol. 1. P. 90—103.
Schneider A. Gregarines nouvelles ou peu connues // Tablettes
Zoologiques. 1887. Vol. 2. P. 67—85.
Schnitzler H. Ober die Fortpflanzung von Clepsidrina ovata //
Arch. Protistenk. 1905. Vol. 6. P. 309—333.
Schrevel J. Gregarines nouvelles de Nereidae et Eunicidae (Anne
lides Polychctes) // C. r. Soc. Biol. 1963. Vol. 157. P. 814—816.
Schrevel J. Gregarines parasites de quelques Eunicidae et Glyceri-
dae (Annelides Polychetes) // C. R. Soc. Biol. 1963. Vol. 157. P. 568—
571.
Schrevel J. Contribution а Г etude de trois Gregarines parasites d'
Annelides Polychctes: Lecudina elongata Mingazzini, 1891; Lecudina
tuzetae Schrevel, 1963; Gonospora varia Leger, 1892 // Arch. zool. exp.
et gen. 1964. Vol. 104. P. 125—142.
Schrevel J. Cycle de Selenidium pendula Giard, 1884, Gregarine
parasite de Nerine cirratulus delle Chiaje (Annelide Polychete) U Protis-
tologica. 1966. Vol. 2. P. 31—34.
Schrevel J. L' ultrastructure de la region aterieure de la Gregarine
Selenidium et son interet pour 1'etude de la nutrition chez les Sporozoai-
res // J. Microsc. Paris. 1968a. Vol. 7. P. 391—410.
Schrevel J. Existence d'un pore d'excretion chez les schizozoites de
Sporozoaires // C. R. Acad. Sci. Paris (Ser. D). 1968b. Vol. 267.
P. 746—748.
Schrevel J. Recherches sur le cycle des Lecudinidae Gregarines pa-
rasites d'Annelides Polychctes // Protistologica. 1969. Vol. 5. P. 561—
588.
Schrevel J. Contribution a I'etude des Selenidiidae parasites
d'Annelides Polychctes. I. Cycles biologiques // Protistologica. 1970a.
Vol. 6. P. 389—426.
Schrevel J. Recherches ultrastructurales et cytochimiques sur le
paraglycogene, reserve glucidique des Gregarines et Coccidies // J. Mic-
rosc. Paris. 1970b. Vol. 9. P. 593—610.
Schrevel J. Contribution a I'etude des Selenidiidae parasites
d'Annelides Polychctes. II. Ultrastructure de quelques trophozoites //
Protistologica. 1971a. Vol. 7. P. 101—130.
Schrevel J. Observations biologiques et ultrastructurales sur les
Selenidiidae et leurs consequences sur la systematique des Gregarino-
morphes // J. Protozool. 1971b. Vol. 18. P. 448—479.
Schrevel J. Facteurs controlant la reproduction des Gregarines.
Etude de 1'enkystement de la Gregarine intestinale, Lecudina tuzetae
Schr., parasite de Nereis diversicolor O. F. Muller (annelide polyche-
te) // Protistologica. 1971c. Vol. 7. P. 439—450.
Schrevel J. Les polysaccharides associes a la surface cellulaire des
Gregarines (Protozoaires parasites). 1. Ultrastructure et cytochimie // J.
Microsc. Paris. 1972. Vol. 15. P. 21—40.
Schrevel J. Motility and cytoskeleton in gregarines // Cell Motility
and the Cytoskeleton. 1986. Vol. 6. P. 240.
Schrevel J. Protists — an exceptional source of cell models // Biol.
Cell. 1994. Vol. 80. P. 241—256.
Schrevel J., Dhainaut A. Incorporation d'Uridine-3H et de Leuci-
ne-3H chez Lecudina tuzetae Schrevel, Gregarine parasite de Г Anneli-
de Polychete Nereis diversicolor O. F. Muller // C. r. Soc. Biol. 1968.
Vol. 162. P. 465—467.
Schrevel J., Fouquet J. P. Mise en evidence d'une activite phosp-
horylasique chez une Gregarine // C. R. Acad. Sci. Paris. 1968. Vol. 267.
P. 1297—1299.
Schrevel J., Besse C. Un type flagellaire fonctionnel de base 6+0 //
J. Cell Biol. 1975. Vol. 66. P. 492—507.
Schrevel J., Besse C., Philippe M. Junctional complex between
Gregarina blaberae gametes II Biol. Cell. 1981. Vol. 41. P. A27-A27.
Schrevel J., Besse C., Vivier E., Ormieres R. Etude ultrastructu-
rale et cytochimique d' inclusions a structure periodique dans les cavites
du reticulum endoplasmique de Gregarines // J. Microsc. Paris. 1974b.
Vol. 21. P. 31—42.
Schrevel J., Buissonnet S., Metais M. Action de 1'uree sur la moti-
lite et les microtubules sous-pelliculaires du Protozoaire Selenidium
hollandei// C. R. Acad. Sci. Paris (Ser. D). 1974a. Vol. 278. P. 2201—
2204.
Schrevel J., Caigneaux E., Gros D., Philippe M. The three corti-
cal membranes of the gregarines. I. Ultrastructural organization of Gre-
garina blaberae // J. Cell Sci. 1983. Vol. 61. P. 151—174.
Schrevel J., Philippe M. Intermediate filaments during the growth
and sexual stages of the unicellular eukaryote Gregarina blaberae II Biol.
Cell. 1982. Vol. 45. P. 208.
Schrevel J., Philippe M. The Gregarines // Parasitic Protozoa.
Vol. 4 / Ed. J. P. Kreier. San Diego et al. 1993. P. 133—245.
Schrevel J., Vivier E. Etude de Г ultrastructure et du role de la regi-
on anterieure (mucron et epimerite) de Gregarines parasites d' Anneli-
des Polychetes // Protistologica. 1966. Vol. 2. P. 17—28.
Sheffield H. G., Garnham P. С. C., Shiroisui T. The fine structu-
re of the sporozoite of Lankesteria culicis // J. Protozool. 1971. Vol. 18.
P. 98—105.
Siedlecki M. Uber die geschlechtliche Vermehrung der Monocystis
ascidiae R. Lank. // Bull. int. Acad. Sci. Cracovie. 1899. Vol. 13.
P. 515—537.
148
ALVEOLATA
Siedlecki M. Contribution a I’etude des changements cellulaires
provoquis par les Gregarines // Arch. anat. microsc. 1901. Vol. 4.
P. 87 100.
Siedlecki M. Veranderungen des Kemplasmarelation wahrend des
Wachstums intracellularen Parasiten // Bull. int. Acad. Sci. Cracovie
(Ser. B). 1911. P. 509—528.
Simmons L. W. Postcopulatory guarding, female choice and the
levels of gregarine infections in the field cricket, Gryllus bimaculatus //
Behav. Ecol. and Sociobiol. 1990. Vol. 26. P. 403—407.
Simmons L. W., Zuk M. Variability in call structure and pairing
success of male field crickets, Gryllus bimaculatus: the effects of age,
size and parasite load II Anim. Behav. 1992. Vol. 44. P. 1145—1152.
Sokolow B. Studien liber Physiologie der Gregarinen // Arch. Pro-
tistenk. 1912. Bd 27. S. 260—314.
Sprague V. Studies on Gregarina blattarum with particular referen-
ce to the chromosome cycle // Ill. Biol. Monographs. 1941. Vol. 18.
P. 5—57.
Stein F. Uber die Natur der Gregarinen // Arch. Anat. und Physiol.
1848. Bd 20. S. 182—243.
Stejskal M. Gregarines parasiting honey bees // Amer. Bee J. 1965.
Vol. 105. P. 374—375.
Steopoe J. Une nouvelle Schizogregarine coelomique chez Nepa
cinerea L. U C. r. Soc. Biol. 1928. Vol. 98. P. 1365—1366.
Theodorides J. Sur la distinction entre les Gregarines des famil-
ies des Cephaloidophoridae et des Porosporidae parasites des Crusta-
ces Decapodes // C. R. Acad. Sci. Paris. 1961. Vol. 252. P. 3640—
3642.
Theodorides J. Quelques Gregarines parasites d'Annelides Polyc-
hctes de la region de Banyuls // Ann. parasitol. hum. et comp. 1969.
Vol. 44. P. 331—350.
Theodorides J. A propos de Diplauxis schreveli Porchet-Hennere
et Fischer 1973 (Eugregarina, Urosporidae) // Ann. parasitol. hum. et
comp. 1978. Vol. 53. P. 437—438.
Theodorides J. The phylogeny of the Gregarinia (Sporozoa) // Ori-
gins of Life and Evolution of the Biosphere. 1984. Vol. 13. P. 339—
342.
Theodorides J. Anisoloboides joliveti, new genus new species
(Apicomplexa, Eugregarina, Gregarinidae), parasite of Brachyomus
histrio Faust (Coleoptera, Curculionidae), with remarks on the other
gregarines from the Curculionidae // Syst. Parasitology. 1992. Vol. 21.
P. 233—237.
Theodorides J. Gregarines of Chrysomelidae // Biology of Chryso-
melidae / Eds P. Jolivet, E. Petitpierre, T. H. Hsiao. Boston, 1988.
P. 417—431.
Theodorides J., Carre C. Parasitisme d1 Alciopidae (Annelida, Po-
lychaeta) de Villefranche-sur-Mer par les Gregarines (Eugregarinida) //
Ann. parasitol. hum. et comp. 1970. Vol. 44. P. 519—521.
Theodorides J., Desportes I. Quelques Gregarines de Coleoptcres
du Laos // Protistologica. 1966. Vol. 2. P. 53—58.
Theodorides J., Desportes I. Sur trois Gregarines parasites d’ln-
vertebres marins // Bull. Inst, oceanogr. Monaco. 1968. Vol. 67(1387).
P. 1—11.
Theodorides J., Laubrier L. Selenidium mercierellae n. sp. (Arc-
higregarinia, Selenidiidae) Gregarine parasite du Serpulien d’ eau sau-
matre Mercierella enigmatica Fauvel. (Note Preliminaire) // Vie et Mi-
lieu. 1962b. Vol. 13. P. 323—326.
Theodorides J., Desportes I. Sporozoaires d'Invertebres pelagiqu-
es de Villefranche-sur-Mer (Etude descriptive et faunistique) // Protisto-
logica. 1975. Vol. 11. P. 205—220.
Theodorides J., Desportes I. Nouveau type d'association chez une
Lecudina (L. postae n. sp., Eugregarina Lecudinidae) parasite de Hyali-
noecia tubicola (Muller) (Polychaeta: Onuphidae) II Ann. parasitol.
hum. et comp. 1978. Vol. 53. P. 443—446.
Theodoridis J., Desportes I., Jolivet P. Gregarines de la Nou-
velle-Guinee et des iles voisines // Cah. Pacif. 1972. Vol. 16. P. 111 —
168.
Theodorides J., Desportes I., Jolivet P. Gregarines de la Thailan-
de II Ann. parasitol. hum. et comp. 1975. Vol. 50. P. 145—159.
Th£odoridis J., Desportes I., Jolivet P. Gregarines from South
Korea II Ann. parasitol. hum. et comp. 1976. Vol. 51. P. 161—174.
Theodorides J., Desportes 1., Jolivet P. Gregarines of Arthropods
of North-Vietnam // Ann. Sci. natur. (Zoologie et Biologie animale, Ser.
13). 1984. Vol. 6. P. 57—69.
Theodorides J., Laird M. Quelques Eugregarines parasites d'In-
vertebres marins de St. Andrews (Nouveau-Brunswick) II Can. J. Zool.
1970. Vol. 48. P. 1013—1016.
Tregouboff G. Sur les Gregarines des Balanes // Arch. zool. exp. et
gen. (Notes et Revues). 1912. Vol. 3. P. 53—61.
Tregouboff G. Cystobia testiculi Gregarine parasite du testicule d'
un Mollusque Gasteropode prosftbranch Ceritium tuberculatum L. // C.
r. Soc. Biol. 1916. Vol. 79. P. 652—655.
Tronchin G., Mocquard J. P., Philippe M., Schrevel J. Cycle bi-
ologique de Gregarina blaberae: description, chronologie, etude de la
croissance, influence du cycle de I'hote, Blaberus craniifer // Protistolo-
gica. 1986. Vol. 22. P. 127—142.
Tronchin G., Schrdvel J. Chronologie des modifications ultrast-
ructurales au cours de la croissance de la Gregarima blaberae II J. Proto-
zool. 1977. Vol. 24. P. 67—82.
Tuzet O., Loubatieres R. Notes sur les Monocystidees II Arch,
zool. exp. et gen. (Notes et Revues). 1946. Vol. 84. P. 132—149.
Tuzet O., Loubatieres R. Phagocytose presence d'une bouche et
d'un rudiment de tube digestif chez quelques Monocystidees // C. R.
Acad. Sci. Paris. 1948. Vol. 226. P. 516—520.
Tuzet O., Ormieres R. Une curieuse evolution du noyau protome-
ritique des Gregarines U Arch. zool. exp. et gen. 1963. Vol. 102.
P. 225—230.
Tuzet O., Ormieres R. Gigaductus anchi n. sp. Gregarine parasite
d'Anchus ruficomis Goeze (Coleoptera Caraboidea) et le probleme des
Gigaductidae // Protistologica. 1966. Vol. 2. P. 546—570.
Tnzet O., Ormieres R., Theodorides J. A propos d'une Gregarine
parasite de Licinus punctatulus Fabr., Ramicephalus licini n. comb.
(= Cometoides licini Tuz. Theod. 1951): remaniement des genres Ancy-
rophora, Ramicephalus et Cometoides II Protistologica. 1968. Vol. 4.
P. 107—113.
Van Beneden E. Recherches sur revolution des Gregarines // Bull.
Acad, roy med. Belg. (Ser. 2). 1871. Vol. 31.
Vavra J. Lankesteria barretti n. sp. (Eugregarinida, Diplocystidae),
a parasite of the mosquito Aedes triseriatus (Say) and a review of the ge-
nus Lankesteria Mingazzini // J. Protozool. 1969. Vol. 16. P. 546—570.
Vavra J., McLaughlin R. E. The fine structure of some develop-
mental stages of Mattesia grandis McLaughlin (Sporozoa, Neogregari-
nida), a parasite of the boll weevil Anthonomus grandis Boheman // J.
Protozool. 1970. Vol. 17. P. 483—496.
Vavra J., Small E. B. Scanning electron microscopy of gregarines
(Protozoa, Sporozoa) and its contribution to the theory of gregarine mo-
vement // J. Protozool. 1969. Vol. 16. P. 745—757.
Vegni Talluri M., Dallai R. Freeze-fracture study of the gregarine
trofozoite. 3. Cytoplasmic differentiation in Lepismatophyla thermo-
biae // Boll. Zool. 1985. Vol. 52. P. 247—258.
Vegni Tallnri M., Dallai R. Evidence for intercellular cohesion in
the septate junction of the protozoon Gregarina // Tissue and Cell. 1991.
Vol. 23. P. 471—479.
Vinckier D. Organisation ultrastructurale corticale de quelques
Monocystidees parasites du ver Oligochete Lumbricus terrestris L. //
Protistologica. 1969. Vol. 5. P. 505—517.
Vinckier D., Devauchelle G., Prensier G. Nosema vivieri n. sp.
(Microsporidiae, Nosematidae) hyperparasite d' une Gregarine vivant
dans le coelome d'une Nemerte // C. R. Acad. Sci. Paris. 1970. Vol. 266.
P. 1737—1739. '
Vinckier D., Vivier E. Organisation ultrastructurale corticale de la
Gregarine Monocystis herculea // C. R. Acad. Sci. Paris (Ser. D). 1968.
Vol. 266. P. 1737—1739.
Vivares С. P., Van Wormhoudt A. Sur la nutrition glycidique
chez Cephaloidophora conformis (Sporozoa, Gregarinia), parasite di-
gestif du Brachyoure Pachygrapsus marmoratus U C. r. Soc. Biol. 1976.
Vol. 170. P. 71—78.
Vivier E. Etude, au microscope electronique, de la spore de Metch-
nikovella hovassei n. sp.: Appartenance des Metchnikovellidae aux
Microsporidies // C. R. Acad. Sci. Paris. 1965. Vol. 260. P. 6982—6984.
Vivier E. Observations ultrastructurales sur 1’enveloppe nucleaire
et ses «pores» chez les sporozoaires // J. Microsc. 1967. Vol. 6.
P. 371—390.
Vivier E. L'organisation ultrastructurale corticale de la Gregarine
Lecudina pellucida; ses rapports avec 1'alimentation et la locomotion //
J. Protozool. 1968. Vol. 15. P. 230—246.
Vivier E. Etude en microscope photonique et electronique des
differents stades du cycle de Metchnikovella hovassei et observations
sur la position systematique des Metchnikovellidae // Protistologica.
1973. Vol. 9. P. 95—118.
Vivier E. The Microsporidia of the Protozoa II Protistologica. 1975.
Vol. 9. P. 345—361.
Vivier E., Desportes I. Phylum Apicomplexa // Handbook of Pro-
toctista / Eds L. Margulis, J. O. Corliss, M. Melkonian, D. J. Chapman.
Boston, 1990. P. 549—573.
Vivier E., Devauchelle G., Petitprez A., Porchet-Hennere E.,
Prensier G., Schrevel J., Vinckier D. Observations de cytologie com-
ТИП SPOROZOA. КЛАСС COCCIDEA
149
рагёе chez les Sporozoaires. I. — Les structures superficielles chez les
formes vegetatives // Protistologica. 1970. Vol. 6. P. 127—150.
Vivier E., Petitprez A. Les ultrastructures superficielles et leur
evolution au niveau de la jonction chez les couples de Diplauxis hatti,
Gregarine parasite de Perinereis cultrifera // C. R. Acad. Sci. Paris
(Ser. D). 1968. Vol. 266. P. 491—493.
Vivier E., Schrevel J. Les ultrastructures cytoplasmiques de Sele-
nidium hollandei, n. sp., Gregarine parasite de Sabellaria alveolata L. //
J. Microsc. Paris. 1966. Vol. 5. P. 213—228.
Vivier E., Schrevel J. Structure et taxonomic des Gregarine // Proc.
Ill Int. Congr. Parasitol. 1995. Vol. A. P. 6—8.
Vivier E., Tuzet O., Ormieres R. Sur le cycle et les affinities des
Gregarines parastites du Polychete Perinereis cultrifera Grube // Arch,
zool. exp. et gen. (Notes et Revues). 1964. Vol. 103. P. 20—29.
Von Frantzius A. Einige nachtragliche Bemerkungen ober Grega-
rinen // Arch. Naturgesch. 1848. Bd 14. S. 188—196.
Wagenbach G. E., Grassle J. P., Mills S. W. Host specificity of
intestinal gregarines (Protozoa, Apicomplexa) in two sympatric species
of Capitella (Polychaeta) // Biol. Bull. 1983. Vol. 165. P. 538.
Walker M. H., Mackenzie C., Bainbridge S. P., Orme C. A stu-
dy of the structure and gliding movement of Gregarina gamhami И
J. Protozool. 1979. Vol. 26. P. 566—574.
Walsh R. D., Callaway C. S. The fine structure of the gregarine
Lankesteria culicis parasitic in the yellow fever mosquito Aedes aegyp-
ti // J. Protozool. 1969. Vol. 16.
Walsh R. D., Olson J. K. Observations on the susceptibility of cer-
tain culicine mosquito species to infection by Lankesteria culicis
(Ross) II Mosquito News. 1976. Vol. 36. P. 154—160.
Ward R. A., Craig G. B., Levine N. D. Ascogregarina nom. nov.
for Ascocystis Grasse, 1953 (Apicomplexa, Eugregarinorida) // J. Para-
sitol. 1982. Vol. 68. P. 331.
Warner F. D. The fine structure of Rhynchocyslis pilosa (Sporo-
zoa, Eugregarinida) // J. Protozool. 1968. Vol. 15. P. 59—73.
Wasielewski v., Th. Uber geiBeltragende Coccidienkeime // Zbl.
Bakteriol. Parasitenk., Abt. 1. 1898. Bd 25.
Watson M. E. Studies on gregaines // Ill. Biol. Monographs. 1916.
Vol. 2. P. 1—258.
Watson Kamm M. E. Studies on gregaines II // Ill. Biol. Mono-
graphs. 1922. Vol. 7. P. 1—102.
Wise M. R., Janovy J., Wise J. C. Host specificity in Metamera
sillasenorum, n. sp, a gregarine parasite of the leech Helobdella triseria-
lis with notes on transmission dynamics // J. Parasitol. 2000. Vol. 86.
P. 602—606.
Wolters. Die Conjugation und Sporenbildung bei Gregarinen II
Arch. Mikroskopische Anatomie. 1891. Bd 37.
Woodcock H. M. On Cystobia irregularis and allied «neogamous»
gregarines II Arch. zool. exp. et gen. 1904. Vol. 2. P. CXXV
(125—128).
Woodcock H. M. The life cycle of «Cystobia» irregularis (Minch.)
together with observations on other «neogamous» gregarines // Quart. J.
Microsc. Sci. 1906. Vol. 50. P. 1—100.
Zhu G., Keithly J. S., Philippe H. What is the phylogenetic positi-
on of Cryptosporidium? // Int. J. Sys. and Evolutionary Microbiol. 2000.
Vol. 50. P. 1673—1681.
Zizka Z. The fine structure of some developmental stages of neo-
gregarine Farinocystis triboIn Weiser (Sporozoa, Neogregarinida) from
the fat body of the beetle Tribolium castaneum Hbst. (abstr. N 175) // J.
Protozool. 1971. Vol. 18. P. 46—47.
Zizka Z. An electron microscope study of autoinfection in neogre-
garines (Sporozoa, Neogregarinida) // J. Protozool. 1972. Vol. 19.
P. 275—280.
Zizka Z. Fine structure of the neogregarine Farinocystis tribolii
Weiser, 1953. Developmental stages in sporogony and parasite-host re-
lations II Ztschr. Parasitenk. 1977. Vol. 54. P. 217—228.
Zizka Z. Fine structure of the neogregarine Farinocystis tribolii
Weiser, 1953. Syzygy and gametes formation // Protistologica. 1978a.
Vol. 14. P. 209—215.
Zizka Z. Fine structure of the neogregarine Farinocystis tribolii
Weiser, 1953. Developmental stages in merogony# J. Protozool. 1978b.
Vol. 25. P. 50—56.
Zizka Z. Fine structure of the neogregarine Farinocystis tribolii
Weiser, 1953. Free gametocytes//Acta Protozoologica. 1978c. Vol. 17.
P. 255—260.
Zuk M. Seasonal and individual variation in gregarine parasite le-
vels in the field crickets Gryllus veletis and Gryllus pennsylvanicus //
Ecol. Entomology. 1987a. Vol. 12. P. 341—348.
Zuk M. The effects of gregarine parasites on longevity, we-
ight-loss, fecundity and developmental time in the field crickets Gryllus
veletis and Gryllus pennsylvanicus // Ecol. Entomology. 1987b. Vol.
12. P. 349—354.
Zuk M. The effects of gregarine parasites, body size, and time of
day on spermatophore production and sexual selection in field crickets //
Behav. Ecology and Entomology. 1987c. Vol. 21. P. 65—72.
Zuk M. The role of parasites in sexual selection — current evi-
den ce and future directions II Adv. Study Behav. 1992. Vol. 21. P. 39—
68.
Класс Coccidea Leuckart, 1879 — Кокцидии
(=Coccidiomorpha Doflein, 1901; Coccidiasina Levine et al., 1980)
Жизненные циклы гомо- и гетероксенные. Гаметогенез по
типу оогамии. Эндогенное развитие у подавляющего большинства
видов внутриклеточное. Гамонты не имеют мукрона или эпимери-
та. Типичный сизигий грегарин отсутствует. Более 3600 видов.
В отличие от грегарин у кокцидий множественное деление,
приводящее к образованию гамет, происходит только при микрога-
мстогенезе. Макрогамета формируется путем роста гамонта, без про-
гпмного деления ядра. Также в отличие от грегарин процесс спорого-
нии у большинства кокцидий протекает в две фазы. На первой фазе
внутри ооцисты формируются ячейки (споробласты или спороцисты,
ко торые прежде обозначались как споры); на второй фазе внутри спо-
роцист образуются спорозоиты. Иногда спороцисты внутри ооцист не
образуются и спорогония ограничивается одной фазой.
В классе Coccidea Leuckart, 1879 выделяют два подкласса: Со-
ccidia Leuckart, 1879 (зоиты имеют коноид) и Piroplasmia Levine,
1961 (коноид отсутствует).
Классификация
Подкласс Coccidiu Leuckart, 1879
Отряд Agamococcidiida Levine, 1979
Отряд Ixorhcidn Levine, 1984
Отряд Protocoecidiida Chctssin, 1956
Отряд Adcleida Liger, 1911
Отряд Eimeriida Leger, 1911
Отряд Haemosporida Danilevsky, 1885
Жизненные циклы кокцидий
Ооциста, процесс спорогонии
Жизненные циклы кокцидий, как и других споро-
виков, завершаются после копуляции гамет противо-
положного пола образованием зиготы, которая покры-
вается оболочкой и становится ооцистой (рис. 54).
Ооциста кокцидий — наиболее постоянная, долгожи-
вущая и легко узнаваемая на светооптическом уровне
стадия развития. Ооциста обеспечивает возможность
заражения нового хозяина.
Спорогония — процесс бесполого размноже-
ния, в результате которого в ооцисте образуются спо-
роцисты и спорозоиты, способные начать новый цикл
развития паразита (рис. 55—56, вкл.). Нового хозяина
могут заразить только спорулированные ооцисты.
Споруляция ооцист может происходить как во внеш-
ней среде (многочисленные виды Eimeria, Isospora,
Toxoplasma gondii), так и в организме хозяина (виды
Eimeria рыб, Cryptosporidium, Sarcocystis, Frenkelia,
Haemogregarina, Plasmodium).
150
ALVEOLATA
Рис. 54. Схематическое изображение структуры ооцист кокцидий.
1 — Eimeria, 2 — Isospora (Cystoisospora). 3 — Caryospora, 4 — Sarcocystis; г — гранула, кр — кристаллоид, мк — микропиле, от — остаточное тело, пнт —
парануклеарное тело, соо — стенка ооцисты, сп — спорозоит, спц — стенка спороцисты, тш — тельце Штида, я — ядро.
Fig. 54. Scheme of coccidian oocysts.
I —Eimeria, 2 — Isospora (Cystoisospora), 3 — Caryospora, 4 — Sarcocystis; г — granule, кр — crystalloid, мк—micropyle, от — residual body, пнт — paranucle-
ar body, coo — oocyst wall, cn — sporozoite, спц — sporocyst wall, mm — Stieda body, я — nucleus.
У большинства кокцидий в ходе споруляции обра-
зованию спорозоитов предшествует формирование
споробластов. Позднее споробласты покрываются соб-
ственными оболочками («спорами» по прежней терми-
нологии. В современной литературе вместо термина
«спора» употребляется название «спороциста»).
Исторически структура ооцист кокцидий служила
в качестве весомого признака в систематике кокцидий
при определении отдельных родов и даже видов. По-
ложив в основу различения родов картину соотноше-
ния числа спороцист в ооцисте и числа спорозоитов в
спороцисте, еще в 1911 г. предложенную Леже (Leger,
1911), Гоар (Ноаге, 1933, 1957) составил своеобразную
«периодическую таблицу» родов кокцидий. Эта табли-
ца и сегодня успешно используется для практических
целей. За эталон ооцисты кокцидий обычно берут
строение ооцист кишечных кокцидий рода Eimeria, по-
скольку в них представлены практически все струк-
турные элементы ооцисты, хорошо различимые со све-
товым микроскопом (рис. 54, 55, 3—6).
У большинства видов Eimeria из наземных хозяев
стенка ооцисты происходит из мембран эндоплазмати-
ческой сети и слоев, образованных путем слияния двух
типов стенкообразующих тел (сот), которые за-
ТИП SPOROZOA. КЛАСС COCCIDEA
151
Рис. 57. Схематическое изображение ооцисты (7) и спороцисты (2) Goussia spp. (По: Upton et al., 1984).
В спороцисте (ец) отсутствует тельце Штида, ио хорошо заметен шов (ш) в месте соприкосновения пластин, составляющих стенку спороцисты; от — оста-
точное тело, си — спорозоит.
Fig. 57. Scheme of oocyst (7) and sporocyst (2) of Goussia spp.
In the sporocyst no Stieda body is present, but there is a suture on the site of opposition between adjacent plates; от — residual body, cn — sporozoite.
кладываются в цитоплазме макрогамет. При формиро-
вании так называемых тонкостенных ооцист у неко-
торых родов кокцидий (Goussia, виды Eimeria из вод-
ных хозяев, Cryptosporidium) сот в макрогаметах не об-
разуются. Сравнительный анализ структуры ооцист в
связи с вопросами систематики кокцидий дается в об-
зоре Бейер с сотр. (2001).
В ооцистах кокцидий рода Eimeria формируется
4 спороцисты, каждая с двумя спорозоитами
(рис. 54, 7). При этом и в ооцисте, и в спороцистах не-
редко выделяются остаточные тела. Внутри каж-
дого спорозоита отчетливо видно ядро, по одну или
по обе стороны от которого расположены рефрактиль-
ные (светопреломляющие) гранулы, или пара-
нуклеарные тела, имеющие гомогенную структуру
(рис; 57, 7). На одном из концов спороцисты находится
тельце Штида, или штидевское тельце, под
которым иногда располагается более мелкое суб-
штидевское тельце. В передней части ооцисты
нередко присутстствует полярная гранула. Стенка
ооцисты обычно состоит из двух оболочек, наружной
и внутренней. В месте сближения оболочек на полюсе
ООЦИСТЫ образуется менее плотный участок стенки,
НЙШППСМЫЙ микропиле, который нередко бывает
покрыт слегка изогнутой шапочкой. В ходе спору-
ЛИЦИН спорозоиты выходят из спороцисты после рас-
творения ТвЛЬЦИ Штида и покидают ооцисту через рас-
крывшееся отверстие микропиле.
Во время спорогонии в ооцисте совершается ме-
тагамное редукционное деление, или мейоз.
Зиготическая редукция у споровиков была
впервые описана у кокцидии Aggregata eberthi (Dobell,
Jameson, 1915). Было показано, что все стадии жизнен-
ного цикла, кроме зиготы, гаплоидны. Впоследствии это
положение было подтверждено и для других Sporozoa,
и теперь зиготическая редукция считается универ-
сальным признаком споровиков. Проведенные иссле-
дования показали наличие у споровиков односту-
пенчатого мейоза. Зиготическая редукция и одно-
ступенчатый мейоз, выявленные у Sporozoa, считаются
примитивными чертами простейших (Райков, 1978).
Простота (примитивность) одноступенчатого мей-
оза Sporozoa обусловлена тем, что после спаривания
гомологичных хромосом их расхождение происходит
без предварительной редупликации. Биваленты оказы-
ваются не 4-, а 2-хроматидные, хиазмы отсутствуют, в
связи с чем кроссинговер практически невозможен.
Весь процесс редукции хромосом завершается в одном
делении. Все последующие деления оказываются
митотическими и завершаются формированием споро-
зоитов. Исходя из цитологической сущности односту-
пенчатого мейоза, нетрудно предположить, что у кок-
цидий должна отсутствовать премейотическая репли-
кация ДНК (Райков, 1978).
Электронномикроскопическая картина процесса
споруляции у кокцидий была прослежена у Eimeria
brunetti и Toxoplasma gondii (Ferguson et al., 1978,
1979). Начальные этапы этого процесса сопровожда-
ются повышением в зиготе синтеза РНК и белка.
Во время митотического деления ядер зиготы образу-
ются центриоли, фибриллы внутриядерного веретена и
центроконусов. После двух делений ядра мембрана об-
разовавшейся 4-ядерной клетки инвагинирует и разде-
ляет цитоплазму на отдельные споробласты. Ядра спо-
робластов делятся еще раз, и в это же время идет
закладка внутреннего мембранного комплекса й дру-
гих органелл будущего спорозоита — коноида,
роптрий, микронем, субпелликулярных
152
ALVEOLATA
Рис. 58. Схематическое изображение спороцисты, лишенной тель-
ца Штида (/), и механизма расхождения пластин внутреннего слоя
стенки спороцисты (2, 3). (По: Chobotir, Scholtyseck, 1982; модифи-
цировано).
Объяснение в тексте.
Fig. 58. Scheme of a sporocyst without a Stieda body (7) and of the se-
paration of the sporocyst wall inner layer plates (2, 3).
Explanation in the text.
микротрубочек, парануклеарных тел, гра-
нул амилопектина — после чего спорозоиты
отделяются от остаточной цитоплазмы споробласта.
Последний покрывается сложно устроенной стенкой,
и с этого момента можно говорить об образовании спо-
роцисты, заключающей внутри себя спорозоитов (два
у Е. brunetti и четыре у Т. gondii).
Тельце Штида было выявлено в спороцистах боль-
шинства изученных видов Eimeria и только у немногих
видов Isospora (рис. 54, Г). Оно имеет вид небольшой
пробочки на вершине спороцисты, которая в процессе
эксцистирования спорозоитов исчезает, тем самым как
бы «откупоривая» отверстие в спороцисте и давая вы-
ход инфекционным спорозоитам, которые затем через
микропиле покидают ооцисту.
Иное строение и иной способ эксцистирования
имеют спороцисты, у которых нет тельца Штида. К ним
относятся, например, кокцидии беспозвоночных (Coe-
lotropha, Dehornia, Aggregata, Klossia), цистообразую-
щие кокцидии (Sarcocystis, Frenkelia, Besnoitia, Cystoi-
sospora), виды Eimeria рыб (рис. 54, 2; 55, 6; 56). Внут-
ренний слой стенки таких спороцист составлен из
плотно прилегающих друг к другу пластин, между ко-
торыми отчетливо заметны швы (рис. 57, 58). При воз-
действии эксцистирующей жидкости швы разрушают-
ся, что приводит к расхождению пластин (рис. 58, 5),
в результате чего спороциста лопается, подобно спе-
лому стручку гороха, и высвобождает спорозоиты.
В спорозоитах, формирующихся в ооцистах изоспоро-
идной структуры (Sarcocystis, Frenkelia, Besnoitia,
Т. gondii, Cystoisospora) и у некоторых других родов
кокцидий (но не Eimeria!) парануклеарные тела име-
ют структуру кристаллоида (рис. 59, 5, вкл.; 60, вкл.;
61, вкл.; 62, вкл.; 63, вкл.; 64, вкл.).
Хорошо известная «родоспецифичность» структу-
ры ооцисты (число спороцист в ооцисте и число споро-
зоитов в спороцисте) имеет целый ряд исключений. Так,
ооцисты' с 8 «голыми» спорозоитами, не заключенными
внутри спороцисты, характерны для трех родов кок-
цидий: Schellackia, Tyzzeria и Pfeiefferinella. Двуспоро-
цистные ооцисты, в каждой из которых имеется по
4 спорозоита (ооцисты изоспороидной структуры),
присущи не только кокцидиям рода Isospora, но и всем
родам цистообразующих кокцидий — Cystoisospora,
Toxoplasma, Hammondia, Besnoitia, Sarcocystis, Frenkelia.
Поразительные результаты были получены при на-
блюдении споруляции ооцист после воздействия на
них высокой температуры (свыше 50 °C) (Matsui et al.,
1989). Оказалось, что в ходе споруляции ооцист Isos-
pora canis и I. heydorni наряду с изоспороидной струк-
турой некоторая часть ооцист демонстрировала струк-
туру, типичную для родов Tyzzeria (8 голых спорозоитов)
и Caryospora (8 спорозоитов, заключенных внутри
единственной спороцисты). А в ходе споруляции ооцист
Eimeria intestinalis появлялись ооцисты с изоспоро-
идной структурой. Полученные результаты еще не по-
лучили адекватного объяснения. В то же время оче-
видно, что такой признак как число спорозоитов на
ооцисту (во всех приведенных примерах их было 8)
оказался более консервативным, чем число спороцист
на ооцисту.
Спорозоиты кокцидий образуются внутри ооцисты
в результате процесса споруляции (спорогонии). Обра-
зованию зиготы (ооцисты) предшествует половой про-
цесс. Зигота — единственная диплоидная стадия жиз-
ненного цикла кокцидий и всех других споровиков.
В ходе споруляции только первое (и единственное)
деление ядра зиготы является редукционным (мейоти-
ческим), возвращающим паразита уже на стадии спо-
робласта в гаплоидное состояние. Все последующие
деления в зиготе оказываются эквационными (митоти-
ческими) и приводят в конечном итоге к образованию
гаплоидных спорозоитов. Попадая в нового хозяина
практически всегда из внешней среды, паразит на ста-
дии спорозоита оказывается наименее адаптирован-
ным к существованию в этом хозяине. Известное иск-
лючение из этого правила составляют спорозоиты
аутоинфектных ооцист кокцидий рода Cryptosporidium
(Fayer et al., 1997).
Проникновение в клетку хозяина
Механизмы проникновения зоитов кокцидий в
клетку хозяина были первоначально изучены с по-
мощью электронного микроскопа (Scholtyseck, 1973b,
1979; Chobotar, Scholtyseck, 1982). При этом было
установлено по крайней мере три способа проникнове-
ТИП SPOROZOA. КЛАСС COCCIDEA
153
Рис. 65. Схема проникновения мерозоита Eimeria в эпителиальную клетку кишечника. (По: Scholtyseck, 1973а).
а — амилопектин, вмк — внутренний мембранный комплекс, — мембрана микроворсинки, мн — микронемы, нмп — наружная мембрана пелликулы,
р — роптриа, эс — эндоплазматическая сеть; стрелки — места мембранного контакта мерозоита и клетки хозяина.
Fig. 65. Scheme of penetration of a merozoite of Eimeria in the intestinal epithelial cell.
a...amylopectin, вмк — inner membrane complex, ммв — microvillus membrane, мн — micronemes, нмп — outer pellicle membrane, p — rhoptries, эс — endoplas-
mic reticulum; arrows — membranous contacts between merozoite and host cell.
НИМ liontu U клетку хозяина: путем перфорирования на-
ружной мембраны, путем инвагинирования наружной
мембраны без перфорации и в результате фагоцитиро-
вания паразита клетками макроорганизма.
Последний способ вряд ли может характеризовать
механизм проникновения, выработанный самим пара-
зитом, поскольку фагоцитироваться могут как живые,
так и неживые объекты. Зоиты кокцидий могут не только
захватываться фагоцитами (макрофагами, лейкоци-
тами, а также клетками с индуцированной фагоцитар-
ной активностью), но и беспрепятственно их покидать
или переживать внутри таких клеток в течение длитель-
ного времени (Jones, Hirsch, 1972; Michael, 1976).
Коноид не играет решающей роли в проникнове-
нии зонтов в клетку. Известно, что организмы, не име-
ющие коноида (гемоспоридии, пироплазмиды), также
154
ALVEOLATA
активно внедряются в клетки макроорганизма. На
>лектронограммах кокцидий самый начальный этап их
проникновения всегда выглядит как инвагинация плаз-
малеммы клетки хозяина, после чего может происхо-
дить или не происходить ее перфорирование (рис. 65).
У подавляющего большинства изученных кокцидий
внутриклеточное развитие проходит внутри паразито-
форной вакуоли.
Огромный технический прогресс в изучении прос-
тейших, достигнутый в последние 2—3 десятилетия,
во многом изменил представления как о механизмах
проникновения в клетку, так и о морфофункциональ-
ной организации паразитофорной вакуоли и ее мемб-
раны (Бейер и др., 2003).
Мерогония
В более ранних публикациях по кокцидиям беспо-
лую фазу их жизненного цикла называли шизого-
нией. Бесполые генерации обозначались как ш и з о -
тональные стадии, а стадии, претерпевавшие про-
цесс шизогонии, именовали шизонтами. Деление
шизонтов давало начало мерозоитам (Wenyon,
1926).
Согласно более поздней терминологии (Scholty-
seck, 1973 а; Chobotar, Scholtyseck, 1982), бесполую фа-
зу эндогенного развития кокцидий называют меро-
г о н и е й, по созвучию с названием конечного продук-
та этого процесса — мерозоитов. Это предложение
аргументируется следующим образом.
Термин шизогония составлен из корней двух грече-
ских слов (schizo — дроблю, разделяю, раскалываю, и
gonia — рождение) и в самом общем виде означает
разделение на множество, однако без указания
на потенции этого множества. Из этого следует, что
шизогония не является синонимом бесполого раз-
множения. В жизненном цикле Sporozoa встречает-
ся по крайней мере три типа разделения на множество
(три шизогонии): при формировании спорозоитов
(спорогония), мерозоитов (мерогония) и микрогамет
(микрогаметогенез). Таким образом, шизогония вхо-
дит как составной элемент в каждую из трех фаз жиз-
ненного цикла Sporozoa, а не только в фазу бесполого
размножения. Именно этим объясняется предложение
называть мерогонией фазу бесполого размножения в
период эндогенного развития кокцидий, приводящую
к формированию мерозоитов (Scholtyseck, 1979).
В свою очередь сама стадия мерозоита также имеет
целый ряд гомологичных стадий, обозначаемых раз-
личными терминами. Эти описательные термины (э н -
дозоит, цистозоит, тахизоит, брадизоит,
метроцит, гипнозоит и др.) будут нами исполь-
зованы в дальнейшем.
После внедрения в клетку хозяина спорозоит
округляется и превращается в следующую стадию раз-
вития — одноядерного трофозоита (трофонта),
половые потенции которого установить практически
невозможно. В ходе развития трофозоиты превращаются
либо в меронтов, либо в гамонтов (предполовые стадии).
Внутриклеточное развитие зоита сопровождается
серьезными преобразованиями всей его морфофунк-
циональной организации, связанными с подготовкой к
делению. Клеточное ядро и ядрышко увеличиваются в
размерах, а элементы эндоплазматической сети, мито-
хондрии и рибосомы становятся более многочислен-
ными; при этом аппарат Гольджи и Гольджи-адъюнкт
(апикопласт) удваиваются. Апикопласт — это
ДНК-содержащая органелла, возникшая у Sporozoa
в результате вторичного эндосимбиоза (Kohler et al.,
1997; Roos et al., 1999).
У многоклеточных животных в процессе митоза
разрушается ядерная оболочка и исчезает ядрышко.
При этом веретено деления обычно хорошо развито, а
центриоли, расположенные на полюсах, окружены
астральными лучами. В отличие от многоклеточных у
простейших при митотическом делении ядра его обо-
лочка часто сохраняется. Степень развития веретена,
центриолей и других структур кинетического аппарата
варьирует в разных группах простейших.
И. Б. Райков дает оригинальную и логичную клас-
сификацию типов митоза у простейших (Raikov, 1982),
в основе которой лежат три кардинальных признака:
строение веретена деления, степень сохранности ядер-
ной оболочки и пространственное положение центров
организации веретена. По первому признаку все мито-
зы простейших можно классифицировать как ортоми-
тозы (наличие единого биполярного веретена, облада-
ющего осевой симметрией) или плевромитозы (нали-
чие двух независимых полуверетен, придающих
фигуре деления билатеральную симметрию). По вто-
рому признаку митозы могут быть открытыми, полу-
открытыми или закрытыми, а по третьему — внутри-
ядерными или внеядерными.
По этой классификации митозы кокцидий относят-
ся к категории полуоткрытого плевромитоза с разной
степенью выраженности внутри- или внеядерности.
Ядерная оболочка не исчезает, исключение (ее отсут-
ствие) составляют две небольшие области, прилежа-
щие к митотическим центрам. Такие центры имеют
вид цитоплазматических центроконусов, имеющих на
концах центры организации микротрубочек (ЦОМТы),
рядом с которыми располагаются пары кинетосом,
или центриолей (рис. 66, 67).
Полюса полуверетен в начале митоза расположены
рядом, а позднее, вследствие их расхождения друг от
друга, оказываются под некоторым углом друг к дру-
гу. Полуверетена состоят из нескольких (15—20) ради-
альных микротрубочек, отходящих от центроконусов.
Одни микротрубочки являются непрерывными и про-
ходят сквозь ядро от полюса к полюсу, другие при-
креплены к кинетохорам хромосом. По мере рас-
хождения центроконусов и полуверетен происходит
расхождение и центромерных участков дочерних хро-
мосом, что, по-видимому, соответствует анафазе мито-
за. Типичная метафаза не наблюдается, экваториаль-
ная пластинка отсутствует: даже центромерные участ-
ки хромосом не лежат в одной плоскости. Эти
особенности возникают как следствие раннего форми-
рования полуверетен, а также раннего начала расхож-
дения хромосом в анафазе.
Полуоткрытый плевромитоз описан для Т. gondii,
видов Eimeria, Sarcocystis, Hepatozoon; в несколько
модифицированном виде он характерен также и для ге-
моспоридий и пироплазмид (Райков, 1978, Raikov,
1982; Бейер и сотр., 1978; Chobotar, Scholtyseck, 1982;
ТИП SPOROZOA. КЛАСС COCCIDEA
155
Рис. 66. Схема митотического деления ядра мерозоита и закладки
внутреннего мембранного комплекса дочерних клеток.
В зачатках дочерних клеток (здк) закладывается внутренний мембранный
комплекс (вмк) и последовательно появляются разные апикальные орга-
неллы; микротрубочки веретена деления сходятся на полюсах, образуя
центроконусы (цк), рядом с которыми располагаются центриоли (ц); к —
коноид, мн — микронемы, ппк — переднее полярное кольцо, я — ядро,
яо — ядерная оболочка, яп — ядерная пора.
Fig. 66. Scheme of nuclear division in the apicomplexan merozoite and
development of the inner membane complex of daughter cells.
In daughter cell anlagen (здк) structures representing the inner membrane comp-
lex and various apical organelles progressively appear; the spindle microtubules
meet on the plates making centrocones; typical centrioles are seen nearby; вмк—
inner membrane complex, к — conoid, мн — micronemes, ппк — anteriour polar
ring, if — centriole, цк — cenrocone, я — nucleus, яо — nuclear envelope, яп —
nuclear pore.
Бейер, 1989). Однако несколько иная картина митоза
наблюдается при мерогонии Aggregata eberthi (Po-
rchet-Hennere, Richard, 1971). У этого паразита между
основаниями двух пар центроконусов образуется цент-
ральное веретено (=центродесмоз), и расхождение до-
черних центроконусов происходит по мере удлинения
центродесмоза.
Виды кокцидий различаются по числу ядерных де-
лений в ходе мерогонии, которое, по-видимому, опре-
делено генетически. В пользу такого предположения
свидетельствует постоянство числа мерозоитов, фор-
мирующихся внутри меронтов определенных генера-
ций У ризных видов.
Если заражение хозяина начинается со стадии спо-
розоита, то следующей стадией развития у классиче-
ских кишечных кокцидий рода Eimeria станет меронт
1-й генерации, внутри которого образуются мерозои-
ты той же генерации. У цистообразующих кокцидий
Т. gondii потомками стадии спорозоита являются бы-
стро пролиферирующие предцистные стадии (эндо-
зоиты, или тахизоиты), которые в свою очередь
дают начало медленно пролиферирующим цистным
стадиям (цистозоитам, или брадизоитам). Важ-
но подчеркнуть, что и тахизоиты, и брадизоиты суть
стадии развития, гомологичные стадии мерозоита кок-
цидий и других споровиков.
В зависимости от генетической программы вида, а
также от условий его развития, мерогония может
включать одну или более генераций. Иногда мерозои-
ты разных генераций различаются не только по числу
внутри одного меронта, но и по размерам. В таких слу-
чаях говорят о макро- и микромеронтах и соответст-
венно макро- и микромерозоитах, как например у
Eimeria bovis или Е. tenella. По сравнению со спорозо-
итами мерозоиты уже значительно более адаптирова-
ны к существованию в хозяине.
Все многообразие способов деления кокцидий при
бесполом размножении сводится к четырем основным
типам (Chobotar, Scholtyseck, 1982). В первых двух
случаях исходной материнской клеткой являются од-
ноядерные меронты, а в двух других — многоядерные
меронты.
Эндодиогения. Этот тип мерогонии характеризу-
ется формированием двух дочерних мерозоитов внут-
ри материнской клетки, которая в этом процессе ис-
пользуется полностью (рис. 68; 69, слева). Такой спо-
соб деления был впервые описан на светооптическом
уровне у Т. gondii (Goldman et aL, 1958) и впоследст-
вии детально изучен с помощью электронного микро-
скопа у других кокцидий (Scholtyseck, 1973 а; Chobotar,
Scholtyseck, 1982). После обнаружения эндодиоге-
нии при делении мерозоитов Eimeria stiedai (из пече-
ни кролика) Шолтизек (Scholtyseck, Ratanavichien,
1976) предложил рассматривать эндодиогению как
фундаментальный тип бесполого размножения у
кокцидий. Деление по типу эндогении выявлено и у
аделеидных кокцидий — гемогрегарин родов Hepato-
zoon (Skofitsch, 1980) и Karyolysus (Сидоренко, 1986).
При эндодиогении ядро меронта претерпевает ми-
тотическое деление. Перед началом деления 4-мемб-
ранная органелла (Гольджи-адъюнкт, или апикопласт)
удваивается, и вслед за этим становятся заметны две
пары центриолей. Ядро меронта приобретает форму
подковы, на заостренных концах которой формируют-
ся центроконусы. Одновременно вокруг Гольджи-адъ-
юнктов закладываются зачатки дочерних мерозоитов в
виде внутренних мембранных комплексов их пеллику-
лы. В дальнейшем каждый Гольджи-адъюнкт стано-
вится передним полярным кольцом будущего мерозо-
ита, а в центре переднего полярного кольца формиру-
ется коноид (Радченко, 1987).
От фибриллярных структур переднего полярного
кольца отходят назад субпелликулярные микротру-
бочки. Дочерние ядра постепенно инкорпорируются в
зачатки дочерних мерозоитов (рис. 70, 1, вкл.), кото-
рые постепенно удлиняются, вырастая по направле-
нию к периферии материнской клетки (рис. 71, 2, 3,
вкл.). Затем мембрана материнской клетки инвагини-
рует между дочерними почками и, покрывая их, стано-
вится наружной мембраной дочерних мерозоитов.
Так в процессе эндодиогении происходит разбор-
ка материнской пелликулы и последующая сборка
156
ALVEOLATA
Рис. 68. Схематическое изображение процесса эндодиогении. (По: Scholtyseck, 1973а).
Одновременно с ядерным делением идет закладка зачатков дочерних клеток (здк) (сравнить с рис. 66). Дочерние мерозоиты получают наружную мембрану
пелликулы (нмп) от материнской клетки, при отделении от которой в дочерних клетках формируется заднее полярное кольцо (зпк), образованное мембрана-
ми внутреннего мембранного комплекса (в.«к) пелликулы; аг — аппарат Гольджи, га — Гольджи-адъюнкт, дк — дочерняя клетка, здк — зачаток дочерней
клетки, м — митохондрия, мн — микронемы, мт — микротрубочки, р — роптрии, я — ядро, яд — ядрышко; стрелки — направление процесса эндодиоге-
нии.
Fig. 68. Schematic representation of endodyogeny.
Simultaneously with the nucleus division, anlagen of daughter cells develop (compare with Fig. 66). The outer membrane of daughter merozoites originates from the
mother cell pellicle. In daughter cells pinching off from the mother cell, a posterior polar ring originates from the inner membrane complex; аг — Golgi complex, га —
Golgi adjunct, дк — daughter cell, здк — daughter cell anlage, зпк — posterior polar ring, м — mitochondrion, лги — micronemes, мт — microtubules,;? — rhoptries,
я — nucleus, яд — nucleolus; arrows — the direction of the process.
ТИП SPOROZOA. КЛАСС COCCIDEA
157
Рис. 69. Схема сравнения процессов эндодиогении (слева) и шизо-
гонии (справа). (По: Scholtyseck, 1973а).
При шизогонии и материнском меронте происходит множественное деле-
ние ядра, сопровождающееся образованием одноядерных цитомеров (цч),
после чего процесс деления и закладка внутреннего мембранного комплек-
са в зачатках дочерних клеток совершаются так же, как и при эндодиоге-
нии,' ли» • — мерозоиты, я — ядро.
Fig. 69. Comparison between endodyogeny (to the left) and schizogony
(to the right).
During schizogony, a multiple iiucleiir division occurs in the mother cell (meront)
followed by formation of numerous uninucleate cytomeres. From this point, the
pattern of nuclear division and Inner membrane complex development in daugh-
ter cells is similar to that during endodyogeny; ме — merozoites, цм — cytome-
ген, и - nucleus.
апикальных и других клеточных органелл дочерних
мерозоитов, включая образование их характерной
трехмембранной пелликулы.
Эндополигения. При эндополигении внутри ма-
теринской клетки формируется не два, а множество
мерозоитов. Этот тип мерогонии был впервые описан
у цистообразующих кокцидий рода Frenkelia и Sarco-
cystis (Piekarski et al., 1971; Cerna, Senaud, 1977; Hey-
dorn, Mehlhom, 1978; Gobel et al., 1978; Dubey et aL,
1980).
После инокуляции мерозоитов в эндотелиальные
клетки мелких кровеносных сосудов внутренних орга-
нов хозяина сформировавшиеся меронты лежат не
внутри паразитофорной вакуоли, а непосредственно в ци-
топлазме зараженной клетки. Растущий меронг значитель-
но увеличивается в объеме, однако внутренний мембран-
ный комплекс пелликулы при этом не резорбируется.
Сильно гипертрофированное ядро такого меронта
становится полиплоидным и приобретает неровные
очертания. На периферии клетки паразита образуется
множество булавовидных утолщений, соизмеримых с
размерами ядер будущих мерозоитов (рис. 72,1, вкл.).
На этом завершается первая фаза процесса эндопо-
лигении. Вторая фаза начинается с появления кине-
тического аппарата ядер и закладки внутреннего мемб-
ранного комплекса (рис. 72, /; 73, вкл.). Дальнейшие
процессы ядерного деления при эндополигении совер-
шаются так же как и при эндодиогении. Отличие со-
стоит в том, что плазмолемма материнской клетки ста-
новится наружной мембраной пелликулы не двух, а
множества дочерних мерозоитов (рис. 72, 2, вкл.).
Мерогония многоядерного подвижного мерозои-
топодобного меронта. Этот тип мерогонии был впер-
вые описан у Т. gondii при развитии в культуральных
клетках (Vivier, 1970) и в кишечнике кошки (Colley,
Zaman, 1970; Sheffield, 1970; Dubey, Frenkel, 1972b), a
также у Eimeria callospermophili (Roberts et al., 1970).
До начала формирования мерозоитов в материнской
клетке (меронте) совершается 2—3 деления ядра. За-
тем в каждом из образовавшихся 4—8 ядер формиру-
ется кинетический аппарат и закладываются дочерние
мерозоиты, как и при эндодиогении (рис. 74). В ре-
зультате образуется 8—20 дочерних мерозоитов. По-
добный тип мерогонии обнаружен также у Cystoisos-
pora felis (Shah, 1971), С. rivolta (Dubey, 1979) vtlsospo-
ra canis (Lepp, Todd, 1974).
Мерогония неподвижного меронта (шизогония).
В отличие от эндодиогении и эндополигении этот тип
мерогонии осуществляется путем экзогенеза (=экзоге-
нии) и наиболее характерен для классических кишеч-
ных кокцидий рода Eimeria, хотя встречается и у дру-
гих родов. Процесс мерогонии включает две фазы:
1) рост и ядерное деление в меронте и 2) формирова-
ние дочерних мерозоитов (рис. 75). В отличие от эндо-
полигении на первой фазе мерогонии в процессе роста
меронта происходит резорбция его внутреннего мемб-
ранного комплекса и других апикальных органелл.
Ядерное деление не сопровождается цитокинезом, в
результате чего меронт становится многоядерным
(рис. 76, 1, 2, вкл.).
На второй фазе меронт подразделяется на от-
дельные одноядерные цитомеры (рис. 69, справа', 75;
77, 5, вкл.), в ядрах которых появляются аппараты
деления, и далее происходят такие же структурные
преобразования, как и при эндодиогении (рис. 77,
3—5, вкл.). В гигантских шизонтах Eimeria bovis на
второй фазе мерогонии обособляется множество блас-
тофоров, т. е. ячеек с многочисленными перифериче-
158
ALVEOLATA
Рис. 73. Схематическое изображение процесса эндополигении Sarcocystis suihominis. (По: Heydorn, Mehlhorn, 1978).
Меронт имеет крупное полиплоидное разветвленное ядро с утолщениями на концах разветвлений, на которых формируются веретена деления и зачатки ме-
розоитов; в — вакуоль, вмк— внутренний мембранный комплекс, га — Гольджи-адъюнкт, к — коноид, кх— клетка хозяина,.» — митохондрия,мт — мик-
ротрубочки, мф — микрофиламенты, нмп — наружная мембрана пелликулы, ппк — переднее полярное кольцо, рб — рибосомы, и — циста, цк — центроко-
нус, яо — ядерная оболочка.
Fig. 73. Scheme of endopolygeny in Sarcocystis suihominis.
A precystic meront has an enlarged and branched polyploid nucleus with numerous thickenings in the branch ends, on which mitotic spindles and merozoite anlagen
form; e — vacuole, вмк— inner membrane complex, га — Golgi adjunct, к — conoid, кх — host cell, м — mitochondrion, мт — microtubules, мф — microfilaments,
илот — outer pellicle membrane, ппк — anterior polar ring, рб — ribosomes, if — cyst, цк — centrocone, яо — nuclear envelope.
ТИП SPOROZOA. КЛАСС COCCIDEA
159
Рис. 74. Схематическое изображение мерогонии в многоядерном подвижном мерозоитоподобном спорозоите Eimeria callospermophili.
(По: Roberts et al., 1970).
аг — аппарат Гольджи, вмк — внутренний мембранный комплекс, к — коноид, кх— клетка хозяина, м — митохондрия, .ми — микронемы, нмп — наружная
мембрана пелликулы, пнт — парануклеарное тело, ппк — переднее полярное кольцо, пфв — паразитофорная вакуоль, р — роптрии, эс — эндоплазматиче-
ская сеть, яо — ядерная оболочка, я — ядро.
Fig. 74. Scheme of merogony in multinucleate motile merozoite-like sporozoite of Eimeria callospermophili.
аг — Golgi complex, вмк— inner membrane complex, к — conoid, кх — host cell, м — mitochondrion, мн — micronemes, нмп — outer pellicle membrane, пнт — pa-
ranuclear body, ппк — anterior polar ring, пфв — parasitophorous vacuole, p — rhoptries, эс — endoplasmic reticulum, яо — nuclear envelope, я — nucleus.
ски расположенными ядрами. Дочерние мерозоиты
Е. bovis образуются путем отделения от таких бласто-
форов. В целом число мерозоитов в одном сегменти-
рованном шизонте этого вида может доходить до
120 тыс. и более (Sheffield, Hammond, 1967).
После отделения мерозоитов от меронта в послед-
нем может иногда сохраняться скопление полисаха-
ридных гранул в виде остаточного тела. Однако на
формирование дочерних мерозоитов может расходо-
ваться и вся цитоплазма материнской клетки, и тогда
остаточное тело отсутствует (рис. 78, 6, вкл.; 79, вкл.).
Гамогония и гаметогенез
После некоторого числа бесполых генераций меро-
зоиты кокцидий приступают к формированию га-
монтов, т. е, предполовых стадий половой фазы жиз-
ненного цикли.
Половые стадии подавляющего большинства Spo-
rozoa формируются из мерозоитов последней генера-
ции. Считается, что число таких генераций у разных
видов определено генетически. В жизненном цикле
протококцидий отсутствует фаза мерогонии, и гамонты
формируются непосредственно из спорозоитов. Женс-
кий гамонт (макрогамонт) превращается в макро-
гамету без прогамного деления ядра. Напротив, ядро
мужского гамонта (микрогамонта) претерпевает мно-
жественное деление, давая начало ядрам будущих
микрогамет. Число микрогамет в микрогамонтах в раз-
ных группах кокцидий варьирует от 2 до несколь-
ких сот.
Микрогаметогенез. Этот процесс у кокцидий
включает два этапа: 1) рост микрогамонта и множест-
венное деление его ядра (рис. 80, /, вкл.), 2) собствен-
но формирование микрогамет (рис. 80, 2, 3, вкл.; 82,
5—8, вкл.; 85). Первый этап микрогаметогенеза напо-
минает первую фазу мерогонии. Однако в отличие от
ядер мерозоитов ядра микрогамет не имеют ядрышка.
Ядра будущих микрогамет обычно располагаются по
периферии материнского гамонта.
Второй этап начинается с появления вблизи каж-
дого дочернего ядра двух центриолей (рис. 85, 2, 3).
Такие ядра удлиняются, а в их периферической части
160
ALVEOLATA
Рис. 75. Схематическое изображение фрагмента многоядерного неподвижного меронта (= шизонта) в процессе ядерного деления. (По:
Scholtyseck, 1973а).
В одноядерных цитомерах (цм) совершается митотическое деление ядра и идет закладка внутреннего мембранного комплекса (вмк) дочерних клеток; га —
Гольджи-адъюнкт, к — коноид, м — митохондрия, мп — микропора, мт — микротрубочки, нмп — наружная мембрана пелликулы, ппк — переднее поляр-
ное кольцо, пфв — паразитофорная вакуоль, р — роптрии, ц — центриоль, цк — центроконус, цм — цитомер, я — ядро, яд — ядрышко, яо — ядерная обо-
лочка.
Fig. 75. Scheme of a fragment of multinucleate motionless meront (schizont) of Eimeria during nuclear division.
га — Golgi adjunct, к — conoid, м — mitochondrion, мп — micropore, мт — microtubules, нмп -outer pellicle membrane, ппк — anteriour polar ring, пфв — parasi-
tophorous vacuole, p — rhoptries, ц — centriole, цк — centrocone, цм — cytomere, я — nucleus, яд — nucleolus, яо — nuclear envelope.
наблюдается концентрация хроматина (рис. 81, 2, 3,
вкл.; 82, 5, вкл.; 85, 3—5). Центриоли трансформиру-
ются в жгутики будущих микрогамет (рис. 81, 3, 4,
вкл.; 85, 4, 5). Осмиофильная часть ядра (хроматин)
увеличивается в размерах и вместе с прилежащей ми-
тохондрией включается в состав будущей микрогаме-
ты (рис. 82, 6, 7, вкл.). Нехроматиновая часть остается
в виде остаточного тела микрогамонта. Созревание
микрогаметы сопровождается удлинением митохонд-
рии, ядра и жгутиков, после чего начинается отделение
микрогаметы от остаточной цитоплазмы материнского
гамонта (рис. 82, 8, вкл.; 85, б).
Несколько иначе протекает микрогаметогенез у
саркоспоридий. Ядро микрогамонта значительно уве-
личивается в размерах, но не разделяется на множест-
во. Перед началом деления в таком полигеномном ядре
формируются многочисленные лопасти, направлен-
ные к периферии материнского гамонта (Mehlhom, He-
ydorn, 1979; Becker et al., 1979). В каждой лопасти на-
блюдается конденсация хроматина, что соответствует
моменту формирования ядра будущей гаметы. Микро-
гаметы формируются одновременно на всей поверхно-
сти микрогамонта. Процессы кариокинеза и цитокине-
за совершаются одновременно.
Как правило, микрогаметы разных видов эймери-
идных кокцидий {Eimeria, Isospora, Т. gondii, Sarcocys-
tis) имеют между собой большое ультраструктурное
сходство; а их размеры варьируют от 4 до 7 мкм
(Scholtyseck, 1973b; Chobotar, Scholtyseck, 1982). Тело
микрогаметы покрыто одной мембраной; полярность
мужской гаметы обусловлена положением переднего
конца (перфоратория), несущего базальные тела
двух или трех свободных жгутиков. Митохондрия
плотно прилегает к ядру микрогаметы (рис. 82, 7, вкл.;
85, 4—6; 86, 3, 4). Микротрубочки, составляющие ци-
тоскелет жгутиков, имеют типичную для подобных об-
разований картину расположения: 9 по периферии и
2 внутри (рис. 81,4, вкл.).
У некоторых кокцидий наблюдаются значительные
отклонения от типичной картины строения микрога-
мет. Так, мужские гаметы Aggregata eberthi достигают
25—30 мкм в длину и покрыты трехмембранной пел-
ликулой, в которой имеются типичные микропоры и
под которой проходят субпелликулярные микротру-
Рис. 63. Ультраструктурная организация зоитов кокцидий (продолжение).
13—16 — зоиты Eimeria iuh ths (<|m>i >> \ К. Понизовского): 13 -15 - - передний полюс мерозоита на продольных (13, 14) и поперечном (15) срезах, 16 — про-
дольный срез дочернего мсро khii.i и формирование заднего полярного кольца; ап — апикальный полюс, вмк — внутренний мембранный комплекс, дме —
дочерний мерозоит, к коноид, нчн наружная мембрана пелликулы, не - пелликула, ппк — переднее полярное кольцо, р — роптрии, смт — субпеллику-
лярпые микротрубочки, я — ядро.
63. Ultrastructural organization of coccidian zoites (continuation).
13—J6 — zoites of Eimeria шнеп\ Пн- apical pole on longitudinal (13. 14) and cross (15) sections, longitudinal section of a daughter merozoite pinching off from mot-
her meront and a posterior polar t i up ... (16); an — apical pole, вмк— inner membrane complex. Оме — daughter merozoites, к — conoid, нмп — inner pellicle
membrane. //. pellicle. ппк — anterior polar ring, p — rhoptries. смт — sirbpclliclc microtubules, я — nucleus.
Рис. 64. Ультраструктурная организация зоитов кокцидий (продолжение).
Мерозоит Eimeria nocens в цитоплазме энтероцита тонкой кишки гуся (фото А. К. Понизовского); к — коноид, м — митохондрии, мв — микроворсинки,
мпфв — мембрана паразитофорной вакуоли, мф — миофибриллы, пе — пелликула, пфв — паразитофорная вакуоль, тс — терминальная сеть, щк — щеточная
каемка.
Fig. 64. Ultrastructural organization of coccidian zoites (continuation).
Merozoite of Eimeria nocens in the cytoplasm of goose enterocyte; к — conoid, м — mitochondrion, мв — microvilli, мпфв — membrane of parasitophorous vacuole,
мф — microfibrilles, ne — pellicle, пфв — parasitophorous vacuole, me — terminal web, щк — brush border.
Рис. 67. Митотический аппарат Eimeria nocens.
донсния и микротрубочки (-пт), к которым прикреплены кинетохоры (к/п) хромосом; 3 — то же при большем увеличении (фото А. К. Пони-
зовского); цк— центроконус, цл — центриоль, я - ядро, яо •— ядсрпая оболочка.
Fig. 67. Mitotic apparatus of Eimeria nocens.
I, I «яИаМ ipimll* hud microtubules with the fixed chromosome kinetochores; 3 — the same at higher magnification; цк — centrocone, цл — centriole,я — nucleus,
яо — nuclear envelope.
Рис. 70. Эндодиогения.
1 — промежуточная клетка Sarcocystis ovifelis (фото Я. С. Грикенене); а — амилопектин, в — вакуоль, вмк — внутренний мембранный комплекс, ?.v— глыбки
хроматина, к — коноид, м — митохондрии, мн — микронемы, нмп — наружная мембрана пелликулы, р — роптрии, рб — рибосомы, я — ядро; стрелки — мес-
та формирования микронем в материнской клетке.
Fig. 70. Endodyogeny.
1 — intermediate cell of Sarcocystis ovifelis; a — amylopectin, в — vacuole, вмк — inner membrane complex, гх — chromatin lumps, к — conoid, м — mitochondrion.
мн — micronemes, нмп — outer pellicle membrane, p — rhoptries, рб — ribosomes, я — nucleus; arrows — microneme accumulations.
Рис. 71. Эндодногсния (продолжение}.
J HIAIIIUIII Лно/l/ilHlhl ftiHii/n ii Mici кс перитонеального экссудата мыши (фото D. G. Р. Ferguson), 3 — промежуточная клетка Sarcocystis tnuris (фото
I1 VlvlMli It РиН‘||И1 I Ipihipiи». hhv t репний мембранный комплекс. Ок - дочерняя клетка, Оме — дочерний мерозоит, м — митохондрия, ме — мерозо-
III , WAV Mill fpillffhHH h щч hil, но мнкроиемы, мпфа— мембрана иарачитофорной вакуоли, нрк промежуточная клетка, пфв — паразитофорная вакуоль,
/< рч|црии. эс - эндоплазматическая сечь, я — ядро, якх — ядро клетки хозяина.
Fig. 71. Endodyogcny (continuation}.
J lliiritcclluliil* Uivliyzollo of 7r'»<'/</<г.мнЛ/ in (he mouse peritoneal exudate, 3 — intermediate cell of Sarcocystis imiris; вмк — inner membrane complex, дк —
iliHIUlllci cell, Оме duiiglilur Hirn /011 • ч nniochundrion. ме — merozoites. мкл — mother cell,мн — micronemes,мпфв — membrane ofparasitophorous vacuo-
le. прк intcnncdiiile i г 11. нфь p.u .riiophorous vacuole, p rhoptries. эс — endoplasmic reticulum, я — nucleus, якх — host cell nucleus.
Рис. 72. Эндополигения.
1 — молодой предцистный меронт Sarcocystis suihominis, на концах лопастей единого полиплоидного ядра заметна закладка внутреннего мембранного комп-
лекса дочерних мерозоитов (стрелки); 2 — предцистный сегментированный меронт S. capracanis с полностью сформированными мерозоитами (фото
Н. Mehlhom); вмк — внутренний мембранный комплекс, га — Гольджи-адъюнкт, м — митохондрия, мн — микронемы, я — ядро.
Fig. 72. Endopolygeny.
1 — young precystic meront of Sarcocystis suihominis, the inner membrane complexes of daughter merozoites appear on the extremes of lobes of a single polyploid
nucleus (arrows); 2 — precystic segmented meront of S. capracanis with totally formed merozoites; вмк — inner membrane complex, га — Golgi adjunct, м — mitoc-
hondrion, мн — micronemes, я — nucleus.
Рис. 76. Шизогония.
Eimeria nocens: 1 —закладка внутреннего мембранного комплекса дочернего мерозоита вблизи пелликулы материнской клетки (стрелки); 2— начало ядер-
пого деления в многоядерном меронте, заметно образование центроконусов (фото А. К, Понизовского); аг — аппарат Гольджи, вмк — внутренний мембран-
ный комплекс, дме— дочерний мерозоит, л/ — митохондрия, мкл -- материнская клетка, не — пелликула, пфв — паразитофорная вакуоль, р— роптрии, рб—
рибосомы, цк — цснтроконус, я — ядро.
Fig. 76. Schizogony.
Eimeria nocens: 1 — emergence of inner membrane complex in the daughter merozoite anlagc near the mother cell pellicle (arrows); 2 — onset of nuclear division in
tilllllliHicleale meront; centrocone formation is seen; аг — Golgi complex, вмк — inner membrane complex, дме — daughter merozoite, м — mitochondrion, мкл —
mother cell, ne — pellicle, пфв — paras itophorous vacuole, p — rhoptries, рб — ribosomes, цк — centrocone, я — nucleus.
Рис. 77. Шизогония {продолжение). (По: Сидоренко, 1986).
Karyolysus sp.-. 3 — начальный этап шизогонии с образованием множества одноядерных цитомеров; 4 — шизонт со сформированными мерозоитами, заметно
расхождение дочерних клеток так же, как и при эндодиогении (стрелка); 5 — цитомеры при большем увеличении; а — амилопектин, дме — дочерний меро-
зоит, зпк — заднее полярное кольцо, кх — клетка хозяина, цит — цитомеры, я — ядро.
Fig. 77. Schizogony (continuation).
Karyolysus sp.: 3 — early step of schizogony with the formation of numerous uninucleate cytomeres; 4 — segmented schzont with merozoites; daughter cells separate
in a manner similar to endodyogeny (arrow); 5 — the cytomeres at higher magnification; a — amylopectin, дме — daughter merozoite, зпк — posterior polar ring, кх —
host cell, цит — cytomeres, я — nucleus.
Рис. 78. Шизогония (продолжение).
Karyolysus sp : 6 - сегментированный меронт (шизонт) с полностью сформированными мерозоитами в клетке семенника ^eP”«bI №ot°Tq- В' БеЙер); Кр -
Karyolysus sp. кристалпоид>Ркх _ метка\озяина> мн - микронемы, смт - субпелликулярные микротрубочки, яд - ядрышко. X 72 000.
Fig. 78. Schizogony (continuation).
Karyolysus sp.: 6 - intracehilar segmented meront (schizont) with completely formed merozoites in the lizard testis; кр - crystalloid, кх - host cell, мн - microne-
y y p mes, смт — subpelhcular microtubules, яд — nucleolus.
Рис. 79. Экстрацитоплазматическая локализация меронтов Cryptosporidium parvum. (По: Бейер, Сидоренко, 1990).
1 — сегментированный меронт (шизонт), 2 — апикальные органеллы мерозоитов; вмк — внутренний мембранный комплекс, гк — гликокаликс, мв — микро-
ворсинка, мпфв — мембрана паразитофорной вакуоли, пе — пелликула, нмп — наружная мембрана пелликулы, по — питающая органелла, пфв — паразито-
форная вакуоль, р — роптрии, рб — рибосомы, смт — субпелликулярные микротрубочки, я — ядро.
Fig. 79. Extracytoplasmic localization of Cryptosporidium parvum meronts.
1 — segmented meront (schizont), 2 — apical organelles in merozoites; вмк — inner membrane complex, гк — glycocalyx, мв — microvilli, мпфв — membrane of pa-
rasitophorous vacuole, ne — pellicle, нмп — outer pellicle membrane, no — feeder organelle, пфв — parasitophorous vacuole, p — rhoptries, рб — ribosomes, смт —
subpellicular microtubules, я — nucleus.
Рис. 80. Микрогаметогенез.
Eimeria nocens: I — многоядерный микрогамонт (фото А. С. Понизовского); я ядро.
Fig. 80. Microgametogenesis.
Eimeria nocens: 1 — multinucleate microgamont; я — nucleus.
Рис. 81. Микрогаметогенез {продолжение).
Eimeria nocens: 2 — разделение хроматиновой и ахроматиновой частей дочерних ядер микрогамет, 3 — то же при большем увеличении, 4 — жгутик микрога-
меты на поперечном срезе (фото А. К. Понизовского); ах — ахроматиновая часть ядра, жг — жгутик, кх — клетка хозяина, м — митохондрия, мкл — материн-
ская клетка, хр — хроматин.
Fig. 81. Microgametogenesis {continuation).
Eimeria nocens: 2 — separation of chromatinous and achromatinous parts of the daughter nuclei, 3 — the same at higher magnification, 4 — cross section of microga-
mete flagellum; ax — achromatinous mass, жг — flagellum, кх — host cell, м — mitochondrion, мкл — mother cell, xp — chromatinous mass.
Рис. 82. Микрогаметогенсз (продолжение).
Eimeria nocens: 5 — разделение ядра формирующейся микрогамсты па хроматиновую и ахроматиновую части, 6 — включение тубулярной митохондрии в
формирующуюся микрогамсту. 7 — полное отделение ахроматииовой части и выход микрогамегы в пространство паразитофорной вакуоли, 8 — полностью
сформированная микрогамета (фото А. К. Попп ювеко! о): а\- - ахроматиновая часть ядра, от — базальное тело, л/ — митохондрия, мкл — материнская клет-
ка, мп — микропора, т- — пелликула, пфв — паразитофориая вакуоль, хр — хроматин, я — ядро.
Fig. 82. Microgametogenesis (conlimialion).
Eimeria nocens; 5 — separation of chromatinous and achromatinous parts of daughter nuclei. 6 — insertion of a mitochondrion into the forming microgamete, 7 —
complete separation of the achromatinous pari of the nucleus and microgamete exit into parasitophorous vacuole. 8 — a completely formed microgamete; ax — achro-
matinous mass, 6m — basal body, л/ — mitochondrion, пк i — mother cell, мп — micropore, ne - pellicle, пфв — parasitophorous vacuole, xp — chromatinous mass,
я — nucleus.
Рис. 83. Микрогаметогенез (продолжение).
Cryptosporidium parvum: 9 — образование микрогамет путем отпочковывания от остаточного тела микрогамонта (встречные стрелки) (фото Н. В. Сидорен-
ко); гк — гликокаликс, мв — микроворсинки, мг — микрогамета, мпфв — мембрана паразитофорной вакуоли, от — остаточное тело, по — питающая орга-
нелла.
Fig. 83. Microgametogenesis (continuation).
Cryptosporidium parvum: 9 — microgamete pinching off from a large residual body of macrogamont (two opposite arrows); гк — glycocalyx, мв — microvilli, мг —
microgamete, мпфв — membrane of parasitophorous vacuole, от — residual body, no — feeder organelle.
1
Рис. 84. Микрогаметогенез (продолжение).
10 — дочерние безжгутиковые микрогаметы; кх — клетка хозяина, мв — микроворсинки, мг — микрогамета, от — остаточное тело.
Fig. 84. Microgametogenesis (continuation).
10 — non-flagellated daughter microgamete; кх — host cell, мв — microvilli, мг — microgamete, от — residual body.
Рис. 88. Гаметы Alveocystis в просвете кишки приапулиды Priapulus caudatus.
1 — крупная микрогамета рядом с фрагментом макрогаметы, покрытой сетчатой стенкой; 2 — микрогамета (видны два ее жгутика) вблизи микропиле макро-
гаметы (стрелка) непосредственно перед оплодотворением (фото N. McLean). X 22 000; а — амилопектин, жг — жгутик, ма — макрогамета, мг — микрога-
мета. я — ядро.
Fig. 88. Gametes of Alveocystis in the intestinal lumen of Priapulus caudatus.
1 — a large microgamete near macrogamete displaying a reticulate net; 2 — microgamete (its two flagella are visible) near the macrogamete micropyle (arrow) shortly
before fertilization; a —• amylopectin, жг — flagellum, ма — macrogamete, мг — microgamete, я — nucleus.
ТИП SPOROZOA. КЛАСС COCCIDEA
161
Рис. 85. Схематичекое изображение процесса микрогаметогенеза у кокцидий рода Eimeria. (По: Scholtyseck et al., 1972).
И МЙИринском микрогамонте происходит множественное деление ядра (шизогония): 1 — дочерние ядра располагаются по периферии гамонта рядом с ми-
111ШН1ДрИЯМи; 2 — между пелликулой гамонта и дочерним ядром находятся центриоли; 3 — ядро, центриоли и митохондрии выдаются в пространство пара-
lllllll|iopiioli вакуоли; 4—б — центриоли дают начало базальным телам, от которых отходят жгутики, и одновременно происходит разделение хроматина на
МН1НаНС11рованиую (хроматиновую) и рыхлую (ахроматиновую) массы (3—5), последняя остается в виде остаточного тела в материнском гамонте. Свобод-
НвИ МИИрогамета располагается в паразитофорной вакуоли (б); ах — ахроматиновая часть, бт — базальное тело, жг — жгутик, кх — клетка хозяина, м — ми-
1Ш11|1ДрИЯ, мгц — микрогаметоцит, мп — микропора, оя — остаточное ядро, пе — пелликула, пфв — паразитофорная вакуоль, хр — хроматин, ц — центриоль,
я — ядро, яо — ядерная оболочка.
Fig. 85. Scheme of microgametogenesis of Eimeria spp.
Ill IIHIlhsr lllicrogamonts, multiple nuclear division occurs (schizogony): 1 — daughter nuclei arranged peripherally near mitochondria; 2 — centrioles located between
lilH IHirleilK and limiting membrane of the microgamont; 3 — the nucleus, centrioles and mitochondria protruding outward into the space of parasitophorous vacuole
(('I'll 4 6 the centrioles give rise to basal bodies, from which flagella originate; simultaneously the nuclear chromatin is separated into condensed (chromatinous)
flllfl hltiny (lichromatinous) masses (3—5), the latter remaining in the form of a residual body in the mother gamont; 6 — the mature microgamete lies in PV; ax — achro-
IIIHlllllHIH IIIIISS, 6m — basal body, жг — flagellum, кх — host cell, м — mitochondrion, л<ги — microgametocyte (microgamont), мп — micropore, оя — nuclear envelo-
pe, ne — pellicle, пфв — parasitophorous vacuole, xp — chromatinous mass, ц — centriole, я ~ nucleus, яо — nuclear envelope.
|| 111 №4163
162
ALVEOLATA
Рис. 86. Схематическое изображение процесса микрогаметогенеза у кокцидий рода Sarcocystis. (По: Mehlhom, Heydorn, 1979).
/ — одноядерный микрогамонт; 2 — приобретение ядром микрогамонта неправильных очертаний с образованием лопастей, имеющих неодинаковую плот-
ность хроматина в разных участках; 3 — образование микрогамет по мере включения в ядро гаметы латеральных конденсированных фрагментов единого
лопастного ядра; 4 — зрелая микрогамета на продольном и поперечном срезах; а — амилопектин, аг — аппарат Гольджи, акс— аксонема, ах — ахроматино-
вая часть ядра, жг — жгутик, к — коноид, м — митохондрия, мгц — микрогаметоцит, мн — микронемы, мп — микропора, ппк — переднее полярное кольцо,
пф — перфораторий, р — роптрии, хр — хроматин, эс — эндоплазматическая сеть, я — ядро.
Fig. 86. Scheme of microgametogenesis of Sarcocystis spp.
1 — uninucleate microgamont; 2—the nucleus acquires irregular shape with numerous chromatin lobes showing different density in different sites; J — microgametes
form as lateral condensed fragments of the single lobulate nucleus are incorporated into their nuclei; 4 — the mature microgamete in longitudinal and cross sections;
a — amylopectin, аг — Golgi complex, акс — axoneme, ax — achromatinous mass, жг — flagellum, к — conoid, м — mitochondrion, мгц — microgametocyte (micro-
gamont), мн — micronemes, мп — micropore, ппк — anterior polar ring, пф — perforatorim, p — rhoptries, xp — chromatinous mass, эс — endoplasmic reticulum,
я — nucleus.
бочки. Это сближает организацию микрогаметы с та-
ковой зоита, т. е. бесполой стадии развития. Однако,
подобно мужским гаметам других кокцидий, микрога-
меты A. eberthi обладают тремя свободными жгутика-
ми, хотя перфораторий на переднем конце таких гамет
отсутствует (Heller, 1970).
Округлые микрогаметы протококцидий Grellia di-
nophili и Coelotropha durhoni практически лишены по-
лярности (Bardele, 1966; Porchet-Hennere, 1970). Каж-
дая гамета имеет по два свободных жгутика длиной до
15—20 мкм. Как и у Л. eberthi, в пелликуле микрогамет
протококцидий выявлены микропоры и проходящие
под пелликулой микротрубочки. Подобно микрогаме-
там эймериидных кокцидий, мужские гаметы прото-
кокцидий имеют митохондрии.
Необычную для эймериидных кокцидий структуру
микрогамет демонстрируют виды рода Cryptosporidi-
um (рис. 87, 7). В отличие от изящных удлиненных
микрогамет Eimeria или Sarcocystis, в теле которых
нет иных цитоплазматических органелл, кроме мито-
ТИП SPOROZOA. КЛАСС COCCIDEA
163
Рис. 87. Схема строения микрогамет споровиков.
1 — Cryptosporidium (no: Brandler, 1982), 2—Plasmodium (по: Mehlhom, Piekarski, 1985); акс — аксонема, вмп— внутренняя мембрана пелликулы, за — зона
адгезии, м — митохондрия, мт — микротрубочки, нмп — наружная мембрана пелликулы, пк — полярное кольцо, у — «улей», я — ядро.
Fig. 87. Scheme of sporozoan microgametes.
I — Cryptosporidium, 2 — Plasmodium; акс — axoneme, вмп — inner pellicle membrane, за — adhesion zone, м — mitochondrion, мт — microtubules, нмп — outer
pellicle membrane, пк — polar ring, у — «hive», я — nucleus.
хондрий, мужские гаметы Cryptosporidium включа-
ют небольшой участок цитоплазмы. Такая микрога-
мета покрывается пелликулой материнского гамонта
(рис. 83, 9, вкл.). В цитоплазме микрогаметы имеется
полярное кольцо, от которого отходят микротрубочки
(Goebel, Braendler, 1982). Микрогаметы Cryptosporidi-
um по своему строению также напоминают бесполые
стадии развития кокцидий. Это сходство еще более
усиливается из-за отсутствия в микрогаметах криптос-
поридий свободных жгутиков (рис. 84, 10, вкл.; 87,1)
или хотя бы их аналогов в виде аксонемы, как у Plas-
modium (рис. 87, 2).
Еще одним примером необычного строения муж-
ских гамет у кокцидий могут служить микрогаметы
рода AIveocystis (Бельтенев, 1983; McLean, 1984). Но в
отличие от Cryptosporidium микрогаметы Alveocystis
имеют жгутики (рис. 88, вкл.).
Итак, в микрогаметах подавляющего большинства
споровиков имеются либо свободные жгутики, либо
аксонемы, представляющие собой вариации жгутико-
вого аппарата. Сам факт наличия жгутиков у Sporozoa
имеет принципиальное значение для установления
родства этого таксона с другими простейшими. Нали-
чие жгутиков в микрогаметах может рассматриваться
как анцестральный признак, однозначно свидетельст-
вующий о наличии филогенетических связей между
споровиками и жгутиконосцами.
Макрогаметогенез. Женские гаметы (макрогаме-
ты) также имеют значительное структурное и функ-
циональное сходство в разных группах Coccidia. Это
крупные округло-овальные клетки (рис. 89, 90, вкл.,
91, вкл.). Центрально расположенное пузырьковидное
ядро имеет ядрышко и покрыто двуслойной оболочкой
с хорошо выраженным перинуклеарным пространст-
вом. Иногда в молодых макрогамонтах еще сохраня-
ются остатки органелл апикального комплекса — роп-
трии, микронемы, субпелликулярные микротрубочки.
По мере роста макрогамонта и далее в макрогамете эти
органеллы постепенно резорбируются. В растущих
макрогамонтах и гаметах значительно увеличивается
число элементов эндоплазматической сети, аппарата
Гольджи, митохондрий, рибосом, запасных веществ
(рис. 91,3, вкл.). У большинства видов кокцидий мак-
рогамонты и гаметы покрыты одной мембраной. Иск-
лючение составляют случаи сохранения трехмембран-
ной пелликулы в макрогаметах Cystoisospora felis и
Т. gondii (Ferguson et al., 1975).
Ооцисты кокцидий, выделяющиеся во внешнюю
среду, обычно покрыты плотными оболочками. Фор-
мированию таких оболочек предшествует образование
в макрогаметах двух типов стенкообразующих тел (сот),
участвующих в образовании соответственно наруж-
ного и внутреннего слоев оболочки ооцисты (рис. 89,
90, вкл., 91, вкл.). В образовании сот принимают участие
элементы эндоплазматической сети и аппарата Гольд-
жи. У некоторых видов Sarcocystis сот либо не образу-
ются совсем, либо формируют только наружную обо-
лочку ооцисты, которая оказывается очень хрупкой.
164
ALVEOLATA
Рис. 89. Схематическое изображение макрогаметы кокцидий рода Eimeria. (По: Scholtyseck, 1973b).
Объяснение в тексте.
а — амилопектин, ввт — внутривакуолярные трубочки, кх — клетка хозяина, м — митохондрия, мп — микропора, пфв —- паразитофорная вакуоль, сот-1 и
сот-И—стенкообразующие тела первого и второго типа, эс— эндоплазматическая сеть, я — ядро, яд — ядрышко, яо — ядерная оболочка, якх— ядро клетки
хозяина.
Fig. 89. Scheme of the macrogamete of Eimeria spp.
a — amylopectin, ввт — intravacuolar tubules, кх — host cell, м — mitochondrion, мп — micropore, пфв — parasitophorous vacuole, com-I, com-11 — wall-forming
bodies of types I and II, эс — endoplasmic reticulum, я — nucleus, яд — nucleolus, яо — nuclear envelope, якх — host cell nucleus.
Ядро и ядрышко, а также цитоплазматическая мас-
са развивающегося макрогамонта значительно уве-
личиваются в размерах; макрогамонт покрывается
дополнительными мембранами, а сот располагают-
ся по его периферии. В растущем паразите идет не-
прерывное накопление запасных веществ (рис. 91,
3, вкл.).
Оплодотворение и формирование
ооцисты
Процесс оплодотворения у кокцидий протекает
очень быстро, что во многом затрудняет его наблюде-
ние. Оплодотворение макрогаметы происходит, по-ви-
димому, еще до формирования оболочек ооцисты. На-
ТИП SPOROZOA. КЛАСС COCCIDEA
165
Рис. 92. Схема образования стенки ооцист кокцидий родов Eimeria (7) и Sarcocystis (2).
кх — клетка хозяина, вс — внутренний слой оболочки ооцисты, кр — кристаллоид, м — митохондрия, мп — микропора, нс — наружный слой оболочки ооци-
сты, пфв — паразитофорная вакуоль, соо — стенка ооцисты, сот-1 и сот-11—стенкообразующие тела I и II типа, спр — споронт,я — ядро, якх — ядро клетки
хозяина.
Fig. 92. Scheme of oocyst wall formation in Eimeria (7) and Sarcocystis (2).
KX — host cell, ec — inner layer of oocyst wall, кр — crystalloid, м — mitochondrion, мп — micropore, нс — outer layer of oocyst wall, пфв — parasitophorous vacuole,
coo — oocyst wall, com-I, com-H — wall-fonning bodies of types I and 11, cnp — sporont, я — nucleus, якх — host cell nucleus.
блюдение процесса оплодотворения у Eimeria bovis
(Scholtyseck, Hammond, 1970) позволило зафикси-
ровать на электронограммах момент проникновения
МИКрогаметы в цитоплазму макрогаметы. Было по-
KiVIllllo, что в макрогамету проникает не только ядро,
по и вся микрогамета целиком, вместе со жгутиками
(рис. 90, 2).
Несколько иначе происходит процесс оплодотворе-
ния у саркоспоридий. У Sarcocystis cruzi (=S. bovicanis)
тело микрогаметы прикрепляется вблизи зрелой мак-
рогаметы. Соединению гамет противоположного пола
епособствует слияние их наружных мембран. В ре-
зультате формируется временный канал, через кото-
рый нуклеоплазма микрогаметы проходит в цитоплаз-
му макрогаметы (Sheffield, Fayer, 1980).
Зрелая макрогамета и молодая зигота неотличимы
друг от друга морфологически, но не функционально.
В молодой зиготе сразу начинается процесс формиро-
вания стенки ооцисты (рис. 91,3; 92). При изучении
Т. gondii было показано (Ferguson et al., 1979), что сот
1-го типа распадаются на более мелкие фрагменты, а
вокруг пелликулы зиготы начинается формирование
нескольких (до 5) дополнительных мембран. Фрагмен-
ты сот заходят в пространство между мембранами и,
166
ALVEOLATA
сливаясь, участвуют в построении наружной оболочки
ооцисты.
Цитоплазматическая масса зрелой ооцисты называ-
ется сиоронтом (рис. 92). В состав споронта входят
ядро с ядрышком, запасные вещества (полисахариды,
липиды), митохондрии, рибосомы, мембраны эндоп-
лазматической сети. Вначале споронт имеет вид бес-
форменной массы, но в процессе споруляции его объ-
ем уменьшается (рис. 55, 1, 2). В это время в ооцисте
совершается сложнейший процесс органеллогенеза
(рис. 92). Сначала образуются спороцисты, затем
спорозоиты (рис. 55, 3, 4). В диплоидном ядре ооци-
сты совершается редукционное деление (мейоз), за
которым следует серия митотических делений уже
гаплоидного ядра; число таких делений определено
генетически. Спорозоиты, образующиеся в ооци-
сте, гаплоидны.
Типы жизненных циклов
Цикл развития, или жизненный цикл кокцидий
можно рассматривать как сложный онтогенез
каждого вида (Каллиникова, 1991). Несмотря на внеш-
нее разнообразие жизненных циклов, они могут быть
сведены к нескольким типам, в основе которых лежит
общий кардинальный признак — половой процесс
по типу оогамии. В литературе эта фаза цикла обозна-
чается как гаметогенез, или гаметогония. Половой
процесс, копуляция гамет противоположного пола и
образование зиготы суть наиболее ответственные
моменты жизненного цикла кокцидий и всех других
Sporozoa.
Половому процессу предшествует бесполое раз-
множение (мерогония) с образованием мерозоитов,
или бесполых расселительных стадий. Во время меро-
гонии происходит умножение заразного начала, а так-
же постепенная адаптация паразита к существованию
в хозяине.
Во время споруляции (спорогонии) в зиготе (ооци-
сте) образуются спорозоиты. Сначала в диплоидном
ядре зиготы происходит редукционное деление (мей-
оз), за которым следует два или более митотических
деления. Диалектика процесса спорогонии состоит в
том, что спорозоиты формируются в результате беспо-
лого размножения внутри зиготы, тогда как сама зиго-
та представляет собой продукт полового процесса. В
жизненном цикле споровиков только зигота диплоид-
на, тогда как все остальные стадии гаплоидны. Меро-
зоиты и спорозоиты (зоиты) имеют разное происхож-
дение и демонстрируют два кардинальных типа беспо-
лых расселительных стадий.
Споровики представляют собой хорошо очерчен-
ную группу протистов, отличную от других простей-
ших. Эта очерченность выражается прежде всего в на-
личии у них последовательной триады фаз жизненного
цикла (рис. 93, 94). У гомоксенных (однохозяинных)
видов триада представляет собой единый непрерыв-
ный процесс и завершается в организме одного хозяи-
на. Напротив, при гетероксенном (двуххозяинном)
развитии полный жизненный цикл осуществляется в
разных хозяевах, однако последовательность фаз цик-
ла при этом не нарушается.
Несколько особняком в этом отношении стоят про-
тококцидии, структура жизненных циклов которых, на
первый взгляд, выпадает из общего правила из-за ка-
жущегося отсутствия у них бесполого размножения.
На самом деле у протококцидий также имеется фаза
бесполого размножения, которая, однако, совершается
не до, а после полового процесса, т. е. во время споро-
гонии внутри ооцисты. Таким образом, несмотря на
сокращенную триаду Sporozoa, в жизненном цикле
протококцидий, как и у других споровиков, имеет мес-
то чередование бесполого размножения и полового
процесса(Бейер, 1989).
Гомоксенный жизненный цикл
кишечных кокцидий рода Eimeria
Полное развитие кокцидий рода Eimeria и некото-
рых других родов совершается в организме одного хо-
зяина (рис. 93). Хозяин (как правило, не хищник) зара-
жается при поедании спорулированных ооцист с пи-
щей и водой, загрязненными фекалиями зараженного
животного (рис. 93, 19). В желудке хозяина ооцисты
эксцистируются, и высвободившиеся спорозоиты (/)
внедряются в клетки кишечника. Растущий внутрикле-
точный трофозоит (2) претерпевает множественное де-
ление ядра и превращается в меронта (шизонта) 1-й ге-
нерации (5), который после созревания (4) распадается
на множество мерозоитов 1-й генерации (5). Послед-
ние, расселяясь по кишечнику, внедряются в новые
клетки и дают начало последующим генерациям меро-
нтов (6—8) и мерозоитов (9, 13). После нескольких
(2—5) бесполых генераций паразит приступает к гаме-
тогенезу (10—14).
Макрогамонт (13) растет и превращается в макро-
гамету (14) без прогамного деления ядра. Микрога-
монт (10—12) дает начало множеству жгутиковых
микрогамет (15), и после оплодотворения макрогаме-
ты образуется зигота (16). Зигота покрывается оболоч-
кой и превращается в ооцисту (17), которая выводится
из организма хозяина с фекалиями в неспорулирован-
ном состоянии (18). Процесс споруляции и образова-
ние спорозоитов (19) происходит во внешней среде в
условиях достаточной аэрации и влажности. С этого
момента ооциста становится инвазионной.
Стадии жизненного цикла, которые развивают-
ся в организме хозяина, называются эндогенными.
После выведения с фекалиями хозяина во внешнюю
среду ооциста становится экзогенной стадией. Пе-
риод времени от момента заражения хозяина спо-
рулированными ооцистами до появления в фекалиях
первых неспорулированных («новых») ооцист назы-
вается препатентным (скрытым) периодом разви-
тия паразита. Время от появления новых ооцист до
момента прекращения их выделения в экскрементах
хозяина называется патентным (открытым) пе-
риодом.
Жизненный цикл типа Eimeria служит примером
моноксенного и гомоксенного развития у споровиков.
К сожалению, до сих пор даже в специальной лите-
ратуре эти понятия нередко ошибочно принимаются
одно за другое. В связи с этим считаем необходимым
дать определения этим и близким понятиям.
ТИП SPOROZOA. КЛАСС COCCIDEA
167
Рис. 93. Схема гомоксенного жизненного цикла типа Eimeria.
Слева'. 1 — внеклеточный спорозоит; 2 — внутриклеточный одноядерный меронт; 3 — многоядерный меронт; 4 — сегментированный меронт; 5—мерозоит
1 -й генерации; 6—8 — мерогония 2-й генерации; 9 — меронт и-ной генерации; 10 — одноядерный микрогамонт; 11 — многоядерный микрогамонт; 12 —
сегментированный микрогамонт с микрогаметами; 13 — молодой макрогамонт; 14— зрелая макрогамета; 15 — микрогаметы; 16— внутриклеточная ооци-
ста; 17 — ооциста в просвете кишки; 18 — неспорулированная ооциста; 19 — спорулированная ооциста. Справа — упрощенная схема развития Eimeria:
1—3 — последовательные генерации мерозоитов; ме — мерозоиты, но — неспорулированная ооциста, со — спорулированная ооциста, 1, 2, 3,... — число ста-
дий мерогонии; стрелки — направление развития.
Fig. 93. Scheme of the homoxenous life cycle of Eimeria type.
To lllf I — a free penetrating sporozoite; 2 — intracellular uninucleate meront; 3 — multinucleate meront; 4 — segmented meront; 5—1st generation merozoite;
(I 8 Jml generation merogony; 9 — «-generation merozoite; 10 — uninucleate microgamont with microgametes; 13 — young macrogamont; 14— mature macroga-
IS microgametes; 16 — intracellular oocyst; 17 — oocyst in the lumen of the intestine; 18 — unsporulated oocyst; 19 — sporulated oocyst. To the right — a
lloipllll0(1 DCliemo of the life cycle: 1—3 — successive merozoite generations; ме — merozoites, но — non-sporulated oocyst, co — sporulated oocyst, 1, 2, 3,... — mero-
gonal generations; arrows — the direction of the development.
ь — узкая хозяинная специфич-
NMfbi ti Si встречаемость паразита только у одного
виде ХОРИИИй.
I'OMOKueiiiio сть не имеет ничего общего со
рпецифичиоитыо и означает только способность пара-
зита запершить полный жизненный цикл (от ооцисты
до ооцисты) » организме одного хозяина (рис. 93).
Антонимом моноксонности является поликсен-
ность, т. е. широкая хозяинная специфич-
ность, обусловленная способностью одного и того же
паразита' развиваться в нескольких хозяевах, которые
относятся к разным видам. При этом гомоксенный по-
ликсенный паразит завершает свой полный жизнен-
ный цикл в организме каждого из этих хозяев. Приме-
рами таких видов могут служить Eimeria falciparum,
Е. contorta, Е. chinchillae.
Антонимом гомоксенности служит гетероксен-
н о с т ь, т. е. способность паразита завершать полный
168
ALVEOLATA
жизненный цикл нс в одном, а в двух и более хозяевах.
Хозяин, в котором паразит претерпевает половой
процесс (гаметогенез), называется окончатель-
ным; а хозяин, в котором проходит бесполое
размножение паразита, но не имеет места обра-
зование гамет, называется промежуточным. Важ-
но подчеркнуть, что в окончательном хозяине может
также осуществляться и бесполое размножение пара-
зита, а в промежуточном происходить образование га-
монтов (гамогенез, не путать с гаметогенезом). Однако
важнейшим отличительным признаком окончатель-
ного хозяина является формирование в нем не га-
монтов,^ гамет паразита.
В разных группах кокцидий можно проследить пе-
реходы от гомоксенности к гетероксенности, причем
сначала факультативной, а затем и облигатной (обяза-
тельной).
Гомоксенный жизненный цикл Schellackia с уча-
стием механического переносчика. Спорозоит Schel-
lackia (рис. 94, /) попадает в кишечник позвоночного
хозяина (ящерицы) при съедании им зараженного кро-
вососа (клеща). Дальнейшее развитие спорозоита со-
вершается в эпителии кишечника ящерицы. Мерого-
ния (2—4) и микрогаметогенез (5—8) осуществляются
внутриэпителиально, тогда как макрогаметогенез
проходит субэпителиально (9—10). После оплодотво-
рения (10) образуется зигота (11), в которой после
споруляции (12—14) формируется 8 спорозоитов, сво-
бодно лежащих в ооцисте. После разрыва ооцисты
спорозоиты (15) проникают в кровеносные сосуды
ящерицы и далее в клетки крови — эритроциты или
лейкоциты.
Беспозвоночный кровосос (клещ) при укусе ящери-
цы засасывает с кровью спорозоитов Schellackia, кото-
рые в дальнейшем перевариваются в его желудке, не
претерпевая при этом никаких видимых изменений
(Lainson et aL, 1976). При съедании инфицированного
кровососа ящерица заражается спорозоитами (15), ко-
торые внедряются в эпителий кишечника (1) и начина-
ют новый цикл развития.
Факультативно-гетероксенный жизненный цикл
Toxoplasma gondii. Жизненный цикл Т. gondii осу-
ществляется гетероксенно, т. е. при участии двух хозя-
ев — промежуточного (свыше 350 видов млекопитаю-
щих, включая человека, а также птиц и рептилий) и
окончательного (домашняя кошка Fells catus и другие
представители сем. Felidae). В промежуточном хозяи-
не осуществляется только бесполое размножение па-
разита, и все стадии развития гомологичны стадии ме-
розоита других споровиков. В окончательном хозяине
происходит не только половой процесс, но и бесполое
размножение.
Полный жизненный цикл Т. gondii, от ооцисты до
ооцисты, может завершаться и гомоксенно, т. е. в орга-
низме одного хозяина — кошки и других кошачьих.
В связи с этим гетероксенность такого цикла рассмат-
ривается как факультативная.
В энтероцитах кишечника кошки совершается не-
сколько раундов мерогонии (рис. 95,1—7), за которы-
ми следует гаметогенез (7—17). Образовавшиеся ооци-
сты выделяются с фекалиями во внешнюю среду в не-
спорулированном состоянии (19). Споруляция ооцист
во внешней среде занимает 2—5 сут (20, 21). Гомо-
ксенное развитие Т. gondii существенно отличается от
гомоксенного развития кишечных кокцидий рода
Eimeria и некоторых других родов.
Препатентный период при гомоксенном развитии
Т. gondii составляет более 20 сут. Это объясняется тем,
что в отличие от видов Eimeria спорозоиты токсоплаз-
мы, вышедшие из заглоченных ооцист, приступают к
дальнейшему развитию не в энтероцитах кишечника, а
в других, внекишечных, органах кошки. По заверше-
нии внекишечного развития образовавшиеся зоиты
(соответствующие цистным стадиям, см. ниже) воз-
вращаются в кишечник и продолжают развиваться
только в энтероцитах, где сначала совершается неско-
лько раундов мерогонии, затем следует гаметогенез,
копуляция гамет и образование зигот.
Начальные этапы эндогенного развития Т. gondii в
окончательном хозяине после скармливания ооцист
полностью совпадают с картиной развития паразита в
промежуточном хозяине. Высвободившиеся из ооцист
спорозоиты проходят через кишечный эпителий, не за-
держиваясь в энтероцитах, и с током крови разносятся
во внутренние органы (генерализованное заражение).
Тахизоиты формируют внутриклеточные скопления,
или псевдоцисты (рис. 95, 22, 23). Скорость размноже-
ния тахизоитов Т. gondii разных штаммов колеблется
от 1—2 до 5 ч.
Через 4—5 и более суток после заражения оконча-
тельного хозяина тахизоиты Т. gondii приступают к
формированию тканевых цист в его головном мозгу
или мышцах. Брадизоиты внутри цист (рис. 95,24,25),
способны к персистированию, т. е. к неопределенно
долгому переживанию в хозяине без потери инвазион-
ности.
Промежуточные хозяева заражаются Т. gondii как
при заглатывании ооцист, так и при поедании ткане-
вых цист, содержащих брадизоитов (хищничество,
каннибализм), при этом заражение человека наиболее
часто происходит при употреблении в пищу сырого
или непрожаренного или непроваренного мяса инфи-
цированных животных. Роль тахизоитов в перораль-
ном заражении нового хозяина окончательно не уста-
новлена.
При поедании окончательным хозяином тканевых
цист, т. е. брадизоитов Т. gondii, эндогенное развитие
паразита значительно сокращается, и первые ооцисты
в фекалиях кошки появляются уже через 3—5, а не 20
и более суток, как при заражении ооцистами. В естест-
венных условиях гетероксенный путь развития Т. gon-
dii имеет первостепенное значение для более успешно-
го (ускоренного) развития и выживания этого паразита
как вида (Dubey et al., 1997).
Облигатно-гетероксенный жизненный цикл
Sarcocystis. Развитие видов Sarcocystis также осущест-
вляется при участии двух хозяев, промежуточного и
окончательного, связанных между собой соответст-
венно как жертва и хищник (рис. 96). В подавляющем
большинстве случаев доказана облигатная гетероксен-
ность таких циклов.
В промежуточном хозяине (жертве) проходит бес-
полое размножение паразита, завершающееся обра-
зованием внутритканевой цисты, стадии, гомологич-
ной гамонтам других споровиков (Бейер, 1989; Beyer,
1989; Beyer, Radchenko, 1995) (рис. 96, 2, 5). В оконча-
ТИП SPOROZOA. КЛАСС COCCIDEA
169
Рис. 94. Схема гомоксенного жизненного цикла Schellackia. (По: Reichenow, 1921; модифицировано).
I Olloptilulli и ходе проникновения в эпителиальную клетку ящерицы; 2—4 — мерогония; 5 — мерозоиты разных генераций; 6—8 — микрогаметогенез;
На MIHijHirilMUlli; 9 — макрогамета; 10 — оплодотворение; 11 — зигота; 12, 13 — спорогония; 14 — спорулированная ооциста; 15 — спорозоиты; кс —
кровеносный сосуд, э — эритроцит.
Fig. 94. Scheme of the homoxenous life cycle of Schellackia type.
1...sporozoiw poiielruliiig lizard’s epithelial cell; 2—4 — merogony; 5 — merozoites of different generations; 6—8 — microgametogenesis; 8a — microgamete; 9 —
niacrogilinole; II) fertilization; 11 — zygote; 12, 13 — sporogony; 14 — sporulated oocyst; 15 — sporozoites; кс — blood vessel, э — erythrocyte.
170
ALVEOLATA
Рис. 95. Схема факультативно-гетероксенного жизненного цикла Toxoplasma gondii.
Слева: 1 — цистозоит (= брадизоит) в ходе проникновения в эпителиальную клетку кишки кошки; 2—6—мерогония в энтероците; 7—мерозоит л-ной гене-
рации; 8—11 — микрогаметогенез; 12 — микрогамета; 13 — проникновение мерозоита; 14—16 — макрогаметогенез; 17— оплодотворение и образование
зиготы; 18 — внутриклеточная ооциста; 19 — неспорулированная ооциста во внешней среде; 20 — спорулированная ооциста; 21 — спорозоиты; 22 — псев-
доциста; 23 — эндозоиты (= тахизоиты); 24 — тканевая циста; 25 — цистозоиты (= брадизоиты). Справа', упрощенная схема развития Т gondii; цифры и
стрелки — те же, что и на рис. 93; ме — мерозоиты, но — неспорулированная ооциста, пц — псевдоциста, со — спорулированная ооциста, сп — спорозоит,
ц — циста, эм — эмбрион.
Fig. 95. Scheme of the facultatively heteroxenous life cycle of Toxoplasma gondii.
On the left: 1 — cystozoite (= bradyzoite) penetrating the cat enterocyte; 2—6 — merogony within enterocytes; 7 — л-generation merozoite; 8—11 — microgametoge-
nesis; 12 — microgamete; 13 — merozoite penetrating the enterocyte; 14—16 — macrogametogenesis; 17 — fertilization and zygote formation; 18 — intracellular
oocyst; 19 — unsporulated oocyst in the environment; 20 — sporulated oocyst; 21 — sporozoites; 22 — pseudocyst; 23 — endozoites (= tachyzoites); 24 — tissue cyst;
25 — cystozoites (= bradyzoites). On the right: a simplified scheme of the life cyclej/Zgures and arrows are the same as in fig. 93; ме — merozoites, но — non-sporula-
ted oocyst, пц — pseudocyst, co — sporulated oocysts, cn — sporozoite, ц — cyst, эм — embryon.
тельном хозяине (хищнике) совершается гаметогенез,
копуляция гамет и образование зиготы (ооцисты)
(рис. 96, 5—9). Особенность ооцист Sarcocystis состо-
ит в том, что они спорулируют в субэпителии кишеч-
ника хозяина еще до выделения во внешнюю среду
(рис. 96, 10, 11).
Как и у Т. gondii, у видов рода Sarcocystis мерого-
ния в промежуточном хозяине включает два этапа:
предцистный (рис. 96,1, 2) и цистный (рис. 96, 3). Од-
нако в отличие от токсоплазмы, у саркоспоридий цист-
ная мерогония завершается образованием не мерозои-
тов (брадизоитов), а гамонтов (ошибочно называемых
в литературе «цистными мерозоитами»). Дальнейшее
развитие цистных гамонтов Sarcocystis возможно толь-
ко в окончательном хозяине (рис. 96, 4—9).
На примере жизненного цикла Sarcocystis можно
видеть, что при облигатно-гетероксенном развитии две
фазы гаметогенеза, гамогония (образование гамонов) и
гаметогония (формирование гамет), оказываются раз-
деленными во времени и пространстве (Бейер, 1989).
Приведенные выше типы жизненных циклов кок-
цидий далеко не исчерпывают всего разнообразия кар-
тины развития этой группы. Однако все это многооб-
разие довольно легко укладывается в рамки, очерчен-
ные гомо- и гетероксенностью развития, представляя
собой определенные комбинации триады Sporozoa.
Из двух хозяев гетероксенного жизненного цикла
эймериидных кокцидий окончательный хозяин счита-
ется предковым и рассматривается как филогенети-
чески информативный, указывающий на время про-
ТИП SPOROZOA. КЛАСС COCCIDEA
171
Рис. 96. Схема облигатно-гетероксенного жизненного цикла типа Sarcocystis. (По: Dubey, 1976; модифицировано).
Слева: 1 — спорозоит в ходе проникновения через стенки кишки промежуточного хозяина, 2 — предцистная мерогония, 3 — мышечная циста (= саркоцис-
та), 4 — «цистный мерозоит» (=гамонт) в ходе внедрения в энтероцит окончательного хозяина, 5—7 — микрогаметогенез, 8 — микрогамета, 9 — макрогаме-
та, 10 — спорулированные ооцисты, II — отдельные спороцисты. Справа — упрощенная схема развития Sarcocystis', м — мерозоиты, мц — метроциты,
пцм — предцистная мерогония, со — спорулированная ооциста, сп — спорозоиты, сц — спороциста, ц — циста, цм — «цистные мерозоиты»; стрелки — на-
правление развития.
Fig. 96. Scheme of the obligatory heteroxenous life cycle of Sarcocystis type.
On the left: 1 — sporozoite penetrating the intermediate host intestinal wall, 2 — precystic merogony, 3 — muscle cyst (= sarcocyst), 4 — cystic merozoite (= gamont)
penetrating epithelial cell of the final host intestine, 5—7 — microgametogenesis, 8 — microgamete; 9 — macrogamete; 10 — sporulation; 11 — sporocysts. On the
right: a simplified scheme of the life cycle; м — merozoites, мц — metrocytes, пцм — precystic merogony, co — sporulated oocyst, cn — sporozoites, сц — sporocyst,
ц — cyst, цм — «cyst merozoites»; arrows — the direction of the development.
похождения паразита и хозяина (Barta, 1989). Напротив,
промежуточный хозяин (хозяева) имеет лишь эколо-
гическое значение. Само становление гетероксенно-
сти у коцидий знаменует прекращение прямого фе-
кально-орального пути гомоксенной трансмиссии
заразного начала и приобретение промежуточного
хозяина в соответствии с экологией каждого отдель-
ного паразита.
Систематический обзор
Отряд Agamococcidiida Levine,
1979 — Агамококцидии
(=Agamococcidiorida Levine, 1979)
Малоизученные кокцидии, в жизненных циклах
которых не идентифицированы стадии мерогонии и
ГАМОГОНИИ, но выявлены ооцисты, спороцисты и спо-
розоиты. Паразиты полихет и кораллов. 2 рода, 5 ви-
дов.
В 1905 г. у полихет Бискайского залива были опи-
СППЫ кокцидии с очень крупными ооцистами, внутри
которых формировались спороцисты со спорозоитами.
У этих кокцидий, получивших название Rhytidocystis
ophellae. l lenncguy, 1907, не были выявлены ни меро-
зоиты, ни гамонты. В 1912 г. был описан другой вид
рода Rhytidocystis — Rh. henneguyi. Спустя 60 лет так-
же на Атлантическом побережье Франции из полихе-
ты Sthenelais boa была описана кокцидия, названная
Dehornia sthenelais Porchet-Hennere, 1972. У описан-
ных кокцидий также не были найдены ни гамонты, ни
меронты или мерозоиты. Единственными стадиями,
которые удалось идентифйцировать, были трофо-
зоиты, ооцисты и спорозоиты. Ультраструктура споро-
зоитов D. sthenelais оказалась типичной для споро-
виков.
Впоследствии из склерактиновых кораллов Agari-
cia agaricites были описаны кокцидии, которые по со-
вокупности признаков (отсутствие мерогонии и гамон-
тов) были помещены в отряд Agamococcidiida (Upton,
Peters, 1986). Однако в отличие от видов Rhytidocystis
в ооцистах нового рода наблюдалось формирова-
ние спорозоитов, которые по завершении споруляции
имели неравные размеры. В последние десятилетия
с агамококцидиями стали сближать и такие орга-
низмы, у которых теоретически предполагается на-
личие полового процесса, хотя он еще строго не
документирован.
Классификация
Сем. Rhytidocystidae Levine, 1979
Сем. Gemmocystidae Upton et Peters, 1986.
Сем. Ixorheidae Levine, 1984
172
ALVEOLATA
Сем. Rhytidocystidae Levine, 1979
('порозоиты внутри крупных ооцист (600 X 250 мкм)
одинакового размера; спороцисты внутри ооцист фор-
мируются. Паразитируют у полихет. 1 род.
Род Rhytidocystis Henneguy, 1907
(= Dehornia Porchet-Hennere, 1972)
Ооцисты с множеством спороцист, каждая с двумя
спорозоитами. 3 вида.
Типовой вид Rhytidocystis opheliae Henneguy,
1907.
Типовой хозяин: морская полихета Ophelia Ы-
cornis.
Трофозоиты в форме плоских овальных чечевич-
ных зерен, покрыты складчатой пелликулой; непо-
движны, достигают размеров 400 (130—500) X 300
(120—400) мкм. Центрально расположенное ядро 50 мкм
в диаметре. Трофозоиты становятся ооцистами, достигая
500—700 X 160—280 мкм. Оболочка ооцисты двухкон-
турная: внутри ооцисты образуются споробласты 10 мкм
в диаметре, которые по мере созревания становятся спо-
роцистами размером 8X5 мкм без выделения остаточ-
ного тела. В каждой спороцисте формируется по 2 спо-
розоита длиной 7 мкм.
Спорозоиты внедряются в кишечник хозяина и
располагаются в соединительной ткани, гонадах и в
полости тела, где могут инцистироваться. Трофозоит
увеличивается в размерах, и от его поверхности отпоч-
ковываются многочисленные споробласты. Споробласты
покрываются оболочкой и становятся спорами ^спо-
роцистами). Внутри спороцисты формируется 2 споро-
зоита, лежащие голова к голове или голова к хвосту.
Rhytidocystis henneguyi de Beauchamp, 1912.
Хозяин: морская полихета Ophelia neglecta.
Зрелые трофозоиты всегда инцистируются индиви-
дуально; оплодотворение отсутствует; эллипсоидные
ооцисты размером до 310 X 220 мкм, с очень тонкой и
гладкой стенкой; имеется остаточное тело, которое
впоследствии исчезает; внутри ооцисты образуются
споробласты, каждый споробласт покрывается обо-
лочкой и превращается в спороцисту (12 X 7 мкм).
В каждой спороцисте по два удлиненных спорозоита с
заостренным передним концом. После разрыва ооци-
сты спорозоиты высвобождаются в полость тела хозя-
ина (целом), в дальнейшем они выходят из полихет
вместе с продуктами гениталий. Паразитируют в поло-
сти тела, в кишечнике и соединительной ткани хо-
зяина.
Rhytidocystis sthenelais (Porchet-Hennere, 1972) Le-
vine, 1979.
(= Dehornia sthenelais Porchet-Hennere, 1972).
Хозяин полихета: Sthenelais boa.
Округлые ооцисты с многочисленными овальными
спороцистами длиной 7 мкм и двуслойной стенкой и
без остаточного тела. Споруляция ооцист совершается
в организме хозяина. В спорозоитах отчетливо выра-
жен коноид, имеются секреторные органеллы апикаль-
ного комплекса — роптрии и микронемы.
Сем. Gemmocystidae Upton et Peters,
1986
Спорозоиты внутри мелких ооцист (14 X 8 мкм)
сразу после формирования имеют неодинаковые разме-
ры; впоследствии мелкие (незрелые) спорозоиты могут
дорастать до крупных (зрелых). Паразитируют у корал-
лов. 1 род.
Род Gemmocystis Upton et Peters, 1986
Ооцисты без спороцист. В каждой ооцисте образу-
ется по 6 спорозоитов, реже больше (до 11). 1 вид.
Типовой вид Gemmocystis cylindrus Upton et Pe-
ters, 1986.
Типовой хозяин: кораллы Dendrogyra cylind-
rus (Cnidaria).
Другие хозяева: Agaricia agaricites, Diploria stri-
gosa, Meandria meandrides, Montastraea cavernosa, Po-
rites astreoides, P. porites, Porites sp. (Cnidaria, Solera-
ctinia).
Ооцисты спорулируют в организме хозяина. Пара-
зитируют в гастродермальных клетках долей мезенте-
риальных филаментов.
Распространение: Горго Сити, 48 км западнее
залива Дискавери, на северной береговой линии Ямай-
ки, на глубине около 6 м.
На гистологических срезах тканей хозяина оваль-
ные ооцисты имеют размеры 13.3 X 7.6 (12—15 X 7—
9) мкм; индекс формы 1.8 (1.5—1.9). Ооцисты распо-
лагаются как внутри, так и снаружи абсорбционных
(экскреторных) гастродермальных клеток долей дис-
тальных концов мезентериальных филаментов. Топо-
логическое воздействие на клетки и ткани кораллов
незначительно.
На рис. 97 приводится схема постулируемого цикла
развития G. cylindrus (Upton, Peters, 1986). Вышедшие
из ооцист (7) спорозоиты (2) соединяются в пары (3),
что может рассматриваться как сингамия. Спорозоиты
обвивают друг друга по спирали и сливаются (4). Об-
разовавшаяся таким образом зигота (5, 6) выделяет во-
круг себя тонкую, слегка волнистую оболочку, кото-
рая становится стенкой ооцисты. На одном из полюсов
ооцисты имеется микропиле. Спороцисты в ооцисте не
образуются. Деление ядра зиготы приводит сначала к
образованию двух спорозоитов, не равных по величи-
не (7, S). Спорозоиты отделяются друг от друга путем
продольного расщепления. Более мелкий (незрелый)
спорозоит постепенно увеличивается по ширине, пока
не достигнет размеров своего исходно крупного (зре-
лого) партнера (9, 10). Далее оба спорозоита в свою
очередь претерпевают также неравное продольное де-
ление (11, 12), но при этом каждый из мелких дочер-
них спорозоитов дорастает до размеров крупного спо-
розоита. Процесс деления вновь повторяется по опи-
санной схеме, реже с некоторыми отклонениями. Так,
мелкие спорозоиты могут давать начало мелким инди-
видуумам без предварительного дорастания до разме-
ров крупных спорозоитов (13, 14). Иногда бинарное
деление в дочерних спорозоитах идет не синхронно и
приводит к образованию внутри ооцисты конечного
ТИП SPOROZOA. КЛАСС COCCIDEA
173
Рис. 97. Предполагаемая схема жизненного цикла Gemmocystis cylindrus. (По: Upton, Peters, 1986).
7 — полностью спорулированная ооциста с эксцистирующимся спорозоитом; 2 — свободный спорозоит; 3 — спорозоиты в паре; 4 — слияние спорозоитов;
5, 6 — зигота на ранних фазах формирования стенки ооцисты соответственно на продольном и поперечном срезах (здесь и далее на обоих срезах в парных
фрагментах); 7, 8 — ооциста после 1-го деления с образованием двух спорозоитов; 9, 10 — ооциста с двумя зрелыми спорозоитами; 11, 12 — ооциста после
2-го продольного деления; 13, 14 — ооциста после 3-го продольного деления; 15, 16 — ооциста с четырьмя зрелыми и двумя незрелыми спорозоитами;
стрелки — направление процесса.
Fig. 97. Putative scheme of Gemmocystis cylindrus life cycle.
1 — totally sporulated oocyst with an excysting sporozoite; 2 — free sporozoite; 3,4 — pairing and fusion of sporozoites; 5, 6 — longitudinal and cross sections (here
and in the following paired images) of zygote at early steps of oocyst wall formation; 7,8 — oocyst after the 1st longitudinal division, and formation of two sporozoites;
9, 10 — oocyst with two mature sporozoites; 11, 12 — oocyst after the 2nd bout of longitudinal division; 13, 14 — oocyst after the 3rd bout of longitudinal division;
15, 16 — oocyst with 4 mature and 2 immature sporozoites; arrows — the direction of the process.
нечетного числа спорозоитов. Наиболее часто внутри
ооцисты формируется 6 спорозоитов (15, 16).
Зрелые спорозоиты достигают в среднем 11.3 X 3.0
(10—12.5 X 2.5—3.5) мкм. Крупное ядро спорозоита
расположено в центре клетки, цитоплазма грануляр-
ная, рефрактильные (парануклеарные) тела отсутству-
ют. Незрелые спорозоиты заметно мельче. Ядро распо-
лагается в задней трети клетки, цитоплазма слегка ба-
зофильная и равномерно окрашенная, рефрактильные
ТОЛИ ПС выявлены.
При изучении агамококцидий не удается наблю-
ДВГЬ стадии, гомологичные гамонтам споровиков;
также Ног данных о процессах оплодотворения или
редукционного деления. С позиции современных пред-
ставлений о споровиках, развитие агамококцидий пред-
ставляет собой исключение, объяснение которому должны
дать последующие исследования этой загадочной груп-
пы, Высказывается предположение о возможном гетеро-
ксенном разви тии агамококцидий (Upton, Peters, 1986).
Отряд Ixorheida Levine, 1984
Гамогония отсутствует, мерогония (?) и споррго-
ния имеются.
Сем. Ixorheidae Levine, 1984
С характеристикой отряда. 1 род.
Род Ixorheis Massin, Jangoux, Sibuet,
1978
Типовой вид Ixorheispsychropotae Massin et al.,
1978.
Типовой хозяин: абиссальная голотурия Psych-
ropotes longicauda.
174
ALVEOLATA
Плоские овальные спорозоиты (8—9 X 6—7 мкм)
проникают в клетки эндотелия кровеносных сосудов ки-
шечника хозяина и далее сильно гипертрофируются, до-
стигая почти 700 мкм в диаметре. Зараженная клетка так-
же увеличивается в размерах, после чего ее ядро фраг-
ментируется и разрушается.
В процессе спорогонии ядро сильно гипертрофиро-
ванного спорозоита многократно делится. Дочерние
ядра располагаются на периферии материнской клетки
вокруг центральной вакуоли. Споробласты образуют-
ся путем отпочковывания от поверхности материнской
клетки, покрываются оболочкой и становятся споро-
цистами. Внутри каждой спороцисты формируется по
два спорозоита.
Авторы оригинального описания I. psychropotae
(Massin et al., 1978) интерпретируют гипертрофиро-
ванные клетки (спорозоиты) как формирующиеся мак-
рогамонты. Микрогамонты обнаружены не были. На-
личие процесса оплодотворения предполагалось толь-
ко теоретически. По мнению Ливайна (Levine, 1984а),
фаза ядерного деления гипертрофированного паразита
может трактоваться как мерогония, за которой следует
спорогония, минуя фазу гаметогенеза.
Таким образом, ни само описание результатов, ни
их интерпретация разными авторами не дает сколь-
ко-нибудь цельного представления о данном объекте,
равно как и обо всей группе агамококцидий.
Отряд Protococcidiida Kheissin,
1956 — Протококцидии
(= Protococcidiorida (Levine et al., 1980b))
Жизненные циклы гомоксенные. Спорозоиты раз-
виваются в гамонтов, минуя фазу мерогонии. Гамого-
ния совершается внеклеточно или внутриклеточно, в
полости тела или в кишечнике хозяина. Ооцисты выде-
ляются во внешнюю среду с экскрементами хозяина.
Спорогония совершается либо в организме хозяина,
либо во внешней среде (воде). Паразиты кольчатых
червей и морских беспозвоночных. 4 семейства, 8 ро-
дов, 14 видов. Позднейшая ревизия этой группы при-
надлежит Вивье (Vivier, 1981).
Классификация
Сем. Coelotrophidae Vivier, 1981
Сем. Myriosporidae Grasse, 1953
Сем. Mackinnoniidae Vivier, 1981
Сем. Angeiocystidae Leger, 1911
Сем. Eleutheroschizonidae Chatton et Villeneuve, 1936
Сем. Coelotrophidae Vivier, 1981
(= Grellidae Levine, 1973)
Развитие внеклеточное или внутриклеточное;
ооцисты спорулируют вне кишечника, обычно в поло-
сти тела. Гамонты симметричные. Паразиты кольча-
тых червей. 2 рода.
Род Coelotropha Неппегё, 1963
Развитие внеклеточное, в микрогамонтах формиру-
ется до нескольких сот двужгутиковых гамет. В ооци-
стах образуется 6—60 спороцист, в каждой по 20—
50 спорозоитов. Стенка спороцисты состоит из двух
створок. Молодые гамонты снабжены рострумом.
Ооцисты находятся в полости тела морских полихет.
2 вида.
Типовой вид Coelotropha durchoni (Vivier,
1963) Vivier et Hennere, 1964.
(= Eucoccidium durchoni Vivier, 1963).
Типовой хозяин: полихетаNereis diversicolor.
Спорозоит банановидной формы, размером 15—
18 мкм в длину (рис. 98, 1), растет и превращается
в трофозоита (2); ядро и ядрышко трофозоита значи-
тельно увеличиваются в размерах (рис. 62, 11, 12).
В трофозоитах длиной 100—150 мкм диаметр ядра
достигает 18—24 мкм. Микрогамонтов образуется
больше, чем макрогамонтов. Гаметогенез протекает
по обычному для кокцидий пути, однако этому
процессу у С. durchoni предшествует редкое для ко-
кцидий явление — сбрасывание экзювия (Vivier,
1979).
Экзювий представляет собой двуслойный цилиндр,
покрывающий тело гамонтов и способствующий сохра-
нению их формы. Макрогамета способна к оплодотво-
рению только после сбрасывания экзювия (рис. 98, 36).
После оплодотворения макрогамета больше не увели-
чивается в размерах.
Микрогамонты растут и приобретают форму сига-
ры: зрелый микрогамонт достигает 120—140 мкм в
длину и 40—60 мкм в ширину. Множественное деле-
ние ядра микрогамонта приводит к образованию ядер
дочерних микрогамет (рис. 98, За). Перед полным со-
зреванием микрогамет на живых объектах можно на-
блюдать их легкое совместное движение внутри мате-
ринского гамонта. Именно в эти моменты происходит
мгновенное сбрасывание экзювия (4), хотя сам чехол
(собственно экзювий) может еще долго оставаться
прикрепленным к гаметоциту.
В микрогамонте, освободившемся от экзювия, про-
должается развитие микрогамет, которые постепенно
приобретают форму полушария и затем отшнуровыва-
ются от основной цитоплазмы материнского гамонта
(4а). Разрушение и выход микрогамонта в полость тела
хозяина происходит под влиянием двух противопо-
ложных механических воздействий: давления изнутри
(со стороны движущихся многочисленных микрога-
мет) и снаружи (со стороны полостной жидкости хозя-
ина). В естественных условиях микрогаметогенез за-
вершается в течение 3—4 сут. Округлые микрогаметы
имеют по два жгутика разных размеров, соответствен-
но 13—15 и 18—20 мкм в длину.
Макрогаметы достигают 120—200 X 50—60 мкм.
Макрогамонт дает начало одной макрогамете, станов-
ление которой знаменует собой процесс сбрасывания
экзювия, после чего происходит оплодотворение и об-
разование ооцисты (5). Спорогония осуществляется в
два этапа, каждый из которых разделяется на отдель-
ные фазы, занимающие по 3—5 сут (6—8, 8а). Иногда
вокруг растущих трофозоитов и гамонтов формируют-
ТИП SPOROZOA. КЛАСС COCCIDEA
175
Рис. 98. Схема развития Coelotropha durchoni. (По: Vivier, 1979).
1 — молодой трофозоит (спорозоит) внутри захватившей его целомической клетки полихеты, 2 — растущий трофозоит после выхода в целомическую жид-
кость, За — множественное деление ядра микрогамонта, 36 — макрогамонт в процессе экзювиации, 4 — микрогамонт в момент сбрасывания экзювия и от-
деления микрогамет (4а), 5 — оплодотворенная макрогамета (зигота), 6 — начало спорогонии в зиготе с образованием споробластов, 7—завершение споро-
гонии с образованием спорозоитов внутри спороцист, 8 — спороциста в момент раскрытия оболочек и высвобождения спорозоитов, 8а — спорозоиты.
Fig. 98. Scheme of the life cycle of Coelotropha durchoni.
1 — young trophozoite (sporozoite) in the polychaete coelomic cell, 2 — growing trophont after releasing into coelomic fluid, 3a — multiple division in microgamont
nucleus, 36 — macrogamont in the process of exuviation, 4 — microgamont at the moment of exuviation and microgamete (4a) release, 5 — fertilized macrogamete
(zygote), 6 — early sporogony with sporoblast formation in the zygote, 7 — final sporogony with sporocyst formation, 8 — sporocyst wall collaps and sporozoite
release; 8a — sporozoites.
ся капсулы (липомы), состоящие из материала тканей
хозяина. Внутри таких капсул паразиты могут выжи-
вать (персистировать) до 4 мес.
Coelotropha vivieri Hennere, 1963.
Хозяин полихета: Notomastus latericeus Sars.
Род Grellia Levine, 1973
(= Eucoccidium Grell, 1953)
После кратковременной локализации в клетках
эпителия кишечника спорозоиты выходят в полость
тела хозяина и здесь, вне клетки хозяина, развиваются
и гамонтов. В ходе микрогаметогенеза формируется
12-—32 дисковидных двужгутиковых гамет. Число
спороцист в ооцисте варьирует в зависимости от раз-
меров макрогаметы. В каждой спороцисте формирует-
ся в среднем по 6 спорозоитов. Ооцисты находятся в
полости тела архианнелид и полихет. 2 вида.
Типовой вид Grellia dinophili (Grell, 1953) Levi-
ne, 1973.
(= Eucoccidium dinophili Grell, 1953).
Типовой хозяин: архианнелида Dinophilus gy-
rociliatus.
Общая схема развития сходна с таковой Coelotrop-
ha durchoni. Спорозоиты (рис. 99, А) выходят из ооцист
{14) в кишечнике хозяина и проникают в полость тела,
где дают начало макро- и микрогамонтам (2—3). Си-
гаровидные макрогамонты продолжают расти и по
достижении 150 мкм в длину превращаются в удли-
ненно-овальные макрогаметы {8). Микрогамонты так-
же продолжают расти {4—5) и округляются, после чего
на их поверхности формируется от 12 до 32 двужгути-
ковых микрогамет (6). После оплодотворения (9) обра-
зуются ооцисты {10—12), в которых формируется до
250 спороцист {13). Внутри спороцисты образуется
5—14 (чаще 6) спорозоитов {14).
Грелль (Grell, 1953) описал у этого вида редкое для
кокцидий явление партеногенеза. Оказалось, что при
очень слабой инвазии хозяина макрогаметы способны
176
ALVEOLATA
Рис. 99. Схема жизненного цикла Grellia di-
nophili в организме полихеты Dinophilus gyro-
ciliatus. (По: Grell, 1956).
А — полный цикл развития: 1 — спорозоиты в про-
свете кишки полихеты; 2 — спорозоиты в полости
тела; 3 — молодые гамонты; 4—6 — развитие микро-
гамонта вплоть до образования микрогамег (7); 8 —
макрогамета; 9 — оплодотворение; 10—13 — разви-
тие ооцисты, приводящее к формированию споро-
цист (74), в каждой из которых образуется 6 и более
спорозоитов; стрелки — направление развития; Б —
сравнение полного цикла развития (слева) с партено-
генетическим вариантом развития (справа).
Fig. 99. Scheme of Grellia dinophili life cycle of
in the polychaete Dinophilus gyrociliatus.
A — the whole life cycle: 1 — sporozoites in the intesti-
nal lumen; 2 — sporozoites in the body cavity; 3 —
young gamonts; 4—6 — microgamont development and
microgamete (7) formation; 8 — macrogamete; 9 — fer-
tilization; 10—13 — oocyst development and sporocyst
(14) formation with 6 or more; arrows — the direction of
the development; Б — comparison of the whole cycle (to
the left) with parthenogenetic development (to the right).
без оплодотворения развиваться в ооцисты, которые
при этом нормально спорулируют и становятся инва-
зионными для нового хозяина (рис. 99, 5). При парте-
ногенетической репродукции протококцидий в их
жизненном цикле не происходит чередования половой
и бесполой фаз развития. Все развитие включает толь-
ко рост спорозоита и его превращение в клетку, на-
поминающую по внешним признакам макрогамету.
Множественное деление ядра такой «макрогаметы»
(разумеется, не включающее редукционного деления)
приводит к образованию дочерних спорозоитов. Одна-
ко называть этот процесс «спорогонией» можно толь-
ко условно, полностью понимая суть происходящих
процессов.
В то же время следует подчеркнуть, что заражение
нового хозяина партеногенетическими ооцистами G. di-
nophili приводит к формированию полноценных мак-
ро- и микрогамонтов и последующей копуляции гамет
с образованием ооцист. Таким образом, в отличие от
большинства кокцидий в жизненном цикле G. dinophili
имеет место не облигатное, а факультативное чередо-
вание бесполой и половой фаз развития.
Grellia ophryotrochae (Grell, 1960) Levine, 1973.
(= Eucoccidium ophryotrochae Grell, 1960).
Хозяин: полихета Ophryotrocha Grell.
Сем. Myriosporidae Grass6, 1953
Гаметогенез совершается в сосудистой системе, в
полости тела и под эпителием кишечника хозяина.
Прослежен процесс экзювиации. У некоторых видов
спорогония происходит после выделения ооцист нару-
жу. В микрогамонте формируется 80—100 микрогаме-
тобластов, в каждом из которых образуется по 4—8
двужгутиковых микрогамет. 3 рода, 7 видов.
Род Myriospora Lermantoff, 1913
Жизненный цикл, по-видимому, гетероксенный. Мик-
рогамонт размером 200 мкм в длину изгибается в виде
подковы и разделяется на 100 цитомеров, внутри кото-
рых формируются дисковидные микрогаметы. У двух
ТИП SPOROZOA. КЛАСС COCCIDEA
177
из четырех видов этого рода микрогаметы двужгути-
ковые. Мпкрогамонт достигает 700—800 X 100 мкм. В
ооцисте содержится несколько сот спороцист, в каж-
дой спороцисте по 2А—32 спорозоита. Спорозоиты
располагаются вокруг остаточного тела спороцисты,
прикрепившись к нему одним концом. Паразиты анне-
лид. 4 вида.
Т и и о в о й вид Myriospora trophoniae Lermantoff,
1913.
Типовой хозяин: аннелида Trophoniaplumosa.
Ьапановидные спорозоиты размером 15—30 X
4 мкм. Микрогамонты достигают 60—200 мкм в дли-
ну, макрогамонты крупнее (150—800 мкм). Внутри
овальных ооцист размером 90—100 X 50—60 мкм об-
разуются также овальные спороцисты (12—50 X 8—
40 мкм). Известны и другие виды этого рода.
Myriospora gopalai Ganapati, 1945.
Myriospora polydorae Ganapati, 1953.
Myriospora petaloprocti Ormieres, 1975.
Хозяин: аннелида Petaloproctus.
Род Myriosporides Неппегё, 1966
Начальный этап развития совершается в стенке
кишки, затем спорозоиты проходят через кишечный
эпителий в полость тела, где могут находиться некото-
рое время в клетках целома (фагоцитах). Гамонты раз-
виваются в полости тела. Внутри микрогамонта фор-
мируется множество микрогаметобластов, в каждом из
которых образуется несколько двужгутиковых гамет.
Перед копуляцией зрелые гамонты обоих полов сбра-
сывают экзювий. В ооцистах формируется около 20 спо-
роцист, содержащих по нескольку десятков спорозои-
тов. Паразитирует в полихетах. 1 вид.
Типовой вид Myriosporides amphiglenae Henne-
гё, 1966.
Типовой хозяин: полихета Amphyglena medi-
terranean
Паразитируют в полости тела и в стенке кишки хо-
зяина.
Сем. Mackinnoniidae Vivier, 1981
Паразиты пресноводных олигохет. Спорозоиты эк-
сцистируются из ооцист в просвете кишки хозяина и
затем внедряются в эпителиальные клетки, где лежат
внутри паразитофорной вакуоли. 1 род.
Род Mackinnonia Janiszewska,
1963
Развитие совершается в полости тела олигохет и
имеет сходство с развитием Myriosporides amphiglenae
с той лишь разницей, что в ооцистах Mackinnonia обра-
зуется больше спороцист, но с меньшим числом спо-
розоитов (2). Овальные микрогамонты достигают
120 мкм в длину, а макрогамонты 45—150 мкм. Упло-
щенные или грушевидные двужгутиковые микрогаме-
ты размером 6.5 X 4.5 X 1.5 мкм. Спороцисты удли-
ненные (6 X 13 мкм) или полукруглые (7—8 мкм в
длину). 2 вида.
Типовой вид Mackinnonia tubifleis Janiszewska,
1963.
Типовой хозяин: олигохета Tubifex tubifex.
Mackinnonia lumbricilli Siau et Ormieres, 1970.
Хозяин: олигохета Lumbricillus lineatus.
В экваториальной области стенки спороцисты име-
ется характерное палочковидное утолщение.
Сем. Angeiocystidae Leger, 1911
Микрогамонты не разделяются на микрогаметобла-
сты, микрогаметы в форме полумесяца. Макрогамон-
ты округлые. В ооцисте формируется 4 овальных спо-
робласта, каждый из которых разделяется на 30 споро-
зоитов. Паразиты полихет. 1 род.
Род Angeiocystis Brasil, 1909
Спорозоиты удлиненные и изогнутые, 25 мкм в
длину. Форма гамонтов от продолговатой до округлой.
В микрогамонте формируется до нескольких десятков
двужгутиковых микрогамет. Паразитируют в сердце
морских полихет. 1 вид.
Типовойвид Angeiocystis audouinae Brasil, 1909.
Типовой хозяин: полихета Audocienia tentacu-
lata.
Сем. Eleutheroschizonidae Chatton
et Villeneuve, 1936
Развитие совершается внеклеточно в просвете ки-
шечника морских полихет.
Гамонты имеют форму шлема, асимметричные. 1 род.
Род Eleutheroschizon Brasil, 1906
С характеристикой семейства. 2 вида.
Типовой вид Eleutheroschizon dubosqui Brasil,
1906.
Типовой хозяин: полихетаScoloplos armiger(в
кишечнике).
Гамонты размером 15—20 мкм развиваются на
поверхности эпителия кишечника морских полихет.
Овальные одноядерные макрогаметы выделяются с эк-
скрементами хозяина во внешнюю среду (воду), где
происходит их оплодотворение. Микрогамонты фор-
мируются в кишечнике хозяина и тоже выделяются во
внешнюю среду (воду), где происходит формирование
множества двужгутиковых микрогамет. Также в воде
совершается и процесс оплодотворения. В ооцисте об-
разуется множество спорозоитов, которые не заключе-
ны внутри спороцист и лежат свободно.
Eleutheroschizon murmanicum Averintsev, 1908.
Хозяин: полихета Ophelia limacina Rathke (в ки-
шечнике).
12 Зак. №4163
178
ALVEOLATA
Таблица 2
Число спороцис! и спорозоитов у разных родов
проюкокцидий (ио: Vivier, Hennere, 1964)
Рол Число спороцист в ооцисте Число спорозоитов в спороцисте
('aryotropha mesnili 20 12
A11 g с i ос) ’st is audoui- nine 4 30
Dorisiella scololepidis Myriospora trophoniae 2 8 24-36
M. gopalai 8 16 24—32
M. polydorae 25—60 12—20
Grellia dinophili 22—50 6
Coelotropha durchoni 30-^5 30—50
Исследования ультраструктурной организации
протококцидий немногочисленны и касаются двух
наиболее изученных видов — Grellia dinophili и Coe-
lotropha durchoni (Vivier, Hennere, 1964; Bardele, 1966;
Porchet-Hennere, 1970). Несмотря на безусловное ульт-
раструктурное сходство с другими представителями
споровиков, существует целый ряд особенностей, ко-
торые отличают протококцидий от истинных кокци-
дий (эукокцидий) отр. Eucoccidiida.
Подобно агамококцидиям, в спорозоитах прото-
кокцидий нет рефрактильных тел. В спорозоитах Grel-
lia dinophili насчитывается большое число субпелли-
кулярных микротрубочек (50). Микрогаметы прото-
кокцидий имеют округлую форму, а в передней части
таких микрогамет отчетливо различается электрон-
ноплотная зона, выполняющая, по-видимому, функ-
цию перфоратория. Жгутики микрогамет имеют обыч-
ное строение.
В отличие от эукокцидий микрогаметы протокок-
цидий имеют микропоры (ультрацитостом). Соотно-
шение длины тела паразита (зоита) к длине коноида
у эукокцидий составляет 20—30, а у протококцидий 75,
что свидетельствует о малой относительной величине
их коноида. По этому признаку протококцидий сближа-
ются с аделеидными кокцидиями — гемогрегаринами.
Также в отличие от эукокцидий микрогамонты и микро-
гаметы протококцидий Grellia dinophili окружены трех-
мембранной пелликулой, в которой имеются микро-
поры.
Подобно некоторым эукокцидиям, стенка спороци-
сты протококцидий составлена из отдельных пластин,
соединенных между собой швами. Начальные этапы
развития макрогамет протококцидий проходят внутри
клетки хозяина, от которой паразит отделен одиноч-
ной мембраной паразитофорной вакуоли, плотно при-
легающей к трофозоиту. Все дальнейшее развитие
макрогаметы совершается внеклеточно.
В отличие от эукокцидий и подобно агамококциди-
ям, у протококцидий число спороцист на ооцисту и
спорозоитов на спороцисту может колебаться в рамках
одного и того же вида (табл. 2).
Итак, на современном уровне знаний о протококци-
диях самым отличительным признаком этой группы
остается выпадение из триады Sporozoa фазы мерого-
нии (но не бесполого размножения!).
Отряд Adeleida Ldger, 1911
(= Adeleidea Leger, 1911)
(= Adeleorina (Levine et al., 1980b))
В отличие от агамо- и протококцидий все аделеид-
ные кокцидии обладают полной триадой Sporozoa.
Жизненные циклы гомо- и гетероксенные. Развитие
происходит внутриклеточно. Макро- и микрогамонты
развиваются в ассоциации, напоминающей сизигий
грегарин. В микрогамонте образуется, как правило, не-
много (2—4) гамет. Зигота подвижна или неподвижна.
Коноид хорошо выражен, хотя и укорочен: отношение
длин тела зоита и коноида более 70. Число субпелли-
кулярных микротрубочек варьирует в пределах 60—
100. Паразиты позвоночных и беспозвоночных. 7 се-
мейств, около 500 видов.
Согласно сводке Вениона (Wenyon, 1926), отряд
Adeleida разделялся на два подотряда: Adeleidea и Нае-
mogregarinidea. Первый включал четыре семейства:
Dobellidae, Legerellidae, Adeleidae и Klossiellidae. По-
дотряд Haemogregarinidea включал три семейства: На-
emogregarinidae, Hepatozoidae и Karyolysidae.
Отряд Adeleida (аделеидные кокцидии) характери-
зовался наличием таких принципиальных признаков,
как ассоциация микро- и макрогамонтов в форме сизи-
гия и формирование внутри микрогамонта небольшого
числа микрогамет (2—-4). Исключением из этого пра-
вила были кокцидии сем. Dobellidae Ikeda, 1914, в мик-
рогамонтах которых формировалось множество мик-
рогамет. На этом основании Венион (Wenyon, 1926)
рассматривал единственный вид этого рода, Dobellia
binucleata Ikeda, 1914, как промежуточную форму
между эймериидными и аделеидными кокцидиями.
В более поздней монументальной сводке по про-
стейшим (Doflein, Reichenow, 1953) род Dobellia был
выведен из аделеидных кокцидий и помещен среди
эймериидных кокцидий (подотр. Eimeriina). Подотряд
Adeleina сводился к одному семейству Adeleidae,
включавшему роды Adelea, Adelina, Klossia, Orcheobi-
us, Chagasella, Karyolysus, Hepatozoon, Klossiella, Lege-
rella и Haemogregarina.
Между тем систематическое положение рода Do-
bellia не прояснилось и до сих пор. Для включения это-
го рода в подотр. Adeleina наличие сизигия в его жиз-
ненном цикле считается более весомым признаком,
чем образование многочисленных микрогамет в мик-
рогамонтах (Upton, 2000).
По системе Ливайна (Levine, 1977), подотряд Ade-
leina (Adeleorina) включает четыре семейства: Adeleidae,
Legerellidae, Klossiellidae и Haemogregarinidae. По струк-
туре жизненного цикла указанные семейства разделя-
ются на две группы: гомоксенные (Adeleidae, Legerelli-
dae и Klossiellidae) и гетероксенные (Haemogregarini-
dae) аделеидные кокцидии. С середины 80-х годов XX в. с
гемогрегаринами стали сближать другую группу крове-
паразитов, объединенных в сем. Dactylosomatidae. В более
поздней сводке (Barta, 2000) аделеидные гемогрегари-
ны разбиваются на несколько более мелких семейств.
Общими признаками гомоксенных аделеидных
кокцидий являются: развитие в организме одного хозя-
ина и только одного вида (моноксенность), паразити-
рование в клетках пищеварительной системы, наличие
ТИП SPOROZOA. КЛАСС COCCIDEA
179
ШЧ1ОДНИЖНОЙ зиготы (ооцисты). Число спороцист в
ипцпсте и спорозоитов в спороцисте у разных родов
|nrtничается. У представителей сем. Klossiellidae ооци-
। н,| лишены типичной стенки.
Классификация
I »>м. Adeleidae Mesnil, 1903
I ем, Legerellidae Minchin, 1903
l гм, Klossiellidae Smith et Johnson, 1902
I ем. Ihiemogregarinidae (Neveu-Lemaire, 1901) Leger, 1911
< ем, Iluctylosomatidae (Jakowska et Nigrelli, 1955) Becker, 1970
Сем. Adeleidae Mesnil, 1903
Гомоксенные паразиты. Половой диморфизм га-
монтов выражен. Зигота неподвижна. Ооцисты покры-
пшотся оболочкой и выделяются во внешнюю среду в
спорулированном состоянии. В ооцисте содержится от
I до 25 спороцист, в каждой спороцисте от 1 до 6 спо-
розоитов. Паразиты преимущественно беспозвоноч-
ных. 9 родов.
Род Adelea Schneider, 1875
Ооцисты эллипсоидные или овальные с тонкими
г гонками, в ооцисте формируется от 6 до 100 плоских
(чюроцист, каждая с 2 спорозоитами. Паразиты члени-
стоногих и моллюсков. 6 видов.
Типовой вид Adelea ovata Schneider, 1875.
Т и ii о в о й х о з я и н: многоножки Lithobiusforficaius.
II ооцистах размером 40—50 X 30—40 мкм форми-
руется 16—32 спороцисты. Спороцисты плоские, дис-
конидные, достигают 20 мкм в диаметре и 4 мкм в тол-
щину, В каждой спороцисте образуется по 2 спорозои-
1й и остаточное тело. Локализуются в кишечнике
многоножек.
Дополнительная информация о других видах рода
Adt'lca, а также родов Adelina, Klossia, Orcheobius,
< 'ha^tisella и Ithania приводится в классической моно-
I рафии Вениона (Wenyon, 1926), а также в более позд-
iiell снодкс Ливайна (Levine, 1977).
Род Adelina Hesse, 1941
Характерно наличие в тонкостенных ооцистах
НИРУСЛМК спороцист с плотными стенками. Паразиты
мингниожек, насекомых, червей (олигохет). Описаны
। Iiy'iail нуейдопиразитизма у млекопитающих (свиньи,
hpiiH4il) и ПТИЦ (журавли) (Levine, 1977). 21 вид.
Г ИII оно II вид Adelina octospora Hesse, 1911.
Г и и о и о II х о ч я и н: пресноводная олигохета Sla-
vlnhi appmidleiildtd.
(loimcriii округлые, 19—23 мкм в диаметре, каждая
। К округлыми спороцистами 7—9 мкм в диаметре. Па-
ри лигирует в кишке и целоме.
Adellnu cryptocerci Yarwood, 1937.
X о в я и н: древесный таракан Cryptocercus punctu-
h i tus.
Паразитирует в жировой и других тканях хозяина.
Спорозоиты высвобождаются из ооцисты в кишеч-
нике таракана, проходят через стенку кишки и попада-
ют в жировую ткань, где приступают к бесполому раз-
множению (мерогонии). На 25-е сут после заражения в
меронтах 1-й генерации формируется от 8 до 40 меро-
зоитов. В мерозоитах последующих генерациий фор-
мируется по 16—32 мерозоита. В ходе гаметогенеза
микро- и макрогамонты соединяются в сизигий. В каж-
дом микрогамонте формируется по 4 микрогаметы,
хотя только одна из них оплодотворяет макрогамету.
Зигота покрывается тонкой оболочкой и становится
ооцистой, внутри которой образуется от 4 до 20 одно-
ядерных споробластов. Споробласты покрываются
плотными оболочками и становятся спороцистами, в
которых затем формируется по 2 спорозоита.
Adelina tenebrionis Sautet, 1930.
Хозяин: жук-скарабей Heteronychus arator.
Adelina triboli Bhatia, 1937.
Хозяин: Tribolium castaneus.
Толщина стенки спороцисты около 220 нм. Па-
разит способен вызывать аутоинфекцию хозяина по-
сле выхода спорозоитов из ооцист в жировое тело
(Zizka, 1985).
Род Orcheobius Schuberg et Kunze,
1906
Гамонты удлиненной формы. Ооцисты с 25—30
спороцистами, в каждой по 4 спорозоита. Паразиты
кольчатых червей. 2 вида.
Типовой вид Orcheobius herpobdellae Schuberg
et Kunze, 1906.
Типовой хозяин: пиявка Herpobdella atomaria
(=Nephesis vulgaris}.
Ооцисты эллипсоидные, размером 180 X 30 мкм, с
25—30 округлыми спороцистами. Паразитируют в се-
менниках пиявок.
Orcheobius cruzi Carini et Anto, 1930.
Хозяин: олигохета неясного таксономического
статуса.
Ооцисты овальные, размером 25 X 38 мкм, с 12 эл-
липсоидными спороцистами, размером 17 X 10 мкм,
каждая с 2—4 спорозоитами. Валидность этого вида
подвергается сомнению (Levine, 1977).
Orcheobius sp.
Хозяин: лягушки сем. Leptodactilidae.
Один из примеров псевдопаразитизма.
Род Chagasella Machado, 1911
(= Chagasia Leger, 1911)
Ооцисты с тремя эллипсоидными спороцистами, в
каждой по 4—6 или более спорозоитов. Паразиты на-
секомых. 4 вида.
180
ALVEOLATA
Г и и u и <> и нид Chagasella hartmanni (Chagas,
Miu kudo, I9l 1.
( . !</</<</ hartmanni Chagas, 1910; Chagas ia hartmanni
(( li.igjis, 1910) Leger, 1911).
Типовой хозяин: клоп Dysdercus ruficollia.
Паразитирует в кишечнике клопа.
Chagasella ganapati Narasimhamurti et Kalavati,
1968.
Хозяин: термиты Odontotermes obesus (Rambur).
Род Ithania Ludwig,
1947
Ооцисты с 1—4 спороцистами, в каждой от 9 до
33 спорозоитов. Паразиты насекомых. 1 вид.
Типовой вид Ithania wenrichi Ludwig, 1947.
Типовой хозяин: комар-долгоножка Tipula ab-
dominalis.
Молодые трофозоиты I. wenrichi лежат в эпители-
альных клетках кишечника внутри паразитофорной ва-
куоли, сохраняя удлиненную форму зоита (рис. 100, /).
Множественное деление ядра мерозоита (2, 3) приво-
дит к образованию сегментированнного меронта (4) с
5—28 мерозоитами, максимум до 80. Число бесполых
генераций не определено. Размеры мерозоитов 27.6—
38.8 X 2.4—4.8 мкм, микрогамонтов 14.4—19.2 X
7.2 мкм. Молодые внутриклеточные макрогамонты
быстро увеличивают свою клеточную массу, что со-
провождается также увеличением их ядра и ядрышка.
Наблюдается раннее соединение гамонтов противо-
положного пола в сизигий (5, 6), после чего макрога-
мета еще продолжает расти и увеличиваться в разме-
рах.
В микрогамонте формируется 4 микрогаметы (8, 9).
Покидая материнский микрогамонт, микрогаметы дви-
жутся по направлению к тому полюсу макрогаметы,
ближе к которому находится ядро женской гаметы
(7(7). Данные о наличии жгутиков в микрогаметах от-
сутствуют. На живом материале микрогаметы имеют
вид подвижных амебоидных клеток. Также на живом
материале удалось наблюдать процесс длительного
вхождения микрогаметы в макрогамету (Ludwig,
1947).
После оплодотворения ооциста высвобождается из
клетки хозяина и попадает в просвет слепых отростков
кишечника комара-долгоножки (77). К этому моменту
ооцисты достигают крупных размеров — 33.6—61.6 X
22.4—49.6 мкм.
С началом третьей фазы цикла (спорогонии) содер-
жимое ооцисты сжимается, и в течение 24 ч наблюда-
ется образование от 1 до 4 споробластов (чаще 2). Спо-
робласты округлые и обычно имеют равные размеры
в пределах той же ооцисты, достигая 20.0—36.6 мкм
в диаметре. Через 5 сут формируются спорозоиты раз-
мером 16.8—21.6 X 3.6—5.6 мкм, которые располага-
ются по периферии спороцисты вокруг центрального
остаточного тела (72, 13). После разрыва оболочки
ооцисты спорозоиты выходят наружу. Способ зараже-
ния личинок комаров не выяснен. Зараженность личи-
нок комаров 7. wenrichi может достигать 70 %.
Род Klossia Schneider, 1875
Крупные ооцисты (40—180 мкм) с многочисленны-
ми (до 160) округлыми спороцистами, в каждой по
4 спорозоита. Паразиты наземных моллюсков родов
Helix и Succinea и насекомых, жуков рода Aphodius.
10 видов, включая транзитные виды, ошибочно выде-
ленные у позвоночных.
Типовой вид Klossia helicina Schneider, 1875.
Типовой хозяин: наземный моллюск Helix
hortensis.
Спорозоиты 77. helicina (рис. 101, 7) выходят из спо-
роцисты в кишечнике моллюска, проходят через его
стенку (рис. 101, 2) и активно проникают в почки, где
внедряются в эпителиальные клетки. Мерогония (ши-
зогония) осуществляется в основном в летнее время и
может повторяться несколько раз, после чего паразит
приступает к гамогонии (рис. 101, 7—9).
Гамонты противоположного пола различаются по
размерам и развиваются в непосредственной близости
друг к другу (рис. 101, 10—77), образуя сизигий, отли-
чающийся, однако, от типичного сизигия грегарин
(Fleischmann, 1977). Макрогамонты (рис. 101, 8—11)
растут и без прогамного деления ядра превращаются
в крупные макрогаметы размером до 100 X 70 мкм
(рис. 102, 7, вкл.). Ядро менее крупного по размерам
микрогамонта (23x9 мкм) делится дважды и дает на-
чало четырем двужгутиковым микрогаметам (рис. 101,
77), одна из которых оплодотворяет макрогамету, в ре-
зультате чего образуется зигота (101, 72).
Ооцисты К. helicina сферические (рис. 101, 72) и в.
спорулированном состоянии напоминают гроздь вино-
града (рис. 102, 2). В процессе споруляции происходит
редукционное деление ядра зиготы, за которым следу-
ет серия митотических делений. В ооцисте формирует-
ся множество (до 150) споробластов (рис. 101, 75), ко-
Рис. 100. Последовательность стадий эндогенного развития Ithania wenrichi в кишечнике личинок комара-долгоножки Tipula ahdominalis.
(По: Ludwig, 1947).
/—10— внутриклеточное развитие в эпителии слепых отростков желудка и средней кишки комара, /1—13 — внеклеточные ооцисты: / — молодой трофозо-
ит; 2, 3 — этапы развития многоядерного шизонта; 4 — зрелый сегментированный шизонт; 5 — макро- и микрогамонты перед соединением в сизигий; 6. 7 —
соединение гамонтов в сизигий; 8 — ядерное деление в микрогамонте; 9 — образование 4 микрогамет в микрогамонте; К) — положение микрогамет (стрел-
ка) перед оплодотворением макрогаметы; 11 — ооциста после высвобождения из клетки хозяина; 12 — ооциста с одной спороцистой; 13 — ооциста с 4 спо-
роцистами с разным числом спорозоитов.
Fig. 100. The sequence of endogenous stages in Ithania wenrichi life cycle in the intestine of Tipula abdominalis larvae.
1—10 — intracellular development in gastric caeca and midgut, /1—13 — free oocysts: / — young trophozoite; 2, 3 development of multinucleate schizont; 4 --
mature segmented schizont; 5 — macro- and microgamonts prior to syzygy formation; 6. 7 — syzygy formation: 8 — nuclear division in microgamont; 9 — formation
of 4 microgametes in microgamont; 10 — position of micro gametes (arrow) before macrogamete fertilization; / / — oocyst after releasing from the host cell; 12 -
oocyst with one sporocyst; 13 — oocysts with 4 sporozoites, each containing different numbers of sporocysts.
ТИП SPOROZOA. КЛАСС COCCIDEA
181
6
13
182
ALVEOLATA
Рис. 101. Схема развития Klossia helicina в моллюске Succinea putris. (По: Grell, 1973).
1—5 — этапы мерогонии, 6 — мерозоиты, 7—10 — гамогония, 11 — оплодотворение, 12 — молодая ооциста, 13 — спорогония, 14 — формирование споро-
цист, 15 — отдельные спороцисты со спорозоитами; стрелки — направление развития.
Fig. 101. Scheme of Klossia helicina development in Succinea putris.
1—5 — merogony, 6 — merozoites, 7—10 — gamogony, 11 — fertilization, 12 — young oocyst, 13 — sporogony, 14 — sporocyst formation, 75 — sporocysts con-
taining sporozoites; arrows — the direction of the development.
торые затем покрываются плотными оболочками и
становятся спороцистами (рис. 101, 14). Одновремен-
но внутри каждой спороцисты происходит ядерное де-
ление, приводящее к формированию четырех инфек-
ционных спорозоитов и остаточного тела (рис. 101,
75). Спорозоиты К. helicina (рис. 102, 1, вкл.) имеют
типичное для кокцидий строение. Внутри спорозоита
образуется кристаллоид. К моменту завершения спо-
рогонии сильно гипертрофированная клетка хозяина
погибает, а ооцисты попадают в просвет почечных
канальцев. Тонкие оболочки ооцист разрушаются, и
спороцисты выделяются наружу вместе с экскретами
почек.
Ультратонкое строение зоитов К. helicina в целом
типично для кокцидий. Особенность составляет оби-
лие роптрий (до 15), расширенные части которых (ам-
пулы) заполнены не гомогенным, а гранулярным ве-
ществом. Число субпелликулярных микротрубочек
достигает 70 и более. В отличие от других кокцидий
к ядру зоитов К. helicina прилегает несколько комп-
лексов Гольджи (диктиосом). Спорозоиты достигают
14 мкм в длину и 2.5 мкм в ширину. Четко выра-
женный коноид укорочен по отношению к длине
тела спорозоита, достигая не более 0.15 мкм. Сверху
коноид покрыт одномембранным куполообразным
слоем.
Мерогония совершается путем синхронного на-
ружного почкования. При формировании мерозоитов в
многоядерном меронте последнее деление осуществ-
ляется по типу эндодиогении (Fleischmann, 1977).
Паразитофорная вакуоль, заключающая бесполые
и половые стадии К. helicina, ограничена тремя мемб-
ранами, а пространство вакуоли заполнено слизис-
тым содержимым. Гамонты располагаются в непо-
ТИП SPOROZOA. КЛАСС COCCIDEA
183
средственной пространственной близости друг к дру-
гу, образуя фигуру, внешне напоминающую сизигий
грегарин, хотя каждый гамонт находится внутри своей
собственной паразитофорной вакуоли и, следователь-
но, гамонты противоположного пола изначально изо-
лированы один от другого, а их пелликулы даже не
контактируют друг с другом. Последующее слияние
мебран паразитофорных вакуолей облегчает копуля-
цию партнеров такого «сизигия» (Scholtyseck et al.,
1977).
В пелликуле крупной макрогаметы К. helicina име-
ется несколько микропор; цитоплазма заполнена мно-
гочисленными включениями: гранулами амилопекти-
на, липидными каплями, элементами эндоплазматиче-
ской сети. Имеются также «серые тела» неизвестной
природы. Аппарат Гольджи представлен в виде неско-
льких наборов диктиосом, беспорядочно разбросан-
ных в цитоплазме. Крупное ядро с компактным яд-
рышком расположено ближе к тому краю макрогаме-
ты, к которому прилегает микрогамонт. В цитоплазме
микрогамонта разбросаны митохондрии, диктиосомы
аппарата Гольджи, гранулы амилопектина и нередко
сохраняются элементы структур апикального комп-
лекса (роптрий и микронем).
Стенка ооцисты К. helicina тонкая и образована
только двумя мембранами; стенкообразующие тела от-
сутствуют. Формирование споробластов внутри ооци-
сты происходит в результате центростремительной ин-
вагинации наружной мембраны зиготы. Так же осуще-
ствляется спорогония и у других аделеидных
кокцидий (Klossiella, Hepatozoori).
Образование спорозоитов К. helicina происходит
в результате синхронного наружного почкования.
Резервные вещества в споробластах имеют структу-
ру кристаллоида. Стенка спороцисты составлена из
нескольких соединенных между собой изогнутых
пластин. Подобное строение стенки спороцисты вы-
явлено также у видов Isospora, Toxoplasma gondii,
Cryptosporidium и некоторых других кокцидий (см.
рис. 58).
Большинство видов Klossia известны как парази-
ты беспозвоночных. В то же время описаны находки
ооцист этого рода и у позвоночных, включая грызунов,
летучих мышей, лисиц и даже кошек (рис. 56, 10, 11).
Однако попытки экспериментального заражения таки-
ми ооцистами соответствующих позвоночных хозяев
оказались безуспешными. Скорее всего ооцисты Klos-
Xla проходили транзитом через кишечник животных, в
пищевой рацион которых входят в том числе и моллю-
ски • хозяева клоссий.
Род Rasajeyna Beesley, 1977
Ооцисты необычного строения, имеют двуслойную
стенку. В ооцисте формируется до 18 спороцист, в
каждой по одному спорозоиту.
Типовой вид Rasajeyna nannyla Beesley, 1977.
Типовой хозяин: комар Tipulapaludosa.
Паразитирует в средней кишке комара (Beesley,
1977).
Род Ganapatiella Kalavati, 1977
Ооцисты с многочисленными спороцистами, в каж-
дой спороцисте по 2 спорозоита. Гамонты объединя-
ются в сизигий. Уникальность этого рода состоит в
том, что в микрогамонте формируется много (до 8)
микрогамет.
Типовой вид Ganapatiella odontotermi Kalavati,
1977.
Типовой хозяин: термиты Odontotermes obesu.
Паразитирует в жировом теле термитов (Kalavati,
1977).
Род Gibbsia Levine, 1986
Мелкие ооцисты с 4 спороцистами, в каждой спо-
роцисте по одному спорозоиту.
Типовой вид Gibbsia archiuli Levine, 1986.
Типовой хозяин: многоножка Archiulus тоге-
leti.
Паразитирует в клетках крови многоножки (Levine,
1986).
Сем. Legerellidae Minchin, 1903
Жизненные циклы гомоксенные и моноксенные.
Половой диморфизм гамонтов выражен. Зигота непо-
движна. Спороцисты внутри ооцист не образуются,
и многочисленные (до 60) спорозоиты свободно лежат
в ооцистах. Паразиты диплопод, нематод и насеко-
мых. 1 род.
Род Legerella Mesnil, 1900
С характеристикой семейства. 6 видов.
Типовой вид Legerella nova (Schneider, 1881)
Mesnil, 1900.
Типовой хозяин: многоножки Glomeris ornata.
Legerella hydropori Vincent, 1927.
Хозяин: жук Hydroporus palustris.
Паразитирует в мальпигиевых сосудах хозяина.
Legerella helminthorum Canning, 1962.
Хозяин: почвенная нематода Mononchus compos-
ticola .
Паразитирует в клетках кишечника нематод.
Legerella parva Noller, 1914.
Хозяин: птичьи блохи Ceratophyllus gallirae и
С. columbae.
Паразитирует в клетках мальпигиевых сосудов
блох. Микрогамонты развиваются в ассоциации (сизи-
гии) с более крупными макрогамонтами. Из четырех
образующихся микрогамет одна оплодотворяет макро-
гамету. Ооцисты попадают в кишечник и далее в экск-
ременты блохи через мальпигиевы трубки. Пути зара-
жения личинок и куколок блох не выяснены.
184
ALVEOLATA
Рис, 103, Схема цикла развития Klossiella mabokensis. (По: Boulard, 1972).
1 — гомоксенное развитие паразита при заражении спороцистами, выделяемыми с мочой хозяина: а—в — гаметогенез и оплодотворение, г — одноядерная
ооциста, д—ж—образование споробластов, з — формирование спороцист, и — разрыв ооцист, к—выход спороцист из ооцисты, л — высвобождение споро-
зоитов в кишке чувствительного хозяина, м — 1-я генерация шизонтов (кишечная шизогония), о — 2-я генерация шизонтов (почечная шизогония), п—с —
3-я генерация шизонов (образование гамонтов), т — гамонты, у — цисты; II—транзитное прохождение цист: хозяин-хищник, не чувствительный к зараже-
нию, распространяет цисты, заглоченные вместе с инфицированной жертвой; III— заражение чувствительного хозяина в местах, удаленных от инфициро-
ванных грызунов: новый хозяин заражается при поедании цист, выделяемых хищником.
Fig. 103. Scheme of the life cycle of Klossiella mabokensis.
I — homoxenous parasite development after infection with sporocysts shed in the host urine: a—в — gametogenesis and fertilization, г — uninucleate oocyst, д—ж —
sporoblast formation, з — sporocyst formation, и — oocyst break, к — sporocyst release from oocyst, л — sporozoite release in the intestine of a sensitive host, м —
I** generation schizonts (intestinal schizogony), о — 2nd genration schizonts (kidney schizogony), n—c — 3rd generation schizogony (gamont formation), m — gamonts,
у — cysts; II—transition of cysts through the intestine of a carnivorous non-sensitive host that previously ate an infected victim;///— infection of a sensitive host in lo-
calities spaced apart from contaminated rodents: a new host is infected on eating cysts shed by carnivorous hosts.
Сем. Klossiellidae Smith et Johnson, 1902
Жизненные циклы гомоксенные. Половой димор-
физм гамонтов выражен. Зигота неподвижна. Типич-
ные оболочки ооцист не формируются. Ооцисты не
имеют защитной стенки. Внутри ооцисты формирует-
ся множество спороцист; остаточное тело отсутствует.
Внутри микрогамонта формируется 2—4 безжгутико-
вых микрогаметы. Хозяева клоссиеллид исключитель-
но позвоночные животные: морские свинки, мышевид-
ные грызуны, лабораторные, сумчатые и австралий-
ские крысы, лошади и другие Equidae, африканские
летучие мыши, толстохвостый галаго Galago crassi-
caudatus, сумчатые Центральной и Южной Амери-
ки. Не исключено также включение в жизненные
циклы паразитов транзитного хозяина (хищные птицы,
рептилии). 1 род.
Род Klossiella Smith et Johnson,
1902
С характеристикой семейства. Стадии гамогонии и
спорогонии формируются в разных органах хозяина.
Устойчивой стадией в цикле развития являются не
ооцисты, а спороцисты, которые выделяются во внеш-
нюю среду с мочой хозяина. 12 видов.
ТИП SPOROZOA. КЛАСС COCCIDEA
185
Типовой вид KlossiellamurisSmithetJohnson, 1902.
Типовой хозяин: мышь Mus musculus.
Klossiella mabokensis Boulard et Landau, 1971.
Хозяин: мышь Praomys jacksoni.
Паразитирует в кишечнике и почках, а также в
клетках ретикулоэндотелиальной системы (РЭС) внут-
ренних органов хозяина.
Второй (транзитный) хозяин: сова, удав.
Спорозоиты К. mabokensis проходят через стенку
кишки (рис. 103, л) и далее проникают в клетки РЭС.
Первая генерация мерогонии занимает почти 1 мес и
совершается в стенке кишки (м). В мерозоитах разме-
ром 15—20 мкм формируется 30—100 мерозоитов. Вто-
рая генерация длится до 15 сут и совершается сначала
в капсуле Боумана почечного клубочка (о); меронты
2-й генерации более мелкие и в них формируется до
70 мерозоитов.
Третья генерация мерозоитов совершается как в
клетках почечных канальцев, так и в клетках РЭС вне
почек, и во многих других внутренних органах (пе-
чень, селезенка, легкие) (и, р, с). Меронты 3-й генера-
ции самые крупные (28—48 мкм), и в них формируется
до 200 мерозоитов. Эти мерозоиты дают начало га-
монтам (/и) примерно через 2 мес после заражения хо-
зяина. Гамонты проникают в клетки почечных каналь-
цев, где дифференцируются на макро- и микрогамон-
тов (а, б, в).
Микрогамонт дает начало четырем безжгутиковым
микрогаметам округлой формы. Одна из четырех мик-
рогамет оплодотворяет макрогамету, что приводит к
образованию зиготы (ооцисты) (г). Ооциста значитель-
но увеличивается в размерах, постепенно заполняя
просвет почечного канальца. Внутри ооцисты фор-
мируется до 12 спороцист (рис. 102, 3, 4', 103, д—з), в
каждой из которых образуется около 20 спорозоитов.
После разрыва ооцисты (и) спороцисты попадают в
мочеточник (к). Спорогония занимает 15 сут, а препа-
тентный период развития длится около 2.5 мес. Споро-
цисты выводятся во внешнюю среду с мочой.
Особенность ооцист Klossiella состоит в отсутст-
вии у них собственной стенки (рис. 102, 3, 4). Споро-
цисты развиваются в пространстве, окруженном мемб-
раной неизвестного происхождения.
Цикл развития К mabokensis имеет сходство с жиз-
ненными циклами К kobayae Seidelin, 1914 и К. muris
Smith et Johnson, 1902. Детальные исследования
по жизненному циклу К mabokensis показали, что
гомоксенное развитие паразита может осложняться
подключением транзитного хозяина. Это оказывется
возможным при поедании зараженных грызунов хищ-
никами (совами, удавами), в организме которых устой-
чивые спороцисты и цисты покоя не персистируют
(см. ниже), но выделяются транзитом во внешнюю
среду (рис. 103, II к), как и в приведенных выше случа-
ях транзита ооцист Klossia.
Другая особенность эндогенного развития Klossiel-
la заключается в том, что инфицированные спорозои-
тами клетки РЭС разносят паразита во внутренние
органы, в которых затем формируются мелкие цисты
(рис. 103, I, у). Морфологически такие цисты имеют
сходство со спороцистами, выделяющимися через
почки при разрушении ооцист (к). Однако цисты име-
ют более плотные оболочки и внутри их формируется
значительно большее число зоитов, или «эндоцитов»
(Landau, 1973).
Цисты Klossiella следует рассматривать как устой-
чивые стадии покоя. Вышедшие из цист при их слу-
чайном разрушении эндоциты могут инициировать
спонтанное развитие, сходное с развитием при перо-
ральном заражении мышей. Интактные цисты, как и
спороцисты Klossiella, разносятся транзитными хозяе-
вами на большие расстояния, способствуя расшире-
нию ареала паразита. Более подробные сведения о
роде Klossiella содержатся в сводке Тэйлора и др. (Tay-
lor et al., 1979).
Как будет показано ниже, образование устойчивых
цист и других долгоживущих (персистирующих) ста-
дий развития у споровиков представляет собой далеко
не редкое явление, играющее важную роль в эволюции
паразитов.
В одной из последних сводок (Barta, 2000) гете-
роксенные аделеидные кокцидии (аделеидные гемо-
грегарины) рассматриваются в рамках не одного, а
четырех семейств. Однако на современном уровне
изученности этой группы дифференциальные диагно-
зы выделяемых семейств оказались настолько рас-
плывчатыми, что мы предпочитаем рассматривать
всех аделеидных гемогрегарин в рамках одного круп-
ного семейства.
Сем. Haemogregarinidae L6ger, 1911
Жизненные циклы облигатно-гетероксенные. По-
ловой диморфизм гамонтов не выражен. Зигота по-
движна. Спорозоиты лежат в ооцисте свободно или за-
ключены внутри спороцист. Паразиты позвоночных и
беспозвоночных животных. Мерогония и гамогония
(образование гамонтов, а не гамет) совершаются в про-
межуточном (позвоночном) хозяине, а гаметогенез
(формирование гамет) и спорогония в окончательном
(беспозвоночном кровососе). Заражение промежуточ-
ного хозяина происходит, как правило, при поедании
окончательного. Число субпелликулярных микротру-
бочек в зоите достигает 60—80. Имеется типичный ко-
ноид. Микрогаметы одножгутиковые. Паразиты чере-
пах, ящериц, амфибий, рыб. Переносчики — пиявки,
изоподы-гематофаги, двукрылые, гамазовые клещи.
4 рода, 380 видов. Однако полные жизненные циклы
изучены лишь для незначительной части видов.
Как справедливо отмечает Ливайн (Levine, 1977,
1982), сем. Haemogregarinidae представляет собой на-
учную трясину, настоящую головоломку для система-
тиков, начиная с крайне неудачного названия для таксо-
номической группы, включающей не грегарин, а кокци-
дий. Это название исторически сложилось из-за способ-
ности гемогрегарин, как и грегарин, к скользящему дви-
жению и наличия сизигия в их жизненных циклах.
Однако безусловная принадлежность гемогрегарин
к кокцидиям определяется наличием у них такого кар-
динального признака, как гаметогенез по типу оогамии.
В то же время сизигий гемогрегарин, как и других аде-
леидных кокцидий, имеет лишь внешнее сходство с
истинным сизигием грегарин. Как известно, у грега-
рин соединяются в пары полностью выросшие гамон-
186
ALVEOLATA
ты после периода активного независимого существо-
вания, тогда как у гемогрсгарин связь гамонтов насту-
пает значительно раньше, т. е. с самого начала их
роста и развит ия как предполовых клеток. У грегарин
вокруг пары гамонтов формируется циста — сизигий,
тогда как у гемогрегарин (и у других аделеидных кок-
цидий) сближенные гамонты сохраняют свою про-
странственную независимость и не покрываются об-
щей оболочкой (Fleischmann, 1977). У гемогрегарин
инцистируется только оплодотворенная макрогамета
(зигота). В свое время, пытаясь исправить ситуацию,
Рейхенов (Reichenow, 1921) даже предложил вместо
термина гемогрегарины использовать термин «гемо-
кокцидии». Однако в литературе этот термин не при-
жился.
Более того, в мировой литературе термином «гемо-
грегарины» обозначены две экологически сходные, но
систематически разные группы споровиков: аделеид-
ные кокцидии сем. Haemogregarinidae Leger, 1911 и
эймериидные кокцидии сем. Lankesterellidae Reiche-
now, 1921.
Неудачные названия характерны и для отдельных
родов гемогрегарин. Так, род Karyolysus отнюдь не
объединяет виды, способные лизировать ядро зара-
женной клетки; и в то же время разрушать ядро могут
многие виды и других родов. В свою очередь, виды
рода Hepatozoon не обязательно локализуются только
в клетках печени хозяина, однако зоиты других видов
гемогрегарин часто встречаются и в гепатоцитах.
Весьма ненадежным родовым и видовым критери-
ем у гемогрегарин является структура их гамонтов,
представляющих собой самую стабильную стадию
развития. Гамонты инкапсулируются не у всех родов.
Недостаточно надежным следует считать и такой кри-
терий, как приуроченность разных гемогрегарин к про-
межуточным хозяевам, относящимся к определенным
классам позвоночных. Также неверно рассматривать
виды рода Haemogregarina как паразитов только вод-
ных позвоночных, Hepatozoon — только млекопитаю-
щих и Karyolysus — только наземных рептилий. Гемо-
грегарины рыб были впервые описаны еще в 1901 г., и
с тех пор долгое время считалось, что их переносчика-
ми являются пиявки.
Более надежным таксономическим критерием мо-
гут быть картина развития гемогрегарин в окончательном
хозяине-кровососе и структура формирующихся ооцист и
спороцист. Однако трудность широкого использова-
ния этого действительно важного признака заключает-
ся в том, что у большинства гемогрегарин все еще
остаются неизвестными их окончательные хозяева.
Мохаммед и Мансур (Mohammed, Mansour, 1959)
предложили считать Haemogregarina sp. sensu lato та-
ких гемогрегарин, у которых еще не выявлены пере-
носчики (окончательные хозяева) и не описаны про-
цессы гаметогенеза и спорогонии. И напротив, к Hae-
mogregarina sp. sensu stricto, по мнению этих авторов,
следует относить виды гемогрегарин, у которых опи-
саны полные жизненные циклы. В последующие годы
делались попытки привести имеющиеся знания о гемо-
грегаринах в более или менее стройную систему (Des-
ser, 1993; Siddall, 1995).
До недавнего времени сем. Haemogregarinidae со-
ставляли 4 рода — Haemogregarina, Hepatozoon, Ka-
ryolysus и Cyrillia. Однако филогенетический анализ с
применением методов молекулярной систематики по-
казал, что это семейство не монофилетическое, а пара-
филетическое (Barta, 1989; Siddall, 1995). После выде-
ления внутри рода Haemogregarina двух родов — Hae-
mogregarina sensu stricto и Desseria Siddall, 1995 —
возникли новые линии гемогрегарин, включающие
роды Dactylosoma Labbe, 1894 и Babesiosoma Jakowska
et Nigrelli, 1956, которые, по данным молекулярной фи-
логении, оказались близки к пироплазмидам (Siddall,
1995). Однако эти новые представления не только не
решили, но еще больше усложнили систематику гемо-
грегарин. Было предложено создать для родов, входя-
щих в сем. Haemogregarinidae, самостоятельные дочер-
ние семейства (Barta, 1989). Но мы не будем следовать
данному предложению в дальнейшем изложении мате-
риала.
Род Haemogregarina Danilewsky, 1885
Ооцисты мелкие. 8 спорозоитов лежат в ооцистах
свободно. Мерогония во внутренних органах и в клет-
ках крови позвоночного хозяина; гамонты только в
клетках крови. Паразиты черепах и других рептилий, а
также амфибий и рыб. Переносчики — пиявки, гемато-
фаги-изоподы. 300 видов.
Типовой вид Haemogregarina stepanowi Dani-
lewsky, 1885.
Типовые хозяева: пресноводная черепахаEmys
orbicularis, пиявка Placobdella catenigera.
Согласно классическому описанию Рейхенова (Rei-
chenow, 1910), спорозоиты Н. stepanowi, высвободив-
шиеся из ооцист в теле пиявки, собираются в зоне ее
хоботка и при акте кровососания передаются позво-
ночному хозяину. Спорозоиты внедряются в эритро-
циты черепахи, где превращаются в меронтов 1-й гене-
рации, дающих начало 12—24 мерозоитам. Эти меро-
зоиты внедряются в новые эритроциты, в которых
совершается 2-я генерация мерогонии с выходом 6 ме-
розоитов. Мерозоиты 2-й генерации наблюдаются так-
же в клетках костного мозга, где они дают начало га-
монтам с неясно выраженным половым диморфизмом.
Гамонты заключены внутри капсул. Копуляция гамет,
образование зиготы, последующая споруляция внутри
ооцисты и образование спорозоитов — все эти процес-
сы совершаются в полости тела пиявки.
Со времени первой публикации жизненного цикла
Н. stepanowi в 1910 г. в литературе не появилось новых
данных по этому виду, хотя совершенно очевидно, что
приведенное выше описание не только устарело, но и
не лишено откровенных неточностей. Вызывает со-
мнение способ передачи спорозоитов от пиявки к чере-
пахе при кровососании. Кровососание как способ
трансмиссии паразитов у гемогрегарин не получило
сколько-нибудь убедительного подтверждения в по-
следующих исследованиях (Paterson, Desser, 1976;
Khan, 1978; Lainson, 1981).
В опытах Рейхенова использовались черепахи, взя-
тые из природы, которые могли быть еще раньше зара-
жены гемогрегаринами. О возможности ошибки экспе-
римента свидетельствует и слишом короткий период
развития гемогрегарин в черепахе, зараженной при
ТИП SPOROZOA. КЛАСС COCCIDEA
187
кровососании пиявки. Кроме того, известно, что сам
Рейхенов не смог впоследствии повторить своего
«классического» исследования.
Haemogregarina balli Paterson et Desser, 1976.
Хозяева: черепаха Chelydra serpentina, пиявка
Placopbdella ornata.
Мерогония в клетках крови и других органов чере-
пахи. Спорогония в клетках кишечника пиявки (Pater-
son, Desser, 1976).
При описании этого вида авторы исследования
(Siddall, Desser, 1991) вводят новое понятие первич-
ные меронты. Такие меронты формируются в окон-
чательном хозяине (пиявке) после завершения споро-
гонии. Спорозоиты, эксцистировавшиеся из ооцист в
кишечнике пиявки, проникают в новые клетки кишеч-
ника, где дают начало первичной мерогонии.
Первичные меронты распадаются на множество меро-
зоитов, которые скапливаются в слюнных железах пи-
явки и якобы инокулируются черепахе при акте крово-
сосания.
Тщательность морфологического описания разных
стадий развития Н. balli не вызывает сомнения. Сомне-
ние начинается с осмысления предлагаемой схемы раз-
вития, которая принципиально не вписывается в схему
жизненного цикла всех известных до сих пор аделеид-
ных гемогрегарин. Известно, что у этих кровепарази-
тов заражение промежуточного хозяина происходит
при поедании окончательного хозяина (беспозвоноч-
ного кровососа) вместе с содержащимися в нем ооци-
стами, а не при инокуляции спорозоитов во время кро-
вососания. Последний путь трансмиссии паразита ха-
рактерен для гемоспоридий.
Постулируемый путь заражения промежуточного
хозяина гемогрегариной Н. balli при инокуляции за-
разного начала окончательным хозяином вызывает со-
мнение. Не меньшее сомнение вызывает также и воз-
можность формирования в окончательном хозяине
стадий, квалифицируемых как первичные меронты.
Столь же сомнительным представляется преимущест-
во мерозоитов перед спорозоитами при инокуляции
промежуточному хозяину (если бы такая инокуляция
имела место в действительности!?). Следует отметить,
ЧТО и у самих авторов данного исследования (Siddall,
Desser, 1991) нет уверенности в достоверности такого
хода развития. Данный пример приводится как ин-
формация к размышлению для заинтересованного чи-
тателя.
Haemogregarina sachai Kirmse, 1978.
Хозяин: палтус Scophthalmus maximus.
Мерогония протекает в клетках внутренних орга-
нов (селезенка), а формирование гамонтов совершает-
ся и крови (эритроциты, лейкоциты) морских рыб.
Чпрпжепис рыб гемогрегаринами приводит к разви-
тию у хозяина анемии в связи с уменьшением числа
эритроцитов в крови. Наблюдаются изменения в лей-
коцитах, а также возрастание числа нейтрофилов и мо-
ноцитов (Kirmse, 1979).
При доста точно высокой интенсивности заражения
у пал тусов, инфицированных Haemogregarina sachai,
имело место увеличение селезенки, гипоплазия эле-
ментов РЭС, миэлоидная метаплазия костного мозга.
Источником заражения палтуса гемогрегаринами в хо-
зяйствах Шотландии стали случайно занесенные в ак-
вариум инвазированные молодые рыбы (Kirmse, 1979).
Род Cyrillia Lainson, 1981
В мелких ооцистах формируется 16—30 свободно
лежащих спорозоитов. Паразиты рыб и пиявок. 2 вида.
Типовой вид Cyrillia gomesi (Neiva et Pinto,
1926) Lainson, 1981.
(= Haemogregarina gomesi Neiva et Pinto, 1926).
Типовые хозяева: пресноводная рыба Syn-
branchus marmoratus, пиявка Haementeria lutzi.
Все стадии развития в рыбах локализуются в зре-
лых эритроцитах (рис. 104). Зрелые гамонты бобовид-
ные. Макрогамонты достигают 11X5 мкм, микрога-
монты 8.8 X 4.7 мкм; последние складываются внутри
эритроцита в виде буквы «U». В мелких меронтах
С. gomesi (10x4 мкм) образуется по 6 мерозоитов
размером 10x3 мкм; в крупных меронтах образуется
большее число мерозоитов. Созревание меронтов про-
исходит преимущественно в капиллярах почек рыбы.
Микро- и макрогамонты С. gomesi располагаются
свободно в области слепой кишки пиявки уже через
15 ч после кровососания на рыбе. Макрогамонты
постепенно приобретают удлиненную форму тела, на-
подобие тела оокинеты Plasmodium, и вскоре прикреп-
ляются к щеточной каемке эпителиальных клеток. Со-
единение гамонтов в сизигий, значительный рост мак-
рогаметы (оогамия), формирование в микрогамонте
4 неподвижных микрогамет и последующая копуляция
гамет — все эти процессы совершаются обычным для
гемогрегарин путем. Создается впечатление, что ооци-
сты Cyrillia развиваются внеклеточно. В самых круп-
ных ооцистах, диаметром 10—12 мкм, происходит
споруляция с образованием 20—30 спорозоитов раз-
мером 4X2 мкм.
Единичные или собранные в группы спорозоитопо-
добные стадии локализуются только в эпителиальных
клетках слепой кишки. Скармливание зараженных пи-
явок чистым рыбам приводило к их последующему за-
ражению. Процесс инвазирования хоботка пиявки спо-
розоитами не наблюдался. Первые стадии развития
С. gomesi появляются в периферической крови рыб че-
рез 12 сут после скармливания им пиявок. Первые
гамонты появляются через 16 сут (Lainson, 1981).
Cyrilia uncinata (Khan, 1978) Lainson, 1981.
(^Haemogregarina uncinata Khan, 1978).
Хозяева: морские рыбы Lycoides lavalaei, L. vah-
lii, морская пиявка Johansonia arctica.
Развитие ооцист и последующая спорогония совер-
шаются внутриклеточно в эпителиальных клетках ки-
шечника пиявки (Khan, 1978). Наблюдается миграция спо-
розоитов в область хоботка пиявки, однако эксперимен-
тальная передача паразита через укус не показана.
Cyrilia ligniersi (Laveran, 1906) Siddall, 1995.
Хозяева: пресноводная рыба Synbranchus mar-
moratus, пиявка Haementeria lutzi.
Имеющиеся в литературе описания жизненных цик-
лов гемогрегарин рода Cyrillia весьма противоречивы и
188
ALVEOLATA
Рис. 104. Схема жизненного цикла Cyrilia gomesi в рыбе Synbranchus marmoratus и в пиявке Haementeria lutzi. (По: Lainson, 1981).
1—12 — развитие в рыбе: 1 — спорозоиты, инъецированные пиявкой, внедряются в эритроциты рыбы; 2—8 последовательные генерации мерогонии в
эритроцитах, преимущественно в капиллярах почек, а также в периферической крови; 9,10 — зрелые гамонты н периферической крови: микрогамонт (71) и
макрогамонт (72); 13—22 — развитие в пиявке: 13 — микро- и макрогамонты, вышедшие из эритроцитов рыбы в просвет слепой кишки пиявки; 14 — при-
крепление и рост макрогаметы на поверхности эпителия кишечника; 15 — соединение в сизигий макрогаме ты и микрогамонта; 16—ядерное деление в мик-
рогамонте, приводящее к образованию 4 микрогамет, и оплодотворение макрогаметы; 17 — оплодотворенная макрогамета с остаточными микрогаметами;
18—21 —деление ядра зиготы, приводящее к формированию 20—30 голых спорозоитов внутри ооцисты; 22 - - спорозоиты из разрушенных ооцист выходят
через эпителий кишечника и мигрируют к хоботку пиявки, откуда они якобы (?) попадают к новому хозяину (рыбе) при акте кровососания.
Fig. 104. Scheme of Cyrilia gomesi life cycle in the fish Synbranchus marmoratus and the leech Haementeria lutzi.
1—12 — development in the fish: 1 — sporozoites injected by the leech penetrate into fish erythrocytes; 2 8- successive merogonal generation in erythrocytes, ma-
inly in kidney capillaries, and in the peripheral blood; 9, 10 — mature gamonts in the peripheral blood: micrognmont (77) and macrogamont (72); 13—22 — develop-
ment in the leech: 13 — micro- and macrogamonts released from fish erythrocytes in the leech caecum; 14 attachment and growth of macrogamete on the surface of
intestinal epithelium; 15 — association of macrogamete and microgamont in a syzygy; 16 — nuclear division in micrognmont resulting in the formation of 4 microga-
metes, and in macrogamete fertilization; 18—21 — nuclear division in a zygote with the formation of 20 30 free sporozoites within the oocyst; 22 — sporozoites
from broken oocysts are released through the intestinal epithelium and migrate towards the leech proboscis, from which they are claimed to reach a new fish host during
blood sucking.
не дают ответа на вопрос о способе заражения проме-
жуточного (позвоночного) хозяина: при инокуляции
возбудителя во время акта кровососания беспозночного
хозяина или при поедании беспозвоночного хозяина по-
звоночным. Вызывает удивление отсутствие экзоэрит-
роцитарной мерогонии в позвоночном хозяине. Нет яс-
ности относительно характера взаимоотношений гемо-
грегарин с клеткой кишечника пиявки. Весьма спорным
является предложение Лэнсона (Lainson, 1981) отно-
сить гемогрегарин рыб к роду Cyrillia, а в род Haemog-
regarina включать паразитов только наземных хозяев.
Род Desseria Siddall,
1995
Спороцисты в ооцистах не формируются, 16 или
более спорозоитов лежат свободно внутри ооцисты.
Внутриэритроцитарная мерогония в позвоночном хо-
зяине отсутствует. Паразиты рыб. 40 видов.
Типовой вид Desseria myxocephali (Fanthamet
al., 1942) Siddall, 1995.
Типовые хозяева: Myxocephalus spp., Malmia-
na scorpi.
ТИП SPOROZOA. КЛАСС COCCIDEA
189
Род Hepatozoon Miller, 1908
(= Leucocytogregarina Sangiorgi, 1912)
Крупные ооцисты с многочисленными спороциста-
ми, в каждой спороцисте 4—16 и более спорозоитов
(рис. 55, 8, 9). Мерогония протекает в клетках внутрен-
них органов позвоночного хозяина — печени, почек,
селезенки, костного мозга; гамонты локализуются в
эритроцитах и лейкоцитах. Во внутренних органах по-
звоночного хозяина формируются тканевые цисты,
что может служить дополнительным способом транс-
миссии паразита через хищников, выступающих в
роли второго промежуточного хозяина. Гаметогенез и
последующая спорогония совершаются в кишке и
в полости тела беспозвоночного кровососа. Микрога-
меты с 1—2 жгутиками. Паразиты млекопитающих,
птиц, рептилий; переносчики-кровососы — пиявки,
клещи, насекомые (комары, муха цеце, вши, блохи).
Около 300 видов.
Типовой вид Hepatozoon muris (Balfour, 1905)
Wenyon, 1926.
Типовые хозяева: белая крыса Rattus norvegi-
cus, клещ Laelaps echidnius.
Род Hepatozoon был впервые описан Миллером
(1908) для того, чтобы объединить гемогрегарин, лока-
лизованных внутри лейкоцитов лабораторных крыс.
Гамогония и спорогония таких паразитов осуществля-
ются в гемоцеле клеща Laelaps echidnius, и здесь же
формируются ооцисты с множеством спороцист. Спо-
розоиты дают начало фазе мерогонии во внутренних
органах крыс, съевших зараженных клещей. Впослед-
ствии виды рода Hepatozoon были описаны также у ля-
гушек, водяных черепах, змей, ящериц, крокодилов,
птиц и млекопитающих, выступающих в роли проме-
жуточных хозяев. Окончательными хозяевами служат
клещи, вши, блохи, редувиидные клещи, двукрылые.
Анализ филогенетических деревьев, построенных для
представителей сем. Haemogregarinidae (Smith, Desser,
1997а), показал, что род Hepatozoon является не моно-,
а парафилетическим, и это неудивительно в свете дан-
ных о типе и локализации стадий геметогенеза и спо-
рогонии у разных видов этого рода. У одних видов He-
patozoon эти фазы цикла осуществляются в кишечнике
клещей, тогда как у других в кишечнике комаров.
Hepatozoon canis lames, 1905.
Промежуточный хозяин: собака Canis.
Окончательный хозяин: клещ Rhipicephalus
sanguineus.
Клещ заглатывает гамонтов Н. canis, заключенных
внутри моноцитов или нейтрофилов (рис. 105, 1). В
кишечнике клеща гамонты соединяются в сизигий
(рис. 105, 2). Сформировавшаяся ооциста (рис. 105, 3)
проходит через стенку кишки и выходит в полость
ГС.П11, или гсмоцель (рис. 105, 4). В результате споруля-
ции образуется 30—50 спороцист (рис. 105, 5), в каж-
дой по 12 24 спорозоита (рис. 105, 6, 7). Спороцисты
в организме клеща остаются интактными, и спорозои-
ты из них не выходят.
При поедании клеща собакой в ее кишечнике спо-
розоиты высвобождаются из спороцист (рис. 105, 7),
проходят через стенку кишки и попадают в кровь и
лимфу (рис. 105, 8, 9). Развитие паразита совершается
в одноядерных фагоцитах и в клетках эндотелия внут-
ренних органов. Зараженные клетки незначительно
увеличиваются в размерах. В зависимости от размеров
различаются макро- и микромеронты (шизонты). Мак-
ромеронты продуцируют небольшое число мерозои-
тов (рис. 105,10—12) и способны к новым раундам ме-
рогонии (рис. 105, 12, обратная стрелка). Напротив,
микромеронты распадаются на множество мелких ме-
розоитов (рис. 105, 13—15), которые в дальнейшем
развиваются в гамонтов внутри лейкоцитов (рис. 105,
16—17).
Меронты Н. canis локализуются в клетках селезен-
ки, печени, легких и мышц, включая миокард, а также
в лимфатических узлах и костном мозгу собаки. В ес-
тественных условиях передача паразита от собаки к
собаке происходит через клеща. В эксперименте опи-
сано заражение собаки Н. canis путем инъецирования
заразного материала из селезенки (но не из перифери-
ческой крови) другой собаки, а также путем внутри-
мышечной инъекции материала из разных органов за-
раженного хозяина (Craig et al., 1978).
Н. canis имеет всесветное распространение и встре-
чается у собак на всех континентах. Болезнь сопро-
вождается лихорадкой, анемией, потерей веса, увели-
чением селезенки. Нередко зараженные собаки поги-
бают.
Переносчиками видов Hepatozoon млекопитающих
являются различные членистоногие-кровососы. Так,
Н. perniciosum белых крыс трансмиссируется клещом
Laelaps echidninus', Н. musculi белых мышей — вошью
Haematopinus spinulosus', Н. scuiri белок переносится
блохой Orchopeas wickhami. Н. balfouri, паразити-
рующий у тушканчика Jakulus jakulus, представляет
интерес как единственный вид гемогрегарин, у которо-
го кроме обычной трансмиссии через кровососа пока-
зана также и передача через плаценту (Hoogstraal,
1961).
Hepatozoon sipedon Smith et al., 1994.
Промежуточные хозяева: водяная змея Ne-
rodia sipedon, леопардовая лягушка Rana pipiens.
Окончательные хозяева: Culexpipiens, Cterri-
tans.
Распространение: Онтарио, Канада.
Бесполое размножение проходит в клетках печени,
легких, почек, сердца, а также в клетках крови змеи
или печени лягушки, где формируются гамонты разме-
ром 19.0 X 3.7 мкм. Образование сизигия, гаметогенез
и формирование ооцист обычно наблюдаются в гемо-
целе и жировом теле комара. Крупные округлые ооци-
сты 260 мкм в поперечнике содержат также округлые
спороцисты диаметром 18 мкм, внутри которых фор-
мируются спорозоиты размером 30.0 X 3.4 мкм.
Образование сизигия, гаметогенез и спорогония у
видов Hepatozoon из рептилий обычно наблюдаются
в гемоцеле комаров или москитов. В некоторых случа-
ях, однако, эти процессы могут происходить в стен-
ке кишки и в просвете тела клещей, как например у
Н. lydosomarum из сцинка Leiolopisma nigriplantare
или Н. mauritanicum из водяной черепахи. При этом
трансмиссия паразита от беспозвоночного хозяина к
позвоночному осуществляется только при поедании
первого последним.
190
ALVEOLATA
Окончательный хозяин
Промежуточный хозяин
Рис. 105. Схема развития Hepatozoon canis. (По: Craig et al., 1978).
1 — гамонт внутри лейкоцита собаки в желудке комара; 2 — образование сизигия; 3 — зигота (оокинета), проходящая через стенку кишки клеща; 4 —
ооциста в полости тела клеща; 5, 6— споруляция ооцисты и образование многочисленных спороцист (7); 7 8 — выход спорозоитов из спороцист в кишеч-
нике собаки, съевшей клеща; 9 — спорозоит вне эпителиального слоя; 10, II макрошизогония в мононуклеарных клетках внутренних органов собаки;
12 — макромерозоит; 13—15 — микрошизогония; 16, 17 •— развитие гамонтов внутри лейкоцитов периферической крови собаки; стрелки — направление
развития.
Fig. 105. Scheme of the life cycle of Hepatozoon cants.
1 — gamont inside dog’s leucocyte in the mosquito stomach; 2 — syzygy formation; 3 — zygote (ookinete) passing through the tick intestine wall; 4 — oocyst in the
tick body cavity; 5, 6 — oocyst sporulation and formation of numerous sporocysts (7); 7, 8 — sporozoite release front sporocysts in the intestine of a dog that previosly
ate a tick; 9 — sporozoite outside the epithelial layer; 10, 11 — macroschizogony in mononucleate cells of dog's inner organs; 12 — macromerozoite; 13—15 — mic-
roschizogony; 16, 17 — gamont development in dog’s peripheral blood leucocytes; arrow - the direction of the development.
Развитие H. sipedon в позвоночном хозяине расши-
ряет прежние представления о характере паразито-хо-
зяинных отношений в целом у гемогрегарин. Поедание
змеями (промежуточный хозяин) комаров (окончатель-
ный хозяин), инфицированных Я. sipedon, не приводи-
ло к последующему заражению таких змей этим ви-
дом, в отличие от того, что имеет место при трансмис-
сии других видов Hepatozoon, также паразитирующих
у змей: Н. rarefaciens, Н. fusifex, Н. domerguei, Н. ае-
gypti, Н. mocassini (Smith et al., 1994).
Отсутствие стадий развития Н. sipedon в тканях за-
раженных змей свидетельствует о том, что ооцисты и
спорозоиты, высвободившиеся из инфицированных
комаров в желудке змеи, сразу перевариваются желу-
дочным соком или по какой-то причине оказываются
неспособными к развитию во внутренних органах
змеи. В то же время при скармливании тех же комаров
лягушкам в клетках паренхимы этих лягушек уже на
7-е сут после заражения наблюдалось формирование
двузоитных цист, однако отсутствовали стадии Н. si-
pedon в периферической крови. При поедании лягушек
змеями печеночные стадии (цисты) приводили к зара-
жению змей //. sipedon.
В редких случаях, при высокой интенсивности ин-
вазии, возможна копгенитальная передача гемогрега-
рин рода Hepatozoon между позвоночными хозяевами
(змеями) (Lowichik, Yager, 1987). Н. sipedon является
потенциально серьезным патогеном, приводящим к за-
болеваниям и гибели особенно молодых змей.
На рис. 106 приводится схема развития Hepato-
zoon aegypti, имеющего в качестве хозяев ящериц и
змей.
В опытах по экспериментальной трансмиссии вида
Hepatozoon, паразитирующего у змей, удавалось
успешно заражать змей не только другого вида, но
даже и другого семейства (Ball et al., 1967). Эти данные
также значительно поколебали ранние представления
об узкой хозяинной специфичности гемогрегарин.
ТИП SPOROZOA. КЛАСС COCCIDEA
191
Рис. 106. Схема развития Hepatozoon aegypti. (По: Bashtar et al., 1984).
/ 5 pn illll'l'lio в змее: 1 — свободный спорозоит; 2 — спорозоит в капиллярах легких; 3 — спорозоит (молодой трофозоит), проникший в клетку эндотелия
цагнЧПЫК капилляров; 4 — деление ядра шизонта; 5 — формирование мерозоитов и их выход из зараженной клетки; 5а — рециклирование преэритроцитар-
III.lx Moponoii i он и начало новых раундов (3—5) в эндотелии змеи; 6—14 — развитие в комаре: 6 — гамонты, соединенные в пары (сизигий), внутри клеток ге-
моцсли; 7 - дифференциация гамонтов, ранее соединенных в сизигий; 8 — ядерное деление в микрогамонте; 9 — образование одножгутиковых микрога-
мот; /0 — оплодотворение; 11 — рост молодой ооцисты; 12 — формирование споробластов внутри ооцисты; 13 — формирование спороцист; 14 — спорозо-
иты внутри спороцисты.
Fig. 106. Scheme of the life cycle of Hepatozoon aegypti.
I 1 development in the snake: / — free sporozoite; 2 — sporozoite in lung capillaries; 3 — sporozoite (young trophozoite) penetrating endothelium of lung capilla-
I leu; 4 nuclear development in a schzont; 5 — merozoite formation and release from the infected cell; 5a — recycling of pre-erythrocytic merozoites and beginning
til new lUHIIN of merogony (3—5) in the snake endothelium. 6—14—development in the mosquito: 6— paired gamonts (syzygy) in cells ofhaemocoel; 7— differentia-
I hill (if III# pi e vloimly paired gamonts; 8 — nuclear division in macrogamont; 9 — formation of uniflagellated microgametes; 10 — fertilization; 11 — young oocyst
growth; 12 — sporoblast formation in oocysts; 13 — sporocyst formation; 14 — sporozoites within sporocysts.
Сходные результаты были получены и при изучении
жизненных циклон видов Hepatozoon из рептилий и
млекопитающих (Landau et al., 1970, 1972).
В результате впервые у гемогрегарин (Hepatozoon
domerguei) было показано образование в первом про-
межуточном (позвоночном) хозяине цист, т. е. покоя-
щихся инвазионных стадий, способных инициировать
новый раунд бесполого размножения во втором проме-
жуточном (также позвоночном) хозяине. Важно под-
черкнуть, что второй промежуточный хозяин выступа-
192
ALVEOLATA
ет по отношению К первому В качестве хищника (Lan-
dau cl al., 1972).
Спорозоиты H. domerguei внедряются преимущест-
венно в печень первого промежуточного хозяина (яще-
рицы Lacerta muralis), где дают начало двум стадиям
развития: меронтам (шизонтам) и цистам. Мерогония
включает несколько раундов. При отсутствии нового
заражения извне меронты и мерозоиты постепенно ис-
чезают из тканей внутренних органов и внедряются в
клетки периферической крови, где дифференцируются
в мужских и женских гамонтов. Напротив, цисты могут
длительное время сохраняться в латентном состоянии
во внутренних органах, преимущественно в печени.
Цистные стадии Н. domerguei заразны для репти-
лий разных видов и даже родов. В эксперименте удава-
лось заразить ящериц Lacerta sicula и змей Madagas
carophis. Эти исследования продемонстрировали воз-
можность дополнительного пути трансмиссии гемо-
грегарин через устойчивые тканевые цисты, которые
можно квалифицировать как персистирующие стадии.
При этом змеи, выполняющие функцию второго про-
межуточного хозяина, выступают в качестве хищника
по отношению к первому промежуточному хозяину.
Оба хозяина в равной степени служат источником за-
ражения для членистоногого кровососа-переносчика, в
результате чего значительно расширяется сфера цир-
куляции в природе Н. domerguei, а возможно и других
гемогрегарин.
Приведенные выше данные по развитию Н. sipedon
также подтверждают гипотезу Ландо (Landau et al., 1972)
о тканевых цистах Hepatozoon как дополнительном
способе трансмиссии паразита, альтернативном к не-
посредственному заглатыванию беспозвоночного крово-
соса с содержащимися в нем ооцистами и спорозоита-
ми. Адаптация к 3-хозяинному (а не обычному 2-хозя-
инному!) циклу развития Н sipedon отчасти объясня-
ется еще и тем, что водяные змеи не едят комаров.
Род Karyolysus Labbe, 1894
В окончательном хозяине гамонты соединяются в
сизигий. В микрогамонте формируется не более 4 мик-
рогамет. Зигота подвижна и способна к дальнейше-
му росту. Остается открытым вопрос о формировании
спороцист внутри ооцист. Есть данные о формирова-
нии внутри ооцист споробластов, в каждом из которых
формируется 20—30 спорозоитов.
Мерогония наблюдается только в клетках внутрен-
них органов позвоночного хозяина. Половой димор-
физм гамонтов не выражен. Гамонты в эритроцитах
инкапсулируются. Зараженные эритроциты сильно ги-
пертрофированы, а их ядра деформированы. Паразиты
наземных рептилий. Виды Karyolysus из теплокровных
неизвестны. Число видов не установлено.
Типовой вид Karyolysus lacertarum (Danilews-
ky, 1886) Reichenow, 1921.
Типовые хозяева: ящерица Lacerta muralis,
клещ Sauronyssus saurarum.
Род Karyolysus был описан Лаббе (Labbe, 1894) при
наблюдении развития паразита в крови ящерицы рода
Lacerta. Однако еще раньше подобного паразита опи-
сал В. М. Данилевский (Danilewsky, 1888) под назва-
нием Haemogregarina lacertarum. Было замечено, что
паразит оказывал заметное воздействие на ядро зара-
женного эритроцита, и именно «кариолитическое»
действие паразита подсказало его родовое название.
Впоследствии Рейхенов (Reichenow, 1921) провел
детальное изучение данного паразита, выявив его
принципиальное отличие от других гемогрегарин, со-
стоявшее в наличии трансовариальной передачи в
клеще-переносчике. Недавние повторные исследова-
ния жизненных циклов четырех видов Karyolysus из
ящериц рода Archaeolacerta, обитающих в Швеции
и Дании, подтвердили данные ранних исследований
(Svahn, 1975).
Karyolysus lacazei Labbe, 1894.
Хозяева: ящерицы рода Darevskia — D. agilis и
D. vivipara.
Karyolysus minor Svahn, 1975.
Хозяева: ящерица D. agilis, клещ Sauronyssus sau-
rarum.
Гамонты Karyolysus высвобождаются из эритро-
цитов ящерицы в кишечнике клеща сразу после акта
кровососания (Svahn, 1975). При этом инкапсулиро-
ванные гамонты высвобождаются медленнее, чем ли-
шенные капсул. Гамонты обоего пола приобретают
вид «червячков» (vermiculae); мужские вермикули
мельче, чем женские. В дальнейшем гамонты приобре-
тают округлые очертания и приходят в соприкоснове-
ние друг с другом. Макрогамонты дифференцируются
в одноядерные макрогаметы, деление ядра микрога-
монта приводит к образованию двух или более микро-
гамет.
У К. lacertae ооцисты развиваются в эпителии ки-
шечника, а у К lacazei — в полости тела клеща.
В ооцисте формируется 16 удлиненных подвижных од-
ноядерных телец, которые Рейхенов (Reichenow, 1921)
называл спорокинетами, поскольку они давали начало
спороцистам («спорам», по терминологии тех лет) в
яйцах клеща. Таким образом, считалось, что спороки-
неты передают инфекционное начало следующему по-
колению беспозвоночного хозяина, в котором продол-
жится жизненный цикл паразита.
Созревание спорокинет происходит только после
повторного кровососания клеща. Зрелые спорокине-
ты внедряются в яйца клеща и там инцистируются.
Инцистированные спорокинеты, или спороцисты, име-
ют овальные очертания и средние размеры до 24.0 X
14.9 мкм (К. lacazei), 28.4 X 20.3 мкм (К. latus) или
30.9 X 18.9 мкм (К. lacertae). Внутри спороцист фор-
мируется множество спорозоитов размером 21.2 X
5.9 мкм (К. latus), 22.3 X 4.8 мкм (К. lacazei) или
19.6 X 4.8 мкм (К. lacertae).
Созревание спороцист происходит в течение 7—
10 сут, в результате чего нимфы нового поколения, на-
падающие на ящериц, уже оказываются инфектив-
ными. Заражение позвоночного хозяина Karyolysus sp.
происходит при поедании инфицированного спороци-
стами беспозвоночного переносчика.
Дальнейшее развитие паразита происходит во внут-
ренних органах ящериц, где формируются два типа эк-
зоэритроцитарных трофозоитов: (7) типичные кокци-
дийные меронты, способные к активной пролифера-
ТИП SPOROZOA. КЛАСС COCCIDEA
193
ции с образованием мерозоитов (рис. 107, 2—4, вкл.);
(2) меронты, остановившиеся в своем развитии на ста-
дии одноядерного трофозоита (рис. 107, 1, вкл.).
Мерозоиты первого типа внедряются в эритроциты
и здесь же дифференцируются в гамонтов, которые
вскоре инкапсулируются (рис. 107, б, вкл.). Активный
выброс экзоэритроцитарных мерозоитов в перифери-
ческую кровь происходит в весенне-летний период,
когда наиболее вероятна встреча промежуточного
(ящерица) и окончательного (кровосос) хозяев гемо-
грегарин.
Мерозоиты второго типа встречаются обычно в
осенне-зимний период, т. е. во время зимней спячки
(диапаузы) обоих хозяев. Меронты второго типа спо-
собны длительно персистировать внутри клеток внут-
ренних органов, в связи с чем их можно сравнить с
гипнозоитами гемоспоридий. Поскольку вокруг гип-
нозоитов Karyolysus не формируются защитные обо-
лочки (рис. 108, вкл.), их нельзя считать ни капсулами,
ни цистами (Бейер, 1979; Бейер, Сидоренко, 1984).
Образование гипнозоитов в жизненном цикле неко-
торых споровиков с облигатно-гетероксенным разви-
тием (гемогрегарины, гемоспоридии) иллюстрирует
адаптацию паразита не только к паразито-хозяинным
отношениям на клеточном и субклеточном уровнях, но
и к особенностям межхозяинных отношений.
В процессе эволюции у кровепаразитов с облигат-
но-гетероксенными жизненными циклами выработал-
ся защитный механизм, препятствующий выбросу га-
монтов в периферическую кровь в осенне-зимний пе-
риод, когда из-за низкой окружающей температуры
встреча обоих хозяев паразита, а следовательно, и его
трансмиссия оказываются невозможными. Этот меха-
низм привел к возникновению «спящих» стадий (гип-
нозоитов), временно выключенных из общего кругово-
рота жизненного цикла. Активизация гипнозоитов
происходит в весенне-летний период, когда оба хозяи-
на гемогрегарин вновь активизируются.
Спорозоиты Karyolysus передаются позвоночному
хозяину при поедании кровососущего переносчика
(а не при инокуляции при кровососании, как у гемо-
споридий!). Спорозоиты эксцистируются из ооцист в
просвете кишечника ящерицы, но затем проходят че-
рез стенку кишки и начинают экзоэритроцитарную ме-
рогонию в клетках внутренних органов. Мерогония
осуществляется по типу экзогении, или шизогонии
(рис. 77).
Род Hemolivia Petit et al., 1990
Ооцисты в форме звезды со множеством спорозои-
тов. Спорозоиты эксцистируются в окончательном
хозяине и тут же дают начало первичной мерогонии.
Зрелые мерозоиты инцистируются в разных тканях
окончательного хозяина. Промежуточный хозяин за-
ражается при поедании окончательного хозяина, со-
держащего инцистированных мерозоитов.
Типовой вид HemoliviastellataPetitetal., 1990.
Типовые хозяева: морская жаба Bufo marinus,
клещ Amblyomma rotondatum.
Паразитирует в эндотелиальных клетках и эритро-
цитах жаб. Клещи заражаются при акте кровососания
на жабах. Гамонты соединяются в сизигий в клетках
кишечника клеща. Ооцисты имеют характерную фор-
му в виде звезды. В ооцистах формируется множество
спорозоитов («спорокинет», по терминологии авторов
оригинального описания), которые после высвобожде-
ния внедряются в клетки различных органов клеща,
где инициируют процесс мерогонии. Образовавшиеся
дочерние мерозоиты инцистируются в организме кле-
ща. Жабы заражаются при поедании клещей, содержа-
щих инцистированных мерозоитов (Petit et al., 1990).
Стадии развития гемогрегарин
в позвоночном хозяине
Морфология и ультраструктура гемогрегарин ро-
дов Haemogregarina, Hepatozoon и Karyolysus были
изучены в основном на стадиях развития из позвоноч-
ного хозяина (Stehbens, Johnston, 1967; Desser, Weller,
1973; Бейер, 1977, 1979; Бейер, Селиванова, 1969; Бей-
ер, Сидоренко, 1972, 1973; Bashtar et al., 1984; Бейер,
Сидоренко, 1984; Nadler, Miller, 1984).
Мерогония Hepatozoon aegypti в организме змеи
Spalerosophis diadema (Bashtar et al., 1984) начинается
в эндотелиальных клетках легочных капилляров. По
мере роста меронта апикальные органеллы зоита пре-
терпевают заметные изменения, при этом коноид, по-
лярные кольца и цистерны внутреннего мембранного
комплекса полностью исчезают. Мерогония Hepatozo-
on совершается по типу шизогонии (эктомерии). Сна-
чала ядра будущих мерозоитов располагаются по пе-
риферии материнского шизонта, а затем над каждым
ядром образуется уплотнение мембраны. Далее в каж-
дом зачатке мерозоита происходит закладка нового
коноида, субпелликулярных микротрубочек, роптрий,
микронем и внутреннего мембранного комплекса. За-
чатки увеличиваются в размерах, и в каждый из них
включается небольшой участок цитоплазмы материн-
ского шизонта. Полностью сформированный дочерний
мерозоит вытягивается в длину и отпочковывается от
материнской клетки апикальным полюсом вперед.
Тонкое строение гемогрегарин имеет принципи-
альное сходство с таковым других Sporozoa, в первую
очередь кокцидий (рис. 60, б—8\ 61, /0; 78, 6). Меро-
зоиты покрыты трехмембранной пелликулой, которая
прерывается в зоне переднего полярного кольца и мик-
ропоры. Коноид хорошо выражен, хотя и несколько
укорочен по отношению к общей длине тела зоита, по
сравнению с эймериидными кокцидиями. Над конои-
дом имеются два преконоидальных кольца (рис. 60, б).
Число субпелликулярных микротрубочек у видов Hae-
mogregarina достигается 40, в у видов Hepatozoon и
Karyolysus превышает 70; роптрии и многочисленные
микронемы располагаются по обе стороны от ядра (см.
рис. 60, S; 78, ’6). Для зоитов гемогрегарин характерно
наличие кристаллоида (см. рис. 59, 5; 60, 7—10).
Пространство паразитофорной вакуоли, окружаю-
щей эритроцитарные стадии гемогрегарин, обычно
очень узкое. Мерозоиты и гамонты Karyolysus сущест-
венно изменяют форму и размеры зараженных клеток
крови (рис. 109, 1, 2, вкл.). В отличие от незаряженных
эритроцитов с их исключительно высокой электрон-
13 Зак. №4163
194
ALVEOLATA
ной плотностью н зараженных клетках крови отчетли-
во заметны ми тохондрии и пиноцитозные пузырьки, а
также значительно повышается уровень ферментов
окисления—восстановления (Бейер, Сидоренко, 1973).
Капсулы вокруг гамонтов Karyolysus имеют разное
строение. По химическому составу и ультраструктуре
аморфное вещество одного из типов капсул имеет
сходство со стенкой спороцист цистообразующих кок-
цидий (рис. 110,1, 4, вкл.); и капсула, и стенка споро-
цисты окрашиваются карболовым фуксином, и в обоих
защитных образованиях выявляется характерный шов
(suture) (Бейер, Сидоренко, 1984).
Стадии развития гемогрегарин
в беспозвоночном хозяине
Развитие Haemogregarina myoxocephali совершает-
ся в клетках кишечника морской пиявки Malmiana
scorpii эпицеллюлярно (Siddall, Desser, 1992). Гамонты
и спорозоиты являются единственными подвижными
стадиями гемогрегарин в слепой кишке пиявки. Га-
меты, зиготы и стадии спорогонии локализуются внут-
риклеточно, что может свидетельствовать о неподвиж-
ности зиготы гемогрегарин («оокинеты», согласно
прежним представлениям). В ходе ядерного деления
микрогамонта Н. balli наблюдается постоянное сохра-
нение ядерной оболочки (Siddall, Desser, 1990), что на-
поминает картину ядерного деления у динофлагеллят.
Подобный тип митоза полностью утрачен у других
споровиков — эймериидных кокцидий и гемоспо-
ридий, — но сохранился у изученных аделеидных кок-
цидий.
В микрогаметах Н. balli и Н. myoxocephali отсутст-
вуют жгутики и митохондрии. У разных видов Hae-
mogregarina дочерние спорозоиты отпочковываются
от материнской клетки либо путем эктополигении (эк-
томерогонии), как у Н. myoxocephali, либо в результате
центростремительного образования пелликулы вокруг
зачатков спорозоитов, как у Н. balli или Н. domerguei
(Siddall, Desser, 1992).
В цитоплазме развивающихся и зрелых спорозои-
тов Н. balli и Н. domerguei были выявлены структуры,
гомологичные плотным гранулам других цистообразу-
ющих кокцидий. Кроме того, у некоторых видов Hae-
mogregarina также обнаружена мультимембранная
структура, ранее обозначавшаяся как Гольджи-адъ-
юнкт (Sheffield, Melton, 1968), а позднее получившая
название апикопласт (Sogin, 1991; Vogel, 1997; Glee-
son, 2000).
Несмотря на наличие многих белых пятен в совре-
менных знаниях о биологии гемогрегарин, структура
их жизненных циклов хорошо укладывается в рамки
цикла развития споровиков: облигатная гетероксен-
ность, мерогония и гамогония в промежуточном (по-
звоночном) хозяине, гаметогенез, копуляция гамет, об-
разование ооцист и спорогония в окончательном хозя-
ине (беспозвоночном кровососе). Единичные случаи
обнаружения «первичной мерогонии» в окончатель-
ном хозяине пока еще не нашли адекватного осмысле-
ния. Общепризнанным считается, что заражение окон-
чательного хозяина происходит при кровососании, а
промежуточного — при съедании кровососа; мерого-
ния осуществляется по типу шизогонии.
С середины 80-х гг. XX в. с гемогрегаринами стали
сближать другую группу кровепаразитов — дактило-
соматид, которых до того относили к пироплазмати-
дам, споровикам, не имеющим коноида. Веским аргу-
ментом в пользу исключения кровепаразита Dactyloso-
та гапагит из числа пироплазматид послужило
обнаружение у него коноида на вершине апикального
полюса (Boulard et al., 1982). Впоследствии сходная
ультраструктура была выявлена и у Babesiosoma stab-
leri, паразита, которого раньше также относили к пи-
роплазматидам (Barta, Desser, 1989). Это заставило пе-
ресмотреть систематическое положение обоих указан-
ных кровепаразитов и поместить их в самостоятельное
сем. Dactylosomatidae (Barta, Desser, 1989).
Сем. Dactylosomatidae Becker, 1970
Жизненные циклы облигатно-гетероксенные. По-
ловой диморфизм гамонтов выражен слабо. Гамонты
соединяются в сизигий. Подвижная зигота проникает в
клетку кишечного эпителия и становится ооцистой.
Ооциста лишена стенки и располагается свободно в
цитоплазме зараженной клетки. Путем наружного поч-
кования формируется 8 спорозоитов, располагающих-
ся по периферии ооцисты.
Паразиты позвоночных, передача возбудителя че-
рез беспозвоночного кровососа. Мерогония и гамого-
ния в позвоночном хозяине, гаметогония, спорогония
и постспорогональная мерогония в беспозвоночном
хозяине.
Органеллы апикального комплекса, включая коно-
ид, хорошо выражены. Микронемы сосредоточены в
апикальной части клетки. Субпелликулярные микро-
трубочки в количестве 32—50 не достигают заднего
полюса зоита. Мерогония и спорогония по типу на-
ружного синхронного почкования. 2 рода.
Род Dactylosoma Labbe, 1894
Беспигментные паразиты эритроцитов бесхвостых
амфибий (лягушек, тритонов, жаб). Жизненные циклы
гетероксенные. Две генерации эритроцитарной меро-
гонии; мерозоиты 2-й генерации дифференцируются в
гамонтов.
Окончательный хозяин — пиявка. Число видов не
определено.
Типовой вид Dactylosoma гапагит (Kruse, 1890)
Labbe, 1894.
(= Drepanidium гапагит Kruse, 1890, Haemogregari-
na гапагит Celli et Sanftlice, 1891, Laverania гапагит
Grassi et Feletti, 1892).
Типовые хозяева: лягушка Rana esculenta, пи-
явки рода Desserobdella.
Меронты 1-й генерации диаметром 6.7—7.9 мкм да-
ют начало 6—16 мерозоитам размером 4.3 X 1.3 мкм.
В меронтах 2-й генерации, достигающих около 5 мкм
в диаметре, образуется 6 мерозоитов размером 3.4 X
1.0 мкм. Крупные гамонты (7.0 X 3.4 мкм) способны
персистировать в эритроцитах в течение 1 мес со дня пер-
ТИП SPOROZOA. КЛАСС COCCIDEA
195
ШН'О появления в периферической крови (рис. Ill, 1,
вкл.), Внутри эритроцита гамонт находится в сложен-
ном состоянии, по принципу перочинного ножа «хвост
к голове» (рис. Ill, 3, вкл.). Эритроцитарные стадии
лежит кнутри паразитофорной вакуоли и не поврежда-
ют ядро 'Лфиженной клетки.
Мерогония D. гапагит совершается путем синхрон-
ного экзогенного (наружного) почкования, характер-
ного для пироплазмид и редко встречающегося у кок-
цидий (например, у Klossia helicina). Мерозоиты лежат
кнутри клетки свободно, без паразитофорной вакуоли
(Barta, Desser, 1989). Спорогония проходит в эпителии
кишечника пиявки. На светооптическом уровне видно
формирование множества (до 30) спорозоитов вокруг
одного, моноспоробластного центра внутри ооцист.
Род Babesiosoma Jakowska et Nigrelli,
1956
(= Haemohormidium Henry, 1910)
Особенностью этого рода является низкий репро-
дуктивный потенциал в ходе реализации жизненного
цикла.
Типовой вид Babesiosoma jahni (Nigrelli, 1929).
(= Dactylosoma jahni Nigrelli, 1929).
Типовые хозяева: тритон Trituris viridescens,
пиявка Desserobdella (Batracobdella) picta.
Паразитирует у амфибий и рыб.
Babesiosoma stabler! Schmittner et McGhee, 1961.
Хозяева: лягушки рода Rana, жабы, пиявка Des-
serobdella (Batracobdella) picta.
Наличие экзоэритроцитарной мерогонии точно не
известно (Barta, Desser, 1986). Имеется две генерации
эритроцитарной мерогонии, каждая из которых дает
начало четырем мерозоитам (рис. 112, 4, 5, 11, вкл.).
Мерозоиты 2-й генерации дифференцируются в гамон-
тов (рис. 111; 2; 112, 6, вкл.). В желудке пиявки, насо-
савшейся крови зараженных лягушек, гамонты покидают
эритроциты и соединяются в пары (рис. 112, 7, 8, вкл.).
В микрогамонте образуется одна микрогамета. По-
движная зигота (оокинета) имеет органеллы апикаль-
ного комплекса, включая коноид (рис. 112,11, вкл.).
Оокинета проникает в эпителиальные клетки кишеч-
ника пиявки (рис. 113,72, вкл.), где и совершается
процесс спорогонии (рис. ИЗ, 13, вкл.). Ооциста не
имеет стенки; спорогония происходит путем наружно-
го почкования, в результате чего образуется 8 спорозо-
итов. После отпочкования спорозоиты лежат свободно
в цитоплазме зараженной клетки кишечника пиявки.
Из клеток кишечного эпителия спорозоиты рассе-
ляются в другие органы пиявки, в первую очередь в
слюнные железы, где совершается постспорогональная
мерогония (синхронное наружное почкование), приво-
дящая к образованию 4 дочерних мерозоитов (рис. 112, 70;
114, 14,15, вкл.). Постспорогональные мерозоиты спо-
собны персистировать в хоботке пиявки до 4 мес.
Сообщение о возможности заражения промежуточ-
ного хозяина гемогрегарин в ходе акта кровососания
пиявки на лягушке (Barta, Desser, 1989) идет вразрез с
многократно доказанным способом трансмиссии у
этой группы кокцидий, при котором позвоночный хо-
зяин съедает беспозвоночного хозяина. Способ транс-
миссии В. stableri, постулируемый указанными
авторами, свидетельствует о сходстве этого кровепа-
разита с пироплазмидами. Это сходство усиливается
еще и тем, что у сравниваемых организмов мерозоиты
после отпочковывания от материнских клеток лежат
свободно в цитоплазме зараженной клетки, а не внутри
паразитофорной вакуоли.
Постспорогональная мерогония в клетках слюнных
желез пиявки может продолжаться до 8 мес. Этим
объясняется предпочтение паразитом для выживания
пиявки, а не лягушки, что в свою очередь объясняет
низкую интенсивность и экстенсивность заражения
лягушек бабезиосомами. По своей большей приуро-
ченности к окончательному хозяину (пиявке) В. stable-
ri также принципиально отличается от гемогрегарин, у
которых паразит может с большей вероятностью со-
храниться как вид в промежуточном (позвоночном)
хозяине.
После кровососания на инфицированных бабезио-
сомами лягушках пиявки, по-видимому, заражаются
на всю жизнь и могут повторно трансмиссировать па-
разита несколько раз.
Итак, несмотря на некоторые черты сходства
аделеидных гемогрегарин (сем. Haemogregarinidae) и
дактилосоматид (сем. Dactylosomatidae), между ними
существуют весьма серьезные различия, ставящие под
сомнение их близкое родство. Это касается таких
признаков дактилосоматид, как структура жизненных
циклов (отсутствие экзоэритроцитарной мерогонии и
включение постспорогональной мерогонии), способ
трансмиссии паразита позвоночному хозяину (через
укус беспозвоночного кровососа, а не при поедании его
позвоночным хозяином), картина клеточного деления
(синхронное наружное почкование), структура ооцисты
(отсутствие собственной оболочки ооцисты), парази-
то-хозяинные отношения на клеточном уровне (сво-
бодное расположение стадий развития в цитоплазме
зараженной клетки, т. е без паразитефорной вакуоли).
Интерес современных исследователей к изучению
гемогрегарин, в частности кариолизид и дактилосома-
тид, объясняется тем, что эти группы считаются бли-
жайшими родственными организмами пироплазматид
родов Theileria и Babesia (Barta, 1989; Siddall, Desser,
1991). Дополнительные сведения о дактилосоматидах
имеются в специальных сводках (Barta, 1991, 2000).
Переходя к рассмотрению других групп кокцидий,
необходимо напомнить, что в мировой литературе тер-
мином «гемогрегарины» обозначаются две экологиче-
ски сходные, но систематически разные группы споро-
виков: аделеидные кокцидии сем. Haemogregarinidae
Leger, 1911,о которых шла речь выше, и эймериидные
кокцидии сем. Lankesterellidae, Reichenow, 1921, о ко-
торых пойдет речь ниже. Эти две группы паразитов
демонстрируют интересный случай параллельной эво-
люции у кокцидий, приведшей к развитию кровепара-
зитов от истинных (классических) кишечных паразитов.
И, как следствие, в жизненных циклах представителей
обеих групп появился беспозвоночный переносчик-
кровосос — червь или членистоногое.
Однако дальнейшая эволюция сравниваемых групп
оказалась неодинаковой. Аделеидные гемогрегарины
196
ALVEOLATA
используют кровососа в качестве окончательного хо-
зяина, возлагая па него часть своего жизненного цик-
ла - гаме тогенез и спорогонию. Напротив, эймериид-
ныс гемогрегарины (ланкестереллы и шеллакии) испо-
льзуют переносчика-кровососа только в качестве
механического средства для транспортировки споро-
зоитов хозяину того же вида.
Несмотря на далеко не полную изученность аделе-
идных гемогрегарин, в самой структуре их жизненных
циклов заложена известная стабильность, чего нельзя
сказать об их эймериидных партнерах. Включение в
цикл развития последних кровососа как механическо-
го переносчика следует рассматривать лишь как на-
чальный этап эволюции в сторону кровепаразитизма.
А конечным звеном в этой длинной цепи станет воз-
никновение сложнейшего по многим параметрам цик-
ла развития гемоспоридий, достигшего наибольшего
совершенства у видов рода Plasmodium.
В жизненных циклах аделеидных гемогрегарин
еще сосуществуют два кардинальных способа транс-
миссии паразита — хищничество и кровососание. На-
против, в циклах развития малярийных паразитов
(виды рода Plasmodium} трансмиссия осуществляется
одним, но совершенным способом, а именно при акте
кровососания. Важно подчеркнуть, что при кровососа-
нии окончательный хозяин гемоспоридий производит
одновременно два действия: заражает промежуточно-
го хозяина и заражается сам, оставаясь при этом жи-
вым и способным к повторному кровососанию. По
сравнению с этим жизненный цикл аделеидных гемо-
грегарин выглядит более примитивным, если не ска-
зать ущербным, поскольку окончательный хозя-
ин-кровосос способен заразить промежуточного хозя-
ина лишь однажды и в момент собственной гибели,
когда его съедает окончательный хозяин.
Отряд Eimeriida L6ger, 1911
Собственно кокцидии, или кокцидии sensu stricto.
Жизненные циклы гомо- и гетероксенные. Развитие
внутриклеточное, редко внеклеточное. Микро- и мак-
рогамонты развиваются раздельно, сизигий не образу-
ется. Микрогамонт продуцирует множество жгутико-
вых гамет. Зигота неподвижна и в размерах не увели-
чивается. Ооцисты выделяются во внешнюю среду и
служат для заражения нового хозяина. Структура
ооцисты до сих пор служит важным систематическим
признаком при различении родов кокцидий. Коноид
хорошо выражен, отношение длины коноида к длине
тела зоита составляет 20—80. Число субпелликуляр-
ных микротрубочек 18—27, в среднем 22, реже боль-
ше. Паразиты позвоночных и беспозвоночных. Около
1500 видов, более 10 семейств.
По сравнению с аделеидными кокцидиями эймери-
идные кокцидии оказываются эволюционно более про-
двинутой группой. В пользу этого свидетельствуют
следующие факты: 1) отсутствие сизигия (хотя неко-
торые картины сближения гамонтов эймериидных
кокцидий могут внешне напоминать сизигий); 2) фор-
мирование в микрогамонте многочисленных микрога-
мет; 3) увеличение числа макрогамонтов относитель-
тно микрогамонтов; 4) сокращение числа спороцист на
ооцисту и спорозоитов на спороцисту (Upton, 2000).
Все это в совокупности приводит к увеличению обще-
го числа инфекционных ооцист, выделяющихся во
внешнюю среду.
Классификация
Сем. Spirocystidae Leger et Duboscq, 1915
Род Spirocystis Leger et Duboscq, 1911
Сем. Selenococcidiidae Poche, 1913
Род Selenococcidium Leger et Duboscq, 1909
Сем. Aggregatidae Labbe, 1899
Род Aggregata Frenzel, 1885
Род Merocystis Dakin, 1911
Род Selysina Duboscq, 1917
Сем. Caryotrophidae Lithe, 1906
Род Caryotropha Siedlecki, 1902
Род Dorisiella Ray, 1930
Сем. Lankesterellidae Reichenow, 1921
Род Schellackia Reichenow, 1919
Род Lankesterella Labbe, 1899
Сем. Atoxoplasmatidae Levine, 1982
Род Atoxoplasma Gamham, 1950
Сем. Pfeifferinellidae Grasse, 1913 emend. Wacha, 1980
Род Pfeifferinella von Wasielewski, 1904
Род Alveocystis Beltenev, 1980
Сем. Barrouxidae Leger, 1911
Род Barrouxia Schneider, 1885
Род Defretinella Hennere, 1966
Род Crystallospora Labbe, 1896
Род Goussia Labbe, 1896
Сем. Calyptosporidae Overstreet, Hawkins, Foumie, 1984
Род Calyptospora Overstreet, Hawkins, Foumie, 1984
Сем. Cryptosporidiidae Leger, 1911
Род Cryptosporidium Tyzzer, 1910
Сем. Eimeriidae Poche, 1913 emend. Beyer, 1977
Род Eimeria Schneider, 1875
Род Tyzzeria Allen, 1936
Род Epieimeria Dykova et Lom, 1981
Род Pseudoklossia Liger ct Duboscq, 1915
Род Grasseella Tuzet ct Ormiircs, 1910
Род Ovlvora Mackinnon ct Ray, 1937
Род Mantoiiella Vincent, 1936
Род Cyclo,vpora Schneider, 1881
Род Dorlsa Levine, 1980
Род Sivatosliclla Ray ct Sarkar, 1967
Род Wenyonella Hotirc, 1933
Род Octosporella Ray ct Raghavachari, 1942
Род Yakimovella Gousseff, 1937
Род Iloarella Arcay-dc-Pcraza, 1963
Род Pythonclla Rny ct Dasgupta, 1932
Род (iaryospora Liger, 1904
Сем. Isosporidac Minchin, 1903
Подсем. ToxophiNininae Biocca, 1957
Род Isosporu Schneider, 1881
Род Cystolsospora Frenkel. 1977
Род Toxoplasma Nicollc et Manceaux, 1908
Род llammondia Frenkel et Dubey, 1975
Род Neospora Dubey, Carpenter, Speer, Topper, Uggla, 1988
Род Besnoitia I lenry, 1913
Подсем. Sarcocystinac Mugridge, 2002
Род Sarcocystis I .ankester, 1882
Род Frenkella Biocca, 1968
Сем. Spirocystidae L6ger et Duboscq, 1915
Жизненный цикл гомоксснпый. Многоядерные за-
крученные в виде спирали червеобразные меронты
длиной 35 мкм находятся в целомической полости
олигохет. Микрогамонты и макрогаметы локализуют-
ся в кишечном эпителии. Микрогаметы лишены жгу-
тиков. В ооцисте формируется один спорозоит. 1 род.
ТИП SPOROZOA. КЛАСС COCCIDEA
197
Род Spirocystis Leger et Duboscq, 1915
С характеристикой семейства. 1 вид.
Типовой вид Spirocystis nidula Leger et Duboscq,
1911.
Типовой хозяин: олигохета Lumbriculus variega-
tus.
Зигота покрывается толстостенной оболочкой и
становится ооцистой, достигающей 35 мкм в длину.
Внутри ооцисты формируется один голый спорозоит
длиной около 40 мкм.
Распространение: Гренобль, Франция.
Сем. Selenococcidiidae Poche, 1913
Гомоксенные кокцидии европейского омара Нота-
rus sp. Структура ооцисты неизвестна. Процесс споро-
гонии не наблюдался. 1 род.
Род Selenococcidium L6ger et Duboscq,
1909
С характеристикой семейства. 1 вид.
Типовой вид Selenococcidium intermediarum Le-
ger et Duboscq, 1909.
Типовой хозяин: европейский омар Нота-
rus sp.
Паразитирует в кишечнике омара.
Подобно грегаринам, подвижные бесполые стадии
развития этого вида обладают мионемами. Однако об-
разование и поведение половых стадий происходит по
кокцидийному типу. Спорозоиты попадают в кишеч-
ник омара с пищей, но не внедряются в стенку кишки,
а растут и развиваются внеклеточно в просвете кишки
(рис. 115, 7). В меронтах имеются структуры, подобные
мионемам. Растущий меронт увеличивается в разме-
рах до 60—100 мкм, сохраняя удлиненную червеоб-
разную форму тела и подвижность (рис. 115, 2, 3).
Ядро внеклеточного меронта делится, после чего
8-ядерный меронт (шизонт) внедряется в клетку ки-
шечника, где округляется (рис. 115, 4, 5) и распадается
на мерозоиты размером 66 X 3 мкм (рис. 115, 6, 11).
Мерозоиты покидают клетку кишечника и иницииру-
ют новые раунды мерогонии. Внеклеточные меронты
дифференцируются на крупные и мелкие шизонты,
дающие начало соответственно четырем макрога-
MOIITUM (рис. 115, 7) и восьми микрогамонтам (рис. 115,
13). 1 ’«МОНТЫ имеют червеобразную форму (рис. 115,8,
12).
Микрогамоиты проникают в клетки кишечника
и дают начало множеству двужгутиковых микрогамет
(рис. 115, 16), макрогамонты превращаются в макро-
гаметы бич прогамного деления ядра (рис. 115, 10).
Образовавшиеся ооцисты (рис. 115, 17, 18) выходят из
кишечника. Дальнейшее развитие ооцист не просле-
жено.
S. intermediarum может рассматриваться как проме-
жуточное звено между грегаринами и кокцидиями,
хотя эта точка зрения нуждае тся в дополнительной ар-
гументации.
Сем. Aggregatidae Labbd, 1899
У подавляющего большинства видов жизненные
циклы облигатно-гетероксенные, со сменой двух бес-
позвоночных хозяев. Ооцисты с многочисленными
спороцистами. Промежуточный хозяин заражается
при поедании экскрементов окончательного хозяина,
содержащих спороцисты со спорозоитами. Оконча-
тельный хозяин заражается при поедании промежу-
точного хозяина. До выделения во внешнюю среду
ооцисты спорулируют в кишечнике окончательного
хозяина. Число спороцист в ооцисте колеблется от ну-
ля до множества. В спороцистах образуется разное
число спорозоитов. 3 рода.
Род Aggregate Frenzel, 1885
(= Benedenia Schneider, 1875; pro parte, Klossia Schnei-
der, 1875; pro parte, Legeria Blanchard, 1900; Eucocci-
dium Luhe, 1902; pro parte, Legerina Jacquemet, 1903)
Жизненные циклы облигатно-гетероксенные. Круп-
ные ооцисты с многочисленными спороцистами, в
каждой спороцисте по 3—28 спорозоитов. Паразиты
крабов и головоногих моллюсков. Мерогония в орга-
низме десятиногих ракообразных, гамогония в голово-
ногих моллюсках. 20 видов, хотя часть из них может
быть сведена в синонимы.
В рамках сем. Aggregatidae род Aggregata изучен
наиболее полно и служит пока еще редким примером
облигатно-гетероксенного жизненного цикла, когда
оба хозяина являются беспозвоночными животными.
Между промежуточным (краб) и окончательным
(каракатица) хозяевами устанавливаются отношения
жертвы и хищника.
Типовой вид Aggregata octopiana (Schneider,
1875) Frenzel, 1885.
Типовой хозяин: осьминог Octopus vulgaris.
Aggregata kudoi Narasihamurti, 1979.
Промежуточные хозяева: крабы Ocypoda
platytardia и C. cordimana (в эксперименте).
Окончательный хозяин: каракатица Sepia
eliptica.
В спороцистах формируется по 6 спорозоитов.
Aggregata eberthi (Labbe, 1899) Leger, Duboscq, 1906.
Промежуточные хозяева: морские крабы
родов Macropipus (=Portunis depurator) и Carcinus.
Окончательный хозяин: головоногий мол-
люск Sepia officinalis.
Распространение: Средиземное и Северное
моря.
Первое описание жизненного цикла A. eberthi и де-
талей ядерного деления на разных стадиях развития
было дано Добеллом (Dobell, 1925). Более поздние
исследования (Heller, 1970; Porchet-Hennere, Richard,
1971) внесли много нового в понимание биологии это-
го паразита.
Бесполое размножение (мерогония) совершается в
клетках целома и подслизистой оболочки кишечника
198
ALVEOLATA
Рис. 115. Схема развития Selenococcidium intermedium в омаре Hommarus sp. (По: Ldgcr, Duboscq, 1910; в модификации Хейсина, 1967).
1 — одноядерный червеобразный меронт в просвете кишки; 2, 3 — ядерное деление в мсронгс; 4, 5 — внутриклеточные меронты; би II — зрелые меронты с
мерозоитами, в дальнейшем развивающиеся в микрогамонтов; 7 — мерозоиты, в дальнейшем развивающиеся в макрогамонтов; 8—10 — развитие макрога-
меты; 12—16 — развитие микрогамонта; 17 — оплодотворение; 18 — зигота (ооциста).
Fig. 115. Scheme of Selenococcidium imtermedium life cycle in Hommarus sp.
1 — uninucleate vermicular meront in the intestinal lumen; 2, 3 — nuclear division in meront; 4, 5 — intracellular meronts; 6 and 11 — mature meronts with merozoi-
tes to develop into microgamonts; 7 — merozoites to develop into macrogamonts; 8—10 — macrogamete development; 12—16 — microgamont development; 17 —
fertilization; 18 — zygote (oocyst).
ТИП SPOROZOA. КЛАСС COCCIDEA
199
Рис. 116. Схема жизненного цикла Aggregata eberthi. (По: Grell, 1968, модифицировано).
1 — мерозоиты; 2—5 — дифференцировка макрогамонта в макрогамету (5); 6—8 — микрогаметогенез; 9 — микрогаметы; 10 — оплодотворение; 11, 12 —
развитие ооцисты; 73 — споробласт; 14 — спорозоиты; 15—18 — мерогония в организме краба; 19 — сегментированный меронт со множеством мерозои-
тов (7), способных продолжать свое развитие в организме каракатицы.
Fig. 116. Scheme of the life cycle of Aggregata eberthi.
1 —merozoites; 2—5 — differentiation of microgamont into macrogamete (5); 6—8 — microgametogenesis; 9 — microgametes; 10— fertilization; 11, 12 — oocyst
development; 13 — sporoblast; 14— sporozoites; 75—18 — merogony in the crab; 19 — segmented meront with numerous merozoites (7) вЫе to further development
in the cattle-fish.
200
ALVEOLATA
Рис. 117. Схематическое изображение этапов прохождения Aggregata eberthi через базальную пластинку кишки краба. (По: Porchet-Hen-
пегё et al., 1981).
А — формирование плотного вещества (стрелка) в межклеточном пространстве кишки; Б — приближение паразита, несущего на апикальном полюсе плот-
ное вещество, к базальной пластинке кишечной клетки; В — начало разрушения базальной пластинки и слияние мембраны, окружающей плотное вещество,
с мембраной зараженной клетки; Г — прохождение вытянутой апикальной части спорозоита через базальную пластинку; бп — базальная мембрана, к— ко-
ноид, кх — клетка хозяина, мкх — мембрана клетки хозяина.
Fig. 117. Scheme of Aggregata eberthi transition through the crab intestine basal plate.
A — dense substane formation (arrow) in the intercellular space of the intestine; Б— approximation of parasite, carrying a dense substance on its apical pole, to the ba-
sal plate; В — rupture of the basal plate and fusion of the membrane limiting the dense substance with the infected cell membrane; Г—transition of the extended apical
part of the sporozoite through the basal plate; 6n — basal plate, к — conoid, кх - host cell, мкх — host cell membrane.
краба, а половой процесс и спорогония в кишечнике
каракатицы (рис. 116). Каракатица заражается при по-
едании инфицированных крабов. Мерозоиты проника-
ют в слизистый слой эпителия тонкой и слепой кишки
каракатицы, а в соединительной ткани дифференциру-
ются на макро- и микрогамонты. В последних форми-
руется множество подвижных жгутиковых микрога-
мет. После оплодотворения макрогамета (зигота) по-
крывается очень тонкой оболочкой и становится
ооцистой. Сильная инвазия приводит к некрозу и слу-
щиванию слизистой кишки.
При изучении A. eberthi было впервые показано,
что редукционное деление (мейоз) совершается в зиго-
те сразу после оплодотворения (Dobell, 1925). На всех
других стадиях жизненного цикла паразит является
гаплоидным, и в гаплоидных ядрах содержится 6 хро-
мосом. Вслед за редукционным делением диплоидного
ядра зиготы следует серия эквационных (митотиче-
ских) делений, приводящих к образованию нескольких
гаплоидных ядер и, как следствие, равного числа одно-
ядерных споробластов. Остаточное тело в ооцисте от-
сутствует. Споробласты покрываются оболочками и
ТИП SPOROZOA. КЛАСС COCCIDEA
201
превращаются в спороцисты размером 8—9 мкм в диа-
метре. В каждой спороцисте формируется in situ по
3 спорозоита и выделяется остаточное тело. В спорозо-
итах хорошо заметны кристаллоидные включения.
Тонкая стенка ооцисты легко разрушается, высвобож-
дая свободные спороцисты, которые выделяются во
внешнюю среду с экскрементами каракатицы.
Краб заражается при поедании экскрементов кара-
катицы, содержащих ооцисты A. eberthi. Спороцисты
лопаются по швам, и высвободившиеся из них споро-
зоиты проходят через стенку кишки в подлежащую со-
единительную ткань. Характерно, что спорозоиты дви-
жутся не через эпителиальные клетки, а между ними
и затем перфорируют базальную пластинку кишки
(рис. 117). Спорозоиты внедряются в клетки лимфоид-
ной ткани подслизистой кишечника, где дают начало
крупным меронтам.
Дальнейшее развитие A. eberthi совершается вне
кишечника. В клетках лимфоидной ткани вокруг ме-
ронтов секретируется аморфное вещество, благодаря
чему меронт приобретает сходство с цистой («шизого-
нальной цистой», по терминологии Добелла). Форми-
рование мерозоитов происходит по типу экзомерого-
нии, т. е. наружного почкования (Porchet-Hennere, Ri-
chard, 1971).
В целом картина жизненного цикла A. eberthi напо-
минает таковую цистообразующих кокцидий рода Sar-
cocystis, включая не только последовательность стадий
развития и хозяев, но и строение отдельных стадий, в
частности ооцист и спороцист.
Внутриклеточные стадии A. eberthi заключены
внутри паразитофорной вакуоли, пространство кото-
рой заполнено осмиофильным материалом (Por-
chet-Hennere, Richard, 1971). Ультраструктура стадий
развития аггрегаты принципиально сходна с таковой
других кокцидий, несмотря на наличие ряда специ-
фических особенностей. Так, коноид составляет 1/80
длины тела зоита, число субпелликулярных микротру-
бочек достигает 60. Меронты сохраняют исходную
трехмембранную структуру пелликулы зоита, однако
теряют субпелликулярные микротрубочки, а внутрен-
ний мембранный комплекс оказывается более хруп-
ким, чем плазмалемма.
Особенность митоза A. eberthi состоит в том, что
между основаниями двух пар центриолей образуется
внеядерное центральное веретено в виде «центродес-
моза», рост которого в длину приводит к раздвиганию
дочерних центроконусов. Таким образом, в отличие от
других кокцидий у A. eberthi формируется не внутри-
ядерное, а внеядерное веретено.
Микрогаметы длиной 25—30 мкм покрыты трех-
мембранной пелликулой, которая образует ундулиру-
ющую мембрану. В пелликуле имеются типичные
микропоры, а под пелликулой проходят микротрубоч-
ки. От переднего конца микрогаметы отходит три жгу-
тика, один из которых направлен назад, к ундулирую-
щей мембране.
Пелликула зрелых макрогамет A. eberthi образует
глубокие впячивания и многочисленные микропоры.
По периферии цитоплазмы макрогаметы располагают-
ся митохондрии, диктиосомы, различные вакуоли. По-
лисахаридные гранулы, липидные капли и многочис-
ленные цистерны эндоплазматической сети собраны в
центральной части макрогаметы. В зиготе подобной
зональности в распределении цитоплазматических ор-
ганелл не наблюдается.
Ооцисты A. eberthi покрыты хрупкой оболочкой,
тогда как плотная оболочка спороцисты составлена из
серии пластин, разделенных швами. Выход спорозоитов
из спороцист осуществляется после растворения швов.
Дополнительные сведения о видах рода Aggregata
содержатся в специальных сводках (Poynton et al.,
1992; Bradbury, 1994).
Род Merocystis Dakin, 1911
Жизненный цикл, по-видимому, гетероксенный.
Ооцисты с многочисленными спороцистами, каждая с
одним спорозоитом. Микрогамонты сегментированы
на цитомеры, внутри каждой из которых формируется
множество микрогамет. Споруляция ооцист в организ-
ме хозяина. Паразиты моллюсков. 1 вид.
Типовой вид Merocystis kathae Dakin, 1911.
Типовой хозяин: моллюскBuccinium undatum.
С характеристикой рода. Паразитирует в почках
хозяина.
Род Selysina Duboscq, 1917
Характер жизненного цикла не выяснен. Ооцисты
без типичных спороцист, но содержат так называемые
гелиоспоры с многочисленными спорозоитами внут-
ри, которые окружают остаточное тело наподобие ле-
пестков цветка. По данным более ранних исследова-
ний (Wenyon, 1926), в ооцистах этого вида имеются
спороцисты размером 15x5 мкм, каждая из которых
содержит по одному спорозоиту. Паразиты личинок и
взрослых особей асцидий. 3 вида.
Типовой вид Selysinaperforans Duboscq, 1917.
Типовой хозяин: асцидия Stolonica socialis.
С характеристикой рода. Многочисленные мерозо-
иты развиваются внутри крупных цист (500 мкм в диа-
метре), покрытых толстой стенкой (до 50 мкм).
Сем. Caryotrophidae Luh6, 1906
Жизненный цикл гомоксенный. В тонкостенных
ооцистах формируется до 20 спороцист, в каждой по
8—12 спорозоитов. В процессе споруляции стенка
ооцисты резорбируется. Паразиты аннелид. 2 рода.
Род Caryotropha Siedlecki, 1902
Ооцисты с тонкими стенками, в которых форми-
руется по 20 спороцист, в каждой спороцисте по 8—
12 спорозоитов. Ооцисты спорулируют в организме
хозяина. 1 вид.
Типовой вид Caryotropha mesnili Siedlecki, 1902.
Типовой хозяин: морская аннелида Polymnia
nebulosa.
Полный жизненный цикл протекает в полости тела
хозяина. Самые ранние стадии развития (трофозоиты
202
ALVEOLATA
4—5 мкм в диаме тре) встречаются в клетках полости
тела или внутри сперматогоний аннелиды. Заражен-
ные клетки сильно гипертрофированы. На начальной
стадии мерогонии формируется 10—16 промежуточ-
ных образований, обозначавшихся разными термина-
ми — меробласты, шизонты, мононтоциты; указанные
образования отделены друг от друга перегородками.
Деление ядра промежуточных образований приводит к
формированию 20—30 мононтов, т. е. мерозоитов раз-
мером 10—12 X 3 мкм, часть которых дифференциру-
ется на макро- и микрогамонтов. В ходе сложного раз-
вития микрогамонтов формируются промежуточные
образования (микрогаметобласты), внутри которых
находятся округлые микрогаметы.
После оплодотворения зигота покрывается тонкой
оболочкой, в которой имеется микропиле, и приоб-
ретает округлую форму. В ооцисте формируется до
20 округлых спороцист, которые покрываются плот-
ными оболочками. В каждой спороцисте образуется по
8—12 спорозоитов размером 10x4 мкм и остаточное
тело. На протяжении всего процесса мерогонии пара-
зит (трофозоит) находится в тесном контакте с ядром
зараженной клетки, что и послужило основанием для
родового названия — Caryotropha.
В настоящее время не все исследователи согласны
с приведенной выше трактовкой мерогонии у Caryo-
tropha. Высказывается мнение, что описанные карти-
ны развития, скорее всего, имеют отношение к процес-
су гаметогенеза, тогда как бесполое размножение у
этого паразита отсутствует. Это позволяет исключить
род Caryotropha из отряда Eucoccidiida и поместить
его в отряд Protococcidiida. Однако Ливайн (Levine,
1980а, 1980b) сохраняет прежний статус сем. Caryot-
rophidae и включает в него второй род — Dorisiella.
Род Dorisiella Ray, 1930
Ооцисты не имеют четких очертаний и спорулиру-
ют в организме хозяина. В ооцисте образуется два спо-
робласта, которые в дальнейшем располагаются внут-
ри паразитофорной вакуоли в цитоплазме зараженной
клетки кишечника хозяина. Внутри каждого споро-
бласта (спороцисты?) формируется по 8 спорозоитов.
1 вид.
Типовой вид Dorisiella scololepis Ray, Л930.
Типовой хозяин: морская полихета Scololepis
fulinginosa.
С характеристикой рода. Паразитируют в кишечни-
ке хозяина.
Сем. Lankesterellidae NoIler, 1902
Жизненные циклы гомоксенные, но с облигатной
трансмиссией через беспозвоночного кровососа как
механического переносчика. Меро-, гамо- и спорого-
ния осуществляются в кишечнике, соединительной
ткани внутренних органов позвоночного хозяина.
Внутри ооцист спороцисты не образуются, и сформи-
ровавшиеся спорозоиты лежат свободно. Число споро-
зоитов в ооцистах разных видов колеблется от 8 до 70.
После разрушения стенки ооцисты высвободившиеся
спорозоиты внедряются в клетки крови и становятся
«спящими спорозоитами». На этом завершается разви-
тие паразита в позвоночном хозяине.
Передача спорозоитов от одного позвоночного хо-
зяина к другому происходит с помощью беспозвоноч-
ного кровососа (клеща, двукрылого или пиявки). Зара-
жение позвоночного хозяина происходит при поеда-
нии им переносчика, инфицированного спорозоитами.
В эксперименте показана возможность трансмиссии
зонтов при акте кровососания переносчика. В орга-
низме переносчика спорозоиты не претерпевают ника-
кого развития, а, попадая в позвоночного хозяина,
приступают к бесполому размножению (мерогонии).
2 рода.
Паразиты, объединенные в данное семейство, в те-
чение долгого времени считались гемогрегаринами хо-
лоднокровных животных. Исследования Рейхенова и
Нёллера (Reichenow, 1921) показали, что стадии, за-
ключенные внутри эритроцитов или лейкоцитов, явля-
ются не мерозоитами или гамонтами, а спорозоитами,
и что все эндогенное развитие паразитов происходит
либо в стенке кишки, либо в эндотелии кровеносных
сосудов внутренних органов хозяина.
Венион (Wenyon, 1926) выделяет внутри сем. Lan-
kesterellidae два подсемейства, каждое с одним родом
соответственно, Schellackia и Lankesterella. Ливайн
(Levine, 1973b) предпочитает не выделять указанные
роды в самостоятельные семейства. Мы придержива-
емся классификации Ливайна.
Род Lankesterella Labbe, 1899
(= Anguillula Chaussat, 1850; Drepanidium Lankester,
1871; Drepanidia Lankester, 1882, lapsus calami',
Haemogregarina Danilevsky, 1885, pro parte;
Drepanidia Grassi et Feletti, 1892, pro parte;
Atoxoplasma Garnham, 1950)
Жизненные циклы гомоксенные, но с облигатным
включением механического переносчика. Эндогенное
развитие паразита осуществляется в клетках эндоте-
лия кровеносных сосудов, а также в макрофагах и лей-
коцитах амфибий, реже рептилий, В ооцистах разных
видов формируется от 8 (у L. hylae из Hyla caerulea) до
16—32 (у L. minima из Rana esculenta) и даже 70 (у
L. minima из Rana catesbeiana) свободных спорозои-
тов. После разрыва стенки ооцисты спорозоиты попа-
дают в кровяное русло и внедряются в клетки белой и
красной крови. Паразиты бесхвостых амфибий, яще-
риц, птиц. Механическими переносчиками служат
кровососы пиявки, клещи, двукрылые. 8 видов.
Типовой вид Lankesterella minima (Chaussat,
1850) NoIler, 1912.
(= Anguillula minima Chaussat, 1850; Drepanidium
гапагит Wallcrstein, 1882; Dactylosomaprinceps Labbe,
1894; Lankesterella гапагит Labbe, 1899; Haemogrega-
rina minima Mathis et Leger, 1911).
Типовые хозяева: лягушки Rana esculenta и R.
catesbeiana.
Переносчик: пиявкаHemiclepsis marginata, Bat-
racobdella picta.
ТИП SPOROZOA. КЛАСС COCCIDEA
203
В позвоночном хозяине мерозоиты L. minima лока-
лизуются внутри фагоцитов и здесь же трансформиру-
ются в гамонтов. В эндотелиальных клетках внутрен-
них органов пиявки, насосавшейся крови инфициро-
ванных R. catesbeiana, формируются ооцисты, в
которых образуется до 70 спорозоитов. Впоследствии
спорозоиты, вышедшие из ооцист, мигрируют к клет-
кам слюнных желез. Трансмиссия патогена позвоноч-
ному хозяину при акте кровососания пиявки была
удачной только в эксперименте. Однако такой способ
передачи паразита позвоночному хозяину не согласу-
ется с общепринятыми представлениями, согласно ко-
торым трансмиссия спорозоитов в естественных усло-
виях возможна только при поедании позвоночным хо-
зяином зараженного беспозвоночного хозяина («Ьу
ingestion of sporozoite-bearing host») (Levine, 1988).
Lankesterella garnhami Lainson, 1959.
(= Atoxoplasma garnhami Lainson, 1959).
Хозяин: домовой воробей Passer d. domesticus.
Переносчик: клещ Dermonyssus gallinae.
Спорозоиты L. garnhami (рис. 118, 7) попадают в
воробья после съедания им зараженных клещей, в теле
которых спорозоиты сохранились в неизменном виде
после акта кровососания на зараженных воробьях (или
канарейках). Спорозоиты проходят через стенку ки-
шечника воробья (рис. 118,2) и попадают в клетки лим-
фо-макрофагальной системы печени, костного мозга и
других внутренних органов. В этих клетках спорозои-
ты растут и становятся меронтами, в которых соверша-
ется процесс мерогонии (шизогонии) (рис. 118, 3—6).
Различается два типа меронтов: макро- и микромерон-
ты (шизонты). Макромеронты дают начало макрога-
монтам (рис. 118, 8—10) и микрогамонтам (рис. 118,
11—13). Дальнейшее развитие совершается в лим-
фоцитах и макрофагах внутренних органов воробья.
Зигота покрывается оболочкой (рис. 118, 10) и стано-
вится ооцистой. Споруляция ооцист происходит в тка-
нях зараженного хозяина (рис. 118, 14). В ооцисте фор-
мируется множество спорозоитов размером 3.8 X
1.8 мкм, не заключенных внутри спороцист (рис. 118,
15). После высвобождения из ооцисты спорозоиты
внедряются в моноциты (рис. 118, 16) и лимфоциты
(рис. 118,17) циркулирующей крови. Внутри этих кле-
ток спорозоиты оказываются несколько крупнее (5.0 X
3.0 мкм). Клещ заглатывает спорозоитов при акте кро-
вососания, спорозоиты передаются новому позвоноч-
ному хозяину при поедании им зараженных клещей.
Принципиально сходным оказалось развитие
L. baznosanui, пока единственного вида Lankesterella
из рептилий.
Lankesterella baznosanui Chiriac et Steopoe, 1977.
Хозяин: ящерица Lacerta vivipara.
Переносчик: предположительно клещ.
Мерогония протекает в клетках эндотелия крове-
носных сосудов ящерицы, преимущественно вен.
Крупные зрелые меронты сдвигают ядро зараженной
клетки. Предположительно имеется две генерации
меронтов. Гамогония и последующее формирование
гамет совершаются также в эндотелии кровеносных
сосудов. В микрогамонте образуется множество мик-
рогамет. В ооцисте формируется 12—16 спорозоитов с
центрально расположенными ядрами. Спорозоиты
крупнее мерозоитов. Способ трансмиссии споро-
зоитов L. baznosanui позвоночному хозяину не вы-
яснен.
На ультраструктурном уровне изучено несколько
видов Lankesterella, включая один вид из Rana pipiens,
L. hylae из древесной лягушки Hyla caerulea (Stehbens,
1966) и L. minima из Rana catesbeiana, R. clamitans и
R. septentrionalis (Tse et al., 1986). Данные по ультра-
структуре ланкестерелл подтвержают их принадлеж-
ность к споровикам. Спорозоиты покрыты трехмемб-
ранной пелликулой, в которой выявляются микропо-
ры. Имеются полярные и преконоидальные кольца, а
также роптрии и микронемы.
У L. minima существуют различия между спорозои-
тами внутри эритроцитов позвоночного хозяина и
спорозоитами в организме «механического перенос-
чика» пиявки Batracobdella picta. В последнем случае
имеет место аффинитет к слюнным железам пиявки,
хотя возможность трансмиссии L. minima через укус
беспозвоночного кровососа не доказана. Форма тела
таких спорозоитов была несколько иной, в них на-
блюдалось скопление плотных тел, а число микронем
было меньше, чем в спорозоитах внутри эритроцитов
позвоночного хозяина. Эти особенности спорозоитов
из механического переносчика могут отражать инте-
ресное, хотя еще мало понятное биологическое явле-
ние старения спорозоитов (aging) в организме пере-
носчика.
Род Schellackia Reichenow, 1919
(= Gordonella Ray et Sarkar, 1969; Lainsonia Landau,
1973)
Трансмиссия паразита типовому хозяину осущест-
вляется с помощью механического членистоногого пе-
реносчика. В эксперименте удалось заразить одного
типового хозяина от другого при каннибализме (Bris-
tovetzky, Papema, 1990). Процессы меро-, гамо- и спо-
рогонии совершаются в клетках кишечника хозяина,
и только спорозоиты внедряются в клетки крови. Ме-
ханическими переносчиками служат клещи и двукры-
лые кровососы. В тонкостенной ооцисте формируется
8 свободных спорозоитов. Паразиты рептилий и амфи-
бий. 12 видов.
Типовой вид Schellackia bolivari Reichenow,
1919.
Типовые хозяева: ящерицы Acanthodactylus
vulgaris и Psammodromus hispanicus.
Механический переносчик: клещ Lyponys-
sus saurarum.
Спорозоиты Sch. bolivari высвобождаются из кле-
ща в кишечнике ящерицы и приступают к мерогонии
в эпителиальных клетках кишки (рис. 119, Д). Через
3—4 нед в соединительной ткани кишки формируются
гамонты. Макрогамонты мигрируют в субэпителий,
тогда как развитие микрогамонтов происходит в эпи-
телии кишечника. В микрогамонте образуется мно-
жество двужгутиковых микрогамет. Ооциста покры-
вается тонкой стенкой, и в ней совершаются одно
редукционное и два митотических деления. В резуль-
тате образуются 8 спорозоитов, свободно лежащих
204
ALVEOLATA
Рис. 118. Схема развития Lankesterella garnhami. (По: Lainson, 1959; модифицировано).
1 — в организме клеща эритроцитарные меронты сохраняются в неизменном виде и после поедания такого клеща воробьем попадают в просвет кишки воро-
бья; 2 — прохождение спорозоита через стенку кишки воробья; 3 — проникновение спорозоита а клетку лимфоидно-макрофагальной системы; 4—6 — по-
следующие этапы мерогонии; 7— макромерозоит; 8—10 — дифференцировка макрогамоита в макрогамету (/0); 11-13 — сегментация микрогамонта и об-
разование микрогамет; 10— оплодотворение; 14 -ядерное деление в ооцисте; 15 — ооциста со множеством спорозоитов; 16, 17 — спорозоиты в мононукле-
арных клетках периферической крови воробья, откуда они затем попадакн в клеща при акте кровососания.
Fig. 118. Scheme of the life cycle of Lankesterella garnhami.
1 — in the tick body, erythrocytic meronts remain unchanged; after being eaten by a sparow, erythrocytic meronts appear in the lumen of spanow intestine; 2 — sporo-
zoite passing through the spanow intestinal wall; 3 — sporozoite penetration of lymphoid-macrophageal cells; 4—6 — merogony; 7— macromerozoite; 8—10 — mac-
rogamont differentiation into macrogamete, and fertilization (10); 11—13 — macrogamont segmentation and microgamete fonnation; 14 — nuclear development in the
oocyst; 15 — oocyst with numerous sporozoites; 16, 17— sporozoites in mononucleate cells of sparrow’s peripheral blood to be taken by a tick during blood sucking.
внутри ооцисты, и остаточное тело. После разры-
ва стенки ооцисты спорозоиты попадают в кровенос-
ные сосуды и внедряются в эритроциты (у Acanthodac-
tylus vulgaris) или лимфоциты (у Psammodromus hispa-
nius). Клещ L. saurarum при кровососании заглатывает
инфицированные спорозоитами клетки крови яще-
рицы. Новый хозяин (ящерица) получает спорозоитов
шеллакии при поедании зараженных клещей, со-
ставляющих естественный пищевой рацион этих реп-
тилий.
ТИП SPOROZOA. КЛАСС COCCIDEA
205
Рис. 119. Схематическое изображение постепенного перехода эндогенных стадий эймериидных кокцидий из кишечного эпителия в суб-
эпителий. (По: Lainson et aL, 1976; модифицировано).
Устойчивые толстостенные ооцисты (уо) классических кокцидий рода Tyzzeria заменяются неустойчивыми тонкостенными ооцистами (ио) кокцидий рода
Schellackia, при разрыве которых спорозоиты выделяются в кровь. I— просвет кишки, II—эпителий кишки, III— субэпителий; А — Tyzzeria, Б — Schella-
I'klil halli.B— Sch. brygooi,T—Sch. landaue. fl—Sch. bolivari',Kc— кровеносный сосуд, ма — макрогамета, ми — микрогаметы, ио — неустойчивая ооциста,
сп — спорозоиты, ш — шизонт.
Иц. 119, Scheme of a progressive sinking (penetration) of endogenous stages of eimeriid coccidia from the intestinal epithelium into the subepitheli-
um.
Resistant thlek-wnllcd oocysts of Tyzzeria are replaced by not resistant thin-walled oocysts of Schellackia; after the rupture of thin-walled oocysts sporozoites are relea-
sed into the blood. / — lumen of the intestine, II— intestinal epithelium, III— subepithelium; A — Tyzzeria, Б—Schellackia balli, В — Sch. brygooi, Г— Sch. lan-
ilaue, Д Sch, halivari; кс — blood vessel, ма — macrogamete, mu — microgametes, ио — non-sporulated oocyst, cn — sporulated oocyst, ш — schizont.
206
ALVEOLATA
Schellackia landaue Lainson, Shaw, Ward, 1976.
Хозяин: бразильская игуана Plychrus macroratus.
Механический переносчик: комар Culexpi-
piens.
Спорозоиты попадают к ящерице при съедании ко-
мара. В течение 30 сут в кишечнике ящерицы соверша-
ются процессы меро- и гамогонии и образования
ооцист. Зигота подвижна, ооциста развивается в lamina
propria. Дополнительное бесполое размножение про-
исходит путем эндодиогении во внекишечных орга-
нах — селезенке и печени.
Споруляция завершается через 30—45 сут. Споро-
зоиты высвобождаются из ооцист и внедряются в эрит-
роциты, лимфоциты, моноциты и клетки РЭС и перехо-
дят в состояние спячки (персистирование). Спорозоиты
попадают в комара при акте кровососания. Проникая в
клетки кишечного эпителия среднего желудка комара,
спорозоиты также переходят к персистированию.
Дополнительные сведения о видах рода Schellackia
содержатся в специальных публикациях (Lainson et al.,
1976; Klein et al., 1988; Bristovetzky, Papema, 1990; Des-
ser, 1993).
При сравнении разных видов Schellackia удается
проследить постепенное уменьшение площади кишеч-
ного эпителия, используемой эндогенными стадиями
паразита для своего развития, и их постепенное по-
гружение в субэпителий (Lainson et al., 1976). Последо-
вательность таких событий представлена на рис. 119.
У Sch. balli формирование и споруляция ооцист совер-
шаются еще в эпителии кишечника. У Sch. brygoi и
Sch. landaue рост, развитие и оплодотворение макро-
гаметы проходят еще в клетках кишечника, тогда как
споруляция и разрыв ооцисты наблюдаются уже в
субэпителии. И наконец, у Sch. bolivari макрогамопт с
самого начала развития попадает в субэпителий.
После разрушения ооцисты спорозоиты Schellackia
внедряются не только в эритроциты, но и в клетки ре-
тикулоэндотелиальной системы внутренних органов
ящерицы. Здесь спорозоиты могут оставаться в тече-
ние неопределенно долгого времени в состоянии ин-
фекционной паузы.
Эндогенные стадии развития Schellackia имеют зна-
чительное ультраструктурное сходство с гомологичны-
ми стадиями классических кишечных кокцидий рода
Eimeria. К числу особенностей микрогамонтов Sch.
agamae относится наличие у них кристаллоида и ми-
тохондрий. В то же время структура парануклеарных
тел в спорозоитах шеллакий сходна с таковой эймерий.
Спорозоиты Sch. agamae оказывают значительное ци-
топатогенное воздействие не только на клетки крови, но
и на другие зараженные клетки, особенно гепатоциты.
Сем. Lankesterellidae представляет интерес как важ-
ное звено в эволюции кишечных кокцидий в сторону
кровепаразитизма, приведшей к образованию гемоспо-
ридий и, по-видимому, пироплазмид. Из двух родов
этого семейства, Schellackia и Lankesterella, первый
оказывается более древним, поскольку мерогония и
часть гамогонии у него совершаются еще в клетках
эпителия кишечника позвоночного хозяина (рис. 119,
Б—Д). У видов Lankesterella все эндогенное развитие
проходит уже не в кишечнике, а в клетках РЭС внут-
ренних органов (рис. 118).
Сем. Atoxoplasmatidae Levine, 1982
Жизненные циклы гомоксенные. Меро- и гамого-
ния в организме хозяина, спорогония во внешней сре-
де. Эндогенное развитие совершается внутриклеточно:
мерогония в клетках крови и кишечника, гаметогония
только в клетках кишечника. Заражение нового хозяи-
на происходит при поедании спорулированных ооцист.
Паразиты птиц. 1 род.
Род Atoxoplasma sensu lato Garnham,
1950
(= Drepanidium Lankester, 1871, pro parte; Haemogrega-
rina Danilewsky, 1885, pro parte; Lankesterella Labbe,
1899, pro parte; Hepatozoon Miller, 1908, pro parte; Leu-
kocytogregarina Porter, 1909, pro parte; Toxoplasma Ni-
colle et Manceaux, 1909, pro parte)
Ооцисты с двумя спороцистами, в каждой по 4 спо-
розоита. Мерогония, гамогония и образование ооцист
в кишечнике хозяина; дополнительно мерогония про-
исходит также вне кишечника и во внутренних орга-
нах. Паразиты воробьиных птиц и родственных хозя-
ев. 19 видов.
В середине XX в. в сем. Lankesterellidae была вклю-
чена группа кровепаразитов птиц, ранее именовавших-
ся «паразитами неизвестного систематического поло-
жения». По своей морфологии эти паразиты напомина-
ли трофозоитов (зоитов) Toxoplasma, но они были
описаны в 1900 г. Лавераном и получили название Ha-
emamoeba danilewskyi (Plasmodium ргаесох). Другие
исследователи относили их к родам Haemogregarina
или Toxoplasma.
Гарием (Garnham, 1950) справедливо отмечал, что
обсуждаемые кровепаразиты не имеют ничего общего
с родом Toxoplasma, и дал им провизорное название
Л toxoplasma, подчеркнув добавлением буквы «А», что
данные возбудители паразитируют только у птиц
(Avcs). В диагнозе рода A toxoplasma Gamham, 1950 об-
ращалось внимание, что его представители паразити-
руют в моноцитах птиц, являются хозяино-специфич-
ными и непатогенными. Этим подчеркивалось прин-
ципиальное различие между родами Atoxoplasma и
Toxoplasma.
Позднее Лэнсон (Lainson, 1959) сообщил об удач-
ной трансмиссии Atoxoplasma от зараженного воробья
к нсзараженному путем скармливания последнему
клещей, ранее кормившихся на первом. Оказалось, что
в клещах паразиты не претерпевали видимого разви-
тия. Так был выделен самостоятельный вид Л. garnha-
mi Lainson, 1959.
Детальное изучение нового вида показало, что
A. garnhami есть не что иное, как один из видов рода
Lankesterella. В связи с этим сам Лэнсон свел A. garn-
hami в синоним Lankesterella garnhami. Однако это не
решило статуса рода Atoxoplasma.
Последующее изучение этой группы привело к не-
ожиданным результатам. При вскрытии воробьев и ка-
нареек, которым скармливали ооцисты Isospora типа
elsospora lacazei», оказалось, что половые стадии этих
паразитов локализовались только в клетках кишечного
ТИП SPOROZOA. КЛАСС COCCIDEA
207
эпителия (Box, 1970). В то же время бесполые стадии
(мерозоиты) выявлялись как в кишечнике, так и в клет-
ках лимфоидно-макрофагальной системы внутренних
органов птиц. Такие зоиты имели морфологическое
сходство со стадиями, ранее описанными как мерозои-
ты A toxoplasma. На этом основании Бокс пришла к вы-
воду, что бесполые стадии в лимфоцитах и макрофагах
канареек суть мерозоиты Isospora serini, а не Atoxop-
lasma (Box, 1975, 1977, 1981). Ливайн (Levine, 1982b)
выделил род Atoxoplasma в самостоятельное семей-
ство.
Типовой вид Atoxoplasma adiei (Aragao, 1911).
(= Haemogregarina adiei paddae Aragao, 1911; Lan-
kesterella adiei (Aragao, 1911) Lainson, 1959; Lankeste-
rella passeris Raffaele, 1938; Toxoplasmapasseris Rous-
selot, 1953; Isospora serini (Aragao, 1933) Box, 1975).
Типовой хозяин: Passer domesticus.
Гомоксенный жизненный цикл, без промежуточно-
го хозяина. Заражение нового хозяина осуществляется
через ооцисты, выделяющиеся во внешнюю среду. Ме-
рогония включает пять генераций, которые протека-
ют в мононуклеарных фагоцитах легких; гаметогенез
происходит только в тонком кишечнике хозяина. Пре-
патентный период может длиться до 230 сут (Box,
1977). Длительный (хронический) характер выделения
ооцист связан с наличием внекишечной мерогонии,
что характерно для изоспорин птиц.
Наиболее полная информация о видах Atoxoplasma
содержится в сводке Ливайна (Levine, 1982b).
Сем. Pfeifferinellidae Grassd, 1953
Жизненные циклы моно- и гомоксенные. Ооцисты
без спороцист, и в них формируются от 2 до 16 свобод-
ных спорозоитов и остаточное тело. В ооцистах хо-
рошо заметно микропиле. В ходе мерогонии (шизо-
гонии) образуется множество мерозоитов. По перифе-
рии ядра макрогаметы располагается от одного до
нескольких ядрышек. Паразиты моллюсков и приапу-
лид. 2 рода.
Род Pfeifferinella von Wasielewski, 1904
Ооцисты размером 12.0 X 1.5—2.0 мкм без споро-
цист, с 8—14 спорозоитами. Ранее описанная в макро-
гамете Р. ellipsoides «вагинальная трубка» (Leger, Hol-
lande, 1912) сегодня рассматривается как модифика-
ция микропиле ооцисты, которое становится заметным
после оплодотворения и в начале процесса споруля-
ции. Паразиты моллюсков. 6 видов.
Типовой вид Pfeifferinella ellipsoides von Wasie-
IcWNki, 1904.
T ИIIО И ы с хозяева: пресноводные моллюски —
Plaiiorhtiiis Corneils, Stagnicola elodes, Physa gyrina, Ap-
lexa liypnornin,
Ооцисты опальные или эллипсоидные, 13—15 мкм
в диаметре, имеют отчетливо видимое микропиле, но
лишены спороцист. В ооцистах формируются 8 споро-
зоитов с заостренными концами размером 12.0 х 1.5—
2.0 мкм и остаточное тело. Мерогония и гамогония в
клетках печени моллюска. Меронты достигают 20 мкм
в диаметре, и в них формируется до 60 мерозоитов. Зи-
гота покрывается оболочкой, и спорулированные
ооцисты выделяются во внешнюю среду.
Pfeifferinella impudica Leger et Hollande, 1912.
Хозяин: наземные моллюски Limax marginatus и
Triodopsis albolabris.
Ооцисты овальные, размером 20 X 10 мкм, имеют-
ся остаточное тело и микропиле. Мерогония и гамого-
ния в клетках печени моллюска. В меронтах размером
30 мкм формируется множество мелких мерозоитов.
Микрогамонты размером 15—40 мкм с множеством
микрогамет, достигающих 0.4 мкм и меньше.
Макрогаметы овальные, размером 10—15 мкм.
В ядре макрогаметы имеется несколько ядрышек
(«кариосом»); цитоплазма содержит гранулы запас-
ного вещества. Ранние авторы (Leger, Hollande, 1912)
различали в макрогамете два полюса: ростральный и
антиростральный. На последнем из полюсов было
замечено формирование временной эозинофильной
трубкообразной структуры («вагинальной трубки»).
Выпячиваясь через клетку хозяина в просвет печени
моллюска, эта трубка служила якобы для улавли-
вания оттуда микрогамет, обеспечивая их доступ к
макрогамете. Впоследствии эти данные не подтвер-
дились.
Pfeifferinella gugleri Wacha, 1980.
(= Alveocystis gugleri Levine, 1985).
Хозяин: моллюск Triodopsis albolabris.
Ооцисты овальные, 21.0 X 14.5 мкм, микропиле
тонкое, немного прогнутое. Остаточное тело имеется.
Меронты, гамонты и ооцисты локализуются в альвео-
лярных клетках печени моллюска. Ооцисты встреча-
ются также и в кишечнике.
Число бесполых генераций неизвестно. В крупных
меронтах (20 X 15 мкм) формируется 24—32 мерозои-
та размером 8—10 X 2.0 мкм. Пузырьковидное ядро
мерозоита располагается в нижней трети тела. Микро-
гамонты эллипсоидные, овальные или округлые, раз-
мером 15.0 X 11.5 мкм. В микрогамонте формируется
множество мелких жгутиковых микрогамет. В оваль-
ных макрогаметах размером 29.0 X 10.5 мкм разли-
чаются два полюса: полярный и антиполярный. Ядро
макрогаметы занимает центральное положение и со-
держит 1—5 фельген-негативных ядрышек.
Спорогония происходит в тканях хозяина, и во
внешнюю среду выделяются преимущественно спору-
лированные ооцисты. Во время деления ядра зиготы
клетка паразита разделяется на две части: полярную,
содержащую ядро, и безъядерную антиполярную с
многочисленными цитоплазматическими гранулами.
В дальнейшем в полярной части формируется 8 сво-
бодных спорозоитов, а остаточное тело ооцисты рас-
полагается в антиполярной части.
Вагинальная трубка, описанная у других видов это-
го рода, у Р. gugleri не была обнаружена. По мнению
автора исследования (Wacha, 1980), вагинальная труб-
ка представляет собой небольшое скопление эозино-
фильного материала, участвующего впоследствии в
формировании стенки ооцисты. Этот материал распо-
лагается внутри серповидной вакуоли, что создает впе-
чатление присутствия некой трубки. Поскольку нали-
208
ALVEOLATA
чие вагиш1ЛЫ1()й трубки исходно рассматривалось в
KU40CTIW решиющого таксономического признака
сем. 1’1’ellToi'lncllidae, Ваша (Wacha, 1980) предлагает
убрать этот признак из диагноза семейства, а вместо
него использовать признак — образование в ядре мак-
рогаметы нескольких нуклеол. В связи с этим следует,
однако, заметить, что у рода Alveocystis, провизорно
включаемого в это семейство, в ядре макрогаметы
имеется всего лишь одно центральное ядрышко.
Представляет интерес, что структура ооцисты,
включающая наличие 8 или более свободных спорозо-
итов и отсутствие спороцисты, характерна не только
для представителей сем. Pfeifferinellidae. Ооцисты по-
добного строения описаны также у Schellackia Reiche-
now, 1919 из сем. Lankesterellidae и у Tyzzeria Allen,
1936 из сем. Eimeriidae.
Род Alveocystis Beltenev, 1980
Спорулированные ооцисты в пределах одного ви-
да имеют непостоянное число спорозоитов (2—16);
спороцисты не выявлены. Имеется несколько гене-
раций мерогонии; меронты разных генераций разли-
чаются морфологически. В крупных макрогаметах
не наблюдается образования стенкообразующих тел.
В микрогамонтах формируется множество крупных
двужгутиковых веретенообразных микрогамет, в ци-
топлазме которых хорошо заметны зернистые включе-
ния. Оплодотворение происходит внеклеточно. Спору-
ляция ооцист совершается во внешней среде, и ее ско-
рость зависит от температуры окружающей воды.
Паразиты морских беспозвоночных приапулид. 1 или
2 вида.
Отдельные стадии жизненного цикла кокцидий
приапулид Северного моря Priapulus caudatus и Halic-
ryptus spinulosus были впервые описаны еще в 40-е гг.
XX столетия. На препаратах кишечника приапулид
удавалось различать меронтов, микро- и макрогамон-
тов, макрогаметы и неспорулированные ооцисты.
Овальные ооцисты внутри клеток достигали 25—30 X
17—20 мкм, тогда как внеклеточные ооцисты, покры-
тые двуслойной оболочкой, были крупнее (27—33 X
13—30 мкм). В оболочке ооцисты имелось микропиле
диаметром 4 мкм. В овальных меронтах формирова-
лось 15—20 мерозоитов без остаточного тела. Люлинг
не дал новому паразиту родового названия, а в качест-
ве видового предложил название «macrocoronata». Для
того чтобы этот организм впоследствии не потерял-
ся, Ливайн (Levine, 1977) отнес его условно к роду
Klossia.
Бельтенев (1980) выполнил детальное светооптиче-
ское исследование кокцидий, паразитирующих на тех
же видах приапулид {Priapulus caudatus и Halicryptus
spinulosus}, но обитающих в Белом море, изучил их
полный жизненный цикл и описал морфологию стадий
разития. Это позволило Бельтеневу обосновать новый
род и вид Alveocystis intestinalis (рис. 120).
Позднее Маклин (McLean, 1984) описал ультра-
структуру меронтов, гамонтов, мерозоитов и гамет
кокцидий из приапулид Тихого океана Priapulus cau-
datus. Было показано, что в ооцистах этой кокцидии
имеется 8 свободных спорозоитов.
Дифференциальный анализ всех имеющихся нахо-
док привел Ливайна (Levine, 1985) к заключению о ва-
лидности рода Alveocystis, описанного Бельтеневым из
приапулид, однако в качестве видового названия ре-
комендовалось использовать ранее предложенное Лю-
лингом название «macrocoronata». Более поздние ис-
следования установили значительное сходство между
родами Pfeifferinella и Alveocystis в морфологии их ста-
дий развития и структуре жизненных циклов. В связи с
этим было предложено считать эти роды синонимами
(Upton, 2000). Однако мы оставляем за собой право со-
хранить самостоятельность рода Alveocystis и вклю-
чить его в качестве второго рода в сем. Pfeifferinellidae.
Типовой вид Alveocystis macrocoronata (Luling,
1942) n. comb. Levine, 1985.
(= Alveocystis intestinalis Beltenev, 1980; Klossia
macrocoronata (Luling, 1942) Levine, 1977; ? macroco-
ronata Luling, 1942).
Хозяева: приапулиды Северного и Белого морей
и Тихого океана—Priapulus caudatus и Halicryptus spi-
nulosus.
Мерогония (шизогония) в эпителиальных клетках
кишечника приапулид (см. рис. 87). В ходе мерогонии
различаются четыре разных морфофункциональных
типа меронтов и мерозоитов, при этом два последних
обозначаются как макро- и микромеронты, формирую-
щие соответственно макро- и микромерозоитов. Встре-
чаются 2-, 3- и 4-ядерные меронты, сохраняющие фор-
му и подвижность мерозоитов, но более крупные
по размерам: 8—12 мкм против 5.0—7.5 мкм. Часть
мерозоитов, попадая в просвет кишки, окружаются
чехлом из слизистого секрета эпителиальных клеток и
при дефекации выводятся наружу. Внутри такого чех-
ла мерозоиты могут сохраняться в неизмененном виде
до 7—8 сут. Дальнейшая судьба мерозоитов неиз-
вестна.
Микромерозоит дает начало микрогамонту, в кото-
ром формируется 60—70 микрогамет в форме корот-
кого, но широкого веретена. Полностью сформировав-
шиеся микрогаметы отпочковываются от поверхности
материнского гамонта. На переднем конце микрогаме-
ты расположены два жгутика, длиннее самой гаметы в
2—4 раза. Ядро микрогаметы смещено к переднему
концу, цитоплазма богата полисахаридами (амилопек-
тином).
Ядро макрогаметы крупное, пузырьковидное, с
крупным центральным ядрышком. В процессе роста в
цитоплазме макрогаметы идет интенсивное накопле-
ние амилопектина. Сот 1-го типа имеют гликопротеи-
новую природу.
Оплодотворение макрогаметы происходит внекле-
точно в просвете кишки. Ооциста заключается в слизи-
стый чехол и выводится наружу с экскрементами хозя-
ина. Оболочка ооцисты толстая и гладкая, в ней отчет-
ливо заметно микропиле. Размеры ооцист варьируют
от 12 до 34 мкм в длину и от 9 до 22 мкм в ширину
(в среднем 22 X 15 мкм). Индекс формы колеблется
от 1.25 до 2.35. Размеры микропиле также подвержены
колебаниям.
Ооцисты спорулируют во внешней среде. Число
спорозоитов в ооцисте зависит от ее исходной величи-
ны. Так, в ооцистах длиной 15, 20 и 25 мкм формиру-
ются соответственно 2,4 (наиболее часто) и 8 спорозо-
ТИП SPOROZOA. КЛАСС COCCIDEA
209
Рис. 120. Схема развития Alveocystis intestinalis в организме Priapulus caudatus. (По: Бельтенев, 1983).
1 — спорозоит, 2 — одноядерный меронт, 3 — мерогония по типу шизогонии, 4 — микрошизогония, 5 — макрошизонт, 6 — микрогамонт, 7 — формирова-
ние микрогамет на поверхности микрогамонта, 8 — микрогамета, 9 — макрошизогония, 10 — макромерозоит, И — молодая макрогамета, 12 — зрелая мак-
рогамета, 13 — спорулированная ооциста.
Fig. 120. Scheme of Alveocystis intestinalis development in Priapulus caudatus.
1 — sporozoite, 2 — uninucleate meront, 3 — merogony (schizogony), 4 — microschizogony, 5 — macroschizont, 6 — microgamont, 7 — microgamete formation on
the surface of a microgamont, 8 — microgamete, 9 — macroschizogony, 10—macromerozoite, 11 —young macrogamete, 12 — mature macrogamete, 13 — sporula-
ted oocyst.
итов. Максимальное число спорозоитов, наблюдавше-
еся в ооцисте, достигало 16. Процесс споруляции
весьма продолжителен и зависит от температуры
воды: при 15—20 °C он занимает не менее 25 сут, а при
3—5 °C около 70 сут; при более низкой температуре
споруляция не идет.
Мерозоиты Alveocystis покрыты типичной трех-
мембранной пелликулой. Имеются микронемы. Коно-
ид хорошо выражен; от полярного кольца отходят
43 субпелликулярные трубочки. Микрогаметы разме-
ром 5x2 мкм имеют по 2 жгутика и 1—2 митохонд-
рии; цитоплазма богата полисахаридами (рис. 88).
Вдоль тела микрогаметы A. macrocoronata проходят
субпелликулярные микротрубочки, напоминая по это-
му признаку безжгутиковые микрогаметы Cryptospori-
dium.
Молодые макрогаметы еще сохраняют трехмемб-
ранную пелликулу зоита. По мере их роста в цитоплаз-
ме накапливаются гранулы амилопектина и липидные
капли; имеется разветвленная шероховатая эндоплаз-
матическая сеть. Зрелые, но еще внутриклеточные
макрогаметы A. macrocoronata покрываются снаружи
сетчатой стенкой сложного строения, в формировании
которой, по-видимому, принимает участие материал
паразитофорной вакуоли (рис. 88). Этот признак также
сближает данного паразита с кокцидиями рыб. Однако
в отличие от них оплодотворение у A. macrocoronata
совершается внеклеточно — в просвете кишки хозяи-
на. При этом микрогамета проникает в тот участок
макрогаметы, в котором отсутствует сетчатая стенка и
который на светооптическом уровне обычно трактует-
ся как микропиле (рис. 88, 2, стрелка). Ооцисты до-
стигают размеров 18—27 X 10—14 мкм с толщиной
стенки 0.7 мкм.
Анализируя статус рода Alveocystis, Ливайн (Levi-
ne, 1985) положил в основу ошибочное положение о
постоянном наличии в ооцистах этого рода восьми го-
лых спорозоитов и на этом основании предложил из-
менить статус вида Pfeifferinella gugleri Wacha, 1980,
включив его в род Alveocystis в качестве второго
вида — A. gugleri.
Сем. Barrouxidae Leger, 1911
Жизненные циклы гомоксенные. В ооцисте форми-
руется разное число спороцист. В спороцистах содер-
жится разное число спорозоитов. В спороцистах раз-
ных родов имеется либо шов, либо тельце Штида. Спо-
руляция ооцист внутри и вне хозяина. Паразиты
пойкилотермных позвоночных и беспозвоночных жи-
вотных. 4 рода.
14 Зак. №4163
210
ALVEOLATA
Род Barrouxia (Barroussia) Schneider, 1885
(= Eimeria Schneider, 1875, pro parte; Echinospora
Ldger, 1897; Urobarrouxia Mesnil, 1903)
Распространение: Европа (Франция), Азия
(Япония), Южная Америка, Африка.
В ооцисте формируются 2—80 спороцист, каждая
с одним спорозоитом. Шов в спороцистах продоль-
ный. Размеры ооцист у разных видов варьируют от
20—80 мкм до 60—70 X 55 мкм. Споруляция ооцист
происходит чаще во внешней среде, реже в организме
хозяина. Эндогенное развитие в эпителиальных клет-
ках кишечника. Паразиты беспозвоночных — много-
ножек, голых моллюсков, насекомых. 10 видов.
Типовой вид Barrouxia ornata Schneider, 1885.
(= Eimeria nepae Schneider, 1887).
Типовой хозяин: водяной скорпион Nepa ci-
nerea.
Распространение: Европа (Франция).
Эндогенное развитие совершается в клетках эпите-
лия кишечника клопа. Ооцисты округлые, 34—37 мкм
в диаметре, с множеством двустворчатых спороцист
размером 20 X 10 мкм. Более подробная информация
об остальных 9 видах рода Barrouxia содержится в
сводке Ливайна (Levine, 1983).
Наличие в спороцистах В. schneideri всего одного
спорозоита делает этого паразита удобным объектом
для изучения такого еще малопонятного феномена, как
определение пола у кокцидий.
Род Defretinella Hennere,
1966
В крупных ооцистах (около 70 мкм в диаметре)
формируется более 50 спороцист, в каждой из которых
образуется по нескольку десятков спорозоитов. Пара-
зиты полихет. 1 вид.
Типовой вид Defretinella eulaliaeHennere, 1966.
Типовой хозяин: полихета Eulalia viridis.
Распространение: Европа.
Мерогония и гаметогенез совершаются в клетках
эпидермиса полихет. В микрогамонте формируется
множество микрогамет. В ооцисте образуется более 50
двустворчатых спороцист, каждая с несколькими де-
сятками спорозоитов. В спороцисте имеется продоль-
ный шов. Ооцисты высвобождаются при разрыве тегу-
мента полихеты и спорулируют вне организма хозяи-
на, в морской воде.
Род Crystallospora Labbe, 1896
Ооцисты с четырьмя спороцистами, каждая с двумя
спорозоитами. Спороцисты напоминают кристаллы,
состоящие из двух пирамид с шестигранными основа-
ниями, соединенными друг с другом при помощи эква-
ториальной шовной линии. Паразиты рыб. 1 вид.
Типовой вид Crystallospora crystalloides (Thelo-
han, 1893) Labbe, 1896.
(= Coccidium crystalloides Thelohan, 1893; Crystal-
lospora thelohani Labbe, 1896; Eimeria crystalloides
(Thelohan, 1893) Doflein, 1909; Eimeria (Crystallospora)
crystalloides (Thelohan) Dogiel, 1948; Crystallospora
crystalloides (Thelohan, 1893) Dykova, Lorn, 1981).
Типовой хозяин: рыбы класса Osteichthyes.
Распространение: Атлантичекий океан у бере-
гов Франции, Тихий океан (залив Петра Великого,
Японское море).
Ооцисты сферические, 20—25 мкм в диаметре, с
очень тонкими стенками и, по-видимому, без микро-
пиле, остаточного тела и полярной гранулы. Стенка
спороцисты размером 13 X 9—10 мкм составлена из
двух створок в форме шестигранной пирамиды; тельце
Штида и остаточное тело отсутствуют. Спорозоиты в
форме полумесяца. Мерогония и спорогония в клетках
подслизистой оболочки тонкой кишки и в пилориче-
ском отделе слепой кишки.
Род Goussia Labbe, 1896
(= Eimeria Schneider, 1875 pro parte;
Coccidium Thelohan, 1894)
Ооцисты с четырьмя спороцистами, в каждой по
2 спорозоита. Ооцисты спорулируют в организме хозя-
ина. В двустворчатых спороцистах отсутствует тельце
Штида. Отличительным признаком рода является на-
личие в спороцистах двух створок и меридиального
шва между ними. В отличие от кокцидий рода Eimeria
в спороцистах Goussia имеется две пластины (створ-
ки), соединенные между собой швом. В отличие от
спороцист цистообразующих кокцидий (Toxoplasma,
Sarcocystis) стенка спороцисты Goussia составлена из
двух, а не из четырех пластин. Меро-, гамо- и спорого-
ния совершаются в хозяине. Паразиты пойкилотерм-
ных хозяев: рептилий, рыб, членистоногих. Распро-
странены всесветно. Свыше 30 видов, относящихся к
двум подродам — Goussia и Plagula.
Подрод Goussia (Goussia) Labbe,
1896
Для видов этого рода характерна высокая оопро-
дукция. В ооцисте формируется 4 спороцисты, в каж-
дой по 2 спорозоита. Спороцисты двустворчатые с
полным опоясывающим швом, без поддерживающей
вуали, апикальной поры или выростов стенки споро-
цисты («споридий»), без тельца Штида. Паразиты пой-
килотермных животных, преимущественно костистых
рыб, а также хрящевых рыб, рептилий, многоножек,
водяных жуков. 26 видов (Dykova, Lorn, 1981; Levine,
1983).
Типовой вид Goussia (Goussia) variabilis (Thelo-
han, 1893).
(= Coccidium variabilis Labbe, 1896; Eimeria variabi-
lis Reichenow, 1921).
Хозяева: рыбы семейств Cottidae, Anguillidae,
Blennidae, Labridae, Gobiesocidae, Gobiidae.
Распространение: всесветно.
Ооцисты округлые, 15—20 мкм в диаметре, с очень
тонкой стенкой, лишенные микропиле, остаточного
тела и полярной гранулы. Спороцисты удлиненные,
овальные, размером 8—11 X 4—5 мкм, с двумя мелки-
ми светопреломляющими образованиями. Остаточное
ТИП SPOROZOA. КЛАСС COCCIDEA
211
тело спороцисты отсутствует. Споруляция совершает-
ся в организме хозяина.
Более поздние исследователи считают типовым
видом данного подрода G. clupearum (Dykova, Lorn,
1981).
Типовой вид Goussia (Goussia) clupearum (The-
lohan, 1894).
(= Coccidium clupearum Thelohan, 1894; Eimeria clu-
pearum (Thelohan, 1894) Doflein, 1909; Eimeria wenyoni
Dobell, 1919).
Типовой хозяин: костистые рыбы: Clupea ha-
rengus, Sardina (Clupea) pilchardus, Sardina melanostic-
ta, Alosa sardina, Engrailis encrasicholus, Sprattus (Clu-
pea) sprattus, Etrumeus micropus; Micromesistius poutas-
sou, Scomber scomber.
Распространение: всесветно.
Паразитируют в печени хозяина. Ооцисты сфери-
ческие, 18—21 мкм в диаметре, без микропиле, редко
без остаточного тела. Спороцисты овальные, размером
9x6 мкм, двустворчатые, имеют остаточное тело.
Спорозоиты серповидные.
Добелл (Dobell, 1919) обнаружил ооцисты G. clu-
pearum в стуле человека и ошибочно полагал, что на-
шел новый вид кокцидий человека. Однако не исклю-
чено, что к человеку эти ооцисты могли попасть из
печени сельди (Clupea harengus) или из другой съе-
добной рыбы. Этот факт внесен в список классиче-
ских научных курьезов в истории мировой паразито-
логии.
Goussia (Goussia) cichlidarum Landsberg, Papema,
1985.
Хозяин: рыбы рода Oreochromis.
Паразитирует в клетках эпителиальной выстилки
плавательного пузыря. Зараженные клетки сильно ги-
пертрофируются, после чего выносятся на поверх-
ность эпителиального слоя, где претерпевают дегра-
дацию и редукцию до размера паразитофорного чехла,
внутри которого паразит завершает эндогенное разви-
тие. Такой чехол соединяется с клетками эпителиаль-
ной выстилки плавательного пузыря, однако подобное
соединение не имеет ничего общего с тем, что проис-
ходит при контаке с клеткой хозяина у кокцидий рода
Cryptosporidium. В дальнейшем паразитофорные чех-
лы, содежащие зиготы Goussia cichlidarum, отъединя-
ются от эпителиального слоя и споруляция ооцист со-
вершается уже внеклеточно, в просвете плавательного
пузыря. В ооцисте формируются 4 спороцисты. Споро-
цисты овальные, с полным опоясывающим швом.
Goussia (Goussia) girellae Kent, 1988.
Хозяин: морская рыба Girella nigricana.
Ооцисты спорулируют после выделения из орга-
низма хозяина.
Goussia (Goussia) schaudinniana (Pinto, 1928).
Хозяин: многоножки рода Lithobius.
Goussia (Goussia) lacacei (Labbe, 1895).
Хозяин: многоножки рода Lithobius.
Goussia (Goussia) hyalina (Leger, 1898).
Хозяева: водяные жуки.
Goussia (Goussia) flaviviridis (Setna, Bana, 1935).
Хозяева: гекконы.
По мнению Ливайна (Levine, 1983), между родами
Barrouxia и Goussia существует определенная бли-
зость, что подтверждается не только их структурным
сходством, но и наличием у обоих сходного круга хо-
зяев. Однако другие исследователи (Overstreet et al.,
1984) помещают род Goussia в сем. Calyptosporidae,
включающее преимущественно паразитов рыб.
Подрод Plagula Overstreet, Hawkins,
Fournie, 1984
Спороцисты двустворчатые, с тонким опоясываю-
щим швом, окружены матриксом, покрытым вуалью,
не поддерживаемой спороподиями. Латинское назва-
ние подрода — Plagula — означает вуаль. 4 вида.
Типовой вид Goussia (Plagula) caseosa Lorn et
Dykova, 1982.
Типовой хозяин: рыбыMacrourus berglax.
Распространение: Северная Америка.
Эндогенное развитие в клетках плавательного пу-
зыря и в газовых железах. Ооцисты формируются в
желчном пузыре, в кишечнике, в мезентериальных
кровеносных сосудах. Ооцисты тонкостенные, сфери-
ческие, около 42 мкм в диаметре, без остаточного тела
и микропиле. Спороцисты эллипсоидные, размером
19 X 14 мкм или 26 X 7 мкм, двустворчатые. Толстая
двуслойная стенка спороцисты опоясана разделяю-
щим швом; тельце Штида и остаточное тело отсутст-
вуют. Споруляция в организме хозяина.
Среди представителей сем. Barouxidae наибольшее
практическое значение имеют виды подрода Goussia
(Goussia) как возбудители кокцидиозов (гуссиозов)
промысловых рыб. Зараженные эпителиальные клетки
разных органов сильно гипертрофируются и разру-
шаются. Внутри гигантских меронтов формируются
многие сотни и тысячи мерозоитов, что приводит
к высокой оопродукции (образованию множества
ооцист). Заражение носит генерализованный характер,
вызывая поражение многих жизненно важных органов
хозяина.
Сем. Calyptosporidae Overstreet, Hawkins,
Fournie, 1984
Облигатно-гетероксенные жизненные циклы с под-
ключением беспозвоночного хозяина, в котором спо-
розоиты претерпевают дополнительное развитие в
форме «дозревания». Паразиты рыб. 1 род.
Род Calyptospora Overstreet, Hawkins,
Fournie, 1984
Ооциста с четырьмя спороцистами, в каждой по
2 спорозоита. Спороцисты покрыты вуалью, поддер-
живаемой одним или более удлиненными выростами
стенки спороцисты (спороподиями). Между вуалью и
212
ALVEOLATA
спороцистой имеется относительно гомогенный мат-
рикс. Штиденскос и субштидевское тельца отсутству-
ют. Апикальное отверстие для выхода спорозоитов по-
крыто мембраной. Опоясывающий шов (suture) корот-
кий и неполный. 6 видов. Полный жизненный цикл
известен только для типового вида.
Типовой вид Calyptospora funduli Overstreet,
Hawkins, Foumie, 1984.
(= Eimeria funduli Duszynski et al., 1979).
Типовые хозяева: карп Fundulus grandis (сем.
Cyprinodontidae), а также Mendia beryllina (сем. Atheri-
nidae).
Беспозвоночные хозяева: естественный —
травяные креветки Palaemonetes pugio; эксперимен-
тальные — Macrobrachium chione, Palaemonetes kadia-
kensis, P. paludosus, P. vulgaris.
Эндогенное развитие проходит в паренхиме печени
и поджелудочной железы рыб. Гаметогенез начинает-
ся после двух генераций мерогонии. Образовавшиеся
ооцисты колонизируют практически все ткани рыбы,
особенно яичники и жировое тело. Ооцисты спорули-
руют in situ и не выделяются из рыбы, пока она жива.
После гибели рыбы ооцисты высвобождаются в окру-
жающую среду (воду). Другие рыбы заражаются не пу-
тем заглатывания ооцист из воды или со дна водоема, а
при поедании их вместе с беспозвоночным хозяином
(креветкой), контаминированным ооцистами. Сущест-
вует предположение, что в беспозвоночном хозяине
спорозоиты С. fundulus «дозревают» до инвазионного
состояния, хотя и не претерпевают видимых измене-
ний (Overstreet, 1981). Дозревание занимает не менее
5 сут.
Структура ооцисты С. funduli отличается от тако-
вой видов Eimeria отсутствием стенкообразующих
тел. Стенка ооцисты С. funduli состоит из двух мемб-
ранных слоев. Есть предположение, что один или оба
слоя имеют не паразитарное, а хозяинное происхожде-
ние (Overstreet et al., 1984). Если это предположение
подтвердится, то стенка ооциста С. funduli должна бу-
дет рассматриваться не как истинная стенка зиготы
(циста), а как капсула.
Сем. Cryptosporidiidae Leger,
1911
Жизненные циклы гомоксенные. В ооцисте фор-
мируется 4 спорозоита. Имеется 2 типа ооцист: толс-
то- и тонкостенные, различающиеся между собой со-
ответственно по наличию и отсутствию единственной
спороцисты. Ооцисты спорулируют in situ. Эндоген-
ное развитие — в клетках ворсинчатого эпителия раз-
ных органов, преимущественно в кишечнике. Эндо-
генные стадии локализуются внутриклеточно, хотя и
экстрацитоплазматически. Мерозоиты 1-й генерации
способны к рециклированию, что приводит к аутоин-
фекции организма хозяина. Экстрацитоплазмати-
ческая паразитофорная вакуоль формируется за счет
слияния мембран микроворсинок эпителиальных кле-
ток. Коноид развит слабо. Микрогаметы безжгути-
ковые. Паразиты млекопитающих, птиц, рептилий
рыб. 1 род.
Род Cryptosporidium Tyzzer,
1910
(= Cryptocystidium Papema et al., 1986)
С характеристикой семейства. Отсутствие жгути-
ков в микрогаметах криптоспоридий рассматривается
как аутоапоморфическое упрощение. Из 20 описанных
видов валидными считаются 8.
По свидетельству Тиццера (Tyzzer, 1910), в 1895 г.
Кларк впервые описал в железистом эпителии мышей
паразита, сходного с Cryptosporidium. В 1907 г. Тиццер
выполнил первое детальное исследование кокцидий из
желез желудка мышей, хотя видовое название Crypto-
sporidium muris было дано спустя 3 года (Tyzzer, 1910).
Еще через 2 года в кишечнике мышей был описан но-
вый вид, отличавшийся более мелкими размерами и
получивший название С. parvum.
На основании светооптического исследования
ооцист нового паразита Тиццер сделал вывод об отсут-
ствии в них спороцист («спор», по старой терминоло-
гии), что и послужило названием нового рода Crypto-
sporidium, т. е. «скрытая спора». Тиццер полагал, что
криптоспоридии локализуются внеклеточно, и даже
рассматривал их как промежуточную форму в эволю-
ции от грегарин к кокцидиям. Это ошибочное сужде-
ние можно объяснить техническим несовершенством
микроскопической техники в начале XX в. Даже самые
большие увеличения светового микроскопа не позво-
ляли в то время рассмотреть внутриклеточную локали-
зацию этих исключительно мелких паразитов (4—
8 мкм в диаметре).
Другой ошибочный постулат Тиццера состоял в
признании им непатогенности криптоспоридий для хо-
зяина. По случайному стечению обстоятельств оказа-
лось, что лабораторные животные, с которыми работал
Тиццер (мыши, крысы, кролики), действительно пред-
ставляют исключение среди других животных как хо-
зяева, естественно устойчивые к криптоспоридиозной
инвазии. Однако сам факт признания непатогенности
криптоспоридий Тиццером, крупнейшим научным ав-
торитетом своего времени, надолго затормозило даль-
нейшие исследования этих паразитов.
До середины 50-х гг. XX в. в литературе появились
всего две публикации о находках криптоспоридий:
С. crotali у змей (Triffit, 1925) и С. meleagridis у птиц
(Slavin, 1955). В 1971 г. наступил кризис в изучении
криптоспоридий: была потеряна стадия ооцисты, что
завело в тупик представления о путях расселения этих
гомоксенных паразитов во внешней среде. Кризис раз-
решился уже в конце 70-х гг., когда спорулированные
ооцисты Cryptosporidium были обнаружены в стенке
кишки телят (Pohlenz et al., 1978) и в фекалиях кошки
(Iseki, 1979).
Вплоть до 1975 г. было известно не более 15 сооб-
щений, в которых описывалось заражение Cryptospori-
dium только восьми видов животных. Болезненное со-
стояние организма связывали с наличием паразита в
пяти случаях, три из которых имели отношение к забо-
леванию телят. После установления первого докумен-
тированного случая криптоспоридиоза телят (Panciera
et al., 1971) в мировой литературе стали появляться ре-
гулярные сообщения о неонатальной криптоспориди-
озной диарее молодняка животных. У птиц, кроме ки-
ТИП SPOROZOA. КЛАСС COCCIDEA
213
шечной формы, была также выявлена респираторная
форма криптоспоридиоза.
В 1976 г. был описан первый случай криптоспо-
ридиоза у человека (Nime et al., 1976), что заставило
исследователей принципиально пересмотреть тицце-
ровскую концепцию непатогенности криптоспоридий,
вплоть до признания их важной роли как возбудите-
лей энтероколитов и диареи у животных и человека. За
сравнительно небольшой срок появилась обширная
литература по изучению криптоспоридий, впоследст-
вии обобщенная в ряде крупных обзоров (Cunent,
1984; Fayer, Ungar, 1986; Tzipori, 1988; Бейер, 1989;
Fayer et al., 1997).
Типовой вид Cryptosporidium muris Tyzzer,
1910.
Типовой хозяин: домовая мышь Mus musculus.
Эндогенное развитие в клетках желез желудка.
Ооцисты 7—8 X 5—6.3 мкм. У крыс, морских свинок,
собак и кошек развитие паразита ограничено желе-
зистыми клетками желудка. Препатентный период 4—
5 сут.
Cryptosporidium felis Iseki, 1979.
Хозяин: домашняя кошка Felis catus.
Cryptosporidium wrairi Vetterling, 1971.
Хозяин: морская свинка Cavia porcellus.
Cryptosporidium andersoni Lindsay, Upton, Owens,
Morgan, Mead, Blagbum, 2000.
Хозяева: крупный рогатый скот Bos taurus, по-
тенциально двугорбый верблюд Camelus bactrianus.
Cryptosporidium meleagridis Slavin, 1955.
Хозяин: индейка Meleagris gallopavo.
Cryptosporidium baileyi Current, Upton, Haynes,
1986.
Хозяин: домашняя курица Gallus gallus.
Cryptosporidium serpentis Levine, 1980.
Хозяева: рогатая змея Elaphe guttata, крысиная
змея E. subocularis, мадагаскарский удав Sanzinia ma-
dagascarensus.
Cryptosporidium nasorum Hoover, Hoerr, Carlton,
Hinsman, Ferguson, 1981.
Хозяин: рыба Naso literatus.
Cryptosporidium parvum Tyzzer, 1912.
Хозяева: мыши, крысы, телята, морские свин-
ки, кролики, ягнята, поросята, кошки, лисицы, чело-
век.
Cryptosporidium hominis Morgan-Ryan, Fall, Wars,
Uijjawi, Sulaiman, Fayer, Thompson, Olson, Lal, Xiao,
2002.
Типовой хозяин: Homo sapiens', другие хозяева
в естественных условиях — дюгони (Dugong dugon) и
ягнята, в эксперименте — гнотобионтные поросята.
Описание жизненного цикла криптоспоридий дает-
ся на примере наиболее изученного вида этого рода —
Cryptosporidium parvum Tyzzer, 1912 (рис. 121).
Эндогенное развитие проходит в эпителиальных
клетках кишечника (энтероцитах) и других органах.
Ооцисты сферические, 4.5—5.3 мкм в диаметре
(рис. 122, 1—6, вкл.). Ооцисты заразны для многих ви-
дов млекопитающих. Препатентный период 4—5 сут.
Полное развитие С. parvum было воспроизведено в ку-
рином эмбрионе и в культуре тканей (Cunent, Long,
1983; Cunent Haynes, 1984).
Эндогенное развитие паразита совершается в дис-
тальной части эпителиальной.клетки (рис. 79,2; 121;
122, 1, вкл.). Спорозоиты высвобождаются из ооцисты
и продвигаются по направлению к эпителиальным
клеткам кишечника. Достигнув энтероцита, спорозоит
не внедряется в него (как это делают другие внут-
риклеточные паразиты), а останавливается на его по-
верхностной мембране, после соприкосновения с кото-
рой апикального полюса зоита, несущего коноид, об-
разуется зона взаимодействия паразита и хозяина
(рис. 123—125, вкл.). В результате формируется уни-
кальная экстрацитоплазматическая паразитофорная
вакуоль, под защитой которой протекает все последу-
ющее эндогенное развитие паразита.
Меронты 1-й генерации (рис. 121, 2, 3) продуциру-
ют 8 мерозоитов и остаточное тело (рис. 121,4). Меро-
зоиты 1-й генерации способны к рециклированию. Это
означает, что наряду с меронтами 2-й генерации они
могут снова давать начало меронтам 1-й генерации.
Меронты 2-й генерации (рис. 121, 5, 6) дают начало
4 мерозоитам также 2-й генерации (рис. 121, 7).
Микрогамонты мельче меронтов (рис. 121, 8), и в
них образуется до 16 безжгутиковых микрогамет
(рис. 121, 9). Макрогамонт в процессе роста увеличи-
вается в размерах (рис. 121, 10, II). После оплодотво-
рения макрогаметы (рис. 121, 12) образуется зигота
(рис. 121, 13), дальнейшая судьба которой зависит от
структуры окружающей ее оболочки (ооцисты).
Споруляция ооцист криптоспоридий происходит
in situ. Толстостенные ооцисты (рис. 121,16), подобно
ооцистам других кокцидий, попадают в просвет кишки
и выделяются при акте дефекации во внешнюю среду.
Часть тонкостенных ооцист (рис. 121, 14) может со-
храняться в организме хозяина. При определенных
условиях (например, при иммунодефиците хозяина)
такие ооцисты могут разрушаться in situ и высвобож-
дать ранее заключенных в них инфекционных споро-
зоитов (рис. 121, 17), что вызывает аутоинвазию мак-
роорганизма. На возможность аутоинвазии хозяина
при заражении крипоспоридиями указывал еще Тиц-
цер (Tyzzer, 1910).
Кокцидии рода Cryptosporidium распространены во
всем мире и к настоящему времени зарегистрированы
более чем у 170 видов хозяев из 50 стран. Для видов
этого рода характерна разная широта специфичности,
которая прослеживается в пределах классов, к кото-
рым относятся их хозяева. Исключение составляет
С. baileyi (из птиц), способный заразить человека при
нарушении иммунного статуса. В то же время С. -wrairi
(из морской свинки) заражает только морских свинок,
а С. felis (из кошек) — только кошек. Напротив, ооци-
сты С. parvum заражают широкий круг млекопитаю-
щих, включая человека.
Было показано, что изоляты ооцист С. parvum мо-
гут обладать разными генотипами, и при этом генотип
214
ALVEOLATA
Рис. 121. Схема жизненного цикла Cryptosporidium parvum в организме теленка.
1—14 — эндогенные стадии развития в зоне щеточной каемки энтероцита: 1 — спорозоит; 2, 3 — мерогония; 4 — сегментированный меронт; 4а — мерозоит
1-й генерации; 5—7— мерогония 2-й генерации; 7а — мерозоит 2-й генерации; 8, 9 — микрогамстогенсз; К). 11 — макрогаметогенез; 12 — микрогамета;
13 — оплодотворение; 14 — спорулированная ооциста; 14а — тонкостенная ооциста; 146 — высвобождение спорозоитов (!) из разрушенной ооцисты; 15,
16 — ооцисты: 15 — толстостенная ооциста; 16 — ооциста в просвете кишки или вне организма; стрелки — направление развития.
Fig. 121. Scheme of the life cycle of Cryptosporidium parvum in the calf.
1—14 — endogenous stages in the enterocyte brush border compartment: 1 — sporozoite; 2, 3 — mcrogony; 4 — segmented meront; 4a — 1st generation merozoite;
5—7 — 2nd generation merogony; 7a — 2nd generation merozoite; 8, 9— microgametogenesis; It). 11 — macrogametogenesis; 72 — microgamete; 13 — fertilization;
14 — sporulated thin-walled oocyst; 146 — sporozoite (7) release from the disrupted oocyst; 15, 16 — oocysts inside and outside the host, respectively; arrows — the
direction of development.
крупного рогатого скота (cattle genotype) имеет самое
широкое распространение. И только С. parvum с этим
генотипом обладает зоонозной природой, т. е. является
общим возбудителем заболеваний у человека и живот-
ных. С. parvum с человеческим генотипом (human ge-
notype) заражает не только человека, но и некоторых
животных, например дюгоней (Morgan et al., 2001).
В последние годы был описан еще один вид крипто-
споридий (С. hominis') с антропозоонозной природой.
Эти два вида морфологически идентичны, но различа-
ются по ряду генетических маркеров (Morgan-Ryan,
2002), а также по неспособности заразить мышей,
крыс, кошек и собак.
Изоляты С. parvum с разными генотипами различа-
ются также и биологически. Только изоляты с геноти-
пом крупного рогатого скота и человеческим геноти-
пом способны заражать пациентов с иммунодефици-
том, тогда как изоляты с генотипами свиней, мышей и
кошек оказываются хозяино-специфичными и никогда
не были изолированы от человека.
Молекулярно-биологические исследования фило-
генетических отношений споровиков, основанные на
сравнении нуклеотидных последовательностей 18 S
рРИК, выявили целый ряд различий между эймериид-
ными кокцидиями родов Eimeria, Toxoplasma, Sarco-
cystis и некоторых других, с одной стороны, и видами
рода Cryptosporidium — с другой. На этом основании
был сделан вывод о якобы некокцидийной природе
криптоспоридий (Tenter et al., 2002).
С этим выводом нельзя согласиться. Наличие у
криптоспоридий таких характерных кокцидийных
признаков, как трехчленный жизненный цикл, гамето-
генез по типу оогамии, независимое развитие гамонтов
и отсутствие сизигия, а также образование устойчивых
ооцист, выполняющих функцию расселения паразита
во внешней среде, оказывается таксономически более
ТИП SPOROZOA. КЛАСС COCCIDEA
215
весомым, чем наличие у них экстрацитоплазмати-
ческой паразитофорной вакуоли, ооцист двух типов
(тонко- и толстостенных) или способности эндоген-
ных стадий к рециклированию. Следует признать, что
данные молекулярной биологии не находят еще адек-
ватной интерпретации филогенетических связей среди
кокцидий (Бейер, 2000; Бейер и др., 2001).
Как и у других споровиков, у Cryptosporidium меро-
зоиты покрыты трехмембранной пелликулой, под ко-
торой проходят субпелликулярные микротрубочки, а
в цитоплазме имеется обильная шероховатая эндо-
плазматическая сеть с многочисленными рибосомами
(рис. 79, 1, 2). Коноид выражен слабо, микропоры не
обнаружены, митохондрии имеются, но на электроно-
граммах выявляются редко.
Мерогония Cryptosporidium осуществляется по
типу шизогонии. Цитокинез наступает после формиро-
вания 4 и 8 ядер в ходе 1-й и 2-й мерогонии. Микро-
гаметы лишены жгутиков и представляют собою круп-
ные клиновидные клетки с утолщенным апикальным
полюсом, крупным ядром и митохондрией (рис. 83, 9;
87, Г). На апикальном полюсе микрогаметы имеется
электронноплотная зона, от которой отходят микро-
трубочки. Эта зона может рассматриваться как гомо-
лог либо базального тела редуцированного жгутика
микрогаметы, либо полярного кольца других кокци-
дий (Gobel, Brandler, 1982). Функцию отсутствующего
перфоратория, хорошо выраженного у кишечных кок-
цидий рода Eimeria, здесь выполняет, по-видимому,
расположенная на переднем конце зона адгезии.
Экстрацитоплазматическая локализация эндоген-
ных стадий развития является наиболее характерной
особенностью криптоспоридий, отличающей их от
других кокцидий (рис. 124). Зоит Cryptosporidium при-
крепляется к наружной мембране эпителиальной клет-
ки между микроворсинками и фиксируется в зоне при-
крепления. Микроворсинки, окружающие зоит, как бы
вырастают ему навстречу, увеличиваются в размерах
и далее смыкаются над растущим трофозоитом. Этому
способствует специфическая организация самой клет-
ки хозяина, обладающей на дистальном конце ха-
рактерной щеточной каемкой микроворсинок, т. е.
микроскопических выростов пелликулы такой клет-
ки. После смыкания микроворсинок над паразитом
он оказывается внутри своеобразной паразитофор-
ной вакуоли, ограниченной двумя мембранами слив-
шихся микроворсинок, между которыми располагают-
ся тонкие филаменты. Далее наружная мембрана пел-
ликулы паразита сливается с внутренней мембраной
паразитофорной вакуоли. В той части трофозоита,
которая обращена к клетке хозяина, его внутренний
мембранный комплекс редуцируется, а наружная
мембрана пелликулы образует сложную мультимемб-
раиную структуру, которой приписывается функция
питающей органеллы (рис. 79, 2; 83, 9; 123, 7, вкл.;
124).
В растущих макрогаметах Cryptosporidium накап-
ливаются резервные вещества (липиды, полисахари-
ды) и происходит закладка стенкообразующих тел.
Плотный внутренний слой, заметный в толстостенных
ооцистах, соответствует единственной спороцисте, в
которой имеется асимметрично расположенный шов
(suture), соединяющий створки спороцисты. Более по-
Рис. 124. Схематическое изображение изменений щеточнокаемча-
того компартмента эпителиальной клетки кишечника теленка при
заражении Cryptosporidium parvum и формирование паразитофор-
ной вакуоли вокруг паразита. (По: Brandler, 1982).
вмк — внутренний мембранный комплекс, вммв — внутренняя мембрана
микроворсинки, гк — гликокаликс, зп — зона прикрепления, м — митохонд-
рия, мв — микроворсинки, нммв — наружная мембрана микроворсинки,
нмп — наружная мембрана пелликулы, по — питающая органелла, пфв —
паразитофорная вакуоль, я — ядро.
Fig. 124. Scheme of structural modification of the enterocyte brush bor-
der compartment in Cryptosporidium parvum infected calf.
вмк — inner membrane complex, вммв — microvillus inner membrane, гк —
glycocalyx, зп — adhesion zone, м — mitochondrion, мв — microvilli, нммв —
outer membrane of microvillus, нмп — outer pellicle membrane, no — feeder or-
ganelle, пфв — parasitophorous vacuole, я — nucleus.
дробная информация о строении ооцист криптоспори-
дий содержится в обзоре Бейер с сотр. (2001).
Уникальность экстрацитоплазматической, хотя и
внутриклеточной, локализации криптоспоридий соче-
тается с неповторимостью ряда других черт их биоло-
гии, указанных в диагнозе сем. Cryptosporidiidae.
В связи с этим нельзя согласиться с предложением Ли-
вайна (Levine, 1984b) о включении в это семейство
рода Epieimeria Dykova et Lorn, 1981, для которого ха-
рактерна сходная, но не идентичная эпиклеточная ло-
кализация эндогенных стадий.
Криптоспоридиоз (С. parvum и, возможно, С. homi-
nis) относится к категории зоонозов, т. е. заболеваний,
общих для животных и человека. Наибольший ущерб в
животноводстве это заболевание наносит молодня-
ку — телятам, ягнятам, поросятам. Внешним проявле-
нием кишечной формы болезни является профузная
диарея, во время которой огромная масса инвазионных
ооцист выносится из организма хозяина и заражает
внешнюю среду. Криптоспоридиоз птиц (С. baileyi)
может быть респираторным, кишечным и почечным.
Болезнь часто протекает в ассоциации с вирусными и
бактериальными инфекциями. Клинические признаки
респираторной формы заболевания включают кашель,
чихание, удушье, хрипы. В трахее, а также в дыхатель-
216
ALVEOLATA
ных и носовых путях скапливается слизь, при этом
излишняя жидкость легко попадает в легкие. Эпителий
дыхательных путей гипертрофируется вследствие
сильной инфильтрации макрофагов и других клеток
иммунной системы. Кишечная инвазия связана с атро-
фией ворсинок и гиперплазией крипт. Почечная ин-
фекция приводит к увеличению размеров самих почек
и к поражению эпителиальной выстилки почечных ка-
нальцев.
Микроскопическая диагностика криптоспоридиоза
осуществляется путем выявления ооцист в стуле боль-
ного на мазках, окрашенных разными красителями
(карболовым фуксином по Цилю-Нильсену, аурами-
ном, генциановым фиолетовым и другими). К числу
недостатков микроскопической диагностики следует
отнести значительную затрату времени и их невысо-
кую чувствительность и специфичность. Более эффек-
тивными в плане диагностики криптоспоридиоза счи-
таются серологические методы выявления криптоспо-
ридий и применение полимеразной цепной реакции
(ПЦР). И если микроскопические методы дают 83.7 %
чувствительности и 98.9 % специфичности, то ПЦР де-
монстрирует 100%-ную надежность в обоих случаях
(Morgan et al., 1998).
Химиотерапия криптоспоридиоза не разработана, по-
этому главное внимание обращается на методы профи-
лактики с учетом путей и способов заражения хозяина.
Особую опасность представляет криптоспориди-
оз для здоровья людей с нарушенной иммунной систе-
мой. Наличие в жизненном цикле Cryptosporidium
аутоинфектных ооцист, способных, по-видимому, к
неопределенно долгому персистированию в организ-
ме ранее зараженного хозяина, позволяет квалифи-
цировать криптоспоридиоз как оппортунистическую,
СПИД-ассоциированную инфекцию (Tzipori, 1988).
Реализация скрытой инфекции при иммунодефиците
осуществляется через механизм рециклирования ме-
розоитов 1-й генерации. При отсутствии иммунного
контроля со стороны хозяина процесс мерогонии при-
водит к образованию огромного числа эндогенных ста-
дий и, как следствие, инфекционных ооцист. При этом
поверхность слизистой кишечника на всем протяже-
нии колонизируется паразитом, что приводит к серьез-
ным нарушениям в работе кишечника. Первые случаи
криптоспоридиоза человека были выявлены в 1976 г.
В 1993 г. в штате Висконсин (США) была зарегист-
рирована массовая вспышка криптоспоридиоза в ре-
зультате заражения через воду более чем 400 тысяч че-
ловек. В разивающихся странах экстенсивность крип-
тоспоридиозной инвазии достоверно выше, чем в
развитых, что свидетельствует о первостепенной важ-
ности соблюдения санитарных норм жизни общества.
Так же как и у животных, криптоспоридиоз челове-
ка сопровождается профузной диареей с примесью
крови (Бейер и др., 1987а, 19876; Fayer et al., 1997), и
при этом происходит значительное обезвоживание ор-
ганизма. Описаны случаи потери пациентами до
12—17 л жидкости в день. Интенсивность заболевания
зависит от иммунного статуса хозяина. Острое кишеч-
ное заболевание у иммунокомпетентных пациентов
купируется в течение 1—2 нед, тогда как при иммуно-
дефиците (при содержании Т-СД4+-лимфоцитов ниже
200 на 1 мкл) оно может длиться многие месяцы, зату-
хая и возобновляясь вновь, т. е. переходя в хрониче-
скую форму. При иммунодефиците криптоспоридиоз
поражает не только тонкий кишечник, но и другие
внутренние органы: легкие, пищевод, желудок, пе-
чень, поджелудочную железу, желчный пузырь, ап-
пендикс, конъюнктиву глаз. Представляет интерес, что
криптоспоридиоз, будучи исходно типично кишечной
инвазией, может проявляться в виде артрита, пораже-
ния сухожилий и подошвенных фасций, а также конъ-
юнктивита, уретрита и эритемы слизистой оболочки.
Зарегистрированы случаи летального исхода при крип-
тоспоридиозе человека. Американский Центр по конт-
ролю и профилактике болезней (CDC) включил крип-
тоспоридиоз в группу Б микроорганизмов, используе-
мых в качестве агентов биологического терроризма,
способных вызывать заболевания средней тяжести, од-
нако нередко с летальным исходом (Atlas, 2002). В эту
же группу входят также возбудители лихорадки Ку,
бруцеллеза, сапа и некоторых энцефаломиелитов.
Сем. Eimeriidae Poche, 1913,
emend. Beyer, 1977
Жизненные циклы гомоксенные. Структура ооцист
разнообразна. Эндогенное развитие внутриклеточное.
Мерогония включает от одной до нескольких генера-
ций. Гаметогенез в эпителии кишечника хозяина. Зи-
гота покрывается оболочкой и становится ооцистой.
Споруляция вне организма хозяина. Микрогаметы с
2 или 3 жгутиками. Коноид и другие органеллы апи-
кального комплекса хорошо выражены и представле-
ны полностью. Паразиты позвоночных и беспозвоноч-
ных. Более 16 родов, свыше 1340 видов.
Предложенный ниже порядок расположения родов,
входящих в данное семейство, не имеет отношения к
возможной последовательности их возникновения в
процессе эволюции. Мы сознательно начинаем изло-
жение с рода Eimeria, поскольку среди кишечных кок-
цидий этот род изучен наиболее полно.
Род Eimeria Schneider, 1875
(=Gregarina Eirner, 1870, pro parte; Cytospermium, Ri-
volta, 1878, pro parte; Psorospermium Rivolta, 1878, pro
parte; Coccidium Leuckart, 1879, pro parte; Orthospora
Schneider, 1881, pro parte; Karyophagus Steinhaus, 1889;
Cytophagus Steinhaus, 1891, pro parte; Pfeifferia Labbe,
1894; Acystis Labbd, 1894, pro parte; Globidium Flesch,
1894, pro parte; Caryophagus Druner, 1894, lapsus cala-
mi', Bananella Labbd, Bananella Labbe, 1895; Pfeifferinel-
la Labbd, 1899; Eimeriella Stiles, 1901; Paracoccidium
Laveran et Mesnil, 1902; Marotelia Ratz, 1905; Jarrina
Leger et Hesse, 1922; Choleoeimeria Papema et Land-
sberg, 1989; Acroeimeria Papema et Landsberg, 1989)
Ооцисты c 4 спороцистами, в каждой по 2 спорозо-
ита. В спороцисте имеется тельце Штида. Ооцисты вы-
деляются из организма хозяина в неспорулированном
состоянии; исключение составляют ооцисты видов,
паразитирующих у рыб. Паразиты млекопитающих,
птиц, рептилий, амфибий, рыб, а также беспозвоноч-
ных. Свыше 1700 видов.
ТИП SPOROZOA. КЛАСС COCCIDEA
217
Типовой вид Eimeria falciformis (Eimer, 1870)
Schneider, 1875.
Типов ой xозяин: домовая мышьMus musculus.
Распространение: всесветно.
Ооцисты овальные или округлые, размером
16—31 X 11—17 мкм, остаточное тело имеется. Стен-
ка ооцисты 1.0—1.5 X 5—2 мкм толщиной, микропиле
отсутствует. Споруляция во внешней среде занимает
1—6 сут. Спороцисты овальные, размером 8—
12 X 5—6 мкм; в каждой спороцисте имеются 2 споро-
зоита, тельце Штида и остаточное тело. В спорозоитах
хорошо заметны крупные рефрактильные глобулы (па-
рануклеарные тела), достигающие до 3 мкм в диа-
метре.
Мерогония осуществляется в эпителии тонкой
кишки. При сильной инвазии эндогенные стадии про-
никают в субэпителий (Haberkom, 1970). Меронты
(шизонты) локализуются в подвздошной, слепой и
ободочной кишке, преимущественно внутри клеток,
расположенных на вершине ворсинок. 2-я генерация
мерогонии совершается в криптах. Бесполая фаза раз-
вития включает до 4 генераций и занимает 1.2—2 сут.
Внутри меронтов формируется 9—20 мерозоитов. При
сильной инвазии свободные мерозоиты выделяются
наружу с фекальными массами. Гаметогенез начинает-
ся после 2-й или 3-й генерации мерогонии. В среднем
препатентный период составляет 4-—5 сут, однако при
сильной инвазии первые ооцисты выделяются уже на
4-е сут после заражения. Патентный период продолжа-
ется до 10 сут.
Сильная инвазия Е. falciformis приводит к развитию
энтеритов, нередко с летальным исходом. У перебо-
левших животных развивается устойчивый иммунитет
к последующему заражению. В экперименте возможно
также заражение хозяина при введении спорозоитов
внутривенно, внутрибрюшинно или подкожно (Haber-
kom, 1970).
Общая схема жизненного цикла кокцидий рода
Eimeria представлена на рис. 93. Картина классическо-
го эндогенного развития эймерий демонстрируется на
примере Е. intestinalis м. Е. magna (рис. 126,1—3, вкл.),
а отклонения от классического пути на примере Е. Ьа-
kuensis (рис. 127). Структурные изменения в ооцис-
тах Eimeria в процессе споруляции показаны на
рис. 55,1—5.
Ультраструктура
Обычно при описании «классической» ультра-
структурной организации зоита Sporozoa за эталон бе-
рется тонкое строение зоитов Eimeria.
В отличие от мерозоитов спорозоиты Eimeria име-
ют 1 или 2 парануклеарных тела гомогенной струк-
туры (см. рис. 59, /). Рудименты парануклеарных тел
могут иногда встречаться и у мерозоитов 1-й гене-
рации.
Зоиты Eimeria покрыты типичной 3-мембранной
пелликулой Sporozoa (рис. 63, 14). Микропоры распо-
ложены на уровне верхнего края ядра, где размещают-
ся и цистерны аппарата Гольджи. Число роптрий варь-
ирует от 2 до 6. Коноид хорошо выражен и составляет
1/30 к длине тела (рис: 63, 13—15).
Мерогония у видов Eimeria протекает по типу ши-
зогонии (рис. 69, справа), которая совершается в два
этапа: 1) образование множества дочерних ядер в ре-
зультате материнского деления и 2) формирование
многочисленных одноядерных мерозоитов. Шизого-
ния осуществляется путем экзогенеза, при котором до-
черние ядра располагаются по периферии меронта
(рис. 76,1,2).
Микрогаметогенез у Eimeria и других эймериид-
ных кокцидий на начальных этапах напоминает ме-
рогонию по типу шизогонии, т. е. расщепления на
множество (рис. 80, 7; 81, 2, 3; 85). В цитоплазме мик-
рогамонтов имеются гранулы амилопектина. Много-
численные ядра будущих микрогамет располагаются в
кортикальной зоне у поверхности микрогамонта. Хро-
матин дочерних ядер конденсируется на периферии
ядра, тогда как ахроматиновая часть составляет оста-
точное тело (рис. 81, 2, 3).
В дальнейшем хроматиновая часть ядра дочерней
микрогаметы приходит в контакт с плазматической
мембраной материнского гамонта, образуя в месте
контакта бугорок, в который затем входят две центри-
оли, после чего формируется внутриядерное веретено
с двумя центроконусами. Вблизи дочерних ядер рас-
полагаются митохондрии; центриоли удлиняются и
трансформируются в жгутики будущих микрогамет
(рис. 81, 3; 82, 5, 6). Созревание микрогаметы сопро-
вождается удлинением ее ядра и митохондрии и значи-
тельным вытягиванием жгутиков (рис. 82, 7, 8). Длина
зрелых микрогамет варьирует от 4—5 (Е. maxima) до
6—7 мкм (Е. perforans). Число жгутиков в микрогаме-
тах разных видов колеблется от 2 до 3. Жгутики отхо-
дят от базальных тел, расположенных в передней час-
ти тела гаметы.
В начале развития молодые макрогамонты еще со-
храняют остатки органелл апикального комплекса ма-
теринского мерозоита. Впоследствии такие органеллы
резорбируются, а пелликула макрогамонта редуциру-
ется до одной мембраны, в которой может быть более
одной микропоры. Кроме микропор, в процессе пита-
ния макрогамет Eimeria принимают участие трубочки,
расположенные внутри паразитофорной вакуоли, че-
рез которые к паразиту поступают вещества из цито-
плазмы зараженной клетки (см. рис. 89). На попереч-
ных срезах эти трубочки имеют вид пузырьков диамет-
ром 500—900 А. Стенка пузырьков не является
элементарной мембраной, но составлена из отдельных
субъединиц (Scholtyseck, 1973b).
Наличие внутривакуолярных складок и трубочек
характерно для макрогамет большинства видов Eime-
ria из наземных хозяев. Однако подобные структуры
не встречаются у видов Eimeria рыб, у цистообразу-
ющих и аделеидных кокцидий, гемоспоридий и про-
тококцидий, за исключением Grellia (Eucoccdium) di-
nophili.
Число мембран в макрогамонтах видов Eimeria из
наземных хозяев варьирует от 1 до 3. Мембраны про-
исходят от цистерн эндоплазматической сети. Стенка
ооцисты обычно формируется за счет не только мемб-
ран, но и слоев, образующихся при слиянии стенкооб-
разующих тел (сот) (рис. 89; 90,1, 2; 91, 3). Однако сот
отсутствуют в ооцистах видов Eimeria, паразитирую-
щих у рыб (Е. iroquoina, Е. dingleyi, Е. variabilis). Сот
218
ALVEOLATA
Рис. 127. Схематическое изображение макроскопических поражений кишечника цыплят, вызываемых разными видами кокцидий рода
Eimeria. (По: Long, Reid, 1982).
Fig. 127. Scheme of macroscopic intestinal lesions in chickens infected with different species of Eimeria.
не обнаружены при формировании ооцист гемогрега-
рин и гемоспоридий.
Стенка ооцист Е. gadi и Е. variabilis состоит из од-
ной мембраны, а у Е. deguisti и Е. iroquoina из двух
мембран, плотно прилежащих друг к другу. У Е. fundu-
li к двухмембранной оболочке ооцисты снаружи при-
легают два слоя гранулярного материала (Paterson,
Desser, 1981).
По своей структуре сот могут быть гомогенными
или губчатыми и обозначаются как сот-1 и сот-П. Сот-1
соответствуют «пластиноидным» гранулам, впервые
описанным в макрогаметах Eimeria (Cheissin, 1958) и
содержащим полисахариды и мукопротеины. В обра-
зовании сот-1 принимают участие цистерны аппарата
Гольджи и толстостенные цитоплазматические пузырь-
ки макрогаметы (Chobotar, Scholtyseck, 1982). Губчатые
сот-П образуются по одному или группами и возни-
кают из материала эндоплазматической сети и аппара-
та Гольджи. Сот-1 и сот-П формируют соответственно
внутреннюю и наружную стенки ооцисты, а по време-
ни возникновения сот-П опережают сот-1.
В цитоплазме растущих и зрелых макрогамет Eime-
ria имеется множество разнообразных включений, гра-
нул запасных веществ (амилопектин, липиды), вакуо-
лей, рибосом, элементов эндоплазматической сети и
аппарата Гольджи. В цитоплазме макрогамет Eimeria
рыб встречаются характерные мультимембранные
включения, лишенные крист. Эти конфигурации напо-
минают Гольджи-адъюнкт и соответствуют апикопла-
сту других кокцидий (Sogin, 1991; Vogel, 1997; Glee-
son, 2000).
Крупное ядро макрогаметы — типичное эукариот-
ное пузырьковидное ядро, покрытое двойной мембра-
ной, в которой различаются ядерные поры. Имеется
ТИП SPOROZOA. КЛАСС COCCIDEA
219
единственное ядрышко, состоящее из множества мел-
ких осмиофильных гранул (рибосом), не ограничен-
ных мембраной от остальной нуклеоплазмы (рис. 90,1;
91, 3).
Процесс оплодотворения макрогаметы знаменует
начало серьезных морфофункциональных преобра-
зований в образовавшейся зиготе, включая активиза-
цию деятельности сот. Толщина двуслойной стенки
ооцисты у Eimeria может доходить до 0.3 мкм. Форми-
рование защитных оболочек даже у внутриклеточных
ооцист прерывает процесс их прямого метаболическо-
го взаимодействия с клеткой хозяина. Ооцисты боль-
шинства видов Eimeria спорулируют во внешней сре-
де. Исключение составляют виды, разивающиеся в ры-
бах и рептилиях, ооцисты которых спорулируют еще
до выделения из организма хозяина. Такие ооцисты
очень чувствительны к неблагоприятным условиям
внешней среды, в первую очередь к высыханию и ме-
ханическому повреждению.
Для видов Eimeria характерна моноксенность,
т. е. строгая хозяинная специфичность. Только в ред-
ких случаях удается заразить одним и тем же видом
Eimeria более чем одного хозяина, но при этом такие
хозяева обычно относятся к близким видам. Предполо-
жение о поликсенности видов Eimeria из грызунов
(Е. falciformis, Е. contorta) не подтвердилось последу-
ющими исследованиями. Ошибочным оказалось и
предположение о том, что Е. arloingi и Е. ninakohlyaki-
movae могут паразитировать у овец и коз. Указанные
виды специфичны только для коз, а у овец паразитиру-
ют Е. ovina иЕ. ovinoidalis (McDougald, 1979).
Менее строгая хозяинная специфичность была вы-
явлена у вида Eimeria из индюков (Е. dispersa) при за-
ражении им цыплят, фазанов, куропаток и перепелов.
Первые два хозяина не заразились совсем, тогда как у
двух вторых хозяев препатентный период Е. dispersa
оказался короче, чем в индюках, а в меронтах началь-
ных генераций развивалось большее число мерозоитов
(Doran, 1978). Есть данные, что хозяевами Е. chinchil-
lae могут быть 7 видов грызунов (Pellerdy, 1974).
Имеются данные о роли генетических различий
внутри линий одного и того же хозяина в деле воспри-
имчивости к заражению тем или иным видом Eimeria.
Оказалось, что эмбрионы разных линий цыплят поро-
ды «белый леггорн» по-разному восприимчивы к зара-
жению Е. tenella (Joyner, 1982). Е. separata из крыс мо-
жет' чппершать полное эндогенное развитие в мышах
только определенной генетической линии.
Локализация в хозяине
11одавляющее большинство видов Eimeria парази-
тирует а кишечнике хозяина, причем обычно в эпите-
лиальных клетках (энтероцитах), имеющих эндодер-
мальное происхождение. В целом об эймериях приня-
то говорить как о кишечных паразитах. Однако из
этого иранилп имеются исключения (Pellerdy, 1974).
Так, Е. stlvdae паразитирует в печени кролика,
Е. truncata в почках гуся, Е. neitzi в матке антилопы-
импалы, Е. ovinoidalis и ретикулярной соединительной
ткани lamina propria овец. Первая генерация Е. bovis
протекает в клетках эндотелия быка и лишь вторая
проходит в энтероцитах кишечника. Вторая генерция
мерогонии и гамогония Е. auburnensis совершается в
мезодермальных клетках коровы. Спорозоиты кокци-
дий кур (Е. tenella, Е. necatrix, Е. acervulina) способны
персистировать в макрофагах кишечника, которые
транспортируют заключенных в них паразитов в крип-
ты, где начинается эндогенное развитие этих парази-
тов. Имеются единичные наблюдения о локализации
стадий эндогеного развития Eimeria в желчном пузыре
козы или в печени свиньи и норки (Desser, 1978).
Эндогенное развитие Eimeria из журавлей обычно
происходит в макрофагах и в субэпителии внутренних
органов хозяина. Было показано, что эти кокцидии за-
вершают свое развитие в легких журавлей. Выход па-
разита из легких представляется возможным при усло-
вии вторичного попадания ооцист в ротовую полость и
далее в кишечник журавля. Такие ооцисты выделяют-
ся в неспорулированном состоянии (Overstreet, 1981).
В эксперименте было показано, что некоторые
виды Eimeria, паразитирующие у птиц и млекопитаю-
щих, могут формировать внекишечные тканевые ста-
дии (Shelton et al., 1968; McCully et al., 1970). Можно
предположить, что при эксцистировании ооцист спо-
розоиты Eimeria могут заражать не только энтероциты
кишечника, но и другие типы клеток, в которых пара-
зиты, однако, не претерпевают дальнейшего развития.
В неспецифическом хозяине такие спорозоиты обычно
переходят в латентное состояние. Однако при поеда-
нии зараженного неспецифического хозяина специфи-
ческим хозяином в кишечнике последнего ранее спав-
шие (латентные) стадии паразита могут активизиро-
ваться и начать эндогенное развитие.
Приведенные выше примеры свидетельствуют о
том, что у облигатно энтеро-эпителиальных паразитов,
каковыми считаются кокцидии рода Eimeria, сущест-
вует потенциальная способность к изменению исход-
ного места их развития в хозяине (кишечника). Спо-
собность к парентеральному (внекишечному) развитию
у видов Eimeria следут рассматривать как важнейшую
предпосылку в эволюции кишечных кокцидий для пе-
рехода от паразитирования в кишечнике к паразитиро-
ванию в крови и внутренних органах хозяина.
Наиболее часто вне кишечника развиваются виды
Eimeria, паразитирующие у пойкилотермных хозяев.
Так, у рыб эндогенные стадии эймерий заселяют все
внутренние органы: семенники, яичники, селезенку,
почки, печень, воздушный и плавательный пузыри, со-
единительнотканную выстилку органов и даже жабры.
Однако при оценке таких данных следует помнить, что
систематика видов Eimeria, паразитирующих у рыб,
постоянно совершенствуется, в результате чего неко-
торые виды, первоначально относившиеся к роду
Eimeria, постепенно переводятся в другие роды и под-
роды, такие как Epieimeria, Calyptospora, Goussia или
Plagula, о чем уже выше шла речь.
Большинство известных видов Eimeria, паразити-
рующих у амфибий и рептилий, локализуются как в
эпителиальных, так и в неэпителиальных клетках, как,
например, Е. kermogati из крокодила. Потенциальная
способность зоитов кишечных кокцидий проникать в
клетки иные, чем энтероциты кишечника, была убеди-
тельно показана в опытах по культивированию этих
паразитов в клеточных культурах и в курином эмбрио-
220
ALVEOLATA
не (Patton, 1965; Long, 1965; Шибалова и corp., 1969;
Doran, 1973, 19X2; Шибалова, 1977).
Многие виды рода Eimeria вызывают тяжелые па-
разитарные заболевания домашних животных и птиц
(')бмериозы), экономический ущерб от которых весьма
ощутим во всех странах мира. Борьба с эймериозами
составляет одну из важнейших задач ветеринарии и во
многом базируется на достижениях фундаментальной
науки по изучению биологии этих кокцидий.
Сведения о видовом составе, биологии и жизнен-
ных циклах кокцидий домашних животных содержат-
ся в ряде обзорных работ (Davies et al., 1963; Мусаев,
Вейсов, 1965; Хейсин, 1967; Колабский, Пашкин,
1974; Pellerdy, 1974; Сванбаев, 1977; Бейер и др., 1978;
Арнастаускене, 1985; Бейер, 1989; Вершинин, 2001).
Ниже приводится несколько примеров материального
ущерба сельскому хозяйству от эймериозов (Long,
Reid, 1982).
Из девяти видов Eimeria кур (рис. 127) наиболее тя-
желые нарушения процессов пищеварения у цыплят
вызывают Е. tenella, Е. necatrix, Е. brunetti и Е. acervu-
lina. Массовое разрушение эпителиальных клеток ки-
шечного эпителия усугубляется развитием болезне-
творных бактерий и сопутствующих воспалительных
процессов.
У крупного рогатого скота паразитируют 16 видов
Eimeria. Наибольшее знчение имеют Е. zuernii и Е. bo-
vis. При заражении Е. bovis пик клинических симпто-
мов у хозяина совпадает с фазой мерогонии паразита.
Первая генерация происходит в толще ворсинок тонкой
кишки, преимущественно в эндотелиальных клетках,
где развиваются гигантские шизонты (300—400 мкм в
диаметре), называемые «глобидиями». Внутри каждо-
го глобидия может развиваться до 100 тыс. мерозоитов
длиной около 11 мкм.
Среди более чем 12 видов Eimeria овец наиболее
патогенными считаются Е. ahsata, Е. arloingi и Е. ovi-
noidalis, вызывающие профузную диарею, общую сла-
бость и падеж животных.
Представляет интерес новый подход к оценке пато-
генного воздействия на хозяина возбудителей эймери-
озов овец (Gregory et al., 1987а, 1987b). При экспери-
ментальном изучении развития Е. bakuensis (=Е. ovina)
было отмечено, что число ооцист, выделяющихся пос-
ле однократного заражения овец, превосходило их тео-
ретически ожидаемое количество почти в 10.8 раз, если
исходить из подсчета стабильного для данного вида
числа бесполых генераций при известной дозе введен-
ных ооцист. Столь огромная продукция ооцист должна
была бы вызвать острейшие клинические проявления
и привести к неминуемой гибели животных. Однако на
практике это не имело места.
Это интереснейшее явление объясняется тем, что
эндогенные стадии Е. bakuensis на определенном этапе
своего развития в хозяине переключались на иной «ре-
жим» существования, отличный от рутинного жизнен-
ного цикла. Часть эндогенных стадий останавливалась
в развитии на стадии одноядерного мерозоита и пере-
ходила к персистированию внутри энтероцитов крипт
тонкой и слепой кишки. Такие мерозоиты стимулиро-
вали митотическое деление зараженных клеток (мито-
генный эффект), вызывая гиперплазию и образование
гигантских полипов в кишечнике. Когда одноядерные
мерозоиты Е. bakuensis приступали к делению, то в от-
личие от мерозоитов других видов Eimeria они не
давали начала многоядерным меронтам, а размножа-
лись обычным митотическим делением, причем син-
хронно с делением самих зараженных клеток полипа
(рис. 128, 4, 5, вкл.). Этому предшествовал процесс
дедифференцировки мерозоитов Е. bakuensis, которые
в результате теряли характерную ультраструктурную
организацию. Естественно, что, утратив трехмембран-
ную пелликулу и другие апикальные органеллы, меро-
зоиты Е. bakuensis уже не могли делиться путем эндо-
диогении.
В гигантских кишечных полипах овец насчитыва-
лось до нескольких миллионов клеток, но при этом
слизистая, выстилающая полип, всегда оставалась ин-
тактной и тем самым минимально травмированной.
Это можно объяснить тем, что, во-первых, заражение
клеток полипа происходило в процессе их деления, а
не путем проникновения зоита извне, как у других кок-
цидий, и, во-вторых, внутриклеточные зоиты никогда
не давали начала многоядерным меронтам, оконча-
тельное развитие которых неизбежно приводило бы к
разрушению зараженной клетки.
В какой-то момент многочисленные мерозоиты из
полипа попадали в энтероциты тонкой кишки овцы,
где, вновь приобретая характерную ультраструктуру
зоитов споровиков, приступали к мерогонии кокци-
дийного типа, за которой следовали процессы гамето-
генеза и образования огромного числа ооцист.
Разумеется, еще далеко не все понятно в таком
необычном цикле развития Е. bakuensis. Сходное, хотя
и не идентичное, развитие наблюдается и у другого
вида из овец — Е. crandallis (Gregory et al., 1987a,
1987b).
Род Tyzzeria Allen, 1936
(= Koidzumiella Matsubayasi, 1936)
Жизненные циклы гомоксенные. Округлые или ци-
линдрические ооцисты без спороцист, в ооцисте фор-
мируются 8 спорозоитов, лежащих свободно, и оста-
точное тело. Микропиле и полярная шапочка в ооци-
сте отсутствуют. Микрогаметы с двумя жгутиками.
Некоторые виды локализуются внутриядерно. Парази-
ты грызунов, водоплавающих птиц, рептилий. 10 ви-
дов.
Схема развития кокцидий рода Tyzzeria показана на
рис. 119, Л.
Типовой вид Tyzzeria perniciosa Allen, 1936.
Типовой хозяин: Anas platyrhynchos domestica.
Спорозоиты размером 10.0 X 3.5 мкм внедряются
в эпителиальные клетки слизистой и подслизистой
оболочки среднего и нижнего отделов тонкой кишки,
где совершается от двух до трех генераций мерогонии.
Через 24—48 ч в меронтах 1-й генерации (11.6 X
8.3 мкм) формируется 8—10 мерозоитов, которые про-
никают в мезенхимные клетки tunica propria и дают на-
чало меронтам 2-й генерации. К 74—84 ч такие ме-
ронты достигают 21 X 18 мкм и в них формируется
до 25 мерозоитов размером 9.4 X 2.1 мкм. Развитие
2-й генерации мерозоитов оказывает наибольший па-
тогенный эффект.
ТИП SPOROZOA. КЛАСС COCCIDEA
221
Гамонты появляются через 48—96 ч после зара-
жения. Мерогония продолжается и после появления
гамонтов. В микрогамонтах диаметром 75—80 мкм
формируются множество двужгутиковых микрогамет
и остаточное тело. Микро- и макрогамонты развивают-
ся в эпителии слизистой кишечника. Первые ооцисты
появляются в кишке на 5—6-е сут, а в экскрементах на
6-е сут после заражения. Наружная оболочка ооцисты
тонкая и прозрачная, внутренняя заметно толще. Спо-
руляция вне организма хозяина завершается в течение
1—2 сут. Спорулировэнные ооцисты достигают в
среднем 11.6 X 9.5 мкм. Спорозоиты размером 9.2—
10.0 X 2.9—3.5 мкм располагаются вокруг крупного
остаточного тела. В спорозоитах имеется одно пара-
нуклеарное тело. Препатентный период 5 сут.
Т. perniciosa вызывает острый геморрагический эн-
терит в хозяйствах по разведению уток, в которых па-
деж птицы может достигать 30—90 % поголовья. Наи-
большие поражения наблюдаются в нижнем отделе
12-перстной кишки (Peiyun et al., 1988).
Tyzzeria parvula Klimes, 1936.
(= Eimeria parvula Kotlan, 1933).
Хозяева: домашний гусь Anser anser и несколько
видов гусей родов Anser и Brantha.
Ооцисты размером 14.8 X 12.8 мкм с 8 свободными
спорозоитами. Эндогенное развитие совершается в те-
чение 5 сут в заднем и среднем отделах тонкой кишки,
преимущественно на верхушках ворсинок. Спорозои-
ты внедряются в эпителиальные клетки ворсинок.
В меронтах формируется 16—32 мерозоита. Макрога-
меты с крупными ядрами. Микрогамонты достигают
9.5 X 7.0 мкм. Наибольшее патогенное воздействие на
макроорганизм оказывают развивающиеся стадии га-
метогенеза. Остальные виды Tyzzeria не имеют прак-
тического значения.
Tyzzeria chalcides Probert, Roberts, Wilson, 1988.
(= Choleoeimeria chalcides Papema et Landsberg, 1989).
Хозяин: сцинк Chalcides ocellatus.
Эндогенное развитие в клетках эпителия желчного
протока и устья желчного пузыря. Макрогаметы раз-
мером 15.4—16.2X14.4—14.9 мкм имеют плотный
наружный покров. В микрогамонтах, достигающих
19.7—20.1 X 19.1—19.6 мкм, образуется более 16 мик-
рогамет. В ооцистах отсутствуют микропиле, поляр-
ная гранула и остаточное тело. В ооцистах размером
32 37 X 17—21 мкм формируется по 8 спорозоитов
(13.4 14.0 — 4.6—5.1 мкм), не заключенных внутри
спороцисты. Споруляция до стадии четырех споробла-
стов занимает 5—6 сут и завершается к 15-м сут при
+ 18 °C. Ооцисты спорулируют в просвете желчного
пузыря сцинка.
Род Epieimeria Dykova et Lorn, 1981
Ооцисты с четырьмя спороцистами, в каждой по
2 спорозоита. В спороцистах имеется тельце Штида.
Мерогония и гаметогенез совершаются эпицеллюляр-
но, а спорогония глубже в цитоплазме клетки хозяина.
Зоиты имеют типичную ультраструктуру споровиков.
Микрогаметы снабжены жгутиками. Микрогаметоге-
нез идет по эймериидному типу. Паразиты рыб. Число
видов не определено.
Типовой вид Epieimeria anguillae (Leger et Hol-
lande, 1922) Dykova et Lorn, 1981.
(= Eimeria anguillae Leger et Hollande, 1922).
Типовойхозяин: угорь Anguilla anguilla (=X. vul-
garis).
Внутриклеточный спорозоит окружен мембраной
паразитофорной вакуоли. Начало роста трофозоита
совпадает с его миграцией внутри вакуоли в апикаль-
ную часть зараженной клетки (рис. 129). С этого мо-
мента растущий паразит сверху и сбоку окружается
двумя мембранами: мембраной паразитофорной ваку-
оли и наружной мембраной (пелликулой) зараженной
клетки. Иногда мембрана паразитофорной вакуоли на
границе с цитоплазмой клетки хозяина образует паль-
цевидные выросты, которые изнутри укреплены плот-
ным материалом
Как и бесполые стадии, гамонты также окружены
паразите форной вакуолью и занимают эпицеллюляр-
ное положение, выдаваясь в виде заметных возвы-
шений в просвет кишки хозяина. По завершении мик-
рогаметогенеза мужские гаметы высвобождаются в
пространство паразитофорной вакуоли. Микрогаметы
имеют удлиненную форму тела размером 1.5 X
0.35 мкм и снабжены двумя жгутиками длиной 3.5 и
0.1 мкм в диаметре.
В растущих макрогаметах происходит интенсивное
накопление полисахаридов; в зрелых макрогаметах от-
четливо различаются два типа сот.
При интенсивной инвазии массовая спорогония
внутри ооцист происходит в просвете кишки. Прото-
плазма зиготы расщепляется на 4 споробласта, и при
этом выделяется остаточное тело. Спорулированные
ооцисты лежат как раздельно, так и собранные в еди-
ный общий «кокцидийный очаг», в котором может
насчитываться до нескольких сот ооцист. При слабом
заражении хозяина ооцисты не всегда успевают поки-
нуть зараженную клетку, поскольку нередко подвер-
гаются внутриклеточной деградации.
Несмотря на внешнее сходство во внутриклеточ-
ной локализации Epieimeria и Cryptosporidium, между
этими родами существуют принципиальные различия.
Так, в отличие от Cryptosporidium у Epieimeria на гра-
нице с клеткой хозяина не формируется мультимемб-
ранная органелла, микроворсинки щеточной каемки не
принимают участия в формировании паразитофорной
вакуоли. Структура ооцист Epieimeria иная, чем у
Cryptosporidium. В спороцисте у Epieimeria имеется
тельце Штида и отсутствует шов, тогда как в спороци-
сте Cryptosporidium имеется шов и отсутствует тельце
Штида. У Epieimeria микрогаметы снабжены жгутика-
ми, а микрогаметогенез идет по типично эймериоид-
ному типу, т. е. с разделением ядра формирующихся
микрогамет на хроматиновую и ахроматиновую части.
Напротив, у- Cryptosporidium формируются безжгути-
ковые микрогаметы, а процесс микрогаметогенеза
идет принципиально иначе. При интенсивной инвазии
хозяина отдельные участки слизистой кишки сильно
изменяются, что связано с эпицеллюлярным положе-
нием эндогенных стадий развития паразита. Заражен-
ные клетки набухают и приобретают неправильные
очертания. Сокращение числа микроворсинок щеточ-
222
ALVEOLATA
Рис. 129. Схематическое изображение эпицеллюлярного развития кокцидий рода Epieimeria в эпителии кишечника рыбы. (По: Benajiba
et al., 1994).
J — этапы становления эпицитоплазматической локализации паразита: 1 — проникновение зоита а клетку хозяина с последующим формированием в ее ци-
топлазме паразитофорной вакуоли, 2 — контактирование зоита с ядром клетки хозяина, 5 • - установление эиицитоплазматической локализации макрогаме-
ты; II— спорогония Epieimeria при слабой интенсивности инвазии: 1 — споруляция ооцисты и клетке хозяина, 2 — некротизация зараженной клетки, 3 —
выталкивание клетки хозяина, содержащей ооцисту, из эпителиального слоя в сторону базальной мембраны; /// — спорогония Epieimeria при сильной ин-
тенсивности инвазии: 1 — начало споруляции ооцисты, 2 — некротизация зараженной клетки,.? выталкивание зараженной клетки в просвет кишечника и
завершение споруляции ооцисты; стрелки — направление движения паразита.
Fig. 129. Scheme of epicellular development of Epieimeria in the fish intestinal epithelium.
I— steps of epicytoplasmic localization of the parasite: I — zoite penetration into the host cell and formation of parasitophorous vacuole, 2 — zoite contact with the
host cell nucleus; establishment of epicytoplasmic localization by the macrogamete; Il — sporogony pattern at a low infection of Epieimeria: 1 — onset of oocyst sporu-
lation, 2 — necrosis of the infected cell, 3 — oocyst-containing host cell is pinched off from the epithelial layer towards the basal membrane; III — sporogony pattern at
a heavy Epieimeria infection: 1 — onset of oocyst sporulation, 2 — necrosis of the infected cell, 3 — oocyst-containing host cell is pinched off into the intestinal lumen,
where oocyst sporulation is completed; arrows — the development of parasite’s movement.
ТИП SPOROZOA. КЛАСС COCCIDEA
223
ной каемки кишечного эпителия приводит к серьез-
ным нарушениям процессов всасывания и пищеваре-
ния у хозяина. Массовый выход зигот и ооцист из зара-
женных клеток вызывает некроз и атрофию слизистой
кишечника рыб с последующим образованием изъязв-
лений и множества округлых полостей. При слущива-
нии пораженного эпителия язв увеличивается общее
количество ооцист, попадающих в просвет кишки, ко-
торые тут же и спорулируют.
Подробные сведения об эпиэймериях содержатся в
сводке Бенаджибы и сотр. (Benajiba et al., 1994).
Род Pseudoklossia Leger et Duboscq, 1915
(= Margolistella Desser et Bower, 1997)
Жизненные циклы гомоксенные. Число спороцист
в ооцисте колеблется от нуля до множества, в каждой
спороцисте по 2 спорозоита. Паразиты морских плас-
тинчатожаберных моллюсков. 8 видов.
Типовой вид Pseudoklossia glomerata Leger et
Duboscq, 1915.
Типовые хозяева: пластинчатожаберные мол-
люски Tapes florodus и Т. virginous.
Ооцисты диаметром 40 мкм с множеством округ-
лых спороцист, достигающих 4—5 мкм в диаметре,
каждая спороциста с 2 спорозоитами. Паразитируют в
почках моллюсков (Morado et al., 1984).
Pseudoklossia semiluna Desser et al., 1998.
Хозяева: двустворчатые моллюски рода Mytilus:
М. edulis, М. galloprovincialis, М. trossulus.
Стадии мерогонии не обнаружены. Гамо- и споро-
гония в эпителии почечных канальцев моллюсков.
Зрелые макрогамонты имеют вид полумесяца разме-
ром 30—32 X 18—26 мкм. Спорулированные ооцисты
округлые, 22.9 мкм в диаметре. В ооцистах формиру-
ется около 24 эллипсоидных спороцист (6x3 мкм), в
каждой по 2 спорозоита.
В цитоплазме молодых макрогамет имеется множе-
ство митохондрий, элементов аппарата Гольджи и ше-
роховатой эндоплазматической сети, а также липид-
ных капель и гранул амилопектина. По периферии
Макрогамет располагаются сот двух типов.
Болес подробные сведения о видах рода Pseudok-
lossia содержатся в ряде публикаций (Desser et al., 1998).
Margolisiella Desser et Bower, 1997.
(- Pseudoklossia chitonis Debaisieux, 1919).
Гомоксенные и моноксенные паразиты морских
двухстворчатых моллюсков. Мерогония, а также гамо-
и спорогония проходят в эпителии почек. Крупные
ооцисты с многочисленными спороцистами, в каждой
но 2-—4 спорозоита. Споруляция совершается in situ, в
организме хозяина.
Типовой вид Margolisiella kabatai Desser et Bo-
wer, 1997.
Типовой хозяин: двустворчатый моллюск Рго-
tothaca staminea.
Паразитирует в эпителии почечных канальцев мол-
люска. Свежевыделенные ооцисты округлые, 41 мкм в
диаметре; в ооцистах формируются 32 овальные споро-
цисты, 9—10 мкм в диаметре. В каждой спороцисте по
4 спорозоита. Стадии, подобные тканевым цистам, до-
стигают 19 мкм в диаметре. Несколько видов рода Pseu-
doklossia (Р. patellae, Р. chitonis, Р. tellinovum, Р. halotis)
следует, по-видимому, включить в род Margolisiella.
Род Grasseella Tuzet et Ormieres, 1960
Жизненный цикл гомоксенный. Ооцисты с множест-
вом спороцист, в каждой спороцисте по 12 спорозоитов.
Паразиты асцидий. 1 вид. (Ormieres, Porchet-Hennere, 1974).
Типовой вид Grasseella microcosmi Tuzet et Or-
mieres, 1960.
Типовой хозяин: асцидияMicrocosmussulcatus.
Род Ovivora Mackinnon et Ray, 1937
Жизненный цикл гомоксенный. Ооцисты с множе-
ством спороцист, в каждой спороцисте по 12 спорозои-
тов. Паразитируют в яйцах эхиурид. 1 вид.
Типовой вид Ovivora thalassemae Mackinnon et
Ray, 1937.
(= Monocystis thalassemae Lankester, 1885).
Типовой хозяин: эхиурида Thalassemaneptuni.
Ovivora (?) Leger, 1897, species inquirendae.
(= Pseudoklossia pelseneeri Leger et Duboscq, 1915,
Hyaloklossia pelseneeri Leger, 1897).
Хозяин: Donax sp., Tellina sp.
В спороцистах образуется 4—6 спорозоитов.
Род Mantonella Vincent, 1936
Ооцисты с одной спороцистой, содержащей 4 споро-
зоита и остаточное тело. Кишечные паразиты водных
беспозвоночных. Позвоночные (водяные черепахи) слу-
жат, по-видимому, лишь транзитными хозяевами. 3 вида.
Типовой вид Mantonellaperipati Wacha etChris-
tiansen, 1976.
Типовые хозяева: Peripatopsis sedgwicki, P. mo-
seleyi.
В крупных меронтах формируются 10—12 удли-
ненных мерозоитов, в мелких — не более четырех.
Крупные микрогаметы достигают 19 мкм в длину. Зи-
гота локализуется ближе к основанию эпителиальной
клетки. В ходе споруляции вначале образуется споро-
бласт с 4 ядрами, который превращается в спороцисту
с 4 крупными спорозоитами (16.0 X 5.5 мкм) и оста-
точным телом. Овальные ооцисты размером 30—36 X
17 мкм покрыты плотной стенкой. Напротив, спороци-
ста имеет тонкую стенку, которая легко разрушается и
высвобождает спорозоиты в пространство ооцисты.
Mantonella potamobii Gousseff, 1936.
(= Yakimovella potamobii Gousseff, 1936).
Хозяин: рак Astacus (=Poramobius) leptodactylus.
Ооцисты овальные, слегка заостренные на одном
конце, снабженном утолщением в виде шапочки. В
ооцистах размером 24—26 X 11—13 мкм формирует-
ся одна спороциста размером 20.0 X 6.5 мкм. Внутри
спороцисты формируются 4 удлиненных спорозоита
(18.5 X 1.4 мкм) и остаточное тело.
224
ALVEOLATA
Род Cyclospora Schneider, 1881
Жизненные циклы гомоксенные. Ооцисты с двумя
спороцистами, в каждой по 2 спорозоита. В спороци-
стах выявляется тельце Штида. Эндогенное развитие
осуществляется внутриклеточно и внеклеточно. Пара-
зиты человека, кротов, рептилий (сцинк, змея), беспоз-
воночных (многоножки). 15 видов. Валидными при-
знаются виды, паразитирующие у грызунов и насеко-
моядных, но не в рептилиях: последние могут быть
видами родов Isospora или Sarcocystis.
Типовой вид Cyclospora glomericola Schneider,
1881.
Типовой хозяин: многоножки Glomeris sp.
Ооцисты размером 25—36 X 9—10 мкм покрыты
плотной оболочкой:
Cyclospora babaulti Phisalix, 1924.
Хозяин: гадюка Vipera berus.
Овальные ооцисты размером 17 X 10 мкм; спорозо-
иты достигают 10.5 X 2.0 мкм. Эндогенное развитие
протекает внутриклеточно.
Cyclospora colobi Eberhard, da Silva, Lilley, Pienia-
zek, 1999.
Хозяин: Colobus guereza.
Cyclospora cercopitheci Eberhard, da Silva, Lilley,
Pieniazek, 1999.
Хозяин: Cercopithecus aethiops.
Cyclospora caryolytica Schaudinn, 1902.
Хозяин: крот Talpa europaea.
Ооцисты размером 16—19 X 13—16 мкм или 15—
18 X 9—10 мкм (Tanabe, 1938). Имеется несколько ге-
нераций мерогонии; в меронте формируется до 16 ме-
розоитов. Эндогенные стадии развиваются внутри
ядер эпителиальных клеток тонкой кишки и распола-
гаются внутри отчетливо заметной паразитофорной
вакуоли. Макро- и микрогамонты достигают соответ-
ственно 7.7—10.7 и 6.5—8.6 мкм в диаметре (Entze-
roth, Scholtyseck, 1984). Двужгутиковые микрогаметы
размером 3—5 X 0.8 мкм. При сильном заражении
С. caryolytica у кротов может развиться диарея с ле-
тальным исходом (Mohamed, Molyneux, 1990).
Cyclospora cayetanensis Ortega, Gilman, Sterling,
1994.
(= Cryptosporidium cayetanensis Tauxe, 1997; Cyclospora cayeta-
nensis Dulol, Heyer, Beaugerie, Chatelet, 1996, lapsus, isospora sp.
Ashford, 1979, тельца CLB, подобные цианобактериям, синезеле-
ные водоросли).
Хозяева: Homo sapiens, а также, возможно, шим-
панзе и бабуины
Полный жизненный цикл неизвестен. Эндогенные
стадии локализуются в эпителии 12-перстной кишки,
внутри клеток окружены паразитофорной вакуолью.
Округлые, слегка овальные ооцисты 7.7—9.9 мкм
в диаметре покрыты двуслойной стенкой. В ультрафио-
летовом свете стенка ооцисты дает ярко-синюю ауто-
флуоресценцию. В ооцисте отсутствует микропиле, но
имеются полярная гранула и остаточное тело. Ооцис-
ты спорулируют во внешней среде. В ооцисте форми-
руется две спороцисты, в каждой по 2 спорозоита.
Спороцисты овальные, средние размеры спороцист
4x6 мкм. В спороцисте имеются тельца Штида и
суб-Штида. Остаточное тело спороцисты составлено
из крупных сферических гранул.
Кокцидии, впоследствии получившие название Cyc-
lospora cayetanensis, были впервые описаны в 1979 г.
Ашфордом (Ortega et al., 1993). Впоследствии из Но-
вой Гвинеи и Перу было получено сообщение о зара-
жении человека кокцидиями, имевшими структуру
ооцисты, соответствовавшую роду Cyclospora (Ortega
et al., 1994). На мазках фекалий зараженного пациен-
та, окрашенных кислотоустойчивыми красителями,
ооцисты С. cayetanensis имеют большое сходство с
ооцистами рода Cryptosporidium, но превосходят их по
размерам. Основные симптомы заболевания при цик-
лоспорозе напоминают таковые при криптоспоридио-
зе — хроническая водянистая диарея, обезвоживание
организма, — особенно четко выраженные у пациен-
тов с нарушениями иммунной системы.
Род Dorisa Levine, 1980
(= Dorisiella Ray, 1930)
Ооцисты с 2 спороцистами, в каждой спороцисте
по 8 спорозоитов. Ооцисты покрыты одно- или дву-
слойными стенками; микропиле в ооцистах не у всех
видов. В спороцистах имеется тельце Штида. Парази-
ты птиц и грызунов. 12 видов.
Ливайн (Levine, 1980а) включает в род Dorisa все
известные виды рода Dorisella Ray, 1930, паразитиру-
ющие только у позвоночных хозяев. В то же время сам
род Dorisiella с типовым видом/?, scololapsis Ray, 1930
помещен в сем. Caryotrophidae, объединяющее гомо-
ксенных паразитов.
Типовой вид Dorisa hoarei Levine, 1980.
Типовой хозяин: четырехполосая змея Elaphe
quatuorlineata sauromates.
Ооцисты в фекалиях змей округлые (18—24 мкм в
диаметре) или овальные (16—26 X 13 мкм), покрыты
двуслойной оболочкой; остаточное тело и микропиле
отсутствуют, но имеется полярная гранула. Спороцис-
ты достигают 14—16 X 8 мкм. В ооцисте формируется
4, 6 или 8 (?) спорозоитов. Остаточное тело имеется
только в спороцистах с 4 спорозоитами. Эндогенное
развитие не прослежено.
Род Wenyonella Ноаге, 1933
Округло-овальные ооцисты с трехслойными обо-
лочками, остаточное тело отсутствует. В ооцисте фор-
мируется 4 спороцисты; тельце Штида выявлено не у
всех видов. В каждой спороцисте образуются по 4 спо-
розоита и остаточное тело. Два из четырех спорозои-
тов внутри спороцисты имеют удлиненную форму, два
других округлую и обычно лишены парануклеарных
тел. Эндогенное развитие внутриклеточное и внутри-
ядерное. Кишечные паразиты млекопитающих, птиц,
рептилий. Свыше 18 видов.
Типовой вид Wenyonella africana Ноаге, 1933.
Типовой хозяин: коричневая домашняя змея
Boedon lineatus.
Рис. 90. Макрогаметы Eimeria.
1 — Е. nocens (фото А. К. Понизовского); 2 — Е. bovis: в цитоплазме макрогаметы хорошо заметны два жгутика и ядро проникшей микрогаметы (фото
Е. Scholtyseck); а — амилопектин, жг — жгутик, кх — клетка хозяина, мг — микрогамета, пфв — паразитофорная вакуоль, сот — стенкообразующие тела,
я — ядро, яд — ядрышко.
Fig. 90. Macrogametes of Eimeria.
1 — Eimeria nocens; 2 — E. bovis'. in its cytoplasm two flagella and the nucleus of a microgamete are clearly seen; a — amylopectin, жг — flagellum, кх — host cell,
мг — microgamete, пфв — parasitophorous vacuole, com — wall-forming bodies, я — nucleus, яд — nucleolus.
Рис. 91. Макрогаметы Eimeria (продолжение).
3 — зрелая макрогамета Е. nocens с обилием гранул амилопектина в цитоплазме (фото А. К. Понизовского); а — амилопектин, жг — жгутик, мг — микрога-
мета, сот — стенкообразующис тела, я — ядро, яд — ядрышко.
Fig. 91. Macrogametes of Eimeria (continuation).
3 — mature macrogamete of E. nocens with numerous amylopectin granules in the cytoplasm; a — amylopectin, жг — flagellum, мг — microgamete, com — wall-for-
ming bodies, я — nucleus, яд — nucleolus.
Рис. 102. Зрелые гаметы и ооцисты гомоксснных аделеидных кокцидий.
/, .? — эндогенные стадии развития Klossia helicina в клетках почек моллюска (фото Т. В. Бейер); 3, 4 — ооцисты Klossia с формировавшимися спороци-
стами (фото Т. R. Shoeb); сз — сизигий, ма — макрогамета, оо — ооциста.
Fig. 102. Mature gametes and oocysts of homoxenous adeleid coccidia.
/, .? endogenous developmental stages of Klossia helicina in molluscan kidney cells; 3. 4 — oocysts of Klossia with forming sporocysts; ма — macrogamete, сз —
5У2У§У« 00 — oocyst.
Рис. 107. Эндогенные стадии развития гемогрегарин рода Karyolysus в организме скальных ящериц.
1—4 — экзоэритроцитарные меронты: несегментированный меронт (7), гипнозоит (2), делящиеся меронты (5, 4); 5, 6 — эритроцитарные стадии: мерозоиты
(5) и инкапсулированные гамонты (5) (фото Т. В. Бейер); в — вакуоль, гм — гамонт, гп — гипнозоит, ме — мерозоит, нэр — незараженный эритроцит, я —
ядро.
Fig. 107. Endogenous stages of Karyolysus in rock lizards.
1—4 — exoerytrocytic meronts: non-segmented meront (7), hypnozoite (2), dividing meronts (3, 4): 5, 6 — erythrocytic stages: merozoites (5) and encapsulated ga-
monts (б); в — vacuole, гм — gamont, гп — hypnozoite, ме — merozoite, top — not infected erythrocyte, я — nucleus.
Рис. 108. Гипнозоит Karyolysus sp. в печени ящерицы. (По: Бейер, 1979).
MHhpyi I lllllioiotnu формируется паразитофорная вакуоль сложного строения; аут - аутосома, мп — микронсмы, мп — микропора, пфв — паразитофорная
вакуоль, р — роптрии, смт — субпелликулярные микротрубочки, щка щелевые каналы, я — ядро.
Fig. 108. Hypnozoite of Karyolysus sp. in the rock-lizard liver.
Him pill unlit* Im hiilhni г< I \\ iilnu a complicated parasitophorous vacuole; aym — autosome, мп microncmes, мп — micropore, пфв — parasitophorous vacule, p —
rhoptries, cum — subpelliular microtubules, i/i/ca - narrow canals, я — nucleus.
Рис. 109. Эритроцитарные стадии развития Karyolysus sp. (По: Бейер, 1977; Бейер, Сидоренко, 1984).
1 — крупная капсула {стрелки) вокруг гамонта, цитоплазма которого претерпела сильное сжатие; 2 — фрагмент инкапсулированного гамонта при большем
увеличении; головки стрелок — периферическая зона зараженного эритроцита, лишенная примембранных белков; нэр — незараженный эритроцит, не —
пелликула, я — ядро, якх — ядро клетки хозяина.
Fig. 109. Erythrocytic stages of Karyolysus sp.
1 — gamont with heavily shrunk cytoplasm surrounded with a thick capsule {arrows)-, 2 — a fragment of the encapsulated gamont at higher magnification; arrow he-
ads — peripheral part of the infected erythrocyte lacking primembrane proteins; пэр — not infected erythrocyte, ne — pellicle, я — nucleus, якх — host cell nucleus.
Рис. ПО. Эритроцитарные стадии развития Karyolysus sp. {продолжение). (По: Бейер, 1977).
3 — эритроцитарный гамонт, покрытый аморфным веществом капсулы (стрелка); 4 — то же, фрагмент при большем увеличении; якх — ядро клетки хо-
зяина.
Fig. ПО. Erythrocytic stages of Karyolysus sp. (continuation).
3 — erythrocytic gamont surrounded with amorphous capsule (arrow); 4— the same at higher magnification; якх — host cell nucleus.
Рис. 111. Стадии развития дактилосоматид. (Фото J. Barta).
Электронограммы стадий развития Dactylosoma гапагит и Babesiosoma stableri: 1 —делящийся вторичный меронт D. гапагит, 2 — гамонт В. stableri в эрит-
роците лягушки, 3 — гамонт D. гапагит в сложенном состоянии.
Fig. 111. Developmental stages of the dactylosomatids.
Electionograms of developmental stages of Dactylosoma гапагит and Babesiosoma stableri'. I — dividing secondary meront of D. гапагит, 2 — gamont of B. stableri
in the frog erythrocyte, 3 — gamont of D. гапагит folded in two.
Рис. 112. Стадии развития дактилосоматид (продолжение).
4—11 — развитие Babesiosoma stableri в крови лягушки Ranapipiens (4—6) и в пиявке Desserobdellapicta (7—10): 4 — крестообразный 4-ядерный первичный
меронт; 5 — вторичный 4-ядерный меронт; 6 — зрелый гамонт с диффузным ядерным материалом; 7 — гамонт, свободно лежащий в содержимом крови пи-
явки; 8 — гамонты, соединенные в сизигий; 9 — зигота (оокинета); 10 — развивающиеся 4-ядерные меронты и свободные мерозоиты в клетках слюнных же-
лез пиявки; 11 — электронограмма первичного неделящегося меронта в эритроците лягушки.
Fig. 112. Developmental stages of the dactylosomatids (continuation).
4—11 —development of Babesiosoma stableri in the blood of the frog Rana pipiens (4—6) and in the leech Desserobdella picta (7—10): 4 — cross-shaped 4-nucleate
primary meront; 5 — secondary 4-nucleate meront; 6 — mature gamont with diffuse nuclear substance; 7 — free gamont in leech blood; 8 — gamonts associated into a
syzygy; 9 — zygote (ookinete); 10 — developing 4-nucleate meronts and free merozoites in leech salivary gland cells; 11 — electronogram of primary non-dividing me-
ront in frog erythrocyte.
Рис. 113. Стадии развития дактилосоматид (продолжение).
12 — молодая зигота Babesiosoma stableri в цитоплазме эпителиальной клетки кишечника пиявки Desserobdella picta (3-и сут после заражения); 13 — зрелая
ооциста (16-е сут после заражения) с 8 спорозоитами, свободно располагающимися в цитоплазме зараженной клетки.
Fig. 113. Developmental stages of the dactylosomatids (continuation).
12 — young zygote of Babesiosoma stableri in the cytoplasm of intestinal epithelial cell of the leech Desserobdella picta (by the 3rd day after infection); 13 — mature
oocyst (by the 16tK day) with 8 sporozoites freely arranged in the infected cell cytoplasm.
Рис. 114. Стадии развития дактилосоматид (продолжение).
14 — развивающийся 4-ядерный меронт Babesiosoma stableri в клетках слюнных желез пиявки Desserobdella picta в процессе отпочковывания 4 мерозоитов;
15 — группа зрелых мерозоитов, свободно лежащих внутри клетки; ме — мерозоиты.
Fig, 114. Developmental stages of the dactylosomatids (continuation).
14 — developing 4-nucleate meront of Babesiosoma stableri in salivary gland cells of the leech Desserobdellapicta', 15 — a group of mature merozoites freely laying
inside the host cell; ме — merozoite.
Рис. 122. Стадии развития Cryptosporidium parvum.
1 — ворсинка тонкой кишки зараженного теленка (фото I. Pavlasek); 2—4, 6 — ооцисты С. parvum при разных методах окраски: анилиновым синим (2),
азур-эозином по Романовскому-Гимза (3, 4), карболовым фуксином по Цилю-Нильсену (6) (фото Т. В. Бейер); 5 — ооцисты С. parvum, выявленные с фазо-
вым контрастом (фото D. Casemore).
Fig. 122. Developmental stages of Cryptosporidium parvum.
1 — calf small intestinal villus heavily colonized with numerous parasites; 2—4, 6 — oocysts stained by: anyline blue (2), azur-eosin after Romanovsky-Giemsa (3, 4),
carbol fuchsin after Ziehl-Neelsen (6); 5 — oocysts as seen with phase contrast.
Рис. 123. Стадии развития Cryptosporidium parvum (продолжение).
Молодая макрогамета С. parvum, окруженная еще не полностью замкнутой паразитофорной вакуолью: в зоне взаимодействия происходит слияние мембран
пелликулы паразита и микроворсинок зараженной клетки (фото Н. В. Сидоренко); гк — гликокаликс, зв — зона взаимодействия, м — митохондрии, мв —
микроворсинки, пе — пелликула, по — питающая органелла, рб — рибосомы, я — ядро, яд — ядрышко.
Fig. 123. Developmental stages of Cryptosporidium parvum (continuation).
Young macrogamete surrounded with not yet fused membranes of parasitophorous vacuole; гк — glycocalyx, зв — zone of interaction, м — mitochondria, мв — micro-
villi, ne — pellicle, no — feeder organelle, рб — ribosomes, я — nucleus, яд — nucleolus.
Рис. 125. Зиготы Cryptosporidium parvum. (По: Бейер, Сидоренко, 1990).
1 — молодая ооциста, заполненная полисахаридными гранулами, 2 — начало споруляции в толстостенной ооцисте; а — амилопектин, по — питающая орга-
нелла.
Fig. 125. Zygotes of Cryptosporidium parvum.
1 — a young zygote (oocyst) filled with polysaccharide granules, 2 — onset of sporulation in the thick-walled oocyst; a — amylopectin, no — feeder organelle.
Рис. 126. Эндогенные стадии развития кокцидий рода Eimeria в эпителии кишечника.
I — Е. intestinalis; 2,3 — Е. magnet (фото Т. В. Бейер); з зигота. макрогамета, мгц - - микрогаметоцит, мер — меронт, но — неспорулированная ооци-
ста, я — ядро.
Fig. 126. Endogenous stages of Eimeria in the intestinal epithelium.
/ —E. intestinalis', 2,3 — E. magna; з — zygote,.1/4/ — macrogamete..— microgametocyte (= microgamont),мер — meront, но — non-sporulated oocyst,я — nuc-
leus.
Рис. 128. Эндогенные стадии развития кокцидий рода Eimeria в эпителии кишечника (продолжение).
Eimeria bakuensis: 4 — внутриядерные меронты; 5 — деление меронтов, происходящее синхронно с делением ядер зараженных клеток; 6 — необычная ульт-
раструктурная организация 2-ядерных меронтов, лишенных органелл апикального комплекса (фото М. Gregory); я — ядро.
Fig. 128. Endogenous stages of Eimeria in the intestinal epithelium (continuation).
Eimeria bakuensis'. 4 — intranuclear meronts; 5 — meront division occurring synchroneously with nuclear division in the infected host cells; 6 — unusual ultrastructu-
ral organization of 2-nucleate meronts lacking characteristic organelles; я — nucleus.
ТИП SPOROZOA. КЛАСС COCCIDEA
225
Распространение: Уганда (Восточная Афри-
ка).
Ооцисты размером 18—19 X 16—18 мкм выделя-
ются в неспорулированном состоянии. Стенка ооцис-
ты двуслойная, микропиле отсутствует. Спороциста
размером 9.6 X 8.0 мкм с четырьмя спорозоитами дли-
ной 7.6 мкм и остаточным телом. В меронтах (15.2—
20.9 X 13.4—15.2 мкм) формируется до 20 мерозоитов
размером 20 X 3 мкм.
Wenyonella philiplevinei Leibovitz, 1968.
Хозяин: домашняя утка Anas platyrhyncha domes-
lica.
Распространение: Нью-Джерси, США.
Ооцисты размером 18.7 X 14.4 мкм. Стенка ооцис-
ты трехслойная, микропиле имеется, остаточное тело
отсутствует. Споруляция ооцист происходит во внеш-
ней среде. Спороцитсты размером 9.4 X 6.1 мкм.
В спороцистах имеются тельце Штида и остаточное
тело.
При экспериментальном заражении развитие эндо-
генных стадий происходит под ядром в клетках ки-
шечника в области дивертикула Меккеля и прямой
кишки, преимущественно в верхней части ворсинок.
Меронты 1-й генерации (17 X 15 мкм) появляются че-
рез 24 ч после заражения и дают начало 6 мерозоитам
(8.0 X 2.6 мкм). Меронты 2-й генерации (14 X 10 мкм)
появляются через 49 ч и дают начало 8 мерозоитам
(8.8 X 2.0 мкм). Через 74 ч появляются меронты 3-й ге-
нерации (15 X 13 мкм), в которых формируется 12 ме-
розоитов (10.6 X 2.9 мкм). Третья бесполая генерация
локализуется под ядром эпителиальной клетки, что об-
легчает проникновение мерозоитов через ее базальную
мембрану в субэпителий, т. е в сердцевину ворсинки.
Именно здесь мерозоиты 3-й генерации дают начало
гамонтам. Гаметогенез начинается через 93 ч после за-
ражения; макро- и микрогамонты достигают соответ-
ственно 12х10и20х11 мкм. Первые ооцисты появ-
ляются в экскрементах хозяина через 120 ч.
W. philiplevinei является одним из наиболее пато-
генных видов кокцидий, паразитирующих у домашней
утки. Сведения о других видах Wenyonella содержатся
в ряде работ (Pellerdy, 1974; Peiyun et al., 1988).
Род Caryospora Leger, 1904
Ооцисты с одной спороцистой, внутри которой рас-
полагаются 8 спорозоитов. Паразиты птиц, рептилий и
грызунов.
До 80-х гг. XX в. виды рода Caryospora считались
гомоксеппыми и моноксенными паразитами рептилий
(Wenyon, 1926; Doflein-Reichenow, 1953). Однако бо-
лее поздние исследования показали, что некоторые
виды Caryospora могут развиваться факультативно ге-
тероксонио, с включением «первичного» и «вторично-
го» хозяев (Stockdale, Cawthorn, 1981; Wacha, Christi-
ansen, 1982; Upton ct al., 1983, 1984, 1985; Upton Peters,
1986; MntUNchka, 1986a; Upton, Barnard, 1988; Upton,
Sundci inann, 1990; Lainson, 1991). Схема жизненного
цикла Caryospora представлена на рис. 130.
Более привычные для кокцидий термины «проме-
жуточный» и «окончательный» хозяева неприемлемы
Рис. 130. Схема гетероксенного жизненного цикла кокцидий рода
Caryospora, включающего первичного (хищник) и вторичного
(жертва) хозяев.
кх — клетка хозяина, кц — кариоциста, ма — макрогамета, ме — мерогония,
мер — мерозоиты, но — неустойчивая ооциста, оо — ооциста, со — спору-
лированная ооциста, сп — спорозоиты; 1, 2, 3... — число бесполых генера-
ций мерогонии; стрелки — направление развития, пунктирная стрелка —
развитие при каннибализме вторичного хозяина.
Fig. 130. Scheme of the heteroxenous life cycle of Caryospora, inclu-
ding a primary (predatory) and secondary (victim) host.
кх — host cell, кц — caryocyst, ма — macrogamete, ме — merogony, мер — me-
rozoites, но — instable oocyst, oo — oocyst, co — sporulated oocyst, cn — sporo-
zoites; 1, 2, 3... — merogonal generations; arrows — the direction of develop-
ment, dotted arrow — development with cannibalistic mode of transmission.
при описании жизненного цикла Caryospora, посколь-
ку в каждом из двух хозяев этого паразита совершает-
ся не часть цикла (например, бесполая или половая,
как у других гетероксенных кокцидий, см ниже), а про-
ходит вся триада Sporozoa, фактически повторяясь
дважды на протяжении всего этого необычного жиз-
15 Зак. №416.1
226
ALVEOLATA
ненного цикла. Однако в разных хозяевах Caryospora
дальнейшая судьба формирующихся ооцист складыва-
ется по-разпому. Между первичным и вторичным хо-
зяевами создаю тся отношения соответственно хищни-
ка и жертвы. Первичный хозяин заражается при поеда-
нии ооцист или зараженного вторичного хозяина;
вторичный хозяин заражается при поедании ооцист
или своих зараженных собратьев (при каннибализме
грызунов).
В первичном хозяине (хищные рептилии, птицы)
все эндогенное развитие паразита происходит в эпи-
телии средней части тонкой кишки. Мерогония вклю-
чает 2—3 генерации; гаметогенез протекает по эймери-
идному типу. В микрогамонте формируется остаточное
тело, вокруг которого располагаются микрогаметы.
Макрогамета имеет крупное ядро с центральным яд-
рышком. Округлые ооцисты Caryospora покрыты тол-
стостенной оболочкой; микропиле и остаточное тело
отсутствуют (рис. 131,1, вкл.). С внутренней стороны
к стенке ооцисты прилегают 1—2 полярные гранулы в
виде светопреломляющих телец. Имеется одна споро-
циста, внутри которой образуется 8 спорозоитов, тель-
ца Штида и суб-Штида и крупногранулярное остаточ-
ное тело. Ооцисты выделяются во внешнюю среду в
неспорулированном состоянии. Патентный период
длится неопределенно долгое время — в течение не-
скольких месяцев и даже лет. Это предполагает на-
личие хотя бы одной стадии мерогонии, способной к
рециклированию, хотя нельзя исключать наличия в
этот период и нового заражения хозяина через ооци-
сты (Upton, Sundermann, 1990).
Во вторичном хозяине (мышевидные грызуны,
цыплята) также проходит полная триада Sporozoa: ме-
рогония, гамогония и спорогония. Меро- и гамогония,
а впоследствии и спорогония Caryospora протекают
в фибробластоподобных клетках соединительной тка-
ни, среди пучков поперечно-полосатых мышечных
волокон языка или между волосяными фолликулами
и мышечными волокнами щек и носа (у мышей)
(рис. 131, 3, вкл.). Нередко наблюдается генерализо-
ванное заражение хозяина.
Полностью сформированные, спорулированные
ооцисты, однако, не выделяются во внешнюю среду,
но эксцистируются in situ, в ткани дермы или в соеди-
нительной ткани. Такие ооцисты, обозначаемые как
тонкостенные, на самом деле лишены самостоятель-
ной стенки, что облегчает процесс их эксцистирова-
ния. Высвободившиеся спорозоиты захватываются
макрофагами и фибробластами и превращаются в спя-
щие стадии, или гипнозоиты, лежащие в клетке хозяи-
на внутри паразитофорной вакуоли. Зараженная клет-
ка хозяина претерпевает существенные изменения,
постепенно превращаясь в моно- или диплозоитную
цисту, или кариоцисту (рис. 131,2, вкл.).
Ооцисты и кариоцисты Caryospora являются ин-
фекционными стадиями, заражающими как нового,
так и того же самого хозяина. В эксперименте была
убедительно показана возможность заражения вторич-
ных хозяев (мышей) друг от друга при поедании ка-
риоцист (Upton et al., 1985). Этот путь заражения впол-
не возможен и в естественных условиях, учитывая
широкое распространение каннибализма среди гры-
зунов.
Типовой вид Caryospora simplex Leger, 1904.
Первичный хозяин: гадюки Vipera aspis,
V. xanthina xanthina.
Вторичный хозяин: домовая мышь Mus mus-
culis.
Распространение: Европа, Северная Америка.
В 80-е гг. XX в. было проведено детальное иссле-
дование жизненного цикла Caryospora simplex (Upton
et al, 1983, 1984).
Округлые ооцисты, выделяемые первичным хозяи-
ном, достигают 13.5—16.2 мкм в диаметре и покрыты
хорошо заметной стенкой толщиной 1.5 мкм. Микро-
пиле отсутствует, тельце Штида имеется. Внутри
единственной спороцисты размером 10.4—12.6 X
8.1—9.5 мкм параллельно друг другу располагаются
8 спорозоитов (11.4 X 2.3 мкм). По обе стороны от
ядра спорозоита отчетливо заметны светопреломляю-
щие парануклеарные тела.
Во вторичном хозяине проходят две генерации ме-
рогонии. Ооцисты тонкостенные, 12.6 мкм в диаметре,
с единственной спороцистой размером 10.7 X 9.7 мкм
(рис. 131,3, вкл.). Спорозоиты, развивающиеся в таких
ооцистах, достигают 12.6 X 2.5 мкм и оказываются
крупнее, чем в толстостенных ооцистах из первичного
хозяина. Кариоцисты округлые, одно- или двуспоро-
зоитные и имеют четкие контуры (рис. 131, 2, вкл.).
Спорозоиты внутри кариоцист имеют парануклеарные
тела и достигают размеров 10.9 X 3.3 мкм.
Таким образом, на разных фазах жизненного цикла
Caryospora инфекционные стадии (спорозоиты) в пре-
делах одного и того же вида различаются по морфоло-
гии и размерам.
Caryospora bigenetica Wacha et Christiansen, 1982.
Первичные хозяева: гремучие змеи Crotalus
horridus, Sistrurus catenatus, Agkistrodon contortrix.
Вторичный хозяин: белая мышь Mus musculis
albinus.
В первичном хозяине эндогенное развитие проте-
кает в эпителиальных клетках 12-перстной и тонкой
кишки. В макрогаметах не наблюдается формирования
сот. Ооцисты округлые, 10.9—15.4 мкм в диаметре.
Спороцисты эллипсоидные, овальные или грушевид-
ные (8.3—11.5 X 6.4—9.0 мкм), стенка спороцисты
гладкая. Спорозоиты достигают 8x2 мкм.
После скармливания вторичному хозяину спорули-
рованных ооцист, выделенных первичным хозяином,
совершается три генерации мерогонии. Гамо- и споро-
гония происходят соответственно на 8-е и 10-е сут в
клетках соединительной ткани и языка вторичного хо-
зяина. Сформировавшиеся ооцисты имеют очень тон-
кие оболочки, в них отсутствуют тельца Штида и
суб-Штида.
Споруляция совершается in situ, и в это время стен-
ку ооцисты трудно отличить от стенки спороцисты.
В клетке хозяина каждая спороциста лежит внутри
крупной вакуоли и 8 спорозоитов располагаются во-
круг остаточного тела. Поскольку стенка ооцисты не-
различима, создается впечатление, что сама зараженная
клетка хозяина становится функционирующей ооцис-
той. При этом вакуоль, заключающая внутри себя спо-
роцисту, служит своеобразным «ооцелем» (полостью
тела ооцисты), в котором происходит спорогония.
ТИП SPOROZOA. КЛАСС COCCIDEA
227
Спорозоиты эксцистируются непосредственно в
тканях вторичного хозяина. Высвободившиеся споро-
зоиты сначала попадают в интерстициальное про-
странство соединительной ткани, а затем проникают в
клетки, в которых окончательно формируются карио-
цисты. В эксперименте была показана возможность,
как гомо-, так и гетероксенной трансмиссии С. simplex
и С. bigenetica-. от мышей к мышам, а также от змей к
мышам и соответственно от мышей к змеям (Wacha et
Christiansen, 1982).
Caryospora bubonis Cawthom et Stockdale, 1981.
Первичный хозяин: сова Bubo virginianus.
Вторичный хозяин: мышьMus musculus.
Распространение: Индия.
В первичном хозяине эндогенное развитие проис-
ходит в задней трети тонкой кишки совы. Препатент-
ный период составляет 8—13 сут. Ооцисты округлые,
43.9 X 40.2 мкм в диаметре, с отчетливой двуслойной
оболочкой. Микропиле и остаточное тело отсутству-
ют. Спороцисты субсферические, размером 26.6 X
25.6 мкм, также с двуслойной оболочкой. Тельце Шти-
да отсутствует, остаточное тело имеется. Спорозоиты
15.5 X 2.5 мкм с одним парануклеарным телом.
Подобно другим эймериидным кокцидиям, виды
Caryospora имеют отчетливо выраженный комплекс
апикальных органелл; число субпелликулярных тру-
бочек достигает 24 (Sundermann, Lindsay, 1989). Мик-
ронемы С. bigenetica располагаются не только в перед-
ней, но и в задней части зоита.
В ходе микрогаметогенеза во вторичном хозяине
Caryospora в микрогамонте формируется крупное оста-
точное тело, богатое амилопектином. Микрогаметы
имеют по два жгутика с обычным расположением мик-
ротрубочек (9+2) и митохондрии с тубулярными микро-
трубочками. Ядро микрогаметы высоко осмиофильно.
Крупное ядро макрогаметы окружено многочис-
ленными амилопектиновыми гранулами. Имеются сот.
Ооцисты лежат свободно или заключены внутри пара-
зитофорной вакуоли.
Во вторичном хозяине зараженные клетки, содер-
жащие кариоцисты, окружены толстым слоем (0.35—
1.0 мкм) фиброзного материала, содержащего амило-
пектин. Спорозоиты внутри кариоцист имеют типич-
ную структуру зоитов споровиков. В ходе развиия ка-
риоцисты приобретают фиброзное покрытие, что
внешне сближает их с цистами цистообразующих кок-
цидий (см. ниже). Наличие неактивных микропор (не
образующих мембранного пузырька в глубь тела зон-
та) в спорозоитах кариоцист позволяет рассматривать
их в качестве персистирующих стадий, сходных с гип-
почоитами изоспорин и гемоспоридий.
Полное развитие С. simplex было прослежено в
культуре тканей. В культуре клеток легкого эмбрио-
ии человека удалось проследить мерогонию, гаметоге-
нез и образование ооцист С bigenetica после инокуляции
спорозоитов (Upton et al., 1984). Мерогония Caryospo-
га идет по типу эндодиогении. Спорозоиты эксцисти-
руются in situ и, покидая зараженные клетки, внедря-
ются в новые, где наблюдалось формирование карио-
цист к 16-м сут после инокуляции спорозоитов.
Уникальность жизненных циклов факультативно
гетероксенпых видов Caryospora ставит этот род в осо-
бое положение внутри сем. Eimeriidae. Вероятно, этот
род заслуживает выделения его в самостоятельное се-
мейство — Caryosporidae Leger, 1904, как это предла-
гали ранние исследователи. Информация о более позд-
них исследованиях по Caryospora содержится в специ-
альных сводках (Upton, Peters, 1986; Matuschka, 1986а;
Upton, Sundermann, 1990).
Интенсивность заражения Caryospora spp. первич-
ного хозяина обычно ниже, чем вторичного, и клини-
ческие симптомы заболевания проявляются только
при стрессовом состоянии хозяина или при заглатыва-
нии им очень больших доз ооцист. В таких случаях мо-
жет развиваться диарея, отягощенная анорексией. Па-
тогенное воздействие видов Caryospora более очевид-
но в отношении вторичного хозяина. Так, массовое
поражение грызунов С. simplex или С. bigenetica при-
водит к деформации «лицевой» части головы животно-
го из-за отека, вызванного наличием множества карио-
цист, вследствие чего возникает комичное сходство
его головы с головой моржа.
Описан случай дерматита у иммунодефицитной со-
баки, вызванный пока неизвестным видом Caryospora
(Dubey et al., 1990). В коже и лимфоузлах собак наблю-
дался пиогрануломатозный дерматит. На мазках дер-
мы были выявлены сегментированные меронты диа-
метром 20 мкм, содержащие до 25 мерозоитов. Внутри
макрофагов и в клетках соединительной ткани отчет-
ливо выявлялись гамонты, неспорулированные и спо-
рулированные ооцисты и кариоцисты. Тонкостенные
кариоцисты достигали 18 мкм в длину и содержали 1—
3 спорозоита. При использовании иммунопероксидаз-
ного теста все стадии развития этого паразита положи-
тельно реагировали с анти-С. bigenetica сывороткой.
По сравнению с гомоксенным развитием Caryospo-
ra от ооцисты до ооцисты в первичном хозяине гете-
роксенное развитие с включением вторичного хозяина
заметно сокращает сроки препатентного развития па-
разита. В последнем случае ускоряется циркуляция па-
разитов во внешней среде, что благоприятствует их
выживанию как видов.
Однако описанная выше факультативная гетеро-
ксенность жизненных циклов показана лишь для не-
многих видов Caryospora (Upton et al., 1983; Upton, Bamart,
1988; Upton, Sundermann, 1990). Гомоксенные виды Ca-
ryospora имеют значительное сходство с другими эй-
мериидными кокцидиями, в первую очередь с кокци-
диями рода Eimeria. В пользу этого свидетельствует,
например, способность Caryospora simplex завершать
свое полное развитие (от ооцисты до ооцисты) в куль-
туре тканей (Upton et al., 1984). Этой способностью обла-
дают Eimeria tenella (Doran, 1973) и виды рода Cryptos-
poridium (Current, Long, 1983; Current, Haynes, 1984).
Псевдопаразиты
Благодаря наличию плотных оболочек ооцисты
кокцидий могут легко проходить транзитом через ки-
шечник также и неспецифических хозяев, которые вы-
ступают по отношению к специфическим хозяевам в
качестве хищников. Иногда ненормальные условия со-
держания ооцист (высокая температура, недостаток
кислорода) могут приводить к нарушению их мор-
228
ALVEOLATA
фологии и, как следствие, к изменению числа форми-
рующихся спороцист и спорозоитов. Есть основание
полагать, что такие изменения не являются наследст-
венными.
Ниже приводятся описанные в литературе роды
эймериидных кокцидий, которые, по данным последу-
ющих исследований, квалифицируются как псевдопа-
разиты, поскольку их ооцисты или некоторые эндоген-
ные стадии относятся к другим родам кокцидий
(Upton, 2000).
Род Sivatoshella Ray et Sarkar, 1967
Округлые ооцисты с двумя спороцистами, в каж-
дой из которых формируется по 16 спорозоитов и оста-
точное тело. Стенка ооцисты 4-слойная, микропиле и
остаточное тело отсутствуют. В спороцисте отчетливо
заметно тельце Штида. Кишечные паразиты воробьи-
ных птиц (муний). 1 вид.
Типовой вид Sivatoshella lonchurae Ray et Sar-
kar, 1967.
Типовые хозяева: мунии Lonchura malabarica
и L. punctulata punctulata.
Округлые ооцисты диаметром 36—38 мкм с двумя
спороцистами размером 20 X 18 мкм, в каждой из ко-
торых формируется около 16 спорозоитов. Предпола-
гается, что подобное строение ооцист может возник-
нуть в результате ненормальной споруляции ооцист
изоспороидной структуры.
Род Octosporella Ray et Raghavachari,
1942
В ооцистах формируются 8 спороцист, в каждой по
2 спорозоита. Большинство ооцист спорулирует в ор-
ганизме хозяина до выделения во внешнюю среду. Па-
разиты рептилий и карповых рыб. 6 видов.
Типовой вид Octosporella mabuiae Ray et Rag-
havachari, 1942.
Типовой хозяин: ящерицаMabuia sp.
Распространение: Индия.
Ооцисты достигают 14—16 мкм в диаметре. Боль-
шинство ооцист выделяется в спорулированном состо-
янии. Неспорулированные ооцисты окончательно со-
зревают во внешней среде в течение 48 ч. В ооцистах
формируются 8 спороцист веретеновидной формы раз-
мером 8.4 X 4.2 мкм; остаточное тело ооцисты не об-
разуется. В спороцистах образуются два спорозоита и
остаточное тело. Макрогаметы и зиготы локализуются
в слизистой и подслизистой оболочках кишечника.
Octosporella notropis Li et Desser, 1985.
Хозяин: карповая рыба Notropis cornutus (Mitchill).
Распространение: озеро Онтарио, Канада.
Округлые ооцисты 19.0—21.5 мкм в диаметре
покрыты тонкой гладкой оболочкой. В ооцисте фор-
мируются 8 спороцист удлиненной формы размером
16.5 X 4.0 мкм, плотно прилегающих друг к другу;
остаточное тело ооцисты крупногранулярное. В споро-
цисте образуется 2 спорозоита размером 11X1 мкм,
расположенных параллельно друг к другу.
Сведения о других видах Octosporella из карповых
рыб содержатся в работе Ли и Дессера (Li, Desser,
1985). Однако ооцисты трех видов нуждаются в пере-
проверке числа спороцист и их структуры. Виды Oc-
tosporella из рептилий и ехидны, вероятно, относятся к
аделеидным кокцидиям (Molnar, 1996).
Род Gousseffia Levine, 1980
(= Yakimovella Gousseff, 1937)
Ооцисты с 8 спороцистами, в каждой из которых
содержится множество (л) спорозоитов. Микропиле
отсутствует. Паразиты европейского ежа. 1 вид.
Типовой вид Gousseffia erinacei Levine, 1980.
Типовой хозяин: европейский еж Erinaceus еи-
ropeus.
Распространение: европейская часть б. СССР.
Валидность этого вида как эймериидной кокцидии
ставится под сомнение. Вероятно, он относится к аделе-
идным кокцидиям членистоногих (Lowenstein, 1991).
Род Hoarella Acray-de-Peraza, 1963
В ооцистах формируется 16 спороцист, каждая с
двумя спорозоитами; микропиле отсутствует. В про-
цессе споруляции ооциста увеличивается в размерах.
Кишечные паразиты рептилий. 1 вид.
Типовой вид Hoarella garnhami Acray-de-Pera-
za, 1963.
Типовой хозяин: ящерица Cnemidophorus lem-
niscatus.
Распространение: Венесуэла.
Свежевыделенные ооцисты достигают размеров
26 X 19 мкм. К моменту формирования 8 спороцист
ооцисты достигают 32 мкм в диаметре. Через 24 ч пос-
ле выделения во внешнюю среду внутри ооцисты фор-
мируется уже 16 споробластов, каждый из которых за-
тем трансформируется в округлую спороцисту диамет-
ром около 9 мкм. В ходе споруляции размеры ооцист
продолжают увеличиваться до конечных размеров 42 X
30 мкм. Внутри спороцисты формируется по 2 споро-
зоита и остаточное тело. Мерогония и гамогония совер-
шаются в эпителиальных клетках кишечника ящерицы.
Высказывается предположение, что ооцисты Hoa-
rella могут принадлежать к аделеидным кокцидиям
членистоногих, а эндогенные стадии быть частью жиз-
ненных циклов кокцидий родов Eimeria или Isospora.
Род Pythonella Ray et Dasgupta, 1937
Ооциста с 16 спороцистами, каждая с 4 спорозоита-
ми. В ооцисте отсутствует микропиле, но имеется оста-
точное тело. Кишечные паразиты рептилий. 3 вида.
Типовой вид Pythonella bengalensis Ray et Das-
gupta, 1937.
Типовой хозяин: питон Python sp.
Распространение: Индия.
Ооцисты округлые, 20—30 мкм в диаметре. В
ооцисте образуется 16 спороцист (8—10 X 6—7 мкм),
в каждой из которых формируется по 4 спорозоита и
ТИП SPOROZOA. КЛАСС COCCIDEA
229
остаточное тело. Макрогаметы развиваются в подсли-
зистой оболочке кишечника. Большинство ооцист вы-
деляется во внешнюю среду в неспорулированном со-
стоянии; реже споруляция может начинаться еще до
выделения ооцист из организма хозяина.
Типовой вид PythonellasceloporiDuszynski, 1969.
Типовой хозяин: ящерица Sceloporus.
Распространено: Коста-Рика.
Неспорулированные ооцисты бесцветные, тонко-
стенные, размером 36.0 X 28.9 мкм, микропиле и поляр-
ная гранула отсутствуют. Спорулированные ооцисты
крупнее (43.7 X 31.4 мкм) и имеют остаточное тело.
В спороцистах размером 8.7 X 8.1 мкм имеется оста-
точное тело, но отсутствует тельце Штида. В спороцисте
образуется 4 спорозоита размером 7—10 X 2—3 мкм.
Сем. Isosporidae Minchin, 1903
(= сем. Sarcocystidae Poche, 1913, подсем. Isosporinae
Wenyon, 1926)
Жизненные циклы гомо- и гетероксенные. Переход
к гетероксенности связан с эволюцией в сторону вне-
кишечной локализации и возникновением окончатель-
ного хозяина-хищника. Ооцисты имеют единую (изо-
спороидную) структуру: 2 спороцисты, в каждой — по
4 спорозоита. Споруляция ооцист происходит как во
внешней среде, так и в организме хозяина. Эндогенное
развитие как в эпителии кишечника, так и вне кишеч-
ника. Два подсемейства, 8 родов.
Основные сведения по данному разделу содержат-
ся в специальных публикациях (Pellerdy, 1974; Tadros,
Laarman, 1976,1982; Dubey, 1977; Бейер, 1977; Бейер и
др., 1978; Chobotar, Scholtyseck, 1982; Dubey et al.,
1989; Tenter et al., 2000, 2002).
Подсем. Toxoplasminae Biocca, 1957
Жизненные циклы гомоксенные или факультатив-
но гетероксенные. В последнем случае полное разви-
тие осуществляется при участии промежуточного и
окончательного хозяина. Во внекишечных органах
промежуточного хозяина формируются тканевые цис-
ты. Цистные стадии представлены клетками одного
морфофункционального типа. В окончательном хозяи-
не эндогенное развитие происходит только в кишечни-
ке и включает бесполое размножение, половой про-
цесс и формирование ооцист. Ооцисты выделяются в
неспорулированном состоянии. 6 родов.
Род Isospora Schneider, 1881
(= Psorospermium Rivolta, 1878, pro parte; Coccidium
Leuckart, 1879, pro parte; Diplospora Labbe, 1893;
Klossia Labbe, 1894, pro parte; Hyaloklossia Labbe,
1896; Lucetina Henry et Leblois, 1925, pro parte)
Жизненные циклы гомоксенные. Мерогония преи-
мущественно в клетках кишечного эпителия. Ооцисты
выделяются во внешнюю среду в неспорулированном
состоянии. Спороцисты с тельцем Штида и без него.
Паразиты млекопитающих, птиц, рептилий, амфибий,
беспозвоночных. Свыше 200 видов.
Типовой вид Isospora гага Schneider, 1881.
(= Isospora incerta Schneider, 1881).
Типовые хозяева: слизистые моллюски Limax
cinereoniger и L. griseus.
Сведения о размерах ооцист и деталях жизненного
цикла в оригинальном описании отсутствуют.
Isospora suis (Biester et Murray, 1934) Matuschka et
Heydorn, 1980.
Хозяева: домашняя свинья Sus scrofa domestica,
дикий кабан Sus scrofa scrofa.
Ооцисты размером 21.2 X 17.8 мкм. Споруляция во
внешней среде в течение 3—5 сут. Остаточное тело в
ооцисте отсутствует. Спороцисты овальные, без тель-
ца Штида, размером 16—18 X 14—16 мкм (по данным
других авторов, 11—14 X 8—11 мкм); спорозоиты до-
стигают 8.9—11.0 X 3.0—3.6 мкм. Эндогенное разви-
тие в клетках эпителия тонкой кишки. Мерозоиты 1-й
и 2-й генераций различаются между собой морфологи-
чески. Гамогония начинается через 120 ч после зара-
жения. Препатентный и патентный периоды составля-
ют соответственно 4—5 и 10—18 сут. В свежем стуле
ооцисты I. suis нередко бывают уже на стадии двух
споробластов. Есть данные о внекишечном развитии
стадий I. suis (Harleman, Meyer, 1983).
Isospora belli Wenyon, 1923.
Хозяин: человек Homo sapiens.
Распространение: Средиземноморье, Южная
Азия, Южная Америка (Чили), США. В странах Евро-
пы встречается редко (в 10 раз и более редко, чем, на-
пример, Giardia lamblia).
Жизненный цикл гомоксенный. Эндогенное разви-
тие в эпителии тонкой кишки, паразиты заключены
внутри паразитофорной вакуоли. Ооцисты овальной
формы размером 30 х 20 мкм, во внешнюю среду выде-
ляются в неспорулированном состоянии.
В течение многих лет I. belli рассматривался как
исключительно кишечный патоген человека, и только
в конце 80-х гг. XX в. у больных СПИДом были выяв-
лены внекишечные стадии этого паразита (Restrepo et
al., 1987).
Внекишечные стадии I. belli обнаруживаются в
огромных количествах в лимфоузлах этих больных.
По своей ультраструктурной организации они напоми-
нают зоитов видов Isospora, паразитирующих у до-
машних хищников: I. felis (у кошки), I. canis (у собаки).
Внутри клеток лимфоузлов зоиты I. belli окружены
паразитофорной вакуолью. Наличие кристаллоида сви-
детельствует в пользу того, что внекишечные зоиты
суть спорозоиты, а не мерозоиты, и, следовательно, не
являются потомками энтероэпителиальных стадий, раз-
вивающихся в кишечнике того же хозяина. Внекишеч-
ные спорозоиты могут попадать в лимфоузлы после
эксцистирования из проглоченных хозяином спору-
лированных-ооцист, выделенных при дефекации, как
тем же самым, так и другим хозяином. После эксци-
стирования в желудке пациента одни спорозоиты про-
должают свое развитие «обычным» путем, т. е. в ки-
шечнике хозяина, тогда как другие мигрируют из ки-
шечника и попадают в лимфоузлы, где, не претерпевая
бесполого размножения, переходят в спящее состоя-
ние (персистирование), превращаясь в «гипнозоитов».
230
ALVEOLATA
Забегая вперед, следует отметить, что поведение
спорозоитов I. belli, мигрировавших из кишечника во
внекишечные органы, очень напоминает развитие To-
xoplasma gondii в окончательном хозяине при зараже-
нии ооцистами.
Эндогенные стадии I. suis сильно разрушают эпи-
телий ворсинок тощей и подвздошной кишок. При
обширных поражениях образуется обильный лейкоци-
тарный экссудат, происходит атрофия ворсинок, изме-
няется структура цилиндрического эпителия слизи-
стой, возникают метаплазия энтероцитов в lamina pro-
pria ворсинок, гиперплазия крипт. Однако описанные
изменения характерны не только для заражения/, suis,
но встречаются и при многих других кишечных инфек-
циях и инвазиях.
Наиболее чувствительны к инвазии поросята пер-
вых дней жизни. Двухнедельные и в большей степени
месячные животные устойчивы к заражению даже
большими дозами ооцист. При моноинфекции I. suis
смертность поросят не превышает 20 %, но значитель-
но повышается при смешанных инфекциях вирусной,
бактериальной или гельминтозной природы. В течение
жизни у свиней вырабатывается сильная возрастная
невосприимчивость к заражению I. suis. Случаи гемор-
рагического энтерита зарегистрированы у верблюдов
при заражении Isospora orlovi (Kinne et al., 2002).
Isospora belli как возбудитель заболевания человека
известен еще с 1915 г. Исследования последних деся-
тилетий показали, что этот изоспороз связан с ослож-
нениями диареи и энтеритов у пациентов с нарушенной
иммунной системой. На острове Гаити (гаитяне со-
ставляют одну из четырех важнейших групп риска при
СПИДе после наркоманов, гомосексуалистов и больных
гемофилией) изоспороз belli регистрируется у 15 % боль-
ных. Изоспороз belli относится к категории оппортуни-
стических инфекций протозойной природы. У больных с
иммунодефицитом отмечены рецидивы вследствие ре-
активации паразитов, персистирующих в форме унизо-
итных цист, или гипнозоитов (Markus, 1978). При этом
неспорулированные ооцисты могут выделяться с ка-
лом в течение более 18 мес (Piekarski, Seitz, 1984).
Клиническая картина изоспороза belli (водянистая
профузная диарея) неотличима от криптоспоридиоза и
циклоспороза. В фекальных пробах больных встреча-
ются кристаллы Шарко-Лейдена и многочисленные
жировые включения. Заболевание приводит к атрофии
слизистой кишечника, укорочению ворсинок, гипер-
трофии крист, инфильтрации lamina propria эозинофи-
лами. Диагноз ставится по выявлению ооцист в фе-
кальных мазках после окрашивания кислотоустойчи-
выми красителями (например, карболовым фуксином
по Цилю-Нильсену). Морфологически ооцисты I. belli
легко отличимы от ооцист Cryptosporidium и Cyclospo-
ra. В отличие от криптоспоридиоза изоспороз belli мо-
жет излечиваться, в частности при применении препа-
рата триметоприм-сульфаметоксазол.
Ревизия видов рода Isospora
Такие признаки, как строгая гомоксенность, энте-
ро-эпителиальная локализация и споруляция ооцист во
внешней среде, характерны для большинства видов
рода Isospora sensu stricto. Степень отклонения от этих
признаков у разных видов Isospora еще недостаточно
изучена; причины подобных отклонений неизвестны, в
частности у I. suis (Harleman, Meyer, 1983). Известно
также, что в свежевыделенном стуле человека ооцисты
изоспороидной структуры встречаются как в неспору-
лированном, так и в спорулировнном состоянии. Исто-
рически первых традиционно относили к виду Isospora
belli, а вторых к/, hominis (Wenyon, 1926). В настоящее
время только первый вид сохранил принадлежность к
роду Isospora, тогда как второй, I. hominis, стал частью
рода Sarcocystis, одного из двух видов саркоспоридий
человека: S. bovihominis или S. suihominis.
Дальнейшая ревизия изоспор привела к тому, что
мелкая форма I. bigemina из кошки стала частью жиз-
ненного цикла Toxoplasma, а крупная частью цикла
развития Sarcocystis (S. ovifelis, S. bovifelis, S. muris').
Мелкую форму I. bigemina из собаки следует, по-види-
мому, считать видом рода Hammondia, а крупную —
рода Sarcocystis (S. ovicanis, S. bovicanis, S. suicanis,
S. equicanis). He окончательно еще определилось поло-
жение I. buteonis из канюка: одни авторы рассматрива-
ют этот вид в рамках рода Sarcocystis, другие Fren-
kelia.
Представляют интерес случаи отклонения от ки-
шечной локализации эндогенных стадий развития ви-
дов рода Isospora, обитающих в одном и том же хозяи-
не. Так, у канарейки встречаются два вида — I. canaria
Box, 1975 и I. serini Aragao, 1933. Все эндогенное раз-
витие первого вида проходит в клетках кишечника
птицы, тогда как у второго вида в кишечнике протека-
ет только гамогония, а мерогония совершается вне ки-
шечника, в мононуклеарных фагоцитах. Морфологи-
чески паразиты второго вида неотличимы от кокцидий
рода Atoxoplasma (Gamham, 1950).
Целый ряд видов Isospora паразитирует в рептили-
ях. Однако по мере дальнейшего изучения оказалось,
что часть этих видов следует отнести к роду Sarcocys-
tis на основании такого признака, как способность
ооцист спорулировать в кишечнике хозяина еще до
выделения во внешнюю среду.
Исследования 70-х гг. XX в. показали, что среди
видов Isospora можно выделить по крайней мере две
группы. В первой группе (I. suis, I. canaria, I. belli и др.)
эндогенное развитие протекает исключительно в эпи-
телии кишечника, а жизненные циклы осуществляют-
ся гомоксенно. Кроме того, в ооцистах этих видов име-
ется микропиле, а в спороцистах сохраняется тельце
Штида и отсутствует шов. К их числу относятся также
I. pachydactyli Upton et Freed, 1988 из геккона Рachy-
dactylus bibrovlii и I. albogularis Upton et Freed, 1990 из
желтоголового геккона Gonatodes albogularis.
Во вторую группу входят виды, эндогенное разви-
тие которых совершается как в кишечнике, так и вне
кишечника. Эти признаки коррелируют с исчезновени-
ем в спороцисте тельца Штида и изменением самой
структуры стенки спороцисты, составленной из от-
дельных пластин, между которыми хорошо заметны
скрепляющие их швы. Возникновение внекишечной
пролиферации связано также с включением в жизнен-
ный цикл второго хозяина и, как следствие, с пере-
ходом к гетероксенности. К числу таких видов отно-
сятся кокцидии кошек и собак: Isospora felis, I. rivolta,
ТИП SPOROZOA. КЛАСС COCCIDEA
231
I. ohioensis и другие (Frenkel, Dubey, 1972). Для таких
видов были одновременно основаны самостоятельные
роды — Cystoisospora и Levineia.
Род Cystoisospora Frenkel, 1977
(= Levineia Dubey, 1977)
Жизненные циклы факультативно гетероксенные.
Ооцисты лишены микропиле и тельца Штида и выде-
ляются в неспорулированном состоянии. Мерогония,
гамогония и образование зигот происходят в кишечни-
ке окончательного (хищного) хозяина. Унизоитные
цисты (гипнозоиты) формируются во внекишечных
органах промежуточного хозяина. Цистные стадии
не заразны для промежуточного хозяина. Ооцисты за-
разны как для промежуточного, так и для окончатель-
ного хозяина. Паразиты млекопитающих. Свыше 8 ви-
дов.
Типовой вид Cystoisosporafelis Frenkel, 1977.
(= Levinea felis Dubey, 1977; Isospora felis (Wasie-
lewski, 1904) Wenyon, 1923; Diplospora bigemina Wasi-
elewski, 1904, pro parte; Isospora bigemina Swellengre-
bel, 1914; Isospora cati Marotel, 1922, pro parte; Lucetina
(Wenyon, 1923) Henry et Leblois, 1926).
Окончательные хозяева: домашняя кошка
Felis catus и, возможно, другие виды рода Felis, а так-
же другие роды сем. Felidae.
Промежуточные хозяева: крупный рогатый
скот, овцы, кролики, грызуны, цыплята.
Ооцисты круглые, усредненные размеры по раз-
ным источникам составляют 40—43 X 28—33 мкм;
оболочка толстая около 1.3 мкм. Споруляция во внеш-
ней среде завершается в течение 60 ч. Остаточное тело
в ооцисте отсутствует. Овальные спороцисты достига-
ют в среднем 23 X 19 мкм и покрыты оболочкой тол-
щиной 0.4 мкм. Остаточное тело спороцисты в виде
скопления крупных гранул (рис. 55, 6).
Эндогенное развитие Isospora felis было детально
изучено Шахом (Shah, 1971). Имеется три генерации
мерогонии. Зрелые меронты 1-й генерации достигают
11—30 X 10—25 мкм и содержат до 16 мерозоитов
размером 11—15 X 3—5 мкм. Мерозоиты 2-й генера-
ции имеют вид одноядерных веретеновидных клеток,
которые затем трансформируются в многоядерные
клетки размером 14 X 5 мкм, соответствующие меро-
зоитам 3-й генерации (мерозоитоподобные шизонты).
В каждом шизонте формируется по 6 банановидных
мерозоитов размером 7x2 мкм.
Асинхронность ядерного деления внутри меронтов
приводит к неодновременному образованию мерозои-
тов, часть которых приступает к новому делению, не
покидая материнский меронт. В результате мерозоиты
2-й И 3-й генераций образуются в той же самой клетке
XO'IHHIlll. В сформировавшихся таким образом цисто-
подобпых образованиях может насчитываться до 36—
70 беспорядочно расположенных зоитов. Этим сегмен-
тированные меронты Cystoisospora принципиально от-
личаются от соответствующих стадий развития Eime-
ria с их упорядоченным расположением мерозоитов.
Мерогония С. felis в клетках эпителия кишечника ко-
шек идет преимущественно путем эндодиогении (Fer-
guson et al., 1976).
Мерозоиты 3-й генерации дают начало гамонтам.
Зрелые микрогамонты достигают 24—72 X 18—
32 мкм, и в них формируются множество жгутиковых
микрогамет размером 5—7 X 0.8 мкм и центральное
остаточное тело. Зрелые макрогаметы достигают 16—
22 X 8—13 мкм; в их центрально расположенных яд-
рах отчетливо заметно ядрышко. Препатентный и па-
тентный периоды составляют соответственно 7—8 и
10—11 сут. Все энтероэпителиальные стадии развива-
ются внутри паразитофорной вакуоли, окруженной
тремя мембранами.
При скармливании спорулированных ооцист С. fe-
lis лабораторным мышам и крысам спорозоиты эксци-
стируются в кишечнике, но затем выходят из него
и внедряются в клетки мезентериальных узлов. Еди-
ничные или соединенные в пары зоиты (спорозоиты)
могут длительно персистировать (до 23 мес после
заражения!) в клетках внекишечных органов хозяи-
на (Frenkel, Dubey, 1972; Dubey, Frenkel, 1972a). Та-
кие стадии получили название унизоитных цист (Fren-
kel, 1974), дормозоитов, или гипнозоитов (Markus,
1978).
Скармливание кошкам внутренних органов мышей
и цыплят соответственно на 25-е и 87-е сут после зара-
жения их ооцистами С. felis привело через неделю к
появлению в фекалиях кошек ооцист, морфологически
идентичных ооцистам С. felis (Frenkel, Dubey, 1972).
Эти результаты послужили доказательством участия
персистирующих стадий (гипнозоитов) в осуществле-
нии жизненного цикла паразита. Однако промежуточ-
ные хозяева (мыши) друг от друга не заражались.
Cystoisospora rivolta Frenkel, 1977.
(= Isospora rivolta Wenyon, 1923; Levinea rivolta Dubey, 1977).
Окончательный хозяин: домашняя кошка
Felis catus и, возможно, другие виды рода Felis, а так-
же другие роды сем. Felidae.
Промежуточный хозяин: мышь Mus muscu-
lus.
Жизненный цикл С. rivolta детально изучен Дюби
(Dubey, 1979).
В окончательном хозяине развитие происходит в
клетках эпителия тонкой, ободочной и слепой кишок, а
также Либеркюновых желез. Ядра зараженных клеток
гипертрофируются. Эндогенные стадии заключены
внутри паразитофорной вакуоли и в ходе развития со-
храняют очертания мерозоитов. Точное число беспо-
лых генераций не определено. Однако по размерам и
числу формирующихся мерозоитов различаются по
крайней мере три разных структурных «типа» мерон-
тов. Деление мерозоитов осуществляется как путем
эндодиогении, так и шизогонии. Среди делящихся кле-
ток паразита различаются многоядерные мерозоитопо-
добные меронты. Характерно, что одно-, дву- и много-
ядерные меронты часто лежат внутри одной и той же
паразитофорной вакуоли. Реже в одной и той же вакуо-
ли можно видеть макро- и микрогамонта. Такие карти-
ны суть результат асинхронного деления паразита в
ходе мерогонии: образовавшиеся мерозоиты присту-
пают к делению, не покидая материнского меронта.
В промежуточном хозяине зоиты С. rivolta обнару-
живаются в клетках внекишечных органов в виде уни-
зоитных цист (гипнозоитов).
232
ALVEOLATA
При скпрмлииппии кошке ооцист С. rivolta препа-
тсн'1'iii.ill период развития составляет 5—6 сут, тогда
как при скармливании ей мышей, ранее зараженных
rivolta, этот период сокращается почти на сутки.
В клетке хозяина гипнозоиты С. felis окружены па-
разитофорной вакуолью, вдоль мембраны которой рас-
полагаются темные тельца неизвестной природы. В ре-
зультате граница такой вакуоли несколько уплотняет-
ся, хотя еще не становится оболочкой цисты, как у
других цистообразующих кокцидий. По своей ульт-
раструктурной организации гипнозоиты соответству-
ют спорозоитам других кокцидий. Сходство со споро-
зоитом придает гипнозоиту наличие в его цитоплазме
крупного парануклеарного тела, имеющего кристал-
лоидную структуру. Однако по своей функциональ-
ной нагрузке гипнозоиты С. felis сходны с мерозои-
тами.
Процесс перехода гомоксенного жизненного цикла
Isospora sensu stricto к гетероксенности у видов рода
Cystoisospora (С. felis, С. rivolta, С. canis и др.) нахо-
дится еще на начальном этапе становления. Проме-
жуточные хозяева этих видов могут в равной степени
рассматриваться как паратенические хозяева. Споро-
зоиты, вышедшие из ооцист, заглоченных такими хо-
зяевами, еще не претерпевают в них дальнейшего раз-
вития, а переходят к персистированию в форме унизо-
итных цист, или гипнозоитов. Но именно гипнозоиты
Cystoisospora уже являются первыми показателями на-
чавшегося перехода прежде гомоксенного жизненного
цикла к гетероксенности. Большое эпидемиологиче-
ское значение гипнозоитов состоит в том, что они спо-
собствуют длительному сохранению инвазионного на-
чала у неспецифического (промежуточного) хозяина и
тем дополнительно обеспечивают выживание паразита
как вида.
Начиная с рода Cystoisospora можно проследить
последовательную эволюцию классических кишечных
кокцидий в сторону внекишечного существования в
хозяине. Это знаменует становление такого понятия в
биологии кокцидий, и в целом споровиков, как «ткане-
вой паразитизм», в дополнение к ранее известным ка-
тегориям кишечного и кровяного паразитизма.
Род Toxoplasma Nicolle et Manceaux,
1908
(= Isospora Schneider, 1881, pro parte; Haemogregarina
Danilewsky, 1885, pro parte; Lankesterella Labbe, 1899,
pro parte)
Распространение: всесветно. В среднем одна
треть населения Земли имеет антитела против токсо-
плазмы.
Жизненный цикл факультативно гетероксенный.
Ооцисты выделяются во внешнюю среду в неспорули-
рованном состоянии. Стенка ооцисты состоит из двух
бесцветных слоев; микропиле, полярная гранула и
тельце Штида отсутствуют. Тканевые цисты без пере-
городок, преимущественно в головном мозгу, реже в
мышцах или легких. Все цистные стадии представле-
ны клетками одного морфофункционального типа. Па-
разиты млекопитающих и птиц. Достоверно известен
1 вид, хотя в литературе имеются описания еще 6 ви-
дов (Levine, 1977).
В 1908 г. независимо друг от друга были зарегист-
рированы две находки ранее не известного однокле-
точного организма у северо-африканского грызуна гун-
ди — Ctenodactylus gundi (Nicolle, Manceaux, 1908) и
домашнего кролика (Splendore, 1908). Форма тела но-
вого организма подсказала родовое название — Toxop-
lasma (toxon по-гречески «арка»); видовое название
gondii этот паразит получил по видовому названию хо-
зяина (рис. 132, I, вкл.).
В 1923 г. чешский офтальмолог Янку впервые об-
наружил токсоплазму у человека. В глазу ребенка с яр-
ко выраженной гидроцефалией и дегенеративными
очагами в области желтого пятна были выявлены обра-
зования, оказавшиеся цистами Toxoplasma (рис. 132, 2,
3, вкл.). В конце 30-х гг. появились сообщения о нали-
чии у человека врожденного токсоплазмоза и о воз-
можности его конгенитальной передачи (Wolf, Cowen,
1937), что значительно стимулировало интерес к этому
паразиту во всем мире. В б. СССР возбудитель токсо-
плазмоза был впервые изолирован Засухиным и Гай-
ским (1930) от животных (сусликов) и позднее Васи-
ной и Засухиным (1958) от человека (из мозга детей,
погибших от врожденного токсоплазмоза).
В ходе исследований было установлено, что ток-
соплазмоз может протекать в двух основных фор-
мах — острой и хронической, — длительность которых
зависит от вирулентности возбудителя по отношению
к данному виду хозяина. При остром токсоплазмозе в
клетках разных органов и тканей наблюдается бурное
размножение аркоподобных организмов, или трофозо-
итов, которые в дальнейшем получили название эн-
до зоиты (Ноаге, 1972), или тахизоиты (Frenkel,
1973). В это время внутри зараженных клеток форми-
руются скопления тахизоитов, или псевдоцисты.
Острый токсоплазмоз носит генерализованный харак-
тер и при сильных инвазиях может завершаться ле-
тально.
При хроническом токсоплазмозе возбудитель пер-
систирует в течение длительного времени внутри
крупных образований, или цист (Levaditi, 1928). В от-
личие от псевдоцист тканевые цисты имеют собствен-
ную оболочку и по мере роста заполняются множест-
вом цистных зоитов — цистозоитов (Ноаге, 1972),
или брадизоитов (Frenkel, 1973).
В течение почти 60 лет после первого описания
Т. gondii эндо- и цистозоиты оставались единственны-
ми известными стадиями развития паразита. Кроме
вертикальной передачи от матери к плоду, другие пути
заражения одного хозяина от другого не были известны.
Однако было ясно, что конгенитальный путь, как от-
носительно редкий, не мог обеспечить всесветного
распространения возбудителя токсоплазмоза у живот-
ных и человека. Не вносили ясности и сообщения о
роли хищничества в распространении токсоплазмоза.
В то же время было достоверно известно, что токсо-
плазмоз превалирует в тех странах, где люди едят сы-
рое мясо.
Шотландский ученый Хатчисон (Hutchison, 1965)
впервые высказал предположение о связи «заразного
начала» Т. gondii с яйцами кошачьей нематоды Тохоса-
ra cati. Хатчисону удалось сохранить это «заразное
ТИП SPOROZOA. КЛАСС COCCIDEA
233
начало» в течение целого года в обыкновенной водо-
проводной воде. Введение этого материала белым мы-
шам привело к развитию у них токсоплазмоза. По-
скольку было известно, что ни эндозоиты, ни цисто-
зоиты не способны сохранять жизнеспособность вне
организма хозяина в течение длительного времени,
Хатчисон выдвинул гипотезу о возможной передаче
Т. gondii через яйца кошачьей нематоды.
Однако нематодная гипотеза была вскоре отвергну-
та, ибо было доказано, что передача Т. gondii может
осуществляться через фекалии кошек, свободных от
яиц токсокары (Frenkel et al., 1969). В «заразных» фе-
калиях неизменно присутствовали ранее не известные
цистоподобные структуры («новые цисты»), которые
при внутрибрюшинном введении вызывали у мышей
токсоплазмоз. Дальнейшие исследования выявили
внутри новых цист наличие двух спороцист, в каждой
из которых было по 4 спорозоита. Так новые цисты
были идентифицированы как ооцисты изоспороидной
структуры.
Но еще более сенсационными явились почти одно-
временно появившиеся сообщения (Hutchison et al.,
1969, 1970; Sheffield, Melton, 1969, 1970; Frenkel et al.,
1970; Overdulve, 1970; Weiland, Kuhn, 1970) о том, что
после скармливания кошке тканевых цист Т. gondii из
мозга мышей в ее фекалиях обнаруживались ооцисты,
которые после споруляции во внешней среде приобре-
тали изоспороидную структуру. В кишечнике кошки
протекали характерные для кокцидий фазы жизненно-
го цикла, включающие мерогонию, гаметогенез по
типу оогамии и образование зигот (ооцист). Это были
первые сообщения, убедительно доказавшие кокци-
дийную природу Toxoplasma gondii.
Несмотря на кажущуюся новизну этого открытия, в
нем не было ничего неожиданного, ибо идея о проис-
хождении токсоплазмоза птиц от какого-то возбудите-
ля кишечной инфекции высказывалась значительно
раньше (Noller, 1920; Coulston, 1942). Предполагалось,
что передача возбудителя из кишечника и внутренних
органов может осуществляться через кровяное русло.
В контексте обсуждения этих фактов большое значе-
ние приобретают данные о наличии внекишечного раз-
вития у Isospora serini (Box, 1975, 1977). Наличие в
жизненном цикле Т. gondii устойчивых ооцист объяс-
нило пути заражения хищников и травоядных.
Таким образом, лишь через 60 лет после первого
описания Т. gondii этот паразит был охарактеризован
как кишечная кокцидия кошки (и других кошачьих) с
гипертрофированной внекишечной бесполой стадией
развития (мерогонией) во многих нефелидных хозяевах
(см.: Frenkel, 1973; Tadros, Laarman, 1976, 1982; Dubey,
1977, 1994; Бейер и др., 1978; Бейер, Полянский, 1979;
Dubey, Beattie, 1988; Бейер, 1989; Tenter et al., 2000).
T и и о в о й вид Toxoplasma gondii Nicolle et Man-
UCIHIX, 1908.
(>* Isospora gondii Tadros et Laarman, 1979; Haemog-
regaiilia Jraiieac de Mello, 1915; Leishmania gondii Ni-
colle et Mnneeiuix, 1908; Toxoplasma canis de Mello,
1910; Toxoplasma eavlae Carini etMigliano, 1911; Toxo-
plasma hominis Wolf, Cowen, Paige, 1939).
Окончательные x о з я e в а: домашняя кошка
Felis catus и по меньшей степени еще 17 представите-
лей сем. Felidae.
Промежуточные хозяева: свыше 350 видов
рептилий, птиц и млекопитающих, включая человека.
Ооцисты в фекалиях кошки округлые или слегка
овальные, 10—12 мкм в диаметре. Протоплазма спо-
ронта в свежевыделенных ооцистах занимает почти
весь объем ооцисты. Споруляция завершается в тече-
ние 1—5 сут, в зависимости от температуры, аэрации и
влажности во внешней среде. После споруляции ооци-
сты приобретают более овальные очертания (11 X 13 мкм
в диаметре). Спороцисты (6x6 мкм) не имеют тель-
ца Штида. В спороцисте формируются 4 спорозоита
(6—8 X 1 мкм) и остаточное тело. Ядра спорозоитов
располагаются почти в центре клетки.
Жизненный цикл Т. gondii осуществляется при
участии двух хозяев, окончательного и промежуточно-
го, между которыми складываются отношения соот-
ветственно хищника и жертвы. Окончательными хозя-
евами токсоплазмы являются только хищники сем. Fe-
lidae. В то же время в качестве промежуточных хозяев
выступают свыше 350 видов как хищных, так и нехищ-
ных животных, относящихся к млекопитающим, пти-
цам и рептилиям (Fayer, 1981). Очень важно подчерк-
нуть, что окончательные хозяева Т. gondii одновремен-
но выступают и в роли промежуточных.
В промежуточном хозяине паразит претерпевает
только бесполое размножение, тогда как в окончатель-
ном хозяине совершается как бесполое размножение,
так и половой процесс, приводящий к образованию
ооцист, т. е. устойчивых расселительных стадий.
Промежуточный хозяин заражается Т. gondii при
поедании как ооцист, так и органов и тканей других
промежуточных хозяев, содержащих тканевые цисты.
Бесполое размножение паразита обычно приводит к
генерализованному заражению почти всех внутренних
органов промежуточного хозяина. Предцистная меро-
гония протекает по типу эндодиогении и дает начало
предцистным мерозоитам, или тахизоитам, размером
4—7 X 5—2 мкм (рис. 132,1, вкл.). Размножение тахи-
зоитов происходит внутри псевдоцист, лежащих в па-
разитофорной вакуоли практически во всех клетках
макроорганизма, отдавая предпочтение, однако, клет-
кам РЭС, печени, лимфоидной ткани и легких. Ритм
размножения тахизоитов достаточно быстрый, поряд-
ка 1—2 ч между делениями или больше, в зависимости
от штамма возбудителя. Ядро тахизоита располагается
в центре тела паразита. Под действием желудочного
сока хозяина тахизоиты быстро разрушаются.
При заражении промежуточного хозяина (мышей)
ооцистами Т. gondii эксцистирование спорозоитов в
кишечнике совершается в течение первых 2 ч (Dubey
et aL, 1997). А в течение последующих 6 ч спорозоиты
сохраняются в эпителии тонкой и в lamina propria под-
вздошной кишки, постепенно переходя к паразитиро-
ванию в клетках мезентериальных лимфоузлов. Через
12 ч спорозоиты конвертируются в тахизоитов в lamina
propria тонкой кишки. Спорозоиты могут схраняться в
энтероцитах кишечника и в клетках лимфоузлов мы-
шей в течение последующих 48 ч. К 4-м сут после зара-
жения мышей через кровеносную и лимфатическую
системы наступает генерализованное заражение внут-
ренних органов. Именно в это время тахизоиты обна-
руживаются в периферической крови зараженных жи-
вотных. С помощью иммуногистологических методов
234
ALVEOLATA
тканевые цисты выявляются в соединительной и мы-
шечной ткани кишечника и в головном мозгу мышей
соответственно на 5-е и 8-е сут после заражения.
Долгое время оставалось загадкой, почему экс-
цистировавшиеся в кишечнике мышей спорозоиты
Т. gondii, будучи способными проникать в энтероциты,
тем не менее не способны в них размножаться. Анализ
новейших морфологических, ультраструктурных, био-
химических и молекулярно-биологических данных по
этому вопросу позволяет заключить, что способность
(или неспособность) зоитов Т. gondii развиваться в
эпителиальных клетках кишечника хозяина, как про-
межуточного, так и окончательного, зависит от струк-
туры паразитофорной вакуоли, образование которой в
зараженной клетке стимулируется самим паразитом.
Это в свою очередь определяется наличием (или отсут-
ствием) у зоитов определенного числа таких апикаль-
ных органелл, как роптрии и плотные гранулы, и соот-
ветственно от уровня специфических белков, синтези-
руемых этими органеллами (см. обзор Бейер и др.,
2003).
Высокое содержание белков роптрий и плотных
гранул в спорозоитах\тахизоитах Т gondii стимулирует
формирование в зараженной клетке паразитофорной
вакуоли, выстланной только одной мембраной. Такие
вакуоли формируются при заражении тахизоитами
клеток всех внутренних органов, за исключением энте-
роцитов кишечника кошки и других кошачьих; в по-
следних развитие токсоплазмы возможно только в слу-
чае формирования паразитофорной вакуоли, выстлан-
ной тремя мембранами (Ferguson et al., 1999). Эти
наблюдения позволяют заключить, что энтероэпители-
альная часть жизненного цикла Т. gondii является про-
должением развития не спорозоита и не тахизоита, а
брадизоита, т. е. цистной стадии.
Вирулентные штаммы Т. gondii обычно приводят к
гибели хозяина. Напротив, авирулентные штаммы вы-
зывают бессимптомное течение токсоплазмоза на
фоне развития у хозяина специфического иммунитета,
после чего инвазия переходит в хроническую фазу.
Это совпадает по времени с формированием тканевых
цист Т. gondii во внутренних органах хозяина, преиму-
щественно в головном мозгу, глазах, сердечной и ске-
летной мышцах, матке, в стенке желудка и тонкой
кишки (Frenkel, 1973; Шевкунова, 1980).
Подобно псевдоцистам тканевые цисты Т. gondii
гомологичны меронтам и могут достигать от 30 до
100 мкм в диаметре (рис. 132, 2, 3, вкл.). Цистные ме-
розоиты (брадизоиты) достигают 5—8 мкм в длину.
Как и тахизоиты, они размножаются путем эндодиоге-
нии, но имеют замедленный темп деления. В отличие
от тахизоитов брадизоиты имеют ядра, смещенные
ближе к заднему концу тела. В цистах Т. gondii отсут-
ствуют перегородки, разделяющие их пространство на
отдельные участки, а все цистные стадии относятся к
одному и тому же морфофункциональному типу кле-
ток — мерозоиту (рис. 132, 3, вкл.). Цисты Т. gondii
имеют собственную оболочку, построенную на основе
мембраны паразитофорной вакуоли. Под действием
пепсина и соляной кислоты оболочка цисты быстро
разрушается, тогда как сами цистные стадии выжива-
ют в желудочном соке до 2—3 ч, будучи более устой-
чивыми к перевариванию, чем тахизоиты. В ходе раз-
вития цисты в цитоплазме брадизоитов накапливаются
значительные запасы амилопектина.
При экспериментальном скармливании тканевых
цист от одного промежуточного хозяина к другому вы-
свободившиеся в кишечнике брадизоиты в течение 1 ч
обнаруживаются в эпителии кишечника и lamina pro-
pria тонкой кишки, где могут оставаться вплоть до 12 ч
после заражения. Конверсия брадизоитов в тахизоиты
и первое деление этих стадий совершаются к 18 ч. Че-
рез 24 ч размножение тахизоитов наблюдается в клет-
ках лимфоузлов, и в это же время тахизоиты обнару-
живаются в периферической крови зараженного хозяи-
на. Первые цисты «нового урожая» формируются не
ранее 6 сут после заражения. В зависимости от штамма
заражение разных органов зонтами Т. gondii может со-
храняться до 49 сут (Dubey, 1997).
Окончательный хозяин заражается Т. gondii при
поедании ооцист и тканевых цист (рис. 95). При зара-
жении ооцистами в окончательном хозяине осуществ-
ляется полный жизненный цикл паразита, включая
не только развитие в эпителии кишечника, но и вне-
кишечные фазы — предцистную и цистную. При
скармливании окончательному хозяину тканевых цист
брадизоиты инициируют энтероэпителиальную фазу
развития. При этом формированию гамонтов в энтеро-
цитах предшествует прохождение, так же как в энтеро-
цитах, нескольких генераций мерогонии (рис. 133,4,5,
вкл.). Все энтероэпителиальные стадии (меронты, га-
монты) растут и развиваются внутри паразитофорной
вакуоли, окруженной тремя мембранами (Ferguson,
1999). Стимулировать формирование подобной вакуо-
ли могут только брадизоиты Т. gondii, которые в окон-
чательном хозяине (в отличие от промежуточного) не
конвертируются в тахизоитов, а сразу внедряются в
энтероциты для продолжения и завершения полного
цикла развития этого паразита (Бейер и др., 2003).
Мерогония совершается по типу эндополигении,
при которой в материнской клетке формируется 4
и более дочерних клеток (Piekarski et al., 1971). Как и
у классических кишечных кокцидий, гаметогенез
Т. gondii протекает по типу оогамии. Первые гамонты
развиваются на 3—4-е сут и распределяются по всей
длине тонкого кишечника кошки. Подобно мерон-
там, гамонты также локализуются над ядром энте-
роцита вблизи щеточной каемки микроворсинки
(рис. 133, 4—6, вкл.). Округлые макрогаметы напоми-
нают яйцеклетки (рис. 133, 6, вкл.; 134, 7, вкл.), тогда
как микрогаметы имеют сходство со сперматозоидами
(рис. 134, 8, вкл.). Первые ооцисты формируются ме-
нее чем через 10 сут (обычно на 4—5-е сут) после зара-
жения кошки тканевыми цистами (рис. 134, 9, вкл.), а
через 12 сут (обычно на 4— 7-е сут) выделяются с фека-
лиями во внешнюю среду.
В отличие от заражения брадизоитами при зараже-
нии окончательного хозяина ооцистами Т. gondii кар-
тина последовательности развития паразита сущест-
венно изменяется. Во-первых, значительно удлиняется
препатентный период: первые ооцисты появляются
только через 25—42 сут. Во-вторых, высвободившие-
ся из заглоченных ооцист спорозоиты оказываются
неспособными размножаться внутри энтероцитов ки-
шечника. Спорозоиты покидают кишечник либо сразу
(Overdulve, 1970), либо после недолгого (до 10 сут) пе-
ТИП SPOROZOA. КЛАСС COCCIDEA
235
риода персистирования в нем (Kuhn et al., 1974).
В клетках внутренних органов совершаются предцист-
ная и цистная фазы развития, что фактически повторя-
ет ситуацию, имеющую место в промежуточном хозя-
ине при заражении ооцистами. На 18—20-е сут сфор-
мировавшиеся брадизоиты возвращаются в кишечник
кошки, где сразу приступают к бесполому размноже-
нию в энтероцитах, и после нескольких генераций мер-
гонии следуют гамо- и гаметогония и образование
ооцист. Препатентный период развития Т. gondii в
кошке после скармливания ооцист длится 3—4 нед в
отличие от 4—6 сут после скармливания тканевых
цист.
Итак, спорозоиты Т. gondii еще способны экцисти-
роваться в кишечнике того хозяина, который выделяет
ооцисты этого вида, но уже не споосбны начать разви-
тие в эпителии кишечника этого хозяина. Именно в
этом состоит принципиальное различие между Т. gon-
dii и всеми представителями подсем. Eimeriinae, а так-
же такими родами подсем. Isosporinae, как Isospora и
Cystoisospora. Особенность кишечной фазы жизненно-
го цикла Т. gondii состоит в том, что она служит про-
должением развития не спорозоита (ооцисты), а бради-
зоита (тканевой цистны).
При заражении ооцистами Т. gondii кошка (и дру-
гие кошачьи) выступает в роли не только окончатель-
ного, но и промежуточного хозяина. Об этом свиде-
тельствуют развитие в кошке предцистной мерогонии
и образование тканевых цист. Пока еще остается загад-
кой, что заставляет цистные стадии, сформировавшие-
ся в организме кошки, «возвращаться» в кишечник, с
тем чтобы завершить энтероэпителиальное развитие
с образованием расселительных стадий (ооцист). Не
меньшей загадкой остается также и эксклюзивность
выбора из всех хищников именно кошки (и других ко-
шачьих) в качестве окончательного хозина этого пато-
гена.
Анализ имеющихся данных позволяет рассмат-
ривать спорозоит Т. gondii как следующую ступень в
эволюции спорозоита (=гипнозоита) Cystoisospora в
сторону внекишечного развития у кокцидий. И если
гипнозоит С. felis способен к длительному персисти-
рованию только в промежуточном хозяине (мыши,
цыплята), то спорозоит Т. gondii может кратковременно
персистировать (но не развиваться!) в кишечнике
окончательного хозяина, а затем инициировать гене-
рализованное заражение во внекишечных органах, за-
вершающееся образованием тканевых цист. И хотя вне-
кишечные стадии Т. gondii (тахи- и брадизоиты) разно-
сятся во внутренние органы хозяина через кровеносную
и лимфатическую системы, это не дает основания от-
носить Т. gondii к категории кровепаразитов, посколь-
ку заражение нового хозяина при токсоплазмозе осу-
Щестпляется при фекально-оральной трансмиссии, а не
при ПК го кровососания беспозвоночного переносчика.
Посмотри на кажущуюся сложность жизненного
цикла 7', gondii, вес развитие этого паразита безуслов-
но вписывается в трехфазный цикл Sporozoa, а нали-
чие гаметогенеза но типу оогамии не оставляет по-
следних сомнений в кокцидийной природе возбудите-
ля токсоплазмоза.
Уникальность факультативно-гетероксенного жиз-
ненного цикла Т. gondii состоит в том, что в природе
возможно бесконечно долгое воспроизведение парази-
та после заражения промежуточных хозяев друг от
друга через тканевые цисты, даже без участия оконча-
тельного хозяина, а также при заражении одного окон-
чательного хозяина от другого через ооцисты, даже без
участия промежуточного хозяина.
Кроме сходства в строении жизненных циклов
кокцидийная природа Т. gondii бесспорно подтвержда-
ется и ультраструктурным сходством с кокцидиями
(рис. 59, 2—4).
Мерозоиты и гомологичные стадии (тахи- и бра-
дизоиты) Т. gondii покрыты трехмембранной пелли-
кулой, под которой проходят 22 субпелликулярные
микротрубочки; число роптрий варьирует от 4 до 8.
Микрогаметы имеют по 3 жгутика, один из которых
рудиментарный. Особенность макрогаметы Т. gondii
состоит в том, что она покрыта не одной, а тремя мемб-
ранами, хотя две внутренние оказываются преры-
вистыми. В центре крупного ядра макрогаметы имеет-
ся отчетливая нуклеола. Паразитофорная вакуоль,
окружающая растущих меронтов и гамонтов Т. gondii,
выстлана тремя мембранами (Scholtyseck, 1979; Fergu-
son, 1999).
Методом замораживания—скалывания было по-
казано наличие бблыпего числа внутримембранных
частиц в плазмалемме пелликулы тахизоитов, чем бра-
дизоитов. Это может свидетельствовать о большей фи-
зиологической активности предцистных стадий по
сравнению с цистными (Torpier et al., 1991). Снаружи
спороцисты Т. gondii покрыты одной мембраной, под
которой располагается внутренний слой, составлен-
ный из четырех слегка изогнутых пластин. Край каж-
дой пластины несколько утолщен, а на границе двух
соседних пластин отчетливо просматривается харак-
терный шов (рис. 64).
Среди других видов сем. Isosporidae Т. gondii имеет
наибольшее число промежуточных хозяев — свыше
350 (Fayer, 1981). Это тем более удивительно, что сам
паразит достоверно представлен одним-единственным
видом Т. gondii Nicolle et Manceaux, 1909. Возможно,
что именно сочетание признаков гомо- и гетероксен-
ности в одном жизненном цикле и привело к всесвет-
ному охвату Т. gondii столь многочисленного числа
животных в качестве промежуточных хозяев.
Важное социально-экономическое значение ток-
соплазмоза определяется его ведущим положением
среди инфекционных причин перинатальной патоло-
гии. Уже в 80-е гг. XX в., с приходом на планету виру-
са иммунодефицита человека и СПИДа, токсоплазмоз
был признан одной из оппортунистических инфекций
протозойной природы.
Основными путями заражения Т. gondii являются
пероральный (через ооцисты и цисты) и конгениталь-
ный (от матери к плоду). Однако распространению за-
разного начала способствуют и многие другие факто-
ры, о существовании которых не было известно до рас-
шифровки полного жизненного цикла этого патогена.
Есть данные, что тараканы, мухи, дождевые черви и
другие копрофаги, заглатывая ооцисты Т. gondii из
почвы, воды или из кошачьих фекалий, могут служить
транспортными хозяевами этого паразита. Пребыва-
ние ооцист в организме копрофагов не вызывает в них
каких-либо изменений (Frenkel, 1974). В свою очередь,
236
ALVEOLATA
птицы и мелкие млекопитающие заражаются Т. gondii
при поедании контаминированных копрофагов. Во
внешней среде ооцисты Т. gondii весьма устойчивы к
разрушению и способны длительно сохранять свои ин-
вазионные свойства.
По данным ВОЗ (1980), одна инвазированная кош-
ка может служить источником загрязнения ооцистами
Т. gondii достаточно большой территории. Большинст-
во кошек выделяют ооцисты раз в жизни после поеда-
ния зараженного промежуточного хозяина. Продолжи-
тельность выделения ооцист (патентный период) до-
стигает от нескольких дней до нескольких недель.
После первичного заражения кошка выделяет миллио-
ны ооцист Т. gondii, которые могут охраняться в почве
до 12—18 мес без потери инвазионное™ (Frenkel,
1974). Подсчитано, что в 20 г фекалий кошек может
содержаться до 20 млн ооцист Т. gondii, а непрерыв-
ное выделение ооцист может продолжаться до 2 нед.
Кроме того, известны случаи повторного выделения
ооцист взрослыми кошками. В эксперименте выде-
ление ооцист Т. gondii провоцировалось заражением
большой дозы ооцист других цистообразующих кок-
цидий (например, Cystoisospora).
Примерно 90 % кошек после первичного заражения
становятся иммунными. Это объясняет очень низкую
(<1 %) выявляемое™ ооцист у кошек при массовом
эпидемиологическом обследовании. После первич-
ного заражения кошки сохраняют антитела к Т. gon-
dii в достаточно высоких титрах в течение 1 года и
дольше.
Оценка титров антител зависит от методов их выяв-
ления. При модифицированной реакции агглютинации
(МА) обычно используются убитые тахизоиты, что по-
зволяет выявлять только иммуноглобулины (IgG).
Красящий тест Сэбина-Фельдмана включает использо-
вание живых тахизоитов и способен выявить IgG и
IgM. Специфический иммуноглобулин (IgM) позволя-
ет распознавать свежую инвазию и ее рецидивы, что
важно при диагностике врожденного токсоплазмоза.
При употреблении иммуносорбентного энзимзависи-
мого метода (ELISA) материалом служат разрушенные
тахизоиты, что позволяет идентифицировать IgG и
IgM. Преимущество этого метода состоит в его авто-
матизированное™, хотя по чувствительности он мо-
жет уступать МА.
Развитие иммунитета не исключает полностью по-
вторного заражения хозяина. Как и при эймериозах,
иммунитет при токсоплазмозе является нестерильным
(премуниция) и связан с наличием в организме живых
паразитов (тканевых цист).
Конгенитальная инфекция у человека возникает в
том случае, если женщина впервые заражается Т. gon-
dii во время беременности. Главная роль в вертикаль-
ной передаче патогена отводится тахизоитам. В пла-
центе развиваются фокальные поражения, откуда ин-
фекция может проникать в плод. В острый период
происходит генерализованное заражение плода; в хро-
нический период доминирует поражение центральной
нервной системы и глаз. Умеренное заражение пло-
да приводит к поражению только органов зрения. При
сильном заражении обычно выявляется классическая
тетрада токсоплазмоза: хориоретинит, гидроцефалия,
судороги и внутричерепные кальцификаты.
Оппортунистическая природа токсоплазмоза про-
является в том, что при неблагоприятных условиях
(иммунодефицит, сопутствующие инфекции, стресс)
происходит реактивация персистирующих (цистных)
стадий. При спонтанном разрыве цист вышедшие из
них брадизоиты сразу конвертируются в тахизоитов.
Бурная пролиферация последних приводит к пораже-
нию глаз и головного мозга, а также к локальному не-
крозу окружающих тканей (Frenkel, 1977). Главным
осложнением токсоплазмоза почти у 40 % больных со
СПИДом является менингоэнцефалит (Ammassari et
al., 1996). В то же время у иммунокомпенетных паци-
ентов большинство высвобождающихся цистных и
предцистных стадий разрушаются иммунными силами
организма (Dubey, 1977), хотя могут возникнуть лим-
фаденопатия, реже энцефалит, миокардит.
Для лечения токсоплазмоза используют комбина-
цию сульфаниламидов с пириметамином. Весьма эф-
фективным оказался также и макролидный антибио-
тик спирамицин. Однако эти и многие другие препара-
ты проявляют свое лечебное действие только против
предцистных стадий и не эффективны против ткане-
вых цист. Применение триметоприм-сульфаметокса-
зола привело к снижению случаев реактивации перси-
стирующих (латентных) стадий. Вопросы профилакти-
ки, основанные на всестороннем знании биологии
возбудителя, играют первостепенную роль в борьбе с
токсоплазмозом.
Род Hammondia Frenkel, 1974
(= Isospora Schneider, 1881, pro parte; Toxoplasma
Nicolle et Manceaux, 1909, pro parte)
Жизненные циклы облигатно-гетероксенные. Ооцис-
ты выделяются во внешнюю среду в неспорулирован-
ном состоянии. Тканевые цисты образуются преиму-
щественно в скелетных и сердечных мышцах. Внутри-
цистныс перегородки отсутствуют. Цистные стадии
представлены клетками одного морфофункционально-
го типа. Эти стадии заразны для окончательного хозя-
ина и не заразны для промежуточного. Ооцисты зараз-
ны для промежуточного и не заразны для окончатель-
ного хозяина. 1 (аразиты млекопитающих. 3 вида.
Попытка выделить очередной штамм Toxoplasma
от кошки привела к обнаружению нового организма,
имевшего сходетво как с Toxoplasma, так и с Sarcocys-
tis и одновременно отличавшегося от обоих (Wallace,
1973; Frenkel, 1974; Frenkel, Dubey, 1975). Новый пара-
зит получил родовое название Hammondia в честь
крупнейшего американского паразитолога Д. Хэммон-
да, скончавшегося в 1974 г.
Типовой вид Hammondia hammondi Frenkel et
Dubey, 1975.
(= Isospora bigemina Liihe, 1906, мелкая форма;
Isospora hammondi Tadros, Laarman, 1976; Toxoplasma
hammondi Levine, 1977; Isospora Overdulve, 1978).
Окончательные хозяева: домашняя кошка
Felis catus и F. silvestris.
Промежуточные хозяева: крысы Rattus rat-
tus и R. norvegicus (в естественных условиях), полевые
мыши (Clethrionomys glareolus, Microtus arvalis, M. ag-
restis, Apodemus sylvaticus, A. flavicollis), хомяк, Crista-
ТИП SPOROZOA. КЛАСС COCCIDEA
237
tus cristatus, кролики, свиньи, зайцы, козы, собаки,
свиньи (в эксперименте).
Неспорулированные ооцисты из фекалий кошки
достигают 10.6 X 11.4 мкм и морфологически неотли-
чимы от ооцист Т. gondii. Споруляция завершается в
течение 2—3 сут при 22—26 °C. Спорулированные
ооцисты несколько крупнее (в среднем 11.4 X 13 мкм)
и также неотличимы от ооцист Т. gondii. Оболочка
ооцисты двуслойная, полярная гранула и микропиле
отсутствуют.
Промежуточный хозяин заражается только при по-
едании спорулированных ооцист, выделенных оконча-
тельным хозяином. Спорозоиты высвобождаются из
кишечника и проходят через его стенку. Мерогония по
типу эндодиогении совершается в lamina propria киш-
ки, пейеровых бляшек и мезентериальных узлов, при-
водя к некрозу зараженных клеток. Через 10—11 сут в
скелетной и сердечной мышцах формируются ткане-
вые цисты размером до 300 X 95 мкм. Цисты Н. ham-
mondi в головном мозгу значительно мельче (20—
25 мкм в диаметре) и встречаются крайне редко. Цист-
ные мерозоиты Н. hammondi мельче брадизоитов To-
xoplasma gondii, достигая в длину соответственно 4—5
и 7—8 мкм (Frenkel, Dubey, 1975). В пораженных
мышцах наблюдаются процессы некроза и воспаления.
В местах разрушения цист не происходит размноже-
ния ни цистных, ни предцистных стадий (Frenkel, Du-
bey, 1975). Срок жизни цист//, hammondi определен по
крайней мере до 500 сут (Frenkel, 1977).
Окончательный хозяин заражается только при по-
едании тканевых цист Н. hammondi, развивающихся в
промежуточном хозяине. Высвободившиеся из цист
брадизоиты приступают в кишечнике кошки к мерого-
нии и последующему гаметогенезу, завершающемуся
образованием зигот (ооцист). Развитие Н. hammondi в
кишечнике кошки во многом напоминает энтероэпите-
лиальное развитие Toxoplasma gondii. Сходство между
этими двумя родами подтверждается также и в их
молекулярной организации и антигенной структуре
(Johnson et al., 1987).
Препатентный период развития Н. hammondi в
окончательном хозяине составляет 5—14 сут, патент-
ный 1—3 нед. После прекращения выделения ооцист
меронты и гамонты в кишечнике кошки больше не
выявляются. Однако у зараженных кошек может
иметь место хроническая инфекция, длящаяся вплоть
до 3 мес, о чем свидетельствует выделение такими жи-
вотными ооцист при отсутствии повторного зара-
жения.
Наличие перекрестной серологической реакции
между Т. gondii и Н. hammondi ставит под сомнение
самостоятельность самого рода Hammondia, который
Ливайн предпочитает рассматривать в рамках рода
Toxoplasma (Levine, 1977). Однако это мнение разделя-
сгси не всеми исследователями из-за обнаружения у
хаммопдий специфических особенностей. Так, у ко-
шек, которым скармливали цисты Н. hammondi, зара-
жение ограничивалось лишь кишечником и не включа-
ло другие органы и ткани, как при заражении Т. gondii.
Ооцисты Н. hammondi незаразны для окончательного
хозяина, а промежуточные хозяева не заражаются друг
от друга. Последнее, по мнению исследователей, ха-
ркктернзует жизненный цикл Н. hammondi как обли-
гатно, а не факультативно гетероксенный, как у Toxo-
plasma.
Hammondia heydorni (Tadros, Laarman, 1976) Du-
bey, 1977.
(= Isospora heydorni Tadros, Laarman, 1976; Isospora bigemina
Liihe, 1906, мелкая форма; Isospora bigemina Dubey et Fayer, 1976;
Isospora wallacei Dubey, 1976; Dubey, Fayer, 1972; Isospora wallacei
Dubey, 1977).
Окончательные хозяева: домашняя собака
Canis familiaris, койот Canis latrans, лисицы Vulpes wi-
pes, Alopex lagopus.
Промежуточные хозяева: крупный рогатый
скот, овцы, козы, американский лось, буйволы, олени,
верблюды, морские свинки.
Ооцисты сферические или субсферические, морфо-
логически неотличмые от ооцист Toxoplasma gondii
и Hammondia hammondi, средние размеры 11.5 X
12.0 мкм. Оболочка двухслойная, бесцветная. В ооцис-
тах отсутствуют микропиле, полярная гранула и оста-
точное тело. Жизненный цикл рассматривается как
облигатно-гетероксенный. Н. heydorni встречается в
среднем у 0.5 % обследованных собак. Заболевание
овец и коз, экпериментально зараженных Н. heydorni,
протекало легко (Dubey, 1977).
Hammondia pardalis Hendricks, Ernst, Courtney,
Speer, 1979.
(= Toxoplasma pardalis Levine et Ivens, 1981; Isospora sp. Long,
Speer, 1977).
Окончательные хозяева: оцелотFelisparda-
lis, Puma concolor (в естественных условиях), Felis ca-
tus, F. yagouaroundi (в эксперименте).
Промежуточный хозяин: Mus musculus (толь-
ко в эксперименте).
Ооцисты овальные, размером 36—46 X 25—
35 мкм. Оболочка ооцисты бесцветная однослойная
толщиной 1.8 мкм. На узком конце ооцисты имеется
микропиле; на широком конце проходит шовная ли-
ния. К внутренней поверхности стенки ооцисты при-
крепляется мелкая сферическая гранула размером
0.5 мкм. Остаточное тело в ооцисте отсутствует. Спо-
розоиты в форме эллипса размером 19—25 X 14—
19 мкм. Оболочка ооцисты толщиной около 1 мкм.
Тельца Штида и суб-Штида отсутствуют; имеется
остаточное тело в виде одиночной глобулы. В спорозо-
итах отсутствует рефрактильное тело. Мерогония в
промежуточном хозяине протекает в клетках мезенте-
риальных лимфатических узлов, в легких и в подсли-
зистой кишечной стенке.
Окончательный хозяин не заражается при пое-
дании ооцист хаммондий. В связи с этим облигатная
гетероксенность жизненного цикла Hammondia рас-
сматривается в качестве весомого аргумента в поль-
зу самостоятельности этого рода, несмотря на нали-
чие очевидного сходства между ним и факультативно
гетероксенным родом Toxoplasma (Hendricks et al.,
1979).
Ультраструктура H. hammondi принципиально сход-
на с таковой классических кишечных кокцидий. Тка-
невые цисты сравниваемых организмов ограничены
гладкой складчатой мембраной, образующей первич-
ную стенку цисты. В мышечном волокне молодые цис-
ты Н. hammondi находятся в непосредственном кон-
238
ALVEOLATA
такте с саркоплазмой зараженной клетки, тогда как бо-
лее старые цисты окружены электронно-прозрачным
пространством толщиной 0.5 мкм, заполненным мел-
кими пузырьками. В этом состоит различие между ци-
стами Hammondia и Toxoplasma', последние в процессе
развития всегда сохраняют тесный контакт с мышеч-
ными филаментами. В обоих случаях цистные стадии
делятся путем эндодиогении и свободно располагают-
ся в основном веществе цисты, не разделенном перего-
родками на отдельные ячейки.
Род Besnoitia Henry, 1913
(= Isospora Schneider, 1881, pro parte; Sarcocystis
Lankester, 1882, pro parte; Globidium Fleisch, 1883, pro
parte; Gastrocystis Brumpt, 1913; Fibrocystis Hadwen,
1922)
Жизненные циклы гетероксенные. Ооцисты вы-
деляются в неспорулированном состоянии. Тканевые
цисты формируются преимущественно в коже и соеди-
нительной ткани хозяина. Паразиты млекопитающих,
птиц, рептилий. 8 видов.
Организмы, ставшие впоследствии известны как
бесноитии, были впервые описаны в 1912 г. у крупного
рогатого скота во Франции Бенуа и Робином (Besnoit,
Robin, 1912). Авторы исследования полагали, что име-
ли дело с новым и необычным видом Sarcocystis. Родо-
вое название Besnoitia было предложено Анри (Henry,
1913). До середины 70-х гг. XX в. жизненный цикл
Besnoitia оставался неизвестным. Первое сообщение о
цикле развития В. besnoiti появилось в 1974 г. (Пете-
шев и др., 1974). К настоящему времени имеется об-
ширная информация о разных видах рода Besnoitia
(Dubey et al., 2003).
Типовой вид Besnoitia besnoiti (Marotel, 1913).
(= Sarcocystis besnoiti Marotel, 1913; Globidium bes-
noiti Wenyon, 1926).
Окончательные хозяева: кошка домаш-
няя Felis catus и дикая Felis libyca (Петешев и др.,
1974).
Промежуточные хозяева: крупный рогатый
скот (Bos taurus), козы, антилопы-гну, импалы и куду
(в естественных условиях), кролики, овцы, хомячки (в
эксперименте).
Распространение: Казахстан, Израиль, страны
Африки.
Однако данные о выделении кошкой ооцист В. bes-
noiti (Петешев и др., 1974) не подтвердились в более
поздних исследованиях (Dubey, 1977; Frenkel, 1977), и
вопрос об окончательном хозяине этого паразита оста-
ется открытым до сих пор.
В промежуточном хозяине В. besnoiti цисты лока-
лизуются в коже, подкожной клетчатке, роговице гла-
за и соединительнотканных участках. Бурное развитие
предцистных стадий вызывает острое течение бо-
лезни, нередко с летальным исходом. Хронический
бесноитиоз сопровождается формированием харак-
терных цист с толстыми фибриллярными оболочками
(рис. 135, 1, 2, вкл.).
В эксперименте успешно осуществляли передачу
инфекционного материала от одного промежуточного
хозяина к другому, но только при условии создания ис-
кусственной иммунодепрессии хозяина. При этом
цистные стадии были более патогенными, чем предци-
стные (Diesing et al., 1988). Еще раньше удавалось за-
ражать коров В. besnoiti при переливании крови от за-
раженного животного (Pols, 1954).
Есть предположение об участии слепней и других
мух в трансмиссии возбудителя от одной коровы к
другой в острый период болезни, а также от коровы к
корове и от кролика к кролику и в хронический период
(Bigalke, 1967). Хван (1969) наблюдал новые случаи
заражения В. besnoiti у коров в зимнее время, в связи с
чем в переносе возбудителя от зараженного к незара-
женному животному предполагалось участие иксодо-
вых клещей. Не исключается также роль каннибализ-
ма, как одного из предполагаемых путей трансмиссии
возбудителя бесноитиоза между промежуточными хо-
зяевами. Несмотря на то что полный жизненный цикл
В. besnoiti все еще не расшифрован, самостоятель-
ность этого вида подтверждается сравнительными эн-
зимологическими исследованиями его изолятов от
крупного скота и диких животных.
Besnoitia darlingi Mandour, 1965.
(= Besnoitia panomensis Schneider, 1965; Besnoitia saurina Gam-
ham, 1966).
Окончательный хозяин: Felis catus.
Промежуточные хозяева: ящерицы родов
Ameiva и Basiliscus, опоссум Didelphis marsupialis.
Неспорулированные ооцисты достигают размеров
12.3 X 11.9 мкм, спорулированные (из опоссума)
12.0 X 10.3 мкм.
Besnoitia oryctofelis Rosenthal, Ventutini, Venturini,
Greiber, 2003.
Окончательный хозяин: домашняя кошка
Felis catus.
Промежуточный хозяин: кролик.
Besnoitia wallacei Frenkel, 1977.
(= Isospora bigemina Ito, Tsunoda, Nishikawa, Matsui, 1974,
крупная форма; Isospora wallacei Tadros et Laarman, 1976).
Окончательный хозяин: домашняя кошка
Felis catus.
Промежуточные хозяева: мыши, крысы,
кролики, полевки, хомячки (в эксперименте); крыса
Rattus norvegicus (в естественных условиях).
Распространение: Центральная Америка.
Неспорулированные ооцисты достигают 16 X
X 13 мкм, а спорулированные 17 X 12 мкм. В проме-
жуточном хозяине мерогония происходит в lamina pro-
pria подвздошной кишки. Меронты иногда локализу-
ются в клетках эпителия или интимы сосудов (Frenkel,
1977; Mason, 1980). В окончательном хозяине паразит
развивается в энтероцитах тонкой кишки. Микро-
гамонты локализуются в бокаловидных клетках. Мик-
ро- и макрогамонты появляются на 13—16-е сут пос-
ле скармливания ооцист. Особенность развития В. wal-
lacei в окончательном хозяине состоит в наличии не
только кишечной, но и внекишечной пролиферации;
однако тканевые цисты не формируются (Frenkel,
1977).
Имеется единственное сообщение о конгениталь-
ной передаче бесноитиоза у коров в Уганде. Передача
ТИП SPOROZOA. КЛАСС COCCIDEA
239
возбудителя венерическим путем не зарегистрирована,
несмотря на значительную частоту встречаемости тка-
невых цист В. besnoiti в репродуктивных органах про-
межуточных хозяев (Петешев и др., 1974).
Среди видов рода Besnoitia, известных пока только
по находкам тканевых цист в промежуточных хозяе-
вах, следует упомянуть В. bennetti Babudieri, 1932 (ло-
шадь, осел); В. tarandi (Hadweik, 1922) Levine, 1961
(северный олень, карибу); B.jellisoni Frenkel, 1953 (бе-
лоногая мышь, сумчатая крыса, опоссум; в экспери-
менте — мышь, крыса, хомячок, морская свинка, кро-
лик). В отличие от других цистообразующих кокцидий
тканевые цисты Besnoitia включают в себя всю клетку
хозяина или ее ядро.
Ультраструктура эндогенных стадий развития Bes-
noitia принципиально сходна с таковой других кокци-
дий. Цисты содержат клетки одного морфофункцио-
нального типа, перегородки в цистах отсутствуют. Это
сближает род Besnoitia с родами Toxoplasma и Ham-
mondia.
Детальное электронномикроскопическое изуче-
ние тканевых цист и цистных стадий В. besnoiti было
проведено Федосеенко (1979). Предцистные стадии
захватываются макрофагами и внутри этих клеток
иммунной системы далее транспортируются к мес-
там их окончательной локализации в хозяине — в
соединительнотканные участки внутренних органов.
Есть основание полагать, что внутриклеточные зои-
ты не покидают заключающие их макрофаги, но
размножаются в них. Зараженная клетка хозяина ги-
пертрофируется и впоследствии становится частью
сложной вторичной стенки цисты. Из этого следу-
ет, что в формировании тканевой цисты В. besnoiti
принимает участие не только мембрана паразито-
форной вакуоли клетки хозяина, как у Toxoplasma
и Hammondia, но и вся зараженная клетка (рис. 136, 7,
8, вкл.).
В процессе роста соединительнотканные цисты
Besnoitia постепенно разрушаются и замещаются гра-
нулемами, превосходящими по своим размерам исход-
ные цисты (Frenkel, 1977). Цистные стадии Besnoitia
заразны для окончательного хозяина.
В отличие от спорозоитов Toxoplasma спорозои-
ты Besnoitia и Hammondia уже полностью утратили
способность эксцистироваться в кишечнике оконча-
тельного хозяина. Это знаменует дальнейшую эволю-
цию факультативно гетероксенного жизненного цикла
токсоплазмы в направлении облигатной гетероксен-
ности циклов развития бесноитий и хаммондий, что,
однако, не исключает возможности передачи зараз-
ного начала от одного промежуточного хозяина к дру-
гому.
Бесноитиоз крупного и мелкого рогатого скота
(Н. besnoiti) имеет большое негативное значение в
сельском хозяйстве, поскольку переболевшие живот-
ные становятся неполноценными: нарушение волося-
ного покрова, приводящее к необратимым дефектам
шкуры, частичная стерилизация самцов (Pols, 1960).
Бесноитиоз не имеет всесветного распространения, но
строго локализован в определенных географических
зонах, таких как Франция, Венесуэла, Китай, Южная
Африка. В б. СССР это заболевание было впервые об-
наружено Всеволодовым в 1961 г.
Род Neospora Dubey, Carprnter, Speer,
Topper, llggla, 1988
(= Toxoplasma Nicolle et Manceaux, 1909, pro parte)
Эти цистообразующие кокцидии имеют определен-
ное сходство с Т. gondii, хотя существуют и определен-
ные различия между ними.
Тканевые цисты не имеют вторичной оболочки или
внутренних перегородок и локализуются только в
клетках нервной системы, реже в ретине глаза. Циста
покрыта плотной аргирофильной, богатой полисахари-
дами стенкой толщиной до 4 мкм (в среднем 1—2 мкм).
Такая оболочка включает первичную цистную стенку,
лежащую поверх толстого гранулярного слоя. В свою
очередь первичная цистная стенка Neospora происхо-
дит от мембраны паразитофорной вакуоли и связана
с цистернами эндоплазматической сети клетки хозяи-
на. В тканевой цисте размером до 100 мкм в диаметре
может насчитываться до 200 брадизоитов. Предцист-
ные и цистные стадии размножаются путем эндодио-
гении. В эксперименте выявлены ооцисты Neospora,
имеющие изоспороидную структуру. Паразиты собак.
1 вид.
До последних лет были известны только две эндо-
генные стадии развития паразита — тахизоиты (пред-
цистные стадии) и брадизоиты (цистные стадии). В
1999 г. были описаны ооцисты N. caninum, выявлен-
ные в фекалиях собак, экспериментально зараженных
тканевыми цистами этого паразита из мозга мышей.
Однако локализация энтероэпителиальных стадий в
кишечнике собаки неизвестна. Предцистные стадии раз-
мером 3x7 мкм имеют форму полумесяца и встре-
чаются преимущественно в клетках эпендимы, в мо-
нонуклеарных клетках спинномозговой жидкости, в
нервных клетках, а также в клетках, окружающих кро-
веносные сосуды.
Типовой вид Neospora caninum Dubey, Carpm-
ter, Speer, Topper, Uggla, 1988.
Типовой хозяин: собака Canisfamiliaris.
До сих пор нет ясности, является ли жизненный
цикл неоспоры облигатно или факультативно гетеро-
ксенным.
Предцистные зоиты не заключены внутри парази-
тофорной вакуоли и свободно располагаются в клетке
хозяина одиночно или группами (рис. 137,1, вкл.). Ци-
сты имеют толстую стенку (рис. 137, 2, вкл.). Делящи-
еся клетки достигают 4.4 X 2.2 мкм, неделящиеся не-
сколько крупнее (5x2 мкм). При скармливании со-
бакам мозга мышей, ранее зараженных штаммом
NC-beef N. caninum, в их фекалиях были найдены не-
спорулированные ооцисты этого возбудителя (Lindsay
et al., 1999). Спорулированные ооцисты N. caninum
имеют округлую форму (11.7 X 11.3 мкм), лишены
микропиле и остаточного тела. Полярная гранула от-
сутствует, но имеются небольшие рефрактильные гра-
нулы, расположенные между спороцистами.
Элипсоидные спороцисты размером 8.4 X 6.1 мкм.
Тельце Штида отсутствует. Спорозоиты удлиненной
формы размером in situ 7.6—8.0 X 2.0—3.0 мкм; оста-
точное тело спороцисты размером 4.3 X 3.9 мкм со-
ставлено из плотных гранул. В спорозоитах отсутству-
ют рефрактильные тела. Ядро спорозоита находится
240
ALVEOLATA
ближе к заднему полюсу. По совокупности признаков
ооциста N. caninum имеет сходство с ооцистами Ham-
mondia heydorni в фекалиях собак и Toxoplasma gondii,
Н. hammondi в фекалиях кошек.
Ультраструктура зоитов N. caninum типична для
представителей споровиков (рис. 138, 3, вкл.). Имеют-
ся трехмембранная пелликула, полярные кольца,
22 субпелликулярных микротрубочки, заканчивающи-
еся ниже уровня ядра. Микроспоры не выявлены.
Выше коноида располагаются два преконоидальных
кольца. Коноид составлен из двух микротрубочек,
свернутых в виде спирали. В передней части зоита рас-
полагается 12 роптрий (или сходных с ними органелл),
при этом 6—8 протоков роптрий простираются в по-
лость коноида. Микронемы наиболее многочисленны
в передней части тела зоита. В цитоплазме зоита
наблюдается 2—6 электронноплотных тела, 1—2 ми-
тохондрии и ряд других включений. Ядро с ядрышком
расположено в задней части тела зоита. Деление цист-
ных стадий путем эндодиогении, как у Toxoplas-
ma gondii. Однако в отличие от Т. gondii цисты Neo-
spora имеют отчетливую аморфную стенку толщиной
1.5—3.5 мкм. Средние размеры цистных стадий
3.6 X 1.6 мкм.
Единственным достоверным способом заражения
нового хозяина N. caninum до сих пор считается транс-
плацентарная передача патогена. У зараженных жи-
вотных наблюдается поражение нервной и мышечной
системы, зарегистрированы случаи дерматита, мио-
кардита, полимиозита, а также летального исхода.
Есть данные о конгенитальной передаче паразита, что
сближает Neospora и Т. gondii (Dubey, Lindsay, 1989;
Dubey et al., 1990). У собак неоспороз вызывает про-
грессирующий паралич.
Вовремя начатое лечение неоспороза может быть
успешным. Хорошие результаты дает сочетание три-
метоприма и сульфадиазина. Более подробная инфор-
мация о патогенезе неоспороза и его лечениии содер-
жится в специальной сводке (Dubey et al., 2001).
Данные многочисленных исследований по N. cani-
num подчеркивают самостоятельность этого патогена,
а также очевидные отличия его морфофункциональ-
ной организации от таковой других цистообразущих
кокцидий. В этом отношении было важно доказать от-
сутствие перекрестной серологической реакции между
родами Neospora и Toxoplasma (Dubey et aL, 2001).
Было также показано, что генетическое сходство меж-
ду N. caninum и Т. gondii в локусе 18S рРНК составляет
99.8 %. А генетические различия в этом локусе важны
с эволюционных позиций, поскольку рибосомальные
гены выполняют жизненно важную функцию, а их му-
тации часто детальны.
В последние годы, однако, в специальной литера-
туре появились публикации, в которых с ссылкой на
правила Международного кода зоологической номенк-
латуры самостоятельность этого патогена подвергает-
ся серьезным сомнениям (Heydorn, Mehlhom, 2002),
а само название N. caninum объявляется nomen nudum.
Критики ставят под сомнение валидность критериев,
использовавшихся при создании нового рода (Neo-
spora) цистообразующих кокцидий в то время, когда
уже существовали достаточно валидные роды, такие
как Hammondia, Toxoplasma и Isospora. Кроме того,
результаты недавних опытов по трансмиссии этого
паразита новому хозяину показали, что изолят ооцист,
взятый из фекалий собак, был морфологически не-
отличим от изолята Hammondia heydorni, по своим
молекулярно-биологическим характеристикам соот-
ветствовал штамму NC-1 N. caninum. Для получения
ответа на этот непростой вопрос требуется проведение
дополнительных всесторонних исследований.
Подсем. Sarcocystinae Poche, 1913
(= подсем. Isosporinae Wenyon, 1926)
Жизненные циклы облигатно гетероксенные (рис. 96).
Ооцисты с хрупкими оболочками, микропиле отсутст-
вует. Ооцисты выделяются во внешнюю среду в пол-
ностью спорулированном состоянии, обычно в виде
свободных спороцист, покрытых более плотными обо-
лочками. В спороцисте содержатся 4 спорозоита и
остаточное тело, отсутствует тельце Штида, но имеют-
ся четкие шовные линии. До выделения во внешнюю
среду ооцисты (спороцисты) могут неопределенно
долго персистировать в стенке кишечника. Основное
вещество тканевых цист (саркоцист) разделено на
отдельные ячейки. Цистные стадии включают три раз-
ных морфофункциональных типа клеток. Два рода.
Число видов не определено.
Род Sarcocystis Lankester, 1882
(= Synchrytium Kuhn, 1865, pro parte; Eimeria Schneider,
1875, pro parte; Coccidium Leuckart, 1879, pro parte;
Isospora Schneider, 1881, pro parte; Meischeria Blan-
chard, 1885; Balbiania Stiles, 1893; Cryptosporidium
Tyzzer, 1907, pro parte; Besnoitia Henry, 1913, pro parte;
Lucetina Henry et Leblois, 1925, pro parte; Arthrocystis
Levine et al., 1970; Hoaresporidium Pande et al., 1972;
Octoplasma Dissanaike et Poopalachelvam, 1975; Endori-
mospora Tadros et Laarman, 1976, pro parte)
С Характеристикой подсемейства.
В промежуточном хозяине совершается только бес-
полое размножение саркоспоридий, включающее
предцистную мерогонию и образование мышечных
цист, или саркоцист. Строение стенки саркоцист
разных видов Sarcocystis имеет разную степень слож-
ности. Основное вещество цисты разделено пере-
городками на отдельные ячейки. Цистные стадии
представлены клетками по крайней мере трех разных
морфофунциональных типов: метроцитами, промежу-
точными клетками и гамонтами. Сами тканевые цисты
Sarcocystis представляют собой гигантские меронты,
внутри которых совершается однонаправленное разви-
тие от малодифференцированных метроцитов через
стадию промежуточной клетки до высокодифференци-
рованных гамонтов (не гамет!). В окончательном хозя-
ине гамонты сразу, без предшествующей мерогонии,
приступают к гаметогенезу. Копуляция макро- и мик-
рогамет приводит к образованию зиготы (ооцисты),
которая спорулирует in situ.
Цистные стадии заразны для окончательного хозя-
ина. Заражение одного промежуточного хозяина от
другого происходит относительно редко и ограничива-
ТИП SPOROZOA. КЛАСС COCCIDEA
241
ется случаями каннибализма (у грызунов). Ооцисты
заразны только для промежуточного хозяина.
Род Sarcocystis состоит из ряда хорошо очерченных
видов, каждый из которых имеет одного или более окон-
чательных и промежуточных хозяев. Паразиты млекопи-
тающих, птиц, рептилий, рыб. Около 130 видов, среди
которых полные жизненные циклы описаны для 56.
Типовой вид Sarcocystis miescheriana (Kuhn,
1965) Lankester, 1882.
(= Endorimospora miescheriana Tadros et Laarman,
1976).
Типовой хозяин: домашняя свинья.
Мышечные цисты (саркоцисты) были впервые
описаны Мишером в 1843 г. в скелетных мышцах до-
машней мыши. Однако выявленные паразиты не полу-
чили никакого названия. В дальнейшем сходные обра-
зования в мышцах других позвоночных обозначались
как «мишеровые мешочки», «рейновские тельца»
«псоросперма», т. е. семя чесотки. Биноминальная
терминология была впервые введена Ланкестером
(Lankester, 1882), предложившим для обозначения
всех встречавшихся к тому времени внутриклеточных
паразитов свиней единое название Sarcocystis mies-
cheri.
В последующие годы саркоцисты Sarcocystis были
также обнаружены в мышцах многих других живот-
ных. В то время ошибочно принималось за аксиому,
что один хозяин может быть заражен только одним ви-
дом Sarcocystis. Считалось, например, что овцы зара-
жены только 5. tenella (Railliet, 1866) Moule, 1886; сви-
ньи — 51. miescheriana (Kuhn, 1865) Lankester, 1884;
крупный рогатый скот — S. hirsuta Moule, 1888.
С середины 50-х гг. XX в. саркоспоридий стали
сближать с Toxoplasma, Besnoitia и М-организмом
(впоследствии — род Frenkelia) не только из-за их спо-
собности формировать тканевые цисты, но и вследст-
вие значительного ультраструктурного сходства их зо-
итов (Ludwik, 1956; Senaud, 1967). Тем не менее до на-
чала 70-х гг. все указанные паразиты оставались
«организмами неизвестного систематического поло-
жения», поскольку их жизненные циклы оставались
неизвестными.
Полный цикл развития Sarcocystis был расшифро-
ван вскоре после разгадки жизненного цикла Toxoplas-
ma. Кокцидийная природа саркоспоридий была впер-
вые доказана в опытах по культивированию цистных
зоитов Sarcocystis из мышц вороньего дрозда. Разви-
тие паразита в культуре завершалось формированием
макро- и микрогамонтов, копуляцией гамет и образо-
ванием ооцист, которые после споруляции демонстри-
ровали изоспороидное строение (Fayer, 1972).
Кокцидийная природа Sarcocystis была бесспорно
доказана также и в опытах по экспериментальному за-
ражению кошек, собак и людей-добровольцев мышеч-
ными цистами соответственно 5. tenella (из овцы),
S. fusiformis (из коровы) и S. miescheriana (из свиньи).
Во всех случаях имело место выделение полностью
спорулированных ооцист изоспороидного строения.
Ооцисты с хрупкими оболочками легко распадались
на две спороцисты с плотными оболочками, каждая с
4 спорозоитами и остаточным телом.
Ооцисты 51. miescheriana, выделенные из стула за-
раженных людей, по морфологии и размерам соответ-
ствовали ооцистам кокцидии человека Isospora ho-
minis.
Результаты последующих исследований по рас-
шифровке жизненных циклов разных видов Sarcocystis
и по другим вопросам изучения саркоспоридий обоб-
щены и проанализированы в ряде специальных публи-
каций (Frenkel, 1973, 1977; Tadros, Laarman, 1976,
1982; Dubey, 1977; Бейер и др., 1978; Вершинин, 1979,
2001; Chobotar, Scholtyseck, 1982; Бейер, 1988, 1989;
Dubey et al., 1989; Beyer, Radchenko, 1995; Radchenko,
Beyer, 1995; Радченко, 1999).
Жизненный цикл, морфология
и ультраструктура
В настоящее время не вызывает сомнения, что
сложный цикл развития саркоспоридий полностью со-
ответствует структуре жизненного цикла споровиков.
Некоторые отклонения от классической триады Sporo-
zoa (рис. 96) могут быть объяснены спецификой эколо-
гии паразито-хозяинных отношений у саркоспоридий.
Развитие саркоспоридий
в промежуточном хозяине
В промежуточном хозяине Sarcocystis мерогония
включает две фазы: предцистную (рис. 139,1,2, вкл.) и
цистную (рис. 140—144, вкл.). В отличие от Т. gondii у
саркоспоридий цистная мерогония завершается обра-
зованием не мерозоитов (брадизоитов), а стадий, гомо-
логичных гамонтам, которые из-за их формы тела
были впервые обозначены как «цистные мерозоиты»
и в таком виде вошли в специальную литературу
(рис. 144, II, вкл.). В этом состоит принципиальное от-
личие цистной фазы рода Sarcocystis от соответствую-
щей фазы развития у ранее рассмотренных родов (To-
xoplasma, Hammondia, Besnoitia) (Beyer et al., 1981;
Бейер, 1988, 1989; Beyer, Radchenko, 1995). У трех по-
следних родов все цистные стадии гомологичны меро-
зоитам, т. е. бесполым стадиям, а у Т. gondii доказана
еще и конверсия цистных стадий (брадизоитов) в пред-
цистные (тахизоиты) (Dubey, 1977).
Предцистная (острая, или васкулярная) фаза длится
в среднем 4—6 нед. Спорозоиты эксцистируются из
заглоченных ооцист (спороцист) и через портальную
циркуляцию достигают кровеносных сосудов. Пред-
цистная мерогония проходит в эндотелии сосудов
внутренних органов и включает не менее двух генера-
ций; при этом деление клеток происходит по типу эн-
дополигении (рис. 72, 73). В клетке хозяина предцист-
ные мерозоиты не заключены внутри паразитофорной
вакуоли, но располагаются свободно в цитоплазме.
Сформировавшиеся предцистные мерозоиты проника-
ют в мышцы, где инициируют цистную фазу развития.
В условиях культуры клеток (СРА, эндотелий ле-
гочных артерий быка) спорозоиты 5. cruzi были спо-
собны к непрерывному культивированию в течение
более чем 1320 сут (Andrews et al., 1990). Размножение
паразита ограничивалось фазой цикла, соответствую-
щей предцистной мерогонии, которая, как было пока-
16 Зак. № 4)63
242
ALVEOLATA
Рис. 145. Схематическое изображение участка тканевой цисты Sarcocystis ovifelis. (По: Грикенене, 1983).
Саркоциста окружена стенкой сложного строения, включающей первичную и вторичную оболочки, из которых последняя (воб) имеет два слоя (/ и II).
В основном веществе цисты располагаются цистные стадии трех морфофункциональных типов: метроциты (мц), промежуточные клетки (пк) и «цистные ме-
розоиты» (ме), гомологичные стадии гамонта. В промежуточной клетке совершается процесс эндодиогении (энд); в — вакуоль, м — митохондрия, мн — мик-
ронемы, мф — миофибриллы, р — роптрии, смт — субпелликулярные микротрубочки, тг — темные гранулы, я — ядро, якх — ядро клетки хозяина, мп —
микропора.
Fig. 145. Scheme of a fragment of tissue cyst of Sarcocystis ovifelis.
The sarcocyst is limited with a complex wall made of primary and secondary walls, the latter containing two layers (1 and II). In the main substance, cystic stages of
three different morpho-functional cell types are presented: metrocytes, intermediate cells, and «cyst merozoites», which are homologous to the gamont stage. Of these
three, only intermediate cells divide by endodyogeny; в — vacuole, воб — secondary sarcocyst wall, м — mitochondrion, ме — «cyst merozoites», мн — micronemes,
мф — miofibrilles, мц —• metrocytes, пк — intermediate cells, p — rhoptries, смт — subpellicular microtubules, тг — dark granules, энд — endodyogeny, я — nucle-
us, якх — host cell nucleus, мп — micropore.
ТИП SPOROZOA. КЛАСС COCCIDEA
243
зано, может включать огромное число бесполых ра-
ундов.
Только что внедрившийся мерозоит свободно рас-
полагается в цитоплазме мышечного волокна. Парази-
тофорная вакуоль формируется позднее, а ее мембра-
на становится основой будущей цистной стенки
(рис. 142, 7, вкл.). Основное вещество саркоцисты раз-
делено перегородками (септами) на множество ячеек,
заключающих внутри себя цистные стадии (рис. 141,
5; 143, 9, вкл.). У большинства видов Sarcocystis цист-
ная стенка состоит только из первичной оболочки с
подстилающим основным веществом (рис. 142, 7, вкл.).
Более сложное строение имеет стенка цисты S. ovifelis
(= S. tenella), включающая, кроме первичной, еще и
вторичную оболочку, в состав которой входят элемен-
ты зараженной клетки (рис. 145). Структура стенки
зрелых саркоцист нередко используется для разли-
чения видов Sarcocystis одного и того же хозяина, хотя
этот признак не может считаться достаточно на-
дежным.
В саркоцисте следует различать по крайней мере
три разных морфофункциональных типа клеток: мет-
роциты, промежуточные клетки и «цистные мерозо-
иты», гомологичные стадии гамонта (Beyer et al., 1981).
Крупные малодифференцированные метроциты
располагаются ближе к внутреннему краю цистной
стенки (рис. 140, 5, 4, вкл.; 142, 7, 8, вкл.). Метроциты
образуются в результате дедифференцировки пред-
цистных мерозоитов и представляют собой материн-
ские камбиальные бесполые клетки, гомологичные
стадии мерозоита. Функция метроцитов состоит в ум-
ножении числа дочерних клеток внутри саркоцисты.
В онтогенезе метроцита нет момента, когда бы он дол-
жен был проникать в новую клетку хозяина. Это объ-
ясняет отсутствие у метроцита не только ригидной
формы тела, но и клеточной полярности, а также на-
бора характерных апикальных органелл. Метроциты
покрыты одномембранной пелликулой, делающей глу-
бокие инвагинации внутрь электроннопрозрачной ци-
топлазмы клетки. В центре метроцита располагается
крупное ядро с ядрышком. Ббльшая часть ядерного
хроматина находится в деконденсированном состоя-
нии, хотя присутствуют и единичные глыбки конден-
сированного хроматина.
Отсутствие полярности в метроцитах объясняет от-
сутствие у них деления путем эндодиогении (рис. 142,
8, вкл.). Деление метроцита совершается иным путем,
пока еще не получившим окончательного осмысления
в литературе. Бесспорным является участие в финаль-
ном разделении материнского метроцита глубоких ин-
вагинаций пелликулы. В результате его деления обра-
зуются дочерние метроциты, которые по своей морфо-
функциональной организации вначале во многом
сходны с материнским, хотя и полностью не идентич-
ны ему. В ходе ряда последующих делений метроцитов
происходит процесс дифференцировки его потомков в
направлении стадии гамонта. Между исходным мате-
ринским метроцитом и гамонтом проходят многие
десятки и сотни клеточных делений. В ходе однонап-
равленного процесса деления метроцита цитоплазма
дочерних метроцитов становится более электронно-
плотной и в них постепенно возникают органеллы апи-
кального комплекса, устанавливается клеточная по-
лярность, а форма таких клеток приобретает удлинен-
но-овальные очертания, однако еще не достигающие
ригидности зоита других кокцидий (рис. 70, Г, 71, 3).
Эти клетки представляют собой промежуточное звено
между метроцитами и гамонтами и поэтому получили
название «промежуточных клеток» (Beyer et al., 1981).
Промежуточные клетки делятся путем эндодиоге-
нии и подобно метроцитам призваны умножать число
стадий внутри саркоцисты. В последующих поколени-
ях этих клеток появляются клетки с еще более плотной
цитоплазмой, с полным набором апикальных органелл
и ригидной формой тела зоитов (рис. 144,11, вкл.). Эти
«цистные мерозоиты» уже дифференцированы по
полу, а потому более не способны к делению внутри
саркоцисты. Дальнейшее развитие таких гамонтов
происходит только в кишечнике окончательного хозя-
ина, где, минуя фазу мерогонии, происходит формиро-
вание микро- и макрогамет (Ruiz, Frenkel, 1976).
Если гамонты в течение длительного времени (в за-
висимости от вида возбудителя) не попадают к оконча-
тельному хозяину, то самые старые из них, располо-
женные в центре саркоцисты, начинают отмирать и в
саркоцистах появляются характерные пустоты. Подоб-
ные пустоты отсутствуют в тканевых цистах Toxoplas-
ma, Hammondia и Besnoitia, чьи цистные стадии пред-
ставлены только бесполыми клетками одного мор-
фофункционального типа.
Развитие саркоспоридий
в окончательном хозяине
В окончательном хозяине Гаметогенез саркоспо-
ридий протекает по типу оогамии. Копуляция гамет
приводит к образованию зиготы (ооцисты). Споруля-
ция ооцист Sarcocystis совершается in situ, в субэпи-
телии кишечника хозяина (рис. 55, 7). Сразу после
споруляции хрупкая оболочка ооцисты разрушается,
высвобождая две спороцисты, каждая с 4 спорозои-
тами.
Таким образом, в облигатно-гетероксенном жиз-
ненном цикле Sarcocystis среднее звено триады Sporo-
zoa (гамогония, т. е. образование гамонтов) оказывает-
ся разорванным не только во времени, но и в простран-
стве, осуществляясь не в одном, а в разных хозяевах,
промежуточном и окончательном (рис. 96). В связи с
этим завершение полного цикла развития Sarcocystis
возможно только при обязательном участии обоих
хозяев.
Отклонения от нормального цикла
развития Sarcocystis
Жизненные циклы некоторых видов Sarcocystis,
паразитирующих в рептилиях, рассматриваются неко-
торыми авторами как дигомоксенные (Matuschka, Вап-
nert, 1987, 1989; Bannert, 1992). Это объясняется изве-
стной экологической особенностью ящериц, способ-
ных поедать мелкие движущиеся предметы, включая
продолжающий двигаться фрагмент хвоста, как отбро-
шенного другой ящерицей, так и своего собственного.
В результате такая ящерица, первоначально выступа-
244
ALVEOLATA
ющая н рол и промежуточного хозяина Sarcocystis (на-
личие цист и мышцах), после поедания цистных ста-
дий становится и окончательным хозяином, поскольку
вышедшие из саркоцист стадии (гамонты) могут завер-
шат!. полное развитие, вплоть до образования споро-
цист со спорозоитами, в кишечнике этой же ящерицы.
В эксперименте, при пероральном заражении мы-
шей линии SCID (severe combined immunodeficient) ци-
стными стадиями S.' muris, было показано, что неко-
торые стадии (гамонты) приступали к гаметогенезу с
последующим формированием в тонкой кишке мышей
спороцист со спорозоитами в течение 24 ч после скар-
мливания цист. Спороцисты сохранялись в кишечнике
мышей вплоть до 62 сут (Koudela et al., 1999). Ранее,
также в эксперименте, было показано наличие спо-
рулированных ооцист (спороцист) S. rodentifelis в со-
скобах слизистой кишечника зараженных мышей (Gri-
kienene, Kutkiene, 1998). Приведенные факты имеют
несомненный научный интерес и нуждаются в даль-
нейшем осмыслении.
Номенклатура видов Sarcocystis
После расшифровки полных жизненных циклов
саркоспоридий исследователи столкнулись с трудно-
стями согласования прежних и новых видовых назва-
ний. В середине 70-х гг. XX в. было предложено ком-
бинировать в видовых названиях паразита названия
его промежуточного и окончательного хозяев (Hey-
dorn et al., 1975). Такой принцип наименования видов
оказался удобным для практического применения, од-
нако противоречил правилам Международного Кодек-
са зоологической номенклатуры, поскольку допускал
создание новых названий для уже ранее описанных
видов.
Так, саркоспоридии овец были первоначально опи-
саны под названием Sarcocystis tenella Moule, 1886.
Впоследствии оказалось, что у овец могут паразитиро-
вать несколько видов Sarcocystis, имеющих в качестве
окончательного хозяина соответственно кошку и соба-
ку. В результате появились два новых видовых назва-
ния — S. ovifelis Heydorn et al., 1975 и S. ovicanis Hey-
dorn et al., 1975. Когда и эти виды были подвергнуты
ревизии, оказалось, что у овец паразитирует 4 вида
Sarcocystis. Сходным образом ранее описанный («ста-
рый») вид 5. hirsuta Moule, 1888 из крупного рогатого
скота распался на три хорошо очерченных вида, имею-
щих в качестве окончательных хозяев соответственно
кошку, собаку и человека.
Номенклатура видов Sarcocystis усложняется еще и
тем, что их изоспороидные ооцисты (и спороцисты)
были ранее описаны как разные виды рода Isospora
Schneider, 1881.
Форма и размеры ооцист (спороцист) разных видов
Sarcocystis имеют принципиальное сходство, в связи с
чем они не могут использоваться для дифференциации
видов. В равной степени для той же цели нельзя ис-
пользовать продолжительность препатентного и па-
тентного периодов в окончательном хозяине из-за их
непредсказуемых вариаций (Dubey et al., 1989).
Ооцисты Sarcocystis, выделяемые окончательными
хозяевами, служат основным источником заражения
саркоспоридиями нехищных животных. В то же время
хищники заражаются при поедании саркоцист.
Заболевания промежуточных хозяев называются
саркоцистозами, что подчеркивает наличие у за-
раженных хозяев мышечных цист (саркоцист). Заболе-
вания окончательных хозяев называются саркоспо-
ридиозами, что соответствует понятию «кишечный
кокцидиоз, вызываемый Sarcocystis~». Термин сарко-
споридиоз может также употребляться и в широком
смысле для обозначения заболеваний, вызываемых
кокцидиями рода Sarcocystis.
Из двух форм саркоцистоза — острой и хрониче-
ской — первая сопровождается наиболее выраженны-
ми симптомами и нередко заканчивается летально.
Хроническая форма также не безразлична для зара-
женного животного: наличие крупных саркоцист при-
водит к механическому травмированию мышц и даже
к их полной атрофии. В экстрактах из макроцист S. gi-
gantea (овца) были обнаружены фракции лектинов, об-
ладающих митогенным воздействием на лимфоциты.
Способность токсинов, выделенных из саркоцист, вы-
зывать бласттрансформацию и стимулировать бескон-
трольное размножение клеток хозяина открывает но-
вую страницу в изучении патогенеза саркоцистоза как
в медицине, так и в ветеринарии.
В острый период болезни предцистные мерозоиты
обнаруживаются в периферической крови, поэтому в
эксперименте саркоцистоз можно воспроизвести при
переливании крови больного животного (Fayer, Leek,
1979; Dubey et al., 1981; Прус, 1983). Передача возбу-
дителя от одного промежуточного хозяина к другому в
естественных условиях возможна при каннибализме
грызунов (крыс, полевок) (Арнастаускене, Грикенене,
1989) и рептилий (ящериц) (Matuschka, 1987).
Доказана роль насекомых-копрофагов как механи-
ческих переносчиков ооцист (спороцист) Sarcocystis и
других кокцидий, что приводит к бесконтрольному за-
грязнению внешней среды, в том числе пищи и воды
(Smith, Frenkel, 1978; Markus, 1980). В то же время еще
окончательно не доказана конгенитальная трансмис-
сия саркоцистоза, несмотря на наличие единичных на-
блюдений (Никольский, 1931; Cunningham, 1973).
Саркоспоридии наносят большой экономический
ущерб сельскохозяйственным животным во всех стра-
нах мира. Зараженность крупного рогатого скота, овец
и свиней достигает 70—100 %. До сих пор не разрабо-
таны эффективные методы диагностики и лечения сар-
коцистоза (Tadros, Laarman, 1976, 1982; Dubey, 1977;
Вершинин, 1977, 2001).
Саркоспоридии
крупного рогатого скота
Sarcocystis cruzi (Hasselmann, 1926) Wenyon, 1926.
(= Sarcocystis bovicanis Heydorn et al., 1975).
Окончательные хозяева: собака Canis fami-
liaris, койот Canis latrans, рыжая лиса Vulpes vulpes,
енот Procyon lotor, волк Canis lupus.
Промежуточные хозяева: крупный рогатый
скот Bos tauris, бизон Bison bison.
Высокопатогенный вид. Саркоцисты микроскопи-
ческие, менее 500 мкм в длину, локализуются во всех
ТИП SPOROZOA. КЛАСС СОСС1ОЕА
245
поперечно-полосатых мышцах (рис. 135, 6, вкл.), в во-
локнах Пуркинье, в сердце и в клетках центральной
нервной системы, что представляет собой один из ред-
ких случаев среди саркоспоридий (Dubey, 1982).
Sarcocystis hirsuta Moule, 1888.
(== Sarcocystis bovifelis Heydorn et al., 1975).
Окончательный хозяин: Felis catus.
Промежуточный хозяин: Bos taunts.
Слабопатогенный вид. Микроскопические сарко-
цисты, до 8 мкм в длину и 1 мкм в ширину. Стенка
саркоцисты толщиной до 7 мкм, имеет поперечную ис-
черченность. Выросты цистной стенки достигают
7.0 X 1.5 мкм и содержат многочисленные микротру-
бочки.
Sarcocystis hominis (Railliet et Lucet, 1891) Dubey,
1976.
(= Sarcocystis bovihominis Heydorn et al., 1975).
Окончательные хозяева: человек Homo sa-
piens, обезьяна-резус Macaca mulatto, бабуин Papio cy-
nocephalus, возможно шимпанзе Pan troglodytes.
Промежуточный хозяин: крупный рогатый
скот Bos taurus.
Слабопатогенный вид. Стенка саркоцисты толщи-
ной до 6 мкм, имеет радиальную исчерченность. В вы-
ростах микроворсинок имеются многочисленные мик-
ротрубочки. Цистные стадии (вероятно, гамонты) до-
стигают 7—9 мкм в длину.
Саркоспоридии овец
Sarcocystis tenella (Railliet, 1886) Moule, 1886.
(= Sarcocystis ovicanis Heydorn et al., 1975).
Окончательные хозяева: собака Canisfami-
liaris, койот Canis latrans, рыжая лиса Vulpes vulpes.
Промежуточный хозяин: овца Ovis aries.
Высокопатогенный вид. Микроскопические сарко-
цисты, до 700 мкм в длину, в поперечно-полосатых
мышцах сердца и языка, в клетках центральной нерв-
ной системы. Цистная стенка толщиной 1—3 мкм, вы-
росты микроворсинок без микротрубочек (рис. 143, 9,
10, вкл.).
Sarcocystis arieticanis Heydorn, 1985.
Окончательный хозяин: собака Canis fami-
liaris.
Промежуточный хозяин: овца Ovis aries.
Малопатогенный вид. Саркоцисты в поперечно-по-
лосатых мышцах, но не в клетках центральной нерв-
ной системы. Саркоцисты длиной до 900 мкм с тонкой
оболочкой (1 мкм) и волосовидными выростами (до
5—9 мкм). В выростах стенки нет микротрубочек. Пе-
регородки в цистах не заметны.
Sarcocystis gigantea (Railiet, 1886) Ashford, 1977.
(= Sarcocystis ovifelis Heydorn et al., 1975).
Окончательный хозяин: домашняя кошка
Felis catus.
Промежуточный хозяин: овца Ovis aries.
Слабопатогенный вид. Округло-овальные или гру-
шевидные макроскопические саркоцисты белого цвета
длиной до 1 см выявляются обычно у старых овец
(рис. 146, вкл.). Локализуются преимущественно в мыш-
цах пищевода, глотки и языка, реже в диафрагме, но не
в центральной нервной системе. Тонкая стенка сарко-
цисты (менее 2 мкм) часто бывает окружена вторичной
соединительнотканной оболочкой. Внутрицистные
септы тонкие. В старых цистах в местах отмирания га-
монтов хорошо заметны центральные пустоты.
Sarcocystis medusiformis Collins et al., 1979.
Окончательный хозяин: кошка Felis catus.
Промежуточный хозяин: Ovis aries.
Саркоцисты длиной 8 мкм и шириной 0.2 мкм. Ло-
кализуются преимущественно в диафрагме, мышцах
живота и туловища. Стенка саркоцисты тонкая (менее
2 мкм), вторичная оболочка отсутствует. Выросты
стенки цисты имеют трапециевидную форму.
У коз паразитирует 3 вида: S. capracanis Fischer,
1979, S. hircicanis Heydorn et Unterholzner, 1983 и
5. moulei Neveu-Lemaire, 1912 (= S. caprofelis El-Refait
et al., 1980).
У свиней выявлено 3 вида: S. miescheriana (Kuhn,
1865) Labbe, 1899 (= S. suicanis Erber, 1977) (рис. 143,
5, 6); S. suihominis (Tadros, Laarman, 1976) Heydorn,
1977; S. porcifelis Dubey, 1976.
У лошадей зарегистрировано 3 вида; S. bertrami
Doflein, 1901; S. equicanis Rommel et Geisel, 1975 и
5. fayeri Dubey et al., 1977. У буйволов описано 2 вида:
S. levinei Dessanaike et Kan, 1978 и S.fusiformis (Railliet,
1897) Bernard et Bauche, 1912, а у верблюдов 1 вид
S. cameli Mason, 1910.
Саркоспоридиоз человека
История изучения случаев человеческого саркоспо-
ридиоза представляет большой познавательный и
практический интерес, поскольку этой области иссле-
дования по-прежнему уделяется незаслуженно малое
внимание. Человек в качестве окончательного хозяина
служит для развития двух видов — S. hominis (из крупно-
го рогатого скота) и S. suihominis (из свиньи). В обоих
случаях заражение происходит при поедании человеком
непроваренного или непрожаренного мяса, содержащего
саркоцисты соответствующего вида возбудителя. Ки-
шечный саркоспоридиоз обычно сопровождается серьез-
ными нарушениями пищеварения у пациента.
В литературе имеются немногочисленные сведения
о роли человека в качестве промежуточного хозяина
S. lindemanni (см.: Dubey, 1977), однако валидность
этого вида в настоящее время ставится под сомнение.
В 1863 г. русский ученый Линдеманн описал под на-
званием «псороспермии» (чесоточные спермин) некие
микроскопические структуры, локализованные в ство-
ле волос или в полулунном и трехстворчатом клапанах
сердца. Однако эти организмы не имели ничего об-
щего с саркоспоридиями. Первые случаи обнаруже-
ния Sarcocystis у человека были описаны Картулисом
(Kartulis, 1893). Все такие находки получали название
Sarcocystis lindemanni Rivolta, 1878. Однако более
поздние исследования показали, что под названием
5. lindemanni скрывается несколько самостоятельных
видов Sarcocystis.
246
ALVEOLATA
У человеки можно наделить по крайней мере семь
разных морфологических типов мышечных цист, соот-
ветитиующих нескольким видам Sarcocystis, ни один
из которых, однако, не соответствует описанию вида
Л’, llildtwanni (Beaver et al., 1979). Четыре типа, выяв-
ленные в скелетных мышцах, по ряду признаков напо-
минают саркоцисты видов, обнаруженных у обезьяны.
Остальные три типа были описаны из сердечной мыш-
цы человека, и один из них имел сходство с видом Sar-
cocystis из сердца быка (рис. 147, вкл.). До 1974 г. у
человека было зарегистрировано 27 случаев саркоспо-
ридиоза, из которых лишь 16 могли считаться досто-
верными (Jeffrey, 1974).
Бивер (Beaver et al., 1989) описывает уже 40 случа-
ев человеческого саркоцистоза, которые географиче-
ски распределяются следующим образом: 13 находок
из Юго-Восточной Азии, 8 из Индии, 5 из Централь-
ной и Южной Америки, 4 из Африки и Европы, 3 слу-
чая из США; в двух случаях локализация не указана.
К концу XX в. было зарегистрировано 52 случая сарко-
цистоза человека, включая 41 случай заражения ске-
летных мышц и И случаев поражения сердечной
мышцы (Dubey et al., 1989; Amess et al., 1999). Одна
четверть находок (13 случаев) была сделана в Ма-
лайзии.
Мышечный саркоцистоз в большинстве случаев
протекает бессимптомно, но может сопровождаться
миалгией, мышечной атрофией, полиартритом, обра-
зованием подкожных набуханий. Это может быть свя-
зано как с процессом разрушения саркоцист, так и с от-
ветной реакций зараженного организма. В настоящее
время саркоцистозный эозинофильный миозит квали-
фицируется как еще одна оппортунистическая инфек-
ция протозойной природы у пациентов с нарушенным
иммунным статусом. Описан случай обнаружения зои-
тов Sarcocystis sp. в мокроте больного с иммунодефи-
цитом (СПИД). Не исключено, что при генерализован-
ном заражении организма мог произойти разрыв эндо-
телия кровеносных сосудов легких, в результате чего
предцистные мерозоиты Sarcocystis попали в мокроту
(Amess et al., 1999).
Однако до сих пор остается загадкой источник за-
ражения человека саркоспоридиями в тех случаях, ког-
да он выступает в качестве промежуточного хозяина, и
трудно предположить, какие животные могли бы вы-
ступать в качестве окончательных хозяев таких видов.
Саркоцистоз обезьян
Окончательная идентификация видов Sarcocystis
приматов затруднена, поскольку незвестны их оконча-
тельные хозяева. У обезьян описано 2 вида.
Sarcocystis korlei Castellani et Chalmere, 1909.
Промежуточные хозяева: Macaca mulatto,
Erythrocebus patos, Cercopithecus mitis.
Саркоцисты в скелетных мышцах, до 800 мкм в
длину. Оболочка цисты до 5—6 мкм. Цистные стадии
размером 9—14 X 3—4 мкм.
Sarcocystis nesbiti Mandour, 1969.
Промежуточный хозяин: Macaca mulatto.
Саркоцисты в скелетных мышцах до 1100 мкм в
длину и 1.2—1.6 мкм в ширину; стенка цисты гладкая.
Цистные стадии размером 7—9 X 2—3 мкм.
Саркоспоридиоз кошек, собак
и других хищных млекопитающих
Саркоцисты в мышцах хищных животных встреча-
ются редко. Такие случаи зарегистрированы у кошек,
собак, идийского льва, енота, лисицы, черного медве-
дя, индийского леопарда. Из числа этих находок пол-
ный жизненный цикл был изучен только для вида Sar-
cocystis из корсака Vulpes corsac. Корсак служит одно-
временно промежуточным и окончательным хозяином
этого вида. Информация о видах Sarcocystis других ди-
ких млекопитающих содержится в ряде специальных
публикаций (Levine, Ivens, 1986; Dubey et al., 1989;
Вершинин, 1979, 2001).
Саркоспоридиоз птиц
Из многочисленных видов Sarcocystis домашних
птиц лишь для немногих известны окончательные
хозяева. У цыплят Gallus gallus описано два вида:
S. harvathi и Sarcocystis sp. (Wenzel et al., 1982). У уток
зарегистрирован один вид 5. riyeli, окончательным хо-
зяином которого является полосатый скунс Maphitis
mephitis.
В мышцах диких птиц, воробьев, канареек, голубей
паразитирует S. falcatulata. В качестве окончательного
хозяина этого вида выступает опоссум Didelphis virgi-
niana. Саркоцисты длиной 3.2 мм имеют толстую стен-
ку с выростами высотой 1—5 мкм.
Дикие птицы выступают в качестве окончательных
хозяев целого ряда видов Sarcocystis. В качестве при-
мера можно привести S. rauschorum Cawthom et al.,
1984 (окончательный хозяин снежная сова Nyctea scan-
diaca, промежуточный — лемминг Dicrostonyx ri-
chaedsoni), S. cernae Levine, 1977 (пустельга Falco tin-
nunculus, полевка Microtus arvalis), S. dispersa Cernd
et Sdnaud, 1977 (длинноухая и обыкновенная амбар-
ная совы Asio otus и Tyto alba, домашняя мышь Mus
musculus).
Саркоспоридий пойкилотермных
животных
Из 12 видов Sarcocystis рептилий окончательные
хозяева выявлены только у трех. У S. padarcicolubris и
S. chalidicolubris в качестве окончательных хозяев вы-
ступают змеи родов соответственно Coluber и Масго-
protodon. Необычным оказался жизненный цикл S. ga-
lotti, у которого цисты локализуются в мышцах хвоста
ящерицы Gallotia galoti. При поедании ящерицей
фрагмента отброшенного хвоста (своего собственного
или принадлежавшего ящерице того же вида) гамонты,
вышедшие в ее кишечнике из саркоцист, приступают к
формированию гамет, которые после копуляции обра-
зуют зиготы (ооцисты), спорулирующие in situ (Matus-
chka, Bannert, 1987). Змеи служат окончательными хо-
ТИП SPOROZOA. КЛАСС COCCIDEA
247
зяевами видов Sarcocystis, паразитирующих в мышцах
мелких млекопитающих (Dubey et al., 1989).
Имеется единичное сообщение об обнаружении
5. salvelini в мышцах живота форели, Salvelinusfontina-
lis (Fantham, Porter, 1943). Саркоцисты этого вида име-
ют вид беловатых нитей длиной 0.5 мм. Цистные ста-
дии достигают 5.2—8.8 X 1.5—2.5 мкм.
Род Frenkelia Biocca, 1968
(= Isospora Schneider, 1881, pro parte; Toxoplasma Ni-
colle et Manceaux, 1909, pro parte; Endorimospora Tad-
ros et Laarman, 1976, pro parte)
Жизненные циклы облигатно гетероксенные (рис. 148).
Ооцисты выделяются в спорулированном состоянии,
но перед этим могут длительно персистировать в ки-
шечнике окончательного хозяина. Ооцисты не имеют
микропиле, их хрупкие оболочки легко разрушаются.
Спороцисты покрыты плотными оболочками, тельце
Штида отсутствует, остаточное тело имеется.
В промежуточном хозяине осуществляется беспо-
лое размножение, включающее предцистную мерого-
нию и формирование тканевых цист, локализованных
в центральной нервной системе (в головном мозгу).
Основное вещество цисты разделено перегородка-
ми на отдельные ячейки. Цистные стадии представле-
ны клетками разных морфофункциональных типов.
Зрелые цистные стадии гомологичны гамонтам других
споровиков. Тканевые цисты суть гигантские мерон-
ты, внутри которых совершается однонаправленное
развитие (мерогония), завершающееся образовани-
ем морфологически неразличимых гамонтов разного
пола.
В кишечнике окончательного хозяина совершается
гаметогония, с последующей копуляцией гамет и фор-
мированием ооцист, спорулирующих in situ.
Паразиты млекопитающих и птиц. 2 вида.
В 30-е гг. XX в. из головного мозга полевки Micro-
tus agrestis были описаны паразиты, получившие на-
звание Toxoplasma microti (Finlay, Middleton, 1934).
Впоследствии сходный организм был выделен из по-
левки другого вида, Microtus modestus (Frenkel, 1956).
По своим биологическим признакам оба выделенных
паразита принципиально отличались от рода Toxoplas-
ma, Поскольку не передавались от одного хозяина к
другому при субинокуляции. Новый паразит был на-
зван М-организмом (организм из Microtus"), а позднее
Биокка (Biocca, 1968) создал для него самосоятельный
род Frenkelia с видом F. microti.
Эрхардова (Erhardova, 1955) описала цисты Frenke-
lia из полевки Clethrionomys glareoli и дала новому
паразиту название F. glarioli. Впоследствии Роммель
И Крампитц (Rommel, Krampitz, 1975) расшифрова-
ли полный жизненный цикл F. glarioli и дали этому
паризиту новое название — F. clethrionomyobuteonis.
Было показано, что цистные стадии этого вида продол-
жаю!' свое развитие й кишечнике хищной птицы, ка-
нюка Buteo buteo, с образованием ооцист, которые спо-
рулируют в стенке кишки и выделяются во внешнюю
среду в инвазионном (спорулированном) состоянии.
Такие ооцисты (спороцисты) оказались морфологиче-
ски неотличимы от ооцист (спороцист) ранее известного
Рис. 148. Схема цикла развития Frenkelia glareoli. (По: Blanke,
1984).
I — зигота (молодая ооциста); 2 — зрелая ооциста с двумя спороцистами;
3 — спороциста с четырьмя спорозоитами и остаточным телом; 4 — споро-
зоиты в печени мыши; 5 — предцистная мерогония; 6—свободный мерозо-
ит; 7 — циста в головном мозгу мыши; 8 — зараженная мышь — жертва ка-
нюка; 9 — высвобождение цистных стадий (гамонтов) в кишечнике каню-
ка; 10 — гамонты в клетках кишки и формирование гамет, которые после
копуляции дают начало зиготе (7); стрелки — направление развития.
Fig. 148. Scheme of the life cycle of Frenkelia glareoli.
I — zygote (young oocyst); 2 — mature oocyst with two sporocysts; 3 — sporo-
cyst with 4 sporozoites; 4 — sporozoites in the mouse liver; 5 — precystic mero-
gony; 6—free merozoite; 7 — cyst in the mouse brain; 8 — infected mouse (vic-
tim); 9 — release of cystic stages (gamonts) in the buzzard intestine; 10—estab-
lishment of gamonts inside enterocytes followed by gametogenesis, copulation of
gametes and zygote (7) formation; arrows — the direction of the development.
вида Isospora buteonis Henry, 1932 из ястреба и совы
(Rommel, Krampitz, 1975; Tadros, Laarman, 1976).
Типовой вид Frenkelia microti (Finlay et Middle-
ton, 1934); Biocca, 1965.
Пр омежуточные хозяева: в естественных
условиях европейская полевка Microtus agrestis, в экс-
перименте более 15 видов грызунов.
Окончательные хозяева: обыкновенный ев-
ропейский канюк Buteo buteo и краснохвостый канюк
В. borealis.
Спороцисты размером 11.7—14.6 X 8.7—11.5 мкм.
Препатентный и патентный периоды в окончательном
хозяине составляют соответственно 7—8 сут и 5—
7 нед. Предцистная мерогония в промежуточном хозя-
ине проходит в клетках паренхимы печени на 6—
7-е сут после заражения ооцистами. Цисты впервые
обнаруживаются на 23-е сут и локализуются в голов-
ном и спинном мозгу. Цисты крупные, до 0.2—1.0 мм,
имеют неправильные очертания (рис. 135, 3). Стенка
цисты складчатая, толщиной менее 1 мкм.
Frenkelia glareoli (Erhardova, 1955) Biocca, 1965.
(= F. clethrionomyobuteonis Rommel, Krampitz, 1975).
Промежуточный хозяин: европейская по-
левка Clethrionomys glareolus.
Окончательный хозяин: обыкновенный ев-
ропейский канюк Buteo buteo.
248
ALVEOLATA
Спороцисты размером 11.3—13.8 X 7.8—IO.Omkm.
Предцистная мерогония проходит в клетках парен-
химы печени на 5—8-е сут после заражения ооцистами
и осуществляется путем эндополигении. В меронтах
формируется 20—30 мерозоитов. Цисты в мозгу обра-
зуются на 18-е сут; цисты микроскопические, до
0.4 мкм (к 120-м сут). Известен один достоверный слу-
чай трансплацентарной передачи F. glareoli (Tadros,
Laarman, 1978). Показана возможность заражения про-
межуточных хозяев F. glareoli друг от друга при пере-
ливании крови в первые сутки после заражения, когда
в крови еще циркулируют предцистные мерозоиты
(Krampitz et al., 1976).
Ультраструктурная организация зоитов Frenkelia
соответствует таковой других споровиков. Апикаль-
ные органеллы выражены отчетливо. Число субпелли-
кулярных микротрубочек (22) соответствует их числу
у эймериидных кокцидий.
Данные о патогенном воздействии изученных ви-
дов Frenkelia на промежуточных хозяев противоречи-
вы (Dubey et al., 1989). Несмотря на заметное пораже-
ние цистами френкелий головного мозга полевок (око-
ло 4 % площади), клинические признаки болезни у таких
животных не выражены, кроме случаев диуреза. Из-
вестны случаи падежа полевок от церебрального френ-
келиоза. Молодые полевки переживают спонтанное
заражение легче, чем старые. При экспериментальном
френкелиозе Microtus agrestis в острый период заболе-
вания (предцистная мерогония) наблюдалось воспале-
ние в тканях печени, легких, сердца и скелетных
мышц.
Методом непрямой иммунофлуоресценции выяв-
лена сильная перекрестная реакция между Sarcocystis
и Frenkelia (Tadros, Laarman, 1975). В связи с этим
было высказано предположение о возможной идентич-
ности этих родов. В самом деле, в строении их жизненных
циклов имеется много общего: в окончательном хозяине
происходит развитие только половых стадий, споруляция
ооцист совершается в стенке кишки, в промежуточном
хозяине происходит предцистная мерогония и формиро-
вание цист, цистные стадии включают несколько клеточ-
ных типов, цистная мерогония завершается образованием
стадий, гомологичных гамонтам других споровиков. В то
же время существуют серьезные различия в форме и раз-
мерах тканевых цист Sarcocystis и Frenkelia, которые вы-
ходят за рамки межвидовых различий.
THE CLASS COCCIDEA LEUCKART, 1879
SUMMARY
The chapter consists of two parts that include, respectively, general
and systematic description of the Coccidia.
The general part involves description of organization of the Cocci-
dia and patterns of their life cycles. Special attention is paid to coccidian
morphology (ultrastructure), modes of cell division and reproduction,
metabolic peculiarities and host-parasite relationships, as well as to qu-
estions pf phylogeny and taxonomy.
Since the Leuckart’s time (1879), the sporozoan life cycle has been
known as alternation of generations consisting of three phases («the triad
of Sporozoa»): merogony (asexual development before sexual process),
sexual process (gamo- and gametogony, and gamete copulation), and
sporogony (asexual development after sexual process).
The coccidian development may be completed in the body of one
host (homoxenous life cycle) or two or rarely more hosts (heteroxenous
cycle). The coccidian hosts may belong to one species (narrow host spe-
cificity), or to two or rarely more species (broad specificity). The res-
pective life cycles being called monoxenous or polyxenous. Thus, ho-
moxenous life cycle may be either mono- or polyxenous. Heteroxeny of
the life cycle may be facultative or obligate. An example of the former is
that pf Toxoplasma gondii. The asexual development of this parasite in-
volves precystic merogony and tissue cyst formation, both harbouring,
extraintestinal organs of the intermediate host, while the sexual process
is confined to the intestine of the final host (domestic cat and other fe-
lids)..Now there is every reason to believe that all felids may combine
functions of both final and intermediate host of T. gondii.
Unlike, in cyst-forming coccidia with obligate heteroxenous life
cycles (Sarcocystis, Frenkelia), two phases of sexual process (gamo-
and gametogony) are separated not only in time, but also in space, being
accomplished in the intermediate and final hosts, respectively. In the
intermediate host, a unidirectional development of the parasite occurs
through at least three different morphofunctional cell types, starting
from the stage of a little differentiated nonpolarized metrocyte, which
lacks apical organelles and is unable to divide by endodyogeny. The
second stage is an intermediate cell, which is already polarized due
to the presence of apical organelles and divides by endodyogeny.
The third stage is homologous to gamont stage of other Sporozoa (wrongly
termed in the literature as «cyst merozoites»!) with a full set of apical or-
ganelles and rigid body shape. These gamonts are highly differentiated
cells, which no longer divide asexually within the tissue cysts in the in-
termediate host, but immediately start gametogony in the final host in-
testine.1
In the Sporozoa with obligate heteroxenous life cycles (haemo-
sporidia, haemogregarines, sarcosporidia, frenkelas), gamonts of
advanced age are commonly eliminated from the circulation in the in-
termediate host (either in the blood, or within tissue cysts), thus preclu-
ding the involvement of old pre-sexual stages in gametogenesis. This
may seem to be of primary importance for the parasite’s survival as a
species.
The second part of the Chapter contains systematic description of
the main coccidian genera and species. Special attention has been paid
to agents of medical and veterinary medical importance, primarily to
those of opportunistic infections of protozoan nature (Cyclospora caye-
tanensis Cryptosporidium parvum, Isospora belli, Toxoplasma gondii,
Sarcocystis sp.).
ЛИТЕРАТУРА
Антухаев И. К. Изучение ультраструктурной организации
кокцидии гуся Eimeria kotlani. I. Внутриядерное развитие макрога-
мет// Цитология. 1977. Т. 19. С. 288—292.
Арнастаускене Т. В. Кокцидии и кокцидиозы домашних и ди-
ких животных Литвы. Вильнюс, 1985.
Арнастаускене Т. В., Грнкенене Я. С. Возможность развития
Sarcocystis sp. от рыжей полевки в организме лабораторных крыс
без участия окончательного хозяина// Тр. АН Лит. ССР. Сер. В.
1989. Т. 4. 108. С. 51—60.
Бейер Т. В. Токсоплазмиды, их жизненные циклы и положе-
ние в системе# Паразитология. 1977. Т. 11. С. 382—393.
Бейер Т. В. Взаимодействие между кокцидией Karyolysus sp. и
клетками печени скальных ящериц в период зимней спячки И Цито-
логия. 1979. Т. 21. С. 295—299.
Бейер Т. В. Современные представления о саркоспоридиях
(Sarcocystis, Eimeriidae, Sporozoa, Apicomplexa): морфофункциона-
льная организация, жизненный цикл, практическое значение // Па-
разитология. 1988. Т. 22. С. 3—13.
Бейер Т. В. Клеточная биология споровиков — возбудителей
протозойных болезней животных и человека. Л., 1989.
Бейер Т. В. Еще раз о кокцидийной природе криптоспоридий
(Sporozoa, Apicomplexa) // Паразитология. 2000. Т. 34. С. 183—195.
ТИП SPOROZOA. ЛИТЕРАТУРА
24»
Бейер Т. В., Пашкин П. И., Рахманова А. Г. и др. Диагнос-
тика, клиника, лечение и профилактика криптоспоридиоза. Мето-
дические рекомендации. Л., 1987а.
Бейер Т. В., Полянский Ю. И. О положении «токсоплазмид»
в системе// Токсоплазмиды. Л., 1979. С. 6—22. (Протозоология.
Вып. 4).
Бейер Т. В., Сафонова Н. В., Хазенсон Л. Б., Чайка Н. А.
Лабораторная диагностика криптоспоридиоза у детей. Л., 19876.
Бейер Т. В., Свежова Н. В., Радченко А. И., Сидорен-
ко Н. В. Пути формирования и разнообразие паразитофорных ва-
куолей у паразитических простейших. Кокцидии (Sporozoa, Api-
complexa) // Цитология. 2003. Т. 45. С. 339—356.
Бейер Т. В., Свежова Н. В., Сидоренко Н. В. Структура
ооцист и вопросы систематики кокцидий // Цитология. 2001. Т. 43.
С. 1005—1012.
Бейер Т. В., Селиванова Г. В. Цитофотомстрическое иссле-
дование количества ДНК в ядрах гемогрегарин из диплоидных и
триплоидных скальных ящериц Армении И Цитология. 1969. Т.П.
С. 739—743.
Бейер Т. В., Сидоренко Н. В. Цитохимическое изучение ге-
могрегарин из рептилий Армении. И. Сдвиги в содержании гемо-
глобина и общих белков в эритроцитах скальных ящериц, заражен-
ных гемогрегаринами// Паразитология. 1972. Т. 6. С. 385—390.
Бейер Т. В., Сидоренко Н. В. Цитохимическое исследование
гемогрегарин из рептилий Армении. III. Активность дегидрогеназ
у гемогрегарин из периферической крови скальных ящериц и в за-
раженных эритроцитах# Цитология. 1973. Т. 15. С. 598—606.
Бейер Т. В., Сидоренко Н. В. Изменения ультраструктуры
внутриэритроцитарных мерозоитов гемогрегарин в процессе их
превращения в гамонтов// Цитология. 1984. Т. 26. С. 132—137.
Бейер Т. В., Сидоренко Н. В. Электронномикроскопическое
исследование криптоспоридий. II. Стадии гаметогенеза и спороге-
неза С. parvum// Цитология. 1990. Т. 32. С. 592—598.
Бейер Т. В., Шибалова Т. А., Костенко Л. А. Цитология кок-
цидий. Л., 1978.
Бельтенев А. Е. Alveocystis intestinalis n. g., n. sp., новый вид
кокцидий из кишечника приапулид И Вопросы паразитологии вод-
ных беспозвоночных животных. Вильнюс, 1980. С. 10—11.
Бельтенев А. Е. Жизненный цикл Alveocystis intestinalis n. g.,
n. sp (Sporozoa, Coccidiomorpha) — паразита кишечника приапу-
лид И Вест. Ленингр. ун-та. 1983. Т. 15. С. 11—20.
Богуш А. А., Пышко И. И. Распространение саркоспоридио-
за среди животных в Белоруссии И Тр. Белорус. НИВС. 1974. Т. 12.
С. 130—132.
Васина С. Г., Засухин Д. Н. Сообщение об изучении врожден-
ного токсоплазмоза// Мед. паразитология и паразитар. болезни.
1958. Т. 27. С. 454—460.
Вершинин И. И. Саркоцисты и родственные им организмы И
Арахнозы и протозойные болезни сельскохозяйственных живот-
ных. М., 1977. С. 192—213.
Вершинин И. И. Саркоспоридии и изоспоры животных и че-
ловека// Токсоплазмиды. Л., 1979. С. 24—37. (Протозоология.
Вып. 4).
Вершинин И. И. Кокцидиозы животных и их дифференциаль-
ная диагностика. Екатеринбург, 1996.
Вершинин И. И. Атлас основных видов кокцидий животных и
их морфобиологическая характеристика. Екатеринбург, 2001.
Грикенене Я. С. Цитологическое иследование цистных ста-
дий Sarcocystis ovifelis Heydorn et al., 1975: Автореф. дис. ... канд.
биол. наук. Л., 1983.
Засухин Д. Н., Гайский Н. A. Toxoplasma nicanorovi — новый
кровепаразит Citellus pigmaeus Pallas И Вести, микробиологии, эпи-
демиологии, паразитологии. 1930. Т. 9. С. 96—100.
Каллиникова В. Д. Эволюционные преобразования жизнен-
ных циклов Sporozoa и филэмбриогенезы И Успехи соврем, биоло-
гии, 1991. Т. 111. С. 108—121.
Колабский Н. А., Пашкин П. И. Кокцидии сельскохозяйст-
шшиых животных. Л., 1974.
Коегыгов A. IO. Морфология макрогамет и ооцист Alveocys-
//,» IhIiWIiuiIIs (Sporozoa: Coccidia) // Паразитология. 2000. Т. 34.
('. .1:1*1 .1,19,
Крылов М. В., Добровольский А. А. Макросистема и фи-
логении (шороинкон, Принципы построения макросистемы одно-
клеточных животных. Л., 1980. С. 62—74. (Тр. ЗИН АН СССР.
Т. 94).
Лысенко А. Я., Туркинов М. X., Лавдовская М. В., Подоль-
ский В. М. ВИЧ-инфекции и СПИД-ассоциируемые заболевания.
М„ 1996.
Мусаев М. А., Вейсов А. М. Кокцидии грызунов СССР. Баку,
1965.
Мыльников А. П. Ультраструктура и биология некоторых
представителей отряда Spiromonadida (Protozoa) // Зоол. журн.
1991. Т. 70. С. 5—15.
Никольский С. Н. К вопросу о способе заражения саркоспо-
ридиями крупного рогатого скота И Троп, медицина и ветеринария.
1931. №4. С. 200—220.
Пак С. М., Перминова В. В., Ештокина Н. В. Sarcocystis ci-
tellivulpes sp. n. из желтых сусликов (Citellus fulvus) // Токсоплаз-
миды. Л., 1979. С. Ill—114. (Протозоология. Вып. 4).
Петешев В. М., Галузо И. Г., Поломошнов А. П. Кошки —
дефинитивные хозяева бесноитий Besnoitia besnoiti И Изв. АН Каз.
ССР. Сер. биол. 1974. Т. 1. С. 33—38.
Прус М. А. Экспериментальный саркоцистоз ягнят И Ветери-
нария. 1983. № 8. С. 39—41.
Радченко А. И. Электронномикроскопическое изучение про-
цесса деления промежуточных клеток в цисте кокцидий Sarcocystis
muris II Цитология. 1986. Т. 28. С. 1165—1171.
Радченко А. И. Морфофункциональное изучение процесса де-
ления промежуточных клеток в цисте кокцидий Sarcocystis muris //
Цитология. 1987. Т. 29. С. 404—409.
Радченко А. И. Современные представления о жизненном
цикле цистообразующих кокцидий (Eucoccidiida, Sporozoa, Api-
complexa) // Цитология. 1999. Т. 41. С. 466—478.
Райков И. Б. Ядро простейших: морфология и эволюция. Л.,
Наука. 1978.
Сванбаев С. К. Кокцидии сельскохозяйственных животных
Казахстана. Алма-Ата, 1977.
Сидоренко Н. В. Электронномикроскопическое исследование
процесса мерогонии у Karyolysus sp. (Adeleida, Sporozoa, Apicom-
plexa) // Цитология. 1986. T. 28. С. 1172—1177.
Федосеенко В. М. Ультраструктура цист Besnoitia besnoiti И
Токсоплазмиды. Л., 1979. С. 100—105. (Протозоология. Вып. 4).
Хван М. В. Besnoiti besnoiti у крупного рогатого скота в Казах-
стане И Успехи протозоологии. Л., 1969. С. 259—260.
Хейсин Е. М. Кокцидии кишечника кролика // Учен. зап. Ле-
нингр. гос. пед. ин-та им. А. И. Герцена. 1947. Т. 51. С. 1—229.
Хейсин Е. М. Жизненные циклы кокцидий домашних живот-
ных. Л., 1967.
Хованских А. Е. Биохимия кокцидий и кокцидиозов. Л., 1984.
Шевкунова Е. А. Эпидемиология токсоплазмоза И Проблема
токсоплазмоза. М., 1980. С. 63—93.
Шибалова Т. А. Культивирование кокцидий кур // Арахнозы и
протозойные болезни сельскохозяйственных животных. М., 1977.
С. 182—191.
Шибалова Т. А., Королев А. А., Собчак И. А. Культивирова-
ние кокцидий на куриных эмбрионах// Ветеринария. 1969. № 11.
С. 68—71.
Aikawa М., Sterling С. S. Intracellular parasitic protozoa. New
York etc., 1974.
Ammassari A., Murrl R., Cingolani A., Luca de A., Antinori A.
AIDS-associated cerebral toxoplasmosis: an update on diagnosis and
treatment // Toxoplasma gondii / Ed. U. Gross. Berlin, 1996. P. 209—
222.
Andrews O. D., Fayer R., Dubey J. P. Continuous in vitro cul-
tivation of Sarcocystis cruzi II J. Parasitol. 1990. Vol. 76. P. 254—
255.
An Illustrated Guide to the Protozoa II Organisms traditionally re-
ferred to as Protozoa or newly discovered groups. 2nd ed. / Ed. J. J. Lee,
G. F. Leedale, Ph. Bradbury. Lawrence, Kansas, 2000. Vol. 1.
Arnastauskiene T., Grikieniene J. Possibility of the development
of Sarcocystis taken from the bank vole in the organism of laboratory
rats without the definite host particiation // Lietvos TSR Mok. Akad.
Darbai C. 1989. Vol. 4. P. 51—60.
Arness M. K., Brown J. D., Dubey J. P., Neafie R. C., Grans-
from D. E. An outbreak of acute eosinophilic myositis attributed to hu-
man Sarcocystis parasitism// Am. J. Trop. Med. Hyg. 1999. Vol. 61.
P. 548—553. •
Atlas R. M. Bioterrorism: from threat to reality // Annu. Rev. Mic-
robiol. 2002. Vol. 56. P. 167—185.
BaldaufS. L., Roger A. J., Wenk-Siefert 1., Doolittle W. I. A
kingdom-level phylogeny of eukaryotes based on combined protein
data// Science. 2000. Vol. 290. P. 972—977.
Ball G. H., Chao J., Telford S. R. The life history of hepatozoon
rarefaciens (Sambon and Seligman, 1907) from Drymarohon coralis
250
ALVEOLATA
(Colubridae), and its experimental transfer to Constrictor constrictor
(Boidae)//J. Parasitol. 1967. Vol. 53. P. 897—909.
Ball S. J., Pittilo R. M. Fine structure of the merozoites of Barro-
ussia schneideri parasitic in Lithobius forficatus // Int. J. Parasitol.
1983. Vol. 13. P. 145 -149.
Banncrl B. Sarcocystis simonyi sp. nov. (Apicomplexa: Sarcocys-
tidae) from the endangered Hierro giant lizard Gallotia simonyi (Repti-
lia: Lacertidae) // Parasitol. Res. 1992. Vol. 8. P. 142—145.
Bardele C. F. Elektronenmikroskopische Untersuchungen an dem
Sporozoon Eucoccidium dinophili Grell // Ztschr. Zellforsch. Mikrosk.
Anat. 1966. Vol. 74. P. 559—595.
Barta J. R. Phylogenetic analysis of the class Sporozoa (phylum
Apicomplexa Levine, 1970): evidence for the independent evolution of
heteroxenous life cycles // J. Parasitol. 1989. Vol. 75. P. 196—206.
Barta J. R. The Dactylosomatidae // Adv. Parasitol. 1991. Vol. 30.
P. 1—37.
Barta J. R. Suborder Adeleorina Leger, 1911 //An Illustrated Gui-
de to the Protozoa. 2nd ed. Organisms traditionally referred to as Pro-
tozoa or newly discovered groups / Eds J. J. Lee, G. F. Leedale,
Ph. Bradbury. Lawrence, Kansas, 2000. Vol. 1. P. 305—318.
Barta J. R., Desser S. S. Development of Babesiosoma stableri
(Dactylosomatidae, Adeleida, Apicomplexa) in its leech vector (Bat-
racobdella picta) and the relationship of the dactylosomatids to the pi-
roplasms of higher vertebrates // J. Protozool. 1989. Vol. 36. P. 241—
253.
Bashtar A.-R., Ghaffar F. A., Mehlhorn H. Hepatozoon aegypti
nov. sp. 2. Electron microscope studies on the erythrocytic stages and
schizogony inside the snake, Spalerosophis diadema // Z. Parasitenk.
1984. Bd 70. S. 43—52.
Beaver P. C., Gadgil R. K., Morera P. Sarcocystis in man: a re-
view and report of five cases // Amer. J. Trop. Med. Hyg. 1979. Vol. 28.
P. 819—844.
Beesley J. E. The life cycle of Rasajeyna nannyla n. gen., n. sp., a
coccidian pathogen of Tipula paludosa Meigen// Parasitology. 1977.
Vol. 74. P. 273—283.
Benajiba M. H., Marques A., Lorn J., Bouix G. Ultrastructure
and sporogony of Eimeria (syn. Epieimeria) anguillae (Apicomplexa) in
the eel (Anguilla anguilla) // J. Euk. Microbiol. 1994. Vol. 41. P. 215—
222.
Becker B., Mehlhorn H., Heydorn A. O. Light and electron mic-
roscopic studies on gametogony and sporogony of 5 Sarcocystis species
in vivo and in tissue cultures // Zbl. Bakteriol. Hyg. I. Abt. Orig. A.
1979. Vol. 244. P. 394—404.
Besnoit C., Robin V. Sarcosporidiose cutanee chez une vache //
Rev. Vet. 1912. T. 37. P. 649—655.
Beyer T. V. Evolutionary aspects among the Apicomplexa // Coc-
cidia and Coccidiomorpha. Les Colloques de 1’INRA. 1989. Vol. 89.
P. 157—170.
Beyer T. V„ Grikieniene J. S., Sidorenko N. V. Sarcocystis ovi-
felis (Eimeriidae, Sporozoa, Apicomplexa): modes of asexual reproduc-
tion in the cyst stages// Progress in protozoology. Warszawa, 1981.
Beyer T. V., Radchenko A. I. Cytological investigation of
cyst-forming coccidia of the genus Sarcocystis Lankester, 1882.1. The
sarcocyst as a peculiar kind of meront, comprizing three different cell
types whose successive development terminates in gamont formation //
Protozool. Abstr. 1995. Vol. 19. P. 645—649.
Beyer T. V., Scholtyseck E., Entzeroth R. Fine structure of the
merozoite of a haemogregarine from the testis of a lizard // Z. Parasi-
tenk. 1983. Bd 69. S. 439—445.
Bigaike R. D. The artificial transmission of Besnoitia besnoiti
from chronically infected to susceptible cattle and rabbits // Onderstepo-
ort J. Vet. Res. 1967. Vol. 34. P. 303—316.
Biocca E. Class Toxoplasmatea: critical review and proposal of the
new name Frenkelia gen. n. for M-organism // Parasitology. 1968.
Vol. 10. P. 89—98.
Boulard Y., Vivier E., Landau I. Ultrastructure de Dactylosoma
ranarum (Kruse, 1890); affinites avec les Coccidies; revision du statut
taxonomique des Dactylosomatides // Protistologica. 1982. T. 18.
P. 103—121.
Box E. D. Atoxoplasma associated with an isosporan oocyst in ca-
naries // J. Protozool. 1970. Vol. 17. P. 391—396.
Box E. D. Exogenous stages of Isospora serini (Aragao) and Iso-
spora canaria sp. n. in the canary (Serinus canarius Linnaeus) // J. Proto-
zool. 1975. Vol. 22. P. 165—169.
Box E. D. Life cycles of two Isospora species in the canary (Seri-
nus canarius Linnaeus) // J. Protozool. 1977. Vol. 24. P. 57—67.
Box E. D. Isospora as an extraintestinal parasite of passeriform
birds// J. Protozool. 1981. Vol. P. 244—246.
Bradbury P. C. Parasitic protozoa of molluscs and Crustacea // Pa-
rasitic Protozoa / Ed. J. P. Kreier, Chapter 3. 2nd ed. New York, 1994.
Vol. 8. P. 139—264.
Brandler U. Licht- und elektronenmicroskopische Untersuchun-
gen der Entwicklung von Cryptosporidium sp. in Darm experimenell in-
fizierte Mause. Inaugural Dissertation. Munchen, 1982.
Bristovetzky M., Paperna M. Life cycle and transmission of
Schellackia cf. agamae, a parasite of the starred lizard Agama stello //
Int. J. Parasitol. 1990. Vol. 20. P. 883—892.
Canning E. U. Sexual differentiation of merozoites of Barrouxia
schneideri (Butschli) // Nature. 1962. Vol. 195. P. 720—721.
Cerna Z. Multiplication of merozoites of Sarcocystis dispersa
Cerna, Koralova et Sulc, 1978 and Sarcocystis cemae Levine, 1977 in
the blood stream of the intermediate host // Folia Parasitol. (Prague).
1983. Vol. 30. P. 5—12.
Cerna Z., Senaud J. Sur un type nouveau de multiplication ase-
xuee d’un Sarcosporidie, dans le foie de la souris // C. R. Acad. Sci. (D)
(Paris). 1977. Vol. 284. P. 347—349.
Cesbron-Delauw M. F. Dense granule organelles of Toxoplasma
gondii — their role in the host-parasite relationship // Parasitol. Today.
1994. Vol. 9. P. 93—96.
Chapman H. D. Anticoccidial drug resistance // The Biology of the
Coccidia / Ed. P. L. Long. Baltimore, 1982. P. 429—452.
Cheissin E. M. Cytologische Untersuchungen verschiedener
Stadien des Lebenszyklus der Kaninchenkokzidien. I. Eimeria inte-
stinalis E. Cheissin, 1948 // Arch. Protistenk. 1958. Bd 102. S. 265—
290.
Cheissin E. M., Snigirevskaya E. S. Some new data on the fine
structure of the merozoites of Eimeria intestinalis (Sporozoa, Eimerii-
dea)// Protistologica. 1965. T. 1. P. 121—128.
Chobotar B., Scholtyseck E. Ultrasrtucture // The Biology of the
Coccidia / Ed. P. L. Long. Baltimore, 1982. P. 101—165.
Colley F. C., Zaman V. Observations on the endogenous stages of
Toxoplasma gondii m the cat ileum. 2. Electron microscope study //
Southeast. Asian. J. Trop. Med. Publ. Health. 1970. Vol. 1. P. 465—
480.
Coulston F. The coccidial nature of avian Toxoplasma // J. Parasi-
tol. 28, suppl. 1942.
Craig T. M., Smallwood J. E., Knauer K. W., McGrath J. P.
Hepatozoon canis infection in dogs: clinical, radiographic and hema-
toogic findings II J. Amer. Vet. Med. Assoc. 1978. Vol. 173. P. 967—
972.
Cunningham С. C. Sarcocystis in the heart muscle of a foal // Vet.
Rec. 1973. Vol. 92. P. 684—687.
Current W. L. Cryptosporidium and cryptosporidiosis // Acquired
Immune Deficiency Syndrome. New York, 1984. P. 355—373.
Current W.L. Cryptosporidiosis// J. Amer. Vet. Med. Assoc.
1985. Vol. 187. P. 1334—1338.
Current W. L., Haynes T. B. Complete development of Crypto-
sporidium in cell culture // Science. 1984. Vol. 224. P. 603—605.
Current W. L., Long P, L. Development of human and calf Cryp-
tosporidium in chicken embryos// J. Infect. Diseases. 1983. Vol. 148.
P. 1108—1113.
Davies S. F. M., Joyner L. P., Kendall S. B. Coccidiosis. Edin-
burgh, London, 1963.
Desser S. S. Extraintestinal development of eimeriid coccidia in
pigs and chamois // J. Parasitol. 1978. Vol. 64. P. 933—935.
Desser S. S. The Haemogregarinidae and Lankesterellidae // Para-
sitic Protozoa/Ed. J. P. Kreier. New York, 1993. Vol. 4. P. 247—272.
Desser S. S., Bower S. M. Margolisella kabatai gen. et sp. n. (Api-
complexa: Eimeriidae), a parasite of native littleneck clams, Protothaca
staminea, from British Columbia, Canada, with a taxonomic revision of
the coccidian parasites of bivalves (Mollusca: Bivalvia) // Folia Parasi-
tologica (Praha). 1997. Vol. 44. P. 241—247.
Desser S. S., Bower S. M., Hong H. Pseudoklossia semiluna n. sp.
(Apicomplexa: Aggregatidae): a coccidian parasite of the kidney of blue
mussels, species of Mytilus, from British Columbia, Canada // Parasite.
1998. Vol. 4. P. 17—22.
Desser S. S., Siddall M. E., Barta J. R. Ultrastructural observa-
tions on the developmental stages of Lankesterella minima (Apicomple-
xa) in experimentally infected Rana catesbiana tadpoles // J. Parasitol.
1990. Vol. 76. P. 97—103.
Desser S. S., Weller I. Structure, cytochemistry, and locomotion
of Haemogregarina sp. from Rana berlandieri // J- Protozool. 1973.
Vol. 20. P. 65—73.
D’Haese J., Mehlhorn H., Peters W. Comparative electron mic-
roscope study of pelicular structure in Coccidia (Sarcocystis, Besnoitia
and Eimeria) II Intern. J. Parasitol. 1977. Vol. 7. P. 505—518.
ТИП SPOROZOA. ЛИТЕРАТУРА
251
Diesing L., Heydorn A. O., Matuschka F. R., Bauer C., Pipa-
no E., de Waal D. T., Podgieter F. T. Besnoitia besnoiti: studies on
the definite host and experimental infections in cattle // Parasit. Res.
1988. Vol. 75. P. 114—117.
Dobell С. C. A revision of the coccidia parasitic in man // Parasito-
logy. 1919. Vol. 11. P. 147—149.
Dobell С. C. The life history and chromosome cycle of Aggregata
eberthi (Protozoa: Sporozoa: Coccidia)// Parasitology. 1925. Vol. 17.
P. 1—136.
Doflein F., Reichenow E. Lehrbuch der Protozoenkunde. 6th ed.
Jena, 1953.
Doran D. J. Cultivation of coccidia in avian embryos and cell cul-
ture // The coccidia: Eimeria, Isospora, Toxoplasma, and related genera.
Baltimore, 1973. P. 183—252.
Doran D. J. The life cycle of Eimeria dispersa Tyzzer, 1929 in tur-
keys// J. Protozool. 1978. Vol. 25. P. 293—297.
Doran D. F. Behavior of Coccidia in vitro // The Biology of the
Coccidia / Ed. P. L. Long. Baltimore, 1982. P. 229—285.
Dubey J. P. A review of Sarcocystis of domestic animals and of
other coccidia of cats and dogs // J. Amer. Vet. Med. Assoc. 1976.
Vol. 169. P. 1061—1078.
Dubey J. P. Toxoplasma, Hammondia, Besnoitia, Sarcocystis, and
other tissue cyst-forming coccidia of man and animals // Parasirtic Pro-
tozoa. New York etc., 1977. Vol. 3. P. 101—237.
Dubey J. P. Life cycle of Isospora rivolta (Grassi, 1879) in cats and
mice II J. Protozool. 1979. Vol. 26. P. 433—443.
Dubey J. P. Mouse pathogenicity of Toxoplasma gondii isolated
from a goat// Am. J. Vet. Res. 1980. Vol. 41. P. 427-429.
Dubey J. P. Quantitative parasitemiain calves fed Sarcocystis cruzi
sporocysts from coyotes II Amer. J. Vet. Res. 1982. Vol. 43. P. 1085—
1086.
Dubey J. P. Toxoplasmosis // J. Am. Vet. Med. Assoc. 1994.
Vol. 205. P. 1593—1598.
Dubey J. P. Bradyzoite-induced murine toxoplasmosis: stage con-
version, pathogenesis, and tissue cyst formation in mice fed bradyzoites
of different strains of Toxoplasma gondii // J. Eukariot. Microbiol.
1997. Vol. 44. P. 592—602.
Dubey J. P., Barr В. C., Barta J. R. et al. Redescription of Neos-
pora caninum and its differentiation from related coccidia // J. Parasitol.
1997. Vol. 32. P. 929— 946.
Dubey J. P., Beattie С. P. Toxoplasmosis of animals and man.
Boca Raton, Florida, 1988.
Dubey J. P., Black S. S., Sangster L. T., Lindsay D. S., Sunder-
mann C. A., Topper M. J. Caryospora-associated dermatitis in dogs //
J. Parasitol. 1990. Vol. 76. P. 52—55.
Dubey J. P., Frenkel J. K. Extra-intestinal stages of Isospora felis
and /. rivolta (Protozoa: Eimeriidae) in cats // J. Protozool. 1972a.
Vol. 19. P. 89—92.
Dubey J. P., Frenkel J. K. Cyst-induced toxoplasmosis in cats // J.
Protozool. 1972b. Vol. 19. P. 155—177.
Dubey J. P., Liddell D., Mattson F., Speer C. A., Howe D. K.,
Sebkins M. C. Characterization of the Oregon isolate of Neospora hug-
hesi from a horse // J. Parasitol. 2001. Vol. 7. P. 345—353.
Dubey J. P., Lindsay D. S. Transplacental Neospora caninum and
neosporosis // Vet. Parasitol. 1989. Vol. 67. P. 1—59.
Dubey J. P., Shkap V., Pipano E., Fish L., Fritz D. L. Ultrast-
ructure of Besnoitia besnoiti tissue cysts and bradyzoites // J. Euk. Mic-
robiol. 2003. Vol. 50. P. 240—244.
Dubey J. P., Speer C. A., Douglas T. G. Development of ultra-
structure of the first-generation meronts of Sarcocystis cruzi in calves
fed sporocysts from coyote species // J. Protozool. 1980. Vol. 27.
P. 380—387.
Dubey J. P., Speer C. A., Fayer R. Sarcocystosis of Animals and
Man. Boca Raton, Florida, 1989.
Dubey J. P., Speer C. A., Fayer R. Cryptosporidiosis of Animals
and Man. Boca Raton, Florida, 1990.
Dubey J. P., Speer C. A., Shen S. K., Kwok О. С. H., Blixt J. A.
Oocyst-induced murine toxoplasmosis: life cycle, pathogenicity, and
itauc conversion in mice fed Toxoplasma gondii oocysts // J. Parasitol.
1097. Vol. 85. P. 870—882.
Dubey J. P., Weisbrode S. E., Speer C. A., Sharma S. P. Sarco-
суиОк in goats: clinical signs and pathologic and hematologic findings //
J, Amor. Vet. Med. Assoc. 1981. Vol. 178. P. 683—699.
Dykova I., Lorn J. Fish coccidia: critical notes on life cycles, clas-
«Itlcntion and pathogenicity// J. Fish Dis. 1981. Vol. 4. p. 487—505.
Dyson J., Grahame J., Evennett P. J. The apical complex of the
gregarine Digyatum oweni (Protozoa, Apicomplexa) // J. Nat. Hist.
1994. Vol. 28. P. 1—7.
Entzeroth R., Scholtyseck E. Ultrastructural study of intestinal
coccidia of the European mole (Talpa europaea) // Zbl. Bakt. Hyg.
A. 1984. Bd 256. S. 280—285.
Erhardova B. Nalez cizopasniku podohny ch toxoplasme v mosku
nomika rudeko Clethrionomys glareolus // Schr. Cech. Biol. 1955.
Vol. 4. P. 251—252.
Fantham H. B., Porter A. On ostrich Plasmodium and Sarcocystis
of Canadian fishes. III. Plasmodium struthionis, n. sp., from Sudanese
ostriches and Sarcocystis salveloni, sp. n., from Canadian speckled trout
(Salvelinus fontinalis), together with a record of a Sarcocystis in the eel
pout (Zoarces angularis) // Proc. Zool. Soc. London, Ser. В // 1943.
Vol. 113. P. 25—35.
Fayer R. Gametogony of Sarcocystis in cell culture // Science.
1972. Vol. 175. P. 65—67.
Fayer R. Coccidian taxonomy and nomenclature // J. Protozool.
1981. Vol. 28. P. 266—267.
Fayer R., Leek R. G. Sarcocystis transmitted by blood transfu-
sion // J. Parasitol. 1979. Vol. 65. P. 890—893.
Fayer R., Reid W. M. Control of Coccidiosis // The Biology of the
Coccidia / Ed. P. L. Long. Baltimore, 1982. P. 453—487.
Fayer R., Speer C. A., Dubey J. P. The general biology of Cryp-
tosporidium // Cryptosporidium and Cryptosporidiosis / Ed. R. Fayer.
Florida, 1997. P. 1—42.
Fayer R., Ungar B. L. Cryptosporidium spp. and cryptosporidio-
sis // Microbiol. Revs. 1986. Vol. 50. P. 458—483.
Ferguson D. J. P. Structural and molecular differences in the
host-parasite relationship between the enteric (coccidian) and exoente-
ric forms of Toxoplasma gondii# J. Protozool. Res. 1999. Vol. 9.
P. 141—151.
Ferguson D. J. P., Birch-Andersen A., Hutchison W. M.,
Siim J. Chr. Ultrastructural studies on the endogenous development of
Eimeria brunetti. I. Schizogony // Acta pathol. microbiol. Scand. B.
1976. Vol. 84. P. 401—413.
Ferguson D. J. P., Birch-Andersen A., Hutchison W. M.,
Siim J. Chr. Light and electron microscopy on the sporulation of the
oocyst of Eimeria brunetti. 1. Development of the zygote and formation
of the sporoblasts. 2. Development into the sporocyst and formation of
the sporozoite // Acta pathol. microbiol. Scand. B. 1978. Vol. 86.
P. 1—24.
Ferguson D. J. P., Birch-Andersen A., Siim J. Chr., Hutchi-
son W. M. Ultrastructural studies on the sporulation of oocysts of To-
xoplasma gondii. 1. Development of the zygote and formation of the
sporoblasts. 2. Formation of the spocyst and sporocyst wall // Acta pa-
thol. microbiol. Scand. B. 1979. Vol. 87. P. 171—190.
Ferguson D. J. P., Hutchison W. M., Dunachie K., Siim J. Chr.
Ultrastructural study of early stages of asexual multiplication and mic-
rogametogony of Toxoplasma gondii in the small intestine of the cat //
Acta pathol. microbiol. Scand. B. 1974. Vol. 82. P. 167—181.
Ferguson D. J. P., Hntchison W. M., Siim J. Chr. The ultra-
structural development of the macrogamete and formation of the oocyst
wall of Toxoplasma gondii// Acta pathol. microbiol. Scand. B. 1975.
Vol. 83. P. 491—509.
Findlay G. M., Middleton A. D. Epidemic disease among voles
(Microtus) with special reference to Toxoplasma // J. Anim. Ecol. 1934.
Vol. 3. P. 150—160.
Fleischmann B. Elektronenmikroskopischer Beitrag zum Para-
sit-Wirt-Verhaltniss des Coccids Klossia helicina (Coccidia: Adelei-
dea) // Dissertation. Univertitat. Berlin, 1977.
Frenkel J. K. Pathogenesis of toxoplasmosis and of infections
with organisms resembling Toxoplasma // Ann. N. Y. Acad. Sci. 1956.
Vol. 64. P. 215—251.
Frenkel J. K. Toxoplasmosis: parasite life cycle, pathology, and
immunology // The coccidia: Eimeria, Isospora, Toxoplasma, and rela-
ted genera / Ed. P. L. Long. Baltimore, 1973. P. 343—410.
Frenkel J. K. Advances in the biology of Sporozoa // Z. Parasi-
tenk. 1974. Bd45. S. 125—162.
Frenkel J. K. Besnoitia wallacei of cats and rodents: with a reclas-
sification of other cyst-forming isosporid coccidia// J. Parasitol. 1977.
Vol. 63. P. 611—628.
Frenkel J. K., Dubey J. P. Rodents as vectors for feline coccidia,
Isospora felis and Isospora rivolta// J. Infect. Dis. 1972. Vol. 125.
P. 69—72.
Frenkel J. K., Dubey J. P. Hammondia hammondi gen. nov., sp.
nov., from domestic cats, a new coccidian related to Toxoplasma and
Sarcocystis // Z. Parasitenk. 1975. Bd 46. S. 3—12.
Frenkel J. K., Dubey J. P., Miller N. L. Toxoplasma gondii: fecal
forms separated from eggs of the nematode Toxocara cati // Science.
1969. Vol. 164. P. 432—433.
252
alveolata
Frenkel J. K., Dubey J. P., Miller N. L. Toxoplasma gondii in
cats: fecal stages identified as coccidian oocysts // Science. 1970.
Vol. 165. P. 893—896.
Garnham P. С. C. Blood parasites of East African vertebrates,
with a brief description of exoerythrocytic schizogony of Plasmodium
pitmani // Parasitology. 1950. Vol. 40. P. 328—337.
Garnham P. С. C., Baker J. R., Bird R. G., Bray R. S. Electron
microscope studies of motile stages of malaria parasites. 2. The fine
structure of the sporozoite of Laverania (= Plasmodium) falcipara //
Trans. Roy. Soc. Trop. Med. Hyg. 1961. Vol. 55. P. 98—102.
Gellin B. G., Soave R. Coccidian infections in AIDS // Med. Cli-
nics North America. 1992. Vol. 76. P. 205—234.
Gilson I., Buggy В. P., Brunnill C. F., Busalacchi M., Ivantic K.
Impact of a community-wide outbreak of cryptosporidiosis on patients
with AIDS // Int. Confer. AIDS. Yokohama, Japan, 1994. P. 10.
Gleeson M- T. The plastid in Apicomplexa: what use is it? // Int.
J. Parasitol. 2000. Vol. 30. P. 1053—1070.
Giibel E., Rommel M., Krampitz H. E. Ultrastrukturelle Unter-
suchungen zur ungeschlechtlichen Vermehrung von Frenkelia in der
Rotelmaus // Z. Parasitenk. 1978. Bd 59. S. 29—42.
Giibel E., Brandler U. Ultrastructure of microgametogenesis, mic-
rogametes and gametogamy of Cryptosporidium sp. in the small intesti-
ne of mice // Protistologica. 1982. T. 18. P. 331—334.
Goldman M., Carver R. K., Sulzer A. J. Reproduction of Toxo-
plasma gondii by internal budding# J. Parasitol. 1958. Vol. 44.
P. 161—171.
Gregory M. W., Catchpole J., Norton С. C., Pittilo R. M. Sync-
hronized division of coccidia and their host cells in the ovine intestine //
Parasitol. Res. 1987a. Vol. 73. P. 384—386.
Gregory M. W., Catchpole J., Pittilo R. M., Norton С. C. Ovine
coccidiosis: observations on «oocyst patches» and polyps in naturally
acquired infections // Intern. J. Parasitol. 1987b. Vol. 17. P. 1113—
1124.
Grell K. Entwicklung und Geschlechtsbestimmung von Eucoccidi-
um dinophili // Arch. Protistenk. 1953. Bd 99. S. 156—186.
Grell K. Protozoologie. Berlin etc., 1956.
Grell K. Protozoology. Berlin, 1973.
Grikeniene J., Kutkiene L. New experimental data on the labora-
tory rat as a definite host of Sarcocystis rodentifelis // Acta Zool. Parasi-
tol. Lit. 1998. Vol. 8. P. 121—124.
Gustafson P. V., Agar H. D., Cramer D. J. An electron micro-
scope study of Toxoplasma// Amer. J. Trop. Med. Hyg. 1954. Vol. 3.
P. 1008—1021.
Haberkorn A. Die Entwicklung von Eimeria falciformis (Eimer,
1970) in der weissen Maus (Mus musculus)// Z. Parasitenk. 1970.
Bd 34. S. 49—67.
Harleman J. H., Meyer R. C. Isospora suis infection in piglets. A
review// Vet. Quarterly. 1983. Vol. 5. P. 178—185.
Heller G. Elektronenmikroskopische Untersuchungen an Aggrega-
te eberthi aus dem Spiraldarm von Sepia officinalis (Sporozoa, Cocci-
dia). 2. Die Entwicklung der Mikrogameten// Z. Parasitenk. 1970.
Bd33. S. 183—193.
Hendricks L. D., Ernst J. V., Courtney С. H., Speer C. A. Ham-
mondia pardallis sp. n. (Sarcocystida) from the ocelot, Felis pardallis,
and experimental infection of other felines // J. Protozool. 1979.
Vol. 26. P. 39—A3.
Henry A. A haemogregarine and a leucocytozoon from Gadus aeg-
lifinus // J. Path. Bact. 1913. Vol. 18. P. 232—237.
Heydorn A. O., Gestrich R., Mehlhorn H., Rommel M. Proposal
for a new nomenclature of the Sarcosporidia // Z. Parasitenk. 1975.
Bd 48. S. 73—82.
Heydorn A. O., Mehlhorn H. Light and electron microscopic stu-
dies on Sarcocystis suihominis. 2. The schizogony preceding cyst for-
mation II Zbl. Bakteriol. Hyg. I. Abt. Grig. A. 1978. Bd 240.
S. 123—134.
Heydorn A. O., Mehlhorn H. Neospora caninum is an invalid spe-
cies name: an evaluation of facts and statements // Parasitol. Res. 2002.
Vol. 88. P. 175—184.
Hoare C. A. Studies on some new ophidian and avian coccidia
from Ugands, with a revision of the classification of the Eimeriidea //
Parasitology. 1933. Vol. 25. P. 359—388.
Hoare C. A. Classification of Coccidia Eimeriidae in a «periodic
system» of homologous genera// Rev. Brasil. Maleriol. 1957. Vol. 8.
P. 197—202.
Hoare C. A. The development of stages of Toxoplasma // J. Trop.
Med. Hyg. 1972. Vol. 75. P. 56—58.
Hoogstraal H. The life cycle and incidence of Hepatozoon balfouri
(Laveran, 1905) in Egyptian jerboas (Jaculus spp.) and mites (Haemo-
laelaps aegyptius Keegan, 1956) // J. Protozool. 1961. Vol. 8. P. 231—
248.
Hoppe H. C., Ngo H. M., YangM., Joiner K. A. Targeting of
rhoptry organelles of Toxoplasma gondii involves evolutionary conser-
ved mechanisms // Nature. 2000. Vol. 2. P. 449—456.
Hutchison W. M. Experimental transmission of Toxoplasma gon-
dii // Nature. 1965. Vol. 206. P. 961—962.
Hutchison W. M., Dunachie J. F., Siim J. Chr., Work K. Life
cycle of Toxoplasma gondii // Brit. Med. J. 1969. Vol. 4. P. 806.
Hutchison W. M., Dunachie J. F., Siim J. Chr., Work K. Cocci-
dian-like nature of Toxoplasma gondii// Brit. Med. J. 1970. Vol. 1.
P. 142—144.
Jacobs L. Toxoplasma and toxoplasmosis // Advs. Parasitol. Lon-
don, 1967. Vol. 5. P. 1^—45.
Jeffrey H. C. Sarcosporidiosis in man // Trans. Roy. Soc. Trop.
Med. Hyg. 1974. Vol. 68. P. 7—29.
Johnson A. M., Iliana S., Dubey J. P., Dame J. B. Toxoplasma
gondii and Hammondia hammondi: DNA comparison using cloned
rRNA gene probes // Exp. Parasitol. 1987. Vol. 63. P. 272—279.
Johnson A. M., Murray P. J., Iliana S., Baverstock P. J. Rapid
nucleotide sequence analysis of the small subunit ribosomal RNA of
Toxoplasma gondii evolutionary implications for the Apicomplexa//
Mol. Biochem. Parasitol. 1987. Vol. 25. P. 239—251.
Joiner K. A., DubremetzJ. F. Toxoplasma gondii: a protozoon
for nineties//Infect. Immunol. 1993. Vol. 61. P. 1169—1172.
Jones T. C., Hirsch J. G. The interaction between Toxoplas-
ma gondii and mammalian cells. 1. Mechanism of entry and intrace-
llular fate of the parasite//J. Exp. Med. 1972. Vol. 136. P. 1157—1172.
Joyner L. P. Host and site specificity // The Biology of the Cocci-
dia / Ed. P. L. Long. Baltimore, 1982. P. 35—62.
Iseki M. Cryptosporidium felis n. sp. (Protozoa: Eimeriorina) from
the domestic cat // Jap. J. Parasitol. 1979. Vol. 28. P. 285—307.
Kalavati C. Morphology and life cycle of a new adeleid cocci-
dium Ganapatiella odontotermi n. gen., n. sp. from the adipose tissue
of Odontotermes obesus // Arch. Protistenk. 1977. Bd 119. S. 217—
223.
Kartulis S. Ober pathogene Protozoen bei dem Menschen // Zschr.
Hyg. Infekt. 1893. Bd 13. S. 1—17.
Керка О., Scholtyseck E. Weitere Untersuchungen der Feinstruk-
tur von Frenkelia spec. (= M-Organismus, Sporozoa) // Protistologica.
1970. T. 6. P. 249—266.
Kinne J., АН M., Wernery U., Dubey J. P. Clinical large intesti-
nal coccidiosis in camels (Camelus dromedarius) in the United Arab
Emirates: description of lesions, endogenous stages, and rediscription
of Isospora orlovi Tsygankov, 1950 oocysts II J. Parasitol. 2002.
Vol. 88. P. 548—552.
Khan R. A. A new haemogregarine from marine fishes // J. Parasi-
tol. 1978. Vol. 64. P. 35-^14.
Kirmse P. The ultrastructure of Haemogregarina sachai (Coccidia:
Adeleidea) from the farmed marine flatfish Scophthalus maximus L. //
Z. Parasitenk. 1979. Bd 58. S. 201—210.
Klein T. A., Young D. G., Greiner E. C., Telford S. R., jr., But-
ler J. F. Development and experimental transmission of Schellackia
golvani and Schellackia occidentalis by ingestion in infected blood-fee-
ding arthropods // Int. J. Parasitol. 1988. Vol. 18. P. 259—267.
Kohler S., Delwiche C. F., Denny P. W., Tilney L. G., Webs-
ter P., Wilson R. J. M., Palmer J. D., Roos D. S. A plastid of probab-
le green algal origin in apicomplexan parasites // Science. 1997.
Vol. 275. 7 March. P. 1485—1489.
Koudela B., Modry D., Svobodova M. The severe combined im-
munodeficient mouse as a definite host for Sarcocystis muris // Parasi-
tol. Res. 1999. Vol. 85. P. 737—742.
Krampitz H. E., Rommel M. Experimentelle Untersuchungen
liber das Wirtsspektrum der Frenkelien der Erdmaus // Berliner.
Munchen, tiemrztl. Wsch. 1977. Bd 90. S. 17—19.
Krampitz H. E., Rommel M., Geisel O., Kaiser E. Beitrage zum
Lebenszyklus der Frenkelien. II. Die ungeschlechtliche Entwicklung
von Frenkelia clethrionomyobuteonis in der Rotelmaus // Z. Parasitenk.
1976. Bd51.S. 7—12.
Kuhn D. H., Juhr M., Rommel M., Boch J. Experimentelle To-
xoplasma-Infektionen bei der Katze. III. Entwicklungsstadien nach ora-
ler Toxoplasma-Oozysten-Infektion im Dann der Katze // Berl. Miinch.
tierarztl. Wschr. 1974. Bd 84. S. 41—46.
Labbe A. Recherches zoologiques et biologiques sur les parasites
endoglobulaires du sang des vertebres // Arch. Zool. Exp. Gen. 1894.
Vol. 2. P. 255—258.
Lainson R. Atoxoplasma Gamham, 1950, as a synonym for
Lankesterella Labbe, 1899. Its life cycle in the English sparrow (Passer
ТИП SPOROZOA. ЛИТЕРАТУРА
253
domesticus domesticus, Linn.)// J. Protozool. 1959. Vol. 6. P. 360—
371.
Lainson R. On Cyrilia gomesi (Neiva et Pinto, 1926) gen. nov.
(Haemogregarinidae) and Trypanosoma bourouli Neiva et Pinto, in
the fish Synbranchus marmoratus: simultaneous transmission by the
leech Haementeria lutzi // Parasitological Topics I Ed. E. U. Canning.
Society of Protozoologists, Special Publication. 1981. Vol. 1.
P. 150—158.
Lainson R., Paiva do Nascimento F., Shaw J. J. Some new spe-
cies of Caryospora (Apicomplexa, Eimeriidae) from Brasilian snakes,
and a redescription of C. jararacae Carini, 1939 // Mem. Instit. Oswaldo
Cruz. 1991. Vol. 86. P. 349—364.
Lainson R., Shaw J. J., Ward R. D. Schellackia landauae sp. nov.
(Eimeriorina: Lankesterellidae) in the Brazilian lizard Polychtus mar-
moratus (Iguanidae): experimental transition by Culex pipiens fati-
gans // Parasitology. 1976. Vol. 72. P. 225—243.
Landau I. Deversite des mecanisms assurant la perannite de Г in-
fection chez les sporozoaires coccidiomorphes // Mem. Mus. Nat. Hist.
Natur. 1973. Vol. 77. P. 1—62.
Landau L, Chabaud A. G., Michel J. C., Brygoo E. R. Mise en
evidence d’un double mode de transmission chez un Hepatozoon de rep-
tiles malgoches // C. R. Acad. Sc. Paris. Ser. D. 1970. T. 270.
P. 2308—2310.
Landau I., Michel J. C., Chabaud A. G., Brygoo E. R. Cycle
biologique d’Hepatozoon domerguei, discussion sur les caracteres fon-
damentaux d’un cycle de Coccidie // Z. Parasitenk. 1972. Bd 38.
S. 250—270.
Lankester E. R. On Drepanidium ranarun, the cell parasite of the
frog’s blood and spleen (Gaule’s Wurmchen)// Quart. J. Mier. Sci.
1882. Vol. 22. P. 53—69.
Leger L. Caryospora simplex, coccidie monosporee et la classifi-
cation des coccidies // Arch. Protistenk. Bd 12. S. 71—79.
Leger L., Duboscq O. Selenococidium intermedium Leg. et Dub.
et la systematique // Arch. Zool. Exp. Gen. Ser. 5. 1910. T. 5.
P. 187—238.
Leger L., Hollande A. C. La reproduction sexuee chez les coccidi-
es monosporees du genre Pfeifferinella// Arch. Zool. Exp. Gen. 1912.
Ser. 5. T. 9. P. 1—18.
Lepp D. L., Todd K. S. Life cycle of Isospora canis Nemeseri,
1959 in the dog// J. Protozool. 1974. Vol. 21. P. 199—206.
Levaditi C., Schoen R., Sanchis Bayarri V. L’encephalomyelite
toxoplasmique chronique du lapin et de la souris // C. R. Seances. Soc.
Biol. Fil. (Paris). 1928. T. 99. P. 37-40.
Levine N. L. Taxonomy of the Sporozoa // J. Parasitol. 1970.
Vol. 56. P. 208—209.
Levine N. D. Protozoan parasites of domestic animals and man. 2nd
ed. Minneapolis, Minnesota, 1973a.
Levine N. D. Grellia gen. n. for Eucoccidium of Grell (1953) pre-
occupied# J. Protozool. 1973b. Vol. 20. P. 548—549.
Levine N. D. The adeleid coccidia// Protozoology. 1977. Vol. 3.
P. 173—182.
Levine N. D. Dorisa n. gen. (Protozoa, Apicomplexa, Eimerii-
dae) // J. Parasitol. 1980a. Vol. 66. P. 1—11.
Levine N. D. Some corrections of Coccidien (Apicomplexa: Proto-
zoa) nomenclature // J. Parasitol. 1980b. Vol. 66. P. 830—834.
Levine N. D. Taxonomy and life cycles of Coccidia // The Biology
of the Coccidia / Ed. P. L. Long. Baltimore, 1982a. P. 1—33.
Levine N. D. The genus Atoxoplasma (Protozoa, Apicomplexa) //
J. Parasitol. 1982b. Vol. 68. P. 719—723.
Levine N. D. The genera Barrouxia, Defretinella and Goussia of
the coccidian family Barrouxidae (Protozoa, Apicomplexa) // J. Proto-
zool. 1983. Vol. 30. P. 542—547.
Levine N. D. Nomenclatural corrections and new taxa in the api-
complexan protozoa// Trans. Amer. Microsc. Soc. 1984a. Vol. 103.
P. 195—204.
Levine N. D. Taxonomy and review of the coccidian genus Cryp-
l(i«poridium (Protozoa, Apicomplexa)// J. Protozool. 1984b. Vol. 31.
I', 9'1 98.
Lvvliii* N, D. Species of the coccidan genus Alveocystis //J. Proto-
/niil. 1985. Vol. 32. P. 368—369.
LmvIiiv N. I). Gibbsia archiuli (Apicomplexa, Eucoccidiorida)
n. g., n. »|>. Oom lhe millipede Archiulus moreleti//J. Protozool. 1986.
Vol, I I, P, .100 301.
Levine N. I). The protozoan phylum Apicomplexa. Vol. 1. Florida,
1988.
Levine N. I)., Ivons V. The coccidian parasites (Protozoa, Api-
complexa) of Artiodactyla. Urbana; Chicago, 1986. (Ill. Biol. Mono-
graphs; vol. 55).
Levine N. D., Tadros W. Named species and hosts of Sarcocystis
(Protozoa: Apicomplexa: Sarcocystidae) // Syst. Parasitol. 1980. Vol. 2.
P. 4—59.
Li L., Desser S. S. Three new species of Octosporella (Protozoa:
Coccidia) from cyprinid fish in Algonquin Park, Ontario // Canad.
J. Zool. 1985. Vol. 63. P. 1859—1862.
Lindsay D. S., Upton S. J., Owens D. S., Morgan U. M.,
Mead J. R., Blagburn B. L. Cryptosporidium andersoni n. sp. (Api-
complexa: Cryptosporidiidae) from cattle, Bos taurus // J. Euk. Microbi-
ol. 2000. Vol. 47. P. 91—95.
Lindsay D. S., Upton S. J., Dubey J. P. A structural study of the
Neospora caninum oocysts // Int. J. Parasitol. 1999. Vol. 29. P. 1521—
1523.
Long P. L. Development of Eimeria trenella in avian embryos //
Nature. 1965. Vol. 208. P. 509—510.
Long P., Reid M. A guide for diagnosis of coccidiosis in chi-
ckens II The University of Georgia, College of Agriculture. Experiental
Stations. Research Report 404 (Report 355 revised). August 1982.
Lowenstein M. Parasitosen des Igels und deren Bekampfung. //
Wiener tierarztl. Wschr. 1991. Bd 78. S. 127—135.
Lowichik A., Yaeger R. G. Ecological aspects of snake haemogre-
garine infections from two habitats in southeastern Lousiana // J. Parasi-
tol. 1987. Vol. 73. P. 1109—1115.
Ludvik J. Vergleichende elektronenmikroskopische Untersuchun-
gen an Toxoplasma gondii und Sarcocystis tenella// Zbl. Bakteriol.
Hyg. I. Abt. Grig. 1956. Bd 166. S. 60—70.
Ludwig F. W. Studies on the protozoan fauna of the larva of the
crane-fly, Tipula abdominalis. II. Tlie life history of Ithania wenrichi
n. gen., n. sp., a coccidian, found in the ceca and mid-gut, and a diagnosis
of Ithanidae, n. subfamily// Trans. Am. Miscosc. Soc. 1947. Vol. 66.
P. 22—33.
Mahrt J. L. Endogenous stages of the life cycle of Isospora rivolta
in the dog # J. Protozool. 1967. Vol. 14. P. 754—759.
Markus M. Terminology for invasive stages of protozoa of the
subphylum Apicomplexa (Sporozoa) // S. Afr. J. Sci. 1978. Vol. 74.
P. 105—106.
Markus M. B. Flies as natural transport hosts of Sarcocystis and
other coccidia // J. Parasitol. 1980. Vol. 66. P. 361.
Mason R. W. The discovery of Besnoitia wallacei in Australia and
the identification of a free-living intermediate host // Z. Parasitenk.
1980. Bd 61. S. 173—178.
Massin C., Jangoux M., Sibuet M. Description d’lxoreis psuchro-
potae nov. gen., nov. sp., coccidie parasite du tube digestif de 1’holothu-
rie abyssale Psychropotes longicauda Theel// Protistologica. 1978.
T. 14. P. 243—259.
Matsui T., Morii T., lijima T., Kobayashi F., Fujino T. Trans-
formation of oocysts from several coccidian species by heat treatment //
Parasitol. Res. 1989. Vol. 75. P. 264—267.
Matuschka F. R. Caryospora telescopis sp. n. (Apicomplexa,
Eimeriidae) from cat snake, Teloscopus fallax (Serpentes: Colubridae),
and Caryospora spec, from the West Caucasian viper, Viupera kaznako-
vi (Serpentes: Voperidae) // Arch. Protistenk. 1986a. Bd 132. S. 93—
99.
Matuschka F. R. Sarcocystis clethrionomyelaphis n. sp. from sna-
kes of the genus Elaphe and different voles of the family Arvicolidae //
J. Parasitol. 1986b. Vol. 72. P. 226—231.
Matuschka F. R. Reptiles as intermediate and/or final hosts ofsar-
cosporidia// Parasitol. Res. 1987. Vol. 73. P. 122—132.
Matuschka F. R., Bannert B. Cannibalism and autotomy as pre-
dator = prey relationship for monoxenous sarcosporidia // Parasitol.
Res. 1987. Vol. 74. P. 88—93.
Matuschka F. R., Bannert B. Recognition of cyclic transmissions
of Sarcocystis stehlinii n. sp. in the Grand Canaria giant lizard // Parasi-
tol. Res. 1989. Vol. 76. P. 383—387.
McCully R. M., Basson P. A., DeVos A., DeVos A. J. Uterine
coccidiosis of the impala caused by Eimeria neitzi spec. nov. // Onders-
tepoort J. Vet. Res. 1970. Vol. 37. P. 45—58.
McDougald L. R. Attempted cross-transmission of coccidia bet-
ween sheep and goats and description of Eimeria ovinoidalis sp. n. //
J. Protozool. 1'979. Vol. 26. P. 109—113.
McDougald L. R. Chemotheraty of Coccidiosis // The Biology of
the Coccidia / Ed. P. L. Long. Baltimore, 1982. P. 373—427.
McLean N. Ultrastructure of a cocidium (Apicomplexa: Sporozoa:
Coccidia) in Priapulus caudatus (Priapulida) // J. Protistol. 1984.
Vol. 31. P. 241—247.
Mehlhorn H., Heydorn A. O. Electron microscopical study on ga-
mogony of Sarcocystis suihominis in human tissue cultures // Z. Parasi-
tenk. 1979. Bd 58. S. 97-113.
254
ALVEOLATA
Mehlhorn H., Piekarski (J. Grundriss der Parasitenkunde: Parasi-
ten des Mcnschcn und dur Nutzticrc. Stuttgart, 1985.
Michel IC. Sporozoite of Eimeria acervulina within intestinal mac-
rophages in normal experimental infections II Z. Parasitenk. 1976.
Bd 49. S. .1.1 40.
Mohiininied H. A., Molyneux D. H. Developmental stages of
Cyclospora talpae in the liver and bile duct of the mole (Talpa euro-
piica)// Parasitology. 1990. Vol. 101. P. 345—350.
Mohammed A. H. H., Mansour N. S. The haemogregarine com-
plex (an analytical systematic review) // Bull. Fac. Sci. Cairo Univ.
1959. Vol. 35. P. 39—51.
Molnar K. Nodular and epicellular coccidiosis in the intestine of
cyprinid fishes // Dis. Aquat. Org. 1989. Vol. 7. P. 1—12.
Molnar K. Remarks on the morphology, site of infection and vali-
dity of some coccidian species from fish// Acta Vet. Hungar. 1996.
Vol. 44. P. 295—307.
Molnar K., Baska F. Light and electron microscopy studies on
Epieimeria anguillae (Leger and Holande, 1922), a coccidium parasiti-
zing the European eel, Anguilla anguilla L. // Fish Dis. 1986. 9.
P. 99—110.
Molnar K. Remarks on the morphology, site of infection and vali-
dity of some coccidian species from fish // Acta Vet. Hungar. 1996.
Vol. 44. P. 295—307.
Morado J. F., Sparks A. K., Reed S. K. Coccidian infection in
the kidneys of the native littleneck clam, Protothaca staminea // J. In-
vert. Pathol. 1984. Vol. 43. P. 207—217.
Morgan U. M., Forbes D. A., Thompson R. C. A. Molecular epi-
demiology of Cryptosporidium parvum infection // Europ. J. Protistol.
1998. Vol. 34. P. 262—266.
Morgan U. M., Xiao L., Hill B. D., O’Donoghue R., Limor J.,
Lal A., Thompson R. C. A. Detection of the Cryptosporidium parvum
«human» genotype in a dugong (Dugong dugon) // J. Parasitol. 2001.
Vol. 86. P. 1352—1354.
Morgan-Ryan U. M., Fall A., Ward L. A., HijjawiN., Sulai-
man I., Fayer R., Thompson В. C. A., Olson M., Lal A., Xiao L.
Cryptosporidium hominis n. sp. (Apicomplexa: Cryptosporidiidae)
from Homo sapiens// J. Euk. Microbiol. 2002. Vol. 49. P. 433—440.
Mugridge N. B. The phylogeny and molecular biology of the fami-
ly Sarcocystidae (Apicomplexa) PhD // Thesis. University of Technolo-
gy. Sydney, 2002.
Nadler S. A., Miller J. H. A redescriptioh of Hepatozoon mocassi-
ni (Laveran, 1902) n. comb, from Agkistrodon piscivorus leucostoma
Troost, 1836 // J. Protozool. 1984. Vol. 31. P. 321—324.
Nicolle C., Manceaux L. Sur une infection a corp de Leishmann
(ou organismes voisin) du gondi // C. R. Acad. Sci. (Paris). 1908.
Vol. 147. P. 763—766.
NimeF. A., BurekJ.D., Page D. L., Holscher M. A., Yar-
dey J. H. H. Acute enterocolitis in a human being infected with pro-
tozoan Cryptosporidium// Gastroenterology. 1976. Vol. 70. P. 592—
598.
Noller W. Kleine Beobachtungen an parasitischer Protozoen.
(Zugleich vorlaufige Mitteilung fiber die Befruchting und Sporogonie
von Lankesterella minima Chaussat)// Arch. Protistenk. 1920. Bd41.
S. 169—189.
Ortega Y. R., Gilman R. H., Sterling C. R. A new coccidian pa-
rasite (Apicomplexa: Eimeriidae) from humans H J. Parasitol. 1994.
Vol. 80. P. 625—629.
Ortega Y. R., Sterling C. R., Gilman R. H., Cama V. A.,
Diaz F. Cyclospora species — a new protozoan pathogen of humans //
New England J. Med. 1993. Vol. 328. P. 1308—1312.
Overdulve J. P. The identity of Toxoplasma Nicolle & Manceaux,
1909 with Isospora Schneider, 1881// Proc. Koninkl. Nederl. Akad.
Wetensch. (Amsterdam). Ser. C. 1970. Vol. 73. P. 129—151.
Overdulve J. P. Excretion of Toxoplasma gondii by non-inimuni-
zed and immunized cats: its role in the epidemiology of toxoplasmosis //
Proc. Koninkl. Nederl. Akad. Wetensch. (Amsterdam). Ser. C. 1978.
Vol. 81. P. 1—18.
Overstreet R. M. Species of Eimeria in non-epithelial sites // J.
Protozool. 1981. Vol. 28. P. 258—260.
Overstreet R. M., Hawkins W. E., Foutnie J. W. The coccidian
genus Calyptospora n. g. and family Calyptosporidae n. fam. (Apicom-
plexa), with members infecting primarily fishes// J. Protozool. 1984.
Vol. 31. P. 332—339.
Panciera R. J., Thomassen R. W., Garner F. M. Cryptosporidi-
an infection in a calf// Vet. Pathol. 1971. Vol. 8. P. 479—484.
Patterson W. B., Desser S. S. Observation on Haemogregarina
balli sp. n. from the common snapping turtle Chelydra serpentina//
J. Protozool. 1976. Vol. 23. P. 294—304.
Paterson W. B., Desser S. S. Ultrastructure of macrogametogene-
sis, macrogametes and young oocysts of Eimeria iroquoina Molnar and
Fernando, 1974 in experimentally infected fathered minnows (Pimepha-
les promelas; Cyprinidae) // J. Parasitol. 1981. Vol. 63. P. 496—504.
Patton W. H. Eimeria tenella: cultivation of the asexual stages in
cultured animal cells// Science. 1965. Vol. 150. P. 767—769.
Peiyun Y., Jinshu J., Fanyao K., Kunhua L. Studies on the life
cycle of Tyzzeria pemiciosa and Wenyonella philiplevinei, two coccidi-
an parasites of Pekin duck, and studies on the pathology, diagnosis and
control of coccidiosis they caused // Proc. Intern. Symp. on waterfowl
production. The satellite conference for the XVIII World’s Poultry Con-
gress. 11—18 Sept., 1988. Beijing, China, 1988. P. 283—292.
Pellerdy L. P. Coccidia and coccidiosis. Budapest, 1974.
Penny D. P., Preiser P., Willamson D., Wilson I. Evidence for a
single origin of the 35 kb plastid DNA in apicomplexans // Protist. 1998.
Vol. 149. Vol. 51—59.
Petit G., Landau I., Baccam D., Lainson R. Description et cycle
biologique d’Hemolivia stellata n. g„ n. sp., hemogregarine de crapauds
Brasiliens// Ann. Parasitol. Hum. Comp. 1990. Vol. 65. P. 3—15.
Piekarski G., Pelster B., Witte H. M. Endopolygenie bei Toxo-
plasma gondii // Z. Parasitenk. 1971. Bd 36. S. 122—130.
Piekarski G., Seitz H. M. Parasitare Erkrankungen des Darmes //
Klinische Gastroenteroenterologie. 1984. Bd 12. S. 545—564.
Pohlenz J., Moon H. W., Cheville N. F., Bembrick W. J. Cryp-
tosporidiosis as a probable factor in neonatal diarrhea in calves //
J. Amer. Vet. Med. Assoc. 1978. Vol. 172. P. 452—457.
Pols J. W. The artificial transmission of Globidium besnoiti to catt-
le and rabbits // J. Soc. Afr. Vet. Med. Assoc. 1954. Vol. 25. P. 37—48.
Pols J. W. Studies on bovine besnoitiosis with special reference
to the aetiology// Onderstepoort J. Vet. Res. 1960. Vol. 28. P. 265—
356.
Porchet-Неппегё H. La microgametogdnese chez la coccidie Coe-
lotropha durchoni (Vivier-Неппегй); etude au microscope electroni-
que // Arch. Protistenk. 1970. Bd 112. S. 21—29.
Porchet-Неппегё E. Quelques precisions sur l’ultrastructure de
Sarcocystis tenella 1. L’endozoite (apres coloration negative) // J. Pro-
tozool. 1975. Vol. 22. P. 214—220.
Porchet-Hennere E., Richard A. Structure fine des microgametes
d'Aggregata eberthi Labbe // Protistologica. 1970. T. 6. P. 71—81.
Porchet-Hennere E., Richard A. La sporogenese chez la coccidie
Aggregata eberthi: 6tude en microscopie electronique // J. Protozool.
1971. Vol. 18. P. 614—628.
Poynton S. L., Reinschussel R., Stoskopf M. K. Aggregata do-
belli n. sp. and Aggregata millerorum n. sp. (Apicomplexa: Aggre-
gatidae) from two species of octopus (Mollusca: Octopodidae) from
die Eastern North Pacific ocean // J. Protozool. 1992. Vol. 39. P. 248—
256.
Radchenko A. I., Beyer T. V. Cytological investigation of
cyst-forming coccidia of the genus Sarcocystis Lankester, 1882. II. In-
volvement of cell organelles in the process of asexual reproduction wit-
hin the sarcocyst// Protozool. Abstr. 1995. Vol. 19. P. 651—657.
>, Raikov I. B. The Protozoan Nucleus. Morphology and Evolution.
Wien; New York, 1982.
Reichenow E. Haemogregarina stepanowi: die Entwicklungsges-
chichte einer Hamogregarine //Arch. Protistenk. 1910. Bd 20. S. 254—
350.
Reichenow E. Die Hamococcidien der Eidechsen. Vorbemerkun-
gen and 1. Teil: Die Entwicklungsgeschichte von Karyolysus // Arch.
Protistenk. 1921. Bd42. S. 179—291.
Restrepo C., Macher A. M., Radany E. H. Disseminated extrain-
testinal isosporiasis in a patient with acquired immune deficiency syn-
drome // Amer. J. Clin. Pathol. 1987. Vol. 87. P. 536—542.
Roberts W., Hammond D. M., Anderson L. C., Speer C. A. Ult-
rastructural study of schizogony in Eimeria callospermophili // J. Proto-
zool. 1970. Vol. 17. P. 584—592.
Rommel M., Krampitz H. E. Beitrage zum Lebenszyklus der
Frenkelien. 1. Die Identitat von Isospora buteonis aus dem Mausebus-
sard mit einer Frenkelienart (F. clethrionomyobuteonis spec, n.) aus der
Rotelmaus// Berlin. Mfinchen. tierarztl. Wochenschr. 1975. Bd 88.
S. 338—340.
Roos D. S., Donald R. D., Morrissette N. S., Moulton A. L. Mo-
lecular tools for genetic dissection of the protozoan parasite Toxoplas-
ma gondii // Methods Cell Biol. 1999. Vol. 45. P. 27—63.
Ruiz A., Frenkel J. K. Recognition of cyclic transmission of Sar-
cocystis muris by cats // J. Infect. Dis. 1976. Vol. 133. P. 409—418.
Russell D. G., Burns R. G. The polar ring of coccidian sporozoi-
tes: a unique micritubule-organizer centre // J. Cell Sci. 1984. Vol. 65.
P. 193—207.
ТИП SPOROZOA. ЛИТЕРАТУРА
255
Russell D. G., Sinden R. E. The role of the cytoskeleton in the
motility of coccidian sporozoites // J. Cell Sci. 1981. Vol. 50.
P. 345—359.
Schmittner S. M., McGhee R. B. The intraerythrocytic develop-
ment of Babesiosoma stableri n. sp. in Rana pipiens pipiens // J. Proto-
zool. 1961. Vol. 8. P. 381—386.
Scholtyseck E. Die Deutung von Endodyogenie und Schizogonie
bei Coccidien und anderen Sporozoen // Z. Parasitenk. 1973a. Bd 42.
S. 87—104.
Scholtyseck E. Ultrastructure II The Coccidia: Eimeria, Isospora,
Toxoplasma, and related genera / Eds D. M. Hammond, P. L. Long.
Baltimore, 1973b. P. 81—144.
Scholtyseck E. Fine structure of parasitic protozoa II An atlas of
micrographs, drawings and diagrams. Berlin etc., 1979.
Scholtyseck E., Chobotar B. Electron microscope observations
concerning the penetration of a host cell by Eimeria ferrisi in vivo // Z.
Parasitenk. 1975. Bd46. S. 91—94.
Scholtyseck E., Fleischmann B., Moltmann U. Studies on Klos-
sia helicina and Klossia sp. // Haliotis. 1977. Vol. 8. P. 67—73.
Scholtyseck E., Hammond D. M. Electron microscope studies of
ihacrogametes and fertilization of Eimeria bovis//Z. Parasitenk. 1970.
Bd34. S. 310—318.
Scholtyseck E., Mehlhorn H., Hammond D. M. Electron micro-
scope studies of microgametogenesis in Coccidia and related groups //
Z. Parasitenk. 1972. Bd38. S. 95—131.
Scholtyseck E., Piekarski G. Elektronenmikroskopische Unter-
suchungen an Merozoiten von Eimeria (Eimeria perforans und E. stie-
dae) und Toxoplasma gondii zur systematischen Stellung von T. gon-
dii II Z. Parasitenk. 1965. Bd 26. S. 91—115.
Scholtyseck E., Ratanavichien A. Endodyogenie in Eimeria stie-
dai Merozoiten II Trans. Amer. Micros. Soc. 1976. Vol. 95. P. 553—556.
S6naud J. Contribution a I’etude des sarcosporides et des toxoplas-
mes (Toxoplasmea) // Protistologica. 1967. T. 3. P. 167—232.
Shah H. L. The life cycle of Isospora felis Wenyon, 1923, a cocci-
dium of the cat// J. Protozool. 1971. Vol. 18. P. 3—17.
Sheffield H. G. Schizogony in Toxoplasma gondii: an electrop
microscope study// Proc. Helminthol. Soc. Wash. 1970. 37.
P. 237—241.
Sheffield H. G., Fayer R. Fertilization in the coccidia: fusion of
Sarcocystis bovicanis gametes // Proc. Helmonthol. Soc. Wash. 1980.
Vol. 47. P. 118—121.
Sheffield H. G., Hammond D. M. Electron microscope observa-
tions on the development of first generation merozoites of Eimeria bo-
vis // J. Parasitol. 1967. Vol. 53. P. 831—841.
Sheffield H. G., Melton M. L. The fine structure and reproduction
of Toxoplasma gondii // J. Parasitol. 1968. Vol. 54. P. 209—226.
Sheffield H. G., Melton M. L. Toxoplasma gondii: transmission
through feces in absence of Toxocara cati eggs // Science. 1969.
Vol. 164. P. 431—432.
Sheffield H. G., Melton M. L. Toxoplasma gondii: the oocyst,
sporozoite and injection of cultured cells // Science. 1970. Vol. 167.
P. 892—893.
Shelton G. C., Kinter L. D., MacKjntosh D. O. A coccidia-like
organism associated with subcutaneous granuloma in a dog // J. Amer.
Vet. Med. Ass. 1968. Vol. 152. P. 263—267.
Siddall M. E. Phylogeny of adeleid blood parasites with a partial
systematic revision of the haemogregarine complex // J. Euk. Microbiol.
1995. Vol. 42. P. 116—157.
Siddall M. E., Desser S. S. Gametogenesis and sporogonic deve-
lopment of Haemogregarina balli (Apicomplexa: Adeleina: Haemogre-
garinidae) in the leech Placobdella omata // J. Protozool. 1990. Vol. 37.
P. 511—520.
Siddall M. E., Desser S. S. Merogonic development of Haemogre-
garina balli (Apicomplexa: Adeleina: Haemogregarinidae) in the leech
Placobdella omata (Glossiphonidae), its transition to a chelonian inter-
mediate host and phylogenetic implications // J. Parasitol. 1991.
Vol. 77. P. 426—436.
Siddall M. E., Desser S. S. Ultrastructure of gametogenesis and
sporogony of Haemogregarina (sensu lato) myoxocephali (Apicomple-
хи: Adeleina) in the marine leech Malmiana scorpii // J. Protozool.
1992. Vol. 39. P. 545—554.
Siddall M. E., Desser S. S. Ultrastructure of merogonic develop-
ment of Haemogregarina (sensu lato) myoxocephali (Apicomplexa:
Adeleina) in the marine leech Malmiana scorpi and localization of in-
fective stages in the salivary cells H Europ. J. Protistol. 1993. Vol. 29.
I». 191—201.
Skofltsch G. Nachweis von Schizogonie und Endodyogeniestadien
von Hepatozoon erhardovae Krampitz, 1964 (Apicomplexa: Sporozoa,
Adeleidea) im Gehim der Rotelmaus (Clethrionomys glareolus) // Mitt.
Naturwiss. Ver. Steiermark. 1980. Bd 110. S. 175—180.
Slavin D. Cryptosporidium meleagridis (sp. n.) // J. Comp. Pathol.
1955. Vol. 65. P. 262—265.
Smith T. G., Desser S. S. Phylogenetic analysis of the genus He-
patozoon Miller, 1908 (Apicomplexa: Adeleorina)// Syst. Parasitol.
1997a. Vol. 36. P. 213—221.
Smith T. G., Desser S. S. Ultrastructural features of the game-
togenic and sporogonic development of Hepatozoon sipedon (Apicomp-
lexa: Adeleorina). The applicability of ultrastructural data in diffe-
rentiating among Hepatozoon species// Parasite. 1997b. Vol. 2.
P. 141—151.
Smith T. G., Desser S. S., Martin D. S. The development of He-
patozoon sipedon sp. nov. (Apicomplexa: Hepatozoidae) in its natural
host, the Northern water snake (Nerodia sipedon sipedon), in the culici-
ne vectors Culex pipiens and C. territans, and in an intermediate host,
the Northern leopard frog (Rana pipiens) // Parasitol. Res. 1994.
Vol. 80. P. 559—568.
Smith D. D., Freiikel J. K. Cockroaches as vectors of Sarcocystis
muris and of other coccidia in the laboratory // J. Parasitol. 1978.
Vol. 64. P. 315—318.
Speer C. A., Dubey J. P. Ultrastructure of schizonts and mero-
zoites ofSarcocystis neurona//Vet. Parasitol. 2001. Vol. 95. P. 367—371.
Stehbens E. W. Observations on Lankesterella hylae // J. Protozo-
ol. 1966. Vol. 13. P. 59—62.
Stehbens E. W., Johnston M. R. L. The ultrastructure of a hae-
mogregarine parasitic in Gehyra variegata (Dumeril and Bibron,
1836)// Parasitology. 1967. Vol. 57. P. 251—261.
Stockdale P. H. G., Cawthorn R. J. The coccidian Caryospora
bubonis in the great homed Owl (Bubo virginianus) // J. Protozool.
1981. Vol, 28. P. 255—257.
Sundermann C. A., Lindsay D. S. Ultrastructure of in vivo produ-
ced caryocysts containing the coccidian Caryospora bigenetica (Api-
complexa: Eimeriidae) // J. Protozool. 1989. Vol. 36. P. 81—86.
SVahn K. Blood parasites of the genus Karyolysus (Coccidia, Ade-
leidae) in Scandinavian lizards. Description and life cycle // Norvegian
J. Zool. 1975. Vol. 23. P. 277—295.
Tadros W., Laarman J. J. Sarcocystis and related coccidian para-
sites; a brief general review, together with a discussion on some biologi-
cal aspects of their life cycles and a new proposal for their classificati-
on II Acta Leidensia. 1976. Vol. 44. P. 1—107.
Tadros W., Laarman J. J. Apparent congenital transmission of
Frenkelia (Coccidia: Eimerida): first recorded incidence // Z. Parasi-
tenk. 1978. Bd 58. S.41.
Tadros W., Laarman J. J. Current concepts on the biology, evo-
lution and taxonomy of tissue cyst-forming eimeriid coccidia // Advs.
Parasitol. 1982. Vol. 20. P. 293—468.
Tadros W., Laarman J. J., Van der Eijk J. A study of serologi-
cal cross reaction amongst the four members of the «Toxoplasmea» by
the Indirect Immunofluorescence (I.F.A) technique // Proc. 2nd Eur.
Multicoll. Parasitol. Trogir, 1975. P. 9—10.
Tanabe M. On the species of coccidia of the mole, Mogera wogura
coteana, with special reference to the life history of Cyclospora caryoly-
tica // Keijo J. Med. 1938. Vol. 9. P. 21—52.
Taylor J. L., Wagner J. E., Kusewil D. F., Mann P. C. Klossia
parasites of animals: a literature review// Vet. Parasitol. 1979. Vol. 5.
P. 137—144.
Tenter A. M. Impact of molecular phylogenetic analyses on classi-
fication and taxonomy of coccidia with isosporan-type oocysts // Cont-
rol of Coccidiosis into the Next Millennium. Proc 7“ Intern. Coccidio-
sis Confer, and European Union COSR820 Workshop. 1—5 Sept. 1997.
Oxford, 1997. P. 67.
Tenter A. M., Barta J. R., Beveridge I., Duszynski D. W. et al.
The conceptual basis for a new classification of the coccidia // Int. J. Pa-
rasitol. 2002. Vol. 32. P. 595—616.
Tenter A. M., Heckeroth A. R., Weiss L. M. Toxoplasma gondii:
from animals to humans // Int. J. Parasitol. 2000. Vol. 30.
P. 1217—1258.
Tenter A. M., Johnson A. M. Phylogeny of the tissue cyst-for-
ming coccidia// Adv. Parasitol. 1997. Vol. 39. P. 69—139.
Torpier G., Darde M. L., Caron H., Darcy F., Capron A. To-
xoplasma gondii: membrane structure differences between zoites de-
monstrated by fracture analysis // Exper. Parasitol. 1991. Vol. 72.
P. 99—102.
Triffitt M. J. Observations on the new species of coccidia parasite
in snakes II Protozoology. 1925. Vol. 1. P. 19—26.
Tse B., Barta J. R., Desser S. S. Comparative ultrastructural fea-
tures of the sporozoite of Lankesterella minima (Apicomplexa) in its
256
ALVEOLATA
anuran host and leech vector// Canad. J. Zool. 1986. Vol. 64.
P. 2344—2347.
Tyzzer E. E. An extracellular coccidium, Cryptosporidium muris
(gen et sp. nov.) of the gastric glands of the common mouse // J. Med.
Res. 1910. Vol. 23. P. 487—509.
Tzipori S. Cryptosporidiosis in perspective // Adv. Parasitol. 1988.
Vol. 27. P. 63—129.
Upton S. J. Suborder Eimeriorina Leger, 1910. An Illustrated Gui-
de to the Protozoa // Organisms traditionally referred to as Protozoa or
newly discovered groups I Eds J. J. Lee, G. F. Leedale, Ph. Bradbury.
Lawrence, Kansas, 2000. Vol. 1. P. 318—319.
Upton S. J., Bernard S. M. Development of Caryospora bigeneti-
ca (Apicomplexa: Eimeriorina) in experimentally infected mice // Int.
J. Parasitol. 1988. Vol. 18. P. 15—20.
Upton S. J., Campbell T. W., Wiegel M., McKown R. D. The
Eimeriidae (Apicomplexa) of raptors: review of the literature and des-
cription of new species of the genera Caryospora and Eimeria // Canad.
J. Zool. 1990. Vol. 68. P. 1256—1265.
Upton S. J., Current W. L., Ernst J. V., Bernard S. M. Deve-
lopment of the viperid parasite, Caryospora simplex, in mice // J. Alaba-
ma Acad. Sci. 1983. Vol. 54. P. 114—124.
Upton S. J., Haynes T. B., Current W. L., Bernard S. M. Deve-
lopment of Caryospora simplex (Apicomplexa: Eimeriidae) from sporo-
zoite to oocyst in human embryonic lung cell culture // J. Protozool.
1984. Vol. 31. P. 398—403.
Upton S. J., Lindsay D. S., Current W. L., Bernard S. M. Mou-
se-to-mouse transmission of Caryospora simplex (Apicomplexa: Eime-
riidae) // J. Parasitol. 1985. Vol. 71. P. 395—396.
Upton S. J., Peters E. C. A new and unusual species of coccidium
(Apicomplexa, Agamococcidiorida) from Caribbean scleractinian co-
rals// J. Invert. Pathol. 1986. Vol. 47. P. 184—193.
Upton S. J., Sundermann C. A. Caryospora: biology// Coccidio-
sis of man and domestic animals / Ed. P. L. Long. Chapter 9. 1990.
P. 187—204.
Vivier E. Observations nouvelles sur la reproduction asexuite de
Toxoplasma gondii et considiirations sur la notion d’endogitnuse //
C. R. Acad. Sci. D. (Paris). 1970. T. 271. P. 2123—2126.
Vivier E. Donnees nouvelles sur les sporozoaires. Cytologie-cyc-
les-systematique // Bul.Soc.Zool. France. 1979. Vol. 104. P. 345—381.
Vivier E. Un nouveau groupe taxonomique: 1’ordre des Coelotro-
phida (protozoaires-coccides). Revue des families, gendres et especes //
Protistologica. 1981. T. 17. P. 353—357.
Vivier E., Неппегё E. Cytologie, cycle et affinites de la coccidie
Coelotropha durchoni, nomen nudum (= Eucoccidium durchoni Vivi-
er), parasite de Nereis diversicolor O. F. Muller (annelide polychete) //
Bull. Biol. Fr. Belg. 1964. T. 98. P. 153—206.
Vogel G. Parasites shed light on cellular evolution // Science. 1997.
Vol. 275. P. 1422.
Wacha R. S. On the taxonimic status of the family Pfeifferinellidae
(Coccidia), with a description of Pfeifferinella gugleri sp. n. // J. Proto-
zool. 1980. Vol. 27. P. 368—371.
Wacha R. S., Christiansen J. L. Development of Caryospora bi-
genetica n. sp. (Apicomplexa, Eimeriida) in rattlesnakes and laboratory
mice II J. Protozool. 1982. Vol. 29. P. 272—278.
Wallace G. D. Sarcocystis in mice inoculated with Toxoplasma-
like oocysts from cat feces// Science. 1973. Vol. 18. P. 1375—1377.
Weiland G., Kuhn D. Experimentelle Toxoplasma-Infektion bei
der Katze. II. Entwicklungsstadien der Parasiten im Darm, // Berl.
Munch, tierarztl. Wschr. 1970. Bd 23. S. 123—132.
Wenyon С. M. Protozoology. Vol. 2. London, 1926.
Wenzel R., Erber M., Boch J., Schellner H. P. Sarkosporidi-
en-Infektion bei Haushuhn, Fasan und Blesshuhn// Berl. Munch, ti-
erarztl. Wschr. 1982. Bd 95. S. 188—191.
Widmer G., Carraway M., Tzipori S. Waterborne cryptosporidi-
osis: a perspective from the USA# Parasitol. Today. 1996. Vol. 12.
Vol. 286—290.
Wolf A., Coven D. Granulomatous encephalomyelitis due to an en-
cephalitozoon (encephalitozoic encephalomyelitis). A new protozoan dise-
ase of man //Bull. Neurol. Inst. New York. 1937. Vol. 6. P. 306—335.
YarwoodE. A. The life cycle of Adelina cryptocerci nov. sp., a
coccidian parasite of the roach Cryptocercus punctatus // Parasitology.
1937. Vol. 29. P. 370—390.
Yung S., Lang-Unnasch N. Targeting of a nuclear encoded protein
to the apicoplast of Toxoplasma gondii // J. Euk. Microbiol. 1999.
Vol. 46. P. 79S—80S.
Zizka Z. Ultrastructure of the sporozoite and the sporocyst wall
of the coccidian species Adelina tribolii Bhatia, 1937 within the course
of an autoinfection// Arch. Protistenk. 1985. Bd 129. S. 119—126.
Отряд Haemosporida (Danilewsky,
1885) — Гемоспоридии
Облигатно-гетероксенные споровики. Мерогония проходит в
клетках крови и (или) в клетках тканей позвоночных животных. Га-
метоциты развиваются и локализуются в клетках крови и обладают
половым диморфизмом. Половой процесс и спорогония проходят в
организме кровососущих двукрылых (Diptera, Insecta). Гаметоге-
нез протекает внеклеточно. Сизигий не формируется. Микрогаме-
тоцит продуцирует 8 микрогамет, а макрогаметоцит — одну мак-
рогамету. Зигота трансформируется в подвижную оокинету. Ооци-
сты изменяются в размерах. Споры отсутствуют. Спорозоиты
концентрируются в слюнных железах переносчиков. Заражение
позвоночных хозяев осуществляется активно.
Ультраструктура
Гемоспоридии имеют единый план строения, свой-
ственный всем Sporozoa. Среди особенностей ультра-
тонкой организации гемоспоридий прежде всего сле-
дует отметить наличие коноида в оокинетах и его от-
сутствие в спорозоитах, а также отсутствие пелликулы
и микропоры в мерозоитах некоторых видов Leucocy-
tozoidae. Митохондрии в микрогаметоцитах некото-
рых видов лейкоцитозоид располагаются в выемке
оболочки ядра клетки-хозяина. У ряда видов лейкоци-
тозоид зараженные клетки, содержащие гаметоциты,
приобретают уникальную веретенообразную форму,
что сопровождается появлением своеобразных «пуч-
ков» микротрубочек в ядре и (или) в цитоплазме клет-
ки-хозяина.
Жизненные циклы
Жизненные циклы гемоспоридий облигатно-гете-
роксенные. Они проходят со сменой хозяев, способов
размножения и с формированием различных в морфо-
функциональном отношении стадий развития. Общая
схема метаморфоза гемоспоридий такова. Паразиты
развиваются с участием двух групп хозяев — позво-
ночных и переносчиков (кровососущие двукрылые).
Позвоночные являются промежуточными хозяевами, а
переносчики — окончательными. Переносчики во вре-
мя питания инокулируют в организм позвоночных
спорозоиты, которые дают начало агамным стадиям,
делящимся бесполым путем в клетках фиксированных
тканей хозяина. Эти стадии получили название экзо-
эритроцитарных меронтов. В результате множествен-
ного или бесполого деления (мерогония) в меронтах
формируются одноядерные мерозоиты, представляю-
щие собой бесполые стадии расселения внутри орга-
низма хозяина. Обычно имеется несколько генераций
(поколение) экзоэритроцитарного развития, в ходе ко-
торого паразит постепенно адаптируется к хозяину.
В результате мерогонии происходит лавинообразное
увеличение исходного инфекционного начала. Экзо-
эритроцитарные мерозоиты индуцируют новый цикл
мерогонии и (или) развитие половых стадий (гамето-
циты или гамонты) в клетках крови. Гаметоциты об-
ладают половой потенцией (продуцируют гаметы).
Стадии, дающие начало макрогаметам, получили
название макрогаметоцитов в отличие от микрогаме-
ТИП SPOROZOA. КЛАСС COCCIDEA
257
тоцитов, которые продуцируют микрогаметы. Макро-
гаметоциты обычно легко отличаются от микрогаме-
тоцитов благодаря более интенсивной окраске цито-
плазмы и компактному, имеющему четкие очертания,
ядру. Перечисленные признаки полового диморфизма
гаметоцитов — одна из наиболее легко диагностируе-
мых отличительных особенностей гемоспоридий. Га-
метоциты заразны для переносчиков.
Развитие инфекции в организме позвоночных хозя-
ев в первом приближении включает следующие основ-
ные периоды: 1 — препатентный, когда паразиты раз-
виваются вне периферической крови; 2 — острый, ха-
рактеризующийся появлением паразитов в крови и
быстрым нарастанием паразитемии; 3 — кризис, когда
паразитемия достигает пика; 4 — хронический и 5 —
латентный, когда паразитемия резко снижается и затем
элиминируется под воздействием иммунного ответа
хозяина.
Паразиты обычно персистируют в организме по-
звоночных хозяев. У большинства видов гемоспо-
ридий в период размножения позвоночных хозяев
имеет место рецидив паразитемии, что способствует
заражению переносчиков и передаче инфекции молод-
няку.
Вскоре после питания на зараженных хозяевах
в средней кишке переносчиков гаметоциты присту-
пают к гаметогенезу, и совершается половой процесс,
который проходит по типу оогамии. При этом гаме-
тоциты освобождаются из клеток-хозяев. Одним из
основных стимулов к началу гаметогенеза является
изменение концентрации кислорода и углекислого
газа при попадании крови из позвоночного хозяина
в переносчика. Макрогаметоцит дает начало одной
округлой макрогамете, а микрогаметоциты претер-
певают эксфлагелляцию, в результате чего фор-
мируется до 8 подвижных нитевидных микрогамет.
Оплодотворение происходит внеклеточно. Зигота
трансформируется в удлиненную подвижную оокине-
ту. Последняя проникает через перитрофическую мем-
брану и сквозь эпителиальный слой средней кишки.
Оокинета обычно округляется под базальной мемб-
раной, давая начало ооцисте, которая окружена капсу-
лоподобной стенкой, строящейся из материала хо-
зяина. В процессе развития (спорогония) в ооцисте
формируется множество одноядерных удлиненных те-
лец (спорозоиты). Последние по мере созревания
ооцист попадают в гемоцель, а затем проникают в
слюнные железы переносчика. Спорозоиты заразны
для позвоночных хозяев. Заражение новых хозяев осу-
ществляется инокулятивно во время акта кровососа-
ния инфицированных переносчиков. Не исключено,
что некоторые примитивные виды, паразитирующие у
рептилий, могут заражать позвоночных хозяев и при
поедании инфицированных переносчиков, хотя убе-
дительных экспериментальных подтверждений это-
го нет.
На всех стадиях развития, за исключением ста-
дии зиготы, гемоспоридии гаплоидны. Лишь зигота
имеет диплоидный (2м) набор хромосом. Редукци-
онное деление (мейоз) происходит на начальных ста-
диях формирования оокинет. Жизненные циклы и
особенности морфологии представителей семейств
I laemoproteidae, Plasmodiidae, Gamiidae и Leucocyto-
zoidae наряду co сходными чертами имеют сущест-
венные различия (см. диагнозы семейств и
родовых групп).
Классификация
Принципы классификации темоспоридий основа-
ны, главным образом, на особенностях их жизненного
цикла, морфологии стадий, развивающихся в крови, а
также по приуроченности к позвоночным хозяевам.
Некоторые таксоны родовой группы выделены на
основе уникального строения экзоэритроцитарных ме-
ронтов, ооцист и некоторых других стадий развития
паразитов. В настоящее время большинство система-
тиков принимает 4 семейства гемоспоридий — Нае-
moproteidae, Plasmodiidae, Gamiidae и Leucocytozoidae.
В классификации гемоспоридий на уровне родовой
группы единого мнения нет. Более того, в разных се-
мействах гемоспоридий для таксонов примерно одно-
го ранга используются различные категории родовой
группы. В сем. Plasmodiidae во всех системах прини-
мается один род — Plasmodium с многочисленными
более или менее дифференцированными подродами.
В семействах Haemoproteidae и Leucocytozoidae описа-
но несколько родов, различия между которыми зачас-
тую менее четкие, чем между подродами Plasmodium.
В результате возникла недостаточно обоснованная
асимметрия в классификации гемоспоридий, относя-
щихся к одним и тем же семействам, но заселивших
позвоночных из разных классов. Это особенно четко
проявляется в системе гемопротеид млекопитающих,
при выделении новых родов которых используются
данные по морфологии и локализации экзоэритроци-
тарных меронтов — наиболее слабо изученных стадий
развития в отряде Haemosporida. Морфология экзо-
эритроцитарных меронтов гемопротеид млекопитаю-
щих столь разнообразна, что для многих более или ме-
нее хорошо изученных в этом отношении видов пред-
лагается создавать новые роды (Dasgupta, 1967; Landau
et al., 1984), однако это представляется преждевремен-
ным. Кроме того, данное предложение не согласуется
с принципами классификации других гемопротеид.
Например, экзоэритроцитарные меронты некоторых
гемопротеид птиц не менее разнообразны по морфоло-
гии, чем экзоэритроцитарные меронты гемопротеид
млекопитающих, однако они группируются в одни и
те же подроды. В этой связи важно отметить, что среди
гемоспоридий птиц имеются виды (например, Leuco-
cytozoon simondi Mathis et Leger, 1910; L. marchouxi
Mathis et Leger, 1910), которым свойственны мегало-
меронты, но которые формируют их при развитии не у
всех хозяев. Это свидетельствует о необходимости
весьма осторожного применения признаков морфоло-
гии и локализации экзоэритроцитарных меронтов при
классификаций гемоспоридий.
В настоящее время предпочтительным представ-
ляется не группировка близких видов в пределах се-
мейств гемоспоридий во множество слабодифферен-
цированных родов, а использование категории подро-
дов (Coatney et al., 1971; Killick-Kendrick, 1978;
Лысенко, 1986; Telford, 1988, 1994; Крылов, 1996;
Валькюнас, 1997), что впервые было предложено и ре-
17 'JllK. №4163
258
ALVEOLATA
ализовано в сем. Plasmodiidae Коррадетги, Гарнемом и
др. (Corradetti et al., 1963; Garnham, 1964, 1966). При
распространении такого подхода к классификации ге-
моспоридий всех семейств уменьшается асимметрия в
использовании таксонов родовой группы в различных
семействах отряда Haemosporida. Кроме того, это
упрощает определение родовой принадлежности ви-
дов, жизненные циклы которых не изучены, а таких ге-
моспоридий большинство, что удобно для фаунисти-
ческих и прикладных исследований. Однако при этом
не снимаются все таксономические проблемы, связан-
ные с недостаточной исследованностью циклов разви-
тия и нуклеотидной последовательности ДНК многих
видов, а также с невозможностью дифференциации
групп на основе изучения наиболее легко доступных
для исследования стадий, которые развиваются в кро-
ви (меронты и гаметоциты). Эти проблемы лишь пере-
носятся на уровень разграничения подродов, что ока-
зывает значительно меньшее влияние на номенклатуру
и в настоящее время представляется приемлемым.
В будущем подроды гемоспоридий при необходимо-
сти могут быть легко повышены в ранге до родов. Од-
нако ввиду несомненного филогенетического родства
представителей различных семейств гемоспоридий и
логичности в связи с этим сохранения соразмерности
их классификации это должно быть предпринято во
всех семействах гемоспоридий, включая наиболее хо-
рошо изученные виды семейств Plasmodiidae. Данных
для такой ревизии пока недостаточно.
Экспериментально установлено, что одни и те же
виды гемоспоридий в норме не заражают позвоночных
животных, относящихся к разным классам. Это, несо-
мненно, является свойством их генотипа. В этой связи
гемоспоридии, заселяющие позвоночных различных
классов, обычно группируются в различные родовые
группы в границах одних и тех же семейств. Этот тра-
диционный подход к классификации гемоспоридий
в основном отражает современные представления об
их эволюции и принимается нами. Кроме того, группи-
ровка подродов гемоспоридий по классам позвоноч-
ных хозяев удобна в практическом отношении, так как
она избавляет от необходимости трудоемкого сравне-
ния видов, паразитирующих у позвоночных различ-
ных классов, при их определении.2 * * * * * В Однако ввиду раз-
личной изученности видов, паразитирующих у позво-
2 Важно отметить, что естественное распределение видов пара-
зитов по хозяевам, как и их географическое распространение, нс
только отражает свойства генотипа паразитов, но и зависит от мно-
жества других обстоятельств, в том числе и экологических. В этой
связи данные по приуроченности паразитов к хозяевам в природе
вряд ли надежны в качестве видовых признаков в пределах уста-
новленных родовых групп без соответствующих эксперименталь-
ных наблюдений и изучения нуклеотидной последовательности их
ДНК. К сожалению, в последние десятилетия многие виды гемо-
споридий птиц описывались только на основе находок морфологи-
чески не отличимых паразитов у различных хозяев, что противоре-
чит некоторым экспериментальным наблюдениям и существенно
ограничивает возможности зоогеографических исследований.
В систематике некоторых групп гемоспоридий до сих пор не утвер-
дилась так называемая «нулевая гипотеза», а именно: два организ-
ма должны рассматриваться как один вид, до тех пор пока не будет
доказано обратное. Возможность применения современных мето-
дов анализа структуры ДНК гемоспоридий из окрашенных мазков
крови существенно облегчает реализацию этого принципа на прак-
тике.
ночных различных классов, в диагнозах родовых
групп одних и тех же семейств используются раз-
ные признаки. Существенное несовпадение признаков
в диагнозах различных подродов, представители ко-
торых заселили рептилий, птиц и млекопитающих,
противоречит логике таксономии и в будущем долж-
но будет устранено. Данных для этого в настоящее
время недостаточно.
Филогения
Филогенетические отношения между подродами
гемоспоридий недостаточно ясны. Имеющиеся сведе-
ния о нуклеотидной последовательности ДНК гемо-
споридий немногочисленны и пока не оказали сущест-
венного влияния на систему отряда Haemosporida на
уровне семейств и родовых групп.
Автор разделяет мнение Телфорда (Telford, 1994)
относительно того, что имеющиеся в литературе не-
многочисленные находки видов Plasmodium у амфи-
бий, скорее всего, являются ошибочными определе-
ниями.
Важно отметить, что Миера с соавт. (Misra et al.,
1972) описали новый вид кровепаразита у пресновод-
ной рыбы Ophicephalus punctatus в Индии. Для этого
паразита был создан новый род — Mesnilium, в кото-
рый входит единственный вид М. malariae. Согласно
первоописанию, экзоэритроцитарное развитие прохо-
дит в ретикулоэндотелиальных клетках внутренних
органов, а в эритроцитах проходит мерогония и фор-
мируются гаметоциты, в которых имеются пигмент-
ные гранулы. В первоописании также указано, что час-
тичное развитие паразита проходит в пиявках. Внешне
паразит похож на гемоспоридию. Однако существен-
ным препятствием для помещения рода Mesnilium в от-
ряд Haemosporida, как это сделано в первоописании,
является отсутствие сведений об ультраструктуре
М. malariae и данных об его спорогонии. Гемоспори-
дии представляют собой эволюционно четко обособ-
ленную монофилетическую ветвь споровиков со спо-
рогонией исключительно в кровососущих двукрылых
(Diptera, Insecta). Рыбы экологически изолированы от
этих переносчиков. Не исключено, что Mesnilium мо-
жет быть одной из ветвей гемогрегарин (отряд Adelei-
da). Возможно также, что эта пресноводная рыба мо-
жет быть случайным хозяином, заражающимся гемо-
споридией, путем поедания кровососущих двукрылых
со спорозоитами малярийных паразитов, которые в
норме развиваются у рептилий. Виды Plasmodium —
обычные паразиты ящериц в Индии. Mesnilium mala-
riae до его более подробного изучения имеет смысл от-
нести в группу видов с неизвестным систематическим
положением.
В связи с вышеизложенным в отряде Haemosporida
принимаются следующие таксоны.
Сем. Haemoproteidae Doflein, 1916
Род Haemoproteus Kruse, 1890
Паразиты амфибий и рептилий
Подрод Haemocystidium Castellani et Willey, 1904
Подрод Simondia Gamham, 1966
ТИП SPOROZOA. КЛАСС COCCIDEA
259
Паразиты птиц
Подрод Parahaemoproteus Bennett, Gamham et Fallis, 1965
Подрод Haemoproteus Kruse, 1890
Паразиты млекопитающих
Подрод Hepatocystis Levaditi et Schoen, 1932 emend. Gam-
ham, 1948
Подрод Nycteria Gamham et Heisch, 1953
Подрод Polychromophilus Dionisi, 1899
Сем. Plasmodiidae Mesnil, 1903
Род Plasmodium Marchiafava et Celli, 1885
Паразиты рептилий
Подрод Sauramoeba Gamham, 1966
Подрод Carinamoeba Gamham, 1966
Подрод Lacertamoeba Telford, 1988
Подрод Paraplasmodium Telford, 1988
Подрод Asiamoeba Telford, 1988
Подрод Ophidiella Gamham, 1966
Паразиты птиц
Подрод Haemamoeba Grassi et Feletti, 1890
Подрод Giovannolaia Corradetti, Gamham et Laird, 1963
Подрод Novyella Corradetti, Gamham et Laird, 1963
Подрод Bennettinia Valkiiinas, 1997
Подрод Huffia Corradetti, Gamham et Laird, 1963
Паразиты млекопитающих
Подрод Plasmodium Marchiafava et Celli, 1885
Подрод Vinckeia Gamham, 1964
Подрод Laverania Grassi et Feletti, 1890
Сем. Gamiidae Lainson, Landau et Shaw, 1971
Род Gamia Lainson, Landau et Shaw, 1971
Паразиты рептилий
Подрод Gamia Lainson, Landau et Shaw, 1971
Род Fallisia Lainson, Landau et Shaw, 1974
Паразиты рептилий
Подрод Fallisia Lainson, Landau et Shaw, 1974
Паразиты птиц
Подрод Plasmodioides Gabaldon, Ulloa et Zerpa, 1985
Род Progamia Lainson, 1995
Паразиты рептилий
Подрод Progarnia Lainson, 1995
Сем. Leucocytozoidae Fallis et Bennett, 1961
Род Leucocytozoon Berestneff, 1904
Паразиты рептилий
Подрод Saurocytozoon Lainson et Shaw, 1969
Паразиты птиц
Подрод Leucocytozoon Berestneff, 1904
Подрод Akiba Bennett, Gamham et Fallis, 1965
Систематический обзор
Сем. Haemoproteidae Doflein, 1916
Мерогония проходит в клетках тканей позво-
ночных хозяев. В клетках крови она отсутствует.
Малярийный пигмент (гемозоин) формируется в га-
метоцитах. Половой процесс и спорогония в мухах-
кровососках (Hippoboscidae, Nycteribiidae), в кровосо-
сущих мокрецах (Ceratopogonidae) и в слепнях (Taba-
nidae).
Типовой род Haemoproteus Kruse, 1890, единст-
венный род семейства.
Род Haemoproteus Kruse, 1890
(= Haemamoeba Grassi et Feletti, 1890 (partim);
Laverania Grassi et Feletti, 1890 (partim); Halteridium
Labbe, 1894)
Характеристика семейства. В роде 7 подродов, пред-
ставители которых паразитируют у амфибий, репти-
лий, птиц и млекопитающих.
Типовой видHaemoproteuscolumbaeKruse, 1890.
Паразиты амфибий и рептилий
Подрод Haemocystidium Castellani
et Willey, 1904
Экзоэритроцитарная мерогония проходит в клетках
эндотелия и соединительной ткани многих внутренних
органов. Экзоэритроцитарные меронты вариабельны
по форме, не имеют псевдоцитомеров. Спорогония не
изучена. Паразиты ящериц. Несколько видов описано
у амфибий и змей.3
Типовой видHaemoproteus (Haemocystidium) si-
mondi Castellani et Willey, 1904.
Видовой состав. В подрод входятН. (На.) edo-
mensis Papema et Landau, 1991; H. (Ha.) grahami Shortt,
1922; H. (Ha.) kopki Mello, 1916; Я (Ha.) papernai Tel-
ford, 1996; H. (Ha.) tarentolae Parrot, 1927 и другие ге-
моцистидиумы (всего около 15 видов).
Haemoproteus (Haemocystidium) simondi Castella-
ni et Willey, 1904.
Распространение: Индо-Малайская зоогеогра-
фическая область. 3
3 Гемопротеиды исключительно редко регистрируются у ам-
фибий и змей. У амфибий описаны Haemoproteus lanoraiea Fan-
tham, Porter et Richardson, 1942 (хозяин Bufo americanus), H. lauren-
tiae Fantham, Porter et Richardson, 1942 (хозяин тот же) и Н. ovalis
Ray et Choudhury, 1981 (хозяин Rana limnocharis), а у змей —
H. mesnili (Bouet, 1909) (обнаружен у двух видов сем. Elapidae) и
Н. najae (Wenyon, 1908) (хозяева Naja naja и N. nigricollis). Боль-
шинство этих видов регистрировалось только один раз, и их типы
не сохранились. Сведений об их жизненных циклах нет. Реаль-
ность существования гемопротеид у жаб рода Bufo спорная, так как
эти животные не привлекательны для кровососущих двукрылых —
переносчиков всех известных в настоящее время видов гемоспори-
дий. Вполне возможно, что R. limnocharis и змеи являются случай-
ными хозяевами тех видов гемопротеид, которые в норме развива-
ются у ящериц. Не исключено также, что под этими названиями
описаны виды рода Plasmodium, гаметоциты которых присутство-
вали в крови в момент обследования — ситуация обычная для ма-
лярийных паразитов ящериц (Papema, Landau, 1990, 1991). До по-
лучения дополнительной информации о гемопротеидах амфибий и
змей упомянутые выше виды отнесены к подроду Haemocystidium
sensu latu.
260
ALVEOLATA
Хозяин и: /Ipinidticlylus leschenaulti (Gekkonidae,
Saurin) ( гппоной хозяин). Паразит обнаружен у гекко-
юн роди Hvmidactylus. Находки у других хозяев требу-
ю| нодтнерждения.
Переносчик: неизвестен.
Жизненный цикл и морфология
Экзоэритроцитарная мерогония изучена недоста-
точно. Шорт (Shortt, 1962) обнаружил единственный
небольшой созревающий меронт, содержавший около
30 ядер, в клетке Купфера в печени спонтанно зара-
женного геккона. У других видов этого подрода —
Н. (На.) papernai и Н. (На.) quettaensis, паразитирую-
щих у агам в Пакистане, вторичные экзоэритроцитар-
ные меронты развиваются в клетках эндотелия капил-
ляров и соединительной ткани многих внутренних ор-
ганов, включая легкие, сердце, печень, селезенку и
бедренную мышцу (Telford, 1996). Обычно они пред-
ставляют собой округлые или овальные тела, и лишь
изредка в легких и в бедренной мышце обнаруживают-
ся меронты удлиненной формы. Наибольший диаметр
крупных зрелых меронтов не превышает 30 мкм. В них
формируется менее 100 мерозоитов. Однако большин-
ство меронтов значительно мельче (максимальный
диаметр около 8—15 мкм). В самых мелких меронтах
развивается лишь 8—16 мерозоитов. Цитомеры не
формируются. Цистоподобная стенка вокруг меронтов
не образуется.
Молодые гаметоциты (рис. 149, 1, 2). Самые
юные занимают в зараженном эритроците любое по-
ложение. Цитоплазма окрашивается в голубые тона,
обильная, содержит несколько крошечных эозинофи-
льных гранул.4 Вакуоли не отмечены. Ядро крупное.
Пигментые гранулы мелкие, немногочисленные, бес-
порядочно разбросаны в цитоплазме. Очертания гаме-
тоцитов ровные, реже волнистые, иногда слегка аме-
боидные (рис. 149, 2). Инвазия одного эритроцита не-
сколькими гаметоцитами (вплоть до 5—6) (рис. 149, 2)
встречается часто. Однако до зрелого состояния обыч-
но вырастает один гаметоцит, а другие элиминируют-
ся. По мере роста гаметоциты смещают ядро заражен-
ного эритроцита и деформируют эритроциты, которые
округляются (рис. 149, 2).
Макрогаметоциты (рис. 149, 3—б). Цитоплазма
окрашивается в различные оттенки синего цвета, гомо-
генная, обычно содержит одну крупную вакуоль, что
характерно для этого вида (рис. 149, 4, 5). В некоторых
гаметоцитах присутствует до трех крупных вакуолей
(рис. 149, 6). Очертания гаметоцитов ровные, а форма
округлая (рис. 149, 4) или овальная (рис. 149, 6). Вы-
росшие гаметоциты обычно вплотную прилегают к
ядру зараженного эритроцита, которое может частич-
но располагаться в «выемке» гаметоцита (рис. 149, 5).
Ядро гаметоцита компактное, окрашивается в различ-
ные оттенки розового цвета, вариабельной формы
(чаще удлиненное), занимает в гаметоците эксцент-
4 Во всех случаях, где приводятся сведения об окраске парази-
тов, имеется в виду окраска различными модификациями краски
Романовского (азур-эозин, по Романовскому, краска Гимзы и др.).
Остальные методы окраски оговариваются специально.
ричное положение, содержит четко выраженное
ядрышко. Пигментные гранулы мелкие (< 0.5 мкм),
беспорядочно разбросаны в цитоплазме, довольно час-
то располагаются в виде линий ближе к пелликуле га-
метоцитов (рис. 149, 5). Наибольший диаметр вырос-
ших гаметоцитов в среднем около 13 мкм. Зараженные
эритроциты по сравнению с незараженными гипертро-
фированы и деформированы (округлены), а их ядро не
изменено, но сильно смещено к оболочке эритроцитов
(рис. 149, 4—б).
Микрогаметоциты (рис. 149, 7—9). От макрога-
метоцитов отличаются признаками полового димор-
физма. Цитоплазма окрашивается в розовые тона, ге-
терогенная, вакуолизирована, но крупная вакуоль,
столь характерная для макрогаметоцитов, обычно не
формируется. В ядре заметны скопления хроматина.
Пигментных гранул больше, чем в макрогаметоцитах.
Они беспорядочно разбросаны в цитоплазме. Встреча-
ются пигментные гранулы средних размеров (0.5—
1 мкм). Микрогаметоциты округлой формы обыч-
но встречаются чаще, чем макрогаметоциты. Наи-
больший диаметр выросших микрогаметоцитов в
среднем 11 мкм. Другие признаки, как у макрога-
метоцитов.
Спорогония не изучена у всех видов этого подрода.
Подрод Simondia Garnham, 1966
Экзоэритроцитарная мерогония проходит в клетках
селезенки. Мегаломеронты имеются. В них формиру-
ются псевдоцитомеры. Гаметоциты созревают медлен-
но (более 2 мес). В ооцисте формируется один герми-
нативный центр. Спорогония проходит в слепнях (Та-
banidae). Паразиты черепах (Testudines).
Типовой вид Haemoproteus (Simondia) metchni-
kovi (Sitnond, 1901).
Видовой состав. В подрод входят Н. (S.) саиса-
sica Krasilnikov, 1965; Н. (S.) chelodinae (Johnston et
Cleland, 1909); H. (S.) geochelonis Lainson et Naiff,
1998; H. (S.) testudinis (Laveran, 1905); H. (S.). trionyxii
Misra et Choudhury, 1977 и другие симондии (всего
около 10 видов).
Haemoproteus (Simondia) metchnikovi (Simond,
1901).
Распространение: вероятно, космополит в
ареале распространения черепах, хотя отмечен моза-
ично. В Северной Америке проникает в умеренные
широты до штата Мичиган.
Хозяева: Chitra indica (Trionychidae, Triony-
choidea) (типовой хозяин). Паразит обнаружен у Chry-
semys picta, Emys blandingi, Graptemys geographi-
ca, Pseudemis elegans и некоторых других видов че-
репах.
Переносчик: Chrysops callidus (Tabanidae).
Жизненный цикл и морфология
Спорозоиты внедряются в клетки селезенки и дают
начало мегаломеронтам. В ходе роста мегаломеронтов
формируются псевдоцитомеры, в которых развива-
ТИП SPOROZOA. КЛАСС COCCIDEA
261
10 мкм
Рис. 149. Haemoproteus (Haemocystidium) simondi.
1,2 — молодые гаметоциты, 3—6 — макрогаметоциты, 7—8 — микрогаметоциты; вк — вакуоль, пг — пигментная гранула, яд — ядрышко, якх — ядро клет-
ки-хозяина, яп — ядро паразита.
Масштаб: 10 мкм.
Fig. 149. Haemoproteus (Haemocystidium) simondi.
1,2 — young gametocytes, 3—6 — macrogametocytes, 7—8 — microgametocytes; вк — vacuole, m — pigment granule, яд — nucleolus, якх — host-cell nucleus,
яп — nucleus of parasite.
Scale bar: 10 pm.
ются мерозоиты. Мегаломеронты созревают в тече-
ние 3—4 нед. В них содержатся миллионы мерозои-
тов. Зрелые мегаломеронты лопаются. Большинство
мерозоитов внедряется в эритроциты и дают начало
гаметоцитам, а часть мерозоитов индуцирует вто-
ричную мерогонию в селезенке. Вторичные экзо-
♦ритроцитарные меронты ответственны за поддер-
жание хронической паразитемии и персистирование
паразита в организме позвоночного хозяина. Препа-
тентный период после заражения спорозоитами со-
ставляет около 30—32 дней (DeGiusti et al., 1973).
Гаметоциты развиваются очень медленно, созревая
лишь через 3 месяца после внедрения мерозоитов в
эритроциты.
Молодые гаметоциты (рис. 150, 1—4). Обычно
расположены вблизи одного из полюсов зараженного
262
ALVEOLATA
10 мкм
Рис. 150. Haemoproteus (Simondia) metchnikovi.
1—4 — молодые гаметоциты, 5—8 — макрогаметоциты, 9—12 — микрогамстоциты; пк — нвкуоль, иг — пигментная гранула, якх — ядро клетки-хозяина,
яп — ядро паризита.
Масштаб: 10 мкм.
Fig. 150. Haemoproteus (Simondia) metchnikovi.
1—4 — young gametocytes, 5—8 — macrogametocytes, 9—12 — microgametocytes; «к — vacuole, m — pigment granule, якх — host-cell nucleus, яп — nucleus
of parasite.
Scale bar: 10 pm.
эритроцита, округлой или овальной формы, довольно
часто в форме запятой (рис. 150, 7). Цитоплазма окра-
шивается бледно в голубовато-розовые тона, обильная.
Периферия гаметоцитов окрашивается интенсивнее,
чем их центральная часть. В цитоплазме растущих га-
метоцитов появляются единичные крупные вакуоли
(рис. 150, 3, 4). Ядро крупное, обычно расположено эк-
сцентрично. Пигментные гранулы появляются в юных
гаметоцитах, мелкие, немногочисленные, беспорядоч-
но разбросаны в цитоплазме. Очертания гаметоцитов
ТИП SPOROZOA. КЛАСС COCCIDEA
263
ровные, реже волнистые, иногда слегка амебоидные.
Множественное заражение одного эритроцита юными
гаметоцитами встречается часто. Однако до зрелого
состояния обычно вырастает один гаметоцит, а другие
элиминируются. По мере роста гаметоциты могут
слегка смещать ядро зараженного эритроцита, но
обычно не деформируют клетку-хозяина.
Макрогаметоциты (рис. 150, 5—8). Цитоплазма
окрашивается в розоватый цвет с синим оттенком, гра-
нулированная, обычно содержит одну или несколько
(2—4) крупных вакуолей (рис. 150, 6, 7), что характер-
но для этого вида. Очертания гаметоцитов варьируют
от ровных (рис. 150, 7) до амебоидных (рис. 150, 6, 8),
а форма — от округлой (рис. 150, 5) до удлиненной
(рис. 150, S). Молодые гаметоциты обычно округлой
формы, расположены на одном из полюсов эритроци-
тов, по мере дальнейшего роста вытягиваются вдоль
ядра клетки-хозяина. Растущие гаметоциты довольно
часто расположены асимметрично по отношению к
ядру зараженного эритроцита (рис. 150, 6, 7). Вырос-
шие гаметоциты обычно охватывают своими концами
ядро эритроцита, которое слегка смещается к пери-
ферии (рис. 150, 8). Ядро гаметоцита окрашивается в
различные оттенки розового цвета, вариабельной фор-
мы (чаще удлиненное), трудно различимо на фоне ро-
зоватого цвета цитоплазмы. Пигментные гранулы
обычно мелкие (< 0.5 мкм) и средних размеров (0.5—
1 мкм), округлой или овальной формы, часто сгруп-
пированы в одну или несколько кучек, хотя могут
располагаться и беспорядочно. Изредка отмечаются
крупные (1—1.5 мкм), палочковидные пигментные
гранулы. При этом чем крупнее гаметоциты, тем чаще
в них встречаются пигментные гранулы средних и
крупных размеров. Число пигментных гранул в вырос-
ших гаметоцитах варьирует, но чаще их 10—14. Длина
выросших удлиненных гаметоцитов в среднем около
16 мкм.
Микрогаметоциты (рис. 150, 9—12). От макрога-
метоцитов отличаются признаками полового димор-
физма. Цитоплазма окрашивается в розовые тона,
гетерогенная, вакуолизирована. Ядро гаметоцита диф-
фузное, его границы трудноразличимы. В ядре присут-
ствуют скопления хроматина. Пигментных гранул ме-
ньше, чем в макрогаметоцитах. Длина выросших удли-
ненных микрогаметоцитов в среднем 15 мкм. Другие
признаки, как у макрогаметоцитов.
Спорогония завершается в слепне Chrysops calli-
dus, который является естественным переносчиком.
Ооцисты развиваются в стенке средней кишки под ба-
зальной мембраной. В них формируется один гермина-
тивный центр. Диаметр зрелых ооцист в гистологиче-
ских срезах около 20 мкм. В них формируется около
100—200 спорозоитов, которые проникают в слюнные
железы переносчика. Спорозоиты представляют собой
оерпонидпые клетки, один конец которых закруглен, а
другой слегка заострен. Ядро расположено в центре
cilopo'lon in или слегка эксцентрично. Длина спорозои-
тов в ни тинных и сухих окрашенных препаратах около
9- 12, в ширина — 1—1.4 мкм.
Паразиты птиц
Подрод Parahaemoproteus Bennett,
Garnham et Fallis, 1965
Спорогония в кровососущих мокрецах (Ceratopogo-
nidae). Эксфлагелляция происходит при температуре
ниже 20 °C. Диаметр выросших ооцист менее 20 мкм.
В ооцистах формируются один герминативный центр
и менее 100 спорозоитов. Средняя длина спорозоитов
более 10 мкм. Спорозоиты имеют примерно одинаково
слегка заостренные концы. Позвоночные хозяева иных
групп птиц, нежели Columbiformes.
Типовой вид Haemoproteus (Parahaemoproteus)
danilewskii Kruse, 1890.
Видовой состав. В подрод входят Н. (Р.) frin-
gillae (Labbe, 1894); Н. (Р.) handai Maqsood, 1943;
Н. (Р.) lophortyx O'Roke, 1929; Н. (Р.) mansoni Castella-
ni et Chalmers, 1910 (= H. meleagridis Levine, 1961);
H. (P.) nettionis (Johnston et Cleland, 1909) и другие
виды парагемопротеусов (всего около 130 видов).
Haemoproteus (Parahaemoproteus) mansoni Cas-
tellani et Chalmers, 1910.
(= Haemoproteus canachites Fallis et Bennett, 1960; H. meleagri-
dis Levine, 1961).
Распространение: Голарктика. Известны еди-
ничные выносы паразита вместе с птицами за пределы
этой зоогеографической области, где формируются ло-
кальные очаги инфекции.
Хозяева: Lagopus scoticus (Phasianidae, Gallifor-
mes) (типовой хозяин). Паразит обнаружен у многих
видов курообразных птиц, включая Alectoris chukar,
Bonasa umbellus, Lagopus lagopus, Meleagris gallopavo,
Phasianus colchicus, Tetrao urogallus, Tetrastes bonasia и др.
Переносчики: Culicoides arboricola, C. edeni,
C. haematopotus, C. hinmani, C. knowltoni, C. sphagnu-
mensis (Ceratopogonidae).
Жизненный цикл и морфология
Экзоэритроцитарная мерогония подробно изучена у
экспериментально зараженных домашних индюшат.
Спорозоиты, инокулируемые переносчиком в кровяное
русло птиц, дают начало меронтам, большинство кото-
рых развивается в скелетной мускулатуре. Реже меронты
регистрируются в мускулатуре сердца и селезенке. Раз-
витие меронтов происходит в клетках эндотелия крове-
носных сосудов, в миофибробластах, а также в ретику-
лярных клетках селезенки. В процессе мерогонии фор-
мируются по меньшей мере две генерации меронтов
(рис. 151). Спорозоиты дают начало первичной мерого-
нии в эндотелии кровеносных сосудов и в мышечных во-
локнах скелетной мускулатуры. Рост и созревание ме-
ронтов первой генерации завершаются через 5—8 дней
после заражения птиц спорозоитами. Диаметр меронтов
колеблется в пределах 12—20 мкм. Ядро клетки-хозяина
не гипертрофируется. Растущие меронты имеют грану-
лированную базофильную цитоплазму. Зрелые меронты
(рис. 151,1) заполнены удлиненными, тонкими мерозои-
тами, длина которых достигает 5—6, а ширина — около
264
ALVEOLATA
20 мкм
20 мкм
20 мкм
100 мкм
Рис. 151. Экзоэритроцитарные меронты Haemoproteus (Parahaemoproteus) mansoni в грудной мышце индюшат. (По: Atkinson et al., 1986,
с изменениями).
7 — зрелый меронт первой генерации, содержащий удлиненные мерозоиты (паразит развивается в мышечном волокне); 2 — растущий мегаломеронт с цито-
мерами; 3 — фрагмент зрелого мегаломеронта с формирующимися мерозоитами; 4 — фрагмент зрелого мегаломеронта, наполненный многочисленными
мерозоитами; мег — мегаломеронт, мер — меронт, ц — цитомер.
Масштаб: 20 мкм (7—3), 100 мкм (4).
Fig. 151. Exoerythrocytic meronts of Haemoproteus (Parahaemoproteus) mansoni from pectoral muscle of turkey.
7 — mature meront of the first generation with elongate merozoites (the parasite develops within a muscle fiber); 2 — growing megalomeront with cytomeres; 3 —
a fragment of nearly mature megalomeront with merozoites developing inside branching cytomeres; 4 — a fragment of mature megalomeront packed with numerous
merozoites; мег — megalomeront, мер — meront, ц — cytomere.
Scale bars: 20 pm (1—3), 100 pm (4).
ТИП SPOROZOA. КЛАСС COCCIDEA
265
1 мкм. Вокруг меронтов первой генерации не отмечается
образования капсулоподобных структур и скопления фор-
менных элементов, ответственных за клеточный иммуни-
тет. Удлиненные мерозоиты первой генерации индуциру-
ют вторичную мерогонию — мегаломеронты в скелетной
мускулатуре и в мышце сердца, а также меронты в рети-
кулярных клетках селезенки. По мере роста мегаломерон-
тов вокруг них формируется четко выраженная гиалино-
вая капсулоподобная стенка. Развитие мегаломеронтов
проходит через стадию формирования многочисленных
округлых цитомеров (рис. 151, 2), которые впоследствии
распадаются на более мелкие части. Мерозоиты отпочко-
вываются от внешней поверхности цитомеров (рис. 151,
5). Выросшие мегаломеронты удлиненной формы. Их
длина достигает 456, а ширина колеблется в пределах
30—150 мкм. Ядро клетки-хозяина не гипертрофируется.
Зрелые мегаломеронты заполнены многочисленными
округлыми мерозоитами диаметром около 1 мкм (рис.
151,4). Каждый мерозоит содержит небольшое ядро и от-
носительно крупную вакуоль. Мерозоиты внедряются в
эритроциты и дают начало гаметоцитам.
Единичные меронты также регистрируются в селезен-
ке. Вероятно, они ответственны за рецидивы и поддержа-
ние хронической паразитемии. Эти меронты развиваются
в ретикулярных клетках, ядро которых не гипертрофиру-
ется. В отличие от мегаломеронтов вокруг меронтов в се-
лезенке не формируется капсулоподобная стенка. Диа-
метр этих меронтов не превышает 10—15 мкм.
Препатентный период у индюшат при внутрибрю-
шинном и внутривенном введении спорозоитов со-
ставляет 17 дней, а у Bonasa umbellus при подкожном
заражении спорозоитами штамма, выделенного от Са-
nachites canadensis, — 14 дней.
Паразитемия нарастает быстро, причем интенсив-
ность заражения в пик паразитемии у разных позво-
ночных хозяев при заражении одной и той же дозой
спорозоитов неодинаковая. Повышенное количество
гаметоцитов в периферической крови сохраняется
в течение 5—14 дней, а затем паразитемия снижается.
Морфология гаметоцитов и характер их воздейст-
вия на зараженный эритроцит при развитии у разных
позвоночных хозяев сходные.
Молодые гаметоциты (рис. 152, 1—3). Самые
юные занимают в зараженном эритроците любое по-
ложение, относительно часто располагаются ближе к
одному из его полюсов (рис. 152, I, 2). По мере роста
вытягиваются вдоль ядра эритроцита, располагаясь
латерально по отношению к нему (рис. 152, 3). Очер-
тания гаметоцитов ровные, реже амебоидные. Между
пелликулой гаметоцитов и ядром эритроцитов обычно
имеется незанятое пространство («щель») (рис. 152, 3).
Макрогаметоциты (рис. 152, 4—10). Цитоплазма
окрашивается в различные оттенки синего цвета, го-
могенная, слабовакуолизированная, обычно содержит
гранулы валютина. Очертания гаметоцитов ровные,
реже волнистые. Растут вокруг ядра зараженного эрит-
роцита, слегка смещая его к периферии. Между пелли-
кулой средневыросших гаметоцитов и ядром эритро-
цитов довольно часто имеется незанятое пространство
(«щель») (рис. 152, 5, 7), которое впоследствии исчеза-
ет (рис. 152, 8). Выросшие гаметоциты полностью
окружают ядро и полностью заполняют клетку-хозяи-
на (рис. 152, 9,10). Ядро гаметоцита компактное, окра-
шивается в различные оттенки розового цвета, вариа-
бельной формы, занимает в гаметоците центральное
или близкое к центральному положение. Пигментные
гранулы средних размеров (0.5— 1 мкм) и мелкие
(< 0.5 мкм), беспорядочно разбросаны в цитоплазме и
часто маскируются валютином. Их число в среднем
около 24. Зараженные эритроциты по сравнению с не-
зараженными гипертрофированы, а их ядро атрофиро-
вано в длину. Длина выросших гаметоцитов в среднем
около 22, а ширина — 3 мкм.
Микрогаметоциты (рис. 152, 11, 12). От макрога-
метоцитов отличаются признаками полового димор-
физма. Пигментных гранул меньше, чем в макрогаме-
тоцитах (в среднем около 16). Другие признаки как у
макрогаметоцитов.
Рецидивы паразитемии четко выражены в весен-
не-летнее время и синхронизированы с периодом раз-
множения птиц. Паразитемия вследствие рецидива
поддерживается в течение нескольких месяцев.
Паразит, выделенный от Canachites canadensis, завер-
шает спорогонию в мокрецах Culicoides sphagnumensis,
содержащихся при комнатной температуре. Эксфлагелля-
ция некоторых зрелых гаметоцитов происходит в течение
3 мин после заглатывания крови мокрецами. Процесс га-
метогенеза не синхронизирован, и по истечении 20 мин в
содержимом кишечника еще регистрируется эксфлагел-
ляция. Зиготы обнаружены в средней кишке через 12 ч по-
сле заглатывания гаметоцитов. Их диаметр в среднем ра-
вен 5.5 мкм. Они окрашиваются в синий цвет, без вакуо-
лей или с единичными выкуолями. В это же время
отмечаются первые этапы формирования оокинет. Их раз-
витие проходит через стадию образования длинного паль-
цевидного выроста цитоплазмы (рис. 153, 1), который
дает начало червеобразной оокинете (рис. 153, 2). Ци-
топлазма оокинеты окрашивается бледнее, чем зиготы.
Оокинеты содержат ядро со скоплениями хроматина, а
также крупные вакуоли. Пигментные гранулы у фор-
мирующихся оокинет скапливаются в задней части и
отделяются вместе с участком цитоплазмы в виде
остаточного тела. Сформировавшиеся оокинеты без
пигмента или с единичными гранулами пигмента (рис.
153, 2). Первые стадии формирования ооцист отмече-
ны в стенке средней кишки на 4-й день после зараже-
ния. В это время большинство ооцист заполнено гомо-
генной массой (рис. 153, 3) и лишь в некоторых отме-
чаются начальные стадии формирования спорозоитов
(рис. 153, 4). На 5-й день после заражения в большин-
стве ооцист происходит процесс формирования споро-
зоитов. На 6-й день во многих ооцистах обнаружива-
ются сформировавшиеся веерообразно расположен-
ные и связанные с остаточным телом спорозоиты
(рис. 153, 5). Диаметр ооцист в это время в среднем ра-
вен 9.5 мкм. Каждая ооциста содержит 20—30 спорозо-
итов. На 7-й день спорозоиты становятся подвижными
и располагаются в ооцисте беспорядочно относитель-
но остаточного тела (рис. 153, 6). В это время споро-
зоиты впервые отмечаются в слюнных железах пере-
носчика. На 8-й день в большинстве ооцист регист-
рируются либо только остаточные тела, либо
остаточные тела и несколько (2—6) спорозоитов.
Освобождение спорозоитов из ооцисты происходит
постепенно. Длина живых спорозоитов в нативных
препаратах слюнных желез 11—15 мкм. Спорозоиты
266
ALVEOLATA
Рис. 152. Haemoproteus (Parahaemoproteus) mansoni, (По: Валькюнас, 1997).
1—3 — молодые гаметоциты, 4—10 — макрогаметоииты, 11—12 — микрогаметоциты; вк — нпкуоль, пг — пигментная гранула, яд — ядрышко, якх — ядро
клети-хозяина, яп — ядро паразита.
Масштаб: 10 мкм.
Fig. 152. Haemoproteus (Parahaemoproteus) mansoni.
1—3 — young gametocytes, 4—10 — macrogametocytes, 11—12 — microgametocytes; вк — vacuole, иг — pigment granule, яд — nucleolus, якх — host-cell nucle-
us, яп — nucleus of parasite.
Scale bar: 10pm.
имеют примерно одинаковую ширину на всем протя-
жении, за исключением концов, которые слегка за-
острены (рис. 153, 7).
Морфологические особенности развития парази-
тов, выделенных от индюшат, в мокреце Culicoides
edeni сходны с описанными выше (Atkinson, 1991).
Спорогония завершается в основном через 5—6 дней,
хотя единичные зрелые ооцисты отмечаются уже через
3 дня после заражения. В ооцистах формируется около
50 спорозоитов.
ТИП SPOROZOA. КЛАСС COCCIDEA
267
ост
Рис. 153. Haemoproteus (Parahaemoproteus) mansoni. (По: Fallis, Bennett, 1960, с изменениями).
1 — начальная стадия формирования оокинеты, 2 — полностью сформировавшаяся оокинета, 3 — молодая ооциста, 4 — схематическое изображение разви-
вающейся ооцисты (видны дискретные массы цитоплазмы, остаточное тело и гранулы пигмента), 5 — зрелая ооциста (видны типично организованные пол-
ностью сформировавшиеся спорозоиты и остаточное тело), 6 — зрелая ооциста на последней стадии развития (спорозоиты расположены иррегулярно и могут
двигаться внутри ооцисты, заметно остаточное тело), 7—спорозоит; вк — вакуоль, ост — остаточное тело, пг — пигментная гранула, яп — ядро паразита.
Масштаб: 10 мкм.
Fig. 153. Haemoproteus (Parahaemoproteus) mansoni.
1 — initial stage of development of ookinete, 2 — full grown ookinete, 3 — young oocyst, 4 — diagrammatic representation of developing oocyst (discrete masses of
cytoplasm, a residual body and pigment granules are seen), 5 — mature oocyst (characteristically arranged completely developed sporozoites and a residual body with
pigment granules are seen), 6 — mature oocyst (irregularly arranged sporozoites, which can move about within the oocyst, and a residual body with pigment granules
are seen), 7 — sporozoite; вк — vacuole, ocm — residual body, m — pigment granule, яп — nucleus of parasite.
Scale bar: 10 pm.
Подрод Haemoproteus Kruse, 1890
Спорогония в мухах-кровососках (Hippoboscidae).
Эксфлагелляция при температуре ниже 20 °C не про-
исходит. Диаметр выросших ооцист более 20 мкм.
В ооцистах формируется несколько герминативных
центров и более 100 спорозоитов. Средняя длина спо-
розоитов менее 10 мкм. У спорозоитов один конец бо-
лее заостренный, чем другой. Позвоночные хозяева
видов отр. Columbiformes.
Типовой вид Haemoproteus (Haemoproteus) со-
lumbae Kruse, 1890.
Видовой состав. В подрод входят Н. (Н.) kry-
lovi Subkhonov, 1980; Н. (Н.) palumbis Baker, 1966;
Н. (Н.) pteroclis Shamsuddin et Mohammad, 1980;
H. (H.) sacharovi Novy et MacNeal, 1904; H. (H.) turtur
Covaleda Ortega et Gallego Berenguer, 1950 (всего 6 видов).
Haemoproteus (Haemoproteus) columbae Kruse, 1890.
(= Laverania danilewskyi Grassi et Feletti, 1890 (partim, nom.
praeocc., non Kruse, 1890); Haemoproteus maccallumi Novy et Mac-
Neal, 1904 (partim); Haemamoeba melopeliae Laveran et Pettit, 1909
(partim); Haemoproteus turtur Covaleda Ortega et Gallego Berenguer,
1950 (partim)).
Распространение: обнаружен во всех зоогео-
графических областях. Наивысшая экстенсивность за-
ражения отмечается в тропических и субтропических
широтах. В Голарктике экстенсивность заражения
снижается в направлении с юга на север. В окрестно-
стях Санкт-Петербурга и в Англии не регистриро-
вался.
268
ALVEOLATA
Рис. 154. Экзоэритроцитарные меронтьт Haemoproteus {Haemoproteus) columbae в легких экспериментально зараженных голубей Columba
livia. (По: Ahmed, Mohammed, 1977, с изменениями).
1—3 — меронты иррегулярной формы; 4 — меронт с ядрами, расположенными по периферии паразита; 5 — растущий меронт; 6,7 — зрелые меронты; 8 —
молодой меронт с цитомерами; 9 — фрагмент крупного меронта с многочисленными цитомерами; вк — вакуоль, ле — мерозоит, ц — цитометр, яп — ядро
паразита.
Масштаб; 10 мкм (2—4), 20 мкм (/, 5—9).
Fig. 154. Exoerythrocytic meronts of Haemoproteus (Haemoproteus) columbae from lungs of experimentally infected Columba livia.
1—3 — irregular in form meronts; 4 — meront with nuclei located on the periphery of the parasite; 5 — growing meront; 6, 7 — mature meronts; 8 — young meront
with cytomeres; 9 — a fragment of large meront with numerous cytomeres; вк — vacuole, ме — merozoite, if — cytomere, яп — nucleus of parasite.
Scale bars; 10 pm (2—4), 20 pm (/, 5—9).
ТИП SPOROZOA. КЛАСС COCCIDEA
269
Хозяева: Columba livia (Columbidae, Columbifor-
mes) (типовой хозяин). Паразит обнаружен у многих
видов голубеобразных птиц, включая Columba oenas,
Macropygia nigrirostris, Streptopelia turtur, Turtur abys-
sinicus, Zenaida macroura (всего около 40 видов).
Жизненный цикл и морфология
Экзоэритроцитарная мерогония изучена недоста-
точно. Наиболее часто меронты регистрируются в лег-
ких. У интенсивно зараженных птенцов единичные
меронты были обнаружены в печени и селезенке, что
отмечается довольно редко. Вопрос о том, в каких
клетках они развиваются, окончательно не решен.
Наиболее распространено мнение о локализации ме-
ронтов в клетках эндотелия кровеносных сосудов лег-
ких. Однако имеются также сведения о их развитии в
мононуклеарных лейкоцитах и в макрофагах легких.
Размеры меронтов сильно варьируют. Длина самых
крупных червеобразных паразитов обычно не превы-
шает 100 мкм. Большие меронты могут блокировать
капилляры альвеол. Размеры паразитов не являются
показателем их зрелости. Так, описаны червеобразные
меронты длиной около 60 мкм, в которых дифферен-
циация мерозоитов еще не начиналась, и меронты дли-
ной около 20 и шириной 10 мкм, в которых мерозоиты
уже сформировались. Форма меронтов сильно варьи-
рует. Наиболее обычны червеобразные, вытянутые вдоль
стенок альвеол паразиты (рис. 154,1—3). Довольно часто
они имеют V-образную форму (рис. 154, Z) или доль-
чатое строение (рис. 154,3), причем в различных долях
одного меронта процесс мерогонии может проходить
асинхронно. Описаны также округлые и овальные ме-
ронты. В некоторых округлых меронтах отмечается
скопление ядер по периферии (рис. 154, 4). В отдель-
ных меронтах содержатся небольшие четко выражен-
ные вакуоли (рис. 154, 1, 5, 6). Их обычно не более 10,
а диаметр колеблется в пределах 0.5—2.5 мкм. В ходе
развития в меронтах формируются псевдоцитомеры
(рис. 154, 8, 9).5 Меронты окружены тонкой оболоч-
кой. Формирование цистоподобных структур вокруг
них не отмечено. Зрелые меронты лопаются, и из них
высвобождаются многие сотни мерозоитов, которые
внедряются в эритроциты и дают начало гаметоцитам.
У двух погибших спонтанно зараженных Gallicolumba
luzonica в Южной Африке были выявлены мегаломе-
ронты (Earle et aL, 1993), которые отличаются от опи-
санных выше паразитов. Обнаруженные мегаломерон-
ты сходны с мегаломеронтами Н. (Р.) mansoni. Они
двух типов — меронты, окруженные тонкой оболоч-
кой, которые развиваются в скелетной мускулатуре, в
легких, печени, почках и железистом желудке, и тол-
стостенные меронты, которые развиваются в скелет-
ной мускулатуре, в сердце и мускульном желудке.
Многие меронты в скелетной мускулатуре разделены
септами на отдельные доли (рис. 155). Длина крупных
мегаломеронтов в скелетной мускулатуре превышает
5 При фиксации тканей птиц формолом Ценкера в растущих
меронтах отмечаются многочисленные трещины, и создается впе-
чатление наличия в них большого числа цитомеров, что является
артефактом метода фиксации. При фиксации тканей жидкостью
Карнуа или жидкостью Буэна этого явления не наблюдается.
Рис. 155. Многокамерный меронт Haemoproteus (Haemoproteus)
sp. в скелетной мускулатуре Gallicolumba luzonica. (По: Earle et al.,
1993, с изменениями).
Масштаб: 300 мкм.
Fig. 155. Multilocular megalomeront of Haemoproteus (Haemoprote-
us) sp. in the skeletal muscle of Gallicolumba luzonica.
Scale bar: 300 pm.
1000, а ширина — 500 мкм. Они видны невооружен-
ным глазом и обычно расположены в просвете
капилляров. Меронты, вероятно, начинают развитие в
клетках эндотелия капилляров и по мере роста попада-
ют в просвет кровеносных сосудов. Разрыв мегаломе-
ронтов приводит к некрозу прилегающих тканей.
Препатентный период развития колеблется от 22 до
38 дней (в среднем около 30 дней). Рецидивы имеют
место. Зрелые (способные к гаметогенезу) макрогаме-
тоциты появляются в крови через 68, а микрогамето-
циты — через 116 ч после внедрения мерозоитов в
эритроциты. В это время длина гаметоцитов достигает
примерно 11 мкм. Рост гаметоцитов продолжается до
11-го дня, когда они достигают своих максимальных
размеров.
Молодые гаметоциты (рис. 156, 1). Самые юные
занимают в зараженном эритроците любое положение.
Растущие располагаются вдоль ядра зараженного
эритроцита, обычно не соприкасаясь с ним, и растут в
длину, заполняя клетку-хозяина от полюса до полюса.
Рост в длину сопровождается интенсивным ростом в
ширину, что вызывает смещение ядра эритроцита (рис.
156, 7). Паразит соприкасается с оболочкой эритроци-
та. Во время первичной паразитемии весьма обычна
инвазия одного эритроцита несколькими гаметоцита-
ми, причем в одном эритроците может присутствовать
до 15 юных гаметоцитов. Зрелого состояния достигали
не более двух гаметоцитов. Во время рецидивов мно-
жественная инвазия отмечается редко.
Макрогаметоциты (рис. 156, 2—5). Цитоплазма
окрашивается в различные оттенки синего цвета, гомо-
генная, в некоторых препаратах содержит гранулы ва-
лютина. Растут, смещая ядро зараженного эритроцита
на периферию. При полном развитии заполняют почти
всю цитоплазму эритроцитов (рис. 156, 5) и обычно
270
ALVEOLATA
Рис. 156. Haemoproteus (Haemoproteus) columbae. (По: Вплькюнас, 1997).
1 — молодой гаметоцит, 2—5 — макрогаметоциты, 6—8 — микрогаметоциты; пг — 11ИГМС11ТИПЯ гранула, якх — ядро клетки-хозяина, яп — ядро паразита.
Масштаб: 10 мкм.
Fig. 156. Haemoproteus (Haemoproteus) columbae.
I — young gametocyte, 2—5 — macrogametocytes, 6—8 — microgametocytes; m — pigment granule, якх — host-cell nucleus, яп — nucleus of parasite.
Scale bar: 10 pm.
входят в контакт с ядром зараженной клетки (рис. 156,
3, 5). Очертания гаметоцитов ровные (рис. 156, 4) или
слегка волнистые (рис. 156,2, 3, 5). Их ядро вариабель-
ной формы, занимает в паразитах в основном цент-
ральное положение и содержит локальное скопление
хроматина. Пигментные гранулы как средних (0.5—
1 мкм), так и крупных (> 1 мкм) размеров, округлой
формы, беспорядочно разбросаны в цитоплазме. Их
число в среднем около 28. Длина выросших гаметоци-
тов в среднем около 15, а ширина — 3.5 мкм.
Микрогаметоциты (рис. 156, 6—8). От макрогаме-
тоцитов отличаются признаками полового диморфиз-
ма. Очертания паразитов ровные. В отличие от макро-
гаметоцитов содержат меньше более крупных пигмен-
тных гранул (в среднем около 11), расположенных в
основном в безъядерной зоне и склонных к агрегации в
ТИП SPOROZOA. КЛАСС COCC1DEA
271
Рис. 157. Haemoproteus (Haemoproteus) columbae.
I — микрогамета; 2 — макрогамета; 5 — оокинета; 4,5 — спорозоиты; вк — вакуоль, пг — пигментная гранула, яп — ядро паразита.
Масштаб: 10 мкм. (1—3 — по: Mohammed, 1958, с изменениями; 4,5 — по: Валькюнас, 1997).
Fig. 157. Haemoproteus (Haemoproteus) columbae.
1 — microgamete; 2 — macrogamete; 3 — ookinete; 4, 5 — sporozoites; вк — vacuole, m — pigment granule, яп — nucleus of parasite.
Scale bar: 10 pm.
большие локальные скопления. Средние размеры не-
сколько меньше, чем макрогаметоцитов. Другие при-
знаки как у макрогаметоцитов.
Способность пигмента в гаметоцитах Н. (Н.) colum-
bae к агрегации в крупные массы — одна из отличи-
тельных особенностей вида. Агрегация пигмента отме-
чается на поздних стадиях развития гаметоцитов и у
спонтанно зараженных птиц при однократном иссле-
довании крови регистрируется не всегда.
Гаметогенез наиболее быстро проходит при темпе-
ратуре, близкой к температуре тела позвоночного хо-
зяина. Эксфлагелляция in vitro при температуре 28 °C
отмечается через 7 мин после экспозиции на воздухе
крови, содержащей зрелые гаметоциты, а при темпера-
туре 32—35 °C — через 2.5 мин. При температуре
ниже 20 °C индуцировать эксфлагелляцию in vitro не
удавалось. Микрогаметы имеют типичное для гемо-
споридий строение (рис. 157, /). В макрогаметах от-
сутствуют крупные вакуоли (рис. 157, 2). Оокинеты
червеобразной формы, содержат пигмент и крупные
вакуоли (рис. 157, 3). Длина оокинет достигает 23—
25 мкм. Начальные стадии развития ооцист отмечают-
ся на 4-й день после заглатывания переносчиком гаме-
тоцитов. В каждой ооцисте формируется несколько
герминативных центров, от которых отпочковываются
спорозоиты. Диаметр выросших ооцист достигает 35—
40 мкм и даже более. В каждой ооцисте формируется
несколько сотен спорозоитов. Они представляют со-
бой удлиненные тела, один конец которых заострен
более, чем другой (рис. 157, 4, 5).
При содержании Pseudolynchia canariensis на зара-
женных птицах процесс спорогонии завершается по
истечении 9—10 дней. Эта муха-кровососка слабо вос-
приимчива к паразиту, хотя является основным из из-
вестных в настоящее время переносчиков Н. (Н.) co-
lumbae. Формирование спорозоитов происходит при-
мерно у 10 % мух, заглотивших зрелые гаметоциты.
В мухе-кровососке Ornithomyia avicularia спорозоиты
не формируются, хотя ооцисты отмечаются.
Паразиты млекопитающих
Подрод Hepatocystis Levaditi et Schoen,
1932 emend. Garnham, 1948
(= Rayella Dasgupta, 1967 (syn. nov.))6
Экзоэритроцитарная мерогония проходит в клетках
печеночной паренхимы (гепатоциты). Экзоэритроци-
тарные меронты представляют собой мероцисты
(обычно более 500 мкм в диаметре, реже более мел-
кие). Мерозоиты формируются по периферии мероци-
сты, часто в области более или менее выраженного
6 Род Rayella был создан для Hepatocystis-nopo&nbm. паразитов
гигантской летяги Petaurista magnificus. От Hepatocystis он отлича-
ется главным образом двумя признаками — морфологией экзо-
эритроцитарных меронтов (мероцисты) и скоростью эксфлагелля-
ции. Мероцисты Rayella представляют собой небольшие цистопо-
добные меронты, расположенные группами в печени. Система
Hepatocystis на уровне видов построена в основном на основе мор-
фологии экзоэритроцитарных меронтов, которые в этом отноше-
нии весьма разнообразны. В связи с этим морфология мероцист
вряд ли может быть основой для выделения нового таксона родо-
вой группы. Различия в скорости эксфлагелляции видов Hepatocys-
tis (менее 3 мин) и Rayella (около 8 мин) невелики. Кроме того, ско-
рость эксфлагелляции существенно зависит от температуры окру-
жающей среды и детально не изучена у многих видов Hepatocystis
в стандартных условиях. Представители одних и тех же подродов
гемоспоридий зачастую существенно различаются по скорости
эксфлагелляции (Валькюнас, 1997). Столь незначительные раз-
личия в скорости эксфлагелляции вряд ли могут быть приняты в
качестве признака родовой группы. В связи с вышеизложенным
Rayella рассматривается как младший синоним подрода Hepato-
cystis и соответственно переводится в ранг подрода.
2.72.
ALVEOLATA
«ободка», окружающего центрально расположенную
цистоподобную вакуоль (или несколько вакуолей).
Спорогония проходит в средней кишке кровососущих
мокрецов (Ceratopogonidae). Некоторые виды развива-
ются в головном и грудном отделах мокрецов. Парази-
ты летучих мышей (Chiroptera), грызунов (Rodentia),
парнокопытных (Artiodactyla), приматов (Primates) и
некоторых других млекопитающих.
Типовой вид Haemoproteus (Hepatocystis) kocki
(Laveran, 1899)
Видовой состав. В подрод входят Н. (Не.) bai-
пае Mialhe et Landau, 1977; Н. (Не.) brayi Miltgen, Lan-
dau, Bail et Yap, 1976; H.(He.) rayi Tokura et Wu, 1961;
H. (He.) semnopitheci (Knowles, 1919); H. (He.) vassali
(Laveran, 1905) и другие гепатоцистисы (всего около
25 видов).
Haemoproteus (Hepatocystis) kochi (Laveran, 1899).
Распространение: Эфиопская зоогеографиче-
ская область, где встречается мозаично.
Хозяева: Cercopithecus aethiops (Cebidae, Pri-
mates) (типовой хозяин). Паразит часто встречается у
обезьян из родов Cercopithecus и Cercocebus, реже его
находят у представителей родов Colobus и Erythro-
cebus.
Переносчики: Culicoides adersi и, вероятно,
другие виды мокрецов (Ceratopogonidae).
Жизненный цикл и морфология
Первичная экзоэритроцитарная мерогония не изу-
чена. Вторичные экзоэритроцитарные меронты разви-
ваются в клетках печени (гепатоциты), которые гипер-
трофируются уже на ранних стадиях развития меро-
нтов. Ядро клетки-хозяина делится. В результате
формируется 4 ядра, которые увеличиваются в разме-
рах и затем располагаются парами на противополож-
ных концах клетки-хозяина. В зрелых меронтах ядра
клетки-хозяина не всегда удается различить. Вокруг
паразита формируется вакуолеобразное пространство,
в результате чего цитоплазма зараженной клетки от-
тесняется к периферии. Очертания растущих меронтов
постепенно становятся неровными, с выемками, ядра
располагаются беспорядочно. По мере роста паразита
выемки углубляются, в них проникают ядра, а в цито-
плазме появляются вакуоли. Постепенно формируется
мероциста (рис. 158, У). Вакуоли в цитоплазме парази-
та увеличиваются в размерах и сливаются, формируя в
центре меронта большую цистоподобную вакуоль,
которая заполнена жидким коллоидоподобным содер-
жимым. Эта циста окрашивается гематоксилином не-
равномерно в розовые тона. Цистоподобная вакуоль
оттесняет часть меронта, где расположены делящиеся
ядра, к периферии мероцисты. Эта часть меронта при-
обретает форму «ободка» вокруг цистоподобной ва-
куоли. Деление ядер продолжается, и в области ободка
могут формироваться структуры, похожие на псевдо-
цитомеры. Ободок зрелого меронта заполнен гомоген-
ной массой одноядерных мерозоитов. Вокруг меронта
имеется цистоподобная стенка, которая образована
оболочкой клетки-хозяина и остатками ее цитоплазмы,
мембраной меронта, а также прилегающими к мероци-
сте волокнистыми структурами печеночной ткани.
Прилегающие к мероцисте гепатоциты спрессовыва-
ются так, что различимыми становятся почти только
их ядра, которые также участвуют в формировании
стенки мероцисты. Наибольший диаметр фиксирован-
ных в формалине мероцист на гистологических срезах
около 1—2 мм, а ширина их ободка около 100—
200 мкм. Клеточная реакция вокруг мероцисты выра-
жена. В мероцисте формируются миллионы мерозои-
тов, которые после разрыва мероцисты попадают в си-
нусоиды печени, а затем в кровь. Некоторые мерозои-
ты внедряются также в гепатоциты и дают начало
новому циклу экзоэритроцитарной мерогонии.
Препатентный период около 2 мес после зараже-
ния спорозоитами. Паразит в организме однократно
зараженных обезьян сохраняется в течение несколь-
ких лет.
Молодые гаметоциты (рис. 159, 1—5). Самые
юные представляют собой мелкие кольца с небольшим
ядром (рис. 159, /), которое по мере роста парази-
та приобретает форму ленты (рис. 159, 2) или несколь-
ких хроматиновых сгустков (рис. 159, 3). Цитоплазма
скудная. Растущие трофозоиты могут иметь амебоид-
ные очертания (рис. 159, 3). Пигмент появляется рано,
но он трудноразличим, так как пигментные гранулы
мелкие (пылевидные) и немногочисленные. По мере
роста паразита вакуоль исчезает, а его очертания вы-
равниваются. Созревающие гаметоциты округлой фор-
мы (рис. 159, 4, 5).
Макрогаметоциты (рис. 159, 6). Цитоплазма окра-
шивается бледно в серо-голубые тона. Ядро неболь-
шое, окрашивается в розовый цвет, содержит одну или
несколько компактных масс хроматина, окрашенных в
красные тона. Пигментные гранулы пылевидные, мно-
гочисленные, беспорядочно разбросаны в цитоплазме.
Выросшие гаметоциты несколько крупнее незаражен-
ных эритроцитов, полностью заполняют зараженные
клетки. Наибольший диаметр выросших гаметоцитов
около 9.5 мкм. Зрелые гаметоциты освобождаются
из зараженных эритроцитов и циркулируют в крови
свободными. Гаметоциты вырастают и созревают в те-
чение 4 дней. Продолжительность их жизни около 3—
4 нед.
Микрогаметоциты (рис. 159, 7, 8). От макрогаме-
тоцитов отличаются признаками полового диморфиз-
ма. Ядро очень крупное (занимает примерно от 1/3 до
1/2 гаметоцита), бледно окрашенное, содержит много-
численные ярко окрашенные скопления хроматина в
виде небольших сгустков и нитей. Наибольший диа-
метр выросших гаметоцитов около 9 мкм. Другие при-
знаки, как у макрогаметоцитов.
Спорогония в мокреце Culicoides adersi при темпе-
ратуре 25—28 °C завершается по истечении 5—6 дней.
Эксфлагелляция отмечается в течение 3—5 мин после
заглатывания мокрецами зрелых гаметоцитов. Сфор-
мировавшиеся микрогаметы представляют собой змее-
видные тела длиной в среднем около 12 мкм. Макрога-
меты имеют типичную для гемоспоридий округлую
форму. Длина зрелых оокинет около 16 мкм. Оокине-
ты содержат компактное ядро и пигмент в виде одной
массы иррегулярной формы. Они проникают в гемо-
цель мокреца и расселяются по всему телу насекомого.
Наибольшее их число отмечается в области головы и
ТИП SPOROZOA. КЛАСС COCCIDEA
273
груди, где спорогония завершается.7 В ооцистах фор-
мируется несколько герминативных центров. Диаметр
зрелых ооцист около 40 мкм. Они лопаются в пери-
оде между 5 и 6 днями после заражения мокрецов.
Спорозоиты попадают в гемоцель, а затем проникают
в слюнные железы или непосредственно в прилегаю-
щие ко рту отделы головы насекомого. Спорозоиты
представляют собой веретенообразные тела с компакт-
ным центрально расположенным ядром. Длина споро-
зоитов в сухих окрашенных препаратах около 11—
13 мкм.
Подрод Nycteria Garnham et Heisch, 1953
(= Biguetiella Landau, Baccam, Ratanaworabham, Yen-
butra, Boulard et Chabaud, 1984 (syn. nov.))8
Экзоэритроцитарная мерогония проходит в клетках
печеночной паренхимы (гепатоциты). Печеночные ме-
ронты похожи на меронты видов Plasmodium млекопи-
тающих, разнообразны по форме и размерам, но их
наибольший диаметр не превышает 300 мкм. Мероци-
сты отсутствуют. Переносчики неизвестны. Паразиты
летучих мышей (Chiroptera).
Типовой видHaemoproteus (Nycteria) medusifor-
mis Gamham et Heisch, 1953.
Видовой состав. В подрод входят Н. (N.) Ьги-
cechwatti Landau, Baccam, Ratanaworabhan, Yenbutra,
Boulard et Chabaud, 1984; H. (N.) congolensis (Krampitz
et Anciaux de Faveaux, 1960); H. (N.) erardi Rosin, Lan-
dau et Hugot, 1978; H. (N.) gabonensis Rosin, Landau et
I Ingot, 1978; H. (N.) minuta (Landau, Baccam, Ratanawo-
rubhan, Yenbutra, Boulard et Chabaud, 1984) и другие
пиктерии (всего 8 видов).
7 Спорогонию в области головы и груди ранее относили к при-
ишку родовой группы Hepatocystis (Garnham, 1966). В настоящее
ирсмя известны гепатоцистисы, спорогония которых проходит в
средней кишке переносчика, как это имеет место у подавляющего
большинства видов гемоспоридий. Например, у Н. (Не.) brayi,
II, (Не.) levinei Landau, Humphery-Smith, Chabaud, Miltgen, Cope-
iiinn ct Boulard (Miltgen et al., 1976; Landau et al., 1985). В связи с
*i им признак локализации спорогонии исключен из диагноза ро-
диной группы Hepatocystis.
8 Род Biguetiella (с единственным видом В. minuta) был создан
ППЯ Nycteria-подобного паразита летучей мыши Hipposideros lar-
Vd/IM', От видов Nycteria он отличается главным образом двумя
признаками — размерами экзоэритроцитарных меронтов и деталя-
ми строения гаметоцитов. Меронты этого паразита развиваются
и Г(’||цтоцитах, их диаметр не превышает 15 мкм, округлой формы.
Ядро гаметоцитов мелкое, в микрогаметоцитах оно веретено-
обрпшой формы. Система Nycteria на уровне видов построена
глпииым образом на основе морфологии экзоэритроцитарных
мрроптоп, которые развиваются в гепатоцитах и разнообразны по
рйтмерпм И форме. В этой связи размеры и форма экзоэритроци-
I |||ШМХ меронтов, взятые в отдельности, вряд ли могут быть осно-
itoil дли пыделения нового таксона родовой группы. Приоритет-
ным представляется то, что эти меронты развиваются в гепатоци-
IIIЯ II похожи на печеночные меронты видов Plasmodium
МЛСКО1111ГШОЩИХ, что является важными диагностическими при-
'IIIIIMIIMII никтсрий. Морфология ядра гаметоцитов также вряд ли
MtuMH быть основанием для образования нового таксона родовой
ГРУППЫ Гомосиоридий, так как представители одних и тех же под-
родои I liwmoNporida зачастую существенно различаются по дета-
лям ci роения гаметоцитов и их ядер (Gamham, 1966; Валькюнас,
1997), I) синти с вышеизложенным Biguetiella рассматривается
младшим синонимом Nycteria и соответственно переводится в
риш подрода.
Haemoproteus (Nycteria) medusiformis Gamham et
Heisch, 1953.
Распространение: Эфиопская зоогеографиче-
ская область.
Хозяева: Nycteris thebaica (Nycteridae, Chiroptera)
(типовой хозяин) и другие виды этого рода.
Переносчик: неизвестен.
Жизненный цикл и морфология
Первичная экзоэритроцитарная мерогония не изу-
чена. Вторичные экзоэритроцитарные меронты разви-
ваются в клетках печени (гепатоциты), которые гипер-
трофируются уже на ранних стадиях развития меро-
нтов. Ядро клетки-хозяина не изменяется в размерах,
но смещается к периферии и по мере развития меронта
вытесняется из нее. Вокруг паразита формируется ва-
куолеобразное пространство (рис. 158, 2). Ядра расту-
щих меронтов крупные (около 2 мкм в диаметре),
плотно упакованные, цитоплазма зернистая. Очерта-
ния растущих меронтов постепенно становятся неров-
ными. По мере роста паразиты приобретают причуд-
ливую дольчатую форму (рис. 158, 2). Псевдоцитоме-
ры не формируются. Зрелые меронты заполнены
гомогенной массой мерозоитов. Наибольший диаметр
крупных зрелых меронтов в гистологических срезах
достигает 60—75 мкм. В них содержатся многие тыся-
чи мерозоитов диаметром около 1.5 мкм. Клеточная
реакция вокруг меронтов не выражена.
Молодые гаметоциты (рис. 159, 9, 10). Самые
юные представляют собой иррегулярной формы клет-
ки. Амебоидность очертаний нехарактерна. Цитоплаз-
ма скудная, окрашивается в бледно-розовые тона. Ти-
пичная для малярийных паразитов млекопитающих
стадия «кольца» не отмечается, хотя в цитоплазме рас-
тущих гаметоцитов часто присутствует небольшая ва-
куоль иррегулярной формы. Хроматин ядра рассредо-
точен в виде отдельных фрагментов или ленты при-
чудливой формы (рис. 159, 9), что редко наблюдается у
гемопротеид млекопитающих. По мере роста паразита
вакуоль исчезает, а очертания гаметоцитов выравнива-
ются. Созревающие гаметоциты округлой формы.
Пигмент появляется поздно и обычно заметен лишь в
примерно наполовину выросших паразитах. Пигмент-
ные гранулы слегка удлиненной формы. Зараженные
эритроциты постепенно увеличиваются в размерах. От
оболочки эритроцитов, содержащих растущие гамето-
циты, довольно часто отходят нитевидные филаменты
длиной до 4 мкм. Филаменты (рис. 159, 9—11) разли-
чимы только в хорошо окрашенных препаратах. Они
характерны для этого вида (видовое название medusi-
formis отражает эту особенность развития паразита).
Филаменты отходят от едва различимых в световой
микроскоп утолщений на оболочке эритроцита. Число
филаментов обычно около 10—12. По мере созревания
гаметоцитов клетка-хозяин утрачивает эти структуры,
функциональное значение которых неясно.
Макрогаметоциты (рис. 159,11—13). Цитоплазма
растущих гаметоцитов окрашивается в бледно-розова-
тые тона. Ядро растущих паразитов диффузное (рис.
159, И), похоже на ядро микрогаметоцитов, розовато-
III liih. № 4161
274
ALVEOLATA
Рис. 158. Созревающие экзоэритроцитарные меронты Haemoproteus (Hepatocystis) kochi (7), H. (Nycteria) medusiformis (2) и H. (Polychro-
mophilus) murinus (3) (гистологические срезы печени).
1 — мероциста, 2 — дольчатой формы меронт в гепатоците, 3 — растущий меронт в мезодермальной клетке; змм — зона мерогонии мероцисты («ободок»),
цвм — цистоподобная вакуоль мероцисты, цсм — цистоподобная стенка мероцисты, яг — ядро гепатоцита, якх — ядро клетки-хозяина, яп — ядро паразита.
Масштаб: 500 мкм (7), 50 мкм (2), 20 мкм (3).
Fig. 158. Maturing exoerythrocytic meronts of Haemoproteus (Hepatocystis) kochi (1), H. (Nycteria) medusiformis (2) and H. (Polychromophilus)
murinus (3) (histological sections of liver).
1 — merocyst, 2 — lobular in shape meront in hepatocyte, 3 — growing meront in mesodermal cell; змм — merogony zone of merocyst (a ‘rim’), цвм — cyst-like va-
cuole of merocyst, цсм — cyst-like wall of merocyst, яг — nucleus of hepatocyte, якх — host-cell nucleus, яп — nucleus of parasite.
Scale bars: 500 pm (7), 50 pm (2), 20 pm (3).
го цвета, плохо различимо на фоне примерно такого же
цвета цитоплазмы. В зрелых гаметоцитах хроматин
ядра концентрируется в виде одной небольшой грану-
лы вблизи центра гаметоцита, что характерно и для
микрогаметоцитов. Признаки полового диморфизма
гаметоцитов различимы лишь у полностью выросших
гаметоцитов. Они сводятся главным образом к незна-
чительным отличиям в окраске цитоплазмы, которая в
зрелых макрогаметоцитах становится слегка зерни-
стой и приобретает бледно-голубоватый оттенок. Од-
нако эти детали окраски гаметоцитов различимы толь-
ко в хорошо окрашенных препаратах. Пигментные
гранулы слегка удлиненной формы, беспорядочно раз-
бросаны в цитоплазме. Их число около 20—30. Вырос-
шие гаметоциты в среднем крупнее незараженных
эритроцитов и полностью заполняют зараженные
клетки. Наибольший диаметр зрелых гаметоцитов око-
ло 8 мкм. Филаменты вокруг зараженных эритроцитов,
содержащих полностью выросшие гаметоциты не от-
мечаются (рис. 159, 12, 13).
Рис. 159. Haemoproteus (Hepatocystis) kochi (1—8), Н. (Nycteria) medusiformis (9—15) и H. (Polychromophilus) melanipherus (16—20).
1—5, 9,10,16, 17 — молодые гаметоциты; 6, 11—13,18 — макрогаметоциты; 7, 8,14, 15, 19,20 — микрогаметоциты; пг— пигментная гранула, ф — фила-
мент, эг — эозивофиловая гранула, яп — ядро паразита.
Масштаб: 10 мкм.
Fig. 159. Haemoproteus (Hepatocystis) kochi (1—8), H. (Nycteria) medusiformis (9—15) and H. (Polychromophilus) melanipherus (16—20).
1—5, 9,10, 16, 17 — young gametocytes; 6,11—13, 18 — macrogametocytes; 7, 8, 14, 15, 19, 20 — microgametocytes; m — pigment granule, ф — filament, эг —
eosinophilic granule, яп — nucleus of parasite.
Scale bars: 10 pm.
ТИП SPOROZOA. КЛАСС COCCIDEA
275
10 мкм
276
ALVEOLATA
Микрогаметоциты (рис. 159, 14, 15). От макрога-
метоцитов лишь незначительно отличаются по призна-
кам полового диморфизма, что характерно для этого
вида. Микро- и макрогаметоциты трудно различить по
форме ядра и расположению хроматина. Цитоплазма
выросших гаметоцитов приобретает ярко-розовый
цвет, гомогенная, без голубоватого оттенка. Вблизи
ядра расположена ярко окрашенная эозинофиловая
гранула (рис. 159, 75). Другие признаки, как у макрога-
метоцитов.
Спорогония не изучена. Наблюдать эксфлагелля-
цию in vitro и in vivo не удавалось. Развитие в комаре
Aedes sp. не завершается, хотя единичные оокинеты,
имеющие типичное для гемоспоридий млекопитаю-
щих строение, формируются. Их длина около 8—11 мкм.
Подрод Polychromophilus Dionisi,
1899
(= Bioccala Landau, Rosin, Miltgen, Hugot, Leger, Be-
veridge et Baccam, 1980 (syn. nov.); Dionisia Landau,
Chabaud, Miltgen et Baccam, 1980 (syn. nov.))9
Экзоэритроцитарная мерогония проходит в мезо-
дермальных клетках многих внутренних органов. Эк-
зоэритроцитарные меронты вариабельны по форме и
размерам, но их наибольший диаметр не превышает
300 мкм. Мероцисты отсутствуют. Спорогония в кро-
вососущих мухах сем. Nycteribiidae. Паразиты летучих
мышей (Chiroptera).
Типовой вид Haemoproteus (Polychromophilus)
melanipherus Dionisi, 1899.
Видовой состав.В подрод входят Н. (Ро.) ada-
mi Landau, Rosin, Miltgen, Hugot, Leger, Beveridge
et Baccam, 1980; H. (Po.) bunoi (Landau, Chabaud, Milt-
gen et Baccam, 1980); H. (Po.) corradettii Landau, Rosin,
Miltgen, Hugot, Leger, Beveridge et Baccam, 1980,
H. (Po.) deanei Gamham, Lainson et Shaw, 1971; if. (Po.)
murinus Dionisi, 1899 (всего 6 видов).
Haemoproteus (Polychromophilus) melanipherus
Dionisi, 1899.
Распространение: вероятно, широко распро-
странен в Старом Свете. Один из немногих видов ге-
моспоридий млекопитающих, трансмиссия которого
имеет место в умеренных широтах Палеарктики.
Хозяева: Miniopterus schreibersi (Vespertilionidae,
Chiroptera) (типовой хозяин). Паразит обнаружен у ле-
тучих мышей из родов Miniopterus, Myotis, Rhinolophus
и некоторых других.
Переносчик: неизвестен. Вероятно, мухи-крово-
соски из сем. Nycteribiidae.
9 Род Dionisia и подрод Bioccala были созданы для Polychro-
mophilus-полобных паразитов летучих мышей. От видов Polychro-
mophilus они отличаются, главным образом, небольшими размера-
ми экзоэритроцитарных меронтов, локализацией меронтов в мезо-
дермальных клетках различных органов и деталями строения
гаметоцитов — признаки, которые используются для выделения
видов полихромофилусов и существенно варьируют на уровне ви-
довой группы этих гемоспоридий. Указанные признаки вряд ли мо-
гут быть основой для выделения новых таксонов родовой группы
гемопротеид. В связи с вышеизложенным Dionisia и Bioccala рас-
сматриваются младшими синонимами подрода Polychromophilus.
Жизненный цикл и морфология
Экзоэритроцитарная мерогония не изучена. У близ-
кого вида Н. (Po.) murinus экзоэритроцитарные ме-
ронты развиваются в мезодермальных клетках многих
внутренних органов, включая ретикулярные клетки
костного мозга, ретикулоэндотелий печени, легких, се-
лезенки и других органов. Диаметр зрелых меронтов
обычно не превышает 30 мкм (рис. 158, 5). Заражен-
ные клетки они не гипертрофируют.
Молодые гаметоциты (рис. 159, 16, 17). Самые
юные представляют собой мелкие кольца с небольшим
ядром. Цитоплазма скудная. По мере роста приобрета-
ют овальную форму. Хроматин ядра довольно часто
сгруппирован в виде нескольких компактных гранул
(рис. 159, 17). Пигментые гранулы появляются рано и
обычно располагаются на периферии паразита.
. Макрогаметоциты (рис. 159, 18). Цитоплазма
окрашивается в голубые тона, зернистая, вакуолизи-
рованная. Ядро окрашивается в красные тона, не-
большое, обычно расположено вблизи периферии па-
разита. Ядрышко неразличимо. Пигментные гранулы
компактные, довольно крупные, многочисленные, бес-
порядочно разбросаны в цитоплазме. Выросшие гаме-
тоциты несколько крупнее незаряженных эритроцитов.
Наибольший диаметр выросших гаметоцитов в сред-
нем около 8 мкм. Зрелые гаметоциты освобождаются
из эритроцитов и циркулируют в крови свободными.
Микрогаметоциты (рис. 159, 19, 20). От макрога-
метоцитов отличаются признаками полового димор-
физма. Цитоплазма окрашивается бледно в розоватые
или сероватые тона. Ядро крупное, расположено вбли-
зи периферии гаметоцита, бледно окрашенное, содер-
жит скопления хроматина в виде небольших сгустков
и нитей. Вне ядра обычно различима компактная
округлая эозинофиловая гранула, похожая на ядрышко
(рис. 159, 19, 20). Наибольший диаметр выросших га-
метоцитов около 7—8 мкм. Другие признаки как у
макрогаметоцитов.
Спорогония не изучена. Близкий вид Н. (Po.) muri-
nus спорогонию завершает в мухе-кровососке Nycteri-
bia kolenatii (Gardner, Molyneux, 1988). Эксфлагелля-
ция легко индуцируется in vitro и отмечается через
4—15 мин после экспозиции крови со зрелыми гамето-
цитами на воздухе при комнатной температуре. Длина
микрогамет в сухих окрашенных препаратах в среднем
около 10 мкм. Ооцисты развиваются в средней кишке
под базальной мембраной. В них формируется несколько
герминативных центров. Диаметр зрелых ооцист в на-
тивных препаратах 52—71 мкм. Спорозоиты проника-
ют в слюнные железы переносчика. Они представляют
собой веретенообразные тела с примерно одинаково
закругленными концами. Ядро спорозоита овальное,
расположено слегка эксцентрично. Длина спорозоитов
в нативных препаратах в среднем 7.4, а ширина — 1.1 мкм.
Сем. Plasmodiidae Mesnil, 1903
Мерогония проходит в клетках тканей и в клетках
крови позвоночных хозяев. Малярийный пигмент (ге-
мозоин) в меронтах, развивающихся в клетках крови, и
в гаметоцитах формируется, хотя при заселении моло-
ТИП SPOROZOA. КЛАСС COCC1DEA
277
дых эритроцитов у некоторых видов может отсутство-
вать. Половой процесс и спорогония в комарах (Culici-
dae), в москитах (Phlebotomidae) и в мокрецах (Cerato-
pogonidae).
Типовой род Plasmodium Marchiafava et Celli,
1885, единственный род семейства.
Род Plasmodium Marchiafava et Celli,
1885
(= Haemamoeba Grassi et Feletti, 1890 (partim); Lavera-
nia Grassi et Feletti, 1890 (partim); Proteosoma Labbe,
1894; Haemosporidium Lewkowicz, 1897; Haemomenas
Ross, 1899; Billbraya Papema et Landau, 1990
(syn. nov.))10
Характеристика семейства.
Типовой вид Plasmodium malariae (Grassi et Fe-
letti, 1892).
В роде 14 подродов, представители которых пара-
зитируют у рептилий, птиц и млекопитающих.
Паразиты рептилий
Подрод Sauramoeba Garnham, 1966
Эритроцитарные меронты и гаметоциты крупные.
Размеры зрелых эритроцитарных меронтов превыша-
ют размеры ядер незаряженных эритроцитов в сред-
нем в 3—7 раз. Эритроцитарные меронты содержат от
11 до 130 мерозоитов. Размеры зрелых гаметоцитов
превышают размеры ядер незаряженных эритроцитов
в среднем в 2—5 раз. Размеры зрелых гаметоцитов
обычно меньше или равны размерам зрелых эритроци-
тарных меронтов. Макрогаметоциты в среднем круп-
нее микрогаметоцитов. Гаметоциты развиваются в
клетках эритроцитарного ряда. Экзоэритроцитарная
мерогония проходит в лейкоцитах. Спорогония не изу-
чена. Паразиты ящериц (Sauria, Squamata).
Типовой вид Plasmodium (Sauramoeba) diplo-
glossi Aragao et Neiva, 1909.
Видовой состав. В подрод входятР. (S.) beltra-
ni Pelaez et Perez-Reyes, 1952; P. (S.) cnemidophori Cari-
ni, 1941; P.(S.) giganteum Theiler, 1930; P. (S.) guyan-
10 Род Billbraya был создан для Plasmodium-nonotmova парази-
та австралийского геккона Phyllodactylus marmoratus. Основной
отличительный признак этого рода — разграничение во времени
паразитемии эритроцитарных меронтов и гаметоцитов. Первичная
паразитемия у экспериментально зараженного геккона сначала в
течение одного месяца была представлена только эритроцитарны-
ми мсроитпми, которые затем исчезали. На протяжении следующе-
го мсеяцп а крови присутствовали только гаметоциты. Во время ре-
цидивов в крови находили также только гаметоциты. Дивергенция
мнлирийиых паразитов рептилий по признаку продолжительности
мерогонии в крови и гамстоцитогамии значительна и недостаточно
И'|учсип. I hi этот факт обра тили внимание еще в прошлом столетии
Томпсон и Х||фф (Thompson, Huff, 1944) на примере Plasmodium
(Paraplasmodium) mc.xlcaiium (см. с. 332). Признак разграничения
во времени |шрп’)11тсмии эритроцитарных меронтов и гаметоцитов
малярийных паразитов рептилий в настоящее время вряд ли может
быть использован для выделения нового таксона родовой группы в
сем. Plasmodiidae. В этой связи Billbraya рассматривается младшим
синонимом рода Plasmodium.
nense Telford, 1979; Р. (S.) heischi Gamham et Telford,
1984 и другие саурамебы (всего около 10 видов).
Plasmodium (Sauramoeba) diploglossi Aragao et
Neiva, 1909.
Распространение: неотропическая зоогеогра-
фическая область.
Хозяева: Diploglossus fasciatus (Anguidae, Sauria)
(типовой хозяин), Mabuya mabouya.
Переносчик: неизвестен.
Жизненный цикл и морфология
Жизненный цикл изучен фрагментарно. Лэнсон и
Шо (Lainson, Shaw, 1969) обнаружили в перифериче-
ской крови спонтанно зараженной ящерицы Mabuya
mabouya один экзоэритроцитарный меронт в моноци-
те. Многочисленные экзоэритроцитарные меронты в
мононуклеарных лейкоцитах также наблюдались упо-
мянутыми авторами в отпечатках селезенки и печени
этой ящерицы. Телфорд (Telford, 1970) обнаружил в
периферической крови спонтанно зараженных М. ma-
bouya два экзоэритроцитарных меронта — в лимфоците
и тромбоците; первый содержал 12, а второй — 18 ядер.
Эритроцитарная мерогония несинхронизирована.
При экспозиции крови зараженных ящериц на воздухе
эксфлагелляцию индуцировать не удалось, хотя гаме-
тоциты округляются. Путем внутримышечной иноку-
ляции зараженной крови типового позвоночного хозя-
ина заразить ящериц Ameiva surinamensis, Hemidacty-
lus mabouja, Mabuya agilis и Tropidurus torquatus не
удалось.
Трофозоиты (рис. 160,1, 2). Развиваются в клетках
эритроцитарного ряда. Самые юные вариабельной
формы, в клетке-хозяине определенного положения не
имеют. Отмечается стадия «кольца». По мере роста па-
разиты удлиняются. Выросшие трофозоиты, длина са-
мых крупных из которых может достигать 4—6, а ши-
рина — 3 мкм, часто прилегают к ядру зараженного
эритроцита (рис. 160,2). Ядро паразита крупное, четко
выраженное. Цитоплазма обильная, иногда содержит
мелкую вакуоль. Очертания паразитов вариабельные.
В цитоплазме имеется несколько мелких пигмент-
ных гранул золотисто-серого цвета. Выросшие трофо-
зоиты могут слегка смещать ядро зараженного эритро-
цита.
Эритроцитарные меронты (рис. 160, 3—8). Рас-
тут вдоль ядра зараженного эритроцита, которое вы-
росшие паразиты могут окружать (рис. 160, 7, 8) либо
сильно смещать (рис. 160, 6). Цитоплазма обильная,
окрашивается в различные оттенки голубого цвета,
обычно не содержит четко выраженных вакуолей.
Очертания паразитов обычно ровные, а форма удли-
ненная. Ядра в меронтах расположены аморфно. Пиг-
ментные гранулы в растущих меронтах мелкие, округ-
лые, разбросаны в цитоплазме (рис. 160, 3). В зрелых
меронтах они имеют тенденцию группироваться в
одну или несколько кучек на одном из концов паразита
(рис. 160, 7). В зрелых меронтах формируются 11—50
(чаще около 20—30) мерозоитов. Выросшие меронты
вызывают гипертрофию зараженных эритроцитов, ко-
торые могут округляться (рис. 160, 8). Ядро заражен-
278
ALVEOLATA
Рис. 160. Plasmodium (Sauramoeba) diploglossi.
1,2 — трофозоиты; 3—8 — эритроцитарные меронты; 9, 10 — макрогаметоциты; 11—12 — микрогаметоциты; пг — пигментная гранула, якх — ядро клет-
ки-хозяина, яп — ядро паразита.
Масштаб: 10 мкм.
Fig. 160. Plasmodium (Sauramoeba) diploglossi.
1,2 — trophozoites; 3—8— erythrocytic meronts; 9,10 — macrogametocytes; Il—12 — microgametocytes; m — pigment granule, якх — host-cell nucleus, яп —
nucleus of parasite.
Scale bar: 10 pm.
ных эритроцитов округляется и может смещаться на
периферию. Длина зрелых меронтов колеблется в пре-
делах 6—20 (в среднем 13), а ширина — в пределах
3—8 (в среднем 4) мкм.
Макрогаметоциты (рис. 160, 9, 10). Развиваются в
клетках эритроцитарного ряда. Цитоплазма окрашива-
ется в различные оттенки голубого цвета, иногда со-
держит небольшие округлые вакуоли. Для этого вида
характерен рост гаметоцитов вокруг ядра зараженных
эритроцитов (рис. 160, 10) вплоть до полного окруже-
ния ядра. Однако многие гаметоциты также вытягива-
ются вдоль ядра эритроцита и сильно смещают ядро.
Форма гаметоцитов удлиненная. Ядро компактное, за-
нимает в гаметоците близкое к центральному положе-
ние. Пигментные гранулы мелкие (< 0.5 мкм) и сред-
них размеров (0.5—1 мкм), округлой или овальной
ТИП SPOROZOA. КЛАСС COCCIDEA
279
формы, золотисто-серого, темно-коричневого или чер-
ного цвета, обычно беспорядочно разбросаны в цито-
плазме, но могут быть и сгруппированы в кучки. Их
число около 20—30. Воздействие гаметоцитов на клет-
ку-хозяина проявляется также, как у эритроцитарных
меронтов, но гаметоциты, смещающие ядро заражен-
ных эритроцитов, встречаются чаще, чем меронты.
Длина зрелых гаметоцитов колеблется в пределах
7—20, а ширина — в пределах 4—8 мкм.
Микрогаметоциты (рис. 160, 11, 12). От макрога-
метоцитов отличаются признаками полового димор-
физма. Их размеры в среднем несколько меньше раз-
меров макрогаметоцитов. Другие признаки, как у мак-
рогаметоцитов.
Подрод Carinamoeba Garnham, 1966
Эритроцитарные меронты и гаметоциты мелкие.
Размеры зрелых эритроцитарных меронтов в среднем
меньше размеров ядер незараженных эритроцитов.
Эритроцитарные меронты обычно содержат от 4 до 8,
изредка до 12 мерозоитов. Размеры зрелых гаметоци-
тов в среднем обычно не превышают размеры ядер не-
зараженных эритроцитов, хотя у некоторых видов га-
метоциты в среднем могут быть несколько крупнее
ядер незараженных эритроцитов. Размеры зрелых га-
метоцитов в среднем обычно равны размерам зрелых
эритроцитарных меронтов или превышают их, но не
более чем в 2 раза. Половой диморфизм в размерах га-
метоцитов обычно не выражен. Гаметоциты развива-
ются в клетках эритроцитарного ряда, обычно в зре-
лых эритроцитах. Экзоэритроцитарная мерогония мо-
жет проходить в тромбоцитах. Спорогония не изучена.
Паразиты ящериц (Sauna, Squamata).
Типовой вид Plasmodium (Carinamoeba) mina-
sense Carini et Rudolph, 1912.
Видовой с о став. В подрод входят Р. (С.) attenu-
atum Telford, 1973; Р. (С.) cordyli Telford, 1987;
Р. (С.) mabuiae'Weny on, 1909; Р.(С.) rhadinurum Thomp-
son et Huff, 1944; P. (C.) scelopori Telford, 1977 и дру-
гие каринамебы (всего около 10 видов).
Plasmodium (Carinamoeba) minasense Carini et Ru-
dolph, 1912.
(= Plasmodium carinii Leger et Mouzels, 1917).
Распространение: наиболее часто регистриро-
вался в Неотропической зоогеографической области.
Паразит также обнаружен в Индо-Малайской области
на п-ове Малакка.
Хозяева: Mabuya mabouya (= М. agilis) (Scincidae,
Suuria) (типовой хозяин), Ameiva ameiva, Anolis capita,
(ioiiyocephalus borneensis, Iguana iguana и некоторые
другие виды ящериц из упомянутых родов.
Перенос ч и к: неизвестен.
Жизненный цикл и морфология
Экзоэритроцитарная мерогония нс изучена у всех
представителей подрода Carinamoeba.
Трофозоиты (рис. 161, /). Развиваются в молодых
и зрелых эритроцитах. Самые юные вариабельной
формы, в клетке-хозяине занимают любое положение.
Их очертания ровные. Ядро четко выражено. Вырос-
шие трофозоиты обычно располагаются вблизи одного
из полюсов зараженных эритроцитов и, как правило,
не соприкасаются с их ядром. В цитоплазме выросших
трофозоитов имеется несколько (обычно 1—3) мелких
гранул пигмента сероватого или черного цвета. Вакуо-
ли в трофозоитах обычно отсутствуют. Воздействие
паразитов на зараженную клетку не выражено.
Эритроцитарные меронты (рис. 161, 2—10).
Обычно развиваются в зрелых эритроцитах и распола-
гаются вблизи одного из полюсов клетки-хозяина. Ци-
топлазма окрашивается бледно в различные оттенки
голубого цвета, обычно не содержит вакуолей. Ядра
четко выражены. Растущие меронты вариабельной
формы, обычно иррегулярных очертаний. Амебоид-
ные выросты цитоплазмы не выражены. Ядра в вы-
росших меронтах чаще располагаются веерообразно
(рис. 161, 3, 4, 6, 7), реже — в виде морулы (рис. 161,8)
или розетки (рис. 161, 5, 9). Пигментные гранулы мел-
кие (< 0.5 мкм), немногочисленные (чаще их число
1—5), обычно расположены в виде одной более или
менее компактной группы. В меронтах формируется
4—8 (мода 6) мерозоитов. Меронты не воздействуют
или слабо воздействуют на зараженный эритроцит, что
проявляется в основном в незначительном смещении
его ядра. Размеры выросших меронтов у разных под-
видов варьируют. У номинативного подвида их длина
в среднем около 5, а ширина — 4 мкм.
Макрогаметоциты (рис. 161, 11—13). Обычно
развиваются в зрелых эритроцитах. Цитоплазма окра-
шивается в различные оттенки голубого цвета, гомо-
генная. Гаметоциты, как правило, не соприкасаются
с ядром клетки-хозяина. Форма выросших гамето-
цитов округлая, реже овальная. Ядро гаметоцитов
вариабельной формы, окрашивается бледно. Пигмент-
ные гранулы мелкие (< 0.5 мкм), беспорядочно разбро-
саны в цитоплазме или образуют скопления. Их число
обычно не превышает 10. Воздействие на клетку-хо-
зяина, как у меронтов. Размеры выросших гаметоци-
тов у разных подвидов варьируют. У номинативного
подвида их длина в среднем около 6, а ширина —
5 мкм.
Микрогаметоциты (рис. 161,14—16). От макрога-
метоцитов отличаются признаками полового димор-
физма. Другие признаки как у макрогаметоцитов.
Подрод Lacertamoeba Telford, 1988
Эритроцитарные меронты и гаметоциты средних
размеров (по размерам занимают промежуточное по-
ложение между видами Sauramoeba и Carinamoeba).
Размеры зрелых эритроцитарных меронтов превыша-
ют размеры ядер незараженных эритроцитов в 1.5—2
раза. Эритроцитарные меронты содержат от 4 до 55
мерозоитов. Средние размеры зрелых гаметоцитов ва-
рьируют от несколько меньших, чем размеры ядер, не-
зараженных эритроцитов до размеров, превышающих
размеры ядер незараженных эритроцитов до 2 раз. Раз-
меры зрелых гаметоцитов в среднем обычно равны
размерам зрелых эритроцитарных меронтов или слег-
ка превышают их, но не более чем в 2 раза. Гаметоци-
280
ALVEOLATA
ТИП SPOROZOA. КЛАСС COCCIDEA
281
ты обычно развиваются в эритроцитах. У некоторых
видов они также развиваются в тромбоцитах и лимфо-
цитах. Половой диморфизм в размерах гаметоцитов не
выражен. Экзоэритроцитарная мерогония у изученных
видов проходит в клетках ретикулоэндотелиальной си-
стемы, особенно часто в клетках серии лимфоидных
макрофагов. Спорогония проходит в комарах (Culici-
dae) и кровососущих мокрецах (Ceratopogonidae). Па-
разиты ящериц (Sauria, Squamata).
Типовой вид Plasmodium (Lacertamoeba) tropi-
duri Aragao et Neiva, 1909.
Видовой состав. В подрод входят Р. (L.) Ьгу-
gooi Telford et Landau, 1987; P. (L.) colombiense Ayala et
Spain, 1976; P. (L.) floridense Thompson et Huff, 1944;
P. (L.) michikoa Telford, 1988; P. (L.) vacuolatum Lain-
son, Shaw et Landau, 1975 и другие лацертамебы (всего
около 35 видов).
Plasmodium (Lacertamoeba) vacuolatum Lainson,
Shaw et Landau, 1975.
Распространение: обнаружен в Бразилии и
Гвиане.
Хозяева: Plica umbra (Iguanidae, Sauria) (типовой
хозяин).
Переносчик: неизвестен.
Жизненный цикл и морфология
Экзоэритроцитарная мерогония не изучена.
Трофозоиты (рис. 162, 1, 2). Обычно развиваются
в зрелых эритроцитах. Самые юные округлой или
овальной формы, в клетке-хозяине занимают любое
положение. Они имеют небольшое ядро и четко выра-
женную вакуоль (рис. 162, 7). По мере роста удлиня-
ются, приобретая бобовидную или каплевидную фор-
му. Вакуоль увеличивается в размерах, располагается
ближе к одному из концов трофозоита, содержит еди-
ничные мелкие золотистые гранулы пигмента. Очерта-
ния паразитов обычно ровные, изредка слабоамебоид-
ные. Воздействие трофозоитов на клетку-хозяина не
выражено.
Эритроцитарные меронты (рис. 162, 3—10).
Обычно развиваются в зрелых эритроцитах. Цитоплаз-
ма окрашивается в различные оттенки голубого цвета,
содержит одну крупную вакуоль, которая по мере со-
зревания меронтов уменьшается в размерах. Растущие
меронты овально-удлиненной (обычно бобовидной
или каплевидной) формы (рис. 162, 3, 5). Вакуоль на-
ходится на одном из концов паразита. Выросшие ме-
ронты располагаются вблизи одного из полюсов зара-
женных эритроцитов. Их очертания ровные, а форма
вариабельная (округлая, овальная, бобовидная, капле-
видная, веерообразная). Ядра в выросших меронтах
расположены аморфно (рис. 162, 7, 9) или по перифе-
рии паразита (рис. 162, 8). Пигментные гранулы мел-
кие, многочисленные, сосредоточены в вакуоле. В ме-
ронтах формируется 8—20 (в среднем 16) мерозоитов
(рис. 162, 10). Длина сформировавшихся мерозоитов
около 2, а ширина — около 1 мкм. Меронты на за-
раженные эритроциты не воздействуют или слабо
воздействуют, что проявляется в незначительном
смещении их ядра. Длина выросших меронтов колеб-
лется в пределах 4—8, а ширина — в пределах 3—
4.5 мкм.
Макрогаметоциты (рис. 162, 11—13). Развивают-
ся в зрелых эритроцитах. Цитоплазма окрашивается в
различные оттенки голубого цвета, содержит одну
крупную вакуоль, которая обычно расположена вбли-
зи пелликулы гаметоцита (рис. 162, 12). По мере роста
паразита размеры вакуоли уменьшаются. Форма гаме-
тоцитов округлая, реже овальная. Они расположены
вблизи одного из полюсов зараженных эритроцитов.
Ядро гаметоцитов вариабельной формы, окрашивается
в различные оттенки розового цвета. Пигментные
гранулы мелкие (<0.5 мкм), многочисленные, золоти-
стого цвета, сосредоточены в вакуоле. Воздействие
гаметоцитов на клетку-хозяина проявляется так же,
как у меронтов. Длина зрелых гаметоцитов колеблется
в пределах 4—7.5, а ширина — в пределах 3.5—
5.5 мкм.
Микрогаметоциты (рис. 162, 14—16). От мак-
рогаметоцитов отличаются признаками полового
диморфизма. Другие признаки, как у макрогамето-
цитов.
Подрод Paraplasmodium Telford,
1988
Эритроцитарные меронты средних размеров, а га-
метоциты крупные. Размеры зрелых эритроцитарных
меронтов превышают размеры ядер незаряженных
эритроцитов в 1.5—2 раза. Эритроцитарные меронты
содержат от 4 до 30 мерозоитов. Размеры зрелых гаме-
тоцитов превышают размеры ядер незаряженных эрит-
роцитов в среднем в 3—6 раз. Размеры зрелых гамето-
цитов превышают размеры зрелых эритроцитарных
меронтов также в среднем в 3—6 раз. Макрогаметоци-
ты крупнее микрогаметоцитов. Гаметоциты разви-
ваются в эритроцитах. Экзоэритроцитарная мерогония
у изученных видов проходит в фиксированных клет-
ках внутренних органов и в циркулирующих лейко-
цитах крови. Спорогония может завершаться в моски-
тах (Phlebotomidae). Паразиты ящериц (Sauria, Squa-
mata).
Рис. 161. Plasmodium (Carinamoeba) minalsense.
I трофоннн, } 10 эритроцитарные меронты, 11—13 — макрогаметоциты, 14—16 — микрогаметоциты; пг — пигментная гранула, якх — ядро клет-
ки-хозяина, яп — ядро паразита.
Масштаб: 10 мкм.
Fig. 161. Plasmodium (Carinamoeba) minasense.
1 — trophozoite, 2.10 erythrocytic meronts, 11--13 — macrogametocytes, 14—16— microgametocytes; m — pigment granule, якх — host-cell nucleus, яп —
nucleus of parasite.
Scale bar: 10 pm.
282
ALVEOLATA
Рис. 162. Plasmodium (Lacertamoeba) vacuolatum.
1,2 — трофозоиты; 3—10 — эритроцитарные меронты; 11—13 — макрогаметоциты; 14—16 — микрогаметоциты; вк — вакуоль, пг— пигментная гранула,
якх — ядро клетки-хозяина, яп — ядро паразита.
Масштаб: 10 мкм.
Fig. 162. Plasmodium (Lacertamoeba) vacuolatum.
1,2 — trophozoites; 3—10 — erythrocytic meronts; /7—13 — macrogametocytes; 14—16 — microgametocytes; вк — vacuole, m — pigment granule, якх —
host-cell nucleus, як — nucleus of parasite.
Scale bar: 10 pm.
ТИП SPOROZOA. КЛАСС COCCIDEA
283
Типовой вил Plasmodium (Paraplasmodium) те-
xicanum Thompson et Huff, 1944.
Видовой состав. В подрод входят Р. (Р.) chiri-
cahuae Telford, 1970; Р. (Р.) pifanoi Scorza et Dagert,
1956 (всего 3 вида).
Plasmodium (Paraplasmodium) mexicanum Thomp-
son et Huff, 1944.
Распространение: Северная Америка. Единст-
венный вид малярийных паразитов рептилий, который
проник и циркулирует в Голарктике, севернее 40-й па-
раллели.
Хозяева: Sceloporus torquatus (= S. ferrariperezi)
(Iguanidae, Sauria) (типовой хозяин). Естественными и
экспериментальными хозяевами являются Crotaphytus
collaris, Gerrhonotus multicarinatus, Phrynosoma asio,
Sceloporus graciosus, S. grammicus, S. horridus, S. occi-
dentalis, S. undulatus и некоторые другие виды ящериц,
главным образом из сем. Iguanidae. Ящериц из се-
мейств Helodermatidae и Scincidae путем инокуляции
инфицированной крови заразить не удалось.
Переносчики: Lutzomyia vexatrix, L. steward
(Phlebotomidae).
Жизненный цикл и морфология
Первичная экзоэритроцитарная мерогония не изу-
чена. Вторичные экзоэритроцитарные меронты разви-
ваются в клетках гемопоэтической системы, в цирку-
лирующих лейкоцитах и в фиксированных эндотели-
альных клетках внутренних органов, включая головной
мозг, причем мерогония паразита у разных позвоночных
хозяев может существенно отличаться по приуроченности
к различным клеткам-хозяевам. Соответственно отли-
чается и морфология паразитов. У типового позвоноч-
ного хозяина экзоэритроцитарные меронты присутству-
ют в периферической крови. Они развиваются в нор-
мобластах, полинуклеарных лейкоцитах, лимфоцитах,
моноцитах, макрофагах, тромбоцитах и некоторых дру-
гих клетках (рис. 163,13—16, 18—21). Зрелые меронты
округлой или овальной формы. В них обычно развива-
ется от 10 до 40 удлиненных мерозоитов (рис. 163, 22).
Такие же меронты и мерозоиты обнаруживаются в от-
печатках внутренних органов зараженных ящериц. Эк-
зоэритроцитарные меронты развиваются также в раз-
личных фиксированных мезодермальных клетках, осо-
бенно часто в ретикулоцитах селезенки и костного
мозга, а также в эндотелиальных клетках капилляров
внутренних органов и подкожных тканей (рис. 164, 13).
Препатентный период при заражении спорозоита-
ми через укус москита колеблется от 23 до 40 дней
(Klein et al., 1987). Эритроцитарная мерогония несин-
xpoiiiriiipoiiana.
Трофозоиты (рис. 164, 1). Развиваются в клетках
эритроцитарного ряда, вариабельной формы, постоян-
ного мешоположения в клетках-хозяевах не имеют. Их
очертания при развитии у разных видов позвоночных
варьируют от ровных до резко амебоидных. Пигмент-
ные гранулы темпо-золотистого или темно-коричнево-
го цвета, различимы лишь в крупных трофозоитах. Их
число варьирует от 2 до 5. Воздействие трофозоитов на
зараженные эритроциты не выражено.
Эритроцитарные меронты (рис. 163, 8—10; 164,
2—7). Развиваются в молодых и зрелых эритроцитах.
Цитоплазма окрашивается в голубые тона, обычно не
содержит четко выраженных вакуолей. Форма и очер-
тания растущих меронтов вариабельны. Выросшие ме-
ронты обычно округлой или овальной формы. Доволь-
но часто располагаются вблизи одного из полюсов
эритроцитов, хотя могут быть обнаружены в клет-
ке-хозяине в любом положении. Ядра в выросших ме-
ронтах расположены аморфно (рис. 163, 8; 164, 3, 5),
по периферии паразита (рис. 164, 4, 6) или веерообраз-
но (рис. 164, 7). Пигментные гранулы обычно тем-
но-золотистого цвета, по мере созревания меронтов
группируются в кучку. Меронты на зараженные эрит-
роциты обычно не воздействуют или слабо воздейст-
вуют, что проявляется в незначительном смещении их
ядра. Наибольший диаметер зрелых меронтов колеб-
лется от 5 до 11 мкм. В них формируется 8—20 меро-
зоитов. Форма последних удлиненная. Их длина около
3—4, а ширина — 0.5—1 мкм.
Макрогаметоциты (рис. 163, 1, 2, 4, 5, 7; 164,
8—10). Развиваются в молодых и зрелых эритроцитах.
Цитоплазма окрашивается в различные оттенки голу-
бого цвета. В зрелых гаметоцитах различимы мелкие
вакуоли. Форма гаметоцитов овально-удлиненная
(рис. 163,1, 2, 5; 164, 8, 9), реже округлая (рис. 164,10)
или неправильная (рис. 163, 4, 7). Гаметоциты обычно
занимают латеральное по отношению к ядру заражен-
ного эритроцита положение, хотя некоторые паразиты
располагаются на одном из полюсов эритроцитов.
Ядро гаметоцитов окрашивается в различные оттенки
голубого цвета, компактное, обычно занимает близкое
к центральному положение. Ядрышко четко выраже-
но, обычно расположено на границе с цитоплазмой
(рис. 163, 4, 5; 164, 8—10). Пигментные гранулы вари-
абельной формы, беспорядочно разбросаны в цитоплаз-
ме или сгруппированы в кучки. Их число обычно колеб-
лется от 10 до 40. Выросшие гаметоциты существенно
деформируют зараженные эритроциты и смещают их
ядро, которое при этом обычно сильно не деформирует-
ся. Размеры выросших гаметоцитов существенно варьи-
руют у разных хозяев и у одних и тех же хозяев в различ-
ные периоды паразитемии. Длина зрелых гаметоцитов
обычно колеблется в пределах 11—22 (чаще около
14—15), а ширина — 5—12 (чаще около 8—9) мкм.
Микрогаметоциты (рис. 163, 3, 6; 164, 11, 12). От
макрогаметоцитов отличаются признаками полового
диморфизма. Их размеры меньше, чем макрогаметоци-
тов. Длина гаметоцитов обычно колеблется в пределах
12—14, а ширина — 7—9 мкм. Другие признаки, как у
макрогаметоцитов.
Способность продуцировать гаметоциты и число
гаметоцитов у разных хозяев существенно варьируют.
Паразитемия у типового хозяина представлена глав-
ным образом гаметоцитами, которые у эксперимен-
тально зараженных Crotaphytus collaris не развивают-
ся. У этой ящерицы паразитемия представлена лишь
трофозоитами и меронтами (Thompson, Huff, 1944).
Однако у паразита восстанавливается способность
продуцировать гаметоциты при инокуляции заражен-
ной крови С. collaris типовому хозяину.
Весенние рецидивы паразитемии имеют место.
В хронический период инфекции паразитемия пред-
284
ALVEOLATA
Рис. 163. Plasmodium (Paraplasmodium) mexicanum из экспериментально зараженных ящериц Sceloporus torquatus (1—3), S. undulatus
(4—6), Crotaphytus collaris (7—9,12—19, 22) и Phrynosoma cornutum (10,11, 20, 21). (По: Thompson, Huff, 1944, с изменениями и дополне-
ниями).
1,2, 5, 7 — макрогаметоциты; 3, 6 — микрогаметоциты; 8—10 — эритроцитарные меронты в зрелых эритроцитах (8, 9) и в эритробласте (10); 11,12 — тро-
фозоиты в эритробласте (11) и лимфоците (12); 13—16 — экзоэритроцитарные меронты в лимфоцитах (13,14,16) и в тромбоците (15); 17 — трофозоит в мо-
ноците; 18,19 — экзоэритроцитарные меронты в моноцитах; 20, 21 — экзоэритроцитарные меронты в полинуклеядерном лейкоците (20) и циркулирующем
макрофаге (21); 22 — мерозоиты из экзоэритроцитарного меронта; пг — пигментная гранула, яд — ядрышко, якх—ядро клетки-хозяина, ял — ядро паразита.
Масштаб: 10 мкм.
Fig. 163. Plasmodium (Paraplasmodium) mexicanum from experimentally infected lizards Sceloporus torquatus (1—3), 5. undulatus (4—6), Cro-
taphytus collaris (7—9, 12—19, 22) и Phrynosoma cornutum (10, 11, 20, 21).
I, 2, 5, 7 — macrogametocytes; 3, 6—microgametocytes; 8—10 — erythrocytic meronts in mature erythrocytes (8, 9) and erythrocytoblast (10); 11,12 —trophozoi-
tes in erythrocytoblast (11) and lymphocyte (12); 13—16 — exoerythrocytic meronts in lymphocytes (13,14,16) and thrombocyte (15); 17— trophozoite in monocyte;
18,19— exoerythrocytic meronts in monocytes; 20, 21 — exoerythrocytic meronts in granulocyte (20) and circulating macrophage (21); 22 — merozoites from exo-
erythrocytic meront; m — pigment granule, яд — nucleolus, якх — host-cell nucleus, ял — nucleus of parasite.
Scale bar: 10 pm.
ставлена только гаметоцитами, среди которых преоб-
ладают зрелые паразиты.
Спорогония завершается в москитах Lutzomyia ve-
xatrix через 9—11 дней после заражения при темпера-
туре 24—26 °C и относительной влажности 75 %
(Ayala, Lee, 1970). Оокинеты многочисленны в содер-
жимом кишечника москитов в период между 10 и 18 ч
после питания на зараженных ящерицах. Сформиро-
вавшиеся оокинеты представляют собой червеобраз-
ные тела с компактным ядром и пигментными
гранулами в цитоплазме (рис. 164, 14). Один их конец
закруглен, а другой заострен. Длина оокинет около
10— 16, а ширина — 2—3 мкм. Оокинеты мигрируют
через стенку средней кишки москитов и инцистируют-
ТИП SPOROZOA. КЛАСС COCCIDEA
285
пг
яп
Рис. 164. Plasmodium {Paraplasmodium) mexicanum.
I 1Ii.i; J 7 эритроцитарные меронты; 8—10 — макрогаметоциты; 1], 12 — микрогаметоциты; 13 — экзоэритроцитарный меронт в эндотепи-
tillMlult kltetlm liilillinmipii юпоииого мозга; 14— оокинета; 15— спорозоиты; вк—вакуоль, яг — пигментная гранула,яд — ядрышко,якх — ядро клетки-хо-
зяина, яп — ядро паразита.
Масштаб: 10 мкм.
Fig. 164. Plasmodium {Paraplasmodium) mexicanum.
I -—trophozoites; 2 7 erythrocytic meronts; Я—10 — macrogametocytes; 11,12 — microgametocytes; 13 — exoerythrocytic meront in endothelial cell of brain ca-
pillary; 14 — ookinete; 15 sporozoites; вк — vacuole, m — pigment granule, яд — nucleolus, якх — host-cell nucleus, яп — nucleus of parasite.
Scale bar: 10 pm.
286
ALVEOLATA
ся с ее наружной стороны, давая начало ооцистам.
В ооцистах формируется несколько герминативных
цен трон. Через 9 дней после заражения диаметр ооцист
достигает 25 мкм. Они содержат активные спорозои-
ты. Диаметр зрелых ооцист достигает 30—40 мкм. Они
содержат многие сотни спорозоитов. Спорозоиты
(рис. 164, /5) отмечены в гемоцеле и в слюнных желе-
зах москитов в период между 11 и 14 днями после зара-
жения. В сухих окрашенных препаратах длина сфор-
мировавшихся спорозоитов колеблется в пределах
4—6 мкм в длину, а ширина около 0.8 мкм. По форме и
размерам они похожи на эритроцитарные и экзоэрит-
роцитарные мерозоиты. Скорость спорогонии у раз-
ных штаммов паразита при содержании москитов в
аналогичных условиях варьирует. Причины этого не
выяснены. Появление спорозоитов в слюнных железах
москитов отмечается уже через 6.5 дня после зараже-
ния, хотя заразными для ящериц они становятся не ра-
нее 8-го дня (Klein et al., 1987).
Подрод Asiamoeba Telford, 1988
Эритроцитарные меронты и гаметоциты непропор-
ционально сильно отличаются по размерам. Размеры
зрелых эритроцитарных меронтов в среднем не превы-
шают 1/4 размеров ядер незараженных эритроцитов.
Эритроцитарные меронты содержат 3—4 мерозоита.
Размеры зрелых гаметоцитов превышают размеры
ядер незараженных эритроцитов в среднем в 2—8 раз.
Зрелые гаметоциты крупнее зрелых меронтов в сред-
нем в 4—14 раз. Макрогаметоциты обычно крупнее
микрогаметоцитов. Гаметоциты развиваются в эритро-
цитах. Экзоэритроцитарная мерогония и спорогония
не изучены. Паразиты ящериц (Sauria, Squamata).
Типовой вид Plasmodium (Asiamoeba) saurocau-
datum Telford, 1983.
Видовой состав. В подрод входятР. (A.) clelan-
di Manawadu, 1972; Р. (A.) lygosomae Laird, 1951;
Р. (A.) lionatum Telford, 1982; Р. (A.) vastator Laird,
1960 (всего 5 видов).
Plasmodium (Asiamoeba) saurocaudatum Telford, 1983.
Распространение: обнаружен в Таиланде и
Сингапуре.
Хозяева: Mabuya multifasciata (Scincidae, Sauria)
(типовой хозяин).
Переносчик: неизвестен.
Жизненный цикл и морфология
Экзоэритроцитарная мерогония не изучена.
Трофозоиты (рис. 165, 7). Развиваются в эритроци-
тах. Обычно занимают латеральное по отношению к
ядру зараженного эритроцита положение и не касают-
ся его ядра. Их форма часто близка к треугольной.
Амебоидность нехарактерна. Вакуоли изредка присут-
ствуют в выросших трофозоитах. Пигмент в виде од-
ной маленькой гранулы появляется в трофозоитах,
длина которых достигает около 2—3, а ширина —
1 мкм. Воздействие паразитов на зараженные эритро-
циты не выражено.
Эритроцитарные меронты (рис. 165, 2—6). Раз-
виваются в эритроцитах и чаще занимают латеральное
положение по отношению к ядру клетки-хозяина. Ци-
топлазма окрашивается в голубые тона, невакуолизи-
рованная. Двухъядерные и зрелые меронты обычно ве-
ерообразные (рис. 165, 2—5). Зрелые меронты могут
быть также крестовидной формы (рис. 165, 6). Ядра в
выросших меронтах расположены веерообразно или
крестовидно. Пигментная гранула обычно одна, распо-
ложена в основании веерообразных меронтов. В меро-
нтах формируется 3—4 мерозоита, длина которых око-
ло 1.5, а ширина — 1 мкм. Цитоплазма в мерозоитах
неразличима. Воздействие паразитов на зараженные
эритроциты не выражено. Размеры зрелых меронтов в
среднем не превышают 1/4 размеров ядер незаражен-
ных эритроцитов. Их длина колеблется в пределах око-
ло 2—3, а ширина — в пределах 1—3 мкм.
Макрогаметоциты (рис. 165, 8—12). Развиваются
в эритроцитах. Цитоплазма окрашивается в голубые
тона. Юные гаметоциты (рис. 165, 7) овальной или уд-
линенной формы, часто расположены латерально по
отношению к ядру зараженного эритроцита. По мере
роста гаметоциты сильно увеличиваются в размерах.
Они округляются и могут полностью заполнять зара-
женные эритроциты. В выросших гаметоцитах часто
присутствуют немногочисленные (обычно 1—2, из-
редка до 5) крупные вакуоли (рис. 165, 8, 10—72).
Ядро гаметоцитов вариабельной формы, окрашивается
в различные оттенки розового цвета. Ядрышко четко
выражено, расположено на границе с цитоплазмой
(рис. 165, 8—72). Пигментные гранулы многочислен-
ные, мелкие (< 0.5 мкм) и средних размеров (0.5—
1 мкм), округлые или слегка удлиненные, беспорядоч-
но разбросаны в цитоплазме, сгруппированы в кучки
или агрегированы в компактные массы темно-желтого
цвета. Гаметоциты сильно деформируют и гипертро-
фируют зараженные эритроциты, ядро которых дефор-
мируется и смещается на периферию. Воздействие га-
метоцитов существенно зависит от возраста инвазии.
В период хронической паразитемии гаметоциты сильно
гипертрофируют ядро зараженных эритроцитов, что не-
характерно для первичной паразитемии. Длина вырос-
ших гаметоцитов колеблется в пределах 8—19, а ши-
рина — в пределах 5—14 мкм. Их размеры превышают
размеры ядер незараженных эритроцитов в среднем в
2—8 раз, причем наиболее крупные гаметоциты разви-
ваются в период хронической паразитемии, когда ме-
ронты в периферической крови обычно отсутствуют.
Микрогаметоциты (рис. 165, 73—76). От макрога-
метоцитов отличаются признаками полового димор-
физма. Цитоплазма окрашивается бледно и может
быть почти бесцветной. Рядом с ядром на границе с
цитоплазмой присутствует одна или две компактные
массы хроматина. Размеры микрогаметоцитов в сред-
нем несколько меньше размеров макрогаметоцитов.
Другие признаки, как у макрогаметоцитов.
Подрод Ophidiella Garnham, 1966
Размеры эритроцитарных меронтов и гаметоцитов
в среднем равны размерам ядер незараженных эритро-
цитов или превышают их. Эритроцитарные меронты
ТИП SPOROZOA. КЛАСС COCCIDEA
287
Рис. 165. Plasmodium (Asiamoeba) saurocaudatum.
I Tpoi|ii>'loiiT, } fi эритроцитарные меронты, 7—72— макрогаметоциты, /3—16— микрогаметоциты; вк — вакуоль, пг—пигментная гранула, якх —
ядро клетки-хозяина, яп — ядро паразита.
Масштаб: 10 мкм.
Fig. 165. Plasmodium (Asiamoeba) saurocaudatum.
I - trophozoite, 2- ft erythrocytic meronts, 7——12 — macrogametocytes, 13—16—microgametocytes; вк — vacuole, m — pigment granule,якх — host-cell nuc-
leus, яп — nucleus of parasite.
Scale bar: 10 pm.
288
ALVEOLATA
содержат от 8 до 36 мерозоитов. Макрогаметоциты
обычно в среднем крупнее микрогаметоцитов. Гамето-
циты развиваются в клетках эритроцитарного ряда.
Экзоэритроцитарная мерогония и спорогония не изу-
чены. Паразиты змей (Serpentes, Squamata).
Типовой вид Plasmodium (Ophidiella) wenyoni
Garnham, 1965.
Видовой состав. В подрод входят Р. (О.) bids
Fantham et Porter,-1950; P. (О) melanoleuca Fantham et
Porter, 1950; P. (O.) pessoai Ayala, Moreno et Bolanos,
1978; P. (O.) pithonis Fantham et Porter, 1950; P. (O.) to-
modoni Pessoa et Fleury, 1968 (всего 6 видов).
Plasmodium (Ophidiella) wenyoni Gamham, 1965.
Распространение: Бразилия.
Хозяин: Thamnodynastes pallidus (Colubridae, Ser-
pentes) (типовой хозяин).
Переносчик: неизвестен.
Жизненный цикл и морфология
Экзоэритроцитарная мерогония не изучена.
Трофозоиты (рис. 166,1, 2). Развиваются в эритро-
цитах и обычно расположены на одном из полюсов
клеток-хозяев. Их форма вариабельная, а очертания
варьируют от ровных до резко амебоидных. Цитоплаз-
ма вакуолизирована. Пигментные гранулы труднораз-
личимы. Выросшие трофозоиты не деформируют зара-
женные эритроциты, но могут слегка смещать их ядро.
Эритроцитарные меронты (рис. 166, 3—6). Раз-
виваются в зрелых эритроцитах. Обычно расположены
вблизи одного из полюсов клетки-хозяина. Цитоплаз-
ма окрашивается в голубые тона, обычно не содержит
четко выраженных вакуолей. Форма меронтов вариа-
бельная, а очертания обычно неровные, довольно час-
то волнистые. Пигментные гранулы мелкие, темно-ко-
ричневые, трудноразличимые. Ядра в выросших меро-
нтах расположены аморфно (рис. 166, б) или по
периферии (рис. 166, 5), реже веерообразно. В меро-
нтах формируется около 8—14 ядер. Меронты на ста-
дии сегментации мерозоитов не были обнаружены. Па-
разиты слегка деформируют зараженные эритроциты
и смещают их ядро. Длина выросших меронтов около
5—9 (в среднем 6.1), а ширина — 4—8 (в среднем
5.2) мкм.
Макрогаметоциты (рис. 166, 7—10). Развиваются
в зрелых эритроцитах и обычно расположены вблизи
одного из полюсов клеток-хозяев. Цитоплазма окра-
шивается в голубые тона, слабовакуолизированная.
Форма гаметоцитов чрезвычайно вариабельна, но бли-
же к округлой или овальной, чем к удлиненной. Очер-
тания паразитов варьируют от ровных до волнистых
и рваных. Ядро гаметоцитов компактное, небольшое.
Ядрышко различимо в некоторых гаметоцитах. Пиг-
ментные гранулы мелкие (0.5 мкм), округлые, тем-
но-коричневого цвета, обычно беспорядочно разброса-
ны в цитоплазме, но могут также быть сгруппированы
в кучки. Число пигментных гранул колеблется от 4 до
25. Выросшие гаметоциты слегка деформируют зара-
женные эритроциты и смещают их ядро. Длина зрелых
гаметоцитов около 6—14 (в среднем 8), а ширина —
4—9 (в среднем 5.2) мкм.
Микрогаметоциты (рис. 166, 11, 12). От макрога-
метоцитов отличаются признаками полового димор-
физма. В ядре присутствует несколько компактных
скоплений хроматина. Размеры микрогаметоцитов в
среднем меньше размеров макрогаметоцитов. Другие
признаки как у макрогаметоцитов.
Паразиты птиц
Подрод НаетатоеЬа Grassi et Feletti,
1890
Растущие эритроцитарные меронты содержат обиль-
ную цитоплазму. Размеры выросших эритроцитарных
меронтов превышают размеры ядер зараженных эрит-
роцитов. Выросшие гаметоциты округлые, овальные
или иррегулярной формы. Их размеры существенно
превышают размеры ядер зараженных эритроцитов.
Экзоэритроцитарная мерогония проходит в клетках
ретикулоэндотелиальной системы. Стеблевидный вы-
рост (ножка) в ооцистах отсутствует. Паразиты птиц
из многих отрядов.
Типовой вид Plasmodium (Haemamoeba) relic-
turn (Grassi et Feletti, 1891).
Видовой состав. В подрод входятР. (Н.) cathe-
merium Hartman, 1927; Р. (Н.) grifflthsi Gamham, 1966;
Р. (Н.) matutinum Huff, 1937; Р. (Н.) subpraecox (Grassi
et Feletti, 1892); P. (H.) tejerai Gabaldon et Ulloa, 1977 и
другие гемамебы (всего 10 видов).
Plasmodium (Haemamoeba) relictum (Grassi et Fe-
letti, 1891).
(= Haemamoeba relicta Grassi et Feletti, 1891; Haemoproteus ala-
udae Celli et Sanfelice, 1891 (partim); Proteosoma grassii Labbe, 1894;
Haemamoeba majoris Laveran, 1902 (partim); Plasmodium passeris
Johnston et Cleland, 1909; Proteosoma biziurae Gilruth, Sweet
et Dodd, 1910; Plasmodium inconstans Hartman, 1927; P. maior Raf-
faele, 1930; P. capistrani Russell, 1932; P. chloropsidis Mello,
1935; P. paddae Brumpt, 1935; P. praecox var. muniae Das Gupta et
Siddons, 1941; P. relictum var. spheniscidae Fantham et Porter, 1944;
P. ploceii Chakravarty et Kar, 1945; P. pericrocoti Chakravarty et Kar,
1945).
Распространение: всесветное, за исключением
крайних северных и южных регионов планеты.
Хозяева: Passer hispaniolensis (Passeridae, Passeri-
formes) (типовой хозяин). Паразит обнаружен у более
300 видов птиц из разных отрядов, но главным обра-
зом у воробьиных.
Переносчики: многочисленные виды комаров
из родов Aedes, Anopheles, Culex и Culiseta (Culicidae).
Эффективным переносчиком является Culex pipiens.
Этот комар распространен всесветно, что (наряду с
широкой специфичностью к позвоночному хозяину)
объясняет космополитическое распространение Р. (Н.) re-
lictum.
Практическое значение. Ввиду космопо-
литического распространения и обширного круга по-
звоночных хозяев этот патогенный паразит имеет
большое значение при реализации программ по охране
и восстановлению популяций редких и исчезающих
видов птиц (Riper III, 1991; Валькюнас, 1997). Страда-
ют от паразита птицы в зоопарках (Cranfield et al.,
1990).
Рис. 131. Стадии развития кокцидий рода Caryospora.
1 - (', duszvnskii: ооциста, выделенная с фекалиями змеи Elaphe obsoleta spiloides\ 2, 3 — С. simplex: кариоциста (2) и неспорулированные ооцисты (3) в тка-
ни щечных мышц мыши через 40 сут после заражения (фото S. Upton).
Fig. 131. Developmental stages of Caryospora.
1 - oocyst of C. duszynskii in feces of the snake Elaphe obsoleta spiloides-, 2, 3 — caryocyst (2) and unsporulated oocyst (3) of C. simplex in cheek muscles of a mouse
40 days after infection.
Рис. 132. Эндогенные стадии развития Toxoplasma gondii.
В организме мыши: 7 — тахизоиты в перитонеальном экссудате; 2, 3 — цисты в головном мозгу (фото Т. В. Бейер); кх — клетка хозяина, ц — циста, цз — цис-
тозоит, э — эндозоит (= тахизоит).
Fig. 132. Endogenous developmental stages of Toxoplasma gondii.
In the mouse body: 7 — tachyzoites in the peritoneal exudate; 2, 3 — tissue cyst in the brain; кх — host cell, ц — cyst, цз — cystozoite, э — endozoite (= tachyzoite).
Рис. 133. Эндогенные стадии развития Toxoplasma gondii (продолжение).
В кишечнике кошки: 4, 5 — бесполые стадии разных генераций; 6 — макрогаметы (фото Т. В. Бейер); лиг — макрогамета, ме — мерозоит, я — ядро.
Fig. 133. Endogenous developmental stages of Toxoplasma gondii (continuation).
In the cat intestine: 4, 5 — asexual stages of different generations; 6 — macrogametes; ма — macrogamete, ме — merozoite, я — nucleus.
Рис. 134. Эндогенные стадии развития Toxoplasma gondii (продолжение).
II кишечнике кошки: 7— макрогамета и сегментированный микрогаметоцит с микрогаметами, 8— ядра микрогамет после окраски на ДНК по Фёльгену,
V ооцисты на разных этапах созревания оболочки, реакция ШИК на полисахариды (фото Т. В. Бейер); мг — микрогамета, мгц — микрогаметоцит, оо —
ооциста.
Fig. 134. Endogenous stages of Toxoplasma gondii (continuation).
I II flic ent intestine: 7—macrogamete and a segmented microgamont with a few microgametes, 8 — Feulgen-stained (DNA) nuclei of microgametes, 9 — oocyst wall at
different steps of maturation, PAS (polyaccharides) staining; мг — microgamete, мгц — microgametocyte, oo — oocyst.
Рис. 135. Тканевые цисты кокцидий.
1,2 — Besnoitia besnoiti (фото Т. В. Бейер); 3 — Frenkelia glareoli (фото с препарата J. Vavra); 4, 5 — Sarcocystis dispersa (фото с препарата Z. Сета); 6 —
S. bovicanis (фото А. Л. Метсиса).
Fig. 135. Tissue cysts of different genera of cyst-forming coccidia.
1,2 — Besnoitia besnoiti', 3 — Frenkelia glareoli', 4, 5 — Sarcocystis dispersal 6 — S. bovicanis.
Рис. 136. Тканевые цисты кокцидий (продолжение).
Hexiwilitl heXHuili'. f l|ipill MUM । ......mi. A' — участок вторичной оболочки рядом с зараженной клеткой; встречные стрелки — первичная оболочка
цпе и*1 (фото II, М. иН’Д<нчнч1Ко) -• ни \>< и. «ам* вторичная оболочка, к коноид, кв — коллагеновые волокна, кх — клетка хозяина, мн — микронемы,
/• ..... ц - циста, дз — цистозонт. я — ядро, якх — ядро клетки хозяина.
l ip, 1 К». I г.'.не cysls of different genera of cyst-forming coccidia (continuation).
/, <V iiesnoitia besnoiti'. I'rngineni .»i th. w h..h . \ a w all (7). fragment of the secondary cyst wall near the infected cell (<?); two opposite arrows — primary cyst wall;
и vacuole, воб — secondary wall > *.....I /< <dl;igvnous fibers, кх - host cell, мп — micronemes.y?— rhoptries, ц — cyst, цз — cystozoite, я— nucleus,
якх — host cell nucleus.
Рис. 137. Стадии развития Neospora caninum.
1 — зоиты («тахизоиты») в печени экспериментально зараженной крысы, окраска гематоксилином-эозином; 2 — тканевая циста в мозгу спонтанно заражен-
ной собаки, окраска толуидиновым синим (фото J. Р. Dubey).
Fig. 137. Developmental stages of Neospora caninum.
1 — zoites («tachyzoites») in the liver of an experimentally infected rat, eosin-haematoxylin staining; 2 — tissue cyst in the brain of a spontaneously infected dog, tolui-
dine blue staining.
Рис. 138. Стадии развития Neospora caninum (продолжение).
3 — скопление зоитов N. caninum в клетках спинного мозга спонтанно зараженной собаки (фото J. Р. Dubey).
Fig. 138. Стадии развития Neospora caninum (continuation).
3 — a group of N. caninum zoites in the spinal cord cells of a spontaneously infected dog.
Рис. 139. Эндогенные стадии развития кокцидий рода Sarcocystis.
.S', disperse: 1,2 — предцистные меронты в печени мыши: незрелый (7) и сегментированный (2) (фото с препаратов Z. Сегп£); ме — мерозоиты, мер — меронт,
я — ядро.
Fig. 139. Developmental stages of Sarcocystis disperse in the intermediate host.
1,2 — precystic meronts in the mouse liver: immature (7) and segmented (2) ones; ме — merozoites, мер — meront, я — nucleus.
Рис. 140. Эндогенные стадии развития кокцидий рода Sarcocystis (продолжение).
S. fusiformis: 3, 4 — фрагменты цисты из мышц буйвола (фото с препарата Г. Д. Гаибовой); ме — «цистные мерозоиты», мц — метроциты.
Fig. 140. Endogenous stages of Sarcocystis fusiformis in the intermediate host (continuation).
3, 4 — fragments of cysts from buffalo muscles; ме — «cyst merozoites», мц — metrocyte.
Рис. 141. Эндогенные стадии развития кокцидий рода Sarcocystis (продолжение).
5, 6 — из мышц свиньи, нативный препарат (фото Т. В. Бейер); цме — «цистные мерозоиты», цс — цистная стенка, я — ядро.
Fig. 141. Developmental stages of Sarcocystis miescheriana in the intermediate host (continuation).
5, 6 — cyst stages on squashed preparations of fresh pig muscles; цме — «cyst merozoites», цс — cyst wall, я — nucleus.
1
Рис. 142. Эндогенные стадии развития кокцидий рода Sarcocystis (продолжение).
7 — метроциты S. bovicanis на периферии саркоцисты (фото А. Л. Метсиса), 8 — глубокие инвагинации пелликулы делящихся метроцитов S. muris облегча-
ют цитокинез (фото Е. Vivier, Е. Porchet-Hennere); а — амилопектин, в — вакуоль, ин — инвагинация, кх — клетка хозяина, м — митохондрии, мпфв — мемб-
рана паразитофорной вакуоли, мц — метроцит, овц — основное вещество цисты, пе — пелликула, щ — щель, я — ядро.
Fig. 142. Developmental stages of Sarcocystis spp. in the intermediate host (continuation).
7 — metrocytes of S. bovicanis on the sarcocyst periphery, 8 — dividing metrocytes of S', muris'. deep pellicle invaginations seem to fascilitate cytokinesis; a — amylo-
pectin, в — vacuole, uh — invagination, кх — host cell, м — mitochondria, мпфв — membrane of parasitophorous vacuole, мц — metrocyte, овц — ground substance of
the cyst, ne — pellicle, щ — fissure, я — nucleus.
Рис. 143. Эндогенные стадии развития кокцидии рода Sarcocystis (продолжение).
S, Iviwlltl,' V участок цисты, но данным сканирующей электронной микроскопии. Ю к> же. фрш мет при большем увеличении (фото Е. Vivier, Рог-
chet-Henncrc); ме — мерозоиты, мп — микропора. с ccim.i саркоцисты.
|<Чц. 143. Developmental stages of Sarcocystis tenella in the intcmicdiale host (continuation).
V Ihlgnioilt of NlircocyHt no okIihj- (<> scanning electron microscopy. 10 — the same al higher map.ml'icalion; wc merozoites, мп — micropore, c — septae.
Рис. 144. Эндогенные стадии развития кокцидий рода Sarcocystis (продолжение).
S. ovifelis: 11 — средняя часть саркоцисты с многочисленными цистными стадиями продвинутого возраста — гамонтами (фото Я. С. Грикенене); к — коно-
ид, мн — микронемы, р — роптрии, я — ядро.
Fig. 144. Endogenous stages of Sarcocystis ovifelis in the intermediate host (continuation).
11 — the middle part of a sarcocyst containing numerous gamonts (= cyst stages of advanced age); к — conoid, мн — micronemes, p — rhoptries, я — nucleus.
Рис. 146. Цисты (макроцисты) Sarcocystis ovifelis в мышцах пищевода
овцы; стрелки — многочисленные макроцисты, видимые невооруженным
взглядом (фото Я. С. Грикенене).
Fig. 146. Cysts (macrocysts) of Sarcocystis ovifelis in the ovine oesophageal
musles.
Numerous macrocysts (arrows) are easily recognized with the naked eye.
Рис. 147. Цисты Sarcocystis в мышцах человека.
1—3 — мышцы из левого колена взрослого человека
(при разных увеличениях), 4 — саркоциста из мышцы
сердца 8-летнего мальчика (фото Р. С. Beaver).
Fig. 147. Tissue cysts of Sarcocystis in human musc-
les.
1—3 — sarcocysts from the left knee muscles of an adult
man (at different magnifications), 4 — sarcocyst from the
heart muscle of an 8 year old boy.
Рис. 223. Внешний вид различных инфузорий I.
а — Blepharisma, б — Chilodonella, в — Aspidisca (дорсальная сторона), г — Aspidisca (вентральная сторона), д — Coleps, е — Colpoda, ж — Condilostoma,
з — Dendrocometes. Электронограммы, сканирующий микроскоп.
Масштаб: 10 мкм (б, д), 20 мкм (в, г, е, з), 40 мкм (а), 100 мкм (ж).
Фотографии любезно предоставлены проф. Христианом Барделе, Тюбинген, Германия.
Fig. 223. General view of different ciliates I.
a — Blepharisma. 6 — Chilodonella, в — Aspidisca (dorsal view), г — Aspidisca (ventral view), d — Coleps, e — Colpoda, ж — Condilostoma, з — Dendrocometes.
Scunning electron micrographs.
Bar = 10 pm (6, d), 20 pm (в, г, e, з), 40 pm (a), 100 pm (ж).
Рис. 224. Внешний вид различных инфузорий II.
fl И l.<'\>’/>hvllum, 6 — Didinium. <’ — Кегона, О — Metopus, е — Ophryoscolex. .ж- — Paramecium. з — Phascolodon. Электронограммы, сканирую-
щий микроскоп.
Масштаб: 10 мкм (?), 20 мкм (г, д). 40 мкм (а. а, е. ж). 100 мкм (б).
Фотографии любезно предоставлены проф. Христианом Бардслс. Тюбинген. Германия.
It /.ННН/М, fi I Г'п th,»,
Fig. 224. General view of different ciliates IT.
/ m/iuium. г — Kerona. d — Metopus, e — Ophryoscolex, ж — Paramecium, з — Phascolodon. Scunning electron micrographs.
Bar= 10 pm (?), 20 pm (г, d), 40 pm (а, в, e. ж). 100 pm (o).
Рис. 225. Внешний вид различных инфузорий III.
а — Pseudourostyla, б — Spirochona, в — Phascolodon, г — Pseudomicrothorax, д — Tetrahymena, е — Urocentrum. Электронограммы, сканирующий микро-
скоп.
Масштаб: 10 мкм (Э), 20 мкм (б, в, г, е), 40 мкм (а).
Фотографии любезно предоставлены проф. Христианом Барделе, Тюбинген, Германия.
Fig. 225. General view of different ciliates III.
a — Pseudourostyla, 6 — Spirochona, в — Phascolodon, г — Pseudomicrothorax, d — Tetrahymena, e — Urocentrum. Scunning electron micrographs.
Bar =10 gm (d), 20 pm (б, в, г, e), 40 pm (a).
ТИП SPOROZOA. КЛАСС COCCIDEA
289
Рис. 166. Plasmodium (Ophidiella) wenyoni.
1,2 — трофоюиты; .1—6 — эритроцитарные меронты; 7—10 — макрогаметоциты; 11, 12 — микрогаметоциты; иг — пигментная гранула, якх — ядро
клетки-хозяина, яп — ядро паразита.
Масштаб: 10 мкм.
Fig. 166. Plasmodium (Ophidiella) wenyoni.
1,2 - trophozoites; 3—6 — erythrocytic meronts; 7—10 — macrogametocytes; 11, 12 - niicrountnotocytes; m — pigment granule, якх — host-cell nucleus, яп —
nucleus of parasito.
Scale bar: 10 pin,
19 Зак. №4163
290
ALVEOLATA
Жизненный цикл и морфология
Развитие в позвоночном хозяине и в переносчике
различных подвидов и штаммов Р. (Н.) relictum зачас-
тую отличается в деталях. Ниже приводится описание
развитая в канарейке штамма этого паразита, выделен-
ного из типового позвоночного хозяина (испанский во-
робей) в типовом местонахождении (Сицилия). Пер-
вичные экзоэритроцитарные меронты (криптозоиты и
метакриптозоиты) развиваются в клетках ретикулоэн-
дотелия во многих органах (рис. 167,1, 2), включая пе-
чень, селезенку, легкие, почки, сердце, костный и го-
ловной мозг. Важно отметить, что в головном мозгу
лишь изредка регистрируются единичные меронты.
Вторичные экзоэритроцитарные меронты (фанерозои-
ты) (рис. 167, 3; 168) обнаружены в клетках эндотелия
капилляров головного мозга канареек, погибших по-
сле инокуляции им крови, содержавшей зрелые эрит-
роцитарные меронты. Фанерозоиты регистрируются
не ранее 18-го дня после заражения канареек. В период
с 18-го по 64-й день после заражения в капиллярах
головного мозга они регистрируются регулярно. Еди-
ничные фанерозоиты выявлены также в печени. В тка-
нях других органов они не обнаружены. Во всех орга-
нах, за исключением головного мозга, экзоэритроци-
тарные меронты представляют собой округлые или
овальные тела (рис. 167,1, 2). В головном мозгу обна-
ружены меронты удлиненно-червеобразной формы
(рис. 167, 3; 168,1—4). Максимальная длина экзоэрит-
роцитарных меронтов во всех органах не превышает
120 мкм, а максимальное число мерозоитов в них 180.
Однако размеры меронтов обычно меньше. Цитоплаз-
ма растущих меронтов окрашивается в интенсивно-го-
лубой цвет, не содержит вакуолей. Мерозоиты, форми-
рующиеся в экзоэритроцитарных меронтах, овальные
или слегка удлиненные. Препатентный период разви-
тия при заражении спорозоитами не превышает 120 ч.
Эритроцитарная мерогония синхронизирована слабо,
и потому точно определить периодичность эритро-
цитарной мерогонии сложно. Обычно цикл эритро-
цитарной мерогонии завершается через 30—36 ч. Ме-
розоиты из эритроцитарных меронтов освобождаются
в утренние часы. Гаметоциты в крови появляются од-
новременно с трофозоитами. Первичная паразитемия
обычно длится не более 30 дней. Затем болезнь пере-
ходит в хроническую форму, и в течение 3—4 мес в пе-
риферической крови регистрируются лишь единичные
паразиты.
Трофозоиты (рис. 169, 1, 2). Развиваются в моло-
дых и зрелых эритроцитах. Самые юные округлые или
овальные, реже иррегулярные. Иногда отмечаются не-
большие амебоидные выросты цитоплазмы. Ядро от-
носительно крупное. Стадия «кольца» нехарактерна.
По мере роста количество цитоплазмы увеличивается,
появляется одна гранула пигмента, которая располага-
ется ближе к пелликуле паразита. В цитоплазме не-
которых растущих трофозоитов имеется одна или не-
сколько мелких вакуолей. Выросшие трофозоиты
содержат несколько гранул темно-золотистого или ко-
ричневого пигмента. Очертания выросших трофозои-
тов обычно ровные или иррегулярные, реже слабоаме-
боидные. Ядро клетки-хозяина смещается, а сама клет-
ка деформируется на самых ранних этапах развития
трофозоитов (рис. 169, 2). При интенсивной паразите-
мии весьма обычна инвазия одного эритроцита не-
сколькими паразитами.
Эритроцитарные меронты (рис. 169, 3—9). Фор-
ма округлая, овальная или иррегулярная. Сильно сме-
щают и могут полностью вытеснять ядро из заражен-
ных эритроцитов (рис. 169, 8). По мере роста меронта
размеры ядер уменьшаются. Пигментные гранулы со-
браны в одну, реже в несколько (не более трех) локаль-
ных масс, которые не имеют постоянного местополо-
жения в паразите. Пигмент может агрегироваться в
одно монолитное скопление (рис. 169, 6). Пигментные
гранулы черного цвета. В зрелых меронтах цитоплазма
плохо различима. Число мерозоитов в меронтах у раз-
ных штаммов колеблется от 6 до 32, но наиболее час-
то — от 10 до 24.
Макрогаметоциты (рис. 169, 10—14). Обычно
округлой или овальной, реже иррегулярной формы.
Сильно смещают и могут полностью вытеснять ядро
из зараженного эритроцита. Клетка-хозяин деформи-
руется. Цитоплазма гаметоцитов окрашивается интен-
сивно в различные оттенки синего цвета, изредка
содержит мелкие (диаметр < 1 мкм) вакуоли. Ядро га-
метоцитов компактное, не имеет постоянного место-
положения. Ядрышко обычно четко выражено. Пиг-
ментные гранулы мелкие (< 0.5 мкм), реже средних
размеров (0.5—1 мкм), округлые, обычно беспорядоч-
но разбросаны в цитоплазме. Иногда пигментные гра-
нулы образуют скопления вблизи пелликулы гамето-
цита, что в целом нехарактерно для этого вида. Пиг-
мент темно-коричневый или черный. Число гранул
пигмента колеблется в больших пределах, но обычно
их менее 30. Наибольший диаметр гаметоцитов в сред-
нем около 7 мкм.
Микрогаметоциты (рис. 169, 15, 16). От макрога-
метоцитов отличаются признаками полового димор-
физма.
У комаров Culex pipiens при температуре 22—25 °C
оокинеты регистрируются в содержимом кишечника
через 24—48 ч после заглатывания крови, содержащей
зрелые гаметоциты. Оокинеты представляют собой
червеобразные тела, длина которых в сухих окрашен-
ных препаратах в среднем около 16, а ширина —
3 мкм. Содержат центрально расположенное ядро,
крупные вакуоли и многочисленные гранулы пигмента
(рис. 167, 4, 5). Ооцисты впервые регистрируются в
средней кишке комаров через 4 дня после заражения.
Созревают через 6 дней. Процесс спорогонии несинх-
ронизирован. Диаметр выросших ооцист при фикса-
ции раствором Карнуа в среднем около 38 мкм. Ооци-
сты содержат гранулы пигмента, количество которых
не превышает 12. Обычно пигмент сгруппирован в
кучку, не имеющую в ооцисте постоянного местополо-
жения (рис. 167, 6—9). Спорозоиты обнаружены в
слюнных железах переносчика на 7-й день после зара-
жения. Они представляют собой червеобразные тела с
центрально расположенным ядром (рис. 167, 10—12).
Длина спорозоитов в сухих окрашенных препаратах в
среднем около 14, а ширина — 1.4 мкм.
ТИП SPOROZOA. КЛАСС COCCIDEA
291
10 мкм
>l(i I
Рис. 167. Plasmodium (Haemamoeba) relictum.
|Ы M flOIIII l ирныо меронты: растущий (7) и зрелый (2) меронты первой генерации в селезенке, растущий фанерозоит в головном мозгу (3); 4,5 —
IM 1 IHHIMDI’M соответственно на 3-й, 4-й, 6-й и 7-й дни после заражения переносчиков; 10—12 — спорозоиты; вк — вакуоль, ме — мерозоит,
« пг — пигментная гранула, яп — ядро паразита.
MrtlllMfil 10 МКМ (/ 5, 10—12), 30 мкм (6—9). (1—5, 10—12 — по: Валькюнас, 1997, -6—9 — по: Garnham, 1966, с изменениями).
Fig. 167. Plasmodium (Haemamoeba) relictum.
I 1 KHtlirylhhlvy I le 1ЦНГ011111 uro Whig (/) and mature (2) meronts of the first generation in spleen, and growing phanerozoite in brain (3); 4, 5 — ookinetes; 6—9—
tltwy III HI 1, 4, ft ttlltl 7 tiny I It h»r lllftwl Ion of vectors, respectively; 10—12 — sporozoites; вк — vacuole, ме — merozoite, m — pigment granule, an — nucleolus of
parasite.
Scale bar: 10 pm (1—5, 10—12), 30 pm (6—9).
292
ALVEOLATA
Рис. 168. Молодые (1, 2) и зрелые (3, 4) фанерозоиты Plasmodium (Haemamoeba') relictum в головном мозгу канареек.-(По: Валькюнас,
1997).
ме — мерозоит, якх — ядро клетки-хозяина, яп — ядро паразита.
Масштаб: 10 мкм.
Fig. 168. Young (J, 2) and mature (3, 4) phanerozoites of Plasmodium (Haemamoeba) relictum in brain of experimentally infected canaries.
ме — merozoite, якх — host-cell nucleus, яп — nucleus of parasite.
Scale bar: 10 pm.
Подрод Giovannolaia Corradetti,
Garnham et Laird, 1963
Растущие эритроцитарные меронты имеют обиль-
ную цитоплазму. Размеры выросших эритроцитарных
меронтов превышают размеры ядер зараженных эрит-
роцитов. Выросшие гаметоциты удлиненные. Экзо-
эритроцитарная мерогония проходит в клетках ретику-
лоэндотелиальной системы. Стеблевидный вырост
(ножка) в ооцистах отсутствует. Паразиты птиц мно-
гих отрядов.
Типовой вид Plasmodium (Giovannolaia) circum-
flexitm (Kikuth, 1931).
Видовой состав. В подрод входят Р. (G.) durae
Herman, 1941; Р. (G.)fallax Schwetz, 1930; Р. (G.) gabal-
doni Garnham, 1977; P. (G.) lophurae Coggeshall, 1938;
P. (G.) polare Manwell, 1934 и другие джиованнолайи
(всего около 15 видов).
Рис. 169. Plasmodium (Haemamoeba) relictum. (По: Валькюнас, 1997).
1,2 — трофозоиты; 3—9 — эритроцитарные меронты: 10—14 —- макрогаметоциты; 15. 16 — микрогаметоциты, ме — мерозоит, пг — пигментная гранула,
яд — ядрышко, якх — ядро клетки-хозяина, яп — ядро паразита.
Масштаб: 10 мкм.
Fig. 169. Plasmodium (Haemamoeba) relictum.
1,2— trophozoites; 3— 9 — erythrocytic meronts; 10—14 — macrogametocytes; 15, 16 — microgametocytes, ме —merozoite, m--- pigment granule, яг) — nucleo-
lus, якх — host-cell nucleus, яп — nucleus of parasite.
Scale bar: 10 pm.
293
ТИП SPOROZOA. КЛАСС COCCIDEA
13
294
ALVEOLATA
Plasmodium (Giovannolaia) circumflexum (Kikuth,
1931).
( I'mleosonid circumflexum Kikuth, 1931; Plasmodium heroni
Basu, 1938).
Распространение: всесветное, за исключением
крайних северных и южных регионов планеты. Наибо-
лее часто регистрируется в Голарктике.
Хозяева: Turdus pilaris (Turdidae, Passeriformes)
(типовой хозяин). Паразит обнаружен у более 100 ви-
дов птиц из разных отрядов.
Практическое значение. Изучено недоста-
точно. Штамм, выделенный из цесарок в Южной Аф-
рике, вызывает тяжелую малярию у молодых индеек
(Huchzermeyer, Vyver, 1991). Патогенность для диких
птиц исследована недостаточно (Валькюнас, 1997).
Переносчики: комары из родов Culiseta иМап-
sonia (Culicidae).
Жизненный цикл и морфология
Первичная экзоэритроцитарная мерогония не изу-
чена. Вторичные экзоэритроцитарные меронты (фане-
розоиты) обнаружены в клетках ретикулоэндотелия у
больных или погибших экспериментально зараженных
канареек и индюков. Меронты выявлены в головном
мозгу, легких, печени, селезенке, почках и костном
мозгу. У канареек фанерозоиты (рис. 170, 4) обычно
регистрируются в острый, а у индюков — в хрониче-
ский период инфекции примерно через 2 нед после
острой фазы. Длина фанерозоитов в эндотелии капил-
ляров головного мозга индюков колеблется от 17 до
29, а ширина — от 9 до 19 мкм. Сформировавшиеся
мерозоиты удлиненной формы, содержат компактное
ядро и имеют заостренные концы (рис. 170, 3). Инку-
бационный период у канарейки при заражении инфи-
цированной кровью и спорозоитами составляет 7—
8 дней. У других видов птиц он может несколько удли-
няться. Эритроцитарная мерогония синхронизирована.
Выделяются две группы штаммов — с периодично-
стью, близкой к 24 ч, и с периодичностью около 48 ч.
Сегментация меронтов обычно происходит в вечерние
часы.
Трофозоиты (рис. 171,1—4). Развиваются в моло-
дых и зрелых эритроцитах. Самые юные округлые или
овальные, реже треугольные, не имеют постоянного
местоположения в эритроците. Их очертания ровные.
Стадия «кольца» нехарактерна. По мере роста парази-
ты удлиняются, размеры ядра сильно увеличиваются,
в цитоплазме появляется одна или несколько мелких,
округлых гранул пигмента (рис. 171, 2, 3). Выросшие
трофозоиты вариабельной формы не имеют постоян-
ного местоположения в эритроците, хотя часто регист-
рируются вблизи одного из полюсов клетки-хозяина.
В цитоплазме присутствуют единичные мелкие вакуо-
ли. Пигментные гранулы мелкие, темно-коричневые,
сгруппированы в кучку на одном из концов паразита
(рис. 171, 4). Их число не более 6. Воздействие трофо-
зоитов на зараженный эритроцит не выражено. Инва-
зия одного эритроцита несколькими паразитами при
высокой паразитемии встречается часто.
Эритроцитарные меронты (рис. 171, 5—13). Раз-
виваются в зрелых и молодых эритроцитах. Цитоплаз-
ма окрашивается в интенсивно-голубые тона,
обильная, содержит мелкие вакуоли, причем отдель-
ные вакуоли присутствуют в сегментирующихся меро-
нтах и прилегают к группе гранул пигмента (рис. 171,
11). Ядра в молодых меронтах крупные. Деление ядра
начинается в довольно крупных меронтах, длина кото-
рых достигает длины ядра эритроцита. Форма меро-
нтов удлиненная, а очертания обычно ровные. В ходе
развития большинство меронтов охватывают своими
концами ядро эритроцита и могут полностью окружать
его, не смещая (рис. 171, 9, 10, 13). Реже меронты вы-
зывают смещение ядра клетки-хозяина (рис. 171,3,11,
12). Ядра в зрелых меронтах расположены беспоря-
дочно. В меронтах формируется 8—30 (чаще 12—20)
мерозоитов, причем среднее число мерозоитов у раз-
ных штаммов существенно варьирует. Мерозоиты
слегка удлиненной формы, содержат крупное ядро и
небольшой участок цитоплазмы (рис. 171, 13). Пиг-
ментные гранулы темно-коричневые, сгруппированы в
кучку, расположенную ближе к одному из концов па-
разита, что особенно характерно для молодых меро-
нтов. В зрелых меронтах пигмент обычно агрегирован
в одну или несколько компактных масс, которые также
часто расположены на одном из концов паразита, хотя
могут занимать и центральное положение (рис. 171,
11). Воздействие меронтов на эритроциты, как прави-
ло, не выражено. Однако встречаются паразиты, до-
вольно сильно смещающие ядро эритроцита (рис. 171,
12). Длина выросших меронтов, как правило, превы-
шает 12 мкм.
Макрогаметоциты (рис. 171, 14—18). Развивают-
ся в зрелых и молодых эритроцитах. Цитоплазма окра-
шивается в голубые тона, обычно содержит мелкие
вакуоли. Начиная с ранних стадий развития имеют уд-
линенную форму и вариабельные очертания. Амебо-
идные выросты цитоплазмы отмечаются на концах га-
метоцитов (рис. 171,16). Выросшие гаметоциты удли-
ненные, занимают латеральное по отношению к ядру
эритроцита положение. Отмечается два типа роста га-
метоцитов. Обычно гаметоциты охватывают своими
концами ядро эритроцита и могут полностью окружать
его (рис. 171, 17, 18), реже гаметоциты смещают ядро
на периферию клетки и не окружают его. Ядро гамето-
цитов компактное, относительно крупное, чаще распо-
ложено ближе к центру гаметоцита. Пигментные гра-
нулы темно-коричневые, мелкие (0.5 мкм) и средних
размеров (0.5—1 мкм), обычно беспорядочно разбро-
саны в цитоплазме, реже собраны в одну или несколь-
ко кучек (рис. 171, 15, 16). Их число обычно более 12,
но менее 30. Воздействие гаметоцитов на зараженные
эритроциты не выражено или проявляется, главным
образом, в более или менее заметном смещении их ядер.
Длина выросших гаметоцитов превышает 16 мкм.
Микрогаметоциты (рис. 171, 19, 20). От макро-
гаметоцитов отличаются признаками полового ди-
морфизма. Растут вокруг ядра эритроцита и обычно
полностью окружают его. Смещение ядра эритроцита
нехарактерно. Другие признаки, как у макрогамето-
цитов.
В комаре Culiseta annulata при температуре 20—
23 °C диаметр ооцист в период с 4-го по 7-й день уве-
личивается с 13 до 28 мкм. Зрелые ооцисты отмечены
на 12-й день развития. Их диаметр достигает 60 мкм. В
ТИП SPOROZOA. КЛАСС COCCIDEA
295
30 мкм
5 мкм
10 мкм
Рис. 170. Plasmodium (Giovannolaia) circumflexum. (По: Gamhatn, 1966, с изменениями).
/ — срез ооцисты с формирующимися спорозоитами; 2 — спорозоит; 3 — фрагмент зрелого экзоэритроцитарного меронта, распавшегося на отдельные ме-
розоиты, 4 — экзоэритроцитарный меронт в головном мозгу канарейки; ме — мерозоит, якх — ядро клетки-хозяина, яп — ядро паразита.
Масштаб: 30 мкм (/), 5 мкм (2), 10 мкм (3, 4).
Fig. 170. Plasmodium (Giovannolaia) circumflexum.
I — section of oocyst with developing sporozoites; 2 — sporozoite; 3 — a fragment of ruptured phanerozoite with completely developed elongate merozoites, 4 — pha-
nerozoite in brain of canary; ме — merozoite, якх — host-cell nucleus, яп — nucleus of parasite.
Scale bar: 30 pm (/), 5 pm (2), 10 pm (3, 4).
это же время регистрируются спорозоиты в слюнных
железах. В развивающихся ооцистах формируется
много герминативных центров, от которых отпочко-
вываются спорозоиты (рис. 170, 7). Спорозоиты пред-
ставляют собой веретенообразные тела, один конец ко-
торых более заострен, чем другой (рис. 170,2). Ядро рас-
положено в центре спорозоита, хроматин в виде четко
выраженных дискретных глыбок. Длина спорозоитов в
сухих окрашенных препаратах около 8—9 мкм.
Подрод Novyella Corradetti, Garnham
et Laird, 1963
Рдотущие эритроцитарные меронты содержат не-
большой Количество цитоплазмы. Размеры выросших
'ЗрИТроЦИСйрных меронтов не превышают размеров
ЙДСр 'ШрНЖОИИЫХ эритроцитов или лишь незначитель-
но iipeHhililBioi их, Выросшие гаметоциты удлинен-
ные, ' )кн>эритроцитпрппя мерогония проходит в клет-
ках ретикулоэндотелиальной системы. Стеблевидный
вырост (ножки) а ооцистах отсутствует. Паразиты
ПТИЦ многих отрядов.
Типовой вид Plasmodium (Novyella) vaughani
Novy et Mac Neal, 1904.
Видовой состав. В подрод входятР. (N.) bertii
Gabaldon et Ulloa, 1981; P. (N.) dissanaikei Jong, 1971;
P. (N.) hexamerium Huff, 1935; P.(N.) kempi Christensen,
Barnes et Rowley, 1983; P. (N.) rouxi Sergent, Sergent
et Catanei, 1928 и другие новеллы (всего около 10 ви-
дов).
Plasmodium (Novyella) vaughani Novy et Mac Neal,
1904.
(= Haemamoeba tenuis Laveran et Marullaz, 1914; Proteosoma
tumbayaensis Mazza et Fiora, 1930; Plasmodium tenuis Manwell, 1935
(P. tenue); P. merulae Corradetti et Scanga, 1972 (emend, pro P. vaug-
hani merulae)).
Распространение: всесветное, за исключением
крайних южных и северных регионов планеты.
Хозяева: Turdus migratorius (Turdidae, Passerifor-
mes) (типовой хозяин). Паразит обнаружен у более
150 видов птиц из разных отрядов. Наиболее часто ре-
гистрируется у воробьиных.
Переносчики: комары из родов Culiseta и Culex
(Culicidae).
296
ALVEOLATA
ТИП SPOROZOA. КЛАСС COCCIDEA
207
Жизненный цикл и морфология
Первичная экзоэритроцитарная мерогония не изу-
чена у всех видов этого подрода. При заражении чер-
ного дрозда Turdus merula спорозоитами Р. vaughani
merulae, выделенными из Culex pipiens, вторичные эк-
зоэритроцитарные меронты (фанерозоиты) обнаружи-
вались через 7—11 дней в макрофагах печени, селезен-
ки, почек, костного мозга, легких, а также в головном
мозгу. Наиболее многочисленны фанерозоиты в пече-
ни и селезенке. Число ядер в большинстве меронтов не
превышает 70, хотя иногда может достигать 100—130.
Число генераций и последовательность мерогонии во
внутренних органах птиц неизвестны. Скрытый пери-
од развития у канареек, экспериментально зараженных
путем инокуляции крови инвазированных птиц, про-
должителен и подвержен значительным индивидуаль-
ным вариациям. При внутримышечном заражении ка-
нареек паразиты в крови могут появляться лишь через
6—7 нед. При внутривенном заражении инкубацион-
ный период обычно длится около одной недели, но
иногда удлиняется до 6 нед. Скрытый период при экс-
периментальном заражении спорозоитами около 11—
12 дней. Эритроцитарная мерогония несинхронизиро-
вана, и в любой период паразитемии могут быть обна-
ружены все стадии развития паразита. Обычно цикл
мерогонии завершается по истечении 24—26 ч. Гаме-
тоциты в периферической крови появляются одновре-
менно с трофозоитами. Количество паразитов увели-
чивается и уменьшается медленно. Пик паразитемии
выражен слабо. Первичная паразитемия длится меся-
цами, а у некоторых экспериментально зараженных
канареек персистирует до 450 дней.
Трофозоиты (рис. 172,1—3). Развиваются в моло-
дых и зрелых эритроцитах. Растущие трофозоиты ва-
риабельной формы, довольно часто амебоидные и име-
ют одну небольшую, четко выраженную псевдоподию
(рис. 172,2, 3). Стадия «кольца» нехарактерна, хотя из-
редка наблюдается (рис. 172, Г). Ядро трофозоитов от-
носительно небольшое. В выросших трофозоитах
обычно содержится одна, реже — две гранулы пиг-
мента. В самых крупных трофозоитах иногда присут-
ствует одна округлая, бесцветная глобула. Воздейст-
вие трофозоитов на зараженный эритроцит не выра-
жено.
Эритроцитарные меронты (рис. 172, 4—13). Раз-
виваются в молодых и зрелых эритроцитах. Цитоплаз-
ма окрашивается в бледно-голубые тона и по мере со-
зревания меронта становится плохо различимой. Раз-
меры ядер по мере созревания меронта сильно
уменьшаются. Форма выросших меронтов округлая,
овальная, веерообразная или иррегулярная. Ядра в зре-
лых меронтах расположены беспорядочно, розетко-
видно или веерообразно. В меронтах формируется
4—8 (чаще 4 или 6) мерозоитов. Диаметр сформиро-
вавшихся мерозоитов, как правило, не превышает
1 мкм. Цитоплазму в них различить не удается. В ме-
ронтах довольно часто присутствует одна четко выра-
женная округлая, бесцветная глобула, которая обычно
располагается вблизи гранул пигмента и может сохра-
няться при сегментации меронтов (рис. 172, 13). Пиг-
ментные гранулы мелкие (0.5 мкм), немногочислен-
ные (1—3), неодинакового размера, черного или чер-
но-коричневого цвета. Наиболее часто в меронтах
присутствуют две неодинакового размера гранулы
пигмента, причем более крупная из них свет преломля-
ет интенсивнее. Меронты обычно не соприкасаются с
ядром и не имеют постоянного местоположения в за-
раженном эритроците, хотя чаще они регистрируются
вблизи одного из полюсов клетки-хозяина. Воздейст-
вие меронтов на зараженный эритроцит не выражено.
Длина меронтов в среднем около 3, а ширина — 2 мкм.
Макрогаметоциты (рис. 172, 14—17). Обычно
развиваются в зрелых эритроцитах. Цитоплазма окра-
шивается в различные оттенки бледно-голубого цвета,
гомогенная, обычно содержит мелкие, четко выражен-
ные вакуоли. Начиная с ранних стадий развития гаме-
тоциты имеют удлиненную форму и вариабельные
очертания. Выросшие гаметоциты удлиненные, зани-
мают латеральное по отношению к ядру зараженного
эритроцита положение. Ядро гаметоцитов компактное,
вариабельной формы, окрашивается бледно, чаще ре-
гистрируется вблизи центра гаметоцита. Пигментные
гранулы мелкие (<0.5 мкм) и средних размеров
(0.5—1 мкм), беспорядочно разбросаны в цитоплазме.
Число гранул у разных штаммов колеблется от 2 до 24,
но обычно их около 10. Чем меньше гранул пигмента,
тем они крупнее. Воздействие гаметоцитов на зара-
женный эритроцит не выражено. Длина гаметоцитов в
среднем около 12, а ширина — 2 мкм.
Микрогаметоциты (рис. 172,18—20). От макрога-
метоцитов отличаются признаками полового димор-
физма. Другие признаки, как у макрогаметоцитов.
Рецидивы паразитемии у экспериментально зара-
женных канареек выражены и часто сопровождаются
более высокой интенсивностью инвазии, чем при пер-
вичной паразитемии. Стадии, дающие начало рециди-
ву, неизвестны.
Развитие в переносчике изучено фрагментарно. Се-
вероамериканский штамм, выделенный от Agelaius
phoeniceus, в комарах из родов Aedes, Anopheles и Cu-
lex не развивается. Этот штамм завершает спорогонию
в организме комара Culiseta morsitans. Ооцисты в сред-
ней кишке комара обнаруживаются в период со 2-го до
Рис. 171. Plasmodium (Giovannolaia) circumflexum. (По: Валькюнас, 1997).
/ / '||К)<|КПО11ТЫ; 5—13 — эритроцитарные меронты; 14—18 — макрогаметоциты; 19, 20 — микрогаметоциты; вк — вакуоль, пг — пигментная гранула,
якх — ядро клетки-хозяина, яп — ядро паразита.
Масштаб: 10 мкм.
Fig. 171. Plasmodium {Giovannolaia) circumflexum.
/ V trophozoites; 5—13 — erythrocytic mcronts; 14—18 — macrogametocyics; 19, 20 — microgametocytes; вк — vacuole , m — pigment granule, якх —
host-cell nucleus, яп nucleus of parasite.
Scale bar: 10 pm.
298
ALVEOLATA
ТИП SPOROZOA. КЛАСС COCCIDEA
280
14-го дня после кормления на зараженных птицах.
Спорозоиты наиболее многочисленны в средних долях
слюнных желез комара.
Подрод Bennettinia Valkiunas, 1997
Растущие эритроцитарные меронты содержат не-
большое количество цитоплазмы. Размеры выросших
эритроцитарных меронтов не превышают размеров
ядра зараженного эритроцита. Выросшие гаметоциты
округлые, овальные, иррегулярной формы, реже удли-
ненные. Их размеры не превышают размеров ядра
зараженного эритроцита. Экзоэритроцитарная мерого-
ния проходит в клетках ретикулоэндотелиальной сис-
темы. Стеблевидный вырост (ножка) в ооцистах име-
ется. Обнаружены только у курообразных (Gallifor-
mes) птиц.
Типовой вид Plasmodium (Bennettinia) juxtanuc-
leare Versiani et Gomes, 1941, единственный вид под-
рода.
Plasmodium (Bennettinia) juxtanucleare Versiani
et Gomes, 1941.
(= Plasmodium japonicum Ishiguro, 1957).
Рапространениe: широко распространенный
паразит курообразных птиц в тропиках и субтропиках.
Не обнаружен в Австралии.
Хозяева: домашняя курица Gallus gallus (Phasia-
nidae, Galliformes) (типовой хозяин). Паразит развива-
ется также у банкиевских кур, павлинов, индюков и
некоторых других курообразных птиц.
Переносчики: комары из рода Culex (Culicidae).
Практическое значение. Паразит вызывает
малярию у домашних кур, индюков, павлинов и неко-
торых других видов курообразных птиц. Вирулент-
ность различных штаммов сильно варьирует. Наибо-
лее вирулентны неотропические, а наименее вирулентны
азиатские штаммы. Смертность кур при заражении нео-
тропическими штаммами может превышать 90 %, при-
чем гибнут не только молодые, но и взрослые куры.
Жизненный цикл и морфология
Первичная экзоэритроцитарная мерогония не изу-
чена. Вторичные экзоэритроцитарные меронты (фане-
розоиты) выявлены у экспериментально зараженных
цыплят в ретикулоэндотелии селезенки, головного и
костного мозга, печени, легких, почек, мускулатуры
сердца, яичников и поджелудочной железы. Фанерозо-
иты не содержат вакуолей и во всех органах, за исклю-
чением головного мозга, имеют округлую или оваль-
ную форму. В головном мозгу фанерозоиты слегка вы-
тягиваются вдоль капилляров. Длина зрелых меронтов
около 15 мкм, и они содержат до 50 ядер, расположен-
ных по периферии паразита. Центральное остаточное
тело в меронтах обычно выражено (рис. 173). При
внутривенном заражении инфицированной кровью
препатентный период у разных хозяев колеблется от 4
до 53 и даже до 106 дней, а при заражении спорозоита-
ми — от 11-го до 21-го дня. Независимо от способа
заражения паразитемия характеризуется слабовыра-
женным пиком и продолжительным (несколько меся-
цев) хроническим периодом. Периодичность мерого-
нии выражена слабо и составляет около 24 ч. Большинство
меронтов созревает в утренние часы. Интенсивность
паразитемии у разных хозяев сильно варьирует и мо-
жет превышать 90 % зараженных эритроцитов.
Трофозоиты (рис. 174,1, 2). Развиваются в зрелых
и молодых эритроцитах. Самые юные вариабельной
формы, содержат незначительное количество цито-
плазмы (рис. 174, 7). Очертания паразитов ровные или
иррегулярные. Четко выраженные амебоидные вырос-
ты цитоплазмы нехарактерны. Выросшие трофозоиты
обычно вплотную прилегают к ядру эритроцита и со-
держат 1—2 гранулы пигмента темно-коричневого
цвета. Изредка в цитоплазме трофозоитов отмечается
одна небольшая вакуоль. Типичная стадия «кольца»
нехарактерна. При высокой паразитемии весьма обыч-
на инвазия одного эритроцита несколькими парази-
тами.
Эритроцитарные меронты (рис. 174, 3—9).
Обычно развиваются в зрелых, реже — в молодых
эритроцитах. В период хронической паразитемии ме-
ронты обнаружить в периферической крови трудно,
так как в это время они концентрируются в кровото-
ке внутренних органов. Цитоплазма окрашивается в
бледно-голубые тона и по мере созревания меронта
становится плохо различимой. Меронты обычно
вплотную прилегают к ядру и чаще располагаются
вблизи одного из полюсов эритроцита. Размеры ядер
по мере развития меронтов сильно уменьшаются. Фор-
ма выросших меронтов округлая или неправильная.
Ядра в них обычно сосредоточены по периферии (рис.
174, 7, 3). В меронтах развивается 2—6 (чаще 3—5) ме-
розоитов. Диаметр сформировавшихся мерозоитов
около 1 мкм. В меронтах формируются 1—4 гранулы
пигмента темно-коричневого цвета. Обычно в зрелых
меронтах присутствует одна относительно крупная
глыбка пигмента (рис. 174, 7, <?). Воздействие парази-
тов на зараженный эритроцит не выражено. Длина вы-
росших меронтов не превышает 5 мкм и обычно значи-
тельно меньше.
Макрогаметоциты (рис. 174, 10—14). Развивают-
ся в зрелых, реже — в молодых эритроцитах. Гамето-
Рис. 172. Plasmodium {Novyella) vaughani. (По: Валысюнас, 1997).
/ ,/ трофозоиты, 4—13 — эритроцитарные меронты, 14—17 — макрогаметоциты, 13—20 — микрогаметоциты; бг — бесцветная глобула, вк — вакуоль,
ме — мерозоит, пг — пигментная гранула, якх — ядро клетки-хозяина, яп — ядро паразита.
Масштаб: 10 мкм.
Fig. 172. Plasmodium (Novyella) vaughani.
/ ,1 trophozoites, 4—13 — erythrocytic meronts, 14—17 — macrogametocytes, 18—20 — microgametocytes; бг — colourless globule, вк — vacuole, ме — mero-
zoite, m — pigment granule, якх — host-cell nucleus, яп — nucleus of parasite.
Scale bar: 10 pm.
300
ALVEOLATA
Рис. 173. Зрелые фанерозоиты Plasmodium (Bennettinia)juxtanucle-
аге. (По: Gamham, 1966, с изменениями).
ме — мерозоит, ост — остаточное тело, якх — ядро клетки-хозяина, яп —
ядро паразита.
Fig. 173. Mature phanerozoites of Plasmodium (Bennettinia) juxtanuc-
leare.
ме — merozoite, ocm — residual body, якх — host-cell nucleus, яп — nucleus
of parasite.
обычно смещают ядро эритроцита. Длина гаметоцитов
не превышает 7, а ширина — 5 мкм.
Микрогаметоциты (рис. 174, 15, 16). От макрога-
метоцитов отличаются признаками полового димор-
физма. Другие признаки, как у макрогаметоцитов.
Рецидивы омечаются при удалении селезенки. При
этом может быть заражено до 60 % эритроцитов.
Развитие малайского штамма изучено в комаре Си-
lex sitiens при температуре 27 °C (Bennett et al., 1966).
Примерно 2/3 ооцист формируется в задней половине
средней кишки комара. Ооцисты диаметром около
15 мкм приобретают стеблевидный вырост (ножка),
посредством которого они присоединяются к стенке
кишки (рис. 175, 4—10). Наличие стеблевидных
ооцист — характерная особенность Р. (В.) juxtanuclea-
ге. При просмотре выроста сверху он выделяется на
фоне ооцисты в виде темного пятна (рис. 175, 4), а при
просмотре сбоку представляет собой конусовидную
структуру, слегка расширяющуюся в направлении к
ооцисте (рис. 175, 5—10). Зона спорозоитогенеза (ши-
рина около 7 мкм) расположена по периферии ооци-
сты. В центральной части ооцист концентрируются
беспорядочно ориентированные спорозоиты (рис. 175,
10). Спорозоиты не формируются в зоне стебелька и не
попадают туда. Длина стебелька у сформировавшихся
ооцист в среднем 28, а ширина — 18 мкм. Стенка сте-
белька по сравнению со стенкой ооцисты несколько
утолщена (рис. 175, 5—10). После разрыва ооцист и
освобождения спорозоитов стебельки некоторое время
сохраняются на стенке средней кишки.
Спорозоиты в слюнных железах комара появляют-
ся на 12-й день после заражения. Они представляют
собой удлиненные тела, длина которых в среднем
13 мкм, а ширина колеблется от 1 до 2 мкм. Ядро обыч-
но расположено в передней половине спорозоитов.
циты в периферической крови немногочисленны.
Обычно их количество не превышает 14 % от общего
числа паразитов в крови. В период хронической пара-
зитемии обнаружить гаметоциты трудно. Цитоплазма
окрашивается в бледно-голубые тона, гомогенная, из-
редка содержит единичные мелкие вакуоли. Очерта-
ния гаметоцитов ровные, реже иррегулярные. Моло-
дые гаметоциты округлые или слегка удлиненные, до-
вольно часто вплотную прилегают к ядру эритроцита
(рис. 174, 10, 11). Выросшие гаметоциты округлые,
овальные, иррегулярные, реже удлиненные, чаще рас-
положены вблизи одного из полюсов эритроцита и не
касаются его ядра (рис. 174, 13). Пигментные гранулы
мелкие (<0.5 мкм), немногочисленные (менее 10),
обычно сгруппированы в кучку вблизи пелликулы га-
метоцита (рис. 174, 12—14). Выросшие гаметоциты
Подрод Huffia Corradetti, Garnham
et Laird, 1963
Растущие эритроцитарные меронты содержат обиль-
ную цитоплазму. Выросшие эритроцитарные меронты
вариабельной формы и размера. Выросшие гаметоци-
ты удлиненные. Экзоэритроцитарная мерогония про-
ходит в клетках гемопоэтической системы, а у некото-
рых видов и в клетках ретикулоэндотелиальной систе-
мы. Стеблевидный вырост (ножка) в ооцистах
отсутствует. Паразиты птиц многих отрядов.
Типовой вид Plasmodium (Huffla) elongatum
Huff, 1930.
Видовой состав. В подрод входятP. (Ни.) huffi
Muniz, Soares et Batista, 1951; P. (Hu.) hermani Telford
et Forrester, 1975 (всего 3 вида).
Рис. 174. Plasmodium (Bennettinia) juxtanucleare. (По: Валькюнас, 1997).
1,2 — трофозоиты; 3—9 — эритроцитарные меронты; 10—14 — макрогаметоциты; 15, 16 — микрогаметоциты; ме — мерозоит, пг — пигментная гранула,
якх — ядро клетки-хозяина, яп — ядро паразита.
Масштаб: 10 мкм.
Fig. 174. Plasmodium {Bennettinia) juxtanucleare.
1,2 — trophozoites; 3—9 — erythrocytic meronts; 10—14 — macrogametocytes; 15, 16 — microgametocytes; ме — merozoite, m — pigment granule, якх —
host-cell nucleus, яп — nucleus of parasite.
Scale bar: 10 pm.
ТИП SPOROZOA. КЛАСС COCCIDEA
301
14
302
ALVEOLATA
Рис. 175. Схема развитая стебелька в ооцисте Plasmodium (Bennettinia) juxtanucleare. (По: Bennett et al., 1966, с изменениями и дополне-
ниями).
/—з — молодые ооцисты на 2—7-й день после заражения переносчиков; 4,5 — начальные стадии формирования стебелька на 7-й день после заражения пе-
реносчиков (4 — вид стебелька сверху, 5 — вид сбоку); 6—9 — формирование стебелька в ооцистах на 8—10-й день после заражения переносчиков (стенка
стебелька утолщается, а в ооцисте и стебельке присутствуют вакуоли и преломляющие свет гранулы); 10 — дифференцирующаяся ооциста; вк — вакуоль,
эс — зона спорозоитогенеза, пег — преломляющая свет гранула, с — спорозоит, ст — стебелек.
Fig. 175. Diagrammatic representation of development of peduncle in oocyst of Plasmodium (Bennettinia) juxtanucleare.
1—3 — young oocysts from the 2nd to 7th day after infection of vectors; 4, 5 — initial stages of development of peduncle on the 7th day after infection of vector (4 — a
peduncle viewed from above, 5 — a peduncle viewed from laterally); 6—9 — development of peduncle in oocyst from 8th to 10th day after infection of vector (the wall
of the peduncle gradually thickening, and randomly distributed vacuoles and refractive granules are present both in oocyst and peduncle); 10 — differentiating oocyst;
вк — vacuole, sc — zone of sporozoitegenesis, пег — refractive granule, c — sporozoite, cm — peduncle.
Plasmodium (Huffia) elongatum Huff, 1930.
Распространение: обнаружен во всех зоогео-
графических областях, за исключением Австралий-
ской.
Хозяева: канарейка Serinus canaria (Fringillidae,
Passeriformes) (типовой хозяин). Паразит выявлен у
более 150 видов птиц разных отрядов. Наиболее часто
регистрируется у воробьиных.
Переносчики: комары из рода Culex (Culicidae).
Практическое значение. Изучено недоста-
точно. Влияние паразита на свободноживущих птиц
неизвестно. Plasmodium (Н.) elongatum вызывает лета-
льные эпизоотии у пингвинов в зоопарках (Cranfield et
al., 1990). Природным резервуаром инфекции являют-
ся дикие воробьиные птицы.
Жизненный цикл и морфология
Первичная экзоэритроцитарная мерогония не
изучена. Вторичные экзоэритроцитарные меронты
(фанерозоиты) в большом количестве развиваются
при заражении спорозоитами и путем инокуляции кро-
ви. Основным местом их локализации являются кро-
ветворные органы. Наиболее обильны фанерозоиты в
мигрирующих клетках гемопоэтических тканей кост-
ного мозга, а также селезенки и печени. Они развива-
ются в клетках-предшественниках эритробластов,
в эритробластах, реже — в нормобластах и тром-
боцитах. В клетках ретикулоэндотелия фанерозоиты
у адаптированных хозяев не регистрировались. Разме-
ры паразитов варьируют в зависимости от размеров
клеток-хозяев. Фанерозоиты содержат базофильную
цитоплазму, ярко окрашенные ядра и окружены бо-
лее светлым участком цитоплазмы клетки-хозяина
(рис. 176, I—5). При развитии в более зрелых клетках
эритроцитарного ряда в меронтах иногда присутствует
небольшая гранула пигмента (рис. 176, 5). Ядро за-
раженных клеток слегка деформируется, смещается
и может вытесняться, что особенно часто наблюда-
ется при сильном заражении. В этом случае паразиты
выглядят лежащими внеклеточно. В фанерозоитах
формируется небольшое количество (обычно ме-
нее 30) удлиненных мерозоитов, имеющих округлое
центрально расположенное ядро (рис. 176, 5). Ме-
розоиты в зрелых меронтах расположены беспорядоч-
но или упорядоченными рядами (рис. 176, 3, 4, 6),
что весьма характерно для этого вида. Вторичная эк-
ТИП SPOROZOA. КЛАСС COCCIDEA
303
Рис. 176. Фанерозоиты Plasmodium (Huffia) elongatum в клетках эритроцитарного ряда костного мозга канарейки.
1,2 — молодые; 3—6 — зрелые; (по: Валькюнас, 1997). ме — мерозоит, якх — ядро клетки-хозяина, яп — ядро паразита.
Масштаб: 10 мкм.
Fig. 176. Phanerozoites of Plasmodium (Huffia) elongatum in the cells of erythrocytic series of bone marrow of canary.
1,2 — young parasites; 3—6 — mature parasites; ме — merozoite, якх — host-cell nucleus, яп — nucleus of parasite.
Scale bar: 10 pm.
зоэритроцитарная мерогония приурочена к внут-
ренним органам. В периферическую кровь фанеро-
зоиты попадают редко. У необычных хозяев (на-
пример, пингвины Spheniscus demersus), к развитию у
которых паразит не адаптирован, фанерозоиты в
огромном количестве развиваются в клетках рети-
кулоэндотелия во многих органах. Основным местом
их локализации являются гистиоциты в легких, се-
лезенке, печени и сердце. Реже они регистрируются
в почках, скелетной мускулатуре, кишечнике, го-
ловном и костном мозгу. Фанерозоиты у пингвинов
представляют собой округлые или овальные тела диа-
метром около 15—20 мкм и содержат большое коли-
чество (100 и более) мерозоитов. В мазках-отпечат-
ках внутренних органов мерозоиты выглядят округ-
лыми.
Препатентный период при заражении спорозоита-
ми обычно составляет 9—12 дней, но может сокра-
щаться до 5 дней или быть еще короче. При заражении
путем инокуляции инфицированной крови препатент-
ный период длится около 11 дней. Первичная парази-
темия низкая (обычно не превышает 10 % зараженных
эритроцитов, но, как правило, менее 1 %). Паразите-
мия нарастает медленно (в течение 1—3 нед), а затем
переходит в хроническую форму, длящуюся несколько
месяцев. Меронты в периферической крови малочис-
ленны, а преобладают гаметоциты. Большинство эрит-
роцитарных меронтов концентрируется в кроветвор-
ных органах. Эритроцитарная мерогония четко син-
хронизирована. Цикл мерогонии составляет 24 ч. Сег-
ментация большинства меронтов происходит в утрен-
ние часы. По мере увеличения числа пассажей кровью
количество гаметоцитов уменьшается, и штаммы мо-
гут утрачивать способность продуцировать гаметоци-
ты.
Трофозоиты (рис. 177, 1—4). Развиваются в моло-
дых эритроцитах. Самые юные округлые или оваль-
ные, довольно часто содержат вакуоль. Типичная ста-
дия «кольца» отмечается редко. По мере роста при-
обретают иррегулярные очертания и амебоидные
выросты, чаще регистрируются вблизи одного из по-
люсов зараженной клетки. Пигмент в виде 1—2 не-
больших темных гранул появляется лишь в самых
крупных трофозоитах, развивающихся в более зрелых
эритроцитах (рис. 177, 2, 3). У паразитов, развиваю-
щихся в эритробластах, пигмент обычно отсутствует
(рис. 177, 4). Воздействие трофозоитов на зараженный
эритроцит обычно не выражено.
Эритроцитарные меронты (рис. 177, 5—13). Раз-
виваются в молодых эритроцитах. Цитоплазма окра-
шивается в голубые тона, обычно лишена вакуолей.
Ядра в растущих меронтах чаще концентрируются по
периферии паразита. Форма меронтов вариабельная,
но преобладают округлые и овальные паразиты. Ядра
в зрелых меронтах чаще расположены веерообразно
(рис. 177, 10, 12), реже — розетковидно (рис. 177, II).
В некоторых меронтах мерозоиты расположены в виде
параллельного ряда (рис. 177, 12). В меронтах форми-
304
ALVEOLATA
ТИП SPOROZOA. КЛАСС COCCIDEA ЗОВ
руется 6—12 более или менее удлиненных мерозоитов
с заостренными концами. Изредка встречаются округ-
лые мерозоиты (рис. 177, 11), которые чаще формиру-
ются при развитии паразита у необычных хозяев (на-
пример, пингвины). При сегментации меронта отмеча-
ются локальное скопление пигмента и диффузное
остаточное тело (рис. 177, 13). Пигментные гранулы
мелкие, черные, немногочисленные, часто агрегиру-
ются в небольшую массу (рис. 177, 8—13). Меронты
смещают ядро и деформируют зараженные клетки.
Длина выросших меронтов обычно не превышает
7 мкм.
Макрогаметоциты (рис. 177, 14—17). Развива-
ются в зрелых эритроцитах. Цитоплазма окрашивает-
ся в голубые тона, гомогенная, изредка содержит
мелкие вакуоли. Начиная с ранних стадий развития га-
метоциты имеют удлиненную форму. Молодые гаме-
тоциты хорошо отличаются от трофозоитов ровными
очертаниями и большим числом беспорядочно раз-
бросанных гранул пигмента (рис. 177, 14). Выросшие
гаметоциты удлиненные, тонкие, занимают латераль-
ное по отношению к ядру эритроцита положение.
Их очертания вариабельные, а концы закруглены.
Ядро гаметоцитов компактное, вариабельной формы,
расположено ближе к центру гаметоцита. Пигментные
гранулы мелкие (< 0.5 мкм) и средних размеров
(0.5—1 мкм), беспорядочно разбросаны в цитоплазме.
Их число обычно не превышает 20. Воздействие гаме-
тоцитов на зараженный эритроцит проявляется в ги-
пертрофии в длину и в незначительном смещении его
ядра. Длина гаметоцитов не превышает 17, а шири-
на — 3 мкм.
Микрогаметоциты (рис. 177,18—20). От макрога-
метоцитов отличаются признаками полового димор-
физма. Пигментные гранулы имеют тенденцию обра-
зовывать скопления и могут агрегироваться в локаль-
ные крупные массы. Очертания гаметоцитов более
вариабельны, чем макрогаметоцитов. Другие призна-
ки, как у макрогаметоцитов.
Естественными переносчиками являются комары
Culexpipiens и С. restuans. При температуре 26 °C и от-
носительной влажности 80—86 % спорозоиты в слюн-
ных железах комаров появляются через 8—9 дней.
Однако некоторые штаммы развиваются медленнее, и
появление спорозоитов в слюнных железах регистри-
руется не ранее 13-го дня после заражения. Размеры
ооцист в период их созревания сильно варьируют,
но обычно их диаметр составляет 40—60 мкм. Длина
спорозоитов в окрашенных препаратах около 12—
14 мкм. Они представляют собой слабоизогнутые
или прямые тела, один конец у которых заострен,
а другой закруглен.
Паразиты млекопитающих
Подрод Plasmodium Marchiafava et Celli,
1885
Эритроцитарные меронты крупные. Выросшие га-
метоциты округлые. Препатентный период составляет
более 4 дней. Паразиты высших приматов (Anthropoi-
dea).
Типовой вид Plasmodium (Plasmodium) malariae
(Grassi etFeletti, 1892).
Видовой состав. В подрод входятР. (Р.) coat-
neyi Eyles, Fong, Warren, Guinn, Sandosham et Wharton,
1962; P. (P.) hylobati Rodhain, 1941; P. (P.) knowlesi Sin-
ton et Mulligan, 1932; P. (P.) ovale Stephens, 1922;
P. (P.) vivax (Grassi et Feletti, 1890) и другие малярий-
ные паразиты (всего около 20 видов).
Plasmodium (Plasmodium) malariae (Grassi et Fe-
letti, 1892).
(= Haemamoeba malariae Feletti et Grassi, 1889; Plasmodium ma-
lariae quartanae Celli et Sanfelice, 1891; P. malariae quartanae Kruse,
1892; Haemamoeba laverani var. quartana Labbe, 1894; Haemospori-
dium tertianae Lewkowicz, 1897; Plasmodium quartanae Billet, 1904;
P. rodhaini Brumpt, 1939).
Распространение: космополит в пределах лет-
ней изотермы 16 °C, но распространен мозаично. Наи-
более часто встречается в Западной и Восточной Аф-
рике, в Гайане и некоторых районах Индии.
Хозяева: Homo sapiens (Hominidae, Primates) (ти-
повой хозяин). Естественным хозяином является Pan
troglodytes. Экспериментально заражен Aotus trivir-
gatus.
Переносчики: многочисленные виды комаров
из рода Anopheles (более 30 видов). Восприимчивость
комаров обычно низкая.
Жизненный цикл и морфология
Паразит характеризуется относительно медленным
развитием в позвоночном и беспозвоночном хозяевах
по сравнению с другими видами малярийных парази-
тов человека. Экзоэритроцитарные меронты развива-
ются в паренхиматозных клетках печени (гепатоциты)
(рис. 178, 8—11). Вокруг паразитов обычно различи-
ма вакуоль (рис. 178,8, 9). Молодые меронты округлой
или овальной формы с ровными очертаниями. Их ци-
топлазма гомогенная, обычно не содержит вакуолей.
По мере созревания меронты постепенно приобрета-
ют более или менее выраженную дольчатую форму
(рис. 178, 10). В цитоплазме растущих меронтов появ-
Рис. 177. Plasmodium (Huffia) elongatum. (По: Валькюнас, 1997).
/—4 — трофозоиты, 5—13 — эритроцитарные меронты, 14—17 — макрогаметоциты, 18—20 — микрогаметоциты; ме — мерозоит, ост — остаточное тело,
пг — пигментная гранула, якх — ядро клетки-хозяина, яп — ядро паразита.
Масштаб: 10 мкм.
Fig. 177. Plasmodium (Huffia) elongatum.
1—4 — trophozoites, 5—13 — erythrocytic meronts, 14—17 — macrogametocytes, 18—20 — microgametocytes; ме — merozoite, ocm — residual body, m — pig-
ment granule, якх — host-cell nucleus, яп — nucleus of parasite.
Scale bar: 10 pm.
20 Зак. №4163
306
ALVEOLATA
яг
якх
Рис. 178. Plasmodium (Laverania) falciparum (7—7) и Plasmodium (Plasmodium) malariae (8—11).
1 — микрогамета, 2 — оокинеты, 3 — спорозоиты, 4—7 и S—11 — последовательные стадии развития экзоэритроцитарных меронтов указанных видов в ге-
патоцитах; вк — вакуоль, иг — пигментная гранула, пц — псевдоцитомер, яг — ядро гепатоцита, якх — ядро клетки-хозяина, ял — ядро паразита. Пояснения
даны в тексте.
Fig. 178. Plasmodium (Laverania) falciparum (I—7) and Plasmodium (Plasmodium) malariae (8—11).
1 — microgamete, 2 — ookinete, 3 — sporozoites, 4—7 и 8—11 — successive stages of development of exoerythrocytic meronts in hepatocytes; вк — vacuole, иг —
pigment granule, пц — pseudocytomere, яг — nucleus of hepatocyte, якх — host-cell nucleus, яи — nucleus of parasite. Explanations are given in the text.
ляются вакуоли (рис. 178, 10), которые особенно мно-
гочисленны по периферии паразита. Ядра расположе-
ны беспорядочно, в растущих меронтах они округлой
формы. В созревающих меронтах преобладают слегка
удлиненные ядра. Их средняя длина около 3 мкм.
В ходе развития меронтов псевдоцитомеры не форми-
руются. Однако содержимое меронтов довольно часто
разделено на отдельные участки своеобразными «тре-
щинами» (рис. 178, 10). Экзоэритроцитарная мерого-
ния проходит медленно и завершается примерно по ис-
течении 14—16 дней. В цитоплазме созревающих ме-
ронтов отмечаются азурофильные нити. Наибольший
диаметр крупных меронтов достигает 40—85 мкм, но
чаще он составляет около 50—55 мкм. В меронтах
формируются многие тысячи (обычно около 15 тыс.)
мерозоитов. Клеточная реакция на присутствие меро-
нтов не выражена. Клетка-хозяин увеличивается в раз-
мерах, ее ядро смещается и заметно гипертрофируется
по сравнению с ядрами незараженных гепатоцитов
(рис. 178, 8—10). Сформировавшиеся мерозоиты округ-
лой формы диаметром в среднем около 2 мкм. Они со-
держат ядро, которое часто имеет полулунную форму,
и небольшой участок цитоплазмы. Развивается лишь
одна генерация экзоэритроцитарных меронтов. Вторич-
ная экзоэритроцитарная мерогония отсутствует. Парази-
ты в печени не персистируют. Рецидивы отсутствуют.
Мерозоиты из экзоэритроцитарных меронтов попа-
дают в кровь в период между 14-м и 16-м днями после
заражения человека спорозоитами. Препатентный пе-
риод обычно длится 15—16 дней. Продолжительность
инкубационного периода у разных штаммов паразита
колеблется в значительных пределах вплоть до 60—
70 дней. Обычно инкубационный период длится около
18—40 (в среднем 28) дней. Возвраты повышенной па-
разитемии (recrudescence) в связи с возобновлением
эритроцитарой мерогонии имеют место. Продолжи-
тельность инфекции у однократно зараженных людей
при отсутствии лечения колеблется от 3 до 50 лет и
ТИП SPOROZOA. КЛАСС COCCIDEA
307
даже более. Паразит персистирует во внутренних орга-
нах в незначительном количестве на стадии эритроци-
тарных бесполых стадий.
Трофозоиты (рис. 179, 1—10). Развиваются в зре-
лых или почти зрелых эритроцитах. Юные трофозоиты
представляют собой небольшие «кольца», диаметр ко-
торых равен примерно 1/3—1/4 диаметра зараженных
эритроцитов (рис. 179,1, 2). Они содержат четко выра-
женную вакуоль и компактное ядро. Вакуоль исчезает
через несколько часов после появления трофозоитов в
эритроцитах. Цитоплазма окрашивается в голубые то-
на, хорошо различима. Трофозоиты растут медленнее,
чем все другие виды малярийных паразитов человека.
Инвазия одного эритроцита несколькими трофозоита-
ми нехарактерна. Амебоидность очертаний трофозои-
тов также нехарактерна, хотя у некоторых штаммов
паразита изредка отмечается. Небольшая пигментная
гранула появляется в юных трофозоитах на стадии
кольца. Количество пигмента быстро увеличивается.
В созревающих трофозоитах насчитывается от 30 до
50 компактных пигментных гранул неправильной или
округлой формы, темно-коричневого или черного цве-
та. По мере роста трофозоиты приобретают причуд-
ливую форму (рис. 179, 3—6). Очертания трофозоитов
весьма вариабельные. Их форма варьирует от округ-
лой до причудливо-неправильной. Весьма характерны
для этого вида лентовидные трофозоиты (рис. 179, 4, б,
7). Трофозоиты созревают в течение около 54 ч. Вы-
росшие трофозоиты (рис. 179, 9, 10) заполняют значи-
тельную часть зараженных эритроцитов, которые не
изменяются в размерах. В некоторых зараженных эри-
троцитах отмечаются точечные азурофильные вклю-
чения (зернистость Циманна) (рис. 179, 8, 9), которые
различимы лишь при соответствующей окраске.
Эритроцитарные меронты (рис. 179, 11—15).
Развиваются в зрелых эритроцитах. В периферической
крови они обычны. Цитоплазма окрашивается в голу-
бые тона, обычно не содержит вакуолей. В них фор-
мируется 6—12, изредка 14 (чаще 8) мерозоитов. Пиг-
ментные гранулы в молодых меронтах беспорядочно
разбосаны в цитоплазме (рис. 179, 11, 12). По мере со-
зревания меронтов пигмент группируется в центре ме-
ронтов (рис. 179, 13—15), а в зрелых меронтах он мо-
жет агрегироваться в одну темного цвета массу, распо-
ложенную в центре меронта. Ядра довольно часто
располагаются вокруг этой массы пигмента, что при-
дает зрелым меронтам розетковидную форму, столь
характерную для эритроцитарных меронтов этого вида
(рис. 179,15). Размеры зрелых меронтов варьируют, но
не превышают размеров незараженных эритроцитов.
Процесс созревания меронтов длится около 18 ч. Вы-
росшие меронты полностью заполняют зараженные
эритроциты. Зараженные клетки не отличаются по раз-
мерим и форме от незараженных. Цикл эритроцитар-
ной мерогонии четкий, его длительность составляет
72 ч. Сегментация меронтов обычно происходит утром
или вскоре после полудня. Приступы лихорадки у за-
рнженных людей повторяются каждый четвертый день
И интервалом в два дня.
Макрогаметоциты (рис. 179,16—18). Развивают-
ся а зрелых эритроцитах. Молодые гаметоциты похо-
жи ни растущие трофозоиты, от которых их отличить в
Ш'ЮНОЙ микроскоп трудно. Гаметоциты в перифери-
ческой крови появляются позднее бесполых стадий.
Вероятно, начальные стадии развития гаметоцитов
проходят во внутренних органах. Цитоплазма гамето-
цитов окрашивается в различные оттенки голубого
цвета. Ядро небольшое, компактное, окрашивается в
красные тона, обычно расположено эксцентрично
(рис. 179, 17, 18). Пигментные гранулы многочислен-
ны, такой же формы, как в трофозоитах, беспорядочно
разбросаны в цитоплазме. Они не обнаруживаются в
области ядра гаметоцита. Выросшие гаметоциты пол-
ностью заполняют зараженные- эритроциты, размеры
которых не изменяются или они несколько мельче, чем
незараженные эритроциты. Диаметр выросших гаме-
тоцитов около 7 мкм.
Микрогаметоциты (рис. 179,19, 20). От макрога-
метоцитов отличаются признаками полового димор-
физма. Другие признаки, как у макрогаметоцитов.
Спорогония в многочисленных видах комаров рода
Anopheles при температуре 28 °C обычно завершается
по истечении 14—16, а при температуре 20 °C — по
истечении 30—35 дней. Скорость спорогонии у раз-
ных штаммов паразита при содержании комаров в
аналогичных условиях варьирует. Эксфлагелляция
происходит примерно через 1 ч после заглатывания ко-
марами зрелых гаметоцитов. Микрогамета представ-
ляет собой нитевидное тело с центрально расположен-
ным ядром. Длина микрогамет около 16 мкм. Зрелая
макрогамета овальной формы. Сформировавшиеся
оокинеты представляют собой червеобразные тела с
компактным ядром. В цитоплазме содержится боль-
шое количество пигментных гранул. Оокинеты миг-
рируют через стенку средней кишки москитов и ин-
цистируются с ее наружной стороны, давая начало
ооцистам. Число ооцист обычно невелико. Пигмент-
ные гранулы беспорядочно разбросаны в молодых
ооцистах. По мере созревания ооцист пигмент обычно
группируется в кучку вблизи пелликулы ооцисты, что
характерно для созревающих ооцист этого вида. В
ооцистах формируется несколько герминативных цен-
тров. Диаметр ооцист у разных штаммов паразита и
при развитии у разных видов комаров колеблется от
15 до 90 мкм, но чаще их диаметр составляет около
40 мкм. В них формируется несколько тысяч спорозои-
тов, которые попадают в слюнные железы в период
между 14 и 20 днями после заражения. Спорозоиты пред-
ставляют собой веретенообразные тела с центрально
расположенным ядром в виде лентовидного утолще-
ния, которое может занимать примерно 1/3 клетки.
В фиксированных и окрашенных препаратах длина
сформировавшихся спорозоитов около 13—14 мкм.
Подрод Vinckeia Garnham, 1964
Эритроцитарные меронты небольшие. Выросшие
гаметоциты округлые. Препатентный период длится
менее 4 дней. Паразиты низших приматов (Lemuridae),
грызунов (Rodentia), рукокрылых (Chiroptera), пар-
нокопытных (Artiodactyla) и некоторых других низ-
ших млекопитающих. Обнаружены только в Старом
Свете.
Типовой вид Plasmodium (Vinckeia) bubalis She-
ather, 1919.
308
ALVEOLATA
10 мкм
Рис. 179. Plasmodium (Plasmodium) malariae.
1—10 — трофозоиты; 11—15 — эритроцитарные меронты; 16—IS — макрогаметоциты; 19, 20 — микрогаметоциты. Зернистость Циманна присутствует в
некоторых зараженных эритроцитах (в, 9); пг — пигментная гранула, яп — ядро паразита.
Масштаб: 10 мкм.
Fig. 179. Plasmodium (Plasmodium) malariae.
1—10 — trophozoites; 11—15 — erythrocytic meronts; 16—18 — macrogametocytes; 19, 20 — microgametocytes. Ziemann’s stippling is visible in some infected
erythrocytes (5, 9); m — pigment granule, яп — nucleus of parasite.
Scale bar: 10 pm.
ТИП SPOROZOA. КЛАСС COCCtDEA
309
Видовой состав. В подрод входятР.(V.) atheru-
ri Berghe, Peel, Charddme et Lambrecht, 1958; P.(V.) ber-
ghei Vincke et Lips, 1948; P.(V.) chabaudi Landau, 1965;
P.(V.) girardi Buck, Couduriere et Quesnel, 1952; P.(V.)
vinckei Rodhain, 1952 и другие винкейи (всего около
20 видов).
Plasmodium (Vinckeia) vinckei Rodhain, 1952.
Распространение: тропическая Африка, где
встречается мозаично.
Хозяева: Thamnomys surdaster (Muridae, Roden-
tia) (типовой хозяин). Виды рода Aethomys заражаются
легко. Паразит хорошо развивается у белых мышей.
Некоторые штаммы адаптированы к лабораторным хо-
мякам.
Переносчики: Anopheles dureni (Culicidae) —
естественный переносчик. Экспериментальным пере-
носчиком является A. stephensi.
Жизненный цикл и морфология
Описаны 4 подвида, которые имеют отличитель-
ные особенности в развита и морфологии. Ниже при-
водятся сведения по номинативному подвиду Р. v. vin-
ckei Rodhain, 1952. Экзоэритроцитарная мерогония
проходит в гепатоцитах и у разных хозяев завершается
примерно по истечении 53—61 ч. Ядро зараженного
гепатоцита не гипертрофируется. Диаметр зрелых эк-
зоэритроцитарных меронтов в среднем обычно около
30---40 мкм. В них формируется несколько тысяч ме-
розоитов. Паразиты персистируют в печени. Вторич-
ная экзоэритроцитарная мерогония и рецидивы имеют
место.
Трофозоиты (рис. 180,1—5). Обычно развиваются
в зрелых эритроцитах, округлой формы. Цитоплазма
скудная. Ядро растущих трофозоитов небольшое, ком-
пактное, может быть разделено на две неодинакового
размера порции (рис. 180, 2, 5). Амебоидность очерта-
ний трофозоитов нехарактерна. Пигмент появляется в
крупных трофозоитах в виде небольшой гранулы золо-
тистого цвета. Инвазия одного эритроцита нескольки-
ми трофозоитами встречается часто (рис. 180, 4). При
этом зараженные клетки могут гипертрофироваться.
Эритроцитарные меронты (рис. 180, 6, 7). Разви-
ваются в зрелых эритроцитах. Зрелые меронты неболь-
шие, занимают около 2/3 зараженных эритроцитов.
Пигмент обильный уже на ранних стадиях развития
меронтов, золотистого цвета, в зрелых меронтах со-
бран в одну компактную массу, расположенную между
мерозоитами (рис. 180, 7). В меронтах у разных хозяев
формируется 6—16 (в среднем обычно 8 или 10) меро-
ilOHTOB. Цикл эритроцитарной мерогонии составляет
около 24 ч.
Макрогаметоциты (рис. 180, 8, 9). Развиваются в
чрслых эритроцитах. Цитоплазма гаметоцитов окра-
111111111СТСЯ в различные оттенки голубого цвета. Ядро
небольшое, компактное, окрашивается в красные тона,
обычно расположено на периферии гаметоцита. Пиг-
ментные гранулы разбросаны в цитоплазме. Вырос-
шие гаметоциты округлые, диаметром около 6—8 (в
ОЦвДНСМ около 7) мкм, заполняют зараженные эритро-
ЦНТЫ, ко торые могут слегка гипертрофироваться.
Микрогаметоциты (рис. 180,10—12). От макрога-
метоцитов отличаются признаками полового димор-
физма. Они несколько мельче, чем макрогаметоциты.
Другие признаки, как у макрогаметоцитов.
Спорогония в комаре Anopheles stephensi при тем-
пературе 21 °C обычно завершается по истечении
14 дней. Сформировавшиеся оокинеты представляют
собой червеобразные тела с компактным ядром, кото-
рое расположено в дистальной половине клетки. Один
конец (апикальный) оокинет заострен, а другой (ди-
стальный) закруглен. Пигмент обычно сконцентриро-
ван в одну компактную массу. Длина зрелых оокинет
около 8—10 мкм. Диаметр зрелых ооцист обычно ко-
леблется в пределах 40—70 мкм. В них формируется
несколько тысяч спорозоитов, которые попадают в
слюнные железы комаров в период между 13 и 14 дня-
ми после заражения при температуре 21 °C. Спорозои-
ты представляют собой веретенообразные тела с цент-
рально расположенным ядром. В фиксированных и
окрашенных препаратах длина сформировавшихся
спорозоитов обычно около 15 мкм.
Подрод Laverania Grassi et Feletti, 1890
Эритроцитарные меронты крупные. Выросшие га-
метоциты удлиненные (полулунные). Препатентный
период длится более 4 дней. Паразиты высших прима-
тов (Anthropoidea).
Типовой вид Plasmodium (Laverania) falciparum
(Welch, 1897).
Видовой состав. В подроде 2 вида. Кроме ти-
пового вида, в подрод входит P.(L.) reichenowi Sluiter,
Swellengrebel et Ihle, 1922 (естественный хозяин Pan
troglodytes).
Plasmodium (Laverania) falciparum (Welch, 1897).
(= Oscillaria malariae Laveran, 1881; Plasmodium malariae Mar-
chiafava et Celli, 1885; Laverania malariae Feletti et Grassi, 1889; Ha-
emamoeba praecox Grassi et Feletti, 1890 (partim); Ematozoo falcifor-
me Antolisei et Angelini, 1890; Haemamoeba immaculata Grassi, 1891
(partim); Plasmodium malariae quotidianae Celli et Sanfelice, 1891;
Haemamoeba febris irregularis Sakharov, 1892; Plasmodium malariae
irregularis Kruse, 1892; Haemamoeba laverani Labbe, 1894; Haemato-
zoonfalciformeyh&yerelti&Ne^on, 1895;77. falciparum Welch, 1897;
Haemosporidium undecimanae Lewkowicz, 1897; H. sedecimanae
Lewkowicz, 1897; H. vigesimotertianae Lewkowicz, 1897; Plasmodi-
um tropica Koch, 1899).
Распространение: в настоящее время распро-
странен в тропиках и субтропиках, а также в странах
с теплым климатом обычно в пределах летней изо-
термы около 20 °C. Наиболее часто регистрируется в
тропической Африке, в северо-западной Индии и в
Шри-Ланке. В прошлом ареал охватывал значитель-
ную часть Голарктики с отдельными вспышками
тропической малярии даже в ее северных регионах
(г. Сольвычегодск, Россия, около 61° с. ш.).
Хозяева: Homo sapiens (Hominidae, Primates) (ти-
повой хозяин). Экспериментально заражены Alouatta
fusca, A. villosa, Aotus trivirgatus, Ateles fusciceps, Cebus
capucinus, Hylobates lar, Macaca mulatto, M. nemestrina,
Pan troglodytes, Saguinus geoffroyi, Saimiri sciureus и
некоторые другие виды приматов.
Переносчики: многочисленные виды комаров
из рода Anopheles (более 80 видов). Восприимчивость
310
ALVEOLATA
ЯП
Рис. 180. Plasmodium (Vinckeia) vinckei.
1—5 — трофозоиты; 6, 7—эритроцитарные меронты; 8,9 — макрогаметоциты; 10—12 — микрогаметоциты; пг — пигментная гранула, яп — ядро паразита.
Fig. 180. Plasmodium (Vinckeia) vinckei.
1—5 — trophozoites; 6,7 — erythrocytic meronts; 8, 9 — macrogametocytes; 10—12 — microgametocytes; m — pigment granule, яп — nucleus of parasite.
одних и тех же видов Anopheles к различным штаммам
паразита может варьировать от 100%-ной заражаемо-
сти до полной резистентности.
Жизненный цикл и морфология
Экзоэритроцитарные меронты развиваются в па-
ренхиматозных клетках печени (гепатоциты) (рис. 178,
4—7). В ходе развития меронтов формируются псевдо-
цитомеры, содержащие множество ядер (рис. 178, 5,
6). По мере созревания меронтов число псевдоцитоме-
ров увеличивается, а число ядер в них уменьшается.
Очертания меронтов варьируют от ровных до более
или менее дольчатых (рис. 178, б, 7). Экзоэритроцитар-
ная мерогония завершается примерно по истечении
5.5—7 дней. Диаметр зрелых меронтов достигает
40—60 мкм. В них формируются многие тысячи (в
среднем около 30 тыс.) мерозоитов. Клеточная реак-
ция на присутствие меронтов не выражена. Клетка-хо-
зяин увеличивается в размерах, ее ядро смещается,
но его размеры по сравнению с размерами ядер неза-
раженных эритроцитов обычно не изменяются или из-
меняются лишь незначительно (рис. 178, 4—6). Диа-
метр сформировавшихся мерозоитов в среднем около
0.7 мкм. Они содержат ядро и небольшой участок ци-
топлазмы. Развивается лишь одна генерация зкзоэрит-
роцитарных меронтов. Вторичная экзоэритроцитарная
мерогония отсутствует. Паразиты в печени не перси-
стируют. Рецидивы отсутствуют.
Мерозоиты из экзоэритроцитарных меронтов по-
падают в кровь в период между 5 и 7 днями после зара-
жения человека спорозоитами. Продолжительность
препатентного периода у разных штаммов паразита
колеблется от 7 до 10 дней. Инкубационный период
длится около 9—14 (в среднем 12) дней. Возвраты по-
вышенной паразитемии (recrudescence) в связи с во-
зобновлением эритроцитарной мерогонии возможны.
Продолжительность инфекции у однократно заражен-
ных людей при отсутствии лечения примерно 1—
2 года.
Трофозоиты (рис. 181, 1—6). Развиваются в эрит-
роцитах всех стадий созревания. Юные трофозоиты
представляют собой мелкие «кольца» (диаметр около
1.2 мкм) с четко выраженной вакуолью и компактным
ядром; их диаметр равен примерно 1/5—1/6 диаметра
ТИП SPOROZOA. КЛАСС COCCIDEA
311
зараженных эритроцитов (рис. 181, 7). Они часто при-
легают к оболочке зараженных эритроцитов, что ха-
рактерно для этого вида. Инвазия одного эритроцита
несколькими трофозоитами встречается часто даже
при невысокой паразитемии (рис. 181, 1, 2). Амебоид-
ность очертаний трофозоитов нехарактерна, хотя у не-
которых штаммов паразита изредка отмечается. Хро-
матин ядра довольно часто располагается в виде двух
небольших гранул (рис. 181, 2). По мере роста размеры
ядра и вакуоли трофозоитов увеличиваются, а в цито-
плазме появляется 1—3 гранулы пигмента. На этой
стадии развития (примерно через 24 ч после появления
паразитов в крови) число трофозоитов в перифериче-
ской крови уменьшается. Трофозоиты продуцируют
белок, который проникает в оболочку эритроцита и
вызывает образование своеобразных утолщений, по-
средством которых зараженные эритроциты «слипа-
ются» друг с другом, а также прикрепляются к эндоте-
лиальным клеткам внутренних органов, включая го-
ловной мозг, сердце, плаценту, селезенку, костный
мозг и другие органы. Таким образом, растущие тро-
фозоиты концентрируются в кровотоке внутренних
органов, где впоследствии проходит эритроцитарная
мерогония. Очертания трофозоитов обычно ровные.
Их форма варьирует от округлой до неправильной.
Трофозоиты лентовидной формы в кровотоке внут-
ренних органов встречаются часто. При массовом за-
ражении появляются нетипичной формы трофозоиты,
включая паразитов с резко амебоидными очертаниями.
В выросших трофозоитах вакуоль неразличима, ядро
округляется, число пигментных гранул увеличивается.
В цитоплазме зараженных эритроцитов, содержащих
выросшие трофозоиты, появляются азурофильные ир-
регулярные образования, известные как пятнистость
Маурера (рис. 181,6), которая различима лишь при со-
блюдении определенных требований окраски.
Эритроцитарные меронты (рис. 181, 7—72). Раз-
виваются в эритроцитах всех стадий созревания, глав-
ным образом в кровотоке внутренних органов. В пери-
ферической крови они встречаются исключительно
редко при очень сильном заражении. Эритроцитарная
мерогония во внутренних органах начинается пример-
но через 24 ч после появления первых трофозоитов в
крови. Цитоплазма меронтов окрашивается в голубые
тона, обычно не содержит вакуолей. Форма и очерта-
ния меронтов вариабельны. Выросшие меронты зани-
мают большую часть зараженных эритроцитов. В них
формируется 8—24 (чаще 8—16) мерозоитов. Пигмен-
тные гранулы в растущих меронтах сгруппированы в
кучку, а в выросших агрегированы в одну желто-
вато-коричневую массу. В цитоплазме зараженных
эритроцитов при соответствующей окраске различима
пятнистость Маурера (рис. 181, 10). Размеры зрелых
меронтов варьируют, но не превышают размеров неза-
раженных эритроцитов. Обычно диаметр зрелых ме-
ронтов около 5—6 мкм. Зараженные эритроциты не
увеличиваются в размерах. Цикл эритроцитарной
мерогонии завершается через 48 ч. Периодичность
эритроцитарного развития 3 дня. Однако синхрониза-
ция мерогонии нестрогая. Довольно часто бывает не-
сколько различных генераций созревающих меронтов.
Н результате периодичность приступов лихорадки
у больных людей выражена не столь четко, как при
заражении другими видами малярийных паразитов
человека.
Макрогаметоциты (рис. 181, 13—18). Развивают-
ся в эритроцитах всех стадий созревания. Начало им
дают мерозоиты, формирующиеся в эритроцитарных
меронтах. Гаметоциты в периферической крови об-
наруживаются примерно через 8—11 (чаще 10) дней
после появления бесполых стадий. До этого они разви-
ваются в кровотоке внутренних органов, обычно в се-
лезенке и костном мозгу. Форма юных гаметоцитов
обычно округлая (рис. 181, 13, 14), хотя паразиты ир-
регулярной формы также отмечаются. Цитоплазма га-
метоцитов окрашивается в различные оттенки голубо-
го цвета. Ядро компактное, окрашивается в красные
тона. Пигментные гранулы многочисленные, вариа-
бельной формы, довольно часто удлиненные, тем-
но-коричневого или черного цвета. В растущих гаме-
тоцитах они беспорядочно разбросаны в цитоплазме
(рис. 181,14—16), а в зрелых гаметоцитах концентри-
руются по периферии ядра (рис. 181, 17, 18). По мере
созревания гаметоциты сначала округляются, а затем
удлиняются, приобретая удлиненную (полулунная)
форму с заостренными концами. На этой стадии разви-
тия они присутствуют в периферической крови. Зара-
женные эритроциты деформируются, вытягиваясь
вдоль гаметоцитов. Длина макрогаметоцитов обычно
около 12— 14 мкм.
Микрогаметоциты (рис. 181, 19, 20). От макрога-
метоцитов отличаются признаками полового димор-
физма. Ядро диффузное, занимает примерно половину
гаметоцита, содержит мелкие азурофильные гранулы.
Форма выросших микрогаметоцитов сосисковидная с
закругленными концами. Пигментные гранулы в зре-
лых гаметоцитах обычно располагаются в области
ядра и маскируют его (рис. 181, 20). Длина микрогаме-
тоцитов обычно 9—11 мкм. Другие признаки, как у
макрогаметоцитов.
Спорогония в многочисленных видах комаров рода
Anopheles при температуре 25—28 °C завершается по
истечении 9—11 дней. Скорость спорогонии у разных
штаммов паразита при содержании комаров в анало-
гичных условиях варьирует. Эксфлагелляция происхо-
дит примерно через 10—15 мин после заглатывания
комарами зрелых гаметоцитов. Микрогамета пред-
ставляет собой нитевидное тело с центрально располо-
женным ядром (рис. 178, 7). Длина микрогамет около
16—25 мкм. Зрелая макрогамета имеет овальную фор-
му, ядро расположено вблизи пелликулы. Примерно
через 30 мин после заражения комаров округлая зигота
начинает трансформироваться в удлиненную оокине-
ту. Сформировавшиеся оокинеты появляются в сред-
ней кишке комаров через 12—18 ч после заражения
(рис. 178, 2). Они представляют собой червеобразные
тела с компактным ядром, которое обычно расположе-
но ближе к одному из концов оокинет. В цитоплазме
обычно имеется одна или несколько вакуолей. Пиг-
ментные гранулы обычно сгруппированы на одном из
концов оокинет. Длина сформировавшихся оокинет
около 11—14, а ширина — 2.5 мкм. Оокинеты мигри-
руют через стенку средней кишки москитов и инцисти-
руются с ее наружной стороны, давая начало ооци-
стам. Ооцисты содержат пигментные гранулы. В ооци-
стах формируется несколько герминативных центров.
312
•_______________________alveolata
ТИП SPOROZOA. КЛАСС COCCIDEA
313
Пигментные гранулы по мере созревания ооцист часто
располагаются в виде рядов или цепочек, но есть иск-
лючения. Размеры зрелых ооцист у разных штаммов
паразита и при развитии у разных видов комаров суще-
ственно варьируют. Обычно их диаметр около 30—
60 мкм, хотя крупные ооцисты достигают в диаметре
80 мкм. В них формируется несколько тысяч споро-
зоитов. Спорозоиты представляют собой веретено-
образные тела примерно с одинаково заостренными
концами (рис. 178, 13). Ядро расположено в центре
спорозоита. В сухих окрашенных препаратах длина
сформировавшихся спорозоитов около 10.5—12 мкм.
Сем. Garniidae Lainson, Landau et Shaw,
1971
Мерогония проходит в клетках тканей и в клетках
крови позвоночных хозяев. Малярийный пигмент (ге-
мозоин) отсутствует во всех стадиях развития (имеют-
ся исключения). Паразиты рептилий и птиц.
Типовой род Garnia Lainson, Landau et Shaw,
1971.
Паразиты рептилий
В семействе три рода — Garnia, Fallisia и Рго-
garnia.
Род Garnia Lainson, Landau et Shaw, 1971
Характеристика семейства. Мерогония в перифери-
ческой крови и развитие гаметоцитов проходят в клет-
ках эритроцитарного ряда. Набор заражаемых клеток
крови у разных видов варьирует. Способность проду-
цировать малярийный пигмент (гемозоин) у большин-
ства видов утрачена либо значительно редуцирована.
В последнем случае отмечаются штаммы, продуциру-
ющие и не продуцирующие малярийный пигмент. Од-
нако даже у штаммов, не утративших способность про-
дуцировать пигмент, в клетках эритроцитарного ряда
преобладают паразиты, не имеющие пигмента. Пара-
зиты рептилий.
В род входит один подрод — Garnia.
Подрод Garnia Lainson, Landau et Shaw,
1971
Характеристика рода.
Типовой вид Garnia (Garnia) gonatodi (Telford,
1970).
Видовой состав. В подрод входят G. (G.) lain-
soni (Telford, 1978); G. (G.) morula (Telford, 1970);
G. (G.) multiformis Lainson, Shaw et Landau, 1975;
G. (G.) telfordi Lainson, Landau et Shaw, 1971; G. (G.) utin-
gensis Lainson, Landau et Shaw, 1971 и другие гарнии
(всего 10 видов).
Garnia (Garnia) gonatodi (Telford, 1970).
Распространение: Неотропическая зоогеогра-
фическая область. Распространен мозаично.
Хозяева: Gonatodes albogularis (Gekkonidae, Sau-
ria) (типовой хозяин). Паразит обнаружен у ящериц из
рода Gonatodes.
Переносчик: неизвестен.
Жизненный цикл и морфология
Экзоэритроцитарная мерогония не изучена. Трофо-
зоиты, меронты и гаметоциты развиваются в зрелых и
незрелых эритроцитах. Единичные меронты отмеча-
лись также в лимфоцитах, что в целом нехарактерно
для этого вида.
Трофозоиты (рис. 182, 1, 2). Самые юные обычно
овально-удлиненные, не имеют постоянного местопо-
ложения в клетке-хозяине. Цитоплазма окрашивается
бледно в различные оттенки голубого цвета. Ядро чет-
ко выражено. По мере роста приобретают иррегуляр-
ные или амебоидные очертания. На одном из концов
трофозоита часто формируется длинный нитевидный
вырост (рис. 182, 2). Растущие трофозоиты обычно
расположены латерально по отношению к ядру клет-
ки-хозяина. Выросшие трофозоиты обычно имеют уд-
линенную форму и вариабельные очертания. Их дли-
на, как правило, не превышает 6, а ширина — 2 мкм.
Малярийный пигмент отсутствует. Воздействие на
ядро и зараженный эритроцит не выражено или слабо
выражено.
Эритроцитарные меронты (рис. 182, 3—8). Цито-
плазма окрашивается в различные оттенки голубого
цвета, обильная. Ядра четко выражены. По мере роста
окраска цитоплазмы становится бледнее. Очертания
меронтов вариабельные. Преобладают меронты удли-
ненной формы, расположенные латерально по отноше-
нию к ядру зараженного эритроцита (рис. 182, 4, 6),
реже они располагаются на одном из полюсов эритро-
цита (рис. 182, 7). Часто встречаются также округлые и
овальные меронты, которые обычно располагаются на
полюсе зараженного эритроцита (рис. 182, 8). Ядра в
зрелых меронтах обычно расположены аморфно,
реже — в виде морулы и веерообразно. Их число ко-
леблется в пределах 12—50 (в среднем 28). Заражен-
ные эритроциты округляются, а их ядро смещается,
Рис. 181. Plasmodium (Laverania) falciparum.
I 6- трофозоиты; 7—12 — эритроцитарные меронты; 13—18 — макрогаметоциты; 19, 20 — микрогаметоциты. Пятнистость Маурера присутствует в не-
которых зараженных эритроцитах (6, 10); пг — пигментная гранула, яп — ядро паразита.
Масштаб: 10 мкм.
Fig. 181. Plasmodium (Laverania) falciparum.
/ 0 irophozoites; 7—12 — erythrocytic meronts; 13—18 — macrogametocytes; 19,20—microgametocytes. Maurer’s clefts are visible in some infected erythrocy-
tes (6, /0); m — pigment granule, яп — nucleus of parasite.
Scale bar: 10 |im.
314
ALVEOLATA
Рис. 182. Garnia (Gamia) gonatodi.
/, 2 - трофозоиты; 3-8 - эритроцитарные меронты; 9-13,15,16- макрогаметоциты, 14 - микротаметоцит; яд - ядрышко, якх- ядро клетки-хозяина
яп — ядро паразита.
Масштаб: 10 мкм.
Fig. 182. Gamia (Garnia') gonatodi.
1, - trophozoites, 3—8 — erythrocytic meronts; 9—13, 15,16 — macrogametocytes, 14 — microgametocyte; яд — nucleolus, якх — host-cell nucleus, яп — nucle-
us of parasite.
Scale bar: 10 gm.
ТИП SPOROZOA. КЛАСС COCCiDEA
315
причем наибольшее воздействие на клетку-хозяина
оказывают полностью выросшие округлые меронты
(рис. 182, 8). Малярийный пигмент в меронтах отсут-
ствует. Длина меронтов у типового позвоночного хозя-
ина в среднем около 12, а ширина — около 6 мкм. Фор-
ма сформировавшихся мерозоитов удлиненная. Один
их конец заострен, а другой закруглен. Их длина около
2—2.5, а ширина — около 1 мкм. Они имеют четко вы-
раженное, расположенное в центре ядро и бледно
окрашенную цитоплазму.
Макрогаметоциты (рис. 182, 9—13, 15, 16). Цито-
плазма окрашивается в различные оттенки голубого
цвета, гомогенная, часто содержит азурофильные гра-
нулы. Очертания ровные или слегка волнистые. Расту-
щие гаметоциты удлиненные, с заостренными концами
(рис. 182, 9—12). Среди выросших паразитов преобла-
дают паразиты банановидной формы (рис. 182,12, 13).
Весьма обычны также «толстые» сосисковидные пара-
зиты (рис. 182, 15, 16). Изредка (около 5 % от общего
числа гаметоцитов в типовом материале) встречаются
округлые паразиты. Ядро гаметоцитов вариабельной
формы, расположено в центре гаметоцитов. Ядрышко
обычно четко выражено, расположено на границе с ци-
топлазмой (рис. 182, 10—12). Выросшие гаметоциты
слегка смещают ядро и вызывают слабое округление
клетки-хозяина. Пигмент в гаметоцитах отсутствует.
Длина удлиненных гаметоцитов у типового позвоноч-
ного хозяина в среднем около 17, а ширина 5 мкм.
Микрогаметоциты (рис. 182, 14). От макрогаме-
тоцитов отличаются признаками полового диморфиз-
ма. Цитоплазма окрашивается в розоватые тона. Дру-
гие признаки, как у макрогаметоцитов.
Развитие в переносчике не изучено.
Род Fallisia Lainson, Landau et Shaw,
1974
Характеристика семейства. Мерогония в перифери-
ческой крови и развитие гаметоцитов проходят в тромбо-
цитах и лейкоцитах. В клетках эритроцитарного ряда па-
разиты не развиваются. Паразиты рептилий и птиц.
В род входят два подрода — Fallisia и Plasmodio-
ides.
Подрод Fallisia Lainson, Landau et Shaw,
1974
Характеристика рода. Паразиты рептилий?
Типовой вид Fallisia (Fallisia) effusa Lainson,
Landau et Shaw, 1974.
Видовой состав.В подрод входят F. (F.) auda-
ciosa Lainson, Shaw et Landau, 1975; F. (F.) copemani
Papema et Landau, 1990; F. (F.) modesta Lainson, Landau
et Shaw, 1974; F. (F.) simplex Lainson, Shaw et Landau,
1975; F. (F.) siamense (Telford, 1986) и другие фалли-
сии (всего около 10 видов).
Fallisia (Fallisia) effusa Lainson, Landau et Shaw, 1974.
Распространение: Неотропическая зоогеогра-
фическая область.
Хозяин: Neusticurus bicarinatus (Teiidae, Sauria).
Экстенсивность заражения некоторых популяций в се-
верной Бразилии достигает 80 % и более.
Переносчик: неизвестен.
Жизненный цикл и морфология
Мерогония во внутренних органах не изучена.
Трофозоиты, меронты и гаметоциты развиваются,
главным образом, в тромбоцитах, реже — в лимфо-
цитах.
Трофозоиты (рис. 183, 1, '2). Вариабельной фор-
мы, их очертания более или менее амебоидные. Цито-
плазма окрашивается в различные оттенки голубого
цвета. Ядро четко выражено. Слабо воздействуют
на зараженную клетку, что проявляется в основном в
смещении на периферию и слабой деформации ее
ядра.
Меронты в периферической крови (рис. 183,
3—6, 18, 19). Цитоплазма окрашивается в различные
оттенки голубого цвета, обильная. Ядра четко выраже-
ны. Форма меронтов округлая, реже — овальная. Од-
нако при множественном заражении одной клетки па-
разиты деформируются и приобретают вариабельную
форму (рис. 183, 5). Очертания меронтов ровные. Ме-
розоиты в зрелых меронтах расположены аморфно.
Мерозоиты удлиненной формы, с одним заостренным
и другим закругленным концом (рис. 183, 19). Длина
мерозоитов около 2, а ширина — 1 мкм. Меронт силь-
но воздействует на зараженную клетку, которая гипер-
трофируется, округляется, а ее ядро смещается на
периферию и деформируется (рис. 183, 3—6). Особен-
но сильному воздействию подвергаются клетки, со-
держащие несколько паразитов. Длина выросших ме-
ронтов в среднем около 14, а ширина — 10 мкм. В пе-
риферической крови имеет место несколько циклов
мерогонии. В одной клетке-хозяине могут одновре-
менно развиваться меронты и гаметоциты (рис. 183,
18, 19).
Макрогаметоциты (рис. 183, 7—10, 12—15, 17).
Цитоплазма окрашивается в различные оттенки голу-
бого цвета, гомогенная, содержит мелкие азурофиль-
ные гранулы, а также обычно одну, реже несколько
четких мелких (диаметр < 2 мкм) вакуолей (рис. 183,
10, 12—14). Форма гаметоцитов овальная или удли-
ненно-овальная. При заражении одной клетки не-
сколькими паразитами, что характерно для этого вида,
гаметоциты деформируются и принимают различную
форму (рис. 183, 13, 14). Очертания гаметоцитов ров-
ные. Ядро гаметоцитов четко выражено, окрашивается
в различные оттенки розового цвета, вариабельной
формы. Ядрышко четко выражено, расположено на
границе с цитоплазмой. Воздействие гаметоцитов на
зараженные клетки проявляется так же, как у меро-
нтов. При развитии гаметоцитов в тромбоцитах проис-
ходит сильное утолщение оболочки клетки-хозяина,
которая приобретает вид цисты (рис. 183, 10—17, 20).
При развитии гаметоцитов в лимфоцитах, а также
при развитии меронтов во всех типах клеток-хозяев
формирование цистоподобной оболочки не отмечает-
ся. Множественное заражение одной клетки трофо-
зоитами, меронтами и гаметоцитами весьма обычно
316
ALVEOLATA
ТИП SPOROZOA. КЛАСС COCCIDEA
317
(рис. 183, 15—20). Длина выросших гаметоцитов в
среднем около 10, а ширина — 6 мкм.
Микрогаметоциты (рис. 183, 11, 15—20). От мак-
рогаметоцитов отличаются признаками полового ди-
морфизма. Размеры микрогаметоцитов несколько
меньше размеров макрогаметоцитов. Другие призна-
ки, как у макрогаметоцитов.
Количественное соотношение макро- и микрогаме-
тоцитов в ходе паразитемии существенно варьирует.
Число макрогаметоцитов может превышать число
микрогаметоцитов в 1.3—50 раз. На поздних стадиях
паразитемии микрогаметоциты иногда совсем не обна-
руживаются, в то время как макрогаметоциты много-
численны.
Развитие в переносчике не изучено. При экспози-
ции крови, содержащей зрелые гаметоциты, на возду-
хе индуцировать гаметогенез не удалось.
Паразиты птиц
Подрод Plasmodioides Gabaldon,
Ulloa et Zerpa, 1985
Характеристика рода. Паразиты птиц.
Типовой видFallisia (Plasmodioides) neotropica-
lis Gabaldon, Ulloa et Zerpa, 1985; единственный вид
подрода.
Fallisia (Plasmodioides) neotropicalis Gabaldon, Ul-
loa et Zerpa, 1985.
Распространение: обнаружен только в Нео-
тропической зоогеографической области.
Хозяева: домашний голубь Columba livia (Colum-
bidae, Columbiforme) (типовой хозяин). Паразит обна-
ружен у многих видов аистообразных птиц (Ciconiifor-
mes) в Венесуэле. Наиболее экстенсивно заражены
птенцы. Домашний голубь интродуцирован в Неотро-
пики. Скорее всего, он заразился от аистообразных
птиц, так как в других зоогеографических областях
представители рода Fallisia у птиц не обнаружены.
В Венесуэле похожие на F. (Р.) neotropicalis парази-
ты выявлены также у птенцов Polyborus plancus (Falco-
niformes) и Anhinga anhinga (Pelecaniformes), однако
их видовая принадлежность окончательно не установ-
лена.
Переносчик: неизвестен.
Практическое значение. Изучено недоста-
точно. При сильном заражении птенцы домашних го-
лубей могут гибнуть.
Жизненный цикл и морфология
Мерогония во внутренних органах птенцов Colum-
ba livia легко индуцируется путем инокуляции крови,
содержащей зрелые меронты. Вторичные экзоэритро-
цитарные меронты (фанерозоиты) многочисленны у
интенсивно зараженных птенцов, погибших в возрасте
до 1 мес. Они выявлены в мазках-отпечатках головно-
го мозга, сердца, легких, печени, селезенки, почек и
костного мозга. Клетки, в которых проходит развитие
паразита, точно идентифицировать не удалось. Скорее
всего, паразит развивается в ретикулярных клетках и в
гистиоцитах соединительной ткани. Форма фанерозо-
итов в головном мозгу удлиненно-червеобразная, а в
других органах обычно округлая и лишь изредка удли-
ненная. Диаметр округлых зараженных клеток около
15 мкм. У них крупное ядро. Инвазия одной клетки не-
сколькими паразитами (от 2 до 10) регистрируется час-
то. При этом ядро клетки-хозяина часто приобретает
дольчатое строение, а меронты располагаются в «вы-
емке» ядра. Фанерозоиты содержат относительно
крупные ядра и несколько четко выраженных вакуо-
лей. Число мерозоитов в меронтах обычно более 100.
Меронты удлиненной формы похожи на таковые у
Plasmodium птиц.
При сильном заражении, ведущем к гибели позво-
ночного хозяина, фанерозоиты могут попадать в пери-
ферическую кровь. Они легко отличаются от меро-
нтов, развивающихся в клетках периферической кро-
ви, более крупными размерами ядер.
В периферической крови трофозоиты, меронты и
гаметоциты развиваются, главным образом, в тромбо-
цитах, реже — в лимфоцитах и моноцитах. Единичные
трофозоиты регистрировались в гранулоцитах и рети-
кулоцитах, однако дальнейшее развитие паразита в
этих клетках не отмечалось.
Трофозоиты (рис. 184,1, 2, 5). Вариабельной фор-
мы, их очертания ровные. Цитоплазма окрашивается в
различные оттенки голубого цвета. Ядро крупное, чет-
ко выражено. В тромбоцитах трофозоиты обычно рас-
положены вблизи одного из полюсов клетки-хозяина
(рис. 184, 1, 2). Паразит по мере роста сильно смещает
ядро и слегка гипертрофирует зараженный тромбоцит
(рис. 184, 2). В мононуклеарных лейкоцитах пара-
зит обычно расположен в «выемке» ядра и окружен
более светлым участком цитоплазмы клетки-хозяина
(рис. 184, 5). Ядро зараженных мононуклеарных лей-
коцитов выросшими трофозоитами заметно смещается
на периферию.
Меронты в периферической крови (рис. 184, 5, 4,
6, 7). Цитоплазма окрашивается в различные оттенки
Рис. 183. Fallisia (Fallisia) effusa.
/, 2 — трофозоиты; 3—6,18,19 — меронты в периферической крови; 7—10,12—14, 17 — макрогаметоциты; И, 15—20 — микрогаметоциты; 5, 9, 12—20 —
инвазия клеток-хозяев несколькими паразитами, включая меронты (5,18, 19), гаметоциты (9,12—20) и мерозоиты (79); вк — вакуоль, яд — ядрышко,якх —
ядро клетки-хозяина, яп — ядро паразита.
Масштаб: 10 мкм.
Fig. 183. Fallisia (Fallisia) effusa.
1, 2 — trophozoites; 3—6, 18, 19 — mcronts in peripheral blood; 7—10, 12—14,17 — macrogametocytes; 11,15—20 — microgametocytes; 5, 9,12—20 — infection
of host-cells with several parasites, including meronts (5,18,19), gametocytes (9,12—20) and merozoites (79); вк — vacuole, яд — nucleolus, якх — host-cell nucleus,
яп — nucleus of parasite.
Scale bar: 10 pm.
318
ALVEOLATA
Рис. 184. Fallisia (Plasmodioides) neotropicalis. (По: Валькюнас, 1997),
1,2,5 — трофозоиты; 3,4, 6, 7 — меронты в периферической крови; 8—10,13,14 — макрогаметоциты; / /, 12 — микрогамстоциты; аг — азурофильная гра-
нула, ме — мерозоит, яд — ядрышко, якх — ядро клетки-хозяина, яп — ядро паразита,
Масштаб: 10 мкм.
Fig. 184. Fallisia (Plasmodioides) neotropicalis.
1, 2,5 — trophozoites; 3, 4,6, 7— meronts in peripheral blood; 8—10,13,14 — macrogametocytes; 11,12 — microgametocytes; аг—azurophilic granule,ме — me-
rozoite, яд — nucleolus, якх — host-cell nucleus, яп — nucleus of parasite.
Scale bar: 10 pm.
ТИП SPOROZOA. КЛАСС COCCIDEA
319
голубого цвета, обильная. Ядра четко выражены. Фор-
ма растущих меронтов вариабельная, а очертания ров-
ные. По мере роста и созревания меронты округляют-
ся. Выросшие нед сформированные меронты имеют
округлую, реже овальную или серповидную (рис. 184,
4, 7) форму. Число ядер в выросших меронтах обычно
9—23. В отдельных лопнувших меронтах обнаружива-
ется до 43 мерозоитов. Мерозоиты в зрелых меронтах
расположены беспорядочно (рис. 184, 4, 7). Меронты
сильно воздействуют на зараженную клетку, которая
гипертрофируется, а ее цитоплазма обычно полностью
или почти полностью заполняется паразитом. Ядро
клетки-хозяина смещается на периферию и деформи-
руется (рис. 184, 4, 7). При развитии в мононуклеар-
ных лейкоцитах паразит обычно располагается в «вы-
емке» ядра клетки-хозяина (рис. 184, 6), что нехарак-
терно при развитии паразита в тромбоцитах (рис. 184,
3, 4). Длина выросших меронтов около 6—8, а шири-
на — около 6 мкм.
Макрогаметоциты (рис. 184, 8—10, 13, 14). Цито-
плазма окрашивается в различные оттенки голубого
цвета, гомогенная, содержит азурофильные гранулы.
Эти гранулы не содержат валютина. Вакуоли в цито-
плазме обычно отсутствуют. Ядро четко выражено, ва-
риабельной формы, окрашивается в различные оттен-
ки розового цвета, обычно содержит хорошо различи-
мое ядрышко. Форма гаметоцитов вариабельная и
зависит от формы и положения ядра клетки-хозяина
(рис. 184, 9,10, 14). Воздействие гаметоцитов на зара-
женную клетку проявляется так же, как у меронтов.
При инвазии несколькими паразитами зараженные
клетки сильно деформируются и могут принимать
причудливую форму. Длина гаметоцитов в среднем
около 8.5, а ширина — около 5.5 мкм.
Микрогаметоциты (рис. 184, 11, 12). От макрога-
метоцитов отличаются признаками полового димор-
физма. Другие признаки, как у макрогаметоцитов.
У экспериментально зараженных птенцов голубей
пик паразитемии отмечается в период между 2 и 3 нед
после инокуляции крови, содержащей зрелые меро-
нты. В это время обычно около 50 % тромбоцитов,
12 мононуклеарных лимфоцитов и 2 % гранулоцитов
заражено. Гранулоциты, вероятно, способны фагоци-
тировать паразита.
Развитие в переносчике не изучено. Есть косвен-
ные свидетельства, что переносчиком может быть
Aedeomyia squamipennis (Culicidae) (Gabaldon et al.,
1985). Однако это требует проверки. Оокинеты форми-
руются в средней кишке Anopheles albimanus. Они
представляют собой червеобразные тела, содержат от-
носительно крупное ядро и азурофильные гранулы.
Длина оокинет колеблется примерно от 11 до 15, а ши-
рина — от 2.8 до 3.2 мкм.
Род Progarnia Lainson, 1995
Характеристика семейства. Мерогония в перифери-
ческой крови проходит в основном в лейкоцитах и
тромбоцитах, но также и в клетках эритроцитарного
ряда. Гаметоциты развиваются в лейкоцитах и тромбо-
цитах. Паразиты крокодилов (Crocodilia).
В роде один подрод — Progarnia.
Подрод Progarnia Lainson, 1995
Характеристика рода. Паразит крокодилов (Croco-
dilia).
Типовой вид Progarnia (Progarnia) archosauriae
Lainson, 1995; единственный вид рода и подрода.
Progarnia (Progarnia) archosauriae Lainson, 1975.
Распространение: Северная Бразилия.
Хозяин: Caiman crocodilus (Alligatoridae).
Переносчик: неизвестен.
Жизненный цикл и морфология
Мерогония во внутренних органах не изучена.
Меронты в периферической крови (рис. 185,
1—4, 6, 7). Наиболее часто развиваются в лимфоцитах
(рис. 185, 1, 2) и моноцитах (рис. 185, 3), реже — в
тромбоцитах (рис. 185, 4) и эритроцитах (рис. 182, 6,
7), причем обычно меронты регистрировались в моло-
дых эритроцитах. Цитоплазма окрашивается в различ-
ные оттенки голубого цвета, обильная, слабовакуоли-
зированная, обычно содержит азурофильные гранулы
(рис. 185, 2). Ядра четко выражены. По мере роста
окраска цитоплазмы становится бледнее. Форма и
очертания меронтов вариабельные. В лейкоцитах пре-
обладают меронты округлой и овальной формы с ров-
ными очертаниями (рис. 185,1—4), а в эритроцитах —
неправильной, угловатой формы (рис. 185, 6), довольно
часто с амебоидными очертаниями. Число ядер в зре-
лых меронтах, формирующихся в лимфоцитах и моно-
цитах, колеблется от 8 до 22. В зрелых тромбоцитар-
ных и эритроцитарных меронтах число ядер в среднем
меньше. Ядра в зрелых меронтах обычно расположены
аморфно (рис. 185,1, 2). Малярийный пигмент в меро-
нтах отсутствует. Воздействие паразитов на заражен-
ные клетки слабое и проявляется их деформацией, а
также смещением и деформацией их ядер. Размеры ме-
ронтов при развитии в различных клетках существен-
но варьируют. Самые крупные меронты отмечаются в
моноцитах (длина около 14, а ширина — около 9 мкм),
а самые мелкие — в эритроцитах (соответственно око-
ло 7 и 4 мкм). Сформировавшиеся мерозоиты удли-
ненной формы. Один их конец закруглен, а другой
слегка заострен (рис. 185, 5). Мерозоиты имеют ком-
пактное ядро, которое расположено на одном из кон-
цов мерозоита, и одну четко выраженную азурофиль-
ную гранулу. Длина мерозоитов, сформировавшихся
в лейкоцитарных меронтах, в среднем 3, а ширина —
1.7 мкм.
Макрогаметоциты (рис. 185,8—10). Развиваются,
главным образом, в лимфоцитах, моноцитах и тромбо-
цитах. Единичные паразиты отмечались также в базо-
филах. Цитоплазма окрашивается в различные оттенки
голубого цвета, гомогенная, содержит вакуоли и мно-
гочисленные азурофильные гранулы. Форма гамето-
цитов округлая или овальная. Их очертания ровные.
Ядро гаметоцитов иррегулярной формы, не имеет в га-
метоцитах постоянного местоположения. Выросшие
гаметоциты деформируют зараженные клетки, обычно
располагаясь в «выемке» их ядер. Цитоплазма в зара-
женных тромбоцитах, содержащих зрелые гаметоци-
320
ALVEOLATA
Рис. 185. Progamia (Progarnia) archosauria.
I—4, 6, 7—меронты; 1,2 — в моноцитах; J — в лимфоците; 4 — в тромбоците; 6, 7— в молодых эритроцитах; 5 — мерозоиты, освободившиеся из лейкоци-
тарных меронтов; 8—10 — макрогаметоциты; 8,9 — в моноцитах, 10 — в тромбоците; 11 — микрогаметоцит в тромбоците; аг — азурофильная гранула,
вк — вакуоль, якх — ядро клетки-хозяина, яп — ядро паразита.
Масштаб; 10 мкм.
Fig. 185. Progarnia (Progarnia) archosauria.
I—4, 6,7— meronts; 1,2 — in monocytes; 5 — in lymphocyte; 4 — in thrombocyte; 6, 7— in young erythrocytes; 5 — merozoites from leukocytic meronts; 8—10 —
macrogametocytes; 8,9 — in monocytes, 10 — in thrombocyte; 11 — microgametocyte in thrombocyte; аг — azurophilic granulie, вк — vacuole, якх — host-cell nuc-
leus, яп — nucleus of parasite.
Scale bar: 10 pm.
ты, обычно неразличима (рис. 185, 10). Пигмент в га-
метоцитах отсутствует. Длина зрелых гаметоцитов
около 5—8 мкм.
Микрогаметоциты (рис. 185, 11). От макро-
гаметоцитов отличаются признаками полового ди-
морфизма. Цитоплазма окрашивается в розоватые
тона. Азурофильных гранул и вакуолей меньше, чем в
макрогаметоцитах. Ядрышко четко выражено. Число
микрогаметоцитов значительно меньше, чем макро-
гаметоцитов. Другие признаки, как у макрогамето-
цитов.
Сем. Leucocytozoidae Fallis et Bennett,
1961
Мерогония проходит в клетках тканей позвоноч-
ных хозяев. В клетках крови она отсутствует. Гамето-
циты развиваются в клетках эритроцитарного и (или)
лейкоцитарного рядов. Малярийный пигмент (гемо-
зоин) отсутствует на всех стадиях развития. Половой
процесс и спорогония происходят в кровососущих мош-
ках (Simuliidae), мокрецах (Ceratopogonidae) и комарах
(Culicidae). Паразиты птиц и рептилий.
ТИП SPOROZOA. КЛАСС COCCIDEA
321
Типовой род Leucocytozoon Berestneff 1904;
единственный род семейства.
Род Leucocytozoon Berestneff, 190410
Характеристика семейства.
Типовой вид Leucocytozoon danilewskyi (Zie-
mann, 1898).
В род входят три подрода — Saurocytozoon, Leuco-
cytozoon и Akiba.
Паразиты рептилий
Подрод Saurocytozoon Lainson et Shaw,
1969
Экзоэритроцитарная мерогония не изучена. Гаме-
тоциты развиваются в клетках лейкоцитарного и эрит-
роцитарного рядов. Зараженные клетки имеют округ-
лую форму. Спорогония в кровососущих комарах (Си-
licidae). Паразиты рептилий.
Типовой вид Leucocytozoon (Saurocytozoon) tu-
pinambi Lainson et Shaw, 1969.
Видовой состав. Кроме типового вида, в под-
род входит L. (S.) mabuyi Lainson, Landau et Shaw, 1974
(всего 2 вида).
Leucocytozoon (Saurocytozoon) tupinambi Lainson
et Shaw, 1969.
Распространение: обнаружен в Неотропиче-
ской и Индо-Малайской зоогеографических областях,
где распространен мозаично.
Хозяева: ящерицы Tupinambis teguixin (= Т. nig-
ropunctatus) (Teiidae, Sauria) (типовой хозяин) и Croco-
dilurus lacertinus.
Переносчик: естественный переносчик неизве-
стен. Спорогония завершается в экспериментально за-
раженных комарах Culex pipiens.
Жизненный цикл и морфология
Экзоэритроцитарная мерогония не изучена. Гаме-
тоциты развиваются в лимфоцитах и незрелых эритро-
цитах.
Молодые гаметоциты (рис. 186, 1—5). Овальной
формы, расположены в «выемке» ядра клетки-хозяина.
Их очертания ровные. Цитоплазма окрашивается блед-
но. В ней рано появляются азурофильные гранулы.
Растущие паразиты оказывают сильное воздействие на
зараженные клетки, ядро которых деформируется и
смещается на периферию.
Макрогаметоциты (рис. 186, 4—9). Цитоплазма
окрашивается в различные оттенки голубого цвета,
гомогенная, содержит большое число отчетливо вы-
раженных азурофильных гранул. Ядро гаметоцита
окрашивается в различные оттенки розового цвета, ва-
10 Авторство родового названия и типовой вид рода установле-
ны решением Международной комиссии по зоологической номен-
клатуре (International Commission of Zoological Nomenclature,
2001).
риабельной формы, не имеет в гаметоците постоянно-
го местоположения. Форма выросших гаметоцитов
округлая или овальная. Ядро клетки-хозяина дефор-
мировано, смещено на периферию, имеет форму ленты
или чаши, окружает гаметоцит до 1/2 длины его пери-
метра. Очертания внешнего края ядра у недеформиро-
ванных клеток-хозяев обычно иррегулярные (рис. 186,
4—6) или рваные (рис. 186, 7, 9), реже — ровные
(рис. 186, 8). Вокруг растущих гаметоцитов обычно
сохраняются остатки цитоплазмы клетки-хозяина, ко-
торые имеют неопределенную форму. Цитоплазму в
зараженных клетках, содержащих выросшие гаме-
тоциты, обычно различить не удается (рис. 186, 8). Ди-
аметр выросших гаметоцитов обычно около 13—
15 мкм.
Микрогаметоциты (рис. 186,10—12). От макрога-
метоцитов отличаются признаками полового димор-
физма. Азурофильные гранулы не столь многочислен-
ны, как у макрогаметоцитов. Ядро гаметоцитов диф-
фузное и трудноразличимое. Другие признаки, как у
макрогаметоцитов.
При экспозиции крови, содержащей зрелые гамето-
циты, на воздухе индуцировать гаметогенез и форми-
рование оокинеты не удалось. Спорогония завершает-
ся в комаре Culexpipiens (Landau et al., 1973). Оокине-
ты имеют типичную для гемоспоридий червеобразную
форму, не содержат крупных вакуолей. Их длина ко-
леблется в пределах 20—24, а ширина — в пределах
2—4.5 мкм. Ооцисты развиваются медленно в эпите-
лиальном слое средней кишки. Они не выпячиваются в
область гемоцеля. Крупные ооцисты достигают
30—60 мкм в диаметре. В них формируется несколь-
ко герминативных центров. Спорогония завершается
через 16 дней. Зрелые ооцисты содержат несколько
сотен веретенообразных спорозоитов, которые не уда-
валось регистрировать в слюнных железах. Не исклю-
чено, что одним из путей заражения новых хозяев
может быть поедание ими инфицированных перенос-
чиков.
Паразиты птиц
Подрод Leucocytozoon Berestneff, 1904
Первая генерация экзоэритроцитарных меронтов
развивается в клетках печени (гепатоциты). Мерозои-
ты первой генерации округлой или овальной формы.
Их длина менее 3 мкм. Меронты второй генерации раз-
виваются внутриклеточно. Препатентный период при
заражении спорозоитами обычно составляет менее
10 дней (имеются исключения). Гаметоциты развива-
ются в клетках эритроцитарного ряда и (или) в мононук-
леарных лейкоцитах. Зараженные клетки имеют округлую
и (или) веретенообразную форму. Спорогония в крово-
сосущих мошках (Simuliidae). У спорозоитов один ко-
нец закруглен, а другой заострен. Паразиты птиц.
Типовой вид Leucocytozoon (Leucocytozoon) da-
nilewskyi (Ziemann, 1898).
Видовой состав. В подрод входят L. (L.) majo-
ris (Laveran, 1902); L. (L.) marchouxi Mathis, Leger,
1910; L. (L.) smithi (Laveran et Lucet, 1905); L. (L.) toddi
Sambon, 1908; L. (L.) hamiltoni Valkiunas, lezhovaet Mi-
21 3nx. №4163
322
ALVEOLATA
Рис. 186. Leucocytozoon (Saurocytozoon) tupinambi.
1—3 — молодые гаметоциты, 4—9 — макрогаметоциты, 10—12 — микрогаметоциты; аг — азурофильная гранула, оцкх — остатки цитоплазмы клетки-хозя-
ина, якх — ядро клетки-хозяина, яп — ядро паразита.
Масштаб: 10 мкм.
Fig. 186. Leucocytozoon (Saurocytozoon) tupinambi.
1—3 — young gametocytes, 4—9 — macrogametocytes, 10—12 — microgametocytes; аг — azurophilic granule, оцкх — remnants of the host-cell cytoplasm, якх —
host-cell nucleus, яп — nucleus of parasite.
Scale bar: 10 pm.
ТИП SPOROZOA. КЛАСС COCCIDEA
323
ronov, 2002 и другие лейкоцитозооны (всего около
35 видов).
Leucocytozoon (Leucocytozoon) danilewskyi (Zie-
mann, 1898).
(= Haemamoeba ziemanni Lavcran, 1902 (partim); Leucocytozoon
ziemanni (Laveran, 1902); L. lutzi Carini, 1920; L. ziemanni var. bubo-
nis Fantham, 1926; L. ziemanni var. nebraskensis Coatney et Rouda-
bush, 1937; L. bubonis Fantham, 1926 (Glushchcnko, 1963 emend, pro
var. bubonis)).
Распространение: обнаружен у соовообраз-
ных птиц во всех зоогеографических областях. Наибо-
лее часто регистрируется в Голарктике, реже — в Эфи-
опской и Индо-Малайской областях. Из Неотропиков
и Австралийской области известны лишь единичные
находки.
Хозяева: Athene noctuae (Strigidac, Strigiformes)
(типовой хозяин). Паразит обнаружен у многих видов
совообразных птиц (> 20 видов).
Переносчики: Simulium aureuin, S. latipes, Prosi-
mulium decemarticulatum (Simuliidae).
Жизненный цикл и морфология
Обнаружено 4 типа экзоэритроцитарных меро-
нтов: печеночные в паренхиматозных клетках печени
(рис. 187,1—3), почечные в тубулярных клетках почек
(рис. 187, 7, 8), мегаломеронты в клетках ретикулоэн-
дотелия селезенки, печени, почек, сердца, кишечни-
ка, гонад и костного мозга (рис. 187, 4, 5) и мелкие чер-
веобразные меронты в эндотелии клеток легких
(рис. 187, б). Меронты не удалось обнаружить в голов-
ном мозгу.
Спорозоиты внедряются в клетки печени и почек и
дают начало первой генерации меронтов (рис. 187,
1—3, 7, 8). Мерозоиты, развивающиеся в этих меро-
нтах, дают начало гаметоцитам в округлых клет-
ках-хозяевах (рис. 188,1—3, 6). Препатентный период
составляет 4 дня. Развитие гаметоцитов завершается
через 2 дня. По истечении этого периода они становят-
ся заразными для переносчика.
В печени на 5-й день после заражения регистриру-
ются многочисленные одноядерные мерозоиты и
«осколки» печеночных меронтов (синцитии), содержа-
щие несколько ядер (рис. 187, 9). Синцитии разносятся
кровью во многие органы. Они захватываются клетка-
ми ретикулоэндотелиальной системы, и прежде всего
макрофагами, где они не фагоцитируются, а дают
начало мегаломеронтам (рис. 187, 4, 5). Последние
наиболее многочисленны в селезенке и печени. Ядро
клетки-хозяина (достаточное тело») гипертрофиро-
вано, обычно расположено в центре мегаломеронта
(рис. 187, 4). Максимальный диаметр выявленных у за-
раженных сов мегаломеронтов составлял 160 мкм. Со-
зревание мегаломеронтов происходит примерно в те-
чение 3 дней. Продуцируемые ими мерозоиты прони-
кают в эритробласты и лимфоциты и дают начало
гаметоцитам, клетки-хозяева которых принимают ве-
ретенообразную форму (рис. 188, 4, 5, 7, 8; рис. 189,
1—4). Созревание этих гаметоцитов завершается при-
мерно через 2 дня. Из мегаломеронтов высвобождает-
ся большое число мерозоитов, что ведет к быстрому
нарастанию паразитемии.
Роль червеобразных меронтов (рис. 187, 6) в цикле
развития паразита неясна.
Макрогаметоциты (рис. 188, 1—4, 7). Развивают-
ся в округлых и веретенообразных клетках-хозяе-
вах. Цитоплазма окрашивается в различные оттенки
синего цвета, часто содержит небольшие вакуоли.
Гранулы валютина обычно присутствуют. Форма
гаметоцитов в округлых клетках-хозяевах округлая
(рис. 188,1—3), а в веретенообразных — округлая или
овальная (рис. 188, 4, 7). Ядро гаметоцитов вариабель-
ной формы. Ядрышко четко выражено. Ядро округлых
клеток-хозяев смещается на периферию, деформиру-
ется и обычно имеет вид более или менее выраженной
чаши, реже лентовидное, окружает гаметоцит менее
чем на 1/2 длины его периметра. Ядро веретенообраз-
ных клеток-хозяев сильно деформировано и гипер-
трофировано, смещено на периферию, вытянуто в виде
ленты, имеет четко выраженные гантелевидные
утолщения на концах, которые вплотную прилегают
к гаметоциту (рис. 188, 4, 7). Цитоплазма округлых
клеток может быть вся заполнена гаметоцитом
(рис. 188, 3), но обычно вокруг паразита сохраняются
ее остатки в виде лоскутков неопределенной формы
(рис. 188, 1, 2). Цитоплазма веретенообразных клеток
сохраняется в виде отростков различной формы и дли-
ны (рис. 188, 4, 7).
Микрогаметоциты (рис. 188, 5, 6, 8). От макрога-
метоцитов отличаются признаками полового димор-
физма. Другие признаки, как у макрогаметоцитов.
Гаметоциты в округлых и веретенообразных клет-
ках-хозяевах заразны для переносчиков. При темпера-
туре около 21 °C оокинеты в организме переносчика
регистрируются примерно через 8 ч после заглатыва-
ния зрелых гаметоцитов (рис. 189, 5). Их длина в сред-
нем 35, а ширина — 5 мкм. Они мигрируют в стенку
средней кишки мошек, округляются и дают начало
ооцистам. На 5—7-й день диаметр ооцист достигает в
среднем около 16 мкм. В них присутствуют сформиро-
вавшиеся спорозоиты, которые регистрируются в
слюнных железах переносчика с 6-го по 27-й день по-
сле заражения. Длина спорозоитов в среднем 12, а ши-
рина — 4 мкм. У них один конец закруглен, а другой
заострен (рис. 189, 7).
Подрод Akiba Bennett, Garnham et Fallis,
1965
Первая генерация экзоэритроцитарных меронтов
развивается в клетках эндотелия капилляров многих
внутренних органов. В гепатоцитах меронты не разви-
ваются. Мерозоиты первой генерации удлиненные.
Их длина более 3 мкм. Меронты второй генерации мо-
гут развиваться внеклеточно. Препатентный период
при заражений спорозоитами составляет более 10 дней.
Гаметоциты развиваются в клетках эритроцитарного
ряда. Зараженные клетки имеют округлую форму.
Спорогония в кровососущих мокрецах (Ceratopogoni-
dae). Спорозоиты имеют заосгренные концы. Паразиты
птиц.
Типовой вид Leucocytozoon (Akiba) caulleryi
Mathis et Leger, 1909; единственный вид подрода.
324
ALVEOLATA
20 мкм
।-----------
20 мкм
20 мкм
150 мкм
100 мкм
« ® «= 10
10 мкм
50 мкм
20 мкм
Рис. 187. Экзоэритроцитарные меронты Leucocytozoon (Leucocytozoon) danilewskyi. (По: Khan, 1975, с изменениями и дополнениями).
1—3 — меронты в печени: 1 — молодой паразит, 2 — паразит с цитомерами, 3 — зрелый паразит; 4,5 — мегаломеронты: 4 — растущий паразит в стенке яич-
ника (видны многочисленные цитомеры), 5 — зрелый паразит в селезенке; 6—червеобразный паразит в легких; 7 — зрелый паразит в почках; 8 — фрагмент
меронта в кубоидальных клетках почек; 9 — синцитий из печеночного меронта; 10 — мерозоиты из печеночного меронта; мег — мегаломеронт, мер — ме-
ронт, ц — цитомер, якх — ядро клетки-хозяина.
Масштаб: 20 мкм (1—3, 6, 8), 150 мкм (4), 100 мкм (5), 50 мкм (7), 10 мкм (9, 10).
Fig. 187. Exoerythrocytic meronts of Leucocytozoon (Leucocytozoon) danilewskyi.
1—3 — meronts in liver: 7 — young parasite, 2 — parasite with cytomeres, 3 — mature parasite; 4,5 — megalomeronts: 4 — growing parasite in ovarian wall (numero-
us cytomeres are seen), 5 — mature parasite in spleen; 6 — worm-like in shape parasite in lungs; 7 — mature meront in kidney; 8 — a fragment of meront in cuboidal
cell of kidney; 9— syncytium from hepatic meront; 10 — merozoites from hepatic meront; мег — megalomeront, мер — meront, ц — cytomere, якх — host-cell nuc-
leus.
Scale bar: 20 pm (7—3, 6, 8), 150 pm (4), 100 pm (5), 50 pm (7), 10 pm (9. 10).
ТИП SPOROZOA. КЛАСС COCCIDEA
325
Рис. 188. Leucocytozoon (Leucocytozoon) danilewskyi, (По: Валькюнас, 1997).
/—4, 7 — макрогаметоциты; 5,6,8 — микрогаметоциты; вк — вакуоль, гв — гранула палютина, оцкх — остатки цитоплазмы клетки-хозяина, яд — ядрышко,
якх — ядро клетки-хозяина, яп - ядро паразита.
Масштаб: 10 мкм.
Fig. 188. Leucocytozoon (Leucocytozoon) danilewskyi,
I—4, 7 — macrogametocytes; 5, 6, 8 — microgametocytes; вк — vacuole, гв — valutin granule, оцкх — remnants of the host-cell cytoplasm, яд — nucleolus, якх —
host-cell nucleus, яп — nucleus of parasite.
Scale bar: 10 pm.
Leucocytozoon (Akiba) caulleryi Mathis et Leger,
1909,
(“ Leucocytozoon schuffneri Prowazek, 1912 (partim)).
Распространение: Южная и Юго-Восточная
Азия. Самая восточная находка в Японии, а запад-
ная — в южной части Казахстана.
Хозяева: домашние куры Gallus gallus (Phasiani-
dae, Galliformes) (типовой хозяин). У диких птиц пара-
зит не регистрировался.
Переносчики: Culicoides arakawae, С. circumsc-
riptus, С. odibilis, С. schultzei (Ceratopogonidae).
Практическое значение. Вызывает леталь-
ные эпизоотии у домашних кур в Юго-Восточной
Азии. В Японии до проведения массовой химиопрофи-
лактики экстенсивность заражения в некоторых мест-
ностях достигала 80—100, а смертность — 70—80 %.
Наибольшие потери птицеводство несет в весенне-лет-
ний период.
Жизненный цикл и морфология
Спорозоиты, инокулируемые мокрецами в кровя-
ное русло птиц, внедряются в клетки эндотелия капил-
ляров селезенки, легких, печени, сумки Фабрициуса и
других органов. Они дают начало первой генерации
326
ALVEOLATA
Рис. 189. Leucocytozoon (Leucocytozoon) danilewskyi. (По: Khan, 1975, с изменениями и дополнениями).
1—4 — начальные стадии развития гаметоцитов в молодых эритроцитах; ядро зараженных клеток сильно гипертрофируется, а веретенообразные выросты
цитоплазмы появляются на ранних стадиях развития гаметоцитов (4); 5 — оокинета; 6 — молодая ооциста; 7 — спорозоиты; вк — вакуоль, оцкх — остатки
цитоплазмы клетки-хозяина, яд — ядрышко, яп — ядро паразита, якх — ядро клетки-хозяина.
Масштаб: 10 мкм.
Fig. 189. Leucocytozoon (Leucocytozoon) danilewskyi.
1—4 — initial stages of development of gametocytes in mature erythrocytes; the nucleus of infected cell is markedly enlarged, and the host cell assumes the cytoplas-
mic processes at early stage of development of gametocyte (4); 5 — ookinete; 6—young oocyst; 7 — sporozoites; вк — vacuole, оцкх — remnants of the host-cell cy-
toplasm, яд — nucleolus, ял — nucleus of parasite, якх — host-cell nucleus.
Scale bar: 10 pm.
меронтов, появление которых регистрируется между 3
и 6 днями после заражения. Появление юных меронтов
отмечается на 3-й день. Зрелые меронты появляются в
период между 5 и 6 днями после заражения. Их диа-
метр составляет в среднем около 55 мкм. Ядро зара-
женных клеток увеличивается в размерах и смещается
на периферию (рис. 190, 7). Зрелые меронты окружены
тонкой пелликулой и содержат множество удлинен-
ных мерозоитов первой генерации (рис. 190, 2). Длина
сформировавшихся мерозоитов в среднем 7.1, а ши-
рина — менее 1 мкм. Эти мерозоиты в свою очередь
внедряются в клетки эндотелия капилляров самых раз-
личных органов и дают начало второй генерации меро-
нтов (мегаломеронты) (рис. 190, 3—5). Мегаломерон-
ты созревают через 14—15 дней после заражения спо-
розоитами. Диаметр зрелых мегаломеронтов обычно
колеблется от 100 до 200 мкм и относительно часто до-
стигает 300 мкм. Диаметр крупных мегаломеронтов
может достигать 500 мкм. Размеры мегаломеронтов за-
висят от особенностей их локализации. Отдельно рас-
тущие меронты крупнее, чем развивающиеся группа-
ми. В мегаломеронтах формируется огромное количе-
ство овальных мерозоитов второй генерации, длина
которых около 1.7, а ширина— 1 мкм. Эти мерозоиты
внедряются в эритроциты и дают начало гаметоцитам.
Препатентный период составляет 14—15 дней. Гаме-
тоциты (рис. 191) развиваются в молодых и зрелых
эритроцитах. В процессе роста гаметоцитов ядро вы-
тесняется из клетки-хозяина (рис. 191, 9, 10, 12, 13).
Выросшие гаметоциты часто регистрируются внекле-
точно (рис. 190, 10, 13).
Диаметрвыросшихмакрогаметоцитов (рис. 191,
5—7, 9, 10) около 15 мкм.
Микрогаметоциты (рис. 191,11—13). От макрога-
метоцитов отличаются признаками полового димор-
физма. Их размеры несколько мельче размеров макро-
гаметоцитов.
Рецидивы паразитемии не наблюдаются.
В средней кишке мокрецов, питавшихся кровью за-
раженных птиц, формируются гаметы и зиготы. Ооки-
неты формируются через 30—60 мин после заглатыва-
ния зрелых гаметоцитов. Длина оокинет около 21, а
ширина — 7 мкм. Оокинеты содержат крупное ядро и
большое количество крупных вакуолей. Они проника-
ют в стенку средней кишки, где превращаются в ооци-
сты. Диаметр зрелых ооцист около 10 мкм. В них фор-
мируется менее 100 спорозоитов, длина которых около
10, а ширина — 1.2 мкм. Спорозоиты имеют заострен-
ТИП SPOROZOA. КЛАСС COCCIDEA
327
30 мкм
200 мкм
Рис. 190. Экзоэритроцитарные меронты (7, 3—5) и мерозоит (2) Leucocytozoon (Akiba) caulleryi.
1 — зрелый меронт первой генерации в эндотелиальной клетке селезенки, 2 — удлиненный мерозоит первой генерации в периферической крови, 3 — расту-
щий мегаломеронт в легких, 4 — зрелый мегаломеронт в сердце, 5 — группа мегаломеронтов в легких; кол» — капсулообразная оболочка мегаломеронта,
мег — мегаломеронт, якх — ядро клетки-хозяина, яп — ядро паразита.
Масштаб: 30 мкм (7, 3), 10 мкм (2), 100 мкм (4), 200 мкм (5) (7—2 — no: Morii, Fukuda, 1992, с изменениями и дополнениями; 3—5 — по: Isobe, Akiba, 1990, с
изменениями).
Fig. 190. Exoerythrocytic meronts (7, 3—5) and a merozoite (2) of Leucocytozoon (Akiba) caulleryi.
1 — mature meront of the first generation in endothelial cell of spleen, 2 — long slender merozoite of the first generation in the peripheral blood, 3 — growing megalo-
meront in lungs, 4 — mature megalomeront in heart, 5 — a group of megalomeronts in lungs; ком — capsule-like envelope of tnegalomeront, мег — megalomeront,
якх — host-cell nucleus, яп — nucleus of parasite.
Scale bar: 30 pm (7, 3), 10 pm (2), 100 pm (4), 200 pm (5).
328
ALVEOLATA
Рис. 191. Leucocytozoon (Akiba) caulleryi. (По: Валькюнас, 1997).
7—4 — молодые гаметоциты; 5—7,9,10— макрогаметоциты; 8— макро- и микрогаметоцит в одной клетке-хозяине; 11—13 — микрогаметоциты; вк — ва-
куоль, оцкх — остатки цитоплазмы клетки-хозяина, яд — ядрышко, якх — ядро клетки-хозяина, яп — ядро паразита.
Масштаб: 10 мкм.
Fig. 191. Leucocytozoon (Akiba) caulleryi.
1—4 — young gametocytes; 5—7, 9,10 — macrogametocytes; 8 — macro- and microgametocyte in the same host cell; 11—13 — microgametocytes; вк — vacuole,
оцкх — remnants of the host-cell cytoplasm, яд — nucleolus, якх — host-cell nucleus, яп — nucleus of parasite.
Scale bar: 10 pm.
ТИП SPOROZOA. ЛИТЕРАТУРА
329
Рис. 192. Спорозоиты Leucocytozoon (Akiba) caulleryi. (По: Валькюнас, 1997).
яп — ядро паразита.
Масштаб: К) мкм.
Fig. 192. Sporozoites of Leucocytozoon (Akiba) caulleryi.
яп - nucleus of parasite.
Scale bar: 10 pin.
ные концы (рис. 192). При температуре 25 °C процесс
спорогонии завершается через 2—3 дня.
Выжившие птицы приобретают стерильный им-
мунитет. При повторном заражении переболевших
цыплят спорозоитами блокируется развитие мегало-
меронтов, хотя меронты первой генерации развива-
ются.11
ORDER HAEMOSPORIDA DANILEWSKY, 1885
SUMMARY
Obligate heteroxenous parasitic protists that inhabit amphibians,
reptiles, birds, and mammals and use blood-sucking dipteran insects
(Insecta: Diptera) as vectors. Merogony takes place in the blood cells
and (or) fixed tissues of the vertebrate hosts. Gametocytes develop in
blood cells; they are characterised by sexual dimorphic characters. Se-
xual process and sporogony take place in the blood-sucking dipterans.
Gametogenesis occurs outside the cells. Syzygy is absent. Each micro-
gametocyte produces eight microgametes, and each macrogametocyte
forms one macrogamete. Zygote transforms into motile ookinete. Du-
ring development, oocyst changes in size. Spores are absent. Sporozoi-
tes concentrate in the salivary glands of the vectors. Infection of verteb-
rate hosts takes place actively. Among the peculiarities of the ultrastruc-
ture of the haemosporidians, the absence of a conoid in sporozoite and
merozoite, and the presence of this organelle in ookinete should be po-
inted out first of all.
At present, taxonomists usually distinguish four families of the hae-
mosporidian parasites: Haemoproteidae, Plasmodiidae, Gamiidae, and
Leucocytozoidae. We accept one genus with seven subgenera in the fa-
mily Haemoproteidae, one genus with 14 subgenera in the family Plas-
modiidae, three genera (each with one or two subgenera) in the family
Gamiidae, and one genus with three subgenera in the family Leucocyto-
zoidae. For each taxon, author, date of the description, synonyms, and
diagnosis are given. Description and illustrations of the type species of
each subgenus are also given.
ЛИТЕРАТУРА
Валькюнас Г. Гемоспоридии птиц // Acta Zool. Lit. 1997.
Vol. 3—5 (a monograph). P. 1—607.
Крылов M. В. Определитель паразитических простейших.
СПб., 1996.
Лысенко А. Я. Этапы изучения, эволюция, филогения, таксо-
номия и география малярийных плазмодиев млекопитающих И Ма-
лярийные паразиты млекопитающих / Рсд. Т. В. Бейер, 3. И. Глазу-
нова, В. Д. Каллиникова, А. Я. Лысенко. Л., 1986. С. 5—28. (Про-
тозоология. Вып. 11).
Ahmed F. Е., Mohammed А.-Н. II. Schizogony in Haemoproteus
columbae Kruse // J. Protozool. 1977. Vol. 24. P. 389—393.
Atkinson С. T. Vectors, epizootiology, and pathogenicity of avian
species of Haemoproteus (Haemosporina: I laemoproteidae) II Bull. Soc.
Vector Ecol. 1991. Vol. 16. P. 109—126.
Atkinson С. T., Greiner E. C., Forrester D. J. Pre-erythrocytic
development and associated host responses to Haemoproteus meleagri-
dis (Haemosporina: Haemoproteidae) in experimentally infected do-
mestic turkeys II J. Protozool. 1986. Vol. 33. P. 375—381.
Ayala S. C., Lee D. Saurian malaria: development of sporozoites
in two species of phlebotomine sandflies // Science. 1970. Vol. 167.
P. 891—892.
Bennett G. F., Warren M., Cheong W. H. Biology of the Malay-
sian strain of Plasmodium juxtanucleare Versiani and Gomes, 1941. II.
The sporogonic stages in Culex (Culex) sitiens Wiedmann // J. Parasitol.
1966. Vol. 52. P. 647—652.
Coatney G. R., Collins W. E., Warren M., Contacos P. G. The
primate malarias. Washington, 1971.
Corradetti A., Garnham P. С. C., Laird M. New classification
of the avian malaria parasites // Parassitologia. 1963. Vol. 5, N 1.
P. 1—4.
Cranfield M. R., Shaw M., Beall F., Skjoldager M., laleggio D.
A review and update of avian malaria in the African penguin (Sphenis-
cus demersus) // Proc. Am. Ass. Zool. Vet. 1990. P. 243—248.
11 Работа над главой «Гемоспоридии» выполнена благодаря
гранту Литовского государственного фонда по науке и образо-
ванию.
330
ALVEOLATA
Dasgupta В. A new inului'iu I parasite of the flying squirrel // Parasi-
tology. 1967. Vol. 57. P. 467.474.
DeGiusti D. L., Sterling C. R., Dobrzechowski D. Transmission
of the eheloninn haenioproteid Haemoproteus metchnikovi by a tabanid
tly Chrysops cnllidus // Nature. 1973. Vol. 242. P. 50—51.
Earli R. A., Bastianello S. S., Bennett G. F., Krecek R. C. His-
topathology and morphology of the tissue stages of Haemoproteus co-
lumbnc causing mortality in Columbiformes // Avian Pathol. 1993.
Vol. 22. P. 67—80.
Fallis A. M., Bennett G. F. Description of Haemoproteus canachi-
tes n. sp. (Sporozoa: Haemoprpteidae) and sporogony in Culicoides
(Diptera: Ceratopogonidae) // Can. J. Zool. 1960. Vol. 38. P. 455—464.
Gabaldon A., Ulloa G., Zerpa N. Fallisia (Plasmodioides) neotro-
picalis subgen. nov. sp. nov. from Venezuela II Parasitology. 1985.
Vol. 90. P. 217—225.
Gardner R. A., Molyneux D. H. Polychromophilus murinus: a
malarial parasite of bats: lifehistory and ultrastructural studies // Parasi-
tology. 1988. Vol. 96. P. 591—605.
Garnham P. С. C. The subgenera of Plasmodium in mammals II
Ann. Soc. beige Med. trop. 1964. Vol. 44. P. 267—272.
Garnham P. С. C. Malaria parasites and other Haemosporidia.
Oxford, 1966.
Huchzermeyer F. W., Vyver F. H. van der. Isolation of Plasmo-
dium circumflexum from wild guineatowl (Numida meleagris) and the
experimental infection in domestic poultry II Avian Pathol. 1991.
Vol. 20. P. 213—223.
International Comission of Zoological Nomenclature. Opinion
1971. Leucocytozoon (Protista, Haemosporida): Berestneff (1904)
adopted as the author and date, and Leukocytozoen danilewskyi Zie-
mann, 1898 adopted as the type species // Bull. Zool. Nom. 2001.
Vol. 58. P. 145—147.
Isobe T., Akiba K. Early schizonts of Leucocytozoon caulleryi //
J. Parasitol. 1990. Vol. 76. P. 587—589.
Khan R. A. Development of Leucocytozoon ziemanni (Laveran) //
J. Parasitol. 1975. Vol. 61. P. 449—457.
Killick-Kendrick R. Taxonomy, zoogeography and evolution //
Rodent malaria I Eds R. Killick-Kendrick, W. Peters. New York, 1978.
P. 1—52.
Klein T. A., Young D. G., Telford S. R., Kimsey R. Experimen-
tal transmission of Plasmodium mexicanum by bites of infected Lutzo-
myia vexator (Diptera: Psychodidae) // J. Amer. Mosq. Contr. Ass.
1987. Vol. 3. P. 154—164.
Lainson R., Shaw J. J. New host records for Plasmodium diplog-
lossi, P. tropiduri Aragao andNeiva, 1909, and P. cnemidophori Carini,
1941 // Parasitology. 1969. Vol. 59. P. 163—170.
Landau I., Baccam D., Ratanaworabhan N., Yenbutra S., Bou-
lard Y., Chabaud A. G. Nouveaux Haemoproteidae parasites de Chi-
ropteres en Thailande // Ann. Parasitol. Hum. Comp. 1984. Vol. 59.
P. 437—447.
Landau I., Humphery-Smith I., Chabaud A. G., Miltgen F.,
Copeman B., Bouiard Y. Description et transmission experimentale
de I’haemoproteide Hepatocystis levinei n. sp. Parasite et Chiropteres
australiens // Ann. Parasitol. Hum. Comp. 1985. Vol. 60. P. 373—
382.
Landau I., Lainson R., Bouiard Y., Michel J.-C., Shaw J. J. De-
velopment chez Culex pipiens de Saurocytozoon tupinambi (Sporozoai-
re, Leucocytozoidae), parasite de lezards bresiliens // C. R. Acad. Sci.
Paris. Ser. D. 1973. T. 276. P. 2449—2452.
Miltgen F., Landau I., Canning E. U., Boorman J., Kremer M.
Hepatocystis de Malaisie. III. — Developement d’Hepatocystis brayi
chez Culicoides nubeculosus et C. variipennis II Ann. Parasitol. Hum.
Comp. 1976. Vol. 51. P. 299—302.
Misra К. K., Haidar D. P., Chakravarty M. M. Observations on
Mesnilium malariae gen. nov., spec. nov. (Haemosporidia, Sporozoa)
from the fresh water Teleost, Ophicephalus punctatus Bloch // Arch.
Ptotistenk. 1972. Bd 114. S. 444—452.
Mohammed A. H. H. Systematic and experimental stidies on pro-
tozoal blood parasites of Egyptian birds. Cairo, 1958. Vol. 1, 2.
Morii T., Fukuda M. Observations on first-generation schizogony
of Leucocytozoon caulleryi in chickens И J. Protozool. 1992. Vol. 39.
P. 281—287.
Paperna I., Landau I. Billbraya australis n. gen. n. sp. from the
South Australian gecko Phyllodactylus marmoratus // Ann. Patrasitol.
Hum. Comp. 1990. Vol. 65. P. 170—176.
Paperna I., Landau I. Haemoproteus (Haemosporidia) of lizards //
Bull. Mus. natl. Hist, nat., Paris. 1991. Vol. 13. P. 309—349.
Riper III C. van. The impact of introduced vectors and avian mala-
ria on insular passeriform bird population in Hawaii // Bull. Soc. Vector
Ecol. 1991. Vol. 16. P. 59—83.
Shortt H. E. Exo-erythrocytic schizont of Haemoproteus, parasite
of the gecko Hemidactylus sp., in the liver // Trans. R. Soc. Trop. Med.
Hyg. 1962. Vol. 56. P. 3.
Telford S. R. Saurian malarial parasites in eastern Panama // J. Pro-
tozool. 1970. Vol. 17. P. 566—574.
Telford S. R. A contribution to the systematics of the reptilian ma-
laria parasites, family Plasmodiidae (Apicomplexa: Haemospororina) //
Bull. Florida State Mus. Biol. Sci. 1988. Vol. 34. P. 65—96.
Telford S. R. Plasmodia of reptiles // Parasitic Protozoa. 2nd
ed. Vol. 7 / Eds I. R. Baker, J. P. Kreier. New York etc. 1994.
P. 1—71.
Telfoprd S. R. Two new species of Haemocystidium Castellani &
Willey (Apicomplexa: Plasmodiidae) from Pakistani lizards, and the
support their meronta provide for the validity of the genus // Syst. Para-
sitol. 1996. Vol. 34. P. 197—214.
Thompson P. E., Huff C. G. A saurian malarial parasite, Plas-
modium mexicanum, n. sp., with both elongatum-like and gallinace-
um-types of exoerythrocytic stages // J. Inf. Dis. 1944. Vol. 74.
P. 48—67.
Подкласс Piroplasmia Levine, 1961 — Пироплазмы
Пироплазмы — простейшие с гетероксенным жизненным
циклом, паразитирующие у позвоночных животных и в клещах
надсем. Ixodoidea. В организме позвоночных хозяев пироплаз-
мы развиваются в эритроцитах н клетках лимфатической сис-
темы, у беспозвоночных — в гемолимфе, гемоцитах, клетках
стенки кишечника, яйцевых и других клетках. У клещей-пере-
ноечнков пироплазмы могут передаваться от одной фазы их раз-
вития к другой и циркулировать трансовариально от генерации
к генерации. Стадии пироплазм, инвазирующие позвоночных
хозяев, созревают в слюнных железах клещей. Их передача по-
звоночным хозяевам осуществляется клещами при питании
кровью.
Пироплазмы распространены всесветно. Особенно богатая фа-
уна пироплазм в странах с жарким климатом: в Африке, Южной и
Центральной Америке, Южной Европе, Австралии и Азии.
Практическое значение пироплазм определяется их способно-
стью вызывать тяжело протекающие заболевания животных. На-
ходки пироплазм в организме человека придают проблеме еще
большее значение.
Пироплазмозы относятся к трансмиссивным природно-очаго-
вым заболеваниям, что существенно осложняет разработку эффек-
тивных мер борьбы с ними.
История изучения
В конце XIX в. в долине р. Дунай вспышка забо-
левания неизвестной этиологии уничтожила около
50 тыс. животных, что побудило румынское прави-
тельство создать специальную комиссию, в которую
входил Виктор Бабеш. Комиссии было поручено изу-
чить заболевание и разработать меры борьбы с ним.
Бабеш нашел в эритроцитах больных животных мик-
роорганизмы, которые он назвал Haematococcus bovis,
использовав термин Haematococcus для обозначения
формы и локализации организма. Систематическое по-
ложение возбудителя болезни определялось им как
промежуточное между бактериями и простейшими.
Бабеш предложил назвать это заболевание «бактери-
альная гемоглобинурия». Ему удалось воспроизвести
заболевание крупного рогатого скота гемоглобину-
рией, вводя кровь от больных животных. На рисунках,
ТИП SPOROZOA. КЛАСС COCCIDEA
331
которые приводит Бабеш (Babes, 1889), изображены
паразиты грушевидной формы, располагающиеся в
центре эритроцита. Размеры либо равны радиусу эрит-
роцита, либо несколько превышают его. Угол расхож-
дения между парными грушевидными формами варьи-
рует от тупого до острого (рис. 199, 2). Таким образом
в 1888 г. Бабеш открыл и впервые описал пироплазм,
вызывающих гемоглобинурию у крупного рогатого
скота. В 1892 г. он описал еще один вид пироплазм Ha-
ematococcus ovis, на этот раз у овец. Обнаруженного у
овец паразита Бабеш также считал гематококком.
Смит и Килборн (Smith, Kilbome, 1893), обследуя
животных, больных «техасской лихорадкой», нашли у
них в эритроцитах организмы грушевидной формы,
часто соединенные попарно цитоплазматическими мо-
стиками. Исследователи назвали этих паразитов Pyro-
soma bigemina. По мнению авторов, родовое название
должно было отражать грушевидную форму парази-
тов. Большой заслугой Смита и Килборна нужно счи-
тать то, что они впервые доказали роль клещей в пере-
носе этого заболевания и правильно определили систе-
матическое положение возбудителя болезни, поместив
его в тип Protozoa. В этом же году ученик Бабеша
Старковичи (Starcovici, 1893), обобщая работы Бабеша
и сравнивая описанных в Румынии паразитов с возбу-
дителями «техасской лихорадки» Pyrosoma bigemina,
предложил заменить родовое название Haematococcus
на Babesia в связи с тем, что название Haematococcus
было преоккупировано. С этого времени паразиты,
описанные Бабешем у крупного рогатого скота и овец,
стали называться Babesia bovis и В. ovis. Два года спус-
тя Вандоллек (Wandollek, 1895) предложил заменить
родовое название Pyrosoma на Apiosoma. Одновремен-
но Паттон (Patton, 1895) предложил название Piroplas-
та. В дальнейшем из этих трех названий получило
признание и широко распространилось лишь одно —
Piroplasma.
Мак Фадиан и Стокман (Mac Fadyean, Stockman,
1911) описали в Англии у крупного рогатого скота са-
мую мелкую пироплазму — Piroplasma divergens. Пар-
ные грушевидные формы этих паразитов имеют харак-
терное взаимное расположение под тупым углом. Ино-
гда угол расхождения между двумя особями достигает
180°, и в этих случаях одна особь паразита служит как
бы продолжением другой. Авторы подчеркивают, что
одной из характерных особенностей паразита является
его периферическое положение в эритроците. Парные
грушевидные формы паразитов располагаются иногда
на самом краю эритроцитов и напоминают по форме
очки. Через 7 лет Сонс (Sohns, 1918) нашел у крупного
рогатого скота, привезенного на о-в Ява из Австралии,
паразитов меньшего размера, чем Piroplasma bigemi-
пит, очень похожих на Р. divergens. Их парные груше-
видные формы в эритроцитах также располагались от-
носительно друг друга под тупым углом. Сонс (Sohns,
1918) образовал для этих паразитов новый род Micro-
babesia. Год спустя Мениль (Mesnil, 1919) предложил
заменить родовое название Babesia, которое дал Стар-
ковичи паразитам, описанным Бабешем, на Babesiella.
В этот род Мениль выделил паразитов, имеющих раз-
меры меньшие, чем Piroplasma bigeminum. Изменение
родового названия он мотивировал тем, что название
Babesia уже ранее было использовано Тревисаном для
обозначения бактерий — Babesia xantopyretica (Trevi-
san, 1889). Мениль считал, что лучше не использовать
дважды родовое название даже в том случае, если одно
обозначает простейшее, а другое — бактерию. Ново-
введение Мениля еще сильнее запутало и без того не-
ясную номенклатуру паразитов этой группы. Впослед-
ствии оказалось, что родовое название Babesia Trevi-
san, 1889 свободно, так как оно является синонимом
Streptococcus Rosenbach, 1884 (Breed et al., 1948).
В 1926 г. Якимов предложил паразитов рода Babe-
siella разделить на две группы — Babesiella и Francai-
ella. В дальнейшем — непонятно, на каком основании
выделенные Якимовым группы Babesiella и Francaiel-
la приобрели в отечественной литературе ранги подро-
дов, а в некоторых публикациях даже родов. В настоя-
щее время паразитов, формирующих при размножении
в эритроцитах две грушевидные стадии, относят к ро-
ду Babesia и помещают в сем. Babesiidae Poche, 1913.
Первые представители сем. Theileriidae были одновре-
менно обнаружены у крупного рогатого скота Тейлером
(Theiler, 1904), Джунковским и Лусом (Dschunkowsky,
Luhs, 1904). Первоночально их поместили в род Pirop-
lasma и назвали Piroplasma parvum и Р. annulatum. Поз-
же паразитов, имеющих наряду с эритроцитарными ста-
диями многоядерные стадии и развивающихся в клет-
ках лимфатической системы, Беттенкур с соавт. (Bet-
tencourt et al., 1907) выделили в род Theileria, а Дю Туа
(Du Той, 1918) включил этот род в сем. Theileriidae.
Несколько обособленное место от описанных выше
паразитов занимали пироплазмы, которые формируют
в эритроцитах стадии, состоящие из четырех особей и
напоминающие по форме мальтийский крест. Этих па-
разитов длительное время помещали то в род Nicollia
Nuttall, 1908, то в ^o^Nuttallia Franca, 1910 или Smithia
Franca, 1910 и даже в род Babesia Starcovici, 1893. Ра-
боты по расшифровке жизненных циклов этих пиро-
плазм показали, что у них имеются многоядерные пре-
эритроцитарные стадии, что сближает их с представи-
телями рода Theileria. В 1961 г. Ливайн (Levine, 1961)
повысил ранг пироплазмид до подкласса, а в 1981 г.
образовал в пределах отряда Piroplasmida для парази-
тов, эритроцитарные стадии которых не имеют суб-
пелликулярных микротрубочек, новое семейство Ant-
hemosomatidae.
Попытки расшифровать жизненный цикл пироплазм
были предприняты выдающимся микробиологом, од-
ним из основателей современной бактериологии, Ро-
бертом Кохом (Koch, 1906). Однако длительное время
вопрос о существовании в жизненном цикле пиро-
плазм полового процесса оставался спорным. Лишь во
второй половине XX в. удалось убедительно показать,
что развитие Theileria annulata и Т. parva проходит с
участием полового процесса (Schein, 1975; Mehlhom
et al., 1975; Mehlhom, Schein, 1976). Половые стадии
были также обнаружены у Babesia bigemina в кишеч-
нике клеща в первые 20 ч после насыщения (Weber,
Friedhoff, 1977). Электронно-микроскопические иссле-
дования позволили открыть половой процесс у Т. mic-
roti (=Babesia microti) (Rudzinska et al., 1983). В 1981 г.
вышла в свет монография М. В. Крылова «Пироплаз-
миды», в которой были подведены итоги фундамен-
тальных исследований по данной проблеме за столет-
ний период.
332
ALVEOLATA
Классификация
Подкласс Piroplasmia Levine, 1961
Отряд Piroplamida Wenyon, 1926
Сем. Theileriidae Du Toit, 1918
Род Theileria Bettencourt, Franca, Borges, 1907
Сем. Babesiidae Poche, 1913
Род Babesia Starcovici, 1893
Род Echinozoon Gamham, 1951
Сем. Anthemosomatidae Levine, 1981
Род Anthemosoma Landau, Boulard, Houin, 1969
Морфофункциональная
организация
Пироплазмы содержат разнообразные структури-
рованные органеллы, которые проходят свой цикл раз-
вития: возникают, развиваются, функционируют, ис-
чезают и создаются вновь. Высокая динамичность ор-
ганелл сделала необходимым изучение их структур в
процессе онтогенеза и функциональной активности.
Стало очевидно, что пироплазмы наряду с наличием
сходных черт в строении, имеют существенные мор-
фологические различия с другими Protozoa (рис. 193—
195). Все это значительно изменило наши представле-
ния о морфогенезе различных стадий жизненного цик-
ла пироплазм и способствовало созданию новых пред-
ставлений о филогении, эволюции и положении их в
системе.
Пелликулярный комплекс. Пелликулярный ком-
плекс состоит из пелликулы и ее производных: мемб-
ран, микропоры и полярных колец. В этот комплекс
включают также ряд субпелликулярных микротрубо-
чек, радиально расходящихся от апикального полярно-
го кольца.
Пелликула. Пелликула (= оболочка) отделяет
внутреннее содержимое клетки паразита от внешней
среды. Пограничное расположение пелликулы обу-
словливает ее полифункциональность. Пелликула по-
лупроницаема, ее лабильные функции и структурную
организацию поддерживает постоянный приток энер-
гии. Для пелликулы характерно поглощение веществ
(эндоцитоз) из внешней среды. Против градиента кон-
центрации в клетку паразита поступает вода, растворы
веществ и, по-видимому, даже комплексы молекул.
Пелликула участвует в транспорте веществ из организ-
ма хозяина в клетку паразита. Через нее происходит и
выделение (экзоцитоз) различных веществ: ассимиля-
тов (секреция), диссимилятов (экскреция) и продук-
тов, не использованных в метаболизме (рекреция).
Пелликула выполняет также структурную функцию и
служит для клетки паразита как бы наружным ске-
летом, придавая ей характерную форму. Кроме того,
она защищает внутреннее содержимое клетки от раз-
личных неблагоприятно действующих биотических и
абиотических факторов и, по-видимому, участвует в
организации движения паразита.
Структурная организация пелликулы у различных
стадий развития пироплазм, так же как и у других спо-
ровиков (грегарин, кокцидий и гемоспоридий), неоди-
накова. У стадий расселяющихся — мерозоитов и ки-
нет — она состоит из трех мембран. Наружный слой
пелликулы представлен типичной плазматической
мембраной, включающей в себя бимолекулярный ли-
пидный комплекс, покрытый с внешней стороны муко-
полисахаридами, а с внутренней — структурными или
ферментными белками. Внутренний слой построен из
двух цитоплазматических мембран, формирующих
альвеолярные пузырьки. Лабиринтная структура внут-
реннего слоя, которую часто называют внутренним
мембранным комплексом, придает пелликуле своеоб-
разное сетевидное строение. Наружный слой пеллику-
лы и внутренний мембранный комплекс разделены
межмембранным пространством.
Трехмембранная пелликула описана у подвижных
стадий Babesia bovis и В. bigemina из клещей-перенос-
чиков, у кинет Theileria annulata из клеща Hyalomma
anatolicum excavatum и у кинет Т. parva из клещаRhipi-
cephalus appendiculatus, а также у мерозоитов Anthe-
mosoma garnhami из позвоночного хозяина.
Трофозоиты A. garnhami окружены одной мембра-
ной и имеют прямой контакт со стромой эритроцитов;
одна мембрана описана у трофозоитов Babesia sp. и
В. felis и у трофозоитов Theileria annulata. Стадии
Т. parva клещей, которые рассматриваются как микро-
гаметы, имеют тоже одну мембрану.
При трансформации трофозоита в мерозоит у него
заново формируется внутренний мембранный комп-
лекс под наружной плазматической мембраной, и пел-
ликула приобретает трехмембранное строение.
Таким образом, строение пелликулы пироплазм на
различных стадиях их жизненного цикла меняется.
Поскольку в жизненном цикле пироплазм формирует-
ся несколько генераций мерозоитов и трофозоитов, из-
менение строения пелликулы происходит несколько
раз. Характерными особенностями этой перестройки
являются постоянное присутствие наружной плазма-
тической мембраны и частичное или полное исчезно-
вение двух внутренних цитоплазматических мембран
с последующей их репарацией de novo. Наличие трех
мембран у расселяющихся, обычно внеклеточных ста-
дий пироплазм, — мерозоитов и кинет — и исчезнове-
ние двух внутренних цитоплазматических мембран у
внутриклеточных стадий — трофозоитов — позволяет
думать, что две внутренние цитоплазматические мем-
браны выполняют защитные функции при внеклеточ-
ном существовании пироплазм, а на наружную плаз-
матическую мембрану возлагаются сложные метабо-
лические взаимоотношения с клеткой хозяина.
У внутриклеточных стадий некоторых пироплазм
(Babesia, Anthemosoma) описаны явления глубокой ин-
вагинации наружной плазматической мембраны в ци-
топлазму. Эти участки заполняются содержимым
клетки хозяина. По-видимому, таким образом, осуще-
ствляется один из способов захвата и переваривания
цитоплазмы клетки хозяина. Рудзинска (Rudzinska,
1976) считает, что Theileria microti (=Babesia microti)
переваривает цитоплазму клетки хозяина экстрацел-
люлярно. Внеклеточные стадии этого паразита погло-
щают ферритин пиноцитозом. Babesia bigemina, В. di-
vergens и В. ovis формируют пищеварительные вакуо-
ли путем инвагинации цитоплазмы клетки хозяина.
У Theileria equi (=Nicollia equi) питание осуществляет-
ся при участии двух структур: микропоры, с помощью
которой паразит поглощает гемоглобин эритроцитов,
и трубочек, образованных наружной плазматической
ТИП SPOROZOA. КЛАСС COCCIDEA
333
Рис. 193. Общая схема ультратоикой организации пироплазмид.
аг — аппарат Гольджи, апк — апикальное полярное кольцо, в — вакуоль, вмк —
внутренний мембранный комплекс, дпк — дистальное полярное кольцо, м — мик-
ропора, ми — митохондрия, мн — микронема, нпм — наружная плазматическая
мембрана, р — рибосома, ро — роптрия, спм — субпелликулярные микротрубоч-
ки, эр — эндоплазматический ретикулум, я — ядро, яд — ядрышко, яо — ядерная
оболочка, ял — ядерная пора. (По: Крылов, 1981).
Fig. 193. General diagram fine structure of Piroplasmida.
аг — Golgi apparatus, апк — apical polar ring, e — vacuole, вмк — inner membrane
complex, дпк — distal polar ring, м — micropore, mu — mitochondria, мн — microne-
mes, нпм — outer plasmatic membrane,p — ribosome,po — rhoptry, спм — subpellicu-
lar microtubules, эр — endoplasmic reticulum, я — nucleus, яд — nucleolus, яо — nuc-
lear membrane, ял — nuclear pore.
334
ALVEOLATA
нпм
я
cm
Рис. 194. Babesia ovis, зоит из слюнных желез клеща Rhipicephalus bursa.
апк — апикальное полярное кольцо, вмк—внутренний мембранный комплекс, дпк—ди-
стальное полярное кольцо, ми — митохондриальные структуры, нпм — наружная плаз-
матическая мембрана, ро — роптрия, ст — сферическое тело, эп — экскреторный про-
ток, я — ядро. (По: Scholtyseck, 1979, фрагмент).
Fig. 194. Babesia ovis, zoite in the salivary glands of tick Rhipicephalus bursa.
апк — apical polar ring, вмк — inner membrane complex, дпк — distal polar ring, mu — mito-
chondria, нпм — outer plasmatic membrane, po — rhoptry, я — nucleus, cm — spheroid body,
эп — excretory ductules.
я
Рис. 195. Babebsia ovis, мерозоиты.
апк — апикальное полярное кольцо, вмк — внутренний
мембранный комплекс, вп — вакуоль пищеварительная,
дпк — дистальное полярное кольцо, ми — митохондриаль-
ные структуры, нпм — наружная плазматическая мембрана,
пв — паразитофорная вакуоль, пп — перенуклеарное про-
странство, ро — роптрия, ст — сферическое тело, э — эрит-
роцит, эм — элементарная мембрана клетки хозяина, эр —
эндоплазматический ретикулум, я — ядро. (По: Scholtyseck,
1979).
Fig. 195. Babesia ovis, merozoites.
апк — apical polar ring, вмк — inner membrane complex, ea —
food vacuole, дпк — distal polar ring, mu — mitochondria,
н/ш — outer plasmatic membrane, ne — parasitophorous vacu-
ole, nn — perinuclear space, po — rhoptry, cm — spheroid
body, э — erythrocyte, эм — unit membrane, эр — endoplas-
mic reticulum , я — nucleus.
вп
дпк
ро
ЭР
пп
апк
эм
я пв вмк
ми
нпм
ТИП SPOROZOA. КЛАСС COCCIDEA
335
мембраной, через которые трофозоиты Т. equi втягива-
ют плазму крови. Питание Anthemosoma garnhami по-
казано на серийных электронно-микроскопических
снимках (Vivier, Petitprez, 1972). В клетке паразита об-
разуются полости (впячивания), в которые проникает
строма эритроцитов хозяина. В полостях паразита про-
исходит внеклеточное переваривание цитоплазмы
клетки хозяина с последующим транспортом продук-
тов гидролиза через плазматическую мембрану в клет-
ку паразита.
Транспорт питательных веществ в клетку пиро-
плазм осуществляется не только через пелликулу, но и
через специализированную органеллу, которая назы-
вается ультрацитостом, или микромера.
Микропора. Микропора (-- ультра цитостом) впер-
вые описана Гарнемом с соавт, ((iarnliam et al., 1961) у
спорозоитов Plasmodium falciparum и inviniiiin «микро-
пиле». Термин микропора предложили позже Ви-
вье и Эннере (Vivier, Hennere, 1964). Это структурное
образование, характерное для всех споровиков, было
найдено у Theileria parva, Т. anmilata, Т, mutanx, Т microti
(= В. microti), Т. lawrencei, Babesia bovis и В. bigemina.
Структурно микропора формируется с участием
наружной плазматической мембраны, образующей в
передней трети или средней части тела паразита инва-
гинацию. Внутренний мембранный комплекс преры-
вается у основания инвагинации наружной плазмати-
ческой мембраны и образует цилиндрическую струк-
туру. Микропора на тангенциальных срезах выглядит
как уплотненное двухслойное кольцо, а на поперечных
представляет собой канал, сформированный внутрен-
ним мембранным комплексом. Подвижные стадии
обычно имеют по одной микропоре, однако коли-
чество их может варьировать в зависимости от стадии
развития и вида паразита. Аналогичные образования
описаны у трофозоитов и меронтов. Микропора у
внутриклеточных стадий выполняет функцию ультра-
цитостома и участвует в поглощении паразитом содер-
жимого клетки хозяина.
Полярные кольца. У пироплазм на апикальном
полюсе отсутствует' структура, имеющая вид полого
усеченного конуса коноид. Однако, так же как и
для всех споровиков, для них характерно наличие
утолщенных структур, сформированных внутренним
мембранным комплексом, — полярных колец.
Эти образования на апикальном полюсе найдены у
многих видов пироплазм, на апикальном и дистальном
полюсах они описаны у стадий Babesia ovis, В. bovis,
В. bigemina, развивающихся в геле клещей-переносчи-
ков. Относительно роли полярных колец пока трудно
сказать что-либо определенное. Можно думать, что
они несут структурную функцию и служат каркасом
для субпелликулярных микротрубочек.
Субпелликулярные микрот рубочки. От апикаль-
ного полярного кольца под внутренним мембранным
комплексом радиально расходятся субпелликулярные
микротрубочки. Микротрубочки найдены у различных
групп Protozoa и в клетках Metazoa, однако этот тер-
мин не объединяет идентичные в физиологическом по-
нимании структуры и его следует рассматривать всего
лишь как морфологический.
Ультратонкое строение субпелликулярных микро-
трубочек споровиков относительно хорошо изучено на
Eimeria necatrix. Стенка микротрубочки состоит из не-
скольких (8—15) протофибрилл. Спирально упакован-
ные протофибриллы придают структуре поперечную
исчерченность.
Количество субпелликулярных микротрубочек и
их длина у различных видов паразитов существенно
варьируют. Часть субпелликулярных микротрубочек,
по-видимому, доходит до дистального полюса. Так, у
Theileria annulata обнаружено 60 субпелликулярных
микротрубочек, из которых 40 простираются только на
1/3 длины тела паразита, а 20 достигают дистального
полярного кольца. У Т. parva описано 40 субпеллику-
лярных микротрубочек, а у червеобразных стадий Ba-
besia bovis из клещей только 32. Субпелликулярные
микротрубочки известны также у стадий В. ovis, разви-
вающихся в яйцевых клетках клеща Rhipicephalus bur-
sa, у эритроцитарных стадий В. canis и у В. bigemina.
Формирование субпелликулярных микротрубочек de
novo описано у кинет Т. parva, развивающихся в кле-
щах.
Функция субпелликулярных микротрубочек оста-
ется неясной. Предполагается, что они играют роль
каркаса и участвуют в организации движения у споро-
виков. Субпелликулярные микротрубочки разрушают-
ся под действием колхицина или мочевины, что приво-
дит к утрате двигательных способностей паразита. Эти
данные интерпретируются как непрямое доказательст-
во участия субпелликулярных микротрубочек в дви-
жении паразитов.
Ядро. Ядра пироплазм относятся к эукариотному
типу. Пироплазмы — простейшие со сложным циклом
развития, в котором одноядерные стадии паразитов че-
редуются с многоядерными. Стадии, развивающиеся в
эритроцитах, обычно одноядерные. Иногда деление
ядра опережает деление цитоплазмы, и тогда у пред-
ставителей семейств Theileriidae, Anthemosomatidae и
Babesiidae 2 или 4 особи, каждая из которых содержит
по одному ядру, остаются некоторое время соединен-
ными цитоплазматическими мостиками. Много ядер
(несколько десятков), объединенных одной цитоплаз-
мой, имеют преэритроцитарные стадии представи-
телей сем. Theileriidae, которые развиваются в лимфо-
цитах и гистиоцитах. Многоядерные стадии, содержа-
щие от нескольких десятков до нескольких сотен ядер,
формируются в эпителиальных клетках кишечника, ге-
молимфе, гемоцитах и слюнных железах клещей-пере-
носчиков. Эти многоядерные стадии найдены у всех
пироплазм. Во всех случаях многоядерность у пироп-
лазм — временное явление, связанное с особым типом
размножения, при котором ядерные деления опережа-
ют деление цитоплазмы. Многоядерные стадии впо-
следствии дают начало одноядерным стадиям, число
которых равно числу ядер в многоядерных плазмоди-
ях. В пределах каждой многоядерной стадии ядра мор-
фологически одинаковы, поэтому пироплазм можно
отнести к равноядерным (гомокариотным) простей-
шим. Ядра у пироплазм небольшие, обычно их диа-
метр варьирует в пределах 0.3—2.2 мкм.
Ядро у пироплазм покрыто ядерной оболочкой, со-
стоящей из двух параллельных мембран — наружной
и внутренней — разделенных перенуклеарным про-
странством. Ядерная оболочка имеет поры, представ-
ляющие собой образования, в которых наружная мем-
336
ALVEOLATA
брана переходит во внутреннюю. На тангенциальных
срезах поры имеют вид плотных колец — аннуло-
сов. В просвете поры иногда видны или центральные
гранулы, или трубочки. Ядерная пора с аннулосом,
центральной гранулой или трубочкой и другими
структурами называется поровым комплексом.
Число поровых комплексов на единицу поверхности
ядра у простейших варьирует в широких пределах и в
большинстве случаев пропорционально размеру ядра.
Такое классическое строение ядерной оболочки с раз-
личной степенью полноты описано у представителей
сем. Theileriidae.
Внешняя ядерная оболочка переходит в мембраны
цистерн гранулированной эндоплазматической сети.
Непрерывный переход внешней ядерной оболочки в
мембраны эндоплазматической сети описан у червеоб-
разных стадий Babesia bigemina из клеща-перенос-
чика.
Ядрышко — область ядра, в которой происходит
транскрипция рибосомальных генов, описано у трофо-
зоитов В. ovis из клеща Rhipicephalus bursa и у черве-
образных мерозоитов В. bigemina.
Согласно классификации ядер простейших, пред-
ложенной Райковым (1978), ядра пироплазм следует
относить к разряду типичных пузырьковидных ядер,
так как они содержат деконденсированный хроматин.
Митоз у пироплазм изучен недостаточно. Извест-
но, что цитокинезу предшествует ядерное деление. В
начальных стадиях этого процесса внутри ядра появ-
ляются микротрубочки (Aikawa, Sterling, 1974). Бют-
тнер (Buttner, 1967а, 1967b) обнаружил у тейлерий в
ядрах меронта полуверетена с зернистыми полюсами,
встроенными в поры ядерной оболочки. Подобные об-
разования были описаны у Anthemosoma garnhami при
формировании «почек» в лопастном ядре меронта (Vi-
vier et al., 1974).
Цитоплазматические органеллы. Все, что нахо-
дится между ядром и пелликулой, принято называть
цитоплазмой. Цитоплазма включает в себя различные
органеллы12 — сложные структуры, выполняющие
специфические функции. Цитоплазма пироплазмид
наряду с типичными для животных клеток органелла-
ми содержит органеллы, характерные только для пред-
ставителей типа Sporozoa. У пироплазм, так же как
и у многих простейших, описаны эндоплазматическая
сеть, рибосомы, митохондрии, комплекс Гольджи.
Центриоли обнаружены у стадий Babesia ovis, развива-
ющихся в клеще Rhipicephalus bursa. Для цитоплазмы
пироплазм, так же как и для цитоплазмы всех спорови-
ков, характерны роптрии и микронемы. Кроме пере-
численных органелл у пироплазм в цитоплазме опи-
саны гранулы кристаллической формы, электронно-
плотные гранулы, «серые тела», большие и мелкие ва-
куоли, ограниченные одной мембраной с электрон-
но-прозрачным содержимым, классифицируемые как
клеточные включения.
Эндоплазматическая сеть и рибосомы. Большая
часть цитоплазмы заполнена системой пластинчатых
мембран, образующих так называемую эндоплазма-
12 Субпелликулярные микротрубочки относятся к цитоплазме,
однако в связи с тем, что они имеют пространственную и функцио-
нальную связь с пелликулой, мы сочли целесообразным рассмот-
реть их в разделе «Пелликулярный комплекс».
тическую сеть. В одних частях клетки плотно упако-
ванные мембраны эндоплазматической сети образуют
канальцы диаметром 50—100 нм, в других частях они
могут быть расширены и формируют уплощенные
мешочки, которые называют цистернами. Мембраны
разделяют цитоплазму на множество отсеков, что,
по-видимому, дает возможность для одновремен-
ного осуществления в клетке различных биохимиче-
ских процессов. Эндоплазматическая сеть у пироплазм
представляет собой непосредственное продолжение
ядерной оболочки и, как у всех животных, выполняет
ряд функций: синтез белков и липидов, транслокацию
веществ, запасание питательных веществ, переварива-
ние поступающих в клетку веществ и обновление с по-
мощью гидролаз собственных белков и нуклеиновых
кислот.
К мембранам эндоплазматической сети у пиро-
плазм прикреплено множество рибосом. Следователь-
но, эндоплазматическая сеть пироплазм относится к
гранулярному, или шероховатому типу. Наряду с при-
крепленными к эндоплазматической сети рибосомами
встречаются рибосомы, свободно взвешенные в основ-
ном веществе цитоплазмы. Рибосомы — мелкие нук-
леопротеидные частицы, которые синтезируются в
ядре и окончательно собираются в цитоплазме. Рибо-
сомы эндоплазматической сети пироплазм, как и у
всех эукариот, относятся к классу рибосом с констан-
той седиментации 80S. Структурная организация ри-
босомы универсальна: она состоит из двух неравных
субъединиц, на которые может диссоциировать и за-
тем вновь реассоциировать. На рибосомах происходит
синтез белка.
Эндоплазматическая сеть и рибосомы описаны у
стадий Theileria parva, развивающихся в клеще-пере-
носчике, у эритроцитарных стадий Т. annulata, Babesia
sp. и В. felis, у различных стадий развития В. ovis и
В. canis, а также у эритроцитарных стадий Anthemoso-
ma garnhami.
Комплекс Гольджи. Между ядром и передним по-
лярным кольцом у пироплазмид обнаружены блюдце-
видные или трубчатые структуры, ограниченные глад-
кими мембранами. Эти образования называют либо
аппаратом Гольджи, либо комплексом Гольджи. Функ-
ции комплекса Гольджи связаны с упаковкой, хране-
нием и транспортом различных продуктов жизнедея-
тельности клетки. Микропузырьки и цистерны, отпоч-
ковывающиеся от блюдцевидных структур комплекса
Гольджи, осуществляют транспортную роль. Кроме
того, считают, что этот комплекс участвует в синтезе
углеводных продуктов (мукополисахаридов и глико-
протеидов). У пироплазм он изучен недостаточно. Во
многих работах по ультратонкой организации пиро-
плазм отсутствуют твердые указания на наличие комп-
лекса Гольджи, и о его присутствии часто судят лишь
предположительно. Трубчатые структуры между яд-
ром и передним полярным кольцом описаны у мерозо-
итов В. bovis из клеща Boophilus micropilus. Похожие
структуры обнаружены также в эритроцитарных ста-
диях Theileria annulata.
Митохондрии. Структура и размеры митохондрий
широко варьируют в зависимости от вида организма,
типа ткани и метаболического состояния клетки. Фор-
ма митохондрий может быть сферической, цилиндри-
ТИП SPOROZOA. КЛАСС COCCIDEA
337
ческой, гантелевидной и неправильной. Агрегируя,
митохондрии образуют нитевидные структуры. В од-
ной клетке может содержаться до нескольких сот ми-
тохондрий, их размеры колеблются от 0.3 до 2.0 мкм.
Тело митохондрий ограничено непрерывными мемб-
ранами. Наружная мембрана гладкая, внутренняя
может образовывать многочисленные складки — у пи-
роплазм обнаружены митохондрии с трубчатыми кри-
стами. Число крист и их форма изменяются в зависи-
мости от метаболического состояния клетки. Смысл
крист и их перестроек заключается, по-видимому, в
увеличении или уменьшении поверхности внутренней
мембраны, на которой протекают процессы переноса
электронов и окислительного фосфорилирования. Про-
межуток между внутренней и наружной мембранами
называется межмембранным пространством,
а область, ограниченная внутренней мембраной —
матриксом. Матрикс заполнен студнеобразной по-
лужидкой массой, имеющей очень тонкую структуру и
состоящей на 50 % из белков. Структурная организа-
ция матрикса меняется в зависимости от физиологиче-
ской активности клетки. В митохондриях с большим
числом крист матрикс развит обычно слабее, чем в ми-
тохондриях с меньшим числом крист. В митохондриях
обнаружены структурные белки, ферменты, ДНК, РНК
и рибосомы. Часть белков кодируется ДНК митохонд-
рий, часть — в ядре клетки. Главная функция митохон-
дрий — превращение потенциальной энергии пи-
щевых веществ в биологически полезную энергию.
Гранулы сукцинатдегидрогеназы локализуются на
внутренней митохондриальной мембране и внутри ор-
ганеллы. Методом электронной микроскопии в мито-
хондриях Babesia bigemiina и В. bovis была выявлена
цитохромоксидазная активность. Это позволяет пред-
положить, что перенос электронов у пироплазм осу-
ществляется по типу аэробных клеток.
Роптрии и микронемы. Густавсон с соавт. (Gus-
tafson et al., 1954) обнаружили на апикальном полюсе у
Toxoplasma gondii электронно-плотные тела и назвали
их «токсонемы». Дальнейшие исследования показали,
что подобные структуры встречаются у всех Sporozoa,
а форма, количество и пространственное расположение
их варьируют. Сено (Senaud, 1967) предложил для этих
органелл новый термин — роптрии, которым в настоя-
щее время пользуется большинство исследователей,
Роптрии в виде извилистых булавовидных струк-
тур локализуются обычно в апикальной и в ряде случа-
ев в дистальной частях клетки парази та, 11л попереч-
ных срезах видно, что роптрии имеют одну мембрану
н выглядят как электронно-плотные структуры раз-
личной формы — от круглой до эллипсоидальной.
I 1родольные срезы показываю т, ч то роп трии сужаю тся
к апикальному полюсу.
Вокруг роптрии в средней части клетки паразита и
даже на дистальном полюсе располагаются мелкие
электронно-плотные осмиофильные образования —
микронемы. Диаметр их варьируе т, а количество непо-
стоянно и может достигать большого числа.
Роптрии и микронемы имеют функциональную и
структурную общность. Эта точка зрения получила
косвенное подтверждение благодаря установленной
цитохимической общности в комплексе ропт-
рии—микронемы цистозоитов Toxoplasma gondii. Роп-
трии и микронемы — единый комплекс, представляю-
щий собой железу, секрет которой синтезируется в
микронемах и, проходя по тонким протокам, концент-
рируется в резервуарах — роптриях. Из роптрии по уз-
ким протокам, открывающимся вблизи полярного коль-
ца на апикальном полюсе паразита, секрет выделяется
во внешнюю среду. Предполагается, что фермент, про-
дуцируемый комплексом роптрии—микронемы, спо-
собствует проникновению паразита в клетку хозяина.
Косвенным доказательством этого предположения
служат наблюдения за редукцией этого комплекса у
внутриклеточных стадий кокцидий. Рудзинска (Rud-
zinska, 1976) обнаружила, что роптрии и микронемы у
расселяющихся стадий Theileria microti (=Babesia mic-
roti) формируются из пузырьков аппарата Гольджи.
Таким образом, структурная организация пиро-
плазм имеет много черт, характерных для всех Sporo-
zoa:
1) пелликула расселяющихся стадий состоит из
трех мембран;
2) пелликула трофозоитов имеет одну плазматиче-
скую мембрану;
3) на всех стадиях развития, кроме микрогамет, в
пелликуле присутствуют одна или несколько микро-
пор;
4) под внутренним мембранным комплексом у по-
движных стадий проходит ряд субпелликулярных
микротрубочек;
5) на апикальном и дистальном полюсах располо-
жены полярные кольца;
6) на апикальном полюсе и в ряде случаев на диста-
льном локализуются роптрии и микронемы.
В отличие от остальных Sporozoa у всех стадий раз-
вития пироплазм отсутствует коноид и типичный эука-
риотный жгутик. Эти особенности в тонком строении
пироплазм позволяют уточнить их место в системе.
Жизненные циклы
Развитие Theileriidae Du Toit, 1918 в позвоноч-
ном хозяине. В организме позвоночного хозяина тей-
лсрии развиваются в клетках лимфатической системы
и И эритроцитах. Клещи-переносчики инокулируют
позвоночному хозяину из слюнных желез мелкие, име-
ющие I мкм и диаметре, одноядерные стадии — спо-
розоиты. Спорозоиты внедряются в лимфатические
клетки » первые 10 мин после инокуляции. Вместе
с лимфоцитами по периферическим лимфатическим
сосудам тейлерии мигрируют в близрасположенные
лимфатические узлы, а затем с током лимфы рассе-
ляются в другие лимфатические узлы и селезенку.
Спорозоиты быстро растут и превращаются в сфери-
ческие стадии размером 10—15 мкм в диаметре —
меронты. Ядра в растущих меронтах делятся бинар-
ным делением, формируя многоядерный меронт, кото-
рый в ранних работах называли «коховские шары» или
«коховские тела» (рис. 196, 1, 2; 197; 198).
Паразиты стимулируют деление лимфатических
клеток и делятся вместе с ними. В этот период лимфа-
тические узлы увеличиваются, воспаляются и появля-
ются симптомы, идентичные лейкозу. Меронты внут-
ри лимфатических клеток сходны у всех видов тейле-
22 Зак. №4163
338
ALVEOLATA
Рис. 196. Стадии развития тейлерий.
1—3 — преэритроцитарные стадии развития тейлерий: / — макромеронт в цитоплазме клетки хозяина; 2 — микромероит в цитоплазме клетки хозяина; 3 —
схематическое изображение строения мерозоита (по: Schein et al., 1978); 4 — схема строения микрогамонта Theileria parva из кишечника клеща; 5,6—то же
на поперечных разрезах; в — вакуоль, вмк — внутренний мембранный комплекс, см — митохондрия, мн — микронемы, мт — микротрубочки, нпм — на-
ружная плазматическая мембрана, ок — опорное кольцо, пк — полярное кольцо, р — рибосомы, ро — роптрии, спд — структура с двойной мембраной,
эти — электронно-плотный шпиль, я — ядро. (По: Mehlhom, Schein, 1976).
Fig. 196. Development stages of Theileria.
1 — macromeront; 2 — micromeront; 3 — merozoite; 4 — microgamont of Theileria parva', 5, 6 — cross-section; e—vacuole, вмк— inner membrane complex, лги —
mitochondria, мн — micronemes, мт — microtubule, нпм — outer plasmatic membrane, пк — polar ring, p — ribosome, po — rhoptry, эпш — thorn-like apex, я —
nucleus.
ТИП SPOROZOA. КЛАСС COCCIDEA
339
Рис. 197. Клетка хозяина, содержащая меронты Theileria annulata на различных стадиях развития (схема электронограммы).
кх — клетка хозяина, мкх — митохондрия клетки хозяина, нпм — наружная плазматическая мембрана меронта, от — остаточное тело, оя — остаточное
ядро, рм — развивающиеся мерозоиты, ро — роптрии, я — ядро. (По: Schein et al,, 1978).
Fig. 197. The meronts of Theileria annulata.
кх — host cell, мкх—mitochondria host’s cell, нпм — outer plasmatic membrane of meront, от — residual body, оя — residual nucleus, po — rhoptry, я — nucleus.
рий, варьирует лишь число ядер в пределах 12—50.
Меронты продуцируют одноядерные стадии — меро-
зоиты — на 8—10-й день после инвазии у Т. annulata и
на 12—14-й день у Т. parva. Мерозоиты грушевидной
формы размером 1—2 мкм (рис. 196,5). В этот период па-
тогенный эффект тейлерий сильно выражен, что сопро-
вождается появлением тяжелых клинических признаков,
сопровождающихся летальными исходами. Смертность
при заражении Т parva может достигать 90 %. Мерозоиты
освобождаются при разрушении лимфатических клеток и
активно внедряются в эритроциты с 8-го дня после инва-
зии у Т. annulata и с 13-го у Т. parva.
Размножение тейлерий в эритроцитах осуществля-
ется бинарным делением и почкованием. Интенсив-
ность 31'01'0 процесса неодинакова у разных видов тей-
лерий. Наибольшее число делящихся эритроцитарных
стадий наблюдается у Т. mutans, несколько меньше —
у Т, annulata и значительно реже размножение в эрит-
роцитах регистрируется у Т. parva. Паразитемия мо-
жет быть очень высокой. Так, при заражении Т. annula-
ta иногда поражается около 90 % эритроцитов. Эрит-
роцитарные стадии представлены, главным образом,
двумя различными формами: гонкими, запятовидными
и сферическими, или овоидными. Запятовидные ста-
дии 1—1.5 мкм в длину у 7’. parva и до 2.5 мкм у Т. an-
nulata и Т. mutans. Репродукция этих стадий осуществ-
ляется бинарным делением, вызывая разрушение
эритроцитов. Тейлериозы могут вызывать эритроцито-
пению. Заболевание сопровождается симптомами ане-
мии. Овоидные стадии (около 20 %) размером 2—3 мкм
в диаметре — гамонты (Mehlhom, Schein, 1993).
Развитие Theileriidae Du Toit, 1918 в беспозво-
ночном хозяине. Гамонты вместе с кровью хозяина
при питании клеща попадают в его кишечник и пре-
вращаются в стадии, которые называют лучистые
тела («strahlen korper» или «ray bodies»). Лучистые
тела формируются, начиная со 2-го или 4-го дня после
завершения питания из овоидных или сферических
стадий (микрогамонтов) (рис. 196, 4). Первые лучи-
стые тела веретенообразной формы 8—12 мкм в длину
и в начале — одноядерные. Эти стадии имеют одну
плазматическую мембрану, стилет или шипоподобный
конец длиной 2.5 мкм и несколько жгутикоподобных
выростов длиной 4—7 мкм. Ядро в них делится дваж-
ды, формируя микрогамонт, который в свою очередь
дает начало четырем одноядерным микрогаметам.
Женские гамонты предположительно не делятся, пре-
вращаясь в одноядерные макрогаметы. После синга-
мии формируется некоторое число зигот, которые по
содержанию ДНК можно определить как диплоидные
или тетраплоидные (Mehlhom, Schein, 1993).
На 12—30-й день после завершения питания кле-
щом зиготы превращаются в сигаровидные подвиж-
ные кинеты (рис. 199, 7). В кинетах формируются за-
ново две внутренние мембраны и субпелликулярные
микротрубочки. Кинеты величиной 19 мкм у Т. parva,
340
ALVEOLATA
Рис. 198. Схематическое изображение двух типов формирования мерозоитов в клетках лимфатической системы позвоночного хозяина у
Theileria annulata, Т. parva, Т. lavrencei и Т. mutans.
1 — первый тип формирования мерозоитов осуществляется путем следующих друг за другом бинарных делений ядер, в меронтах имеется остаточное тело и
остаточное ядро; 2 — второй тип формирования мерозоитов осуществляется путем одновременных делений ядер, без остаточного тела и остаточного ядра;
в — вакуоль, вмк — внутренний мембранный комплекс, дя — делящиеся ядра, кх — клетка хозяина, м — микропора, ми — митохондрия, мих — митохонд-
рии клетки хозяина, мн — микронема, мх — мембрана клетки хозяина, мш — молодой меронт, нпм — наружная плазматическая мембрана, от — остаточное
тело, оя — остаточное ядро, пк — полярное кольцо, рм — развивающийся мерозоит, ро — роптрия, спм — субпелликулярные микротрубочки, эр — эндо-
плазматический ретикулум, я — ядро. (По: Schein et al., 1978).
Fig. 198. Diagrammatic representation of the two types of merozoite formation observed in Theileria annulata, T. parva, T. lavrencei and T. mutans.
1 — the first type appears rosette-like, 2 — whereas in the second One more than two merozoites arise from a nucleus of the schizont; e — vacuole, вмк — inner memb-
rane complex, кх — host cell, м — micropore, mu — mitochondria, mux — mitochondria host’s cell, мн — micronemes, мх — membrane of host cell, мш — young nte-
ronte, нпм — outer plasmatic membrane of meront, от — residual body, оя — residual nucleus, пк — polar ring, рм — development meront, po — rhoptry, спм — sub-
pellicular microtubules, эр — endoplasmic reticulum, я — nucleus.
17 — у T. annulata и 34 мкм — у T. mutans проникают в
клетки кишечника и гемолимфу клещей и затем, после
превращения нимф в имаго, в клетки слюнных желез.
Кинеты многих видов тейлерий одноядерные, за иск-
лючением кинет Т. parva, найденных в гемолимфе кле-
щей. В этих кинетах ядра делятся, формируя четыре
особи. Появление кинет в яйцевых клетках клеща
у тейлерий не наблюдали. В 1-й день после прикреп-
ления клеща к позвоночному хозяину кинеты обна-
руживаются внутри клеток слюнных желез, где
они становятся полиморфными, а их пелликула теряет
внутренний мембранный комплекс, состоящий из двух
мембран. Цитоплазма и ядро паразита увеличиваются.
Путем инвагинации формируется споронт, состоящий
из цитомероподобных компартментов. Повторные
ядерные деления формируют в споронте сотни ядер,
которые в этот период становятся мельче. Образова-
ние цитомеров заканчивается в первые 5 дней после
начала питания клеща. В слюнных железах клеща в
этот период формируется несколько тысяч гаплоид-
ных спорозоитов размером 1 мкм в диаметре. Спорозо-
иты вместе со слюной инокулируются клещом в кровя-
ТИП SPOROZOA. КЛАСС COCCIDEA
341
Рис. 199. Трансформация сферической стадии Theileria annulata в подвижную (кинету) (У).
в — вакуоль; вб — вакуоль большая, в которой происходит трансформация неподвижной стадии в кинету; вмк — внутренний мембранный комплекс кинеты;
ме — мембрана, окружающая большую вакуоль; мн — микроиема; нпм — наружная плазматическая мембрана кинеты; от — остаточное тело; пк — поляр-
ное кольцо; рк — развивающаяся кинета; сдм — структура с двойной мембраной; я — ядро; яо — ядерная оболочка (по: Mehlhorn, Schein, 1977а). Эритроци-
тарная стадия развития Babebsia bovis (Babes, 1888) (2). (По; Babes, 1889, фрагмент рисунка, ув. 6 раз).
Fig. 199. Theileria annulata, transformation spherical stages (/).
e —- vacuole, еб — large vacuole, вмк — inner membrane complex, мн — micronemes, нпм — outer plasmatic membrane, от — residual body, пк — polar ring,/» —
developing kinete, сдм — structure with double membrane, я — nucleus, яо — nuclear membrane, 2 — Babesia bovis (Babes, 1888) developing in the erythrocytes.
ное русло позвоночного хозяина (рис. 200). Таким об-
разом, для тейлерий характерно наличие в жизненном
цикле внутриклеточных многоядерных преэритроци-
тарных стадий, развивающихся в клетках лимфатиче-
ской системы, и трансфазная передача в организме
клещей.
Развитие Babesiidae Poche, 1913 в позвоночном
хозяине. Клещ-переносчик, чаще всего однохозяин-
ный, при питании вместе со слюной вводит в организм
позвоночного хозяина спорозоиты. Спорозоиты вне-
дряются в эритроциты и быстро размножаются бинар-
ным делением или почкованием. Для этих паразитов
типичны парные стадии грушевидной формы. После
деления ядра дочерние клетки длительное время не
расходятся полностью, а остаются соединенными тон-
кими цитоплазматическими мостиками. Иногда мож-
но наблюдать стадии, состоящие из трех особей с чет-
ко обособленными ядрами, объединенными общей ци-
топлазмой. Для некоторых видов бабезий (Babesia
canis, В. trautmani) характерно наличие в эритроците
нескольких особей паразитов (3—4 и даже 16). На при-
мере В. bigemina и В. bovis в экспериментах с перели-
ванием крови восприимчивым животным от заражен-
ных было показано, что с момента инокуляции парази-
342
ALVEOLATA
Рис. 200. Жизненный цикл тсйлсрий.
1 — спорозоит; 2 — меронт (коховский шар); 3 — мерозоит; 4 — эритроцитарные стадии; 5 — переселяющиеся эритроцитарные стадии; 6 — гамонт; 7,9 —
предположительно неделящаяся макрогамета; 8—8.3 — четырехъядерный микрогамонт, формирующий четыре одноядерных микрогаметы; 8.4 — микрога-
мета; 9 — макрогамета; 10— зигота; 11—13 — формирование кинеты; 14 — молодой споронт; 15 — формирование спорозоитов; асж — альвеолярная клет-
ка слюнной железы, бд — бинарное деление, ев — внутренняя вакуоль, м — меронт, мсп — молодой споронт, с — спорозоит, фс — формирование спорозои-
тов, ш — шипообразный выступ, я — ядро. (По: Mehlhorn, Schein, 1993, с изменениями).
Fig. 200. Life cycle of Theileria spp.
1 — sporozoite; 2 — meront; 3 — merozoite; 4, 5 — stages in the erythrocytes; 6 — gamont; 7—9— macrogametes; 8—8.3 — microgamont; 8.4 — microgamete; 9—
macrogamete; 10— zygote; 11—13 — kinete; 14 — young sporont; 15 — sporozoite; асж— alveolar cell of salivary glands, бд— binary cell-fission, ee — inner va-
cuole, лг — meront, мсп — young sporont, фс — forming sporozoites, ш — thorn-like apical structure, я — nucleus.
ТИП SPOROZOA. КЛАСС COCCIDEA
343
тов позвоночному хозяину клещом, бабезии постоянно
локализуются в кровяном русле позвоночного хозяина
(Hoyte, 1961; Крылов, 1962, 1964а). Наряду с эритро-
цитарными стадиями у бабезий найдены стадии, лока-
лизующиеся внеклеточно в плазме крови и содержащие
от 2—3 до 5—15 ядер (Драчинский, 1903; Kinoshita,
1907;Delpy, 1946; Cerruti, 1962; Крылов, 19646,1981).
Размножение паразитов вызывает разрушение
эритроцитов, что сопровождается гемоглобинурией.
Некоторое число эритроцитарных мерозоитов прини-
мает овоидную форму, эти стадии определяются как
гамонты.
Развитие Babesiidae Poche, 1913 в беспозвоноч-
ном хозяине. Гамонты вместе с кровью попадают в
кишечник клеща при его питании. Дальнейшее разви-
тие гамонтов происходит в организме клеща. У неко-
торых видов, например В. canis, морфологические из-
менения гамонтов — превращение в лучистые тела —
начинаются в позвоночном хозяине. В организме кле-
ща овоидные гамонты быстро (в течение одного дня)
трансформируются в лучистые тела длиной 4—7 мкм,
которые содержат до четырех ядер. Четырехъядерные
стадии делятся на четыре одноядерные особи. Два
типа этих стадий в течение 3—5 дней после заверше-
ния клещом питания соединяются, превращаясь в зи-
готы, которые дают в свою очередь начало кинетам.
Эти подвижные стадии размером около 9—15 мкм,
сформировавшиеся в кишечнике, перфорируют клетки
стенки кишечника и проникают в гемолимфу, гемоци-
ты и различные органы клеща, включая яйцевые клет-
ки половозрелых самок клещей. В этих клетках пара-
зит растет и превращается в споронт, который в конце
концов делится на большое число одноядерных цито-
меров, давая начало спорокинетам. Спорокинеты про-
никают в яйцевые клетки, инвазируя следующую гене-
рацию клещей. Развитие спорокинет в слюнных желе-
зах следующей генерации клеща начинается только
после начала их питания. Ядра в спорокинетах, нахо-
дящихся в слюнных железах, многократно делятся и
дают начало большому числу спорозоитов у В. bovis и
В. canis на 2—3-й день, а у 5. bigemina в большинстве
случаев на 8, 9, реже на 4—16-й день после начала пи-
тания клеща. Спорозоиты одноядерные, имеют гапло-
идный набор хромосом (Mehlhom, Schein, 1993). Раз-
меры спорозоитов варьируют в зависимости от вида
бабезий от 1.5 до 3 мкм в длину. В одной альвеоле
слюнных желез формируется от 5 до 10 тыс. спорозои-
тов, которые при питании клеща вместе со слюной
инокулируются позвоночному хозяину, где продолжа-
ют свое развитие в эритроцитах (рис. 201).
Специфичность
Экспериментально установлено, что заражение од-
ним и тем же видом пироплазм позвоночных живот-
ных, относящихся к разным классам, не удается. Не
удалось привить Babesia musculi — паразита мышей
{Mus musculus) — ни амфибиям {Rana temporaria), ни
пресмыкающимся {Lacerta vivipara), ни птицам {Co-
lumba livia, Gallus gallus).
В большинстве случаев остаются безуспешными
попытки заражения одним и тем же видом пироплазм
животных из различных отрядов без подавления их ес-
тественной резистентности. Известно лишь несколько
случаев, когда интактные животные заразились пиро-
плазмами от животных, относящихся к разным отря-
дам. Золотистому хомячку {Mesocricetus auratus) была
перевита Babesia sp., выделенная от человека (Ristic
et al., 1971). Удалось заразить кролика {Oryctolagus си-
niculi) паразитом В. rodhaini из грызуна Thamnomys
surdaster. Оба хозяина относятся к разным, но очень
близким в филогенетическом отношении отрядам Ro-
dentia и Lagomorpha. Описано несколько случаев зара-
жения людей Theileria microti {=Babesia microti) из по-
левки обыкновенной {Microtus arvalis) (Healy et al.,
1976) и спенэктомированных людей и шимпанзе {Pan
troglodytes) В. divergens из крупного рогатого скота.
Предположение, что человек переболевает пиро-
плазмозами бессимптомно при проверке одними ис-
следователями не подтвердилось (Gamhaxn et al., 1969),
другие (Osomo et al., 1976) смогли показать на боль-
шом материале (38 случаев из 101) наличие в крови
людей антител к В. canis. Эти же авторы в трех случаях
заразили бабезиями, выделенными из человека, сплен-
эктомированных хомяков. Вероятно, бабезиоз распро-
странен среди людей гораздо шире, чем думали до сих
пор (Mehlhorn, Schein, 1993). Предполагается, что на
один случай бабезиоза с проявлением клинических
признаков приходятся сотни случаев бессимптомного
паразитоносительства (Osomo et al., 1976).
Многочисленные попытки заразить животных из
различных отрядов одним и тем же видом пироплазм,
предпринятые различными исследователями, оказа-
лись безуспешными. Не удалось перевить В. musculi из
домовых мышей крупному рогатому скоту {Bos tau-
rus), собаке {Canis familiaris), овце {Ovis aries), козе
{Capra hircus), лисе {Vulpes vulpes) и ежу {Hemiechinus
auritus). He смогли заразить крупный рогатый скот Ni-
collia tadzhikistanica — паразитом краснохвостой пес-
чанки {Meriones erythrourus), а В. bovis — паразита
крупного рогатого скота — не смогли перевить сплен-
эктомированным краснохвостым песчанкам. Без-
успешны потытки перенести В. ninense — паразита
обыкновенного ежа {Erinaceus europaeus) — собакам,
кроликам, морским свинкам, белым мышам. Не смог-
ли заразить В. hylomysci — паразитом грызуна Hylo-
myscus Stella — собаку, кошку {Felis catus) и предста-
вителя отряда рукокрылых Pipistrellus pipistrellus. Не
заразились крупный рогатый скот и лошади {Equus са-
ballus) паразитом В. mephitis из полосатого скунса
{Mephitis mephitis). Можно привести еще несколько
подобных примеров. Однако и этот анализ экспери-
ментальных работ и отдельных наблюдений по встреча-
емости одних и тех же видов пироплазм у животных
из различных отрядов показывает, что в большинстве
случаев определенные виды пироплазм приурочены к
паразитированию у хозяев, относящихся только к одно-
му отряду. •
Не всегда возможен перенос пироплазм даже меж-
ду животными, близкими в филогенетическом отно-
шении. Не удалось заразить Nicollia tadzhikistanica из
краснохвостой песчанки спленэктомированных белых
мышей и белых крыс {Rattus norvegicus), а В. musculi
из белых мышей — интактных золотистых хомячков
{Mesocricetus auratus) и белых крыс. В экспериментах
344
ALVEOLATA
Рис. 201. Жизненный цикл бабезий.
1 — спорозоит; 2—4— эритроцитарные стадии; 5, 6 — гамонты; 7, 8 — гамогония; 9—11 — формирование зиготы; 12—14 — формирование кинет; 15, 16—
формирование цитомеров; 17—19 — спорокинеты; 20, 21 — формирование спорозоитов в слюнных железах клеща; кх — клетка хозяина, л — лучистые вы-
росты, рк — растущая кинета, сп — спорокинета, ц — цитомер; остальные обозначения, как на рис. 200. (По: Mehlhom, Schein, 1993, с изменениями).
Fig. 201. Life cycle of Babesia spp.
1 — sporozoite; 2—4 — stages in erythrocytes; 5, 6 — gamonts; 7, 8 — gamogony; 9—11 — zygote; 12—14 — kinete; 15,16 — cytomere; 17—19 — sporokinetes;
20—21 — sporozoites in salivary glands of tick; кх — host cell, л — ray-like protrusion, рк — grow kinete, cn — sporokinete, ц — cytomer.
ТИП SPOROZOA. КЛАСС COCCIDEA
345
Энига и Фридхофа (Enigk, Friedhoff, 1962) паразит
крупного рогатого скота В. divergens не вызвал зара-
жения спленэктомированных овец и коз, а В. capreoli
из косуль (Capreolus capreolus), наоборот, вызывал
заражение спленэктомированных овец, коз и крупного
рогатого скота. В. bigemina из крупного рогатого скота
не заражает спленэктомированных ланей (Cervus da-
ma) и интактных благородных оленей (С. elaphus elap-
hus), овец и коз.
Наряду с этим установлены факты, когда один вид
пироплазм паразитирует у нескольких видов позво-
ночных животных; при этом в большинстве случаев
между хозяевами прослеживается та или иная степень
родства. Иногда хозяева относятся к разным семейст-
вам одного отряда. Так, В. divergens может паразити-
ровать у крупного рогатого скота и северного оленя
(Rangifer tarandus), В. ovis — у овец и Cervus dama,
В. musculi — у белых мышей и тонкопалого суслика
(Spermophilopsis leptodactylus). В других случаях хозя-
ева принадлежат к одному семейству. Так, В. rodhaini,
выделенная из древесных крыс (Thanmomys surdaster),
паразитирует у белых мышей, белых крыс и Хомяковых
крыс (Cricetomys gambianus). В. capreoli заражает Capre-
olus capreolus, Cervus dama и C. elaphus elaphus; Theileria
annulata встречается у крупного рогатого скота и азиат-
ского буйвола (Bubalus bubalis). Одинаковые виды пи-
роплазм могут паразитировать у хозяев, относящихся к
одному роду. Так, В. ovis паразитирует у овец и архаров
(Ovis ammoriy, В. motasi — у овец и муфлонов (Ovis musi-
топ); В. canis — у собак и койотов (Canis latrans frustar);
В. herpailuri — паразита ягуарунди (Felis yagouaroun-
di) — удается передать домашней кошке.
При рассмотрении материалов по встречаемости
пироплазм у различных хозяев нельзя не обратить вни-
мание на специфичность как на один из критериев, ис-
пользуемых для диагностики вида у этих патогенных
одноклеточных. Правильное определение роли этого
признака и относительной его ценности в сочетании с
другими признаками совершенно необходимо при
описании новых видов пироплазм.
Филогения
Распространение пироплазм ограничено позвоноч-
ными и переносчиками — кровососущими членисто-
ногими. Наиболее широко пироплазмы распростране-
ны у позвоночных, в то время как у членистоногих они
обнаружены пока только в надсем. Ixodoidea класса
Arachnoidea. Следовательно, позвоночные животные
освоены пироплазмами значительно лучше, чем кро-
вососущие членистоногие, а это указывает на более
древнюю связь пироплазм и позвоночных.
Можно предположить, что группы хозяев, у кото-
рых встречае тся наибольшее количество и разнообра-
зие видов паразитов, — самые древние. Раннюю связь
в пределах типа Chordata пироплазмы, вероятно, име-
ли с классом Mammalia, а в пределах этого класса — с
отрядами Artiodactyla, Rodentia, Carnivora.
Ультратонкая организация Piroplasmia обнаружи-
вает ряд сходных черт с таковой Haemosporida и Eime-
riida. На примере жизненных циклов кокцидий, гемо-
споридий и пироплазм можно детально проследить все
Таблица 3
Схема эволюции кровепаразитизма у споровиков
(по: Крылову, 1981)
Систематическое положе- ние паразитов Локализация в организме позвоночного хо- зяина
эпителий кишечника клетки ретикуло- эндотелиальной системы и других тканей клетки крови
Piroplasmida
Babesia — — +
Theileria — + 4-
Adeleida
Dactylosoma — — 4-
Babesiosoma — — 4-
Haemosporida
Plasmodium — 4- 4-
Leucocytozoon — 4- 4-
Haemoproteus — + +
Eimeriida
Schellackia bolivari 4- + 4-
Eimeria stiedae — —
E. truncata — + —
Toxoplasma + + —
Sarcocystis + + —
E. arloingi + + —
E. acervulina + — —
Примечание. + паразиты развиваются, - паразиты не развиваются.
стадии перехода от типичного кишечно-эпителиально-
го образа жизни к кровепаразитизму (табл. 3). Так,
одни виды кокцидий сем. Eimeriidae (Eimeria acervuli-
па, Е. brunetti, Е. maxima, Е. mitis, Е. mivati, Е. intestina-
lis) являются типичными кишечно-эпителиальными
паразитами, другие же заселяют и стенку кишечника, и
органы, структурно или функционально связанные с
кишечником. Например, шизонты Е. arloingi обнару-
жены в эпителиальных клетках кишечника и в мезен-
териальных лимфатических узлах овец, кокцидия кро-
лика Е. stiedae паразитирует в печени, а кокцидия до-
машних гусей (Anser anser) Е. truncata — в почках. В
жизненном цикле саркоспоридий имеются стадии, раз-
вивающиеся в стенке кишечника по «кокцидийному»
типу, и стадии, заселяющие самые разнообразные ор-
ганы и ткани своих хозяев, при этом кровяное русло
часто используется как путь расселения тканевых ста-
дий паразитов. Наконец, на примере жизненного цикла
Schellakia bolivari из ящериц Acanthodactylus и Psam-
modromus можно проследить типичный переход к
кровепаразитизму. Большая часть стадий жизненно-
го цикла Schellakia bolivari развивается в стенке ки-
шечника, и только спорозоиты внедряются в эритро-
циты. Вместе с кровью спорозоиты попадают в кишеч-
ник клеща Liponussus saurarum, питающегося на
ящерицах. Заражение ящериц осуществляется пассив-
но при поедании ими инвазированных спорозоита-
ми клещей.
Пассивный способ передачи инвазии менее эффек-
тивен по сравнению с активной инокуляцией пере-
носчиком инвазионных для позвоночного хозяина ста-
дий паразитов, и поэтому последний должен получить
346
ALVEOLATA
наиболее широкое распространение. Однако активная
трансмиссия паразитов возможна при условии проник-
новения их в слюнные железы переносчика. Способ-
ность к расселению в теле переносчика сохраняют
лишь стадии, предшествующие формированию споро-
зоитов, например гаметоциты. Следовательно, возник-
новение активного способа передачи кровепаразитов
должно сопровождаться перемещением процесса га-
могонии в беспозвоночного хозяина. По мнению
В. А. Догеля (1947), этот путь циркуляции кровепара-
зитов в природе становится для наиболее продвинутых
форм единственным.
Типичный пример активного участия беспозвоноч-
ного хозяина в переносе кровеспоровиков мы наблю-
даем у Haemoproteus, Leucocytozoon и Plasmodium, но
и у этих паразитов, полностью оторвавшихся от ки-
шечника позвоночного хозяина, еще остались стадии,
которые развиваются либо в печени, либо в селезенке,
либо в эндотелиальных клетках кровеносных сосудов.
Характерно, что у тейлерий, так же как у гемоспори-
дий, в жизненном цикле присутствуют стадии пре-
эритроцитарной мерогонии, развивающиеся в селезен-
ке и лимфатических узлах, и стадии, паразитирующие
в переносчике, которые похожи на половые формы
споровиков.
Следующий шаг к типичному кровепаразитизму
сделали представители сем. Babesiidae: у них все ста-
дии, паразитирующие в позвоночном хозяине, лока-
лизуются только в эритроцитах. Преэритроцитарные
стадии множественного деления тейлерий, развиваю-
щиеся в лимфоцитах и гистиоцитах, могут рассматри-
ваться как анцестральные, и это делает тейлерий наи-
более вероятными претендентами на роль наиболее
древних организмов в подклассе Piroplasmia.
Признание тейлерий древними представителями
пироплазм позволяет объяснить эволюцию этой груп-
пы простейших.
Самая богатая фауна тейлерий отмечена у предста-
вителей отряда Artiodactyla, а в пределах этого отря-
да — у жвачных. Этот факт позволяет предположите-
льно определить время появления тейлерий в истории
Земли. Скорее всего, возникновение тейлерий можно
датировать миоценом, потому что в этот период жвач-
ные широко распространились и бурно развивались.
Дальнейший основной путь расселения пироплазм по
хозяевам мог идти через иксодовых клещей.
Некоторые группы позвоночных оказались наибо-
лее подходящими для заселения их пироплазмами, и
в настоящее время мы регистрируем богатую фауну
пироплазм у Rodentia и Carnivora. Другие группы
позвоночных, по-видимому, менее пригодны для су-
ществования в них пироплазм, и у них обнаружены
единичные виды этих кровепаразитов.
Изучение филогении и эволюции пироплазм на
основе анализа нуклеотидных последовательностей
гена малой субъединицы рибосомальной РНК показа-
ло, что Babesia и Theileria сестринские парафилитиче-
ские группы (Allosopp et al., 1994).
Систематический обзор
Сем. Theileriidae Du Toit, 1918
(= Gonderiidae Neitz, Jansen, 1956)
Передача инвазии осуществляется клещами транс-
фазно, трансовариальная передача отсутствует; в по-
звоночном хозяине имеются преэритроцитарные мно-
гоядерных стадии, развивающиеся в клетках лимфати-
ческой системы.
Род Theileria Bettencourt, Franca, Borges,
1907
(= Gonderia Du Toil, 1918; Cytauxzoon Neitz, Thomas,
1948; Haematoxenus Uilinberg, 1964)
Преэритроцитарные многоядерные стадии развива-
ются в клетках лимфатической системы; эритроцитар-
ные стадии мелкие, чаще округлой или палочковидной
формы.
Типовой вид Theileriaparva (Theiler, 1904).
Theileria parva (Theiler, 1904) (рис. 202).
(= Piroplasma kochi Stephens, Christophers, 1903; P. parvum The-
iler, 1904; Theileria kochi (Stephens, Christophers, 1903)).
Распространение: Африка.
Хозяева позвоночные: Bos taurus (крупный
рогатый скот), Bubalus агпее (азиатский буйвол), Syn-
cerus caffer (африканский буйвол).
Переносчики: Hyalomma anatolicum, Н. drome-
darii (рис. 203, 2), H. excavatum, Н. impressum, Н. trun-
catum, Rhipicephalus appendiculatus, R. capensis, R. car-
nivoralis, R. compositus, R. evertsi, R. kochi, R. parvus,
R. pulchellus, R. simus.
Развитие в позвоночном хозяине. Первые
стадии развития тейлерий микроскопически обнару-
живаются в периферических лимфатических узлах на
5—8-е сут после заражения животных. Инкубацион-
ный период при заражении через клещей варьирует от
8 до 26 сут, чаще 12—14 сут. Заболевание без врачеб-
ного вмешательства длится от одной до трех недель,
обычно две недели. Жарретт и Броклсби (Jarrett, Brock-
lesby, 1966) различают в позвоночном хозяине две
генерации меронтов. Макромеронты содержат до
85 ядер, чаще 8. Размеры макромиронтов обычно око-
ло 4.8 мкм в диаметре, но могут достигать 15.9 мкм.
Хроматиновые гранулы в макромеронтах имеют диа-
метр 0.3—2.2 мкм. Биопсией установлено, что количе-
ство макромеронтов на 1000 лимфоцитов варьирует
от 4 до 760, в среднем 264 (Barnett et al., 1961). Некото-
рыми исследователями макромеронты интерпретиру-
ются как агамонты. Макромеронты продуцируют мак-
ромерозоиты размером 1.8—2.6 мкм в диаметре, кото-
рые дают начало новой генерации макромеронтов.
Микромеронты появляются в более поздние сроки ин-
вазии, содержат 50—120 ядер и рассматриваются сто-
ронниками мнения о наличии полового процесса в
жизненном цикле Т. parva как гамонты. Они содержат
хроматиновые гранулы 0.3—0.9 мкм в диаметре, раз-
множаются почкованием и продуцируют микромеро-
ТИП SPOROZOA. КЛАСС COCCIDEA
347
Рис. 202. Стадии Theileria parva, развивающиеся в эритроцитах.
Fig. 202. Theileria parva developing in the erythrocytes.
зоиты, диаметр которых варьирует от 0.6 до 1 мкм.
Стадии множественного деления обнаружены в лим-
фоцитах и внеклеточно.
Шайн с соавт. (Schein et al., 1978) считают, что ни
макромеронтов, ни микромеронтов не существует. По
их мнению, макромеронты — это меронты в стадии де-
ления ядер, а микромеронты — стадия формирования
свободных мерозоитов. Эти авторы различают два
способа формирования мерозоитов.
1. Мерозоиты формируются в результате следую-
щих друг за другом бинарных делений ядер. Послед-
ние ядерныс деления служат сигналом к образованию
мерозоитов. В этих меронтах имеется остаточное тело
и большое остаточное ядро. Предполагается, что это
образование может дать начало еще одной генерации
мерозоитов.
2. Мерозоиты формируются в результате одновре-
менного одноразового деления нескольких ядер; оста-
точного тела и остаточного ядра нет.
Мерозоиты, образовавшиеся первым и вторым спо-
собом, структурно не различаются и имеют длину
1 мкм, а ширину в области ядра 0.6 мкм.
Стадии Т: parva, развивающиеся в клетках лим-
фатической системы, удавалось культивировать в те-
чение нескольких месяцев в культуре тканей бычьих
лимфоцитов и почках эмбрионов хомяка (Hulliger et
al., 1964; Hulliger, 1965; Malmquist, Brown, 1974). В пе-
риод митотического деления клеток хозяина тейлерии
распределялись между дочерними клетками в позд-
ней анафазе. Отдельные ядра в стадиях множествен-
ного деления тейлерии размножаются монотомиче-
ски асинхронно с делением клеток хозяина (Hulliger,
1965).
Зараженность эритроцитов достигает 60—95 %, в од-
ном эритроците обычно встречаются 1—3 паразита.
Максимальное количество тейлерии в одном эритроците
может достигать 11. Размножение в эритроцитах проис-
ходит редко и осуществляется бинарным делением. Фор-
348
ALVEOLATA
Рис. 203. Dermacentorpictus — самка-переносчик пироплазм (7), Hyalomma dromedarii — самка-переносчик пироплазм (2).
Fig. 203. Dermacenter pictus — vector tick (I), Hyalemma dromedarii — vector tick (2).
мирование в одном эритроците 4 особей, расположенных
крестом, происходит редко (0.3 % случаев).
Развитие в беспозвоночном хозяине. Кле-
щи передают инвазию трансфазно. Заражаются тейле-
риями личинки или нимфы, а передают паразитов по-
звоночному хозяину соответственно либо нимфы,
либо имаго. Каудри и Хем (Cowdry, Ham, 1932) счита-
ли, что в теле клеща-переносчика развитие Т. parva
происходит с участием полового процесса. Половой
процесс в жизненном цикле Т. parva описали Мелхорн
и Шайн (Mehlhom, Schein, 1976), Шайн с соавт. (Schein
et al., 1977) и Мелхорн с соавт. (Mehlhom et al., 1978).
По мнению этих исследователей, копуляция происхо-
дит в кишечнике клеща-переносчика в первые 24 ч по-
сле отделения от хозяина. В результате сингамии фор-
мируется зигота. Зигота — диплоидна (Mehlhom, Sche-
in, 1993). Развитие кинет начинается после линьки
нимф клеща, т. е. через 20 сут после насыщения кле-
щей. Трансформация зиготы в кинету происходит пу-
тем впячивания во внутреннюю большую вакуоль.
Во время этого процесса мембрана, ограничивающая
вакуоль, становится наружной мембраной кинеты, две
внутренние мембраны, также как и субпелликулярные
микротрубочки, формируются заново (рис. 199, 1).
Процесс трансформации зиготы в кинету протека-
ет быстро. Созревшие кинеты покидают кишечник и
проникают в слюнные железы клеща. Деление ядер
в кинетах начинается на пути их миграции в слюнные
железы. Спорозоиты формируются в слюнных желе-
зах. Спорозоиты — гаплоидны (Mehlhom, Schein,
1993).
Зараженные Theileria parva клещи могут переда-
вать позвоночному хозяину паразитов через 24 ч после
подсадки. Изучение продолжительности жизни тейле-
рии в голодных клещах показало, что простейшие по-
гибают раньше переносчика и клещи освобождаются
от инвазии Т. parva. Продолжительность переживания
тейлерии в голодных клещах не превышает 10 мес, в то
время как клещи способны питаться после 15-месячно-
го голодания.
Практическое значение. Вид патогенен.
Theileria annulata (Dschunkowsky, Luhs, 1904)
(рис. 204).
(= Gonderia annulata (Dschunkowsky, Luhs, 1904); G. dispar
(Sergent, Donatien, Parrot, Lestoquard, Platureux, Rougebief, 1924);
Piroplasma annulatum Dschunkowsky, Luhs, 1904; Theileria dispar
Sergent, Donatien, Parrot, Lestoquard, Plantureux, Rougebief, 1924;
T. turkestanica Oboldoueff, Galuzo, 1928).
Распространение: Азия, Северная Африка,
Южная Европа.
Хозяева позвоночные: Bison bison (бизон),
Bos taunts (крупный рогатый скот), Bubalus агпее (ази-
атский буйвол); не удалось заразить Cervus elaphus
bactrianus (тугайного оленя), кроликов, морских сви-
нок, белых мышей, белых крыс, коз, голубей.
Переносчики: Hyalomma aegyptium, Н. anatoli-
cum, Н. asiaticum, Н. detritum, Н. dromedarii (рис. 203, 2),
Н. excavatum, Н. inpressum, Н. rufipesglabrum, Н. scu-
pense, Н. transiens, Н. truncatum, Н. turanicum.
Развитие в позвоночном хозяине. Инку-
бационный период при заражении через клещей варьи-
рует от 8 до 25 сут, при заражении суспензией из селе-
зенки или лимфатических узлов, или кровью, получен-
ной на пике заболевания, наиболее часто колеблется в
пределах 17—18 сут. Мелкие одноядерные стадии па-
разитов, инокулированные клещом, продолжают свое
развитие путем множественного деления в лимфоци-
тах селезенки и лимфатических узлах. Размеры стадий
множественного деления чаще всего не превышают
8 мкм, но могут достигать 15 и даже 27 мкм в диамет-
ре. Различают две формы множественного деления —
макромеронты (гранулы хроматина в нцх 0.4'—1.9 мкм
в диаметре, в результате их деления образуются мак-
ромерозоиты размером 2—2.5 мкм в диаметре) и мик-
ТИП SPOROZOA. КЛАСС COCCIDEA
349
Рис. 204. Стадии Theileria annulata, развивающиеся в эритроцитах.
Fig. 204. Theileria annulata developing in the erythrocytes.
ромеронты (содержат хроматиновые гранулы меньше-
го размера — 0.3—0.8 мкм в диаметре, продуцируют
микромерозоиты величиной 0.7—1 мкм в диаметре).
Шайн с соавт. (Schein et al., 1978) считают, что макро-
меронты — меронты в стадии формирования мерозои-
тов. Мерогония у Т. annulata протекает сходно с тако-
вой у Т. parva. Подробнее об этом процессе можно
прочесть в описании жизненного цикла Т. parva. Обра-
зовавшиеся в результате мерогонии одноядерные па-
разиты внедряются в эритроциты, где продолжают
размножаться бинарным делением. В эритроцитах пе-
риферической крови встречаются паразиты круглой,
овальной, запятовидной, палочковидной, крестообраз-
ной (делящиеся стадии) и точечной, очень бедной ци-
топлазмой, формы. В паразитах овальной формы хро-
матин часто располагается в виде одного скопления по
периферии, иногда как бы выступая за пределы цито-
плазмы; такие формы напоминают перстень. В про-
долговатых формах хроматин в виде шапочки концен-
трируется на утолщенном конце, напоминая шляпку
гриба. Размеры овальных форм варьируют от 0.5 до
2 мкм, продолговатых — от 0.5 до 2.9 мкм; обычно
размеры паразитов меньше радиуса эритроцита. В од-
ном эритроците встречается до 9 паразитов, чаще 2—
3. Поражение эритроцитов может быть довольно силь-
ным и на пике паразитемии достигать 80—95 %. Эрит-
роцитарные стадии рассматриваются как гамонты.
Тейлерии могут встречаться в организме позво-
ночного хозяина после однократного заражения в те-
чение 6 лет, что позволяет рассматривать позвоночно-
го хозяина как основного резерванта тейлерий в при-
роде.
Стадии множественного деления можно культивиро-
вать in vitro на культуре ткани крупного рогатого скота.
Низкие температуры не убивают паразитов. Стадии, раз-
вивающиеся в кровяном русле, и 15-суточная культура
тейлерий сохраняли способность заражать позвоночных
хозяев при -196 °C в течение 23—38 сут.
350
ALVEOLATA
Развитие в беспозвоночном хозяине.
Развитие тейлерий в клеще Hyalomma anatolicum изу-
чали Сержаи с соавт. (Sergent et al., 1936). Они не виде-
ли форм, которые с уверенностью можно было бы рас-
сматривать как половые, и не наблюдали копуляции,
тем не менее существование полового процесса им ка-
залось несомненным. Эритроцитарные стадии разви-
тия оценивались ими как гаметоциты, которые в ки-
шечнике клеща, по их предположению, превращаются
в гаметы и сливаются в зиготу; последняя мигрирует в
клетки кишечника, инцистируется и находится в по-
кое, пока не закончится метаморфоз клеща. После
окончания линьки переносчика паразиты мигрируют в
его слюнные железы, формируют 3—4 споробласта,
которые в свою очередь претерпевают множественное
деление, распадаясь на большое количество мелких
одноядерных спорозоитов.
Серия работ по расшифровке развития Т. annulata в
клеще Hyalomma anatolicum excavatum, проведенная
на световом уровне (Schein, 1975; Schein et al., 1975) и
с помощью электронного микроскопа (Mehlhom et al.,
1975), позволила их авторам считать формы Т. annula-
ta, паразитирующие в клеще, похожими на половые
стадии споровиков. В первые 24—96 ч после оконча-
ния питания клеща исследователи описывают в про-
свете кишечника четырехъядерные стадии с несколь-
кими жгутикоподобными придатками, оценивая их как
микрогамонты; из них, по мнению авторов, очевидно
развиваются стройные веретенообразные или иглооб-
разные микрогаметы. Сферические стадии интерпре-
тируются как макрогаметы. На 5-е сут питания клещей
в эпителиальных клетках их кишечника образуются
«зиготы» с вакуолеподобным центром. Они растут,
увеличиваются в размерах, наиболее интенсивно окра-
шиваются на 12-е сут. Через 12 сут после окончания
питания клещей сферические зиготы принимают про-
долговатую форму, а в конце 13-го дня они вытягива-
ются в булавовидные кинеты. Зиготы диплоидные.
(Mehlhom, Schein, 1993). Трансформация неподвиж-
ных стадий зигот в подвижные кинеты осуществля-
ются путем впячивания в большую внутреннюю ва-
куоль. Этот процесс сопровождается формированием
оболочки кинеты (рис. 199, 1). Наружная мембрана
оболочки кинеты представляет собой мембрану боль-
шой вакуоли, в которую осуществляется впячивание,
а две внутренние мембраны формируются заново
(Mehlhom, Schein, 1977а, 1977b). Кинеты активно про-
никают через клетки кишечника и на 17-е сут обна-
руживаются в гемолимфе. На 18-е сут кинеты или
оокинеты проникают в слюнные железы, и начина-
ется процесс спорогонии. В общих чертах этот про-
цесс протекает следующим образом. Внедрившиеся в
альвеолы слюнных желез кинеты растут и после се-
рии ядерных делений формируют первичные деля-
щиеся тела, достигающие 20 мкм. В это время клещи
линяют, и дальнейшее развитие тейлерий происходит
в перелинявших взрослых клещах. Первичные деля-
щиеся тела (споронты) дают начало вторичным деля-
щимся телам (первичные споробласты), которые де-
лятся в свою очередь еще раз и формируют вторичные
споробласты. Вторичные споробласты делятся на од-
ноядерные особи — спорозоиты (Schein, Friedhoff,
1978).
Трансовариальная передача у тейлерий отсутствует
либо происходит в очень редких случаях.
Практическое значение. Вид патогенен.
Theileria hirci Dschunkowsky, Urodschevich, 1924.
(= Gonderia hirci (Dschunkowsky, Urodschevich, 1924)).
Распространение: Азия, Северная Африка, Ев-
ропа.
Хозяева позвоночные: Carpa hircus (коза),
Ovis aries (овца).
Переносчики: Hyalomma anatolicum, Hyalomma
spp, Rhipicephalus bursa.
Развитие в позвоночном хозяине. Пато-
генный вид тейлерий, описан из коз в Европе, леталь-
ность варьирует от 46 до 100 %. Болезнь продолжается
от 5 до 42 сут. Инокулированные клещом-переносчи-
ком паразиты первоначально размножаются множест-
венным делением в лимфоцитах селезенки и лимфати-
ческих узлов. Меронты имеют диаметр 8—20 мкм
и содержат до 80 хроматиновых гранул, размеры кото-
рых варьируют от 1 до 2 мкм в диаметре. Созревшие
меронты распадаются и дают начало одноклеточным
мерозоитам размером 1—2 мкм в диаметре. Эритроци-
тарные стадии полиморфны: круглые, овальные, про-
долговатые и бедные цитоплазмой точковидные.
Встречаются стадии, размножающиеся в эритроци-
тах, с 2, 3 и 4 ядрами. Четырехъядерные эритроци-
тарные стадии развития тейлерий часто имеют форму
креста. Размеры круглых форм колеблются от 0.6 до
2 мкм, продолговатых — около 1.6 мкм. Количество
зараженных паразитами эритроцитов обычно быва-
ет очень значительным и может достигать 95 %. Пе-
рекрестный иммунитет между Т. hirci и Т. ovis отсут-
ствует.
Пра ктическое значение. Сильно патогенный
вид, наносит большой экономический ущерб в резуль-
тате гибели зараженных животных, достигающей ино-
гда 100 % и потерь продуктивности.
Theileria camelensis Jakimoff, Schohov, Koselkine, 1917.
Распространение: Азия.
Хозяин позвоночный: Camelus bactrianus
(двугорбый верблюд).
Переносчик: Hyalommadromedarii (рис. 203,2).
Theileria dromedari Rao, Mishra, Shanna, Prasad, 1988.
Распространение: Азия.
Хозяин позвоночный: Camelus dromedarius
(одногорбый верблюд).
Theileria equi (Laveran, 1901) (рис. 205).
(= Babesia equi (Laveran, 1901); Nicollia equi (Laveran, 1901);
Nuttallia asini Dschunkowsky, Luhs, 1913; N. equi (Laveran, 1901);
N. minor Zassuchin, 1932; Piroplasma equi Laveran, 1901).
Распространение: Азия, Америка, Африка,
Европа.
Хозяева позвоночные: Equus asinus (осел),
Е. caballus (лошадь,), Е. asinus X Е. caballus.
Переносчики: Dermacentordaghestanicus (=D. ni-
veus), D. marginatus, D. nuttalli, D. pictus (=D. reticula-
tus) (рис. 203, 7), D. silvarum, Hyalomma anatolicum
(=H savignyi), H detritum, H dromedarii, H excavatum,
H marginatum (=H plumbeum), H scupense, (=H. ura-
ТИП SPOROZOA. КЛАСС COCCIDEA
351
Рис. 205. Стадии Theileria equi, развивающиеся в эритроцитах.
Fig. 205. Theileria equi developing in the erythrocytes.
lense, H. volgense), Rhipicephalus bursa, R. evertsi,
R. sanguineus, R. turanicus (=R. secundus).
Развитие в позвоночном хозяине. Инку-
бационный период обычно не превышает 8—10 сут,
в отдельных случаях может затягиваться до 21 сут.
В экспериментах на 1 спленэктомированном и 6 интак-
тных пони было изучено развитие Т. equi в позвоноч-
ном хозяине. У лошадей путем биопсии на 12-й и 14-й
день после подсадки клещей Hyalomma anatolicum
excavatum в лимфатических узлах обнаружены макро-
и микромеронты, похожие на коховские тела тейлерий
крупного рогатого скота.13 На этом основании вид пе-
реведен в род Theileria. В культуре лимфоцитов, инва-
зированных спорозоитами Т. equi, которые были полу-
чены из слюнных желез Н. anatolicum excavatum, через
4—5 дней после подсадки клещей также наблюдались
13 Внутриклеточные многоядерныс преэритротарные стадии у
Т. equi впервые наблюдал Трофимов (1952).
макро- и микромеронты. Спорозоиты из слюнных же-
лез клещей не инвазировали эритроциты в культуре,
но после развития в лимфоцитах успешно заражали
эритроциты (Schein et al., 1981). После завершения ме-
рогонии в лимфатических узлах меронты дают начало
мерозоитам. Мерозоиты Т. equi размером 2 X 1.5 мкм
имеют грушевидную форму, окружены пелликулой
и содержат апикальный комплекс без коноида (Molt-
mann et al., 1983). Мерозоиты внедряются в эритро-
циты. Размножение в эритроцитах осуществляется
почкованием с формированием характерных стадий,
состоящих из-4 особей, соединенных цитоплазматиче-
скими мостиками. В периферической крови Т. equi
имеет преимущественно кольцевидную, овальную,
круглую или грушевидную форму. Паразиты груше-
видной формы встречаются редко и никогда не распо-
лагаются парами, как у Babesia caballi.
В зависимости от сроков паразитирования форма и
размеры Т. equi изменяются. Крупными считают пара-
352
ALVEOLATA
зитон, размеры которых равны или превышают радиус
эритроцита (2.5—3.2 мкм). Т. equi средних размеров
достигают половины радиуса эритроцита, а мелкие
паразиты не превышают 1/4 его радиуса. В начале
заболевания преобладают крупные особи, затем по
мере развития болезни их количество уменьшается и
начинают доминировать Т. equi средних размеров.
В период выздоровления и паразитоносительства со-
кращается число T..equi средних размеров и остаются
преимущественно мелкие паразиты. В период парази-
тоносительства характерная, для Т. equi стадия маль-
тийский крест превращается в стадию, состоящую из 4
точек хроматина, с очень бледной цитоплазмой. Пара-
зитоносительство может продолжаться очень длитель-
ное время, по-видимому более 13 лет.
Развитие в беспозвоночном хозяине.
Процесс развития Т. equi в клещах протекает с участи-
ем полового процесса, сходного с таковым у тейлерий
(Mehlhorn, Schein, 1993). Трансовариальная передача
этих паразитов в клещах, по-видимому, отсутствует.
Абрамовым (1962) было показано, что имагинальные
стадии клещей Dermacentor marginatus и Hyalomma
plumbeum могут осуществлять трансмиссию Т. equi
при прерывистом питании с интервалами в 6—28 сут.
Такой тип циркуляции возбудителей в пределах одной
половозрелой стадии клеща является биологической
особенностью Т. equi.
Практическое значение. Вид патогенен.
Theileria microti (Franca, 1910).
(= Nuttallia microti (Franca, 1910); Smithia microti Franca, 1910;
Nicollia microti (Franca, 1910)).
Распространение: Калифорния, Португалия.
Хозяева позвоночные: Homo sapiens (чело-
век), Microtus arvalis (полевка обыкновенная), М. cali-
fonicus (полевка калифорнийская), Neotoma lepida lepi-
da (хомяк пустынный), Peromyscus californicus insignis
(хомячок калифорнийский), Spermophilopis beecheyi
(калифорнийский суслик), Sylvilagus audoboni (кролик
степной).
Замечания. Жизненный цикл протекает по тей-
лерийному типу (Mehlhorn, 1993). На этом основании
вид переведен в род Theileria.
Практическое значение. Заболевание про-
должается 19—24 дня, у спленэктомированного чело-
века продолжительность болезни составила 67 дней.
После переболевания паразиты обнаруживаются в
крови в течение 4 мес.
Сем. Babesiidae Poche, 191314
(= Piroplasmidae Franca, 1910)
Передача инвазии осуществляется клещами транс-
овариально; преэритроцитарные внутриклеточные
многоядерные стадии развития в позвоночном хозяине
отсутствуют.
14 В связи с тем что Piroplasma Patton, 1895 рассматривается
как младший синоним Babesia Starcovici, 1893, название семейства
должно быть Babesiidae Poche, 1913, потому что оно основано на
действительном названии рода.
Род Babesia Starcovici, 1893
(= Apiosoma Wandolleck, 1895; Babesiella Mesnil, 1919;
Francaiella Jakimoff, 1926; Haematococcus Babes, 1888;
Microbabesia Sohns, 1918; Microsoma Lebedeff, Tscher-
notsky, 1911; Patonella Ray, Idnani, 1943; Piroplasma
Patton, 1895; Pyrosoma Smith, Kilbome, 1893; Rangelia
Carini, Maciel, 1914; Rosiella Nuttall, 1912).
Для представителей рода характерны развивающи-
еся в эритроцитах парные грушевидные стадии, соеди-
ненные тонкими цитоплазматическими мостиками.
Типовой вид Babesia bovis (Babes, 1888).
Babesia bovis (Babes, 1888) (рис. 206).
(= Babesia argentina (Lignieres, 1903); B. berbera (Sergent, Dona-
tien, Parrot, Lestoquard, Plantureux, Rougebief, 1924); Babesiella ar-
gentina (Lignieres, 1903); B. berbera (Sergent, Donatien, Parrot, Lesto-
quard, Plantureux, Rougebief, 1924); B. major Sergent, Donatien, Par-
rot, Lestoquard, Plantureux, 1926; Francaiella argentina (Lignieres,
1903); F. berbera (Sergent, Donatien, Parrot, Lestoquard, Plantureux,
Rougebief, 1924); F. colchica Jakimoff, 1928; F. major (Sergent, Dona-
tien, Parrot, Lestoquard, Plantureux, 1926); F. sibirica Nicolsky, Avde-
ev, Kaurcev, 1961; Haematacoccus bovis Babes, 1888; Microbabesia
argentina (Lignieres, 1903); M. major (Sergent, Donatien, Parrot, Les-
toquard, Plantureux, 1926); Piroplasma argentinum Lignieres, 1903).
Распространение: Европа, Азия, Африка, Аме-
рика, Австралия.
Хозяева позвоночные: Bos taurus (крупный
рогатый скот), Bubalus агпее (азиатский буйвол).
Переносчики: Boophilus annulatus, В. australis,
В. calcaratus (рис. 207, Т), В. decoloratus, В. microplus,
Haemaphysalis punctata, Rhipicephalus bursa.
Развитие в позвоночном хозяине. Инку-
бационный период при заражении через клещей со-
ставляет 9—15 сут; при подкожном заражении ста-
диями, паразитирующими в крови, 12 сут. Паразиты
размножаются в эритроцитах бинарным делением и
почкованием. В кровеносных сосудах внутренних ор-
ганов обнаружены многоядерные внеэритроцитарные
стадии, которые интерпретируются как вышедшие из
эритроцитов и способные развиваться вне клеток.
Положение паразитов в эритроцитах обычно цент-
ральное, в одном эритроците чаще встречаются 1—2,
реже 3—4 паразита. Пораженность эритроцитов редко
превышает 4—5 %. Паразиты имеют овальную, коль-
цевидную, лимоновидную, грушевидную, амебоид-
ную и точковидную формы. Грушевидные и лимоно-
видные стадии часто соединены между собой тонкими
цитоплазматическими мостиками, угол расхождения
парных паразитов, как правило, тупой. Размеры гру-
шевидных стадий обычно равны радиусу эритроцита.
Размеры других стадий варьируют в пределах 1.4—
2.8 X 1.3—1.5 мкм. Размеры паразитов и расположе-
ние грушевидных парных стадий относительно друг
друга служат ведущими диагностическими признака-
ми вида.
Вид В. bovis в большинстве случаев встречается
вместе с В. bigemina. Это объясняется наличием обще-
го для этих паразитов клеща-переносчика Boophilus
calcaratus и четкими иммунологическими различиями.
Вид В. bovis в организме позвоночного хозяина раз-
множается медленнее, чем В. bigemina. После оконча-
ния острого периода болезни паразиты обнаруживают-
ся микроскопически в крови с большим трудом, но за-
ражение кровью переболевших животных даже через
ТИП SPOROZOA. КЛАСС COCCIDEA
353
Рис. 206. Стадии Babesia bovis, развивающиеся в эритроцитах.
Fig. 206. Babesia bovis developing in the erythrocytes.
6 мое после выздоровления вызывает у восприимчи-
вых животных тяжелое заболевание.
Р11 з в и г и е в беспозвоночном хозяине. В
клсще-нсрсносчике развитие В. bovis сопровождается
образованием стадий, различных в морфологическом и
физиологическом отношении. Через 36 ч после начала
питания личинок клеща в эпителиальных клетках их ки-
шечника образуются короткие сигаровидные стадии
В. bovis, размеры которых варьируют в пределах 7.2—
13.8 X 2.6—5.6 мкм. Они претерпевают множественное
деление и дают начало большому количеству червеоб-
разных паразитов, величина которых колеблется в преде-
лах 14.3—16.9 X 2.8—3.5 мкм. Часть червеобразных ста-
дий проникает в яйца и передается следующей генера-
ции клещей, а часть мигрирует в слюнные железы
личинок, где из них на 2—3-и сут после подсадки личи-
нок формируется множество мелких (1.5—1 мкм) инва-
зионных для позвоночного хозяина стадий (Riek, 1966).
Практическое значение. Вид патогенен.
Babesia bigemina (Smith, Kilbome, 1893) (рис. 208).
(= Apiosoma bigeminum (Smith, Kilbome, 1893); Babesia hudso-
nius bovis Bowhill, 1909; B. kollei Chavelot, 1904; Piroplasma australe
Miranda, Horta, 1913; Piroplasma bigeminum (Smith, Kilbome, 1893);
P. jakimovi Nikolsky, Avdeev, Kaurcev, 1961; Pyrosoma bigemina
Smith, Kilbome, 1893).
Распространение: Австралия, Азия, Централь-
ная и Южная Америка, Африка, Европа.
Хозяева позвоночные: Bison bison (бизон),
Bos taurus (крупный рогатый скот), Bubalus агпее (ази-
атский буйвол), Gazella soemmeringi (газель сомалий-
ская), Mazama. americana repertica (мазама большой),
Odocoileus virginianus chiriquensis (олень виргинский),
Syncerus caffer (африканский буйвол), Homo sapiens
(человек) спленэктомированный.
Переносчики: Boophilus annulatus, В. australis,
В. calcaratus (рис. 207, 7), В. decoloratus, В. microplus,
Haemaphysalis punctata, Rhipicephalus appendiculatus,
R. bursa, R. evertsi, R. rossicus.
23 Зак. №4163
354
ALVEOLATA
Рис. 207. Boophilus calcaratus — самка-переносчик пироплазм (7), Ixodes ricinus, самка-переносчик пироплазм (2).
Fig. 207. Boophilus calcaratus — vector tick (7), Ixodes ricinus — vector tick (2).
Замечание. Положение этого вида в системе
было определено правильно при первоописании. Смит
и Килборн (Smith, Kilbome, 1893) отнесли В. bigemina
к Protozoa и, что также очень важно, впервые доказали
несомненную роль клещей в переносе возбудителя
«техасской лихорадки».
Первое подробное описание паразита в России
дали Джунковский и Лус (Dschunkowsky, Luhs, 1904).
Развитие в позвоночном хозяине. В. bi-
gemina вызывает тяжелое, остро протекающее заболе-
вание — бабезиоз. Инкубационный период варьирует
от 10 до 28 сут. Летальность при этом заболевании мо-
жет достигать 50—90 %, гибель животных отмечается
обычно на 4—8-е сут после появления клинических
признаков заболевания.
Клещи-переносчики инокулируют позвоночному
хозяину мелкие одноядерные продолговатой и оваль-
ной формы стадии В. bigemina, образовавшиеся в
слюнных железах клещей в результате деления много-
ядерных паразитов. Созревание инвазионных для по-
звоночного хозяина стадий В. bigemina происходит в
слюнных железах нимф в большинстве случаев между
8-м и 9-м днем после прикрепления личинок к позво-
ночному хозяину (Hoyte, 1961; Крылов, 1962, 1964;
Riek, 1968; Potgieter, Els, 1977). В редких случаях,
по-видимому, возможна передача возбудителя позво-
ночному хозяину на 4-е сут после подсадки большого
числа инвазированных бабезиями личинок клещей-пе-
реносчиков (Крылов, 1962). Сроки развития В. bigemi-
na в беспозвоночном и позвоночном хозяевах хорошо
согласуются с метаморфозом клеща-переносчика.
Основной переносчик В. bigemina — клещ Boophylus
calcaratus — однохозяинный; на одном животном па-
разитируют все три фазы развития клеща — личинки,
нимфы и имаго. Процесс этот занимает 21—30 сут.
Первые клинические признаки заболевания появляют-
ся у позвоночного хозяина в большинстве случаев че-
рез 16—20 сут после прикрепления личинок кле-
щей-переносчиков, а гибель зараженных животных
может наступить только через 20—28 сут после под-
садки клещей-переносчиков. Таким образом, к тому
времени, когда у позвоночного хозяина развивается
тяжелая стадия заболевания, большинство клещей за-
канчивает метаморфоз. Если бы инвазионные для по-
звоночного хозяина стадии В. bigemina созревали в
первые дни питания клещей, то большая часть позво-
ночных хозяев и вместе с ними не закончившие разви-
тие клещи погибли бы от пироплазмоза до окончания
метаморфоза клещей.
После инокуляции клещом паразитов позвоночно-
му хозяину В. bigemina развивается исключительно в
кровяном русле последнего. Об этом свидетельствует
отсутствие какого-либо существенного разрыва во
времени между инокуляцией В. bigemina клещом по-
звоночному хозяину и появлением паразитов в его
кровеносном русле (Hoyte, 1961; Крылов, 1962, 1964).
Вопрос о том, каким образом происходит развитие
В. bigemina в кровяном русле позвоночного хозяина,
окончательно не решен.
Стадии, развивающиеся в эритроцитах, размножа-
ются делением на два и почкованием, формируя в
одном эритроците от 1 до 3 паразитов; чаще всего
встречаются 1—2 паразита. Обычно паразиты распо-
лагаются в центре эритроцита. Количество заражен-
ных эритроцитов невелико — 10—15 %, но под влия-
нием факторов, угнетающих защитные механизмы
позвоночного хозяина, может быть значительно боль-
ше. Эритроцитарные стадии паразитов полиморфны:
овальные, кольцевидные, амебоидные, грушевидные.
Парные грушевидные стадии, соединенные узким ци-
топлазматическим мостиком, чаще всего располагают-
ся относительно друг друга под острым углом и счита-
ются типичными для В. bigemina. Эритроцитарные
стадии обычно по своим размерам превышают радиус
эритроцита и варьируют в ширину от 1.14 до 3 мкм,
в длину от 1.7 до 6 мкм (рис. 207). Размеры парных
ТИП SPOROZOA. КЛАСС COCCIDEA
355
Рис. 208. Стадии Babesia bigemina, развивающиеся в эритроцитах.
Fig. 208. Babesia bigemina developing in the erythrocytes.
i рушснидных форм в среднем — 1.71—3.16 мкм. Ци-
KHIIIIITMII паразитов часто бывает вакуолизирована
и окрпн пишется по Романовскому в голубой цвет,
идро и красновато-рубиновый.
Кроме эритроцитарных стадий в организме позво-
ночного хозяина у В. bigemina описаны стадии, встре-
чиннцисги свободно вне эритроцитов, в плазме крови
luiiiitiiiDipoii внутренних органов. Внеэритроцитарные
('П1дии микроскопически обычно диагносцируются в
периоды наиболее яркого проявления клинических
iipitiiiiiKoii заболевания и сильной паразитемии. Эти
г । пдпи В, bigemina обнаружены в мелких кровеносных
сосудах легких, почек, сердечной мышцы, спинного
мозга, печени и селезенки. Наибольшее количество их
встречается в органах, богатых кислородом. Особенно
много виеэритроцитарных стадий найдено в капилля-
рах легких. Чаще всего встречаются округлые или не-
правильной формы тельца размером 1.2—4.8 мкм в
длину и 1.2—3 мкм в ширину с различными по величи-
не и форме ядрами. В некоторых из них содержится по
2—3 ядра, сохранивших между собой перетяжку, реже
встречаются 5—15-ядерные стадии, достигающие раз-
мера 7.7 х 9.9 мкм. Количество виеэритроцитарных
стадий В. bigemina нарастает вместе с числом эритро-
цитарных стадий.
Развитие в беспозвоночном хозяине.
Стадии В. bigemina в организме клеща-переносчика,
где они претерпевают сложное развитие, еще более
разнообразны. Попав в кишечник клеща вместе с эрит-
роцитами, паразиты покидают их и начинают размно-
жаться в просвете кишечника путем бинарного деле-
ния, формируя особи с 2, 4 и 6 ядрами.
В этот период в просвете кишечника клеща обнару-
живаются паразиты круглой, грушевидной или амебо-
идной формы с крупным ядром и гомогенной или ва-
куолизированной цитоплазмой, иногда образующие
цитоплазматические выросты различной величины.
Размеры этих стадий варьируют от 3 X 3 до 5 X 3 мкм,
диаметр ядра — около 1 мкм. Из образовавшихся путем
деления одноядерных особей формируются сравнитель-
но крупные булавовидные стадии — кинеты, внедряю-
щиеся в эпителиальные клетки кишечника клеща.
356
ALVEOLATA
Относительно трактовки природы двуядерных и
крупных булавовидных стадий существуют две точки
зрения. Денис (Dennis, 1932) полагает, что двуядерные
стадии ото продукт изогамной копуляции, а Рик
(Rick, 1964, 1968) — даже анизогамной.
Внедрившиеся в эпителиальные клетки кишечника
клеща булавовидные стадии претерпевают множест-
венное деление, сопровождающееся отпочковыванием
агамонтов. Стадии множественного деления, развива-
ющиеся в эпителиальных клетках кишечника, содер-
жат от 2—4 до 150—200 ядер и достигают размеров
10—18 X 30—45 мкм. Образовавшиеся из стадий мно-
жественного деления агамонты округлой и амебоид-
ной формы в процессе роста становятся булавовидны-
ми и проникают в новые клетки кишечника, где вновь
приступают к агамному размножению. Процесс этот
может, вероятно, неоднократно повторяться и имеет
большое биологическое значение, так как способству-
ет расселению паразитов по телу клеща и прежде всего
попаданию В. bigemina в яйцевые клетки. Множест-
венное деление в пищеварительных клетках кишеч-
ника постепенно затухает, а булавовидные или вытя-
нутые сигаровидные стадии интерпретируются как
оокинеты. Они проникают в гемолимфу, а через нее в
различные органы, в том числе и в половые клетки. Бу-
лавовидные стадии в яйцевых клетках размножаются
делением на два и множественным делением, которое
продолжается и в отложенных яйцах в первые дни ин-
кубации. Особенно интенсивно развитие паразита в
яйцах идет на 10—15-е сут после инкубации. В даль-
нейшем часть паразитов погибает, а часть оокинет
проникает в органы и слюнные железы формирующей-
ся личинки, где в результате асинхронной мерогонии к
8—9-му дню питания клеща образуются мелкие одно-
ядерные формы размерами 1—5 X 2.2—2.7 мкм (спо-
розоиты), которые инвазируют позвоночного хозяина.
Заразить позвоночного хозяина способны только те
стадии паразита, которые сформировались в слюнных
железах нимф. Все другие стадии развития паразита в
беспозвоночном хозяине не могут инвазировать тепло-
кровного хозяина.
Вебер и Фридхоф (Weber, Friedhoff, 1977) изучили
ультратонкую организацию стадий В. bigemina, разви-
вающихся в кишечнике клеща в первые 20 ч после на-
сыщения. Эти стадии впервые были описаны Кохом
(Koch, 1906) и названы «Strahlenkorper». Вебер и
Фридхоф предположительно оценивают их как поло-
вые. «Strahlenkorper» содержат многочисленные поры
и микротрубочки, а также необычную структуру, на-
званную Вебером и Фридхофом «светлое тело». Через
цитоплазматические отростки проходит пучок длинных,
расположенных параллельно микротрубочек, не со-
ставляющих конфигурацию 9 + 2. Количество их варь-
ирует от 2 до 10. Пелликула паразитов имеет одну
мембрану. Другие органеллы, типичные для подвижных
стадий споровиков, не были найдены. Развитие В. bige-
mina в клеще нормально происходит при температуре
28 °C, температура ниже 20 °C тормозит развитие.
Для В. bigemina характерна повторность цикла в
теле клеща при питании последнего даже на неспеци-
фических для В. bigemina хозяевах. Такая особенность
циркуляции бабезиид в ряде поколений клеща до-
казана для В. ovis в клещах Rhipicephalus bursa, для
В. caballi в клещах Dermacentor silvarum и Hyalomma
plumbeum. Характер взаимоотношений В. bigemina с
клещом-переносчиком указывает на важное эпизоото-
логическое значение беспозвоночного хозяина как
длительного резерванта бабезиид в природе.
Практическое значение. Вид патогенен.
Babesia divergens (MacFadyean, Stockman, 1911)
(рис. 209).
(= Babesiella bovis (Babes, 1888); B. divergens (MacFadyean,
Stockman, 1911); B. karelica Jakimoff, 1928; Francaiella caucasica
Jakimoff, Belavin, 1927; F. occidentals Jakimoff, Bourzeff, 1927; Mic-
robabesia bovis (Babes, 1888); M. divergens (MacFadyean, Stockman,
1911); Piroplasma divergens MacFadyean, Stockman, 1911; P. ruptu-
raelienis Jong, 1902).
Распространение: Европа.
Хозяева позвоночные: Bos taurus (крупный
рогатый скот), Capreolus capreolus (косуля), Cervus
dama (лань), C. elaphus (благородный олень), Homo sa-
piens (человек),15 Pan troglodytes (шимпанзе),16 Rangi-
fer tarandus (северный олень).
Переносчики: Ixodes hexagonus, I. persulcatus,
I. ricinus (рис. 207, 2).
Развитие в позвоночном хозяине. Стадии,
заражающие позвоночного хозяина, инокулируются
клещом через 48 ч после подсадки. Инкубационный
период при заражении через клещей 7—10 сут; при
заражении стадиями, развивающимися в крови, 2—
10 сут. Болезнь протекает остро и длится 4—8 сут.
В отличие от гемоспоридий у В. divergens отсутствуют
внутриклеточные преэритроцитарные стадии. В орга-
низме позвоночного хозяина паразит развивается толь-
ко в кровяном русле. Это было показано с переливани-
ем восприимчивым животным-реципиентам крови, по-
лученной от животных-доноров в различные сроки
после подсадки на последних клещей-переносчиков
(Крылов, 1964а). Размножение в эритроцитах осущест-
вляется бинарным делением и почкованием. В. diver-
gens — самая мелкая бабезия, паразитирующая в орга-
низме крупного рогатого скота. Размеры ее варьируют
от 1.5 до 2.43 мкм в длину и от 0.4 до 1.12 мкм в шири-
ну. Паразиты полиморфны: кольцевидные, овальные,
амебоидные, точковидные, ланцетовидные и груше-
видные. В одном эритроците встречается до 4 парази-
тов. В. divergens занимает в эритроците преимущест-
венно периферическое положение. Встречаются пар-
ные грушевидные стадии, которые как бы «сидят» на
эритроците. Размеры их меньше радиуса эритроцита.
Угол расхождения между парными грушевидными
стадиями, как правило, тупой, иногда достигает 180°, и
в э тих случаях одна особь паразита служит как бы про-
должением другой. Зараженность эритроцитов может
достигать 40 %, но обычно не превышает 7—15 %.
Развитие в беспозвоночном хозяине.
Петров (1938, 1939), изучавший развитие В. divergens в
клещах Ixodes ricinus, описывает анизогамную копуля-
цию. В кишечнике клеща, по его мнению, развиваются
только половые особи гаметы, которые, сливаясь,
дают червеобразную подвижную зиготу. Она проника-
15 Спонтанные случаи заболевания людей произошли после
удаления у них селезенки (Skrabalo, Deanovic, 1957; Fitzpatrick et
al., 1968; Рабинович и др., 1978).
16 Шимпанзе заразили В. divergens после спленэктомии (Gam-
ham, Bray, 1959).
ТИП SPOROZOA. КЛАСС COCCIDEA
357
Рис. 209. Стадии Babesia divergens, развивающиеся в эритроцитах.
Fig. 209. Babesia divergens developing in the erythrocytes.
ет через стенку кишечника в различные органы клеща.
I lopo ilt гы, попавшие в слюнные железы, при питании
плеши рпзмпожаются множественным делением и об-
рнтуюг спорозоиты, заражающие позвоночного хозяй-
ки, 'liiroThi, которые не попали в слюнные железы,
округляются и остаются в покоящемся состоянии до
tex пор. пока пе попадут с током гемолимфы или ак-
тивно н слюнные железы следующей фазы развития
клеща, где они развиваются таким же образом, как и в
слюнных железах предшествующей фазы развития
клеща. Зиготы — диплоидны, спорозоиты — гаплоид-
ны (Mehlhorn, Schein, 1993).
Практическое значение. Вид патогенен.
Babesia ovis (Babes, 1892) (рис. 210).
(= Amoebosporidium polyphagum Bonome, 1895; Babesia hirci
(Dschunkowsky, Luhs, 1909); Babesiella ovis Lestoquard, 1924; Fran-
caiella ovis (Babes, 1892); F. ovis Jakimoff, 1931; Haematococcus ovis
Babes, 1892; Microbabesia ovis (Babes, 1892); Piroplasma hirci
(Dschunkowsky, Luhs, 1909); P. ovis (Laveran, Nicolle, 1899)).
Распространение; Азия, Африка, Европа.
Хозяева позвоночные: Capra hircus (коза),
Cervus dama (лань), С. elaphus (благородный олень),
Ovis аттоп polii (архар), О. aries (овца).
Переносчики: Amblyomma hebraeum, Dermacen-
tor marginatus, Haemaphysalis otophila (?), Ixodes per-
sulcatus, I. ricinus (рис. 207, 2), Ornithodoros canestrini,
O. lahorensis, Rhipicephalus bursa.
Развитие в позвоночном хозяине. Клещи
Rhipicephalus bursa способны передавать В. ovis овцам
через 96 ч после прикрепления. Клинические признаки
заболевания у животных появляются через 8—10 сут
после подсадки переносчиков. Инкубационный пери-
од при заражении кровью больных животных варьиру-
ет от 2 до 10 сут, в среднем 6—7 сут. Развитие бабезий
в организме позвоночного хозяина осуществляется
только в кровяном русле путем бинарного деления в
эритроцитах (рис. 210). Помимо эритроцитарных ста-
дий, в кровеносных сосудах легких и других органов
358
ALVEOLATA
Рис. 210. Стадии Babesia ovis, развивающиеся в эритроцитах.
Fig. 210. Babesia ovis developing in the erythrocytes.
обнаружены внеэритроцитарные стадии. В. ovis — са-
мая мелкая бабезия овец. Размеры ее 1—2.5 мкм, фор-
ма паразитов чаще всего овальная. Грушевидные пар-
ные паразиты обычно располагаются относительно
друг друга под тупым углом и занимают перифериче-
ское положение в эритроците. Зараженность эритроци-
тов варьирует от 1 до 5 %. Описаны случаи транспла-
центарного заражения.
При отсутствии реинвазии организм овец освобож-
дается от паразита через 11—12 мес; иногда паразито-
носительство продолжается до 32 мес.
Вид В. ovis менее вирулентна, чем В. motasi. Пере-
крестный иммунитет у овец между этими видами бабе-
зий отсутствует.
Развитие в переносчике. Циркуляция пара-
зита в клещах-переносчиках осуществляется трансова-
риально. В. ovis может длительное время паразитиро-
вать в клещах без прохождения развития в позвоноч-
ном хозяине. Марков и Абрамов (1970) установили
передачу бабезий в 44 поколениях клещей Rhipicepha-
lus bursa. Продолжительное голодание (288 сут) не
стерилизует клещей от паразитов. Непременным усло-
вием для развития В. ovis в теле клещей Rhipicephalus
bursa является их питание: в голодных клещах бабезии
не развиваются. Первые стадии развития бабезий в
клещах обнаруживаются через 18 ч после их прикреп-
ления к позвоночному хозяину. Через 48 ч количество
разнообразных стадий паразитов достигает максиму-
ма, в дальнейшем число бабезий резко сокращается.
В половой системе клещей бабезии появляются через
48 ч после подсадки и размножаются множественным
делением, образуя несколько генераций меронтов.
Наиболее характерные стадии паразитов, развивающи-
еся в нимфах и имаго переносчиков, — булавовидные
и округлые. В слюнных железах переносчиков бабезии
обнаруживаются через 24 ч после подсадки клещей на
позвоночных животных, а через 96 ч формируются ин-
вазионные для позвоночного хозяина стадии.
ТИП SPOROZOA. КЛАСС COCCIDEA
359
Рис. 211. Стадии Babesia motasi, развивающиеся в эритроцитах.
Fig. 211. Babesia motasi developing in the erythrocytes.
Фридхоф (устное сообщение) предполагает нали-
чие ПОЛОВОГО процесса в жизненном цикле В. ovis. Лу-
ЧЩ}ТЫ| ТОЛП у В. ovis крупнее, чем таковые, описанные
КОХОМ (КООП, 1906) у В. bigemina. Максимальные раз-
меры ЛуЧИОТЫХ Юл из кишечника клеща следующие:
неправильной .формы — 8 X 2.4 мкм, делящиеся —
11,1 X 6,5, ОТВДИИ с двумя длинными «лучами» —
19.4 X 2,6, Сферические стадии с заострением — 3.9,
сферические без заострения — 4.5 мкм. Кинета форми-
руется но ранее чем через 92 ч, а лучистые тела раз-
виваются В UCpilblC 115 ч после завершения питания
клеща.
Практическое точение. Вид патогенен.
Babesia motasi Wenyon, 1926 (рис. 211).
(= Piroplasma ovis Lesioquiii'd, 1925).
Распространение: Азия, Африка, Европа.
Хозяева позвоночные: Capra hircus (коза),
Cervus dama (лань), С. elaphus (благородный олень),
Ovis aries (овца).
Переносчики: Dermacentorsilvarum, Haemaphy-
salis otophila, H. punctata, Rhipicephalus bursa, Ixodes
ricinus (рис. 207, 2).
Развитие в позвоночном хозяине. Самая
крупная бабезия, встречающаяся у овец и коз. Размеры
эритроцитарных стадий 2.5—4 мкм. Чаще всего на-
блюдаются единичные и парные грушевидные стадии.
Расположение в эритроците центральное, угол расхож-
дения между парными грушевидными паразитами
острый. Инкубационный период при заражении кро-
вью варьирует от 1 до 10 сут, наиболее короткий инку-
бационный период при интравенозном способе зара-
жения. Овцы, иммунные к В. motasi, остаются воспри-
имчивыми к В. ovis.
360
ALVEOLATA
Рис. 212. Стадии Babesia caballi, развивающиеся в эритроцитах.
Fig. 212. Babesia caballi developing in the erythrocytes.
Передача инвазии клещами осуществляется транс-
фазно и трансовариально.
Практическое значение. Вид патогенен.
Babesia caballi (Nuttall, Strickland, 1910) (рис. 212).
(= Piroplasma caballi Nuttall, Strickland, 1910).
Распространение: Европа, Африка, Азия, Аме-
рика.
Хозяева позвоночные: Equus asinus (осел),
Equus asinus X Equus caballus, Equus burchelli (бурчел-
лова зебра), E. caballus (лошадь).
Переносчики: Dermacentor dagestanicus, D. mar-
ginatus, D. nitens, D. nuttalli, D. pictus (рис. 203, 1),
D. silvarum, Hyalomma anatolicum, H. detritum, H. dro-
medarii (рис. 203, 2), H. excavatum, H. marginatum,
H. plumbeum, H. scupense, Rhipicephalus bursa, R. san-
guineus (рис. 213, 2).
Замечание. Первое описание возбудителя пи-
роплазмоза лошадей принадлежит Белицеру (1906,
1909), который не выделял возбудителя пироплазми-
доза лошадей в самостоятельный вид и ошибочно счи-
тал его идентичным В. bigemina. Натл и Стрикленд
(Nuttall, Strickland, 1910) провели сравнительное изу-
чение кровепаразитов, вызывающих маляриеподобное
заболевание лошадей, и четко разделили их на два ви-
да. Возбудителя, описанного Лавераном, они отнесли
xNuttallia equi (Piroplasma equi Laveran, 1901), а пара-
зита, описанного Белицером в России, назвали Babesia
caballi (=Piroplasma caballi Nuttall, Strickland, 1910).
Развитие в позвоночном хозяине. Инку-
бационный период при заражении через клещей варьи-
рует от 7 до 19 сут. Развитие паразита в позвоночном
хозяине осуществляется только в кровеносном русле.
Описаны случаи трансплацентарной передачи возбу-
дителя (Neitz, 1956). Паразиты размножаются в эрит-
роцитах бинарным делением и почкованием, в одном
эритроците встречается от 1 до 3 паразитов. Размеры
грушевидных форм составляют 2.5—-4 мкм в длину,
ТИП SPOROZOA. КЛАСС COCCIDEA
зет
Рис. 213. Haemaphysatis longicornis, самка-переносчик пироплазм (7), Rhipicephalus sanguineus, самка-переносчик пироплазм (2).
Fig. 213. Haemaphysalis longicornis — vector tick (7), Rhipicephalus sanguineus — vector tick (2).
овальных — 1.5—3 мкм в диаметре. Для вида харак-
терны парные грушевидные стадии, соединенные друг
с другом под острым углом тонким цитоплазматиче-
ские мостиком. Количество пораженных эритроцитов
при пироплазмозе варьирует от 2.5 до 10 %. Паразиты
обычно сохраняются в организме позвоночного хозяи-
на от 1 года до 3 лет. Стадии, развивающиеся в позво-
ночном хозяине, живут в нитрированной крови при
температуре 2—4 °C от 5 до 10 сут. Повторное замора-
живание и оттаивание обусловливает гибель парази-
тов. Нагревание до 50 °C также убивает В. caballi.
Развитие в беспозвоночном хозяине.
Марциновский и Белицер (1907, 1908) описали разви-
тие В. caballi в клеще Dermacentor reticulatus. На осно-
вании своих наблюдений они предполагают, что на
2—3-и сут после окончания питания клеща происхо-
дит копуляция паразитов с образованием оокинеты,
которая мигрирует затем в различные органы, продол-
жил свое развитие множественным делением. Передача
ИНВиэии в клещах осуществляется от фазы к фазе и
ТрйИСОвариально. Последний способ передачи инвазии
УДАЛОСЬ установить в 13 поколениях клеща Hyalomma
р/м/пЬвШП, питавшихся на всех фазах развития на неспе-
ЦИфнЧбОКИХ ДЛЯ В. caballi хозяевах (Абрамов, 1962).
ПрЙИ'ГИЧеское значение. Вид патогенен. Пи-
Р0ПЛММ01 ЛОПКЩСЙ протекает в острой и хронической
форМб. ЛбТЙЛ1.110СТ1. обычно наблюдается через 1—
J ПбД 1106 Л в ПОИИЛСНПЯ клинических признаков заболе-
шшия,
BllllCftlll IruilliiiHiinl (Knuth, Du Toil, 1921)
(рис. 214),
(= Piropltisiiiu sills l.iuizlllu, 192'1; /’. trautmanni Knuth, Du Toit,
1921).
Распространение: Азия, Африка, Европа.
Хозяин позвоночный: Sus xcrofa domestica
(свинья).
Переносчики: Boophilus decoloratus (?), Derma-
centor pictus (рис. 203, 1), Rhipicephalus sanguineus
(рис. 213, 2), R. turanicus.
Развитие в позвоночном хозяине. Инку-
бационный период при заражении через клещей 12—
25 сут, при заражении стадиями, развивающимися в
крови, — 3—9 сут. Эритроцитарные стадии поли-
морфны: кольцевидные, овальные, амебоидные, гру-
шевидные одиночные и парные. В эритроците может
локализоваться от 1 до 8 паразитов. Иногда паразиты
встречаются вне эритроцитов в плазме крови. Размно-
жение осуществляется бинарным делением и почкова-
нием. На пике паразитемии преобладают грушевидные
стадии паразитов (до 90 %). Зараженность эритроци-
тов может быть высокой и достигать 65 %. Эта бабезия
крупная; размеры паразитов варьируют от 0.6 до
6 мкм.
Практическое значение. Вид патогенен.
Babesia canis (Piana, Galli-Valerio, 1895) (рис. 215).
(= Achromaticus canis (Piana, Galli-Vaierio, 1895); Babesia rossi
(Nuttall, 1910); Piroplasma canis (Piana, Galli-Valerio, 1895); P. rossi
Nuttall, 1910; Pyrosoma bigeminum var. canis Piana, Galli-Vaierio,
1895; Rossiella rossi (Nuttall, 1910)).
Распространение: Азия, Америка, Африка,
Европа.
Хозяева позвоночные: Canis aureus (шакал),
С. familiaris (собака), С. latrans (койот), С. lupus (волк),
С. (Thos) adustus (шакал полосатый), С. (Thos) mesome-
las (шакал чепрачный), Nyctereutes procyonoides (соба-
ка енотовидная), Vulpes vulpes (лисица).
Переносчики: Dermacentor andersoni, D. margi-
natus, D. pictus (рис. 203, 7), D. venustus, Haemaphysalis
leachi, Hyalomma marginatum, Rhipicephalus sanguineus
(рис. 213, 2).
Развитие в позвоночном хозяине. Инку-
бационный период при заражении через клещей колеб-
362
ALVEOLATA
Рис. 214. Стадии Babesia trautmanni, развивающиеся в эритроцитах.
Fig. 214. Babesia trautmanni developing in the erythrocytes.
лется от 5 до 21 сут, в среднем 8—10 сут, при зара-
жении кровью — 5—7 сут. Размеры эритроцитарных
стадий варьируют: длина грушевидных 4—5 мкм, диа-
метр овальных 2—4 мкм. В начале заболевания пара-
зитов в крови мало, но на 2—4-е сут количество их рез-
ко возрастает. Зараженность эритроцитов достигает
6—10 %, число паразитов в одном эритроците колеб-
лется от 1 до 16.
Развитие в беспозвоночном хозяине.
Христоферс (Christophers, 1907а, 1907b), изучавший
развитие В. canis в клеще Rhipicephalus sanguineus, ви-
дел, как паразиты выходят из эритроцитов собак в ки-
шечник клеща, растут, достигают длины 3.5 мкм и пре-
вращаются в булавовидные тельца, форма которых на-
поминает оокинету паразитов, вызывающих малярию.
Звездчатые формы, описанные Кохом (Koch, 1906), он
встречал очень редко. Христоферс был убежден в су-
ществовании полового процесса у В. canis. Регенданц
и Рейхенов (Regendanz, Reichenov, 1933) очень тща-
тельно изучали развитие В. canis в клеще Dermacentor
reticulatus. Ими было показано, что паразиты переда-
ются клещом позвоночному хозяину на 3—4-е сут пос-
ле подсадки. В эпителиальных клетках стенки кишеч-
ника клеща они наблюдали огромное количество аме-
боидных форм паразитов, возникающих, по их
мнению, путем быстро следующих друг за другом де-
лений на два. Зигота и кинета — диплоидны, меронты,
гамонты в эритроцитах, а спорозоиты — гаплоидны
(Mehlhorn, Schein, 1993).
Практическое значение. Вид патогенен.
Род Echinozoon Garnham, 1951
Для представителей рода характерно наличие «ни-
тей», окружающих зараженные эритроциты.
Типовой вид Echinozoon hoogstraali Gamham,
1951.
ТИП SPOROZOA. КЛАСС COCCIDEA
363
Рис. 215. Стадии Babesia canis, развивающиеся в эритроцитах.
Fig. 215. Babesia canis developing in the erythrocytes.
Echinozoon hoogstraali Gamham, 1951 (рис. 216).
Распространение: Судан.
Хозяин позвоночный: Heteroxyrax brucei,
Н. syriacus (даманы).
Развитие в позвоночном хозяине. Моло-
дые стадии паразита могут быть 2 мкм в длину. Хрома-
тин в них собран в одну глыбку или разделен на не-
сколько долей. В более поздних стадиях развития хрома-
тин по форме часто напоминает буквы V или U. Форма
этих стадий овальная или сферическая. При развитии по-
следующих стадий паразита появляются «нити», окру-
жающие зараженные эритроциты (рис. 216). В дальней-
шем наблюдаются два типа паразитов: мелкий тип (раз-
меры менее половины эритроцита, в среднем 5 мкм в
диаметре) и крупный тип (достигают 9 мкм в длину). Па-
разиты второго типа часто овальной или грушевидной
формы. Между этими типами паразитов имеются проме-
жуточные формы. При размножении ядро паразита де-
лится на 2—5 и более частей. Размножение осуществ-
ляется бинарным делением и почкованием или шизо-
гонией. В одном эритроците встречается до 5 парази-
тов. «Нити», отходящие от поверхности пораженных
паразитами эритроцитов, обычно длиной 2.5 мкм. Ко-
личество нитей варьирует от 16 до 30. В некоторых
случаях кажется, что «нити» отходят от хроматиновых
масс паразитов, но Гарнем (Gamham, 1951) считает,
что это ошибочное впечатление. Поскольку перенос-
чик Е. hoogstraali неизвестен, остается неизученным
полный жизненный цикл, что заставляет пока условно
считать паразита представителем сем. Babesiidae.
Сем. Anthemosomatidae Levine, 1981
В эритроцитах формируется путем почкования ме-
ронта от 5 до 32 (обычно 8—16) мерозоитов, гамонты
круглые или овальные; имеются полярное кольцо и
роптрии, субпелликулярные микротрубочки отсутст-
вуют; паразит млекопитающих.
364
ALVEOLATA
Рис. 216. Стадии Echinozoon hoogstraali, развивающиеся в позвоночном хозяине. (По: Gamham, 1951).
Fig. 216. Echinozoon hoogstraali developing in the vertebrate host.
Род Anthemosoma Landau et al.,
1969
Характеристика семейства.
Типовой вид Anthemosoma garnhami Landau,
Boulard et Houin, 1969.
Anthemosoma garnhami Landau, Boulard, Houin,
1969 (рис. 217).
Распространение: Африка.
Хозяин позвоночный: Acomyspercivali (игли-
стая мышь); в экспериментальных условиях заражены
Mus musculus var. albinos (домовая мышь).
Развитие в позвоночном хозяине. Агам-
ное размножение осуществляется в эритроцитах путем
почкования. Эти стадии чаще всего содержат 8—16 ме-
розоитов, максимально 32 (рис. 217). Ядра в стадиях
размножения располагаются по периферии на нож-
ках цитоплазмы. Гаметоциты круглой или овальной
формы. Инкубационный период при заражении
восприимчивых животных кровью, полученной от
больных грызунов, 48—52 ч. Максимальная пара-
зитемия наблюдается на 10—15-е сут после зара-
жения. Электронно-микроскопические исследования
серийных срезов показали, что деление ядра осуществ-
ляется почкованием. Ядро имеет неправильную мно-
голопастную форму. Питание происходит через кле-
точную мембрану паразита, образующую впячивания
и полости, захватывающие строму эритроцитов хо-
зяина.
ТИП SPOROZOA. КЛАСС COCCIDEA
365
Рис. 217. Схема формирования мерозоитов Anthemosoma garnhami
в эритроцитах хозяина. (По: Vivier et al., 1969).
Fig. 217. Anthemosoma garnhami in the erythrocytes.
Род Tunetella Brumpt, Lavier,
1935
Представители рода размножаются в эритроцитах
рептилий бинарным множественным делением с фор-
мированием стадий овальной и грушевидной формы.
Типовой вид Tunetella emydis Brumpt, Lavier,
1935.
Tunetella emydis Brumpt, Lavier, 1935.
Распространение: Северная Африка, Тунис.
Хозяева позвоночные: Emys leprosa, Е. orbi-
cularis (Reptilia).
Развитие в позвоночном хозяине. Размно-
жение осуществляется в эритроцитах бинарным и мно-
жественным делением, которое Брумпт и Лавье
(Brumpt, Lavier, 1935) назвали псевдошизогонией. В
результате образуются особи размером 2—5 мкм в
диаметре. Крупные паразиты имеют сферическую,
овальную и грушевидную форму. Редко наблюдаются
стадии вне эритроцитов, в плазме крови.
Бедность сведений о развитии Т. emydis в организ-
ме позвоночного хозяина и полное отсутствие данных
о переносчике затрудняют решение вопроса о система-
тическом положении паразита. До появления дополни-
тельных материалов, видимо, следует Т. emydis оста-
вить в сем. Babesiidae условно.
Tunetella chelonia Carini, 1937.
Хозяин позвоночный: Chelonia mydas (Rep-
tilia).
Insertae sedis
Сем. Haemohormidiidae Levine,
1984
Мерогония имеется: мерозоиты формируются би-
нарным делением и мерогонией; ядра не имеют эндо-
сомы или нуклеол; паразиты рыб, рептилий и птиц; пе-
реносчики и другие стадии развития не известны; опи-
сан один род Haemohormidium.
Род Haemohormidium Henry,
1910
(- Nuttallla C’uipano, 1929; Babesiosoma Jakowska
el Nigrelli, 1956, in part)
Характеристика семейства.
Замечания. Исследования в световом и элект-
ронном микроскопах Haemohormidium terranowae
и Haemohormidium sp. не позволили обнаружить
структур, характерных для Sporozoa (=Apicomplexa).
У обоих видов в эритроцитах найдены одноядер-
ные, двухъядерные и четырехъядерные формы.
В ядрах подтверждено наличие ДНК (Siddall et al.,
1994).
Род Sauroplasma Du Toit, 1937
Паразиты, встречающиеся в эритроцитах, округлой
или неправильной формы, стадии с большими вакуо-
лями напоминают перстень. Размножение осуществля-
ется бинарным делением и почкованием.
Замечания. Левайн (Levine, 1971) поместил этот
род в сем. Dactylosomatidae. Отсутствие материалов по
жизненному циклу и ультраструктуре делает невоз-
можным в настоящее время определение положения
паразита в системе.
Типовой видSauroplasma thomasiDuToit, 1937.
Sauroplasma thomasi Du Toit, 1937.
Распространение: Африка.
Хозяева позвоночные: Zonozaurus madagas-
cariensis, Cordylus giganteus (Reptilia).
Развитие в позвоночном хозяине изучено
недостаточно.
Род Serpentoplasma Pienaar, 1962
Эритроцитарные стадии представляют собой мел-
кие сферические или овальные тела (меньше 1 мкм в
диаметре) типичной перстнеобразной формы с ясной
центральной вакуолью и обычно периферическим рас-
положением хроматина. Размножение осуществляется
бинарным делением и почкованием.
Типовой вид Serpentoplasma najae Pienaar,
1962.
366
ALVEOLATA
Serpentoplasma najae Pienaar, 1962.
Распространение: Южная Африка.
Хозяин позвоночный: Naja nigricollis (Rep-
tilia).
Переносчик: Aponomma laeve capensis (?).
Род Sogdianella Schurenkova,
1938
Часть жизненного цикла проходит в эритроцитах
птиц с образованием 4 мерозоитов и одноядерных не-
делящихся стадий, возможно гаметоцитов; другая
часть жизненного цикла проходит в клетках ретику-
лоэндотелиальной системы легких, печени, с образо-
ванием большого числа (20—30) мерозоитов в одной
клетке хозяина.
Типовой вид Sogdianella moshkovskii Schurenko-
va, 1938.
Sogdianella moshkovskii Schurenkova, 1938.
Распространение: Республика Таджикистан.
Хозяин позвоночный: Gypaetus barbatus
(Nnqs).
Развитие в позвоночном хозяине. Моло-
дые эритроцитарные стадии мелкие (1—1.5 мкм в диа-
метре), круглой или овальной формы, с ядром, распо-
ложенным на периферии тела паразита. В молодых
стадиях паразита делящиеся ядра представлены в виде
2 параллельно лежащих палочек. У более поздних ста-
дий наблюдается увеличение объема цитоплазмы и
2 удлиненных ядра, иногда соединенных тонким хро-
матиновым мостиком.
В дальнейшем ядра расходятся и округляются. Раз-
меры паразитов значительно увеличиваются, диаметр
их достигает 5—7 мкм; оба ядра в этой стадии вновь
претерпевают деление, формируя 4 мерозоита. Кроме
4 мерозоитов, в результате деления образуется оста-
точное цитоплазматическое тело. Нередки случаи на-
хождения в одном эритроците 2 паразитов, в результа-
те деления которых образуется 8 мерозоитов.
Наряду с описанными стадиями встречаются пара-
зиты, сильно вытянутые в длину, которые тесно приле-
гают к одному из концов эритроцита и охватывают его
ядро. В подобных стадиях удается насчитать 4—
6 ядер, разбросанных в разных местах цитоплазмы.
Часто в одном эритроците встречается два таких пара-
зита.
Помимо описанных стадий обнаружены паразиты с
одним ядром овальной или круглой формы с диамет-
ром 3—5 мкм, возможно гаметоциты. Зараженные
эритроциты не изменяют свою форму, ядро клетки хо-
зяина паразит не смещает.
Кроме эритроцитарных стадий описаны паразиты,
развивающиеся в клетках ретикулоэндотелиальной си-
стемы, клетках селезенки, почек, легких и печени.
Особенно много паразитов (до 20—30 экз.) обнаружи-
вали в клетках печени. Наряду с внутриклеточными
стадиями встречали стадии, локализующиеся в плазме
крови, с 8—10—15 ядрами.
По мнению Щуренковой (1938), помещению па-
разита в семейства Haemoproteidae или Plasmodiidae
препятствует отсутствие у него пигмента, а в сем. Thei-
leriidae — наличие стадий, размножающихся в эритро-
цитах. Поэтому она помещает S. moshkovskii в
сем. Babesiidae. Современные представления о жиз-
ненных циклах паразитов из сем. Babesiidae свидетель-
ствуют о том, что развитие этих организмов в позво-
ночном хозяине осуществляется только в эритроцитах.
Следовательно, вид S. moshkovskii, имеющий стадии,
которые развиваются в клетках ретикулоэндотелиаль-
ной системы, не может быть помещен в сем. Babesii-
dae. В то же время известно, что у части видов из
сем. Theileriidae имеются стадии, размножающиеся в
эритроцитах, и это сближает S. moshkovskii с тейлерия-
ми. С другой стороны, вид S. moshkovskii имеет ряд
сходных черт с представителями сем. Plasmodiidae, от-
сутствие пигмента не обязательно препятствует поме-
щению его в это семейство. Малярийные паразиты,
развивающиеся в юных формах эритроцитов, пигмент
не формируют. Одним словом, решение вопроса о по-
ложении S. moshkovskii в системе требует дополни-
тельных проверочных работ по жизненному циклу.
Прежде всего необходимо доказать, что внутриклеточ-
ные стадии в печени и эритроцитарные стадии принад-
лежат одному и тому же паразиту.
Замечания. За последние 30—60 лет в эритроци-
тах птиц было обнаружено и описано более 10 видов
кровепаразитов, которых изначально отнесли к родам
Nicollia (=Nuttallia) и Babesia. До сих пор не получено
доказательств о их принадлежности к пироплазмам.
Pop Achromaticus Dionisi, 1899
Стадии, паразитирующие в позвоночном хозяине,
полиморфны, встречаются в эритроцитах и внеклеточ-
но в плазме крови. Размножение осуществляется би-
нарным делением и почкованием.
Наличие у представителей рода Achromaticus, и в
том числе у типового вида, форм, удивительно похо-
жих на паразитов из родов Babesia, Nicollia (= Nuttal-
lia) и даже на эритроцитарные стадии Theileria, застав-
ляет осторожно отнестись к решению вопроса о поло-
жении этих паразитов в системе. Весьма вероятно, что
род Achromaticus сборный, однако окончательно это
можно будет установить только после проведения спе-
циальных экспериментальных исследований.
Типовой в ид Achromaticus vesperuginis Dionisi,
1899.
Achromaticus vesperuginis Dionisi, 1899 (рис. 218).
Распространение: Азия, Африка, Европа.
Хозяева позвоночные: Nyctalus noctula
(= Vesperugo noctula), Pipistrellus pipistrellus, P. kuhli
(= Vesperugo kuhli), Scotophylus heathi belangeri (Mam-
malia).
Переносчик: Argas vespertilionis (= Pteroptus
vespertilionis).
Развитие в позвоночном хозяине. Труд-
ность решения вопроса о положении Achromaticus ves-
peruginis в системе определяется, с одной стороны, не-
достаточностью знаний о жизненном цикле, с дру-
гой — тем, что описания этого паразита приведены из
различных видов рукокрылых, иногда принадлежащих
даже к разным родам.
ТИП SPOROZOA. КЛАСС COCCIDEA
367
Рис. 218. Стадии Achromaticus vesperuginis, развивающиеся в эритроцитах.
Fig. 218. Achromaticus vesperuginis developing in the erythrocytes.
Диониси (Dionisi, 1899) обследовал летучих мышей
Nyctalus noctula (= Vesperugo noctula) и нашел в их
крови многочисленных и разнообразных по форме и
времени появления в эритроцитах беспигментных па-
разитов. Диониси делит обнаруженных им паразитов на
две большие группы: наблюдающиеся в период спячки
хозяев и появляющиеся после окончания спячки. Во вре-
мя спячки вс тречаются паразиты грушевидной формы
величиной 1/6 диаметра эритроцита и сферической
формы величиной 1/5 диаметра эритроцита. Наряду с
этими стадиями наблюдаются паразиты кольцевидной,
дисковидной и пирамидальной формы. В плазме крови,
внеклеточно, обнаруживаются паразиты грушевидной
формы различной величины с одной или несколькими
глыбками хроматина; и наконец, в этот же период можно
видеть крупные, занимающие 3/4 диаметра эритроци-
та, стадии с ячеистой цитоплазмой и мелкими глыб-
ками хроматина, окруженного светлой зоной. Часто
встречаются эритроциты с несколькими паразитами.
После окончания спячки хозяина различия в формах
паразитов становятся более существенными. Наряду с
формами, характерными для периода спячки, появляют-
ся новые, которых Диониси делит на 4 группы.
К первой группе относятся паразиты дисковидной
формы, размеры их варьируют от 1/16 до 1/10 диамет-
ра эритроцита, хроматин представлен одной компакт-
ной глыбкой.
Ко второй группе принадлежат паразиты с боль-
шим количеством хроматиновых глыбок в цитоплаз-
ме. Эти стадии бывают различной формы: в виде веера
с хроматином, состоящим из 4 глыбок, дисковидные с
6 глыбками хроматина, кольцевидные с хроматином
по периферии (как жемчуг в перстнях). Встречаются
паразиты, у которых хроматин располагается кольцом
вокруг цитоплазмы паразита, или треугольником, или
крестом.
К третьей группе относятся паразиты, имеющие
форму мелких колец, соединенных друг с другом тон-
368
ALVEOLATA
кими участками цитоплазмы. Таких паразитов в одном
эритроците может быть до 5.
К четвертой группе принадлежат паразиты со
сложной структурой; в одном эритроците бывает 1—3,
иногда большее количество паразитов.
Сравнивая формы паразитов в период спячки хозя-
ев и после ее окончания, Диониси приходит к заключе-
нию, что в период спячки имеются взрослые стадии,
возможно гаметоциты, а в период бодрствования хозя-
ина появляются молодые, размножающиеся стадии па-
разитов.
В. Л. Якимов с соавт. (1910) провели подробное
изучение паразитов летучей мыши в Туркестане. Эти
авторы наблюдали все формы паразитов, обнаружен-
ные Диониси, и дали описания ряда новых стадий их
развития.
Паразиты были обнаружены внутри эритроцитов
и внеэритроцитарно, в плазме крови. Паразиты, распо-
лагающиеся внеклеточно, в плазме крови, были вытя-
нутой, грушевидной, округлой, треугольной или сер-
повидной формы. В эритроцитах встречались парази-
ты серповидной, круглой, амебоидной, грушевидной,
полулунной и неправильной формы. Размеры парази-
тов серповидной формы широко варьировали: мел-
кие — 2.13—2.48 X 0.47—1.6 мкм, средние — 4.26 X
0.35— 1.7 мкм, крупные занимали 1/2—2/3 диаметра
эритроцита. Размеры паразитов круглой формы коле-
бались от 1.42 до 2.84 мкм, величина крупных парази-
тов грушевидной (одиночной) формы варьировала в
пределах 2.13—5.68 X 1.42—2.48 мкм. Паразиты гру-
шевидной (парной) формы были удивительно похожи
на таковые Babesia bigemina; их размеры в длину до-
стигали 1/3—2/3, в ширину 1/5—1/3 диаметра эритро-
цита. Некоторые стадии напоминали по форме Theile-
ria equi.
Полиморфизм стадий, развивающихся в позвоноч-
ном хозяине, невольно наводит на мысль о смешанной
инвазии.
Род Elleipsisoma Franca, 1912
Паразитируют в эритроцитах, эллипсоидальной
и овальной формы, ядра крупные, расположены ближе
к периферии клетки хозяина. Размножение осуществ-
ляется бинарным делением и шизогонией в капил-
лярах легких. Зараженные эритроциты деформиру-
ются.
Типовойвид Elleipsisoma thomsoni Franca, 1912.
Elleipsisoma thomsoni Franca, 1912.
Распространение: Европа.
Хозяева позвоночные: Talpa caeca, T. euro-
paea (Mammalia). Впервые этого паразита наблюдал
Томсон (Thomson, 1906) у кротов в Англии, последую-
щее изучение провел Франса (Franca, 1911) в Порту-
галии.
Развитие в позвоночном хозяине. Парази-
ты обнаруживаются в эритроцитах и внеэритроцитар-
но, в плазме крови. Крупные формы достигают 8 мкм в
диаметре. Большинство паразитов овальной формы,
размеры варьируют от 6 до 7.5 мкм в длину и от 4.5 до
6 мкм в ширину. Размножение осуществляется бинар-
ным и множественным делением. Множественное
деление паразитов никогда не наблюдается в перифе-
рической крови, а происходит в капиллярах легких.
Спорадически у паразитов наблюдаются гранулы чер-
ного пигмента (Franca, 1911, 1912). Этот факт позволя-
ет усомниться в справедливости решения Франса
поместить род Elleipsisoma в отряд Piroplasmida. Ульт-
раструктура отличается от таковой представителей
рода Babesia — есть коноид, предлагается сохранить
родовое название (Mohamed, Molyneux, 1984). Не-
достаточная изученность части жизненного цикла,
протекающей в позвоночном хозяине, и полное отсут-
ствие сведений о переносе паразитов делают пока не-
возможным правильное определение места этих орга-
низмов в системе.
Род Entopolypoides Mayer, 1933
Для представителей рода характерны эритроцитар-
ные стадии, образующие цитоплазматические вырос-
ты, похожие на щупальца полипов.
Рис. 219. Стадии Entopolypoides macaci, развивающиеся в эритро-
цитах. (По: Mayer, 1934, фрагмент рисунка, ув. 6 раз).
Fig. 219. Entopolypoides macaci developing in the erythrocytes.
ТИП SPOROZOA. ЛИТЕРАТУРА
369
Т и и о и о ii ни & Entopolypoides macaci Mayer, 1933.
Entopolypoides macaci Mayer, 1933 (рис. 219).
Рис и рос гранение: Африка, Индия, Филип-
пины,
Хоти сна позвоночные: Cercopithecus pygeri-
tus, Miwaca bus (Mammalia).
Pa i нит не в позвоночном хозяине. Ранние
стадии ри ши гия паразита мелкие, круглой формы, поз-
же появляются амебоидные стадии и стадии с цито-
плазматическими выростами, похожими на щупальца
полипов (рис. 219). Кровью, полученной от больных
животных, удалось заразить обезьян рода Масаса; ана-
логичные опыты по заражению кролика, мышей, крыс
и морских свинок были безуспешны.
Развитие в беспозвоночном хозяине не
изучено, В экспериментах по трансмиссии инвазии
членистоногими (Anopheles maculipennis, Rhipicepha-
lus sp.) получены негативные результаты (Mayer, 1933,
1934).
Замечание. Одни исследователи считают род са-
мостоятельным (Levine, 1971), другие — сводят его в
синоним рода Babesia (Ноаге, 1981).
Организмы, ошибочно
отнесенные к Protozoa
В истории изучения пироплазм известно несколько
случаев, когда исследователи ошибочно принимали
риккетсиоподобные организмы и конгломераты ви-
русных частиц, размножающихся в эритроцитах, за
простейших и описывали их как самостоятельные
виды. Для некоторых из них были созданы новые роды
и даже семейства. Диагностические ошибки стали оче-
видными при изучении этих организмов в электрон-
ном микроскопе. Структурная организация Aegyptinel-
la, Anaplasma, Immanoplasma и Pirhemocyton оказалась
отличной от Eucaryota, что явилось причиной исклю-
чения этих организмов из Protozoa.
SUBCLASS PIROPLASMIA LEVINE, 1961 - PIROPLASMS
SUMMARY
Piroplasms are protozoans with a hotoroxcnlc life cycle parasitizing in
vertebrates and in ticks of the sunerliunlly Ixodoitlcn. In the organism of
vertebrate hosts piroplasms develop in erythrocytes and lymphocytes, in
the organism of invertebrate hosts In hemolymph, hemocytes, cells of
intestine wall, egg cells and other cells. In vector ticks piroplasms may be
transmitted from one developmental phase to another and circulate transo-
varially from generation to generation. Stages of piroplasms invading ver-
tebrate hosts mature in salivary glands of ticks. Piroplasms arc transmitted
to vertebrate hosts by the sticKing process of ixodid ticks.
Piroplasmids have worldwide distribution. Particularly rich fauna
of piroplasmids is found in countries with hot climate: in Africa, South
and Central America, southern Europe, Australia and Asia.
Practical importance of piroplasms is determined by their ability to
cause serious diseases of animals. The findings of piroplasms in human
organism attach even greater importance to the problem.
Piroplasms belong to transmissive natural focal diseases and
this complicates essentially development of efficient measures of their
control.
ЛИТЕРАТУРА
Абрамов И. В. Особенности пирониптмотп и иуттплиозл лоша-
дей различных ion (’ССР: Аптороф, дне.... докт. М., Пет. акад.,
1962. 34 с.
Белицер А. II, Материалы к niy'iciiiiio малярии (пироплазмоза
лошадей) и России Я Армий иет. внук. 1906, С, 847 874.
Белицер A. II, Исследоняине iiHpoiuiniMoiu лошадей и
1908году и РитапикоИ губернии// Архип пег. наук. 1909.
С.1179 1184,
Догель II, А. Куре общей itapirmroiioruu. Л„ 1947.
ДрачипскнН С, И. К понросу о мсроприитних при кровавой
моче крупного рогатого икота И Тр. I Пссрос. ист. съезда, С.-П.
1903. Т. 2. С. 296 31(1,
Крылов М. II. Исследопаиип но m.iiiciiciiiiio локализации Pi-
roplasma bigcinlniim и нотионочном хо шине И Изв. АН ТаджССР.
1962.Т. 1,№8. (’. 75 HI,
Крылов М. II, Некоторые данные но циклу развития Piroplas-
ma bigeminum в позвоночном хо нише // Тр. 5-й конф, по природно-
очаговым болезням, Фруип', 1964п. Ими. 4. С. 160—161.
(Крылов М. В.) Krylov М. V. I ixoerylhrocytal development sta-
ge of Piroplasma bigeminum# Aeta protozool. 19646. Vol. 2, fasc. 8.
P. 98-102.
Крылов M. В. Пироплпзмиды. JI.. 1981.
Марков А. А., Абримоп И. В. И тоги 20-лстних наблюдений
повторных циклов развития Hnbcsiu ovis в 44 поколениях Rhipicep-
halus bursa// Тр. Всесоюзн. иит-та зкенерим. вет. 1970. Т. 38.
С. 5 —14.
Марцииовский Е. М., Белицер А. В. О развитии пироплазм в
теле клеща // Вет. жизнь. 1907. № 46. С. 696—697.
Марцииовский Е. М., Белицер А. В. О развитии пироплазм
лошади в теле клеща// Вести, обществ, вет. 1908. №10.
С. 444—445.
Петров В. Г. Развитие Babesia bovis в клещах Ixodes rici-
nus L. II Сов. ветеринария. 1938. № 3. С. 51—52.
Пет ров В. Г. К вопросу о развитии Babesiella bovis в организ-
ме клеща Ixodes ricinus// Тр. Ленингр. пироплазм, ст. 1939. № 1.
С. 58 65.
Рабинович С. А., Воронина 3. К., Степанова Н. И., Маруш-
вили Г. М., Бакрадзе Т. Л., Одишария М. С., Гвасалия Н. И.
Первое обнаружение бабезиоза человека в СССР и краткий ана-
лиз описанных в литературе// Мед. паразитол. 1978. X» 3. С. 97—
107.
Райков И. Б. Ядро простейших. Л., 1978.
Трофимов И. Т. Патологическая анатомия и патогенез нут-
талиоза лошадей // Уч. зап. Казан, вет. ин-та. 1952. Т. 58. С. 45—
96.
Щуренкова А. И. Sogdianella moshkovskii gen. nov. sp. nov. —
представитель подотряда Piroplasmidea у хищной птицы Gypaetus
barbatus L. // Мед. паразитол. и паразит, болезни. 1938. Т. 7, № 6.
С. 932—937.
(Якимов В. Л., Белавин В. С.) Jakimoff W. L., Belavin W. S.
Espece nouvelle du Babesiella en Russie// J. Trop. Med. 1926. T. 8.
P. 51.
(Якимов В. Л., Коль-Якимова Н., Корсак Д. В.) Jaki-
moff W.L., Kohl-Jakimoff N., Korsak D. W. Hamatoparasitologi-
sche Notizen. IV. Piroplasmore der Feldmausen // СЫ. Bakteriol.
I. Orig. 1910. Bd 55. S. 370—373.
(Якимов В. Л., Шохор В. И., Козелкин П. М.) Jaki-
moff W. L., Schokhar W. I., Koselkine P. M. Maladies animals du
Turkestan russe a parasites endoglobulaires. A. Piroplasmoses. II. Pi-
roplasmose des chevaux. C. Nuttallioses. I. Nuttalliose des chevaux //
Bull. Soc. Pathol. Exot. 1907. T. 10. P. 302—311.
24 Зак. № 4163
370
ALVEOLATA
Aikawa M., Sterling C. R. Intracellular parasitic protozoa. N. Y.,
1974.
Allosopp M. T. E. P., Cavalier-Smith T., De Waal D. T., Allo-
sopp B. A. Phylogeny and evolution of the piroplasms // Parasitol.
1994. Vol. 108, N 2. P. 147 - 152.
Babes V. Sur I’hcmoglobinurie bacterienne du Boeuf// Comp.
Rend. Acad. Sci. Paris. 1888. T. 107. P. 692—694.
Babes V. Die Aetiogie der seuchenhaften Hamoglobinurie des Bin-
ders // Arch. Pathol. Anat. 1889. Bd 115, N 1. S. 81—108.
Babes V. L’ctiologie d’une enzootie des moutons, denommee
«Carceag» en Roumanie // Comp. Rend. Acad. Sci. Paris. 1892. T. 115.
P. 359—361.
Barnett S. F., Brocklesby D. W., Vidler В. O. Studies on macro-
schizonts ofTheileriaparva //Res. Vet. Sci. 1961. Vol. 2, N 1. P. 11—18.
Bettencourt A., Franca C., Borges J. Un cas de piroplasmose ba-
cilliforme chez le daim// Arch. R. Inst. Bacteriol. 1907. T. 1.
P. 341—349.
Breed R. S., Murray E. G. D., Hitchens A. P. Bergey’s Manual
of Determinative Bacteriology. Baltimore, 1948.
Brumpt E., Lavier J. Sur un piroplasmide nouveau, parasite de
tortue, Tunetella emydis n. g. n. sp. // Ann. Parasitol. Hum. Comp. 1935.
T. 13. P. 544—550.
Buttner D. W. Die Feinstruktur der Merozoiten von Theileria par-
va// Z. Tropenmed. Parasitol. 1967a. Bd 18. S. 224—244.
Buttner D. W. Elektronmikroscopische Studien der Vermehrung
von Theileria parva im Rind// Z. Tropenmed. Parasitol. 1967b. Bd 18.
S. 245—268.
Cerruti C. G. Recherche sui ciclo Schizogonico di Babesiella per-
roncitoi (Cerruti, 1939)//Vet. Ital. 1962. T. 13. P. 1149—1162.
Christophers S. R. Preliminary note on the development of the Pi-
roplasma canis in the tick// Brit. Med. J. 1907a. Vol. 1. P. 76—78.
Christophers S. R. Piroplasma canis and itr live cycle in the tick //
Sci. mem. Off. Meat and San. Dep. Gov. India. 1907b. Vol. 29, N 5.
P. 1—83.
Cowdry E. V., Ham A. W. Studie an east coast fever. I. The live
cycle of the parasite in tick // Parasitol. 1932. Vol. 24. P. 1—49.
Deply L. P. Description de formes schizogoniques de Babesia bi-
gemina. Comparaison avec des formes identiques, decrites par
E. Dschunkowsky, 1937, sous le nom Luhsia bovis n. sp. // Ann. Parasi-
tol. Hum. Comp. 1946. T. 21. P. 225—234.
Dennis E. The life-cycle of Babesia bigemina (Smith and Kibome)
of Texas cattlefever in the tick Margaropus annulatus (Say), with notes
on the embryology of Margaropus // Univ. Calif. Publ. Zool. 1932.
Vol. 36. P. 263—298.
Dionisi A. Les parasites endoglobulaires des chauves-Souris //
Arch. Ital. Biol. 1899. Vol. 31. P. 153—156.
Dschunkowsky E., Luhs J. Die Peropolasmosen der Rinder // Cbl.
Bakteriol. I. Orig. 1904. Bd 35. S. 486—492.
Dschunkowsky E., Urodschevich V. Theileriasis in goats sheep
and cattle, with a discription of Theileria hirci n. sp. from Serbia // Para-
sitol. 1924. Vol. 16. P. 107—110.
Du Toit P. J. Zur Systematik der Piroplasmen // Arch. Protistenk.
1918. Bd39. S. 84—104.
Du Toit P. J. Un nouveau Piroplasme, Sauroplasma thomasi n. g.
n. sp. d’un Lezard// Ondestepoort J. Vet. Res. 1937. Vol. 9.
P. 289—299.
Enigk K., Friedhoff K. Zur Wirtsspezifitat von Babesia divergens
(Piroplasmidea) // Z. Parasitenk. 1962. Bd 21, N 4. S. 238—256.
Fitzpatrick J. E. P., Kennedy С. C., Me Geon M. G., Orepou-
los D. G., Robertson J. H., Soyannwo M. A. O. Human case of piro-
plasmosis (babesiosis)//Nature. 1968. Vol. 217, N 5131. P. 861—862.
Franca C. Sur la classification des Piroplasmes et description de
deux formes de ces parasites // Arch. R. Inst. Bacteriol. 1910. T. 3.
P. 10—18.
Franca C. Note sur les hematozoaires de la Guinee Portugaise //
Arch. R. Inst. Bacteriol. 1911. T. 3. P. 229.
Franca C. Sur la Hematozoaires et description de deux formes de
ces parasites// Arch. R. Inst. Bacteriol. 1912. T. 3. P. 10—18.
Garnham P. С. C. A new Piroplasma from the rock hyrax // J. Pa-
rasitol. 1951. Vol. 37. P. 528—532.
Garnham P. С. C., Bird R. G., Baker J. R., Bray R. S. Electron
microscope studies of motile stages of maleria parasites. II. The fine
structure of the sporozoite of Laverania (Plasmodium) falcipara //
Trans. R. Soc. Trop. Med. Hyg. 1961. Vol. 55. P. 98—102.
Garnham P. С. C., Bray R. S. The susceptibility of the higher pri-
mates to piroplasms // J. Parasitol. 1959. Vol. 6, N 4. P. 352—355.
Garnham P. С. C., Donnely J., Hoogstraal H., Kennedy С. C.,
Walton G. A. Human babesiosis in Ireland; Further observation and the
medical significance of this infection// Brit. Med. J. 1969. Vol. 4,
N 5686. P. 768—770.
Gustafson P. V., Agar H. D., Cramer D. J. An electron micro-
scope study of Toxoplasma// Amer. J. Trop. Med. Hyg. 1954. Vol. 3.
P. 1008—1021.
Healy G. R., Speilman A., Gleason N. Human babesiosis reservo-
ir of infection on Nantucket Island II Science. 1976. Vol. 192, N 4238.
P. 479—480.
Henry H. On the hematozoa of British sea-fish // J. Pathol. Bacteri-
ol. 1910. Vol. 14. P. 463—465.
Ноаге C. A. On the status of Entopolypoides (Piroplasma) // Para-
sitol. Top. 1981. P. 112—116.
Hoyte H. M. D. Initial development of infection with Babesia bige-
mina// J. Protozool. 1961. Vol. 8. P. 462—467.
Hulliger L. Cultivation of three species of Theileria in lymphoid
cell in vitro II J. Protozool. 1965. Vol. 12. P. 649—655.
Hulliger L., Wilde J. К. H., Brown C. G. D., Turner L. Mode of
multiplication of Theileria in cultures of bovine lymphocitic cells // Na-
ture (London). 1964. T. 203. P. 728—730.
Jarrett W. F. H., Brocklesby D. W. A. Preliminary electron mic-
roscopic study of East Coast Fever (Theileria parva infection) // J. Pro-
tozool. 1966. Vol. 13, N 2. P. 301—310.
Kinoshita K. Untersuchungen uber Babesia camis (Piana und Yal-
li-Valerio) // Arch. Protistenk. 1907. Bd 8. S. 294—320.
Knuth P., Toit P. J. Die Piroplasmose des Schweines. Die durch
Piroplasma trautmanni (nov. spec.) verursachte Piroplasmose // Hand-
buch der Tropenkrankheiten. Zweite Auflage «Tropenkrankheiten der
Haustiere». Leipzig, 1921. Bd 6. S. 294—320.
Koch R. Beitrage zur Entwicklungsgeschichte der Piroplasmen //
Z. hyg. Infectionskr. 1906. Bd 54. S. 1—9.
Landau J., Boulard J., Houin R. Anthemosoma garnhami n. g.
n. sp. premier Dactylosomidae connu chez un mammifere И C. R. Acad.
Sci. 1969. T. 5. P. 873—875.
Laveran A. Contribution a 1’etude du Piroplasma equi // Comp.
Rend. Soc. Biol. 1901. T. 53. P. 385—388.
Levine N. D. Problems in the systematics of the «Sporozoa» //
J. Protozool. 1961. Vol. 8. P. 442—451.
Levine N. D. Taxonomy of the piroplasms // Trans. Amer. Micro-
scop. 1971. Vol. 90, N 1. P. 2—33.
Levine N. D. Anthemosomatidae fam.n. (Protozoa: Apicomple-
xa) // J. Parasitol. 1981. Vol. 67, N 3. P. 440—441.
Levine N. D. Some corrections of coccidian (Apicomplexa: Proto-
zoa) nomenclature // J. Parasitol. 1981. Vol. 66. P. 830—834.
Mac Fadyean J., Stockman S. A new species of piroplasm found
in the blood of British cattle // J. Comp. Pathol. Therap. 1911. Vol. 24.
P. 340—354.
Malmquist W. A., Brown C. G. D. Establishment of Yheileria
parva — infected lymphoblastoid cell lines using homologous feeder
layers // Res. Vet. Sci. 1974. Vol. 16. P. 134—135.
Mayer M. Uber eincn ncuen Blutparasiten des Affen (Entopo-
lypoides macaci n. g. n. sp.) // Arch. Schiffs. Tropenhyg. 1933. Bd 37,
NILS. 304—505.
Mayer M. Ein neucr, eigenartiger Blutparasit des Affen (Entopoly-
poides macaci n. g. n. sp.)// Cbl. Bakteriol. I. Orig. 1934. Bdl31.
S. 132—136.
Mehlhorn H., Schein E. Elektronenmikroskopische Untersuchun-
gen an Entwicklungsstadicn von Theileria parva (Theiler, 1904) im
Darm der Ubertragerzecke Hyalomma anatolicum excavatum (Koch,
1844) // Tropenmed. Parasitol. 1976. Bd 27, N 25. S. 182—191.
Mehlhorn H., Schein E. Electron microscopic studies of the life
cycle of Theileria annulata and T. parva // The Fifth Intern. Congr. Pro-
tozool. New York, 1977a. P. 22.
Mehlhorn H., Schein E. Electron microscopic studies of the de-
velopment of kinetes in Theleria annulata Dschunkowsky et Luhs,
1904 (Sporozoa, Piroplasmea)// J. Protozool. 1977b. N 2. P. 249—
257.
Mehlhorn H., Schein E. The Piroplasms: «Л long Story in short»
or Robert Koch has Seenit/ Europ. J. Protistol. 1993. Vol. 29.
P. 279—293.
Mehlhorn H., Schein E., Warnecke M. Electron microscopic stu-
dies of the development of kinetes of Theleria parva Theiler, 1904 in the
vector Rhipicephalus appendiculatus Neumann, 1901 // Acta Tropica.
1978. Vol. 35. P. 123—136.
Mehlhorn H., Weber G., Schein E., Buschener G. Elektronen-
mikroskopische Untersuchung an Entwicklungsstadicn von Theileria
annulata (Dschunkowsky et Luhs, 1904) im Darm und in der Hamolym-
phe von Hyalomma anatolicum excavatum (Koch, 1844)// Z. Parasi-
tenk. 1975. Bd48. S. 137—140.
ТИП CILIOPHORA. ОБЩАЯ ЧАСТЬ
371
Mesnil F. (Ист названия) И Bull. Inst. Pasteur. Paris, 1919. T. 17.
P. 193 -194.
Mohamed Hassan A., Molyneux D. H. Elleipsisoma Thomson!
Franca 1912 an Apicomplexa parasite in the red blood cells of the mole
(Talpa curopaea) // Parasitol. 1984. Vol.89, N 3. P. 407—415.
Moltinann U. G., Mehlhorn H., Schein E., Rehbein G., Vo-
igt W. I’., Zweygarth E. Fine structure of Babesia equi Laveran, 1901
within lymphocytes and erythrocytes of horses, an in vitro and in vivo
Nllldy // .1. Parasitol. 1983. Vol. 69, N 1. P. 111—120.
Neitz. W. O. Classification, transmission and biology of piroplasms
of domestic animals // Ann. N. Y. Acad. Sci. 1956. Vol. 64, N 2.
I'. 57 -111.
Neitz W. O., Jansen B. A discussion on the classification of the
Theileriidae// J. Vet. Res. 1956. Vol. 27. P. 7—18. Onderstepoort.
Nuttall G. H. F., Strickland C. Die Parasiten der Pferdepiroplas-
mose resp. der «Biliary Fever» // Cbl. Bakteriol. I. Orig. 1910. Bd 56.
S. 524—525.
Osorno В. M., Vega C., Ristic M., Robles C., Ibarra S. Isolation
of Babebsia spp. from asymptomatic human beings // Vet. Parasitol.
1976. Vol. 2, Nl.P. Ill—120.
Patton W. S. The name of the southern or splenic cattlefever para-
site // Amer. Naturalist. 1895. Vol. 29. P. 498.
Piana G. P., Galli-Valerio B. Su di un infezione del cane con pa-
rassiti endoglobulari nel sangue // Mod. Zooiatro. 1895. T. 6.
P. 163—169.
Pienaar V. Haematology of some south African Reptiles. Johan-
nesburg, 1962.
Poche F. Das System der Protozoa // Arch. Protistenk. 1913. Bd 30.
S. 125—321.
Potgieter F. T., Els H. J. Light and electron microscopic observa-
tions on the development of Babesia bigemina in larvae nymphae and
non-replete famales of Boophilus decoloratus// J. Vet. Res. 1977.
Vol. 44, N 4. P. 213—231. Onderstepoort.
Rao J. R., Mishra A. K., Sharma N. N., Kalicharan Pra-
sad M. C. Biochemical studies on sera of camels (Camelus dromedari-
es) naturally infected with Theileria dromedary n.sp. // Riv. Parasitol.
1988. Vol. 49, N 1.P.63...66.
Rcgendanz. I’., Reichenow E. Die Entwicklung von Babesia canis
in Dcnnaccntor reticulates // Arch. Protistenk. 1933. Bd 79, N 1. P. 50—71.
Riek R. F. The life cycle of Babesia bigemina (Smith, Kilbome,
1893) in the tick vector Boophilus microplus (Canestrini)// Austral.
J. Agr. Res. 1964. Vol. 15, N 5. P. 802—821.
Riek R. F. The life cycle of Babesia argentina (Lignieres, 1903) in
the tick vector Boophilus microplus (Canestrini) // Austral. J. Agr. Res.
1966. Vol. 17. P. 247—254.
Riek R. F. Babesiosis // Infect. Blood diseases of man and animals.
New York, 1968. Vol. 2. P. 219—268.
Ristic M., Conroy J. D., Siwe S., Helay G. R., Smith A. R., Hu-
xoll D. L. Babesia species isolated from a woman with clinical babesio-
sis // Amer. J. Trop. Med. Hyg. 1971. Vol. 20, Nl.P. 14—22.
Rudzinska M. A. Ultrastructure of intraerythrocytic Babesia mic-
roti with emphasis on the feeding mechanism // J. Protozool. 1976.
Vol. 23, N 2. P. 224—233.
Schein E. On the cycle of Theileria annulata (Dschunkowsky et
Luhs, 1904) in the midgut and hemolymph of Hyalomma anatolicum
excavatum (Koch, 1844)// Z. Parasitenk. 1975. Bd 47, N 2.
S. 165 167.
Schein E., Buscher G., Friedhoff K. Lichtmikroskopische Unter-
Miluhungcn fiber die Entwicklung von Theileria annulata (Dschunkows-
ky et Luhs, 1904) in Hyalomma anatolicum excavatum (Koch, 1844)//
Z, PuiUHilcnk. 1975. Bd48, N2. S. 123—136.
Schein IC„ Friedhoff K. Lichtmikroskopisshe Untersuchungen
liber die I<nEvlcklung von Theileria annulata (Dschunkowsky und Luhs,
1904) in Hyalomma anatolicum excavatum (Koch, 1844) // Z. Parasi-
tenk. 1978. Bd 56. S. 287—303.
Schein E., Mehlhorn H., Warnecke M. Elektron microscopic stu-
dies on the schizogony of four Theileria species of cattle (T. parva,
T. lawrencei, T. annulata and T. mutans) // Protistologica. 1978. T. 14.
P. 337—348.
Schein E., Rehbein G., Voigt W. P., Zweygarth E. Babesia equi
(Laveran, 1901).I. Development in horses in lymphocyte culture // Pro-
penmed. Parasitol. 1981. Bd 32, N 4. S. 223—227.
Schein E., Warnecke M., Kirmse P. The development of Theile-
ria parva (Theiler, 1904) in the gut of Rhipicephalus appendiculatus //
Parasitol. 1977. Vol. 75. P. 309—316.
Scholtyseck E. Fine structure of Parasitic Protozoa. An Atlas of
Micrographs, Drawingsand Diagrams. Berlin; Heidelberg; New York,
1979.
Senaud J. Contribution a 1’etude des sarcosporidies et des toxo-
plasmes (Toxoplasmea)// Protistologica. 1967. T. 3. P. 170—232.
Sergent E., Donatien A., Parrol L., Lestoquard F. Etude mor-
phologique du cycle evolutif de Theileria dispar chez le boeuf et chez la
tique // Ann. Inst. Pasteur. 1936. T. 37. P. 30—55.
Siddall M. E., Desser S. S., Measures L. N. Light and electron
microscopic examination of so-called piroplasms of fishes from Atlan-
tic Canada and systematic revision of the Haemohormiidae (insertae se-
dis) // J. Parasitol. 1994. Vol. 80, N 6. P. 1018—1025.
Skrabalo Z., Deanovic Z. Piroplasmosis in man. Report on a
Case // Docum. Med. Geogr. Trop. 1957. Vol. 9. P. 11—16.
Smith T., Kilbome F. L. Investigations into the nature, causation
and preventation of Texas or southern cattle fever// U. S. Dept. Agr.
Bur. Anim. Indus. Bull. 1893. N 1. 301 p.
Sohns J. C. F. Microbabesia divergens in Nederlandsch-Indie //
Nederl.-Ind. Bl. Diergeneesk., Diemt. 1918. C. 385—459.
Starcovici C. Bemerkungen uber durch Babes entdeckten Blutpa-
rasiten und die durch denselben hervorgebrachten Krankheiten, die se-
uchenhafte Hamoglobinurie des Rindes (Babes), das Texasfiever (Th.
Smith) und der Carceag der Schafe (Babes)// Cbl. Bakteriol. I. Orig.
1893. Bd 14. S. 1—8.
Theiler A. East coast fever// Trans. Afr. J. 1904. Vol. 2.
P. 421—438.
Thomson J. D. Blood parasites of the mole including a new form
of intracorpuscular parasite // J. Hyg. 1906. Vol. 6. P. 574.
Vivier E., Hennere E. Etude a 1’aide du microscope electronique
des trophozoites de la coccidian Coelotropha durchoni // J. Microscop.
1964. T. 3. P. 57—58.
Vivier E., Petitprez A. Observations ultrastructurales sur I’hema-
tozoaire Anthemosoma garnhami et examen de criteres morphologiques
utilisables pour la taxonomie chez les sporozoaires // Protistologica.
1969. T. 5. P. 363—379.
Vivier E., Petitprez A. Etude du systeme vacuolaire de I’hemato-
zoaire Anthemosoma garnhami a 1’aide des coupes series et de reconst-
ritutions tradimensionnelles // J. Ultrastr. Res. 1972. T. 41.
P. 219—237.
Vivier E., Petitprez A., Ponchel G. Multiplication nucleaire et
schizogonie chez Anthemosoma (Piroplasma) etude de coupes series a
1’aide de la microscopic electronique// Protistologica. 1974. T. 10.
P. 113—123.
Wandolleck B. Pyrosoma bigeminum// Cbl. Bakteriol. I. Orig.
1895. Bd 17. S. 554—556.
Weber G., Friedhoff K. Ultrastructure of proposed sexual stages
(koch’s strahlenkorper) of Babesia bigemina (Apicomplexa: Piroplas-
mea) in tick gut// The fifth Intern. Congr. Protozool. NewYork, 1977.
P. 147.
Wenyon С. M. Protozoology. London, 1965 (faesmile of 1926 edi-
tion).
Тип CILIOPHORA Doflein, 1901 — ИНФУЗОРИИ
Общая часть
Инфузории — ресничные простейшие, число сво-
бодноживущих видов которых в современной фауне
достигает, по разным оценкам, от 3 до 30 тыс. (Finlay et
al., 1996; Finlay, Fenchel, 1999; Foissner, 1999) и, как
правило, принимается равным 8—9 тыс. видов (Cor-
liss, 1979; Lynn, Corliss, 1991; Lynn, Small, 2000). Число
эндокомменсалов и паразитов среди представителей
типа Ciliophora обычно считается значительно мень-
шим (около 30 % от общего числа), хотя, как и общее
количество, оно не определено более или менее точно
(Finley et al., 1996; Foissner, 2001). Несмотря на значи-
тельный полиморфизм представителей типа, инфузо-
372
ALVEOLATA
рии — одна из наиболее гомогенных групп в царстве
Protista (Lynn, Corliss, 1991). Это преимущественно
гетеротрофные формы, принадлежность которых к
инфузориям определяется несколькими достаточно
четкими признаками: наличием ядер двух типов —
макро- и микронуклеусов (ядерный дуализм или гете-
роморфизм); присутствием на протяжении всего жиз-
ненного цикла или хотя бы на некоторых его стадиях
поверхностно расположенных ресничек, образован-
ных типичным набором микротрубочек (9+2) и связан-
ных с базальными телами (кинетосомами); значитель-
ным развитием и специализацией поверхностного слоя
клетки (кортекса), существенная составляющая кото-
рого — инфрацилиатура — система, образованная
единичными, парными или множественными кинето-
сомами и их микротубулярными и микрофиламентоз-
ными дериватами; прохождением полового процесса в
виде конъюгации, в ходе которой партнеры, как прави-
ло, временно объединяются и обмениваются гаметиче-
скими ядрами; присутствием у большинства предста-
вителей под поверхностью клетки специальных корти-
кальных пузырьков (альвеол), окруженных унитарной
мембраной и подстилающих клеточную плазмалемму.
Инфузории — преимущественно свободноплаваю-
щие, всесветно распространенные одиночные простей-
шие, хотя встречаются виды-эндемики и разнообраз-
ные прикрепленные и колониальные формы. Коммен-
сальные (экто- и эндо-) и паразитические виды могут
заселять различные компартменты тела многочислен-
ных беспозвоночных и позвоночных животных, а так-
же некоторых простейших.
Размер клетки инфузорий существенно варьирует,
и среди представителей типа встречаются как действи-
тельно микроскопические клетки с линейными размера-
ми, не превышающими 10 мкм (некоторые Colpodea и
Oligohytnenophorea), так и хорошо видимые простым
глазом «гигантские» Spirostomum ambiguum и Bursaria
truncatella, достигающие длины 3—4.5 мм. Соответст-
венно клеточный объем инфузорий может колебаться от
102—103 мкм3 yNivaliella и Cyclidium до 108— 109 мкм3 у
Bursaria и трофонтов Ichthyophthirius (Lynn, Corliss,
1991). Столь же сильно варьирует и форма тела инфу-
зорий: если наиболее часто это простейшие сфериче-
ские или вытянуто-овальные с разными модификация-
ми, то среди обитателей псаммона, например, можйо
встретить и дорсовентрально сплющенных червеобраз-
ных Karyorelictea, а в сапропеле — спирально скрученных
представителей Armophorea и листообразных Loxodes.
Представители типа Ciliophora занимают самые
разнообразные экологические ниши и, как уже было
сказано, могут становиться экто- и эндокомменсалами
и паразитами других одно- и многоклеточных живот-
ных. В свою очередь многие Ciliophora служат хозяе-
вами для бактериальных экто- и эндобионтов, грибов,
водорослей и других простейших. Свободноживущие
формы встречаются повсеместно: в любых пресных,
солоноватых и полносоленых морских водах как по-
стоянного, так и временного характера. Пруды, реки,
озера (в том числе соленые и гиперсоленые), моря, бо-
лота, лужи и заплески, песок, почва, лесная подстилка,
листья и кора деревьев, тающий лед — вот далеко не
полный перечень экологических ниш, занимаемых ин-
фузориями. Очевидно, что распространение и число
инфузорий, в целом, ограничивается (помимо присут-
ствия некоторого количества воды) только температу-
рой, которая должна быть выше точки замерзания, и
присутствием пищи.
Подавляющее большинство инфузорий — гетеро-
трофы, хотя некоторые могут постоянно поддержи-
вать в качестве симбионтов зеленые водоросли или
хлоропласты, принадлежавшие съеденным простей-
шим, и получать необходимое питание за счет этих фо-
тосинтетиков. В отношении питания представители
Ciliophora также демонстрируют значительное разно-
образие: среди них есть бактерио-, альго- и фунгиофа-
ги, растительноядные, хищники, гистофаги и канниба-
лы (редко), причем встречаются как полифаги так и
стено- и даже олигофаги. В то же время сами инфузо-
рии играют важную роль в пищевых цепях, служа до-
бычей для многих мелких водных беспозвоночных.
Обилие инфузорий как в планктоне, так и в бентосе
приводит к тому, что им принадлежит значительная
роль в круговороте азотистых соединений во всех ти-
пах водных (а часто и почвенных) экосистем (Laval-Pe-
uto et al., 1986; Fenchel, 1987; Anderson, 1988).
Многочисленными исследованиями было показа-
но, что инфузории могут служить индикатором качест-
ва воды и общего состояния водоемов, где они обита-
ют (Curds, 1966; Bick, 1972; Antipa, 1977; Foissner,
1988). Некоторые виды этих простейших с успехом ис-
пользуются в качестве объектов при биотестировании
(Инфузории в биотестировании, 1998).
Инфузории безусловно были в числе первых жи-
вых микроскопических организмов, обнаруженных и
описанных Левенгуком (Dobell, 1932; Woodruff, 1945).
С тех пор они прочно вошли в научный обиход, и по-
мимо многих тысяч исследований, посвященных раз-
личным представителям этой группы простейших, не-
которые инфузории стали излюбленными модельными
объектами для решения самых разнообразных вопро-
сов цитологии, молекулярной биологии, генетики,
биохимии и физиологии.
История изучения
Начало изучения мира Protista неразрывно связано
с изобретением и прогрессом микроскопической тех-
ники («мудрых стекол») в первой половине XVII в. Од-
нако даже при наличии микроскопов, которые привле-
кали сначала внимание лишь узкого круга физиков,
астрономов и философов (Соболь, 1949), должен был
появиться исследователь, которого заинтересовал бы
«невидимый мир живых существ». Прошло более пол
столетия, прежде чем такой человек явился в лице
дельфтского мануфактурщика и оптика-самоучки Ан-
тона ван Левенгука (1632—1723). Именно ему, не-
смотря на отсутствие какого-либо научного образова-
ния, принадлежат первые достоверные наблюдения
живых инфузорий среди множества других микроско-
пических объектов, описанных им в письмах к Лон-
донскому Королевскому Обществу, начиная с 1674 г.
(Dobell, 1932; Corliss, 1975, 2002). Левенгуку же при-
надлежит и первое изображение инфузории (очевидно,
Nyctotheroides) из кишки лягушки (1683 г.). Эти по-
разительные для того времени наблюдения были по-
ТИП CILIOPHORA. ОБЩАЯ ЧАСТЬ
373
лучены с помощью простых микроскопов (по сути
увеличительных луп) собственной конструкции, кото-
рые обладали, правда, значительным увеличением (до
300 раз). Вероятно, Левенгук, среди прочих техни-
ческих новаций, первым добился в своих микроскопах
и осветительного эффекта, напоминающего «темное
ноле»,
(.'удя по подробным описаниям исследователя, ви-
димо, он имел дело также с Carchesium, Chiliodonella,
Coleps, Colpidium, Cyclidium, Dileptus, Kerona, Parame-
cium, Vorticella и некоторыми другими широко распро-
страненными видами инфузорий (Corliss, 1975, 2002).
При этом Левенгук отмечал не только морфологиче-
ские детали наблюдаемых зверюшек («animalcules»),
но и измерял их, а также описал их размножение, со-
кратимость и, по-видимому, некоторые стадии конъю-
гации.
В это же время, правда, появилось еще несколь-
ко исследователей «невидимого мира». Например, в
1678 г. Христиан Гюйгенс (1629—1695) в письме к
брату описал нескольких инфузорий (Dobell, 1932).
Буонанни в 1691 г. впервые опубликовал изображение
инфузории (по-видимому, Colpidium). Кинг двумя го-
дами позднее изобразил нескольких простейших,
включая Euplotes (Corliss, 1991).
В середине следующего, XVIII в., безусловно, до-
минировали воззрения отца современной таксоно-
мии и биологической номенклатуры Карла Линнея
(1707—1778), который, будучи ботаником, мало инте-
ресовался водными «зверюшками» и не очень доверял
микроскопу. Только в 12-м издании его «Systema Natu-
rae» (1767) появилось 4 рода простейших, среди кото-
рых были персонифицированы Volvox и Vorticella. Все
остальные Protozoa оказались включенными в два дру-
гих рода с весьма красноречивыми названиями: Chaos
и Furia. «Таинственные живые молекулы, разобраться
в которых надлежит потомкам», — так охарактеризо-
вал инфузорий Линней (Соболь, 1949). Однако еще в
1703 г. анонимный автор опубликовал очевидное изоб-
ражение Paramecium (Woodruff, 1945; Wichterman,
1953). Эту же инфузорию исследовал Луи Жобло
(1645—1723), который в 1718 г. первым описал у ин-
фузорий ресничный покров, ядра и сократительные ва-
куоли. В 1752 г. Джон Хилл (1716—1775) в своей изве-
стной книге «История животных» дал «туфлеобраз-
НоП» инфузории существующее поныне название —
ннрпмецня. Ему же принадлежат, среди многих дру-
гих, Н1Г111ПННЯ Cyclidium и Enchelys. К сожалению, при-
оритет Хиллп не сохранен для истории, так как его
О1Н1ШН1ИИ были произведены за 6 лет до 1758 г., с янва-
ря которого, согласно Международному коду зоологи-
ческой номенклатуры, родовые названия признаются
валидными, Следует упомянуть, что Абраам Трамбле
(1710 1784), прославившийся изучением гидр, также
в 1744..1748 гг, исследовал деление у «воронкообраз-
ных полипов» инфузорий рода Stentor и описал раз-
множение Epistylis, Carchesium и Zoothamnium (Кана-
ев, 1972; Corliss, 1991).
Вообще за XVIII в. достаточно много исследова-
телей описывало и изображало в своих работах ин-
фузорий, как и ряд других мелких одноклеточных и
многоклеточных животных (жгутиконосцев, амеб, ко-
ловраток, личинок трематод), считавшихся тогда «на-
ливочными животными» (infusoria) (см. Куторга,
1839). С. С. Куторга (1805—1861) — один из первых
русских исследователей инфузорий писал: «это откры-
тие (инфузорий) привело в движение всех исследова-
телей, и всякий, кто имел микроскоп, спешил полюбо-
ваться неутомимым движением этого незримого
мира» (Куторга, 1839). Среди таких ученых были Бей-
кер, описавший в 1753 г. Lacrymaria, и Вризберг, кото-
рый впервые (1765) использовал термин «инфузории»
для простейших. В 1769 г. Эллис экспериментально
вызвал экструзию трихоцист у Paramecium, а Гванцати
впервые в 1796 г. описал цисты у инфузории, по-види-
мому принадлежавшей к роду Amphileptus (Corliss,
1991).
Несомненно, особого внимания заслуживает науч-
ная деятельность Отто Фридриха Мюллера (1730—
1784) — знаменитого датского зоолога и, очевидно,
первого систематика инфузорий. В его выдающихся
монографиях «Vermium terrestrium et fluviatilium seu
animaliun infusoriorum, helminthicorum et testaceorum»
(1773) и «Animalcula infusoria fluviatilia et marina»
(1786) приведено около 300 описаний видов различ-
ных протистов, а также бактерий и мелких многокле-
точных, значительная часть которых принадлежит к
морским и пресноводным инфузориям. Им были опи-
саны инфузории из морского песка, скутикоцилиати-
ды, гимностоматиды, тинтиниды, олиготрихи, суктории,
колониальная Ophrydinium, имеющая домик морская
Folliculina, а также приведены некоторые замечания
по их экологии и физиологии. Названные в соответст-
вии с биномиальной номенклатурной системой Лин-
нея, многие инфузории до сих пор сохраняют в своем
названии буквы О. F. М. Существенной заслугой Мюл-
лера была правильная интерпретация феномена конъ-
югации инфузорий как сексуального процесса. Потре-
бовалось, однако, почти 100 лет, чтобы протозоологи
наконец приняли эту точку зрения.
К концу XVIII в. относится и первая работа, выпол-
ненная в области протозоологии русским автором.
Зоолого-физиологическая диссертация М. М. Терехов-
ского (1740—1796) «О Chaos infusorium Линнея», на-
писанная в 1775 г., была защищена в Страсбургском
университете (Соболь, 1949). Ее автор путем длитель-
ных, последовательных экспериментов с различными
«инфузорными» настоями в 88 параграфах своей дис-
сертации доказал, что инфузории «как все животные
происходят путем размножения от предшествующих
родителей». Таким образом, Тереховский еще в 1775 г.
опроверг распространенную идею о самозарождении
инфузорий (основные работы, выполненные на эту
тему Спалланцани (1729—1799), появились в 1765 и
1776 гг.) и неопровержимо доказал их животную при-
роду — вопросы, волновавшие ученый мир и в первой
половине XIX в. «Пусть те, кому дано исследовать
природу глубже, определят, относятся ли эти водные
анималькули к червям или насекомым, или к другому
классу животных — писал в заключении к своей рабо-
те Тереховский, — пусть они также, следуя Хиллу и
Мюллеру, точнее определят их роды и виды» (Соболь,
1949). Этот завет был выполнен исследователями ин-
фузорий следующего, XIX в.
XIX в. принес небывалый рост интереса к Protista,
который реализовался прежде всего по двум направле-
374
ALVEOLATA
ниям. Продолжение описания новых видов протистов
и уточнение деталей их морфологии, очевидно, было
связано с расширением географии исследований и
дальнейшим совершенствованием микроскопической
техники: появление сложного объектива Шевалье,
микроскопа Листера и коррекционного окуляра Росса
(Карпов, 2001). Первые попытки классификации про-
стейших на основе характеристик их групп (направ-
ление, положившее начало систематики Protozoa) ока-
зались возможными лишь по достижении «крити-
ческой массы» видовых описаний и с началом их
сравнительного таксономического изучения (Corliss,
1991).
После О. Ф. Мюллера первым крупным исследова-
телем и систематиком инфузорий был, несомненно,
начавший свои работы в конце первой четверти XIX в.,
X. Г. Эренберг (1795—1876). После выпуска им фун-
даментальной монографии «Infusionsthierchen als Vol-
Ikommene Organismen» (Ehrenberg, 1838), в которой
были приведены описания около 350 видов инфузорий
(в тогдашнем понимании состава этой группы), снаб-
женные множеством прекрасных иллюстраций, и раз-
вита «полигастрическая» теория их организации,
Эренберг стал на десятилетие непререкаемым автори-
тетом в протозоологии. Собственно, как отдельная
дисциплина в пределах зоологии она появилась имен-
но благодаря его трудам. В то же время его теория ин-
фузорий как совершенных организмов (обладающих
всеми особенностями многоклеточных, но в мини-
атюре) безусловно послужила тормозом на пути разви-
тия учения о Protozoa — это название было введено в
науку Гольдфусом (1782—1848) в 1817 г. (Goldfuss,
1817). Созданная накануне опубликования (1838—
1839) основ классической клеточной теории Шванна
(1810—1882) и Шлейдена (1804—1881), теория Эрен-
берга отражала «житейский» взгляд на возможности
функционирования любого живого организма. Нали-
чие в составе тогдашних инфузорий церкарий и колов-
раток дало дополнительный повод искать сходной ор-
ганизации у собственно инфузорий, и, конечно, она
была обнаружена. Эренберг «открыл» у наливочных
животных пищеварительный тракт (включая зубы и
различные железы), мускулатуру, половые органы,
глаза и зачатки нервной системы.
Система инфузорий в начале XIX в. в основном
представляла собой разные модификации взглядов Ла-
марка (1744—1829) и Кювье (1773—1838), которые
сами не занимались инфузориями и использовали для
своих систем материал О. Ф. Мюллера. Так, Ламарк в
1815г. поместил инфузорий в два первых класса своей
системы (не имеющие никакой организации или сход-
ные с полипами). Кювье (1817) составил из инфузорий
отдельный класс, разделив его на два отряда: Rotiferes
(коловратки) и Infusoires homogenes (куда попали
все простейшие). В книге Швейгера, выпущенной в
1820 г., мюллеровские инфузории попали в класс зоо-
фитов, разбитый на два отряда: состоящие из «просто-
го вещества» (инфузории) и «разновещественные»
(полипы) (Куторга, 1839).
По Эренбергу, инфузории (Polygastrica) также долж-
ны были причисляться к зоофитам или лучистым, где
составляли два класса: бескишечных (амебы, жгутико-
носцы, диатомовые) и кишечных (собственно инфузо-
рии и некоторые солнечники). В пределах последней
группы он выделил 4 отдела, положив в их основу
лишь два признака: положение рта и порошицы (цито-
прокта), что привело к крайне искусственной системе.
Русский последователь Эренберга С. С. Куторга, со-
ставивший на основе трудов немецкого автора, с неко-
торыми собственными добавлениями, книгу «Естест-
венная история наливочных животных» (Куторга,
1839), тем не менее, поместил инфузорий в класс чле-
нистых животных. В пределах этого класса он полагал
их наиболее близкими с Entozoa (внутренностным или
глистам). Отдел наливочных был разделен Куторгой
на два отряда. К первому — дрожалкам (Vibratoria) —
были причислены бескишечные (амебы и жгутико-
носцы), а также кишечные (инфузории). Ко второму —
коловратки (Rotatoria). Этой же схемы придерживался
для инфузорий и другой российский ученый П. Ф. Го-
рянинов (1796—1865), который, однако, поместил
этих простейших в состав зоофитов (Горянинов, 1837).
При неправильной интерпретации строения инфу-
зорий рисунки Эренберга поражают своей точностью,
а его исследования географического распространения
наливочных животных в Северной Африке, Аравии,
Германии, Европейской и Азиатской России безуслов-
но надолго стали главным источником информации по
зоогеографии простейших. Таким образом, участвуя в
путешествии по России, предпринятом А. Гумбольтом
(1769—1859) в 1829 г., Эренберг стал первым исследо-
вателем инфузорий на бескрайних просторах нашего
Отечества (от Санкт-Петербурга до Барнаула).
Младшим современником Эренберга был Феликс
Дюжарден (1801—1860), который, помимо значитель-
ных достижений в исследовании амеб (он, собственно,
предложил термин Rhizopoda), занимался и инфузори-
ями и первым «восстал» против теории Эренберга (Du-
jardin, 1841). Однако его система деления инфузорий
на симметричных (Coleps) и асимметричных (все про-
чие простейшие) оказалась не менее искусственной
(Шевяков, 1896). С появлением деления животных на
многоклеточных и одноклеточных (Siebold, 1845) и
четкого определения понятия клетка (X. Моль, Ф. Лей-
диг и М. Шульце) теория Эренберга к 60-м гг. XIX в.
была «сдана в архив». Фактически к этому времени
одноклеточные уже были разделены на два класса:
Rhizopoda и Infusoria (Siebold, 1845), и позднее, говоря
об инфузориях, исследователи имели в виду именно
Ciliata — одноклеточных, снабженных мерцательны-
ми ресничками (Perty, 1852). Тогда же начал свои ис-
следования инфузорий Э. Бальбиани, которому мы
обязаны правильной оценкой феномена конъюгации у
этих простейших (1861).
Значительный шаг вперед в изучении инфузорий
был сделан в 50-е гг. XIX в. Клапаредом (1832—1871)
и Лахманом. Эти ученые на основании собственных
продолжительных и тщательных наблюдений издали
в 1858—1861 гг. двухтомный труд «Les Infusoires et les
Rhizopodes» (Claparede, Lachmann, 1858—1861), где
выделили Suctoria в отдельную группу, а остальных
Ciliata разбили на 10 семейств. Почти одновременно
(в 1859 г.) появилась в печати и система Ф. Штейна
(1818—1885), сыгравшая кардинальную роль в разви-
тии цилиатологии позапрошлого, а, отчасти, и про-
шлого (XX) вв.
ТИП CILIOPHORA. ОБЩАЯ ЧАСТЬ
375
Штейн положил в основу классификации реснич-
ный покров и на основании распределения ресничек по
телу инфузорий разбил всех Ciliata на 4 отряда: Holo-
tricha, l letcrotricha, Hypotricha и Peritricha. Flagellata и
Suctoria также получили в его системе ранг отряда.
Любопытно, что в одной из первых макросистем жи-
вых организмов Геккеля (1834—1919), где однокле-
точные были уже объединены в царство Protista (1866),
инфузории оказались включенными им на приведен-
ной схеме в группу Articulata (т. е. высокоорганизован-
ных многоклеточных!). Видимо, взгляды Эренберга,
от которых он не отказался до конца жизни, еще нахо-
дили себе сторонников.
Штейн, занимаясь исключительно инфузориями на
протяжении нескольких десятков лет, описал много
новых родов и видов, так что его система включала
уже 23 семейства и 107 родов. В результате тщатель-
ного изучения представителей гипотрих и гетеротрих
Штейном были выпущены две монографии, посвящен-
ные соответствующим отрядам (Stein, 1859, 1867), од-
нако его блестящая серия осталась незавершенной.
Дальнейшее развитие исследований инфузорий оказа-
лось связанным сразу с несколькими учеными: это
были О. Бючли (1848—1920) и Р. Гертвиг (1850—
1937) в Германии, Э. Мопа (1842—1916) во Франции и
В. Кент (1845—1908) в Англии. Все они родились в
одно десятилетие с 1842 по 1850 г. и во многом направ-
ление их работы совпадало, хотя след в науке они оста-
вили не одинаковый.
О. Бючли — «архитектор протозоологии», как его
назвал Добель (Dobell, 1951), и «гигант среди гиган-
тов», по определению Корлиса (Corliss, 1978), начал
изучать инфузорий с 1871 г. и, несмотря на то что он
был зоологом широкого профиля, конечно, больше
всего сделал именно в протозоологии. Надо сказать,
что, по-видимому, интересом к инфузориям и фунда-
ментальными знаниями в этой области Бючли был во
многом обязан самообразованию: почти 4 года (1871,
1873—1876) он работал самостоятельно в собственной
(частной) лаборатории в родном Франкфурте (Нови-
ков, 1922; Fokin, 2004b). Уже в 1876 г. Бючли публику-
ет работу, где впервые после домыслов Эренберга,
Дюжардена и Клапареда были правильно поняты и
оиисщспы события, происходящие с ядерным аппара-
том инфузорий при конъюгации. Помимо полового
П|ЮЦ0иои инфузорий Бючли исследовал физиологию и
морфогенез Ciliata, их жизненные циклы, цитологию.
Птшледнми область исследований привела ученого к
ПЦНЛИ1У итроонпя протоплазмы, при моделировании
которого Нючли применил, в том числе, и свои знания
Но КОЛЛОИДНОЙ II физической химии. Его теория яче-
истой структуры цитоплазмы, созданная в 90-х гг.
XIX и,, были широко риоирострапсна еще в первой чет-
псрги XX и, (I артмин, 1929),
Нельзя нс упомянуть, что школу Бючли как прото-
зоолога прошло немало молодых людей, в разное вре-
мя учившихся и рпбогппших и Гейдельберге, где Бюч-
ли был профессором зоологии 42 года. Среди них та-
кие известные немецкие и русские протистологи и
клеточные биологи, как Ф. Блохмапн, Р. Лаутерборн,
М. Гартманн, К. Гамбургер, В, Т, Шевяков, С. И. Ме-
тальников, Н. К. Кольцов, С. В. Аперснцсв и А. С. Ще-
потьев (Fokin, 2004b).
Вершиной творчества Бючли-протистолога было
написание трехтомного труда Protozoa (1880—1889),
где третий том (Biitschli, 1887—1889) был почти цели-
ком (953 стр.!) посвящен инфузориям. Там Бючли
предложил свою классификацию класса Ciliata. Класс
был разбит на два подкласса (Ciliata и Suctoria). Под-
класс ресничных подразделялся на два отряда сообраз-
но устройству рта и глотки (Gymnostomata и Trichoso-
toinata), и последний по наличию адорального ряда
ресничек был разделен на две группы в ранге подотря-
да: Aspirotricha и Spirotricha. Спиротрихи были в свою
очередь разделены на четыре группы (следуя системе
Штейна): Heterotricha, Oligotricha, Hypotricha и Peri-
tricha. Все Ciliata включали 25 семейств, содержащих
142 рода. На тот момент это была самая совершенная
система, в основе которой лежал комплекс признаков,
а отряды и семейства представляли собой достаточно
естественные группировки (Шевяков, 1896).
Э. Мопа не был профессиональным биологом, од-
нако след, оставленный им в цилиатологии, также
весьма значителен. В 80-е гг. XIX в. он опубликовал
серию замечательных работ, посвященных кариоло-
гии, половому процессу и размножению у инфузорий
(Maupas, 1883, 1886, 1888).
Р. Гертвиг был известен не только как протистолог,
но и как экспериментальный эмбриолог. Очевидно, от
своего учителя Э. Геккеля он унаследовал интерес к
простейшим, среди которых исследовал прежде всего
радиолярий, инфузорий и солнечников. В области ци-
лиатологии он заслуживает памяти как автор очень
глубокой работы, посвященной конъюгации инфузо-
рий (Hertwig, 1889). Так же как и Бючли, Гертвиг был
прекрасным педагогом, и среди его учеников было не-
мало видных протистологов.
В. С. Кент был разносторонним зоологом, и инфу-
зории являлись лишь одной из многих групп беспозво-
ночных и позвоночных животных, над которыми рабо-
тал этот английский ученый (Esteban et al., 2002). В ци-
лиатологии он оставил след прежде всего изданием
фундаментальной серии (3 тома) «А Manual of the Infu-
soria» (Kent, 1880—1882) и описанием значительного
числа видов среди перитрих и сукторий. Последние
были выделены Кентом в отдельную группу Tentaculi-
fera (Corliss, 1978).
Приблизительно в это же время исследования ин-
фузорий начались и в Новом Свете. Наиболее замет-
ной фигурой среди цилиатологов США был в конце
XIX в. А. С. Стокс. Он выпустил солидную сводку по
фауне инфузорий Соединенных Штатов, а также напи-
сал учебные пособия по изучению микроскопических
объектов (Stokes, 1888, 1894, 1896).
В России вторая половина XIX в. была ознаменова-
на появлением исследователя, вполне сравнимого по
широте взглядов и глубине мысли с лучшими пред-
ставителями Западноевропейской школы. Это был вы-
пускник Петербургского университета, а потом, к не-
счастью лишь недолгое время (1854—1861), и его про-
фессор, Л. С. Ценковский (1822—1887) — выдающийся
русский ученый (польского происхождения), один из
основателей отечественной протистологии и микроби-
ологии (Райков, 1959; Kuznicki, 1982; Fokin, 2001b).
Его рассуждение «О строении простейших живых ор-
ганизмов», представленное для получения доцентуры
376
ALVEOLATA
в 1847 г. (Райков, 1959), и докторская диссертация «О
низших водорослях и инфузориях» (Ценковский,
1856) включали исследования различных протистов, в
том числе и инфузорий (Enchelys, Stylonychia и Vorti-
cella), и убедительно показали, что простейшие состо-
ят из одной клетки и соответственно не имеют никаких
органов, приписываемых им Эренбергом. Ученый, по
сути введший в российскую практику университетско-
го преподавания микроскоп, Ценковский открыл и опи-
сал несколько десятков различных протистов и про-
следил для многих из них жизненные циклы. Одним из
первых он исследовал процессы цистообразования у
Ciliata и экспериментально доказал невозможность са-
мозарождения у простейших (Ценковский, 1859). В сво-
их публичных лекциях Ценковский проводил мысль о
связи одноклеточных и многоклеточных животных и
первым обратил внимание на явление симбиоза у низ-
ших организмов (Райков, 1959; Fokin, 2001b). Обстоя-
тельства жизни не позволили ему создать реальную
протистологическую научную школу. Во второй части
своей научной карьеры (в Одессе и особенно в Харь-
кове) Л. С. Ценковский переключился на микробиоло-
гические исследования (Метелкин, 1950). Однако его
протистологические работы были продолжены рядом
учеников и последователей (А. С. Фаминцын, А. О. Вер-
жесниовский, М. С. Воронин и К. С. Мережковский). В
том числе, возможно под влиянием работ Ценковско-
го, И. И. Мечников (1845—1916) начал свою научную
карьеру именно с изучения инфузорий, опубликовав
несколько своих наблюдений над этими простейшими
(Мечников, 1864а, б, 1865; Metchnikoff, 1864).
Среди перечисленных ученых К. С. Мережковский
(1855—1921) в первой части своей научной карьеры
(1877—1886) наиболее целенаправленно занимался
именно инфузориями. Ему принадлежат первые (после
серии работ Э. И. Эйхвальда 1844—1860 гг.) фауни-
стические сводки по простейшим России: «Этюды над
простейшими Севера России» (1878), «Материалы для
фауны инфузорий Черного моря» (1880) и «О некото-
рых новых или малоизвестных инфузориях» (1881).
Достойно упоминания, что среди русских исследо-
вателей инфузорий последней четверти XIX в. было
две женщины, случай по тем временам чрезвычайно
редкий. Это были Ю. И. Андрусова (1863—1942)
и С. М. Переяславцева (1849—1903), которые также
занимались изучением фауны инфузорий Черного
моря (Андрусова, 1886; Переяславцева, 1886). Извест-
ный физиолог растений, ученик Л. С. Ценковского,
А. С. Фаминцын (1843—1918) также неоднократно об-
ращался к исследованию простейших, и преимущест-
венно инфузорий (Фаминцын, 1889, 1890).
В конце XIX в. активные исследования инфузорий
проводились также в Варшавском, Киевском и Ново-
российском университетах. В первом долгое время
(1864—1889) работал известный польский протисто-
лог А. О. Вержесниовский (1837—1892), хотя пик ци-
лиатологических работ там пришелся на время заве-
дования зоотомическим кабинетом его преемника,
проф. П. И. Митрофанова (1857—1925). Помимо фау-
нистических работ (Эйсмонд, 1890) существенное вни-
мание исследователи в Варшаве уделяли вопросам ци-
тологии инфузорий (Пржесмыцкий, 1894; Сосновский,
1897; Кудельский, 1898; Мавродиади, 1913).
Большую работу по морфологии и биологии щупаль-
цевых инфузорий опубликовал киевлянин Н. А. Кеп-
пен (1888), а П. П. Бучинский (Одесса) занимался изу-
чением протистофауны лиманов (Бучинский, 1895).
Один из учеников Мечникова по Новороссийскому
университету В. М. Хавкин (1860—1930), ставший
впоследствии известным бактериологом, положил на-
чало изучению бактериальных эндобионтов инфузо-
рий (Hafkine, 1890).
С осени 1894 г. цилиатология в России получила
значительное подкрепление — в Петербург из Герма-
нии вернулся В. Т. Шевяков (1859—1930). Окончив
Гейдельбергский университет, где он учился у О. Бюч-
ли (перед этим 4 года он был студентом-вольнослуша-
телем у Н. П. Вагнера в С.-Петербургском университе-
те), Шевяков еще в Германии начал успешные иссле-
дования инфузорий (Fokin, 2000, 2004b; Фокин, 2001).
Сразу по окончании университета он совершил круго-
светное путешествие (1889—1890). Главной целью
этой десятимесячной поездки было исследование гео-
графического распространения пресноводных про-
стейших, и прежде всего Ciliata. Написанная по мате-
риалам поездки монография (Schewiakoff, 1893), была
через 3 года удостоена в России Брантдовской акаде-
мической премии. По возвращении на родину Влади-
мир Тимофеевич защитил магистерскую диссертацию
«К биологии простейших», опубликованную в виде
пространной статьи, две (из трех) глав которой были
посвящены морфологии и распространению инфузо-
рий (Шевяков, 1894).
Через 2 года В. Т. Шевяков представляет в качестве
докторской диссертации работу «Организация и систе-
матика Infusoria Aspirotricha (Holotricha auctorum)»
(1896), которая блестяще завершила серию моногра-
фий, начатую Ф. Штейном. Плод десятилетних наблю-
дений и размышлений ученого (408 страниц текста и
7 больших таблиц превосходных рисунков) включил
сравнительно-анатомическое описание морфологии
инфузорий, анализ ряда биологических и физиологи-
ческих особенностей группы, их географическое рас-
пространение и подробное обсуждение системы и фи-
логенетических связей холотрих.
Классификация инфузорий, предложенная Шевя-
ковым, несколько отличалась от системы Бючли. Так,
Holotricha представлялась ему более естественной
группой, не заслуживающей разделения на Gymnosto-
mata и Trichostomata в ранге отрядов. Все Ciliata были
разделены Шевяковым на 2 отряда: Spirotricha и Aspi-
rotricha. Их состав, естественно, изменился. Отряд As-
pirotricha, рассматриваемый Шевяковым как более
примитивный, включил в себя Holotricha Штейна, с не-
которыми добавлениями. На основе устройства рта и
глотки у представителей этого отряда он был разбит на
3 подотряда: Gymnostomata, Trichostomata и Astomata.
Всего отряд Aspirotricha был разделен Шевяковым на
19 семейств, содержащих 80 родов и 181 вид. Несколь-
ко таксономических групп, выделенных Шевяковым:
Astomata, Prostomata, Pleurostomata (Шевяков, 1896),
сохранились в системе Ciliophora до наших дней
(Lynn, Small, 2000).
С момента появления Шевякова Петербургский
университет становится крупнейшим протозоологиче-
ским центром России. Многие ученики Владимира Ти-
ТИП CILIOPHORA. ОБЩАЯ ЧАСТЬ
377
мофссвича отдали дань научной тематике своего про-
фессора. Среди них такие известные ученые XX в.,
как С. И. Метальников, М. Н. Римский-Корсаков,
Л. К. Линько, С. В. Аверинцев, В. А. Догель, И. Н. Фи-
линьсн и И. К. Дембовский.
11ачало XX в. принесло значительное расширение
гос гана и географии сообщества протозоологов-цили-
птологов. Помимо уже названных ученых на научное
поприще вступили их ученики и младшие коллеги.
Большое значение для консолидации научных сил,
обмена свежей информацией и привлечения новых
исследователей имел первый международный прото-
зоологический журнал «Archiv fur Protistenkunde»
(1902), организованный Ф. Шаудином (1871—1906), а
также появление первых учебников по протозоологии
(Calkins, 1901; Doflein, 1901). Впоследствии в России
также был создан протистологический журнал («Рус-
ский архив протистологии»), игравший аналогичную
роль, но, к сожалению, просуществовавший лишь 8 лет
(1922—1929).
Г. Н. Калкинс (1869—1943) был первым профессо-
ром, начавшим читать специальный курс «Протозоо-
логия» и возглавившим одноименную кафедру. Сам он
занимался по преимуществу физиологией и клеточны-
ми циклами простейших и работал прежде всего с па-
рамециями. В 1912 г. его учебник был переведен на
русский язык (Калкинс, 1912) московским зоологом
В. С. Елпатьевским.
Ф. Дофляйн (1873—1924), ученик Р. Гертвига, имел
весьма широкий круг научных интересов, в том числе
занимался и эпибионтными инфузориями Chonotricha
(Янковский, 1973). Именно ему принадлежит выделе-
ние инфузорий в отдельный тип Ciliophora (Doflein,
1901). Другой немецкий протозоолог, работавший и у
Бючли, и у Гертвига, — М. Гартманн (1876—1962) вы-
пустил «Практикум по протозоологии» (Hartmann,
1907). Гартманн, занимавшийся вначале систематикой
и сравнительной морфологией различных простей-
ших, и том числе и инфузорий, впоследствии сосредо-
точился па теоретических вопросах. Исследование по-
лового процесса у простейших и анализ организации
их ядер интересовали Гартманна на протяжении всей
ого долгой научной жизни (Hartmann, 1952, 1955). Это
ииприилемио активно развивал и один из ближайших
сотрудников Гартманна — К. Беляр (1895—1929), чья
пераим книга о ядре простейших (Belaf, 1926) обещала
ому Пиестищес научное будущее, к несчастью трагиче-
ски iioeoeroHliiiicccH. Влияние упомянутых ученых
па рптвитие цилипгологии трудно переоценить. То же
самое следует оката ть и о самой удивительной фигуре
в систематике И фаунистике Ciliophora первой трети
XX в. А. Кило (1877 -1946).
Будучи учителем гимназии и занимаясь изучением
инфузорий в качестве хобби (Foissner, Wenzel, 2004),
Каль опубликовал спою первую работу в 49 лет (Kahl,
1926). За 9 лет в серии «Животный мир Германии» и
«Животные Северного и Западного морей» появилось
свыше 1000 страниц видовых описаний, ключей для
определения и рисунков, выполненных им без всяких
помощников и отражавших практически всю совокуп-
ность данных по известным к тому времени свободно-
живущим и эктокоммснсальпым инфузориям (Kahl,
1930—1935, 1933,1934, 1934а). Последняя крупная ра-
бота А. Каля, опубликованная в 1943 г., была обнару-
жена совсем недавно (Kahl, 1943; Foissner, Wenzel,
2004). Им была проведена ревизия системы Ciliophora
и предложена ее новая версия, вобравшая в себя дости-
жения Штейна, Бючли, Шевякова и Шаттона — неи-
моверная работа подвижника-одиночки!
Во Франции первая четверть XX в. также ознаме-
новалась появлением выдающихся исследователей,
особенно много работавших в области изучения ин-
фузорий: Э. Шаттона (1883—1947) и Э. Фаре-Фремье
(1883—1971). Оба они широко использовали в своих
исследованиях разработанный Шаттоном метод имп-
регнации кортекса инфузорий серебром (Chatton,
Lwoff, 1930). Шаттону, который изучал прежде всего
морские и симбиотические формы, принадлежит от-
крытие правила десмодексии, установление основных
типов деления протистов и выявление автономности
процесса умножения кинетосом у инфузорий. Он впер-
вые отчетливо осознал эволюционное расстояние меж-
ду бактериями и другими организмами, предложив
термины про- и эукариоты. Ряд работ по цилиатологии
были выполнены Шаттоном совместно с будущим
нобелевским лауреатом А. Львовым (1902—1994), по-
томком выходцев из России, который особенно в на-
чале своей научной карьеры много занимался именно
инфузориями (Chatton, Lwoff, 1922, 1935, 1939) и со-
хранил интерес к этой тематике до конца своей долгой
жизни (Soyer-Gobillard, Schrevel, 2003).
Фаре-Фремье, работавший по преимуществу с прес-
новодными свободноживущими простейшими, исполь-
зовал обнаруженные коллегой особенности кортикаль-
ного морфогенеза инфузорий для анализа эволюции и
филогении Ciliophora. Он уделял особенное внимание
процессам стоматогенеза в различных группах инфу-
зорий, что позволило ему позднее создать новый вари-
ант системы этого типа (Faure-Fremiet, 1950а).
Надо отметить, что, помимо традиционно «силь-
ной» немецкой и французской школ цилиатологов, с
начала XX в. сформировалась замечательная плеяда
американских исследователей инфузорий. Параллель-
но с Г. Калкинсом начал работать в университете шта-
та Иллинойс С. А. Кофойд (1865—1947), занимавший-
ся прежде всего паразитическими простейшими и эн-
докомменсалами. Он исследовал также инфузорий из
рубца домашних жвачных и Entodiniomorpha слонов и
занимался тинтинидами и «нейромоторным» аппара-
том инфузорий и жгутиконосцев (Corliss, 1978). Дру-
гим видным протозоологом этого же поколения был
Г. С. Дженнингс (1868—1947). Специалист в области
поведения и физиологии простейших, он работал пре-
имущественно на инфузориях. Дженнингс одним из
первых начал исследования по генетике Ciliophora
(Jennings, 1929) и стал использовать в качестве объекта
Р. bursaria (Jennings, 1939). Первый студент Калкинса
Л. Л. Вудруф (1879—1947) также работал исключи-
тельно на инфузориях, занимаясь в основном вопроса-
ми их цитологии и жизненных циклов. Кроме того, он
опубликовал ряд работ по истории зоологии, и в том
числе по истории исследования парамеций (Woodruff,
1926, 1938, 1945).
В России начало XX в. ознаменовалось дальней-
шим развитием Санкт-Петербургской школы прото-
зоологов. Среди ее представителей наиболее выделялся
378
ALVEOLATA
В. А. Догель (1882-1955), ставший признанным ли-
дером отечественной протозоологии в советское вре-
мя. В области цилиатологии он работал исключительно
над представителями семейства Ophryoscolecidae и изу-
чил эту группу досконально (Догель, 1923, 1925а, 1925в,
1927). Его многочисленные ученики также исследова-
ли инфузорий (Тассовский, 1916, 1918; Раммельмейер,
1925; Полянский, 1928; Стрелков, 1928; Фурсенко,
1928; Богданович, 1930; Жинкин, 1930; Хейсин, 1930).
Интересные работы по цитологии, фаунистике и
физиологии некоторых Ciliophora опубликовали в пер-
вой четверти XX в. С. И. Метальников (1907, 1911;
Метальников, Галаджиев, 1916), Н. К. Кольцов (1911),
Б. А. Сварчевский (1912, 1928) и Л. Л. Россолимо (1916),
Л. Л. Россолимо и Т. А. Перцева (1929). Обширные эко-
лого-фаунистические исследования инфузорий развер-
нула на Байкале Н. С. Гаевская (1927, 1933).
Середина и конец XX в. в истории цилиатологии
настолько богаты разнообразными событиями, а круг
исследователей и направления их работы в это время
настолько расширились, что этот период требует спе-
циального, большого обзора.
Общее число работ, выполненных на различных Ci-
liophora, не поддается учету. Достаточно сказать, что
только с использованием Paramecium за 250 лет (преи-
мущественно в XX в.) было выполнено свыше 5 тыс.
исследований. Несмотря на то что работы, сделанные
на инфузориях в XVIII—XIX вв., частью не потеряли
своего научного значения и, конечно, представляют
значительный исторический интерес, я буду ссылаться
в настоящем разделе лишь на исследования XX в., как
на наиболее соответствующие современному уровню
протистологической науки.
Воистину всемирную известность снискали такие
представители инфузорий, как Paramecium и Tetrahy-
тепа. Результатом длительного и глубокого изучения
некоторых Ciliophora и неослабного интереса к этим
простейшим со стороны как протистологов, так и уче-
ных других специальностей можно считать целую се-
рию публикаций, посвященных монографическому
описанию ряда инфузорий: Paramecium (Kalmus, 1931;
Wichterman, 1953, 1986; Beale, 1954; Jurand, Selman,
1969; Wagtendonk, 1974; Janisch, 1987; Gortz, 1988);
Tetrahymena (Elliot, 1973; Asai, Forney, 2000); Blepha-
risma (Giese, 1973); Stentor (Tartar, 1961); Ophryoglena
(Canella, Rochi-Canella, 1976); Colpodea (Foissner,
1993).
Различные аспекты систематики, биологии и моле-
кулярной биологии инфузорий нашли свое отражение
в фундаментальных книгах Калкинса (Calkins, Som-
mers, 1941), Львова (Lwoff, 1950), Корлисса (Corliss,
1961, 1979), Нэнни (Nanney, 1980), а также в крупных
сводках и коллективных монографиях (Серавин, 1967;
Райков, 1978; Осипов, 1981; Small, Lynn, 1985; Лука-
шенко, Рыбакова, 1986; Gall, 1986; Frankel, 1989; Lynn,
Corliss, 1991; Hausmann, Bradbury, 1996; Hausmann,
Hiilsmann, 1996; Hiwatashi, 1999; Lynn, Small, 2000; Ha-
usmann et al., 2003).
Значительное число монографий и руководств
было посвящено фауне инфузорий отдельных миро-
вых регионов, стран, морей, озер и рек, а также инфу-
зориям определенных экологических систем и систе-
матических групп (Gajewskaja, 1933; Bhatia, 1936; Чо-
рик, 1968; Dragesco, 1965, 1966, 1970; Янковский,
1973; Мамаева, 1979; Curds, 1969, 1982; Ogimoto, Imai,
1981; Curds etal., 1983; Агамалиев, 1983; Maeda, Carey,
1985; Maeda, 1986; Dragesco, Dragesco-Kemeis, 1986;
Локоть, 1987; Matthes et al., 1988; Бойкова, 1989; Carey,
1992; Foissner, 1994; Petz et al., 1995; Довгаль, 1996;
Корнилова, 2004). Ряд этих изданий снабжены лишь
списками обнаруженных видов (Patterson et al., 1989;
Dini et al., 1995; Жариков, 1996; Жуков и др., 1998;
Yingzhi, Yun Fen, 2000; Fokin, 2001a), в то время как
другие включают значительное число иллюстраций и
содержат исчерпывающие данные по морфологии, си-
стематике и экологии большого числа представителей
исследованных групп Ciliophora (Янковский, 1973;
Foissner et al., 1991, 1992, 1994, 1995, 1999, 2002).
В некоторых монографиях и руководствах имеется
весьма важный материал по методам выделения жи-
вых культур инфузорий из природы, их поддержания в
лабораторных условиях и основным приемам изуче-
ния и идентификации Ciliophora (Иванов и др., 1981;
Finlay et al., 1988; Lee, Soldo, 1992; Foissner, 1993; Жа-
риков, 1996; Алекперов и др., 1996).
Несколько международных и национальных кол-
лекций живых культур микроорганизмов содержат в
том числе и некоторый материал по Ciliophora (АТСС,
ССМР, США; SCCAP, Дания; ССМ, Чешская Респуб-
лика; ССАР, Великобритания). Существуют значи-
тельные коллекции ряда видов инфузорий и в России
(например, в БиНИИ СПбГУ, Санкт-Петербург). Хотя,
как правило, исследователи ограничиваются поддер-
жанием лишь непосредственных объектов своей рабо-
ты, а многие экологи, гидробиологи и исследователи
протистофауны вообще никогда не создавали живых
коллекций обнаруженных простейших.
Результаты исследований, посвященных Ciliopho-
ra, печатаются в ряде специальных периодических
изданий: Protist (с 1902 по 1997 — Archiv fur Protisten-
kunde), Journal of Eukaryotic Microbiology (c 1954 no
1988 — Journal of Protozoology), European Journal of
Protistology (c 1965 no 1986 — Protistologica), Acta Pro-
tozoologica (c 1963), Japan Journal of Protozoology (c
1967), Protistology (c 1999) и в многочисленных между-
народных и отечественных журналах, тематически
связанных с изучением простейших.
Конечно, инфузории — одна из ключевых групп
царства Protista, постоянно упоминаются в многочис-
ленных учебниках, учебных пособиях и сводках как по
протистологии и протозоологии, так и по зоологии
беспозвоночных, экологии и эволюции (Hyman, 1940;
Догель, 1951; Grasse, 1952—1953; Doflein, Reichenaw,
1949—1953; Mackinnon, Hawes, 1961; Догель и др.,
1962; Pitelka, 1963; Raabe, 1964; Lipsi, 1965; Райков,
1967, 1978; Chen, 1967—1972; Kudo, 1971; Grell, 1973;
Fanner, 1980; Puytorac et al., 1987; Puytorac, 1994; Хаус-
ман, 1988; Sleigh, 1989; Карпов, 1990; Margulis et al.,
1990; Mehlhorn, Ruthmann, 1992; Foissner, 1994; Co-
ombs et al., 1998; Карпов, 2001; Корнилова, 2004).
Как видно из списка литературы, цитированной
выше, число отечественных сводок по Ciliophora весь-
ма мало, и в то же время значительный интерес к инфу-
зориям, безусловно, требует появления таких работ.
При этом следует отметить, что многие из перечислен-
ных выше зарубежных изданий малодоступны даже в
ТИП CILIOPHORA. ОБЩАЯ ЧАСТЬ
379
библиотеках столичных городов России. Таким обра-
зом, настоящий обзор призван, хотя бы отчасти, вос-
полнить существующий дефицит русских источников
но морфологии, биологии и систематике представите-
лей одной из интереснейших групп протистов — ин-
фузориям, а также дать представление об основных
iTillinx истории развития цилиатологии в течение пер-
ных 250 лет ее существования. Эта история, несмотря
на ряд публикаций (Calkins, 1901; Бродский, 1937; Cor-
liss, 1978, 1991; Kuznicki, 1982, 2003; Entzeroth, 1994;
Geus, 1994; Leadbeater and Green, 2000; Vickerman et
al., 2000; Fokin, 2001b; Wolf and Hausmann, 2001; Кор-
нилова, 2004), до сих пор слабо освещена в литературе.
Классификация
Тип Ciliophora Doflein, 1901
Подтип Postciliodesmatophora Gerassimova, Seravin, 1976
Класс Karyorelictea Corliss, 1974
Отряд Protostomatida Small, Lynn, 1985
Отряд Loxodida Jankowski, 1978
Отряд Protoheterotrichida Nouzarede, 1977
Класс Heterotrichea Stein, 1859
Отряд Heterotrichida Stein, 1859
Отряд Licnophorida Corliss, 1957
Подтип Intramacronucleata Lynn, 1996
Класс Spirotrichea Butschli, 1889
Подкласс Protocruziidia Puytorac et al., 1984
Отряд Protocruziida Jankowski in Small, Lynn, 1985
Отряд Hypotrichia Stein, 1859
Отряд Kiitrichida Nozawa, 1941
Отряд Euplotida Small, Lynn, 1985
Подкласс Choreotrichia Small, Lynn, 1985
Отряд Tintinnida Kofoid, Champbell, 1929
Отряд Choreotrichida Small, Lynn, 1985
Подкласс Stichotrichia Small, Lynn, 1985
Отряд Plagiotimida Albaret, 1974
Отряд Stichotrichida Faure-Fremiet, 1961
Отряд Urostylida Jankowski, 1979
Отряд Sporadotrichida Faure-Fremiet, 1961
Подкласс Oligotrichia Butschli, 1887
Отряд Halteriida Petz, Foissner, 1992
Отряд Strombidiida Petz, Foissner, 1992
Подкласс Phacadiniidia Small, Lynn in Shin et al., 2000
Отряд Phacadiniida Small, Lynn, 1985
Класс Litostomatea Small, Lynn, 1981
Подкласс Haptoria Corliss, 1974
Отряд Haptorida Corliss, 1974
Отряд Pleurostomatida Schewiakoff, 1896
Отряд Cyclotrichida Jankowski, 1980
Подкласс Trichostomatia Butschli, 1889
Отряд Vestibuliferida Puytorac et al., 1974
Отряд Entodiniomorphida Reichenow in Doflein &
Reichenow, 1929
КЛИПС Aiinophoridea Jankowski, 1964
Отряд Armophorida Jankowski, 1964
Отряд Clevelandellida Puytorac, Grain, 1976
OimiA Odontostomatida Sawaya, 1940
KtlhUC I'hyllophuryngea Puytorac et al., 1974
rioilKHiU'C I'hyllopharyngia Puytorac et al., 1974
Отряд Chhunydodontida Deroux, 1976
Отряд DlHtcriida Deroux, 1976
I kviioiimc Rliynvliodida Chatton, Lwoff, 1939
Отряд llypocomatida Deroux, 1976
Подклпсс Clionotilehlii Wnllengren, 1895
Отряд Hxogoinmidii Jankowski, 1972
Отряд ('lyplogcnimldii Jankowski, 1975
Подкласс Sucloilii Claparcdc, Lachmann, 1858
Отряд Exogcnlda Collin, 1912
Отряд Endogcnldn Collin, 1912
Отряд Evaginogenida Jankowski, 1978
Класс Nassophorca Small, Lynn, 1981
Отряд Syn hymen i Ida Puylorac ct al., 1974
Отряд Nassulida Jankowski, 1967
Отряд Microthoracida Jankowski, 1967
Класс Colpodea Small, Lynn, 1981
Отряд Cyrtolophosidida Foissner, 1978
Отряд Bryometopida Foissner, 1978
Отряд Bryophryida Puytorac et al., 1979
Отряд Bursariomorphida Femandez-Galiano, 1978
Отряд Colpodida Puytorac et al., 1974
Отряд Sorogenida Foissner, 1985
Класс Prostomatea Schewiakoff, 1896
Отряд Protostomatida Schewiakoff, 1896
Отряд Protodontida Corliss, 1974
Класс Plagiopylea Small, Lynn, 1985
Отряд Plagiopylida Small, Lynn, 1985
Класс Oligohymenophorea Puytorac et al., 1974
Подкласс Peniculia Faure-Fremiet in Corliss, 1956
Отряд Peniculida Faure-Fremiet in Corliss, 1956
Отряд Urocentrida Puytorac et al., 1987
Подкласс Scuticociliatia Small, 1967
Отряд Philasterida Small, 1967
Отряд Pleuronematida Faure-Fremiet in Corliss, 1956
Отряд Thigmotrichida Chatton, Lwoff, 1922
Подкласс Hymenostomatia Delage, Herouard, 1896
Отряд Hymenostomatida Delage, Herouard, 1896
Подкласс Apostomatia Chatton, Lwoff, 1928
Отряд Apostomatida Chatton, Lwoff, 1928
Отряд Astomatophorida Jankowski, 1966
Отряд Pilisuctorida Jankowski, 1966
Подкласс Peritrichia Stein, 1859
Отряд Sessilida Kahl, 1933
Отряд Mobilida Kahl, 1933
Подкласс Astomatia Schewiakoff, 1896
Отряд Astomatida Schewiakoff, 1896
Морфофункциональная
организация
В водных экосистемах инфузории — наиболее за-
метные представители Protista, благодаря их сравни-
тельно крупным размерам и подвижности. Как и все
эукариотические клетки, они имеют стандартный на-
бор клеточных органелл и структур, хотя некоторые
особенности организации Ciliophora присущи только
этим простейшим.
Тело инфузорий состоит из двух основных ком-
партментов: цитоплазмы и карио- или нуклеоплазмы.
Первая отделяется от внешней среды особым наруж-
ним слоем — кортексом, куда входит и типичная плаз-
матическая мембрана, а вторая (от цитоплазмы) —
ядерной оболочкой. Поскольку клетки Ciliophora име-
ют ядра двух типов (макро- и микронуклеусы), карио-
плазма инфузорий представлена также двумя состав-
ляющими — макро- и микронуклеоплазмой, каждая из
которых обычно отделена от цитоплазмы отдельной
ядерной оболочкой — производной гладкого эндо-
плазматического ретикулума. Мелкий микронуклеус
(или несколько микронуклеусов) содержит сравни-
тельно сильно конденсированный хроматин, который
часто рассматривают как неактивный, хотя, по-види-
мому, это не совсем так (Fokin, Ossipov, 1981; Ng, 1986;
Фокин, 2002). Крупный единственный макронуклеус,
иногда разделенный на связанные между собой или
полностью автономные многочисленные фрагменты
(Heterotrichia, Hypotrichia), содержит хроматин разной
степени конденсации, активный на протяжении всего
жизненного цикла клетки (Raikov, 1995, 1996).
Цитоплазматическая составляющая клетки инфу-
зорий разделена на ряд субкомпартментов, связанных
380
ALVEOLATA
между собой. Кортекс клетки представлен поверхност-
ным слоем толщиной 1—4 мкм, включающим пелли-
кулу, которая песет наружную цилиатуру и инфраци-
лиатуру. Иногда поверхностную зону цитоплазмы
обозначают как эктоплазму. Граница между кортексом
(эктоплазмой) и эндоплазмой у большинства инфузо-
рий выражена нечетко, хотя у представителей некото-
рых групп (Litostomatea) между экто- и эндоплазмой
залегает хорошо различимый филаментозный слой.
В эндоплазме расположены ядра, пищеварительные и
сократительные вакуоли, гладкий и шероховатый эн-
доплазматический ретикулюм, комплекс Гольджи, ми-
тохондрии (как правило) и некоторые другие органел-
лы и включения.
Организация клетки инфузорий, как и других про-
тистов, может рассматриваться на разных ее уровнях:
макромолекулярном, суборганелльном, органелльном,
системно-органелльном и клеточно-организменном
(Riedl, 1978; Lynn, Corliss, 1991), хотя не во всех случа-
ях эти уровни одинаково хорошо выявляются. В общей
характеристике организации клетки инфузорий, я буду
оперировать в основном понятиями суборганелльного,
органелльного и системно-органелльного уровней.
Объяснение некоторых терминов дано в тексте и в спе-
циальном приложении. Развернутое толкование мно-
гочисленных специальных терминов и понятий, свя-
занных с морфологией инфузорий, приведено в моно-
графии Корлиса (Corliss, 1979), иллюстрированном
глоссарии Protoctista (Margulis et al., 1993) и иллюстри-
рованном гиде Protozoa (Lynn, Small, 2000).
Кортекс
Особенности кортикальной организации инфузо-
рий определяют собственно внешний вид клетки этих
простейших (рис. 220—225). Кортекс несет барьерную
функцию, отделяя внутреннюю среду организма от
среды внешней. Он подразделяется на две составляю-
щие: оральный и соматический, соотношения и осо-
бенности которых значительно варьируют в разных
группах инфузорий (рис. 220, А; 226; 227).
Плазматическая мембрана. Поверхность кортек-
са представлена плазматической (клеточной) мембра-
ной толщиной около 10 нм со слоем гликокалекса, ко-
торый может модифицироваться клеткой в ответ на из-
менение условий внешней среды (рис. 220, 5; 221, А).
Эта мембрана имеет типичное трехслойное строение и
несет значительное число внутримембранных частиц
определенной топографии и архитектоники (рис. 228).
Функции этих частиц пока не ясны (Bardele, 1981;
Hausmann, Hiilsmann, 1996). Гликокаликс, который со-
стоит в основном из мукополисахаридов, также имеет
характерную структуру и связан с коммуникативной
системой клетки инфузорий. В нем расположены мно-
гочисленные рецепторные молекулы, что позволяет
клетке-организму селективно абсорбировать из окру-
жающей среды различные вещества. Иногда снаружи
плазматической мембраны клетку инфузорий (особен-
но у некоторых гипотрих и олиготрих) покрывает
еще одна мембраноподобная структура, — перилемма
функция которой также неизвестна (Hausmann, Hiils-
mann, 1996).
В совокупности со структурами, расположенными
под плазматической мембраной: альвеолами, эпиплаз-
мой и сопутствующими микротрубочками (общей тол-
щиной менее 1 мкм), этот слой кортекса именуется
пелликулой (рис. 220, А; 221, А; 229—232). В пределах
типа, композиция пелликулы может варьировать.
Даже в одной клетке в зависимости от зоны кортекса
(несущей реснички или безресничной) пелликула мо-
жет не совпадать по своей сложности. В целом архи-
тектоника пелликулы у инфузорий также может разли-
чаться. У многих инфузорий она образует различные
складки и гребни или, как у Paramecium и других пе-
никулин, имеет вид гексогональных (иногда прямо-
угольных) ячеек, в центре которых расположены рес-
нички, а в окружающих ячейку гребнях — трихоцисты
(рис. 220, Б; 223—225, вкл.; 233, вкл.).
Альвеолы. Альвеолы пелликулы инфузорий пред-
ставляют собой окруженные мембраной уплощенные
мешочки, образующие слой сразу под плазматической
мембраной (рис. 220; 221, А; 230—233, вкл.). Эти
составляющие пелликулы характерны, кроме инфузо-
рий, для Apicomplexa и Dinoflagellata. Однако даже
среди инфузорий развитие этих структур может быть
не одинаково: они не найдены у Karyorelictea, слабо
представлены у некоторых Spirotrichea, Litostomatea и
Phyllopharyngea (Chonotrichia) и в то же время достига-
ют значительного развития и сложности организации у
большинства представителей других классов Ciliopho-
ra. Топография и размеры альвеол не одинаковы у раз-
ных видов инфузорий, но сходны в клетках, принадле-
жащих к одному виду.
Альвеолы большинства инфузорий представляют-
ся пустыми при электронно-микроскопическом иссле-
довании (рис. 230—232, вкл.) и их функции остаются
пока не до конца ясными. Предполагается, что они мо-
гут быть связаны с регуляцией перемещения ионов,
определяющей биение ресничек (Satir, Wissig, 1982).
Некоторые инфузории тем не менее содержат в аль-
веолах определенный материал (рис. 231, а, вкл.). Так,
клетки Coleps содержат в альвеолах карбонат кальция
(Faure-Fremiet et al., 1968). Nassula и сходные формы
класса Nassophorea имеют альвеолы, заполненные
плотным веществом неясной природы (Eisler, 1986), а
Euplotes содержит в альвеолах плотный фиброзный
материал, сходный по консистенции с расположенным
в эпиплазме этих инфузорий (Hausmann, Kaiser, 1979).
Эпиплазма. Ниже альвеолярного слоя в кортексе
инфузорий обычно представлен слой фиброзного или
филаментозного материала, называемый эпиплазмой
(рис. 220, 229, 232, вкл.; 234, вкл.). Этот слой может
быть выражен у разных инфузорий в неодинаковой
степени, а иногда, возможно, отсутствует совсем. От-
части степень выявления эпиплазмы зависит от харак-
тера подготовки материала для микроскопирования,
поэтому говорить об отсутствии эпиплазмы в случаях,
когда она не выявляется при электронно-микроскопи-
ческом исследовании, следует с известной осторож-
ностью. По-видимому, эпиплазма играет важную роль
в поддержании общей формы тела инфузорий, являясь
частью цитоскелета. По крайней мере у мелких коль-
подид, сохранение формы тела которых не требует до-
полнительных структур, она выражена слабо. В то же
время крупные виды инфузорий, как правило, имеют
ТИП CILIOPHORA. ОБЩАЯ ЧАСТЬ
381
3
1
13
14
II)
j'H
I ♦ "
ГТ
— 5
Рис. 220. Общий вид (А) и фрагмент организации (5) кортекса инфузорий.
1 — цитостом; 2 — пароральная кинета; 3 — оральные поликинеты; 4 — периоральные
кинеты; 5 — цитопрокт; 6 — пора сократительной вакуоли; 7 — альвеолы; 8 — мито-
хондрии; 9 — межкинетальное пространство; 10 — пелликула (а — плазмалемма, 6 —
альвеола, в — эпиплазма, г — супраэпиплазматические микротрубочки); 11 — кортекс;
12 — филаментозный слой; 13 — соматическая дикинетида; 14 — соматическая моноки-
нетида (а1 — трансверсальная лента микротрубочек, 61 — кинетодесмальная фибрилла,
в> — кинетосома, г! — лента постцилиарных микротрубочек); 75—основание реснички;
16 — парасамальный сак; 17 — базальные микротрубочки. (По: Lynn, Small, 2000, с из-
менениями).
Fig. 220. General (A) and particular (Б) organization of ciliate’s cortex.
1 — cytostom; 2 — paroral kinety; 3 — oral polykinetid; 4 — perioral kinety; 5 — cytoproct;
6 — contractile vacuole pore; 7 — alveolus; 8 — mitochondria; 9 — interkinetal space; 10 —
pellicule (a — plasmalemma, 6 — alveolus, в — epiplasm, г — supraepiplasmic microtubes);
Il — cortex; 12 — filamentous layer; 13 — somatic dikinetid; 14 — kinetid (al — transverse
microtubular ribbon, 61 — kinetodesmal fibril, el — kinetosome, г> — postciliary microtubu-
lar ribbon); 15 — base of cilium; 16 — parasomal sac; 77 — basal microtubules.
Л 1 в
б
сильно развитый слой эпиплазмы (Lynn, Corliss, 1991).
В местах локализации цитофарингса, цитопрокта, пор
сократительных вакуолей и экструсом эпиплазма
обычно не выражена. Впрочем, эпиплазма может быть
слабо представлена и в случае значительного развития
других армирующих структур в пелликуле — микро-
трубочек или микрофиламентов.
Микротрубочки. Пелликулярные микротрубочки
обычно достаточно многочисленны в кортексе инфу-
зорий (рис. 220, 221). Значительная их часть связана с
кинетосомами, но как в несущих реснички частях кор-
текса, так и в лишенных ресничек областях поверхно-
сти инфузорий могут встречаться микротрубочки, не
связанные с органеллами локомоции (Sundermann,
Paulin, 1981; Lynn, Zimmerman, 1981). Пелликулярные
микротрубочки иногда располагаются выше эпиплаз-
мы, но в других случаях подстилают ее (рис. 220, Б;
229; 232, вкл.; 235, вкл.). Супраэпиплазматические
микротрубочки характерны для представителей класса
Oligohymenophorea (Tetrahymena, Colpidium, Colpoda,
Conchophthirus), у которых они могут иметь вид тяжей
между кинетами, образующих специфический слой в
районе цитофаригса. Встречаются они и изолированно
друг от друга (Allen, 1967; Antipa, 1971; Lynn, Zimmer-
man, 1981; Paulin, 1996). Субэпиплазматические мик-
ротрубочки наиболее характерны для участков тела
382
ALVEOLATA
Рис. 221. Детали строения различных участков кинетиды.
А — продольный и поперечные срезы кинетиды: / — верхушка реснички, 2 — аксонема, 3 — верхняя часть переходной зоны реснички, 4 — нижняя часть пе-
реходной зоны реснички, 5 — кинстосома, Axs — аксосома, ВР1 — базальная поперечная пластинка, TMt — трансверсальные микротрубочки, PS — парасо-
мальнай сак, РА — альвеола, Kd— кинетодесма; Б — организация триплетов микротрубочек в кинетосоме; В, Г— возможная ориентация кинетосом в дики-
нетиде. А, В, С — микротрубочки в кинетосомном триплете; / — порядковый номер триплетов микротрубочек в кинетосоме; PcMt — постцилиарные микро-
трубочки; Rt, LJ't -- правая и левая стороны поверхности кортскса. Стрелка указывает направление к переднему концу клетки. (По: Corliss, 1979, с
изменениями).
Fig. 221. Details of kinctid construction.
A — longitudinal and across sections ofkinetid: 1 — top of the cilium, 2 — axonema, 3 — upper part of the transitional zone of cilium, 4 — lower part of the transitional
zone ofcilium, 5 — kinetosomal fibril, Axs — axosoma, BPl — basal transversal plate, TMt — transversal microtubules, PS — parasomal sak, PA — alveole, Kd— ki-
netodesmal fibril; Б\ organization of the microtubules triplet in kinetosome; В, Г— possible orientation of kinetosomes in dikinetid. А, В, C — microtubules in kineto-
somal triplet; I — order of numbering of microtubular triplet in kinetosome; PcMt— postciliary microtubular ribbon; Rt. Lft — right and left sides of the cortex surface.
Arrow indicates direction to the arterial end of the cell.
Рис. 222. Схемы организации переходной зоны реснички у
представителей Oligohymcnophora.
a Apostomntia, Astomatia, Pcrilrichia; б — Scuticociliatia, Hymenosto-
matia; <i Peniculia; 1 - центральный дублет микротрубочек, 2 — пери-
ферические дублеты микротрубочек, 3 — аксосома, 4 — аксосомное
кольцо. 5 аксосомная поперечная пластинка, 6 — переходная спи-
раль, 7 - промежуточная поперечная пластинка, 8— терминальная по-
перечная пластинка.
Fig. 222. Schemes of cilium’s transitional zone organization in Oli-
gohymenophora.
a — Apostomatia, Astomatia, Peritrichia; 6 — Scuticociliatia, Hymenosto-
matia; в — Peniculia;/ — central doublet of microtubules, 2 — peripheral do-
ublet of microtubules, 3 — axosome, 4 — axosomal ring, 5 — axosomal
transversal plate, 6 — transitional helix, 7 — intermeddle transversal plate,
8 — terminal transversal plate.
ТИП CILIOPHORA. ОБЩАЯ ЧАСТЬ
383
Nth IMi В(фИ11ИТМ рнаПОЛОЖвИНЙ ротового KoprcKcn у различных инфузорий.
/ 1 ни III....... шипим (Ml/»/)/li;iWt Этгвйл)| 1 <•- ноикилько именинниц ОТ IIWIIOVR (Л'ис/шб'.*); J, 4 на вентральной стороне клетки (Spathidium,
Ii/.IIH »»i.i), n III i MHIIU4IIIMII IIS M»lif>RflbliyM eropilliy II pnillllll millllH (Pluglopyla, Dileplux, Aim lilUlii Colpidium, Paramecium). (По: Corliss, 1979).
H|i IMi Different powltlon of oral cortex In ноте dilutes.
I, ’ al apli al |iula (//ii/ll/l/irHI, Pfflffl(/«ll)| J — tlllftoil И hit from the pole (Вп<Муя); J. 4 — on ventral surface, to different extents (Spathidium, Glaucoma);
n III lilllllllKi Io verllllll degree! onto ventral aurfnce (Plaglopyla, DlleptU», two species of Colpidium and Paramecium).
инфу uipiili, iiiiiiipiiiiiiIX цилиптуры, и соответственно
iniuie otipinoiiniiiiii нииболее чисто встречаются у хи-
пшрих, ф|111оф|||кч1геид и сукторий (Sundermann, Pau-
lin, 1'Ж|; (lilni, |98?.; I lol'nuinn, 1987). У значительного
числи инфузорий пелликулярные микротрубочки ред-
ки или их появление связано с определенной фазой
клеточного цикла. 'Гак, например, у Paramecium супра-
•Н1нила (магические микротрубочки появляются лишь
в процессе клеточного деления, а в интерфазе исчеза-
в>1 (Simdararaman, Hanson, 1976).
Микрофиламенты. Роль кортикальных микрофи-
памсигов (рис. 220, 5; 221, Л; 232, вкл.), как уже было
сказано, прежде всего формообразующая. Кроме того,
они имеют большое значение при клеточном делении,
составляя в его плоскости сократимое кольцо. Это об-
pirioiiiiiiiie, сжимаясь, осуществляет перешнуровку
Ivlin инфузории, в результате чего возникают две до-
черпни ocotin. безусловно, природа филаментов, обна-
руженных и корюксс инфузорий, может быть различ-
ной, дпже ci’ini они участвуют в одних процессах (со-
kpiimeiiiiii) II некоторых случаях у инфузорий был
iiiiHiiini'ii 11И1НЧ11ЫЙ актин (Cohen et al., 1980), но часто
принцип pniiii। ы сократимых элементов инфузорий от-
пиши’ 11 и nt пк । пиомиозипового типа (Hausmann, Hiils-
iiiaiin, I ‘Wo). Гик, ciin iMiiii, обнаруженный в спазмоне-
мах с ।ctieiiuoi нрсдсзавпгелей подкласса Peritrichia,
otieciicHiiiiiie। чрезвычайно быстрое сокращение этих
оОразований. У Strutur, Spirostomum и ряда других Не-
Ieiolrichia за сокращение зела отвечают иные типы фи-
ламентов, образующих продольно ориентированные
мионемы (рис. 232, /, вкл.; 234, б, вкл.). Во всех пере-
численных случаях сокращение этих клеточных эле-
ментов не связано с Л ГФ, по оказывается кальций-за-
висимым.
С соматическим отделом кортекса связано значи-
тельное число постоянных компонентов клетки инфу-
зорий. Это прежде всего кинетиды, различного рода
экструсомы и включения (пигментные гранулы), а так-
же цитопрокт и поры сократительных вакуолей, если
таковые вакуоли имеются (рис. 220, 221, 223—225,
вкл.; 227, вкл.; 233, вкл.; 236, вкл.). Соматическая часть
кортекса инфузорий служит прежде всего для плава-
ния, для прикрепления к субстрату, выделения защит-
ных образований на поверхности клетки, а также для
сенсорного взаимодействия с окружающей средой.
Основной единицей соматической части кортекса яв-
ляется кинетида (рис. 220; 221, Л; 230, вкл.; 231, вкл.).
Это комплексная структура, включающая базальное
тело (кинетосому), три типа фибриллярных дериватов,
которые с ней связаны, мембранное углубление (пара-
сомальный сак) и собственно ресничку (Corliss, 1979;
Lynn, Corliss, 1991; Paulin, 1996).
Реснички. Ресничка (рис. 221, Л; 223—225; 230—
232, вкл.) представляет собой окруженную мембраной
совокупность микротрубочек (аксонему), включаю-
щую девять периферических дублетов (А- и Б-микро-
трубочки) и один центральный (9+2). В то время как
структурные модификации кинетосомы и аксонемы
достаточно редки, переходная зона ресничек оказыва-
ется сравнительно пластичной (рис. 222). При совпаде-
нии основной ее функции (прикрепление реснички) к
настоящему времени известно свыше 10 типов органи-
зации этой структуры у Protista, в том числе несколько
для Ciliophora (Grain et al., 1988; Карпов, 1990, 2001;
Фокин, 1994, 1995; Karpov, Fokin, 1995). В этой зоне
реснички — участке кинетиды, расположенном в мес-
те перехода из клетки во внешнюю среду, — выделяют
систему поперечных пластинок, колец и иногда спира-
лей и «колес», а также аксосому с проксимальными
концами центральной пары микротрубочек аксонемы
(рис. 222, 230, вкл.; 231, вкл.). В переходной зоне рес-
нички центральные микротрубочки заканчиваются,
384
ALVEOLATA
причем одна из них входит в аксосому (аксиальное
зерно), а вторая оканчивается в аксонемном цилиндре
слепо.
Морфологическое богатство структур, связанных
с переходной зоной, и их консерватизм позволяют с
успехом применять этот признак в таксономии и фило-
генетике групп ранга тип—класс (иногда подкласс).
Организация переходной зоны ресничек у разных ин-
фузорий закономерно различается в деталях (рис. 222).
Так, у большинства представителей Peniculia (Oligohy-
menophora) обнаружена одна из наиболее сложных
(среди инфузорий) форм этого отдела ресничек, харак-
терной особенностью которой служит не только нали-
чие аксосомного кольца, но и присутствие концентри-
ческой структуры, напоминающей переходную спи-
раль (Фокин, 1994; Karpov, Fokin, 1995). Эта структура
располагается между промежуточной и аксосомной
поперечными пластинками и состоит из четырех обо-
ротов тонкой фибриллы, связанной с А-микротрубоч-
ками (рис. 221, в; 230, вкл.). Достаточно сложные и ха-
рактерные структуры переходной зоны ресничек отме-
чены также для Colpodea и Nassophorea (Фокин, 1995).
Некоторые детали строения мембраны ресничек
(количество и топография межмембранных частиц)
дают известный материал для сравнительного анализа
инфузорий (Bardele, 1981). При использовании техни-
ки замораживания—скалывания на протоплазматиче-
ской части мембраны ресничек отчетливо заметны
группы межмембранных частиц различной архитекто-
ники: «кружево», «плакетки», «розетки» и «линии»
(рис. 228). Если «кружево», образованное двойным ря-
дом межмембранных частиц, всегда присутствует в
основании ресничек инфузорий, то остальные элемен-
ты и их сочетания являются характерными признаками
различных групп Ciliophora (Bardele, 1981).
В кинетосоме периферические дублеты становятся
триплетами: А, Б и С-микротрубочки (рис. 221, Б). Два
деривата кинетосом также состоят из микротрубочек:
постцилиарная лента микротрубочек обычно связана с
задним триплетом 9 кинетосомы, а трансверсальная
микротубулярная лента отходит от левого переднего
края кинетосомы у триплетов 3 и 4. Третий дериват —
поперечно исчерченная фибрилла (кинетодесма), от-
ходит от триплетов 5, 6 и 7 (рис. 220, Б; 221, А). Как
правило, кинетиды собраны в продольные ряды — ки-
неты, справа от которых располагаются кинетоде-
смальные филаменты, направленные к переднему кон-
цу тела (рис. 220, Б; 221, Л; 230, д, вкл.; 232, а, в, е,
вкл.). Это положение кинетодесмальных дериватов ки-
нетосом было выявлено Шаттоном и Львовым и назва-
но правилом десмодексии (Chatton, Lwoff, 1935). У
представителей Karyorelictea и Spirotrichea наиболь-
шее развитие получают постцилиадесмы, располагаю-
щиеся также справа от кинет, но направленные к зад-
нему концу тела простейшего (рис. 220, Б; 221, Б, В, Г;
232, б, г, вкл.). У ряда других таксонов инфузорий пре-
имущественное развитие получают трансверсальные
микротрубочки, вытянутые поперек ресничных рядов
и начинающиеся с левой стороны кинет (рис. 220, Б;
221, В, Г; 237, г, вкл.). Парасомальные саки обычно
располагаются впереди или справа от кинетосом в ки-
нете (рис. 220, Б, 221, Л; 231, б, в, вкл.). Ниже слоя ки-
нетосом у ряда инфузорий могут располагаться мито-
хондрии, иногда образующие характерные скопления
вдоль кинет (рис. 220, Л; 231, в, г, вкл.; 234, вкл.), часть
этих органелл располагается в эндоплазме.
Значительное число исследований показало, что
устройство соматических кинетид у инфузорий может
существенно варьировать. Эти вариации, включающие
изменения в размерах, расположении и форме кинето-
сомальных дериватов, а также вариации числа кинето-
сом хорошо совпадают с делением Ciliophora на груп-
пы ранга класса (Lynn, 1981; Small, Lynn, 1985; Lynn,
Small, 2000; Lynn, 2003). Кинетиды могут быть класси-
фицированы как монокинетиды — одна кинетосома с
фибриллярными дериватами; дикинетиды — две кине-
тосомы с фибриллярными дериватами, и поликинети-
ды — более чем две кинетосомы (рис. 220, Л; 227, вкл.;
230, вкл.; 232, а, б, ж, вкл.; 234, а, вкл.; 238, вкл.). По-
следние могут образовывать ряды или скопления, при-
чем фибриллярные дериваты в этих случаях присутст-
вуют не у каждой кинетосомы. Так, в дикинетиде час-
то лишь одна из кинетосом имеет типичный набор
дериватов (рис. 232, а, б, вкл.; 234, а, вкл.). Кроме того,
представители некоторых групп имеют в кортексе до-
полнительные фибриллярные компоненты: гименосто-
матиды — базальные микротрубочки, расположенные
вдоль левой стороны кинетосом (рис. 220, 5); филло-
фарингиды — субкинетальные микротрубочки, отхо-
дящие от основания кинетосом; некоторые гапториды
и кольподиды обладают нематодесмами или микроту-
булярными тяжами, которые отходят от поверхности
пелликулы в глубь цитоплазмы клетки (рис. 232, ж,
вкл.; 235, вкл.; 238, вкл.).
Функция самих ресничек представляется очевид-
ной — это органеллы локомоции, способные к слож-
ному (трехплоскостному) движению. Фибриллярные
дериваты кинетосомы, по-видимому, играют роль яко-
ря для локомоторной единицы. При этом в случае
сильного развития они могут выполнять и определен-
ную роль формообразующих элементов кортекса. Па-
росомальный сак, возможно, имеет значение при эндо-
цитозе (Nilsson, Deurs, 1983), хотя не всегда ясно, ка-
кие вещества могут в норме поглощаться из
окружающей инфузорию среды (Lynn, Corliss, 1991).
Очевидно, что кинетом должен выполнять и неко-
торые сенсорные функции. Долгие поиски в начале
XX в. «нейромоториума» у инфузорий или каких-либо
специальных субклеточных структур, координирую-
щих их «ощущения», давно забыты. Тем не менее на-
личие у многих инфузорий укороченных ресничек
(рис. 223, в), не участвующих в локомоции (например,
«сенсорные щетинки» гипотрих), с еще пока недоста-
точно изученной ролью (Gortz, 1982; Lynn, Corliss,
1991) говорит о том, что, возможно, некоторые специа-
лизированные реснички у разных инфузорий действи-
тельно имеют сенсорные функции. На это указывает и
специальный, наиболее богатый состав межмембран-
ных частиц в оболочке специализированных ресничек
у гимностоматид, офрисколицид, гетеротрих и олиго-
трих (Bardele, 1981).
Общее число кинетид, достигающее, например, у
Р. caudatum 15 тыс., сохраняется от деления до деле-
ния. Их репликация происходит перед цитокинезом,
но для многих инфузорий этот процесс не изучен в де-
талях. В случае дикинетид родительские кинетосомы
Рис. 227. Детали строения кортекса инфузорий рода Paramecium.
а — ротовые ci рук I уры iluini >р к игi 101, 6 часть орального кортекса, окружающая ротовое отверстие; в — участок дорсального кортекса с порой сократите-
льной вакуоли; / iipiiiiiiin.ir момОрлпеллы: дорсальный и вентральный пеникулюсы (звездочка) и квадрулюс (большая звездочка)', д — оральные мембра-
неллы: парорплышн МНМПрнн<-чин tini'.iiciiiiKa) и квадрулюс; е, ж — дорсальный участок кортекса со множественными порами сократительной вакуоли; з —
lllllillipuii | .1 * инн» клетка, интерференционный контраст; б—з — клетки, импрегнированные нитратом серебра.
Масштаб: а, б, г, д — 10 мкм, в, е, ж — 5 мкм, з — 15 мкм.
Fig. 227. Some cortical structures of ciliates of Paramecium.
a — oral strueliucii of llvlnp <। II. о pin I of oral cortex surrounding the oral overture; в — part of dorsal cortex with the pore of contractile vacuole; г — oralmembra-
nelles: dorsal uiul vellllal pehli'ull (•<).<<» IvA.v) und quadrulus (large asterisks)-, d — oral membralelles: endoral membrane (snowflake) and quadrulus; e, ж — dorsal part
ol t'Of<<* «Illi iiiullipiires of the contractive vacuole; з — cytoproct. a — living cell, DIC; б—з — silver impregnated cells.
Bar = 10 pm (а, б, г, d), 5 pm (в, e, ж), 15 pm (a).
Рис. 228. Различные варианты архитектоники межмембранных частиц в плазма)инсской мембране инфузории Cyclidium glaucoma,
а — простой «коврик» из передней части клетки; б — сложный «коврик» из задней части клсз ки; в «плас)инка» из апикальной зоны, лишенной ресничек.
Сканирующий микроскоп.
Масштаб: а. б — 0.07 мкм; в — 0.13 мкм.
Фотографии любезно предоставлены проф. Христианом Барделе. Тюбинген. Германия.
Fig. 228. Variants of the intramembrane particles architectonic pattern in case of ciliate Cyclidium glaucoma.
ci — particle plate from the naked apical area; 6 — a simple pellicular rug from the anterior part of the cell: в — a complex pellicular rug from the posterior part of the
cell. Scanning electron micrographs.
Bar = 0.07 pm (ci. 6}: 0.13 pm («)•
г
fin !>'>. Дс|п,11п строения соматического кортекса Spirostomum minus (а, в) и Microthorax sp. (б, г).
'» ...' influx с нид-шиплазматическими микротрубочками (стрелки) и многочисленными митохондриями. Звездочка —вакуоль с пиг-
.... "< гоплазмы Microthorax sp. Пелликула кутикулярного типа с сильно развитой эпиплазмой, пронизанной порами (боль-
шие стрелки) и субэпиплазматическими микротрубочками (стрелка).
Масштаб: 0.4 мкм (а, в); 0.3 мкм (б, г).
|:1ц HU I и hub. of the comatic cortex structure of Spirostomum minus (a, в) and Microthorax sp. (б, г).
« •> pm I tt| ihw HMtiphi•***♦ hi '. 'nunc, wиli Mipiacpiplasmic microtubules (arrows) and a numerous mitochondria. Asterisk— vacuoles with pigment granules, б, г —
। hiH .«I lip- н hiphiHHi bI W<i i:4h, н.п t|. I hr pellicle of cuticular type with well developed epiplasm which perforated by a pores (big arrows). The subepiplasmic mic-
rotubules also presented (arrow).
Bar = 0.4 pm (a, e); 0.3 pm (б, г).
Рис. 230. Детали организации переходной зоны ресничек у инфузорий отряда Peniculida.
а—в, д — Paramecium caudatunr, г — Fro/itoiiia mariner, 1 периферические дублеты микротрубочек. 2 - центральный дублет микротрубочек, 3 — аксосо-
ма, 4 — аксосомное кольцо, 5 — аксосомальная поперечная пластинка, 6 - фибриллярная спираль. 7 субьаксосомиая поперечная пластинка, 8 — терми-
нальная поперечная пластинка.
Fig. 230. Details transitional zone organization of cilia in ciliates of the order Peniculida.
a—в, d — Paramecium caudatunv, г — Frontonia marina', 1 — periphery microtubular doublet, 2 — central microtubular doublet, 3 — axosomc, 4 — axosomal ring,
5 — axosomal transitional plate, 6 — fibrillar helix, 7 — subaxosomal transitional plate, 8 — terminal plate.
Pile. 231. Особенности строения участка кортекса, прилежащего к кинетосоме у различных инфузорий.
и 1р .........содержат гранулы неизвестной природы {стрелка). Рядом с кинетосомой расположен один из каналов субпелликулярной ваку-
нчн|ШНИ «рмпрпппнный микротрубочками; б — Climacostomum virens. Момент выброса содержимого пигментной вакуоли; рядом с кинетосомой
ЩШЙ|ЖН1|* illiiinpn । п I ольджи; в — Paramecium caudatum с хорошо выраженными альвеолами {большая стрелка) и кинетодесмальными филамента-
ПН ИНЫМИ м щиик।hi.hi.ix гребнях, по бокам кинеты. Справа от кинетосомы — кинетосомальный сак {стрелка)', г — Frontonia leucas. Альвеолы за-
нннннЦЫ М|Н1Н1|||НП|н< мирным материалом. Ниже кинетосомы расположены цистерны аппарата Гольджи и микротрубочки. Звездочка — митохондрии.
Масштаб: 0.4 мкм.
Ilg. 231. Peculiarities of the cortical part belong to kinetosomal territory in different ciliates.
11 I'liiiodoii мр AIvmiiIi *h » । tihiniiiiiij1. some granules of unknown nature {arrow). Nearby kinetosome the canal of subpellicular vacuole system is located. It is surro-
unded liy hi hi i HiihiiluM t n i //iihh iis/omiim virens. The moment of extrusion some material from a parasomal sac is shown; close to the kinetosome the Golgi complex
in h it iilod, и imn < iiihhi I inn with well developed alveoli {big arrow) and kinetodesmal filaments is shown. The filaments are located aside of kinety in the
h и ip.l 11 ii II пи I vol ill nt, ( hi Hi»’ 11 phi nhlr id kinetosome parasomal sac is seen {arrow); г — Frontonia leucas. Some fine fibrillar material distributed inside of alveoles. Un-
di’i I he kinetosome the Golgi complex and microtubules are located. Asterisk — mitochondria.
Bar= 0.4 pm.
Рис. 232. Дериваты кинетосом и фибриллярные компоненты кортекса инфузорий.
а — участок кортекса Paramecium caudatum с дикинстидами и трихоцистами (поперечный срез). Звездочка - трихоцисты; большая стрелка — кинетодесмаль-
ный филамент; стрелка — постцилиарные микротрубочки;укороченная стрелка — надэлиплазматическнс микротрубочки; две реснички перерезаны на уровне
аксосомы; б — участок кортекса Spirostomum minus. Стрелка — постцилиарная микротубулярная лепта; «наконечник» — трансверсальные микротрубочки;
в — кинетодесмы в гребнях пелликулы Р. caudatum (стрелка); г — постцилиодесма Folliculina sp., состоящая из лен г постцилиарных микротрубочек (стрелка);
д — субпелликулярная фибриллярная сеть у Prorodon sp. Звездочка — элементы кортикальной фибриллярной сети; видна ресничка, перерезанная на уровне пе-
реходной зоны; е — соматические кинеты у Ladops-is benedictia. Параллельно ресничным рядам расположены кинетодесмы (стрелка); ж — нематодесма (боль-
шая стрелка), отходящая от кинетосомы у Prorodon sp.; в цитоплазме видны многочисленные полисомы и мукоциста (укороченная стрелка); з — продольная
эктоплазматическая «мионема» у S’, ambiguum; ниже расположена перерезанная ресничка и лента надэпиплазматических микротрубочек (стрелка).
Масштаб: 0.4 мкм.
Fig. 232. Kinetosome associated structures and fibrillar components of ciliate’s cortex.
a — part of Paramecium caudatum cortex with dikinetids and trichocysts (across section). Asterisk — trichocysts; big arrow — kinetodcsmal fibril; arrow — the po-
stciliary microtubular ribbon; arrowhead — supraepiplasmic microtubules; two cilia cut off at the level of axosome; 6 — part of the Spirostomum minus cortex, ar-
row — postciliadesme; light arrowhead — the transversal microtubules; asterisk — part of cortex filamentous network; в — kinetodesmes inside of the pellicular
combs of P. caudatum (arrow); г — postciliadesme of Folliculina sp., consisted of postciliary microtubule ribbons (arrow); d — subpcllicular fibrillar network in Pro-
rodon sp.; the cilium which is visible cut off at the level of transitional zone; e — somatic kineties of Ladopsis benedictia. The kinetodesmes are going along of ciliary’s
rows (arrow); ж — nematodesme (big arrow) going off from the Prorodon sp. kinetosome; in the cytoplasm a number of polyribosomes and a mucocyst (arrowhead)
arc visible; з— longitudinal ectoplasmic «mioneme» of S’, ambiguum; cilium with a typical structure and the ribbon of supraepiplasmic microtubules (arrow) are visible.
Bar = 0.4 pm.
Рис. 233. Трихоцисты представителей отряда Peniculida.
и V'liiriim Kii<I|hii / iimhuihi umuuitii с многочисленными трихоцистами; б — многочисленные трихоцисты в пелликуле F. leucas; в—д — детали строе-
нии I рпхишич у |1|к и ниш о ш и ।и uni I'urnmecium: в (Р. nephridiatum),? (Р. caudatum) — продольный срез через дистальную часть трихоцисты, д (Р. dubosc-
</1И| ПО11И|" чныИ • |" .ре । 1ни.1и <>11ярпый слой пелликулы, а — живая клетка, интерференционный контраст; б—д — электронограммы.
Масштаб: 2 мкм («), 0.4 мкм (б—б).
1>ц. 233. Trichocysts of representatives of the order Peniculida.
a purl of l''niiiluiii,i ,n iiiuihuIii 11 II « uh и ши । leious trichocysts; 6 — a number of trichocysts are located inside of pellicle ofF. leucas; в—d — details of trichocysts
eiiiisliiiclioil ill (lie p.rnir. I ‘ill .on,, Hun HTiii'Mnlaiivis: и (P. nephridiatum), г (P. caudatum) — longitudinal section of the distal part of trichocysts, д (P. duboscqui) —
in hi;'. Hou <>1 ihc .-dvcolar layer of pellicle, a — living cell, D1C; 6—d — electron micrographs.
Bar = 2 pm (a); 0.4 pm (6—d).
Рис. 234. Строение эктоплазмы у Protophrya ovicola (Oligohymenophorea) и Spirostomum minus (Heterotrichea).
a — граница соматического и орального кортекса у Р. ovicola. Дублеты соматических ресничек {большая стрелка), кинстосомы эндоральной мембраны
{стрелка). Митохондрии {снежинка) расположены субпелликулярно, между кинетами; б — граница соматического и орального кортекса у S. minus. Мито-
хондрии {снежинка) расположены равномерно около нижней границы кортекса. От кинетосом мембранел в глубь цитоплазмы отходят нематодесмальные
дериваты {стрелка). Продольно и поперечно расположены мионемы и пучки микротрубочек, осуществляющих сокращение тела простейшего {большие
стрелки).
Масштаб: 1 мкм.
Fig. 234, Structure of ectoplasm in Protophrya ovicola (Oligohymenophorea) and Spirostomum minus (Heterotrichea).
a — a border of somatic and oral cortex in P. ovicola. The dublets of somatic kinetids {big arrow), kinetosomes of endoral membranelle {arrow). Asterisk — subpellicu-
lar mitochondria are located between kineties; 6 — a border between oral and somatic cortex in S. minus. Mitochondria are located randomly along of low level of cor-
tex. The nematodesmal filaments are going into the cytoplasm {arrow). Longitudinal and across located «mionems» and a bandages of microtubules which connected
with a cell contractility {big arrows).
Bar = 1 pm.
Рис. 235. Микротрубочки в цитоплазме различных инфузорий.
н и । \ и ниг lopuiii.fii.ic (стрелки} микротрубочки у Paramecium caudatunr, г — поперечные ленты микротрубочек, подстилающие эктоп-
назму у Spirostomum minus', д — нематодесма в эндоплазме у Frontonia marina.
Масштаб: 0.5 мкм (а), 0.8 мкм (б—д).
Fig. 235. Microtubules in the cytoplasm of different ciliates.
uiiI'|m IIh и hi i и nd । н r,h и и I \ ) microtubules in Paramecium caudatunr, г — across-going microtubules under the ectoplasm of Spirostomum minus-, d —
nematodesmata in the endoplasm of Frontonia marina.
Bar = 0.5 pm (a); 0.8 цт (6—д').
Рис. 236. Ультратонкис детали строения сократительной вакуоли у представителей рода Paramecium.
ci — продольный срез через участок пелликулы с двумя выделительными порами (/< nephridiatum)\ б поперечный срез через альвеолярный слой пеллику-
лы в районе выделительной поры (Р. caudatum}-, в — трансверсальный срез через выдели тельную пору, расположенную между кинетами (Р. biaurelia ), в эк-
топлазме видны ленты микротрубочек, армирующих центральную ампулу сократительной вакуоли; <* поперечный срез через эктоплазму Р. nephridiatum.
Видны многочисленные ленты микротрубочек, армирующие цен тральную ампулу сокраписльпой вакуоли (стрелки}.
Масштаб: 1 мкм.
Fig. 236. Some ultrastructures of the contractile vacuole of Paramecium.
ci — longitudinal section of the part of pellicle with two contractile vacuole pores (P. nephridiatum}^ 6 across section of the alveolar layer of pellicle in the region of
contractile vacuole pore (P. caudatum}', в — transversal section of the contractile vacuole pore, located between kinetics (/< biaurelia}. The ribbons of microtubules,
covered the central ampule are seen in the ectoplasm; г — across section of the ectoplasm in P. nephridiatum. The ribbons of microtubules, covered the central ampule
are seen (arrows}.
Bar - 1 pm.
Рис. 237. Экструсомы различных инфузорий.
</, ч ipilMiHIHlHM Mh .1. |< । про ion и и. । jj и поперечный срезы); в — трихоцисты Pseudomicrothorax dubium (поперечный срез); г — токсицисты Dilep-
т\ инчгг (поперечный срез); д — мукоцисты Prorodon sp. (поперечный срез).
Масштаб: 0.4 мкм.
(‘тречм! КИНО |од»ч . ,н >| »%>. ш (.). стречка — трансверсальные ленты микротрубочек (г). Фотография в любезно предоставлена Клаусом Эсле-
ром, Тюбинген, Германия. (
Fig. 237. Extrusomes of different ciliates.
a. 6 - trichocysts ol'A7/< > » .p i1 < i и ’ । ' J и i. 11 .и к! .к toss sections); в — trichocysts of Pseudomicrothorax dubium (across section); г — toxicysts of Dileptus anser
(across section), trans vci•••J u.iiihni. . w< II \ r.ihlr (<//7<иг); d — mucocysts of Prorodon sp. (across section), transversal microtubules and kinetodesmes (large ar-
row} well visible.
Bar= 0.4 pm.
Рис. 238. Организация поликинет у некоторых инфузорий.
б — соматическая цирра у Stylonychia mytilus (поперечные срезы на разном уровне). Видны многочисленные нематодесмы, отходящие от кинетосом
{стрелки}-, в — участок зоны адоральных мембранелл у Blepharisma japonicum. Видны связи кинетосом в поликинете {стрелка} и постцилиарные дериваты
кинетосом {нижняя стрелка}.
Масштаб: 0.5 мкм.
Фотографии любезно предоставлены Клаусом Эйслсром, Тюбинген, Германия.
Fig. 238. Organization of polykinetids in some ciliatcs.
a, 6 — somatic polykineties of Stylonychia mytilus (across sections under the different levels). A numerous nematodesmata going off from kinetosomes are visible {ar-
rows}; в — part of zone of adoral membranelies of Blepharisma japonicum. A connection between kinetosomes inside of polykineties {arrow} and postciliary microtu-
bular ribbons of kinetosomes {low arrow} are detected.
Bar = 0.5 pm.
Рис. 239. Экто- и эндобионты различных инфузорий.
'< мнниипн||)М hi и । п h инки комплекса Vorticella convollaria, в районе адорального ресничного пояса; б — многочисленные эктобионтные бактерии
НШМ||МП1КЛм/hilus. Видны прикрепительные филоменты бактерий (стрелка); в, г — бактериальные эндобионты (звездочка) и гидрогеносо-
IHfniH'i........... > it tafus. Под плазматической мембраной видны мукоцистоподобные экструсомы (в), а — живая клетка, интерференционный
контраст; б—г — электронограммы.
Масштаб: 2 мкм (а), 0.5 мкм (б—г).
Fig. 239. Ecto- and endobionts of different ciliates.
• I limlPl III UH III? hI i i-II I и limp hi I he Vorticella convollaria complex; 6 — numerous ectobiotic bacteria on the surface of the Metopus striatus cell. Attached
Hliiiiioiih nt |||H hlllil*llH th • -и i-н I hi • un ). ч, / bacterial endobionts (asterisk?) and hydrogenosomes (snowflake) in the cytoplasm ofM striatus. Mucocyst-like extru-
niilHH hi»- * I'tlhli- । hiDi' in plasmatic membrane (в). Electron micrographs, a — living cells, DIC; 6—г — electron micrographs.
Bar = 2 pm (a), 0.5 pm (6—г).
Рис. 240. Цитоплазматические включения у различных инфузорий.
а — кортикальные пигментные гранулы у Spirostomum ambiguum', б — многочисленные митохондрии в кортсксе конъюгирующей Paramecium multimicro-
nucleatunr, в, г — «литосомы» — вакуоли с минеральным включением у Euplotes aediculatus, на фото г видны также цитоплазматические бактерии {стрелка).
а. б — живые клетки, интерференционный контраст; в, г — электронограммы.
Масштаб: 5 мкм {а. б); 1 мкм {в, г).
Фотографии а п г любезно предоставлены Клаусом Эслером, Тюбинген, Германия.
Fig. 240. Cytoplasmic inclusions in different ciliates.
a — cortical pigment granules of Spirostomum ambiguum', 6 — numerous mitochondria in the cytoplasm of Paramecium multiline ronucleatum\ в, г — «litosomes» —
inclusions with mineral substance in Euplotes aediculatus. Some cytoplasmic bacteria arc presented on the figure .• {arrow). a. 6 — living cells, DIC; в, г — electron
micrographs.
Bar= 5 gm {а, б); 1 pm {a. .•)-
Pit»!. 241. Варианты организации сократительных вакуолей у инфузорий на примере рода Paramecium.
•1 «<<hpH1II|lllhHH HUyilllh Ovi ill’"к<> 1Я[цих каналов и армирования микротрубочками центральной ампулы (Р. putrinum); б — сократительная вакуоль без
।ipinuинпннм МЙ1ШИОИ {КlillblMt- । 1н> г мпкротубулянтными лентами на поверхности центральной ампулы (стрелка); в—е — сократительные вакуоли с
npiiiHI'liillillMlI hllllHIIItMIP fl /* i" < hh.uiim (9—16 каналов), г — P. caudatum (6—8 каналов), 0 — P. tetraurelia (5—7 каналов), e — P. bursaria (5—7 кана-
jh"• .....иiciibHbie поры — множественные). Живые клетки, интерференционный контраст.
Масштаб: 10 мкм.
ИЦ. 'И \ 11 I > 11 10,1 О f the contaractile vacuole types in Ciliophora according in Paramecium.
a div coiilnicl llv vuviiolu wlllliu" ’ ”H’ ‘и,,' . ni.ih and microtubules on the surface of central ampule (P. putrinum); 6 — the contractile vacuole without collecting
* hiiiiIn (/’. hill will» lilh ♦. .< и i .ИI и 111 'in .n ., >i । i he surface of central ampule (arrow); в—e — the contractile vacuole with collecting canals: в — P. nephridia-
tutiip) 16 ennuis), ,* P. и* J t о P. tetraurelia (5—7canals),e— P. bursaria (5—7 canals; pores of contractile vacuole are numerous). Living
cells, DIC.
Bar = 10 pm.
Рис. 242. Детали организации ротового аппарата некоторых инфузорий.
а — нематодесмы («клюшки»), составлявшие ротовую «корзинку» Nassula omata. Давленый препарат живой клетки, интерференционный контраст; б —
участок зоны адоральных мембранелл Spirostomum minus; в — цитофарингиальные структуры (циртос) Pseudomicrothorax dubius, состоящие из нематодесм
(верхняя стрелка) и лент микротрубочек (стрелка), б—в —электронограммы.
Масштаб: 3 мкм.
Фото в любезно предоставлено Клаусом Эйслером, Тюбинген, Германия.
Fig. 242. Some details of oral apparatus in certain ciliates.
a — nematodesmata, constructed the oral basket of Nassula ornata. Crash preparation from the living cell, DIC; 6—part of oral membranelles zone in Spirostomum mi-
nus; в — cytopharyngeal structure (cyrtos) of Pseudomicrothorax dubius showing the nematodesmata (upper arrow) and associated microtubular ribbons (arrow).
6—в — electron micrographs.
Bar = 3 pm.
Рис. 243. Детали организации орального кортекса различных инфузорий.
a t't . - ч<1оп sp. Циркуморально расположенный нсматодесмальный аппарат (нижняя стрелка) и надэпиплазматические микротрубочки (стрелка)', б —
3 Mi’Mhp шеллы из состава орального кортекса у Frontonia marina. Нематодссма. отходящая в глубь цитоплазмы (стрелка); в — участок глотки Paramecium
cauihiliiHi . - тистальиый участок глотки Р. caudatum с дискоидальными везикулами (нижняя стрелка), транспортируемыми к месту образования фагосом
вдоль лепт цитофарингиальных микротрубочек (стрелка).
Масштаб: 1 мкм (а—в); 0.4 мкм (г).
Fig. 243. Some details of oral cortex organization in certain ciliates.
a- Гl^• l. >n sp. Ncmatodesmal apparatus located around of oral overture (low arrow) and supraepiplasmic microtubules (arrow); 6—3 membranells from the oral set
of b'rmuiua. Ncmatodesma going into the cytoplasm (arrow); в — part of the buccal cavity of Paramecium caudatum; г — distal part of the buccal cavity of
/' •Imiini with discoid vesicles (low arrow). The later arc transported to the place of phagosome formation along of ribbons of microtubules (arrow).
Bar = 1 pm (a—в); 0.4 pm (c).
Рис. 244. Ядерный аппарат различных инфузорий рода Paramecium.
а — участок живой клетки Р. caudatum, интерференционный контраст. Верхняя ше точка — макронуклсус. звездочка мпкронуклсус, видны глотка, сокра-
тительная вакуоль и кристаллы; б — живая клетка Р. bursaria. интерференционный контраст. с необычно большим количеством микронуклсусов (4); сне-
жинка — хлореллы; в — общий вид ядерпш о аппарата Р. calkinsi. Электронограмма.
Масштаб; 10 мкм (и. о); 3 мкм (в).
Fig. 244. The nuclear apparatus of genus Pnramecium.
a — part of the P. caudatum living cell, DIC. Upper asterisk — macronucleus: asterisk — micronuclcus; buccal cavity, contractile vacuole and crystals are visablc; 6 —
living cell of P. bursaria, DIC. with unusual large number of the mi (4); snowflake — Chlorelia cells; a — general view of the nuclear apparatus of P. calkinsi. Electron
micrograph.
Bar= 10 pm (a. of 3 pm (в).
Рис. 245. Цитоплазматические включения и структуры в клетках инфузорий.
и v'lih ши осомы с пищевыми бактериями {стрелка) и бактериальный эндоцитобионт, содержащий значительное число вирусных частиц; б — цистер-
ны iiiitiiipii । а 1 ош.джн в эндоплазме Protophrya ovicola; в — первичная фагосома в цитоплазме Spirostomum minus; г — мембраны ШЭР в эндоплазме Parame-
cium calkinsi; д — вторичная фагосома Р. nephridiatum; е — полисомы в эктоплазме Prorodon sp.
Масштаб: 1 мкм.
Fig. 245. Cytoplasmic inclusions and structures in ciliate cells.
,i pin 1of phagosome with food bacteria {arrow) and bacterial endocytobiont, containing a number of viral particles; 6 — cisterns of Golgi complex in the cytoplasm
<il Piiiio/'liiva ovicola; в — primary phagosome in the cytoplasm of Spirostomum minus; г — membranes of R.ER. in the endoplasm of Paramecium calkinsi; d— secon-
dary phagosome of P. nephridiatum; e — polyribosomes in the ectoplasm of Prorodon sp.
Bar = 1 pm.
Рис. 246. Варианты общей морфологии микронуклеусов (/ш) у инфузорий на примере представителей рода Paramecium.
а, б — Р. bursaria, mi «компактного» типа; в, е — Р. caudatum. mi «компактного» типа; г. г) — Р. putrinum, mi «компактного» типа; ж, з — Р. calkinsi, mi «эн-
досомного» типа; и — Р. jenningsi, mi «хромасомного» типа; к — Р. polycaryum, mi «везикулярного» тина; .7, л/ — Р. duboscqui, mi «эндосомного» типа; Р. пе-
phridiatum, mi «эндосомного» типа; о, п — Р. biaurelia, mi «везикулярного» типа, б, в, d, з, л, о — живые клетки, интерференционный контраст; а, г, е, ж, и, к,
м, н, п — фиксированные клетки, окраска по Фельгену. та — макронуклсус.
Масштаб: 3 мкм.
Fig. 246. Variation of general mophology of the micronuclci (mi) in ciliates according to example of the Paramecium genus.
a, 6 — P. bursaria, mi of the «compact» type; в, e — P. caudatum, mi of the «compact» type; г, d — P. putrinum, mi of the «compact» type; ж, з — P. calkinsi, mi of
the «endosomal» type; и — P. jenningsi, mi of the «chromosomal» type; /< — P. polycaryum, mi of the «vesicular» type; :i, л/ — P. duboscqui, mi of the «endosomal
type; P. nephridiatum, mi of the «endosomal» type: o. n — P. biaurelia, mi of the «vesicular» type, б, в, d, з, .7, о — living cells, DIC; а, г, e, ж. и. к, л/, и, п — fixed
cells, Fculgcn reaction, та — macronucleus.
Bar = 3 pm.
Put M /. Варианты ультраструктуры микронуклеусов (mi) у представителей рода Paramecium.
I* iillliliiliim I l-i <1 они... м । pa «ахрома! it новая» юна {стрелка)', б — Р. jenningsi', в — Р. biaurelia', г — Р. calkinsi-, д — Р. multimicronucleatum;
е - Р. nephridiatum-, ж — Р. duboscqui.
Масштаб: 1 мкм.
1‘ 1и -Н 1 ч ни . of uhrastructurc of the micronuclei (mi) in some representatives of Paramecium.
/’, caudalurn A< 111 < ч i > u 1111 > > . <>n< >.!<>• н> «I on ihc one of the poles {arrow)', 6 — P. jenningsi; в — P. biaurelia; г P. calkinsi; d — P. multimicronucleatum; e —
P. nephridiatum; ж — P. duboscqui.
Bar = 1 pm.
Рис. 248. Микронуклсус (mi) на различных стадиях клеточного цикла инфузорий.
а — делящееся ядро Paramecium bursaria (живая клетка, интерференционный контраст); б — необычная организация mi в клетках Р. caudatum, устойчивых к
инфекции бактериями Holospora undulata (окраска по Фельгену); в — деление ядра Prorodon sp.; г — участок mi Р. dubosequi с микротрубочками (стрелка)',
д — ядро Р. calkinsi со скоплениями микрофиламентов (стрелки)', е — участок «ахроматиновой» зоны mi Р. caudatum с многочисленными микрофила-
мептами.
Масштаб: 5 мкм (а, б); 0.5 мкм (в—<)); 0.1 мкм (е).
Fig. 248. The micronucleus (mi) at the different stages of cell cycle of ciliates.
a — mi division in Paramecium bursaria (living cell, DIC); 6 — unusual structure of the mi in cells of A caudatum, resistant against the infection of Holospora undula-
ta (Feulgen stained cell); в — mi division in Prorodon sp.; г — part of the mi of P. dubosequi with microtubules (arrow); d— mi of A calkinsi with a clusters of micro fi-
laments (arrows); e — part of the «achromatic» zone of the mi in P. caudatum with numerous microfilaments.
Bar= 5 pm (a, 6); 0.5 jim (в—d); 0.1 jim (e).
Рис. 249. Перинуклеарные и внутриядерные бактерии, инфицирующие предо иши гилей рода Paramecium.
а а двойное заражение ядерного аппарат (б. в) Р. uephridiatum и цитоплазмы (</). Сшреаки Holospora bacillata и перинуклеарные бактерии; г — акти-
вированная стадия бактерии //. undulata в циюплазмс инфузории Р. caudatum. За бакдерисп в щиоилазмс хорошо заметен менее электронно-плотиый мик-
рофиламентозный (актиновый?) «хвост», очевидно участвующий в передвижении бак i ерпн к комнарз менту окончательной локализации — микронуклеусу.
а — клетка, окрашенная по методу Фёльгсна; б ядро, выделенное из живой клеки. шиерферепциоппый контраст; в, г — электронограммы.
Масштаб: 5 мкм (а. б)-. 1 мкм (в.
Fig. 249. Perinuclear and endonuclcar bacteria invade ciliates of Paramecium.
a—в — double infection of the cytoplasm (a) and the nuclei (б, в) of P. nephridiaium. Arrows — Holospora bacillata and perinuclear bacteria; г — activated stage of
H. undulata in the cytoplasm of P. caudatum. Cytoplasmic microti lament «tail» with less electron density (ac tine?) clear visible beside and (mainly) after the bacterium.
These microfilaments presumably play a role in the bacteria transportation to the final compartment — micronucleus. a — Fculgen stained cell; 6 — infected nucleus
isolated from the living cell: «. e — electron micrographs.
Bar= 5 pm (а. б): I pm («. г).
Рис. 250. Начальные этапы конъюгации некоторых инфузорий.
а — образование пары у Loxophyllum meleagris. Инфузории агглютинируют передними концами тела, где расположен рот (стрелка); б — обмен пронуклеу-
сами у Parameciumputrinum (стрелка); в — слияние кортекса конъюгирующих клеток в зоне ротового аппарата у Frontonia acuminata; снежинка — место со-
единения партнеров; г — I мейотическое деление микронуклеуса у Р. putrinum (стадия спирализации хромосом); звездочки — микронуклеусы. Живые клет-
ки, интерференционный контраст.
Масштаб: 10 мкм.
Fig. 250. First conjugation steps of some ciliates.
a -—pair formation in Loxophyllum meleagris. Ciliates stick together by the anterior ends, where the oral apparatus is located (arrow); 6 — pronuclei exchanging in Pa-
ramecium putrinum (arrow); в — part of cortex fusion between a conjugants of Frontonia acuminata in the region of its oral apparatus; snowflake — indicates point of
pellicle fusion; г — I meiotic division of micronuclei in P. putrinum. Asterisk indicate micronuclei (chromosomes are visible). Living cells, DIC.
Bar = 10 pm.
Рис. 251. Особенности организации макронуклсуса инфузорий.
tl MIIOI HMIWIH И....... >|и.1 пп Minh |.ч 11<и । и я при /’. ciimlaium; 6 дополнительный слой уплотс..lx цис । ери Г)Р (стречка) вокруг оболочки макронуклеу-
ги; н фрИ1М»мн . ьф>п .< <i ip.i t1 ,«н,чн,1 ш,ии/,1 в окружении мембран Фрагмеш содержит нуклеолы с разным соотношением гранулярного и фибрил-
инрного ............. н< ohi.riihiii ип vi onio юна мл । рпкеа ядра /’. eaudatiim и окружении нукиеои (спцн-чкн); <) с i рук гура зачатка нового макронуклеу-
* н \ / iihiiiihi 11укпеоны о icv । с । nyioi, чисть xpoMin пип obpinycT iiJioiiii.ie глобулы различного размера.
Miiviii ndr, 0,2 мкм б); I мкм (к О).
Мц. 251. Soine leiiliiics of organization of'the macronuclcus in ciliates.
a numerous poivs in the en\ elope о I i he nib leii’i iii /' , ,ш,1,ннт; о additional layer of Hat cisterns of SER (arrow) around of the nuclear envelope; в — the frag-
ment of old macroi me lens mu loiimled by К Г К iiieinb.. in b'nmhHiia marina. The fragment has a nucleoli with different rate of granular and fibrillar components;
<• - unusual «empty» /one ol the undent niaii i\. winch surrounded by a number of nucleoli (arrow); d — structure of the macronuclear anlagen in F. marina, the nu-
cleoli are absent, pari of chromatin represented as a solid bodies with the different size.
Bar = 0.2 pm {a, 6); 1 pm {в—d).
Рис. 252. Особенности организации макронуклеуса инфузорий рода Paramecium при инфекции клетки бактериями рода Holospora.
а, б — ядрышковый аппарат макронуклеуса Р. caudatum с зараженным генеративным ядром. Сложные ядрышки (п) и образование полисом в ядре (б); в —
фибриллярные включения неизвестной природы, обнаруженные в ядре зараженной клетки; г — конгломерат фибриллярного материала различной структу-
ры (дегенерирующее ядрышко?) в макронуклеусе (стрелка), зараженном бактериями.
Масштаб: 0.5 мкм.
Fig. 252. Peculiarities of organization of the macronucleus in ciliates of Paramecium infected with ^o/as'/Mra-bacteria.
a, 6 — nucleolar apparatus of the macronucleus in P. caudatum infected with H. undulata. The complex nucleoli (a) and polyribosomes production in the nucleus (6);
в — fibrillar inclusion unknown nature in the infected cell; г — inclusion of fibrillar materials with different structure (degraded nucleolus?) inside of the nucleus infec-
ted with bacteria (arrow).
Bar = 0.5 pm.
Рис. 253. Killer-эндонуклеобионты инфузории Spirostomum ambiguum.
а — участок зараженного макропуклсуса. Стрелками обозначены бактерии, несущие R-тела; б, в — бактерия с R-телом и вирусными частицами (стрелка).
Продольный (б) и поперечный (в) срезы. R-тсло — скрученное в рулон тело белковой природы, связанное с токсическим действием зараженной инфузории
на апосимбиотических представителей того же вида.
Масштаб: 2 мкм (а); 0.2 мкм (б, в).
Fig. 253. Killer-endonuclcobionts of ciliate Spirostomum ambiguum.
a — part of the infected macronuclcus. Arrows indicated the bacteria bearing R-bodies; б, в — bacterium with R-body and viral particles (arrow). Longitudinal (б) и ac-
ross (в) sections. R-body — rolled proteinous ribbon, connected with the toxic action of infected ciliate to the aposymbiotic ones.
Bar = 2 pm (a); 0.2 pm (б, в).
Рис. 254. Репликация ДНК макронуклеуса (та) у инфузории Euplotes aediculatus (а, в) и Stylonychia mytilus (б).
а, б — «репликационные полоски» при светооптическом наблюдении (стрелки): а — фиксированная клетка с ядерным аппаратом, окрашенным по методу
Фёльгена; б — участок живой клетки, интерференционный контраст; в — электронограмма участка репликации в макронуклеусе.
Масштаб: 10 мкм (а); 1 мкм (б); 0.5 мкм (в).
Фотография в любезно предоставлена Клаусом Эйслером, Тюбинген, Германия.
Fig. 254. DNA replication process in the macronucleus (ma) of ciliate Euplotes aediculatus (a, в) and Stylonychia mytilus (6).
a, 6 — bunds of replication under the light microscopy (arrows): a — fixed cell, stained by Feulgen method; 6 — part of the living cell, DIC; в — place of replication in
the ma (electron micrograph).
Bar = 10 pm (a); 1 pm (6); 0.5 цт (в).
Рис. 255. Митохондрии различных инфузорий.
a Spirostomum minus-, б — бактериоподобное включение в матрикс митохондрии 5. minus-, в, г— митохондрии Р. nephridiatum с фибриллярными включе-
ниями {стрелки}-, д — митохондрия Stylonychia mytilus-, е — митохондрии Mesnilella fastigata.
Масштаб: 1 мкм {а, в—д}; 0.6 мкм (б).
Fig. 255. Mitochondria of different ciliates.
a — Spirostomum minus-, 6 — bacteria-like inclusion in the matrix of mitochondria of S. minus; в, г — mitochondria of P. nephridiatum with fibrillar inclusions {ar-
rows}; d — mitochondria of Stylonychia mytilus; e — mitochondria of Mesnilella fastigata. Electron micrographs.
Bar = 1 pm {а, в—d}; 0.6 pm {6).
Рис. 256. Детали организации спонгиома сократительных вакуолей у инфузорий.
а — Paramecium caudatum} б — Frontonia leucas} в — Ophryoglena sp.; г — P. nephridiatum.
Масштаб: 0.5 мкм.
Fig. 256. Some views of ciliate’s contractile vacuole spongiome.
a — Paramecium caudatum} 6 — Frontonia leucas} в — Ophryoglena sp.; г — P. nephridiatum.
Bar = 0.5 pm.
Рис. 257. Эндобионты различных инфузорий.
а бактерии в макронуклсусс и хлореллы в цитоплазме Frontonia leucas:, б — клетка Chlorella sp. в цитоплазме Р. bursaria-, в — пакеты спор микроспоридий
н цитоплазме Frontonia sp.; г — споры микроспоридий в цитоплазме Vorticella sp. а. б — элсктронограммы: «, г — живые клетки, интерференционный конт-
раст.
Масштаб: 2 мкм (а); 0.5 мкм (б); 10 мкм {в. г).
Fig. 257. Endobionts of different ciliates.
a — bacteria inside of the macronucleus and Chlorella algae in the cytoplasm of Frontonia leucas: 6 — Chlorella sp. in the cytoplasm of P. bursaria: в — packages of
microsporidian spores in the cytoplasm of Frontonia sp.: г — spores of microsporidia in the cytoplasm of Vorticella sp. a. 6 - electron micrographs, в, г — living cells,
DIC.
Bar= 2 pm (a); 0.5 pm (6); 10 pm (в. <)-
Рис. 258. Mate-killer эндобионты в цитоплазме Para-
mecium nephridiatum.
а — зараженная бактериями вегетативная клетка; б — конъю-
гирующая пара парамеций, одна из которых {правая) зараже-
на бактериями; в — цитоплазматическая бактерия, вызываю-
щая mate-killer эффект клетки хозяина. Видны многочислен-
ные вирусные капсиды и паракристаллическое тело
{снежинка), по-видимому обеспечивающее токсический эф-
фект. а, б — клетки, окрашенные по методу Фёльгена; в —
электронограмма.
Масштаб: 10 мкм {а, б); 0.5 мкм (в).
Fig. 258. Mate-killer endobionts in the cytoplasm of Paramecium nephridiatum.
a — infected vegetative cell; 6 — pare of conjugants; one of them {right) infected with the bacteria; в — the cytoplasmic bacteria produ-
ced a mate-killer effect of the host cell. Numerous viral capsids and a paracristal body {snowflake) which presumably supported to the
killer effect are visible, a, 6 — Feulgen stained cells; в — electron micrograph.
Bar = 10 pm {a, 6); 0.5 pm {в).
Рис. 262. Цисты покоя некоторых инфузорий.
а — Vorticella echini, б — Podophrya halophila, в — Enchelydium blattereri.
Масштаб: 40 мкм {а, б); 20 мкм (в).
Фотографии любезно предоставлены проф. В. Фойснером, Зальцбург, Австрия.
Fig. 262. The resting cysts of some cilaites.
a — Vorticella echini, 6 — Podophrya halophila, в — Enchelydium blattereri.
Bar = 40 pm {a, 6); 20 pm (e).
ТИП CILIOPHORA. ОБЩАЯ ЧАСТЬ
385
разделяются и передняя становится задней во вновь об-
разующемся переднем дублете, в то время как роди-
тельская задняя остается в этом же положении в возни-
кающей (дочерней) задней дикинетиде. Некоторые фиб-
риллярные компоненты при этом теряются и возникают
de novo у дочерних дублетов. Умножение соматических
поликинетид идет более сложно и изучено до сих пор
только для Paraurostyla (Jerka-Dziadosz, 1980).
Видоизменения кортекса. Часть соматического
кортекса некоторых инфузорий может видоизменяться
и служить для прикрепления клетки к субстрату. Наи-
более характерно развитие этих приспособлений для
симбиотических форм. Как правило, такие видоизме-
нения участка поверхности тела инфузории возникают
на переднем (тигмотактильная зона цилиатуры) или
заднем (огранеллы прикрепления) концах клетки. Для
тигмотактильных участков кортекса (например, у Соп-
chophthirus) изменений компонентов ресничек не от-
мечено, однако они значительно короче и их инфраци-
лиатура устроена иначе (Antipa, 1971). Прикрепление
симбиотических форм (Suctoria, Chonotricha, Peritri-
cha) часто происходит на стадии бродяжки при помощи
специального образования (скопулойд, скопула), кото-
рое позднее соединяются с образующимся стебельком
(Willey, Walkosz, 1975; Wibel et al., 1997). У свободно-
живущих форм прикрепление к субстрату осуществля-
ется различным образом (Hausmann, Hiilsmann, 1996;
Hausmann et al., 2003): посредством выделения слизи-
стого материала (Stentor), внутри- и внеклеточными
стебельками {Carchesium, Vorticella), пальцевидными
выростами {Epistylis и Erastophrya). Прикрепительные
аппараты подвижных перитрих и ряда эндобионтных
инфузорий работают по принципу присоски, что по-
зволяет не только быстро входить в контакт с хозяи-
ном, но и покидать его. Наиболее сложно устроенный
аппарат для прикрепления — прикрепительный диск
имеют представители отряда Mobilida (Peritrichia) —
Trichodina (Hausmann, Hausmann, 1981; Estes et al.,
1997).
Экструсомы. Часть кортекса инфузорий, иногда
только оральная, иногда лишь соматическая, несет раз-
личное число экструсом — пузырьковидных или вере-
теновидных структур с содержимым, которое может
выделяться наружу путем эндоцитоза. В настоящее
время для простейших известно около 10 типов этих
образований, часть которых встречается и у инфузо-
рий (Rosati, Modeo, 2003). Наиболее хорошо изучены
экструсомы некоторых представителей Peniculia —
трихоцисты (рис. 233, вкл.; 237, вкл.). Этот тип экстру-
сом (размером 2—4 X 0.4—1 мкм), занимающих по-
стоянное место в пелликуле, где их апикальные концы
имеют прямой контакт с плазматической мембраной
(посредством межмембранных частиц), имеет, по-ви-
димому, защитный характер, что экспериментально
показано для Paramecium (Harumoto, Miyake, 1991;
Knoll et al., 1991; Sugibayashi, Harumoto, 2000).
Содержимое трихоцисты парамеций в покоящемся
состоянии представлено паракристаллическим веще-
ством, в состав которого входят (по преимуществу)
два белка (Peterson et al., 1987). Форма трихоцист мо-
жет несколько различаться у разных инфузорий {Para-
mecium, Frontonia, Disematostoma, Pseudomicrothorax):
от бутылко- или амфорообразной до кеглевидной или
веретеновидной (рис. 233, а—в, вкл.; 237, а, вкл.). Ве-
роятно, что композиция паракристаллического содер-
жимого трихоцист также не одинакова у разных
инфузорий. Для трихоцист и мукоцист, характерных
для инфузорий из подклассов Peniculia и Hymenosto-
matia, показан генезис их из Гольджи-подобных струк-
тур в эндоплазме. Сформировавшиеся трихоцисты
попадают в кортикальный слой, где они встраиваются
в пелликулу. Их число у парамеций примерно втрое
меньше, чем количество ресничек. Так, у Р. multimic-
ronucleatum около 8000, у Р. caudatum около 5000, а у
Р. tetraurelia — около 1000 трихоцист (Hausmann, Al-
len, 1976; Hausmann, Hiilsmann, 1996; Plattner, 2002).
У парамеций экструзия трихоцист может быть
вызвана изменением концентрации ионов в окружаю-
щей среде (Plattner et al., 1984). Вершина трихоцисты
соприкасается с плазматической мембраной между кор-
тикальными альвеолами посредством кольцевой струк-
туры (розетки слияния), образованной 8—11 меж-
мембранными частицами (Plattner, 2002). Экструзия
происходит в два этапа: сначала сливаются плазмати-
ческая мембрана и мембрана трихоцисты и затем в те-
чение миллисекунды содержимое экструсомы выстре-
ливает наружу, удлиняясь примерно в десять раз. Сра-
зу вслед за этим мембрана трихоцистной вакуоли
отделяется от плазматической мембраны и распадает-
ся на мелкие везикулы, которые мигрируют в эндо-
плазму и используются для синтеза новых экструсом.
Полная замена трихоцист клеткой происходит за
время менее 10 ч, что указывает на значимость этих
структур. Однако мутанты, лишенные трихоцист, пол-
ностью жизнеспособны. Опыты тем не менее показы-
вают, что такие мутанты поедаются хищниками {Di-
leptus, Monodinium, Climacostomum) значительно быст-
рее, чем «нормальные» парамеции (Harumoto, 1994;
Miyake, Harumoto, 1996; Sugibayashi, Harumoto, 2000).
Мукоцисты во многом напоминают трихоцисты
(рис. 232, д, ж, вкл.; 237, д, вкл.; 239, в, вкл.). Они так-
же имеют паракристаллическое содержимое, состоя-
щее из нитчатых составных элементов. При экструзии
это содержимое, однако, разворачивается в трехмер-
ную сеть филоментов, что требует нескольких секунд.
Их функции неясны, хотя, предположительно, муко-
цисты участвуют в процессе инцистирования, харак-
терного для многих инфузорий и при построении ло-
рики и других защитных «футляров», выделяемых не-
которыми Ciliophora.
Токсицисты несомненно служат орудием нападе-
ния и защиты. Этот тип экструсом наиболее распро-
странен у хищных инфузорий (рис. 237, г, вкл.). При
экструзии из капсулы токсицисты выстреливает труб-
ка, либо выварачивающаяся как палец перчатки, либо
удлиняющаяся телескопически. Вонзившись в тело
жертвы, трубки токсицист механически удерживают
добычу и парализуют ее. Соответственно назначению
токсицисты располагаются обычно около ротового ап-
парата (представители классов Litosomatea и Prostoma-
tea). Сходные задачи выполняют гаптоцисты у Suctoria
и, возможно, рабдоцисты у некоторых Karyorelictea
(Lynn, Corliss, 1991; Rosati, Modeo, 2003).
Пигментные гранулы. Некоторые инфузории
обладают постоянной окраской, обусловленной при-
сутствием в кортексе специальных пигментоцист
25 Зак. №4163
386
ALVEOLATA
или пигментных гранул, локализованных вдоль кинет
(рис. 229, а, вкл.; 240, а, вкл.). Пигменты стенторин у
Stentor и блефаризмин у Blepharisma, содержащиеся в
таких окруженных мембраной гранулах, обеспечива-
ют фоточувствительность этих инфузорий и имеют
определенную защитную функцию (Miyake et al., 1990;
Miyake, Harumoto, 1995; Miyake et al., 2001).
В состав соматической части кортекса входят так-
же постоянные образования, связанные с комплексом
сократительных вакуолей (поры, которые открывают-
ся на поверхности кортекса) и с процессом питания
инфузорий (цитопрокт, через который происходит де-
фекация вакуолей с непереваренными пищевыми
остатками) (рис. 220, Л; 227 в, е—з, вкл.). В зависимо-
сти от видовой принадлежности расположение этих
кортикальных структур может быть различным (так
же как и детали их устройства), но чаще поры сократи-
тельных вакуолей открываются в определенных мес-
тах на дорсальной стороне тела, а цитопрокт распола-
гается в задней части инфузории на вентральной ее
стороне. Так, у Paramecium и Tetrahymena эти струк-
туры хорошо различимы как на живых объектах (при
использовании дифференциального интерференцион-
ного контраста), так и при импрегнации кортекса се-
ребром (рис. 227, вкл.). У парамеций поры сократи-
тельных вакуолей открываются в передней и задней
трети дорсальной поверхности соматического кортек-
са (Фокин, 1986, 2002), у тетрахимен — латерально в
правой задней части клетки (Nanney, 1980), у F. 1еи-
cas — в середине дорсальной стороны тела (Foissner
et al., 1994).
Поры сократительных вакуолей. Поры сократи-
тельных вакуолей могут быть единичными: одна ваку-
оль — одна пора или множественными — до 3—5 пор
на одну вакуоль (рис. 220, Л; 227, вкл.; 236, вкл.; 241, б,
е, вкл.) и соответственно они располагаются в кортек-
се (в составе кинет или в межкинетном пространстве)
над тем участком эндоплазмы, где локализованы ос-
тальные компоненты комплекса сократительной ваку-
оли (Patterson, 1980; Фокин, 1986; Fokin et al., 1999).
Исключение составляют некоторые виды (Ps. dubius,
Р. putrinum, Lembadion bullinum), у которых пора при-
обретает вид извитого выводного протока значитель-
ной длины (до 5—10 мкм). У большинства же видов
инфузорий поры сократительных вакуолей представ-
ляют собой короткий (иногда чуть расширенный к
концу) цилиндрический канал, стенки которого арми-
рованы спирально скрученными микротрубочками
(рис. 236, вкл.). Основание поры закрывает плазмати-
ческая мембранная диафрагма, отделяющая выводной
канал от резервуара сократительной вакуоли. Это мем-
бранное образование исчезает при систоле сократите-
льной вакуоли и после выбрасывания порции жидко-
сти, «схлорываясь» восстанавливает изолированность
содержимого вакуоли от внешней среды.
Цитопрокт. Цитопрокт — гребневидный удлинен-
ный выступ на пелликуле, который вытянут вдоль
тела, начинаясь (у Paramecium) за ротовой зоной кор-
текса (рис. 220, Л; 227, з, вкл.). Около этой кортикаль-
ной органеллы альвеолы, эпиплазма и филаментозная
сеть прерываются, и эндоплазма соприкасается с плаз-
матической мембраной. У представителей подкласса
Choreotrichia цитопрокт отсутствует (Lynn, Small,
2000). Наиболее полно эта органелла исследована у
Paramecium (Allen, Wolf, 1974). Процесс дефекации за-
нимает лишь несколько секунд. Фагосомы, оказавшие-
ся в зоне цитопрокта, попадают к нему, видимо, за счет
«направляющих» микротрубочек, отходящих от кор-
текса в глубь эндоплазмы. После слияния мембран пи-
щеварительной вакуоли и плазмалеммы содержимое
фагосомы попадает в окружающую клетку среду, а фа-
госомная мембрана везикулируется на множество пу-
зырьков, возвращаемых в мембранную транспортную
систему инфузории.
Эктобионты. С поверхностью соматического кор-
текса инфузорий нередко связаны эктобионты, в боль-
шинстве случаев бактерии (рис. 239, а—в, вкл.). Они
наиболее типичны для инфузорий из анаэробных мес-
тообитаний (Fenchel, Finlay, 1991). Вероятно, для мно-
гих видов, обитающих в местах с дефицитом кислоро-
да, характер такого симбиоза должен быть облигат-
ным, однако специально этот вопрос в большинстве
случаев не исследовался. Известен по крайней мере
один достоверный случай реального облигатного сим-
биоза между инфузориями и их эктобионтами — без-
рогая кареореликтида Kentrophoros, которая питается
за счет бактерий, постоянно присутствующих на до-
рсальной поверхности ее тела (Fenchel, Finlay, 1989).
Оральный кортекс. Часть кортекса, связанная с
ротовыми структурами инфузорий, носит название
оральной (рис. 220, Л; 226; 227, а, б, г, д, вкл.; 242, вкл.;
243, вкл.). Она может быть сильно специализирована
в связи с процессом питания, и ее морфологическое
строение значительно варьирует в пределах типа Cili-
ophora. Представители подкласса Suctoria не имеют в
дефинитивном состоянии ни ресничек, ни ротового ап-
парата, а на расселительной стадии бродяжек-томитов
обладают только соматической цилиатурой (Довгаль,
1996,2002). Роль рта у этих инфузорий выполняют щу-
пальца, тогда как у большинства остальных инфузорий
(кроме Astomatia) всегда имеются оформленные цито-
фарингиальные структуры, служащие для захвата
пищи. Окружающая рот цилиатура часто тоже оказы-
вается измененной в связи с функцией питания.
Наиболее просто устроены оральные зоны у пред-
ставителей Litostomatea и Prostomatea, у которых пе-
редние кинетиды каждой соматической кинеты диф-
ференцированы в дикинетиды. У литостомей транс-
версальные микротубулярные ленты формируют и
поддерживают форму цитофарингса (Foissner, Foiss-
ner, 1985). У простомат эту роль выполняют постци-
лиарные микротрубочки (Huttenlauch, Bardele, 1987).
Реснички этой зоны могут быть несколько длиннее,
чем соматические, а иногда они образуют мелкие по-
ликинеты (щетки). Часто у этих инфузорий в состав
оральной зоны кортекса входят специализированные
экструсомы (Lynn, Corliss, 1991).
Представители класса Nassophorea также имеют
оральные дикинетиды и оформленный постцилиарны-
ми лентами микротрубочек цитофарингс. Эти инфузо-
рии, однако, обладают наиболее сложно устроенной
ротовой структурой, называемой корзинкой, или цир-
тосом (рис. 242, а, в, вкл.). Микротубулярные тяжи в
совокупности с нематодесмами облегчают прохожде-
ние пищи в цитоплазму (Hausmann, Peck, 1979). Пред-
ротовые структуры у представителей этой группы
ТИП CILIOPHORA. ОБЩАЯ ЧАСТЬ
387
оформлены как поликинетиды. Когда оральная зона
образует углубление (глотку), как например у предста-
вителей Peniculia — Paramecium, Frontonia или Aeo-
bursaridium, поликинеты, именуемые в данном случае
пеникулюсами и квадрилюсом, оказываются погру-
женными (рис. 227, а, б, г, д, вкл.; 243, б, вкл.; 244, а, б,
вкл.). Биение их ресничек создает ток, увлекающий в
глотку к ротовому отверстию бактерий или других ин-
фузорий, служащих пищей.
Олигохименофоры являются преимущественно
бактериофагами-фильтраторами. Система олигохиме-
ниума: 3 продольные поликинеты на левой стенке
глотки и пароральная (эндоральная) мембрана, распо-
ложенная под углом к ним на правой, создает опти-
мальные условия для захвата и фильтрации из окружа-
ющей среды бактерий и других мелких объектов. Рес-
нички поликинет осуществляют направленный ток
воды, а пароральная мембрана служит фильтром, за-
держивающим бактерий в глотке. В зоне ротовых по-
ликинет отсутствуют альвеолы, а расположение пара-
сомальных саков и филаментозных дериватов кинето-
сом отлично от соматической зоны кортекса (Lynn,
Corliss, 1991).
Спирально закрученная адоральная зона поликине-
тид у Spirotrichea настолько заметна, что она дала на-
звание всему классу (рис. 242, б, вкл.). Эти инфузории,
используя оральные реснички, одновременно создают
ток воды к ротовому отверстию и фильтруют находя-
щиеся в воде мелкие пищевые объекты (Fenchel, 1986).
Долгое время крупные кольподиды Bursaria и
Woodrujfia, также имеющие адоральную зону полики-
нетид, причислялись к спиротрихам (Corliss, 1979). На
самом деле структура соматических кинетид (в том
числе и переходной зоны ресничек) различна в этих
двух классах Ciliophora, и на этом основании упомяну-
тые виды были перемещены в Colpodea (Lynn, Corliss,
1991; Foissner, 1993; Фокин, 1995). Кроме того, харак-
тер фильтрации воды в ротовом аппарате кольподид
больше напоминает Oligohymenophora, чем Spirotri-
chea (Fenchel, 1986).
Среди представителей Phyllopharyngea имеются
виды с сильно различающимся устройством ротовой
зоны. У хонотрих, очевидно, произошло простое пере-
мещение части соматической цилиатуры, с изменени-
ем ее позиции на 180°. В отрядах Chlamydodontida,
Disteriida и Hypocomatida большинство инфузорий об-
ладают корзинковидным цитофарингсом, или цирто-
сом, весьма напоминающим ротовой аппарат Nasso-
phorea (Corliss, 1979). Наконец, как было уже отмече-
но, Suctoria не имеют рта, и питание осуществляется у
этих инфузорий через специализированные пищевые
щупальца, обладающие сложным микротубулярным
«скелетом».
Безротые инфузории, относящиеся в подавляющем
большинстве к подклассу Astomatia класса Oligohy-
menophorea, по-видимому, питаются эндоцитозом, с
использованием парасомальных саков, или пиноци-
тозом, через пелликулу. Вопрос этот до сих пор не изу-
чен, но наблюдения над безротыми мутантами Tetra-
hymena (Rasmussen, Orias, 1975) говорят в пользу
существования таких возможностей. Особый случай
питания безрогой инфузории за счет эндоцитоза экто-
бионтных бактерий, постоянно присутствующих на
дорсальной стороне клетки инфузории, описан для
представителя Karyorelictea — Kentrophoros (Centro-
phorella) (Faure-Fremiet, 1950a; Fenchel, Finlay, 1989).
Домики. Помимо кортекса, имеющего в том числе
и защитные функции, некоторые инфузории выделяют
на поверхность тела постоянные защитные образова-
ния типа лорики или футляра. Чисто гиалиновая или
армированная (агглютинированная) природными час-
тичками лорика присутствует у всех представителей
отряда Tintinnida (Spirotrichea) и у некоторых Hetero-
trichea: Folliculina, Stentor. Виды, имеющие лорику
или футляр, встречаются и в других группах инфузо-
рий, но, по-видимому, не среди литостомей и нассофо-
рей (Lynn, Corliss, 1991). Развитие лорики изучено
пока лишь для нескольких форм, в том числе для Eufol-
liculina (Mulisch, Hausmann, 1983). Для этой инфузо-
рии было показано, что в секреции лорики участвуют
мукоцистоподобные тельца, расположенные в кортек-
се инфузорий.
Эндоплазма и ее включения
Основные органеллы и системы клетки инфузорий
расположены в эндоплазме. Наиболее заметные из
них, особенно при светооптическом микроскопирова-
нии, — элементы ядерного аппарата, пищеваритель-
ные и сократительные вакуоли (рис. 244, а, б, вкл.; 245,
а, в, д, вкл.). Как уже было отмечено, присутствие в
клетке инфузорий ядер двух типов — соматического
(макронуклеус) и генеративного (микронуклеус) —
считается неотъемлемой особенностью типа Ciliophora
(рис. 244, вкл.). До сих пор не найдено одноклеточных,
принадлежащих к этому типу, у которых отсутствовал
бы ядерный гетероморфизм. Некоторое время таковым
считался Stephanopogon, имеющий несколько одина-
ковых ядер (Raikov, 1969; Corliss, 1979), но, по совре-
менным данным, это простейшее принадлежит к гете-
ротрофным жгутиконосцам (Lipscomb, Corliss, 1982;
Patterson, Brugerolle, 1988). Макронуклеусы, как пра-
вило, очень крупные ядра, богатые ДНК, делящиеся
амитотически. У некоторых инфузорий соматическое
ядро представлено в вегетативных клетках множест-
вом фрагментов, а у кариореликтид макронуклеусы
сравнительно мелкие, содержат мало ДНК (парадип-
лоидные) и не способны делиться. Потеря макронукле-
уса для инфузории всегда легальна, тогда как клетки,
лишенные микронуклеуса, могут при определенных
условиях существовать и даже давать жизнеспособные
амикронуклеарные линии (Fokin, Ossipov, 1981; Ng,
1986).
Микронуклеус. Микронуклеусы — мелкие, обыч-
но шаровидные ядра, редко превышающие 10 мкм в
диаметре (рис. 244, вкл.; 246—248, вкл.). Если инфузо-
рия имеет 1 или 2 микронуклеуса, то часто они распо-
лагаются рядом с соматическим ядром или даже в его
углублении, хотя у многих (особенно крупных) инфу-
зорий, которые имеют множественные (до 10 и более)
генеративных ядер, они могут находиться в различных
местах эндоплазмы. У Karyorelictidae ядра часто обра-
зуют комплексы (группы) сближенных ядер, в состав
каждой из которых входят 2 или несколько макронук-
леусов и 1 микронуклеус (Райков, 1978). В редких
388
ALVEOLATA
случаях — у представителей Cyrtolophosidida (Colpo-
dea) — микронуклеус оказывается включенным в
перинуклеарное пространство макронуклеуса и ядер-
ный комплекс, имеющий общую оболочку, становится
неразрывным (Foissner, 1993; Raikov, 1996). Обычно
же микронуклеус инфузорий имеет типичную ядер-
ную оболочку, несущую значительное число пор.
Хроматин микронуклеусов в большинстве случаев
сильно конденсирован й представляет собой одно или
несколько плотных хроматиновых тел, занимающих
большую часть объема ядра (рис. 246, вкл.; 247, вкл.).
Тем не менее морфология этих ядер у разных инфу-
зорий, часто даже близкородственных, может существен-
но различаться. Например, среди видов рода Parameci-
um есть обладающие генеративными ядрами «компакт-
ного», «хромосомного», «эндосомного» и «везикулярного»
типа (Fokin, 1997). У некоторых представителей Кагу-
orelictae имеются «спермальные» микронуклеусы (Rai-
kov, 1996).
Кариоплазма генеративных ядер помимо хрома-
тина может содержать белковые тела, кристаллоиды,
центры организации микротрубочек, микрофиламен-
тозные агрегаты (Raikov, 1996; рис. 248, вкл.). Изредка
кариоплазму и перинуклеарное пространство мик-
ронуклеуса могут заселять бактериальные эндобионты
(Gortz, 1986; Фокин, 1993; Fokin, 2004а; рис. 249, а,
вкл.).
Деление микронуклеусов инфузорий происходит
по типу внутриядерного (закрытого) ортомитоза (Рай-
ков, 1978). Перед делением хромосомы ядра конденси-
руются и образуют метафазную пластинку. Аппарат
веретена деления в это время становится заметным, а
форма микронуклеуса, изменяясь, становится эллип-
соидной (рис. 248, а, в, вкл.). В веретене деления гене-
ративного ядра выявляются микротрубочки двух ро-
дов: непрерывные (тянущиеся от одного полюса ядра
до другого) и связанные с кинетохорами хромосом (за-
канчивающиеся на одном из полюсов). Позиция кине-
тохоров и детали их морфологии могут несколько раз-
личаться у разных инфузорий. Иногда они не одинако-
вы даже в пределах родовой группы (Paramecium}
(Lewis, 1975). На стадии анафазы—телофазы происхо-
дит наибольшее удлинение ядра, приводящее к тому,
что дочерние микронуклеусы оказываются на проти-
воположных концах делящейся клетки. Это необычно
длинное веретено деления обеспечивает гарантирован-
ное попадание генеративного ядра в каждую из дочер-
них клеток, а при реорганизации ядерного аппарата
в ходе конъюгации — попадание зачатков макро- и
миронуклеусов в концевые участки цитоплазмы, что
необходимо для их последующей диференцировки
(Yang, Takahashi, 2002).
Ядерная оболочка, интактная на всех стадиях карио-
кинеза, может непосредственно становиться оболоч-
кой дочерних микронуклеусов (Paramecium, Nassula,
Didinium и многие другие виды). У ряда видов: Dilep-
tus, Blepharisma, Stentor — под внутренней мембраной
делящегося ядра образуется новая оболочка дочерних
ядер, после чего двойная мембрана «родительского»
ядра распадается (Райков, 1978; Осипов, 1981).
Как генеративное ядро микронуклеус способен к
двуступенчатому мейозу. Характерной особенностью
профазы I мейотического деления микронуклеуса мно-
гих инфузорий является своеобразная стадия «серпа»,
когда линейные размеры ядра значительно увели-
чиваются и оно приобретает соответствующую форму.
У некоторых инфузорий эта стадия отсутствует, а про-
фазное ядро напоминает «парашют». Нередко инфузо-
рии, принадлежащие к одной группе (Paramecium,
Frontonia), имеют разную морфологию профазного
микронуклеуса (Fokin et al., 2001).
Хромосомы микронуклеуса обычно мелкие и
многочисленные — гаплоидный набор от 16 до 150
(рис. 250, г, вкл.), хотя у Tetrahymena генеративное
ядро имеет лишь 5 пар хромосом. У некоторых видов
известна вариация числа хромосом между клонами.
Для Р. bursaria, Р. putrinum и Р. caudatum показано,
что генеративное ядро не является диплоидным, каким
оно обычно считается у инфузорий, а представляет со-
бой низкополиплоидное образование (Chen, 1940; Jan-
kowski, 1972; Осипов, 1981; Fokin, 1997).
В составе кариоплазмы микронуклеусов не выявля-
ются ядрышкоподобные структуры (рис. 247, 248,
вкл.) и транскрипционная активность этого ядра при-
нимается близкой к нулю. Соответственно этот тип
ядер инфузорий обычно считался инертным в вегета-
тивной жизни клетки. Однако за последнюю четверть
века накопилось много данных о роли генеративного
ядра в процессах морфогенеза и особенно стоматоге-
неза различных инфузорий (Фокин, 1978, 2002). Экс-
периментальное удаление микронуклеуса у различных
инфузорий (Paramecium, Tetrahymena, Euplotes, Pseu-
dourostyla, Stylonychia} всегда приводит к нарушениям
нормального хода стоматогенеза и функционирования
ротового аппарата инфузорий, а также общего морфо-
генеза клетки (Фокин, 1983а, 19836; Ng, 1986; Tam,
Ng, 1986; Takahashi, 1988; Lu, Ng, 1991; Oka, Mikami,
1996; Фокин, 2002). При этом даже в пределах рода Pa-
ramecium существует некоторая видовая специфика
этих функций микронуклеуса и связанных с ними кле-
точных процессов (Фокин, 1983а, 19836; Tam, Ng,
1986).
Стоматогенетическая роль генеративного ядра в
ходе ядерной реорганизации при конъюгации инфузо-
рий хорошо известна (Осипов, Тавровская, 1969; Ng,
1986; Chau, Ng, 1989). Таким образом, очевидно, что
некоторые (единичные) гены микронуклеуса активны
на протяжении всего жизненного цикла инфузорий.
В этом смысле противопоставление морфогенети-
ческой роли генеративного ядра в половой и вегетатив-
ной части жизни клетки, которое обычно подчеркива-
ется в литературе, оказывается неоправданным. Эта
роль должна быть распространена на весь жизненный
цикл инфузорий.
Макронуклеус. Соматическое ядро инфузорий —
макронуклеус, в вегетативной жизни транскрипцион-
но активно, обычно называется полиплоидным. На са-
мом деле организация этого типа ядер у инфузорий
значительно варьирует в разных группах и, как пра-
вило, амплификации подвергается не весь геном ядра,
а лишь его часть (иногда весьма незначительная, как у
гипотрих). Еще большее разнообразие имеют морфо-
логия макронуклеуса, его размеры и форма. В зависи-
мости от видовой принадлежности макронуклеус ин-
фузорий может быть сферическим, удлиненным, кол-
басовидным, лентовидным, бобовидным, кустистым,
ТИП CILIOPHORA. ОБЩАЯ ЧАСТЬ
389
четкообразным или разделенным на две и более части
(Райков, 1978; Raikov, 1996). Размеры соматического
ядра, по-видимому, находятся в соответствии с вели-
чиной клетки инфузории, и у крупных форм (Bursaria,
Spirostomum) макронуклеус может достигать длины
2 - -3 мм.
Ядро окружено типичной ядерной оболочкой с
многочисленными порами (рис. 251, вкл.), число кото-
рых может существенно варьировать, но обычно (Pa-
ramecium, Tetrahymena) достигает 100 и более на
1 мкм2. Внешняя мембрана оболочки макронуклеуса
часто контактирует с эндоплазматическим ретикулу-
мом и иногда с оболочкой микронуклеусов (Raikov,
1969; Осипов, 1981; Raikov, 1996).
При светооптическом наблюдении макронуклеус
кажется заполненным достаточно плотным хромати-
ном, как правило, дающим интенсивную окраску на
ДНК, выявляемую по методу Фельгена. Электронно-
микроскопические исследования этого ядра инфузо-
рий показывают, что в его матриксе расположено
обычно большое число мелких хроматиновых тел
(0.1—0.5 мкм диаметром), часто аностоматизирующих
между собой. Помимо хроматина макронуклеус всегда
содержит значительное число нуклеол (часто весьма
крупных — до 1—2 мкм), состоящих из гранулярного
и фибриллярного компонентов различной конфигура-
ции и площади (рис. 251, вкл.; 252, вкл.). У некоторых
видов постоянно (или в определенном физиологиче-
ском состоянии) большинство нуклеол расположено
вплотную к внутренней мембране ядерной оболочки.
Размеры, структура и положение нуклеол как структур
очень динамичных зависят от состояния клетки и
условий внешней среды (рис. 251, в—д, вкл.; 252, а, б,
вкл.).
В качестве дополнительных элементов (включе-
ний) в макронуклеусе могут встречаться плотные или
рыхлые фиброзные белковые сферы (Blepharisma, Hal-
teria, Lacrimaria, Stentor), актиновые микрофиламенты
и микротрубочки (Stylonychia, Tetrahymena, Parameci-
um, Acineta) и нередко бактериальные эндобионты
(Raikov, 1969; Осипов, 1981; Gortz, 1986; Фокин,
1993а; Fokin, 2004а; Raikov, 1996; рис. 249, а—в; 252, в,
г; 253). Значительно реже — в макронуклеусе некото-
рых инфузорий — Р. putrinum, Eupletes sp. и Paraholos-
ticha sterkii могут поселяться жгутиконосцы (Gortz,
1996).
У некоторых инфузорий (Phyllopharyngea) макро-
нуклеус дифференцирован на две части (два кариоме-
ра): ДНК-богатый ортомер и ДНК-бедный парамер
(Янковский, 1973; Radzikowski, 1985). Ортомер может
окружать парамер, как это имеет место у Chilodonella.
Если ортомер содержит многочисленные плотные хро-
матиновые тела и нуклеолы, то парамер состоит лишь
из эндосомы (конденсированного ДНК-содержащего
тела). Функциональное значение гетеромерии остается
пока неясным.
Репликация ДНК проходит в макронуклеусе в тече-
ние интерфазы и занимает значительное время (Rai-
kov, 1996). Для большинства инфузорий этот процесс
идет асинхронно, однако у Hypotrichida и части Oligo-
trichida репликация ДНК происходит локально (поло-
ски репликации), волнообразно перемещаясь вдоль
ядра (Gall, 1959; Raikov, 1996; рис. 254, вкл.). Как пра-
вило, репликации предшествует компактизация ядра
или слияние его частей (в случае существования не-
скольких фрагментов).
Деление макронуклеуса инфузорий (за исключени-
ем соматических ядер Karyorelictea, которые вообще
не делятся) происходит амитотически (Raikov, 1978,
1996). Оно не включает конденсацию хромосом и не
связано с качественным изменением и точной сегрега-
цией содержимого ядра. Характерно, что микротру-
бочки, обычно появляющиеся в кариоплазме на стадии
удлинения макронуклеуса, не связаны с хроматином и
служат, по-видимому, именно для вытягивания ядра.
У представителей Heterotrichida микротрубочки, также
сопровождающие деление макронуклеуса, располага-
ются вне ядра (Jenkins, 1977). У некоторых гипотрих
(Stylonychia) перед началом вытягивания макронукле-
уса происходит интенсивная ротация кариоплазмы,
механизм которой пока не известен. Функционально
такое «перемешивание» содержимого ядра способст-
вует, по-видимому, эквивалентному распределению
хромосомного материала между дочерними макронук-
леусами. После вытягивания делящийся макронуклеус
образует два, как правило равных, компактных про-
дукта (дочерних ядра). Далее они приобретают форму
и размеры нативного макронуклеуса (удлиненный,
четковидный, фрагментированный и т. д.). В ряде слу-
чаев (Suctoria, Astomatida) возможно также неравное
деление или почкование макронуклеуса, причем оно
может быть единичным или множественным. Быстрое
развитие нового соматического ядра из почки или мел-
кого фрагмента (одного сегмента четковидного ядра у
Stentor или Spirostomum) представляет собой регенера-
цию и показывает, что даже незначительная часть мак-
ронуклеуса эквипотентна целому ядру (Фокин, Сково-
родкин, 1991).
Несмотря на элиминацию части генома микронук-
леуса (при развитии макронуклеуса), в некоторых слу-
чаях возможно говорить о распределении геномов в
ходе деления соматического ядра (Colpodidae, Нуше-
nostomatia). Так, у Tetrahymena делящийся макронук-
леус содержит около 90 хроматиновых кластеров, со-
ответствующих, по-видимому, геномным наборам
(Raikov, 1995; Nilsson, 2000). Показано, например, что
содержание ДНК в таких агрегатах у Tillina соответст-
вует диплоидному хромосомному набору (Frenkel,
1982).
Количество ДНК в макронуклеусах инфузорий (на
стадии GJ варьирует от 1.4 пг (Uronema) до 38 000 пг
(Bursaria). Соматическое ядро Т. termophila, например,
содержит 10 пг ДНК, разные Paramecium — от 70 до
300, крупные виды Stylonychia — около 1000, и Sten-
tor — 3000 пг (Raikov, 1996). Таким образом, количе-
ство ДНК макронуклеуса в целом оказывается пропор-
ционально размерам инфузории. Количество ДНК в
макронуклеусах во много раз превышает этот показа-
тель для дипйоидного генеративного ядра: в 23 раза у
Т. termophila, в 430 раз у инфузорий группы Р. aurelia
и в 6500 раз у Spirostomum (Райков, 1978), что и служи-
ло поводом говорить о полиплоидности соматического
ядра инфузорий (Райков, 1967).
Сравнение нуклеотидных последовательностей
ДНК макронуклеуса и микронуклеуса показало умень-
шение (для ряда видов значительное) размера генома
390
ALVEOLATA
нативного соматического ядра. Это означает, что при
развитии макронуклеуса происходит редукция ряда
последовательностей (Steinbriick, 1983, 1986; Ammer-
mann, 1985). Если для Tetrahymena такие потери со-
ставляют 10---15 % (Gorovski, 1980; Karrer, 2000), то у
Stylonychia при развитии нового макронуклеуса теря-
ется свыше 95 % генома микронуклеуса (Steinbriick,
1990). Таким образом, нативный макронуклеус у мно-
гих видов инфузорий состоит по большей части из
многочисленных копий лишь некоторых генов или их
комплексов. Поскольку амплификация части генети-
ческого материала не соответствует классическому по-
нятию полиплоидии, Шварцем (Schwartz, 1978) для
макронуклеусов инфузорий был предложен термин
«амплиплоидия», что в большей степени соответству-
ет современным данным о генетической природе сома-
тического ядра Ciliophora (Raikov, 1996).
Данные биохимии, электронной микроскопии и осо-
бенно результаты пульсэлектрофореза показывают,
что макронуклеус инфузорий не содержит целых хро-
мосом. Очевидно, при развитии макронуклеуса хромо-
сомы фрагментируются, какие-то их части утрачива-
ются или перестраиваются (Blackbum, Karrer, 1986;
Raikov, 1996). По-видимому, возможны два пути ре-
организации генома соматического ядра инфузорий.
В первом случае макронуклеус содержит достаточно
длинные молекулы ДНК, представляющие собой фраг-
менты хромосом (субхромосомы). Каждый из таких
фрагментов содержит несколько или даже много ге-
нов. Так дело обстоит у Tetrahymena и Paramecium
(Karrer, 1986, 2000; Preer, 1989; Steinbriick, 1990). Воз-
можно, что эта модель реализуется также у Stentor,
Blepharisma, Bursaria и Colpoda (Raikov, 1996). Другой
путь наиболее типичен для гипотрих: макронуклеус
содержит лишь короткие фрагменты ДНК (минихро-
мосомы), соответствующие одному гену (Steinbriick,
1990; Bleyman, 1996; Raikov, 1996). Нечто подобное
происходит у некоторых олиготрихид и циртофорид,
например у Halteria и Chilodonella (Metenier, Huf-
schmid, 1988). Подсчеты показывают, что базовый ге-
ном макронуклеуса гипотрих (Oxytricha, Stylonychia и
Euplotes) состоит из 10—40 тыс. минихромосом. При-
нимая во внимание, что количество копий этих образо-
ваний также весьма значительно, можно говорить о
миллионах минихромосом в одном макронуклеусе.
Митохондрии. Инфузории не нуждаются в специ-
альной дыхательной системе, поскольку кислород и
углекислый газ свободно диффундируют через пел-
ликулу клетки. Однако большинство этих простейших
имеют митохондрии — органеллы дыхания, свойст-
венные всем эукариотам и содержащие типичный
набор ферментов: цитохромов и цитохром-оксидаз
(Blum, 1996). Хорошо заметные митохондрии (1—
3 мкм) располагаются в эндоплазме, хотя обычно они в
большом числе входят и в состав кортекса (Lynn, Cor-
liss, 1991; рис. 229, вкл.; 234, вкл.; 240, б, вкл.; 255,
вкл.). Совокупность митохондрий именуется хонд-
риомом, который в некоторых случаях имеет строго
определенную клеточную топографию. Число мито-
хондрий значительно варьирует у разных инфузо-
рий и, по-видимому, зависит от размеров клетки, видо-
вой принадлежности и экологии этих простейших.
Так, у представителей комплекса Т. pyriformis около
1500 митохондрий, у Paramecium — в несколько раз
больше.
Матрикс митохондрий отделен от цитоплазмы
двойной мембраной (рис. 255, вкл.). Внутренняя мемб-
рана образует многочисленные выросты (кристы), за-
полняющие объем органеллы. Характерной чертой ми-
тохондрий инфузорий считается присутствие в них то-
лько трубчатых крист, которые могут иметь разную
упорядоченность и размеры (рис. 229, вкл.; 255, вкл.),
но никогда не переходят в пластинчатые, дисковидные
или пузырьковидные (Lynn, Corliss, 1991; Серавин,
1993; Фокин, 1993а; Фокин и др., 1993; Paulin, 1996;
Карпов, 2001). Помимо крист в матриксе митохондрий
иногда обнаруживаются кристаллические или фибрил-
лярные включения (рис. 255, в, г, вкл.). Крайне редко
структура митохондрий (видимо, в связи с физиологи-
ческим состоянием клетки) может быть нарушена
(Yusa, 1964), в том числе и в результате инфекции этих
органелл бактериоподобными симбионтами (Yamata-
ka, Hayashi, 1970; Puytorac, Grain, 1972; Fokin et al.,
2003; рис. 255, б, вкл.).
В анаэробных условиях значительная часть пред-
ставителей 8 отрядов инфузорий (Armophorida, Entodi-
niomorphida, Haptorida, Heterotrichida, Odontostomati-
da, Plagiopylida, Thigmotrichida и Vestibuliferida) утра-
тила митохондрии и приобрела их функциональный
аналог — гидрогеносомы (Muller, 1988; Fenchel, Fin-
lay, 1991, 1995). Гидрогеносомы—небольшие пузырь-
ки (0.5—1.5 мкм), ограниченные двойной мембраной
(рис. 239, в, г, вкл.), содержат ферменты, окисляющие
пируваты и малаты, с освобождением молекулярного
водорода. Обычно эти структуры рассматриваются как
дериваты утраченных в эволюции митохондрий (Кар-
пов, 2001).
Другие мембранные органеллы. Помимо мито-
хондрий или гидрогеносом в эндоплазме инфузорий
встречается значительное число других мембранных
органелл и структур, характерных для эукариотной
клетки (Allen, 1988; Paulin, 1996). Среди них перокси-
сомы — мелкие тельца округлой формы, ограничен-
ные мембраной и содержащие оксидазы; лизосомы
(первичные и вторичные) — мелкие вакуолеобразные
тельца (0.5—0.8 мкм), содержащие литические фер-
менты и играющие исключительную роль в клеточной
защитной системе, системе пищеварения и транспорта
(Allen, Fok, 1993; Blum, 1996; Radek, Hausmann, 1996).
Мембранные компоненты эндоплазмы представлены
эндоплазматическим ретикулумом (как гладким, так и
содержащим многочисленные рибосомы) и его дери-
ватами: аппаратом Гольджи (диктиосомами) и мемб-
ранными составляющими системы сократительных ва-
куолей (рис. 234, а, вкл.; 245, б, г, вкл.; 256, вкл.).
Включения. В эндоплазме, как правило, содержит-
ся некоторое количество продуктов метаболизма клет-
ки в виде капель жира, гликогена и кристаллов (крис-
таллоидов). В зависимости от физиологического со-
стояния и видовой принадлежности эти включения
могут быть более или менее многочисленными. Крис-
таллы, обнаруженные в цитоплазме инфузорий, всегда
заключены в вакуоль и состоят прежде всего из со-
лей кальция и фосфора (рис. 240, б, г, вкл.; 244, а, вкл.;
250, б, вкл.). Также в виде включений у инфузорий от-
мечены соли бария (Loxodes) и магния (Lynn, Corliss,
ТИП CILIOPHORA. ОБЩАЯ ЧАСТЬ
391
1991; Hausmann, Hiilsmann, 1996; Grover et al., 1997;
Creutz et al., 2002). Считается, что конкреции солей
кальция в цитоплазме Spirostomum играют функцио-
нальную роль в процессах сокращения—вытягивания
у этой инфузории (Vivier et al., 1969).
Эндобионты. Весьма обычным явлением можно
теперь считать присутствие в эндоплазме (а иногда и в
кортексе) инфузорий эндобионтных микроорганизмов
(рис. 239, в, г, вкл.; 240, г, вкл.; 244, б, вкл.; 245, а, вкл.;
256, в, вкл.; 257, вкл.; 258, вкл.). Это могут быть другие
инфузории (Suctoria), водоросли, грибы, дрожжи, мик-
роспоридии и наиболее часто бактерии (Heckmann,
Gortz, 1991; Фокин, 1993а; Fokin, 2004а; Gortz, 1996,
1998). Так, для представителей рода Paramecium опи-
сано свыше 30 различных бактерий, могущих заселять
цитоплазму инфузорий (Heckmann, Gortz, 1991; Фо-
кин, 1993а; Fokin, 2004а). Как правило, бактериальные
эндобионты не могут жить вне тела хозяина, и в этом
смысле они безусловно являются облигатными. Инфу-
зории же, за исключением их части, приуроченной к
анаэробным местам обитания, некоторых видов рода
Euplotes, Parauronema acutum и, возможно, Climacos-
tomum, могут существовать без каких-либо внутрикле-
точных бактерий (Фокин, 1993 а; Fokin, 2004а). Доста-
точно часто в природе можно обнаружить «зеленых»
инфузорий, в цитоплазме которых постоянно поддер-
живаются водоросли (рис. 244, б, вкл.; 257, а, б, вкл.),
наиболее типичны — Chlorella sp. В ряде случаев воз-
можно поддержание в цитоплазме Chiliophora и плас-
тид, попавших в хозяина в составе пищевых объектов
(водорослей, жгутиконосцев и т. д.) и стабилизировав-
шихся в цитоплазме инфузорий в качестве эндобион-
тов (Laval-Peuto, Febvre, 1986).
Фагосомы. Значительное число пищеварительных
вакуолей (фагосом) и ассоциированных с ними струк-
тур обычно наблюдается в клетках физиологически ак-
тивных инфузорий, обладающих фаготрофным типом
питания (рис. 245, а, в, д, вкл.). По пищевым предпоч-
тениям инфузории делятся на целый ряд групп (см. об-
щую характеристику типа), и соответственно в фаго-
сомах можно обнаружить самые разные включения.
Считается, что пиноцитоз возможен у инфузорий че-
рез парасомальные саки (Radek, Hausmann, 1996).
Многие Ciliophora — бактериофаги. Образование
фагосом и дальнейший пищеварительный цикл наи-
более подробно были изучены именно для этих Cilio-
phora (Paramecium, Tetrahymena'). Очевидно, в общих
чер тах он сходен у всех инфузорий (рис. 259, Б). Фаго-
сомы образуются в цитостоме, в конце глоточного
углублении, за счет замыкания пойманных бакте-
рий (пли других пищевых объектов) в мембрану. Эта
мембрана происходит от дискоидальных пузырьков
(0.3 мкм диаме тром), во множестве аккумулирующих-
ся на эндоплазматической поверхности так называе-
мой «ребристой стенки» глотки парамеции (рис. 243, г,
вкл.). Подобные структуры были обнаружены также у
Climacostomum, Eu/blliculina и Euplotes (Radek, Haus-
mann, 1996).
Было рассчи тано, ч то клетка парамеции затрачивает
около 16 000 мкм2 мембран для образование фагосом в
течение 20 мин питания. Очевидно, что эти мембраны
не возникают de novo, а мигрируют по транспортной
системе клетки от уже сформировавшихся пищевари-
тельных вакуолей (при уменьшении их объема на
II стадии пищеварения) и (или) из зоны цитопрокта.
Рециклирующие мембраны разной конфигурации об-
наружены у всех исследованных в этом отношении ин-
фузорий (Fok, Allen, 1988; Lynn, Corliss, 1991; Allen,
1995; Radek, Hausmann, 1996).
Процесс пищеварения у инфузорий включает по
крайней мере 4 стадии: I — образование фагосом, II —
их закисление — конденсацию, III — слияние с лизо-
сомами, с последующим перевариванием содержимого
вакуолей, VI — дефекацию (рис. 259, Б). На стадии за-
кисления (сразу после образования пищеварительной
вакуоли) фагосомы сливаются с ацидосомами, что
приводит к резкому снижению значений pH и созда-
нию оптимальной среды для действия литических фер-
ментов (для Tetrahymena ацидосомы не найдены).
Образованные вакуоли за счет циклоза, со скоростью
примерно 3 мкм/с, перемещаются по эндоплазме.
В процессе движения, вероятно, принимают участие
актомиозиновая система и микротрубочки, связанные
с цитофарингсом (рис. 235, а—в, д, вкл.; 259, Б, 3).
В течение нескольких минут на поверхности фагосом
образуются выросты, отшнуровывающиеся в цито-
плазму, что приводит к компактизации фагосомы (ста-
дия II; рис. 259, Б, 5—6) и трансформации свойств ее
мембраны (Allen, Fok, 1983). Далее вокруг фагосомы
накапливаются лизосомы (рис. 259, Б, 6) и через 7—
8 мин после начала циклоза они синхронно сливаются
с ее мембраной, трансформируя вакуоль в фаголизосо-
му (стадия III; рис. 259, Б, 7). Комплекс энзимов, вхо-
дящий в состав лизосом, переваривает пищу, а от по-
верхности вакуоли снова отшнуровывается значитель-
ное число пальцевидных выростов — рециклирующих
лизосом (стадия IV; рис. 259, Б, 8, вкл.). Пищеварение
завершается за 20—25 мин. После этого фагосомы ока-
зываются способными вследствие очередного измене-
ния их мембраны к взаимодействию с микротрубочка-
ми, направляющими их к цитопрокту (Fok, Allen, 1993;
рис. 259, Б, 11). Процесс дефекации описан в разделе,
посвященном кортексу.
Сократительные вакуоли. Работа системы осмо-
регуляции, поддерживающей определенный баланс
жидкости и солей внутри клетки инфузорий (особенно
пресноводных), направлена на удаление излишней
воды, которая проникает извне, и регуляцию ионного
состава цитоплазмы с помощью различных ионных
помп и каналов. У большинства инфузорий она пред-
ставлена в эндоплазме комплексом одной или несколь-
ких (многих) сократительных вакуолей (сферических
образований переменного диаметра), включающих
(в наиболее полном виде) спонгиом, систему соби-
рающих каналов (канала) и центральную ампулу
(рис. 241, вкл.; 256, вкл.; 259, А). Вакуоль сравнитель-
но медленно заполняется жидкостью (диастола) и пе-
риодически быстро опорожняется во внешнюю среду
(систола), вследствие чего ее размер изменяется во
времени в среднем от 2 до 20 мкм (в зависимости от
видовой принадлежности). Частота пульсаций сокра-
тительных вакуолей у разных инфузорий не одинакова
и, по-видимому, зависит от размера клетки простейше-
го и осмомолярности окружающей среды: у мелких
форм сокращения более часты, чем у крупных, а у не-
которых морских инфузорий — очень редки. Для час-
392
ALVEOLATA
Рис. 259. Схемы организации сократительной вакуоли (А) и процесса пищеварения (Б) у Paramecium.
А: 1 — ленты микротрубочек на поверхности приводящих каналов и центральной ампулы, 2 — пора, 3 — участок спонгиома, 4 — приводящие каналы. (По:
Jurand, Selman, 1969); Б: 1 —ряды микротрубочек с дискоидальными везикулами, 2 — ацидосомы, 3 — постфагальные микротрубочки, 4 — первичная пи-
щеварительная вакуоль (pH = 7), 5 — образование вторичной пищеварительной вакуоли (pH = 5), 6 — вторичная пищеварительная вакуоль на стадии слия-
ния с лизосомами (pH =3), 7 — третичная пищеварительная вакуоль (pH повышается от 3 до 6), 8 — четвертичная пищеварительная вакуоль, готовая к
транспорту в зону цитопрокта (77), 9 — аппарат Гольджи, 10 — эндоплазматический ретикулюм. (По: Fok, Allen, 1993, с изменениями). Жирная стрелка
указывает на ротовое отверстие, куда поступает пища (бактерии); тонкие стрелки — пути перемещения клеточных мембран (вакуолей), вовлеченных в про-
цесс пищеварения.
Fig. 259. Schemes of contractile vacuole organization (A) and process of digestion (5) in Paramecium cell.
A: 1 — microtubular ribbons on the surface of collecting canals and a central ampoule, 2 — pore, 3 — part of spongiom, 4—collecting canals; Б: 1 — microtubular rib-
bons with discoidal vesicles, 2 — acidosomes, 3 — postphagal microtubules, 4 — primary digestive vacuole (pH = 7), 5 — appearance of secondary digestive vacuole
(pH = 5), 6 — secondary digestive vacuole at the stage of fusion with lysosomes (pH = 3), 7 — third step of (pH increased from 3 to 6), 8 — forth step of digestive vacu-
ole development, whichisready for transportation to cytoproct (77) area, 9—Goldgi apparatus, 10— endoplasmic reticulum. Fat arrow is indicating on oral overture,
arrows indicate ways of membranes (vacuoles) transportation during digestion process.
ти морских форм сократительные вакуоли вообще не
обнаружены.
Относительно движения воды в цитоплазме ин-
фузорий нет однозначного мнения. Вероятно, и отток
жидкости из эндоплазмы в систему сократительных
вакуолей осуществляется комбинацией нескольких
пассивных (физических) и активных (биохимических)
процессов. Спонгиом инфузорий, осуществляющий пер-
вичный сбор жидкости, представляет собой комплекс
постоянно присутствующих в цитоплазме «жестких»
трубочек шириной около 60 нм и системы мембран
гладкого эндоплазматического ретикулума (лакун и
пузырьков), связанной с просветом собирающего ка-
нала (каналов). Этот комплекс у Paramecium представ-
ляется наиболее сложным. У большинства видов рода
имеется несколько (от 5 до 16) приводящих, радиально
расположенных, каналов, связанных с собственными
спонгиомными участками (рис. 259, А). Именно там
происходит выход жидкости в просветы каналов, с об-
ратным транспортом большинста ионов, содержащих-
ТИП CILIOPHORA. ОБЩАЯ ЧАСТЬ
393
ся в растворе. Скапливаясь некоторое время в каналах,
жидкость из них поступает (обычно синхронно) в цен-
тральную ампулу, что приводит к значительному уве-
личению объема последней (Patterson, 1980). Для ряда
инфузорий наличие специальных собирательных кана-
лов не выявлено, иногда такие отличия демонстриру-
ют близкородственые виды (представители родов Pa-
ramecium и Frontonia).
Характер сокращения объема центральной ампулы
сократительной вакуоли инфузорий дает основание
думать, что оно осуществляется активно за счет сокра-
тимых элементов, окружающих центральную ампулу.
В случае инфузорий рода Paramecium определенную
роль в этом процессе могут играть ленты микротрубо-
чек, армирующие приводящие каналы и с них пере-
ходящие на стенки центральной ампулы (рис. 241, б;
259, Л). Далее эти микротубулярные ленты в виде про-
туберанца сходятся к поре сократительной вакуоли,
образуя в ее стенке плотную спираль (Jurand, Selman,
1969). Аналогичные микротубулярные ленты выявле-
ны и для Р. duboscqui, не имеющей в сократительных
вакуолях приводящих каналов (Фокин, 1986). Струк-
тура и топография пор сократительных вакуолей, вхо-
дящих в состав кортекса инфузорий, обсуждались ра-
нее в соответствующем разделе.
Морфогенез
В ходе жизненного цикла многие инфузории могут
значительно менять свой облик, при этом некоторые
органеллы или их комплексы исчезают или появля-
ются заново, увеличиваясь или уменьшаясь в числе.
Процесс закономерной трансформации морфологии и
состояния клетки простейших в целом называют мор-
фогенезом (Hausmann, Hiilsmann, 1996). Одним из наи-
более регулярно повторяющихся морфогенетических
процессов в ходе жизненного цикла инфузорий счита-
ется процесс клеточного деления (рис. 260, А). Деле-
ние клетки инфузорий затрагивает самые разнообраз-
ные стороны ее организации, и в сравнительном аспек-
те его изучение дает много ценной информации о
таксономических и филогенетических связях в преде-
лах группы. Помимо кариокинеза, кратко рассмотрен-
ного выше, особенное значение имеет кортикальный
сомато- и стоматогенез, в ходе которого дочерние
клетки восстанавливают характерный набор клеточ-
ных компонентов и план строения своего тела (Гераси-
мова, 1989; Lynn, Corliss, 1991; Lynn, 2003).
Деление. Деление у инфузорий может происходить
в активной фазе или в цисте размножения и может
быть моно- или политомическим (Foissner, 1996). При
монотомическом делении, которым обладает боль-
шинство инфузорий, в результате деления образуются
две дочерние особи: протер — передняя и опистер —
задняя (рис. 260, Л). Палинтомическое деление (палин-
томия, стробиляция или почкование) приводит к по-
явлению нескольких (многих) дочерних особей, как
правило отличающихся от материнской клетки мень-
шими размерами (рис. 260, Б). Этот тип деления харак-
терен для апостомат, астомат, хонотрих и сукторий
(рис. 260, Б-, 261). Монотомическое деление может
быть трансверсальным (деление вдоль главной оси
тела, что происходит у большинства инфузорий), энан-
тиотропическим (при котором происходит некоторое
отклонение оси деления от главной оси тела — Oligo-
trichia) или продольным (когда оси продуктов деления
располагаются параллельно — Peritrichia).
Перед завершением клеточного деления в норме
все компоненты тела инфузории должны быть удво-
ены. Для соматических структур это прежде всего
кинетосомы с их фибриллярными дериватами, поры
сократительных вакуолей и цитопрокт. Образование
новых кинетосом происходит обычно в связи с предсу-
ществующими, и этот процесс, начавшись еще в интер-
фазный период, интенсифицируется у болыпинста ин-
фузорий перед стоматогенезом. Новые поры сократи-
тельных вакуолей также появляются перед самым
процессом деления. У большинства инфузорий, облада-
ющих 1 терминальной сократительной вакуолью (Tetra-
hymena), ее сохраняет задний продукт деления. Если
сократительных вакуолей две, то обе дочерние клетки
получают по одной предсуществующей поре и одну до-
страивают заново (Paramecium). Сходным образом вос-
создается в ходе деления цитопрокт: поскольку обычно
он располагается в задней части клетки, передний про-
дукт деления (протер) должен образовать эту органеллу
заново. В случае сидячих форм (Chonotricha) органоид
прикрепления также образуется заново у протера.
Кортикальный стоматогенез в ходе клеточного де-
ления — одна из наиболее интенсивно изучаемых
проблем цилиатологии. Как уже было отмечено, осо-
бенности стоматогенеза позволяют систематикам вы-
являть филогенетические связи между группами инфу-
зорий, что и определяет повышенный интерес иссле-
дователей к этой проблематике (Corliss, 1979; Puytorac
et al., 1994; Eisler, Fleury, 1995). Кроме того, изучение
особенностей стоматогенеза инфузорий (и их морфо-
генеза вообще) составляет предмет исследования био-
логии развития как удобный пример субклеточной
дифференцировки (Nanney, 1980; Frankel, 1989). В ка-
честве примера использования данных по стоматоге-
незу можно привести историю помещения хонотрих в
класс Phyllopharyngea вместе с циртофоридами. Осно-
вываясь на морфостатических характеристиках, было
бы трудно распознать связь этих значительно различа-
ющихся групп (Lynn, Corliss, 1991). Однако исследо-
вание развития ротовых и соматических частей кор-
текса при почковании хонотрих ясно показало их зна-
чительное сходство с циртофоридами (Guilcher, 1951;
Янковский, 1973).
Стоматогенез. Представители каждого класса ин-
фузорий в целом обладают идентичным типом стома-
тогенеза. Последовательность событий при развитии
нового ротового аппарата инфузорий в значительной
мере сходна. Сначала появляется зачаток структуры,
располагающийся обычно в районе экватора материн-
ской клетки. Далее начинается пролиферация кинето-
сом, входящих в ротовые структуры. Она происходит в
большинстве случаев в связи с предсуществующими
кинетами. У гипотрих, некоторых олиготрих и энтоди-
ниоморфид, однако, оральные кинетосомы образуются
de novo (Corliss, 1979; Foissner, 1996). При умножении
кинетосом может сохраняться структура кинет (хапто-
риды, простоматиды, циртофориды и кольподиды) или
пролиферация идет так интенсивно, что исходная
394
ALVEOLATA
Б
Рис. 260. Жизненный цикл у Folliculina (Л) и у Ichthyophthirius (Б).
А: 1 — прикрепленная инфузория, 2 — 4 — процесс деления, 5 — бродяжка, 6 — 10 — образование лорики, 11 — трофонт. (По: Mulisch, Patterson, 1987, с из-
менениями); Б: а — теронт, b — инцистированне в тканях хозяина, с — циста, d—выход из тела хозяина, е — инцистирование в донных осадках с последую-
щим палинтомическим делением. (По: Mehlhorn, 1988).
Fig. 260. Life cycle of Folliculina (A) and Ichthyophthirius (Б).
A: I — sessile ciliate, 2 — 4 — process of division, 5 — swarmer, 6— 10 — secreting anew lorica, 11 — trophont; Б: a — theront, b — encystment inside host tissue,
c — cyst, d — release of the host body, e — encystment in the sediment and consecutive palintomic fission.
ТИП CILIOPHORA. ОБЩАЯ ЧАСТЬ
395
Рис. 261. Жизненный цикл Chonotricha.
/I —- типичный цикл; развитие на нелиняющих (а) и линяющих (б) рачках; Б— ббразование телотомитов; В — трофогенез.
1—8 — рост' трофоптоп, 9 77 — конъюгация, 20—30 — почкование и полигеммия, 34—37 — образование трофотомитов. (По: Янковский, 1973).
Fig. 261. Life cycle of Chonotrichs.
/—8 — trophonl growth, 9—17 — conjugation, 20—30 — budding and polygemmy processes, 34—37 — trophotomont’s formation.
396
ALVEOLATA
структура ресничных радон полностью исчезает (раз-
личные группы инфузорий). Наконец, у ряда инфузо-
рий дифференцировка оральных структур связана с из-
менением топографии (ротацией или перемещением)
зачатка. Завершение стоматогенеза обычно совпадает
с началом цитокинеза — разделения материнской
клетки надвое.
Согласно выше перечисленным особенностям, сто-
матогенез инфузорий подразделяют на следующие
главные типы (Foissner, 1996): I — апокинетальный (ро-
товой аппарат развивается вне связи с предсущест-
вующими структурами), II — паракинетальный (в связи
со специальными посторальными соматическими кине-
тами), III — буккокинетальный (в связи с предсущест-
вующей оральной инфрацилиатурой), IV — телокине-
тальный (в связи с предсуществующей соматической
инфрацилиатурой) и V — миксокинетальный (когда в
развитии принимают участие и соматические кинеты, и
родительский ротовой аппарат). I тип стоматогенеза ха-
рактерен для большинства представителей Oligothrichia
и Hypotrichia; II — для многих Heterotrichea и Кагуоге-
lictea; III — для большинства Oligohymenophorea; IV —
для Protostomatea, Colpodea, Litostomatea и Phyllopha-
ryngea и V — вероятно, для Apostomatia (Foissner, 1996).
Инцистирование. Весьма перспективным феноме-
ном для изучения морфогенеза считаются процессы
ин- и эксцистирования. Инцистирование — переход
подвижных простейших в покоящуюся стадию, свя-
занный с переживанием неблагоприятных условий или
размножением (рис. 260, Б; 262, вкл.), — явление ши-
роко распространенное среди инфузорий, хотя для не-
которых групп (Paramecium) способности образовы-
вать цисты не выявлено (Corliss, 1979; Фокин, 2002).
Как было уже отмечено, существенную роль в образо-
вании стенок цисты играет наличие у инфузорий муко-
цист, за счет экструзии которых формируются ее слои.
Очевидно, что процесс образования стенки цисты
включает несколько стадий, так как обычно в ней вы-
является несколько различно устроенных слоев (от 1
до 4) и зрелая циста часто представляет собой образо-
вание со сложной архитектоникой (Bussers, 1984;
рис. 262, вкл.). При инцистировании большинство ин-
фузорий теряет свой ротовой аппарат и соматическую
цилиатуру (Matsusaka, Noguchi, 1989; Diaz et al., 2000).
Образование цист деления или питания не приводит к
глубоким изменениям в инцистирующейся клетке и
сложность устройства самой цисты оказывается значи-
тельно меньшей.
Обратный процесс эксцистирования также связан с
существеными морфогенетическими перестройками
клетки инфузории, направленными на воссоздание
активной, подвижной формы. При выходе из цисты
покоя клетки либо прорывают ее стенку (Euplotes),
либо покидают цисту через специальное отверстие
(микропиле) — Nyctotherus, Bursaria (Lynn, Corliss,
1991; рис. 262, б, вкл.).
Половой процесс
Большую часть жизненного цикла инфузории не
проявляют сексуальности, размножаясь бинарным
делением (почкованием, стробиляцией, палинтомией).
При этом с течением времени клетки клона обычно
последовательно проходят ряд стадий: незрелости,
взросления, зрелости и старости, в которые они могут
(или не могут) вступать в половой процесс, имеющий
у Ciliophora характер конъюгации (рис. 263). Собст-
венно, возможность вступления в конъюгацию (или
автогамию) связана именно с фазой зрелости и иссле-
дована прежде всего для нескольких модельных объ-
ектов (Tetrahymena, Paramecium, Euplotes, Blepharisma
и некоторые другие) в лабораторных условиях. Однако
для конъюгации необходимы не только определенный
возраст клеток, но и принадлежность их к разным, но
комплементарным типам спаривания, образующим
сингены (Sonnebom, 1957; Dini, Nuberg, 1993; Miyake,
1996). Как правило, только в пределах одного сингена
конъюгация инфузорий оказывается возможной и
приводит к образованию жизнеспособного потомства.
Число типов спаривания в одном сингене при бинар-
ной системе всегда два, а при множественной — обыч-
но кратно двум (Р. bursaria — 4, 6, 8; Uronychia — 10;
Е. octocarinatus — 10, однако Tetrahymena — 7). Мно-
жественная система типов спаривания делится на го-
мополярную и гетерополярную (Miyake, 1996). При
первой каждый тип спаривания комплементарен всем
остальным, а у видов со второй системой — некоторые
комбинации оказываются некомплементарными. По-
следняя ситуация наиболее характерна для видов с бо-
льшим числом типов спаривания (Euplotes, Stylonyc-
hia). Типы спаривания у инфузорий (в зависимости
от видовой принадлежности) определяются генотипи-
чески или эпигенетически и иногда (Р. multimicronuc-
leatum, синген 2) изменяются во времени (Barnett,
1966).
Число сингенов (биологических видов) существен-
но варьирует у представителей Ciliophora. Так, среди
парамеций встречаются виды, для которых известно от
одного сингена (Р. polycaryum) до 15—16 (комплекс
Р. aurelia, Р. caudatum). Инфузорий с бинарной систе-
мой типов спаривания до сих пор известно крайне
мало: виды Paramecium (за исключением Р. putrinum и
Р. bursaria), Aspidisca, Blepharisma, Glaucoma, E. Cras-
sus, Tokophrya, в то время как остальные изученные в
этом отношении инфузории обладают множественной
системой (Dini, Nuberg, 1993;Miyake, 1996; Fokin etaL,
2001). Для значительного числа видов Ciliophora сис-
тема типов спаривания до сих пор не установлена.
Возможность вступления клеток в конъюгацию
определяется окончанием периода незрелости, кото-
рый может быть продолжительным — несколько меся-
цев (Р. bursaria)', умеренным — около месяца (Р. cau-
datum)', коротким — 1—3 нед (Р. jenningsi), или может
отсутствовать вообще (Р. tetraurelia).
На основе взаимораспознавания партнеров проис-
ходит формирование конъюгационной пары, клетки в
которой претерпевают полный или частичный процесс
конъюгации (рис. 250, 261, 263). Иногда партнеры рас-
ходятся раньше стадии обмена пронуклеусами, и тогда
ядерная реорганизация в клетках может проходить по
типу автогамии. Насколько часто конъюгация проис-
ходит в природных условиях, для большинства видов
неизвестно, а для некоторых инфузорий конъюгация
вообще никогда не наблюдалась (Lucchesi, Santangelo,
2004).
ТИП CILIOPHORA. ОБЩАЯ ЧАСТЬ
397
Рис. 263. Основные этапы конъюгации (А) и схема полового процесса (Б) у инфузорий.
А —этапы анизоморфной монозиготической конъюгации Chonotricha (а—ж). Масштаб: 40 мкм (по Янковский, 1973, с изменениями); Б— ядерная реорга-
низация при анизоморфной монозиготической (левый столбик) и изоморфной бизиготической (правый столбик) конъюгации; 1 — предконъюганты, 2 —
конъюгирующие пары, 3 — прогамная, 4 — метагамная фазы конъюгации. (По Myiake, 1996, с изменениями).
Fig. 263. Representation (A) and scheme (Б) of the main steps of conjugation process in ciliates.
A — steps of anizomophic monozigotic conjugation in Chonotricha (a—ж). Bar = 40 pm; Б—nuclear reorganization during anizomorphic monozigotic (left) and iso-
morphic bizigotic (right) conjugation. I — proconjugants, 2 — pares of conjugants, 3 — progamic, 4 — metagamic stages of conjugation.
В большинстве случаев у инфузорий в конъюга-
цию вступают клетки одинакового размера, которые
образуют две зиготы (пару эксконъюгантов). Такая
конъюгация называется изоморфной бизиготической
(рис. 263, 5). Каждый конъюгант дает два (иногда бо-
лее) гаплоидных ядра, одно из которых стационарное,
а второе — мигрирующее. Реципрокное слияние про-
нуклеусов (в результате перехода мигрирующих ядер в
конъюгационного партнера) приводит к образованию
двух диплоидных зигот (синкарионов).
У Peritrichia и некоторых Suctoria конъюгиру-
ют клетки, значительно различающиеся по размерам
(макро- и микроконъюганты), и в результате процесса
ядерной реорганизации в конъюгантах образуется по
одному про нуклеусу. Меньший конъюгант сливается с
более крупным, образуя лишь одну зиготу (один экс-
конъюгант). Такой вариант конъюгации называется
анизоморфной монозиготической (Finley, 1952; Miyake,
1996; рис. 263, А, Б). В ряде случаев (Ephelota, Meto-
pus, Urostyla, Chonotricha) обнаружена также изоморф-
ная монозиготическая конъюгация (Янковский, 1973;
Miyake, 1996). Помимо этого, при определенных усло-
виях возможны конъюгация между клетками одного
клона (селфинг) или половой процесс в пределах
единственной клетки (автогамия): Р. aurelia комплекс,
Р. jenningsi, Р. polycaryum, Е. minuta, Т. rostrata (Wich-
terman, 1986; Miyake, 1996).
В основе взаимораспознавания конъюгантов может
лежать прямое или непрямое взаимодействие между
клетками. Так, инфузории Paramecium и Tetrahymena
должны вступать в кратковременный механический
контакт (по-видимому, столкновения при плавании)
перед образованием пар. В этот период костимуляции
происходит модификация части кортекса: у тетрахи-
398
ALVEOLATA
мен — переднего конца клетки, у парамеций — части
вентральной поверхности, окружающей буккальную
зону (Fujishima, 1988; Miyake, 1996). Этот этап может
занимать несколько часов. У других инфузорий (В1е-
phrisma, Euplotes, Dileptus) предконъюгационное взаи-
модействие между партнерами непрямое: посредством
растворимых в воде гамонов и соответствующей
системы рецепторов (Luporini, Miceli, 1986; Miyake,
1996).
Процесс конъюгации распадается на прогамную и
метагамную фазы (рис. 263, Б). Прогамная фаза начи-
нается с объединения партнеров и заканчивается обра-
зованием зиготы — синкариона (рис. 250; 263, Б); ме-
тагамная — простирается от момента образования
синкариона до восстановления вегетативного ядер-
ного аппарата. Часть продуктов деления микронуклеу-
са на прогамной фазе (всегда) и на метагамной фазе
(часто) дегенерирует, что приводит к восстановлению
исходного ядерного аппарата обычно в ходе двух
или трех постконъюгационных делений эксконъ-
югантов (Miyake, 1996; Fokin et al., 2001). Конъюгаци-
онный цикл считается завершенным при вступлении
потомков эксконъюгантов в следующий половой про-
цесс.
Старое соматическое ядро у эксконъюгантов деге-
нерирует, однако время и особенности этого процесса
значительно различаются в разных группах инфузо-
рий, часто даже близкородственных. Весьма характер-
ным изменением старого макронуклеуса в ходе конъ-
югации является его фрагментация, которая может на-
чинаться как на прогамной, так и на метагамной
(наиболее часто) фазе процесса (Raikov, 1972; Fokin
et al., 2001). Нередко старый макронуклеус дегенери-
рует без изменения (Karyorelictea, многие Heterotri-
chea, Tetrahymena, Р. bursaria), а иногда началу этого
процесса предшествует дополнительное деление мак-
ронуклеуса (Urocentrum, некоторые Euplotes, Р. du-
boscqui).
Помимо обычной конъюгации для инфузорий (Pa-
ramecium) известна цитогамия, при которой в образо-
вавшийся паре конъюгантов ядерная реорганизация
проходит без обмена пронуклеусами, что, следова-
тельно, можно рассматривать как парную автогамию
(Wichterman, 1986). «Полусексуальная» конъюгация
была обнаружена у Bl. japonicum (Miyake et al., 1991).
У этого мультимикронуклеарного вида часть микро-
нуклеусов не вступает в мейоз, а прямо дифференци-
руется в макронуклеусы в начале конъюгационного
процесса. Остальные микронуклеусы претерпевают
нормальную ядерную реорганизацию с образованием
новых элементов ядерного аппарата. Таким образом,
в одной клетке (в результате доминирования одной
из групп макронуклеусов) могут быть либо все ядра,
возникшие половым путем, либо только микрону-
клеусы.
Как уже было сказано, для некоторых инфузорий
(иногда только для некоторых линий одного вида —
Е. minuta, Е. crassus) помимо конъюгации известна ав-
тогамия, при которой процессы ядерной реорганиза-
ции проходят практически по такой же схеме, но в пре-
делах одной клетки (Nobili, 1966; Miyake, 1996). Среди
комплекса видов Tetrahymena у Т. rostrata автогамия
происходит в цистах (Corliss, 1965).
Симбиоз
Долгое время наличие симбиотических организмов
(в широком смысле этого понятия, предложенного
Де Бари (De Вагу, 1879)) в составе или на поверхности
клетки Protista воспринималось как ситуация случай-
ная и нестабильная (Kirby, 1941), хотя еще в XIX—на-
чале XX в. некоторые отечественные протистологи
правильно оценили возможное значение этого фено-
мена (Ценковский, 1856; Фаминцын, 1889; Мережков-
ский, 1909). С усовершенствованием микроскопиче-
ской техники и особенно с появлением электронного
микроскопа стало очевидно, что в большинстве групп
простейших отсутствие симбионтов, особенно бакте-
риальных, является скорее исключением. Именно к та-
ким таксонам относится и тип Ciliophora (Preer, Preer,
1984; Heckmann, Gortz, 1991; Фокин, 1993a; Fokin,
2004a).
Симбиоз у инфузорий дает примеры разнообраз-
ных комбинаций этих простейших с про- и (иногда)
эукариотами. Очевидно, некоторые особенности Ci-
liophora (например, почти исключительно распростра-
ненный у них фаготрофный тип питания) создают
предпосылки для возникновения этого явления. Ха-
рактер взаимодействия между партнерами в симбиоти-
ческих системах Ciliophora далеко не всегда подробно
исследовался, но, очевидно, он может представлять
все переходы от паразитизма до мутуализма (Gortz,
1996).
В последние время, в том числе и в связи с разви-
тием симбиотической теории происхождения эука-
риотной клетки, симбиозу у инфузорий, особенно
внутриклеточному, уделялось значительное внимание.
Адаптации и взаимоотношения партнеров в симбиоти-
ческой системе, экологическая и эволюционная значи-
мость симбиоза у инфузорий, механизмы инфекции —
вот только часть вопросов, интенсивно изучаемых ци-
лиатологами (Gortz, 1988, 1996). При этом сами инфу-
зории также могут выступать в роли симбионтов (ком-
менсалов, паразитов) различных многоклеточных и из-
редка одноклеточных животных.
Бактериальные эндобионты могут заселять все
основные компартменты клетки инфузорий: они
встречаются в кортексе, эндоплазме, макро- и микро-
нуклеусах и перенуклеарном пространстве, и даже в
митохондриях (Фокин, 1993а; Fokin et al., 2003; Fokin,
2004a; Fokin, Karpov, 1995; Fokin et al., 2000; рис. 245, a;
249, a—e; 253; 255, 6; 258). Для клетки хозяина, за не-
которым исключением (часть инфузорий анаэробных
местообитаний, несколько видов Euplotes и, возможно,
Climacostomum), такое сожительство факультативно и,
как правило, лишь незначительная доля популяции за-
ражена бактериями, хотя в некоторых из них заражен-
ными оказываются почти все клетки (Lloyd et al.,
1996). Следует, однако, оговориться, так как в боль-
шинстве случаев симбиоз инфузорий с бактериями
глубоко не исследовался, и сказать, облигатный ли он
или факультативный (для хозяина), иногда нельзя. С
другой стороны, подавляющее большинство эндоби-
онтных бактерий, обнаруженных в инфузориях, не мо-
жет существовать вне хозяина, и, следовательно, они
являются облигатными симбионтами. Поддерживать
эти микроорганизмы вне тела инфузории обычно не
ТИП CILIOPHORA. ОБЩАЯ ЧАСТЬ
399
удается даже на весьма сложных искусственных сре-
дах (Soldo, 1973, 1974; Gortz, 1983). Исключение со-
ставляют метаногенные бактерии, обычные в цито-
плазме анаэробных инфузорий: по крайней мере, пред-
ставители родов Methanobacterium и Methanoplanus
могут культивироватся вне тела хозяина (Bruggen
et al., 1984, 1986).
Существенный интерес представляет группа бакте-
рий, разнородных (по-видимому) в филогенетическом
отношении, которые сообщают хозяину killer-свойства
(способность убивать инфузорий, не содержащих этих
эндоцитобионтов). По преимуществу это представите-
ли рода Caedibacter (рис. 253), наиболее исследован-
ные для комплекса видов Р. aurelia (Preer et al., 1974;
Quackenbush, 1988), хотя они известны также для
Р. caudatum, Р. duboscqui и для Spirostomum (Schmidt
et al., 1987; Fokin, Gortz, 1993; Fokin et aL, 2003). Ха-
рактерной чертой этих бактерий считается присут-
ствие у них R-тел — скрученных в виде цилиндра про-
теиназных лент длиной до 20 мкм и размерами (в упа-
кованном виде) — 0.4—0.5 X 0.4—0.8 мкм. С этими
структурами обычно связаны капсиды бактериофагов
и способность вызывать killer-эффект посредством ток-
сина неизвестной, но, по-видимому, белковой природы
(Quackenbush, 1988; рис. 253).
Эффект может быть дистанционным, что предпола-
гает выход токсина (или структур, его содержащих) во
внешнюю среду, или контактным, когда для проявле-
ния killer-эффекта клетка, несущая бактерии, должна
вступить в конъюгацию с чувствительной парамецией.
Другие бактерии, не образующие R-тел, сообщают kil-
ler-свойства Parauronema acutum (Soldo, 1973) иР. ne-
phridiatum (Фокин, 1989), причем в последнем случае
эффект наступает только при конъюгации с апосимби-
онтным партнером — mate-killer (рис. 258). Очевидно,
что такие симбионты дают своему хозяину определен-
ные преимущества при внутривидовой, а иногда и
межвидовой борьбе за источники пищи. Экологиче-
ское значение такого рода ассоциаций для клетки-хо-
зяина было экспериментально продемонстрировано в
натурных экспериментах (Landis, 1988).
Длительное время в качестве модельной для изуче-
ния взаимодействий про- и эукариотических партне-
ров по симбиозу используется система Parameci-
w/н-бактерии рода Holospora (Осипов, 1981; Gortz,
1983а, 1988, 1996; Фокин, 1993; Сабанеева и др., 2002;
Fokin, 2004а). Облигатные, высоко инфекционные
бактериальные эндонуклеобионты парамеций, отно-
симые к роду Holospora, обладают жизненным цик-
лом, состоящим из инфекционной и вегетативной фаз
(рис. 249, б—г). В клетку хозяина в результате нор-
мального процесса фагоцитоза могут попадать обе
формы этих бактерий, однако только инфекционные,
имеющие специальную клеточную дифференцировку
(наличие цитоплазматической, периплазматической
части и переднего «акросомного» конца) и размеры от
10 до 20 мкм, служат источником заражения новых хо-
зяев (рис. 249, г). После слияния первичной фагосомы
с ацидосомами инфекционные формы холоспор «акти-
вируются» и покидают пищеварительную вакуоль хо-
зяина в окружении части ее мембраны. Далее, в окру-
жении мембраного комплекса, возникающего за счет
клетки-хозяина, активированные инфекционные фор-
мы холоспор, оказавшиеся возле ядер, взаимодейству-
ют (согласно их ядерной специфичности) с оболочкой
макро- или микронуклеуса парамеции. В результате
этого взаимодействия они оказываются включенны-
ми в кариоплазму, где через непродолжительное время
фрагментируются, переходя к вегетативной части сво-
его жизненного цикла. Процесс инфекции занимает не
более 1 ч. Жизненный цикл бактерий замыкается, ког-
да после нескольких дней вегетации в ядрах инфузо-
рии дифференцируются новые инфекционные формы,
которые выводятся из клеткй хозяина во внешнюю
среду и заражают новых хозяев-парамеций.
Значительный набор этих бактерий (10 видов, ин-
фицирующих 6 видов парамеций), возможность лабо-
раторного заражения холоспорами апосимбиотиче-
ских клеток парамеций и экспериментального кон-
струирования сочетаний, в которых эндобионты и
хозяева имеют различные морфологические и генети-
ческие особенности, делают эту симбиотическую сис-
тему очень удобной для решения ряда важных вопро-
сов симбионтологии и клеточной биологии. Одними из
центральных в этом ряду являются проблема клеточ-
ного распознавания и вопросы, связанные с путями ин-
фекции прокариотами эукариотической клетки (Оси-
пов, 1981; Gortz, 1988, 1996).
В сравнении со жгутиконосцами (Ball, 1969) инфу-
зории имеют не так много бактериальных эктобионтов
(эпибионтов). Весьма распространены эпибионтные
бактерии, как уже отмечалось, у многих инфузорий,
живущих в условиях дефицита кислорода (Fenchel,
Finley, 1991; рис. 239, а, б). Вероятно, для некото-
рых из них симбиоз с бактериями облигатен. Среди
примеров такого рода симбиоза такие интересные и
впечатляющие случаи, как облигатный симбиоз карио-
реликтиды К. latum и перитрихи Z. niveum с серными
бактериями (Raikov, 1974; Fenchel, Finlay, 1989; Bau-
er-Nebelsick et al., 1996). Если для Kentrophoros бак-
терии — это источник питания, то роль прокариот в
жизни Zoothamnium пока не была детально исследова-
на. Бактериальная «шуба», плотно покрывающая всю
поверхность микро- и макрозооидов и переносимая
последними на новые колонии — аргумент в пользу
взаимовыгодное™ такого сожительства.
Интересный пример облигатного симбиоза демон-
стрирует морская птотутхъ Euplotidium itoi. Эпибион-
ты широкой полосой покрывают часть маргинальной
поверхности клетки, располагаясь в индивидуальных
углублениях кортекса хозяина (Vemi, Rosati, 1990; Ro-
sati, 1999). Ранее они рассматривались как специализи-
рованные экструсомы, поскольку эти микроорганизмы
имеют сложный аппарат экструзии, несколько напо-
минающий R-тела бактерий рода Caedibacter и аппа-
рат экструзии криптомонад (Gortz, 1996). Действи-
тельно, при определенных воздействиях происходит
«выстреливание» содержимого аппарата, хотя его зна-
чение пока непонятно. Одно из возможных объясне-
ний сводится к тому, что эти микроорганизмы дейст-
вительно функционально замещают защитные экстру-
сомы, которыми Euplotidium не обладает (Rosati et al.,
1999).
Одним из интенсивно изучаемых примеров сим-
биотической системы между инфузориями и водорос-
лями служит Р. bursaria, практически всегда имеющая
400
ALVEOLATA
Рис. 264. Схема поселения различных Chonotricha на Gammarus (Amphipoda). (По: Янковский, 1973).
Fig. 264. Scheme of localization different Chonotrichs on the surface of Gammarus (Amphipoda).
в своей цитоплазме 200—300 зеленых водорослей рода
Chlorella (Reisser, et al., 1985; Reisser, 1986). Водорос-
ли располагаются в специальных (периальгальных) ва-
куолях, образованных мембранами хозяина и не спо-
собных сливаться с лизосомами, что предохраняет
симбионтов от переваривания (рис. 257, а, б). Нахо-
дясь в цитоплазме парамеций, водоросли также оказы-
ваются защищенными от вирусов, часто лизирующих
несимбиотические хлореллы или водоросли, покинув-
шие клетку-хозяина (Reisser et al., 1988).
Парамеции, содержащие водоросли, в свою оче-
редь оказываются в лучшем положении, чем апосим-
бионтные клетки при недостатке пищи: некоторые «зе-
леные» инфузории могут существовать при достаточ-
ной освещенности без дополнительного питания
месяцами. Клетки Chlorella продуцируют значитель-
ное количество мальтозы, которая используется хозяи-
ном-парамецией. Такая ситуация меняет поведение
инфузорий, которые предпочитают в противополож-
ность своим апосимбиотическим родственникам более
освещенные местообитания (Cronkite, 1986). Наличие
хлорелл в цитоплазме Р. bursaria делает хозяина зна-
чительно более устойчивым к всевозможным стрес-
сам, в том числе к бактериальной инфекции (Gortz,
1983b). Кроме того, показано, что «зеленые» параме-
ции реже служат объектом нападения D. nasutum, что
говорит о наличии защитной функции хлорелл в этой
симбиотической системе (Berger, 1980).
Хотя большинство Ciliophora — свободноживущие
простейшие, среди них встречаются и симбиотические
виды (Gortz, 1996; Bradbury, 1996). К ним относятся
экто- и эндокомменсалы различных беспозвоночных и
позвоночных животных и незначительное число пара-
зитических инфузорий. Так, представители Ophryosco-
lecidae (Litostomatea) во множестве населяют рубец
жвачных; виды Nycthoterus (Armophorea) — кишечный
тракт бесхвостых амфибий; инфузории группы Phylas-
terida (Oligohymenophorea) — живут на кишечнопо-
лостных, заселяют мантийную полость разнообразных
моллюсков, кишечный тракт иглокожих и рыб; пред-
ставители Ophryoglenina (Oligohymenophorea) парази-
тируют на рыбах (Ichthyophthirius), в моллюске Dreis-
sena и поденке Caenis (Ophryoglena). К немногим пато-
генным инфузориям относится и единственный вид,
заражающий человека, — Balantidium (Litostomatea).
Нередко к эндопаразитизму переходят представители
Tetrahymena (Oligohymenophorea): они обнаружены в
личинках мошки, москитов и даже в мочеполовой сис-
теме млекопитающих (Lynn et al., 2000). Некоторые
Suctoria (Sphaerophrya) паразитируют в клетке инфу-
зорий: Euplotes, Uroleptus, Urostyla, Bursaria, Parame-
cium, и в то же время Cyathodinium (Suctoria, Evagino-
genida) заселяют пищеварительный тракт гвинейских
свиней, a Allantosoma multisuctores (Suctoria, Endogeni-
da) была обнаружена в африканском носороге (Hoven
et al., 1998).
Ряд эпибионтных инфузорий известен удивитель-
ной хозяинной и топографической специфичностью —
они поселяются в строго определенных местах покро-
вов хозяина (прежде всего различных членистоногих).
Так, Dendrocometesparadoxus (рис. 223, з) встречается
только на жабрах бокоплава Gammarus pulex. На G. lo-
custra поселяется около 10 различных видов эпибион-
тов, весьма определенным образом распределяясь по
членистым придаткам этого ракообразного (Fenchel,
1965). Такая же тенденция строгой приуроченно-
сти к участкам тела рачка наблюдается у хонотрих
(рис. 264), причем обычно инфузории прикрепляются
ТИП CILIOPHORA. ОБЩАЯ ЧАСТЬ
401
к придаткам, находящимся в постоянном движении,
что создает оптимальные условия для их питания (Ян-
ковский, 1973).
Для неподвижных инфузорий-эпибионтов большое
значение имеет плотность популяции хозяина, что зна-
чительно облегчает их расселение. Некоторые же эпи-
биопты не закрепляются постоянно на одном хозяи-
не, а могут менять субстрат, активно плавая. В таких
случаях часто вырабатываются специальные прикре-
пительные приспособления типа диска у Trichodina.
Представители этого рода перитрих из отряда Mobilida
(Oligohymenophorea) встречаются на гидрах, в разно-
образных моллюсках, у гребневиков (Esters et al.,
1997). Многие виды паразитируют на рыбах и даже на
амфибиях. Kerona polyporum (Spirotrichea) в противо-
положность триходинам не выработала специальный
прикрепительный аппарат, но за счет углубления на
вентральной поверхности клетки может прочно приса-
сываться к покровам хозяина-гидры.
Эпибионтные Suctoria (Phyllopharyngea) в качестве
хозяев используют широкий набор беспозвоночных
животных, в том числе и инфузорий. Наиболее обыч-
ны эти эпибионты (паразиты) на ротовых частях поли-
хет, на гидрополипах и ракообразных. Из инфузорий
они предпочитают поселяться на Peritrichia (Oligohy-
menophorea).
Жизненные циклы
и полиморфизм
В большинстве случаев жизненный цикл у инфузо-
рий состоит из значительного числа бесполых поколе-
ний, когда клетка (трофонт) размножается попереч-
ным делением, давая фенотипически и генотипически
себе подобных, и периода конъюгации, в результате
которой образуются генотипически новые особи, чем
жизненный цикл и завершается. Наличие диморфных
или полиморфных стадий, процесса почкования и ин-
цистирования в жизненном цикле многих инфузорий
делает его иногда достаточно сложным (рис. 260, Б;
261). Как правило, сложными жизненными циклами
обладают сидячие, комменсальные и редкие среди ин-
фузорий паразитические формы, что связано с их раз-
множением и распространением (поисками и сменой
субстратов или хозяев).
В качестве максимально простого жизненного цик-
ла можно привести таковой парамеций, для которых
неизвестна стадия цистообразования и которые не
дают при делении полиморфных форм (Wichterman,
1986). Большое число инфузорий образуют цисты по-
коя (прежде всего при недостатке питания или другой
форме стресса), а некоторые — и цисты размножения,
что приводит к появлению известного полиморфизма
в пределах одного жизненного цикла (рис. 260, Б). По-
лиморфизм может возникать и в результате изменения
условий окружающей среды (прежде всего соотноше-
ния пищи и хищников). Так, у Т. vorax при обилии мел-
ких инфузорий, служащих ей пищей, появляется мак-
ростомная форма инфузории, способная питаться объ-
ектами, сравнимыми с ней по величине (Williams,
1961). Сходное явление было обнаружено для Е. versa-
tilis (Tuffrau et al., 2000), у которого при обилии пищи
(бактерий) деление клетки происходит неравномерно
и протер оказывается меньше, чем опистер. Возник-
шие гигантские клетки (увеличение размеров может
быть более чем в 2 раза) становятся каннибалами.
Наличие в среде значительного числа хищников
также вызывает появление гигантских форм Euplotes,
которые за счет размеров и формы своего тела ста-
новятся недоступными в качестве пищевого объекта
(Tuffrau, 1959; Kuhlmann, Heckmann, 1987; Kusch,
1993).
Другим примером диморфизма могут служить
клеточные вариации в жизненных циклах сидячих ин-
фузорий (хонотрих, перитрих и сукторий), где «личи-
ночные» формы — «бродяжки» — обычно мелкие по-
движные клетки, служащие для расселения, тогда как
«взрослые» инфузории значительно крупнее, лишены
подвижности и соматической (или всей) цилиатуры
(рис. 261). Для некоторых колониальных инфузорий в
пределах колонии также отмечен полиморфизм зоо-
идов (Bauer-Nebelsick et al., 1996). Для представителей
этих же групп, а также некоторых гименостоматид и
астоматид характерны почкование (моно- и полигем-
мия) и палинтомия (рис. 260, Б\ 261).
Так, для Chonotricha (рис. 261) жизненный цикл
включает рост и питание трофонтов (активно питаю-
щихся и растущих форм), образование томонтов (не-
питающихся делящихся или почкующихся форм), ко-
торые продуцируют томиты (почки — до отделения от
материнской клетки и бродяжки — после отделения).
Томиты не питаются, оседают на субстрате и начина-
ют метаморфоз, превращаясь в трофонтов (Янковский,
1973). Не все трофонты вырастают во взрослые фор-
мы; начиная со стадии молодого трофонта развитие
может пойти двумя путями — с конъюгацией или без
нее. К конъюгации, по-видимому, способны только
молодые трофонты, и этот процесс коррелирует с ли-
нькой хозяина (рачка). Молодые эксконъюганты (тро-
фонты) возобновляют питание и рост и, достигнув
максимальной величины, приступают к наружному
или внутреннему почкованию (Янковский, 1973).
Известный полиморфизм в жизненном цикле де-
монстрируют и сидячие инфузории, обладающие ло-
рикой (рис. 260, А). Так, Ей. uhligi в результате деления
дает типичную форму (трофонта), помещенную в ло-
рику, и подвижную бродяжку, которая, закрепившись
на субстрате, развивает из зачатка характерный рото-
вой аппарат и секретирует лорику de novo (Mulisch,
Patterson, 1987).
Исключительное явление среди инфузорий пред-
ставляет собой жизненный цикл колькодиды Sorogena
stoianovitchae (Olive, Blanton, 1980), образующей воз-
душный сорокарп, весьма напоминающий сходные об-
разования у представителей Mycetozoa. Сорогена пи-
тается мелкими представителями рода Colpoda. При
уменьшении количества пищи клетки Сорочены обра-
зуют агрегат на поверхности воды, оседая на бактери-
альную пленку. Из этого агрегата вырастает воздуш-
ное плодовое тело (сорокарп), несущее множество со-
роцист. После нескольких дней свободного плавания
зрелый спорокарп разрушается и цисты падают на по-
верхность воды (в сухом состоянии они сохраняют
жизнеспособность около двух лет), где через пору из
них выходят активно плавающие клетки.
26 Члк. К" 4163
402
ALVEOLATA
Достаточно распространены сложные жизненные
циклы у паразитических инфузорий, относящихся к
подклассам Hymenostomatia и Apostomatia (Oligohy-
menophorea): Ichthyophthirius, Cryptocaryon и Vampy-
rophrya (Bradbury, 1996). Представители первого рода
паразитических инфузорий редко встречаются в при-
роде, но являются серьезной проблемой для прудовых
и озерных рыборазводных предприятий и аквариумов.
Инфекционные формы Ichthyophthirius (мелкие терон-
ты, имеющие развитую цилиатуру и Либеркюнову ор-
ганеллу — характерный признак всех Ophryoglenina),
тысячами выходят из цист размножения, которые на-
ходятся на дне водоема, и заражают хозяина (различ-
ных рыб). В эпителии (кожа и жабры) хозяина инфузо-
рии превращаются в активно питающихся трофонтов,
достигающих размеров более 1 мм, лишенных орга-
неллы Либеркюна и имеющих измененную цилиатуру
(Ewing, Косап, 1986). После нескольких дней питания
трофонты покидают хозяина и, опустившись на дно,
инцистируются (Ewing, Косап, 1987). В цистах раз-
множения в результате палинтомии образуется огром-
ное количество мелких томитов, которые при благо-
приятных условиях (значительном количестве рыб
подходящих видов) замыкают жизненный цикл этой
инфузории (Bradbury, 1996).
Апостоматида Vampyrophrya — эктопаразит пела-
гических копепод (Grimes, Bradbury, 1992). Томиты
этой инфузории находят хозяина и прикрепляются на
поверхности его хитинового покрова. В случае по-
вреждения панциря вампирофрии быстро эксцистиру-
ются и переходят к питанию тканями хозяина, после
чего инцистируются и в цисте размножения образуют
множество томитов. Последние покидают цисту и, ак-
тивно плавая, ищут новых рачков, на покровах ко-
торых оседают. Если зараженные рачки поедаются
другими животными (некоторыми Cnidaria или Chae-
tognata), инфузории могут эксцистироваться в кишке
хищника и питаться за его счет, давая более мелких
трофонтов (Bradbury, 1996).
Филогения и эволюция
По современным представлениям инфузории прои-
зошли от фаготрофных бентических жгутиконосцев,
обладавших дикинетидами с фибриллярными дерива-
тами, среди которых, по-видимому, наибольшее разви-
тие имели посцилиарные микротрубочки. В результате
полимеризации дикинетид предков образовалась паро-
ральная цилиатура инфузорий, позднее давшая начало
адоральным мембранеллам и соматической цилиатуре
(Bardele, 1992; Schlegel, Eisler, 1996).
Сравнительный анализ ультраструктурных особен-
ностей (наличие альвеол) и последовательностей нук-
леотидов в генах рРНК показывает, что из ныне суще-
ствующих групп наиболее близки к инфузориям Dino-
flagellata и Apicomplexa (Corliss, 1988; Schlegel, 1991;
Wolters, 1991; Wright et al., 1997; Kuvardinaet al., 2002),
образующие в системе Кавалье-Смита инфрацарство
Alveolata (Corliss, 1998; Patterson, 2000). Отсутствие у
динофитовых гистонов и присутствие конденсирован-
ных хромосом и внеядерного митотического аппарата
давали основания рассматривать эту группу как пред-
ковую для эукариот. Молекулярно-биологические дан-
ные, однако, указывают, скорее, на происхождение
современных Dinoflagellata в период возникновения
большинства других групп: животных, растений, гри-
бов, красных водорослей (Sogin et al., 1986).
Палеонтологические данные об инфузориях огра-
ничены находками некоторых тинтинид, обладавших
лорикой (Ордовик, Палеозойская эра, 400—450 млн
лет назад) и фолликулин. По морфологическим осо-
бенностям обнаруженных окаменелостей эти инфузо-
рии мало отличаются от современной фауны и могут
быть помещены в соответствующие современные се-
мейства и даже роды (Corliss, 1979). Отмечены также
находки гипотрих, нассулид, кольподид и пеникулин в
янтаре (возрастом 220—230 млн лет) из триаса. При-
чем в последнем случае находка была описана как но-
вый (вымерший) вид: Р. triassicum (Schonbom et al.,
1999). Очевидно, что инфузории появились значитель-
но раньше — в палеозое (Wright, Lynn, 1997а).
Инфузории — эволюционно очень продвинутая
группа протистов. Ее представители обладают значи-
тельным числом молекулярных и морфологических
особенностей. С точки зрения общего плана строения
(уникальных черт) — ресничного покрова с эктоплаз-
матической фибриллярной системой и гетероморфно-
го ядерного аппарата — Ciliophora считается тем не
менее наиболее гомогенным типом среди прочих Pro-
tista. Частные планы строения групп, в него входящих,
их цитоархитектоника, обладающая множественными
модификациями, и прочие особенности позволяют ана-
лизировать эволюционные (филогенетические) взаи-
моотношения в пределах типа, основываясь на мор-
фологических и биологических данных (Bardele, 1981,
1989; Small, Lynn, 1981, 1985; Puytorac et al., 1984, 1994;
Герасимова, 1989; Lynn, 2001, 2003).
Изначально это были только сведения относитель-
но характера соматической и оральной цилиатуры.
Значительную помощь систематикам на этом этапе
оказало появление методик импрегнации кинетома со-
лями серебра (Klein, 1926; Chatton, Lwoff, 1930; Gelei,
Horvath, 1931). Применение электронного микроскопа
сместило «центр тяжести» на данные по ультраструк-
туре и прежде всего инфрацилиатуре инфузорий (Puy-
torac et al., 1974; Lynn, 1975, 1976, 1981; Герасимова,
Серавин, 1976; Серавин, Герасимова, 1977; Small,
Lynn, 1981). Однако наиболее известная классифика-
ция инфузорий 70-х гг. (Corliss, 1974, 1979), использу-
емая в учебниках до сегодняшнего дня, во многом еще
была ориентирована на данные по буккальному и
общему морфогенезу различных инфузорий (Lynn,
1996b). Существенное значение для ее появления сыг-
рали воззрения на систему инфузорий Янковского
(1967), а информация по ультраструктурной организа-
ции Ciliophora еще не использовалась в этой системе в
полной мере (Corliss, 1979). Однако вместо двух под-
классов, Holotricha и Spirotricha, на которые были раз-
делены представители класса Ciliata, подтипа Ciliopho-
ra (Corliss, 1961), в системе 1979 г. удалось обосновать
3 класса типа Ciliophora, которые включали уже 7 под-
классов и 23 отряда (Corliss, 1979; рис. 265).
Исследование кольподид, предпринятое Лином
(Lynn, 1975), показало, что в этой группе разнообразие
организации оральных структур весьма значительно, в
ТИП CILIOPHORA. ОБЩАЯ ЧАСТЬ
403
Рис. 265. Схема филогении инфузорий, предложенная на основании данных световой микроскопии. (По: Bardele, 1989).
Fig. 265. Proposal scheme of Ciliophora phylogeny according to,data of light microscopy.
404
ALVEOLATA
то время как соматическая цилиатура устроена одно-
образно. Очевидно, Герасимовой и Серавиным, с од-
ной стороны, и Лином — с другой, практически одно-
временно и независимо была высказана идея о консер-
вативности организации соматических кинетосом и их
дериватов у инфузорий и возможности построения на
основе этого признака филогенетической схемы клас-
сификации Ciliophora (Герасимова, Серевин, 1976; Lynn,
1976). В результате анализа ультраструктуры сомати-
ческой цилиатуры у представителей основных групп
инфузорий в 1981 г. Смолом и Лином была предложе-
на макросистема Ciliophora, где инфузории были раз-
биты на 3 подтипа, 8 классов, 15 подклассов и 48 отря-
дов, прежде всего по данным электронной микроско-
пии (Small, Lynn, 1981, 1985). Такой подход позволил
определить место в системе для ряда родов, положение
которых прежде было проблематично или неверно (на-
пример, для Bursaria и Sorogena), и обосновать классы
Ciliophora как монофилетические образования.
В основу построения системы Ciliophora Корлисом
была положена организация прежде всего орального
аппарата: Kinetofragminophora (с простым ротовым
аппаратом), более продвинутые Oligohymenophora (с
усложненным ротовым аппаратом) и Polyhymenophora
(с наиболее сложным и хорошо развитым ротовым ап-
паратом), что отвечало, по воззрениям большинства
протозоологов, филогенетической линии развития Ci-
liophora (рис. 265). Схема, построенная на основе струк-
турного консерватизма соматического кортекса (Small,
Lynn, 1985; Lynn, Corliss, 1991), радикально отличалась
от предыдущей. Kinetofragminophora и Polyhymenophora
перестали существовать, оказавшись полифилити-
ческими группировками, и только Oligohymenophorea
сохранили статус класса. При этом подкласс Spirotri-
cha получил ранг класса, так же как и отряды (иногда в
несколько измененном составе) Karyorelictida, Prosto-
matida, Colpodida, Nassulida, (Small, Lynn, 1985).
Начиная с середины 80-х гг. XX в. в протистологии
явно начали преобладать использование в филогенети-
ческих построениях молекулярных маркеров: энзимов,
ДНК/ДНК гибридизации и во все большей степени
сравнения нуклеотидных последовательностей гена
рРНК (Schlegel, Eisler,1996). Аналогичным образом
развивалась и филогенетика инфузорий (Lynn, 1996а,
1996b; Schlegel, Eisler, 1996; Lynn, Small, 1997;
Struder-Kypke et al., 2000; Miao, Shen, 2001; Wright, Co-
lomi, 2002; Lynn, 2003).
Основным результатом, сразу полученным при ис-
пользовании сравнительного анализа последователь-
ностей нуклеотидов в гене рРНК, оказалась диамет-
рально противоположная топология примитивных (со-
гласно прежним воззрениям) и продвинутых групп
Ciliophora (Greenwood et al., 1991; Schlegel, 1991; Bar-
dele, 1992). Так, Bl. americanum (Polyhymenophora),
которую помещали рядом с гипотрихами, согласно
анализу рРНК, дивергировала в процессе эволюции Ci-
liophora очень рано вместе с кариореликтидами, так же
как и Stentor (Greenwood et al., 1991; Schlegel, 1991),
что подтвердило выделение класса Heterotrichea, сде-
ланное по морфологическим признакам. В то же время
Prostomatea, считавшаяся одной из примитивных
групп инфузорий (Puytorac et al., 1987; Bardele, 1989),
оказалась близка к Colpodea, Plagiopylea и Oligohyme-
nophorea (Fleury et al., 1992; Shin, et aL, 2000; Striider-
Kypke et al., 2000; Wright, Collomi, 2002).
Сравнительно-морфологические (морфогенетиче-
ские) данные дают основание думать, что Prostomatea
возникли в результате апикального смещения ротово-
го комплекса и его редукции с последующей утратой
адоральной цилиатуры, в то время как парораль стала
циркуморальной цилиатурой. Видимо, нечто похожее
произошло с гапторидами, трихостоматидами и энто-
диниоморфидами (Litostomatea), у которых утрачен-
ная первичная ротовая цилиатура была замещена за
счет соматической (Bardele, 1992; Foissner, 1996; Lynn,
2001). Филогенетическая схема инфузорий, построен-
ная прежде всего на базе онтогенетических данных
(Foissner, 1996), во многих деталях совпала с данными
молекулярного анализа.
Дополнение дендрограммы, построенной на осно-
вании анализа рРНК, данными по новым видам (пер-
воначально в анализ были вовлечены в основном
представители Oligohymenophora и Polyhymenophora),
позволило к настоящему времени получить репрезен-
тативные схемы филогенетических связей основных
классов Ciliophora (Leipe et al., 1994; Hammerschmidt
et al., 1996; Wright, Lynn, 1997b; Striider-Kypke et al.,
2000; Shin et al., 2000; Baumgartner et al., 2002; Lynn,
2003). Уже полностью или частично известны нуклео-
тидные последовательности гена рРНК более чем для
120 видов инфузорий. Тем не менее для некоторых
групп этих простейших реконструкция филогенеза с
использованием данных молекулярной биологии до
сих пор отсутствует или полученные картины крайне
фрагментарны и нестабильны из-за использования для
анализа лишь единичных видов. Очевидно, что для
уточнения и стабилизации позиций отдельных групп
потребуется дополнительное исследование видов, до
сих пор нс вовлеченных в анализ.
Молекулярные данные подтвердили монофилию
Ciliophora и существование теперь уже 10 (Plagiopylia
и Spirotrichia переведены в ранг классов) классов этих
простейших (Lynn, Small, 1997, 2000; Shin et al., 2000;
Baumgartner et al., 2002; Wright, Colorni, 2002). Очевид-
но, что статус класса заслуживает и дивергентная
группа Armophorca: отряд Armophorida (Metopidae,
Caenomorphidac) 4- отряд Clevelandellida (Nyctotheridae,
Clevelandellidae, Sicuophoridae) + отряд Odontostomati-
da, хотя ее положение в системе пока неоднознач-
но (Wright, Lynn, 1997b; Shin et al., 2000; Baumgartner
et al., 2002; Wright, Colorni, 2002; Lynn, Striider-Kypke,
2002; Lynn, 2003).
Разделение тина на Postciliodesmatophora, Rhabdo-
phora и Cyrtophora (первый подтип был выделен по
преобладанию среди дериватов кинетосом посцилиар-
ных микротрубочек, а в торые два — по организации
ротового аппарата) (Small, Lynn, 1985) уступило те-
перь место двум подтипам. В качестве дополнительно-
го признака при этом было использовано положение
микротрубочек при делении макронуклеуса (Lynn, 1996b).
Сохранивший свое название подтип Postciliodesmato-
phora включает наиболее древних инфузорий: Кагуоге-
lictea и Heterotrichea. У представителей этих классов
микротрубочки при делении соматического ядра рас-
полагаются в цитоплазме. Все остальные инфузории
пока объединены в подтип Intramacronucleata (с внут-
ТИП CILIOPHORA. ОБЩАЯ ЧАСТЬ
405
100/30
100/14
39/2
67/1 [_
100/2б1_
30/6|_
38/0 _
49/0
89/8
100/26
41/2
98/6,_____
99/20
66/9
60/1
85/6
58/1
47/1
66/1
100/16
32/2
45/3
100/64
92,5
77/9
100/22
72/0
74/4
63/2
100/141~
60/1
Euplotes aedicularus
Stylonychia pustulata
Halteria grandinella ___
Trithigmostoma steini
Discophrya collini
Pseudomicrothorax dubius
Furgasonia blochmanni
Obertrumia aurea___ _____
Trimyema compressum
Plagiopyla nasuta
Lembadion bullinum
Frontonia sp.
Frontonia vernalis
Paramecium bursaria
Paramecium putrinum
Paramecium duboscqui
Paramecium polycaryum
Paramecium woodruffl
Paramecium nephridiatum
Paramecium calkinsi
Paramecium multimicronucleatum
Paramecium jenningsi
Paramecium tetraurelia
Paramecium primaurelia
Paramecium caudatum
Urocentrum turbo
Tetrahymena thermophila
Tetrahymena corlissi
Colpidium campyllum
Glaucoma chattoni
Ichthyophthirius multifiliis
Ophryoglena catenula
Opisthonecta henneguyi
Cyclidium porcatum
Cohnilembus verminus
Pseudocohnilembus marinus
Uronema marinum
Anophryoides heamophila
Cyclidium glaucoma
Colpoda inflata
Bursaria truncatella
Prorodon teres
Coleps hirtus
Pentculia
Hymeno-
stomatla
Spirotrichea
Phyllopharyngea
Nassophorea
Plagiopylea
Oligohymeno-
I phorea
Peritrichia ’
Scuticociliatia
Colpodea
Prostomatea
Рис. 266. Дендрограмма филогенетических взаимоотношений представителей 7 классов Ciliophora, построенная по данным анализа нук-
леотидных послсдо1штсл1.1|1>с гсй гена 18S рРНК (a maximum parsimony method). (По: Striider-Kypke et al., 2000).
Fig. 266. Л maximum parsimony tree of 7 classes of ciliates inferred from SS rRNA gene sequences.
406
ALVEOLATA
римакронуклсарными микротрубочками), хотя автор
системы признает возможность находки более фун-
даментальных признаков, отличающих эти группы
(Lynn, 1996b). Наиболее филогенетически близкими к
Heterotrichea могут считаться Spirotrichea и Litostoma-
tea (Lcipc cl al., 1994), хотя значительная бифуркация
на дендрограммах в подтипе Intramacronucleata делает
такие выводы предварительными.
Взаимоотношения в классе Spirotrichea достаточно
полно проанализированы в последнее время молеку-
лярными методами (Shin et al., 2000; Chen, Song, 2002).
В результате обоснован новый подкласс Phacodiniidia
и подтверждено существование подкласса Protocruzii-
dia (Puytorac et al., 1984). Оба подкласса, так же как
Choreotrichia и Oligotrichia, признаны по данным моле-
кулярного анализа монофилетическими. Анализ фило-
генетических связей в подклассе Hypotrichia (Chen,
Song, 2002) показал, что эта группа также монофилети-
ческая, с базальной позицией рода Euplotes.
Монофилия Prostomatea, Colpodea и Oligohymeno-
phorea также получила подтверждение в работах по-
следних лет (Foissner, 1996; Striider-Kypke et al., 2000;
Lynn, 2001). Очевидно, что эти классы достаточно тес-
но связаны между собой. Несомненна близость к этой
группировке и Plagiopylea (Baumgartner et al., 2002),
обладающих рядом «олигоменофорных» черт. По дан-
ным Райта с соавт. (Wright et al., 1997), плагиопилиды
должны даже составить подкласс Plagiopylia в составе
Oligohymenophorea, что, правда, не подтверждается
более поздними данными (Striider-Kypke et al., 2000;
Wright, Colomi, 2002). С другой стороны, показано
близкое родство между Colpodea и Nassophorea (Bern-
hard et al., 1995; Striider-Kypke et al., 2000).
Полномасштабный анализ филогенетических свя-
зей внутри одного из крупнейших классов Ciliopho-
ra — Oligohymenophorea пока затруднен из-за отсутст-
вия данных по двум подклассам: Astomatia и Aposto-
matia. Сделанные работы (Striider-Kypke et al., 2000;
Miao et al. 2001; рис. 266) позволили, однако, предста-
вить взаимосвязи у пеникулин и перитрих, в частности
восстановить разделение пеникулин на два отряда:
Peniculida и Urocentrida (Puytorac et al., 1987;
Striider-Kypke et al., 2000).
Анализ нескольких Litostomatea (no SS rRNA) по-
казал, что у изученных представителей этой группы в
соответствующем гене последовательность нуклеоти-
дов на 100 единиц короче (за счет helix Е23-5 зоны),
чем у остальных инфузорий (Wright, Lynn, 1997b;
Wright et al., 1997), что является, по-видимому, харак-
терной чертой представителей класса.
Совмещение филогенетических схем, предложен-
ных на основе морфологических данных (Puytorac et
al., 1987; Puytorac et al., 1994; Foissner, 1996; Lynn,
Small, 2000; Lynn, 2003) с дендрограммами, построен-
ными в результате сравнения рРНК (Wright, Lynn,
1997; Wright et al., 1997b; Shin et al., 2000; Striider-Kyp-
ke et al., 2000), показывает совпадение основных пози-
ций и взаимосвязей групп внутри типа.
Безусловно, для наиболее полного представления
об эволюции и филогении Ciliophora, по-видимому,
необходимо использовать в сочетании с морфологиче-
скими и другие (помимо рРНК) молекулярные призна-
ки (гены): тубулин, гистоны, хитшоковые белки. Чис-
ло таких работ пока минимально (Bernhard, Schlegel,
1998; Budin, Philippe, 1998).
Я глубоко признателен моим коллегам, нашедшим
возможность предоставить некоторые иллюстрации
для настоящего обзора: проф. Д. Корлису, США, проф.
К. Барделе, Германия, проф. В. Фойснеру, Австрия,
проф. Д. Лину, Канада, проф. А. Мияке, Италия,
д-ру К. Эйслеру, Германия и проф. А. В. Янковскому,
Россия. Некоторые иллюстрации были получены в
ходе совместных исследований с д-ром М. Стру-
дер-Купке, Канада, д-ром М. Швейкертом, Германия,
и д-ром И. Н. Сковородкиным, Россия. Я благодарю их
за сотрудничество.
Aknowledgments
Му great pleasure to thank all my colleagues, who pro-
vided some illustrations for the review: Prof. J. O. Corliss
(USA), Prof. C.-F. Bardele (Germany), Prof. W. Foissner
(Austria), Prof. D. H. Lynn (Canada), Prof. A. Miyake (Ita-
ly), Prof. A. V. Jankowski (Russia) and Dr. K. Eisler
(Germany). Some illustrations used were obtained during
joint researches with Dr. M. Striider-Kypke (Canada), Dr.
M. Schweikert (Germany) and Dr. I. N. Skovorodkin (Rus-
sia). I am grateful to them.
THE PHYLUM CILIOPHORA DOFLEIN, 1901
SUMMARY
The review presents concise information on the basic aspects of
functional morphology and biology of representatives of the phylum Ci-
liophora (ciliates). The data used are drawn from original articles, inclu-
ding those by the author of the review, from numerous monographs on
concrete ciliate species (groups), as well as from the recent extensive re-
views devoted to ciliates (Linn, Corliss, 1991; Hausmann, Bradbury,
1996; Lynn, Small, 2000). Presentation of the material follows the clas-
sification of the phylum given in the second edition of «The Illustrated
Guide to Protozoa», section Ciliophora (Lynn, Small, 2000), with some
modifications. The systematic part is not included into the review.
The review begins with a general characteristic of Ciliophora. Refe-
rences are given to the most important literature on ciliates published in
the last 50 years. The review offers for the first time a brief history of ci-
liophoran studies from late XVIIth to early XXth century, with special
emphasis on personal contributions of different scientists into develop-
ment of ciliatology.
Morphological-functional organization of the ciliate cell is descri-
bed with the use of light and electron microscopy data. Descriptions are
given for each of the cell compartments — cortex (ectoplasm) and en-
doplasm (nuclear apparatus, cytoplasmic organelles, and inclusions) —
ТИП CILIOPHORA. ЛИТЕРАТУРА
407
ill nub orgunelle, organelle and system-organelle levels. Issues associa-
led willi morphogenesis, sexual process, symbiosis and life cycles in ci-
1 hili'll iiie Irenlcd separately. The concluding section of the review focu-
nil phylogeny and evolution of the group. It contains abriefhistori-
। nl uulllne nf the basic approaches used in elaborating the system of
< iliophoin mid the main results obtained in the recent decade from the
analysis of rRNA structure in representatives of the main classes of the
phylum.
The review is abundantly illustrated with light- and electron-mic-
roscopical photographs, most of which are original. It includes several
schemes previously published elsewhere. The list of references compri-
ses 122 and 346 items of Russian and foreign literature, respectively.
ЛИТЕРАТУРА
Ai пмплиев Ф. Г. Инфузории Каспийского моря. Систематика,
тмикн ия, зоогеография. Л., 1983.
Алекперов И. X., Асадуллаева Э. С., Заидов Т. Ф. Методы
спори и изучения свободноживущих инфузорий и раковинных
пмеб. СПб., 1996.
Андрусова Ю. И. Инфузории Керченской бухты// Тр. СПб.
iiliin-na естествоиспыт. 1886. Т. 16. С. 236—258.
(Богданович А. К.) Bogdanowicz А. К. Uber die Konjugation
von I,oxodes striatus (Engelm.) Petard und Loxodes rostrum (O. F. M.)
lihrcnb. // Zool. Anzeig. 1930. Bd 87. P. 209—222.
Бойкова Э. Б. Простейшие — биомониторы морской среды.
Рига, 1989.
Бродский А. История протозоологии. (История развития на-
ших знаний о простейших животных). Ташкент; Самарканд, 1937.
Бучинский П. П. Простейшие организмы Хаджибейского и
Куяльницкого лиманов^1 Зап. Новорос. общ-ва естествоиспыт.
1895. Т. 20. С. 137—148.
(Гаевская Н. С.) Gajewskaja N. S. Zur Kenntnis der Infusorien
des Baikalsee// Bull. Acad. Sci. USSR. 1927. Bd 2. P. 313—318.
(Гаевская H.) Gajewskaja N. Zur Oekologie, Morphologic und
Systcmatik der Infiisorien des Baikalsees. Stuttgart, 1933.
Гартман M. Общая биология. Часть I. M.; Л., 1929.
Тассовский Г. Н. К фауне инфузорий Кольского залива и его
окрестностей// Тр. Имп. Петр, общ-ва естествоиспыт. 1916. Т. 65.
(’.139—215.
Тассовский Г. Н. К микрофауне кишечника лошади // Тр.
Петр, общ-ва естествоиспыт. 1918. Т. 69. С. 20—42.
Герасимова 3. П. План строения инфузорий (Ciliophora) //
'loom журн. 1989. Т. 68. С. 5—16.
Герасимова 3. П., Серавин Л. Н. Эктоплазматическая фиб-
риллярная система инфузорий и ее значение для выяснения фило-
гении этих простейших И Зоол. журн. 1976. Т. 55. С. 645—656.
Горянинов П. Ф. Зоология, основанная на зоотомии и приме-
ненная к общей пользе, особенно к медицине с присоеденением об-
ilti’ll оргппикологии и краткой антропологии. СПб., 1837.
Лов гиль И. В. Определитель щупальцевых инфузорий (Cilio-
lihorn, Slictoria) фауны Украины // Вести, зоологии. 1996. Отд. вып.
Т./..('. 3 42.
(Дош ил!. И. В.) Dovgal I. V. Evolution, phylogeny and classifi-
eiilion of Suetorea (Ciliophora)// Protistology. 2002. Vol. 2. P. 194—
270,
(Догель В. A.) Dogiel V. A. Cellulose als Bestandteil des Skelet-
on bei Einigen Infusorien// Biol. Zbl. 1923. Vol. 43. P. 289— 291.
(Догель В. A.) Dogiel V. A. Die Geschlechtsporozesse bei Infuso-
iIpii Npozicll bei der Ophryoscoleciden) neue Tatsachen und Theoreti-
Hi'lio IO Wllgungcn // Arch. Protistenk. 1925a. Bd 50. P. 283—442.
(Догель В, A.) Dogiel V. A. Nouveaux Infusoires de la Famille
lie» I IpIliyoHColecidae Parasites d’Antilopes Africaines// Ann. Parasi-
lul lllllll ('limp, 1925b. Vol. 3. C. 116—142.
(Дтель ll< A.) Dogiel V. A. Monographic der Familie Ophryo-
Hriileelilng t Tl, I, Arch, Protistenk. 1927. Bd 59. P. 1—288.
ДИПМЬ Hi At Общая протистология. M., 1951.
Д|Ц (Ш1, Ni Ан lloJlliiiCKiiii Ю. И., Хейсин E. M. Общая прото-
Hniiini ни M i Л, IW,
Жирнноп Ni Hi Киднетр снободноживущих инфузорий водо-
spiiiiHniiHl llmirii (14161'1111, ртшредслсние, обзор методов исследова-
нии). Tiiiii.h। in, 1990,
(Жникип JI. II,) Zlllllklll I,. N. Zur Frage der Reservestoffe bei
In I iiniii leu (I'ell und (llykogeil bei Stentor polymorphus // Zeit. Morph.
6kol, fiere 1930. Bd IH, I’, 217 248,
Жуков l>. <!>., '/ICriiptm II, А., Мыльникова 3. M. Кадастр сво-
бодноживущих простейших Волжского бассейна. Ярославль, 1998.
Иванов А. В., Полянский К). И., Стрелков А. А. Большой
практикум по зоологии Occhoiiioiio’IIHiIX. Простейшие, губки, ки-
шечнополостные, гребневики, плоские черни, пемертины, круглые
черви. 3-е изд. М., 1981.
Инфузории в биотсстировании// Тез, Международной заоч-
ной научно-практической конференции, СПб,, 1998.
Калкинс Г. Н. Протозоология. М., 1912.
Канаев И. И. Абраам Трамбле. Л., 1972.
Карпов С. А. Система протистощ 2-е изд. Омск, 1990.
Карпов С. А. Строение клетки протистов. СПб., 2001.
(Карпов С. А., Фокин С. И.) Karpov S. A., Fokin S. I. The
structural diversity of flagellar transitional zone in heterotrophic flagel-
lates and other protists// Tsitologia. 1995. Vol. 37. P.1038—1052.
Кеппеи H. Наблюдения над щупальцевыми инфузориями
(Tentaculifera)//Зап. Новорос. общ-ва. естествоиспыт. 1888. Т. 13.
С. 1—79.
Кольцов Н. К. Исследования о сократимости стебелька Zoo-
thamnium altemans// Биол. журн. 1911. Т. 1. С. 55—111; Т. 2.
С. 113—138.
Корнилова О. А. История изучения эндобионтных инфузорий
млекопитающих. СПб., 2004.
Кудельский А. В. О метаморфозе ядерного аппарата у Parame-
cium// Bibl. Anat. 1898. Vol. 5. P. 270—275.
Куторга С. С. Естественная история наливочных животных,
составленная преимущественно из наблюдений Эренберга. СПб.,
1839.
Локоть Л. И. Экология ресничных простейших в озерах Цент-
рального Забайкалья. Новосибирск, 1987.
Лукашенко И. П., Рыбакова 3. И. Генетика инфузорий Tetra-
hymena и Paramecium. М., 1986.
Мавродиади П. К вопросу об ядерном аппарате инфузорий И
Изв. Варш. ун-та 1913. Т. 31. С. 1—9.
Мамаева Н. В. Инфузории бассейна Волги. Экологический
очерк. Л., 1979.
Мережковский К. С. Этюды над простейшими животными
Севера России. СПб., 1878.
Мережковский К. С. Материалы для фауны инфузорий
Черного моря// Тр. СПб. общ-ва естествоиспыт. 1880. Т.П.
С. 3—13.
(Мережковский К. С.) Mereschkowsky С. On some new or lit-
tle-known Infusoria// Ann. mag. nat. hist. 1881. Vol. 3. P. 209—219.
Мережковский К. С. Теория двух плазм как основа симбиоге-
незиса, нового учения о происхождении организмов. Казань, 1909.
Метальников С. И. О питании инфузорий и их способности
выбирать пищу// Тр. СПб. общ-ва естествоиспыт. 1907. Т. 38.
С. 175—181.
Метальников С. И. К физиологии внутриклеточного пище-
варения у простейших// Изв. СПб. Биол. лаб. 1911. Т. 11.
С. 3—121.
Метальников С. И., Галаджиев М. А. К вопросу о бессмер-
тии простейших одноклеточных животных // Изв. Имп. Акад. наук.
1916. С. 1809—1816.
Метелкин А. И. Л. С. Ценковский — основатель отечествен-
ной школы микробиологии. М., 1950.
Мечников И. И. Исследования о штиле вортицеллей // Зап.
Имп. АН СПб. 1864а. Т. 4. С. 45—50.
Мечников И. И. О паразитизме у инфузорий // Зап. Имп. АН
СПб. 18646. Т. 4. С. 149—151.
(Мечников И. И.) Metchnikoff Е. Uber die Gattung Sphaero-
phtya// Arch. anat. physiol, med. 1864. Bd 2. P. 258—261.
Мечников И. И. Некоторые факты из жизни инфузорий //
Вест, естеств. наук. 1865. Т. 7. С. 1564—1569.
Новиков М. М. О. Бючли и его научная работа // Сообщ. на-
учно-техн. раб. в респуб. 1922. Т. 9. С. 3—23.
Осипов Д. В. Проблемы гетероморфизма ядер у однокле-
точных организмов. Л., 1981.
Осипов Д. В., Тавровская М. В. Микронуклеус и морфогенез
кортекса у Paramecium caudatum //Успехи протозоологии. Л., 1969.
С. 103—104.
Переяславцева С. М. Protozoa Черного моря. Одесса, 1886.
(Полянский Ю. И.) Poljansky Y. I. Uber die Konjugation von
Bursaria truncatella II Zool. Anz. 1928. Bd.79. P. 51—59.
Пржесмыцкий M. О клеточных зернистостях у Protozoa//
Прот. Варш. общ-ва естествоиспыт. 1895. Т. 6. С. 1—90.
408
ALVEOLATA
Райков Б. Е. Русские бпологи-энолюционисты до Дарвина.
Материалы к истории эволюционных идей в России. М.; Л., 1959.
Т. 4. С. 552- 612.
Райков И. Б. Кариология простейших. Л., 1967.
(Райков И. Б.) Raikov I. В. The macronucleus of ciliates // Rese-
arch in Protozoology. Vol. 3 // Ed. T. T. Chen. N. Y., 1969. Vol. 3.
P. I 128.
(Райков И. Б.) Raikov I. В. Nuclear phenomena during conjuga-
tion and autogamy in ciliates // Research in Protozoology // Ed.
T. T. Chen. N. Y„ 1972. P. 147—289.
(Райков И. Б.) Raikov I. В. Etude ultrastructurale des bacteries
cpizoiqucs ct endozoiques de Kentrophoros latum Raikov, cilie holo-
trichc mcsopsammique// Cah. Biol. Mar. 1974. Vol. 15. P. 379—393.
Райков И. Б. Ядро простейших. Морфология и эволюция. Л.,
1978.
(Райков И. Б.) Raikov I. В. Structure and genomic organization
of the polyploid macronucleus of ciliates: a comparative review// Acta
Protozool. 1995. Vol. 34. P. 151—171.
(Райков И. Б.) Raikov I. В. 1996. Nuclei of Ciliates // Ciliates.
Cells as a organisms // Eds K. Hausmann, Ph. C. Bradbury. Stuttgart,
1996. P. 221—242.
Раммельмейер E. С. К вопросу о делении инфузории Tripal-
maria dogieli // Рус. арх. протает. 1925. Т. 4. С. 83—93.
Россолимо Л. Л. Наблюдения над Loxodes rostrum
О. F. Muller// Тр. Имп. общ-ва люб. естествознан. антроп. этно-
граф. 1916. Нов. сер. Т. 3. С. 1—18.
(Россолимо Л. Л., Перцева Т. A.) Rossolimo L. L., Perze-
wa Т. A. Zur Kenntnis Einiger Astomen Infusorien: Studien an Ske-
lettbildung // Arch. Protistenk. 1929. Bd 67. P. 237—252.
Сабанеева E. В., Фокин С. И., Карнилова E. С. Путь бакте-
рии Holospora в клетке Paramecium (Ciliophora, Protista) от фагосо-
мы до ядра// Цитология. 2002. Т. 44. С. 1089—1096.
Сварчевский Б. А. Хромидиальные образования у Protozoa в
связи с вопросом о двойственности ядерного вещества И Зап. Киев,
общ-ва естествоиспыт. 1912. Т. 22, вып. 1. С. 1—177.
(Сварчевский Б. A.) Svarchevski В. A. Zur Kenntnis der Bai-
kalprotistenfauna. Die an den Baikalgammariden lebenden Infusorien.
Dendrosomidae // Arch. Protistenk. 1928. Bd 61. P. 349—378.
Серавин Л. H. Двигательные системы простейших. Строение,
механохимия и физиология. Л., 1967.
Серавин Л. Н. Основные типы и формы тонкого строения
крист митохондрий; степень их эволюционной консервативности
(способность к морфологической трансформации) // Цитология.
1993. Т. 35. С. 3—34.
Серавин Л. Н., Герасимова 3. П. Новая макросистема инфу-
зорий // Вести. ЛГУ. 1977. Т. 3. С. 30—38.
Соболь С. Л. История микроскопа и микроскопических иссле-
дований в России в XVIII веке. М.; Л., АН СССР, 1949.
Сосновский И. К. Об отношении ядра к клеточному телу
у Protozoa// Раб. зоотом. лаб. Имп. Варш. ун-та. 1897. Т. 20.
С. 1—47.
(Стрелков A. A.) Strelkov A. A. Nouvells especes du genre Cyc-
lopostium habitant 1’intestin du chcval // Ann. Parasitol. 1928. Vol. 6.
P. 164—178.
(Хавкин В. M.) Hafkine W. M. Maladies infcctieuses des Pa-
ramecies // Ann. Inst. Pasteur. 1890. Vol. 4. P. 148—162.
Хаусман К. Протозоология. M., 1988.
(Хейсии Е. М.) Cheissin Е. М. Morphologische und Systcmati-
sche Studien uber Astomata aus dem Baikalsee// Arch. Protistenk.
1930. Vol. 30. P. 532—614.
Фаминцын А. С. Симбиоз водоросли Chaetoceros из семейст-
ва Diatomaceae с инфузорией Tintinnus inquilinus // Тр. СПб. общ-ва
естествоиспыт. Отд. ботаники. 1889. Т. 20. С. 3—4.
Фаминцын А. С. О психической жизни простейших предста-
вителей живых существ// Тр. VIII съезда рус. естествоиспыт. и
врачей. СПб., 1890. С. 32—39.
Фокин С. И. Функциональная значимость генеративного ядра
инфузорий рода Paramecium в вегетативной жизни клетки: Авто-
реф. дис. канд. биол. наук. Л., 1978.
Фокин С. И. Морфология инфузории Paramecium bursaria по-
сле УФ облучения генеративных ядер// Цитология. 1983а. Т. 25.
С. 328—333.
Фокин С. И. Морфология и жизнеспособность клеток микро-
нуклеарных клонов инфузории Paramecium caudatum// Цитология.
19836. Т. 25. С. 811—817.
Фокин С. И. Морфология сократительных вакуолей инфузо-
рий рода Paramecium (Hymenostomatida, Peniculina) как видовой
признак // Зоол. журн. 1986. Т. 65. С. 5—16.
Фокин С. И. Mate-killer-эффект, вызываемый эндобионта-
ми инфузории Paramecium woodruffi // Цитология. 1989. Т. 31.
С. 1085—1089.
Фокин С. И. Бактериальные эндобионты инфузорий и их ис-
пользование в экспериментальной протозоологии// Цитология.
1993а. Т. 35. С. 59—91.
Фокин С. И. Стабильность типа крист митохондрий у инфузо-
рий // Цитология. 19936. Т. 35. С. 3—10.
Фокин С. И. Морфология переходной зоны ресничек инфузо-
рий (Ciliophora). I. Представители класса Oligohymenophora // Ци-
тология. 1994. Т. 36. С. 345—352.
Фокин С. И. Морфология переходной зоны ресничек инфузо-
рий (Ciliophora). II. Представители классов Kinetofragminophora и
Polyhymenophora// Цитология. 1995. Т. 37. С. 145—153.
Фокин С. И. Карьера профессора Шевякова. Карлсруэ—Гей-
дельберг—Санкт-Петербург—Иркутск // Русско-немецкие связи в
биологии и медицине// Ред. Э. И. Колчинский. СПб., 2001.
С. 68—76.
Фокин С. И. Ревизия рода Paramecium О. F. Muller, 1773:
сравнительно-биологический анализ, систематика и филогенетиче-
ские связи: Автореф. дис. докт. биол. наук. СПб., 2002.
(Фокин С. И.) Fokin S. I. Morphological diversity of the micro-
nuclei in Paramecium // Arch. Protistenk. 1997. Bd 148. P. 375—387.
(Фокин С. И.) Fokin S. I. Professor W. T. Schewiakoff: life and
science// Protist. 2000. Vol. 151. P. 181—189.
(Фокин С. И.) Fokin S. I. Ciliophora // Explorations of the fauna
of the seas. List of species of free-living invertebrates of Eurasian arctic
seas and adjacent deep waters / Ed. В. I. Serenko. RAS // Zool. Inst.
2001a. Vol. 51 (59). P. 21—28.
(Фокин С. И.) Fokin S. I. The rise and development of proti-
stology in St. Petersburg, Russia // Protistology. 2001b. Vol. 2. P. 68—
72.
(Фокин С. И.) Fokin S. I. Bacterial endocytobionts of Ciliophora
and their interactions with the host cell // Int. Rev. Cytol. 2004a.
Vol. 236. P. 181—247.
(Фокин С. И.) Fokin S. I. 2004b. Professor Otto Biitschli und Se-
ine Russischen Schiller// Microkosmos. 2004b. Bd 93. P. 91—99.
(Фокин С. И., Герц Г.-Д.) Fokin S. I., Gortz H.-D. Caedibacter
macronucleorum sp. nov., a bacterium inhabiting the macronucleus of
Paramecium dubosequi II Arch. Protistenk. 1993. Vol. 143. P. 319—324.
Фокин С. И., ГудковА. В., Карпов С. А., Серавин Л. H.
Влияние некоторых стероидов на ультраструктуру митохондрий
амеб, жгутиконосцев и инфузорий (Protista)// Цитология. 1993.
Т. 35. С. 44—48.
(Фокин С. И., Карпов С. A.) Fokin S. I., Karpov S. A. Bacteri-
al endocytobionts inhabiting the perinuclear space of Protista // Endocy-
tobiosis Cell Res. 1995. Vol. 11. P. 81—94.
(Фокин С. И. и др.) Fokin S. I., Przybos E., Chivilev S. M.
Nuclear reorganization variety in the Paramecium (Ciliophora, Penicu-
lida) and its possible evolution// Acta Protozool. 2001. Vol. 40.
P. 249— 261.
(Фокин С. И., Осипов Д. В.) Fokin S. I., Ossipov D. V. Gene-
rative nucleus control over cell vegetative functions in Paramecium //
Acta Protozool. 1981. Vol. 20. P. 51—73.
(Фокин С. И. и др.) Fokin S. I., Sabaneyeva E. V., Borkhseni-
ous O. N., Schweikert M., Gortz H.-D. Paramecium calkinsi and
P. putrinum (Ciliophora, Protista) harboring alpha-subgroup bacteria in
the cytoplasm// Protoplasma. 2000. Vol. 213. P. 176—183.
Фокин С. И., Сковородкин И. H. Holospora obtusa — эндо-
нуклсобионт инфузории Paramecium caudatum — в поисках макро-
нуклсуса И Цитология. 1991. Т. 33. С. 101—115.
(Фокин С. И. и др.) Fokin S. I., Schweikert М., Briimmer F.,
Gortz H.-D. Spirostomum spp. (Ciliophora, Protista) — a suitable sys-
tem for endocytobiosis research// Protoplasma. 2004. Vol. 217 (in
press).
(Фокин С. И. и др.) Fokin S. I., Schweikert M., Gortz H.-D.,
Fujishima M. Bacterial endocytobionts of Ciliophora. Diversity and
some interactions with the host // Europ. J. Protistol. 2003. Vol. 39.
P. 475—480.
(Фокин С. И. и др.) Fokin S. I., Stoeck T., Schmidt H. J. Redis-
covery of Paramecium nephridiatum Gelci, 1925 and its characteris-
tics // J. Euk. Microbiol. 1999. Vol. 46. P. 416— 426.
(Френкель M. A.) Frankel M. Tillina magna (Ciliophora, Colpo-
didae): structural changes of the macronucleus correlated with its diviti-
on// Protistologica. 1982. Vol. 18. P. 259—272.
(Фурсенко A. B.) Furssenko A. V. Lebcnscyclus und Morpholo-
gie von Zoothamnium arbuscula Ehrenberg (Infusoria Peritricha) //
Arch. Protistenk. 1928. Bd 67. P. 376—500.
ТИП CILIOPHORA. ЛИТЕРАТУРА
409
(11 Iciihkoii В. 'Г.) Schewiakoff W. T. Die Geographische Verbrei-
tiiuu tier Susswnsscr-Protozoen// Memoir Acad, taper. Science de
Si I'l'h’i Nlnuiz, 1893. VII ser. Vol. 41, 8. P. 1—201.
IIIi'iihkoh В. T, К биологии простейших// Зап. Имп. Акад.
1111УК. ( ПО, 1894. 'Г. 75. Прилож. 1. С. 1—96.
HIiMHlh'lll) В. 'Г. Организация и систематика Infusoria Aspiro-
iih lni (Ilololrlchn auctorum)// Зап. Имп. АН СПб. 1896. Сер. VIII,
I 4 < , 1 395.
(111 епмкоп В. Т.) Schewiakoff W. Т. Die Acantharia des Golfes
von Neupcl // Fauna e Flora del golfo di Napoli, Stazione Zoologica di
Napoli. 1926. Bd 37. P. 1—755.
Цепковский Л. С. О низших водорослях и инфузориях. Дис-
сертация, написанная на степень доктора естественных наук маги-
стром ботаники Львом Ценковским. СПб., 1856.
Цепковский Л. С. О самозарождении. Речь на годичном акте
Пегсрбургского университета. СПб., 1859.
Чорик Ф. П. Свободноживущие инфузории водоемов Молда-
вии. Кишинев, 1968.
(Эйхвальд Э. И.) Eichwald Е. Beitrage zur Infusiorienkunde
Russlands // Bull. Soc. tap. Nat. Moscow. 1844. Vol. 47. P. 480—587.
Эйхвальд Э. И. О минеральных водах России, с описанием ин-
фузорий Старой Руссы И Военно-мед. журн. 1860. Т. 77. С. 45—97.
Эйсмонд О. П. Инфузории, живущие на ракооборазных рода
Gainmarus // Варшава, 1890.
Янковский А. В. Новая система ресничных простейших
(Ciliophora) И Тр. ЗИН АН СССР. 1967. Т. 43. С. 3—52.
Янковский А. В. Инфузории. Подкласс Chonotricha// Фауна
СССР. Т. II, вып. 1, 1973.
(Янковский А. В.) Jankowski A. W. Cytogenetics of Parameci-
um putrinum C. et L., 1858// Acta Protozool. 1972. Vol. 10.
P. 285—394.
Aescht E. (Ed.). Die Urtiere. Ene Verborgene Welt. Linz, 1994.
Allen R. D. Fine structure, reconstruction and possible functions of
components of the cortex of Tetrahymena pyriformis // J. Protozool.
1967. Vol. 14. P. 553—565.
Allen R.D. Cytology// Paramecium/ Ed. H.-D. Gortz. Berlin;
Heidelberg, 1988. P. 4-^10.
Allen R. D. Intracellular membrane trafficking in Paramecium //
Proceed. 4th Asian Conf, on cell motility and cytogenesis / Eds H. Asai,
Y, Naitoh. Tokyo, 1995. P. 91—99.
Allen R. D., Fok A. K. Nonlysosomal vesicles (acidosomes) are
involved in phagosome acidification in Paramecium// J. Cell Biol.
1983. Vol. 97. P. 566—570.
Allen R. D., Fok A. K. Endosomal membrane traffic of ciliates //
Advances in cell and molecular biology of membranes / Ed. H. Plattner.
Vol. 2. Membrane traffic in protozoa. Stuttgart, 1993. P. 57—83.
Allen R. D., Wolf R. W. The cytoproct of Paramecium caudatum:
HliTicturc and function, microtubules, and fate of food vacuole membra-
nes//J. Cell Sci. 1974. Vol. 14. P. 611—631.
Aminermann D. Chromatin diminution and chromosome elimina-
tion: mechanisms and adaptive significance// Evolution of genome
size / Ed. T. Cavalier-Smith. N. Y., 1985. P. 427—442.
Anderson O. R. Comparative Protozoology: Ecology, Physiology,
I ll't> I IlHlory, Berlin, 1988.
Anll|»i G. A. Structural differentiation in the somatic cortex of a
1-lllnlMil pioloz.oan, Conchophthirus curtus Engelmann, 1862 // Protisto-
lliylrit 1971, Vol, 7. P. 471—501.
АиНри G, A. Use of commensal protozoa as biological indicators
ill W#l»l l|lllllily und pollution// Trans. Am. Microsc. Soc. 1977.
Vul I', 4Ю <IK9,
Alni 11ц Flll liey <1. I). (Eds). Tetrahymena thermophila. Methods
in I i'll llloliiuy, 111Й0. Vol. 62.
Bull < Jt lli I >|UlllliHIIIH living on and in protozoa // Research in pro-
tozoology / fid, T, I, ('Iwn. I .ondon; N. Y., 1969. Vol. 3. P. 565—718.
Iliirdele |i, loniil and phylogenetic aspects of the ciliary
iiii'iiibuinc: n coni|Htfitlive freeze-fracture study// BioSystems 1981.
Vol. Id. P. 403 421,
Bnrdele С. I'1, From elllllle ontogeny to ciliate phylogeny: a pro-
gram// Hull. Zool. 1989, Vol, ,42, P. 235 -243.
Bardele C. F. The eilialv tree turned upside down// J. Protozool.
1992. Vol. 39. P. 11 A.
Barnett A. A circildiltn rhythm of milling type reversals in Parame-
cium multimicronuclenlum, syngen 2, and its genetic control // J. Cell
Physiol. 1966. Vol. 67. P. 239 270.
Bauer-Nebelsick M., Bardele I1'., Ott J. A. Redescription
of Zoothamnium neveum (Hemprich, Ehrenberg, 1831) Ehrenberg,
1838 (Oligohymenophora, Peritrichida), a ciliate with ectosymbiotic,
chemoautotrophic bacteria// Europ. J. Protistol. 1996. Vol. 32. P. 18—
30.
Baumgartner M., Stetter К. O., Foissner W. Morphological,
small subunit rRNA, and phylogenetical characterization of Trimyema
minutum (Kahl, 1931), an anaerobic ciliate from submarine hydrother-
mal vents growing from 28 °C to 52 °C // J. Eukaryot. Microbiol. 2002.
Vol. 49. P. 227—238.
Beale G. H. The genetics of Paramecium aurelia. London, 1954.
Berger J. Feeding behaviour of Didinium nassutum on Parameci-
um bursaria with normal or apochlorotic zoochlorellae // J. Gen. Micro-
biol. 1980. Vol. 118. P. 397—404.
Bernhard D., Schlegel M. Evolution of histone H4 and H3 gens in
different ciliate lineages // J. Mol. Evol. 1998. Vol. 46. P. 344—354.
Belaf K. Der Formwechsel der Protistenkeme. Eine verglei-
chend-morphologische Studie// Ergebnisse und Forschritte der Zoo-
logy. Jena, 1926.
Bick H. Ciliated protozoa. An illustrated guide to the species used
as biological indicators in freshwater biology. Geneva, 1972.
Bhatia B. L. Protozoa: Ciliophora // The fauna of British India /
Ed. R. B. S. Sewell. London, 1936.
Blackburn E. H., Karrer К. M. Genomic reorganization in cilia-
ted protozoa// Ann. Rev. Genet. 1986. Vol. 20. P. 501—521.
Bleyman L. K. Ciliate genetics // Ciliates cells as organisms / Eds
K. Hausmann, Ph. C. Bradbury. Stuttgart etc., 1996. P. 292—324.
Blum J. J. Ciliate metabolism // Ciliates cells as organisms / Eds
K. Hausmann, Ph. C. Bradbury. Stuttgart etc., 1996. P. 179—195.
Bradbury Ph. C. Pathogenic ciliates // Ciliates cells as organisms /
Eds K. Hausmann, Ph. C. Bradbury. Stuttgart etc., 1996. P. 463—478.
Budin K., Philippe H. New insights into the phylogeny of eukary-
otes based on ciliate Hsp70 sequences // Mol. Biol. Evol. 1998. Vol. 15.
P. 943—956.
Bussers J.-C. Les appareils protecteurs des infusoires cilies // Trai-
te de Zoologie/ Ed. P.-P. Grasse. Paris, 1984. Vol. 2. P. 439—455.
Biitschli O. Protozoa // Klassen und Ordnungen des Thierreich in
Wort und Bild. Vol. 3 / Ed. H. G. Bronn. Leipzeig; Heidelberg,
।gg7___1889
Calkins G. N. Protozoa. N. Y., 1901.
Calkins G. N., Summers F. M. (Eds). Protozoa in Biological Re-
search. N.Y., 1941.
Canella M. F., Rocchi-Canella I. Biologie des Ophryoglenina (ci-
lies hymenostomes histophages) // Ann. Univ. Ferrara. 1976. Vol. 3
(Supplement). P. 1—510.
Carey P. G. Marine interstitial ciliates. An illustrated key. London
etc., 1992.
Chatton E., Lwoff A. Impregnation, par diffusion argentique, de
I’infraciliature des cilies marins et d’eau douce, apres fixation cytologi-
que et sans dessiccation// Comp. Rend. Soc. Biol. 1930. Vol. 104.
P. 834—836.
Chatton E., Lwoff A. Les cilies apostomes. Morphologie, cytolo-
gie, ethologie, evolution, systematique. Premiere partie. Apercu histori-
que et general. Etude monographique des genres et des expeces // Arch.
Zool. Exp.Gen. 1935. Vol. 77. P. 1—453.
Chau M. F., Ng S. F. Nucleogenesis and stomatogenesis in sexual
reproduction of Paramecium tetraurelia may be controlled by chromo-
somal factors of the germ nucleus (micronucleus) // Europ. J. Protistol.
1989. Vol. 24. P. 110—118.
Chen T. T. Polyploidy and its origin in Paramecium // J. Hered.
1940. Vol. 31. P. 175—184.
Chen T. T. (Ed.). Research in protozoology. N. Y., 1967—1972.
Vol. 1—4.
Chen Z., Song W. Phylogenetic positions of Aspidisca steini and
Euplotes vannus within the order Euplotida (Hypotrichia: Ciliophora)
inferred from complete small subunit ribosomal RNA gene sequences //
Acta Protozool. 2002. Vol. 41. P. 1—9.
Cohen J., Garreau de Loubresse N., Beisson J. Actin microfila-
ments in Paramecium: localization and role in intracellular move-
ments // Cell Motil. 1980. Vol. 4. P. 443—468.
Coombs G. H., Vickerman K., Sleigh M. A., Warren A. (Eds).
Evolutionary Reiationships Among Protozoa. The Netherlands, 1998.
Corliss J. O. The ciliated protozoa. Monograph. Pure and Appl.
Biol., Zoology. 1961. Vol. 7.
Corliss J. O. L’autogamy et senescence du cilie hymenostome Tet-
rahymena rostrata (Kahl) // Ann. Biol. 1965.Vol. 4. P. 49—69.
Corliss J. O. The changing world of ciliate systematics: historical
analysis of past efforts and a newly proposed phylogenetic scheme of
classification for the protistan phylum Ciliophora // Syst. Zool., 1974.
Vol. 23. P. 91—138.
410
ALVEOLATA
Corliss J. O. Three cenluries of protozoology: a brief tribute to its
founding father, A. van Leeuwenhoek of Delft// J. Protozool. 1975.
Vol. 22. P. 3 7.
Corliss J. О. Л salute to fifty-four great microscopists of the past: a
pictorial footnote to the history of protozoology. Hart I // Trans. Amer.
Microsc. Soc. 1978. Vol. 97. P. 419—458.
Corliss J. O. The ciliated Protozoa. Characterization, classification
and guide to the literature. 2-nd ed. N. Y., 1979.
Corliss J. O. The 200th Anniversary of «О. F. M., 1786»: A Tribu-
te to the first comprehensive taxonomic treatment of the Protozoa //
J. Protozool. 1986. Vol. 33. P. 475—478.
Corliss J. O. The question of the ancestor of the Ciliophora: a brief
review of the continuing problem// BioSystems. 1988. Vol. 21.
P. 323—331.
Corliss J. O. Historically important events, discoveries, and works
in protozoology from the mid-17th to the mid-20th century// Rev. Soc.
Mex. Hist. Nat. 1991. Vol. 42. P. 45—81.
Corliss J. O. Some Important Anniversaries in the History of Pro-
tozoology// Rev. Soc. Mex. Hist. Nat. 1997. Vol. 47. P. 5—17.
Corliss J. O. Classification of protozoa and protist: the cunent sta-
tus II Evolutionary Relationships Among Protozoa / Eds G. H. Coombs,
K. Vickerman, M. A. Sleigh, A. Warren. The Netherlands, 1998.
p. 409—447.
Corliss J. O. Haeckel’s Kingdom Protista and Current Concepts in
Systematic Protistology// Landsmuseum, Neue Folge, 1998. Vol. 131.
P. 85—104.
Corliss J. O. Professor Calkins, Conjugation, and the Physiologi-
cal Life Cycle of Ciliates# Protist. 1998. Vol. 149. P. 89—97.
Corliss J. O. Biodiversity of the Cilioprotists and the Contributi-
ons of Faure-Fremiet to the Field// Protist. 1998. Vol. 149. P. 277—
290.
Corliss J. О A salute to Antony van Leeuwenhoek of Delft, most
versatile 17th century founding father of protistology// Protist. 2002.
Vol. 153. P. 177—190.
Creutz С. E., Mohanty S., Defalco T., Kretsinger R. H. Purine
composition of the crystalline cytoplasmic inclutions of Paramecium
tetraurelia// Protist. 2002. Vol. 153. P. 39—45.
Cronkite D. L. Relations between photobehaviour and ionically
stimulated swimming in Paramecium bursaria// J. Protozool. 1986.
Vol. 33. P. 52—56.
Curds C. R. An ecological study of the ciliated protozoa in activa-
ted sludge // Oikos. 1966. Vol. 15. P. 282—289.
Curds C. R. An Illustrated Key to the British Freshwater Ciliated
Protozoa Commonly Found in Actived Sludge. London, 1969.
Curds C. R. British and other freshwater ciliated protozoa.
Part I. Ciliophora: Kinetofragminophora. London etc., 1982.
Curds C. R., Gates M. A., Roberts D. M. British and other fresh-
water ciliated protozoa. Part II. Ciliophora: Oligohymenophora and Po-
lyhymenophora. Keys and notes for the identification of the free-living
genera. London etc., 1983.
De Bary A. Die Erscheinungen der Symbiose. Strassburg, 1879.
Diaz S., Martin-Gonzdlez A., Borniquel S., Gutierrez J. C. Cyr-
tolophosis elongata (Colpodea Ciliophora): some aspects of ciliary pat-
tern, division, cortical and nuclear changes during encystment and res-
ting cyst ultrastructure// Europ. J. Protistol. 2000. Vol. 36.
P. 367—378.
Dini F., Lucchesi P., Macchioni G. Protozoa // Checklist delle
specie della fauna Italia/ Eds A. Minelli, S. Ruffo. Bologna, 1995.
P. 1—92.
Dini F., Nuberg D. 1993. Sex in Ciliates // Advances in microbial
ecology // Ed. J. G. Jones. N. Y„ 1993. Vol. 13. P. 85—153.
Dobell C. Antony van Leeuwenhoek and his «little animals». Lon-
don, 1932.
Dobell C. In Memoriam. Otto Butschii (1848—1920). «Architect
of Protozoology». Isis. 1951. Vol. 42. P. 20—22.
Doflein F. Die Protozoen als Parasiten und Krankheitserreger nach
biologischen Gesichtspunkten dargestellt. Jena, 1901.
Doflein F., Reichenaw E. Lehrbuch der Protozoenkunde. Stutt-
gart, 6 Aufl. 1949—1953.
Dragesco J. Cilies mesopsammiques d’Afrique Noire. Cahiers de
Biol. Marine. 1965.Vol. 6. P. 357—399.
Dragesco J. Quelques Cilies fibres du Gabon. Perigueux, 1966.
Dragesco J. Cilies fibres du Cameroun // Ann. Fac. Sci. Yaounde,
1970.
Dragesco J. Free living ciliates from Uganda // Ann. Fac. Sci. Ca-
meroun, 1972. P. 87—126.
Dragesco J., Dragesco-Kerneis A. Cilies fibres de 1’Afrique inter-
tropicale /! Faune tropicale 1986. Vol. 26. P. 1—559.
Dujardin M. F. Histoire naturelie des zoophytes. Infusoires. Paris,
1841.
Ehrenberg C. G. Die Infusionsthierchen als Vollkommene Orga-
nismen. Leipzig, 1838.
Eisler K. Licht- und Elektronenmikroskopische Untersuchungen
zur Corticalen Morphologic und Morphogenese nassulider Ciliaten. Ein
Beitrag zur Klarung der Stellung der Nassulida (Ciliata, Cyrtophora) in
einem Naturlichen System der Ciliaten. Tubingen, 1986.
Eisler K., Fleury A. Morphogenesis and evolution in ciliates //
Protistological Actualities // Eds G. Brugerolle, J.-P. Mignot. Cler-
mont-Ferrand, 1995. P. 102—127.
Elliot A. M. (Ed.). Biology of Tetrahymena. Stroudsburg, 1973.
Entzeroth A. Geschichte der Deutschsprachigen Protozoen-For-
schung // Die Urtiere. Eine verborgene Welt / Ed. Aescht. Linz, 1994.
P. 81—90.
Esteban G. F., Corliss J. O., Finlay B. J. Saville-Kent’s string of
pearls // Protist. 2002. Vol. 153. P. 413—430.
Esters A. M., Reynolds B. S., Moss A. G. Trichodina ctenophori
n. sp., a novel symbiont of ctenophores of the Northeren coast of the
Gulf of Mexico // J. Euk. Microbiol. 1997. Vol. 44. P. 420—426.
Ewing M. S., Kocan К. M. Ichthyophthirius multifiliis (Ciliopho-
ra) development in gill epithelium// J. Protozool. 1986. Vol. 33.
P. 369—374.
Ewing M. S., Kocan К. M. Ichthyophthirius multifiliis (Ciliopho-
ra). Exit from gill epithelium//J. Protozool. 1987. Vol. 34. P. 309—312.
Farmer J. N. The protozoa. Introduction to protozoology. St. Lou-
is, 1980.
Faure-Fremiet E. Morphologie comparee et systematique des ci-
lies//Bull. Soc. Zool. France. 1950. Vol. 75. P. 109—122.
Faure-Fremiet E. Caulobacteries epizoiques associees aux Cent-
rophorella (Cilies holotriches) // Bull. Soc. Zool. France. 1950a.
Vol. 75. P. 134—137.
Faure-Fremiet E., Andre J., Ganier M.-C. Calcification tegu-
mentaire chez les cilies du genre Coleps Nitzsch !/ J. Microsc. (Paris).
1968. Vol. 7. P. 61—68.
Fenchel T. On the ciliate fauna associated with the marine species
of the amphipod genus Gammarus J. G. Fabricius // Ophelia. 1965.
Vol. 2. P. 281—303.
Fenchel T. Protozoan filter feeding // Progress in Protistology / Eds
J. O. Corliss, D. J. Patterson. Bristol, 1986. Vol. 1. P. 65—117.
Fenchel T. Ecology of Protozoa: the biology of free-living phago-
trophic protists. Berlin, 1987.
Fenchel T., Finlay B. J. Kentrophoros: a mouthless ciliate with a
symbiotic kitchen garden// Ophelia. 1989. Vol. 30. P. 75—93.
Fenchel T., Finlay B. J. The biology of free-living anaerobic cilia-
tes // Europ. J. Protistol. 1991. Vol. 25. P. 201—215.
Finlay B. J., Corliss J. O., Esteban G. F., Fenchel T. Biodiversi-
ty at the microbial level: the number of free-living ciliates in the bio-
sphere// Quart. Rev. Biol. 1996. Vol. 71. P. 221—237.
Finlay B. J., Esteban G. F., Fenchel T. Protozoan diversity: con-
verging estimates of the global number of free-living ciliate species //
Protist. 1998. Vol. 149. P. 29—37.
Finlay B. J., Fenchel T. Devergent perspectives on Protist species
richness// Protist. 1999. Vol. 150. P. 229—233.
Finlay B. J., Rogerson A., Cowling A. J. Collection, isolation,
cultivation and identification of freshwater Protozoa // Culture Collecti-
on of Algae and Protozoa. Ambleside, Cumbria, 1988.
Finley H. E. Sexual differentiation in peritrichous ciliates //
J. Morph. 1952. Vol. 91. P. 569—605.
Fleury A., Delgado P., Iftode F., Adoutte A. A molecular phylo-
geny of ciliates: what does it tell us about the evolution of the cytoskele-
ton and of developmental strategies? // Develop. Genetics. 1992.
Vol. 13. P. 247—254.
Foissner W. Taxonomic and nomenclatural revision of Sladecek’s
list of ciliates (Protozoa: Ciliophora) as indicators of water quality//
Hydrobiologia. 1988. Vol. 166. P. 1—64.
Foissner W. Colpodea (Ciliophora). Stuttgart; Jena; N. Y., 1993.
Foissner W. Die Urtiere (Protozoen) des Bodens // Die Urtiere.
Eine verborgene Welt / Ed. E. Aescht. Linz, 1994. P. 169—218.
Foissner W. Ontogenesis in ciliated Protozoa, with emphasis on
stomatogenesis // Ciliates cells as organisms / Eds K. Hausmann,
Ph. C. Bradbury. Stuttgart etc., 1996. P. 95—177.
Foissner W. Protist diversity: estimates of the near-imponderable //
Protist. 1999. Vol. 150. P. 363—368.
Foissner W. Protozoan biodiversity — myphs and facts // Abstr. XI
Intern. Congress Protozool. Salzburg, Austria, 2001. P. 14.
Foissner W., Agatha S., Berger H. Soil Ciliates (Protozoa, Cilia-
phora) from Namibia (Southwest Africa) with emphasis on two contras-
ТИП CILIOPHORA. ЛИТЕРАТУРА
411
ting environments, the Etosha region and the Namib desert II Denisia.
2002. Vol. I—2.
Foissner W., Berger H., Kohmann F. Taxonomische und Okolo-
gischc Revision der Ciliaten des Saprobiensystems. Bd II: Peritrichia,
I letcrotrichida, Odontostomatida. Miinchen, 1992.
Foissner W., Berger H., Kohmann F. Taxonomische und Okolo-
glschc Revision der Ciliaten des Saprobiensystems. Bd III: Hymenosto-
mntida, Prostomatida, Nassulida. Munchen, 1994.
Foissner W., Berger H., Blatterer H., Kohmann F. Taxonomi-
sche und Okologische Revision der Ciliaten des Saprobiensystems. IV:
Gymnostomatea, Loxodes, Suctoria. Munchen, 1995.
Foissner W., Berger H., Schaumburg J. Identification and ecolo-
gy of limnetic plankton ciliates. Munchen, 1999.
Foissner W., Blatterer H., Berger H., Kohmann F. Taxonomi-
sche und Okologoische Revision der Ciliaten des Saprobiensystems.
Band I: Cyrtophorida, Oligotrichida, Hypotrichina, Colpodea. Mun-
chen, 1991.
Foissner W., Foissner I. Oral monokinetids in the free-living hap-
torid ciliate Enchelydium polynucleatum (Ciliophora, Enchelyidae): ul-
trastructural evidence and phylogenetic implications II J. Protozool.
1985. Vol. 32. P. 712—722.
Foissner W., Wenzel F. Life and legacy of an outstanding ciliate
taxonomist, Alfred Kahl (1877—1946), incluting a facsimile of his for-
gotten monograph from 1943 // Acta Protozool. 2004. Vol. 43 (Suppl.).
P. 3—69.
Fok A. K., Allen R. D. The lysosome system // Paramecium / Ed.
H.-D. Gortz. Berlin etc., 1988. P. 301—324.
Fok A. K., Allen R. D. Membrane flow in the digestive cycle of
Paramecium // Advances in biochemistry and biology of membranes.
Membrane traffic in protozoa / Ed. H. Plattner. Vol. 2. Greenwich,
1993. P. 85—111.
Frankel J. Pattern Formation: Ciliate Data and Models. N. Y.,
1989.
Fujishima M. Conjugation II Paramecium / Ed. H.-D. Gortz. Ber-
lin etc., 1988. P. 70—84.
Gall J. G. (Ed.). The molecular biology of ciliated protozoa. Flori-
da, Orlando, 1986.
Gall J. G. Macronuclear duplication in the ciliated protozoan Eup-
lotes// J. Biophis. Biochem. Cytol. 1959. Vol. 5. P. 295—308.
Gelei J., Horvath P. Eine nasse Silber-bzw. Gold-methode fur die
Herstellung der Reizleitenden Elemente bei den Ciliaten // Z. Wiss.
Mikrosk. 1931. Bd 48. P. 9—29.
Giese A. C. Blepharisma. The biology of a light-sensitive protozo-
an. Stanford, 1973.
Goldfuss G. A. Uber die Entwicklungsstufen des Thieres. Ntiren-
bcrg, 1817.
Gorovski M. A. Genom organization and reorganization in Tetra-
hymcna// Ann. Rev. Genet. 1980. Vol. 14. P. 203—239.
Gortz H.-D. The behavior and fine structure of the dorsal bristles
of Euplotes minuta, E. aediculatus, and Stylonychia mytilus (Ciliata,
Hypotrichida)// J. Protozool. 1982. Vol. 29. P. 353—359.
Gortz H.-D. Endonuclear symbionts in Ciliates // Int. Rev. Cytol.
1983a. Suppl. 14. P. 145—176.
Gortz H.-D. Infection of Paramecium bursaria with bacteria and
yonsts II J. Cell Sci. 1983b. Vol. 58. P. 445—453.
Giirtz H.-D. Endonucleobiosis in ciliates // Inter. Rev. Cytol. 1986.
Vol 102. P. 169—213.
Glll'tz ll.-D. (Ed.). Paramecium. Berlin; Heidelberg, 1988.
GhlTz ll.-D. Symbiosis in Ciliates // Ciliates. Cells as a organisms /
Kiln К, IIhUHllllinn, Ph. C. Bradbury. Stuttgart, 1996. P. 441—462.
Glll'U ll.-D. Aquatic symbionts and pathogens — ancient and
now/* Iligulliu for pathogens / Ed. C. L. Greenblatt. Jerusalem, 1998.
I». 07 iff,
Grain .1,, MillllOl J.-l’., Puytorac P. Ultrastructures and evolutio-
nary inodalhioH of 11 nuollnr and ciliary systems in protists // Biol. Cell.
1988. Vol. 6.1, I', 219 2.17,
Gi'iinnC1 P.-P, I'rolozonlrcH// Traitd de Zoologie. Paris. 1952—
1953.
Grell K. Protozoology, ,1hl cd. Berlin, 1973.
Greenwood S. .1., Schlegel M., Sogln M., Lynn D. H. Phylogene-
tic relationships of Blepluirismn amcricana and Colpoda inflata within
the phylum Ciliophora inferred Horn complete small subunit rRNA
gene sequences // J. Protozool, 1991. Vol. 38. P. 1—6.
Grim J. N. Subpellicular microtubules of Euplotes eurystomus:
their geometry relative to cell for m, surface contours and ciliary orga-
nells // J. Cell Sci. 1982. Vol. 56. P. 471.484.
Grimes В. H., Bradbury Ph. C. The biology of Vampyrophrya
pelagica (Chatton, Lwoff, 1930), a histophagous apostome ciliate asso-
ciated with marine calanoid copepods/' J. Protozool. 1992. Vol. 39.
P. 65—79.
Grover J. E., Rope A. F., Kaneshiro E. S. The occurrence of bio-
genic calcian struvite, (Mg, Ca) NH4PO4 • 6H2O, as intracellular crys-
tals in Paramecium//!. Euk. Microbiol. 1997. Vol. 44. P. 366—373.
Guilcher Y. Contribution a Г etude des cilies gemmipares, chono-
triches et tentaculiferes// Ann. Sci. Nat. Zool. 1951. Vol. 13.
P. 33—132.
Hammerschmidt B., Schlegel M., Lynn D. H., Leipe D. D., So-
gin M. L., Raikov I. B. Insights into the evolution of nuclear dualism
in the ciliates revealed by phylogenetic analysis of rRNA sequences //
J. Euk. Microbiol. 1996. Vol. 43. P. 225—230.
Hartmann ML Praktikum der Protozoologie. Jena, 1907.
Hartmann M. Polyploide (polyenergide) Kerne bei Protozoa //
Arch. Protistenk. 1952. Bd 98. P. 125—156.
Hartmann Ml. Sex problems in Algae, Fungi, and Protozoa //
Amer. Nat. 1955. Vol. 89. P. 321—346.
Harumoto T. The role of trichocysts discharge and backward
swimming in escaping behaviour of Paramecium from Dileptus marga-
ritifer // J. Euk. Microbiol. 1994. Vol. 41. P. 560—564.
Harumoto T., Miyake A. Defensive function of trichocysts in Pa-
ramecium// J. Exp. Zool. 1991. Vol. 260. P. 84—92.
Hausmann K., Allen R. D. Membrane behaviour of exocytic ve-
sicles. II. Fate of the trichocyst membranes in Paramecium after indu-
ced trichocyst descharge// J. Cell Biol. 1976. Vol. 69. P. 313—326.
Hausmann K., Bradbury Ph. C. (Eds). Ciliates cells as orga-
nisms. Stuttgart etc., 1996.
Hausmann K., Hausmann E. Structural studies on Trichodina pe-
diculus (Ciliophora, Peritricha). II. The adhesive disc II J. Ultrastruct.
Res. 1981. Vol. 74. P. 144—155.
Hausmann K., Hiilsmann N. Protozoology. 2-nd ed. Stuttgart;
N. Y., 1996.
Hausmann K., Hiilsmann N., Radek R. Protistology. 3rd revised
ed. Berlin; Stuttgart, 2003.
Hausmann K., Kaiser J. Arrangement and structure of plates in
the cortical alveoli of the hypotrich ciliate, Euplotes vannus II J. Ultra-
struct. Res. 1979. Vol. 67. P. 15—22.
Hausmann K., Peck R. K. The mode of function of the cytopha-
ryngeal basket of the ciliate Pseudomickrothorax dubius // Differentiati-
on. 1979. Vol. 14. P. 147—158.
Heckmann K., Gortz H.-D. Prokaryotic symbionts of ciliates //
The prokaryotes / Eds A. Balows, H. G. Truper, M. Dworkin, W. Har-
der, K.-H. Schleifer. 2nd ed. Berlin; N. Y, 1991. P. 3865—3890.
Hertwig R. Uber die Conjugation der Infusorien // Ab. K. Bayer.
Akad. D. Wiss. 1889. Vol. 17. P. 151—233.
Hiwatashi K. (Ed.). Genetics of ciliates. Sendai, 1999 (in Japane-
se).
Hofmann A. H. Stomatogenesis in cyrtophorid ciliates. II. Chilo-
donella cyprini (Moroff, 1902): the kinetofragment as an anlagen-
complex// Eur. J. Protistol. 1987. Vol. 23. P. 165—184.
Huttenlauch I., Bardele C. F. Light and electron microscopical
observations on the stomatogenesis of the ciliate Coleps amphacanthus
Ehrenberg, 1833 // J. Protozool. 1987. Vol. 34. P. 183—192.
Hyman L. H. Protozoa through Ctenophora// The invertebrates.
New York, 1940.
Janisch R. Biomembranes in the life and regeneration of Parameci-
um. Brno, 1987.
Jenkins R. A. The role of microtubules in macronuclear division of
Blepharisma// J. Protozool. 1977. Vol. 24. P. 264—275.
Jennings G. N. Genetics of the Protozoa// Bibliogr. Genet. 1929.
Vol. 5. P. 105—330.
Jennings G. N. Genetics of Paramecium bursaria. I. Mating types
and groups, mailing behaviour, self-sterility; their development and in-
heritance// Am. Nat. 1939. Vol. 73. P. 414—431.
Jerka-Dziadosz M. Ultrastructural study on development of the
hypotrich ciliate Paraurostyla weissei. I. Formation and morphogenetic
movements of ventral ciliary primorida // Protistologica. 1980. Vol. 16.
P. 571—589.
Jurand A., Selman G. G. The anatomy of Paramecium aurelia.
London; N. Y., 1969.
Kahl A. Ncuc und wenig bekannte Formen der holotrichen und he-
tcrotrichcn Ciliaten// Arch. Protistenk. 1926. Vol. 55. P. 197—438.
Kahl A. Urtiere Oder Protozoa. I: Wimpertiere oder Ciliata (Infuso-
ria) // Die Tierwelt Deutschlands / Ed. F. Dahl. Jena, 1930, part 18;
1931, 21; 1932, 25; 1935, 30.
Kahl A. Ciliata Libera et Ectocommensalia// Die Tierwelt der
Nord- und Ostsee / Eds G. Grimpe, E. Wagler, Leipzig, 1933.
P. 29—146.
412
ALVEOLATA
Kahl A. Ciliata Endocommcnsalia et Parasitica // Die Tierwelt der
Nord- und Ostsec / lids (i. Griinpc, E. Wagler, Leipzig, 1934a.
P. 147-183.
Kahl A. Suctoria // Die Ticrwelt der Nord- und Ostsee / Eds
G. Grimpc, E. Wagler, Leipzig, 1934b. P. 184--226.
Kahl A. Infiisoricn (1 Tcil).llandbucher fur die praktische wissen-
schaftliche Arbeit 31/32. Stuttgart, 1943. Reprinted in Acta Protozool.
2004. Vol. 43 (Suppl.). P. 11 — 62.
Kalnnis H. Paramecium das Pantoffeltirchen. Eine Monographi-
sche Zusammcnfassung der Wichtigsten Kenntnisse. Jena, 1931.
Karrer К. M. The nuclear DNAs of holotrichous ciliates // The
molecular biology of ciliated protozoa / Ed. J. G. Gall. Orlando, 1986.
P. 85 110.
Karrer К. M. Tetrahymena genetics: two nuclei are better
than one // Methods in Cell biology. Tetrahymena thermophila/
Eds D. J. Asai, J. D. Forney. San Diego etc., 2000. Vol. 62. P. 127—
186.
Kent W. S. A manual of the Infusoria. London, 1880—1882.
Kirby H. Organisms living on and in protozoa // Protozoa in biolo-
gical research/ Eds G. N.Calkins, F. M. Summers. N. Y., 1941.
P. 1009—1113.
Klein В. M. Ergebnisse mit einer Silbermethode bei Ciliaten //
Arch. Protistenk. 1926. Vol. 56. P. 243—279.
Knoll G., Haacken-Bell B., Plattner H. Local trichocist exocyto-
sis provides an efficient escape mechanism for Paramecium cells // Eur.
J. Protistol. 1991. Vol. 27. P. 381—385.
Kudo R. R. Protozoology. 6th ed. Springfield, 1971.
Kuhlmann H. W., Heckmann K. Interspecific morphogens regu-
lation prey-predator relationships in protozoa// Science. 1987.
Vol. 227. P. 1347—1349.
Kusch J. Induction of defense morphological changes in ciliates //
Oecologia. 1993. Vol. 94. P. 571—575.
Kuvardina O. N., Leander B. S., Aleshin V. V., Milnikov A. P.,
Keeling P. J., Simdyanov T. G. Phylogeny of colpodellids (Alveolata)
using small subunit rRNA gene sequences suggests they are the free-li-
ving sister group to Apicomplexans // J. Euk. Microbiol. 2002. Vol. 49.
P. 498—504.
Kuznicki L. Protozoology in Poland — past and present // Acta
Protozool. 1982. (Special volume). P. 75—111.
Kuznicki L. Protozoologia w Polsce 1861—2001. Warszawa,
2003.
Landis W. G. Ecology// Paramecium / Ed. H.-D. Gortz. Berlin;
Heidelberg, 1988. P. 419—436.
Laval-Peuto M., Febvre M. On plastid symbiosis in Tontonia ap-
pendiculariformis (Ciliophora, Olygotrichina) // BioSystems. 1986.
Vol. 19. P. 137—158.
Laval-Peuto M., Heinbokel J. F., Anderson O. R., Rassoulzade-
gan F., Sherr B. F. Role of micro- and nanozooplankton in marine food
webs // Insect. Sci. Applic. 1986. Vol. 7. P. 387—395.
Lee J. J., Soldo A. T. (Eds). Protocols in Protozoology. Society of
Protozoology. Lawrence, 1992.
Leipe D. D., Bernhard D., Schlegel M., Sogim M. Evolution
of 16S-like ribosomal RNA genes in the Ciliophora taxa Litostoma-
tea and Phyllopharyngea// Europ. J. Protistol. 1994. Vol. 30. P. 354—
361.
Lewis L. W. The evolutionary significance of ultrastructural varia-
tions in the micronuclear spindle apparatus in the genus Paramecium //
BioSystems. 1975. Vol. 7. P. 380—385.
Lipscomb D. L., Corliss J. O. Stephanopogon, a phylogcnctically
important «ciliate», shown by ultrastructural studies to be a flagellate //
Science. 1982. Vol. 215. P. 303—304.
Lipsi J. Protozoologie. Bucarest, 1965.
Lloyd D., Williams A. G., Amann R., Hayes A. J., Durrant L.,
Ralphs J. R. Intracellular prokaryotes in rumen ciliate Protozoa: detec-
tion by confocal laser scanning microscopy after in situ hybridization
with fluorescent 16S rRNA probes// Europ. J. Protistol. 1996. Vol. 31.
P. 523—531.
Lu L., Ng S. F. Somatic function of the micronucleus of Stylony-
chia mytilus during asexual propagation // Europ. J. Protistol. 1991.
Vol. 27. P. 26—39.
Lucchesi P., Santangelo G. How often does coniugation in ciliates
occur? Clues from a sevenyears study on marine sandy shores // Aquat.
Microb. Ecol. 2004. Vol. 36. P. 195—200.
Luporini P., Miceli C. Mating pheromones // The molecular bio-
logy of ciliated protozoa / Ed. J. G. Gall. N. Y., 1986. P. 263—
299.
Lynn D. H. Comparative ultrastructure and systimatics of the Col-
podida.Toronto, 1975.
Lynn D. H. Comparative ultrastructure and systematics of the Col-
podida. Structural conservatism hypothesis and a description of Colpo-
da steinii Maupas// J. Protozool. 1976. Vol. 23. P. 302—314.
Lynn D. H. The organization and evolution of microtubular or-
ganells in ciliated protozoa// Biol. Rev. 1981. Vol. 56. P. 243—292.
Lynn D. H. Systematics of Ciliates // Ciliates. Cells as a orga-
nisms / Eds K. Hausmann, Ph. C. Bradbury. Stuttgart, 1996. P. 51—72.
Lynn D. H. My journey in ciliate systematics // J. Euk. Microbiol.
1996a. Vol. 43. P. 253—260.
Lynn D. H. The evolution of stomatogenesis in the class Oligohy-
meniphorea and related classes (Phylum Ciliophora) // J. Euk. Microbi-
ol. 2001. Vol. 48. P.7A.
Lynn D. H. Morphology or moleculs: how do we identify the maj-
or lineages of ciliates (Phylium Ciliophora)? // Europ. J. Protistol. 2003.
Vol. 39. P. 356—364.
Lynn D. H., Corliss J. O. Ciliophora // Microscopic anatomy of
invertebrates / Eds F. W. Harrison, J. O. Corliss. N. Y.; Toronto, 1991.
P. 333—467.
Lynn D. H.,Gransden S. G., Wright A.-D. G., Josephson G.
Characterization of new species of the ciliate Tetrahymena (Ciliophora:
Oligohymenophorea) isolated from the urine of a dog: first report of
Tetrahymena from a mammal// Acta Protozool. 2000. Vol. 39.
P. 289—294.
Lynn D. H., Small E. B. A revised classification of the phylum Ci-
liophora Doflein, 1901 // Rev. Soc. Mex. Hist. Nat. 1997. Vol. 47.
P. 65—78.
Lynn D. H., Small E. B. Phylium Ciliophora// An illustrated gui-
de to the Protozoa / Eds J. J. Lee, S. H. Hutner, E. C. Bovee. Lawrence,
2000. P. 371—655.
Lynn D. H., Striider-Kypke M. C. Phylogenetic position of Lic-
nophora, Lechriopyla, and Schizocaryum, three unusual ciliates (Phy-
lum Ciliophora) endosymbiotic in echinoderms (Phylum Echinoderma-
ta) // J. Euk. Microbiol. 2002. Vol. 49. P. 460—468.
Lynn D. H., Zimmerman A. M. Cytoskeletal function of cortical
microtubules in the ciliate Colpoda// Protoplasma. 1981. Vol. 108.
P. 29—38.
Lwoff A. Problems of morphogenesis in ciliates. The kinnetosomes
in development, reproduction and evolution. N. Y., 1950.
Mackinnon D. L., Hawes R. S. J. An introduction to the study of
protozoa. Oxford, 1961.
Maeda M. An illustreted guide to the species of the Families Halte-
riidae and Strobilidiidae (Oligotrichida, Ciliophora), free swimming
protozoa common in the aquatic environment // Bull. Ocean Res. Inst.
Univ. Tokyo. 1986. Vol. 21. P. 1—67.
Maeda M., Garey P. G. An illustrated guide to the species of the
Families Strombidiidae (Oligotrichida, Ciliophora), free swimming
protozoa common in the aquatic environment// Bull. Ocean Res. Inst.,
Univ. Tokyo. 1985. Vol. 19. P. 1—68.
Margulis L., Corliss J. O., Melkonian M., McKhann H. (Eds).
Handbook of Protoctista. A guide to the algae, ciliates, foraminifera,
sporozoa, water molds, slime molds and the other protoctists. Boston,
1990.
Margulis L., McKann H. I., Olendzenski L. (Eds). Illustrated
glossary of Protoctista. Boston; London, 1993.
Matsusaka T., Noguchi O. Cortical morphogenesis during encyst-
ment in a ciliate, Euplotes encysticus Yonezawa, 1985 // Europ. J. Pro-
tist. 1989. Vol. 24. P. 133—137.
Matthes D., Guhl W., Haider G. Suctoria und Urceolariidae. Pro-
tistenfauna Vol. 7/1. Stuttgart; N. Y., 1988.
Maupas E. Contribution a I’etude morphologique et anatomique
des infusoires cilies// Arch. Zool. Exper. Gener. 1883. Vol. 1.
P. 427—664.
Maupas E. Sur la conjugaison des infusoires cilies // Cmpt. Rend.
Ac. Sc. Paris. 1886. Vol. 102. P. 1569—1572.
Maupas E. Recherches experimentales sur la multiplication des in-
fusoires cilies // Arch. Zool. Exper. Gener. 1888. Vol. 6. P. 165—277.
Mehlhorn M., Ruthmann H. A. Allgemeinc Protozoologue. Jena,
1992.
Metenier G., Hufschmid J.-D. Evidence of extensive fragmentati-
on of macronuclear DNA in two non-hypotrichous ciliates // J. Protozo-
ol. 1988. Vol. 35. P. 71—73.
Miao W., Shen Y.-F. Phylogenetic relationships of the subclass
Peritrichia (Oligohymenophorea, Ciliophora) with emphasis on the ge-
nus Epistylis, inferred from small subunit rRNA gene sequences //
J. Euk. Microbiol. 2001. Vol. 48. P. 583—587.
Miyake A. Fertilization and sexuality in ciliates // Ciliates. Cells as
a organisms / Eds K. Hausmann, Ph. C. Bradbury. Stuttgart, 1996.
P. 243—290.
ТИП CILIOPHORA. ЛИТЕРАТУРА
413
Miyake A., Harumoto Т., Salvi В., Rivola V. Defensive function
ol pii'incnt granules in Blepharisma japonicum// Europ. J. Protistol.
1990. Vol. 25. P. 310—315.
Miyake A., Harumoto T. Defensive function of extrusomes in ci-
llulrs: II. Pigment granules // Proceed. 4th Asian Conf, on cell motility
niul l ylogcnesis / Eds H. Asai, Y. Naitoh. Tokyo, 1995. P. 69—76.
Miyake A., Harumoto T. Defensive function of trichocists in Pa-
iiillli'cillin against the predatory ciliate Monodinium balbiani// Europ.
I Piotistol. 1996. Vol. 32. P. 128—133.
Miyake A., Harumoto T., lio H. Defence function of pigment gra-
nules in Stentor coeruleus// Europ. J. Protistol. 2001. Vol. 37.
P. 77 88.
Miyake A., Rivola V., Harumoto T. Double paths of macronucle-
us differentiation at conjugation in Blepharisma japonicum// Europ.
.1, Piotistol. 1991. Vol. 27. P. 178—200.
MulischM., Hausmann K. Lorica constraction in Eufolliculina
i>p, (Ciliophora, Heterotrichida)// J. Protozool. 1983. Vol. 30.
P. 97 104.
Mulisch M., Patterson D. J. Stomatogenesis during cell division
in the loricate ciliate Eufolliculina uhligi. A scanning electron micro-
scope study// Europ. J. Protistol. 1987. Vol. 23. P. 193—201.
Miiller M. Energy metabolism of protozoa without mitochondria //
Ann. Rev. Microbiol. 1988. Vol. 42. P. 465—488.
Nanney D. L. Experimental ciliatology. An introduction to genetic
nnd developmental analysis in ciliates. N. Y. etc., 1980.
Ng S. F. The somatic function of the micronucleus of ciliated proto-
zoa 1! Progress in Protistology / Eds D. J. Patterson, J. O. Corliss. Bris-
tol, 1986. Vol. 1. P. 215—286.
Nillson J. R., van Deus B. Coated pits and pinocytosis in Tetrahy-
iiieiin // .1. Cell Sci. 1983. Vol. 63. P. 209—222.
Nilhon J. R. On macronuclear «subnuclei», or genome segregati-
on, nnd «ainitosis» in amicronucleate Tetrahymena pyriformis OL.
Л study utilizing the effect of vanadate on nuclear divition// Europ.
,1, Piolistol. 2000. Vol. 36. P. 423—436.
Noblli R. Mating types and mating inheritance in Euplotes mi-
niilii Yocom (Ciliata, Hypotrichida) // J. Protozool. 1966. Vol. 13.
P. IK 41.
Ogiinoto K., Imai S. Atlas of rumen microbiology. Tokyo, 1981.
Oku K., Mlkami K. Interspecific compatibility of the germinal
itileionucleiis with the cytoplasm in Paramecium: preservation of the
P. tiichium micronuclcus in the cytoplasm of P. caudatum// Europ.
.1. Piotistol. 1996. Suppl. 1. P. 114—120.
Olive L. S., Blanton R. L. Aerial sorocarp development by the ag-
gicgntivc ciliate, Sorogena stoianovitchae // J. Protozool. 1980. Vol. 27.
P ,’9I 299.
I'ullei'ion I). .1. Contractile vacuoles and associated structures:
Iholi iiigonl/nllon mid lltnction // Biol. Rev. 1980. Vol. 55. P. 1—46.
I), J, Changing view of protistan systematics: taxonomy
ul |'i11I11/11H Й11 overview U An Illustrated guide to the Protozoa / Eds
I I I up, (I, F, l.eetlale, Ph, Brndbury. Laurence, Kansas, 2000.
P 7 9.
PalluNtin D| J|| Irttgerollt G> The ultrastructural identity of
tjiephiiiiiipoiioi) ipegon ina the relRtediieHH of the genus to other kinds
Id ptolhu ГMllfop, Ji Proilliool. IDO. Vol, 23, P, 279 -290.
i'nlloHiin Bi Ju LlHIH J<i Corllta J. O. The ecology of hetero-
tiiiphli' IlngallalH Kild oillmmi living In marine sediments // Progress in
Pi in iMuliigv / Udi ft, Ji Pallorsttn, J, 0. Corliss, Bristol, 1989. Vol. 3.
P Illi 171,
I'millii J, J, Mniphiilogy and cytology of Ciliates // Ciliates. Cells
и» к u^imisme I BdS K, Hausmann, Ph. C. Brndbury. Stuttgart, 1996.
Pally J, At Mi Zur Kenlnlss kleinster Lcbensfonncn nach Bau,
ItiiiI,Hunan, Hyslmnmlk, mil N|H’clalvcrzcichniss dor in dor Schweiz,
liiuilmi hiaian neilln, 1881.
Pvliusnn J, Nu llvilser Ju Nvlson I). Dissociation and reassociati-
on ol uh hiii'vsl in tilelni bltitihamlcnl mid ultrastuctural studies //J. Cell,
•h i 19H7. Vol. И7. P. ,1 JS,
Petz. W„ Song Wo Wllhvi'l N. Taxonomy and ecology of the cilia-
le luiiuii (Pioluzoa, Cillophoia) In the endopagial and pelagial of the
Weddell Sen, Anlarellva, Nlnllln, Vol. 40. Linz, 1995.
Piletkn 1). R. Elcclion miicioseoplc structure of protozoa. Oxford,
1963.
Planner II. My favorite' cell Paramecium // BioEssays. 2002.
Vol. 24. P. 649- 658.
Plattner H., Matt II., Kcrskt'ii II., Поиске B., Sturzl R. Syn-
chronous exocytosis in Paramecium cells. I. A novel approach// Exp.
Cell Res. 1984. Vol. 151. P. 6 13.
Preer J. R. Update on the molecular genetics of Paramecium //
J. Protozool. 1989. Vol. 36. P. 182—184.
Preer J. R., Preer L. B. Endosymbionts of Protozoa II Bergey’s
manual of systematic bacteriology I Ed. N. R. Kreg. Baltimore; Lon-
don, 1984. Vol. 1. P. 795—813.
Preer J. R., Preer L. B., Jurand A. Kappa and other endosym-
bionts in Paramecium aurelia//Bact. Rew. 1974. Vol. 38. P.113—
163.
Puytorac P. de. Infusoires cilies // Traite de Zoologie. Vol. 2.
Fasc. 2. Paris etc., 1994.
Puytorac P. de, Batisse A., Bohater J., Corliss J. O., Deroux G.,
Didier P., Dragesco J., Fryd-Versavel G., Grain J., Groliere C.-A.,
Hovasse R., Iftod F., Laval M., Roque M., Savoie A., Tuffrau J.
Proposition d’une classification du phylum Ciliophora Doflein, 1901
(reunion de systematique, Clermont-Ferrand)// C. R. Acad. Sci. 1974.
Vol. 278. P. 2799—2802.
Puytorac P. de, Grain J. Bacteries intramitochondriales et parti-
cularitee de 1’ultrastructure cytostomopharyngienne cher le cilie Uro-
tricha ovata Kahl // C. R. Soc. Biol. 1972. Vol. 166. P. 604—607.
Puytorac P. de, Grain J., Legendre P. An attempt at reconstruc-
ting a phylogenetic tree of the Ciliophora using parsimony methods //
Europ. J. Protistol. 1994. Vol. 30. P. 1—17.
Puytorac P. de, Grain J., Legendre P., Devaux J. Essai d’appli-
cation de 1’analyse phenetique a la classification du phylum des Cilio-
phora II J. Protozool. 1984. Vol. 31. P. 496—507.
Puytorac de P., Grain J., Mignot J.-P. Precis des protistologie.
Paris, 1987.
Quackenbush R. L. Endosymbionts of killer paramecia // Parame-
cium / Ed. H.-D. Gortz. Berlin; Heidelberg, 1988. P. 406—418.
Raabe Z. Zarys Protozoologii. Warsaw, 1964.
Radek R., Hausmann K. Phagotrophy of Ciliates // Ciliates. Cells
as a organisms / Eds K. Hausmann, Ph. C. Bradbury. Stuttgart, 1996.
P. 197—219.
Radzikowski S. Replication, divition, and mechanisms controlling
the variable DNA content in the heteromeric macronucleus of Chilodo-
nella steini (Ciliata) // Arch. Protistek. 1985. Vol. 130. P. 381—396.
Rasmussen L., Orias E. Tetrahymena: growth without phagocyto-
sis// Science. 1975. Vol. 190. P. 464—465.
Reisser W., Meier R., Gortz H.-D., Jeon F. W. Establishment,
maintenance and integration mechanisms of endosymbionts in proto-
zoa // J. Protozool. 1985. Vol. 32. P. 383—390.
Reisser W. Endosymbiotic associations of freshwater protozoa and
algae // Progress in Protistology / Eds D. P. Patterson, J. O. Corliss.
Bristol, 1986. Vol. 1. P. 195—214.
Reisser W., Klein T., Becker B. Studies of phycoviruses I. On the
ecology of viruses attacking Chlorella exsymbiotic from an European
strain of Paramecium bursaria// Arch. Hydrobiol. 1988. Vol. 111.
P. 575—583.
Riedl R. Order in living organisms. A systems analysis of evoluti-
on. N. Y„ 1978.
Rosati G. Epixenosomes: symbionts of the hypotrich ciliate Euplo-
tidium itoi // Symbiosis 1999. Vol. 26. P. 1—23.
Rosati G., Modeo L. Extrusomes in ciliates: diversification, distri-
bution, and phylogenetic implication // J. Euk. Microbiol. 2003.
Vol. 50. P. 383—402.
Rosati G., Petroni G., Quochi S., Modeo L., Verni F. Epixeno-
somes peculiar epibionts of the hypotrich ciliate Euplotidium itoi de-
fend their host against predators // J. Euk. Microbiol. 1999. Vol. 46.
P. 278—282.
Quackenbush R. L. Endosymbionts of killer paramecia // Parame-
cium / Ed. H.-D. Gortz. Berlin; Heidelberg, P. 406—418.
SlitIr В. H., Wissig S. L. Alveolar sacs of Tetrahymena: ultrastruc-
tural characteristics and similarities to subsurface cisterns of muscle and
nerve// J. Cell Sci. 1982. Vol. 55. P. 13—33.
Schlegel M. Protist evolution and phylogeny as discerned from
small subunit ribosomal RNA sequence comparisons // Europ. J. Protis-
tol. 1991. Vol. 27. P. 207—219.
Schlegel M., Eisler K. 1996. Evolution of Ciliates // Ciliates. Cells
as a organisms / Eds K. Hausmann, Ph. C. Bradbury. Stuttgart, 1996.
P. 73—94.
Schmidt H. J., Gortz H.-D., Quackenbush R. L. Caedibacter
caryophila sp. nov., a killer symbiont inhabiting the macronucleus of
Paramecium caudatum // Int. J. Syst. Microbiol. 1987. Vol. 37. P. 459—
462.
Schbnborn W., Dorfelt H., Foissner W., Krienity L., Schafer U.
A fossilized microcenosis in Triassic amber// J. Euk. Microbiol. 1999.
Vol. 46. P. 571—584.
414
ALVEOLATA
Schwartz V. Struktur und Entwicklung des Macronucleus von Pa-
ramecium bursaria // Arch. Protistenk. 1978. Bd 120. P. 255—277.
Shin M. K., Hwang U. W., Wright A.-D. G., Krawczk C.,
Lynn D. II. Phylogenetic position of the ciliates Phacodinium (oder
Phacodoniida) anil Protocruzia (subclass Protocruziidia) and sys-
tematics of the spirotrich ciliates examined by small subunit riboso-
mal RNA gene sequences // Europ. J. Protistol. 2000. Vol. 36. P. 293—
302.
Siebold С. T. E. Lchrbuch der Vergleichenden Anatomic der Wir-
bcllosscn Thicrc / Eds С. T. E. von Siebold and H. Stannius. Lehrbuch
der Vergleichenden Anatomie 1, Berlin, 1845.
Sleigh M. Protozoa and other protists. 2nd ed. London, 1989.
Small E. B., Lynn D. H. A new macrosystem for the phylum
Ciliophora Doflein, 190Г// BioSystems. 1981. Vol. 14. P. 387—401.
Small E. B., Lynn D. H. Phylum Ciliophora Doflein, 1901 //An il-
lustrated guide to the ptotozoa / Eds J. J. Lee, S. H. Hutner, E. C. Bo-
vec. Society of Protozoa, Lawrence, 1985. P. 393—575.
Sogin M. L., Elwood H. J., Gunderson J. H. Evolutionary diver-
sity of eukaryotic small-subunit rRNA genes // Proc. Nat. Acad. Sci.
USA. 1986. Vol. 83. P. 1383—1387.
Soldo A. T. The biology of the xenosome, an intracellular symbi-
ont//Int. Rev. Cytol. 1973. Suppl. 14. P. 79—109.
Soldo A. T. Intracellular particles in Paramecium // Paramecium: a
current survey / Ed. W. J. van Wagtendonk. Amsterdam; N. Y., 1974.
P. 377- 442.
Sonneborn T. M. Breeding system, reproductive methods, and
species problems in Protozoa// The species problem / Ed. E. Mayer.
Washington DC, 1957. P. 155—324.
Soyer-Gobillard M.-O., Schrevel J. Andre Lwoff (1902—1994),
Nobel prize of medicine, as protistologist// Protist. 2003. Vol. 154.
P. 455—468.
Stein F. Der Organismus der Infusionsthiere nach Eigenen For-
schungen in Systematischer Reihenfolge Bearbeitet. Abt. I. Die Hypo-
trichen Infusionsthiere. Leipzig, 1859.
Stein F. Der Organismus der Infusionsthiere nach Eigenen For-
schungen in Systematischer Reihenfolge Bearbeitet. Bd II (Allgemei-
nes u. Heterotricha). Leipzig, 1867.
Steinbriick G. Overamplification of genes in macronuclei of hy-
potrichous ciliates// Chromosoma. 1983. Vol. 88. P. 156—163.
Steinbriick G. Molecular reorganization during nuclear differenti-
ation in ciliates// Results and problems in cell diffentiation / Ed.
W. Hennig. Berlin, 1986. Vol. 13. P. 105—174.
Steinbriick G. Recent advances in the study of ciliate genes//
Europ. J. Protistol. 1990. Vol. 26. P. 2—14.
Stokes A. C. A preliminary contribution towards a history of the
fresh-water infusoria of the United States // J. Trenton Nat. Hist. Soc.
1888. Vol. 1. P. 71—344.
Stokes A. C. Microscopical Praxis. Portland, Connecticut, 1894.
Stokes A. C. Aquatic Microscopy for Beginners: or Common Ob-
jects from Ponds and Ditches. Portland, Connecticut, 1896.
Striider-Kypke M. C., Wright A.-D. G., Fokin S., Lynn D. H.
Phylogenetic relationships of the subclass Peniculia (Oligohymenopho-
rea, Ciliophora) inferred from small subunit rRNA gene sequences II
J. Euk. Microbiol. 2000. Vol.47. P. 419—429.
Sugibayashi R., Harumoto T. Defensive function of trichocysts in
Paramecium tetraurclia against hetcrotrich ciliate Climacostomum vi-
rens// Europ. J. Protistol. 2000. Vol. 36. P. 415—422.
Sundararaman V., Hanson E. D. Longitudinal microtubules and
their functions during asexual reproduction in Paramecium U Genet.
Res. Cambridge 1976. Vol. 27. P. 205—211.
Sundermann C., Paulin J. Ultrastructural features of Allantosoma
intestinalis, a suctorian ciliate isolated from the large intestine of the
horse // J. Protozool. 1981. Vol. 28. P. 400—405.
Takahashi T. Reorganization in amicronucleates with defective
mouth of the ciliate Pseudourostyla levis // J. Protozool. 1988. Vol. 35.
P. 142—150.
TamL-W., Ng S. F. Stomatogenesis in Paramecium tetraurelia:
genetics and phenotypes of mutants affecting the development of the
oral apparatus // Can. J. Zool. 1986. Vol. 65. P. 2177—2187.
Tartar V. The biology of Stentor. London, 1961.
Tuffrau M. Polymorphisme par anisotomie chez le cilie Euplo-
tes balteatus (Dujardin)// C. R. Acad. Sci. 1959. Vol. 248. P. 3055—
3057.
Tuffrau ML, Fryd-Versavel G., Tuffrau H., Genermont J. Des-
cription of Euplotes versatilis n. sp., a marine tropical ciliate exhibiting
an unusually extensive phenotypic plasticity II Europ. J. Protistol. 2000.
Vol. 36. P. 355—366.
Van Bruggen J. J. A., Zwart К. B., Assema van R. M., Stumm С. K.,
Vogel G. V. Methanobacterium formicicum, an endosymbiont of the
anaerobic ciliate Metopus striatus McMurrich // Arch. Microbiol. 1984.
Vol. 139. P. 1—7.
Van Bruggen J. J. A., Zwart К. B., Hermanns J. G. F., Hove
van E. M., Stumm С. K., Vogel G. V. Isolation and characterization
of Methanoplanus endosymbiosus sp. nov., an endosymbiont of the ma-
rin sapropelic ciliate Metopus contortus Quennerstedt // Arch. Microbi-
ol. 1986. Vol. 144. P. 367—374.
Van Hoven W., Gilchist M. C., Stenson M. O. Sex new ciliated
Protozoa species of Trichostomatida, Entodiniomorphida and Suctoria
from the intestine of wild African rhinoceroses // Acta Protozool. 1998.
Vol. 37. P. 113—124.
Van Wagtendonk W. J. (Ed.). Paramecium. A current survey.
Amsterdam etc., 1974.
Verni F., Rosati G. Peculiar epibionts in Euplatidium itoi (Ciliata,
Hypotrichida)// J. Protozool. 1990. Vol. 37. P. 337—343.
Vickerman K., Sleigh M., Leadbeatera B., McCready S. A cen-
tury of Protozoology in Britain. British Section of the Soc. Protozool.
2000.
Vivier E. B., Legrand B., Petitprez A. Recherches cytochimiques
et ultrastructurales sur des inclusions polysaccharidiques et calciques du
spirostome; leurs relations avec la conyractilite // Protistologica. 1969.
Vol. 29. P. 38—44.
Wibel R., Vacchiano E. J., Maciejewski J. J., Buhse H. E.,
Clamp J. The fine structure of the scopula-stalk region of Vorticella
convallaria // J. Euk. Microbiol. 1997. Vol. 44. P. 457—466.
Wichterman R. The biology of Paramecium. N. Y.; Toronto,
1953.
Wichterman R. The biology of Paramecium, 2nd ed. N. Y.; Lon-
don, 1986.
Willey R., Walkosz R. The scopula of Ophrydinium versatile (Ci-
liophora: Peritricha) II Trans. Am. Microscop. Soc. 1975. Vol. 94.
P. 427—432.
Williams N. E. Polymorphism in Tetrahymena vorax // J. Protozo-
ol. 1961. Vol. 8. P. 403—410.
Wolters J. The troublesome parasites — molecular and morpholo-
gical evidence that Apicomplexa belong to the dinoflagellate — ciliate
clade // BioSystems.1991. Vol. 25. P. 75—83.
Woodruff L.L. The versatile Sir John Hill, M. D.// Am. Nat.
1926. Vol. 60. P. 417—442.
Woodruff L. L. Philosophers in little things// Univ. Okloh. Bull.
1938. N 729. P. 21 -33.
Woodruff L. L. The early history of the genus Paramecium with
secial reference to P. aurelia and P. caudatum U Trans. Conn. Acad. Art.
Sci. 1945. Vol. 36. P. 517—531.
Wright A.-D. G., Colorni A. Taxonomic re-assignment of Crypto-
caryon irritans, a marine fish parasite // Europ. J. Protist. 2002. Vol. 37.
P. 375—378.
Wright A.-D. G., Dehority B. A., Lynn D. H. Phylogeny of the
rumen ciliates Entodinium, Epidinium and Polyplastron (Litostomatea:
Entodiniomorphida) inferred from small subunit ribosomal RNA
sequences// J. Euk. Microbiol. 1997. Vol. 44. P. 61—67.
Wright A.-D. G., Lynn D. H. Maximum ages of ciliate lineages
estimated using a small subunit rRNA molecular clock: crown eukaryo-
tes date back to the Paleopterozoic // Arch. Protistenk. 1997. Vol. 148.
P. 329—341.
Wright A.-D. G., Lynn D. H. Monophyly of the trichostome cilia-
tes (Phylum Ciliophora: class Litostomea) tested using new 18S rRNA
sequences from the vestibuliferids, Isotricha intestinalis and Dasytricha
ruminantium, and the haptorian, Didinium nasutum // Protist. 1997.
P. 305 315.
Yarnataka S., Hayashi R. Electron microscopic studies on the mi-
tochondria and intramitochondrial microorganisms of Haltcria geleia-
na// J. Electr. Microscop. 1970. Vol. 19. P. 50 62.
Yang X., Tahahashi M. Nuclei may anchor at specific location du-
ring nuclear determination in Paramecium caudatum // Europ. J. Protis-
tol. 2002. Vol. 38. P. 147 -154.
Yingz.hi N., Yun Fen S. Protozoa // Pictorial keys to soil animals of
China/ Ed. Yin Wenying. Beijing; N. Y., Science Press, 2000.
p. 409—427.
YusaA. Observations on atypical mitochondria in Paramecium
caudatum // J. Protozool. 1964. Vol. 11. P. 237—239.
ТИП CILIOPHORA. СИСТЕМАТИЧЕСКИЙ ОБЗОР
415
Систематический обзор
Тип CILIOPHORA Doflein, 1901
I OliloKiici очные эукариоты с ядерным дуализмом (макронукле-
V1 II микронуклеус) и ресничным аппаратом, имеющимся на всех
। I плпих жизненного цикла, а у части сидячих форм — только на
। iiviiiii мигранта. Соматические кинетосомы одиночные (моноки-
|н< I иды - моносомы) или парные (дикинетиды = дисомы), обычно
। nlipiiiibi в ряды (кинеты = сомакинеты), несимметричные и поляр-
ные, совокупность которых (кинетом) характерна для каждого так-
roiiii, и у подвижных форм служит основным определительным
при шиком. С кинетосомами связан сложный комплекс фибрилл.
К инетом делится на 3 зоны: ротовой комплекс (кинеты, мембраны,
мембранеллы), соматическая цилиатура (реснички или циррусы
поодиночке или в рядах) и тигмотактический аппарат — участки
кинет или комплексы кинет и их фрагментов для сигнализации о
субстрате или для временного прикрепления к субстрату.
Питание разного типа, чаще всего фаготрофное; осмотрофия
(точнее, пиноцитоз) встречается у многих групп клеточных или
। кансвых паразитов — у сукторий рода Endosphaera, у всех Asto-
nuitida, у потерявших ротовой аппарат тетрахименид Curimostoma
и Dogielella. Характерно наличие трихоцист, трихитов, немадесм и
других фибриллярных дериватов кинетосом, образующих опорный
и защитный аппараты. Ядра нескольких типов: неделящиеся пара-
диплоидные у примитивных форм (отряд Karyorelictida), полипло-
идные у высших, гомеомерные и гетеромерные (с полярными или
концентрическими зонами «хроматина»). Обновление ядерного
аппарата происходит путем автогамии или конъюгации, изогамной
или анизогамной, с временным соединением или реже с полным
слиянием двух клеток. Дифференцировка вида на изолированные
группы клонов по типам спаривания (сингены) доказана у немно-
гих видов гименостомат (тетрахимены), пеникулид (парамеции),
гипотрих (эуплотесы).
Размножение делением или почкованием, всегда со сложными
процессами морфогенеза; в онтогенезе могут рекапитулироваться
предковые признаки, например тетрахимениум у скутицид. Выяв-
лено несколько способов образования ротовой цилиатуры (стома-
тогенез), свойственных для разных отрядов цилиат. Почкование
характерно для части паразитов (астоматы, гистероцинетиды, рин-
ходиды рода Sphenophrya, апостоматы отряда Pilisuctorida), и для
многих сидячих (седентарных) групп — для всех хонотрих и для
Ооныпинства сукторий; перитрихи диморфные, мигранты могут
ре 1ко отличаться от трофонтов.
('аободноживущие формы, комменсалы и паразиты. Свобод-
ные виды заселяют все типы водных биотопов (моря, реки, озера,
Полота, теплые источники, черный ил без кислорода), обычны в
почве, во мхах; недавно открыта богатая фауна в воде бромелие-
ных растений Южной Америки с большим числом еще не изучен-
ных эндемичных родов и видов. Каждый биотоп заселен характер-
ным набором видов. Комменсалы обитают на покровах хозяев или
и полостях, широко открытых во внешнюю среду (ротовая, ман-
тийная, жаберная полости); паразиты — это виды, питающиеся
тканями и полостными соками хозяина или обитатели пищевого
тракта (желудок, кишечник) независимо от их способа питания.
Сами цилиаты могут быть комменсалами и паразитами на других
цилиатах, к примеру суктории родов Endosphaera, Pseudogemma,
Tachyblaston, Riftus, Tokophryella — паразиты сукторий и перит-
рих.
Цилиаты — древняя группа, судя по распространению на всех
континентах и поразительной дивергенции; в ископаемом состоя-
нии известны пелагические морские тинтинниды, как исключение,
некоторые фолликулиниды и перитрихи-лорикаты; несколько без-
раковинных мобильных видов, например Paramecium triassicum,
найдено в янтаре. Количество видов в подтипе определяется циф-
рой 8000, но только одна недавняя экспедиция в южноафрикан-
скую полупустыню Намиб обнаружила несколько сотен новых ви-
дов и 37 новых родов. Долгое время господствовало мнение о кос-
мополитном распространении всех не-симбионтных цилиат, но это
неверно, есть множество локальных эндемиков и видов, встречаю-
щихся только на южных континентах.
Изученность симбионтов беспозвоночных ничтожна. Следует
ожидать значительного роста числа видов и родов симбионтных и
свободных цилиат в ближайшей перспективе. В систематике цили-
ат характерна тенденция к дроблению родов, выделяемых у гапто-
рид, никтотерид, гипотрих и гименостомат и в других группах, не-
редко по ничтожным признакам и поэтому трудно определимых;
подроды за редкими исключениями у цилиат не выделяются.
Ниже дан обзор большинства родов типа Ciliophora, указан ти-
повой вид и примерный состав рода. Нужно помнить, что взгляды
систематиков на валидность родов различаются, к примеру Маттес
(Matthes, 1988) не признал валидными все эндемичные роды сукто-
рий из Байкала, но они приняты другими специалистами по сукто-
риям. Поэтому имел бы ценность полный аннотированный список
всех родовых названий, независимо от их валидности, что нельзя
сделать здесь ввиду ограничения объема данной главы. Недавно
опубликован полный (точнее, с пропуском около 10 названий) спи-
сок родов Ciliophora Аэшт (Aescht, 2001), полезный, но к сожале-
нию, полный ошибок; по возможности они исправлены ниже. Фак-
тически этот список выведен Линном (Lynn, 2002) в Интернет как
основа для готовящегося 3-го издания книги Корлисса (Corliss,
1979). В тексте далее, чтобы избежать бесконечных повторений,
даются ссылки без цитирования (по Аэшт..., по Линну...), имеются
в виду указанные выше публикации.
Большое число родов и видов предложено несколькими авто-
рами, поэтому фамилии их при упоминании таксонов сокращены:
С. et L. — Claparede et Lachmann, Ch. et Lw. — Chatton et Lwoff,
D. — Dragesco, E. — Ehrenberg, F. — Foissner, J. — Jankowski, K. —
Kahl, M. — Muller, P. — Puytorac, R. — Raabe. Если автор типового
вида тот же, что и рода, при видовом названии он не упоминается.
Система типа Ciliophora
HoMelhimc классификации — Пюйторака (Puytorac,
199*1; и Thiltc de Zoologie), Линна и Смолла (Lynn,
Nnuill, I997, 2002), Линна (Lynn, 2002, 2003). Класси-
фикацию ф|Н1ИЦу'.1СКИх авторов (Puytorac, 1994) нельзя
।ipiniiiTi, бет ппжных поправок — в главах книги, напи-
санных I IbcpoM I hollropuicoM, большое число таксонов
iipiiiiiicbinucTCil шпорам, которые их никогда не пред-
лагали; в других случаях игнорируется приоритет и
давно известные группы ннодятся как новые. Эти заме-
чания будут сделаны ниже в диагнозах соответствую-
щих высших таксонон цилиат.
Тип Ciliophora
Подтип 1. Postciliodesmatophora
Класс 1. Karyorelictea
Класс 2. Heterotrichea
Подтип 2. Intramacronucleata
Класс 3. Spirotrichea
Класс 4. Armophorea
Класс 5. Litostomatea
Класс 6. Phyllopharyngea
Класс 7. Nassophorea
Класс 8. Colpodea
Класс 9. Prostomatea
Класс 10. Plagiopylea
Класс 11. Oligohymenophorea
416
ALVEOLATA
Подтип Postciliodesmatophora Gerasimova et Seravin, 1976
’ hu группа о тграничена от остальных цилиат по данным элект-
ронной микроскопии кортекса. Инфузории с соматическими дики-
нсгидами (парными кинетосомами; далее в книге я пользуюсь толь-
ко своим термином «дисомы»), имеющими постцилиодесмы —
особый тип постцилиарных пучков микротубул. Нет парасомаль-
ных мешков. Ротовые дисомы, когда имеются, образуют с помо-
щью этих постцилиарных пучков опорный аппарат глотки. Рото-
вой ресничный аппарат составлен поликинетидами с 2—3 рядами
кинетосом в основании и сложной инфрацилиатурой. У гетеротрих
поликинетиды ограничивают широкое перистомальное поле. На-
бор экструсом — мукоцисты, рабдоцисты и пигментоцисты (пиг-
ментосомы). Слабо развит слой кортикальных альвеол. При деле-
нии клетки ротовой аппарат протера обычно реорганизуется пол-
ностью, не сохраняется неизмененным. Подтип включает 2 класса.
Класс Karyorelictea Corliss, 1974
Тело длинное, червеобразное, обычно сократимое, виды с су-
бовальным телом (Loxodes., Cryptopharynx) почти несократимые.
Характерна тенденция к частичной редукции соматической цилиа-
туры, вплоть до исчезновения кинет на одной из сторон тела. При
всем многообразии внешнего облика общее — ядерный аппарат
с мелкими макронуклеусами, с незначительным содержанием
ДНК — парадиплоидные (чуть больше диплоидного набора хромо-
сом), не делятся при делении клетки. Микронуклеусы делятся
эумитотически и при сложной трансформации часть их превраща-
ется в новые макронуклеусы. Род Loxodes обычен в пресных водах,
все остальные роды класса обитают в море — в песке, иле, водо-
рослевом грунте; нет анаэробных форм, комменсалов и паразитов.
Фойсснер (Foissner, 1998) в эту группу включает 135 видов в 2
подклассах и 3 отрядах. За последние годы добавилось несколько
родов и предложено новое сем. Aveliidae; с учетом монографии
Дражеско (Dragesco, 1999) о гелеидах система класса представля-
ется следующим образом:
Класс Karyorelictea Corliss, 1974
Подкласс Protoheterotrichia Puytorac et al., 1987
Отряд Protoheterotrichida Nouzarede, 1977
Сем. Geleiidae Kahl, 1933 (сейчас сменился автор, по-
скольку род Geleta Kahl, 1933 невалиден)
Сем. Aveliidae Dragesco, 1999
Подкласс Trachelocercia Puytorac et al., 1987
Отряд Loxodida Jankowski, 1978
Сем. Kentrophoridae Jankowski, 1980
Сем. Cryptopharyngidae Jankowski, 1980
Сем. Loxodidae Butschli, 1889
Отряд Trachelocercida Jankowski, 1978
Сем. Sultanophryidae Foissner et Al-Rasheid, 1999
Сем. Trachelocercidae Kent, 1881
Сем. Prototrachelocercidae Foissner, 1996
Роды неясного положения — Ciliofaurea Dragesco, 1960 и Cor-
lissia Dragesco, 1960. Из состава класса исключен род Protocruzia с
нетипичным для высших цилиат ядерным аппаратом. Род Stepha-
nopogon с несколькими морскими видами, считавшийся первичной
цилиатой без диморфизма ядер, уже давно исключен из типа Ci-
liophora, предков цилиат ищут среди Dinoflagellata. В итоге класс
небольшой, около 15 родов, распадается на несколько морфологи-
чески обособленных групп, которые внешне трудно признать род-
ственными. Молекулярные филограммы (к примеру, Shin et al.,
2000) показывают близкое родство представителей кариореликтид
Tracheloraphis sp. и Loxodes striatus как боковой ветви с Heterotri-
chea в монофилетическом кластере отрядов, что соответствует
морфологическим данным — мембранеллы перистома гетеротрих
возникли от левосторонней полосы дисом перистома гелеид.
Отряд Trachelocercida Jankowski, 1978
Одна из сторон тела, условно вентральная, лишена ресничек —
имеется широкий или узкий ацилон (acilon — безресничный участок
тела цилиат, термин автора). Ранее считалось, что заглатывание до-
бычи идет по всему ацилону и это объединяло роды отряда, но сейчас
такой способ питания не подтвердился — трахелоцерки заглатывают
добычу ртом и даже имеют достаточно сложную ротовую цилиатуру.
В моих прежних схемах эта группа носила название Epitrichina
Jank., 1967 и Trachelocercina Jank., 1975; простоматы с иеделящи-
мися ядрами были отделены от форм с типичным для цилиат набо-
ром ядер. Позже (Янковский, 1980) группа имела ранг отряда Tra-
chelocercida Jank., 1980. Под новым названием Protostomatida Small
et Lynn, 1985 были объединены Trachelocercidae и Kentrophoridae,
но безротые кентрофоросы не выводятся от трахелоцерк, они воз-
никли в независимой ветви локсодид, поэтому объединить их нель-
зя и указанный отряд нельзя сохранить, как и его название.
В Traite (Puytorac, 1994) подкласс Trachelocercia Jank., 1980
включает отряд Trachelocercida Kent, 1881; Кент никогда не пред-
лагал такого таксона, и автор отряда не может быть автором под-
класса, за исключением классиков старины (Штейн, Бючли, Шевя-
ков, Каль), чьи отряды давно уже стали подклассами и классами. В
итоге авторство обеих групп в схеме Пюйторака ошибочное.
Вторая ошибка в Traite — подкласс Loxodia Jank., 1980 с отря-
дом Loxodida Jankowski in Small et Lynn, 1985; вновь автор подо-
тряда или отряда не может быть автором подкласса или класса, и
отряд предложен мной раньше — Loxodida Jank., 1980.
Хотя внешне нет ничего общего с гетеротрихами, трахелоцер-
ки родственны с ними, но их тигмон и циклонема поразительно на-
поминают тигмон гапторид. Это конвергенция, а сами трахелоцер-
ки оказались потомками локсодид, стоящих ближе к гетеротрихам.
Сем. Trachelocercidae Kent, 1881
(рис. 267)
Ротовой аппарат апикальный, простой, без цирту-
ма, немадесм, с фибриллярной глоткой, образованной
фибриллами апикальных кинетосом. Червеобразные
формы с тонким телом, округлым или овальным в по-
перечном сечении. Сомакинеты продольные, простой
топографии; за исключением нескольких видов, име-
ется тигмон — отделившиеся апикальные фрагменты
кинет или группа кинетосом.
Род Trachelocerca долгое время был общеприня-
тым и крупным, в него включали разных цилиат; затем
он был подразделен на 4 рода — Trachelocerca s. str.
(дистальный конец хвоста изогнутый), Nephrocerca
Delphy, 1939 (с сократимой вакуолью), Gruvelina Del-
phy, 1939 (с хвостом по оси тела) и Protrichophora Del-
phy, 1939 (с мукоцистами, тип рода не фиксирован).
Эти роды не были позже приняты, их признаки несу-
щественны. Стало общепринятым подразделение этой
группы по легко видимому признаку — наличию или
отсутствию продольной безресничной полосы (ацило-
на) и, если она имеется, ее ширине (Dragesco, 1960);
полосы нет у Trachelocerca, она возникает у Trachelo-
raphis и у Trachelonema достигает ширины тела. Эта
классификация сейчас устарела и все большее внима-
ние уделяется ротовой и тигмотактической цилиатуре.
6 родов отряда различаются по топографии кинето-
ма в апикальной зоне; если не применять импрегнацию
протарголом, определить роды можно косвенно по со-
четанию признаков (вырезка у края рта, ширина поло-
сы ацилона, ядра). Рот окружен простым кольцом
длинных ресничек с непрерывной дикинетой в основа-
нии (состоит из пар кинетосом) — Trachelocerca, Тга-
ТИП CILIOPHORA. КЛАСС KARYORELICTEA
417
Рис. 267. Karyorelictida. (По: Foissner, Dragesco, 1996).
Trachelolophos gigas (A—И, My, T.filum (К, Л).
Fig. 267. Karyorelictida.
chelolophos; такое же непрерывное кольцо, но сложной
формы, обходит рудиментарный тигмон—Kovalevaia',
кольцо прервано фрагментами кинет — Trachelora-
phis', имеется двойное кольцо, две тесно прилегающие
дикинеты, прерванные тигмоном — Prototrachelocer-
са. Различия по типу тигмотактических фрагментов
кинет: их нет у Trachelocerca, видна небольшая группа
беспорядочных дисом внутри замкнутой кольцевой
кинеты — Trachelolophos, один фрагмент находится в
боковой дуге цельного кольца — Kovalevaia, 3 фраг-
мента составляют тигмон у Tracheloraphis (кольцо
прерванное, одинарное) и у Prototrachelocerca (кольцо
прерванное, двойное). У Sultanophrys кольцо одно,
прервано тигмоном, родовой признак — наличие осо-
бой биполярной кинеты, ограничивающей соматиче-
ские ряды правой стороны тела, как у локсодид.
Род Trachelocerca Ehrenberg, 1840
Типовой вид Т. sagitta (=Vibrio sagitta Muller,
1786) по монотипии. В ранней литературе к роду отно-
сили гапторид (лакримарий), в соответствии с перво-
начальным составом рода. С подразделением трахело-
церк на 3 рода большинство видов ушло в состав Trache-
loraphis (Dragesco, 1960); примеры оставшихся ви-
дов — Т. arenicola Kahl, 1933; Т. binucleata Dragesco,
1960; Т. coluber Kzidi, 1933; T. entziKahl, 1927; T. geope-
hriD.,1953; T gracilis (D., 1953); T. lacrymariae D., 1953;
T. laevis (Quennerstedt, 1867); T. minuta D., 1960; T. mul-
tinucleata’D., 1960; T. nigricans Kahl, 1933; T. schultzeiD.,
1960; T. subviridis Sauerbrey, 1928; T. tenuicollis Quen-
nerstedt, 1867; T. variabilis Kovaleva, 1966; T. bruna
Lepsi, 1962 и др. Сечение тела округлое, нет ацилона;
цилиатура равномерная, в биполярных рядах.
Сейчас на протарголовых препаратах проверено
немного видов, и валидны лишь те, которые сходны по
апикальной цилиатуре. У Т. incaudata Kahl, 1933 и
Т. binucleata Dragesco, 1960 вокруг рта видно стандарт-
ное не прерванное кольцо дисом («циклонема» по
моей терминологии); среди рядов сомакинет, подходя-
щих к апексу, есть 2 смежных ряда — «bristle kineti-
es» — ряды, которые ограничивают ацилон у трахело-
церцид. Но нет фрагментов кинет у рта (тигмона), ви-
димых у Tracheloraphis, вероятно, они утрачены
вторично. Поэтому апикальный кинетом простой и род
по этой причине валидный, но включает немного ви-
дов. Типовой вид валидный, но пока не изучен.
27 Зак. №4163
418
ALVEOLATA
Род Ttacheloraphis Dragesco, 1960
'Г и И о и о й вид Т. phoenicopterus (= Trachelocerca
phocriicopterus Cohn, 1866). Форма тела, рот, как у пре-
дыдущего вида, но начинается редукция кинетома —
появляется узкий продольный ацилон у Т. aragoi, да-
лее он расширяется в серии видов Т. incaudatus,
Т. swedmarki и почти достигает ширины тела у плос-
кого вида Т. griseus. Хорошо изучен ядерный аппарат
типового вида (цитохимия, ультраструктура ядер и их
реорганизация), в общих чертах (на неточных схемах)
раньше выявляли кинетом, но лишь в 2 последних де-
сятилетия с отработкой новых фиксаторов началось
быстрое накопление данных по соматической и рото-
вой цилиатуре.
На схемах Т. prenanti, Т. africanus, Т. margaritatus,
Т. flexuosus, Т. griseus и других видов апикальное коль-
цо дисом (циклонема) прервано в зоне расположения
3 диагональных фрагментов — это вершины сомаки-
нет со сближенными кинетосомами, отделившиеся от
кинет для образования тигмона. Края ацилона ограни-
чены специальной кинетой, которая у тигмона повора-
чивает вниз. Есть простые варианты (Г. griseus) и
сложные картины кинетома у Т. prenanti с дополни-
тельными фрагментами кинет, но родовой признак
(разрыв акронемы фрагментами кинет) общий для все-
го рода.
Поскольку род Trachelonema ликвидирован (но мо-
жет быть сохранен здесь как подрод!), а в составе Tra-
chelocerca мало проверенных видов, род Tracheloraphis
включает сейчас почти всех трахелоцерцид. Примеры
видов — Т. aragoi (Dragesco, 1954); Т. binucleata D.,
1960, Т. conformis Wright, 1982; T. discolor Raikov, 1962;
T. ditis Wright, 1982; T, enigmatica D., 1960; T. phoeni-
copterus (Cohn, 1866); T. oligostriata (R., 1962); T. mo-
nocaryon D., 1960; T. nivea Wright, 1982; T. totevi Kova-
leva et Golemansky, 1979; T. swedmarki D., 1960; T. stria-
tus D., 1962; T stephani D., 1965; T. primitarum Epstein,
1994; T. prenanti D., 1960; T. gracilis D., 1960; T. kahli
R., 1962 и мн. др.
Род Trachelonema Dragesco, 1960
Типовой вид T. longicollis; также T. grassei D.,
1960; T. lanceolata Raikov, 1962; T. oligostriataP., 1962;
T. binucleata Agamaliev, 1966; T. minima D., 1960 и др.;
эти виды сейчас перенесены в состав Tracheloraphis в
связи с ликвидацией рода, без выделения подрода для
этой группы видов. Тело плоское, дорсальная сторона
полностью безресничная, обращена вверх от субстра-
та. Сейчас валидность рода подвергается сомнению,
но нет данных об идентичности околоротовой цилиа-
туры у этого рода и у Tracheloraphis; кроме того, нали-
чие безресничной полосы в дорсальном кинетоме (у
Tracheloraphis) и полное отсутствие всей дорсальной
цилиатуры (у Trachelonema) — это признаки валидно-
го подрода или рода. Тип рода — лентовидная форма с
суженным антероном; группа ядер (4 макро- и 2 мик-
ронуклеуса) в центре тела; ресничная сторона плоская,
безресничная выпуклая. При сокращении ацилон вол-
нистый, складчатый. Число кинет у трахелонем неве-
лико, иногда меньше 10, топография простая.
Род Trachelolophos Foissner
et Dragesco, 1996
Типовой вид Г. gigas Foissner et Dragesco, 1996;
также T. filum {Tracheloraphisfilum Dragesco et Drages-
co-Kemeis, 1986). Тело червеобразное, с очень узким
ацилоном и несимметричной цилиатурой по обе сторо-
ны безресничной полосы; справа от ацилона кинеты
продольные, слева подходят к шву под углом (типич-
ная унисеканта). Имеется ротовая воронка; циркумо-
ральное кольцо дисом наружное, не прервано, но тиг-
мон — группа кинесом и их реснички — сместился
вглубь воронки на дно полости, вероятно после мигра-
ции комплекса в глубь воронки кольцо дисом сомкну-
лось вновь. Дисомы полости рта не собраны в четкие
короткие ряды, и это тоже важное отличие от других
родов. Соматическая цилиатура практически полная,
место ацилона маркирует двойной ряд дисом, изогну-
тый у вершины и поворачивающий вниз с инверсией
положения реснички в паре аргиросом. В соматиче-
ских рядах обе кинетосомы пары несут реснички. Фиб-
риллы в акроне отходят от соматических дисом и от
дисом околородового ресничного кольца. Ядра в ли-
нии вдоль тела, чередуются овальные макронуклеусы
и многочисленные микронуклеусы, не собранные в
группы.
Род Kovalevaia Foissner, 1997
Типовой вид АГ. sulcata (= Trachelonema sulcata
Kovaleva 1966; Kovalevaia in Foissner, 1997). Тело ши-
рокое, заметно сплющенное, величиной 0.6—1.2 мм;
ядра многочисленные, не образуют стабильных ком-
плексов, 9—60 макронуклеусов расположены в нечет-
ком продольном ряду. Имеется конический акрон, не-
много соматических кинет (меньше 25) и только одна
тигмокинета (короткий ряд дисом) у рта внутри цикло-
немы; это важное отличие от других родов, имеющих
до 3 фрагментов в тигмозоне или (у Trachelolophos)
группу разрозненных дисом в полости рта. Как у всех
трахелоцерцид, имеется кольцо дисом вокруг рта (цик-
лонема по моей терминологии), но она не кольцевая,
как обычно — на одной стороне ряд дисом обходит бо-
ковую выемку с тигмокинетой. Соматический кинетом
стандартный для семейства; ацилон — вся верхняя
сторона тела, вдоль нее проходит узкий биполярный
осевой желобок. Второй вид Tracheloraphis teissieri
Dragesco, 1960 {Kovalevaia in Foissner, 1997) — более
узкий и вытянутый червеобразный вид длиной до
0.9 мм, с 18—26 макронуклеусами, 8—14 кинетами, с
более узким ацилоном; описание вида см.: Агамалиев,
1983.
Сем. Prototrachelocercidae Foissner, 1996
Род Prototrachelocerca Foissner, 1996
Типовой в и д Р. fasciolata (= Trachelocerca fas-
ciolata Sauerbrey, 1928, позже в составе Trachelorap-
his). Темно-коричневые гиганты (1.5 — 3 мм) с обили-
ем протрихоцист, с обширным ацилоном, складчатым
ТИП CILIOPHORA. КЛАСС KARYORELICTEA
419
при сокращении; циркуморальное кольцо кинетосом
(дисом) прервано в зоне нескольких обособленных
фрагментов — вершин соматических кинет у рта (фор-
ма тигмона). Продольный желобок широкий, справа
от него кинеты продольные, слева в верхней части
тела подходят под углом; вдоль желобка идут 2 тесно
сближенных ряда дисом, вплоть до тигмона — гомо-
лог кинет, ограничивающих ацилон у локсодид. При
сокращении тела в фиксаторах ресничная сторона
сжимается сильнее, так как нет мионем в ацилоне. Вто-
рой вид Р. caudata (Dragesco et Raikov, 1966 in Trache-
locerca). Перистом этих видов отличается, усложнен
у второго вида.
Сем. Sultanophryidae Foissner
et Al-Rasheid, 1999
Единственный род семейства отличается от осталь-
ных трахелоцерцид деталями инфрацилиатуры. Перед-
няя секантная система находится справа от безреснич-
ной полосы (ацилона); имеется специальная латераль-
ная кинета между левой ветвью щетинковой кинеты и
первым соматическим рядом ресничек. У всех других
родов трахелоцерк передняя секанта находится слева
от ацилона, и латеральной кинеты нет. Вероятно лате-
ральный ряд — это гомолог дорсолатерального ряда
локсодид, так как оба имеют сходное положение и от
обоих в цитоплазму отходят крупные фибриллы. Поэ-
тому предполагается, что локсодиды и трахелоцерки
родственны, локсодиды дали начало линии, ведущей к
упрощенным трахелоцеркам, и род Sultanophrys нахо-
дится недалеко от места дивергенции этих групп, со-
храняя часть предковых признаков.
Род Sultanophrys Foissner et Al-Rasheid,
1999
Типовой видУ. arabica (здесь и далее при на-
звании типового вида автор не упоминается, если сов-
падает с автором рода). Крупный вид (около 670—
900 мкм) с широким телом; 13—47 макронуклеусов в
продольной линии; обширный ацилон, как у Trachelo-
nema, достигает ширины тела, складчатый при сокра-
щении. Кортекс с 2 типами гранул в продольных поло-
сах, клетки темные. Передний шов (секантная систе-
ма) справа от ацилона, и специализированный ряд
ресничек (латеральная кинета) между левой ветвью
тигмофрагмента и первым рядом сомакинет. Сомати-
ческих кинет около 35. Циркуморальное кольцо рес-
ничек незамкнутое, прервано 3 фрагментами кинет.
Тропический вид, открыт в Красном море. Вид, опи-
санный как Tracheloraphis margaritatus (Dragesco, Dra-
gesco-Kemeis, 1986) имеет секанту справа, а не слева
от ацилона и может быть видом группы S. arabica.
Система родов трахелоцерцид фактически разраба-
тывается в последние годы, когда накопились данные
по кинетому; этих пигментированных форм трудно
импрегнировать протарголом, и у многих видов ранее
изучался только ядерный аппарат. В систематике сей-
час учитывается ацилон и цилиатура околоротовой
зоны, по аналогии с простоматами.
Отряд Loxodida Jankowski, 1980
Тело плоское, широкое, антерон отогнут вбок, как у
амфилептид. Правая сторона тела с нормальной сома-
тической цилиатурой — продольными рядами ресни-
чек вдоль всего тела, левая с краевыми рядами или без
них, с обширным ацилоном. У фаготрофных форм со-
хранен крупный перистом со сложной ротовой цилиа-
турой у края вентральной (правой) стороны тела и
фибриллярная глотка; у безротых кентрофоров оста-
лись фрагменты ротовых инфракинет. Ядра амфилеп-
тидного типа (разрозненные сферы), но не полиплоид-
ные. Один род только в пресной воде, все остальные
только в море.
Сем. Kentrophoridae Jankowski, 1980
(рис. 268)
Нет постоянного ротового аппарата на переднем
конце тела, нет специализированной околоротовой ци-
лиатуры и тигмофрагмона. Антерон несимметричный,
как у амфилептид. Одна сторона тела полностью ли-
шена цилиатуры и покрыта сплошным слоем эпибак-
терий — специфическими комменсалами, изученными
в электронном микроскопе. Часть симбионтов втяги-
вается внутрь тела и переваривается вдоль полосы,
другого способа питания нет. Сторона с ацилоном (ле-
вая) имеет круговую маргинальную кинету и, как лок-
содиды, специальный дорсолатеральный ряд с особым
положением кинетосом и особыми их дериватами; та-
кой ряд среди трахелоцерцид был найден только у Sul-
tanophrys. Ядра в немногочисленных группах (макро-
нуклеусы + микронуклеусы). Бактерии с сульфидным
метаболизмом, поэтому виды цилиат-хозяев приуро-
чены к зонам с недостатком кислорода; в отлив на ли-
торали видны участки гниения водорослей и детрита с
пятнами белого, красного и черного цвета, здесь много
анаэробов. Соединение безротых форм и видов с хоро-
шо развитым ротовым аппаратом противоречит прак-
тике систематики цилиат, поэтому род Kentrophoros
отделяется на уровне семейства (возможно обособле-
ние в ранге подотряда).
Род Kentrophoros Sauerbrey, 1928
Типовой в и д К. fasciolatum по монотипии. Про-
тозоологи часто игнорировали правила номенклатуры,
и название рода было произвольно заменено на Cent-
rophorus Kahl, 1931 и позже на Centrophorella Kahl,
1933; во многих работах было принято второе назва-
ние, но сейчас восстановлено название Kentrophoros.
Большинство видов — длинные лентовидные формы с
плоским гибким телом; у типового вида и К. uninuclea-
tum наиболее простой ядерный аппарат, как у амфи-
лептид; у других видов ядра расположены группами
или в продольной линии. Апекс часто в виде клюва,
что подчеркивает родство с гелеидами. Края тела ото-
гнуты, прикрывают полосу бактерий у К. tubiformis.
Примеры видов — Kentrophoros canalis Wright,
1982; К. gracilis Raikov, 1963; К. uninucleatus R., 1962;
К. tubiformis Raikov et Kovaleva, 1968; K. trichocystus
420
ALVEOLATA
Рис. 268. Karyorelictida. Kentrophoros fistulosum (A—Ж); K.flavum (3—M). (По: Foissner, 1995a (A—Ж); Raikov, Kovaleva, 1968 (3—77)).
Fig. 268. Karyorelictida.
(D., 1954); K.ponticus Kovaleva, 1966; K. minutus (D.,
1960); К longissimus (D., 1954); K. latusR., 1962; К lan-
ceolatus (Faure-Fremiet, 1951); К grandis (D., 1954);
К flavus Raikov et Kovaleva, 1968; K.faurei (D., 1954) и др.
Перенос видов из Centrophorella в состав Kentrophoros
произвел Карей (Carey, 1992), но вместо comb. п. он ис-
пользовал обозначение пот. п. и поэтому такой пере-
нос был объявлен невалидным (Foissner, 1995а, 1995b).
Подрод Cryptosymbion Jankowski subgen. n.
Типовой вид К. fistulosum (= Centrophorella fis-
tulosa Faure-Fremiet, 1950; Kentrophoros in Carey,
1992). В крупных родах часто имеются аберрантные
виды; среди видов Kentrophoros выделяется К. fistulo-
sum — весь ацилон находится как бы внутри тела, в
желобке, при разрастании и соединении краев реснич-
ной зоны тела. Нет бактерий на ресничной стороне, все
они находятся в желобке на ацилоне. Такая морфоло-
гия нетипична для остальных кентрофорид, и вид за-
служивает ранга подрода или рода. Гигантский вид с
10 ядерными комплексами вдоль всего тела. Хорошо
изучен кинетом этого вида; сохранена кинета, ограни-
чивающая края ацилона, у вершины тела она повора-
чивает вниз (судя по инверсному расположению кине-
тодесм); вершины кинет превращены в короткие ком-
пактные ряды дисом без их отделения, сходные с тиг-
мокинетами трахелоцерцид. Сходный вид — К. tubi-
formis Raikov et Kovaleva, 1968; заслуживает особого
внимания и аберрантный вид К. canalis Wright, 1982.
Сем. Loxodidae BQtschli, 1889
(рис. 270, 271)
Относительно крупные формы с клювовидным
острым антероном, отогнутым влево; перистом вытя-
нут по оси тела, ниже клюва, погружен в виде желобка;
справа и слева перистом ограничен рядами дисом,
условно обозначаемых Paroral и Endoral; ротовой ки-
нетом более сложный, чем у амфилептид. Ядра с ка-
риосомой, слабо красятся на ДНК, число их зависит от
размеров тела. Имеются статоцисты — «везикулы
Мюллера».
Род Loxodes Ehrenberg, 1830
Типовой в и д L. rostrum (Muller, 1773). Левая
сторона тела безресничная, не считая периферической
каймы ресничек; ацилон иногда с поперечными склад-
ТИП CILIOPHORA. КЛАСС KARYORELICTEA
421
ками, чаще ровный; перистом широкий и глубокий;
нет фибриллярного скелетного аппарата в цитоплазме.
Тело плоское, вытянутое, веретеновидное, цитоплазма
с лакунами, апекс отогнут к вентральному ребру в
виде клюва, статоцисты в линии вдоль дорсального
ребра, ядра центральные или в продольном осевом
ряду, у L. гех около 100 ядер рассеяны в беспорядке.
Число и положение ядер — видовой признак, к приме-
ру, 2 макронуклеуса в центре тела у L. rostrum, 2 раз-
розненных у L. striatus, осевая группа у L. magnus.
Правосторонние кинеты простой топографии, бипо-
лярные, заканчиваются на апексе; вдоль дорсального
ребра справа идет обособленный ряд вплотную сбли-
женных кинетосом. На левой стороне тела кинет мало,
но топография их сложная; ацилон ограничен длин-
ным левосторонним рядом, вдоль перистомального
края идет кинета с дисомами. Межкинеты с мукоци-
стами; со статоцистами связаны специальные реснич-
ки. Перистомальная цилиатура — 2 ряда вплотную
сближенных дисом вдоль правой стенки полости и
продолжение их на левом краю в виде короткого внут-
реннего ряда и длинного наружного, разъединенных
апикально; имеется короткая коническая фибрил-
лярная глотка. Питание в основном микроводорос-
лями.
Много видов в пресных водах — L. striatus (Engel-
mann, 1862 т Drepanostomay, L. kahli Dragesco etNjine,
1971 (для L. magnus in Kahl, 1930); L. magnus Stokes,
1887; L. vorax Stokes, 1887; гигантский тропический
вид L. rex Dragesco, 1970; L. penardi Dragesco, 1960;
L. rostrum (Muller, 1773); L. punjabensis Bhatia, 1936;
L. bahaduri Bhatia et Mullick, 1930; L. viridis Kahl, 1928
и др. L. marinus Duj., 1841 — не локсодес, вероятно,
неопределимый вид рода Ciliofaurea.
В случае подразделения на подроды нужно учесть
синонимы — Pelecida Dujardin, 1841 (Р. rostrum) и
Drepanostoma Engelmann, 1862 (гомоним, D. striata).
Род Remanella Foissner, 1996
Типовой вид R. multinucleata Kahl, 1933. Род
Remanella Kahl, 1933 предложен для группы видов без
обозначения типового вида, поэтому невалиден, и все
виды перенесены Фойсснером (Foissner, 1996с) в но-
ны й род с тем же названием.
Морской род, близкий к Loxodes, сходны контуры
гели, топография кинет, имеются статоцисты в дор-
сальном ряду (двух типов, простые и сложные), иногда
одиночные (у R, unicorpusculata) или немногочислен-
ные на уровне перистома; цитоплазма часто с лакуна-
ми, отличия более узкий перистом, пигмент вдоль
перистома, наличие соматических фибрилл (кальцие-
вых спикул) по всей цитоплазме (форма цитоскелета),
система волнообразных складок кортекса на ацилоне,
особо сложная у R. rotundata. Принципиальных отли-
чий в топографии кинетома и ротовой цилиатуры
нет. Тело обычно вытянутое, плоское, иногда ленто-
видное, способное к скручиванию и сокращению; осо-
бо удлинена змеевидная R. caudata. При удлинении
тела перистом остается мелким и узким. Ядра округ-
лые или удлиненные, у мелких видов по 2 макронукле-
уса и интеркалярный микронуклеус, у более крупных
2 ядра или полоса ядер. Межкинеты зернистые, с про-
трихоцистами, книдоцистами и токсицистами других
типов.
Крупный морской род; примеры видов — R. Ьгипеа
(Kahl, 1933); R.faurei (Dragesco, 1954); R. granulosa
(Kahl, 1933); R. levii (D., 1960); R. margaritifera K., 1933;
R. minuta D., 1954; R. obtusa (Faure-Fremiet, 1951);
R. rotundata Tucolesco, 1962; R. rugosa K., 1933; R. swed-
markiD., 1954; 7?. unicorpusculata D., 1965; R. unirugosa
Hartwig, 1973; R. caudata (D., 1953); R. dragescoi Aga-
maliev, 1966; R. microstoma D.; 1953; R. multicorpuscu-
lata Vacelet, 1961; R. trichocystus (D., 1954) и др.
Сем. Cryptopharyngidae Jankowski, 1980
(рис. 269)
Тело овальное, плоское, перистом несимметричен,
выдается вбок, имеет вид воронки на краю тела суба-
пикально. Скульптура покровов сложная, часто с плас-
тинками и зубцами кортекса. Перистомальная цилиа-
тура — наружный и внутренний ряды дисом, ограни-
чивающие правый край и вершину ротовой полости, у
одного рода ряд перешел на левую сторону тела. Вся
правая (выпуклая) сторона тела ресничная, левая несет
лишь периферический ряд разрозненных дисом. Нет
везикул Мюллера (статоцист), которые позже в эволю-
ции появляются у Remanella и локсодид. Ядерный ап-
парат — несколько мелких округлых макронуклеусов
и несколько микронуклеусов, обычно в компактных
группах.
Род Cryptopharynx Kahl, 1928
В первоописании назван также Cryptodon.
Типовой вид С. setigerus Kahl, 1928. Тело вытяну-
тое, длиной около 90 мкм, слегка искривлено, несим-
метричное, сужено и отогнуто к вентральному ребру;
кинеты немногочисленные (около 15), изогнутые, поч-
ти все биполярные, вдоль кинет ребра и токсицисты
(называются также мукоцисты и протрихоцисты),
отмечался слой мукуса (с эпибактериями?). Верши-
ны кинет со сгущением дисом, образуют полосу без
отделения сегментов. Левая сторона безресничная, с
рядом щетинок по периферии. Рот небольшой, округ-
лый, с широкой глоткой, фибриллы которой образова-
ны кинетосомами ротовых кинет — это две дуги R1 и
R2 вокруг рта справа, с ацилоном слева. В центре тела
2 мелких «локсодидных» ядра и 1 микронуклеус. Не-
редкий бентосный вид, неоднократно переописан,
встречается и в крайних условиях — морской сапро-
пель, пересоленные марши с испарением (до 97 %о);
особи плавно скользят по субстрату, способны свора-
чиваться.
Примеры видов — С. setigerum var. furcatum Dra-
gesco, 1960 (крупный вид длиной до 130 мкм; вытяну-
тое тело части особей с вильчатыми палочками по пе-
риферии); С. multinucleatum D., 1960 (больше 10 ядер,
длинный извитой перистом на выступе ребра, с корич-
невым пигментом вдоль ротовой ресничной полосы);
С. enigmaticus D., 1954 (рот как у С. setigerus, кинеты
прямые, весь безресничный вент покрыт тельцами
422
ALVEOLATA
Рис. 269. Karyorelictida. (По: Foissner, 1996b).
Apocryptopharynx hippocampoides (А, Б, E)', Cryptopharynx setigerus (В, Г)\ C. (Apocryptopharynx?) mauritanicus (Ж); филогения локсодид (Д): (7) Cryptopha-
rynx, (2) Apocryptopharynx, (5) Remanella и Loxodes (1, 2, 3 — ротовые кинеты).
Fig. 269. Karyorelictida.
Phylogeny of loxodids (Д); (7, 2, 3 — oral kineties).
сложной формы, равномерно покрывающими и всю
кайму тела); С. mauritanicus D., 1965 (кинеты полиме-
ризованы, перистом вытянутый, с ресничной спиралью;
безресничная верхняя сторона (левая) с орнаментом —
бугорками и песчинками).
Род Apocryptopharynx Foissner,
1996
Типовой в и д Л. hippocampoides. Во всем схожи
с Cryptopharynx, но одна из перистомальных кинет (на
безресничной стороне тела) образует резкий изгиб,
V-образная. Это вид с широким телом, довольно гус-
той цилиатурой с продольными кинетами; перистом
очень крупный по сравнению с С. setigerus, с широкой
фибриллярной глоткой. Правый ряд дисом R1 идет
вдоль края перистома и у вершины заворачивает вниз
на короткое расстояние в виде линии дисом; ряд R2 за-
ворачивает далеко вниз в виде такой же линии. У этого
рода идет вытягивание рта, который в итоге превра-
тится в длинный желобок у локсодид, окаймленный
справа и слева фрагментами полос R1 и R2.
Род Pilopharynx Jankowski gen. n.
Типовой вид Р. wardsi comb. n. {Cryptopharynx
in Small et Lynn, 1985). Соматическая и ротовая цилиа-
тура как у Cryptopharynx; тело широкое, примеро с 18
изогнутыми кинетами; рот небольшой, овальный, на
выступе тела, окружен почти замкнутой дикинетой и
дугой такого же строения справа; вероятно, есть до-
полнительные короткие кинеты ниже перистома; глот-
ка узкая и длинная. Вся кайма тела с четкими зубцами,
которых нет у остальных криптофарингид; это при-
знак особого рода или подрода.
Род Ciliofaurea Dragesco,
1960
Типовой вид Faurea arenicola D., 1954; назва-
ние Faurea Dragesco, 1954 заменено как гомоним. Род
неясного положения, возможно близкий к криптофа-
рингидам. У С. arenicola тело широкое, овальное при
виде сверху, плоское на нижней стороне и слегка вы-
пуклое дорсально. Кинетом односторонний, на правой
ТИП CILIOPHORA. КЛАСС KARYORELICTEA
423
Рис. 270. Karyorelictida.
Loxodes rex (Л); L. striatus (Б, E, Ж); L. magnus (В. Г, Д, 3). (По: Dragesco, 1970 (A); Dragesco, Dragesco-Kemeis, 1986 (5); Foissner, Rieder, 1983 (В—Ж); Puyto-
rac, Njine, 1970 (3)).
Fig. 270. Karyorelictida.
стороне, с большим числом продольных рядов; пери-
стом в виде длинной боковой щели начинается под
клювовидным апексом; цилиатура рта не изучена при
импрегнации. Вероятно, ротовой аппарат этого рода (на
примере С. Ьгипеа), как у Loxodes или Remanella, с ко-
ричневым пигментом, системой фибрилл, специальны-
ми кинетами с обеих сторон щели. Дорсум С. arenicola
покрыт частицами детрита, вероятно со слоем мукуса.
Примеры видов: С. ornata (D., 1954), с небольшим
числом (16) кинет и палочковидными выростами на
бе'|рсс11ичпой стороне тела; С. brunea D., 1965, с вытя-
нутым телом, длинной ротовой щелью, орнаментом
кортекса сложной формы, компактной группой ядер в
центре тела; вдоль перистома слева ряд ресничек,
справа ряд пектиислл (поликинета); на правой стороне
20—22 кинет; С. longissima D., 1960 крупнее осталь-
ных (около 400 мкм), с лентовидным ядром, ротовой
щелью, трихоцистами (вероятно, это вид другого
рода); С. mirabilis (D., 1954) -— 12 кинет справа, 8—
12 ядер, токсицисты в цитоплазме.
Эти формы видели и раньше, но старая литература
игнорируется. Если сравнить рисунок С. ornata (Dra-
gesco, 1954), Paramecium glaucum и P. microstomum
(Claparede et Lachmann, 1859), то это, конечно, один
вид, кстати, первый вид — тип \w\aParamaecidium Sa-
vi, 1915. Поэтому род Ciliofaurea невалиден, хотя ни-
кто не захочет восстановить забытое название.
В каталоге Аэшт Paramaecidium — это синоним рода
Paramecium, но это неправильно. Вид Loxodes marinum
Dujardin, 1841 зарисован с безресничной левой сто-
роны, напоминает Ciliofaurea arenicola (Dragesco,
1954)
Отряд Protoheterotrichida Nouzarede,
1977
Соматическая цилиатура равномерная, без замет-
ного ацилона; тело вытянутое, червеобразное, сокра-
тимое; органеллы кортекса и пигментные гранулы
(пигментосомы) в межкинетах делают особей темны-
ми, непрозрачными. Соматическая цилиатура доволь-
но простая, с дифференцировкой участков (перикинет)
на уровне перистома слева; усложнена ротовая цилиа-
тура — имеются поликинеты правее или левее рта (это
родовой признак) и дополнительные ряды дисом внут-
ри и снаружи от поликинет, иногда и полоса фибрилл.
Мембранеллы гетеротрих могли произойти от пекти-
424
ALVEOLATA
Рис. 271. Karyorelictida.
Remanella brunnea (Л, Б), R. mullicorpusculata (В, Г), Geleia simplex (Д), G. decolor (Л), Ciliofaurea brunnea (E—К). (По: Dragesco, 1965b (Л—K), 1999 (Л)).
Fig. 271. Karyorelictida.
нелл (коротких рядов) в основании левой поликинеты
(например, у Gruberia. внешне похожих на гелеид).
Обычные виды в морском песке и бентосе.
Сем. Geleiidae Foissner, 1998 пес Kahl,
1933 (рис. 271, 272)
Тело вытянутое, но не червеобразное, почти не
сплющено; перистом овальный или в виде широкой
щели, расположен близко к вершине тела. Узкая или
массивная поликинета расположена слева от перисто-
ма (у авелиид справа); справа находится фрагмокинета
(из мелких сегментов), которой нет у авелиид. Роль со-
макинет в перистомальном комплексе незначитель-
ная — сгущены кинетосомы на уровне перистома в од-
ной кинете, примыкающей ко рту слева; у авелиид
имеется целая группа таких обособленных рядов; в
данном обзоре я ввожу термин «перикинеты» для обо-
значения фрагментов сомакинет или участков цельных
кинет, модифицированных для создания дополнитель-
ной ротовой цилиатуры.
Род Geleia Foissner, 1998
Тело вытянутое, с субапикальным перистомом и
коротким швом (секантой) до клювовидной вершины
тела; в центре тела обычно 2 макро- и 1 микронуклеус
в компактной группе; ротовая зона овальная, реже уд-
линена. Перистомальный комплекс несколько варьи-
рует у разных видов, но всегда имеется широкая поли-
ТИП CILIOPHORA. КЛАСС KARYORELICTEA
425
Рис. 272. Karyorelictida. (По: Dragesco, 1999).
Geleia major (A)' Gellertia heterotricha (S); Parduczia arcachonense (B); Parduczia orbis (Г); Avelia multinucleata (Д).
Fig. 272. Karyorelictida.
кинета слева от перистома, с множеством вплотную
сближенных косых сегментов; справа более узкая по-
лоса, простой внутренний ряд дисом и наружная поло-
са аргентофильных фибрилл.
Род Geleia Kahl, 1933 был предложен для 3 новых
видов без указания типа; роду посвящена большая ли-
тература, но только недавно Фойсснер (Foissner, 1998)
указал типовой вид Geleia fossata (Kahl, 1933) и авто-
матически стал автором рода. Дражеско (Dragesco,
1999) приводит все виды рода, к примеру, как Geleia
major (Dragesco, 1954) Foissner, 1998, но в статье
Фойсспера назван только типовой вид G. fossata. Это
значит, что все остальные виды надо цитировать так:
Geleia major (Dragesco, 1954) Foissner in Dragesco,
1999. Это довольно компактный кластер видов с небо-
льшими отличиями, с однотипным кортексом, пери-
стомом, сходными ядрами. Валидные виды, кроме на-
званных, — G. simplex (Faure-Fremiet, 1951) с 3 разны-
ми морфотипами; G. decolor (Kahl, 1933); G. major (D.,
1954), тоже с разными морфами; G. nigriceps (Kahl, 1933);
G. swedmarki (D., 1954); G. obliqua (D., 1954); G. tenuis
(D., 1960); G. acuta (D., 1960); G. luci(jD., 1960); G. hya-
lina (D., 1960); G. vacuolata (D., 1960); напомним, что
для всех этих видов автор новой комбинации «Foissner
in Dragesco, 1999», но не «Foissner, 1998».
Род Gellertia Dragesco, 1999
Типовой вид по монотипии G. heterotricha {Geleia
in Dragesco, 1954). Внешне это типичная Geleia с тол-
стым умеренно вытянутым телом (до 600 мкм), 2 ядра-
ми, небольшим числом кинет простой топографии.
При импрегнации протарголом справа от рта виден
внутренний ряд разрозненных дисом и наружная фраг-
мокинета (прерывистый ряд коротких сегментов дики-
неты); слева двойной ряд дисом, фактически узкая по-
ликинета; левые сомакинеты не дифференцированы на
уровне перистома. Нет массивной цельной левой по-
ликинеты, в отличие от видов Geleia, но в остальном
перистом сходный.
Сем. Aveliidae Dragesco, 1999 (рис. 272)
Внешне такие же червеобразные формы, как гелеи-
ды, но намного крупнее (гиганты до 0.5 см) с полной
цилиатурой. Перистом овальный или вытянутый, ши-
рокая полоса из множества косых кинет (поликинета)
находится правее рта, а не левее, в отличие от гелеид.
По Дражеско, это различие достаточно для выделения
нового семейства.
426
ALVEOLATA
Род Avelia Nouzarede, 1977
Родовое название Avela Nouzarede, 1975 как гомо-
ним было заменено на Avelia. Типовой вид Л. таг-
tinicense (Avela in Nouzarede, 1975) валидный, но плохо
изучен; открыт на Мартинике, пока не найден в морях
Европы. Это темно-коричневые умеренно вытянутые
цилиаты с 50 кинетами; рот небольшой, овальный, не
щелевидный, сдвинут далеко вниз на узком хоботко-
видном антероне. Справа от рта изолированная поли-
кинета и внутренний ряд ресничек, слева, вероятно,
ряд и аморфная группа кинетосом.
Фактически единственная картина перистома по-
лучена только у A. multinucleata Dragesco, 1999; это
гиганты (до 3 мм) с широким телом, относительно
недлинным хоботком, 2—3 парами ядер. Короткий
овальный перистом справа ограничен поликинетой и
внутренним рядом, слева рядом дисом и фибрилляр-
ной полосой (не поликинетой), дифференцированы
только 2 сомакинеты на уровне перистома слева (у
Parduczia 3—4).
Avelia arcachonense (Avela in Nouzarede, 1975) —
редкий вид из Франции, плохо изучен, его валидность
под сомнением; нет данных о ротовой цилиатуре. Нет
точных данных и по виду Avelia gigas (Geleia in Dra-
gesco, 1954), но этот вид валидный; длина тела при
растяжении до 2 мм, передняя треть тела резко сужена,
в середине этого отдела находится длинная ротовая
щель; зарисовки in vivo показывают такой же ротовой
кинетом, как у типового вида; вид имеет сотни ядер.
Род Parduczia Dragesco, 1999
Типовой в и д Р. orbis (= Geleia orbis Faure-Fre-
miet, 1950; = Avelia orbis in Dragesco et Dragesco-Keme-
is, 1986). Гигантские змеевидные цилиаты; над длин-
ным узким щелевидным субапикальным перистомом
тело сужено и отогнуто вбок, сохраняется апикальный
клюв. Перистомальная щель ограничена одинаковыми
по длине рядами, состоящими из дисом. Левосторон-
ний ряд простой, не поликинета, в отличие от других
родов — в левых рядах на уровне перистома тесно
сближены все дисомы, образуя (у типового вида) 4 раз-
розненные диплокинеты. Справа сомакинеты сближа-
ются, но мало изменены; обособлена широкая полики-
нета с множеством косых пектинелл-монокинет, и не-
посредственно у перистома интрабуккальный ряд
дисом такой же длины. Несмотря на гигантские разме-
ры, особи имеют 2 мелких ядра и микронуклеус в цент-
ре тела, за исключением Р. murmanica с 4—16 парами
макронуклеусов.
Р. murmanica (Geleia in Raikov, 1962). Вид длиной
до 2.5 мм, с 56—62 кинетами, почти не сплющенный,
пока не был импрегнирован протарголом, но по форме
и длине ротовой щели (130 мкм) можно предположить,
что это вид рода Parduczia.
Р. filiformis (Geleia in Nouzarede, 1977). С Мартини-
ки — не тропический эндемик, найден и изучен во
Франции; длина тела 1.5 X 3.4 мм X 25—65 мкм, при
фиксации сжимается вдвое; перистом однотипный с
Р. orbis, но резче обособлены 3 левые кинеты от сома-
тических.
Р. martinicense (Geleia in Nouzarede, 1977). Длина
тела 1.2—2.5 мм, имеет очень узкую ротовую щель со
стандартной для рода ротовой цилиатурой.
Р. arcachonense (Geleia in Nouzarede, 1965). Круп-
нейшая цилиата длиной до 0.5 см; перистомаль-
ный комплекс типичный, левее щели 3 продольных
ряда отграничены от поперечных рядов дисом (па-
ратен).
Geleia floridensis Lackey, 1957. Вид длиной
1.4—2 мм, темно-коричневый; ядра не изучены, пери-
стомальная щель очень длинная, от клюва, расширяет-
ся внизу; этот вид, не замеченный специалистами, мо-
жет быть синонимом вида Parduczia orbis со сходными
размерами, формой тела и перистомом.
Род неопределенного положения — Corlissia Dra-
gesco, 1960 (= Corlissia Dragesco, 1954); типовой вид
С. picta. Редкий малоизученный вид из морского псам-
мона; точное строение перистома неизвестно; макро-
нуклеус и аргиром, скорее, такого типа, как у гимено-
стомат, а не кариореликтид; узкий щелевидный рот на
краю тела, как у Ciliofaurea brunea. Линн (Lynn, 2002)
включает род в состав кариореликтид. Этот род рас-
смотрен далее в составе плейронематин.
Класс Heterotrichea Stein, 1859
Крупные формы, нередко пигментированы; тело плоское или
коническое, обычно вытянутое и сократимое, с крупным перисто-
мом. Соматические кинеты хорошо развиты, без тенденции к ре-
дукции, многочисленные, составлены дикинетидами с наложением
постцилиарных полос микротубул. Ротовая левосторонняя мемб-
рана четкая, часто крупная, полоса мембранелл длинная, извитая, у
стенторид почти кольцевая. В основаниях мембранелл не менее
3 кинет, это поликинеты такой же формы, как у гипотрих. Макро-
нуклеус массивный, часто цепочковидный, гантелевидный, иногда
распыленного типа; ядра амфилептидного типа (2 макронуклеуса
по оси тела), обычные у большинства гипотрих, у гетеротрих не
встречаются, эта деталь говорит об их разном происхождении; нет
и реорганизационных полос, проходящих через макронуклеус ги-
потрих при делении. В делении ядра участвуют экстра-ядерные
микротубулы (отличие от всех последующих цилиат, объединяе-
мых в группу Intramacronucleata). Пресноводные и морские формы,
подвижные и сидячие, в основном свободноживущие; комменсалы
единичные, паразитов нет. В пресной воде и в море есть свои ха-
рактерные виды, к примеру Spirostomum, Climacostomum, Linosto-
mella — облигатно пресноводные гетеротрихи; Anigsteinia,
Chattonidium, Condylostentor встречаются только в море. Находки
стенторов в море единичные; кондилостомы, напротив, очень ред-
ко встречаются в пресной воде и обычны в море; морские виды
Blepharisma непигментированы и, вероятно, не относятся к этому
роду; Fabrea обитает в ультрагалинных приморских водоемах.
Отряд Heterotrichida Stein, 1859
Соматические дикинетиды (дисомы) с парными
ресничками или с одной, в последнем случае обычно
передняя кинетосома несет ресничку. Мощные лево-
сторонние мембранеллы с основаниями из поликине-
тид служат для питания и движения. Система субпел-
ликулярных альвеол слабо развита.
ТИП CILIOPHORA. КЛАСС HETEROTRICHEA
427
Подотряд Heterotrichina Stein,
1859
Безраковинные формы, подвижные или временно
прикрепленные к субстрату — фактически все гетеро-
трихи, кроме сем. Folliculinidae. Подотряд включает
много семейств при небольшом числе родов, и такое
дробление кажется неоправданным; ряд семейств со-
держат только по одному роду. В данной сводке при-
нято 5 семейств.
Сем. Blepharismidae Jankowski in Small
et Lynn, 1985 (рис. 273—275)
Плоские удлиненные формы с незначительной со-
кратимостью, часто пигментированы; перистом по
краю антесомы, вытянутый, узкий; кинеты и зона мем-
бранелл не спирализованы; ядра всех типов, перечис-
ленных в диагнозе класса. Подвижные пресноводные и
морские виды, очень обычные в пробах бентоса.
Род Blepharisma Perty,
1849
Типовой вид В. persicinum.
Родовые синонимы — Apgaria Stokes, 1884; Tricho-
mecium Fromentel, 1875; Ypsistomon Bory de St. Vincent,
1824. Эти названия не были учтены при разделении
рода на подроды. По форме ядра выделены подроды
Compactum Hirshfield, Isquith et Bhandary, 1965 (типо-
вой вид В. hyalinum Perty, 1849), Filiformis (типовой
вид В. intermedium Bhandary, 1962), Halteroides (ти-
повой вид В. tropicum Bhandary, 1962) n Blepharisma
s. str. (типовой вид В.persicinum Perty, 1849). Ядро
соответственно овальное, палочковидное, двойное или
цепочковидное (нодулы соединены в цепочку). Эти
подроды не были приняты рядом авторов, поскольку
монофилия групп не доказана, и возможна вариация
типа ядра у разных линий одного вида. В дополнение к
этим 4 типам ядер можно выделить 5-й тип — «распы-
ленный» макронуклеус в виде 20—28 нодул у В. multi-
nucleata Dragesco, 1960.
Рис. 273. Heterotrichida.
Blepharisma intermedium (A—В); В. undulans (Г.Д): В. americanum (Е, Ж); В. japonicum (3); Pseudoblepharisma crassum (И}. (По: Tuffrau, 1968 (Е, Жу, Groliere,
1977 (И); Dragesco, 1970 (3); Dragesco, Dragesco-Kerneis, 1991 {Г, Д); AI-Rasheid et al., 2001 (Л—В)).
Fig. 273. Heterotrichida.
428
ALVEOLATA
Рис. 274. Heterotrichida.
Spirostomum ambiguum (А, Б, E)', S. minus (B); Anigsteinia Candida (Г, Д)\ Gruberia calkinsi (Ж, 3); G. aculeata (И)-, Condylostentor auriculatus (= Stentor, Condy-
lostoma) (К). (По: Augustin, Foissner, 1992 (A—B, E)', Al-Rasheid, 2000b (Г, Д); Dragesco, 1963b (Ж, 3); Ozaki, Yagiu, 1943 (И, K)).
Fig. 274. Heterotrichida.
Род Apgaria Stokes, 1884 предложен для 3 новых ви-
дов без выделения типового вида — A. undulans,
A. elongata, A. ovata; тип рода по моему обозначению
A. ovata с овальным ядром, поэтому подрод Compac-
tum ликвидируется.
Род Blepharisma включает немало пресноводных
видов; статус морских видов спорный (см. далее род
Anigsteinia). В лаборатории в чашках Петри на рисе
и флагеллатах легко разводятся В. lateritia, В. ovata,
В. persicinum, В. steini, В. undulans, B.japonicum —
обычные объекты лабораторных исследований; по-
следний вид — не эндемик Японии, встречается в При-
морье у Владивостока, но не был никем отмечен в Ев-
ропе.
Тело сплющено латерально, обычно крупное; кине-
ты немногочисленные, продольные; межкинеты зер-
нистые, несут пигментные гранулы. Окраска тела ро-
зовая, малиновая (особый пигмент — блефаризмин),
изредка голубая у В. coeruleum, В. violacea, В. falcatum,
В. lentis. Перистом крупный, узкий, идет по краю тела
до экватора и ниже; ундулирующая мембрана корот-
кая, у мелкой ротовой воронки.
Примеры видов с овальным ядром (это большинст-
во видов рода) — В. bimicronucleatum Villeneuve-Bra-
chon, 1940; В. coerulea Gaj., 1933; В. ovata (Stokes, 1884
in Apgaria); B. steini Kahl, 1932; B. violacea Tucolesco,
1962; B. lentis Gelei, 1954; B. lateritium (Ehr., 1831);
B. hyalinum Perty, 1852; B. falcatum Gelei, 1954; B. icht-
hyoides Gelei, 1933; B. elongata (Stokes, 1884 in Apga-
ria); B. tardum Kahl, 1928.
Примеры видов с цепочковидным ядром — В. mus-
culus (Ehr., 1831); В. persicinum Perty, 1849; В. dawsoni
Christie et Hirshfield, 1967; B. dileptus Kahl, 1928;
B. grayi Hartwig et Parker, 1977; с прямым палочковид-
ным ядром — В. Japonicum Suzuki, 1954.
Род Anigsteinia Isquith, 1968
Типовой вид Blepharisma clarissimum Anigstein,
1912. Все виды морские, бесцветные (пресноводные
виды блефаризм почти все розовые, малиновые или го-
лубые); отсутствие пигмента в гранулах интеркинет —
это, конечно, не родовой признак, нужны морфологи-
ческие отличия. Оба рода включают виды с короткой и
длинной ундулирующей мембраной правее рта, сома-
тический кинетом сходный, ядра у Anigsteinia цепоч-
ковидные, одного типа, как у части блефаризм. Ряд ав-
ТИП CILIOPHORA. КЛАСС HETEROTRICHEA
429
Рис. 275. Heterotrichida.
Condylosloma patulum (/); C. arenarium (Б, В); C. longicaudata (Д); Blepharisma (Anigsteinial) parasalinarum (Г, E). (По: Dragesco, 1963b (А, fffc 1996 (Г, E);
Dragesco, Dragesco-Kemeis, 1986 (Б, B)).
Fig. 275. Heterotrichida.
торов сохраняет этот род, другие не считают валид-
ным. Как отличительный признак рода, указывается
положение крупной сократимой вакуоли с каналом у
постерона, резкое вытягивание тела у типового вида и
близких форм, удлинение цепочки ядерных нодул, бо-
лее короткая мембрана, чем у блефаризмы. Состав
рода: A. clarissima (Anigstein, 1912 in Blepharisma)-,
И, arenicola (Kahl, 1932); A. longissima (= Blepharis-
ma clarissimum var. longissima Kahl, 1932); A. velata
(Vucelet, 1961); A. salinara (Florentin, 1899 in Spirosto-
miini)', описание типового вида В. clarissimum (см.:
Агамалисн, 1983).
Род Parablepharisma Kahl, 1932
Включает типовой вид Р. pellitum Kahl, 1932;
Р. bacteriophora Villeneuve-Brachon, 1940; Р. chlamy-
dophora Kahl, 1932; P. collareTA.ah\, 1932;P. kahli Tuco-
lesco, 1962; P. kahli f. uninucleata Tucolesco, 1962. Род
предложен для группы видов без обозначения типо-
вого вида, невалидный по правилам номенклатуры
и меняет авторство — Parablepharisma Jank. gen. n. с
переносом всех названных видов — Р. bacteriophora,
Р. chlamydophora, Р. pellitum, Р. collare, Р. kahli comb. nn.
Тело незначительно вытянутое, не червеобразное,
антерон заострен, сократимая вакуоль у постерона;
мембрана короткая, у рта; ядра разного типа, обычно
овальные, у Р. pellitum в виде разрозненных мелких
нодул. Внешний облик, как у Blepharisma-, вероятно,
родовой признак — наличие тонкого мукозного слоя
на всей поверхности тела, заселенного эпибактериями
в полосах межкинет. Морской бентос.
Род Pseudoblepharisma Kahl, 1926
Типовой вид Р. tenuis Kahl, 1926; Р. crassum
Kahl, 1927; Р. montana Tucolesco, 1962. Тело вытяну-
тое, перистом краевой, относительно небольшой,
крупная вакуоль у постерона, густые кинеты, овальное
ядро. На покровах тела возможны поселения родобак-
терий, бесцветных или пурпурных. Валидность рода
пока неясна; по Линну и Смоллу (Lynn, Small, 2002),
«передние или прецитостомные дикинетиды пар-
оральной инфрацилиатуры в группах по 4 — кварте-
430
ALVEOLATA
Рис. 276. Heterotrichida.
Copemetopus subsalsus (A—Г); Condylostoma terricola (Д); Linostomella vorticella (= Condylostoma, Linostoma) (E—bf). (По: Al-Rasheid, 2001b (A—Г)', Foissner,
1995b (Ду, Patsch, 1974 (E); Packroff, Wilbert, 1991 (Ж)-, Dragesco, Dragesco-Kemeis, 1986 (3); Tuffrau, 1968 (И)).
Fig. 276. Heterotrichida.
ты», t. e. основание ундулирующей мембраны состоит
не из одного линейного ряда дисом, а из групп дисом;
для всех видов это не проверено. Пресноводный бен-
тос, сапропель, иногда в зоне серобактерий.
Сем. Spirostomatidae Stein, 1867
(= Spirostomidae) (рис. 274, 278)
Крупные формы с узким вытянутым телом, очень
сократимые; перистом узкий, растянут по оси тела,
с небольшой мембраной; ядра различного типа, от
овальных до распыленных. Морской и пресновод-
ный бентос.
Род Gruberia Kahl, 1932
Типовой в и д G. uninucleata Kahl, 1932; G. lance-
olata (= Spirostomum lanceolatum Gruber, 1884; G. cal-
kinsi Beltran, 1933; G. hyalina Dragesco, 1960; G. tenuis
Dragesco, 1960; G. binucleata (Dragesco, 1954); G. acu-
leata Ozaki et Yagiu, 1941; G. uninucleata var. grandis
Dragesco, 1960). Все виды морские. Внешне очень по-
хожи на гелеид, но имеют полиплоидный макронукле-
ус, способный к делению; гетеротрихи типа Gruberia
произошли от кариореликтид — это не конвергенция.
Отличия от Spirostomum — более короткий перистом,
клювовидный антерон (как у гелеид), вероятно разное
строение мембраны (данные противоречивы). Grube-
ria при фиксации не сжимается спиралью, как спиро-
стомы, сомакинеты остаются продольными. Тело уз-
кое, червеобразное, длиной до 1 мм, с длинным щеле-
видным боковым перистомом, большим числом кинет;
ядро овальное у типового вида, двойное у G. binuclea-
ta, цепочковидное с большим числом нодул у осталь-
ных видов.
Род Spirostomum Ehrenberg, 1834
Типовой вид Trichoda ambigua Muller, 1786
(S. ambiguum in Ehrenberg, 1834). Крупные непигмен-
тированные червеобразные формы с тупым антеро-
ном, без клюва, с очень длинным и узким перистомом,
большим числом мембранелл и короткой мембраной.
Крупная вакуоль с длинным каналом занимает ши-
рокий постерон; кортекс с зернистыми межкинетами;
ТИП CILIOPHORA. КЛАСС HETEROTRICHEA
431
Рис. 277. Heterotrichida.
Fabrea salina (A, B): F. salina («Bursalinus synspiralis») (B); Pseudoblepharisma crassum (Г—E); Climacostomum virens (Ж—К). (По: Tuffrau, 1968 (A, S); Kalmus,
1929 (B); Groliere, 1977 (Г—Е); Augustin, Foissner, 1992 (Ж—PC)}.
Fig. 277. Heterotrichida.
кинеты немногочисленные, продольные, но при сокра-
щении особи скручиваются. Все виды пресноводные;
6 видов рода включены в каталог морского псаммона
(Carey, 1992), но это ошибка.
Ядра разного типа; по типу ядер и форме тела пред-
ложены 3 подрода — Spirostomum s. str. с цепочкой
ядер, Spironectum Jankowski, 1967 (типовой вид S. teres
С, cl I I859, с овальным ядром), Spirogonella Jankow-
Nki, 1978 (типовой вид Uroleptus filum Ehr., 1833 = Spi-
rostomum caudatum (Muller, 1786), с узким вытянутым
телом, оплньным ядром, клювом и длинным каудаль-
ным отростком. Другие валидные виды — S. yagiui
Shigcnaka, 1959 (с палочковидным ядром, что не отра-
жено в системе подродов); 5. ephrussii Delphy, 1939
(вид с овальным ядром); S’. inflatum Kahl, 1927; S. minus
Roux, 1901; S. loxodes Stokes, 1885; S. intermedium
Kahl, 1932. Эти подроды были предложены в тезисах,
невалидные и здесь предлагаются вновь — Spironec-
tum Jank. subgen. n., Spirogonella Jank. subgen. n. с ука-
занными выше типовыми видами и отличительными
признаками.
Виды рода, чаще всего обычный в пробах S. ambi-
guum, легко разводится в культурах и служит объек-
том работ разной тематики. Сейчас описан новый вид
с зоохлореллами — S. viride. Родовой синоним — Pel-
tierius Ormancey, 1852 (типовой вид Р. barbatus).
Сем. Chattonidiidae Villeneuve-Brachon,
1940
Один аберрантный род гетеротрих из морского
бентоса в солоноватых водах; тело бесцветное, сокра-
тимое, широкое, коническое, вытянуто сзади, где рас-
положена полость с 6—7 рядами ресничек, вероятно
тигмотактическая органелла; ядро извитое, лентовид-
ное; кинеты продольные; перистом развернут спираль-
но на широком антероне, дно перистома с радиальны-
ми ребрами, как у стенторов.
Род Chattonidium Villeneuve-Brachon, 1940
Типовой вид Ch. setense по монотипии. С при-
знаками семейства. Редкий малоизученный вид из при-
брежного эпибентоса в морских лагунах.
432
ALVEOLATA
Рис. 278. Heterotrichida.
Spirostomum teres (Л, E); 5. ambiguum (Б—Д)', Stentorpofymorphus (Ж); S. amethystinus (3); S. caudatus (И); S. fuliginosus (K); S. coeruleus (Л). (По: Patsch, 1974
(А, Г, Жу, Dragesco, 1970 (3, И); Dragesco, Dragesco-Kerneis, 1986 (Z>, В, E, Ky Tuffrau, 1968 (Д, Л)).
Fig. 278. Heterotrichida.
Сем. Climacostomidae Repak, 1972
(рис. 276, 277)
Мешковидные непигментированные несократимые
формы с широким спиральным перистомом; мембрана
разного типа. 3 рода из бентоса пресных вод, морей и
пересоленных (ультрагалинных) водоемов; родство их
не доказано, перистом неодинаковый, семейство, веро-
ятно, сборное (полифилетичное).
Род Climacostomum Stein,
1859
Типовой вид С. virens (Spirostomum virens Ehr.,
1833). Плоские удлиненно-овальные формы с узким
антероном, с зоохлореллами, перистом с концентриче-
скими ребрами на дне, глотка узкая и длинная, канало-
видная, кинеты многочисленные, слегка извитые; ва-
куоль с длинными каналами. Кинеты полярные, кроме
части вентральных; мембранеллы перистома 2 типов,
основание мембраны — поликинета с серией попереч-
ных паратен (пектинелл), что нетипично для гетеро-
трих. Хорошо культивируются в чашках Петри. Недав-
но описанный вид С. minimum Foissner, 1980 меньше
по величине и имеет более короткое ядро. Морской
вид С. gigas Meunier, 1910 из Арктики сохранен в со-
ставе рода (Carey, 1992), но он очень плохо описан и не
имеет ничего общего с С. virens.
Род Fabrea Henneguy,
1890
Типовой вид/7, salina (= Bursalinus synspiralis
Kalmus, 1929) по монотипии. Встречается в море,
но чаще в приморских пересоленных лужах, ваннах,
озерах, например в солеварнях, от Арктики до тропи-
ков. Крупные мешковидные формы длиной до 450 мкм
с резким сужением антесомы и острым апексом,
отогнутым вбок, с небольшим клювом; кинеты пре-
рваны спиральным перистомом, занимающим значи-
тельную часть тела. Такого разрыва кинет нет у других
родов семейства. Мембрана длинная, спиральная;
ядро лентовидное. Легко инцистируются при высуши-
вании.
ТИП CILIOPHORA. КЛАСС HETEROTRICHEA
433
Род Copemetopus Villeneuve-Brachon,
1940
Типовой в ид C. subsalsus’, также С. chesapeaken-
sis Small cl Lynn, 1985. Тело очень широкое, тупое спе-
реди, сужается кзади, ядро гантелевидное или из 2—
3 независимых сферул, кинеты не прерваны перисто-
мом; имеется нетипичная для гетеротрих дорсальная
тигмозопа — участок с длинными ресничками и гус-
тыми кинетосомами; зона мембранелл извитая, у вер-
шины зела поворачивает вниз. В основании мембраны
поликине та (по три ряда кинетосом в каждой из много-
численных косых пектинелл). Редкие малоизученные
формы из приморских соленых водоемов, встречаются
вместе е b'abrea.
Сом. Condylostomatidae Kahl, 1929
(In Doflein et Reichenow, 1929)
(рис. 274—276)
(Ющий признак — наличие перистома такого типа,
как у гипотрих. Тело плоское, вытянутое, гибкое и со-
кратимое, С густой продольной цилиатурой в правиль-
ных продольных рядах; полоса ротовых мембранелл
дугонидния, развернута вдоль расширенного апекса;
мембрпнп длинная, на краю широко открытой буккаль-
ной полости. Обычные виды в пресных водах и в море,
всеядные и хищники.
Род Condylostoma Bory de St. Vincent,
1824
Тип 0 и о II ЙИД С, patens (Trichoda patens Muller,
1786), | IcniioillI'IIIHhllbie написания Kondyliostoma Bory,
1824 и KfilltlyhiSloma Dujardin, 1841 не были позже
приня ты, НО официально не отвергнуты. Тело плоское
и длинное, широкое, мешковидное, часть видов с зоо-
хлореллами, Папистом субапикальный, с характерным
для рода обособлением 3—7 мембранелл сверху спра-
ва, похожих пи циррусы гипотрих. Возможно, эти
структуры . дериваты кинет, а не обособившиеся
основания правых мембранелл апекса. Кинеты много-
численные, продольные, идут параллельно перистому
до апекса справа, подходят ко рту и левой стенке поло-
сти под углом; имеются стоматогенные послеротовые
ряды. Нет признаков дифференцировки вентральной
и дорсальной цилиатур (модифицированных у гипот-
рих), нет переходных форм к низшим гипотрихам.
Ядро лентовидное или цепочковидное, нет видов с
овальным ядром. Внешне кондилостомы очень напо-
минают гипотрих типа уростилы, сохраняющих про-
дольные ряды и зернистые межкинеты, родство групп
несомненно; уменьшение числа кинет ведет от урости-
лнд к окситрихидам и к независимой линии холости-
хид с двойным осевым рядом (диаксонемой).
Кондилостомы очень редко отмечаются в пресных
водах вдали от моря, где обитают особые виды рода —
не популяции морских видов (например, в Байкале);
в море обычны в бентосе лагун и открытого берега.
Культивируются на флагеллатах. Относительно круп-
ный род, включает не менее 30 видов, пока не под-
разделен на подроды; примеры видов — С. acuta
Dragesco, 1960; С. arenarium Spiegel, 1926; С. caudatum
S., 1926; C. curva Burkovsky, 1970; C. enigmatica D.,
1954; Cjjeldi Hartwig, 1973; C. granulosum Bullington,
1940; C. kahli D., 1960; C. remanei S., 1928; C. lacustris
(= C. remanei var. lacustris Kovalchuk, 1980); C. magnum
S., 1926; C. minima D., 1960; C. minutum B., 1940;
C. nigra D., 1960; C. oxyoura (= C. remanei var. oxyoura
D., 1960); C psammophilum Bock, 1952; C. patulum C. et
L., 1858; C. reichi Wilbert et Kahan, 1981 (гиганты вели-
чиной до 2.5 мм); С. tenuis Faure-Fremiet, 1958 (мор-
ской вид с симбионтными водорослями); С. vorax
Villeneuve-Brachon, 1940; С. subterraneum Lepsi, 1962;
С. psammophila Bock, 1954; C. patens Dujardin, 1841;
C. terricola Foissner, 1995 (почвенный вид с крупным
перистомом) и др. Определитель части видов — свод-
ка Карея по морскому псаммону (Carey, 1992). Один из
пресноводных видов С. tardum Penard, 1922 во всем от-
личается от стандартных кондилостом, особенно по
типу перистома, и был недавно перенесен в состав
рода Condylostomides.
Род Electostoma Jankowski, 1979
Типовой вид Condylostoma vastum Bock, 1952 из
литорального псаммона, вид с осевым апикальным пе-
ристомом (у кондилостом перистом смещен влево) и с
резким укорочением тела; обособленные перистомаль-
ные циррусы не отмечены; ядро в виде нескольких но-
дул, не соединенных в цепочку. Этот вид пока плохо
изучен, вероятно редкий; отсутствие циррусов нужда-
ется в проверке.
Род Procondylostoma Jankowski, 1979
Типовой вид Condylostoma ancestralis Villeneu-
ve-Brachon, 1940 — внешне типичная кондилостома с
длинным плоским мешковидным телом, 30—35 кине-
тами, цепочковидным ядром из 11—15 нодул; нет обо-
собленной группы циррусов у вершины тела, четко
выявляемых у С. arenarium (Villeneuve-Brachon, 1940).
Род Predurostyla Jankowski, 1978
Типовой вид Condylostoma arenarium Spiegel,
1926, также C. remanei Spiegel, 1928, C. vorax Villeneu-
ve-Brachon, 1940, C. psammophila Bock, 1952. Род был
предложен для видов с фронтальными циррусами, но
невалиден как синоним рода Condylostoma, поскольку
такие циррусы есть у типового вида кондилостом," обо-
собить следовало формы без таких циррусов (Procon-
dylostoma ancestralis).
Род Condylostomides Da Silva Neto, 1994
Типовой вид C. grolieri. Некрупные формы из
континентальных соленых вод; тело расширено у анте-
рона и сужается к постерону, ядра — несколько сфе-
рул, кинеты простой топографии, перистом смещен
’Н 1ц«, № 4163
434
ALVEOLATA
влево от оси тела, сужается к вершине, с обособлением
ряда мелких циррусов в узкой полосе вдоль верхней
части основания длинной и высокой ундулирующей
мембраны. Второй вид С. etoschensis Foissner et al.,
2002 открыт в соленых почвах Намибии; возможно, в
состав этого рода нужно перенести и пресноводный
вид Condylostoma tardum Penard, 1922.
Род Linostomella Aescht, 1999
(in Foissner et al., 1999)
Типовой вид Condylostoma vorticella (Ehren-
berg, 1833). Вид был выделен мной в новый род Lino-
stoma Jankowski, 1978, но это гомоним, поэтому назва-
ние было заменено новым. Вид напоминает мелких
кондилостом — тело короткое и широкое, плоское, с
широко открытым перистомом и короткой цепочкой
ядер; ундулируюшая мембрана гигантская; кинеты
многочисленные. Родовой признак один — отсутствие
группы циррусов у вершины тела справа; такое отли-
чие от кондилостом свойственно и С. vastum (род Elec-
tostoma), но этот вид имеет иную топографию кинет,
они идут вдоль мембраны у С. vastum и подходят к ней
у С. vorticella. Вид обитает в планктоне пресных вод,
хорошо изучен новыми методами импрегнации.
Род Condylostentor Jankowski, 1978
(рис. 274)
Типовой вид Stentor auriculatus Kahl, 1932 по
монотипии, из морского бентоса, вероятно синони-
мичный с S. auricula Kent, 1881 (Condylostentor auricula
comb. n.). Тело трубчатое, резко расширят ся к верши-
не и сужается к постерону, как у Stentor, кинеты поли-
меризованы, сложной топографии на вентральной сто-
роне; перистом в виде гигантской воронки, очень глу-
бокой, без концентрических ребер на дне и краях (в
отличие от стенторов); ядро типового вида в виде
длинной цепи нодул, у S. auricula округлое, но не иск-
лючено, что это слияние нодул перед делением клетки,
а не постоянный видовой признак. Полоса мембранелл
спиральная, огибает весь антерон и входит в инфунди-
булюм. Род сводили в синонимы Condylostoma, хотя у
Condylostentor нет апикальных циррусов, отделивших-
ся от зоны мембранелл; сейчас в связи с открытием
рода Maristentor такая синонимия исключается. Назва-
ние рода не означает, что род считается филогенетиче-
ски промежуточным между Condylostoma и Stentor.
Сем. Stentoridae Carus, 1863
Тело широкое, конусовидное, не сплющено, сокра-
тимое при раздражении или фиксации, плавно расши-
ряется к вершине, постесома ножковидная, нередко
вытянутая; кинеты многочисленные, продольные.
Межкинеты широкие, с массой гранул, обычно с пиг-
ментом; есть ярко-зеленые, синие, красные, малиновые
виды. Несколько видов с симбионтными зоохлорелла-
ми. Перистом широко открытый апикально, ведет в
инфундибулюм. Спиральная полоса из сотен мембра-
нелл проходит по краю перистома и закручена в пред-
ротовой воронке; ундулируюшая мембрана короткая,
обычно не заметна, глубоко погружена. Ядра разного
типа, но при делении ядро всегда сферическое, нодулы
сливаются вместе. Один из видов планктонный (S. ni-
ger), один симбионтный (S. pygmaeus = S. baicalius)
на ногах глубоководного байкальского бокоплава Gar-
jaewia cabanisi. В море единичные находки, к приме-
ру S. coeruleus на морских моллюсках-древоточцах в
Индии в период минимальной солености. Большинство
видов в бентосе и перифитоне пресных вод, прикреп-
лено сократимой ножкой к субстрату; у части видов нож-
ка секретирует тонкий гибкий слизистый домик, по-
крытый детритом (S. loricatus, S. muelleri, S. roeselii).
Род Stentor Oken, 1815 (рис. 278, 279)
Типовой вид5. muelleri Ehr., 1831. Родовое на-
звание — гомоним (есть обезьяны Stentor Geoffrey,
1812), но решением Номенклатурного комитета со-
хранено как nomen conservandum. Родовые синонимы
Salpistes Wright, 1859; Stentorina Bory de Saint Vincent,
1824 (S. stentorea) и Stentorella Reichenbach, 1828
официально отвергнуты; непригодно также название
Tubaria Thienemann, 1828 (типовой вид Т. stentorea).
С диагнозом семейства. Крупный род, по типу ядерно-
го аппарата разбит на несколько подродов; наличие ба-
зального домика для различения подродов не исполь-
зуется.
Типовые виды подродов — Stentor Oken, 1815 s. str.,
типовой вид S. muelleri Ehr., 1831, с цепочкой нодул;
Rhabdocaryon Jank., 1967, с лентовидным ядром, типо-
вой вид S. roeselii Ehr., 1835; Meserellus Jank., 1967, c
округлым ядром, типовой вид S. multiformis (Muller, 1786).
Stentor acrobaticus Silen, 1948 — это ликнофорида,
идентичная c Licnophora lyngbycola (L. acrobatica Jan-
kowski comb. и ). Крупный род; примеры валидных ви-
дов: S. amethystinus Leidy, 1880; S. viridis Ghosh, 1921;
S.J'elici Villcneuve-Brachon, 1940; S. caudatus Dragesco,
1970; S'. gracilis Maskell, 1887; S. globator Stokes, 1885;
S'. baicalius Foissner et Wolfl, 1994 (= S. pygmaeus
Swarcz., 1929, гомоним); S', igneus Ehr., 1838; 5. striatus
Maskell, 1886; S’, polymorphus (Muller, 1773); S. introver-
sus Tartar, 1958; S. sphaericus Vuxanovici, 1961; S. galli-
nulus Penard, 1922; S. andreseni Nilsson, 1986 и др.
Род Filistentor Jankowski gen. n.
Тело резко вытянутое, прикреплено длинным ните-
видным придатком ко дну высокого мукозного доми-
ка; ядро лентовидное; перистомальная зона плоская,
очень широкая, далеко выдается за края тела. Стенто-
ры обычно прикреплены узкой нижней частью тела,
реснички покрывают все тело; этого нет у Filistentor,
прикрепительная нить без ресничек, перистом нети-
пичный для стенторов.
Типовой вид/*’, barretti (= Stentor barretti Barrett,
1870) из Темзы у Лондона, вторично найденный и по-
дробно изученный лишь в недавнее время. Не исклю-
чена идентичность этого вида с морским видом Stento-
folliculina tubicola Hadzi, 1938, но это nomen dubium,
ТИП CILIOPHORA. КЛАСС HETEROTRICHEA
435
Рис. 279. Heterotrichida.
NlfiHliii »|ip. (/I); S. niger (5); S. multimicronucleatus (B); S. roeselii (Г); Peritromus arenicolus (Д, E); P. montanus (Ж)', P.faurei (3). (По: Foissner et al., 1999 (A);
Dragesco, 1966a (Б.Д, E)\ Dragesco, Dragesco-Kerneis, 1986 (В, Г); Tuffrau, 1968 (3); Ozaki, Yagiu, 1941 (Ж)).
Fig. 279. Heterotrichida.
ВИД 110 ll'iyieii прижизненно, и осталось неизвестным,
IIMwr ли oil топкую нитевидную фиксаторную орга-
llfiliiy ОСНОВНОЙ признак Filistentor.
₽0Д Pliiustentor Vuxanovici, 1961
1 VIINMI ЛИНИИ (Lynn, 2002) род приведен в числе
ПИЛИВ 1 IniIrtM N0(IIn; но это просто плохо изученные
HiliiMHHIiHHl UUllOll iwieiioro (с зоохлореллами) вида
.Vlf'iHor/1Я^Ж(Н'/|/||М (Muller, 1773).
I ll НОВОЙ ВИД tcntaculatus и его «подвид»
/' ! л/шр/rtt IIMBIO ГI i никуолизованных сократимых от-
рои un iviiii « тк| пивные выросты»; обе формы найде-
ны и гпирофитонв oiepil и Румынии. Род невалидный.
рода неясного поиожения среди гетеротрих.
Род Pediotilomum Kahl, 1932
Г и п о в о й вид Climacostomiim (liedrum Faure-Fre-
niict, I924. Каль (Kahl, 1932) сближал этот род с Perit-
romus. Род четкий — это морские планктонные формы
со впяченной дорсальной стороной тела и обширным
вентральным перистомом; зона мембранелл спираль-
ная снизу и идет по всей верхней извитой части тела;
кинеты прерваны ротовой зоной, сложной топогра-
фии; ядро двойное. За ресничный ряды дна перистома
могли принять ребра кортекса.
Сем. Maristentoridae Miao, Simpson,
Fu et Lobban, 2005
Род Maristentor Lobban, Schefter,
Simpson, Pochon, Pawlowski
et Foissner, 2002
Типовой вид M dinoferus. На коралловом рифе
у о-ва Гуам (Марианские о-ва) было замечено множе-
ство крупных стенторов (размеры особей при растяже-
нии сократимого тела до 800 X 250 мкм); 6 авторов
(Lobban et al., 2002) подробно изучили их и описали
как новый вид и род стенторид. Трофонты с простым
округлым ядром, пигментированы, по форме тела на-
436
ALVEOLATA
поминают стенторов, по нс имеют ребер на обширной
поверхности перистома между мембраной и спиралью
мембранелл; у всех стенторов они легко видны без
окраски, как широкие дуговидные концентрические
полосы с пигментом такого же типа, как в продольных
полосах вне перистома. Как и кораллы, особи М. dino-
ferus содержат симбионтных зооксантелл — динофла-
геллат рода Symbiodinium, около 500—800 в клетке
хозяина, и имеют собственный кортикальный флуо-
ресцентный пигмент, вероятно облегчающий фотосин-
тез симбионтов — аналог стенторина и блефаризми-
на пресноводных гетеротрих. Реснички внутри перис-
томального поля, ограниченного спиральной зоной
мембранелл, сохранены, но не в рядах, рассеяны в бес-
порядке. Ундулирующая мембрана мелкая. Проведен
молекулярный анализ ДНК вида в сравнении с карио-
реликтидами и гетеротрихами; род Maristentor вначале
был провизорно отнесен к Stentoridae, но он более бли-
зок к Folliculinidae, хотя и не имеет разрастания боковых
лопастей перистома и прочной или мукозной раковины.
С открытием этого рода выявлен единый кластер внут-
ри гетеротрих — филогенетическая группа Blepha-
rismidae, Stentoridae, Maristentoridae и Folliculinidae.
Роды Diplogmus и Propygocirrus, спиростомиды не-
ясного положения (Lynn, 2002), рассматриваются
ниже в отряде Protocruziida класса спиротрих.
Подотряд Coliphorina Jankowski, 1964
Альтернативное название Folliculinina Jank., 1980.
В системе Линна (Lynn, 2002) таксон не различает-
ся, в Traite (Puytorac, 1994) считается отрядом спирот-
рих. Отличительный признак фолликулинид — сидя-
чий (седентарный) образ жизни, наличие раковины и
диморфизм, не характерный для гетеротрих. Образова-
ние мукозных трубок (домиков) отмечено у многих
бентосных стенторид; это привело в эволюции к обра-
зованию прочных хитиноидных раковин строго опре-
деленной формы, цвета и строения для каждого вида и
рода фолликулинид. Переходной формой между труб-
чатыми (тубикольными) стенторами и фолликулини-
дами может быть пресноводный вид Stentor barretti
или морская Stentofolliculina tubicola.
Трофонты одиночные, после деления томит поки-
дает домик. Внешний облик как у стенторов, но обыч-
но тело резко вытянутое, узкое, прикреплено скопулой
ко дну домика; перистом апикальный, очень широкий,
разрастается с образованием двух крыловидных лопа-
стей (wings); полоса мембранелл проходит по всему
краю апекса и уходит спиралью в глубокую буккальную
полость. Все тело покрыто ресничками в продольных
рядах с зернистыми широкими межкинетами, несущи-
ми мелкие гранулы — пигментосомы. Как и у стенто-
ров, цвет тела варьирует, преобладают синие и зеленые
виды. Зоохлорелл и зооксантелл нет. Мигранты узкие,
длинные, червеобразные с зачатком перистома, не-
большой апикальной зоной мембранелл; тело с густой
цилиатурой, ядро овальное. Дважды мигранты неопре-
деленных фолликулинид принимались за новые роды
цилиат (Micromidas, Heterostentor), эти роды невалид-
ные. Морфогенез у стенторов и фолликулин несхо-
ден — у первых перистом протера сохраняется, у вто-
рых реорганизуется и образуется заново. Изучено, од-
нако, деление лишь немногих видов подотряда. Ядро у
трофонтов 2 типов — овальное или цепочковидное, у
томитов всегда овальное; форма макронуклеуса учи-
тывается для дифференцировки родов фолликулинид.
Раковина прикреплена к субстрату клеевидной мас-
сой («коллетодерма»); в простой бутылковидной рако-
вине различают 3 отдела: камера (ампулла), атриум,
шейка, устье; у ряда форм раковина двойная — наруж-
ная экзотека и внутренняя эндотека, или имеется двой-
ное устье раковины. Поверхность у большинства ро-
дов камеры ровная; шейка часто с рельефом, например
со спиральными или кольцевыми ребрами. В атриуме
может располагаться замковый аппарат.
Питание фильтрацией. Паразитов среди фоллику-
лин нет, но комменсализм очень част. Специфические
комменсалы — роды Pachyfolliculina и Mirofolliculina
на древоточцах-лимнориях, Pebrilla на раках-отшель-
никах (пагуридах), Metafolliculina nordgardi на Rocine-
la (Isopoda). В нашем материале (не опубликовано) —
новые виды на лимнориях, амфиподах и крабах. Кроме
нескольких видов, почти все роды и виды морские,
обитают от литорали до больших глубин, заселяют лю-
бой прочный субстрат (камни, раковины моллюсков,
ветви гидроидов); фолликулиниды столь массовые в
зоне подводных курильщиков (hot vents), что служат
там пищей для крабоидов Munnopsis. Обзор пресно-
водных видов (см.: Янковский, 1998): в Северной Аме-
рике, Европе и северной части Азии — это Folliculina
boltoni (= Ascobius lentus?); в Южной Америке 4 вида,
включая эндемичный локальный род Botticula. Недав-
но в водоемах карстовой зоны Сербии открыт новый
пресноводный вид Lagotia dinaridica Primc-Habdija et
Matonickin, 2005; ранее в Сербии отмечался также вид
Diafolliculina hadzii Matjasic, 1962 на трубках пресно-
водных полихет.
Систематика группы в очень плохом состоянии, на-
копилось множество неверных определений, плохих
описаний и рисунков, и часто неизвестно, что видели
прежние авторы. Большое число видов не зарисовано в
живом сос тоянии (in vivo); точное строение раковины,
наличие и тип замкового аппарата, индивидуальная из-
менчивость ранними авторами не изучались, и статус
ряда видов неясен; всевозможные формы обозначались
одним названием Folliculina ampulla. Многие типовые
виды остались неизученными, более того, обычно тип
рода не обозначался при введении новых родов. В ка-
талоге родов цилиат Эрпы Аэшт (Aescht, 2001) многие
роды фолликулинид объявлены nomina nuda в связи с
отсутствием фиксированных типов, но Аэшт сама спо-
собствовала еще большей путанице, не зная литерату-
ры, ее каталог полон ошибок и ложной информации —
не была учтена статья Рипгелста (Ringuelet, 1953)
с обозначением типов для всех родов семейства.
Сем. Folliculinidae Dons, 1914
(рис. 280-282)
С диагнозом подотряда. С возрастанием числа ро-
дов они были сгруппированы в несколько подсемейств
или групп без латинских названий (Hadzi, 1951) — Fol-
liculininae (=Eufolliculininae), Lagotinae (=Semifolliculi-
ТИП CILIOPHORA. КЛАСС HETEROTRICHEA
437
Рис. 280. Folliculinidae.
bolloni (Л—Д); Eufolliculina uhligi (Е—И); Magnifolliculina binalata (K); Lagotia expansa (JI, M). (По: Mulisch, 1987 (Ж, 3); Mulisch, Patterson, 1983
(E, И); Uhlig, 1964 (K); Matthews, 1968 (Д M); А—Д — ориг.).
Fig. 280. Folliculinidae.
Рис. 281. Folliculinidae.
Lagotia expansa var. depressa (A); L. expansa (5); Ascobius sileni (В, Гу, «Folliculina ampulla» (Ascobius faure-fremieti) (Д). (По: Matthews, 1968 (A—Г); Fa-
ure-Fremiet, 1932b (Д)).
Fig. 281. Folliculinidae.
438
ALVEOLATA
Рис. 282. Folliculinidae.
Lagotia gigantea (A); Pebrillapaguri (E, B)-, Parq/blllculina vlolacaa (/); Pachyjblllculina gunnari (Д); Lagotia viridis (£); Folliculina boltoni (Ж)', Botticula ringue-
leti (3). Фолликулиниды на литорали у Сиднея (И—Т); Lagotia Intact (A/)i Parq/blliculina vlolacea (A); Lagotia obslelrica (Л); L. expansa (Л0; L. viridis (T); L. spi-
rorbis (H), L. faure-fremieti (0); Eufolliculina sp. (IT)', Melq/blllcullna ballerina (P)', I'ollicullnopsls annulata (C). (Ho: Matthews, 1968 (A—E); Dioni, 1972 (Ж, 3);
MulM et nl., 1986 (Й™7)),
Fig. 282. Folliculinidae.
Folliculinids on the littoral nt Sydney (И—Т),
ninae), Folliculinopsinae. Эта классификация пока
преждевременна, многие плохо изученные роды не на-
ходят место в системе. Поэтому^ список родов дается
ниже в алфавитном порядке. По Йовану Хаджи (Hadzi,
1951), можно различить следующие группы родов.
1. Раковина плавно переходит в шейку, без септы и
расширения шейки. Роды с цепочковидным ядром —
Stentofoliculina, Eufolliculina, Metafolliculina, Mirofolli-
culina, Platyfolliculina, Pachyfolliculina. Роды с овальным
ядром — Lagotia, Pedifolliculina, Folliculina, Ascobius.
2. Раковина без септы, с расширением шейки —
Pebrilla, Atriofolliculina, Latifolliculina, Donsia.
3. Раковина с септой, но без расширения шейки;
роды с цепочковидным ядром — Folliculinopsis, Am-
pullofolliculina, Tapetofolliculina', с простым ядром —
Claustrofolliculina, Halofolliculina, Perifolliculina, Pseu-
dofolliculina, Echinofolliculina, Diafolliculina.
4. Раковина с септой и с расширением шейки — Ра-
rafolliculina, Planifolliculina, Splitofolliculina, Epifolli-
culina, Aulofolliculina. Этот список включает роды, из-
вестные к 1951 г., позже добавлено 5 новых родов.
Род Alexandrina Hadzi, 1938
Типовой вид A. karagjorgjevici, подробно, мо-
нографически описанный вид, также A. moebiusi (Kahl,
1932). Поскольку тип рода обозначен не был (впервые
указан мной здесь), род невалиден. Хаджи вначале от-
рицал идентичность типового вида и Folliculinopsis an-
nulata, ио позже изменил мнение (Hadzi, 1951). По
этой причине род также неприемлем.
Род Ampullofolliculina Hadzi, 1951
Типовой вид по монотипии A. lageniformis (=Folli-
culina ampulla in Andrews, 1949). Ядро цепочковидное,
раковина с септой, но без расширения шейки выше
септы. Раковина бутылковидная с короткой гладкой
шейкой (без ребер и спирали), септа — фактически
устье внутренней раковины — в виде конуса с цент-
ральным отверстием, лопасти перистома короткие и
широкие, прикрепление коротким псевдостилом.
ТИП CILIOPHORA. КЛАСС HETEROTRICHEA
439
Род Angustofolliculina Silen, 1947
Типовой в ид A spirorbis. Род не признается по-
следующими авторами, тип рода сейчас в составе Lagotia.
Ампулла плавно переходит в узкую шейку без септы, на
шейке спиральное ребро с 4—5 оборотами, ядро оваль-
ное; по Маттесу (Matthews, 1958), имеется лишь одна ло-
пасть перистома и род может быть валидным, но Хаджи
рисует 2 лопасти, как у всех фолликулинид. У разных ав-
торов вид имеет разную длину и скульптуру шейки, ве-
роятно это сборный вид. Обитают на трубках и оперку-
люмах раковин полихет типа Spirorbis и на раковинах
двустворчатых моллюсков.
Род Ascobius Henneguy, 1884
Типовой вид Л. lentus по монотипии, вероятнее
всего идентичен с описанным ранее видом Folliculina
boltoni (Ascobius boltoni — перенос в этот род в работе
Янковского, 1998). Вид подробно переописан как
A. lentus в ФРГ (Mulisch et al., 1998) и в России по сбо-
рам в Байкале (Янковский, 1998). Пресноводный вид с
растений и любого прочного субстрата, в Байкале на
подошвах корковых губок вместе с разными видами
лорикат. Раковина короткая и широкая, с очень корот-
кой шейкой, приклеена широкой базальной пластин-
кой; нет септы, прикрепление зооида без сужения тела
(псевдостила), ядро овальное, лопасти перистома не-
крупные, неравной длины. Вероятно, это одна из наи-
более примитивных фолликулинид.
Для некоторых описаний этого вида в литературе
Хаджи выделяет новые виды A. claparedei и A. faure-
fremieti. Рингелет (Ringuelet, 1953) вводит в состав
рода также морской вид Folliculina simplex (Ascobius
simplex, A. s. var. irregularis), но у других авторов это вид
рода Semifolliculina. Этот последний вариант исклю-
чен, так как у типового вида S. gigantea длинная узкая
шейка со сложной скульптурой. Итак, 3 видовых на-
звания (A. lentus, F. boltoni, S. simplex) могут относиться
к одному эвригалинному виду; при их изучении следует
проверить толерантность к солености, возможность
адаптации к морской воде у пресноводных фолликулин.
Род Atriofolliculina Hadzi, 1951
Типовой вид по Аэшт, не обозначен, и род невалиден,
по тго ошибка, типовой вид рода обозначил Ринге-
лет - Folliculina hirundo Kent, 1882. Поэтому автор рода
меняется - Atriofolliculina Ringuelet, 1953 с видами
A. hirundo (Kent, 1881) Ringuelet, 1953; A. andrewsi (Hadzi,
1951) comb, n. ii A.faureana (Hadzi, 1951) comb. n. (=At-
riofolliculina in Hadzi, 1951). Сборный род, включает
формы с лежащей па субстрате и прямой раковиной,
что недопустимо, у перитрих-лорикат такие виды все-
гда относят к разным родам). Поэтому 2 вида перене-
сены в состав рода формально, а род включает здесь
только типовой вид. К сожалению, описание и рисунок
вида даны по литературе, вид не переописан заново.
Раковина зеленая, с 2 сужениями, без септы, без удли-
нения шейки, без скульптуры; ядро овальное, лопасти
необычайно длинные, достигают длины тела, прикреп-
ление ко дну раковины псевдостилом.
Род Aulofolliculina Hadzi, 1951
Типовой вид A. labyrinthica Hadzi, 1951; также
Aulofolliculina gjorgjevici Hadzi, 1938. Раковина очень
длинная, узкая, с четким делением на 3 отдела — ампу-
лу, атриум и шейку, разделенными устьем внутренней
раковины (эндотеки) со сложным рельефом; шейка ис-
черчена продольно, с наружной спиралью, резко вытяну-
тая. Зооид с овальным ядром, перистом живых несокра-
тимых форм не описан. Обитают в кормидиях мшанок
Retepora beaneana. По Хаджи, вид Parafolliculina mirabi-
lis in Faure-Fremiet, 1936 определен неверно, это A. laby-
rinthica.
Род Botticula Dioni, 1972
Типовой вид В. ringueleti по монотипии. Пре-
сноводный вид из перифитона р. Парана в Аргенти-
не. Раковина с широкой клеющей пластинкой, плавно
переходит в длинную узкую шейку, лишенную наруж-
ного рельефа; ампула с массивными стенками. Тро-
фонт в живом виде не изучен, строение перистома не-
известно; ядро цепочковидное; способ прикрепления
зооида к раковине не изучен. Повторно вид не был
найден.
Род Claustrofolliculina Hadzi, 1951
Типовой вид С. clausa. Раковина удлинен-
но-овальная с четким делением на 3 зоны; атриум не-
большой, с устьем внутренней раковины; ядро оваль-
ное; прикрепление коротким узким псевдостилом.
Шейка длинная, может достигать длины ампулы, с
продольной исчерченностью и спиральным ребром.
Лопасти перистома небольшие, неширокие. В принци-
пе строение раковины как у Aulofolliculina, отличия не-
большие — в форме внутреннего устья. Сходный
вид — С. pectinicola Ringuelet, 1953.
Род Diafolliculina Hadzi, 1951
Типовой в и д D. thomseni (- Folliculina boltoni in
Thomsen, 1921). По Аэшт, род невалиден, так как не
обозначен тип рода, первоначально включены 3 ви-
да — D. thomseni, D. rotunda Hadzi, 1951 и D. similis
Hadzi, 1951. Рингелет обозначил типовым видом —
D. thomseni, и поэтому должен считаться автором ро-
да — Diafolliculina Ringuelet, 1953 с видами D. thomse-
ni (Hadzi) Ringuelet, 1953; D. rotunda comb. n. и D. si-
milis comb. n. (ранее в составе Diafolliculina Hadzi,
1951).
Тип рода — это пресноводный вид из Уругвая, дру-
гие виды морские. Раковина очень простая, овальная, с
небольшой шейкой, с устьем эндотеки, без атриума,
замкового аппарата, рельефа шейки. Зооид с овальным
ядром, прикреплен ко дну раковины без псевдостила, с
относительно короткими и широкими лопастями пери-
стома. В сущности это типичная F. boltoni, но с устьем
эндотеки. Вид D. hadzii Matjasic, 1962 описан с тру-
бок пресноводных полихет в Югославии; зарисованы
2 пластинки у основания шейки.
440
ALVEOLATA
Род Donsia Hadzi, 1936
Типовой нид/->. mirabilis (= Semifolliculina mira-
bilis Dons, 1917), позже включавшийся в состав Lagotia
и Parqfolliculina. Раковина удлиненно-овальная, без
эндотеки и внутреннего устья, разделена сужениями на
атриум и шейку, без септы; зооид in vivo не изучен —
Хаджи работал с коллекциями и почти никогда не ри-
совал живых несократившихся фолликулинид. Веро-
ятно, лопасти перистома короткие и широкие. Ядро
овальное. Прикрепление коротким псевдостилом.
Род Echinofolliculina Dons, 1934
Типовой вид#, mortenseni по монотипии. Ампу-
ла раковины отделена от шейки небольшим атриумом,
шейка со спиральным ребром. Эндотека со сложным
устьем в виде кольца; развиты шипы — 3 вентраль-
ных, 1 широкий в центре и 2 мелких латеральных. Яд-
ро овальное, постерон оттянут (псевдостил). Вид очень
плохо изучен, рисунки Донса не дают точного пред-
ставления о строении раковины, не показана раковина
сбоку; последующие авторы не находили вид.
Род Epifolliculina Hadzi, 1951
Типовой вид Е. diaphana по монотипии. Рако-
вина стандартного типа (удлиненно-овальная камера,
суженная недлинная шейка без скульптуры), с атриу-
мом и устьем эндотеки; в зоне устья — небольшие
шипы, направленные внутрь от стенок раковины. Зоо-
ид с простым ядром, in vivo не изучен. Эпибионты на
кормидиях мшанок Retepora.
Род Eufolliculina Hadzi, 1951
Типовой в и д Е. ampullacea (=Folliculina ampulla
in Laackmann, 1910). По Аэшт, тип рода Folliculina то-
ebiusiKahi, 1932 (=F. ampulla in Moebius, 1885, partim)
впервые обозначен недавно (Mulisch, Patterson, 1983),
но родовое название она приписывает Хаджи вопреки
правилам номенклатурного кодекса и вопреки собст-
венной практике во всех других аналогичных случаях.
Это недопустимо. Типовой вид рода Е. ampullacea
Hadzi, 1951 впервые был обозначен Рингелетом и поэ-
тому он должен быть автором рода — Eufolliculina
Ringuelet, 1953, с видами Е. ampullacea (Hadzi) Ringue-
let, 1953 ис переносом всех остальных видов в состав
валидного рода — Е. laterimarginata (Hadzi, 1938);
Е. moebiusi (Kahl, 1932); Е. lignicola (Folliculinopsis lig-
nicola Faure-Fremiet, 1936); E. uhligi (Mulisch et Patter-
son, 1983) comb. nn. Вид E. uhligi культивируется в
ФРГ и сейчас это один из основных объектов для изу-
чения морфологии, морфогенеза, физиологии, ультра-
структуры и генного анализа фолликулинид.
Типовой вид рода, в итоге, не Е. moebiusi, а Е. am-
pullacea, к сожалению, худший выбор, поскольку на-
звание дано для очень примитивного описания с од-
ним мелким рисунком; не зная плана строения фолли-
кулинид, Лаакманн мог не заметить эндотеку или
септу. Формально род по признакам типового вида
должен включать формы с овальной камерой, широ-
кой шейкой такой же длины, без атриума и без эндоте-
ки; зооид с цепочкой ядер и коротким псевдостилом.
Шейка раковины Е. uhligi с наружным рельефом.
Род Filellum
Это валидный род гидроидов, не цилиат, но часть
эпибионтных фолликулинид на разных гидроидах при-
писывалась неспециалистами к этому роду — F. ex-
pansum Levinsen, 1893; F. gabrielae Vannucci, 1955,
ныне в составе рода Lagotia.
Род Folliculina Lamarck, 1816
Типовой в и д F. ampulla {-Vorticella ampulla Mul-
ler, 1756). У Мюллера примитивное описание с мелким
рисунком, и ранние авторы любой вид и род определя-
ли как F. ampulla', множество таких случаев разбирает-
ся в монографии Хаджи (Hadzi, 1951). При этом сам
вид в книге Хаджи не зарисован и не описан, текст
краткий. Вид, не описанный до сих пор, не может быть
типовым; вероятно, нужна петиция об обозначении
другого вида для сохранения старинного рода Follicu-
lina. Принято считать, что F. ampulla имеет неболь-
шую овальную раковину, короткую шейку без атриу-
ма, септы, эндотеки, без рельефа на шейке; зооид с
овальным ядром. Морской вид, вероятно непигменти-
рован, размеры и способ прикрепления зооида неизве-
стны. Хаджи считает валидным вид F. boltoni Kent,
1881, но он ничем не отличается от типа рода Ascobius
(A. lentus Henneguy, 1884) и был перенесен мной в со-
став Ascobius (A. boltoni = A. lentus). Хорошо описан
многими авторами вид F. simplex Dons, 1917, тоже
типа Ascobius-, нужно проверить толерантность вида
к пресной воде, если вид эвригалинный, тогда это си-
ноним вида F. boltoni. В итоге оптимальное решение
проблемы — объявление F. ampulla неопределимым
видом, ликвидация рода Ascobius с видом A. lentus и
петиция с обозначением нового типового вида Follicu-
lina boltoni.
Род Folliculinopsis Faure-Fremiet, 1935
По Аэшт, название невалидно, так как при установ-
лении рода не фиксирован типовой вид. Это верно, но
тип рода был позже обозначен Рингелетом (Ringuelet,
1953) в статье о фолликулинидах Антарктики, которую
Аэшт не знает и не цитирует—F. annulata. Но еще рань-
ше тип рода четко указал Хаджи в своей монографии
(Hadzi, 1951. Р. 137), что Аэшт не заметила. Поэтому ав-
тор рода меняется — Folliculinopsis Hadzi, 1951 с видами
F. annulata (Faure-Fremiet, 1936) Hadzi, 1951; F. ligni-
cola comb. n. (Folliculinopsis lignicola Faure-Fremiet, 1936),
F. mobiusi comb. n. (-Alexandrina mobiusi Hadzi, 1938).
Синоним типового вида — Alexandrina karagjorgje-
vici Hadzi, 1938. Раковина с мелкой камерой и очень
длинной шейкой, с эндотекой, без четкого атриума на
уровне устья эндотеки; шейка с поперечными кольца-
ТИП CILIOPHORA. КЛАСС HETEROTRICHEA
441
ми. Зооид с небольшим псевдостилом, длинными уз-
кими лопастями перистома, цепочкой ядер. Скульпту-
ра шейки отличается в описаниях разных авторов.
Род Freia Claparede et Lachmann, 1858
В книге этих авторов (Claparede et Lachmann, 1858)
3 вида — новые виды F. elegans, F. aculeata и старин-
ный вид F. ampulla Muller без указания типового вида
рода; род Folliculina при этом не упоминается. Кент
(Kent, 1881) обозначил типовым для Freia вид V. am-
pulla. Родовое название использовалось некоторое
время для разных фолликулин как Freia и Frey а, но к
концу XIX в. получило распространение предложен-
ное ранее название Folliculina.
Род Halofolllculina Hadzi, 1951
По Аэшт, род нсиалиден, так как нс указан типовой
вид — Хаджи включил 2 вида, II. elegans (С. et L.,
1858) и Н. annulata (Andrews, 1944), Аэшт не цитирует
статью Рингелета с указанием типового вида Freia ele-
gans', поэтому автор рода меняется — Halofolliculina
Ringuelet, 1953; типовой вид Н. elegans (С. et L., 1858)
Ringuelet, 1953, также Н. annulata comb. n. (=Parafolli-
culina annulata Andrews, 1944).
Тип рода подробно изучен; раковина овальная, с
короткой шейкой, без атриума, с эндотекой и устьем, с
коротким псевдостилом, ядро округлое.. Вид позже не-
правильно определяли, описывая фолликулин с раз-
ным типом раковины. Второй вид Н. annulata такого
же типа, с кольцом на стенке шейки. Вид Н. corallasia
Antonius, 1999 нужно перевести в состав рода Рингеле-
та, а не Хаджи как Halofolliculina corallasia comb. n.
Род Heterostentor Song et Wilbert, 2002
Типовой вид по монотипии Н. coeruleus из бентоса
в Субантарктике. Вид тщательно изучен, с применени-
ем импрегнации протарголом, считается гетеротрихой
неясного положения, близкой к Stentor. Это крупные
червеобразные особи с синим пигментом, овальным яд-
ром, большим числом продольных кинет и спиральной
зоной мембранелл на узкой вершине тела. По всем при-
знакам это, по моему мнению, мигранты неопределен-
ного вида и рода фолликулинид, не изучавшихся авто-
рами статьи в месте сбора Heterostentor (Song, Wilbert,
2002). Осмотренные мною пробы гидроидов из Антар-
ктики всегда покрыты множеством раковин фоллику-
линид, и мигрантов этих диморфных цилиат Сонг и
Вильберт по ошибке приняли за новый род гетеротрих.
Род Lagotia Strethill Wright, 1857
Типовой вид при первоописании не фиксирован,
но по правилам номенклатуры такие роды, предло-
женные до 1931 г., валидны. Род был предложен для
3 видов и долгое время не признавался (предпочитали
название Freia, предложенное почти одновременно).
Типовой вид указан Рингелетом (1953) как L. viridis
Strethill Wrigth, 1858 (Аэшт датирует 1857 г.). Раковина
простая, овальная, переходит в шейку без атриума, нет
септы, эндотеки, шейка короткая и широкая, со спи-
ральным опорным ребром. Зооид с небольшим псевдо-
стилом, ядро округлое; перистом с длинными узкими
лопастями. В каталог Хаджи включены виды: L. viridis,
L. lutea Faure-Fremiet, 1936; L.flava Silen, 1947; L. acu-
leata (C. etL., 1858); L. faure-fremieti Hadzi, 1951; L. ex-
pansa (Levinsen, 1893 = Filellum expansum) с несколь-
кими «формами» в зависимости от типа субстрата,
L. gigantea Dons, 1913; L. abyssorum Giard, 1883; L. similis
Dons, 1915; L. stylifer Strethill Wright, 1862; L. coerulea
Hadzi, 1951; L. obstetrica Strethill Wright, 1862 (один из
первоначально включенных видов), L. donsi Hadzi, 1951;
L. minima Hadzi, 1951; L. minor (Dons, 1948); L. spirorbis
Dons, 1912; род Lagotia оказывается наиболее крупным
родом фолликулинид. Подробно описан новый пресно-
водный вид рода из бентоса в карстовом районе Сербии
Lagotia dinaridica Primc-Habdija et Matonickin, 2005.
Род Latifolliculina Hadzi, 1951
Типовой вид! incolorea по монотипии (=Para-
folliculina amphora in Faure-Fremiet, 1936). Раковина
овальная, сплющена, отделена сжатием от атриума;
шейка очень короткая и широкая, без рельефа; нет сеп-
ты и эндотеки. Зооид прикреплен широким постеро-
ном без псевдостила, ядро округлое, лопасти широкие
неравной длины и формы — округлая и заостренная.
Строение зооида, как у Ascobius, раковина простая, и
фактически единственное различие родов — форма пе-
реднего конца раковины.
Род Magnifolliculina Uhlig, 1964
По Аэшт, род невалидный, так как нет указания ти-
пового вида. Улиг (Uhlig, 1964) предложил род для 3
очень тщательно изученных новых видов М. alata,
М. binalata, М. roestensis и отметил их сходство с един-
ственным видом рода Valletofolliculina (V. bicornis).
Раковина у фолликулинид гладкая, у нового рода с
продольными складками и тенденцией к образованию
шиповидных выростов на постероне. Зооиды с цепоч-
кой ядер, длинными лопастями перистома, небольшим
псевдостилом. Обозначать типовой вид для рода Mag-
nifolliculina не следует по двум причинам. Для этих ви-
дов пригодно название Valletofolliculina', кроме того, один
из включенных видов Parafolliculina roestensis Dons,
1931 является типовым для монотипического родаРе-
rifolliculina Hadzi, 1951, предложенного на 2 года рань-
ше рода Valletofolliculina. Поэтому род Magnifolliculi-
na ликвидируется, а виды М. alata (тип рода) и М. bina-
lata я отношу к Perifolliculina — Р. alata, Р. binalata
comb. nn.
Род Metafolliculina Dons, 1925
По Аэшт, типовой вид — М. nordgardi по моно-
типии, по Рингелету типовой вид рода Lagotia producta
Strethill Wright, 1859. В каталог Хаджи включены
442
ALVEOLATA
виды: M. andrewsi Hadzi, 1938; M. producta (Strethill
Wright, 1859); M. longicollis Hadzi, 1938; M. elongata
Das, 1949; M. nordgardi Dons, 1924; недавно описан
вид M. ballerina Mulisch et al., 1986. Виды M. gunneri
и M. limnoriae включены в состав рода по ошибке
(Small, Lynn, 1985), это типовые виды других валид-
ных родов Pachyfolliculina и Mirofolliculina.
Род сборный, не должен существовать в таком сос-
таве. У типового вида М. nordgardi зооид не описан,
раковина прямостоящая, в виде трубки, шейка и каме-
ра примерно равны по длине, шейка с кольцами; нет
септы, эндотеки, атриума. М. ballerina описана при-
жизненно —г зооид тонкий, очень вытянут, с длинным
псевдостилом, цепочкой ядер, длинными узкими лопа-
стями перистома. Судя по кольцевому рельефу, камера
мелкая, шейка в несколько раз длиннее; раковина пря-
мостоящая. У остальных видов раковина лежит на суб-
страте, и это исключает их из состава рода. Типовой
вид рода — комменсал на изоподах Rocinela dammoni-
ensis в Норвегии, остальные виды свободноживущие.
Род Micromidas Delphy, 1938
Типовой вид М. hians по монотипии. Вид най-
ден в море во Франции, принят за простомат — спати-
диид, но отмечена сократимость особей, как у стен-
торов; апекс с неглубокой широкой воронкой; ядро
овальное. Это вероятнее всего неопределимый мигрант
фолликулинид.
Род Mirofolliculina Dons, 1927
Типовой в и д М. limnoriae (-Freya limnoriae Gi-
ard, 1883). Крупные яркоокрашенные сине-зеленые ра-
ковины расположены на дорсальной стороне посте-
рона (над пластинчатыми жабрами и плеоподами) и
прилегающих сегментах изопод-древоточцев разных
видов рода Limnoria в морях северного полушария,
специфичны для рода хозяев; этого вида нет на древо-
точцах Phycolimnoria из водорослей. Камера с необыч-
ными для фолликулин волнистыми краями, даже на
ровном субстрате — это родовой признак. Шейка ко-
роче камеры, плавно сужается к устью, без атриума,
септы, эндотеки, рельефа. Зооиды также с волнистыми
краями, ядро цепочковидное, лопасти длинные и уз-
кие, пигментация яркая, как у раковины. Обычны в мо-
рях России; морфология особей из наших северных и
дальневосточных морей идентичная.
Род Orthofolliculina Jankowski gen. n.
Типовой вид О. violacea (= Folliculina violacea
Giard, 1888). Ранее вид включался в состав Parafollicu-
lina, с типом Р. amphora. Последний вид имеет лежа-
щую на субстрате раковину, у Р. violacea раковина
прямостоящая и различие этих форм такое же, как у
лорикат Platycola и Cothurnia. По методу «аналогич-
ных решений» для аберрантной Р. violacea предлагает-
ся новый род. Раковина вытянутая вертикально, пря-
мая, сине-зеленая или коричневая, с четким делением
на камеру, атриум и шейку разной длины; имеется эн-
дотека с внутренним устьем, прикрепление раковины
широкой базальной пластинкой. Зооид с псевдости-
лом, округлым ядром; лопасти узкие и очень длинные.
Обычный перифитонный вид в море, хорошо изучен
многими авторами.
Род Pachyfolliculina Hadzi, 1951
Типовой в и д Р. gunneri по монотипии (=Follicu-
lina gunneri Dons, 1927). Как и Mirofolliculina, специ-
фичный комменсал изопод-древоточцев Limnoria,
столь же широко распространен; на хозяине занимает
другой локус — только на середине вентральной сто-
роны, на сомитах. Раковина крупная, широкая, тем-
но-коричневая, простая, переходит в короткую широ-
кую шейку без рельефа, септы, атриума, эндотеки.
Зооид с узким псевдостилом, цепочкой ядер, длин-
ными широкими лопастями перистома. Этот вид (в со-
ставе рода Folliculinopsis) указывали также для панци-
ря крабов Carcinus maenas, аномур Porcellanaplatyche-
les, отмечали на стенках галерей в источенной
лимнориями древесине; эти указания нуждаются в
проверке. На крабах и пагуридах я находил другие
виды фолликулинид с простой раковиной, прилегаю-
щей к субстрату.
Род Parafolliculina Dons, 1913
По Аэшт, род валиден, но типовой вид никем не
обозначен. Это ошибка, в литературе дважды указан
вид Р. amphora как типовой. В книге Хаджи (Hadzi,
1951. Р. 172) указано «Gattung Parafolliculina Dons
1913 mit der Art P. amphora Dons, 1913 als Typus», да-
лее дан подробный диагноз рода и описание видов.
Рингелет (Ringuclet, 1953) вторично указал тип рода
Р. amphora и дал диагноз рода. Вид имеет широкую
овальную раковину, овальную переднюю камеру; зад-
няя камера как бы вдается в глубь передней и имеет
простое поперечное внутреннее устье; нет рельефа ра-
ковины и, собственно, нет шейки. Зооид с узким фик-
саторным постероном, округлым ядром; лопасти пери-
стома широкие, относительно короткие. Обычный вид
в море, отмечен и изучен многими авторами. У Хаджи
описано в составе рода 6 валидных видов — Р. ampho-
ra Dons, 1913; Р. glutinata Hadzi, 1951; Р. americana
Hadzi, 1951; P. tristanensis Dons, 1948; P. labiata Dons,
1942; P. violacea (Giard, 1888).
Род Pebrilla Giard, 1888
Типовой вид P. paguri, специфический ком-
менсал на панцире раков-отшельников (пагурид) в Ев-
ропе, США, в Азии — на Pagurus, Eupagurus и других
родах, неизвестны на крабоидах, тоже относящихся
к Anomura. Раковина с характерным экваториальным
сужением в виде глубокого поперечного желобка, нет
усложнения устья и шейки (замкового аппарата); яд-
ро цепочковидное; лопасти перистома очень узкие
и длинные. Особо заселены нелиняющие особи хозяев,
ТИП CILIOPHORA. КЛАСС HETEROTRICHEA
443
зараженные изоподами или саккулиной. Форе-Фремье
(Faur£-Fremiet, 1936) считал пебрилл подродом в
составе Folliculinopsis (предложенного позже), но это
невозможно по номенклатурным правилам и непри-
емлемо для форм с совершенно разным типом рако-
вины.
Род Pedifolliculina Hadzi, 1951
По Аэшт, типовой вид Pseudofolliculina arctica
Dons, 1915 по монотипии; это ненужное название для
валидного рода Pseudofolliculina, уходящее в синони-
мику. Рингелет указывает тот же тип для другого рода
Pedifolliculina, а для Pseudofolliculina типовым выбран
вид Р. melitta Laackmann, 1910. Подробнее это разби-
рается ниже (см. Pseudofolliculina). Вопреки мнению
Рингелета, род Pedifolliculina невалидный.
Род Perifolliculina Hadzi, 1951
Типовой вид Parafolliculina roestensis Dons,
1931 по монотипии; синоним — Magnifolliculina Uhlig,
1964. Раковина лежит на субстрате, не прямостоящая,
сложной формы, с продольными ребрами, утолщения-
ми стенки, в частности в зоне устья; нет атриума в ко-
роткой шейке; ядро округлое.
Род Planifolliculina Hadzi, 1951
Типовой в и д Р. cumbens по монотипии; ракови-
на удлиненно-овальная, с резко обособленной неболь-
шой вздутой камерой (Vorhof), в которую вдается одна
базальная лопасть дна раковины; замкового аппарата
пот; ядро простое, округлое.
Род Platyfolliculina Hadzi, 1938
Типовой вид Р. sahrhageana Hadzi, 1938 по мо-
нотипии (это название предложено Хаджи для Folli-
culina ampulla in Sahrhage, 1917). Раковина простая,
опальная, без ребер, замкового аппарата и других
усложнений; неширокая слегка вытянутая шейка без
вздутия; ядро цепочковидное. Зооид прикреплен ши-
роким основанием ко дну раковины.
Род Prlsoofolliculina Deflandre et Deunff,
1957
T и п о и о й а и Д /', pulehra-, по Корлиссу, это сино-
ним, по Аэшт > валидный род. Ископаемые таксоны
цилиат в данной главе не рассматриваются.
Род Pseudofolliculina Dons, 1915
См. выше вероятный синоним — род Pedifolliculina
Hadzi, 1951. По Аэшт, типовой вид Р. arctica Dons,
1914 по монотипии; по Хаджи и Рипгелету, тип рода
Folliculina melitta Laackmann, 1910. Путаница объяс-
нима тем, что Доне вначале определил свой норвеж-
ский вид как антарктический вид Р. melitta, а позже
признал свой вид новым — Р. arctica. Поэтому нельзя
считать типовым вид Лаакманна из Антарктики, тип
рода не Р. melitta, а Р. melitta sensu Dons, 1913. Рако-
вина котурнидная (прямостоящая), равномерной ши-
рины, без резкого сужения шейки, без камеры и зам-
ковых элементов, прикреплена широким массивным
стебельком, дно камеры далеко удалено от субстрата.
Поверхность раковины с 3 ' спиральными ребрами,
удаленными одно от другого. Ядро округлое. Вид
из Антарктики Р. melitta сходен с Р. arctica, но имеет
базодиск и отличается пропорциями отделов рако-
вины.
Спор о типовом виде можно решить, сведя вид
Донса в синонимы беломорской Cothurnia grandis
Mereschkowsky, 1878 (Pseudofolliculina grandis comb, n.) —
зооид Мережковским не показан, но раковина как у
вида Донса. Это частый вид на гидроидах в Белом и
Баренцевом морях, идентичный с Р. arctica.
Род Pseudoparafolliculina Andrews
et Nelson, 1942
Типовой в ид P. portitor A. et N., 1942. Раковина
котурнидная, не прилегает к субстрату, вытянутая,
утолщена в зоне сужения шейки и имеет внутреннюю
камеру; зооид проходит через ее апикальное сужение
при расправлении перистома; ядро цепочковидное.
Вид описан в краткой заметке с икряных капсул тур-
беллярий Bdelloura, паразитирующих на мечехвостах
Limulus. В письме к Хаджи, готовящего монографию
фолликулинид, авторы попросили заменить название
рода на Tapetofolliculina A. et N., 1950; это название и
год приняты в каталогах Хаджи и Рингелета, но от-
вергнуты в каталоге Аэшт.
Род Semifolliculina Dons, 1914
Типовой вид S', gigantea Dons, 1914 (обычно да-
тируется 1913 г.). В каталоге Аэшт этот род невалиден;
виды семифолликулин относят к Donsia, Ascobius и к
Lagotia. Тип рода — вид с небольшой овальной рако-
виной и непропорционально длинной шейкой, в 2—
3 раза длиннее тела; имеется 2—3 продольно исчер-
ченных устья, между ними и раковиной проходит
спиральная складка; ядро округлое. Этот вид сейчас
упоминают как Lagotia gigantea. Сине-зеленые, интен-
сивно окрашенные раковины встречаются в обраста-
ниях на двустворках.
Род Splitofolliculina Hadzi, 1951
По Аэшт, род невалиден ввиду отсутствия фикса-
ции типового вида. Это ошибка, Аэшт не знала о такой
фиксации в статье Рингелета — S. adherens Hadzi,
1951; поэтому род меняет автора — Splitofolliculina
Ringuelet, 1953; второй вид S', longicollis (Hadzi, 1951)
comb. n. Раковина овальная, с невысокой узкой шей-
444
ALVEOLATA
кой без рельефа; имеется четкий двойной атриум, фак-
тически вторая внутренняя раковина, открывающаяся
узким плоским устьем в атриум; при виде сверху за-
метна пластинка в атриуме; ядро округлое. Как и боль-
шинство видов фолликулинид, тип рода прижизненно
не изучен, Хаджи работал только с фиксированным
коллекционным материалом.
Род Stentofolliculina Hadzi, 1938
Типовой вид S. tubicola Hadzi, 1938 —.очень
плохо изученный вид, найдена лишь одна особь на
мшанке Retepora с цепочковидным ядром, с котурнид-
ной (прямостоящей) раковиной равномерной ширины,
без четкой шейки, без рельефа и атриума; дно ракови-
ны утолщено, массивное. В названии рода отражено
мнение Хаджи о близости рода к Stentor ввиду наличия
трубчатой мягкой раковины, покрытой мелким детри-
том, как у части пресноводных стенторов. Хотя со вре-
менем нашли и изучили большинство видов Хаджи,
тип рода не был вторично никем не отмечен и род Sten-
tofolliculina пока сомнительный. Возможно, S. tubicola
идентична со старинным видом гетеротрих Stentor bar-
retti из Темзы, но этот вид хорошо изучен и валидный,
a S. tubicola неопределимая.
Род Tapetofolliculina Andrews et Nelson
in Hadzi, 1951
Типовой вид Pseudoparafolliculinaportitor And-
rews et Nelson, 1942 по монотипии. Первоначальное
название рода авторам не понравилось, и в письме к
Хаджи они попросили заменить его другим, что недо-
пустимо. Строение типового вида см. выше (род Pseu-
doparafolliculina).
Род Valletofolliculina Andrews, 1953
Типовой вид К. bicomis по монотипии. Ракови-
на вытянутая, с короткой широкой шейкой и широким
карнизом устья; нет замковых пластинок и атриума;
вдоль верхней части раковины (дорсально) идут два
краевых ребра, сходящихся спереди и сзади; сзади они
особо утолщены и посылают вбок два тупых шипа.
Предлагая новый род Magnifolliculina, Улиг (Uhlig, 1964)
не считает его идентичным с Valletofolliculina, так как
у нового рода нет вздутий с боковыми шипами.
Род Улита имеет внутреннюю раковину, которая, ве-
роятно, не была замечена у Valletofolliculina, ее можно
с трудом видеть у подобных форм при виде раковины
сбоку. Итак, если роды валидные, они несомненно
очень близкие и отличаются деталями скульптуры вер-
хней стенки раковины, несущей глубокие продольные
складки.
Новый род «Вермифолликулина» будет описан ав-
тором с тельсона изопод-древоточце в лимнорий Ба-
ренцева моря; раковина простая, коричневая, извитая,
с длинной шейкой без атриума и скульптуры; ядро
цепочковидное. На лимнориях обычны другие фолли-
кулины — коричневая Рachyfolliculina gunneri на абдо-
мене и сине-зеленая Mirofolliculina limnoriae на тель-
соне и прилегающих сегментах.
Большинство фолликулинид имеет раковину типа
перитрихи Platycola, прикленную к субстрату; прямо-
стоящие раковины (типа Thuricola или Cothurnia) — у
типовых видов родов Pedifolliculina, Atriofolliculina,
Pseudofolliculina, Metafolliculina, Pseudoparafolliculina
(=Tapetofolliculina), Stentofolliculina, Orthofolliculina',
сохранение видов с обоими типами раковины в пре-
делах одного рода (как у Parafolliculina) недопусти-
мо. Хорошие цветные любительские снимки ярко-
окрашенных живых фолликулинид можно найти в Ин-
тернете.
Отряд Peritromida Jankowski, 1978
Тело овальное, плоское вентрально, вздутое дор-
сально; вся вентральная сторона с продольными со-
макинетами, дорсальная почти лишена ресничек. Та-
кая редукция нетипична для гетеротрих, поэтому сем.
Peritromidae заслуживает более высокого ранга. Пери-
стом узкий, краевой, полоса мембранелл удлинена
и огибает весь антерон, мембрана небольшая. Ядра —
2 и более с ферул.
Сем. Peritromidae Stein, 1867 (рис. 279)
С диагнозом отряда. Один род в морском бентосе.
Единственное семейство отряда (Peritromidae) не
соответствует диагнозам гипотрих и гетеротрих, к ко-
торым их всегда приписывали; в первом издании Gui-
de (Small, Lynn, 1985) семейство приведено как таксон
неопределенного положения (incertae sedis) после
отряда гипотрих. В новой системе Линна (Lynn, 2002)
это одно из семейств гетеротрих. Традиционно так-
сон включался в состав гипотрих; Каль (Kahl, 1932)
впервые перенес перитромид в состав гетеротрих,
но важные отличия не позволяют отнести их к обоим
отрядам. В системе Янковского (1980) в классе Spi-
rotricha предложен новый отряд Peritromida, краткий
диагноз которого дан ранее в тезисах (Янковский,
1978).
Относительно крупные формы; вентральная сторо-
на тела плоская, дорсальная с периферической плос-
кой каймой и сильным вздутием (дорсальный горб).
Особи сократимые, при раздражении сворачиваются в
трубку или сжимаются. Вся вентральная сторона по-
крыта ресничками в продольных рядах, обычно гус-
тых, тесно сближенных; в основании ресничек дисо-
мы. Дорсальная сторона считалась бсзресничной или с
шипами по краям горбовидного вздутия; импрегнация
протарголом в недавнее время выявила 2 кинеты,
окаймляющие вздутый участок (трофосому); ряды не-
равной длины, короткие шиповидные реснички (ще-
тинки) отходят от базальных групп аргиросом, вероят-
но от дисом в небольших ямках. Все вентральные
кинеты заканчиваются у полосы мембранелл, располо-
женной поперек тела вдоль дуги антерона. Основания
мембранелл у перитромид — равные по длине кинеты,
у гипотрих и гетеротрих кинеты в основании нерав-
ные. Инфундибулюм небольшой, с несколькими мемб-
ТИП CILIOPHORA. КЛАСС HETEROTRICHEA
445
ранеллами, окаймлен короткой ундулирующей мемб-
раной (далее сокращенно УМ). Ядра фрагментирова-
ны, обычно имеется 2 овальных ядра, у одного вида 4,
при каждом 1 или 2 микронуклеуса. Наличие 2 ядер —
типичная картина для многих гипотрих, свидетельство
родства групп, но у перитромид пока не выявлены
полосы реорганизации хроматина, проходящие через
ядра гипотрих — важный филогенетический маркер.
Питание всеядное (бактерии, водоросли). Обычные
формы в бентосе солоноватых и морских вод, нет
в пресных водах.
Род Peritromus Stein, 1863
Типовой в и д Р. еттае по монотипии; род часто
датируется 1867 г., поскольку в 1863 г. название вида
не было напечатано; в Guide (Small, Lynn, 1985) по
ошибке — Peritromus Kahl, 1932. Небольшая группа
видов в илу и детрите на дне лагун и на морской лито-
рали, на крупных водорослях, в плотных сгустках мел-
ких водорослей; не встречаются в бескислородной
зоне. Строение однотипное, род не делится на подро-
ды, нетипичен лишь вид Р. tetramacronucleatus с 4 яд-
рами.
Р. arenicolus Dragesco, 1965 (Р. еттае var. arenico-
lus D., 1963). Тело очень широкое, дорсум равномерно
выпуклый, 18 кинет, крупные микронуклеусы, слой
мукуса с бактериями на пелликуле дорсально, ядра с
кариосомами (плотным ярко красящимся центром),
что нетипично для гипотрих. Дорсальные щетинки от-
ходят от мелких бугорков.
Р. californicus Kirby, 1934. Размеры тела 89—
158 мкм, 16—19 кинет, 2—5 микронуклеусов, четкие
продольные ребра вентрально вдоль кинет, нет вакуо-
ли, небольшой горб с редкими щетинками, по всей
кайме тела равномерно расположены короткие проч-
ные щетинки, не замеченные другими авторами и не-
давно выявленные протарголом у P.faurei.
Р. ciliatus comb. n. (Kerona ciliata Gourret et Roeser,
1888). Плохо изученный вид обычного типа, в диагно-
зе вида лишь родовые признаки. Это синоним вида
Р. faurei или Р. еттае.
Р. еттае Stein, 1863. Типовой вид рода, пока мало-
изученный. Размеры 70—100 мкм, 2 макронуклеуса,
относительно узкий и высокий горб, около 30 кинет,
удлиненная полоса мембранелл, нетипично длинная
мембрана от рта до вершины тела.
/*. ettiystoimis Vacelet, 1961. Размеры особи до
150 МКМ, перистом очень длинный, горб небольшой, с
неровными кппнми, кинетом не изучен.
Р. faiii't'l к., 1932 (=Р. еттае in Faure-Fremiet,
1924). Размеры тела 67—150 мкм, осевой горб с длин-
ными шипами пп бугорках, около 25—30 кинет, из них
16 -17 биполярных, 3 4 фрагмента выше рта, 6—8
ниже рта. Короткая мембрана, длинная полоса мембра-
нелл; впервые выявлены сократимые фибриллы вдоль
ребер вентральной стороны. Импрегнация серебром
выявила 26—30 кинет у крупной расы (75—176 мкм);
на горбе много мелких выступов сложной формы и 2
ряда щетинок. Точная картина кинетома получена при
импрегнации протарголом (Song, Wilbert, 1997b); вы-
явлены 2 дорсальных ряда щетинок, кинеты вента про-
стой топографии, специализированные краевые кине-
ты и ряд щетинок, параллельный полосе мембранелл у
апекса.
Р. gigas Faure-Fremiet, 1924. Размеры тела 270 мкм,
необычайно длинный извитой перистом, нет шипов по
краям горба, есть мелкие краевые шипики вдоль кай-
мы тела вне перистома; вид найден в пробах морского
планктона.
Р. hydrarum Chardez, 1983. Имеет 2 ядра, в осталь-
ном нетипичен для данного рода. Симбионты пресно-
водных гидр Бельгии. По Бергеру (Berger, 1999), это
плохое описание вида гипотрих с гидр Kerona pedicu-
lus, обычного симбионта, отмеченного на гидрах в Ев-
ропе, США и Японии.
Р. kahli Villeneuve-Brachon, 1940. Размеры тела 120—
150 мкм, очень густые кинеты (число не указано, на
рисунке около 40), полоса мембранелл уходит далеко
вправо, в основаниях мембранелл дикинеты (резкое
отличие от других спиротрих), относительно длинная
мембрана, дорсальные папиллы, эктоплазма с трихита-
ми. Хотя применена импрегнация серебром, не показа-
ны краевые, дорсальные кинеты и апикальный дуго-
видный ряд щетинок.
Р. lucidus comb. n. (Spirostomina lucida Gruber,
1884 — типовой вид рода Spirostomina Gruber, 1884).
По всем авторам, это спиротриха типа Peritromus, с 2
ядрами, сплошным вентральным кинетомом, вид
очень мелкий (60 мкм). Продольное положение пери-
стома, закрученность в обратную сторону (зеркально)
нетипичны для перитромид, и пока вид включен в со-
став рода Peritromus условно. Это может быть карио-
реликтида Cryptopharynx.
Р. minimus Vacelet, 1961. Размеры 65 мкм, с едва
заметным горбом, относительно небольшим перисто-
мом, округлым контуром тела; кинетом и ротовой ап-
парат не изучены.
Р. minor Ozaki et Yagiu, 1941. Эти авторы описали
2 новых вида рода и переописали 2 известных вида без
импрегнации, но с большой точностью. Размеры Р. mi-
nor 65—70 мкм, тело вытянутое (следовательно, это не
синоним вида Р. minimus), с обширным дорсальным
горбом, выступ которого достигает постерона, на вей-
те 20 разрозненных кинет, вдоль всей каймы тела у
всех 4 изученных видов показаны короткие прямые
реснички или щетинки, кроме апекса, где щетинок нет
вдоль всей дуги перистома.
Р. montanus К., 1928 (Р. еттае var. montanus in
Kahl, 1928). По данным японских авторов (Ozaki,
Yagiu, 1941), поднявших ранг таксона до вида, это
крупные формы (70—100 мкм) со звездчатым конту-
ром горба, большим числом кинет (около 25), крупны-
ми ядрами, длинным перистомом с большим числом
мембранелл; при сокращении особи скручиваются
вентом внутрь, растягивая свой узорный дорсальный
горб.
Р. ovalis ’ Faure-Fremiet, 1924. Размеры около
70 мкм, дорсальный горб с ровным контуром, круп-
ный, тело несократимое, со светлой плоской каймой,
ядра и кинетом не изучены, перистом нетипично длин-
ный, до нижней четверти тела; вид найден в морском
планктоне.
Р. sandinae Tucolesco, 1962. Тело крупное, широ-
кое, перистом обычного типа, вент с четкими продоль-
446
ALVEOLATA
ними ребрами вдоль кинет, горб узорчатый, разветв-
ленный, сложной формы, по краям тела разрозненные
щетинки, направленные вверх.
Р. xieburthl Small et Lynn, 1985. Дан рисунок поч-
ти без описания вида; не показан дорсум и горб,
вид отличается субэкваториальным положением и
формой цитостома; на рисунке 17 кинет с дисомами
по всей длине рядов, в основании мембранелл дики-
псты.
Р. tetramacronucleatus Ozaki et Yagiu, 1941. Раз-
меры 130—150 мкм, узкое вытянутое тело, 4 макро-
и 6 микронуклеусов, вакуоль в нетипичном положе-
нии (у постерона), горб с ровным контуром, перистом
с большим числом узких мембранелл, огибает всю
переднюю треть тела, вент с 26 изогнутыми кине-
тами.
Р. tortugensis Bullington, 1940. Размеры 70—
147 мкм, тело очень широкое, шляпообразное при
виде сбоку, края горба с зубцами, по периферии тела
сплошные мелкие реснички и разреженные длинные
щетинки, полоса мембранелл уходит далеко вправо,
имеется 2 вакуоли.
На примере видов Peritromus видно, что примене-
ние методов серебрения не гарантирует точного описа-
ния вида цилиат — рисунки видов, импрегнированных
серебром и протарголом, не показывают ряда очень
важных признаков, выявленных у P.faurei Сонгом и
Вильбертом (Song, Wilbert, 1997b).
Подтип Intramacronucleata Lynn, 1996
У трахелоцерцид и близких кариореликтид макронуклеусы не
делятся, и эта самая примитивная группа включается в первый под-
тип; у родственного отряда гетеротрих ядро делится с помощью эк-
страядерных микрофибрилл, что является примитивной формой
митоза. Все следующие группы цилиат, начиная с протокруциид,
факодиниид и гипотрих, при делении используют только внутри-
ядерные микрофибриллы, поэтому их можно отделить, по Линну,
от низших цилиат на уровне подтипа.
Класс Spirotrichea Butschli, 1889
Методы молекулярной филогенетики, сравнение стоматогене-
за и данные по ультраструктуре кинетид и связанных с ними фиб-
рилл заставили изменить традиционный состав спиротрих — гете-
ротрихи исключены, относимые ранее к спиротрихам метопиды и
никтотерусы также исключены, но ушли в другой класс; в состав
спиротрих вошла мелкая группа неясного положения (протокруци-
иды) и после проверки остались не привлекавшие внимание обита-
тели мхов «псевдогетеротрихи» группы Phacodinium. Эуплотиды
отделились от основного массива гипотрих, но остались в составе
Spirotrichea. Роды с резкими различиями морфологии объединяет в
один класс прежде всего ультраструктура кинетид и их дериватов
(Lynn, 1991, 2003).
Подкласс Protocruziidia Puytorac, Grain et Mignot, 1984
Мелкие каплевидные формы; кинеты продольные, немного-
численные, простой топографии, с дисомами по всей длине; пери-
стом с дикинетой в основании мембраны и с вертикальным рядом
поперечных мембранелл, не сдвинутых налево, как у гетеротрих и
гипотрих; нет безресничной зоны (ацилона) между мембранеллами
и основанием мембраны. Стоматогенез с участием послеротовой
сомакинеты и основания мембраны. Ядра необычные — агрегация
мелких сферул, в центре которой расположен микронуклеус; каж-
дая долька макронуклеуса делится синхронно и независимо, при-
нимает вид хромосом.
Отряд Protocruziida Jankowski, 1980
Авторство таксона требует обсуждения; в литера-
туре разные варианты. Данный таксон указан как Pro-
tocruziida Puytorac et al., 1984 (Puytorac et al., 1987) и
как Protocruziida Jankowski in Small et Lynn, 1985 (Puy-
torac, 1994; Lynn, Small, 2002; Lynn, 2002), но это невоз-
можно по правилу приоритета. В действительности от-
ряд предложен Янковским (1980) в статье по системе ци-
лиат, которую обычно не цитируют — в приложении
(Отряды неясного положения в системе. С. 117) дан сле-
дующий диагноз: «Отряд Protocruziida ordon. Мелкие
каплевидные формы из морского детрита, с редукцией
кинетома на одной из сторон тела, комплексным ядром
(по Аммерманну); вестибулюм латеральный, узкий, с
рядом ресничек и циррусов. Пока не изучена ульт-
раструктура кортекса, нет смысла гадать о родствен-
ных связях таксона; это могут быть видоизмененные
филастерины, гетеротрихи или амфилептиды. Ти-
повой род Protocruzia». Филогения и положение от-
ряда неясны и сейчас, филограммы у разных авторов
не совпадают, «соседями» считают самые разные так-
соны.
Сем. Protocruziidae Jankowski, 1980
(рис. 283)
Вновь, как и в случае с отрядом, в литературе дез-
информация — указывается Protocruziidae Jankowski in
Small et Lynn, 1985; в действительности описание се-
мейства предложено в той же статье, с. 120: «Семейст-
во Protocruziidae fam. п., типовой род Protocruzia, с ре-
дукцией кинетома на одной из сторон тела, нетипич-
ным для цилиат набором ядер и аберрантным
перистомом — щель с рядами щетинок и циррусов».
Итак, авторство семейства и отряда корректировано,
но автором подкласса является Пюйторак. В составе
семейства лишь один род, поэтому более подробное
описание морфологии дается ниже в справке о роде
Protocruzia.
Род Protocruzia Faria, Da Cunha et Pinto,
1922
Типовой вид Colpoda pigerrima Cohn, 1866 no
монотипии; частое в литературе название Protocrucia
неправильно, род назван именем протозоолога Осваль-
ТИП CILIOPHORA. КЛАСС SPIROTRICHEA
447
Рис. 283. Protocruziida.
Protocruzia depressa forma monomicronucleata (A, B): P. contrax (B—Ж); P. tuzeti (3—Л). (По: Ammermann, 1968 (A, By, Song, Wilbert, 1997a (5—ACy, Groliere et
al., 1980a (3—Л)).
Fig. 283. Protocruziida.
да Круза (Oswaldo Cruz); иногда также ошибочно упо-
минается как Protocrucia Da Cunha, 1915. Род включа-
ет несколько мелких (до 60 мкм) морских видов; не-
сколько видов плохо описаны и не могут быть валид-
ными, неопределимые; хорошо изучены только
Р. depressa и Р. tuzeti. Похоже, что никто не хочет
определять свой вид как Р. pigerrima, и тип рода на-
всегда останется неизученным. По диагнозу у Каля
(Kahl, 1935), размеры 30—50 мкм; тело узкое, вере-
теновидное, сплющено дорсовентрально, перистом с
крупными, выдающимися вбок «ресничками» до трети
длины тела, ядро округлое, центральное, реснички ко-
роткие и густые. Род у Каля — в составе отряда Tricho-
somata неясного положения (incertae sedis). Вид ранее
был перенесен в состав рода Blepharostoma, но это
ошибка. Собственно, новый род был предложен не для
вида Конна, а для изученной формы из Бразилии, опре-
деленной как С. pigerrima. Размеры тела 21 X 11 мкм;
на рисунке вид сбоку, перистом на 2/5 длины тела; все-
го 6 разрозненных кинет при виде справа. Для других
видов указан размер 50—60 мкм, и это единственная
«разница», давшая право игнорировать типовой вид.
В моих культурах протокруций из Черного моря на-
блюдалась значительная вариация размеров в зависи-
мости от питания, фазы роста, возраста культуры.
Так же плохо описаны и типовые виды 2 родов циа-
лиат, несомненно идентичных с Protocruzia — Diplog-
mus Mansfeld, 1923 (типовой вид D. contrax) viPropygo-
cirrus Mansfeld, 1923 (типовой вид P. adhaerens)-, в ка-
талоге Аэшт они числятся как валидные; оба рода
считались Калем синонимами Protocruzia, но восста-
новлены Корлиссом (Corliss, 1979) в списке родов ци-
лиат, без изучения видов. Первый вид никем не при-
знан, название второго иногда использовалось, но и от
него отказались; виды неопределимые и роды нева-
лидные.
448
ALVEOLATA
Cryptochilum fusiforme Gourret et Roeser, 1888, из
моря у о-ва Корсика зарисован лучше, показано поло-
жение ядра и вакуоли, сплющенность тела, характер-
ное заострение отклоненного влево апекса; размеры не
указаны; вид сводится Калем в синонимы Р. pigerrima.
Protocruzia halophila Ruinen, 1944. По всем призна-
кам не имеет ничего общего с данным родом; у типич-
ных Protocruzia форма тела каплевидная, как у тетра-
химен, а вид Руйнена сужается кзади.
Р. granulosa К., 1933. Тело червеобразное, нети-
пично длинное (120—180 мкм, при сокращении 70—
90 мкм), перистом у вершины тела сбоку, очень мел-
кий для такого вида; одно ядро в центре тела, продоль-
ные кинеты; в эктоплазме рядами расположены круп-
ные протрихоцисты; инфузории нередкие на песчаном
дне у о-ва Гельголанд. Возможно, это одна из псам-
монных гелеид, но не вид рода Protocruzia.
Р. chesapeakensis Lynn et Small, 1985. Дан рисунок
и небольшое пояснение, стандартного диагноза нет,
ядро и вакуоль не зарисованы. Вид изучен при импрег-
нации; имеется 1 послеротовая кинета и несколько
краевых вентрально, все с дисомами, найден scuti-
cus — пара кинетосом у рта; перистом почти до эква-
тора, двойная мембрана до апекса, по оси перистома
линия из 6 чуть скошенных мембранелл с 3 рядами ки-
нетосом в основании. Кинеты вента разрежены, сгуща-
ются справа. Аргиром не выявлен.
Р. tuzeti Villeneuve-Brachon, 1941. Вид хорошо изу-
чен на импрегнированных препаратах, подробно изу-
чена морфология, морфогенез, ультраструктура (Groli-
еге et al., 1980). Размеры тела 30—42 X 18—25 мкм,
тело каплевидное, с 10—11 кинетами, состоящими из
дисом по всей длине; кинеты сближены по краям тела
и дорсально, на вейте всего 3—4 ряда. Перистом до 1/5
длины тела, с 6 мембранеллами с 2—4 рядами в осно-
вании, мембрана — дуга из дисом. Ниже перистома
слева, у кинеты, изолированная пара кинетосом. Ядро
центральное, из многих плотно сближенных сферул
вокруг округлого микронуклеуса. Культуры вида по-
лучены и автором обзора — при засеве воды с рисом в
чашках Петри наугад частицами гнилых водорослей в
Крыму нередко в массе разводится Protocruzia sp. та-
кого же типа, выносящая сапробные условия в культу-
ре, при которых остальные цилиаты гибнут; сотни осо-
бей плотным кольцом окружают зерна риса, внешне
похожи на тетрахимен, но мельче. Культуры легко вес-
ти и на искусственной морской воде (аптечной мор-
ской соли).
Р. depressa Ammermann, 1968. Размеры 40—50 X
15—30 мкм; тело искривленное, каплевидное, сплю-
щено латерально, на правой стороне 4 ряда, на левой
2—3 и обширный ацилон; кинеты изогнутые, не про-
дольные; вакуоли нет; имеется мембрана и много
сближенных мембранелл в узком перистоме, на 2/5
длины тела; у апекса около 20 трихоцист; ядро из до-
лек в одной массе. Различимы 3 «формы» — £ топо-
micronucleata, f. dimicronucleata, f. polymicronucleata
(с 1, 2 и 3—6 микронуклеусами); первая форма разво-
дится на морской воде, другие на солоноватой. Акцент
в работе на делении ядер — дольки ядра, не сливаясь,
принимают вид хромосом и одновременно делятся все
макро- и микронуклеусы.
Важные признаки для выделения таксона высокого
ранга — уникальные ядра, стоматогенез за счет одной
дисомы нижней особи (следовательно, дисома верхней
особи — не скутикус) и ультраструктура кортекса. Си-
стематическое положение рода всегда было загадкой,
вид сближали с филастеринами (Small, Lynn, 1985), ге-
теротрихами; Янковский (1980) считал род исходной
формой для отряда гетеротрих, Корлисс (Corliss, 1979)
допускал, что часть видов — филастериды, другие —
гетеротрихи. Если сравнить 4 молекулярные фило-
граммы разных авторов, однозначного ответа на поло-
жение группы нет; по одной из них (Shin et al., 2000;
Lynn, 2003) виды Protocruzia группируются co спирот-
рихами, но линия рода отходит от базальной части
ствола, т. е. нет прямого родства со всеми спиротриха-
ми (Oxytricha, Strombidium, Euplotes, Phacodinium), с
которыми проводилось сравнение. Но по другим мар-
керам выявляется родство с кариореликтидами, за пре-
делами подтипа Intramacronucleata. Protocruzia очень
рано отделилась от первых цилиат, эволюция ближай-
шей ветви которых при бифуркации дальше пошла к
гипотрихам и к метопидам.
Подкласс Phacodiniida Small et Lynn, 1985
Отряд Phacodiniida Small et Lynn, 1985
(рис. 348a, 350a)
Кинетосомы располагаются парами (дисомы) по
ходу кинеты у гипотрих и гетеротрих; у Phacodinium
видны пластинки (platelets) по ходу кинет, в которых
кинетосомы расположены примерно 2 рядами в каж-
дой обособленной группе; каждая кинета состоит из
15—18 таких пластинок, с расстояниями, примерно
равными их длине. Факодиниид считали гетеротриха-
ми, но молекулярная филогения исключает это родст-
во и группирует таксон с гипотрихами (Lynn, 2003).
Паразитические формы с такими пластинками, нерод-
ственные факодиниям (род Plagiotoma из кишечника
дождевых червей) не были включены в состав гипот-
рих и образовали особый отряд; поэтому такое же ре-
шение принято для факодиниев и близких форм (Shin
et al., 2000). Предлагалось даже повысить ранг группы
до подкласса, сохранив авторство Смолла и Линна
(Shin et al., 2000). Если это принять, авторы должны
смениться — авторство может сохраниться только при
смене ранга смежных таксонов (род — подрод, отряд —
подотряд, класс — подкласс); авторами подкласса дол-
жны считаться Шин с соавт. в цитированной статье. Ти-
повой род отряда Phacodinium — обитатель мхов, близ-
кие роды тоже во мхах и почве, но к отряду приписыва-
ется также род Reichenowella, выделяемый в особое
семейство и совершенно неизученный.
ТИП CILIOPHORA. КЛАСС SPIROTRICHEA
449
Сем. Reichenowellidae Kahl, 1932
Крупные формы с удлиненным телом и субапи-
кальным перистомом, по левому краю которого идет
небольшая полоска мелких мембранелл.
Род Reichenowella Kahl, 1932
Типовой в и д R. nigricans.
Хищники из сапропеля пресных и слабо солонова-
тых вод. Крупные вытянутые латерально сплющенные
формы (200—250 мкм) с небольшим узким субапи-
кальным перистомом, в виде неширокого и относитель-
но короткого желобка, идущего вниз от апекса. Мемб-
рана не замечена, мембранеллы мелкие, малочислен-
ные (10—12). Кинет немного, около 24; ряды слегка
спиральные, разрозненные, подходят с обеих сторон к
ротовой щели; между кинетами ряды «протрихоцист».
Ресничный покров густой, каудальных ресничек нет.
Ядро червеобразное, с 2—3 микронуклеусами; ваку-
оль крупная, терминальная. У Каля (Kahl, 1932) в со-
ставе гетеротрих, но у гетеротрих перистом всегда
крупный. В Traite (Puytorac, 1994) семейство включено
в данный отряд условно, до изучения рода.
Сем. Transitellidae Fryd-Versavel
et Tuffrau, 1978
Обитатели почвы и мхов, без прочного панциря, с
крупным перистомом; глотка с немадесмами. Вент-
ральная сторона и дорсум с разным типом цилиату-
ры — на дорсуме продольные ряды щетинок, как у
гипотрих, на венте кинеты немногочисленные, кинето-
сомы расположены группами по ходу кинет. Стомато-
генез паракинетного типа, зачаток нового перистома
образуется на концах вентральных кинет в области
заднего шва (секанты). Название семейства может из-
мениться на Reichenowellidae Kahl, 1932, поскольку
часть авторов считает Transitella синонимом рода Ba-
lantidioides, и Reichenowella близка к Balantidioides
(Foissner et al., 1982).
Род Balantidiopsis Penard, 1922
Типовой вид#, muscicola Penard, 1922.
')то название уже есть у цилиат — один из видов
балантидиев в лягушках выделен в новый род Balanti-
tllo/isis Butschli, 1889. Каль в определителе приводит
род Balantidioides Penard, 1930, фактически Balantidio-
ides Penard in Kahl, 1930, поскольку такой публикации
у 11снарда нет. Типовой вид В. muscicola — вид с гиб-
ким кортексом (метаболичный), величиной 60—
100 мкм, обитатель мхов; предположительно питается
только коловратками Callidina, обычными во мхах.
Описания у Пенарда (Penard, 1922) и Каля (Kahl, 1930)
различаются, точного рисунка нет. Вид легко узнать
по необычному числу вакуолей— 10—12 по Пенарду,
вдвое больше по Калю; в перистоме около 20 мелких
мембранелл; тело желтовато-красное; кортекс с поло-
сами точек — протрихоцист (мукоцист). Перистом
апикальный, почти поперечный; кинеты не сходятся к
постерону; ядро вытянутое, извитое.
В. bivacuolata Kahl, 1932 из мхов имеет такие же
размеры (80—110 мкм) и форму тела, но кортекс более
прочный, ядро короче, имеются только 2 вакуоли;
окраска красноватая; питание флагеллатами. Пери-
стом более крупный, чем у В. muscicola. Вид переопи-
сан Венцелем (Wenzel, 1953), показавшим необычную
топографию кинетома — реснички расположены не
поодиночке, а группами (по 6) в желобках вдоль высо-
ких ребер кортекса; кинеты не сходятся к одной точке,
а идут параллельно по дуге налево вниз, вероятно к
длинному шву; в широком желобке перистома около
16 крупных мембранелл; нет ацилона между зоной
мембранелл и правым краем перистома; 2 вакуоли в
типичном положении. Ядро массивное, вытянутое, не-
мадесмы не замечены. Этот вид хорошо описан (Iftode
et al., 1983), а первый остается загадкой, и неясно, от-
носятся ли они к одному роду.
Род Transitella Gellert, 1950
Типовой вид Т. lichenicola по монотипии.
Из мхов и лишайников; длина тела 80 мкм, питание
детритом. По Аэшт, название Transitella — синоним
рода Balantidioides', другие авторы считают род валид-
ным. Вид был переописан как Т. lichenicola, затем вто-
рично как Т. bivacuolata, название типового вида было
сведено в синонимику, а род считался валидным
(Fryd-Versavel, Tuffrau, 1978). По Фойсснеру (Foissner
et al., 1982), название Balantidioides валидное, род
включает виды В. muscicola (Penard, 1922); В. bivacuo-
lata Kahl, 1932; В. dragescoi F. et al., 1982 и В. corbifera
(^Transitella corbifera Fryd-Versavel et Tuffrau, 1978).
В итоге невалидными оказались вид и род Transitella
lichenicola Gellert, 1950 и сем. Transitellidae, валидно
сем. Reichenowellidae с родами Transitella и Balantidio-
ides. Названия Transitella, Transitellidae все же приня-
ты в последних сводках по цилиатам (Puytorac, 1994;
Lynn, Small, 2002).
Reichenowella.
Сплющенные формы с высокими закругленными
ребрами панциревидного кортекса, в желобках между
которыми расположены равномерно по всему телу
группы длинных ресничек, образующих циррусовид-
ные пектинеллы. Найдены 2 мембраны перистома, на-
ружная и внутренняя; мембранеллы идут почти на по-
верхности тела на 2/3 левой стороны и продолжаются
за пределами ротового желобка на апексе. В основании
мембранелл, как у гетеротрих и гипотрих, по 3 ряда не-
равной длины, верхний укорочен. От мембранелл к
основаниям мембран в глубь тела идут немадесмы, об-
разующие массивную корзинку (циртум). Все сомати-
ческие ряды состоят из разрозненных групп дисом, от
них также отходят пучки фибрилл в цитоплазму.
Сем. Phacodiniidae Corliss, 1979
Кортекс прочный, панциревидный; перистом очень
длинный, широкий, без заметной корзинки немадесм
(без циртума); кинеты биполярные, простой топогра-
29 Чин №4163
450
ALVEOLATA
фии, реснички расположены пучками вдоль кинет, с
тесными прерывистыми группами кинетосом, без сли-
яния в циррусы; вентральный и дорсальный кинетом
идентичные. Вместо ундулирующей мембраны в пери-
стоме — группа коротких кинет, ресничное поле.
Род Phacodinium Prowazek, 1900
Типовой вид Ph. muscorum.
Из мхов и лишайников. Уже ранние авторы отмети-
ли идентичность этого вида и Conchophthirius metchni-
coffi Certes, 1891, и первый вид был сведен в синони-
мику второго. В свежих настоях мхов и лишайников
изредка можно найти светлых плоских цилиат с проч-
ным панцирем, величиной около 100 мкм. Тело овальное,
кинеты немногочисленные (12—15), простой топогра-
фии, биполярные; каждый ряд с 15—18 пластинка-
ми — группами тесно сближенных дисом. В дорсаль-
ных пластинках 1—3 кинетосомы, каждая с ресничками,
в вентральных 9—11 кинетосом; местами встречаются
и двойные пластинки с 16 кинетосомами. Между кине-
тами — продольные ребровидные складки панциря.
Перистом рястянут от апекса почти до нижнего конца
тела, содержит 39—45 мембранелл с 4 рядами кинето-
сом в основании. Справа вместо стандартной для спи-
ротрих одной или двойной мембраны видно поле рес-
ничек с множеством кинетосом в основании, несколь-
ко напоминающее поликинету у рода Euplotes, также
не имеющего классической мембраны. Поэтому пред-
лагалось включить подотряд Phacodiniina Feman-
dez-Galiano et Calvo, 1992 (в третий раз предлагаемый
как новый!) в состав отряда гипотрих. Подчеркнем,
что у всех родов отряда пектинеллы не соответствуют
циррусам гипотрих — у гипотрих в основании цирру-
сов группы рядов (паратены) из большого числа кине-
тосом. Как и другие моховые виды (бриофилы), фако-
динииды быстро инцистируются. Phacodinium легко
импрегнируется по Шаттону, выявляется кинетом и
очень сложный аргиром, нетипичный для беспанцир-
ных гипотрих, у которых простая мелкоячеистая сеть
импрегнируется серебром лишь в редчайших случаях.
Подкласс Hypotrichia Stein, 1859
В основном удлиненные плоские бентосные формы с диффе-
ренцировкой вентральной и дорсальной цилиатуры; на дорсуме со-
хранились немногочисленные продольные ряды с дисомами, одна
из которых несет короткую сенсорную ресничку (щетинку); на вей-
те перистом и сложно дифференцированные циррусы. В основании
циррусов — группа кинетосом, обособленных от остальных групп;
циррусы в рядах или образуют сложный узор (паттерн), характер-
ный для каждого вида. Как правило, различаются ряды маргиналь-
ных циррусов (МЦ, по краям тела), трансверсальных (ТЦ, крупные
циррусы в поперечном ряду сзади), каудальные (КЦ), фронто-веит-
ральные (ФВЦ — все остальные, от апекса до трансверсалий).
Маргинальными рядами называют или краевые ряды (по кайме
тела), или все вентральные ряды кроме послсротовых и диаксоне-
мы, или (редко) краевые ряды называют маргиналиями, внутрен-
ние парамаргиналиями. Совокупность всех вентральных циррусов,
кроме маргиналий, обозначается как фронто-термииальные (ФТЦ),
но этот термин используется редко. В свою очередь ФВЦ делятся
на фронтальные (ФЦ) и вентральные (ВЦ); над ТЦ обычно не-
сколько мелких ВЦ, их можно назвать субтрансверсальные (СТЦ);
к мембране перистома часто тесно прилегает один циррус, обособ-
ленный от остальных, или небольшой ряд — буккальные циррусы
(БЦ). Вентральные циррусы у части родов идут в виде двойного
ряда; эту группу называют мидвентральные ряды (МВЦ), но автор
применяет свой термин — «диаксонема» (diaxonema). Эта терми-
нология дает возможность сравнивать не диагнозы видов, а форму-
лы кинетома; к примеру, формула для Onychodromopsis flexilis (в
английском варианте) — MCR3, MCL2, FC3, SFC3, VC3, STC2,
NC5, ССЗ; формула для Histriculus histrio — MCR1, MCL1, FC3,
BC1, SFC4, VC3, STC2, TC5, CC0.
Перистом обычно крупный, в передней половине тела слева;
вдоль правого края полости — 2 ундулирующие мембраны, обыч-
но параллельные в нижнем отделе, параллельные или расходящие-
ся в верхней половине. Наружная мембрана в литературе обознача-
ется как пароральная, внутренняя как эндоральная. Полоса мемб-
ранелл (адоральная зона мембранелл, АЗМ) начинается в
небольшой полости у рта и огибает дугой обширный ацилон на дне
перистома, переходит на дорсум и огибает вершину тела. Мембра-
неллы имеют ступенчатое (параллельное) расположение, каждая
состоит из 2 или 2.5 рядов кинетосом. У части родов основания
мембранелл апикального отдела отличаются по форме от боковых,
и у нескольких родов АЗМ разорвана безресничной перемычкой на
2 четких отдела.
Деление связано со сложной реорганизацией кинетома; кроме
того, перестройка цилиатуры наблюдается при физиологической
реорганизации, перед конъюгацией и инцистированием, после вы-
хода из цисты и при образовании макростомов. Выявлено различие
морфогенеза, иногда даже у морфологически близких, но неродст-
венных видов; знание морфогенеза помогает точно определить го-
мологию ФВЦ и ТЦ, восстановить ряды, утраченные у высших
родов (окситрихид) на венте. Процессы морфогенеза все больше
учитываются в систематике родов, филогенетике и общей класси-
фикации подкласса при группировке родов в семейства. Пока этот
процесс не закончен, здесь используется временная классификация
Линна (Lynn, 2002).
Ядро обычно двойное (амфилептидного типа) или в большом
числе фрагментов, независимых или соединенных в цепочку; у от-
дельных видов десятки мелких овальных ядер заполняют все тело.
Хроматин очень плотно сжат, конденсирован, при окраске двой-
ные ядра гипотрих красятся быстро и очень интенсивно, у других
цилиат на тех же препаратах медленно и не так ярко. Перед делени-
ем через ядра проходит реорганизационная полоса, меняющая
структуру ядра. По наличию такой полосы определено родство с
гипотрИХПМИ аберрантных групп — Halteriidae, Strombidiidae, Lic-
nophoridac.
Распространение всесветное — почва, мох, другой террофи-
тон, временные И постоянные водоемы всех типов, пресные воды,
эстуарии и морс; нет видов в анаэробных черных илах (где много
метопид и других групп), мало видов в пресноводном планктоне и
практически пет в морском. Часть видов обитает в перифитоне в
мукозных трубках, иногда ветвящихся (Stichotricha, Strongylidium,
Archimedea, Schizosiphon). Симбиоз нехарактерен для подкласса,
исключение Kerona па гидрах. Все виды легко инцистируются.
В старой литературе было принято мнение о космополитизме ци-
лиат, поскольку цисты должны разноситься ветрами по всей Земле;
казалось бы, гипотрихи должны быть подтверждением этой тео-
рии, но при широком распространении ряда видов, вплоть до почв
Антарктики, эндемизм очень велик, и есть роды с распространим
только во фрагментах Гондваны. Поэтому желательно изучение
пресноводных и наземных (почвенно-моховых) гипотрих в воз-
можно большем числе стран,
Классификация группы в современных сводках не совпадает,
разделение на отряды, подотряды И семейства разное у разных ав-
торов; здесь каталог родов дается по системе Линна (Lynn, 2002),
которая будет принята в новом издании книги Корлисса. Фо-
ре-Фремье (Faure-Fremiet, 1961а) разделил гипотрих (включая эуп-
лотид) на подотряды Sticliotrichina и Sporadotrichina; ФВЦ диффе-
ренцированы в обеих группах, по у первых сохранено большое
число рядов МЦ, они ближе к предковым гетеротрихам. Исследо-
вания морфогенеза показали, что обе группы полифилетичные, и
делить только на эти 2 группы нельзя. В этом авторы руководств
согласны, но предлагают разные варианты — во французской схе-
ме (Tuffrau, Fleury, 1994) подкласс, названный Oxytrichia, делится
на отряды Urostylida, Discocephalida и Oxytrichida; в варианте Лин-
на (Lynn, 2002) дискоцефалиды отнесены к эуплотидам, подкласс
ТИП CILIOPHORA. КЛАСС SPIROTRICHEA
451
Рис. 284. Hypotrichida.
Stylonychia ovalis (/I), Rigidocortex octonucleatus (5); Sterkiella histriomuscorum (B); Cyrtohymena /Steinia/ quadrinucleata (Г, Ж); Parastylonychiaplouneouri (Д);
Stylonychia notophora = S. putrina(E). (По: Dragesco, 1963b (Д); 1966b (Л); Foissner, 1988b (В, Г); Airgustin, Foissner, 1992 (B); Dragesco, Njine, 1971
Fig. 284. Hypotrichida.
452
ALVEOLATA
Stichotrichia делится на отряды I’lagiotoinida, Stichotrichida, Urosty-
lida и Sporadolrichida. Эуплотид нередко отделяют от окситрихид
на уровне подклассов, а само старинное название Hypotrichida Ste-
in, 1859 в этом случае сохраняют только для эуплотид. В данном
обзоре за основу взят вариант Линна, в котором по умолчании до-
пускается монофилия каждой из трех групп.
Гипотрихи постоянно присутствуют на молекулярных филог-
раммах — подкласс представлен родами Oxytricha, Holosticha, Sty-
lonychia, Onychodromus', виды Oxytricha nova и О. trifallax, приво-
димые на всех ранних филограммах, в действительности относятся
к Sterkiella — S. nova и S. histriomuscorum (Foissner, Berger, 1998).
Филограммы подтверждают родство гипотрих типа Oxytricha, оли-
готрих, Halteria, плагиотомид и Euplotidae; последние выводятся
не от окситрихид, как считали раньше, а от общего ствола спирот-
рих, отделились рано в эволюции (Lynn, Small, 1997; Shin et al.,
2000; Lynn, Struder-Kypke, 2002). Поэтому сейчас все указанные
группы остаются в составе Spirotricha, но эуплотиды и окситрихи-
ды не объединяются в традиционный общий таксон Hypotricha
(Hypotrichida). Это название дано классу во французском варианте
(Puytorac, 1994) и подклассу эуплотид у Линна (Lynn, 2002), но
лучше использовать его не для эуплотид, а для основного массива
родов (сем. Oxytrichidae, Urostylidae, Amphisiellidae, Keronidae,
Kahliellidae и др.), с которыми ассоциируется понятие «гипотри-
хи». Предлагался перенос пресноводного эпибентосного рода Hal-
teria из олиготрих в состав гипотрих, в соответствии с молекуляр-
ной филограммой, но пока нет переходных форм, и слишком вели-
ки различия морфологии окситрихид и хальтерий; временно
Halteria возвратилась в Oligotrichia.
Примеры почвенных, бентосных и пелагических родов гипо-
трих приведены на рис. 284—290.
Для определения и изучения гипотрих мною предложен про-
стой новый метод окраски циррусов — фиксация глутар-альдегид-
иым раствором фосфорно-вольфрамовой кислоты (в 40—50 %
спирте), короткая отмывка в воде, быстрая окраска в разбавленном
растворе фиолетовых чернил (метил-виолет, можно использовать
кристалл-виолет, генциан-виолет и толуидиновый синий), корот-
кая отмывка в воде; сохранность окраски от нескольких часов до
нескольких дней. После окраски особи помещаются в каплю сахар-
ного сиропа; после подсыхания сиропа в течение часа до тонкой
пленки (кристаллизация сахара не происходит) капаем каплю вазе-
линового масла и изучаем просветленных особей при иммерсии.
Метод «сахарной пленки» очень полезен при изучении окрашен-
ных, импрегнированных и нефиксированных раковинных Protozoa
и форм с прочным кортексом (эуплотиды, одонтостоматы, сукто-
рии). Методика окраски чернилами (только фиолетовыми) приме-
нима ко всем гипотрихам, пресноводным и морским, мешковид-
ным и змеевидным, и дает четкую элективную окраску циррусов;
ядра видны, но не красятся. Не нужны осмий и протарголь, недо-
ступные многим цилиатологам и фаунистам; при навыке процеду-
ра фиксации и окраски, до заключения в каплю раствора сахара, за-
нимает не более минуты. Можно одновременно окрасить десятки
особей, но лучше поодиночке, чтобы легче отмывать их микропи-
петкой от фиксатора.
Отряд Stichotrichida Faure-Fremiet,
1961
Условно, только для удобства группировки родов,
гипотрих можно разделить на 3 группы, несомненно
сборные и не монофилетические, в качестве временно-
го варианта классификации; пока морфогенез изучен
не у всех родов, и только несколько обычных пресно-
водных видов используются для построения молеку-
лярных филограмм. В первой группе вентральные цир-
русы в одном или нескольких рядах; у вторых имеется
двойной осевой ряд (диаксонема) с зигзагообразным
положением циррусов по ходу дикинеты (как кинето-
сомы в основании ундулирующей мембраны гимено-
стомат); в третьей группе рядов нет, циррусы разроз-
нены. Число маргинальных рядов, которому раньше
придавали значение, не учитывается — большое число
рядов МЦ встречается у представителей всех 3 групп.
Каждая из 3 групп включает почвенные, пресноводные
и морские роды; симбионтная Кегопа относится к Stic-
hotrichida.
Сем. Amphisiellidae Jankowski, 1979
Имеется только один вентральный ряд циррусов
(исключая Pseudouroleptus)', передний сегмент этого
ряда образуется циррусами крайне правого вентраль-
ного зачатка, а задний сегмент из второго справа вент-
рального зачатка.
Род Amphisiella Gourret et Roeser, 1888
Типовой вид И. marioni из морского бентоса. В
первоописании — вид с 2 рядами МЦ, удаленными от
краев тела, и длинным рядом ВЦ от уровня перистома
до группы ТЦ на нижнем конце тела. ВЦ относительно
короткий, не биполярный; другие циррусы — 3 ФЦ,
1 БЦ и 3 разрозненных цирруса между рядом ВЦ и пе-
ристомом, иногда в нечетком ряду. К роду приписыва-
ли разные формы, включая виды с цефализацией; в
каталоге Боррора (Воггог, 1972) 7 видов. По данным
Виклоу (Wicklow, 1982), у типового вида есть еще ко-
роткий ряд у вершины МЦ справа и 2 СТЦ. Валидные
виды — A. quadrinucleata Berger et Foissner, 1989;
A. vitiphila (Foissner, 1987).
Род Amphisiellides Foissner, 1988
Типовой вид Uroleptoides atypica Hemberger,
1985 (A. atypicus). Ряд ВЦ короткий; топография цир-
русов в верхней половине тела, как у Amphisiella, име-
ется 1 БЦ, относительно короткий ряд ВЦ, 3 ФЦ и не-
сколько циррусов между рядом ВЦ и перистомом; ро-
довое отличие — у постерона имеется группа ТЦ, с
другой стороны па дорсуме каудальные циррусы. Дру-
гой вид — A, illuvialis Eigner et Foissner, 1994 с длин-
ным осевым рядом циррусов сзади вместо типичного
поперечного ряда ТЦ.
Род Hemiamphisiella Foissner, 1988
Типовой вид Я. terricola. Тело особо вытяну-
тое, ряды циррусов изогнутые, осевой ряд ВЦ длин-
ный, ТЦ в продольном ряду; во фронтальном поле кро-
ме 3 стандартных для гипотрих циррусов имеется один
циррус левее вершины ВЦ; один изолированный цир-
рус расположен между ВЦ и МЦ ниже рта; имеются
каудалии с основаниями на дорсуме; над ТЦ — допол-
нительный ряд циррусов у постерона. Также Н. quadri-
nucleata (F., 1984).
Род Orthoamphisiella Eigner et Foissner,
1994
Типовой вид О. stramenticola. Нет ТЦ и кауда-
лий (КЦ) сзади у постерона; ряд ВЦ смещен вправо
вплотную к МЦ; спереди, кроме 3 ФЦ, 4 продольных
ТИП CILIOPHORA. КЛАСС SPIROTRICHEA
453
Рис. 285. Hypotrichida.
Urosoma karini (Л); Pseudokeronopsis rubra (Б—Г); Australothrix australis (Д, E); Laurentiella macrostoma (9/Q; Paruroleptus musculus (3); Orthoamphisiella stra-
menticola (И, К). (По: Foissner, 1987b (zl); 1988b (Б—Гу Blatterer, Foissner, 1988 (Д,Е); Dragesco, Njine, 1971 (Ж); Foissner et al., 1990 (3); Eigner, Foissner, 1991
(Я, /0).
Fig. 285. Hypotrichida.
454
ALVEOLATA
Рис. 286. Hypotrichida.
Amphisiella annulata (J); Paraurostyla weissei (Б—Г); Strongylidium microstoma (Д); S. granuliferum (E); Wallachia schiffmanni (Ж)\ Erionella IKeronopsisI mac-
rostoma (3). (По: Berger, 1999 (Я), 2004 (A); Jerka-Dziadosz, 1965 (5); Dragesco, 1963b (3); Dragesco, Dragesco-Kemeis, 1986 (Г, Д); Foissner, 1976 (Жр,
1987c (£)).
Fig. 286. Hypotrichida.
ТИП CILIOPHORA. КЛАСС SPIROTRICHEA
455
Рис. 287. Hypotrichida.
Australothrix alwlnae (A, !>')', Pseudourostyla franzi (В—Д)', «Keronopsis» multiplex (E); Metaurostylopsis rubra (Ж)\ Urostyla grandis (3, И). (По: Foissner, 1987c
(Л—Д); Foissner ct al., 1991 (3); Patsch, 1974 (Я); Ozaki, Yagiu, 1943 (£); Song, Wilbert, 2002 (2K); Blatterer, Foissner, 1988 (A, £)).
Fig. 287. Hypotrichida.
456
ALVEOLATA
Рис. 288. Hypotrichida.
Holosticha Steuben (A—B); «Keronopsis» arenicola (Г); Bicoronella costaricana (Д, E); Pseudokeronopsis rubra (Ж, 3). (По: Foissner, 1987b (А—В) 1988b (Ж 3)
1995b (Д, E); Dragesco, 1963b (Г)). ’ ’ ’
Fig. 288. Hypotrichida.
ТИП CILIOPHORA. КЛАСС SPIROTRICHEA
457
Рис. 289. Hypotrichida.
Spirotrachelostyla spiralis (Л); Stleliotricha marina (5, 3); Mucotrichidium hospes (В--Д); Bakuella marina (E, Ж); Epiclintesambiguus(Hiq.^o-. Агамалиев,
1983 (£, Ж); Dragesco, Dragesco-Kerneis, 1986 (Л); Hu, Song, 2001 (Б, 3); Foissner et al., 1990 (B-Д); Song, Warren, 1996 (И, K)).
Fig. 289. Hypotrichida.
1
458 ALVEOLATA
Рис. 290. Hypotrichida.
Hypotrichidium conicum (Я africanuml) (А, Б, 3, И); H. tisiae (S); Parakahliella haideri (Г); Styxophrya quadricomuta (/(); Spirelta plancticola (E); Pelagotrichidi-
umfaurei (Ж). (По: Dragesco, 1970 (А, Б); Tuffrau, 1972 (В, Ж—И)’ Berger, Foissner, 1989 (Г); Foissner et al., 1987 (Д), 1999 (£))•
Fig. 290. Hypotrichida.
ТИП CILIOPHORA. КЛАСС SPIROTRICHEA
459
коротких ряда циррусов, один из которых (крайне ле-
вый, у перистома) соответствует БЦ. Ряд ВЦ недлинный,
сверху подходит к полосе мембранелл; снизу марги-
нальные ряды подходят один к другому, не соединя-
ясь, 11айдены в настое опавших листьев в Австрии.
Род Paramphisiella Foissner, 1988
Типовой вид Amphisiella acuta F., 1982. С длин-
ным диагональным рядом ВЦ, спереди только один
циррус в дополнение к обычному набору (3 ФЦ, 1 БЦ);
у постерона маргинальные ряды сближаются, ТЦ нет,
на дорсуме — основания 4 каудалий.
Род Circinella Foissner, 1994
Типовой вид С. arenicola. Длинные узкие чер-
веобразные цилиаты с незначительной цефализацией,
нетипичные для основной массы гипотрих, обитатели
почвы. Кинетом очень упрощенный — по краям тела 2
длинных ряда МЦ, левый ряд внизу переходит на до-
рсум; нет ТЦ и каудалий; ряд ВЦ в передней трети
тела, короткий; между перистомом и апексом спра-
ва — несколько циррусов в дополнение к 1 БЦ и 3 ФЦ.
Перистом очень мелкий, с четким делением на боко-
вую и апикальную части полосы мембранелл.
Род Paragastrostyla Hemberger, 1985
Типовой в и д Р. lanceolata. Обычно указывается
дата 1981 г. Ряды МЦ сходятся у заостренного нижне-
го конца тела; в этой зоне нет ТЦ, несколько каудалий
имеют основания на дорсуме. Ряд ВЦ короткий, до
четверти длины тела; между ним и вершиной маргина-
лий — короткий дополнительный ряд; нет циррусов
между ВЦ и перистомом кроме стандартного набора
(3 ФЦ, 1 БЦ).
Род Periholosticha Hemberger, 1985
Типовой в и д Р. lanceolata. Обычно указывается
дата 1981 или 1982 г. •— этот и другие роды Хемберге-
ра предложены в диссертации, которую Аэшт не счи-
тает опубликованной работой; поэтому валидна позд-
няя дата (Hemberger, 1985) названия в статье. Близкий
вид Р. wilberti Song, 1990. Почвенные виды с длинным
узким телом; ряды маргиналий сходятся внизу, здесь
нет ТЦ и каудалий; спереди продольный ряд ВЦ до
трети длины тела; нет одиночных циррусов, кроме
стандартного набора БЦ и ФЦ. У Р. wilberti 4—5 ФЦ,
3—4 фронто-терминалий, 3—5 мидвентралий (осевой
ряд), 2 каудалии; нет ТЦ. По типу морфогенеза, не-
смотря на отсутствие диаксонемы, это типичный пред-
ставитель сем. Urostylidae.
На примере вышеназванных родов видно, что со-
временная систематика родов гипотрих основана на
мозаике признаков, прежние роды дробятся, различия
становятся малозначительными, а роды трудными для
определения и требуют импрегнации протарголом.
Род Uroleptoides Wenzel, 1953
Типовой вид U. kihni. Вид выделен из мхов;
ряды МЦ не смыкаются снизу, здесь имеется 4 обособ-
ленных длинных цирруса; ряд ВЦ (мидвентральный)
достигает постерона; спереди второй диагональный
ряд на уровне перистома, 3 ФЦ, нет буккального цир-
руса. Боррор и Эванс (Borror, Evans, 1979) описывают
под этим названием вид с более коротким рядом ВЦ
(чуть ниже экватора), спереди 3 ФЦ, 1 БЦ и 2 цирруса;
это описание основано на окраске протарголом, описа-
ние Венцеля (Wenzel, 1953) — на живом материале.
Ранее Боррор (Borror, 1972) считал тип рода идентич-
ным с Amphisiella marioni, но сейчас род и вид Венцеля
валидные.
Хорошо изучены почвенные виды U. quadrinu-
cleata F., 1984; U. binucleata Berger et Foissner, 1989;
U. qingdaoensis Song et Wilbert, 1989. Варианты ки-
нетома (расположение ТЦ в поперечном или продоль-
ном ряду, наличие дополнительного цирруса ниже
перистома) не считаются поводом для выделения но-
вых родов.
Род Pseudouroleptus Hemberger, 1985
Типовой вид Р. caudatus. Датировка 1981 г. не-
верна, это дата диссертации. Между 2 маргиналиями
находятся 2 продольных ряда циррусов, один короче
другого, оба подходят к постерону; ниже перисто-
ма одиночный циррус; правее рта, кроме 3 ФЦ и 1 БЦ
только один циррус. Имеются каудальные циррусы;
ТЦ у типового вида четко не выражены или отсутству-
ют, но имеются у Р. procerus. Другие виды, кроме ти-
пового, — Р. buitkampi (Foissner, 1982); Р. humicola
(Gellert, 1956); Р. procerus Berger et Foissner, 1987;
P. terrestris Hemberger, 1985. Бергер (Berger, 1999) иск-
лючает их из состава рода, но не включает в другие
роды гипотрих.
Род вначале отнесен к Amphisiellidae (имеющему
только один мидвентральный ряд), затем перенесен в
состав Oxytrichidae, поскольку в морфогенезе одна из
стадий сходна (зачатки «третьего неокинетального
типа»); Бергер (Berger, 1999) приводит род в конце мо-
нографии окситрихид как приложение, не высказав
своего мнения.
Род Apoamphisiella Foissner, 1997
Типовой вид Onychodromopsis tihanyensis Gel-
lert et Tamas, 1958. По краям тела ряды МЦ, сходящие-
ся снизу; вдоль оси тела 2 ряда ВЦ, удаленные один от
другого, до 6 очень четких ТЦ в диагональном ряду;
нижние циррусы мидвентралий — над ТЦ (СТЦ); под
перистомом один циррус; спереди кроме стандартных
ФЦ и одного буккального цирруса лишь 2 обособлен-
ных цирруса; на дорсуме — основания группы кауда-
лий. У типичных амфизиеллид тело очень тонкое, су-
жается кзади, поэтому ТЦ плохо выражены, отсутству-
ют или расположены продольно. У данного рода тело
широкое, как у уростилы, поэтому хорошо развиты
ТЦ. Бергер перенес род из амфизиеллид в сем. Oxytri-
460
ALVEOLATA
chidae, поскольку имеется характерный для окситрих
разрыв дорсального ряда D-З (на дорсуме счет кинет
идет от края тела, противоположного перистомаль-
ному). Морфогенез неизвестен, и такой перенос вре-
менный.
Род Stenotricha Jankowski, 1978
Типовой вид Strongylidium arenicolus Dragesco,
1954; переописание у Dragesco, 1960. Тип рода Stron-
gylidium (S. crassum) — пресноводный вид со спираль-
ными кинетами, включая 2 разрозненных мидвентраль-
ных ряда, и заметной цефализацией; у морского вида
5. arenicolus цефализация выражена, но все остальное
не совпадает. Вид имеет 2 краевых ряда МЦ, правый
и левый, идущие без спирализации до хвостового су-
жения тела сзади, где расположены несколько ТЦ;
правее перистома 2 полоски циррусов, у апекса 3 ФЦ.
Буккального цирруса либо нет, либо он не замечен.
Предположительно это амфизиеллида.
Род Lamtostyla Buitkamp, 1977
Типовой вид/., lamottei.
Из почвы в Африке. Тело широкое, окситрихидно-
го типа (амфизиеллиды вытянутые, узкие), но кине-
том, как у амфизиеллид. 2 ряда МЦ удалены снизу, не
смыкаются; между ними 2 ТЦ, нет каудалий; вентраль-
ный ряд короткий, заканчивается чуть ниже перисто-
ма; спереди 3 ФЦ, 1 БЦ и справа от него 3 цирруса,
не расположенные в линию. Практически весь вент —
сплошная безресничная зона. Вначале род был вклю-
чен в состав холостихид, затем отнесен к Ciadotri-
chidae, Oxytrichidae и Amphisiellidae. Бергер (Berger,
1999) исключил род из состава окситрихид, а другие
относимые к роду виды включил в род Tachysoma.
Другие виды — L. halophila Foissner et al., 2002; L. de-
corata Foissner et al., 2002; L. granulifera Foissner, 1997;
L. longa (Hemberger, 1985); L. australis (Blatterer et Fo-
issner, 1988).
Род Tetrastyla Shewiakoff, 1893
Типовой вид T. oblonga-, по Калю (Kahl, 1932) и
Корлиссу (Corliss, 1979) — синоним рода Amphisiella
(A. oblonga in Kahl, 1932), но с тех пор род Amphisiella
изменил свой состав. Вид найден в Новой Зеландии в
лесной почве; размеры 160 мкм, краевые ряды МЦ не
смыкаются, снизу 4 ТЦ (по Калю, должно быть 5, но у
амфизий эта группа редуцируется вплоть до полной
утраты). У апекса 4 ФЦ, от них вниз справа идет моно-
кинета (ВЦ) почти на всю длину тела; буккальный
циррус не замечен. Вероятно, описание и рисунок не-
точные, но это амфизиеллида. Дражеско (Dragesco,
1960) сообщает о находке вида в псаммоне Женевско-
го озера, без рисунка; размеры 100 мкм, зоохлорелл
нет, имеется 3 ТЦ, 5 ФЦ — это особая «мезопсаммон-
ная форма» вида, отличающаяся от типовой. Возмож-
но, распространение настоящей Т. oblonga, как и мно-
гих южных родов, ограничено континентами Гондва-
ны. Род нельзя включать в определительные таблицы,
можно приводить в приложении как неточно описан-
ную форму сем. Amphisiellidae.
Род Nudiamphisiella Foissner, Agatha,
Berger, 2002
Типовой вид N. terricola из террофитона. Тело
вытянутое, с 2 маргиналиями, без ТЦ и СТЦ, с группой
каудалий; перистом короткий, справа несколько ФЦ, 2
очень короткие мембраны, БЦ и ряд СФЦ; он продол-
жается ниже с перерывом и смещением влево чуть бо-
лее длинного сегмента. Фактически признак рода —
разрыв амфикинеты и отсутствие ТЦ.
Род Afroamphisiella Foissner, Agatha
et Berger, 2002
Типовой вид A. multinucleata, также A. abdita
(Lamtostyla abdita F., 1997). A. multinucleata — амфи-
зиеллиды из пересоленной почвы в Намибии; ядра мно-
гочисленные, мукоцисты в продольных рядах, амфинема
прямая, не прервана. Имеются краевые маргиналии,
1 или несколько ФЦ, в целом кинетом редуцирован —
нет каудалий, ТЦ, СТЦ и БЦ (отсутствие буккалий —
редкий случай у гипотрих); нет циррусов группы ВЦ
ниже рта. У этого вида при делении амфинема образу-
ет зачатки ротовой цилиатуры, а у Orthoamphisiellidae
Eigner, 1997 этот ряд не является стоматогенным.
Сем. Epiclintidae Wicklow et Borror, 1990
Вентральная цилиатура состоит из большого числа
диагональных рядов циррусов, фронтальная цилиату-
ра ограничена несколькими мелкими циррусами; ТЦ в
вытянутом продольном ряду; диаксонемы нет. При де-
лении многочисленные зачатки (поля кинетосом) от 3
до 7, образуют вентральные кинеты.
Род Epiclintes Stein, 1863
Типовой вид Trichodafelis Muller, 1786. Вокруг
названия вида полемика, не закончена и сейчас. По
Аэшт, современные авторы предпочитают название
Е. ambiguus (Muller) Butschli, но его нельзя применять,
поскольку Trichoda ambigua Muller — вид гетеротрих
рода Spirostomum (S. ambiguum), что принято всеми
цилиатологами. Третье название — Oxytricha auricula-
ris С. et L., 1858 (Epiclintes auricularis in Stein, 1867).
По Боррору (Borror, 1972), дальнейшие синонимы —
E. vermis Gruber, 1888; E. pluvialis Smith, 1900; E. cau-
datus Bullington, 1940. Название E. auricularis было
широко принято в XIX в., но после монографии Бючли
(Butschli, 1889) было принято название Е. ambiguus.
Правильное название типового вида восстановлено
(как comb, п.) недавно. Валидными видами рода счита-
ются также виды Е. caudatus и Е. radiosa, хотя послед-
ний вид всегда относили к Mitra. Типовой вид — очень
крупные формы (300 мкм) с тонким червеобразным те-
ТИП CILIOPHORA. КЛАСС SPIROTRICHEA
461
лом, с цефализацией и длинным сократимым «хвос-
том»; имеется 2 краевых маргинальных ряда, смыкаю-
щиеся снизу, непропорционально длинный ряд ТЦ до
середины тела, и диагональные ряды по всему телу, до
апекса; у конца хвоста — группа каудалий; передние
циррусы не дифференцированы на ФЦ и БЦ. Особи
очень сократимые, редкие в морском бентосе. У раз-
ных рас находят 4 ряда циррусов кроме маргинальных
или 10 рядов. Ядра нетипичные, 75—140 элементов
(нодул) в нескольких продольных цепочках.
Epiderites Marschall, 1873 — ненужное замещаю-
щее название для Epiclintes Stein, 1863.
Diplagiotricha Bory, 1824 — это название имеется в
книге Бючли (Biitschli, 1889), но по Аэшт, Бори не
предлагал такого рода, только установил группу (се-
мейство?) «.Oxitricha diplagiotriques» для Trichoda ат-
bigua Muller.
Claparedia Diesing, 1866 — гомоним, непригодное
название; считается синонимом Epiclintes, но с обозна-
чением Янковским (1979) типового вида Oxytricha ret-
ractlis С. et L., 1858 — это синоним Mitra или Urolep-
tus.
Сем. Kahliellidae Tuffrau, 1979
Примитивные гипотрихи без трансверсальных цир-
русов, без фронталий или с их слабой дифференциров-
кой; в дополнение к краевым маргиналиям на венте
расположено разное количество параллельных рядов с
циррусами такого же типа; нет диаксонемы. Достовер-
но сюда относятся роды Kahliella, Engelmanniella, De-
viata, Neogeneia и род Perisincirra, валидность которо-
го была ранее под сомнением (Foissner et al., 2002).
Род Cladotricha Gajewskaja, 1926
По А')Щ'Г, типовой вид рода — С. koltzowi по обо-
значению Янковского (1979), считавшего тип рода си-
нонимом вида Uroleptus packi (Calkins, 1919); против
этой синонимии высказались Боррор и Эванс (Borror,
Evans, 1979). В первоописании типового вида выделе-
ны «морфы» С. koltzowii var. lata, var. spiralis, «var.?
morpha?» (так) pisciformis, var. gigas, forma typica, mor-
pha minima — в зависимости от солености среды в ак-
вариумах. Это не виды, вид один, поэтому типовой вид
рода указан — не по последующему обозначению Ян-
ковским, как ошибочно считает Аэшт, а по монотипии.
Боррор и Эванс (Borror, Evans, 1979) переописали вид
при импрегнации протарголом — это тонкие вытяну-
тые формы с 4 ядрами в цепи, по краям с рядами МЦ,
на венте 1 длинный ряд циррусов справа и 1 короткий
продольный ряд у апекса; у полосы мембранелл 2 цир-
руса, вент вне этих рядов без цилиатуры; нет ТЦ и кау-
далий. Каль (Kahl, 1932) также предполагал синони-
мию или близость с Strongylidium packi, и в каталоге
гипотрих Боррора (Borror, 1972) повторена эта синони-
мия типового вида (Strongylidium packi = Uroleptus
packi).
Первоописание вида столь плохое, что он вообще
неопределим. Типовой вид выделен Гаевской из соле-
ных озер у Севастополя. Плохое описание морфологии
вида создало трудности для последующих авторов; в
соленых озерах позже нашли виды С. variabilis Ruinen,
1938; С. halophila Wilbert, 1995, но признаки С. koltzo-
wii оставались неизвестными до статьи Боррора и
Эванса (Borror, Evans, 1979). Вероятно, С. variabilis от-
носится к новому роду.
Род Deviata Eigner, 1995
Типовой вид D. abbrevescens. Тело вытянутое,
2 длинных ядра в цепи; на венте маргинальные ряды
и 3 вентральных (левый ряд укорочен), на дорсуме
2 маргинальных ряда (дорсальный и вершина правого
вентрального); нет ТЦ и каудалий; спереди обособле-
ны ФЦ, ниже циррусы расположены без четкого по-
рядка; вероятно, есть один буккальный циррус.
Род Perisincirra Jankowski, 1979
Типовой вид Uroleptus kahli Groliere, 1975. Из
болота во Франции; тело очень тонкое и длинное, с уз-
ким коротким перистомом, по краям тела пары МЦ;
нет трансверсалий и каудалий; на уровне перистома
справа лишь несколько циррусов. При первоописании
вид отнесен одновременно к Uroleptopsis (U. kahli Gro-
lere, 1975). Точной схемы кинетома нет, поэтому были
трудности с таким типовым видом; род Perisincirra
был принят, включал ряд видов, затем перешедших в
состав Hemisincimr, сейчас он восстановлен вновь и
включает виды, несходные с типовым, например
Р. longicirrata Foissner, Agatha et Berger, 2002 и сход-
ные — P. paucicirrata F., A. et B., 2002. Каудалии име-
ются и, видимо, не были замечены и у типового вида,
но ТЦ и вентральных рядов нет, это признак рода.
Род Engelmanniella Foissner, 1982
Типовой вид Uroleptus mobilis Engelmann, 1862.
Очень крупный вид (300 мкм) из пресных вод с гибким
змеевидным телом, 6 макронуклеусами в линии, ко-
ротким перистомом; отмечены циррусы по краям все-
го тела. Позже описаны Uroleptus halseyi Calkins, 1929
и U. mobilis var. americanus Calkins, 1929 с большим
числом ядер в цепочке; это вероятные синонимы типо-
вого вида.
На дорсуме Е. mobilis полный и укороченный ряд
щетинок и ряд маргиналий, на венте 2 краевых ряда
МЦ и параллельно им, близко к краям тела по одному
ряду ВЦ. На «хвосте» мелкие циррусы — ТЦ или кау-
далии; спереди 3 ФЦ, буккальный циррус и продоль-
ная линия из 3 циррусов; ядра многочисленные. Типо-
вой вид очень изменчивый, морфология меняется при
долгом культивировании. Пока род числится в сем.
Kahliellidae, родственные связи не выяснены.
Род Kahliella Corliss, 1960
Замещающее название для гомонима Kahlia Hor-
vath, 1932.
462
ALVEOLATA
Типовой вид Kahlia acrobates Horvath, 1932.
Другие включенные виды — К. bacilliformis (Gelei,
1954) и К. costa la (Kahl, 1932). Хорват различал также
подвид К. acrobates var. simplex (Kahliella simplex Hor-
vath in Corliss, 1960). В каталоге Боррора (Borror, 1972) род
включает также К. multiseta Dragesco, 1970 и К. zignis
(Uroleptus in Entz, 1884). Признак рода — равномерный
(у типового вида) или почти равномерный (у К. multi-
seta) ресничный покров вента; продольные ряды цир-
русов неотличимы от краевых маргиналий, нет ТЦ и
каудалий, но у вершины тела дифференцированы ФЦ
и ряд других циррусов; вероятно, 2 цирруса около по-
лосы мембранелл можно считать буккальными.
Род Plesiotricha Dragesco, 1970
Типовой вид Uroleptopsis multiseta. По Аэшт,
«типовой вид сейчас считается синонимом вида Kahli-
ella microstoma Dragesco et Dragesco-Kerneis, 1986»
(правильнее наоборот). «Род неприемлемый, посколь-
ку был лишь условно предложен для типового вида по-
сле 1960 г. Синоним рода Kahliella по типовому виду».
В оригинале (Dragesco, 1970) новый род Plesiotricha
предложен следующим образом: «Кажется вероятно
полезным (il serait peut-etre utile) создать новый род
для этой инфузории, который мы предлагаем назвать
Plesiotricha и который характеризуется многочислен-
ными недифференцированными кинетами». Это впол-
не четкое, не «условное» выделение нового рода.
Типовой вид выделен в Камеруне; описаны типич-
ная форма и «вариетет», первая с 7 вентральными ря-
дами на равных расстояниях, вторая с продольным
ацилоном, разделяющим 3 правых и 4 левых ряда; нет
обособленных ФЦ, БЦ и ТЦ. Вопрос о синонимии ро-
дов неясен, поскольку у Kahliella обособлены крупные
ФЦ; сейчас тип рода считается валидным видом рода
Kahliella — К multiseta (Lynn, Small, 2002).
Род Neogeneia Eigner, 1995
Типовой вид A. hortualis. Вид с обособленными
ФЦ и одним буккальным циррусом, без ТЦ и кауда-
лий; в краевых рядах МЦ циррусы разрежены, вся вен-
тральная сторона полна циррусов в кажущемся беспо-
рядке. Изучение морфогенеза позволяет определить
гомологию всех циррусов и выявить на венте 7 рядов
(кроме краевых), в основном укороченных, с разре-
женными циррусами.
Род Parakahliella Berger, Foissner
et Adam, 1985
Типовой вид Paraurostyla macrostoma F., 1982;
также P. haideri Berger et Foissner, 1989. По краям тела
маргинальные ряды, нет ТЦ, есть каудалии с основа-
ниями на дорсуме; четко выражены ФЦ и БЦ, правее
одиночные циррусы; вентральные ряды короткие, раз-
ной длины; маргиналии снизу смыкаются. Это почвен-
ные виды; для аберрантного морского вида Р. marina
Foissner et al., 1982 позже предложен монотипический
род Pseudokahliella. Этот род был отделен ранее на
уровне нового сем. Parakahliellidae Eigner, 1997. Новые
виды из почв Африки — Р. halophila, Р. namibicola,
Р. binucleata (Foissner et al., 2002).
Род Fragmocirrus Foissner, 2000
Типовой в ид F. espeletiae F., 2000; также F. ter-
ricola (Buitkamp, 1977).
Почвенные виды с удлиненным телом, краевыми
маргиналиями, с несколькими БЦ короткими рядами
на уровне перистома и 1 длинным осевым вентраль-
ным рядом в 2 сегментах; есть несколько ТЦ и кауда-
лии. Этот род имеет отдельные признаки Parakahliella,
но точное положение в системе неизвестно.
Род Pseudokahliella Berger, Foissner
et Adam, 1985
Типовой вид Kahliella marina Foissner, Adam et
Foissner, 1982. Крупный вид из морского бентоса, одна
из примитивных гипотрих с большим числом (8) вент-
ральных рядов в дополнение к 2 маргинальным рядам
с более тесно сближенными циррусами. Можно заме-
тить дифференцировку поля кинет на 2 зоны — 4 пря-
мых коротких ряда правее перистома и извитые ряды с
более тонкими циррусами правее их; часть рядов захо-
дит на дорсум, несущий всего 3 кинеты с мелкими ще-
тинками. Дифференцировка кинетома особо четкая
при делении, когда остаются крупные ромбические
апикальные циррусы у протера и новообразуются у
нижней особи. Перистом крупный, до экватора тела,
с большим числом мембранелл. Сапробный вид, как
и встречающийся совместно крупный вид Ponturosty-
la naumanni (=Р. enigmatica), нередок у берегов южно-
го Крыма.
Сем. Oxytrichidae Ehrenberg, 1838
Обычно некрупные гибкие гипотрихи, величиной
40—100 мкм, редко до 300—400 мкм, с овальным те-
лом; как правило, имеется 2 ядра, реже цепочка ядер.
Много пигментированных видов — гранулы пигмента
рассеяны по кортексу или собраны в правильные ряды
между рядами циррусов или дорсальных щетинок. Ти-
пичные окситрихиды имеют по одному краевому ряду
маргиналий и небольшое число рядов на дорсуме;
часть видов с большим числом маргиналий относили к
уростилидам, но у типичных уростил имеется двойной
осевой ряд циррусов (диаксонема), отсутствующий у
всех окситрихид, — это важнейший признак семейст-
ва. Нет свойственного амфизиеллидам ряда циррусов
(амфикинеты) правее и ниже перистома, нет спирали-
зации кинет. Как правило, число фронто-вентральных
циррусов невелико — это 3 массивных фронталии, 1
или несколько буккалий, несколько циррусов в 2 груп-
пах — правее перистома и ниже рта; у постерона
трансверсалии и субтрансверсалии; нижние участки
дорсальных кинет несут несколько каудалий. Сеть ар-
гирома с мельчайшими ячейками выявляется лишь при
ТИП CILIOPHORA. КЛАСС SPIROTRICHEA
463
удачной импрегнации методом Шаттона. Семейство,
вероятно, монофилетичное, роды объединены сход-
ным типом морфогенеза при делении клеток. Процесс
конъюгации частый, хорошо изучена динамика ядер-
ных изменений у окситрих и крупных стилонихий.
Цисты с гладкой или зубчатой оболочкой, это допол-
нительный таксономический признак для дифферен-
цировки видов. Как правило, виды семейства легко
культивируются в лаборатории; стилонихии служат
одним из объектов изучения в студенческом практику-
ме по беспозвоночным. Следовало включить также ок-
ситрих и близкие роды — они предпочитают поверх-
ностную пленку культуры, и множество особей легко
перенести с пленки на предметное стекло для окраски
ядер и циррусов. Основная масса видов обитает в пре-
сной воде, террофитоне (мох и почва), морские виды
единичные. Часть видов заражается специфическими
паразитическими сукториями рода Sphaerophrya.
По Бергеру (Berger, 1999), окситрихиды — высшие
гипотрихи группы Sporadotrichina, родственны холо-
стихидам; эволюция сразу же пошла от основания дву-
мя стволами, которые дали 2 кластера родов — под-
сем. Oxytrichinae (Oxytricha, Gonostomum, Urosoma,
Tachysoma, Urosomoida, Notohymena, Cyrtohymena, Al-
lotricha) и Stylonychiinae (Sterkiella, Histriculus, Stylo-
nychia, Coniculostomum, Steinia).
Род Oxytricha Bory de Saint Vincent, 1824
Этот род (первоначальное написание Oxitricha)
был предложен для многих видов разных отрядов —
гипотрих, эуплотид, гетеротрих, и в его состав включа-
ли позже всевозможных гипотрих разных семейств.
Как типовые виды предлагали считать Oxytricha crassa
Claparede et Lachmann, 1858; О. platystoma Ehr., 1831,
ио сейчас эти виды числятся в родах Holosticha и Stei-
nia, В нарушение правил номенклатуры типовым ви-
дом признан недавно описанный вид О. granulifera Fo-
issner et Adam, 1983 (по правилам, нельзя обозначать
как типовой один из позднее описанных видов, кото-
рого нет в первоначальном диагнозе рода).
Род крупный, но ряд видов были плохо описаны и
нуждаются в повторном изучении; валидных видов не-
много. Типовой вид — узкая вытянутая форма с крае-
выми маргиналиями, соединяющимися у постерона;
имеются 3 фронталии, буккальный циррус, и 2 группы
правее и ниже перистома с несколькими циррусами в
каждой; у постерона трансверсалии и 2 субтрансверса-
лии; на дорсуме несколько каудальных циррусов. Ро-
товые мембраны почти параллельные или пересекают-
ся под небольшим углом. Между рядами щетинок рас-
положены многочисленные ряды пигментных гранул.
Род имеет космополитное распространение, виды ок-
ситрих обычны в пробах почвы, болотных мхов, в пру-
дах и озерах. Примеры видов — О. aeruginosa Wrzesni-
owski, 1866; О. balladyna Song et Wilbert, 1989; O. chlo-
relligera Kahl, 1932 (редкий случай симбиоза с
зоохлореллами, не характерного для большинства ги-
потрих); O.fallax Stein, 1859; О. faurei Tucolesco, 1962;
О. hymenostoma Stokes, 1887; О. longa Gelei et Szaba-
dos, 1950 и др. Это один из крупнейших родов в отряде
гипотрих.
Род Allotricha Sterki, 1878
Типовой вид A. mollis Sterki, 1878 по моноти-
пии. Перистом, зона мембранелл и обе мембраны как у
окситрих; состав и расположение групп вентральных и
каудальных циррусов, тип ядерного аппарата также
совпадают. Родовое отличие — наличие нескольких
рядов маргиналий справа. Несколько видов в почве и
пресной воде; кроме типового вида, хорошо изучен
вид A. antarctica, и вероятно, в этот род может быть
включен вид без кортикальных гранул, ошибочно от-
несенный к Pleurotricha — Р. variabilis Reuter, 1961.
Род Cyrtohymena Foissner, 1989
Типовой вид Oxytricha (Steinia) muscorum Kahl,
1932 по первоначальному обозначению. Относительно
крупный род (около 15 видов) в основном пресновод-
ный, исключая С. marina (Kahl, 1932) Foissner, 1989.
По краям тела по одному ряду маргиналий; топогра-
фия вентральных циррусов как у окситрих, имеются
каудалии и 5 классических групп вентралий. Родовые
признаки — резкий изгиб верхней мембраны перисто-
ма относительно почти прямой нижней мембраны, и
хорошо выраженная фибриллярная глоточная корзин-
ка. Часть видов с кортикальными гранулами. Ядра ам-
филептидные. Ранее часть видов включалась в состав
рода Steinia, имеющего такой же тип мембран.
Примеры видов — С. muscorum (Kahl, 1932); С. cit-
rina (Berger et Foissner, 1987); C. australis Foissner,
1995; C. primicirrata (Berger et Foissner, 1987); C. graci-
lis (Kahl, 1932); C. candens (Kahl, 1932); C. inquieta
(Stokes, 1887); C. (Cyrtohyroenides) aspoecki F., 2004.
Род Notohymena Blatterer et Foissner,
1988
Типовой в и д TV. rubescens; сейчас в составе рода
также N. antarctica Foissner, 1996; N. australis (Foissner
et O’Donoghue, 1990) и N. selvatica (Hemberger, 1985).
Это виды окситрихидного паттерна — имеются по
одному ряду краевых маргиналий, каудальные реснич-
ки и стандартный для окситрих набор вентралий. Осо-
бенность в форме мембран перистома — нижняя мем-
брана незначительно изогнутая, верхняя изогнута
сильнее и у вершины имеет характерный только для
этого рода сегмент — короткий ряд дисом, отклонен-
ный от мембраны. Имеются гранулы кортекса, и опре-
деление должно идти прежде всего in vivo по типу гра-
нул. Ядра амфилептидные. Отличия рода малозначи-
тельные, и это пример того, насколько далеко зашло
дробление родов у гипотрих.
Род Urosomoida Hemberger in Foissner,
1982
Типовой вид Uroleptus agilis Engelmann, 1862.
Вытянутые веретеновидные формы, внешний облик
как у Urosoma-, ядра амфилептидные, мембраны пери-
стома почти параллельные, хорошо развит циртум
464
ALVEOLATA
(корзинка глоточных фибрилл); кинетом окситрихид-
ного тина по одному ряду маргиналий, 4 группы
циррусов в аптссоме вентрально. Обычно уменьшено
число трапсверсалий. Примеры видов — U. granulifera
Foissner, 1996; U. agiliformis Foissner, 1982; U. perthen-
sis Foissner et O’Donoghue, .1990 (вид из Австралии и
южной Африки); U. dorsiincisura Foissner, 1982; U. ап-
tarctica Foissner, 1996; U. minima Hemberger, 1985.
Род Gonostomum Sterki, 1878
Типовой вид Oxytricha affinis Stein, 1859. Вытя-
нутое тело с 2 MA, краевыми маргиналиями и несколь-
кими каудалиями; мембраны перистома нетипичные
для окситрихид, наружная мембрана почти прямая и
короткая, внутренняя состоит из нескольких кинето-
сом, далеко удалена от рта. Нет циррусов ниже пери-
стома; уменьшено число трансверсалий; правее пери-
стома немногочисленные циррусы собраны в нечеткий
ряд. Из хорошо изученных видов к роду принадлежат
также G. kuehnelti Foissner, 1987 и G. gonostomoida
(Hemberger, 1985).
Род Plagiotricha Kent, 1882
Типовой вид Oxytricha strenua Engelmann, 1862.
Название рода неприемлемо как гомоним; кроме того,
это синоним предыдущего рода, поскольку Кент включил
в его состав также типовой вид рода Gonostomum —
G. affine. В определителе Бергера (Berger, 1999) вид ва-
лидный, включен в состав рода Gonostomum — G. stre-
пиит, — в основном по типу ротовых мембран; кинетом
своеобразен — нетипично расположение группы транс-
версалий в 2 продольных рядах, и очень четко выражено
линейное положение субфронталий. Род Gonostomum
с разными типами кинетома может быть сборным.
Род Urosoma Kowalewski, 1883
Типовой вид U. cienkowskii Kowalewski, 1882.
Позже сведенный в синонимы валидного вида Oxytric-
ha caudata Ehr., 1833 (U. caudata in Berger, 1999). Уз-
кие вытянутые червеобразные формы с длинным хвос-
товым отростком, частые в почве и террофитоне. По
краям тела по одному ряду маргиналий; имеется 1 бук-
кальный циррус, фронталии, группа циррусов ниже рта
и справа от перистома четкий, короткий ряд субфронта-
лий. Обе мембраны укорочены, почти параллельны.
Имеются каудалии (хвостовые щетинки) и ряд транс-
версалий. Ядра амфилептидные. Около 10 видов, к при-
меру U. macrostyla (Wrzesniewski, 1866); U. emarginata
(Stokes, 1885); U. acuminata (Stokes, 1887); U. octonucle-
ata Berger et Foissner, 1989; U. similis (Foissner, 1982).
Род Tachysoma Stokes, 1887
Типовой вид Trichoda pellionella Muller, 1773
(T. pellionellum) по последующему обозначению. Это
одна из обычнейших гипотрих со множеством синони-
мов, часто включавшаяся в состав Oxytricha. Ранние
авторы основным признаком рода считали длинные
прямые щетинки по краям тела (у этого вида нетипич-
но длинные реснички дорсальных кинет); сейчас при
импрегнации выявлено точное положение циррусов,
как у окситрих, но с коротким косым рядом субфрон-
талий. Все вентральные циррусы длинные, щетинко-
видные; нет каудалий, и это важное отличие от оксит-
рих. Ядра амфилептидные. В составе рода около 10 ви-
дов, из них при импрегнации изучены кроме типового
вида также Т. humicola Gellert, 1957; Т. terricola Hem-
berger, 1985; Т. granuliferum Berger et Foissner, 1987.
Морские виды T. rigescens (Kahl, 1932), T. ovata Song et
Wilbert, 1997 и T. dragescoi Song et Wilbert, 1997 дале-
ко уклоняются от типовой формы рода, имеют двой-
ной ряд вентралий — подобие диаксонемы. Род Meso-
tricha Kent, 1882 с типовым видом Stylonychia echinata
Claparede et Lachmann, 1858 — вероятный синоним ти-
пового вида Tachysoma, но поскольку это название
долгое время не использовалось, его объявили nomen
oblitum и отказываются восстановить как валидное
вместо синонимичного более позднего названия.
Род Australocirrus Blatterer et Foissner,
1988
Типовой вид Л. oscitans по монотипии. Почвен-
ный вид с типично «Гондванским» распространени-
ем — Австралия, южная Африка, Бразилия. Тело ши-
рокое, плоское, с массивным перистомом, длинными
параллельными мембранами; ряды маргиналий укоро-
чены, субфронталии в коротком ряду, есть циррусы
правее мембран и ниже рта; ядра амфилептидные; дор-
сум с неправильным положением щетинок и с 3 кау-
далиями.
Род Onychodromopsis Stokes, 1887
Типовой вид O.flexilis по монотипии. Также
О. kahli Sramek-Husek, 1957 (плохо изученный вид,
возможно другого рода). Некоторые описания О. flexi-
lis не относятся к этому виду, и в сущности до сих
пор нет хороших рисунков типового вида. Родовой
признак — увеличение числа рядов маргиналий
(3 справа, 2 слева), положение фронталий и субфрон-
талий в поперечных рядах, наличие короткого ряда
субперистомалий. Топография мембран перистома не
изучена.
Род Rubrioxytricha Berger, 1999
Типовой вид R. haematoplasma (Blatterer et Foissner,
1990 in Oxytricha}-, R. indica Naqvi et al., 2006; R.ferru-
ginea (Stein, 1859 in Oxytricha). Овальные формы с ам-
филептидными ядрами, уменьшенным числом кауда-
лий; маргинальные ряды длинные, почти смыкаются
снизу; мембраны длинные, слегка перекрещиваются.
Вентрум с 5 группами циррусов, не собранных в ряды
спереди. Ярко-окрашенные виды с полосами кортика-
льных пигментных гранул.
ТИП CILIOPHORA. КЛАСС SPIROTRICHEA
465
Род Parurosoma Gelei, 1954
T и no ко й в и д P. dubium Gelei, 1954, но Paruroso-
ma считалась вначале подродом рода Holosticha,
поэ тому правильное обозначение — Holosticha {Paru-
rosoma) dubium Gelei, 1954. Тело вытянутое, как у Uro-
soma, с хвостовидным отростком, перистом и ундули-
руютие мембраны как у уросомы, имеются каудалии;
послеродовые вентралии в рядах; в отличие от уросо-
мы увеличено число маргиналий — 2 справа и 2 слева.
Вид пока не изучен при окраске протарголом, известен
in пресных вод в Венгрии.
Род Pseudostrombidium Horvath,
1933
Типовой в и д Р. planctonicum Horvath, 1933 по
монотипии, из пресноводного планктона. Тело капле-
видное, заостряется кзади, с увеличенным числом мас-
сивных каудалий; мембраны перистома параллельные,
ио изогнуты; перистом обширный. Справа и слева по
одному ряду маргиналий, вентральные циррусы в не-
ясных рядах. Несмотря на важные отличия от оксит-
ркх, морфогенез при делении сходный. Редкий холод-
НОПОДНЫЙ вид из чистых вод.
Род Stylonychia Ehrenberg,
1830
'Ги новой вид S. mytilus по последующему обо-
значению. Это обычная гипотриха в настоях из пре-
сных вод. Тело крупное, с широким перистомом и об-
ширным ацилоном спереди; мембраны перистома
длинные, параллельные; по краям тела по 1 ряду мар-
гиналий. Циррусы крупные, массивные, в 6 группах —
спереди, у мембран, справа от перистома, ниже рта, и у
постерона. Вероятно, вместо перечисления групп про-
ще указывать для Oxytrichidae формулу кинетома —
А, В, С, D, Е, F (соответственно фронталии, буккалии,
субфронталии, субперистомалии, субтрансверсалии и
трансверсалии), с указанием числа циррусов в каждой
группе — в данном случае АЗ, В1, С4, D3, Е2, F5. Мар-
гиналии не смыкаются сзади; каудалии очень длин-
ные, острые.
Столь обычный вид, конечно, хорошо изучен мно-
гими авторами, но лишь недавно выяснено, что есть
2 сиблинг-вида (двойники) — собственно 5. mytilus и
5. lemnae Amtnermann et Schlegel, 1983; несмотря на
сходство, эти виды заражаются разными видами сук-
торий. Морфологические отличия небольшие, требу-
ются хорошо импрегнированные препараты — поло-
жение вершин дорсальных рядов и положение нижне-
го цирруса в группе субфронталий. Оба вида легко
культивируются, и служат объектом студенческого
практикума.
Перистом не столь непропорционально велик
у других видов рода, например у S. notophora Stokes,
1885; S. bifaria (Stokes, 1887); S. phytophaga (Gelei
ct Szabados, 1950); S. pseudograndis Wang et Nie,
1935; S. putrina Stokes, 1885; S. vorax Stokes, 1885
и др.
Род Tetmemena Eigner, 1999
Типовой видKeronapustulata Muller, 1786. Все-
гда относимый ранее к Stylonychia —- это одна из обыч-
нейших пресноводных гипотрих. В монографии Берге-
ра (Berger, 1999) род не признается валидным, но сей-
час в новой литературе название рода принято в связи
с продолжающимся дроблением известных родов от-
ряда. Вначале для этого типового вида предложено на-
звание Clara Eigner, 1997 (С. pustulata, С. vorax), но
оно непригодно как гомоним.
Перистом у Tetmemena не гипертрофирован, ти-
пичный для окситрих; мембраны как у стилонихий;
вентральные циррусы в 6 группах с такой же число-
вой формулой, как у 5. mytilus', каудалии тоже как
у стилонихий. Родовые отличия небольшие, но автор
рода считает род Stylonychia полифилетическим,
виды 5. pustulata и S. vorax неродственными виду
5. mytilus. Различия родов касаются скорее морфо-
генеза кинетома при делении, чем морфологии в
интеркинезе.
Род Coniculostomum Njine, 1979
Типовой вид Laurentia monilata Dragesco et Nji-
ne, 1971 по монотипии. Тот же вид является типовым
для нового подрода Laurosticha Jankowski, 1979 в со-
ставе рода Laurentiella', оба названия предложены в
пределах одного года, второе датируется сентябрем,
для первого выяснить месяц публикации не удалось,
поэтому я отказываюсь от приоритета и принимаю на-
звание Coniculostomum.
Крупные формы с гигантским перистомом и об-
ширной безресничной зоной спереди (ацилоном); ядро
нетипичное для окситрихид, длинная полоса из слив-
шихся нодул. Слева один ряд маргиналий, справа
они полимеризованы; мембраны прямые, длинные;
вентральные циррусы в нечетких группах, многочис-
ленные, не образуют заметных рядов. Сзади 3 длин-
ные каудалии. Южный тепловодный вид, как и С. indi-
са (Ammermann, Sapra et Schlegel, 1987 in Pleurotricha)
(синоним — C. bimarginata Kamra, Sapra et Am-
mermann, 1994). У этого вида все вентральные цирру-
сы массивные, маргинальных рядов справа только 2,
слева 1 ряд.
Род Steinia Diesing, 1866
Типовой вид Oxytricha platystoma Ehr., 1831;
этот вид был указан как типовой для Oxytricha, но для
окситрих предложено считать типовым вид О. granuli-
fera. Род Steinia не всегда признавался или сводился в
подрод рода Oxytricha, но сейчас считается валидным,
поскольку положение мембран перистома учитывает-
ся в диагностике родов гипотрих. У Steinia перистом
непропорционально велик, обе мембраны удлинены и
резко изогнуты влево, закручены около воронковид-
ной полости под апексом. Ядра и соматический кине-
том, как у окситрих, с 6 группами вентральных цирру-
сов и с одним рядом маргиналий на каждом краю тела.
Другие виды — Steinia sphagnicola Foissner, 1989 (вид
U) Зак. №4163
466
ALVEOLATA
с разрывом внутренней мембраны на 3 зоны), S. biva-
cuolata (Gelei et Szabados, 1950) из почвы, мха и пре-
сных вод.
Род Histriculus Corliss, 1960
Типовой вид Histrio steinii Sterki, 1878 по моно-
типии; первоначальное название рода, принятое в ли-
тературе — Histrio Sterki, 1878, непригодно как гомо-
ним. Частый вид в поверхностной пленке из пресно-
водных проб; особи внешне похожи на окситрих, но
лишены каудальных циррусов, и краевые ряды марги-
налий смыкаются снизу. Мембраны перистома длин-
ные, параллельные, незначительно изогнутые. Циррусы
в 6 группах, как у окситрих. Другие виды — Н. sphagni
(Stokes, 1891), Н. complanatus (Stokes, 1887), //. vorax
(Stokes, 1991), в море найден вид Н. similis (Qucnner-
stedt, 1867), но пока нет его переописания методом им-
прегнации, не доказано отсутствие каудалий.
Род Sterkiella Foissner, Blatterer, Berger
et Kohmann, 1991
Типовой вид Oxytricha cavicola Kahl, 1935.
Крупный пресноводный вид с широким телом, ядра в
виде 4 нодул, кинетом окситрихидный, дорсум с кау-
далиями. На венте краевые ряды маргиналий и стан-
дартные для окситрих 6 групп циррусов. Основной
признак рода — положение мембран; внутренняя мем-
брана продольная, слабо изогнутая, а наружная резко
изогнута, перекрещивается с внутренней мембраной.
Примеры видов — 5. admirabilis (Foissner ct Adam.
1979 = Stylonychia quadrinucleata Alekperov et Musaev,
1988); S. thompsoni Foissner, 1996; 5. terricola Berger,
1999; 5. histriomuscorum (Foissner et al., 1991); S. trlcir-
rata (Buitkamp, 1977); 5. quadrinucleatus (Sick, 1933).
Вид 5. histriomuscorum c 2 ядрами использовался
многократно для молекулярных филограмм цилиат
под непригодным названием Oxytricha trifallax Greslin
et al., 1989.
Род Parastylonychia Dragesco, 1963
Типовой в и д Р. plouneouri по монотипии. Мор-
ской вид из сапробной литорали; вид изучен при
импрегнации протарголом, но недостаточно полно,
нет картины дорсума, неясно, есть ли каудалии. Тело
овальное, крупное (200 мкм), у краев тела по одному
ряду маргиналий, не смыкающихся сзади; циррусы
вента в 6 группах, с 2 короткими рядами субперис-
томалий. Мембраны перистома длинные, параллель-
ные. Имеется 4 ядра в продольном ряду, как у стер-
киеллы.
Род Pleurotricha Stein, 1859
Типовой вид Stylonychia lanceolata Ehr., 1835.
Вид с 2—3 рядами правых маргиналий и 1 рядом сле-
ва. Мембраны перистома длинные, резко изогнутые;
каудалий нет; вентралии в 7—8 группах, с нечеткими
рядами правее и ниже перистома. Отсутствие кауда-
лий подтверждено рядом авторов, это важный признак
рода у окситрихид. Ядра амфилептидные. Цисты с
узорчатой стенкой, покрыты короткими шипами.
Обычный вид, вероятно идентичный с описанным по-
зже видом Pleurotricha tchadensis Dragesco, 1972. Вто-
рой валидный вид — Р. grandis Stein, 1859 — редкий
пресноводный вид, не изученный должным образом
после первоописания, хозяин неопределенных сукто-
рий рода Sphaerophrya. Морской вид Р. planensis Fer-
nandez-Leborans, 1984 с каудалиями и длинным осе-
вым рядом циррусов может относиться к амфизиел-
лидам.
Род Rigidocortex Berger, 1999
Типовой вид Australocirrus octonucleatus Fois-
sner, 1988 по монотипии. Из почвы в Австрии и тропи-
ческих странах. Тело широкое, ядра в продольной по-
лосе, не соединены в цепочку; имеются каудалии; края
тела с одним рядом маргиналий. Вентральный кине-
том в 6 стандартных группах, дорсум с необычным по-
ложением рядов щетинок. Мембраны перистома длин-
ные, почти параллельные.
Род Onychodromus Stein, 1859
Типовой вид О. grandis. Крупный пресновод-
ный вид с прямоугольным телом, большим перисто-
мом, длинными параллельными мембранами; 4 ядра в
осевой линии, не соединены в цепочку. Дорсум неров-
ный, с характерными выступами. Имеются каудалии;
по краям тела по одному ряду маргиналий; вентраль-
ные циррусы немногочисленные, с характерным рас-
положением в коротких рядах. Подробно изучен мор-
фогенез и онтогенетически идентифицированы все
циррусы вента как остатки 6 продольных рядов цирру-
сов предка.
В торой вид О. quadricornutus Foissner, Schlegel et
Prescott, 1987 (=Styx Lin et Prescott, 1985) явно родст-
вен с предыдущим видом, но отличия очень велики и
заставляют выделить новый род Styxophrya Foissner
et al., 2004 для указанного типового вида. Полимеризо-
ваны ряды циррусов правее перистома и ряды дорсаль-
ных щетинок; ядра в виде длинной продольной цепочки
нодул; дорсум с выростами и шипами. Вероятно имеют-
ся по одному краевому ряду маргиналий, а многочислен-
ные ряды циррусов соответствуют субфронталиям и бук-
кальным циррусам. 11азвание Styx sp. было предложено
без диагноза и описания вида, и это двойной гомоним,
поэтому неприменимо для названия нового рода. Вид
Onychodromus indica Kamra et Sapra, 1993 считается си-
нонимом типового вида, но в любом случае должен
быть перенесен в сос тав нового рода.
Род Laurentiella Dragesco et Njine,
1971
Типовой вид Laurentia macrostoma Dragesco,
1966 по монотипии. Название Laurentia — гомоним,
заменено на Laurentiella. Бергер (Berger, 1999) свел
ТИП CILIOPHORA. КЛАСС SPIROTRICHEA
467
указанное название типового вида в синонимику ва-
лидного вида Paruroleptus strenuus Dingfelder, 1962
(Lauretiella strenua) и ликвидировал также вид Lauren-
tia acuminata Fedriani, Martin et Perez-Silva, 1976 как
синоним.
Крупный пресноводный вид из временных водо-
емов (лужи, канавы) с коническим телом, гигантским
перистомом, неправильным положением дорсальных
щетинок; наружная мембрана длиннее внутренней; не-
сколько ядер не соединены в цепочку. Можно разли-
чить 2 краевых ряда маргиналий, длинный ряд про-
дольных трансверсалий, и сложную систему вентра-
лий, в которой полимеризованы и собраны в длинные
косые ряды циррусы между фронталиями и субтранс-
версалиями. Цисты покрыты массой длинных шипов.
Род Pattersoniella Foissner, 1987
Типоной вид Р, vitiphlla но монотипии. Из поч-
вы в Австралии и на островах Океании. Крупный вид с
большим числом ядсрпых подул, крупным перисто-
мом; мембраны длинные, пересекаются, изогнутые;
дорсум с неправильным положением циррусов. Края
тела с одним рядом маргиналий; фронталии и букка-
лии собраны в четкие ряды, трансверсалии многочис-
ленные, остальные циррусы расположены парами на
участке от фронталий до двух субтрансверсалий.
В морфогенезе выявляется положение циррусов в 10 ря-
дах, 9 из которых соответствуют 9 трансверсалиям.
Приложение к сем. Oxytrichidae — несколько ро-
дов, филогения которых пока неизвестна.
Род Ancystropodium Faure-Fremiet, 1907
Типовой вид Л. maupasi по монотипии. Мало-
изученный аберрантный вид гипотрих из пресных вод.
Тело бочонковидное, сужается кзади и переходит в
очень длинный тонкий сократимый прикрепительный
отросток, который может полностью втягиваться в
тело, его конец несет часть циррусов. Перистом апи-
кальный, мембраны параллельные, маргиналии с
длинными щетинковидными циррусами, остальные
циррусы в коротких рядах, без изучения морфогенеза
их нельзя точно идентифицировать. Вид валидный и
необычный, но пока не был повторно изучен.
Род Gastrostyla Engelmann, 1862
Типовой вид G. steinii Engelmann, 1862. Это
один из обычнейших видов гипотрих в настоях мхов,
опавших листьев, в пробах из прудов, вид хорошо изу-
чен при импрегнации. Внешне особи похожи на оксит-
рих, но имеют 4 ядра в продольной линии и лишены
каудалий. Перистом относительно небольшой, мемб-
раны равной длины, пересекаются; по краям тела ряды
маргиналий; дорсум с четкими рядами длинных ще-
тинок, на венте 7 групп циррусов, частично в рядах;
характерен длинный ряд циррусов от рта до субтранс-
версалий. Обычный космополитный вид всегда имеет
синонимы. Не зная точной морфологии G. steinii, срав-
нивая некачественные рисунки, этот вид описывали
под 7 другими названиями и относили к разным родам
гипотрих. Другие достоверные виды — G. dorsicirrata
Foissner, 1982 (аберранты с полимеризацией каудалий
и амфизиеллидным рядом циррусов); G. muscorum
Kahl, 1932; G. mystacea (Stein, 1859); G. minima Hem-
berger, 1985; морской вид G. pulchra (Perejaslawzewa,
1886).
Род подразделен недавно на несколько подродов
(Foissner et al., 2002) — типовой подрод Kleinstyla
(тип рода G. bavariensis Foissner, Agatha et Berger,
2002) и Spetastyla (тип рода Oxytricha mystacea Stein,
1859 {Gastrostyla in Sterki, 1878) в основном по мор-
фогенезу.
Род Nothopleurotricha Diesing, 1866
Типовой вид Pleurotricha setifera Engelmann,
1862 по монотипии. Пресноводный вид с параллель-
ными мембранами узкого перистома, амфилептидны-
ми ядрами; имеются ряды маргиналий, фронталии,
буккалии, и длинный косой ряд циррусов от уровня
мембран до субтрансверсалий. Пока нет повторного
описания вида, точная картина вентрального кинетома
неизвестна, в частности наличие каудалий. В опреде-
лителе Бергера вид включен в состав Gastrostyla —
G. setifera (Engelmann, 1862) Kent, 1882.
Морской вид Oxytricha stenocephala Borror, 1963 c
четкой цефализацией плохо изучен и несомненно не
относится к роду Gastrostyla, в который он включен в
книге Бергера. Сейчас для него предложен новый род
Hemigastrostyla Song et Wilbert, 1997.
Род Paraurostyla Borror, 1972
Типовой вид Urostyla weissei Stein, 1859. Обыч-
ный в пресных водах крупный вид с темным от массы
включений мешковидным телом; многократно описан
под разными синонимическими названиями, но сейчас
очевидно, что имеется как минимум 2 сиблинг-вида,
как у стилонихий, и один из синонимов может быть ва-
лидным. Перистом относительно крупный, с парал-
лельными изогнутыми мембранами; слева 1 ряд марги-
налий, справа несколько рядов, и в узкой полосе меж-
ду ними идут вентральные циррусы. Можно различить
обособленные фронталии, субфронталии в коротком
ряду и 1 буккалию, но ниже рта рисуют или корот-
кие маргиналии, или ряд субперистомалий. Трансвер-
салии многочисленные, в длинном косом ряду. Име-
ется 2 ядра, в отличие от многоядерной Urostyla gran-
dis со сходной формой тела. Вид легко культивируется
и служит объектом работ по физиологии и морфоге-
незу.
На культурах этого вида мной отработан новый ме-
тод элективной окраски кинетома гипотрих (фиксация
спиртовым раствором фосфорно-вольфрамовой кисло-
ты, отмывка, окраска фиолетовыми чернилами, отмыв-
ка, изучение при иммерсии в пленке густого сахара).
Валидными видами рода Бергер также считает Pa-
raurostyla granulifera Berger et Foissner, 1989 и P. poly-
nucleata Alekperov, 1993.
468
ALVEOLATA
Род Ponturostyla Jankowski, 1989
Типовой вид Paraurostyla enigmatica Dragesco
et Dragesco-Kerneis, 1986 = Mixotricha enigmatica.
Название Mixotricha — гомоним, есть род флагеллат
Mixotricha в австралийских термитах, поэтому
было заменено на Ponturostyla. Типовой вид описан
из солоноватых вод западной Африки, позже найден
в Китае; никто не сравнивал Р. enigmatica с Urostyla
naumanni Lepsi, 1935 с румынского берега Черно-
го моря. Эти виды идентичные, поэтому правиль-
ное название типового вида Ponturostyla naumanni
comb. n.
Это крупные мешковидные гипотрихи, обычные в
Крыму у Алушты, легко культивируются в чашках
Петри на рисе в морской воде. Ядра многочислен-
ные — 6—8 нодул в продольной линии, не соединены
в цепочку. Коричневые гранулы в рядах на венте, в
беспорядке на дорсуме. Маргиналии полимеризованы
с обеих сторон тела, как у уростилы, но нет диаксоне-
мы, поэтому род относится к окситрихидам. Различи-
мы стандартные для окситрих 6 групп вентральных
циррусов; мембраны перистома длинные, пересекают-
ся; каудалий нет; дуга мембранелл не прервана. В со-
став рода предлагалось включать также пресноводный
вид Pleurotricha grandis Stein, 1859, но он пока не вы-
делен в культуру и не изучен при импрегнации протар-
голом.
Род Vermioxytricha Foissner, Agatha
et Berger, 2002
Типовой вид V. arenicola; также V. muelleri
(=Hemisincirra muelleri F., 1986). Узкие червеобразные
формы с крайней редукцией цилиатуры, что нетипич-
но для окситрихид; обитатели почвы. АЗМ разорвана
на 2 сегмента, боковой и апикальный; мембраны пери-
стома мелкие, параллельные; ФВЦ в небольшой груп-
пе около мелкого перистома. Нет каудалий, ТЦ, СТЦ и
нет циррусов на всем венте ниже рта, кроме 2 стан-
дартных маргиналий.
Род Apourosomoida Foissner, Agatha
et Berger, 2002
Типовой вид A. halophila; вероятно к этому
роду относится также вид Urosomoida minima Hem-
berger, 1985. Тип рода из почвы, это вытянутые фор-
мы с небольшим апикальным разрывом полосы
мембранелл, 2 короткими мембранами мелкого пери-
стома. Ряды маргиналий короткие; имеются ФЦ,
ряд ФВЦ, 1 БЦ, короткий осевой ряд циррусов ниже
рта; сзади только 1 ТЦ и дорсально нетипичная груп-
па каудалий.
Род Parentocirrus Voss, 1997
Типовой в и д R hortualis. Тело овальное, по кра-
ям вента — маргиналии, не смыкающиеся снизу; нет
ТЦ; на дорсуме основания каудалий; имеются крупные
ФЦ, ряд буккальных циррусов и несколько циррусов
правее; вдоль тела справа идут 2 полных ряда ВЦ
и слева несколько циррусов, остаток 2 утраченных
рядов. Нижние циррусы этих рядов укрупнены и
расположены так, как ТЦ, но циррусы 2 правых рядов
не обособлены. Второй вид Р. brasiliensis Da Silva Pai-
va et Da Silva Neto, 2004 отличается размерами
тела, числом вентральных циррусов и дорсальным
паттерном.
Род Erimophrya Foissner, Agatha
et Berger, 2002
Типовой вид£ glatzeli, такжеЕ. arenicola (Fois-
sner et al., 2002). Узкие змеевидные почвенные виды с
мелким перистомом и со значительной редукцией ци-
лиатуры; сохранены краевые маргиналии, несколько
неравных дорсальных кинет; ниже перистома только 1
циррус, справа неясные короткие ряды не амфизиел-
лидного типа; ядра амфилептидные
Род Anatoliocirrus Ozbek et Foissner
in Foissner et al., 2002
Типовой вид A. capari. Из почвы в Турции, На-
мибии и Коста-Рике. Положение рода неясное, в Рага-
kahliellidae или Oxytrichidae. Крупный вид с широким
телом, полным набором циррусов — маргиналии R2,
L4, буккалия, фронталии, СТЦ, ТЦ, необычные ряды
каудалий; внутренняя мембрана перистома вероятно
фрагментирована, наружная необычная, в виде длин-
ной прямой поликинеты. Вдоль ацилона от уровня рта
идет длинная двойная кинета (не диаксонема), выше
рта эго линия одиночных циррусов.
Род Etoschothrix Foissner, Agatha
et Berger, 2002
Типовой вид E. terricola. Из почвы в ЮАР;
крупный вид (до 186 мкм) с многочисленными ядрами
(до 60), с редукцией кинетома — вокруг широкой вен-
тральной стороны по I ряду маргиналий, снизу немно-
го ТЦ и каудалий, ниже перистома 2 цирруса, справа
от перистома несколько циррусов в нечетких рядах.
Важный признак разрыв зоны мембранелл; нижний
прямой сегмент и удаленная от него верхняя дуга с
мелкими циррусовидпыми мембранами. Ундулирую-
щие мембраны параллельные, разного строения. На
дорсуме только 1 ряд щсгипок.
Род Erniella Foissner, 1987
Типовой вид Е. filiformis, второй вид Е. wilberti
Lin et Song, 2004 — крупный вид с разрывом полосы
мембранелл; верхние фрагменты создают подобие
коронального ряда циррусов. Имеется 2 маргиналии,
2 диагональных вентральных ряда справа; спереди
1 БЦ и 3 ФЦ, ниже рта 1 ВЦ. Нет каудалий; сохранена
короткая полоска из нескольких ТЦ и СТЦ.
ТИП CILIOPHORA. КЛАСС SPIROTRICHEA
469
Род Wallackia Foissner, 1976
Типовой вид W. schiffmanni. Маргинальные
ряды разрежены, на венте 2 продольных биполярных
ряда, 3 четкие ФЦ, двойной ряд циррусов вдоль поло-
сы мембранелл; ТЦ нет, на конце тела длинные пря-
мые каудальные щетинки. На дорсуме 3 ряда длинных
щетинок (короче каудальных). Второй вид W. bujorea-
ni Berger et Foissner, 1989, вероятно, имеет трансверса-
лии; детальное описание вида см. Фойсснер с соавт.
(Foissner et al., 2002).
Род Trachelochaeta Sramek-Husek, 1954
Типовой вид T. bryophila (по ошибке назван там
же Т. sphagni). Узкая вытянутая гипотриха(80—ПО X
25—35 мкм) с 2 короткими рядами МЦ, между ними
2 продольных ряда ВЦ; имеются трансверсалии и
4 очень длинные каудальные щетинки; передняя поло-
вина тела сужена и оттянута, как хоботок, несет двой-
ной ряд из пар циррусов от апекса до рта; у апекса
2 группы ФЦ. Дорсальный кинетом не описан, но зари-
сован ряд длинных щетинок только вдоль правого края
тела. Это очень своеобразный род неясного положе-
ния; по Боррору (Воггог, 1972), в составе окситрихид,
но в монографии Бергера (Berger, 1999) род не рас-
сматривается, поскольку нет подтверждения данных
по морфологии типового вида.
Род Gigantothrix Foissner, 1999
Типовой вид G. herzogi. Из почвы в Кении.
Крупные (300 X 160 мкм) эллипсоидные особи с лен-
той из нссосдинснных овальных ядер; дорсум с рядами
щетинок неравной длины, местами в беспорядке; на
венте 15 рядов, 1 Христом крупный, с перекрестом рав-
ных по длине мембран; мембранеллы верхнего и пра-
вого сегмента АЗМ очень мелкие, как циррусы, мемб-
ранеллы продольной левой полосы широкие. Увеличе-
но число всех компонентов вентральной цилиатуры —
буккальных циррусов, фронто-вентралий (корона и
мелкие диагональные ряды), парамаргиналий; слева не-
широкий ацилон. Несмотря на крупные размеры, нет
TII, СТЦ и каудалий. Предположительно этот род при-
надлежит к подгруппе стилонихиин надсемейства Оху-
li ichoidea; детали морфогенеза, противоречащие этому,
могут бы ть результатом независимой конвергенции.
Сем. Keronidae Dujardin, 1841
Имеются маргиналии и на венте косые параллель-
ные ряды циррусов; нет стандартной дифференциров-
ки циррусов на фронтальные, буккальные, субфрон-
тальные; у апекса дуговидный ряд циррусов под поло-
сой мембранелл. Род Кегопа в монографии Бергера
(Berger, 1999) рассматривается в составе окситрихид, в
Traite (Tuffrau, Fleury, 1994) в сем. Keronidae (Кегопа и
Keronopsis), у Линна (Lynn, 2002) также среди керо-
нид, включающих 3 рода — Кегопа, Keronopsis и Рага-
holosticha.
Род Кегопа Muller, 1786
Род с очень трудной таксономической историей —-
Мюллер описал 14 видов в основном неопределимых;
понятие о типовом виде тогда не существовало. Не-
сколько видов, например Кегопа pustulata, перешли в
другие роды, остальные остались невалидными. Эрен-
берг (Ehrenberg, 1838) открыл цилиат на гидрах и
включил их в род Кегопа (К. polyporum), хотя у Мюл-
лера уже был этот вид (Cyclidum pediculus), зарисован-
ный столь же плохо, как и все остальные открытые им
виды. Оба вида нельзя признать типовыми для Кегопа,
поскольку их не было в первоначальном составе рода.
Янковский (1979) предложил использовать название
Alastor Perty, 1852, предложенное специально для вида
с гидр, но, по Аэшт, это гомоним. В виде исключения
С. pediculus был объявлен типом рода Кегопа Muller,
1786 — К pediculus (Muller, 1773) Blochmann, 1886.
В литературе в равной мере использовались названия
К pediculus и К polyporum, но сейчас принято только
первое. Вид Peritromus hydrarum Chardez, 1983, по
Бергеру (Berger, 1999), — синоним типового вида ке-
роны, плохое описание этой гипотрихи; симбионты
гидр внешне сходны с морскими спиротрихами Perit-
romus, имеющими 2 ядра, но у них разный паттерн ци-
лиатуры.
Типовой вид — крупные почковидные плоские ци-
лиаты с 2 ядрами, медиальной вакуолью, дорсум с
большим числом продольных кинет, что редко встре-
чается у гипотрих; несколько каудалий закреплены до-
рсально. Вент с 2 маргиналиями, 5 ТЦ и с 5 параллель-
ными извитыми рядами одинаковых циррусов, направ-
ленными диагонально; обособлена мелкая группа
буккальных циррусов и дуговидный ряд ФЦ вдоль
апикальной части перистома. Вид не встречается вне
хозяина, не питается эпителием — это «чистильщики»
(cleaners) или фильтраторы. Гидры обитают на всех
континентах, но Кегопа известна только на гидрах Ев-
ропы, США и Китая. На эндемичных гидрах Байкала
нет кероны и триходин, но они всегда заражены тетра-
хименами.
Род Keronopsis Penard, 1922
Типовой вид К helluo. По Аэшт, синонимы
рода — Paraholosticha и Estuaricola, но оба этих назва-
ния не имеют никакого отношения к Keronopsis s. str.
(с диагнозом по типовому виду). Морфологию типово-
го вида игнорировали, в состав рода включалось мно-
жество видов, например червеобразные морские фор-
мы с диаксонемой, которой нет у К helluo', сейчас род
очищен от посторонних видов и вновь стал моноти-
пичным. К helluo — очень крупный редкий вид из
мхов (250—300 мкм); дорсальный кинетом не описан,
ядра в виде цепочки овальных нодул, кинеты спираль-
ные; имеются краевые МЦ (правый уходит на дорсум),
ряд из многочисленных мощных ТЦ, 2 диагональных
ряда ВЦ, удаленные один от другого (не диаксонема)
от апекса до нижней трети тела, корона циррусов —
дуга вдоль апекса — и ряд мелких буккальных цирру-
сов вдоль правой стенки перистома. В каталоге гипо-
трих Боррора (Воггог, 1972) в составе Keronopsis 17 ви-
470
ALVEOLATA
дов; кроме типа рода все виды с диаксонемой. Ограни-
чение состава рода Keronopsis вызвало проблему
устройства большого числа видов, перешедших в со-
став Holosticha или в новые роды.
Род Paraholosticha Wenzel, 1953
Типовой вид Paraholosticha herbicola К., 1932.
Род предложен Калем {Paraholosticha Kahl, 1932) без
обозначения типового вида и поэтому невалиден; Вен-
цель вторично предложил род как новый с тем же на-
званием (такую процедуру я назвал «принцип Венце-
ля»), Этот род считался синонимом Keronopsis, но за-
тем валидным родом. В каталоге Боррора (Borror,
1972) это валидный род с 7 видами {Р. herbicola, Р. al-
pestris, Р. lichenicola, Р. muscicola, Р. папа, Р. polycha-
eta, Р. vitrea) в основном из почвы и террофитона;
Р. polychaeta — морской вид. Тип рода — крупные ци-
лиаты (150—190 мкм) из мхов, с маргиналиями, 2 раз-
розненными биполярными рядами ВЦ, 2 продольными
рядами циррусов между ними и перистомом, и коро-
ной апикальных циррусов (ФЦ); нет ТЦ и каудалий.
Боррор ставил под сомнение отсутствие ТЦ у этого
рода, так как они иногда смещены к постерону и их
можно не заметить среди МЦ, но позже выяснено, что
их действительно нет по крайней мере у Р. папа. Виды
из террофитона составляют подрод Paraholosticha
s. str. с типовым видом Р. herbicola. Кинетом точно вы-
явлен у Р. muscicola, Р. sterkii и Р. vitrea.
Подрод Desicaryon Jankowski, 1979
Типовой вид Keronopsis arenivorus D., 1954 из
морского песка. Это вид такого же типа, как Paraholos-
ticha, с маргиналиями, 2 биполярными вентральными
рядами и апикальной короной циррусов, вероятно с
буккальным рядом, но в отличие от почвенно-моховых
форм с каудалиями и длинным рядом мощных ТЦ. К
сожалению, неясно, являются ли близкие вентральные
ряды независимыми (как у Keronopsis и Paraholostic-
ha) или диаксонемой с четкой координацией положе-
ния циррусов в обоих рядах. Валидность подрода зави-
сит от точного переописания вида.
Подрод Estuaricola Jankowski,
1979
Типовой вид Paraholosticha polychaeta Borror,
1966. Подрод предложен в составе Paraholosticha для
одного морского вида. По Аэшт, со ссылкой на мнение
Фойсснера, это синоним Keronopsis, но у последнего
кинеты спиральные, корональные циррусы только
справа, не в дуге, имеется длинный ряд буккальных
циррусов и нет 2 рядов циррусов под апексом. Estuari-
cola валидный род (Е. polychaeta comb, п.), как и Desi-
caryon (D. arenivorus comb, n.) — эти виды имеют ТЦ,
отсутствующие у Paraholosticha. Р. polychaeta имеет
маргиналии, 2 разрозненных вентральных ряда, длин-
ную изогнутую корону апикальных циррусов, 2 БЦ и
2 ряда циррусов правее.
Сем. Psilotrichidae Butschli, 1889
Диагноз по Боррору (Borror, 1972) — с шиповидны-
ми выростами сзади; на венте 7 слегка изогнутых
групп циррусов; послеротовой диагональный ряд цир-
русов развивается из зачаткового поля N 4; нет ТЦ.
Этот таксон включает Psilotricha и Hemiholosticha, но
диагноз относится только к типовому виду первого
рода. Тело мелкое, овальное; циррусы относительно
однотипные по размерам, в 5—10 слегка изогнутых ря-
дах; нет обособленных ФЦ; БЦ мало отличаются от
других циррусов; хорошо развита буккальная цилиату-
ра, обычно с крупной ундулирующей мембраной. Ва-
лидность семейства подтвердилась позже при изуче-
нии морфологии и своеобразного, уникального морфо-
генеза Р. succisa.
Род Psilotricha Stein, 1859
Типовой вид? acuminata Stein, 1859 из прес-
новодного бентоса; морфология изучена у близкого
вида Р. succisa (Muller, 1786 in Trichoda). Тело не вы-
тянутое, как обычно у гипотрих, незначительно сплю-
щено; вероятно, вид обитает в толще воды над дном
(эпибентос) или в планктоне. Циррусы разрежены,
сходные, ряды нечеткие, трудно гомологизировать
кинетом этой формы и стандартный паттерн гипотрих.
Имеются маргиналии, 3—4 ФЦ, 2 БЦ, пара до-
полнительных циррусов спереди и 3 ряда ВЦ разной
длины и положения. Нет ТЦ и каудалий. По Дингфель-
деру (Dingfelder, 1962), имеются зоохлореллы. Psi-
lotricha можно считать очень древним родом гипо-
трих.
Описано несколько видов и родов гипотрих такого
типа, часть без шиповидных выростов и с более про-
стой топографией циррусов: Р. auminata Stein, 1859;
возможные синонимы — старинные виды Т. furcifera
(М., 1773) или Т. forceps (М., 1773); Р. succisa (М.,
1786); Р. dragescoi Groliere, 1975; Balladina viridis Pe-
nard, 1922 {Psilotricha viridis in Kahl, 1932).
Род Pigostyla Tagliani, 1922 предложен для преды-
дущего вида {Pigostyla viridis) и не признан Калем
(Kahle, 1932) и Боррором (Borror, 1972) при ревизии
гипотрих как синоним рода Psilotricha. Но вид валид-
ный в составе рода Psilotricha. По Боррору, вид имеет
маргиналии, 2 ряда ВЦ справа и один короткий ряд под
перистомом; нет ФЦ и дополнительных циррусов, нет
буккальных циррусов; если описание правильное, это
вид особого подрода или рода.
Род Hemiholosticha Gelei, 1954
Типовой вид Я. viridis. В каталоге Аэшт валид-
ный род, но всеми признан синонимом рода Psilotri-
cha', поскольку название вида гомоним, оно было заме-
нено новым — Psilotricha geleii Stiller, 1960. Это мел-
кая форма (45 X 35 мк) с панцирем, с 2 дорсальными и
2 боковыми ребрами, 2 рядами маргиналий и 3 вент-
ральными рядами циррусов; на дорсуме 3 ряда щети-
нок; цитоплазма с зоохлореллами. Постерон без вырез-
ки и краевых зубцов.
ТИП CILIOPHORA. КЛАСС SPIROTRICHEA
471
Род Urospinula Corliss, 1960
Типовой вид Urospina bicaudata Gelei, 1944.
Urospinula — замещающее название для гомонима
Urospina Gelei, 1944. Сейчас типовой вид считают си-
нонимом вида Psilotricha succisa, поэтому род Urospi-
na невалидный. При замене названия рода кроме типо-
вого вида были включены также виды U. calcibia Ge-
lei, 1954 и U. sinistrocaudata Gelei, 1954, но их считали
разновидностями типового вида Psilotricha bicaudata
var. calcibia и var. sinistrocaudata.
Сем. Spirofilidae Gelei, 1929
Временная группа для объединения родов со спи-
ральными рядами циррусов — изогнутыми или пере-
крученными вокруг тела. Линн (Lynn, 2002) считает
семейство в предлагаемом им объеме (12 родов) поли-
филетичным. Семейство было предложено только для
Spirofilum Gelei, 1929, а этот род не все авторы считают
валидным, сводят в синонимию рода Hypotrichidium
Ilowaisky, 1921. По правилам номенклатуры допуска-
ется название семейства, основанное на синониме, но
это нежелательно, и по возможности лучше этим пра-
вилом не пользоваться; например, название Gyrocoryt-
hidae долгое время применялось, но было заменено на
Caenomorphidae в связи с инвалидацией рода Gyrocorys.
Этой ситуации в данном случае легко избежать, поско-
льку типовые виды обоих родов резко отличаются и
Янковский (1979) не считает роды синонимичными.
Семейство включает бентосные и планктонные фор-
мы, и скручивание кинет может быть конвергенцией.
Род Atractos Vorosvary, 1950
Типовой вид Л. contortus. Тело вытянутое, плав-
но сужается кзади, не сплющено, с 2 ядрами и неболь-
шим субапикальным перистомом; вероятно, полоса
мембранелл укорочена, не огибает апекс. Тело скруче-
но так, что вентральные и дорсальные ряды три раза
повторяются при виде с вента. Неясно, есть ли ФЦ;
4 ряда вентральных циррусов в виде четкой полосы и
4 ряда мелких дорсальных щетинок закручены и
подходят к постерону, несущему неясно что — или ка-
удалии, или ТЦ. Гомология рядов неясна; непонятно,
почему нет левых маргиналий, имеющихся у всех ги-
потрих с самым разным типом кинетома. Можно допу-
стить (на развернутой модели с распрямленными про-
дольными рядами), что есть правая и левая полосы
циррусов с 4 рядами в каждой, в которых крайние
ряды являются маргиналиями. Вид редкий, найден в
пресноводном планктоне.
Род Mucotrichidium Foissner, Oleksiv
et Muller, 1990
Типовой вид Uroleptus hospes E., 1831. Тело вы-
тянутое, заострено сзади, с крупным перистомом; мар-
гиналии перекручены, проходят на обеих сторонах
тела; дорсальные ряды щетинок частично заходят на
вент. Имеются каудалии и ТЦ, но не в типичном поло-
жении в связи с перекручиванием тела; спереди 3 ФЦ,
буккальный ряд и 2 коротких ряда ФВЦ, от перистома
вниз идет извитой ряд ВЦ, ниже рта расположен до-
полнительный циррус. Это вид из нетипичного для ги-
потрих биотопа — обитатель мукуса на дне пресных
вод (желатиновый слой, окружающий кладки икринок
насекомых и лягушек).
Род Spiretella Borror, 1972
При ревизии гипотрих Боррор (Borror, 1972) пред-
ложил заменить гомологичное название Spiretta Gelei,
1944 новым — Spiratella Borror, 1972, с диагнозом
рода и comb. п. для типового вида Spiretta plankticola
Gelei, 1944. Янковский (1979) заметил гомонимию это-
го второго названия — есть пелагический крылоногий
моллюск Spiratella Blainville, 1817 (Pteropoda, Spiratel-
lidae); поэтому было предложено новое название Mic-
rospiretta Jank., 1975. Но сложность в том, что в одном
месте статьи Боррор предлагает название Spiretella
пот. п., (в тексте, с. 8), в другом (в каталоге, с. 12 и в
подписи к рис. 29) Spiratella пот. п. Это название так-
же дано в начале статьи: «Новые названия Spiratella и
Psammomitra предлагаются как замещающие названия
для Spiretta и Micromitra, которые должны быть убра-
ны как младшие гомонимы» (Borror, 1972. Р. 1).
Аэшт считает, что Боррор предложил род Spiretella,
a Spiratella — «misspelling», ошибка в написании, «не-
пригодное неверное написание в оригинале». Трижды
повторенное второе название — не ошибка, и именно
оно является гомонимом. Проблема в том, заменить ли
его новым или воспользоваться названием Spiretella', ве-
роятно, эту опечатку можно объявить доступным валид-
ным названием, и замена не нужна. Здесь поэтому род
приводится как Spiretella (=Spiratella, Microspiretta).
Каль (Kahl, 1935) в приложении к 4-томному опре-
делителю цилиат приводит название «Spiretta plancti-
cola gen. u. spec. v. Gelei, 1933», без диагноза, но с ри-
сунком, отсылая к статье Гелей, в которой дан этот ри-
сунок вида; поэтому вид и род можно датировать
1933 г. Род монотипичен; типовой вид — в пресновод-
ном планктоне, это крупные особи (до 160 X 90 мкм) с
2 спиральными рядами маргиналий правее и левее пе-
ристома, не достигающими постерона; в правом ряду
40 циррусов, в левом 30; спирализована и полоса с
-100 мембранеллами. Закручены кинеты дорсума — с
вента видны 3 ряда у апекса, 4 ряда длинных щетинок
снизу; вероятно, обособлена группа ТЦ.
Род Spirofilopsis Corliss, 1944
Типовой вид Spirofilum tubicolonatans Gelei,
1944. Spirofilopsis — замещающее название для гомо-
нима Spirofilum Gelei, 1944. Гелей ранее уже предло-
жил род Spirofilum Gelei, 1929 для планктонной гипот-
рихи 5. tisiae с совершенно другой организацией, и ве-
роятно забыв об этом предложил новый род с тем же
названием для бентосной формы, живущей в трубках в
перифитоне. Типовой вид — мелкая гипотриха с ци-
линдрическим телом, перистом развернут на расши-
472
ALVEOLATA
ренном антероне, на венте 2 краевых ряда и одиночные
циррусы правее рта; на дорсуме 2 продольных, слегка
спиральных ряда, непохожих на ряды мелких щети-
нок. Особи обитают в верхней части секретируемых
ими коротких тонкостенных трубок. Название вида
двойное (Spirofilum tubicola natans), что недопустимо,
поэтому было позже видоизменено. Дингфельдер
(Dingfelder, 1962), переописавший типовой вид, сво-
дит его в синонимы вида Oxytricha tubicola Gruber,
1880 — Spiroftlopsis tubicola (Gruber) Dingfelder. В спи-
ске Боррора (Borror, 1972) — Stichotricha tubicola
comb, n., т. e. род не признается валидным.
Род Urostrongylum Kahl, 1932
Типовой вид Stichotricha contorta Kahl, 1928. В
каталоге Боррора 2 вида — U. contortum (Kahl, 1928 in
Stichotricha) Kahl, 1932 и U. caudatum Kahl, 1932; типо-
вой вид по последующему обозначению первый вид;
по Аэшт, это тип рода по обозначению Каля (иначе род
был бы невалидным).
Тело вытянутое, передний и задний концы сужены
и оттянуты в виде хоботка и хвоста. Кинетом — спи-
ральный ряд, несколько раз закрученный вокруг тела;
спереди 3 ФЦ и несколько буккальных циррусов; нет
ТЦ и каудалий.
Род Strongylidium Sterki, 1878
Типовой в и д S. crassum. Сборный род, морфо-
логия типа точно не изучена; по Калю (Kahl, 1932), это
вид с диаксонемой, по другим авторам вентральные
ряды разрознены. Вид описан из пресных вод, обитает
в тонкостенных длинных трубках, в их верхней части;
тело крупное, веретеновидное, с цефализацией и уз-
ким хвостом. По схеме Боррора, имеются 2 ряда мар-
гиналий, удаленные от краев тела и извитые; спереди 3
ФЦ, 1 БЦ и 2 цирруса справа; от них начинаются 2 раз-
розненных ряда ВЦ. По другим данным нет никаких
фронтальных циррусов, есть ТЦ на конце хвоста; 2
средних ряда вентралий сближены почти вплотную, но
циррусы их отклонены в одну сторону (в настоящей
диаксонеме циррусы рядов направлены в разные сто-
роны). По схеме Каля, есть ТЦ, ФЦ и БЦ, два осевых
ряда — классическая диаксонема, все их циррусы на-
правлены в разные стороны. Если так, то этому роду
место среди Urostylidae.
В каталоге гипотрих Боррора в составе рода 10 ви-
дов и 2 синонима, включая Cladotricha koltzowii Gaj.,
1925; второй синоним (S. lanceolatum Kow., 1882) по-
зже признан валидным и переописан, валиден также
вид S. -wilberti F., 1982. У последнего вида точно нет
диаксонемы, на венте маргиналии и 3 ряда ВЦ разной
длины, имеются ФЦ, БЦ и каудальные реснички.
Род Hypotrichidium llowaisky, 1921
Типовой вид Н. conicum. Из пресноводного
планктона. Крупный вид (90—120 мкм) с гигантским
перистомом и «сокращенной» нижней частью тела —
имеет вид волчка, на уровне перистома тело сужено,
ниже-резко расширяется и вновь сужается к заострен-
ному постерону. Вдоль перистома справа 3 ряда раз-
ной длины, ниже несколько рядов закручены вокруг
тела по спирали и один ряд идет к постерону; нет обо-
собленных ФЦ, БЦ, ТЦ и каудалий.
Последующие авторы по-разному изображают
форму тела и положение рядов, поэтому описывались
разные виды (Н. geleii, Н. labiatum, Н africanum), и
проблема их валидности пока не может быть решена.
В африканской расе из Камеруна ниже перистома тело
заострено, ряды диагональные, не идут к хвосту; у
расы из Франции ряды ниже перистома короткие, пра-
вый ряд не прерван, все ряды зарисованы не так, как у
других авторов. Вероятно, имеется ряд БЦ, 2 ряда пра-
вее (один — маргинальный), и 2 ряда левее под пери-
стомом, где тело резко перекручено; между БЦ и длин-
ными рядами справа короткий ряд циррусов. У гипо-
трих форма тела может изменяться при фиксации,
отсутствие хвоста на рисунках некоторых рас может
быть артефактом, а не видовым признаком.
Род Spirofilum Gelei, 1929
Типовой вид 5. tisiae. Переописан Гелей (Gelei,
1954). Каль (Kahl, 1932) сводил этот вид в синонимы
вида//, conicum, но с этим никто не согласился, и сам Ге-
лей перенес вид в состав рода Hypotrichidium как валид-
ный вид. В первоописании действительно вид был недо-
статочно точно зарисован и Каль сомневался в его валид-
ности; но изучение вида при импрегнации окончательно
делает валидным не только вид, но и род Spirofilum.
Тело крупное (125 мкм), перистом гигантский, за-
нимает 2/3 вента, мембраны далеко расходятся одна от
другой, мембранеллы вытянутые, очень крупные. Пра-
вее перистома несколько БЦ и циррусы неясной гомо-
логии; справа ряд маргиналий, уходящий косо влево
вниз. Под перистомом 2 коротких изогнутых ряда. Нет
ТЦ, каудалий, постерон не оттянут. Внешний вид, по-
ложение и число рядов циррусов, степень их закручен-
ное™ — все это отличает Н. tisiae от Н. conicum на
уровне рода. У этах видов и Н. faurei сочетаются при-
митивные признаки кинетома с развитием особо слож-
ных фибриллярных систем в основаниях циррусов;
морфогенез кинетома проще, чем у других гипотрих,
кроме примитивной Kahliella.
Род Peritromoides Bhatia, 1936
Типовой вид A simplex — крупные гипотрихи с
коротким широким телом и небольшим каудальным
выростом; перистом узкий, левосторонний, правее в
очень широкой зоне 4 продольных ряда неравной дли-
ны; под перистомом на одном уровне расположены 5
коротких рядов на равном удалении от верхних рядов
и от постерона. Вид найден в пресноводном планктоне
в Индии. По Корлиссу (Corliss, 1979), это синоним ро-
да Onychodromus, по Янковскому (1979) — синоним
рода Hypotrichidium. Бергер (Berger, 1999) в моногра-
фии окситрихид согласен, что это не синоним Ony-
chodromus, но напоминает Hypotrichidium. Это одно из
ТИП CILIOPHORA. КЛАСС SPIROTRICHEA
473
описаний гипотрих, которому нельзя доверять. В прин-
ципе положение рядов и их обособление, как у Н. coni-
cum sensu Dragesco {Н. africanum Jank., 1979), но фор-
ма тела и величина перистома отличается.
Род Pelagotrichidium Jankowski, 1978
Типовойвид Hypotrichidium faurei Tuffrau, 1972.
По Аэшт, Янковский (1979) ошибочно датировал ти-
повой вид 1970 г. и обозначил вид как nomen nudum;
но действительно вид вначале был назван в тезисах и
лишь потом описан в статье (Tuffrau, 1972). Как и все
виды группы Hypotrichidium, это планктонный вид из
пресных вод; размеры около 280 мкм; перистом ги-
гантский, широко открытый, как у Bursaria, с обшир-
ным ацилоном и глубокой полостью; основания мем-
бран сближены. Спереди группа ФЦ и ряд БЦ; от апекса
начинаются 2 изогнутых ряда, достигающие постеро-
на. Тело ниже перистома не перекручено, ни один ряд
не переходит на дорсум. Род Pelagotrichidium при-
нят Фойсснером в книге о планктонных инфузориях
(Foissner et al., 1999).
Отряд Urostylida Jankowski, 1979
Гипотрихи с разным числом вентральных рядов
циррусов, с четко обособленными ФЦ и ТЦ; у всех ро-
дов имеется двойной осевой ряд вентральных цирру-
сов, обозначенный Янковским (1979) новым термином
«диаксонема». Эти ряды тесно сближены, циррусы на-
правлены вправо у правого ряда и влево на левом,
положение оснований координировано; в эволюции
гипотрих фактически возникла новая органелла. На
протарголовых препаратах часто красятся лишь ба-
зальные пластинки циррусов, поэтому важно изучать
живой материал или окрашивать кинетом анилиновы-
ми красителями (методы Гелей, Хорвата, Мюгард, Ян-
ковского и др.), чтобы отличить диаксонему от парных
рядов с одинаковым направлением циррусов. Морфо-
генез диаксонемы 2 типов; ряды могут быть укорочен-
ными или биполярными; у Bakuella сохранена верхняя
часть диаксонемы, нижняя превращена в серию диаго-
нальных фрагментов. Отряд включает небольшое чис-
ло родов, часть которых имеет широкое, космополит-
ное распространение в почве, пресных водах и в море.
Сем. Pseudokeronopsidae Borror
et Wicklow, 1983
Фронтальные циррусы в четком дуговидном ряду
вдоль апикальной части перистома; нет полимериза-
ции маргинальных рядов — у краев тела по одному,
редко по 2 ряда.
Род Bicoronella Foissner, 1995
Типовой вид В. costaricana. Из почвы в Цент-
ральной Америке. Крупный вид (150—200 мкм); по
краям тела по 1 ряду маргиналий, не смыкающихся
снизу; сзади ряд из 10 ТЦ и над ними 2 СТЦ (супра-
трансверзалии); спереди короткий ряд, 2 БЦ и вдоль
апикальной полосы мембранелл дуга из большого чис-
ла ФЦ. Вентральные ряды начинаются у конца зоны
мембранелл и идут вниз на 3/4 длины тела; левый ряд
у вершины образует вторую дугу коронарных цирру-
сов. Ядро распыленное — около 65 овальных нодул.
Род Tricoronella Blatterer et Foissner,
1988-
Тип о в о й вид Г. pulchra. Тело крупное, широкое,
с большим числом мелких ядер; слева одна маргина-
лия, справа ряд и фрагмент. Диаксонема длинная, до
ТЦ, с чередованием крупных циррусов правого ряда и
более мелких слева; у вершины диаксонема отделяет 3
длинных параллельных ряда, фактически 3 коронар-
ных ряда циррусов параллельно апикальной дуге мем-
бранелл. Над постероном длинный ряд трансверсалий
и 2 СТЦ; у перистома 2 БЦ; на дорсуме основания
группы каудалий и многочисленные ряды щетинок.
Род Pseudokeronopsis Borror et Wicklow,
1983
Типовой вид Oxytricha rubra Ehr., 1838. Этот
вид всегда относили к Keronopsis и к Holosticha
{Н. rubra = Н. flavorubra), но у типового вида первого
рода (К. helluo Penard, 1922) нет диаксонемы, и этот
род включает сейчас лишь несколько видов из терро-
фитона. Р. rubra — морской вид, очень обычен в про-
бах, в массе разводится в чашках Петри с частицами
детрита, обрастаний и гнилых водорослей; цвет тела
не красный {rubra), а, скорее, оранжевый и коричне-
вый; изредка встречаются бесцветные расы. Пигмент
«керонопсин» токсичен для хищников. Тело длинное,
змеевидное, очень гибкое и метаболичное. Кинетом —
краевые ряды маргиналий, группа ТЦ сзади, длинная
диаксонема от конца полосы мембранелл почти до ТЦ;
спереди диаксонема как бы продолжается 2 дугами
циррусов. У апекса также несколько отдельных цирру-
сов. Верхние дуги циррусов не вполне напоминают
«короны» Bicoronella и могут содержать разное число
циррусов; рисунки вида у разных авторов не совпа-
дают.
Род Keronopsis долгое время был сборным, вмести-
лищем множества видов, объединенных только нали-
чием диаксонемы; игнорировалось ее отсутствие у ти-
пового вида. При очистке рода многие виды перешли в
состав Holosticha, положение других видов неясное; в
составе рода Pseudokeronopsis сейчас Р. rubra (Е.,
1838), Р. carnea (Cohn, 1866), P.flava (Cohn, 1866),
Р. sepetibensis Wanick et Da Silva Neto, 2004 и близкие
пигментные морские виды со змеевидным телом; вос-
становлена их валидность и даны четкие характери-
стики; в частности, бикорона у Р. rubra состоит из
14—16 ФЦ, у второго вида из 10—14 ФЦ, у третьего из
9 циррусов. Находки рода в пресных водах — ошибка,
это пигментные виды типа Rubrioxytricha ferruginea
(Stein, 1859), Oxytricha aeruginosa Wrzesniowski, 1866
или оранжевый вид Diaxonella trimarginata J., 1979.
474
ALVEOLATA
Род Thigmokeronopsis Wicklow, 1981
Типовой в и д Th. jahodai. Уникальный аберрант-
ный вид с обширным полем тигмокинет. Тело массив-
ное, широкое, вытянутое; по краям по одному ряду
маргиналий; диаксонема биполярная, снизу подходит
к группе ТЦ, в верхней части плавно переходит в 2
дуги коронарных циррусов (правая более обособлена);
у перистома только 1 БЦ,- Между левым маргинальным
рядом и диаксонемой на всю длину тела, от ТЦ до пе-
ристома, лежат около 40 диагональных рядов мелких
циррусов. Позже открыт вид Th. crystallis Petz, 1995,
имеющий неширокую полосу циррусов, которая рас-
положена без столь четкого порядка, как у Th. jahodai.
Морские виды, не найдены в России.
Сем. Bakuellidae Jankowski, 1979
Диаксонема в верхней части сохраняет типичное
строение, циррусы одного из сближенных рядов чере-
дуются с циррусами другого в виде зигзагообразной
линии; ниже положение циррусов меняется и они ре-
организуются в короткие параллельные диагональные
ряды; полоса узкая в верхней части и постепенно рас-
ширяется в нижней. Почвенные, пресноводные и мор-
ские формы.
Род Keronella Wiackowski, 1985
Типовой в и д К. gracilis. По краям тела по одно-
му ряду маргиналий, сзади большое число ТЦ в дуго-
видном ряду, спереди корона циррусов ФЦ (поэтому
род включали в состав сем. Pseudokeronopsidae); ниже
апикальной дуги — вторая менее правильная дуговид-
ная группа, отходящая от вершины диаксонемы. Диа-
ксонема идет далеко вниз, положение циррусов посте-
пенно меняется, и вместо зигзагообразной линии вид-
ны отдельные продольные короткие монокинеты.
Правее вершины диаксонемы — добавочный ряд цир-
русов на уровне перистома. Фактически это переход от
видов предыдущего семейства к Bakuella.
Род Parabakuella Song et Wilbert,
1988
Типовой в и д Р. typica. Из почвы в Китае; разме-
ры 150—250 мкм, ядро фрагментировано (около 30 но-
дул), по краям тела по одному ряду маргиналий, нет
ТЦ, каудалии с основаниями на дорсуме; спереди
один буккальный циррус, 7—10 ФТЦ (фронто-терми-
налий) — ряд из 3 стандартных циррусов апикально и
полоса вдоль перистома; вторая полоса правее диаксо-
немы. Диаксонема типичного строения идет только до
перистома, здесь циррусы перестраиваются и идут
3 рядами, резко увеличиваясь в длину. В принципе ки-
нетом, как у предыдущего рода, но нет короны апи-
кальных циррусов. Ряды циррусов в нижней части диа-
ксонемы у видов этого семейства следует обозначить
новым термином (бакунемы, bakunemes). Род считается
валидным в ревизии бакуеллид (Алекперов, 1992).
Род Metabakuella Alekperov, 1989
По Аэшт, типовой вид Bakuella perbella Alekperov
et Mamajeva, 1988; это — ошибка, типовой вид Ke-
ronella perbella Alekperov et Musaev, 1988. Некрупные
формы из пресных вод (90 мкм); имеют типичный для
бакуеллид набор циррусов — маргинальные ряды,
длинный ряд ТЦ, спереди корону циррусов (поэтому
вид включался в состав Keronella) и вторую корону от
вершины диаксонемы; имеется короткий ряд вдоль пе-
ристома и ряд правее диаксонемы; последняя имеет
тройной состав — у вершины дуговидный (нижний)
ряд корональных циррусов, в средней части типичная
диаксонема, и в нижней части серия бакунем возраста-
ющей длины, вплоть до 2 очень длинных продольных
рядов справа. С левой стороны тела число рядов цир-
русов увеличено — кроме маргиналий, имеется не-
сколько добавочных рядов, называемых «парамарги-
нальными». Кроме М. perbella к роду относится также
М. variabilis (Воггог et Wicklow, 1983), не имевшая
раньше определенного места в системе. Основное от-
личие рода Metabakuella от Keronella — добавочные
ряды маргиналий.
Род Bakuella Agamaliev et Alekperov,
1976
По Аэшт, типовой вид рода не был выделен при его
установлении и позже был обозначен Янковским
(1979), «который сделал род валидным, не заявив чет-
ко о смене авторства», поэтому в каталоге Аэшт род
приводится как Bakuella Jankowski, 1979. В ревизии
гипотрих Янковского не сказано, что это род без типо-
вого вида — авторы рода четко указали тип рода в пер-
воописании, и затем Агамалиев (1983) в книге об ин-
фузориях Каспия вновь повторил указание типового
вида В. marina.
Род предложен для 2 новых видов, морского вида
В. marina и пресноводного В. crenata; первый (типо-
вой) вид с 100—140 фрагментами ядра, второй с ти-
пичным для большинства гипотрих «амфилептидным»
набором из 2 овальных ядер. Пока ядра не учитывают-
ся в родовой систематике гипотрих, но вполне возмож-
но, что в будущем этот признак будет учтен на уровне
подродов. Янковским (1979) выделен подрод Loxocine-
ta для типового вида В. crenata Agamaliev et Alekperov,
1976; в ревизиях бакуеллид этот подрод не упомина-
ется.
Типовой в и д В. marina — крупная вытянутая
форма (до 200 мкм) с очень большим числом ядер; пе-
ристом небольшой, до 1/4 длины тела. Вентральный
кинетом — краевые ряды МЦ, 3 ФЦ, 3 БЦ, короткий
ряд справа у вершины диаксонемы, снизу длинный ряд
ТЦ и 1 СТЦ. Диаксонема в верхней трети типичного
строения, но ниже на значительной части состоит из 10
диагональных сегментов (бакунемы) возрастающей
длины. Вероятно, это не эндемик Каспия, вид переопи-
сан из соленого озера в Канаде, но с меньшим числом
бакунем (6 вместо 10). Другие валидные виды: В. imb-
ricata Alekperov, 1982 (пресноводный вид с большим
числом ядер); В. pampinaria Eigner et Foissner, 1992
(многоядерный вид из почвы); В. edaphoni Song, Wil-
ТИП CILIOPHORA. КЛАСС SPIROTRICHEA
475
bert et Berger, 1992 (почвенный вид); В. granulifera
Agatha, Foissner et Berger, 2002 (гиганты с длиной тела
до 400 мкм из почв полупустыни Намиб в Африке с
массой ядер); В. agamalievi Воггог et Wicklow; В. kreuz-
kampii Eigner et Foissner, 1992; B. walibonensis Eigner et
Foissner, 1992; B. muensterlandii Alekperov, 1992; B. po-
lycirrata Alekperov, 1988.
Род Pseudobakuella Alekperov, 1992
Типовой вид Bakuella salinarium (Michailo-
witsch et Wilbert, 1990), также Pseudobakuella gracilis
Alekperov, 1992 (синоним — вид «Bakuella spec. N 1»
in Michailowitsch et Wilbert, 1990). Края тела с одним
рядом маргиналий, бакунемы начинаются от средней
части диаксонемы, эти полосы очень четко разграни-
чены; имеется ряд БЦ, 3 и более ФЦ, нет апикальной
короны, имеется только 2 ФТЦ.
Основные признаки родов в системе Алекперова
(1992) — 3 ФЦ, стандарт для гипотрих — Bakuella
Agam. et Alek., 1976; более 3 ФЦ, дуговидный ряд цир-
русов спереди — Keronella Wiackowski, 1985; нет ТЦ,
есть каудалии — Parabakuella Song et Wilbert, 1988;
есть парамаргинальные ряды — Metabakuella Alekpe-
rov, 1989; только 2 ФТЦ, в отличие от всех остальных
родов семейства — Pseudobakuella Alekperov, 1992.
Сем. Pseudourostylidae Jankowski,
1979
ФЦ образуют четкий дуговидный ряд параллельно
апикальной зоне мембранелл; ФВЦ в нескольких ря-
дах справа и слева от диаксонемы; имеются ТЦ; ряды
маргиналий в морфогенезе происходят из одного за-
чатка. Семейство выделено для форм без типичной
дифференцировки циррусов на фронтальные, буккаль-
ные и субфронтальные, все это заменено 2 дуговид-
ными рядами, являющимися продолжением рядов
диаксонемы. Если по этому признаку объединить Pse-
udourostylidae и Pseudokeronopsidae, по приоритету
пригодно первое название. В системе Линна (Lynn,
2002) приняты оба семейства, но, вероятно, их Следует
объединить.
Род Pseudourostyla Воггог, 1972
Типовой вид Urostyla cristata Jerka-Dziadosz,
1964. Крупный вид, нередкий в пробах пресноводного
бентоса, легко разводится в лаборатории и служит
объектом серии исследований во многих странах. Тело
темное, очень широкое, с ~50 ядрами; кортекс с экст-
русомами уникального типа, не найденными у других
гипотрих; крупный перистом с длинной полосой мем-
бранелл; обе мембраны неравны по величине и несут
реснички разной длины. Сзади длинный ряд ТЦ, спе-
реди 2 дуговидных ряда циррусов, продолжение обеих
кинет диаксонемы, идущей вниз до ТЦ. На дорсуме 8
рядов щетинок, на венте правее и левее диаксонемы по
нескольку «парамаргинальных» рядов, в дополнение к
краевым маргинальным; разные авторы называют
цифры 5 + 6, 6 + 6, 7 + 7 рядов (включая маргиналии).
Верхние дуги циррусов плавно или с небольшим пере-
рывом переходят в диаксонему. Второй вид, изучае-
мый в основном в Японии — Р. laevis Takahashi, 1973;
в почве в Австрии найдена Р. franzi F., 1987, вид с мар-
гинальными рядами не только на венте, но и на значи-
тельной части дорсума.
Сем. Urostylidae Butschli, 1889
У вершины тела стандартные ФЦ, нет дуги коро-
нальных циррусов; диаксонема цельная, не отделяет
фрагменты в нижней половине; число рядов по обе
стороны от диаксонемы варьирует от одного до не-
скольких — в дополнение к краевым (маргинальным)
рядам могут образоваться парамаргинальные. В мор-
фогенезе многочисленные краевые ряды происходят
из одного зачатка. У Линна (Lynn, 2002) семейство
включает также роды, относимые к принятому в лите-
ратуре сем. Bakuellidae (см. выше) и к также принято-
му сем. Holostichidae Faure-Fremiet, 1961. Сейчас чис-
ло краевых рядов не служит важным признаком для
обособления групп родов, тем более что увеличение их
числа характерно не только для примитивных родов
типа Kahliella, но и независимо для многих высших
форм. Urostyla, считавшаяся родом примитивной груп-
пы, имеет диаксонему и очень сложную систему ФВЦ
на уровне перистома. Бергер (Berger, 1999) включает в
состав Oxytrichidae виды с краевыми и с дополнитель-
ными рядами. Поэтому Holostichidae нельзя четко от-
граничить от Urostyla, если не учитывать возможные
различия морфогенеза. Название семейства — гомо-
ним, есть сем. Urostylidae у насекомых (Hemiptera); по-
следнее изменено Кержнером, название для цилиат
осталось прежним.
Род Urostyla Ehrenberg, 1830
=Prooxytricha, Trichogaster и Metaurostyla
Типовой вид U. grandis Ehr., 1830 (= Trichoda
patens Muller, 1786) по монотипии. Это крупные тем-
но-коричневые гипотрихи, обычные в пресноводном
бентосе; легко культивируются на рисе, служат одним
из основных лабораторных объектов у цилиатологов.
Размеры тела 200—300 мкм, по некоторым авторам до
400—500 мкм; всеядный вид, разводится на бактериях,
микроводорослях и на кольпидиях. Вид изменчивый,
циррусы плохо видны, поэтому вид не раз описывался
под другими названиями; часто не видели диаксонемы
и считали это отличительным признаком новых видов.
Каль (Kahl, 1932) хорошо зарисовал весь кинетом, кро-
ме диаксонемы.
Типовой вид имеет большое число ядерных фраг-
ментов (70—140), крупный перистом, мукоцисты в
кортексе; на дорсуме 3 ряда щетинок. Сзади группа из
8—13, чаще 10 ТЦ; число рядов по обе стороны от аци-
лона трудно установить, вид очень изменчивый, число
зависит от размеров и упитанности, часть рядов не-
полная и фрагментарная; как правило, с каждой сторо-
ны по 5—7 рядов. Они не идут равномерно, как на не-
476
ALVEOLATA
которых рисунках вида; по оси имеется безресничная
полоса с короткой диаксонемой, снизу переходящей в
монокинету. Кинетом на уровне перистома очень сло-
жен — имеются косые ряды циррусов, буккальный ряд
и 2 ряда, сверху расходящиеся на дуги фронтальных
циррусов. Как правило, правые соматические ряды
подходят к ТЦ, левые удлинены и огибают ТЦ, походя
к постерону; каудалий нет. Итак, Urostyla — вид с диа-
ксонемой, но очень короткой (до уровня рта) и перехо-
дящей далее в монокинету.
Описан ряд валидных видов, отнесенных к Urosty-
la, но не имеющих диаксонемы, или имеющих 2 ряда
неясной гомологии (пример: U. chlorelligera Foissner,
1980; U. viridis Stein, 1859; U. hologama Heckmann,
1965; U. latissima Dragesco, 1970). Систематическое
положение таких форм должно решаться при изучении
морфогенеза и методами молекулярной филогении.
Род Metaurostyla Jankowski, 1979
Типовой видИpolonica. Боррор (Borror, 1972)
в каталоге гипотрих приводит рисунок Urostyla gran-
dis без диаксонемы, как и многие прежние авторы, поэ-
тому для U. grandis sensu Jerka-Dziadosz, 1972 был
предложен новый род и вид Metaurostyla polonica', вто-
рой вид М. raikovi (=Paraurostyla raikovi Alekperov,
1977). В последнее время доказано, что U. grandis име-
ет диаксонему, и с разработкой нового простого мето-
да окраски циррусов она была выявлена мной у этого
вида, поэтому указанные род и вид ликвидируются как
синонимы. Название Metaurostyla использовал Алек-
перов для новых видов с Кавказа, но они должны быть
перенесены в другие роды.
Род Australothrix Blatterer et Foissner,
1988
Типовой вид A. australis В. et F., 1988. Также
A. alwinae В. et F., 1988; A. zignis (Entz, 1884 in Uroleptus)',
A. gibba (Clap, et Lachm., 1859 in Oxytricha) vlA. steineri
Foissner, 1995. Первые 2 вида, найденные в почвах
Австралии, образуют компактную группу; A. zignis —
морской вид, A. gibba — пресноворръш, A. steineri най-
дена в почвах Коста-Рики. Для рода характерно увели-
чение числа рядов на дорсуме и венте, отсутствие ТЦ,
четкое обособление 3 крупных ФЦ, наличие одного БЦ
и короткой диаксонемы — ряд начинается от конца по-
лосы мембранелл и идет до перистома, у A. steineri раз-
личим с трудом — лишь несколько пар циррусов в
ряду; у A. alwinae чуть ниже перистома. У постерона
на дорсуме основания каудалий, иногда множествен-
ных.
Род Birojimia Berger et Foissner, 1989
Типовой вид В. terricola. Вытянутые формы с
одним левым рядом МЦ и 2 и более рядами справа;
ядро фрагментировано; ТЦ в четком ряду, за ними у
постерона смыкаются ряды маргиналий; имеются
СТЦ; четко выражены 3 ФЦ. Диаксонема начинается
от ФЦ и идет до экватора, циррусы разрежены, род не-
типичный, но с характерным для уростилид чередова-
нием циррусов в зигзагообразной полосе. На дорсуме
пара каудалий.
Род Diaxonella Jankowski, 1979
Типовой в и д D. trimarginata. В одной из статей
объект работы — пресноводный вид с вытянутым
овальным телом и окрашенной цитоплазмой был опре-
делен как Keronopsis rubra; но настоящая К. rubra
(ныне в составе Pseudokeronopsis) — это червеобраз-
ная морская гипотриха с мелким перистомом и интен-
сивной оранжевой, коричневой или кирпично-красной
окраской тела, культивируется только на морской
воде. Поэтому для вида Keronopsis rubra in Jerka-Dzia-
dosz et Janus, 1978 (нетоним) был предложен новый
род и вид, принятый в литературе. Позже вид был вы-
делен Янковским в культуру из Ангары и изучен но-
вым методом окраски циррусов. Это оранжевые гипот-
рихи с 2 маргиналиями и дополнительным рядом слева
(у гипотрих чаще добавляются парамаргиналии справа);
ядро фрагментировано, сзади линия многочисленных
ТЦ, спереди линия буккалий, 3 крупных ФЦ и несколь-
ко поперечных групп ФТЦ; от них начинается диаксо-
нема классического типа (2 вплотную сближенных
ряда с чередованием циррусов, направленных в разные
стороны), идущая вниз почти до ряда трансверсалий.
Род Amphisia Sterki, 1878
Типовой вид Л. multiseta по обозначению Ян-
ковского (1979). Обозначение типа формальное, не для
валидации — род не принят в литературе и считается
синонимом рода Holosticha Wrzesniowski, 1877. Назва-
ние рода часто использовалось в литературе для раз-
ных пресноводных и морских видов, но идея рода не
была ясна, поскольку это название не было связано с
определенным, хорошо описанным видом. Типовой
вид — узкая вытянутая форма с пигментацией цито-
плазмы, 2 рядами маргиналий и 2—3 рядами ВЦ,
включая диаксонему; имеется 3—5 ФЦ и 5—10 ТЦ;
ядро двойное, вакуоль медиально слева.
Род Klonostricha Vuxanovici, 1962
Род (в оригинале также Klonostriche) предложен
для 2 новых видов без указания типа — К. gibba,
К. horrida и К horrida var. bivacuolata; по Боррору
(Borror, 1972), первый вид К. gibba — синоним вида
Chaetospira muelleri Lachmann, 1856, поэтому как ти-
повой вид Янковским (1979) был обозначен второй
вид К horrida. Указание типового вида для родов,
предложенных с 1931 г., приводит к смене автора, поэ-
тому Аэшт в каталоге родов цилиат приводит род как
Klonostricha Jankowski, 1979 (К. gibba comb, n., К. hor-
rida in Jank., 1979). Бергер (Berger, 1999) возражал про-
тив этого, считая обозначение Вуксановича Klonostri-
cha gibba n. gen., n. sp. достаточным для обозначения
типа, но это правило действует только до 1951 г.
ТИП CILIOPHORA. КЛАСС SPIROTRICHEA
477
К. horrida — пресноводный вид с веретеновидным
телом, узким хоботком и коротким хвостом; перистом
вытянут почти на всю длину тела слева; от вершины
хоботка вниз идет диаксонема; нет ФЦ и БЦ, вероятно
есть ТЦ (как у 2 других форм рода); ядро одно, вакуоль
над постероном. Описание без импрегнации, с одним
мелким рисунком. Род неясного положения, не чис-
лится среди валидных родов гипотрих в современной
литературе.
Род Notocephalus Petz, Song et Wilbert,
1995
Типовой вид Tachysomaparvulum Corliss et Sny-
der, 1986. Вид описан из Антарктики при импрегнации
и вторично изучен авторами рода из проб антарктиче-
ского льда. По Аэшт, правильно название N. parvulus.
Включение в состав Tachysoma при первоописании —
ошибка, тахисомы — окситрихиды, имеющие простую
монокинету, не диаксонему.
Типовой вид — гипотрихи с коротким широким те-
лом, 2 ядрами; перистом из двух отделов с очень широ-
кими мембранеллами сбоку и очень мелкими на апек-
се; дорсум с 3 цельными рядами щетинок (у окситри-
хид один из рядов обычно прерван). Каудалий нет, ТЦ
четкие, СТЦ нет; спереди крупные ФЦ обычного типа,
нет БЦ и других фронтотерминалий; полоса мидвент-
ралий в виде четкой диаксонемы от вершины тела до
экватора. Отсутствие каудалий, буккалий и других
ФТЦ — признак рода.
Род Platytrichotus Stokes, 1886
Типовой вид — Р. opisthobolus. Несомненный
синоним рода Uroleptus. Вид описан из сфагнового бо-
лота в США; это крупные гипотрихи с 2 маргинальны-
ми рядами, БЦ и 3 ФЦ, ТЦ не обозначены на рисунке;
диаксонема от ФЦ до нижнего конца тела. Стокес сам
считал вид близким к Uroleptus', одно из различий —
образование каудальных выростов тела с расширенной
вершиной (отсюда название вида). Ядро одно, оваль-
ное, что сомнительно. По Боррору (Borror , 1972), не-
валиден не только род, но и вид как синоним Uroleptus
musculus (Muller, 1773) Ehr., 1831. Это тип рода Uro-
leptus, поэтому название Platytrichotus нельзя исполь-
зовать для подродов.
Род Pseudoamphisiella Song, 1996
Типовой вид Holosticha lacazei Maupas, 1883.
Вид переописан методом импрегнации. Крупная ги-
потриха из морского детрита; реальный вид без сино-
нимов в каталоге Боррора (Borror, 1972). Размеры
200—250 мкм, ядро фрагментировано, кортекс со сло-
ем экструсом. Кинетом — 2 ряда МЦ, длинная полоса
ТЦ, буккальные циррусы, четкие ФЦ; диаксонема на
всю длину тела. Петц со соавт. (Petz et al., 1995) допус-
кают распространение вида и в пресных водах, сино-
нимизируя вид с Holosticha intermedia-, они отличают-
ся по числу ядер. Также Р. alveolata (Kahl, 1932).
Род Territricha Berger et Foissner,
1988
Типовой в ид Г. stramenticola. Крупные почвен-
ные цилиаты (100—150 мкм) с 2 ядрами, 2 рядами МЦ
(сближаются снизу), с четкими ТЦ и 2 СТЦ; спереди
3 ФЦ, 1 БЦ и группа разрозненных циррусов. Типич-
ной диаксонемы нет, но ниже перистома идет ряд из
4 разрозненных пар циррусов, который можно при-
нять за примитивную форму диаксонемы. На дорсуме
сложная система рядов щетинок, с биполярными ряда-
ми по краям и полем фрагментов в центре; прерван
один из рядов на дорсуме, как у окситрихид, поэтому
Бергер (Berger, 1999) рассматривает этот род в моно-
графии указанного семейства; у Линна (Lynn, 2002) в
составе уростилид. Типичная диаксонема должна на-
чинаться у вершины тела справа; правее перистома то-
лько одна подобная пара циррусов.
Род Paruroleptus Wenzel,
1953
Типовой вид Uroleptus caudatus Stokes, 1886 по
обозначению Венцеля (Wenzel, 1953). Каль (Kahl,
1932) предложил подрод Paruroleptus Kahl, 1932 в со-
ставе рода Holosticha Wrzesniowski, 1877 sensu lato, не
указав типового вида; первоначально включены 6 ви-
дов: P.magnificus Kahl, 1932; Р. piscis (Kowalewski,
1882 in Amphisia)', P. caudatus (Stokes, 1886 m Holostic-
ha)', P. lacteus Kahl, 1932; P. musculus Kahl, 1932;
P. musculus var. simplex Kahl, 1932.
Следующие авторы приняли этот таксон как род
Paruroleptus Kahl, был описан ряд новых видов, смена
автора рода не была замечена. В каталоге гипотрих
Боррор (Borror, 1972) не признал этого рода, распреде-
лив 6 видов Каля между родами Holosticha и Uroleptus,
но сейчас он принят и тип рода переописан методом
импрегнации. Это обычный болотный вид с червеоб-
разным телом, величиной 120—350 мкм; тело заостря-
ется кзади, имеются 2 ядра, крупный перистом. Кине-
том — краевые маргиналии, 5 ТЦ на конце хвоста,
3 ФЦ, 1 БЦ; диаксонема четкая, типичная, идет через
все тело от апекса до ТЦ. На конце хвоста трансверса-
лии, нижняя часть правых маргиналий и, вероятно сла-
бо, обособленные каудалии.
Янковским (1979) указан типовой вид Р. lacteus,
это вторичное указание невалидно. В каталоге Аэшт
род Paruroleptus не считается валидным, это синоним
рода Uroleptus. Но ранее род считали валидным, был
описан новый вид Р. notabilis Berger et Foissner, 1987;
переописан вид Trichoda gallina Muller, 1786 в составе
Paruroleptus, и общепринятое название Р. musculus
было сведено в синонимы вида Р. gallina.
Род Uroleptopsis Kahl, 1932
Типовой вид U. citrina по указанию Каля. Пер-
воначально включены 3 вида — U. citrina Kahl, 1932;
U. viridis (Perejaslawzewa, 1885 in Oxytricha) и U. ros-
coviana (Maupas, 1883 in Uroleptus). Длинные червеоб-
разные пигментированные гипотрихи, желтые от оби-
478
ALVEOLATA
лия мукоцист, величиной 150—250 мкм, с фрагменти-
рованным ядром, небольшим перистомом; по краям
тела маргиналии, не смыкающиеся снизу, в этой зоне
нет ТЦ и каудалий. По Калю, нет БЦ, ФТЦ и обособ-
ленных ТЦ; диаксонема типичная для семейства, поч-
ти до постерона, сверху оба ряда продолжаются в виде
двух длинных дуг параллельно зоне мембранелл, цир-
русы в них укрупняются справа налево.
В каталоге Боррора (Borror, 1972) род валидный,
подчеркиваются 3 признака — отсутствие ТЦ и ФЦ,
распыленный тип ядра. Включены 4 вида, один пре-
сноводный U. ovata (Horvath, 1933 in Paraholosticha) и
3 морских— U. citrina Kahl, 1932; U. roscoviana (Mau-
pas, 1883 in Uroleptus) и U. viridis (Perejaslawzewa,
1886 in Oxytricha).
Род сводился в синонимику Pseudokeronopsis, но
после ревизии типового вида этого рода и ряда близ-
ких видов вновь признается валидным, поскольку
внешне сходные пигментные морские виды Pseudoke-
ronopsis имеют ряд ТЦ.
Род Holosticha Wrzesniowski,
1877
По Аэшт, типовой вид — Н. kessleri по обозначе-
нию Янковского (1979); это неверно, у Боррора (Bor-
ror, 1972) читаем — «тип по монотипии — Н. kessleri».
Список видов у Боррора включает 23 названия валид-
ных видов и 18 не принятых видов, сведенных в сино-
нимы; тип рода первоначально обозначался как Holos-
ticha kessleri и как Oxytricha kessleri. К сожалению,
Н. kessleri не принадлежит к хорошо изученным ви-
дам — вид валидный, отмечен в пресных, солоноватых
и морских водах, описан Калем; инргда вид относили к
роду Amphisia.
На импрегнированных препаратах сейчас изучены
многие известные и новые виды рода — Н. spindleri,
Н. sylvatica, Н. tetracirrata, Н. camerounensis, Н multis-
tilata, Н. alveolata, Н. distyla, Н. diademata, Н. warreni,
Н. scutellum, Н. multicaudicirrus, Н. contractilis, Н. simi-
lis (по Фойсснеру, син. — Keronopsis monilata Kahl,
1928) и др. Родовое название общепринятое, род круп-
ный, более 100 видов, широко распространен в почве,
террофитоне, пресных водах, в эстуариях и в море;
признаки рода — наличие 2 маргинальных рядов, ряда
ТЦ, иногда очень длинного, крупных обособленных
ФЦ, отсутствие каудалий; на уровне перистома — БЦ
и несколько обособленных ФТЦ, от которых начинает-
ся длинная диаксонема. Раньше часто указывалось,
что граница с Keronopsis неясная, и виды часто пере-
мещали из одного рода в другой; сейчас роды различа-
ются по признакам их типовых видов, — у Keronopsis
нет диаксонемы и имеется корона циррусов, этот род
не относится к уростилидам.
При ревизии этого крупного рода (Berger, 2003) он
был подразделен на 4 рода; в составе Holosticha s. str.
остались, кроме типового вида, Н. bradburyae Gong et
al., 2001; H. foissneri Petz et al., 1995; H. heterofoissneri
Hu et Song, 2001; H. pullaster (M., 1773); H. spindleri
Petz et al., 1995. Общий признак — разрыв полосы
мембранелл (АЗМ) с подразделением ее на апикаль-
ную и боковую полосы разной толщины.
Род Anteholosticha Berger, 2003
Типовой вид Holosticha monilata Kahl, 1928.
Уростилиды с непрерывной полосой мембранелл оди-
наковой толщины; нет каудалий (важный признак
рода); имеются 3 ФЦ, ФТЦ, БЦ, по одному ряду марги-
налий, несколько ТЦ. Род предположительно сборный,
утрата ТЦ могла произойти в разных линиях неза-
висимо. Род включает около 30 видов, ранее отно-
симых к Holosticha, примеры видов — A. adami (F.,
1982); A. arenicola (К., 1932); A. bergeri (F., 1987);
A. brevis (К., 1932); A. grisea (К., 1932); А. тапса (К.,
1932); A. muscicola (Gellert, 1956); A. warreni (Song et
Wilbert, 1997); A. sphagni (Groliere, 1975); A. thononen-
sis (D., 1966); A. randani (Groliere, 1975); A. pulchra (K.,
1932)и др.
Род Caudiholosticha Berger, 2003
Типовой вид Holosticha stueberi F., 1987. A3M
непрерывная; кинетом — 3 ФЦ, БЦ, ФТЦ, немного ТЦ,
2 маргиналии и группа каудалий. Предположительно
сборный род, требует дальнейшего подразделения по
типу ундулирующих мембран, по аналогии с критери-
ями родов у Oxytrichidae. Примеры видов — С. algi-
vora (К., 1932); С. interrupta (D., 1966); С. islandica
(Berger et Foissner, 1989); C. multicaudicirrus (Song et
Wilbert, 1989); C. navicularum (K., 1932); C. setifera (K.,
1932); C. sylvatica (F., 1982); C. tetracirrata (Buitkamp
et Wilbert, 1974); C. viridis (K., 1932).
Род Biholosticha Berger, 2003
Tтвой вид Holosticha discocephalus K., 1932.
Также В. arenicola (D., 1963 in Keronopsis). Буккальная
зона очень узкая; имеются только 2 ФЦ; нет БЦ; ТЦ в
поперечном ряду. Вероятно, эти 2 морских вида родст-
венные, признаки не конвергентные; тело узкое, вытя-
нутое, с цефализацией на уровне перистома.
Род Trichototaxis Stokes,
1891
Типовой вид Т. stagnatilis. В первоисточник не
заглядывали, и название рода всегда писали как Tric-
hotaxis, в частности в определителе Каля (Kahl, 1932).
Правильное название рода Trichototaxis восстановлено
Янковским (1979). В каталоге Боррора в составе рода 8
видов и 1 синоним —• Т. stagnatilis (=Holosticha aqua-
rumdulcium), T. crassus (C. et L., 1858), T. velox (Quen-
nerstedt, 1869), T. pulchra Borror, 1972 и др. Поскольку
изменилось принятое написание названия рода, все
виды Trichotaxis перенесли в состав Trichototaxis как
comb. nn. для каждого вида, но это ошибка — название
Trichotaxis не предлагалось как валидное название
рода, поэтому достаточно вместо эрронима написать
правильное название. Аналогично, у микроспоридий
рода Pleistophora некоторые виды описывали под на-
званием Plistophora, и это не требует их переноса
(comb. п.).
ТИП CILIOPHORA. КЛАСС SPIROTRICHEA
479
Типовой вид пресноводный, с овальным телом, ве-
личиной 160 мкм, с фрагментированным или цепочко-
видным ядром; имеются маргиналии, диаксонема, чет-
кие TI(; ФЦ не обособлены, являются продолжением
рядов диаксонемы. Признак рода — наличие одного
ряди МЦ справа и 2 рядов слева. При импрегнации изу-
чены морские и пресноводные виды, к примеру
7'. aeruginosa Foissner, 1980; Т. multinucleatus Burkovs-
ky, 1970. Имеются типичные обособленные ФЦ и ряд
буккальных циррусов, нет СТЦ.
Род Uroleptus Ehrenberg, 1831
Типовой вид Trichoda musculus М., 1773 по обо-
значению Боррора (Borror, 1972). В каталоге Боррора 8
валидных видов — U. musculus, U. caudatus, U. lacteus,
U. lamella, U. muscorum, U. novitas, U. piscis, U. viola-
ceus и 13 синонимов — U. hospes, U. opisthobolus,
U simplex, U. setiformis, U gibbosus, U. ophryoglena,
U. rattulus, U. limnetis, U. longicaudatus, U. poianae,
U. viridis, U dispar, U sphagni. Один из этих видов —
это тип рода рода Platytrichotus Stokes, 1886 (Р. opist-
hobolus S., 1886), другой — тип рода Paruroleptus Sto-
kes, 1886 (U. caudatus Stokes, 1886).
Описания видов отличаются, определения видов
часто неверные. Род включает в основном вытянутые
червеобразные формы только с 2 рядами маргиналий,
по одному у краев тела (отличие от Trichototaxis)-, чет-
ко обособлены ФЦ, имеется ряд ТЦ; диаксонема обыч-
но длинная, до уровня трансверсалий. С типовым ви-
дом ситуация осложняется тем, что Trichoda musculus
М., 1773 — это коловратка, а не инфузория. Название
рода не должно применяться для цилиат. Нужно при-
писать авторство рода Эренбергу или восстановить
как валидное одно из названий синонимичных видов, к
примеру можно использовать забытое название Tric-
hoda ga/Zzna Muller, 1786 (Uroleptus gallina). Валидные
почвенные виды — U. notabilis (F., 1982), U paranota-
bilis Foissner et al., 2002.
Род Tricholeptus Fromentel, 1875
Типовой в ид 7. aculeatus. Вероятно, это пресно-
водный вид, как все другие цилиаты в книге Фромен-
тсля (Fromentel, 1874); дан схематический рисунок —
контуры тела, перистом; тело червеобразное, плавно
июстряется кзади, окружено ресничками; на хвосте
пучок длинных ресничек. Это может быть только Uro-
leptus, вероятно, U. violaceus Stein, 1859. Род Tricholep-
tus неналидеп ввиду плохого описания типового вида и
явной синонимии.
Род Paramitrella Jankowski, 1978
Типовой вид Epiclintes caudatus Bullington,
1940 — гигантский морской вид (260—440 мкм) с бе-
регов Флориды, с очень длинным желтоватым телом;
особи червеобразные, форма тела нетипичная для ги-
потрих — перистом расширен, далее длинная узкая
шейка, туловище и очень длинный гибкий хвост. Ки-
нетом известен только по живым особям; перистом за-
нимает весь расширенный апекс, нет ФЦ, ТЦ и
каудалий; с краев тела по одному ряду маргиналий, от
рта до конца хвоста идет диаксонема. Тело покрыто
мелкими прямыми шипами в правильных рядах, точно
координированых с циррусами маргиналий; при боль-
шом увеличении они не изучались. Тело очень сокра-
тимое, вид активный, с быстрым движением.
По автору, вид очень сходен с Epiclintes ambiguus,
но последний имеет 6 рядов циррусов (2 МЦ, 4 ВЦ).
Тем не менее в каталоге Боррора вид Е. caudatus нева-
лиден как синоним вида Е. ambiguus (Muller, 1786)
Biitschli, 1889.
Род Parabirojimia Hu, Song et Warren,
2002
Типовой в ид P. similis. Крупный морской вид из
Китая (до 300 мкм). Тело вытянутое, ядра в цепочке
нодул; кинетом — полимерные маргиналии справа,
ряд ТЦ, нет ФТЦ, нет каудалий; спереди корональная
дуга — резко видоизмененная вершина разорванной
надвое полосы мембранелл и группа ФЦ.
Род Eschaneustyla Stokes, 1886
Типовой вид Е. brachytona по монотипии из
пресных вод в США, также Е. terricola F., 1982. Тело
вытянутое, ядра многочисленные, ТЦ и СТЦ нет, есть
группа дорсальных каудалий; маргиналии краевые;
все циррусы вента в диагональных рядах, коротких на
уровне перистома и длинных ниже рта. Диаксонема
нетипичная для уростилид, оба ряда не сближены, не-
равной длины, но их циррусы направлены в разные
стороны, поэтому это не дополнительные ряды марги-
налий. Оба вида детально изучены при импрегнации
протарголом. Почвенный вид из Африки — Е. lugeri
Foissner, Agatha et Berger, 2002.
Род Neokeronopsis Warren, Fyda et Song,
2002
Типовой вид Holosticha (подрод Keronopsis)
spectabilis K., 1932. Крупный пресноводный вид (до
500 мкм) с плоским широким овальным телом, как у
окситрих; кинетом — 2 маргиналии, 2 дуги циррусов
спереди (ФЦ и СФЦ); от них начинается длинная диа-
ксонема, до диагонального ряда с большим числом
ТЦ; в нижней части диаксонемы несколько коротких
косых групп циррусов; каудалии — по 2—3 цирруса на
нижнем конце дорсальных рядов. Ядра амфилептидные.
Морфогенез кинетома при делении как у окситрихид.
Род Metaurostylopsis Song, Petz
et Warren, 2001
Типовой вид Urostyla marina Kahl, 1932. Также
M. rubra Song et Wilbert, 2002; M. songi Lei et al., 2005;
M. salina Lei et al., 2005.
480
ALVEOLATA
7 uio вытянутое, ядра многочисленные, марги-
налии полимеризованы с обеих сторон, заходят и
на дорсум; каудалий нет; имеются ТЦ, БЦ, ФЦ, не-
сколько СФЦ, от них вдоль перистома идет короткая
диаксонема; кортекс с рядами гранул без пигмен-
та (М. songi) или с красным пигментом (М. rubra).
Пигментированная Urostyla marina sensu Dragesco,
1965 — это, вероятно, вид М. rubra, хотя не совпадает
число маргиналий,-
Род Afrothrix Foissner, 1999
Типовой вид Л. darbyshirei из почвы в южной
Африке. Крупные цилиаты с вытянутым телом длиной
230—330 мкм, 2 амфилептидными ядрами, мелким уз-
ким перистомом с разрывом зоны мембранелл на
2 удаленных сегмента разной формы. Мембраны пра-
вее перистома параллельные, равной длины. Имеются
2 маргиналии, снизу комплекс ТЦ + СТЦ, нет дорсаль-
ных каудалий; спереди цилиатура необычная — 3 ФЦ
смещены вправо, имеется 1 БЦ и короткий ряд парных
циррусов на уровне перистома (диаксонема), с не-
сколькими добавочными циррусами. Практически вся
вентральная поверхность вне рядов маргиналий лишена
цилиатуры. У A. multinucleata Foissner, Agatha et Ber-
ger, 2002 диаксонема практически не выражена, при-
надлежность рода к уростилидам под сомнением.
Ряд родов гипотрих пока не имеет места в системе
отряда, в частности из-за недостаточных первоописа-
ний и отсутствия данных по морфогенезу. Ряд таких
родов приведен в моем каталоге (Янковский, 1979).
2 примера даны ниже.
Род Pescozoon Jankowski, 1979 с типовым видом
Balladyna euplotes Dragesco, 1960; это морской псам-
монный или бентосный вид с овальным телом, апи-
кальным осевым перистомом; нет ФЦ, БЦ и вообще
разрозненных циррусов спереди, сзади группа ТЦ; по
краям вента 2 маргиналии, на венте идут 3 симметрич-
ных ряда, включая 1 осевой.
Род Isosticha Kiesselbach, 1936 с типовым видом
I. contractilis. Этот морской род пропущен в каталоге
Аэшт (Aescht, 2001); внешний вид как у кондилосто-
мы, тело почти червеобразное, длиной 575—775 мкм,
слегка расширено на уровне перистома. Дорсум без
цилиатуры, на венте много рядов в равномерном поло-
жении, правее и выше перистома нет стандартных ФЦ
и СФЦ. Если не считать группу коротких ТЦ сзади, это
типичная кондилостома.
Отряд Euplotida Jankowski,
1980
Авторство отряда приписывают Смоллу и Линну
(Small, Lynn, 1985) — отряд был ими предложен как
новый в 1-м издании Guide, но еще раньше он был
предложен мной (Янковский, 1980) в статье с диагно-
зом (не в тезисах), поэтому таксон валидный. Смолл и
Линн считали эуплотид и «традиционных» гипотрих
(например, окситрих) неродственными группами,
остальные авторы объединяют их в составе Hypotrichi-
da. Это название сейчас используют или только для
эуплотид, или для других семейств.
Низшие роды эуплотид с метаболичным телом, вы-
сшие с прочным панцирем; перистом крупный, с
2 мембранами справа и дуговидной зоной мембранелл
слева, огибающей апекс; у части родов зона мем-
бранелл вторично видоизменена — прервана, с редук-
цией апикальной части зоны. Соматическая цилиа-
тура — дорсальные ряды щетинок, краевые ряды ще-
тинок или циррусов, и хорошо развитая система
вентральных циррусов. В целом нехарактерно наличие
и полимеризация маргинальных рядов. У панцирных
форм легко выявляется аргиром в виде сети или пра-
вильных прямоугольников. Ядро одно или фрагменти-
ровано, разных очертаний, характерно прохождение
реорганизационной полосы хроматина перед делени-
ем макронуклеуса. Светлая широкая полоса идет от
концов ядра к его середине, меняя структуру хромати-
новых элементов. В этом отношении эуплотиды близ-
ки к гипотрихам и едва ли возникли независимо
от них.
Отряд в целом космополитный, древний, многие
роды отмечены на всех континентах или по всему Ми-
ровому океану — Euplotes, Aspidisca, Diophrys, Uro-
nychia и др. Почти все виды свободноживущие, обита-
ют в почве, мхах, пресных и соленых континенталь-
ных водах, в море при любой солености. В пресной
воде и в море обитают роды Euplotes, Aspidisca, только
в море — Uronychia, Euplotidium, Gastrocirrhus; мор-
ской род Diophrys имеет несколько пресноводных ви-
дов на Кавказе (Агамалиев, 1983). Большинство видов
бентосное, реже в пелагиали. Симбионтные виды
встречаются в родах Euplotes и Diophrys', облигатно
симбионтные роды — Paraeuplotes (на кораллах, акти-
ниях) и Euplotaspis (в асцидиях).
В новом издании Guide (Lynn, Small, 2002) принята
следующая классификация подкласса Euplotia:
Подкласс Euplotia
Отряд Kiitrichida Nozawa, 1941 (Kiitrichidae)
Отряд Euplotida Small et Lynn, 1985 (Euplotidae, Aspidiscidae,
Diophryidae fam. n.)
Отряд Uronychiida ordo n. (Uronychiidae)
Отряд Gastrocirrhida ordo n. (Gastrocirrhidae)
Отряд Discoccphalida Wicklow, 1982
Система по Линну (Lynn, 2002):
Подкласс Hypotrichia Stein, 1859
Отряд Kiitrichida Nozawa, 1941 (Kiitrichidae)
Отряд Euplotida Small et Lynn, 1985
Подотряд Discoccphalina Wicklow, 1982 (Erionellidae, Dis-
cocephalidae)
Подотряд Euplotina Small et Lynn, 1985 (Uronychiidae, Aspi-
discidae, Certesiidac, Gastrocirhidae, Euplotidae)
В системе цилиат Янковского (1980) отряд Hypo-
trichida делится на подотряды Keronina, Chaetospirina,
Holostichina, Oxytrichina, Euplotina, Gastrocirrhina и As-
pidiscina. Линн (Lynn, 2002) считает, что взгляды раз-
ных авторов на систему цилиат, ранее дивергентные,
сейчас идут к консенсусу; судя по приведенным схе-
мам, такого согласия нет. Неясно, в частности, вклю-
чать ли Kiitricha и Discocephalus в состав отряда эуп-
лотид — неясны границы этого отряда. В данной свод-
ке они включены в отряд эуплотид как подотряды.
ТИП CILIOPHORA. КЛАСС SPIROTRICHEA
481
Подотряд Kiitrichina Tuffrau et Fleury, 1994
Авторство таксона приписывают Нозава (Nozawa,
1941), но в статье Нозавы с описанием Kiitricha такого
таксона нет. Поэтому автором подотряда нужно счи-
тать Тюффро и Флеури (Tuffrau, Fleury, 1994), хотя
формально обозначения ordo п. в их главе нет.
Некрупные овальные формы с обширной ротовой
полостью; зона мембранелл стандартного типа, без
фрагментации; на обеих сторонах тела — большое
число кинет; нет тенденции к развитию сложной си-
стемы фронтальных циррусов; трансверсальные цир-
русы в четком ряду, крупнее соматических. Примитив-
ные морские формы, вероятно не являющиеся предше-
ственниками эуплотид (выводимых от дискоцефалид).
Сем. Kiitrichidae Nozawa, 1941
С диагнозом подотряда. У Линна (Lynn, 2002)
включает роды Caryotricha и Kiitricha', вероятно, к это-
му семейству относится и род Musajevella.
Род Musajevella Alekperov, 1984
Типовой в и д М. minima из Каспия. Перистом от-
носительно меньше, чем у близких родов, до экватора
тела; на дорсуме около 13 продольных идентичных ки-
нет, на центе 6 правых рядов идут по дуге вниз, вероят-
но к широкому каудальному шву (бисеканте), а 5 ле-
вых рядов укорочены, идут вдоль полосы мембранелл
и закапчиваются над правыми кинетами, высоко над
постсроном. Ядро С-образное. Нет ни следа дифферен-
цировки циррусов, но это все же не гетеротрихи.
Род Caryotricha Kahl, 1932
Типовой в и д С. convexa. Форма тела типичная,
овальная; ни дорсуме около 7 продольных желобков с
вздутыми ребрами между ними, в желобках короткие
щетинки; па венте обширный перистом, как у Lembadi-
оп, с полосой мембранелл слева. Вентральные реснич-
ки в виде топких циррусов, намного длиннее дорсаль-
ных, расположены в 5 дуговидных рядах, не диффе-
ренцированы; пе г рядов левее и ниже перистома, здесь
находится только ряд из 5 ТЦ. Рот узкий, на вершине
трубки, поднятой над дном перистома. Нозава (Noza-
wa, 1941) предложил новое сем. Kiitrichidae для этого
рода и для Kiitricha; Каль (Kahl, 1932) относил род к
окситрихидам. Вид был повторно изучен (неопублико-
ванные данные Fryd-Vcrsavel, см.: Tuffrau, Fleury,
1994); выявлены 3 крупных ТЦ в той же зоне, что и у
Kiitricha, а 5 циррусов снизу слева, принятые ранее за
TI (, могут быть остатком кинет.
Род Kiitricha Nozawa, 1941
Типовой видК. marina. Хорошо изученный вид,
переописан несколькими авторами. Типовая раса с рав-
номерной цилиатурой, почти все ряды с короткими цир-
русами, вентральные ряды не отличаются от дорсаль-
ных; перистом гигантский, на 4/5 длины тела; по всему
правому краю — мембрана, слева большое число мем-
бранелл в полосе. На дорсуме около 9 рядов, на венте 7
правых рядов, ряд длинных буккальных циррусов вдоль
всего правого края перистомальной полости, 2 ряда ле-
вее и ниже перистома, и в одном из правых рядов особо
крупные 8 циррусов, вероятно ТЦ. Возможно, буккаль-
ный ряд циррусов есть и у Caryotricha. Ядро двойное.
Более точные данные получены позже с применением
протаргола, показаны усложнение кинетома в апикаль-
ной зоне, дифференцировка ТЦ на 2 отдела (1+5 цир-
русов), дезорганизация дорсальных рядов снизу.
Подотряд Discocephalina Wicklow, 1982
Овальные или вытянутые формы с четкой цефали-
зацией — обособлена поперечной перетяжкой апика-
льная часть тела с небольшим перистомом. Марги-
нальные циррусы имеются у низших форм, далее исче-
зают; от левых МЦ остаются сегменты. Четко развиты
и сложно дифференцированы вентральные циррусы,
очень крупны и многочисленны ТЦ. Обитатели мор-
ского псаммона. Таксон объединяет группу родов с
тенденцией к укорочению тела, утрате МЦ и к укруп-
нению ТЦ.
Сем. Erionellidae Wicklow, 1982 (рис. 286)
Наиболее примитивные дискоцефалиды, внешне —
типичные гипотрихи, с гибким вытянутым телом, об-
ширным, широко открытым перистомом; у гипотрих
правый край обычно продольный, у Erionella отогнут
далеко вправо. Цефализация небольшая, выражена
широкая шейка. По краям тела укороченные ряды МЦ
(3 ряда справа, 1 слева); возможно, осевой ряд — вент-
ральные, а не маргинальные циррусы. У апекса 2 отде-
льных цирруса. Мощно развиты ТЦ, около 13 в длин-
ном дуговидном ряду.
Род Erionella Jankowski, 1978
Типовой вид Keronopsis macrostoma Dragesco,
1963, с диагнозом рода. Ядра фрагментированы. Род
предложен для одного вида, позже (Lynn, Small, 2002)
в него перенесли также вид Keronopsis arenicola Dra-
gesco, 1963 — с этим нельзя согласиться, это типичная
Holosticha с диаксонемой, с ТЦ обычного типа, узким
перистомом, 2 ядрами; общее у них лишь наличие 2
ФЦ. В каталоге гипотрих (Воггог, 1972) К. macrostoma
была исключена из состава Keronopsis, признана ва-
лидным видом неясного положения.
Сем. Discocephalidae Jankowski, 1979
(рис. 291, 292)
В журналах по энтомологии замечено название
подсем. Discocephalinae (Heteroptera, клопы Pentatomi-
dae), валидное и используемое по крайней мере с
И hih №4163
482
ALVEOLATA
Рис. 291. Discocephalina.
«Amphisiella» Jaurei (Psammocephalus faurei) (A—B, Д, И—М)\ Psammocephalus horrori (Г); P. lithophora (E); P. diageseoi (3), Marginotricha grandis (Ж)', Dis-
cocephalus ehrenhergi (H). (По: Dragesco, 1963b (A-В): Wicklow, 1982 (Г -/!)).
Fig. 291. Discocephalina.
ТИП CILIOPHORA. КЛАСС SPIROTRICHEA
483
Рис. 292. Discocephalina.
Discocephalus ehrenbergi. (По: Dragesco, 1965a (Б—Гу, Wicklow, 1982 (/!)).
Fig. 292. Discocephalina.
1960 г.; авторство не установлено. В связи с гомони-
мией название заменяется новым — Marginotrichidae
Jankowski fam. n. с типовым родом Marginotricha. Се-
мейство включает гипотрих с вытянутым телом у ис-
ходных форм и овальным у высших, с четкой цефали-
зацией, небольшим перистомом, с тенденцией к утра-
те рядов МЦ и с мощными циррусами. По Виклову
(Wicklow, 1982), это предшественники эуплотид.
У форм с овальным телом кортекс панциревидный,
прочный, от МЦ остается лишь несколько сегментов.
Род Marginotricha Jankowski, 1978
Типовой вид Discocephalus grandis Dragesco,
1954. Тело вытянутое, плоское, гибкое, ядра фрагмен-
тированы, перистом очень короткий и узкий. Сохране-
ны 3 ряда МЦ — 2 справа, 1 слева, все ряды укороче-
ны, не достигают постерона. Правее перистома группа
длинных циррусов, снизу мощный ряд длинных ТЦ на
выступе тела, на постероне справа 2 цирруса, слева ряд
циррусов. Если считать Erionella исходным родом
группы, то от сплошного дуговидного ряда циррусов,
огибающих постерон, остались 2 сегмента.
Род Psammocephalus Wicklow, 1982
Типовой вид Р. borrori. ТакжеР. faurei (Drages-
co, 1963), Р. lithophora (Faure-Fremiet, 1954), Р. marioni
(Gourret et Roeser, 1888), P. dragescoi Wicklow, 1982;
3 первых вида ранее относили к роду Amphisiella.
Внешний облик, как у предыдущего рода, сохранены
краевые ряды МЦ по одному справа и слева; имеются
дифференцированные ФЦ; сзади 2 группы циррусов;
мощные ТЦ многочисленные, в дуговидном ряду; от
перистома до ТЦ идет осевой вентральный ряд цирру-
сов; над ТЦ — 2 мелких добавочных цирруса. Вид
Р. lithophora, вероятно, не относится к этому роду или
заслуживает выделения в особый подрод — по краям
тела по 2 ряда МЦ, сзади крупные сегменты с цир-
русами.
Род Prodiscocephalus Jankowski, 1979
Типовой вид Discocephalus minimus Dragesco,
1968. Тело укорочено, сохранены короткие краевые
ряды МЦ, но они состоят из немногих циррусов; име-
ется вентральный ряд, но всего с 2 циррусами; спереди
7 циррусов, вероятно вершина ряда МЦ, 3 ФЦ и 1 БЦ;
сзади, как и у предыдущего рода, дуга массивных ТЦ и
2 сегмента МЦ.
Род Discocephalus Ehrenberg in Hemprich
et Ehrenberg, 1832
Типовой вид D. rotatorius. В литературе боль-
шая путаница с автором рода и датой установления
(Aescht, 2001). В оригинале — небольшая особь с це-
фализацией и всего с 8 циррусами, по 4 у каждого края
тела. Вид подробно переописан позже с выделением
очень близкого нового вида D. ehrenbergi Dragesco,
1960. Внешний облик, как у предыдущего рода, боль-
ше циррусов у апекса и сложнее их топография, резко
не равны по длине циррусы обоих краевых сегментов,
особо удлинены многочисленные ТЦ, почти пол-
484
ALVEOLATA
ностыо iic'H’tiiii Mil, (маргиналии), имеются супра-
тршiciicpriuii.iibie циррусы. На венте фактически 3 ряда
цирругон, очень коротких и фрагментарных.
Род Polycoccon Sauerbrey, 1928
Типовой в и д Р. octangulus. Это синоним вида
Discocephalus rotatorius, типового вида рода, и поэто-
му название не может быть использовано как родовое
при дроблении рода Discocephalus.
Подотряд Euplotina Jankowski,
1979
Тело мелкое, панцирное, с прочным кортексом, с
продольными рядами мелких щетинок на дорсуме и с
очень сложной дифференцировкой циррусов на венте;
перистом обычно крупный (кроме Aspidisca), с удли-
ненной зоной мембранелл, фрагментированной у час-
ти родов. Легко выявляется аргиром кортекса, обычно
не импрегнируемый у гипотрих. На венте фронталь-
ные, мидвентральные, трансверсальные циррусы и ка-
удалии; снизу слева остаток маргиналий. В филограм-
ме родов подотряда (Song, 1995); различаются группы
Gastrocirrhus + Discocephalus + Swedmarkia у основа-
ния древа; Uronychia, Diophrys и Euplotidium + Certe-
sia, Cytharoides + Euplotes посредине, на вершине Eup-
lotaspis + Aspidisca. Такая группировка служит осно-
вой для различения семейств подотряда. Ниже
семейства даны в произвольном порядке.
На молекулярных филограммах цилиат (Lynn,
Small, 1997; Shin et al., 2000; Lynn, Struder-Kypke, 2002;
Lynn, 2003) представлен род Euplotes, дискоцефалид
нет. Эуплотиды — не дериваты окситрихид, отдели-
лись от базального ствола группы спиротрих, ведуще-
го далее к 2 ветвям — Phacodinium и Oxytrichidae +
+ Oligotrichida. В этой линии отделяются вначале эуп-
лотиды, затем факодиниум, затем олиготрихи, и остав-
шаяся группа Sporadotrichida включает всех остальных
известных гипотрих. Поэтому последних не объединя-
ют в один парафилетический таксон Hypotrichia.
Сем. Euplotidae Ehrenberg, 1838
(рис. 293—297)
Тело овальное, плоское, с хорошо развитым пери-
стомом; дуга мембранелл не прервана; справа 2 не-
большие мембраны, одна из которых погружена, обыч-
но заметна верхняя (пароральная) мембрана. На дорсу-
ме немного продольных кинет, идущих вдоль ребер
панциря; они несут мелкие сенсорные неподвижные
щетинки. На венте немного ФВЦ, ТЦ, у постерона не-
сколько КЦ, снизу слева рудименты ряда МЦ, обычно
2 коротких цирруса. ФВЦ расположены по опреде-
ленной схеме, не в беспорядке — они соответствуют
определенным ТЦ, что выявляется в ходе морфогене-
за. У всех родов 5 ТЦ; им должны соответствовать
справа налево 1, 2, 2, 2, 2 цирруса и крайне левый ФЦ,
не зависящий в морфогенезе от ТЦ. Импрегнация маз-
ков методом Клейна или Шаттона (сухой и влажный
способ) легко выявляет аргиром — импрегнируемые
серебром края альвеолярных ячеек кортекса; это сеть
на венте и на дне перистома и четкая структура на дор-
суме с определенным паттерном для каждого вида.
Ядро С-образное, вытянуто на всю длину тела, иногда
с отростками (Euplotes woodruffi, Е. parawoodruffi). На
Euplotes легко изучать прохождение реорганизацион-
ной полосы сквозь ядро. Изучены конъюгация, автога-
мия; инцистирование выявлено не у всех форм, многие
виды неспособны к образованию цист и гибнут при
высыхании, ухудшении условий или при голодании.
Виды семейства часты в пресных водах (включая вре-
менные эфемерные биотопы — почву, мох, лужи), но
больше видов в эстуариях и в море; трудно взять мор-
скую пробу без Euplotes. Известны симбионтные фор-
мы — с морскими ежами связаны Е. tuffraui, Е. baltea-
tus, и часто регистрируются неопределенные виды в
кишечнике ежей Strongylocentrotus. Виды рода хорошо
культивируются, служат объектом большого числа ра-
бот по строению, ультраструктуре, организации ядер,
по феромонам и размножению, выращиваются как
корм. Часть видов имеет эндобактерий в цитоплазме; у
2 видов открыты паразитические суктории рода Sphae-
rophrya. Панцирь не спасает от хищников; морские
виды — излюбленный объект мелкой суктории Acineta
foetida', для защиты от пресноводных хищников (Lem-
badion, мелкие турбеллярии) часто образуются крыло-
видные выросты тела.
До недавнего времени различался один род Euplo-
tes Ehrenberg, in Hemprich et Ehrenberg, 1831, с типо-
вым видом Euploea charon Ehr., 1830 (nec Trichoda cha-
ron Muller, 1773). Автора и год всегда упоминали
неправильно, чаще всего как Ehrenberg, 1831 (см.:
Aescht, 2001). Род четко отграничен от других родов,
и к нему приписывали мало посторонних видов, на-
пример Е. psammophilus Vacelet, 1961 (ныне в составе
Euplotidium). Как отмечено в диагнозе, по типу дор-
сального аргирома можно различить несколько групп
видов в составе рода, и это казалось единственной
возможностью разделить вид на подроды или роды.
Такое деление было предложено Янковским (1979);
род Euplotes с типом Е. charon был разделен на 4 под-
рода, позже на 4 рода.
1. Euplotes Ehr., 1830. Типовой вид Е. charon
(Muller, 1773) Ehr., 1830. Также Е. alatus Kahl, 1932;
Е. antarcticus Fenchel et Lee, 1972; E. balteatus (Dujar-
din, 1841) Kahl, 1932; E. Corsica Berger et Foissner,
1989; E. crenosus Tuffrau, 1960; E. euryhalinus Valbone-
si et Luporini, 1990; E.focardii V. et L., 1990; E. nobilii
V. et L., 1990; E. harpa Stein, 1859; E. iliffei Hill, Small et
Iliffe, 1986; E. indentatus Carter, 1972; E. inkystans Chat-
ton in Tuffrau, 1960; E. kurekchayi Aliev, 1987; E. magni-
cirratus Carter, 1972; E. moebiusi Kahl, 1932; E. neapoli-
tanus Wichtennan, 1964; E. ogusiMiev, 1987; E. octocir-
ratus Agamaliev, 1957; E. platystoma Dragesco et
Dragesco-Kerneis, 1986; E. polycarinatus Carter, 1972;
E. quinquecarinatus Gelei, 1950; E. rariseta Curds, West
et Dorahy, 1974; E. sharuri Aliev, 1987; E. trisulcatus
Kahl, 1932. Почти все виды морские, только один вид в
пресной воде и один симбионт в морских ежах. Виды
рода, как правило, имеют 10 ФВЦ и двойной или слож-
ный аргиром дорсума. Немногие виды могут инцисти-
роваться. За одним исключением (бактерии у Е. moebi-
ТИП CILIOPHORA. КЛАСС SPIROTRICHEA
485
Рис. 293. Euplotida.
Euplotes sp. (A); E. mutabilis 1Б)\ E. moebiusi (В, Г)-, E. charon (Д, E)\ E. eurystomus (Ж, 3). (По: Dragesco, 1962 (A); Tuffrau, 1960 (БД—3); Curds, 1977 (В, Г)).
Fig. 293. Euplotida.
usi) нет бактерий или зоохлорелл в цитоплазме. Итак,
род определяется по полному набору ФВ циррусов, без
утраты одного из них.
2. Moneuplotes Jankowski, 1979. Типовой вид
М. vannus (Muller, 1786) Jank., 1979. Произвольная за-
мена типа отмечена в каталоге родов цилиат Аэшт, где
правильно указан тип рода — Е. cristatus Kahl, 1932.
Это действительно недопустимо, нельзя указывать
М. vannus как типовой вид. Не замечено другое — я
считал Moneuplotes подродом и не переносил Е. vannus
в состав рода — обозначение М. vannus (М.) Jank.,
1979 ошибочное, нужно М. vannus (М.) Jank. comb. n.
Moneuplotes включает только морские виды, неспособ-
ные к инцистированию. Имеются 10 ФВЦ, но добавоч-
ные морфогенетические полосы кинетосом при деле-
нии иногда дают начало большему, чем обычно, числу
ФВЦ. Такой диагностический признак нечеткий —
если циррусов спереди 10, это может быть и Euplotes, и
Moneuplotes. Дорсальный аргиром «одиночного типа»,
и дорсум обычно гладкий (у Euplotes с продольными
ребрами). Кроме типового вида в составе рода указаны
M.balticus (Kahl, 1932); М. crassus (Dujardin, 1841);
М. cristatus (Kahl, 1932); M. minuta (Vocom, 1930);
M. mutabilis (Tuffrau, 1960). Видов больше, поскольку
морфологическим видам соответствуют изолированные
реальные виды (сиблинги) со сходной морфологией,
судя по данным генетики, биохимии, физиологии.
3. Euplotoides Воггог et Hill, 1995. Типовой вид
Е. patella (Muller, 1773). В основном пресноводные ви-
ды, один вид эвригалинный (Е. woodruff). 9 ФВЦ, с по-
терей цирруса в ряду VI-З (проще говоря, нет верхнего
цирруса во втором ряду справа). Дорсальный аргиром
двойного типа (как у Е. patella). Состав, кроме типового
вида — Е. aediculatus (Pierson, 1943); Е. agamalievi (Aliev,
1987); Е. amieti (Dragesco, 1970); E. daidaleos (Diller et
Kounaris, 1966); E. dogieli (Agamaliev, 1967); E. eurystomus
(Wrzesniowski, 1970); E. octocarinatus (Carter, 1972);
E. palustris (Hagen, 1980); E. plumipes (Stokes, 1884);
E. woodruff (Gaw, 1939). Зоохлореллы встречаются у
одного вида, эндобактерии Polynucleobacter necessarius—
у 8 видов (часть видов в этом отношении не изучена).
4. Euplotopsis Воггог et Hill, 1995. Типовой вид
Е. afflnis (Dujardin, 1841). Пресноводные и морские ви-
ды с 7, 8 или 9 ФВЦ; утерян циррус VI-2 вида Euplotes
charon, т. е. нет второго (нижнего) цирруса во второй
справа паре циррусов; у Euplotoides в этой паре нет
верхнего цирруса. У некоторых популяций Е. raikovi и
Е. strelkovi в этом месте может быть аргентофильная
пластинка без цирруса. Дорсальный аргиром разного
типа — двойной, тройной, сложный (сетчатый); обыч-
486
ALVEOLATA
Рис. 294. Euplotida.
Certesia quadrinucleata (A); Swedmarkia arenicola {Б—Д)\ Euplotaspis cionaeeola (li '}). (цо: Dragesco, 1965a (Б—Д); Wicklow, 1983 (A); Chatton, Seguela,
1936 (6’ 4)).
Fig. 294. Euplotida.
но имеются ребра вдоль кинет. Несколько видов могут
инцистироваться. Нет эндобактерий и зоохлорелл. Со-
став, кроме типового рода,—Е. aberrans (Dragesco, 1960);
Е. apsheronicus (Agamaliev, 1966); Е. bisulcatus (Kahl,
1932); E. elegans (Kahl, 1932); E. encysticus (Yonezawa,
1985); E.finki (Foissner, 1982); E. gracilis (Kahl, 1932);
E. latus (Kahl, 1932); E. muscicola (Kahl, 1932); E. mus-
corum (Dragesco, 1970); E. папа (Jones et Owen, 1974);
E. novemcarinata (Wang, 1930); E. parkei (Curds, 1974);
E. poljanskyi (Agamaliev, 1966); E. raikovi (Ag., 1966);
E. rotunda (Gelei, 1950); E. strelkovi (Ag., 1967); E. tegu-
latus (Tuffrau, 1960); E. zenkowitchi (Burkovsky, 1970).
В этом списке мы видим Е. tegulatus, тип подрода
Mideuplotes Jank., 1978; это значит, что название Euplo-
topsis невалидно, сведение Mideuplotes в синонимику
рода Euplotopsis у Аэшт является ложным, и данный
род должен носить название Mideuplotes. Странно, что
даже опытные специалисты не заметили эту ошибку —
введение ненужного названия Euplotopsis. Кроме ти-
пового вида М. tegulatus род включает в новой комби-
нации Mideuplotes aberrans, М. apsheronicus, М. bisul-
catus, М. elegans, М. encysticus, M.finki, М. gracilis,
М. labiatus, М. latus, М. muscicola, М. muscorum, М. па-
па, М. novemcarinata, М. parkei, М. poljanskyi, М. raiko-
vi, М. rotunda, М. strelkovi, М. tegulatus, М. zenkowitschi
comb. nn. (ранее все виды в составе Euplotes') и Euplo-
topsis incisa Foissner et al., 2002 (Mideuplotes incisus
comb. n.). По типу дорсального аргирома род делится
далее на 2 подрода — Mideuplotes и Neteuplotes.
Euplotes taylori Garnjobst, 1928 и E. longipes C. et L.,
1859 принадлежат к Moneuplotes (M. taylori, M. lonipes
Jank. comb, n.); в списках нет E. roscoffensis Dragesco,
1960; E. thononensis D., 1960; E. terricola Penard, 1922;
E. tuffraui Berger, 1965 и мн. др. видов с аберрантным
или малоизученным кинетомом и аргиромом.
Видов эуплотид намного больше, но часть плохо
описана, часть сведена в синонимы (при этом всегда
возможна ошибка). Интересны 2 вида из морского
планктона, Е. caudata Meunier, 1910 и Л. truncata Meu-
nier, 1910, с каудальными отростками. Определители
видов Euplotes sensu lato, устаревшие и неполные, —
Curds, 1975, Curds, Wu, 1983.
Можно ли использовать синонимичные названия
при дроблении рода Euplotes"? Ниже дан их список:
Euploea Ehrenberg, 1830, типовой вид Е. charon
Ehr., 1830, гомоним.
ТИП CILIOPHORA. КЛАСС SPIROTRICHEA
487
Рис. 295. Euplotida.
Uronychia transfuga (A—B); Euplotidium prosaltans (Г, Д); Diophrys irmgard (£); Aspidisca pulcherrima (Ж); A. orthopogon (3—И). (По: Dragesco, 1963b (£);
Dragesco, Dragesco-Kemeis, 1986 (A—В, Ж); Deroux, Tuffrau, 1965 (3—И); Tuffrau, 1985 (Г, Д')).
Fig. 295. Euplotida.
Euploia Lohmann, 1920, типовой вид E. pelagica.
Плохо описанный вид.
Clypta Gistel, 1848 nom. n. для Euploea; но Эренберг
уже заменил это название другим — Euplotes.
Tribulina Bory, 1824, типовой вид Т. rostellum, пло-
хо описанный вид.
Himantopus Muller, 1786, типовой вид//, charon, го-
моним.
llimantophorus Ehrenberg, 1838, типовой вид
//. charon — тип рода Euplotes.
Crateromorpha Perejaslawzewa, 1886, типовой вид
С. mirabilis. Очень плохо описанный неопределимый
морской вид рода Euplotes. Нет точного рисунка цир-
русов.
Ploesconia Bory, 1824; типовой вид пока не фикси-
рован, к роду до и после монографии Эренберга (Eh-
renberg, 1838) относили всех эуплотесов, а затем также
виды рода Diophrys и Uronychia, например Р. crassa,
Р. balteata, Р. patella, Р. vannus, Р. charon', последний
вид здесь обозначается типовым, и Ploesconia уходит в
синонимику названия Euplotes. В итоге все приведен-
ные выше названия неприменимы для дробления рода
Euplotes.
Сем. Certesiidae Borror et Hill,
1995
Тело овальное, перистом меньше, чем у Euplotes,
занимает четверть вентральной стороны; справа длин-
ная мембрана, точнее мембранелла, с широким полем
кинетосом в основании; полоса мембранелл перистома
не огибает апекс. Аргиром и дорсальные ряды пока
не выявлены. На венте доминируют 5 мощных ТЦ;
нет каудалий; левые маргиналии (5—11) более много-
численные, чем у эуплотесов, в одном ряду; труд-
но определить паттерн ФВЦ — в кажущемся бес-
порядке рассеяны 11 крупных циррусов; нет краевых
щетинок справа. В целом кинетом несимметричен,
много элементов утрачено справа. Ядро в виде 4 оваль-
ных нодул, не в цепочке. При морфогенезе над за-
чатками 5 ТЦ образуются по 2 цирруса, над зачат-
ком мембраны нижней особи — еще один непарный
циррус.
488
ALVEOLATA
Рис. 296, a. Euplotida.
Diophrys scutum (А, Б,Ж); Uronychia transfuga (B—E)-, 1). nutgnunt (3—К). (По: Song, I’nckrofl', 1993 (/f); Dragesco, 1963b (S); Ozaki, Yagiu, 1943 (В, Г); Raikov,
Kovaleva, 1968 (Ж, 3); Dragesco. Drngesco-Kcrncis, 1986 (A, E): Petz et al., 1995 (И, K)).
Fig. 296, a. Euplotida.
Род Certesia Fabre-Domergue, 1885
(рис. 294)
С диагнозом семейства. Типовой вид C. quadri-
nucleata. Редкий морской вид, хорошо изучен лишь в
недавнее время. Род монотипичен; второй вид Certesia
ovata Vacelet, 1961 мельче типового, с такими же ядра-
ми, отличается деталями положения циррусов, вид
плохо описан и позже не изучался.
Сем. Aspidiscidae Ehrenberg,
1838
У Линна (Lynn, 2002) семейство включает 2 резко
различающихся рода, и общий диагноз дать трудно.
По Боррору и Хиллу (Borror, Hill, 1995), виды семейст-
ва почти округлые спереди, плоские, дисковидные, с
сильным тигмотаксисом. Нет левых МЦ; ФВЦ и ТЦ
очень толстые, короткие, со свободными вершинами
(реснички у вершины не склеены), вероятно, нет унду-
лирующих мембран (пароральной и эндоральной).
Ядро С-образное. Пресные воды, море (Aspidisca)-,
симбионты (Euplotaspis). Родство этих форм не доказа-
но. У Линна, вероятно, в этом семействе (incertae sedis)
числится также род Paraeuplotes.
Pop, Aspidisca Ehrenberg, 1830
(рис. 295, 297a)
Типовой вид Trichoda lyncens Muller, 1773. Очень
мелкие формы с прочным панцирем, часто с зубцами
и шипами, дорсум с несколькими ребрами вдоль ки-
нет, несущих щетинки. На венте косой ряд ТЦ, и
ФВЦ в кажущемся беспорядке, не более 8. Нет МЦ.
Ядро С-образное. Перистом, дуговидный у большин-
ства эуплотид, распался на 2 части — рот с небольшой
полосой мембранелл сместился к заднему концу тела,
в середине тела перерыв, у апекса мелкая группа цир-
русов — остаток апикальной части полосы мембра-
нелл. Поскольку это не примитивный род отряда
эуплотид, отделение апикальных мембранелл проис-
ходит неоднократно и независимо в эволюции гипо-
ТИП CILIOPHORA. КЛАСС SPIROTRICHEA
489
Рис. 296, б. Euplotida.
Euplotes acanthodus (A, E): Gastrocirrhus stentoreus (В—Д); G. monilifer (E, Ж); Diophrys scutum (3); G. adhaerens (И). (По: Petz et al., 1995 (A, Б); Hu, Song,
2003 (B—E)\ Ozaki, Yagiu, 1943 (3); Dragesco, Dragesco-Kemeis, 1986 (Ж, И)).
Fig. 296, 6. Euplotida.
трих. Такой набор признаков достаточен для валида-
ции семейства.
Вентральный аргиром сетчатый, дорсальный не-
скольких типов. Как и у Euplotes, эти различия послу-
жили основой для выделения подродов (Янковский,
1979).
1. Aspidisca s. str. Типовой вид Л. lynceus. Меж-
ду дорсальными кинетами простые перемычки («soli-
tary type»).
2. Dimaspidisca Jank., 1979. Типовой вад A. fus-
ca Kahl, 1928. Между кинетами по 2 продольных ряда
прямоугольников.
3. Netaspidisca Jankowski, 1979. Типовой вид Л. асе-
rosa Jank., 1979 (=А. caspica № 3 — Агамалиев, 1983).
Со сложной мелкоячеистой сетью аргирома между дор-
сальными кинетами. Агамалиев описал в разные годы
под одним названием A. caspica виды с 3 типами арги-
рома, но это невозможно, тип аргирома специфичен для
видов.
При кажущемся беспорядке расположения ФВЦ
у Aspidisca они соответствуют в морфогенезе зачат-
кам трансверсалий; слева направо это непарный
циррус с особым морфогенезом и дериваты ТЦ 1—5
(2, 2, 1, 1 и 1 циррус ФВЦ). Однако у Aspidisca вариа-
ция числа ФВЦ больше, чем у Euplotes (соответствен-
но 7—15 и 9—10), и число ТЦ разное, поэтому для
каждого вида гомологию ФЦ и ТЦ нужно устанав-
ливать при изучении морфогенеза. Это затрудняет раз-
деление на подроды по принципу Боррора и Хилла.
Этот род пока подразделяют на 3 группы по типу
ФВЦ — группа A. lynceus с 7 ФВЦ, группа A. polystyla
с 7—8 ФВЦ иного положения и группа 2 видов (A. bi-
nucleata, A. mutans) с более 8 ФВЦ. Родовые сино-
нимы:
Aspidiscopsis Ghosh, 1921, типовой вид Л. bengalen-
sis, с длинной полосой мембранелл; очень плохо опи-
санный неопределимый вид.
Coccudina Вогу, 1824, типовой вид не обозначен —
здесь как тип рода указывается С. cicada (Trichoda cicada
Muller, 1786). В каталоге родов гипотрих (Янков-
ский, 1979) указан род Coccudina Dujardin, 1841 с типом
С. costata Duj., 1841, но родовое название введено
раньше.
Onychaspis Stein, 1859, типовой вад Aspidisca poly-
styla-, установлен как подрод в составе Aspidisca для
вида с большим числом ТЦ.
490
ALVEOLATA
Рис. 297, a. Euplotida.
Aspidisca caspica (Л, Бу Aspidisca sp. (B); A. lyncaster (Гу A. cicada (Д—И); Paraeuplotes tortugensis (К, Л). (По: Wichterman, 1942 (К, Л); Tuffrau, 1965 (Л);
Augustin, Foissner, 1992 (Д—РГу, Petz et al., 1995 (В); Лгамалиев, 1983 (A, £)).
Fig. 297, a. Euplotida.
Monostylus Perejaslawzewa, 1886, типовой вид
M. heterotrichus — фрагмент гипотрихи или синоним
Aspidisca, вид неопределим. Второе и третье названия
могут быть использованы при дроблении рода Aspi-
disca.
Опубликован определитель видов Aspidisca (Wu,
Curds, 1979; Carey, 1992), но позже ряд видов, считав-
шихся валидными, ушел в синонимику. Примеры ви-
дов рода — A. aculeata (Е., 1838); A. binucleata К.,
1932; A. dentata К., 1928; A.fusca К., 1928 {-A. irinae
Burkovsky, 1970); A. leptaspis Fresenius, 1865; A. lyncas-
ter (М., 1979); A. lynceus (М., 1773); A. magna К., 1930
(=А. maxima Vacelet, 1961, нетипично крупный мор-
ской вид величиной до 160 мкм); A. major Madsen,
1931; A. steini Buddenbrock, 1920; A. turrita (Е., 1838);
A. pulcherrima К., 1935; A. polystyla Stein, 1859; A. mu-
tans К., 1932; A. sedigita Quennerstedt, 1867 и др.
Сем. Paraeuplotidae Wichterman,
1942
У Вихтермана название семейства приведено
без диагноза в описании типового вида, но оно прием-
лемо, поскольку совпадает с описанием рода. Род Parae-
uplotes раньше включали в сем. Aspidiscidae; Корлисс
(Corliss, 1979) включает в сем. Paraeuplotidae также
род Euplotaspis-, в обзорах эуплотид этот род не упо-
минается.
Морские формы, симбионты на кораллах Eunicea
crassa у Флориды; позже отмечены в актиниях Випо-
dosoma cavernata на берегах Техаса, но без описания
и рисунков, поэтому проверить определение нельзя.
Тело почти округлых очертаний, заполнено зооксан-
теллами, вероятно динофлагеллатами рода Symbiodini-
ит (как у хозяев); ядро изогнутое, почти кольцевид-
ное. Дорсум без рядов щетинок (но импрегнация
не применялась), с продольной складкой. На венте
гигантский перистом — апикальная дуга и полоса
мембранелл до постерона. Кинетом необычный —
дуга ресничек параллельно апикальной дуге мембра-
нелл; широкая полоса ресничек вдоль правого края
зела; пучок каудальных циррусов и 2 очень высоко
расположенных ТЦ. Вероятно, дуги ресничек — это
полосы мелких циррусов, распавшихся на реснички в
фиксаторе. По Вихтерману, нет пищевых вакуолей
(но эпибионты кораллов обычно питаются отделя-
емой слизью).
Род Paraeuplotes Wichterman,
1942
Типовой вид Р. tortugensis, с диагнозом семей-
ства.
Сем. Gastrocirrhidae Faure-Fremiet,
1961
Морские планктонные эуплотиды, исключая не-
сколько бентосных форм, с относительно широким
перистомом, открытым апикально. Мембрана ко-
роткая, зона мембранелл резко удлинена; иногда име-
ТИП CILIOPHORA. КЛАСС SPIROTRICHEA
491
Рис. 297, б. Plagiotomida. (По: Albaret, 1975).
Plagiotoma lumbrici (A—3); P. africana (И—Л).
Fig. 297, 6. Plagiotomida.
1отся левые маргинальные и правые каудальные
циррусы. Ядро С-образпое, не фрагментировано, ино-
гда в цепочке. У Боррора и Хилла (Воггог, Hill, 1995)
в составе семейства 3 рода — Cytharoides, Euplotidium,
Gastrocirrhus', у Линна (Lynn, 2002) также Swedmarkia.
Недавно род Euplotidium был разбит на 2 рода.
Род Gastrocirrhus Lepsi,
1928
Типовой вид G. intermedius. Описание вида
краткое и настолько плохое, что Каль (Kahl, 1932) счи-
тал вид фрагментом окситрих; это затрудняет синони-
мию последующих видов и рода Cirrhogaster. Вид най-
ден в пробах с колоний морских мшанок (Bryozoa) у
Бейрута; перистом широко открытый, как у Stentor, но
с циррусами, как у гипотрих (поэтому «intermedius»).
Позже род включался в состав Euplotidae.
Тело вздутое, как бы срезанное поперек на верши-
не, с ресничками по всему краю воронки и с мелкими
циррусами по периферии тела. Точное описание кине-
тома — у вида G. adhaerens Faure-Fremiet, 1964. Мемб-
ранеллы огибают весь край широкой воронки, спуска-
ются в полость; постерон с дугой из 12 особо длинных
тигмотактичных циррусов; на венте 2 продольных
ряда с 8 циррусами в каждом; ядро цепочковидное.
Нет МЦ слева, нет каудалий; нижний ряд можно счи-
тать ТЦ, правый боковой — МЦ, осевой — ФЦ. Веро-
ятно нет левых МЦ и правых каудалий. G. trichocystus
Ito, 1958 — вероятный синоним вида G. adhaerens. Ти-
повой вид фактически неопределим.
Род Cirrhogaster Ozaki et Yagiu,
1942
Типовой вид С. monilifer с водорослей в Япо-
нии. Вид подробно и точно описан, авторы знали G. in-
termedius по определителю Каля; и все же Боррор и
Хилл (Воггог, Hill, 1995) сводят тип рода в синонимы
вида G. adhaerens. Японские авторы считают описание
Лепши точным и дают ряд различий, например цепоч-
ка ядер у С. monilifer и овальное ядро у G. intermedius',
но у Лепши примитивный набросок, явно ошибочный.
С. monilifer имеет стандартную для рода форму тела,
492
ALVEOLATA
длинную цепочку ядер, снизу дуга из 12 циррусов (в
2 зонах, 7 1 5), выше в продольных рядах 2 + 5 + 3 цир-
руса (у G. adhaercns 8 + 8). Валидность рода неясная,
скорее всего, это синоним рода Gastrocirrhus.
Род Spongiocirrhus Jankowski, 1979
Типовой вид Gastrocirrhusstentoreus Bullington,
1940. Название предложено ранее как подрод в составе
Gastrocirrhus; новый статус — род (S'. stentoreus
comb. п.). Валидность рода зависит от правильности
описания и единственного рисунка вида. Это морской
вид из Флориды; форма тела, как у G. intermedius, пе-
ристом на 2/3 длины тела; ядро не видели; сзади вмес-
то широкой дуги длинных циррусов — короткий ряд с
5 циррусами — это типичные для эуплотид ТЦ, сме-
щенные вправо. Имеется 2 ФЦ, 4 правых МЦ, 5 более
тонких ВЦ; с 5 ТЦ (принятыми за каудалии) всего 16
циррусов. Движение — плавание без спирализации и
прыжки.
Род Cytharoides Tuffrau, 1974
Типовой вид С. balechi из морского планктона в
Антарктике. Тело пятиугольное, с гигантским пери-
стомом, идущим от апекса почти до постерона; мемб-
рана дуговидная, на 1/3 длины полости, со второй ко-
роткой мембраной; полоса мембранелл дуговидная,
длинная; аргиром — пятиугольники кортекса. Кине-
том — группа ФЦ у апекса, 2 ВЦ (над трансверсалия-
ми), 5 ТЦ в почти продольном ряду, не крупнее осталь-
ных циррусов, краевой ряд правых МЦ у нижнего кон-
ца тела примерно с 12 циррусами; нет левого ряда МЦ;
дорсум с рядами щетинок. Позже переописан тип рода
(Agatha et al., 1993) и добавлен новый вид С. australis
Agatha, Spindler et Wilbert, 1903; по этой работе несо-
мненно родство Cytharoides и Euplotes, в частности, у
первого выявлены дорсальный аргиром типа Е. patella
и типичная для эуплотесов мелкоячеистая вентральная
сеть. Место этого рода может быть в сем. Euplotidae.
Pop, Euplotidium Noland, 1937
Типовой вид Е. agitatum. Морской вид. Тело с
панциревидным кортексом, вытянутое, на дорсуме
пелликула с бугорками и 3 ребрами; перистом огибает
весь апекс, вероятно, с длинной мембраной; ядро С-об-
разное. Кинетом простой — сзади 5 длинных ТЦ, слева
нет никаких циррусов, справа 2 параллельных ряда с 5
и 4 циррусами (ФВЦ). Бугорки пелликулы — эпибакте-
рии. В обзоре эуплотид (Borror, Hill, 1995) приведен
рисунок вида с такими же ФВЦ (8 + 6), с 9 ТЦ и одним
мелким циррусом слева от ТЦ (рисунок инвертирован).
Род Paraeuplotidium Lei, Choi et Xu, 2002
Типовой вид Euplotidium itoi Ito, 1958. Также
E. arenarium Magagnini et Nobili, 1964, E. helgae Hart-
wig, 1980, E. prosaltans Tuffrau, 1985, E. psammophilus
(=Euplotes psammophilus Vacelet, 1961), переведенные
в состав нового рода. Фактически все валидные виды
рода Euplotidium, кроме типового, вошли в новый род.
Внешний облик родов совпадает, перистом сходен, но
у Paraeuplotidium ФВЦ расположены не в рядах — раз-
рознены поодиночке без четкого узора, нет каудаль-
ных циррусов и имеется снизу слева один обособлен-
ный циррус — остаток ряда МЦ предка. Как и у Euplo-
tes, изучение морфогенеза позволяет координировать
ФВЦ с определенным ТЦ; полимеризация ТЦ у Euplo-
tidium привела соответственно к полимеризации ФВЦ.
Виды рода хорошо культивируются, служат объектом
изучения уникальных эпибактерий, способных к вы-
стреливанию защитных органелл; бактерии (обознача-
емые ненужным новым термином «эпиксенозомы»)
локализованы в ямках кортекса. Опытный исследова-
тель цилиат Вейбо Сонг, описавший немало эуплотид,
не признает род Paraeuplotidium валидным, но в сущ-
ности авторы этого рода использовали тот же прин-
цип, что и Боррор и Хилл (Borror, Hill, 1995) при дроб-
лении рода Euplotes.
Род Swedmarkia Dragesco, 1954
Типовой вид S. arenicola. Из морского песка;
редкий, но хорошо изученный вид. Линн (Lynn, 2002)
относит этот род к сем. Gastrocirrhidae, вероятно сбли-
жая его с Euplotidium. Тело короткое и широкое, с ги-
гантским перистомом — около половины вента; поло-
са мембранелл идет слева и апикально, до выступа
тела спереди справа; мембрана вдоль всего правого
края полости, рот почти у постерона. Дорсум с не-
сколькими искривленными рядами щетинок, аргиром
сетчатый; вдоль мембраны вентрально — ряд буккаль-
ных циррусов; имеется 5 мощных ТЦ, группа ФЦ, не-
сколько ВЦ и справа ряд маргиналий; слева циррусов
пет, по часть их перешла справа на дорсум. Ядро в
виде множества фрагментов. Вид изучен в электрон-
ном микроскопе. Сонг (Song, 1995а) считает род эуп-
лотидой и интерпретирует ряды ниже, левее рта, как
МЦ, ниже правее рта, как каудалии, а все остальные
разрозненные циррусы, как ФВЦ.
Сем. Uronychiidae Jankowski,
1979
Семейство предложено только для Uronychia с уни-
кальным типом перистома, но сейчас в него включают
также Diophrys и близкие роды с перистомом обычно-
го типа. Поэтому их следует разделить хотя бы на
уровне подсемейств.
Подсем. Diophryinae Lynn et Small,
2002
Типовой род Diophrys', также Paradiophrys и Dioph-
ryopsis. Перистом стандартного типа; тело овальное,
имеется четкая группа ФВЦ; 2 ундулирующие мембра-
ны с тонкими основаниями ограничивают перистом
справа.
ТИП CILIOPHORA. КЛАСС SPIROTRICHEA
493
Род Diophrys Dujardin, 1841
Типовой вид D. marina. Этого вида в каталогах
сейчас нет, он сведен в синонимы вида Stylonychia ар-
pendiculata Ehr., 1838 (Diophrys appendiculatus). ФВЦ
меньше, и они более изменчивы по числу, чем у Euplo-
tes', обычно имеются 3 крупные каудалии дорсально
справа; дуга мембранелл огибает апекс, мембраны
длинные, вдоль всего правого края. Дорсум с рядами
щетинок; аргиром сетевидный. Ядра обычно фрагмен-
тированы на несколько сегментов. Морские и солоно-
ватоводные виды, часть видов — морские реликты в
пресных водах Кавказа. К роду приписывалось много
видов, но часть их не признается валидными; в послед-
ней сводке валидными считаются лишь D. appendicu-
lata с большим числом синонимов и D. scutum. 4 вида
выделены в составе 2 новых родов. Поскольку синони-
мия видов рода условная (вероятная, но не доказана), в
списке рода можно назвать виды: D. oligothrix Borror,
1965; D. peloetes В., 1965; D. quadricaudatus Agamali-
ev, 1967; D. scutoides Ag., 1967; D. scutum D., 1841; в
определителе Карея (Carey, 1992) не признаются ва-
лидными виды D. kasymovi Ag., 1971 и D. magnus Rai-
kov et Kovaleva, 1968 как синонимы D. scutum.
Род Paradiophrys Jankowski, 1978
Типовой вид Diophrys irmgard Mansfeld, 1923.
План строения, как у Diophrys, отличия — по кинето-
му. У Р. irmgard, Р. kahli D., 1963 и Р. multinucleata
Hartwig, 1973 снизу вентрально кроме мощных ТЦ и 2
суб-трансверсалий имеются не только правые, но и ле-
вые циррусы в компактном ряду — левые маргиналии.
Ядро в 2 крупных или многочисленных мелких фраг-
ментах. Дорсум с несколькими рядами щетинок.
Род Diophryopsis Hill et Borror,
1992
Типовой вид Diophrys histrix Buddenbrock, 1920.
Монотипический род из морского эпибентоса. Тело
мелкое, не сплющено, широкое, ядро С-образное или в
2 сегментах; перистом широко открытый. На венте
5 мощных ТЦ, 3 крупные каудалии с основаниями на
дорсуме, 2 суб-трансверсалии и группа ФВЦ в двух
коротких рядах. Щетинки очень длинные, в связи с
планктонным образом жизни. Слева от перистома —
1—2 маргиналии. Род отличается от Diophrys необыч-
ным обликом, развитием длинных щетинок (до
15 мкм), смещением каудалий высоко вверх и укоро-
чением дорсальных рядов.
Синонимичные названия диофриид:
Planiplotes Andrusova, 1886, типовой вид Р. wagne-
ri', вид неопределим.
Pamplota Thomson, 1888, предложено для замены
предыдущего названия.
Schizopus Claparede et Lachmann, 1858, типовой вид
S. norwegicus, гомоним. Вид считается синонимом
D. appendiculatus.
Stylocoma Gruber, 1884, типовой вид S'. ovifbrmis,
гомоним.
Styloplotes Stein, 1859, типовой вид S. appendicula-
tus', это тип рода Diophrys.
Аэшт (Aescht, 2001) в списке валидных родов цили-
ат приводит Hyloplotes Butschinsky, 1897 с типовым ви-
дом Н. appendiculatus, но такого рода не существует,
это просто опечатка; Бучинский (Butschinsky, 1897) ни-
когда не предлагал новых видов и родов цилиат. Оши-
бочное название принятого в то время рода Styloplotes
приведено им в списке цилиат Одесских лиманов.
По типу ядер в составе Diophrys выделены подроды
Diophrys s. str. (тип рода D. scutum), Epidiophrys Jank.,
1979 (D. quadricaudatus Agamaliev, 1967), Polydiophrys
Jank., 1979 (D. tetramacronucleata Kattar, 1970) и Moni-
lidiophrys Jank., 1979 (D. magnus R. et K., 1968) соот-
ветственно c 2, 3, 4 ядрами и 2 цепочковидными яд-
рами); это подразделение основано на слишком мел-
ких признаках и кажется ненужным. Аналогично, род
Paradiophrys включает подроды Paradiophrys s. str.
(D. irmgard, D. kahli, c 2 ядрами) и Lacifer Jank., 1979
(D. multinucleatus Hartwig, 1973, с необычным у эупло-
тид распыленным типом ядра).
Подсем. Uronychiinae Jankowski,
1979
Перистом гигантский, зона мембранелл прервана,
сохранены апикальная зона и сегмент снизу у рта, мемб-
рана огибает весь перистом. Морской бентос, сапропель.
Род Uronychia Stein, 1859
Типовой вид Trichoda transfuga Muller, 1776 из
морского детрита. Тело широкое, бочонковидное, ядро
фрагментировано, перистом гигантский, занимает до
половины поверхности вента. По всему краю глубокой
перистомальной ямки (буккона) расположена гигант-
ская мембрана (УМ) с дикинетой в основании, в виде
почти замкнутого кольца. Нет привычной у гипо-
трих дуговидной полосы мембранелл; над ртом лишь
4 мембранеллы, далее перерыв до апекса, и на апексе
дуга из небольшого числа мембранелл. Дорсум с про-
дольными рядами щетинок, частично и на венте слева.
Аргиром в виде сложной сети ячеек, ориентированных
продольно на дорсуме. Вентральный кинетом необы-
чен, как и перистом, — нет стандартной группы раз-
розненных крупных ФВЦ, но 4 полоски под апексом
справа считаются видоизмененными фронтальными
циррусами. В постесоме 5 гигантских ТЦ справа,
3 массивных маргиналии слева и 3 столь же массивные
каудалии с основаниями на дорсуме. Сохранен ряд
мелких правых МЦ или 2 его рудимента.
Род относится к группе гипотрих, названных «espe-
ces retrocursifs» — с попятным движением; перемеще-
ние прыжками назад или плаванием с вращением. То-
пография циррусов легко видна без окраски, виды
рода хорошо изучены. Кроме типового вида род вклю-
чает U. binucleata Young, 1922; U. setigera Calkins,
1902; U. multicirrus Song, 1997; U. heinrothi Budden-
brock, 1920; U. magna Pierantoni, 1909; U. uncinata Tay-
lor, 1927; U. bivalvorum Fenchel, 1965; U antarctica
Valbonesi et Luporini, 1990; высказывалось мнение, что
494
ALVEOLATA
виды U. heinrothi, U. uncinata и U. bivalvorum — сино-
нимы типового вида U. transfuga (Borror, Hill, 1995),
но по крайней мере IJ. uncinata — валидный вид. U. bi-
valvorum - симбионт морских двустворок, открыт в
Дании (Fenchol, 1965а). Из состава рода исключены
плохо описанные, недостоверные виды U. festinans и
пресноводная эуплотида U. раирега.
Род Campylopus Claparede et Lachmann,
1858
Типовой вид С. paradoxus, гомоним. Название
этого рода непригодно в случае дробления рода Uro-
nychia', кроме того, этот вид считается синонимом
U. transfuga Stein, 1859, т. е. типовые виды обоих ро-
дов совпадают.
Род Euplotaspis Chatton et Seguela, 1936
Типовой видЕ cionaecola из жаберной полости
асцидий Ciona intestinalis (Франция). В США найдена
в Ascidia paratropa, Pyura haustor, Ascidiella callosa’,
обычны в России в асцидиях Баренцева и Японского
морей. Предпочитают крупных одиночных асцидий,
не колониальных, у которых мелкие зооиды собраны в
цепочки. Вид пока один, точное сравнение форм из
разных морей и хозяев не проводилось.
Тело овальное, перистом в виде гигантской краевой
дуги, рот почти у постерона; мембрана УМ одна, не-
большая. Справа и на дорсуме ряды кинетосом со ще-
тинками. Справа на венте 14 коротких мощных цирру-
сов с крупными основаниями, из них 6 одиночные и
вдоль правого края тела 4 пары вплотную сближенных
циррусов. Снизу 5 ТЦ с мелкими циррусами, 1 правый
каудальный циррус; нет левых маргиналий. Ядро
С-образное. Вид не относится к прыгающим «ретро-
курсивным» эуплотидам, движение — медленное пла-
вание по субстрату. Легко импрегнируется аргиром на
венте в виде мелкоячеистой сети. Авторы рода считали
Eupotaspis промежуточным между Euplotidae и Aspi-
discidae, как начало регресса кинетома; у Линна (Lynn,
2002) род помещен в сем. Aspidiscidae, которое лучше
сохранить для форм с разрывом полосы мембранелл.
По филограмме Сонга (Song, 1995а) Euplotaspis нахо-
дится на вершине древа эуплотид, рядом с Aspidisca.
В данном обзоре род приводится после списка эупло-
тид как род неясного положения (incertae sedis) и не от-
несен к известным семействам отряда.
Отряд Plagiotomida Albaret, 1974
Тело вытянутое, сужается к антерону, сильно
сплющено латерально, полоса мембранелл проходит
по краю тела. Правая сторона тела плоская, левая не-
сколько выпуклая. Перистом — длинная полоса мемб-
ранелл, сближенных вплотную, идущих от апекса до
экватора и здесь входящих в небольшой инфунди-
булум. Наружные мембранеллы видели и ранние авто-
ры, но наличие мембраны (ундулирующей = парораль-
ной), свойственной всем спиротрихам, было доказано
недавно при импрегнации протарголом. Мембрана
двойная, оба ряда — гаплокинеты, не примыкающие
вплотную одна к другой, идут на правой стенке инфун-
дибулума. В основаниях мембранелл по 3 ряда кинето-
сом, верхний ряд короче двух нижних; в инфундибу-
луме мембранеллы дуговидные, сохраняют такую же
топографию кинетосом в основаниях. На дне инфун-
дибулума и его левой стенке — мощная фибриллярная
опорная пластинка, соединенная пучками микротубул
со всеми основаниями мембранелл. Вглубь тела от рта
отходит пучок толстых фибрилл.
Соматическая цилиатура развита на обеих сторо-
нах тела, справа это примерно 22 продольных ряда,
слева не меньше, ряды подходят справа к вершине по-
лосы мембранелл, слева ко всей полосе от рта до апек-
са. В передней половине тела в основаниях ресничек
сложные элементы, ниже экватора простые ряды кине-
тосом. В антесоме протаргол выявляет четкие пластин-
ки с 2 рядами гранул (3 + 3), от которых в обе стороны
отходят пучки микрофибрилл; в постесоме пластинки
включают только по одному набору гранул. Это не-
много напоминает циррусы гипотрих.
2 ряда кинетосом правее полосы мембранелл особо
устроены, их пластинки соединены фибриллами меж-
ду собой и с мощным фибриллярным стержнем, иду-
щим вдоль перистома, к которому идут также фибрил-
лы от всех мембранелл. Пучок фибрилл резко расши-
ряется в инфундибулуме.
Сократительная вакуоль одна, под перистомом.
Ядро одно, уникального вида — напоминает гроздь
винограда или ветку с листьями, причудливо изрезан-
ное, крупное, с 1—2 крупными микронуклеусами, за-
нимает значительную часть тела. Кортекс без трихо-
цист, мукоцист, пигментосом, без желобков и ребер.
Отряд включает одно семейство и один род — парази-
ты в кишечнике наземных олигохет.
Сем. Plagiotomidae Butschli, 1887
С диагнозом отряда.
Род Plagiotoma Dujardin, 1841
(рис. 297, б)
Типовой вид P.lumbrici (= Leucophra lumbrici
Schrank, 1803) по монотипии.
Это род с очень сложной таксономической исто-
рией. Долгое время кишечных эндопаразитов из раз-
ных животных относили к Opalina и Plagiotoma, и в
итоге последние включали виды современных родов
Nyctotherus (Р. cordiformis, Р. gyoryana), Conchophthi-
rius (Р. acuminata'), Balantidium (P. coli, P. blattarum),
также свободные виды (P. lateritia, ныне в составе
Blepharisma) и т. д. Указание Фроментеля (Fromentel,
1874) Р. cordiformis как типового вида рода неверно.
Включение Эрлем (Earl, 1972) вида никтотерид из вод-
ных моллюсков Nyctotherus kempi Chakravarty, 1936
(из кишечника гастропод Pila globosa, Ampullariidae, в
Индии) в состав Plagiotoma — ошибка, у таких форм
удлинен перистом вдоль тела и есть некоторое внеш-
нее сходство с плагиотомой, но строение особей и ки-
ТИП CILIOPHORA. КЛАСС SPIROTRICHEA
495
истом типичное для никтотерид. В составе рода 4 до-
стоверных вида.
/’. africana Albaret et Njine, 1975. Из неопределен-
ных дождевых червей Камеруна. Близки к типовому
виду, ио несколько мельче, с более компактным ядром
Гк’| ствола снизу, только с одним микронуклеусом;
чисть 'тела ниже экватора укорочена, поэтому пери-
с том кажется непропорционально крупным; кинеты не
с толь густые справа, чем у Р. lumbrici, а слева по всей
поверхности расположение кинетосом хаотичное, чис-
ло кинет трудно подсчитать.
Р. dichogasteri Mandal et Nair, 1975. Из дождевых
червей Индии Dichogaster bolaui'. длина тела
63 — 105 мкм, внешний облик, как у Р. lumbrici, описа-
ние вида банальное — фактически перечислены толь-
ко признаки рода, кинетом и точное строение перисто-
ма не изучены, на каждой стороне тела примерно
11 13 кинет; перистом длинный, со ртом ниже эква-
тора тела; ядро с 8—13 сегментами, у типового вида с
12 20 дольками; имеются 2 микронуклеуса.
Р. drawidi Mandal et Nair, 1976. Из червей Pellogas-
tcr bengalensis в Индии. Тело заострено сзади, пери-
стом вытянутый, рот ниже экватора, величина особей
93 106 мкм, ядро более компактное, чем у других ви-
дов, — всего 2 неравных фрагмента у большинства особей,
3 у четверти осмотренных цилиат; микро нуклеус один.
('оматический кинетом не изучен, на рисунке показано
13 кинет слева; точное строение перистома неизвест-
но. При осмотре 9 видов дождевых червей в штате
()рисса этот вид нашли только в указанном хозяине.
/’. lumbrici (Schrank, 1803) Dujardin, 1841. Единст-
венный вид из люмбрицид Европы, имеет широкий
круг хозяев, но не заражает всех дождевых червей, из-
вестных в Европе. Отмечен в Lumbricus castaneus,
/,. J'riendi, L. herculeus, L. terrestris, L. rubellus, L. spp.,
Nicodrilus giardi, N. longus, N. spp., Scherotheca (= Allo-
lobophora) savignyi и в неопределенных хозяевах, обы-
чен в России; находки в северной и южной Америке,
вероятно, в завезенных, не местных видах червей; рас-
пространение в Азии неизвестно. Крупный вид длиной
140—175 мкм; рот у экватора, полоса мембранелл де-
лит тело на 2 равные части; кинеты многочисленные,
18—25 справа; на правой стороне тела в антесоме пла-
стинки с 2 рядами кинетосом, ниже с одним рядом (у
Р. africana все левые основания двойные). Ядро особо
разветвленное с осевым стержнем снизу; имеется
2 микронуклеуса.
Изучение строения, ультраструктуры и морфогене-
за пластинок, лежащих в основаниях ресничек, показа-
ло ошибочность традиционного объединения плагио-
томид и никтотерид и родство первых с гипотрихами,
вторых с метопидами, которых сейчас исключают из
состава гетеротрих. В итоге плагиотомиды остаются в
составе спиротрих, но ввиду уникального типа цилиа-
туры не включаются в состав гипотрих, а выделяются
в особый отряд. Внешнее сходство с никтотеридами
конвергентное и незначительное. Процесс морфогене-
за, ныне важный признак отрядов у цилиат, скорее,
сходен с таковым у гетеротрих, чем гипотрих, — ниже
перистома на 5—6 кинетах возникают зачатки реснич-
ных полей, далее реорганизуется вся система кинет пе-
редней и нижней части томонта и образуется полоса
мембранелл. Ядро конденсируется, но не сливается
в сферу, остается аморфным и вновь растягивается
после деления. Базальные пластинки, их микротубулы,
как у части примитивных гипотрих, но латеральное
сплющивание тела, отсутствие слияния ресничек в
циррусы, отсутствие дифференцировки локальных
групп пластинок, нетипичное строение наружных
мембранелл — все это делает невозможным включе-
ние плагиотомид в состав Hypotrichida. Молекулярный
анализ (Affaa et al., 2004) подтверждает родство Pla-
giotoma с гипотрихами и принадлежность рода к Spi-
rotrichea.
Подкласс Licnophoridia Lynn, 2003
Лиин (Lynn, 2002) приписывпст ивторетво подклассп Корлиссу
(Corliss, 1957), впервые предложившему подотряд Licnophorina в
составе отряда гетеротрих; однако в подобных случаях авторство
сохраняется только в таксонах группы отряда (подотряд, отряд,
нлдотряд); при переходе к высшему уровню должен фиксироваться
lioiii.iii автор подкласса или класса.
Ликнофориды — морские комменсалы на беспозвоночных
многих групп и иногда на рыбах; свободноживущий вид один, об-
лигатно связан с морскими цианофитами. Тело бочонковидное, вы-
тянутое, несимметричное, с обширной базальной присоской; пери-
стом занимает весь расширенный верхний конец тела; имеется по-
лоса мембранелл и мембрана; соматическая цилиатура почти
полностью редуцирована, сохранились лишь ресничные кольца на
присоске и местами безресничные ряды кинетосом на кортексе.
Мощная фибриллярная система управляет сокращением тела и
присоски. Макронуклеус в виде цепочки с большим числом оваль-
ных нодул (англ, nodules — части фрагментированного ядра). Сто-
матогенез апокинетического типа.
Отряд Licnophorida Corliss, 1957
Небольшая группа видов с уникальной морфоло-
гией, не имеющая филогенетически близких форм сре-
ди известных цилиат; фактически включает лишь один
род Licnophora, если считать Pachystomos синонимом.
Единичные виды без латинских названий отмечались
ранними авторами на морских беспозвоночных, или их
относили к роду перитрих Trichodina-, Клапаред (Cla-
parede, 1867), изучивший симбионтов моллюсков и по-
лихет в Норвегии, предложил новый род Licnophora
для 2 видов — Trichodina auerbachii и Licnophora coh-
nii. Этот автор отметил сходство перистома ликнофор
и гипотрих типа Stylonychia, но внешний облик «очень
сходен с триходинами». Эти необычные цилиаты на-
долго остались предметом спора, их включали в состав
перитрих, спиротрих неясного положения, затем в от-
ряд гетеротрих, и в недавней публикации (Lynn, Struder-
Kypke, 2002) ликнофоры сближены с гипотрихами, по-
скольку имеют реорганизационные полосы в делящем-
ся макронуклеусе. По этой же причине пелагические
Halteria были выведены из состава олиготрих. Род
Euplotes и близких к нему форм исключали из состава
гипотрих, но наличие реорганизационной полосы по-
зволяет считать их настоящими гипотрихами, не про-
дуктом конвергенции. Итак, процесс деления ядер сбли-
жает внешне несходные таксоны цилиат в одну труп-
496
ALVEOLATA
пу — гипотрихи типа Oxytricha, типа Euplotes,
«олиготрихи» Halteriidae и «гетеротрихи» Licnophoridae.
Морфология ликнофорид уникальная, переходные
предковые формы пока неизвестны. Тело мелких и
средних размеров, до 170 мкм, очень гибкое, подвиж-
ное и сократимое; особи сжимаются при раздражении
и фиксации. Живые особи прикреплены широким
светлым вогнутым диском, но прикрепление времен-
ное, особь может .быстро скользить по субстрату, рас-
качивая перистом на расширенной вершине бочонко-
видного тела. Условно различимы 3 отдела — перистом,
тело (иногда обозначается как шейка) и базальный
диск. Поверхность тела неровная, без продольных ки-
нет или складок, без полос гранул (мукоцист, пигмен-
тосом), характерных для гетеротрих; можно видеть
кольцевые складки, сходящиеся вентрально ко рту. На
покровах тела импрегнация выявляет сетчатый арги-
ром и множество аргиросом, сходящихся на дорсуме в
неясные поперечные ряды без ресничек.
Полоса мембранелл охватывает почти замкнутым
кольцом край широкой апикальной площадки с арги-
ромом такого же типа, как и на остальной поверхности
тела, без дуговидных складок, какие имеются к приме-
ру у гетеротрих Stentor или Climacostomum. В основа-
нии мембранелл дикинеты (у гипотрих трикинеты).
Несколько мелких концевых мембранелл входят в не-
большой инфундибулум. Ундулирующая мембрана
идет снаружи от отверстия ротовой воронки до базоди-
ска, иногда обозначалась в старой литературе как па-
рус (velum).
Диск плоский (вогнутый в центре) и очень широ-
кий, шире тела в его базальном отделе, сверху имеет
вид гомогенной каймы, нижняя поверхность очень
сложного строения, не имеет аналогий у цилиат. Без
импрегнации видно несколько концентрических мемб-
ран с неровным наружным краем, составленных слип-
шимися ресничками. Центр диска без заметных струк-
турных элементов. Особое ресничное образование сер-
повидной формы отмечено уже в ранних работах.
Импрегнация серебром позволила Вилленев-Брашон
(Villeneuve-Brachon, 1940) выявить почти замкнутые
гаплокинеты в основании мембран и обширное поле
кинетосом в основании особой ресничной структуры
на границе диска и вентральной стороны тела. Форма,
размеры, число кинетосом этого поля оказались важ-
ным видовым признаком; дополнительно был открыт
второй непарный элемент — монокинета или полики-
нета между этим полем и центром диска. Виды рода
очень сходны внешне, род космополитный и, вероят-
но, богат видами, поэтому структура присоски должна
служить важным видовым признаком.
Опорный аппарат тела — мощный осевой стер-
жень, состоящий из микрофибрилл, ярко красится ге-
матоксилином, идет вдоль всей полосы мембранелл к
ее правому краю и спускается к базодиску; над диском
особо утолщен, рассылает отростки радиально к рес-
ничным кольцам диска.
Размножение делением, цист нет; деление кажется
диагональным, но это поперечное деление, усложнен-
ное разким расширением перистома.
Типичные фильтраторы, поедающие без разбора
частички из наружной среды или из пищевых течений
на хозяевах, например в водных легких трепангов, на
жабрах асцидий. Ликнофориды — пример комменса-
лизма; паразитических видов (с тканевым питанием)
нет, паразиты самих ликнофор тоже неизвестны.
Находки в пресных водах неубедительны (см. ниже
род Prolicnophora}-, на морских цианофитах один вид
L. lyngbycola (см. род Pachystomos}-, на рыбах один вид
L. hippocampi (новый вид с другого отряда рыб найден
Янковским у Владивостока и пока не описан). Исклю-
чая названные формы, род Licnophora в целом при-
урочен к морским беспозвоночным, встречается по
всему океану, заселяет полихет, моллюсков, гид-
роидов, актиний, трепангов, морских ежей, морских
звезд, офиур; нет на ракообразных и на многих других
беспозвоночных. В наших северных морях легче все-
го найти ликнофор на голожаберных моллюсках и в
голотуриях.
Сем. Licnophoridae Butschli, 1887
(рис. 298, а)
С диагнозом отряда. Поскольку отряд состоит фак-
тически из одного рода, ниже дается аннотированный
список известных видов Licnophora.
Род Prolicnophora Jankowski,
1978
Типовой вид L. setifera Maskell, 1886. Также
L. europaea Garbini, 1898. Описания и рисунки ви-
дов — в определителе гетеротрих Каля (Kahl, 1932).
Оба описания выполнены на необычайно низком уров-
не, рисунки очень плохие; что видели авторы, осталось
неизвестным. Было большой ошибкой выделять род
для таких форм. Типовой вид рода — в пресной воде у
Веллингтона (Новая Зеландия), с очень длинной шей-
кой, широким перистомальным диском, ресничным
базодиском без мембран; все тело покрыто мелкими
ресничками. Длина тела до 71 мкм, при сокращении
28 мкм. «Очень быстрое движение, прыжки или вра-
щение» — одно это исключает родство с медленно
скользящими ликнофорами. Ядро овальное, в диске.
Род невалиден.
Род Pachystomos Rudzinska,
1952
Типовой вид Р. olisthus R., 1952 по монотипии.
В каталоге Аэшт указано, что это новое название для
замещения Pachystomus R., 1948 с типом Р. olisthus R.,
1948, но в статье (Rudzinska, 1952) об этом ничего не
сказано, публикацию 1948 г. установить не удалось.
Pachystomus — гомоним. В краткой заметке Рудзинска
упоминает о новой перитрихе Р. olisthus, найденной в
Угревом пруду (Eel pond) в Вудс Холе, США; это соло-
новатый водоем, сообщающийся с морем. Нашли 3
особи, которые ходили на двух лапковидных придат-
ках на тонкой сегментированной палочке. Ядра, пери-
стом, кинетом не изучены. Род включен в сем. Scyphi-
diidae отряда перитрих. В Traite (Puytorac 1994) это со-
мнительный род, вероятно, с видом рода Scyphidia. В
ТИП CILIOPHORA. КЛАСС SPIROTRICHEA
497
Рис. 298, a. Licnophorida.
Licnophora limpetae (Л); L. macfarlandi (Б); L. lyngbycola (В). (По: Stevens, 1904 (5); Van As et al., 1999 (Я); Faure-Fremiet, 1937 (И). Г—L. lyngbycola (= Sten-
tor acrobaticus, = Pachystomos olisthus)- ориг.; Г—подвижный зооид на фрагменте нити цианофиты.
Fig. 298, a. Licnophorida.
Г — mobile zooid on fragment of cyanophyte.
Zoological Record— в составе перитрих; в Guide (Lynn,
Small, 2002) Pachystomos не упоминается.
Второй вид такого типа — Stentor acrobaticus Silen,
1948, найден в море на водорослях Fucus в Швеции
(Silen, 1948). Особи с широким перистомом, пооди-
ночке или группами движутся на широких сегменти-
рованных палочках. В каталоге видов Stentor (Foissner,
Wolfl, 1994) вид фактически исключен из состава Sten-
tor; «вероятно, он секретирует палочку, по которой
быстро скользит вверх и вниз».
Оба названия — синонимы валидного вида Licno-
phora lyngbycola Faure-Fremiet, 1937; вид изучен мною
на Сахалине в лагуне Буссе. Это специфический сим-
бионт нитевидных цианофит типа Lyngbya и Phormidi-
ит, которыми в массе обрастают любые субстраты на
морской литорали. Случайно отделившиеся от субст-
рата фрагменты цианофит с ликнофорами были при-
няты за секретируемую ими палочку. Высота тела
L. lyngbycola около 100 мкм, тело резко расширено
апикально в зоне перистома, шейка короткая, диск
небольшой. Строение типичное для рода, но пропор-
ции тела и диска не такие, как у других видов. Воз-
можно, это валидный подрод, но не род; пока оба
вида переносятся в состав Licnophora и внутри этого
рода объявляются синонимами вида L. lyngbycola —
L. olisthus comb, n., L. acrobatica comb. n. Вид L. lyng-
bycola недавно найден и детально изучен в Китае (Song
et al., 2003).
Род Licnophora Claparede,
1867
По Аэшт, тип рода не фиксирован; это не совсем
точно. Род предложен для 2 видов, Trichodina auerba-
chii Cohn, 1866 и L. cohnii sp. n.; подробно изучен вид,
определенный как!,, auerbachii, вероятно неверно. Ти-
повые виды в то время за редчайшими исключениями
цилиатологи не обозначали. За 2 года до публикации
каталога Аэшт (Aescht, 2001) в статье по Licnophora
limpetae (Van As et al., 1999, P. 249) читаем: «The follo-
wing year Claparede erected the genus Licnophora with
the type L. auerbachii (Cohn, 1866)»; это следует счи-
тать указанием типового вида.
L. aeolis Poljansky, 1951. Найден в массе на «адап-
тивных жабрах» голожаберных моллюсков Aeolis sp.
(Nudibranchia) на литорали у Владивостока; в США
«Trichodina sp.» отмечены на Aeolis alba в Калифор-
нии. Длина тела L. aeolis 45—65, ширина диска 25—
30, перистома 27—38 мкм, в полосе 120—-140 мембра-
32 Зпк. №4163
498
ALVEOLATA
Рис. 298, 6. Oligotrichida. (По: Foissner et al., 1999).
Pelagohaheria viridis (Л -Ж, Ky, Ilalleria bifurcala (T); //. grandinella (/f).
Fig. 298, 6. Oligotrichida.
нелл; 20 и более долек ядра без соединения в цепь рас-
сеяны по всему телу.
L. asterisci (Gruber, 1884 in Trichodina). На жаб-
рах Asteriscus gibbosus, ныне Asterina gibbosa, в Ита-
лии. Вид сводился в синонимы сборного вида L. аиег-
bachii, но он валидный. Виды ликнофор на морских
звездах, по моим данным, не обитают на других хо-
зяевах.
L. auerbachii (Cohn, 1866 in Trichodina). Типовой
хозяин у Кона — нудибранхи мелкого вида Doris sp.; с это-
го хозяина вид не изучен, и все последующие опреде-
ления ликнофор с других хозяев, таких как L. auerba-
chii, недостоверны. Признаки сборного вида — разме-
ры 80—120 мкм, ядро из 10—25 нодул; хозяева —
планарии Thysanozoon, полихеты Syllis и Psygmobran-
chus, гидроиды Cladonema, двустворчатки Pecten, Сар-
sa, Tellina, офиуры Ophiothrix, звезды Asterina, Asteris-
cus, Astropecten, полихеты Haplosyllis, Pterosyllis, Pio-
nosyllis и др.
L. bassoni L. Van As et J. Van As, 2000. На жабрах
литоральных гастропод-трохид Turbo sarmaticus (ти-
повой хозяин) и Т. cidaris', подробно изучены при им-
прегнации протарголом и в электроскане. Размеры
40—70 мкм, ядро с 14—32 дольками. Вид назван в
честь Линды Бассон, поэтому правильное название
L. bassonae nom. согг.
L. biecheleri Villeneuve-Brachon, 1940. Со стенок
передней части гастральной полости актиний Sagar-
tia parasitica-, размеры 90—100 мкм, ядро из 40—50 до-
лек.
L. bullae Dustin, 1915. С гастропод Bulla hydatis,
Франция; размеры 123—130 мкм, ядро из 15—20 час-
тей.
L. chattom Villeneuve-Brachon, 1939. Со стенок жа-
берной полости асцидий Phallusia mammillata, воз-
можно, также в Ascidia mentula var. rosea, Франция;
размеры 70—90 мкм, ядро из 10—20 частей.
L. cohnii Claparede, 1867. С жабер полихет Psyg-
niobranchus protensus в Норвегии; размеры 55—60 мкм,
число долек ядра не выявлено.
L. conklini Stevens, 1904. С жабер аберрантных
гастропод Crepidula plana в Вудс-Холе, США; раз-
меры 100—135 мкм, ядро с 4 дольками — минималь-
ное число у видов рода. Вид, описанный позже в
США (Вудс-Хол) как L. macfarlandi Stevens с того же
хозяина, конечно, определен неправильно. Вид из
Франции с пателлоидной гастроподы Fissurella gibbe-
rula, определенный как L. conklini, величиной всего
ТИП CILIOPHORA. КЛАСС SPIROTRICHEA
499
SO 60 X 25—35 мкм, не может относиться к этому
ниду.
L. hippocampi Meng et Yu, 1985. С жабер и кожи
морских коньков (рыбы сем. Syngnathidae) Hippocam-
pus trimaculatus в Китае; размеры 50—87 мкм, ядро с
/ 10 дольками. На биостанции «Восток» около г. На-
ходка ликнофоры неопределенного вида постоянно
обитают на замковых рыбах («trigger-fish») сем. Balis-
1 iilae, вероятно, на Thamnoconus modestus (Янковский,
псопубл.); на промысловом атлантическом виде бали-
стид из северной Атлантики Batistes capriscus найдены
только триходины и перитрихи рода Ellobiophrya
( Caliperia). Оба семейства рыб богато представлены
в тропиках, где можно ожидать находок других ликно-
фор.
L. limpetae L. Van As, J. Van As et Basson, 1999. C
жабер гастропод в ЮАР — Patella barbata (типовой
хозяин), Р. cochlear, Р. compressa, Р. longicosta, Р. mi-
niata; размеры 50—95 мкм, ядро из 13—25 частей.
L. luidiae Hamon, 1954. В планктоне у берегов Ал-
жира, эпибионт на пелагических личинках — бипин-
нариях астероидов Luidia sarsi и L. ciliaris', размеры
35—68 мкм, ядро с 12—17 дольками.
L. macfarlandi Stevens, 1901. Подробнее переопи-
санная позже с трепангов (крупных промысловых го-
лотурий) в США — в терминальных частях каналов
дыхательного дерева (respiratory tree) Holothuria cati-
fornica (ныне Stichopus или Parastichopus, отряд Aspi-
dochirota). Размеры 140—180 мкм, ядро из 25—30 до-
лек. Вид из водных легких трепанга Cucumaria planci
во Франции тоже назван L. macfarlandi, вероятно,
определение неверное. Ликнофоры всегда обитают в
наших дальневосточных трепангах рода Apostichopus,
имеются и в норовых хиридотах.
L. okadai Uyemura, 1940. Описаны с гидроидов
рода Hydractinia', род хозяев встречается и свободно-
живущим, но чаще всего обитает на панцире раковин,
занятых отшельниками (Pagufidae). Оригинал статьи
недоступен. На биостанции «Восток» и на Мурмане
гидрактинии с пагурид несут только гименостомат
рода Pleurocoptes.
Накопилось немало данных о ликнофорах, не опре-
деленных до вида, на ряде других хозяев. Заселены
гастроподы Астаеа, морские ежи Mespilia и другие,
древоточцы Martesia, Teredo, Nausitora в Индии,
двустворчатки Thyasira sarsi в Дании, нудибранхи
Pleurobranchus aurantiacus и многие неопределенные
виды голожаберников; аберрантный вид ликнофор
найден мною вместе с новым видом фронтоний в норо-
вой голотурии Chiridota pellucida на о-ве Беринга.
На импрегнированных препаратах пока изучены лишь
4 вида из приведенного выше списка, поэтому диаг-
ностировать виды на новых хозяевах пока невоз-
можно.
Подкласс Oligotrichia Butschli, 1887
Крупная группа преимущественно планктонных цилиат, в
пресных водах и в море; единичные виды в бентосе, несколько ви-
дон — симбионты морских беспозвоночных (на пелагических
гуиикатах, на покровах и в кишечнике морских ежей). Развит мощ-
ный фильтрационный аппарат в виде кольцевой полосы апикаль-
ных мембранелл; перистом непропорционально велик по отноше-
нию к небольшому коническому телу, мембранеллы служат для
нн гания и движения. Подкласс включает 2 отряда, с типичной ра-
ковиной, не прилегающей к телу, и без раковины или с плотно при-
легающей к телу «перилеммой» — наружным цитоскелетом (луч-
ше использовать термин перитека или эпитека). Кроме ротовой ци-
лпатуры имеется и соматическая, обычно в виде рудиментов, реже
с полными биполярными кинетами. Ядро одно или в редких случа-
ях фрагментировано. Деление в свободноплавающем состоянии,
сложного типа — зачаток цилиатуры дочерней особи образуется на
стенках погруженной эмбриональной камеры, и в процессе деле-
ния полоса мембранелл оказывается на поверхности тела, где про-
должает удлиняться вплоть до момента деления надвое. У цилиат
П цепом различаются 2 типа деления — гомеотропное (полярность
|1Ш1<1Жен11Я рта у обеих дочерних клеток совпадает) и энантио-
ipiHIHOU У олиготрих, полярность томитов противоположная,
у Hllrtilli’ll особи новый перистом направлен вниз. У олиготрих
псп. 2 типи деления — у Halteria соматическая цилиатура воз-
никнет lllliono, у других групп — из зачатка кинетосом внутри ки-
нет; род llaltvrla может быть потомком окситрихид, а не олиго-
। рих.
I lepiioiHiHiuihiio, как и все старинные высшие таксоны, отряд
< llipolrlehida нктпочпл смесь всевозможных родов из разных групп,
ио постепенно рамки таксона сузились до 2 близкородственных се-
мейств - Strombidliduc и Tintinnidae. Система группы усложня-
лась, особенно п последние годы, когда большое число видов было
щучено точным методом импрегнации протарголом; сейчас мы
«пасм топографию кинетома, ротовых мембранелл и экструсом у
представителей известных и новых родов. В современных схемах
ранг прежнего отряда олиготрих повышен до подкласса, в его co-
in аве различаются 3 отряда.
Н Traite (Puytorac, 1994) олиготрихи считаются классом Oligo-
Hicliea Butschli, 1889, который подразделяется на 2 подкласса —
< iligotrichia Butschli s. str. (отряд Oligotrichida) и Strobilia subcl. nov.
(отряд Choreotrichida). По Линну (Lynn, Small, 2002; Lynn, 2002)
класс Spirotricha включает среди других 2 подкласса:
Подкласс Oligotrichia Butschli, 1887
Отряд Strombidiida Petz et Foissner, 1992
Подкласс Choreotrichia Small et Lynn, 1985
Отряд Tintinnida Kofoid et Campbell, 1929
Отряд Choreotrichida Small et Lynn, 1985
Подотряд Strombidinopsina Small et Lynn, 1985
Подотряд Strobilidiina Small et Lynn, 1985
Подотряд Leegaardiellina Laval-Peuto, Grain et Deroux, 1994
В системе Янковского (1980), не цитируемой в сводках по оли-
готрихам, в составе спиротрих подклассов нет; среди других разли-
чаются 2 отряда:
Отряд Oligotrichida Butschli, 1879
Подотряд Strombidiina subordo n.
Подотряд Strobilidiina subordo n.
Отряд Tintinnida Kofoid et Campbell, 1929
Подотряд Eutintinnina subordo n.
Подотряд Tintinnina subordo n.
Эти отряды логично объединить в один подкласс Oligotrichia.
Сравнение схем показывает приоритет групп Strombidiina и Strobi-
lidiina в последней схеме и первую попытку подразделить крупный
отряд тинтиннид на подотряды (раковина открыта с обеих сторон
или только у вершины).
Еще один вариант — схема австрийских авторов (Petz, Foiss-
ner, 1992):
Класс Oligotrichea Butschli, 1887
Подкласс Halteriia subcl. n.
Отряд Halteriida ordo n.
Подкласс Oligotrichia Butschli, 1887
Отряд Strombidiida Jankowski, 1980
Отряд Oligotrichida Butschli, 1887
Подотряд Tintinnina Kofoid et Campbell, 1929
Подотряд Strobilidiina Jankowski, 1980
Нельзя согласиться co схемой Линна, в которой стромбидии
выделяются в особый подкласс; лучше всех олиготрих числить в
500
ALVEOLATA
одном подклассе с 3 отрядами (стромбидии, стробилидии, тинтин-
ниды); такая схема показывает постепенный переход от гипотрих к
видам с кольцевой зоной мембранелл и наружной раковиной. На1-
tcriidac могут быть четвертым отрядом олиготрих, но ранг подклас-
са кажется завышенным. Итак, в данной сводке в составе класса
спиротрих различается подкласс Oligotrichia с несколькими отря-
дами, представляющими собой цельную монофилетическую груп-
пу.
Осталась незамеченной и никем не цитируется статья Стерки
(Sterki, 1X98), предложившего новую систему цилиат:
Класс Ciliata
Подкласс Peritricha (1 отряд, и возможен второй отряд для Lic-
nophora и Kentrochona)
Подкласс Pantotricha
Надотряд Gymnostomata (1 отряд)
Надотряд Trichostomata
Отряд Aspirotricha
Отряд Oligotricha
Отряд Zonotricha
Класс Suctoria
В этой схеме впервые виды олиготрих с боковым перистомом
были отделены от видов с апикальной зоной мембранелл: Oligotri-
cha включают в основном тинтиннид, a Zonotricha — виды типа
Strombidium, Halteria и Gyrocorys (последний род здесь по ошибке,
это ценоморфы из группы метопид).
Олиготрих вначале считали потомками гетеротрих, но много-
кратно в литературе отмечались общие черты с гипотрихами — на-
личие циррусов у Halteria, сходство мембранелл перистома, нали-
чие реорганизационной полосы в макронуклеусе — перед делени-
ем через ядро проходит полоса реорганизации хроматина, и при
окраске ядро состоит из 3 сегментов — светлая полоса и по обе сто-
роны от нее зоны хромосом с разной яркостью окраски. Эта полоса
свойственна всем гипотрихам и ликнофоридам (ранее ошибочно
включавшимся в состав гетеротрих), и данный признак безошибоч-
но говорит о родстве этих групп; у гетеротрих такого способа реор-
ганизации ядер нет. Среди гипотрих есть планктонные виды, но
обычно со спиральными кинетами; олиготрихи могли произойти
от бентосных форм с мелким телом и редукцией части циррусов и
перешли в планктон независимо от известных сейчас пелагических
пресноводных гипотрих.
Такую филогению подтверждают данные молекулярных фи-
лограмм (например, Shin et al., 2000) Halteria ^randinclla про-
изошла от типичных бентосных окситрихид, наиболее близка к
роду Oxytricha: Strombidium purpureum потомок предков 1 ипог
рих групп Oxytrichidae + Holostichidac. Эти 2 рода олиготрих нель-
зя объединять в одном парафилетическом отряде, а хальтерий мож-
но ввести в состав гипотрих.
Молекулярной филогенетике олиготрих посвящены и епеци
альные статьи (Striider-Kypke, Wright, Lynn, 2000; Striider-Kypke,
Lynn, 2003) с анализом РНК большого числа видов стромбидиид и
тинтиннид с учетом филогении всех остальных групп цилиат. Сем.
Halteriidae включается непосредственно в состав гипотрих группы
Stichotrichia рядом с сем. Oxytrichidae. От общего корня отходят
2 ветви, Hypotricha и Oligotricha; вторая ветвь в свою очередь даст
2 независимые ветви — Slrobilidium + Tintinnida и Strombidiidae.
Сборных парафилетичсских родов в составе тинтиннид и олиго-
трих пока не обнаружено. Итоговая классификация выглядит сле-
дующим образом:
Подкласс Stichotrichia (включает сем. Halteriidae в отряде Sporado-
trichina)
Подкласс Oligotrichia (отряд Strombidiida)
Подкласс Choreotrichia
Отряд Choreotrichida (сем. Strobilidiidae, Strombidinopsidae и
др., второе семейство в подотряде Strombidinopsidina)
Отряд Tintinnida
В этой схеме желательно избежать дублирования названий
групп Choreotrichia и Choreotrichida и заменить второе приоритет-
ным названием Strobilidiida Jank., 1980.
Новейший обзор родов олиготрих — Agatha, 2004, где также
сравниваются филограммы этой группы и предлагается несколько
новых родов при дроблении известных родов олиготрих; эти пред-
ложения отражены в данном обзоре. Важно отметить, что здесь
Halteriidae, ранее перенесенные в состав гипотрих, возвращены в
состав олиготрих, поскольку нет морфологических доказательств
происхождения их от Oxytrichidae. Хальтерииды отделились от ба-
зальной части ствола в виде особой независимой ветви, а вторая
ветвь ведет к 4 семействам стромбидиид; or ее основания, но не от
вершины, отделились безраковинные Choreotrichida типа Strobili-
dium и их потомки тинтинниды.
Представители олиготрих показаны на рис. 298, б—301, б.
Отряд Halteriida Petz et Foissner, 1992
Тело мелкое, овальное; адоральная зона мембра-
нелл в виде изогнутой полосы с четким делением на
апикальное полукольцо и погруженную в перистом
группу мембранелл (как у гипотрих и стромбидиид).
Характерно слияние ресничек экваториальной зоны в
длинные циррусовидные щетинки. Стоматогенез осо-
бого типа — при делении соматическая цилиатура воз-
никает заново, у других олиготрих путем интракине-
тальной пролиферации. Небольшая группа видов с
2 родами в эпибентосе и планктоне пресных вод.
Сем. Halteriidae Claparede
et Lachmann, 1858
С диагнозом отряда. Вероятно, это примитивные
олиготрихи — нет эпитеки (перилеммы, прилегающей
к телу раковинки), нет пучков или кольца экструсом;
сохранившаяся цилиатура — короткие экваториаль-
ные фрагменты, поликинеты, реснички которых слива-
ются в длинные прямые щетинковидные циррусы.
Род Pelagohalteria Foissner,
Skogstad et Pratt, 1988
Типовой вид Halteria viridis Fromentel, 1876 no
моногинии. Очень мелкие формы с широким телом и
мощными мембранеллами наружного почти замкнуто-
го кольца; около 17 мембранелл в наружной зоне, око-
ло 6 в полости перистома; в основаниях соответствен-
но по 3 и 2 ряда кинетосом. Основание мембраны —
длинная монокинета у правого края предротовой поло-
сти. В цитоплазме симбионтные зоохлореллы. При им-
прегнации по Шаттону видна сплошная сеть аргирома
из ячеек неправильной формы, не в рядах; наличие
сети у хальтериид не противоречит родству с гипотри-
хами типа Oxytricha, поскольку у последних, обычно
нс имнрегнируемых методом Шаттона, иногда все же
удавалось выявить сетку такого же типа при импрегна-
ции сухих мазков или влажным методом. В принципе
организация этого рода и Halteria сходная, различие
может показаться мелким — в экваториальной зоне в
основании ресничек у хальтерий ряды кинетосом, у
рода Pelagohalteria в 9 группах кинетосомы располо-
жены внизу в виде поперечной полосы из 5—6 кинето-
сом, выше — в продольной линии, еще выше в виде
2—3 поперечных кинетосом. Соответственно нижние
циррусы идут поперек тела или иод углом к оси, но не
продольно.
Кроме типового вида к роду относится Р. cirrifera
(= Halteria grandinella var. cirrij'era Kahl, 1932) без зоо-
хлорелл, с 7 группами щетинок, также с поперечными
рядами в основании каждой и с другим паттерном
оснований верхних щетинок.
ТИП CILIOPHORA. КЛАСС SPIROTRICHEA
501
Рис. 299, a. Oligotrichida.
Slhmibldiiim glaciate (А, S. antarcticum (Г, Д); S. sulcatum (E, Ж); Strombidinopsis elongata (3); Strombidinopsis minima (И, К). (По: Petz et al., 1995 (А—ДУ,
Deroux, 1974 (E, Ж); Song, Bradbury, 1998 (3—K)).
Fig. 299, a. Oligotrichida.
Род Halteria Dujardin,
1841
Типовой вид Trichoda grandinella Muller, 1773
ио моногинии. Обычный вид в пресных водах, часто
ноиилястся в настоях и пробах из водоемов разного
।инн; легко и в массе культивируется в чашких Пет-
ри особи неподвижно висят в толще воды и пере-
Hlilll ню гея внезапными прыжками. Внешний вид, пе-
рце him, ядро, как у предыдущего рода; мембранеллы
IlfpHU 1оми резко неравной длины и толщины в двух
IHIWWIH' ниружиом и внутреннем; вакуоль с порой
У МОНИН перистома слева; ядро овальное; ар-
I НрнМ М11вИИД1П»1Й. Полоса ресничек по экватору
(<ц>1НЧ1Ш|ЫшЫ piH'Utcne») состоит из примерно 7 изо-
iiiipoiiiiiniMM групп щетинок, в основании которых об-
Hiipy/hllBlK? ГУН продольная кинета; в каждой группе
рв ।П11ЧНМ1.1 ,* верхние щетинки и одна толстая щетинка
(циррус) снизу; нее они щшравлены вбок, создавая во-
круг гели цнлинтуру дли инрепия в воде и для прыж-
ков. В отличие от стромбидиид нет обособленной вен-
ipiuii.iioii кинеты и КНИОТЫ экваториального кольца,
не г полосы эксгрузом, По Янковскому (неопубликова-
но), импрегнация нефиксированных особей, вносимых
<«• з фиксации на солнце в раствор азотнокислого се-
рсора, выявляет интенсивно импрегнируемые тельца в
цитоплазме Halteria и «трихиты» (токсицисты) вдоль
ротовой щели Amphileptus, поэтому возможно наличие
нетипичных экструсом в цитоплазме хальтерий. Эта
методика к цилиатам ранее не применялась. Типовой
вид описан в большом числе работ (монография халь-
териид — Foissner et aL, 1999).
Валидные виды — Н. maxima Szabo, 1934; Н. de-
cemsulcata Szabo, 1934; H. geleiana Szabo 1935; H. chlo-
relligera Kahl, 1935; H. bifurcata Tamar, 1968; H. ovifor-
mis Gelei, 1950; H. minima Gelei, 1954; H. faurei Drages-
co et al., 1986; H. tamari Dragesco et al., 1986; описан и
ряд неопределимых видов.
Род Meseres Schewiakoff,
1882
Типовой вид М. cordiformis. Одновременно
были описаны 2 вида — тип рода и М. stentor. Эти
виды отличаются по форме тела — каплевидное ши-
рокое у первого вида и узкое вытянутое у М. stentor.
У незначительно расширенного апекса — апикальная
и буккальная зоны мембранелл; вдоль всего тела идут
тесно сближенные продольные ряды коротких ресни-
чек, подходящие вплотную к мембранеллам и заканчи-
вающиеся на узком постероне без образования швов.
Эти виды, вероятно, не были переописаны в литерату-
ре методами импрегнации; морфология рода известна
502
ALVEOLATA
Рис. 299, (>. Oligotrichida.
Strobilidium gvrans (A—Д); Halteria grandinella (E, Ж); Strobilidium caudal ши (У, К. I!—/J); Strombidinopsis elongata Rimostrombidium lacustris («.Strobilidi-
um velox») (Л. M). (По: Deroux, 1974 (A—Жу Foissner et al., 1999 (?. ИУ Petz, Foissner, 1992 (К, II-1’У Packroff, Wilbert, 1991 (Л. M)).
Fig. 299, 6. Oligotrichida.
только по третьему виду M. corlissi Petz et Foiss-
ner, 1992, который не имеет ничего общего с вида-
ми Шевякова. Трудно допустить, что Шевяков мог
неправильно зарисовать кинетом у своих видов; мож-
но предположить, что это не олиготрихи, а просто-
маты.
Вид М. corlissi следует выделить в особый род,
как типовой вид рода Petzinus Jankowski gen. n. (F. cor-
lissi comb. n.). Тело овальное, мелкое, ядро и ва-
куоль типичные для хальтерий; к постерону тело не
заостряется, в отличие от типичных Meseres', в апи-
кальном полукольце около 16 крупных мембра-
нелл с трикинетами в основании, в полости около
15 мелких вплотную сближенных мембранелл с
поликинетами неправильной формы в основании.
Рудимент цилиатуры — 8 продольных, слегка на-
клонных рядов дисом; ряды удлинены и не достигают
постерона и зоны мембранелл; в отличие от Meseres
ряды разрозненны, удалены один от другого на боль-
шие расстояния. Это также исключает принадлеж-
ность вида к Meseres. Подробно изучен стоматоге-
нез (Petz, Foissner, 1992); новая полоса мембра-
нелл образуется в глубокой полости и соединена
длинным узким каналом с поверхностью тела. Нет
наружного панциря, видимых экструсом; аргиром
не изучен.
Отряд Strombidiida Jankowski,
1980
Тело коническое, с расширенной вершиной и уз-
ким постсроном; на вершине развернута полукольцом
апикальная (наружная) полоса крупных мембранелл,
группа более мелких мембранелл у левого края по-
лосы спускается в буккальную полость. В отличие от
Strobilidiida кольцо мембранелл незамкнутое, в прин-
ципе такого типа, как у гетеротрих и гипотрих. Ци-
лиатура в поперечном кольце, часто имеется также
продольный вентральный ряд; вдоль кольца распо-
ложены вершины экструсом, имеющих вид палочек
(трихитов) в группах или поодиночке; от кольца на-
чинается также перилемма (эпитека) — прочный
наружный панцирь, часто с сетевидным узором,
прикрепленный ко всей нижней половине тела. Виды
стромбидиид обычны в бентосе и планктоне пресных
ТИП CILIOPHORA. КЛАСС SPIROTRICHEA
503
Рис. 300, a. Oligotrichida.
Meseres corlissi (A—Г); Rimostrombidium lacustris (Д, E). (По: Petz, Foissner, 1992 (A—Г); Foissner et al., 1999 (Д, E)).
Fig. 300, a. Oligotrichida.
II морских под, один вид в сапропеле, 2 вида — симби-
онты морских ежей в наших северных и дальневос-
точных морях.
Сем. Strombidiidae Faure-Fremiet,
1970
С ЩйГНО'юм отряда. Крупная дивергентная группа;
аЙШИЙ lipH'IIlllK — незамкнутое полукольцо апикальных
М1М||ИШ№1| мелкие буккальные органеллы располо-
М1ЙЫ>|А<Л1В9Г0 кроя полосы, не внутри нее. По мере
НЧучвИИЛ ИШвТИЫХ видов возрастает число родов, ряд
НОВЫМ РОДНИ И ИНДИИ описан из проб планктона; пока
н нохо ITiyMUlIhl вимбионтные виды, рисунки которых
по сои гнети гну ют диигпозам известных родов.
Род Anthoatrombldium Jankowski,
1360
Типовой вид Strohllidium rapulum Yagiu, 1933
(Strombidium in Kahl, 1934). Вид симбионтный, встре-
чается в морских ежах Тихого океана, отсутствует в
Баренцевом и Белом морс; типовой материал из Antho-
cidaris crassispina в южной Японии; найдены в Stron-
gylocentrotus nudus и S'. pulchellus у Владивостока
(мельче типовой расы, но в остальном сходные); отме-
чены в S. intermedius у Курильских о-вов; в целом этот
симбионт обитает в 5 видах 3 родов хозяев. Локус —
кишечник; тело крупное, до 130 мкм, вытянутое, с хво-
стовидным придатком; апикальная зона с длинными
мембранеллами, внутренняя с большим числом тесно
сближенных коротких мембранелл; нет панциря, не най-
дены кинеты и экструсомы. Валидность рода зависит от
правильности описания и рисунка вида, пока не изучен-
ного методом импрегнации. В обзоре родов отряда
(Agatha, 2004) симбионтные виды не упоминаются.
Род Arcostrombidium Jankowski gen. n.
Типовой вид Strombidium grande Levander, 1894
sensu Czapik, 1976. Род установлен для вида, описан-
ного под таким названием у Чапик, не для первоописа-
ния у Левандера. Внешне стандартный вид с овальным
телом, четким делением полосы мембранелл на 2 отде-
ла. У типичных Strombidium при виде с вента кинета
расположена на одном уровне поперек тела, панцирь
и полоса экструсом также поперечные, начинаются
504
ALVEOLATA
Рис. 300, 6. Oligotrichida.
Rimostrombidium humile (A—B); R. lacustris (Г—Ж); Limnoslrombidium viride (3—K)', Heterostrombidium / Strombidium! calkinsi (Л). (По: Faure-Fremiet, 1932
(37); Foissner ct al., 1999 (A--K)).
Fig. 300, 6. Oligotrichida.
вдоль кинеты. У S'. grande кинета и указанные органел-
лы спиральные, ряд начинается в середине вента, идет
направо и возвращается у постерона; ветви кольцевой
кинеты не сходятся, а подходят к верхней и нижней ча-
сти продольной (вентральной) кинеты. Это разли-
чие — признак нового рода или подрода. Спиральная
кинета имеется также у S. obliquum, но этот вид пока
не переводится в состав нового рода. S. grande —псам-
монный вид с литорали в Черном море.
Род Cephalotrichium Meunier,
1910
Типовой вид С. tonsuratum из планктона Аркти-
ки. В первоисточнике много рисунков, подробный
текст (Meunier, 1910), но вид все же практически
не изучен, точное положение вида неясное. Крупные
формы (около 100 мкм) с коническим телом; полоса
мембранелл, вероятно, незамкнутая, поэтому нельзя
согласиться с переносом вида в состав Strobilidium в
определителях олиготрих. «Саркоплазма» толстая и
малопрозрачная (имеется панцирь?); нет никаких рес-
ничных органелл, сетчатой эпитеки, кольца экструсом.
Род неопределимый, описание типового вида явно
ошибочное. У Каля (Kahl, 1932) в сем. Strobilidiidae.
Род Clypeolum Gourret et Roeser,
1888
Типовой вид С. corsicum. По Аэшт, родовое на-
звание — синоним рода Strombidium и гомоним. По
Калю, это синоним вида Strombidium oblongum Entz,
1884 (= Strombidium corsicum}’, позже такой же вид был
описан как Strombidium kahli Bock, 1952. Тело вытяну-
тое, узкое, щитовидное, полоса мембранелл с 2 зона-
ми, перистом мелкий; названные виды не могут отно-
ситься к Strombidium, поскольку полоса экструсом
идет не поперек тела, а огибает одну из сторон по пе-
риметру от перистома до заостренного постерона; края
тела кажутся исчерченными. У типовой формы также
обособлены 2 цирруса для фиксации на субстрате; это
не выявлено у У. oblongum и S. kahli. Род представляет-
ся валидным, родовое название как гомоним должно
быть изменено.
ТИП CILIOPHORA. КЛАСС SPIROTRICHEA
505
Рис. 301, a. Oligotrichida.
I'vlagostrobilidium neptuni (A—Г)\ Spirostrombidium pseudocinctum (Д, £); Pelagostrombidium fallax (Ж, 3). (По: Petz et al., 1995 (A—E); Foissner et al., 1999
(X 3)).
Fig. 301, a. Oligotrichida.
РОД Sertvlnella Alekperov et Mamaeva,
1992
Типовой в и Д S, pectinate из планктона Беринго-
ва пролива на шельфе Чукотки. Размеры тела 50—
75 мкм, спереди мощные мембраиеллы, занимают весь
апекс; буккон обширный, на всей вентральной стороне
тела, справа вдоль его края столь же длинная кинета с
необычно длинными ресничками. Вне перистома нет
обособленных сомакинет или их рудиментов, нет кор-
тикального панциря. Ядро вытянутое, редкой формы у
итромбидиид. Своеобразные признаки вида — это не
аномалия, вид обычен в арктическом планктоне.
Род Conocylis Meunier, 1910
Род предложен для 2 видов из арктического планк-
тона без указания типа; здесь как типовой вид обозна-
чается С. helix. По общему мнению, этот вид — сино-
ним вида Laboea strobilus, типового вида рода, описан-
ного на 2 года раньше, поэтому название Conocylis
становится невалидным. Данный род раньше уже при-
знавали синонимом ввиду идентичности С. helix и La-
boea strobila.
Менье (Meunier, 1910) после списка тинтиннид
приводит род Conocylis gen. п. как провизорный род
для форм типа Tintinnus по ротовой цилиатуре, но в от-
личие от тинтиннид прилегающих всем телом к рако-
вине; включены 3 новых вида — С. helix, С. constricta
и С. striata без указания типового вида; все виды раз-
ного типа и не могут относиться к одному роду. Пер-
вый вид имеет спиральное тело, два других — вытяну-
тое, с продольными ребрами или кинетами (как у
Strombidinopsis). Если как типовой указать первый вид,
это синоним Laboea', но Conocylis обычно понимают как
группу видов с роговидным не спиральным телом, по-
этому при указании как типового вида С. constricta или
С. striata это может быть синоним Strombidinopsis.
Здесь принят первый вариант — синонимия с Laboea.
Род Cyrtostrombidium Lynn et Gilron, 1993
Типовой вид С. longisomum из тропического
планктона у Ямайки. Тело очень узкое и вытянутое;
апикальная зона мембранелл в виде незамкнутого
кольца из 12—18 органелл, вероятно, без внутренней
полосы мелких мембранелл, но у рта мембраиеллы
мельче; нет также мембраны правее рта. Рот и глотка
506
ALVEOLATA
Рис. 301, 6. Oligotricliida.
Tontonia gracillima (A); T. antarctica (1> -Г, Ж); Spiroslrombidium echini (JI, hi}\ l.cegtiaiiliellu I'lhidcchlcri ( 'I, hl}. (I Io: l;aurc-l;remiet, 1924 (A}; Petz et al., 1995
(/; /', Ж И}; Song et al., 1994 (J(, hi}}
Fig. 301, 6. Oligotrichida.
окружены опорными немадесмами, как у простомат и
нассулид. Кольцевая поперечная кинета расположена
очень высоко, на уровне рта, не спиральная; вниз от
нее вентрально идет продольная кинета с дисомами;
только передняя кинетосома несет ресничку. Валид-
ные виды рода — С. wailesi Lynn et Gilron, 1993 и
C. boreale Kim, Suzuki et Taniguchi, 2002.
Род Echinostrombidium Jankowski,
1978
Типовой вид Strombidium symbioticum Jank.,
1974. По Аэшт, род валидный, но диагноз напечатан в
тезисах, поэтому родовое название предлагается
вновь — Echinostrombidium gen. п., типовой вид
Е. symbioticum comb. п. При изучении симбионтов се-
верных эхинид ранее осматривали только содержимое
кишечника, но на покровах много холотрих (JDrages-
соа) и олиготрих. Вид недостаточно изучен, не был
импрегнирован, но при сравнении с видами Strombidi-
um из морской пелагиали, имеющих четкий панцирь,
не было замечено такого панциря у симбионтов ежей.
Полоса экструсом проходит косо по венту и дорсаль-
ной стороне. 11еристом крупный, с четким делением на
2 стандартные зоны.
Род Heterostrombidium Song,
1999
Типовой вид Strombidium calkinsi Faure-Fremiet,
1932 по монотипии; также Н. paracalkinsi Lei, Xu et
Song, 1999. Это тип рода Thigmostrombidium Jankow-
ski, 1978; по Аэшт — род валидный, но она не видела
первоисточника — название напечатано в тезисах, а
такие таксоны Аэшт нс признает валидными. Поэтому
приоритет принадлежит Сонгу.
Тело широкое, мешковидное, почти сферическое;
перистом очень крупный, в наружной полосе около
16 мембранелл, во внутренней 7-.8 мелких мебра-
нелл; поперечная кинета смещена ниже экватора,
замкнутая, отмечает зону экструсом и начало панциря
(перилеммы); имеется осевая вентральная кинета над
ТИП CILIOPHORA. КЛАСС SPIROTRICHEA
507
посгсроном слева. Обособлено несколько крупных
специализированных тигмотактических мембранелл
дни фиксации на субстрате; они соединены с частью
мембранелл дорсальной полосы и как бы являются их
продолжением.
Вид найден в массе на предметных стеклах в тан-
ках с проточной водой в Вудс-Холе (США), позже
и Ки тае; отмечена временная фиксация двумя лате-
рит.ными циррусами вне зоны мембранелл. Сходный
нид — S.faurei Dragesco, 1960 (Heterostrombidium fau-
cet comb, n.), с цефализацией и высокой кольцевой ки-
пе гой; обособлены боковые циррусы слева, не дор-
стн.но,
S. clavellinae Buddenbrock, 1922 — вероятно, вид
(того же рода, но плохо изученный (Н. clavellinae
comb, п.); описан как комменсал пелагической туника-
T I.I Clavellina lepadiformis, плавает в мантийной поло-
сти и скользит по эпителию, может прикрепляться с
помощью 3—4 особо длинных (или добавочных?) пе-
рнстомальных циррусов левее рта. Кинетом и другие
органеллы не изучены.
S. sauerbreyae Kahl var. fourneleti Dragesco, 1960
имеет 2 добавочных цирруса левее рта вентрально
(И. fourneleti comb. п.). Кольцо экструсом низкое, ки-
пе том не изучен. Виды с вентральными циррусами мо-
гут относиться к другому роду, тем более что добавоч-
ные циррусы не являются продолжением апикальных.
Род Laboea Lohmann, 1908
Типовой вид, по Аэшт, не фиксирован, но род ва-
ттный; синонимы — Conocylis, Strombidium. Как ти-
повой здесь обозначается первый вид L. strobikr, два
других первоначально включенных вида (L. conica,
/„ globosa) по строению не принадлежат к этому роду.
Вероятна следующая синонимия: L. conica = С. соп-
slrlcla, L. strobila — С. helix, L. globosa — это или
<striata, или близкий вид; для обоих родов не были
УК1Г1ПНЫ типовые виды.
Тело коническое, вытянутое, перистом с большим
числом мембранелл и 2 четкими зонами; имеется
диппнпя мембрана правее рта. От рта влево идет рес-
1111'1111111 полоса с дисомами в основании, закрученная
инирилыо вокруг всего тела до постерона, где располо-
жен рудимент вентральной (продольной) кинеты; име-
ОПИрильпая полоса экструсом и панцирь. Спи-
|ШЛМ1МЙ ряд состоит из моносом, вентрального ряда
Htf > CHlMMlIhlй морской вид, питается микроводоросля-
МН lttnvh^4thti Pyromonas и сохраняет (секвестирует)
М Ш1|1ОНЛЙ6ТМ добычи, как и многие другие планктонты
г пмфнчОЙИММ (Миксотрофным) двойным способом
ни пиши, Ядро нетипичное для олиготрих, в виде
'о 72 мелких фрйгмептов. Род Laboea признан в ли-
icpirrypc, но MtlUTIi ИНТоров относит типовой вид к роду
Strombidium НСПЯ11 1и1о,
Род Limnostrombldium Krainer, 1995
Типовой нид Strombidium viride Stein, 1867.
Пресноводный вид е зоохлореллами. Вид подробно
описан и изучен при импрегнации протарголом. Опи-
сание морского вида без зоохлорелл под этим названи-
ем не может относиться к этому виду. Это могут быть
не зоохлореллы, а хлоропласты добычи, как у многих
пелагобионтов (это установлено в электронном микро-
скопе).
Тело коническое, ромбовидное, с цефализацией; в
полосе мембранелл 15 наружных и 9 внутренних орга-
нелл разной величины и строения. Кольцевая кинета
экваториальная; экструсомы в пучках, прикреплены
намного выше кинеты, образуя второе поперечное
кольцо (важное отличие от Strombidium). Сетчатый
панцирь начинается от кинеты, не от экструсом, плот-
но прилегает к нижней половине тела. Вентральный
ряд ресничек длинный, осевой. Второй вид — L. pela-
gicum (Strombidium viride forma pelagica Kahl, 1932);
такая корректировка видового названия для Strombidi-
um pelagicum Krainer, 1991 неверна, поскольку поня-
тие forma не включается в сферу действия номенкла-
турного кодекса. Это значит, что название Каля нельзя
использовать, и название вида — Limnostrombidiumpe-
lagicum (Krainer, 1991) comb. n. пес S. pelagicum Kahl,
nec S. pelagoviride Krainer. Как и типовая форма, вид
имеет массивный панцирь и специализированное
опорное кольцо над поперечной кинетой.
Род Lissostrombidium Jankowski,
1978
Типовой вид Strombidium turcicum Hovasse из
морского планктона, без цитоскелета и без полосы эк-
струсом. Это родовое название предложено в тезисах
(что не указано в каталоге Аэшт) и поэтому невалид-
ное; кроме того, оно основано на плохом описании
вида, вероятно идентичного с Cephalotrichium tonsura-
tum Meunier, 1910, столь же плохо описанным видом.
Могут ли существовать виды стромбидиид без кинет,
экструсом и панциря, или это результат некачествен-
ного описания видов при малом увеличении, без им-
мерсии? Название рода не заменяется новым.
Род Metastrombidium Faure-Fremiet,
1924
По Аэшт, название рода валидное, хотя при перво-
описании типовой вид не был назван (Metastrombidium
sp.); Янковским вид назван М. sonnifer Jank., 1980, это
типовой вид рода. Вторичное указание другого вида
как типового для рода (М. nigrum Mirabdullajev, 1985)
незаконно и здесь отвергается, тем более что виды рез-
ко различаются по всем признакам. Тело типовой расы
М. sonnifer широкое, мешковидное, ядро С-образное,
апикальная полоса с очень длинными основаниями
мембранелл; не показан переход левого края полосы в
буккальную’полость; 4 мембранеллы идут слева вниз
за пределами полосы, параллельно одна другой. Нет
(или не зарисовано) кольца экструсом, нет вентраль-
ной кинеты, нет панциря. Морской вид, пока не изу-
ченный заново.
М. nigrum — вид из планктона пресноводного пру-
да у Ташкента; никаких добавочных мембранелл нет,
кольцо практически замкнутое, прервано узкой букка-
508
ALVEOLATA
льной полостью с группой мелких мембранелл; нет
панциря и экструсом; вдоль тела идут 24—26 продоль-
ных биполярных кинет. Число мембранелл необычай-
но велико для олиготрих (38—42 и 18—21 в двух зо-
нах). Это, конечно, не Metastrombidium, но положение
вида неизвестно — новый род или Strombidinopsis. Ме-
tastrombidium пока приводят в приложении к списку
валидных родов олиготрих.
Род Novistrombidium Song et Bradbury,
1998
Типовой вид Strombidium testaceum Anigstein,
1914 из морского бентоса. Тело коническое, с четким
делением апикальной полосы мембранелл на 2 зоны;
имеется крупный перистом, сетчатый панцирь и внизу
вентрально короткий поперечный ряд мелких щети-
нок; экструсомы в пучках по краю очень высокого пан-
циря, почти доходящего до зоны мембранелл. Вид по-
вторно изучен при импрегнации, выявлены высокие
ребра между мембранеллами. Пучки экструсом преры-
вистые, отсутствуют в середине вента; имеется нети-
пичная для стромбидиев цилиатура — поперечная ки-
нета прервана, отсутствует на венте, ее правая часть
выше левой; осевая вентральная кинета нормально-
го типа. Поперечная кинета далеко удалена от полосы
экструсом. Все эти признаки нетипичны для стром-
бидиев.
Род Parastrombidium Faure-Fremiet,
1924
Типовой вид Р.faurei Kahl, 1932 — для нена-
званного типового вида Форе-Фремье (Parastrombidi-
um sp.). Это еще одна загадка, как и род Metastrombidi-
um того же автора. Вид некрупный (95 мкм), мешко-
видный, найдена лишь одна особь, показана с дорсума;
апикальная зона с большим числом мембранелл; неяс-
но, есть ли буккальная зона; по периферии тела— мел-
кие реснички. Внутреннее строение, кортекс и сомати-
ческая цилиатура не изучены. Род недостоверный, не-
определимый. Каль (Kahl, 1932) сближал типовой вид
с Strobilidium, не с Strombidium.
Род Pelagostrombidium Krainer,
1991
Типовой вид Strombidium mirabile Penard, 1916
(но позже как типовой вид указывался Psilotricha fallax
Zacharias, 1896). Тело коническое или овальное, в пе-
ристоме около 15 + 12—13 мембранелл; буккальная
зона четко обособлена, в глубокой полости. Вид с чет-
кой цефализацией; панцирь массивный, высокий, поч-
ти до зоны мембранелл, на венте с выемкой ниже рта;
поперечная кинета следует вдоль края панциря, с дисо-
мами; вентрального осевого ряда нет. Сходно строение
вида Р. fallax, ранее относимого к гипотрихам (Psilot-
richa fallax Zacharias, 1896). Экструсомы в пучках,
очень длинные; над поперечной кинетой желобок с
особой формой цитоскелета, с мелкоячеистым обру-
чем. Между мембранеллами высокие ребра; панцирь
с полигональными полисахаридными пластинками
(соответствуют субпелликулярным альвеолам).
Род Peristrombidium Jankowski, 1978
Типовой вид Strombidium latum Kahl, 1932.
Морской вид с краевым цитоскелетом. Вид пока по-
вторно не изучен при импрегнации; кроме того, хотя в
каталоге Аэшт род валиден, он предложен в тезисах, и
поэтому это название неприемлемое и не заменяется
новым. Трихиты видны по всей периферии плоского
тела, перистом крупный, нет поперечного кольца ки-
нетосом и сетчатого панциря от этого кольца до посте-
рона в отличие от Strombidium. Слева от перистома —
основания 2 циррусов, намного длиннее мембранелл
перистома.
Род Spirostrombidium Jankowski, 1978
Типовой вид S. coronatum Sauerbrey, 1928. От-
личительный признак рода в первоописании — «со
спиральным цитоскелетом». Аэшт считает род валид-
ным и приводит типовой вид как S. sauerbreyae Kahl,
1932 — это пот. п. для гомонима S. coronatum Sauerb-
rey, 1928 пес S. coronatum (Leegaard, 1915) Kahl, 1932.
Это спорно, поскольку второй вид был включен после
первого вида, и поэтому менять надо было название
второго вида.
Род принят в литературе, но он невалиден как пред-
ложенный в тезисах, поэтому здесь предлагается вновь
Spirostrombidium Jank. gen. п., типовой вид Strombidi-
um cinctum Kahl, 1932. Пелагические формы с широ-
ким перистомом, сложной топографией кинет, с тен-
денцией к их скручиванию (спирализации). Кольцо
трихитов расположено высоко под перистомом.
Род Parallelostrombidium Agatha,
2004
Типовой вид Strombidium rhyticollare Corliss et
Snyder, 1986. Вид хорошо изучен при импрегнации се-
ребром, описан из пористого морского льда в Антарк-
тике; тело роговидное, тонкое и длинное, заострено к
постерону; число мембранелл велико в наружной зоне
и в глубоком узком букконе; мембрана очень длинная;
глотка с фибриллами. Кинета огибает тело по спирали,
от зоны мембранелл до постерона, полоса экструсом
расположена вплотную к кинете; второй (осевой) ряд
ресничек идет косо на венте, переходя на дорсум; тело
как бы перекручено в своей нижней половине. Сетча-
тый кортекс (панцирь) выявлен по всему телу.
Род Omegastrombidium Agatha, 2004
Типовой вид Strombidium elegans Florentin,
1901. Тело овальное, вытянутое, перистом очень уз-
кий, с боковой щелью; расположение кинет и зон три-
хитов нетипичное для стромбидиев.
ТИП CILIOPHORA. КЛАСС SPIROTRICHEA
509
Род Strombidium Claparede et Lachmann,
1859
Типовой вид S. sulcatum. В первоописании два
iiiipiinii гп родового названия, Strombidium и Strombidi-
uii, в литературе второе название использовалось
ti'ivin. редко, было принято первое название, и оно
цонжио быть официально закреплено. Крупный род,
ниже после выделения многих видов в другие роды;
шпоной вид — по указанию Фроментеля (Fromentel,
1874). Виды рода повсеместно распространены в прес-
ной воде, эстуариях, в море, в основном в эпибентосе,
реже в планктоне. В литературе много неверных опре-
делений, плохих описаний; методы импрегнации при-
менены относительно недавно. Хорошо изучена ульт-
рас труктура вида.
Основные признаки вида и рода — коническое
। г по, четкое деление полосы мембранелл на 2 отдела,
низкое (экваториальное) положение поперечной кине-
। и, наличие длинной осевой вентральной кинеты, сов-
падающей с полосой экструсом. От этих рядов начина-
ется массивная узорчатая (ячеистая) эпитека, покрыва-
ющая всю нижнюю половину тела; ряд экструсом чуть
выше кинеты, и полоса между ними продольно исчер-
чена. Вентральный ряд продольный, в узком желобке;
нет перерыва поперечной кинеты и укорочения про-
дольной. Экструсомы длинные, расположены пооди-
ночке радиально, сходятся к постерону. Наличие вида
н море сомнительно, эти находки могут относиться к
одному из множества морских форм.
11ормальный биотоп для видов рода — вода над
дном (эпибентос) и верхний слой грунта и планктон.
Как исключение, известен вид из анаэробного песка,
насыщенного серобактериями, — У purpureum Kahl,
1932, живущий в симбиозе с несернистыми фотосинте-
шчсскими эндобактериями; таких бактерий считают
предшественниками митохондрий в эволюции клетки,
lien, и виды рода, вызывающие «красный прилив» (red
Ihlc), кик динофлагеллаты и простомата Myrionecta
rubra. Эпдобионтные виды из морских ежей, вероятно,
оз носятся к другим родам (см. Anthostrombidium, Echi-
nostrombidium).
В списке цилиат морей Европы 45 видов рода
Strombidium', другие виды описаны из пресных вод, из
I ропнкон, из антарктического льда. Точное знание
t*l |К)«1ШМ типового вида позволило отделить ряд родов,
И1ШМ Которых ранее относили к сборному роду Strom-
hldlllllli По мнению современных специалистов, не
1Ш1КИ0 Ш1И0П11И0, ио и определение олиготрих и тин-
1НН1Н1Д фиуиистами сейчас невозможно без примене-
нии ('НОЖНОГО И Дорогостоящего метода импрегнации
npoiпритом. Не проверялись другие возможности,
иапримнр окриика цилиатуры толуидиновым синим
пог нс фиксации ОСМИСМ (метод Фенхеля для гипотрих
Uronyehla « см. Kenuliel, 1965в).
Крупный род должен быть разделен на группы ви-
дон (подроды), Ядра у стромбидиев однотипные, пери-
стом также, добавочных мембранелл нет; экструсомы
поодиночке или в пучках; у S. rehwaldi имеются допол-
нительные пучки «трихитов» у перистома над эквато-
риальной полосой. Нетипично строение S. ioanum
Lynn et Gilron (осевая кинета па дорсуме, ядро фраг-
ментировано), У. echini Song (2 осевых ряда на дорсу-
ме, поперечный ряд спиральный); по форме ядра и
положению экструсом от типичных стромбидиев отли-
чаются виды У. meganucleatum, У. kahli (Dragesco et
Dragesco-Kemeis, 1986). Разгрузка рода от посторон-
них форм еще не закончена.
Примеры видов: У. arenicola Dragesco, 1960; У. cinc-
tum Kahl, 1932; У. elegans Florentin, 1899; У faurei D.,
1960; У kahli Bock, 1952; У viride Stein, 1867; У stylifer
Levander, 1894; У oculatum Gruber, 1888; У macronuc-
leatum D., 1960; У hadai Maeda et Carey, 1985; У obtu-
sum Alekperov et Mamaeva, 1992 и др.
Род Woodania Leegaard, 1915
Типовой вид W. conicoides. Плохо описанный
мелкий морской вид, переведен Калем (Kahl, 1932) в
состав Strombidium', описан из пробы морского планк-
тона, вероятно по деформированной особи. Возможно,
это типичный Strombidium типа У sulcatum. Род нева-
лиден как синоним Strombidium.
Сем. Tontoniidae Agatha, 2004
Род Tontonia Faure-Fremiet, 1914
Типовой вид Т. appendiculariformis по моноти-
пии из морского планктона. Тело коническое, углова-
тое, с обширным, широко открытым перистомом и
длинной полостью с большим числом мелких тесно
сближенных мембранелл; мембрана длинная, на пра-
вой стенке полости. Описания вида в первоисточнике
и у новых авторов расходятся; по Форе-Фремье, все
тело покрыто сетчатым панцирем, диагональный ряд
экструсом проходит ниже рта. По другим данным, пан-
цирь и кольцо экструсом идут поперек тела на уровне
середины перистома, а ниже рта расположено второе
поперечное кольцо экструсом, также в четком желоб-
ке. Вентрально внизу справа находится основание
очень длинного сократимого придатка — «хвоста»,
способного к активному движению; на придатке —
широкая полоса тесно сближенных рядов мелких ще-
тинок. Ядро фрагментировано. Как и другие планкто-
ны, вид способен к удержанию хлоропластов, продол-
жающих нормально функционировать в чужой клетке.
У Т. turbinata Song et Bradbury, 1998 нижний ряд
экструсом — иллюзия, вызванная спирализацией по-
перечной кинеты; положение кинет нетипичное для
предыдущего вида, они не должны быть в составе од-
ного рода.
Род Paratontonia Jankowski, 1978
Типовой вид Tontonia gracillima Faure-Fremiet,
1924. По описанию и рисунку Форе-Фремье вид очень
резко отличается от типа предыдущего рода, был вы-
делен в особый род Paratontonia Jank., 1978 (в тезисах,
поэтому название невалидное). Вероятно, это вид не с
зоохлореллами, а с захваченными (секвестированны-
ми) хлоропластами. Положение перистомальных мем-
бранелл не соответствует таковым у Tontonia', кине-
510
ALVEOLATA
том, панцирь и жструеомы нс зарисованы. Это потен-
циально типовой вид нового рода — Paratontonia Jank.
gen. n. (P. gracillima comb, n.) с крупными апикальными
мембранеллами на суженном антероне. Род, Paratonto-
nia принят в обзоре олиготрих (Agatha, 2004), но это не
означает его валидации в номенклатурном смысле.
Род Spirotontonia Agatha, 2004
Типовой вид Tontonia grandis Suzuki et Han,
2000. Тело узкое, почти целиком закрыто рельефным
панцирем; перистом типичный для олиготрих, не об-
ширный, как у Т. appendiculariformis. Вентральная ки-
нета закручена вокруг тела, с большим числом витков;
на венте видны 3 параллельные диагональные полосы
кинетосом; нет осевого ряда.
Род Pseudotontonia Agatha, 2004
Типовой вид Tontonia cornuta (Leegaard,
1915 — Laboea in Leegaard, 1915; Strombidium in Kahl,
1932). Этот вид сочетает признаки стромбидиев и тон-
тониид, более близок к стромбидиям. Сократимый
хвостовой придаток небольшой, цилиатура на хвос-
те — вероятно, продолжение вентрального ряда с ло-
кальной полимеризацией кинетосом; поперечная кине-
та расположена высоко, ниже рта; трихиты образуют
внутренний конус; осевая кинета длинная.
Виды тонтониид неопределенного положения:
Т. poopsia Montagnes et Lynn, 1998; T. antarctica Petz et
al., 1995 (вместо кольцевого ряда видна спираль, начи-
нающаяся справа, огибающая дорсум и возвращающа-
яся на вент по диагонали от перистома до постерона;
придаток массивный, с одной дикинетой); Т. simplici-
dens Lynn et Gilron, 1993 — кинетом типа Strombidium,
с поперечной кинетой и длинной осевой вентральной
кинетой; нет спирализации кольцевого ряда. Очевидно
многообразие типов кинетома у сборного рода Tonto-
nia-, к сожалению, пока нет четкой схемы кинетома ти-
пового вида.
Отряд Strobilidiida Jankowski, 1980
В системе Линна (Lynn, 2002) отряд Choreotrichida
Small et Lynn, 1985 делится на 4 подотряда — Leegaar-
diellina, Lohmanniellina, Strobilidiina и Strombidinopsina,
каждый с одним семейством; в данной сводке они не
признаются. Для третьего подотряда указано авторство
Strobilidiina Small et Lynn, 1985, но он был введен
раньше, тоже как подотряд, в статье (не в тезисах, и по-
этому валидный) — Strobilidiina Jankowski, 1980. Посколь-
ку подотряды не различаются, это название пригодно
для обозначения всех безраковинных олиготрих с коль-
цевой зоной мембранелл; Choreotrichida — синоним.
Среди Strombidiida кроме планктонтов немало бен-
тосных форм и симбионтов; стробилидииды только
планктонные в пресной воде и в море. Общий при-
знак — замкнутая полоса (кольцо) мембранелл на рас-
ширенном антероне; буккальная полость мелкая, нахо-
дится внутри кольца, цилиатура разного типа: 1) ло-
кальное удлинение нескольких наружных мембранелл,
2) отделение фрагментов внутрь зоны от нескольких
мембранелл, 3) кроме отделения фрагментов часть
мембранелл кольца подразделяется на два неравных
сегмента. Внутренние фрагменты могут точно соот-
ветствовать наружным мембранеллам, либо их верши-
ны помещаются между ними, либо фрагменты пол-
ностью обособлены.
Ядро обычно удлиненное, С-образное. Нет панциря
(эпитеки), нет пучка трихитов (экструсом). Сохранены
немногочисленные наружные кинеты, биполярные у
Strombidinopsis, в виде продольных фрагментов у ос-
тальных родов. При делении не образуется глубоко по-
груженная зона мембранелл с извитым каналом; зача-
ток расположен на поверхности тела, и стоматогенез
протекает без погружения ресничного поля.
Сем. Strombidinopsidae Small et Lynn,
1985
Тело вытянутое, узкое, не сплющено; кинеты бипо-
лярные, простой топографии, сходятся внизу у заост-
ренного постерона без образования швов; один из ря-
дов, условно обозначаемый К 1 (кинета 1), со сгущени-
ем кинетосом в сегменте над постероном. Морской
планктон; нет видов в пресных водах.
Род Strombidinopsis Kent, 1881
Типовой вид S. gyrans. По Аэшт, «типовой вид
по монотипии S. gyrans сейчас считается синонимом
вида Tintinnidium semiciliatum (по Фойсснеру). Тем
временем было описано несколько видов, но фактиче-
ски род не имеет гипового вида и требует выяснения
(clarification)». Другие синонимы — Strombidinopsis
paradoxus Smith, 1899 и Tintinnidium ranunculi Penard,
1922. Род имеет сложную таксономию и синонимию,
раньше иногда сводился в синонимы рода Tintinnidi-
um, но сейчас окончательно признан валидным.
У Кента описано 2 вида, а не один, поэтому указа-
ние Аэшт («по монотипии») неверное. Название S. cla-
paredei Kent предложено для вида, зарисованного и
описанного Клапаредом и Лахманном без названия;
это крупный цилиндрический вид без раковины, с про-
дольными рядами мелких неподвижных щетинок и
апикальными мембранеллами; вид S. gyrans Kent, 1881
плохо описан, это пресноводный вид без раковины, с
тонкими ресничками по всему телу и длинными рес-
ничками на апексе. Вид неопределимый, название
S. gyrans отсутствует в современной литературе, и род
следует объявить невалидным либо дать петицию в
ICZN о смене типового вида. S. claparedei Kent, 1881
тоже плохо описан, но по крайней мере показаны про-
дольные кинеты. По Калю (Kahl, 1932), у S. gyrans
имеется лишь несколько кинет в разных участках тела,
часть их не достигает постерона.
Типичный Strombidinopsis — вид с роговидным вы-
тянутым телом, кольцом длинных апикальных мемб-
ранелл, 2 ядрами; кинеты (не более 25) сходятся к по-
стерону; нет трихитов и раковины; аргиром не изучен.
Реснички по ходу кинет расположены парами (дисо-
ТИП CILIOPHORA. КЛАСС SPIROTRICHEA
511
мы). Основания мембранелл расположены косо, не
вдоль тела, на апикальном валике; мембраиеллы плав-
но удлиняются у рта, входя в буккальную полость без
фрпгмонтации или с отделением 1—2 мелких фраг-
M0IITOII. Мембрана длинная, изогнутая, вытянута вдоль
ПОЛОСЫ мембранелл. Примерный состав рода: S'. clapa-
IwM Kent, 1881 (предлагаемый типовой вид; переописан
Oct импрегнации); S. pelagicum comb. n. (Strobilidium
In Fiiur6-Fremiet, 1924); S'. marinum comb. n. (Strobilidi-
um in Faure-Fremiet, 1924); S. acuminatum Faure-Fre-
iniet, 1924; S. cheshiri Snyder et Ohman, 1991 (предпо-
ложительно синоним вида S. acuminatum)-, S. multiauris
Montagnes et Taylor, 1994; S. elongata Song et Bradbury,
1998; S’. elegans S. etB. 1998; S. minima (Gruber, 1884 in
Strombidium); S. spinifera (Leegaard, 1915); S. chilorhax
Lynn et al., 1991; S. sphaira Lynn et al., 1991. Второй
род — Parastrombidinopsis Kim et al., 2005 (P. shimi).
Сем. Lohmanniellidae Montagnes et Lynn,
1991
Это семейство выделялось в особый подотряд, но
различия незначительные. Тело мешковидное, широ-
кое и короткое, внутренние мембраиеллы немногочис-
ленные (4—5), обособлены от наружных и не кажутся
их продолжением. Кинетом почти редуцирован — над
постероном несколько продольных рядов, каждый с
несколькими моносомами (у стромбидинопсид с дисо-
мами и парными ресничками).
Род Lohmanniella Leegaard, 1915
С диагнозом семейства. Род предложен для 2 новых
видов, L. spiralis и L. oviformis; это мелкие морские
виды (до 44—60 мкм) с округлым телом и сложно диф-
ференцированной зоной мембранелл; соматические
реснички не замечены. Сейчас хорошо изучен второй
вид, но как типовой вид обозначается L. spiralis. Род
недостаточно изучен; вероятно имеется 2 типа мемб-
ранелл или кажется, что они 2 типов; кинеты без рес-
ничек или вообще отсутствуют.
Сем. Leegaardiellidae Lynn et Montagnes,
1988
Как и предыдущее семейство, выделено в особый
подотряд, но ранга семейства достаточно. Тело низкое
и широкое, перистом очень крупный, в виде широкой
воронки; часть мембранелл заворачивает внутрь во-
ронки, а в зоне рта отделяют 5—7 фрагментов. Сома-
тических кинет нет, исключая рудимент у постеро-
на — продольный ряд и короткие фрагменты, все с ди-
сомами.
Род Leegaardiella Lynn et Montagnes, 1988
Типовой вид L. sol; название предложено для
«крупной формы» Lohmanniella oviformis Leegaard,
1915. Виды рода мелкие и средних размеров, с оваль-
ным, коническим или роговидным телом; по крайней
мере один вид с тонкой гиалиновой раковинкой. По-
стерон с несколькими короткими фрагментами кинет;
ротовая цилиатура — кольцо мембранелл и отходящие
от них внутренние мембраиеллы и длинная мембрана;
всегда 2 ядра; вакуоль над постероном. L. sol Lynn et
Montagnes, 1988 — типовой вид без лорики; второй ва-
лидный вид L. ovalis L. et М., 1988.
L. elbraechteri Petz, Song et Wilbert, 1995 — вид c
лорикой. Этот вид выделяется как типовой в новый
подрод Loridiella Jank. subgen.’ n. — в отличие от типа
рода, тело коническое, заключено в тонкую раковину.
Сем. Strobilidiidae Kahl in Doflein
et Reichenow, 1929
Морские и пресноводные формы с коническим те-
лом; перистомальное поле апикальное, с замкнутой
полосой наружных мембранелл; группа внутренних
(ротовых) мембранелл значительно редуцирована,
обычно одна или несколько около рта, иногда вообще
отсутствуют.’ Соматические кинеты с короткими так-
тильными щетинками моно- и дикинетидного типа,
удлинены, не редуцированы, почти биполярные, ино-
гда часть их закручена спиралью у постерона. Корти-
кальные выросты покрывают кинетосомы и направля-
ют реснички влево; под ними — плотное вещество,
импрегнируемое протарголом. Трихиты (экструсомы)
не образуют четкого кольца или их нет. Нет раковины
и сетчатого панциря (эпитеки).
Род Strobilidium Schewiakoff, 1893
Типовой вид S. adhaerens по монотипии. Вид
хорошо описан, четкий, но тем не менее род имеет, по
Аэшт, 9 синонимов — Anthostrombidium, Arachnella,
Arachnidium, Arachnidiumia, Cephalotrichium, Para-
strombidium, Patronella, Sphaerotrichium, Turbilina (и
Torquatella = Patronella). Эта синонимия неверна, к
примеру, Cephalotrichium не имеет сомакинет, Antho-
strombidium с типовым видом Strobilidium rapulum —
это стромбидииды с четким делением полосы мембра-
нелл на наружную и внутреннюю и также без кинет.
Указанное выше название типового вида отсутст-
вует в современных работах, вероятно как синоним; по
Дингфельдеру (Dingfelder, 1962), правильное название
вида — Strobilidium cometa (Muller, 1786) (синонимы
Trichoda cometa Muller; Strombidium caudatum Fromen-
tel, 1876; S. claparedei Kent, 1881; S. intermedium Mas-
kell; S. gyrans Stokes, 1887; Strobilidium adhaerens Sche-
wiakoff, 1893). Название S. cometa также не использу-
ется, a S. gyrans считается валидным видом.
Фойсснер (Foissner et al., 1999) восстанавливает на-
звание Strombidium caudatum Fromentel, 1874 и ликви-
дирует названия S. gyrans и S. adhaerens; это поддер-
жано решением ICZN. Итак, название типового
вида — Strobilidium caudatum (Fromentel). Род делится
на 2 группы видов — у типового вида несколько кинет
относительно короткие, но три из них непропорцио-
нально удлинены и спирализованы вокруг постерона;
ядро С-образное, лежит поперек тела под кольцом
512
ALVEOLATA
мембранелл. В перистоме мембранеллы, уменьшаясь,
образуют короткую внутреннюю полосу; по другой
схеме мембранеллы в одном участке удлинены внутрь
воронки и здесь имеются также очень мелкие фрагмен-
ты. Постерон секретирует длинную нить для прикреп-
ления к субстрату; эту нить зарисовал Фроментель, и
только по этому признаку можно определить его вид.
Виды без спирализации кинет, фактически все, кро-
ме типового, не должны включаться в состав рода:
S. armeniensis Zharikov, 1987; S. humile Penard, 1922;
S. hyalinum Mirabdullajev, 1985; 5. saltans Vuxanovici,
1962; S. conicum Kahl, 1932; S. velox Faure-Fremiet,
1924; S. lacustris Foissner et al., 1988; S. epacrum Mon-
tagnes et Lynn, 1991; S. elegans Hada, 1950 (гомоним);
S. syowaensis Hada, 1950; S. marinum F.-Fr., 1924. Эти
виды имеют разный тип внутренних мембранелл, и
пока этот признак не используется для различения ро-
дов; у S. lacustris мембранеллы наружной зоны, умень-
шаясь, входят вовнутрь кольца; у S. velox кольцо еди-
ное, лишь слегка удлинены несколько мембранелл
близ мембраны. Эти формы составляют следующий
род Rimostrombidium.
Род Rimostrombidium Jankowski, 1978
Типовой вид Strobilidium velox Faure-Fremiet,
1924. Отличительный признак — с ребрами кортекса.
Мелкие виды с коническим телом, короткими кинета-
ми, достигающими полюсов тела и не закрученными
спирально на постероне; ряды продольные или слегка
наклонены к оси тела; ядро С-образное. Представите-
лем рода может служить хорошо изученный вид S. la-
custris. Наружная полоса мембранелл входит внутрь
кольца; имеется около 10 кинет, прикрытых складкой
кортекса (отсюда название рода: rim = ребро).
Род принят в литературе и все же не валиден — на-
звание предложено в тезисах, а не в статье; такие роды
по правилам номенклатуры невалидные. Поэтому
то же родовое название предлагается вновь — Rimost-
rombidium Jankowski gen. п., типовой вид Strobilidium
velox Faure-Fremiet, 1924; диагноз рода помещен выше.
Другие виды — R. lacustris comb. n. (Foissner et al.,
1988 in Strobilidium)', R. armeniensis comb. n. (Zharikov,
1987 in Strobilidium)', R. humile comb. n. (Penard, 1922
in Strombidium)', R. saltans comb. n. (Vuxanovici, 1962
in Strobilidium)', R. brachykinetum comb. n. (Krainer,
1995 in Rimostrombidium)', R. hyalinum comb. n. (Mi-
rabdullajev, 1985 in Strobilidium)', R. orientale comb. n.
(Song et Bradbury, 1988 in Rimostrombidium)', R. sphae-
ricum comb. n. (Lynn et Montagnes, 1988 in Strobilidi-
um)', R. veniliae (Montagnes et Taylor, 1994) comb, n.;
R. undinum comb. n. (Martin et Montagnes, 1993 in Stro-
bilidium).
Род Pelagostrobilidium Petz, Song
et Wilbert, 1995
Типовой вид Strobilidium neptuni Montagnes et
Taylor, 1994. Мелкие морские пелагические формы с
широким низким телом, С- образным ядром под пери-
стомом; кольцо мембранелл цельное, но у мембраны и
рта незначительно удлинены несколько мембранелл
и имеются 2 мелких фрагмента. Кинеты немногочис-
ленные, длинные, идут под углом к оси тела, не дости-
гают апекса; 2 ряда не достигают постерона, другие
удлинены снизу, один из рядов закручен и идет почти
поперек тела, нарушая симметрию кинетома. Р. simile
Song et Bradbury, 1998 — вид co сходным строением
тела и таким же числом кинет (5); дорсальный ряд сме-
щен далеко вниз и лежит почти поперек тела. Третий
валидный вид, изученный на протарголовых препара-
тах, — Р. spirale (Leegaard, 1915).
Приложение. Синонимы стробилидиид и роды
неясного положения
Род Arachnella Kent, 1882
Типовой вид Л. globosa', также A. convoluta. Как
гомоним, название заменено на Arachnidium Kent, 1882
и Arachnidiumia Strand, 1928. Мембранеллы в замкну-
том кольце; тело со спиральными ребрами, более мно-
гочисленными, чем у Rimostrombidium. Род неясного
положения.
Род Turbilina Enriques, 1908
Типовой вид Т. instabilis. Этот род по общему
признанию синоним рода Strobilidium', тип рода — си-
ноним вида S. adhaerens Schew. = S. gyrans Stokes, т. e.
типового вида Strobilidium. Род невалидный.
Род Torquatella Ray Lankester,
1874
Типовой вид Т. typica. Как гомоним, родовое
название заменено на Patronella Corliss, 1979. Под
этим названием Форе-Фремье (Faure-Fremiet, 1924)
описал вид другого рода, Strombidinopsis, с широким
мешковидным телом, без трихитов, с 2 ядрами. Тип
рода Torquatella плохо описан, вероятно это синоним
Strombidium (с типичным делением зоны мембранелл
на 2 отдела, одним ядром и поперечным кольцом экст-
русом). Под названием Strobilidium typicum (Lankester,
1874) из планктона у Чукотки описан вид с бочонко-
видным ровным телом, без панциря и сомакинет, с не-
широким апикальным кольцом мембранелл (Алекпе-
ров, Мамаева, 1992).
Род Ciliospina Leegaard, 1915
Типовой вид С. norwegica по монотипии из
морского планктона.
Найдены лишь 2 особи с кольцевой зоной мембра-
нелл и с 2 длинными боковыми выростами тела (по
Калю, артефакт фиксации пробы планктона или не за-
мечены заглоченные диатомеи). Позже таких форм не
находили, и род приводят в списках форм неясного по-
ложения среди олиготрих. В первоописании вида нет
данных о цилиатуре, ядре и трихитах.
ТИП CILIOPHORA. КЛАСС SPIROTRICHEA
513
Род Sphaerotrichium Wulff, 1919
Типовой вид S. elegans. Плохо описанный мор-
ской планктонный вид неясного положения; размеры
тела 30 мкм, тело сферическое, апикальное кольцо
замкнутое, ядро овальное или вытянутое; данных о ци-
лиатуре и экструсомах нет. Это вид рода Lohmanniella
или Strobilidium.
Итоговая схема классификации олиготрих (Agatha,
2004):
Класс Oligotrichea Butschli, 1889
Подкласс Halteriia Petz et Foissner, 1992
Отряд Halteriida P. et F., 1992
Сем. Halteriidae C. et L., 1859 (Halteria, Pelagohalteria,
Meseres)
Подкласс Oligotrichia Butschli, 1889
Отряд Choreotrichida Small et Lynn, 1985
Подотряд Strobilidiina Jankowski, 1980
Сем. Strobilidiidae Kahl, 1929 (Strobilidium, Rimostrom-
bidium, Pelagostrobilidium)
Сем. Strombidinopsidae Small et Lynn, 1985 (Strombidi-
n opsis)
Сем. Leegaardiellidae Lynn et Montagnes, 1988 (Leega-
ardiella)
Сем. Lohmanniellidae Montagnes et Lynn, 1991 (Loh-
manniella)
Подотряд Tintinnina Kofoid et Campbell, 1929
Отряд Oligotrichida Butschli, 1889
Сем. Strombidiidae Faure-Fremiet, 1970 (сборное не мо-
нофилетичное семейство, будет подразделено поз-
же; Strombidium, Parallelostrombidium, Omegast-
rombidium, Spirostrombidium, Novistrombidium, La-
boea)
CeM.Tontoniidae Agatha, 2004 (Tontonia, Paratontonia,
Spirotontonia, Pseudotontonia)
Сем. Cyrtostrombidiidae Agatha, 2004 (Cyrtostrombidi-
um)
Сем. Pelagostrombidiidae Agatha, 2004 (Limnostrombidi-
um, Pelagostrombidium)
Отряд Tintinnida Kofoid et Campbell, 1929
Цилиаты с перистомом типа Strobilidium, постоян-
но подвижные в планктоне; имеют раковинку (лорику)
с очень большим разнообразием формы и орнамента.
Тело цилиндрическое или конусовидное, иногда очень
вытянутое, очень сократимое. Перистомальная цилиа-
тура — замкнутое кольцо мембранелл (используется
также термин «парамембранеллы»), особо развитая,
доминирующая структура клетки, идущая по левоза-
крученной апикальной спирали; между мембранеллами
расположены выступы кортекса с экструсомами осо-
бого типа, в виде удлиненных капсул. Соматическая
цилиатура имеется, но в значительной степени редуци-
рована, сохранена в верхнем отделе, где расположены
короткие прямые продольные кинеты, играющие, ве-
роятно, тигмотактическую (не локомоторную) роль;
движение и питание обеспечивает кольцо мембранелл.
Кортекс и цилиатура окружены дополнительной мемб-
раной (перилеммой). Размножение делением такого
типа, как у олиготрих, с образованием погруженного
ресничного зачатка задней особи, на поздних стадиях
выходящего на поверхность тела. Макронуклеус рети-
кулярной структуры, при делении через ядро проходит
полоса репликации хромосом, как у гипотрих.
Распространение группы — планктон всего Миро-
вого океана, где тинтинниды составляют существен-
ный трофический компонент микропланктона. В соло-
новатых прибрежных водах разнообразие меньше, в
пресных водах встречается около 15 описанных видов,
не все из которых валидные; это в основном роды Со-
donella, Tintinnidium и Membranicola. Симбионтных
родов и видов нет.
Долгое время изучались в основном фиксирован-
ные пробы планктона (в спирте или формалине), в ко-
торых особи сжавшиеся и темные, характерные при-
знаки видов не видны. Наблюдения живого материала
позволили впервые выявить разнообразие типов кле-
ток, показали наличие соматической цилиатуры видо-
измененного типа — короткие щетинки в прямых ря-
дах в основном в верхней половине тела. Но такие ра-
боты были исключением, и систематика группы велась
по типу раковин без учета строения трофонта; вначале
различали несколько сборных родов, например Tintin-
nus, Favella, Parafavella, затем критерии стали более
дробными. Современная система отряда основана на
монографии Кофойда и Кэмпбелла (Kofoid, Campbell,
1929), в которой учтены только формы раковины и нет
упоминания о типе ядер, цилиатуры, строении кольца
мембранелл. Индекс родов тинтиннид см.: Loeblich,
Tappan, 1968; Aescht, 2001.
В последние годы цилиат изучают на протарголо-
вых препаратах, — белковое серебро красит ядра, ки-
нетосомы, реснички, щетинки, фибриллы, мионемы,
мембраны и мембранеллы. Для фиксации материала
пригодны различные фиксаторы, лучше всего раствор
Буэна (пикро-ацето-формол) или смесь этого раствора
со спиртом; пригоден старый спиртовой материал,
если отмыть спирт и обработать смесью Буэна. Без,
применения протаргола невозможна не только работа
морфологов и систематиков, но и фаунистов, невоз-
можно определение видов у безраковинных олиго-
трих, в меньшей степени импрегнированные препара-
ты тинтиннид нужны фаунистам. Изучение тинтиннид
перешло в новый этап, сейчас выявлен кинетом у воз-
растающего числа родов и видов; как ожидалось, не
всегда форма раковины коррелирована с типом цилиа-
туры и строением перистома. Подробно изучены так-
же морфогенетическе процессы при делении особи,
иногда более напоминающем почкование.
Топография кинет у предшественников тинтиннид
различна при сходном типе перистома, и это один из
признаков новых родов; у тинтиннид кинетом порази-
тельно различен, но пока нет случаев выделения родов
только по различиям цилиатуры. Можно различить
примитивный тип кинетома у Tintinnidium — в основ-
ном прямые кинеты значительной длины, почти до по-
стерона, разрозненные и расположенные примерно на
равных расстояниях; но и у этого рода видны безрес-
ничные поля и группы специализированных рядов раз-
ной длины со сгущением кинетосом. Различают 4 типа
кинетома у тинтиннид, вплоть до практически полной
редукции рядов у Salpingacantha.
В ротовой зоне расположено апикальное кольцо
мембранелл, обычно на поверхности специального ва-
лика; в основании мембранелл по 2—3 ряда кинето-
сом; ряды почти прямые у пресноводных форм, изви-
тые у большинства морских. Сохранена ундулирую-
щая мембрана исходного аппарата стробилидиид —
длинный дуговидный ряд с зигзагообразной дикине-
33 Зак. №4163
514
ALVEOLATA
Рис. 302, a. Tintinnida.
Tintinnidiumpusilium (Л.Жу Cymatocylis convollaria (Б, В,Д, E); Codonellopsis glacialis (Г, 3. И). (По: Petz et al., 1995 (5—E, 3, H); Foissner et al., 1999 (А, Ж)).
Fig. 302, a. Tintinnida.
той в основании, только одна кинетосома в парах несет
ресничку.
Систематика тинтиннид усложнена открытием по-
лиморфизма. В жизненном цикле Favella ehrenbergii,
изученном на материале чистых линий, чередуются
стадии с ровной поверхностью раковины, с орнамен-
том разного типа, с каудальным шипом и без него.
Протер (передняя особь) после деления имеет ракови-
ну без орнамента (тип Favella), после второго деления
(через сутки после первого) образует раковину с се-
рией поперечных апикальных ребер; на других стади-
ях ребра могут достигать постерона, или мы видим ти-
пичных Coxliella с низкой камерой, с широкими ребра-
ми и высокой трубчатой частью с более тесным
расположением колец. Возможен иной тип полимор-
физма у других тинтиннид, пока не изученных. Это
значит, что в планктоне одновременно встречаются де-
финитивные раковинки, протолорики и эпилорики по
терминологии Лаваль-Пейто и Берана (Laval-Peuto,
1977; Beran, 1993), изучивших этот цикл.
Доказано различие типов раковины, образуемой
протером и трофонтом не только у Favella, но и у Tin-
tinnopsis campanula, Helicostomella subulata, Parafavel-
la denticulata', в планктоне доминирует одна из форм,
реже встречаются другие, и, кроме того, возможны
аномалии при образовании раковины. Система, осно-
ванная только на «постоянном для вида» типе ракови-
ны, оказывается ошибочной; неясно даже, какая форма
раковины видоспецифична, в диагнозе вида у тинтин-
нид в будущем придется указывать спектр типов рако-
вины. Пока в современных сводках цилиат принята
классическая система Кофойда и Кэмпбелла. Предста-
вители пресноводных и морских родов тинтиннид
показаны на рис. 302, а—303, б. Ископаемые роды
тинтиннид за несколькими исключениями не включе-
ны в данный обзор.
Сем. Ascampbelliellidae Corliss, 1960
Раковина мелкая, конусовидная с расширенным во-
ротничком — кольцевым апикальным выступом по
всему периметру широкого устья; нижний конец рако-
вины расширен или почти заострен. Нет спирализации
ТИП CILIOPHORA. КЛАСС SPIROTRICHEA
515
Рис. 302, б. Tintinnida.
Tintinnidium fluviatile (/J): Tintinnopsis cylindrata (fl, B\, Tintinnidium semiciliatum (Ту Membranicola tamari (Д—К). (По: Foissner et al., 1999. Цифрами обозна-
чены номера рядов).
Fig. 302, б. Tintinnida.
Numbers designate somatic rows.
колец у вершины раковины; если устьевых колец (ре-
бер) несколько, они разделены желобком. Устье с ров-
ным, редко с зубчатым краем. На срезе стенка ракови-
ны трехслойная, промежуточный слой гиалиновый
или с неясной призматической структурой, иногда на-
блюдается агглютинация кокколитов на раковине.
Обитатели всего Мирового океана, частые в сборах от
полярных морей до тропиков.
Род Ascampbelliella Corliss,
1960
Название предложено для замены гомонима Crate-
rella Kofoid et Campbell, 1929. Типовой вид Tintin-
nus urceolatus Ostenfeld, 1899. В составе рода около
10 видов.
516
ALVEOLATA
Рис. 303, a. Tintinnida.
Parafavella denticulata (Л); Tintinnidiuni fluviatile (S); Codonellopsis ecaudata (H); Tintinnopsis amphora (Г); Climacocylis scalaria (Д); Daturella datura (£); Die-
tyocysta elegans (Ж); Parafavella acuta (3); Ptychocylis obtusa (IT); Parafavella obtusa (K); Favella taraikaensis (Л); Coxliella meunieri (M); Tintinnopsisfimbriate
(H); Codonellopsis ostenfeldi (0); Acanthostomella norvegica (ГТ); Slenosemella ventricosa (P); Epiplocylis deflexa (C); Helicostomella subulate (T); Steenstrupiella
robusta (У); Salpingella acuminata (Ф); Codonellopsis pacifica (X). (По: Бурковский, 1973 (A); 1976 (3, П); Бурковский и др., 1974 (И—Я, Т—Ф); Traite, 1994
(Б—Ж, О—С, X)).
Fig. 303, a. Tintinnida.
Род Acanthostomella Jorgensen,
1927
Типовой вид Amphorella norvegica Jorgensen,
1927. Известно 7 видов.
Род Luxlella Lecal, 1953
Типовой вид L. mitra', также L. glans. Возмож-
но, это невалидный род, описанный по фенотипу про-
толорики тинтиннид рода Acanthostomella.
Род Niemarshallia Corliss, 1960
Типовой вид Craterella aperta Marshall, 1934.
Монотипический род неясного статуса, возможно, так-
же один из фенотипов Ascampbelliella.
Сем. Codonellidae Kent,
1881
Сборная, гетерогенная группа с большим числом
родов разного типа. Раковина в форме урны, колоколь-
чика, конуса или цилиндра, иногда со сжатием ниже
устья, без спирализации ребер, исключая Tintinnopsis.
Нижний конец раковины замкнутый, сужен или заост-
рен, иногда с роговидным отростком. Стенка ракови-
ны обычно однослойная, чаще всего без орнамента,
или с кольцевым, или решетчатым узором и с агглюти-
нацией посторонних частиц у некоторых видов. Мак-
ронуклеусы полимеризованы, от 2 до 8, редко до 16.
Большинство родов морские, несколько видов в соло-
новатых и пресных водах.
ТИП CILIOPHORA. КЛАСС SPIROTRICHEA
517
Рис. 303, б. Tintinnida.
Tintinnopsis butschlii (/): Stenosemella ventricosa (2); Leprotintinnus pellucidus (5); Tintinnidiuni mucicola (4); Tintinnopsis umula (J); T. kofoidi (б); T. apertula
(7); Codonellopsis orientalis (S); Coxliella annulata (9); Helicostomella subulata (10); Rhizodomus tagatzi (11); Parafavella ventricosa (12); Favella ehrenbergii
(13); Ptychocylis obtusa (14); Acanthostomella norvegica (15); Undella californiensis (16); Tintinmis exigua (17); Salpingella acuminata (18). (По: Стрелков, 1955).
Fig. 303, 6. Tintinnida.
518
ALVEOLATA
Род Codonella Haeckel, 1873
Тино в о й в и д С. galea. В основном в планктоне
пресных вод. Особо част вид С. cratera (Leidy, 1877)
(= Codonella lacustris Entz, 1885), имеющий соматиче-
скую цилиатуру, как у Tintinnopsis, и поэтому иногда
включаемый в состав последнего.
Род Codonaria Kofoid et Campbell, 1939
Типовой вид Cyttarocylis cistellula Fol, 1884.
Род Codonopsis Kofoid et Campbell,
1939
Типовой вид Суttarocylis ollula Brandt, 1906
Род Tintinnopsis Stein, 1867
Типовой вид T. beroidea. Наиболее крупный
род тинтиннид, включает около 130 видов; сборный
род, часть видов описана несомненно по фенотипу
протолорики и поэтому невалидна.
Род Poroecus Cleve, 1922
Замещающее название для гомонима Porella Cleve,
1899. Типовой вид Porella apiculata Cleve, 1899.
Сем. Tintinnidiidae Kofoid et Campbell,
1929
Раковина трубчатая, иногда изогнутая, может
иметь спиральное ребро ниже устья, но сужение (шей-
ка) встречается лишь как исключение. Нижний конец
трубки замкнутый у Tintinnidium, открыт у Leprotintin-
nus; как правило, раковина тинтиннид снизу замк-
нутая, но по этому признаку нельзя делить отряд на по-
дотряды, это различие не коррелировано с различиями
кинетома. Стенка раковины мягкая, желатиновая в от-
личие от прочной раковины у всех остальных тинтин-
нид; на срезе это скопление мельчайших шариков,
склеенных в однослойную пластинку; часты картины
агглютинации постороннего материала (частицы дет-
рита, диатомеи). Ядро в 2—3 фрагментах, апекс с
12—17 мембранеллами. Соматическая цилиатура от-
носительно хорошо развита, густая, кинеты многочис-
ленные, это представители примитивных тинтиннид.
Встречаются в пресных, солоноватых и морских во-
дах. Это единственная группа тинтиннид, где все роды
неизвестны в ископаемом состоянии.
Род Leprotintinnus Jorgensen, 1900
Типовой вид Tintinnus pellucidus Cleve, 1899.
Включает наиболее крупных из известных видов тин-
тиннид.
Сем. Codonellopsidae Kofoid et Campbell,
1929
Раковина в форме волчка с гиалиновой цилиндиче-
ской шейкой и закругленной или овальной камерой,
обычно покрыта детритом. Шейка со стенкой из мель-
чайших альвеол, со спирализацией или простая, ино-
гда с фенетрами — вырезками стенки. Камера иного
строения, обычно округлая и замкнутая, кроме рода
Laackmanniella', постерон ровный, с небольшим высту-
пом или роговидным придатком. В клетке 2—8 ядер,
апекс с 18—20 мембранеллами; соматическая цилиа-
тура густая, с разрозненными ресничными полями.
Все виды семейства морские.
В отдельные семейства Calpionellidae и Colomielli-
dae выделялись 8 ископаемых родов, но по типу рако-
вины они, скорее всего, принадлежат к данному семей-
ству. Сем. Codonellopsidae включает несколько совре-
менных родов в 2 подсемействах — Codonellopsinae
Campbell, 1954 и Stenosemellinae Campbell, 1954.
Род Codonellopsis Jorgensen, 1924
Типовой вид Codonella orthoceras Haeckel, 1873.
Крупный род (26 видов) с несколькими подродами.
Род Laackmanniella Kofoid et Campbell,
1929
Типовой вид Codonella naviculaefera Laack-
mann, 1907. С агглютинацией крупных диатомей в рай-
оне камеры; шейка раковины удлиненная, без посто-
ронних частиц.
Род Stenosemella Jorgensen, 1924
Типовой вид Tintinnus ventricosa Claparede et
Lachmann, 1858.
Род Micropoculum Dons, 1922
Типовой вид не фиксирован; род предложен
для нескольких видов. Это формы типа Codonellopsis,
но родовое название последнего не заменяется, по-
скольку виды плохо описаны и материал не сохранен.
Род Tintinnidium Kent, 1881
Род Wangiella Nie, 1934
Типовой вид Tintinnus fluviatilis Stein, 1863.
Син. Arachnella. Хорошо изученный пресноводный
род.
Типовой вид W. dicollaria. Ранее в сем. Dictyo-
cystidae, но это, скорее всего, синоним рода Stenose-
mella.
ТИП CILIOPHORA. КЛАСС SPIROTRICHEA
519
Род Luminella Kofoid et Campbell, 1939
Типовой вид Tintinnopsis punctata Wailes, 1925.
Как и предыдущий род, ошибочно включался в сем.
Dictyocystidae — нет существенных отличий по типу
раковины от Stenosemella. В каталоге Аэшт этот и пре-
дыдущий род валидные.
Сем. Dictyocystidae Kent, 1881
Раковина без спиральной структуры, с многочислен-
ными фенетрами шейки и камеры. Гиалиновая шейка
имеет 1 или 2 ряда фенетр с правильным расположени-
ем — округлых, прямоугольных или узорчатых, чаще
всего закрытых прозрачной пленкой. Камера обычно
овальная, закругленная или заостренная снизу, но без
шипа, часто также пронизана одним или несколькими
кольцами фенетр; иногда на раковине агглютиниро-
ванные кокколиты. Отмечены во всех морях.
Род Dictyocysta Ehrenberg, 1854
Типовой вид D. elegans.
Сем. Metacylididae Kofoid et Campbell,
1929
Раковина трубковидная, спереди со спиральным
орнаментом, это аналог шейки, но без заметного сужения;
устье раковины всегда без зубцов; гиалиновая стенка
раковины тонкопризматического строения, иногда с
агглютинацией кокколитов. В цикле развития возможны
фенотипы с другой формой раковины — паралорики
(внешне, как Coxliella) и эпилорики. Обычно в клетке
по 2 ядра, редко до 8. Морское космополитное семей-
ство, в пресных водах только один вид. В ископаемом
материале 3 рода, ранее относимых к Calpionellidae.
Род Metacylis Jorgensen, 1924
Типовой вид Tintinnus mediterraneus Meresch-
kowsky, 1880. 19 видов.
Род Pseudometacylis Balech, 1968
Типовой в и д Р. ornata, монотипический род.
Род Helicostomella Jorgensen, 1924
Типовой вид Tintinnussubulata Ehrenberg, 1834.
8 видов из северных морей.
Род Climacocylis Jorgensen, 1924
Типовой вид Cyttarocylis (подрод Coxliella) sca-
larius Brandt, 1906. 2 подрода с 7 видами.
Прежнее название сем. Coxliellidae Kofoid et Camp-
bell, 1929 сейчас не сохранено, поскольку род Coxliel-
la — не валидный род, а сходная стадия в сложном
цикле развития разных родов, описанных по дефини-
тивным трофонтам. К примеру, имеется несколько фе-
нотипов вида Favella ehrenbergii (favella, decipiens,
coxliella)-, они способны к взаимному скрещиванию
при конъюгации в лабораторных культурах. Все фено-
типы принадлежат к одному виду, поэтому нужно лик-
видировать виды Coxliella decipiens, С. annulata и Fa-
vella markusovszky как невалиДные.
Роды Stylicauda Balech, 1951 (типовой вид Tintin-
nopsis platensis Cunha et Fonseca, 1917) и Rhizodomus
Strelkow et Wirketis, 1950 (типовой вид R. tagatzi) чис-
лятся валидными в каталоге Аэшт, но, по предположе-
нию Лаваль-Пейто (Laval-Peuto, 1977), это фенотипы с
паралориками типа Coxliella видов рода Tintinnopsis.
Сем. Ptychocylididae Kofoid et Campbell,
1929
Очень гетерогенная сборная группа без четкой ха-
рактеристики. Раковина в виде колокола с удлиненной
камерой; устье часто с зубцами, иногда двойное, с
желобком между краями устьев; нет суженной и вытя-
нутой шейки. Ниже устья складки, никогда не коль-
цевые; камера с сужением и шипом сзади, цилиндри-
ческая. Стенка раковины состоит из одного альвео-
лярного слоя, но по светопреломлению трехслойная.
Возможно образование паралорик и эпилорик со спи-
ральным орнаментом. В клетке обычно 2 ядра.
Род Ptychocylis Brandt, 1896
Типовой вид Tintinnus urnula Claparede et Lach-
mann, 1858. 13 видов.
Род Cymatocylis Laackmann,
1910
Типовой вид Cyttarocylis drygalskii Laackmann,
1907.
Род Protocymatocylis Kofoid et Campbell,
1929
Типовой вид Cymatocylis vanhoeffeni forma sub-
rotundata Laackmann, 1910. Известен из Антарктики,
как и 2 предыдущих рода. Включает 46 видов с лори-
ками разного типа, требует ревизии.
Род Favella Jorgensen, 1924
Типовой вид Tintinnus ehrenbergi Claparede et
Lachmann, 1859. Крупный род с 37 видами, число кото-
рых нужно уменьшить, так как часть их описана по фе-
нотипам в полиморфном цикле развития Т. ehrenbergi
и других видов.
520
ALVEOLATA
Род Wailesia Kofoid et Campbell, 1939
Типовой вид Dictyocysta apiculata Wailes, 1925.
Возможно, это лишь одна из стадий (аномальная
протолорика) в цикле Ptychocylis игпикг, род сомни-
тельный.
Сем. Epiplocylididae Kofoid et Campbell,
1939
Раковина короткая, массивная, край устья гладкий,
иногда расширен в виде небольшого воротничка и с
утолщенным валиком ниже его. Камера цилиндриче-
ская спереди, коническая снизу, с шипом или роговид-
ным отростком. Стенка раковины гиалиновая, с орна-
ментом на поверхности, частично или полностью, в
виде полигональной сетки, ограниченной выпуклыми
ребрами; к устью узор меняется на вертикальные или
спиральные ребра. В клетке 2 макронуклеуса. Обита-
тели теплых и тропических морей.
Род Epiplocylis Jorgensen, 1924
Типовой вид Cyttarocylis acuminata Daday,
1887. 26 видов.
Род Epiplocyloides Hada, 1938
Типовой вид Cyttarocylis reticulata Ostenfeld et
Schmidt, 1902. 9 видов.
Род Parapetalotricha Hada, 1970
Типовой вид P. meridiana. По Аэшт, это тип по
монотипии, но род предложен также для Petalotricha
entzi Kofoid. Отличия от Petalotricha могут быть недо-
статочными для выделения рода.
Сем. Rhabdonellidae Kofoid et Campbell,
1929
Раковина коническая или бутылковидная, часто
очень длинная, устье без зубцов, с другим орнаментом
(ребра у Epirhabdonella, желобки у Rhabdonella и
Rhabdonellopsis'y. нижний конец камеры часто с отро-
стком, роговидным или ланцетовидным. Стенка рако-
вины гиалиновая, трехслойная, альвеолярного стро-
ения. На поверхности стенки орнамент — полоски,
ребра, иногда сквозные поры. Трофонты очень мелкие
по сравнению с раковиной, около 1/5 ее длины; имеют-
ся 2 ядра и 16—20 мембранелл.
Род Rhabdonella Brandt, 1906
Типовой вид Tintinnusspiralis761,1881.27видов.
Род Rhabdonellopsis Kofoid et Campbell,
1929
Типовой вид Cyttarocylis hebe var. apophysata
Cleve, 1900. 7 видов.
Род Epicancella Kofoid et Campbell, 1929
Типовой вид Cyttarocylis nervosa Cleve, 1900.
1 вид.
Сем. Cyttarocylididae Kofoid et Campbell,
1929
Раковина колокольчатая, с заметно вытянутой ка-
мерой, с четкой шейкой, ограниченной желобками и
ребрами; нет спиральной скульптуры раковины; стен-
ка раковины трубчатой трехслойной структуры у Peta-
lotricha, иногда сетчатая (у Cyttarocylis). Ядра много-
численные, до 50. Тропические моря, Средиземное
море. Ископаемые роды неизвестны.
Род Cyttarocylis Fol, 1881
Типовой вид Dictyocysta cassis Haeckel, 1873.
11 видов.
Род Protorhabdonella Jorgensen, 1924
Типовой вид Cyttarocylis simplex Cleve, 1900.
2 подрода с 6 видами.
Род Epirhabdonella Kofoid et Campbell, 1939
Типовой вид Protorhabdonella (Eurhabdonella)
mira Kofoid et Campbell, 1929. 3 вида.
Сем. Xystonellidae Kofoid et Campbell, 1929
Раковина вытянутая, бокаловидная; устье иногда
зубчатое, может быть сужено у основания или утолще-
но и пронизано желобком. Ниже устья могут быть
1—3 кольцевых утолщения. Камера удлинена, с про-
стым или сложной формы роговидным выростом.
Стенка тела трехслойная, гиалиновая с тонкопризмен-
ным строением либо с крупными альвеолами. Извест-
но несколько ископаемых видов.
Род Petalotricha Kent, 1881
Типовой вид Tintinnus ampulla Fol, 1881. 9 ви-
дов.
Род Parundella Jorgensen, 1924
Типовой вид Tintinnus caudatus Ostenfeld, 1899.
25 видов.
ТИП CILIOPHORA. КЛАСС SPIROTRICHEA
521
Род Xystonella Brandt, 1906
Типовой вид Cyttarocylis treforti Daday, 1887.
3 подрода с 11 видами.
Род Xystonellopsis Jorgensen, 1924
Типовой вид Undella paradoxa Cleve, 1900.
8 подродов с 33 видами.
Род Parafavella Kofoid et Campbell,
1929
Типовой вид Tintinnus denticulatus Ehrenberg,
1840. 33 вида, приуроченные к арктическим и север-
ным морям; в России подробно изучены Бурковским
(1973, 1976) на Белом море (морфология, видовой со-
став, экология, изменчивость раковины). В жизненном
цикле есть фаза паралорики типа Coxliella.
Род Spiroxystonella Kofoid et Campbell,
1939
Типовой вид Cyttarocyis (Xystonella) scandens
Brandt, 1906.
(= Xystonella scandens Brandt, 1907).
По Лаваль-Пейто (Laval-Peuto, 1977), род невалид-
ный как фаза развития (паралорика) одного из видов
Xystonella.
Сем. Undellidae Kofoid et Campbell,
1929
Раковина обычно короткая, в виде вазы или урны,
редко вытянутая и трубчатая; устье узкое, без зубцов,
иногда с валиком. Нет четкого деления на шейку и ка-
меру; нижний конец раковины закрытый, сужен, с не-
большим выступом, но без роговидного придатка.
Покров раковины совершенно ровный или с многочис-
ленными кольцевыми ребрами; никогда нет продоль-
ных или спиральных ребер. Стенка раковины гиалино-
вая, трехслойная, альвеолярной структуры. Клетка
имеет 2—4 ядра, апекс с 18—22 мембранеллами. Рас-
пространены в теплых и тропических морях. Из 6
пключенных родов в ревизии тинтиннид сохранено
3 рода. Ископаемые формы неизвестны.
Род Undella Daday, 1887
Типовой нид U. hyalina. 31 вид (из них 7 сомни-
тельных).
Род Undellopsis Kofoid et Campbell,
1929
Типовой вид Undella marsupialis Brandt, 1906.
2 вида.
Род Amplectella Kofoid et Campbell,
1929
Типовой вид Undella collaria Brandt, 1906.
15 видов.
3 родовых названия, употребляемые в литературе,
сейчас признаны синонимами — Proplectella Kofoid et
Campbell, 1929 (типовой вид Tintinnus claparedei Entz,
1885), Rotundocylis Kufferath, 1952 и Micrundella Bush,
1948 (типовой вид M. membranata Busch, 1948 по по-
следующему обозначению); название невалидно как
предложенное без указания типа, в каталоге Аэшт при-
водится как Micrundella Loeblich et Tappan, 1968). Эти
3 родовых названия признаны синонимами рода Un-
della.
Синонимы рода Amplectella — Amplectellopsis Ko-
foid et Campbell, 1929 (типовой вид A. biedermani) и
Cricundella Kofoid et Campbell, 1929 (типовой вид Un-
della tredivisa Brandt, 1906).
Сем. Tintinnidae Claus, 1876
Раковина без спиральной или кольцевой структу-
ры, прочная (кроме Daturella), прозрачная; форма ра-
ковины разнообразная, обычно в виде удлиненной
трубки, амфоры, рога; устье с зубцами или без них;
иногда расширен участок раковины ниже устья. Каме-
ра цилиндрическая, почти коническая или пирами-
дальная, ее нижний конец открытый или закрытый.
Стенка раковины очень тонкая, вероятно однослойная,
иногда с призматическим строением. На камере часто
орнамент в виде полос, ребер, пластинок с продоль-
ным или диагональным положением. Морские виды в
основном из теплых морей; только один вид солонова-
товодный, в пресной воде отсутствуют. 23 валидных
рода группируются в 3 подсемейства, которые следует
выделить в самостоятельные семейства, хотя бы по
различиям соматической цилиатуры (двух типов, час-
то со значительной редукцией кинетома).
Подсем. Salpingellinae Kofoid et Campbell,
1939
Раковина трубчатая, вытянутая, иногда роговид-
ная; устье вывернуто в виде карниза; камера узкая, ци-
линдрическая или почти коническая, всегда открытая
снизу, с орнаментом разного типа. Стенка обычно бес-
структурная, редко призматическая. Распространены
во всех морях, но более часты в тропиках.
Род Eutintinnus Kofoid et Campbell,
1939
Типовой вид Tintinnus birictus Kofoid et Camp-
bell, 1929. 30 видов.
Род Clevea Balech, 1948
Типовой вид по монотипии С. melhersi.
522
ALVEOLATA
Род Salpingella Jorgensen, 1924
Типовой вид Tintinnus acuminatus Claparede et
Lachmann, 1858. 22 вида.
Род Salpingelloides Campbell, 1942
Типовой вид Tintinnus costatus Laackmann,
1910. 3 вида.
Род Salpingacantha Kofoid et Campbell,
1929
Типовой вид Tintinnus acuminatus var. undatus
Jorgensen, 1899. 7 видов.
Род Rhabdosella Kofoid et Campbell,
1929
Типовой вид Salpingella {Rhabdosella) octogena-
ta. 2 вида.
Род Epicranella Kofoid et Campbell, 1929
Типовой вид E. prismatica. 5 видов.
Род Daturella Kofoid et Campbell, 1929
Типовой вид Tintinnus datura Brandt, 1906.
12 видов. По Аэшт, этот вид может быть неопредели-
мой тинтиннидой или частью ископаемого моллюска;
остальные виды нужно выделить в особый род.
Подсем. Tintinninae Claus, 1876
Авторство семейства нередко приписывают Ко-
фойду и Кэмпбеллу (Kofoid, Campbell, 1929), но по
правилам номенклатуры — автор Клаус. Раковина
мелкая и короткая, вершина с шейкой и воронкой, но
без сужения в основании шейки и без опорного кольца
ниже устья; устье обычно без зубцов, постерон закры-
тый, иногда с нитевидным тонким выростом; нет про-
дольного орнамента, исключая мелкие ребра у Ampho-
rides и Amphorellopsis.
Род Tintinnus Schrank, 1803
Типовой вид Trichoda inquilina Muller, 1776.
5 видов.
Род Bursaopsis Kofoid et Campbell,
1929
Типовой вид Amphorella striata Daday, 1887.
2 вида.
Род Canthariella Kofoid et Campbell, 1929
Типовой вид C. brevis. 4 вида.
Род Steenstrupiella Kofoid et Campbell,
1929
Типовой вид Tintinnus steenstrupii Claparede et
Lachmann, 1858. 6 видов.
Род Amphorides Strand, 1928
Типовой вид Tintinnus amphora Claparede et
Lachmann, 1858. Замещающее название для гомонима
Amphorella Daday, 1887. Гомонимия и новое название
не были замечены, и название Amphorella долгое время
использовалось в литературе. 7 валидных видов.
Род Odontophorella Kofoid et Campbell,
1929
Типовой вид О. serrulata по монотипии.
Род Amphorellopsis Kofoid et Campbell,
1929
Типовой вид Amphorella acuta Schmidt, 1901.
8 видов.
Род Dadayiella Kofoid et Campbell, 1929
Типовой вид Tintinnus ganymedes Entz, 1884.
9 видов.
Род Buschiella Corliss, 1960
Типовой вид Imperfecta subantarcticum Busch,
1948. Замещающее название для гомонима Imperfecta
Busch, 1948.
Род Proamphorella Kofoid et Campbell,
1939
Типовой вид Tintinnus quinquealatus Laack-
mann, 1907. Монотипический род; раковина, как у Am-
phorides, но без шейки, вероятно, это фенотип в цикле
развития Amphorides.
Подсем. Stelidiellinae Kofoid et Campbell,
1929
Раковина крупная, широкая, у Stelidiella достигает
300 X 80 мкм; выражена шейка; вершина раковины с
широкой полосой орнамента, иногда с фенетрами (вы-
резками стенки); устье без зубцов. Камера коническая
ТИП CILIOPHORA. КЛАСС ARMOPHOREA
523
или цилиндрическая, закрытая снизу, обычно с высо-
кими продольными пластинками. 3 современных рода
распространены в тропиках и субтропиках.
Род Stelidiella Kofoid et Campbell,
1939
Типовой вид Tintinnusstelidium Biedennann, 1893.
3 вида.
Род Ormosella Kofoid et Campbell, 1929
Типовой вид О. cornucopia (= Tintinnus conicus
Brandt, 1906nec T. conicus Dixon et Jolly, 1898). 7 видов.
Род Brandtiella Kofoid et Campbell, 1929
Типовой вид Tintinnuspalliatus Brandt, 1906. 1 вид.
Род Prostelidiella Kofoid et Campbell,
1939
Типовой вид Stelidiella phialia Kofoid et Camp-
bell, 1929.
В ископаемом состоянии известны виды родов Ат-
phorellina, Calpionella, Calpionellites, Calpionellopsis,
Campbelliella, Chitinoidella, Codonella, Colomiella, Cox-
liella, Coxliellina, Crassicollaria, Daturellina, Dicloeo-
pella, Favelloides, Hadziella,. Lorenziella, Parafavella,
Patelloides, Pseudarcella, Remanellina, Rhabdonelloides,
Salpingellina, Stenosemellopsis, Tintinnopsella, Tintin-
nopsis, Tytthocorys, Vautrinella, Yvoniellina:, большин-
ство названных родов не имеют представителей в
современной фауне. Ряд новых родов такого типа
добавлен в последние годы (Dobeniella, Hemistomio-
sphaera, Kejvia, Colomisphaera, Deflandronella, Delga-
della, Furssenkoiella, Metacyclina и мн. др.: см.: Aescht,
2001).
Класс Armophorea Lynn, 2002
3 группы родов (группы Metopus, Caenomorpha и Epalxella)
всегда включались в состав подкласса Spirotricha, первая как
сем. Metopidae, вторая как подотряд Armophorina в отряде Hete-
rotrichida, третья как смежный отряд Odontostomatida, выводимый
от метопид. Это было логично в период, когда классификация
велась только по морфологическим признакам. Молекулярные
данные показали отсутствие родства Metopus и гетеротрих (Lynn,
Small, 1997 и другие схемы); представители 2 других назван-
ных групп в молекулярных филограммах пока отсутствуют.
Одна из филограмм (Lynn, Struder-Kypke, 2003) показывает родст-
во Metopus и Nyctotherus, в котором не сомневались и ранее, — ана-
эробные паразиты кишечника никтотериды произошли от ана-
эробных сапропелебионтных метопид. Но точная филогения са-
мих метопид пока неясная. Метопиды отделились у начала
ствола древа Ciliophora; по Агата и Фойсснеру (Agatha, Foissner,
2000), метопиды неродственны гетеротрихам и окончательно иск-
лючаются из состава отряда, но происхождение их неизвестно.
Ближайшие группы в некоторых схемах — гипотрихи и гимно-
стоматы.
В системе Линна и Смолла (Lynn, Small, 2002) метопусы и
2 родственные группы считаются отрядами Incertae sedis в подтипе
Intramacronucleata (это почти все цилиаты, кроме Karyorelictida и
Heterotrichida); еще две группы неясного положения — отряды
Phacodiniida и Clevelandellida (никтотерусы). Есть смысл поэтому
объединить метопид и близкие им формы в новый класс Armopho-
Г011, что сделано Линном (Lynn, 2002) в интернет-версии конспекта
.! го издания книги Корлисса «The ciliated Protozoa» (здесь группа
ДН11П как класс без указания автора).
От Metopidae при утрате значительной части кинетома и раз-
ifH'iiiii циррусов независимо произошли отряды армофорид н одон-
тоитоматид, Общее, объединяющее их в один класс, — тенденция
к редукции цилишуры, наличие особой группы кинет вдоль поло-
сы мембранелл (penzonal stripe); соматическая цилиатура состоит
из дикипегид (дисом), в перистоме — парамембранеллы (по тер-
минологии Пюйторака - - Puytorac, 1994), в основании ундули-
рующей мембраны — диойной ряд кинетосом (diplostichomonade).
Класс монофилетический, со значительной внутренней морфо-
логической дивергенцией без смены экологической ниши (са-
пропель). Было бы лучше считать армофорид подклассом в клас-
се, объединяющем эти 3 группы и произошедших от метопусов
никтотерид (отряд Clevelandellida), который наконец нашел
бы место в системе. Такую общую группу можно назвать Armo-
nyctea nom. п., а подкласс Armophorea сохранил бы авторство
Линна.
Отряд Metopida Jankowski, 1980
Этот таксон был предложен как новый подотряд ге-
теротрих со следующим кратким диагнозом: «Тело
искривленное; перистом спирально извитой, узкий.
Эта группа в отличие от блефаризмин может быть род-
ственна Bryometopus» (Янковский, 1980). Отряд вклю-
чает виды с хорошо развитой цилиатурой и гибким те-
лом, без прочного панциря и без развития системы
циррусов, хотя единичные циррусы могут возникать у
нескольких видов. Раньше метопид и ценоморф объ-
единяли в одной группе Armophorida, но сейчас выяв-
лено различие морфогенеза, поэтому предлагается
считать их группами одного таксономического уров-
ня — отрядами (Foissner et al., 2002). Тело метопид
обычно вытянутое, кинеты немногочисленные, с пар-
ными кинетосомами (дисомами) по всей длине; панци-
ря нет; макронуклеус один, вакуоль сзади у постерона;
циртума нет, но есть длинная фибриллярная глотка. По-
сле конъюгации в развивающемся зачатке нового ядра
образуются крупные политенные хромосомы, как и у
никтотерид. Перистом узкий, извитой; тело и перистом
отогнуты влево в антесоме, перистом идет по диагона-
ли к правому краю тела. В перистоме — полоса мемб-
ранелл, вероятно не соответствующих мембранеллам
гетеротрих по своему строению — у гетеротрих и ги-
потрих выявляются ряды кинетосом в основании
(обычно 2 полных и 1 неполный ряд), у метопид это
одна неровная линия кинетосом (парамембранелла).
Мы убеждаемся в необходимости термина для обозна-
чения любой группы тесно сближенных, правильно
ориентированных ресничек; можно использовать за-
бытый термин Йожефа Гелей «пектине ллы» (Gelei,
1954). Этот термин пригоден для обозначения цирру-
сов, мембранелл, парамембранелл, групп синцилиев,
пеникулюсов и других структур независимо от того,
склеены ли реснички или нет, расположены ли кинето-
524
ALVEOLATA
Рис. 304, a. Metopida.
Metopus contortus (A, 3); M. sigmoides (Б); Brachonella spiralis (Г, Д, Metopus hasei (E, Ж)\ Bothrostoma undulans (К). (По: Dragesco, 1996 (A, 3); Dragesco,
Dragesco-Kerneis, 1986 (E, Ж, Г—И)-, Schrenk, 1989 (Б, В); К — ориг).
Fig. 304, a. Metopida.
сомы рядами или в беспорядке, сколько рядов лежит в
основании. Вероятно, пектинеллы метопид состоят
каждая из ряда дисом, как и в соматических рядах, но
число и положение пектинелл не соответствует таково-
му кинет — пектинелл больше, и они не являются про-
должением кинет.
Перистом имеет вид неглубокого желобка, по пра-
вому краю окаймлен ундулирующей мембраной с
дисомами в основании; над желобком нависает край
выпуклой вершины тела, по которому у всех метопид,
ценоморфид и одонтостомат проходит полоса из 3—
5 вплотную сближенных кинет; это не вершины пра-
вых кинет, они снизу обособлены от соматической ци-
лиатуры. Эта полоса была названа мною «perizonal stri-
pe», сокращенно perizona или perizonium; термин при-
меняется в литературе. Это не просто дополнение к
фильтрационному аппарату клетки; они участвуют в
морфогенезе при делении особи.
Стадии деления в природе и культурах встречаются
редко, поэтому предполагалось, что метопусы делятся
в цистах; однако деление происходит у подвижных
клеток. Деление равное, включает частичную реорга-
низацию ротового аппарата. Перед делением форма
тела меняется, исчезает скручивание антесомы, все
кинеты распрямляются; стоматогенез целиком сомати-
ческий, сводится к образованию фрагментов у некото-
рых дорсолатеральных рядов (плейротелокинез, по
терминологии Фойсснера); эти фрагменты становятся
пектинеллами задней особи, а мембрана образуется
2 крайне левыми кинетами перизоны, которые выделяют
кинетосомы зачатка. Перизона задней особи образуется
3 крайне правыми кинетами исходной полосы при их де-
лении и 2 дорсолатеральными кинетами, которые до-
бавляются к зачатку. Такой онтогенез несвойствен
другим группам цилиат. Высыхание водоема и дру-
гие неблагоприятные условия метопиды переносят в
цистах.
Виды метопид заселяют анаэробные зоны водо-
емов — сапропель, встречаются и над сапропелем в
аэрируемых участках, но лучше всего их искать в чер-
ном илу на дне небольших прудов. В основном виды
пресноводные, морские виды единичные. Характерен
ТИП CILIOPHORA. КЛАСС ARMOPHOREA
525
Рис. 304, б. Metopida.
Metopus laminarius (А, Б); M. tenuis (5); Parametopella (ранее Parametopus') circumlabens (Г, Д)', Copemetopus simplex (£); Brachonella spiralis (Ж, 3). (По: Tuf-
frau, 1968 (Ж, 3); Small, Lynn, 1985 (Г—£); А—В — ориг).
Fig. 304, 6. Metopida.
облигатный симбиоз с бактериями — в цитоплазме ме-
таногены разных видов, на покровах тела встречаются
другие симбионты. Метопид, особенно Metopus palae-
formis, можно найти в гнили городских мусорных сва-
лок, вместе с плагиопилидами Trimyema, тоже ана-
эробными формами с метаногенами в цитоплазме
(типа Methanobacterium formicicum). Как и тримиемы,
метопусы приспособились к эндобиозу в морских
ежах, в кишечнике которых накапливается плотная
масса полупереваренных фрагментов водорослей и со-
здаются анаэробные условия, но без серобактерий.
В составе отряда одно семейство.
Сем. Metopidae Kahl, 1927
(рис. 304, а, 304, б)
С диагнозом отряда. Есть сем. Metopidae у цилиат
и амфипод (с типовым родом Metopa) группы Gam-
maridea, предложенное задолго до Каля, поэтому на-
звание семейства цилиат нужно изменить на Metopu-
sidae Jankowski nom. n.
Род Metopus Claparede et Lachmann,
1858
Типовой вид M. sigmoides C. et L., 1858 по мо-
нотипии. Позже это название многократно применя-
лось, но было восстановлено приоритетное название
Trichoda S Muller., 1786 {Metopus es in Kahl, 1932) (бук-
ва S здесь — видовое название, данное Мюллером).
Крупный род; часть видов уходит в синонимику, дру-
гие описываются как новые. У Каля (Kahl, 1932) 57 ви-
дов в 6 группах (группа I, II, III..., VI) без латинских
названий, не подродов; группы различаются по форме
тела, длине и положению перистома. Тип рода Metopus
es — обитатель черного сапропеля, хорошо изучен при
импрегнации’(Villeneuve-Brachon, 1940); импрегниро-
ваны также М. pulcher, М. contortus, М. jankowskii,
М. nivaaensis и др. виды.
У типового вида тело вытянутое, величиной 120—
160 мкм, концы тела скручены в противоположные
стороны, особенно верхний; перистом идет по диаго-
нали, почти достигает правой стороны, несет около
30 пектинелл; около 24 кинет идут продольно под пе-
526
ALVEOLATA
ристомом, образуют еекантный шов справа; над пери-
стомом 5 кинет перизоны, выше — вершины дорсаль-
ных кинет; кинеты перизоны (вероятно, можно ис-
пользовать новый термин «перикинеты») не являются
продолжением соматических рядов, обособлены; сза-
ди крупная вакуоль, у апекса скопление гликогена
(Jankowski, 1964а, 1964в).
Род Metopus разделен на 2 подрода, типовой и
Urostomides Jankowski, 1964 (типовой вид М. striatus),
с укорочением тела ниже перистома. В обзоре рода
(Esteban et al., 1995) различаются 5 групп видов без ла-
тинских названий для групп — не подроды, как и у
Каля. Большое число видов эти авторы сводят в сино-
нимику, но с рядом инвалидаций другие авторы не со-
гласны. Часть видов перенесена в состав Brachonella.
Состав рода, по Эстебану, следующий.
Группа!. Тело узкое, вытянутое, перистом узкий,
диагональный, относительно небольшой. Валидные
виды: М. palaeformis Kahl, 1927; М. hasei Sondheim,
1929; М. setosus Kahl, 1927; M. laminarius Kahl, 1927;
M. micrans Jank., 1964. Синонимы: M. tenuis, M. hyali-
nus, M. rostratus, M. latusculisetus, M. fusus, M. setifer,
M. trichocystiferus.
Группа II. Антерон расширен, участок тела ниже
перистома укорочен, почти треугольный. Эта группа
соответствует подроду Urostomides Jank., 1964, с типо-
вым видом М. striatus McMurrich, 1884; другой валид-
ный вид — М. turbo Dragesco et D.-Kemeis, 1986; сино-
нимы: M. acuminatus, М. acutus, М. bacillatus, М. dena-
rius, М. dentatus, М. fastigatus, М. gibbus, М. minimus,
М. pulcher, М. pullus, М. recurvatus, М. recurvatus var.
pusillus, M. violaceus.
Группа III. Сходны с типовым видом, тело умерен-
но вытянутое, расширено медиально, сужается к по-
стерону сильнее, чем в группе I. В сущности никакой
особой разницы с группой I нет. Валидные виды:
М. acidiferus Kahl, 1935; М. contortus (Quennerstedt,
1867); М. es (Muller, 1786); M. contractus Penard, 1922;
M. nivaaensis Esteban, Fenchel et Finlay, 1995; M. halo-
philus Kahl, 1932; M. major Kahl, 1932. Синонимы:
M. entorhipidioides, M. mathiasi, M. bivillus, M. saprope-
licus, M. daphnides, M. caucasicus, M. ridiculus. В этой
группе ряд морских видов (М. contortus, М. halophilus,
М. nivaaensis').
Группа IV. Тело широкое, эллипсоидное, постерон
расширен и плавно закруглен. Валидные виды: М. Ъаг-
batus Kahl, 1927; М. fuscus Kahl, 1927; М. ovalis Kahl,
1927; M. tortus Kahl, 1927; синонимы: M. fuscoides,
M. jankowskii, M. ventrosus.
Группа V. Тело длинное, задний конец оттянут и
обособлен, имеет вид хвоста. Валидные виды: М. spi-
nosus Kahl, 1927; М. propagatus Kahl, 1927; M. vestitus
Kahl, 1935: M. verrucosus Da Cunha, 1915. Синонимы:
M. curvatus, M. convexus, M. attenuatus, M. strelkowi,
M. ovatus, M. caudatus.
Если будут найдены более четкие отличия по кине-
тому или ротовой цилиатуре, для подродов можно ис-
пользовать следующие названия.
Род Metopus s. str.
Типовой вид М. es (Muller, 1786) (= М. sigmoi-
des, группа III).
Род Tesnospira Jankowski, 1964
Типовой вид Т. alba. Сейчас считается синони-
мом вида I группы Metopus palaeformis Kahl, 1927; для
вида характерно уменьшение размеров перистома и
числа пектинелл; антесома небольшая, не крышевид-
ная, как часто у метопид.
Род Urostomides Jankowski,
1964
Типовой вид Metopus striatus McMurrich, 1884.
С непропорциональным уменьшением постесомы (ни-
же перистома). Название пригодно для видов группы II.
Род Spirorhynchus Da Cunha,
1915
Типовой вид S. verrucosus.
Название пригодно для группы V. Это морской вид
с вытянутым веретеновидным телом, суженным и от-
тянутым сзади; апекс хоботковидный. Все тело, кроме
апекса, покрыто бактериями в разрозненных группах,
вначале принятых за бугорки пелликулы. По Вилле -
нев-Брашон (Villeneuve-Brachon, 1940), у близкого
вида М. vestitus кинеты закручены спиралью, широкие
межкинеты покрыты плотным слоем бактерий. По Эс-
тебану, спирализации рядов нет, цилиатура обычного
типа. BvtjiAmphileptus lacazei Gourret et Roeser, 1886 из
моря у Марселя — это метопида, а не амфилептида;
вид переносится в состав Metopus (М. lacazei comb, n.),
и вид Spirorhynchus verrucosus сводится в синонимику;
поэтому правильное название типового вида — A laca-
zei (G. et R., 1886) Jank. comb. n.
Род Metopoides Gassovskij, 1941
Типовой вид M. citrinus. Это название отсутст-
вует в каталоге родов цилиат Аэшт. Первоисточник
(Труды Пединститута в Мелитополе) найти не уда-
лось, в частности в Мелитополе; вероятно, том не со-
хранился в военные годы. В любом случае название
невалидно как гомоним (Metopoides Della Valle, 1893,
Amphipoda). Вид найден Тассовским в пересоленных
водоемах Крыма, морфология неизвестна.
Род Caenomorphina Blochmann,
1898
Типовой вид С. heinrici. Синоним рода Metopus.
Вид имеет короткое и широкое тело, соответствует
группе III (как у М. contractus). Название рода пригод-
но для обозначения подрода.
ТИП CILIOPHORA. КЛАСС ARMOPHOREA
527
Род Dicella Werneck in Ehrenberg, 1841
Плохо описанный вид метопуса, вид неопредели-
мый и поэтому родовое название непригодное для обо-
значения подрода.
Род Electothigma Jankowski, 1967
Типовой вид Metopides acuminatus (Stokes,
1886). Род не установлен должным образом, диагноз
не дан; название упомянуто в цитологической статье и
поэтому не было замечено. При изучении М. acuminatus
была выявлена редукция цилиатуры у апекса при со-
хранении инфракинет (рядов безресничных кинетосом);
сохранен лишь ряд ресничек, соответствующий ряду
циррусов у Caenomorpha. Изучение не было продол-
жено, и ситуация с этим видом осталась неясной.
Род Metopides Quennerstedt, 1867
Типовой вид М. contortus по монотипии. На-
звание неприменимо как гомоним. Вид морской,
внешне типичный Metopus, но с более широким телом.
Часто отмечаемый, хорошо изученный вид рода Me-
topus, ничем не отличающийся от типового вида на
уровне подрода.
Род Eometopus Small et Lynn, 1985
Типовой вид Е. simplex. Кратко описанный вид,
неясно, морской или пресноводный; тело массивное,
сужено сзади; кинеты немногочисленные, с дисомами;
справа вентрально длинная унисеканта; нет искривле-
ния и вздутия антерона; перистом обширный, с круп-
ным ацилоном, небольшим числом пектинелл, 2 мемб-
ранами; 3 перикинеты не линейные, разбиты на сег-
менты. Название «simplex» не подходит для столь
аберрантной формы.
Род Bothrostoma Stokes, 1887
Типовой вид В. undulans. Ранее считался сино-
нимом Metopus. «Трудный» род, вызвавший противо-
речивое отношение; тип рода включали в Pleuronema,
Blepharisma, переносили в Metopus-, реже род принима-
ли как валидный. Вид найден в пруду в США; тело
плоское, широкое, заостряется к апексу; перистом ши-
роко открытый, с крупными пектинеллами, широким
ацилоном, перикинеты типичные для метопид. Веро-
ятно, есть несколько видов этого рода — В. mirabilis
(Kahl, 1927), В. extenta (Kahl, 1927), В. nasuta (Da Cun-
ha, 1915). Импрегнация пока не проводилась.
Род Parametopidium Aescht, 2001
Типовой вид Metopus circumlabens Biggar et
Wenrich, 1932 по монотипии. Замещающее название
для Parametopus Groliere, Puytorac et Grain, 1980 (гомо-
ним). Тело очень широкое, закруглено у апекса, сужа-
ется или заостряется книзу; кинет немного, с
нарушенной топографией и швом ниже рта; у верши-
ны тело отогнуто далеко влево, образуя «клюв»; при
виде с вента нет крышевидного переднего отдела, на-
висающего над перистомом у Metopus. Перистом
очень широкий, с непропорционально большим ацило-
ном и тонкой полосой пектинелл, уходящей в глубо-
кую глотку. Перикинеты вида по-разному изображены
у разных авторов.
Типовой вид — симбионт в кишечнике морских
ежей Карибского бассейна — в Lytechinus variegatus,
Echinometra lucunter, Tripneustes esculentus, Diadema
antillarum, D. savignyi, E. matthaei, E. m. oblonga,
E. aciculatus, E. calamaris, Heterocentrotus trigonius,
Mespilia globulus, Tripneustes gratilla, T. ventricosus,
D. setosa, E. subangularis, E. vanbrunti, D. mexicanum,
неспецифичен для альготрофных хозяев. По Бергеру, в
разных хозяевах ксенодемы вида отличаются биомет-
рически, поэтому возможно, что это сборный вид.
Другие виды — Parametopidium rotundus comb. n.
(= Metopus rotundus Lucas, 1934), P. brevicristatus
comb. n. (= M. brevicristatus Biggar et Wenrich, 1932) и
P. histophagus comb. n. (= M. histophagus Biggar et
Wenrich, 1932).
Общее распространение — в тепловодных ежах
США, Мексики, Южной Америки и Индо-Паци-
фики; никогда не были отмечены в наших северных
и дальневосточных ежах. Наименее видоизменен по
сравнению со свободноживущими видами мелкий
симбионтный вид М. brevicristatus, остальные виды
отличаются сильнее от типичных метопусов. В мор-
ских ежах, таким образом, обитают виды всех 3 наи-
более характерных представителей анаэробного сап-
ропеля — Trimyema, Plagiopyla и метопусы; ассо-
циация древняя, образовались новые роды Lechriopyla
и Parametopidium.
Род Brachonella Jankowski,
1964
Типовой вид Metopus contortus Levander, 1894.
По Аэшт, в другой статье в тот же год был указан как
тип другой вид рода — Metopus spiralis Smith, 1897,
«ап invalid action». Вероятно, не читался текст статьи
Янковского (Jankowski, 1964а, 1964в) с подробной ар-
гументацией и полным текстом консультации Корлис-
са — первый вид предложен раньше, но это гомоним,
поэтому валидно второе (синонимичное) название.
Итак, тип рода — В. spiralis. Частый эрроним в литера-
туре — Brachionella. Вид массивный, с непропорцио-
нально удлиненной полосой пектинелл, огибающей по
спирали все тело в глубоком желобке; на всем протя-
жении над ней нависает карниз с перикинетами. Сома-
кинеты продольные ниже перистома, прерваны рото-
вым желобком на дорсуме, идут диагонально над пе-
ристомом вентрально. Глотка направлена снизу вверх
(у метопусов сверху вниз).
Удлинение и спирализация перистома характерны
для ряда видов метопид, но внешний облик видов и по-
ложение спирали отличаются, род неоднотипный, был
разделен при первоописании на 2 подрода.
528
ALVEOLATA
1. Brachonella Junk., 1964, s. str. Типовой вид В. spi-
ralis (Smith, 1897). Начало и конец спирали на разной
высоте, рот у постерона, нижняя часть тела вытянутая.
Включает виды В. darwini (Kahl, 1927); В. caduca
(Kahl, 1927); В. inversa Jank., 1964; В. elongata Jank.,
1964; В. mitriformis Alekperov, 1994.
2. Atopospira Jank., 1964. Нижняя часть тела укоро-
чена (как у метопусов подрода Vrostomides), ротовая
спираль почти поперечная, с небольшой разницей в
положении начала и конца спирали. Включает виды
В. galeata (Kahl, 1927), типовой вид В. campanula
(Kahl, 1932); В. cydonia (Kahl, 1927); B.fastigata (Kahl,
1927); В. pyriforme (Levander, 1894). Вид В. inversa
был переописан при импрегнации протарголом; кар-
низ с перикинетами продолжается дальше перисто-
мального желобка, уходя на дорсум, но сам перистом
короче, поэтому вид был перенесен в состав Metopus.
Этот вид все же не типичен для Metopus. В состав
Brachonella ранее включались также виды М. pyrifor-
mis Levander, 1894; М. intercedens Kahl, 1927 и AL lema-
ni Dragesco, 1960.
Род Tropidoatractus Levander,
1894
Типовой вид T. acuminatus = Metopus cuspidatus
Penard, 1922. Тело мелкое (60—90 мкм), светлое, в
прочном панцире, со спиральными складками и вы-
сокими ребрами кортекса; о принадлежности к мето-
пидам говорят наличие полосы перикинет и крупная
вакуоль у постерона, все остальное сильно видоизме-
нено. Тело веретеновидное, заостряется кзади, расши-
рено у апекса; полоса пектинелл короткая, погружена
в перистомальную полость, отделена высокой безрес-
ничной стенкой от перикинет. Полоса перикинет со-
стоит из многочислнных поперечных (вторичных) ря-
дов кинетосом. Реснички в сомакинетах, идущих
вдоль ребер панциря, парные по всему телу, пары ки-
нетосом разрознены одна от другой. Бентос пресных
вод, в сапропеле.
Род Palmarella Jankowski,
1975
Замещающее название для Palmarium Gajewskaja,
1925. Типовой видР. salinum Gaj., 1925. Это назва-
ние непригодно как гомоним. В обзоре сапропелефау-
ны (Jankowski, 1964а, 1964в) подробно описан один из
видов, Р. latum (= Metopus latus Kahl, 1927); род вклю-
чает также Р. mucicola (Kahl, 1927) и Р. angusta (Kahl,
1927). Тип рода — из соленого приморского озера у
Севастополя; похожие виды были приписаны в состав
Palmarium и здесь переводятся в Palmarella — Р. sali-
na (Gaj.), Р. lata (Kahl), Р. mucicola (Kahl), P. angusta
(Kahl) comb. nn.
Типовой вид не изучен должным образом; у других
видов рода тело плоское, широкое и короткое, без пан-
циря; перистом широкий спереди, треугольный; поло-
са пектинелл прямая, не закручена спиралью; перики-
неты идут по краю апекса, не видно сомакинет выше
них — антесома не вздутая; в перистоме обширная
безресничная поверхность между пектинеллами и
апексом. Мелкие малоподвижные бентосные формы
величиной 40—65 мкм.
Отряд Armophorida Jankowski,
1964
Предложен как подотряд в составе отряда гетеро-
трих, когда была принята система Штейна—Каля. Так-
сон был принят в литературе, но не только для цено-
морф, как предложено вначале, а также и для метопу-
сов. Фойсснер считает, что в связи с разным типом
морфогенеза эти группы должны иметь одинаковый
ранг — 2 отряда (Foissner et al., 2002). Еще раньше я
обособил метопид от ценоморф на уровне подотряда
(Янковский, 1980); сейчас обе эти группы исключены
из состава гетеротрих. Metopida Jank., 1980 включают
формы с полной соматической цилиатурой, Armopho-
rida Jank., 1964 — виды с редукцией значительной час-
ти кинетома и с образованием системы циррусов. От-
дельные соматические синцилии или циррусы иногда
образуются и у метопид, но у них кинетом не реду-
цирован. Кортекс прочный, панциревидный, особен-
но у видов Caenomorpha. В основном пресновод-
ные формы.
Сем. Ludioidae Jankowski fam. n.
(рис. 305, a)
Мелкие формы без кинет, имеется несколько оди-
ночных циррусов, нет рядов циррусов на панцире.
Род Ludio Penard, 1922
Типовой вид L. parvulus из пресноводного бен-
тоса. Очень мелкие формы (30—35 мкм); тело поч-
ти сферическое или слегка вытянутое, заострено сни-
зу, с крупной вакуолью, округлым ядром; перистом
ниже экватора, в виде диагонального желобка; над
ним спиральная полоса перикинет. Задний конец тела
с коротким или длинным шипом; на теле 2—3 очень
длинных цирруса. Этот род мог произойти от Cirran-
ter при уменьшении размеров и упрощении кине-
тома.
Сем. Caenomorphidae Poche, 1913
(рис. 305, а)
Это замещающее название для Gyrocorythidae (в
принятом ранее написании — Gyrocorina или Gyrocori-
da Stein, 1867), основанном на роде Gyrocorys Stein,
1860; название рода невалидно как синоним, поэтому,
хотя в таких случаях допускается сохранение названия
семейства, это нежелательно и цилиатологами не при-
нято. Семейство включает несколько родов с редук-
цией кинет; циррусы многочисленные, собраны в 1—
2 ряда на апексе.
ТИП CILIOPHORA. КЛАСС ARMOPHOREA
529
Рис. 305, a. Armophorida. (Ориг).
Cirranter mobilis (А, Б, 3, И)’, Caenomorpha sapropelica (В, Г); С. uniserialis (Ду, Ludio parvulus (Е, Ж).
Fig. 305, a. Armophorida.
Род Cirranter Jankowski,
1964
Замещающее название для Trochella Penard, 1922
(гомоним); типовой вид Trochella mobilis Penard, 1922.
Размеры всего 45—55 мкм; тело в верхней части в
виде полусферы, в нижней сужено и укорочено; ядро
округлое, крупная вакуоль у постерона. Перистом в
полукольцевом желобке поперек тела, над ним нависа-
ет карниз с перикинетами. Соматический кинетом ре-
дуцирован — есть пучок каудальных ресничек и спе-
реди полоска из 6—8 циррусов в мелком желобке (Jan-
kowski, 1964а, 1964в). Вид изучен при импрегнации;
описания всех авторов расходятся. По новым данным,
спереди имеется полоса ресничек, а не циррусов; нет
никакой каудальной цилиатуры; найдена мембрана у
рта; перизона состоит из продольных кинет, а не косых
фрагментов. Последнее несущественно — в перизоне
кинетосомы продольных кинет координированы в рас-
положении и принимают вид косых фрагментов (клас-
сические паратены). Каудальная цилиатура изображе-
на рядом авторов; циррусы могут быть синцилиями
(2 сближенные или скленные реснички), разошедши-
мися при фиксации. Род четкий, но не признавался Ка-
лем (Kahl, 1932), включившим вид (без соматических
кинет!) в состав Metopus в качестве подрода. Проме-
жуточным звеном между Metopus и Cirranter может
быть вид М. campanula Kahl, 1932 (ныне в составе
Brachonella) с такой же формой тела.
Род Caenomorpha Perty,
1852
Типовой вид С. medusula по монотипии. Из
пресноводного бентоса. Первоописание очень плохое,
но авторы условились обозначать описываемый вид
этим названием. Вполне возможно, что Перти видел
С. uniserialis. По новым данным, С. medusula — вид
длиной до 90 мкм, с прочным панцирем, шлемовид-
ным телом, без кинет; на левой стороне тела располо-
жены 2 продольных ряда циррусов, по 8—10 длинных
гибких цирруса в каждом; сзади длинный шип,'у осно-
вания которого мелкие ряды ресничек. Ядро не цель-
34 Зак. №4163
530
ALVEOLATA
Рис. 305, 6. Odontostomatida.
Atopodinium fibulatum (А, Б); Saprodinium dentatum (B—Д); Saprodinium mimeticum (£); Epalxella (ранее Epalxis) antiquorum (Ж). SK— соматические ряды.
(По: Schrenk, Bardele, 1991 (Г, Д); А—В, E, Ж— ориг.) .
Fig. 305, б. Odontostomatida.
SK — somatic kineties.
ное, в виде 3—4 овальных элементов, микронуклеус
один; вакуоль у постерона. Перикинеты и полоса пек-
тинелл завиты вокруг тела спиралью, как у метопид
Brachonellcr, рот смещен к шипу, глотка направлена
вверх. Пектинеллы лежат в очень глубоком желобке,
прикрытом спиральным карнизом. Показаны по 2 ряда
кинетосом в «мембранеллах» и соединение кинетосом
перикинет в паратены — косые ряды по 5 кинетосом в
каждом — в соответствии с числом перикинет (5). Схе-
ма дана без серебрения, при контрастном боковом
освещении особей, фиксированных сулемой. Позже
применена импрегнация аммиачно-карбонатным се-
ребром; как и в случае с Cirranter, циррусы представ-
ляют собой парные реснички, вероятно слившиеся; в
пектинеллах по 3 ряда вплотную сближенных кинето-
сом. Аргиром — в виде мелкоячеистой сетки по всему
телу.
Виды рода неоднотипные, различаются по чис-
лу циррусов (синцилий) и по ядрам; поэтому можно
различить 2 рода вместо одного по кинетому и в преде-
лах рода выделить подроды по ядрам. Типичные Сае-
nomorpha, кроме типового вида, С. levanderi К., 1927;
С. sapropelica К., 1927 — виды со сложной системой
складок панциря; виды с более простым панцирем —
С. lauterborni К., 1927; С. corlissi J., 1964; признак
рода — наличие 2 кинет на левой стороне тела.
Род Sulfonecta Jankowski, 1978
Типовой вид Caenomorpha wniseria/is Levander,
1894 (в каталоге Аэшт по ошибке «Levine, 1894»). Раз-
меры особей 65—75 мкм, ядро округлое. Антесома в
виде каски, нижняя часть тела оттянута в виде шипо-
носного придатка, дополнительный шип у рта; на при-
датке тела — несколько рядов мелких ресничек. Ряд
тонких гибких циррусов виден субапикально на левой
стороне тела; вероятно, в диагнозе армофорид пра-
вильнее говорить не о циррусах (из большого числа
ресничек, с широкими пластинками в основании у ги-
ТИП CILIOPHORA. КЛАСС ARMOPHOREA
531
потрих и у Condylostoma), а о синцилиях — паре сбли-
женных или склеенных ресничек. Вид повторно изу-
чил Сола (Sola et al., 1990) в Испании; пектинеллы со-
стоят из 3 рядов ресничек, мембрана из 2 рядов,
паратены перикинет из 10—15 парных кинетосом, все-
го их 100—120 в полосе; сомакинета состоит из
90—100 кинетосом в зигзаговидной линии (не сказано,
какого типа цилиатура — реснички, синцилии или
циррусы); у шипа 3—4 короткие кинеты.
Род Calcaria Gruber, 1879
Типовой вид С. contorta по монотипии. Назва-
ние рода неприемлемо как гомоним, не может быть ис-
пользовано для разделения рода Caenomorpha на под-
роды или роды. Род никем не был принят, вид считает-
ся синонимом С. medusula.
Род Gyrocorys Stein, 1860
Типовой вид G. oxyura Stein, 1860. Уже ранни-
ми авторами вид был сведен в синонимы вида Caeno-
morpha medusula. Это форма с 2 рядами циррусов ле-
вее перистома; название не может быть использовано
для дробления рода Caenomorpha.
Вероятными синонимами С. medusula являются
также Trichodina tentaculata Ehr., 1831; Strombidium
polymorphum Eberhard, 1862 partim и Caenomorpha con-
voluta Tatem, 1868.
Отряд Odontostomatida Sawaya,
1940
Как гомоним, прежнее название отряда Ctenosto-
mata Kahl, 1932 заменено новым; есть название отряда
Ctenostomata Busk, 1852 в классе мшанок (Bryozoa).
Регрессирующие формы, потомки метопид, обитатели
сапропеля пресных вод, редко в море. Тело мелкое,
сплющено латерально; число сомакинет уменьшено до
8; реснички сохранены лишь у переднего и заднего
концов тела и исчезли в экваториальной зоне; во мно-
гих отделах сохранена инфрацилиатура без ресничек.
У наиболее упрощенных форм реснички сливаются в
синцилии (Mylestoma). Зона пектинелл уменьшена (до
8—10); сохранены перикинеты в укороченной полосе.
Кортекс прочный, панциревидный, рельефный, с реб-
рами, желобками, складками, шипами. Ядро одно или
в нескольких овальных нодулах. Переходные формы
между Metopidae и этой группой неизвестны, у мето-
пид нет тенденции к утрате цилиатуры в отдельных
участках кинет. План строения все же однотипен, и Ре-
lodinium может быть моделью переходной формы.
Сем. Epalxellidae Corliss, 1960
(рис. 305, б, 306, а)
Правые и левые инфракинеты четкие, реснички
сохранены на больших участках рядов; полоса пери-
кинет поперечная; снизу тело с обширной выемкой,
панцирь по краям выемки с зубцами и шипами.
Эти роды наиболее близки к метопидам, особенно
Pelodinium.
Род Pelodinium Lauterborn, 1908
Типовой вид Р. reniforme. Вероятные синони-
мы — Р. rotundum Kahl, 1926 и Epalxis penardi Wetzel,
1928. Как и у метопид, имеется синистральный изгиб
верхней половины тела, судя по топографии ребер и
кинет. На правой стороне тела около 6 невысоких ре-
бер, круто сворачивающих влево у апекса; на значи-
тельной части 4 из них несут реснички. Перикинет 5,
стандартное число для метопид; кинетосомы их не со-
браны в косые короткие ряды (паратены), четко види-
мые у ряда метопид и у ценоморф; 2 ядра; обилие гра-
нул гликогена в антесоме, как у метопусов; вакуоль
ниже экватора. Шипов немного — один над перисто-
мом, нижняя часть панциря незначительно расширена,
с зубцами и небольшими шипами. По Шренку
(Schrenk, 1989), у Pelodinium по 4 ряда инфракинет на
каждой стороне тела; на правой стороне реснички есть
снизу до экватора, на левой в 2 укороченных рядах у
перистома и в 2 длинных дуговидных рядах до апекса.
Между перикинетами и перистомом 2 коротких дуго-
видных ресничных ряда.
Сравнение кинетома всех родов показывает един-
ство плана организации, с последовательной редук-
цией кинет и ресничек в них. Примитивный род Pelodi-
nium имеет ряды R1—R4 и L1—L4, всего 8 кинет с
наиболее полной цилиатурой среди одонтостомат.
У всех родов 5 перикинет и 2 надротовых ряда. Ребра
и желобки, сохранившиеся на месте утраченных ки-
нет или ресничных участков у видов отряда, помо-
гают гомологизировать оставшиеся сегменты кинет.
Аргиром в виде сплошной сети из мельчайших яче-
ек выявлен у Epalxis penardi Wetzel (вероятно, это
Р. reniforme).
Род Epalxella Corliss,
1960
Типовой вид Epalxis mirabilis Roux, 1899. Заме-
щающее название для гомонима Epalxis Roux, 1899.
Тело снизу более расширено, чем у Pelodinium, обычно
несет здесь узкие шипы; кинетом более редуциро-
ван — реснички сохранены лишь в нижних отделах
краевых рядов Rl, R4, в нижних отделах L3, L4 и в вер-
хних сегментах одной или двух левых кинет. Продоль-
ные ребра на обеих сторонах тела очень четкие. Ядро
в 1—4 частях. Характерна асимметрия панциря — пра-
вый край выемки ровный или слегка волнистый, а с
левой стороны с глубокими вырезками, зубцами и
шипами.
Е. antiquorum (Penard, 1922). Крупный вид с очень
рельефным панцирем, местами с характерными для
вида веретеновидными ямками (фенетрами) в панци-
ре; цилиатура относительно хорошо развита, почти все
нижние сегменты достигают экватора тела; сверху
справа реснички в 2 длинных сегментах, шипы у по-
стерона и на апексе; 2—4 ядра. Отмечены палочковид-
532
ALVEOLATA
Рис. 306, a. Odontostomatida.
Mylestoma anatinum (A, />); Disetmiorphella (Discomorpha) pevlinata (В E). Кинетом 3 родов одонтостомат (Ж—If). Пары видов на рис. Ж—И— Mylestoma
pusilium, М. anatinum (Ж); Epalxella striata, antit/iiatum (Ч)', Saprodinium piiltinitim, S. dentatum (li). (IIo: Schrenk, 1989 (А, E, Ж—/7); Foissner et al., 1992 (B,
lyjl.K opiii-,).
l'lK. 306, «. Odontostoinntidn.
Kinctonic of odonloslonmlid gcticni. Species pairs fig. Ж И.
ные эндобактериии, вероятно метаногены, как и у мс-
топид.
Е. bidens (Kahl, 1932). Крупный вид, до 70 мкм,
панцирь менее рельефный, без ямок, ребра левой с то-
роны без нижних зубцов, правые с зубцами; кинетом
хорошо развит, как у предыдущего вида; 2 ядра.
Е. elliptica (Penard, 1922). Мелкий вид с небольшой
выемкой снизу, без шипов, с невысокими ребрами; то-
пография кинетома неизвестна, Пенард показывает
лишь полный краевой ряд ресничек L4. Это может
быть вид нового рода, но в литературе каждый автор
по-разному описывает этот вид.
Е. exigua (Penard, 1922). Очень мелкий вид со
значительной редукцией кинетома, сегменты правых
и левых рядов не достигают экватора, слева сверху
только 1 ряд ресничек. Синоним Е. longiciliata (Kahl,
1926).
Е. mirabilis (Roux, 1899). 2 ресничных сегмента
справа, 4 + 1 слева.
Е. striata (Kahl, 1926). 2 ресничных сегмента справа
по Калю (4, по Янковскому), 4 + 1 слева; нет зубцов
панциря.
Е. triangula (Kahl, 1932). Вид без шипов, 2 сегмента
справа, 4 l 1 слева.
Род Saprodinium Lauterborn,
1908
Типовой вид Discomorpha dentata Lauterborn,
1901 (У dentatiim). Тело очень широкое при виде сбо-
ку, с четкими ребрами; часть их идет от перикинет до
постерона, расходясь в стороны. Постерон резко рас-
ширен, вогнутый, полос ть окаймлена шипами и зубца-
ми, обычно с обеих сторон. Кинетом более редуциро-
ван, чем у Epalxella, сохранены лишь очень мелкие
сегменты с ресничками справа и слева снизу и один
ряд разной длины сверху слева. Эти сегменты подхо-
дят к зубцам или расположены па их расширенном
основании. Аргиром стандартного типа, мелкояче-
истая сеть равномерно покрывает все тело. Переописа-
ние см.: Schrenk, 1989.
Вид под этим названием описан Дражеско (Drages-
co, 1960) из нетипичного биотопа — песок пляжа
ТИП CILIOPHORA. КЛАСС ARMOPHOREA
533
Рис. 306, б. Clevelandellida.
Nyclotheroides cordiformis (A—Г, Ж); Nyctotheroides hylaeifl, Я); Ichthyonyctus schulmani (3, И). (По: ХаКи, 1971 (3,33); Albaret, 1975 (Д—Ж); Puytorac, Oktem,
1967 (A, £); В, Г— ориг.).
Fig. 306, б. Clevelandellida.
оз. Леман (Женевское оз.), эта раса резко отличается
от типовой по форме тела и кинетому. В псаммоне от-
крыто большое число «эндемиков» этой ниши, и, воз-
можно, это один из них; обозначим его как S. lemani
sp. n. — тело растянуто в стороны, ядро в 3 нодулах, в
дополнение к краевой линии ресничек L4 есть дуга L3,
которой нет у типичных S. dentatum.
S. halophilum Kahl, 1932. Из морского бентоса в
зоне сапропеля и серобактерий; 2 ядра; кинетом стан-
дартный.
S. integrum Kahl, 1928. 1—2 ядра, длинные крюко-
видные шипы сзади, кинетом стандартный; форма
тела, как у Epalxella.
S. mimeticum (Penard, 1922) (= S. tortum Kahl, 1926).
С массивными шипами и относительно длинными сег-
ментами кинет. Описано две формы — f. obliquum,
f. simplex.
S. putrinium Lackey, 1925. Тело сверху сужено,
как у Epalxella. Переописание у Шренка (Schrenk,
1989).
S. spinigerum Kahl, 1932. С очень длинными шипа-
ми сзади и добавочным шипом над перистомом.
S. triangulum Kahl, 1932. Как Epalxella, но с шипами
сзади. Этот или подобные виды могут быть переход-
ными формами между Epalxella и видами типа S. putri-
nium, S. dentatum, S. halophilum.
Сем. Mylestomatidae Kahl in Doflein
und Reichenow, 1929
Мелкие виды с далеко зашедшей редукцией цилиа-
туры; нет ресничных сегментов на правой стороне
тела, на левой стороне сохранены 4 мелких сегмента у
постерона. Длина перизоны уменьшена, она располо-
жена косо над перистомом.
Род Atopodinium Kahl,
1932
Типовой вид A. fibulatum. Род дважды установ-
лен Калем как новый в 1932 г. Наименее изученный
род, пока найдено лишь несколько особей. Дисковид-
534
ALVEOLATA
ные особи со вздутой правой стороной, длинными ши-
пами сзади, псризопа очень короткая, от сомакинет
остался лишь мелкий фрагмент снизу справа; движе-
ние должны обеспечивать перикинеты. Ядро одно, пе-
ристом небольшой.
Род Mylestoma Kahl, 1928
Типовой вид Aspidisca bipartita Gourret et Roe-
ser, 1886 (M. bipartitum).
Частый эрроним в литературе — Myelostoma. Еди-
ничные сохранившиеся реснички утраченных сома-
кинет обычно слиты в циррусовидные синцилии. Род
сборный, включает виды с самым разным типом ор-
ганизации, служит «временным хранением» для раз-
ных мелких видов, из которых пока лишь 2 изуче-
ны при импрегнации — М. pusilium и М. anatinum
(Schrenk, 1989). Иногда выражен апикальный шипик;
снизу тело незначительно расширено, с зубцами, без
шипов.
М. anatinum (Penard, 1922). Реснички в рядах L1,
L2, синцилии в рядах L3, L4. Реснички малоза-
метные, обычно отмечают 2—3 длинных каудальных
цирруса.
М. bipartitum (Gourret et Roeser, 1886). Морской вид
с очень длинными синцилиями сзади.
М. discoideum Penard, 1922. Вид с килем по краю
округлого тела; постерон не расширен, смещен на вен-
тральное ребро; вероятно, имеются 2 тонкие синци-
лии, которых нет на рисунке при первоописании. Ядро
цельное. Нет ни следа панциря. Перизона относитель-
но длинная.
М. flagellatum Penard, 1922. Постерон расширен,
окаймлен 3 длинными ресничками; вдоль дорсального
ребра ряд ресничек, которого нет у типичных видов
рода.
М. pusilium Kahl, 1932. Постерон не расширен, зуб-
цов панциря сзади нет (но есть у рта), под перистомом
ряд ресничек, и отдельно группа из 2—3 особо длин-
ных ресничек.
М. spinigerum Kahl, 1932. Сзади шип и синцилии.
М. uncinatus (Penard, 1922 in Epalxis). Постерон
расширен, с 2 синцилиями.
Сем. Discomorphellidae Corliss, 1960
(= Discomorphidae Poche, 1913).
Дисковидные формы без вырезки тела снизу; поло-
са перикинет разбита на 2 разрозненных сегмента; со-
матическая цилиатура почти полностью утрачена, со-
хранены рудименты у постерона.
Род Discomorphella Corliss, 1960
(рис. 306, а)
Типовой вид Discomorpha pectinata Levander,
1893; заменяющее название для гомонима Discomor-
pha Levander, 1893. Тело дисковидное, с широким
светлым килем, спереди длинный острый шип, такие
же шипы сбоку и снизу; постерон без выемки, обыч-
ной у одонтостомат. Аллометрически удлинен дорса-
льный край плоского тела, и отдел, соответствующий
постерону, сместился вверх к перистому. Ядро одно,
не фрагментировано, вакуоль у ядра. Перикинеты под-
няты на высоком валике и состоят из поперечных
групп — паратен, края валика зубчатые, волнистые.
Перистом мелкий, с несколькими пектинеллами, в
стандартном положении. Кроме перикинет и 2 дуго-
видных кинет между перизоной и ртом (имеющихся
без редукции у всех одонтостомат) сохранен лишь ряд
ресничек по краю тела у перистома и синцилии на дру-
гой стороне постерона.
Вид очень хорошо изучен, применены 3 способа
импрегнации. При импрегнации сухих мазков выявле-
на схема инфракинетома и аргирома; это подтверж-
дено методом Шаттона и протарголом. Выявлены без-
ресничные ряды кинетосом на обеих сторонах тела,
топография которых слева нарушена разрывом и сме-
щением перизоны. Топография сохранившихся ресни-
чек и синцилий совпадает при изучении вида in fixo и
импрегнации; 2 ресничные дуги под перикинетами —
не мембрана перистома, а фрагменты кинет, не связан-
ные с желобками и ребрами кортекса, в отличие от пе-
рикинет. Топография безресничных кинетосом четко
видна в сканирующем микроскопе.
Второй вид — Discomorphella lauterborni (Wetzel,
1928) (= Discomorpha pectinata var. lauterborni Wetzel,
1928 in Kahl, 1932). Часть авторов считает вид ва-
лидным, не подвидом и не синонимом типового
вида; если есть различия в положении шипов, они
требуют подтверждения. Но есть мнение, что это
все же синоним.
Отряд Clevelandellida De Puytorac
et Grain, 1976
Соответствует надсем. Clevelandelloidea Albaret,
1975. Сплющенные несимметричные формы с тигмо-
тактичсской правой стороной тела, часто образующей
присоску. Кинеты полимеризованы, всегда имеется
сложная система швов — безресничных полосок
(можно обозначить принятым во французской лите-
ратуре термином «секанты»), топография которых
служит для дифференцировки родов. Перистом хоро-
шо развит, иногда с дополнительным вестибулюмом
с вершинами группы соматокинет, разделен на 2 зо-
ны, как у гетеротрих — от апекса идет полоса мем-
бранелл, уходящих в роговидный инфундибулюм
(буккоп). От рта вглубь тела идут фибриллы глотки.
Ядро с сильно развитой системой наружных фиб-
рилл — кариофоров; микронуклеус один, тесно при-
легает к макропуклсусу. После конъюгации в разви-
вающемся зачатке нового ядра четко виден клубок
крупных полигонных хромосом; это важный общий
признак с сем. Metopidae, от которого выводятся ни-
ктотерусы.
Относительно крупная группа, число родов и видов
непрерывно возрастает по мере изучения новых хозя-
ев. Все виды эндопаразитические в кишечнике беспо-
звоночных и низших (холоднокровных) позвоночных;
наибольшее количество видов — в амфибиях и репти-
лиях. Заражены олигохеты, в основном наземные, не-
ТИП CILIOPHORA. КЛАСС ARMOPHOREA
535
которые моллюски, среди ракообразных, как исключе-
ние, отдельные виды; много паразитов в насекомых и
многоножках; среди позвоночных на всех континентах
заражены лягушки, жабы, квакши и другие амфибии, в
тритонах и саламандрах никтотерусов нет; заражены
ящерицы, игуаны, вараны, черепахи, змеи (в тропи-
ках); в крокодилах и кайманах никтотериды пока не
найдены, но могут быть. Пресноводные и морские
рыбы тропического пояса — хозяева нескольких ро-
дов, включая специфичные для рыб роды Cichlido-
therus, Paracichlidotherus, Ichthyonyctus, Inferostoma',
нет видов в европейских рыбах и на всей территории
России. Обилие видов на всех континентах, космо-
политное распространение родов Nyctotherus и Nycto-
theroides — свидетельство древности группы. Вполне
возможно, что никтотерусы были паразитами дино-
завров в век рептилий. Находки в человеке — ошиб-
ка (Nyctotherus faba Schaudinn, 1899, N. africanus Cas-
tellani, 1905), это почвенные кольподы, случайно ока-
завшиеся в пробах или вышедшие из проглоченных
цист.
Сложный кинетом не мог быть известен без приме-
нения метода импрегнации; накопилось множество
описаний видов, где кинетом вообще не упоминается,
к примеру в богатой фауне южной Америки. Все виды
относили долгое время к роду Nyctotherus (у типового
вида которого кинетом до сих пор неизвестен!), затем
Грассе (Grasse, 1928) добавил новый род Nyctotheroi-
des без кариофоров; позже эти роды разделили на под-
роды по форме «глотки» (буккона с внутренней частью
адоральной зоны мембранелл), что не было никем при-
нято. Импрегнация протарголом позволила выявить
многообразие типов инфрацилиатуры и число родов
резко увеличилось, сейчас не менее 20. У Sicuophora и
близких родов протаргол выявил также опорный аппа-
рат кортекса и присоски — сплошное поле перифери-
ческих элементов 2 типов, для которых здесь предла-
гается новый термин «скелосомы» (skelosomes) — ни-
тевидные и массивные Т-образные пластинки у разных
родов. Это дополнительный признак для различения
родов и семейств отряда.
В составе Heterotrichida никтотерусы всегда объ-
единялись с родом Plagiotoma, но Альбарет (Albaret,
1975) доказал их независимое происхождение, и сей-
час плагиотомиды перенесены в группу Hypotrichida.
Никтотерусы в составе плагиотомид были выделены в
особое подсемейство Nyctotherinae, формы с опорной
системой — в подсем. Sicuophorinae Amaro, 1972, для
Inferostoma предложено подсем. Inferostomatinae На
Ку, 1971; аберрантные виды из тропических тараканов
рода Panesthia еще раньше обособлены в сем. Cleve-
landellidae Kidder, 1938; к настоящему времени все эти
таксоны приняты в ранге семейств, добавлено сем.
Neonyctotheridae Affaa, 1987, которое в данной сводке
не признается.
Сем. Nyctotheridae Amaro, 1972
(рис. 306, 6—307, а)
Нет поперечных секант, нет опорного аппарата
кортекса, нет тенденции к образованию четкой присо-
ски с дифференцированным кинетомом — правая сто-
рона тела плоская, может быть вдавлена, но кинетом
не изменен. Перистом стандартного типа, с наружной
и внутренней зонами АЗМ, отверстие буккона (поло-
сти с погруженным участком полосы мембранелл)
примерно медиальное. Роды различаются по топогра-
фии швов. Далее приняты термины в следующем зна-
чении — секанта — любой шов, разделяющий кинеты;
унисеканта — когда одни кинеты идут параллельно
шву, другие подходят к ним под углом, бисеканта —
когда вершины кинет подходят друг к другу под уг-
лом с двух сторон по всей линии шва. Более четкие
швы апикальные, менее выражены у постерона. Мож-
но различить апикальные правые и левые швы (AR,
AL), задние правые и левые швы (PR, PL) и предрото-
вой шов OS.
Паразиты широкого круга хозяев — всех хозяев,
перечисленных выше для всего отряда. Другие семей-
ства приурочены к очень узкому кругу хозяев — си-
куофориды в основном к амфибиям, инферостоматиды
к рыбам, кливланделлиды в таракане рода Panesthia,
но и в этих 3 группах хозяев встречаются обычные ни-
ктотерусы.
Род Nyctotherus Leidy, 1849
Типовой вид A. veloxLeidy, 1849. Из многонож-
ки Julus marginatus в США. Кинетом не изучен, поэто-
му важно точно определить хозяина и импрегнировать
паразитов. Название хозяина позднее Spirobolus margi-
natus (Diplopoda, отряд Julida, сем. Spirobolidae), сей-
час Narceus americanus annularis или Narceus annula-
ris', вид N. marginatus или вообще отрицают, или счи-
тают северным подвидом вида Narceus annularis.
О типе кинетома Nyctotherus сейчас судят по виду
N. ovalis Leidy, 1850 из тараканов Blatta orientalis. Па-
разиты европейских Julus terrestris (сем. Julidae) тоже
не изучены и определяются как N. velox, используются
для построения «молекулярных филограмм» цилиат.
Даже паразиты тропических мириапод Spirostreptus —
тоже «А. velox». Мною детально изучен кинетом ни-
ктотерусов из крымских тараканов, лягушек и мириа-
под Ommatojulus flavipes, показано различие видов на
родовом уровне. В монографии Альбарета (Albaret,
1975) нет ссылки на статью Хаусман (Hausman, 1958) с
рисунком правой стороны A velox из типового хозяи-
на без импрегнации; показано 2 осевых шва AR и PR,
но рисунок может быть неточным.
К роду относили множество видов, не определяя
топографию кинетома, полный список с указанием хо-
зяев — у Альбарета (Albaret, 1975). Виды определя-
лись по размерам, форме тела, кариофорам, длине и
положению перистома, но все это второстепенные
признаки. Род пока сборный, служит «временным хра-
нилищем» для десятков неопределимых видов, опи-
санных на всех континентах. Вероятно, типовой вид
имеет бисеканту AR, идущую по оси тела, нижний шов
PR плохо выражен, на левой стороне тела швов прак-
тически нет. Число кинет обычно относительно неве-
лико, поэтому швы слабо выражены.
Вначале род включал виды с карпофорами — ядер-
ной подвеской, но кариофоры есть и у многих дру-
гих родов, важнее отличия кинетома. Род был разделен
536
ALVEOLATA
Рис. 307, a. Clcvclandcllida.
Metanyctotherus congoi (A, £), Neonyctotherus drage.scoi (В, Г); Geimania kyphodes (Д—Ж)', Prosieuophora ba.mglul (J, И). (По: Albaret, 1975 (Л, Б, Д—Ж); Affaa,
1983 (В. 1У, Pyutorac et Oktem, 1967 ('?, И)).
Fig. 307, a. Clevelandcllida.
на 3 подрода по форме буккона — Nyctotherus s. str.
(N. velox Leidy, 1849), Curviperistomatus Amaro et
Sena, 1967 (A. ochoterenai Schouten, 1937), Recurvi-
peristomatus A. et S., 1967 (A. uichancoi Kidder, 1937).
Этот признак совершенно несуществен, и подроды
не приняты.
Род Nyctotheroides Grasse, 1928
Типовой вид Nyctotherus cordiformis (Ehrenberg,
1838).
Этот таксон введен как подрод никтотерусов без
кариофоров, сохранен по другим причинам — разли-
чается топография инфрацилиатуры. Вид внешне име-
ет типичный облик никтотерусов; тело овальное, сужа-
ется к концам, правая сторона с длинным краевым апи-
кальном швом AR, отделяющим группу тесно
сближенных краевых кинет от вершин подходящих к
ним соматокинет, это типичная унисеканта. На левой
стороне швы AL и PL, расположенные почти на одной
линии. Кроме основных секант можно различить и
мелкие дополнительные швы, особенно у видов с по-
лимеризацией кинет. Nyctotherus — паразиты очень
широкого круга хозяев, a Nyctotheroides — только
амфибий. Род отмечен на всех континентах, но много-
численные определения локальных паразитов амфи-
бий как A. cordiformis неверны — едва ли этот север-
ный вид имеется в Австралии или в Южной Америке.
В Европе заражены все наземные и водные амфибии,
кроме саламандр и тритонов.
Как и Nyctotherus, род Nyctotheroides был подразде-
лен на подроды по несущественному признаку — по
форме буккальной трубки (прямая, изогнутая, спи-
ральная и т. д.) — Nyctotheroides s. str. (A. cordiformis),
Spiroperistomatus Amaro et Sena, 1968 (A. macropharyn-
geus (Bezzenberger, 1904)), Sigmaperistomatus A. et S.,
1968 (A. crossodactyl (Carini, 1945)), Aduncuperisto-
matus A. et S., 1968 (N. tejerai (Pinto, 1926)), Rectiperis-
tomatus A. et S., 1968 (A. coralli (Carini, 1933)), у части
указанных типовых видов кинетом неизвестен. В ката-
логе родов цилиат Аэшт (2001) по ошибке все они чис-
лятся валидными родами, хотя никто и никогда не при-
знавал их как подроды, и тем более не считал родами.
ТИП CILIOPHORA. КЛАСС ARMOPHOREA
537
Рис. 307, б. Clevelandellida.
Sicuophora heimi (A—В); S. mabokensis (Г); Inferostoma jankowskii (Д—Ж). (По: Albaret, 1970 (A—Г); Ха Ки, 1971 (Д—Ж)).
Fig. 307, 6. Clevelandellida.
В данной сводке один из подродов (Spiroperistomatus)
впервые признан родом сикуофорид, остальные под-
роды невалидные.
Род Metanyctotherus Albaret, 1970
Типовой вид М. congoi(= Nyctotherus congoiTu-
zet et al., 1957) по монотипии. Из многоножек Африки
(Spirostreptus, Ophistreptus, Scaphiostreptus). У Nycto-
therus есть только шов AR, у Metanyctotherus оба шва AR
и AL — короткие швы правее и левее перистома. Нет
четкой полосы тигмокинет на краю тела, столь характер-
ной для Nyctotheroides. При виде сверху шов AL про-
должает зону мембранелл, шов AR идет от вершины АЗМ
под прямым углом, далее делится на 2 шва. В многонож-
ках Африки распространены в основном виды рода Nyc-
totherus; Metanyctotherus найдены в немногих хозяевах.
К роду позже приписаны несхожие виды, вероят-
но неродственные, круг хозяев расширен, род стал
сборным. По особенностям кинетома мы отделяем
2 вида, М. rancureli и М. vachoni, ранее исключен-
ные из состава рода.
Род Pronyctotherus Albaret et Njine,
1975
Типовой вид Р. dragescoi из неопределен-
ных наземных олигохет Камеруна; в другой неопре-
деленной олигохете Р. bouchei A. et N., 1975 и Р. сате-
rounensis A. etN., 1975. Массивные вытянутые формы
с полимеризацией кинет; практически нет апикаль-
ных секантных зон на обеих сторонах тела, хотя ки-
неты здесь разной длины и многие не достигают апек-
са. Есть шов PR, почти нет такого шва слева. Нет
кариофоров; перистом типичный для семейства. Род
считается наиболее примитивным среди никтотерид.
Род Cryptonyctus Jankowski gen. n.
Типовой вид С. chabaudi (= Nyctotheroides cha-
baudi Albaret, 1972) из амфибий Rhacophorus (Мадага-
скар), также C. puytoraci, С. teocchii comb. nn. (Nycto-
theroides puytoraci Albaret, 1968, N. teocchii Albaret,
1975). Типовая форма с очень большим числом кинет,
538
ALVEOLATA
что приводит к неправильному, непараллельному по-
ложению многих рядов; справа характерная для Nyc-
totheroides краевая секанта AR без взаимного соедине-
ния кинет, слева трудно различить секанты среди мно-
жества кинет и их фрагментов. Перистом очень
длинный, имеется обширный вестибулюм, куда вхо-
дит большое число сомакинет на обеих стенках поло-
сти, справа и слева. Вестибулюм — важный родовой
признак, отсутствует у низших никтотерид, рассмот-
ренных выше. У С. puytoraci такой же вестибулярный
комплекс, у С. teocchii кинеты идут только на пра-
вой стенке полости. В этот род можно включить и вид
Nyctotheroides anomalus Affaa, 1979 с двусторонней
вестибулярной цилиатурой (С. anomalus comb. п.). Па-
разиты амфибий Африки, в Bufo, Leptodactylus и Rha-
cophorus.
Род Cameronyctus Jankowski nom. n.
Название Cameronyctus Jankowski, 1986, предло-
женное для замены гомонима Paranyctotherus Ngas-
sam, 1983 пес Sandon, 1941, не признано, так как опуб-
ликовано в тезисах, а не в статье, поэтому здесь пред-
лагается вторично; типовой вид С. albareti comb. n.
(= Р. albareti Ngassam, 1983). Paranyctotherus Sandon,
1941 — это балантидиида из лягушек Xenopus laevis,
название рода обманчивое. Типовой вид Camero-
nyctus найден в наземных олигохетах Eupolyporeutus
Камеруна. Внешний облик типичный для никтотерид,
вестибулюма нет, отличия небольшие — имеется одна
секанта справа (AR), 1 предротовой шов и 1 послеро-
товой. В олигохетах Европы никтотерусы не встреча-
ются, единственное описание и рисунок Nyctotherus sp.
из энхитреид в зоне выбросов водорослей на берегу
Белого моря — это ошибка, в них обитает кроме асто-
мат внешне сходная гименостомата Hysterocineta.
Род Cichlidotherus Affaa, 1989
Типовой вид С. meanjae по монотипии. Из прес-
новодных рыб Камеруна — неопределенных цихлид
рода Chromidotilapia. Cichlidae имеют взрывную эво-
люцию в крупных озерах Африки, можно ожидать
описания новых видов. Позже виды такого типа были от-
мечены в Pelvicachromis toeniatus и Chromidotilapia gun-
theri. Внешний облик и перистом типичные для Nycto-
therus, вестибулюма нет, кинеты не полимеризованы,
нет правосторонней присоски. Справа короткая бисе-
канта AR, более длинный шов PR сзади, слева длинная
бисеканта AL и столь же длинная бисеканта PL. Итак,
развиты все 4 основных шва, и все — бисеканты.
Род Dizonyctus Jankowski,
gen. n.
Типовой вид D. cardiostomatus comb. n. (= Nyc-
totherus cardiostomatus Ngassam, 1983). Род впервые
предложен в тезисах и поэтому не признан валидным в
каталоге Аэшт; здесь предлагается вторично. Типовой
вид — в наземных олигохетах (дождевых червях) Ка-
меруна. Уникальный вид с очень резким расширением
мембранелл в глубине буккона, фактически с димор-
физмом внутренних мембранелл; наружные мембра-
неллы тоже диморфные — выше полосы стандартного
типа виден ряд апикальных фрагментов, как бы руди-
менты мембранелл. У остальных никтотерид мембра-
неллы примерно равны по длине оснований в наруж-
ной полосе и несколько уменьшаются ко рту в полости
(букконе). Диморфизм мембранелл обеих зон — важ-
ный родовой признак Dizonyctus.
Род Falconyctus Jankowski,
1978
Типовой вид F. indicus (= Nyctotherus indicus
Bhaskar Rao, 1969). Название Faltonyctus в той же
статье — ошибка(эрроним). Типовой вид в кишеч-
нике таракана Corydia peteveriana (Blattidae) в Индии.
Кинетом не изучен, форма перистома, расположение и
величина мембранелл адоральной зоны не выяснены,
нет данных о топографии швов. Плохо описанный вид.
Очень мелкие формы (до 64 мк) с необычной формой
тела. При виде справа и слева на одном из краев тела
(перистомальном) имеются аморфные неодинаковые
выросты тела, от зоны кариофоров ядра до постерона;
тело как бы разрастается вбок и покрыто здесь множе-
ством неправильных складок. Особенно крупны меди-
альные выросты тела. Реснички на выростах тела
длиннее соматических. Топография кинетома должна
быть здесь резко видоизменена. Это не аномалия, а по-
стоянный признак вида (материал массовый). Такая
особенность не встречается у других никтотерид и
служит признаком рода независимо от положения
швов и строения перистома.
Род Indonyctus Jankowski,
1978
Типовой вид I. marina (=Nyctotherus marina
Santhakumari et Balakrishnan Nair, 1973) по монотипии.
Из мантийной полости и цекума (пищеварительного
кармана кишечника) моллюсков-древоточцев Индии
Nausitora hedleyi и Teredo furcifera. Тело вытянутое,
с резким удлинением перистома; либо перистом зари-
сован неправильно, либо укорочена наружная часть
зоны мембранелл и удлинена внутренняя полоса. При-
менена импрегнация кинетома, но рисунки явно упро-
щены; показаны немногочисленные сомакинеты, без
швов по оси тела продольно, параллельно узкому пе-
ристому, как у анцистрид. Род пока спорный, может
быть основан на неточных рисунках. Одновременно в
морских моллюсках найден вид Metanyctotherus гапси-
reli Laval et Tuffrau, 1973, также в древоточцах (в за-
падной Африке).
Род Kudoella Earl, 1972
Род предложен при ревизии никтотерид для 2 ви-
дов, Balantidium praenucleatum Kudo et Meglitsch, 1938
и Nyctotherus pyriformis Chakravarty et Chatterjee, 1957
ТИП CILIOPHORA. КЛАСС ARMOPHOREA
539
(в новой комбинации у Эрля — К. praenucleatum, К. ру-
riformis). Дважды в первоописании род назван Kuodel-
la, но название в честь протозоолога Ричарда Кудо, по-
этому верно Kudoella.
Типовой вид К. praenucleatum.
Роду посвящена специальная статья Эрля (Earl,
1973), также с указанием типа К. praenucleatum. Поз-
же Эрль (Earl, 1980) включает в род 7 видов, в ос-
новном плохо изученных: К. praenucleatum, К. hof-
straensis, К. delta, К. dragescoi, К. bouchei, К. сате-
rounensis, «К. chatterjee» — это ошибка, нужно
К. pyriformis.
Род Pronyctotherus Albaret, 1975 ликвидируется как
синоним Kudoella Earl, 1972. К сожалению, в обеих
статьях Эрля нет рисунка типового вида или других
видов. Тип рода обитает в таракане Blatta orientalis
(шт. Иллинойс, США), первоначально был принят за
балантидиев, но по всем признакам это никтотериды;
вероятно, они лишены швов на обеих сторонах тела.
О морфологии Kudoella Эрль судит по виду К. hofstra-
ensis, описанному из Periplaneta americana в Нью-
Йорке и лишенному швов. Это важное отличие от
вида N. ovalis из тех же тараканов в Европе. Итак, Ku-
doella, как Nyctotherus, но буккальное отверстие лежит
у вершины, перистом короче, швов нет, есть карио-
форы. Этот род не фигурирует в каталоге Альбарета
(Albaret, 1975), вероятно считающего вид баланти-
диидой. Следует ждать описания импрегнированного
материала.
Род Micronyctus Jankowski, 1978
Типовой вид М. madagascari (= Nyctotherus та-
dagascari Tuzet et Manier, 1954). Из многоножек-дип-
лопод Sphaerotherium типа S. imbecillum (Мадагаскар).
Мелкие формы с упрощенным кинетомом; форма тела,
перистом, ядра типичные для никтотерид. Если верно
первоописание, кинет очень мало, левая сторона тела
без швов, правая с одним очень коротким швом AR в
виде унисеканты. Имеется всего 10—И левых кинет,
12—14 правых — минимальное число у видов отряда.
Кинеты разрознены, далеко отстоят одна от другой,
нет фрагментации, укорочения и интеркалярных ки-
нет, столь характерных для остальных видов.
Род Teronyctus Jankowski gen. n.
Типовой вид Т. rancureli (= Metanyctotherus
rancureli Laval et Albaret, 1973). Из моллюска-древо-
точца Teredo adami — единственного вида рода, име-
ющего накопительную ректальную сумку, массивный
вырост с запасами полупереваренной пищи; этот отдел
заселен бактериями, грибами и инфузорями 3 отрядов.
Хозяин — в манграх лагун западной Африки. Внешне
вид мало изменен по сравнению с типичными никто-
терусами по форме тела, типу перистома, имеет ка-
риофоры; справа и слева в антесоме есть швы AR и
AL; все признаки изменчивые, как и длина тела
(80—350 мк). Тип рода Metanyctotherus (М. Congo t) —
в многоножках тропической Африки. Высказано мне-
ние, что «настоящий» Metanyctotherus должен вклю-
чать только 3 вида — типовой вид, М. paulini Grim,
Reed et Fishelson, 1996 (из рыб) и М. vachoni Albaret,
1975, а М. rancureli не относится к этому роду. У ти-
пового вида шов AR бисекантный, у М. rancureli уни-
секантный — кинеты правой стороны тела подходят
вершинами к длинной прямой полосе кинет, парал-
лельной перистому. Это различие достаточно для вы-
деления нового подрода или рода.
Род Pseudonyctotherus Earl,
1970
Типовой вид Р. corlissi по монотипии. Вновь
трудный, спорный род Эрля (Earl, 1970), как и Kudoel-
la, не признанный специалистами. Вид паразитирует в
амфибиях Hyla versicolor (шт. Огайо, США). В катало-
гах цилиат род невалиден как синоним рода Nyctothe-
roides. Замысел автора трудно понять; это внешне, по
ядрам и ротовому аппарату типичный Nyctotheroides',
кинетом совершенно не изучен, микрофотографии не-
ясные; вероятно, топография швов, как у Nyctotheroi-
des. Единственное отличие — ямка у постерона; по
Эрлю, «Pseudonyctotherus — как Nyctotheroides, кроме
того, что имеет сплющенный воронковидный экскре-
торный аппарат и имеются рассеянные прозрачные ва-
куоли, но нет сократимой вакуоли». Альбарет, не при-
знавая рода, перевел типовой вид как валидный вид
в состав Nyctotheroides.
Род Paracichlidotherus Grim, 1992
Типовой вид Р. leeuwenhoeki по монотипии. Из
кишечника морских рыб Zebrasoma scopas (Барьерный
риф, Австралия). Постепенно растет список никтоте-
рид из пресноводных и морских рыб. Тело удлинен-
ное, перистом без вестибулюма, швы мелкие, располо-
жение, как у Nyctotheroides, — AR, PR, AL, PL; кинеты
вне швов продольные, параллельные, не полимеризо-
ваны. Выделение нового рода не кажется необходи-
мым, отличия в топографии швов по сравнению с Cich-
lidotherus небольшие, но, вероятно, родовой при-
знак — наличие обособленных фрагментов кинет с
плотными рядами кинетосом в зоне швов у постерона.
В норме кинетосомы в кинетах у постерона разреже-
ны. Кроме того, в антесоме у Cichlidotherus есть тигмо-
тактическая зона — участок кинетома у швов, у нового
рода нет, как и у Nyctotherus.
Род Pygmotheroides Affaa, 1979
Типовой вид Р. njinei по монотипии. Из амфи-
бий Leptodactylodon в Камеруне. Форма тела типичная
для никтотерусов, правый верхний шов AR, такой же
как у Nyctotheroides, ограничивает полосу длинных
сближенных краевых тигмокинет, снизу швы PR и PL.
Видоизменена зона мембранелл — ее наружная часть
идет не вдоль тела, как обычно, а поперек в виде длин-
ной дуги. Соответственно изменилось положение всех
кинет и швов, подходящих к АЗМ, — шов AL диаго-
нальный, кинеты над АЗМ почти поперечные.
540
ALVEOLATA
Род Vestonyctus Jankowski, 1978
Типовой вид И. vachoni (= Metanyctotherus vac-
honi Albaret, 1975). При введении рода указаны напи-
сания Vesonyetus (принятое Аэшт как валидное) и Ves-
tonyctus (эрроним), но я ввел именно Vestonyctus
(vest —- от слова вестибулюм), a Vesonyetus — опечат-
ка. Внешний облик типично никтотеридный, на пра-
вой стороне кинеты полимеризованы, швы почти по-
перечные, на левой диагональный шов AL. Наружный
отдел АЗМ небольшой, дуговидный, внутренний
идет диагональной полосой; в зоне погружения АЗМ
образуется гигантская воронка, которой нет у типа
рода Metanyctotherus', в нее входят многочисленные
сомакинеты. Такой комплекс обозначается как «мезо-
стом». Возможно, мезостом образуется независимо
в разных линиях эволюции при полимеризации кинет
и погружении части их в ротовую воронку. Типовой
вид в кишечнике многоножек Африки; в многоножках
Европы и США — только виды с типичным перис-
томом.
Род Pilonyctus Jankowski gen. n.
Типовой вид Р. kempt (= Nyctotherus kempt
Ghosh, 1921). Из кишечника пресноводных гастропод
Pita globosa в Индии. Это один из немногих видов, пе-
реописанных ранними авторами при импрегнации (на
сухих мазках методом Клейна). Основные родовые
признаки — удлинение тела и перистома, сдвиг задне-
го полюса (постерона) на левую сторону тела, с изме-
нением топографии кинет. Нет швов слева, справа
один шов внизу, начиная от инфундибулярного отвер-
стия. Такой кинетом несвойствен никтотерусам. После
описания вид был перенесен в состав рода гетеротрих
Plagiotoma — Р. kempt — это ошибка, у Р. lumbrici
из дождевых червей другое строение кинетома, пе-
ристома, ядер, это сильно видоизмененные гипо-
трихи. Достаточно разницы в форме ядер, чтобы иск-
лючить принадлежность N. kempi к плагиотомам.
Вид следует изучить заново, обратив внимание на то-
пографию швов.
Род Gasconyctus Jankowski gen. n.
Типовой вид G. ampullariarum (= Nyctotherus
ampullariarum Cordero, 1928). Родственные пилидам
молюски ампуллярииды обитают в Южной Амери-
ке — в Ротасеа canaliculata описаны Nyctotherus am-
pullariarum Cordero, 1928 и Parasicuophora corderoi
Gascon, 1975; первый вид был ранее перенесен в Nyc-
totheroides и позже в состав Parasicuophora. Места
сбора — северная Аргентина, Уругвай, хозяева — Ат-
pullaria (Ротасеа) canaliculata, A. insularium, A. me-
gastoma. Тело вытянутое, перистом удлинен, нет сдви-
га постерона на левую сторону тела, имеется четкая
правая секанта AR — унисеканта у Р. corderoi, бисе-
канта у Р. ampullariarum. Нет опорных пластинок кор-
текса (скелосом), нет присоски, нет секант постесомы
и нет верхнего левого шва AL. Нет причин включать
эти формы в состав Parasicuophora, имеющего скелет
кортекса и иную топографию швов. Как типовой вы-
бран вид с особо длинным перистомом; второй вид
пока включается в новый род (G. corderoi comb, п.), но
перистом и шов не такие, как у типа, не исключено по-
этому, что это вид другого рода.
Род Ichthyonyctus Jankowski, 1974
Типовой вид I. schulmani (= Nyctotherus schul-
mani На Ку, 1971) из кишечника рыб Вьетнама — рас-
тительноядных карповых Squaliobarbus curriculus с
медленным перевариванием пищи, что создает среду
для бактерий и цилиат. Внешний облик типично ни-
ктотеридный, перистом без вестибулюма, положение
2 отделов перистома как у Nyctotherus, ядра с карпофо-
рами. Справа сложная система швов — длинные диа-
гональные секанты AR, PR и поперечный шов, отделя-
ющий вершины почти всех вентральных кинет с обра-
зованием присоски. Шов AR продолжается и на
присоске. Слева секанта AL на 1/3 длины тела, в дру-
гом участке кинетома шов PL; оба шва — унисеканты.
Первоначально в состав рода были включены все ра-
нее известные виды из рыб (N.baueri На Ку, 1971;
N. piscicola Daday, 1905; N. carinii Schouten, 1940;
N. pangasia Tripathi, 1960; N. mackinnoni Schouten,
1940; N. dilleri Earl et Jimenez, 1969), но это ошибка,
присоску имеет только I. schulmani. У Nyctotherus pis-
cicola имеется подобие присоски без фрагментации ки-
нет и без поперечного шва, как простая вмятина у вер-
шины правой стороны тела. По личному сообщению
Эрля, никтотерусы из рыб Мексики не имеют такой
присоски и не принадлежат к Ichthyonyctus.
Род Spirocytopharynxa Li, Wang et Xiao,
2002
Род предложен для 3 новых видов — S. sinensis,
S. guangxiensis и S. quadranus из амфибий Китая Rana
spinosa и R. quadranus. Основной признак рода — спи-
рально закрученная глотка с полосой мембранелл. Не
обсуждается приоритет подрода Spiroperistomatus
Amaro et Sena, 1968 (типовой вид Nyctotherus macrop-
haryngeus Bezzenberger, 1904), но идентичность этих
таксонов кажется несомненной. Не указан тип рода,
поэтому род нсвалиден. Как типовой вид здесь обозна-
чается S', sinensis, род меняет авторство (Spirocytopha-
rynxa Jank., gen. п.) и все 3 вида переходят в состав
Nyctotheroides (подрод Spiroperistomatus) — N. sinen-
sis, N. quadranus, N. guangxiensis comb. nn.
Род Macrocytopharynxa Li, Wang et Xiao,
2002
Род предложен для 2 видов без указания типа и по-
этому невалиден; включены М. pyriformis (= Nyctothe-
roides pyriformis Nie, 1932) и M. lingchuanensis sp. n. из
Rana limnocharis. Это массивные формы с большим
числом кинет и широкой вестибулярной полостью,
несущей много сомакинет. Точной схемы вестибулю-
ма нет, но, вероятно, это синоним рода Vestonyctus —
ТИП CILIOPHORA. КЛАСС ARMOPHOREA
541
И. pyriformis comb. n„ V. lingchuanensis comb. n.
Как типовой мною обозначается вид М. pyriformis,
и этот род по правилам номенклатуры меняет ав-
торство — Macrocytopharynxa Jank. gen. n., с видами
М pyriformis (тип рода) и М. lingchuanensis. Если вес-
тибулярная цилиатура разного типа, не соответствует
топографии у V. vachoni (Albaret, 1975), род может
быть валидным.
Сем. Inferostomatidae На Ку, 1971
(рис. 307, б)
По Альбарету, этот таксон включает Ichthyonyctus
и Inferostoma, общее — поперечное расположение пра-
вого шва и особая присоска. Однако семейство предло-
жено только для Inferostoma, и основной признак —
резкое удлинение наружной полосы мембранелл со
сдвигом буккона к заднему концу тела. Паразиты рыб
Вьетнама.
Род Inferostoma На Ку, 1971
Типовой вид I.jankowskii по монотипии. Из
кишечника того же хозяина, что и Ichthyonyctus, встре-
чается вместе с Nyctotherus baueri, кинетом которого
неизучен. Тело резко расширено, закруглено апикаль-
но, широкое и как бы срезанное поперек у постерона.
Перистом аллометрически удлинен на всю длину тела,
от апекса к постерону, состоит из 2 наружных зон —
полоса узких мембранелл в экваторе переходит в поло-
су широких мембранелл, т. е. имеется диморфизм на-
ружных мембранелл — дополнительный родовой при-
знак. На постероне мембранеллы входят в буккон, иду-
щий вверх до экватора тела. Слева 2 диагональных
шва AL и PL, справа швы ограничивают обширную
присоску с 2 группами кинет на дне и стенках швом
AR. Шоп PR. идет независимо от верхней секанты от
экватора до постерона. Неизвестно, есть ли опорный
аппарат (скелосомы) кортекса — изучались лишь пре-
параты, окрашенные гематоксилином Гейденгайна,
живые и фиксированные особи не осматривались. Все
известные роды с скелосомами обитают в амфибиях и
относятся к сем. Sicuophoridae.
Сем. Clevelandellidae Kidder, 1938
(рис. 309, б)
Аберрантные формы из кишечника наземных насе-
комых — тараканов (только тропического рора. Panest-
hia) и термитов. Кинеты многочисленные, во многих
зонах неправильные, фрагментированы; нет присоски,
цитоскелета, швы обычного для никтотерид типа.
Префундибулюм растянут и смещен вниз, сохране-
ны лишь отдельные мембранеллы или фрагменты
сомакинет в зоне шва, не связанные функционально
с инфундибулюмом. Погруженная зона мембранелл
(инфундибулюм) направлена снизу вверх, у части
форм последовательно удлиняется зона инфундибу-
лярного отверстия с кинетами, образуя вытянутый
рострум.
Род Clevelandella Kidder,
1938
Это пот. п. для гомонима Clevelandia Kidder, 1937.
Род включает виды С. panesthiae Kidder, 1937 (типовой
вид); С. constricta К., 1937; С. hastula К., 1937; С. соп-
torta К., 1937; С. elongata К., 1937; С. nipponensis К.,
1937; С. parapanesthiae К., 1937 и перенесенные в этот
род виды Emmaninius (см. ниже). Хозяева — тараканы
Panesthia javanica и Р. spadica. Обе стороны тела без
передних швов; сзади справа вершины кинет сходятся,
образуя массу фрагментов, к участку тела над сократи-
мой вакуолью, слева различим длинный шов, левее ко-
торого кинеты идут продольно, правее круто заворачи-
вают к тому же центру. Нижний конец тела вытяну-
тый, трубковидный, с концентрическими кинетами.
Префундибулюм редуцирован, внутренняя зона АЗМ
идет снизу вверх от широкого скошенного отверстия
рострума до ядра, подвешенного на кариофорах. Сома-
кинеты не входят в полость рострума. Япония, Филип-
пины, Индия; на Андаманских о-вах найден вид С. kid-
deri Mandal et Nair, 1974 в Panesthia sp. В типовом хо-
зяине встречается и исходная форма — Nyctotherus
uichancoi Kidder, 1937.
Род Emmaninius Yamasaki,
1939
Род предложен для 3 новых видов в кишечнике Pa-
nesthia angustipennis в южной Японии, это ксилотрофы
из стволов погибших деревьев. Тип рода ранее не обо-
значен, и род считается синонимом рода Clevelandella;
здесь типовым видом обозначается Е. longicollis, дру-
гие виды Е. papillaris и Е. plantiformis', авторство рода
меняется (Emmaninius Jankowski gen. п.). Принята
идентификация Е. papilloris = С. panesthiae, Е. planti-
formis = С. constricta, Е. longicollis = С. nipponensis.
Эти виды встречаются соместно с Nyctotherus panest-
hiae Yamasaki, 1939. Название Emmaninius можно ис-
пользовать как подрод или род для форм с особым уд-
линением рострума, внутри которого находится вся
зона мембранелл. Состав рода прежний — Е. longicol-
lis, Е. plantiformis, Е. papilloris comb. n.
Род Metaclevelandella Uttangi et Desai,
1963
Типовой вид по монотипии М. termitis из ки-
шечника термита Capritermes incola в Дхарваре, Ин-
дия. Хозяин в отличие от многих термитов и Panesthia
не принадлежит к ксилотрофным видам. Очень мелкие
формы с округлым ядром без кариофоров, перистом
открывается узким отверстием над постероном, кине-
том показан Только слева — все ряды сходятся радиа-
льно к зоне сократимой вакуоли. Неизвестна топогра-
фия правых кинет и в зоне простомального шва. Внут-
ренняя зона мембранелл небольшая, изогнутая, почти
у постерона, нет рострума. Независимо от топографии
сомакинет род валидный, у других кливланделлид
трубка с мембранеллами направлена вверх от посте-
рона.
542
ALVEOLATA
Рис. 308, a. Clevelandellida. (По: Albaret, 1973).
Metasicuophora petteri (A—B); Parasicuophora xavierac (Г, JI).
Fig. 308, a. Clevelandellida.
Род Paraclevelandia Kidder,
1938
Типовой вид P. brevis Kidder, 1937, также
P. simplex Kidder, 1937. В кишечнике Panesthia javani-
ca и P. spadica. В отличие от Clevelandella особи ли-
шены рострального выроста тела. Перистом широкий,
начинается у постерона в виде асимметричного широ-
кого отверстия и, сужаясь, идет вверх; вся зона мемб-
ранелл внутри тела, до крупного ядра с кариофорами.
Кинеты сходятся к зоне вакуоли.
Род Panesthia широко распространен также в Авст-
ралии, на Новой Гвинее, можно ожидать роста сем.
Clevelandellidae при изучении других локальных видов
хозяев. В ксилотрофном таракане Cryptocercus в даль-
невосточной тайге России найдена обильная фауна
флагеллат, но инфузорий нет.
Сем. Sicuophoridae Amaro, 1972
(рис. 307, а—309, а)
Никтотсриды с развитым опорным слоем под кор-
тексом клегки и с тенденцией к образованию обшир-
ной присоски на правой стороне тела. Элементы опор-
ного слоя 2 типов — нитевидные {Parasicuophora) и
в виде компактных Т-образных структур {Sicuophora,
Prosicuophora, Metasicuophora), выявляются на по-
перечных срезах в оптическом и электронном мик-
роскопе, могут быть окрашены при гистохимической
реакции на полисахариды. Предлагаемое общее на-
звание для обоих типов структур — скелосомы. Опор-
ный слой может быть развит под всем кортексом, толь-
ко под присоской или (у Neonyctotherus) вне присос-
ки. На этом основании последний род выделялся
в особое сем. Neonyctotheridae Affaa, 1987, но этого
ТИП CILIOPHORA. КЛАСС ARMOPHOREA
543
Рис. 308, б. Clevelandellida.
I’arasicuophora xavierae (Л, JT); Prosicuophora basoglui (Б, В, Ж, И); Vestonyctus (ранее Metanyctotherus) vachoni (Г, Д, E)\ Sicuophora macropharyngea (3); Me-
tasicuophora petteri (К, M). (По: Albaret, 1973 (К, M)', 1975 (И—И, JI)).
Fig. 308, 6. Clevelandellida.
мало для выделения семейства, по другим призна-
кам это стандартные сикуофориды. Хозяева большин-
ства родов — амфибии Африки, Мадагаскара, Индии,
восточной Азии; виды этого семейства отсутствуют
в амфибиях России. Род Geimania обитает в назем-
ных черепахах Галапагос, в остальных черепахах
виды Nyctotherus.
Род Albaretia Affaa in Aescht,
2001
Род Albaretia Affaa, 1986 был предложен для 2 ви-
дов без указания типа, поэтому признан невалидным.
Типовой вид A. terroni, также A. maxima comb. n.
для Albaretia maxima in Affaa, 1986, оба вида из голова-
стиков лягушек Acanthixalus spinosus в Камеруне. По
накопившимся данным, фауна никтотерид в голо-
вастиках может не совпадать с фауной во взрослых
наземных стадиях в связи с разным типом питания.
Левая сторона тела выпуклая, с глубоким осевым
желобком, переходящим медиально в очень широкое
отверстие инфундибулюма. По диагнозу и рисункам
неясно, входят ли сомакинеты в перистом — наиболее
важный родовой признак у никтотерид не выявлен.
Слева сложная система нижних швов — 4 длинных
секанты, справа очень короткие верхний и нижний
швы. Практически вся правая сторона тела превраще-
на в гигантскую присоску с полимеризацией кинет
(при длине тела до 300 мк). Под присоской скелосо-
мы 2 типов (реакция PAS Бауэра на полисахариды
без срезов цилиат, тотально). Тип рода считается вер-
шиной эволюции в линии Parasicuophora — Albaretia
maxima — A. terroni.
Род Sicuophorides Jankowski
gen. n.
Типовой вид S. magnus comb. n. (= Nyctotherus
magnus Bezzenberger, 1904, позже в составе Nyctothero-
ides, Prosicuophora и Sicuophora', = Sicuophora mabo-
544
ALVEOLATA
Рис. 309, a. Clevelandellida.
Sicuophora r.enopi (A—Гу, Pronyctotherus drageseoi (E); S. heimi (Д, Ж)-, S, macropluiryngea (3, И). (По: Puytorac, Grain, 1968 (А—Г); Albaret, 1970 (Д); 1973 (3,
//); Albaret, 1975 (E. Ж)).
Fig. 309, a. Clevelandellida.
kensis Albaret, 1970). Из амфибий Rana hexadactyla,
R. (Discoglossus) occipitalis, R. cyanophlyctis в Азии и
центральной Африке. Крупные формы, с коротким
префундибулюмом и длинной внутренней полосой
мембранелл; обширная воронка инундибулюма нети-
пична для никтотерид, обычно она узкая. У Sicuophori-
des имеется вестибулюм — часть сомакинет заходит в
воронку по ее правой стенке. Такого вестибулюма нет
у типового вида Sicuophora — S. xenopi. Имеется около
225 кинет, из них 100 правых и 125 левых, вестибуляр-
ных кинет около 12. Наружная полоса с 45 мембранел-
лами, внутренняя — 150. Скелосомы как у Sicuophora
по топографии, но более вытянутые. Анализ сикуофо-
рид исключает вид S. magna из состава рода Sicuopho-
ra. Нужно подчеркнуть, что род Sicuophorides предла-
гается здесь для N. magnus sensu Albaret, 1970 (5. ma-
bokensis') и N. magnus sensu Albaret, 1975 (S'. magna) из
Африки; если будет восстановлен вид S. mabokensis,
он должен обозначаться как Sicuophorides mabokensis
comb. п. и быть типовым для рода.
Род Parasicuophora Albaret,
1968
Типовой вид Р. mantellae по монотипии. Из
амфибии Mantella aurantiaca (Мадагаскар). Вид и род
были описаны Альбаретом вначале в тезисах, названия
в тезисах невалидные. Кинеты полимеризованы, почти
вся нижняя (правая) сторона превращена в гигантскую
присоску, с 2 швами AR, PR; краевые кинеты сближе-
ны и образуют кольцо вокруг присоски. Слева густые
кинеты с мелкими швами AL, PL. Присоска намечена у
Р. mantellae и более выражена у Р. xavierae Albaret,
1973, но не столь велика, как у Sicuophora. Опорные
элементы нитчатые, под присоской.
К этому роду позже был отнесен ряд видов без вес-
тибулюма, с воронкой, включались и виды из пресно-
водных гастропод Ротасеа canaliculata Южной Аме-
рики (см. род Gasconyctus), в недавнее время также но-
вые виды из амфибий Китая — Р. macrostoma,
Р. wuchangensis, Р. microhylae, Р. minutis (Wang, Xiao,
Li, 1998). Только у последнего вида показана система
поперечных скелосом. Вид Nyctotheroides hubeiensis
ТИП CILIOPHORA. КЛАСС ARMOPHOREA
545
Рис. 309, б. Clevelandellida. (По: Albaret, 1975).
Paraclevelandia simplex (А, Б); Clevelandella parapanesthiae (Г); C. constricta (Д, E).
Fig. 309, 6. Clevelandellida.
Li, Wang et Xiao, 1998 (N. hupehensis в подписи к
рисункам) имеет радиальные скелосомы, присоски
нет, это явно сикуофориды неопределенного родово-
го статуса.
Род Metasicuophora Albaret,
1973
Типовой вид М. petteri по монотипии. В шпор-
цевых лягушках центральной Африки Xenopus fraseri.
Крупные формы с широкой плоской каймой по всей
периферии тела; число кинет необычайно велико
(100—125 на инфероне, 150—155 на левой = верхней
стороне). Почти вся правая сторона превращена в ги-
гантскую присоску с массой кинет; справа короткие
встречные швы AR, PR, с фрагментацией всех кинет
между ними, слева лишь продолжение правосторон-
них швов. Перистом сдвинут вниз от антерона, распо-
ложен по диагонали, вздута средняя часть левой сторо-
ны, также с множеством кинет, без их фрагментации.
Вестибулюма (вхождения соматокинет в перистом)
нет. Опорные скелосомы сложной формы под всей
верхней (левой) частью тела в основном Т-образные,
как у Sicuophora.
Род Wichtermania Earl,
1972
2 вида, W. cheni (типовой вид; = Nyctotherus cheni
Wichterman, 1934) и W. kalii (N. kalii Uttangi, 1951). По
Эрлю (Earl, 1970): «Wichtermania — какNyctotheroides,
но у нее АЗМ достигает апекса и имеет кайму на пра-
вой стороне, окружающую все тело». Последующие
авторы не принимали этот род, вероятно, потому,
что оба вида не были описаны точным методом имп-
регнации, положение швов и тип опорного аппа-
рата остались неизвестными. Раньше эти виды были
переведены в состав Sicuophora, и Альбарет сохранил
их здесь, но это неприемлемо, так как род понимался
им в слишком широком смысле; в данной сводке к Si-
cuophora мы относим только аберрантный типовой
вид S. xenopi.
Тип рода Wichtermania (N. cheni) описан из Rana
spinosa на мазках, присланных Вихтерману в США из
Китая, имеет широкую плоскую кайму на инфероне,
особи «шляпообразные», вероятно вся поверхность
вне каймы — присоска. Кинеты каймы сближены
вплотную, многочисленные, кажутся концентрически-
ми, более разрежены на вздутом участке тела слева,
имеющем очертания никтотерусов. На швы в то время
не обращали внимания, они не были замечены. Пока
временно род сохраняется как валидный. Несколько
новых видов Wichtermania недавно описано в Китае —
W. multigranularis, W. oviformis, W. vesiformis, W. reti-
culatus, W. granuliformis, W. obliquoides (Xiao, Wang,
Li, 2002).
Род Geimania Albaret,
1975
Типовой вид G. jaboti. Также G. kyphodes (Gei-
man et Wichterman, 1937), G. teleacus (G. et W., 1937) (y
прежних авторов в составе Nyctotherus и Nyctotheroi-
des), тип рода из черепах Testudo tabulata (= Geochelo-
пе, Бразилия, Гвиана), другие виды из гигантских чере-
пах Галапагоса Testudo hoodensis, Т. elephantinus (ныне
Geochelone elephantopus, G. e. hoodensis, G. gigantea
elephantina).
Тело почковидное, задний конец тела оттянут, с
ямкой и цитопигом. Справа короткая секанта AR,
кинетом простой топографии, слева короткая секанта
AL. По оси вздута значительая часть левой стороны
тела, вдоль этой стороны идут краевые желобки с
мелкими скелосомами под ними, кинеты в зоне желоб-
ков и левостороннего вздутия тела продольные.
Нет обширной обособленной присоски справа (на ин-
фероне). В целом внешний облик никтотероидный,
но род помещается в состав сем. Sicuophoridae толь-
ко по наличию скелосом. У сикуофорид опорный ап-
парат присоски имеет вид пластины из множества
вплотную сближенных скелосом, и более мелкие и
35 Зак. №4163
546
ALVEOLATA
разреженные элементы подстилают кортекс осталь-
ной части тела. Родство Geimania и сикуофорид еще
не доказано.
Род Neonyctotherus Affaa,
1983
Типовой вид'#. dragescoi Affaa, 1983. Второй
вид — N. reticulatus Affaa, 1983, из амфибий Камеруна;
хозяева — головастики Nyctibates и Astylosternus (пер-
вый вид), второй вид в головастиках многих хозяев
разных семейств, в частности в хозяевах типового
вида. Тело каплевидное, заострено снизу, кинеты у
N. dragescoi не полимеризованы; справа короткий осе-
вой шов AR и по диагонали длинный шов, ограничива-
ющий тигмотактическую полосу сближенных кинет.
Нижние швы на обеих сторонах незначительные. Сле-
ва косой шов AL переходит в длинную безресничную
полосу (ацилон) вдоль всего дорсального края тела, на
краю вздутого участка тела. Такое положение швов ве-
дет к образованию зоны дорсальных тигмокинет на
обеих сторонах тела. Ядро округлое, что нетипично
для никтотерид. Скелосомы образуют под всем кор-
тексом, особенно на правой стороне, сплошной рети-
кулюм, имеют вид толстых нитей. Род позже выделен
в новое сем. Neonyctotheridae Affaa, 1987, близкое к си-
куофоридам, по форме тела (двояковыпуклое, без при-
соски), швам и ретикулярному скелету под всем кор-
тексом, но здесь оно не принимается, это один из мно-
гих типов сикуофорид.
Род Prosicuophora De Puytorac et Oktem,
1967
Типовой вид P. basoglui по монотипии. В ам-
фибиях Bufo и Hylarana в Габоне. Тело крупное, резко
несимметричное, кинеты полимеризованы. На правой
(нижней) стороне верхнюю половину тела занимает
небольшая присоска с продольными кинетами и слоем
мелких опорных пластинок кортекса (скелосом) под
присоской, по всему телу от них идут пучки фибрилл.
Очень четкие швы AR и особо длинный шов PR (бисе-
канты) с зеркальным положением кинет идут от кон-
цов тела по правую сторону тела, их нет на присоске.
Левая сторона с коротким предротовым швом AL. При
изменении формы тела изменилось и положение пери-
стома, идущего параллельно присоске, с глубоким
спиральным букконом. В списке Эрля (Earl, 1972) род
включает также виды Р. magnus (Bezzenbergrer, 1904),
Р. macropharyngeus (В., 1904), Р. malabarica (Earl,
1972); в каталоге Альбарета (Albaret, 1975) эти 3 вида
отнесены к Sicuophora, но здесь мною исключаются из
последнего рода.
Род Sicuophora Puytorac et Grain, 1968
У Альбарета 7 видов, у Эрля 3 вида, здесь род со-
хранен только для типового вида S. xenopi Puytorac et
Grain, 1968 по монотипии, из шпорцевых лягушек Га-
бона, Африка (Xenopus fraseri). Вид особо видоиз-
менен, не соответствует всем другим видам этого
сборного рода. Правая сторона тела вздутая, оттянута
далеко вбок и к субстрату прикреплена обширной при-
соской; между присоской и перистомом — зона коль-
цевых кинет. Наружная полоса мембранелл дуговид-
ная, внутренняя спиральная; длинный шов идет по
дорсальной стороне тела, пересекает присоску и воз-
вращается к антерону. Нет вестибулюма и вестокинет.
Скелосомы Т-образные, разрознены под кортексом,
образуют массивную сплошную пластинку над присо-
ской. Бочонковидный облик тела, с особым положени-
ем перистома, сомакинет и швов, свойствен только
S. xenopi, другие виды имеют более типичный никто-
теридный облик, сплющены на левой стороне. Поэто-
му желательно отделить тип рода от остальных видов.
Sicuophora bufonicola Affaa, 1990, добавленная после
монографии Альбарета, тоже не соответствует морфо-
логии S. xenopi.
Род Spiroperistomatus Amaro et Sena,
1967
Типовой вид 5. macropharyngeus comb. n.
(= Nyctotherus macropharyngeus Bezzenberger, 1904).
Из лягушек Индии (Rana tigrina, R. cyanophlyctis,
R. hexadactyla). Облик тела никтотеридный, кинеты
полимеризованы, положение перистома типичное для
никтотсрусов, внутренняя полоса мембранелл закру-
чена спиралью. Почти вся правая сторона тела превра-
щена в обширную присоску, четко отграниченную от
продольных краевых кинет. Шов не пересекает всю
присоску в отличие от Sicuophora. Справа швы AR, PR
и шов вдоль перистомального края присоски, слева
шов AL; левосторонняя цилиатура не усложнена, у по-
стерона многие кинеты укорочены без четкого шва.
Под присоской поле вплотную сближенных ромбиче-
ских скелосом. Подрод Spiroperistomatus Amaro et
Sena, 1968, с типом N. macropharyngeus был предло-
жен в составе рода Nyctotheroides и фактически это
сводило в синонимию род Sicuophora в широком смыс-
ле, но все авторы отказывались использовать название
подрода для нового рода и даже не обсуждали этот так-
сон, в нарушение правила приоритета, тем более что
оба названия были предложены почти одновременно.
По Альбарету, «название Sicuophora уже широко ис-
пользуется, и мы его сохраняем». Поскольку типовые
виды обоих таксонов здесь рассматриваются в разных
родах, синонимии нет.
Класс Litostomat
Переднеротые цилиаты, считавшиеся наиболее примитивны-
ми, в новых системах представлены двумя неродственными груп-
пами — Litostomatea и Prostomatea; данные молекулярной филоге-
нетики исключают их близкое родство, хотя все же могут быть об-
a Small et Lynn, 1981
щие корни для этих и родственных им классов (кольподы, нассули-
ды). Внешне сходные простоматы оказываются в разных классах и
отрядах, и точное определение положения вида требует электрон-
ной микроскопии соматической и ротовой цилиатуры. Можно за-
ТИП CILIOPHORA. КЛАСС LITOSTOMATEA
547
мк I un., что из современных схем исчезло традиционное название
(lyniDostoniata Butschli, 1889, которое можно было сохранить и не
шменять новыми (Litostomata, Haptorida); крупный отряд Prosto-
llllilidn сейчас включает лишь несколько родов.
Класс литостомат можно охарактеризовать лишь особенно-
г I ИМИ ультраструктуры кинетома. По Линну (Lynn, 2002), давшему
иную характеристику для всех классов, у литостомат сомати-
ческие монокинетиды (непарные кинетосомы) имеют 2 попе-
речных пучка микрофибрилл в виде полос, слегка конвергентный
шютцилиарный пучок, и латерально направленную кинетоде-
t мильную фибриллу, которая не покрывает собой фибриллы сосед-
них кинетосом; один поперечный пучок расположен тангенциаль-
но к периметру кинетосомы и идет вперед к соматическому ребру
плево от кинетосомы, а другой поперечный пучок расположен
радиально к периметру кинетосомы и идет поперек к прилегающе-
му соматическому ребру. Ротовые кинетосомы (в кольце вокруг
рга) простые, обычно парные; от них отходят опорные палочки
(немадесмы) стенки глотки. Добавочные немадесмы могут отхо-
дить также от соматических кинетосом в рядах, прилегающих к ро-
товой зоне, которые становятся околоротовыми кинетами (oralized
kinetids).
Значительное число родов класса принадлежит к отрядам пе-
реднеротых, щелеротых и хоботковых цилиат; более сложны эндо-
паразитические трихостоматы и энтодиниоморфы, выводимые не
от спиротрих, как в старых системах, а от простомат. Свободножи-
вущие виды заселяют всевозможные биотопы — почву, мох, бен-
тос и пелагиаль пресных вод и все доступные биотопы в море. Про-
стоматы перешли к эндопаразитизму и дали начало ряду аберрант-
ных, внешне несходных групп специфических паразитов —
балантидиев, изотрих, блефарокоритид, энтодиниид, загадочных
паразитов австралийских кенгуру. Балантидии заражают некото-
рых беспозвоночных, амфибий, рептилий и позвоночных, осталь-
ные названные группы только в млекопитающих; находка изотрих
в насекомых — ошибка, это балантидии.
Подкласс Haptoria Corliss, 1974
Организация соматических кинетид (кинетосом и
комплекса фибрилл), как у класса в целом, но пучки
постцилиарных микротубул накладываются по ходу
кинеты; кортикальные альвеолы слабо развиты; обыч-
но имеются кортикальные пластинки; между попереч-
ными микротубулами ротовых дикинетид находятся
токсицисты; немадесмальный аппарат глотки типа
рабдома (не циртум); на дорсальной поверхности в од-
ном или нескольких рядах могут располагаться рес-
нички с булавовидными вершинами.
В отличие от подкласса трихостомат, нет погру-
женной перистомальной цилиатуры; как правило, ро-
товые реснички наружные, несложной топографии.
Отряд Haptorida Corliss, 1974
Фойсснер (Foissner et al., 1995) восстанавливает на-
звание Gymnostomatea Butschli, 1889 для класса Litos-
lomatea Small et Lynn, 1981 — смена общепринятого
старинного названия ничем не обоснована; первое на-
звание предлагалось для переднеротых и щелеротых
цилиат (типа Amphileptus), и после разбивки таксона на
две неродственные группы (простомат и литостомат)
название гимностомат можно сохранить для основно-
го массива родов и семейств. С этими доводами можно
согласиться, но дублирование названия класса на
уровне отряда нежелательно. По Фойсснеру, класс
Gymnostomatea без подклассов включает 3 отряда —
Gymnostomatida Butschli, 1889, Spathidiida W. Foissner
et I. Foissner, 1988 и Cyclotrichida Jank., 1980. Лучше не
повторять вновь название класса для одной из под-
групп, и для первого отряда использовать название
Haptorida. Такой вариант принят в данном обзоре.
Линн (Lynn, 2002) замечает, что классификация
подгрупп внутри гапторид не разработана, опублико-
ванные варианты противоречивы, и сейчас трудно вы-
брать один из них. Поэтому в каталоге Линна подотря-
ды не различаются. Вероятно, нельзя принять схему
авторов Traite (Puytorac, 1994) — отряд Haptorida де-
лится здесь на подотряды Acropisthiina, Belonophryina,
Archistomatina; отряд Spathidiida—на подотряды Spat-
hidiina, Didiniina, Lacrymariina, Trachelophyllina, Dilep-
tina, Echelyina, а род Helicoprorodon выделяется в но-
вый отряд Helicoprorodontida. Для амфилертид восста-
навливается таксон Pleurostomatida Schewiakoff, 1896 в
ранге отряда, а мезодинии и близкие роды выделяются
в новый отряд Mesodiniida (Mesodinium, Myrionecta,
Askenasia). Можно заметить, что в составе Spathidiida
различаются 6 подотрядов и 10 семейств, у гапто-
рид — 3 подотряда и 3 семейства. Выделение подотря-
дов практически для каждого семейства теряет смысл,
и эти отряды лучше подразделять непосредственно
на семейства. Хотя 4 подотряда из 9 введены авто-
ром данной сводки, они предлагались с тем, чтобы
все остальные роды составляли единую группу про-
стомат; при ее дроблении еще на 5 подотрядов само
применение таксона «подотряд» становится нежела-
тельным.
Состав отрядов не совпадает у Фойсснера и Пюйто-
рака, поэтому и в этом отношении система недорабо-
тана и применена здесь не будет. В сводках Фойсснера
Gymnostomatida (= Haptorida s. str.) автор включает, к
примеру, дилептид, а у Пюйторака они отнесены к
Spathidiida. Архистоматы — единственная паразити-
ческая группа — в Traite отнесены к гапторидам, но
Фойсснер выводит их от одного из родов полиморфно-
го отряда Spathidiida. В итоге в данной сводке различа-
ется лишь один отряд Haptorida без подотрядов.
Пюйторак (Puytorac, 1994) предлагает следующий
вариант:
Класс Litostomatea
Отряд Haptorida Corliss, 1974
Acropisthiina Foissner et Foissner, 1988 (Acropisthiidae)
Belonophryina Jank., 1980 (Actinobolinidae)
Archistomatina Puytorac et al., 1974 (Buetschliidae)
Отряд Spathidiida Foissner et Foissner, 1988
Spathidiina Jank., 1980 (Spathidiidae, Homalozoonidae,
Pseudoholophryidae)
Didiniina Jank., 1978 (Didiniidae)
Lacrymariina Lipscomb et Riordan, 1990 (Lagynophryidae,
Lacrymariidae)
Trachelophyllina subordo n. (Trachelophyllidae,
Pseudotrachelocercidae)
Dileptina Jank., 1978 (Tracheliidae)
Enchelyina Foissner et Foissner, 1988 (Enchelyidae)
Отряд Helicoprorodontida ordo n. (Helicoprorodontidae)
При диагностике родов и семейств гапторид для из-
бежания многословных повторений здесь вводятся не-
сколько терминов. У многих родов вершина тела (ан-
терон = апекс) сужена и четко обособлена от тела
кольцевым сужением; этот отдел для краткости назы-
548
ALVEOLATA
вается «акрон» (acron). 1 la границе акрона и тела лежит
кольцо двойных кинетосом (дисом = дикинетид) —
это обособленные вершины каждой соматической ки-
неты (сомакинеты); кольцо можно обозначать терми-
ном «циркон» (circon). Часта цефализация — акрон
расположен на обособленном, вздутом отделе перед-
ней части тела («физон», fison или physon); пример —
обычный пресноводный вид Lacrymaria olor. Несколь-
ко сомакинет дифференцированы; по ходу рядов по
всему телу расположены одиночные кинетосомы («мо-
носомы», monosomes), но в верхних участках несколь-
ких рядов выявляются только парные кинетосомы
(«дисомы», disomes). Это специализированные участ-
ки с тактильной функцией — дисомы несут короткие
щетинки, сигнализирующие о контакте с субстратом
или с добычей; только одна кинетосома пары или обе
несут щетинки. Отделы сомакинет с дисомами и ще-
тинками можно назвать «тигмокинеты» (thigmokineti-
es), а их совокупность — «тигмон» (thigmon). Кинето-
сомы в продольных рядах (кинетах) соединены фиб-
риллами, но часто кинетосомы смежных рядов
выстраиваются строго координированно в виде попе-
речных, кольцевых или косых рядов — между ними
нет фибриллярной связи, это как бы вторичные ряды.
Для их обозначения мною был введен термин «адес-
мокинеты» (adesmokineties), но он не был замечен, и
все авторы применяют лишь введенный позже термин
«паратены» (paratenes); поэтому в сводке принят лишь
этот второй термин. Апикальное ресничное кольцо у
гапторид является именно такой паратеной — образо-
вано вершинами всех кинет. Ниже циркона часто вид-
на вторая обособленная зона — вершины всех рядов
тесно сближены, расположены косо к оси тела, в них
сближены вплотную все моносомы; этот отдел особо
выражен у форм, где он обособлен сжатием вершины
тела {Phialina), или у видов с очень редкими кинетосо-
мами вне кольца (Acropisthium). Для обозначения тако-
го отдела кинетома можно использовать термин
«фрагмон» (fragmon); кольцо может быть расположено
на физоне или на теле без его сужения.
Гапториды — в основном обитатели пресных вод,
болот, наземного мха (террофитона) и почвы, их мень-
ше в море; есть роды с пресноводными и морскими ви-
дами (например, Fuscheria, Spathidium, Lacrymaria,
Phialina, Didinium) и чисто морские роды — Chaenea,
Pseudotrachelocerca, Helicoprorodon и несколько дру-
гих. Сапробные хищники Chaenea размножаются в
массе в чашках Петри с пробами гниющих водорослей
с морской литорали, питаясь скутицидами типа Urone-
та. Большое число новых видов сейчас выявлено в
почвах, особенно в засоленных почвах южных конти-
нентов; отряд гапторид быстро укрупняется по мере
расширения района работ. В монографии цилиат из
почв Намибии (Foissner et al., 2002) около трети видов
относятся к гапторидам. Облигатно-симбионтный род
один — Branchioecetes — с жабер водяных осликов
(аселлот), гаммарид и речных раков. Второй (новый)
род такого типа найден мною в осадке пробы с фикси-
рованными камбаридами из США.
Если не считать аберрантных дилептусов, гаптори-
ды — переднеротые инфузории; рот округлый, оваль-
ный или щелевидный, в последнем случае может быть
сильно растянут (у Bryophyllum до постерона), но это
нетипично. Стенки рта и глотки без прочных палочко-
видных немадесм такого типа, как у хилодонелл и на-
ссулид, составлены экструсомами — трихоцистами
(токсицистами) разной формы, от длинных палочко-
видных до широких каплевидных или дубинковидных;
они выстреливаются при контакте с добычей. Посто-
янной глотки с прочными стенками обычно нет. Фор-
ма экструсом впервые учитывается сейчас для диффе-
ренцировки видовых групп (родов), ранее на них не
обращали должного внимания. Экструсомы вне глотки
лежат в цитоплазме и кортексе, поодиночке, пучками
или непрерывными полосами; иногда участки кортек-
са с ними способны к вытягиванию {Actinobolus, Le-
gendrea и близкие к ним роды из планктона и бентоса).
Выросты тела гапторид с токсицистами у вершины,
постоянные или сократимые, обозначаются далее но-
вым термином «токсофоры» (по аналогии с щупальце-
носными выростами тела сукторий «актинофорами»).
Такие формы, а также дидинииды рассматриваются
авторами гипотез о происхождении сукторий от гапто-
рид, а не от ринходид типа Hypocoma. От дисом и мо-
носом в верхней части кинет могут отходить фибрил-
лы; если кинетосомы тесно сближены, фибриллы идут
плотными тяжами (в тесных группах), например у Еп-
chelys gasterosteus, Е. geleii; так образуется подобие
постоянной глотки.
Сомакинеты продольные, простой топографии, но
в антесоме (передней половине тела) часть рядов пре-
образована в тигмокинеты — моносомы заменяются
здесь дисомами с короткими неподвижными щетинка-
ми. Число и топография рядов тигмона — также важ-
ный новый критерий для дифференцировки родов;
внешне сходные цилиаты могут принадлежать к раз-
ным родам только по типу тигмона, выявляемого при
импрегнации. Кольцо ресничек в основании апекса
(роговой зоны) обычно составлено дисомами, как у
простомат типа Holophrya или Urotricha; они несут
особо длинные реснички. Ниже их в антесоме могут
также дифференцироваться передние участки кинет —
моносомы расположены вплотную в коротких косых
рядах {Acropisthium, Lacrymaria) или в виде полос (Di-
leptus). Ядро простой формы, двойное {Trachelophyl-
lum), в виде ленты, цепочки или фрагментировано; это
важно для различения видов, но на родовом уровне
учитывается только для родов группы Dileptus. У Spat-
hidium, одного из крупных родов гапторид, выявлены
всевозможные типы ядер, но в диагнозах родов спати-
диид они не упоминаются.
Редукция цилиатуры — редкое явление у гапторид,
Didiniidae в этом отношении — исключение; частич-
ная редукция характерна для медленно движущихся
плоских Homalozoon. Сидячих (неподвижных) форм
нет, клетки подвижные в непрерывном поиске добычи;
исключение — некоторые лакримарии: трофонты мед-
ленно движутся или лежат на субстрате, размахивая
очень длинным растяжимым и гибким хоботком.
Своеобразен кортекс трахелофиллид — клетки цели-
ком покрыты слоем пластинок или перфорированных
сферул сложной формы; сейчас рамки семейства, ра-
нее крупного, ограничены только несколькими родами
с таким покровом. Питание детритом или чаще хищ-
ное. Симбиоз с зоохлореллами отмечается очень ред-
ко, нетипичен для гапторид; из паразитов можно отме-
ТИП CILIOPHORA. КЛАСС LITOSTOMATEA
549
тить сукторий рода Sphaerophrya, специфичных для
Myriokaryon.
В молекулярных филограммах гапториды пред-
ставлены родами Spathidium, Didinium, Homalozoon,
Loxophyllum и некоторыми другими; эта ветвь родст-
венна эндопаразитам млекопитающих (от прими-
тивных простомат до энтодиниоморф), другая ветвь
от основания (общего предка) идет к Metopus
(Lynn, Small, 1997), к спиротрихам (Lynn, 2003) или
к комплексу из 6 других классов (Shin et al., 2000).
Суктории группируются с гипостоматами внутри
класса Phyllopharyngea и неродственны гапторидам
типа Actinobolina и Didinium, от которых их выводит
часть авторов.
Примеры бентосных и планктонных гапторид при-
ведены на рис. 310, а—314, б.
Сем. Acropisthiidae W. Foissner
et I. Foissner, 1988
Соматическая цилиатура равномерная; цитостом
округлый, временный или постоянный, на вершине не-
большого конуса. Кинеты продольные, биполярные,
но все кинетосомы в них ориентированы в виде попе-
речных кольцевых паратен. Четко обособлен тигмон и
между ним и цирконом широкая кольцевая полоса из
тесно сближенных косых кинет — фрагмон.
Род Acropisthium Perty, 1852
Типовой вид Л. mutabileиз пресных вод (в даль-
нейшем биотоп указывается только для редких в отря-
де морских форм). Форма тела приспособлена к обита-
нию в толще воды в пелагиали; тело в виде вытянутого
волчка, заостряется кзади, реснички в немногочислен-
ных поперечных кольцах (паратенах); фрагмон широ-
кий; 3 тигмокинеты неравные по длине, очень четко
отделены от остальной цилиатуры; ядро овальное. Эк-
струсомы (далее применяется частый в ранней литера-
туре термин «токсицисты») простые, палочковидные,
короткие, отходят от апекса; корневые фибриллы, об-
разующие глотку, отходят от одной из кинетосом каж-
дой пары циркона.
Син.: Siagonophorus Eberhard, 1862 (типовой вид
S. euglenoides) и Dinophrya Lieberkuhn in Butschli, 1889
(типовой вид£>. lieberkuhni Butschli, 1889); эта синони-
мия принята всеми авторами.
Род Clavoplites Foissner, Agatha
et Berger, 2002
Типовой вид C. edaphicus Foissner et al., 2002,
также C. australiensis Foissner et al., 2002, C. terrenum
(= Enchelydium terrenum F., 1984). Тело вытянутое, ки-
нетосомы в рядах разрежены; акрон удлинен и изог-
нут; сбоку 4 короткие тигмокинеты неравной длины.
Корневые фибриллы (немадесмы) отходят от цирко-
на и от монокинет суженной передней части тела;
у апекса токсицисты необычной формы — короткие и
толстые, заострены к обоим концам. В принципе стро-
ение то же, что у Sikorops, но родовым отличием счи-
тается форма токсицист — впервые у цилиат этот
новый критерий рода используется Фойсснером для
гапторид.
Род Sikorops Foissner, 1999
Типовой вид S. woronowiczae по монотипии;
позже описаны S. minor и 5. namibiensis (Foissner et al.,
2002). Тело вытянутое, сужается к концам, с неболь-
шим числом кинет; акрон мелкий, токсицисты оваль-
ные или вытянутые, короткие, в акроне; фибриллы от-
ходят от всех передних кинетосом, образуя подобие
глотки. Тигмон — вершины 3 кинет неравной длины.
Края акрона исчерчены косыми фибриллами.
Род Chaenea Quennerstedt, 1867
Типовой вид С. vorax, частый на морской лито-
рали, легко разводится в культурах на мелких цилиа-
тах (Uronema, Cyclidium, Pseudocohnilembus) в чашках
Петри с добавлением кусков водорослей; могут загла-
тывать крупных цилиат. Описан ряд видов — С. teres
(Duj., 1841); С. minor Kahl, 1926; С. elongata (С. et L.,
1858); C. psammophila D., 1960; C. robusta K.,
1930; двухъядерная C. tesselata (K., 1933); пресновод-
ная C. limicola Lauterbom, 1901 и др. Узкие змеевид-
ные формы с очень гибким сократимым телом, неболь-
шим числом кинет (12—14) с относительно густой ци-
лиатурой; акрон очень мелкий, с несколькими
длинными палочковидными токсицистами; физон обо-
соблен незначительно, нечетко, несет слегка скошен-
ные ряды тесно сближенных моносом (фрагмон). Тиг-
мокинеты короткие — 3 ряда непосредственно у апек-
са, обе кинетосомы в парах несут щетинки. Ядро
обычно распыленного типа — десятки мелких фраг-
ментов по всему телу.
Сем. Fuscheriidae Foissner, Agatha
et Berger, 2002
Близки к акропистиидам, сходны по форме тела;
особи вытянутые, с небольшим числом продольных
кинет и небольшим акроном; физон не обособлен,
фрагмон также — нет кольца косых рядов спереди;
циркон четкий. В тигмоне несколько коротких тигмо-
кинет. Вероятно, основной признак семейства — обра-
зование длинных фибрилл не только дисомами цирко-
на, но и кинетосомами всех соматических рядов перед-
ней части тела; импрегнация протарголом выявляет
апикальный конус фибрилл (псевдофаринкс). Выделе-
ние семейства по такому признаку не кажется оправ-
данным.
Род Fuscheria Foissner, 1983
Типовой вид F. nodosa', хорошо изучены также
F. terricola Berger, Foissner et Adam, 1983; один вид
морской (F. marina Song), остальные почвенные и пре-
550
ALVEOLATA
Рис. 310,«. Haptorida.
Enchelyodon trotzi (A); Lagynophrya acuminata (Б, B)', Chaenea teres (Г. Д, JI); Ohliquostoma enchelyadonlides (E, Ж); Pleuroplites australis (3—К); деление то-
монта Cryptocatyon irritans (M—C). (По: Foissner, 1987b (Я); 2000b (3—K); Foissner et al., 1999 (/>, B); 2002 (£, Ж); Petz et al, 1995 (Г, Д, Л); Sikama, 1938
(JW-Q).
Fig. 310, a. Haptorida.
Fission of tomont of Cryptocaryon irritans (M—C).
сноводные. Короткое узкое каплевидное тело, немного
кинет, 2 неравные тигмокинеты с прямыми прочными
щетинками ниже рта; палочковидные токсицисты
плотной группой окружают рот в центре низкого акро-
на, образуя широкую корзинку вокруг узкой апикаль-
ной глотки; ядро не фрагментировано, бобовидное или
извитое. Кинетосомы разрежены, спереди незначи-
тельно сближаются; нет обособленного фрагмона; вы-
явлен аргиром в виде тончайшей сети многочислен-
ных ячеек между кинетами.
Род Actinorhabdos Foissner,
1984
Типовой вид A. trichocystifera по монотипии,
незначительно отличается от предыдущего рода; тело
удлиненно-овальное, ядро почковидное, кинет немно-
го, спереди 2 неравные тигмокинеты; фибриллы отхо-
дят от всех кинетосом вершины тела, образуя кониче-
ский пучок. Токсицисты не палочковидные — вздутые
в нижней половине, прямые узкие в верхней — это
основное отличие от фушерии.
Род Diplites Foissner,
1998
Типовой вид D. telmatobius F., 1998, также
D. arenicola Foissner et al., 2002. Мелкие узкие клетки с
овальным ядром, небольшим числом кинет; разрежен-
ные кинетосомы не образуют кольцевых поперечных
паратен; ядро почковидное, акрон небольшой, физона
нет и, что редко, нет сгущения кинетосом у апекса.
2 тигмокинеты неравной длины; щетинки расположе-
ны не только на их парных кинетосомах, но и на приле-
гающих моносомах короткого ряда ниже тигмона. Са-
мые верхние кинетосомы всех рядов и циркон образу-
ют небольшую фибриллярную воронку; у гапторид это
специализированные «oralized somatic kinetosomes» —
ТИП CILIOPHORA. КЛАСС LITOSTOMATEA
551
Рис. 310, б. Haptorida.
Pseudotrachelocerca trepida (А—Г); Enchefys geleii (Д—Ж); Fuscheria terricola (3, If); Paraspathidium fuscum (K, JT); Lagynophrya trichocystis (M, H). (По: Fois-
sner, 1981b (3, If, M, H); 2000b (Д, E, Ж); Petz et al., 1995 (А—Г); Лгамалиев, 1983 (К, Л)).
Fig. 310, 6. Haptorida.
вершины кинет выполняют стомогенную функцию,
ниже апекса служат для движения и не имеют длинных
корневых фибрилл.
Род Dioplitophrya Foissner, Agatha
et Berger, 2002
Типовой вид D. otti по монотипии, из почвы юж-
ной Африки. Незначительно вытянутое тело, С-образное
ядро, около 20 кинет с густой цилиатурой без паратен,
с особым сгущением кинетосом спереди; широкий
низкий акрон с мелким ртом; 3 неравных коротких ко-
сых ряда в тигмоне. Длинные фибриллы, сливаясь в
несколько конических пучков, отходят от циркона,
тигмона и соматических «стомогенных» моносом.
Основной признак рода — 2 типа токсицист, прикреп-
ленные к вершине акрона и образующие 2 воронки —
стандартные для семейства (длинные тонкие палочки с
небольшим вздутием на свободном нижнем конце), и
короткие толстые палочки, особо утолщенные (но не
круглые) в нижней половине.
Сем. Enchelyodontidae Foissner, Agatha
et Berger, 2002
Цилиндрические несократимые клетки с продоль-
ными кинетами и округлой или эллипсоидной кинетой
циркона; акрон хорошо развит, иногда вздутый; тиг-
мон с 3 рядами диплосом, левый ряд продолжается в
виде монокинеты, несущей щетинки в верхней части.
Нет фрагмона — обособленного кольца верхних фраг-
ментов кинет; моносомы спереди сгущаются без осо-
бого порядка.
Род Enchelyodon Claparede et Lachmann,
1859
Типовой вид E.farctus', к роду приписывали
большое число видов простомат с разной формой
тела, разной формой ядра, пресноводных и морских;
большинство их не изучено при импрегнации или
даны упрощенные неправильные схемы кинетома
(Е. camerounensis D., 1965; Е. fascinucleatus К., 1933;
552
ALVEOLATA
Рис. 311, a. Haptorida.
Bryophyllum tegularum (Л—Гу Epispathidium ascendens (Д, E); E. terricola (Ж, 3); Protospathidium muscicola (И—Л). (По: Fryd-Versavel et al., 1976 (A—Г); Fois-
sner, 1987a (Д— 3); Dragesco, Dragesco-Kerncis, 1979 (M—JI)).
Fig. 311, a. Haptorida.
E. laevis (Quennerstedt, 1867); E. sulcatus K., 1930;
E. vacuolatus D., 1960; E. elegans K., 1926). Кроме ти-
пового вида, кинетом хорошо изучен у большого чис-
ла видов, к примеру у новых видов Е. kenyaensis, Е. аг-
matides, Е. minutus (Foissner et al., 2002), E. nodosus
Berger et al., 1984, E. tratzi F., 1987. Тело вытянутое,
сужается к вершине, ядра разного типа, тигмон —
вершины нескольких кинет. Общий признак, при
всем разнообразии видов, полусферический или плас-
тинчатый закрытый акрон в отличие от Enchelydium.
Сохранение в составе рода аберрантного вида Е. me-
gastoma Foissner et al., 2002 мешает диагностике
рода — он уникален во всем, в частности имеет нети-
пично длинные для гапторид тигмокинеты (до эква-
тора) и обширную фибриллярную воронку, образо-
ванную длинным кольцом дикинетид (дисом) цирко-
на; кинеты многочисленные, ядро змеевидное. Для
этого вида здесь предлагается новый подрод Enchelyo-
don (Safrodon) Jank. subgen. n. с указанными призна-
ками.
Род Enchelydium Kahl,
1930
Типовой вид E. fusidens. По Аэшт, это гомоним
старинного названия нематод, но это можно игнориро-
вать, поскольку последнее не отражено в Zoological
Record; однако издание справочника началось в 1864 г.,
и он не должен был включать название Enchelydium
Ehr., 1836 (Nematoda). Каль предложил свой род для
5 видов — Е. fusidens К., 1930; Е. virens К., 1930;
Е. amphora (К., 1926); Е. labeo (Penard, 1922); Е. thecata
(К., 1926), обозначив первый вид как «typische Art» (не
Typus-Art), но это все же можно считать указанием
типа. Валидация гомонима должна быть узаконена ре-
шением ICZN.
Особенность рода — крупный, четко обособлен-
ный акрон, «цилиндрический и открытый»; это оп-
ределение непонятно, на рисунках видов этого и пре-
дыдущего родов акрон однотипный. Импрегнация
типового вида, вероятно, еще не была проведена;
примером рода считается вид Е. polynucleatum, но сей-
ТИП CILIOPHORA. КЛАСС LITOSTOMATEA
553
Рис. 311, б. Haptorida.
Spetazoon australiense (А, Б); Trachelophyllum apiculatum (B—Ж)', Lacrymaria lagenula (3, И); Pelagolacrymaria moserae (К). (По: Foissner, 1994c (А, Б)', Song,
1994 (B—Ж)', Petz et al., 1995 (3, И); Foissner et al., 1999 (K)).
Fig. 311, 6. Haptorida.
час он перенесен в состав рода Enchelys другого се-
мейства. Еще одна сложность с этим родом — рань-
ше не находили «ротовых дикинетид» (дисом) и
поэтому род считали близким к архиастоматам из
пищевого тракта млекопитающих; но в монографии
почвенных цилиат Намибии говорится о том, что цир-
кон «составлен кинетидами, вероятно дикинети-
дами» (Foissner et al., 2002). Примером рода является
Е. blattereri Foissner et al., 2002 — массивные особи
с полимеризацией кинет, нетипично длинным тиг-
моном; крупный акрон с широкой полостью кажет-
ся постоянно открытым, но он затянут тонкой плен-
кой.
Род Pseudoenchelys Tucolesco, 1962, с одним видом
Ps. armata считается синонимом предыдущего рода,
но вид может быть валидным; это мелкие вытяну-
тые особи с извитым ядром и широким низким ак-
роном, открытым и окруженным кольцом длинных
ресничек.
Сем. Enchelyidae Ehrenberg,
1838
Включалось Фойсснером в подотряд Enchelyina,
вследствие особой организации монокинет фрагмона.
В списке Линна (Lynn, 2002) 18 родов — это смесь
изученных и неизученных, валидных и сомнительных
родов разных групп; если ограничиться родами с имп-
регнированными видами, в данный момент можно
включить не больше 5 родов — Enchelys, Apoenchelys,
Obliquostoma, Papillorhabdos и, вероятно, Foissnerides.
Остальные родовые названия приведены в конце гла-
вы в списке родов неясного положения.
Семейство включает удлиненные мешковидные
цилиаты с плавным сужением к вершине, несущей ак-
рон; сбоку 3—4 тигмокинеты без продолжения ще-
тинок на монокинетах. Циркон, если имеется, не-
различим, не имеет вид четкого обособленного коль-
ца дисом — ниже акрона сгущаются кинетосомы
(моносомы) всех рядов и образуют кольцо из слегка
554
ALVEOLATA
Рис. 312, a. Haptorida.
Myriokaryon lieberkuhni (A—Г); Homalozoon vermiculare (Д—M); Helicoprorodon gigas (H). (По: Foissner, 2003 (A—Г)', Dragesco, 1966b (Ж—ЛУ); Dragesco et al.,
1974 (Д, £); Al-Rasheid, 2000a (//)).
Fig. 312, a. Haptorida.
скошенных рядов. Фибриллы отходят от этих «сто-
могенных» фрагментов, соединяясь в виде глубо-
кого конуса.
Род Enchelys Muller, 1773
Типовой вид Е. farcimen; в первоисточникеЕп-
chelis, но это название было произвольно видоизмене-
но следующими авторами, по Аэшт в 1827 г., по моему
каталогу в 1817 г. Название Encheleis Scopoli, 1777
предложено для замены рода Enchelis, что не было ни-
кем принято. Этот род был одним из крупнейших сре-
ди цилиат, включал множество разных видов не толь-
ко простомат, но и других современных отрядов; типо-
вой вид пока не импрегнирован, и «представителями»
рода служат другие виды, например Е. gasterosteus
Kahl, 1926; Е. vermiformis F., 1987; хорошо изучен-
ный вид Enchelyodon polynucleatus сейчас переведен
в состав Enchelys. Примеры видов — Е. marina (Me-
unier, 1910); Е. pectinata К., 1930; Е. simplex К., 1926
и др.
Е. longitricha Foissner et al., 2002. Некрупный вид с
небольшим числом кинет, мелким акроном с неболь-
шой воронкой в центре; ядро извитое; тигмон с 3 ряда-
ми разной длины с длинными и короткими щетинками;
у вершины тела не обособлен циркон, кинетосомы
сближены без очень четкого обособления (без фрагмо-
на) и образуют короткие ряды, слегка отклоненные
вбок.
Е. gasterosteus. Вид с широким акроном; токсицис-
ты палочковидные, без шарика на нижнем конце (от-
личие от Fuscheriidae). У этого вида также не удалось
различить кольцо дисом; вершины кинет отогнуты
вбок без отделения от соматических кинетосом и обра-
зуют фибриллярную корзинку.
Род Apoenchelys Foissner, Agatha
et Berger, 2002
Типовой вид A. bamforthv, узкое вытянутое
тело, 2 ядра, 2 длинные тигмокинеты, широкий низкий
акрон с центральной воронкой и исчерченной стенкой;
немного кинет; у вершины кинетосомы незначитель-
но сближаются без четких обособленных рядов и
дают начало фибриллярной воронке; верхние к^не-
тосомы всех кинет не образуют четкого кольца дисом
ТИП CILIOPHORA. КЛАСС LITOSTOMATEA
555
Рис. 312, б. Haptorida.
Mesodinium pulex (Л); M. rubrum (Myrionecta rubra) (Б—Г); Myrionecta sp. (E, Ж); Mesodinium pupula (Д). Родовые признаки планктонных гапторид — Meso-
dinium (3)', Askenasia (И)\ Myrionecta (К); Rhabdoaskenasia (Л). (По: Czapik, Jordan, 1976 (A)', Fenchel, 1968 (Б—Г); Petz et al., 1995 (£, Ж); Dragesco, 1963a (Д);
Krainer, Foissner, 1990 (3—Л)).
Fig. 312, 6. Haptorida. Fig. 3—JJ show distinctive features of planctonic haptorids.
или моносом, фактически нет циркона. Основное от-
личие от Enchelys — 2 ряда в тигмоне Apoenchelys,
3 ряда у Enchelys.
Род Obliquostoma Foissner, Agatha
et Berger, 2002
Типовой вид О. enchelyodontides, также О. па-
mibiense Foissner et al., 2002 — почвенные виды из На-
мибии. Тело вытянутое, ядро извитое; немного сома-
кинет, 2 тигмокинеты, скошенная вниз воронка акрона
неравной толщины с наружным рельефом (исчерчена
косыми линиями); имеется циркон, но нетипичный, ве-
роятно, с одной стороны образован дисомами, с дру-
гой — чередуются моносомы и дисомы; вершины ки-
нет со сгущением моносом, эти сегменты отогнуты
вбок. Токсицисты эллипсоидные или с сужением
сверху.
Род Papillorhabdos Foissner, 1984
Типовой вид Р. multinucleatus F., 1984, также
Р. carchesii F., 1984. Тип рода с овальным телом, боль-
шим числом кинет, фрагментированным ядром, с
4 длинными тигмокинетами, до трети длины тела; у
рта кинетосомы в рядах особо сгущаются, эта зо-
на дает корневые фибриллы псевдофаринкса; крайне
верхнее кольцо не обособлено четко от остальных по
расположению и структуре; токсицисты по всей клет-
ке, двух типов.
Род Foissnerides Song et Wilbert,
1989
Типовой вид F. heliophagus — тело вытянутое,
овальное; четкий физон отграничен от тела кольцом
дисом; очень длинная фибриллярная глотка с неболь-
шим ртом; дисомы с парными щетинками не собраны в
несколько четких рядов, как обычно у гапторид, а рас-
1
556
ALVEOLATA
Рис. 313, a. Haptorida.
Askenasia sp. (A); A. chlorelligera (Б, By.Liliimorpha viridis (Г—Ж); Cyclotrichiuni viride (3, И). (По: Krainer, Foissner, 1990 (A—В); Оболкина, 19956 (Г-Ж)).
Fig. 313, a. Haptorida.
сеяны примерно по 10 сомакинетам без особого поряд-
ка, сгущаются у вершины кинет; в остальном стандар-
тные гапториды.
Сем. Lagynophryidae Puytorac, 1994
Новое семейство предложено только для одного
рода Lagynophrya с краткой характеристикой — «рото-
вая зона в виде апикального вздутия (конуса), который
может вытягиваться в трубку, с 2 типами токсицист;
форма тела овальная; немадесмы раздвоенные (bifur-
ques); мукоцисты 2 типов». Пример — рисунок Lagy-
nophrya fusidens (это L. acuminata'). В каталоге Линна
(Lynn, 2002) этого семейства нет.
точно известен у 2 видов, тип рода не изучался; имп-
регнация по Шаттону (L. halophila, L. maxima) не дает
точной картины кинетома и не выявляет трихоцисты,
важные для диагностики родов. Клетки некрупные,
овальные или слегка вытянутые, изогнутые, с кониче-
ским акроном (L. acuminata) или с плоским акроном
обычного типа, это не признак рода; ядро овальное, ки-
нет немного, тигмон с 3 неравными рядами щетинок;
четкий классический циркон (кольцо дисом) — у
L. acuminata, возможно, есть и у других видов. Прямые
фибриллы, напоминающие немадесмы, отходят от
циркона; вероятно, нет фрагмона и нет отходящих от
него фибрилл. Часть видов с веретеновидными токси-
цистами у рта и короткими мукоцистами в рядах по
всему кортексу.
Род Lagynophrya Kahl,
1927
L. mutans Kahl, 1927 (типовой вид); L. acuminata
Kahl, 1935; L. halophila Kahl, 1930; L. maxima Burkovs-
ky, 1970; L. pumilio Mansfeld, 1923; L. contractilis K.,
1928 и другие пресноводные и морские виды. Кинетом
Сем. Pleuroplitidae Foissner,
1996
Семейство включает 2 рода с пучком экструсом
(токсицист) спереди сбоку на «вентральной» стороне;
тигмон включает немного изоморфных или группу ге-
тероморфных кинет.
ТИП CILIOPHORA. КЛАСС LITOSTOMATEA
557
Рис. 313, б. Haptorida. (По: Foissner et al., 1999).
Rhabdoaskenasia minima (А, Б); Askenasia sp. (5); A. acrostomia (Г—E).
Fig. 313, 6. Haptorida.
Род Pleuroplites Foissner,
1988
Типовой вид P. australis — мелкие каплевид-
ные формы с узким апексом, небольшим акроном, не-
сколькими кинетами с редкими ресничками; короткие
прямые токсицисты с незначительным вздутием одно-
го конца локализованы в основном в боковом пучке
спереди и рассеяны по телу. Четко обособлен цир-
кон — кольцо диплосом; тигмокинеты длинные, в них
чередуются моносомы с нормальными длинными рес-
ничками и дисомы с короткими прямыми парными ще-
тинками — «гетероморфные» ряды, не встречавшиеся
у перечисленных выше родов.
Род Pleuroplitoides Foissner,
1996
Типовой вид Р. smithi по монотипии; наход-
ка второго рода такого типа в почвах и террофито-
не Австралии дала возможность обособить их в от-
дельном семействе. Дорсальные щетинки тигмона в
2 изоморфных рядах — только ряды щетинок без
ресничек; пучок токсицист не связан с апикальной
воронкой.
Сем. Pseudotrachelocercidae Song,
1990
Тигмон сложной формы — до сих пор встреча-
лись ряды диплосом в верхних отделах 2—4 сома-
тических монокинет; у единственного рода и вида дан-
ного семейства таких рядов нет, одна из сомакинет
у вершины переходит в ряд дисом и щетинок, кото-
рый по направлению к вершине дезорганизуется и
превращается в полосу разрозненных дисом, ори-
ентированных поперек тела или под углом; акрон
не выражен.
Род Pseudotrachelocerca Song,
1990
Типовой вид Trachelocerca trepidaKahl, 1928 —
обычный вид в морской литорали, исключенный из
состава кариореликтид по форме тела и ядрам (яд-
ро одно, вытянутое, полиплоидное, способное к де-
лению) и включавшийся в роды Chaenea и Enchelyo-
don.
Крупные (до 100—150 мкм) узкие вытянутые клет-
ки с щелевидным ртом, с особым сужением слегка со-
кратимой антесомы; ядро извитое, лентовидное; кине-
558
ALVEOLATA
Рис. 314, a. Haptorida.
Monodinium balbianii (А, В); M. alveolatum (5); Didinium gargantua (Г.ДУ, D. nasulum (Ж-И). (По: Petz ct al., 1995 (f,Z0; Foissner et al., 1999 (A—В,Е—И)).
Fig. 314, a. Haptorida.
ты многочисленные, у вершины тела овальный циркон
с дисомами, ниже — кольцо четко обособленных фраг-
ментов кинет с тесным сгущением кинетосом (фраг-
мон); один из соматических рядов переходит в линию
дисом со щетинками и выше дезорганизуется, не имеет
четкой конфигурации — в волнистой линии или се-
рии разрозненных дисом. Возможно, вид идентичен с
Enchelyodon striatus Gourret et Roeser, 1886.
Сем. Pseudoholophryidae Berger,
Foissner et Adam, 1984
Апикальная зона видоизменена — акрон очень
мелкий, щетинки тигмона не в продольных рядах, ко-
торые у части гапторид могут достигать половины
длины тела; щетинки расположены в верхней части
или даже почти по всей длине нескольких или многих
сомакинет вперемежку с обычными ресничками; сома-
кинеты слегка спиральные.
Род Pseudoholophrya Berger, Foissner
et Adam, 1984
Типовой вид P. terricola Berger et al., 1984, так-
же P. minuta Foissner et al., 2002. Удлиненно-овальные
клетки с четкой спирализацией кинет; мелкий акрон с
вытянутыми токсицистами и фибриллярной корзин-
кой, образованной цирконом; последний состоит из
дисом; сближенные кинетосомы у апекса не образуют
кольцо фрагментов (фрагмон). У обоих видов наруше-
на топография многих кинет — в антесоме (Р. terrico-
la) или до нижней трети тела (Р. minuta) моносомы че-
редуются в беспорядке с дисомами, нормальные длин-
ные гибкие реснички с парами коротких неподвижных
щетинок; особо контрастна картина у второго вида,
имеющего непропорционально длинные реснички.
Род Ovalorhabdos Foissner, 1984
Типовой вид О. sapropelica — мешковидное
тело, полимеризация спиральных кинет, щелевид-
ный рот на вытянутом узком акроне, четкая линия ди-
ТИП CILIOPHORA. КЛАСС LITOSTOMATEA
559
Рис. 314, б. Haptorida. (По: Foissner et al., 1999).
Actinobolina smalli (Б, Г); Belonophrya pelagica (А, В, Д, E).
Fig. 314, 6. Haptorida.
сом (циркон) вдоль основания акрона. Как нередко
у цилиат с большим числом кинет, не все ряды дости-
гают акрона, часть укорочена, в одном участке обра-
зуется шов (секанта); тигмокинеты отсутствуют или не
замечены.
Род Paraenchelys Foissner,
1993
Типовой вид Р. spiralis F., 1983 (водный вид),
также Р. wenzeli Foissner et al., 2002 и почвенные виды
Р. terricola F., 1984; P.pulchra Foissner et al., 2002;
P. brachyarmata Foissner et al., 2002; P. brachyoplites
Foissner et al., 2002. Каплевидные или вытянутые виды
с мелким акроном, слегка извитыми кинетами, обычно
многочисленными; токсицисты овальные или с длин-
ным прямым отростком, подвешены на акроне и сво-
бодно лежат в цитоплазме. Четких тигмокинет нет, но
можно заметить отдельные пары кинетосом и участки
дезорганизации многих кинет в верхней половине
тела, где дисомы тигмона чередуются с соматически-
ми моносомами. По ходу рядов токсицисты могут раз-
личаться по длине, тоже в беспорядке.
Род Songophrya Foissner,
2003
Типовой вид 5. armata F., 2003. Это название
предложено для нетонима (неверного определения)
вида Holophrya еттае Bergh, 1896 sensu Song et Wil-
bert; позже вид включался в состав рода Pseudopro-
rodon, ныне ликвидированного ввиду идентичности
типовых видов у Prorodon и Pseudoprorodon. Род, ве-
роятно, относится к сем. Pseudoholophryidae; «настоя-
щая» Н. еттае — тип нового рода Berghophrya в се-
мействе мириокарионид.
Типовой вид имеет небольшой симметричный
округлый апикальный акрон с кольцом дикинет вокруг
основания (циркон); кинеты полимеризованы, ряды и
кинетосомы в них расположены теснее слева, разреже-
ны справа. Значительная часть левых кинет несет ди-
сомы щетинок, справа их нет, только моносомы. Не
обособлены фрагменты вершин кинет — нет фрагмо-
на. Разрозненные пучки токсицист расположены вдоль
вентрального края тела.
560
ALVEOLATA
Сем. Trachelophyllidae Kent, 1882
Ранее семейство включало серию родов по типу ки-
нстоми, по сейчас оставлены только гапториды, все
тело которых покрыто слоем, ранее считавшегося му-
козным; с применением электроскана выяснено, что
эго скопление мельчайших телец сложной формы —
пластинки, полусферы или сферы с фенестрами (от-
верстиями) и сложным рельефом стенок; форма их ха-
рактерна для разных видов. Названия для них нет,
можно предложить термин «феносомы» (phenosomes),
от слова «фенестры». Включенные сюда роды различ-
ны по форме тела и цилиатуре, но обычно имеют по 2
разрозненных ядра, делящихся независимо при моно-
томии; это и наличие феносом говорит об их тесном
родстве.
Род Trachelophyllum Claparede
et Lachmann, 1859
Типовой вид Т. apiculatum (Perty, 1852 in Trac-
helius), также T. pusilium C. etL., 1858; T. biacuminatum
Foissner et al., 2002; T. chilense Burger, 1906; T. clava-
tum Stokes, 1886; T. falciforme Penard, 1922; T. fontinale
Penard, 1922; T. lamella Blochmann, 1895; T. tachyblastum
Stokes, 1884; T. triangulatum Tucolesco, 1962; T. vesti-
tum Stokes, 1884 и другие виды; не все виды достовер-
ные. Хорошо изучен тип рода и Т. attenuatum Tucoles-
co, 1962— виды с острым и тупым высоким акроном,
небольшим числом кинет, с четким цирконом; верши-
ны 2 рядов превращены в тигмон обычного типа; к уз-
кому акрону прикреплен пучок длинных палочковид-
ных токсицист, другие рассеяны в цитоплазме. Особи
малоподвижные, скользят по дну на одной стороне
тела. Размеры типового вида по разным авторам от 130
до 350 мкм; Т. sigmoides К., 1926 достигает 500 мкм.
В монографии почвенных цилиат Намибии (Fois-
sner et aL, 2002) дано детальное описание Т. apicula-
tum, новых видов Т. africanum, Т. pannonicum, Т. costa-
ricanum и новых родов семейства, выделяемого в но-
вый подотряд Trachelophyllina.
Род Lepidotrachelophyllum Nicholls
et Lynn, 1984
Типовой вид L.fornicis-, этот крупный (до
350 мкм), тщательно описанный вид все же не новый, в
принципе не отличается от рисунка Т. lineare Lepsi,
1960; род тоже не новый, не может быть сохранен —
нет особых отличий от типичных трахелофиллов.
L. fornicis — веретеновидные клетки с 2 разрозненны-
ми ядрами, крупной вакуолью, узкой шейкой; все тело,
даже акрон, покрыто сферическими феносомами в не-
скольких слоях; акрон выпуклый, с полярной шапоч-
кой; четко обособлено кольцо дисом (циркон); среди
30 рядов очень длинных ресничек четко обособлены
2 длинных ряда щетинок равной длины с моносомами
(вероятно, ошибка, эта зона обычно состоит из дисом).
Ценность представляет детальное изучение строения
(общий вид, ультраструктура) и химии феносом у это-
го вида.
Род Epitholiolus Foissner, Agatha
et Berger, 2002
Типовой вид Lacrymaria chilensis Burger, 1906.
Известные пока трахелофиллиды имеют не менее
4 разных структурных типов «эпикортикальных чешу-
ек» (феносом); это используется в диагностике видов и
родов по фотографиям в электроскане. Данный род
имеет чешуйки 3-го типа; другие родовые признаки —
два ядра не удалены в разные участки тела, находятся в
середине с микронуклеусом между ними (редкий слу-
чай амфилептидного ядра у гапторид); конъюгация не
полярная, а краевая (эти 2 признака едва ли родового
ранга). Тип рода — узкие тонкие клетки с крупным ак-
роном, небольшим числом кинет, редкими длинными
ресничками; две тигмокинеты неравны по длине; ток-
сицисты двух типов, длинные и короткие. Слой фено-
сом очень тонкий и не показан на рисунках автора
вида Бюргера, принявшего вид за лакримарий; феносо-
ма относительно простая — пористый круг в основа-
нии и 4 дуги к вершине.
Род Bilamellophrya Foissner, Agatha
et Berger, 2002
Типовой вид В. australiensis, В. etoschensis,
В. hawaiiensis (Foissner et al., 2002) с веретеновидным
телом и толстым слоем феносом. Тип рода с 3 рядами
щетинок, коротких в 2 рядах дисом и длинных в спе-
циализированном ряде моносом слева; 2 ядра далеко
удалены к краям тела; токсицисты и фибриллы цирко-
на образуют правильную узкую глотку; фрагмона нет.
Покровный слой необычный — на феносомах I типа
расположен слой феносом II типа, первые с плоской
дисковидной решеткой в основании, вторые с вогну-
той решеткой и высоким конусом; величина структур
около 1.6 и 2 мкм.
Род Spetazoon Foissner, 1994
Типовой вид 5. australiense — стандартный
для группы внешний облик и кинетом; ядра удалены
одно от другого; 2тигморяда почти равной длины,
без дополнительных рядов щетинок; акрон с импрег-
нируемой шапочкой, закрывающей рот. Феносомы в
многослойной массе, особого типа — сферы с мелко-
ячеистым основанием и крупными правильными гек-
сакональными фенетрами. Не заметно клея или фиб-
рилл, удерживающих их вместе у подвижных цилиат,
И они должны разлетаться при движении ресничек, но
все же слой постоянно сохраняется. Ранние авторы ча-
сто не рисовали слоя, вероятно принимали его за грязь
на теле цилиат; без электроскана заметить отдельные
феносомы и изучить их структуру невозможно.
Фойсснер (Foissner et aL, 2002) использует данные
о трахелофиллидах для анализа эндемизма свободных
цилиат — эта проблема до сих пор дискутируется; от-
крыто еще 3 новых рода Trachelophyllidae в Южной
Америке (Венесуэла и Аргентина); большинство родов
семейства отсутствует в Европе, и современное их рас-
пространение совпадает с историей распада южного
ТИП CILIOPHORA. КЛАСС LITOSTOMATEA
561
гиперконтинента (теория Гондваны — Лавразии). По
типу феносом можно с абсолютной точностью опреде-
лить виды и роды группы, и их эндемизм бесспорный.
Сем. Homalozoonidae Jankowski, 1980
Включает только один род с нетипичной для гапто- I
рид морфологией — в пробах из озер и болот можно
найти длинных плоских лентовидных цилиат с мед-
ленным движением; края тела волнистые, гибкие; ядро
в виде длинной цепочки мелких нодул; вдоль края тела
много сократимых вакуолей. Перистом внешне, как у
спатидиид, но при импрегнации цилиатура и фибром
резко различаются. Характерна значительная редук-
ция кинет — при больших размерах (до 650 мкм) нет
полимеризации кинет — всего около 20 сомакинет и
краевой ряд щетинок выявляются на дорсальной сто-
роне тела, 5 сомакинет и 2 ряда щетинок на венте;
ряды щетинок продолжаются далее вниз рядами моно-
сом. Изогнутая полоса дисом огибает широкий акрон,
в толще которого расположен плотный пучок прямых
многочисленных токсицист. Нет кольца фрагмона, но
кинетосомы верхних отделов сомакинет сближены.
Род Homalozoon Stokes, 1890
Типовой вид Litonotus vermicularis Stokes, 1887
(Н. vermiculare) хорошо изучен современными авто-
рами при импрегнации протарголом; вид пресновод-
ный, но выносит соленость до 7.5 %о. Вид имеет 5 ря-
дов кинет без ресничек (3 дорсально, 2 латерально) и
18—20 рядов с ресничками вентрально. Фибриллярная
глоточная корзинка хорошо видна, тяжи рассеяны по
телу и собраны в осевой стержень; у рта скопление
пигмента.
Син.: Leptodesmus Zacharias, 1903, типовой вид
L. tenellus (название рода одновременно синоним и го-
моним); в рисунке Захариаса легко узнать типичных
Н. vermiculare.
Craspedonotus Kahl, 1926, типовой вид С. vermicu-
laris Kahl, 1926; вероятно, Каль таким образом обозна-
чил перенос вида Стокеса в другой род. Это название
также гомоним.
Craspedonotana Strand, 1928 — новое название для
замены предыдущего, ненужное, так как есть пригод-
ное название Homalozoon.
Вид Chaenia crassa Maskell, 1887 — синоним вида
L. vermicularis.
Род Flexiphyllum Conn in Conn et Edmondson, 1918,
типовой вид F. elongatum. Это название пропущено в
каталоге родов цилиат Аэшт. Конн цитирует статью
1905 г. с этим родом {Flexiphyllum elongatum Conn,
1905), но там вид зарисован с пометкой «new genus»
без видового и родового названия, поэтому датируется
здесь 1918 г. (Conn, 1905; Conn, Edmondson, 1918). Вид
найден в бентосе прудов в Коннектикуте (США);
это длинные лентовидные формы, предпочитающие
скользить по субстрату, реже (с изгибами тела) плыву-
щие в воде; строение не изучено; рисунок, как Н. ver-
miculare, но длиннее; диагноз краткий — «Длинные
лентовидные формы без хоботка (в отличие от Trache-
lophyllum)-, рот терминальный, с отчетливой глоткой.
Ядро в задней части тела (это пищевая масса, не ядро);
ряд мелких вакуолей — вдоль одной из сторон тела»
(Conn, Edmondson, 1918). Название рода уходит в си-
нонимику.
Виды Н. caudatus Kahl, 1935 и Н. flexile (Stokes,
1890) соответствуют диагнозу рода. Тяжелую пробле-
му для систематика представляют другие виды Homa-
lozoon — они не изучены должным образом и кажутся
не соответствующими плану строения типового вида.
У Н. minutus Dragesco, 1966 тело бочонковидное, с не-
сколькими овальными ядрами; этот вид лишен рядов
щетинок; при импрегнации не изучен. Н. multinuclea-
tus Dragesco, 1966 — вытянутые формы с распылен-
ным ядром; найдены в пробе с типичными Н. vermicu-
lare', вдвое мельче, только с одной вакуолью.
Сем. Lacrymariidae Fromentel, 1876
Тело вытянутое, узкое, с очень четким обособлени-
ем трех отделов (тело, физон, акрон); у части видов
тело растяжимое, вытягивается в длинный подвижный
хоботок. Сомакинеты спиральные, тигмон нечеткий —
вместо длинных рядов дисом у вершины многих кинет
местами расположены дисомы с длинными щетинка-
ми. Акрон мелкий, с длинными токсицистами (псевдо-
фаринксом), отделен сужением с кольцом дисом (цир-
коном) от вздутия (физона) с тесно сближенными спи-
ральными рядами моносом. Бентос пресных вод,
почва, в планктоне род Pelagolacrymaria', нередки в
море. Семейство указано как новое (Lacrymariidae Fo-
issner, 1983), но позже восстановлен приоритет Фро-
ментеля (Lacrymarina Fromentel, 1876).
Род Lacrymaria Bory de St. Vincent, 1826
В оригинале—Lacrimatoria', название произвольно
изменено Эренбергом и новое название принято в по-
следующей литературе. Типовой вид Lacrimatoria
olor (Muller, 1786) (название вида часто приписыва-
лось Эренбергу); это синоним вида Brachionus proteus
Pallas, но это название не применялось и сейчас не мо-
жет быть восстановлено.
Тип рода и близкие виды многократно изучались
при импрегнации, но только в новейших работах выяв-
лено наличие и точное положение щетинок тигмона.
Тело веретеновидное, заострено кзади, очень гибкое,
может скручиваться; ядра разного типа (от сферы до
распыленного), у лакримариид это различие не ис-
пользуется для выделения подродов или родов; перед-
няя половина тела у L. olor сильно растяжимая; особи
часто лежат на субстрате или медленно движутся, вра-
щая во все стороны тонкий длинный извитой сократи-
мый хоботок в поисках добычи. Кинеты немногочис-
ленные, продольные, их верхние части несут дисомы
со щетинками, около 5 пар в каждом ряду. На физоне
тесно сближенные спиральные ряды моносом; выше
циркон с дисомами. Токсицисты прямые, образуют уз-
кую глотку.
Описано много видов с разным типом ядер, числом
и положением вакуолей, числом кинет, с разной сте-
36 Зак. №4163
562
ALVEOLATA
пенью растяжимости шейки; все виды с несократимым
телом нужно перенести в состав старинного рода Phia-
lina, восстановленного Фойсснером. Кроме L. olor, ти-
пичные лакримарии — L. marina К., 1933; L. longissi-
ma D., 1966; L. pulchra Wenzel, 1953; L. coronata C. et
L., 1858; L. lagenula K., 1927; L. australis Foissner et
O’Donoghue, 1990; L. versatilis (M., 1786); L. kahli (D.,
1954) и др.; большинство видов относится к Phialina, а
у части сократимость-не проверялась. Есть и промежу-
точные формы с небольшой сократимостью шейки.
Род Tongitheca Jankowski gen. n.
Типовой вид Lacrymaria vaginifera Song et Wil-
bert, 1989 (T. vaginifera comb. n.). Внешний вид, как у
L. olor, веретеновидное тело переходит в очень длин-
ную тонкую шейку, способную к скручиванию и к пол-
ному сокращению; ядро овальное. Найдены в прес-
новодном перифитоне; секретируют тонкую ракови-
ну, повторяющую очертания тела. Это единственный
раковинный вид гапторид, поэтому желательно обо-
собление на уровне подрода или рода. Это не аберра-
ция — особи часто встречаются в обрастаниях на пред-
метных стеклах и всегда в домиках. Кинеты немного-
численные, особи некрупные; четко обособлен физон с
густыми ресничками; при полном сокращении особь
лежит на дне раковины.
Род Pelagolacrymaria Foissner, Berger
et Schaumburg, 1999
Типовой вид P. moserae Foissner et al., 1999,
также P. rostrata Kahl, 1935 в пресноводном планкто-
не. Тело бочонковидное — широкоовалыюс, ядро
сложной формы (цепь нодул) у Р. moserae, овальное у
Р. rostrata. Сомакинеты спиральные на теле и физоне;
длинных рядов тигмокинет нет, ряды состоят из моно-
сом. В верхней части тела 4 кольца дикинет — апи-
кальное, в сужении физона и 2 кольца ниже, несущие
ресничку и щетинку в каждой паре кинетосом (в дисо-
ме). Это видоизмененный тигмон, не встречающийся у
бентосных форм. Акрон необычный — широкий и вы-
тянутый, в виде длинного продольно исчерченного ро-
струма; внутри глотка с длинными токсицистами; кор-
текс рельефный, со спиральными ребрами на теле и
физоне. Вид Р. rostrata валидный, если правильно за-
рисовано почковидное ядро.
Род Phialina Bory de St. Vincent, 1824
Син.: Stravolaema Bory de St. Vincent, 1824 (типо-
вой вид S’. echinorhynchus по монотипии). Типовой вид
Phialina — Enchelis pupula Muller, 1773 по указанию
Фойсснера; Аэшт считает это неправильным, так как
такого вида нет в первоописании рода.
Эренберг (Ehrenberg, 1838) из 5 видов оставил в со-
ставе Phialina только Ph. hirundinoides, сведя вид в си-
нонимы Ph. vermicularis {Trichoda in Muller); поэтому
данный вид обозначается здесь типовым для рода. Под
этим названием вид был принят позже частью авторов;
различался и второй вид с зоохлореллами Ph. viridis,
поэтому нельзя сказать, что род, восстановленный
лишь недавно, ранее никем не признавался.
Общий признак видов рода — несократимое тело,
неспособность к образованию растяжимой гибкой по-
движной шейки; тело цилиндрическое, с четким физо-
ном и акроном; ядро обычно простой формы, овальное
(у лакримарий встречается распыленное ядро). Кине-
ты не спиральные или слегка изогнутые, в верхней час-
ти у Ph. minima несут триплеты — щетинку и 2 рес-
нички в каждом. Циркон один, на границе с акроном.
Экструсомы, как у лакримарий, в виде длинных пало-
чек. Стандартный набор дисом — у Ph. jankowskii', ар-
гиром в виде мелкоячеистой сети.
При восстановлении рода включены виды Ph. pu-
pula (тип рода); Ph. macrostoma F., 1983; Ph. lata (Vu-
xanovici, 1962); Ph. conifera (Burkovsky, 1970); Ph. ver-
micularis (M., 1773); Ph. vertens (Stokes, 1885); Ph. co-
ronata (C. et L., 1859); Ph. minima (Foissner et al., 2002);
Ph. cylindrica (Vuxanovici, 1959); Ph. foliacea (Vuxano-
vici, 1962); Ph. macrostoma F., 1983; Ph. jankowskii F.,
1984. Можно добавить Ph. decussata (Tucolesco, 1962);
Ph. crassa sp. n. (= Lacrymaria caudata f. crassa Kovalc-
huk, 1980); Ph. lanceolata (Gelei, 1954); Ph. conifera
comb. n. (Lacrymaria conifera Burkovsky, 1970). В опре-
делителе псаммобионтов Карея (Carey, 1992) из 28 ви-
дов Lacrymaria только 2 принадежат к этому роду
(L. acuta К., 1933, L. kahli D., 1954), остальные виды —
фиалины: Ph. trichocystus D., 1953; Ph. sapropelica К.,
1928; Ph. rotundata D., 1954; Ph. multinucleata D., 1954;
Ph. monilata Agamaiev, 1966; Ph. minuta D., 1963;
Ph. ovata Burkovsky, 1970; Ph. maurea D., 1965 и др.
Род Phialinides Foissner, 1988
Типовой вид Ph. australis F., 1988, также Ph. ar-
matus Foissner et al., 2002. Узкие змейковидные формы
с небольшой сократимостью; немного кинет, в их верх-
ней части группы кинетосом в триплетах, в каждом
щетинки и реснички. Акрон четкий, со своеобразными
токсицистами — длинные палочки утолщаются к ниж-
нему концу. На границе акрона и физона стандартное
кольцо дисом, под физоном второе кольцо; фактиче-
ски имеется два циркона, и это основной признак рода.
Необычно и ядро, распыленное на десятки фрагментов
у Ph. armatus.
Род Enchelyotricha Foissner, 1987
Типовой вид Е. binucleata F., 1987 по моноти-
пии, также Е. jesnerae Foissner et al., 2002; вытянутое
тело, небольшая сократимость, 2 удаленных ядра, как
у Trachelophyllum’, у вершины тело слегка расширено,
но без четкого физона и спиральных фрагментов; один
апикальный циркон; палочковидные токсицисты. Од-
на из кинет в верхней части несет длинный ряд дисом с
короткими толстыми щетинками; отдельные дисомы
у вершины других кинет несут реснички и длинные
острые щетинки. К этому роду могут принадлежать
Enchelyodon contractilis Vuxanovici, 1963; Е. retortus
V., 1963.
ТИП CILIOPHORA. КЛАСС LITOSTOMATEA
563
Этот род вначале был отнесен к Trachelophyllidae,
но сейчас семейство включает только формы со слоем
фсносом на поверхности; от Enchelyodontidae отлича-
ется формой тигмона. Сейчас род перенесен в состав
I .acrymariidae в основном ввиду наличия своеобразных
двойных (bifurcated) корневых фибрилл глотки, отхо-
дящих от кинетосом циркона, как у лакримарий.
Род Lagynus Quennerstedt, 1867
Типовой вид Lacrymaria elegans Engelmann,
1862. Род признавался многими авторами и сейчас
окончательно признан валидным; тип рода переописан
при импрегнации. Тело вытянутое, очень сократимое,
ио не вытягивается в виде хоботка; кинеты полимери-
зованы; реснички расположены в четких поперечных
кольцах (паратены) по всему телу; как у лакримарий,
обособлен физон с большим числом сближенных
монокинет. Шейка особо сократимая, делится на не-
сколько отделов кольцевыми сжатиями, особенно чет-
кими у сокращенных форм; верхнее кольцо обособле-
но, состоит из триплетов с ресничками и щетинками, и
между ним и цирконом расположены отдельные дисо-
мы. Овальное ядро, крупная вакуоль, широкий акрон с
прямыми токсицистами — признаки типового вида.
Валидный вид — L. cucumis (= Lacrymaria cucumis Pe-
nard, 1922).
Ранее считали возможным перенос рода из Lacry-
mariidae в сем. Metacystidae (Prostomatida) или в новое
сем. Lagynidae Sola, Guinea, Longas et Femandez-Galia-
no, 1990 для этого рода в составе Prostomatida, но пока
условно род включается здесь в состав Lacrymariidae.
Сем. Helicoprorodontidae Small et Lynn,
1985
Крупные вытянутые червеобразные формы из мор-
ского псаммона; тело не сплющено, кинеты полимери-
зованы, с густой цилиатурой; передний конец тела без
акрона (полярного выступа), с постоянным открытым
ртом; глотка образована длинными фибриллами; ток-
сицисты в цитоплазме и у рта, поодиночке и в пучках.
У вершины тела сомакинеты закручены спирально, со-
здав необычный комплекс, не встречающийся у других
гапторид; вероятно, поэтому род выделен в особый от-
ряд Helicoprorodontida (Puytorac, 1994). Кроме этого
рода к отряду приписан еще Spiroprorodon Fenchel et
Lee, 1972, и диагноз сборного отряда дан для обоих ро-
дов; но второй род — синоним валидного рода Gymno-
zoum, относимого к циртофоридам.
Род Helicoprorodon Faure-Fremiet, 1950
Типовой вид Chaenea gigas К., 1933 по моно-
типии; размеры тела около 0.5 мм, ядро цепочковид-
ное, у рта четкая длинная глоточная корзинка, имити-
рующая циртум. Описан ряд видов с разным типом
ядер, от относительно мелких форм (150 мкм) до ги-
гантов (1200 мкм). Точная топография спирального
отдела кинет выявлена лишь у 2 видов, и, возможно,
по ядрам и кинетому будут выделены другие роды или
подроды.
Н. gigas (К„ 1933) — до 1—2 мм длиной, необы-
чайно сократимые (до 300 мк); в ядерной цепочке
16—40 нодул, Н. barbatus D., 1960 — длина тела
600 мкм; форма тела типичная, но с булавовидными
придатками в зоне спиральных кинет (несомненно, ви-
доизмененные толстые щетинки тигмона). Н. minutus
Bock, 1952 — размеры тела 150 X 20 мкм, при сокра-
щении около 40 мкм; 5—11 разрозненных нодул ядра,
не в цепочке; апекс спиральный, как у типового вида.
Другие валидные виды — Н. multinucleatum D., 1960 и
Н. maximus D., 1960.
Детально описанный вид Holophrya coronata De
Morgan, 1924 — несомненно вид данного рода, поэто-
му правильное название вида — Helicoprorodon сого-
natus (De Morgan) comb. n.
При виде с апекса Н. multinucleatum виден откры-
тый мелкий рот, кольцо дисом (циркон); кинеты под-
ходят к почти замкнутому ребру, заканчиваясь здесь, и
только 3 из них входят в просвет и закручиваются спи-
ралью, внутри этой зоны к ним присоединяются еще
2 спиральных ряда; обособлена апикальная спираль из
коротких кинет (фрагмон). У Н. gigas в просвет входят
5 кинет и закручиваются до рта без обособления фраг-
мона; если это верно, род можно подразделить на
2 рода по типу цилиатуры. Концы всех кинет у рта не-
сут дисомы, вероятно в дополнение к кольцевой кине-
те у рта (циркону).
Род Trachelotractus Foissner, 1997
Типовой вид Trachelocerca entzi Kahl, 1927.
Очень сократимые псаммонные цилиаты, длиной до
1.3 мм при полном растяжении, внешне напоминаю-
щие кариореликтид, но с другой цилиатурой и с много-
численными ядрами. Сомакинеты состоят из моносом,
кроме 2 обособленных кинет с ресничными дисомами,
образующих тигмон у апекса и спираль вокруг рта. Ки-
нетосомы акрона и шейки несут четкие нематодесмы,
это кинеты ротового комплекса, не соматические. Ак-
рон с коронообразным перибуккальным ребром, несу-
щим длинные экстру сомы (токсицисты); экструсомы в
клетке 3 типов. Ротовой аппарат простой — кониче-
ская глоточная воронка с несколькими дисомами у
края, вероятно элемент тигмона. Отличие от Helicopro-
rodon — тигмон у рта и расположение экструсом акро-
на, спиральных у Helicoprorodon, в одном пучке у
Trachelotractus.
Сем. Spathidiidae Kahl, 1929
Эта группа родов выделена в особый подотряд
Spathidiina Jank. в отряде Spathidiida Foissner. В ката-
логе Линна (Lynn, 2002) включает, кроме типичных
спатидиев, также ряд родов с аберрантной морфоло-
гией; часть их приведена здесь, другие в списке гапто-
рид неясного положения.
Типичные спатидииды — вытянутые формы с пло-
ским антероном; акрон четкий, идет вдоль длинной ро-
товой щели, несимметричный, наклонен к венту; мно-
564
ALVEOLATA
го токсицист и фибрилл обширной глотки. Тигмон в
виде полос дисом со щетинками, типичный для гапто-
рид; у вершины тела дифференцированы участки ки-
нет, кинетосомы сгущаются, ряды часто отклонены
вбок — эго одна из форм фрагмона. Много видов в
пресной воде, мхах, почве, редко в море.
Род Spathidium Dujardin, 1841
Типовой вид S. hyalinum по монотипии; син.:
Habrodon Perty, 1852 (типовой вид Я. curvatus)', Peleky-
dion Eberhard, 1862 (типовой вид Р. barbatulumy, Spat-
hidiopsis Kalil, 1926 (пес Spathidiopsis Fabre-Domergue,
1889); типовой вид 5. distoma, Diceras Eberhard, 1862;
типовой вид D. viridans (гомоним; заменено на Dicera-
tula Corliss, 1960).
У типичных спатидиев, например 5. seppelti Petz et
Foissner, 1997, тело широкое, вытянутое, толстое,
плавно сужается и сплющивается к узкой шейке, отде-
ляющей расширенный дуговидный апекс; четкий ак-
рон вытянут и наклонен вниз, ограничивает длинную
ротовую щель; мощные пучки фибрилл отходят от по-
лосы дисом (циркона) вдоль краев акрона, образуя лег-
ко видимый глоточный конус. Вакуоль сзади, ядра раз-
ного типа, от овального до фрагментированного на де-
сятки нодул; у части видов ядро в виде очень длинной
извитой ленты или цепочка нодул. Кинеты полимери-
зованы, цилиатура густая; у вершины на одной сторо-
не обособлены несколько рядов дисом со щетинками,
обычно 3 неравных ряда; один из них может продол-
жаться вниз рядом сближенных моносом. Для рода
очень характерно сгущение кинетосом и ресничек в се-
рии коротких рядов и их асимметрия — слегка изогну-
тые справа и резко загнутые (С-образные) слева — э го
одна из форм фрагмона.
Крупный род в основном пресноводный и почвен-
ный; в Черном море част галофильный вид S. marinum
Lepsi, 1926 с коротким телом. Активные хищники, лег-
ко разводятся на тетрахименах или кольпидиях. Спи-
сок видов привести нельзя, поскольку большинство
видов не импрегнированы и нет точной картины кинет
и тигмона; ряд видов перешел в состав Supraspathidi-
um. Из типичных спатидиев, кроме типового вида,
можно назвать S. amphoriforme Greeff, 1888; S. seppelti
Petz et Foissner, 1997; S. rusticanum Foissner, 1991;
5. extensum Kalil, 1933; У turgitorum, S. namibicola,
S. etoschense, S. aciculare, S. contractile, S. lanceoplites
(последние 6 видов описаны как новые в почвах Афри-
ки — Foissner et al., 2002). Неясен статус многих ви-
дов — 5. chlorelligenim К., 1930; У curvatum К., 1928;
5. deforme (К., 1928); У extensum К., 1933; S. fossicola
К., 1933; У binucleatum Lepsi, 1964 и др.; у разных ро-
дов спатидиид внешний облик сходный, различия — в
топографии вершин кинет у перистома.
Род Supraspathidium Foissner et Didier,
1982
Типовой вид Spathidium teres Stokes, 1886; так-
же У multistriataV. etD., 1982; У lieberkuehni (Butschli,
1889); У gigas (Da Cunha, 1914); У elongatum (Penard,
1922); У vermiforme (Penard, 1922); У polyvacuolatum
(Vuxanovici, 1959); У canaliculatum (Lepsi, 1959); У la-
tissimum (Lepsi, 1959); У etoschense Foissner et al., 2002;
У armatum Foissner et al., 2002 и др. виды; большинст-
во крупных видов, прежде относимых к Spathidium,
принадлежит к этому роду. Внешний облик, ядра, ва-
куоли, тенденция к полимеризации кинет как у спати-
диев; перистом такой же растянутый и асимметрич-
ный. Родовое отличие — в топографии вершин кинет и
форме циркона. У Supraspathidium справа кинеты под-
ходят под углом к циркону, имеющему вид непрерыв-
ной линии; слева все вершины кинет обособлены, рез-
ко изогнуты, упираются в циркон и разбивают его на
серию коротких фрагментов; это особо четко показано
у У armatum.
Род Epispathidium Foissner, 1984
Типовой вид Е. regium; также Е. ascendens
(Wenzel, 1953), Е. polynucleatum Foissner et al., 2002 и
другие виды. Крупные вытянутые клетки со сложным
ядром; во всем как спатидии, но справа верхние участ-
ки кинет со сгущением кинетосом (нужен термин) обо-
соблены от кинет, имеют вид почти прямых полосок,
подходящих под углом к циркону; слева циркон цель-
ный или с пробелами в одну дисому в местах соедине-
ния циркона с серией извитых участков кинет. Родо-
вые отличия незначительные и не у всех видов четкие.
Характерна асимметрия кинетома — на правой сторо-
не кинет намного меньше, чем на левой. Много дор-
сальных тигмокинет неравной длины.
Род Apospathidium Foissner, Agatha
et Berger, 2002
Типовой вид A. terricola Foissner et al., 2002,
A. atypicum (Buitkamp et Wilbert, 1974). В отличие от
мешковидных спатидиев, тело заострено кзади и сужа-
ется кпереди, где расположен относительно неболь-
шой акрон, наклоненный вниз к венту. Ядро вытяну-
тое, кинет немного, щетинки в 3 рядах дорсально.
Циркон не имеет вид единой линии — с обеих сторон
разбит на короткие изогнутые сегменты, под которы-
ми расположены такие же вершины сомакинет. В ито-
ге акрон ограничен серией изогнутых двойных кинет,
верхняя из которых несет дисомы, нижняя моносомы.
В отличие от спатидиев токсицисты расположены не
только в ротовой зоне, но и по всему телу в кортексе.
A. atypicum имеет такой же тип двойного циркона и не-
большое число кинет; это пока единственный север-
ный вид рода.
Род Semispathidium Foissner, Agatha
et Berger, 2002
Типовой вид У enchelyodontides. Мелкий тон-
кий вид, напоминает многих гапторид других се-
мейств, но не спатидиев. Ядро фрагментировано, рото-
вой конус четкий, кинет немного; щетинки в 3 нерав-
ных дорсальных рядах дисом, циркон в виде единой
ТИП CILIOPHORA. КЛАСС LITOSTOMATEA
565
липни, не прерван; вершины кинет не обособлены и не
прилегают к этому кольцу, подходят под небольшим
углом. Внешне напоминают Enchelyodon, и только при
импрегнации выявляется кинетом, характерный для
г.пптидиев. Основной отличительный признак — фор-
ма акрона: длинная ротовая щель с валиками наклоне-
на иниз к венту у спатидиев; у нового рода валик апи-
кальный, симметричный, не растянут далеко вниз, нет
аллометрии (непропорционального удлинения) вали-
ка, характерной для спатидиев. Род включает также
Д». lagyniforme (Kahl, 1930), вероятно также несколько
плохо описанных видов родов Enchelyodon и Spathidi-
um (Е. mucicola, S. cylindricum).
Род Arcuospathidium Foissner,
1984
Типовой вид Spathidium cultriforme Penard,
1922. Тело узкое, тонкое, вытянутое и плоское в перед-
ней трети, акрон резко несимметричный, отклонен
вбок, растянут далеко вниз, как у амфилептид. Ядро
лентовидное или фрагментировано. Кинет немного,
всего 4—6 у части видов, около 20 у типового вида;
щетинки в нескольких длинных рядах дорсально. Цир-
кон непрерывный, не выражено сгущение кинетосом и
нет обособления вершин сомакинет, особенно у тон-
ких змеевидных видов A. namibiense Foissner et al.,
2002 и A. etoschense Foissner et al., 2002; с трудом мож-
но различить такие участки у A. lorjeae Foissner et al.,
2002. Род включает также A. novaki Foissner et al., 2002;
A. bulli F., 2000; A. vlassaki F., 2000 и ряд других видов
и подвидов A. namibiense и A. cultriforme.
Род Protospathidium Dragesco
et Dragesco-Kerneis, 1979
По Аэшт, этот род установлен без указания ти-
пового вида, поэтому автор рода меняется — Pro-
tospathidium Foissner, 1984 с типовым видом Р. musci-
cola Dragesco et Dragesco-Kerneis, 1979. Валидные
виды — Р. terricola Foissner, 1998; Р. namibicola Fois-
sner et al., 2002; P. vermiforme Foissner et al., 2002 и др.
Фойсснер описал заново аберрантный вид Spathidium
bonneti Buitkamp, 1977, как Protospathidium, но он
оставлен в составе спатидиев, а само переописание от-
носится к новому виду Р. vermiforme (Foissner et al.,
2002).
P. muscicola — мелкий вид с тонким телом, с
10—12 кинетами и мелким валиком акрона (spatula по
терминологии Дражеско); это отличает новый род от
спатидиев с длинным изогнутым плоским акроном.
Нет единой кинеты циркона, вместо нее акрон окружа-
ют двойные ряды в виде серии косых фрагментов.
Каждый элемент состоит из 4 верхних и 6 нижних мо-
носом; нижние ряды продолжаются короткими сег-
ментами со сближением кинетосом; имеются 2 нерав-
ных ряда дисом со щетинками. У червеобразной Р. ver-
miforme, напоминающей нематод, циркон разбит на
короткие разрозненные фрагменты со ступенчатым
расположением, к которым подходят изогнутые вер-
шины сомакинет и 3 ряда тигмона.
Род Aperthospathuta Foissner, Agatha
et Berger, 2002
Типовой вид A. inermis, A. armata, A. dioplites
(род и все 3 вида описаны в монографии цилиат На-
мибии — Foissner et al., 2002). Гибкие спатидииды
с прерванным цирконом из дисом, укороченным на ле-
вой стороне акрона и открытым вентрально; акрон чет-
ко отделен от тела, растянут, изогнут влево вниз, асим-
метричный. В норме у гапторид циркон непрерывный,
кольцевой или овальный. Тигмон — 2—3 ряда равной
длины. Сомакинеты немногочисленные, с очень ред-
кими кинетосомами; нет сгущения кинетосом у вер-
шин кинет. Ядро овальное, акрон с удлиненно-оваль-
ными токсицистами и фибриллярным конусом глотки,
образованной дисомами акрона. Этот род, Longispatha
(L. elegans), и Rhinottrix (R. porculus) выделены в сем.
Aperthospathulidae Foissner, Xu et Kreutz, 2005.
Род Enchelaria Foissner, Agatha et Berger,
2002
Типовой вид E. multinucleata', найден вто-
рой вид (не изучен) и в состав рода будет переведена
часть видов гапторид родов Enchelys, Enchelyodon и
Spathidium. Вытянутые тонкие не сплющенные чер-
веобразные формы с распыленным ядром, неболь-
шим числом кинет; акрон очень мелкий, совершенно
нетипичный для спатидиид, округлый, окружен зам-
кнутой кинетой циркона. Тигмон с 2 рядами щетинок.
Кинеты равномерно подходят к апексу, кинетосомы
в их вершинах незначительно сгущаются; нет четкой
системы фрагментов. В ротовой зоне веретеновид-
ные токсицисты; длинная глоточная корзинка образо-
вана только цирконом, нет «oralized somatic kinetoso-
mes» (дающих корневые фибриллы глотки у многих
примитивных видов гапторид вместе с кинетосомами
циркона). Тип рода нетипичен для спатидиид, и с
его включением семейству трудно дать четкую ха-
рактеристику.
Род Vartospathidium Jankowski
gen. n.
Типовой вид Spathidium papilliferum Kahl,
1930 (V. papilliferum comb. n.). Этот вид уже был выше
в списке видов Epispathidium', в отличие от типич-
ных видов этого рода, имеющих стандартный для
семейства акрон (2 валика по краям длинной на-
клонной ротовой щели), V. papilliferum имеет
2—3 четких воронковидных выступа вместо простого
щелевидного рта, внутри которых расположены пучки
токсицист. Имеется и общая обширная фибрилляр-
ная корзинка от кинетосом циркона. В системати-
ке нужно учитывать все признаки, не только кинетом,
однотипный у этого аберрантного вида с видами Epis-
pathidium. В отличие от Spathidioides пучки распо-
ложены по длине акрона (на месте ротовой щели), не
на одном конце — вершине тела. Это одна из форм
токсофоров — выступов тела с токсицистами у гап-
торид.
566
ALVEOLATA
Род Cultellothrix Foissner, 2003
Тино в о й в и д С, velhoi из пробы почвы в Брази-
лии; внешне напоминают Spathidium lionotiformis Kahl,
1930 {Cultellothrix in Foissner, 2003), но это валидные
виды. Основной признак рода — латеральное положе-
ние т игмона на левой стороне тела. Размеры тела око-
ло 120 X 25 мкм, антерон плоский, ядро длинное, из-
витое; тигмон — 3 ряда щетинок, один из рядов укоро-
чен; длинный послеротовой ряд идет на дорсум,
вершины около 12 кинет видоизменены в дополнение
к тигмону. Экструсомы в коротких косых рядах в рото-
вом валике. Этот вид был ранее по ошибке определен и
описан как Spathidium lionotiforme Kahl, 1930.
Следующие роды условно отнесены к спатидии-
дам.
Род Spathidioides Brodsky, 1925
Типовойвид^. sulcata — тело широкое и корот-
кое, ядро почковидное, расширенный антерон занят
ртом без четкого акрона; широкая трубчатая глотка
равной ширины идет через все тело до постерона;
асимметричный выступ занят воронкой с прочными
разрозненными немадесмами. Вероятнее всего это
спатидиида, неродственная предыдущему роду. Близ-
кий вид — Spathidioides excavata Kahl, 1930, с округ-
лым ядром, четкой полосой щетинок и выступом с три-
хоцистами в том же локусе.
Род Cranotheridium Schewiakoff, 1893
Типовой вид С. taeniatum по монотипии. Меш-
ковидные формы с широким телом, многочисленны-
ми кинетами, небольшой апикальной ротовой ворон-
кой с акроном и фибриллярной глоткой. У C.foliosus
при импрегнации найден циркон в виде длинной по-
лосы вокруг растянутого рта и 2 тигмокинеты с ди-
сомами.
Род Legendrea Faure-Fremiet, 1908
Типовой вид L. loyezae по монотипии; позже
приписан ряд форм, которые должны принадлежать к
другим родам. Это представитель группы бентосных
пресноводных видов, редких и малоизученных, имею-
щих выступы или длинные отростки тела с мелкими
токсицистами на вершине. L. loyezae — мешковидные
формы с коротким широким телом; кинеты многочис-
ленные, спереди длинный скошенный вниз акрон; от
расширенного постерона отходят длинные тонкие от-
ростки с токсицистами, обозначенные мною новым
термином «токсофоры» (toxophores).
Род Legendrea включил позже несколько видов с
токсофорами разного типа и в разных участках тела,
но даже если эти цилиаты близкородственны и не кон-
вергентны, они должны быть отнесены к разным ро-
дам или к подродам внутри Legendrea sensu lato. Пе-
нард (Penard, 1922) добавил к роду Legendrea 5 видов,
Каль (Kahl, 1930) оставил 2 из них — оба они не соот-
ветствуют морфологии типа рода и выделяются ниже в
2 новых рода; Калем исключены виды L. interrupta,
L. crassa и L. porculus.
Род Lacerus Jankowski gen. n.
Типовой вид Legendreapespelicani Penard, 1922
(Lacerus pespelicani comb. n.). В каталоге Аэшт род La-
cerus Jank., 1967 валидный, но он указан в тезисах, а не
в статье, поэтому другой автор может не признать род;
название вводится вновь. Крупный вид (200 мкм) с от-
носительно небольшим числом кинет, длинным узким
ртом в виде наклонного акрона; изогнутое ядро, одна
вакуоль сзади; тигмокинеты не отмечены (импрегна-
ция не проведена). Токсофоры крупные, прямоуголь-
ные, каждый с плотным пучком прямых токсицист,
расположены по периферии сплющенного вытянутого
тела, в частности у обеих краев ротовой щели; их нет в
той зоне, где должны располагаться тигмокинеты спа-
тидиид, несомненно не замеченные прежними авто-
рами.
Род Thysanomorpha Jank. gen. n.
Типовой вид Legendrea bellerophon Penard, 1914
(T. bellerophon comb. n.). Как и в предыдущем случае,
род введен в тезисах (Thysanomorpha Jank., 1967); в
каталоге Аэшт род валидный, но она не видела ори-
гинала (тезисы конференции в Кишиневе), иначе при-
знала бы название непригодным. Размеры тела около
100—180 мкм; тело широкое, сплющено, со скошен-
ной вершиной и длинным валиком акрона (явно спати-
диидный комплекс со щелевидным ртом); ядро вытя-
нутое, сзади крупная вакуоль. От всей ротовой щели в
глубь тела отходят фибриллы глоточного конуса.
Вся кайма плоского тела на расстоянии от рта несет
равномерно расположенные выступы (токсофоры),
способные к значительному сужению и удлинению,
такая особь похожа на сукторий; вершины выростов
несут пучок мелких токсицист. Отмечен тигмон —
один ряд мелких щетинок на дорсальном (высо-
ком) крае тела.
Род Penardiella Kahl, 1930
Типовой вид Legendrea interrupta Penard, 1928;
также Р. crassa Р., 1922 и Р. undulata К., 1930. Тело
плоское, широкое при виде сбоку, спереди длинная ро-
товая щель с конусовидной глоткой; от нее начинается
кайма, огибающая все тело у Р. crassa и 2/3 тела у
Р. interrupta; это исчерченная полоса, вероятно с па-
лочковидными токсицистами.
Род Spathidiodes Kahl, 1926
Типовой вид S. hyalinum; Каль (Kahl, 1930) по
ошибке считал это название гомонимом рода Spathi-
dioides (выше) и заменил на Spathidiella Kahl, 1930.
Это мелкие гапториды (40—50 мкм) с округлым яд-
ТИП CILIOPHORA. КЛАСС LITOSTOMATEA
567
ром, несколькими кинетами и скошенным апикальным
наликом, сужающимся к венту; тигмон не отмечен;
циркон с длинными ресничками, направленными впе-
ред. Место рода среди гапторид неясно, условно среди
спатидиид, хотя у спатидиид ядро всегда более слож-
ной формы.
Род Perispira Stein, 1859
Типовой вид Р. ovum по монотипии. Мешко-
видные формы длиной 70—120 мкм с коротким и ши-
роким телом, слегка сплющенным латерально; спере-
ди скошенный длинный валик акрона, продолжаю-
щийся аллометрически в виде высокого ребра по
спирали вокруг тела; кортекс рельефный, с ребрами
вдоль кинет. Импрегнирован вид Р. pyriformis; выявле-
ны 2—-3 дорсальные тигмокинеты и очень редкие ки-
нетосомы в нескольких разрозненных соматических
рядах; глотка очень широкая, в стандартном для спати-
диид положении, токсицисты и фибриллы не идут
ниже вслед за спиральным валиком. Другие виды —
Р. strephostoma Stokes, 1886, Р. oligospira Gelei, 1954;
большой разброс данных по размерам типового вида
(40—175 мкм) говорит о наличии нескольких видов
типа Р. ovum.
Род Trichospira Roux, 1899
Типовой вид Т. dextrorsa', также Т. cincinnata
Penard, 1922. По Калю (1930), первым описан вид Pa-
ramecium inversum С. et L., 1858 (Т. inversa = T. dextror-
sa)', вид Пенарда T. cincinnata может относиться к Pe-
rispira. От небольшого субапикального рта начинается
спиральный валик; края тела с токсицистами; кинетом
не изучен. Род выделен в сем. Trichospiridae Kahl,
1926. Тип рода очень похож на Perispira strephostoma
Stokes, 1886.
Сем. Bryophyllidae Foissner, 1985
В основном крупные плоские особи; акрон растя-
нут в виде щели по всему апексу, отклоненному вбок и
вниз, и уходит к постерону, может быть закручен здесь
на выступе тела или огибает постерон; фибриллярная
корзинка под апикальным отделом акрона, токсицис-
ты под всей удлиненной полосой в плотном ряду. Кро-
ме перечисленных ниже форм может включать также
род Penardiella (дан выше в приложении к спатидии-
дам).
Род Bryophyllum Kahl, 1931
Типовой вид В. loxophylliforme Kahl, 1931; так-
же В. lingua Gelei, 1934 с подвидами, В. tegularum
Kalil, 1931, В. caudatum, В. carinatum Gelei, 1934,
В. spathidioides Gelei, 1934(синоним?), В. paucistriatum
Foissner et al., 2002, B. penardi Kahl, 1931 и другие
виды. Тело массивное, плоское, с необычно большим
числом кинет; особи медленно движутся по дну, края
тела гибкие, волнистые. Ядро сложной формы, ва-
куоли рассеяны по телу, с многочисленными порами.
Вершина тела, как у спатидиид, с аллометрически уд-
линенным высоким валиком (акроном) и щелевидным
ртом; акрон продолжается далее по всей кайме тела до
постерона, где у части видов образуется отросток с
окончанием валика. Ряд видов изучил Гелей своим ме-
тодом серебрения; на протарголовых препаратах дру-
гие авторы изучили В. lingua, В. tegularum и В. penardi,
доказано родство со спатидиидами; неясно, следует ли
считать особое удлинение акрона признаком нового
семейства.
Кинеты идут параллельно до апикальной части ак-
рона, достигают кинеты циркона; кинетосомы сгуща-
ются и без фрагментации эти участки кинет изгибают-
ся к высокой дорсальной стороне; справа у края 3 ряда
длинных щетинок в тигмозоне. Под всей лентой удли-
нившегося акрона равномерно расположены токсицис-
ты, как у Penardiella', в сущности В. tegularum и В. pe-
nardi незначительно отличаются от Р. interrupta и род
Penardiella. может быть невалидным синонимом. Дру-
гие виды более своеобразные, особенно массивный
В. caudatum. Кинета циркона идет вдоль всей полосы
до постерона, не прервана у вершины; вдоль полосы —
сплошной ряд токсицист 2 типов, длинных и коротких
(мукоцисты?); щетинки в серии неравных рядов; фиб-
риллы глоточной корзинки секретируются только в
верхней части желобка.
Род Amphibothrella R. Grandori
et L. Grandori, 1934
Типовой вид Л. enigmatica, позже не изученная;
крупные плоские клетки с большим числом кинет и
ядер (или показаны пищевые вакуоли); общая форма,
число и топография кинет, наличие зоны схождения
кинет (секанты) снизу вентрально и крупная вакуоль в
этом месте — все это бесспорно говорит от идентич-
ности этого вида и Bryophyllum, скорее всего, В. tegula-
rum', у других видов бриофиллов заострена вершина,
или мало кинет, или имеется каудальный отросток,
или другая форма антерона, Род сейчас невалиден, а
название Amphibothrella можно использовать в буду-
щем, если В. tegularum будет обособлен на уровне по-
дрода или рода.
Род Apobryophyllum Foissner, 1998
Типовой вид A. terricola F., 1998, Л. etoschense
F., 1998; Л. vermiforme Foissner et al., 2002. Тип рода —
плоские вытянутые узкие клетки; кайма от апекса до
постерона образована удлинением желобка и валиков
акрона; токсицисты сплошным слоем расположены
под всем валиком, под дорсальным краем и вдоль пло-
ских сторон тела. Кинет немного, вершины почти всех
левых рядов несут щетинки (дисомы в основании), че-
редующиеся с ресничками; левосторонние тигмокине-
ты типичные, дикинетидные; правые тигмокинеты
фрагментированы и, вероятно, монокинетидые (из мо-
носом). A. vermiforme резко отличается от типового
вида — особи червеобразные, гибкие, акрон заметен
568
ALVEOLATA
лишь у вершины тела, с мельчайшими токсицистами,
кинет немного, щетинки чередуются с ресничками; все
же это бриофиллиды, поскольку импрегнация выявля-
ет продолжение желобка до постерона.
Род Branchioecetes Kahl, 1931
По краткому указанию Аэшт, род невалиден, так
как не указан типовой вид. Этот род предложен для Lo-
xophyllum aselli Svec, 1897 и L. gammari Penard, 1922, c
одновременным переносом их из амфилептид в дилеп-
тид (Tracheliidae); особо подробно описан первый вид,
который здесь обозначается как типовой, со сменой ав-
тора — Branchioecetes Jank. gen. n., В. aselli comb. n.
(типовой вид), В. gammari comb. n. Вероятно, есть и
третий вид на речных раках Astacus на Украине, на-
званный Branchioecetes astaci Boschko; этот вид зари-
сован, но пока нет точного описания морфологии и не-
известны отличия от 2 вышеназванных видов рода.
Близкий новый вид на камбаридах, полученных мною
из США, имеет особо сложный глоточный аппарат и
может относиться к особому новому роду.
Виды с аселлот и гаммарид крупные (до 300 мкм),
однотипные, на морских ракообразных не встречают-
ся. Тело, как у Loxophyllum, серповидное, плоское, ро-
товая щель идет от апекса до рта, расположенного сбо-
ку; токсицисты залегают по всему периметру тела
плотным исчерченным слоем; рот с короткой фибрил-
лярной глоткой, у рта нередко виден выступ тела (ток-
софор). Пенард (Penard, 1922) рисует тигмокинету со
щетинками на дорсуме, там, где она расположена у
спатидиид; у вида с гаммарид не показано продолже-
ние полосы токсицист ниже рта. Облигатные коммен-
салы хозяев, хищники, вероятно питаются перитриха-
ми, обрастающими хозяев.
Сем. Myriokaryonidae Foissner, 2002
Крупные резко вытянутые червеобразные формы с
дифференцировкой апикального и латерального отде-
лов акрона, с разным положением токсицист и фиб-
рилл в этих отделах. Акрон сохраняется на вершине и
растянут на значительную часть тела сбоку, вместе с
циркуморальной кинетой (цирконом). Обитатели пре-
сных вод и почвы.
Род Myriokaryon Jankowski, 1973
Типовой вид Prorodon lieberkuhniButschli, 1889
по монотипии. Очень крупные червеобразные формы
из озерного бентоса; найдены в толще воды, но это не
планктонный род; вид изучен мною на живом и окра-
шенном, но не импрегнированном материале, поэтому
род был провизорно включен в состав дилептид, хотя
отмечена его близость к спатидиидам. Тщательное
изучение на протарголовых препаратах (Foissner,
2003) показало принадлежность вида к спатидиидам.
Вид был трудным для систематиков, его включали
в Pseudoprorodon, сходных форм описывали в составе
Spathidium (S. gigas Da Cunha, 1914), Cranotheridium
(C. elongatum Penard, 1921). У расы из Африки разме-
ры тела до 1.1 мм, трихиты глотки до 70 мкм, больше
100 кинет, вдоль ротовой щели идет аргентофильная
кинета со слившимися кинетосомами; цитоплазма
полна токсицист, ядер и сократимых вакуолей в допол-
нение к крупной вакуоли в постероне. По Фойсснеру,
кинеты правой и левой сторон примерно равны по чис-
лу; на дорсуме 7 полных и 1 неполный ряд дисом ще-
тинок; акрон отходит от апекса далеко вниз, ротовая
щель растянута, по всей длине валик окружен кинетой
циркона; справа кинетосомы сближены в вершинах
всех кинет, слева вдоль щели идут неправильные попе-
речные полоски (фрагмон).
Род Cephalospathula Foissner, 2003
Типовой вид С. brasiliensis из пробы почвы —
червеобразные формы, похожие на нематод, с ленто-
видным ядром, терминальной и дополнительными ва-
куолями; на переднем конце тела расширенный учас-
ток акрона с короткими и длинными токсицистами; эта
зона наклонена вбок и продолжается в виде четкого ва-
лика до 1/4 длины тела сбоку вентрально. Число кинет
относительно невелико, вдоль дорсума идет несколько
тигмокинет (на треть длины тела) с щетинками разно-
го типа; циркон ограничивает весь валик. Местами ки-
нетосомы в вершинах рядов сближены, но без четких
полос фрагмона. Кинетосомы циркона образуют в сум-
ме большое число фибрилл, поэтому видна обширная
глоточная корзинка.
Род Berghophrya Foissner, 2003
Типовой вид Holophrya emmae Berh, 1896. Вид
хорошо изучен, поэтому без применения протарголя и
повторного изучения этот редкий вид включен в дан-
ное семейство и выделен в новый род. Под этим назва-
нием по ошибке был описан другой вид цилиат
(см. Songophrya в сем. Pseudoholophryidae). Типовой
вид — широкие клетки величиной 160—200 мкм с
лентовидным ядром; апикальный отдел акрона слег-
ка смещен вниз, расширен, овальный, продолжает-
ся по венту узким валиком; от акрона отходит глотка
с прямыми фибриллами; длинные токсицисты рас-
положены пучками под всем акроном и ниже вне его.
Кинеты многочисленные, сходятся вдоль всего акро-
на под углом к валику, как у Arcuospathidium-, на дор-
суме несколько рядов щетинок. Отличия от Myrio-
karyon — по форме тела, типу ядер, положению пуч-
ков токсицист.
Род Kahlophrya Foissner, 2003
Типовой вид Pseudoprorodon armatus К., 1930
(К. ar mat а). Вероятный синоним — Prorodon armatides
F., 1997. Широкие вытянутые клетки с относительно
небольшим акроном, расширенным апикально и вытя-
нутым узкой полосой в широком субапикальном отде-
ле тела; весь акрон ограничен кинетой циркона. Сома-
кинеты многочисленные, но не полимеризованы, как у
ТИП CILIOPHORA. КЛАСС LITOSTOMATEA
569
мириокариона; ряды заканчиваются в верхней части
акрона и в целом соответствуют типу Arcuospathidium.
Дорсальная тигмозона включает около 20 рядов; у ми-
риокариона все ряды (около 8) изоморфные, состоят из
дисом с короткими щетинками; у калофрии имеется
только один изоморфный ряд, все остальные гетеро-
морфные — с неправильным чередованием моносом с
ресничками и дисом со щетинками. Тенденция к такой
гетероморфии имеется и в нижней части рядов мирио-
кариона и цефалоспатулы. Имеется около 20 полос со-
матических токсицист — их нет у мириокариона и це-
фалоспатулы, но похожие структуры есть у Arcuospat-
hidium и Apobryophyllum.
Сем. Actinobolinidae Kahl, 1930
(рис. 314, б)
Некрупные овальные клетки с апикальным ртом,
четкой и правильной глоточной корзинкой, поднятой
над телом в виде исчерченного акрона; циркон про-
стой — кольцевая линия дисом; тигмон — несколько
рядов щетинок. Тело заполнено крупными токсициста-
ми, выступающими над кортексом в «щупальцах»
(токсофорах), способных к сокращению и растяже-
нию. Обитатели пресноводного планктона или мелких
временных водоемов.
Род Belonophrya Andre, 1914
Типовой вид В. pelagica по монотипии. Назва-
ние рода можно было использовать для гомонима Acti-
nobolus вместо нового названия Actinobolina Strand,
1928, но Штранд не был специалистом и не знал лите-
ратуры; к его названию привыкли и род Belonophrya
игнорировали без обсуждения. К примеру, Дингфель-
дер (Dingfelder, 1962) считал В. pelagica синонимом
более позднего вида A. vorax, но не комментировал эту
ситуацию и не восстанавливал первое название. Каль
(Kahl, 1930) различает 2 валидных вида Actinobolina —
A. vorax и A. radians = Belonophrya pelagica, также не
комментируя пригодность родового названия.
Предлагая название подотряда Belonophryina, ав-
тор главы намеревался восстановить этот род как ва-
лидный вместо Actinobolina, но Фойсснер, изучивший
оба рода, признал их самостоятельными (Foissner et al.,
1995).
В первоописании В. pelagica — овальная форма с
широким апикальным ртом, глоткой с палочками, поч-
ковидным ядром; по телу в беспорядке рассеяны пря-
мые палочки со слегка расширенными концами —
«циррусы» для адаптации бентосных Holophrya к оби-
танию в планктоне; выросты слегка подвижные, могут
растягиваться до ширины тела.
По Фойсснеру (Foissner et al., 1999), сократимые
токсофоры при растяжении превышают длину тела;
вершина каждого включает прямую токсицисту; кине-
та циркона образует правильную коническую глотку с
тесно сближенными фибриллами; имеется тигмокине-
та с дисомами щетинок; нет сгущения кинетосом у рта
и обособления фрагментов кинет. В принципе нет осо-
бого отличия двух родов по строению трофонта и по
кинетому, но Фойсснер как родовой признак у гапто-
рид использует тип экструсом — выстреленные тельца
сложной формы, ламповидные у Belonophrya и палоч-
ковидные с булавовидной вершиной и длинной осевой
нитью у Actinobolina (сравниваются токсицисты у
фиксированных и импрегнированных протарголом ци-
лиат).
Род Actinobolina Strand, 1928
Типовой вид Actinobolus radians Stein, 1867 по
монотипии; также A. vorax (Wenrich, 1929); A. smalli
Holt, Lynn et Corliss, 1974; A. wenrichii Wang et Nie,
1933; A. multinucleata Foissner, Agatha et Berger, 2002.
2 вида с зоохлореллами (A. smalli, A. wenrichii), один c
фрагментированным ядром — около 20 нодул у
A. multinucleata-, внутри рода виды отличаются по типу
токсицист.
Организация клетки, как у предыдущего рода, но
они имеют разный тип токсицист. Вдоль кинет видны
поры токсофоров, вероятно с особой фибриллой; нет
токсицист в межкинетах; длинные внутренние трубки
токсицист закручены в виде пучка в цитоплазме. Кине-
ты имеют сложный паттерн, реснички отходят группа-
ми, по 3 реснички в группе у A. vorax, по 3 реснички и
одному токсофору в каждой группе у A. radians', у
A. multinucleata импрегнируется группа кинетосом и
фибрилла.
Активные пловцы, питаются мелкими цилиатами и
даже коловратками планктона; в лаборатории культи-
вируются на олиготрихах Halteria, которые в массе по-
являются в старых пробах и сохраняются на зернах
риса в чашках Петри; добыча убивается при контакте с
токсицистами и заглатывается целиком.
Сем. Didiniidae Poche, 1913 (рис. 314, а)
В каталоге Линна (Lynn, 2002) это смесь видов про-
стомат и гапторид; семейство должно включать только
2 рода — Monodinium и Didinium, каждый с неболь-
шим числом видов. Бочонковидные формы с очень
широким антероном — мелкий акрон примитивных
гапторид резко расширился у дидиниид и занял весь
апекс; в центре — выступ (рострум) со ртом, несущий
внутри длинную глотку с прямыми, вплотную сбли-
женными токсицистами; это одна из форм токсофоров
гапторид. Сохранено кольцо коротких косых кинет с
тесно сближенными моносомами — фрагмон, полно-
стью обособившийся от утраченных соматических ки-
нет; на их месте остались импрегнируемые продоль-
ные фибриллы. Ниже фрагмона в одном участке
тела — дорсальный тигмон, несколько неравных ко-
ротких рядов щетинок; в результате ошибки (блока)
деления или генной мутации стадия незаконченного
деления стала постоянной у Didinium, у которого дуб-
лируется тот же комплекс в нижней части тела. Актив-
ные быстрые пловцы в толще воды, питаются флагел-
латами и цилиатами; D. nasutum легко разводится в ла-
боратории на крупных парамециях (Р. caudatum,
Paramecium aurelia), это один из основных объектов
изучения цилиат.
570
ALVEOLATA
Род Monodinium Fabre-Domergue, 1888
Типовой вид M. balbianii', М. balbianii var. па-
пит К., 1926; М. balbianii var. rostratum К., 1930;
M. balbianii var. breviproboscis Foissner et al., 1995;
M. perrieri Delphy, 1925; M. alveolatum K., 1930; M. im-
pressum (K., 1926); M. minimum (Gelei, 1954); M. vorax
Faure-Fremiet, 1945; M. chlorelligerum Krainer, 1995;
M. armatum, «Didinium riasutum subtilis» in Gajewskaja,
1933.
Мелкие виды, различаются по размерам, наличию
зоохлорелл, форме рострума (несимметричный у
М. perrieri), числу фибрилл на месте утраченных ря-
дов, по форме ядра; в обоих родах есть пресноводные и
морские виды. Кольцо пектинелл (фрагмон) всегда
одно, с прилегающими тигмокинетами; на безреснич-
ной поверхности тела — продольные биполярные фиб-
риллы. Прежние авторы, опубликовавшие отличные
рисунки импрегнированных монодиниев и дидиниев,
не показывали обособленного циркона — кольца ди-
сом, которое должно быть на границе акрона и кольца
пектинелл у всех гапторид. Такое кольцо все же имеет-
ся (Foissner et al., 1999).
Род Didinium Stein, 1859
Типовой вид Vorticella nasuta Muller, 1773
(D. nasutum); также D. chlorelligerum Kahl, 1935;
D. gargantua Meunier, 1907; D. bosphoricum. Родовые
синонимы — Wagneria Alenitzin, 1874 (типовой вид
W. cylindriconica), Chytridium Eberhard, 1862 (типовой
вид Ch. steinii). Всегда c 2 идентичными наборами —
кольцом пектинелл и ниже компактной группой нерав-
ных тигмокинет со щетинками. Все тело с продольны-
ми тонкими импрегнируемыми фибриллами по числу
пектинелл, от вершины хоботка до постерона. Посто-
янно открытого рта нет, рострум служит для высасы-
вания добычи; в акроне и в цитоплазме — мелкие и
длинные токсицисты.
Подотряд Dileptina Jankowski,
1978
В основном узкие червеобразные формы, обитате-
ли бентоса и планктона пресных вод — озер, болот,
мхов, редко в почве; морские виды единичные, только
в бентосе. Симбионтных видов нет. Соматическая ци-
лиатура однотипная; на дорсальной стороне имеются
ряды коротких сенсорных щетинок. Дорсальная часть
апекса вытянута в виде хоботка, обычно длинного и
гибкого, несущего вершины кинет и тигмон. Буккаль-
ная зона включает постоянный широкий рот, окру-
женный гладкой выпуклой складкой (акрон); складка
огибает рот снизу и уходит к апексу вдоль хоботка, об-
разуя «вентральный пояс» с многочисленными токси-
цистами. Околоротовая цилиатура включает 3 отдела:
1) на уровне вентрального края цитостома передние
концы вентральных сомакинет, отделяющих несколь-
ко ротовых дисом, в которых часть теряет правую ки-
нетосому; 2) вдоль правого края вентральной полосы
ротовые дисомы лежат в удлиненной сомакинете;
3) вдоль левого края полосы дисомы циркона располо-
жены на вершинах коротких фрагментов сомакинет,
добавочные ротовые дисомы выявляются между ними.
Глотка четкая, с 2 группами немадесм — внутренняя с
фибриллярным кольцом, связывающим немадесмы, и
наружная, отходящая от ротовых дисом циркона. Тиг-
мон с 2—3 рядами щетинок, локальная дифференци-
ровка верхних отделов нескольких сомакинет; у всех
гапторид, даже симметричных, локализация тигмона
позволяет обозначить дорсальную и вентральную сто-
роны тела. Токсицисты только одного типа вдоль без-
ресничной полосы хоботка и в цитоплазме.
Ядра изменчивые, можно найти переходы от оваль-
ного к лентовидному, четковидному (в цепочке) и рас-
пыленному (pulverised); эти различия использовались
для различения подродов, но в последнее время поли-
морфный род Dileptus разбит на роды (без подродов)
по типу цилиатуры хоботка и по наличию глотки (нет у
Dimacrocaryon).
Обычные пресноводные формы, часты также в
террофитоне, легко инцистируются и переносят мороз
и высушивание, редки в море (только дилептусы,
например D. marinus). Dileptus — активные хищники,
находятся в постоянном движении, медленно раз-
махивая гибким длинным хоботком с токсицистами;
в лаборатории легко культивируются на кольпидиях.
У Trachelius тело крупное, хоботок мелкий и почти
неподвижный; у Teuthophrys — тройной, с одним
ртом.
Эту группу можно отделить от остальных гапторид
в особом подотряде; ранг отряда Probosciphorida, пред-
лагаемый Пюйтораком (Puytorac, 1994) для дилептид и
спатидиид, не имеющих хоботка, завышен и таксон не
принят.
Сем. Tracheliidae Ehr., 1838
(рис. 317, а, б)
В подотряде одно семейство с несколькими рода-
ми, с приведенным выше диагнозом.
Род Dileptus Dujardin, 1841
По Аэшт, типовой вид Vibrio anser Muller, 1773 по
обозначению Каля; однако ранее Фроментель (Fromen-
tel, 1874) указал типовой вид для Amphileptus (A. cyg-
nus С. et L. — на рисунке это дилептус) и Dileptus —
D. folium Duj. (= Loxophyllum fasciola, типичная амфи-
лептида), спутав 2 рода разных семейств; вид «anser»
дан в составе Amphileptus. Нужно официальным реше-
нием ICZN игнорировать такое обозначение, не приня-
тое следующими авторами. В составе Dileptus вид
D. anser принят многими авторами, указавшими также
на синонимию с видом A. margaritifer, и сейчас это на-
звание восстановлено как валидное (D. margaritifer).
Крупный род, но не все виды изучены при импрегна-
ции и для ряда видов нельзя указать точное родовое
положение.
Типичные дилептусы — вытянутые веретеновид-
ные или червеобразные формы с очень подвижным
гибким хоботком, двойной глоточной корзинкой; ядро
ТИП CILIOPHORA. КЛАСС LITOSTOMATEA
571
Loxophyllum
Рис. 315, a. Amphileptida. Кинетом 7 валидных родов амфилептид. (По: Foissner, Leipe, 1995).
А, Б—Litonotus-, В—Acineria; Г,Д— Siroloxophyllum', Е—Loxophyllum-, Ж, 3—Amphileptus', И— Pseudoamphileptus (симбионт на рыбах); К — Opisthodon.
В схеме нет рода Kentrophyllum и добавленных позже родов Amphileptiscus Song, 2002 и Apoamphileptus Lin et Song, 2004.
Fig. 315, a. Amphileptida. Kinetome of 7 valid genera of amphileptids.
Drawing omits genera Kentrophyllum Petz, Song et Wilbert, 1995; Amphileptiscus Song, 2002 and Apoamphileptus Lin et Song, 2004.
у D. anser в цепочке (10—20 округлых подул), у
D. margaritifer распылено на сотни (до 500) фрагмен-
тов; род не делится на подроды по этому признаку.
Основная родовая особенность, отличие от внешне
сходных родов (кроме Rimaleptus) — паттерн кинето-
ма в районе вентрального желобка — справа только
один продольный ряд кинетосом, слева серия косых
фрагментов вдоль всего края желобка до вершины хо-
ботка. Эти ряды образованы справа прилегающей про-
дольной сомакинетой, обособленной от остальных и
идущей вплотную с желобком, слева обособленными
вершинами группы кинет; кроме них у всех родов со-
хранен циркон — линия двойных кинетосом (дисом),
огибающая кольцом рот и уходящая к апексу по обеим
сторонам желобка.
Примеры видов — D. breviproboscis Foissner, 1981;
D. mucronatus Penard, 1922; D. orientalis Song, Packroff
et Wilbert, 1988; D. anguillula Kahl, 1932; D. costarica-
nus F., 1995; D. cygnus (C. et L., 1859) и многие другие;
статус морского вида D. marinus Kahl, 1933 пока нея-
сен, как и статус D. aculeatus D., 1960, D. estuarinus D.,
1960, D. thononensis D., 1960, D. massuttii K., 1930,
D. marouensisD., 1963, D. gabonensisD., 1965 и других
видов прежнего сборного рода Dileptus.
Родовые синонимы — Phragelliorhynchus Herrick,
1884 (Ph. nasutus), возможно также Liosiphon Ehr.,
1853 (partim; Liosiphon in Stein = Nassula') и Cephalor-
hynchus Diesing. \
Род Dimacrocaryon Jankowski,
1967
Типовой вид Dileptus amphileptoides Kahl, 1931.
Для разграничения групп видов в крупном и быстро
растущем роде Dileptus мною было предложено 3 под-
572
ALVEOLATA
Рис. 315, 6. Amphileptida.
Litonotus kopimorphus (A—B); Amphileptus (подрод Fixonolus) carchesii (Г, Д)', Lilonotus yinae (E, Ж)', Loxophyllum rostratum (3—К). (По: Canella, 1960 (Г, Д);
Song, 1991a (E, Ж); Petz et al., 1995 (А В, 3—K)).
Fig. 315, 6. Amphileptida.
рода — Dileptus, Dimacrocaryon и Monilicaryon', остал-
ся аберрантный вид из мхов D. tenuis с лентовидным
ядром. Впоследствии эти названия принял Фойсснер
(Foissner et al., 1995) для выделения новых родов се-
мейства по типу кинетома в сочетании с типом ядер и
наличием глотки (циртума). В каталоге Аэшт названия
валидные, но они были предложены мною в тезисах и
по современным требованиям неприемлемы, поэтому
вводятся вновь Dimacrocaryon Jank. gen. п., типовой вид
D. amphileptoides comb. n. Виды рода имеют дилептид-
ный кинетом (правее циркона сомакинета, ряд моносом,
левее серия косых фрагментов), но в отличие от дилеп-
тусов и, как исключение, в этом семействе лишены по-
стоянной фибриллярной глоточной корзинки. Имеется
2 макронуклеуса и один микронуклеус между ними.
Род Monilicaryon Jankowski, 1967
Типовой вид Dileptus monilatus (Amphileptus
in Stokes, 1886; Dileptus in Kahl, 1931); как непригод-
ное название (в тезисах) предлагается вновь Monilica-
ryon Jank. gen. п., типовой вид рода М. monilatus
comb. п. Тело узкое, червеобразное, ядро в виде длин-
ной цепочки нодул; правее и левее желобка по одно-
му ряду моносом, нет левосторонней полосы фрагмен-
тов кинет, характерной для большинства видов ди-
лептид.
Род Pseudomonilicaryon Foissner, 1997
Типовой вид Dileptus gracilis Kahl, 1931 по
монотипии; ядра, как у Monilicaryon, в виде длинной
цепочки нодул, с несколькими микронуклусами; кине-
том как у Dileptus — справа вдоль рта и хоботка моно-
кинета, слева непрерывный ряд пектинелл (поликине-
та) и длинная сложная полоса тигмона из вершин груп-
пы кинет. К этому роду принадлежит ряд видов,
прежде относимых к Dileptus — Р. massuttii (Kahl,
1933), из моря и засоленной почвы, Р. japonicum Fois-
sner, Agatha et Berger, 2002, P. angustistoma F., Ag.
et B., 2002 и другие; D. grandis Dragesco, 1963 — веро-
ятный синоним вида P. massuttii.
ТИП CILIOPHORA. КЛАСС LITOSTOMATEA
573
Рис. 316, a. Amphileptida.
Siroloxophyllum utriculariae (A—Ж)', Acineria punctata (3—К). (По: Song, Wilbert, 1989 (И—JT)', Foissner, Leipe, 1995 (A—3)).
Fig. 316, a. Amphileptida.
Род Rimaleptus Foissner,
1984
Типовой вид Dileptus binucleatus Kahl, 1931 c
2 длинными осевыми ядрами и микронуклеусом меж-
ду ними; кинетом, как у Dileptus (монокинета спра-
ва, полоса фрагментов слева), ядра, как у Dimacroca-
ryon (2 макронуклеуса), но в отличие от последне-
го имеется постоянная немадесмальная корзинка
глотки.
Род Pelagodileptus Foissner, Berger
et Schaumburg, 1999
Типовой вид Dileptus trachelioides Zacharias,
1894 — пелагический вид, ранее чаще относимый к
роду Amphileptus. Предлагался также перенос в Paradi-
leptus или выделение в новый род; такой род был пред-
ложен в Китае, но остался незамеченным. По Аэшт,
название Pseudodileptus, вероятно, приводят по ошиб-
ке не для обозначения нового рода, это опечатка; но та-
кой род действительно давно,уже был предложен в Ки-
тае, поэтому валидность названия Pelagodileptus под
сомнением.
Тип рода — как бы переходная форма между Di-
leptus и Trachelius', тело утолщенное, ядра в цепоч-
ке, справа 2 специализированные кинеты, слева по-
лоса коротких косых фрагментов в дополнение к
стандартной для гапторид кинете циркона с двой-
ными кинетосомами. Ротовое отверстие вытянутое, уз-
кое, со сложной системой фибрилл глотки. Несколько
тигмокинет начинаются на уровне ротовой щели. Этот
вид ранее описывался также как новый вид другого
рода — Paradileptus caducus Kahl, 1932. Р. trachelioi-
des особо близок к Pseudomonilicaryon angustistoma
по размерам и форме тела, типу ядер, имеет овальный
рот (округлый у дилептид), но имеет полимерные ки-
неты (до 120—200) и всегда содержит симбионтных
зоохлорелл.
574
ALVEOLATA
Рис. 316, 6. Amphileptida,
Kentrophyllum antarcticum (А, Б.Ду. Loxophyllum compressum (fl); Pseudoamphileptus macrostoma (Гу, Loxophyllum raikovi (E—3); «Hemiophrys» disciformis (И);
Loxophyllum helus (X); Pseudoamphileptus macrostoma (JI—M). (По: Dragesco, 1965b (B—3); Foissner, 1983 (Г, Л—Н); Petz et al., 1995 (А, Б,Д); Dragesco, Dra-
gesco-Kemeis, 1986 (К); Шульман, 1984 (//)).
Fig. 316, 6. Amphileptida.
Род Paradileptus Wenrich,
1929
Типовой вид Amphileptus flagellatus Rousserlet,
1890; обычные виды — P. elephantinus (Svec, 1897),
P. conicus Wenrich, 1929 и P. robustus Wenrich, 1929
(эти 2 вида могут быть невалидны как синонимы),
Р. estensis Canella, 1951, Р. minutus Dragesco, 1972.
Тело массивное, мешковидное, ядро в виде длинной
цепочки, по телу рассеяны токсицисты и вакуоли; тон-
кий длинный гибкий хоботок переходит в закручен-
ную предротовую зону (не узкий продольный жело-
бок, как у дилептусов); глоточная корзинка постоян-
ная, двойная, из тесно сближенных фибрилл. Кинетом
предротовой полосы, как у Pelagodileptus, две моноки-
неты правее циркона, широкая полоса косых фрагмен-
тов левее; тигмон — полосы щетинок в серии обособ-
ленных кинет.
Син.: Tentaculifera Sokoloff, 1931 (типовой вид
Т. mexicana), вероятно идентичный с Paradileptus coni-
cus Wenrich, 1929, который в свою очередь также нева-
лиден как синоним вида Р. flagellatus.
Род Trachelius Schrank,
1803
Типовой вид Т. ovum Ehr. 1831; родовые сино-
нимы— Нагmodirus Petty, 1852 (типовой вид Я. ovum)
и Ophryocerca Ehr., 1831 (типовой вид О. ovum). Тело
вздутое, мешковидное, полное крупных водных лакун;
особи малоподвижные, с коротким хоботком, способ-
ным к незначительному растяжению. Кинеты полиме-
ризованы, подходят ко рту с трубчатой глоткой и ко
всему предротовому желобку; в дополнение к циркону
справа один ряд моносом, слева косые фрагменты по-
ликинеты. Ядро почковидное или гантелевидное. Име-
ется специализированный участок кинет (как у просто-
маты Placus) с небольшой воронкой — дополнитель-
ная к щетинкам тигмотактическая зона.
ТИП CILIOPHORA. КЛАСС LITOSTOMATEA
575
Рис. 317, a. Dileptida. (По: Foissner, 1995b).
Dileptus costaricanus (A—liy, D. similis (Г—Ж).
Fig. 317, a. Dileptida.
Род Teuthophrys Chatton et Beauchamp,
1923
Типовой вид T. trisulca по монотипии. Крупный
вид с широким мешковидным телом, от расширенной
вершины которого отходят 3 массивных хоботка; ядро
в виде цепочки или извитой ленты; цитоплазма с зоо-
хлореллами; африканская раса всегда с палочковид-
ным ядром, вероятно род не монотипичен. Желобки на
внутренней стороне хоботков, расширяясь, подходят
ко рту; кинеты полимеризованы, 3 ряда превращены в
тигмокинеты и не дублируются около других хобот-
ков; вдоль желобков масса палочковидных токсицист.
Кинетом по краям желобков аберрантный, вероятно с
широкими полосами сближенных моносом справа и
слева от циркона. Планктонный вид, характерный для
крупных озер.
Син.: Triloba paradoxa Mudrezowa-Wyss, 1929 из
озера близ Москвы; название рода одновременно си-
ноним и гомоним.
Приложение
Haptorida
В морском бентосе встречаются длинные червеоб-
разные простоматы неясного положения, в основном
не изученные при импрегнации, исключая один род
Paraspathidium.
Род Paraspathidium Noland,
1937
Р. trichostomum (типовой вид), Р. obliquum Drages-
co, 1963, Р. fuscum Kahl, 1928, Р. longinucleatum Czapik
et Jordan, 1976. На Каспии изучены/5, obliquum (Агама-
лиев, 1983); это крупные толстые особи с полярным
или боковым перистомом; у открытого рта сгущение
кинетосом и четкое обособление фрагментов всех ки-
нет (полосы моносом); глотка с немадесмами. Судя по
рисункам Агамалиева, есть кинета циркона. Р. longi-
nucleatum внешне — типичные спатидии с лентовид-
ным ядром.
576
ALVEOLATA
Рис. 317, 6. Dileptida.
Teuthophrys trisulca (A—H'j; Dileptus similis (Г); Paradileptus conicus (Д, Ж); P. estensis (£); Trachelius ovum (3). (По: Clement-Iftode, Versavel, 1968 (A, If); Dra-
gesco, Dragesco-Kerneis, 1986 (3); Foissner, 1995b (Г); Foissner et al., 1999 (5, Д—Ж)).
Fig. 317, 6. Dileptida.
Род Coelosomides Strand, 1928
Это новое название для гомонима Coelosoma Anig-
stein, 1912, типовой вид С. marina Anigstein, 1912; так-
же С. vermiformis Burkovsky, 1970 (Белое море), С. teis-
sieri Dragesco, 1960. Тело относительно короткое и ши-
рокое, особо расширено спереди, где внутрь тела
впячивается участок антерона с вершинами сомаки-
нет; рот с короткой воронковидной глоткой. Вид поз-
же изучали при импрегнации, но топография кинетома
в ротовой зоне пока не выяснена.
Род Psammophrya Jankowski
gen. n.
Типовой вид Pseudoprorodon arenicola Kahl,
1923. Название предложено в тезисах и не признано
Аэшт, поэтому здесь предлагается вновь. Тело очень
длинное, не сплющено, с длинным цепочковидным яд-
ром, терминальной вакуолью и большим числом мел-
ких дополнительных вакуолей по всему телу; кинеты
полимеризованы; апекс с широкой ротовой воронкой и
боковым желобком (как у Myriokaryonidae?); зарисо-
ван акрон, рот с токсицистами. Этот род может при-
надлежать к гапторидам, хотя 4 известных рода мирио-
карионид пресноводные. Род Pseudoprorodon сейчас
невалидный.
Род Ophionecta Jankowski
gen. n.
Типовой вид Holophrya oblonga Maupas, 1883
(Trachelocerca oblonga in Kahl, 1930); как и предыду-
щий род, предложен в тезисах и здесь предлагается
вновь. Это необычайно длинные толстые клетки с сот-
нями вплотную сближенных кинет, цепочкой ядер,
сложной системой вакуолей и каналов. Перистом ско-
шен вниз от апекса, несимметричный, с трихитами или
токсицистами, вероятно ограничен кинетой циркона.
Отличия от гапторид — дисомы по ходу кинет и пра-
вильная сложная сеть аргирома (у гапторид видна мел-
коячеистая сеть другого типа). Как и у предыдущего
ТИП CILIOPHORA. КЛАСС LITOSTOMATEA
577
вида, от расширенного субапикального рта вниз идет
узкий желобок — признак мириокарионид. Можно
вспомнить, что многие гапториды эвригалинные, час-
ты в засоленных почвах.
Описания других подобных форм очень отличают-
ся (Prorodon multinucleatus Dragesco, 1954; Pseudopro-
rodon mononucleatus Bock, 1952, P. incisus, Prorodon
vermiforme и др.); все они, конечно, не относятся к
этим родам простомат и, вероятно, в морском песке
обитает особая группа простомат или гапторид, не по-
лучившая пока должного внимания — в данное время
изучается в основном почвенная фауна южных конти-
нентов. Условно эту группу видов можно назвать «ор-
тостоматами». Часть видов с апикальным ртом, часть с
вестибулюмом разного типа.
Роды простомат неясного
положения
Род Acaryophrya Andre, 1915
Типовой вид A. helenae; по результатам изуче-
ния A. collaris перенесен из простомат в состав гапто-
рид. Широкие овальные клетки с короткой глоткой и
акроном; слегка спиральные кинеты многочисленные,
много тигмокинет с дисомами; вокруг ротовой зоны
кольцо циркона.
Род Apionidium Perty, 1852
Типовой вид Л. modestum — пелагические гру-
шевидные формы с расширением тела к вершине; ро-
товая зона не зарисована.
Род Baeonidium Perty, 1849
Типовой вид В. remigans. Зарисованы клетки в
основном с овальным телом, реснички в разном поло-
жении; вид совершенно неопределимый, на одном ри-
сунке похожи на Spathidium.
Род Balanophrya Kahl, 1927
Типовой вид В. mamillata — синоним рода Aca-
ryophrya.
Род Celeritia Tucolesco, 1962
Типовой вид С. globosa — простоматы с шаро-
видным или овальным телом, спиральными кинетами,
каудальной ресничкой; мелкий апикальный рот с уз-
кой глоткой; не показан акрон и токсицисты.
Род Choanostoma Wang, 1930
Типовой вид Ch. pingi из пресноводного планк-
тона — широкие бочковидные формы с ядром в ви-
де короткой цепи нодул, боковой вакуолью, тело с не-
многочисленными кинетами; спереди вздутый акрон,
окруженный циррусами — пучками слипшихся рес-
ничек, явно отходящих от кольцевого циркона. Это
простомата, не олиготриха, но принадлежность к пере-
численным выше семействам неясная.
Род Crobylura Andre, 1914
Типовой вид С. pelagica, найдена вместе с ва-
лидным родом Belonophrya Andre, 1914, но первый род
пока не принят. Мешковидные широкие клетки с
очень широким срезанным передним концом; ядро
овальное, передняя половина тела полна токсицист,
сзади пучок каудалий. К сожалению, даны 2 рисунка
только сбоку, нет данных о перистоме. Есть боль-
шое сходство с пелагическим родом гапторид Spathidi-
osus Gajewskaja, 1933 (вероятно, простомат, судя по
типу тигмона), но у последнего нет крупного пучка
каудалий.
Род Cryptocaryon Brown, 1951
Типовой вид С. irritans; позже описан как Icht-
hyophthirius marinus Nie et Lee, 1960. Быстро растущая
литература по виду заслуживает специальной моно-
графии. Тканевой паразит морских рыб, в основном
тепловодных и аквариальных, отсутствует в холодных
водах, неизвестен в морях России (на Дальнем Востоке
с юга достигает лишь вод Кореи). Долгое время вид
считался гименостоматой типа Ichthyophthirius, хотя
ясно рисовали апикальный рот; апекс с широким же-
лобком, сужающимся и уходящим вбок; около 50 би-
полярных кинет; ядро из нескольких крупных нодул в
цепочке или независимых. Размножение в цистах вне
хозяина (рис. 310, а); деление резко неравное, затем
делятся оба деривата первого деления, и так до образо-
вания множества мельчайших томитов, выходящих из
цисты; процесс начинается как периферическая палин-
томия. Жабры и наружные покровы всего тела зара-
женных хозяев покрыты бугорками — подкожными
паразитами; по аналогии с ихтиофтириусом в запад-
ной литературе принято обозначение «white-spot di-
sease». Оптимальная температура выше 19 °C , но есть
неотличимые штаммы с развитием при 12—16. Род
выделен в новое сем. Cryptocaryonidae неясного поло-
жения среди переднеротых цилиат по особенностям
морфологии и жизненного цикла.
Род Ctenoctophrys Weill,
1946
Типовой вид С. chattoni из морского планктона;
род пропущен в каталоге Аэшт. По выражению Вейля,
это «окторадиальная инфузория с признаками медуз и
ктенофор». Мелкие (до 62 X 72 мкм) полусферические
цилиаты с очень широким плоским апексом, сложным
ядром, 8 радиальными ресничными желобками ан-
терона; края верхней половины тела с продольными
кинетами. Эти формы недавно переописали, не зная об
этом виде, под другим названием — Askenasia regina
37 Зак. №4163
578
ALVEOLATA
Earland et Montagnes, 2002 {Ctenoctophrys regina
comb, n.); это нс асксназия, род валидный, относится к
мезодиниидам.
Род Dactylochlamys Lauterborn, 1901
Типовой вид D. pisciformis’, также D. hystrix
Wetzel, 1928, вероятно синонимичный с типом рода.
Хорошо изученный аберрантный вид гимностомат, не-
сомненно гапторида с вытянутым телом, мелким по-
лярным ртом с акроном и кольцом ресничек, овальным
ядром; кортекс с длинными острыми шипами по ходу
немногочисленных кинет. Токсицисты в цитоплазме и
шипах не показаны, это не токсофоры, но желательны
новые наблюдения и импрегнация кинет протарголом.
По Калю (КаЫ, 1930), рта нет — это суктория.
Род Diceras Eberhard, 1862
Типовой вид D. viridans. Как гомоним, название
заменено на Diceratula Corliss, 1960. Неопределимый
вид; Бючли (Butschli, 1889) считал род синонимом
Spathidium.
Род Fundenia Vuxanovici, 1962
Типовой вид F. complanata с подвидомF. с. var.
pellucida. Простоматы или гапториды с плоским оваль-
ным телом, вытянутым ядром; мелкий рот на акроне
спереди сбоку, других деталей нет; величина до
120 мкм. Внешне очень похожи на томитов крупных
перифитонных сукторий (дискофрий) — так же распо-
ложена скопула, вакуоль не терминальная, сходно и
ядро.
Род Gymnopithus Kahl, 1926
Типовой вид G. ovatus — мелкий пресноводный
вид с овальным телом, круглым ядром, ребристым
кортексом; спереди четкие ресничные паратены. Цент-
ральная вакуоль и значительная редукция цилиатуры
несвойственны гапторидам.
Род Haematophagus Woodcock et Lodge,
1920
Типовой вид Н. megapterae из ротовой полости
китов-цедильщиков (на пластинах китового уса Ме-
gaptera nodosa). Линн (Lynn, 2002) включил род в со-
став гапторид, но по неопубликованным данным
Смолла (тезисы доклада) и нашему материалу, это ме-
тацистиды типа Vasicola, живущие в домиках. Тело с
кольцевыми складками, реснички в четких многочис-
ленных паратенах (кольцах); поразительно изменчивы
размеры трофонтов и их домиков, от мельчайших до
1.5 мм. У Корлисса (Corliss, 1979) этот род приведен в
сем. Enchelyidae, но сейчас оно включает лишь неболь-
шую часть подвижных гапторид.
Род Lagynurus Mansfeld, 1923
Типовой вид L. pumilio из бентоса в Адриатике.
Очень мелкий вид (15 мкм); круглое ядро, каудалия,
срезанный поперек широкий апекс с группами длин-
ных ресничек по краю; короткие реснички по всему
телу. Находка в пресной воде недостоверная; рисунки
других авторов ничего не добавляют к плохому перво-
описанию.
Род Microcardiosoma Vuxanovici, 1963
Типовой вид М. multiseta из пресных вод;
12—14 кинет, густая цилиатура, узкий или широ-
кий четкий акрон с направленным вверх реснич-
ным кольцом (циркон), овальное ядро. Вид пока не
переописан.
Род Microchoanostoma Vuxanovici, 1963
Типовой вид М. enigmatica — пресноводный
вид с широким овальным телом, сужающимся кзади;
почковидное ядро, много кинет, рот с акроном и ис-
черченной конической глоткой такого типа, как у гап-
торид, а не простомат.
Род Micropithus Kahl, 1926
Типовой вид М. simplex', по Аэшт, синоним
рода Pithothorax Kahl, 1926, но опытный Каль не мог
допустить такой ошибки — М. simplex целиком по-
крыт ресничками, а Р. rotundus имеет лишь рудименты
цилиатуры спереди и сзади. Это простомата с несколь-
кими кинетами, мелким ртом, круглым ядром, боковой
вакуолью; спереди реснички сгущены и направлены
вперед.
Род Microregma Kahl, 1930
Типовой вид М. binucleatum по нашему обозна-
чению; эрроним у Каля Microregina. Род предложен
для 4 видов мелких простомат с простой цилиатурой;
рот у типовой формы щелевидный, отклонен вбок;
глотка не показана, тигмона нет. Вид позже не изучал-
ся; морские цилиаты пока не получили такого внима-
ния, как пресноводные и почвенные.
Род Monomastix Roux, 1899
Типовой вид М. ciliatus', гомоним и синоним
рода Ileonema в свою очередь невалидного как вероят-
ный синоним какого-то рода гапторид {Ileonema Sto-
kes, 1884, типовой вид I. dispar). М. ciliatus — узкие
особи с вытянутым телом, короткой узкой глоткой и
акроном, с 2 ядрами и одной вакуолью; особенность —
длинный извитой жгут, до середины тела. При всем
многообразии цилиофор таких цилиат нет и не может
быть, авторы этих 2 родов в чем-то ошиблись; у I leone-
ТИП CILIOPHORA. КЛАСС LITOSTOMATEA
579
та это явно полузаглоченная пища, а не толстый апи-
кальный жгут. Эти фиктивные роды включались в
столь же фиктивную группу Mastigociliata.
Род Nannophrya Kahl, 1933
Типовой вид N. truncata — мелкий морской
вид с ребрами панциря, равномерной цилиатурой,
передний конец (рот) расширенный и плоский, с син-
цилиями, направленными вперед. Вид N. costata Tu-
colesco, 1962 из Черного моря имеет более узкий ан-
терон и рот.
Род Orcavia Tucolesco, 1962
Типовой вид О. spelea — широкое тело, много
меридиональных кинет, 9 ядер (?) на рисунке; спереди
глубокая полость, перистом не изучен.
Род Pithothorax Kahl, 1926
Типовой вид Р. processus К., 1926; Р. rotundus
К., 1927; Р. ovatus К., 1927; Р. simplex К., 1927; мелкие
простоматы с редукцией цилиатуры, как у локсоцефа-
лиды Balanonema. Спереди кольцевые паратены, сзади
пучки ресничек и каудалия. Каль сам ввел тип рода
Gymnopithus (G. ovatus) в состав рода, признав указан-
ное название синонимом.
Род Proboscidium Meunier, 1910
Типовой вид Р. armatum из фиксированных
проб морского планктона в Арктике. Трудный род —
мало рисунков, противоречивые данные о строении.
Размер клетки около 150 мкм, с массой кинет, вытяну-
тым или извитым ядром; рот широкий, субапикаль-
ный, с отростком разной длины (возможно, это резуль-
тат плохой фиксации цитоплазмы).
Род Pseudoenchelys Tucolesco, 1962
Типовой вид Р. armata-, вероятный синоним
рода Enchelydium. Вытянутые мешковидные формы с
широким антероном и ртом, извитым ядром, неболь-
шим числом кинет, токсицисты по всему кортексу и в
ротовой зоне. Если это вид Enchelydium, следует пере-
нести в этот род (Е. armatum comb. n.).
Род Rhopalophrya Kahl, 1926
Типовой вид Rh. acuta К., 1926; Rh. gracilis К.,
1926; Rh. crassa K., 1926; Rh. elegans Horvath, 1956. Уз-
кие мелкие клетки из пресной воды и почвы с неболь-
шим числом кинет; рот с ресничками и глоткой, часто
с хоботком (обособлена вершина тела — акрон), несу-
щим токсицисты. Кинетом не изучен.
Род Schewiakoffia-Corliss, 1960
Новое название для Maupasia Schewiakoff, 1893,
ненужное, так как уже есть замещающее название
Mastigothrix. Вид с длинным передним жгутиком в до-
полнение к цилиатуре едва ли существует, описание
недостоверное.
Род Spasmostoma Kahl, 1927
Типовой вид S. viride из сапропеля; мелкие
овальные особи; немного кинет (около 20), округлое
ядро, короткие ряды тигмона; вытянутый рот с более
длинными ресничками по краю (циркон); коническая
глотка с палочками; от рта вверх отходит пучок палоч-
ковидных подвижных мембран.
Род Spathidiella Kahl, 1930
Новое название для Spathidiodes Kahl, 1926 пес
Spathidioides Brodsky, 1925, но это не гомонимы. Чер-
номорский вид Spathidiella arenaria Lepsi, 1962 к это-
му роду не относится.
Род Spathidiosus Gajewskaja,
1933
Типовой вид S. bursa из планктона Байкала; пе-
реописан Оболкиной (19956) при серебрении по Шат-
тону. Широкие мешковидные сплющенные формы с
растянутым широким ртом, округлым ядром, с пучка-
ми токсицист по всему телу. По Оболкиной, постерон
безресничный, кинеты полимеризованы, по перифе-
рии ротовой зоны полоса из верхних частей кинет со
сгущением кинетосом; рот закрыт, полон фагоплазмы.
Неожиданным было выявление полосы из 5 коротких
косых фрагментов кинет на одной стороне, как у урот-
рих, поэтому допускается перенос рода из гапторид в
состав простомат.
Род Quasillagilis Busch, 1920
Типовой вид Q. constanziensis из черноморско-
го планктона. Размеры слишком мелкие для цилиат
(9—13 мкм); показан субапикальный рот с небольшой
глоткой и ресничками, поперечный ресничный жело-
бок, каудалия и кольцо длинных ресничек в нижней
части тела. Найдены в фиксированном материале; по-
хожи на перидиней.
Род Sphaerobactrum Schmidt,
1920
Типовой вид S. warduae из пресноводного
планктона. Тело сферическое (100—200 мкм), с тол-
стым альвеолярным слоем, как у совместно встречен-
ных Bursellopsis-, рта нет; цитоплазма полна зоохло-
релл; кинетом полный, без редукции. При делении об-
разуются цепочки из 4 особей длиной до 720 мкм.
580
ALVEOLATA
Род Thalassiomastix Busch, 1923
Типовой вид Th. atlantica; тело грушевидное,
мелкое (20 мкм), ресничек нет в нижней четверти; рот
мелкий, смещен вбок от апекса, с длинными прямы-
ми ресничками (токсицисты при фиксации?). Непра-
вильно ориентированный и очень плохо изученный
вид; род нельзя включать в определительные таблицы
цилиат.
Род Urochaenia Savi, 1913
Типовой вид U. ichthyoid.es из горного озера в
Италии. Крупные слегка сплющенные сократимые и
гибкие клетки; тело червеобразное с овальным ядром;
сзади вакуоль и циррусовидные придатки; много ки-
нет, у рта реснички удлинены; рот без акрона. Этот род
не был принят; тип рода очень похож на Enchelyodon,
например на Е. elongatus. Это несомненно гапториды;
циррусы сзади — пучки каудальных ресничек. Вероят-
но, синоним старинного рода Enchelyodon.
Отряд Cyclotrichida Jankowski, 1980
(рис. 312, 6—313, 6)
Переднеротые формы с широким телом, в планкто-
не пресных вод и в море; нет булавовидных ресничек;
соматические реснички двух типов, простые и цирру-
совидные (с несколькими кинетосомами в основании);
нет немадесм глотки. Характерна тенденция к редук-
ции части цилиатуры, развитию обширного ацилона
(безресничной поверхности); оставшаяся цилиатура
служит для движения и фильтрации пищи.
Сем. Mesodiniidae Jankowski, 1980
С диагнозом отряда; единственное семейство в от-
ряде. Включает обычных, часто массовых обитателей
планктона, отсутствующих в бентосе; основное разно-
образие в пресных водах, в море монотипический род
Myrionecta и часть видов Mesodinium.
Род Askenasia Blochmann, 1895
Типовой вид Л. volvox по монотипии. Название
рода — синоним рода Stephanidina Eichwald, 1852,
предложенного для вида Trichodina volvox того же ав-
тора. Вскоре этот вид перенесли в состав рода Halteria
(в новой системе — в отряде олиготрих, с полуколь-
цом апикальных мембранелл, отсутствующих у A. vol-
vox). В определителе Каля (Kahl, 1930) признана иден-
тичность Halteria volvox и Askenasia elegans Bloch-
mann, 1895, но Каль неправильно цитирует вид как
A. volvox (С. et L., 1859). Дингфельдер (Dingfelder,
1962) первым скорректировал название вида как
A. volvox (Eichwald, 1852) Blochmann, 1895.
Род включает несколько видов из пресноводного
планктона; диагностика видов велась до последнего
времени без импрегнации, и у очень мелких подвиж-
ных цилиат точная топография кинетома не была
изучена. Импрегнация протарголом была впервые про-
ведена Крайнером и Фойсснером (Krainer, Foissner,
1990), что позволило диагностировать виды рода и вы-
делить новый род Rhabdoaskenasia.
Типовой вид A. volvox — мелкий вид (до 40—
50 мкм) с грушевидным телом и С-образным ядром;
вакуоль медиальная, с накопительными везикулами.
Пелликула тонкая, гибкая, при давлении покровного
стекла особи лопаются, изучение вида возможно лишь
при фиксации, лучше всего разбавленной сулемой.
Импрегнация выявляет 47—48 продольных кинет, по
другим данным около 60; ряды не биполярные, остав-
ляют открытыми обширные ацилоны у рта и в нижней
половине тела, как у хальтерий. В ротовой зоне имп-
регнируется звездчатая фигура из аргиросом, от кото-
рых в глубь тела отходят толстые фибриллы. Вероят-
но, нет постоянно открытого рта с немадесмальной
трубчатой глоткой.
Соматическая цилатура сложно дифференцирова-
на — по ходу кинеты снизу вверх различимы 3 отде-
ла — несколько кинетосом с длинными щетинками,
пучок которых направлен вбок, щетинки расходятся
радиально от поверхности тела; выше — длинный
двойной ряд кинетосом с аргентофильными фибрилла-
ми между ними, несущий полосу склеенных ресни-
чек — типичную мембранеллу, по традиции обознача-
емую как «пектинелла»; еще выше ряд кинетосом,
сближенных в нижней части ряда и разрозненных в
верхней, они образуют пектинеллу с короткими рес-
ничками. У живых и фиксированных особей хорошо
видно кольцо экваториальных щетинок, кольцо круп-
ных пектинелл с характерным изгибом и верхнее
кольцо мелких пектинелл, направленных вперед. Ар-
гиром — фибриллы (аргиронемы) в передней части
тела и диагональные ряды прямоугольников, каждый с
безресничной аргиросомой в центре в постесоме; нет
каудальных ресничек. Звездчатая фигура на антероне
состоит из кинетосом, по одной от каждой сомакине-
ты, расположенных на разном уровне; это модифика-
ция циркона низших гапторид.
Фойсснер (Foissner et al., 1999) приводит все иллю-
страции вида по литературе и отмечает несоответст-
вие изученного им вида с первоописанием по числу
пектинелл (24 по Эйхвальду, около 60 по Фойсснеру),
но рисунки в первоисточнике примитивные и упро-
щенные, поэтому отныне типичная для вида морфоло-
гия — в цитированной книге Фойсснера. Для всех ви-
дов рода характерно наличие 3 зон каждой кинеты,
парных кинетосом спереди без ресничек, отсутствие
боковой тигмозоны. Род ранее приписывался к отряду
Haptorida, но был перенесен в состав Cyclotrichida. Ва-
лидных видов 4: типовой вид, A. stellaris (Leegaard,
1920) Kahl, 1930; A. acrostomia Kramer et Foissner, 1990
и A. chlorelligera Krainer et Foissner, 1990.
A. acrostomia имеет несколько вакуолей в разных
местах постесомы, обширную терминальную вакуоль,
кольцо дисом вместо звездчатой фигуры вокруг рта
и пучок длинных апикальных экструсом, выдающих-
ся над телом и почти достигающих постерона; это од-
новременно опорный аппарат клетки. По внешнему
облику этот вид похож на Monodinium. Ядро С-образ-
ное.
ТИП CILIOPHORA. КЛАСС LITOSTOMATEA
581
A. chlorelligera очень близка к предыдущему виду,
имеет овальное ядро, терминальную и одну дополни-
тельную вакуоль, звездчатую фигуру вокруг рта из ди-
сом, более короткие токсицисты (экструсомы); виды
легко различить по аргирому.
A. stellaris отличается по форме тела (низкое и рас-
тянутое в стороны, почти дисковидное); ядро вытяну-
тое, но не С-образное; апекс со звездчатой фигурой и
широким ртом с длинными токсицистами.
Виды Askenasia faurei Kahl, 1930 и A. humilis Ga-
jewskaja, 1928 признаны валидными, но по типу кине-
тома они перенесены в состав рода Cyclotrichium.
Род Rhabdoaskenasia Krainer et Foissner,
1990
Типовой вид R. minima. Пресноводный вид с
мелким грушевидным телом (20—35 мкм) и массив-
ным ядром, с одной боковой вакуолью, без крупной
терминальной вакуоли; экструсомы погружены в ци-
топлазму, не подняты над телом. По ходу кинеты сни-
зу вверх различимы зоны щетинок (только 2 радиаль-
ные щетинки), крупной и мелкой пектинелл и обособ-
ленных парных кинетосом в правильном кольце
вокруг рта. Особенность рода — наличие постоянного
опорного аппарата рта и глотки; от верхних кинетосом
отходят длинные немадесмы, к которым прикреплены
экструсомы, а от других кинетосом верхней пары от-
ходят ко рту фибриллы, образуя систему радиальных
опорных элементов. Кроме дубинковидных экструсом,
закрепленных на стенке глотки, у постерона имеются
экструсомы другого типа — длинные тонкие палочки с
нитевидным акроном. Ротовой аппарат типа рабдома
(не циртус). Авторы рода временно помещают его в
состав сем. Mesodiniidae, не исключая обособление в
составе самостоятельного семейства в связи с наличи-
ем немадесм глотки.
Род Mesodinium Stein, 1863
Типовой вид М. acarus. Штейн установил род
Mesodinium в 1863 г., но включил в состав рода 2 вида
(М. acarus и М. pulex) только в 1867 г., поэтому род в
литературе обычно упоминают со второй датой. Тип
рода — пресноводный вид; М. pulex и три других вида,
ныне сведенные в синонимы, обитают в море. Накопи-
лось много упрощенных рисунков по живому материа-
лу, особенно по морским видам; они очень противоре-
чивы, и до последних лет оставалось неясным точное
строение типового вида и родовой статус морских
форм — относятся ли они к Mesodinium или могут
быть видами особого рода.
Изучение типового вида при импрегнации (Krainer,
Foissner, 1990) показало значительные отличия от As-
kenasia. Тело грушевидное, с крупной терминальной
вакуолью, фактически полостью над постероном, и
мелкой боковой вакуолью выше; ядро овальное, у всех
видов рода нет удлинения макронуклеуса; рот широ-
кий, без немадесмальной глотки; экструсомы булаво-
видные, отсутствуют в цитоплазме, расположены в
едином осевом пучке, выдаются над ртом. Кинеты рез-
ко укорочены, имеется лишь узкий экваториальный
поясок; по ходу кинет снизу вверх всего 2 отдела, ниж-
ний с дикинетами, верхний с монокинетами; от них от-
ходят пектинеллы, направленные вниз и прилегающие
в покое к телу особи, и длинные циррусы, по 3 от каж-
дой монокинеты, расходящиеся радиально в стороны.
Морфология морского вида М. pulex изучена при
импрегнации; по форме тела вид сходен с пресновод-
ным, тело грушевидное, кинеты короткие, с 2 зонами;
нижний ряд в каждой кинете состоит из парных кине-
тосом, над ним не короткая мбнокинета, как у типово-
го вида рода, а по 2 группы кинетосом, как в основа-
нии циррусов гипотрих (3 + 3 + 2 кинетосомы в каж-
дой группе). Соответственно цилиатура каждого
ряда — это 2 крупных цирруса, направленные вверх и
вбок, и пектинелла, направленная вдоль краев тела
вниз. Такой кинетом резко отличается от схемы у
М. acarus, и поэтому М. pulex должен быть выделен в
особый род или как минимум подрод — Mesodinium
(Moredinium subgen. п.), типовой вид AT. pulex, с приве-
денным выше диагнозом.
Другие морские виды — М. cinctum Kahl, 1930;
М. pupula Kahl, 1935.
Род Myrionecta Jankowski gen. n.
Типовой вид Halteria rubra Lohmann, 1908
(Mesodinium rubrum у всех последующих авторов).
Этот вид при массовом развитии вызывает цветение
моря — red tide (правильнее brown tide), отмеченное во
многих морях; одиночные особи могут быть собраны
практически повсюду в океане, вспышки размножения
отмечаются редко. Особи грушевидные, но ивертиро-
ваны по сравнению с грушевидными М. acarus — тело
расширено апикально, сужено ниже экватора; в цито-
плазме большое число пигментных хроматофоров или
симбионтных микроводорослей красно-коричневого
цвета, питание амфизойное — фотосинтез и фаготро-
фия (ряд авторов отрицает фаготрофию). Ротовое от-
верстие с пучком булавовидных токсицист, отсутству-
ющих в цитоплазме; немадесм нет. Экваториальный
ресничный пояс относительно широкий, по ходу кине-
ты 2 обособленных отдела — нижний ряд (дикинета) и
более короткий верхний — дикинета, дающая начало
3 радиальным циррусам. От нижней дикинеты отходят
пектинеллы, направленные вниз. Такой кинетом отли-
чается от схемы у пресноводного вида М. acarus и от
схемы для морского вида М. pulex, поэтому red-tide ci-
liate, как обычно называют М. rubrum в литературе,
может быть выделен в особый род. Такой род был
предложен ранее—Myrionecta Jankowski, 1976 — был
принят в литературе (в Интернете более 400 сайтов
«Myrionecta»), в частности принят Фойсснером при
анализе родов сем. Mesodiniidae (Foissner et al., 1999),
но был отвергнут Аэшт как название, предложенное в
тезисах, поэтому здесь предлагается вновь.
Если верна схема кинетома М. pupula Kahl, 1933
(два кольца по экватору, с дикинетой внизу и моноки-
нетой выше, без щетинок, с 2 пектинеллами), то по от-
сутствию щетинок это вид особого рода; пока условно
он остается в составе Mesodinium, нужно повторное
изучение этой формы.
582
ALVEOLATA
Сем. Cyclotrichiidae Jankowski, 1980
В системе Линна (Lynn, 2002) Cyclotrichium и близ-
кие роды помещены в сем. Didiniidae отряда Haptorida;
ио отряд Cyclotrichida был предложен именно для это-
го рода и близких форм, не дидиниумов. Семейство
включает пелагических пресноводных форм с широ-
ким телом, полимеризацией кинет, без экваториаль-
ных щетинок, с более простым кинетомом, чем у мезо-
диниид.
Род Cyclotrichium Meunier, 1910
Типовой вид С. cyclokaryon Meunier, 1910.
Морской вид с коническим телом, длинным С-образ-
ным ядром; нет циртума и немадесм, рот в виде звезд-
чатой апикальной щели без пучка трихитов (экстру-
сом). В первоисточнике вид хорошо иллюстрирован на
многих рисунках, показано только одно кольцо ресни-
чек, у одной неделящейся крупной особи 2 кольца,
удаленных одно от другого, субапикальное и медиаль-
ное. Кинеты в кольце полимеризованы, ряды и кинето-
сомы в них сближены вплотную, реснички короткие,
щетинок нет. Можно принять за основу для типового
вида наличие одного субапикального кольца коротких
недифференцированных ресничек. Менье рисует и
стадии деления, показывая только одно кольцо у каж-
дой дочерней особи. Тело исчерчено, множество тон-
ких вплотную сближенных фибрилл идут от кольца до
рта и до постерона, кинеты кольца соответствуют фиб-
риллам кортекса.
Подробно изучен пресноводный вид С. viride Ga-
jewskaja, 1933 (= С. limneticum Kahl, 1935) — вид с ши-
роким телом, в принципе такого же типа, как морской
типовой вид. Имеется субапикальное кольцо из мно-
жества фрагментов монокинет; у вершины каждого
ряда по одной паре обособленных кинетосом; от коль-
ца к ротовой зоне идут фибриллы, к постерону ряды
аргиросом — кинетосом без ресничек; ядро овальное.
2 аберрантных вида, ранее отнесенные к Askenasia,
перенесены в состав Cyclotrichium — A.faurei Kahl,
1930 и A. humilis Gajewskaja, 1933; у обоих видов по
2 кольца ресничек, щетинок нет, антерон расширен,
особенно у байкальского вида A. humilis', оба вида не
соответствуют диагнозу рода и едва ли относятся к од-
ному роду, слишком резкие различия внешнего обли-
ка, нет соматических ресничек ниже пояска у С. humi-
lis. Для С. sphaericum, A. faurei и A. humilis предложен
род Dicyclotrichium Xu, Song, Hu, 2005 — тело оваль-
ное, с узким ртом и глоткой, имеются 2 кольца ресни-
чек — узкое верхнее и широкое нижнее, и продольные
ряды мелких ресничек до постерона; ядро овальное;
терминальная вакуоль с каналами.
Род Liliimorpha Gajewskaja, 1933
Типовой в и д L. viridis из планктона Байкала;
повторное описание Оболкиной (19956) резко отлича-
ется от рисунка Гаевской, но несомненно является точ-
ным, основано на импрегнированных препаратах.
Тело низкое и очень широкое, антерон с радиальными
ребрами, расходящимися от ротовой зоны; имеется
звездчатая фигура из парных кинетосом (дисом), несу-
щих более короткие реснички, чем соматические; ки-
неты в широком кольце, полимеризованы, не отмечена
дифференцировка их вершин. Постесома с короткими
ресничками; здесь выявляется аргиром в виде непра-
вильной сети, с дисомами в каждой ячейке; тело запол-
нено зоохлореллами.
Вид не эндемичен для Байкала, как считалось ра-
нее, отмечен в одном из озер в Германии; вероятно это
холодноводный зимний вид, развивается подо льдом,
когда планктон не собирают.
Род Pelagovasicola Jankowski, 1980
Типовой вид Didinium cinctum Voigt, 1901.
Крупная пелагическая простомата из прудов и озер ве-
личиной до 180 мкм. Тело удлиненное, сужается к по-
стерону, ядро почковидное, вакуоль терминальная, с
20 приводными каналами; цитоплазма полна пластид и
зоохлорелл; экструсомы нитевидные, длинные, до
30 мкм, в антесоме. Около 88—127 кинет идут от по-
стерона до широкой апикальной площадки с неболь-
шим ртом; по ходу каждой кинеты кинетосомы груп-
пируются в 6 сегментов, у постерона их расположение
беспорядочное. В итоге вид имеет 6 ресничных колец
разной ширины, крупнее снизу вверх, и обособленные
реснички у вершины верхнего кольца. Постерон с не-
большой безресничной площадкой (ацилоном). Кине-
том вида описан Крайнером и Фойсснером (Krainer,
Foissner, 1990), подробно разобравшим также сино-
нимию вида; в монографии цилиат планктона Форе-
Фремье (Faure-Fremiet, 1924) этот вид был неправиль-
но определен как Dinophrya lieberkuhnii Butschli; для
этого описания Каль предложил вид Didinium faurei
Kahl, 1930 — синоним вида Р. cinctum.
Отряд Pleurostomatida Schewiakoff, 1896
(рис. 315, а—316, б)
Небольшой отряд по числу родов, но с быстро рас-
тущим числом видов. Несколько крупных родов широ-
ко распространены в пресных водах, мхах (террофито-
не), в солоноватых и морских водах; один род (Pseudo-
amphileptus) облигатно симбионтный на рыбах,
несколько видов других родов обитают на ракообраз-
ных и рыбах, питаясь в основном зооидами других
симбионтов — перитрих.
Группа очень четкая, хорошо отграниченная от
других «холотрих». Тело латерально сплющено, сужа-
ется к обоим концам, при виде сбоку ланцетовидное
или веретеновидное, с незначительно выпуклой дор-
сальной стороной. Цилиатура обеих сторон тела резко
асимметричная. На правой стороне это ряды моносом
(монокинетид), в которых все кинетосомы несут рес-
нички; кинеты многочисленные, сложной топографии.
Левая сторона тела выглядит безресничной, и у многих
плохо описанных видов цилиатура не отмечалась, или
рисовали несколько краевых кинет, или отмечали про-
дольные желобки. Только при интенсивном изучении
плейростомат в последние годы разными методами
ТИП CILIOPHORA. КЛАСС LITOSTOMATEA
583
импрегнации выяснилось, что на левой стороне со-
хранены продольные инфракинеты (ряды моносом; в
меньшем числе, чем на правой стороне) и в передней
части тела имеются ряды укороченных щетинковид-
пых ресничек — аналог тигмона простомат («bros-
se-borsten» немецких авторов — щетина щетки).
Ротовой аппарат включает длинную закрытую ро-
говую щель, вытянутую вдоль вентрального ребра
тела от апекса вниз на разное расстояние у разных ро-
дов, обычно не длиннее середины тела, у Loxophyllum
идущую до постерона. Немадесм (прочных палочек
стенки глотки) нет, но хорошо видны и четко выявля-
ются при окраске протарголом фибриллы длинной
изогнутой глотки. Имеется специализированная рото-
вая цилиатура — ряды тесно сближенных кинетосом,
идущие по обе стороны вентрального ребра; у видов
Amphileptus имеется по одной кинете правее и левее
рта, у части других родов один ряд слева (L1) и два
справа (Rl, R2). Стоматогенез простой, «соматическо-
го» типа — новый ротовой аппарат возникает на конце
нескольких сомакинет.
Характерно наличие крупных многочисленных
токсицист, расположенных правильными рядами
вдоль ротовой щели и иногда также в других участках
краевой зоны, и во множестве рассеянных в цитоплаз-
ме. Их можно выявить новым методом — внести ам-
филептид в раствор азотнокислого серебра и выста-
вить для проявления на солнце. Ядро цельное лишь в
исключительных случаях (у Litonotus alpestrisy, как
правило, имеются 2 овальных ядра по оси тела и ин-
теркалярный микронуклеус между ними. Макронукле-
усы полиплоидные, быстро и интенсивно красятся на
ДНК по Фёльгену, плотные, хорошо видны прижиз-
ненно. Сократительная вакуоль одна у постерона или
несколько в ряду.
Ротовая цилиатура не фильтрационного типа, нет
полосы пектинелл или мембранелл. Питание хищное в
основном цилиатами, которые могут быть крупнее на-
павшего хищника. Реже поедаются флагеллаты, диато-
меи, крупные локсофиллы могут заглатывать тардиг-
рад, коловаток; мелкие виды питаются бактериями.
Обычно плейростоматы ползают по субстрату и при
случайном контакте с добычей расширяют ротовую
щель, обездвиживают жертву токсицистами и медлен-
но заглатывают. После этого многие виды инцистиру-
ются, вновь выходя после переваривания пищи в еди-
ной гигантской гастриоли. Для образования цист покоя
особи могут собираться в компактные агрегаты. Обыч-
ные цилиаты в пробах из пресных и морских вод; часть
видов можно найти на колониях перитрих в перифито-
не, на циклопах, на Asellus, Gammarus, Astacus, на ры-
бах; вероятно, от таких форм, питавшихся перитриха-
ми типа Apiosoma и Heteropolaria, произошли специ-
фичные амфилептиды на покровах пресноводных рыб.
Методические трудности надолго задержали разви-
тие систематики отряда (предложенного Шевяковым
как подотряд гимностомат). Прижизненно кинетом
плохо виден, поэтому в литературе накопилось множе-
ство описаний неопределимых видов, с которыми
трудно сравнивать рисунки других видов и современ-
ные описания. Амфилептиды не импрегнируются на
сухих мазках методом Клейна; могут быть окрашены
рельефным методом Бресслау (нигрозин или опало-
вый синий), но он редко применялся. Импрегнация по
Шаттону-Львову дает хорошие постоянные препара-
ты, но применяется также редко. В последние деся-
тилетия идет интенсивное изучение плейростомат
универсальным методом — при импрегнации протар-
голом; с большой четкостью выявляются все кинето-
сомы, реснички, кинеты, фибриллы, ядра, токсицисты.
Таксономическая история группы на уровне родов
драматична — многократно нарушались элементар-
ные правила систематики, произвольно менялись ро-
довые названия, различия родов почти до последнего
времени оставались неизвестными; между тем нарас-
тало число новых видов, относимых чаще всего к роду
Hemiophrys, ныне ликвидированному. В итоге можно
считать валидными около 10 родов; род Kentrophyllum
здесь не признается как синоним забытого рода Litoso-
lenus\ признан валидным спорный род Acineria, виды
которого очень обычны в пресных водах.
В каталоге Линна (Lynn, 2002) отряд Pleurostomati-
da без подотрядов делится на 2 семейства — Amphilep-
tidae и Litonotidae, принятые здесь, хотя различия их
незначительные.
Фойсснер и Лейпе (Foissner, Leipe, 1995) предлага-
ют новую классификацию отряда плейростомат, осно-
ванную на сравнении ротовой и соматической инфра-
цилиатуры.
Отряд Pleurostomatida Schewiakoff, 1896
Подотряд Amphileptina Jankowski, 1967 — рот
окаймлен правой и левой ротовыми кинетами, состав-
ленными дикинетидами (дисомами); цилиатура пра-
вой стороны тела с бисекантой.
Сем. Amphileptidae Butschli, 1889
(Amphileptus, Opisthodon,
Pseudoamphileptus)
Подотряд Litonotina W. Foissner et I. Foissner, 1988 —
рот окаймлен правой и левой стомокинетами, и в до-
полнение к ним справа прилегает соматический ряд,
который создает типичную стомокинету, но она состо-
ит из моносом; фибриллы, образующие стенки глотки,
выделяются всеми тремя кинетами; латеральная цили-
атура справа с дорсолатеральными кинетами или без
них; ресничные ряды последовательно укорачиваются
вдоль ротовых и дорсолатеральных кинет.
Сем. Litonotidae Kent, 1882 — без дорсолатераль-
ных кинет; в составе роды Litonotus, Acineria и, вероят-
но, Heminotus.
Сем. Loxophyllidae Foissner et Leipe, 1995 — с обо-
собленными дорсолатеральными кинетами; включает
Loxophyllum и Siroloxophyllum. Классификация ниже
дается по более простой схеме Линна.
Сем. Amphileptidae Butschli, 1889
Имеются 2 ротовые кинеты, по одной правее и ле-
вее ротовой щели; сомакинеты правой стороны в
своей верхней части укорочены и сходятся парами зер-
584
ALVEOLATA
кально вдоль длинного бисекантного шва вдали от ро-
товой щели, идущего по оси тела медиально. Обозна-
чение роз овых кинет — ряды Р1 на левой стороне тела,
Р2 на правой.
Род Amphileptus Ehrenberg, 1830
Типовой вид A. cygnus (М., 1773) по обозначе-
нию Фроментеля (Fromentel, 1874); крупный род с бы-
стро растущим числом видов, одинаково частых в пре-
сной воде и в море. Хотя обозначение типа принято
в каталоге Аэшт, на рисунке Фроментеля изобра-
жен скорее Dileptus, чем Amphileptus, поэтому можно
отвергнуть такую индикацию. Типичные амфилепту-
сы — некрупные плоские ланцетовидные формы с уз-
ким задним концом тела и вытянутым хоботковидным
антероном, с 2 ядрами, большим числом вакуолей в
1—2 краевых рядах, с длинной ротовой щелью и мас-
сой фибрилл, отходящих от ротовых кинет. Ротовая
цилиатура — это специализированные верхние части
2 сомакинет, идущих вдоль вентрального ребра спра-
ва и слева; ниже рта это гаплокинеты (только с моно-
сомами), как и все остальные ряды, а на уровне рта
они, не прерываясь, состоят из тесно сближенных ди-
кинетид (дисом), несущих особо длинные реснички;
это имитация ротовых мембран высших цилиат. У
большинства видов 2 ядра, у A. carchesii — 4. Сомаки-
неты многочисленные на обеих сторонах тела, бисе-
кантный шов четкий (по традиции у плейростомат обо-
значается термином «spica»); левосторонние ряды с
короткими щетинками. Тигмон расположен на ле-
вой стороне на уровне перистома вдоль дорсального
ребра плоского тела, это один специализированный
ряд дисом.
Виды рода предпочитают зооидов вортицелл и ко-
лоний перитрих как основную пищу, и часть видов
специфична для определенных перитрих; по крайней
мере A. carchesii, описанный с крупных колоний пре-
сноводной зоотамниды Carchesium polypinum, адапти-
рован только к этому хозяину — секретирует фикса-
торную нить для закрепления на ветвях колонии. В ли-
тературе многократно описан процесс захвата и
поедания зооидов и образование цист питания и цист
покоя. Наличие секреторной ампулы и выделяемой ею
нити — достаточные признаки для обособления этого
вида на уровне подрода Amphileptus {Fixonotus Jankow-
ski subgen. n.) carchesii Stein, 1867 (типовой вид по ука-
занию и монотипии); кроме того, бисеканта у A. carc-
hesii идет через все тело справа, не только на уровне
перистома. Все остальные виды рода относятся к типо-
вому подроду Amphileptus (подрод Amphileptus Ehren-
berg, 1830) с типовым видом Л. cygnus.
Из большого числа видов, относимых к данному
роду, отметим часть достоверных, описанных или изу-
ченных заново с применением протаргола: A. meiianus
Song et Wilbert, 1989; A. affinisS. etW., 1989; A. ensifor-
mis S. et W., 1989; A. fusiformis S. et W., 1989; A. pro-
ceroformis S. et W., 1989; A. procerus (Penard, 1922 in
Lionotus)', A. pleurosigma (Stokes, 1884 in Litonotus)
(= Hemiophrys avellens Canella, 1960); A. piger (Vu-
xanovici, 1962 in Litonotus)', A. parafusidens S. et W.,
1989; A. fusidens {Hemiophrys in Kahl, 1926); A.falcatus
S. et W., 1989; A. agilis {Hemiophrys in Penard, 1922);
A. punctatus (Kahl, 1926 in Lionotus)', A. claparedii Ste-
in, 1867.
Род Hemiophrys Wrzesniowski, 1866
Типовой вид H. diaphones по монотипии; вто-
рично предложен как новый — Hemiophrys Wrz., 1870.
Этот таксон был предложен как подрод в составе рода
Litonotus, тип рода обозначен как L. {Н.) diaphones, по-
этому неправ Каль (Kahl, 1931), считавший Hemioph-
rys родом, a «Lionotus» подродом в его составе. После-
дующие авторы, пользуясь определителем Каля, опи-
сали много видов рода Hemiophrys. Сейчас очевидно,
что 2 названных рода не идентичные и принадлежат к
разным семействам. Признак рода Hemiophrys, по
Калю, — зеркальное схождение кинет в верхней части
тела справа, но это характерно и для предложенного
ранее рода Amphileptus. Современные авторы считают
род Hemiophrys невалидным как синоним рода Amphi-
leptus — нет достаточных отличий их типов на родо-
вом уровне. Часть видов (в списке выше) перенесена в
состав второго рода, часть ожидает повторного изуче-
ния — Н. salmica Burkovsky, 1970; Н. lanceolata D.,
1965; Н. rotunda К., 1930; Н. inquieta Biemacka, 1963;
Н. polymicronuclei Li, 1990; H. baltica Fenchel, 1965
и мн. др. Последний вид адаптирован к питанию пе-
ритрихами на морских гаммарусах. Первоописание
типового вида банальное — размеров нет; не отмече-
на (но предполагается, судя по длинным ресничкам)
ротовая щель и нет «трихоцист» в этой зоне в отли-
чие от Litonotus, что считалось отличительным при-
знаком подрода.
Род Opisthodon Stein, 1859
Типовой вид О. niemeccensis, позже в составе
рода Loxophyllum —L. niemeccense (Stein, 1859) Kahl,
1931. Редкий пресноводный вид, долгое время оста-
вавшийся неизученным; размеры 60—100 мкм; тело
широкое, резко сужается к апексу, с каймой и боль-
шим числом кинет, вакуоль и 2 ядра в медисоме. По
Штейну и со ссылкой на него у всех ранних авторов,
нет щелевидного рта в антесоме; сзади имеется цир-
тум — типичная глоточная корзинка с немадесмами,
причем в этом месте топография кинет не нарушена.
Пенард, детально изучивший вид (Penard, 1922),
убедительно доказал отсутствие циртума у постерона;
вид имеет стандартную для плейростомат ротовую
щель, не более 1/4—-1/5 длины тела, за циртум Штейн
принял пучок трихитов. Род считался валидным по на-
личию каймы вокруг всего тела и длинных прочных
щетинок, как у Litosolenus. Пенард считает типовой
вид последнего рода {L. armatus) близким или иден-
тичным с О. niemeccensis, но без переноса в состав это-
го рода. О. niemeccense сейчас хорошо изучен при
окраске протарголом; как у Amphileptus имеется бисе-
кантный шов справа, 2 ротовые кинеты и одна тигмо-
кинета в типичном положении (у дорсального ребра
левой стороны тела), но другой формы — извитая, с
верхним карманом.
ТИП CILIOPHORA. КЛАСС LITOSTOMATEA
585
Род Pseudoamphileptus Foissner,
1983
Типовой вид Hemiophrys macrostoma Chen,
1955; это специфические симбионты пресноводных
рыб, впервые найдены в Китае на Aristichthys nobilis,
Hypophthalmichthys molithrix, Ctenopharyngodon idella,
позже на других рыбах в Евразии и США. Обитают на
жабрах, реже на покровах тела. Вид мелкий
(35—71 мкм), тело широкое, антерон сужен, но не вы-
тянут; имеется 2 ядра, 8—15 вакуолей. Кинеты отно-
сительно немногочисленные, на правой стороне идут
продольно, с небольшим швом не медиально, как у
Amphileptus, а у вершины ротовой кинеты; на левой
стороне несколько разрозненных рядов и полоса тесно
сближенных кинет вдоль дорсального ребра. Ротовая
щель растянута на 3/4—4/5 длины тела, и так же длин-
ны две ротовые кинеты, по одной с обеих сторон рта,
с тесно сближенными дисомами. По Фойсснеру, толь-
ко у этого рода из всех плейростомат тигмокинета
смещена с дорсального ребра к вентральному и идет
вдоль ротовой щели и левой ротовой кинеты почти на
ту же длину. Как и другие амфилептиды, вид заглаты-
вает целиком зооидов перитрих, одиночных и коло-
ниальных, не образуя вокруг них пищевой вакуоли
(гастриоли); ферменты проникают сквозь пелликулу
жертвы.
На рыбах обитают и другие амфилептиды, но они
пока не были импрегнированы, и таксономический
статус их неясен. Эти виды также неспецифичны к хо-
зяевам, широко распространены в северной Америке и
Евразии. Amphileptus branchiarum Wenrich, 1924 (по-
зже в составе рода Hemiophrys) — более крупный
вид (60—120 мкм) с такими же ядрами и вакуолями,
питается цилиатами с покровов рыб, по Венричу так-
же клетками эпителия; может заглатывать подвиж-
ных симбионтов (триходин); часто инцистируется;
имеется левосторонний секантный шов. Особи могут
ввинчиваться в эпителий и, образовав цисту пита-
ния, вращаются в ней. Как A. branchiarum определены
также эпибионтные плейростоматы на головастиках
лягушек.
Hemiophrys disciformis Chen, 1956 с тех же хозяев
в Китае, что и Н macrostoma, имеет характерный крю-
чок спереди и спиральные левые кинеты. Если опи-
сание верное, это новый род отряда. Поскольку род
Hemiophrys ликвидирован, пока условно вид пере-
носится в состав рода Amphileptus — A. disciformis
comb. n.
Amphileptus voracus Davis, 1947 описан в США с
жабер 4 видов рыб родов Carpiodes, Ictiobus, Ictalurus
и Margariscus. Случайные «гости» на рыбах — виды
Litonotus agilis, L. hirundo, L. impatiens.
Род Epiphyllum Lin, Song et Warren,
2005
Типовой вид E. soliforme (Faure-Fremiet, 1908).
Тело овальное или листовидное, без резкого сужения у
полюсов; секантные швы имеются на обеих сторонах
тела; имеется периферическая кинета; сомакинеты
многочисленные по обе стороны от рта; имеются пери-
буккальные папиллы вдоль левой стороны ротовой
щели; нет крупных латеральных щетинок в отличие от
Kentrophyllum.
Род Apoamphileptus Lin et Song, 2004
Типовой вид A. robertsi. Шов (spica) располо-
жен на правой стороне тела; обе стороны с одной око-
лоротовой кинетой, окружающей ротовую щель и не
идущей к постерону. Кинеты обеих сторон укорачива-
ются у вентрального края, образуя послеротовой шов;
2 и более дополнительных фрагментов с тесно сбли-
женными дисомами расположены в передней части
левой стороны. Ядра — 2—6 нодул; справа 33—43 ки-
неты, слева 7, не считая фрагментов; токсицисты от-
сутствуют или не выявлены. Хорошо изученный пре-
сноводный вид Amphileptus claparedei включен в со-
став нового рода.
Род Amphileptiscus Song et Bradbury,
1998
Типовой вид по монотипии — морской вид
A. shiv, внешне типичные амфилептусы, отличаются
деталями строения перистома и цилиатуры; апекс за-
кручен и загнут влево; швы (секанты) только справа.
Сем. Litonotidae Kent, 1882
Ротовая щель разной длины, от 1/4 до полной дли-
ны тела; справа имеется 2 ряда ротовых кинет со сбли-
жением дисом, слева один ряд. Один из рядов правой
пары может состоять из моносом. Соматические кине-
ты идут продольно, не образуя осевой бисеканты спра-
ва; часть их заканчивается у унисекантного шва, при-
мыкающего к ротовой кинете.
Род Acineria Dujardin, 1841
Типовой вид Л. incurvata — внешне типичные
амфилептиды, с небольшим числом кинет, 2 ядрами;
топография кинет, как у Litonotus, правые ряды подхо-
дят к ротовым рядам, образуя унисекантный шов. Ро-
товая щель стандартного типа, на четверть длины тела,
имеет вид желобка, ограниченного 2 правыми и одной
левой ротовыми рядами (стомокинетами). У апекса скоп-
ление токсицист. На левой стороне тела на уровне пе-
ристома крайне левый ряд образует тигмокинету с тесно
сближенными парами кинетосом. По всем этим при-
знакам вид соответствует диагнозу рода Litonotus', ро-
довой признак — вытягивание в хоботок переднего кон-
ца тела и его'перекручивание так, как у неродственных
гапторид Bryophyllum. Вентральная часть хоботка с
вершинами правых кинет видна с левой стороны тела.
В пресной воде более част вид A. uncinata Tucoles-
co, 1962, более мелкий, с меньшим числом кинет.
A. punctata Song et Wilbert, 1989 — крупный вид (до
180 мкм) с 6—7 кинетами слева и 24—28 справа. Ве-
роятно, добавочный родовой признак — смещение ча-
586
ALVEOLATA
сти правосторонних кинет (правее тигмокинеты) на
левую сторону тела. Плохо описан вид A. nasuta Lepsi,
1962 с одним ядром.
Род Litonotus Wrzesniowski, 1870
Типовой вид Loxophyllum fasciola Claparede et
Lachmann, 1859 по монотипии; сейчас этот вид счита-
ется синонимом валидного вида Litonotus cygnus (Mul-
ler, 1773). Название рода без всякой причины было
вскоре изменено на Lionotus Butschli, 1889; это назва-
ние больше полувека было общепринятым, но позже
вернулись к исходному написанию рода. Кроме того,
это гомоним и уже по одной этой причине название
неприемлемое. Как гомоним неприемлемо также на-
звание Leionota Wrzesniowski, 1869 с типом L. fasciola.
Вначале был предложен новый род Gastrotricha
Wrzesniowski, 1866 с 4 видами — G. fasciola (Ehr. in
Amphileptus)', G. folium (Duj. in Dileptus)} G. varsavien-
sis n. sp. и G. diaphanes n. sp., без обозначения типово-
го вида. Фактически автор рода отделил плейростомат
от дилептид, которых он отнес к Amphileptus. Позже от
названия рода Gastrotricha отказались ввиду ложной
гомонимии с названием класса Gastrotricha; сейчас уже
поздно восстановить пригодное первоначальное назва-
ние рода. Новый род Litonotus включал 2 подрода —
Litonotus s. str. (L. folium, L. fasciola, L.varsaviensis) и
Hemiophrys subgen. n. (L. diaphanes).
Общий признак рода — веретеновидное тело с уз-
кими концами, небольшое число сомакинет, длинная
ротовая щель (до половины длины тела), наличие у
большинства видов 2 ядер. Справа ротовая монокине-
та и дикинета, слева одна ротовая дикинета (ряд ди-
сом). Кинеты подходят справа к унисеканте вдоль ро-
тового ряда. Часто имеется узкая светлая кайма тела —
плоский край дорсума. Виды рода более часты в пре-
сных водах. Примеры валидных видов, хорошо изу-
ченных на протарголовых препаратах, — L. alpestris
Foissner, 1978; L. crystallinus (yuxanovici, 1960); L. cyg-
nus (Muller, 1773 in Vibrio; много синонимов); L.fusi-
dens (K., 1926); L. varsaviensis (Wrzesniowski, 1866 in
Gastrotricha)} L. bonnensis Song et Wilbert, 1989; L. an-
guilla K., 1931; L. triqueter Penard, 1922; L. obtusus Ma-
upas, 1888; L. uninucleatus (Kahl, 1931 in Loxophyllum)}
L. minusculus Song et Wilbert, 1989; L. mononucleatus
Song et Wilbert, 1989; L.yinae Song, 1991.
Вероятно, к этому роду относится вид Hemiophrys
salmica Burkovsky, 1970 (Z. salmica comb. n.).
Род Loxophyllum Dujardin, 1841
Типовой вид Kolpoda meleagris Muller, 1773 no
обозначению Фроментеля. По Аэшт, род Opisthodon —
синоним рода Loxophyllym, но по Фойсснеру, это ва-
лидный род другого семейства. Крупный род, распро-
страненный в пресных водах и в море. Плоские вы-
тянутые листовидные формы с удлиненным телом и
цепочковидным ядром; четкий род, основные призна-
ки — растяжение ротовой щели от апекса до постерона
и полимеризация тигмокинет — на левой стороне тела
вершины сомакинет сближены и состоят из вплотную
расположенных дисом. Токсицисты расположены под
всей вентральной ротовой щелью; справа от нее 2 ро-
товых ряда с удлиненными густыми ресничками, слева
один ряд, целиком превращенный в полоску дисом.
Края тела волнистые, с широкой светлой каймой,
вдоль дорсума бугорки с пучками токсицист. Топогра-
фия кинетома на правой стороне тела сложнее, чем у
других плейростомат, — имеются 3 унисекантных
шва, к которым подходят кинеты — вдоль дорсального
края, и у апекса и постерона вентрально. Род сборный,
может быть подразделен на несколько родов. Примеры
видов — L. carinatum Vuxanovici, 1959; L. helus Stokes,
1884;/,. schewiakoff! Burkovsky, 1970; L. semilunareNu-
xanovici, 1960; L. variabilis D., 1960; L. compressum D.,
1965; L. acutum D., 1965; L. levigatum Sauerbrey, 1928;
L. lanceolatum D., 1960; L. vorax Stokes, 1886; L. vermi-
forme Sauerbrey, 1928; L. undulatum Sauerbrey, 1928;
L. serratum K., 1933; L. multinucleatum Ozaki et Yagiu,
1941; L. psammophyllus D., 1960; L. asetosum Burkovsky,
1970; L. chaetonotum Borror, 1965; L. elegans Wenzel,
1961; L. hyalinum Vacelet, 1961; L. multiplicatumY^., 1931;
L. trichocystum Hartwig, 1973 и др.
Род Siroloxophyllum Foissner et Leipe, 1995
Типовой вид Amphileptus utriculariae Penard,
1922 (позже в составе рода Loxophyllum). Пенард (Pe-
nard, 1922) нашел вид в прудовой воде; размеры
65—120 мкм, реснички на обеих сторонах тела, более
многочисленные на плоской нижней стороне; на верх-
ней стороне 4—6 глубоких продольных желобка; 2 ва-
куоли, 2 ядра; токсицисты по всем краям тела, особен-
но у рта. В последнее время вид хорошо изучен рядом
авторов точным методом импрегнации; размеры 90—
270 мкм, 2 вакуоли по диагонали, четкие желобки слева,
топография 17—21 правосторонних кинет как у Lito-
notus (со швом у вершины тела). Ротовая щель закры-
тая, узкая, плохо видна; опорная спиральная полоска
огибает все тело (признак рода), но, вероятно, ротовая
щель имеется только на уровне ротовых кинет, не уд-
линена. Кинетом простой, слева продольные ряды
идут в желобках, все тело окаймлено краевой кинетой
и группой тигмокинет (не образующих поля, как у Loxo-
phyllum). Справа кинеты заканчиваются у ротовой ще-
ли, ограниченной здесь 2 рядами (моно- и дикинетой).
Род Kentrophyllum Petz, Song et Wilbert,
1995
Типовой вид К. antarcticum — крупная форма,
во всем как Loxophyllum, но с правильно расположен-
ными щетинками (соединенные реснички дисом?) по
периферии всего тела. Можно предположить идентич-
ность этого рода с забытым родом Litosolenus.
Род Litosolenus Stokes, 1893
Типовой вид не выделен. Род предложен для
2 новых видов — L. armatus и L. verrucosus} тип рода,
по нашему обозначению, первый вид L. armatus. Оба
ТИП CILIOPHORA. КЛАСС LITOSTOMATEA
587
пили сходны по форме тела, родовой признак — нали-
чие редких, регулярно расположенных крупных щети-
нок по периферии тела. Типовой вид — это морской
нид с крупным листовидным телом, очень широкой
КН0ТЧПТОЙ каймой вокруг всего тела, 4 ядрами в цепоч-
ке II 2 вакуолями; впечатление клеток несомненно со-
здают пересекающиеся кинеты и токсицисты в непре-
рывном краевом ряду; у L. verrucosus токсицисты не
'шрисованы.
11о Калю (Kahl, 1931), L. armatus — синоним валид-
ного вида Loxophyllum setigerum Quennerstedt, 1867;
вид L. verrucosus — или синоним того же вида, или «в
крайнем случае разновидность (Varietat) L. setigerum».
Род валидный, включает кроме Litosolenus setigerum
(Quennerstedt, 1867) comb. n. также L. raikovi comb. n.
(Dragesco, 1963 in Loxophyllum), L. kahli Dragesco,
1960, L. pseudosetigerum comb. n. (Dragesco, 1960 in Lo-
xophyllum), L. chaetonotum (Borror, 1965 in Loxophyl-
lum) и типовой вид синонимичного рода Kentrophyl-
lum — L. antarcticum (Petz et al., 1995) comb. n.
Приложение
Плохо изученные роды плейростомат
Род Heminotus Kahl, 1933
Типовой вид Н. caudatus из морского бентоса;
изучен позже без импрегнации, точная картина кине-
тома неизвестна. Внешний облик как у псаммонных
кариореликтид {Remanella, Kentrophoros) — тело
очень длинное, с шейкой и хвостом, с четкой цефали-
зацией; при движении тело с волнообразными склад-
ками; ядра распыленного типа, с сотнями нодул; ваку-
оли в продольном ряду. Размеры по Калю 1—2 мм —
крупнейший вид плейростомат. Как у Acineria, апекс
завернут на левую сторону тела. Правая сторона с гус-
той цилиатурой, левая с 4 желобками. Токсицисты рас-
положены вдоль всего волнистого края тела; длина ро-
товой щели неизвестна.
Род Lentophyllum Jankowski gen. n.
Типовой вид Loxophyllum vermiforme Sauerbrey,
1928 из морского песка; изучен позже без импрегна-
ции. Тело лентовидное, червеобразное, складчатое, ве-
личиной 1—1.25 мм, волнистое, легко скручивается;
ядро цепочковидное, с 10—28 нодулами; вакуоль у по-
стерона; безресничная сторона с осевым желобком. Ток-
сицисты только у вентрального ребра; на левой стороне
11 безресничных складок (но раньше не замечали мель-
чайших щетинок), на правой 30—39 кинет, точная то-
пография которых и наличие швов пока неизвестны.
Род Lionotopsis Conn, in Conn
et Edmondson, 1918
Типовой вид L. anser — плохо описанный пре-
сноводный вид с контурами тела как у амфилептид, с
апикальным пучком токсицист, 2 ядрами по оси тела и
группой вакуолей в продольном ряду; точная топогра-
фия кинетома неизвестна. Это может быть простомата
Trachelophyllum или плохо зарисованная амфилептида.
Формально род валидный, но тип рода неопределим, и
это название никогда не применялось в литературе.
Род Stomophyllum Biitschli, 1889
Типовой вид не указан. По Аэшт, предложен
как подрод в оставе рода Loxophyllum для неопублико-
ванных рисунков неназванного вида рода. В последу-
ющей литературе это название не упоминается.
Подкласс Trichostomatia Biitschli, 1889
Эндопаразитические простоматы и дериваты их дивергентной
эволюции, в основном приуроченные к разным группам хозяев.
Первоначально отряд трихостомат был предложен для промежу-
точных форм в линии Gymnostomatida — Trichostomatida — Hyme-
nostomatida (появление ротовых ресничек и их слияние в мембраны
у гименостомат). К трихостоматам относили прежде всего кольпо-
дид, плагиопилид, различных паразитов, а также множество гиме-
ностомат с погруженным ртом, у которых не могли выявить тип
перистомальной цилиатуры.
В новейшей классификации Линна (Lynn, 2002, 2003) группа
включает очень много разнородных форм, связанных прежде всего
общностью происхождения и ультраструктурой кинетид; в этом
подклассе нашли свое место и аберрантные паразиты австралий-
ских сумчатых. Если исключить переднеротых архистомат, оста-
нутся произошедшие от них независимо отряды с разным типом
вестибулюма; такой таксон не может существовать, поэтому они
не отнесены к гапторидам; общим признаком бючлиид и всех вы-
сших трихостомат кроме ультраструктуры кортекса может быть
отсутствие гаптоцист и кольца дикинетид (дисом), образующего
фибриллярную стенку глотки у гапторид.
Отряд Vestibuliferida Puytorac et al., 1974
Перистомальная цилиатура — полосы фрагментов
кинет вокруг вестибулюма и частично на его стенках;
стоматогенез простой, без участия кинетосомальных
зачатков перистома протера. Кишечные паразиты в
основном в травоядных позвоночных.
Сем. Balantidiidae Reichenow in Doflein
et Reichenow, 1929
Клетки овальные, мешковидные, иногда вытяну-
тые, полностью покрыты ресничками в густых про-
дольных рядах простой топографии, идущих от пери-
стома до постерона; кинетосомы расположены вплот-
ную, цилиатура густая. Перистом в виде широкой
полости, отходит от апекса вентрально вниз, иногда
значительно вытянут, имеет вид глубокого плоского
мешка; на внутренних стенках, ведущих к щелевидно-
му рту, нет рядов ресничек или специализированной
цилиатуры, поэтому полость нельзя назвать вестибу-
лярной, хотя в литературе принят этот термин. По кра-
ям полости при импрегнации или рельефном освеще-
нии можно видеть по одной достаточно широкой поло-
588
ALVEOLATA
Рис. 318, a. Archistomatida.
Didesmis quadrata (А—Д, 3—И, M—H)\ D. ovalis (К, JI, O); «Didesmis» synciliata (Plexobundleia) (£); Hlepharoconus dicerotis (Ж)', Ampullacula ampulla (У); Po-
lymorphella ampulla (П—Q, (По: Grain, 1966 (Б—Д, 3, H,M, H, П— 7); Wolska, 1964a (A ,E); Wolska, 1966a (JI, O); Van Hoven etal., 1998 (E, Ж)' Корнилова, 2004 (У)).
Fig. 318, a. Archistomatida.
се тесно сближенных фрагментов, обособленных от
соматических кинет — по одной полосе справа и сле-
ва, идущих на всю длину перистома. Если их не пока-
зывают на иллюстрациях, например на большинстве
рисунков паразита человека Balantidium coli, такие ри-
сунки неправильные. Полосы четко показаны Фо-
ре-Фремье (Faure-Fremiet, 1955) у паразитов лягушек и
тритонов; при делении они образуются за счет обособ-
ления вершин большинства сомакинет. Полосы слегка
погружены на верхних внутренних стенках воронки,
хорошо видны при придавливании особи и иммерси-
онном увеличении. Движение медленное, тело гибкое,
метаболичное. Всеядные формы, тело заполнено час-
тицами детрита, бактериями, активно поедается крах-
мал хлеба, дрожжи. Ядра — один макронуклеус и один
микронуклеус, нет видов с фрагментацией ядер. В на-
ружной среде клетки легко инцистируются, циста тон-
костенная, без рельефа стенки; заражение хозяев через
почву или питьевую воду.
Паразиты беспозвоночных, рыб, амфибий, реп-
тилий, млекопитающих многих отрядов, включая при-
матов и человека. Материал для изучения можно най-
ти в лягушках (где одновременно обитают 2—3 вида
балантидиев и никтотерусы), тараканах и в кале
комнатных черепах Testudo horsfieldi. Виды семейст-
ва встречаются на всех континентах, группа древняя,
но с незначительным родообразованием, в основном
стандартного типа; вероятно, в будущем крупный
род Balantidium распадется на несколько по незна-
чительным признакам. Сейчас можно выделить 3—
4 рода балантидиид — стандартные виды типа В. coli,
с крупной присоской {В. duodeni) и резко вытяну-
тые типа В. sushili', высказано мнение, что паразит
человека не относится к роду Balantidium. В мире из-
вестно около 60 видов и подвидов балантидиид, ки-
нетом изучен при импрегнации только у нескольких
видов, для большинства нет точной картины кине-
тома; нет и детального изучения инфрацилиатуры
паразита человека в сравнении с типовым видом из
лягушек, поэтому вопрос о родовом статусе В. coli не
решен. Примеры видов балантидиид на рис. 319, а—
319, б.
ТИП CILIOPHORA. КЛАСС LITOSTOMATEA
589
Рис. 318, б. Archistomatida.
Alloiozona trizona (Л—Г, Е—И, JT)' Blepharozoum trizonum (Д, К). (По: Grain, 1966 (А—Г, Е—И, Л)\ Wolska, 1964а (Д, К)).
Fig. 318, б. Archistomatida.
Род Balantidium Claparede et Lachmann,
1858
Типовой вид Bursaria entozoon Ehr., 1838по мо-
нотипии. Нередкие в ранней литературе указания
В. coli как типового вида рода неверны, в ранней лите-
ратуре (Claparede, Lachmann, 1858) этот вид включался
в состав сборного рода Plagiotoma (Р. coli).
Типовой вид можно найти повсеместно в ля-
гушках — в широком круге хозяев — Rana temporaria,
R. lessonae, R. ridibunda, R. dalmatina, R. esculenta и
других, в Bombina variegata, Bufo viridis, в саламандрах
Salamandra taeniata, в тритонах Triturus alpestris,
T. cristatus и многих других хозяевах. Тело вытянутое,
но не столь резко, как у аберрантного вида В. sushilv,
кинеты полимеризованы и, как часто у подобных
форм, местами с нарушением правильного положения
кинетосом — с делинеацией и фрагментацией рядов.
Перистом длинный и узкий, полосы фрагментов (ки-
нетофрагмон) очень четкие, поэтому балантидиев дол-
гое время относили к Spirotricha (Heterotrichida), при-
нимая ряд пектинелл за зону мембранелл (АЗМ);
даже в монографии спиротрих Вилленев-Брашон (Vil-
leneuve-Brachon, 1940), изучившей многие роды мето-
дом импрегнации, включены балантидии (В. entozoon)
как один из родов спиротрих с полихименовой «адо-
ральной зоной мембранелл» с дикинетами в основа-
нии вдоль левого края полости. Сходство, однако,
незначительное и конвергентное, мембранелл нет,
ундулирующей мембраны нет, стоматогенез прими-
тивный — от вершин почти всех сомакинет, как у про-
стомат.
Род Balantidiopsis Butschli,
1889
Типовой вид Balantidium duodeni Stein, 1867 по
монотипии, единственный до сих пор вид рода. Род не
считают валидным, но отличия от балантидиев значи-
тельные — тело короткое и широкое, в виде вогнутого
диска; одна из сторон превращена в обширную присо-
ску, и подстилающий ее слой кортекса видоизменен,
здесь особо крупные альвеолы. У типичных баланти-
диев из ректума тех же и других хозяев присоски нет,
это активно движущиеся клетки с равномерной цилиа-
590
ALVEOLATA
Рис. 319, a. Balantidiida.
Stentoropsis barbi (А, В, K); Balantidium elongatum (Б, Д, E)\ B. coli (Г)\ Balantidium duodeni (Balantidiopsis duodeni) (If)', B. entozoon (Ж, 3); B. polyvacuolum
(Л). (По: Гаврилова, 1969 (А, Б, К); Lom, 1957 (В, И); Faure-Fremiet, 1955 (Д— 3); Wolska, 1962 (Г)', Lee, 1963 (77)).
Fig. 319, a. Balantidiida.
турой. Род Balantidiopsis нужно восстановить как ва-
лидный. Материал для изучения — в средней кишке
лягушек, вида нет в саламандрах и тритонах. Автор
рода Бючли понимал род Balantidium в широком смыс-
ле, включая даже неродственные виды из полихет и
медуз, и тем не менее выделил новый род для одного
из видов (В. duodeni); род иногда принимали неспециа-
листы, но в основном игнорировали. Вспомним в этой
связи одно из правил систематики — спорный род мо-
жет быть бесспорным подродом.
Род Dilleria Earl,
1973
Типовой вид BalantidiumsushiliRay, 1932изки-
шечника Rana tigrina в Индии — с резко вытянутым
телом и длинной перистомальной щелью; точной кар-
тины кинетома нет. У вида хорошо изучена система
фибрилл на уровне перистома, характерная для балан-
тидиид в целом — тонкие фибриллы поодиночке или в
пучках отходят от оснований ресничек (кинетосом);
апекс сужается для движения в плотном слое детрита.
По Рею (Ray, 1932), имеется полоса мембранелл и ун-
дулирующая мембрана, но, скорее всего, перистом ти-
пичный для балантидиев, с полосой вдоль обоих краев
полости. Род не очень четкий, нет особо важных отли-
чий от балантидиев, поэтому его редко считают валид-
ным. К этому роду можно отнести и Balantidium graci-
le Bezzenberger, 1904 (Dilleria gracile comb, n.) — чер-
веобразные клетки с крупным перистомом из Rana
tigrina, R. hexadactyla и R. cyanophlyctis в Индии.
Род Paranyctotherus Sandon,
1941
Типовой вид Balantidium kirbyi Rodriguez, 1939
по монотипии, из шпорцевой постоянно водной ля-
гушки Xenopus laevis в южной Африке. Интересно, что
в этом хозяине все цилиаты (балантидии, никтотерусы
и триходины) образуют четкие аберрантные роды.
Внешний вид, как у предыдущего рода и паразитов
тритонов, тело в виде широкого вытянутого мешка, су-
ТИП CILIOPHORA. КЛАСС LITOSTOMATEA
591
Рис. 319, б. Balantidiida.
Paranyctotherus (ранее Balantidium) sushili (Л); Balantidium polyvacuolum — паразит Кишечника рыб (Б—Е). (По: Ray, 1932 (Л); Lee, 1963 (Б—Е)).
Fig. 319, б. Balantidiida.
Balantidium polyvacuolum — parasite of fish intestine (Б—Е).
жается к постерону; кинеты полимеризованы; вдоль
длинной боковой щели — по одной четкой полосе
фрагментов; мощные пучки фибрилл отходят от апек-
са. Основной родовой признак — наличие очень длин-
ной извитой глоточной трубки, в своей верхней части
несущей фрагменты правой полосы. Другой вид Р. xe-
nopi (Grain, 1965). Название Paranyctotherus Ngassam,
1983 (никтотериды) — гомоним, заменено на Camero-
nyctus Jank. nom. n. (C. albareti comb. n.). Род Сандона
четкий, но тем не менее не всеми принят, обычно счи-
тается невалидным и не упоминается в сводках; род
валиден в сводке Эрля (Earl, 1971), вероятно отнесен
здесь к никтотеридам.
Род Stentoropsis Dogiel et Bychowsky,
1934
Типовой вид S. barbi из кишечника раститель-
ноядных рыб — аральских и туркестанских усачей
из опресненных участков Аральского моря; позже най-
ден в реках этого района. Первоописание очень пло-
хое, форма тела искажена, никаких данных о кинетоме
и перистоме нет, сравнения с неродственными стен-
торами неправомочны. По Гавриловой (1969), вид
оказался обычным балантидием, что и следовало ожи-
дать — балантидии часты в южных растительно-
ядных рыбах. Тело мешковидное, перистом в виде ши-
рокой щели, ограничен 2 стандартными полосами
фрагментов; кинеты полимеризованы. Нет важных от-
личий от типичных балантидиев из лягушек. На маз-
ках (импрегнация сухих мазков по Клейну) нельзя
было различить глотку и положение нижних частей
полос внутри перистома; нужно новое изучение хо-
рошо фиксированного материала и импрегнация
протарголом.
Род Protobalantidium Abe,
1927
Судя по названию, род считался предшественни-
ком балантидиев, но это смесь разных видов, включая
мелких гименостомат; типовой вид, по обозначению
Аэшт, Balantidium knowlesii Ghosh, 1925. Данный
вид — не балантидия, а вид другого отряда и класса —
592
ALVEOLATA
тетрахименида типа Leptoglena (= Tetrahymena) из ге-
моцеля личинок комаров Culex; личинки двукрылых
по всему миру заражаются тетрахименидами, но ни-
когда не балантидиями. Для валидации предложенно-
го позже названия Tetrahymena род Protobalantidium
решением ICZN официально признан «отвергнутым
названием».
Род Balantioides Alexeieff, 1931
Типовой вид Paramecium coli Malmsten, 1857
(Holophrya coli in Stein, 1859). He замеченный и не при-
знанный род; и все же идея Алексеева заслуживает
внимания. Кинетом и перистом в то время у баланти-
диев никем не изучался и точной картины инфрацили-
атуры не было; у паразитов человека правее перистома
заметили сильно красящееся утолщение, сгусток цито-
плазмы или участок кортекса; у части других видов
этого нет (у В. entozoon, В. elongatum). Это считалось
признаком нового рода. У В. testudinis, также относи-
мого к новому роду, тоже есть круговое утолщение
края перистома, а у балантидиев из свиньи этого нет
(хотя до сих пор не решен вопрос о статусе видов из
свиньи и человека — один вид или два).
Если непосредственно на одном препарате срав-
нить балантидиев из лягушки (типовой вид В. entozo-
on) и неопределенный вид из комнатной черепахи Tes-
tudo horsfieldi, они сильно отличаются по форме тела,
относительной величине перистома; возможно, Balan-
tioides валиден как подрод для отделения от типичных
видов форм с коротким каплевидным телом; заметить
утолщение края перистома не удалось, важнее провес-
ти точное сравнение кинетома и перистома у В. coll и
В. entozoon методами импрегнации серебром. Пока во-
прос о родовом статусе паразита человека неясен.
Примеры видов балантидиев и их хозяев приведе-
ны ниже.
В пресноводных растительноядных рыбах —
В. ctenopharyngodonis Chen, 1955; В. polyvacuolum Lee,
1963; В. piscicola Daday, 1905; В. strelkovi HaKy, 1971;
В. spinibarbichthys На Ку, 1971; В. steinae На Ку, 1971;
В. fulinensis Feng, 1991; В. pangasi Mukherjee et Haidar,
1986; В. mrigalae M. et H., 1986; B. sinensis Nie — в ки-
шечнике толстолобика, белого амура в Китае и Вьет-
наме и в эндемиках Южной Америки; В. granulosum
Gauthier, 1920 — в форели во Франции (тетрахимена?);
неопределенные виды в Африке — в разных рыбах
Нила в Египте; в Мексике — в Cichlasomafenestratum.
Как и у человека, возможно бессимптомное обитание в
хозяине или тяжелое поражение стенок кишечника. В
пресноводных и морских рыбах встречаются также ни-
ктотерусы. Для В. granulosum из Salvelinus fontinalis
показано патогенное значение для хозяев; подробно
патология изучена и документирована для В. polyvacu-
olum в Китае.
Быстро растет список балантидиев в морских ры-
бах, в основном в тропических рыбах-хирургах («sur-
geonfishes» Acanthuridae) — В. sigani Diamant et Wil-
bert, 1985 (Siganus); B.jocularum Grim, 1993 (Naso);
B. zebrascopi Grim, 1992 (Zebrascopas); B. acanthuri
Grim, 1989 (Acanthurus); B. prionurium Grim, 1985 (Pri-
onurus) и др.
Большинство видов балантидиев описаны из амфи-
бий — лягушек, жаб, квакш, тритонов; к примеру,
В. entozoon (Ehr., 1830); В. amygdali Bhatia et Gulati,
1927; В. bicavata В. et G., 1927; B. corlissi Shete et Krish-
namurthy, 1984; B. cyanophlycti S. etK., 1984; B. elonga-
tum Stein, 1862; B. giganteum Bezzenberger, 1904; B. ga-
napatii S. et K., 1984; B. helenae Bezz., 1904; B. rotun-
dum Bezz., 1904; B. mininucleatum S. et K., 1984;
B. ranarum Ghosh, 1921 и многие другие виды. Вероят-
но, В. rotundum Bezzenberger, 1904 (из Rana esculenta
var. chinensis) относится к другому роду — Balantidi-
opsis rotundum comb. n., внешне это типичный В. duo-
deni с альвеолярной присоской и вогнутым телом.
В наземных и пресноводных черепахах часты ба-
лантидии, условно определяемые как В. testudinis Cha-
gas, 1911(типовой хозяин Testudo graeca); вид из
Т. horsfieldi (= Agrionemys), из цейлонских Geomyda
trijuga, из американских Geochelone radiata, G. sulcata
и других не должны определяться как В. testudinis.
В морских черепахах Chelonia mydas найден В. bacteri-
ophorus Fenchel, 1965 с симбионтными эпибактерия-
ми. В гигантских черепахах Testudo elephantinus отме-
чен тот же вид В. testudinis, хотя никтотерусы в них
принадлежат к особому роду Geimania; на этом приме-
ре видно фактически нежелание изучать точное строе-
ние и кинетом балантидиев, что приводит к обилию
фальшивых определений. Для зарисовки кинетома
можно применить простой метод автора — живые ба-
лантидии или никтотерусы помещаются в 10—20%-й
раствор морской соли; особи слегка сжимаются, цито-
плазма светлеет, кинеты и цилиатура перистома видны
с большой четкостью при иммерсии и рельефном бо-
ковом освещении.
Балантидии есть у других рептилий, к примеру
в змеях Южной Америки (В. serpentis Fantham et Por-
ter, 1950), но менее часты, чем никтотерусы, обычно
отмечаемые в ящерицах, варанах; у гаттерии, кайма-
нов, аллигаторов, крокодилов тех и других либо нет,
либо не было желающих паразитологов добывать и
изучать их.
В птицах инфузории встречаются в редчайших слу-
чаях (в камышнице Gallinula в Индии, в хоацине из
района Колумбии, в пингвинах, случайные инфекции
кольпод и тетрахимен в голубях); поэтому интересно
описание Balantidium struthionis Hegner, 1934 из ки-
шечника африканского страуса Struthio camelus.
Заражены многие млекопитающие — морские
свинки (В. caviae Neiva, Cunha et Travassos, 1914), та-
пиры (В. tapiri Carini, 1942), крысы (B.frugivori Bhas-
kar Rao et al., 1976Д верблюды (В. cameli Hegner, 1934
в Camelus bactrianus), опоссумы Didelphis marsupialis
(B. marsupialis H., 1934) и другие хозяева на разных
континентах; В. caviae — один из первых видов цили-
ат, к которым применен обычный ныне метод импрег-
нации протарголом.
В мышах Lissemys — В. dogieli Das et Mukherjee,
1974, в свиньях — В. suis McDonald, 1922 (спорный
вид), тот же и особый вид в кабанах. Приматы часто за-
ражены В. coli, а также своими видами — В. rhesum
Ghosh, 1927 в макаках, В. cynocephale Burowa, 1938 в
бабуинах Papio cynocephale, В. simile Hegner, 1934
(Масаса mulatto), В. wenrichili., 1934 (Atelesgeoffroyi),
В. cunhamunizi H., 1934 (Cebus variegatus), B. philippi-
ТИП CILIOPHORA. КЛАСС LITOSTOMATEA
593
nensis Hegner, 1934 (Macacus philippinensis) и др.; ин-
фекции В. coli отмечены в макаках, шимпанзе, горил-
лах, орангутанах.
Несколько видов балантидиев, описанные из жвач-
ных в Индии (В. caprae Abraham, 1962 и др.), — несо-
мненно ошибка, это изотрихи. Инфекции неопреде-
ленных балантидиев или «В. coli» отмечаются в коро-
вах, лошадях, хомяках, водосвинках (капибарах) и
других домашних и лабораторных животных.
Из беспозвоночных основные хозяева — тараканы
(5. ovatum Ghosh, 1922, В. blattarum G., 1922), термиты
(В. geigyi Gisler, 1967), но в насекомых чаще встреча-
ются Nyctotheridae. В. depressum (Ghosh, 1921 mBalan-
tidiopsis) — эндопаразит моллюсков-ампулляриид Pila
globosa в пресных водах Индии. Много неправильных
определений; вид из гидр В. hydrae в ФРГ — тетрахи-
мена, из морских моллюсков-литторин Бразилии В. lit-
torinae — тигмотриха, из амфипод-талитрид Франции
В. luciensis — безротая апостомата рода Collinia', таких
ложных балантидиев много в литературе. В сумчатых
Австралии (кенгуру) балантидии пока не найдены, но,
когда автор обзора осматривал присланный фиксиро-
ванный материал, один из эндемичных родов (Mega-
vestibulum) был удивительно похож на балантидиев, но
имел сетчатый кортекс.
Касаясь паразитов человека, сразу же отклоним
«разновидности» и «подвиды» В. coli и второй вид
В. minutum Schaudinn, 1899 (включая В. minutum var.
italicum Sangiorgi et Ugdulena, 1917) — все это выпол-
нено на очень низком непрофессиональном уровне,
как и описания видов Nyctotherus из человека — рода,
никогда не встречающегося в млекопитающих (это
почвенные кольподы). Тщательного изучения кинето-
ма и ядер В. coli из язв кишечного тракта человека
пока нет; вопрос об идентичности с паразитом свиней
В. suis остался нерешенным. Сейчас предполагают,
что в основном в сельской местности человек заража-
ется от свиней, у которых есть свидетельства как бес-
симптомного носительства «комменсальных» цилиат,
так и случаев острого поражения тканей кишечника с
кровавым поносом и гибелью молодняка. Болезненное
состояние кишечника человека (гастрит, дуоденит,
язвы) располагает к заражению тканей. Эксперименты
показывают нормальное размножение балантидиев од-
ного штамма в макаках, свинье, человеке и лаборатор-
ных подопытных животных (хомяк, мышь, крыса); ве-
роятно, именно В. coli неспецифически заражает раз-
ных животных в зоопарках, к примеру случайное
заражение В. coli тапиров или горилл; для изучения
строения и патологии В. coli многолетние культуры
вида можно вести в хомяках.
Свободно проникая сквозь мукозные оболочки ки-
шечника человека, трофонты балантидиев разрушают
окружающие ткани секрецией гиалуронидазы, вызы-
вая их локальный некроз; язвы расширяются и углуб-
ляются в ткани, часть инфузорий входит через разру-
шенные стенки в кровеносные и лимфатические сосу-
ды и разносится по телу, провоцируя внутренние
кровоизлияния и абсцессы; в этих случаях возможен
летальный исход. Лекарства при первых признаках по-
ражения — карбазон, тетрациклины, дийодогидроок-
сихинон, как и для лечения более частых энтамеб, вы-
зывающих сходную болезнь (амебиаз).
Сем. Isotrichidae Butschli, 1887
(рис. 320, а—320, 6)
Пюйторак (Puytorac, 1994) различает 2 самостоя-
тельных семейства — Isotrichidae и новое сем. Dasyt-
richidae; первое включает только Isotricha, второе Da-
sytricha и Protoisotricha Kopperi, 1935 — очень плохо
описанный род с перистомом на нижнем конце тела.
Пока он не найден и не изучен заново. В данном об-
зоре принята обычная схема — одно семейство с рода-
ми Isotricha и Dasytricha, но с выделением новых ро-
дов для I. prostoma и D. kabanii. Семейство иногда да-
тируют 1889 г.; Бючли (Butschli, 1889) ввел его в
частях книги, вышедших в 1887 (с. 1232) и 1889 гг.
(с. 1715).
Семейство включает крупных цилиат с прочным
кортексом, полной соматической цилиатурой; рес-
нички густо, вплотную расположены в многочислен-
ных тесно сближенных рядах; нет обособления тигмо-
кинет; в отличие от свободноживущих гапторид,
реснички однотипные — нет укороченных неподвиж-
ных щетинок, локальной дифференцировки кинет
(тигмозоны). Заметна линия сдвига перистома с перво-
начально субапикального положения вниз; у вершины
тела это четкая секанта, ниже — зона с несимметрич-
ным положением кинет. Хорошо развит фибрилляр-
ный опорный аппарат, одиночные фибриллы и их
пучки соединяют участки кортекса, перистом и ядро
(кариофора нет у Dasytricha). Рот смещен до ниж-
ней четверти тела у Isotricha, до постерона у Rumino-
tricha. Перистом вестибулярного типа, несет на
внутренних стенках вершины части соматокинет или
их фрагменты; нет мембрано-подобных структур.
Относительно небольшая воронка открывается вглубь
и вверх, несет реснички на всей поверхности вплоть
до рта.
Эндопаразиты травоядных млекопитающих — в
рубце домашних и диких животных.
Род Dasytricha Schuberg,
1888
Типовой вид D. ruminantium. Ранние авторы
ориентировали виды изотрихид неправильно, ртом
вверх; поэтому гомология с другими трихостоматами
не была очевидна. Кинетом сохраняет следы первона-
чального субапикального положения перистома и его
сдвига к постерону — явление, нередкое у эндопарази-
тов; рот смещается далеко вниз, к примеру, у клевелан-
делл, произошедших от никтотерусов, либо растягива-
ется вся ротовая щель (Nathella, Vestibulongum, Pycnot-
hrix). Предки изотрихид с передним ртом вероятнее
всего вымерли вместе с хозяевами.
Типовой вид — овальные клетки длиной до
100 мкм, мельче изотрих, с относительно небольшим
числом кинет (около 40), идущих слегка спирально от
перистома до длинного шва (секанты); кинетом несим-
метричен, есть и другой шов снизу. Перистом неболь-
шой, в виде узкой трубки, направленной вверх от по-
стерона; вся внутренняя поверхность вестибулярной
воронки занята кинетами, обособленными от сомати-
ческих. В литературе рисуют несколько различные
1|< Зпк. №4163
594
ALVEOLATA
Рис. 320, a. Isotrichida.
Dasytricha niminantiiini (A /'); /sotrlcha intestinalis (JI 3). (По: Grain, 1962 (3); 1964 (A—Ж)).
Fig. 320, a. Isotrichida.
картины ротовой цилиатуры — имеются полосы фраг-
ментов кинет вокруг вестибулярного отверстия, нс
имеющие континиума с сомакинетами; внутри поло-
сти есть полоса продольных и поперечных кинет на
двух стенках, либо кинеты только продольные. В клет-
ке много фибрилл (тяжей) опорного характера, в част-
ности подходящих к перистому, но уже ранними авто-
рами отмечено отсутствие кариофоров. У балантидиев
всегда есть пучок апикальных фибрилл; он виден и
у дазитрих, длинные фибриллы сходятся к апексу.
Хорошо изучен процесс деления и морфогенез пе-
ристома (Grain, 1964).
Род Isotricha Stein, 1858
Типовой вид I. intestinalis по монотипии. Род
часто датируют 1859 г., но он назван годом раньше.
Массивные овальные клетки с заострением кпереди;
кинеты полимеризованы, около 200, сильнее сближе-
ны, чем у дазитрих; хорошо заметен шов на месте
сдвига рта. В клетке мощный фибриллярный тяж от
апекса, большое число отдельных фибрилл идут от
кортекса к противоположной стороне тела или к пери-
стому и ядру; образуется кариофор, как у никтотеру-
сов. Сзади анальная трубка с широкой порой, по
кортексу рассеяны поры вакуолей. Перистом в нижней
четверти тела, глоточная трубка направлена вбок.
Цилиатура здесь сложная — часть сомакинет без
фрагментации входит в воронку снизу; справа поло-
са фрагментов, слева обособленный превестибулюм,
часть рядов которого уходит в воронку. Фактически
ротовая цилиатура изотрих менее обособлена от сома-
тической, чем у дазитрих. Грайн (Grain, 1964, 1966)
изучил при импрегнации морфогенез при делении
всех трех известных изотрихид; выяснен способ об-
разования дифференцированных комплексов пери-
стомальных кинет.
Род Ruminotricha Jankowski
gen. n.
Типовой вид Isotricha prostoma Stein, 1859.
Тело узкое, вытянутое, перистом смещен к постерону;
как и у других изотрихид, много сократимых вакуолей
ТИП CILIOPHORA. КЛАСС LITOSTOMATEA
595
Рис. 320, б. Isotrichida. (По: Grain, 1966).
Isotricha prostoma (A—Г, E, Ж)' Dasytricha ruminantium (Д, 3, IT).
Fig. 320, 6. Isotrichida.
в основном ниже экватора; в антесоме много попереч-
ных фибрилл и единый продольный тяж; другие фиб-
риллы (кариофоры) соединяют ядро с перистомом и
кортексом. Перистомальная цилиатура обособлена от
соматической; этот факт и другое положение перисто-
ма — родовые отличия от Isotricha s. str. Сомакинеты
не продолжаются в глубь воронки, все ряды перистома
независимые от сомакинет. Отверстие перистома не
строго полярное, слегка сбоку от постерона, но в прин-
ципе расположено, как у дазитрихи. Все 3 рода оди-
наково часты у жвачных, нередко встречаются со-
вместно.
Кроме указанных типовых видов, описан ряд
других, но часто без достаточных деталей и без имп-
регнации; возможна синонимия. Формально мож-
но назвать следующие виды (могут быть невалид-
ными):
Isotricha caulleryi Weill, 1929. Из космополитного
таракана Periplaneta americana во Вьетнаме; тараканы
считаются вторым хозяином или переносчиком изо-
трих, но это могут быть балантидии.
Isotricha ferrum-equinum Shedrina,1926. С субполяр-
ным ртом, одной вакуолью, почковидным ядром; тело
массивное; анальная трубка показана на противопо-
ложном от рта конце тела, но это невозможно, явно
спутана с апикальным пучком фибрилл; кариофоров
нет. Вид считается специфическим для одногорбого
верблюда.
Dasytricha bovis Jirovec, 1932. С полярным ртом.
Balantidium caprae Abraham, 1962 (типичная Rumi-
notricha)'.D. elongatum Jirovec, 1932 (как руминотрихи,
с субполярным ртом); I. magna из антилоп, упоминает-
ся в некоторых статьях, найти описание не удалось;
I. jalaludinii Imai et al., 1995; D. nipponicum Hukui,
1940 — типичная дазитриха по всем родовым призна-
кам; D. ozakii Hukui, 1940, как I. intestinalis, ротовая
цилиатура показана неправильно; D. rectum Hukui,
1940, как Ruminotricha prostoma; D. hukuokaensis Hu-
kui et Nishida, 1954 — крупнее известных видов (до
180 мкм); рот субтерминальный.
Род Camelotricha Jankowski
gen. n.
Типовой вид Dasytricha kabanii Selim et al.,
1996, эндопаразиты одногорбого верблюда Camelus
dromedarius в Египте. Вид очень сходен с Dasytricha
ruminantium по форме тела, форме ядра, положению
вестибулюма на постероне, но крупнее и имеет другой
паттерн цилиатуры — кинеты густые, спиральные; нет
ресничек на нижней четверти тела, здесь обширный
ацилон; сохранена цилиатура непосредственно у пери-
стома и в воронке. Точной схемы кинетома нет, имп-
регнация не проводилась. Вид встречается в пробах со-
вместно с D. ruminantium.
596
ALVEOLATA
Сем. Pycnotrichidae Poche, 1913
Очень крупные, до 3 мм, червеобразные формы с
утолщенным прочным кортексом, образующим пан-
цирь вокруг зоны эндоплазмы. Кортекс трехслойный,
местами образует пластрон. Соматическая цилиатура
прекрасно развита, с многочисленными продольными
кинетами. Ротовой аппарат необычный — рот с фиб-
риллярной немадесмальной корзинкой лежит у ниж-
него конца желобка, проходящего в передней части
тела Nicollella и достигающего заднего конца тела у
Collinina и у Pycnothrix. Желобок не гомологичен тако-
вому Infundibulorium, Paraisotrichopsis, Sulcoarcus —
он образован при впячивании больших участков кор-
текса, так что в итоге образуется своеобразный вес-
тибулюм — ресничная полость, идущая через все
тело ко рту. Вероятно, желобок нельзя назвать вести-
булюмом — это не внутренняя полость, а скорее все-
го сильно растянутое вестибулярное отверстие раз-
ной длины у разных родов; может достигать по-
стерона и по дорсуму идти вверх. К краям желобка
подходят вершины всех сомакинет, дно безресничное.
Нижняя часть желобка продолжается в глубь тела
в виде короткого вестибулюма, далее идет цитофа-
ринкс и рот.
Шаттон и Перард (Chatton, Perard, 1919) для 3 изу-
ченных ими родов предложили эволюционную линию,
с постепенным удлинением желобка; по этой гипотезе,
безресничное дно желобка гомологично собственно
рту других трихостомат, затем в эволюции рот растя-
гивается по поверхности клетки и при этом теряет
функцию заглатывания, которое происходит только у
его нижнего конца у Collinina и Nicollella, а у Pycnoth-
rix вдоль щели образуются самостоятельные рты и
фибриллярные глотки. Род Muniziella не находит места
в этом ряду, хотя раньше считался пикнотрихидой; на-
против, роды из других хозяев могут быть включены в
состав семейства (Nathella, Infundibulorium, Vestibulon-
gum).
В таксономической ревизии цилиат Похе (Poche,
1913) выделил новый отряд, названный Pycnotrichidea
Poche, 1913 (по современной транскрипции Pycnotric-
hida), в период, когда новые отряды у цилиат не пред-
лагались; отряд включал один известный тогда род
Pycnothrix Schubotz, 1909; автор рода также не считал
род простой холотрихой, не находил для него места в
системе. При подразделении трихостомат группы Ves-
tibuliferida на подотряды одним из них можно считать
пикнотрихид.
Сем. Nicollellidae Chatton et Perard, 1919 сейчас не
признается, но может быть подсемейством для исход-
ной формы этой группы. Предлагая это название, авто-
ры не знали, что Похе уже предложил семейство для
пикнотрих.
Род Nicollella Chatton et Perard, 1919
Типовой вид N. ctenodactyli Ch. et P., 1919 из
толстого кишечника гунди Ctenodactylus gundi на юге
Туниса. Крупные вытянутые особи (500—550 мкм)
прикреплены апексом к мукусу кишечника хозяев.
Тело асимметричное, перистомальный желобок дли-
ной до половины длины тела; уже ранние авторы
правильно интерпретировали эту структуру как пред-
ротовой желобок и мелкий рот с небольшой узкой
глоткой. Сзади экскреторная вакуоль с канальцем и
порой, вероятно нет сократимой вакуоли; постерон
раздвоен и утолщен внутри; на уровне желобка вся
антесома состоит из массивного покровного слоя
толщиной до 60 мкм; ядро овальное. Деления с косой
бороздой, вплоть до образования мелких особей (до
70 X 40 мкм). Макрофаги, иногда заглатывают особей
своего вида.
Род Collinina Chatton et Perard, 1924
Это новое название для гомонима Collinella Chatton
et Perard, 1919.
Типовой вид Collinella gondii Ch. et P., 1919.
Вид обычен в толстой кишке (цекуме) гунди в Тунисе,
встречается совместно с Nicollella ctenodactyli. Особи
несколько крупнее николлеллы (550—600 мкм), чер-
веобразные, слегка сплющенные; кортекс антерона не
столь утолщен (до 20 мкм); цитоплазма вакуолизова-
на; сзади у заостренного постерона вакуоль — сокра-
тимая или экскреторная, с каналом. Растянутый узкий
перистомальный желобок сдвигает мелкий рот к по-
стерону, где тело несимметричное; панциревидное
вздутие кортекса с поперечной исчерченностью дости-
гает рта — идет гораздо ниже, чем у предыдущего
рода. Вероятно, это не только панцирь, но и система
кольцевых мионем.
Род Pycnothrix Schubotz, 1909
Типовой вид Р. monocystoides из кишечника
даманов Procavia capensis (Hyracoidea) в Южной Аф-
рике; затем их отметили при осмотре паразитов Pro-
cavia brucei в Эфиопии (Абиссинии), и именно этот
материал позже изучили Шаттон и Перард. Хозяева
родов неродственны, относятся к разным отрядам мле-
копитающих, но имеют сходный образ жизни и пи-
тание.
Типовой вид — очень крупные клетки длиной до
2—3 мм при ширине 0.3—0.5 мм; утолщение кортекса
(панцирь толщиной до 50 мкм) идет по вентральной и
дорсальной сторонам всего тела; мионемы также по
всему телу; желобок достигает постерона и заворачи-
вает вверх к апексу; цитопрокт (или пора вакуоли)
смещен вверх от постерона. Шуботц пишет о двух же-
лобках, но это один изогнутый; по всей длине желобка
местами видны самостоятельные рты с короткими
фибриллярными глотками. Вместо одной вакуоли —
система ветвистых каналов в эндоплазме. Несмотря на
гигантские размеры клетки, ядро остается мелким.
Макрофаги. Деление сложное, морфогенез при имп-
регнации не изучен.
Кроме указанных видов, остались неизученными и
не названы 2 мелких вида из даманов в ЮАР — один
из них Шаттон по рисунку Шуботца отнес к Collinina,
но вид, скорее всего, новый; второй вид напоминает
Nicollella', на юге Африки в другом хозяине могут оби-
тать виды всех 3 родов, найденных на севере.
ТИП CILIOPHORA. КЛАСС LITOSTOMATEA
597
Род Infundibulorium Bozhenko, 1925
Типовой вид/, cameli из кишечника двугорбого
верблюда Camelus bactrianus, вскрытых в Саратове.
Размеры in fixo 80—128 X 50—100 мкм; тело с проч-
ным кортексом, но метаболичное, перистом расширен-
ный, расположен сзади у анальной трубки (цитопрок-
та); от верхней половины тела, но не от апекса к нему
идет узкий желобок; цилиатура густая. Особи оренти-
рованы неправильно; топография, число кинет и стро-
ение перистома не изучались.
Вид долго не замечали и предпочитали определять
такие формы, как Buxtonella sulcata', даже сейчас (Puy-
torac, 1994) они считаются близкими, но разными ви-
дами, хотя для этого нет оснований. В Индии материал
из Camelus dromedarius определен как Infundibulorium,
из коров как Balantidium coli var. bovis Cooper et Gulati
(вероятно, это Buxtonella sulcata). Даже в России вид
называют В. sulcata', выявлено широкое распростране-
ние вида — у 27 % здоровых коров.
Род Buxtonella Jameson, 1926
Типовой вид В. sulcata из цекума (кишечника)
коров в Кембридже; нет в козах и овцах, особи массо-
вые в 5 из 8 вскрытых коров. Тело с густыми ресничка-
ми (топография не изучена); от апекса к постерону
идет широкий желобок с валиком по краю и с исчер-
ченным дном; у рта тело расширено, здесь виден цито-
прокт; глотка небольшая, безресничная — это конец
желобка; имеется несколько вакуолей, обычно две.
Цисты крупные, с толстой гладкой стенкой.
Не может быть сомнения в идентичности с типом
предыдущего рода, второе название не должно больше
применяться или по крайней мере нужен формальный
перенос В. sulcata в состав Infundibulorium (Puytorac,
1994). В ряде работ отмечено нахождение букстонелл
и описано заболевание «букстонеллез» в Европе и
США; клинические картины в Новой Зеландии, в Япо-
нии, Бразилии могут указывать на всемирное распро-
странение опасного патогена. Как и балантидии, тро-
фонты могут внедряться сквозь мукус в ткани кишеч-
ника и вызывать диарею и язвы; масса цилиат
накапливается в тканях, разрушая их, питаются эрит-
роцитами и клетками эпителия. До трети коров — но-
сители цилиат; заражение выделяемыми цистами. В
коровах находят и балантидиев со сходными цистами,
и, вероятно, раньше часть случаев балантидиоза вызы-
валась видом В. sulcata.
Род Nathella Singh, 1953
Род предложен для 2 видов без обозначения типо-
вого вида — N. kumarii и N. rayi, поэтому в каталоге
Аэшт признан невалидным; типовым здесь обознача-
ется N. kumarii — Nathella Jankowski gen. n., с видами
N. kumarii comb. n. и N. rayi comb. n.
Оба вида обитают в Индии в кишечнике мелких
рыб Mystus cavasii; хозяин — не фитофаги, питаются
беспозвоночными. Вид изучен очень детально, с при-
менением многих цитологических методик, в частно-
сти для точного выявления кинетома. Крупные формы
с широким телом, большим числом кинет вдоль же-
лобка, идущего на всю длину тела вентрально. Рот с
небольшой глоткой смещен к концу тела; вестибуляр-
ной цилиатуры нет. Желобок ресничный, сомакинеты
с обеих сторон подходят к нему под углом; вдоль краев
по обеим сторонам идут обособленные полосы из гус-
то сближенных ресничек, независимые от подходящих
к желобку сомакинет. Эти кинетосомы дают корневые
нити, и вдоль всей щели идут пучки немадесм. Токси-
цисты (фибриллы?) расположены вдоль желобка и
свободно в цитоплазме. Кортекс резко утолщен, осо-
бенно спереди, исчерчен, напоминает панцирь афри-
канских пикнотрих. Виды различаются по длине рото-
вой щели и топографии кинетома.
Вторично виды не изучались. Находка в тропиче-
ских рыбах резко расширяет круг хозяев пикнотрихид;
но вместе с тем топография кинет, обособленная от ки-
нет цилиатура желобка могут быть основанием для от-
деления Nathella в особое семейство.
Род Muniziella Da Fonseca, 1939
Типовой вид М. cunhai по монотипии, паразит
кишечника (цекума) водосвинки Hydrochaerus capyba-
ra в Бразилии. Вид кратко описан с простыми рисунка-
ми; позже изучен по фиксированному материалу. Тело
крупное (750—1620 X 480—820 мкм), не червеобраз-
ное, овальное, не сплющено; ядро почковидное; кор-
текс вздутый, исчерченный, панциревидный, особенно
на вентральной стороне. Желобок нетипичный для
выше рассмотренных родов — длиной 2/3 общей дли-
ны тела, очень глубокий (на поперечном срезе занима-
ет 3/4 ширины тела), это не растянутый рот, а инваги-
нация значительной части поверхности тела вслед за
погрузившимся желобком; он не достигает концов
тела, удален от них. Безресничное дно желобка откры-
то в эндоплазму. Хищник, пища — бактерии, растения,
другие инфузории, даже крупные циклопостииды.
Слишком многое отличает вид от африканских
пикнотрих и паразитов наземных млекопитающих.
Если все же включать род в состав пикнотрихид, нуж-
но обособить на уровне подсем. Muniziellinae sub-
fam. п. (желобок на дне ресничной щели, не на поверх-
ности тела; удален от концов тела). Этот род раньше
лишь провизорно включался в состав пикнотрихид,
это особая линия эволюции.
Род Vestibulongum Grim, 1988
Типовой вид V. corlissi из кишечника морских
рыб-хирургов Acanthurus xanthopterus в ЮАР; хозяин
питается вододослями и имеет особый отдел кишечни-
ка (gizzard) для их переваривания, в котором обитают
симбионты. Тело крупное, широкое, не вытянуто; ядро
овальное; желобок идет по всей вентральной стороне,
уходит на край тела и ведет к небольшому субтерми-
нальному рту; вероятно, нет значительного утолщения
кортекса. В отличие от Nathella из пресноводных рыб,
у данного рода края желобка не имеют специальной
цилиатуры, окаймлены полосами фибрилл. Долгое
598
ALVEOLATA
время изучались лишь эктопаразитические цилиаты
морских рыб; сейчас быстро накапливаются данные по
эндоцилиатам — видам Balantidiidae и Nyctotheridae;
если Vestibulongum пикнотрихида, это первое указание
семейства для морских рыб.
Отряд Archistomatida Puytorac et al., 1974
(рис: 318, а, б)
Овальные или каплевидные, не сплющенные фор-
мы с характерной для всех родов конкрементной ваку-
олью в передней половине тела под кортексом, над ко-
торой располагается тигмофрагмон (тигмон) — группа
коротких кинет с сенсорными щетинками. Всегда со-
хранена инфрацилиатура в виде правильных продоль-
ных рядов аргиросом, но соматическая цилиатура про-
являет тенденцию к редукции и кольцевому распо-
ложению. Рот апикальный, с постоянной глоткой без
прочных немадесм, с фибриллами; могут быть не-
сколько конусов, продуцируемых апикальными кине-
тосомами. Рот часто на небольшом выступе (акроне),
ограничен валиками. Ротовая цилиатура — кольцо
сближенных фрагментов сомакинет (соответствует
фрагмону гапторид). Конкрементная вакуоль (стато-
циста) крупная, с кальцитными тельцами (литосо-
мами); при эволюции у высших трихостомат она исче-
зает, но в этом месте сохраняется тигмотактический
ресничный комплекс. Ядро простой формы, нет четко-
видных, лентовидных ядер, редка фрагментация ядра.
Все роды паразитические в разных группах млекопи-
тающих.
Сем. Buetschliidae Poche, 1913
Включает простые формы с округлым или оваль-
ным апикальным ртом; можно обособить формы со
щелевидным ртом, продолжающимся в виде желобка
от апекса до постерона (Paraisotrichopsidae fam. п.). В
Traite (Puytorac, 1994) сем. Buetschliidae sensu lato c
17 родами делится на новые подсем. Buetschliinae, Ро-
lymorphellinae, Blepharoconinae и Didesminae; в эти
подсемейства не включаются аберрантные роды с же-
лобком, род Meiostoma и 8 плохо изученных родов.
Предполагается, что эти подсемейства соответствуют
4 независимым эволюционным линиям от форм с пол-
ной цилиатурой до родов, утерявших часть кинетома.
В данном обзоре все роды семейства, кроме 2 родов
с удлинением рта, рассматриваются в алфавитном по-
рядке. Недавно предложен род Gymnobuetschlia Kornilo-
va, 2004 (типовой вид Buetschlia omnirora Dogiel, 1928)
Род Alloiozona Hsiung, 1930
Типовой вид A. trizona по монотипии. Под этим
названием вид тщательно описан Грайном (Grain,
1966) на импрегнированных препаратах; и все же, не-
смотря на хорошие рисунки в первоисточнике, род
принят не всеми — не раз высказывалось мнение об
идентичности этого рода и Blepharozoum (подробнее
см. ниже в диагнозе последнего). По Грайну, особи
широкие, веретеновидные, очень мелкий рот окружен
валиком (акрон); кинеты полимеризованы, их верши-
ны обособлены (тесно сближены ряды и кинетосомы в
них) и окружают рот широким кольцом. Это типичный
фрагмон гапторид. Пока неясно, сохранена ли кольце-
вая кинета с дисомами (циркон) вокруг рта. Импрегна-
ция выявляет аргиросомы в четких биполярных рядах,
но реснички несут лишь 3 широкие полосы — апи-
кальная, медиальная и у постерона; средний ряд сужа-
ется дорсально. На одной из сторон тела (дорсально)
от рта отходят около 15 сближенных специализиро-
ванных тигмокинет со сгущением кинетосом; под ни-
ми лежит крупная вакуоль с кальцитными литосомами.
Пора вакуоли на меридиане тигмона, у постерона
трубка цитопрокта. У данного вида изучено строение,
деление (морфогенез кинетома), ультраструктура. Ток-
сицист такого типа, как у гапторид, нет; митохондрий
нет, имеются ферментные тельца — гидрогеносомы.
Паразиты лошадей, кулана, африканского носорога.
Род Ampullacula Hsiung, 1930
Типовой вид Paraisotricha ampulla Fiorentini,
1890 по монотипии. Фиорентини рисует каплевидную
форму с острым длинным сократимым рострумом и
сферическим телом, но рострум обычно короче и
шире. Различимы 2 отдела рострума, сужение у рта и
более широкий отдел ниже, где находится конкремент-
ная вакуоль; кортекс рельефный, с ребрами; мелкий
рот с длинной фибриллярной глоткой. Реснички сохра-
нены на всем роструме (вероятно, эта зона соответст-
вует кольцевому фрагмону предыдущего рода) и не-
сколько ресничек на небольшом выступе постерона.
Плохо изученный вид, который нельзя включать в
определители цилиат. Паразиты лошадей.
Род Amylophorus Pereira et Almeida, 1942
Типовой вид Л. rochalimai из кишечника агути
Dasyprocta azarae в Бразилии. Известен только по не-
полному первоописанию, ротовая цилиатура и топо-
графия кинет не изучены; внешний облик типичен для
бючлиид — овальное тело, узкий рот, короткая глотка;
вероятно, с полной цилиатурой, без редукции ресни-
чек. Можно согласиться с Корниловой (2004), отме-
тившей сходство этого рода с балантидиями (2 вакуо-
ли, почковидное ядро, отсутствие конкрементной ва-
куоли, питание крахмалом и т. д.); вид переносится
временно в состав балантидиид — Balantidium rochali-
mai Jank. comb. п. Род Balantioides Alexeieff, 1931
предложен раньше, Amylophorus — синоним.
Род Blepharocodon Bundle, 1895
Типовой вид В. appendicalatus из лошади.
Очень мелкие грушевидные формы; плохо описанный
вид. Тело безресничное, расширено спереди, где толь-
ко одно ресничное кольцо окружает весь апекс. Не за-
рисованы рот, глотка, кинеты или ребра кутикулы,
тигмокинеты; по автору, рот — это широкая полость
ТИП CILIOPHORA. КЛАСС LITOSTOMATEA
599
по леей передней поверхности тела, окруженная одним
кольцом или рядом очень активных ресничек; не пока-
'Ш1П>| сократимая и конкрементная вакуоли и цито-
прокт. Такой род нельзя включать в определительные
таблицы цилиат.
Род Blepharoconus Gassovsky, 1919
Типовой вид В. hemiciliatus по монотипии, из
лошадей. Тело вытянутое, сужается к постерону, с по-
лусферической вершиной; весь антерон на треть дли-
ны тела покрыт сближенными рядами коротких ресни-
чек; дополнительный пучок (не ряды) на постероне.
Рот мелкий, глотка коническая, вероятно из несколь-
ких концентрических групп фибрилл. По Стрелкову
(1939), несимметричная ресничная зона делится на не-
сколько частей поперечными кольцами; на безреснич-
иой поверхности они продолжаются до постерона в
виде тонких ребер кутикулы. Вид В. cervicalis Hsiung,
1930 — вероятный синоним типового вида. В. benbroo-
ki Hsiung, 1930 — в лошади; В. krugerensis Eloff et Van
Hoven, 1980 — в африканском слоне; В. dicerotos Van
Hoven et al., 1998 — в африканском носороге.
Род Blepharomonas Kopperi, 1937
Типовой вид В. mollis. Многословное описание
(3 страницы) сопровождается одним примитивным ри-
сунком, кинетом не изучен, тигмон не показан. Веро-
ятно, цилиатура полная, без редукции; на рисунке
особь овальная, мелкий апикальный рот с короткой
трубкой, вакуоли с конкрециями («конвакуоль», kon-
vacuole, термин новый) нет; на постероне пучок из не-
скольких длинных ресничек. В кишечнике грызунов и
в арвиколидах (полевая и лесная мыши), особенно час-
то встречается в леммингах в Финляндии. Это один из
родов, которые нельзя приводить в определительных
таблицах до повторного изучения.
Род Blepharoplanum Kopperi, 1937
Типовой вид В. leporis из зайцев и кроликов в
Финляндии; вновь 3 страницы текста и очень прими-
тивный рисунок, показывающий неспособность автора
изучить объект. Показана вытянутая овальная клетка с
4 сократимыми вакуолями, без конвакуоли; спереди
мелкий рот; по всей периферии густые реснички. Этот
и предыдущий род условно приводятся в составе се-
мейства бючлиид.
Род Blepharoprosthium Bundle, 1895
Типовой вид В. pireum из цекума и колона ло-
шади, кулана, осла; также В. polytrichum Strelkow, 1939
(из лошади), В. parvum Hsiung, 1932 (из коровы) и
В. musculus Dogiel. Тело вытянутое, гибкое и сократи-
мое, особенно в переднем суженном отделе; конваку-
оль и сократимая вакуоль показаны в типичном для се-
мейства локусе; вся верхняя суженная часть покрыта
ресничками, у постерона группа ресничек. Активные
хищники, могут заглатывать крупных блефароко-
рисов. По более точным данным (Стрелков, 1939),
овальный рот несколько отклонен вбок, сократимый
антерон с 25—30 кинетами, сзади на мелком выступе
пучок ресничек (не широкая полоса, как в первоописа-
нии), глотка двойная, длинная.
Род Blepharosphaera Bundle, 1895
Типовой вид В. intestinalis по монотипии, из це-
кума и колона Лошади, позже найдена в зебре, у слона
и носорога Африки. Тело почти округлое, мелкий рот
поднят на небольшом выступе (акроне); ресничные
ряды полимеризованы, равномерно идут от апекса до
нижней четверти тела, где расположена вакуоль; сзади
пучок каудалий,-
Другие виды — В. caviae Kopperi, 1937 из морских
свинок кавиид в Финляндии; вероятно, это вид другого
рода — вытянутый рот, полная цилиатура, низко рас-
положена конвакуоль. Полная цилиатура без ацилона
(безресничной зоны) сзади показана у «В. intestinalis»
из африканского слона, это не соответствует диагнозу
рода. В. ellipsoidalis Hsiung, 1930 и В. citriformis Strel-
kow, 1939 описаны из лошади, В. ceratotherii Van Ho-
ven et al., 1998 из носорога в ЮАР (вновь совершенно
нетипичные для рода).
Род Blepharozoum Gassovsky, 1919
Типовой вид В. zonatum по монотипии, из ло-
шади. На рисунке у вытянутой широкой клетки, заост-
ряющейся кзади, показана полная цилиатура, но в тек-
сте пишется о том, что при плавании реснички места-
ми плотно прилегают к телу и образуют 2 поперечных
кольца, кажущиеся безресничными, — на середине те-
ла и в постесоме. Последующие авторы выяснили, что
безресничные кольца действительно имеются, и это
поставило вопрос о статусе рода Alloiozona. Вольска
(Wolska, 1964а) предполагает, что Гасовский мог ви-
деть кинетосомы в безресничных зонах и поэтому ре-
шил, что все тело ресничное. Общего мнения нет, часть
авторов считает названный род невалидным; другие
признают его, поскольку у A. ampulla иначе располо-
жены кольца ресничек, имеется четкий тигмон, и рот
окружен широким кольцом сближенных фрагментов
кинет — пока такой фрагмон не был показан у Blepha-
rozoum. Итак, оба вида и рода могут быть валидными.
В бегемоте Hippopotamus amphibius описан В. Ы-
nucleatum Thurston et Grain, 1971 с равномерной пол-
ной цилиатурой без следа колец ацилона; это не ошиб-
ка, применены 2 метода импрегнации. Формально
этот вид принадлежит к Prorodonopsis (Р. binucleatus
comb, п.), но родство их еще предстоит доказать.
Род Buetschlia Schuberg, 1888
Типовой вид В. parva из лошади; в первоописа-
нии — овальная форма с широким апексом и только
апикальным кольцом ресничек; но к виду относят та-
600
ALVEOLATA
ких цилиат с полной соматической цилиатурой; перво-
начальный диагноз рода ошибочный, легче заметить
направленные вперед апикальные реснички в плотном
апикальном кольце, чем соматические. Описан ряд ви-
дов: В. lanceolata Fiorentini, 1890; В. parva forma coni-
rostris; В. папа Dogiel, 1928; В. omnivora Dogiel, 1928;
В. neglecta; В. bovis (перенесена в Pseudobuetschlia);
В. postciliata, В. trciliata из коров, овец, верблюда.
Сборный род; В. lanceolata с острым ресничным апи-
кальным конусом не может относиться к Buetschlia.
Род Buetschliella Jirovec, 1933 (гомоним; см.: Pseu-
dobuetschlia).
Род Buissonella Da Cunha et Muniz, 1925
Типовой вид В. tapiri в тапирах Бразилии; пере-
описан по материалу из Tapirus terrestris в зоопарках
Польши. Тело каплевидное, передняя сократимая
часть отделена асимметричным желобком; имеется
мелкий апикальный рот, почковидное ядро, 2 сократи-
мые вакуоли, конвакуоль типичная для семейства. Ци-
лиатура полная, ряды биполярные. В тех же тапирах
нашли и Balantidium coli без конвакуоли, очень напо-
минающих В. tapiri; возможно, это не балантидии.
Род Bundleia Da Cunha et Muniz, 1928
Типовой вид Buetschlia postciliata Bundle, 1895
по указанию Аэшт (Aescht, 2001) и в каталоге Корни-
ловой (2004), но в первоисточнике вид из тапира на-
зван Bundleia bathypharyngea — это вид типа В. postci-
liata из лощади. Ситуация с типом рода пока неясная.
Вид В. postciliata переописан во Франции и Японии.
Особи овальные, почти все тело без ресничек, с про-
дольной исчерченностью; реснички сохранены в 2 коль-
цах косых фрагментов — широком апикальном и не-
большом каудальном; мелкий тигмон (4 фрагмента)
над конвакуолью. Другие виды — В. bathypharyngea
Da Cunha et Muniz, 1928; В. vorax Strelkow, 1939;
В. папа S., 1939; B. asymmetrica S., 1939; B. triangularis
S., 1939; B. elongata S., 1939; B. inflata S., 1939; B. do-
HchostomaS., 1939; 5. piriformis S., 1939; B. elongata S.,
1939; B. benbrooki Hsiung, 1930 (Blepharoconus?).
Подрод Chlamydobundleia Strelkow,
1939
Типовой вид В. (Ch.) elongata — толстый кор-
текс, пучок ресничек (не кольцо) сзади, в остальном
типичные для рода.
Подрод Fibrillobundleia Strelkow, 1939
Типовой вид В. (F.) benbrooki, также В. inflata и
В. dolichostoma. Признаки подрода — сильное разви-
тие околоротовых фибрилл (опорных фибрилл глот-
ки); рот на суженном переднем конце тела, нередко
окружен «плазматической шейкой» (акроном). Топо-
графия кинет не выявлена.
Род Cucurbella Thurston et Grain, 1971
Типовой вид С. vivax из бегемота в Уганде; тело
каплевидное или бутылковидное, с вытянутым хоботко-
видным антероном, слегка асимметричным и отклонен-
ным вбок; ядро необычное для семейства (распыленное
на мелкие фрагменты, до 50 нодул); цилиатура полная,
кинет немного, на уровне хоботка сближены фрагменты
и кинетосомы в них, образуя типичный фрагмон, здесь рес-
нички длиннее остальных; узкая глотка с длинными фиб-
риллами. Это один из немногих видов семейства, у которых
найдена секантная зона кинетома (ниже рта). Видовое
название отражает активное, быстрое движение особей.
Род Didesmis Fiorentini, 1890
Типовой в и д D. quadrata по обозначению Бюйссо-
на (по Аэшт), но в книге Бюйссона (Buisson, 1923) ти-
повой вид рода нигде не обозначен. Поэтому данный
вид — по указанию Аэшт. Клетки сужаются книзу, где
постерон оттянут, и к вершине с очень широким ртом;
цилиатура в значительной степени редуцирована, сохра-
нено широкое апикальное кольцо и такое же нижнее,
прерванное порой вакуоли. Над конвакуолью мелкие про-
дольные фрагменты кинет (тигмон). Виды D. quadrata
и D. ovalis принадлежат к числу наиболее изученных
бючлиид (морфология, ультраструктура, кинетом и его
морфогенез при импрегнации); в частности, показано на-
личие разрозненных кинетосом в продольных рядах по
всей безресничной поверхности. Типовой вид имеет,
кроме того, широкую биполярную полосу с поперечны-
ми фибриллами, легко видную без импрегнации и хоро-
шо выявляемую серебром; ее нет у D. ovalis, и эти
виды можно отнести к разным родам. Didesmis s. str.
включает D. quadrata и D. spiralis; Стрелков (1939)
считает этот вид синонимом типового.
Род Fiorentinus Jankowski, 1986
По Аэшт, типовой вид Didesmis ovalis Fiorentini,
1890 по первоначальному обозначению и монотипии;
род является «младшим объективным синонимом рода
Holophryoides Gassovsky, 1919, так как имеет тот же типо-
вой вид». Это дезинформация — тип рода Holophryoi-
des — не Didesmis ovalis, a Paraisotricha ovalis F., 1890,
поэтому никакой синонимии нет; Фиорентини дал оди-
наковые названия (ovalis) двум видам разных родов.
Типовой вид мельче, чем D. quadrata, тело более
закругленное, кинетом однотипный; нет продольного
желобка кортекса с продольными и поперечными фиб-
риллами, даже при импрегнации нет ни следа такой
структуры. В этом отношении роды Didesmis и Fioren-
tinus четко разграничены. Вид хорошо изучен Воль-
ской (Wolska, 1964а, 1966а) и Грайном (Grain, 1966).
Род Hemiprorodon Strelkow, 1939
Типовой вид Я gymnoposthium из лошадей; ши-
рокие клетки плавно сужаются к вершине, отклонен-
ной вбок; крупный рот с фибриллярной глоткой; толь-
ТИП CILIOPHORA. КЛАСС LITOSTOMATEA
601
ко одна вакуоль (у части бючлиид 2—3); реснички
сближены у рта без обособления фрагмона, в мно-
гочисленных продольных рядах идут вплоть до ниж-
ней 1/6 части тела, образующей ацилон; сзади мел-
кий выступ без ресничек (у других бючлиид обычно
ресничный).
Род Holophryoides Gassovsky, 1919
Типовой вид, по Аэшт, Didesmis ovalis Fiorentini,
1890, но в первоисточнике тип рода по монотипии Ра-
raisotricha ovalis F., 1890; поэтому Fiorentinus (предло-
женный для D. ovalis) не может быть синонимом рода
Holophryoides. Paraisotricha у ранних авторов была
смесью простомат и трихостомат.
Н. ovalis и Н. triangularis обитают в кишечнике ло-
шади; клетки удлиненно-овальные, с широким ртом и
четкой глоткой, равномерно покрыты густым войло-
ком ресничек без следа ацилона. Второй вид не был
должным образом включен, по Тассовскому, «вместе с
описанным здесь видом (Н. ovalis) должна быть вклю-
чена Paraisotricha triangularis Fior.»; это не comb, n.,
поэтому при первоописании род монотипичный.
Род Holophryozoon Jirovec, 1933
Типовой вид Н. bovis из рубца коров; очень
мелкие овальные клетки с редкими длинными, разроз-
ненными ресничками; рот мелкий, глотка узкая и
длинная, не конусовидная, как обычно у бючлиид;
конвакуоли нет. Причина выделения рода непонятна,
нет рисунка кинетома; полная соматическая цилиатура
(без зон ацилона) характерна и для других родов, хотя
у Н. bovis минимальное у бючлиид число ресничек.
Есть некоторое сходство с Oligoisotricha bubali, но рес-
ничек меньше. Ввиду очень плохого описания род
нельзя включать в определители цилиат.
Род Нsiungella Imai in Aescht,
2001
Типовой вид Hsiungia triciliataImai, 1988; родо-
вое название Hsiungia — гомоним. Вид описан из руб-
ца жвачных; тело овальное, цилиатура рудиментар-
на» — стандартное кольцо фрагментов на суженном
иитсроцс, изолированная группа ресничек (не щети-
нок?) над конвакуолью, две группы на разных уровнях
медиально и несколько ресничек у цитопрокта. Это на-
поминает кинетом Blepharoconus krugerensis из сло-
нов, но у последних реснички над конвакуолью не изо-
лированы от верхней полосы фрагментов.
Из африканского слона Loxodonta africana в Заире
и ЮАР описан вид Blepharoconus krugerensis Eloff et
Van Hoven, 1980 с таким же положением кинет; верх-
няя зона более широкая и смыкается с боковыми фраг-
ментами, изолированными у Hsiungella. Если рисунки
авторов верны, это разные роды, но нужно специаль-
ное сравнение видов и рисунки с разных сторон. Сей-
час можно перенести африканский вид в состав Hsiun-
gella (Н. krugerensis comb. n.).
Род Levanderella Kopperi, 1937
Типовой вид L. rodentium по монотипии. Как и
в случае других видов Коппери, длинное описание
(5 страниц) сопровождается одним примитивным ри-
сунком, на котором ничего нельзя понять. Показана
сфера с длинными ресничками по всей периферии, со
множеством поперечных колец, ядро в центре и 3 ва-
куоли вдоль одного края тела; нет рта, глотки, конва-
куоли, цитопрокта, продольных кинет. По Коппери,
вид обычен в белках, кроликах,'зайцах, леммингах, по-
левой мыши и водяной полевке в Финляндии; цилиа-
тологи этих хозяев не осматривают. Такой род нельзя
включать в определители цилиат.
Род Malacosoma Kopperi, 1937
Типовой вид М. intestinale Kopperi, 1937; как
гомоним название рода заменено на Kopperia Corliss,
1960 (К. intestinalis). Тело слегка вытянуто и сужается
кзади; цилиатура полная, со сплошным войлоком
нетипично длинных ресничек в многочисленных диа-
гональных рядах; у постерона пучок особо длинных
каудалий; мелкий рот слегка сбоку от апекса; ядро и
сократимая вакуоль (вероятно, конвакуоль) в нетипич-
ном положении (в антесоме). Паразиты морской свин-
ки (Cavia), часты у всех осмотренных особей; нет в
грызунах; не найдены последующими авторами. Коп-
пери сближал род с изотрихидами.
Род Microcetus Orpin et Mathiesen, 1986
Типовой вид М. lappus', как гомоним, название
рода заменено на Microcetella Aescht, 2001 (Microcetel-
la lappus). Паразиты коров; очень мелкие узкие цилиа-
ты с апикальным ртом, несколькими извитыми кине-
тами, без ацилона; точной схемы строения нет, кине-
том не изучен. Одна из особенностей — особый тип
глотки, только 2 палочки, дорсальная и вентральная.
У внешне сходных Oligoisotricha bubali глотка друго-
го типа, без палочек и с исчерченной глоткой. Нет
данных о конкрементной вакуоли, род не отнесен к
бючлиидам. Нужно повторное изучение вида с приме-
нением импрегнации. У Корниловой (2004) предпо-
ложительно в составе Isotrichidae, что совершенно иск-
лючено — рот не смещен к постерону, не погружен,
нет ресничного вестибулюма.
Род Oligoisotricha Imai, 1981
Типовой вид Isotricha bubali Dogiel, 1928 из ин-
дийского водного буйвола Bubalus bubalis на Тайване.
Мелкие цилиаты с овальным несимметричным телом;
мелкий рот чуть сбоку от апекса, тонкая глотка с про-
дольными палочками, центральное ядро, цитопрокт
сзади; по периферии показаны реснички по всей кайме
тела; топография кинет не изучена, конвакуоль не за-
рисована. В каталоге Аэшт указано — «Янковский пе-
ренес типовой вид в Pingius’, Дехорити, Орпин и Ма-
тиесен считают род валидным».
602
ALVEOLATA
Размеры особей совпадают с Pingius minutus Hsi-
ung, 1932, форма тела сходная, и сзади нет ресничек в
зоне цитопрокта. Неясно отличие этих родов и причи-
ны выделения I. bubali в особый род — все основные
признаки совпадают. Никто из авторов, цитированных
Аэшт, не обсуждает отличия от рода Pingius и даже
не цитируют работу Хсюнга (Hsiung, 1932), поэтому
нельзя ссылаться на их мнение о валидности Oligoi-
sotricha. Предлагая новый род Microcetus, Орпин и
Матиесен (Orpin, Mathiesen, 1986) тоже не упоминают
Pingius, несомненно они даже не знали этот род; ва-
лидность Microcetus также под сомнением.
Род Parabundleia Imai et Ogimoto, 1983
Типовой в и д Р. ruminantium из зебу Bos indicus
в Тайланде. Это бючлииды с крайней редукцией цили-
атуры — тело овальное, с конвакуолью и одной сокра-
тимой вакуолью; спереди узкий рот и тонкое кольцо
удлиненных ресничек по краю широкого акрона; груп-
па длинных ресничек над конвакуолью (не щетинки,
как у гапторид) и пучок каудалий.
Род Pingius Hsiung, 1932
Типовой вид Р. minutus из коров в Китае. Очень
мелкие (22—28 мкм) угловатые клетки с толстой кути-
кулой, овальным ядром, без конвакуоли, с густой ци-
лиатурой; сзади безресничный участок близ цитопига;
сократимая вакуоль у постерона. Рот с длинной кони-
ческой глоткой, показаны палочки или утолщенные
стенки. В первоописании (Hsiung, 1932) нет ни мотива-
ции, ни сравнений, ни диагноза нового рода. В частно-
сти, нет сравнения с Isotricha bubali Dogiel, 1928 (тип
рода Oligoisotricha Imai, 1981); вероятно, оба эти рода
имеют один и тот же типовой вид, называемый по-раз-
ному. Oligoisotricha бесспорно идентична с Pingius, а
типовой вид последнего можно свести в синоним вида
Isotricha bubali (Pingius bubali comb. n.). Валидность
рода и вида Microcetus lappus тоже под сомнением. Ве-
роятно, в жвачных существуют мелкие простоматы без
конвакуоли, описанные под 3 родовыми названиями.
По Корниловой (2004), Pingius minutus «очень похож
по внешнему виду на Oligoisotricha bubali', и рисунок,
и описание пракически полностью совпадают»; пред-
положительно род Pingius отнесен к изотрихидам, что
исключено по типу и положению перистома.
Род Polymorpha Dogiel, 1929
Типовой вид Р. ampulla из лошади, кулана,
осла, индийского слона и носорога Африки; название
рода как гомоним заменено на Polymorphella Corliss,
1960 (Р. ampulla, Р. pellucida). Благодаря публикациям
Грайна (Grain, 1965 и др.), это хорошо изученный род.
Тип рода — вытянутые формы с узким антероном; ци-
лиатура сохранена на конусовидной верхней части
тела (около трети длины тела) в продольных и косых
рядах с четкой секантой; сзади несколько коротких
фрагментов кинет с ресничками вокруг цитопрокта; на
безресничной поверхности импрегнируются продоль-
ные фибриллы. Аргиром (сеть между кинетами) у бюч-
лиид пока не найден. Фибриллы отходят от верхних
кинетосом, образуя глотку и опорный аппарат антеро-
на. В ресничном комплексе нельзя различить тигмоки-
неты и нет сенсорных щетинок; нет токсицист; вероят-
но, нет кольца дисом вокруг рта (циркона); если это
верно, бючлиид не следует объединять с гапторидами,
хотя происхождение их от гапторид бесспорно.
Род Prorodonopsis Gassovsky, 1919
Типовой вид Р. coli из лошади. Грушевидные
слегка изогнутые клетки с сужением передней части
тела, где четко заметны продольные кинеты; все тело
густо покрыто ресничками; конвакуоль в типичном
положении, сзади 3—4 сократимые вакуоли. Антесома
с «трихитами» (длинными фибриллами) вокруг мелко-
го рта.
Род Pseudobuetschlia Jirovec, 1933
Типовой вид Buetschliella bovis Jirovec, 1933;
как гомоним рода астомат, название рода Buetschliella
Jirovec, 1933 заменено новым. В коровах кроме изот-
рих и трихостомат были найдены мелкие (15—20 мкм)
каплевидные простоматы без конвакуоли, с продоль-
ными полосками ресничек только на суженном апи-
кальном отделе вокруг широкого рта. Продольных ре-
бер на ацилоне нет, сзади нет цитопрокта и пучка рес-
ничек; это наиболее упрощенный род бючлиид, если в
состав семейства включать и виды без конкрементной
вакуоли.
Род Plexobundleia Kornilova, 2005
Типовой вид Didesmissynciliata Van Hoven, Gil-
christ, Liebenberg et Van der Merwe, 1998 (P. synciliata)
из носорога Rhinoceros в южной Африке. Овальные
клетки с расширенным апексом и суженным постеро-
ном; сзади группа ресничек; на безресничной поверх-
ности тела тончайшие спиральные ребра кутикулы. У
Didesmis и Fiorentinus из лошади ребра прямые, спере-
ди кольцо из косых фрагментов кинет, реснички их не
сливаются. У вида из носорога узкое кольцо состоит из
циррусов (пектинелл), а не отдельных ресничек — ки-
нетосомы в каждой группе вплотную сближены и от
них отходят «составные реснички» (compound cilia) в
виде длинных циррусовидных пектинелл. Этот вид за-
служивает как минимум ранга подрода внутри Dides-
mis, но лучше выделить в новый род, поскольку таких
циррусов нет не только у дидесмид, но и у остальных
родов семейства бючлиид.
Род Sciurella Kopperi, 1937
Типовой вид У intestinalis', как гомоним назва-
ние рода заменено на Sciurula Corliss, 1960. В толстой
кишке белок в Финляндии найдено несколько простей-
ТИП CILIOPHORA. КЛАСС LITOSTOMATEA
603
ших, среди них цилиаты нового рода, зарисованного
столь же плохо, как все остальные виды в статье это-
го автора (Коррей, 1937). Показана веретеновидная
клетка с полной цилиатурой, тело сужается к обоим
концам, ядро центральное, рот и глотка не зарисованы,
кинеты в косых рядах. Статус рода, его место в систе-
ме неизвестны; род нельзя включать в определители
цилиат.
Род Wolskana Ito, Imai, Ogimoto
et Nakahara, 1996
Типовой вид W. tokarensis из лошадей местной
породы токара-пони в Японии. Мелкие каплевидные
клетки с 11—12 спиральными кинетами, несущими от-
носительно длинные реснички; антерон сужен, несет
кольцо из большого числа косых фрагментов кинет
(фрагмон), реснички этой зоны сближены вплотную и
направлены вперед. Имеется конвакуоль, сзади сокра-
тимая вакуоль и цитопрокт. Спереди плоский акрон с
мелким апикальным ртом; фибриллы отходят от всех
кинет фрагмона до задней четверти тела, образуя мас-
сивную коническую воронку.
Сем. Paraisotrichopsidae Jankowski
fam. n.
У бючлиид рот апикальный, округлый или незна-
чительно удлиненный; у двух родственных родов
(тоже имеющих конкрементную вакуоль) рот продол-
жается в виде желобка до экватора или далее до посте-
рона. Такие формы можно обособить в подсемействе
или отдельном семействе; допускается, что эти 2 рода
родственные, не конвергентные.
Род Sulcoarcus Hsiung,
1935
Типовой вид 5. pellucidulus из лошадей, му-
ла, осла, кулана. Тело очень широкое, особо расши-
рено и сплющено спереди, несимметричное; антерон
с широким глубоким желобком, ограниченным краем
тела и высоким дорсальным щитовидным выростом.
Точной картины кинетома нет, схема приблизи-
тельная; вероятно, есть реснички на одной стенке же-
лобка. Тело без продольных кинет; кроме цилиату-
ры желобка видны реснички постерона, изоли-
рованные пучки и полоса ресничек неясной
топографии. По Стрелкову (1939), имеется сложная
цилиатура желобка, 2 боковых пучка, каудалии и
длинная полоса ресничек слева.
Род Paraisotrichopsis Gassovsky,
1919
Типовой вид Р. composita из лошади и кулана.
Тело широкое, слегка сплющено, целиком ресничное;
конвакуоль, ядро и сократимая вакуоль на одном уров-
не. Передний конец тела с желобком, ограниченным
валиком; желобок идет по краю тела до постерона, на
всем пути ограничен с обеих сторон поперечными
фрагментами кинет (фрагмон).
Отряд Blepharocorythida Wolska,
1971
Соматическая цилиатура почти редуцирована, со-
хранено лишь несколько полос фрагментов кинет в пе-
редней и задней части тела. Конкрементной вакуоли нет,
но сохранился тигмофрагмон, лежащий у бючлиид над
этой вакуолью, и иногда можно различить рудимент
конвакуоли. Тело мелкое, обычно сплющено латераль-
но, кортекс прочный — с эпиплазмой и лежащим под
ней слоем микротубул, как у примитивных энтодинио-
морф. Дорсальная сторона антерона превращена в вы-
ступ (frontal cap) разной формы, нависающий над
широким вентральным вестибулярным отверстием,
начинающимся у апекса и отклоненным вбок к вент-
ральной стороне.
Собственно перистомальная цилиатура (без тигмо-
на) — 2 полосы коротких косых рядов с тесно сбли-
женными кинетосомами, соответствуют «полибрахи-
кинетам» офриосколецид, но для блефарокоритид этот
термин не используется. Полосы с такими фрагмента-
ми — одна из форм кинетофрагмона, для них можно
использовать термин «фрагмозоны» (fragmozones).
Полосы расположены на несократимых участках, пе-
редняя часть тела неспособна к втягиванию и растяже-
нию в отличие от многих энтодиниоморфид. Полоса А
окаймляет снаружи вентральный край вестибулюма,
полоса В начинается у вершины и уходит далеко вниз
в глубь вестибулюма. У части видов она видоизмене-
на, резко расширена в своей нижней части.
Нет четкого деления тела на плотную периплазму и
жидкую фагоплазму, которые легко видны у энто-
диниид и разделены фибриллярной стенкой. Нет ске-
летных пластинок вокруг вестибулюма или под кути-
кулой, свойственных большинству энтодиниоморф.
Блефарокоритиды сохраняют многие признаки Buetsc-
hliidae — у одного из высших родов типа Didesmis,
точнее, Fiorentinus без продольной исчерченной поло-
сы в эволюции наружная кольцевая зона фрагментов
могла разделиться на 2, и вторая полоса погрузилась в
вестибулюм. Отряд сочетает признаки исходных бюч-
лиид и энтодиниоморф, которые по Вольской (Wolska,
1971) могли произойти от блефарокорид или вероят-
нее от общего предка.
Паразиты кишечного тракта травоядных млекопи-
тающих, в основном лошадей, мулов, куланов, зебр,
тапиров; харониды в рубце руминант, в носорогах, ряд
родов в гиппопотамах, слонах.
В системе Линна (Lynn, 2002, 2003) класс Litosto-
matea Small et Lynn, 1981 включает подклассы Haptoria
Corliss, 1974 и Trichostomatia Butschli, 1889, последний
делится на отряды Vestibuliferida и Entodiniomorphida
(подотряды Archistomatina, Blepharocorythina, Entodi-
niomorphina).
В принципе архистоматины — простые перед-
неротые цилиаты, произошедшие монофилетически
от гапторид; нет погруженной цилиатуры вестибу-
люма в отличие от двух других подотрядов. Как про-
604
ALVEOLATA
Рис. 321, a. Blepharocorythida.
Spb'ocorys indicus (A—B); Paraisotricha colpoidea (Г, Ж, 3, II—С)', P. minuta (Д, E, И); Lalteuria polyl'aria (X); Raabena bella (Л, M). (По: Wolska, 1964b (Г, Д, Ж,
3,0, IT), 1967 (Л, M); 1970 (А. Б, B); Grain, 1966 (E, И, H, P, Q; Timoshenko, Imai 1997 (K)).
Fig. 321, a. Blepharocorythida.
стоматы и гапториды, группа заслуживает ранга от-
ряда, как и блефарокоритиды. В итоге система выгля-
дит так:
Класс Litostomatea
Подкласс Haptoria
Отряд Gymnostomatida (= Haptorida)
Отряд Pleurostomatida
Отряд Cyclotrichida
Подкласс Trichostomatia
Отряд Archistomatida
Отряд Blepharocorythida
Отряд Entodiniomorphida
Отряд Vestibuliferida
Отряд Reikostomatida ordo и.
Отряд Balantidiida
Сем. Blepharocorythidae Hsiung, 1929
(рис. 321, а, б)
С признаками отряда. Кроме довольно однотипных
родов включает Circodinium с необычной формой
тела; в приложении приводится также род Latteuria,
вероятно аберрантная блефарокоритида, перисто-
мальная цилиатура которой включает наружную по-
лосу и вестибулюм с неизвестной пока топографией
цилиатуры.
Род Blepharocorys Bundle,
1895
Типовой вид Diplodinium uncinatum Fiorentini,
1890 (5. uncinata) из цекума и колона лошадей. Тело
вытянутое, с прочным панцирем, несущим продоль-
ные ребрышки; сзади тело раздвоено, спереди расши-
рено, сложного строения, с вырезками, выступами,
иногда и с закрученным шипом антерона (у типового
вида). Ядро почковидное, у вестибулюма. Перистом
широко открытый, ведет в длинную трубчатую по-
лость с цилиатурой (вестибулюм); рот на дне полости;
стенки вестибулюма с серией поперечных опорных
фибриллярных колец. Сзади у цитопига и поры вакуо-
ли небольшая группа фрагментов (пектинелл) в узкой
полоске, соответствующая заднему кольцу фрагмона у
бючлиид. Спереди сбоку дорсальная полоска коротких
ТИП CILIOPHORA. КЛАСС LITOSTOMATEA
605
Рис. 321, б. Blepharocorythida.
Blepharocorys uncinata (А, Б,Д); B.jubata (В); В. equi (Г); Ochoterenaia appendiculate (Ж); Triadinium caudatum (3); Circodinium minimum (PT)',
Triadinium galea (X); ротовая цилиатура Tripalmaria dogieli (E). (По: Grain, 1966 (А, Б ,Д)', Wolska, 1966b (S); 1971 (PI, K)\ 1978a (£); 1978b (Ж); 1981 (3); Ja-
cobson, 1931 (Г)).
Fig. 321, 6. Blepharocorythida.
Buccal ciliature of Tripalmaria dogieli (£).
косых рядов; у гапторид они несут сенсорные щетин-
ки, у бючлиид и блефарокоритид реснички. При имп-
регнации сухим методом Клейна (обычно не применя-
емым для цилиат из травоядных млекопитающих) об-
наружена сплошная масса продольных аргиронем;
кинетосомы и аргиром у В. equi такого же типа, как у
этодиниоморфы Cycloposthium.
Перистомальная цилиатура — широкая полоса ко-
сых фрагментов (фрагмозона А) по вентральному
краю полости, идущая длинной дугой, и длинная узкая
полоса прямых кинет, уходящая от края вестибулюма
вниз до рта — полоса В из 4 кинет.
Кроме типового, валидные виды В. angusta Gassov-
sky, 1919; В. cardionucleata Hsiung, 1930; D. curvigula
G., 1919 (с особо длинной изогнутой глоткой, отходя-
щей от вестибулюма); B.jubata Bundle, 1895 (с изви-
тым апикальным отростком); В. microcorys G., 1919;
В. unifasciculata; В. equi', В. valvata (Fiorentini, 1890) и
др. Вид из леммингов в Финляндии (В. caudata Koppe-
ri, 1937) плохо описан и зарисован, но может относить-
ся к этому роду. В капибаре Hydrochaerus вид
В. hydrochoeri Da Cunha et Muniz, 1925. Blepharocorys
bovis Dogiel, 1926 — синоним типового вида следую-
щего рода.
Род Charon Jameson, 1925
Гомоним; название дважды заменено на Charonina
Strand, 1928 й Charonella Bhatia, 1935.
Типовой вид Charon ventriculi Jameson, 1925 из
коров, быков, овец, изучен при импрегнации. В прин-
ципе организация, как у Blepharocorys, поэтому род
ранее не всегда принимался как валидный; в частно-
сти, в монографиях Догеля (Dogiel, 1927) и Стрелкова
(1939) вид включен в состав Blepharocorys, род не со-
606
ALVEOLATA
хранен. Тело коническое, с широким перистомом, без
вырезок и апикального шипа; длинная роговидная по-
лость вестибулюма широкая, стенки укреплены дуга-
ми фибрилл. Основное отличие по цилиатуре — поло-
са А с небольшим числом фрагментов (пектинелл), до-
рсальная полоса С из нескольких продольных рядов,
внутренняя полоса В неравной ширины, состоит из
многочисленных косых фрагментов (у всех видов
Blepharocorys в длинной изогнутой полосе В равной
толщины по 4—5 продольных кинет, это не фрагмозо-
на). Только при импрегнации было выявлено важное
отличие родов, и одновременно род Charonina был
очищен от посторонних видов. Поскольку строение
полосы В совпадает с фрагмоном бючлиид, Вольска
(Wolska, 1971) считает этот род наиболее примитив-
ным в семействе.
У Charonina nuda (Hsiung, 1932) нет цилиатуры
на постероне, возможно это Parentodinium — род, не-
известный в год описания вида, или другой род блефа-
рокоритид, или ошибочное описание морфологии.
Ch. equi обитает в колоне лошади, это тип рода Cha-
ronnautes.
Вид Charonina hippopotami Thurston et Grain, 1971
из бегемота импрегнирован, но все же очень плохо
изучен; не выявлена цилиатура вестибулюма, не пока-
зана полоса А вокруг узкого бокового отверстия, ви-
ден лишь пучок ресничек вдали от перистома; массив-
ный вырост с длинными рядами тигмофрагмона изог-
нут вправо над перистомом. Это особый род —
Hippocharon Jankowski gen. п., типовой вид Н. hippo-
potami comb. n.
Из черного и белого носорога в ЮАР описаны
Ch. odontophora Gilchrist et al., 1994; Ch. dicerotis G.
et al., 1994; Ch. tortuosa G. et al., 1994; Ch. tenuis G. et al.,
1994; Ch. tetragona G. et al., 1994; все без импрегнации
и точных данных о перистомальной цилиатуре.
Род Charonnautes Strelkow, 1939
Типовой вид Charon equi Hsiung, 1930 — очень
плохо описанный вид из лошади и кулана; тело тонкое,
вытянутое, сзади 2 пучка ресничек, спереди цилиатура
показана явно неправильно, топография полос и их
структура неизвестны. Паразиты лошади; включались
в состав Charonina, исключены из этого рода Стрелко-
вым (1939), не нашедшем таких форм при многолет-
нем исследовании цилиат семейства эквид.
Род Ochoterenaia Chavarria, 1933
Типовой вид О. appendiculata из лошади в Мек-
сике; изучены при импрегнации. Ранее род считался
синонимом рода Blepharocorys, но отличается по важ-
ным признакам — имеет 2 пучка каудалий и пальце-
видный вырост тела у цитопрокта. Тело плоское,
фронтальный выступ зубцевидный, кортекс рельеф-
ный, вестибулюм отходит вбок. Кинетом не изучался
до работ Вольской (Wolska, 1978b); найдены 5 полос
на антероне — стандартная полоса А по краю воронки,
длинная извитая полоса С из 4 кинет в вестибулюме
(укрепленном дуговыми фибриллами), 5 фрагментов
вентрально и 2 неравные фрагмозоны на апикальном
выступе тела. Сложный кинетом, панциревидный кор-
текс, особые каудалии — признаки валидного рода.
Род ЯааЬепа Wolska, 1967
Типовой вид R. bella из индийского (Elephas
maximus) и африканского Loxodonta africana слонов (в
зоопарке Лодзи). Бочонковидные латерально сплю-
щенные клетки с 2 полосами пектинелл сзади (пекти-
неллы — отдельные фрагменты в полосах, короткие
ряды кинетосом); спереди тело с небольшим дорсаль-
ным выступом и широко открытым перистомом. По
краю воронки типичная зона А и рядом короткая зона
С в том месте, где у дидесмид находится вакуоль с кон-
крециями; на выступе начинается полоса В в виде ши-
рокой спиральной ленты, спускающейся вниз в ворон-
ковидный вестибулюм; в вестибулюме полоса резко
расширяется, состоит в своей нижней половине из
длинных продольных кинет. Вестибулюм укреплен
полосой поперечных фибрилл.
Род РагагааЬепа Wolska, 1968
Типовой вид Р. dentata из индийского слона в
зоопарке. Плоское прямоугольное тело; серия зубцов
панциря сзади; 2 тупых выступа тела спереди; непро-
порционально широкий вестибулюм. Полосы А, С и
внутренняя часть полосы В в вестибулюме, такие же
как у Raabena, но полоса В разорвана на 2 части —
внутреннюю и наружную; последняя представлена не-
большой изогнутой полоской пектинелл. У этих двух
родов сохранен рудимент конвакуоли под кинетами
зоны С.
Род Circodinium Wolska, 1971
Типовой вид Triadinium minimum Gassovsky,
1919 из лошади — аберрантный вид с необычной фор-
мой тела; род отнесен вначале к Ditoxidae, затем к бле-
фарокоритидам. Тело сплющено, почти сферическое
при виде сбоку; перистом очень широкий, аллометри-
чески смещен вниз от апекса при разрастании одной
стороны тела; гигантская вестибулярная воронка на-
правлена вверх и резко изогнута. Сзади у цитопрокта
на узком постероне несколько ресничек, дуговидная
полоска смещена высоко вверх; фактически имеются
2 каудалии. По краю воронки длинная полоса А; поло-
са В разорвана, ее наружная часть далеко удалена от
воронки в виде мелкой дуги на антероне; в воронке
длинная изогнутая полоса с 4 продольными кинетами
без пектинелл. Вид позже найден в кулане и африкан-
ском носороге.
Род Gassovskiella Grain, 1994
Типовой вид Triadinium galea Gassovsky, 1919
из колона лошади. Внешне похожи на предыдущий
вид; тело плоское, шлемовидное, с тупым выступом
ТИП CILIOPHORA. КЛАСС LITOSTOMATEA
607
С'ШДИ, ядро вытянуто; исчез рудимент кинет на посте-
роне, сохранился левый ряд пектинелл; спереди и
справа у края панциря небольшие полоски ресничек. В
перистоме полоса А по краю воронки, с резким укруп-
нением на внутреннем краю; в вестибулюме одна
очень широкая полоса. Видоизменены все 3 реснич-
ные зоны, находимые у примитивных блефарокори-
гид; разрастается весь антерон и сужается постерон.
Нид отмечен также в осле, зебре, кулане, африканском
носороге.
Изучение рода Circodinium привело Вольскую
(Wolska, 1971) к выводу о существовании группы ро-
дов, непосредственно выводимых от дидесмид. У при-
митивной Raabena имеются 2 каудальные зоны кинет;
буккальная полоса единая, не дифференцирована. У
Charonina, Pararaabena и Spirocorys буккальная поло-
са разорвана на массивную основную зону и неболь-
шой фронтальный фрагмент. От этих форм эволюция
идет независимо по 2 направлениям — к Blepharocorys
с одной каудалией и дальнейшей фрагментацией бук-
кальной полосы и к Ochoterenaia (те же признаки + пу-
чок ресничек на выступе тела). Без диагноза был пред-
ложен новый отряд Blepharocorythida.
Род Spirocorys Wolska,
1969
Типовой вид 5. indicus из индийского слона;
род временно (условно) помещен в сем. Blepharocoryt-
hidae. Вытянутые каплевидные скрученные клетки с
узким спиральным отверстием вестибулюма; тело как
бы перекручено в разные стороны в своей верхней и
нижней части. 2 каудальные зоны превращены в не-
равные широкие полосы пектинелл, лежащие в спи-
ральном ряду; у апекса видна длинная спиральная по-
лоса А по всему краю скрученного длинного перисто-
ма, мелкая группа С и крупный наружный фрагмент
полосы С; в воронке вестибулюма полоса фрагментов
неравной толщины, пектинеллы постепенно вытягива-
ются вниз.
Род Triadinium Fiorentini, 1890
Типовой вид Т. caudatum из кишечника лоша-
ди. У Линна (Lynn, 2002) в составе сем. Ditoxidae, но
этот род очень близок к высшим блефарокоритидам и
разделение их в разных отрядах невозможно.
Тело шлемовидное, сплющено, сзади небольшой
вырост с несколькими ресничками (рудиментарная ка-
удалия); вторая каудалия крупная, смещена высоко
вверх по краю тела. Строение в принципе, как у Circo-
dinium, но несколько изменена буккальная цилиатура.
Тело более вытянутое, чем у названного рода, но ши-
рокое отверстие вестибулюма также обращено вниз
вследствие аллометрии одной из сторон тела. Имеется
апикальный ряд (небольшая полоса фрагментов), ру-
димент тигмона (несколько коротких кинет) и единая
спиральная кинета вокруг края перистома; вероятно
нет внутренней буккальной цилиатуры; полоса разной
толщины огибает кольцом весь край перистома и не
продолжается в конический вестибулюм, но крупный
фрагмент на конце полосы может принадлежать к вес-
тибулярной зоне С. Такая форма говорит о радиации,
не линейной эволюции в рамках отряда — у очень
близких форм зона С может быть нетипично массив-
ной или утрачивается. Род Triadinium нельзя помещать
в состав энтодиниоморфид, в основном имеющих
апикальный перистом, который может втягиваться
внутрь тела.
Сем. Paraisotrichidae Da Cunha, 1917
(рис. 321, а)
У Линна (2002) семейство включает Enterophrya,
Paraisotricha и Rhizotricha', первый род кажется нерод-
ственным, это эндемик Южной Америки; следуя авто-
рам Traite (Puytorac, 1994), мы ограничиваем таксон
двумя последними родами из лошади.
Тело вытянутое, с прочным панцирем, продольные
кинеты равномерно покрывают все тело и разграниче-
ны высокими широкими ребрами, на срезе которых
много элементов эргастоплазмы. Вакуоль с минераль-
ными конкрециями лежит под сложной специализиро-
ванной цилиатурой, изученной одновременно и неза-
висимо Вольской и Грайном (Wolska, 1964b; Grain,
1965). Вестибулярное отверстие узкое, субапикальное,
не достигает вершины тела. На его стенках и на вер-
шине несколько обособленных полей вплотную сбли-
женных фрагментов кинет с особо длинными реснич-
ками. Вентральные кинеты и короткие фрагменты
образуют вестибулярный комплекс на вентральной
стороне воронки, их вершина входит в полость по ле-
вой ресничной стенке. У постерона сократимая ва-
куоль и цитопрокт.
Род Rhizotricha Wolska,
1964
Типовой вид Paraisotricha beckeri Hsiung, 1930
по монотипии из лошади, кулана и слона. Панцирь это-
го вида особо прочный, рельефный; 10—12 сомакинет
спирально закручены влево. Вершина воронки почти
достигает апекса; у апекса нет левой полосы ки-
нет.Фронтальное поле кинет редуцировано до узкой
полосы фрагментов.
Род Paraisotricha Fiorentini,
1890
Типовой вид Р. colpoidea по последующему
обозначению, из цекума и колона лошадей, осла, кула-
на, слона и носорога. Апекс закругленный; около
13—50 сомакинет незначительно изогнуты вправо. На
верхней стенке вестибулярного отверстия над конва-
куолью крупное поле длинных фронтальных ресничек,
на левой стенке полоса коротких кинет — продолже-
ние вестибулярного поля; ниже рта простая топогра-
фия кинет, в антесоме 5 обособленных зон цилиатуры.
Долгое время этот род был сборным, ряд видов выде-
лен в новые роды. Валидный вид Р. minuta Hsiung,
1930.
608
ALVEOLATA
Приложение
Род Latteuria Timoshenko et Imai, 1997
Род предложен для 3 новых видов — L. polyfaria
(типовой вид), L. media и L. trifaria из фекалий азиат-
ского и африканского слонов в зоопарках Киева, Мо-
сквы и Варшавы. После сравнения с известными рода-
ми вестибулифер род отнесен к Paraisotrichidae, но по-
скольку цилиатура точно не изучена, предполагалось
помещение рода в Protocaviellidae или выделение в са-
мостоятельное семейство.
Тело грушевидное, с узким апексом, отклоненным
вбок (типичная polar cap), овальным ядром, 2 вакуоля-
ми; нет сужения сзади. Вдоль широкого вестибулюма
полоса ресничек (зона А), кинетом вестибулюма не
изучен; на широком заднем конце тела несколько
длинных разрозненных дуговидных кинет. Найдена
мелкая конвакуоль в апикальном выступе. В зоне А
L. polyfaria зарисованы продольные кинеты, что нети-
пично для блефарокоритид.
Сем. Enterophryidae Hasselmann, 1918
(= Protocaviellidae Grain in Corliss, 1979,
= Hydrochoerellidae Ito et Imai, 2000)
В каталоге Линна в состав Protocaviellidae включе-
ны роды Protocaviella и Hydrochoerella в отряде вести-
булифер; для второго рода недавно выделено новое
сем. Hydrochoerellidae, но здесь эти роды и Enterophrya
рассматриваются вместе.
Обитатели кишечника капибары Hydrochoerus hyd-
rochaeris в Южной Америке; встречаются совместно,
близкородственны, но с резким различием морфоло-
гии. Общее — отсутствие конвакуоли, полная сомати-
ческая цилиатура; нет каудалий и других пучков и по-
лос ресничек вне перистома; перистом щелевидный
или широко открытый, с верхней наружной и внутрен-
ней вестибулярной полосами ресничек.
Род Protocaviella Kopperi, 1937
Типовой вид Paraisotricha acuminata Da Cunha,
1915. Для того же вида предложен род Eriocharon Ito et
Imai, 2000 (E. acuminatus), уходящий в синонимику.
Сам Коппери под названием Р. acuminata (ошибка
определения — нетоним) описал другой вид из мор-
ской свинки Cavia в Финляндии; дано многословное
описание (4 страницы) и 2 примитивных рисунка, на
которых ничего нельзя понять. Второй вид Paraisotric-
ha hydrochaeri Da Cunha, 1915, из того же хозяина не
был включен в состав нового рода, поэтому обозначе-
ние вида в Traite (Puytorac, 1994) как Protocaviella hyd-
rochoeri (Da Cunha, 1915) Kopperi, 1935 неверно.
Настоящая бразильская P. acuminata тщательно
описана Батиссом (Batisse, 1966), но без импрегнации.
Клетки изогнутые, почковидные, не сплющены, с из-
витыми продольными ребрами вдоль соматических
кинет; ядро овальное, вакуоль субтерминальная, на по-
стероне цитопрокт. Широко открытый перистом (от-
верстие вестибулюма) растянуто по оси тела сбоку;
глотка коническая, с опорными фибриллами. Кине-
том — верхняя округлая группа пектинелл и полоса
фрагментов на левой стенке полости, уходящая в глу-
бину вестибулюма от края тела; вдоль правой стенки
тонкая линия ресничек. Вероятно это ряд А и 2 фраг-
мента ряда В.
У Р. hydrochaeri рот смещен вверх, различимы те
же 3 отдела стомокинет; это более примитивная фор-
ма, ближе к блефарокоритидам и к Paraisotricha.
Род Enterophrya Hasselmann, 1918
Типовой вид Е. elongata из морских свинок
Бразилии Cavia арегеа и С. elongata', из первого хозяи-
на описана также Е. piriformis, оба без рисунков, но по
диагнозу Е. piriformis ясно, что это суктория Cyathodi-
nium типа С. cunhai. Типовой вид позже найден в круп-
ных кавиидах — водосвинке Hydrochoerus hydrochae-
ris, фиксированные пробы без импрегнации изучены
Батиссом (Batisse, 1966). Тонкие червеобразные слегка
извитые клетки с несколькими кинетами; одно или не-
сколько ядер и узкий перистом спереди сбоку; у вер-
шины короткий пучок ресничек, на правой стенке и на
дне мелкого вестибулюма полоса фрагментов.
Предлагая новое семейство, Корлисс (Corliss, 1979)
не заметил сем. Enterophryidae Hasselmann, 1918, о ко-
тором также кратко упоминает Бюйссон в монографии
цилиат из млекопитающих. По Бюйссону (Buisson,
1923), «это семейство, близкое к Anoplophryidae, со-
здано Хассельманном для его рода Enterophrya, кото-
рый включает единственных безротых инфузорий, из-
вестных у высших позвоночных»; далее дается диа-
гноз и рисунки рода Enterophrya, у которого вначале
не заметили мелкого бокового рта. Коппери (Kopperi,
1937) вновь приводит это семейство в подотряде Asto-
mata. Поэтому Protocaviellidae Grain — синоним. Коп-
пери нашел типовой вид в морских свинках, леммин-
гах, мышах, крысах, кроликах и ряде других хозяев в
Финляндии, рисует мелкие червеобразные формы без
перистома.
Род Hydrochoerella Da Cunha et Muniz,
1925
Типовой вид H intestinalis по монотипии; пере-
описан Батиссом (пробы из водосвинки). Описывая
виды 4 родов, Батисс не цитирует Коппери, предло-
жившего новый род Protocaviella, и Стрелкова (1939),
исключившего Protocaviella и Hydrochoerella из соста-
ва Paraisotrichidae по отсутствию конкрементной ваку-
оли.
Относительно крупные вытянутые овальные сплю-
щенные клетки с ребрами вдоль ресничных рядов; пе-
ристом широкий, диагональный, субапикальный, над
небольшим ртом — длинная широкая полоса пекти-
нелл (вероятно, зона А); сомакинеты расположены как
у плагиопилид, подходят к перистому и к полосе А над
ним. В коротком вестибулюме узкая полоса кинет;
сложная система фибрилл прикрепляет узкую изогну-
тую глотку к краям тела.
ТИП CILIOPHORA. КЛАСС LITOSTOMATEA
609
Род Anacharon Ito et Imai, 2000
Род предложен для 2 новых видов, A. gracilis (типо-
вой вид) и A. lepturus из цекума капибары. Тело узкое,
вытянутое, с обширным перистомом; сомакинеты не-
многочисленные (7—8), прерваны у постерона; в вес-
тибулюме длинная полоса пектинелл и серия аргиро-
нем у дна полости; узкая короткая полоса ресничек
расположена у вершины вестибулюма.
Род Cunhamunizia Ito et Imai, 2000
Типовой вид С. batissei по монотипии, из цеку-
ма капибары. Тело мелкое, широкое, с 11—13 слегка
извитыми кинетами без перерыва у постерона; над не-
большим перистомом диагональная полоса пектинелл,
огибающая антесому; справа от рта несколько кине-
тосом, в коротком вестибулюме реснички на левой
стенке.
Род Ogimotoa Ito et Imai, 2000
Типовой вид О. trichoradiata из цекума капиба-
ры. Тело почти сферическое, с 14—22 изогнутыми ки-
нетами без перерыва у постерона; перистом глубокий,
открыт в виде изогнутой диагональной щели. По пра-
вому краю ротовой полости узкая полоса пектинелл,
на внутренней правой стенке широкая полоса от вер-
шины вестибулюма до рта.
Род Ogimotopsis Ito et Imai, 2000
Род предложен для 2 новых видов О. campanulata
(типовой вид) и О. pum.Ua из цекума капибары. Тело
каплевидное, широкое, с 16 изогнутыми кинетами; пе-
ристом непропорционально велик, широко открытый
и глубокий; левая стенка полости с полосой кинет,
правая с безресничными аргиронемами.
Род Paracunhamunizia Ito et Imai,
2000
Типовой вид Р. calocoma по монотипии, из це-
кума капибары. Тело вытянутое, расширено в перед-
ней половине, с 12—15 кинетами, сближенными на до-
рсуме и разрозненными по краям тела и вентрально, с
широким ацилоном слева. Перистом небольшой, пра-
вее и выше него группа ресничек, над ним длинная ши-
рокая дуга пектинелл, уходящая далеко на ацилон; в
перистоме короткая дуга пектинелл.
Род Uropogon Ito et Imai, 2000
Типовой вид U. urai по монотипии, из цекума
капибары. Мелкий вид с коротким телом, округлым
спереди и заостренным сзади; 11—16 кинет прерваны
снизу, разной длины; значительная часть тела без ци-
лиатуры (ацилон). Перистом — поперечная трубка,
смещена вниз, с полосой пектинелл слева и группой
кинетосом справа; над перистомом широкая полоса
пектинелл.
Сем. Paraplagiopylidae Jankowski fam. n.
Аберрантный род Paraplagiopyla Thurston et Grain,
1971 не имеет места в системе и приводится в прило-
жении к трихостоматам. Единственный (типовой) вид
Р. kiboko найден в пробах из бегемота Hippopotamus
amphibius в Уганде, изучен при импрегнации. Сходст-
во с Plagiopyla из черного анаэробного ила (в названии
рода) кажущееся, план строения различен.
Тело плоское, расширено в антесоме, обе стороны
безресничные, но импрегнация протарголем выявляет
большое число инфракинет с кинетосомами; все они
подходят с разных сторон к диагональной щели вести-
булюма; ряды полимеризованы, и как обычно у таких
форм видны зоны схождения кинет (секанты) на обеих
сторонах тела. По всей периферии тела идет обособ-
ленный желобок с 10 вплотную сближенными реснич-
ными рядами, в каждом ряду тесно сближены реснич-
ки; полоса не продолжается вглубь вестибулюма; та-
кой органеллы нет у плагиопилид. Вестибулюм
глубокий, с системой опорных фибрилл, вероятно без
цилиатуры. Имеются 2 сократимые вакуоли на разных
уровнях — так, как у ряда бючлиид и блефарокоритид;
нет конкрементной вакуоли. Этот род обычно помеща-
ют в состав Plagiopylidae, но даже если они родствен-
ны, род совершенно не соответствует диагнозу семей-
ства, имеющего мощную вестибулярную цилиатуру
другого типа — передние концы.большинства кинет в
поперечной перистомальной щели.
Сем. Protohalliidae Da Cunha et Muniz,
1927
Название основано на роде Protohallia Da Cunha et
Muniz, 1927 — новое название для Hallia Da Cunha et
Muniz, 1927 (гомоним), предложенного для замены
Rhipidostoma Da Cunha et Muniz, 1925 (гомоним); соот-
ветственно менялось название семейства (Rhipidosto-
matidae, Halliidae, Protohalliidae).
Типовой вид Rhipidostoma uncinata C. et M.,
1925 из капибары в Бразилии; второй вид Protohallia
папа Ito et Imai, 2000.
Вид переописан Батиссом (Batisse, 1966), не решив-
шим вопрос о положении рода в системе цилиат; более
точные данные получили японские авторы (Ito, Imai,
2000а, 2000b). Тип рода — овальные не сплющенные
цилиаты с немногочисленными (14—22) слегка спи-
ральными кинетами; снизу ряды подходят к попереч-
ной ротовой щели, боковые и дорсальные ряды огиба-
ют щель и подходят к ее расширенному левому концу.
Щель ведет в глубокую коническую фибриллярную
глотку, которую Батисс считал настоящей немадесма-
льной корзинкой (nasse = cyrtum); стенка укреплена
толстыми прямыми палочками, не фибриллами. Края
щели с узкими полосами фрагментов кинет; справа
и слева по одной узкой полосе пектинелл, справа так-
же группа кинетосом; выше субапикально ресничное
39 Зпк. №4163
610
ALVEOLATA
кольцо. Нетрудно видеть те же элементы соматиче-
ской и перистомальной цилиатуры, что и у Enterophry-
idae (= Hydrochocrcllidae); род выделен в особое семей-
ство по наличию массивной немадесмальной глоточ-
ной корзинки.
Несколько других родов неясного положения при-
ведены после списка энтодиниоморфид.
Отряд Entodiniomorphida Reichenow
in Doflein et Reichenow, 1929
Отряд включает большую группу родов в основном
с сократимым ресничным антероном, способным к
втягиванию внутрь тела; соматической цилиатуры
обычного типа (продольные ряды) нет, но всегда со-
храняются их рудименты — аргентофильные точки
(аргиросомы) в правильных продольных рядах, впер-
вые выявленные Якобсон (Jacobson, 1931) при импрег-
нации сухим методом Клейна. Деление простое, и ки-
нетосомы медиальной части рядов дают зачаток новой
ротовой цилиатуры. Возможно, стоматогенные кине-
тосомы временно появляются перед делением (по ре-
зультатам изучения энтодиниев в электронном микро-
скопе). Кортекс часто продольно исчерчен, с ребрами
между инфракинетами.
Конкрементной вакуоли нет; сохранена группа
фрагментов (зона С), которая у бючлиид распо-
лагалась над этой органеллой и сохранилась также
у блефарокоритид. Сократимые вакуоли расположе-
ны характерным образом для простомат и баланти-
диев — в линии, одна в антесоме, другая в посте-
соме, каждая с выводной порой. Сзади небольшой
канал (цитопрокт), открывающийся порой наружу (ци-
топиг).
Кортекс прочный, с подстилающим слоем микро-
фибрилл, ограничивающих наружный слой (периплаз-
му, используя литературный термин) от обширного
внутреннего цитоплазменного мешка (фагоплазмы);
можно видеть фибриллы, расходящиеся от глотки на
границе зон и смыкающиеся у цитопрокта. Концы тела
неровные, в складках и бугорках, сзади часто образу-
ются выросты, зубцы, короткие или длинные шипы
панциря; у монопостиид — шипы по краям вести-
булюма.
Рудименты соматической цилиатуры расположены
компактными группами на сократимых (втяжных) уча-
стках панциря или в виде дуговидных полос, к приме-
ру у Gorillophilus и Elephantophihis.
Ротовой ресничный комплекс долгое время счи-
тали зоной мембранелл и группу относили к спиро-
трихам, но классического полихимениума (мембра-
на + полоса поперечных мембранелл с 3 кинетами
в основании каждой) нет. Импрегнация серебром вы-
являет обычно 3 компонента перистомальной цилиа-
туры — зоны А, В и С, такие же как в отряде блефаро-
коритид. Зона С — остаток тигмона, несколько фраг-
ментов на дорсальной стороне под зоной А; эта зона —
широкая полоса тесно сближенных фрагментов, как у
бючлиид типа Alloiozona’, зона В — длинная узкая ду-
говидная извитая полоска, контактирующая с обоими
концами зоны А. Эти зоны легко видеть у энтодини-
ид и циклопостиид, где они однотипные, но нужно
знать общий план строения, чтобы различить их к
примеру у Parentodinium или Monoposthium — раньше
у них рисовали апикальный конус, в беспорядке по-
крытый ресничками. «Дополнительная мелкая зона
мембранелл», к примеру у Diplolophus, — это участок
растянутой зоны В, отделенный выростом панциря.
В основаниях полос А и В — серия вплотную сбли-
женных коротких кинет с компактными кинетосома-
ми в каждой (гаплокинеты). Реснички ряда могут сбли-
жаться в синцилии; основания их можно назвать
пектинеллами, используя старый и почти забытый тер-
мин, применяемый в основном для олиготрих. Плас-
тинки во французской литературе называют «полибра-
хикинеты» — «многочисленные короткие ряды рес-
ничек».
Многие роды имеют опорные пластинки вокруг ве-
стибулюма или под кутикулой — клетчатые полисаха-
ридные пластинки (пластрон); для определения важно
выявить их хлор—цинк—иодом. У форм без видимых
пластинок (Entodinium) электронная микроскопия вы-
являет их зачаток, скопление полисахаридных телец,
связанных с ядром.
На покровах и внутри тела поселяются бактерии;
патогенные грибки приводят к гибели; хищные сукто-
рии (Allantosomatidae) высасывают цитоплазму энто-
диниоморфид.
Питание бактериями, растительными частицами, у
крупных форм также хищное; конъюгация редкая
(изучена у Opisthotrichum janus)-, инцистирования нет.
Виды отряда считаются безвредными и отчасти полез-
ными симбионтами, но есть публикации, не замечен-
ные и никогда не цитируемые, о частом поражении
тканей северного оленя простоматами и энтодиниида-
ми — цилиаты проникают через порезы и расчесы
вглубь ткани, из грунта или при зализывании ран, и
размножаются в тканях, по кровеносным и лимфатиче-
ским сосудам могут разноситься по телу. Поэтому
мнение о нейтральности или пользе кишечных форм
основано на незнании литературы. За рубежом также
описано проникновение бючлиид и изотрих в ткани
хозяев.
Отряд Entodiniomorphida делится на ряд семейств
с учетом наличия, числа и положения каудалий, со-
кратимости перистомальной зоны, наличия пластинок,
по типу перистомальной цилиатуры. Здесь мы в ос-
новном следуем Линну (Lynn, 2002, Интернет), разли-
чая примерно 8 семейств (часть спорные, например
Rhinozetidae, результат излишнего дробления). В спис-
ке Линна нет Pseudoentodiniidae, Monoposthiidae, Ра-
rentodiniidae, Amylovoracidae, нельзя согласиться и с
составом ряда семейств, например с включением
блефарокоритид Triadinium и Gassovskiella в состав
энтодиниоморф.
Некоторые примеры энтодиниоморф приведены на
рис. 323, а—324, б.
Сем. Ophryoscolecidae Stein,
1859
Мешковидные формы с прочным панцирем, в
основном с опорными пластинками кортекса (пластро-
ном), с четким делением тела на фагоплазму и пери-
ТИП CILIOPHORA. КЛАСС LITOSTOMATEA
611
плазму; ротовая цилиатура на сократимых участках
in п ерона, при фиксации весь перистом глубоко погру-
жается, исключая наружные отделы ресничных полос.
Легко различить широкую зону А, узкую извитую лен-
ту (полоса В) и рудимент тигмокинет (зона С под зо-
ной А). Панцирь рельефный, с продольными безрес-
пичными кинетами и ребрами. Много видов с шипами
постерона.
Паразиты жвачных, обычны в коровах, овцах, ко-
зах, в диких руминантах, меньше видов в других хозяе-
вах. В основном по типу пластрона семейство делится
на подсемейства и роды; согласия до сих пор нет, к
примеру ряд родов диплодиниин считают либо само-
стоятельными, либо (как и вначале) подродами одного
рода Diplodinium', неясен статус и валидность родов
Amphacanthus и Eodinium. Род Cunhaia не соответству-
ет плану строения семейства.
Латтеур (Latteиг, 1966) в ревизии семейства разли-
чает подсемейства Entodiniinae, Diplodiniinae, Epidinii-
nae, Opisthotrichinae, Ophryoscolecinae, Caloscolecinae;
они приняты в Traite (Puytorac, 1994) и ранг первого
подсемейства повышен до сем. Entodiniidae (с одной
ресничной зоной, без пластрона).
Род Amphacanthus Dogiel,
1926
Типовой вид A. ovumrajae', название рода как
гомоним заменено на Campylodinium, эта замена при-
нята Аэшт, но поскольку тезисы конференций не при-
знаются номенклатурным кодексом научными публи-
кациями, название предлагается вновь — Campylodini-
um Jankowski nom. п., типовой вид С. ovumrajae
(Dogiel, 1926 in Amphacanthus) comb. n.
Возможно, замена не нужна, поскольку род Догеля
не признается — классификация родов идет в основ-
ном по типу пластинок, а не форме тела и шипов.
A. ovumrajae — мелкие симметричные бочонковидные
клетки с одной апикальной ресничной зоной, без мел-
кой боковой; по краям перистома мелкие острые
шипы, края постерона с закрученными более длинны-
ми шипами, расходятся далеко в стороны. Края сплю-
щенного тела имеют вид очень широких светлых боко-
вых килей, ограничивающих небольшой участок тела с
пищевыми вакуолями (фагоплазму). Один вид в верб-
люде Camelus dromedarius с несколькими внутривидо-
выми формами.
Род Anoplodinium Dogiel,
1927
Типовой вид не фиксирован; из включен-
ных Догелем видов можно указать как тип рода Л. psit-
taceum Dogiel, 1927. Род признавали в основном в ста-
рой литературе как род или подрод рода Diplodinium',
имеются две «зоны мембранелл» примерно на рав-
ной высоте, обе сократимые; нет скелетной пластин-
ки (пластрона); вид с 2 сократимыми вакуолями.
Как род идентичен с Diplodinium, как подрод не всеми
принят, может быть идентичен с подродом Diplodi-
nium s. str.
Авторитетный специалист Нуаро-Тимоте (Noi-
rot-Timothee, 1960) считает подрод валидным. Приме-
ры видов — D. (A.) denticulatum из овец и коров,
D. (A), komareki из оленей.
Род Caloscolex Dogiel, 1926
С. camelinus (типовой вид), С. cuspidatus из одно-
горбых верблюдов Camelus dromedarius. 2 ресничные
зоны (воспользуемся далее ' литературным терми-
ном «цилиофор»), относительно крупная адораль-
ная зона (вздутый антерон); дорсальная зона обычно
мелкая, у данного рода в виде длинной полосы во-
круг верхней трети тела, образует воротничок вокруг
массивного апекса с многочисленными фибриллами
глотки; 7 вакуолей в поперечном ряду; оперкулюма
нет, ядро палочковидное; 3 крупные пластинки обра-
зуют веерообразный сетчатый пластрон, особо массив-
ный апикально.
Род Cunhaia Hassel man n, 1925
Типовой вид С. curvata; род неясного положе-
ния, не включенный ни в одно семейство (Puytorac,
1994); в каталоге Корниловой (2004) в составе офри-
осколецид. Паразиты морских свинок Cavia арегеа
в Бразилии. Мелкие (60—80 мкм) латерально сплю-
щенные изогнутые клетки, заостренные сзади, с крюч-
ком; перистом сократимый (втяжной), со спиралью
пектинелл; нет каудалий и пучков на уровне рта, нет
пластрона; ресничная полоса с 2 зонами, адоральной
и дорсальной. По автору рода, он близок к Entodinium,
но ресничная полоса Cunhaia продолжается вниз
вдоль края тела. Род иногда неправильно датируют
1924 г. Род включался вначале в Ophryoscolecidae
рядом с Entodinium, но уже тогда семейство было сбор-
ным; сейчас оно очищено от посторонних форм, кро-
ме Cunhaia. Находка настоящих (не конвергент-
ных) энтодиниид в Cavia сомнительна, родство с Ento-
dinium не очевидно.
Род Diplodinium Schuberg,
1888
Типовой вид Entodinium dentatum Stein, 1858.
2 цилиофора на одном уровне (адоральный и дорсаль-
ный), 2 вакуоли, имеется оперкулюм (зоны разделе-
ны выступом панциря), ядро изогнутое. Постерон
по краям от цитопрокта часто с зубцами или шипами;
один длинный шип у D. moucheti. Эти детали важны на
уровне видов и для различения «форм» — нетипичных
особей и популяций, без придания им видового стату-
са. Согласия нет, у одних авторов это небольшой род без
подродов, у других Diplodinium sensu lato включает
кроме типового подроды Eudiplodinium, Ostracodini-
ит, Metadinium, Enoploplastron, Elytroplastron, Polyp-
lastron.
В сумме большое число видов, многие с форма-
ми — D. anisacanthum Da Cunha, 1914 (6 форм); D. mi-
nor Dogiel, 1925; D. elongatumD., 1927; D. babici Wert-
612
ALVEOLATA
Рис. 322, а. Эндемики Австралии (Isotrichida?).
Bandia smalesae (A—By Bitricha oblata (Г, Д, 3); Bitricha tasmaniensis (E. Ж)-, Bandia dehorityi (И—M); Bandia cribbi (H—П). (По: Cameron et al., 2000 (Г— 3);
Cameron, O'Donoghue, 2002 (A—В, И—П)).
Fig. 322, a. Endemics of Australia (Isotrichida?).
heim, 1933; D. psittaceum D., 1927; D. komareki Kubiko-
va, 1935; D. giraffae Noirot-Timothee, 1963; D. archon
Latteur, 1966; D. zambiense Imai et al., 1992; D. lochinva-
rense Imai et al., 1992; D. africanum Imai, 1988; D. sinha-
licum Imai, 1986; D. mahidoli Imai et Ogimoto, 1983;
D. italicum Moriggi, 1941 и др.
По Латтеуру (Latteur, 1966), род Diplodinium может
быть не монофилетичным — одна линия перехода про-
слежена в козах в Пакистане, вторая в антилопах
Африки; независимо появляется боковая борозда
или тонкая перемычка, разделяющая единую реснич-
ную зону на две.
Род Diploplastron Kofoid et Mac Lennan,
1932
Типовой вид Diplodinium affineDogieletFedoro-
wa, 1925; этот род не всегда считается валидным ро-
дом или подродом. 2 неравных цилиофора на одном
уровне, 2 вакуоли, 2 длинных пластрона под правой
стороной тела (могут смыкаться снизу), вытянутое
ядро; нет зубцов и шипов панциря.
Род Elytroplastron Kofoid et Mac Lennan,
1932
Типовой вид Diplodinium (Polyplastron) bubali
Dogiel, 1928 — два верхних цилиофора; 2 пласт-
рона под правой стороной, одна мелкая пластинка под
вентральным краем и одна длинная пластинка под
левой стороной; фибриллы под обеими сторонами;
4 вакуоли в линии вдоль края тела. Тип рода чаще все-
го в быках и зебу, Е. hegneri (Becker et Talbot, 1927)
в корове.
Род Enoploplastron Kofoid et Mac Lennan,
1932
Diplodinium triloricatum Dogiel, 1925 (типовой вид),
E. confluens (Dogiel, 1925), E. garstangi Van Hoven, 1975.
Как Ostracodinium, но имеет 1 широкую и 2 узкие пла-
стинки по обе стороны от широкой, всего 3 — две
латерально справа и 1 у вентрального края тела; сзади
они сливаются и образуют полуконус вокруг глот-
ки. 2 вакуоли у относительно короткого ядра. Пери-
стом, как у Diplodinium-, это отделяет род от Epidinium,
тоже со сходным пластроном, но имеющим зоны на
разном уровне.
Род Entodinium Stein, 1859
По Аэшт, типовой вид Е. bursa по обозначению
Бюйссона (Buisson, 1923); по моему каталогу, род
предложен дважды — в 1858 и 1859 г.; Бюйссон не
обозначал типовой вид.
Клетки обычно мелкие; тело сплющено латераль-
но, имеется только одна роговая зона (цилиофор) без
оперкулюма, только одна вакуоль, нет пластрона; ядро
овальное или вытянутое. У этого рода в электронном
микроскопе обнаружены зачатки пластрона — скопле-
ние полисахаридных элементов у ядра. Хорошо изуче-
но строение, кинетом, ультраструктура, морфогенез
ТИП CILIOPHORA. КЛАСС LITOSTOMATEA
613
Рис. 322, б. Reikostomatida. (По: Cameron et al., 2001).
Macropodinium spinosus (А, Д); M. bicolor (Б, Ж); M. tricresta (В, Г, E); M. marai (3).
Fig. 322, 6. Reikostomatida.
при делении (образование 2 зачатков цилиофора неза-
висимой от перистома группой кинетосом, позже они
сливаются), виды культивируются и служат объектом
биохимических анализов. Очень крупный род с не-
сколькими десятками видов; полный список видов у
Корниловой (2004); примеры видов, предложенных в
последние годы — Е. imaii Gocmen, 2001; Е. oektemae
(iocmen et al., 2001; E. monuo Guirong et al., 2000; E. dogi-
eli Kornilova et Shitova, 1997; E. williamsi Oktem et Gocmen,
1996; E. semahatae Oktem et al., 1996; E. basoglui Oktem,
Gocmen, 1996; E. okoppensis Ito et Imai, 1990; E. ovibos
Dehority, 1985; E.javanicum Imai, 1985; E. carinatum Kle-
ynhans, 1982; E. tsunodai Imai, 1981; E. ogimotoi Imai,
1981; E.fujitai Imai, 1981; E. bubalum Imai, 1981; E. tri-
tmgulum Dehority, 1979; E. ciculum Dehority, 1979 и др.
Много «форм», особенно у шипоносных видов.
11остерон с шипами, иногда крупными, у Е. pisciculum,
l ostratum, Е. indicum (3 массивных шипа), Е. cau-
datum, Е. ovoidonucleatum, Е. laterospinum, Е. ciculum,
Е. spinonucleatum и др. Можно понять выделение под-
рода Amphacanthus (выше), имеющего также и шипы
апгсрона, хотя он не принят. Космополитный род с
широко распространенными и локальными видами в
домашних и диких жвачных; в грызунах — мало-
изученные виды Е. paludicolae Kopperi, 1937 (из водя-
ной полевки), Е. lemmi Kopperi, 1937 (из лемминга).
Род Eodinium Kofoid et Mac Lennan,
1932
Типовой вид E. lobatum. Вероятно то же, что
Anoplodinium Dogiel, 1927 (частично). 2 цилиофора на
равном уровне, крупный и мелкий; 2 вакуоли, палоч-
ковидное ядро; между зонами вырост (оперкулюм);
нет пластрона. Примеры видов — Е. posterovesicula-
tum (Dogiel, 1927); Е. bilobosum (D., 1927); E. polygona-
le (D., 1925); E. rectangulatum Kofoid et Mac Lennan,
1932; E. bispinosum Kleynhans et Van Hoven, 1976.
Род Epidinium Crawley, 1923
Типовой вид Diplodinium ecaudatum Fiorentini,
1889. 2 ресничные зоны, мелкая дорсальная чуть ниже
основной; 2 вакуоли, палочковидное ядро, нет оперку-
614
ALVEOLATA
Рис. 323, a. Entodiniomorphida.
Entodinium ovibos (Л); Diplodinium (Ostracodinium) minorum (Б, B); D. (O.) esalqum (Г); D. (Eudiplodinium) banksi (Д); D. (O'), brazili (£); Eudiplodinium medium
(Ж); E. affine (3); Ostracodinium gracile (И); Eudiplodinium maggii costatum (A); Diplodinium denlatum (JT); Eudiplodinium neglectum bovis (M); Polyplastron mul-
tivesiculatum (H); Ostracodinium (EnopIoplastron) triloricatum (O); Rhinozeta multiplatus (IT); Rh. cristata (P); Rh. rhinozeta (С). (По: Dehority, 1975 (Б, B), 1979
(Г, £), 1985 (А, Д); Noirot-Timothee, 1960 (Б—O'); Van Hoven et al., 1988 (П—C)).
Fig. 323, a. Entodiniomorphida.
люма; 3 пластрона расположены на одной (вентраль-
ной) стороне, снизу сливаются, занимают значитель-
ную часть тела. При сравнении видов для пластинок
используют термины (справа налево) примитива, стер-
нум и парастернум. Примеры видов — Е. bengalensis
(Ghosh, 1922); Е. spinosum (Ghosh, 1922); Е. lobatum
Dogiel, 1928; E. eberleini Kofoid et Mac Lennan, 1932;
E. camerounense Noirot-Timothee, 1963; E. dactylodon-
ta Latteur, 1966; E. lunatus Van Hoven, 1975; E. graini
Gocmen, 2000.
Rumidinium Jankowski
subgen. n.
Типовой вид Epidinium eberleini (Da Cunha,
1914). Вид с мощным развитием пластинок панци-
ря, одна из которых заходит в каудальный шип (вы-
рост панциря). Типичные Epidinium имеют тройную
пластинку вдоль всего тела вне шипов; шипы эн-
тодиниоморфид всегда лишены опорных элементов,
поэтому данный вид, если это постоянный при-
знак, можно выделить в новый подрод в составе Epi-
dinium.
Род Epiplastron Kofoid et Mac Lennan,
1933
Типовой вид E. africanum Dogiel, 1927 (= Oph-
ryoscolex ecaudatus africanus Dogiel, 1925), также
E. spinosum (Dogiel, 1932); удлиненные изогнутые
клетки; дорсальная зона смещена вниз от апекса; удли-
ненное ядро, 2 вакуоли, 5 пластронов (слитых снизу) с
вторичными пластинками окружают фибриллярную
глотку, как у Epidinium. Симбионты антилоп.
ТИП CILIOPHORA. КЛАСС LITOSTOMATEA
615
Рис. 323, б. Entodiniomorphida.
Elephantophilus zeta (А, E); Monoposthium acanthum (В, Г); Parentodinium ostrea (Д); P. africanum (E, Ж, 3); Arachnodinium noveni (И); Phalodinium digitalis (X);
Triplumaria longinucleata (O); Telamodinium onyx (IT); Troglodytella abrassarti (P); Cochliatoxum periachtum (С, T); панцирь Cycloposthiutn (JT); Ostracodinium
(M); Eudiplodinium (H). (По: Kofoid, 1935 (A, Jacobson, 1931 (JI—H); Dehority, 1986 (O—P); Senaud, Grain, 1972 (С, T); Van Hoven et al., 1987 (И, K); Thurs-
ton, Noirot-Timothee, 1973 (B—3)).
Fig. 323, 6. Entodiniomorphida. Carapace of Cycloposthium (JT).
Род Eremoplastron Kofoid et Mac Lennan,
1932
Типовой вид Diplodinium rostratum Fiorentini,
1889 из оленей, с массивным шипом сзади; ресничные
зоны на разном уровне; пластинка одна, небольшая,
резко сужается книзу; 2 вакуоли, почковидное ядро.
Часть авторов не признает этот таксон как подрод или
род, в ревизии энтодиниид Любинского (Lubinsky,
1957) он принят. Примеры видов — Е. rotundum Kofoid
et Mac Lennan, 1932; E. magnodentatum К et M., 1932;
E. brevispinum K. et M., 1932; E. neglectum (Dogiel,
1925 — Eudiplodinium neglectum) и его многочислен-
ные формы, позже выделенные в самостоятельные
виды, принятые не всеми — Е. spectabile, Е. insigne,
Е. giganteum, Е. tarandi, Е. impalae (= Diplodinium ellip-
ticum Gassovsky, 1925); E. bovis', E. monolobum', E. dilo-
bunv, E. rugosum.
Род Eudiplodinium Dogiel,
1927
Типовой вид Diplodinium maggii Fiorentini,
1889. 2 цилиофора на одном уровне (отличие от пре-
дыдущего рода), 2 вакуоли, почковидное ядро у
D. maggii, одна пластинка с резким сужением книзу,
имеется выступ апекса (оперкулюм); включаются
виды с тонкой пластинкой (тип рода) и с массивной
раздвоенной (Е. sablei); у Е. banksi вырезка почти
до основания пластрона, фактически имеются 2 плас-
тинки. Виды’ с шипами встречаются как исключение.
В перистоме четко выявлены 3 элемента в каждой
из монокинет полосы — снаружи 2 мелкие реснички,
в центре длинная синцилия с острой вершиной (сли-
тые реснички), на внутренней стороне (на краю вес-
тибулюма) широкая короткая синцилия; нет связи обе-
их полос, апикальной и дорзальной (имеющей другое
616
ALVEOLATA
Рис. 324, a. Entodiniomorphida.
Ditoxum gravinucleatum (Л); D. funinucleatum (5); Spirodinium equi (В, Г)', Triplumaria hamertoni (Д, Ж, 3); T. selenica (£, И—Л). (По:
Hsiung, 1935 (А, В, Г); Dehority, 1986 (5); Hoare, 1937 (Д Ж, 3); Latteur et al., 1970 (£, И, К, JI)).
Fig. 324, a. Entodiniomorphida.
строение). Примеры видов — E. confusion Noirot-
Timothee, 1963; E. sablei VanHoven et al., 1979; E. bubalus
Dehority, 1979; E. microlateralisNan Hoven, 1983; E. ke-
nyensis Imai, 1988; E. dehorityi Gocmen et al., 2001.
Род Metadinium Awerinzew et Mutafowa,
1914
Типовой вид M. medium. Как Eudiplodinium,
но с 2 крупными пластинками. 2 цилиофора (мел-
кий чуть ниже крупного), 2 вакуоли, вытянутое ядро
сложной формы, 2 вытянутые пластинки с широки-
ми вершинами (слиты в нижней половине у М. rotun-
datum). Род принят как валидный. Примеры видов —
М. carinatum Ghosh, 1922; М. quadratum G., 1922;
М. tauricum (Dogiel et Fedorova, 1925); M.ypsilon
(D., 1925); M. magnum (D., 1925); M. fissilaminatum
(D., 1932); M. rotundatum Kofoid et Christenson,
1934; M.zavattarii (Moriggi, 1940); M. caudatum Lu-
binsky, 1963;M. banksi (Dehority, 1985); M. ossiculiimai
et al., 1992.
Род Ophryoscolex Stein,
1859
Типовой вид О. inermis; род предложен дваж-
ды как новый, с 2 видами. 2 цилиофора; дорсальная
зона очень длинная и полукольцом охватывает тело
намного ниже апикальной зоны; вакуолей больше
двух (9 у О. caudatus в 2 поперечных рядах); нет опер-
кулюма; палочковидное ядро. Пластрон — 3 пластин-
ки на венте; сзади сложная система шипов, иногда раз-
двоенных; мелкие шипы окружают вытянутые тер-
минальные или один особо длинный осевой шип; в
культурах шипы не столь выражены. Примеры ви-
дов — О. purkynjei Stein, 1859; О. caudatus Eberlein,
1895; О. eberleini Ghosh, 1922; О. buissoni Dogiel, 1927;
О. bicinctusP1927; О. bicoronatusP., 1927; О. quadri-
coronatus D., 1927; O. spinosus Kofoid et Mac Lennan,
1933; O. monoacanthus Femandez-Galiano et Campos,
1992.
ТИП CILIOPHORA. КЛАСС LITOSTOMATEA
617
Рис. 324, б. Entodiniomorphida. (По: Ito, Imai, 2000).
Cycloposthium cristatum (А, Б, В, JT)\ C. elongatum (Г—Е, M, H); C. incurvum (Ж—K).
Fig. 324, 6. Entodiniomorphida.
Род Opisthotrichum Buisson,
1923
Типовой вид О. thomasi (современное название
Opisthotrichum janus = Ophryoscolex janus Dogiel, 1923)
в антилопах ряда видов и родов в Африке. Напомина-
ют Epidinium, но дорсальная зона крупная и смещена
далеко вниз к экватору и даже ниже; одна крупная пла-
стинка панциря; 2 вакуоли в нижней половине тела;
ядро компактное. Редкий пример монотипического
рода у офриосколецид.
Род Ostracodinium Dogiel,
1927
Типовой вид Diplodinium mammosum Railliet,
1890 по выбору последующих авторов, но это синоним
валидного вида D. dentatum Fiorentini, 1889, поэтому
правильно О. dentatum. По Корниловой (2004), ти-
повой вид — Ostracodinium mammosum (= Diplodinium
fiorentinii Awerinzew et Mutafowa, 1914, = O. dentatum
Dogiel, 1927); в современной литературе Ostracodinium
считается подродом Diplodinium или родом. 2 рес-
ничные зоны примерно на одном уровне, 2 вакуоли,
длинное ядро; одна массивная пластинка панциря,
но она может быть сверху или до половины раздвое-
на у части видов, и такие виды тоже включают в состав
Ostracodinium (примеры — О. tauricum, О. ypsilon,
О. magnum, О. caudatum, О. rotundatum, О. minorum).
Крупный род; примеры видов — О. obtusum Dogiel
et Fedorova, 1925; О. gracile D., 1925; О. crassum D.,
1927; O. uninucleatum Hsiung, 1932; O. trivesiculatum
Kofoid et Mac Lennan, 1932; O. quadrivesiculatum K.
etM., 1932; O. venustum K. et M., 1932; O. clipeolum K.
et M., 1932; O. rugoloricatum K. et M., 1932; O. mysorei
Kofoid et Christenson, 1934; O. gauri K. et C., 1934;
O. minorum Dehority, 1975; O. brazili D., 1979; O. esal-
qum D., 1979; O. nucleolobum D., 1979; O. tieteD., 1979;
O. bohor Van Hoven, 1983; O. iwawoi Imai, 1989;
O. munham Ito et Imai, 1990; O. damaliscus Ito et aL,
1997.
618
ALVEOLATA
Род, Polyplastron Dogiel, 1927
Типовой вид Diplodinium multivesiculatum Dogi-
el et Fedorowa, 1925; как и все таксоны Догеля, предло-
жен как подрод (в составе Diplodinium). 2 ресничные
апикальные зоны, примерно на одном уровне, 5—9 ва-
куолей, крупный оперкулюм, палочковидное ядро,
2 крупные пластинки панциря справа и 3 тонкие слева
у разных сторон тела. Спереди скопление глюциновых
телец, из-за которых пластинки могут казаться соеди-
ненными у вершины. Вид хорошо растет в культурах
на бактериях и клетчатке, но также активно поедает
виды Epidinium или Eudiplodinium, вид всеядный. При-
меры видов — Р. monoscutum (Dogiel, 1927); Р. fenest-
ration (D., 1927); Р. californiense Bush et Kofoid, 1948;
P. arcticum Lubinsky, 1958; P. bengalensis Chowdhury et
Chatterjee, 1960; P. alaskum Dehority, 1974; P. saigae
Kornilova et Shitova, 1997.
Сем. Rhinozetidae Van Hoven, Gilchrist
et Hamilton-Attwell, 1988
Включает только один род из цекума черных (Dice-
ros bicornis) и белых носорогов (Ceratotherium simurn)
в ЮАР — Rhinozeta с типовым видом Rh. rhinozeta.
Вытянутые сплющенные клетки с 4 маргиналиями,
3 мелкими вентрально и 1 дорсально снизу; спереди
сократимый конус, несущий реснички на поверхности
или окруженный ими (топография не изучена); глотки
нет; трофоплазма внутри толстого кортекса. Крупная
цельная пластинка кортекса сужается вниз, с типич-
ным сетчатым строением; панцирь местами склад-
чатый, особенно снизу. В каждом виде хозяина оби-
тают особи типового вида определенного размера (в
среднем 86 и 124 мкм), но кроме этого других разли-
чий нет.
Кроме R. rhinozeta в этих хозяевах одновременно
найдены новые виды R. addoensis (при виде сбоку 3+2
маргиналии, панцирь с продольными складками),
R. cristata (пластинка сбоку, с глубокими вырезками
края), R. multiplatus (крупные ребра вдоль тела), R. uni-
laminatus (пластинка под всей левой стороной), R. tri-
ciliata (2+1 маргиналия) и R. caecalis (3 + 1); позже
добавлен вид R. pedale Van Hoven, Gilchrist et Stenson,
1998. Итак, встречаются комбинации 2/1, 3/1 и 3/2 мар-
гиналии. К сожалению, рисунки очень неаккуратные,
неясно, пучки это или полосы, что важно для синони-
мии; не изучен перистом. Особи этого рода похожи на
Megadinium (3 + 2, со сходной пластиной) с маргина-
лиями в виде прямых полосок. Если маргиналии разно-
го типа, достаточно ли это для ранга семейства? Если
одинаковые, род Rhinozeta невалиден. Чем отличается
Rhinozeta от циклопостиид Triplumaria, Tricaudalia,
Prototapirellal
Сем. Telamodiniidae Latteur et Dufey,
1967
3 монотипических рода, описанные очень кратко, с
одним рисунком по каждому виду; имеются маргина-
лии (3 + 2 у всех родов) с прямыми или дуговидными
пластинками в основании; цитоскелет разного типа, у
Telamodinium — кольцо или дуга вокруг перистома,
у других родов вероятно крупная боковая пластинка;
ротовая цилиатура не изучена. Семейство приводится
условно, до повторного изучения этих родов.
Род Megadinium Latteur et Dufey,
1967
Типовой вид М. aethiopicum', диагноз очень
краткий, хозяин и место сбора этого и двух следующих
родов не указаны; для Telamodinium опух Грайн (Grain,
1994) указывает бородавочника Phacochoerus aethiopi-
cus в Заире. Крупные клетки (до 200 мкм); тело вытя-
нутое, сужается книзу с широким циклопостом (новый
термин для каудальной пластинки, характерной для
циклопостиид и монопостиид). Ротовая зона не изуче-
на, на небрежном рисунке показаны 2 ресничных
ряда — дуговой и прямой. Маргиналии в виде плас-
тинок (не пучков), огибают края тела (формула 3 + 2—
3 пластинки на стороне с ядром, 2 на противополож-
ной). Ядро длинное, извитое; в периплазме 2+2 вакуо-
ли. Показаны контуры одной крупной пластинки, но в
тексте пишется о 2 пластинках, на левой и правой сто-
ронах; они сходятся под углом.
Род Teratodinium Latteur et Dufey,
1967
Типовой вид Т. sphaerodom, хозяин и место сбо-
ра не указаны, вероятно совпадают с предыдущим ро-
дом. Размеры до 208 мкм; перистом не изучен, показа-
ны контуры 2 ресничных полос; ядро длинное; по кра-
ям тела 2+2 вакуоли; пластрон не показан; имеются
3 пластинки, длинная широкая глубоко под дорсаль-
ным краем, две другие соответственно под всей правой
и левой сторонами тела, не контактируют. Это напо-
минает панцирь Cycloposthium и Triplumaria. Маргина-
лии в виде длинных дуг, огибающих края тела (3 + 2).
Род Telamodinium Latteur et Dufey, 1967
Типовой вид Т. onyx', хозяин не назван, вероят-
но в колоне африканского бородавочника Phacochoe-
rus aethiopicus', позже найдены в носороге в ЮАР. Ве-
ретеновидные узкие клетки (150 мкм) с острым посте-
роном; ядро неравной толщины, длинное; около
12 вакуолей лежат парами под маргиналиями; марги-
налии (3 + 2) в виде длинных дуг, огибающих края
тела. Панцирь несколько схож с Troglodytella, но не та-
кой массивный; клетчатая пластинка огибает сужен-
ный и вытянутый антерон и продолжается вниз одним
узким выступом.
Этот род очень отличается от двух предыдущих, но
все они выделены в новое подсем. Telamodinae (sic) в
новом сем. Spirodinidae Latteur et Dufey, 1967, хотя оно
уже было предложено Стрелковым (1939). По Грайну
(Grain, 1994), род Telamodinium можно поместить в Ро-
lydiniellidae (но он имеет сократимый цилиофор), и
род имеет также признаки Troglodytellidae.
ТИП CILIOPHORA. КЛАСС LITOSTOMATEA
619
Сем. Polydiniellidae Corliss, 1960
Замещающее название для Polydiniinae Kofoid,
1935; у Линна (Lynn, 2002) включает также Pterodini-
ит. Крупные вытянутые клетки, слегка сплющенные;
цилиофор несократимый, апикальный. Соматическая
цилиатура — маргиналии с длинными полосами кине-
тосом в основании, огибают края тела и постерон.
Многочисленные вакуоли в поперечных рядах между
маргиналиями. Имеются пластинки панциря. Симби-
онты хоботных.
Род Polydinium Kofoid, 1935
Типовой вид Polydinium mysoreum из индийско-
го слона; название рода — гомоним, заменено на Poly-
diniella Corliss, 1960. Встречаются совместно с близ-
ким родом Elephantophilus', мельче последнего (200—
250 мкм) и имеют меньше пластинок и «мембранелл»,
при виде сбоку 4 + 3; у расы из ЮАР это число совпа-
дает. В остальном признаки двух родов сходные, но у
полидиниев вытянутое ядро, не извитое, и имеется ши-
рокая длинная пластинка панциря, расширенная спе-
реди; правее и левее ее такие же пластинки, они соеди-
нены фибриллами у вершины и окружают глоточную
корзинку. Степень развития пластрона отличает этот
род от Elephantophilus, имеющего рудимент пластро-
на. Ротовая ресничная полоса незамкнутая, слегка спи-
ральная, огибает рот и спускается в вестибулюм. На
постероне в зоне экскреторной вакуоли небольшая по-
лоска щетинок.
Род Elephantophilus Kofoid, 1935
Типовой вид Е. zeta из индийского слона Elep-
has maximus. Крупный вид (250—290 мкм), способен
заглатывать большие куски растений. Тело вытянутое,
у постерона, по данным разных авторов, полоска мел-
ких щетинок (в Индии) или нормальных длинных рес-
ничек (у африканской расы); длинные полосы «мемб-
ранелл» (пектинелл) по спирали огибают все тело; пе-
ристом с узкой длинной глоткой без ресничек.
Вентрально видны 4 + 4 полосы маргиналий у индий-
ских форм, 4+5 полос у рас из африканского слона
Loxodonta africana в ЮАР и Заире. Апикальная полоса
пектинелл почти замкнутая, овальная, огибает узкую
ротовую щель; ядро Z-образное. Зарисована одна плас-
тинка вдоль глотки — неясно, профиль пластинки или
тонкий рудимент. У африканской расы вида показана
крупная гантелевидная сетчатая пластинка; идентич-
ность вида из обоих хозяев не доказана.
Род Thoracodinium Latteur, 1958
Типовой вид Th. vorax из Elephas indicus
(= Е. maximus) в бельгийском зоопарке. Очень круп-
ный вид (220-—565 мкм); кортекс с тонкой исчерчен-
ностью; имеется не меньше 6 полос маргиналий (4 + 4
при виде с вента); пластинки ограничены валиками,
несут густые реснички, не мембраиеллы, огибают все
тело по спирали, снизу непарная дуга. Имеется 100—
200 мелких сократимых вакуолей по всему кортексу;
ядро Z-образное. Цитоскелет — 3 узкие относительно
короткие пластинки вокруг глотки, одна у правой сто-
роны тела, 2 слева, их вершины соединены. Питание
всеядное — куски растений, другие инфузории, вклю-
чая крупных Polydinium mysoreum, которые заглатыва-
ются целиком. Как и виды 2 предыдущих родов, были
найдены также в Loxodonta africana (ЮАР и Заир)
(Eloff, Van Hoven, 1980); рисунок показывает другой
тип пластинок и их соединения, но они должным обра-
зом не изучены; с вентральной стороны видны 3 +
4 пластинки.
Род Pterodinium Latteur et Dartevelle,
1971
Типовой вид Р. microlithovorax; как гомоним,
название рода заменено на Pterodiniella Aescht, 2001
без формального переноса вида, необходимого в таких
случаях — Pterodiniella microlithovorax. Паразиты ин-
дийского слона Elephas maximus и Loxodonta africana в
ЮАР и Заире; тело крупное, широкое, с утолщенной
периплазмой; соматическая цилиатура по сравнению с
предыдущими родами упрощенная — 2 длинные сбли-
женные дуговидные полосы ресничек на дорсальной
стороне и 2 дуги вентрально, удаленные к концам тела.
Ядро вытынутое, тонкое; многочисленные вакуоли
рассеяны по кортексу. Строение перистома не изуче-
но. Этот род наиболее примитивен в семействе, число
маргиналий (2 + 2) близко к формуле циклопостиид
(2 + 1), ряды не полимеризованы.
Сем. Troglodytellidae Corliss, 1979
2 рода с необычным для энтодиниоморф типом
панциря — вершина боковой пластинки у энтодиниид
часто расширена; эта тенденция приводит к ее непро-
порциональному разрастанию, и в итоге она покрыва-
ет весь антерон вплоть до края перистома. Соматиче-
ская цилиатура — длинные дуговидные маргиналии,
огибающие края тела, и особо удлиненная полоса у по-
стерона. Паразиты приматов (гиббоны, сиаманги,
шимпанзе и гориллы), нет в макаках (только баланти-
дии) и в других обезьянах.
Род Troglodytella Brumpt et Joyeux, 1912
Типовой вид Т. abrassarti, также Т. gorillae Rei-
chenow, 1971, Т. gabonensis Imai, Ikeda, Collet et Bon-
homme, 1991. Первый вид впервые обнаружен в кале и
кишечнике шимпанзе в Конго; размеры 145—260 мкм,
тело широко'е, закруглено у вершины и на постероне;
ядро в виде тонкой длинной извитой ленты. Реснички
в 2 маргиналиях справа (где ядро) и 1 слева; верхняя
дуга почти кольцевая, огибает антесому, ниже 2 более
короткие дуги, и у постерона вновь полукольцевая по-
лоса ресничек; постерон широкий, с неровным волнис-
тым краем; здесь нет цитопрокта, он смещен высоко
вверх по левому краю тела; вакуоли в рядах вдоль мар-
620
ALVEOLATA
гиналий. Панцирь с боковыми пластинами и шлемо-
видной апикальной частью покрывает всю антесому.
Перистомальная цилиатура методом импрегнации не
изучена.
В шимпанзе Камеруна обнаружен «вариетет» Т. ab-
rassarti var. acuminata Reichenow, 1917, с заостренным
коническим постероном, и открыт новый вид Т. goril-
las R., 1917, с более короткой верхней и левой марги-
налиями. Этот вид заново изучен по материалу из зоо-
парка Японии, где открыт также вид Т. gabonensis с
другой формой панциря и с другим орнаментом кор-
текса; у этого вида верхняя маргиналия почти замкну-
тая, панцирь меньше, чем у остальных видов.
Род Gorillophilus Imai, Ikeda, Collet
et Bonhomme, 1971
Типовой вид G. thoracatus из гориллы; очень
близок к Т. gabonensis, но имеет 3 почти замкнутые
маргиналии, охватывающие тело 3 кольцами; вакуоли
с порами и ряды косых ребер под каждой полосой, кро-
ме нижней. Панцирь короче, верхняя маргиналия уда-
лена от его края; перистом сократимый, с округлым
краем полости.
Сборы в Габоне (Goussard et al., 1983) также выяви-
ли необычных симбионтов гориллы со сферическим
телом и длинным хоботком, иногда в несколько раз
длиннее тела; пока опубликованы фотографии нена-
званного нового вида и рода.
Сем. Pseudoentodiniidae Wolska,
1986
Включает один монотипический род Pseudoentodi-
nium Wolska, 1986 (типовой вид Р. elephantis) из кала
индийского слона в зоопарке Лодзи. Ресничный по-
кров ограничен адоральной зоной, нет пучков или по-
лос соматических ресничек (маргиналий); строение
изучено при импрегнации аммиачным серебром.
Инфрацилиатура перистома включает вентральную и
2 дорсальные полосы (передний и задний фрагменты);
перистом сократимый, как у энтодиниид. Цитоскелет
состоит из 12 пластинок в левой части тела спереди и
12 симметричных пластинок под правой стороной. Ряд
признаков сближает этот вид с Parentodinium, но се-
мейство выделено для рода с цитоскелетом. У офри-
осколецид, однако, род Entodinium без цитоскелета не
отделяется в особое семейство.
Сем. Ditoxidae Strelkow, 1939
В каталоге Линна включает роды Ditoxum, Tetrato-
xum и Triadinium, но часть их очень близка к блефаро-
коритидам и их нельзя поместить в другой отряд, кото-
рый станет полифилетичным и сборным. Роды Triadi-
nium и Gassovskiella (нет в списке Линна) рассмотрены
выше в составе отряда блефарокоритид. Типовой род
Ditoxum практически не изучен, строение перистома
неизвестно; импрегнация Tetratoxum выявила перисто-
мальную цилиатуру энтодиниидного типа, это не бле-
фарокоритиды. Семейство включает овальных цилиат
с наклоненным вбок перистомом, апикальной дуго-
видной маргиналией и 1 (Ditoxum) или 2 (Tetratoxum)
маргиналиями снизу.
Род Ditoxum Gassovsky, 1919
Типовой вид/), funinucleum из лошади; вытяну-
тые клетки (190—203 мкм) с плавно закругленными
концами, без заметного рельефа кутикулы; вытянутое
ядро, одна вакуоль; снизу показана одна правая (у
ядра) маргиналия, вероятно полоса ресничек, не пу-
чок; сверху на уровне рта маргиналия в виде полосы.
Вершина тела отделена желобком, сужена и отклонена
вбок; перистом не изучен. В монографии Стрелкова
(1939) — виды D. funinucleum Gassovsky, 1919; D. ha-
mulus Strelkow, 1931; D. brevinucleatum S., 1931;
D. gravinucleatum Hsiung, 1935; хозяева — лошадь, ку-
лан, осел, зебра.
Род Tetratoxum Gassovsky,
1919
Типовой вид, по Аэшт,Blepharocorys unifascicu-
latum Fiorentini, 1890; правильнее Diplodinium unifasci-
culatum F., 1890 (Blepharocorys in Sharp, 1914). Парази-
ты лошади; хорошо изучены при серебрении и в элект-
ронном микроскопе. Вначале этот частый вид
относили к Blepharocorys. Другие виды — Т. excava-
tum Hsiung, 1930; Т. parvum Н., 1930 в Китае.
Тело овальное, асимметричное, кортекс с продоль-
ными ребрами; пластинок панциря нет. Снизу по кра-
ям 2 сходные длинные дуговидные полосы ресничек
(маргиналии), у вершины на уровне перистома такая
же дуга, огибающая край тела. Перистом асимметрич-
ный, при разрастании кортекса сместился вбок, распо-
ложен на выступе тела, отделенном складкой. При им-
прегнации выявлена длинная почти замкнутая полоса
фрагментов (зона А), узкая и очень длинная направ-
ленная вбок извитая полоса В; концы полос контакти-
руют. Идентичный перистом у Spirodinium. Рудимент
тигмона (зона С) вплотную прилегает снизу к зоне А;
верхняя маргиналия (дорсальная часть адоральной
зоны) не соответствует тигмону энтодиниоморф и бле-
фарокоритид. К сожалению, пока нет общепринятой
терминологии для трех зон перистома; в Traite (Grain,
1994) зоны обозначены как адоральная превестибуляр-
ная полоса, адоральная вестибулярная и паралабиаль-
ная органелла (проще обозначать как зоны А, В и С,
или зоны А, В и тигмон). Единственное отличие от
предыдущего рода — наличие 2 маргиналий снизу
(одна у Ditoxum).
Сем. Parentodiniidae Ito, Miyazaki et Imai,
2002
В первоисточнике включается один род Parentodi-
nium-, допускается возможность включения Lavierella
и Endoralium, если это не циклопостииды, а также
аберрантного вида Entodinium chatterjeei Das Gupta,
ТИП CILIOPHORA. КЛАСС LITOSTOMATEA
621
1935. Ранее Parentodinium включался в состав Мопо-
posthiidae, но у этих цилиат, близких к циклопостии-
дам, хороню развит пластрон и имеется каудалия.
Parentodinium лишен пластинок панциря, сомати-
ческой цилиатуры (маргиналий), кроме нескольких
ресничек у цитопрокта. Резко усложнена перистомаль-
ная цилиатура — зона А гигантская, покрывает почти
весь конус, вглубь вестибулюма идет узкая полоска
продольных кинет (как у блефарокоритид) — не поло-
са фрагментов, как у энтодиниид и циклопостиид.
Род Parentodinium Thurston
et Noirot-Timothee, 1973
Типовой вид Р. africanum из бегемота Hippopo-
tamus amphibius в Уганде. Вытянутые мешковидные
формы с широким вестибулярным отверстием на анте-
роне; сзади цитопрокт, здесь также выемка края тела у
Р. africanum и глубокая ямка у Р. ostrea в тех же хозяе-
вах. Ядро мелкое, овальное; вакуоль одна, у постерона;
пластинок панциря нет. Перистомальная цилиатура на
очень крупном апикальном вздутии тела — цилиофо-
ре, при сокращении он целиком глубоко втягивается в
полость, и края полости («крипта») смыкаются, как у
сократившихся перитрих. Цилиатура не была изучена,
показаны беспорядочные длинные реснички и очень
узкая длинная глотка.
В Японии в пробах из Hippopotamus найдены оба
названных вида и описаны новые виды — Р. pediculum
Ito, Miyazaki et Imai, 2002 и P. lituus Ito, Miyazaki et
Imai, 2002; по очертаниям постерона выделены «фор-
мы» Р. ostrea f. ostrea, euostrea, ablobum и P. pediculum
f. pediculum, dorsale. Это сплющенные клетки с нети-
пичной для всех остальных энтодиниоморфид ротовой
цилиатурой; каудалия имеется у 3 видов, нет у Р. litu-
us. Крипта — это кольцевой мускул по внутреннему
краю полости близ вершины; имеется сложный рет-
рактильный аппарат, не замеченный в первоописании
видов — 2 треугольные базальные пластины и отходя-
щие от них вверх высокие аргентофильные палочки.
Соматическая цилиатура —лишь несколько продоль-
ных кинет у цитопрокта; в перистоме найден стандарт-
ный для отряда рудимент тигмона (зона С, 4 коротких
ряда); зона А обширная, покрывает почти весь конус; в
вестибулюм от нее отходит зона В — полоса из 4 про-
дольных кинет (не полоса сближенных косых фраг-
ментов, как у остальных энтодиниоморф), такую поло-
су мы видели ранее у блефарокоритид. Вероятно, от-
ряд Entodiniomorphida двуфилетичный.
Род Endoralium Eloff et Van Hoven,
1980
Типовой вид E. loxodontae из слона Loxodonta
africana — мешковидные клетки без наружной ци-
лиатуры и панциря; ядро округлое, снизу; перистом
глубокий, цилиофор целиком втягивается в ротовую
полость. Прижизненно особи не зарисованы и не изу-
чены; рисунок сократившейся особи очень схема-
тичный, трудно понять строение и отличия от ранее
установленного рода Parentodinium-, вероятно, у на-
званного рода конусовидный цилиофор целиком втя-
гивается в полость, не меняя форму, а у Endoralium
зарисован очень длинный «сигмоидный» ряд ресни-
чек, глубоко впяченный внутрь сократившегося и втя-
нутого на дно цилиофора; глотка воронковидная.
У Parentodinium покровы тела ровные, у Endoralium
имеются боковые продольные складки кортекса, осо-
бенно справа.
Род Parentodinium в статье не упоминается (Eloff,
Van Hoven, 1980), вероятно не был известен авторам;
Endoralium считается одним‘из примитивных родов
офриосколецид и включается вместе с Entodinium в
«новое» (уже давно существующее!) подсем. Entodi-
niiae (так в оригинале) Eloff et Van Hoven, 1980, sub-
fam. n.
Род Lavierella Buisson, 1923
Типовой вид/,, africana из носорога Rhinoceros
bicornis. В Traite (Grain, 1994) это род неясного поло-
жения, не отнесенный ни к одному из семейств; в ката-
логе Корниловой (2004) это или циклопостиида, или
офриосколецида. Без импрегнации цилиатуры родство
Lavierella не выяснено. Это мелкие особи (45—55 мкм) с
вытянутым ребристым исчерченным телом; вершина
тела — плоский цилиофор, округлый при виде сбо-
ку, целиком покрытый густыми ресничками, отделен
шейкой; рот — поперечная апикальная щель; глот-
ка длиной 10 мкм, с фибриллами; другие признаки —
округлое ядро, несколько вакуолей, нет панциря. В
том же хозяине много циклопостиид с каудалиями. По
Бюйссону (Buisson, 1923), близки к Bozasella-, оба рода
не включены им в известные семейства энтодинио-
морф.
Этот вид (но на рисунке совсем другой), по Элоффу
и Ван Ховену (Eloff, Van Hoven, 1980), обитает в слоне
Loxodonta africana-, при сокращении ротовой конус
втягивается в глубокую полость. Второй вид с очень
узким трубчатым телом — L. klipdrifi Van Hoven, Gilc-
hrist et Stenson, 1998 из Rhinoceros.
Род Bozasella Buisson, 1923
Типовой вид В. rhinocerotis из африканского
носорога — также с мешковидным телом без панциря
и наружной цилиатуры; описание краткое, вид практи-
чески неизучен, но род может быть включен в данное
семейство. Некрупные формы с удлиненным телом,
округлым ядром, без пластинок панциря; сзади над по-
стероном на одной из сторон тела 2 пучка каудалий,
под перистомом длинная полоса ресничек; апекс вы-
пуклый, с фибриллярным конусом глотки, с густой ци-
литаурой, топография которой не выяснена.
Подсем. Monoposthiinae Noirot-Timothee,
1976
Предложено как подсемейство, принято авторами
Traite (Grain, 1994), но не замечена гомонимия — есть
сем. Monoposthiidae Filipjev, 1934 для морских не-
622
ALVEOLATA
матод — десмодорид с типовым родом Monoposthia
De Man, 1886. 1 loo тому без обращения в ICZN (это не
спорный случай) название цилиат меняется на Мопо-
posthiuminac Jankowski nom. nov.
Узкие вытянутые формы с рудиментом соматиче-
ской цилиатуры (мелкий пучок на постероне), слож-
ным панцирем, глубокой апикальной воронкой, на дно
которой целиком втягивается ресничный конус (цили-
офор) такой же формы,-как у Parentodinium. Ротовая
цилиатура предположительно циклопостиидного типа.
Симбионты в пищевом тракте капибары, носорогах,
бегемота (Южная Америка, Африка).
Род Monoposthium Thurston
et Noirot-Timothee, 1973
Типовой вид М. acanthum по монотипии, из
преджелудка Hippopotamus amphibius в Уганде; тело
вытянутое, сплющено, сзади зубцевидный шип и мел-
кая каудалия с несколькими ресничками; ядро вытяну-
тое, вакуоль у ядра; панцирь — сеть полигонов кортек-
са — вероятно по всему телу. Цилиофор в виде взду-
той полусферы, покрытой ресничками; узкий рот с
тонкой глоткой на вершине; эта органелла полностью
втягивается на дно очень глубокой полости, верхний
край которой несет кольцо с шипами. Сфинктер (мус-
кульное кольцо) не показан (имеется у Parentodinium
со сходным типом цилиофора).
В первоописании род сближался с Lavierella и от-
несен к Cycloposthiidae как одна из примитивных форм
этого семейства; род оставлен в этом семействе Ито и
Имаи (Ito, Imai, 2000а), изучившими при импрегнации
новый вид М. cynodontum из капибары Hydrochoerus
hydrochaeris в Боливии; вид имеет типичную складча-
тую базальную пластинку (циклопост), одну кауда-
лию, почти полный панцирь с крупными ячейками, ти-
пично циклопостиидную цилиатуру перистома, длин-
ное ядро и 2 вакуоли — в целом настолько типичную
циклопостиидную организацию, что выделение подсе-
мейства для рода кажется ненужным. В Traite (Grain,
1994) подсемейство включает формы только с одной
каудалией.
Новые виды из белого носорога Ceratotherium si-
mum в ЮАР — М. vulgaris, М. latus, М. bracchium Van
Hoven, Gilchrist et Attwell, 1987; с разной формой тела,
зубчатым краем панциря и продольным желобком,
третий вид с необычным боковым выростом, все без
венца зубцов, как и вид из капибары; род можно раз-
бить на подроды, отделив аберрантные формы от ти-
пового вида.
Род Phalodinium Van Hoven, Gilchrist
et Hamilton-Attwell, 1987
Типовой вид Ph. digitalis по монотипии, из бе-
лых носорогов Африки — мешковидные формы тако-
го же типа, как Parentodinium, но без цитоскелета; сни-
зу необычные толстые пальцевидные выросты с крюч-
ком у основания; нет каудалий; перистом не изучен —
показан полусферический цилиофор с ресничками на
дне или краях неширокой апикальной воронки.
Род Arachnodinium Van Hoven, Gilchrist
et Hamilton-Attwell, 1987
Типовой вид A. noven г, как гомоним название
заменено новым —Arachnodinella Aescht, 2001. Назва-
ние рода годом раньше с видом Arachnodinium rhino-
seraliss не основано на диагнозе вида (только снимок)
и отвергнуто Аэшт.
Тело вазообразное, закруглено сзади и резко рас-
ширено спереди, как у Monoposthium latus из тех же
хозяев; сзади такой же шип, но нет каудалии; сетчатый
панцирь в описании рода и вида не упоминается; ваку-
оль и ядро не замечены. От края апекса отходят 9 ги-
гантских шипов (6 + 3 в двух группах), достигающих
длины тела; они могут складываться в продольные на-
ружные желобки кутикулы. Перистом на ретрактиль-
ной полусфере, с типичной для этой группы родов
полостью — очень широкий предротовой ворон-
кой. Род отнесен к циклопостиидам; в Traite (Grain,
1994) — среди родов неясного положения перечисле-
ны Cunhaia, Lavierella, Bozasella, Phalodinium и «Агас-
hnoidium» (эрроним).
Сем. Spirodiniidae Strelkow,
1939
В каталоге Линна 2 рода, Cochliatoxum и Spirodini-
um, внешне несходные, поэтому для диагноза семейст-
ва важны признаки Spirodinium. Тело вытянутое, без
панциря, перистом открыт вбок, не апикальный; име-
ется небольшая маргиналия снизу и крупная кольцевая
полоса ниже перистома; ротовая цилиатура циклопос-
тиидная, но нет пластинки (циклопоста) снизу и боко-
вых пучков ресничек (каудалий).
Род Spirodinium Fiorentini,
1890
Типовой вид S. equi по монотипии; род предло-
жен дважды как новый в 1890 г. Паразиты лошади;
тело вытянутое, узкое, несимметричное, с небольшой
маргиналией (полоса ресничек, не пучок) высоко над
постероном и почти замкнутой полосой, отделяющей
складчатую перистомальную зону от тела; перистом
отклонен вбок, широкий; панциря нет. Нет глубокой
воронки, характерной для монопостиид. Ранние авто-
ры принимали верхнюю и даже нижнюю маргиналию
за часть единой спирально закрученной ротовой рес-
ничной полосы. Цилиофор несократимый, рот не втя-
гивается в тело.
Цилиатура перистома — фрагмент С, крупная дуга
А и длинная тонкая петля В с фрагментами кинет. У
блефарокоритид и у Parentodinium 3—4 кинеты идут
вдоль полосы, у энтодиниоморф вместо них видна по-
лоса многочисленных поперечных фрагментов по не-
сколько кинетосом в каждом. Это, конечно, паратены
(адесмокинеты) — не фрагменты кинет, гг результат
координированного расположения кинетосом в тех ря-
дах, которые есть у названных выше групп. Такие
«вторичные» ряды сохраняются без изменений у энто-
диниоморфид.
ТИП CILIOPHORA. КЛАСС LITOSTOMATEA
623
Другие виды — S. ferrum-equinum Strelkow, 1931;
•S', magnum Ike, Imai, Ishii, 1983; S. confusum Hsiung,
1935; S. nanum S., 1931; S. uninucleatum H., 1935; хозя-
ева — лошадь, мул, кулан, зебра.
Род Cochliatoxum Gassovsky, 1919
Типовой вид С. periachtum из лошади; позже де-
тально переописан рядом авторов, включая электрон-
ную микроскопию. Крупный вид (400—510 мкм) с
овальным телом и вытянутым изогнутым ядром, часты
и резко вытянутые особи; соматическая цилиатура
включает 3 полосы — дорсальные (верхняя и нижняя)
и вентральная снизу. Перистом смещен вбок от апекса.
Ротовая цилиатура — 2 извитые полосы на поверх-
ности и частично на стенке инфундибулюма. Вне рес-
ничных зон панцирь неровный, складчатый. Много-
численные мелкие вакуоли выделяют мукус, поры их
открываются между складками. В полосах по 10—
12 кинет, их реснички собраны в синцилии; наличие
полос, а не ретрактильных пучков — общий признак
с Spirodinium-, наличие синцилий и фибриллярной гло-
точной корзинки — общее с офриосколецидами и цик-
лопостиидами.
Род Toxodinium Da Cunha, 1938
Типовой вид Cycloposthium vorax Da Cunha
et Muniz, 1926 из капибары Hydrochoerus hydrochaeris
в Бразилии — широкие веретеновидные клетки с
острыми концами; четкий циклопост не показан; ядро
вытянутое, перистом отклонен вбок от апекса; ро-
товая цилиатура и цилиофор не зарисованы. Нет ске-
летного аппарата, свойственного циклопостиуму,
но кортекс утолщенный — нет ни наружного панциря,
ни внутренней пластинки вдоль ядра; у Cycloposthium
и Triplumaria она находится на дне желобка, у Tricau-
dalia ее рудимент не связан с кортексом, желобка
нет. Другое отличие, подчеркнутое автором рода, у
Cycloposthium типа С. bipalmatum сзади находятся
2 пучка ресничек на придатках (каудалии), у Toxodini-
um здесь 2 линии ресничек (полосы), окружающие
края тела двумя длинными дугами; нет верхней мар-
гиналии.
Этот род просто «потеряли» — по непонятным
причинам он не упоминается в ревизии всех родов
Cycloposthiidae Латтеура и Дюфея (Latteur, Dufey,
1967), описавших и ряд новых родов с такими же по-
лосами (не пучками) ресничек, его нет в после-
дующей литературе, и в частности в монографии цик-
лопостиид капибары Ито и Имаи (Ito, Imai, 2000в),
С. vorax не найден и не переописан, но упоминается в
тексте, а первоисточник по Toxodinium не цитируется
и род не упомянут в детальном обсуждении системати-
ки группы.
Действительно ли у Т. vorax нет панциря — пред-
стоит проверить; остальные виды из водосвинки име-
ют панцирь. Ито и Имаи нашли в этом хозяине все пе-
реходы от форм с каудалией до видов с длинной поло-
сой пектинелл, поэтому таксономическая значимость
этого признака, ранее четкого, пока неясна.
Сем. Cycloposthiidae Poche, 1913
Тело вытянутое, сплющено латерально; хорошо
развит панцирь, часто окружающий все тело; сомати-
ческие реснички на ретрактильных выступах, обычно
по обе стороны от характерной для включаемых родов
складчатой каудальной пластинки (циклопоста). Пери-
стом — ретрактильная полусфера, при сокращении
втягивается внутрь и стенки почти смыкаются; рото-
вая цилиатура — фрагмент С, широкая дуга А и тонкая
длинная петля В, уходящая в сторону; реснички этой
петли могут быть приняты за вторую «зону мембра-
нелл». 2 посемейства различаются в Traite (Grain,
1994) по числу каудалий — 1 (Monoposthiinae) и 2
(Cycloposthiinae). Монопостииды рассмотрены выше.
Pop, Cycloposthium Bundle, 1895
Типовой вид Entodinium bipalmatum Fiorentini,
1890 из лошади; описано много видов из разных групп
хозяев. Типичные циклопостии — вытянутые клетки
со складчатым неровным апексом; панцирь покрывает
как минимум одну сторону тела, но обычно обе, и в до-
полнение имеется продольная внутренняя опорная
пластинка в дорзальном желобке вдоль ядра. Ядро рез-
ко вытянутое, с серией вакуолей; вдоль ядра идет
длинная широкая глоточная корзинка с фибриллярной
стенкой. Перистом сложный, верхний край тела имеет
вид широкой воронки, способной к сокращению при
втягивании апикальной полусферы с цилиатурой; плот-
ные фибриллярные пластинки («моториум») обеспе-
чивают движение цилиофора. В перистоме — руди-
ментарный тигмон (зона С), очень широкая дуговид-
ная полоса А из множества сближенных монокинет и
тончайшая длинная извитая петля В (у офриосколецид
зона А длинная и неширокая, зона В широкая).
На постероне 2 ретрактильных пучка ресничек; нет
полос; такие формы выделяются в особые семейства,
хотя не проведен специальный анализ топографии ки-
нет в этих зонах.
Хозяева — лошадь, кулан, осел, африканский носо-
рог, слон; много видов в капибаре Южной Америки.
Крупный род; примеры видов — С. hydrochoeris Da
Cunha, 1915; С. incurvum D. С., 1915; C. compressum
D. С., 1915; С. dentiferum Gassovsky, 1919; C. ishikawai
G., 1919; C. magnum C. et M., 1917; C. cristatum C. et
M., 1917; C. caudatum C. et M., 1927; C. minutum C. et
M., 1927; C. piscicauda Strelkow, 1928; C. scutigerum S.,
1928; C. edentatum S., 1929; C. affine S. 1929; C. corru-
gatum Hsiung, 1930; C. plicatocaudatum S., 1939; C. len-
ticularis Hollande et Batisse, 1959; C. elongatum H. et B.,
1959; C. bursa Ito et Imai, 2000; C. ponomarevi Kornilo-
va, 2001; C. hemioni K., 2001.
Подрод Denticycloposthium Strelkow, 1939
Типовой вид Cycloposthium dentiferum Gassovs-
ky, 1919; край перистомальной воронки у других видов
ровный, у этого вида с крупным зубцом; циклопост
двойной, ствол резко расширяется в виде пластинки;
снизу 2 пучка (не полосы) синцилий.
624
ALVEOLATA
Подрод Dlcycloposthium Strelkow, 1939
'Г и 11 о в о И вид Cycloposthium plicatocaudatum,
также С. ischlkawae. В Traite (Grain, 1994) это род неяс-
ного положения; основной признак (в названии подро-
да) 2 дуги ресничек в задних маргиналиях вместо
2 пучков на трихофорах; нет верхней маргиналии.
Род Berrtolinella Carpano, 1941
Типовой вид В. intestinalis по монотипии из ло-
шадей в Албании. Найдены в массе в одной лошади;
величина 100—160 мкм, тело вытянутое, овальное, с
неровным краем, спереди венец ресничек, сзади по бо-
кам 2 каудалии, ядро вытянуто вдоль края тела, между
ним и кортексом длинная исчерченная пластинка (пла-
строн). Автор рода приводит список 14 известных ро-
дов «олиготрих» из млекопитающих, открытых до
1923 г. (до монографии Бюйссона); он пишет, что
«почти все» роды списка не имеют такой пластинки,
поэтому род новый, хотя вид похож на Cycloposthium
bipalmatum'. другие родовые отличия несущественные,
видового плана. Еще самые ранние авторы зарисовали
пластинку в том же локусе С. bipalmatum, а по Нуа-
ро-Тимоте (Noirot-Timothee, 1960) панцирь имеется у
всех циклопостиид. Итак, Bertolinella — синоним рода
Cycloposthium. По Корниловой (2004), автор рода
«ошибся, приняв за новый вид полуразрушенные тела
нескольких разных инфузорий из родов Cycloposthium,
Tetratoxum, Ditoxum».
Род Triplumaria Ноаге, 1937
Типовой вид Т. hamertoni из индийского носо-
рога Rhinoceros unicornis в Лондонском зоопарке.
Прочный сетчатый панцирь покрывает все тело, от-
крыт только у перистома; снизу циклопост и 2 кауда-
лии; в отличие от Cycloposthium добавляется еще один
пучок (маргиналия) на уровне перистома спереди. Со-
хранена внутренняя пластинка на дне желобка вдоль
длинного ядра, как у циклопостия. Вид найден позже в
слонах ЮАР, но идентичность видов не доказана.
Тщательно изучена также Т. selenica Latteur, Tuffrau et
Wespes, 1970 из африканского слона; впервые дана
четкая схема перистома, его цилиатуры, ретракторов,
двойного панциря в зоне ядра. Из носорога в Африке
описана Т. corrugata Van Hoven et al., 1998 с длинным
исчерченным циклопостом, из индийского и африкан-
ского слонов в зоопарках описали виды Т. longinuclea-
ta, Т. nucleocaudata, Т. asiatica, Т. heterofasciculata,
Т. irreguris, Т. doliiformis, Т. dvoinosi, Т. acuticaudata,
Т. ovina, Т. antis, Т. poljanskii Timoshenko et Imai, 1995.
Род Tripalmaria Gassovsky, 1919
Типовой вид T. dogieli. Хорошо изученный вид
из лошади; тело широкое, с неровным контуром; ядро
сложной формы, двуветвистое; желобок отделяет обо-
собленный антерон, цилиатура которого не была поня-
та ранее. При импрегнации найдены зоны А, В и руди-
мент тигмона С, характерные для циклопостиид. Нет
мембранелл, от кинет перистома отходят синцилии и
их пучки. Имеются 2 каудалии по сторонам от очень
широкого циклопоста, и одна маргиналия на уровне
рта. Пластрон — 2 пластинки, периферическая слева
под всей поверхностью и тонкая справа на уровне по-
лосы А перистома, она соединена с массивной плас-
тинкой. В лошади обитает также Т. minor, в зебре близ-
кий неназванный новый вид, всегда с характерным бо-
ковым выступом тела между 2 пучками ресничек.
В Traite (Grain, 1994) как валидное приведено
сем. Tripalmariidae Bonhomme et al., 1989 с ретрактиль-
ным ротовым цилиофором, 3 маргиналиями, пластин-
ками панциря (кроме Trifascicularia). Этих признаков
недостаточно, особой разницы нет, цилиофор у Cyclo-
posthium тоже ретрактильный. Ранг группы — не выше
подсемейства.
Род Trifascicularia Strelkow, 1931
Типовой вид Т. cycloposthium по монотипии, из
колона зебры. Некрупные клетки с небольшим ядром в
нетипичном положении (высоко в антесоме); сократи-
мые вакуоли не найдены; сзади очень широкий цикло-
пост и 2 маргиналии, третья лежит очень высоко у пе-
ристома; перистомальный отдел ограничен желобком
и сужен, от ретрактильной полусферы вглубь тела от-
ходит тонкая фибриллярная глотка. Нет общего панци-
ря (отличие от Cycloposthium и Triplumaria), нет одно-
сторонней пластинки (отличие от Tricaudalia, Protota-
pirella, Tripalmaria) и вообще нет даже рудимента
пластрона, как исключение среди циклопостиид. Если
Entodinium и близкие формы включаются в состав оф-
риосколецид, имеющих пластинки, то и в этом случае
Trifascicularia нельзя исключить из циклопостиид.
Род Tricaudalia Buisson, 1923
Типовой вид Т. brumpti из африканского носо-
рога, встречается вместе с 2 видами близкого рода Рго-
totapirella. Основной признак нового рода — наличие
3, а не 4 маргиналий (2 сзади и 1 спереди на уровне
перистома); нижние пучки разделены очень широким
циклопостом. Тело плоское, с волнистым контуром
панциря, как у многих обитателей слонов и носорогов;
перистом отделен сужением; кортекс с одной стороны
превращен в пластрон — крупную сетчатую перифе-
рическую скелетную пластинку на левой (дорсальной)
стороне плоского тела; вторая пластинка («tigelle») уз-
кая и извитая, вдоль длинного ядра под правой сто-
роной тела, вероятно на вершине связана с основным
пластроном.
Род Hoarella Mandal et Choudhury,
1983
Типовой вид Н. indica', ввиду гомонимии назва-
ние рода заменено новым — Betella Mandal et Choud-
hury, 1983 (сем. Cycloposthiidae); публикация недо-
ступна.
ТИП CILIOPHORA. КЛАСС LITOSTOMATEA
625
Род Rhabdothorax Latteur et Bousez,
1970
Типовой вид R. macrostegon по монотипии, го-
моним; новое название Rhabdothoracella Aescht, 2001,
с видом R. macrostegon из азиатского слона. Крупные
клетки с 3 глубокими продольными желобками —
один вентральный, 2 дорсальных; цитопрокт суб-
терминальный; ядро вытянутое; 6 вакуолей в ряду;
снизу 2 маргиналии и широкий циклопост, сверху
почти у апекса третий пучок ресничек — все 3 пучка
на трихофорах, не в виде полос. Мощный цитоске-
лет — 5 пластинок, узкие справа и слева, массивные
вентрально и 2 дорсально вокруг 3 продольных желоб-
ков панциря.
Род Prototapirella Da Cunha,
1918
Типовой вид Р. intestinalis', род дважды пред-
ложен как новый. У Грайна (Grain, 1994) — единст-
венный род группы с названием «Famille des Prototapi-
rellidae (Noirot-Timothee, 1976) nov. fam.» — ранг под-
семейства поднят им до семейства. В длинном
диагнозе не указано основное отличие от Cyclopo-
sthiidae; наличие лишней каудалии — не признак се-
мейства.
Внешне это типичные циклопостии с плоским те-
лом, длинным ядром у дорсального края, с серией ва-
куолей вдоль ядра; сзади округлый вырост (цикло-
пост) с боковыми маргиналиями; над ними медиаль-
ный и апикальный пучки ресничек (формула 3 + 1).
Сократимый цилиофор перистома как у циклопостиев;
цилиатура не изучена. Широкая сетчатая скелетная
пластинка покрывает всю правую сторону плоского
тела; вероятно есть и вторая узкая пластинка (на схеме
панциря циклопостиид ее нет, и нет образующего
ее желобка панциря). Тип рода — из тапира Tapirus
(Prototapirus) americanus в Бразилии. В первоописа-
нии и у Бюйссона (Buisson, 1923) цитоскелет не упо-
мянут, но при анализе текста и рисунков статей автора
рода ясно, что он имеется и у типового вида этого
рода.
Описаны виды из других хозяев — Р. clypeata Buis-
son, 1923 (африканский носорог); Р. elephantisB., 1923
(африканский слон); Р. gorillae Imai, Ikeda, Collet, Bon-
homme, 1991 (горилла в Габоне); находка типового
вида в слонах в ЮАР (Eloff, Van Hoven, 1980), вероят-
но, ошибка, идентичность видов не доказана.
Циклопостииды в капибаре
Hydrochoerus capybara
Выше дана информация о забытом роде Toxodinium
Da Cunha, 1938 с 2 нижними маргиналиями в виде
дуговидных полос (не пучков ресничек) и «без панци-
ря» (таких видов в капибаре нет); предложены и дру-
гие названия, но в монографии (Ito, Imai, 2000в) все
виды отнесены к роду Cycloposthium без разделения
подродов.
Род Diplolophus Hollande et Batisse,
1959
По Аэшт, название непригодное, так как не фикси-
рован типовой вид. Эти авторы (Hollande, Batisse,
1959) нашли в пробах 6 видов Cycloposthium и разде-
лили их на 3 группы: 1) С. hydrochoeri', 2) С. minutum,
С. lenticularis, С. elongatum', 3) С. compressum, С. cau-
datum', для последней предложен новый подрод Dip-
lolophus — с основной апикальной и мелкой боко-
вой ротовой цилиатурой. Это ошибка, видны стандарт-
ные зоны А и В — импрегнация показала единый
тип цилиатуры у всех видов из водосвинки. Тем не ме-
нее этот таксон принят в Traite (Grain, 1994) как
род без обозначения типа — цитоскелет как у цикло-
постиев, маргиналии 2 типов — длинная полоса и ко-
роткая каудалия у одной особи (это не очевидно на
рисунках видов).
Типовой вид С. compressum.
Род Carinoposthium Jankowski,
1980
Типовой вид Cycloposthium caudatum Da Cunha
et Muniz, 1927; это пригодное название для замены
предыдущего. Типовым для Diplolophus я считал
С. compressum. Вид имеет нетипичную форму тела, с
разрастанием одной из сторон в виде бокового киля;
панцирь покрывает все тело; маргиналии удалены вы-
соко вверх от постерона и, вероятно, состоят из полос,
не пучков ресничек; четкие трихофоры не показаны у
С. caudatum, но зарисованы у С. hydrochoeri.
Род Paracycloposthium Grain,
1994
Типовой вид Cycloposthium hydrochoeri Da Cun-
ha, 1915 отличается от типичных Cycloposthium отсут-
ствием продольного желобка на венте и особым ци-
тоскелетом; имеет пучки, не ряды маргинальных рес-
ничек.
Ито и Имаи (Ito, Imai, 2000а) не придали значения
разнице типов каудалий; у крупных видов (С. cauda-
tum, С. cristatum, С. compressum, С. elongatum) это чет-
кие полосы, у мелких (С. lenticularis) и у крупной
С. bursa вероятно пучки; С. hydrochoeri сохраняет
план строения Monoposthium cynodontum из того же
хозяина. Типы родов Carinoposthium и Paracyclopost-
hium имеют разные типы перистома. В будущем эти
два названия и Toxodinium можно использовать
для разграничения подродов или родов этой абер-
рантной группы видов из капибары, отличающихся от
типичных циклопостиид Евразии и Африки. Предсто-
ит также решить, различается ли топография цилиату-
ры в пучках (на трихофоре и в длинных дуговидных
полосах), нужно ли отделять виды с 2 типами маргина-
лий в разных семействах, валидно ли сем. Telamodinii-
dae. Предполагается, что в пучках (каудалиях) беспо-
рядочное поле ресничек, в полосах — тесно сближен-
ные косые ряды пектинелл.
40 Зак. № 4163
626
ALVEOLATA
Приложение
Паразитические трихостоматы
неясного положения
Род Helicozoster Latteur, 1967
Типовой вид Н. indicus из цекума слона (в зоо-
парке Бельгии). Тело'и ядро овальное, вакуоли в боко-
вом ряду, перистом в виде диагональной щели; от него
по спирали отходит желобок, оба края которого исчер-
чены и несут густые реснички. Сомакинеты отсутству-
ют на постероне, укорочены, длина и топография их
отличаются во всех частях тела; выше желобка они
разрежены, ниже сгущаются в компактное поле. Этот
аберрантный род выделяется здесь в новое сем. Helico-
zosteridae Jankowski fam. n. с приведенным выше диа-
гнозом единственного рода. Другие роды с желобками
{Paraisotrichopsis, Sulcoarcus, Infundibuloriuni) не соот-
ветствуют Heicozoster по топографии цилиатуры; в ка-
талоге Корниловой (2004) род предположительно от-
несен к Paraisotrichidae.
Из носорогов в ЮАР описаны Helicozoster africa-
nus Van Hoven et al., 1998 и H. apicalis Van Hoven et al.,
1998; первый вид похож на Н. indicus и относится к
данному роду, второй имеет короткую спираль, дру-
гую форму тела; кинетом не изучен. В южноафрикан-
ском слоне обнаружен Н. proboscidiferus Eloff et Van
Hoven, 1980 с резкими отличиями от Helicozoster по
типу перистома и цилиатуры (нет ацилона; ротовая
спираль короткая); вероятно, в слонах и носорогах
есть группа родственных видов с постепенным скру-
чиванием тела и удлинением желобка.
Род Taliaferria Hegner et Rees, 1933
Типовой вид Т. clarki из цекума и толстой киш-
ки обезьяны «красный паук» (red spider monkey) Ateles
geoffroyi в Панаме; нет в обезьянах 2 других родов в
той же местности; отнесены к Nicollellidae (Pycnotric-
hida), поскольку кортекс утолщен; у Корниловой
(2004) в сем. Pycnotrichidae. Дан один упрощенный
схематический рисунок общего вида (контуры тела и
глотки); по описанию, кинеты густые, биполярные;
глотка с фибриллярной стенкой; нет ресничного вести-
булюма; перистом субапикальный, сбоку. Без повтор-
ного изучения нельзя ничего предположить, но ясно,
что это не пикнотрихида — нет длинного узкого же-
лобка и вытягивания тела.
Род Meiostoma Sandon, 1941
Типовой вид М. georhychi из кротовой крысы
(mole rat) Georhychus capensis (Bathyergidae). Крупный
цекум этого подземного грызуна содержит бактерии,
флагеллаты и цилиаты, вначале описанные как Balanti-
dium, затем как новый род и вид. Другой неназванный
вид (без диагноза и рисунков) найден в социальном хо-
зяине Heterocephalus glaber, живущем в группах. Тип
рода — крупные вытянутые формы (длина тела до
800 мкм) с полной цилиатурой, без удлинения пери-
стома и без желобка (поэтому это не пикнотрихиды);
рот предположительно апикальный; в антесоме есть
подобие конкрементной вакуоли бючлиид; ядро цент-
ральное. Предполагают, что это не литостоматы, а
простоматы — группа, не имеющая паразитических
видов.
Эндопаразиты сумчатых (Marsupialia)
Австралии (рис. 322, а, б)
В австралийских кенгуру нет всех трех групп, засе-
ляющих травоядных млекопитающих на остальных
континентах — нет бючлиид (гапторид), блефарокори-
тид (трихостомат) и энтодиниоморфид, кроме случай-
ной вторичной инвазии Cycloposthium edentatunv, инт-
родукция домашних животных не изменила состав
симбионтов. Обследовано большое число видов сум-
чатых в континентальной Австралии и Тасмании (на
Новой Гвинее работа пока не проводилась); число ро-
дов цилиат невелико (6), и некоторые роды имеют все-
го несколько видов, но изучение начато только в сере-
дине 1990-х годов; в дополнение к уже известным ви-
дам будет описано 16 новых, в основном в родах
Polycosta aAmylovorax. Обилие цилиат в кенгуру было
установлено ранее на континенте и в Тасмании, приво-
дились фотографии основных родов и видов, но таксо-
номическое изучение проведено не было.
Необычный новый род Macropodinium был открыт
в 1996 г. цилиатологом из США (Dehority, 1996); вско-
ре сформировалась группа активно работающих авст-
ралийских специалистов (Cameron, Adlard, O’Donog-
hue, 2001; Cameron, O’Donoghue, 2001, 2002a, 2002b,
2002c, 2003, 2004a, 2004b; Cameron, O’Donoghue, Ad-
lard, 2000, 2001, 2002, и др.). Вначале был допущен
ряд ошибок — род Macropodinium отнесли к энтодини-
оморфам, виды нынешнего рода Amylovorax описали
в составе распространенного рода изотрихид Dasytri-
cha, неверно ориентировав цилиат (D. dehorityi,
D. dogieli, D. mundayi) (Cameron, O’Donoghue, Adlard,
2000); амиловоракс — это простоматы, а у дазитрих
рот смещен к постерону. Сейчас все роды считаются
эндемичными для Австралии, проведены исследова-
ния в сканирующем и электронном микроскопе, про-
слежен морфогенез, применены методы молекуляр-
ного анализа, составлены филограммы, показывающие
родство всей этой фауны с литостоматами и одновре-
менно независимое положение по отношению к изве-
стным группам симбионтов млекопитающих вне Авст-
ралии.
Роды Bitricha и Bandia имеют общие признаки
строения, а в целом известные пока роды очень резко
различаются по строению; должны быть найдены пе-
реходные формы, если они не вымерли вместе с хозяе-
вами. Пока выявлен лишь фрагмент существующей
или почти исчезнувшей эндемичной фауны. Полезен
каталог родов с описанием и рисунками типовых ви-
дов группы Корниловой (2004).
Молекулярная филограмма (Cameron, Wright,
O’Donoghue, 2003) позволяет считать Macropodinium
боковой ветвью от основания ствола, от вершины ко-
торого отходят ветви изотрих и энтодиниоморф. Это
не потомок известных гапторид или энтодиниид; род
ТИП CILIOPHORA. КЛАСС LITOSTOMATEA
627
можно включить в состав трихостомат в качестве от-
дельного отряда, если изменить диагноз трихостомат
или считать боковой (сестринской) группой, не зави-
симой от Entodiniomorphida + Vestibuliferida. Уникаль-
ная морфология и морфогенез при делении в сочета-
нии с данными по филогении позволяют выделить все
роды австралийских эндемиков в новый отряд.
Род Amylovorax Cameron et О’Donoghue,
2002
Типовой вид Л. dehorityi (=Dasytricha dehorityi
Cameron, O’Donoghue et Adlard, 2000). Тело вытяну-
тое, почковидное, с густой цилиатурой в слегка спи-
ральных продольных рядах; ядро овальное; на апексе
очень мелкий рот погружен на дно небольшой ямки,
короткая прямая глотка укреплена фибриллами. Эти
цилиаты составляют иногда основную массу в пробах
из преджелудка (forestomach = foregut) — ферментаци-
онной камеры кенгуру. Род выделен в новое сем. Ату-
lovoracidae Cameron et O’Donoghue, 2002, некоторое
внешнее сходство с изотрихидами признано конвер-
генцией.
Известные виды и хозяева (указаны только роды
сумчатых) —A. dehorityi (С., О. et А., 2000); A. dogieli
(С., О. et А., 2000) (в Macropus); A. mundayi (С., О.
et А., 2000) (Thylogale); A. quokka С. et О., 2002 (Se-
tonix).
Род Bitricha Cameron, O’Donoghue
et Adlard, 2000
Типовой вид В. oblata С., О. et А., 2000 (из Mac-
ropus); второй вид В. tasmaniensis С., О. et А., 2000
(Thylogale). Род отнесен к сем. Amylovoracidae. Почко-
видные формы, тело изогнуто, расширено в передней
половине; рот смещен к экватору или несколько ниже,
ведет в небольшую глотку без заметных немадесм.
Соматические кинеты полимеризованы, с необычной
топографией — на правой стороне тела все ряды про-
дольные, на левой снизу идут до рта, сбоку огибают
его и подходят к длинному предротовому шву, ука-
зывающему путь смещения рта с первоначально пе-
реднего положения. Вокруг рта кольцо из коротких ра-
диальных фрагментов кинет, как у части изотрихид —
обособленные вершины левосторонних рядов, изме-
нивших свое положение. Вероятно, предок имел апи-
кальный рот с фрагмоном такого типа, как у многих
гапторид и бючлиид. Обычный и массовый род в про-
бах из кенгуру.
Род Bandia Cameron et O’Donoghue,
2002
Типовой вид В. beveridgei из преджелудка кен-
гуру-куокка Setonix brachyurus; род отнесен к сем.
Amylovoracidae. Тело удлиненное, широкое, сужено
сзади, расширено и закруглено спереди; ядро вытяну-
то вдоль тела; вакуоль сзади, могут быть и добавочные
вакуоли в цитоплазме. Соматическая цилиатура гус-
тая, кинеты полимеризованы и идут по спирали; спра-
ва кинеты продольные, слева по спирали несколько
кинет подходят ко рту, остальные огибают его и упи-
раются в предротовой шов (униполярную секанту).
Перистом небольшой — неглубокая ямка в передней
части тела, с характерной для предыдущего рода пред-
ротовой цилиатурой — кольцо радиальных фрагмен-
тов. От погруженного рта вглубь тела идет короткая
прямая глотка с тонкими фибриллами. Перистом неве-
лик для столь крупных форм, что обычно у эндобионт-
ных цилиат.
По нескольку кинет вплотную сближены и такие
группы перемежаются с ребрами кортекса или с ря-
дами папилл; такой структуры нет у близкого рода Bit-
richa, имеющего простые монокинеты. Над ртом реб-
ра исчезают и ряды ресничек расположены равно-
мерно.
Вторая особенность рода — полиморфизм, неизве-
стный в других группах цилиат, — существуют по
2 формы почти всех видов кроме В. cribbi; в пробах
вместе с обычными формами с полной цилиату-
рой можно найти особей с обширным безресничным
участком (ацилоном) на дорсуме шириной в 3—
8 групп кинет; у таких форм тело часто резко расшире-
но ввиду разрастания безресничного щитка. Он обра-
зуется при разрастании ребер (межкинет), возможно
даже при разрастании одного ребра; функция пластин-
ки неясная:
Род кажется сборным, вероятно можно выделить
3 подрода.
Подрод Bandia s. str.
Все особи только с обширной дорсальной пластин-
кой, нет форм с цилиатурой обычного типа (австра-
лийские авторы обозначают их как «grooved and
not-grooved forms»).
Типовой вид Bandia (Bandia) beveridgei, вид
с мощными ребрами между группами кинет и мел-
кими тонкими ребрами между каждой из кинет в рес-
ничной полосе; вдоль дорсума идет плотная широкая
пластинка.
Подрод Armidallis Jankowski
subgen. n.
Все особи вида всегда лишены дорсальной плас-
тинки.
Типовой вид Bandia (Armidallis) cribbi Cameron
et O’Donoghue, 2002 из Macropus parryi, некрупный
широкий вид с высоко расположенным перистомом.
Второй вид Bandia (Armidallis) equimontanensis С. et
О., 2002 (из Petrogale assimilis).
Подрод Кепдигипа Jankowski
subgen. n.
Полиморфные виды, в чистых популяциях возмож-
но развитие форм с ребром (нужен термин) из обыч-
ных особей. Виды и хозяева: Bandia (Kenguruna) tarn-
628
ALVEOLATA
mar C. et O., 2002 (типовой вид) — в Macropus eugenii;
В. (К.) deveneyi C. et О., 2002 — в Macropus robustus;
В. (К) smalesae С. et О., 2002 — в Macropus agilis.
Род Polycosta Cameron et O’Donoghue,
2003
Типовой видР. roundi. Тело удлиненно-оваль-
ное, перистом в виде неширокой почти продольной су-
бапикальной щели; нет кольца радиальных фрагмен-
тов кинет вокруг полости; глотка с опорными фибрил-
лами, образованными кинетами вестибулюма и
прилегающих сомакинет; в вестибулюме вершины ки-
нет, подходящих справа, на левой стенке ресничек нет.
Спиральные соматические ряды, разделенные широ-
кими ребрами, подходят к перистому, не образуя швов
(секант). Сзади глубокая выемка у цитопрокта. Хозяе-
ва видов: Р. roundi С. et О., 2003 — Wallabia bicolor;
Р. turniae С. et О., 2003 — Macropus dorsalis; Р. sebas-
topolensis C. et О., 2003 — Petrogale herberti; P. parma
C. et O., 2003 — Macropus eugenii. Это аберрантный
вид co сгущением ресничек в передней части 7 «дор-
сальных» кинет, образующих дифференцированный
щиток. Этот род выделен в новое сем. Polycostidae Ca-
meron et O’Donoghue, 2003 по комбинации призна-
ков — соматическая цилиатура, как у Amylovoracidae,
буккальная, как у Macropodiniidae.
Род Megavestibulum Cameron
et O’Donoghue, 2003
Типовой вид М. morganorum С. et О., 2003 из
Macropus dorsalis; также М. kuhri С. et О., 2003 из Wal-
labia bicolor; род отнесен к Macropodiniidae, но во
внешнем облике Megavestibulum и Macropodinium нет
ничего общего. Тело грушевидное, расширено в ниж-
ней половине; спереди обширная воронка, ведущая в
широкую полость (вестибулюм); стенки и края поло-
сти гибкие, растяжимые, могут смыкаться, поэтому в
фиксированном материале особи с щелевидным лате-
ральным ртом похожи на балантидиев (но имеют сет-
чатый панцирь); ротовая цилиатура плохо развита —
концы кинет незначительно входят внутрь у краев по-
лости. Сомакинеты многочисленные, кортекс с пра-
вильными рядами поперечных фибрилл, фактически
аргиром виден без импрегнации. Питание растениями
и другими цилиатами, это факультативный хищник с
гигантским ртом и слабым развитием фильтрационно-
го комплекса. Оба включенных вида однотипные, род
четкий и не делится на подроды.
Мною будет описан новый род из кенгуру Тас-
мании. В Тасмании раньше обследовали не только
преджелудок, но и пищевод у местных макроподид;
здесь тоже оказались цилиаты, и один из видов с длин-
ным, не сплющенным червеобразным телом пока не
был описан группой австралийских специалистов и не
числится в предварительном списке новых видов. Ки-
нетом в виде большого числа продольных кинет, рот
апикальный, с розеткой из мелких фрагментов кинет;
этот новый род принадлежит к группе Bitricha—Ату-
lovorax.
Род Macropodinium Dehority, 1996
Типовой вид М moiri. Дехорити, специалист по
энтодиниоморфам в США (Dehority, 1996), описал но-
вое семейство этого отряда — Macropodiniidae Dehori-
ty, 1996 с одним новым родом Macropodinium, вклю-
чавшим 5 новых видов из 4 видов 2 родов австралий-
ских кенгуру; дальнейшие исследования рода
проводились австралийскими специалистами (Камеро-
ном, Одонохью и Адлардом), открывшими ряд новых
видов и исключившими этот род и семейство из соста-
ва энтодиниоморф. Это наиболее аберрантный род
среди известных эндемиков Австралии, переходные
формы от более простых родов неоткрыты или вымер-
ли с хозяевами.
М. moiri — плоские овальные цилиаты с сетчатым
панцирем; на обеих сторонах кинеты слегка изогнутые
и пересекаются желобками, идущими не поперек ки-
нет, как обычно у цилиат (включая Megavestibulum в
тех же хозяевах), а по спирали; эти желобки легко имп-
регнируются методом Шаттона и хорошо видны у
фиксированных цилиат. На краях тела кольцо тесно
сближенных ресничных рядов, здесь у большинства
видов проходят широкие поперечно исчерченные же-
лобки, укрепленные фибриллами; начинаясь на посте-
роне у цитопрокта, они огибают все тело и заканчива-
ются у ротовой воронки. Желобки такого типа встре-
чаются в 2 других неродственных группах цилиат — у
морских гипостомат рода Chlamydodon (незамкнутые
или в виде кольца; «railroad track» английских авторов
у 2 смежных родов) и у паразитических астомат Сое-
lophrya и Dicoelophrya из дождевых червей Африки;
первый род астомат имеет одну краевую полосу с
опорными кольцами, второй две, и принцип разграни-
чения этих родов следует применить к Macropodinium.
Сходная боковая или вентральная продольная полоса с
легко видимыми поперечными фибриллами имеется у
Plagiopyla и у бючлииды Didesmis.
Ядро овальное, у перистома; вакуоль медиальная;
перистом по Дехорити — воронка с одним рядом
длинных ресничек (во много раз длиннее соматиче-
ских) на внутренней стенке справа или на дне. К насто-
ящему времени описаны виды из следующих хозяев
(только в Macropodidae; в вомбатах Lasiorhinus и Vo-
mbatus только новые неописанные пока виды Amylovo-
rax): Wallabia bicolor — Macropodinium bicolor С., О. et
А., 2001; Thylogale billardierii — M. marai С., О. et А.,
2001; Setonix brachyurus — M. moiri Dehority, 1996 (тип
рода), M. setonixium D.,1996, M. baldense D., 1996; Pet-
rogale godmani — M. petrogale С., O. et A., 2002, M. ti-
tan С., O. et A., 2002; нет видов рода в 3 других видах
Petrogale; Macropus rufogriseus — М. yalanbense D.,
1996; M. robustus subsp. erubescens — M. ennuensis D.,
1996, M. yalanbense; M. giganteus — M. yalanbense;
M. fuliginosus — M. yalanbense; M. eugenii — M. hallae
С., O. et A., 2002, M. ocallaghani С., O. et A., 2002;
M. dorsalis — M. tricresta С., O. et A., 2001, M. spinosus
С., O. et A., 2001. M. rufus — M. ennuensis.
Видов рода нет в 3 других видах Macropus; виды
Macropodinium yalanbense и М. ennuensis неспецифи-
ческие, все остальные встречаются только в одном
виде хозяина. Морфология однотипная, но виды отли-
чаются, в частности, по желобкам:
ТИП CILIOPHORA. КЛАСС PHYLLOPHARYNGEA
629
I) желобков нет — М. ocallaghani, М. yalanbense',
2) только правый желобок — М. petrogale, М. spi-
нони.ч, М, tricresta',
3) ТОЛЬКО левый желобок — М. ennuensis, М. titan',
4) желобки с обеих сторон тела — М. setonixium,
М, tntiirl (тип рода), М. hallae, М. marai, М. bicolor,
М Mdvnse.
Род можно разбить на 4 подрода, но по резуль-
1ЙТДМ кладистического анализа цельной группой яв-
ЛИ0ТС» только первая; эти 2 вида выделяются в новый
род Reikostoma Jankowski gen. n. с видами R. yalanben-
st> comb. n. (типовой вид) и R. ocallaghani comb. n. —
мпкроподинии без опорных желобков по обеим сто-
ронам плоского тела; остальные признаки как у ти-
пового вида макроподиниев. Следует подождать ре-
зультатов молекулярного анализа, чтобы проверить
монофилию групп видов и выделить подроды или ро-
ды у оставшихся видов Macropodinium. Для сем. Mac-
ropodiniidae предлагается новый отряд Reikostomatida
Jankowski ordo n. — плоские формы с сетчатым пан-
цирем, большинство видов с краевыми желобками; со-
матическая цилиатура в краевой полосе вокруг тела;
перистомальная цилиатура — фрагменты кинет у края
апикального желобка и ресничный ряд в вестибулюме.
Остальные роды цилиат из кенгуру пока не включают-
ся в состав отряда, положение их неясное.
Класс Phyllopharyngea Puytorac et al., 1974
Группа с большим морфологическим многообразием; общие
призпаки можно выявить на ультраструктурном уровне. Ресничная
итидия с соматическими кинетосомами типа монокинетид; каждая
имеет латеральную кинетодесмальную фибриллу, редуцирован-
ный (или отсутствующий) поперечный пучок микротубул, обычно
сопровождаемый поперечной фибриллой, направленной влево, и
постцилиарный пучок, идущий назад до соединения с пучками пе-
редних монокинетид. Субкинетальные немадесмы, имеющие вид
пучков фибрилл, отходят от соматических монокинетид, идут под
кинетами у циртофорид и хонотрих вперед, у ринходид и сукторий
назад. Ротовой отдел с радиально расположенными пучками мик-
ротубул (phyllae) вокруг просвета глотки; у циртофорид они за-
ключены в корзинку (циртум) из крупных палочковидных нема-
десм, состоящих из микротубул с гексагональной упаковкой и со-
единенных вместе в трубку филаментами у клеточной мембраны.
4 подкласса.
Подкласс Hypostomatia Schewiakoff, 1896
Трофонты подвижные, в основном обитатели бентоса; тело
сплющено, цилиатура сохранена только на вентральной стороне и
имеет тенденцию к дальнейшей редукции; на дорсуме лишь один
рудимент кинеты — тигмотактический ряд ресничек спереди.
Мембранелл (с поликинетами в основании) нет; ресничный рото-
вой аппарат — несколько кинет, сохраняющих структуру сомаки-
нст. Рот на поверхности тела, ведет в длинную трубчатую глотку
(эндофаринкс), на срезе которой видны радиальные пластинки
микротубул; эпифаринкс, если не утерян вторично, состоит из не-
многочисленных крупных палочковидных немадесм. Ядро гетеро-
мерное, 2 структурных типов — концентрическое у низших форм,
полярное у высших (тип Chilodonella и Dysteria).
Данный таксон был цельным и четким до включения в него
аберрантных Gymnozoum (-Kryoprorodon) из морского планктона,
в котором нет остальных (бентосных) форм с плоским телом и од-
носторонней цилиатурой (планктонный пресноводный род Phasco-
lodon произошел от бентосных форм и изменен незначительно).
Гипостоматы широко распространены в пресных водах и в море;
много облигатных симбионтов, часть родов включает только сим-
бионтные виды, другие — свободные формы и комменсалов (при-
мер — Chilodonella в бентосе и на рыбах). От этого подкласса про-
изошли независимо ринходиды и хонотрихи, а суктории могут
быть потомками ринходид.
Отряд Gymnozoida Jankowski ordo n.
В каталоге цилиат Линна (Lynn, 2002, Интернет) в
составе отряда Chlamydodontida Deroux, 1976 в под-
классе Phyllopharyngia среди семейств обычных гипо-
стомат с плоским телом и односторонней вентральной
цилиатурой (наиболее известный пример — Chilodo-
nella) приведено сем. Kryoprorodontidae с одним родом
Gymnozoum, очень резко отличающимся по всем при-
знакам от остальных родов отряда. Внешне это типич-
ные простоматы с овальным, не сплющенным телом;
рот апикальный, с длинной немадесмальной корзин-
кой (опорный элемент глотки); цилиатура полная, по
всему телу, но сложной топографии — часть кинет за-
ворачивает вправо ниже рта, оставляя значительный
безресничный участок на одной стороне (условно вен-
тральной); дорсальные кинеты достигают рта, осталь-
ные укорочены, заканчиваются под полосой изогну-
тых рядов. Ниже рта имеется также группа обособлен-
ных фрагментов, которые называют «адоральные
мембранеллы»; на другой стороне тела ниже рта лежит
короткий поперечный фрагмент монокинеты. Нет
стандартного для гипостомат комплекса ротовых ки-
нет, и одно это исключает принадлежность рода к ги-
постоматам. Стоматогенез у простомат наиболее про-
стой, телокинетический, у Gymnozoum усложнен, но не
напоминает таковой хилодонелл.
Сем. Gymnozoonidae пот. п.
(Gymnozoidae пот. согг.?) (рис. 325, а)
Прежнее название семейства — Kryoprorodontidae
Alekperov et Mamajeva, 1992, основано на невалидном
роде Kryoprorodon, который сейчас все авторы счи-
тают синонимом рода Gymnozoum. Петц (Petz et al.,
1995) замечает по этому поводу: «Согласно статье 40
ICZN (1985), название семейства не заменяется, хотя
оно не основано на типовом роде Gymnozoum. Однако
название семейства Kryoprorodontidae неудачное, по-
скольку оно предполагает родство с прородонтидами».
Среди цилиат больше нет таких случаев, в частности у
метопид название Gyrocorythidae, основанное на сино-
нимичном названии Gyrocorys, было заменено на Сае-
nomorphidae (валидный типовой род Caenomorpha),
и это не встретило возражений и было принято. Очень
нежелательно поэтому единственное исключение
для вышеназванного семейства. Это к тому же очень
редкий морской род, который изучали лишь несколь-
630
ALVEOLATA
Рис. 325, a. Gymnozoida.
Gymnozoum sympagicum (A—B); G. viviparum (Г—Ж);
«Spiroprorodon» garrison! (3—К). (По: Corliss, Snyder, 1986 (3—/0; Petz et al., 1995 (A—Ж)).
Fig. 325, a. Gymnozoida.
ко авторов, название малоизвестное и для таких таксо-
нов сохранять название, основанное на синониме, не
следует.
В составе семейства описано 3 рода, но 2 названия
(Spiroprorodon и Kryoprorodori) сейчас признаны сино-
нимами и семейство поэтому монотипическое. Диа-
гноз семейства совпадает с диагнозом отряда.
Род Gymnozoum Meunier, 1910
Типовой вид G. viviparum. Менье (Meunier,
1910) опубликовал двухтомник по результатам изуче-
ния фиксированных проб микропланктона Арктики,
по обе стороны от архипелага Новая Земля в Баренце-
вом и Карском морях; среди новых родов и видов по-
дробно описан Gymnozoum viviparum, зарисованный на
2 таблицах. Менье показывает типичную для Holoph-
rya и Prorodon форму тела — овальное или каплевид-
ное, не сплющенное, сужается к апексу; спереди рот с
длинной фибриллярной глоткой, местами извитой —
это пучок фибрилл, а не прочные прямые немадесмы; у
нижнего конца глотка расширяется и фибриллы схо-
дятся вновь. Кинетом простой, все ряды биполярные, что
показано у всех 30 зарисованных им особей. Питание
хищное, разными цилиатами, перидинеями и даже ко-
ловратками; в цитоплазме видны и мелкие особи того
же вида, что Менье считал признаком живорождения,
но это позже правильно истолковали как каннибализм.
Вид внешне обычного для простомат типа не при-
влек внимания цилиатологов; Каль (Kahl, 1930) привел
род в приложении к простоматам в списке цилиат не-
ясного положения в связи с тем, что ни на одном ри-
сунке Менье нет ресничек, хотя они зарисованы им у
всех других цилиат планктона. Кроме того, два рисун-
ка делящихся особей показывают «преждевременное»
(по Калю) образование рта сбоку задолго до перешну-
ровки особей; в норме у простомат рот обоих дерива-
тов деления полярный, у задней особи образуется при
перешнуровке томонта.
Точное описание вида дано в недавнее время, когда
уже были описаны синонимичные роды Spiroprorodon
и Kryoprorodon. Вид некрупный (65—100 мкм), тело
незначительно сплющено, несимметричное; имеется
24—40 сомакинет — 19—35 продольных, 4 извитых и
очень короткий изогнутый ряд в ацилоне, идущий по-
ТИП CILIOPHORA. КЛАСС PHYLLOPHARYNGEA
631
Рис. 325, б. Hypostomatida.
Chilodonella uncinata (A—В); Trithigmostoma cucullulus (Г, Д); Pseudochilodonopsis marina (E—3); Gastronauta derouxi (И, К). (По: Foissner, 1988a (А—Д);
Song, 1991 (E—3); Blatterer, Foissner, 1992 (И, K)).
Fig. 325, 6. Hypostomatida.
перек тела вдали от других кинет. Правее ацилона
ряды постепенно удлиняются. Ротовая цилиатура не-
типичная для простомат и для гипостомат — на дорсу-
ме короткий фрагмент, на венте 9 «мембранелл» — в
каждой группе одна дисома и фрагмент из 5 кинето-
сом. Макронуклеус гомеомерный, с нуклеолами. Ваку-
оль одна, в антесоме, с порой на дорсуме. Питание
хищное, другими цилиатами и особями своего вида
(каннибализм), также заглатываются диатомеи и фла-
геллаты — вид всеядный.
Род Gymnozoum ранее, когда не была известна то-
пография кинетома, относили к сем. Enchelyidae или
сем. Prorodontidae отряда гимностомат. Это непра-
вильно, так как нет обособленного участка кинет или
их фрагментов с короткими щетинками (тигмон), и не
все кинеты биполярные. Проведенное недавно изуче-
ние ультраструктуры показало принадлежность рода к
Phyllopharyngia — группе, включающей гипостомат,
ринходид и сукторий. Кроме того, Gymnozoum имеет
аргиром такого типа, как у хилодонелл. Рот несколько
поднят над телом, как у многих циртофорид и у всех
ринходид. Петц отмечает признаки сходства цилиату-
ры рода Gymnozoum и гипостомат типа Aegyriana и
Trichopodiellcr, поскольку у этих родов имеется секре-
торная органелла (железа) и мобильный придаток с
выводным каналом железы (стилон или подит). Петц
сохраняет Gymnozoum в особом семействе, помещая
его в состав циртофорид. Опорный аппарат глотки —
не фибриллы, как у Менье, а длинные немадесмы.
G. sympagicum Petz et al., 1995 — близкий вид, име-
ет меньше сомакинет, более крупный ацилон сзади
и вентрально, вакуоль экваториальная; центральный
фрагмент кинеты и поперечные ряды выше него рас-
положены почти на равных расстояниях и образуют
характерную систему, не встречающуюся у гипо-
стомат.
Род Spiroprorodon Fenchel et Lee,
1972
Типовой в ид б1, glacialis из рыхлого льда в море
Уэдделла в Антарктике, в зоне массового развития
микрофлоры, особенно диатомей. Пробы и культуры
632
ALVEOLATA
можно хранить в морозильнике в лаборатории при
-2 °C (морская вода замерзает при -4 °C); особи разру-
шаются при +5 °C и поэтому трудны для фиксации и
изучения. Особи очень крупные, 175—250 мкм, с три-
хоцистами в антесоме; рот и глотка широкие с боль-
шим числом (минимум 22) тонких длинных изогнутых
«трихитов», почти достигающих постерона. Сомаки-
неты многочисленные (38), продольные, с короткими
ресничками, кинетосомы в рядах тесно сближены; 5
рядов аллометрически удлинены вправо, преграждая
доступ к апексу примерно для половины униполярных
рядов. Ядро округлое, вакуоль у постерона.
В обсуждении род Gymnozoum не упомянут, новый
род сближен с Helicoprorodon и отнесен к сем. Enche-
lyidae. Вероятно, рисунки вида неправильные — не по-
казан ацилон сзади и вентрально, нет поперечного
фрагмента, правые ряды не укорочены в нижней части
тела. Вследствие трудностей фиксации даже переох-
лажденным осмием импрегнировано (методом Шатто-
на) мало особей, вероятно поэтому картина кинетома
неправильная.
S', garrisoni Corliss et Snyder, 1986 описан по мате-
риалу в том же секторе Антарктики; материал фикси-
рован методом Буэна и импрегнирован протарголом.
Картина кинетома у типового вида рода признана до-
стоверной, и поэтому вид с другим типом цилиатуры
признан новым, но фактически это лишь более точное
описание морфологии Gymnozoum. Судя по различию
размеров (45—90 мкм у 5. garrisoni), это не тип рода
S. glaciale. Вид имеет 25 кинет, 4 ряда удлинены и
смыкаются с противоположными кинетами; на венте и
у нижнего конца тела широкий ацилон; дуговидная по-
перечная кинета смещена далеко вниз, удалена от
группы изогнутых апикальных рядов. Протаргол выяв-
ляет обширную глотку со сплошной стенкой, расши-
ренную у постерона. Вокруг рта, с одной стороны, мо-
нокинета, с другой — группы коротких фрагментов с
парами кинетосом у каждого. У этого вида изогнутые
кинеты практически полностью огибают рот, а у G. vi-
viparum лишь половину тела. Вид валидный.
Ядро у видов семейства рисуют овальным или поч-
ковидным, часто с перетяжкой, делящей ядро на не-
равные части. Петц считает ядро гетеромерным, но
четко это не показано; у гипостомат со стилоном, с ко-
торыми он сближает род Gymnozoum, ядро септимер-
ное, из 2 отделов неравной длины.
S'. intermedius Agatha, Spindler et Wilbert, 1993 со-
бран в Арктике, распределение отряда биполярное; то-
пография кинетома типичная для Gymnozoum.
Род Kryoprorodon Alekperov et Mamajeva,
1992
Типовой вид К arcticum. Обычный вид в пробах
арктического планктона в районе Чукотки и Аляски
(Берингов пролив); размеры тела 150—250 мкм, рот с
15—16 трихитами, глотка массивная, до постерона,
ядро гомеомерное, вакуоль с порой в постесоме. На
венте широкий ацилон, у постерона расположение ки-
нетосом неправильное, но ацилона нет; не отмечена
поперечная дуговая кинета; в остальном кинетом та-
кой же, как в более точной статье Петца. Ряды правее
ацилона снизу укорочены, вправо заворачивают 4 ря-
да, 3 из них огибают половину тела, 13 дорсальных ря-
дов биполярны; у рта полоса фрагментов кинет.
Питание диатомеями и олиготрихами рода Strombi-
dium.
При описании нового рода Gymnozoum не упомина-
ется, не назван и тип рода Spiroprorodon, только вто-
рой вид S. garrisoni, перенесенный в состав рода Kry-
oprorodon. Новое сем. Kryoprorodontidae помещено в
отряд Prorodontida.
Петц (Petz et al., 1995) перенес все виды в состав
Gymnozoum и привел определительную таблицу валид-
ных видов G. glaciale, G. arcticum, G. intermedium,
G. sympagicum и G. viviparunr, пока нет общих видов в
Арктике и Антарктике, в этих районах эволюция идет
независимо. Переходные формы от простомат к Gym-
nozoum и от последнего к гипостоматам неизвестны.
Отряд Chlamydodontida Deroux, 1976
(рис. 325, 6—327, а)
Вентральная сторона широко открытая, не сверну-
та в желобок; цилиатура относительно хорошо разви-
та; у нижнего конца тела нет секреторной железы и нет
наружного выводящего канала в структуре, называе-
мой стилон или подит. Вентральное поле ресничек
ниже перистома часто разделено на 2 поля, правое и
левое, продольной безресничной полосой (ацилоном).
Ядро 2 типов, цикломерное и полярное (септимерное),
соответственно с концентрическим или линейным по-
ложением светлой и темной зон с разной конденсацией
хроматина.
Сем. Chilodonellidae Deroux, 1970
Соматическая цилиатура равномерно покрывает
вент или собрана в 2 краевые полосы; нет никаких
структур в зоне, где появляется фиксаторная ямка,
железа или стилон у других гипостомат. В данном от-
ношении это наиболее примитивная группа родов от-
ряда хламидодонтид. Центральная кинета (здесь край-
не правый ряд левой полосы) укорочена, ниже ее до
постерона ровная пелликула с сеткой ячеек аргирома.
Рот округлый, не растянут поперек тела; ротовые ки-
неты удлинены, но не прерывают правых сомакинет.
Род Chilodonel/а Strand, 1928
Типовой вид Chilodon uncinatus Ehr., 1838; заме-
щающее название для гомонима Chilodon Ehr., 1831
(Mollusca). Эренберг сам заметил гомонимию и ис-
пользовал название Euodon Ehrenberg, 1835, но позже
объявил его ошибкой (Schreib-fehler); эта статья цити-
руется 1833, 1834и 1835 гг., название дано только в со-
четании с Kolpoda cucullulus - Loxodes cucullulus. Хотя
была попытка восстановить название Euodon как
валидное (Е. siegelae Marcus, 1943), она не замечена
и забыта.
Название Metastoma Jank., 1976 предложено для
Ch. uncinatus, поскольку при разделении рода на два
ТИП CILIOPHORA. КЛАСС PHYLLOPHARYNGEA
633
самостоятельных — типовым для Chilodon считали
вид не «cucullulus», a «.uncinata». Это, по Аэшт, ошиб-
ка; кроме того, название Metastoma опубликовано в те-
зисах и является гомонимом, поэтому вдвойне непри-
годно.
Типовой вид Ch. uncinatus — одна из самых рас-
пространенных цилиат в пресных водах, вид всегда по-
является на дне и на поверхностной пленке настоев, в
пробах почвы, мхов, опавших листьев, в любых типах
континентальных вод — это мелкие плоские бесцвет-
ные формы, питающиеся бактериями (более крупные
хилодонеллиды предпочитают диатомей). Точная кар-
тина кинетома была впервые выявлена методом Клей-
на — это первый вид цилиат, импрегнированный на
сухих нефиксированных мазках. Позже кинетом и сто-
матогенез вида описан многими авторами. Род круп-
ный, поэтому важно точно установить признаки типо-
вого вида. Кинеты в 2 полосах, 4 справа и 5 слева, уко-
рачиваются от оси тела в обе стороны, особо резко в
левой полосе; кинетом меняется непрерывно, к момен-
ту деления возникают мелкие дополнительные ряды.
Ротовая цилиатура — 2 околоротовых изогнутых ряда
и почти прямой длинный ряд от рта к левому «клюву».
Хорошо развит циртум с немадесмами, имеются 2 ва-
куоли по диагонали, ядро гетеромерное концентриче-
ского типа, аргиром сетчатый.
Накопилось много описаний видов, кинетом кото-
рых не был точно выявлен, и виды остаются неопреде-
лимыми. Виды Ch. longidens Nemec, Ch. porcellionis
Dogiel et Fursenko по ошибочным рисункам кинетома
заслуживают новых родов, но изучение их (это симби-
онты наземных изопод — мокриц) не выявило замет-
ных отличий от Ch. uncinatus. Примеры видов: Ch. ар-
lanata Kahl, 1932; Ch. capucina (Penard, 1922) (часто ас-
социирован c Gammarus и Asellus, но обитает и
свободно в бентосе); Ch. dentatus (Ehr., 1833) (на-
звание было широко принято, вид считался валидным,
отличия от Ch. uncinata — по типу циртума, но это
ошибка); Ch. dorsisuprema F., 1980 (синоним вида
Ch. uncinata?); Ch. longidens (Nemec, 1895) (с мокриц,
в первоописании с кольцевой полосой кинет), Ch. те-
galotrochae (Stokes, 1884); Ch. minuta Dragesco, 1966;
Ch. porcellionis (Dogiel et Furssenko, 1921; на мокри-
цах Oniscus, Porcellio, Tracheoniscus, с нетипичным
положением левой вакуоли, прямой глоткой, дуговид-
ной полосой кинет); Ch. rotundus (Lepsi, 1947); Ch. tur-
gidula (Penard, 1922); Ch. uncifera Tucolesco, 1962;
Ch. serpentis sp. n. (=Chilodon cyprini var. serpentis Fant-
ham et Porter, 1950, в змеях Naja nivea, Boaedon linea-
tum, Ablabophis rufulus, Trimerorhinus tritaeniatus в
ЮАР; плохо описанный вид с широким ацилоном,
число кинет больше, чем у Ch. uncinata; считается па-
тогенным эндопаразитом в кишечнике); Ch. siegelae
comb. n. (Euodon in Marcus, 1943, симбионт олигохет в
Бразилии).
На рыбах пресных вод описаны 2 неспецифических
к определенным хозяевам, широко распространенных
вида Chilodon cyprini Moroff, 1902 и Ch. hexasticha Ki-
emik, 1909; эти названия приняты, но первое заменено
мною на более раннее, оставшееся незамеченным на-
звание Chilodon piscicola Zacharias, 1894 (с Albur-
nus sp.), и это название, опубликованное Шульманом
(1984), теперь принимается вместо позднего синони-
ма. Другие синонимы — Ch. brasiliensis Carini, 1931;
Ch. truttae Moore, 1934; Ch. titowi Lukjanceva, 1972.
Вид Ch. hexasticha, многими вначале не признавав-
шийся, — реальный вид, имеет 4—10+ 4—8 кинет
(справа и слева) и широкий ацилон между ними, пред-
почитает взрослых рыб; Ch. piscicola имеет 7—15 +
8—14 кинет, встречается на мальках и мелких рыбах;
между видами много других различий. Питание муку-
сом и бактериями на покровах рыб, виды можно счи-
тать паразитами.
Род Trithigmostoma Jankowski, 1967
Типовой вид Kolpoda cucullulus Muller, 1786.
Вид, обычно относимый ранее к Chilodonella. В преж-
нем объеме род Chilodonella не имел определенной ха-
рактеристики, поэтому он распался на несколько чет-
ких родов. Вид Т. cucullulus тоже обычен, но не заселя-
ет бактериальную пленку культур, ищет на дне
диатомей и мелких беспанцирных водорослей; разме-
ры более крупные, чем у Ch. uncinata, число кинет
больше, около 20, и распределены они равномерно по
всему венту, без полосы ацилона. В остальном роды
сходные по топографии кинет правее и левее рта, по
наличию 3 неравных предротовых кинет, по типу ядер;
у обоих имеется мелкий фрагмент кинеты спереди на
дорсуме — тактильная органелла. Родовое название
означает, что 3 ротовые кинеты гомологичны 3 кине-
там тигмона у предковых простомат. Встречаются
виды Trithigmostoma с постоянным слоем слизи на
теле (Т. alpestris, Т. pituitosum), с незначительным раз-
растанием дорсума (Т. marginata).
Число видов рода постепенно возрастает при изу-
чении известных хилодонелл и открытии новых видов.
Основные биотопы — любые типы пресных вод, поч-
ва, мох; часты в зонах развития диатомей и цианофит;
легко инцистируются и переносят мороз и высыхание.
Виды хилодонелл встречаются на беспозвоночных и
рыбах, есть и вид из змей — Ch. serpentis; виды Trithig-
mostoma только свободноживущие; оба рода отсутст-
вуют в море. Нередкие указания на наличие Т. cucullu-
lus в солоноватых водах не доказаны точными рисун-
ками вида, определения нельзя проверить.
Примеры видов: Т. alpestris F., 1979; Т. bavariensis
(Kahl, 1931); Т. chattoni (Mac Dougall, 1936); T. hyalina
(Kidder et Summers, 1935) (симбионт морских амфи-
под-талитрид, вероятно, не принадлежит к этому
роду); Т. illinoisensis Small et Lynn, 1985; T. marginata
(Sramek-Husek, 1957); T. pituitosum F., 1979; T. plicata
(Tucolesco, 1962 in Chilodonella') comb, n.; T. spiraliden-
tis (Bhatia et Mullick, 1930); T. srameki F., 1988 (=Chilo-
donella hyalina in Sramek-Husek 1952, гомоним); T. stei-
ni (Blochmann, 1895; считался синонимом, но это са-
мый крупный вид рода с наибольшим числом кинет,
около 30).
Род Chlamydodontopsis Ghosh, 1921
Под названием С. bengalensis Ghosh, 1921 описана
типичная Trithigmostoma, поэтому важно выяснить,
пригодно ли это родовое название для замены более
634
alveolata
Рис. 326, a. Hypostomatida.
Odontochlamys gouraudi (A—B); Trithigmostoma sratneki (Г, Д); T. steini (E); Gastronauta membranaceus (Ж, 3); «Gastronauta» clathratus (И). (По: Foissner,
1988a (A—By, Blatterer, Foissner, 1992 (Г—Е, 3); Deroux, 1978a (Ж, И)).
Fig. 326, a. Hypostomatida.
позднего. Род Chlamydodontopsis Ghosh, 1921 упомя-
нут в нескольких сводках, но, по Аэшт, это не новый
род Гхоша, а неправильное цитирование названия Chi-
lodontopsis Blochmann, 1895. Название Trithigmostoma
поэтому валидное. Каль (1931) приводит вид в составе
рода Chilodontopsis, но считает эту форму, вероятно,
видом Chilodonella sensu lato. Позже вид упоминался
только в составе Chilodonella как валидный. Это круп-
ный вид рода Trithigmostoma, примерно с 30 кинета-
ми — явный синоним вида Т. steinii (Blochmann, 1895).
Род Trichodon Fromentel,
1874
Предложен для 2 новых видов без указания типа —
Т. ciliatus и Т. acuminatus’, родовой признак — наличие
очень длинной циррусовидной щетинки у рта (это
предротовая мембрана Ml). Хотя соматический кине-
том не изучен, по форме тела и размерам легко узнать
обычнейшие виды Ch. uncinata и Ch. cucullulus. Назва-
ние Trichodon нельзя использовать как более раннее
для замены названия Trithigmostoma, поскольку это
гомоним. Как типовой вид рода здесь обозначается
Trichodon acuminatus Fromentel, 1874; это мелкие
формы с сужением тела у постерона, 2 вакуолями по
диагонали; кинетом у обоих видов не изучен, но у
крупного вида Т. ciliatus показан единый кольцевой
ресничный ряд вокруг тела и несколько вакуолей, зад-
ний конец тела расширен, это бесспорно Trithigmo-
stoma cucullulus. Итак, Trichodon — синоним рода Chi-
lodonella.
Род Odontochlamys Certes,
1891
Типовой вид О. gouraudi. Вентральная сторона
тела плоская, кинетом и ротовой аппарат, как у мелких
хилодонелл, поэтому род Odontochlamys долгое время
не считали валидным; циртум, ядра, число и положе-
ние вакуолей, топография кинет — все сходное, но у
данного рода причудливо разрастается вздутый до-
рсум, у типового вида образует звездчатую структуру
с желобками и ребрами, у О. convexa в виде простого
крышевидного выроста тела с неровным контуром.
Виды легко можно найти в настоях опавших листьев, в
пробах мха и почвы, это аэрофилы, в отличие от хило-
ТИП CILIOPHORA. КЛАСС PHYLLOPHARYNGEA
635
Рис. 326, б. Hypostomatida.
Thigmogasterpardus (А, Б); Th. potamophilus (B—Ey. Odontochlamys alpestris (Ж, 3); Chlamydodon mnemosyne (И, К). (По: Deroux, 1978a (A—B); Blatterer, Fois-
sner, 1992 (Ж, 3); Foissner et al., 1991 (Г—£); Dragesco, Dragesco-Kemeis, 1986 (If, K)).
Fig. 326, 6. Hypostomatida.
донелл, обильных в гниющей воде. Число видов ранее
монотипического рода сейчас увеличилось, поэтому
очень важно установить признаки типовой формы
рода. О. gouraudi имеет 5 + 6 кинет (полосы R и L) из
моносом по всей длине; 3 предротовые кинеты в точ-
ности как у Ch. uncinata, из дисом по всей длине; пора
правой вакуоли высоко, почти у рта; тигмокинета до-
рсально у апекса, из разрозненных моносом. Дорсаль-
ное вздутие — горб (hump) с широкими радиальными
выростами с боков и сзади, вершина которых имеет
сложный рельеф.
Примеры видов: О. geographicus (Penard, 1922 in
Chilodoriy, О. alpestris F., 1981; О. convexa (Kahl, 1931
in Chilodonella').
Род Pseudochilodonopsis Foissner,
1979
Типовой вид Chilodonpiscatoris Blochmann, 1895,
относимый ранее с другими сходными видами к роду
Chilodonella. Вновь можно сказать, что это почти по
всем признакам типичные хилодонеллы, за исключе-
нием одного признака — строения мембраны Ml. Тело
плоское вентрально, умеренно выпуклое дорсально, у
одного вида с шиповидным выростом дорсума; часто
особи вытянутые, с заостренным постероном. Сомати-
ческий кинетом, ядра, циртум, мембраны М2 и М3 как
у хилодонелл; размеры крупнее, поэтому это не бакте-
риотрофы, а альгофаги, питаются более крупной добы-
чей. Ml фрагментирована на 4—6 фрагментов, распо-
ложенных в линию или ступеньками; независимо от
типа фрагментации такие виды выделяются в данный
род. У нассулид линейное или ступенчатое расположе-
ние пектинелл сейчас считается родовым признаком,
поэтому можно ожидать дробления рода Pseudochilo-
donopsis. При установлении рода в его состав были
введены виды хилодонелл Р. piscatoris, Р. algivora,
Р. acuta и не вполне соответствующий им вид Ch. plu-
rivacuolata.
Примеры видов: Р. piscatoris (Blochmann, 1895);
Р. kloiberi F., 1979 (синоним предыдущего?); Р. algivo-
ra Kahl, 1931; Р. marina Song, 1991 (единственный
морской вид, обычен в Крыму); Р. similis Song et Wil-
636
ALVEOLATA
Рис. 327, a. Hypostomatida.
Alinostoma (ранее Chilodonella) plurivacuolata (A); Lynchella nordica (Б, Ж); Coeloperix diremptum (B); Chlamydonella galeata (Г, Д); «Lynchella» tentaculata
(E); Atopochilodon distichuni (3, И). (По: Deroux, 1976b (3, И), 1978a (Б—Ж); Deroux, Dragesco, 1968 (7)).
Fig. 327, a. Hypostomatida.
bert, 1898; P. macrostoma comb. n. (Chilodonella
in Sramek-Husek, 1954); P. acuta K., 1932; P. mutabilis
F., 1981 (этот вид можно выделить в особый под-
род, поскольку фрагменты не ступенчатые); P.fluvi-
atilis F., 1988; Р. carinata comb. n. (Chilodonella in Vu-
xanovici).
Род Alinostoma Jankowski,
1980
Типовой вид Chilodonella plurivacuolata Deroux
et Dragesco, 1968; по Аэшт, это синоним вида Pseudo-
chilodonopsis piscatoris, типа предыдущего рода и поэ-
тому название невалидное. Это ошибка, виды резко
различаются по всем признакам. Типовой вид нетипи-
чен для других видов Pseudochilodonopsis, поэтому на-
звание Alinostoma можно использовать при разделении
рода на подроды. У A. plurivacuolata тело очень длин-
ное и узкое, нетипичной формы для хилодонелл, с уве-
личением числа кинет в обеих полосах и большим чис-
лом вакуолей в 2 рядах; полоса фрагментов не ступен-
чатая, почти линейная (у Р. piscatoris ступенчатая).
Примеры видов: A. multivacuolatum Alekperov, 1993;
A. polyvacuolatum (Foissner et Didier, 1981).
Род Thigmogaster Deroux,
1976
Типовой вид Г. pardus по монотипии; тело изог-
нутое, почковидное, дорсум слегка вздутый, с неров-
ным краем; циртум, ядра, как у хилодонелл. Имеются
3 ротовые мембраны, но Ml короче, чем у хилодонелл.
Кинеты немногочисленные, также хилодонеллидного
типа по числу и положению, но полосы кинет сближе-
ны, ацилон очень узкий, фактически отсутствует одна
осевая послеротовая кинета. Кинеты левой полосы на-
много короче правосторонних. Питание микроводо-
рослями; морской вид. Основной родовой признак, ве-
роятно, укорочение Ml и сужение ацилона, осталь-
ное, как у хилодонелл. Ml у хилодонов достигает
ТИП CILIOPHORA. КЛАСС PHYLLOPHARYNGEA
637
Рис. 327, б. Hypostomatida.
Trochilioides fdans (TrochiliaT) (A—By Trochilia petrani (Г), Trochilioides bathybius (Д—Ж); Trochilioides tenuis (3); Chlamydonyx paucidentatus (И, ICy, Wil-
bertella (ранее Parachilodonelld) distyla (Л, M). (По: Deroux, 1976a (3—K), 1978a (A—Жу Patsch, 1974 (Л, M)).
Fig. 327, 6. Hypostomatida.
вершины клюва, у Thigmogaster к клюву подходят вер-
шины 3 апикальных кинет. Род более част в пресной
воде.
Примеры видов: Т. potamophilus F., 1988; Т. nanus
Song et Wilbert, 1989; T. oppositevacuolatus Augustin et
Foissner, 1989.
Род Chilodonatella Dragesco,
1966
Типовой вид Ch. minuta, редкий пресновод-
ный вид (около 20 мкм) со вздутым телом, одной ваку-
олью, гомеомерным ядром; рот на поверхности тела,
ведет в массивный циртум; 4 кинеты огибают апекс в
виде цельной дуги, нет полос правых и левых кинет.
Вид изучен без импрегнации, во всем нетипичен для
гипостомат. Повторное описание Ch. minuta (импрег-
нация протарголом), вероятно, не относится к этому
виду.
Подсем. Phascolodontinae Jankowski
subfam. n.
Пелагические формы с широко открытой воронко-
видной вершиной тела и вздутым дорсальным отде-
лом; вентральная сторона ниже рта имеет вид желобка.
Род Phascolodon Stein,
1859
Типовой вид Ph. vorticella, некрупные формы
(60—90 мкм) из толщи воды пресных вод; хорошо изу-
ченный вид, переописанный при импрегнации. Апекс
резко расширен, по его внутренней стенке идут дугой
2 надротовые сомакинеты, а 2 крайне правые проходят
по наружной части стенки воронки; ниже их на дорсу-
ме длинная поперечная тигмокинета. Такая дифферен-
цировка обеспечивает плавание и питание при перехо-
де от бентоса к пелагиали. На всем теле сохраняется
аргиром — мелкоячеистая сеть кортекса. Формула ки-
нетома R5, L7, SO 2 + 2 (5 рядов справа, 7 слева, 2 сна-
638
ALVEOLATA
ружи и 2 внутри воронки над ртом). Кинеты обеих по-
лос сближаются, дос читают постерона в виде компакт-
ного поля. Ротовая цилиатура видоизменена, но в
морфогенезе воспроизводится комплекс типа Chilodo-
nella. Рот смещен к краю воронки; циртум прямой, с
немадссмами; 2 вакуоли лежат по диагонали. Описан
процесс ипцистирования. Питание всеядное, в частно-
сти планктонными микроводорослями.
Другие виды: Ph. contractilis Kahl, 1926 — более
мелкий вид, более плоский, с быстрым движением и
сокращениями тела при вращении, тело в желобках;
Ph. limneticum Gelei, 1954 (вероятно, синоним типово-
го вида) — мелкий вид (50—60 мкм), в остальном
строение типичное. По Дингфельдеру (Dingfelder,
1962), в крупных водоемах живет типичная форма, в
лужах мелкая форма вида.
Сем. Chitonellidae Small et Lynn, 1985
Сидячие формы со складчатой раковиной, ве-
роятно секретируемой на дорсуме; кнаружи обращена
вентральная сторона. Кинеты в 2 полосах, имеется
циртум, ротовая цилиатура — полоса кинетосом
над ртом.
Род Chitonella Small et Lynn, 1985
Типовой вид Ch. chesapeakensis S. et L., 1985,
очень кратко описанный вид с 3 мелкими рисунками,
из соленого марша. Раковина низкая и очень широкая
у вершины, с небольшим фиксоном, края раковины в
поперечных складках. Трофонт лежит в раковине вен-
том вверх, при импрегнации выявляются 2 (правиль-
нее 4, в двух парах) кинеты справа и 4 слева; над ртом
поперечная дуга из дисом; тигмокинета с 5 кинетосо-
мами; ядро округлое, гетеромерное; 2 вакуоли лежат
по диагонали; рот и циртум типичные. Нужно повтор-
ное изучение вида.
Сем. Lynchellidae Jankowski, 1968
Семейство было предложено для рода Lynchella с
глубокими вырезками в панциревидном кортексе; сей-
час в него включают формы со сплошной вентральной
цилиатурой (без ацилона), с нетипичным для хилодо-
нов ресничным ротовым аппаратом — кинетами раз-
ной длины, уходящими вправо и пересекающими со-
макинеты.
Род Chlamydonella (N 2) Petz, Song
et Wilbert, 1995
Типовой вид Chlamydonella (N 1) pseudochilo-
don Deroux, 1970. Трудно иначе цитировать типовой
вид, когда новый род носит то же название — обычная
практика у цилиат («принцип Венцеля»), Жильбер
Деру в серии блестящих работ и в диссертации (Dero-
ux, 1978b) описал новыми методами множество гипо-
стомат, но часто не обозначал тип рода; новый род
Chlamydonella при первоописании включал 2 вида —
Ch. pseudochilodon и Ch. galeatw. типовой вид указан,
но Аэшт считает диссертацию неопубликованной ра-
ботой, хотя это очень спорно. Авторы рода N 2 обозна-
чили как типовой вид Ch. pseudochilodon и перенесли в
состав своего рода 5 видов рода.
Примеры видов: Ch. pseudochilodon (Deroux, 1970);
Ch. alpestris (F., 1979); Ch. galeata (Deroux, 1970);
Ch. minuta (Patsch, 1972); Ch. polonica (Foissner et al.,
1981) comb, n., Ch. stricta Deroux, 1976; Ch. rostrata
(Vuxanovici, 1963). Вероятно, пресноводный вид Chi-
lodonella kahli Tucolesco, 1962 тоже принадлежит к
данному роду (Chlamydonella kahli comb. n.).
Аберрантный вид — Ch. prostomata Song et Wilbert,
2000 из льдов Антарктики; тело вытянутое, дуговые
кинеты сдвинуты на дорсум, рот растянут в стороны;
вместо стандартной надротовой Y-кинеты видны
фрагменты в ступенчатом, не линейном ряду. Хотя ав-
торы вида считают признак несущественным в родо-
вом плане, можно выделить подрод Sowilonix Jankows-
ki subgen. п. в составе рода Chlamydonella с типовым
видом Ch. prostomata с указанным отличием от осталь-
ных видов рода.
Род Chlamydonellopsis Blatterer
et Foissner, 1990
Типовой вид Ch. plurivacuolata из пресных вод.
Форма тела, топография кинетома как у предыдущего
рода; родовой признак — наличие мелких щупальце-
видных придатков, рассеянных в беспорядке по всему
венту. Вентральные кинеты в сплошном поле, без за-
метного ацилона; верхние дуговидные ряды поворачи-
вают к клюву. Импрегнируются поры 4 вакуолей. Над-
ротовой ряд один, незначительно фрагментирован, пе-
ресекает правые кинеты. Щупальца изучались в
электронном микроскопе (Lynn, Foissner, 1994); нет
радиальных септ — полос микротубул, имеющихся у
сукторий; внутри щупалец мелкие экструсомы. В заго-
ловке и по всему тексту статьи род пишется только как
Pseudochlamydonellopsis, но такого рода нет.
Род Atopochilodon Kahl, 1933
Типовой в и д Л. arenifer из морского псаммона;
мелкие формы (20—40 мкм) с зубцами левее рта и на
постероне. Каль показывает удлиненное септимерное
ядро, 2 вакуоли по диагонали, сплошное поле вент-
ральных кинет, дуги ресничек выше рта и пересечение
нижней из их правых кинет; ясно, что это линчеллиды
типа Chlamydonella. Вид, нередкий в пробах Каля, по-
вторно никем не найден; изучен другой вид A. distic-
hum Deroux, 1976. Это вид с нешироким продольным
ацилоном (Каль мог не заметить этой полосы), 2 поля-
ми кинет (8 + 6); над ртом типичная двойная кинета,
обозначаемая иногда в литературе как Y-кинета. Деру
(Deroux, 1978b) включил этот род в подсем. Chlamydo-
nellinae сем. Chlamydodontidae по принятой им схеме
классификации, вместе с Lynchella, Gastronauta и
Chlamydonella. Не исключена идентичность типового
вида и A. distichum.
ТИП CILIOPHORA. КЛАСС PHYLLOPHARYNGEA
639
Род Lynchella N 2 Jankowski, 1968
Каль предложил род Lynchella N 1 Kahl, 1933 для
2 видов без указания типа —• L. gradata и L. aspidisci-
formis', виды очень резко отличаются по морфологии и
несомненно не относятся к одному роду. Мною был
указан типовой вид L. gradata Kahl, 1933, и по новым
правилам автор, который обозначил тип для рода,
предложенного после 1931 г., становится автором
рода.
Lynchella sensu lato — набор всевозможных форм,
сейчас распался на серию родов. Роды, предложенные
мною для известных видов в тезисах, признаны нева-
лидными. Тип рода не изучался; это мелкая форма
(50—60 мкм) из морского бентоса, как и все последую-
щие виды и роды линчеллид; панцирь закруглен
сверху, заострен снизу; с очень глубокими боковыми
желобками — внутри створок тело прикреплено толь-
ко в 2 участках к краям панциря. Кинетом сплошной,
ротовые кинеты не выявлены, правые ряды не прерва-
ны; снизу слева подобие стилона.
L. nordica (Jankowski, 1968) comb. n. — панцирь та-
кой же формы, с глубокими желобками, все правые ки-
неты прерваны. Вид изучен при импрегнации протар-
голом; выявлена надротовая Y-кинета (слегка фраг-
ментированная); нет щупальцевидных придатков
кортекса. Предлагалось перенести вид в состав Chla-
mydonella (Song et Wilbert, 2000), но главный признак
Lynchella — глубокие боковые желобки и уникальная
форма панциря, а не кинетом.
L.fencheli (Jankowski, 1968) comb. n. — крупный
вид с большим числом кинет, слоем экструсом, с та-
ким же типом панциря и разрывом всех правых кинет.
L. cypris (Jankowski, 1968) comb. n. — мелкий вид с
таким же панцирем и разрывом всех правых кинет; от-
мечены придатки панциря у L. psammophila (Vacelet,
1961) comb. n.
Род Lynchellodon Jankowski, 1980
Типовой вид Chlamydodon lynchelliformis Bor-
ror, 1972; тело равномерно закруглено, без шипов и же-
лобков панциря; кинетом не изучен достаточно точ-
но, не показана надротовая кинета, нет разрыва пра-
вых кинет; ядро септимерное; по всей периферии тела
проходит широкая исчерченная полоса — опорный
аппарат с дугами фибрилл (аналогия с Chlamydodon).
По сочетанию этих признаков вид выделен в но-
вый род.
Lynchellodon eforianus comb. n.
(^Lynchella eforiana Tucolesco, 1962).
Несомненно, это тот же вид, нет почти никакой разницы в опи-
саниях и рисунках; у L. lynchelliformis лучше показана топография
кинет. Если не будет возражений, это тип рода, а вид Боррора —
синоним.
Род Flectocarina Jankowski, 1976
Типовой вид Lynchella dirempta Deroux, 1970.
Название невалидно, по Аэшт, поскольку предложено
в тезисах. См. Coeloperix.
Род Coeloperix Gong et Song, 2004
Типовой вид Lynchella diremptum Deroux, 1978.
По Аэшт, название невалидно, поскольку содержится
в диссертации — «in doctoral thesis, thus an unpublished
work». Диссертацию Деру (Deroux, 1978b) можно счи-
тать опубликованной книгой; часто ее датируют
1976 г. По всему краю овального тела проходит глубо-
кий желобок с опорной арматурой — многочисленны-
ми фибриллярными кольцами; вентральный кинетом
стандартного типа — поле кинет ниже рта, надротовая
Y-кинета и все правые кинеты фрагментированы. Если
это название нельзя принять, валидно название Lync-
hellodon.
Вид Lynchella aspidisciformis Kahl, 1933 был вклю-
чен в состав Flectocarina, но Аэшт объявила род нева-
лидным, как предложенный в тезисах. Это вид с таким
же желобком, как у рассматриваемых здесь родов, но
также с придатком тела снизу слева (крупным щупаль-
цем). Если не считать это важным отличием, можно
включить вид в состав двух «конкурентных» родов —
Lynchellodon aspidisciformis comb. п. и Coeloperix aspi-
disciformis in Gong et Song, 2004.
Род Paralynchella Jankowski gen. n.
Типовой в ид Lynchella tentaculata Deroux, 1976.
Тело очень широкое, с полимеризацией кинет, разры-
вом всех правых кинет при удлинении надротовой
Y-кинеты. Рот щелевидный, растянут в стороны; ядро
округлое; по краям тела такие же глубокие желобки
без опорного обруча, как и у типа рода Lynchella; тиг-
мокинета в 2 сегментах. Внизу в зоне разрежения ки-
нетосом прикреплены 6 массивных гибких тактильных
«щупалец».
Сем. Gastronautidae Deroux, 1994
Некрупные хилодонеллиды с длинным щелевид-
ным ртом, растянутым поперек тела и пересекающим
часть правых кинет; кинетом полный; продольный
ацилон, если имеется, неширокий; дорсальная тигмо-
кинета фрагментирована. Ротовой ресничный аппарат
отличается от хилодонеллидного типа, гомологию
провести трудно; имеется цельная замкнутая кинета
вокруг рта, и вероятно, 1—2 ряда выше нее соответст-
вуют надротовым кинетам хилодонелл.
Род Gastronauta Engelmann in Butschli,
1889
Типовой вид G. тетЬгапасеа (сейчас приня-
то написание G. membranaceus'). В литературе автор
и год всегда указывались неверно; Бючли (Butschli,
1889) использовал неопубликованные материалы
Энгельманна, который должен считаться автором
рода.
Тело овальное, ядро разной формы, цикломерное;
2 вакуоли лежат по диагонали; дорсум незначительно
выпуклый, с ровным контуром. Рот смещен далеко
640
ALVEOLATA
вниз от апекса, растянут поперек тела в виде гигант-
ской щели, немадесм нет; глотка узкая, идет вверх от
рта. Ротовая щель прерывает часть правых кинет; воз-
можно, несколько фрагментов левее рта принадлежат
левым кинетам. Всего 9—10 кинет справа и 6 слева; 4
крайне правых ряда огибают рот и идут по дуге до
фрагментов левых кинет. Рот окружен цельной кине-
той, над ним дуги сегментов кинет. Между правой и
левой полосой —. небольшой продольный ацилон. На
дорсуме 2 фрагмента тигмокинеты. Это характерный
обитатель болот и мхов. Под этим названием описыва-
лись разные виды и даже роды гипостомат; их сравне-
ние и точные диагнозы приводятся Фойсснером (Fois-
sner, 2001). G. runcina Wilbert, 1971 сейчас сведен в си-
нонимы типичной G. membranaceus.
G. derouxi Blatterer et Foissner, 1992 — вид с 16—
19 кинетами; выносит обитание в засоленной почве,
широко распространен, имеет локальные морфотипы.
G. aloisi Oberschmidleitner et Aescht, 1996 отличает-
ся от типового вида деталями кинетома.
G.fontzoui Nie et Но, 1943 — крупный вид
(92—118 мкм) с большим числом кинет, 19—21 справа
и 6—7 слева, с относительно короткой ротовой щелью,
расположенной диагонально. Вид валидный, обитает
на пресноводных креветках Китая (Palaemon nipponen-
sis), обычен на жабрах хозяев.
Chlamidodon stagnalis Dumas, 1929 — синоним
вида G. membranaceus. В Байкале на глубине 10 м, где
много эндемиков в бентосе, встречается очень круп-
ный плоский новый вид с полимеризацией кинет.
Род Gastronecta Jankowski,
1976
Типовой вид G.vittata Jank., 1976 предложен
для «Gastronauta membranaceus Engelmann, 1862» in
Penard, 1922. Это «нетоним» — неверное определение
вида, у вида Пенарда (Penard, 1922) кинетом сплош-
ной, нет ацилона. По Аэшт, род невалиден, поскольку
предложен в тезисах и «без описания»; но отличие от
Gastronauta только по одному признаку (нет ацилона),
что было четко указано. Поскольку сейчас названия
родов, предложенные в тезисах, не признаются и счи-
таются nomen nudum, род невалиден.
Род Paragastronauta Foissner,
2000
Типовой в и д G. clatratus Deroux, 1976. Фактиче-
ски это тот же вид, что и Gastronecta vittata Jank., 1976,
но второе название невалидно (предложено в тезисах).
Вид почти во всем идентичен с Gastronauta, имеет та-
кую же топографию кинет, но лишен ацилона — все
вентральные ряды расположены на равных расстояни-
ях. Ротовая щель длиннее, чем у Gastronauta, прерыва-
ет больше кинет справа, рот дальше сдвинут назад от
апекса, над ртом больше сегментов кинет. Для опреде-
ления видов семейства важно положение тигмокинеты
и число кинетосом в ней; у Gastronauta разрозненные
пары кинетосом, у Paragastronauta на дорсуме 2 фраг-
мента кинеты.
Сем. Chlamydodontidae Stein, 1859
Первоначально таксон включал разных гипостомат
и нассулид, сейчас (в каталоге Линна) содержит лишь
2 рода — Chlamydodon и Cyrtophoron. Общие призна-
ки — полимеризация кинет, продольное положение
рта, переход части правых кинет на дорсум, септимер-
ное ядро; ротовая цилиатура — фрагменты кинет у
Cyrtophoron, фрагменты с удлиненным рядом у Chla-
mydodon. На венте снизу небольшая тигмотакти-
ческая ямка.
Род Cyrtophoron Deroux, 1975
Типовой вид С. isagogicum по монотипии. В от-
личие от Chlamydodon, нет полосы опорных циклоки-
нет по краям тела. Кинетом полный, без ацилона; боль-
шинство правых кинет уходит на дорсум и возвраща-
ется с левой стороны; у рта 3 небольших фрагмента
предротовых кинет, расположенных вдоль узкой ще-
ли. Тигмокинета в двух фрагментах. У постерона в се-
редине ресничного поля небольшая ямка, на дне и
ниже ее специализированные (утолщенные) участки
5 сомакинет с вплотную сближенными кинетосомами,
несущими особо длинные реснички. Циртум очень ко-
роткий и широкий, ротовая щель узкая, продольная. В
морском бентосе. Из соленых озер и минеральных вод
Азербайджана описаны 3 вида — Cyrtophoron apshero-
nica Aliev, 1991; C. poljanskyi Aliev, 1991 и C. burkows-
kyi Aliev, 1991.
Род Chlamydodon Ehrenberg,
1835
Типовой вид Ch. mnemosyne по монотипии.
Первоначальное написание — Chlamidodon, но уже
ранние авторы предпочитали название Chlamydodon
как грамматически правильное, и оно всеми принято.
Дата описания рода обычно указывалась неправильно;
вариант Clamidodon — ошибка.
До сих пор все виды числились в составе одного
рода, но по типу опорного кольца можно различить 2
подрода или рода. Род Chlamydodon s. str. включает
виды с замкнутым кольцом, остальные (с незамкнутым
дуговидным опорным аппаратом) выделяются в новый
род. Все виды морские или из приморских пересолен-
ных озер.
Типовой вид Ch. mnemosyne — крупный вид с
широким телом, несколькими вакуолями, септимер-
ным ядром; спереди сбоку пигментное пятно (фото-
сенсорный глазок). Кинеты многочисленные, около
30, равномерно покрывают весь вент. При полимериза-
ции рядов часть их не умещается на венте и переходит
на дорсум; рот сдвинут далеко вниз от апекса. Над
ртом 3 мембранеллы, лежащие ступеньками в узком
бисекантном диагональном шве — 2 мембраны над
ртом и более длинная мембрана Ml левее и выше. Ки-
неты ограничены периферическим замкнутым желоб-
ком с поперечными опорными фибриллами. В нижней
части ресничного поля ямка с тесно сближенными ки-
нетосомами 4—5 рядов.
ТИП CILIOPHORA. КЛАСС PHYLLOPHARYNGEA
641
Примеры видов: Ch. apsheronicus Aliev, 1987;
Ch. minutus Dragesco, 1965; Ch. obliquus Kahl, 1931;
Ch. pedarius Kaneda, 1953 (объект серии работ в Япо-
нии; вероятный синоним); Ch. rectus Ozaki et Yagiu,
1941; Ch. roseus Dragesco, 1966; Ch. exocellatus Ozaki et
Yagiu, 1941; Ch. cyclops Entz, 1886.
Род Campylodon Jankowski, 1976
Типовой вид Kolpoda triquetra Muller, 1786. По
Аэшт, название невалидное как гомоним и как предло-
женное в тезисах. Здесь дается другое название
рода — Nezamidon Jankowski gen. п., типовой вид
К. triquetra Muller, 1786.
Организация кинетома и ротового аппарата, как у
предыдущего рода; отличие по типу опорного аппара-
та — желобок с фибриллярными септами незамкну-
тый, открыт сзади. Видов с таким полукольцом мень-
ше, чем видов в составе Chlamydodon, но они столь же
часты в морских пробах, особенно типовой вид. N. tri-
quetrus (Muller, 1786) част в литоральных ваннах, в пе-
ске, детрите; многократно переописанный вид. Разме-
ры 55—90 мкм, тело вытянутое, сужено сзади, спереди
пигментное пятно; рот растянут, вакуоли много-
численные, на венте около 30—40 кинет; шов с рото-
выми кинетами почти поперечный. Пока не отме-
чена тигмотактическая ямка, вероятно имеющаяся не
у всех видов семейства. При виде сбоку глубокий же-
лобок отделяет вздутый дорсум от плоской вентраль-
ной стороны. Примеры видов: N. major sp. п. для Chla-
myodon triquetrus var. major Kahl, 1931; вид с резким
заострением тела сзади, величиной до 100 мкм, N. ка-
symovi (Aliev, 1987) comb, n., N. erythromaculatus
(Tucolesco, 1962) comb, n., N. erythrorhynchus (Perejas-
lawzewa, 1886) comb, n., вероятный синоним вида
N. triquetrus.
Приложение
Роды неясного положения в отряде
Chlamydodontida
Род Dysterioides Matthes, 1950
Типовой вид D. sessilia в составе сем. Dysterii-
dae, но типичного стилона нет, это может быть моди-
фикация хилодонов. Вместе с Chilodonella porcellionis
встречается на жабрах 3 видов наземных изопод (мок-
риц) — Porcellio scaber, Oniscus asellus и Tracheoniscus
rathkei в Германии, вторично никем не найден; при
специальном поиске не найден на изоподах Петербур-
га и Крыма.
Трофонты сидячие, цепочки особей видны по все-
му краю жабер и экзоподитов. Мелкие формы с взду-
той дорсальной частью, без рельефа, вент в виде
глубокого желобка; глотка без немадесм (или не заме-
чены); округлое ядро, 2 вакуоли. Кинетом, конечно,
показан неправильно, в виде единого кольца из 5 ки-
нет; должно быть деление на правую и левую полосы.
Ротовые кинеты не замечены. Прикрепление бес-
структурной органеллой, небольшим вздутием или
выступом тела, точное положение которого не вы-
яснено (возможно, не органелла, а секреция). Деле-
ние не изучено.
Род Talitrochilodon Jankowski, 1980
Типовой вид Chilodonella hyalina Kidder et Sum-
mers, 1952 (T. hyalinus), симбионт береговых скакунов
(«морских блох») амфипод-талитрид Orchestia agilis,
обитающих под выброшенными водорослями и в пес-
ке в США. Встречаются на талитридах Крыма и Саха-
лина. Некрупные формы (40 мкм) с 23—25 кинетами;
ниже рта одной кинеты нет, здесь узкий ацилон; 2 ва-
куоли; у рта 2 короткие мембранеллы, нет длинной
мембранеллы вдоль предротового шва. Нет никаих
фиксаторных органелл. В море мало настоящих хи-
лодонеллид, в основном это пресноводная группа, поэ-
тому нельзя исключить вторичную утрату стилона
у этого вида.
Род Atelepithites Deroux,
1976
Типовой вид A. misellum, мелкий морской
вид без следа стилона; кинеты в 2 полосах, 5 + 6, как
у хилодонелл, положение и поры 2 вакуолей также
сходные, но ядро вытянутое, септимерное (у хило-
донов цикломерное). Правее полосы R 2 ряда разроз-
ненных кинетосом; циртум короткий и широкий; рото-
вой ресничный комплекс своеобразный — мембранел-
ла ниже рта (явно рудимент ряда М2 хилодонов)
и несколько мелких мембранелл левее рта. Имеется
тигмокинета.
Род Trochochilodon Deroux,
1976
Типовой вид Г. flavum из морского бентоса (по
Аэшт, правильно Т. flavus). Включается в состав сем.
Plesiotrichopidae, но у данного рода нет никакого фик-
саторного аппарата, поэтому нет основания числить
его среди дистериид. Тело узкое, вытянутое, на дорсу-
ме сложная система продольных ребровидных складок
кортекса, частично и на венте слева в безресничной
зоне. Кинеты в 2 полосах, 6 + 4, 3 правых идут к апексу
и огибают рот; глотка с немадесмами, ядро у этого
вида и всех далее описываемых родов септимерное. У
рта 2 мелких фрагмента — основания мембран, и руди-
мент Ml слева. Положение и поры 2 вакуолей как у хи-
лодонелл, по диагонали.
Вид Т. rigidus comb. n. (=Chilodorella rigida Kahl,
1933) описан- из морских губок у Неаполя, вероят-
но случайно в губках, не комменсал; по всем при-
знакам такого же типа, как типовой вид, но описание
недостаточно точно, так как не проведена импрегна-
ция. Если определение правильно, этот вид нужно
перенести в состав Trochochilodon. Формы с таким
же кинетомом, но без ребер панциря, обычны в наших
морях.
41 Зак. №4163
642
ALVEOLATA
Род Asellarcon Jankowski gen. n.
Типовой вид Chilo don granulatus Penard, 1922.
Специфические симбионты на жабрах водяного ос-
лика — - изоподы Asellus aquations и бокоплава Gamma-
rus pulex. Тело плоское, округлых очертаний, на дор-
суме спереди тигмокинета со сближенными кинето-
сомами; на венте 9 рядов, с уменьшением длины
справа налево; почти все ряды огибают мелкий рот,
смещенный влево; у рта несколько мелких фрагмен-
тов стомокинет. Крайне левый ряд удлинен, смыкается
с крайне правым и ограничивает вентральную сторо-
ну, действующую как присоска на подвижном хо-
зяине.
Род Cyrtohymenostoma Das, Chatterjee
et Ray gen. n.
Типовой вид C. gallinulae. Подробное описание
дано в трудах III Конгресса протозоологов (Ленинг-
рад), изданных в виде книги, но Аэшт объявляет род
невалидным как предложенный в тезисах. Вторично
вид был позже описан в трудах одной из конференций
паразитологов, также в тезисах (Das, 1990). Приходит-
ся в третий раз предлагать род как новый, и для описа-
ния использовать микрофотографии, любезно при-
сланные авторами.
Эндобионты в кишечнике птиц-камышниц — Gal-
linula chloropus indicw, вид хозяина распространен
в Европе, част в России, на предмет паразитических
цилиат не осматривался; возможно, заражен лишь ин-
дийский подвид. Авторы изучили вид на нигрозино-
вых препаратах, без импрегнации. Тело удлинен-
но-овальное, как у хилодонелл;совпадает также поло-
жение и число кинет в 2 полосах (5 + 6), их укорочение
от центра к периферии тела, число и положение пор
вакуолей (2 по диагонали); 3 правых ряда огибают
рот; ацилон обширный. Различия — по типу стомо-
кинет, на снимках видны 3 поперечные мембраиеллы
и короткая ундулирующая мембрана. Положение
рода в системе неясное, пока нет более точных дан-
ных о ротовом аппарате вида, но род представляет-
ся валидным.
Отряд Dysteriida Deroux, 1976
(рис. 327, 6—328, 6)
Гипостоматы с прикрепительной органеллой раз-
ного типа, у большинства родов с секреторной же-
лезой, наружный проток которой находится внут-
ри сложно устроенного выроста тела. В литературе
нет общепринятого термина для этой органеллы; из
числа применяемых обозначений здесь принят термин
«стилет», несколько измененный «стилон». Кинетом
у ряда видов в предыдущем, более примитивном отря-
де Chlamydodontida усложнен именно в том месте,
где расположен стилон дистериид — над постероном
кинетосомы в рядах сближены, здесь проходит тиг-
мотактическая полоса, а еще выше наблюдается раз-
режение кинетосом и ресничек или образование
ямки, в которую у Chlamydodon и у Cyrtophoron по-
гружены без фрагментации специализированные уча-
стки кинет.
Электронная микроскопия выявляет сложное стро-
ение железы и протока; у части видов выделяется
длинная гибкая нить (Caligicola filans, Hartmannula
brodskyi), но чаще особи непосредственно прикрепле-
ны к субстрату клейкой вершиной стилона. Прикреп-
ление может быть временным или постоянным, насто-
лько прочным, что дистерии сохраняются на хозяине
при фиксации, окраске и заключении в бальзам (по на-
шему опыту работы с симбионтами лимнорий или ки-
товых амфипод— циамид). У хонотрих трофонты си-
льно модифицированы, а томиты воспроизводят строе-
ние дистериид, сохраняют железу без стилона.
Прикрепившись к хозяину или к водорослям, дистерии
фильтруют воду для питания.
Ротовой аппарат сложнее, чем у примитивных хи-
лодонелл. У гипостомат глоточная трубка двойная,
внутренняя (стенки из радиальных пластинок микро-
тубул) и наружная, из немадесм; у дистериид число не-
мадесм часто уменьшается, они образуют обособлен-
ные зубцы или изогнутые пластинки у вершины, и
у рода Dysteria эти элементы достигают особой слож-
ности. Следует иметь в виду, что немадесмы не имп-
регнируются протарголом, поэтому не показаны
на многих рисунках гипостомат (но имеются у изучен-
ных видов); рисуют часто лишь внутреннюю трубку
глотки.
Ядро у примитивных гипостомат (хилодонеллид)
цикломерное, темнокрасящийся парамер окружает
светлый эндомер с кариосомой. Далее в эволюции от-
ряда Chlamydodontida преобладает септимерный тип
ядра — положение зон не концентрическое, ядро раз-
делено септой на 2 половины или неравные части.
Только такой тип ядра свойствен всем дистериидам и
сохраняется у их потомков — хонотрих. Размножение
изотомией; конъюгация встречается очень редко; цис-
ты неизвестны.
Распространение отряда и части родов всесвет-
ное, в основном в море и в эстуариях, в приморских
соленых озерах; в пресной воде немного видов, самый
частый из них Trochilia minuta. Анаэробных видов
нет, и в черном илу, где много Trimyema, Plagiopyla,
Metopus, Epalxella и других анаэробов, нет гипостомат.
Многие виды развиваются в сапробных зонах, на-
пример в скоплениях гниющих водорослей на лито-
рали, и здесь покрываются серобактериями. Спектр
биотопов очень разнообразен, но в псаммоне видов
меньше, чем в детрите. Легче всего найти дистериид
в смывах грунта с камней, губок, гидроидов в верх-
ней сублиторали. Цилиаты морских глубин (абисса-
ли) практически неизвестны, но в пробах грунта из
гидро герм с глубины 2615 м среди цилиат были най-
дены и дистерииды нового рода, близкого к Trochi-
lioides.
На беспозвоночных можно найти много случайно
прикрепившихся или ползающих видов отряда; обли-
гатный симбиоз — у родов Allosphaerium (на берего-
вых амфиподах — талитридах), Brooklynella (на жаб-
рах и покровах тела морских рыб), Parachilodonella (на
жабрах изопод-лигиид, морских мокриц, живущих на
границе суши и моря), Kyaroikeus (в дыхательных по-
лостях дельфинов и китов). Отдельные виды свобод-
тип ciliophora. класс phyllopharyngea
643
Рис. 328, a. Hypostomatida.
Hartmannulopsis dysteriana (A, Бу, Orthotrochilia agamalievi (B); Hartmannula acrobates (Г)-, Trochilioidesfimbriatus (Д—3); Microxysma acutum (И, К). (По: De-
roux, 1978a (В, Г, И, K); Deroux, Dragesco, 1968 (А, Б); Foissner, 1984b (Д— 3)).
Fig. 328, a. Hypostomatida.
ma — macronucleus, mi — micronucleus.
ноживущих родов адаптированы к симбиозу; напри-
мер, часть видов рода Trochilioides заселяет морских
амфипод рода Gammarus.
Классификация отряда, по Линну (Lynn, 2002), —
4 семейства без подотрядов и 2 рода в приложении (in-
certae sedis) — Horocontus и Dysterioides (второй род
рассмотрен в приложении к отряду Chlamydodontida).
Состав семейств здесь изменен, в Dysteriidae остав-
лены лишь роды с разрастанием дорсума и четкой гра-
ницей краев вентрального желобка, как Dysteria, но с
разным типом панциря, кинетома или циртума. Соот-
ветственно увеличен состав других семейств; Kyaroi-
keidae остается монотипичным.
В Traite (Puytorac, 1994) приводится сложная си-
стема группы, не принятая здесь. Новый отряд Dy-
.steriida Deroux, 1994 делится на 2 подотряда и 6 се-
мейств:
Подотряд Hartmannulina Deroux, 1994
Сем. HartmaniTulidae Poche, 1913
Сем. Aegyrianidae Deroux, 1994
Сем. Plesiotrichopidae Deroux, 1976
Подотряд Dysteriina Deroux, 1976
Сем. Dysteriidae C. et L., 1858
Сем. Trochiliidae Deroux, 1976 (ранее подсемейство)
Сем. Trochilioididae Faure-Fremiet, 1945 (ранее подсемейство)
Вентральная сторона тела сужена, имеет вид глубо-
кого желобка; дорсальная поверхность панциревидно-
го кортекса разрастается, заходит на края тела, грани-
цы ресничного желобка очень четкие. Прикрепление
крупным стилоном с секреторной железой у основа-
ния. Характерна тенденция к олигомеризации цилиа-
туры; число кинет велико у Предположительно исход-
ного рода Hartmannulopsis и уменьшается до несколь-
ких кинет у других родов. Морская группа, 2 вида в
пресной воде.
В XIX в. было принято название Ervilina Dujardin,
1841 (=Erviliinae, Ervilinea, Erviliens), семейство вклю-
чало все роды с подитом (стилоном). Род Dysteria дол-
го не признавался, виды такого типа относили к родам
Iduna, Ervilia, Huxleya, Trochilia, Aegyria, Cypridium.
Поскольку название рода Ervilia — гомоним, осно-
ванное на нем название семейства непригодно (нева-
лидное).
644
ALVEOLATA
Рис. 328, 6. Hypostomatida.
Cyrtophoron isagogicum (немадесмы — А, Д); Trochilioides recta (Д); Chlamydonella stricta (B); Pithites vorax (Гу, Dysteria monostyla (E—3); Brooklynella hosti-
lis (И). (По: Deroux, 1965 (E, Ж, 3), 1975 (А, Д), 1967c (B), 1978a (F); Deroux, Dragesco, 1968 (Г); Lom, Corliss, 1971 (И)).
Fig. 328, 6. Hypostomatida.
Род Dysteria Huxley, 1857
Типовой вид D. armata по монотипии. Данное
название применяли к разным видам; в первоописании
это мелкий вид рода без килевидного выступа вдоль
дорсального ребра, имеющегося у некоторых крупных
видов рода. Тело незначительно вытянутое, вентраль-
ный желобок очень узкий по всей длине, слегка расши-
рен у апекса и у стилона. На правой стенке полости —
полоса из 6 компактных кинет; 4 из них особо удлине-
ны и огибают рот. Левая полоса редуцирована до
3 мелких фрагментов над ртом. Ротовая цилиатура —
3+2 мембранеллы над ртом. На экваторе слева —
группа мелких стоматогенных кинет. Имеются 2—
4 вакуоли, удлиненное ядро, тонкий стилон. Вместо
трубки из тонких многочисленных немадесм видны
лишь 2 пластинчатые немадесмы, зубцы у предковых
гипостомат разрослись в «максиллы» сложной формы.
На панцире сохранился аргиром — сеть прямоуголь-
ников кортекса. Итак, у типового вида нет дорсального
киля; поэтому можно ограничить число видов, оставив
лишь виды с простым панцирем, без киля и без шипов,
с развитыми максиллами. Многие виды, к сожалению,
очень плохо описаны, на киль и максиллы не обращали
никакого внимания, и распределить их по родам нель-
зя. Обзор рода сделали Гонги Сонг (Gong, Song, 2004).
Примеры видов — D. angusta (С. et L., 1858); D. legu-
теп (Dujardin, 1841) (условно здесь, максиллы не пока-
заны); D. monostyla (Ehr., 1838); D. oblongnucleata Oza-
ki et Yagiu, 1941; D. procera Kahl, 1931; D. pectinata
(Nowlin, 1910) (максиллы не показаны).
Род Agnathodysteria Deroux,
1976
Типовой вид A. littoralis', внешний вид, как у
D. armata, и несомненно ряд примитивно описанных
видов относится к данной форме. Панцирь ровный или
с продольными складками, но без четких ребер; кине-
том типичный для Dysteria-, вентральный желобок не-
сколько шире, чем у дистерий. Родовое отличие — в
ТИП CILIOPHORA. КЛАСС PHYLLOPHARYNGEA
645
строении циртума. У дистерий глотка (эндофаринкс)
окружена по краям 2 массивными немадесмами, с рас-
ширением у вершины; апикальные зубцы преврати-
лись в максиллы. У Agnathodysteria сохранены 6 тон-
ких цемадесм в виде корзинки, которую пока еще мож-
но различить; далее у дистерий она уже ничем не
шшоминает типичную корзинку гипостомат. Трудно
различить максиллы или крупные зубцы над цирту-
мом, вероятно максилл нет, когда они имеются у дис-
герий, то легко видны и были хорошо изучены и зари-
сованы многими авторами. Поле кинет крупнее, чем у
дистерий, есть небольшая разница в топографии ки-
нет. A. balani (Jank., 1967) — это мелкий вид (29 X
18 мкм) с небольшим числом кинет и простым цирту-
мом, вероятно относится к данному роду, не к Dysteria,
поскольку лишен максилл.
Род Mirodysteria Kahl,
1933
Типовой вид М. aplanata с плоским панцирем и
зубцом спереди. Кинеты прерваны, в середине тела об-
ширный ацилон; сверху 4 ряда, снизу 3; циртум с мел-
кими немадесмами, максилл нет. Вдоль фрагментов
кинет—ряды протрихоцист (мукоцист). Найдены толь-
ко 3 особи в морском песке. Частый эрроним в литера-
туре — Microdysteria.
Род Viridysteria Jankowski
gen. n.
Типовой вид Mirodysteria decora Deroux, 1976.
Это вид с крайней редукцией кинетома; кинетосомы в
3 рядах справа собраны в группы по 3—4, образуя пре-
рывистые группы по всей длине ресничной полосы.
Нет обширного ацилона, изображенного у типового
вида рода Mirodysteria. Не всегда кинетом такой пол-
ный, как на рисунках вида в литературе. В любом слу-
чае этот вид нужно исключить из состава предыдуще-
го рода — он имеет 2 верхних зубца и 2 мощных шипа
по краям глубокой выемки панциря, и по вооружению
панциря должен быть типом как минимум подрода.
Циртум практически не изучен; у М. decora имеются
2 крупные немадесмы, как у дистерий.
Род Xiphodysteria Jankowski
gen. n.
Типовой вид Dysteria spinifera Dragesco,
1966. По внешнему облику типичные дистерии, но с
шипами у вершины дорсального ребра и в его нижней
части. Циртум, как у Dysteria, с 2 массивными плас-
тинчатыми немадесмами и с максиллами. Кинетом
нс изучен. Сочетание 2 признаков (максиллы и
шипы панциря) позволяет отделить вид от типичных
дистерий (D. armata) хотя бы на уровне подрода. «Ор-
намент панциря» — это эпибактерии, частые у дисте-
риид.
Род Cypridium Kent, 1882
Типовой вид не фиксирован. Кент предложил
род для нескольких видов с дорсальными шипами или
зубцами панциря; у типичных дистерий панцирь без
зубцов. Все виды отнесены ранее к роду Dysteria. Со-
став рода: С. aculeatum С. et L., 1858 (2 острых зубца
вдали от концов тела, на концах килевидного ребра);
С. spinigerum С. et L., 1858 (2 мелких шипа без киля);
С. lanceolatum С. et L., 1858 (без зубцов панциря, но,
вероятно, с килем); С. crassipes С. et L., 1858 (без ши-
пов и зубцов, с дорсальным килем). Как тип рода здесь
обозначается вид С. aculeatum. Вид изучен мною на
Мурмане, выявлены 2 параллельных выроста панциря
вдоль дорсального ребра (2 киля) с зубчатыми конца-
ми и желобком между ними. Это крупный вид дисте-
рий с усложненным панцирем. Циртум с 2 крупными
немадесмами и максиллами, как у дистерий.
Род Limnodysteria Jankowski gen. n.
TopLimnodysteria Jankowski, 1976 был предложен в
тезисах конференции (и поэтому признан невалид-
ным) для вида Dysteria meridionalis Dragesco, 1966 и
D. scutellum Wilbert, 1971; здесь предложен вторично.
Первый вид морской, внешне типичные дистерии, но
без шипов панциря; особенность вида — отсутствие
немадесм глотки, имеющей вид простой трубки.
D. scutellum — пресноводный вид, очень мелкий
(22—27 X 8 мкм), с панцирем, как у дистерий; глотка
без немадесм. Очень трудно выбрать типовой вид; оба
описания циртума могут быть ошибочными, даже у
мелкой Trochilia сохранены немадесмы. К тому же не-
ясно, имеет ли D. meridionalis дорсальный киль или
нет. Как типовой вид здесь выбран D. scutellum.
Род Spirodysteria Jankowski, 1976
Типовой вид Dysteria kahli Tucolesco, 1962. Род
предложен в тезисах и поэтому невалиден; здесь не
предлагается вторично, но упоминается, чтобы обра-
тить внимание на уникальный вид дистериид из Чер-
ного моря — тело очень длинное и узкое, трубчатое,
искривленное, вентральный желобок длинный и уз-
кий, сзади мелкий шиповидный стилон, передний ко-
нец панциря вздутый; циртум не изучен — не предпо-
лагалось, что он будет иметь решающее значение в
классификации родов дистериид. В любом случае,
если действительно существуют дистерииды с такой
формой тела, их следовало бы обособить в подрод или
род; но лучше ждать повторной находки вида.
Род Ervilia Dujardin, 1841
Типовой вид Е. legumen по монотипии. По
Аэшт, это гомоним, поэтому род здесь подробно не
рассматривается. В состав рода первоначально и позже
включали разные виды, поэтому Ervilia — частичный
синоним родов Trochilia, Aegyria и Dysteria. Соответ-
ственно неприменимо и название семейства Ervilina
646
ALVEOLATA
Duj., 1841. Г омонимия не была известна, и родовое на-
звание использовалось повсеместно вплоть до 1880 г.,
когда было вытеснено названиями Trochilia и Dysteria.
Тип рода Е. legumen отождествляли с видом Euplotes
monostylus Ehr., 1833 (ныне Dysteria monostyla).
Род Torodysteria N 2 Jankowski gen. n.
Название рода Iduna Claparede et Lachmann, 1859 —
гомоним, поэтому было заменено новым — Torodyste-
ria N 1 Jankowski, 1976 с типовым видом Iduna sulcata
С. et L., 1859. По Аэшт, это напрасная замена, посколь-
ку Iduna не только гомоним, но и синоним рода Dyste-
ria. Но можно иметь и другое мнение. Это морской
вид; по диагнозу рода (Claparede, Lachmann,
1858—1859), створки панциря самостоятельные, не со-
единены по всему краю; вероятно, вид имеет 2 дор-
сальных киля, и у таких форм желобок между ними
мог быть принят за полость между створками. Важнее
другое — правая створка панциря с 4 четкими про-
дольными ребрами, которых нет у других дистерий.
Крупный вид (140 мкм), после первоописания вновь не
найден. Крупные дистерии часто имеют такие кили
дорсального ребра панциря, но видов с ребрами на
створке пока не найдено. Второй вид — Torodysteria
quinquecostata (Tagliani 1913 in Dysteria) comb, n., ве-
личиной 145—155 мкм, из кратерного пресноводного
озера у Неаполя; левая створка с одним ребром, правая
с 5 четкими ребрами и глубокими желобками между
ними.
Род Microxysma Deroux, 1976
Типовой вид М. acutum с морской литорали.
Вид сочетает признаки Dysteria и Trochilioides — пан-
цирь, как у дистерий, но более вытянутый и скручен-
ный, поверхность панциря с большим числом тонких
продольных ребер, напоминающих дорсальные склад-
ки Trochilioides и отсутствующих у дистерий. Кине-
том желобка не только с правой полосой, как у дисте-
рий, но и с левой — диагональная полоса коротких ря-
дов уходит влево вверх. Над ртом 2 мембранеллы;
циртум с 6 немадесмами, 2 из которых соединены
с зубцами.
Род Gastrochaeta Dujardin, 1841
Типовой в и д G. fissa-, эрроним — Gasterochaeta.
Мелкий, плохо описанный вид со вздутой дорсальной
стороной и узким вентральным ресничным желобком;
все авторы считают род синонимом Dysteria, вид неоп-
ределимый.
Род Hartmannulopsis Deroux et Dragesco,
1968
Типовой в ид Я. dysteriana, крупный вид из мор-
ского бентоса. Панцирь образован разрастанием до-
рсальной стороны тела, поэтому род включен в состав
дистериид; в остальном у этого рода и Dysteria нет ни-
чего общего, но род может быть исходной формой для
дистерий. Число кинет полимеризовано в обширной
правой полосе и по сравнению с дистериями также и в
мелкой левой полосе; 3 стомокинеты лежат вдоль
предротового шва; обособлена группа кинет по эква-
тору в правой полосе. Рот очень крупный, растянут
продольно; циртум короткий и массивный, только
2 немадесмы из 6 соединены с длинными зубцами;
максилл нет.
Сем. Hartmannulidae Poche, 1913
Вентральная сторона тела широкая, не в виде узко-
го продольного желобка; дорсальная поверхность не
разросшаяся, не сужает вент; нет панциря; всегда име-
ется стилон с протоком секреторной железы. Dysterii-
dae панцирные формы с разросшейся дорсальной сто-
роной; у Plesiotrichopidae нет стилона. Синоним —
Onychodactylina Entz, 1884; это название предложено
раньше, но основано на гомониме.
Род Hartmannula Poche, 1913
Типовой вид Onychodactylus acrobates Entz,
1884; замещающее название для Onychodactylus Entz,
1884 (гомоним, есть тритоны с таким названием).
Обычная гипостомата из морского обрастания, внача-
ле найдена на деревцах диатомей Gomphonema. Круп-
ный вид (140—200 мкм), с широким телом; край вента
четко очерчен, но видна неровная волнистая линия по
периферии всего тела — это альвеолярный покров,
секреция эктоплазмы, покрывающая весь дорсум (ана-
логия с секрецией мукозного покрова у некоторых ви-
дов Trithigmostoma и у сукторий). Вид хорошо изучен
современными методами; на венте сплошное поле ки-
нет, около 46—48; ряды постепенно укорачиваются
справа налево, верхний левый ряд — фрагмент выше
рта; ацилона нет. Рот плоский, вытянут по оси тела;
циртум с 18 немадесмами, короткий и широкий, мас-
сивный, у вершины каждой немадесмы — небольшой
зубец. Имеется 3 стомокинеты (мембранеллы) нерав-
ной длины, 2 над ртом и одна выше в зоне секанты (не-
большого предротового шва, направленного влево).
Протаргол выявляет сложную систему фибрилл, отхо-
дящих от немадесм и кинетосом; вся толща тела про-
низана сетью фибрилл разной толщины и ориентации.
Стилон выделяет прочную гибкую нить, как биссус
мидий, особь закрепляется на ней и высоко поднята
над субстратом, фильтруя воду. Апекс с пигментным
пятном.
Примеры видов: Н. brodskyi Faure-Fremiet et Guilc-
her, 1947 (для вида H. acrobates sensu Brodsky, 1908);
H. entzi Kahl, 1931 (для «плоской формы» Aegyria oliva
in Entz, 1884); H. angustipilosa Deroux et Dragesco, 1968
(более мелкий вид, чем типовой, с меньшим числом
кинет и их резким укорочением справа налево);
Н. ocellata Tucolesco, 1962 (вдвое мельче типового
вида, плохо описанный сомнительный вид); Н. pachi-
dermus (Perejaslawzewa, 1886 in Chlamydodon) comb, n.,
синоним типового вида.
ТИП CILIOPHORA. КЛАСС PHYLLOPHARYNGEA
647
Род Sigmocineta Jankowski, 1967
Типовой в ид 5. nordica из мантийной полости
балянусов Мурмана. Размеры особей около 75 мкм, на
центе 35—38 кинет, идущих высоко над стилоном, с
резким укорочением справа налево; рот растянутый,
расположен диагонально, с большим числом нема-
деем; циртум длинный, широкий. При описании вид
сравнивался с рисунками Hartmannula oliva из старой
литературы, показывающими кинеты до постерона с
обеих сторон стилона, точные рисунки вида Н. acroba-
tes (Dragesco, 1966) не были доступны. Н. oliva — вид
другого рода (Aegyriana). Поэтому Sigmocineta сейчас
считается синонимом рода Hartmannula.
Род Aegyriana Deroux, 1975
Типовой вид Aegyria oliva Claparede et Lach-
mann, 1858. Замещающее название для гомонима Aegy-
ria С. et L., 1858 с типом A. oliva по указанию Фромен-
теля (Fromentel, 1874). По Аэшт, синонимами названия
Aegyria являются Ervilia и Glenotrochilia, а само назва-
ние рода — синоним родов Dysteria или Hartmannula.
Аэшт считает название Aegyriana Deroux, 1975 «не-
нужным замещающим названием для Aegyria, по-
скольку это синоним рода Dysteria».
Разобраться в этой путанице нетрудно — при уста-
новлении рода к нему отнесли виды разных родов со-
временной системы — дистерий разного типа и A. oli-
va. Название широко использовалось, число видов уве-
личилось, и только в 1874 г. Фроментель указал как
тип A. oliva, а не дистерий. Поэтому Aegyria не может
быть синонимом родов Dysteria и Ervilia.
Еще раньше A. oliva был указан как тип рода Gle-
notrochilia Diesing, 1866, а все остальные виды Aegyria
перенесены в состав рода Trochilia', род Aegyria вооб-
ще был ликвидирован. Новый род зарегистрирован в
ежегоднике Zoological Record (как Glenotrochila) и по-
этому не может быть отвергнут как nomen oblitum.
Итак, один вид A. oliva трижды без цитирования
предшественников был обозначен как типовой для ро-
дов Glenotrochilia (1866), Aegyria (1874) и Aegyriana
(1975); 2 последних указания невалидные, но никто не
заметил и не исправил этой ошибки. Сонг и Вильберт
(Song, Wilbert, 2002) вновь, в четвертый раз, предлага-
ют «новый род» Aegyriana gen. п. с типом A. oliva (С. et
L., 1858) и описывают новый вид A. paroliva.
Род Glenotrochilia Diesing, 1866
Типовой ви д Aegyria oliva С. et L., 1858 по моно-
типии. Вид позже относили к Trochilia, Dysteria, Hart-
mannula, Aegyriana. Крупный вид с утолщением дорсу-
ма; тело очень широкое, розовое, с темным глазком
спереди слева; рот щелевидный, вытянут по диагона-
ли; циртум плоский, с большим числом тонких нема-
десм с мелкими зубцами у вершины каждого (прими-
тивный тип среди родов отряда); над ртом широкий
ацилон с 3 мембранеллами, положение Ml слева от рта
гоже примитивный признак. Кинеты полимеризованы,
огибают рот и уходят на дорсум, снизу огибают с обе-
их сторон стилон и резко укорачиваются справа на-
лево. Указаннный выше род Sigmocineta, если вид
валидный — это промежуточная форма между Glenot-
rochilia и Hartmannula. Второй вид — G. paroliva
(Song et Wilbert, 2002) comb. n.
Род Anemadesma Jankowski gen. n.
Типовой вид Aegyriana minuta Deroux, 1976 —
мелкий вид с продольными ребрами (складками) на
дорсуме, с небольшим числом кинет; рот округлый;
циртум тонкий, трубчатый; никаким способом окраски
не удалось выявить немадесмальную арматуру вокруг
цилиндрической глоточной трубки. Кинеты образуют
сплошное поле на венте, часть рядов уходит на до-
рсум, огибая рот. У рта 2 мембраны, по обеим сторо-
нам циртума.
Род Anemadesma Jank., 1976 предложен в тезисах
для указанного типа и здесь предлагается вторично;
основное отличие от Glenotrochilia — утрата немадесм.
Если род не будет признан или будет считаться подро-
дом предыдущего, для типового вида предлагается обо-
значение Glenotrochilia minuta (Deroux, 1976) comb. n.
Род Chlamydonyx Deroux, 1976
Типовой вид Ch. paucidentatus. Тело вытянутое,
вентральная сторона отграничена от дорсальной чет-
кой продольной складкой. Кинеты немногочисленные,
плавно укорачиваются справа налево, вплоть до мел-
кого сегмента левее рта; всего 2—3 крайне правых
ряда огибают рот — эта деталь сохранится у большин-
ства следующих родов, в этом отношении Chlamydo-
nyx — промежуточная форма между Hartmannula и
Trochilioides. Рот небольшой, щелевидный, глоточная
трубка узкая; имеется 8—10 немадесм. Над ртом 2 рав-
ные параллельные стомокинеты; левее, в зоне шва,
третий ряд такой же длины.
Род Schedotrochilia Deroux, 1976
Типовой вид У disjoncta', очень мелкие формы
(до 20 мкм) с овальным телом, несколькими рядами
ресничек; рот щелевидный, с длинной изогнутой глоткой.
Кинетом включает 3 четкие зоны — длинные правые
ряды (2 из них идут дугой вдоль апекса), группа чуть
скошенных коротких экваториальных рядов и левее
рта полоса из 3 коротких сегментов кинет. Над ртом 2
параллельные мембраны, третья смещена влево вдоль
апикального шва. У мелких форм трудно выявить не-
мадесмы, особенно на протарголовых препаратах в ба-
льзаме, поэтому строение циртума остается неясным.
Род Orthotrochilia Deroux, 1976
По Аэшт, род невалиден, так как в первоописании
не указан типовой вид. Род предложен для 2 видов; ти-
повым здесь обозначается О. pilula Deroux, 1976, и
род меняет авторство — Orthotrochilia Song, 2003 (так-
648
ALVEOLATA
же О. agamalievi) Это вытянутые овальные формы с
16 кинетами, с быстрым уменьшением их длины спра-
ва налево, до мелких фрагментов у рта; 2 ряда огибают
рот. Рот щелевидный, с корзинкой из большого числа
немадесм; ротовая цилиатура — мембрана у рта и ле-
вее, у края тела; вершины кинет образуют ровный ряд
ниже рта. Дорсум со скдадками, также и в безреснич-
ной зоне вента. Рот расположен диагонально или поч-
ти поперек тела. Вид из Каспия Trochilioides recta in
Agamaliev, 1974 имеет 20—22 кинеты, ротовой аппа-
рат не изучен, число и форма немадесм неизвестны.
О. pilula (Deroux, 1976) Song, 2003 — более мелкий
вид со складками дорсума, с меньшим числом кинет, с
мембраной справа и слева от рта; циртум не изучен.
Род Paratrochilia Kahl, 1933
Типовой в и д Р. chilodontoides, ранее в сем. Dys-
teriidae. Размеры тела 35 мкм, тело широкое, сужается
кзади; на дорсуме выпуклая центральная часть и плос-
кая кайма; на венте в безресничной зоне 2—3 складки,
огибающие циртум. Кинеты многочисленные, умень-
шаются налево вверх до небольших фрагментов, не за-
ходят за циртум слева снизу. Рот с тонкими немадес-
мами, растянут в стороны, поперечный, перед ним по-
перечный желобок; 2 правых кинеты уходят на
дорсум. Ротовая цилиатура не изучена. Вид изучен без
импрегнации, точной картины кинетома нет, но если
сравнить этот вид и Orthotrochilia agamalievi, мы
убеждаемся в идентичности этих видов (отличается
лишь положение нижней вакуоли). Поэтому род Ort-
hotrochilia Deroux является невалидным по отсутст-
вию обозначения типа и по синонимии.
Род Sepoides Jankowski,
1976
Типовой вид 5. radiatus Jank., 1976 для Trochi-
lioides sp. in Patsch, 1974. По Аэшт, род невалиден как
предложенный в тезисах и без диагноза, но в оригина-
ле указан отличительный признак — «без немадесм, с
предротовыми кинетами по обеим сторонам рта».
Здесь род предложен вновь — Sepoides Jankowski
gen. п., типовой вид S. radiatus для указанного вида из
пресноводного обрастания; размеры тела около
20 мкм, справа 3 кинеты (2 огибают рот), ниже рта ров-
ная поперечная полоса из 6 рядов почти равной длины;
над ртом мелкая стомокинета справа и слева. Глотка
без немадесм, но у столь же мелкого вида Trochilia mi-
nuta видны четкие немадесмы; ядро септимерное;
складки кортекса не отмечены. Есть несомненное
сходство вида с морской Orthotrochilia pilula, но по-
следний вид со складками вне ресничной зоны и с
плавным укорочением кинет.
Род Parachilodonella Dragesco, 1966
Типовой в и д Р. lygiae, эктокомменсалы на плео-
подах и жабрах Ligia — изопод группы Oniscoidea
(мокрицы), живущих на границе суши и моря; для
дыхания смачивают жабры морской водой. Назва-
ние вида следует изменить на Р. ligiae nom. согг. Тело
веретеновидное, заострено снизу, с мелким стилоном;
2 вакуоли лежат по диагонали, как у хилодонелл; ядро
цикломерное; по оси тела широкая безресничная зона
с 2 продольными складками кортекса. Цилиатура в
2 полосах, слева и справа; число и положение кинет,
их уменьшение к периферии, как у хилодонелл; почти
все правые ряды огибают рот. Над ртом 2 короткие
поперечные стомокинеты и длинный ряд вдоль шва —
вновь как у хилодонелл. Этот вид считали проме-
жуточным между Chilodonella и Hartmannula, но это
ошибка; последних легче вывести от хламидодонтид
типа Cyrtophoron. Описание выше дано по расе из
Франции; материал из Крыма во многом не совпадает с
этим описанием, в частности 2 складки находятся на
дорсуме, не вдоль ацилона; число кинет больше, аци-
лон сужен, тело сзади не заострено. Вероятно, это раз-
ные виды с разных хозяев.
Р. gammari Jank. sp. п. для Trochilioides sp. in Fen-
chel, 1965 — симбионты литоральных амфипод Gam-
marus duebeni в Дании; это вид того же типа, что и ком-
менсал лигий. Внешне, как Chilodonella, отличие —
крупный стилон в нижней части ацилона, между по-
лосами кинет. Глотка с тонкими немадесмами, как и
у Р. ligiae.
Род Trochilioides Kahl,
1931
Всеми признанный род оказывается невалид-
ным вследствие отсутствия указания типового вида
(по Аэшт); виды рода изучены многими авторами, осо-
бо тщательно Жильбером Деру (Deroux, 1976а,
1976b, 1976с), но никто не обозначил типа. Здесь как
типовой вид указывается Trochilia recta Kahl, 1928 и
род меняет авторство — Trochilioides Jank. gen. n.
В оригинале Каль (Kahl, 1931) включил 4 вида: Т. stria-
ta (Ervilia striata Buddenbrock, 1920), T. recta (Trochi-
lia recta Kahl, 1928), T. crassa (Trochilia crassa Le-
vander, 1894), T dubia (Trochilia dubia Wallengren,
1903).
Морские виды (кроме двух), обычные в бентосе.
Тело плоское, овальное, рот щелевидный, попереч-
ный, окружен циртумом с тонкими немадесмами; ки-
неты немногочисленные, в 2 полосах — правая полоса
удлинена, 3 ряда огибают рот; левая полоса резко уко-
рочена, поперечная, нет плавного укорочения вент-
ральных кинет, как у Orthotrochilia. Над ртом 3 парал-
лельные короткие мембраны.
В литературе описано много видов с плохими
рисунками, без точных данных о кинетоме, рото-
вых мембранах и строении циртума; валидных ви-
дов мало, фактически лишь несколько видов, изучен-
ных на протарголовых препаратах. Примеры видов
(comb, nn.): Т. bathybius (Jank., 1968), Т. recta (Kahl,
1928), T. tenuis (Deroux, 1976), T. fimbriata (Foissner,
1984), T. artemiae (Tucolesco, 1962). Симбионт мор-
ских гаммарид T. trivialis (Fenchel, 1965) — вид с плав-
ным уменьшением длины кинет, вероятно не относит-
ся к этому роду.
ТИП CILIOPHORA. КЛАСС PHYLLOPHARYNGEA
649
Род Trochilia Dujardin, 1841
Типовой вид Т. sigmoides по монотипии. Виды
рода повсеместно встречаются в пресной воде, в соло-
новатых водах, в пересоленных озерах и в море, это
одни из наиболее частых, но малозаметных мелких ви-
дов цилиат. Накопилась большая путаница в системе
рода, и сейчас лишь несколько видов считаются валид-
ными. В литературе к Trochilia часто приписывали
виды, ныне относимые ко многим родам гипостомат.
Т. sigmoides — морской вид; пресноводный вид
определяют как Т. minuta (Roux, 1899 in Dysteropsis). В
первоописании вида из Средиземного моря даны 4 ри-
сунка, все с дорсума — показаны продольные дуговид-
ные складки панциря, образующие 5—6 ребер. Склад-
ки дорсума переходят слева на вент; рот щелевидный,
диагональный, с узкой длинной извитой глоткой; ки-
нетом — 3 ряда справа (2 огибают рот), группа корот-
ких экваториальных кинет, 2 коротких ряда левее рта.
Правее рта 2 параллельные мембраны, левее 1 мелкая
мембрана. Стенки циртума образованы 2 плоскими не-
мадесмами. Ядро септимерное. Крупный валидный
вид Т. petram Dragesco, 1966 найден в море.
Род Dysteropsis Roux, 1899
Типовой в и д D. minuta из пресных вод; назва-
ние использовалось редко, род считали синонимом
Trochilia и Dysteria', по новым данным вид отличается
от морской Т. sigmoides. Правее и левее рта по 2 мел-
кие мембраны, нет складок кортекса, справа 4 кинеты;
рот округлый, циртум из многих идентичных тонких
немадесм. В принципе название Dysteropsis валидное,
если разбить род на 2 подрода по типу панциря (глад-
кий или ребристый), как у дистеривд.
Виды, не считающиеся валидными: Т. palustris Ste-
in, 1859; Т. marina Mereschkowsky, 1880; Т. polonica
Wrzesniowski, 1867; T. fluviatilis Stein, 1860; T. salina
(Entz, 1878 in Ervilia)', T. striata (Buddenbrock, 1922);
T. pusilia (C. et L., 1859 in Aegyria).
Род Caligicola Jankowski, 1976
Типовой вид Trochilioidesfilans Faure-Fremiet et
Guilcher, 1947 из морского обрастания, вначале найден
на копеподах Pseudocaligus с покровов рыб. По Аэшт,
род невалиден как предложенный в тезисах, поэтому
здесь предлагается вновь с тем же типом — Caligicola
Jankowski gen. п. Тело очень тонкое и длинное, нети-
пичной формы для гипостомат; особи секретируют
длинную прикрепительную нить, выделяемую по-
движным стилоном (подитом), и раскачиваются над
субстратом, фильтруя воду. Кинетом в первоописании
показан неправильно — широкая полоса вдоль всего
правого края до апекса, шов с диагональной кинетой,
и короткая полоса слева с 5 рядами. На протарголовых
препаратах кинетом однотипен с Trochilia, в пра-
вой полосе 4 ряда, в левой 2; сходен ротовой аппарат и
циртум (2 широкие пластинки). Отличия — по фор-
ме тела и складкам — Trochilia имеет внешний облик
дистерий; у Caligicola тело вытянутое, постерон ниже
стилона резко расширен, с концентрическими склад-
ками. Caligicola можно считать подродом в составе
Trochilia.
Сем. Kyaroikeidae Sniezek et Coats, 1996
Тело длинное, узкое, равномерно ресничное, при-
креплено к субстрату секрецией постерона, стилона
нет; рот и ротовая цилиатура на дне глубокой полости
(буккон); немадесм нет.
Род Kyaroikeus Sniezek, Coats et Small,
1995
Типовой вид К. cetarius, специфический симби-
онт в мукусе дыхательных путей китообразных; най-
ден в слизи атлантического бутылконоса — дельфина
Tursiops truncatus, косаток Orcinus orca и Pseudorca
crassidens, белуги Delphinapterus leucas, вероятно оби-
тает в широком круге хозяев. Крупные гипостоматы
(100—250 мкм) с очень длинным и тонким телом, при-
креплены к субстрату нитью, выделяемой расширен-
ным участком постерона; стилона или подобных орга-
нелл нет. Ядро септимерное. Слегка изогнутые кинеты
покрывают почти все тело, расположены вплотную;
если гомологизировать кинетом гипостомат обычного
типа и этого вида, 44—51 правые кинеты полимеризо-
ваны, расположены на венте, краях, дорсуме и слева
подходят к полосе тесно сближенных кинет и несколь-
ким фрагментам (4 кинеты левой полосы). Широкий
ацилон, сужаясь, идет от апекса до нижнего конца тела
(под ним 13—14 продольных фибрилл). Рот погружен
на дно полости, вместе с стомокинетами — циркумо-
ральными и преоральным рядом. Цилиат в слизи китов
отмечали и раньше, но строение их впервые изучено
при импрегнации этого вида. В ротовой полости уса-
тых китов, цедящих планктон, много перитрих (коло-
нии Epistylis) и лорикатных простомат Haematophagus,
но таких гипостомат не отмечено.
Сем. Plesiotrichopidae Deroux, 1976
У Линна (Lynn, 2002) в составе этого семейства
приводятся роды Atelepithites, Parachilodonella, Pithi-
tes, Plesiotrichopus и Trochochilodoiv, общее у них —
отсутствие стилона. Неизвестно, первичный ли это
признак или следствие утраты стилона, не доказана
монофилия семейства и родство включаемых родов.
Поэтому сейчас семейство представляется искусствен-
ным набором видов самого разного плана строения,
без прикрепительного комплекса или с органеллами
разного типа для временной или постоянной фикса-
ции. В данном обзоре состав семейства изменен.
Род Plesiotrichopus Faurd-Fremiet, 1965
Типовой в и д Р. natans. Тело тонкое, вытянутое,
сужается кзади, незначительно сплющено, с узким
ацилоном между 2 полосами кинет (8 + 5 рядов); ядро
650
ALVEOLATA
с неровным контуром, 2 вакуоли вдоль правого края.
Рот небольшой, окружен немадесмами; над ртом
2 мембраш,I, греи,я смещена влево, длиннее осталь-
ных. Кинет ы правой полосы биполярные, 3 из них оги-
бают рот; левая полоса укорачивается влево. Крупная
сферическая фиксаторная железа открывается тонким
извит ым каналом в ресничную ямку с нижними частя-
ми кинет правой полосы. Ряд признаков сближает
вид с примитивными гИпостоматами.
Род Cirrothigma Jankowski,
1976
Типовой вид Parachilodonella distyla Wilbert,
1970. Род предложен в тезисах, поэтому объявлен
Аэшт невалидным; позже предложен род Wilbertella
Gong et Song, 2006 с указанным типом. Пресновод-
ный вид из обрастания, изучен при импрегнации
протарголом. Мелкие овальные формы с септимерным
ядром; 2 вакуоли по диагонали; рот мелкий, не рас-
тянут, циртум с 10—12 простыми немадесмами. Нет
ацилона, ряды кинет в 2 полосах — правой (6) и левой
(5); 2 ряда огибают рот сверху; ротовые кинеты не-
равной длины, одна из них вытянута и пересекает пра-
вые ряды. В зоне разрежения кинетосом 2 зубовидных
придатка, без внутренней ампулы и канала. Род не-
ясного положения; по типу кинетома близок к Chla-
mydonella.
Род Horocontus Deroux, 1976
Типовой вид Н. arcuatus из морского бентоса.
Тело мелкое (25 мкм), плоское, панцирь с 2 зубцами
спереди; имеется ацилон; на дорсуме концентрические
изогнутые складки панциря; глотка тонкая, с мелким
ртом. В правой полосе 3 ряда (2 огибают рот), левая
полоса в виде серии фрагментов кинет ниже рта; над
ртом 3 параллельные мембраны. Неясно, есть ли сти-
лон и секреторная железа; неясно и с циртумом — пол-
ностью редуцированы немадесмы или не видны в
бальзаме. Такие формы нужно изучать in fixo при бо-
ковом освещении.
Род Pithites Deroux et Dragesco,
1968
Типовой вид P. vorax из морского бентоса (ме-
тод работы — экспозиция предметных стекол на 1—
2 недели, фиксация Буэном и окраска протарголом).
Мелкий вид (30—35 мкм), прикреплен к субстрату
прочной нитью, секретируемой небольшой железой и
выделяемой небольшим участком кортекса без стило-
на. Вакуоли нет; ядро септимерное; кинеты в 2 поло-
сах, правые особо удлинены и заходят всей полосой на
дорсум, левые укорачиваются (5—6 и 6—7 рядов в по-
лосах); ротовая цилиатура необычная — полукольцо
кинетосом ниже рта, дуга из фрагментов по 2—3 кине-
тосомы выше рта; рот щелевидный, глотка очень ко-
роткая, немадесмы не зарисованы. Питание хищное,
заглатывает мелких цилиат.
Род Atelepithites Deroux, 1976
Типовой вид Л. misellum из морского обраста-
ния. Организация клетки, как у Pithites, с 2 полосами
кинет и широким ацилоном; имеются короткие нема-
десмы циртума; одна вакуоль снизу слева; ядро вытя-
нутое; ротовая цилиатура — ресничная дуга ниже рта,
4 мелких фрагмента выше и левее. Нет ни следа секре-
торного аппарата — железы, стилона и прикрепитель-
ной нити.
Род Huxleya Claparfede et Lachmann, 1858
Типовой вид Н. crassa-, гомоним, невалидное
название. Род предложен для 2 видов разной морфоло-
гии, Н. sulcata С. et L., 1858 (типичная морская Trochi-
lia с ребрами панциря) и Н. crassa С. et L., 1858; общий
признак один — «без панциря». Первый вид признан
синонимом Trochilia sulcata Duj., 1841, второй (типо-
вой) вид неопределим — показан с дорсума, с шипом
снизу. Ввиду плохого описания и гомонимии род нева-
лиден.
Род Brooklynella Lom et Nigrelli, 1970
Типовофвид В. hostilis; открыты в морском ак-
вариуме Нью Йорка при осмотре микропаразитов рыб;
встречаются на разных хозяевах (как и пресноводные
Chilodonella piscicola и Ch. hexasticha) — в аквариуме
на 14 видах 10 родов рыб. Род вначали поместили в
сем. Dysteriidae, но по кинетому и отсутствию стилона
позже сближали с Chlamydodon. Встречаются в массе
на жабрах и поверхности тела хозяев в основном на ви-
дах рода Sparus. Считаются патогенами, разрушают
эпителий и вызывают воспаление кожи рыб. Вид хоро-
шо изучен при импрегнации протарголом, включая
процессы морфогенеза при делении, а также в скани-
рующем микроскопе.
Тело широкое, овальное, некрупное (56—86 мкм),
с большим числом вплотную сближенных кинет, тесно
сближены и кинетосомы в рядах; поле кинет непре-
рывное, но можно различить 2 зоны, правую (от посте-
рона до апекса, дуговидную) и левую (ниже и левее
рта). Рот слегка сплющен, окружен 8 немадесмами
простого типа (без эпидентов — мой термин для обо-
значения зубцов над немадесмами), глотка прямая,
длинная. Ядро септимерное. Над ртом 2 + 1 мелкие
мембраны. В зоне, где расположен стилон дистериид,
находится небольшое вздутие, внутри с канальцами,
секретирующими фиксаторный материал. Один из по-
слеротовых рядов ресничек удлинен и закручен в зоне
железы. Канальцы железы открываются в общую пору
на вершине придатка.
Род Allosphaerium Kidder et Summers,
1935
Типовой вид Л. convexa (правильно, по Аэшт,
A. convexum). Мелкие овальные плоские формы, сим-
бионты амфипод-талитрид морской супралиторали;
ТИП CILIOPHORA. КЛАСС PHYLLOPHARYNGEA
651
лег на постоянно-водных талитридах рода/7уа/е. Ядро
септимерное, 2 вакуоли лежат по диагонали, циртума с
немадесмами нет, кинетом непрерывный — кинеты
расположены на равных расстояниях, 3 правых ряда
удлинены и огибают рот. Условно кинетом можно раз-
делить на 2 зоны по ряду, идущему к аналогу стило-
пн — над нижними концами удлиненных правых кинет
находится мелкая округлая прикрепительная органел-
ла без секреторной железы под ней в цитоплазме, без
стилона, не выделяющая фиксаторную нить. Ротовой
ресничный аппарат — 3 короткие поперечные мембра-
ны, 2 над ртом и одна сдвинута влево, в небольшой
зоне, ограниченной сомакинетами. Систематическое
положение рода неопределенное; в связи с отсутстви-
ем стилона род сближали с Chlamydodontidae.
Состав рода: A. convexa К. et S., 1935 (тип рода, на
жабрах и икринках Talorchestia longicornis, США; дли-
на тела 24—36 мкм, 17 кинет), A. caudatum К. et S.,
1935 (Orchestia agilis, 35—45 мкм, 14 кинет), Л. granu-
losum К. et S., 1935 (О. agilis, О. palustris, 32—42 мкм,
17 кинет), Л. sulcatum К. et S., 1935 (О. agilis, О. palust-
ris, 2А—32 мкм, 12 кинет), A. palustris К. et S., 1935
(О. palustris, редко на Т. longicornis', 46—59 мкм,
27 кинет), A. paraconvexa Dobrzanska-Kaczanowska,
1962 (на Talitrus saltator в Польской Балтике; вначале
описан как A. convexa', с 14 кинетами), A. isseli Del-
la-Valle, 1938 — на Talitrus saltator, Orchestia monta-
gui, O. platensis, O. mediterranea в Италии; этот вид не
был замечен специалистами, вероятно предыдущий
вид нужно свести в синонимы. Виды рода Allosphaeri-
um обычны на береговых талитридах Черного моря и
всех дальневосточных морей; но в наших северных мо-
рях хозяев-талитрид нет.
Род Trichopodiella Corliss, 1960
Замещающее название для Trichopus Claparede et
Lachmann, 1859; типовой вид Trichopus dysteria C. et
L., 1859 из морского бентоса в Норвегии. Этот вид все-
гда представлял собой неразрешимую загадку, и до
сих пор никем не найден и не описан. При виде сбоку
тело сужено и закруглено у вершины, вздутое ниже;
реснички апикальные и вдоль вентрального края; на
месте стилона виден пучок ресничек; рот с немаде-
смами; ядро овальное; вакуоль дорсально снизу.
По описанию и рисунку нельзя представить себе стро-
ение вида — инфузорий нужно рисовать с разных сто-
рон. Вид сближали с Aegyria, Dysteria, по Калю (Kahl,
1931) это «сомнительный, плохо описанный вид».
Фактически род существует без типового вида — опи-
сывают виды с другой формой тела, совершенно не-
сходные с примитивным рисунком в первоисточнике.
Род Trichopodiella должен быть объявлен неопредели-
мым, либо нужно подать обоснованную петицию в
ICZN о смене типового вида в связи с невозможностью
определения Т. dysteria (по аналогии с типом рода
Oxytricha}.
Представитель этого фиктивного рода во всех свод-
ках по цилиатам — Т. lachmanni Faure-Fremiet, 1957.
Тело не сплющено, вздутое, как адаптация к обитанию
в толще воды; ядро овальное, вакуоль медиальная,
книзу тело сужено и оттянуто в виде асимметричного
придатка. Рот щелевидный, очень длинный, диаго-
нальный; глотка короткая и очень широкая, под всей
ротовой щелью; немадесм нет. Кинеты полимеризова-
ны, сложной топографии, окружают все тело; условно
можно различить правую и левую полосы, в обеих чис-
ло кинет резко увеличено. Выступ постерона ведет в
полость с концами (обособленными сегментами) ки-
нет, реснички которых видны в виде компактного пуч-
ка. В полости расположена небольшая ампула, кото-
рую гомологизируют с железой Aegyriana {Glenotroc-
hilia}. Активный пловец и хищник, поедает других
цилиат в толще воды над дном.
Т. elongata Deroux, 1976 — менее измененный вид с
не сплющенным удлиненным телом, ротовой щелью,
плоской глоткой, почти весь дорсум без кинет, нет ал-
лометрии ресничных зон; сзади ацилон без следа желе-
зы. Т. pulex Deroux, 1976 — очень мелкий вид, кинетом
только вентральный, рот щелевидный, правее и левее
рта 2 мембраны; ампулы нет, по морфологии все 3 ви-
да не могут относиться к одному роду, типовой вид ко-
торого вообще неопределим, и его смена не улучшит
ситуации. В данной ревизии тип рода Trichopodiella
объявляется неопределимым, а вид Т. lachmanni Fa-
ure-Fremiet, 1957 выделяется в новый род Selicineta
Jankowski gen. n.
Подкласс Rhynchodia Chatton et Lwoff, 1939
Трофотомонты мелкие, овальные или удлиненные, с сосущей
трубкой и экструсомами типа гаптотрихоцист. Соматическая цили-
атура с тенденцией к редукции и укорочению кинет, может быть
утеряна у части родов (с сохранением инфрацилиатуры) на стадии
трофонта, но имеется у томитов сфенофрий. Характерно подразде-
ление групп кинет на несколько зон.
Кинетосомы с микротубулами; нет кинетодесм, но с каждой
кинетосомой связана короткая фибрилла, расположенная справа от
кинет. Питание паразитическое, высасыванием добычи или клеток
эпителия хозяина. Размножение делением надвое, часто неравным,
ведущим к почкованию у сфенофриид. Стадии конъюгации очень
редкие; инцистирование неизвестно.
Трофонты анцистрокомид внешне сходны по форме тела с тро-
фонтами тигмотрих типа Ancistrum, обычно обитающих в тех же
хозяевах: тело каплевидное, прикрепление апексом, где рас-
положена тигмотактическая цилиатура у тигмотрих и присоска
у ринходид; сходен ядерный аппарат, число кинет обычно не-
велико. Поэтому Rhynchodida выводились от фаготрофных анцист-
рид и обе группы включались в состав отряда Thigmotrichida
как подотряды (Chatton, Lwoff, 1949, 1950; Raabe, 1970а, 1970b).
Виды ринходид рода Ancistrocoma считались примитивными, а
у других родов с небольшим числом кинет обособленные рес-
ничные ряды принимали за рудимент ундулирующей мембра-
ны предка. Электронная микроскопия показала сходство ринходид
с Hypostomatida и полное отсутствие общих признаков с Anci-
stridae (Thigmotrichida). У части дистериид рот поднят над те-
лом, глотка имеет вид узкой трубки, немадесмы утрачены; та-
кие формы могли перейти от заглатывания добычи к высасыванию
перитрих, эпителия червей или моллюсков, дав начало ринхо-
дидам.
652
ALVEOLATA
Рис. 329, a. Rhynchodida.
Hypocomides sp. с морских гастропод Margarites на Мурмане, ориг. (A); Heterocinetopsis unionidarum (Б, B)\ Ancistrocomapholadis (Г); А. туае (Д, Ж); Pelecy-
ophrya tapetis (Е). (По: Raabe, 1970b (Б, В); Chatton, Lwoff, 1950 (Г-Ж)).
Fig. 329, a. Rhynchodida.
Fig. A — Hypocomides sp. on marine gastropod Margarites, Murmansk coast.
Отряд Rhynchodida Chatton et Lwoff,
1939
Подотряд Ancistrocomina Jankowski,
1980
В системе цилиат Пюйторака (Puytorac, 1994) и
Линна (Lynn, 2002) подотряд с таким названием при-
писан Шатто ну и Львову (Chatton, Lwoff, 1939), кото-
рые такого таксона никогда не предлагали. Тело капле-
видное, иногда вытянутое, с апикальной присоской и
длинной глоточной трубкой в цитоплазме. Кинетом
обычно с 3 четкими зонами — несколько удлиненных
кинет огибают осевую зону укороченных тесно сбли-
женных рядов, образующих тигмотактическое поле;
эта группа кинет лежит в неглубокой выемке тела.
Роды ринходид легко сравнивать по формуле кинето-
ма — числу кинет в зонах А, В и С (справа налево).
Кортекс с мелкоячеистой сетью аргирома; импрегни-
руются края субпелликулярных альвеол такого типа,
как у предковых гипостомат. Характерна тенденция к
укорочению кинет и уменьшению их числа. Размноже-
ние делением, иногда неравным; почкования и димор-
физма (томонт, томит) в цикле развития нет. Все
виды — паразиты на эпителии хозяев, в основном мол-
люсков, полихет и форонид.
Сем. Ancistrocomidae Chatton et Lwoff,
1939 (рис. 329, a—330, a)
С характеристикой подотряда. В каталоге Раабе
(Raabe, 1970а, 1970b) семейство подразделено на не-
сколько подсемейств (Ancistrocominae, Hypocomidi-
nae, Hypocomellinae), но родовые критерии часто столь
невелики и неясны, что различение групп родов пока
преждевременно. Подсемейства должны быть моно-
филетичными, что также не выяснено. Роды различа-
ются условно по топографии кинет и величине присос-
ки: дробление родов привело к тому, что можно опре-
ТИП CILIOPHORA. КЛАСС PHYLLOPHARYNGEA
653
Рис. 329, б. Rhynchodida.
Ancistrocoma pelseneeri (A—В); A. thorsoni (Г)- Ancistrocoma (Parachaenia) туае (Д, E)\ Crebricoma carinata (Ж); Hypocomella cardii (3); Goniocoma macomae
(И—М): Hypocomides elsinora (H, О). (По: Chatton, Lwoff, 1950 (A—В,Д, E, И—М)', Fenchel, 1965 (Г, H, O); Raabe, 1970b (Ж, 3)).
Fig. 329, 6. Rhynchodida.
делить вид у ринходид, но трудно сказать, к какому
роду он относится. Трофонты паразитируют на эпите-
лии наружных покровов (щупальца червей, жабры по-
лихет, голова и щупики гастропод), на эпителии ман-
тийной полости и жабер двустворчаток в пресной воде
и в море; указание на эндопаразитизм (в кишечнике
моллюсков) требует проверки. Трофонты прочно при-
креплены вершиной короткой присоски (можно обо-
значить термином «мукрон»), висят на эпителии хозя-
ина; реснички в этой фазе малоактивные или непо-
движные. Присоска способна втягиваться в тело, если
паразитов отделить от хозяина. После отделения тро-
фонты плавают с медленным вращением. Деление рав-
ное или анизотомическое, полоса деления зооидов ка-
жется диагональной. Макронуклеус овальный или
слегка вытянутый. В постесоме всасываемая жидкость
накапливается в крупной пищевой вакуоли. Основное
разнообразие видов в море; в одном хозяине, например
в мидиях, может быть несколько видов ринходид раз-
ных родов. Распространение группы всесветное.
Род Ancistrocoma Chatton et Lwoff,
1926
Типовой вид Л. pelseneeri по обозначению Раа-
бе (Raabe, 1970а, 1970b); синонимы по Аэшт — Ho-
locoma, Parachaenia, Syringopharynx. Паразиты мор-
ских двустворчатых моллюсков. Тело вытянутое, уз-
кое спереди, формула кинетома А5 (4), В5, С1, всего
кинет 13, реже 12 у типового вида. Кинеты изог-
нутые, укорочены в тигмозоне (полоса В), почти
достигают постерона в зонах А и С. Имеется очень ши-
рокая безресничная зона (ацилон). Род введен для 2 ви-
дов; второй вид A. pholadis Ch. et Lw., 1926 с камне-
точцев Pholas Candida сведен позже в подвид A. pel-
seneeri var. pholadis. Тип рода с жабер Масота
balthica, вместе с Goniocoma и Thigmophrya. Вид в
Муа arenaria в США, определенный как A. pelseneeri,
ранее описан как тип рода Parachaenia. Ancistro-
coma dissimilis Kozloff, 1946 с камнеточцев Pholadi-
dea (Penitella) penita в США — валидный вид рода.
654
ALVEOLATA
Рис. 330, a. Rhynchodida.
Raabella helensis (Л); Hypocomides astartae (,E—Г); Heterocinetopsis reichenowi (ДУ Holocomaprimigenius (Ж—Иу Hypocomides modiolariae (К, Л, O); Isocomi-
des mytili (M. H); Hypocomagalma dreissenae (П, P). (По: Chatton, Lwoff, 1950 (Ж—И, M—O); Fenchel, 1965 (Л—Г, E, К, Л, П, P); Raabe, 1970b (Д)).
Fig. 330, a. Rhynchodida.
A. thorsoni Fenchel, 1965 из Abra nitida в Дании — абер-
рантный вид по кинетому, заслуживает особого под-
рода.
Род Anisocomides Chatton et Lwoff, 1950
Типовой вид Hypocomides zyrphaeae Ch. et Lw.,
1926 по монотипии, на жабрах двустворчаток Pholas
(Zyrphaea) crispata (в литературе принято название
Zirfaea, поэтому правильное название паразита —
Н. zirfaeae). В каталоге Аэшт тип рода указан как Hy-
pocomides vittata Ch. et Lw., 1926 по ошибке — такого
вида у ринходид нет. Мелкие каплевидные формы с
3 зонами кинет и фрагментом кинеты снизу слева; зо-
на В представлена лишь 2 кинетами, что нетипично
для ринходид; зона А подразделена на две — А1 и А2,
с 2 рядами в каждой. Формула кинетома А4, В2, С5.
В сумме без фрагмента имеется 12 кинет.
Род Branchiocoma Jankowski
gen. n.
Типовой вид Hypocomagalma pholadidis Koz-
loff, 1946, на жабрах и пальпах камнеточцев Pholadi-
dea penita в Калифорнии. Узкие вытянутые формы с
полимеризацией кинет. Тип рода пресноводная Hypo-
comagalma (Н. dreissenae) едва ли родственна с пара-
зитами фоладид; у Branchiocoma нет аллометрии ки-
нет зоны С и нет непропорционального укорочения
зоны В, зоны В и С слиты в единое ресничное поле, не-
значительно удлиненное в нижнем левом углу. В сум-
ме имеется 22—24 кинет; левая полоса кинет не отгра-
ничена четко от медиальной, не подходит под прямым
углом к правой полосе.
Род Colligocineta Kozloff,
1965
Типовой вид С. furax по монотипии со щупиков
сабеллидной (сидячей в песчаных трубках) полихеты
Laonome kroyeri в США. Другие виды — С. affinis К.,
1976 на простомальных циррах полихеты Sabella pavo-
nina (Англия); С. finleyi К., 1976 с того же хозяина и
С. scololepidis К., 1976 с подвижной иловой полихеты
Scolelepis fuliginosa во Франции (правильное название
вида паразитов С. scolelepidis). Мелкие каплевидные
формы с относительно небольшим овальным полем
кинет; зона В укорочена, зоны А и С удлинены и смы-
каются снизу, обходя ямку ниже тигмозоны В. У этих
видов кинеты краевых зон как бы соединяются попар-
но, создавая впечатление кольцевых кинет; у неопре-
деленного вида с Мурмана (на Polydora") ряды подхо-
дят почти вплотную, но не соединяются. Формула ки-
нетома типового вида А2, В5, СЗ. Род приурочен к
полихетам семейств Sabellidae и Spionidae, живущих в
ТИП CILIOPHORA. КЛАСС PHYLLOPHARYNGEA
655
Рис. 330, б. Rhynchodida.
Sphenophrya sphaerii (A—Ж); S. naumiana (3, И); S. cardii (К, JT); Gargarius gargarius (AT); Sphenophrya sp. из Anomalocardium (H, O); 5. dosiniae (П—С). (По:
Chatton, Lwoff, 1921 (Л—У), 1950 (ЛЦ; Fenchel, 1965 (K, JT); Raabe, 1970b (А—И); Puytorac et al, 1980 (H, 0)).
Fig. 330, 6. Rhynchodida.
трубках, иногда в массовых скоплениях на литорали
или поодиночке (Polydora) как перфораты раковин
моллюсков.
Род Crebricoma Kozloff,
1946
Типовой вид Hypocomina carinata Raabe, 1934
по монотипии, с мидий Mytilus edulis. Сложность в
том, что как Н. carinata автор этого рода описал вид из
мидий Калифорнии, позже обозначенный как Cr. koz-
loffi Ch. et Lw., 1950. Какой вид является типовым для
рода? Действительно ли в одном виде хозяина обитают
2 вида кребриком? У Раабе (Raabe, 1970а, 1970b) раса
из Балтики имеет 20—25 кинет, у паразита на пальпах
и жабрах мидий в США 30 рядов, в остальном виды
сходные. Относительно крупные формы с изогнутым
вытянутым телом, с широким ребровидным антеро-
ном; у других ринходид тело заостряется к щупальцу.
Плоская вогнутая вентральная сторона занята боль-
шим числом кинет; в зоне А лишь 2 ряда, зоны В и С
сливаются и кинеты в этой полосе плавно удлиняются
справа налево; нет безресничной полоски или ребра меж-
ду ними. По Шаттону и Львову (Chatton, Lwoff, 1950),
род предложен для вида С. kozloffi, который является
типовым видом, но приоритет имеет вид С. carinata.
Род Enerthecoma Jarocki,
1935
Типовой в и д £. properans по монотипии, с эпи-
телия мантийной полости и ктенидиев пресноводных
гастропод Viviparus fasciatus. Основные признаки
рода — удлиненное тело, симметричное положение
кинет, имеющих равную длину. Рисунка вида в его
первоописании нет. Под тем же названием вид описан
в Калифорнии в другой живородке V. malleatus, но эта
форма позже была признана другим видом Е. kozloffi
Ch. et Lw., 1950, имеет продольное ребро, разделяю-
щее кинеты на 2 группы (5 + 3 кинеты). Раабе (Raabe,
1970а, 1970b) не признает этого вида. Другие виды:
Е. dissimilis Mahmood et Khan, 1980 из мантийной по-
656
ALVEOLATA
лости V. dissimilis в Индии; Е. tegularum (Kozloff, 1946)
из морских гастропод Tegula brunnea в Калифорнии;
Е. melanoidii Kalavati et al., 1987, из кишечника (?) пре-
сноводной тропической гастроподы Melanoides tuber-
culatus в Индии. Типовой вид рода до сих пор не пере-
описан.
Род Goniocoma Chatton et Lwoff, 1950
Типовой вид Efypocomella тасотае Ch. et Lw.,
1926 по монотипии, с жабер Macoma balthica (Bival-
via). Мелкие формы с резким сужением тела у апекса,
тело вытянуто и отогнуто вбок под присоской. Топо-
графия кинетома сложная, различимы 3 отдела кинето-
ма; в краевых зонах А и С кинеты полимеризованы, и
часть кинет аллометрически удлинена, огибая нижний
конец тела; имеется мелкий фрагмент кинеты у нижне-
го края зоны С. Практически все тело покрыто рядами
ресничек. В Дании кроме типового хозяина этот вид
найден также в двустворчатках Abra alba, но не в A. ni-
tida, имеющей другой комплекс паразитов.
Род Heterocineta Mawrodiadi, 1927
Типовой вид Н. anodontae по монотипии, с жа-
бер пресноводных наяд (Unionidae). Род и вид позже
признаны невалидными (Chatton, Lwoff, 1950), хотя
после первоописания к нему относили 7 новых видов.
Валидным признано описание вида Н. anodontae in Ja-
rocki, 1934, позже (Raabe, 1970а, 1970b) названного
Hypocomatophora unionidarum Jarocki et Raabe, 1932; в
другой сводке (Chatton, Lwoff, 1950) этот вид числится
в составе рода Heterocinetopsis. Мавродиади не дал
точной картины кинетома типового вида и спутал
виды ринходид и гименостомат в унионидах, но тем не
менее следовало сохранить этот род и вид как Hetero-
cineta anodontae.
Род Heterocinetopsis Jarocki, 1935
Типовой вид Н. reichenowi по монотипии, с жа-
бер гастропод Viviparus fasciatus из Варшавы, вместе с
Enerthecoma properans. Тело вытянутое, с небольшим
числом кинет и нечетким разделением зон А и В, при-
мерно равных по длине; кинеты зоны С значительно
длиннее. Формула кинетома А2, В4, С6; кинеты распо-
ложены в небольшом углублении тела. В состав рода
включали несколько видов, приписанных вначале к
Heterocineta (Н. siedlecki Jarocki, 1935; Н. fluminicolae
(Kozloff, 1946), Н. goniobasidis К., 1946) и позже иск-
люченных из состава рода; валидные виды также Hete-
rocinetopsis reichenowi Jarocki, 1935 и Н. ohridanus Ra-
abe, 1965.
Род Holocoma Chatton et Lwoff, 1950
Типовой вид H. primigenius по монотипии, на
жабрах Macoma balthica на морской литорали встреча-
ется вместе со сходным видом Ancistrocoma pelseneeri.
Тело очень узкое, изогнутое, длинное, с вытянутым яд-
ром, реснички покрывают все тело, кинеты многочис-
ленные — 19—23 рядов, из них 6—-10 незначительно
укорочены; формула кинетома А6, В6—10, С 7; по
Фенхелю (Fenchel, 1965а, 1965b), имеется 15—17 ря-
дов (А8, В6, С2—3). Имеется очень узкий продольный
ацилон дорсально. Отношение к этому роду неопреде-
ленное, часть авторов считает вид валидным, а род —
синонимом рода Ancistrocoma (Xu, Song 2000b); по
мнению других, вид и род Holocomaprimigenius валид-
ные. У Н. primigenius полоса ацилона узкая, у типового
вида рода Ancistrocoma занимает почти весь дорсум,
поэтому род можно сохранить хотя бы как подрод ан-
цистроком.
Род Hypocomagalma Jarocki et Raabe,
1932
Типовой вид Н. dreissenae по монотипии, с си-
фонов и жабер двустворчатки обрастателя Dreissena
polymorpha', в исходном ареале (Каспии) паразиты это-
го вида не изучались. Вместе с хозяином выносят осо-
лонение в Балтике, более того, этих паразитов меньше
в пресноводных популяциях хозяев, больше в море, в
отличие от сопутствующей гименостоматы Conchopht-
hirus acuminatus. Вид Н. pholadidis Kozloff, 1946 из
морских камнеточцев выделен в особый род Branchio-
сота. Тип рода — мелкие широкие каплевидные фор-
мы; 24 кинеты разрежены на дорсуме, сближены вент-
рально, с 3 группами кинет — 8 коротких тигмокинет в
центре, правее и левее четко обособленные полосы
длинных кинет А и С. Практически все тело покрыто
ресничками.
Род Hypocomatidium Jarocki et Raabe,
1932
Типовой вид Н. sphaerii по монотипии, с мантии
и жабер мелких пресноводных двустворчаток Евразии
и северной Америки — Sphaerium согпеит (типовой
хозяин), S. lacustre, S. baicalense, S. rivicola, Pisidium
casertanum, P. obtusale. Мелкие каплевидные формы с
3 разрозненными группами кинет, с незначительным
числом кинет в каждой; всего 9 рядов, формула кине-
тома А2, В2, С5. Ряды сближены в полосе С, разреже-
ны в полосах А и В. Такой же внешний облик и кине-
том имеют томиты пресноводных сфенофриид, и этот
род служит исходным для Sphenophrya. Вид Н. jarockii
приведен ниже в составе рода Tripleurocoma.
Род Hypocomatophora Jarocki et Raabe,
1932
Типовой вид Н. unionidarum по монотипии, с
жабер и мантии наяд Anodonta cygnea и Unio pictorunr,
тело мелкое (37 мкм), слегка вытянутое, с 11 (редко
10) кинетами, с плавным удлинением кинет справа на-
лево. Вид найден в США на нескольких локальных ви-
дах унионид. Вероятно, неспецифичны к хозяевам в
пределах семейства наяд. Тип рода идентичен с Hete-
ТИП CILIOPHORA. КЛАСС PHYLLOPHARYNGEA
657
rocineta anodontae Mawrodiadi, но род Heterocineta от-
вергают как nomen nudum (co сборным, плохо описан-
ным типовым видом), a Hypocomatophora сводят в си-
нонимы рода Hypocomella с однотипным кинетомом.
Датировка родов — 1924 (Hypocomella), 1927 (Hetero-
cineta), 1932 (Hypocomatophora)', если не восстанавли-
вать название Heterocineta, валидно название Hypoco-
matophora.
Род Hypocomella Chatton et Lwoff,
1924
Типовой вид Hypocoma cardii Ch. et Lw., 1922
по монотипии, с жабер сердцевидок Cardium edule.
Тело удлиненно-овальное, мелкое (30 мкм), кинеты
вентральные, у типового вида 12—13 рядов на равных
расстояниях, но разной длины, 9—10 справа и 3 слева;
особо удлинена зона С, зоны А и В слившиеся. Этот
вид предпочитает не эпителий жабер, а междужабер-
ныс желобки, где скапливается в массе. Н. raabei Ch. et
Lw., 1950 — в C. edule, С. lamarcki и С. exiguum, раса
из последнего вида хозяев выделена в новый подвид
//. raabei var. roscoffensis Ch. et Lw., 1950. Из Cardium
edule описан также вид простомат Enchelys pisi Delphy,
1938, показано 7 кинет на одной стороне тела, всего
14 рядов; описание плохое, это несомненно ринходида
данного рода, но вид неопределим и никем не принят.
Виды из других хозяев — Н. maziarskii (Jarocki, 1935 in
Heterocineta) с гастропод Coretus corneus в Варшаве,
11. katharinae Kozloff, 1961 с жабер хитонов Katharina
tunicata, США, Н. goniobasidis (К., 1946) из Goniobasis
pHcifera, Н. janickii (Jar., 1934) из видов Physa в Поль-
ше и Калифорнии, Н. makedonica (Raabe, 1965) из гид-
робиид Pseudamnicola sturanyi в Охридском озере,
II. siedleckii (Jar., 1935) из аберрантных гастропод Ас-
roloxus lacustris в Варшаве, Н. krzysiki (Jar., 1934) из
Hithynia tentaculata в Польше и Венгрии.
Род Hypocomides Chatton et Lwoff,
1922
Типовой вид Я. modiolariae по обозначению Ра-
абе (Raabe, 1970а, 1970b); паразиты мелких модиол
Mtisculus marmoratus', род предложен для 2 видов с жа-
бер модиол и мидий, но вид с мидий сейчас выделяется
в особый род Isocomides. Другие виды — Н. elsinora
Fenchel, 1965, Н musculusF., 1965, Н. hiatellae F., 1965,
Н. astartae F., 1965, все из морских двустворок родов
Mtisculus, Modiolaria, Astarte, Hiatella (=Saxicava), Bo-
tula. Кинетом этих форм существенно различается, род
может быть сборным. Типовой вид рода — вытянутые
формы с четкими зонами кинет; удлинена зона А, от-
деленная широким ацилоном от тигмозоны В и левой
полосы С, снизу слева — фрагмент кинеты. Формула
кинетома А2, В15, С8. У других видов число кинет
меньше, зоны В и С разрознены, с широким ацилоном.
Виды рода обычны на Мурмане в указанных видах хо-
зяев, найдены в США в Botula californiensis и Kellia la-
perousii (H. botulae, H. kelliae). В Китае описан вид с
жабер мидий Mytilus edulis — Hypocomides weihaiensis
Xu et Song, 1998 (Crebricoma weihaiensis comb. n.).
Род Hypocomidium Raabe, 1938
Типовой вид Я. fabius R., 1938, также H. granum
R., 1938, из морских двустворок Cardium edule и Mya
arenaria в Польской Балтике. Очень мелкие формы
(17 мкм) с овальным телом и мелкой присоской; кине-
ты немногочисленные, разрозненные, занимают зна-
чительную часть вентральной стороны, лежат в не-
большом углублении кортекса. Зоны трудно разли-
чить, нет ребер или ацилона между рядами, поэтому
формула кинетома не приводится. Имеется всего 6—
8 кинет, почти симметричных, правые ряды лишь не-
значительно длиннее остальных. Кинетом этого рода в
сущности сходен с цилиатурой Hypocomella, но род
можно сохранить, так как эти виды имеют присоску,
способную втягиваться внутрь тела; у Н. fabius из сер-
дцевидок наблюдали короткий и широкий мукрон при-
соски, как у Pelecyophrya. Поэтому диагностический
признак Раабе (кинетом) отвергается, но род сохраня-
ется по типу присоски (Chatton, Lwoff, 1950).
Род Hypocomina Chatton et Lwoff,
1924
Типовой вид Hypocoma patellarum Lichtenstein,
1921 по монотипии, с жабер гастропод Patella coeru-
lea; в южной Европе серия видов пателл, в северной
также акмеида Testudinalia, ринходиды на них не отме-
чены. Плоские овальные формы с апикальной присос-
кой, небольшим эллипсоидным ресничным полем, раз-
деленным продольным ребром кортекса на 2 тесно
сближенные зоны; ряды незначительно удлиняются от
обоих краев зоны к ее центру; кинет немного (8—
10, обычно 9). Этот род ближе всех стоит к сем. Нуро-
comidae — общее строение, ядра как у анцистрокомид,
кинетом типа Hypocoma parasitica. Hypocomina tegula-
rum Kozloff, 1946 описана из Tegula brunnea в Кали-
форнии.
Род Ignotocoma Kozloff, 1961
Типовой вид I. sabellarum по монотипии, с про-
стомальных циррусов сидячих полихет Schizobranchia
insignis (основной хозяин, в трубках длиной до 20 см) и
Eudistylia polymorpha (сем. Sabellidae) на северо-запа-
де США. Кинеты начинаются ниже присоски, идут
единым полем, без деления на зоны А—С, но можно
различить 2 группы, разделенные ребром; всего кинет
16 (8 + 8) или 15 (7 + 8). Отмечены интенсивные инва-
зии на щупальцах густой кроны хозяев, служащих для
питания и дыхания.
Род Ihsignicoma Kozloff, 1946
Типовой вид/, venusta по монотипии, из мор-
ской двустворки Botula californiensis, США. Размеры
тела до 50 мкм, тело вытянутое, с широким антероном,
к которому подходят вершины всех кинет. Четко выра-
жены все 3 зоны кинетома — А2, В16—17, С14—15 и
V-образный длинный фрагмент кинеты под зоной С.
42 Зак. №4163
658
ALVEOLATA
Всего 33—35 кинет, много для анцистрокомид, поэто-
му этот род считали примитивным. Длина ресничек
8—9 мкм, в фрагменте 12—14 мкм. Все кинеты нерав-
ной длины, в зонах В и С удлиняются справа налево,
заходят на дорсальную сторону. Род всегда считался
валидным, но недавно ликвидирован (Xu, Song, 2000а,
2000b), типовой вид переведен в Hypocomides (Н. ve-
nusta). Различия родов все же существенные — у
Н. modiolariae (типовой вид рода Hypocomides) анте-
рон узкий, стандартный для анцистрокомид, у I. venus-
ta кинеты начинаются от всего ребра, а не сходятся к
щупальцу.
Род Isocomides Chatton et Lwoff, 1950
Типовой вид Hypocomides mytili Ch. et Lw., 1922
по монотипии, с эпителия мантийной полости и жабер
мидий Mytilus edulis. Крупные вытянутые формы с ци-
линдрическим телом; кинеты многочисленные, идут
единой широкой полосой, ограничены справа и слева
ребрами кортекса. Ряды кончаются почти на одном
уровне, зоны А—С неразличимы, но продольный гре-
бень делит ресничную полосу на 2 части, без ацилона.
Ниже ресничной полосы — короткий поперечный
фрагмент кинеты. Всего 14—18 кинет (8—11 и 6—7),
длиной до 2/3 длины тела. В целом характерно ровное
поле кинет и фрагмент под ним. Под названием Hypo-
comides mytili описывались другие ринходиды — Raa-
bella helensis Ch. et Lw., 1950 в Балтике и в США; пере-
описание типового вида у Фенхеля (Fenchel, 1965а) из
мидий Дании.
Род Kozloffiella Raabe, 1970
Типовой вид Heterocinetaphoronopsidis Kozloff,
1945 по монотипии, со щупалец форониды Phoronopsis
viridis в Калифорнии; сейчас это название сведено в
синонимы вида Ph. harmeri. Тело каплевидное, слегка
вытянутое, кинет мало, всего 8 (3 + 2 +3 в трех зонах),
особо удлинены левые ряды, тигмозона четко не обо-
соблена. На дорсуме идет продольный желобок вдоль
края тела, начинается слева вентрально у рта и идет
почти до постерона, на 4/5 длины тела. У других видов
рода Heterocineta (из пресноводных моллюсков) и у
других родов ринходид такого желобка нет, поэтому
Раабе выделил Н. phoronopsidis в новый род, принятый
в литературе, но все же пока спорный, предложенный
по одному незначительному признаку>
Род Minicoma Jankowski gen. n.
Типовой вид Hypocomella quatuor Raabe, 1968
{M. quatuor comb, n.), паразиты аберрантных гало-
фильных гастропод Theodoxus (=Nerita) fluviatilis в
Польше. Очень мелкие формы с крайне упрощенным
кинетомом, сохранены лишь 4 кинеты в зонах В и С,
по 2 ряда в каждой; левые кинеты (зона С) несколько
удлинены и изогнуты. Крайняя олигомеризация кинет,
отсутствие зоны А — признаки нового рода, или по
крайней мере подрода. У типичных видов рода Hypo-
comella (Н. cardii, Н. chattoni) кинет больше, сохране-
на зона А. Неритиды имеют тенденцию к обитанию в
солоноватых водах, в лагунах и заливах, поэтому инте-
ресно изучить их симбионтов в сравнении с пресно-
водными Acroloxus.
Род Nordicoma Jankowski, 1979
Родовое название приведено в книге Корлисса
(Corliss, 1979), но род пока не описан. Это овальные
формы с широким телом, удлиненным ядром, густым
полем кинет, разделенных на 2 вплотную сближенных
зоны с 8—9 и 7—8 кинет; снизу фрагмент кинеты. Па-
разиты в очень мелком массовом виде двустворчаток
под камнями на литорали Мурмана.
Род Parachaenia Kofoid et Bush,
1936
Типовой вид Р. туае по монотипии, из крупной
двустворки Муа агепапа, закапывающейся в песок на
верхней литорали; паразитизм на тканях в первоописа-
нии не установлен; род приписан к Gymnostomata, так
как имеет узкий рот и длинную глоточную трубку. При
сравнении с совершенно неродственными формами
(свободноживущими простоматами типа Prorodon)
это, конечно, новый род, но специалисты перенесли
вид в состав ринходид {Ancistrocoma туае in Kozloff,
1946) и внутри этого рода объединили с A. pelseneeri
Ch. et Lw., 1926. Однако последний вид обитает в дру-
гом хозяине — мелкой двустворке Масота balthica,
обычной среди нор Муа. В итоге род Parachaenia лик-
видирован, а вид признан валидным (Fenchel, 1965 а,
1965b).
Тело А. туае узкое и вытянутое, с обширным дор-
сальным ацилоном и четким делением кинетома на
3 зоны; кинеты полимеризованы. Обследование мол-
люсков в США выявило вид в Муа arenaria, Cryptomya
californica, Масота irus, М. nasuta, М. secta и М. incon-
spicua.
Род Raabella Chatton et Lwoff, 1950
Типовой вид/?, helensis (=Hypocomides mytili in
Raabe, 1938) по монотипии, из мидий Европы и США.
По Раабе (Raabe, 1970а, 1970b), в Балтике 2 формы
вида — Н. mytili f. minor (14 кинет) и f. major (16 ки-
нет). Вид из калифорнийских мидий {Hypocomides my-
tili in Kozloff, 1946) не идентичен с балтийским, может
быть новым видом (Fenchel, 1965а, 1965b). Тело капле-
видное, ядро округлое, кинеты немногочисленные, в
непостоянном числе, формула кинетома А2, В5—8,
С7—8. Очень четко выражены все 3 зоны, разде-
ленные безресничными полосами; вершины кинет зон
А и С подходят к присоске на дорсуме. В отличие от
Hypocomides, Isocomides и Anisocomides, нет фрагмен-
та кинет. К роду относят также виды из США R. parva
(Kozloff, 1946), R. botulae (К., 1946) и R. kelliae (К.,
1946) из двустворчаток Botula californiensis и Kellia la-
perousii.
ТИП CILIOPHORA. КЛАСС PHYLLOPHARYNGEA
659
Род Stegotricha Bower et Meyer, 1993
Типовой вид 5. enterikos по монотипии, в не-
обычном для ринходид локусе — в просвете тубул пи-
щеварительной железы устриц Crassostrea gigas на за-
паде Канады; вид хозяина обычен у нас на Дальнем
Востоке, завезен для культивирования в Европу. До
описания вида он многократно отмечался в европей-
ских промысловых устрицах Ostrea edulis и Crassostrea
angulata как Ancistrocoma sp. или вообще без латин-
ского названия, считался патогенным для хозяев. Эту
форму под названием Ancistrocoma pelseneeri считали
случайным мигрантом из норовых моллюсков Муа
arenaria, обитающих около устричных полей. Enchely-
odon sp. прежних авторов — это тоже Stegotricha. Тело
вытянутое, широкое, сплошь ресничное, кинеты не де-
лятся четко на 3 зоны, изогнуты, часть рядов не достигает
концов тела. Нет широкого или узкого продольного аци-
лона, но выявляется полоса с редкими аргиросомами.
Род Syringopharynx Collin, 1915
Типовой вид 5.pterotracheae по монотипии, на
жабрах пелагического моллюска Pterotrachaea согопа-
ta; вид относили к роду гимностомат Enchelys, но по-
зже восстановили как валидный. Шаттон и Львов
(Chatton, Lwoff, 1950) изучили этот вид, нашли присо-
ску и убедились, что это не простоматы, а ринходи-
ды — аберрантный род семейства, резко отличающий-
ся от остальных анцистрокомид и требующий повтор-
ного изучения. По Раабе (Raabe, 1970а, 1970b), это род
неясного положения среди ринходид. Тело вытянутое,
острое у вершины, с 14 продольными, слегка изогну-
тыми кинетами, идущими до обоих концов клетки; нет
деления на зоны А—С; ядро вытянутое; аргиром не
изучен. Возможная синонимия с Ancistrocoma (у Раа-
бе) исключена, поскольку нет широкой безресничной
полосы и нет укорочения зоны тигмокинет (полоса В).
Род Tripleurocoma Jankowski gen. n.
Типовой вид Hypocomatidiumjarockii Ch. et Lw.,
1950 (T. jarockii comb, n.), паразиты на жабрах дву-
створок Nucula nucleus. Тело вытянутое, изогнутое, с
четкими зонами кинетома А—С, разделенными ацило-
ном; кинеты удлинены, особенно в зоне А; формула
кинетома АЗ, В2, С6. Строение тела и кинетом в прин-
ципе, как у Hypocomatidium, но вид желательно отде-
лить от Н. sphaerii, хотя бы на уровне подрода, так как
только у Н. jarockii в правой полосе имеются 3, а не
2 кинеты, обычные у анцистрокомид.
Подотряд Sphenophryina Jankowski, 1980
Монофилия родов, включаемых в данный таксон,
не доказана; сем. Sphenophryidae было предложено в
составе класса сукторий для одного монотипического
рода Sphenophrya', позже добавлено несколько родов,
существенно отличающихся от сфенофрий. Общий
признак — тип присоски; у рассмотренных выше форм
она узкая, трубчатая; у сфенофриид отверстие трубки
растягивается с образованием воронки или длинной
щели, и сторона тела с присоской прилегает к эпите-
лию хозяев для высасывания тканевой жидкости. Ки-
нетом — 2—3 полосы кинет, удаленные одна от дру-
гой, не образующие компактного ресничного поля и
вентральной тигмозоны. Размножение неравным деле-
нием или (у сфенофрий) почкованием, с образованием
подвижного мигранта.
Сем. Sphenophryidae Chaton et Lwoff,
1921
С признаками подотряда. Паразиты морских дву-
створчатых моллюсков (Bivalvia); 2 вида в пресных во-
дах Европы в сфериидах и дрейссене.
Род Pelecyophrya Chatton et Lwoff, 1922
Типовой вид Р. tapetis по монотипии, паразиты
на жабрах Tapes aureus (Франция). Е1еподвижные лате-
рально сплющенные формы с заостренным антероном,
отогнутым вбок и сплющенным, с зубчатым краем.
Инфракинеты ресничек лежат по обе стороны от апи-
кального киля в 2 продольных полосах; различимы
зоны А справа, В и С слева (формула кинетома А5, В2,
С2). Ядро овальное; присоска субапикальная, короткая
и широкая, с четкими фибриллами стенки, не растяну-
та на все тело в отличие от сфенофрий. Размножение
неравным делением; ресничек нет у протера, они обра-
зуются у задней особи, уплывающей после деления.
Зачаток новой присоски («сифона») образуется между
группами кинет А и В + С (у Lwoffia в зоне присоски).
Диморфизм в онтогенезе может быть дополнительным
общим признаком семейства.
Род Lwoffia Kozloff, 1955
Типовой в и д L. cilifera по монотипии, паразиты
мидий Brachidontes (=Mytilus) recurvus во Флориде.
Трофонты очень мелкие (16—30 мкм), плоские, меш-
ковидные, с апикальным фиксаторным полем, по обе
стороны от которого лежат разрозненные системы кинет
в 3 коротких параллельных полосках (5 рядов слева,
3+2 справа). Кинеты трофонтов и томонтов несут рес-
нички, при отделении от эпителия особи плавают на всех
стадиях цикла. В принципе такой набор кинет соответ-
ствует кинетому анцистрокомид, но внешний облик
трофонтов и топография кинет у Lwoffia видоизмене-
ны. Антерон расширенный, ребровидный; пелликула с
концентрическими фибриллами и складками; отвер-
стие присоски вытянутое; ядро овальное. Размножение
псевдо-продбльным (диагональным) делением.
Род Gargarius Chatton et Lwoff, 1934
Типовой в ид G gargarius по монотипии, пара-
зит на жабрах европейских мидий Mytilus edulis (Ат-
лантика) и М. galloprovincialis (Черное море). Тело
660
ALVEOLATA
огурцевидное, сплющено дорсо-вентрально, антерон в
виде массивного отростка (хоботка), направленного
вбок; по краям тела зубчатые ребристые выступы, ве-
роятно опорная система фибрилл. Реснички на венте в
3 полосах — 4 компактных ряда справа и 2 + 2 слева.
Присоска гигантская, растянута почти на всю длину
тела; глоточные фибриллы короткие по всей длине
присоски, кроме ее вершины (хоботка). Ядро вытяну-
тое, неправильной формы. Размножение анизотомией,
не почкованием; томиты гипокомидного типа.
Почти одновременно этот вид был описан в Поль-
ше как Rhynchophrya cristallina Raabe, 1935 (Gargarius
cristallinus comb, n.); для этой расы указано 10 кинет
(4 справа, 6 слева). Название рода Rhynchophrya не-
пригодно как синоним и как гомоним рода сукторий
Rhynchophrya Collin, 1919.
Род Sphenophrya Chatton et Lwoff,
1921
Типовой вид S. dosiniae по монотипии. Тело вы-
тянутое, распластано по субстрату, прилегает щеле-
видным устьем, растянутым до обоих концов тела.
Ресничек у трофонтов нет, но сохранены инфракинеты
на одной из сторон тела, условно вентральной — зо-
на А справа, зона В + С слева, обе зоны расположены
зеркально и несут 5 + 3 кинеты в компактных полосах.
Ядро вытянуто вдоль тела. Размножение почкованием;
деление особи резко неравное, мелкий каплевидный
томит очень похож на анцистрокомиду Hypocomatidi-
ит (из сфериид) с ресничками в 3 полосах; это может
указывать на пресноводное происхождение рода Sphe-
nophrya.
Сфенофрии нередки в морских двустворчатках, но
пока описано немного видов — S. туае Mjassnikowa,
1930 (в Муа arenaria, М. truncata), S. minor Poljansky,
1951 (в Cardium sp.), S. cardii Ch. et Lw., 1950 (в Cardi-
um edule, C. lamarcki), S. anomalocardiae Puytorac et al.,
1980 (в Anomalocardium brasiliense). Неопределенный
вид рода обычен в камнеточцах рода Hiatella (=Saxica-
va) на Мурмане. Типовой вид считается поликсенным,
указан для Dosinia exoleta (типовой хозяин), Corbula
gibba, Timoclea (=Venus) ovata в Европе, Spisula
(=Mactra) solidissima в США.
Род Parasphenophrya Jankowski gen. n.
Типовой вид Sphenophrya dreissenae Dobrzans-
ka, 1958 (P. dreissenae comb. n.). Название Parasphe-
nophrya Jank., 1986 введено как подрод рода Sphenoph-
rya в тезисах, поэтому невалидно и здесь предлагается
вновь. Внешний вид трофонтов, положение фиксатор-
ной зоны и присоски, план строения кинетома, как у
типичных сфенофрий, но кинеты зоны А удлинены
и не подходят попарно к полосе С. Это более при-
митивный род сфенофриид, поскольку томиты у па-
расфенофрий в точности повторяют стадию Нуросота-
tidium. Другие виды: Р. naumiana comb. n. (Sphenoph-
rya naumiana Raabe, 1958) из Dreissena sp. типа
D. polymorpha в озере Охрид (Сербия) и Р. sphaerii
comb. n. (Sph. sphaerii Mjassnikowa, 1930) из Sphaerium
corneunr, описание и рисунки видов у Раабе (Raabe,
1970а, 1970b).
Подотряд Hypocomatina Deroux, 1976
Тело сплющено, антерон сужен, с узкой или широ-
кой присоской. Кинетом вентральный, образует об-
ширную тигмозону из 2 полос ресничек; иногда имеет-
ся дополнительный фиксаторный аппарат — реснич-
ная ямка у постерона. Морфогенез деления, как у
циртофорид. Макронуклеус вытянутый, изомерный.
Паразиты разных беспозвоночных, от простейших до
асцидий и иглокожих. Гипокомид считали предками
сукторий, и сейчас эта гипотеза подтверждена при изу-
чении их ультраструктуры — у Hypocoma acinetarum
кроме мукоцист выявлены экструсомы («гаптотрихо-
цисты»), как у анцистрокомид Ignotocoma sabellarum,
которых нет у гипостомат, но сходные структуры име-
ются в вершинах щупалец сукторий. Данный таксон
предложен в ранге отряда, но нет принципиальных от-
личий от анцистрокомид, поэтому он принят здесь как
подотряд ринходид.
Сем. Hypocomidae Butschli, 1889
(рис. 331, а, б)
Низшие формы ринходид с субапикальной присос-
кой, иногда смещенной вбок, С-образным ядром, фик-
саторной ямкой; кинетом в целом гипостоматидного
типа. Паразиты перитрих, сукторий, многоклеточных.
2 группы родов: 1) кинетом однородный, без фикса-
торной цилиатуры в ямке ниже зоны В у заднего конца
тела; 2) обособлена группа фрагментов кинет, погру-
женных в фиксаторную ямку, как у части гипостомат.
Род Hypocoma Gruber, 1884
Типовой вид Н. parasitica. Эктопаразиты мор-
ских и пресноводных колониальных перитрих типа
Epistylis и Zoothamnium. Тело дисковидное, вздутое на
дорсальной стороне, присоска субапикальная, кинеты
немногочисленные, около 11, в двух зонах, разделен-
ных ребровидной продольной складкой кортекса. В от-
личие от других гипокомид, нет фиксаторной ямки у
постерона. 2 фрагмента кинет лежат у присоски и эква-
ториально справа.
Типовая раса в море, позже вид найден в пресной
воде на Apiosoma и Epistylis. Бючли (Biitshli, 1889) счи-
тал род переходной формой от холотрих к сукториям,
Коплен (Collin, 1912) — высшими сукториями (сходны
с томитами Ephelota). Раабе (1970а, 1970b) исключил
всех гипокомид из состава ринходид; сейчас вновь вы-
сказано мнение, что это ринходиды.
Род Acinetoides Plate, 1888
Типовой вид, по нашему обозначению, A. greef-
fi, также A. zoothamni — синоним рода Hypocoma. Оба
вида нужно перевести в состав Hypocoma — Н. greeffi
ТИП CILIOPHORA. КЛАСС PHYLLOPHARYNGEA
661
Рис. 331, a. Hypocomatida.
Hypocoma acinetarum (А, К, Л, О); Н. rostellum (Б, В), Н. parasitica (Г—3, М, Р}. (По: Deroux, 1975 (Б, В, Ж, И, О); 1978а (Г-—Е, 3);
Ergens, Lorn, 1970 (lif, Н)).
Fig. 331, a. Hypocomatida.
(Plate, 1888) comb, n., H. zoothamni (Plate, 1888)
comb. n. Пока нет доказательства поликсении и эврига-
линности вида, идентичность пресноводной формы с
морской кажется сомнительной.
Род Parahypocoma Chatton et Lwoff,
1939
Типовой вид Р. collini, паразиты монасцидий.
Плоские формы с овальным телом, апикальной при-
соской, С-образным ядром; кинеты полимеризованы,
покрывают всю вентральную часть тела. Удлинены
безресничные швы у обоих концов тела, иногда смыка-
ющиеся в единый мид-вентральный шов; кинеты
зоны В укорочены, остальные ряды в зонах А и С уко-
рачиваются от периферии тела к мид-вентральной
зоне. Мезопаразиты в дыхательной полости Ciona,
Ascidia, Clavelina.
Род Rhynchocoma Jankowski,
nom. n.
Типовой вид R. hyperparasitica Ch. et Lw., 1939.
Родовое название предложено для замены Heterocoma
Chatton et Lwoff, 1939, непригодного как гомоним; ти-
повой вид переносится здесь в состав Rhynchocoma —
Rh. hyperparasitica comb. n. Симбионты колониальных
пелагических туникат (Salpa mucronata и S. democrati-
cd), питаются живущими в жаберной полости на пери-
коронарных дугах хозяев сукториями Actinobranchium
salparum {-Trichophrya salparum). Внешне это типич-
ные гипокомиды с С-образным ядром, апикальной
присоской, фиксаторной ямкой; кинеты немногочис-
ленные, разрознены в зонах А и В, сближены вплот-
ную в зоне С; в целом кинетом симметричен, без алло-
метрии полос А и С. Как и у гипокомы, имеется 11 ки-
нет (3 + 3 + 5), но они расположены реже и на большей
площади вентральной стороны тела.
662
ALVEOLATA
Рис. 331, 6. Hypocomatida.
Hypocoma parasitica (Л); Crateristoma kindi (Б, В, E—И), Parahypocoma rhamphisokarya (Г, Д, К). (По: Chatton, Lwoff, 1950 (A); Burreson, 1973 (Л, Д,Ку,Б, В,
E—И— ориг.).
Fig. 331, 6. Hypocomatida.
Род Lophophorina Penard,
1922
Типовой вид L. capronata, по монотипии. Это
забытый род, не упоминаемый почти никем после его
описания; здесь он впервые вводится в состав отряда
гипокоматид. До сих пор род относили к гипостоматам
в сем. Chiamydodontidae. Это, однако, типичная гипо-
комида по облику тела, наличию подвижного апикаль-
ного цирруса у левого края тела, по форме ядра (С-об-
разное); в центре тела образуется единая пищевая мас-
са, как у гипокомы. Вид найден на Gammarus и
считался комменсалом, но это явно паразит перитрих,
в массе обитающих на гаммаридах. Картина кинетома
на рисунке Пенар да (Penard, 1922) неточная — показа-
на широкая полоса тесно сближенных кинет, но особи
с Asellus на моих препаратах имеют 3 зоны кинет, в
сумме 11 рядов. Этот род может быть невалидным как
синоним старинного рода Hypocoma.
Род Нагтосота Jankowski,
1980
Типовой вид Hypocoma rostellum Deroux, 1976
по монотипии, паразиты на антапикальной поверх-
ности диска и на нижней стороне тела и рук офиуры
Amphipholis squamata во Франции. Овальные формы с
субапикальной присоской, смещенной влево, узким
извитым ядром; имеется фиксаторная ямка, которой
нет у Hypocoma. Различимы 3 зоны кинет — С-образ-
ная зона А, прямая полоса С; в зоне В кинеты укорачи-
ваются справа налево, с образованием унисекантного
шва слева. Имеется небольшая фиксаторная ямка у
нижних концов кинет.
Род Enigmocoma Jankowski,
1976
Типовой вид Hypocoma acinetarum Collin,
1907 по монотипии. Название рода предложено в тези-
сах и поэтому невалидное, и здесь предлага-
ется вновь — Enigmocoma Jank., gen. п. (тип рода
Е. acinetarum comb. п.). Эктопаразиты на сукториях
в морском перифитоне, отмечены на Acineta pappilife-
ra (=Acinetella pappilifera~) и на Ephelota gemmipara.
Возможно, есть 2 разных вида энигмоком, посколь-
ку различается способ прикрепления к этим хозяе-
вам; типовой хозяин — эфелота. Вид чаще всего на-
ходят на эфелотах, и все публикации по Enigmo-
coma основаны на этой расе паразита; на ацинетах
обычно паразитирует суктория Pseudogemma. По Кол-
лену (Collin, 1912), этот вид образует защитную
оболочку на ацинетах, но ее нет у трофонтов с эфе-
лоты.
ТИП CILIOPHORA. КЛАСС PHYLLOPHARYNGEA
663
11лоские овальные формы с субапикальной ротовой
трубкой, лентовидным ядром; кинетом, как у гипоко-
мы, по с глубокой фиксаторной ямкой ниже полосы В,
несущей погруженные фрагменты или нижние части
кинет зоны В. Периферические полосы кинет А и С
смыкаются у нижнего конца тела.
Вид неясного положения — Hypocoma ascidia-
гит Collin, 1912 из сидячих туникат (асцидий) Bot-
ryllus sp. (типовой хозяин), Perophora listeri, Ascidiel-
la aspersa, Clavelina папа и различных ботриллид.
Основной диагностический признак (кинетом) не
изучен.
Род Crateristoma Jankowski, 1967
Типовой вид С. kindi по монотипии, эндобионт
в мантийной полости морского желудя Semibalanus Ъа-
lanoides (ранее — род В al anus) на Мурмане, активный
хищник, заглатывает целиком других цилиат (гипосто-
мат, мигрантов перитрих, томитов апостомат рода As-
koella, обычных в балянусах) с помощью широкой рас-
тяжимой глотКи, при виде сбоку имеющей вид двойно-
го конуса. Ядро лентовидное, вытянуто вдоль тела.
Кинетом односторонний, в виде сплошной полосы;
снизу центральные кйнеты укорочены, а краевые оги-
бают небольшой ацилон без фиксаторной ямки; у рта
удлинена группа кинет. По типу глотки это не ринхо-
дида, но остальное (включая ядро), как у гипокомид;
род приводится здесь в приложении к Hypocomidae.
Подкласс Chonotricha Wallengren, 1895
Одиночные, не колониальные формы (исключая клематохон,
пока не описанный новый род на мизидах, имеют ветвящийся сте-
белек, как у перитрих). Трофонты неподвижные, несократимые,
прикреплены к субстрату ножкой или прочным стебельком разной
длины, иногда без заметных органелл прикрепления (Heliochona).
Относительно некрупные формы, длиной порядка 70—120 мк. Раз-
личимы 3 отдела особи — тело, шейка и пищевая воронка, часто
сплющенная. Кутикула утолщена, играет роль панциря, поэтому
нет раковинных форм. Хорошо развит дополнительный опорный и
защитный аппарат — складки панциря, шипы, лепестки, желобки,
завитки стенки воронки. Рот лежит на дне воронки в атриуме. Рес-
ничный аппарат сохранен только на внутренней стенке воронки, у
хилодохонид с большим числом кинет, у остальных форм в виде 3
четких отделов — зона А (горизонтальная полоса гаплокинет), В
(диагональная зона) и С — мелкие фрагменты кинет у рта. Зона С
соответствует ротовому кинетофрагмону предковых цилиат — ги-
постомат, зоны А и В — всей вентральной соматической цилиатуре
гипостомат. Нет поликинет и мембранелл. Вглубь тела от рта отхо-
дит тонкая трубчатая глотка без немадесм, в электронном микро-
скопе на срезах это кольцо пластинок, состоящих из микротубул.
Поверхность тела лишена ресничек, но импрегнируются продоль-
ные ряды аргиросом; панцирь продольно исчерчен; аргиром, чет-
кий у предковых гипостомат, у хонотрих пока неизвестен. Ядер-
ный аппарат — один макронуклеус гетеромерного (септимерного)
типа, как у многих высших гипостомат, и несколько мелких микро-
нуклеусов. Макронуклеус трехслойный, состоит из эпи-, орто- и
парамера с четкими границами, деление ядра протекает сложным
путем, с возвратом к цикломерному типу и восстановлением эндо-
сомы.
Жизненный цикл включает 2 общие фазы — размножение на
нелиняющих и линяющих рачках протекает по-разному. В первом
случае трофонты питаются, вырастают в трофотомонтов, размно-
жающихся моногеммическим почкованием (наружным или внут-
ренним); во втором случае они прекращают питание и последова-
тельно почкуются, пока от томонта не останется безъядерный ру-
димент. Томиты отделяются после длительной лаг-фазы, поэтому в
процессе диминутивного почкования при линьке часто образуют-
ся, особенно у эндогеммин, стробилы из 2—7 протомитов, не пре-
терпевающих видимых морфологических изменений. Такое раз-
множение — одна из форм полигеммии (стробиляция), быстрое по-
следовательное почкование с задержкой отделения томитов.
Конъюгация редкая, как у сукторий, спариваются два трофонта,
расположенные рядом. Один из них отделяется от субстрата,
уменьшается в размерах и полностью адсорбируется макроконъю-
гантом или образует рудимент, отпадающий после кариогамии. В
синконъюганте образуется один зачаток макронуклеуса и несколь-
ко новых микронуклеусов.
Хонотрихи — эктокомменсалы высших ракообразных (Mala-
costraca); исключения — один вид с морских водорослей (род Е1е-
utherochona), 3 вида на гарпактикоидных копеподах рода Tisbe, и
несколько видов на копеподе Balaenophilus на китах, вероятно род-
ственных циамихонам на аберрантных амфиподах с китов. За ис-
ключением форм с паразитов китов, все остальные хонотрихи
известны со свободноживущих ракообразных. Заселены почти иск-
лючительно подвижные придатки хозяев — жабры, антенны, рото-
вые части, плеоподы, гнатоподы, переоподы и торакоподы. Харак-
терна жесткая специфичность к хозяину (исключая спирохон), по-
ликсенные виды единичные.
Хонотрихи — преимущественно морская группа, в море выяв-
лено около 40 родов, в пресных водах 3, и один из последних (Spi-
rochona) част на пресноводных и морских амфиподах. Много энде-
миков с небольшими ареалами.
Подкласс богат видами, имеет сложную внутреннюю структу-
ру. Хонотрихи, считавшиеся отрядом, были подразделены мною на
2 подотряда — Exogemmina Jank., 1972 и Endogemmina Jank., 1972
по способу почкования — наружное или в специальной сумке. Вто-
рое название напоминает название Endogenea у сукторий, но мор-
фогенез томитов в этих группах совершенно различен, поэтому
оно было заменено новым — Cryptogemmina Jank., 1975, т. е. «сум-
чатые хонотрихи». Виды двух групп, сейчас принимающихся в ли-
тературе как отряды, приурочены к разным группам хозяев, за иск-
лючением копепод Tisbe, на которых обитают как те, так и другие;
экзогеммиды обитают на изоподах, амфиподах, мизидах, декапо-
дах, сумчатые хонотрихи — на изоподах и амфиподах других се-
мейств, на копеподе Balaenophilus', основная эволюция и многооб-
разие на филлокаридах (вильчатках отряда Leptostraca). На Tisbe в
Субантарктике обитают одновременно экзо- и криптогеммиды, на
Amphithoe севера Европы экзогеммиды, на Amphithoe северной Па-
цифики только криптогеммиды. Среди изопод лимнорииды несут
экзогеммид, сфероматиды криптогеммид. В пресных водах пока
известны только спирохониды на гаммаридах, но в ФРГ отмечена
Heterochona на недавнем эвригалинном мигранте Gammarus tigri-
nus.
Ранее авторы включали хонотрих в состав перитрих, но выяв-
ление кинетома воронки показало полную идентичность цилиату-
ры трофонтов хонотрих и гипостомат. Томиты хонотрих внешне
выглядят так же, как гипостоматы. Ультраструктура глотки этих
групп сходная, массивных немадесм у хонотрих нет, но они утеря-
ны и у ряда родов высших гипостомат. Прикрепительная органелла
томитов, секретирующая стебелек или диск после оседания на хо-
зяине, соответствует стилону гипостомат. Большое число родов ги-
постомат — облигатные симбионты ракообразных, как и почти все
хонотрихи, кроме рода Eleutherochona. В «молекулярных филог-
раммах» хонотрих пока нет, исключая один неопределенный вид
эндогеммид Isochona sp. (Snoeyenbos-West et al., 2005), поэтому не
решен спорный вопрос о том, какая группа родов примитивная —
хилодохониды или лобохониды.
Монография о хонотрихах опубликована в серии «Фауна
СССР» автором (Янковский, 19736); в нее не включены описания
хонотрих с китообразных (Янковский, 1971). В период с 1973 г.
до настоящего времени предложены новый отряд Chilodochonida
Batisse, 1994, новые роды Segmentochona, Physochona, Isochonop-
sis, новые виды этих и других родов; все эти дополнения отражены
в соответствующих местах каталога родов. Полезный, хотя и
664
ALVEOLATA
Рис. 332, a. Chonotricha.
Chilodochona palinuri (А, Б); Vasichona paguri (В, E, Ж, If); Chilodochona aranei (Г, Д, 3). Все рисунки на табл. 332a—3346 оригинальные.
Fig. 332, a. Chonotricha.
All drawings on plates 332a—3346 are originals.
неполный справочник по хонотрихам — обзор седентарных ци-
лиат на ракообразных (Femandez-Leborans, 2001), в котором дан
список известных хонотрих и их хозяев, рисунки представителей
родов.
В тезисах мексиканских авторов (Мадразо-Гарибай и Ло-
пес-Очотерена) говорится об открытии 12 новых видов хонотрих
на покровах мантийной полости и жабрах двустворчатых моллю-
сков побережья Кампече; статья с рисунками позже не появилась,
но вышла другая публикация с описанием серии видов перит-
рих-сцифидиид на тех же моллюсках, причем все сцифндии опре-
делены неправильно (Madrazo-Garibay, Lopez-Ochoterena, 1988).
Вероятно, авторы вначале спутали одиночных (не-колониальных)
перитрих с хонотрихами.
Отряд Chilodochonida Batisse, 1994
(рис. 332, а)
Тело массивное, не сплющенное, овальное или ци-
линдрическое, с короткой широкой шейкой, без псев-
достила. Воронка массивная, дорсальный край ворон-
ки имеет вид щитка. Кинеты на всей внутренней по-
верхности воронки полимеризованы; 3 полосы кинет,
четкие у всех остальных хонотрих, не обособлены.
Ядро вытянуто поперек тела. Нет форм с шипами тела
или воронки, столь обычными у остальных групп. По-
лимеризованы ампулы у основания стебелька.
Сем. Chilodochonidae Wallengren,
1895
С диагнозом отряда. Отличие от остальных се-
мейств хонотрих — по комплексу признаков: нет ши-
пов, подошвы, удлинения шейки и псевдостила, утол-
щены стенки тела и воронки, полимеризованы ампулы,
нет бесстебельчатых форм, не найдены стадии конъю-
гации, но главный признак отряда — единая полоса из
большого числа кинет на вентральной стороне во-
ронки. Симбионты декапод, мизид и глубоководных
амфипод-лизианассид. Заселяют только ротовые при-
датки хозяев, нет видов на переоподах и жабрах.
Род Chilodochona Wallengren, 1895
Типовой вид Ch. qvennerstedti Wallengren, 1895;
Ch. aranei Jank., 1972; Ch. palinuri Jank., 1973; Ch. car-
cini Jank., 1973; Ch. capbretonensis Femandez-Leborans
et Sorbe, 1999. Воронка заметно сплющена, широко
растянута в стороны, с небольшим щитком на одной из
сторон. Крупный род, много неописанных видов отме-
чено на крабах, лангустах, креветках, мизидах, амфи-
подах. Вероятно, это будет крупнейший род хонотрих.
Распространение всесветное. Вид Ch. capbretonensis
описан недавно в Испании с мизид Boreomysis arctica.
Род Vasichona Jankowski, 1972
Типовой вид V. paguri Jank., 1972; V. opiliophila
Lynn — второй вид с максилл краба Chionoecetes opilio
в Канадской Пацифике, обычен в России на том же хо-
зяине. Воронка узкая, не растянута в стороны, не
сплющена, с высоким дорсальным щитком.
Род Cryptochona Jankowski, 1973
Типовой вид Cr. tumida с максиллипед песчаной
креветки Crangon dalli, Кунашир. Щиток воронки раз-
растается в стороны и почти перекрывает полость во-
ТИП CILIOPHORA. КЛАСС PHYLLOPHARYNGEA
665
Рис. 332, б. Chonotricha.
Segmentochona spiralis (А, Б); Oenophorachona urceolata (B); 0. sagitta (Г)', Lobochona limnoriae (Д); Toxochona mirabilis (E, Ж).
Fig. 332, 6. Chonotricha.
ронки. Высказано мнение, что важно само наличие
щитка, а не степень его развития, поэтому род Cryptoc-
hona невалиден как синоним рода Vasichona. Но эти
различия очень четкие и пока нет переходных форм. В
данном случае и во всех последующих аналогичных
контроверсиях следует помнить, что спорный род у
Metazoa часто принимается как четкий валидный под-
род, включающий один или несколько аберрантных
видов, а у цилиофор выделять подроды пока не при-
нято, и само слово «подрод» (subgenus) в дискуссиях
никогда не упоминается. В этом отношении система-
тика родов цилиат находится на первобытном, пещер-
ном уровне.
Отряд Exogemmida Jankowski,
1972
Введение Батиссом (Batisse, 1994) отряда Chilodoc-
honida для части экзогеммин ставит вопрос о названии
последних — либо оно должно быть изменено, либо
сохранено, и тогда отряд Exogemmida следует разде-
лить на 2 подотряда — Chilodochonina и Lobochoni-
па — по типу цилиатуры воронки. Вероятно, авторитет
издания Traite de Zoologie приведет к принятию Chilo-
dochonida как отряда; такой отряд уже использован
Линном (Lynn, 2002) и будет принят также в готовя-
щемся 3-м издании книги Корлисса.
В этой ситуации временно сохраняется название
Exogemmida для 5 семейств, и в зависимости от типа
воронки отряд делится на 2 подотряда. Общее для эк-
зогеммид — идентичный тип цилиатуры воронки, та-
кой же как у криптогеммид, но не у хилодохонид; на-
личие 3 четких обособленных полос кинетома с не-
большим числом кинет в каждой. Дорсальная стенка
воронки имеет поле вплотную сближенных диагональ-
ных кинет, вентральная — горизонтальную полосу ки-
нет, заходящую с обеих сторон на дорсум.
Подотряд Lobochonina Jankowski
subordo п. (рис. 332, б)
Дорсальный край воронки складчатый, но не свер-
нут спиралью. Края воронки у части родов с шипами.
Морские формы; хозяева — изоподы и амфиподы.
Один род на водорослях — единственное исключение
у хонотрих.
Сем. Lobochonidae Jankowski,
1967
Края ротовой воронки без тонких шипов, тело без
массивных шипов, нет дорсального щитка воронки
(это отличия соответственно от Heliochonidae, Filicho-
nidae и Phyllochonidae). На водорослях, копеподах,
изоподах и амфиподах.
Род Lobochona Dons,
194Q
Типовой вид!, limnoriae Dons, 1940; L. tenue
Jank., 1973; L. insularum Matsudo et Mohr, 1964; L. pro-
rates Mohr, Matsudo et Le Veque, 1963. Тело бутылко-
видное, края воронки без складок типа Physochona, нет
особого удлинения шейки и псевдостила (нижней час-
666
ALVEOLATA
ти тела), прикрепление диском, стебелька нет. Только
на изоподах-дрсвоточцах Limnoria и Phycolimnoria
(сем. Limnoriidae), заселяют щетинки щитовидных
наджаберных плсопод.
Род Oenophorachona Matsudo et Mohr,
1968
Типовой вид О. ectenolaemus М. et М., 1968;
О. urceolata Jank., 1973; О. sagitta Jank., 1973; в подго-
товке 5 новых видов. Трофонты типа Lobochona, но с
ножкой (очень короткий стебелек — не диск, как у ло-
бохон) и с умеренно вытянутой шейкой и постесомой,
образующей псевдостил. На плеоподах гаммарид рода
Anisogammarus в северной Пацифике, в море и в соло-
новатых лагунах; не выносят полного опреснения —
отсутствуют у озерных видов рода Anisogammarus на
Сахалине, Курилах и Командорах; хонотрихи пока не
найдены на Jesogammarus — эндемике озера Бива в
Японии.
Род Toxochona Jankowski, 1972
Типовой вид T.mirabilis. Нижняя часть тела
не удлинена, без псевдостила; шейка необычайно
длинная, в 2—3 раза длиннее тела. На гнатоподах Ani-
sogammarus у Владивостока. Обилие щетинок и ши-
пов на гнатоподах рачков привело к резкому удлине-
нию шейки, это приближает воронку к токам воды с
пищей.
Род Physochona Batisse et Crumeyrolle,
1988
Типовой вид Ph. australis. Тело короткое и ши-
рокое, с тонким коротким стебельком, воронка с не-
ровным контуром (crenelated), по форме типично лобо-
хонидная. На вентральной стороне тела копеподы Tis-
be sp. в Субантарктике, о-в Кергелен; платибионты;
переоподы заняты криптогеммидой Isochonopsis. На
Мурмане обычная литоральная копепода Tisbe furcata,
массовая в зоне гниющих водорослей, несет только
криптогеммин на переоподах, Physochona пока мною
не найдена.
Род Segmentochona Jankowski,
1989
Типовой вид 3. spiralis (=Stylochona spiralis
Bonnier in Giard, 1894). Этот вид не был включен в мо-
нографию хонотрих (Янковский, 19736), отсутствует в
справочнике Zoological Record. Вид изучен по матери-
алу из Англии с мелкой амфиподы Chelura terebrans из
ходов лимнорий в источенной древесине. Внешне ти-
пичные лобохоны, но с уникальной массивной опор-
ной пластиной вдоль тела, имеющей сложное внутрен-
нее строение (ранее принята за спираль). Семейство
хелюрид (3 рода) всесветное, можно ожидать откры-
тия новых видов рода.
Род Eleutherochona Jankowski gen. n.
Типовой видЕ sivertseni (=Stylochona sivertseni
Dons, 1948) в Южной Атлантике, на литорали
о-ва Тристан-да-Кунья, в массе на водорослях родофи-
тах Epymenia. Короткая шейка, широкое тело, массив-
ный длинный стебелек. Других хонотрих на водорос-
лях никто не отмечал, при специальном поиске они не
найдены мною в морях России. Аэшт (Aescht, 2001)
считает род Eleutherochona Jank., 1971 невалидным по
формальной причине — название введено с указанием
ТВ, но без диагноза нового рода. Подробное иллюст-
рированное описание, по Донсу, приведено в моногра-
фии хонотрих (Янковский, 19736).
Сем. Filichonidae Jankowski, 1973
Тело не сплющено, шейка вытянута, псевдостила
(удлинения постесомы) нет. Воронка простая, кониче-
ская, не сплющена, без шипов. Прикрепление диском.
В целом морфология как у лобохонид, но отличитель-
ный признак семейства — развитие соматических ши-
пов, единственный случай у экзогеммин. 2 рода с плео-
под изопод-древоточцев Limnoria в северных и дальне-
восточных морях России.
Род Aurichona Jankowski, 1973
Типовой вид Л. armata. Тело тонкое, вытянутое,
с узкой шейкой и вытянутой передней частью тела; на
границе тела и шейки — 2 массивных тупых шипа, бо-
ковые выросты тела. Нижняя часть тела (постерон) узкая,
сужается к диску. На лимнориях Мурмана и в Япон-
ском море у Владивостока; редкий симбионт, на лим-
нориях в основном встречаются типичные лобохоны.
Род Filichona Jankowski, 1973
Типовой вид/7.paradoxa. Тело короткое, широ-
кое, мешковидное, без удлинения антесомы, шейка
резко вытянута, в 2—3 раза длиннее тела. На границе
тела и шейки 5—8 массивных тупых шипов вокруг
основания шейки. Постерон расширен и прилегает к
субстрату, как у Heliochona, но различим прикрепите-
льный диск. Редкий симбионт лимнорий, пока найден
на южном Сахалине и у Владивостока.
Сем. Phyllochonidae Jankowski, 1973
Некрупные формы с дорсо-вентрально сплющен-
ным листовидным телом без шейки и псевдостила. Во-
ронка необычного типа — гигантская, плоская, шире
тела, сужается к вершине. Вентральный край воронки
с широкой выемкой и продольными складками, огра-
ничивающими ресничную зону, дорсальный край раз-
растается с образованием парусовидной защитной
пластинки. Цилиатура воронки нетипичная для экзо-
геммин — с разрывом горизонтальной полосы. 1 род с
плеопод лимнорий.
ТИП CILIOPHORA. КЛАСС PHYLLOPHARYNGEA
667
Род Phyllochona Jankowski, 1972
Типовой вид Ph. vexillata. С признаками семей-
ства. Трофонты обитают на утолщенном основании
щетинок плеопод лимнорий на Мурмане и в Японском
море, типичные лобохоны заселяют щетинки выше
топы филлохон.
Сем. Heliochonidae Jankowski, 1972
(рис. 333, а)
Бутылковидные, не сплющенные формы с четкой
границей тела, шейки и воронки, тело вытянутое у He-
terochona и мешковидное у Heliochona. Воронка замет-
но сплющена, со складками, карманами и лепестками
стенок. На дорсальной стенке воронки типичная пря-
моугольная зона диагональных кинет; вентральная ци-
лиатура особая, с подразделением горизонтальной по-
лосы на 2 зоны — узкая полоса вдоль края воронки
и группа разрозненных диагональных кинет у рта.
Стенки воронки снаружи исчерчены, несут шипы
вдоль всего края. Прикрепление ножкой (очень ко-
ротким стебельком). 2 рода на плеоподах, гнатоподах,
ротовых придатках и жабрах гаммарид и амфитоид
(Amphipoda). Обычны во всех морях России кроме
внутренних (Арал, Каспий), где хонотрихи пока во-
обще неизвестны.
Род Heterochona Jankowski, 1972
Типовой вид Н. scheutenii (Stein, 1854 in Spiro-
chona)\H. coronata (Kent, 1881 in Stylochonap, H. psych-
ra (Matsudo et Mohr, 1965 in Heliochona)', H. crinita
Jank., 1972; H. peregra Jank., 1973; H. exilis Jank., 1973;
H. trifaria Jank., 1972. Тело бутылковидное, с четкой
узкой шейкой, иногда вытянута шейка и псевдостил.
Края воронки с набором шипов возрастающей сложно-
сти, от простых однотипных до систем из нескольких
типов шипов. Постерон не прилегает к субстрату, су-
жается к ножке. Частые, типичные эпибионты гамма-
рид в солоноватых лагунах и открытых морских при-
брежьях, отсутствуют при миграции хозяев по ручьям
в пресные воды; к примеру, виды рода Heterochona за-
селяют Gammarus oceanicus, G. zaddachi, G. setosus,
Marinogammarus obtusatus, но отсутствуют у примор-
ского эвригалинного речного вида Gammarus duebeni
на Мурмане. Заселяют плеоподы, реже гнатоподы и
максиллы хозяев, отсутствуют на жабрах, занятых ге-
лиохонами. Северные и дальневосточные моря, Атлан-
тика, Северная Америка. Пока не найдены в Черном
море. Дальневосточные виды в обработке, пока не
описаны. Из новых работ отметим находку Н scheute-
nii на интродуцированной гаммариде Gammarus tigri-
nus в солоноватых водах Германии.
Род Heliochona Plate, 1888
Типовой вид Н. sessilis Plate, 1888; Н pontica
Jank., 1973; Н elegans Jank., 1972; H. alternans Jank.,
1972. Тело мешковидное, широкое, прилегает к субст-
рату особо расширенной нижней частью (постероном),
окружающей прикрепительный диск. Система шипов
сложная, с чередованием шипов разного типа вдоль
вентральной стенки воронки. Симбионты Gammaridae,
Anisogammaridae и Ampithoidae обитают только на
жабрах — платибионты, в отличие от сетобионтного
рода Heterochona. Моря Европы, северной Пацифики,
оба побережья и Арктический сектор Северной Аме-
рики. В монографии хонотрих (Янковский, 19736) для
Н. pontica условно указан хозяин Gammarus locusta, но
это местные морские виды гаммарид — G. olivii, G. in-
sensibilis, G. subtypicus, G. aequicauda.
Подотряд Spirochonina Jankowski
subordo n.
Тело бутылковидное, прикрепление диском, сте-
бельчатых форм нет. Воронка без шипов, вентральный
край ровный, дорсальный свернут спиралью. Реснич-
ный аппарат с 2 полосами кинет, дорсальным полем
диагональных кинет и горизонтальной полосой; учас-
ток последней заворачивается спиралью в завитке.
Симбионты гаммарид.
Сем. Spirochonidae Stein, 1854
(рис. 333, б)
С диагнозом подотряда. Удлиненные формы с
бутылковидным не сплющенным телом, исключая
один вид с плеопод, с короткой шейкой; воронка
крупная, шире тела, стенки не утолщены, без шипов.
Вентральный край воронки ровный у спирохон, с од-
ной или несколькими складками у кавихон и серпен-
тихон. Дорсальная стенка со складками, карманами и
с характерным спиральным завитком, образован-
ным при разрастании и скручивании стенки в зоне ле-
вого лепестка воронки лобохонид. Зоны А и В предро-
товой цилиатуры не контактируют, включают типич-
ное число кинет (7—9 и 19—22), зона А не делится
на 2 полосы, но 3 верхние кинеты лежат на особой на-
клонной площадке под углом к остальным, эти ряды
входят в спираль, заканчиваясь на разных уровнях.
Кутикула тела продольно исчерчена. Ядро овальное,
не вытянуто. Прикрепление к субстрату короткой
терминальной ножкой, стебелька нет. Удлинение ниж-
ней части тела (псевдостил) намечается у спирохон
и достигает особого развития у других родов. Секре-
торные ампулы фиксаторного аппарата (фиксона) у
трофонтов отсутствуют, исчезают после оседания то-
мита (у остальных хонотрих сохраняются на стадии
трофонта). Жизненный цикл типичный, с наружным
почкованием, при линьке хозяев с диминуцией и поли-
геммией.
Семейство четкое — только у спирохонид имеется
завиток воронки, отогнуты вентральные края с образо-
ванием карниза, несколько обособлены ряды в полосе
А. Нет лепестков воронки, шипов, стебелька, полиме-
ризации кинет. Включает 3 рода и 27 видов, хозяева—
только амфиподы Gammaridae в пресных водах се-
верного полушария и Anisogammaridae (ранее вклю-
чавшиеся в состав гаммарид) в эстуариях и морях
668
ALVEOLATA
Рис. 333, a. Chonotricha.
Heterochona peregra (Л); Heliochona sessilis (Б—Д)\ Heliochona alternans (E); Heliochona pontica (Ж).
Fig. 333, a. Chonotricha.
по обоим берегам Северной Пацифики. Заселены жаб-
ры хозяев, как исключение плеоподы и гнатоподы
нескольких байкальских видов гаммарид.
Род Spirochona Stein,
1852
Типовой вид 5. gemmipara Stein, 1852. Относи-
тельно некрупные формы с цилиндрическим телом,
сплющенным только у A simplex. Воронка с относи-
тельно небольшим числом витков, примерно 2.5—
3 оборота. Вентральная стенка воронки ровная, дуго-
видная, без складок и вырезок. Нижняя часть тела ши-
рокая, псевдостил слабо выражен — небольшой и ши-
рокий, со складками. Типовой вид распространен в Ев-
ропе и северной Азии, типовой хозяин Gammarus
pulex, также обычны на G. komareki, G. fossarum,
G. (Carinogammarus) roeseli, G. balkanicus, G. lacustris,
G. kischineffensis, Dikerogammarus villosus в Европе и
на Дальнем Востоке. В США S. gemmipara отмечена
только на G. lacustris', новый вид 5. americana (Dovgal
et Grigorovich, 2000) кратко описан с одной из рас
G. lacustris в Канаде, но описание и иллюстрации
очень плохие и вид недостоверный. На интродуциро-
ванном виде G. tigrinus, быстро расширяющем ареал в
Европе, пресноводная S. gemmipara отмечена вместе с
морским видом Heterochona scheutenii.
Вокруг Байкала 2 вида гаммарид, спирохоны обыч-
ны на G. lacustris. В Байкале группа видов на эндемич-
ных гаммаридах — S. simplex Swarczewsky, 1928;
S. globulus Sw., 1928; 5. tuba Sw., 1928; S. brevis Jank.,
1973; S. gnathopodialis Jank., 1973; часть из них на не-
типичном для спирохонид локусе — на плеоподах и
гнатоподах. Один из байкальских видов хозяев Gmeli-
noides fasciatus быстро распространяется в восточной
Европе, но спирохоны (5. brevis) на расе у Петербурга
не отмечены. В Пацифике пока описано только 2 вида:
S. halophila Matsudo et Mohr, 1968 и S. marina Jank.,
1973, но их должно быть больше, судя по специфично-
сти других хонотрих на Anisogammarus. Можно отме-
тить, что для амфипод Байкала, ранее относимых к
Gammaridae, сейчас предложена серия семейств, и
G. fasciatus, несущий примитивных спирохон, не отно-
сится теперь к гаммаридам.
Род Cavichona Jankowski,
1973
Типовой вид С. cincinnata Jank., 1973. В основ-
ном крупные формы; длина тела спирохон до 105 мк,
кавихон до 360 мк; тело не сплющено, воронка часто с
увеличением числа витков спирали и широким карни-
зом, вентральная стенка воронки с центральной вырез-
кой, но без продольных складок; вырезка делит карниз
на 2 части, расположенные под углом. Нижняя полови-
на тела обычно вытянутая, превращена в четкий псев-
достил, исключая 2 примитивных вида рода. Эндеми-
ки Байкала, 16 видов на жабрах амфипод от литорали
до больших глубин озера, — С. elegans (Swarczewsky,
1928 in Spirochonay, C. elegantula (Sw., 1928); C. cincin-
nata Jank., 1973; C. oligocineta Jank., 1973; C. pro tecta
Jank., 1973; C. multifida Jank., 1973; C. acanthogammari
Jank., 1973; C. tenue Jank., 1973; C. crassa Jank., 1973;
C. abyssalis Jank., 1973; C. brevistyla Jank., 1973; C. vir-
gata Jank., 1973; C. rhabdomorpha Jank., 1973; C. exilis
Jank., 1973; C. carinuri Jank., 1973; C. laticollis Jank.,
1973; часть видов вместе с хозяевами обитает в Ангаре
у Иркутска.
ТИП CILIOPHORA. КЛАСС PHYLLOPHARYNGEA
669
Рис. 333, б. Chonotricha.
Spirochona gemmipara (A); S. brevis (Б); томит Cavichona multifida (5); Phyllochona vexillata (Гу, Cavichona acanthogammari (Д); C. cincinnata (E).
Fig. 333, 6. Chonotricha.
Род Serpentichona Jankowski, 1973
Типовой вид S. anthus (Swarczewsky, 1928 in
Spirochona); второй неописанный вид на Pachyschesis.
Эндемики Байкала, с жабер Acanthogammarus (Brachy-
uropus) reicherti; мелкий вид Pachyschesis branchialis
паразитирует в выводковой сумке хозяев и часто несет
серпентихон на жабрах. Очень крупные формы, дли-
ной до 300 мк, с вытянутым не сплющенным телом,
характерна тенденция к недоразвитию завитка ворон-
ки. Вентральный край воронки неровный, волнистый,
с центральной вырезкой (как у Cavichona) и с серией
дополнительных вырезок справа и слева от нее, они
возникают уже на ранних стадиях онтогенеза. Карниз
у спирохон единый, у кавихон двойной, у серпентихон
до 8 карнизов с продольными складками. Псевдостил
длинный, пелликула с продольными ребрами. Энде-
мик Байкала, на жабрах траловых амфипод, нет на ли-
торали.
Отряд Cryptogemmida Jankowski, 1978
(рис. 334, а, б)
В книге (Янковский, 19736) я подразделил хонот-
рих на группы Exogemmina и Endogemmina, позже в
тезисах второе название было заменено на Cryptogem-
mida. Поскольку таксоны в тезисах сейчас не призна-
ются, название датируется 1978 г.
В основном некрупные формы длиной 50—70, мак-
симум 90—110 мк. Тело у примитивных форм бутыл-
ковидное, у большинства других сплющенное, углова-
тое, листовидное, растянуто в стороны; шейка обычно
короткая, воронка сплющена и расширена при виде с
вентральной стороны, вентральный край ровный или с
продольными складками, дорсальный поднят и часто
складчатый, без лепестков и завитков стенки. Цилиа-
тура воронки однотипная, простая — нет полимериза-
ции кинет, зона А цельная лишь у наиболее примитив-
ных форм, зона В уменьшена в размерах, иногда почти
рудиментарная. Различимы 2 типа цилиатуры, типич-
ная и инверсная, при инверсии зона В перемещается
на вентральную стенку и разрывает зону А. Однако
высказывалось мнение, что у видов с Nebalia воз-
можна зеркальная симметрия при поселении на пра-
вых и левых придатках хозяев, поэтому если ориенти-
ровать особь по положению зародышевой сумки, воз-
можны 2 варианта: сумка справа — к нам обращена
вентральная стенка воронки (стандартная морфоло-
гия), сумка слева — к нам обращена та же сторона
воронки, поэтому поворачиваем особь и при правом
положении сумки видим ее с дорсальной стороны,
тогда цилиатура инверсная. На Nebalia много видов
хонотрих, и пока неясно, у каких именно видов воз-
можна инверсия.
Основная форма опорного и защитного аппарата —
шипы, имеющиеся у большинства родов (20 из 26),
иногда имеются несколько типов шипов, до 5 у Chono-
saurus. Прикрепление диском, ножкой или длинным
стебельком, стебелек может быть утрачен при мигра-
ции сетобионтов на ровную поверхность придатков.
Псевдостил обычно не выражен. Секреторная ампула
одна (у хилодохон несколько, у спирохон отсутству-
ет). Кортекс тела обычно без продольных импрегниру-
емых складок, вентральная стенка воронки ровная или
со складками, дорсальная стенка всегда усложнена си-
670
ALVEOLATA
Рис. 334, a. Chonotricha.
Oxychonina (= Oxychona, гомоним) suprema (Л); 0. multifida tli'y, Echinichona simplex (B'y, Pterochona pacifica (Г); Armichona insecta (Д).
Fig. 334, a. Chonotricha.
стемой складок. Ядро овальное. Размножение моно-
геммией, развитие первой почки выросшего трофонта
начинается на поверхности тела справа от основания
воронки, затем образуется впячивание, углубляется и в
итоге отделяющийся томит оказывается в глубокой
сумке. Долгое время продолжается морфогенез внеш-
не дефинитивного томита, и затем он отделяется от
дна сумки и уплывает. У томита много ампул, у тро-
фонтов одна. Развитие следующего томита начинается
на стенке сумки, и он постепенно вырастает в пустой
сумке, оставшейся после первого почкования. При
линьке хозяев томиты образуются один за другим, и
поскольку есть лаг-фаза накапливаются в сумке, сам
томонт уменьшается в размерах вплоть до безъядерно-
го рудимента.
5 семейств с примерно 30 родами; предложено мно-
го монотипических родов для аберрантных форм.
Криптогеммиды и их хозяева пока неизвестны в пре-
сных водах, не выносят понижения солености, широко
распространены в прибрежных зонах, в пелагиали и на
глубинах всего Мирового океана. Круг хозяев неширо-
кий, основная эволюция идет на филлокаридах (отряд
Leptostraca — тонкопанцирные раки, сем. Nebaliidae),
по набору симбионтов можно дифференцировать виды
хозяев. На литорали Мурмана и в Субантарктике крип-
тогеммиды обитают на свободноживущих копеподах
Tisbe, в Пацифике на амфиподах рода Amphithoe и на
изоподах типа Idothea, на Командорах найдены на дру-
гом неопределенном роде амфипод. Обычны на пара-
зитах китов — на копеподах Balaenophilus и на абер-
рантных амфиподах Cyamidae. У амфитоид заселены
плеоподы, редко переоподы, у видов с китов конечно-
сти и весь панцирь рачков, у небалиид практически
все придатки тела, изредка панцирь. Эволюция крип-
тогеммид начинается с примитивных форм типа Iso-
chona, очень близких к лобохонидам; далее эволю-
ция идет разными путями на разных хозяевах; при
всем многообразии сохраняется идентичный спо-
соб размножения.
Сем. Isochonidae Jankowski,
1973
Крупные вытянутые формы; тело цилиндрическое,
не сплющено, шейка короткая, воронка относительно
некрупная, коническая, почти не сплющена. Строение
воронки простое — вентральный край ровный, без
складок, дорсальный ровный или с 1—2 очень слабо
выраженными складками, карманы воронки едва наме-
чены или отсутствуют. Дорсальная стенка обычно
выше вентральной, нередко несет осевой щиток. Ци-
лиатура воронки обычного типа, зоны А1 и В широкие
у форм с амфипод и уменьшены у видов с небалиид.
Шипов нет, ампула крупная, прикрепление ножкой
или стебельком. Круг хозяев широкий (все остальные
семейства только на небалиидах) — амфиподы (Ampi-
thoidae), копеподы (Balaenophilus, Tisbe), «китовые
вши» Cyamidae — группа амфипод, обычно включаю-
щаяся в подотряд капреллид, и филлокариды рода Ае-
balia. Это примитивные формы, близкие к роду Lobo-
chona среди экзогеммид.
Род Trichochona Mohr,
1948
Типовой вид Г. lecythoides Mohr, 1948 по моно-
типии, также Т. surgens Jank., 1973 с «гнездовых» ам-
фипод рода Ampithoe (=Amphithoe), строящих домики
ТИП CILIOPHORA. КЛАСС PHYLLOPHARYNGEA
671
Рис. 334, б. Chonotricha.
Cyamichona mysticeti (A); Isochona migratoria (£); Pleochona coronata (B); Crassichona insolita (Г); Chonosaurus rex (Д); Dentichona sp. (£); Thalassochona gam-
belli (Ж)\ Eurychona vitrea (3); Ctenochona ternipara (И)', Ceratochona cimex (K).
Fig. 334, 6. Chonotricha.
из растительных фрагментов на камнях и водорослях
литорали. Типовой вид со щетинок плеопод A. lacerto-
sa, A. humeralis, A. valida, второй вид с A. rubricatoides
в Северной Пацифике (США, Россия). Тело бутыл-
ковидное, сужено к основанию, края воронки ровные
у Т. lecythoides, с небольшим дорсальным щит-
ком у Т. surgens с литорали о-ва Беринга. Стебелек
относительно короткий у Т. surgens, вытянутый у
типового вида.
Род Isochona Jankowski,
1973
Во всем как Trichochona, но прикрепление корот-
кой ножкой — фиксоном, длина которого примерно
равна ширине. Дорсальный край воронки может нести
продольные складки. Это наиболее примитивный род
криптогеммид, близкий к экзогеммидам рода Lobo-
chona.
Типовой вид I. rotundata Jank., 1973 с Nebalia
spp. на южных Курилах и Сахалине, обитают на уз-
ком локусе — щетинки протоподита торакопод. В
дальнейшем практически у всех хонотрих с Nebalia
будет отмечен крайне узкий локус на хозяине. Круп-
ная I. migratoria Jank., 1973 с амфипод Ampithoe ja-
ponica и A. rubricata в морях Дальнего Востока близка
к Trichochona с берегов США. I peltifera Jank., 1973;
I. crassa Jank., 1973; I. pleonicola Jank., 1973 заселяют
разные придатки дальневосточных небалиид.
Род Isochonopsis Batisse et Crumeyrolle,
1988
Типовой вид/, kerguelensis по монотипии, на
свободноживущих литоральных копеподах Tisbe sp.
Этот род был выделен в особое сем. Isochonopsidae
В. et С., 198,8, которое здесь не признается. По опи-
санию авторов (Batisse, Crumeyrolle, 1988), воронка не-
значительно сплющена, неширокая, по всему краю
волнистая — стенки с большим числом правильных
складок, гибкие стенки могут смыкаться, закрывая
воронку (это сомнительно, у хонотрих жесткий пан-
цирь). Прикрепление ножкой. Цилиатура особого
типа, поэтому выделено новое семейство — правое
672
ALVEOLATA
ресничное поле разделено на 2 отдела, горизонталь-
ную полосу из нескольких сближенных кинет и
зону диагональных кинет. Однако такой комплекс
я зарисовал у типового вида рода Isochona. Родо-
вым признаком Isochonopsis остается поэтому кре-
нуляция стенки воронки. Род считается субантарк-
тическим (типовой вид с литорали о-ва Кергелен),
но очень близкий вид обычен на параподиях одного из
2 локальных видов Tisbe на Мурмане и будет описан
отдельно как новый вид I. tisbica.
Род Cyamichona Jankowski,
1971
Очень крупные хонотрихи с бутылковидным те-
лом, слегка суженным базально; воронка колокольча-
тая, не сплющена, без складок стенки, цилиатура во-
ронки в 2 зонах (полоса А и диагональная зона В).
Края воронки отогнуты вбок, образуя карниз. При-
крепление массивным стебельком, внутри тела одна
крупная секреторная ампула и прямоугольный эндо-
стил. Сумка очень глубокая, с утолщенной стенкой
(редкий случай у хонотрих), вмещает всего томита,
обычно же у хонотрих только 1/2—2/3 тела томита.
Поверхность тела с рядами папилл. Симбионты кито-
вых вшей — уникальной группы амфипод, которых
часть авторов исключает из состава подотряда Caprel-
lina, выделяя особый подотряд Cyamina; заражены
практически все известные виды и роды циамид по
всему Мировому океану. Пока описаны виды Cyamic-
hona mysticeti Jank., 1971 (типовой вид рода, с Cyamus
nodosus и С. ceti = С. mysticeti с полярного гренланд-
ского кита) и Cyamichona megapterae Jank., 1971 — с
Cyamus boopis = Paracyamus boopis с горбача Megapte-
ra nodosa. Новые неописанные виды рода — на дру-
гих циамидах.
Род Thalassochona Jankowski,
1971
Типовой вид Th. gambelli Jank., 1971; также
Th. antennaria Jank., 1971. Тело мелкое, широкое, с не-
большой шейкой, веретеновидное; воронка кони-
ческая, с ровными стенками, не отклоненными вбок и
не образующими карниза; поверхность стенок с про-
дольными опорными ребрами, они продолжаются и
за края воронки, образуя мелкие тесно сближенные
игольчатые шипы. Воронка с 2 зонами кинет. При-
крепление ножкой у типового вида, очень коротким
стебельком у других видов, нижняя часть тела сужена,
вытянутая, эндостил удлиненный, с одной мелкой сек-
реторной ампулой. Виды рода населяют антеннулы,
антенны, нижние сегменты и щетинки переопод сим-
бионтной копеподы Balaenophius unisetus (Harpacticoi-
da) с сейвала Balaenoptera borealis и голубого ки-
та-пигмея Balaena musculus, сборы в районе южной
Африки.
Род Inermichona Jankowski, 1971
Типовой вид7.patella}ank.,1971,также 1. grind-
leyi Jank., 1971 с сегментов тела, I пары ног и с вершин
эндоподита II—IV пар переопод того же хозяина, что и
Thalassochona. Внешний облик сходен с предыдущим
родом, стебелек короткий у второго вида, ножковидный
у типового вида. Воронка коническая, лишена про-
дольных ребер и мелких шипиков стенки. Ввиду узости
локусов представлены небольшим числом особей на
рачках; Th. gambelli — единственный сетобионт на Ва-
laenophilus, остальные виды платибионты. Второй вид
Balaenophilus описан недавно в Японии на морских че-
репахах, в описании инфузории не упоминаются.
Круг хозяев изохонид включает также изопод — в
районе Камчатки новые изохониды обитают на идоте-
идах и сфероматидах.
Сем. Actinichonidae Jankowski, 1973
Мелкие, относительно некрупные формы со сплю-
щенным телом (кроме Crassichona), воронка простая,
не сплющена, без вентральных складок и боковых кар-
манов, цилиатура воронки стандартная, с небольшой
зоной В. Стебельчатых форм нет, прикрепление мел-
кой ножкой. Семейство предложено для группы близ-
кородственных родов эндогеммин, обитающих в
основном в общем локусе, на основании щетинок про-
топодита торакопод. При внешнем разнообразии роды
объединяет тенденция к разрастанию тела (появление
киля, якорных отростков и т. д.) и поворот воронки
вправо, поэтому эту группу не следует объединять с
изохонидами. Хозяева, как и у всех следующих се-
мейств, — только виды филлокарид (род Nebalia), жи-
вущие в илах сублиторали морей всего мира. Каждый
вид небалиид имеет характерный набор хонотрих, осо-
бо дивергентных у N. nemurensis (южный Сахалин, Ку-
нашир, Шикотан).
Род Cristichona Jankowski, 1973
Типовой вид С. paciflca Jank., 1973, также С. tes-
selata Jank., 1973 с филлокарид Баренцева и дальнево-
сточных морей, заселяют антенны, торакоподы и щу-
пик максиллулы рачков. Мелкие формы с узким вытя-
нутым телом, высокой шейкой, с сетчатым рельефом
кортекса и четкими складками вентральной стенки во-
ронки, без шипов; сумка сдвинута вниз от типичного
положения; прикрепление ножкой, как у Isochona. Ку-
тикула нижней части резко утолщена и радиально ис-
черчена, состоит из пластинок, такая же перемычка от-
деляет ампулу от эндостила. Такое утолщение панциря
на уровне секреторного комплекса характерно для
ряда криптогеммид.
Род Carinichona Jankowski, 1973
Типовой вид С. globulus по монотипии, с сег-
мента торакопод Nebalia sp. у Владивостока. Очень
мелкие формы с мешковидным телом, вытянутым на
ТИП CILIOPHORA. КЛАСС PHYLLOPHARYNGEA
673
уровне шейки, пелликула со складками, но без рядов
папилл, особо развиты поперечные складки на стенках
сумки. Прикрепление мелкой дисковидной ножкой на
основании щетинок торакопод. Тело несимметричное,
сумка оттянута далеко в сторону, стенки сумки сплю-
щены, образуют ребристый киль.
Род Rhizochona Jankowski,
1973
Типовой вид Rh. armata по монотипии, с того
же сегмента торакопод Nebalia sp. на литорали
о-ва Итуруп, локус — основание щетинок базиподита,
частично прото- и эндоподита торакопод. Мелкие
мешковидные формы с вытянутой шейкой, прикрепле-
ны к щетинкам, тело разрастается между 2 смежными
щетинками, образуя характерные для рода выросты —
с массивным шипом на стенке сумки, с роговидным
выступом противоположной части тела. Покровы тела
ровные, без ребер и папилл, воронка с ровным краем,
без ребер и складок, иногда с дорсальным шипом, ци-
лиатура в 2 полосах.
Род Actinichona Jankowski, 1973
Типовой в ид A. gaucho Jank., 1973, также Л. cus-
pidata Jank., 1973, со щетинок протоподита, частично
базиподита торакопод; особи прикреплены только к
нижней части (основанию) щетинок, по одной особи
на щетинке. Правее зоны, занятой актинихонами, рас-
полагаются Carinichona, у основания протоподита
Isochona. Район находок актинихон — острова Путя-
тин, Сахалин, Шикотан, Итуруп. Тело плоское и очень
широкое, шейка короткая, вентральная стенка воронки
ровная у A. cuspidata, с зубцевидными шипами у A. ga-
ucho, у обоих видов с дорсальным осевым шипом.
Прикрепление ножкой. Нет заметного утолщения и ис-
черченности панциря на уровне ампулы.
Род Kentrochonopsis Doflein,
1897
Типовой в ид К. multipara по монотипии, с «жа-
берных пластинок» Nebalia geoffroyi в Адриатике; судя
по рисункам оригинала, особи прикреплены к наруж-
ной стороне крупных щетинок I фильтрационного
ряда прото-, коксо- и базиподита торакопод, только в
их базальной части, как все актинихониды. Род ранее
обычно не признавался валидным, считалось, что при-
знаком рода является полигеммия, а это лишь одна из
форм размножения при линьке хозяина. Однако зари-
сованы и нормальные трофонты и трофотомонты, от-
личающиеся от Kentrochona. Тело широкое, суженное
и изогнутое снизу, вершина тела с плечами по обе сто-
роны от основания воронки, вооружение воронки
изображается по-разному, с длинными шипами на
стенках, только на дорсуме или также на вентральной
стенке. Плохо изученный вид, отсутствует в Баренце-
вом море и на Дальнем Востоке; в Черном море филло-
карид нет. Систематика хозяев была подвергнута глу-
бокой ревизии, сейчас вида N. geoffroyi нет среди ва-
лидных видов рода; в Европе открыта серия новых ви-
дов Nebalia, прежние определения неверные.
Род Crassichona Jankowski,
1973
Типовой вид С. insolita по монотипии, с поверх-
ности протоподита, реже базиподита торакопод Neba-
lia sp., о-в Шикотан. Аберрантный вид, заслуживает
выделения в особое подсемейство. Тело массивное,
мешковидное, неправильных очертаний, не сплюще-
но, резко утолщены края тела, воронки и сумки, по-
лость воронки имеет вид узкого извитого канала, вент-
ральный край воронки ровный, дорсальный с вырос-
том, поверхность тела без ребер и папилл, панцирь
внизу не утолщен. Воронка глубокая, вмещает всего
томита, ее вершина лежит не ниже, а выше шейки,
придавая особи горбатый вид. Цилиатура воронки не
изучена. Прикрепление небольшим базальным дис-
ком.
Сем. Stylochonidae Mohr, 1948
Мелкие и крупные формы, тело не цилиндриче-
ское — листовидное, часто почти треугольное и ром-
бическое, резко сплющено дорсовентрально. Шейка
короткая, тело особо широкое на уровне шейки, пелли-
кула иногда с рядами папилл, воронка резко сплющена
и растянута в стороны, вентральный край (гипохон)
ровный, эпихон высоко поднят, со складками и карма-
нами. Цилиатура воронки с зонами Al, А2 и В — по-
следняя рудиментарная, лежит на эпихоне. Характерна
тенденция к образованию шипов на теле и воронке.
Прикрепление стебельком, кроме вторично-бессте-
бельчатого рода Ctenochona. Семейство предложено
Мором для всех хонотрих (экзо- и эндогеммин) кроме
спирохон и хилодохон, мной сохранено только для
Stylochona и выводимых от нее родов криптогеммид.
Все роды и виды обитают только на филлокаридах
рода Nebalia в морях Мирового океана.
Род Stylochona Kent, 1881
Типовой вид S. nebalina Kent, 1881. Первона-
чально род предложен для неродственных видов S', ne-
balina (сумчатые) mS. coronata Kent, 1881 (экзогемми-
ды на гаммарусах), позже включен вид с водорослей
S. sivertseni Dons, 1948 (почкование не изучено). Род
сохранен только для типового вида, S. coronata пере-
несена в Heterochona, S. sivertseni — в Eleutherochona.
По морфологии типовой формы стилохоны имеют почти
треугольное плоское тело, сужающееся книзу, при-
креплены небольшим стебельком к щетинкам придат-
ков хозяев, воронка со складками и зубцами эпихона,
соматических шипов обычно нет, панцирь часто утол-
щен и исчерчен в нижней части тела. Другие виды —
S', maxillaris Jank., 1973; S', glabra Jank., 1973; S', villosa
Jank., 1973; S. setaria Jank., 1973 — все с филлокарид
северной Атлантики и морей Дальнего Востока.
43 Зак. № 4163
674
ALVEOLATA
Род Spinichona Jankowski, 1973
Типовой вид У horrida по монотипии, со щети-
нок щупика максиллулы Nebalia sp. у о-ва Путятина
в р-не Владивостока. Мелкие плоские формы типа Sty-
lochona nebalina, с мощным развитием соматиче-
ских шипов по краям всего тела, сумки, на дорсаль-
ной стенке воронки, прикрепление тонким стебельком,
воронка со складками эпихона. Шипы 4 типов по дли-
не и форме.
Род Dentichona Jankowski, 1973
Типовой вид 2). marginata по монотипии, с ров-
ной поверхности и бугорков (видоизмененных щети-
нок) эпиподита торакопод Nebalia sp. в Японском
море. Тело мелкое, плоское, пятиугольное, не вытяну-
тое, без утолщения и исчерченности стенок панциря,
воронка с ровным вентральным краем и складчатым
эпихоном (дорсальной стенкой). Воронка без шипов,
по краям тела несколько коротких тупых шипов, ши-
роких в основании (у Spinichona игольчатые). При-
крепление очень длинным тонким стебельком. На час-
ти рас хозяев найдены «анактиниды» — такие же хо-
нотрихи, но без соматических шипов; неясно,
принадлежат ли они к этому виду или это более при-
митивный бесшиповый вид рода. Признаки рода,
если включать анактинид — пятиугольное тело и
длинный стебелек.
Род Flectichona Jankowski,
1973
Типовой вид F. crenata Jank., 1973 с литорали
Соловецких о-вов Белого моря, также F. filicauda
Jank., 1973, обитающие на щупике и на щетинках мак-
силлулы Nebalia из Шикотана. Тело поднято на высо-
ком стебельке, особо широкое у шейки, иногда с попе-
речной исчерченностью кортекса. Сумка глубокая,
вмещает почти всего томита. Воронка резко расшире-
на, эпихон с глубокими карманами, сложной формы,
края воронки зубчатые, с мелкими шипами.
Род Armichona Jankowski,
1973
Типовой в ид A. gibbosa Jank., 1973, также Л. in-
secta Jank., 1973 и A. hexadenta Jank., 1973 с поверхно-
сти щупика максиллулы Nebalia', встречаются на Мур-
мане, Камчатке, Сахалине, у Владивостока. Никогда
не встречаются совместно с флектихонами, заменяя
их. Типовой вид обнаружен m Nebalia у о-ва Путятина
в Японском море, платибионты на максиллуле рачков.
Представляют собой мелкие широкие формы с мешко-
видным телом, покрытым продольными рядами зубчи-
ков (папилл); края тела с выемками и складками, шей-
ки почти нет, воронка непропорционально крупная, с
боковыми шипами, края стенок складчатые, эпихон
наклонен к вентральной стенке, складчатый. Прикреп-
ление длинным стебельком.
Род Oxychonina Corliss, 1979
Название предложено для замены гомонима Oxy-
chona Jankowski, 1973 в книге Корлисса (Corliss, 1979),
без переноса видов. В каталоге Аэшт род Oxychonina с
типовым видом Oxychona multifida Jank., 1973 «по пер-
воначальному обозначению и монотипии»; следова-
тельно, тип должен обозначаться как Oxychonina multi-
fida (Jank., 1973) Aescht, 2001. Для второго вида пред-
лагается обозначение Oxychonina suprema (Jank., 1973)
comb. n. (=Oxychona suprema). Виды рода обитают на
щетинках экзоподита торакопод Nebalia, собранных на
литорали о-вов Путятин, Шикотан и Итуруп, вид с Са-
халина пока не описан, в Японии отмечены бесшипо-
вые оксихоны типа О. suprema. Типовой вид — крупные
формы с удлиненным телом, края тела выше ампулы с
короткими зубцевидными шипами, нет утолщения и
исчерченности панциря на уровне эндостила, прикреп-
ление очень длинным стебельком. Воронка с ровным
гипохоном вентрально и со складчатым эпихоном, без
маргинальных ребер и зубчиков. Вид О. suprema —
«анактинида» вида О. multifida, бесшиповая форма та-
кого же типа, не встречается совместно с О. multifida и,
вероятно, специфична для другого вида хозяина.
Род Eriochona Jankowski, 1973
Типовой вид /Г. horrida Jank., 1973 с поверхно-
сти щупика максиллулы Nebalia bipes у Кильдина в Ба-
ренцевом море, также Е. glacialis Jank., 1973 в пробах у
Камчатки. В принципе такой же облик тела, как у
Oxychona, но более развиты шипы — по обоим краям
тела от стебелька до шейки, у типового вида также на
нижней части воронки справа и слева, у Е. glacialis над
шейкой; прикрепление длинным стебельком.
Род Paraoxychona Jankowski, 1973
Типовой в и д F. inversa по монотипии. Найдены
всего 2 особи на основании щетинок экзоподита тора-
копод Nebalia sp. у о-ва Итуруп; внешний облик, как у
Oxychonina suprema, с вытянутым плоским телом без
соматических и апикальных шипов, с длинным сте-
бельком. Родовой признак — инверсия зон цилиатуры —
если расположить томонта стандартным образом, за-
родышевой сумкой справа, на вентральной стенке во-
ронки мы видим дорсальную цилиатуру. Сейчас изве-
стно наличие зеркальных форм хонотрих в зависимо-
сти от их поселения на придатках левой или правой
стороны рачков. Неясно, включает ли такой димор-
физм инверсию цилиатуры. Род пока сохраняется
условно, под вопросом; если это О. suprema, тогда на-
звание Paraoxychona должно заменить название Oxy-
chonina как пригодное для переименования гомонима.
Род Pterochona Jankowski, 1973
Типовой вид Р. pacifica по монотипии, с повер-
хности щупика максиллулы Nebalia sp.; заселен только
ограниченный участок у основания щупика, поэтому
ТИП CILIOPHORA. КЛАСС PHYLLOPHARYNGEA
675
пи хозяине можно найти лишь несколько особей вида;
найдены у Владивостока. Более простой вид с неширо-
кими крыльями и без соматических шипов — в мате-
риале из США, шт. Вашингтон. Вероятно, род ограни-
чен северной Пацификой. Очень крупные формы с не-
обычным крестовидным телом: края тела оттянуты в
стороны в виде крыльев, покрытых сверху зубчатыми
шипами. Сумка очень глубокая, вмещает всего томита.
11рикрепление длинным тонким стебельком. Нет утол-
щения и исчерченности панциря на уровне эндостила.
Края воронки складчатые, эпихон с глубокими боко-
выми карманами, поверхность воронки покрыта ряда-
ми мелких зубцевидных папилл. Вероятно, крылья со-
ответствуют нижним шипам оксихон и дентихон, а
зубчики на вершине крыльев — всем остальным боко-
вым шипам предков.
Род Ctenochona Jankowski, 1973
Типовой вид С. ternipara по монотипии, с по-
верхности щупика максиллулы Nebalia sp. у о-ва Иту-
руп; заселена в основном проксимальная часть придат-
ка, средняя и дистальная части заняты видом Согопо-
chona. Тело плоское, листовидное, растянуто далеко
в стороны, сложной формы, с небольшой шейкой,
прикрепление мелким диском, вероятно это вто-
рично-бесстебельчатый род. Сумка вмещает всего то-
мита. Оба края тела со сплошным рядом коротких зуб-
цевидных шипов. Воронка с зубчиками вентрального
края и со складками, карманами и шипами дорсальной
стенки. Цилиатура воронки с четкими зонами Al, А2
и В. Воронка и латеральные шипы тела — общие
признаки с рядом других стилохонид, поэтому, не-
смотря на отсутствие стебелька, род включается в это
семейство.
Сем. Echinichonidae Jankowski, 1973
Мелкие и крупные формы с ромбическим или вере-
теновидным телом, резко сплющенные дорсовентраль-
но, с короткой шейкой, расширенной плоской ворон-
кой; края эпихона и гипохона почти параллельные. Ги-
похон ровный, эпихон без складок или карманов или с
одной очень мелкой продольной складкой левее зоны
В. Шипы едва намечены или отсутствуют у низших
форм, развиты у высших. Прикрепление стебельком,
кроме рода Coronochona с диском. Сумка глубокая,
вмещает всего томита. Заселяют щетинки и щупик
максиллулы Nebalia в Японском море, на юге Сахали-
на и на южных Курильских о-вах. Поскольку плоская
воронка с полной редукцией складок и карманов
встречается только у группы близкородственных эндо-
геммин, эти роды желательно отделить от других в со-
ставе особого семейства или подсемейства.
Род Eurychona Jankowski, 1973
Типовой в и д Е1. vitrea по монотипии, с литорали
Шикотана и Итурупа. Тело широкое, пятиугольное,
сужается книзу, воронка широкая, с мелкими зубчика-
ми по всему краю, без складок и шипов, кроме неболь-
шой продольной складки левее зоны В. Кинетом
воронки — зоны А1 и А2 обычного типа и почти реду-
цированная дорсальная зона В. Прикрепление длин-
ным стебельком. Нет утолщения и исчерченности пан-
циря на уровне эндостила.
Род Echinichona Jankowski, 1973
Типовой видЕ. regina Jank., 1973, также Е. sim-
plex Jank., 1973 с дистального отдела концевых щети-
нок щупика максиллулы Nebalia sp. в Японском море.
Крупные вытянутые формы с ромбическим телом, не-
пропорционально крупной плоской воронкой, утол-
щенным панцирем, небольшие зубцы намечаются по
краям тела и воронки у Е. simplex, хорошо развиты в
виде зубцевидных шипов у Е. regina, вида с особо глу-
бокой зародышевой сумкой. Ресничная зона В воронки
уменьшена до простой узкой полоски. Прикрепление
стебельком, достигающим половины длины тела.
Род Coronochona Jankowski,
1973
Типовой вид С. pectinata по монотипии, плати-
бионты с ровной поверхности (не щетинок) щупика
максиллулы Nebalia с литорали о-ва Итуруп. Некруп-
ные формы с широким мешковидным несимметрич-
ным телом, непропорционально крупной воронкой,
глубокой зародышевой сумкой. Поверхность панциря
местами с рядами папилл, стенка панциря не исчер-
чена на уровне эндостила. Соматических шипов
нет, имеются 2 шипа на шейке и зубцевидные шипы
по всему краю воронки, мелкие на гипохоне и круп-
ные на эпихоне. Единственная дорсальная складка,
очень мелкая, в зоне В дорсально. Прикрепление нож-
кой, стебелька нет. Воронка в принципе такого же
типа, как у Echinichona, поэтому астилия может быть
вторичной при переходе к обитанию со щетинок на
ровном субстрате.
Сем. Inversochonidae Jankowski, 1973
Тело сплющено дорсовентрально, относительно
некрупное, удлинено у примитивных форм и укороче-
но, почти прямоугольное у форм с торакопод. Нет вы-
ростов тела и килей в отличие от актинихонид. Ворон-
ка не коническая, сплющена, растянута в стороны; ги-
похон ниже эпихона, всегда с 2 продольными
складками, ограничивающими осевой желобок (кар-
ман). Ресничный аппарат воронки инверсного типа по
сравнению с другими родами криптогеммид — на эпи-
хоне ресничек нет, зона В перешла на гипохон, на дне
кармана, разрывая полосу А на 2 одинаковых фрагмен-
та правее и левее кармана. Пелликула ровная, без скла-
док и папилл. Шипов нет у примитивных форм, разви-
ты у высших родов. Прикрепление подошвой, без сте-
белька. Несколько родов с плеопод и торакопод
Nebalia, семейство в целом космополитное, роды ло-
кальные.
676
ALVEOLATA
Род Pleochona Jankowski, 1973
Типовой вид Л coronata по монотипии, с плео-
под Nebalia у о-ва Итуруп. Тело вытянутое, узкое, осо-
бо плоское снизу, прикреплено диском без заметной
секреции в виде ножки. На вершине тела (гипоколлю-
ме) несколько крупных шипов. Воронка относительно
неширокая (по сравнению со следующими родами),
вентральный край ровный или с мельчайшими зубца-
ми, дорсальный (эпихон) поднят и разрастается в виде
группы симметричных шипов. При иммерсии не уда-
ется найти дорсальную цилиатуру; на гипохоне полоса
из примерно 6 кинет, прерванная зоной В с диагональ-
ными кинетами на дне глубокого кармана. Зона А2
включает несколько коротких кинет по обе стороны от
складок кармана. У этих форм должен быть резко из-
менен морфогенез по сравнению с типичными крипто-
геммидами с дорсальной зоной В. Сейчас проверяется
гипотеза о диморфизме и зеркальной симметрии таких
форм на правых и левых придатках хозяина.
Род Kentrochona Rompel, 1894
Типовой вид К. nebaliae Rompel, 1894, также
К. robusta Jank., 1973, с торакопод Nebalia в Средизем-
ном море (первый вид) и на Камчатке (К. robusta). В
первоописании спутаны хонотрихи 2 родов, Kentro-
chona и Stylochona, и последующие авторы сводили
второй род Ромпеля Kentrochonopsis {К. multipara) в
синонимы рода Kentrochona. Сейчас ясно, что такой
синонимии нет. Тело почти прямоугольное, плоское,
прикреплено субтерминальным диском, несет не-
сколько боковых шипов. Воронка гигантская, плоская,
с 2 вентральными шипами и 2 более крупными дор-
сальными шипами. Платибионты на торакоподах Ne-
balia, вероятно «N. geoffroyi» в Адриатическом море,
по Ромпелю, заселяют эпи- и экзоподиты торакопод;
по Дофлейну, в основном экзоподит, в меньшей степе-
ни другие сегменты этого сложного придатка.
Род Ceratochona Jankowski, 1973
Типовой вид С. cimex Jank., 1973, также С. scan-
dens Jank., 1973, с внутренних (не дистальных) краев
почти всех сегментов торакопод Nebalia в Баренцевом
море и на Дальнем Востоке от южных Курил до Кам-
чатки. Очень мелкие формы с угловатым телом, растя-
нутым в стороны; края тела с несколькими шипами;
воронка широкая, без шипов у типовой формы, с не-
сколькими зубцами у второго вида, ядро вытянуто по-
перек тела. Кинетом с зонами Al, А2 и В, последняя
прерывает обе зоны А.
Род Chonosaurus Jankowski, 1973
Типовой вид Ch. rex Jank., 1973, также Ch. gale-
atus Jank., 1973, на торакоподах Nebalia в дальнево-
сточных морях (тип рода) и в Баренцевом море
(Ch. galeatus), платибионты на дистальных отделах эн-
до- и экзоподита торакопод, прикреплены обычно око-
ло щетинок, прислоняясь к ним. Тело короткое и ши-
рокое, угловатое, сплющено, прикреплено диском на
значительном удалении от постерона. Края тела с
крупными толстыми шипами по всему периметру,
края воронки с мелкими ребрами и зубчатой каймой,
от основания эпихона отходит гигантский осевой шип.
Цилиатура воронки стандартного типа для родов се-
мейства, с вентральными зонами Al, А2, прерванными
сместившейся сюда с эпихона зоной В, лежащей в глу-
боком осевом кармане воронки.
В дополнение к списку родов хонотрих укажем род
«Клематохона» в личном письме Дж. Мора (J. L. Mohr,
Калифорния, США) с ротовых частей глубоководных
мизид Gnathophausia ingens\ это единственный коло-
ниальный род группы, с ветвящимся стебельком, как у
перитрих типа Epistylis. На прибрежных и траловых
мизидах Атлантики и Северной Пацифики пока обна-
ружены лишь одиночные хонотрихи типа Chilodocho-
па capbretonensis.
Подкласс Suctoria Claparede et Lachmann, 1859
В основном сидячие или свободно парящие в планктоне фор-
мы, исключая аберрантный род Cyathodinium с признаками неоте-
нии и сохранением ресничек, и роды группы Allantosoma — непри-
крепленные безресничные формы из кишечника млекопитающих.
Внутриклеточные паразиты (Endosphaera, Sphaerophrya) без руди-
мента органелл прикрепления, но в жизненном цикле сферофрий
есть стебельчатая стадия цисты. Основная масса видов прикрепле-
на к субстрату, чаще всего стебельком, реже диском или прикрепи-
тельной пластинкой, или всем телом (Heliophrya).
На поверхности тела импрегнация выявляет большое число
рассеянных в беспорядке аргиросом, вероятно безресничные кине-
тосомы и поры пелликулы (как у перитрих), и сетевидный аргиром
такого типа, как у гипостомат и ринходид. При морфогенезе эти ар-
гиросомы участвуют в образовании цилиатуры томита.
Типичный представитель группы — род Acineta, раковинные
стебельчатые формы с 2 пучками щупалец по краям тела апикаль-
но, с развитием томита внутри тела в зародышевой камере (томос-
фере, термин новый). Щупальца у сукторий расположены пооди-
ночке, в рядах или в пучках, очень разнообразны по форме и строе-
нию; можно выделить как минимум 15 типов щупалец. Если
учесть, что число родов очень велико, становится очевидной роль
щупалец для систематики — один род не может включать виды с
разным типом щупалец. Типичное щупальце (у ацинет и токо-
фрий) — длинная тонкая трубка с каналом и расширенным акро-
ном, содержащим токсические экструсомы (гаптоцисты); канал и
стенка щупальца с опорным аппаратом — имеется наружное коль-
цо микротубул и внутренний набор микротубулярных пластинок
(phyllae), четко видимые на поперечном срезе в электронном мик-
роскопе. По новым данным, число и форма пластинок может отли-
чаться у морфологически близких видов, и в будущем это даст воз-
можность дифференцировать морфологически неотличимые виды,
например спорные виды рода Capriniana на жабрах пресноводных
рыб. Даже внешне одинаковые щупальца могут относиться к раз-
ным типам. Так, у многих видов рода Discophrya при фиксации
тонкие булавовидные щупальца мгновенно сокращаются и могут
втягиваться в тело, а у Tokophrya такие же щупальца фиксируются
почти несокращенными. Ветвление щупалец встречается, как иск-
лючение у Dendrocometes и близких родов, и возможно, у плохо
описанного рода Dendrocometides. У эндопаразитов щупальца
длинные в свободной стадии (Sphaerophrya parameciorum), резко
укорачиваются при захвате хозяина и погружении в цитоплазму.
Полная редукция щупалец наблюдается у форм группы Endosphae-
ra, заражающих цилиат, крупных сукторий, коловраток и турбел-
лярий; родство их с сукториями очевидно при изучении томитов
ТИП CILIOPHORA. КЛАСС PHYLLOPHARYNGEA
677
пшшстидного типа. Возможно, все разнообразие щупалец сводится
к нескольким структурным типам, но на практике мы имеем дело с
различиями во внешнем облике и сократимости щупалец, как отме-
чено выше, по крайней мере 15 типов. Для выростов тела с токси-
цистами (экструсомами) гапторид я ввел термин «токсофоры», на-
пример у Legendrea и Actinobolus, но суктории неродственны им и
для них этот термин лучше не использовать.
Щупальца отходят от всей поверхности тела в беспорядке (у Po-
dophrya, Prodiscophiya) или чаще от определенных участков, которые
следует обозначить специальным термином «актинофоры»; термин
был предложен мною для обозначения щупальценосных выростов
тела, например у Dendrosoma, но в литературе применяется для любых
участков тела со щупальцами. Как и у ринходид, внутренние каналы
щупалец продолжаются в цитоплазме. В одной из групп (Ophryodend-
ridae) актинофор превратился в сократимую складчатую ленту, несу-
щую щупальца на вершине. Щупальца могут быть неподвижными
или находятся в медленном движении — растягиваются, сокращают-
ся, извиваются, раскачиваются в стороны. Очень активны немного-
численные гибкие щупальца у Rhyncheta, Dentacineta, Acinetopsis, Та-
lizona, Umula с быстрым поисковым движением. Но чаще суктории
пассивно ожидают случайного контакта с пищевым организмом; кон-
такт более вероятен при полимеризации щупалец, их удлинении или
ветвлении или поднятии над телом и субстратом на выростах тела
(актинофорах). Пища у свободных видов — цилиаты, флагеллаты,
зооспоры водорослей; симбионты сохраняют хищное питание или
высасывают хозяев. При высасывании добыча разрушается, поэтому
нет видов с симбионтными водорослями (хлореллы или ксантеллы),
но эндобактерии известны у части сукторий — дискофриид и (в спе-
циальных каналах) офриодендрид.
Ядро (макронуклеус) обычно овальное, с одним или несколь-
кими мелкими микронуклеусами, ярко красится на ДНК; реже ядро
вытянутое, неправильной формы или ветвящееся. Характерна вы-
сокая степень конденсации хроматина, быстрая и интенсивная
окраска ядер по Фёльгену и другими методами. Обычно ядро гру-
бозернистое, иногда концентрическое, с зонами разной структуры.
Наиболее сложно коронообразное ядро эфелотид. Вакуоль с порой
в кортексе, нередко с узким выводным каналом; число вакуолей —
один из видовых признаков, например у Podophrya.
Прикрепительный комплекс (фиксон — мой термин для сукто-
рий, перитрих и фолликулинид) разного типа, обычно прочный
стебелек, всегда несократимый (без мионемы), с продольными
фибриллами, каждая из которых секретируется кинетосомой ско-
пулы; фиксация на субстрате с помощью диска, не всегда заметно-
го (можно выявить окраской конгоротом). Диск может быть очень
широким у бесстебельчатых форм, приклеивая всю нижнюю сто-
рону тела. У Metacineta диск переходит в раковину без стебелька,
но обычно стебелек плотный, четко отграничен от раковины.
В зоне контакта с раковиной стебелек часто расширяется; этот от-
дел я называю «эпикон»; он особо развит, к примеру у Basitokoph-
rya, Sibiracineta, у многих эфелотид, например Podocyathus. Если
стенки раковины сужаются снизу, но настоящего прочного сте-
белька нет, этот отдел я называю «псевдостил», а всю раковину с
ложным стебельком «стилотека». Пример — род Metacineta; если
будет найден вид метацинет с прочным фибриллярным стебель-
ком, он должен быть исключен из состава рода. Вариант покро-
ва — постоянная мукозная оболочка вокруг тела, реже вокруг тела
и стебелька, до субстрата — у пресноводных родов Cryptophrya,
Cryptacineta, у одного вида Brachyosoma, у морской парацинетиды
Luxophrya; такую оболочку я называю «мукотека».
Размножение почти равным делением у подофриид, вероятно
примитивных форм; далее в эволюции путем анизогамии, наруж-
ного, полувнутреннего и внутреннего томитогенеза (схемы про-
цессов см.: Puytorac, 1994). Общепринятое деление подкласса на
экто-, эндо- и эвагиногеммид очень упрощенное, есть исключения
и усложнения, а 2 первые группы сборные. Среди экзогеммид вы-
деляются роды с крупными червеобразными безресничными томи-
тами, ползающими, как пиявки (Ophryodendron, Rhabdophrya, The-
cacineta и др.); группа Vermigenea несомненно монофилетичная, с
идентичным способом размножения и с поразительным разнообра-
зием внешнего облика, вплоть до имитации родов Dendrosoma, Ра-
racineta, Trichophrya. Томиты сукторий чаще активно плавающие,
с цилиатурой — рядами кинетосом и ресничек. Топография (пат-
терн) кинетома строго определенная для каждой группы; всегда
имеется апикальная или боковая скопула — импрегнируемый уча-
сток кортекса, округлый или овальный, со скоплением аргиросом.
Прикрепляясь к субстрату скопулой, томит ацинет секретирует
диск, стебелек, растущий трофонт быстро образует раковину. То-
мит может сохранять несколько коротких неактивных щупалец,
удлиняющихся после оседания; реснички сбрасываются, кинетосо-
мы теряют правильное расположение, и у молодых трофонтов нет
рядов кинетосом. Раковины образуются независимо в разных груп-
пах подкласса, как и у перитрих, имеют разное строение и форму;
особый вариант у части дискофриид — широко открытая полура-
ковина (далее обозначается как семитека или гемитека), вмещаю-
щая нижнюю часть тела трофонта. Конъюгация известна для части
видов, соединяются соседние трофонты.
Группа в целом космополитная, распространение многих ви-
дов и родов очень широкое, но есть виды, не отмеченные в других
районах или просто редкие. Заселены все биотопы — почва, терро-
фитон, пресные и морское воды, эстуарии; планктонные виды из-
вестны в пресной воде и в море. Суктории избегают анаэробных
зон, занятых многими другими цилиатами (за исключением Enche-
lyomorpha), отсутствуют в псаммоне, обычны в перифитоне, где
могут достигать большой численности. Тенденция к обрастанию
приводит к появлению специфического эктокомменсализма и
криптобиоза на многих группах водных животных, от одноклеточ-
ных до китообразных; особо заселены ракообразные почти всех от-
рядов, имеющие твердый панцирь. Каждая группа хозяев имеет ха-
рактерный набор симбионтных сукторий. Паразитизм (питание тка-
нями хозяина) встречается у экзо- и эндогеммин, отсутствует у Ver-
migenea, вероятно также у дискофриид (Evaginogenea). Чаще всего
заражены другие инфузории и суктории; например Endosphaera,
виды которой заражают перитрих (одиночных и колониальных, ра-
ковинных и безраковинных, сессилид и триходинид) и сукторий.
В пищевом тракте наземных хозяев — только роды аберрантных
групп Allantosoma (в непарнокопытных) и Cyathodinium (в морских
свинках — кавиидах); суктории в индийских слонах, отмеченные
Дж. Мором, остались неизученными, но, вероятно, сходны с афри-
канскими Vanhovenia. Новый род Strelkowella недавно описан Кор-
ниловой (2004) из лошадей локальной породы в Якутии.
На ультраструктурном уровне для сукторий характерен опре-
деленный паттерн кинетофибрилл — у томитов имеются соматиче-
ские монокинетиды (моносомы), в рядах или в беспорядке, каждая
с незначительно конвергентным постцилиарным пучком, короткой
кинетодесмальной фибриллой, направленной вбок, и поперечной
фибриллой; по обеим сторонам кинетосомы расположены парасо-
мальные мешки; пучки немадесм, отходящие от кинетосом, идут
назад под каждой кинетой.
Суктории — крайне дивергентная группа по всем признакам —
по форме тела, раковине, типу щупалец, фиксаторному аппарату,
способу питания и почкования, по циклам развития, по форме и ци-
лиатуре томитов. Систематика подкласса пока упрощенная, не отра-
жает этой дивергенции; в последнем варианте (Lynn, 2002) различа-
ются 3 отряда: Exogenida, Endogenida и Evaginogenida, не делящиеся
на подотряды; здесь нет специального таксона для группы родов с
безресничными червеобразными томитами, для вторично-бесщу-
пальцевых форм, для плавающих трофонтов с цилиатурой, для форм
с ветвлением щупалец. Более сложные варианты классификации
см.: Янковский (1981) и Довгаль (2002).
Филогения сукторий неизвестна; на молекулярных схемах сук-
тории группируются с гипостоматами, но предками их считаются
ринходиды — мелкие эктопаразиты с сосущим хоботком, точнее
только ринходиды сем. Hypocomidae, которых часть авторов рас-
сматривает в составе отряда Hypostomatida вместе с хилодонелла-
ми и дистериями. Ринходиды всех трех подгрупп (анцистрокоми-
ды, сфенофрииды, гипокомиды) пока не представлены на молеку-
лярных филограммах, и это дает основания для поиска других
возможных предков среди простомат, вероятно не тех, кто имеет
длинные сократимые щупальца с токсицистами (Actinobolina), а
форм типа Didinium; я сторонник старинной гипотезы (Butschli,
1889) о родстве сукторий и Hypocoma. Монофилия подкласса сук-
торий сейчас считается бесспорной, так как при всем многообра-
зии морфологии и способов размножения ультраструктура щупа-
лец сходная. Для молекулярных филограмм использовали генный
банк Prodiscophrya collini (на схемах названа Discophrya collini);
суктории и гипостоматы оказались смежными ветвями далеко от
гапторид (Striider-Kypke, Lynn, 2003). Недавно добавлены Acine-
ta sp., Ephelota spp. и Tokophrya lemnarum; эфелоты — крупные
морские суктории, местами массовые, с ветвящимся ядром в толще
всего тела, которых легко собрать для анализа ДНК (Snoeyen-
bos-West et al., 2004). Показана монофилия и единство всех 4 групп
Phyllopharyngia, включая сукторий, и примитивность экзогеммии
по отношению к эндо- и эвагиногеммии.
Из общих сводок можно рекомендовать не потерявшую цен-
ность книгу Коплена (Collin, 1912) с замечательными иллюстраци-
ями многих родов, компактный определитель морских видов Каля
678
ALVEOLATA
Рис. 335, a. Suctoria. Sphaerophrya terricola (Л—Ж); Loricophrya (Paracineta) lauterborni (3—H); Podophrya fallax (О). (По: Dingfelder, 1962
(O); Foissner, 1986a (А—Ж), 1995b (3—H)).
Fig. 335, a. Suctoria.
(Kahl, 1934a, 1934b), специальный выпуск журнала Protistology с
монографическим обзором Довгаля (Dovgal, 2002), готовящего том
по сукториям в серии «Фауна Украины». Книга Маттеса (Matthes,
1988) очень полезная, но в то же время слишком субъективная и
должна использоваться с крайней осторожностью; к примеру, Мат-
тес объявляет богатую дивергентную фауну симбионтных сукто-
рий Байкала несуществующей; роды Tokophrya и Discophrya — ха-
отический набор всевозможных форм, в которых раковинные роды
не отделяются от безраковинных; подроды не выделяются; ряд ви-
дов пропущен. К сожалению, Аэшт (Aescht, 2001), решая вопрос
о валидности родов, ссылается на эту книгу и объявляет мно-
гие роды невалидными. Личное мнение одного автора — не ар-
гумент; к примеру, я считаю Stylostoma (на морских копеподах)
валидным родом, Довгалъ отрицает этот род, а Батисс выделяет его
в новое семейство (глава Suctoria в сводке Traite de Zoologie — Ва-
tisse, 1994). Нужно помнить одно из основных правил системати-
ки — спорный род — это четкий подрод внутри полиморфного
рода.
В этой книге я акцентирую внимание на родах цилиат, приводя
также спорные и синонимичные названия; структура подкласса
здесь упрощена и не дискутируется. Довгаль (Dovgal, 2002) приво-
дит основные схемы классификации сукторий, включая свой вари-
ант; в другой публикации им дана следующая схема (авторы се-
мейств здесь опущены) (Довгаль, 2002):
Класс Suctorea С. et L., 1859
Подкласс Exogenia Collin, 1912
Отряд Podophryida Jank., 1967 (Podophryidae, Allantosoma-
tidae, Severonidae)
Отряд Phalacrocleptida Jank., 1978 (Phalacrocleptidae)
Отряд Metacinetida Jank., 1978 (Metacinetidae, Paracineti-
dae, Praethecacinetidae, Manuelophryidae)
Отряд Tachyblastonida Jank., 1978 (Tachyblastonidae)
Отряд Ephelotida Raabe, 1964 (Ephelotidae)
Подкласс Vermigenia Jank., 1978
Отряд Spelaeophryida Jank., 1978 (Spelaeophryidae, Leca-
nophryidae, Dendrosomididae, Dentacinetidae)
Отряд Thecacinetida Batisse, 1975 (Thecacinetidae)
Отряд Ophryodendrida Jank., 1975 (Ophryodendridae, Rhab-
dophryidae)
Подкласс Endogenia Collin, 1912
Отряд Acinetida Raabe, 1964 (Acinetidae, Acinetopsidae, To-
kophryidae, Corynophryidae, Rhynchetidae, Choanophry-
idae, Dactylostomatidae)
Отряд Trichophryida Jank., 1978 (Trichophryidae, Dendroso-
midae, Erastophryidae, Solenophryidae, Pseudogemmidae)
Отряд Endosphaeriida Jank., 1978 (Endosphaeriidae)
Подкласс Evaginogenia Jank., 1978
Отряд Discophryida Jank., 1975 (Discophryidae, Prodiscoph-
ryidae, Periacinetidae, Rhynchophryidae, Heliophryidae)
Отряд Trypanococcida Dovgal, 2002 (Trypanococcidae)
Отряд Dendrocometida Raabe, 1964
Подотряд Stylocometina Jank., 1981 (Stylocometidae,
Enchelyomorphidae)
Подотряд Dendrocometina Dovgal, 2002 (Dendrocometi-
dae, Cometodendridae)
Отряд Cyathodiniida Jank., 1975 (Cyathodiniidae)
ТИП CILIOPHORA. КЛАСС PHYLLOPHARYNGEA
679
Рис. 335, б. Suctoria. (Ориг.).
Sphaerophrya parameciorum в Paramecium caudatum (A—И); S. insolita
в Bursaria truncatella (K—H).
Fig. 335, 6. Suctoria.
Отряд Vermigemmida Jankowski, 1980
(рис. 336, a—337, a)
Трофонты разнообразной формы, нет общего плана
строения; общий признак — наружное почкование (эк-
зогеммия) с образованием крупных длинных червео-
образных томитов, лишенных цилиатуры и передвига-
ющихся по субстрату как пиявки, с прикреплением
мукроном. По внешнему облику это наиболее дивер-
гентная группа сукторий с сочетанием разных призна-
ков у каждого рода (наличие или отсутствие стебелька,
раковины, актинофоров и щупалец разного типа).
В основном морская группа, в пресной воде отмечено
несколько симбионтных видов (на копеподах и кревет-
ках морского происхождения); вся дивергенция — в
море. Преобладают комменсальные формы, перифи-
тонных видов немного, паразитов нет.
Сем. Thecacinetidae Matthes,
1956
Трофонты похожи на парацинет (раковина стебель-
чатая, рюмковидная, не сплющена); имеется один апи-
кальный осевой пучок щупалец), поэтому не исключе-
но, что эти группы родственны, хотя различаются по
типу почкования. По крайней мере один вид — исклю-
чение, с цилиатурой на коротком широком (не черве-
образном) томите, но у большинства видов томиты
червеобразные и безресничные. Обитают в морском
перифитоне, на нематодах, копеподах, редко на других
мелких беспозвоночных.
Род Thecacineta Collin, 1909
Типовой в и д Acineta calix Schroder, 1906—1907.
Род сборный, с раковиной и томитами разного типа,
поэтому важны признаки типового вида; к сожалению,
томиты в типовом материале не отмечены. 7 особей
680
ALVEOLATA
Рис. 336, a. Suctoria.
Thecacineta calix (Л); Th. laophontae («.Th. calix» in Matthes, 1956) (Б—Г); Vostonica tenax (Д—Ж); Leboransia («Ophryodendron») mysidacii (3—Л). (По: Batisse,
1968b (A); Matthes, 1956 (Б—Г); Femandez-Leborans, Tato-Porto, 2002 (3—Л); Д—Ж — ориг.).
Fig. 336, a. Suctoria.
вида, идентичные взрослые трофонты, найдены на од-
ной особи неопределенной морской нематоды в фик-
сированном коллекционном материале со станции Га-
усса в Субантарктике. Раковина некрупная (до 80 X
36 X 20 мкм), на тонком коротком стебельке, стенка с
14—17 поперечными кольцевыми складками (ребра-
ми); трофонт прикреплен ко дну раковины; спереди
пучок булавовидных щупалец на вздутом актинофоре;
ядро овальное.
Сукторий с северных копепод Laophonte обычно
определяют как Т. calix, но это особый вид, названный
мною Т. laophontae. На нематодах встречаются виды с
2 типами раковин, гладкой и с поперечными ребрами,
которые не могут относиться к одному роду. Заселены
преимущественно литоральные виды Spirina, Chroma-
dora, Desmodora, Epsilonema', симбионты обычны в
морях России. Строению типового вида соответствуют
виды Th. desmodorae Schulz, 1931; Th. donsi Allgen,
1935; Th. subantarctica Allgen, 1949; Th. paradesmodo-
rae Allgen, 1914 (все с нематод) и часть видов семейст-
ва с других хозяев — Th. laophontae Jank., 1981 с копе-
под Laophonte cornuta и некоторые другие виды с реб-
ристой раковиной. У аберрантного (или плохо зарисо-
ванного) вида Th. oblonga Allgen, 1935 кольцевые реб-
ра имеются только в нижней половине раковины, это
вид особого рода.
Род Lissacineta Jankowski,
1978
Типовой вид Thecacineta cothurnioides Collin,
1909 с тергума абдоминальных сомитов гарпактициды
Cletodes longicaudatus (Copepoda). Раковина бокало-
видная, вытянутая, не сплющена, сужается к стебель-
ку, трофонт прикреплен к ее стенке в нижней трети
тела; ядро округлое; спереди 5—15 щупалец в цент-
ральном пучке; стебелек узкий и тонкий. Стенка рако-
вины гладкая, без следов поперечных ребер. Размно-
жение не изучено; пока мы допускаем, что текацинеты
с ресничными томитами живут только на клещах (На-
lacaridae), а все остальные виды семейства с копепод,
нематод и гидроидов имеют длинных червеобразных
безресничных томитов. Поэтому вид с галакарид с та-
ТИП CILIOPHORA. КЛАСС PHYLLOPHARYNGEA
681
Рис. 336, б. Suctoria.
Lecanophryella paraleptastaci (A—Г); Dendrosomides grassei (Д—3); Trophogemmapoljanskyi (И—М). (По: Довгаль, 1985 (A—Г); Batisse, 1986 (Д—3); И—Н—
ориг.).
Fig. 336, 6. Suctoria.
кой же гладкой раковиной должен быть отнесен к дру-
гому роду. Род Lissacineta включает кроме типового
вида также L. scanica (Allgen, 1934 in Paracineta)
comb, n., L. spirinae (Allgen, 1934 in Thecacineta)
comb, n., L. oregonensis (Murphy, 1963 in Praethecacine-
ta) comb, n., L. trichophora (Allgen, 1951 in Thecacine-
ta), L. stresemanni (Allgen, 1951 in. Paracineta) comb, n.,
L. sivertseni (Allgen, 1951 in Thecacineta) comb, n.,
L. longe-petiolata (Allgen, 1951 in Thecacineta) comb. n.
Род Litacineta Jankowski,
1978
Типовой вид Thecacinetagracilis sp. n. (=Paraci-
neta crenata var. gracilis Wailes, 1928) с гидроидов на
западе Канады. Стебелек длинный, раковина узкая, с
несколькими кольцами в верхней половине; размноже-
ние не изучено. Независимо от типа томита, это осо-
бый род по орнаменту раковины, но нет уверенности,
что это вермигеммина; на копеподах обитают и пара-
цинеты со сходным типом трофонта.
Сем. Dentacinetidae Batisse, 1992
Раковина рюмковидная, не сплющена, граненая (с
несколькими продольными ребрами); стебелек до по-
ловины длины раковины; ядро овальное. Вместо типич-
ных для текацинет акротенных щупалец на выпуклой
вершине тела прикреплены несколько толстых изви-
тых подвижных щупалец, очень гибких и легко сокра-
тимых — «поисковые щупальца» (Greif-Tentakeln),
встречающихся у немногих видов сукторий. 2 рода с
неясными отличиями здесь объединяются в один род.
Род Dentacineta Jankowski,
1978
Типовой вид Acinetopsis campanuliformis Collin,
1909 с признаками семейства; комменсал на антеннах
морских гарпактикоид Ameira sp. во Франции. На
апексе 6 щупалец, редко 5, неравной длины; при длине
раковины 45—50 мкм расправленное щупальце вытя-
гивается до 100 мкм, сокращается до 35 мкм; стебелек
682
ALVEOLATA
Рис. 337, a. Suctoria.
Ophryodendron sp. с пагурид, Сахалин (Л); Loricodendron («Ophryodendron») hollandei (Б—Г); Ophiyodendron uschakovi (Д—3). (По: Batisse, 1969b (Б—Г); A,
Д—3 — ориг.).
Fig. 337, a. Suctoria.
Ophryodendron sp. from pagurids of Sakhalin (A).
не длиннее 20 мкм; раковина с 6 ребрами и узорчатым
устьем. У этого вида размножение не отмечено.
Dentacinetides collini Batisse, 1992 — типовой вид
рода Dentacinetides Batisse, 1992 со сходной морфоло-
гией трофонта (но ребер больше) и с такими же щу-
пальцами; томит длинный, огурцевидный (не пиявко-
образный), без полосы ресничек, поэтому оба рода
были включены в состав подотряда Ophryodendrina.
Хозяин — панцирь гарпактикоиды Robertogurneya si-
milis (Diosaccidae). Оба вида можно объединить в од-
ном роде (Dentacineta collini Jank., comb. n.).
Сем. Praethecacinetidae Dovgal, 1996
Род Praethecacineta Matthes, 1956
По Аэшт, типовой вид Acineta inclusa Meunier;
по Калю (Kahl, 1934), вид Th. halacari Schulz, 1934
предложен для «Thecacineta inclusa Dons, 1928 nec
Meunier, 1910». Это неточно, Шульц описал вид с
неопределенных клещей — галакарид Германии по
своему материалу как новый и затем отождествил с
ним вид из Норвегии, неправильно определенный
как Th. inclusa. Поэтому тип рода — Thecacineta hala-
cari Schulz, 1933 (Praethecacineta in Matthes, 1956). По
Довгалю (Dovgal, 2002), тип рода P. halacari (Schulz,
1933).
Род спорного положения. Внешне это типичная
Thecacineta с длинным стебельком, вытянутой узкой
раковиной с большим числом кольцевых ребер; длин-
ный стебелек четко отграничен от дна раковины (не те-
костил); трофонт прикреплен несколько расширенной
базальной частью тела к стенке у дна раковины, не
сплющен, несет длинные сократимые щупальца на
всем полусферическом апексе. Отличие от текацинет
по способу размножения и форме томита — вместо
длинных пиявкообразных безресничных томитов об-
разуются огурцевидные почки с длинной полосой тес-
но сближенных кинет и ресничек.
ТИП CILIOPHORA. КЛАСС PHYLLOPHARYNGEA
683
Рис. 337, б. Suctoria.
Prodiscophrya collini (A—Ж); Dendrocometes paradoxus (3, И); Discophrya laccobii (K)\ D. hydroi (JT)', D. stammeri (M). (По: Guilcher, 1951 (Г, Д, E); Matthes,
1988 (K—M'y, Batisse, 1994 (3, И); Foissner et al., 1995 (А—В, Ж)).
Fig. 337, 6. Suctoria.
На Мурмане клещи обычны в прибрежном перифи-
тоне, несут текацинет с гладкой и ребристой ракови-
ной. Поэтому неверно определение Батиссом (Batisse,
1965) вида с гладкой раковиной как Praethecacineta ha-
lacari Schulz; для этого вида мной предложено назва-
ние Lissacineta allgeni, принятое в Traite (Puytorac,
1994). Этот вид, как и настоящая Th. halacari, имеет
короткого томита с большим числом кинет. Довгаль
(Dovgal, 2002) выделяет такие формы в новое сем. Рга-
ethecacinetidae в подклассе Exogenia, оставляя в Theca-
cinetidae только формы с безресничными томитами
(кроме нескольких ресничек на апексе). Отметим
здесь, что раньше не придавали значения типу орна-
мента раковины — в состав Praethecacineta вклю-
чались Th. cothurnioides без ребер, Th. gracilis с ребра-
ми в верхней половине раковины и Th. halacari с боль-
шим числом ребер по всей длине раковины. Предки
вермигеммид неизвестны, поэтому Praethecacineta за-
служивает тщательного повторного изучения как веро-
ятный переходный род от Paracinetidae к вермигем-
минам.
Сем. Nemertodendronidae Jankowski,
1981
Аберрантные формы с вазообразным телом, как у
офриодендрид, и с уникальным среди сукторий типом
щупалец — вместо плоской складчатой ленты с мас-
сой щупалец на вершине имеется группа тонких длин-
ных прямых трубочек с несколькими крючковидными
щупальцами на вершине каждого выроста.
Род Nemertodendron Jankowski,
1978
Типовой вид Ophryodendron prenanti Duboscq,
1925 — редкий морской вид, несколько особей обна-
ружено на немертинах Cephalothrix linearis', на Мурма-
не не встречается на немертинах, но найден на щупи-
ках полихет рода Syllis, добываемых из щелей в камнях
и друз полихет и мидий; единичные особи также в пе-
рифитоне на мшанках, раковинах акмеид. Щупальца
подвижные, сократимые, отходят в группе по 3—5 щу-
684
ALVEOLATA
палец от апекса; ядро извитое, длинное; стебелька нет,
прикрепление диском (ножкой). Томиты массивные,
без соматической цилиатуры.
Сем. Rhabdophryidae Jankowski, 1970
Тело вытянутое, иногда ветвится, раковины нет, то-
миты червеобразные, без цилиатуры. Нет складчатой
ленты в отличие от офриодендрид; щупальца пооди-
ночке, рядами или группами отходят от поверхности
тела. Морские перифитонные виды и симбионты.
Род Rhabdophrya Chatton et Collin, 1910
Типовой видА trimorpha, эпибионт копеподы
Cletodes longicaudatus (Harpacticoida) из тралов у бере-
гов Франции; трофонты рассеяны по всему телу и при-
даткам хозяина.
Особи палочковидные, вытянутые, не сплющены,
покрыты мукозной эпикутикулой; разрозненные не-
многочисленные щупальца не булавовидные — корот-
кие, толстые, с тупой вершиной (пахитены), рассеяны
по телу, вероятно расположены 2 боковыми группами,
не собраны в ряды или пучки. Расположение щупалец
координировано, щупальца одной группы чередуются
со щупальцами противоположного края. Ядро оваль-
ное, стебелек очень короткий (5 мкм) с узким базости-
лом и широким эпиконом. Размножение — отделени-
ем червеобразных томитов у вершины тела.
Род Cucumophrya Kunz, 1936
Типовой вид С. leptomesochrae, морской эпиби-
онтный вид с псаммонной копеподы Leptomesochra
confluens (Harpacticoida), с торакса и абдомена хозяев.
Тело мелкое, вытянутое, плоское, с 4—5 регулярными
вздутиями по всей длине; щупальца расположены
группами по 5—10 в каждой, в рядах, а не в компакт-
ных пучках; группы с обеих сторон тела расположены
на одном уровне, не чередуются; у крупных особей 5
групп щупалец; нет апикальной группы. Ядро эллип-
соидное; стебелек короткий, с широким базодиском.
Стадии размножения не отмечены. Рабдофриид с не-
ветвящимся телом следует отнести к одному из родов
по типу щупалец, в остальном они сходные — щупаль-
ца одиночные у рабдофрий и в рядах у Cucumophrya.
Род Stylogemma Jankowski, 1981
Типовой вид Rhabdophrya wailesi Kahl, 1934
(это название предложено для Podophrya elongata С. et
L., 1859 in Wailes, 1932). Вид P. elongata — пресновод-
ная перифитонная дискофориида, а Вайлес (Wailes,
1932) нашел свой вид на морской батипелагической
копеподе Euchaeta japonica на западе Канады и непра-
вильно определил свой вид.
Трофонты некрупные, с вытянутым лентовидным
телом; щупальца булавовидные, прямые, многочис-
ленные, поодиночке или в небольших пучках, распре-
делены по краям тела, сгущаются в апикальной зоне;
ядро удлиненное; стебелек узкий и длинный, до поло-
вины длины тела. По Вайлесу, вид размножается боко-
выми почками в нижней части тела; показаны 2 таких
почки без ядер и со щупальцами. Это, конечно, не то-
миты, а боковые выросты тела такого же типа, как у
Trophogemma. Вид плохо изучен, неточно зарисован
при малом увеличении, топография щупалец не выяс-
нена (в рядах, полукольцах или поодиночке). У близ-
кого рода Trophogemma нет стебелька и щупальца рас-
положены рядами.
Род Trophogemma Jankowski, 1970
Типовой в и д Г. poljanskii с антенн креветок Spi-
rontocaris arcuata (Hippolytidae) из тралов у о-ва Куна-
шир; сходные формы на других креветках Дальнего
Востока и Мурмана. Артробионты, поселяются на со-
членениях сегментов антенн в зоне щетинок. Трофон-
ты крупные (до 225 мкм), тело пластинчатое, с 11—
13 рядами (не пучками) щупалец — один апикальный
ряд, 4—5 пар латеральных и по одному ряду на верши-
нах актинофоров. Латеральные ряды расположены по-
лудугами, ряды обеих сторон тела чередуются, на вер-
шине массивное непарное щупальце. Щупальца корот-
кие и толстые, как у офриодендрид. У основания тела
2 боковых выроста (актинофоры); червеобразный то-
мит образуется вне связи с ними, тоже у основания
тела. Ядро вытянуто, но не ветвится и не заходит в ак-
тинофоры. Прикрепление коротким широким фиксо-
ном, не стебельком; локализация — на основании ще-
тинок антенн. Род четкий, промежуточный между ро-
дами Rhabdophrya (без актинофоров) и трехветвистым
Dendrosomides, ветви которого произошли от актино-
форов трофогеммы.
Род Stylarcon Jankowski, 1981
Типовой вид Dendrosomides truncatus Dons,
1915; также У nymphonis (Gassovsky, 1916 m Dendroso-
mides') и S. populiformis (Gass., 1916 in Dendrosomides).
Внешний вид как у рабдофрий, боковых актинофоров
нет; тело и ядро вытянутые, прикрепление длинным
стебельком. Щупальца расположены пучками по кра-
ям тела. Обычные обрастатели морских субстратов,
часты на водорослях, гидроидах, мшанках; много в
сублиторали Мурмана. У Каля (Kahl, 1934а, 1934b) эти
виды в составе рода Rhabdophrya.
Род Lecanophryella Dovgal, 1985
Типовой в и д T. paraleptastaci с сегментов тела
пресноводной гарпактикоиды — копеподы морского
происхождения Paraleptastacus spinicauda triseta на
Украине. Тело с коротким стебельком, двуветвистое,
изредка с 3 ветвями; ядро овальное; ветви (актинофо-
ры) толстые, особо расширены у вершины, где несут
многочисленные булавовидные щупальца на всей вер-
шине, не в рядах. Томиты плоские, широкие, с четкой
апикальной присоской. В морском перифитоне род не
ТИП CILIOPHORA. КЛАСС PHYLLOPHARYNGEA
685
встречается. Сходный вид с более длинным стебель-
ком и всегда с 3 ветвями тела, со сходным ядром и
положением апикальных пучков щупалец — Acineta
satyanandani Santhakumari, 1986 (L. satyanandani in
Jankowski, 1992) с тропической морской остракоды
Cypridina dentata в Индии; ядро принято за картину
внутреннего почкования.
Род Dendrosomides Collin, 1905
Типовой в и д £>.paguri — эпибионт пагурид
Eupagurus excavatus и Е. cuanensis, на длинных щетин-
ках торакальных придатков цефалоторакса. Тело при-
чудливой формы — кустовидное, ветвящееся, от ци-
линдрического базального участка вверх и в стороны
поднимаются 3, иногда 4 ветви примерно равной дли-
ны и толщины. Щупальца расположены небольшими
пучками по 2—5 в каждом на вздутиях по краям каж-
дой ветви, чередуются. На схеме Гийше (Guilcher,
1951) щупальца расположены короткими поперечны-
ми рядами, вероятно дуговидными; ветви как бы сег-
ментированы, как и антенны рачков. Ядро ветвистое,
из базальной зоны идут ветви в каждый актинофор.
Длинный томит образуется у основания тела. Род мож-
но вывести от Trophogemma, также с декапод, при
удлинении боковых ветвей и ветвлении ядра. Хоро-
шо описан, с отличными иллюстрациями второй
вид D. grassei Batisse, 1986 с Catapaguroides timidus
(Франция).
Род Rondosomides Jankowski,
1981
Типовой вид Dendrosomides lucicutiae Bowman,
1977 с пелагических каланоидных копепод Lucicutia
gaussiae и L. flavicornis, на сомитах и их придатках.
Трофонты и томиты прикреплены небольшим стебель-
ком; тело ветвится, образует 4—8 боковых ветвей, рас-
ходящихся в стороны от небольшой базальной части.
Щупальца тонкие, булавовидные, расположены полу-
кольцевыми рядами по ходу каждой ветви, с массив-
ным пучком на апексе. Ядро округлое, не ветвится.
В принципе это вид рода Dendrosomides, но если у пе-
ритрих различие формы ядра имеет значение на уров-
не родов, у гетеротрих на уровне подродов, то можно
выделить род или хотя бы подрод Rondosomides для
данного вида.
Сем. Lecanophryidae Jankowski,
1978
Поскольку Lecanophrya в каталоге Аэшт объявлена
nomen nudum, как род без указания типового вида,
здесь дается новое название — Collinophryidae пот. п.
Тело короткое, широкое, на небольшом фиксоне в
виде ножки или короткого стебелька, не ветвится, без
боковых актинофоров; щупальца расположены рядами
на вершине тела, обычно в небольшой полости. Томи-
ты длинные, червеобразные, без цилиатуры. Облигат-
ные симбионты морских ракообразных.
Род Vostonica Jankowski, 1994
Типовой вид К tenax с сомитов псаммонных ко-
пепод Cylindropsyllus sp. (Harpacticoida) в Японском
море. Мелкий вид с плоским широким телом, прикреп-
лен непрочным складчатым стебельком с тонкими
стенками; ядро овальное; вершина тела разрастается в
обе стороны, оба выроста и апекс несут ряды коротких
толстых несократимых щупалец; у вершины тела ваку-
оль и 2 симметричных выроста панциря. Томиты длин-
ные, узкие, с небольшой апикальной присоской.
Род Spinarcon Jankowski, 1981
Типовой вид 5. antennaris с антенн гаммарид
Мурмана (Gammarus oceanicus, G. setosus) и на высо-
коширотном арктическом криофильном рачке G. wil-
kitzkii. Тело колокольчатое, без раковины, с неболь-
шим аморфным фиксоном; щупальца в 10—15 рядах
на дуговидном валике, окаймляющем широкую ско-
шенную площадку, по 5—7 щупалец в каждом. Щу-
пальца не булавовидные, короткие и толстые, как у
части рабдофриид. Ядро небольшое, не ветвится. Осо-
би локализованы на основании каждого членика ан-
тенны, прикреплены к сегментам, не к щетинкам (арт-
робионты). В материале с о-ва Беринга новый вид рода
с длинным ядром найден на антеннах капреллид —
аберрантных амфипод с водорослей.
Род Lecanophrya Kahl, 1934
По Аэшт, Каль (Kahl, 1934а, 1934b) предложил род
для 3 видов без указания типового вида, поэтому родо-
вое название — nomen nudum; синоним — Collinoph-
rya-, поскольку тип рода L. drosera Kahl, 1934 указан
мной, род приводится в списке Аэшт как валидный —
Lecanophrya Jankowski, 1994. Аэшт права и в то же
время ошибается. Род Collinophrya Kahl, 1934 моноти-
пичен, поэтому сейчас это уже не синоним, а валидное
название для замены рода Lecanophrya Kahl, 1934, ко-
торый уходит в синонимику.
Первоначально в состав Lecanophrya включены
виды L. drosera Kahl, 1934 (с антенн гарпактицид Ni-
tocra typica); L. crassimarginata Kahl, 1934 (с антенн
неопределенных гарпактикоидных копепод) и L. trun-
cata (Acineta in Collin, 1909) с копепод Ameira sp., под
вопросом в виде приложения к данному роду. Одно-
временно описан новый род Collinophrya с типовым
видом С. dimorpha; вид встречен на одном хозяине (Ni-
tocra typica) совместно с чаще встречающейся L. drose-
ra. Отмечены формы f. discifera и f. tentaculifera, по
Калю, фазы развития одного вида.
Сейчас ясно, что все это лишь стадии развития
томитов в цикле L. drosera. Поэтому если род Leca-
nophrya признан невалидным, нужно воспользовать-
ся доступным названием Collinophrya. В состав рода
кроме типового вида С. dimorpha (=С. drosera
comb, п.) входят С. crassimarginata comb. п. и C. trun-
cata comb. n.
Типичная Collinophrya — мелкая форма с коло-
кольчатым телом, округлым ядром, со щупальцами
686
ALVEOLATA
разной длины в дугах вдоль края апекса и на внутрен-
ней стенке полости, всего видно 3—5 полуколец (вали-
ков) со щупальцами. Томит узкий, длиннее тела то-
монта, с апикальной присоской, расположен на антен-
нах; после долгого ожидания, если не удается перейти
на новую особь хозяина, томит сокращается и превра-
щается в трофонта. Поэтому на антеннах рачков мож-
но найти все стадии развития (томитогенез и метамор-
фоз прикрепленного томита), принятые Калем за раз-
ные формы, виды и роды сукторий. У гидроидов роды,
описанные и названные только по стадии медуз без
знания сидячих гидроидов, считаются валидными (на-
пример, пелагическая медуза Proboscidactyla и симби-
онтный гидроид Lar на устье трубок полихет — это
один вид), поэтому не может быть возражений против
валидации «личиночного» рода Collinophrya. Сукто-
рия Enchelyomorpha — тоже личиночный род, описан
по мигрантам, трофонтов нашли лишь недавно.
Сем. Spelaeophryidae Jankowski
in Batisse, 1975
Тело вытянутое, слегка сплющено, плавно расши-
ряется к вершине, где несет апикальный пучок много-
численных щупалец; ядро вытянутое, не ветвится;
прикрепление полураковиной (семитекой) — нижний
конец тела погружен в прочную воронку, приклеен-
ную одной стороной к субстрату. Симбионты пресно-
водных креветок морского происхождения, локализо-
ваны только на сегментах антенн.
Род Spelaeophrya Stammer, 1935
Типовой вид 5. troglocaridis с антенн креветок
Troglocaris schmidti (сем. Atyidae) из пещер Югосла-
вии, богатых морскими реликтами; встречаются толь-
ко на щупике обеих антенн, иногда в массе. Тело коло-
кольчатое, прикреплено утолщенным кортексом без
стебелька; на вершине масса тонких щупалец булаво-
видного типа, но извитых.
Раньше такой же вид был описан как Solenophrya
polypoides Daday, 1910с антенн креветок Caridina wyc-
kii в восточной Африке; фиксон не зарисован, в осталь-
ном вид такого же типа, как и S. troglocaridis', впервые
показано отделение толстого червеобразного томита.
Род Solenophrya по диагнозу типового вида — обитате-
ли пресноводного перифитона, это дискофрииды. По-
скольку заметных различий с S. troglocaridis нет, аф-
риканский вид считался синонимом типового, и в си-
нонимику сводили также виды из Японии, что очень
сомнительно; вероятно, эти виды специфичные, но ви-
довые различия незначительные и пока не выявлены.
Маттес (Matthes, 1988) приводит вид как Spelaeophrya
polypoides (Daday, 1910) Matthes, 1962.
В Югославии описали вид с тем же названием —
Spelaeophrya polypoides Hadzi, 1940 с антенн кревет-
ки Atyaephyra desmarestii из наземного озера, не трог-
лофилов; вид сравнивался только с S. troglocaridis.
Описание очень подробное, богато иллюстриро-
вано, но видовое название (гомоним) позже заменено
не было, поскольку вид считался синонимом вида из
Африки. Здесь оно заменяется новым — Spelaeophrya
doiranica nom. n. (=5. polypoides Hadzi, 1940 nec Daday,
1910).
Род Hydranthosoma Miyashita, 1933
Аэшт не нашла первоисточник и упоминает лишь
цитирование этого названия у Корлисса (Corliss, 1979)
как синоним рода Spelaeophrya. Вид с антенн пресно-
водной (не пещерной) креветки Xiphocaridina sp. в
Японии был подробно описан только под новым родо-
вым названием Hydranthosoma без латинского назва-
ния вида; позже этот вид изучили вновь, название Hyd-
ranthosoma как непригодное было отвергнуто и за-
менено новым — Hydrophiya Nozawa, 1938 с типовым
видом Н. miyashitai, хотя можно было сохранить
название рода для нового вида, как в случае с валид-
ным родом Endosphaera, тип которого был описан
без латинского названия и позже был назван Е. engel-
manni.
Тело вытянутое, с длинным ядром, несколькими
вакуолями, вершина тела с толстыми прямыми щу-
пальцами (не булавовидными, как по ошибке рисовали
раньше у спелеофриид). Прикрепление трофонтов се-
митекой, у томитов ее нет.
Род Spathocyathus Nie et Lu, 1945
Типовой вид 5. caridinae с озерных креветок
Caridina sp. в Китае. Трофонты стандартной морфо-
логии, но с более крупной семитекой, чем у назван-
ных выше видов, достигающей половины высоты
тела трофонтов. Поэтому Маттес (Matthes, 1988) не-
прав, сводя этот вид и вид из Японии в синонимы
S. polypoides. Размножение червеобразными томита-
ми. Щупальца в двойном кольце по периферии расши-
ренного апекса, прямые, направлены вбок в наружном
кольце и вверх во внутреннем. К сожалению, точная
топография щупалец при виде особи сверху у спе-
леофрий не изучалась, и данные о типе щупалец про-
тиворечивые.
Сем. Stylostomatidae Batisse, 1975
Тело с выростами, несущими щупальца; семитеки у
основания тела нет; прикрепление обычно коротким
стебельком.
Род Asterifer Jankowski, 1967
Типовой вид Ophryodendron faurei Guilcher,
1950 с цефалоторакса и антенн морской копеподы Psa-
mathe (=Scutellidium) longicauda во Франции. Посколь-
ку род предложен в тезисах и поэтому невалиден, то
же название предлагается вновь — Asterifer gen. n. —
с указанным типовым видом.
Тело цилиндрическое, не сплющено, с овальным
ядром и коротким массивным стебельком; вершина
тела превращена в розетку с 6 актинофорами, направ-
ТИП CILIOPHORA. КЛАСС PHYLLOPHARYNGEA
687
ленными во все стороны от апекса; на вершине вырос-
тов по одному ряду коротких, вероятно несократимых
булавовидных щупалец; каналы их соединяются в
длинный общий пучок по оси тела. Томиты очень
длинные и узкие, также на коротком широком сте-
бельке, с вытянутым ядром и небольшим мукроном
(расширением вершины). Нет сократимой складчатой
ленты актинофора, поэтому вид не только не отно-
сится к Ophryodendron, но по строению тела не имеет
аналогий у вермигеммид и заслуживает самостоятель-
ного семейства. По Аэшт, род не принят Маттесом; но
ведущий специалист по морским сукториям Батисс
считает род валидным в главе о сукториях в Traite (Ba-
tisse, 1994).
Род Hastarcon Jankowski, 1981
Типовой вид Н. islandicus с сомитов неопреде-
ленной траловой амфиподы на Мурмане; на рачках,
сохраненных как ксенотипы для определения, найде-
ны все стадии развития — длинные томиты с мукро-
ном и трофонты с относительно длинным широким
стебельком, вытянутым ядром и серией коротких ру-
ковидных выростов, несущих на вершине толстые ко-
роткие прямые несократимые щупальца. В сущности
это видоизмененная Rhabdophrya с боковыми вы-
ростами тела. Ядро не ветвится и не заходит в эти ак-
тинофоры.
Род Crevicometes Jankowski, 1981
Типовой вид С. murmanicus с жабр прибрежных
креветок Spirontocaris arcuatus Мурмана. Тело оваль-
ное, растянуто в стороны, невысокое, прочно прилега-
ет к субстрату; у отделенных от жабр особей можно
увидеть небольшой фиксон (ножку), тело не приклее-
но всей нижней частью. От тела вбок отходит один
крупный вырост, несущий на вершине кольцо корот-
ких толстых несократимых щупалец рабдофриидного
типа (пахитены); такие же щупальца покрывают вер-
шину тела и 1—3 щупальца иногда встречаются на
стволе актинофора. Кортикальный панцирь прочный,
как обычно у вермигеммид, остается на субстрате при
гибели особи. Фактически это адаптация к обитанию в
узких промежутках тесно сближенных жаберных плас-
тинок креветок; изменена форма тела, уменьшены раз-
меры, отсутствует стебелек.
Род Leboransia Dovgal, 2003
Типовой вид Ophryodendron mysidacii Fernan-
dez-Leborans et Tato-Porto, 2002 с покровов тела и при-
датков морских мизид Schistomysis parkei в Испании;
такие же формы найдены мною на стайных береговых
мизидах в Японском море и на пелагических острако-
дах. Род Ophryodendron долгое время понимали в
очень широком смысле, для форм с разным строением
трофонта, разным типом актинофоров и щупалец, но
всегда с червеобразными томитами; сейчас это лишь
суктории со складчатым лентовидным актинофором,
которого нет у симбионтов мизид. Авторы описывают
2 формы вида, но явно имеются 2 вида с разной морфо-
логией, вазообразные с узкой ножкой (щупальца
высоко подняты над субстратом) и мешковидные, при-
клеенные к субстрату широким основанием. Нужно
четко указать поэтому, к какой форме относится назва-
ние типа — только к вазообразной; широкая форма
здесь обозначается как Leboransia expansa sp. п. На ми-
зидах у биостанции Восток найдена только вазообраз-
ная форма, это также аргумент в пользу валидности
нового вида; по морфологии L. -expansa может быть ти-
пом нового рода, но нужно повторное изучение этих
симбионтов. У обеих форм щупальца расположены на
вершине нескольких очень коротких бугорковидных
актинофоров; щупальца короткие, прочные, прямые,
рабдофриидного типа.
Род Stylostoma Milne, 1886
Типовой вид 5. forrestii Milne, 1886 по моноти-
пии. По Аэшт, «Янковский неправильно цитировал
Acineta trinacria Gruber, 1884 как типовой вид»; но вид
Мильне невалиден как синоним, еще в старинной ра-
боте Коллена (Collin, 1912) он был сведен в синоними-
ку вида Acineta trinacria Gruber, 1884 {Ophryodendron
trinacrium in Collin, 1912) и никем не признавался, поэ-
тому формально тип рода S. forrestii, а фактически
5. trinacria. Описывая новый вид и род с «Cyclops sp.»
в Англии, автор рода не знал литературу; оба этих вида
идентичные, хозяин — не циклопы, которых нет в
море, а гарпактикоиды рода Tisbe, самый обычный вид
морских копепод, местами массовый на гниющих
водорослях. Вид Acineta trinacria позже находили на
гарпактикоидной копеподе Tisbefurcata и на неопреде-
ленных копеподах в Италии, Германии, у берегов
Гренландии; название 5. forrestii никем не было при-
нято.
Тело веретеновидное, вытянутое, прикреплено ши-
роким стебельком; ядро удлиненное, не ветвится; к
вершине тело сужается, и от апекса отходят радиально
3 массивных актинофора с большим числом несокра-
тимых коротких щупалец на вершине. На Мурмане на
разных видах Tisbe обитают 2 вида Stylostoma, один из
которых будет описан как новый, а для 5. trinacria бу-
дет выделен неотип.
Род Thisarcon Jankowski, 1981
Типовой вид Ophryodendron conicum Schroder,
1907 с ног копепод в коллекциях из Антарктики; стебе-
лек длинный, тело вазообразное, широкое, ядро из-
витое. У Stylostoma 3 актинофора отходят радиально
почти от одной точки — от узкого апекса, а у Thisarcon
передняя часть тела резко расширена, длинные парал-
лельные актинофоры отходят по периферии этой пло-
щадки, разрознены. Если найдутся промежуточные
формы, можно снизить ранг до подрода. При осмотре
траловой гаммариды Paramoera walkeri из Антарктики
мною найдено много сукторий такого типа, как Т. coni-
сит, видовые отличия пока не установлены. Возмож-
но, вид неспецифичен для копепод.
688 ALVEOLATA
Сем. Ophryodendridae Stein,
1867
У большинства видов тело вазообразное, подня-
то над субстратом, иногда стебельчатое; раковина,
как исключение, имеется только у одного вида (род Lo-
ricodendrori). Вершина тела с одним или несколь-
кими актинофорами в виде длинной плоской по-
перечно-складчатой ленты, вершина которой усеяна
короткими толстыми щупальцами; лента подвижная,
может сокращаться и распрямляться, изгибается и от-
клоняется в стороны. Пресноводных видов нет, в море
заселен перифитон (Corethria), но чаще встречаются
облигатно-симбионтные виды на полихетах, клещах,
ракообразных, иглокожих, т. е. на видах с прочным
панцирем.
Род Corethria Wright, 1859
Типовой вид С. sertulariae. Обычный обраста-
тель на гидроидах, камнях, раковинах моллюсков на
Мурмане; часть находок на животных, например на
пантоподах и декаподах, может относиться к этому
виду, но другие виды (с клещей, капрелл) специфич-
ные.
В каталоге Аэшт род невалиден как синоним рода
Ophryodendron, но роды четко отличаются по форме
тела — высокое вазообразное у второго рода и низкое,
распластанное по субстрату у Corethria. Род Ophryo-
dendron по-прежнему принимается сейчас в очень ши-
роком смысле, род сборный, не делится на подроды.
Типичная Corethria — плоская дисковидная форма с
ветвистым ядром, широким основанием, прочно при-
клеенная к субстрату; от края тела отходит очень длин-
ный гибкий подвижный актинофор; томиты образуют-
ся на верхней стороне. Среди офриодендрид нет видов
с ресничными томитами. Томиты малоподвижные, не
уходят далеко от томонта, и часто на субстрате видны
группы тесно сближенных трофонтов.
Род Corethria никем не признавался валидным; сам
автор рода признал свой род и вид как синонимы опи-
санного в тот же год вида О. abietinum, хотя они резко
различаются по вешнему облику и способу прикрепле-
ния. В монографии сукторий Коллена (Collin, 1912)
род также не признается, но вид считается валидным.
Описывались и изображались внутренние томиты, вы-
ходящие из тела после эндопалинтомии томонта в
виде ресничных мигрантов; возможно, это неизучен-
ные эндопаразиты. Коллен также изображает крупную
сферу с ядром, считая это «первичной эмбриональной
массой»; внутренняя закладка томита у вермигеммин
пока неизвестна.
О. halacaridis Dons, 1943 — вид рода Corethria
(С. halacaridis comb, п.), обычен на клещах Мурмана.
О. porcellanum Kent, 1882 с аномур (крабоидов) Porcel-
lanaplatycheles, вероятно также вид коретрий — Coret-
hria porcellanum comb. п. Я имею большой материал по
Corethria sp. на фиксированных крабоидах с о-ва Бе-
ринга, это неспецифические обрастатели на панцире
хозяев; подробное описдйие готовится для журнала
Zootaxa.
Род Ophryodendron Claparede
et Lachmann, 1859
Типовой вид О. abietinum; синонимы, по Аэшт,
Asterifer, Corethria, Euophryodendron, Loricodendron,
Proophryodendron. Такая синонимия вызвана лишь
тем, что род понимается до сих пор в очень широком
смысле — практически это любые виды с сократи-
мым лентовидным складчатым актинофором и даже
без него (Asterifer). Род Loricodendron предложен для
единственного раковинного вида вермигеммин и при-
знан валидным автором вида Батиссом (Batisse, 1994).
Corethria распластана по субстрату в виде широкого
диска, не вазообразная (так отличаются раковины у пе-
ритрих Platycola и Cothurnia). 2 других названных
выше синонима рассматриваются ниже.
Тип рода О. abietinum — обычный перифитонный
морской вид; как и Corethria, его легче всего найти на
кустистых гидроидах типа Halecium, Sertularia, Clyt-
hia, Obelia, Campanularia в сублиторали и в тралах на
небольших глубинах. Тело высокое, вазообразное, су-
жается к основанию; от апикальной ямки отходит один
актинофор с пучком щупалец на вершине; каналы щу-
палец сходятся в единый осевой пучок, идущий по
всей длине актинофора; ядро ветвистое. Стебелька
нет, прикрепление диском, вероятно соответствую-
щим базодиску у стебельчатых цилиат. Томит массив-
ный, прикреплен временным стебельком — тонким
игольчатым стержнем, вдающимся глубоко в тело; при
морфогенезе он теряется. И у этого вида находили по-
движных внутренних ресничных мигрантов (неизвест-
ных эндопаразитов?); в моем материале с Мурмана
их нет.
К роду можно отнести немного валидных видов.
О. belgicum Fraipont, 1878 близок к типовому виду или,
по ряду авторов, идентичен с ним; О. stellatum Wailes,
1925 с полихет Syllis armillaris — типичный офриоден-
дрон. С полихет Антарктики Harmothoe spinosa описан
вид О. uschakovi Jankowski et Awerinzew, 1972 с систе-
мой каналов в цитоплазме, вероятно заполненных сим-
бионтными бактериями. Из состава рода исключаются
виды со стебельком, раковиной, ветвящимся актино-
фором или с полимеризацией актинофоров, и род
впервые получает четкую характеристику. О. annula-
torum De Saint Joseph, 1886 с различных полихет Фран-
ции соответствует диагнозу рода.
Коллен (Collin, 1912) предложил разделить сбор-
ный полиморфный род Ophryodendron sensu lato на 2
«секции» (не роды) — Pro-Ophryodendron (для про-
стых видов с несократимыми выростами тела — акти-
нофорами) и «подрод» Eu-Ophryodendron с длинной
сократимой лентой; виды с несколькими такими лен-
тами являются промежуточным звеном между обеими
группами. Типовые виды для обеих групп не указаны.
В каталоге Аэшт группы признаны синонимом рода
Ophryodendron; после Коллена они никем не признава-
лись. В данной сводке обе «секции» не считаются так-
сономически валидными. Чтобы не допустить их вос-
становления, я объявляю типовым видом подрода или
рода Eu-Ophryodendron вид Ophryodendron abietinum
Claparede et Lachmann, 1859, и названный таксон ухо-
дит в синонимику валидного рода Ophryodendron С.
ТИП CILIOPHORA. КЛАСС PHYLLOPHARYNGEA
689
et L., 1859. Типом подрода или рода Pro-Ophryodend-
ron я объявляю вид Stylostoma forrestii Milne, 1886, и
названный таксон уходит в синонимику рода Stylosto-
ma Milne, 1886.
Род Loricodendron Jankowski, 1973
Типовой вид Ophryodendron hollandei Batisse,
1969 с копепод группы Harpacticoida — Rhynchothales-
tris rufocincta. По Аэшт, это «синоним рода Ophryoden-
dron по мнению Маттеса», который его не изучал и во-
обще не имел опыта работы с морскими сукториями;
род принят автором вида Батиссом (Batisse, 1994), и
отделение раковинной формы от безраковинных ка-
жется логичным и должно быть обязательным прави-
лом для всех групп цилиат.
Трофонты массивные, мешковидные, прикреплены
ко дну раковины широким основанием, без стебелька;
ядро почти кольцевое, много микронуклеусов; массив-
ный актинофор отходит от ямки на апексе. Раковина
обширная, вздутая, с широким устьем и основанием.
В цитоплазме трофонтов — каналы с бактериями;
часть их сохраняется при почковании у червеобразно-
го томита и при морфогенезе передается трофонту.
Пока неизвестно, служат ли они дополнительным ис-
точником пищи, как у Kentrophoros. Такие же зерни-
стые каналы в толще всего тела имеет вид офриоденд-
рид из Антарктики О. uschakovi, и изучение этого уни-
кального симбиоза, оставшегося незамеченным,
должно стать темой специального исследования.
Род Setarcon Jankowski, 1981
Типовой вид Ophryodendron pedicellatum
l lincks, 1873 из обрастаний гидроидов. Тело чашевид-
ное, короткое и широкое, с одним актинофором, отхо-
дящим от дна вогнутого апекса. У особей О. abietinum,
встречающихся на гидроидах одновременно с О. pedi-
cellatum, томиты сходные, прикреплены тонким иголь-
чатым стебельком; у О. abietinum он теряется у мас-
сивного вазообразного трофонта, прикрепленного ши-
роким основанием, а у О. pedicellatum сохраняется при
морфогенезе, в группе томитов и трофонтов все клетки
прикреплены на тонких изогнутых стебельках равной
длины. Валидность рода зависит от правильности пер-
воописания и рисунков вида; позже он не был найден,
но возможно вид О. pedunculatum Koch, 1876 (Setarcon
pedunculatum comb, n.) принадлежит к этому роду, как
считали и ранние авторы. Род Setarcon должен вклю-
чать стебельчатых офриодендрид со стебельком и од-
ним актинофором.
Род Isopodarcon Jankowski, 1981
Типовой вид Ophryodendron multicapitatum
Kent, 1882 с панциря изопод родов Миппа, Idothea и на
неопределенных видах в западной Европе. Осмотр
•пих и других изопод в морях России не выявил вида,
но сходные формы обычны на полихетах рода Нагто-
thoe. Трофонт вазообразный, расширен к вершине,
прикреплен прочным прямым стебельком; на вершине
1—4 сходных актинофоров, по краю апекса образуют-
ся томиты, иногда несколько сразу, вначале круглые,
далее удлиняются, становятся червеобразными и упол-
зают с томонта. Типовой вид наблюдался 3 авторами,
нет сомнений в правильности первоописания и рисун-
ка Кента.
Род Vinarcon Jankowski, 1981
Типовой вид V. asteris с морских звезд Asterias
rubens на Мурмане. Внешний облик типичен для вы-
сших офриодендрид — тело вытянутое, вазообразное,
с одним плоским актинофором, несущим щупальца на
вершине и краях трубки; родовой признак — отсутст-
вие полимеризации актинофоров, наличие прочного
стебелька, наличие ампулы в фиксаторной зоне —
уникальное явление среди офриодендрид. Тип рода
Ophryodendron (О. abietinum) имеет прикрепительную
подошву без ампулы.
Род Elitarcon Jankowski, 1981
Типовой видЕ1. harmothois с полихетHarmothoe
imbricata (Aphroditidae) на литорали Мурмана. По все-
му телу в зонах параподий хозяев рассеяны группы
трофонтов с вазообразным телом, всегда без стебель-
ка, со складками кортекса снизу; прикрепленные осо-
би наклонены к субстрату под углом и эта сторона смя-
тая и складчатая. На вершине тела несколько актино-
форов, обычно равной длины, т. е. они образуются при
морфогенезе одновременно, а не один за другим. Ядро
извитое, лентовидное. При отделении особей от субст-
рата незаметен специальный фиксон.
Род Syllarcon Jankowski, 1981
Типовой вид 5. draconematis с крупных бентос-
ных нематод Draconema sp. типа D. cephalatum на
Мурмане. Вероятно, поселение на этих нематодах слу-
чайное, вид никогда не был найден позже при специ-
альном осмотре многих сотен нематод этого и других
родов. Возможно, это перифитонный вид Ophryodend-
ron belgicum Fraipont, 1878, в таком случае 5. dracone-
matis — синоним. Размеры трофонтов некрупные, тело
вазообразное, без стебелька, с одним тонким актино-
фором, несущим на вершине апикальную розетку все-
го с 2—6, обычно с 3—5 щупальцами; то же изображено
и у О. belgicum, поэтому мнение ряда авторов об иден-
тичности О. abietinum (с массой щупалец на краях тол-
стого актинофора) и 5. belgicum comb. п. не оправдано.
Род Schizactinia Jankowski, 1967
Типовой вид Ophryodendron multiramosum Wen-
zel, 1961 (не Wetzel, 1953, как ошибочно указано в ори-
гинале и повторено в каталоге Аэшт). Аэшт считает
название валидным, но, вероятно, не видела первоис-
точник — это тезисы конференции, а все роды в тези-
Ы Зак. №4163
690
ALVEOLATA
сах, по Аэшт, невалидные. Поэтому род предлагается
здесь вторично — Schizactinia Jankowski gen. п., типо-
вой вид S. multiramosa comb. n.
При осмотре многих видов губок в Италии отмети-
ли ряд обычных подвижных цилиат и единственного
специфического симбионта, сукторию О. multiramo-
sum, вероятно питающуюся клетками губок Adocia si-
mulans из тралов с глубины 30 м; найдены лишь 3 осо-
би, на других губках их нет. Тело вазообразное, с не-
большим сужением базальной части (псевдостилом);
вероятно, нет стебелька. Вершина тела с неправильны-
ми выростами и одним осевым актинофором; у верши-
ны актинофор не цельный, как у всех других родов, а
расщеплен на мелкие ветви, с 1—5 щупальцами каж-
дая. Ядро сложного контура. Валидность рода зависит
от правильности описания вида, особенно основного
признака рода — ветвления вершины актинофора; в
морях России он не был найден.
Род Stylophryodendron Jankowski, 1978
Типовой вид Ophryodendron roscoffensis Batisse
et Dragesco, 1967. Симбионт амфипод Leucothoe spini-
carpa с губок Halichondria sp. и Hymeniacidon sangui-
nea во Франции. Тело вазообразное, с прочным корот-
ким стебельком и широкой вершиной, где один за дру-
гим отделяются мелкие томиты; в середине апекса —
основание актинофора, иногда с мелким придаточным
актинофором. Ядро сетевидное; тело заполнено систе-
мой каналов (тубул) с симбионтными бактериями.
Род Pleurophryodendron Jankowski, 1978
Типовой вид Ophryodendron reversum Collin,
1909, симбионт на каудальной фурке и абдомене гар-
пактикоидной копеподы Ameira sp. (вместе с видами
Stylostoma и Acinetopsis). Прикрепление тонким изви-
тым стебельком; томит на панцире образует мелкий
фиксон в ожидании нового хозяина; если контакта и
перехода нет, начинается морфогенез, образуется от-
носительно длинный изогнутый стебелек и затем то-
мит превращается в короткого чашевидного трофонта.
Сохраняется также и овальная форма ядра, что нети-
пично для офриодендрид. Новый томит образуется на
дне глубокой полости, как у сумчатых хонотрих. Спо-
соб размножения и простое ядро — отличительные
признаки рода.
Род Spongiarcon Jankowski, 1981
Типовой вид Ophryodendron variabilis Gruber,
1884. Грубер нашел 2 особи в осадке с неизвестного
хозяина в море у Генуи; вид вторично найден мной
при осмотре корковых губок Halichondria ратсеа, по-
крывающих валуны в зоне прибоя и отливов на лито-
рали и в верхней сублиторали скалистых берегов на
Мурмане. Местами на покровах губок видны сгустки
из десятков трофонтов. Это очень изменчивый вид по
облику трофонтов, тело всевозможной формы, с не-
правильными отростками, с одним небольшим актино-
фором, несущим немного щупалец на вершине. Мас-
сивного стебелька нет, вместо него для прикрепления
к рыхлым тканям губок в зоне прибоя служат тонкие
игольчатые стебельки личиночного типа, как у томитов
других офриодендрид; 1—4 таких стебельков заякори-
вают особь на хозяине. Ядро от вытянутого до ветви-
стого, также неправильной формы, как и контуры тела.
Система каналов с бактериями не обнаружена.
Отряд Podophryida Jankowski, 1967
(рис. 335, а, б)
Небольшая группа родов с наиболее простым ти-
пом размножения — равное деление (изотомия) или с
небольшой разницей в размерах (анизотомия), но не с
почкованием и диморфизмом; безресничные кине-
тосомы дают крупный зачаток цилиатуры, и к концу
деления мигрант имеет ресничные ряды, обычно про-
дольные, в 2 группах, и подвижные реснички. Возмож-
но превращение особи без деления в крупного мигран-
та с такой же цилиатурой, как у нормальных томитов.
Тело сферическое, щупальца тонкие, булавовидные
(акротены по моей терминологии) — наиболее частый
тип щупалец у сукторий, рассеяны в беспорядке по
телу. Питание хищное, при этом у части видов или рас
имеется предпочтение к определенному виду цилиат;
это привело к специфическому паразитизму. Свобод-
ные трофонты ловят проплывающую добычу, остава-
ясь на месте; у паразитов мелкие ресничные мигранты
плавают часами и прикрепляются при случайном кон-
такте к своему виду хозяина, сбрасывают реснички,
ряды кинетосом дезорганизуются, щупальца резко
укорачиваются, трофонт растет и приступает к делению;
одна из дочерних форм (более мелкая) покидает пара-
зитарную камеру и уплывает на поиск нового хозяина.
В жизненном цикле есть стадия цисты размноже-
ния (у части свободных подофрий) и цисты покоя, с
кольцевыми ребрами стенки и коротким массивным
стебельком. Возможно, этой стадии нет у сферофрий,
рода с неясными границами и совершенно неизучен-
ным типовым видом. Виды семейства распространены
в пресной воде, в почве, террофитоне, во временных
водоемах, где могут быть массовыми при наличии дру-
гих цилиат; в море только род Parapodophrya. Часть
видов подофрий встречается в засоленных почвах.
Сем. Podophryidae Butschli, 1889
Щупальца — типичные акротены, без утолщения в
базальной части, сохраняются прямыми при фиксации
формалином, изогнуты в смеси Буэна (поэтому на ри-
сунках у импрегнированных протарголом особей щу-
пальца извитые). Томиты и тотальные мигранты с про-
дольными рядами кинетосом и ресничек.
Род Orcula Weisse, 1846
Типовой вид О. trochus — гомоним и синоним
рода Podophrya', по общему мнению всех авторов, это
циста неопределенного вида подофрий, возможно наи-
ТИП CILIOPHORA. КЛАСС PHYLLOPHARYNGEA
691
более частого вида Р. fixa. Это родовое название нель-
зя использовать как подродовое или родовое при дроб-
лении рода.
Род Podophrya Ehrenberg, 1834
Типовой вид Trichodafixa Muller, 1786 по моно-
типии. Вид част в пробах бентоса, хорошо изучен; тро-
фонты быстро инцистируются, переносят долгое высу-
шивание, поэтому вид обычен во временных водоемах,
лужах, особенно с цианофитами. Он легко культиви-
руется в лаборатории на кольпидиях и тетрахименах.
Подофрии очень легко импрегнируются на сухих маз-
ках и влажным методом Шаттона, поэтому хорошо
изучен кинетом, аргиром и морфогенез цилиатуры в
жизненном цикле.
Трофонты сферические, с длинным тонким проч-
ным стебельком, округлым ядром и одной вакуолью (у
одного вида 2 вакуоли); многочисленные щупальца
равномерно распределены по всей поверхности тела.
Импрегнация выявляет сеть аргирома с множеством
мелких ячеек и аргиросом, вероятно, это безресничные
кинетосомы, рассеянные по телу. Задолго до видимого
деления у сферических трофотомонтов появляется за-
чаток ресничной полосы, которая быстро растет по
мере перешнуровки особи. Обычно имеется 7 или 8 ки-
нет (число рядов — важный видовой признак), кото-
рые легко сосчитать только в компактной полосе у де-
лящихся форм; далее кинетосомы и кинеты мигранта
расходятся, ряды огибают тело в виде краевого кольца,
четкость теряется.
Цисты бочонковидные, оболочка очень толстая, с
апикальной пробкой и высокими поперечными коль-
цевыми ребрами. Число ребер варьирует у разных рас,
и вид может быть надвидом, группой трудно различи-
мых реальных видов; встречаются расы с 4, 5 и 6 реб-
рами, причем можно найти изолированные популяции
в мелких лужах, в каждой из которых число ребер цис-
ты одинаковое, но отличается от другой популяции.
Отмечалось деление в цистах перед эксцистированием
на 2 или 4 томита, но могут выходить и неделящиеся
особи. Интересен диморфизм стебелька — равномерно
тонкий, игольчатый у трофонтов и широкий кониче-
ский у цист; такого диморфизма нет у других сидячих
цилиат.
Находки вида в море — ошибка, особи не пере-
носят солености. Находки на циклопах и других рач-
ках случайны, или это неправильное определение
внешне сходных мелких токофрий, у которых на ран-
них стадиях расположение щупалец равномерное, не
в пучках.
P.fixa var. algiriensis Maupas, 1876 — вероятный
синоним вида Р. libera.
У вида Р. bengalensis Ghosh, 1929 нет важных отли-
чий от типового вида.
P.fallax Dingfelder, 1962 — реальный вид с макси-
мальным числом кинет томита (12—15) и особо длин-
ным стебельком; цисты с 12 ребрами. Вид повторно
найден мной в луже с цианофитами в Алуште; под по-
кровным стеклом трофонты быстро превращаются в
крупных мигрантов, широкая полоса кинет делит тело
на 2 части, поэтому положение щупалец неравномер-
ное; число щупалец очень велико, до 80; стебелек не
исчерчен, гомогенный в отличие от первоописания.
Описание и рисунки «P.fixa» книге Пенарда (Penard,
1920) относятся к этому виду.
Р. halophila Kahl, 1933 — реальный вид, выносит
осолонение, подробно изучен при импрегнации про-
тарголом. Томит с 6 кинетами, циста с 12—13 ребра-
ми, трофонт часто теряет стебелек, Трофонты стебель-
чатые, циста как у P.fixa, томит с 4 продольными крае-
выми кинетами. Подробное переописание из почвы в
Австрии (Foissner, 2004).
Р. libera Perty, 1852 — трофонты обычно без сте-
белька, циста с 10—11 ребрами.
Р. maupasi Butschli, 1889 — солоноватоводный вид
с мукозной оболочкой по всему телу; цисты без коль-
цевых ребер.
Р. sandi Collin, 1911 — вид с большим числом щу-
палец и примерно 10 кинетами томита.
Р. tristriata Foissner, Agatha, Berger, 2002 — из поч-
вы в Австралии; трофонты без стебелька, циста с ко-
ротким стебельком; томит с 9 кинетами в продольных
рядах.
Р. bivacuolata Foissner, 2004 — вид из почвы в
Австрии с 10 кинетами томита, 2 вакуолями и 6 коль-
цевыми ребрами цисты.
Род Sphaerophrya Claparede et Lachmann,
1859
Типовой вид 5.pusilia по монотипии. Трудный
род для систематиков, ничего неизвестно о строении,
цикле развития и цисте типового вида, поэтому до сих
пор неясны критерии рода и статус паразитических по-
дофриид. В этой ситуации следует либо оставить род
неопределимым и не пользоваться этим названием,
либо обозначить другой типовой вид с разрешения
ICZN.
5. pusilia найдена в пресной воде, вероятно замече-
но лишь несколько особей, одна из которых прикрепи-
лась к «oxytrique» левее перистома (Claparede, Lach-
mann, 1859). Показаны лишь очень мелкие, не дефини-
тивные формы, одна на гипотрихе, 2 отдельно, с
несколькими короткими щупальцами на вершине тела.
Гипотриха хорошо зарисована, но названия ее нет в
двухтомнике этих авторов; это не окситриха, не урос-
тила, можно исключить еще ряд родов, но точно опре-
делить ее нельзя; есть некотоое сходство с Onychodro-
mopsis. Неясно, что это — свободный вид или паразит
гипотрих, неизвестно положение кинет у томита и тип
цисты.
Реальные виды — S. magna Maupas, 1881,5. terrico-
la Foissner, 1986 (почвенный вид с 4 рядами ресничек у
томитов); к роду приписано много неопределимых ви-
дов (5. gelatinosa Buck, 1884; 5. hydrostatica Engel-
mann, 1878; S. maupasi Butschli, 1889; S. ovata Weisse,
1847; S. parva Greeff, 1888; 5. mobilis comb. n. = Podo-
phrya mobilis Miller, 1871). Пока не найдены цисты, не
доказано отсутствие стебелька у трофонтов, пока не
определен хозяин типового вида и не изучена эта ин-
фекция и ее специфичность, род не имеет четкого диа-
гноза. Чтобы не усложнять ситуацию, можно относить
к этому роду паразитические формы и не пользоваться
692
ALVEOLATA
предложенным для них названием Kystopus Jankowski,
1967 с типовым видом Sphaerophryaparameciorum Ма-
upas, 1881. Общее у этих видов — отсутствие стебель-
ка на стадии паразитических трофонтов, поэтому
включение их в состав Podophrya нежелательно; нет
диморфизма стебелька, появляющегося только на ста-
дии цисты.
Род неоднороден, паразитические виды различают-
ся по типу томитов и по форме цисты, поэтому предла-
гались следующие подроды.
Sphaerophrya s. str. С. et L., 1859, типовой вид S. pu-
silia C. et L., 1859, томиты предположительно с узкой
поперечной полосой циклокинет.
Kystopus Jank., 1967, типовой вид S. parameciorum
Maupas, 1881, узкая полоса кинет идет продольно по
краям плоского тела томитов.
Arcacineta Jank., 1981, типовой вид S. canelli Cle-
ment, 1967, кинеты продольные, разрозненные, равно-
мерно распределены по телу томита.
Stenophaga Jank., 1981, типовой вид S. doliolum Pe-
nard, 1922, почкование полувнутреннее, томиты с по-
перечным пояском циклокинет. Это паразит стенто-
ров, но у них я видел лишь анизотомию обычного
типа, нужно проверить правильность первоописания
вида.
Parasphaerophrya Jankowski, 1981, типовой вид
S. urostylae Maupas, 1881 с уникальным типом цист, с
неровной многогранной оболочкой, всегда без четких
поперечных колец, характерных для цист всех осталь-
ных подофриид.
Ниже приводится список паразитических сукторий
и их хозяев; не цитируются многочисленные ошибоч-
ные определения, к примеру определение паразитов
парамеций как .S'. sol — этот вид вначале был описан
как свободноживущий, у парамеций свои виды пара-
зитов.
S. parameciorum var. caedax Jank., 1963 (синоним
вида S. parameciorum Maupas, 1881 из Paramecium cau-
datum)', S. canelli Clement, 1967 {Euplotes eurystomus,
E. patella)-, S. doliolum Penard, 1922 {Stentor niger);
S. epizoica Hammann, 1952 {Vorticella campanula, реже
на других видах перитрих; в Байкале на вортицеллах и
Carchesium)', S. grelli Dieckmann, 1985 {Stylonychia lem-
nae); S. hungarica Kormos, 1960 {Paramecium', неясно,
паразиты или нет); S. iftodi (Curds, 1986 in Podophrya)
{Nassulopsis elegans)', S. incursella comb. n. {=Podophrya
parasitica stibsp. incursella Jank., 1963; Paramecium bur-
saria)', S. insolita Jank., 1973 {Bursaria truncatella)',
Sphaerophrya n. sp. {Myriokaryon lieberkuhni, Haptori-
da); S. parasitica subsp. nassulae Guilcher, 1951 {Nassula
ornata', синоним вида 5. parasitica из того же хозяина);
S. parameciae Guilcher, 1951 {Paramecium caudatum',
синоним вида S. parameciorum)-, S. parameciorum Mau-
pas, 1881 {P. caudatum)', S. parasitica Faure-Fremiet,
1945 {Nassula ornata)', S. parurolepti Foissner, 1980 {Pa-
ruroleptus caudatus)', S. stentoris Maupas, 1881 {S. stento-
rea) {Stentor roeseli)', Sphaerophrya sp.{Stentor polymor-
phus, S. coeruleus)', S. stokesii Mamaeva, 1979 {Stokesia
vernalis); S. stylonychiae Kent, 1881 {Stylonychia myti-
lus)', S. urostylae Maupas, 1881 {Urostyla grandis).
Список показывает ограниченное число видов сфе-
рофрий по сравнению с обилием возможных хозяев: в
гапторидах 1 вид, в нассулидах 2, в кольподидах {Bur-
saria) 1, в пеникулинах 3, в гетеротрихах 2, в эуплоти-
дах 1, в перитрихах 1, в гипотрихах 4 (5 с типовым
видом рода, если это паразит).
Сем. Parapodophryidae Jankowski,
1973
Внешний облик, как у подофрий, но щупальца дру-
гого типа — тонкие, с акроном, у основания расшире-
ны; как и у подофрий, равномерно распределены по
телу, полимеризованы. Томит простоматного типа, с
субапикальным кольцом ресничек и продольными
желобками. При морфогенезе ресничная зона развива-
ется в инвагинированном кармане, расположенном по-
перек тела, и после эвагинации происходит переориен-
тировка томита по оси тела трофонта. Род не прими-
тивный по сравнению с Podophrya-, есть общие черты
морфогенеза с вермигемминами, поэтому окончатель-
ный вывод о положении рода в системе может дать
только молекулярная диагностика. Виды рода встреча-
ются в пресной и солоноватой воде; в пробах воды с
добавлением грунта, ватта или водорослей из Белого и
Баренцева морей часто разводится вид Р. typha, питаю-
щийся гипотрихами, в основном червеобразными пиг-
ментированными Pseudokeronopsis rubra, несмотря на
их яд — керонотоксин.
Род Parapodophrya Kahl, 1931
Типовой вид Sphaerophrya soliformis Lautebom,
1908 (=5. sol Lauterborn, 1901, гомоним). С диагнозом
семейства. Примеры видов — Р. comosa Penard, 1920,
Р. palmigera Р., 1920, Р. typha Kahl, 1928.
Отряд Exogenida Collin, 1912
Таксон обычно включал всех сукторий с наружным
почкованием, независимо от типа морфогенеза, поло-
жения кинет, формы томитов. Желательно или повы-
шение ранга до надотряда, или распределение групп
родов по нескольким отрядам — отделение примитив-
ных подофриид, несходных с ними вермигеммид и
остальных родов как минимум в 3 отрядах. К экзогем-
мидам можно отнести метацинет, парацинет и отдель-
ные аберрантные роды; эфелотиды с 2 типами щупа-
лец и синхронной полигеммией выделены в особый
отряд экзогеммид. Общее у Exogenida — щупальца од-
ного типа, почкование наружное, у томитов сложная
топография кинет.
Сем. Metacinetidae Butschli, 1889
Раковинные виды; раковина сложной формы, узор-
ная, с продольными щелями, число и положение ко-
торых видоспецифичны; щупальца выходят вдоль этих
щелей. Щупальца булавовидные, подофриидного ти-
па. Трофонт прикреплен только к щелям, висит в поло-
сти раковины; нет апикального пучка щупалец. Стебе-
лька обычного типа нет, стенки раковины снизу су-
ТИП CILIOPHORA. КЛАСС PHYLLOPHARYNGEA
693
жшотся и образуют ложный стебелек (текостил), не
смыкаясь; весь комплекс — типичная стилотека. To-
mi । гы крупные, со сложным положением кинет, покры-
вающих значительную часть тела.
Род Metacineta Butschli, 1889
Типовой вид Cothurnia mystacina Ehrenberg,
1831 по монотипии; с диагнозом рода. В литературе от
времен Эренберга до 1980-х гг. под названием М. mys-
tacina описывали и рисовали всевозможные виды, и
столь же произвольной была синонимизация, когда
многие виды этого и других родов сводили в синони-
мы единственного (типового) вида рода. Сейчас ясно,
что существует ряд валидных видов, большинство ко-
торых ранее не признавалось или считалось «форма-
ми» вида М. mystacina. Ридер (Rieder, 1985) выделяет 4
вида: М. micraster (2 формы), М. longipes (4), М. тасго-
caulis (2) и М. mystacina (4 формы). Сущность понятия
«форма» или «вариетет» неясна, возможно, это реаль-
ные виды. По крайней мере 3 вида должны быть добав-
лены к этому списку. Для части видов предлагались
новые роды; ниже дан аннотированный алфавитный
список видов рода с комментариями по валидности и
родовому положению.
М. acuminata (Acineta in Stokes, 1887). Вероятно с
4 щелями (число щелей можно точно установить толь-
ко при зарисовке с апекса; у большинства ранних авто-
ров таких рисунков нет); стебелек короткий, не длин-
нее раковины.
М. alata (Acineta in Stokes, 1885). Вид с необычайно
длинным стебельком, в 5—6 раз длиннее раковины;
раковина с 6 щелями.
М. angularis (Acineta in Maskell, 1887). Вероятно
метацинета, очень плохо описанный вид.
М. baikalensis (Jankowski, 1982 in Beckmania), сим-
бионтный вид с дорсума бокоплава Spinacanthus para-
siticus, обитающего на губках Байкала. Вид выделялся
в особый род по форме раковины, но повторное изуче-
ние показало, что это типичная Metacineta.
М. butschlii Kann, 1933. Вид не описан по правилам
номенклатуры.
М. cothurnia (Acineta in Clap, et Lachm., 1859). Мор-
ской вид с узорчатым краем раковины.
М. cuspidata (Acineta in Kellicott, 1885). Раковина
широкая, низкая, с очень коротким обособленным сте-
бельком, 2 пучка щупалец по краям апекса выходят из
широких вырезок раковины; щелей нет. Щупальца не-
многочисленные, извитые, подвижные, «в поисковом
движении как руки гидры». Щупальца тонкие у вер-
шины, утолщаются к основанию (у метацинет булаво-
видные, неподвижные, равной толщины). Точного со-
временного переописания вида нет, но для него пред-
ложены 2 родовых названия — Vasacineta Jank., 1981 и
Kellicotta Curds, 1985. Пресноводный перифитонный
вид, возможно эндемик Северной Америки.
М. elegans (Acineta in Maskell, 1886) (=A. speciosa
Maskell, 1887). Плохо изученный вид с бокаловидной
раковиной, без щелей, с 2 пучками щупалец по краям
тела над раковиной; стилотека короче раковины.
М. flos (Acineta in Maskell, 1888). Вид с такой же ра-
ковиной, но с вырезками верхнего края; щупальца в
беспорядке на апексе, выходят в широких вырезках
между зубцами раковины. Плохо описанный вид.
М. macrocaulis (Acineta in Stokes, 1887), позднее в
составе Discophrya и Tokophrya. Валидный длинносте-
бельчатый вид, частый в пресных водах.
М. macrostyla (Podophrya in Stokes, 1885). По одним
авторам, валидный вид рода Podophrya, по другим — в
составе Discophrya или Tokophrya, но это явно метаци-
нета, зарисованнная столь же плохо и неправильно, как
предыдущий вид. Возможно, это один вид (синонимы)
с очень длинным пустотелым стебельком, расширяю-
щимся к вершине, который есть только у метацинет.
М. micraster (Solenophrya in Penard, 1914) — типо-
вой вид рода Discacineta Jankowski, 1981. Очень мел-
кие формы вообще без стебелька (признак нового
рода); прикрепление мелким базодиском на нижнем
конце раковины; при виде сверху 5 щелей. Хорошо
изученный валидный вид. Щупальца отходят не по
всей длине щели, как обычно у метацинет, а только от
нижнего конца каждой щели; это может быть дополни-
тельным родовым признаком для Discacineta.
М. mystacina (Cothurnia in Ehrenberg, 1831). Эрен-
берг рисует особей с коротким текостилом, не свыше
длины раковины; это как бы промежуточный вид меж-
ду М. micraster и М. macrocaulis. Суктории с такой ра-
ковиной действительно часты в перифитоне и хорошо
изучены; стилотека обычно не длиннее трети или по-
ловины длины раковины, число щелей варьирует, и по
этому признаку вид делится на формы или подвиды.
Щупальца отходят в рядах вдоль всей щели, а не в ба-
зальных пучках, как у Discacineta; у томитов широкая
ресничная полоса идет от постерона вправо вверх, оги-
бает дорсум и возвращается слева, подходя вплотную
к правой зоне, где расположена мелкая скопула.
Ридер (Rieder, 1985) по числу щелей раковины вы-
делил «разновидности» (varieties) М. mystacina var. qu-
inquifida — 5, sexifida — 6, septifida — 7, octofida — 8,
novemfida — 9, decemfida — 10, tridecemfida — 13 щелей;
позже добавлена var. pachystyla Batisse; ранние авторы
различали формы var. longipes (приписывалась Эрен-
бергу, Кенту и Мережковскому) и var. brevipes Sand,
добавлена var. intermedia. Форма longipes может быть
валидным названием для длинностебельчатого вида.
М. namibiensis Foissner, Agatha et Berger, 2002 —
хорошо изученный вид из почвы в южной Африке;
мелкие трофонты с 6 щелями панциря и 6 пучками щу-
палец на коротком прочном стебельке, не на стилоте-
ке, — если это верно, это вид особого рода. Томит с
6 краевыми кинетами, подофриидного типа.
М. pentagonalis Nozawa, 1939 — вид без текостила
с 5 щелями; щупальца отходят по всей длине щели, это
не М. micraster. Раковина вазообразная, сужается к
основанию и базодиску без имитации стебелька.
М. rossica (Asellacineta. in Jankowski, 1981). Вид
найден на аселлотах — вначале на Asellus hilgendorfi
на Сахалине,’ затем на A. aquaticus в Петербурге; Дов-
галь (2002) нашел вид на аселлотах Украины, это явно
специфический симбионт. Раковина с 4 щелями, щупа-
льца в рядах вдоль щели; вид очень мелкий, и по ошиб-
ке вначале предполагалось, что имеется настоящий
плотный стебелек, не текостил — сужение стенок ра-
ковины. Повторное изучение показало наличие теко-
стила, но все же Asellacineta может быть подродом, по-
694
ALVEOLATA
скольку края щелей не ровные, а с зубцами и вырезка-
ми, отличающими вид от остальных метацинетид.
М. speciosa (Acineta in Maskell, 1887) — замещаю-
щее название для гомонима A. elegans Maskell, 1886
пес Imhoff, 1883.
М. stagnatilis (Acineta in Stokes, 1886) — типичная
метацинета с коротким четким стебельком, возможно
с 4 щелями; плохое описание и рисунок делают точное
определение невозможным.
М. yoshii Nozawa, 1938 — мелкий вид с 8 щелями,
при виде сверху в виде 8-лучевой звезды; щупальца не-
многочисленные; раковина плавно переходит в широ-
кий толстостенный текостил, до половины общей дли-
ны особи.
Новый род, предположительно метацинетид, оби-
тает на Байкале в перифитоне на раковинах моллю-
сков; камера плоская, приклеена к субстрату, щупаль-
цы выходят через трубчатые выросты раковины.
Сем. Urnulidae Fraipont, 1878
Очень мелкие паразитические формы; раковина с
текостилом, без настоящего стебелька; сохранено
только одно апикальное щупальце, редко 2; размноже-
ние наружным почкованием, с отделением крупного
томита.
Род Urnula Claparede et Lachmann, 1859
Типовой вид U. epistylidis по монотипии, пре-
сноводный вид, паразит колониальных перитрих. На
стволе и ветвях колонии хозяев (не на зооидах) можно
заметить мелкие светлые раковинки, незначительно
сужающиеся к основанию, без плотного стебелька
(стилотека), прикрепленные мелким диском; вершина
узорчатая, при виде сверху со складками, с централь-
ным отверстием и каналом, сквозь которые наружу от
овального трофонта выходит очень длинное змеевид-
ное щупальце, находящееся в непрерывном движении;
при раздражении щупальце быстро и резко сокращает-
ся. Прикрепившись акроном к зооиду, суктория выса-
сывает его цитоплазму, укрупняется и делится путем
анизотомии, отделяя крупного овального томита с
продольными кинетами. Кинетом томита не совпадает
с кинетомом у Metacineta', имеется 6 рядов ресничек на
большей части тела, расположенных диагонально. Не-
редко видно второе более короткое щупальце.
Другие виды паразитируют на сукториях, оседают
у актинофоров и высасывают клеточный сок, прикре-
пив свое щупальце сбоку или к вершине щупальца хо-
зяина, или к его телу. На Байкале Urnula sp. обычны на
эндемичной суктории Stylophrya polymorpha с пере-
опод Eulimnogammarus viridis, при массовой инвазии
она перестает размножаться (блокируется эмбриоге-
нез), но питается, превращается в крупных монстров,
деформируется и погибает. Это особый вид — у всех
остальных сукторий на гаммарусах Байкала таких па-
разитов нет, но только по одной специфичности нельзя
дать описание нового вида паразитов.
U. epistylidis (тип рода) питается зооидами пе-
ритрих, обычно Epistylis plicatilis, наиболее частого в
пресных водах перифитонного вида колониальных пе-
ритрих; отмечены также на Е. bimarginata с Asellus,
Orbopercularia nenningerae с жуков Hydrous.
U. turpissima Kormos, 1958. Вид с сукторий; внача-
ле паразитов сукторий относили к U. epistylidis или
принимали за наружные почки сукторий, например у
зараженных эндогеммин Dendrosoma radians', счита-
лось, что у дендросомы 2 типа почкования, наружное и
внутреннее. Заражены в основном крупные суктории с
актинофорами и пучками щупалец — D. radians, Ler-
naeophrya capitata (=Trichophrya astaci), Stylophrya po-
lymorpha, длинностебельчатые виды Metacineta, реже
мелкие суктории, к примеру Acineta karamani с пре-
сноводных креветок в Сербии. Отличия от вида с пе-
ритрих небольшие, а видовых отличий паразитов на
разных видах сукторий найти не удается. Паразиты
оседают у края актинофоров, вытягивают щупальце и
высасывают хозяина через тонкую мембрану щупалец
жертвы или через клеточную оболочку. Как исключе-
ние, на Tokophrya quadripartita в Японии отмечено
скопление паразитов у основания тела, далеко от щу-
палец; морфология этого вида изучена не была, щу-
пальце не выявлено, пока условно их можно считать
видом рода Urnula.
Род Pseudogemmides Kormos, 1935
Типовой в и д Р. globosa по монотипии,— экто-
паразиты раковинных дискофриид, прикрепляются
толстым стебельком вдоль апикальной щели раковины
пресноводной перифитонной суктории Discophrya Нп-
guifera (ныне Periacineta linguiferd), высасывают цито-
плазму короткой полой ножкой, принятой за широкое
щупальце. Клетка почти округлая, с круглым ядром и
одной вакуолью; раковина покрывает все тело и пере-
ходит в короткую широкую ножку. При виде сбоку ра-
ковина может быть узорчатой. Размножение семи-цир-
кумвагинативное, у томита полоса ресничек располо-
жена не так, как у внешней сходной Pseudogemma —
кинет много, направлены поперек или под углом к оси
тела. Позже сам автор рода отказался от него и свел в
синонимы рода Urnula (Kormos J., Kormos К., 1958).
Фактически это плохо описанная урнула — паразиты,
частые на сукториях; не были замечены щели ракови-
ны и апикальное щупальце. Вид с этого хозяина может
быть валидным (Urnula globosa comb. п.). Этого рода
и вида нет в определителе Маттеса (Matthes, 1988); у
Довгаля (Dovgal, 2002) род и вид валидные в составе
сем. Manuelophryidae.
Сем. Allantosomatidae Jank., 1978
(рис. 340, а)
Пассивно плавающие клетки без органелл прикреп-
ления; тело удлиненное, не сплющенное, почковид-
ное; немногочисленные прямые или булавовидные
щупальца (акротены) имеют разное расположение у
немногочисленных видов этого таксона, и четкие роды
можно выделить по их топографии. Питание — более
крупными цилиатами из пищевого тракта хозяев, пара-
зиты могут надолго присасываться к ним, в частности
ТИП CILIOPHORA. КЛАСС PHYLLOPHARYNGEA
695
И ioiic каудальных пучков ресничек энтодиниид. Раз-
множение долгое время не отмечалось, но сейчас ал-
шштосомы считаются монотомическими видами —
деля тся надвое без почкования. Эта аберрантная груп-
па включает только эндобионтов в лошадях, зебрах,
носорогах и слонах. Довгаль относит единственное
гем. Allantosomatidae к отряду Podophryida, но родство
групп не очевидно и ничем не доказано. Подофрии и
сферофрии обычны в почве, террофитоне и временных
водоемах и могли дать начало аллантосомам при их за-
глатывании травоядными. Родство с подофриидами
можно проверить по типу аргирома и кинетома и по
ультраструктуре щупалец.
Род Allantosoma Gassovsky, 1919
Типовой вид A. intestinalis (по Аэшт, правильно
A. intestinale), также A. cucumis Strelkow, 1939 — щу-
пальца в беспорядке в двух боковых пучках; симбион-
ты лошади. Размеры тела 44—65 мкм, щупалец 5—10;
суктории прикрепляются снизу к каудалиям или телу
крупных трихостомат Blepharocorys curvigula, энтоди-
пиоморфид Cycloposthium bipalmatum и других цилиат
из хозяина.
Род Allantoxena Jankowski, 1978
Типовой вид Allantosoma biseriale Strelkow,
1939, по монотипии, также A. japonensis Imai, 1979 (Al-
lantoxena in Jankowski, 1986); щупальца в 2 четких бо-
ковых рядах, не в пучках; размеры тела 20—35 мкм,
особи прикреплены к Alloiozona trizona, Holophryoides
ovalis и другим более крупным хозяевам в лошади.
У второго вида есть дополнительные щупальца вне
краевых рядов.
Род Arcosoma Jankowski gen. n.
Типовой вид Allantosoma dicomiger Hsiung,
1930, также A. brevicorniger Hsiung, 1928, A. lineare
Strelkow, 1939 (Arcosoma dicorniger, A. brevicorniger,
A. lineare comb. nn.). Название рода Arcosoma Jankows-
ki, 1967 в каталоге Аэшт валидное, но оно опубликова-
но в тезисах и поэтому непригодно по правилам но-
менклатуры; род предлагается вновь. Края тела несут
только по одному щупальцу, у одного вида тело плав-
но переходит в краевые щупальца; симбионты лошади.
Мелкие цилиаты (20—35 мкм), прикрепляются к Blep-
harozoum и другим хозяевам; фактически эктопарази-
ты, а не хищники. Рельеф кортекса у Л. lineare не выра-
жен у других видов.
Род Vanhovenia Dovgal, 2002
Типовой вид Allantosoma multisuctores Van Ho-
ven, Gilchrist et Stenson, 1998; немногочисленные
щупальца рассеяны в беспорядке по всему телу, не со-
браны в ряды или боковые пучки; в африканском но-
сороге из ЮАР и Заира.
Род Strelkowella Kornilova,
2004
Типовой вид .S'. urunbasiensis по монотипии,
из локальной породы лошади в Якутии. Тело огур-
цевидное, длиной 25—46 мкм, ядро овальное, щу-
пальцы длиной 8—18 мкм расположены на массив-
ных краевых четко отграниченных выростах тела —
актинофорах, по 3 выроста на каждом полюсе тела;
на их вершине короткая розетка с примерно 6 щу-
пальцами.
Экзогеммиды неясного положения
Род Severonis Jankowski, 1981
Типовой вид У. spongiarum — обитатели мор-
ского бентоса, обнаружены на литоральных губках
Мурмана; тело мешковидное, овальное, прикреплено к
субстрату мелкими бугорками на базальной стороне
клеток, не приклеено всей подошвой; по остальной по-
верхности равномерно распределены 20—25 толстых
щупалец с акроном и легко видимым каналом, расши-
ренные у основания, гофрированные при сокращении
(не тонкие акротены). Замечены стадии неравного де-
ления, крупный томит с краевой ресничной полосой
(около 10 кинет) и разрозненными укороченными щу-
пальцами. Один род Severonis Jankowski, 1981 (типо-
вой вид S. spongiarum). К морским губкам приспособ-
лен ряд аберрантных родов сукторий; вместе с Severo-
nis на мурманских Halichondria panicea обитает и
более частый вид рода Spongiarcon', на пресноводных
губках изредка встречаются токофрии, специфических
сукторий на Spongillidae нет. Для этого вида было
предложено сем. Severonidae Jank., 1981 неясного по-
ложения в системе.
Род Gajewskajophrya Matthes,
1988
Типовой вид Sphaerophrya melosirae Gajewska-
ja, 1933 открыт в планктоне оз. Байкал в слое 0—
400 м; на длинных тонких палочковидных пелагиче-
ских диатомеях Melosira baikalensis и М. binderiana
прочно прикреплены бесстебельчатые трофонты сук-
торий величиной 60—90 мкм с ромбическим или мно-
гогранным телом, слегка вздутыми углами, с оваль-
ным ядром и несколькими вакуолями; актинофоры не-
сут компактные пучки щупалец — тонкие длинные
акротены. Трофонты напоминают гелиофрий, но раз-
множение наружное; крупные особи удлиняются и
делятся на 2 примерно равные части. Вид найден в озе-
рах Австрии; цветные фотографиии этого вида — в
монографии планктона (Foissner et al., 1999). Это ва-
лидный род неясного положения и филогении, здесь
не отнесен к известным семействам экзогеммид; хо-
телось бы знать цилиатуру томита.
696
ALVEOLATA
Рис. 338, a. Suctoria.
Tokophrya quadripartita (A—E,K), T. cyclopum (Ж); T. actinostyla (И); Tokophryella carchesii (3). (По: Batisse, 1969a (Ж, И); Matthes, 1988 (3); Augustin, Fois-
sner, 1989 (A—E,K)).
Fig. 338, a. Suctoria.
Род Ophryocephalus Wailes, 1925
Типовой вид О. capitatum. Морской паразитиче-
ский вид; типовая раса с Тихоокеанского побережья
Канады, обитает на вершине базостила и на эпиконе
крупных эфелот; в тексте хозяевами указаны Ephelota
coronata и Е. gemmipara, но на рисунке показана за-
раженная Е. plana, обычный морской перифитон-
ный вид отряда эфелотид. Одна особь хозяина несет
несколько паразитов. Трофонты мелкие, диаметр до
55 мкм, округлые или овальные, с округлым ядром, уз-
ким плотным стебельком без эпикона, несколько коро-
че тела; имеется одно краевое щупальце, тонкое и нео-
бычайно длинное (до 100 мкм), с вздутой вершиной;
щупальце гибкое, активное, находится в непрерывном
движении, растягивается и скручивается спиралью.
Размножение полиэкзогеммией — на всей верхней
стороне тела одновременно отделяется несколько мел-
ких круглых почек. Положение рода в системе сукто-
рий неизвестно до изучения томитов. Для рода предло-
жено сем. Ophryocephalidae Jankowski, 1978.
Сем. Paracinetidae Jankowski, 1978
(рис. 338, 6—340, а)
Тело обычно сферическое или мешковидное, ино-
гда сплющено, ядро простой формы; всегда имеется
раковина и стебелек, изредка полый и переходящий в
раковину, как у метацинет (стилотека); щупальца рас-
положены в беспорядке по всей верхней части тела у
сферических форм, в полосе у латерально сплющен-
ных видов. Размножение наружным делением или се-
ми-циркумвагинацией (почкованием) с образованием
апикального протомита. Обитатели морского и пре-
сноводного перифитона, террофитона (лишайники,
мох) и почвы; часть видов — симбионты беспозвоноч-
ных в основном морских ракообразных.
ТИП CILIOPHORA. КЛАСС PHYLLOPHARYNGEA
697
Рис. 338, б. Suctoria.
Praethecacineta halacari (zt); Riftus pygmaeus (Б)', Limnoricus ceter (В, Г)\ Tokophrya infusionum (Д); циста T. quadripartita (E); Choanophrya infundibulifera (Ж);
Cyathodinium piriforme (3, И). (По: Batisse, 1968b (A), 1969a (Д, Ж); Augustin, Foissner, 1989 (E); Paulin, Corliss, 1964 (3. И)\ Б—Г— ориг.).
Fig. 338, 6. Suctoria.
Род Paracineta Collin, 1912
Типовой вид P. patula (Claparede et Lachmann,
1861). Морской перифитонный вид с тонким длинным
полым стебельком, переходящим в расширенную ко-
ническую рюмковидную раковину; трофонт не сплю-
щен, щупальца многочисленные, булавовидные (акро-
тены), рассеяны по верхней части тела; кортекс без
рельефа (найденного у части парацинет). Томит ци-
линдрический, с мелкими щупальцами на одном конце
тела и скопулой на другом; все тело покрыто попереч-
ными кольцами ресничек. Название рода обычно ассо-
циировалось не с этим видом, а с Р. homari и Р. crena-
ta, прекрасно изученными и детально иллюстрирован-
ными в монографии Коллена (Collin, 1912), но по
неудачному последующему выбору как типовой для
рода обозначен вид со стилотекой. Большой список
включаемых видов — в сводке Довгаля (Dovgal, 2002),
но не все они однотипны с типовым — многие виды
будут исключены из этого списка по форме и рельефу
раковины, строению стебелька, положению щупалец
или просто как недостоверные, плохо описанные виды
или синонимы. Стилотека редко встречается у сукто-
рий (в основном у метацинетид), и Р. patula относится
к этим исключениям. Раньше я сохранил этот род для
форм с прочным стебельком, не обозначив типа, а для
вида со стилотекой Р. patula выделил новый род Ste-
macineta Jank., 1978, уходящий теперь в синонимику.
Формально (по Довгалю) в списке парацинет виды
Р. patula (С. et L., 1859); Р. dadayi Kahl, 1934; Р. divisa
(Fraipont, 1877); Р. gaetani Sewell, 1951; P. havniensis
(Ehrenberg, 1838); P. irregularis Dons, 1927; P.jorisi
(Sand, 1895); P. karanakarani Santhakumari, 1986; P. li-
neata Jones, 1973; P. livadiana (Mereschkowsky,
1881); P. meridionalis Jones, 1973; P. moebiusi Kahl,
1934; P. neapolitana (Daday, 1886); P. saifulae
(M., 1877); P. scanica Allgen, 1934; P. scottocalani (Se-
well, 1951); P. stresemani A., 1951; P. trichophora
(A., 1951); P. tuba (Zelinka, 1914); P. vorticelloides (Fra-
ipont, 1877); P. anisostyla (Corynophrya in Fernandez-
Leborans et al., 1996) из перифитона и с морских бес-
позвоночных — нематод, эхинодерид, гидроидов, ко-
698
ALVEOLATA
Рис. 339, a. Suctoria.
Acineta oceanica (J): PhyllacinelaJolyi (Б); Pseudogemma pachystyla на Acineta tuberosa (B); Trematosoma bocqueti (Г—Е); Rimacineta falcata (Ж); Acineta talit-
ris (3). (По: Batisse, 1968a (B), 1972 (Г—£); А, Б,Ж,3 — ориг.).
Fig. 339, a. Suctoria.
пепод и других ракообразных. Но стилотека имеется
только у первого вида, это проверено мной на Мурма-
не; род сборный.
Род Actinocyathula Corliss,
1960
Типовой видActinocyathuscidarisKent, 1882; за-
мещающее название для гомонима Actinocyathus Kent,
1882. Также A. crenata (Fraipont, 1877), A. diadema
(Collin, 1912J, A. homari (Sand, 1899), A. pleuromammae
(Steuer, 1928). Трофонты не сплющены, щупальца
на верхней части тела в беспорядке; раковина четко
отделена от прочного стебелька, не стилотека. Мор-
ские свободноживущие перифитонные виды и ком-
менсалы пелагических копепод, бентосных полихет
и ракообразных. Этот род долгое время никем не при-
знавался без обсуждения и мотивации, просто игнори-
ровался, но при ревизии сукторий был восстановлен
как валидный для части парацинет (Curds, 1987).
Род может быть сборным — у видов типа A. homari
мной обнаружен правильный сетчатый рельеф кортек-
са, неизвестный у A. cidaris и у планктонной A. pleuro-
mammae.
Род Flectacineta Jankowski,
1978
Типовой вид Acineta livadiana Mereschkowsky,
1881 из морского перифитона, описан с водорослей
Ceramium у берегов Крыма. Раковина мелкая (длиной
около 26 мкм), вздутая, не сплющена, с нешироким
устьем, иногда рельефная у вершины; стебелек длин-
ный и тонкий (32 X 1.2 мкм), с каналом, отграничен от
раковины, это не стилотека. Мелкий овальный тро-
фонт подвешен на вершине раковины, вся верхняя
часть тела с пучком радиальных щупалец (акротен).
Этот вид долгое время числился в составе Paracineta, с
разной синонимикой у разных авторов; точный сино-
ним — Acineta neapolitana Daday, 1886, возможно так-
же Alderia ovata Pritchard, 1852 или A. pyriformis P.,
1861. В сводке Курдса (Curds, 1987) 3 вида — F. livadi-
ТИП CILIOPHORA. КЛАСС PHYLLOPHARYNGEA
699
Рис. 339, б. Suctoria.
Rhyncheta cyclopum (A—В); Heliophrya rotunda (= H. collini) (Г, Д); Caprinianapiscium (F—3); Listarcon angarensis (И); Dendrosoma radians (K); Staurophrya
elegans (Л). (По: Matthes, 1988 (Г, Д); Hitchen, Butler, 1972 (/1—3); Foissner et al., 1995 (Д); Ergens, Lom, 1970 (Ж. 3); Prost, 1952 (E); Gajewskaja, 1933 (77); 77—
ориг.).
Fig. 339, 6. Suctoria.
ana, F. dadayi (Kahl, 1934 in Paracineta) и F. elegans
(Imhoff, 1884 in Acineta). Довгаль (Dovgal, 2002) не
считает род валидным, вероятно допускает, что тип
рода имеет стилотеку, как и Paracineta.
Род Limnoricus Janowski,
1981
Типовой вид L. ceter с морских изопод-дре-
воточцев Limnoria lignorum-, встречаются на Мурмане
и в дальневосточных морях, вероятно широко распро-
странены вместе с хозяином в Мировом океане. Рако-
вина плоская, четко отделена от прямого длинного
тонкого стебелька; трофонт плоский, вытянутый, при-
креплен к раковине у ее вершины; щупальца не впол-
не соответствуют типу акротены, раположены в од-
ном дуговидном ряду параллельно краю раковины. Бу-
дет описан второй вид такого же типа с литоральных
клещей-галакарид Мурмана, с коротким извитым
стебельком.
Род Deltacineta Jankowski, 1981
Типовой видD. seticola с литоральных копепод
Nitocra на Мурмане; у Довгаля — синоним предыду-
щего рода, но у типового вида щупальца не в одном, а
в нескольких рядах (это не было показано на рисунке)
и другого типа—типичные сократимые акротены; вид
будет более тщательно изучен для окончательного ре-
шения вопроса о валидности рода. Раковина плоская,
типичной формы для рода Acineta, с постепенным рас-
ширением к вершине, стебелек плотный, короткий,
трофонт занимает всю раковину. Щупальца в рядах,
тонкие, очень сократимые. I
Род Distarcon Jankowski
gen. n.
Типовой вид Corynophrya emeritae Small et
Lynn, 1985 (D. emeritae comb. n.). Род предложен ранее
в тезисах (Distarcon Jank., 1987) и поэтому невалиден,
700
ALVEOLATA
Рис. 340, a. Suctoria.
Enchelyomorpha vermicularis (A—ffy, Allantosoma intestinalis (E); Pseudogemma sp. на Paracineta sp. (Ж, 3); Phalacrocleptes verruciformis (И, PCy, Corynophrya
symbiotica (JTy, Marinecta massiliensis (M). (По: Hsiung, 1928 (E); Foissner W., Foissner I., 1995 (А—Д); Ж—M— ориг.).
Fig. 340, a. Suctoria.
здесь предлагается вновь. Симбионты крабов; хозяин,
судя по названию вида (диагноза в первоисточнике
нет), Emerita analoga', раковина рюмковидная, на тон-
ком длинном стебельке; трофонт не сплющен, разде-
лен на 2 зоны — по вздутой кольцевой зоне рассеяны
короткие острые щупальца, на верхней полусфериче-
ской части несколько длинных акротен. Диморфизм
щупалец редок у сукторий, кроме эфелотид; точное
положение рода в системе выяснится при изучении
томитогенеза.
Род Nipponarcon Jankowski,
1981
Типовой видУ setarius с полихет (неопреде-
ленных нереид) литорали южного Сахалина. Ракови-
на и стебелек четко отделены, стебелек прочный и
длинный, трофонт не сплющен, прикреплен медиаль-
но к стенке раковины; свободная верхняя поверхность
покрыта массой щупалец, вероятно несократимых.
Между трофонтом и дном раковины полость с за-
стывшей ячеистой массой. Парацинетиды часты на
полихетах, это один из аберрантных видов с прикре-
пительным кольцевым ребровидным выступом по эк-
ватору тела.
Род Luxophrya Jankowski,
1978
Типовой вид Podophrya limbata Maupas, 1881; у
Довгаля также L. maupasi = Podophrya maupasi Butsch-
li, 1889. Стебелек очень тонкий, прочный и длинный
(до 325 мкм при длине тела без мукуса 18—45 мкм),
слегка расширен у вершины (с эпиконом); прочной ра-
ковины обычного типа нет, сферический трофонт
окружен «гелиотекой» — студенистой сферой, сквозь
которую легко проходят щупальца; щупальца много-
численные, длинные, типичные акротены, рассеяны по
всему телу. Коллен (Collin, 1912) изучил неравное на-
ружное деление (правильнее почкование); томит вытя-
нутый, с широким поперечным кольцом ресничек,
опоясывающих почти все тело, и многочисленными
ТИП CILIOPHORA. КЛАСС PHYLLOPHARYNGEA
701
Рис. 340, б. Suctoria.
Rhizobranchium cionis (A—By Ephelota gemmipara (Г); Shellephelota branchialis (ДУ Severonis spongiarum (E, Ж); Ophiurephelota tenax (3, И). (По: Batisse,
1994 (Гу, А—В,Д—И— ориг.).
Fig. 340, 6. Suctoria.
мелкими щупальцами. Частый вид в морском перифи-
тоне. Вид включали в состав Podophrya, Tokophrya и
Paracineta. Вариант вида — Р. limbata f. convexa Dons,
1922 из Субантарктики с вогнутой нижней частью му-
котеки на уровне эпикона, с длиной стебелька
150—350 мкм.
Для форм такого же типа, но ббз мукозной ракови-
ны, был предложен род Proluxophrya Jankowski, 1978
с типовым видом Acineta vorticelloides Fraipont, 1878;
на Мурмане част предыдущий вид, но не удалось най-
ти вид без раковины, и поэтому вид и род могут
быть невалидными, это, вероятно, случайные аномаль-
ные особи Luxophrya. Длина зооида 30—40 мкм, сте-
белька 100—200 мкм, у вершины стебелька широкий
эпидиск.
Род Corynacineta Jankowski,
1978
Типовой вид Acineta tuba Zelinka, 1914. Мор-
ской вид; мелкие трофонты расположены в длинной
роговидной раковине с пустотелым стебельком
(стилотекой) иного типа, чем у Paracineta. Этот вид
обычно числят в составе рода Paracineta; после перво-
описания вид остался неизученным, точное положение
щупалец и способ размножения неизвестны.
Род Heliotheca Jankowski,
1978
Типовой вид Thecacineta caepula Penard, 1920
(Я. caepula). Мелкие пресноводные суктории с не-
сплющенной вазообразной раковиной, низкой и широкой;
прикрепление очень коротким прочным стебельком;
ядро овальное, сбоку одна вакуоль. Щупальца тонкие
и длинные, расположены на всем апексе или в кольце
над круглым узким устьем раковины, расходятся ради-
ально вбок и вверх; раковина гладкая, без кольцевого
орнамента. Похожий мелкий вид — Solenophrya saccu-
lus Penard, 1920 из настоя мхов, но у него не отмечен
стебелек; этот вид пока не включается в состав Heliot-
heca. В настое листьев в Крыму я нашел мелкий вид, во
всем как Th. caepula, но с кольцевыми ребрами по всей
раковине (около 12, сверху менее четкие).
702
ALVEOLATA
Род Paradentacineta Jankowski, 1978
Типовой вид Thecacineta cypridinae Collin, 1912
найден на раковине Cypridina mediterranea во Фран-
ции, поселяется по краям створок. Морской вид с рюм-
ковидной не сплющенной раковиной, четко отделен-
ной от короткого исчерченного стебелька; края рако-
вины с продольными ребрами, вершина узорчатая, как
у метацинет. Зооид подвешен у устья раковины, меш-
ковидный, с округлым ядром; от апекса через неболь-
шое устье раковины отходит пучок из нескольких мел-
ких щупалец (акротены). Размножение не изучено,
точное положение в системе сукторий неизвестно. Это
вид типа Dentacineta во всем кроме типа щупалец.
Род Loricophrya Matthes,
1956
Типовой вид Thecacineta parva Schulz, 1932.
Мелкие рюмковидные формы с коротким полым сте-
бельком (стилотекой), не сплющенной широкой рако-
виной; щупальца по всей верхней части тела; прикреп-
ление к раковине расширенной нижней частью тела;
раковина тонкостенная, волнистая при виде сбоку.
Род включает у Маттеса (Matthes, 1988) 12 видов,
по Довгалю (Dovgal, 2002), виды L. sacculus Penard,
1914; L. bifaria (Stokes, 1887); L. caepulaLfsnaxA., 1920);
L. multitentaculata (Sand, 1895); L. oviformis (Dons,
1918); L. sivertseni (Allgen, 1951); L. solenophryaformis
(Sand, 1899). В этом списке есть плохо описанные
виды с морских нематод — такие формы в дейст-
вительности имеют обычную раковину с прочным
обособленным стебельком, это вермигеммиды. Лори-
кофрии встречаются редко, но в настое листьев в
Алуште мною найдены 2 вида — с раковиной, как у
L. lauterborni и с раковиной, в точности такого вида,
как ребристые цисты Podophrya', я считал их откры-
тыми цистами подофрий с апикальным пучком щупа-
лец, но позже нашел иллюстрации таких форм в лите-
ратуре. Это может быть особый новый вид и одновре-
менно переходная форма между родами Podophrya и
Loricophrya.
Хорошо изучен вид L. lauterborni, но для диагноза
рода нужно знать вид Th. parva. Судя по рисункам в
первоисточнике, это вид со стилотекой и всего одним
кольцевым ребром раковины, в этом не сходен с пре-
сноводными видами.
Род Paraloricophrya Jankowski,
1978
Типовой вид Paracineta lauterborni Sondheim,
1929, также Р. bifaria (Acineta in Stokes, 1887). Тело
сферическое, щупальца (акротены) отходят во все сто-
роны от вершины тела. Раковина не сплющенная,
овальная, широко открытая спереди, снизу с мелким
коническим стебельком; тело прикреплено только к
нижней части раковины, не к краям устья. Раковина с
поперечными кольцевыми ребрами, более сближенны-
ми в ее нижней половине, у одной из морф похожа на
цисты подофрий (Foissner, 1995). Деление наружное,
томит массивный, с широкой дуговидной полосой рес-
ничек. У L. edmondsoni (King, 1931) тело шире и коро-
че, стебелек меньше, складки раковины только в ее
нижней части.
Сем. Manuelophryidae Dovgal,
2002
Включает 2 рода, адаптированные к паразитизму
на других цилиофорах, — на пресноводных перитри-
хах и сукториях; это привело к упрощению строения,
но сохранился способ размножения делением надвое.
Мелкие овальные не сплющенные клетки с предельно
упрощенным щупальцевым аппаратом; почкование по
типу анизотомии. Включавшийся сюда третий род
Pseudogemmides Kormos, 1935 (Dovgal, 2002) перене-
сен в состав сем. Urnulidae и там ликвидирован как си-
ноним рода Urnula.
Род Manuelophrya Matthes,
1988
Род был предложен для 2 видов разного облика без
указания типового вида и поэтому невалиден; аноним-
ное указание типа в справочнике Zoological Record
тоже невалидно. В моей статье с описанием таких па-
разитов (Янковский, 1997) указан типовой вид Pottsi-
ocles hannae Guhl, 1985 и сохранено авторство Матте-
са, но Аэшт сменила автора рода — Manuelophrya Jan-
kowski, 1997 с типом М. hannae.
Мелкие сферические формы с одним коротким толс-
тым щупальцем, без стебелька и раковины, прикреп-
лены снизу к зооидам перитрих Haplocaulus walteri
и видов Opercularia, высасывают цитоплазму; томиты
округлые, с поперечным кольцом из 3 рядов ресничек.
Род Mistarcon Jankowski,
1986
Типовой вид Pottsia parasitica Nozawa, 1939.
Мелкие округлые клетки, обычно с одним коротким
щупальцем, высасывающие одиночных и колониаль-
ных пресноводных перитрих, прикреплены к вершине
стебелька хозяина специальной секрецией (ножкой),
окружены тончайшей раковиной; внутри раковины де-
лятся на неравные части (анизотомия), томит с поло-
сой ресничек. Типовой материал из Японии (оз. Бива)
с колоний Zoothamnium sp.; длина тела 25—30 мкм,
щупальца 8—9 мкм; мой материал с устья р. Селенга
на Байкале с колоний Epistylis plicatilis; размеры тела
16—35 мкм, томит с 2 вакуолями и 3 сближенными по-
перечными кольцами ресничек.
Первоначальное включение в состав рода Pottsia
(Pottsiocles) ошибочно — это эндогеммины с другим
типом щупальца, заражающие морских сидячих цили-
ат. Таксон предложен мною как «новый род или по-
дрод в составе Pseudogemmides Kormos, 1935» в тези-
сах Конференции, поэтому невалиден и должен дати-
роваться по журнальной статье (Янковский, 1997) —
Mistarcon Jank., 1997.
ТИП CILIOPHORA. КЛАСС PHYLLOPHARYNGEA
703
Сем. Phalacrocleptidae Kozloff,
1966
Включает один род и вид Phalacrocleptes verruci-
formis Kozloff, 1966 с фронтальной поверхности пин-
нул простомальных циррусов сидячей полихеты Schi-
xobranchia insignis (Sabellariidae) в Пацифике у берегов
шт. Вашингтон, США; мной найдены на сабеллидах
Мурмана (Янковский, 1981). Щупики несут сотни пин-
нул с паразитами, прочно прилегающими к эпителию.
Трофонты мелкие (27—50 X 13—17 мкм), веретено-
видные, с плоской нижней стороной тела и выпуклой
верхней; ядро сферическое; стебелька и раковинки
нет. Вся нижняя поверхность тела усеяна десятками
едва заметных бугорков. Размножение изотомическим
делением. С помощью электронной микроскопии было
выяснено строение этих загадочных образований —
это видоизмененные щупальца сложного строения,
с одной стрекательной капсулой в каждом; капсулы
образуются в цитоплазме и мигрируют к образующим-
ся щупальцевидным бугоркам. Они служат для при-
крепления к ресничкам эпителия хозяина и одно-
временно для их высасывания. Нет фазы ресничного
томита и мигранта на всех стадиях цикла, нет кинето-
сом и полос ресничек после деления. Этот род заслу-
живает выделения в особый подотряд или отряд сук-
торий.
Отряд Tachyblastonida Jankowski, 1978
Паразитические суктории со сложным циклом раз-
вития, специфические паразиты на крупных морских
эфелотидах. Мелкий томит прикрепляется к вершине
эфелоты, проникает внутрь, высасывает цитоплазму
мелким апикальным щупальцем, постепенно растет и
проникает все глубже, разрушая сложное ядро хозяи-
на; взрослые трофонты размножаются последователь-
ным отделением наружных почек с небольшой реснич-
ной зоной; почкование, по Довгалю, семи-циркумваги-
нативное. Томиты оседают на стебельках эфелот,
образуют рюмковидную стебельчатую раковину, не
питаются и постепенно делятся на несколько (до 16)
безресничных червеобразных вторичных томитов, за-
ражающих эфелот; в обоих случаях деление наружное.
Это диморфный вид с чередованием стадий трофонта,
трофо-томонта, томонта и 2 типов томитов. Основной
хозяин — Ephelota gemmipara. Одно сем. Tachyblasto-
nidae Grell, 1970 и один род Tachyblaston Martin, 1909 с
типовым видом Т. ephelotensis.
Род Dactylophrya Collin, 1909 (типовой вид D. ros-
covita) — «личиночный род», синоним вида и рода
Мартина, фактически D. roscovita лишь одна из стадий
в сложном цикле развития Tachyblaston ephelotensis.
Вид описан по одной мелкой особи с гидроида Dipha-
sia attenuata на западе Франции; раковинка рюмковид-
ная, с прочным стебельком, зооид с 12—15 толстыми
бутылковидными выростами всей верхней половины
тела, принятыми за щупальца (ядра не окрасили). Нуж-
но сверить даты публикации обоих родов для проверки
приоритета одного из них; Dactylophrya датируется
как «июль—декабрь 1909 г.» и поэтому явно синони-
мичная.
Отряд Ephelotida Raabe, 1964
(рис. 340, б)
Крупные морские суктории в основном стебельча-
тые (кроме симбионтного рода Tunicophrya), в основ-
ном безраковинные (исключение — комменсал креве-
ток Shellephelotay, обычно массивное вазообразное
тело прикреплено к широкому длинному стебельку,
ядро у большинства видов сложной формы, в виде вет-
вистого кольца; щупальца 2 типов — короткие прямые
сосущие и ловчие, длинные и гибкие, обычно более
многочисленные, расположены на всей выпуклой или
сплющенной вершине тела. Обычные, местами мас-
совые перифитонные виды в море от Арктики до Ан-
тарктики, не выносят пониженной солености. Часть
видов — наружные симбионты на ракообразных, со-
храняют типичный облик эфелот; мезобионты видоиз-
менены — в жаберной полости креветок найден адап-
тированный раковинный вид, в мантийной полости
туникат вид без стебелька; на офиурах упрощенные
формы, относимые к этой группе по типу щупалец и
способу размножения. Одно сем. Ephelotidae Kent,
1882 из морского перифитона и с морских беспозво-
ночных, в основном ракообразных.
Род Ephelota Wright, 1859
По Аэшт (Aescht, 2001), тип рода до сих пор не
фиксирован; годом позже Довгаль (Dovgal, 2002) ука-
зал как типовой вид Е. gemmipara (=Podophrya gemmi-
para Hertwig, 1875). Здесь мы встречаемся с самой
трудной группой сукторий — неясны границы и состав
рода, и под этим названием описывали разные виды;
строение сложное, ядра причудливой формы, и, как
правило, виды рисовали упрощенно, не изучалась ди-
намика признаков в онтогенезе.
В список Довгаля включены как валидные виды
Е. gemmipara (тип рода); Е. butschliana (Ishikawa,
1896); Е. coronata Kent, 1881; Е. cothurnata Dons, 1915;
E. crustaceorum (Haller, 1880); E. dalyelli Holt, 1891;
E. gigantea Noble, 1929; E. lacazei (Gourret et Roeser,
1888); E. mammilata Dons, 1915; E. microsoma (Maupas,
1881); E. minima Noble, 1929; E. neglecta Sand, 1899;
E. plana Wailes, 1925; E. pusilia (Koch, 1876); E. suzaki-
ensis Yagiu, 1980; E. thouleti (Maupas, 1881); E. truncata
(Fraipont, 1878).
E. gemmipara — крупный вид с длинным широким
стебельком, частый на гидроидах типа Sertularia', щу-
пальца 2 типов, ядро в виде кольца с ветвящимися
отростками, стебелек кажется полым или имеет не-
большую плотность, часто с поперечными складками.
Почки массивные, толстые, кинетом на вогнутой внут-
ренней стороне — субапикальную скопулу огибает
компактная полоса из примерно 17 рядов в виде широ-
кой дуги, с фрагментцией у одного из концов полосы.
Этот вид и близкие формы часты в перифитоне, иногда
массовые, могут покрывать ветви гидроидов или кор-
ковые мшанки, служат пищей для некоторых морских
беспозвоночных. Эфелоты служат хозяевами не толь-
ко для известного паразита Tachyblaston ephelotensis,
но и для Pseudogemma sp., иногда в массе покрываю-
щих диск эфелот (материал автора с Мурмана).
704
ALVEOLATA
У других видов иные размеры и пропорции тела и
стебелька, разное число щупалец; иногда их немного,
но всегда должны быть 2 типа щупалец как признак
рода. Тщательная работа Ягиу (Yagiu, 1980) по эфело-
там Японии — основа систематики рода.
Род Sargassephelota Jankowski, 1981
Типовой видEphelota butschliana Ishikawa, 1898
из перифитона на морских водорослях Sargassum.
Все эфелотиды, кроме этого рода, имеют лишь апи-
кальные и краевые щупальца на расширенной вершине
тела; этот вид как исключение имеет и добавочное ба-
зальное кольцо длинных ловчих щупалец на нижней
части, вокруг основания тела. Довгаль не принимает
рода, но просто потому, что, «по нашему мнению,
расположение щупалец не является хорошим основа-
нием для разделения родов у эфелотидных сукторий»
(Dovgal, 2002). Почему же только по расположению
щупалец им различаются роды у Allantosomatidae и
других групп? Тип щупалец и их положение должны
быть отражены в системе сукторий; кроме того, еще
раз укажем, что в систематике Metazoa спорный род
принимают как подрод, и в крупных родах сукторий
нужно различить видовые группы и отдельных абер-
рантов на уровне подродов, поэтому таксон Sargasse-
phelota валидный как подрод или род.
Пока лишь 2 достоверные находки рода в морях
Дальнего Востока; указания для Польской Балтики и
для Атлантического берега США неверные, в обоих
случаях показаны обычные эфелоты без базального
пучка щупалец.
Род Discephelota Jankowski, 1981
Типовой вид Ephelota gigantea Noble, 1929; так-
же D. plana (Wailes, 1925). Этот род — промежуточное
звено между Ephelota и Podocyathus; имеется массив-
ный плоский эпикон, не вогнутый и не чашевидный; у
эфелот он лишь намечается, а у Podocyathus превра-
щен в чашевидную раковину.
Род Metephelota Willis, 1945
Типовой в ид М coronata с китов — массивный
вид с периферическими кольцами ловчих щупалец во-
круг низких прикрепительных щупалец; вершина тела
с широкой и глубокой полостью. Хорошо изучено
строение, в частности на срезах тела при окраске; вид
не встречен в перифитоне. Довгаль в состав рода, все-
гда монотипического, включает также Podocyathus ех-
cavatus Dons, 1938 (М excavata) с вогнутым апексом;
вид описан из перифитона в Норвегии.
Род Podocyathus Kent, 1882
Типовой в и д Р. diadema-, также Р. paguri Zhadan
et Mikrjukov, 1996, частый обрастатель на ротовых
придатках пагурид в наших северных и дальневосточ-
ных морях. У Р. diadema тело некрупное, ядро округ-
лое (важное отличие от эфелот), щупальца 2 типов, но
немногочисленные; чашевидная раковина плотная,
фактически превращена в физон; трофонт сидит на дне
вдавленного складчатого конуса; стебелек тонкий и
длинный, вероятно пустой. Такой род может быть пе-
реходной формой к парацинетидам, также имеющим
наружное почкование.
Род Coronocyathus Jankowski gen. n.
Типовой вид Podocyathus excavatus Dons, 1938 c
блюдцевидным плоским эпиконом, ветвящимся коро-
новидным ядром и глубокой апикальной полостью; я
предложил род Discocyathus Jank., 1981; это гомоним,
и название заменятся новым. С переносом вида в со-
став Metephelota (Dovgal, 2002) я не согласен, у них
разный тип эпикона. Неясно, постоянна ли полость
или образуется временно после почкования — отделе-
ния группы массивных почек.
Род Shellephelota Jankowski,
1981
Типовой вид A branchialis. Типичные эфелоти-
ды лишены раковины; у части видов начинается рас-
ширение эпикона, что приводит к образованию обшир-
ного ложа — диска, на котором расположен трофонт у
Discephelota. Трофонты .S'. branchialis целиком заклю-
чены в тонкостенную раковину, сохраняя при этом ти-
пично эфелотидный внешний облик, обширный эпи-
кон, 2 типа щупалец и коронообразное ядро; раковина
с правильными продольными вздутиями (волнистая) в
соответствии с ветвлением макронуклеуса. Симбион-
ты в жаберной полости япономорской креветки Panda-
lus latirostris заменяются другими симбионтами у кре-
веток Мурмана.
Род Thaumatophrya Collin, 1912
Типовой вид Th. trold{Podophrya troldClaparede
et Lachmann, 1859) из морского обрастания — найдена
лишь одна особь на водоросли Ceramium в Норвегии;
тело некрупное (75 мкм), сферическое, эпикона нет,
прикрепление непосредственно к тонкому длинному
стебельку; имеется немного длинных радиальных лов-
чих щупалец с расширенными основаниями по всему
телу и одно апикальное прикрепительное щупальце;
выявлены внутренние томиты. В каталоге Довгаля ва-
лидный род и вид, но он пока не описан достаточно
убедительно и старинный диагноз может быть оши-
бочным. Непрерывная смена родов {Podophrya, Toko-
phrya, Thaumatophrya, Ephelota) отражает неизучен-
ность вида и его неопределенное положение в системе.
Возможно, это лишь стадия развития крупной перифи-
тонной эфелоты. Описание 2 внутренних томитов и
процесса питания (заглатывание цилиат без высасыва-
ния) кажется ошибочным. Автор рода Коллен (Collin,
1912) сближал род с эндогеммидой Discophrya lyngbyei
(ныне Corynophrya).
ТИП CILIOPHORA. КЛАСС PHYLLOPHARYNGEA
705
Род Tunicophrya Jankowski, 1973
Типовой в и д Ephelota sessilis Collin, 1912. Тело
закруглено при виде с вершины, толстое, со сложно
ветвящимся ядром и 2 типами щупалец; трофонт ти-
пично эфелотидный, но полностью утерян стебелек и
эпикон, трофонты приклеены к поверхности мантии в
жаберной полости туникат в морском бентосе (асци-
дии) и пелагиали (сальпы).
Род Ophiurephelota Jankowski, 1981
Типовой вид (9. tenax — бесстебельчатые эфе-
лотиды с вазообразным телом, прикрепленные неболь-
шим диском; щупальца вероятно лишь одного типа;
ядро извитое, но не ветвящееся, не коронообразное,
как у эфелот. Отсутствие стебелька отличает род от
большинства эфелотид; вазообразное тело, форма ядра
и щупалец — от бесстебельчатого рода Tunicophrya.
Около 15—20 коротких и толстых щупалец располо-
жены в основном по краям расширенного антерона;
прикрепление мелкой ножкой с небольшим базоди-
ском. Вид специфичен для офиур, найден на Мурмане
и в Белом море на лучах Ophiopholis aculeata. Редкий
вид, стадии размножения не отмечены.
Род Alderia Pritchard,
1852
Род предложен для 3 видов морских сукторий раз-
ного типа, описанных и зарисованных без латинских
названий в одной из публикаций. 2 вида с рюмковид-
ной раковиной и апикальными щупальцами принадле-
жат несомненно к Paracinetidae, третий вид с широки-
ми острыми щупальцами, на массивном стебельке без
эпикона — типичная Ephelota gemmipara, описанная
позже вида Alderia apiculosa ‘Pritchard, 1852. Автор
рода позже считал его гомонимом (это ошибка) и сино-
нимом рода Ephelota Wright, 1858; вид был принят как
валидный, но определения материала как Е. apiculosa
были ложными, для форм с массивным эпиконом; в со-
временных списках сукторий его нет.
Toji.Hemiophrya Kent, 1882 был предложен для эфе-
лотид без указания типа; название часто использова-
лось рядом авторов, но постепенно было вытеснено
приоритетным названием Ephelota. Из серии видов:
Н. crustaceorum (Haller, 1880); Н. dalyelli Holt, 1891;
Н. gemmipara in Kent, 1882; H. lacazei Gourret et Roeser,
1888; H. microsoma'M.aup&s, 1881;H. truncata (Fraipont,
1878); H. pusilia (Koch, 1876); H. thouleti Maupas, 1881
и другие как типовой я выбираю Н. gemmipara и свожу
род Hemiophrya в синонимику рода Ephelota.
Подкласс Endogenia Collin, 1912
Почкование внутреннее, обычно моногеммическое — мелкий
подвижный томит с кольцевыми ресничками в компактной полосе
образуется в камере (томосфере), связанной с порой в кутикуле ка-
налом; по мере роста томита камера расширяется, томит вращается
в ней, выходит и уплывает. Стадии полигеммии (несколько томи-
тов в одной камере) наблюдаются при быстром почковании особей
на линяющих рачках у симбионтов; в норме трофотомонты непре-
рывно питаются и продуцируют по одному томиту.
Томит имеет аргентофильную субапикальную или боковую
скопулу, почти замкнутое ресничное кольцо из нескольких кинет;
величина и форма томита, число рядов может служить дополни-
тельной характеристикой видов. К примеру, мелкие активные то-
миты с несколькими кинетами образуются у Acineta foetida, гигант-
ские темные медленно вращающиеся томиты с полем кинет собра-
ны с камней, покрытых массой крупных ацинет типа A. papillifera.
Наличие эндогеммии позволит также решить вопрос о системати-
ческом положении аберрантных видов с нетипичной формой тела,
например пелагических сукторий (многие виды сукторий описаны
без сведений о способе размножения). После оседания томита мор-
фогенез идет очень быстро, реснички сбрасываются, секретируется
стебелек; молодой трофонт непохож на томонта, щупальца могут
быть рассеяны по сферическому телу.
Крупный таксон, включает виды в пресноводном и морском
перифитоне, в пелагиали, большое число симбионтов и паразитов,
в частности виды, паразитирующие на других сукториях (эндосфе-
ры, псевдогеммы).
Отряд Acinetida (рис. 338, а—-339, а)
Авторство в современной литературе приписывают
Раабе (Acinetida Raabe, 1964), но такой таксон сущест-
вовал давно и носил разные названия — Acineta (сов-
падает с названием рода), Acinetina, Acinetia, Acinetiens,
Acinetaria, обычно для обозначения всех сукторий. К
примеру, у Причарда (Pritchard, 1861, р. 564) есть «sub-
group Acinetina — a subclass of Rhizopoda» (сукторий
вначале сближали с корненожками). Постепенно распро-
странились названия Tentaculifera и Suctoria (вариан-
ты — Suctorea, Suctoriae, Suctorida, Succeurs). Поэтому
авторство отряда Acinetida можно приписать Причар-
ду или другим ранним авторам (пока неясно, кто пред-
ложил его первым), но никоим образом не Раабе.
Внутренняя система эндогеней пока недоработана,
различение отрядов и подотрядов преждевременно, но
в любом случае следует отделить вторичнобезротых
эндопаразитов (Endosphaera) на уровне отряда. Система
семейств тоже несовершенна и условна; здесь принят
за основу каталог Довгаля (Dovgal, 2002), но с измене-
ниями — без сем. Choanophryidae, без отряда Trichophry-
ida и т. д. Есть несколько четких групп родов (группа
Acineta, группа Tokophrya, группа Dendrosoma), но есть
много одиночных аберрантов без переходных форм,
которые требуют обособления на уровне семейств.
Сем. Acinetidae Ehrenberg, 1838
В основном раковинные формы; щупальца апи-
кальные, в боковых пучках у ацинет, у ряда родов вто-
рично видоизменено их строение и положение. Бентос
и планктон, комменсалы и паразиты.
Род Acineta Ehrenberg, 1834
Типовой видД. tuberosa Ehrenberg, 1834;ранние
названия «tuberosa Pallas» и «.tuberosa Muller» призна-
ны непригодными, тем более что это название впервые
45 Зак. №4163
706
ALVEOLATA
применили не для морских раковинных ацинет, а для
прудовых токофрий. Решением ICZN все прежние обо-
значения аннулировали; морфология типового вида —
в монографии Эренберга (Ehrenberg, 1838). Под этим
названием и после Эренберга описывают и опреде-
ляют множество разных видов, иногда выделяя
«subsp.» и «var.» (brevistyla, longistyla и подобные); мо-
нография пресноводных сукторий Маттеса (Matthes,
1988) — пример такой дезинформации, как Л. tuberosa,
в ней обозначены многие валидные виды, к примеру
специфические симбионты с очень коротким стебель-
ком на жабрах пресноводных креветок (A. karamani).
Тип рода — это морской вид; в пресных водах часты
виды с мелким или длинным стебельком, но типичная
A. tuberosa, вероятно, не встречается. Аналогично, есть
много указаний мелкой A. foetida для пресных вод, но
в моих лабораторных культурах из Охотского и Черно-
го моря вид совершенно не выносил пресной воды.
Типичная A. tuberosa из моря и эстуариев имеет вид
плоского удлиненного треугольника, длина стебелька
равна или немного меньше длины тела (Batisse, 1966);
томит с 7—8 кинетами в длинной дуге вокруг скопулы
(крайние ряды могут быть укорочены). Ацинеты име-
ют плоский треугольный панцирь с апикальной щелью,
расширенной на обоих концах, где расположены не-
большие вздутия тела (актинофоры), с пучками тонких
длинных булавовидных легко сократимых щупалец
(акротены); их каналы продолжаются в цитоплаз-
ме. Если щупальца раположены рядами (в линию)
вдоль щели, как у A. bocqueti, такие виды нельзя отно-
сить к ацинетам. Панцирь у A. tuberosa прочный, у
близкого морского вида A. laomedeae очень тонкий,
смятый, с желобками. Если имеется четкий постоян-
ный узор раковины в виде диагональных желобков,
можно отделить такие виды на уровне подрода или
рода; пример — мелкие виды с морских клещей A. sul-
cata Dons, 1927 и A. benaesepta Schulz, 1934 с прочным
гофрированным панцирем. Этот признак, как и линей-
ное положение щупалец вдоль щели, может показаться
незначительным, но внутри рода можно группировать
виды в подроды по любому признаку. Дальше приво-
дится ряд моих родов, которые лучше считать подро-
дами внутри крупных родов Acineta и Tokophrya. Мо-
дификация вершины стебелька у крупных пресновод-
ных и галофильных видов — еще один подродовой
признак. Ядро округлое или овальное, вакуоль обычно
одна, с выводным канальцем; стебелек четко отграни-
чен от раковины. Зародышевая камера («томосфе-
ра» — новый термин) небольшая, расположена неда-
леко от устья раковины.
Полный список видов приведен у Довгаля (Dovgal,
2002); этот род и Tokophrya принадлежат к крупней-
шим родам сукторий. В пресных водах часто встреча-
ются мелкие виды A. brevicaulis Rieder, 1936; A. limne-
tis Goodrich et Jahn, 1943; A. variabilis Nozawa, 1938;
A. fluviatilis Stokes, 1885 и др., и крупные формы с
длинным стебельком, часто с модификацией зоны кон-
такта раковины и стебелька — A. papillifera Керреп,
1888 (в оригинале pappilifera); A. compressa С. et L.,
1859; A. maxima Rieder, 1936; A. grandis Kent, 1882.
Встречаются участки с массовым развитием ацинет —
на водорослях и водной траве в ручьях и реках в зонах
обилия развития колониальных перитрих.
Облигатно-симбионтные виды — A. baikalica
(Swarczewsky, 1929); A. commensalis (S., 1929); A. bre-
vistylalS., 1929); J. tubulifera(S., 1929); A. talitris Jank.,
1981; A. nitocrae Dovgal, 1984; A. gammari (Penard,
1920); A. dentata (S., 1929); A. karamani Hadzi, 1940; A.
branchicola Precht, 1935; A. euchaetae Sewell, 1951;
A. puteana Moniez, 1889; A. schulzi Kahl, 1934; A. am-
phiasci Precht, 1935; A. branchicola Precht, 1935; A. co-
rophii Collin, 1912; A. paratuberosa Nie et Ho, 1943 и
др., в основном на креветках, пагуридах, крабах, мизи-
дах, амфиподах, копеподах; большинство таких видов
в море; небольшая группа симбионтных ацинет на гам-
маридах Байкала (по ошибке приписаны к роду верми-
геммин Thecacinata), единичные виды на пресновод-
ных креветках, гаммаридах, копеподах. Ряд перифи-
тонных видов плохо описан и может принадлежать к
неродственному имитатору ацинет — роду Periacineta
с другим типом почкования; обычно у пресноводных
ацинет ядро овальное, у периацинет вытянутое (при-
мер — Acineta urceolata Stokes, 1885 — внешне, как
ацинета, но явно дискофриида).
Непригодные названия — Autacineta, Caneliana,
Tomodiscophrya, Silenella. Поскольку название Acineta
вначале применяли для всех сукторий, род Acineta был
переименован в Autacineta Haeckel, 1866, что по прави-
лам недопустимо. Название Tomodiscophrya Jank.,
1981 предложено для A. paratuberosa с пресноводных
креветок Китая ввиду особого строения томита —
с ресничной полостью между концами ресничной
дуги (я не нахожу ее у других ацинет); если такое раз-
личие существует, оно слишком незначительное.
Род Silenella Fenchel, 1965 (типовой вид б. ovoidea F.,
1965) с галофильных гаммарид Дании — это томит
неизвестного вида сукторий, вероятно Acineta с тех же
хозяев.
Род Noracineta Jankowski, 1978
Типовой вид Acineta infundibuliformis Wang et
Nie, 1933. Морской вид из Китая, обычен в перифито-
не на водорослях, вероятно южный эндемик. Тело не-
высокое, резко растянуто в стороны; по краям 2 пучка
или 2 ряда щупалец, направленные вбок; ядро оваль-
ное. Раковина и стебелек не разграничены (типичная
стилотека); резко сужаясь, раковина переходит в длин-
ный тонкий стебелек длиной около 52 мм (равен высо-
те раковины). Размножение не изучено. Род валидный,
если действительно имеет стилотеку. По Курдсу
(Curds, 1987), это вид рода Anthacineta.
Род Plicophrya Jankowski, 1978
Типовой вид Acineta sulcata Dons, 1927, частый
на галакаридах Мурмана. Это новое название для го-
монима Donsia Jankowski, 1975 (есть род фолликули-
нид Donsia Hadzi, 1951); указание у Аэшт вида Donsia
sulcata Jankowski, 1967 неверно. Мелкие ацинеты с
низким стебельком и широким телом из морского пе-
рифитона; раковина складчатая. Род не принимали, по-
скольку тонкая раковина ацинетид может быть склад-
чатой, смятой, особенно у голодных форм или после
ТИП CILIOPHORA. КЛАСС PHYLLOPHARYNGEA
707
ныхода крупного томита; в культурах мелкого вида с
очень гонкой раковиной Acineta fоetida такие непра-
вильные складки видны у многих особей.
У Р. sulcata имеется очень четкий и постоянный
паттерн ребер и желобков (складок), характерный для
и и да -— несколько симметричных концентрических
ребер встречаются вдоль срединной линии каждой
стороны раковины и расположены зеркально. Этот
утор не зависит от стадии размножения или от упитан-
ности особи; поэтому признак рода — не наличие слу-
чайных складок, а строго определенный рельеф панци-
ря. Такие виды встречаются на галакаридах и острако-
дах морской литорали. К роду (или подроду ацинет)
можно отнести также A. benaesepta Schulz, 1934 с гала-
карид и A. harpacticicola Precht, 1935 с копепод Nitocra
spinipes.
Род Crossacineta Jankowski, 1978
Типовой вид Acineta ornata Sand, 1899. Мелкая
(40—45 мкм) морская суктория с несплющенной рюм-
ковидной раковиной, несущей на поверхности 10—15
выпуклых ребер (опорных колец); трофонт с 2 краевы-
ми пучками щупалец. Все ацинеты с 2 пучками, плос-
кие, не рюмковидные. После первоописания вид не
был вновь найден и остался неизученным. Род пока
условно отнесен к ацинетидам, не должен включаться
в определительные таблицы сукторий. Второй вид Aci-
neta annulata Wang et Nie, 1932 (Crossacineta annulata
comb. n.).
Род Acinetella Jankowski, 1978
Типовой вид Acineta pappilifera Keppen, 1888
(позже принято написание A. papillifera). Крупный вид
из Черного моря у Одессы с длинным стебельком; в
зоне контакта раковины и стебелька имеется уплотне-
ние (шарнир) или небольшая полость, здесь структура
усложнена. Этот признак может быть незначительным
для рода, но пригоден при разделении рода Acineta на
подроды. К этому таксону принадлежат один или не-
сколько пресноводных и солоноватоводных видов
ацинет с особо длинным стебельком; старинные ри-
сунки немногочисленные и неточные, шарнир на гра-
нице стебелька и раковины могли не заметить, и это
усложняет синонимизацию крупных видов ацинет. Со-
став рода (подрода): A. cucullus С. et L., 1859; A. maxi-
ma Rieder, 1936; A. flava Kellicott, 1885; Л. grandis Kent,
1882; A. compressa С. et L., 1858 (часть видов невалид-
на как явные синонимы).
Род Trematosoma Batisse, 1972
Типовой вид A. bocqueti Guilcher, 1950 по моно-
типии, с гарпактикоидных vxmQ-nopPorcellidium fimbri-
atum. Мелкие низкие короткостебельчатые суктории с
широким плоским телом, с большим числом щупалец
в 2 четких верхних рядах правее и левее поры гомо-
сферы, не в краевых пучках; вид можно принять за па-
рацинет, но томит типично ацинетидный. В состав
рода Довгаль включает также виды Т. amphiasci
(Precht, 1935); Т. pusilia (Maupas, 1881); Т. complanata
(Gruber, 1884); T. constricta (Collin, 1909); T. rotunda
(Allgen, 1952); T. falcata (Japk., 1981).
Род Conchacineta Jankowski, 1978
Типовой вид Acineta constricta Collin, 1909, сим-
бионт на щетинках ног Eupagurus cuanensis и других
пагурид Франции. Длина раковины 50—60 мкм, сте-
белька 80 мкм; раковина плоская, широкая, дуговид-
ная на вершине, с выемками сбоку в местах прикрепле-
ния тела; стебелек тонкий и длинный, четко отделен от
дна раковины. Трофонт подвешен к устью раковины;
щупальца — акротены в продольных рядах вдоль апи-
кальной щели. Томит массивный, с увеличенным чис-
лом кинет. Рисунки Коллена (Collin, 1912) и Батисса
(Batisse, 1994) идентичные; Курде (Curds, 1985а) и
Батисс, автор рода Trematosoma, считают Conchacineta
валидным родом по форме раковины, а Довгаль вклю-
чает вид в состав Trematosoma.
Род Rimacineta Jankowski, 1981
Типовой вид/?, falcata. Мелкий вид из морского
перифитона, открыт на фукусах Мурмана; плоская ши-
рокая раковина на тонкой ножке, расширяется к вер-
шине; щупальца в 2 верхних рядах; отличие от трема-
тосомы — четкая система концентрических ребер по
обоим краям раковины, с постепенным сближением к
расширенному основанию. Вновь мы имеем характер-
ный видовой паттерн, а не случайные складки смятой
раковины; это особенно наглядно, если рядом распо-
ложить Acineta tuberosa, Plicophrya sulcata и Rimacine-
ta falcata с 3 разными типами панциря.
Род Soracineta Jankowski,
1978
Типовой вид Acineta dibdalteria Parona, 1881. Ред-
кий морской вид со стебельком и раковиной, как у
мелких ацинет, без поперечных складок; на краях ра-
ковины по одному длинному гибкому толстому щу-
пальцу с акроном длиной до 40 мкм. Раковина мелкая
(50 мкм) на стебельке длиной 30 мкм. Сам автор вида
считал его новым родом, не дав латинского названия.
Второй вид S', orchestii Dovgal, 1999 с талитрид супра-
литорали Черного моря автору обзора найти пока не
удалось, на видах 3 родов талитрид здесь встречается
лишь мелкая ацинета обычного типа (видовая группа
A. corophii) с краевыми пучками щупалец.
Род Anthacineta Jankowski, 1978
Типовой вид Acineta craterellus Collin, 1909.
Крупный морской вид с рюмковидной не сплющенной
раковиной на высоком стебельке; тело широкое, с
2 краевыми пучками щупалец, лишь нижняя часть тела
погружена в раковину. Пока достоверно вид не пере-
708
ALVEOLATA
описан и род провизорный, но Довгаль включил в со-
став Anthacineta вид Acineta infundibuliformis Wang et
Nie, 1933 и мелкий пресноводный вид Л. swarczewskyi
Collin, 1911 со сходной формой раковины. Род принят
в определителе Курдса (Curds, 1987).
Род Veracineta Jankowski, 1978
Типовой вид. Acineta tisbei Guilcher, 1950 с мор-
ских гарпактикоидных копепод Tisbe furcata, по Дов-
галю, также перифитонный пресноводный вид V. pyri-
formis (Acineta in Stokes, 1891). Раковина рюмковид-
ная, на тонком стебельке; трофонт апикальный (явно
голодная особь), с радиальными щупальцами на вер-
шине. Напоминают парацинет, обычных в море. Ва-
лидный род в определителе Курдса.
Род Sparsacineta Jankowski, 1978
Типовой вид Acineta complanata Gruber, 1884.
Морской свободноживущий вид из Италии, пока мало-
изученный. Тончайший длинный стебелек несет рако-
вину, вероятно семитеку, не покрывающую всего зоо-
ида (можно обозначать как «базальная раковина»). Не-
многочисленные щупальца по одним авторам в 2
боковых пучках, по другим рассеяны по телу без осо-
бого порядка над устьем раковины. Это акротены, тон-
кие длинные палочки с акроном. До повторного описа-
ния вида род спорный, не должен включаться в опре-
делители сукторий.
Род Vasacineta Jankowski, 1981
Типовой вид Acineta cuspidata Kellicott, 1885 из
пресноводного перифитона на нитях Oedogonium в Ка-
наде. Мелкая широкая рюмковидная раковина с глубо-
кими вырезками по краям, на очень короткой ножке; с
каждой стороны пучки очень длинных гибких змее-
видных щупалец, подвижных, как щупальца гидры.
Есть некоторое сходство с метацинетами, но у послед-
них неизвестен подобный тип щупалец. Повторного
переописания и валидации рода нет. Для A. cuspidata
предложен также 'род Kellicotta Curds, 1985 (синоним).
Не исключена принадлежность рода к Metacinetidae.
Возможный синоним —Acineta flexilis Stokes, 1894, с
гибкими щупальцами.
Род Slitarcon Jankowski, 1986
Типовой BnpAcineta laevis Dons, 1918. Загадоч-
ный вид из морского перифитона на литоральных во-
дорослях; открыт в Норвегии, очень част на Мурмане;
никогда не удалось видеть щупальца, даже сократив-
шиеся. У ацинет даже при полном сокращении щу-
пальца легко видны, в частности при фиксации форма-
лином. У A. laevis либо особый тип щупалец, либо их
нет. На фукусах, камнях, затонувшей древесине можно
найти мелкие особи (раковина 50 X 50 мкм, стебелек
до 15 X 8 мкм) с плоской раковиной, с дуговидным
верхним краем и коротким широким стебельком;
внешне, как ацинеты, но всегда без щупалец. В норме
у фиксированных ацинет щупальца сокращаются, но
не втягиваются в тело. Похожи на Acineta dibdalteria
(Soracineta), но стебелек короче и шире. Этот род пока
нельзя включать в определители сукторий.
Род Phyllacineta Jankowski,
1978
Типовой вид Acineta jolyi Maupas, 1881, по До-
вгалю, также A. tripharetrata Entz, 1902. Несомненно
неродственные виды из моря и пресной воды. Морской
вид очень крупный (длина раковины 71—104, стебель-
ка до 180 X 2 мкм), на длинном стебельке, с апикаль-
ным пучком щупалец в дополнение к 2 стандартным
для ацинет краевым пучкам; встречается в перифитоне
сублиторали, на раковинах и на панцире ракообраз-
ных; типовая раса на гидроидах и мшанках в тралах у
Алжира; раковина очень плоская, ромбическая, не тре-
угольная, как у ацинет. Пресноводный вид Энтца не
был включен при установлении рода, поскольку он
едва ли родствен морскому виду; формально он может
числиться в составе Phyllacineta (3 пучка щупалец), но
это конвергенция.
Несколько родов, включенных Довгалем (Dovgal,
2002) в состав Acinetidae, не имеют характерной рако-
вины; 3 рода перенесены в состав токофриид (Crypta-
cineta, Ciyptophiya, Acinetides).
Сем. Acinetopsidae Jankowski,
1978
Типовой вид единственного рода Acinetopsis
Robin, 1879 (А. гага) найден на гидроидах; тело сплю-
щено, в высокой стебельчатой гладкой раковине; вмес-
то пучков щупалец видно единственное длинное (до
1 мм) апикальное очень подвижное гибкое сократимое
щупальце. Вероятно, этот же вид описан с гидроидов
как A. tentaculata Root, 1922 — у первого вида размно-
жение не изучено, у второго найдена эндогеммия; вид-
ны короткие щупальца вдоль щели и 1, редко 2 цент-
ральных гибких гофрированных щупальца длиной до
0.5 мм при длине раковины около 187 мкм. Питание
зооидами суктории Ephelota, около которой поселяет-
ся этот специфический хищник. Возможно есть 2 раз-
ных вида с 2 типами щупальцевого аппарата, но Батисс
(Batisse, 1994), повторно изучивший вид, определяет
его как А. гага — щупальца акротены вдоль всей апи-
кальной щели и массивное, гигантское осевое сократи-
мое щупальце.
На Байкале по одной особи описан вид Acinetopsis
elegans Swarczewsky, 1929, включенный Довгалем в
состав данного семейства, но это, конечно, аномалия у
обычной токофрии без раковины и без краевых пучков
щупалец, вид невалидный. Длинностебельчатая рако-
вина вида типичная для крупных ацинет, частых в Бай-
кале; при специальном поиске вид не был вторично
найден в перифитоне и на гаммаридах; препарат Свар-
чевского (выцветший кармин) залит бальзамом и не
может быть изучен при иммерсии.
ТИП CILIOPHORA. КЛАСС PHYLLOPHARYNGEA
709
Сем. Tokophryidae Jankowski, 1978
Во всем типичные ацинеты, но без раковины, ино-
гда с мукозным покровом; как правило, это треуголь-
ные плоские формы с небольшими вздутиями (актино-
форами) по краям, несущими пучки щупалец. Число
актинофоров варьирует (1—4), как и их положение.
Это более примитивные формы, чем Acinetidae, и они
более разнообразны по строению, прочный кортекс не
ограничивает изменчивости актинофоров. Процесс
размножения и томиты у обоих семейств идентичные.
Основное разнообразие ацинетид в море, токофриид в
пресных водах; значительная эволюция и разнообра-
зие последних — у симбионтов байкальских гаммарид.
Находки токофрий в море единичные и требуют по-
вторного изучения.
Род Tokophrya Butschli, 1889
Большинство видов имеет 2 пучка щупалец, а на-
звание рода ассоциируется именно с такими видами,
как Т. cyclopum, Т. lemnarum, Т. infusionum и другими
обычными токофриями; в качестве типового, однако,
был неудачно выбран аберрантный вид Т. quadripartita
{-Podophrya quadripartita Claparede et Lachmann,
1859), который был уже ранее обозначен как типовой
для рода Epitokophrya. Довгаль не считает число акти-
нофоров важным для систематики, но мнения разные,
и теперь необходимо отделить виды с 2 пучками от не-
скольких форм типа Т. quadripartita-, возникает тяже-
лая проблема родового названия — дать новое или ис-
пользовать один из синонимов.
Тип рода — крупный конический не сплющенный
вид с 4 бугорками (актинофорами) по краю расширен-
ной апикальной площадки, каждая с пучком радиаль-
ных щупалец; прикрепление длинным стебельком;
этот вид част в перифитоне и на крупных колониях пе-
ритрих. Тенденция к симбиозу с перитрихами отмече-
на уже первыми микроскопистами, характерна именно
для этого вида, не для Т. infusionum или Т. lemnarum.
Это типовой вид рода Epitokophrya Jankowski, 1978,
установленного вначале как подрод токофрий; данный
род теперь уходит в синонимику.
В каталоге Довгаля (Dovgal, 2002) 5 родовых сино-
нимов и около 45 видов; число пучков щупалец и их
расположение, сплющивание раковины не считаются
родовыми признаками. При таком объеме полиморф-
ный род должен делиться на подроды, для которых
можно использовать синонимичные родовые назва-
ния. Синонимами признаны роды Trinacineta, Armia-
cineta, Sibiracineta, Tokophryona, Basitokophrya, обсуж-
даемые ниже, и род Hypophrya (дискофрииды?). Спис-
ки рода у Довгаля и Маттеса (Matthes, 1988) во многом
различаются; в частности, Маттес не признает валид-
ными виды с гаммарусов Байкала, кроме одного
«крайне изменчивого» вида Т. emarginata-, у Довгаля
эти виды валидные.
Оставляя в стороне плохо описанные, синонимич-
ные и неродственные виды (дискофрииды?), а также
виды только с 2 и 3 пучками щупалец, мы можем оста-
вить в составе рода Tokophrya sensu novo только тип
рода Т. quadripartita-, компромиссное решение — под-
разделение сборного рода Tokophrya на серию подро-
дов, включая особый подрод для пропущеного в
определителе Маттеса вида с циклопов Т. multifascicu-
lata Kormos, 1938 с беспорядочным положением пуч-
ков щупалец.
Синонимы типового вида — Acineta quadriloba Ste-
in, 1859; Т. quadripartita var. longicollis Penard, 1920;
T. mutica (Bovee, 1981); T. trionyxa (Bovee, 1981). Вид
T. emarginata Sw., 1929 описан только по одной особи
с переоподы байкальской гаммариды Odontogammarus
improvisus с глубины 80 м; 4 актинофора расположены
внутри широкой апикальной площадки, стебелек ко-
роткий, этот вид можно считать валидным.
Удаление из состава рода видов с 2 актинофорами
может быть не принято, и пока можно считать их по-
дродом; пригодно любое из синонимичных названий,
например Basitokophrya Jankowski, 1982. Этот подрод
включает свободные и симбионтные виды; типовой
вид Tokophrya ornata Gajewskaja, 1933, мелкий вид
(30—35 мкм) с массивным стебельком, резко расши-
ренным в виде ребристого эпикона, симбионт неопре-
деленных гаммарид Байкала.
Примеры видов подрода (это большинство видов
рода) — Т. actinostyla Collin, 1912; Т. beetoni Small et
Lynn, 1985; T. bengalensis Ghosh, 1929; T. diaptomi
(Kellicott, 1885); T. phreaticum Ueno, 1962; T. stammeri
Strouhal, 1939; T. infusionum (Stein, 1859); T.wenzeli
Matthes et Stiebler, 1970; T. cyclopum (C. et L., 1859);
T. tritoni Guilcher, 1951; T. microcerberi Delamare et
Chappuis, 1956 и др. Часть видов — облигатные симби-
онты водных клещей, изопод, каланоидных и циклопо-
идных копепод, гаммарид, тритонов; я впервые нашел
токофрий на остракодах и олигохетах. По непонятной
причине Сварчевский (Swarczewsky, 1929) отнес всех
открытых им байкальских ацинет к морскому роду
вермигеммин Thecacineta, а всех новых токофрий к
Acineta-, эта ошибка мной давно исправлена. Виды с
2 актинофорами в Байкале, симбионты гаммарид —
Т. cornuta, Т. sphaerifera, Т. lobata, Т. cordiformis,
Т. crypturopi, Т. biloba, Т. ovalis, Т. commensalis, Т. par-
va, Т. pulchra, Т. foecunda, Т. vulgata, Т. pumila, Т. pusil-
ia и Т. pygmaea.
Роды Volverella Bory de Saint Vincent, 1824 {V. asto-
ma) и Halsis Stokes, 1889 {H. furcata) (Halsiopsis in Sto-
kes, 1894) — неопределимые суктории, возможно, со-
ответственно трофонт и томит токофрий (описан без
рисунка как простомата). Эти названия непригодны
для подродов.
Можно предложить следующий вариант класси-
фикации токофриид. Род Tokophrya sensu lato делится
на подроды, которые не могут быть синонимами са-
мого рода; подроды (группы видов или одиночные
аберранты) можно различать по любым мелким при-
знакам, даже просто по форме тела; можно учесть чис-
ло пучков щупалец и их положение, строение сте-
белька.
Подрод Tokophrya s. str. — 4 пучка щупалец на ак-
тинофорах в углах широкого апекса.
Типовой вид Г. quadripartita (С. et L., 1859).
Подрод Tokophryopsis Swarczewsky, 1928 — 4 ши-
роких площадки с массой щупалец в каждой, ограни-
ченные валиком.
Типовой вид Tokophrya gigantea (Sw., 1928).
710
ALVEOLATA
Подрод Tonophrya Jank. subgen. n. — 2 четких крае-
вых пучка щупалец, вершина стебелька (эпикон) не
выражена, в пределах нормы.
Типовой вид Г. infusionum (Stein, 1859).
Подрод Basitokophrya Jank., 1982 subgen. n. —
2 пучка, эпикон обширный.
Типовой вид Г. ornata Gaj., 1933.
Подрод Armiacineta Jank., 1982 subgen. n. — удли-
нены оба актинофора в виде ветвей тела.
Типовой вид Л. seticola Jank., 1982.
Подрод Sibiracineta Jank., 1982 — эпикон образует
крупное коническое вздутие (физон), трофонт прикле-
ен к нему широким нижним концом тела; типовой вид
.S'. endemica Jank., 1982. До подрода можно снизить
ранг любого из приведенных ниже родов.
Род Tokophryopsis Swarczewsky,
1929
Типовой вид Г. gigantea с гаммарид Байкала;
найдена лишь одна особь на переоподе Poeckilogam-
marus sukaczewi с глубины 140 м. Вид имеет 4 актино-
фора, тело коническое, широкое, прикрепление тон-
ким длинным стебельком, но это не обычная повсюду
Т. quadripartita, актинофоры которой — вздутые уча-
стки тела; у байкальского вида это широкие круглые
площадки с массой щупалец в каждом, ограниченные
кольцевым валиком. Вид имеет 4 такие площадки,
хотя часто указывают только 3. Род сохранен как ва-
лидный и монотипический в каталоге Довгаля.
Род Tokophryona Jankowski, 1982
Типовой в и д Г. pelagica — очень мелкие сфери-
ческие формы диаметром 30—35 мкм с несколькими
апикальными щупальцами и тонким нитевидным сте-
бельком длиной 20—32 мкм; эпибионты на цианофи-
тах Anabaena в прибрежном планктоне Байкала, пита-
ются высасыванием вортицеллид Haplocaulus и Pseu-
dovorticella, поселяющихся на тех же водорослях;
щупальца немногочисленные, очень длинные, в одном
апикальном пучке. Вероятно, это облигатно-планктон-
ный вид с синезеленок, как и сопутствующие коротко-
стебельчатые перитрихи, детально изученные Фойс-
снером (Foissner et al., 1999).
Род Armiacineta Jankowski, 1982
Типовой вид A. seticola. Трофонты мелкие,
мешковидные, без раковины, с 2 длинными актинофо-
рами, несущими на вершине пучок щупалец; стебелек
короткий; особи локализованы на ногах у основания
щетинок неопределенного вида глубоководной бай-
кальской гаммариды. Родовой признак — необычное
вытягивание актинофоров, нетипичное для токофрий.
Длинные актинофоры ранее отмечены у Acineta pumila
Sw., 1929 со щетинок ног Gammarus kietlinskii с глуби-
ны 200 м в Байкале, но их длина, положение, общий
вид этой токофрии (Т. pumila in Jankowski, 1982) отли-
чаются от A. seticola.
Род Sibiracineta Jankowski, 1982
Типовой в и д S. endemica с жабр неопределенно-
го глубоководного вида гаммариды Байкала. Тело не-
правильных очертаний, с короткими широкими акти-
нофорами, складчатое; щупальца в 2 боковых пучках;
стебелек плотный и тонкий, относительно длинный;
характерно аллометрическое утолщение эпикона с
образованием опорной базальной чаши. В норме у то-
кофрий стебелек у вершины незначительно расширен,
но у данного вида эпикон непропорционально велик.
Этот род может быть подродом токофрий.
Род Ternacineta Jankowski, 1978
Типовой вид Acineta tripharetrata Entz, 1902,
симбионты на панцире дафний Южной Америки (в Ев-
ропе нет никаких сукторий на дафниях). Формально
основной признак тот же, что у Phyllacineta, и Курде
(Curds, 1985а) поместил вид в состав принятого им
рода Phyllacineta, но мы классифицируем животных, а
не их диагнозы; виды во всем совершенно разные и не
могут быть родственными, 3 пучка щупалец — кон-
вергенция. Нет уверенности, что это ацинетида.
Род Trinacineta Jankowski,
1981
Типовой вид Tokophrya diaptomi Kellicott,
1885 — вид с 3 пучками щупалец; тело длинное, на не-
большом стебельке. Имеются 2 боковых и 1 апикаль-
ный пучок, как у неродственных филлацинет. После
первоописания вид не был найден, и валидация рода
зависит от результатов подробного изучения измен-
чивости числа актинофоров. На диаптомусах в США
описаны котурнии, триходины и суктории, в Европе
лишь триходины, поэтому нужно изучить пресновод-
ный планктон в типовом местообитании (район Босто-
на, США).
Род Tokophryella Jankowski,
1973
Типовой вид Podophrya carchesii Claparede et
Lachmann, 1859. На колониях перитрих Carchesium po-
lypinum, реже на Campanella umbellaria можно найти
мелких каплевидных сукторий величиной 26—87 мкм
на коротком тонком стебельке длиной около 13 мкм,
прикрепленных к сократимым ветвям (не к зооидам);
тело асимметричное, отклонено вверх, на вершине не-
сет несколько (до 12, редко больше) длинных щупалец
в одном компактном пучке; пора томосферы смещена
вбок (у токофрий апикальная); растянутые щупальца в
несколько раз превышают длину тела, служат для
высасывания зооидов перитрих. Это одна из форм
паразитизма, не хищничество; вне хозяина вид не
встречается. На колониях перитрих встречается также
Tokophrya okobojiensis (Goodrich et Jahn, 1943 in Podo-
phrya), как T. carchesii, но поле щупалец шире и стебе-
лек длиннее.
ТИП CILIOPHORA. КЛАСС PHYLLOPHARYNGEA
711
Род Riftus Jankowski, 1981
Типовой вид Discophrya pygmaea Swarczewsky,
1928 — эпибионтный вид на стебельках и ветвях коло-
ний перитрих Zoothamnium sp. на гаммариде Pallasea
hicomis с глубины 40 м в Байкале; мой материал с
крупных колоний Zoothamnium sp. на переоподах
Acanthogammarus victorii с глубины 70 м. Зооид типо-
вой расы грушевидный, сужается книзу, прикреплен
коротким широким стебельком; многочисленные ак-
ротены по всей верхней полусфере; эмбрион внутрен-
ний. В моем материале (Янковский, 1981, 1982; род
дважды описан как новый) стебелька нет, щупальца
гибкие, вершина, как у акротен, но ниже складчатые и
толстые при сокращении. Виды кажутся разными, но я
уверен, что типовая раса была зарисована ошибочно.
Род Riftus считают синонимом Tokophrya sensu lato,
вид сближают (но не синонимизируют) с Т. carchesii
(см. Tokophryella), но по расположению щупалец (весь
апекс) — это валидный подрод или род.
Род Semiacineta Jankowski, 1978
Типовой вид Acineta swarczewskyi Collin, 1911
(для вида Acineta gelatinosa Buck in Swarczewsky 1908,
нетоним). Оба автора ошиблись — это не Acineta. Вид
найден на стебельках Carchesium polypinum — это круп-
ные колонии с индивидуальным сокращением зооидов,
хозяева Tokophryella carchesii и нового рода сукторий в
Байкале. Тело овальное, прикреплено очень тонким сте-
бельком; щупальца не зарисованы; по экватору или чуть
ниже видна полоса, принятая за край полураковины (се-
митеки); размножение эндогеммией. Сейчас я уверен,
что это неправильное описание Т. carchesii — изучен
только окрашенный материал, просветленный в бальза-
ме, поэтому щупалец не заметили. Наличие семитеки не
доказано зарисовками in vivo или in fixo.
Род Lecanodiscus Jankowski, 1973
Типовой вид Discophrya longa Swarczewsky,
1928, симбионт прибрежных сублиторальных гаммарид
Байкала; включает также сходные виды Сварчевского
Discophrya cyathos S., 1928 и Thecacineta robusta S., 1928
(Lecanodiscus longus, L. cyathos, L. robustus). Некруп-
ные незначительно сплющенные конусовидные клет-
ки, прикрепленные широким коротким стебельком;
щупальца в одном пучке на апикальном вздутии (акти-
нофоре), иногда несколько наклоненном вбок и окайм-
ленном валиком; щупальца особого типа, не булавовид-
ные, более толстые. Хозяева и локусы: L. longus — жаб-
ры Axelboeckia carpenteri (типовой хозяин), переоподы
Brandtia lata', L. robustus — жабры A. carpenteri', L. cy-
athos — щетинки переопод Acanthogammarus victorii.
Род Listarcon Jankowski, 1982
Типовой вид L. angarensis; тело крупное,
плоское с 5—7 периферическими пучками щупалец,
коротким тонким стебельком; очень редкий эпиби-
онтный вид на переоподах прибрежной байкаль-
ской гаммариды Eulimnogammarus viridis в истоке
Ангары.
Род Hypophrya Lopez-Ochoterena,
1964
Типовой вид//, fasciculata из пресноводного пе-
рифитона в Мексике — вид с длинным тонким сте-
бельком, без раковины, с типично токофриидным не
сплющенным коническим телом; на расширенном ан-
тероне 2 мощных краевых пучка щупалец на актино-
форах и 2 апикальных пучка с меньшим числом щупа-
лец; у основания тела добавочный базальный пучок,
признак нового рода. Этот род обычно не признают ва-
лидным, типовой вид числится в списке видов Toko-
phrya, но автор обзора считает аберрантные виды сук-
торий с базальными пучками (у токофрий, дискофрий
и эфелотид) типовыми видами самостоятельных ро-
дов. Не изучено размножение Н. fasciculata, поэтому
не исключено родство с дискофриидами; этот род при-
веден также среди дискофриид для сравнения с Multi-
fasciculatum и другими эвагинидами.
Род Acinetides Swarczewsky,
1929
Типовой в и д Л. varians с гаммарид Байкала Ро-
eckilogammarus pictus — вытянутые особи на неболь-
шом прочном стебельке, с 2 актинофорами, несущими
пучки щупалец. Сварчевский рисует относительно
длинный толстый стебелек, но рисунок неправиль-
ный — на его препарате тело продолжается вниз почти
до основания (прикрепительной ножки); на препаратах
этого автора толстый слой бальзама, и он не мог изу-
чить мелкий вид при иммерсионной микроскопии. По-
этому нельзя принять диагноз рода и нельзя согласить-
ся с включением в этот род 3 других видов в каталоге
Довгаля (Dovgal, 2002) — A. gruberi, A. labiata, A. tri-
angularis из морского и пресноводного перифитона.
У Довгаля род в составе ацинетид, но раковины нет на
рисунке Сварчевского и нет в моем материале — это
аберрантные токофрииды.
Род Cryptacineta Jankowski, 1978
Типовой вид Acineta operta Swarczewsky,
1929 — внешне типичная токофрия, но с более округ-
лым телом; пучки многочисленных щупалец на 2 низ-
ких краевых актинофорах, проходят сквозь мукозную
раковину, покрывающую все тело особи; раковина не
прилегает непосредственно к кутикуле сукторий, на-
ходится на расстоянии, как бы подвешена на щупаль-
цах и укреплена на вершине стебелька. Это образова-
ние (не типичная раковина — shell) должно обозна-
чаться другим термином — мукотека (mucotheca) или
муцитека (mucitheca). Обычно она покрыта частицами
ила. Хозяева вида — байкальские гаммариды Carino-
gammarus siedlitzi и С. wagneri, локус — переоподы и
жабры.
712
ALVEOLATA
Род Cryptophrya Jankowski, 1973
Типовой вид Discophrya obtecta Swarczewsky,
1928; эндемик с гаммарид Байкала Brandtia lata (на
плеоподах) и. Acanthogammarus albus (на тергитах пан-
циря). Тело каплевидное, вытянутое, резко сужается к
основанию, на коротком тонком стебельке; все тело и
стебелек находятся внутри общей мукозной ракови-
ны — тонкого слоя мукуса, сквозь который свободно
проходят многочисленные тонкие щупальца апикаль-
ного пучка. «Мукотека» у этого и предыдущего рода
сходна по строению, но секретируется в онтогенезе
по-разному и отсутствует у всех других видов этой бо-
гатой эндемичной фауны.
Род Talizona Jankowski, 1981
Типовой вид Podophrya flexilis Kellicott, 1887
(Tokophrya in Butschli, 1889). Мелкие сферические
клетки с колоний перитрих, типовая раса на Epistylis
digitalis с Cyclops sp. из пруда в США. Трофонты оваль-
ные, прикреплены небольшим стебельком к стволу
или ветвям колонии; спереди несколько (2—4) очень
длинных и гибких змеевидных щупалец с коническим
основанием, с активным поисковым движением, слу-
жащих для высасывания зооидов. Этот вид может
быть модификацией Tokophryella carchesii, сходной во
всем, кроме типа щупалец.
Род Dactylostoma Jankowski gen. n.
Типовой вид Dactylophrya collini Gajewskaja,
1929 с неопределенных гаммарид Байкала; несколько
особей найдено мной, дан новый рисунок вида. Нет
причин для выделения семейства. Название дано
вновь, поскольку предложено ранее в тезисах и поэто-
му невалидно (Dactylostoma Jankowski, 1967). Оваль-
ные клетки на массивном стебельке, со щупальцами
особого типа — толстые пальцевидные выросты на
верхней части тела. Способ размножения пока неизве-
стен, но на гаммаридах Байкала нет дискофриид (кро-
ме дендрокометесов), это несомненно одна из многих
модификаций исходных токофриид.
Род Echinophrya Swarczewsky, 1928
Типовой вид.#, horrida Sw., 1928 по монотипии.
Род в первоисточнике отнесен к Discophryidae sensu
lato, но на байкальских гаммаридах нет дискофриид,
кроме дендрокометид. Тело грушевидное, сужается
книзу, прикреплено коротким широким стебельком,
раковины нет, ядро овальное. Щупальца необычные —
конические, прочные, невысокие, заострены к верши-
не (окситены), вероятно несократимые, расходятся ра-
диально от всей верхней части тела. Стадии размноже-
ния не отмечены. Типовой хозяин — эндемичная гам-
марида Pallasea bicornis с глубины 40 м; редкий вид в
узком локусе — суб-сетобионты на 2 первых парах
грудных ног (переопод), иногда на гнатоподах. Я нахо-
дил такие формы изредка и на крупных литоральных
гаммаридах Байкала. Несомненно этот вид видела
Гаевская (Gajewskaja, 1933) на ногах, реже на жабрах
неопределенных гаммарусов с глубин 600 и 1313 м,
вторично описав его как Disophrya tumida Gaj., 1933
(Echinophrya tumida Jank. comb. n.).
Этот род сближали c Corynophrya, Stylocometes, в
него включали комменсала изопод Сербии Choanoph-
rya stenaselli (Echinophrya in Matjasic, 1963), род пе-
реносили в сем. Stylocometidae. В действительности,
это эндогеммина, одна из модификаций предковой
токофрии.
Род Choanophrya Hartog, 1901
Включает Podophrya infundibulifera Hartog, 1881
(типовой вид) и предположительно Ch. subsessilis Pe-
nard, 1920. Первый вид — симбионты на вентральной
стороне панциря циклопов; тело дисковидное, значи-
тельно сплющено, на пустотелом стебельке с услож-
ненной зоной контакта (эпидиском); немногочислен-
ные массивные трубчатые щупальца отходят от перед-
ней части тела без особого порядка, не собраны в
пучки или группы; щупальца сократимые, складчатые,
с воронковидной вершиной и расширенным кониче-
ским основанием. Этот род выделен в новое сем. Choa-
nopliryidae Dovgal, 2002 около токофриид. Синони-
мы— Podophrya koeppeli Koepel, 1934, Tokophrya cras-
sipes Fric et Vavra, 1894 (=Acineta, Choanophrya)-,
второй вид — это ранняя стадия роста хоанофрии или,
судя по локализации на антенне, — токофрии.
Род Brachyosoma Batisse, 1975
Типовой Podophrya brachypoda Stokes, 1885
(Tokophrya in Butschli, 1889, Hallezia in Sand, 1900,
Trichophrya in Matthes, 1989). Этот вид числился в со-
ставе рода Hallezia', для замены гомонима введено на-
звание Brachyosoma с типом Р. brachypoda, но тип
рода Hallezia по монотипии Acineta multitentaculata
Sand, 1895, для валидации доступно название Spongi-
ophrya Jank., 1978. Синоним типового вида — Trichop-
hrya melo Penard, 1920 (Brachyosoma melo Jank.
comb. n.). Подробное описание подвида (здесь дается
ранг вида) В. mucosa Foissner, 1999 с применением
протаргола (Foissner, 1999).
Типичные особи (В. brachypoda s. str.) — очень
мелкие овальные не сплющенные суктории с короткой
ножкой и 4 компактными угловыми пучками щупалец
на расширенной апикальной площадке; щупальца ак-
ротенные. У В. mucosa все тело окружено слоем муку-
са (мукотекой), вплоть до базодиска; имеются 2 пучка
щупалец, иногда с несколькими добавочными щупаль-
цами вне их. Очень мелкий овальный не сплющенный
трофонт прикреплен короткой ножкой; ядро округлое,
почкование — стандартная для токофрий эндогеммия.
Томит вытянутый, с зачатками щупалец, апикальной
скопулой и ниже нее с 6 поперечными кольцевыми ки-
нетами и 1 фрагментом кинеты сзади. Наличие мукоте-
ки, 2 пучков — признаки нового подрода или рода. Все
другие виды неродственны и напрасно переведены
Курдсом (Curds, 1985b) в состав рода— Tokophrya bat-
ТИП CILIOPHORA. КЛАСС PHYLLOPHARYNGEA
713
hynellae Chappuis, 1944; Trichophrya lycoperdon Penard,
1920 и неопределимый вид Hallezia oviformis Sand,
1899; наличие таких форм из террофитона на пелаги-
ческих морских копеподах {Brachyosoma scottocalani)
невозможно.
Род Muscophrya Jankowski, 1978
Типовой вид Trichophrya lycoperdon Penard,
1920; редкие особи найдены Пенардом (Penard, 1920)
на дне пруда, вид плохо изучен. Тело угловатое, оваль-
ное, на небольшом плоском стебельке или отростке
тела; многочисленные тонкие щупальца с конически-
ми основаниями направлены в стороны от всей верх-
ней полусферы, при сокращении имеют вид острых
треугольников; нет раковины или гелиотеки. Род от-
несен к токофриидам условно до повторного изу-
чения вида. По Курдсу (Curds, 1985b), это синоним
рода Brachyosoma, но у них разные типы щупалец; у
настоящей брахиосомы (названной Trichophrya melo)
Пенард в той же статье четко рисует симметричные
пучки акротен.
Род Peltacineta Jankowski,
1978
Типовой вид Trichophrya cordiformis Schewia-
koff, 1893. Это пример рода, основанного только на
первоописании вида, позже не найденного и не изу-
ченного; валидность рода зависит от правильности
диагноза и рисунков вида. Симбионты копепод Cyc-
lops phaleratus — легко определимого ползающего
вида; найдены совместно с обычным комменсалом To-
kophrya cyclopum, только в углу между 2 каудальными
ветвями тела; здесь помещается только одна плос-
кая треугольная или сердцевидная особь, несущая
на углах по 1 ряду (не пучку) толстых гибких щупалец
с плоской вершиной — не акротены токофрий.
Ядро округлое, кортекс утолщенный, раковины нет,
почкование внутреннее, томит с 3 поперечными коль-
цами ресничек в центре тела. Прикрепление всей ниж-
ней поверхностью тела. Мне пока не удалось найти
этот вид, встречалась лишь Т. cyclopum, заселяв-
шая тело, придатки и в отсутствие Т. cordiformis также
и ее локус.
Род Pelagacineta Jankowski,
1978
Типовой вид Tokophrya interrupta Schroder,
1901; уДовгаля такжеР. campanula (S., 1901) иР. mul-
titentaculata (Small et Lynn, 1985). Первый вид — сим-
бионты на морских пелагических копеподах; сходство
с токофриями кажущееся — длинный стебелек, высо-
кий конический физон (эпикон), 2 пучка щупалец по
краям дисковидного плоского тела, ветвистое ядро —
все это нетипично для Tokophryidae, куда их включает
Довгаль; кроме того, в море практически нет токофри-
ид даже на литорали. Род неясного положения, не то-
кофриида.
Род Pseudocorynophrya Small et Lynn,
1985
Типовой видР. multitentaculata с морских план-
ктонных копепод Rhinocalanus sp. Массивный исчер-
ченный стебелек, слегка суженный к вершине, расши-
ряется в виде вазообразной лорики с исчерченными
стенками, вероятно не сплющенной; трофонт диско-
видный, прикреплен к вершине раковины по перимет-
ру; короткие щупальца (акротены) покрывают всю
плоскую поверхность диска (по тексту, имеются 1—4
группы с тесным сближением щупалец). У Довгаля
род невалиден как синоним предыдущего, вид введен в
состав рода Pelagacineta. Но это своеобразные сукто-
рии несомненно валидного рода, не имеющего никако-
го отношения к токофриям. Способ размножения неиз-
вестен, но род вначале отнесли к ацинетидам. Единст-
венного рисунка трофонта недостаточно, чтобы
понять строение и родственные связи вида.
Род Pasrastylophrya (среди токофриид у Довгаля)
рассмотрен ниже при диагнозе Stylophrya в группе
дендросомид.
Сем. Corynophryidae Jankowski, 1981
Безраковинные суктории на массивном складчатом
стебельке; тело овальное, не сплющено; щупальца од-
ного типа, прямые, с акроном, активные и сократимые,
могут быть расположены в одном апикальном пучке
или распределены по телу равномерно; ядро овальное
или лентовидное. Встречаются в морском перифитоне
и на беспозвоночных. В каталоге Довгаля 2 рода. Нуж-
но вспомнить и вид Thaumatophrya trold (типовой) с
эндотомитами, внешне похожий на коринофрий. Cory-
nophrya homari, включенная в состав семейства (Lynn,
Small, 2002), — это раковинная парацинетида, а у Со-
rynophrya раковины нет.
Род Corynophrya Kahl, 1934
С. lyngbyei (Ehrenberg, 1834), С. columbiae (Wailes,
1943), C. conipes (Mereschkowsky, 1877), C. francottei
(Sand, 1895), C. macropus (Meunier, 1910), C. symbiotica
Jankowski, 1981 на арктической полихете (состав по
каталогу Довгаля; первый вид назван типовым).
У Аэшт — Corynophrya Curds, 1987, поскольку Курде
(Curds, 1987) первым указал типовой вид Acineta lyng-
byei Ehr., 1833; этот вид относили также к Podophrya
и Tokophrya. У Каля (Kahl, 1934) — 8 видов без обо-
значения типового. С диагнозом монотипического се-
мейства, поскольку следующий род принять невоз-
можно. Это смесь малоизученных видов, их родство не
очевидно, способ размножения почти у всех видов не-
известен.
Род Andrusoviella Dovgal, 2005
Типовой вид Podophrya marina Andrusova, 1886
(Corynophrya in Kahl, 1934); найдена одна особь в Чер-
ном море на водоросли Ulva. Первоописание низкого
714
ALVEOLATA
уровня, на рисунке показана суктория с веретеновид-
ным телом, небольшим ядром, на стебельке несколько
короче тела; щупальца гибкие и длинные, подвижные,
не в пучках, отходят от всего тела. Способ размноже-
ния неизвестен. За столетие таких форм не находили;
вид и предложенный для него новый род (в составе Со-
rynophryidae группы эндогеней), вероятно, навсегда
останется спорным, его нельзя включать в определите-
ли сукторий. Ранее Andrusovia D., 2002 — гомоним.
Сем. Erastophryidae Jankowski, 1978
Вытянутые безраковинные формы с нечеткими или
четкими разрозненными пучками щупалец, без настоя-
щего стебелька; трофонты охватывают одним или дву-
мя задними выростами тела (скопулоиды) одиночных
перитрих апиосом в их узкой нижней части и таким не-
обычным образом закрепляются на субстрате. Виды
семейства обитают только на рыбах. Аналогия среди
перитрих — род Ellobiophrya с фиксаторным кольцом,
прочно замкнутым вокруг щупалец мшанок или
на жабрах моллюсков и рыб, и эпистилиды на апио-
сомах рыб.
Род Erastophrya Faure-Fremiet,
1944
Типовой вид#, chattom — частый симбионт на
рыбах, несущих апиосом, встречается повсеместно на
разных рыбах и на разных апиосомах в основном с вы-
тянутым вазообразным телом; типовая раса на колюш-
ках Gasterosteus aculeatus во Франции. Тело не сплю-
щено, ядро овальное, тонкие прямые булавовидные
щупальца (по моим препаратам не акротены токофри-
идного типа) беспорядочно или местами в мелких
группах рассеяны по телу; нижняя часть тела раз-
двоена, отростки смыкаются вокруг узкой нижней час-
ти тела апиосомы. Процесс эндогеммического почко-
вания, строение томита как у токофрий. Иногда на од-
ной апиосоме с удлиненным телом (типа A. piscicola')
закреплены 2 эрастофрии или одновременно Е. chatto-
ni и Heteropolaria Iwoffi. В состав рода включали
и морской вид Trichophrya odontophora Sand, 1899
(Curds, 1985b), плохо изученный и недостоверный,
не имеющий никакого отношения к эрастофриям. Ве-
роятный синоним — Podophrya gasterostei Lachmann,
1859.
Род Chenophrya Dovgal, 2002
Типовой вид Erastophrya wuchangensis Chen,
1964. Тело вытянутое до 50—180 мкм, щупальца в не-
скольких (2—5) компактных разрозненных пучках,
ядро удлиненное, 2 сократимые вакуоли в разных час-
тях тела; прикрепление к апиосомам на рыбах (Apioso-
та piscicola) с помощью одного извитого крючковид-
ного отростка. Этот вид описан в Китае, не встречен в
Европе. Расположение щупалец в четких разрознен-
ных пучках, форма тела и ядра, один скопулоид вместо
двух — признаки четкого рода.
Сем. Enchelyomorphidae Augustin
et Foissner, 1992
Содержит один род и вид — Enchelyomorpha Kahl,
1930, типовой вид Enchelys vermicularis Smith, 1899.
Этот вид был описан в США как аберрантный вид про-
стомат с кольцевыми ресничными рядами и прочными
короткими щетинками, каких не бывает у подобных
гимностомат. Независимо и без латинского названия
та же цилиата была описана в ФРГ как мигрант неизве-
стного вида сукторий — у обычных пресноводных
сукторий томиты другого типа. Каль (Kahl, 1930)
отождествил виденную им форму с Enchelys vermicula-
ris и выделил ее в новый род Enchelyomorpha', вид счи-
тался гапторидой типа Actinobolina и Dactylochlamys,
но недавно нашли стадию трофонта. Трофонты очень
мелкие, округлые, без раковины и стебелька, с округ-
лым ядром; короткие щупальца рассеяны (не в пучках)
по верхней половине тела. Почкование внутреннее; в
цитоплазме одновременно образуются и растут 2 рес-
ничных зачатка, без типичной для ацинет и токофрий
зародышевой камеры (томосферы). Томиты удлиняют-
ся, равномерно покрываются ресничками в попереч-
ных кольцах (около 14) с паратеническим, координи-
рованным расположением кинетосом одновременно в
продольных и поперечных рядах; продольные ряды
образованы фибриллярными дериватами кинетосом.
Короткие щупальца с токсицистами рассеяны по телу
мигранта в беспорядке, четкой аргентофильной скопу-
лы нет, крупная вакуоль сзади, кинеты и реснички сгу-
щаются у узкого апекса с небольшой полярной секан-
той; аргиром сетчатый. В электронном микроскопе
не нашли митохондрий, но есть подобие гидро-
геносом, что говорит об анаэробиозе этого вида —
единственный случай у непаразитических сукторий.
Филогения рода неясная, но возможна гомология ци-
лиатуры с томитами Tokophrya. Род сближается с эва-
гинидами (дискофриидами) по способу образования
томита, но у эвагинид стадия томита довольно одно-
типна, томит Enchelyomorpha не напоминает томита,
например Prodiscophrya, и есть разница в процессе
морфогенеза. Нужно изучать 2 варианта, эндогеммию
и эвагиногеммию, а пока род не имеет точного поло-
жения в системе.
Сем. Pseudogemmidae Jankowski,
1978
Содержит 1 род — Pseudogemma Collin, 1909 — с
несколькими видами, которые считаются специфиче-
скими для определенных хозяев, хотя это не было про-
верено экспериментально. Морфологические различия
трофонтов едва выражены, вероятно виды можно раз-
граничить при импрегнации томитов. Тело псевдо-
гемм очень мелкое, веретеновидное, заключено в тон-
чайшую раковину, плотно прилегающую к телу; ядро
округлое, вакуоль одна. Прикрепление к хозяину щу-
пальцем, которое раньше принимали за стебелек, адап-
тированный к высасыванию хозяина, и считали род
бесщупальцевым. Это короткая двойная трубка (обо-
лочка и внутренний канал) упрощенного строения, без
токсицист; питание высасыванием цитоплазмы и ее
ТИП CILIOPHORA. КЛАСС PHYLLOPHARYNGEA
715
включений. Паразиты патогенные; если паразитов
много, хозяин прекращает питание и гибнет.
Типовой вид Р. fraipontiCollin, 1909 по моноти-
пии с морских перифитонных экзогеммид Paracineta
patula (типовой хозяин) и Р. llmbata (Luxophrya) во
Франции. Паразиты оседают в верхней части тела
трофонтов над раковиной; наблюдались картины эндо-
геммии — образование очень мелкого томита с пояс-
ком ресничек, выходящего через узкое апикальное от-
верстие раковины. Томосфера образуется субапикаль-
но, кинеты параллельны оси тела томонта.
Р. pachystyla Collin, 1912, величиной 20—30 X
12—25 мкм, с широким щупальцем длиной 2—3.5 мкм
высасывает раковинных сукторий Acineta tuberosa,
прикрепляясь вдоль апикальной щели хозяина. Этот
вид особо подробно изучен; томит без щупальца, име-
ет 4 разрозненные кольцевые кинеты.
Р. keppeni Collin, 1912 — паразит массивной Acine-
ta papillifera (=А. compressa), вид повторно не изучал-
ся, считался переходной формой к роду Endosphaera.
Р. metacinetarum Nozawa, 1938 описана на пресно-
водной Metacineta yoshii с обрастаний на Viviparus в
Японии; зарисованная особь непохожа на типичных
псевдогемм, без раковины, с очень широким стебель-
ком вместо узкого щупальца; пока нет новых данных,
этот вид под сомнением. Псевдогеммы зарисованы
позже на М. pentagonalis, но вновь нетипичные, с боко-
вым положением наружного томита, как у Urnula, по-
этому вид с метацинет (М. yoshii) сомнительный.
В моем материале с Мурмана есть крупная эфе-
лотида, сплошь покрытая псевдогеммами — это но-
вый хозяин, а возможно и новый вид рода. По литера-
туре и в моих сборах заражены и другие хозяева —
разные виды ацинет и парацинет, свободные и сим-
бионтные.
Pseudogemmides globosa Kormos, 1938 с широким
полым стебельком для высасывания пресноводной ра-
ковинной суктории Periacineta linguifera — это лишь
ошибочное, плохое описание экзогеммид рода Urnula,
паразитирующего на перитрихах и сукториях; род Pse-
udogemmides ликвидирован, но вид может быть валид-
ным в составе Urnula (U. globosa).
Род Pottsiocles Colliss, 1960
Типовой в и д Р. infusoriorum по монотипии; ро-
довое название Pottsia Chatton et Lwoff, 1927 как гомо-
ним заменено новым. Второй включавшийся позже
вид Pottsia parasitica Nozawa, 1939 — это экзогемми-
ды (см. сем. Manuelophryidae). Типовой вид паразити-
рует на крупных сидячих морских цилиатах — фолли-
кулинидах и лорикатах; обычно указывают роды Folli-
culina и Cothumia, но это Lagotia donsi, Semifolliculina
simplex, Platyfolliculina paguri, Folliculinopsis annulata
и другие фолликулиниды; котурнида Pyxicola soialis и
неопределимый пресноводный вид Cothumia ingenita.
В пресной воде достоверных находок поттсий нет, вид
с котурний не зарисован. Распространение рода широ-
кое — США, Европа, Океания (о-в Самоа). Трофонты
прикреплены к телу хозяев, иногда в массе; тело оваль-
ное или веретеновидное, как у Pseudogemma, но без ра-
ковины; томит с 3 разрозненными поперечными коль-
цами ресничек и с парой длинных апикальных щупа-
лец, образуется в отличие от псевдогеммы на стороне,
обращенной к хозяину. Питание с помощью 2—4 щу-
палец, погруженных в тело хозяина и незаметных при
осмотре паразитов. Вид Pottsiocles sp. с полиэндогем-
мией с неопределенного вида фолликулинид (Small,
Lynn, 1985) — вероятный новый вид Pottsiocles multi-
ferus Jank. sp. n.
Сем. Endosphaeriidae' Jankowski, 1978
Очень мелкие сферические трофонты без следа
кортикального панциря, раковины, прикрепительного
комплекса; тело несколько вытянуто на стороне, обра-
щенной к кутикуле хозяина, здесь расположена вывод-
ная пора зародышевой камеры (томосферы) с опорны-
ми фибриллами кортекса. Ядро округлое, имеется 1—
2 вакуоли в зависимости от вида эндосфер. Щупальца
нет, питание осмотическое или пиноцитозное.
Род Endosphaera Engelmann, 1876
Типовой вид Е. engelmanni Entz, 1896. Род был
вначале описан по виду, не получившему латинско-
го названия, он был назван значительно позже другим
автором; несмотря на это родовое название Endosphae-
ra валидно и всеми принято. Хорошо изученный род
с несколькими видами; судя по специфичности к раз-
ным хозяевам, число видов должно быть велико,
но никаких морфологических отличий у столь регрес-
сивной формы нет, и поэтому практически все находки
в пресных водах и в море условно определяются
как надвид Е. engelmanni', по типу томита и их числу в
томонте удалось отделить 3 других пресноводных
вида.
Круг хозяев Е. engelmanni ограничен перитрихами
обоих отрядов (Sessilida и Mobilida), находки в сукто-
риях относятся к Е. multifiliis. Примеры хозяев — сво-
бодные и симбионтные сессиллиды родов Apiosoma,
Riboscyphidia, Vorticella, Pseudovorticella, пелагиче-
ская Opisthonecta и многие другие; примеры моби-
лид — Trichodina pediculus, Т. labrorum, Т. sphaeroide-
si, Т. halli, Т. multidentis, Т. myicola, Trichodina sp. из
мурманских гребешков Chlamys swifti, Semitrichodina
meridionalis и др., т. e. в основном морские триходины;
это несомненно второй вид этого надвида. Паразиты
совершенно непатогенны для некоторых хозяев, ино-
гда даже считаются симбионтами; хозяева продолжа-
ют питание, размножаются, их ядра не фрагменти-
руются; но есть и противоположные данные о гибели
зараженных хозяев. У байкальских перитрих Spongos-
tena, наполненных пищевыми вакуолями и разными
гранулами, лишь при окраске метилгрюном мне уда-
лось увидеть’группу эндосфер с томитами в совершен-
но нормальном хозяине. Типовой вид хозяина для
Е. engelmanni — Vorticella microstoma.
Е. elisabetharum Guhl, 1985 паразитирует только на
Carchesium kurczycai', это гиганты по сравнению с
Е. engelmanni — длина тела соответственно 125—136
и 9—41 мкм, томит первого вида достигает длины
44—54 мкм. Томонт часто с несколькими томитами (у
716
ALVEOLATA
E. engelmanni только моноэндогеммия). Томит слегка
сплющен, имеет короткий шип спереди для внедрения
в тело хозяина.
Е. terebrans Matthes et Guhl, 1973 — паразит в Epis-
tylis niagarae на речном раке в ФРГ; мелкий вид с
очень мелким (около 6 мкм) вытянутым томитом, име-
ющим на апексе длинный острый шип (перфораторий)
для проникновения в хозяина; по моим новым данным
(в печати) — это эвагиниды, не эндогеммиды, поэтому
можно принять таксоны Довгаля. 3 кольца длинных
ресничек у основания шипа. У томита Е. engelmanni
шипа нет, он активно проникает в хозяина. Подробное
описание вида см.: Esteban et al., 1991 (из Epistylis pli-
catilis, E. urceolata, Vorticella microstoma, Opercularia
microdiscum).
E. multifiliis Gonnert, 1935 заражает только пресно-
водных сукторий, в основном крупных Trichophrya
epistylidis, Т. astaci (=Lernaeophrya), Dendrosoma radi-
ans, Tokophrya spp.; указания для вортицелл не доку-
ментированы. Диаметр тела 30—35 мкм; в камере
обычно несколько томитов, до 4 и иногда больше; то-
мит цилиндрический, длиной около 13 мкм, с 5 кине-
тами. Хозяин погибает при большом числе паразитов в
клетке (до 12). Этот вид — тип рода Parendosphaera
Jank., 1981 для полиэндогеммических видов, но здесь
он считается только подродом единого рода Endos-
phaera.
В моем материале регулярно, каждый год зараже-
ны Dendrocometes sp. на жабрах байкальских лито-
ральных гаммарид Eulimnogammarus cyaneus без за-
метного патогенного влияния даже при массовом зара-
жении.
Сообщение о находке вида «Endosphaera engel-
тап» (так в тексте — Юнчис, 1985) в Heniiophrys bran-
chiarum и в Ichthyophrhirius multifiliis (в дополнение к
видам сессилид и триходин на рыбах) не документиро-
вано рисунками; патогенность определяется числом
паразитов, ихтиофтириус гибнет при 25—30 парази-
тах, триходины при 17—20, эпистилисы при 12—14,
апиосомы при 2—3 эндосферах в клетке хозяина.
Род Acoelophthirius Jankowski, 1981
Типовой видА. acronifer Jank., 1981. Предложен
для вида без латинского названия из морских турбел-
лярий Paraphanostoma brachyposthium (Dorjes, 1979).
Если верно описание вида, выполненное неспециали-
стом по цилиатам, у томитов нет ресничек и четкого
перфоратория, но заострена вершила тела. Второй вид
A. doerjesi паразит в Pseudmecynostomum pellucidum.
Находки таких паразитов в ФРГ и на Галапагос-
ских о-вах говорят о широком распространении рода в
море.
Сем. Trypanococcidae Dovgal, 2002
У Довгаля (Dovgal, 2002) этот таксон выделен в
особый отряд Trypanococcida далеко от эндосфер, в
другом подклассе Evaginogenia; почкование по старым
данным (Penard, 1920) нетипичное для эндосфер, у
которых протекает по типу Acineta или Tokophrya.
Довгаль называет этот процесс «поли-инверсогем-
мия» — ресничная полоса полностью закладывается
на дне и стенках пустой камеры, и затем эта зона вы-
пячивается в виде томита; процесс продолжается, при-
водит к образованию странных групп особей из непол-
ностью отделенных трофонтов. Если не считать томи-
тогенеза, трофонт во всем похож на Endosphaera, как и
его томит.
Род Trypanococcus Zacharias, 1885 (по Аэшт, Тгура-
nococcus Stein in Zacharias, 1885) включает 1 вид —
Т. rotiferorum — из пресноводных коловраток Rotaria
rotaria, R. socialis (=Callidina), Embata parasitica, Ste-
phanocerosfimbriatus. Род Physaliella Penard, 1920 с ти-
повым видом Ph. collini описан независимо и невали-
ден как синоним.
Сем. Actinobranchiidae Jankowski, 1978
Особая группа сукторий обитает на бентосных мо-
насцидиях, колониальных синасцидиях и на пелагиче-
ских туникатах (сальпах и пиросомах) в океане. Рань-
ше эти виды относили к роду Trichophrya, но настоя-
щие трихофрии — это плоские пресноводные формы с
угловыми актинофорами и со щупальцами ацинетид-
ного типа (акротены с апикальным шариком). При-
крепление подошвой или специальными ризоидными
отростками; размножение эндогеммией. Пока извест-
ны несколько видов как минимум 2 родов, различаю-
щихся по внешнему облику, положению щупалец и
способу прикрепления к субстрату.
Род Actinobranchium Jankowski, 1967 с типовым ви-
дом Л. salparum (Entz, 1884 in Trichophrya) и A. pyroso-
mae (Tregouboff, 1916 in Trichophrya) — это гантеле-
видные формы с широкой подошвой и 2 краевыми
пучками щупалец. Большое число щупалец у первого
вида может приводить к разъединению их в нечетких
или четких пучках. Синхронное образование эндото-
митов — уникальный процесс у сукторий, основной
признак нового семейства (Collin, 1912). Томиты токо-
фриидного типа, с разрозненными кольцами ресничек
и апикальной скопулой. Хозяин и локус типового
вида — перикоронарные дуги и иногда дыхательные
сифоны и глоточная корзинка различных пелагиче-
ских сальп, в основном Salpa (=Thalia) democratica.
Вид указан и для ряда бентосных асцидий, но без доку-
ментации, это могут быть ложные определения (нето-
нимы) — Molgula manhattensis, Ciona intestinalis, Asci-
diella aspersa, A. scabra, Boltenia villosa, в колониях
Botryllus sp., в монасцидиях Ascidiaparatropa, A. callo-
sa и др.; это говорит о повсеместном распространении
рода в океане. Неназванный вид — в синасцидии Ре-
rophora annectens в США.
Trichophrya ascidiarum Lachmann, 1859 найдена
в Polyclinum sp. в Норвегии; вид не описан должным
образом, невалиден. Вид Т. salparum subsp. pyroso-
mae — это особый вид Actinobranchium pyrosomae Tre-
gouboff, 1916 из пелагической ночесветки Pyrosoma
elegans.
Род Rhizobranchium Jankowski, 1981 с типом Rh.
morchellii (=Trichophrya morchellii Tregouboff, 1916) —
это овальные формы с корневыми ризоидами и одним
апикальным пучком щупалец; хозяин — синасцидия
ТИП CILIOPHORA. КЛАСС PHYLLOPHARYNGEA
717
Morchellium argus во Франции, локус — эпителий пе-
рикоронарной полости. Второй вид Rh. cionis описан
мною (Янковский, 1981) из монасцидий Ciona sp. на
Мурмане; особо развиты прикрепительные отростки,
нет картин полиэндогеммии; в цитоплазме видны сфе-
ры с эндогеммией — паразиты рода Endosphaeral
Сем. Caprinianidae Jankowski, 1978
Четкая группа из нескольких видов одного рода,
который не соответствует диагнозам раковинных аци-
нетид, стебельчатых токофриид, плоских перифитон-
ных гелиофриид или дендросоматид с узорным телом,
с постепенным превращением угловых актинофоров в
длинные ветвящиеся выросты; морские формы с туни-
кат неродственные. Я вынужден обособить их в сем.
Caprinianidae от остальных эндогеммин.
На пресноводных рыбах обитают Erastophrya и
близкий род, прикрепленные к сидячим перитрихам, и
мешковидные суктории с овальным ядром, прикреп-
ленные широким основанием к эпителию жаберных
пластинок — род Capriniana Strand, 1928.
Типовой вид Caprina aurantiacaMazzarelli, 1906
(или Caprinia).
Название Capriniana дано для замены гомонима.
Синоним — yopPhagobranchium Jank., 1967 с типовым
видом Trichophrya piscium Butschli, 1889; это название
предложено в тезисах и поэтому также невалидно.
Один и тот же вид был независимо, без знания ли-
тературы описан в ФРГ {Trichophrya piscium Butschli,
1889), Италии {Caprinia aurantiaca Mazzarelli, 1906),
Польше {T. intermedia Prost, 1952) и Китае {T. sinensis
Chen, 1955); это виды с разных рыб, но они достаточно
сходные, особенно если учесть небольшую изменчи-
вость трофонтов. Обычно имеется один апикальный
пучок щупалец, но могут появляться дополнительные
щупальца или небольшой пучок на другом краю тела.
Томосфера у вершины тела, томит один, крупный, не-
обычной формы — дисковидный, кольца ресничек
расположены вплотную к краю диска, обе стороны
тела — обширный ацилон. Щупальца — не акротены,
но и не толстые массивные щупальца типа Choanoph-
гуа — это утолщенные палочки с акроном, которые не
сгибаются при фиксации, равномерно в широком пуч-
ке покрывают весь апекс клетки (рисунки вида с тон-
кими акротенами — ошибка). Нет заметной специаль-
ной фиксаторной зоны (секреции).
Каприн находят на возрастающем числе видов рыб,
только в пресных водах; формальный список видовых
названий (не значит их валидности) — С. piscium (But-
schli, 1889); С. aurantiaca Mazzarelli, 1906; С. ictaluri
(Davis, 1947); C. intermedia (Prost, 1952); C. micropteri
(Davis, 1937); C. salvelinus (Davis, 1942); C. catostomi
(Heckmann, 1970); C. sinensis (Chen, 1955); C. hupehen-
sis (Chen et Hsieh, 1964); C. liaohoensis (Chen, 1984); C.
variformis (Li, 1985); C. bivacuola (Li, 1993) (все виды
ранее в составе Trichophrya, что совершенно недопус-
тимо). Иногда упоминают Т. salvelinus Davis, 1942, но
такого вида нет, есть Trichophrya sp. из Salvelinus fonti-
nalis. Нужно проверить число вакуолей, число кинет
томита у разных рас. Если на срезах щупалец в элект-
ронном микроскопе есть разница в числе филлов (phyl-
lae, опорные микрофибриллярные пластинки), это по-
зволит разграничить часть видов. Для каждого вида
нужно выделить типового хозяина и место сбора; для
первого по времени вида С. piscium такого хозяина нет
(«жабры различных пресноводных рыб»).
Сем. Heliophryidae Corliss, 1979
Семейство было предложено для крупного вида с
краевыми пучками щупалец и ветвящимся ядром, ко-
торый к настоящим гелиофриям не имеет никакого от-
ношения и сейчас называется Cyclophrya magna (это
аберрантная дискофриида). И все же семейство валид-
но для плоских симметричных дисковидных бентос-
ных эндогеммид, прикрепленных всей нижнй сторо-
ной диска и имеющих акротены в угловых пучках или
в радиальных рядах, или поодиночке. Расположение в
пучках кажущееся, основания щупалец координирова-
ны в радиальных рядах.
Много лет царила путаница в названиях и валидно-
сти видов и родов подобных форм, встречающихся
только в пресных водах на камнях, раковинах моллю-
сков, растениях, в обрастании на стеклах или на дне
пластиковых чашек Петри после экспозиции в прудах.
Прежде всего разграничим их по способу размноже-
ния — с токофриидной эндогеммией (циркум-вагина-
ция) и с дискофриидной эвагиногеммией. Далее прове-
рим даты и приоритет названий видов и родов. По ре-
зультатам такой работы сем. Heliophryidae включает
только 1 род — Heliophrya, в моем варианте 2 рода
(включая Paraheliophrya). У Довгаля (Dovgal, 2002) се-
мейство принято, помещено в Evaginogenia и содержит
именно такую смесь видов разных подклассов; причи-
на возможно в учете одной из публикаций в США (Мо-
gensen, Butler, 1984), в которой неправильно понят род
Heliophrya, считающийся экзогеммидой, а вид «rotun-
da» оставлен в составе эндогеммид Trichophrya. Сей-
час никто не сомневается, что Heliophrya — род эндо-
геммид. Хронологически виды и роды гелиофрий опи-
сывались в следующем порядке:
Trichophrya rotunda Hentschel, 1916
Heliophrya De Saedeleer et Tellier, 1930 — типовой
вид H. collini De S. et T., 1930
Platophrya gen. n. Gonnert, 1935 — типовой вид
T. rotunda H., 1916
Craspedophrya gen. n. Rieder, 1936 — типовой вид
T. rotunda H., 1916
Поскольку Н. collini идентична с Т rotunda, пра-
вильное название вида — Heliophrya rotunda (Hentschel,
1916) Matthes, 1954. Описывались формы С. rotunda
var. typica и var. sinuosa Rieder, 1936; вторая форма мо-
жет быть видом. Различаются также Н rotunda f. oligo-
fascicularis и H. rotunda f. irregularis Rieder, 1988.
Гелиофрии H. rotunda — очень мелкие малозамет-
ные светлые-диски на дне чашек Петри с пробами из
прудов и озер, симметричные, с угловатым телом ве-
личиной 25—50 мкм; по разным авторам (и у разных
особей) число пучков щупалец, расположенных на уг-
лах, варьирует от 8 до 15, чаще всего имеется 10—12
пучков. Щупальца расположены очень компактными
группами, но в основании их по 2 ряда, реже 1 или 3
ряда точек прикрепления. Вид раковинный, пустая ра-
718
ALVEOLATA
ковина остается после гибели трофонта; в прудах ра-
ковины оранжевые, окрашиваются при аккумуляции
железа, легко видны на раковинах плоских планор-
бидных гастропод. Ядро овальное, вакуолей несколь-
ко, томит очень крупный, с периферическим (не попе-
речным, как у токофрий) компактным кольцом рес-
ничек.
Неясно положение вида Trichophrya myriophylli Pe-
nard, 1920 из перифитона — тело высокое, диаметр
40—66 мкм, с 4 пучками щупалец, способных к вытя-
гиванию в 10 раз длиннее тела, с 2 (редко 3) вакуоля-
ми; томит крупный, с поперечным кольцом кинет. Это
в любом случае не трихофрия — Heliophrya myriophylli
Jank. comb. n.
Род Paraheliophrya Jankowski, 1978
Типовой вид Craspedophrya rotunda forma mini-
ma Rieder, 1936. Маттес (Matthes, 1954) заменил это
название новым — Heliophrya riederi Matthes, 1954,
поскольку forma и varietas не имеют видового или под-
видового статуса и их названия при переводе ранга не
сохраняют авторства; но в первоисточнике есть и вид
Н. minima, поэтому название Н. riederi отвергается.
Итак, тип рода — Paraheliophrya minima (Rieder,
1936).
Внешне это такие же плоские дисковидные формы
с широкой каймой, как Н. rotunda, но щупальца распо-
ложены не в пучках и не в рядах, а поодиночке. Это не
ошибка, описания разных авторов и рисунки вида
сходные, вид реальный. Лично мне признак кажется
важным — у щупальцевых простейших классифика-
цию нужно вести в частности по щупальцевому аппа-
рату. В литературе род не принят.
Род Sphaeracineta Jankowski, 1987
Типовой вид Paracineta estuarina Jones, 1974.
Эндогеммина в широкой капсуловидной раковине,
сквозь которую свободно проходят многочисленные
щупальца, не собранные в пучки. Название рода дано в
тезисах, невалидно, но здесь не заменяется новым, по-
скольку первоописание вызывает большое недоверие.
Это эстуарный эвригалинный вид из обрастаний на
стеклах, помещенных на неделю в море на юге США,
нередкий в этом районе. Раковина прикреплена широ-
ким основанием к субстрату, диаметр зооида 40—
60 мкм, имеются 1—2 вакуоли, диаметр лорики 70—
100 мкм; возможно, это мукозная оболочка — она по-
крыта илом и через нее проходят щупальца. В клетке
могут быть до 4 томитов при последовательной эндо-
геммии и задержке их выхода. Ядро овальное, с 4 мик-
ронуклеусами; у сходной Н. rotunda 1 микронуклеус.
Статус рода неясен.
Род Discosoma Swarczewsky, 1928
Типовой вид/), tenella по монотипии; как гомо-
ним название рода заменено на Discosomatella Corliss,
1960. Этот род был всеми забыт и игнорировался в
дискуссиях по гелиофриидам, и лишь недавно был
кратко обсужден Довгалем (Dovgal, 2002, р. 223), с ко-
торым я категорически не согласен. Довгаль пишет,
что щупальца дискосомы не акротены (not capitate),
поэтому по типу щупалец и форме тела это валидный
род в составе эвагинид Stylocometidae. Я знаю сукто-
рий Байкала и имею обширный материал по D. tenella',
это прежде всего обычная эндогеммида с мелким
округлым томитом в сферической камере (томосфере);
если не считать Dendrocometes, на байкальских гамма-
ридах вообще нет никаких эвагинид (дискофриид
и родственных им форм). Род Stylocometes также от-
сутствует на мелких байкальских изоподах — аселло-
тах. Поэтому род исключается из стилокометид. Щу-
пальца тонкие, совершенно нетипичные для Stylocome-
tes, в одном ряду, всего клетка имеет около 8—9 таких
радиальных рядов; у Heliophrya в 2 рядах, у Paraheli-
ophrya одиночные. В итоге род Discosomatella валид-
ный, находит окончательное место в составе сем. Не-
liophryidae. Эндемики Байкала; указаны для жабр
крупных траловых гаммарид Pallasea kessleri, Garjae-
wia cabanisi, Acanthogammarus albus (типовой хозяин
по моему обозначению), A. victorii, A. godlewskii,
A. grewlnkgi, но встречаются и на литорали у Eulimno-
gammarus viridis.
Сем. Trichophryidae Biitschli, 1889
Граница между этой группой и Dendrosomidae
условная и нечеткая; трихофрииды включают аморф-
ных эндогеммин с углами или выростами тела без вет-
вления актинофоров; во втором семействе ветвление
актинофоров начинается у Baikalodendron и заканчи-
вается у Dendrosoma. В состав трихофриид включают-
ся 2 рода с крупным плоским телом, приклеенным
всей нижней поверхностью к субстрату; щупальцевые
участки — углы тела или недлинные выросты (настоя-
щие актинофоры); ядро вытянутое, может незначи-
тельно ветвиться; микронуклеусы и вакуоли мно-
гочисленные.
Род Trichophrya Claparede et Lachmann,
1859
Типовой вид Т. epistylidis С. et L., 1859. Круп-
ный вид с неправильными волнистыми очертаниями
тела, без удлинения выступов, несущих пучки щупа-
лец. Название вида означает возможную встречае-
мость на стволах колоний перитрих, но это редкость,
обычно вид оседает на водных растениях, раковинах,
камнях, обрастает стекла при достаточной экспозиции,
может быть найден на полиэтиленовой пленке в пру-
дах и канавах. Синонимом считается Т. sinuosa Stokes,
1886, но это вид с удлинением актинофоров. Восста-
новлена валидность забытого вида Т. astaci (Stein,
1859 in Dendrosoma) с пальцевидными выростами тела
и ветвящимся ядром; это неспецифический обраста-
тель на любом субстрате. Т. sinuosa — синоним имен-
но этого вида.
В книге Маттеса (Matthes, 1988) уходит в синони-
мику род Lernaeophrya Perez, 1903 с типовым видом
ТИП CILIOPHORA. КЛАСС PHYLLOPHARYNGEA
719
L. capitata Perez, 1903, найденный вначале на гало-
фильных гидроидах Cordylophora lacustris. Род вали-
ден в сводках Корлисса (Corliss, 1979), в Traite (Batisse,
1994) и Guide (Small, Lynn, 2002), где показан массив-
ный трофонт с большим числом относительно корот-
ких ветвей тела и интенсивно ветвящимся макронукле-
усом. Обнаружена полиэндогеммия — образование то-
митов одновременно в разных частях тела. Томит
толстый, овальный, с продольным кольцом ресничек
(не токофриидного типа). Ситуация с границами Т. as-
taci и L. capitata и с самими родами неясная; видимо, у
Lernaeophrya в оногенезе больше растет тело трофон-
та, чем его актинофоры. У вида Т. cambari Small et
Lynn, 1985 показана только одна ранняя стадия с амор-
фным телом и 2 актинофорами, но виды семейства
нельзя описывать по одной такой особи.
Род Astrophrya Awerinzew, 1904
Типовой вид Л. arenaria по монотипии. 1 особь
найдена в пробе планктона из Волги; тело небольшое,
звездчатое, с 8 длинными лучами; на их поверхности и
на теле сплошной слой мелких частиц (явно донный
ил). Открыты лишь вершины ветвей, каждая с пучком
радиальных щупалец типа акротен. Общего мнения
нет, род и принимали, и отвергали. Такой слой мукуса
с илом и песчинками бывает у Dendrosoma, но есть и у
планктонной Tetraedrophrya — суктории без актино-
форов. Вероятнее всего, A. arenaria невалидна как род
и вид, это молодая особь дендросомы, оторванная от
субстрата и занесенная в толщу воды.
Род Baikalophrya Swarczewsky, 1928
Род считается эндемиком Байкала, предложен для 3
новых видов с гаммарид без указания типа — В. acant-
hogammari (на жабрах Acanthogammarus brevispinus'),
В. lobata (на переоподах Ac. albus) и В. digitata (на
жабрах Poeckilogammarus rostratus):, изучены фикси-
рованные коллекции с небольших глубин (5—20 м).
В моем материале такие формы найдены и на части бе-
реговых гаммарид, но очень редко встречающиеся
на них. Тело многоугольное, расчлененное, с 3—6 уз-
кими, четко обособленными актинофорами; выросты
тела не ветвятся, поэтому место рода среди трихо-
фриид. Предполагалось, что это начальная стадия эво-
люции байкальской линии симбионтных дендросо-
матид.
В книге Маттеса — монографии пресноводных
сукторий (Matthes, 1988) нет ни рода, ни названных ви-
дов даже в синонимике; в обзоре Довгаля (Dovgal,
2002) все они отправлены в синонимику изменчивого
вида Dendrosoma radians, форма которого зависит от
типа субстрата; оба автора не изучали байкальских
симбионтов. Никто не обозначил типового вида; по
моему выбору это В. digitata с широким телом, неболь-
шим числом актинофоров и незначительным ветвле-
нием ядра. Типичная D. radians может быть на покро-
вах тела, но не на жабрах гаммарид. Род Baikalophrya
приведен здесь формально, у меня нет уверенности в
его валидности.
Сем. Dendrosomidae Biitschli, 1889
Более сложные формы с ветвлением актинофоров
и тела, вплоть до появления кустовидных форм. Как
и предыдущее семейство, ограничено пресными во-
дами; на морских субстратах и при экспозиции по-
лиэтиленовых пленок в море нет трихофриид и денд-
росомид.
Род Baikalodendron Swarczewsky, 1928
Типовой вид В. angustatum по монотипии, с
жабр гаммарид Байкала Poeckilogammarus pictus и
Р. rostratus с глубины 30—100 м; типовым я обозна-
чаю первого хозяина. Эрроним при описании рода —
Baikalosoma. Тело вздутое, но относительно некруп-
ное по сравнению с немногочисленными (2—4) вытя-
нутыми ветвями, несущими по 2—5 мелких относи-
тельно коротких актинофоров. Этот род и вид также
не признаются в цитированных сводках Маттеса и
Довгаля.
Род Gorgonosoma Swarczewsky, 1928
Типовой вид G. arbuscula по монотипии, с пан-
циря, но не с жабр байкальских гаммарид Acantho-
gammarus albus (типовой хозяин), более часты на этом
гаммарусе с глубины 20 м; единичные находки на
A. godlewskii и A. victorii. Базальная часть (на субстра-
те) небольшая, вверх отходят ветвящиеся стволы, на
вершинах несущие узкие актинофоры. Ядро базаль-
ное, посылает ветви вверх, ветвящиеся до основания
актинофоров. На траловых гаммаридах хорошо видны
в виде мелких белых кустиков на дорсуме, по краям
тела и на переоподах. Эрроним при описании рода —
Gorgonadendron. В книге Маттеса род и вид числятся в
синонимике перифитонного вида Dendrosoma radians
(есть и в Байкале, особенно на растениях в устье р. Се-
ленги); у Довгаля род и вид валидные, вероятно из-за
массовой синхронной полиэндогеммии — таких кар-
тин нет у обычной дендросомы.
Род Dendrosoma Ehrenberg, 1837
Типовой вид/), radians по монотипии; это обыч-
ный перифитонный вид на крупных растениях, осо-
бенно в текучих водах; част в Неве с ее быстрым те-
чением на летних макрофитах, густо обрастающих
также колониями перитрих и крупными ацинетами.
Кустовидный вид величиной до 2.5 мм, иногда счита-
ется колониальным, но это одна клетка. Нельзя дать
единого рисунка для вида — форма тела зависит от
стадии роста и от субстрата, и изменчива на одном
субстрате. Очень рано от мелкого тела начинают расти
длинные актинофоры; они далее ветвятся, ветви стано-
вятся толще, ядро повторяет форму ветвей, но не захо-
дит в узкие вершинные актинофоры. Часто отмечается
мукозный слой с пылевидными частицами (ил из тол-
щи воды) на теле, иногда до начала актинофоров, но
зона оснований щупалец всегда чистая. При ветвлении
720
ALVEOLATA
образуется по выражению одного автора «лес щупа-
лец». На актинофорах иногда оседают паразитические
суктории рода Urnula, которых вначале принимали за
наружные почки и соответственно считали, что вид
способен к экзо- и к эндогеммии. Кустики могут быть
небольшими, если мало пищи.
Род Sty/ophrya Swarczewsky,
1928
Типовой в ид У polymorpha, по обозначению До-
вгаля (Dovgal, 2002). Род предложен для 2 видов без
обозначения типа — У. capitifera (на жабре гаммариды
Axelboeckia rubra с глубины 60 м в Байкале) и S. poly-
morpha (на ногах и на их щетинках у литоральных гам-
марид Eulimnogammarus viridis и Е. verrucosus). Пер-
вый вид почти неизучен, была найдена лишь одна
особь; это аберрантная форма, возможно особого
рода. Типовой вид массовый на гаммаридах (типовой
хозяин Е. verrucosus), на Е. viridis преобладает более
мелкий новый вид с пятиугольным телом (в обработ-
ке). Актинофоры типичные для трихофрий и дендро-
сом, узкие, с расширенным акроном, несущим плот-
ный пучок мелких щупалец. 2—5 актинофоров распо-
лагаются по краям широкой апикальной площадки;
ниже тело сужается, толщина панциря (не раковины)
возрастает, и в месте прикрепления находится неболь-
шой выступ тела с толстым панцирем и частью цито-
плазмы. Цитоплазма коричневая от массы гранул.
Ядро округлое до треугольного; размножение мо-
ноэндогеммией; при линьке рачка образуется несколь-
ко томитов. Томиты с поперечным пояском из 5 или
6 кинет. Особей можно легко во множестве отделить
и собрать для электронной микроскопии и молекуляр-
ного анализа; хозяин легко доступен у каменистых
берегов Байкала.
Роды Parastylophrya Jankowski, 1978
и Digitophrya Matthes, 1988
Маттес (Matthes, 1988) не признает результатов ра-
бот Сварчевского, не изучавшего живых сукторий (но
фиксация их не изменяет!); признаются лишь резуль-
таты Гаевской (Gajewskaja, 1933), включая вид Dend-
rosomides tumidus Gaj., 1933. Dendrosomides — мор-
ской род вермигеммин. Зарисована 1 особь на недлин-
ном широком продольно исчерченном стебельке;
трофонт выглядит как ладонь с 6 пальцами; ядро вет-
вится от компактной нижней части. Актинофоры, как у
стилофрии. Вид найден «на придатках береговых гам-
марид». Это типовой вид названных выше родов, по-
скольку у стилофрий нет такого стебелька.
За все годы работы на Байкале я не видел ни одной
такой особи при осмотре тысяч стилофрий со всех бе-
реговых гаммарид рода Eulimnogammarus (на других
их практически нет). Нет их и в типовом местонахож-
дении (южный Байкал у Маритуя). Я все больше уве-
рен, что вида с такой морфологией не существует —
это может быть неправильная зарисовка особи Styloph-
rya polymorpha. Род Parastylophrya не должен вклю-
чаться в определители сукторий.
Роды неясного положения
в системе сукторий
Род Spongiophrya Jankowski, 1978
Типовой вид Hallezia multitentaculata Sand,
1895; это тип рода Hallezia, принятого многими авто-
рами для включения разнообразных неродственных
сукторий; но название Hallezia — гомоним. Это плохо
описанный вид, как и все виды Санда; найден на мор-
ской губке Leucosolenia (=Grantia). У единственной за-
рисованной особи тело вытянуто в длину, величиной
300 X 120 мкм, с коротким выступом сзади; ядро вытя-
нутое, антерон слегка сужен и покрыт сплошной мас-
сой мелких тонких щупалец типа акротен; неясно, есть
ли раковина. На морских губках Мурмана есть свои
комменсалы (Spongiarcon, Severonis), но я пока не ви-
дел особей типа Hallezia. Синонимию (идентичность)
с родом Loricophrya, указанную Аэшт, я считаю совер-
шенно невозможной.
Род Pelagacineta Jankowski,
1978
Типовой вид Tokophrya interrupta Schroder,
1906.
Эпибионты на морских пелагических копеподах
родов Euchaeta и Metridia (не определены до вида).
Длина особей со стебельком до 300 мкм, размеры то-
митов около 80 X 40 мкм. Тело дисковидное, расплас-
тано на массивном эпиконе, переходящем в длинный
широкий базостил. Ядро извитое, слегка ветвится. Щу-
пальца извитые, тонкие, гофрированы при сокраще-
нии, расположены в 2 широких группах по краям тела.
Почкование эндогеммией, с образованием крупных
овальных томитов с ресничками на одной стороне
тела; отмечены особи с 3 томитами. Стебелек и его
«воронковидное расширение» (эпикон) пустотелые
(полые). Типовой вид поселяется на абдомене и кау-
дальной фурке, близкий вид Т. campanula по бокам то-
ракса; это типичная Pelagacineta, но с иными пропор-
циями базостила и эпикона и с кольцевым положением
щупалец (Р. campanula comb. п.). Третий вид — Para-
cineta euchaetae Sewell, 1951 (Pelagacineta euchaetae
comb. n.).
Пресноводный
и морской планктон
Род Staurophrya Zacharias,
1893
Типовой вид У. elegans по монотипии. Симмет-
ричные радиальные клетки величиной 60—65 мкм с
6 актинофорами в 3 плоскостях; при виде сбоку в лю-
бом положении клетки видны 4 актинофора. Соответ-
ственно имеется 6 компактных пучков щупалец-акротен,
до 12—15 в пучке; длина щупалец при растяжении до
300 мкм; ядро округлое; имеются 1—2 вакуоли. Цисты
шляпообразные, с узорчатой перитекой и сферической
эндоцистой. Вид считается европейским, но он был от-
ТИП CILIOPHORA. КЛАСС PHYLLOPHARYNGEA
721
крыт н США больше века назад в планктоне оз. Эри и
был но ошибке принят за пелагических корненожек —
Acthiophrys sp. in Vorce, 1882.
Род Tetraedrophrya Zykoff, 1904
Типовой вид Г. planktonica по монотипии. Родо-
вое название считалось невалидным (в частности, в
каталоге Аэшт), поскольку дано лишь название без
диагноза, но полное описание и рисунки вида (Зыков,
1904) не были замечены никем, кроме Довгаля (Dov-
gal, 2002). Единичные особи найдены в летнем планк-
тоне Волги; это мелкие (48 мкм) квадратные особи (на
оптическом срезе треугольные), покрытые тонким
слоем мукуса с илом; ядро округлое или слегка вытя-
нутое; от углов тела без актинофоров отходят пучки из
немногих очень длинных акротен. Вместе с этим ви-
дом собраны и типичные Staurophrya elegans, отнесен-
ные Зыковым к сем. Dendrosomidae.
Род Mucophrya Gajewskaja, 1928
Типовой в и д М. pelagica по монотипии, из планк-
тона Байкала. Гаевская (Gajewskaja, 1933) хорошо зна-
ла Staurophrya, частую на Байкале, но не цитирует вид
Зыкова и его статью о планктоне Волги. М. pelagica —
вид величиной 65—110 мкм с сердцевидным телом и 2
мукозными оболочками, более плотной снаружи и ши-
рокой, менее плотной над телом. Размеры тела с обо-
лочками до 150—180 мкм. 40—50 щупалец относи-
тельно равномерно распределены по телу, пронзают
слой мукуса. Ядро округлое. Почкование не отмечено.
Циста дисковидная (медузообразная), с волнистым
краем. В моих сборах планктона оболочка не всегда та-
кая толстая, есть переходы к Tetraedrophrya', нельзя
исключить их синонимию.
Род Heliocometes Sand, 1899
Типовой вид Acanthocystis conspicua in Zachari-
as, 1897 (Heliozoa). Известен больше по описанию Га-
евской (Gajewskaja, 1933). Сферические клетки диа-
метром 70 мкм, с прочным кортексом, почковидным
ядром; короткие толстые трубчатые щупальца с плос-
кой слегка расширенной вершиной равномерно отхо-
дят от всего тела; размножение не изучено, как и у
вышеназванных родов. В пресной воде отмечен вид
Sphaerophrya mamillata Oppenheim in Oppenheim et
Vorstman, 1976 с радиальными щупальцами от всего
тела (акротены), каждое на вздутии тела; этот стран-
ный вид больше не отмечался.
Род Marinecta Jankowski,
1973
Типовой вид Trichophrya pelagica Daday, 1888.
В морском планктоне встречаются суктории с гантеле-
видным телом, без раковины и стебелька, выделенные
в сем. Marinectidae Jankowski, 1981. Ядро вытянуто
вдоль тела, извитое; щупальца ацинетидные по литера-
туре, извитые в моем материале (результат фиксации?),
расположены 2 широкими пучками по краям тела.
Способ размножения не выяснен. Род предложен в те-
зисах, невалиден и предлагается вновь — Marinecta
Jankowski gen. п., включает M. pelagica (Daday, 1888 in
Trichophrya), M. massiliensis (Gourret et Roeser, 1886 in
Sphaerophrya), M. columbiae (Wailes, 1932 in Trichoph-
rya), M. danae (Grontved, 1951 in Trichophrya) comb. nn.
Эти виды кажутся идентичными, список формальный,
и как типовой вид на этот раз выбирается первый по
времени вид Sphaerophrya massiliensis (М. massiliensis
comb. п.). Единичные особи добыты мною на Мурмане
в воде у берега (не в бентосе); видна отслоенная обо-
лочка вокруг тела, не настоящая раковина.
Подкласс Evaginogenia Jankowski, 1978
Суктории со сходным способом почкования, распространен-
ные в пресной воде, в перифитоне и на водных беспозвоночных;
нет видов в море. Одна аберрантная группа в кишечнике водосви-
нок (кавиид) Южной Америки включается в данный подкласс
(Dovgal, 2002), но я считал их неотеническими постоянно плаваю-
щими томитами, способными к размножению, и отделял столь
своеобразные формы на уровне подкласса Neotenea независимо от
их филогении; здесь они даны в приложении к эвагинидам.
Внешний облик эвагинид очень разнообразен и частично копи-
рует разные роды эндогенид и экзогенид, но нет форм с ветвлением
тела, как у дендросом. Вероятно, развитие начинается с Prodiscop-
hrya — копии рода Podophrya’, далее следует серия видов из пери-
фитона со стебельком и без него, с пучками щупалец разной топо-
графии, с первыми пробами образования раковины (Epidiscophrya,
Catharina); часть видов — копии токофрий, и их нельзя различить
без знания томитогенеза. В этой группе возникает род Discophrya,
основной род эвагинид — крупные трофонты на массивном сте-
бельке; в перифитоне встречается большое разнообразие видов,
выходящих за рамки рода по особенностям морфологии. Большим
стимулом для эволюции становится симбиоз на водных насеко-
мых — клопах и жуках, идет активное видообразование, на многих
хозяевах и в разных локусах возникают отклоняющиеся «морфы»
видов. В меньшей степени заселены другие хозяева; на речных ра-
ках Европы обитает вид с базальными щупальцами (у скопулы) в
дополнение к стандартным апикальным — по моему мнению также
выходящий за пределы рода.
От дискофрий начинаются несколько небольших (по числу ро-
дов) независимых линий. Резкое изменение формы тела приводит к
роду Stylocometes на изоподах рода Asellus; образование раковины
вокруг плоского тела дает род Periacineta, имитирующий эндоге-
нид рода Acineta; паразиты на самих дискофриях с уменьшением
размеров тела и глубокой модификацией щупалец — род Rhync-
hophrya, аналог родов Acinetopsis, Ophryocephalus или Urnula дру-
гих подклассов; приклеивание дисковидного тела с широкой пе-
ритекой к субстрату встречается у эндогенид Heliophrya и у эваги-
нид Cyclophrya, и понадобилось долгое время, чтобы четко
распределить такие формы по 2 подклассам. Уникальный род Den-
drocometes и его байкальский потомок Cometodendron не имеют
аналогов среди других подклассов, но у вермигеммид есть род
Schizactinia с незначительным ветвлением актинофора; филогения
Dendrocometes неясная, непосредственных предшественников нет;
от рода Stylocometes он не выводится, хотя есть некоторое сходство
щупалец.
При всем разнообразии формы тела, щупалец, способов при-
крепления и питания остается неизмененным фундаментальный
признак — процесс томитогенеза. Томит массивный по отноше-
нию к телу томонта и это исключает полиэндогеммию. Цилиатура
томита закладывается при сгущении безресничных кинетосом на
46 Зак. №4163
722
ALVEOLATA
маленьком участке тела, эта ямка впячивается и начинает быстро
расти внутрь, а кинетосомы дают ресничные ряды на стенке круп-
ной внутренней полости сложной формы; вся полость с растущим
томитом вытесняется вверх, томит завершает морфогенез, следы
полости исчезают при его росте, и после некоторой задержки он от-
деляется и уплывает. Скопулоид томита (аргентофильное пятно —
место приклеивания мигранта к субстрату) полярный у внутренних
почек Tokophrya, боковой у эвагинид. Томит слегка сплющен, с
большим числом кинет сложной топографии, широкой полосой
огибающих скопулоид. После смещения протомита наружу каме-
ры нет, а у токофрий она постоянная, особь превращается в трофо-
томонта.
В лаборатории культивируется Prodiscophrya collini (имитатор
подофрий или скорее их потомок); на этом простом виде (без рако-
вины, эпикона стебелька, пучков щупалец) особо детально изучен
и документирован фотографиями морфогенез гигантского томита,
равного объему тела начального томонта. У томитов токофрий
морфогенез полностью заканчивается в эмбриональной камере (то-
мосфере), готовый томит вращается в камере, выходит через узкое
отверстие и немедленно уплывает; у Prodiscophrya морфогенез, на-
чавшийся в узкой обширной полости, долго продолжается после
смещения наружу всего комплекса, камеры внутри нет, томонт, на-
конец, делится и дефинитивный томит уплывает.
Большое число видов сукторий описано без знания способа
размножения и типа томита; таких видов в данной группе немного
в основном это виды, внешне напоминающие Tokophrya и Acineta.
У имитаторов ацинет ядро обычно вытянутое, стебелек короткий и
широкий; у пресноводных ацинет ядро округлое или овальное, сте-
белек четкий, тонкий, удлиненный. С имитаторами токофрий ситу-
ация сложнее — не у всех известен способ размножения; роды Ну-
pophrya и Multifasiculatum в данном обзоре включены в состав эва-
гинид, их нельзя было предлагать как новые без знания томитов.
Дисковидные формы из перифитона сходны, но имеют округлое
ядро у мелких эндогенид и извитое ядро с отростками, а также
меньшее число пучков щупалец у более крупных эвагинид.
В системе Довгаля (Dovgal, 2002) подкласс Evaginogenia
Jankowski, 1978 включает 4 отряда — Discophryida Jank., 1975
(Prodiscophryidae, Discophryidae, Periacinetidae, Rhynchophryidae,
Heliophryidae), Trypanococcida Dovgal, 2002 (Trypanococcidae),
Dendrocometida Raabe, 1964 (Stylocometidae, Dendrocometidae, En-
chelyomorphidae, Cometodendridae) и Cyathodiniida Jank., 1975
(Cyathodiniidae). Ниже каталог родов эвагинид дан только по се-
мействам не потому, что я не признаю такой вариант классифика-
ции — он незавершен и в ряде мест спорный; среди родов есть и
другие аберранты, заслуживающие более высокого ранга, и систе-
матизация группы не закончена. Мне неясно, что может объеди-
нять Stylocometes и Dendrocometes, кроме некоторого сходства
формы щупалец; ветвление массивного ствола со щупальцами —
признак подотряда, но почему сюда включен Stylocometes и тем бо-
лее типичная гелиофриида — эндогеммина Discosomatella с ра-
диальными рядами простых мелких щупалец? Этот род, эндемик
Байкала, нужно объединить с Heliophrya и обоих исключить из эва-
гинид.
Род Enchelyomorpha рассмотрен среди эндогенид, томит и его
морфогенез не дискофриидного типа; род Trypanococcus также ря-
дом с Endosphaera', трудно поверить, что столь сходные трофонты
произошли независимо в разных линиях, и хотелось бы иметь под-
тверждение картин деления Trypanococcus Пенарда (Penard, 1920),
которых до сих пор нет. Сем. Cometodendridae мной больше не
признается, отличие от Dendrocometes незначительное. Сем. Heli-
ophryidae по типовому роду не принадлежит к эвагинидам — у До-
вгаля, это смесь эндогенид Heliophrya и эвагинид Cyclophrya; для
последнего из названных родов я даю название Cyclophryidae
fam. п. Еще одна проблема — сем. Solenophryidae Jank., 1981. У До-
вгаля оно сборное в составе эндогенид; но ведь ясно, что тип рода
Solenophrya (S. crassa) — это эвагинида Cyclophrya magnal Если
никто не восстановит род Solenophrya как валидный вместо Cyclo-
phrya, то первое название нельзя использовать в другом смысле.
Для циатодиниев хотелось бы сохранить таксон Neotenea — ведь у
этих томитов нет стадии стандартного трофонта.
Сем. Prodiscophryidae Jankowski, 1978
Включает род Prodiscophrya Kormos, 1935 с типо-
вым видом Podophrya collini Root, 1914 по монотипии.
Тело каплевидное, на тонком стебельке, достигающем
длины тела; вершина стебелька не расширена, эпикона
нет, как и у предковой экзогеммиды Podophrya. Тон-
кий неплотный светлый стебелек подофрий часто
трудно заметить, и он иногда теряется трофонтом, а у
Р. collini он прочный, легко виден. Тонкие щупальца,
типичные акротены, отходят от всего тела, их намного
больше, чем у подофрий, и нет разрежения у апекса.
Ядро овальное, 1 или 2 вакуоли в антесоме. Для подо-
фрий характерно быстрое инцистирование, цисты с
высокими кольцевыми ребрами и с массивным проч-
ным стебельком, расширяющимся к вершине (род ди-
морфный); эта стадия цисты утеряна у Prodiscophrya и,
вероятно, начиная с этого рода, отсутствует у всех
остальных эвагинид. У подофрий конъюгируют смеж-
ные трофонты, у Prodiscophrya мигранты диморф-
ные — есть и мелкий упрощенный микроконъюгант,
конъюгация эндогамная. Как видно, очень многое раз-
деляет внешне сходных и родственных сукторий. Этот
мелкий хищник легко разводится на тетрахименах или
кольпидиях, массовые культуры которых ведутся от-
дельно, и служит объектом многих исследований; вид
представляет класс сукторий в молекулярных фило-
граммах под названием Discophrya collini (Shin et al.,
2000; Struder-Kypke et Lynn, 2003) и лишь недавно до-
бавились другие роды — Tokophrya и Ephelota (Snoy-
enbos-West et al., 2004).
Во многих публикациях использовано название
Discophrya piriformis Guilcher, 1947, ушедшее в синоними-
ку. Вид D. endogama Kormos, 1957 — другой синоним,
практически не использовался. Я считаю, что первое
название вида — Acineta Solaris Stein, 1859, второе — Suc-
torella Frenzel, 1892 (S. ciliata F., 1892; Tokophrya in Sand,
1899) — вероятно, это особь на ранней стадии томито-
генеза с ресничным зачатком. Автор вида A. Solaris хо-
рошо знал сукторий и подчеркивал, что это не подо-
фрия, и вид имеет очень крупного томита. Поэтому по
приоритету вид должен носить название Suctorella So-
laris, которое, конечно, никем не будет восстановлено.
Сем. Discophryidae Collin, 1912
В основном стебельчатые формы с пучками щупа-
лец, не всегда четкими; возможны отдельные исключе-
ния, например вторичная утрата стебелька у Testudini-
cola. Раковина имеется у немногих форм, не ацине-
тидного типа — базальная или более широкая без
сплющивания тела (отличие от Periacinetidae). Щу-
пальца всегда булавовидные, типа акротены (отличие
от Stylocometidae). Ниже вначале будет рассмотрена
трудная группа перифитонных несимбионтных родов;
это формальный каталог, часть родов можно не при-
знать или понизить до подрода. Род Discophrya разби-
вается на несколько подродов — видовых групп; раз-
личение подродов можно вести по мелким признакам,
недостаточным для ранга рода.
Род Testudinicola Jankowski, 1978
Типовой вид Anarma brevis Goodrich et Jahn,
1943. Мешковидные формы с полной утратой стебель-
ка и фиксона, прикреплены широким основанием. Щу-
ТИП CILIOPHORA. КЛАСС RHYLLOPHARYNGEA
723
пальца в одном апикальном или 2 боковых пучках;
ядро лентовидное, извитое. Виды Т. goodrichi Bovee,
1981 и Т. globovata Bovee, 1981 не относятся к этому
роду. Эти формы можно найти на любом субстрате; в
США их обычно изучают на нитях зеленой водоросли
Basicladia, обрастающих водных черепах рода Chry-
semys.
Pop, Апагта Goodrich et Jahn, 1943
Род предложен для 2 видов без указания типа, поэ-
тому невалиден. В каталоге Аэшт — Anarma Jankows-
ki, 1981 с типовым видом A. multiruga Goodrich et Jahn,
1943. Вазообразные суктории с ребрами и продольны-
ми желобками по всему телу, прикрепление короткой
широкой ножкой (модификация стебелька), на апексе
крупный пучок щупалец. Второй вид A. goodrichi
comb. n. (Testudinicola in Bovee, 1981).
Род Squalorophrya Goodrich et Jahn, 1943
Типовой вид 5. macrostyla по монотипии (эрро-
ним при описании рода — Squalophryap, вазообразные
формы с 4 продольными валиками тела, апикальным
пучком щупалец и широким стебельком; все тело и
стебелек покрыты слоем мукуса. Более длинный узкий
стебелек и нет слоя мукуса у S. stenostyla Hamilton et
Jahn, 1948.
Род Multifasciculatum Goodrich et Jahn,
1943
Типовой в и д AT. elegans по монотипии, с пласт-
рона черепах Chrysemys picta, Chelydra serpentina и Ki-
nosternum subrubrum в США. Тело вытянутое, не
сплющено, с удлиненным ядром, на тонком длинном
стебельке вдвое длиннее тела; щупальца в крупном
апикальном пучке, 2 боковых и 1 базальном вокруг
скопулы (аналогия с Sargassephelotaf
Род Epidiscophrya Jankowski, 1981
Типовой вид!?, scyphostyla (Discophrya elongata
var. scyphostyla Collin, 1912). Вид с плоским вытяну-
тым телом, нечеткими пучками щупалец; у верши-
ны короткий широкий стебелек расширяется, нижний
конец тела трофонта погружен в эту полость. Второй
вид Е. spatulata comb. n. (Discophrya in Rieder, 1936).
Признак рода малозначительный, и в него можно
включить близкие виды со сходной формой тела, с
прочным стебельком, без продольных ребер кортек-
са — Discophrya brachystyla Kormos, 1938; D. minuta
Nozawa, 1938; D. spatulata Rieder, 1936; D. /ata Rieder,
1936; D. robusta Nozawa, 1938; Podophrya cylindrica
Perty, 1852; P. elongata C. et L., 1859 (Epidiscophrya
brachystyla, E. minuta, E. spatulata, E. lata, E. robusta,
E. cylindrica, E. elongata comb. nn.). В отличие от Mul-
tifasciculatum стебелек короче и нет базального пучка
щупалец.
Род Peridiscophrya Nozawa, 1938
пес Peridiscophrya Kormos, 1938
Типовой в и д Р. japonica по монотипии, с обрас-
таний на раковинах Viviparus. Упрощенные формы
только с 1 широким апикальным пучком щупалец; кор-
текс панциревидный, возможно принят за раковину,
суженную ниже трофонта, пустотелую и прикреплен-
ную к субтрату. Второй раковинный вид — Solenoph-
rya calyciformis Penard, 1920 (Р. calyciformis comb. n.).
Если действительно есть стилотека у типового вида,
сходные виды с плотным стебельком не должны вклю-
чаться в этот род.
Род Catharina J. Kormos et К. Kormos,
1958
Типовой вид C.florea-, название рода заменено
позже на Caracatharina ввиду гомонимии с родом хи-
тонов Catharina, но это эрроним для Katharina, гомо-
нимии нет. Тело вытянутое, ядро удлиненное, щупаль-
ца в апикальном пучке; стебелек массивный, рюмко-
видный, в его полость погружена значительная часть
трофонта, иногда до апекса. Такой же вид был описан
ранее как Paracineta crassipes Rieder, 1936, но в прес-
ной воде парацинетид нет. Вероятно, типовой вид име-
ет полый стебелек (стилотеку), Р. crassipes плотный,
и виды принадлежат к разным родам.
Род Hypophrya Lopez-Ochoterena, 1964
Типовой в ид Я fasciculata по монотипии, с ко-
лоний Epistylis plicatilis на раковинах гастропод Lym-
naea и Physa в Мексике. Внешне типичные токофрии,
но с базальным пучком щупалец вокруг скопулы; тело
широкое, коническое, апекс с 4 пучками щупалец на
небольших актинофорах, стебелек почти вдвое длин-
нее тела; стадии размножения не отмечены. Род не все-
ми принят, считается синонимом токофрий (Tokophrya
fasciculata in Matthes, 1988 et Curds, 1985), но у настоя-
щих токофриид, даже у очень изменчивого вида Т. qu-
adripartita с колоний перитрих, нет базальных щупа-
лец, встречающихся у дискофриид. Положение рода в
системе неясно из-за плохого первоописания.
Род Discophrya Lachmann, 1859
Типовой вид/), speciosa по последующему обо-
значению. Крупные плоские суктории с коротким
прочным стебельком и массивным эпиконом; ядро
овальное, вакуоли с выводными каналами вдоль апи-
кального ребра; на вершине тела и по краям 3 пучка
щупалец, но иногда на особях с Hydrobius fuscipes
между ними есть и несколько дополнительных щупа-
лец поодиночке или в мелких группах. Симбионты
крупных водных жуков Hydrous piceus (на элитрах и
головном щитке; типовой хозяин), Н. aterrimus, Hydro-
bius fuscipes, Hydrophilus caraboides (особо часто засе-
лен этими сукториями). На этом виде паразитирует ди-
скофриида Rhynchophrya palpans с длинным щупаль-
724
ALVEOLATA
цем, прикрепленная к эпикону стебелька. В фазовом
контрасте и при раздавливании особей D. speciosa
можно видеть массу симбионтных эндобактерий в
виде мельчайших палочек, после изоляции в культуре
получившие название Flavobacterium buchneri. В ката-
логе родов Аэшт указано, что тип рода обозначен Ян-
ковским (1981), но Маттес (Matthes, 1954, р. 195)очень
четко обозначил «Lecto-Genotypus» D. speciosa.
Род не имел определенной характеристики и гра-
ниц, включал всевозможные виды, не только диско-
фриид; здесь отделены раковинные Periacineta и неко-
торые аберрантные виды. Часть предложенных мною
ранее родов здесь рассматривается как подроды для
обособления групп видов внутри крупного рода, име-
ющего большую перспективу роста.
Подрод Discophrya s. str. включает также D. сорег-
niciana Wietrzykowski, 1914 (=£>. guilcherae Matthes,
1954).
Подрод Venodiscophrya Jankowski, 1981, типовой
вид D. lichtensteinii (Podophrya in Claparede et Lach-
mann, 1859); также D. helophori, D. ochthebii, D. hel-
midis, D. wrzesniowskii, D. brachystyla, D. cybistericola
(Jank., 1981 in Venodiscophrya). Щупальца апикальные,
не собраны в четкие обособленные пучки; ядро оваль-
ное или слегка вытянутое, не ветвится. Комменсалы
водных насекомых. Типовой вид, по Маттесу (Matthes,
1988), существует в серии форм на разных хозяевах,
морфологически различных, но не получающих латин-
ских названий — Forma Cybister, Graphoderes, Halip-
lus, Hyphydrus, Potamonectes (это названия хозяев сем.
Dytiscidae и Haliplidae). Синонимы — Acineta hyphydri
Stein, 1859 (Discophrya hyphydri comb, n.), Podophrya
wrzesniowskii Kent, 1881 (D. wrzesniowskii comb, n.) и
D. brachystyla Kormos, 1938.
Подрод Setodiscophrya Jankowski, 1981, типовой
вид Discophrya hydroi Matthes, 1954 с ног Hydrous ater-
rimus и H. piceus (на элитрах поселяется D. speciosa).
Трофонты типа Discophrya s. str., но с ветвящимся яд-
ром; щупальца в четких разрозненных пучках.
Подрод Mesodiscophrya Jankowski, 1981, типовой
вид D. steinii (Podophrya in Claparede et Lachmann,
1859) в основном с жуков рода Dytiscus, Graphoderes и
Acilius', также D. operculariae (Stein, 1859), D. erlangen-
sis Matthes, 1954, D. deplanata Matthes, 1954, D. setar-
con (Jank., 1981). Ядро ветвящееся, как у Setodiscoph-
rya', щупальца не собраны в четкие пучки, равномерно
распределены по краям передней части тела.
Подрод Ferodiscophrya Jankowski, 1981, типовой
вид Acineta cothurnata Weisse, 1847 (Discophrya in Lach-
mann, 1859), вероятные синонимы Acineta ferrum-equi-
num Ehrenberg, 1840 и A. diademiformis Pritchard, 1861.
Свободноживущие формы из перифитона, на ряске и
других растениях; щупальца не собраны в пучки, по-
одиночке отходят от плоского тела; ядро С-образное
по ранним авторам или ветвится (Penard, 1920). Опре-
деления с жуков Hydrophilus piceus неверные.
Подрод Misacineta Jankowski, 1978, типовой вид
Discophrya cybistri Colin, 1912, также D. acilii Collin,
1912. Маттес (Matthes, 1988) указывает вид для боль-
шого числа хозяев и различает ряд морфотипов, час-
тично приуроченных к разным носителям, без указа-
ния типового хозяина и морфотипа. Род Misacineta
был предложен мною с учетом данных Колена (Collin,
1912) об уникальном типе томита D. cybistri с кольцом
ресничек и исчерченным кортексом, но, по Маттесу
(Matthes, 1988), это мигрант Orbopercularia с округ-
лым ядром; в таком случае род ликвидируется и не раз-
личается как подрод.
Род Cyathodiscophrya Jankowski, 1978
Типовой вид Discophrya cyathostyla Matthes,
1954 с жуков Dryopidae, также D. gessneri М., 1954 и
D. laccobii М., 1954. У типового вида имеется расши-
ренный стебелек, переходящий в гемитеку, в которую
погружена нижняя часть тела трофонта; ядро округ-
лое, щупальца одиночные, не в пучках, по всей кайме
тела. D. gessneri — симбионт водного клопа Aphelochi-
rus aestivalis, D. laccobii — симбионт гидрофилид рода
Laccobius.
Род Coronodiscophrya Jankowski, 1981
Типовой вид Discophryaprismatica Holm, 1928.
Это действительно аберрантная форма дискофриид —
тело не сплющено, цилиндрическое, вершина в виде
плоского диска, несущего по краям 2 кольца равномер-
но распределенных щупалец (не в пучках); вокруг ско-
пулы добавочное кольцо таких же щупалец; ядро
овальное; длинный стебелек без эпикона. Редкий пери-
фитонный вид, не симбионт жуков.
Род Paradiscophrya Jankowski, 1981
Типовой ъп р Podophrya astaci С. etL., 1859, поз-
же в родах Acineta, Tokophrya и Discophrya. Тело ци-
линдрическое, мешковидное, не сплющено, на верши-
не массивного длинного стебелька без широкого эпи-
кона; щупальца не образуют правильного паттерна —
не в пучках, не в кольцах, рассеяны по вершине и кра-
ям тела, часто виден и базальный пучок; ядро не вет-
вится, овальное. Специфический симбионт на ротовых
придатках речных раков Astacidae Европы, иногда
массовый. Неизвестно, есть ли на камбаридах Север-
ной Америки и Дальнего Востока; пока описан лишь
вид Podophrya inclinata Kellicott, 1887 с «плавательной
ножки» Cambarus sp. из р. Ниагара; зарисована одна
особь с коническим стебельком и округлым ядром,
несомненно дискофриида, но неясного положения.
У Маттеса (Matthes, 1988) — это синоним вида D. asta-
ci, но данное обстоятельство ничем не доказано.
Род Elatodiscophrya Jankowski,
1978
Типовой вид Discophrya stammeri Matthes, 1954
с жуков-гидрофилид Helochares lividus', короткий тол-
стый стебелек расширяется в обширную незначи-
тельно сплющенную раковину с краями на разной вы-
соте; трофонт целиком погружен (у Cyathodiscophrya
лишь частично); края тела с 3—4 четкими пучками щу-
палец; ядро удлиненное. В состав рода можно вклю-
ТИП CILIOPHORA. КЛАСС PHYLLOPHARYNGEA
725
нить Discophrya hochi Matthes, 1954 с жука Helophorus
Jlavipes, хотя этот вид имеет одиночные щупальца, не в
пучках.
Сем. Periacinetidae Jankowski, 1978
Дискофрииды, конвергентно имитирующие аци-
нет; раковина плоская, высокая, прикреплена настоя-
щим стебельком или псевдостилом (у одного рода
стенка раковины сужается внизу в виде стебелька).
Свободноживущие перифитонные виды и комменсалы
водных насекомых.
Род Periacineta Collin, 1909
Род предложен для группы раковинных видов Hal-
lezia buckei, Acineta linguifera, A. lacustris', типовой вид
по моему выбору Podophrya buckei Kent, 1881 (Paraci-
neta in Collin, 1909). Вид неоднократно описывался
ранними авторами под разными названиями, имеет
много синонимов (см.: Matthes, 1988, р. 135), приписы-
вался к разным родам — Hallezia, Acineta, Podophrya,
Discophrya. Маттес усложняет ситуацию, описывая се-
рию морфотипов с разных субстратов, — Forma Pla-
norbis, Nepa, Hydrous, Helophorus, Argyroneta (вид c
водяного паука особый — P. argyronetae Jank., 1981),
хотя это в норме перифитонный вид, не комменсал.
Типичная форма вида по старой литературе имеет
плоское вытянутое тело, удлиненное ядро, короткий
прочный стебелек; щупальца в 2 боковых пучках по
краям апикальной щели, как у ацинет. Примеры ви-
дов—Periacineta gyrini Dovgal, 1993; Р. hydrochi (Mat-
thes, 1954); P. striata D., 1993; P. periacinetoides (Noza-
wa, 1938); P. laccophili (M., 1954); P. koeppeli (M.,
1954); виды Янковского (1981) — P. nepae, P. hydroi,
P. helophori, P. planorbis, P. argyronetae.
Подрод Fitonacineta Jankowski, 1981, типовой вид
Acineta periacinetoides Nozawa, 1938. Свободноживу-
щие формы из перифитона с одной осевой сократи-
тельной вакуолью; сюда относятся также явно синони-
мичные виды Р. lacustris (Stokes, 1886), Р. tenuis (No-
zawa, 1938), Р. urceolata (Stokes, 1885) и P. compressa
(Nutting, 1888). Нужно проверить этот признак у
Р. buckei', несколько вакуолей есть у разных симбионт-
ных «форм» вида, но свободных сукторий описывают
по-разному.
Подрод Anisarcon Jankowski, 1981, типовой вид
Acineta notonectae С. et L., 1859. Для этого вида был
предложен род Calix Fraipont, 1878; это гомоним, по-
этому для аберрантного типового вида я предложил
новое название Anisarcon. Раковина вытянутая, на ко-
ротком стебельке, несильно сплющенная, ядро удли-
ненное, щупальца на 2 небольших краевых актинофо-
рах. У ацинет и периацинет края плоской раковины на-
ходятся на одном уровне, у Р. notonectae передний
край раковины намного ниже заднего. Если это не ро-
довой признак, то вид в любом случае заслуживает
ранга подрода. Симбионты водных клопов Notonecta
glauca (типовой хозяин), Corixa spp., Sigara falleni.
Вид относили к родам Acineta, Solenophrya, Calix, Dis-
cophrya, Periacineta.
Род Arcodiscophrya Jankowski, 1981
Типовой вид J. heraldica Jankowski, 1981 —
nom. n. для «Gelenkform» вида Discophrya hydrochi
(Matthes, 1954a). Раковина, как у периацинет, стебель-
чатая, но апикальная щель очень длинная, справа и
слева идет далеко вниз до уровня вершины стебелька;
щупальца в рядах поодиночке вдоль щели, не в 2 крае-
вых пучках. Если важнее положение щупалец, а не
длина щели, род включает также A. koeppeli comb. n.
(Discophrya in Matthes, 1954)- и A. hydrochi comb. n.
(Discophrya in Matthes, 1954). Это симбионты водных
жуков Helmis, Latelmis и Hydrochus.
Роды Peridiscophrya Kormos, 1938
и Kormosia Dovgal, 2002
Название Peridiscophrya было предложено одно-
временно в Японии и Венгрии для разных дискофри-
ид; эту ситуацию я обсудил ранее (Янковский, 1981),
не зная, какое из них должно уйти в синонимику — Pe-
ridiscophrya Nozawa, 1938 или Peridiscophrya Kormos,
1938. Второй род был упомянут для 2 видов — Periaci-
neta linguifera (С. et L., 1859) и Р. buckei (Kent, 1882),
это не было стандартное предложение «gen. п.» —
Кормош просто переименовал род Periacineta в Peri-
discophrya, поскольку это не ацинетиды, а дискофрии-
ды. Поэтому род невалиден. Я предложил оставить на-
звание Peridiscophrya Kormos, 1938 только для Р. lin-
guifera (=Acineta linguifera С. et L., 1859, A. ligulata
Stein, 1859), с диагнозом «внешне типичные парацине-
ты, но стебелек часто полый, образован стенками рако-
вины». Довгаль (Dovgal, 2002) предложил новый род
Kormosia для этого вида, но теперь вновь та же пробле-
ма — какое название предложено раньше — Acineta
linguifera или A. ligulata.
Сем. Rhynchophryidae Jankowski,
1978
С 1 аберрантным родом Rhynchophrya Collin, 1909
(Rh. palpans Collin, 1909). Это редкий случай пара-
зитизма у дискофриид — мелкие вытянутые огур-
цевидные клетки R. palpans прикреплены с помощью
короткого широкого фибриллярного стебелька к мас-
сивному стебельку крупных дискофрий. Типовой
хозяин Discophrya ferrum-equinum var. gracilescens,
сейчас принято название D. speciosa Lachmann, 1859;
это симбионт на надкрыльях (элитрах) водного жука
Hydrous (=Hydrophilus) piceus. Строение паразитов
простое, раковины нет, ядро вытянутое, перитека тон-
кая, несколько вакуолей (3—10) с каналами рассея-
ны по телу. Одно длинное щупальце (реже несколько
более коротких, до 4 щупалец) с длинным осевым ка-
налом в цитоплазме очень подвижное и сократимое,
гибкое, не акротенного типа; питание высасыванием
хозяина; на стебельке хозяина помещается не больше
4—5 клеток паразита. Размеры особей 60—85 мкм,
длина щупальца до 10—200 мкм. Почкование типично
дискофриидное с крупным томитом в продольной ка-
мере.
726
ALVEOLATA
Сем. Stylocometidae Jankowski, 1981
С одним родом Stylocometes Stein, 1867, типовой
вид Acineta digitata Stein, 1859.
Название Digitiphrya Fraipont, 1878 (nee Digitophrya
Matthes, 1988) было предложено для того же типового
вида и уходит в синонимику. Род Pericometes Schnei-
der, 1886 предложен для нового вида Р. digitatus Schn.,
1886, совпадение Названия видов случайное. Род Asel-
licola Plate, 1888 предложен для Acineta digitata St. (так
в подписи к рисункам), следовательно не для своего
нового вида, а для Acineta digitata Stein, 1859. Кроме
того, дано название нового вида Trichophrya digitata
Claparede et Lachmann, 1859 независимо от вида Штей-
на (Podophrya digitata in C. et L., 1859, p. 142).
Все названия касаются одного вида; 3 автора неза-
висимо дали виду одинаковое название, отражающее
пальцевидный тип щупалец, и 3 автора предложили
новый род для вида. Неясно, какая публикация прио-
ритетная — с видом Acineta digitata Stein, 1859 или
Trichophrya digitata C. et L., 1859.
Основной хозяин (типовой) — водный ослик Asel-
lus aquaticus в Европе; отмечены также на Proasellus
banyulsensis в Италии, Р. coxalis в Алжире, вида нет на
эндемичных аселлотах в оз. Охрид и в Байкале. На юге
Сахалина в заплесковом водоеме с гниющими фукуса-
ми я собрал много осликов вида Asellus hilgendorfi с
типичными стилокометесами, вероятно эвригалинны-
ми, как и их хозяин. Обычный локус — края жаберных
пластинок. Указание вида в старой литературе для ко-
лоний Ophrydium versatile крайне сомнительно, я ни-
когда не находил никаких сукторий на мукозных ша-
рах колоний и на самих офридиях.
Трофонты широкие, заметно сплющенные, с проч-
ным кортексом (перитекой), но без раковины; при-
крепление нижней поверхностью тела, но при отделе-
нии особи можно заметить небольшой фиксаторный
участок без стебелька, с подобием ножки. Ядро удли-
ненное, с выступами, незначительно ветвится. Щу-
пальца толстые, пальцевидные (пахитены), несократи-
мые, направлены вверх и в стороны, равномерно рас-
пределены по всей выпуклой апикальной площадке;
краевые щупальца могут быть толще и длиннее. Томит
отделяется в центре апекса. Конъюгация соседних тро-
фонтов изогамная.
Сем. Dendrocometidae Stein, 1852
Крупные дисковидные или вазообразные формы
с ветвлением краевых стволов щупалец — видоиз-
мененных актинофоров; комменсалы пресноводных
гаммарид.
Род Dendrocometes Stein, 1852
Типовой вид D.paradoxus Stein, 1852 по моно-
типии. Вне Байкала только 1 вид, достоверно извест-
ный в Европе, Сибири, на Дальнем Востоке, в Японии;
несколько раз отмечался в США, но нет ни одного точ-
ного иллюстрированного описания этого вида в стра-
нах Северной Америки (см. ниже род Niscometes), хотя
в США и Канаде есть вид Gammarus lacustris, обыч-
ный хозяин вида в Палеарктике. Круг хозяев вне Бай-
кала — G. pulex, G. pulex komareki, G. lacustris,
G. ambulans, G. ochridensis, G. roeselii (=Carinogamma-
rus), G. balkanicus (=Rivulogammarus), неопределен-
ные гаммариды, указания в старой литературе для G.
puteanus неверны, это пещерные Niphargus, они несут
только токофрий. Интродуцированный галофильный
вид G. tigrinus замещает гаммарид в северной Европе,
лишен дендрокометесов. На Дальнем Востоке в при-
морских озерах обитают виды Anisogammarus, всегда
без этого симбионта, но в фиксированных пробах эн-
демичных Jesogammarus из оз. Бива в Японии я нашел
Dendrocometes, неотличимый от европейского вида;
это может означать, что Jesogammarus — потомок
пресноводных гаммарид, а не рода Anisogammarus
морского происхождения.
Тело дисковидное, приклеено к жабре обширной
нижней поверхностью, с выпуклой вершиной; от краев
тела отходят, обычно несимметрично, несколько
(3—6) светлых длинных широких стволов, ветвящихся
на вершине, с каналами всех щупалец по оси ствола;
каждая ветвь с розеткой коротких толстых щупалец,
обычно по 3 щупальца в розетке. Ядро овальное, ваку-
оль одна, с каналом и порой, как у дискофрий. Кортекс
прочный, панциревидный. Томит массивный, при виде
зародышевой камеры сверху ресничная полоса прохо-
дит по периферии тела замкнутым кольцом. При имп-
регнации серебром вся поверхность тела усеяна арги-
росомами; группа их сгущается при локальном деле-
нии и погружается, давая начало крупной камере,
идущей далеко под верхней частью тела почти до по-
стерона. Томит образуется на дне полости, как бы ле-
жит на спине в узкой низкой пещере; вверх обращена
зона скопулы, сбоку продольная полоса ресничек. По
Батиссу (Batisse, 1994), это не вполне типичный для
дискофриид способ морфогенеза, сочетание инвагина-
ции зачатка с циркумвагинацией цилиатуры.
В Байкале эволюция амфипод сопровождалась эво-
люцией симбионтов, но в более скромном масштабе;
число амфипод более 200 видов, видов Dendrocometes
6, из них один известный. D. paradoxus найден только
на Gammarus hyacinthinus, Pallaea grubei и на 3 видах
мелких гаммарид рода Micruropus. Другие виды и хо-
зяева — D. densus Swarczewsky, 1928 (44 вида многих
родов), D. robustus (Pallasea bicornis), D. gigas (Micru-
ropus possolskii, M. wahli), D. gracilis (Acanthogamma-
rus, Pallasea и Plesiogammarus), D. discoideus (Macro-
pereiopus, Microgammarus и Baikalogammarus').
Род Dendrocometides Swarczewsky,
1928
Типовой в ид О. priscus по монотипии, с энде-
миков Байкала Acanthogammarus albus', на жабрах хо-
зяина группы особей окружают трофонтов Cometo-
dendron clavatum. Тело очень мелкое, дисковидное, с
овальным ядром и несколькими острыми щупальцами,
часть из них незначительно ветвится. Стадий размно-
жения не замечено. Это сомнительный род, возможно
томиты рода Dendrocometes на ранних стадиях раз-
вития.
ТИП CILIOPHORA. КЛАСС PHYLLOPHARYNGEA
727
Род Niscometes Jankowski gen. n.
Типовой вид Dendrocometes peregrinus Small
et Lynn, 1985. Род Niscometes Jankowski, 1987 пред-
ложен в тезисах, невалиден и здесь предлагается
вновь для вида с неназванного хозяина в США или
Канаде, зарисованного в Guide (Small, Lynn, 1985).
Дисковидное тело, томит, ядро, ветвящиеся акти-
нофоры, как у D. paradoxus, но по всей кайме тела
имеется кольцо двойных или тройных щупалец такого
же типа, как на вершинах ветвей в тройных розетках.
Ранее вид D. paradoxus несколько раз отмечался в
США, но всегда без комментариев и без рисунков, поэ-
тому до сих пор неизвестно, есть ли он в Северной
Америке.
Род Cometodendron Swarczewsky,
1928
Типовой вид С. erectum. Четкий валидный
род без переходных форм, эндемик Байкала, засе-
ляет жабры и (в отличие от Dendrocometes') также пе-
реоподы и плеоподы хозяев. Род был предложен для
12 видов без указания типа; типовой вид — по обо-
значению Довгаля (Dovgal, 2002). Нужный материал
легко собрать на литорали, заселен, в частности, вид
Eulimnogammarus cyaneus, обитающий непосредст-
венно у кромки воды под камнями, крупный
вид Е. verrucosus с глубин 0.2—10 м и другие при-
брежные гаммариды. У Гаевской (Gajewskaja, 1933)
«очень изменчивый вид» Dendrocometes paradoxus и
в Байкале существует в 2 «морфах» — forma typica
и forma elongata', это искаженная, ложная картина,
род Cometodendron валидный и действительно содер-
жит ряд видов, хотя, возможно, и не все 12 видов ва-
лидные.
Виды, локусы и хозяева рода: С. erectum Swarczew-
sky, 1928 (жабры Odontogammarus, Pallasea, Plesio-
gammarus, Abyssogammarus, Axelboeckia), C. digitatum
(жабры и плеоподы Odontogammarus, жабры Parapal-
lasea, Gammarus, Eulimnogammarus, Crypturopus),
C. clavatum (жабры Acanthogammarus victorii), C. bre-
vimanum (жабры Garjaewia cabanisi), C. spissum (жаб-
ры и плеоподы Odontogammarus, Carinogammarus,
Eulimnogammarus), C. longimanum (на плеоподах Om-
matogammarus и Crypturopus), C. raphanus (жабры
Odontogammarus и Parapallasea), C. subtile (жабры
Ommatogammarus carneolus), C. rhabdophryoideum
(жабры, переоподы и коксы Ommatogammarus albinus),
C. palmetta (плеоподы О. albinus), С. palmettoideum
(плеоподы Crypturopus), С. pedunculatum (жабры Abys-
sogammarus peter si).
Сем. Cyclophryidae fam. n.
Этот таксон соответствует сем. Solenophryidae
Jank., 1981, но я уверен, что восстановление названия
Solenophrya вместо Cyclophrya никем не будет приня-
то. Крупные дисковидные формы, приклеенные к суб-
страту, с ветвящимся ядром и пучками акротенных
щупалец по краям диска. Перифитон пресных вод.
Хронология и синонимика единственного валидного
вида следующая:
Solenophrya crassa Claparede et Lachmann, 1859, тип
рода Solenophrya по монотипии
Cyclophrya magna Gonnert, 1935, тип рода Cycloph-
rya по монотипии
Craspedophrya erhardi Rieder, 1936, тип рода Cras-
pedophrya по указанию в первоописании
Heliophrya erhardi (R., 1936) Matthes, 1954
Trichophrya maxima Oppenheim, 1957 (?)
В перифитоне пресных вод, в частности на стеклах
и полиэтиленовой пленке, можно встретить крупных
дисковидных сукторий Cyclophrya magna диаметром
100—150 мкм, иногда с почти прямоугольным телом,
с длинным извитым ядром, нередко с боковыми отро-
стками, с 6—8 вакуолями близ групп щупалец; по пе-
риферии широкая светлая или исчерченная кайма с не-
ровным краем — клеевая секреция; длинные растяжи-
мые щупальца в 4—6 компактных угловых группах.
Размножение дискофриидного типа, томит и камера
занимают значительную часть тела томонта, после их
вытеснения наружу не остается следа камеры. Томит с
длинным ядром, серией вакуолей с каналами, и зам-
кнутой ресничной полосой вдоль базальной части
тела.
Вид Cyclophrya katharinae Kormos, 1959 в 1.5—2
раза крупнее, чем С. magna, выявлен при изучении то-
митогенеза — отличается местом закладки цилиатуры
эндотомита и динамикой морфогенеза пучков щупа-
лец по отношению к полярности тела томита. Возмож-
но, без учета этого вида в США назван, но не описан
новый вид Heliophrya chapmani, вероятно, с 2 пучками
щупалец и ветвящимся ядром.
Типовой вид рода Solenophrya С. et L., 1859
(S. crassa) по первоописанию — крупная суктория диа-
метром 160 мкм, прикрепленная к субстрату (корни
ряски) дном высокой чаши; трофонт с 4 пучками щу-
палец и серией вакуолей на широком апексе; раковина
открытая, вровень с вершиной тела. Таких раковин не
бывает; если сравнить с фотографиями типичной
С. magna, увидим край каймы, иногда далеко от края
тела, это и было принято за раковину у S. crassa. Род
принимали для разных сукторий (Matthes, 1988), но по
типовому виду это дискофриида, и название рода и
вида имеет приоритет.
728
ALVEOLATA
Подкласс Neotenea Jankowski, 1978
Трофонты постоянно плавающие, без стадии прикрепленного
трофо-томонта; размножение у подвижной формы, имеющей
все признаки личиночного строения. Закладка цилиатуры томи-
та наружная, с инвагинацией зачатков и синхронным развитием
2 томитов.
Отряд Cyathodrniida Jankowski, 1975
Сем. Cyathodiniidae Da Cunha, 1914
Род Cyathodinium Da Cunha, 1914
Род включает несколько видов из кишечника диких
грызунов (морских свинок Caviimorpha) Южной Аме-
рики, в основном из Cavia арегеа и С. porcellus', лучше
остальных изучен вид С. piriforme из подрода Cyatho-
dinioides. Особи конусовидные, сужаются к постерону,
без следа раковины или фиксона; ядро округлое; ваку-
оль одна. Имеется широкая полость с кинетами на дне
и по краям; поперечные ресничные ряды слева подхо-
дят к группе из нескольких эндоспритов — видоизме-
ненных щупалец, судя по данным электронной микро-
скопии. Кинетосомы в рядах ориентированы с образо-
ванием вторичных рядов — паратен. Кинетом сложно
дифференцирован, аргентофильной скопулы нет. При
сравнении с томитами ацинетид очевидна гомология
ресничной полосы и эндоспритов Cyathodinium с рес-
ничной дугой и аргентофильным рядом крупных телец
вдоль внутреннего края полосы томитов.
Подроды выделены по форме тела и обычно в лите-
ратуре не упоминаются. С. conicum Da Cunha, 1914 —
тип подрода Cyathodinium Da Cunha, 1914 s. str., C. pi-
riforme Da Cunha et Freitas, 1936 — тип подрода Cyat-
hodinioides Da Cunha et Freitas, 1936, C. chagasi Da
Cunha et Freitas, 1935 — тип подрода Paracyathodinium
Da Cunha et Freitas, 1940. Различия касаются формы
тела и размеров ресничной полости. Другие виды, ко-
торых трудно распределить по этим подродам, —
С. indiae Bhaskar Rao Т. S. et Bhaskar Rao T., 1976;
C. cunhai Nie, 1950 (для C. piriforme in Lucas, 1932);
C. scotti Da Cunha et Freitas, 1940; C. pentagonum C. et
F., 1940; C. parvus C. et F., 1940; C. intermedius C. et F.,
1940; C. breveC. etF., 1940; C. conicum var.furcataHas-
selmann, 1918. Вид C. sphaericum Kopperi, 1937 описан
из морских свинок в Финляндии, единственный рисунок
не показывает дорсальных ресничных колец и эндо-
спритов. С. vesiculosum Da Cunha, 1914 — аберрантный
вид с мешковидным телом и гигантской полостью.
Класс Nassophorea Small et Lynn, 1981
Цилиаты co сложным аппаратом немадесм глотки (пучки мик-
ротубул, дериваты околоротовых кинетосом); подвижные бентос-
ные и планктонные формы с особым разнообразием в пресных во-
дах и террофитоне. Соматическая цилиатура хорошо развита; про-
слеживается путь от примитивных фургасоний до массивных
планктонных нассулид с полимеризацией кинет; другая линия —
адаптация к грунтам, сплющивание гибкого тела у Chilodontopsis
и у синхимениид. Все виды свободноживущие, симбионтов нет.
Цельная монофилетическая группа с особым типом ультраструкту-
ры кинетид и связанных с ними корневых фибрилл.
Отряд Synhymeniida Puytorac et al., 1974
(рис. 343, а, б)
Тело вытянутое, у донных форм сплющено; имеет-
ся циртум; ротовая цилиатура — синхимениум, цель-
ная полоса или полоса из вплотную сближенных групп
дикинетид (дисом), идущая ниже рта под углом к
оси тела.
Сем. Orthodonellidae Jankowski, 1968
Плоские бентосные формы с широким телом; пе-
редний конец отогнут влево вбок, образуя характер-
ный клювовидный выступ. От выступа вправо вниз
идет синхимениум, проходит под ртом, ограничивает
вершины правых и левых кинет вдоль апикального
шва и пересекает большое число рядов или все кинеты
правой стороны тела.
В современных руководствах приводится так-
же сем. Synhymeniidae Jankowski in Small et Lynn,
1985. Поскольку род Synhymenia был диагностирован в
тезисах, а не в журнальной статье, хотя и принят в
каталоге Аэшт, род невалиден и название семейства
также.
Род Chilodontopsis Blochmann, 1895
Типовой вид Chilodon depressus Perty, 1852, в
новой комбинации Chilodontopsis depressa. Мелкий
пресноводный вид, малозаметный, плоский, с очень
светлым прозрачным телом, без включений, с резким
светопреломлением; морфологию in fixo лучше изу-
чать в сулеме при рельефном боковом освещении.
Форма тела, как у хилодонелл, но иногда тело более
вытянутое; весь постерон занят непропорционально
большой вакуолью с одной экскреторной порой; ядро
округлое, рот узкий, с прямой немадесмальной глот-
кой. По вакуоли вид легко отличить от похожих хило-
донелл, имеющих 2 мелких округлых вакуоли по диа-
гонали или больше, но никогда не на постероне. Шов
от клюва ко рту с длинными ресничками видели уже
ранние авторы; импрегнация серебром выявляет син-
химениум вдоль шва — линию из дисом, почти дости-
гающую правого края, и продольные кинеты — 20—30
на венте, 7—12 на дорсуме; правые кинеты (целые и
прерванные полосой) огибают рот и подходят к синхи-
меновой полосе сверху. На венте кинеты и кинетосо-
мы в них сближены, на дорсуме, кроме 2 краевых ря-
дов, кинеты и кинетосомы разрознены. Вентральные
кинетосомы местами образуют поперечные ряды (па-
ратены). Аргиром — поперечные перемычки между
кинетами — проще, чем у хилодонелл. Одна или не-
ТИП CILIOPHORA. КЛАСС NASSOPHOREA
729
сколько кинет прерваны ртом, их фрагменты лежат ле-
вее рта. Размер особей 50—80 мкм, движение медлен-
ное, скользящее, тело очень гибкое, метаболичное.
Вид Деру (Deroux, 1978b), названный Chilodontop-
sis depressa, по всем признакам не соответствует типо-
вой форме, это ошибка. Указание рода для моря тоже
ошибка, сейчас все морские виды перенесли в состав
Zosterodasys', род разгрузился и от сходных с морски-
ми пресноводных форм. Поэтому примеры рода, при-
веденные в Traite и в Guide (Puytorac, 1994; Lynn,
Small, 2002), неверны, это в обоих случаях не Chilo-
dontopsis. К роду действительно приписывали боль-
шое число более крупных видов, вплоть до последних
лет, но постепенно все они ушли в состав Zosterodasys.
Вид с Кавказа Zosterodasys debilis Alekperov, 1984
более узкий, но таких же размеров, как Ch. depressa
(результат фиксации?), имеет то же строение, сходное
число кинет (20—25 + 10—15), поэтому здесь переводит-
ся в состав Chilodontopsis {Ch. debilis comb, n.) и внут-
ри рода объявляется синонимом вида Ch. depressa.
Род Diacilon Jankowski gen. n.
Типовой вид Chilodontopsis planicaudata Song
et Wilbert, 1989 {D. planicaudatus comb. n.). Авторы
этого вида дали сравнительное описание Ch. depressa
и Ch. planicaudata по импрегнированным препаратам;
второй вид крупнее, синхимениум прерывает все вент-
ральные кинеты и продолжается в виде шва направо; у
рта обширная безресничная зона (ацилон); вентраль-
ные кинеты не биполярные, укорачиваются справа на-
лево, образуя второй обширный ацилон.
Род Derodontopsis Jankowski gen. n.
Типовой вид Chilodontopsis vermiformis Dero-
ux, 1978 — мелкие узкие формы (до 60 мкм) с густой
цилиатурой; шов с полосой пектинелл начинается на
дорсуме и идет ниже рта, пересекает только послеро-
товые кинеты и не заходит на правосторонние ряды. У
дорсальной части полосы — небольшая секанта. Вто-
рой вид D.farinus Jankowski sp. п. для «Chilodontopsis
depressus» in Deroux, 1978; описание и рисунки у Деру
(Deroux, 1978b). Эти виды нельзя включить в состав
Zosterodasys, поскольку на венте шов не продолжается
правее послеротовых кинет.
Род Zosterodasys Deroux,
1978
Типовой вид Z. agamalievi. Внешний облик как
у хилодонелл, с клювом слева, но особи более вытяну-
тые и узкие. В отличие от рода Chilodontopsis, к кото-
рому раньше относили эти формы, нет обширной ваку-
оли у постерона; округлые мелкие вакуоли рассеяны
по телу; кинеты более многочисленные, тесно сближе-
ны, кинетосомы густо расположены в рядах на венте и
дорсуме. Синхимениум очень четкий (у Derodontopsis
различим с трудом), начинается на дорсуме и пересе-
кает всю или почти всю вентральную поверхность,
прерывая правые кинеты. Ядро овальное или вытяну-
тое. Долгое время любой вид такого типа, пресновод-
ный или морской, относили к Chilodontopsis vorax', это
агрегат по крайней мере 5 морфотипов, один из кото-
рых получил название Z. agamalievi. В пресных водах
распространен Z. transversus, на Кавказе также не-
сколько локальных видов, но в основном этот род мор-
ской. Питаются Chilodontopsis бактериями, Zosteroda-
sys — часто диатомеями.
Примеры видов: Z. acuta .Ozaki et Yagiu, 1941;
Z. agamalievi Deroux, 1978; Z. alizadei Aliev, 1990;
Z. azerbaijanicus A., 1990; Z. caspica Femandez-Lebo-
rans et Alekperov, 1995; Z. cantabrica F.-L. et A., 1995;
Z. caudatus (Kahl, 1933); Z. derouxi A., 1990; Z. elonga-
tus (K., 1931); Z. fluviatilis F.-L. et A., 1995 (= Zosteroda-
sys sp. in Aliev, 1990); Z. henarensis F.-L. et A., 1995
(для гомонима Z. derouxi Sola et al., 1990); Z. hisioensis
O. et Y., 1941; Z. jankowskii A., 1990; Z. kasymovi A.,
1990; Z. kryophilus Petz, Song et Wilbert, 1995; Z. kuren-
sis A., 1990; Z. mirabilis Alekperov, 1984; Z. muscorum
(Kahl, 1931); Z. numerosa O. et Y., 1941; Z. oblonga (Ma-
upas, 1883) (плохо описанный неприемлемый вид),
Z. raikovi Aliev, 1990; Z. serrani Femandez-Leborans,
1990; Z. shumerica A., 1990; Z. simplex O. et Y., 1941;
Z. transversus (Kahl, 1928); Z. vorax (Stokes, 1887).
В обзоре рода (Femandez-Leborans, Alekperov,
1995) пропущены 4 морских вида из Японии и часть
пресноводных видов и не упоминаются мои публика-
ции об идентичности Synhymenia (тип рода S. heterove-
siculata) и Zosterodasys, а также моя замена гомонима
Z. derouxi на S. iberica (Янковский, 1988).
Род Synhymenia Jankowski,
1967
Типовой вид Nassula heterovesiculata Gelei,
1939 из пресных вод Венгрии. Внешний облик, как у
видов Zosterodasys, с клювом и полосой, пересекаю-
щей все тело ниже рта; вакуоли многочисленные по
всему телу, кроме них имеется небольшая каудальная
вакуоль; кинеты полимеризованы. Гелей (Gelei, 1939)
применил импрегнацию, дал 2 снимка и рисунок; на
рисунке от апекса до рта идет бисекантный шов, к ко-
торому справа и слева подходят кинеты. Это был
основной повод для установления нового рода. Вид не
был переописан, род считался сомнительным — такой
полосы не может быть у подобных форм. Снимок вент-
ральной стороны у Гелей нечеткий, но все же видно,
что шва нет. Поэтому описанный позже род Zosteroda-
sys был признан синонимом рода Synhymenia, получив-
шего исправленную характеристику. Эти изменения
приведены в тезисах с переносом всех видов Zostero-
dasys в состав синхимений; эта публикация никем не
цитируется.
В каталоге'родовых названий цилиат (Aescht, 2001)
почти все названия, предложенные в тезисах, призна-
ны невалидными. Synhymenia приводится как валид-
ное название, предложено в тезисах (Янковский,
1967а), но «с полной характеристикой в 1968 году».
Это не критерий валидности; в таком же случае, когда
многие названия я давал в тезисах, с подробным диа-
гнозом в журнальной статье (Янковский, 1980 и др.),
730
ALVEOLATA
Рис. 341, a. Nassulida.
Parafurgasonia sp. (A); Nassulopsis muscicola (£); Urliella terricola (В—Д)', «Nassula» laleritia IE. Ж)', Furgasonia («Cyclogramma») rubens (3, Jf); F. blochmanni
(K—M). (По: Faure-Fremiet, 1959 (Д); 1967a (£, Ж); Foissner, 1987a, (В—Д K—1994b (Л); Dragesco, Dragesco-Kerneis, 1986 (3, Ip).
Fig. 341, a. Nassulida.
Аэшт не признавала такие роды валидными. Название
Synhymenia предложено в тезисах, но в статье годом
позже (Янковский, 19686) приведено не как gen. п., а
при всех упоминаниях только с датой 1967 — «.Synhy-
menia gen. п. для Nassula heterovesiculata Gelei, 1939
(имеется лента слившихся мембранелл и предротовой
шов (ПШ), неразличимый у Orthodonella)» (Янков-
ский, 19676, с. 38). Поэтому, хотя название Synhymenia
после исправления диагноза (шва нет) имеет приори-
тет, от него нужно отказаться и использовать обще-
принятое название — Zosterodasys. Типовой вид син-
химений переводится в состав указанного рода как
Z. heterovesiculatus Jank. comb. n.
Род Eucamptocerca Da Cunha,
1914
Типовой вид E. longa из морского бентоса, от-
крыт в Бразилии, отмечен в Восточной Африке (Сома-
ли). Тело длинное и узкое, червеобразное, величиной
240—300 X 25 мкм, плавно заостряется кзади; оттянут
хвост с рядами циррусовидных щетинок. Кинеты не-
многочисленные, в правильных рядах; субапикальный
рот с циртумом, ядро овальное, вакуоль не отмечена.
Число кинет резко уменьшается к хвосту. Кинеты оги-
бают крупный рот с 22 немадесмами, так же как у Zos-
terodasys, и подходят к поперечной синхименовой по-
лосе с пектинеллами, расположенной иным образом
(клюва нет, левый край полосы смещен далеко вниз).
По Калю (Kahl, 1931), это синоним рода Chilodontopsis
sensu lato; у Корлисса (Corliss, 1979) в сем. Nassulidae и
позже в Orthodonellidae; по Аэшт, это nomen dubiurn,
что нельзя принять. Род валидный, и изучение пекти-
нелл (косых дисом, из которых состоит синхимениум
по всей своей длине) должно показать его принадлеж-
ность — пока неясно, расположены ли пектинеллы
вплотную в одном непрерывном ряду (синхимениум)
или с промежутками (дисхимениум).
Род Orthodonella Bhatia,
1936
Типовой вид Orthodon hamatus Gruber, 1884;
родовое название Orthodon Gruber, 1884 заменено но-
вым как гомоним. Для замены доступно название\
Rhabdodon Entz, 1884 (типовой вид Rh. falcatus~), один
ТИП CILIOPHORA. КЛАСС NASSOPHOREA
731
Рис. 341, б. Nassulida.
Nassula terricola (A—Г), Obertrumia kahli (Д—Ж),Ы. aurea (Obertrumia) (3), Zosterograptuspratensis (И). (По: Foissner, 1987a(Л—Ж); Dragesco, Dragesco-Ker-
neis, 1986 (3—И)).
Fig. 341, 6. Nassulida.
вид был независимо описан в том же году; но название
Rhabdodon тоже гомоним, поэтому Orthodonella — за-
мена 2 родовых названий. Тип рода — морской вид
величиной 200—350 мкм; тело плоское, антерон су-
жен и отогнут вбок, дуговидный, образует хоботок;
рот и циртум смещены на четверть длины тела от апек-
са; ядро овальное, одна вакуоль сзади и несколько ва-
куолей выше. Ранние авторы не заметили синхимениу-
м и показывают на его месте лишь светлую полосу (се-
кантный шов), что ошибочно. Янковский (19686)
приводит рисунок мурманской особи с большим чис-
лом тесно сближенных кинет; синхимениум начина-
ется на вершине хоботка, идет вниз ниже рта почти
до правого края тела; кинеты огибают рот, но часть
их прервана ртом. Эта схема позже подтверждена
и усложнена другими авторами — сомакинеты распо-
ложены не равномерно, есть сгущение кинет под син-
химениумом, разрежение справа на венте и на дор-
суме.
Примеры видов: О. banerjeei (Ghosh, 1921) (это
пресноводный вид хилодонелл), О. gutta (Cohn, 1866
in Amphileptus) (плохо описанный морской вид;
тело кзади не сужается, сплошь вакуолизовано, вид
неопределим), О. macrocephalus Ozaki et Yagiu, 1941
(несомненный вид рода, с цефализацией и иным по-
ложением вакуолей), О. parvirostrum (Schewiakoff,
1893) (из пресных вод Австралии; сомнительный
очень мелкий вид, не относится к этому роду), Ortho-
don sp. in Lepsi, 1932 (пресноводный вид Zosterodasys),
О. shenae Song et Wilbert, 2002 — морской вид из Ки-
тая, изучен на протарголовых препаратах О. apohama-
tus Lin, 2003.
Сем. Scaphidiodontidae Deroux,
1978
Плоские формы с клювом слева; синхимениум в
виде сплошной полосы идет от клюва направо, проходит
под ртом, не пересекает кинет; дорсум без цилиатуры.
Род Scaphidiodon Stein,
1859
Типовой вид Trichoda navicula Muller, 1786 по
монотипии. Синоним, по Аэшт, Ehrenbergius Orman-
сеу, 1860. Морской вид с необычным для подкласса
732
ALVEOLATA
Рис. 342, a. Nassulida.
Nassula ornata (A—В, Ж); Obertrumia (ранее Nassula) georgiana (Г); N. picta (Д, E); Nassulopsis elegans (3); Enneameron brunneus (И); Paranassula microstoma
(JC); Nassula sp. (Л). (По: Foissner, 1979a (А, Ж); 1989 (Б, B); Dragesco, Dragesco-Kerneis, 1986 (Гр Янковский, 19686 (3—Лу. Foissner, Berger, Kohmann, 1994
(Д. Е».
Fig. 342, a. Nassulida.
признаком — полной утратой дорсальных кинет. Пока
неизвестно, сохранены ли кинетосомы, рассеяны они
или собраны в ряды на дорсуме, каков аргиром обеих
сторон тела; нужна импрегнация методом Шаттона, а
не протаргол, не выявляющий сети аргирома. Размеры
тела 60—100 X 20—30 мкм, тело плоское, антерон за-
круглен и расширен, кзади тело сужается и несет ха-
рактерный массивный вырост, покрытый ресничками.
Рот и немадесмальная глотка крупные, типичные для
отряда. Ядро вытянутое; много вакуолей по всему
телу. Около 35 кинет идут продольно ниже рта, подхо-
дят к синхимениуму и прерываются им; правые ряды
обходят край синхимениума и заворачивают вокруг
рта, не прерываясь. Такая топография кинет резко от-
личается от их положения у Zosterodasys. Синхимени-
ум — цельная узкая полоса, вероятно из дисом. Перво-
начально вид принимали за гипостомат, сближали с
хилодонтидами и дистериидами, придаток тела сзади
сравнивали с шипом (стилоном) дистериид; в опреде-
лителе Каля (Kahl, 1931) род приведен в составе сем.
Dysteriidae. По неопубликованному рисунку Деру,
синхимениум все же прерывает 3 кинеты под ртом, от-
деляя очень мелкие фрагменты, и вокруг рта идет мем-
брана или один из этих фрагментов. Включавшийся
позже вид Scaphidiodon loricatus Stein, 1862 = Siago-
nophorus loricatus Eberhard, 1862 из пресных вод несо-
мненно не имеет отношения к типовому виду.
Род Chtlodina Sramek-Husek,
1957
Типовой вид Ch. silesiaca из реки в Чехослова-
кии. Внешний вид, как у хилодонов, длина тела
136 мк, глотка узкая, с немадесмами; ротовая и сома-
тическая цилиатура не изучены и не зарисованы, ука-
зано лишь наличие ресничек «на обеих сторонах тела»;
ядро не эндомерное в отличие от хилодонелл; 2 вакуо-
ли со звездчатыми канальцами расположены по оси
тела выше рта и у постерона (у мелких хилодонелл по
диагонали, у крупных их несколько, и всегда без кана-
лов). Кинетом довольно точно зарисован у крупных
ТИП CILIOPHORA. КЛАСС NASSOPHOREA
733
Рис. 342, б. Nassulida.
Colpodidium caudatum (A—Г, Ж—К, И); Pedohymena australiense (Д, Е, М); Apocolpodidium (subgenus Phagoori) macrostoma (JI). (По: Wilbert, 1982 (A—S); Fo-
issner, 1995b (Д, E, 3, И, K, M); Foissner et al., 2002 (JT)- Dragesco, Dragesco-Kerneis, 1986 (Г, Ж)).
Fig. 342, 6. Nassulida.
хилодонелл (Ch. cucullulus, Ch. steinii), но нет описа-
ния и рисунка топографии кинет у нового рода. Нельзя
описывать ресничных простейших без изучения рес-
ничного аппарата, нужно точно знать число и положе-
ние кинет, а не догадываться о таксономическом поло-
жении вида по косвенным признакам (строение ядра,
положение вакуолей). Возможно, это Enigmostoma
(Kuklikophrya) или Zosterodasys. Этот род нельзя при-
нять как валидный.
Отряд Nassulida Jankowski, 1968
(рис. 341, а—343, б)
Тело не сплющено, обычно крупных размеров. Рот
лежит на дне неглубокого безресничного атриума
(ямки) в передней трети тела (исключение — Еппеате-
гоп с цилиатурой в полости). Место смещения рта с
апекса указывает четкий продольный предротовой
шов. Глотка укреплена массивными немадесмами, как
у Prorodon и гипостомат; это типичный циртум низ-
ших холотрих. Ядро гомеомерное, но с признаками ге-
теромерии при делении. Кортикальные альвеолы хоро-
шо развиты, альвеолоцисты имеются у всех нассулид,
изученных в электронном микроскопе. Соматическая
цилиатура прекрасно развита, полная, с тенденцией к
полимеризации кинет при увеличении размеров тела;
нет обособленной зоны тигмокинет. Кинеты составле-
ны моносомами — по одной кинетосоме в тесно сбли-
женных рядах, иногда есть дисомы у апекса. Реснич-
ный ротовой аппарат тетрахименовый у части низших
родов; у Furgasonia это мелкая мембрана и 3 мембра-
неллы с 2 рядами кинетосом в основании. Эволюция
идет в сторону увеличения числа пектинелл, полоса их
уходит влево и пересекает большое число кинет. Мем-
брана в эволюции остается мелкой, малозаметной и
обычно при описании видов не отмечается. Имеются
послеротовые кинеты; стоматогенез полуавтономный,
мембрана самовоспроизводится, и ее кинетосомы при-
нимают участие в образовании нового циртума. Поло-
са мембранелл обозначается в литературе как frange
hypostomienne, hypostomial ciliary band и как синхиме-
ниум, хотя последний термин был введен мной
(19686) специально для обозначения полосы у Ortho-
734
ALVEOLATA
Рис. 343, a. Synhymenida.
Chilodontopsis muscorum (A—B); Zosterodasys kryophilus (Г), Orthodonella shenae (Д—Ж, !4)\ Scaphidiodon navicula (3y, Orthodonella hamata (К, JT}. (По: Fois-
sner, 1988 (А, Б, B); Petz. et a!., 1995 (Г); Song, Wilbert, 2002 (Д—Ж, Ip, Dragesco, 1965b (3); К, JI — ориг.).
Fig. 343, a. Synhymenida.
donella, Synhymenia и близких родов, не разбитой на
обособленные участки (собственно мембранеллы).
Элементы полосы у нассулид обозначаются как мемб-
ранеллы и псевдомембранеллы; здесь используется
старый и забытый термин «пектинеллы», введенный
Г елей для обозначения структур, в которых реснички
не склеены, но обособлены группами. В новом вариан-
те это любая обособленная группа вплотную сближен-
ных кинетосом, независимо от того, сколько рядов в
основании, склеены реснички или нет.
Все виды нассулид свободноживущие, симбионтов
нет. Встречаются в бентосе пресных вод; в морях бо-
лее часты в участках пониженной солености — эстуари-
ях. Крупные виды — в толще пресных вод; мелкие
на дне, в болотах, мхах, реже в почве, встречаются и
в засоленных почвах. Постоянно пелагические нассу-
лиды — Obertrumia аигеа и виды рода Nassulopsis. Пита-
ние бактериями или нитчатыми цианофитами, которые
меняют свой цвет по мере пищеварения при разруше-
нии пигментов и смене цвета при разных pH; поэтому
пелагические виды (Nassula, Nassulides, Obertrumia,
Nassulopsis) ярко и многокрасочно окрашены и нередко
имеют пигментное пятно спереди. Такие виды легко
найти в периоды цветения воды летом, когда неболь-
шие пруды насыщены синезелеными водорослями; в
лаборатории виды нассулид культивируются на циано-
фитах в чистой воде, богатой кислородом, не выносят
сапробности. Цисты покоя известны у части пресно-
водных видов.
Подотряд Nassulopsina Puytorac, 1994
(рис. 341, а—342, а)
В Traitc — новый отряд Nassulopsida, но нет особо
важных, принципиальных отличий этой группы от на-
ссулид. По диагнозу Пюйторака (Puytorac, 1994), поло-
са сплошная, цельная, не разбита на пектинеллы, оги-
бает тело ниже рта полукольцом или почти замкнутым
кольцом. Возможно, это справедливо для Phasmatopsis
(=Beersena), но у Nassulopsis полоса разбита на разроз-
ненные пектинеллы. Поэтому нельзя сказать, что эта
группа имеет синхимениум, либо нужно изменить зна-
чение термина — использовать его для обозначения
ТИП CILIOPHORA. КЛАСС NASSOPHOREA
735
Рис. 343, б. Nassulida, Synhymenida.
Obertrumia xantha (А. Б); Zosterodasys agamalievi (B); Zosterodasys sp. (Г. Ж); «Chilodontopsis depressa» in Deroux, 1978b (Д, E)\ Phasmatopsis Umax (3, И); Na-
ssula heterovesiculata (K) — типовой вид рода Synhymenia-, апикальный шов, показанный Гелей, не существует; участок синхимениума у Zosterodasys кгуор-
hilus (JT); Z. serrani (M). (По: Deroux, 1978b (Д, E, В, Г, 3—И); Gelei, 1939 (Л); Dragesco, Dragesco-Kemeis, 1986 (А, Б)-, Petz et al., 1995 (Л)-, Femandez-Leborans,
1990 (Л/)).
Fig. 343, 6. Nassulida, Synhymenida.
Nassula heterovesiculata (Fig. K) is type of the genus Synhymenia-, apical suture shown by Gelei does not exist, thus genus Synhymenia precedes Zosterodasys.
полосы пектинелл (не склеенных ресничек), или мемб-
ранелл, или простого ряда вплотную сближенных ки-
нетосом. Фойсснер (Foissner et al., 1999) использует
термин синхимениум для прерывистой полосы у Na-
ssulopsis. Я принимаю решение использовать свой тер-
мин синхимениум для полосы ресничных элементов у
нассулид независимо от ее структуры — сплошная,
прерывистая или из разрозненных элементов. Пекти-
неллы — элементы полосы независимо от того, склее-
ны ли в них реснички группы кинетосом или нет.
Сем. Nassulopsidae Deroux in Corliss,
1979
Тело вытянутое, не сплющено; синхименовая поло-
са пересекает тело ниже рта, оба конца видны на до-
рсуме. На венте прерванные кинеты не загнуты вокруг
рта налево, правые и левые фрагменты кинет выше рта
разделены продольным швом. Пелагиаль пресных вод.
Это промежуточные формы между рассмотренными
выше родами синхименид и нассулидами.
Род Nassulopsis Foissner, Berger
et Kohmann, 1994
Типовой вид Nassula elegans Ehrenberg, 1833.
Род предложенный ранее — Nassulopsis Faure-Fremiet,
1959, был принят всеми авторами, типовой вид тщательно
изучен автором рода и позже многократно переописы-
вался. Тем не менее род невалиден — первоначально в
состав рода было включено 7 видов без указания типо-
вого вида — Nassula elegans Ehr., 1833; N. muscicola
Kahl, 1933; N. bivacuolata Sramek-Husek, 1946; N. lage-
nula Faure-Fremiet, 1959; Chilodontopsis elongata Kalil,
1931; Ch. vorax Stokes, 1887; для рода Nassula sensu stricto
тип рода тоже не был указан. Как видно, первоначально
736
ALVEOLATA
это смесь видов разных родов (Nassulopsis и Zosteroda-
sys'y. как пример нового рода зарисована N. muscicola.
Морфология типового вида: размеры 100—300 мкм;
тело узкое, не сплющено, с 60—65 кинетами простой
топографии; 6 рядов прерваны ртом (посторальные ки-
неты); рот в ямке (атриуме), глотка с 24— 26 немадес-
мами, предротовой шов четкий, от апекса до рта; спе-
реди пигментное пятно; примерно 5 вакуолей в вент-
ральном ряду, их поры на одной линии. Пресноводный
вид из толщи воды прудов (эпибентос), питается циа-
нофитами; вместе с видами Nassula вид легко найти в
планктоне прудов с цветением синезеленых водорос-
лей. Указания для моря неверные, это виды Zosteroda-
sys, включавшиеся ранее в состав Nassulopsis. По
Аэшт, синонимом родового названия Nassulopsis явля-
ется Еппеатегоп Jank., 1968, но это ошибка, их рото-
вой аппарат резко различается, Еппеатегоп может
принадлежать к другому ^семейству нассулид. Приме-
ры видов: N. bivacuolata Sramek-Husek, 1946 (только с
2 вакуолями), N.flavicans Vuxanovici, 1961 (с 5 вакуо-
лями и одной добавочной), N. lagenula Faure-Fremiet,
1959 (с 3 вакуолями, кольцо синхимениума почти зам-
кнутое), N. linearis Gelei, 1954 (мелкий вид без пигмен-
та), N. paucivacuolata Foissner, 1979 (с 3 вакуолями и
замкнутым кольцом пектинелл; форма и положение
пектинелл разные в 2 четких отделах полосы, на дор-
суме они сближены вплотную), N. versicolor Andre,
1916 (нет никаких отличий от N. elegans).
Род Beersena Jankowski, 1989
Типовой вид Phasmatopsis Umax Deroux, 1978.
Название рода Phasmatopsis Deroux, 1978 — гомоним
(есть пелагические кальмары Phasmatopsis), поэтому
заменено новым. По Аэшт, второе название Phasmatopsis
(моллюски) — nomen dubium, но оно валидно у совре-
менных авторов. Гомонимия и замена названия не бы-
ли замечены, и род по-прежнему называют Phasmatopsis.
Морской литоральный вид; тело с заметной цефализацией,
сужается кзади, циртум массивный, ядро овальное. Пред-
ротовой шов продолжается на дорсуме и здесь имеет
вид бисеканты до уровня пектинелл. Пектинеллы син-
химениума — это парные утолщенные кинетосомы
каждого ресничного ряда, расположены в желобке,
идущем по спирали примерно на 2/3 кольца. Диффе-
ренцированы 2 отдела (сегмента) синхимениума по
строению и расположению пектинелл; на дорсальной
стороне это 4 сближенные реснички; поры 3 вакуолей
по одной линии.
В. mirabundis (Alekperov, 1986) — вид из пресных
вод Азербайджана величиной 120—150 мкм, имеет
6 вакуолей, 45—50 кинет, 14—16 немадесм, незамкну-
тую дугу парных кинетосом, сверху кинеты сближены
и шов плохо выражен.
Подотряд Parahymenostomatina Grain
et al., 1976 (рис. 341, a)
Включает мелкие нассулиды с тетрахименовым ро-
товым аппаратом, без синхимениума; у рта мелкая ун-
дулирующая мембрана и 3 мембранеллы. Стоматоге-
нез полуавтономный, основание мембраны и часть ки-
нет формируют новый ротовой ресничный аппарат и
циртум.
Сем. Furgasoniidae Corliss, 1979
С диагнозом подотряда; мелкие пресноводные фор-
мы. Эта группа произошла от простомат типа Urotric-
ha, имеющих 3 небольшие тигмокинеты. Рот сместился с
апекса до зоны тигмокинет, сохранив циртум. Утрата
циртума в дальнейшей эволюции привела к появлению
гименостомат; тетрахимениум оказался эффективным
типом ротовой цилиатуры, его модификации (и утра-
та у паразитических групп) привели к появлению не-
скольких отрядов и крупного класса Peritricha.
Род Furgasonia Jankowski, 1964
Типовой вид Nassula tricirrata Gelei, 1932.
Фактически это вид рода Cyclogramma Perty, 1849 (ти-
повой вид С. rubens), но второе название — гомо-
ним — невалидное и синонимичное название Furgaso-
nia стало пригодным замещающим названием. У Каля
(Kahl, 1931) этот вид под вопросом в составе Cyclog-
ramma. Род Cyclogramma, дважды предложенный как
новый в 1849 г., долгое время никем не признавался и
считался синонимом рода Nassula sensu latissimo; при-
знан Калем, а позже Корлисс (Corliss, 1979) предложил
считать Furgasonia (синоним) как валидный род. Но тип
рода Furgasonia другой — N. tricirrata, а не С. rubens.
F. tricirrata — первый импрегнированный сереб-
ром вид рода, раньше кинетом был неизвестен; разме-
ры тела около 60—70 мкм, тело вытянутое, рот в атри-
уме, циртум удлиненный, тонкий, вакуоль медиальная.
Под кортексом слой веретеновидных трихоцист с по-
рами у кинетосом. Правые кинеты заворачивают налево,
предротовой шов смещен вбок. У рта мембрана и 3 ко-
роткие мембранеллы с дикинетой в основании. Был опи-
сан также подвидУ tricirrata var. elongata Gelei, 1950.
У F. blochmanni Faure-Fremiet, 1967 ротовой аппа-
рат, как у типового вида, кинеты полимеризованы, в
основаниях мембранелл по 3 ряда кинетосом. Вид по-
вторно изучен Фойсснером (Foissner, 1979а), впервые
выяснившим тип аргирома у этого рода. Другие
виды — F. membranella Thompson, 1972 (из пресной
воды в Антарктике; кинет немного, М3 далеко смеще-
на вниз), F. protectissima (Penard, 1922) (во всем типич-
ный вид рода; подробно изучен морфогенез при деле-
нии), F. rubens (Perty, 1849) (частый вид с розовой
окраской цитоплазмы), валидный вид F. theresae (Fab-
re-Domergue, 1888), F. trichocystis Stokes, 1894 (типич-
ный вид рода, но невалидный как синоним предыду-
щего вида).
Род Parafurgasonia Foissner et Adam,
1981
Типовой вид Nassula sorex Penard, 1922. Пред-
ротовой шов осевой, не смещен влево; циртум массив-
ный, кортекс с трихоцистами, число кинет невелико,
ТИП CILIOPHORA. КЛАСС NASSOPHOREA
737
имеется ацилон ниже рта; у рта поперечная дуга (мем-
брапелла) и короткий ряд М3; аргиром в виде сети
мельчайших ячеек. Вид Р. foissneri Dragesco et Drages-
co-Kerneis, 1986 может быть идентичен с типовым.
Правее рта ряд кинетосом; трудно решить, что это —
мембрана или сомакинета и состоит ли она из дипло-
сом. Почвенный вид; редукция типичного набора ро-
товых мембранелл объясняется переходом от лимни-
ческой жизни в террофитон.
Род Wolfkosia Foissner, Agatha et Berger,
2002
Типовой вид W. loeffleri по монотипии, из пре-
сных вод и почвы тропических стран. Тело удлинен-
но-овальное, длиной 35—50 мкм, с 14 кинетами, все
кинетосомы парные; кинета правее рта из 2 половинок
разной структуры, рот клювовидный, выступает над
телом, ниже и левее полоса кинетосом и фрагменты
(разрозненные кинетосомы); аргиром сетчатый; ваку-
оль очень высоко у рта; в кортексе слой трихоцист. Ро-
товая цилиатура — дуговидная дикинета над ртом
(мембрана УМ), Ml в виде 2 кинетосом справа, М2 из
5 групп кинетосом, М3 — трикинета ниже и правее
рта; имеются 4 послеротовые сомакинеты. Фактически
редуцированы, но полностью не исчезли Ml и М2.
Сем. Urliellidae Jankowski fam. n.
(рис. 341, a)
Мелкие почвенные формы без атриума, с апикаль-
ным положением рта и редукцией всех 3 ротовых мем-
бранелл.
Род Urliella Foissner, 1989
Типовой вид U. terricola из почвы в Австрии;
тело очень мелкое (40—50 мкм), вытянутое, сплюще-
но, с 11 кинетами, кинетосомы в которых сильно раз-
режены. Рот очень мелкий, смещен к апексу, ведет в
узкий короткий циртум; вакуоль между апексом и эк-
ватором. Правее рта полоска из дисом (основание мем-
браны); левее нет никаких мембранелл, они полностью
исчезли. Пелликула с тонкой сетью аргентофильных
ячеек. Рот слегка поднят над телом, атриума нет. По
ряду признаков этот род считается видоизмененной
пассулидой, родственной Furgasonia, и включался в
сем. Furgasoniidae. Но при таком составе дать диагноз
семейства невозможно, нужно выделить как минимум
подсемейство для столь аберрантной нассулиды; и
родство с Furgasonia еще предстоит доказать.
Сем. Paranassulidae Faure-Fremiet, 1962
У Линна (Lynn, 2002) 2 рода — Paranassula и Еппе-
атегоп, сходные по форме тела, соматическому кине-
тому, но с принципиально различным типом ротовой
цилиатуры. Фактически для каждого рода нужно уста-
новить новое семейство, но сама категория «семейст-
во» потеряет смысл, если каждый отклоняющийся род
цилиат выделять в семейство. Здесь они оставлены
в сборном таксоне Paranassulidae. Крупные формы
с большим числом кинет, продольным предрото-
вым швом, симметричной цилиатурой; имеется цир-
тум; рот в атриуме, имеются дуговидные наружные
мембранеллы или серия радиальных монокинет во-
круг рта.
Род Paranassula Kahl, 1931
Типовой вид — малоизученный морской вид
Paramecium microstomum Claparede et Lachmann, 1859.
Трудный вид — импрегнация была проведена через
100 лет после первоописания, а до этого вид относили
к Nassula, Isotricha, к фронтониидам сем. Clathrostoma-
tidae. Тип рода — некрупный морской вид
(90—ПО мкм) с густой цилиатурой, предротовой шов
продольный, рот близок к апексу, секанта у нижнего
конца тела и длинная секанта на дорсуме (продолже-
ние вентральных швов). Ядро вытянутое, вакуоль
одна, с дорсальной порой. Циртум стандартный, рот в
ямке (атриум), мембрана справа не отмечена, выше рта
2 концентрические дуги (Ml и М2), в атриуме снизу
короткая М3. Кортекс рельефный, со слоем трихоцист;
аргиром в виде рядов прямоугольников вдоль кинет,
совершенно не соответствует мелкоячеистой сети нас-
сулид. Антерон со скоплением гранул; ниже рта много
послеротовых сомакинет.
Вид Р. corlissi Small et Lynn, 1985 описан слишком
кратко, дан рисунок и одна строчка текста в 1-м изда-
нии Guide, повторено во 2-м (Lynn, Small, 2002): «От-
личается наличием дикинетид на теле», т. е. вдоль ки-
нет расположены пары кинетосом. Иногда за дисому
принимают одну кинетосому с порой трихоцисты.
Внешний вид, число и положение кинет, как у типово-
го вида; отмечены мембрана и 2 или 3 погруженные
мебранеллы на стенке атриума.
Род Еппеатегоп Jankowski gen. n.
Типовой вид Nassula brunnea Fabre-Domergue,
1885. Род Еппеатегоп установлен автором без диагно-
за (Jankowski, 1964а, р. 272 — «...Nassula, Nassulopsis,
Paranassula, Еппеатегоп (nom. п. для P. brunnea)»).
Хотя этот род диагностирован позже (Янковский,
19686), специалисты могут признать род, предложен-
ный таким образом, невалидным, поэтому он предла-
гается вторично. По Аэшт, это синоним рода Nassulop-
sis (ссылка на Фойсснера, не изучавшего тип рода), но
это совершенно исключено, у Nassulopsis полукольцо
синхимениума ниже рта охватывает весь вент, и ниче-
го подобного нет у Еппеатегоп, ротовая цилиатура ко-
торого находится в перистомальной полости. В других
монографиях цилиат род валидный.
Морской вид с небольшой цефализацией, величи-
ной 220—300 мкм; тело вытянутое, узкое, ядро растя-
нуто по оси, вакуоль одна, медиальная; спереди пиг-
ментные пятна. Каль (Kahl, 1931) не изучил вид и со-
мневается, действительно ли это вид рода Nassula-, вид
изучен в Японии (Ozaki, Yagiu, 1941); достоверно
•17 Зак. №4163
738
ALVEOLATA
показано отсутствие полосы пектинелл и наличие
2 мембран у рта, выявлен также рельеф (аргиром) из
правильных квадратов вдоль кинет. Форе-Фремье (Fa-
ure-Fremiet, 1959, 1962b) предположил, что вид отно-
сится к Nassulopsis, но позже, изучив вид, отнес его к
Paranassula (Р. brunnea).
На импрегнированных препаратах кинеты много-
численные, симметричные, спереди шов, на дорсуме
2 длинных шва; рот небольшой, на дне воронки; неяс-
но, есть ли мембрана справа, на дне воронки 9 разроз-
ненных радиальных монокинет, ниже рта 16 послеро-
товых кинет; аргиром с шестигранниками, не квадра-
тами. Питание цианофитами.
Сем. Nassulidae Fromentel, 1874
(= Liosiphonidae) (рис. 341, а—343, б)
Виды средних размеров и крупные, не сплющен-
ные, с хорошо развитой соматической цилиатурой;
имеется циртум с немадесмами, небольшая мембрана
справа; снизу от рта начинается полоса мембранелл,
уходящих к левому краю тела и часто также на дор-
сум; предротовой шов осевой, пектинеллы в полосе
крупные и разрозненные (у Nassulopsidae мелкие, сли-
ты или тесно сближены). В основном пресновод-
ные виды из толщи воды (эпибентос), питающиеся ци-
анофитами.
Род Protonassula Jankowski, 1976
Типовой вид Nassula lateritia Claparede et
Lachmann, 1859. Родовое название невалидно, так как
предложено в тезисах.
Род Naxella Fryd-Versavel,
Iftode et Deroux, 1980
Типовой вид Nassula lateritia Claparede etLach-
mann, 1859. По Аэшт, «хотя (род) содержится в не-
опубликованной работе, по моему мнению, его счита-
ют валидным Дражеско, Дражеско-Кернеис, Фойсснер
и О'Донохью»; поэтому название валидное. Это недо-
пустимо и нелогично — в других подобных случаях
признанные всеми роды, предложенные в тезисах,
Аэшт объявляет невалидными. По Аэшт, род Naxella
«ошибочно приписывается Foissner et O'Donoghue,
1990 и Puytorac, 1994» (в Traite); не отмечено, что и ав-
торы Guide (Lynn, Small, 2002) тоже приписывают род
этим авторам.
Типовой вид для рода Naxella впервые указали в
журнальной статье, не в тезисах Фойсснер и О’Доно-
хью (Foissner, O’Donoghue, 1990), поэтому они явля-
ются авторами рода Naxella. Название Protonassula
Jankowski, 1976 имеет приоритет, но невалидно, как
предложенное в тезисах.
Тип рода — N. lateritia С. et L., 1859, ранее в Сус-
logramma; каплевидные формы со вздутым телом,
большим числом кинет, предротовой шов короткий, у
рта мембрана и ниже слева 3 мембраиеллы, располо-
женные в ряду, пересекающем значительное число со-
макинет, их верхние фрагменты над полосой. Рот
несколько выпячен (поднят над телом) для захвата и
высасывания эвглен, основной пищи вида. Примеры
видов Naxella'. N. australis (Foissner et O'Donoghue,
1990) comb, n., N. faurei (F. et O'D., 1990) comb. n. (для
Nassula lateritia sensu Faure-Fremiet, 1967), N. lucida
(Reuter, 1961 in Nassula), N. rosea (Tucolesco, 1962 in
Nassula) (этот и предыдущий вид детально описаны в
монографии цилиат Намибии — Foissner et al., 2002),
N. viridis (Dingfelder, 1962 in Cyclogramma) comb, n.,
N. latericollaris comb. n. (Wang, 1930 in Holophrya,
Kahl, 1935 in Balanophrya). Форма тела, размеры
(45 мкм), смещение рта на вент и его выпячивание у
N. latericollaris, как у N. faurei, но очень мелкие мемб-
ранеллы не были замечены и не совпадает положение
вакуоли.
Род Rhinakis Fryd-Versavel, Iftode
et Deroux, 1980
Типовой вид R.faurei', по Аэшт, род невали-
ден, так как предложен в тезисах, и указанный вид так-
же новый, еще не был описан (nomen nudum)
(Fryd-Versavel et aL, 1980). В тезисах указан признак
рода с 3—5 мембранеллами. В Traite (Puytorac, 1994)
род валидный, с рисунком и диагнозом вида; этот ма-
териал перепечатан в Guide (Lynn, Small, 2002) и род
обозначен как Rhinakis Iftode, Fryd-Versavel et Deroux,
in Deroux, 1994. В Traite как Rhinakis Iftode, Fryd et De-
roux, 1980, без указания gen. n. с видом Rh. faurei sp. n.;
в подписи к рис. 195 —Rh. faurei n. g., n. sp.
Проблему названия и авторов рода предложено ре-
шить следующим образом: признать род Rhinakis De-
roux, 1994 с типовым видом Rh. faurei Deroux, 1994. Но
сам род спорный. Типовой вид (ошибочно названный
Rh. picta в Guide) — каплевидные особи с длинным
предротовым швом и большим числом кинет; вакуоль
мидвентральная; ниже рта налево идет полоска из
5 кинет, пересекая сомакинеты. В отличие от Naxella
нет мембраны правее рта. Naxella с 3 мембранами —
это фактически модификация рода Furgasonia, Rhina-
kis — предшественник Nassula. Род может включать
N. granata Foissner et al., 2002, N. terricola Foissner,
1989 и другие виды из почвы, с увеличением числа
мембранелл в полосе.
Род Nassula Ehrenberg, 1834
По Аэшт, типовой вид N.flava Claparede et Lach-
mann, 1859 по обозначению Фроментеля (Fromentel,
1874). Этот род был предложен для 3 новых видов
Эренберга — N. elegans, N. ornata и N. аигеа', все виды
пресноводные, подробно описаны и зарисованы. Здесь
нет N. flava, поэтому обозначить его как тип рода нель-
зя, это противоречит правилам номенклатуры. Сейчас
N. elegans в составе рода Nassulopsis, N. аигеа в соста-
ве Obertrumia', остается третий вид N. ornata. Этот вид
уже был указан как типовой вид рода Nassula Янков-
ским (19686) в следующей фразе: «Род Nassula долгое
время оставался сборным, и „разгрузка” его от форм,
резко отличающихся от типового вида N. ornata, не за-
ТИП CILIOPHORA. КЛАСС NASSOPHOREA
739
кончена и сейчас». Действительно, позже род распался
на серию самостоятельных родов.
Итак, типовой вид рода — N. ornata Ehrenberg,
1834 по моему выбору. Это массивные клетки с поли-
меризацией кинет; на венте длинные швы у концов
тела, дорсум без швов; полоса мембранелл идет от рта
дугой наверх, у левого края поворачивает вниз и ухо-
дит на дорсум, пересекая множество кинет. Мембра-
неллы в полосе расположены в линии или почти в ли-
нии, не ступеньками, одна мембранелла как бы являет-
ся продолжением другой.
Примеры видов: N. argentula Biemacka, 1963 (из
солоноватых вод и почвы, вероятный синоним вида
N. exigua Kahl, 1931); N. dragescoi Foissner, Agatha
et Berger, 2002 (мелкий почвенный вид); N. etoschensis
F., A. et B., 2002 (из соленых почв); N. exigua К., 1931
(мельчайший вид с длиной тела до 45 мкм, с 4 мемб-
ранеллами); N.flava С. et L., 1859; N. granata F., А.
et Berger, 2002; N. longinassa Foissner, 1980; N. parva
Kahl, 1928; N. terricola F., 1990; N. tuberculata F., A.
et B., 2002 (= N. picta in Foissner, 1996); N. tumida Mas-
kell, 1887.
Род Spirofragma Jankowski, 1976
Типовой вид Nassula gracilis Kahl, 1931; род
предложен раньше следующего, но в тезисах, и поэто-
му невалиден. Вид N. gracilis включен в состав рода
Obertrumia, поэтому название Spirofragma уходит в си-
нонимику.
Род Obertrumia Foissner et Adam, 1981
Типовой вид Nassula georgiana Dragesco, 1972.
Внешний облик, как у Nassula, тело массивное, с боль-
шим числом кинет (около 100); вент с длинным швом
над ртом; мембраиеллы в полосе расположены в ли-
нию, не ступенчатые; полоса мембранелл двойная; от
рта на дорсум идет стандартная для нассулид дуга с
разрозненными элементами; на дорсуме поперек тела
идет прямая полоса из более коротких, вплотную сбли-
женных мембранелл. В первой зоне 12—13, во второй
22—27, всего 34—39 элементов. Дражеско (Dragesco,
1972а) сравнивает свой вид с N аигеа и находит ряд
различий, но Фойсснер (Foissner et al., 1994) позже
свел вид в синоним N. аигеа, поэтому типовой вид ме-
няет название. В дуге мембранелл у О. аигеа Фойсснер
показывает 28 элементов, Дражеско 12—13; синони-
мия не доказана. В Guide (Lynn, Small, 2002) род иллю-
стрирован видом Obertrumia sp. с небольшим числом
кинет и мембранелл; в Traite (Deroux, 1994) род отри-
цается как синоним рода Nassula. Примеры видов:
О. аигеа (Ehrenberg, 1834), О. gracilis (Kahl, 1931),
О. kahli, О. regina (Alekperov, 1984 in Nassula) comb. n.
Род Seminassula Jankowski, 1976
Типовой вид Nassula picta Greeff, 1888. Род
предложен в тезисах, поэтому Аэшт признает название
невалидным, более того, синонимом рода Nassula.
В состав Seminassula была включена Nassula tumida
Maskell, 1887; отличительный признак — полоса мем-
бранелл вентральная, не заходит на дорсум. Сейчас
N. picta — тип рода Nassulides.
Род Nassulides Foissner, Agatha et Berger,
2002
Типовой вид Nassula picta Greeff, 1888. Пред-
лагая новый род для вида, типового для Seminassula,
авторы акцентируют внимание на другом признаке —
мембраиеллы в полосе расположены не в линию, а сту-
пеньками. При этом неважно, заходит ли полоса на до-
рсум. Нередко мембраиеллы у рта расположены косо,
а дальше выравниваются в линию. Внешне это типич-
ные Nassula — тело крупное, плавно закругленное, с
большим числом кинет, четким продольным швом
спереди; ниже рта может быть пластинка — ряд слив-
шихся мембранелл. В сущности отличия нового рода
от Nassula такие же, как у гипостомат Pseudochilodo-
nopsis (со ступенчатыми фрагментами предротовой
кинеты) и Chilodonella-, по «принципу параллельных
решений» предложен новый род у нассулид.
Примеры видов: N. citrea (Kahl, 1930 in Nassula)
comb, n., N. labiata (Kahl, 1933), N. nahchivanica (Alek-
perov, 1984 in Nassula) comb, n., N. picta Greeff, 1888
(по' некоторым авторам, положение мембранелл ли-
нейное, в небольшой дуге только на венте), N. pratensis
(Czapik et Jordan, 1976), N. tumida (Maskell, 1887)
comb. n. У N. vernalis (Gelei et Szabados, 1950) в перво-
описании мембраиеллы не ступенчатые, хотя и не
вполне линейные; этот мелкий вид нуждается в по-
вторном изучении.
Род Zosterograptus Fryd-Versavel, Iftode
et Deroux, 1980
При ревизии сем. Nassulidae в тезисах был предло-
жен новый род Zosterograptus для Nassula pratensis
Czapik et Jordan, 1976 и N, labiata Kahl, 1933 без указа-
ния типового вида, вместе с новыми родами Naxella и
Rhinakis-, род Nassula s. str. включает N. ornata Ehr.,
1833 и N. аигеа Ehr., 1834. Название рода Zosterograp-
tus использовалось позже в литературе без указания
типа. Аэшт признала этот род невалидным, как пред-
ложенный в тезисах и без обозначения типа; предлагая
позже новый род для этих видов, Фойсснер (Foissner et
al., 2002) сменил название рода новым — Nassulides, с
типовым видом Nassulapicta. В Traite ошибочно указа-
ны авторы рода Zosterograptus — Iftode, Fryd et Dero-
ux, 1980, тип рода также не обозначен.
В приведенном выше обзоре нет ряда названий ро-
дов, кратко рассмотренных ниже.
Род Acidophorus Stein, 1859
Типовой вид Nassula ornata Ehr., 1833 по мо-
нотипии (по Аэшт). Это, вероятно, ошибка — ориги-
нал недоступен, но по литературе у Штейна (Stein,
1859) 2 вида на одной странице — A. ornatus Stein и
740
ALVEOLATA
A. rubens Stein (вероятно, для вида Cyclogramma rubens
Perty). Приняв обозначение типа у Аэшт, я свожу Aci-
dophorus в синонимы рода Nassula и тем самым делаю
невозможным использование названия Acidophorus
для гомонимичного рода Cyclogramma (ныне Furgaso-
nia Jankowski, 1964).
Род Liosiphon Ehrenberg, 1853
Типовой вид L. strampfi (иногда пишут
L. stramphii)-, по ранним авторам это синоним рода
Nassula. Штейн (Stein, 1859) различает роды Acidopho-
rus (N. ornata) и Liosiphon (N. ambiguus). У современ-
ных авторов Nassula ambigua Ehr. сохраняется в со-
ставе этого рода, поэтому Liosiphon — синоним рода
Nassula.
Род Archinassula Kahl, 1935
Типовой вид A. muscicola из мхов; считался
примитивной нассулидой. Повторно не переописан,
точная топография кинетома и ротовой цилиатуры не-
известна.
Род Schistophrya Kahl, 1933
Типовой вид S', aplanata из морского песка;
с нетипичным для нассулид экваториальным по-
ложением рта; вакуоль выше рта; трихиты, нема-
десмы, овальное ядро, как у фронтоний; у сплю-
щенного рта нет специальной цилиатуры, обе стенки
волнистые. Строение и положение рода в системе ци-
лиат неясное.
Отряд Colpodidiida Foissner, Agatha
et Berger, 2002
Некрупные (50—100 мкм) цилиаты с тонким вытя-
нутым, заметно сплющенным латерально телом, с чет-
кой мембраной — дикинетой правее ротовой зоны и
3 видоизмененными мембранеллами в неглубокой
буккальной полости; к постерону от нее идут 4 после-
ротовых ряда. Глотка без четких немадесм, направлена
от ротовой полости вверх по диагонали, затем изгиба-
ется и идет к дорсуму и вниз, стенки ее состоят из тон-
ких фибрилл, прижизненно она незаметна. Мембра-
неллы Ml и М2 мелкие, состоят из нескольких дисом;
М3 крупнее, в основании ее несколько коротких кинет
в виде полосы шириной в 3 кинеты. При делении мем-
брана материнской особи образует при расщеплении
новую мембрану задней особи, послеротовой ряд Р4 и
дисомы — зачаток новых мембранелл. Сомакинета
1 инкорпорирована в ротовой комплекс — участвует в
морфогенезе, образуя часть М3; остальная часть М3
возникает за счет зачатка, выделенного при распаде
материнской мембраны. Стоматогенез миксокинеталь-
ный, как у нассулид, но протекает иначе, с участием
одновременно соматической и ротовой цилиатуры, по-
этому группа обособлена на уровне отряда.
Сем. Colpodidiidae Foissner, 1995
С признаками отряда. Упоминается как Colpodi-
diidae Puytorac, Didier, Detcheva et Foissner, 1983 (Fois-
sner, 1990). В будущем Фойсснер считает возмож-
ным обособление родов Pedohymena и Apocolpodidium
в особое семейство. Немногочисленные известные
виды можно найти в почвах (в частности, в засо-
ленных), реже в пресной воде; пробы с кольподидии-
дами собраны в Узбекистане, Афганистане, в Африке
(Кения, Намибия), в Центральной Америке (Коста-
Рика), в Японии и Австралии, виды отряда редки в Ев-
ропе.
Первоначально эти формы отнесли к отряду Colpo-
dida по наличию парных кинетосом и ресничек; более
тщательное исследование (Foissner, 1990, 1995в) пока-
зало родство с примитивными нассулидами (отряд Ра-
rahymenostomatida), конкретно с родом Furgasonia-,
кольподидииды во многом упрощены, мембранеллы
Ml—М3 одинаково хорошо развиты у фургасонии и
первые две почти редуцированы у Colpodidium-, мемб-
рана правее рта, напротив, плохо развита и может от-
сутствовать у низших нассулид, но всегда четко разви-
та у Colpodidiidae.
Род Pedohymena Foissner,
1995
Типовой вид Р. australiensis. Тонкие вытяну-
тые формы с разреженными кинетосомами и нечетки-
ми ресничными рядами; буккальная полость (буккон)
мелкая и узкая, направлена к дорсуму; по краям ее
ограничивает длинная петлевидная мембрана. Ml в
основании имеет всего 4 кинетосомы, М2 — неболь-
шой ряд, М3 — четкая короткая диагональная трики-
нета; рот очень мелкий, глотка короткая и узкая. До-
полнительный ресничный аппарат образован за счет
сгущения кинетосом в участках сомакинет — длинный
ряд правее мембраны и 5 коротких диагональных ря-
дов над перистомом. Посторальные ряды состоят из
моносом (монокинеты). Импрегнация сухих мазков,
по Клейну, выявляет сеть из мельчайших ячеек по все-
му телу, не ряды прямоугольников, как у предковых
фургасониид. Под пелликулой длинные игольчатые
экструсомы.
Род Colpodidium Wilbert,
1982
Типовой вид Colpodidium caudatum Wilbert,
1982 из почвы в Афганистане (Wilbert, 1982); вторично
найден в почве на западе Центральной Африки и в за-
соленных почвах Намибии в ЮАР, а также в пробах
почвы из Австралии, Японии, Тибета, но этого вида
нет в тщательно изученных почвах Европы.
Организация особи, как у Pedohymena-, все кинето-
сомы парные (метод импрегнации по Шаттону), но на
протарголовых препаратах импрегнируется только
одна кинетосома с ресничкой. Кинет несколько боль-
ше, чем у педохимены, кинетосомы не столь разрозне-
ны, на венте ориентированы с образованием попереч-
ТИП CILIOPHORA. КЛАСС NASSOPHOREA
741
ных рядов (паратен); буккальная полость едва выраже-
на, мембрана дуговидная, короткая, правее рта.
Мембранелла Ml — одна пара кинетосом, М2 — одна
или две пары, М3 длинная, из 3 X 13 кинетосом (в трех
рядах), идет с поверхности на дно буккона. Послерото-
вых рядов несколько, это монокинеты, но 2 ряда у рта
имеют дисомы. Дополнительная ротовая цилиатура
очень четко обособлена от соматической — это длин-
ный ряд правее рта и серия длинных диагональных ря-
дов между букконом и вершиной тела, в глубоких же-
лобках. Глотка направлена вверх и вбок, вакуоль ниже
буккона, щелевидный цитопиг в постесоме. Расы из
разных стран отличаются внешним обликом и деталя-
ми строения, но не выделяются в новый вид ввиду из-
менчивости признаков.
Состав рода: С. horribile Foissner, Agatha et Berger,
2002 (из засоленных почв в Кении, вид с крупной рото-
вой зоной, смещенной вниз), С. trichocystiferum F., А.
et В., 2002 (вид с незначительным развитием ротовой
цилиатуры из соленых почв в Австрии), С. microstoma
F., A. et В., 2002 (вид с ацилонами у концов тела и с от-
носительно густой цилиатурой в 24 рядах сложной то-
пографии).
Подрод Pseudocolpodidium Foissner,
Agatha et Berger, 2002
Типовой вид C. bradburyarum F., A. et B., 2002,
аберрантный мелкий вид с овальным телом, с нечетко
выраженными перикинетами над ртом (без сближения
кинетосом); глотка направлена вправо, не вверх, очень
короткая; нет длинных послеротовых кинет, подходя-
щих к буккону, и лишь рудимент одного ряда располо-
жен в полости буккона, имитируя основание мембра-
неллы. Ml состоит из пары кинетосом, М3 — короткая
трикинета.
Род Apocolpodidium Foissner, Agatha
et Berger, 2002
Типовой вид A. etoschense F., A. et B., 2002 из
почв южной Африки. Внешний вид, как у низших нас-
сулид (Furgasonia); число кинет невелико, в средней и
нижней части тела кинетосомы разрознены. Перикине-
ты нечетко выражены, но в принципе, как у Colpodidi-
um. Глотка направлена вбок, короткая; правее рта
С-образная мембрана с дикинетой в основании, левее
Ml (одна дисома), М2 (3 кинетосомы) и М3 — корот-
кий квадратный ряд с несколькими добавочными ки-
нетосомами. Можно говорить о практической редук-
ции двух верхних мембранелл. Токсицисты веретено-
видные, без акрона.
Подрод Phaaoon Foissner, Agatha
et Berger, 2002
Типовой вид Apocolpodidium (Phagoon) mac-
rostoma F., A. et B., 2002 из почвы Флориды. Размеры
тела всего 45 мкм; тело овальное, заострено к постеро-
ну; токсицисты массивные, со сложным акроном. Бук-
кон очень крупный, занимает значительную часть ан-
тесомы; мембрана резко удлинена, уходит далеко
вверх от рта в виде полукруга; в основаниях мембра-
нелл Ml—М3 соответственно 2, 5 и 9 кинетосом. Чис-
ло кинет невелико, имеются перикинеты правее и
выше рта.
Род Foissneria Mirabdullajev,
1986
Типовой вид F. viridis М., 1986 (Colpodidium
viridis in Jankowski, 1992) из пруда в Узбекистане —
вид с плоским телом, зоохлореллами, дуговидной по-
перечной мембраной; это единственный планктонный
вид отряда, о чем говорит и наличие зоохлорелл, не
случайные особи из почвы; вид обычен в рыбоводных
прудах Ташкентской обл., иногда достигает массового
развития и вызывает цветение прудов (Мирабдуллаев,
1986). Новый род Foissneria был правильно сближен с
нассулидами, но отнесен к сем. Furgasoniidae, от кото-
рого отличается по всем признакам. Точная топогра-
фия мембранелл Ml—М3 неизвестна, показаны 3 диа-
гональных утолщенных ряда (дикинеты), почти цели-
ком в глубокой полости; от двух рядов отходят
послеротовые монокинеты. Фрагмент у вершины по-
лости — несомненно короткая Ml, тоже с послерото-
вой кинетой. Вид имеет большое число очень четких
перикинет со сгущением кинетосом, около 12 выше
рта и 3 правее. Перистом, судя по рисункам, находится
на левой стороне плоского тела, у ребра; у других
кольподидиид на правой стороне.
Этот род мельком упоминается в обзоре отряда (Fo-
issner et al., 2002) как синоним рода Colpodidium, но
различия формы тела кажутся достаточными для со-
хранения Foissneria как подрода в составе Colpodidi-
um. При повторном изучении вида нужно обратить
внимание на основания мембранелл, положение пе-
ристома и предротового шва, число перикинет пра-
вее рта.
Отряд Microthoracida Jankowski,
1967
Этот таксон был предложен мной как подотряд
в составе нового отряда Ambihymenida, объединяюще-
го нассулид и микроторацид; названный отряд в лите-
ратуре не был принят, а новые подотряды приняты и
повышены в ранге. Мелкие формы, сильно сплющен-
ные латерально, с панциревидной прочной кутикулой,
обычно со складками, ребрами, желобками и другим
рельефом для большей прочности. Трихоцисты длин-
ные, после выстреливания на вершине несут палоч-
ковидные отростки. 2 вакуоли медиальные, одна час-
то неактивная. Ядро гомеомерное, округлое. Рот у
большинства видов с длинной глоткой, укрепленной
немадесмами, которые утрачиваются у форм типа Mic-
rothorax. Соматическая цилиатура с тенденцией к ре-
дукции, особенно на левой стороне тела. Ротовая
цилиатура различного типа, часто есть короткая мемб-
рана и левее рта 2—3 короткие циррусовидные пекги-
неллы, иногда называемые псевдомембранеллами. Ар-
742
ALVEOLATA
Рис. 344, a. Microthoracida.
Pseudomicrothorax dubius (А, Б)', Dolithorax gen. n. для Pseudomicrothorax foliformis (B—ffy Trochiliopsis australis (E—3); Discotricha papillifera (И—Л). (По:
Dragesco, 1965b (Л); 1970 (Л); Foissner, 1987a (В—Д); Foissner et al., 1988 (£—3); Tuffrau, 1954 (77); Wicklow, Borror, 1977 (К); Б— ориг.).
Fig. 344, a. Microthoracida.
гиром, если имеется, в виде мельчайшей сети. В основ-
ном пресноводные виды, только один род в море
(Discotricha). Очень часты в террофитоне — почве и
мхах. Микроторациды — регрессивная линия, веду-
щая начало от низших нассулид типа Furgasonia-, со-
храняется тетрахименовый набор ротовых органелл,
нет буккальной полости, идет олигомеризация сомати-
ческих кинет, возникают обширные безресничные
поля.
Отряд Microthoracida был подразделен на 2 под-
отряда — Cyrtopharyngina (альтероним Pseudomicrot-
horacina) и Microthoracina (Янковский, 1980), но здесь
они не приняты, достаточно ранга семейств. В системе
Фойсснера (Foissner, 1985) 3 семейства — Microthora-
cidae (5 родов), Pseudomicrothoracidae (1 род) и Discot-
richidae (1 род).
Сем. Pseudomicrothoracidae Jankowski,
1967 (рис. 344, а)
Относительно крупные (по сравнению с микрото-
рацидами) дисковидные формы с резким сплющивани-
ем тела, небольшим числом биполярных кинет без
ацилона. Ротовая цилиатура типично тетрахименовая,
с УМ и 3 четкими мембранеллами; имеется циртум.
Нет сегментов надротовых кинет (перикинет), распо-
ложенных от апекса до рта у микроторацид.
Род Pseudomicrothorax Mermod, 1914
Типовой ви д Р. agilis Mermod, 1914 по моноти-
пии. Р. agilis и Р. dubius Maupas, 1883 — однотипные
виды; первый мельче (40—58 мкм), длина второго до
100 мкм. Третий вид Р. gracilis Kahl, 1926 сам Каль
(Kahl, 1931) свел в синонимы первого вида, но он был
восстановлен позже как валидный вид (Wenzel, 1953).
Вид Р. gellerti Thompson, 1957 — синоним, в совре-
менной литературе не упоминается. На левой стороне
тела типового вида 4 продольных биполярных ряда
дисом, на правой стороне 8 продольных рядов дисом
(формула R8, L4); длинная мембрана и 3 короткие
мембраиеллы с 3 рядами кинетосом в основании, одна
под другой, Ml > М2 > М3. У мембраны снизу — сто-
матогенные кинетосомы и группа кинетосом у по-
ры вакуоли. Циртум массивный, с немадесмами. Кор-
текс с поперечными ребрами в широких межкинетах,
разделяющих глубокие желобки с ресничками; три-
хоцисты крупные, по всему кортексу. Питание циано-
фитами; вид легко инцистируется. Виды рода встре-
чаются повсеместно в прудах, но чаще в лужах с
обильным развитием синезеленых водорослей, нити
которых засасываются внутрь. Тело поэтому цветное,
синезеленое от массы заглоченных фрагментов водо-
рослей.
Виды Pseudomicrothorax легко культивируются
при ярком освещении в тепле на цианофитах Oscillate-
ТИП CILIOPHORA. КЛАСС NASSOPHOREA
743
Рис. 344, б. Microthoracida.
Microthorax simplex (А, К)', M. simulans (Ii—Д): Drepanomonas revoluta (E, И, K); D. pauciciliata (Ж, JI, M)', D. sphagni (3, H, О). (По: Foissner, 1985a (Л—Д);
1987a (E—O)).
Fig. 344, 6. Microthoracida.
ria и служат объектом многих работ по строению, пи-
танию, физиологии цилиат; хорошо изучены морфоге-
нез и ультраструктура. Род считался моделью переход-
ной формы от гимностомат к гименостоматам (Corliss,
1958), но сейчас промежуточным родом считают нас-
сулид Furgasonia.
Род Chilodonopsis Conn,
1918
Можно ли использовать синонимичные назва-
ния для подродов? В главе «Protozoa» Конн и Эд-
мондсон (Conn, Edmondson, 1918) дают рисунок и
описание Chilodonopsis crenula Conn, 1905; этот род
и вид — синонимы Р. dubius. В статье Конна (Сопл,
1905) вид зарисован, но род и вид не названы («new
genus»). Поэтому правильное название типового
вида Chilodonopsis crenula Conn, 1918 in Conn et Ed-
mondson, 1918; это важно, поскольку название 1905 г.
имело бы приоритет перед названием Pseudomicro-
thorax Mermod, 1914. Этот вид нужно сначала пере-
нести в состав Pseudomicrothorax и уже в пределах
этого рода объявить синонимом — Р. crenula Jank.
comb. n.
Род Craspedothorax Sondheim,
1929
Типовой вид Chilodon dubius Maupas, 1883;
род принят Венцелем (Wenzel, 1953) для C. dubius и
С. gracilis, а род Pseudomicrothorax оставлен для
Р. agilis. Оснований для этого нет. Автор рода Cras-
pedothorax не знала литературу и описала вид с ри-
совых полей Мадагаскара под новым родовым на-
званием.
Род Dolithorax Jankowski gen. n.
Типовой вид Pseudomicrothorax foliformis Fois-
sner, 1986. Некрупные формы (55—65 мкм) из проб
сухого мха, с цилиндрическим телом, снизу широким
744
ALVEOLATA
Рис. 345, a. Microthoracida.
Stammeridium kahli (A—Г); Microthorax leptopharyngiformis (Д—Ж); M. australis (3, О, ГГ): M. simplex (И)', Leptopharynx costatus (K—H). (По: Foissner, 1985a
(А—Ж, И)\ 1989 (К—H); Foissner, O’Donoghue, 1990 (3, О, П)).
Fig. 345, a. Microthoracida.
и поперечно срезанным; ядро и вакуоль центральные;
глотка с 20 немадесмами. Вдоль кинет — широкие
ребра с волнистым краем, все они не сходятся у по-
стерона. Число кинет, как у Р. dubius, — R7, L4. В меж-
кинетах длинные трихоцисты, после выстрела с апика-
льными зубцами. Ротовая цилиатура несходна с тако-
вой у Р. dubius — имеются 3 длинные кинеты левее
рта, Ml выше и левее рта, М2 > М3 на уровне и ниже
рта. Аргиром также несходен с Р. dubius — между
кинетами сложная сеть из множества неправильных
ячеек. Нет поперечных ребер кортекса в межкине-
тах (опорных элементов прочного сетчатого панци-
ря), которые легко видны in vivo без серебрения у
Р. dubius.
Сем. Microthoracidae Wrzesniowski, 1870
(рис. 344, а—345, а)
У родов псевдомикроторацид кинеты относитель-
но многочисленные, продольные, без фрагментации,
сходные на обеих сторонах тела; у микроторацид на-
блюдается редукция соматической цилиатуры — чис-
ло кинет уменьшено, часть их или все прерваны, от
некоторых остались мелкие рудименты; редукция ки-
нет и числа ресничек в них может привести к почти
полному отсутствию дорсальной цилиатуры. Это свя-
зано с уменьшением размеров микроторацид — виды
Pseudomicrothorax крупные, ярко окрашены от загло-
ченных синезеленых водорослей, их легко найти и вес-
ти фиксацию и окраску; микроторациды мельчайшие,
бесцветные, за исключением нескольких видов с зоо-
хлореллами, цитологическая работа с ними очень
трудна. У Pseudomicrothorax перистом организован в
принципе, как тетрахимениум у гименостомат (поэто-
му этот род считали представителем переходной груп-
пы от циртофорид к гименостоматам), имеется мемб-
рана, рот и левее 3 косо расположенные мембранеллы.
У микроторацид этот аппарат упрощается, уменьшает-
ся число кинетосом в мембранах, они вовсе могут ис-
чезнуть. Циртум, четкий у Pseudomicrothorax, сохра-
няется у низших микроторацид и исчезает у многих
видов. Сейчас ясно, что переходной формой от нассу-
лид к гименостоматам является род Furgasonia (= Сус-
ТИП CILIOPHORA. КЛАСС NASSOPHOREA
745
Рис. 345, б. Colpodea. (По: Foissner, 1993).
Colpoda aspera (A—В); C. steinii (Г, К)-, Hausmanniella patella (Д); H. discoidea (Е); Colpoda ecaudata [Ж); Anictostoma terricola (3, И).
Fig. 345, 6. Colpodea.
logrammdy, он дает начало также роду Pseudomicrotho-
rax и далее роду Leptopharynx, от которого можно вы-
вести ряд родов микроторацид. Фактически от
фургасонии берут начало 2 линии эволюции цилиат,
прогрессивная и регрессивная. Распространение мик-
роторацид всесветное, но только в почве и пресной
воде; морских видов нет, за исключением Discotricha,
которая может относиться к кольподидам, а не к мик-
роторацид ам.
Род Microthorax Engelmann,
1862
Типовой вид М. pusillus по обозначению
Аэшт; как родовой синоним по ошибке указывается
Hemicyclium, но это валидный род семейства с несход-
ным строением. В первоисточнике дан краткий диа-
гноз рода и описание 2 видов без указания типа —
М. pusillus и М. sulcatus', рисунки обоих видов непра-
вильные. Широко распространенный род, хорошо изу-
ченный многими авторами в последние годы; все опи-
746
ALVEOLATA
сания ранних авторов неточные. Биотоп — бентос
пресных вод, мох, почва.
Тело типового вида в виде фруктовой дольки, плос-
кое, справа 3 дуговидные кинеты, прерванные посре-
дине с образованием широкого ацилона, слева кине-
том почти исчез, сохранились единичные реснички
снизу и характерный для ряда родов набор коротких
диагональных фрагментов с густыми ресничками; обо-
значим этот комплекс термином «эпифрагмон». У
М. pusillus в эпифрагмоне 4 ряда ресничек. Пери-
стом — желобок снизу слева, небольшая ямка в углу
тела; по правому краю ямки — короткая мембрана, на
дне вместо 3 стандартных мембранелл видна лишь уз-
кая косая полоска — рудимент адоральной зоны мемб-
ранелл (только у М. pusillus). Питание бактериями; все
виды семейства — микрофаги. При импрегнации, по
Клейну, вместо одиночных или парных кинетосом в
соматических рядах видны комплексы парных кинето-
сом и поры трихоцист вдоль кинет. Ядро округлое,
медиальное; имеется одна активная и одна медленно
пульсирующая или неактивная придаточная вакуоль
под ядром. Часта конъюгация. Вид должен легко инци-
стироваться, судя по широкому распространению в
почве, мхах, в воде, но пока цисты не описаны.
М. auricula Fabre-Domergue, 1886; кинета R1 цель-
ная, кинетом не изучен.
М. bidentatus Kahl, 1926; ряд R1 цельный, снизу
2 шипа.
М. blochmanni Schouteden, 1906; вид не замечен
специалистами и забыт.
М. costatus Kahl, 1926, все R-кинеты прерваны,
справа короткие продольные ребра и зубцы (у типово-
го вида правая сторона ровная).
М. elegans Kahl, 1931; ряд R1 цельный, справа
2 ребра и зубец.
М. glaber Kahl, 1926; ряд R1 цельный, серия фраг-
ментов кинет расположена вдоль адорального края
правой стороны (нет у типового вида рода); нет цилиа-
туры на левой стороне, кроме мелкого рудимента у
апекса.
М. ovinucleatus Sramek-Husek, 1957; как AT pusillus,
но с овальным ядром и зоохлореллами.
М. leptopharyngiformis Foissner, 1985 — ряд R1
цельный, 3 ряда эпифрагмона на правой стороне, слева
единичные фрагменты и реснички. У микроторацид,
судя по сравнению импрегнированных препаратов и
снимков в СЭМ, многие аргентофильные кинетосомы
лишены ресничек.
М. penicillata Vuxanovici, 1961 — ряд R1 цельный,
слева 2 группы ребер.
М. pusillus Engemann., 1862 — типовой вид; R1 пре-
рван в отличие от многих видов; это важно, поскольку
сборный род подлежит дроблению.
М. scutiformis Penard, 1922 — 2 правых ряда цель-
ные, форма панциря нетипичная для рода.
«Microdysteria kahli» Tucolesco, 1962. Род Каля на-
зывается Mirodysteria, это морские гипостоматы; дан-
ный вид похож на Microthorax scutiformis по типу пан-
циря, но с разрывом кинет — Microthorax kahli
comb. n.
M. spiniger Penard, 1922 — цилиатуры почти нет,
продольные желобки на панцире, крюковидный шип
справа; вид не может принадлежать к Microthorax.
М. sulcatus Engelmann, 1862 — по разным авторам,
правый ряд цельный, без ресничек или прерван. Исто-
рия группы полна неточных рисунков и ложных опре-
делений.
М. transversus Foissner, 1985 — все ряды прерваны,
мембранеллы глубоко в полости перистома, в постесо-
ме слева всего одна ресничка.
М. tridentatus Kahl, 1931 — ряды R2 и R3 цельные,
снизу тело расширено, зубчатое.
М. viridis Kahl, 1931 —R1 цельный; с зоохлорелла-
ми.
Безусловно род сборный, распадется на серию ро-
дов. Виды разнотипные по кинетому, форме панциря,
положению эпифрагмона, по набору мембранелл. Для
типовой формы М. pusillus применен лишь сухой ме-
тод Клейна, поэтому выявлена лишь одна наружная
мембранелла, 2 другие должны быть в полости пери-
стома, топография их неизвестна. Это очень затрудня-
ет классификацию. Пока можно обособить 3 рода.
Род Zelothorax Jankowski gen. n.
Типовой вид Drepanomonas simulans Kahl,
1926; позже в составе Microthorax (Zelothorax simulans
comb. n.). Новый род основан не на диагнозе и рисунке
Каля (Kahl, 1931), а на таковых у Фойсснера (Foissner,
1985) (М. simulans Kahl sensu Foissner, 1985). У Каля
ряд R1 цельный, с зубчатым основанием, у Фойсснера
прерван, с широким ацилоном. Эпифрагмон над ртом
на правой стороне тела. Родовой признак — наличие
продольного ряда слева в глубоком продольном же-
лобке, смещение всего эпифрагмона на вент, и про-
дольное (не поперечное) расположение всех мембра-
нелл перистома. У гименостомат (скутицид) даже го-
раздо более мелкие различия в положении мембранелл
служат родовым признаком. Соматическая цилиатура
справа — рудименты 3 кинет, 3 ряда эпифрагмона,
слева — продольный ряд и по обе стороны от него не-
сколько разрозненных ресничек.
Род Denithorax Jankowski gen. n.
Типовой вид Microthorax ungulatus Penard,
1922. В первоописании ряды R1 и R2 цельные, эпи-
фрагмон на правой стороне, слева нет ресничек, от
вздутий панциря отходят 2 массивных изогнутых
шипа. Форма тела нетипичная для Microthorax — тело
расширяется книзу, а не сужается. Каль (Kahl, 1931)
изучил этот вид, показал мелкий перерыв рядов 1 и 2 и
рудимент ряда 3; слева 2 зубцевидных шипа (у Пенар-
да крюковидные), кинетома на левой стороне тела нет.
Независимо от типа мембранелл (импрегнация пока не
проведена) этот вид слишком сильно отличается от ти-
пового вида М. pusillus.
Род Simithorax Jankowski gen. n.
Типовой вид Microthorax simplex Foissner,
1985, с цельными рядами Rl, R2 и фрагментацией ряда
R3. Эпифрагмон целиком на правой стороне плоского
ТИП CILIOPHORA. КЛАСС NASSOPHOREA
747
гола; перистом глубокий, 3 мембранеллы расположе-
ны параллельно поперек тела. На левой стороне одна
ресничка сзади, несколько разрозненных ресничек
спереди и кинетосомы без ресничек. Вид может совпа-
дать с М. pusillus по типу перистома, но отсутствие
разрыва правых кинет — родовой признак.
Род Hemicyclium Eberhard, 1862
Типовой вид Н. lucidum; по Корлиссу и
Аэшт, — синоним рода Microthorax. У Каля (Kahl,
1931) — в составе Microthorax, с последующими сино-
нимами М. sulcatus Roux, 1901 (точнее, М. sulcatus sen-
su Roux, non Engelmann) и M. haliotideus Penard, 1922.
В определителе родов микроторацид Фойсснера (Fois-
sner, 1985а) род не упомянут, но позже приводится им
как валидный. Синонимия родов исключена, посколь-
ку все 3 правые кинеты у Hemicyclium не прерваны, у
Microthorax с обширным ацилоном. Размеры Н. luci-
dum 50—70 мкм, тело очень широкое, перистом в во-
ронке слева, не сдвинут вплотную к постерону, как
у видов Microthorax', на обеих сторонах тела по 3 реб-
ра, справа 3 дуговидные кинеты — сплошные ряды
кинетосом без ацилона; эпифрагмон не зарисован.
Загадочный вид Microthorax penardi Tucolesco,
1962, если перевернуть рисунок, можно отождествить
с Hemicyclium, но указан слишком мелкий размер
(15 мкм).
Род Lopepoterenia Foissner, 1997
Типовой вид Trichopelma torpens Kahl, 1931;
вероятно, единственный солоноватоводный вид се-
мейства. Величина 60 мкм, тело вытянутое, в виде
дольки мандарина; нет циртума (немадесмальной
глотки); рот смещен непосредственно к клювовидному
апексу; от зоны мембранелл остались мелкие рудимен-
ты. Правая (дорсальная) сторона без ресничек, но с
шипами, видимыми и по краям тела; на левой стороне
около 8 биполярных кинет с короткими ресничками в
желобках.
Род Trochiliopsis Penard, 1922
Типовой вид Т. ораса. По Корлиссу (Corliss,
1979), синоним рода Leptopharynx, у Каля в составе
Trichopelma. Размеры 35—40 мкм; в сапропеле и сап-
робных зонах пресных вод. Внешний вид, как у преды-
дущего рода, но с меньшим числом ресничных желоб-
ков и без шипов. Рот субапикальный, циртум не заме-
чен Пенардом и Калем, но зарисован Фойсснером
(Foissner et al., 1988). Справа 3 кинеты с широким аци-
лоном, реснички в верхних и нижних фрагментах ря-
дов; один ряд вдоль вентрального края тела; 2 мелкие
циррусовидные мембранеллы у рта; эпифрагмон на ле-
вой стороне, где видно несколько мелких фрагментов
кинет. Поры трихоцист открываются у зубчатых же-
лобков. Обе стороны тела с ребрами и 4 желобками
между ними, но реснички имеются лишь в части рядов,
у концов тела. Род близок к Stammeridium.
Род Stammeridium Wenzel, 1969
Типовой вид Stammeriella kahli Wenzel, 1953;
это замещающее название для гомонима Stammeriella
Wenzel, 1953. Вид зарисован Калем (1931), но не был
признан новым; по Венцелю (Wenzel, 1953), сочетает
признаки Drepanomonas и Trichoderum (в данном обзо-
ре — видов Trochiliopsis и Pseudocristigera). Тело вы-
тянутое, плоское, циртум смещен субапикально вверх,
рот (вершина трубки немадесм) выдается над телом,
глотка очень длинная, дуговидная; ядро округлое, ва-
куоли с порами выше и ниже экватора. Слева продоль-
ный желобок — складка панциря, здесь имеется всего
около 7 ресничек. Справа незначительные рудименты
кинет у полюсов тела, эпифрагмон (перикинеты) на
зубцах выше рта, мембрана, добавочный ряд кинето-
сом (Х-кинета) и 2 мельчайшие мембранеллы.
Род Drepanomonas Fresenius, 1858
Типовой вид D. dentata по монотипии. Сино-
нимы по Корлиссу и Аэшт, — Drepanoceras и Pseudoc-
risigera; второй род в данном обзоре считается валид-
ным. Название Drepanoceras Stein, 1878, по Аэшт, яв-
ляется «ненужным замещающим названием для
Drepanomonas, поскольку этот род не преоккупиро-
ван» (т. е. не гомоним). Однако Штейн заменил назва-
ние только потому, что оно ему не понравилось — в
названии «monas», но это не флагеллаты — монады, а
инфузории; кроме того, название Drepanomonas не от-
ражает отличительных морфологических признаков.
Типовой вид имеет серповидную форму —
тело вытянуто, заостряется к обоим концам, изогнуто,
расширено медиально; ядро округлое, под ним 2 ваку-
оли. По обеим сторонам тела по 2 высоких ребра, рес-
нички в желобках; справа 2 цельные кинеты и одна
укороченная, рот на выступе края тела медиально, эпи-
фрагмон над ртом, ряды лежат на зубцах панциря,
ниже импрегнируются мелкие кинеты. Мембранеллы в
неглубоком перистоме, не выявляются сухим методом
серебрения. Размеры особей 40—65 мкм.
Род Pseudocristigera Horvath, 1956
Типовой вид Р. hymenofera по монотипии, ве-
личиной 30—35 мкм, из почвы. Вид описан без знания
литературы и сближался одновременно с гименосто-
матами сем. Philasteridae и со спиротрихами отряда
Heterotrichida, считался «совершенно обособленным в
мире инфузорий»; вид хорошо зарисован, но автор
рода, не зная работ по микроторацидам, не понял стро-
ение вида. Род позже сводили в синонимы Drepanomo-
nas, но различия по форме тела и рельефу панциря тре-
буют обособления хотя бы на уровне подрода.
Типовой вид Р. hymenofera — синоним вида
Drepanomonas revoluta Penard, 1922; это одна из наибо-
лее обычных и хорошо изученных микроторацид.
У Пенар да (Penard, 1922) 2 формы вида, типовой явля-
ется форма с желобком на левой стороне (рис. 168 в
книге Пенарда; рис. 169 относится к другому виду, ве-
роятно Р. muscicola). Тело плавно закруглено на кон-
748
ALVEOLATA
цах, слева продольный осевой желобок, расширенный
у концов тела, особенно снизу, правая сторона ровная.
Справа прерванные ряды редких ресничек, мелкий пе-
ристом над экватором, эпифрагмон по краю ребра, от
рта до апекса, короткие мембранеллы в глотке; слева
редкие краевые реснички и несколько ресничек у же-
лобка.
Типовые виды родов Drepanomonas и Pseudocristi-
gera четко отличаются от других микроторацид, но
есть виды с промежуточной морфологией.
Р. exigua comb. n. (= Drepanomonas exigua Penard,
1922) — ряд R1 прерван, обе стороны с 2 ребрами,
справа длинный шип панциря.
Р. lunaris comb. n. (= Drepanomonas lunaris Fois-
sner, 1979) — правые ряды не прерваны, но кинетосо-
мы в R1 разрежены, не образуют единого ряда; пан-
цирь с ребрами и желобками.
Р. muscicola comb. n. (= Drepanomonas muscicola
Foissner, 1986, = D. sphagni in Foissner, 1979). Вид типа
P. revoluta, с перерывом кинет и большим ацилоном;
мембраны в перистоме продольные, не осевые, как за-
рисовано у Р. hymenofera.
Р. obtusa comb. n. (= Drepanomonas obtusa Penard,
1922) — вид типа P. exigua и P. lunaris.
P. pauciciliata comb. n. (= D. pauciciliata Foissner,
1986); вид типа P. revoluta, с разрывом кинет и лево-
сторонним желобком.
Р. revoluta comb. n. (= D. revoluta Penard, 1922;
= P. hymenofera Horvath, 1956). Типовой вид рода.
P. sphagni comb. n. (=Z>. sphagni Kahl, 1931). Вид
типа P. revoluta, с более развитой цилиатурой слева и
более глубоким перистомом.
Род Leptopharynx Mermod, 1914
Типовой вид L. costatus по монотипии; см.
ниже проблему рода Trichopelma. Хорошо изученный
вид, обычный в пробах из почвы, мхов, прудов. Диско-
видные формы; панцирь без желобков и шипов, с не-
большими ребрами вдоль кинет; ядро округлое, ва-
куоль ниже рта; в части проб с зоохлореллами; круп-
ные веретеновидные трихиты вдоль кинет. Цилиатура
хорошо развита, на правой стороне цельная краевая
кинета R1, почти полные ряды R2 и R3, ротовая мемб-
рана и группа кинетосом у ее нижнего конца; слева
4 кинеты с разрежением кинетосом медиально. Эпи-
фрагмон в виде 3 нечетких косых кинет находится на
ребре над ртом; рот на конце немадесмальной корзин-
ки над экватором. Ротовая цилиатура — мембрана УМ
и 2 мелкие диагональные мембранеллы на поверх-
ности тела, нет перистомальной полости. В этом род
близок к Pseudomicrothorax. Вид хорошо изучен на им-
прегнированных препаратах и в электронном микро-
скопе (Prelle, 1961, 1965).
Род Trichopelma Levander, 1900
Типовой вид Т. sphagnetorum Levander, 1900.
Этот вид описан очень плохо, но все же описанный по-
зже вид Leptopharynx costatus Mermod, 1914 — типо-
вой для рода Leptopharynx, с отличным, точным рисун-
ком сводили в синонимы вида Левандера. Рисунок
Т. sphagnetorum очень упрощен и не противоречит та-
кой синонимии, но одни авторы считали валидным
первый вид, другие — второй. Название Trichopelma
почти до недавнего времени широко использовалось,
в частности в определителе Каля (Kahl, 1931), пока
не выяснилось, что это гомоним. Для замены было
предложено название Trichoderum Strand, 1942.
Штранд не знал, что есть пригодный синоним Leptop-
harynx. К роду Leptopharynx можно отнести несколько
видов.
L. agilis comb. n. (Trichopelma agilis Savoie, 1957).
Рот выше, чем у L. sphagnetorum-, если схема кинетома
точная, отличается и левосторонняя цилиатура.
L. chlorophagus Kumar Das, 1971 — вид из Индии с
зоохлореллами; совершенно неприемлемый вид, очень
примитивное описание и рисунок.
L. euglenivora Kahl, 1926, позже в составе Trichopel-
ma. Аберрантная форма с очень широкой глоткой; рот
овальный, вытянут вдоль края тела; четкие ребра на
обеих сторонах тела, сверху сходятся к одной точке
без образования зубцов (у видов Мермода и Левандера
эти ребра и кинеты подходят к зубчатому участку, до
трети длины тела). По этому признаку L. euglenivora
должна быть отнесена к новому роду; пока выделяется
подрод Shoristoma Jankowski subgen. п., типовой вид
L. euglenivora, с приведенным выше диагнозом.
L. eurystoma (Trichopelma in Kahl, 1931). Как и пре-
дыдущий вид, имеет гигантский циртум и крупный
рот, но правые кинеты и ребра подходят не к одной
точке (апексу), а равномерно вдоль всей предротовой
полосы. Сохранены 3 мелких ряда эпифрагмона; пра-
вая кинета цельная, 2 внутренние прерваны; правее
рта мембрана, под ртом фрагменты кинет; слева ред-
кие кинетосомы в 3 рядах; мембранеллы сближены.
В обоих изданиях Guide вид приводится как L. costa-
tus, но это ошибка.
L. minimus Alekperov, 1993 — описание и рисунок
совпадают с таковыми неназванной мелкой формы
вида/.. costatus (Prelie, 1961); вид без зоохлорелл.
L. sphagnetorum (Trichopelma in Levander, 1900).
Название вида использовалось вплоть до недавнего
времени; по Фойсснеру (Foissner, 1985), синонимия
все же не доказана, лучше пользоваться названием
L. costatus, поскольку есть некоторые различия в пер-
воописаниях видов (но рисунки не противоречат сино-
нимии).
Не названный новый вид Leptopharynx sp. обнару-
жен в Антарктике в пробе растаявшего льда, вероятно
новый; африканская раса L. costatus отличается от ти-
повой добавлением одной кинеты справа.
Сем. Discotrichidae Jankowski, 1975
Морские микроторациды (или кольподиды?) с цир-
русами — реснички вдоль кинет разбиты на группы и
склеены вместе в каждой группе; нет цилиатуры на ле-
вой стороне плоского дисковидного тела; вместо гар-
пуновидных трихоцист пресноводных видов отряда —
веретеновидные мелкие мукоцисты. В Traite (Puytorac,
1994) дается диагноз сем. Discotrichidae fam. nov., но в
Guide (Small, Lynn, 1985) дан диагноз сем. Discotrichi-
ТИП CILIOPHORA. КЛАСС COLPODEA
749
dae Jank., 1975, и это авторство принято Корлиссом
(Corliss, 1979) и Фойсснером (Foissner, 1985а). Воз-
можно также обозначение Discotrichidae Jank. in Small
et Lynn, 1985.
Род Discotricha Tuffrau, 1954 (рис. 344, a)
Типовой вид D. papillifera по монотипии,
встречается в морском псаммоне, изучен многими ав-
торами. Размеры 55—60 мкм, тело плоское, почти
округлых очертаний. На правой стороне маргиналь-
ный ряд ресничек и дуговидные внутренние ряды, в
которых реснички расположены поодиночке или со-
Класс Colpodea
Разнообразные по внешнему облику виды, обитающие во мхах
и почвах, в небольших временных водоемах, в озерах, редко в
море. Все роды объединяют 4 признака, прежде всего ультраструк-
тура элементов инфрацилиатуры кинетосом. По ходу кинеты все
кинетосомы парные — дикинетиды (дисомы) в дуговидных или
спиральных соматических рядах; реснички несут обе или только
одна кииетосома, передняя или задняя. Длинный поперечный пу-
чок микротубул идет назад от задней кинетосомы каждой пары;
пучки в пределах ряда накладываются один на другой и образуют
компактный тяж, так называемую «фибриллу LKM». Кроме попе-
речного тяжа имеется как минимум одна постцилиарная микроту-
була, связанная с передней кинетосомой, и одна поперечная груп-
па, один постцилиарный тяж и одна кинетодесмальная фибрилла,
ассоциированная с задней кинетосомой. Хорошо развит рельеф
кортекса (аргиром), обычно в виде мелкоячеистой сети по всему
телу, часто с правильными рядами аргироконтов. Стоматогенез
простой, как у циртофорид, соматический (телокинетальный), пе-
ред делением топография кинетосом меняется, зачатки нового ро-
тового аппарата образуются не из имеющегося ротового комплек-
браны в циррусы разной величины, особо крупные сза-
ди имитируют трансверсальные циррусы гипотрих.
Глотка с немадесмами, короткая и очень широкая,
ядро с 1—2 микронуклеусами, вакуоль над постеро-
ном. Ротовой ресничный аппарат (узкие мембраны в
мелком перистоме, несколько кинетосом в ряду над
ртом) не соответствует принципу тетрахимениума.
Вся поверхность тела вне кинет занята бугорками во-
круг пор мукоцист. Описания вида у всех авторов от-
личаются, допускается наличие других видов рода.
Морфогенез кинетома при делении сравним с таковым
у Leptopharyngidae — новые адоральные мембранеллы
образуются за счет поля кинетосом неясного проис-
хождения.
Small et Lynn, 1981
са, а из сомакинет вне ротовой зоны. Деление часто происходит во
временных цистах; обитание в почве или мхах возможно при усло-
вии быстрого ин- и эксцистирования и исключительной устойчиво-
сти к высушиванию, перегреву на солнце и к быстрому заморажи-
ванию. Кольподы были объектом работ по способности клеток пе-
реносить «марсианские условия». Преобладают минитрофы
(питание бактериями, грибками, мелкими флагеллатами); полифа-
гов мало, но развитие крупного перистома и переход к хищничест-
ву играют значительную роль в эволюции класса, привели, в част-
ности, к возникновению гигантской Bursaria truncatella. Питание в
спорангиях более крупных грибков, например сапролегний, — пе-
реход к паразитизму. Монография группы опубликована Фойссне-
ром (Foissner, 1993); добавленные позже роды кольподовых, кроме
Hackenbergia (нет в библиотеке), включены в данную сводку.
Молекулярный анализ подтверждает родство кольподид с Na-
ssulida; Colpodea и Nassophorea — 2 близкие ветви в филограммах
цилиат (Shin et al., 2000); филограмма внутри Colpodea показала
таксономическую значимость типа ядер, аргирома и стоматогенеза
в дивергентной эволюции класса (Lynn et al., 1999).
Подкласс Colpodia Foissner, 1985
Класс кольподовых делится на 2 подкласса — Colpodia и Вгуо-
metopia; большинство родов относится к первому подклассу; у пер-
вых аргиром в виде сети правильных прямоугольников, у рта в по-
лости 2 поля кинетосом; у вторых аргиром в виде неправильной
сети или сети в сочетании с рядами прямоугольников, ротовая ци-
лиатура имитирует таковую гетеротрих и гипотрих — имеется
длинная пароральная органелла (гомолог ундулирующей мембра-
ны) справа и полоса ступенчатых поперечных поликинет слева,
имитирующая адоральные мембранеллы спиротрих. Примеры коль-
подид приведены на рис. 345, б—350, б.
Отряд Colpodida Puytorac et aL, 1974
У рта 2 поликинеты; правая полоса состоит из не-
скольких или многочисленных рядов в некотором бес-
порядке, иногда редуцирована до одного ряда дисом;
левая ротовая поликинета состоит из нескольких или
значительного числа рядов монокинетид (моносом); в
дополнение к ротовым полосам часто образуется до-
полнительная ротовая цилиатура при погружении вер-
шин сомакинет в предротовую полость — вестибу-
люм. Стоматогенез меротелокинетального типа —
трофонт округляется, перистом резорбируется, много
фрагментов отделяются на вершине сомакинет, перед
делением ставших биполярными, и дают начало рото-
вым полосам, деление происходит во временных
репродуктивных цистах, за исключением рода Exocol-
poda; обычно образуются 4 томита, новый перистом
возникает из ресничного зачатка.
Сем. Colpodidae Bory de St. Vincent, 1826
Правые и левые поликинеты ротовой зоны пример-
но одинаковой величины.
Род Colpoda Muller, 1773
Типовой вид Kolpoda cucullus Muller, 1773 по
обозначению Фроментеля (Fromentel, 1874). У Мюлле-
ра название рода Kolpoda в греческом варианте, но бы-
стро распространилось латинизированное написание
Colpoda, и оно было официально утверждено Комите-
том ICZN как валидное название рода. Синонимы —
Chasmatostoma, Paracolpoda, Pseudocolpoda, Repoma,
Tillina (последнее пригодно как подродовое).
Наиболее крупный род класса; кроме нескольких
десятков валидных видов описано много неопредели-
мых видов (обзор у Foissner, 1993). По Аэшт, типовой
вид был обозначен в 1938 г. (Taylor, Furgason, 1938),
750
ALVEOLATA
Рис. 346, a. Colpodea. (По: Foissner, 1993),
Relicolpoda gen. or subgen. n. — Colpoda elliotti (A—Г):, Bresslauides terricola В. discoidens (E)\Apocolpoda africana (Ж, 3); Kuehneltiella terricola iff, K).
Fig. 346, a. Colpodea.
но Фойсснер правильно указал приоритет Фроменте-
ля. Типовой вид рода С. cucullus — один из наиболее
обычных почвенных видов класса, принадлежит к
группе крупных видов (40—120 мкм); все кинеты спи-
ральные, если взять модель с продольными рядами и
полярными концами тела и перекрутить верхнюю и
нижнюю половины тела в разные стороны, получится
цилиата рода Colpoda. Линию смещения рта с полюса
указывает длинный краевой предротовой шов (эписе-
канта); постерон смещен вверх на левую сторону тела
при аллометрическом удлинении кинет. Кольподы
легко импрегнируются, по Клейну и Шаттону, выявля-
ется правильный аргиром — фибриллы между смеж-
ными кинетами, создающие сеть с прямоугольными
или ромбическими ячейками (аргироконтами — мой
термин для ячеек аргирома); каждая дисома окружена
кольцевой фибриллой, и этот комплекс интенсивно
импрегнируется. Межкинеты выпуклые, с порами му-
коцист (экструсом).
Правая сторона тела выпуклая, от рта начинается
широкий и глубокий желобок, уходящий на левой сто-
роне вниз по диагонали; цилиатура желобка соматиче-
ская, но специализирована — дисомы тесно сближены
в рядах, сближены между собой и смежные ряды, в
ТИП CILIOPHORA. КЛАСС COLPODEA
751
Рис. 346, б. Colpodea. (По: Foissner, 1993).
Maryna ovata (A—By, Jlsiella palustris (Г—Е)\ Bardeliella pulchra (Ж—K)\ Anictostoma grelli (JI—O').
Fig. 346, 6. Colpodea.
итоге образуется уникальный предротовой комплекс,
который следует обозначить специальным термином,
к примеру «перифрагмон»; в данном обзоре любые
ряды кинетосом и ресничек, четко обособленные без
фрагментации (простое сближение кинетосом у вер-
шины кинет) или с отделением от сомакинет, обра-
зующие дополнительную предротовую цилиатуру,
обозначаются термином автора «перикинеты»; пери-
кинеты в ряду над перистомом обозначаются как «эпи-
фрагмон». Рот расположен на дне небольшой полости
(буккон), глотка короткая и широкая, без немадесм. На
стенках буккона 2 полосы ресничек — 2 поликинеты,
состоящие из серии коротких косых, вплотную сбли-
женных фрагментов (пектинелл), продольная правая и
поперечная левая; при импрегнации, по Клейну, поло-
сы не видны или частично выявляется одна из них (ле-
вая), для точного их изучения нужен метод Шаттона,
Фернандеса или протаргол. В полунаружной левой по-
752
ALVEOLATA
Рис. 347, a. Colpodea. (По: Foissner, 1993).
Grossglockneria acuta (А—ДУ, Cosmocolpoda naschbergeri (E—3); Sorogena stojanovitchae (И—ET).
Fig. 347, a. Colpodea.
лосе примерно 30 рядов моносом параллельны друг
другу, в более короткой внутренней полосе положение
кинетосом не очень четкое, в нескольких параллель-
ных рядах разной длины. Тело несколько сплющено,
особенно у ребра, и при наблюдении в обычном поло-
жении (сбоку) виден крупный циррусовидный пучок
вплотную сближенных ресничек, отходящий от полу-
наружной полосы фрагментов.
Вакуоль у постерона; ядро неоднородное, с эндосо-
мой, как бы состоит из нескольких телец, иногда ка-
жется звездчатым; микронуклеус у всех видов отряда
тесно прилегает к оболочке макронуклеуса. Плавание
медленное, с вращением по спирали; деление в цистах
на 4—8 мелких особей; цисты покоя с более толстыми
стенками, в толще которых иногда выявляются сим-
бионтные бактерии. Хотя кольподовые обитают в хо-
рошо освещенных местах, нет симбиоза с зоохло-
реллами. Основная пища — бактерии и мелкие грибки.
Специфический паразит кольпод — Spiromonas gon-
deri (сейчас в составе рода Colpodella)', в некото-
рых популяциях кольподовых подвижные каплевид-
ные трофонты со жгутиками прикрепляются к покро-
вам кольпод и висят на теле хозина, высасывая
хоботком цитоплазму. Этот род относили к флагелла-
там, но по ультраструктуре это альвеолаты, близкие к
Sporozoa.
ТИП CILIOPHORA. КЛАСС COLPODEA
753
Рис. 347, б. Colpodea. (По: Foissner, 1993).
Bursaria truncatella (А, Б, Г—Е); В. caudata (В) (на рис. Г— стадия Archiastomata adami)\ Bursaridium pseudobursaria (Ж, 3).
Fig. 347, 6. Colpodea.
Archiastomata adami is stage in the cycle of Bursaria.
Виды рода Colpoda распространены на всех конти-
нентах, цисты извлечены даже из толщи гренландско-
го ледника. Часть видов выносит осолонение, встреча-
ется в соленых почвах; Янковский (неопубликованные
данные) эксцистировал мелких моховых кольпод в
черноморской воде (20 %о), и они долго сохраняли
жизнеспособность. Все виды рода свободноживущие,
возможен транспорт цист через кишечник хозяев
(рыбы, лягушки, черепахи, лось, человек), документи-
рованные инвазии тела хозяев — редчайшее исключе-
ние (пример — Colpoda sp. в личинках комаров Culex
tarsalis и в водяном клопе Nepa cinerea). Находка коль-
под в кишечнике морских ежей и в экзувиях пелагиче-
ских морских копепод — ошибка, это плагиопилиды
Trimyema и апостоматы Spirophrya. Кольподы из чело-
века описывались как Nyctotherus faba Jakoby et Schau-
dinn, 1899; N. africanum Castellani, 1905; Balantidium
coli giganteum Krause, 1906 (Nyctotherus giganteus in
Braun, 1908); Nyctotherus sp.; все описания плохие, но
это явно кольподы, что ясно по форме тела и глыбкам
хроматина в округлом ядре. Со временем от этих на-
званий отказались, регистрируя виды как Colpoda spp.,
к примеру Colpoda steini отмечены в мочевом пузыре
пациентов, С. cucullus — в кишечнике; С. steinii отме-
чены в черепахе Kinosternum, С. elliotti в лосе Alces,
С. inflata в карасях, С. cucullus в других рыбах, С. stei-
nii в лягушках и т. д.
Ниже дан почти полный список валидных видов
рода и обсуждается родовое положение нескольких
видов кольпод.
С. ecaudata (Liebmann, 1936) (пример вида с почти
не выраженным предротовым желобком); С. aspera
Kalil, 1926 (также без желобка); С. edaphoni Foissner,
1980; С. maupasii Enriques, 1908 (-С. matritensis,
Cfastigata), С. colpidiopsis К., 1931; С. augustini F.,
1987; С. inflata (Stokes, 1884 in Tillina) (= C. rouxi);
C. oblonga Dragesco, 1972; C. californica K., 1931;
C. cucullus (Muller, 1773); C. simulans K., 1931; C.flavi-
cans (Stokes, 1885 in Tillina)', C. lucida Greeff, 1888;
C. henneguyi Fabre-Domergue, 1889; C. praestans Pe-
nard, 1922 (ранее в составе Tillina)', C. variabilis F., 1980;
C. distincta (Smith, 1899 in Tillina)', C. cavicola K., 1935
c 2 подвидами (= Repoma spiralis)', C. tripartita K.,
1931; C. irregularis K., 1931; C. reniformis K., 1931;
C. ovinucleata F., 1980; C. orientalist., 1993; C. minima
(Alekperov, 1985 in Tillina)', C. magna (Gruber, 1879 in
48 Зак. №4163
754
ALVEOLATA
Рис. 348, a. Colpodea, Phacodiniida.
Paracondylostoma cavistoma subsp, oligostriatum (A—Г)\ Bursaridium pseudobursaria (Д, Л); Balantidioides dragescoi (E—И); «Transitella» corbifera (X); Para-
condylostoma setigerum subsp. chlorelligerum (M). (По: Foissner, 1993 Щ—I-Су, Foissner, Kreutz, 1998 (A—Г,Л, M)).
Fig. 348, a. Colpodea, Phacodiniida.
Tillina-, тип рода Tillina)', C. grandis (Smith, 1899 in Tilli-
na)-, C. gigantea (Dragesco, 1972 in Tillina)', C. bifurcata
Alekperov, 1993; C. formisanoi Foissner et al., 2002;
C. brasiliensis Foissner, 2003 (вид с постоянным мукоз-
ным покровом).
В этом списке приводятся типовые виды 4 родов,
не признаваемых Фойсснером; название одного из них
(Tillina) пригодно как валидное, если род разбить на
подроды по степени скручивания тела. Один из видов
здесь выделяется в новый род Relicolpoda.
Relicolpoda Jankowski
gen. n.
Типовой вид Colpoda elliotti Bradbury et Outka,
1967; вид переописан рядом авторов. Очень мелкие
кольподы (20—30 мкм) с небольшим числом кинет,
без предротового желобка на левой стороне тела; зад-
няя половина тела, особенно постерон с обеих сторон,
с зубцевидными или удлиненными шиповидными вы-
ростами кортекса.
Paracolpoda Lynn, 1978
Типовой вид Colpoda maupasi Enriques, 1908;
также Colpoda steinii Maupas, 1883; C. aspera Kahl,
1926; C. elliotti Bradbury et Outka, 1967. Род предложен
Линном в диссертации и в опубликованном тезисе (в
Dissertation Abstracts, с укзанием типового вида и спис-
ком видов, но без диагноза). Фойсснер в течение ряда
лет пользовался этим названием (Foissner, 1984с), но в
монографии кольподид (Foissner, 1993) свел Paracol-
poda в синонимы Colpoda. Как и многие некрупные
виды кольпод, тип рода не имеет правостороннего
предротового желобка; положение фрагментов в рото-
вых полосах типичное для кольпод — по диагонали в
левой полосе, дугами продольно в правой. Вероятно,
нет основания для валидации рода, но название можно
использовать как подрод для видов без желобка (под-
роды Colpoda, Paracolpoda, Tillina).
ТИП CILIOPHORA. КЛАСС COLPODEA
755
Рис. 348, б. Colpodea. (По: Foissner, 1993).
Jaroschia sumptuosa (A—Г)', Notoxoma sigmoides (Д, E); Tectohymena terricola (Ж, 3); Puytoraciella dibryophryis (И—Л).
Fig. 348, 6. Colpodea.
Род Repoma Novotny, 1971
Типовой вид R. spiralis. Как и предыдущий
род, предложен в диссертации и в тезисах в Dissertati-
on Abstracts, по Аэшт, датируется 1970 г., по Фойс-
снеру (Foissner, 1993), —1971 г. Это вид из дупла де-
рева (tree-hole) с юго-запада США. Предполагалась
статья об этом роде, но он был описан позже как Col-
poda spiralis Novotny, Lynn et Evans, 1977; Фойсснер
свел вид в синонимы валидного вида кольподид С. са-
vicola Kahl, 1935. Итак, род и вид Новотного нева-
лидные. По Фойсснеру, С. cavicola адаптирована к
дуплам деревьев, это не почвенно-моховой вид,
как все другие кольподы; предротовой шов короткий,
ротовая полость почти под апексом; четко выражен
желобок с видоизмененной цилиатурой; обе ротовые
полосы удлинены и изогнуты, дуговидные. Автор рода
предполагал, что в обеих полосах фрагменты кинет
расположены поперек (ступеньками), и рисует такие
ряды, как основной родовой признак, но на фотогра-
фиях Фойсснера во внутренней полосе положение ки-
нетосом в неясных продольных рядах. У Repoma в бук-
756
ALVEOLATA
Рис. 349, a. Colpodea.
Cyrtolophosis mucicola (A—H)'. Rostrophryides australis (Г, Д); Kuklikophrya (ранее в родах Nassula, Enigmostoma) ougandae (£); Etoschophrya oscillaloriophaga
(Ж); Rostrophrya regis (3). (По: Foissner, 1993 (А—Д, 3); Dragesco, 1972 (£); Foissner et a!., 2002 (Ж)).
Fig. 349, a. Colpodea.
кон погружена также группа правых кинет, этого нет у
С. cucullus. Еще одна особенность Repoma — наличие
специализированного участка кинетома ниже буккона,
со сгущением кинетосом в сближенных рядах. В итоге
Repoma можно считать валидным подродом кольпод
или синонимом рода или подрода Tillina. Название
предложено в тезисах, но, как и предыдущее, отклоня-
ется Аэшт не по этой причине, а ввиду синонимии с
Colpoda.
Род Pseudocolpoda llowaisky, 1921
Типовой вид Р. cochlearis cienkowskii (с двой-
ным видовым названием). Иловайский не цитирует
нужной литературы — до него такие формы много-
кратно описывали в составе родов Colpoda и Tillina.
В сущности, это описание типичной Т. magna Gruber,
1879 — очень крупной кольподы с большим числом
кинет и скрученным телом.
ТИП CILIOPHORA. КЛАСС COLPODEA
757
Рис. 349, б. Colpodea. (По: Foissner, 1993).
Semiplatyophrya foissneri (A, 5); Woodruffia australis (B—E); Rostrophrya terricola (Ж—И)', Pseudochlamydonella rheophila (K—H).
Fig. 349, 6. Colpodea.
Род Tillina Gruber, 1879
Типовой вид T. magna — крупный вид (150—
400 мкм) с полимеризацией кинет (около 140 рядов);
много микронуклеусов, что нетипично для кольподид.
Тело скручено, что особо четко видно у плавающих
особей; предротовой желобок широкий и глубокий,
идет по спирали; сзади дорсально тело выпуклое в
зоне вакуоли; вакуоль имеет около 10 длинных при-
водных каналов, до апекса (поэтому вид Т. canalife-
га — синоним). Полимеризация кинет приводит и к не-
померному увеличению их в левой ротовой полосе;
правая полоса представляет собой гигантское поле ки-
нетосом, сближенных вплотную и не собранных в про-
дольные ряды; местами гранулы соединены в короткие
ряды, расположенные хаотично. В глубоком букконе
на правой стенке около 8 обособленных вестибуляр-
ных кинет.
Tillina несомненно является валидным родом,
как минимум подродом кольпод. Основные призна-
758
ALVEOLATA
Рис. 350, a. Colpodea, Phacodiniida.
Bryometopus hawaiiensis (A—В); B. viridis (= B. sphagni in Groliere, 1977) (Г, Д); Phacodinium metchnikqffi (£—3). (По: Foissner, 1993 (Г, Ду 1994a (Л—B); Dra-
gesco, 1970 (Ж—3); Dragesco, Dragesco-Kerneis, 1986 (£))
Fig. 350, a. Colpodea, Phacodiniida.
ки — наличие кинет вестибулюма, дезорганизация
кинетосом во внутренней полосе, спирализация же-
лобка у постерона. Точный состав рода пока уста-
новить трудно, у части видов, ранее относимых к Tilli-
na, ротовой комплекс не изучен (например, у Т. gigan-
tea Dragesco, 1972). Пока в составе рода один
(типовой) вид.
Род Apocolpoda Foissner,
1993
Типовой вид A. africana по монотипии. Не-
крупный вид кольподид (35—50 мкм); число кинет не-
велико, кинетом и аргиром типичные для семейства;
нет желобка со специализированной цилиатурой, име-
ющегося у Repoma, Tillina и крупных кольпод. Пери-
стом почти продольный, с 3 полосами кинет типично-
го строения — с попречными и нечеткими продольны-
ми рядами кинетосом. Рот удален от предротового
шва, над ртом начинается поперечный ряд с тесно
сближенными кинетосомами, идущий к килю и пере-
ходящий на левую сторону под навесом (килем)
кортекса. Вестибулюма с кинетами нет. Парные кине-
тосомы окружены кольцами мукоцист.
Род Corticocolpoda Foissner,
1993
Типовой вид С. kaneshiroae по монотипии;
найден на стволах деревьев на Гавайях; очень близок к
Kuehneltiella по форме тела и кинетому, крупный вид
со сложным рельефом тела, большим числом кинет и
большим вестибулюмом. В отличие от названного
рода и других кольподовых, в левой ротовой полосе
кинетосомы собраны в двойные (парные) пектинеллы,
имитирующие мембранеллы спиротрих. Более типич-
на для кольподид полоса из многих коротких тесно
сближенных монокинет.
ТИП CILIOPHORA. КЛАСС COLPODEA
759
Рис. 350, б. Colpodea. (По: Foissner, 1993).
Cyrtolophosis mucicola (Л); Trihymena terricola (Б—Д); Kreyella minuta (Е—И); Thylakidium pituitosum (K—My, Pseudokreyella terricola (H).
Fig. 350, 6. Colpodea.
Род Krassniggia Foissner, 1987
Типовой вид К. auxiliaris, массивные формы
(160—250 X 110—200 мкм) из почв и лесной подстил-
ки в Африке и Австралии — вид с «гондванским ареа-
лом», вероятно обитающий и в южной Америке. Тело
очень широкое, с полимеризацией кинет, глубоким
предротовым желобком; ресничные полосы у рта ти-
пичного строения, очень мелкие для столь крупного
вида; это компенсируется образованием гигантского
вестибулюма с вершинами большого числа кинет, ши-
роко открытого и продолжающегося в виде желобка.
Это активный хищник, заглатывающий других цилиат.
Ядро некрупное, округлое; вакуоль без каналов. В до-
полнение к ротовой воронке, специализированы со-
макинеты (перикинеты) на поверхности тела у ворон-
ки — кинетосомы в них сближены вплотную.
Род Bresslaua Kahl, 1931
Типовой вид В. vorax Kahl, 1931, хищный вид
из почвы и мхов, с узкой верхней частью тела и резко
расширенной нижней; рот с типичными полосами ки-
нетосом, лежит на дне крупной полости, в которую с
двух сторон входят сомакинеты. Топография кинет в
вестибулюме у этого рода и Tillina не совпадает. Нет
желобка, уходящего на левую сторону тела, но слева
760
ALVEOLATA
имеются специализированные участки 10 кинет со
сближением кинетосом. Вакуоль с длинными узкими
каналами. Вид легко узнать по обширной светлой ро-
товой воронке, остальная часть тела темная, с вакуоля-
ми. Фактически у Bresslaua тройная ротовая цилиату-
ра — полосы тесно сближенных кинетосом, вестибу-
лярная и предвестибулярная на правой стороне тела.
У В. insidiatrix Claff, Dewey et Kidder, 1941 воронка
в виде обширной внутренней полости; вид легко раз-
водится на Glaucoma', В. sicaria С., D. et К., 1941 — на
дрожжах и на Colpoda', В. dissimilis Alekperov, 1985 —
либо очень плохо описанный вид, либо не относится к
этому роду; у типичных Bresslaua вестибулюм шире,
нет трубчатой глотки.
Род Kuehneltiella Foissner, 1990
Типовой вид К. terricola. Тело широкое, меш-
ковидное, с гигантской вестибулярной воронкой на
правой стороне; слева открыта ее верхняя часть, ниже
идет ребровидный край тела. Фактически предротовой
желобок расширен до крайних размеров и продолжает-
ся на левой стороне тела. На внутренних стенках вес-
тибулюма вершины большого числа сомакинет. Имп-
регнация по Шаттону выявляет весь аргиром, это ме-
шает видеть внутренние ряды; при импрегнации
карбонатом серебра («испанский метод») аргиром не
выявляется, очень четко видны внутренние ряды и
2 полосы у рта; левая полоса типичная для кольпод, с
поперечными рядами фрагментов, а правая, вероятно,
почти редуцирована до 1 ряда парных кинетосом. При
укрупнении воронки рот смещается ниже экватора.
Хищный вид из почв Австралии. Второй вид К. musci-
cola Foissner, 1993 — из почвы в Германии, с меньшим
числом кинет.
Род Cosmocolpoda Foissner, 1993
Типовой вид С. naschbergeri из почв Коста
Рики. В пробах почвы, мха и листового опада с матери-
ков, ранее составлявших единый континент Гондвана,
находят много видов и родов кольподид, отсутствую-
щих в Европе. Тип рода — аберрантный вид с почти
продольными, слегка изогнутыми кинетами; ряды не-
многочисленные, удалены один от другого, между ря-
дами множество поперечных ребер, соответствующих
коннективам аргирома. Ротовая полость очень мелкая,
почти у апекса. 2 полосы у рта (поликинеты) типично-
го строения; вестибулюма нет; предротовой шов уко-
рочен. Края тела зубчатые, постерон резко расширен,
правые кинеты не продолжаются на левую сторону
тела. Рельеф кортекса хорошо виден в электроскане.
Род Idiocolpoda Foissner, 1993
Типовой вид I. pelobia из ила высохшей реки
на Гавайях. Мелкий вид с небольшим числом кинет;
рот смещен на левую сторону тела, лежит на дне про-
дольного желобка; у рта 2 мелкие полосы типичного
для кольпод типа; на дне и верхнем крае желобка
2 ряда тесно сближенных дисом. Выше этого необыч-
ного желобка прямые сомакинеты, ниже немного раз-
розненных дисом остальных кинет. От кинетосом двух
рядов желобка отходят назад длинные фибриллы. Фак-
тически в состав ротовой цилиатуры включены кинеты
желобка и сомакинеты выше рта.
Род Dragescozoon Foissner, Agatha
et Berger, 2002
Типовой вид D. terricola F., A. et B., 2002 из
почвы в Бенине (западная Африка). Тело мелкое, поч-
ковидное, с небольшим перистомом, апикальным яд-
ром; 10 кинет разрежены, на левой стороне тела мало
кинетосом; над ртом несколько коротких перикинет.
Двойные реснички только у вершины тела. Ротовая ци-
лиатура рудиментарная — короткий прямой ряд дисом
справа и поперечный ряд из 5 мелких пектинелл слева.
Аргиром — длинные поперечные фибриллы между
редкими сомакинетами.
Род Pseudomaryna Foissner, 2003
Типовой вид Р. australiensis. Тело широкое,
бобовидное, немногочисленные кинеты разрознены,
широкий шов (секанта) смещен вправо; ядро апикаль-
ное, что редко у кольподид. Все кинеты с дисомами, но
в нижней трети тела только одна кинетосома несет
ресничку. Перикинеты немногочисленные, не сближе-
ны в компактную полосу над ртом. Перистом неболь-
шой, смещен чуть ниже экватора; в правой ресничной
полосе поле дуговидных кинет со сложной топогра-
фией кинетосом; левая полоса мелкая, короткая, из не-
скольких пектинелл. Все тело покрыто мукоидным
слоем с частичками ила.
Сем. Exocolpodidae Foissner, Agatha
et Berger, 2002
По всем признакам типичные кольподовые, но де-
ление не в цистах, а в свободном состоянии, томонты
плавают. Вероятно, ранг семейства завышен, это ско-
рее подсемейство кольподид, если оно вообще нужно.
Род Exocolpoda Foissner, Agatha
et Berger, 2002
Типовой вид Colpoda augustini Foissner, 1987
(E. augustini). Мелкие микрофаги e небольшим кони-
ческим вестибулюмом; выше — четкая система пери-
кинет в виде продольной полосы вершин рядов с тес-
ным сближением кинетосом. Левая ротовая полоса
изогнутый ряд четких линий кинетосом (пектинелл);
правая зона видоизменена, вместо ряда или узкой по-
лоски видны 3 продольные линии с разной топогра-
фией кинетосом. Аргиром сетчатый. Циста с массив-
ной наружной оболочкой, эктоцистой, в толще кото-
рой замечены симбионтные бактерии. Деление не в
цистах, это главный признак нового рода и семейства.
ТИП CILIOPHORA. КЛАСС COLPODEA
761
Сем. Hausmanniellidae Foissner, 1987
Виды разной формы, с узким или широко открытым
перистомом; общий признак — левая полоса фрагмен-
тов кинет остается мелкой, как у кольподид; правая по-
лоса у кольподид меньше левой, у родов данного се-
мейства равна или обычно длиннее левой полосы.
Род Hausmanniella Foissner, 1984
Типовой вид Colpoda discoidea Gellert, 1956;
тело широкое, ядро мелкое, вакуоль без каналов; пред-
ротовой шов короткий, перистом в виде небольшой во-
ронки. Нет четкого ресничного желобка, ведущего к
перистому. Левая полоса фрагментов кинет хорошо
видна прижизненно, выдается за край воронки; правая
полоса в виде поля бепорядочно расположенных кине-
тосом огибает верхнюю внутреннюю стенку полости,
густая цилиатура полосы также видна у живых особой;
правая полоса не короче левой. У Н. patella (Kahl, 1931
in Colpoda) воронка широко открытая, четко видны
обе полосы и узкая ротовая щель на дне перистома;
вид Н. quinquecirrata (Gellert, 1955 in Colpoda) пока не
изучен.
Род Bresslauides Blatterer et Foissner,
1988
Типовой вид В. australis, хищники с гигант-
ским, широко открытым перистомом, к которому ве-
дет 'Очень широкий желобок; сомакинеты входят в по-
лость желобка. Верхняя часть тела кажется смятой,
складчатой; желобок продолжается на левой стороне.
Левая поликинета стандартная, в глубине перистома;
правая удлинена вдоль дна и верхней стенки полости,
значительно длиннее левой части, изогнутая, посте-
пенно сужается к концу.
В. discoideus (Kahl, 1931 in Bresslaua) — вид с еще
большим увеличением перистома, фактически вся
верхняя половина тела занята гигантской полостью;
размеры особей до 400 мкм. Особо удлинена правая
полоса кинетосом в виде монокинеты, часть ее у рта —
треугольное поле кинетосом. В перистоме сложней-
шая система сомакинет. У В. terricola (Foissner, 1987 in
Bresslaua) правая поликинета особо удлинена, слож-
ной формы; вздутый антерон нависает над полостью
перистома.
Род Anictostoma Foissner, 1993
Типовой вид A. grelli — крупный вид с узким
телом, веретеновидным или цилиндрическим, кинеты
почти продольные, слегка изогнутые, олигомеризо-
ваны; практически нет воронки, перистом в виде
овальной апикальной площадки со щелевидным про-
дольным ртом. Левая полоса короткая, из 8 кинет; пра-
вая в несколько раз длиннее, огибает края перистома,
состоит из поля кинетосом. Предротовой шов корот-
кий, антерон сужен. Вдоль кинет окраска выявляет
группы экструсом.
Род Corallocolpoda Alekperov, 1991
Типовой вид С. pacifica из кораллового песка
о-ва Рождества в Океании. Крупный вид с широким те-
лом; перистом поверхностный, без воронки и предро-
тового желобка, у нижнего края с короткой широкой
левой полосой, правая огибает дугой края и вершину
перистома. К правой полосе подходят вершины сома-
кинет с конденсацией кинетосом в каждой. По Алекпе-
рову, род близок к Hausmanniella.
Фойсснер в монографии кольподид (Foissner, 1993)
описывает такой же вид, как Anictostoma terricola Fois-
sner, 1993 из почвы пустыни в Африке (Кения) и из
Сингапура, признает его идентичным с видом Алекпе-
рова (статья была им получена, когда менять набор
книги уже было нельзя) и сводит предыдущий род
Anictostoma в синонимы валидного рода Corallocolpo-
da. Позже (Foissner et al., 2002) Фойсснер справедливо
отрицает «слишком поспешную» синонимизацию этих
родов — ведь с видом Алекперова идентичен не типо-
вой вид A. grelli с совершенно иным планом строения.
Более того, виды A. terricola и С. pacifica считаются те-
перь не-таксономическими морфами рода Hausmanni-
ella. Итак, род Anictostoma валидный и монотипиче-
ский, род Corallocolpoda — синоним, одна из морф в
жизненном цикле Hausmanniella.
Род Kalometopia Bramy, 1962
Типовой вид К. perronnei из мхов; размеры
тела до 250 мкм, рот сдвинут далеко вниз к экватору,
кинеты полимеризованы, предротовой шов резко уд-
линенный, дуговидный; кинеты огибают обширную
открытую воронку и идут концентрически на ее стен-
ке, уменьшаясь в размере; ядро необычное, из 7 мел-
ких разрозненных сфер. Над ртом показана мелкая по-
лоса, вероятно левая поликинета.
К. dupliata (Penard, 1922 in Glaucoma) (= Colpoda
eurystoma Gellert, 1950) — вид с цельным ядром и вы-
ступом тела слева, характерным для кольподид и от-
сутствующим у К, perronnei. Полоса R несколько длинней
левой поликинеты, узкая у рта; над ртом вторичная ро-
товая цилиатура — концентрические сомакинеты. Ри-
сунки Фойсснера (К. duplicate) очень напоминают вид
К. perronnei', возможно это один вид, а не два.
Род Avestina Jankowski, 1980
Типовой вид Colpoda acuta Buitkamp, 1977.
Мелкий почвенный вид с быстрым движением (другие
кольподы плавают медленно), веретеновидным телом,
с крайней олигомеризацией кинет — на венте 8 рядов,
кинетосомы разрознены ниже рта, сближены в 3 рядах
над ртом. Перистом поверхностный, без воронки, сни-
зу полоса L; полоса R в виде тонкой дуги по краю пе-
ристома. Родовое название значит «без вестибулюма»
(a-vest). По Фойсснеру, возможна синонимия этого
вида и A. ludwigi Aescht et Foissner, 1990 — это вид
сходной формы, с дуговидной правой диплокинетой и
коротким рядом фрагментов в левой полосе; над ртом
3 соматические диплокинеты. Питание грибками.
762
ALVEOLATA
Сем. Marynidae Poche, 1913
Рот сдвинут далеко вниз, почти к заднему концу
тела. Фойсснер обозначает часть тела над ртом терми-
ном calix, ниже рта uvula. Раньше м аринид ориентиро-
вали постероном вверх, и до 1950-х гг. их системати-
ческое положение было неясным; Гелей (Gelei, 1950)
правильно ориентировал маринид и выявил их тесное
родство с кольподами. Полосы у рта почти равны по
длине, нет аллометрии правой полосы. Обитатели поч-
вы и пресных вод.
Род Maryna Gruber, 1979
Типовой вид М. socialis — обитатели длин-
ных одиночных или ветвящихся слизистых толстостен-
ных трубок; трофонты на вершине трубки, постерон об-
ращен наружу. Этот вид пока не изучен, но виды рода
однотипны, и строение кинетома можно иллюстриро-
вать на примере М. ovata. Тело цилиндрическое, постерон
резко сужен, длинный послеротовой шов маркирован
фибриллами (выявляются при импрегнации серебром,
не протарголом). Фойсснер различает продольные
правые и дорсальные кинеты, ко шву под углом подхо-
дят левые кинеты, у обособленной нижней части тела
поперечное кольцо тесно сближенных послеротовых
кинет и с дорсальной стороны на нижнем выступе про-
дольные «миктеральные» кинеты. Переориентация ки-
нетосом из продольных рядов в поперечные кольцевые
паратены усложняет картину кинетома. Перистом об-
ращен вниз, глотка вверх, но особи в трубках перевер-
нуты. Перистом при сдвиге меняет ориентацию, поло-
сы меняются местами — полоса с фрагментами кинет
правая, дуга с полем кинетосом левая. Род включает
значительное число видов (включая неизученные по-
вторно): М. umbrellata (Gelei, 1950 in Mycterothrix);
M. galeata G., 1950; AT. cardioides (G., 1950 in Mycteroth-
rix)', M. atra (G., 1950 in Mycterothrix)', M. pinguis Din-
gfelder, 1962; M. hyalina D., 1962; M. lichenicola (G.,
1950 in Mycterothrix)', M. antarctica Foissner, 1993;
M. acuminata (Gellert, 1955 in Mycterothrix)', M. socialis
Gruber, 1879 (типовой вид); M. rottalensis (Baumeister,
1943 in Mycterothrix)', M. ovata (Gelei, 1950 in Mycteroth-
rix)', M. rotunda D., 1962; M. grisea G., 1950; M. longi-
nucleata D., 1962; M. minima (G., 1950 in Mycterothrix).
В монографии цилиат Намибии (Foissner et al., 2002)
подробно переописаны M. lichenicola, М. umbrellata,
М. minima и открыт новый вид М. namibiensis.
Все виды рода обитают в трубках, или такое оби-
тание предполагается; трубки короткие или вытяну-
тые, у типового вида ветвящиеся. Особое место зани-
мает вид М. antarctica из мхов в Антарктике — диффе-
ренцировка 2 отделов тела не столь резкая, как у
многих других видов; обе полосы в традиционном
положении — левая снизу, правая над ней; перистом
не повернут вниз, открыт влево; нет полосы скру-
ченных кинет на границе с суженной нижней частью
тела. Род должен быть подразделен минимум на 2 под-
рода.
Род Mycterothrix Lauterborn, 1898
Это замещающее название для гомонима Trichor-
hynchus Balbiani, 1887. Типовой вид для обоих
родов Т. tuamotuensis Balbiani, 1887; второй вид М. ег-
langeri (Lauterborn, 1898). Точного переописания ви-
дов нет, рисунки у прежних авторов различаются, ряд
определений неправильные. Трофонты живут в чаше-
видных мукозных раковинках, вероятно не прикреп-
ленных к субстрату, и в прикрепленных трубках; деле-
ние в цистах; прикрепление ко дну раковины длинной
ресничкой антерона; сзади на постероне пучок непро-
порционально длинных ресничек, вероятно способст-
вует питанию. Перистом мелкий, положение, как у
Maryna. Топография ресничных полос у рта неизвест-
на. Название вида (с о-вов Туамоту) не означает энде-
мизма, вид находили в Париже.
Род llsiella Foissner, 1987
Типовой вид I.venusta Foissner, 1987, также
I. palustris Foissner, 1993. Неприкрепленные формы,
подвижные, без секреции мукозных трубок; рот сме-
щен к постерону, где обособлено незначительное взду-
тие тела; каудальные реснички не в пучке, не удлине-
ны; место сдвига рта видно при импрегнации по Шат-
тону (маркировано сетью фибрилл); вакуоль у
перистома. Кинеты дуговидные, продольные, но кине-
тосомы рядов по всему телу переориентированы в по-
перечные кольцевые ряды — паратены. Ротовая зона
(перистом) неглубокая, окаймлена тонкой дуговидной
левой поликинетой типичного строения и с другой
стороны тонкой дикинетой равной длины. При виде
снизу сомакинеты огибают рот и уходят к бисекантно-
му предротовому шву, растянутому на всю длину тела.
Род Opisthostomatella Corliss, 1960
Типовой вид Opisthostomum bengalensis Ghosh,
1928. Замещающее название для рода Opisthostomum
Ghosh, 1928 (гомоним). Род отнесен к гетеротрихам по
наличию зоны мембранелл у рта, но это типичные Ma-
rynidae со сдвигом рта вниз и вздутым постероном. За
полосу мелких мембранелл приняты двойные реснич-
ки тела и цилиатура перистомальных полос. Вид по-
вторно не найден и остается неизученным.
Сем. Bardeliellidae Foissner, 1994
Мелкие овальные формы с продольным перисто-
мом и гиперразвитием левой ротовой поликинеты.
Род Bardeliella Foissner, 1984
Типовой вид В. pulchra. Тело овальное, вели-
чиной 25—35 мкм, рот сдвинут к нижней трети тела,
глотка короткая. Перистом целиком поверхностный,
без вестибулюма, с узкой дугой (полоса R) справа и не-
пропорционально крупной, растянутой до апекса по-
ТИП CILIOPHORA. КЛАСС COLPODEA
763
лосой L типичного строения, из поперечных фрагмен-
тов кинет. Число фрагментов не соответствует числу
кинет, и полоса теряет связь с соматической цилиату-
рой, становится самостоятельной органеллой. Правее
полосы R — кинета со сгущением кинетосом, осталь-
ные ряды продольные, реснички в поперечных кольце-
вых линиях (паратенах). Фактически имитируется зона
мембранелл спиротрих; реснички сегментов в полосе
L соединены в одну мембрану, короче соматических
ресничек; полоса имеет вид тесной пластинки из мно-
жества таких мембран.
Сем. Grandoriidae Corliss, 1960
Замещающее название для Centrosomatidae Grando-
ri R. et Grandori L., 1934 (нет рода с названием Centro-
soma'} и Lagenellidae G. et G., 1935 (название Lage-
nella — гомоним). Мелкие кольподиды с овальным
телом; рот смещен ниже экватора, сохранился предро-
товой шов; на дорсуме 6 слегка спиральных кинет, на
венте ряды огибают рот и уходят к суженному посте-
рону, несущему пучок склеенных ресничек такой же
длины, как тело.
Род Grandoria Corliss, 1960
Типовой вид Lagenella aculeata Grandori R. et
Grandori L., 1934. Замещающее название для гомонима
Lagenella G. et G., 1934. С диагнозом семейства; очень
плохо описанный вид, пока можно лишь догадываться,
что это кольподида. Не следовало давать новое назва-
ние*роду и семейству, нужно было оставить в списках
недостоверных таксонов (Incertae sedis).
Отряд Grossglocknerida Foissner, 1980
Первоначально предложен как подотряд кольпо-
дид; с повышением ранга кольподовых до класса по-
вышен и ранг гроссглокнерид до отряда. Включает
формы с простой соматической цилиатурой, упрощен-
ной ротовой цилиатурой; нет 2 полос (поликинет)
у рта, имеющихся у всех родов отряда Colpodida. Пи-
тание с помощью узкой ротовой трубки — трофон-
ты прокалывают добычу, высасывая содержимое клетки.
Соматические кинеты в эволюции редуцируются, от
них остаются лишь небольшие фрагменты. Деление в
цистах; кинеты распрямляются и образуют у вершины
небольшие группы кинетосом рудиментарной ротовой
цилиатуры. У кольподид и данного отряда стоматоге-
нез меротелокинетального типа, у всех последующих
отрядов класса — плейротелокинетального типа. Оби-
татели почвы и террофитона (лишайников, мхов).
Сем. Grossglockneriidae Foissner, 1980
С диагнозом отряда. Включает несколько родов
с сосущим ротовым аппаратом, питающихся дрож-
жевыми клетками и мелкими грибками, обильными
в почве.
Род Grossglockneria Foissner, 1980
Типовой вид G. acuta', также G. hyalina F., 1985
и G. ovata F., 1999. Подробно изучено строение, пита-
ние, морфогенез в цистах и сложная ультраструктура
ротовой трубки. Цилиатура полная, кинеты слегка
спиральные, немногочисленные, биполярные, подхо-
дят к постерону и небольшому предротовому шву; ки-
нетосомы расположены парами, аргиром типичный
для кольпод. Тело каплевидное, заострено к апексу;
на левом краю спереди очень мелкий участок ротовой
зоны — небольшая ротовая трубка у основания окруже-
на полукольцевой мембраной, ниже трубки пекти-
нелла с 2 рядами по 3 кинетосомы в основании. Веро-
ятно, это видоизмененные полосы поликинет кольпо-
дид, правая (мембрана) и левая (пектинелла). Реснички
обеих органелл очень короткие, в несколько раз ко-
роче соматических; это характерно для тигмокинет
разных групп цилиат. Ядро в центре, с плотно приле-
гающим микронуклеусом. Кортекс ребристый, меж-
кинеты выпуклые, с множеством беспорядочно рас-
положенных мукоцист под пелликулой. Мукоцисты
мешают импрегнации протарголом, чернятся, этих
цилиат лучше изучать испанском методом серебрения.
Деление бинарное в цистах; есть и цисты покоя.
В электронном микроскопе трубка состоит из ради-
альных септ — тонких изогнутых полос микротубул,
дуговидных на поперечном срезе, с очень узким осе-
вым каналом; между септами рассеяны мелкие экст-
русомы.
При специальном изучении спектра возможной
пищи в культурах основной пищей признаны грибки
3 видов — Mucor mucedo (плесень), неопределенный
вид Мисогасеае и Aspergillus sp.; отвергаются бакте-
рии, флагеллаты, инфузории (включая почвенных
кольпод) и многие роды и виды грибков, включая Peni-
cillium. Хоботком прокалывается стенка спор и гифов
грибков. Род не встречается в пресной воде, только в
почве. У G. hyalina разрежены кинетосомы по ходу ря-
дов, в остальном виды однотипные.
Род Pseudoplatyophrya Foissner,
1980
Типовой вид Platyophrya папа Kahl, 1926. Тело
очень мелкое, тонкое, плоское, со значительной редук-
цией кинетома, остались лишь сегменты нескольких
кинет; сзади каудальная ресничка длиннее тела; у ядра
гигантский микронуклеус. Ротовая зона с дуговидной
мембраной и квадратным основанием пектинеллы, с
мелкой сосущей трубкой (хоботком). Тело гибкое, ме-
таболичное; у следующего рода кортекс прочный.
3 вида — Р. папа, Р. terricola, Р. saltans. Типовой вид
рода Р. папа столь же хорошо изучен, как и типовой
вид рода Grossglockneria. Питание дрожжами; трубка
становится воронковидной, через 10—20 мин после
прикрепления стенка дрожжевой клетки разрывается,
содержимое перетекает в хищника, в цитоплазме обра-
зуется крупная вакуоль, трофонт отделяется от пустой
оболочки дрожжей; далее он инцистируется и в зави-
симости от условий образует цисту покоя или деления
с выходом 2—4 теронтов.
764
ALVEOLATA
Род Mykophagophrys Foissner, 1995
Типовой вид Pseudoplatyophrya terricola F.,
1985. После публикации монографии кольподид Фойс-
снер выделил новый род для одного из видов предыду-
щего рода; отличительный признак — почти полная
цилиатура, правильная сеть аргирома между рядами.
Правее рта укорочены 2 ряда, на плоской левой сторо-
не кинетосомы разрежены, сзади крупный ацилон;
поры мукоцист в правильных рядах между кинетами.
Вид Р. saltans при дроблении рода Pseudoplatyophrya
оказывается видом неопределенного положения —
имеет обширный ацилон сзади, укорочены все ряды,
кроме одного, несущего каудальную пару ресничек.
Род Fungiphrya Foissner, 1999
Типовой вид F. strobli F., 1999. Почвенные ми-
кофаги из южной Африки. Мелкие плоские особи с
полной цилиатурой; перистом на правой стороне тела.
Правая ротовая полоса в виде длинной дуги из 2 па-
раллельных рядов кинетосом, левая — диагональная
полоса из 5 и более пектинелл. Рот на вершине узкой
короткой трубки, питание высасыванием добычи.
У кольподид часто видны лишь мельчайшие муко-
цисты, у Fungiphrya экструсомы 2 типов — мелкие у
ресничек и крупные в сплошных рядах под кортексом.
Аргиром кольподидного типа.
Род Nivaliella Foissner, 1980
Типовой вид N. plana. Очень мелкий вид
(10—25 мкм) с прочным кортексом, тело постоянной
формы, не метаболичное, короткое и широкое при
виде сбоку, с небольшим числом кинет. Кинетом реду-
цирован, в основном сохранены передние пары кине-
тосом, удлинены лишь 2 ряда, один из которых несет
пару каудальных ресничек. Аргиром сохраняет вид
правильной сети, несмотря на отсутствие кинет и ки-
нетосом в значительной части тела. Ротовая цилиатура
(ставшая тигмотактической у видов семейства) и хобо-
ток обычного типа.
2 следующих рода включают плохо описанные
виды, несомненно этого семейства, и приведены по ли-
тературе как приложение к 3 указаным выше досто-
верным, тщательно изученным родам.
Род Pseudoglaucoma Wenzel, 1953
Типовой вид Pseudoglaucoma muscorum Kahl,
1931. Каль предложил род Pseudoglaucoma Kahl, 1931
для 2 видов (J3, muscorum, Р. labiatus) без обозначения
типа; такие роды до 1931 г. валидны, но начиная с ян-
варя 1931 г. по правилам номенклатуры невалидны.
Венцель (Wenzel, 1953) указал типовой вид и привел
род как Pseudoglaucoma gen. п. Не заметив этого, Кор-
лисс (Corliss, 1979) вторично указал Р. muscorum как
типовой вид рода Pseudoglaucoma Kahl, 1931; здесь
двойная ошибка — второе обозначение невалидно, и
род не может сохранять авторство Каля. Другие виды,
отнесенные Калем и последующими авторами к этому
роду, не имеют к нему отношения.
Р. muscorum, по Калю и Венцелю, — мелкий вид с
несколькими продольными кинетами и небольшой уз-
кой треугольной мембраной; за мембрану Каль мог
принять трубку, обычно с расширением у основания;
рельеф пелликулы — явно мукоцисты. Второй вид
рода — Р. digitatum Bhatia, 1936, описанный еще хуже
и неопределимый.
Род Rigchostoma Vuxanovici, 1963
Типовой вид R. membranatum; правая сторона
с несколькими ребрами почти до постерона, без кинет,
левая с большим числом тесно сближенных биполяр-
ных рядов; хоботок в том же участке, что у всех валид-
ных видов отряда. Редукция кинетома справа и обилие
кинет на левой стороне нетипичны для кольподид, и
положение вакуоли в центре тела нетипично для се-
мейства. У этого и предыдущего рода нет каудальных
ресничек. Пока неясно, что видели авторы этих двух
родов.
Отряд Bursariomorphida
Fernandez-Galiano, 1978
(рис. 347, 6—348, а)
В первоначальном варианте Bursariamorphida; этот
таксон был ранее предложен мною как подотряд Bur-
sariina Jank., 1975, но без диагноза и в тезисах, поэтому
не признается валидным. Отряд включает крупные
виды с полимеризацией сомакинет, гигантским пери-
стомом в виде воронки, идущей вниз от расширенного
антерона; сохранены и укрупнены обе поликинеты
кольподид — левая в виде полосы монокинет и правая
в виде дуги или кольца кинетосом; оба ряда начинают-
ся с устья ротовой воронки, левый ряд идет в глубину
до дна воронки (до рта), правый — остается кольцом
на апексе или уходит с вершины вглубь (у бурсарий).
До сих пор рассматривались почвенные виды; не-
сколько видов, составляющих отряд бурсариид, обитают
в толще воды над дном в прудах и небольших времен-
ных водоемах (лужах, канавах), пересыхающих летом.
Размножение в плавающем состоянии, не в цистах.
Сем. Bursariidae Bory de St. Vincent, 1826
Тело мешковидное, перистом роговидный, очень
широкий; левая поликинета вытянута на всю длину
воронки, правая расположена дугой у вершины и
спускается в перистом по вентральной стенке; обе по-
лосы достигают глубоко погруженного рта на дне во-
ронки.
Род Bursaria Muller, 1773
Типовой вид В. truncatella Muller, 1773; указа-
ние Фроментелем (Fromentel, 1874) вида В. decora не-
валидное. Мюллер предложил род Bursaria для 2 ви-
ТИП CILIOPHORA. КЛАСС COLPODEA
765
дов, В. truncatella и В. hirundinella, для инфузории и
водоросли (ныне Ceratium). Раньше к роду Bursaria
приписывали множество видов разных современных
родов и отрядов цилиат (балантидиев, фронтоний и
т. д.), сейчас объем рода ограничен типовым и 2 близ-
кими видами.
В. truncatella — космополитный вид, но, вероятно,
более част в холодных водах; размеры гигантские для
цилиат, до 1 мм и более; разные популяции отличают-
ся по величине и числу кинет (Dingfelder, 1962), и пока
трудно сказать, не является ли вид группой трудно
определимых реальных видов. Тело мешковидное,
расширено апикально, как бы срезано поперек, расши-
ряется и вновь сужается к постерону; ядро лентовид-
ное, микронуклеусы многочисленные; много вакуолей
в беспорядке рассеяны по телу. На вентральной сторо-
не выемка края перистома вниз до экватора. Сомаки-
неты многочисленные, подходят к перистому по всему
его краю, вплотную сближены, спирализованы; ки-
нетосомы по ходу кинет двойные (парные), аргиром
кольподидного типа, но менее правильный, местами в
виде сети аморфных ячеек.
Типовой вид обычно приписывали к спиротри-
хам (гетеротрихам) по наличию полосы мембранелл,
но расположение и структура их нетипичны для спи-
ротрих, и мембранеллы должны иметь поликинету в
основании. Ротовой аппарат бурсарий можно понять
лишь в сравнении с Colpoda — имеются 2 полосы ки-
нетосом, обе гигантские по сравнению с мелкими по-
лосками у рта кольпод. Левая полоса идет широкой из-
витой лентой, постепенно сужаясь, до дна воронки по
ее левой и дорсальной стенке; правая полоса, напро-
тив, шире снизу и, заостряясь, идет от дна вверх по
правой стенке полости, уходит по краю воронки к
дорсальной стенке. Заглатывание добычи у нижнего
конца воронки; это активный хищник, предпочитает
крупных парамеций (Paramecium caudatum)', если их
нет, ест более мелких цилиат и флагеллат. У кольпод
конъюгация наблюдается в редчайших случаях; у бур-
сарий обычна, хорошо изучены процессы реорганиза-
ции ядер. Вид легко инцистируется, цисты с двойной
оболочкой, ровной сферической внутри и с регулярны-
ми складками снаружи, в местах вмятин эктоциста сое-
динена с эндоцистой. Распространение космополит-
ное, но, вероятно, вид более обычен в холодных водах
северных стран. Синоним — В. decora Claparede et
Lachmann, 1859 (трофонт), Bursella oligobursa Gelei,
1954 (постконъюгант или предцистная стадия).
Типовой вид Archiastomata adami Foissner,
1976 по монотипии; крупные каплевидные формы без
перистома с извитым лентовидным ядром, крупной
центральной вакуолью, полимеризацией кинет и мно-
жеством вакуолей по всему телу; выделены в новое
сем. Archiastomatidae Foissner, 1976. Описание основа-
но на предцистной стадии с автофагической вакуолью;
это синоним вида Bursaria truncatella.
В. ovata Beers, 1952 — болеее крупный вид с отно-
сительно узким телом, длинной воронкой перистома;
виды отличимы по типу цист, по спектру пищи — в
моих культурах трофонты этого вида никогда не загла-
тывали виды парамеций, тетрахимен, кольпидиумов и
других цилиат, питаясь как микрофаги, часто заглатывали
зооглеи — слизитые комки с бактериями. Вид в массе
был найден в луже после таяния снега в Петербурге,
где не было других цилиат, в луже с массой цианофит
в Крыму; В. truncatella, напротив, питается в основном
парамециями и без пищи быстро инцистируется.
Размеры тела В. caudata Dragesco, 1972 до 1.5 мм,
боковая вырезка перистома и внутренняя воронка от-
носительно узкая, тело не мешковидное — вытянуто в
длину, неширокое, сильнее сужается от экватора и сза-
ди оттянуто в виде хвоста. Вид описан из Уганды, вто-
рично не изучался (В. tropica пот. п., гомоним).
Сем. Bursaridiidae Foissner, 1993
Объединяет 2 внешне несходных рода с воронко-
видным перистомом, открытым на расширенном апек-
се, как у бурсарий; правая поликинета погружена в по-
лость перистома, левая в перистоме отсутствует (в от-
личие от бурсарий), лежит кольцом по всему
наружному краю воронки.
Род Bursaridium Lauterborn,
1894
Типовой вид В. schewiakowii Lauterborn, 1894;
вид известен только по примитивному рисунку Лау-
терборна; это очень крупная пелагическая цилиата со
слоем длинных мукоцист по всему телу, с альвеоляр-
ной цитоплазмой, вытянутым ядром, длинным узким
извитым перистомом. Для диагноза рода лучше упомя-
нуть другой вид — В. pseudobursaria (Faure-Fremiet,
1924 in Thylakidium) (= В. difficile Kahl, 1927). Тело
расширено у апекса, незначительно сужается к посте-
рону; кинеты многочисленные, продольные. Левая по-
ликинета узкой полосой уходит ко рту, правая состоит
из линии дисом и полосы шириной около 7 кинетосом,
огибающей весь край перистома. На дорсальной стен-
ке воронки — широкая полоса импрегнируемых фиб-
рилл, связанных с левым рядом стомокинет. Активные
хищники, заглатывают флагеллат и цилиат.
В. patulum (Dujardin, 1841 in Bursaria), В. vitreum
Lepsi, 1960 и В. chlorostigma Stein, 1878 — неопреде-
лимые виды; часть из них имеет зоохлореллы, отсут-
ствующие у типового вида.
Род Paracondylostoma Foissner,
1980
Типовой вид Р. setigerum; некрупные узкие
формы длиной 70—90 мкм с округлым ядром, субме-
диальной вакуолью; кинеты многочисленные, про-
дольные; аргиром сложнее, чем у кольподид, — пары
кинетосом не изолированы кольцевыми фибриллами,
вдоль кинеты идет сплошная полоса аргиронем. Рото-
вая полость занимает весь апекс, ведет в воронку, бы-
стро сужающуюся к экватору; от незначительной вы-
резки ее стенки ко рту идет левая поликинета (полоса
фрагментов кинет), весь край воронки окружен сход-
ной полосой фрагментов в виде замкнутого кольца
(правая поликинета кольподид). Второй вид Р. cavisto-
та (Gelei, 1954 in Cyrtolophosis).
766
ALVEOLATA
Отряд Sorogenida Foissner, 1985
Мелкие формы с почти продольными кинетами,
апикальным ртом, без вестибулюма с сомакинетами, с
небольшими поликинетами у рта — имитация просто-
мат. Жизненный цикл сложный и необычный; при до-
статочном количестве пищи деление не в цистах, мо-
гут образоваться цисты покоя; при отсутствии пищи
цилиаты собираются в группы, покрываются оболоч-
кой, выделяют застывающее вещество; сороген подни-
мается над водой на стебельке, превращается в соро-
карп — многоклеточное плодовое тело; трофонты экс-
цистируются из сороцист и приступают к питанию.
В диагнозе отряда Фойсснер (Foissner, 1993) подчерки-
вает особый тип ядерного аппарата — у кольподид
микро- и макронуклеус окружены общей оболочкой, у
сорогенид ядра не объединены, такие же как у других
цилиат. Морфологически по всем признакам, включая
ультраструктуру, сорогены близки к Cyrtolophosis
(отряд Cyrtolophosidida); молекулярный анализ ДНК
(Lasek-Nesselquist, Katz, 2001) показал близость к цир-
толофозидидам Platyophrya vorax, а также близость
кольподид и нассулид и вероятный дифилетизм коль-
подовых — ветвь Platyophrya + Sorogena обособлена
от остальной группы родов.
Сем. Sorogenidae Bradbury et Olive, 1980
(рис. 347, a)
С диагнозом отряда.
Род Sorogena Bradbury et Olive, 1980
Типовой вид S. stoianovichae В. et О., 1980.
Почвенно-моховой вид с плоским телом, небольшим
числом изогнуых биполярных кинет, аргиром кольпо-
дидного типа (фибриллы между смежными кинетами).
Ядро округлое, вакуоль над постероном. Рот почти
апикальный, в виде мелкой щели, справа дуговидная
полоса, слева 4 фрагмента с кинетосомами. Нет рото-
вой полости и вестибулюма, это не фильтраторы, не-
смотря на мелкий рот, заглатываются Colpoda и подоб-
ные ей почвенные цилиаты. Пока пищи достаточно,
трофонты делятся надвое в плавающем состоянии, без
цист; могут инцистироваться (стадия покоя).
Цикл развития этого аберрантного вида напомина-
ет цикл миксомицет, и вид был открыт при изучении
миксомицет специалистами-микологами (Блантон, Олив);
изучен совместно с цилиатологами и позже специали-
стами по кольподидам (Барделе, Фойсснер). Трофонты
быстро делятся; если их много, они собираются вместе
у водной пленки — на фрагментах растений, плавающей
пыльце, на краях чашки Петри или просто на нижней
стороне водной пленки; клетки соединяются вплотную
в агрегат, выделяют общую оболочку, секретируют ши-
рокий ребристый ствол, поднимаются в виде сорогена
над поверхностью воды; после завершения роста ствола
клетки в плотной внутренней массе индивидуально ин-
цистируются; для развития сорокарпа нужно чередование
света и темноты. Сорокарп сохнет, трескается, распа-
дается на фрагменты, в воде клетки эксцистируются
(стадия теронта) и приступают к хищному питанию.
Род Myrioblepharis Thaxter, 1895
Типовой вид М. paradoxa. Этот род пропу-
щен в каталоге Аэшт. Род, возможно, не относится
к этому семейству и не имеет такого цикла разви-
тия, как Sorogena', как и предыдущий род, открыт и
изучен микологами. На плесневых грибках почвы типа
Pythium и Phytophthora были замечены ресничные зоо-
споры, не с 1—2 жгутиками, а сплошь покрытые рес-
ничками и очень подвижные. Такстер (Thaxter, 1895)
описал новый род грибков Myrioblepharis. Миколо-
ги упоминали род в каталогах грибков (Минден),
но после повторного изучения пришли к выводу,
что это обычные грибки, в спорангиях которых споры
поедаются цилиатами (Waterhouse, 1945; Koch, 1964).
Вид цилиат определен и изучен не был, и род Myriob-
lepharis пока не имеет точного места в системе коль-
подид.
Woodruffia sporophaga Beers et Sherwood, 1966 об-
наружена в спорангиях Saprolegnia ferox. Кинеты про-
дольные, многочисленные, вакуоль медиальная, в ро-
товой воронке у апекса изображены структуры, похо-
жие на 2 поликинеты кольподид; деление в цистах до
4 особей. В монографии кольподид Фойсснера вид не
рассматривается, отнесен предположительно к Bursos-
toma, но это хищные гименостоматы-офриоглениды,
спутать их нельзя. Вероятно, вид встречается на плес-
невых грибках на гниющих деревьях, грибах и т. п., на
почве; мною осмотрены грибки, развивающиеся в воде
на мертвых насекомых и рыбках, всегда без цилиат.
Вид не имеет отношения к Woodruffia, и не исключено,
что это новый род кольподид.
Отряд Bryophryida Puytorac,
Perez-Paniagua et Perez-Silva, 1979
Предложен как подотряд кольподид. Мелкие и от-
носительно крупные кольподиды с полным реснич-
ным покровом и аргиромом, как у Colpoda. Ротовой ап-
парат субапикальный, вестибулюм неглубокий или во-
ронковидный. Правая ротовая полоса состоит из про-
стого ряда дисом или из большого числа сегментов
справа от перистома; несколько прямоугольных пекти-
нелл левой полосы либо вся она лежат у рта или уходят
к дорсальной стороне. Ядра не объединены в одно, у
макро- и микронуклеуса свои мембраны. Обитатели
почвы.
Сем. Bryophryidae Puytorac,
Perez-Paniagua et Perez-Silva, 1979
С диагнозом отряда. У Фойсснера (Foissner, 1993)
4 валидных рода и еще один (Telostomatella) помещен
сюда условно. Фойсснер считает возможным разделе-
ние семейства на два по типу правой поликинеты; дей-
ствительно, дать диагноз трудно и семейство sensu lato
кажется сборным. Здесь оно ограничено родами с по-
лосой пектинелл, идущих от рта на дорсум, и с U-об-
разным правым рядом.
ТИП CILIOPHORA. КЛАСС COLPODEA
767
Род Bryophrya Wenzel, 1953
Типовой вид Bryophrya bavariensis Kahl, 1931.
Каль предложил новый род Bryophrya для 3 видов, не
обозначив типа; Венцель указал типовой вид В. bavari-
ensis и приводит род как новый с тем же названием.
Поэтому правильное цитирование типа — В. bavarien-
sis (Kalil) Wenzel. Тип рода — крупный хищный вид с
плоским телом, предротовой шов смещен влево при
удлинении правых кинет, перистом в виде неглубокой
продольной воронки; ядро с 2 микронуклеусами, ваку-
оль у постерона, с длинными боковыми каналами. Ки-
неты полимеризованы, с двух сторон огибают пери-
стом и подходят ко шву (бисеканте). Ротовая цилиату-
ра тройная — 3 вестибулярных ряда со сближенными
дисомами правее перистома, полоса кинет внутри пе-
ристома и слева длинный ряд и серия коротких в одну
линию от рта до вершины шва, где переходят на до-
рсум. Деление в цистах. Другие виды — В. bavariensis
minor Wang, 1977; В. rubescens (Penard, 1922 in Glauco-
ma) и В. flexilis (Penard, 1922 in Glaucoma).
Род Puytoraciella Njine, 1979
Типовой вид P. dibryophryisNjine, 1979 из вре-
менного водоема в Камеруне, найдена в период раз-
вития цианофит. Крупный вид (250 мкм) с большим
числом кинет; правые кинеты огибают рот, левые под-
ходят ко рту и диагональному предротовому шву. Пе-
ристом по величине и положению, как у Bryophrya,
справа и снизу одна дуговидная вестибулярная кине-
та, в перистоме справа и снизу поле из фрагментов ки-
нет (U-элемент); слева вдоль края перистома идет по-
лоса мелких пектинелл, далее они разрознены, идут
вдоль шва и заходят на дорсум. Кинеты дорсума спи-
ральные. Основное отличие от Bryophrya — положе-
ние кинетосом в U-полосе, уменьшение числа вестибу-
лярных кинет, полоса ребер пелликулы у рта, форма
пектинелл — монокинеты в полосе у Bryophrya, трики-
неты в перистоме у Puytoraciella. Только у этого рода
имеется глубокая длинная предротовая воронка со
сплошным полем кинетосом на дне и на стенках — ги-
гантское правое поле, кинетосомы которого собраны
в паратены.
Сем. Parabryophryidae Jankowski fam. n.
Бриофрииды с С-образной правой поликинетой и с
мелким фрагментом левой полосы вместо длинного
ряда пектинелл 2 типов у Bryophryidae.
Род Parabryophrya Foissner, 1985
Типовой вид Р. penardi (Colpoda penardi Kahl,
1931). Тело тонкое, вытянутое,, ядра под общей обо-
лочкой, вакуоль с каналами у постерона; кинеты дуго-
видные, аргиром усложнен — между сомакинетами
двойной ряд прямоугольников. Перистом овальный,
справа вестибулярные кинеты (вершины сомакинет со
сближенными дисомами) и параллельный им широкий
С-образный ряд паратен (правая поликинета); слева
мелкий фрагмент левой полосы из нескольких кинето-
сом в 2 рядах. Кортекс с множеством мукоцист.
Род Notoxoma Foissner,
1993
Типовой вид N. parabryophryoides, узкие вытя-
нутые формы с небольшим числом кинет; кинетосомы
в рядах разрежены, ряды спиральные, биполярные. Ва-
куоль без каналов. Перистом субапикальный, с неболь-
шим предротовым швом, рот щелевидный; справа
перистом ограничен полукольцевой кинетой — это ви-
доизмененный правый ряд кольподид, слева мелкий
рудимент поликинеты — короткий ряд кинетосом у
типового вида, 2 кинеты у второго вида N. sigmoides.
Оба вида найдены только в пробах почвы в Кении, не
отмечены в Европе.
Род Telostomatella Foissner,
1985
Типовой вид Telostoma ferroi Grandori, 1935.
Грандори описал новый род Telostoma с видом T.fer-
roi; Корлисс (Corliss, 1960) отметил гомонимию, но не
дал нового названия, так как считал Telostoma синони-
мом рода Platyophrya, следуя Калю. Однако у плати-
офрии рот щелевидный, апикальный, у грандории сле-
ва, округлый, это не синонимы. Т. ferroi считали сино-
нимом вида Р. angusta. Тип рода — узкие вытянутые
формы с несколькими кинетами, рядом мукоцист
вдоль каждой кинеты; перистом округлый, с дуговид-
ным рядом кинетосом. Систематическое положение
пока неясное. Вид найден в почве в Италии.
Отряд Cyrtolophosidida Foissner,
1978
Первоначально предложен как подотряд кольпо-
дид. Трофонты с С-образной полосой только из одного
ряда дисом справа от рта и с серией мелких прямо-
угольных фрагментов поликинеты (пектинелл) левее
рта. Аргиром разного типа в основном платиофриид-
ный. Микронуклеус расположен в перинуклеарном
пространстве (под мембраной) макронуклеуса. Стома-
тогенез плейротелокинетальный. Последний признак
отличает группу от кольподид и гроссглокнерид с
меротелокинетальным морфогенезом.
Сем. Cyrtolophosididae Stokes,
1888
Первоначальное название Cyrtolophosiidae. Мелкие
вытянутые формы с продольными кинетами; перис-
том вытянут по оси тела, правая полоса С-образная,
но с разрывом в середине, сохранены верхний и ниж-
ний фрагменты; пектинеллы идут полосой по оси
тела; аргиром кольподидный, но местами платиофри-
идный.
768
ALVEOLATA
Род Cyrtolophosis Stokes, 1885
Типовой вид C. mucicola — очень мелкие вере-
теновидные формы с полной цилиатурой, небольшим
числом слегка изогнутых кинет; обитают обычно в ко-
мочках слизи и в длинных мукозных трубках, наполо-
вину погружены внутрь, фильтруют пищу (бактерий)
с помощью «псевдомембраны» (правой полосы) и
4 «псевдомембранелл» — серии пектинелл с прямо-
угольными основаниями примерно равных размеров,
расположенных в линию по оси тела. Правая дуга рес-
ничек не заходит под рот снизу слева. Перистом неглу-
бокий, пектинеллы на дне полости. Предротовой шов
мелкий, выявляется с трудом; правые кинеты идут до
шва, часть рядов послеротовые, идут только до пери-
стома. Состав рода: С. mucicola Stokes, 1885; С. acuta
Kahl, 1926; С. colpidiformis Foissner, 1993; C. major
К., 1926; C. bivacuolata Vuxanovici, 1963; C. minor V.,
1963.
Род Balantiophorus Schewiakoff, 1889
Типовой вид В. minutus Schew., 1889 по моно-
типии; вид плохо описан, но судя по форме тела это си-
ноним валидного вида Cyrtolophosis mucicola, поэтому
название рода уходит в синонимику. К роду Balantiop-
horus приписывали виды В. bursaria Schew., 1892; В. elon-
gatus Schew., 1892; В. chaetophorae Penard, 1922; В. lem-
nae Lepsi, 1927. Пенард (Penard, 1922) и Каль (Kahl,
1931) признали синонимию этих родов. Из списка видов
Cyrtolophosis и Balantiophorus валидны лишь С. muci-
cola, С. elongata, С. acuta, С. colpidiformis и С. minor.
Род Pseudocyrtolophosis Foissner, 1980
Типовой вид Р. alpestris F., 1980; также Р. ter-
ricola F., 1993. Цилиатура сохранена на правой сторо-
не тела, хотя здесь уменьшено число рядов, и в значи-
тельной степени редуцирована слева, где сохранились
несколько пар кинетосом у апекса, 2 пары снизу и в
цельном краевом ряду. Аргиром левой стороны отли-
чается от правостороннего. Пектинеллы практически
заполняют полость мелкого продольного перистома;
справа фибриллы и часть кинетосом правой полосы.
Мукоцисты в беспорядке между сомакинетами, ваку-
оль сзади.
Род Aristerostoma Kahl, 1926
Типовой вид A. minutum К., 1926; также А. та-
rinum К., 1931. Оба вида не переописаны достаточно
полно, но для второго есть описание цилиатуры пери-
стома, совпадающее с паттерном Cyrtolophosis — спра-
ва мембрана с дисомами в основании, слева 4 пекти-
неллы; верхний ряд с монокинетой, нижний с дикине-
тами в основании; микронуклеус под мембраной
макронуклеуса. В этой группе есть один морской вид,
но валиден ли род Aristerostoma по типовому виду, не-
известно; это может быть синоним рода Cyrtolophosis с
полной цилиатурой.
Род Plesicaryon Foissner, Agatha
et Berger, 2002
Типовой вид Balantiophorus elongatus Schewia-
koff, 1892, также P. terricola F., A. et B., 2002. Мелкие
плоские червеобразные формы, покрытые редкими
ресничками; ядра не слиты в общей мембране, незави-
симые; аргиром кольподидного типа. Имеются около
10 продольных кинет с редкими парными кинетосома-
ми; перистом апикальный. Справа ряд вплотную сбли-
женных дисом, слева в мелкой полости над ртом 4 пек-
тинеллы; глотка с фибриллами. Почвенные виды, ве-
роятно космополитные; типовой вид ранее включался
в состав Cyrtolophosis.
Сем. Platyophryidae Puytorac,
Perez-Paniagua et Perez-Silva, 1979
Цилиатура полная, без редукции, передний конец
тела расширен и расположен диагонально, перистом
справа ограничен вытянутой мембраной с основанием
из одного ряда дисом, пектинеллы расположены в па-
раллельном ряду почти вплотную с мембраной; обыч-
но имеется также послеротовая псевдомембрана из ко-
ротких кинет с 2 дисомами в каждой вдоль левого края
перистома. Аргиром платиофриидного типа. Деление
у части видов в цистах, у других делятся плавающие
особи. При стоматогенезе сохраняется мембрана про-
тера. Микронуклеус под мембраной макронуклеуса.
Род Platyophrya Kahl, 1926
Типовой вид Р. vorax К., 1926. Каплевидные
формы с небольшим числом слегка спиральных кинет,
подходящих к узкой, косо расположенной перисто-
мальной щели; кинетосомы сгущаются в передней по-
ловине тела; пора вакуоли субтермально справа. От пе-
ристома отходят фибриллы глотки, напоминающие
тонкие немадесмы. Поверхность тела рельефная, с вы-
пуклыми ребрами. При виде сбоку (с ребра слегка
сплющенного тела) виден овальный мелкий перистом,
с дугой дисом справа и 4—5 мелкими пектинеллами
слева, в изогнутой линии по краю перистома; терми-
ном «псевдомембранеллы» обозначают дифференци-
ровку верхних отделов сомакинет, подходящих к пери-
стому снизу и слева, — образуются 2 дуги (паратены),
каждая состоит из ряда дисом; в итоге рот окружен од-
ной дугой кинетосом справа и 3 слева, с тесно сбли-
женными дисомами в дугах псевдомембранелл. Арги-
ром разного типа на обеих сторонах тела.
Род Buitkampia Foissner, 1985
Предложен для вида Platyophrya angusta Kahl, 1926
sensu Buitkamp, 1977; co временем стало ясно, что опи-
сание неточное — либо были не замечены мелкие
основания пектинелл у этого вида, либо они были пло-
хо импрегнированы или вообще не окрасились протар-
голом. В монографии кольподид Фойсснер признал
невалидным не только этот род, но и сам вид Р. angus-
ТИП CILIOPHORA. КЛАСС COLPODEA
769
ta, сведя его в синонимы типового вида Р. vorax, а так-
же и свой вид Р. procera F., 1980.
Примеры видов рода Platyophrya — Р. macrostoma
Foissner, 1980; Р. citrina F., 1980; Р. hyalina F., 1980;
P. dubia F., 1980; P. sphagni (Penard, 1922 in Glaucoma')
(» P. chlorelligera Kawakami, 1989, вид с зоохлорелла-
ми); P. binucleata F., 1987; P. spumacola Kahl, 1927
(= P. fissistoma Lepsi, 1948, = Woodruffia sinistromemb-
ranellata Gellert, 1955); P. similis (F., 1980 in Wood-
ruffia).
Род Cirrophrya Gellert, 1950
Типовой вид C. haptica Gellert, 1950. В моно-
графии кольподид (Foissner, 1993) род подробно рас-
сматривается как валидный; в каталоге Аэшт, в Guide
и в Traite тоже в числе валидных родов цилиат. Это вид
с большим числом кинет, с секантным швом у вакуоли
снизу; перистом вытянутый, мембрана и 2 псевдомем-
бранеллы типичные для Platyophrya-, в полосе пекти-
нелл большое число параллельных мелких фрагмен-
тов. Вид найден в небольшом числе особей на коре
сосны под слоем водорослей; размеры тела до
160 мкм; цилиатура около 30 кинет со сближенными
кинетосомами; родовой признак — наличие 2—25 со-
сковидных выростов постерона величиной 5—6 X
2 мкм. Это прикрепительные (якорные) отростки, за-
полненные слизью. По авторам Traite, это «уникальная
прикрепительная органелла». Фойсснер отнес к этому
роду также С. terricola F., 1987 и С. australis F., 1993.
Позже (Foissner, Foissner, 1995) выяснилось, что
эти ^выросты, по данным электронной микроскопии,
оказались микроспоридиями нового рода Ciliatospori-
dium Foissner I. et Foissner W., 1995 (C. platyophryae)-,
вид Cirrophrya terricola был перенесен в состав Platy-
ophrya, но 2 других вида пока временно оставлены в
составе Cirrophrya, поскольку их придатки не напоми-
нают червеобразных тонких придатков С. terricola. Но
это могут быть разные стадии или виды микроспори-
дий. Статус рода Cirrophrya очень сомнительный.
Род Platyophryides Foissner, 1987
Типовой вид Platyophrya lata Kahl, 1930 (Р. lo-
tus)-, также Р. magnus F., 1993 и Р. dragescoi F., 1987.
Синоним типового вида — Woodruffia lichenicola Gel-
lert, 1955. Тело мешковидное, изогнутое, с 30—40 би-
полярными кинетами и очень длинной ротовой ще-
лью; глотка короткая и широкая, со сложной системой
фибрилл и немадесм. Перистом справа ограничен ли-
нией дисом, очень короткие реснички которых не
склеены в мембраны; слева вдоль всего края перисто-
ма полоса из 7 длинных пектинелл, длинные реснички
которых склеены в мембраны. Сомакинеты изогнутые,
снизу огибают с двух сторон пору вакуоли. Аргиром
с продольной фибриллой, разделяющей 2 полосы
прямоугольников между смежными рядами кинет.
У Р. dragescoi обнаружены 4 длинные пектинеллы, у
Р. magnus — 9, перистом окаймлен обособленными
вершинами всех сомакинет со сближенными кинето-
сомами.
Род Ottowphrya Foissner, Agatha
et Berger, 2002
Типовой вид Platyophryides dragescoi Foissner,
1987. Тело широкое, с длинным щелевидным диаго-
нальным ртом; кинеты многочисленные, изогнутые,
с правосторонней секантой; антерон отклонен вбок.
Аргиром — двойная сеть прямоугольников между
смежными кинетами. Справа вдоль ротовой щели ли-
ния парорального ряда, слева линия из 6 коротких пек-
тинелл; соматические кинетосомы сгущаются у вер-
шины каждого левостороннего ряда с образованием
параллельной рту полосы перикинет. Второй вид —
О. magna (Platyophryides magnus F., 1993). Род космо-
политный, типовой вид многократно отмечен в почвах
Европы, Австралии и Африки. Platyophrya lata Kahl,
1930 sensu Dragesco et Dragesco-Kerneis, 1979 — это
неверное определение (нетоним), правильное название
Р. dragescoi. По морфологии этот род и Platyophryides
могут относиться к Sorogenida, но возможность агрега-
ции томонтов и образования сорокарпа пока не прове-
рена.
Сем. Woodruffiidae Gelei, 1954
Тело тонкое, вытянутое, рот сдвинут вправо вниз
от клюва; перистом мелкий, диагональный, справа
окаймлен непрерывной дуговидной мембраной с дики-
нетидами (дисомами) в основании, слева к клюву идет
полоса из большого числа пектинелл.
Род Rostrophryides Foissner, 1987
Типовой вид R. africana F., 1987, также R. aust-
ralis Blatterer et Foissner, 1988. Тело вытянутое, с не-
большим числом кинет; перистом не растянутый,
овальный, мембрана С-образная, основания пектинелл
расположены не в одну линию, а ступеньками вдоль
левого края перистома у R. africana, в линию у других
видов. Слева у перистома 2 псевдомембранеллы —
вершины кинет.
Род Rostrophrya Foissner, 1993
Типовой вид Rostrophrya camerounensis Njine,
1979. Новый род Rostrophrya Njine, 1979 был предло-
жен для 2 видов (R. camerounensis n. gen., n. sp. и R. ге-
gis n. sp.) без указания типа, поэтому Фойсснер при-
знал этот род невалидным и вторично дал то же назва-
ние с фиксацией типа; третий вид R. terricola F., 1993.
Размеры типового вида до 300 мкм, кинеты полимери-
зованы, перистом непропорционально мелкий, со ще-
левидным ртом, длинной корзинкой немадесм, мемб-
рана с С-образным основанием, полоса пектинелл идет
от рта до клюва извитой полосой; пектинеллы сближе-
ны в ротовой зоне, разрежены после выхода из пери-
стома. Кинеты полимеризованы, у вакуоли секантная
зона; левее перистома сгущаются все кинетосомы и
сближаются вершины кинет с образованием нечетких
паратен.
49 Зак. №4163
770
ALVEOLATA
Род Kuklikophrya Njine, 1979
Типовой вид К. dragescoi Njine, 1979.
Род Enigmostoma Jankowski, 1975
Типовойвид Nassula ougandae Dragesco, 1972.
Эти названия следует рассмотреть вместе. Второе
название имеет приоритет, было принято в каталоге
Корлисса (Corliss, 1979) и в статьях Фойсснера и Дра-
жеско, но затем было объявлено Фойсснером и Аэшт
невалидным как предложенное в тезисах и без диагно-
за. Оба типовых вида идентичные (синонимы), поэто-
му принятое сейчас название — Kuklikophiya ougandae
(Dragesco, 1972) Foissner, 1993 (= Rostrophrya falcata
Alekperov, 1985). Синонимизируя с видом другого
рода, следует сначала ввести его в состав Kuklikophiya
(К. falcata comb, п.) и лишь затем объявлять синони-
мом.
Тип рода внешне похож на гипостомат рода Pseu-
dochilodonopsis (с заостренным постероном); кинеты
многочисленные, на венте и дорсуме швы у постерона,
аргиром платиофриидный (с двойным рядом прямо-
угольников); рот щелевидный, вытянут по диагонали;
справа и слева дуговидная (U-образная) мембранелла,
от вершины перистома до клюва идет полоса пекти-
нелл. Находка вида такого типа на Кавказе значит, что
это не эндемик центральной Африки, но в Европе род
пока не отмечался.
Род Woodruffides Foissner, 1987
Типовой вид W. terricola F., 1987, также W. те-
tabolicus (Johnson et Larson, 1938 in Woodruffia). У пер-
вого вида перистом и рот непропорционально удлине-
ны вплоть до клюва в виде дуги; полимеризованы ки-
неты, предротовой шов почти не выражен; все ряды
спиральные, переходят на дорсум и закручиваются во-
круг нижнего полюса тела. Аргиром с двойной сетью.
Основание мембраны вдоль всего правого края пери-
стома, незначительно заходит снизу на левую стенку
(отличие от Kuklikophryaf, вдоль левого края большое
число мелких пектинелл. Вакуоль сзади, с 2 каналами.
Хищники, перистом широко открывается для заглаты-
вания крупной добычи; в культурах разводятся на Pa-
ramecium caudatum.
Род Woodruffia Kahl, 1931
Типовой вид W. rostrata Kahl, 1931; внешний
облик, как у Platyophrya, и виды родов часто путали;
кинеты немногочисленные, с легкой спирализацией,
простой топографии. Перистом вытянут по диагонали,
иногда почти продольный; справа дуга мембраны, не-
значительно заходящая на левую стенку; слева около
10 пектинелл, идущих до апекса. В глубь тела от кине-
тосом мембраны отходят тонкие фибриллы, от пекти-
нелл пучки фибрилл (немадесмы). В принципе по со-
матической и ротовой цилиатуре роды Woodruffia и
Woodruffides сходные, но легко различаются по арги-
рому — у Woodruffia, сеть, как у Colpoda (один ряд
прямоугольников между кинетами), у Woodruffides,
как у Platyophrya (2 ряда). W. viridis Gelei, 1954 — си-
ноним вида W. rostrata Kahl, 1931; W. australis Fois-
sner, 1993 — нетипичный вид с небольшим перисто-
мом. W. sporophaga Beers et Sherwood, 1966, вероятно,
не относится к этому роду (см. Myrioblepharisf
Род Rhyposophrya Kahl, 1933
Типовой вид Rh. aplanata Kahl, 1935; род при-
веден Фойсснером (Foissner, 1993) в приложении к
кольподидам — вид морской, совершенно не изучен,
по рисунку нельзя определить даже отряд или класс.
Небольшие почковидные формы с изогнутыми кинета-
ми, рот диагональный, слева, вакуоль у левого края
тела снизу; спереди скопление гранул (не характерное
для кольподид); кортекс с мукоцистами.
Род Etoschophrya Foissner, Agatha
et Berger, 2002
Типовой вид E. oscillatoriophaga — мелкие
овальные клетки с небольшим клювом; аргиром плати-
офриидный на правой стороне и крейеллидный на ле-
вой; рот в виде диагональной щели. Правая мембрана
почти замкнутая вокруг рта, с 24 дисомами; линия из
4 пектинелл выходит за пределы мембранного кольца.
К перистому сходятся 18 кинет, кинетосомы сгущают-
ся у рта, разрежены на дорсуме; под перистомом 4 па-
ратены. Вид найден в соленой почве в Намибии.
Сем. Sagittariidae Grandori L.
et Grandori N., 1935
Первоначальное название Proshymenidae G. et G.,
1934. Мелкие формы, обитающие в длинных толсто-
стенных мукозных трубках, как мариниды и Cyrtolop-
hosis. Кинетом простой, перистом апикальный, с дуго-
видной мембраной и несколькими пектинеллами, не
выходящими в линию за пределы перистома. Аргиром
кольподидного типа.
Род Sagittaria Grandori L.
et Grandori N., 1934
Типовой вид X poligonalis G. et G., 1934; этот
вид не изучен. По описанию авторов, имеет каудаль-
ную ресничку и вентральный желобок апикального пе-
ристома; ядро почковидное, вакуоль у постерона; рес-
нички длинные, разрежены, сгущаются и направлены
вверх вокруг перистома, окруженного высокой мемб-
раной. У хорошо изученных видов длинная глотка с
немадесмами, ее могли принять за канал перистома.
Валидные виды — 5. hyalina Foissner, Czapik et Wiac-
kowski, 1981 и S. australis Pomp et Wilbert, 1988. Апекс
с полярным перистомом, все органеллы на поверхно-
сти тела, полости перистома нет; справа от ротовой
щели одинарная или двойная мембрана, слева ряд из
ТИП CILIOPHORA. КЛАСС COLPODEA
771
3—4 пектинелл и паратены соматических рядов. Тро-
фонты наполовину погружены в широкие и длинные
мукозные трубки, инцистируются на дне трубок. Пер-
вый вид обитает в почве и небольших временных водо-
емах, второй вид эвригалинный из пересоленных почв
Австралии, разводится при 23—80 %о.
Сем. Reticulowoodruffiidae Foissner, 1993
Тело вытянутое, кинетом простой, с продольными
рядами кинет; перистом субапикальный, особый при-
знак — новый, третий тип аргирома: у Woodruffia с од-
ним рядом прямоугольников в межкинетах, у Woodruf-
fides с 2 рядами; у родов данного семейства с сетью из
мелких ячеек неправильной формы в нижней части
тела, в верхней местами, как у Woodruffia, местами, как
у Woodruffides.
Род Reticulowoodruffia Foissner,
1993
Типовой вид R. terricola F., 1993. Вытянутые
узкие гибкие формы длиной до 140 мкм с почти апи-
кальным небольшим перистомом; рот щелевидный,
справа цельная С-образная мембрана, слева 8—9 мел-
ких пектинелл, не выходящих за пределы перистома,
сближенных у рта и разрозненных выше. Кинеты не-
многочисленные (18—22), незначительно изогнутые,
биполярные; аргиром платиофриидный в передней
трети тела, сетчатый в нижней половине, разного типа
навенте и дорсуме. Выделены из пересоленных почв в
Калифорнии, позже найдены в Намибии, США (штат
Юта), всегда в соленых почвах.
Род Semiplatyophrya Wilbert et Kahan,
1986
Типовой вид 5*.foissneri из пересоленных со-
лончаковых почв в Израиле, покрытых галофитами;
позже найдены в пробе мхов в Кении. Многие кольпо-
диды эвригалинные, но группа почти не встречается в
море. Червеобразные узкие формы с незначительным
числом кинет, мелким субапикальным ртом; цилиату-
ра перистома — С-образная мембрана и 4 пектинеллы;
глотка с тонкими немадесмами; на венте цилиатура
полная, на дорсуме кинетосомы разрежены. Кинетом
вентральной (правой) стороны тела кольподидный
(1 ряд прямоугольников), дорсальной стороны (левой)
платиофриидный, с 2 неравными по ширине рядами
прямоугольников. Вид 5*. acrostoma Foissner, Agatha et
Berger, 2002 открыт в соленой почве в Намибии; во-
круг апикального рта кольцо, его правая часть состоит
из дисом, левая из мелких пектинелл.
Сем. Pseudochlamydohellidae Buitkamp,
Song et Wilbert, 1989
Мелкие дисковидные цилиаты из перифитона чис-
тых вод — рек, ручьев; кинеты правой стороны немно-
гочисленные, на левой почти полностью редуцирова-
ны; перистом мелкий, с двойной немадесмальной
трубкой; аргиром особого типа, различный в реснич-
ном и безресничном отделах тела; ротовая цилиату-
ра — дуга дисом мембраны и несколько пектинелл ле-
вее рта.
Род Pseudochlamydonella Buitkamp,
Song et Wilbert, 1989
Типовой вид P. rheophila из рек Германии и
Австрии. Вид был описан как гипостомата, и действи-
тельно по форме тела и положению кинет на обеих
сторонах тела, по наличию двойной немадесмальной
трубки — это полная имитация гипостомат. В перво-
описании нет мембраны и пектинелл, но у расы Фой-
сснера они имеются, а затем были найдены и на плохо
импрегнированном препарате типовой расы; точные
рисунки — в монографии кольподид Фойсснера. На
левой стороне тела видна короткая дуговидная тигмо-
кинета, аргиром сетевидный, 2 типов по ориентации
ячеек; дуговидные ряды ячеек указывают местополо-
жение исчезнувших кинет. Ядро одно или в несколь-
ких нодулах, микронуклеус вне мембраны ядра, ваку-
оль с вентральной порой. На правой стороне тела
4 концентрические кинеты и 4 прямых ниже рта; над
ртом дуга мембраны, ниже рта 4 пектинеллы; во всех
рядах кинетосомы и реснички парные, что не бывает у
гипостомат. Циртум из немадесм, с внутренней глот-
кой. Аргиром правой стороны также 2 разных типов, в
частности с 3 рядами прямоугольнков в межкинетах,
что до сих пор у кольподид не встречалось.
Подкласс Bryometopia Foissner, 1985
Группа родов кольподид с аргиромом особого типа, не встре-
чающимся в ранее рассмотренных отрядах (крейеллидный арги-
ром), с полной цилиатурой у исходных форм и с тенденцией к ре-
дукции цилиатуры на левой стороне у высших форм. По Фойссне-
ру, «система серебряных линий (аргиром) — это единственный
признак, который отделяет этот подкласс от подкласса Colpodia;
это мелкоячеистая сеть, в основном неправильных по форме ячеек.
Дальнейшие исследования могут показать, что V-образный пат-
терн, образованный передними и задними пучками поперечных
микротубул, является более убедительным признаком подкласса»
(Foissner, 1993, р. 667). Включает один отряд Bryometopida; Фойс-
снер допускает возможность выделения части родов в новые отря-
ды по мере добавления новых родов.
Отряд Bryometopida Foissner, 1985
(рис. 350, а)
Первоначально включал псевдогетеротрих из мхов
Bryometopus и близкие роды; сейчас 5 семейств. С диа-
гнозом подкласса. Стоматогенез плейротелокинеталь-
ный; в этом отношении сходен с 4 отрядами подкласса
Colpodia, кроме двух (Colpodida, Grossglocknerida),
имеющих меротелокинетальный вариант морфоге-
неза.
772
ALVEOLATA
Сем. Bryometopidae Jankowski, 1980
Полная имитация гетеротрих. Тело вытянутое, ши-
рокое, с крупным широким перистомом в антесоме
слева, имеющем длинную мембрану и полосу мемб-
ранелл от апекса до нижнего края перистома, где
они погружены в инфундибулюм; сами мембранеллы
тоже сходны —1 поперечные, с выступом спереди спра-
ва. Цилиатура полная, без редукции, с вентральными
швами.
Род Bryometopus Kahl, 1932
Типовой вид В. pseudochilodon из мхов; оваль-
ные формы с относительно небольшим числом кинет
простой топографии, без четкого послеротового бисе-
кантного шва, имеющегося у видов с полимеризацией
кинет; ряды продольные, биполярные, слегка изогну-
тые. Ядро с 2 прилегающими микронуклеусами, ваку-
оль выше постерона слева. Перистом крупный, широ-
ко открытый, с длинной мембраной справа и изогну-
той полосой слева, рот в неглубокой воронке; апекс
смещен влево и этот сдвиг определяет положение вер-
шин кинет и цилиатуры перистома. Аргиром в виде не-
правильной сети дорсально, более сложный на венте.
Левее рта зона перикинет — сближение кинетосом в
вершинах кинет и их переориентация в виде дуговых
паратен.
В каталоге Фойсснера 8 валидных видов, но допус-
кается синонимия 2 форм с зоохлореллами. В ряде ра-
бот вид, называемый В. pseudochilodon, в действитель-
ности относится к другим видам рода. Примеры ви-
дов — В. viridis Foissner, 1987; В. chlorelligerus F.,
1980; В. atypicus F., 1980; В. balantidioides F., 1993;
В. sphagni (Penard, 1922 in Condylostoma) (=B. magnus
F., 1980); B. triquetrus F., 1993; B. edaphonus F., 1980;
B. pseudochilodon Kahl, 1932 (типовой вид).
У большинства видов рода пора вакуоли смещается
вверх к перистому, и ниже нее кинеты сходятся под уг-
лом, в бисекантной зоне; шов почти не выражен у
В. pseudochilodon с низко расположенной вакуолью, и
по этому признаку род можно разделить на подроды.
Другой вариант — по топографии правых кинет; обыч-
но они идут параллельно мембране и подходят к вер-
шине перистома, но у аберрантного вида В. triquetrus
подходят под углом к мембране.
После публикации книги Фойсснера добавлено
2 вида — В. hawaiiensis F., 1994 с гигантским пери-
стомом и 2 сегментами мембраны разного строения
и В. muscicola Olmo et Tellez, 1995 из Испании, но
сами авторы вскоре отождествили этот вид с В. hawaii-
ensis.
Род Thylakidium Schewiakoff,
1892
Типовой вид Th. truncatum. По Аэшт, датиру-
ется 1893 г., по Фойсснеру 1892 г. — род дважды пред-
ложен как новый. Вид зарисован многими авторами и
пока при серебрении не изучен; тело цилиндрическое,
с тесно сближенными биполярными рядами простой
топографии, вакуоль под перистомом, перистом в виде
узкой извитой щели по оси вента. Один из новых видов
следовало отождествить с типовым.
Хорошо изучен вид Th. pituitosum, внешне очень
сходный с типовым. Кинеты многочисленные, с бисе-
кантой ниже поры вакуоли; кинетосомы в рядах распо-
ложены очень тесно, нет редукции ресничек; аргиром
разного типа даже на обеих сторонах вента. Апикаль-
ное отверстие перистома, относительно неширокое,
ведет в глубокую полость со ртом у экватора; вдоль ле-
вого края полости полоса крупных пектинелл, вдоль
правого края и апикально основание мембраны (мо-
нокинета). Множество мукоцист образуют мукозный
домик вокруг тела. Примеры видов — Th. truncatum
Schewiakoff, 1892; 77г. typicum Gellert, 1955; Th. pitui-
tosum Foissner, 1980; Th. magnum Alekperov, 1991;
Th. macrostomum Alekperov, 1991.
Сем. Kreyellidae Foissner,
1979
Очень мелкие формы с плоским телом; цилиатура
частично или полностью редуцирована на левой сто-
роне. Перистом относительно крупный, пектинеллы в
неглубокой полости, дуговидная мембрана снаружи,
не ограничивает нижний край перистома. Очень слож-
ная сеть аргирома разного типа в разных участках
тела. Деление не в цистах, томонты плавают.
Род Microdiaphanosoma Wenzel,
1953
Типовой вид Diaphanosoma arcuata Grandori L.
et Grandori N., 1934. Замещающее название для рода
Diaphanosoma G. et G., 1934 с тем же типом (гомоним).
Мелкие формы с овальным телом; на левой стороне
кинетом практически редуцирован, кроме 3 мелких
сегментов спереди; на правой стороне несколько ки-
нет, в которых часть дисом лишь с одной ресничкой;
ниже рта несколько ресничек; имеется очень длинная
каудальная ресничка. Аргиром сложный; в межкине-
тах мукоцисты. Перистом продольный, краевой, мемб-
рана только у верхнего правого края, пектинеллы в
продольном, слегка погруженном ряду.
Род Udisoma Jankowski
gen. n.
Типовой вид Microdiaphanosoma terricola Fois-
sner, 1993 (U. terricola comb, n.) — длина тела 10—
17 мкм, слева полнее сохранен кинетом, чем у М. arcu-
ata, справа 3 кинеты в основном с парными реснич-
ками; сзади 1 длинная каудалия. 3 пектинеллы в не-
большой полости, сдвинутой далеко вниз от апекса;
мембрана короткая, не идет вдоль правой стенки пери-
стома, как обычно, а подходит к перистому под углом,
ее можно принять за фрагмент сомакинеты. Опреде-
лить, что это именно мембрана перистомальной цили-
атуры, можно по длине ресничек — они короче, чем
все соматические реснички особи.
ТИП CILIOPHORA. КЛАСС COLPODEA
773
Род Kreyella Kahl, 1931
Типовой вид К. muscicola Kahl, 1931; также
A’, minuta Foissner, 1979. Род всегда относили к Microt-
hoiucidae (Nassophorea), тем более что у высших мик-
роторицид часто нет корзинки глоточных немадесм (цир-
I у мп). Тип рода сходен с Microthorax pusillus по форме
ТОЛП, размерам, положению и числу сомакинет, поло-
жению перистома (у левого нижнего края тела). Вид пока
повторно не изучен, описание Каля краткое и неполное,
поэтому морфологию рода пока представляет другой
вид — К. minuta (есть мнение, что виды могут отно-
ситься к разным родам). На левой стороне тела реснички
сохранены в верхних частях 2 рядов, на правой 2 цельных
дуговидных ряда. Перистом ниже экватора слева, огра-
ничен основанием мембраны и полосой пектинелл.
Род Orthokreyella Foissner, 1984
Типовой вид О. schiffmanni. Размеры тела 10—
20 мкм, на левой стороне ресничек нет, на правой —
2 полных дуговидных ряда и 2 дисомы ниже рта — оста-
ток послеротовых кинет. Перистом крупный, в виде
неглубокой полости, широко открытой к левому краю;
дуга мембраны начинается высоко, идет вдоль края по-
лости; пектинеллы далеко внизу, идут поперек тела на-
лево; левее перистома несколько фрагментов кинет.
Сем. Tectohymenidae Foissner, 1993
^Включает 2 рода разного типа с полной цилиату-
рой, с разрывом сомакинеты № 2, с небольшим диаго-
нальным перистомом и мелкоячеистым аргиромом в
виде неправильной сети, без продольных рядов арги-
ронем. По типу мембраны эти роды могут быть обо-
соблены в разных семействах. Деление в цистах.
Род Pseudokreyella Foissner 1985
Типовой вид Р. terricola. Размеры 20—30мкм,
тело почковидное, с 10 кинетами; на дорсуме кинето-
сомы разрежены, на венте (правой стороне) сгущаются
в антесоме. Перистом каплевидных очертаний, удален
от апекса, неглубокий; мембрана огибает правый край,
дно и частично левый край полости, имеет вид моно-
кинеты. 4—5 пектинелл, уменьшаясь в размерах, идут
от рта вверх. Имеется небольшой фибриллярный цир-
тум. Р. australis Foissner, 1993 — вид с более сложным
кинетомом. Р. etoschensis Foissner, Agatha et Berger,
2002 открыт в соленой почве Намибии; видоизменена
левая ресничная зона — это 2 неравные продольные
полоски и несколько кинетосом у их вершины.
Род Tectohymena Foissner 1993
Типовой вид Т. terricola Foissner, 1993 — раз-
меры 35—45 мкм, внешний облик как у Colpoda —
тело каплевидное, с волнистым ребром и субапикальным
перистомом; цилиатура полная, с незначительным раз-
режением дорсально, кинеты биполярные, в спиральных
рядах. Полоса пектинелл почти продольная, погружена
лишь нижняя часть зоны; в перистоме у рта погруженная
правая поликинета в виде U-образной полосы с много-
численными поперечными рядами кинетосом. Арги-
ром в виде неправильной сети ячеек разной формы.
Сем. Trihymenidae Foissner, 1988
Кинетом полный, без редукции кинет и без секант-
ных швов, но кинеты олигомеризованы и кинетосомы
в них разрежены; перистом субапикальный, с мембра-
ной и только 2 пектинеллами; аргиром — неправиль-
ная сеть без продольных полос.
Род Trihymena Foissner, 1988
Типовой вид Т. terricola. Тело узкое, вытяну-
тое, с примерно 10 слегка изогнутыми кинетами, меж-
кинеты вздутые в виде широких ребер; кинетосомы в
рядах разрежены, слегка сгущаются у апекса. Пери-
стом очень мелкий, субапикальный; справа С-образная
мембрана (монокинета), в перистоме 2 пектинеллы с
2 рядами кинетосом в основании каждой, одна идет
вверх вдоль левой стенки мелкой полости, другая — на
дне, подходит к левой пектинелле под углом (в виде
перевернутой буквы V). Такое положение и число пек-
тинелл не встречаются у других кольподид и служат
основанием для выделения рода в особое семейство.
Сем. Jaroschiidae Foissner, 1993
Включает 3 рода со сходной формой тела, полной
цилиатурой, мелкоячеистым аргиромом разного типа;
перистом диагональный, ротовая цилиатура очень
сложная, с включением резко видоизмененных отде-
лов сомакинет и модификацией 2 стандартных элемен-
тов кольподид (правой и левой поликинет). Вероятно,
эти роды лучше отнести к разным семействам.
Род Jaroschia Foissner, 1993
Типовой вид/, sumptuosa. Тело узкое, вытяну-
тое, антерон отогнут вбок, с клювом; вакуоль на посте-
роне. Кинеты слегка спиральные, густые, кинетосомы
не разрежены, швов нет. Сеть аргирома из мельчайших
ячеек, в межкинетах ряды крупных мукоцист. Рот на дне
широкого овального перистома, открытого налево вверх;
ротовая цилиатура необычайно сложная, уникального
типа среди кольподид. Можно различить небольшой ряд
из 4 пектинелл слева и дуговидный ряд, соответствую-
щий правой .поликинете или монокинете остальных
родов класса; поликинета постепенно сужается, огиба-
ет рот снизу и переходит направо, становится дикине-
той и затем гаплокинетой. Имеются также поля сбли-
женных кинетосом, дуговидные дикинеты и короткие
фрагменты со всех сторон от рта. 4 дополнительных
крайне левых сегмента могут быть второй полосой
пектинелл, все остальное — модификация сомакинет.
774
ALVEOLATA
Род Pentahymena Foissner, 1994
Типовой вид P. corticicola из Коста Рики;
крупный вид (130—160 мкм) с полной цилиатурой; ки-
неты полимеризованы, спиральные, четко выражен
диагональный предротовой шов, нет послеротового
шва в связи с низким положением поры вакуоли у по-
стерона. Перистом в виде длинной узкой диагональной
щели, со сложной цилиатурой; справа налево это:
1) вершины сомакинет, огибающие рот, со сближен-
ными вплотную кинетосомами; 2) вплотную сближен-
ные вестибулярные ряды, полностью особособленные
от сомакинет, погружены в перистом; 3) изогнутый
ряд на дне справа, поликинета переходит в монокине-
ту — это правая поликинета («мембрана») кольподид;
4) вторая полоса такого типа, поликинета, на дне пери-
стома слева; 5) длинная полоса очень мелких пекти-
нелл, уходящих вдоль шва к апексу; 6) монокинета-па-
ратена из верхних кинетосом левых сомакинет. У Tri-
hymena вестибулярные кинеты устроены иначе; нет
уверенности, что эти 2 рода близкие и относятся к од-
ному семейству.
Род Dapedophrya Foissner, 1995
Типовой вид Glaucoma flexilis Penard, 1922
(Bryophrya in Foisner, 1993). Некрупные особи с конту-
ром тела, как у вудруффии, длиной 60—80 мкм, с мно-
гочисленными спиральными кинетами, сзади вакуоль
Класс Prostomate
Переднеротых инфузорий всегда объединяли в одну группу от-
ряда или подкласса Gymnostomata — Prostomata. В последние годы
сделана попытка охарактеризовать известные классы цилиат и вы-
делить новые классы не только по обшей топографии кинетома и
строению тела, но и по ультраструктуре кинетид (кинетосом и свя-
занного с ними комплекса микрофибрилл). Разнообразие паттер-
нов кинетид невелико, поэтому, по мнению Линна (Lynn, 2002),
можно выделить 11 классов цилиат. При этом бывший таксон гим-
ностомат распался на два — Haptorida и Prostomatida, имеющих
разные типы кинетид. Вначале считалось возможным объединить
их в составе одного таксона Rhabdophora Faure-Fremiet, но данные
молекулярной филогенетики исключают эту возможность. На фи-
лограммах гапториды (литостоматы) группируются с энтодинио-
морфами, эта ветвь отходит почти от основания филогенетическо-
го дерева, а простоматы (представители Prorodon, Coleps) отходят
от одной из верхних ветвей вместе с Colpodida.
Это значит, что внешне сходные цилиаты, в монофилии кото-
рых никто ранее не сомневался, оказываются неродственными и
конвергентно сходными. Переднее положение рта и немадесм в
эволюции возникало неоднократно, или все же имеется гипотети-
ческая общая предковая группа, пока не открытая.
Сейчас далеко не все виды переднеротых изучены в электрон-
ном микроскопе, поэтому класс включает пока немного родов. По
мере изучения основного массива литостомат (гапторид) часть ро-
дов может перейти в состав простомат. В списке Линна 21 досто-
верный род, но список неполный — нужно добавить Pelagothrix,
Longitricha, Tiarinella, Kotinia и другие роды. Класс включает 2 от-
ряда, Prostomatida и Prorodontida. Таксон Prostomata Schewiakoff,
1893 впервые был предложен как подотряд в составе Gymnostoma-
ta, и поэтому сохранено авторство Шевякова при повышении ранга
до отряда; класс должен иметь другое авторство.
По Линну, ультраструктурная характеристика класса Prostoma-
tea Schewiakoff, 1896 (правильнее класса Prostomatea Small et Lynn,
1985) следующая: соматические монокинетиды (моносомы) обыч-
ного типа, с радиальной поперечной полосой (ribbon), со слегка
с длинными боковыми каналами; перистом каплевид-
ный, с небольшимм швом на апексе. Аргиром в виде
тонкой сети кортекса. Левые кинеты подходят к стенке
перистома, правые — огибают рот и идут к апексу,
сгущаясь у рта. 3 правых сомакинеты видоизменены
на уровне перистома (перикинеты), их вершины обо-
соблены в виде дуг дикинет; ко рту примыкает дикине-
та иного типа. Слева 2 полосы поликинет, изогнутая у
рта и прямая, фрагментированная снаружи, фрагменты
которой видны по всему предротовому шву. Открытие
этого рода и Pentahymena затрудняют классификацию
семейств, поскольку сочетаются признаки Jaroschiidae
и Bryophryidae. Типовой вид Bryophrya bavariensis
имеет более крупные ротовые поликинеты справа, у
Dapedophrya они находятся слева от рта и в этом отно-
шении стоят ближе к Jaroschiidae.
В последние годы привлекла большое внимание
фауна воды на листьях («аквариумах») тропических
бромелиевых — в них много эндемичных видов и ро-
дов цилиат, начата обработка богатой уникальной фау-
ны, включая новые роды кольподид (Foissner, Cordei-
ro, 2000; Foissner et al., 2003). Один из них (пока не на-
зван) из бромелий Бразилии похож на Metopus,
полиморфный; трофонты с крупным ртом, мелкие те-
ронты другой формы; рот медиальный, имеется аци-
лон; деление у подвижных клеток, не в цистах, с обра-
зованием цепочек томитов. Микростомы питаются
бактериями, макростомы — флагеллатами; есть соот-
ветственно 2 типа цист покоя. Этот род будет выделен
в новое семейство в отряде Colpodida.
a Small et Lynn, 1985
конвергентной постцилиарной полосой и с направленной вперед
кинетодесмальной фибриллой, которая не перекрывает такие же
пучки других кинетид. Кинетосомы часто координированы в рас-
положении, образуют поперечные кольцевые ряды (паратены); рот
апикальный или субапикальный; ротовые дикинетиды (дисомы)
расположены радиально или под углом вокруг ротовой зоны. Пост-
цилиарные пучки ротовых дикинетид идут вбок от каждой пары
кинетосом, накладываясь один на другой; у некоторых видов они
образуют кольцо микротубул, служащее опорным аппаратом сте-
нок мелкой предротовой полости; имеется опорный аппарат глотки
типа rhabdos (не cyrtos, как у циртофорин). Стоматогенез вентраль-
ный, с миграцией рта к апексу после деления.
По результатам изучения ультраструктуры ресничек простома-
ты близки к гименостоматам; другие смежные группы — кольпо-
ды, нассулиды и плагиопилиды, также получившие сейчас ранг
классов. Родство с гименостоматами не является неожиданным,
если учесть сходство тигмона и ротовой цилиатуры в линии Urot-
richa (Prorodontida) — Furgasonia (Nassulida) — Dexiotricha (Hyme-
nostomatida) и сходство их аргирома.
По Фойсснеру с соавт. (Foissner et al., 1999), Prostomatida
(включая оба отряда Линна) имеют 3 общих признака: 1) соматиче-
ская цилиатура более или менее полная, в виде продольных рядов
монокинетид (моносом) — реснички в кинетах непарные; пары ки-
нетосом находятся только в вершинах кинет; 2) ротовой аппарат
апикальный; ротовая цилиатура несложная; кольцевой циркумо-
ральный ряд один, состоит из парных кинетосом и является гомо-
логом ундулирующей мембраны более сложных цилиат; часто
встречаются зубцевидные выросты в зоне кольца. Собственно адо-
ральные органеллы, которые обозначают условно вентральную
сторону тела, расположены на поверхности тела и несут короткие
реснички. Ротовой аппарат, по Линну, типа rhabdos, по Фойсснеру,
типа cyrtos, состоит из прямых палочек, не всегда заметных, тон-
ких у части видов; 3) стоматогенез обычно простого типа, мероте-
локинетальный — ротовое кольцо и тигмон образуются при деле-
нии из передних концов нескольких сомакинет.
ТИП CILIOPHORA. КЛАСС PROSTOMATEA
775
Кортекс большинства видов очень сложный, с хорошо разви-
тым слоем альвеол в виде четких продольных рядов прямоугольни-
ков или гексагонов; при импрегнации выявляется аргиром такого
типа, как у иассудид, пеникулид и гименостомат. Возможны от-
дельные исключения — погруженный тигмон у Prorodon mimeti-
etis, образование панциря у Colepidae, у которых кортикальные
альвеолы содержат углекислый кальций.
Сейчас в составе группы около 100 видов в основном в планк-
тоне пресных вод; часть из них (Prorodon viridis, Coleps spetai) мо-
;1<ст вызвать цветение воды при массовом развитии в планктоне.
Много видов в бентосе пресных вод и моря. Питание всеядное или
хищное; паразиты — род Cryptocaryon', известны случаи нападения
l/olophrya и Coleps на турбеллярий Vortex и планарий, аквариаль-
ных рыб, Prorodon sp. (ныне Holophrya) может поедать щупальца
гидр, но в основном хищники поедают одноклеточных. Облигат-
ный комменсализм (на китах) только у монотипического рода Hae-
matophagus.
Отряд Prostomatida Schewiakoff, 1896
(рис. 351, а—354, а)
Рот апикальный, тело симметричное, нет тигмо-
на — обособленных вершин или фрагментов кинет с
тесным сближением всех кинетосом. Сомакинеты про-
дольные, но кинетосомы часто ориентированы так, что
образуют вторичные ряды — серию кольцевых пара-
тен в добавление к стандартному для простомат апи-
кальному кольцу.
Сем. Apsiktratidae Foissner, Berger
et Kohmann, 1994
Свободноподвижные формы без секреции мукоз-
ной трубки или раковины, в остальном с диагнозом от-
ряда.
Род Apsiktrata Foissner, Berger
et Kohmann, 1994
Типовой вид Urotricha gracilis Penard, 1922.
Мелкие формы (до 65 мкм) с тонким вытянутым те-
лом; ядро с крупной кариосомой (интенсивно красится
центр ядра), вакуоль ниже ядра. Кинеты многочислен-
ные, но кинетосомы в рядах разрежены и в передней
половине тела образуют четкие поперечные кольца
(паратены), с их сгущением у апекса; только в апи-
кальном кольце видны дисомы, все остальные кинето-
сомы одиночные. Все кинеты биполярные, но некоторые
ряды подходят к нечеткому шву как сегменты между
биполярными рядами. Рот мелкий, с узкой длинной
глоткой. На постероне каудальная ресничка. В отличие
от типичных Urotricha, нет ацилона сзади (но положе-
ние кинетосом в постесоме хаотичное) и нет тигмо-
на — группы мембранелл по верхнему краю тела.
Сем. Metacystidae Kahl, 1926
Сидячие виды, не прикрепленные к субстрату, оби-
тают в мукозных прозрачных домиках (трубках). Все
сомакинеты биполярные, тигмона нет; кинетосомы ко-
ординированы, с образованием большого числа сома-
тических и ротовых поперечных колец (паратен).
Род Metacystis Cohn, 1866
Типовой вид М. truncatus (правильно М. trun-
catal). В составе рода значительное число пресновод-
ных и морских видов, живущих в тонкостенных пра-
вильных трубках (раковинах), открытых на вершине и
прирастающих широким плоским основанием к субст-
рату. Раковина может тесно прилегать к субстрату од-
ной стороной, но чаще вертикальная (вазообразная).
Тело тонкое, вытянутое, червеобразное, с нешироким
апексом, вздутое сзади в зоне Сократительной вакуоли.
Все тело в поперечных кольцевых желобках — это
многочисленные кольца ресничек (паратены), образо-
ванные при координированном расположении кинето-
сом большого числа продольных кинет; кортекс между
кольцами продольно исчерчен (фибриллы кинет). На
апексе обособленные группы ресничек, направленные
вперед и образующие примитивный фильтрационный
аппарат; всегда есть краевая дикинета (кольцо парных
кинетосом), и в дополнение к ней могут быть еще не-
сколько колец двойных кинетосом. Реснички всего
тела вне этих колец одиночные; экструсом нет; глотка
тонкая, фибриллярная. Особи свободно подвижны
внутри домика.
Примеры видов — М. striata Stokes, 1893; М. crassa
Gourret et Roeser, 1886 (= M. truncata var. crassa)',
M. recurva Penard, 1922; M. tesselata Kahl, 1926; M. exi-
gua Penard, 1922; M. lagenula Penard, 1922 (вид с зоо-
хлореллами); M. daphnicola Penard, 1922 (не симбион-
ты дафний, несмотря на название вида); М. annulata
(= Vasicola annulata Stokes, 1895); M. elongata Kahl,
1928; M. tekirghiolica Tucolesco, 1962; M. truncata T.,
1962; M. папа T., 1962; M. agigeana T., 1962; хорошо
изучены при импрегнации виды М. striata и М. tessela-
ta. У М. striata кроме типичной апикальной дикинеты
имеется и добавочная поликинета, образующая второй
более мощный фильтрационный конус. В море на во-
дорослях Мексики обычен вид М. borrori Aladro-Lubel
et Martinez-Murillo, 2003, ранее принимавшийся за
М. truncatum.
Род Haematophagus Woodcock et Lodge,
1920
Род часто датируют 1921 г.
Типовой вид Н. megapterae, симбионт усатых
китов разных видов; типовой хозяин — горбач Megap-
tera novaeangliae (М. nodosa) в Новой Зеландии. Тро-
фонты в массе обитают на пластинках китового уса —
на фильтрационном аппарате хозяина. Род при перво-
описании был отнесен к стенторидам (Heterotrichida),
но это типичные простоматы, возможно смесь 2—
3 разных видов, судя по очень резким различиям в ве-
личине трофонтов и их домиков. Трофонты достигают
в длину 600 мкм, отдельные гиганты до 1.5 мм; конту-
ры тела волнистые от большого числа кольцевых ки-
нет; рот широкий, с длинной фибриллярной глоткой.
Каль (Kahl, 1932) упоминает вид как Metacystis megap-
terae n. sp. (правильнее n. comb.) и фактически ликви-
дирует род Haematophagus, поскольку нет очевидных
различий на уровне рода. Импрегнация трофонтов
проведена в США Смоллом, но пока опубликованы
776
ALVEOLATA
Рис. 351, a. Prostomata.
Vasicola ciliata (А, Б, O); Pelatractus grandis (E, Ж, 3); Plagiocampa difficilis (В—Д)-, Pseudobalanion (ныне в составе Balanion)planctonicum (И—Л)\ Longifrag-
ma obliqua (M, H). (По: Dragesco et al., 1974 (А, Б, E—3, Я); Foissner, 1981b (B—Д); 1984b (Л, ЛЦ; Foissner, Oleksiv, Muller, 1990 (И, К, Л}).
Fig. 351, a. Prostomata.
только тезисы доклада. Вид обитает в трубчатых доми-
ках разной длины и толщины, в зависимости от разме-
ров трофонта. На пластинах китового уса много также
колониальных перитрих.
Род Pelatractus Kahl, 1931
Типовой вид Vasicola grandis Penard, 1922. Не-
крупные простоматы с широким телом, без каудаль-
ной реснички и каудального кармана, вздутого участка
тела у постерона без ресничных колец на уровне ваку-
оли, имеющегося у Metacystis. Есть и ряд других важ-
ных отличий — рот очень широкий, по периферии с
4—5 ресничными кольцами, обособленными от осталь-
ной цилиатуры; верхнее кольцо с дисомами, нижние с
моносомами. Кинетосомы в рядах не разрежены, рас-
положены парами вдоль рядов, образуют множество
тесно сближенных кольцевых паратен вплоть до ниж-
него конца тела. Импрегнация по Шаттону выявляет
дисомы и аргентофильное тельце между дисомами в
ряду, но импрегнация протарголом показывает лишь
ресничные моносомы. Раковинка отмечена не всеми
авторами, возможно образуется факультативно у части
особей.
Род Vasicola Tatem, 1869
Типовой вид V. ciliata, пресноводный перифи-
тонный вид, всегда в трубчатых домиках. Раковина
очень широкая у основания, сужается к вершине; зоо-
ид контактирует с дном раковины длинной каудальной
ресничкой, апекс клетки поднят над устьем. Размеры
тела до 90 мкм; тело веретеновидное, с 86—92 вплот-
ную сближенными продольными кинетами, кинетосо-
мы в которых расположены на одном уровне и образу-
ют поперечные кольцевые паратены. Глотка двойная, с
наружным и внутренним опорным аппаратом в виде
длинных фибрилл. Вокруг рта кольцо безресничных
аргиросом, дающих начало немадесмам, дикинета и
тетракинета — широкая ресничная полоса; в сомаки-
ТИП CILIOPHORA. КЛАСС PROSTOMATEA
777
Рис. 351, б. Prostomata.
Pelagovasicola cinctum (A—Г); Pelagovasicola sp. (Д, E); Cyclotrichium brunneum (Ж, 3). (По: Foissner et al., 1999 (Л—Г)‘, Оболкина, 19956 (Л—Д)).
Fig. 351, б. Prostomata.
нетах кинетосомы разрежены, расположены парами и
образуют 13—16 кольцевых паратен. При импрегна-
ции методом Шаттона видны пары аргиросом, но при
импрегнации протарголом выявляются моносомы с
одиночными ресничками. На постероне группа кау-
дальных ресничек.
Хорошо изучены V. ciliata Tatem, 1869, V. picta
Groliere, 1976; другие виды — V. procera Tucolesco,
1962, V. vesiculata T., 1962, V. parvula Kahl, 1928,
V. brevis T., 1962, V. lutea Kahl, 1930 и др.
Отряд Prorodontida Corliss, 1974
(рис. 351, a—354, a)
Рот апикальный или субапикальный, округлый
или редко щелевидный; цилиатура усложнена, кроме
продольных кинет имеются специализированные уча-
стки или обособленные фрагменты на одном из краев
тела, разного положения по отношению к оси тела,
разной формы, обычно на поверхности тела, у одного
вида в ямке. Эти органеллы с короткими щетинковид-
ными ресничками иногда называют ротовой цилиату-
рой, но это, скорее всего, тигмотактический аппарат,
сигнализирующий о субстрате (сокращенно «тиг-
мон»). При делении тигмон воспроизводится вершина-
ми кинет на вентральной стороне тела. Имеются ток-
сицисты в кортексе и немадесмы в стенке глотки. Из-
вестно много видов в планктоне и бентосе пресных вод
и морей.
Сем. Balanionidae Small et Lynn,
1985
Тело широкое, срезано поперек на плоском антеро-
не, с большим числом кинет разной длины; тигмон
в отличие от других простомат расположен между
ртом и первым кольцом ресничек. Морской и прес-
новодный планктон.
Род Balanion Wulff,
1919
Типовой вид В. comatum, описан в пробе мор-
ского планктона. Тело грушевидное, с цефализацией,
расширено медиально; глотка до четверти длины
тела; сзади одна каудальная ресничка. Кинетом не изу-
чен, показаны длинные густые реснички по крям тела,
нижняя четверть тела без цилиатуры, кроме каудалии.
В принципе род с таким видом невалиден. В Guide
(Small, Lynn, 2002) изображен без описания морской
вид с другой- формой тела и цилиатурой — имеется
краевое кольцо и поликинета, не показана сомати-
ческая цилиатура; едва заметные полоски кинето-
сом (тигмон) расположены между ртом и кольцом. По-
казана инфрацилиатура по всему телу, но без рес-
ничек.
778
ALVEOLATA
Рис. 352, a. Prostomata.
Kotinia (= Alexandria, гомоним) affinis (AV. К. (Л.) heterolobata (B); Baikalocoleps quadratus (Б); Plagiopogon loricatus (Г.Д)', Coleps elongatus (Ж)\ C. nolandi
(3-Ky, C. similis (Л)-, C. spetai (M). (По: Оболкина, 1995a (A—B\, Czapik, Jordan, 1976 (Г, Д, JT); Foissner et 1999 (Ж—К, M)).
Fig. 352, a. Prostomata.
Род Pseudobalanion Foissner, Oleksiv
et Muller, 1990
Типовой вид P. planctonicum из пресных вод. В
первоописании не нашли мелких органелл тигмона, но
в электронном микроскопе выявили такие фрагменты
у внутреннего края «ундулирующей мембраны» (пер-
вого кольца дисом). Поэтому позже сам Фойсснер лик-
видировал этот род как синоним рода Balanion. Но это
решение спорное — типовой вид В. comatum совер-
шенно не изучен, вероятно, не имеет широкой апикаль-
ной площадки; неизвестна топография кинет, реснич-
ных колец (если они есть), рудимента тигмона. Пока
не изучен данный вид, род Pseudobalanion валиден.
Р. planctonicum — мелкая бочонковидная цилиата с
длинной каудальной ресничкой (достигает длины
тела), широким плоским апексом, окруженным одним
кольцом дисом по краю тела. Кинеты в продольных ря-
дах, длиной до 2/3 длины тела; постерон без ресничек,
кроме каудалии. Кортекс с ребрами вдоль кинет. Рес-
нички парные, с порой экструсомы в основании.
Сем. Colepidae Ehrenberg, 1838
Тело овальное или бочонковидное, концы тела сре-
заны поперек, обычно с шипами. Кинеты продольные,
рот апикальный, глотка с немадесмами и экструсома-
ми. Кортекс прочный, панциревидный, узорчатый,
прочные пластинки образованы карбонатом кальция.
Тигмон — группа мелких фрагментов у переднего конца
тела. Планктон, бентос и псаммон пресных вод и моря.
Род Coleps Nitzsch, 1827
С признаками семейства; род часто датируется
1817 г. Типовой вид Cercaria hirta Muller, 1786 {Coleps
hirtus), обычный пресноводный вид с подвидами hirtus
Muller и viridis Foissner (с зоохлореллами). Вид обычно
разводится в пробах воды из прудов, легко переносит
плохие условия, питание хищное и гистиотрофное;
можно разводить вид в чашках Петри на высушенных
мелких беспозвоночных, например олигохетах.
ТИП CILIOPHORA. КЛАСС PROSTOMATEA
779
Рис. 352, б. Prostomata.
Prorodon ovum (A—Г); vHolophrya ovum» (Д)', Longifragma obliqua (E—И); Prorodon sp. (К, JT). (По: Оболкина, 19956 (3, И, К, Л)', Augustin, Foissner, 1992
(А—Г); Foissner, 1984b (£, Ж)\ Dragesco, Dragesco-Kerneis, 1986 (Д)).
Fig. 352, 6. Prostomata.
При импрегнации протарголом и просветлении в
бальзаме, когда узорчатый панцирь не мешает осмотру
кинетома, видны немногочисленные продольные ряды
с разрозненными кинетосомами, с четкой координа-
цией по горизонтали (типичные паратены); у вершины
тела на краю зубчатого панциря расположено незамк-
нутое кольцо дисом и кольцевая поликинета, между
ней и ртом 3 короткие дикинеты (тигмон). Рот с хоро-
шо видимыми тонкими очень длинными немадесмами,
передний край тела с токсицистами по периметру.
Ядро овальное, вакуоль у постерона; задние шипы пан-
циря крупнее передних. Панцирь состоит из пласти-
нок, обычно по 4 в продольных рядах, 2 средние круп-
нее терминальных; у концов тела мелкие кольцевые
пластинки; сложный рельеф пластинок видоспеци-
фичен.
Род распространен в основном в пресных водах,
реже в море; примеры видов — С. remanei Kahl, 1933;
С. bicuspis Noland, 1925; С. viridis Ehr., 1838; C. uncina-
tus Claparede et Lachmann, 1859; C. trichotus Savi, 1913;
C. arenicolus Dragesco, 1965; C. tesselatus Kahl, 1930;
C. spiralis Noland, 1937; C. pulcher Spiegel, 1926; C. oc-
tospinus Noland, 1925; C. kenti Bhatia, 1922; C. hetera-
canthus Noland, 1937; C. elongatus Ehr., 1833;
C. amphacanthus Ehr., 1833; C. arenarius Bock, 1952;
C. grandis Vacelet, 1961 (до 180 мкм, крупнее параме-
ций); С. lacustris Faure-Fremiet, 1924; С. nolandi Kahl,
1930; C. similis Kahl, 1933; C. spinosus Vacelet, 1961;
C. spetai Foissner, 1984 и др. При большом числе видов
роды обычно делят на подроды; в пределах рода разли-
чимы группы С. hirtus, С. nolandi и С. pulcher с разным
орнаментом панциря.
Родовые синонимы:
Cricocoleps Diesing, 1866. Типовой вид Coleps amp-
hacanthus Ehr. 1833.
Dictyocoleps Diesing, 1866. Род предложен для 6 ви-
дов — Coleps hirtus, С. elongatus, С. viridis, С. uncina-
tus, C. inermis, C. fusus с диагнозами из старой литера-
туры; общий признак — сетчатый панцирь. Если ука-
зать как тип рода последний вид, всеми признанный
род Tiarina уйдет в синонимику; один из видов — тип
рода Plagiopogon Stein, 1859. Поэтому как типовой вид
здесь указывается С. hirtus Nitzsch, и род Dictyocoleps
становится невалидным.
780
ALVEOLATA
Рис. 353, a. Prostomata. (По: Foissner et al., 1999).
Pelagothrix chlorelligera (A—E); Bursellopsis (Bursella, гомоним) spumosa (Ж, 3); Bursellopsis truncata (И, K).
Fig. 353, a. Prostomata.
Pinacocoleps Diesing, 1866. Типовой вид Coleps in-
curvus Ehr., 1833. Роды колепид различали по орна-
менту панциря — только поперечные кольца (Coleps
amphacanthus), только продольные ребра (С. viridis),
клетчатый панцирь у остальных видов. Дизинга вве-
ли в заблуждение примитивные рисунки прежних
авторов с неправильно показанным панцирем ко-
лепид.
Род Nolandia Small et Lynn,
1985
Типовой вид Coleps nolandi Kahl, 1930. Bo
всем, как типичные Coleps, за исключением одной де-
тали — на рисунке в Guide показаны 3 мелких фраг-
мента тигмозоны, расположенные точно по оси тела, а
у С. hirtus они расположены диагонально. По Фойс-
снеру с соавт. (Foissner et al., 1994), — это ошибка, у
С. nolandi положение фрагментов типичное для рода,
нет оснований для выделения вида в особый род.
Род Planicoleps Dragesco
et Dragesco-Kerneis, 1991
Типовой вид С. psammophilus из пресноводно-
го псаммона в Африке, вероятный эндемик озера Тан-
ганьика. Крупный плоский вид с вытянутым телом, по-
лимеризацией кинет, состоящих из дисом; по краям
широкого плоского рта кольцо пектинелл и тигмон из
коротких поперечных фрагментов. Только одна кине-
тосома в паре несет ресничку. Увеличено число плас-
тинок панциря; глотка с многочисленными длинными
немадесмами; по телу рассеяны токсицисты.
Род Baikalocoleps Obolkina,
1995
Типовой вид В. quadratus, эндемик из псаммо-
на Байкала. Очень широкие плоские формы с особо
развитыми продольными ребрами панциря, в желоб-
ках между которыми расположены ряды парных кине-
ТИП CILIOPHORA. КЛАСС PROSTOMATEA
781
Fig. 353, 6. Prostomata.
Рис. 353, б. Prostomata.
Placus antarcticus (Л—3); P. striatus (И—М). (По: Petz et al., 1995 (A—Ж)\ Dragesco, 1963a (Й); Fryd-Versavel et al., 1976 (AT); Patsch, 1974 (К, JI)).
тосом. В рядах по 4 пластинки, концы панциря с зубца-
ми и шипами; рот и короткая глотка с немадесмами не-
сколько погружена, у рта 3 пектинеллы тигмона, также
из парных кинетосом; положение их, вероятно, почти
поперечное.
Род Kotinia Obolkina in Aescht,
2001
Типовой вид Alexandria arcuata Obolkina,
1995. Название Alexandria — гомоним, поэтому заме-
нено новым. Плоские широкие листовидные формы с
большим числом кинет и пластинок панциря, по 6 в
продольных рядах; топография кинетома усложнена,
имеются швы у концов тела. Антерон вогнутый, рот с
короткой глоткой, вокруг рта почти замкнутая дикине-
та, поликинета и тигмон из 5 поперечных фрагментов
в бисекантном (зеркально симметричном) шве. При
осмотре в электроскане четко видны только высокие
продольные ребра и глубокие ресничные желобки
между ними, плохо выражены поперечные желобки.
Второй вид К. heterolobata comb. n. (Alexandria in Ob.,
1995). Этотвид и К. afflnis comb. n. (= Alexandria affinis
Ob., 1995) — эндемики из псаммона сублиторали юж-
ного Байкала.
Род Tiarinella Obolkina, 1995
Типовой вид Т. gracilis из псаммона Бай-
кала — узкие вытянутые веретеновидные формы с
цефализацией и длинным хвостовым отростком; пар-
ные кинетосомы собраны в кольцевые паратены;
рот мелкий, глотка узкая и длинная; вокруг рта ради-
ально расположенные ряды пектинелл и тигмон из
3 продольных фрагментов. Концы тела с длинными
шипами.
Род Macrocoleps Obolkina,
1995
Типовой вид М. aculeatus, четвертый эндемич-
ный род из толщи песка в сублиторали Байкала. Особи
вытянутые, огурцевидные, с относительно небольшим
числом кинет (из парных дисом) простой топографии;
пластинки панциря многочисленные по ходу кинет;
глотка узкая и длинная, рот окружен длинными ра-
диальными пектинеллами. Тигмозона с 3 поперечны-
ми фрагментами. Список эндемиков байкальского
бентоса этим не исчерпан, открыты (но не опубликова-
ны) новые эндемичные колепиды и цилиаты других
отрядов.
782
ALVEOLATA
Рис. 354, a. Prostomata.
Urotricha halteriformis (А, E); U. armata (В, Г)\ U. valida (Д, E); «Urotricha!» simonsbergeri (X); U. faurei (И—Л)', Longifragma oblique (3); U. armata (M). (По:
Оболкина, 19956 (M): Ковальчук, Бабко, 1989 (А, Я); Foissner, 1984b (В, Г, 3); Song, Wilbert, 1989 (Д, Е); Dragesco et al., 1974 (И—JTy, Foissner et al., 1999 (Ж)).
Fig. 354, a. Prostomata.
Род Plagiopogon Stein, 1859
Типовой вид Holophrya coleps Ehr., 1831 по мо-
нотипии; синоним, по Аэшт, — Spathidiopsis. По Калю
(Kahl, 1933), Штейн неправильно определил свой мор-
ской вид как пресноводный вид Эренберга {Plagiopo-
gon coleps), поэтому Каль заменил это название но-
вым — Plagiopogon loricatus Kahl, 1933. Ранние авто-
ры считали правильным название Coleps inermis Perty,
1852, но это тоже пресноводный вид. По описанию
ряда авторов, тело овальное, с каудальной ресничкой;
кинеты многочисленные, панцирь подразделен на мел-
кие пластинки примерно одинаковых размеров, каж-
дая с одной ресничкой в выемке слева; имеется
12—16 кинет и рядов пластинок, по 20—22 в ряду;
пластинки прямоугольные, не закругленные, без выем-
ки, показанной у одной из рас вида. Вид требует по-
вторного изучения.
Род Tiarina Bergh, 1881
Типовой вид Coleps fusus Claparede et Lach-
mann, 1859. Независимо от Берга род вторично предло-
жен как новый — Stappersia Meunier, 1910, с типом
S. fusus sp. п. (не для вида Coleps fusus, совпадение на-
званий случайное). Каль (Kahl, 1930) считал, что эти
авторы изучили разные виды рода, и поэтому для избе-
жания гомонимии обозначил второй вид как Tiarina
meunieri Kahl, 1930. Вид Coleps fusus был ранее вклю-
чен в состав нового рода Dictyocoleps Diesing, 1866, но
не обозначается как типовой вид последнего, посколь-
ку восстановление давно забытого названия не будет
принято.
Т. fusus (правильно T.fusal) — морской планктон-
ный вид с узким вытянутым телом, заостренным у по-
стерона; антерон несколько расширен, рот погружен в
атриум, узкая готка с немадесмами; кинеты немного-
численные, простой топографии, биполярные, у рта
широкие пектинеллы в полукольце и 3 почти продоль-
ТИП CILIOPHORA. КЛАСС PROSTOMATEA
783
Рис. 354, б. Plagiopylida.
Sonderia sinuata (Л, Бу, S. labiata (В—Д). (По: Dragesco, 1968с (Л); Dragesco, Dragesco-Kemeis, 1986 (5); Faure-Fremiet, Tuffrau, 1955 (В—Д)).
Fig. 354, 6. Plagiopylida.
ные тигмокинеты. Кортекс панциревидный, со слож-
ным орнаментом; концы тела с шипами, панцирь раз-
делен желобками на 5 поперечных сегментов с разным
рельефом. Есть данные о том, что это сборный поли-
морфный род, но пока известен только типовой вид,
подвид Т. fusus var. minor Hada, 1970 величиной всего
15 мкм (в норме до 105 мкм) и Т. antarctica Hada, 1970.
Описан случай массового развития вида и цветения
морской воды (с коричневой окраской) у берегов Нор-
вегии, хотя обычно такое цветение вызывает просто-
мата Myrionecta rubra.
Сем. Holophryidae Perty, 1852
Овальные не сплющенные формы из планктона и
бентоса пресных вод. Тигмокинеты четкие, автоном-
ные, не являются модификацией вершины группы ки-
нет; нет панциря; соматическая цилиатура полная, без
участков ацилона, число кинет обычно велико.
Род Holophrya Ehrenberg,
1831
Типовой вид Н. ovum, по обозначению Фро-
ментеля (Fromentel, 1874). Обычно в литературе Ho-
lophrya считалась наиболее простой цилиатой, без тиг-
мокинет, с простой топографией биполярных кинет
без тигмозоны, но таких видов в составе рода нет. Тип
рода и близкие виды имеют каплевидное тело, мелкий
апикальный рот, сложную систему немадесм глотки
(фибриллы отходят от 2 ресничных колец); ядро с ярко
красящейся эндосомой. Кинеты многочисленные, поч-
ти все биполярные, но часть рядов спереди подходит
ко шву, а у постерона положение кинетосом может
быть хаотичным. Обычно имеются 3 длинные тиг-
мокинеты с тесно сближенными кинетосомами в зо-
не уни- или бисекантного шва. В тигмоне нет корот-
ких параллельных фрагментов кинет в отличие от
Urotricha.
Типовой вид в литературе относили к роду Proro-
don — Р. ovum, и этот вид был «представителем» рода;
диагноз Holophrya был неясным и спорным. Обозначе-
ние вида как типового для рода Holophrya Фроменте-
лем прошло незамеченным (кстати, сам Фроментель
отрицал валидность рода Holophrya}, так же как и ука-
зание им аберрантного вида Р. niveum как тип рода
Prorodon (это означает ликвидацию рода Pseudoproro-
don с типом Р. niveum). Сейчас к Holophrya относят
лишь несколько видов, размножающихся в цистах де-
ления, с нечеткими кортикальными альвеолами, с ко-
сым положением тигмокинет, четко обособленных от
сомакинет. Примеры видов (часть из них может отно-
ситься к Prorodon) — Н. spirogyrophaga (Leipe, 1989);
Н. salinarum Foissner, Agatha et Berger, 2002; H. gracilis
Penard, 1922; H. atra Svec, 1897; H. kessleri Mereschk.,
1879; H. nigricans Lauterborn, 1894; H. carchesii Canel-
la, 1964; H. africana Dragesco, 1965; H. caspica Agama-
liev, 1966; H. vorax Dragesco, 1960 и др.
Род Pleurofragma Jankowski,
1976
Боррор (Borror, 1963) описал морской вид Prorodon
mimeticus Kahl, 1930 при импрегнации серебром; это
крупная форма с вытянутым телом, серией вакуолей,
большим числом кинет; ниже рта имеется ямка с обо-
собленными фрагментами подходящих к ее краю
784
ALVEOLATA
10—И сомакинет, уникальная форма тигмона у про-
стомат. Совсем иначе рисуют кинетом вида Смолл
и Линн (Small, Lynn, 1985): имеется около 15 попе-
речных тигмотактических дикинет в виде длинной
ленты, справа кинеты продольные, слева большое чис-
ло кинет подходит ко шву, фрагменты не являются
продолжением сомакинет. Нужно повторное изучение
вида.
Вид Prorodon mimeticus послужил типовым для
3 родовых названий — Pleurofragma Jankowski, 1976;
Oldesloeria Foissner, 1983 и Mimeticus Small et Lynn,
1985. В литературе принято первое название по прио-
ритету, в частности в каталоге родов Аэшт, с замеча-
нием «по моему мнению, содержится в неопублико-
ванной работе, однако было принято (validated) Фойс-
снером». Все новые названия в тезисах Аэшт не
признает, поэтому нужно отказаться от этого названия
и принять для рода второе — Oldesloeria Foissner, 1983
(О. mimetica).
Род BurseZ/ops/s Corliss, 1960
Типовой вид Bursella spumosa Schmidt, 1921;
как гомоним, родовое название заменено новым. Кор-
лисс (Corliss, 1960) включил в состав рода также
В. gargamellae (Faure-Fremiet, 1924), В. truncata Kahl,
1927 и В. oligobursa (Gelei, 1954), но последний вид —
это фаза в цикле развития кольподиды Bursaria.
Тип рода — пресноводный планктонный вид с
мешковидным несимметричным телом, крупным
ртом и широкой глоткой, вакуолярной цитоплазмой;
кинеты полимеризованы, число рядов необычайно
велико и топография нарушена, имеется длинный шов
правее рта. Величина особей 240—560 мкм; это все-
ядный вид, характерный для холодных вод; массовое
развитие наблюдалось мною при летнем прогреве
прибрежных вод ледяного Байкала до 12 °C. При
столь большом числе кинет трудно найти тигмоки-
неты; вероятно, это полоса кинетосом на краю высту-
па тела.
Род Rondostoma Jankowski,
1976
Типовой вид Holophrya gargamellae Faure-Fre-
miet, 1924; по Фойсснеру (Foissner et al., 1999), это си-
ноним валидного вида Bursellopsis nigricans. По Аэшт,
«название содержится в неопубликованной работе» (в
тезисах конференции). Название вида В. gargamellae
принято большинством авторов, иногда в составе Pro-
rodon.
Тело типового вида почти сферическое, симмет-
ричное, нет растяжения рта и нет выступа тела спереди
сбоку, поэтому можно выделить хотя бы подрод в со-
ставе Bursellopsis — В. (Rondostoma subgen. n.) garga-
mellae с указанными отличиями от типа рода В. spumo-
sa. Кинеты полимеризованы и у В. gargamellae, имеет-
ся унисекантный шов, вдоль которого расположены
3 ряда дисом, не являющиеся вершинами укороченных
кинет. Такой же комплекс имеется у Bursellopsis pela-
gica с овальным ртом. Если верна синонимия Фойссне-
ра, типовой вид нового подрода — Bursellopsis
(Rondostoma) nigricans (Lauterbom, 1908 in Holophrya).
К подроду можно отнести и В. truncata (Kahl, 1927 in
Holophrya) (= В. spaniopogon Hiller, 1991).
Сем. Lagynidae Sola, Guinea, Longas
et Fernandez-Galiano, 1990
Тело грушевидное, вздутое спереди, сужено и оття-
нуто сзади; вокруг апикального рта обычная дикинета
и кольцо трикинеты; тигмокинеты почти редуцирова-
ны, едва заметны (несколько кинетосом) на участке
между 2 ротовыми кольцами.
Род Lagynus Quennerstedt,
1867
Типовой вид Lacrymaria elegans Engelmann,
1862; род долгое время не признавался, но сейчас вос-
становлен и, более того, выделен в новое сем. Lagyni-
dae. Тело вытянутое, 37—46 кинет в продольных ря-
дах, но кинетосомы собраны в поперечные кольцевые
паратены по всему телу; оттянутый плоский постерон
занят крупной вакуолью, спереди тело в глубоких по-
перечных желобках, кажется складчатым. Глотка с не-
мадесмами. Циклонема — корокие косые сегменты ки-
нет, каждый с 3 кинетосомами; тигмон — 3—4 группы
по 4—6 щетинок; от краев рта отходят немадесмы,
связанные между собой фибриллами. Сложная сино-
нимика типового вида приведена в определителе Каля
(Kahl, 1930); одно из названий — Lacrymaria (Lagynus)
laevis in Butschli, 1889. Примеры видов—L. verrucosus
(хорошо изучен при импрегнации), L. ornatus Stokes,
1893 и др.
Сем. Placidae Small et Lynn,
1985
Внешний вид, как у Prorodon и Holophrya, рот апи-
кальный, кинеты слегка спиральные; тигмозона — ли-
ния дисом, идущая назад от циркуморальной дикине-
ты; имеется характерная для рода ямка в антесоме, ве-
дущая в канал неясного назначения.
Род Placus Cohn, 1866
Типовой вид Р. striatus по монотипии, с при-
знаками семейства. Рот широкий, с непропорциональ-
но крупной глоткой, укрепленной немадесмами. Ки-
неты многочисленные, извитые, подходят ко рту под
разными углами; кинетосомы в рядах вплотную сбли-
жены, четко видны поперечные фибриллы между ря-
дами. От рта к полости идет дикинета, не нарушая то-
пографию соматических рядов (без шва); 2 ряда про-
должаются ниже этой загадочной органеллы. Морской
род, редко встречается в пресных водах; хорошо изу-
чен многими авторами.
ТИП CILIOPHORA. КЛАСС PROSTOMATEA
785
Род Spathidiopsis Fabre-Domergue, 1889
(Nec Spathidiopsis Kahl). Типовой вид S. socia-
lis. По наличию каналовидной органеллы и очень
длинной тигмокинеты, идущей вдоль ротовой щели и
далее вниз, легко отождествить этот род и Placus, но
вид валидный и сейчас хорошо изучен.
Род Thoracophrya Kahl, 1926
Типовой вид Т. luciae, род установлен для
2 пресноводных видов, позже добавлены 2 морских
вида. По всем признакам это типичный Placus, поэто-
му вид валидный, а род неприемлем как синоним.
В итоге в составе Placus можно различить несколько
валидных видов и ряд синонимов — Р. buddendrocki
(Sauerbrey, 1928 in Thoracophrya)-, Р. dogieli Borkovsky,
1970; P. eforianus Tucolesco, 1962; P. luciae (Kahl, 1926
in Thoracophrya)-, P. ovum (Kahl, 1926 in Thoracophrya)-,
P. salinus Dietz, 1964; P. socialis (Fabre-Domergue, 1889
in Spathidiopsis)-, P. striatus Cohn, 1866; P. gracilis
(= Thoracophrya luciae var. gracilis Kahl, 1928); P. sulcatus
Mansfeld, 1923; P. longinucleatus Song et Wilbert, 1989;
P. antarcticus Petz, Song et Wilbert, 1995. Пока нет
оснований для разделения рода на подроды. Сходный
кинетом у Holophrya sulcata Penard, 1922, но не показа-
на боковая ампула. Род Baznosanuia Tucolesco, 1962 с
типом В. папа может быть мелким видом Placus.
Сем. Plagiocampidae Kahl, 1926
Ротовая дикинета в виде полукольца; с дорсальной
стороны на апексе с одной стороны от рта находятся
сократимые выросты, несущие токсицисты; тигмоки-
неты расположены на правой стороне вента в линии,
почти параллельной краю рта. Мелкие виды из почвы
и пресных вод.
Род Plagiocampa Schewiakoff,
1893
Типовой ви д Р. mutabilis (Р. mutabile) по моно-
типии; лучше изучены почвенный вид Р. difficilis,
планктонные виды Р. rouxi, Р. ovata и др. Тело мелкое,
овальное или каплевидное, ядро с кариосомой, кинеты
немногочисленные, кинетосомы разрозненные, ориен-
тированы в поперечных или диагональных паратенах;
сзади длинная каудальная ресничка (иногда 2); ниже
экватора кинетосомы разрежены и имеется значитель-
ный ацилон. У рта кинетосомы сгущаются, здесь мож-
но различить кольцо моносом (дающих немадесмы
глотки), кольцо дисом и такое же добавочное кольцо у
Р. ovata. На одной стороне рта расположены 3 мелкие
тигмокинеты, по другой стороне отходят крючковид-
ные придатки с токсицистами, сократимые при фикса-
ции. Это пример рода простомат, у которого тигмон
находится внутри ротового кольца, не прерывая его,
как локальное изменение вершин сомакинет. Арги-
ром — сеть продольных пентагонов, по 2 ряда между
смежными кинетами.
К роду можно отнести Р. mutabile Schew., 1893;
Р. incisa Kahl, 1933; Р. atra Grandori, 1934; P. acumina-
ta K., 1933; P. longis K., 1926; P. caudata Alekperov,
1993; P. macrostoma Tucolesco, 1962; P. binucleata T.,
1962; P. multiseta K., 1930; P. marina K., 1930; P. ovata
Gelei, 1954; P. rouxi K., 1926; P. metabolica K., 1930;
P. bitricha Foissner, 1999; P. namibiensis Foissner, Agat-
ha et Berger, 2002; P. pentadactyla F., A. et B., 2002;
P. difficilis F., 1981; P. posticeconica', P. margaritata и
др.; часть их плохо описана и неопределима.
Род Halterioforma Horvath,
1956
С одним видом Н. caudata — несомненно синоним
рода Plagiocampa, вид неопределим.
Род Plagiocampides Foissner, Agatha
et Berger, 2002
Типовой вид P. halophilus по монотипии, из
соленой почвы в Намибии и Коста-Рике. Тело мелкое
(до 40 мкм), овальное, с 13 извитыми кинетами; спере-
ди пучок мелких тонких циррусовидных токсофоров с
одной экструсомой в каждом. У рта почти замкнутое
кольцо дисом с сегментом тигмона (3 мелкие дикине-
ты); дифференцированы и вершины кинет ниже цикло-
немы. Аргиром простой — по 1 ряду прямоугольников
(аргироконтов) между сомакинетами. Фибриллярная
глотка растяжимая, может заглатываться массивная
добыча. Возможно выделение рода в новое семейст-
во, поскольку кортекс и аргиром такого типа, как у
Holophrya.
Род Chilophrya Pack, 1919
Типовой вид Ch. utahensis из США; этот вид
пока не изучен при импрегнации, но внешний облик,
как у предыдущего рода, это явно плагиокампида. Ки-
неты продольные, кортекс рельефный, ряды волнис-
тые, с бугорками; спереди у рта только 1 токсофор;
тело с зоохлореллами. Изучен кинетом другого вида
Ch. terricola Foissner, 1984.
Род Paraurotricha Foissner,
1983
Типовой вид Urotricha discolor Kahl, 1930.
Тело тонкое, узкое, гибкое, с 12—14 продольными ки-
нетами и обширным ацилоном сзади, с одной кауда-
лией; вокруг рта замкнутая циклонема с дисомами,
ниже сбоку тигмон из 3 поперечных фрагментов с
двойным рядом кинетосом в основании каждого; глот-
ка с немадесмами; кольцо мелких токсофоров с верши-
нами токсицист. Важный родовой признак — аргиром;
нет квадратов между рядами, но влево отходят корот-
кие линии (аргиронемы), не достигающие смежных
кинет. Есть и сплошая сеть мельчайших ячеек, особо
четкая на ацилоне.
5(1 Чик. №4163
786
ALVEOLATA
Сем. Prorodontidae Ehrenberg, 1834
Крупные пресноводные формы; рот растянутый,
глотка плоская, кинеты полимеризованы; околорото-
вая дикинета (циклонема) огибает рот и, не смыкаясь,
уходит далеко вниз в виде боковой тигмокинеты, не
фрагментируясь; образуется длинный шов, почти
до экватора, прерывающий несколько укороченных
сомакинет.
Род Prorodon Ehrenberg, 1834
С диагнозом семейства. Вероятно, единственный
род прородонтид. Раньше название рода ассоциирова-
лось прежде всего с некрупными пресноводными ви-
дами типа Р. ovum, Р. viridis, Р. teres с симметричным
телом, овальным или округлым ртом и 3 четкими кине-
тами тигмозоны. Типовым видом рода был указан
Р. teres (Kahl, 1930). Однако позже было замечено, что
Фроментель (Fromentel, 1874) указал как тип рода
аберрантный вид Р. niveus Ehrenberg, 1833, который
всеми был признан как типовой вид рода Pseudoproro-
don Blochmann, 1895. Это значит, что названный род
ликвидируется, a Prorodon становится монотипиче-
ским или включает также виды Р. pratensis Dingfelder,
1962 (с цепочковидным ядром и 3 рядами щетинок);
P.pluvialis D., 1962; Р. еттае (Bergh) (с гигантской
ротовой щелью и несколькими пучками трихитов;
сейчас переведены в новый род гапторид Bergho-
phrya)', Р. ellipticus (Kahl, 1930); P.foliosus Foissner.
При первоописании Эренберг включил 2 вида — Р. te-
res и Р. niveus (альтероним Р. compressus). Десятки ра-
нее включаемых видов должны найти новое место
в сравнении с типовыми видами родов Holophrya и
Prorodon.
Типовой вид рода Р. niveus — активые хищники,
массивные плоские формы с полимеризацией кинет,
подходящих со всех сторон к длинному щелевидному
рту и тигмокинете, почти достигающей экватора; ядро
тонкое, извитое, что редко у простомат; род легко уз-
нать при виде сбоку — имеется полоса длинных нема-
десм вдоль всей длины ротовой щели. Размеры особей
до 700 мкм, обычно 300—500 мкм; имеется до 200 ки-
нет; снизу ацилона нет, но положение кинетосом здесь
беспорядочное.
Виды прежнего рода Prorodon (в широком смысле)
необычайно разнообразны по типу тигмона и должны
разойтись по серии новых родов с 4 вариантами поло-
жения кинет и швов по отношению к тигмокинетам
(Hiller, Bardele, 1988); предстоит также проверить при-
годность синонимов для этих родов. Усложняет ситуа-
цию и то, что смежный род Holophrya считался прими-
тивной гименостоматой без тигмокинет, но она имеет
тигмон, типичный для исключенных видов Prorodon',
часть видов должна войти в состав Holophrya. За недо-
статком места ограничимся списком видов Prorodon,
не соответствующих типу Р. niveus: Р. ovum Ehrenb.,
1831 (= Holophrya discolor E., 1833, это стадия терон-
та — дериват деления); Р. viridis Kahl, 1927; Р. teres Е.,
1833; Р. cinctum Foissner, 1983; Р. bacilliferum Gelei,
1954; P. alditolophon Hiller et Bardele, 1988; P. taeniatus
Blochman, 1895; P. palustris Puytorac et Savoie, 1968;
P. nothus Canella, 1954; P. raabei Czapik, 1965; P. karia-
nus Meunier, 1910; P. binucleatus D., 1965 (гомоним);
P. africanus D., 1970; P. gabonensis D., 1966; P. nucleo-
latus Penard, 1922; P. pyriformis Groliere, 1976; P.fau-
re-fremieti Kovalchuk, 1980; P. marinus C. et L., 1858;
P. platyodon Blochmann, 1895 и мн. др. Prorodon sp. in
Obolkina, 1991 — вероятный эндемик Байкала, обозна-
чается здесь как Р. listvenis Jank. sp. п. (диагноз см.:
Оболкина, 1991) (рис. 352, б).
Род Paraprorodon Foissner, 1983
Типовой вид Prorodon morgani Kahl, 1930; ве-
роятно включает также Р. raabei Czapik, 1965 и Р. bi-
nucleatus Dragesco, 1965 (Р. africanus D., 1970) пес
Р. binucleatus Buddenbrock, 1920. Крупные цилиаты с
большим числом кинет; тигмокинеты у прородонтид
обычно прямые, в виде коротких фрагментов сомаки-
нет; у видов Paraprorodon тигмокинеты извитые. Так
они иногда выглядят у сжавшихся прородонов других
видов, поэтому значимость этого признака сомнитель-
ная; важнее то, что у Paraprorodon кинеты справа и
слева подходят под углом к тигмозоне и не идут вдоль
нее, как у 3 других морфотипов (Hiller, Bardele, 1988),
т. е. шов с тигмозоной бисекантный.
Сем. Urotrichidae Small et Lynn,
1985
Мелкие пелагические пресноводные виды без рес-
ничек на нижней трети или четверти тела, но обычно с
каудальной ресничкой; рот окружен стандартными для
прородонтид кольцами кинетосом, в одном месте пре-
рванными несколькими (обычно 3) косо расположен-
ными компактными дикинетами тигмона.
Род Rhagadostoma Kahl, 1926
Предложен Калем (см.: Kahl, 1930) для 2 видов —
R. nudicaudatum и R. completum, с подвидом R. comple-
tion var. candens. По Аэшт, типовой вид — R. comple-
tum «по оригинальному обозначению»; вторичное ука-
зание Калем как типа вида R. nudicaudatum недействи-
тельно. Каль ввел название как подрод в составе
Holophrya', сейчас принят родовой статус.
Род включает виды с неполным кинетомом — нет
цилиатуры над постероном, кроме группы каудальных
ресничек; кинеты полимеризованы, вокруг овального
рта кольцевая замкнутая дикинета; сбоку длинный
унисекантный шов с длинными тигмокинетами; ядро
извитое.
Род Dissothigma Jankowski, 1976
Типовой вид Urotricha saprophila Kahl, 1930
sensu Patsch, 1974. Род предложен для вида, опреде-
ленного как U. saprophila в книге Петч (Patsch, 1974), и
если название вида изменится, новое название будет
типовым видом. Однако название Dissothigma нева-
ТИП CILIOPHORA. КЛАСС PROSTOMATEA
787
нидно как предложенное в тезисах, поэтому валидным
становится следующее— Urotrichopsis Foissner, 1983,
хотя его считают синонимом. Действительным сино-
нимом становится третье название Patschia Small et
Lynn, 1985 с тем же типовым видом.
Внешний облик типичен для Urotricha, постерон с
группой каудальных ресничек, безресничная зона над
ним достигает 1/5 длины тела; кинеты продольные, но
нечеткие, кинетосомы в них разрежены; вокруг рта ко-
льцо дисом. По одной из сторон тела от рта до ацилона
идет полоса из 3 сближенных кинетосом в 13 попереч-
ных группах, каждая на уровне кинетосом соматиче-
ского ряда. Такой уникальный вид тигмона не встреча-
ется у других простомат и служит признаком валидно-
го монотипического рода.
Род Urotricha Claparede et Lachmann,
1859
Типовой вид U. farcta по монотипии, мелкий вид
(25—30 мкм) с 20—25 сомакинетами простой топогра-
фии; ацилон до трети длины тела. Пары кинетосом в
околоротовом кольце разрознены, кольцо не прервано
в зоне тигмона, составленного 3 косыми группами по
2—3 кинетосомы в каждой. Сзади одна каудалия
(у других видов от 1 до десятка).
С этим видом следует сравнивать все виды рода,
новые и старинные, изученные заново. Род неоднород-
ный, полиморфный по типу тигмона и, вероятно, дол-
жен быть разбит на подроды. Сейчас у цилиатологов
большой интерес к планктону, и почти все виды рода
изучены на протарголовых препаратах, имеются точ-
ные диагнозы и рисунки. В состав рода можно вклю-
чить виды U. valida Song et Wilbert, 1989; U. corlissiana
S. et W., 1989; U. globosa Schewiakoff, 1892; U. discolor
Kahl, 1931; U. armata K., 1927; U. halteriiformis Koval-
chuk et Babko, 1989; U. ovata K., 1926; U. faurei Drages-
co et al., 1974; U. venatrix Kahl, 1935; U. sphaerica Gro-
liere, 1976; U. apsheronica Alekperov, 1984; U. pelagica
K., 1935; U. castalia Munoz et al., 1987; U. matthesi Krai-
ner, 1995; U.furcata Sch., 1892; U. pseudofurcata Krai-
ner, 1995; U. agilis (Stokes, 1886 in Balanitozoonf
U. platystoma (Stokes, 1886); U. multisetosa'Wang etNie,
1934; U. dragescoi Foissner, 1984; U. baltica Czapik et
Jordan, 1975; U. atypica Alekperov, 1993; U. faurei Dra-
gesco et al., 1974; U. psenneri Sonntag et Foissner, 2004;
U. nais Munoz et al., 1987; U. ondina Munoz et al., 1989;
U. vitrea Martin-Gonzales et al., 1985; U. macrostomaFo-
issner, 1983; U. striata Penard, 1922; U. parvula?., 1922;
U. pusilia P., 1922 и др. По топографии кинет в зоне
тигмона и по форме тигмокинет следует выделить не-
сколько подродов.
Род Balanitozoon Stokes, 1886
Типовой вид В. agile S., 1886 был переведен
Калем (Kahl, 1930) в состав Urotricha, и это сейчас
принято; по организации вид вполне соответствует
диагнозу Urotricha. Тело широкое снизу, длиной всего
14—15 мкм, резко сужается и заостряется к апексу, с
1 каудалией и обширным ацилоном; в норме у уротрих
тело овальное. Второй вид В. gyrans S., 1887 по форме
тела (бочонковидное, сужается кзади) и небольшому
ацилону соответствует типичным уротрихам, вероятно
синонимичен с видами Urotricha farcta С. et L., 1859,
U. parvula Penard, 1922 и U. minkiewiczi Schouteden,
1906.
Urotricha simonsbergeri Foissner et al., 1999 — абер-
рантный вид, с полосой тигмокинет 2 типов; крупные
формы с полимеризацией кинет и небольшим ацило-
ном; рот окружен кольцом выступов с токсицистами.
Для вида можно установить новый подрод в составе
Urotricha, поскольку все остальные виды имеют 3 тиг-
мокинеты, иногда с рудиментом четвертой; у U. simon-
sbergeri 15—16 тигмокинет в длинной боковой поло-
се. Это типовой вид подрода Urotricha (Simotricha sub-
gen. n.).
Род Pelagothrix Foissner et aL,
1995
Типовой вид P. chlorelligera — пресноводный
планктонный вид с альвеолярным сетчатым слоем по
всему телу; мелкий округлый апикальный рот окружен
кольцом моносом и кольцом дисом; кинеты немного-
численные, сзади небольшой ацилон; тигмозона с
3 продольными рядами двойных кинетосом от рта до
середины тела. Второй вид Р. plancticpla F. et al., 1995,
практически без ацилона, с более четкими рядами тиг-
мокинет равной длины. В состав нового рода перене-
сен также третий вид Р. alveolata (Urotricha in Kahl,
1926). Аргиром у видов рода нетипичный — реснички
отходят не от каждой альвеолы, а через ряд в отличие
от Urotricha, Bursellopsis, Longitricha и Longifragma.
Деление не в цистах в отличие от Holophrya.
Род Longitricha Gajewskaja,
1933
Типовой вид L.flava. Пелагический вид из
Байкала с низким и широким телом (форма, нетипич-
ная для овальных уротрих), большим числом кинет,
ацилон занимает около 1/5 длины тела, реснички удли-
нены. Тигмон не был изучен, но судя по сходству фор-
мы тела Urotricha puytoraci Dragesco, Iftode et
Fryd-Versavel, 1974 близок или идентичен с ним. U. pu-
ytoraci имеет двойное кольцо дисом и внутреннее
кольцо кинетосом, образующих немадесмы. Тигмон —
3 очень мелких фрагмента. Вдоль первого кольца ди-
сом идет и кольцо моносом; вероятно это усложнение
и отсутствие каудальных ресничек — признак нового
рода, в остальном имеющего типичное для уротрих
строение.
Род Longifragma Foissner,
1984
Типовой вид Urotricha obliqua Kahl, 1926 хо-
рошо изучен в литературе, в частности по материалу
из планктона в оз. Байкал (Оболкина, 19956). Тело ши-
рокое, с крупным ртом и длинной фибриллярной глот-
788
ALVEOLATA
кой; кинеты полимеризованы (70—96, в зависимости
от размеров тела); швы у полюсов тигмозоны почти не
выражены; ацилон значительный, с 8—11 каудалиями.
Основной признак рода — дезорганизация 3 тигмоки-
нет, удлинившихся в узкой полосе вдоль кинет от рта
до ацилона. Выявляются не 3 коротких косых фраг-
мента с дикинетой в основании, как обычно у уротрих,
а серия дисом в разных сочетаниях вдоль всей тигмо-
зоны.
Сем. Cryptocaryonidae Wright et Colorni,
2002
Паразиты морских рыб со сложным циклом разви-
тия; трофонты под кожей рыб, томонты с множествен-
ным делением по схеме, отличающейся от пресновод-
ного рода Ichthyophthirius. С одним родом.
Род Cryptocaryon Brown, 1951
Типовой вид С. irritans по монотипии; позже
был описан вид Ichthyophthirius marinus Nie et Lee,
1960, синонимичный с C. irritans. Быстро растущая ли-
тература по виду заслуживает специальной моногра-
фии. Летальный тканевой гистиотрофный паразит
морских рыб в основном тепловодных и аквариаль-
ных, редок в холодных водах. Долгое время вид счита-
ли гименостоматой типа ихтиофтириуса (не вынося-
щего солености), хотя на рисунках и снимках вида чет-
ко был виден рот в виде широкого апикального
желобка, сужающегося и уходящего вбок. Имеется
около 50 биполярных кинет; ядро состоит из несколь-
ких крупных нодул в цепочке или независимых. Рото-
вая цииатура — кольцо пектинелл (мелких «цирру-
сов») вокруг рта, с рядом из 3 сближенных кинетосом
в основании каждой.
Размножение палинтомией в толстостенных много-
слойных цистах вне хозяина; первое деление резко не-
равное, затем делятся оба деривата и далее вновь до
образования множества мельчайших томитов, выходя-
щих из цисты (стадия теронта); процес начинается как
периферическая палинтомия. Жабры и кожа всего тела
зараженных рыб покрываются светлыми бугорками —
подкожными паразитами; по аналогии с ихтиофтириу-
сом в западной литературе принято обозначение whi-
te-spot disease. Фаза трофонта, заполненного клетками
тканей и гемоцитами хозяина, длится 3—5 сут, в цисте
множественное деление длится 5—10 сут. Девастация
молоди рыб в промысловых садках оборачивается
большим экономическим ущербом; методы профилак-
тики и лечения — на многих сайтах в Интернете. Оп-
тимальная температура для развития 19 °C, но есть не-
отличимые штаммы с развитием при 12—16 °C (най-
дены в Корее). Распространение вида пантермальное,
по берегам тепловодных морей (США, Китай, Япония,
Австралия и т. д.); пока нет находок в морях России.
Первые молекулярные анализы сближали вид с Colpo-
dea, но это ошибка; позже вид нашел место в классе
Prostomatea. Этот небольшой класс включает отряды
Prostomatida и Prorodontida; Cryptocaryon на филограм-
ме (Wright, Colorni, 2002) располагается ближе к Co-
leps, чем к Holophrya, тем самым показывая родство с
прородонтидами; переходная предковая форма неиз-
вестна.
Класс Со nt of г ag me a Jankowski, 1980
(= подкласс Plagiopylia Small et Lynn, 1985,
позже класс Plagiopylea S. et L., 1985 in Lynn, 2002)
Plagiopyla и близкие роды цилиат иногда относили к гетеро-
трихам, принимая серию фрагментов кинет за адоральную зону
мембранелл, но большинство авторов включали их в сборный от-
ряд Trichostomata по наличию ресничек у рта, не склеенных в мем-
браны и мембранеллы. Поскольку плагиопилы неродственны тем
трихостоматам, которые остались в составе отряда (например, Ba-
lantidium), дальнейшее их объединение невозможно. Для этой
группы родов независимо был предложен отряд Plagiopylida Jank.,
1978 (см/. Янковский, 1980. Р. 106) и отряд Plagiopylida Small et
Lynn, 1985. Первоначально у обоих авторов отряд включал только
плагиопилид, позже было показано родство с ними аберрантного
рода Trimyema неясного систематического положения, и сейчас
этот род включается в данный отряд. Итак, авторство отряда и под-
класса в схеме Линна (Lynn, 2002) указано неправильно.
Plagiopylidae в начальном составе (без Trimyema) получали
очень четкую характеристику, теперь же охарактеризовать под-
класс трудно — эти роды очень резко различаются по морфологии.
В системе Янковского (1980) тримиемы обособлены от других ци-
лиат в виде отряда Trimyemida неопределенного положения.
Первоначальный диагноз подкласса Contofragmina: «Сомати-
ческие кинеты, образуя краевые дифференцированные зоны вдоль
ротовой щели, аллометрически удлиняются и входят в глубокий
вестибулюм, продолжаясь без фрагментации на его стенках» (Ян-
ковский, 1980). У Trimyema кинеты и кинетосомы олигомеризова-
ны, не продолжаются в глубине перистома.
Диагноз класса Plagiopylea Small et Lynn, 1985 в Traite (Puyto-
rac, 1994. P. 259) (здесь подкласс поднят до класса): «Соматиче-
ские кинеты составлены монокинетидами. От участка, прилегаю-
щего к триплетам 2—3 каждой кинетосомы, отходит пучок микро-
тубул, представляющий собой трансверсальные фибриллы, на-
правленные вперед. Ротовая зона более или менее впячена внутрь
тела. Ее инфрацилиатура образована вершинами соматических ки-
нет, иногда с добавлением сегментов дополнительных кинет. Сво-
бодные виды, обычные в анаэробных средах пресных, морских или
солоноватых вод, или эндокомменсалы».
Диагноз полкласса Plagiopylia в Guide (Small et Lynn, 1985): «С
густой цилиатурой; обычны в анаэробных местообитаниях; сома-
тические монокинетиды уникальные, с дивергентным постцилиар-
ным пучком, хорошо развитой кинетодесмальной фибриллой, от-
ходящей от триплетов 6, 7 и направленной вперед; необычный пу-
чок микротубул возникает из сгустка вещества около триплетов 2,
3 и идет вперед или назад (не выяснено); исчерченная полоса на
правой стороне образуется у правого края ротовой полости; рото-
вые реснички частично являются удлинением кинет тела, которые
идут внутри и вдоль стенки ротовой полости; ротовая полость об-
разует неглубокий желобок, со ртом у основания глубокого труб-
чатого кармана, с рядами ротовых ресничек; много экструсом типа
мукоцист в кортсксс тела. 1 отряд, 2 семейства». С включением
Trimyema значительная часть признаков, например наличие исчер-
ченной полосы вдоль края тела, исключена из диагноза. Итак, при
выделении отряда и подкласса, а теперь класса (в системах Пюйто-
рака и Линна) основной акцент делается на ультраструктуру — на
паттерн соматических кинетосом и их дериватов.
Молекулярные данные бесспорно показывают родство Plagio-
pyla и Trimyema и, что неожиданно, родство этой ветви не с трихо-
стоматами, а с Oligohymenophora, т. е. с Hymenostomatida (Lynn,
ТИП CILIOPHORA. КЛАСС CONTOFRAGMEA
789
Siniill, 1997). Это удивительно, поскольку нет ничего общего в их
IUICI1IIICM облике, ротовом аппарате и в топографии кинет; переход-
ные формы неизвестны. Более реальная картина на филограмме ро-
дов Trimyema и Plagiopyla (Baumgartner et al., 2002) как боковой
истин класа Prostomatea, что соответствует простому онтогенезу
нлагиопилы.
Отряд Plagiopylida Jankowski, 1978
(рис. 354, 6—355, а)
(= Отряд Plagiopylida ordo n. in Small et Lynn, 1985)
Некрупные формы с овальным сплющенным те-
лом, хорошо развитой соматической цилиатурой, с
тенденцией к полимеризации кинет. Дорсальная цили-
атура развита аллометрически, смещая поперечную
ротовую щель на вентральную сторону, субапикально
(у Sonderia) и еще ниже у остальных родов. Широкая
ротовая щель ведет в глубокий вестибулюм, ротовой
комплекс — кинетофлексон (термин автора для погру-
женных вершин кинет без их отделения в виде апика-
льных фрагментов), почти все кинеты входят в рото-
вую щель и продолжаются на ее внутренних стенках,
образуя глубокую ресничную воронку. Ядро цельное,
не фрагментировано (исключая Plagiopyla binucleata).
Морские и пресноводные свободноживущие формы,
обычные в сапропеле, в зонах скопления серобакте-
рий, в черных илах; 2 вида в кишечнике морских ежей
фактически в том же биотопе, в плотной массе расти-
тельных остатков без кислорода.
Сем. Plagiopylidae Schewiakoff, 1896
’ (= Sonderiidae Small et Lynn, 1985)
Ротовая щель широкая, почти поперечная, субапи-
кальная; ресничная воронка идет вниз или вбок, резко
сужаясь ко рту. У части родов воронка открывается
округлым отверстием. В строении Sonderia и Plagiopy-
la нет существенной разницы, часть родов сильнее от-
личается от них, чем эти роды один от другого. Поэто-
му здесь сем. Sonderiidae не признается.
Род Sonderia Kahl,
1928
По Аэшт, типовой вид рода до сих пор не указан, но
род валидный. Первоначально в составе рода описаны
виды S. mira, S. vestita, S. vorax; второй вид нетипичен
для рода, как типовой вид здесь обозначается 5. vorax
Kahl, 1928. Род сборный, виды отличаются по всем
признакам, часть видов выделена в особые роды Опсо-
sonderia и Parasonderia, но остальные виды не сходят-
ся по важным признакам; серебром импрегнировано
лишь несколько видов, поэтому дальнейшее дробле-
ние рода пока преждевременно.
Тип рода — крупная (80—180 мкм) овальная фор-
ма с непропорционально большим дуговидным суб-
апикальным перистомом, обширной и глубокой ро-
товой воронкой, в которую входят вершины большин-
ства кинет. Кинеты многочисленные, тесно сближены,
сложной топографии — ряды левее послеротовых
снизу заворачивают направо, образуя длинный уни-
секантный шов. Ядро овальное, сократимая вакуоль
снизу справа, кортекс с экструсомами, тело покры-
то тонким слоем мукуса с эпибактериями. Солонова-
товодный вид; род Sonderia в пресной воде не встре-
чается.
S. cyclostoma Kahl, 1931 — см.: Parasonderia.
Вид S. labiata Faure-Fremiet et Tuffrau, 1955 описан
в псаммоне с красными серобактериями; хорошо изу-
ченный вид, наиболее близкий к типовому. Импрегна-
ция серебром выявляет исчерченную продольную по-
лосу от рта до уровня вакуоли— это 2 кинеты с особо
развитыми фибриллами между ними. Все сомакинеты
входят в перистомальную полость и идут глубоко вниз
до рта. На уровне устья воронки образуются утолщен-
ные участки кинет без фрагментации ресничных ря-
дов. Пожалуй, все это характерно и для типового
вида, но импрегнация не показывает поворота левых
кинет направо вниз и шва (унисеканты); небольшой
шов такого типа выявлен справа у постерона. Если ри-
сунок S. vorax верный, по топографии кинет можно
выделить подрод или род для S. labiata. По Калю
(Kahl, 1931), у типового вида нет исчерченной полосы,
но она может быть узкой и выявляться только при имп-
регнации.
S', macrochilus Kahl, 1931. Размеры тела около
130 мкм; есть исчерченная полоса и слой мукуса с бак-
териями, унисеканта сдвинута влево, ограничивает то-
лько крайне левые кинеты, перистом средней ширины
в ряду S. vorax — S. macrochilus — S. schizostoma.
S. megalabiata Alekperov et Asadullayeva, 1996 —
вид из Каспия величиной 80—100 мкм со 100—120 ки-
нетами; узкая короткая исчерченная полоса (тигмон)
идет от перистома вниз; четкая секанта — у заднего
конца тела.
S. mira Kahl, 1928. Очень мелкий вид (25—35 мкм);
топография кинет, как у типового вида, но их меньше;
перистом открывается справа, округлый, воронка идет
налево поперек тела субапикально. Легко видна двой-
ная исчерченная полоса между ртом и постероном
справа, непропорционально широкая и крупная для
столь мелкого вида. По Калю, эта полоса не гомоло-
гична таковой Plagiopyla, покрыта полем мелких рес-
ничек; видны поперечные гаплокинеты, а не фибрил-
лы. Вид совершенно несходен с типовым и выделяется
здесь в новый род Kahlisonderia Jankowski gen. п., тип
рода К. mira comb. n.
S. paralabiata Small et Lynn, 1985. Крупный вид, за-
рисованный и практически не описанный авторами
(Small, Lynn, 1985); импрегнирован протарголом; во
всем как 5. labiata, но отличается овальной формой
ядра и тем, что по ходу кинет лежат не моносомы, а
группы ресничек — по 3, 4 или 5 ресничек в группе.
Имеется исчерченная полоса в типичном положении и
сетчатый аргиром; кинеты сходятся к постерону без
образования секантного шва.
S. pharyngea Kirby, 1934. Размеры 84—110 мкм;
найдены в пересоленном приморском озере при
57 промилле; тело покрыто слоем «желатины» с сим-
бионтными бактериями; постерон с группой ка-
удальных ресничек; перистом, как у S. vorax, но с
очень длинной плоской воронкой до экватора тела;
ядро округлое, в цитоплазме рассеяны трихоцисты, ки-
неты многочисленные, без секантных зон снизу.
790
ALVEOLATA
Рис. 355, a. Plagiopylida.
Plagiopyla nasuta (A, B);P. ovala Plagiopyla sp. (/y Sonderia sinuata (Д); Parasonderia kahli (E—3). (По: Klein, 1930 (/I ): Dragesco, 1968c (Д); Dragesco, Dra-
gesco-Kerneis, 1986 (Б, B); Ozaki, Yagiu, 1941 (/); Faure-Fremiet, 1973 (Д)).
Fig. 355, a. Plagiopylida.
S. schizostoma Kahl, 1931. Размеры около 150 мкм,
тело сужается к вершине (у S. vorax расширено), пери-
стом очень узкий, щелевидный, воронка относительно
небольшая, край перистома с кортикальной пластин-
кой; не показана исчерченная полоса и секанта, топо-
графия кинет простая; питание только серобактериями
рода Beggiatoa с образованием черных вакуолей (у ча-
сти других зондерий — только красными родобактери-
ями).
S. sinuata Kahl, 1931. Хорошо изученный вид вели-
чиной 150—250 мкм. Во всем сходен с типом рода, но
намного крупнее, перистом шире открыт, унисеканта
ограничивает почти все вентральные кинеты, исчер-
ченная полоса короткая, число кинет, по данным раз-
ных авторов, 65—70 или 80—90; на поверхности тела
густой слой эпибактерий.
S. tubigula Kahl, 1930 — см. Oncosonderia.
S. vestita Kahl, 1928. Размеры 50—100 мкм, это мел-
кая копия вида S. vorax. Перистом поперечный, верете-
новидный, кинет немного, секанта четкая, кортекс с
трихоцистами, пелликула с эпибактериями. Воронка
сильнее сдвинута вниз, чем у типового вида, дорсаль-
ные кинеты сильнее изогнуты апикально.
Род Oncosonderia Jankowski, 1980
Типовой вид Sonderia tubigula Kahl, 1931 по
монотипии. Тело узкое, вытянутое, величиной НО—
150 мкм; у Каля один рисунок, не дающий точного плана
строения; по диагнозу вида нет секантной зоны вент-
рально, перистом аберрантный — длинная «ресничная
глотка» (воронка инфундибулюма) идет от апекса до
постерона через все тело в виде узкой трубки; перисто-
мальная щель очень узкая, поперечная, изогнутая;
имеется опорный аппарат у вершины и на стенках во-
ронки. Как и у зондерий, на пелликуле мукус с бакте-
риями, под пелликулой слой крупных трихоцист; ис-
черченная полоса не выявлена. Отсутствие секанты,
аберрантный перистом — признаки нового рода.
ТИП CILIOPHORA. КЛАСС CONTOFRAGMEA
791
Рис. 355, б. Trimyemida. (По: Augustin et aL, 1987).
Trimyema compressa (A—E, Л—П)\ T. pleurispirale (Ж, К); T. echinometrae (3, И).
Fig. 355, 6. Trimyemida.
Род Parasonderia Jankowski gen. n.
(= Parasonderia Faure-Fremiet, 1963, 1973)
Род co сложной историей. По Аэшт, название рода
невалидное, потому что не был указан типовой вид.
Статья (Faure-Fremiet, 1973) с подробным описанием и
точными рисунками подготовлена по архивам Фо-
ре-Фремье протозоологами Андре и Дражеско; род Pa-
rasonderia был назван Форе-Фремье раньше (Fa-
ure-Fremiet, 1963) без указания типа как новый род для
видов с округлой ротовой воронкой; 3 вида, выделен-
ные в новый род, не названы. В 1973 г. в составе рода
названы Р. kahli и Р. cyclostoma, а вид Sonderia vestita
Kahl отнесен к нему, но без прямого переноса — без
обозначения comb. п. Это значит, что род действитель-
но невалиден, поэтому как типовой здесь обозначается
вид Р. kahli (F.-Fr., 1973) comb. n.
Размеры тела Р. kahli 50—65 мкм; особи эллипсо-
идные, широкие, с округлым отверстием перистома,
направленным вправо; у типичных зондерий перистом
щелевидный, лежит поперек тела. Воронка небольшая,
широко открытая в глубине у рта, с вершинами всех
кинет в тесно сближенных изогнутых рядах. Кинет не-
много (27—29), имеются 2 шва на венте снизу; между
рядами — прямоугольники аргирома; исчерченная по-
лоса (нужен термин!) идет от рта до постерона. Ядро
нетипичное для отряда, в виде пластинки, изогнутой
вокруг воронки перистома. На кутикуле не просто
слой мукуса, как до сих пор описывали у зондерий, а
правильные альвеолы без эпибактерий. Второй вид —
Р. cyclostoma (Kahl, 1931) comb. п. Вид S. vestita к дан-
ному роду не относится, оставлен в составе рода Son-
deria.
Род Pseudoplagiopyla Small et Lynn,
1985
Типовой вид Р. sinistra S. et L., 1985 по моно-
типии. Авторами даны 2 рисунка и краткая аннотация
к ним, без диагноза рода и вида. По иллюстрациям,
тело вытянутое, ротовая воронка узкая, трубчатая, пе-
ристом овальный, не щелевидный; кинеты продоль-
ные, немногочисленные, без секантной зоны снизу;
специальные фрагменты кинет, вероятно с дисомами в
основании, не только окружают перистом, но продол-
792
ALVEOLATA
жаются вправо, прерывая все кинеты; ядро гантеле-
видное; исчерченная полоса не показана. Сведений об
экологии и питании нет.
Род Sonderiella Kahl,
1928
Типовой вид Saprophilus scandens Kahl, 1926
по монотипии. Очень мелкие формы (20—25 мкм);
строение перистома и топография кинет почти не изу-
чены. Общее с зондериями, по Калю — лишь наличие
мукозного слоя (Gallerthulle) на пелликуле и длинные
трихоцисты. Тело каплевидное, сужается книзу, кине-
ты сходятся к постерону без секанты, исчерченная по-
лоса не найдена, перистом не щелевидный, воронки
нет, вакуоль в нетипичном для зондерий положении, в
антесоме. Перистом диагональный, овальный; верх-
ний и нижний края с ресничками и с «губой эктоплаз-
мы» (складкой кортекса). Кинеты не продолжаются в
глубь воронки. Временно этот род оставлен среди пла-
гиопилид в ожидании точного описания.
Род Plagiopyla Stein,
1860
Типовой вид Р. nasuta по монотипии. Тело от-
носительно крупное, овальное, сплющено латерально;
под пелликулой плотный слой трихоцист; ядро оваль-
ное, вакуоль у постерона. Кинеты многочисленные,
сближены вплотную, местами с небольшими швами.
Справа от угла перистома вниз идет исчерченная поло-
са, обычно не достигающая постерона. Перистом в
виде поперечной щели, окаймлен вершинами кинет,
которые входят в воронку и продолжаются на ее стен-
ках у рта. В принципе так же устроена и Sonderia, но у
плагиопил поперечная ротовая щель сильнее сдвинута
на вент при аллометрическом удлинении дорсальных
кинет. Нет мукозного слоя на поверхности тела, в ко-
тором обитают симбионтные бактерии у зондерий. Фа-
культативные анаэробы, обитают в сапропеле и илах
пресных вод и в море, выносят отсутствие кислорода;
2 вида эндобионтные в морских ежах, питающихся
растениями.
Р. binucleata Agamaliev, 1978 — вид из Каспия ве-
личиной 80—100 мкм с более коротким и широким те-
лом, чем у Р. nasuta, с 2 ядрами; цитопиг и пора вакуо-
ли выше нижнего конца полосы тигмона, у Р. nasuta
ниже этой полосы.
Р. cucullio (Quennerstedt, 1867) Wallengren, 1918.
Морской вид, плохо описан, неопределим и не счита-
ется валидным.
P.frontata Kahl, 1931, морской вид величиной
80—120 мкм, с узким вытянутым телом.
Р. marina Gourret et Roeser, 1886 (= P. nasuta var.
marina). Размеры 42—Т1 мкм; первоописание основа-
но на мелких отличиях. Морской вид, подробно опи-
санный другими авторами под названием Р. nasuta, в
действительности Р. marina, хотя и крупнее
(70—114 мкм).
Р. minuta Powers, 1933. Облигатный симбионт мор-
ских ежей в США и Мексике — в Echinometra vanbrun-
ti, Strongylocentrotus droebachiensis-, нет в наших север-
ных и дальневосточных ежах. Мелкие особи (50—
75 мкм) с широкой перистомальной щелью; встреча-
ются в хозяевах нерегулярно, спорадически, питаются
нитчатыми водорослями.
Р. nasuta Stein, 1860. Обычный пресноводный вид,
очень частый на дне прудов, в черном илу, сапропеле,
в скоплениях пурпурных или бесцветных серобакте-
рий; предпочитает анаэробные условия. Легко импрег-
нируется серебром; это один из первых видов цилиат,
импрегнированных на сухих мазках методом Клейна;
позже изучался с применением влажного метода Шат-
тона, протаргола и испанским методом серебрения.
Размеры тела 120—160 мкм, тело эллипсоидное, име-
ется 70—75 тесно сближенных кинет; секанта снизу
слева отмечена не у всех рас вида. Все ряды подходят к
перистому и здесь утолщаются, превращаясь в дикине-
ты по всему периметру перистома. Исчерченная поло-
са легко видна прижизненно, хорошо импрегнируется
серебром; выявляется и правильная сетка аргирома.
Воронка с вершинами кинет идет вбок и вниз (у Р. ma-
rina вверх и затем вниз). Под названием Р. nasuta опи-
сано много других видов, особенно в ранней литерату-
ре; к примеру мелкий морской вид из США длиной
65—95 мкм или вид Агамалиева (1983) из Каспия
(70—80 мкм, 60—70 кинет). Нужно определить отно-
шение пресноводных форм к солености в лаборатор-
ных культурах вида. Пока Р. nasuta считается измен-
чивым эвригалинным видом со многими «локальными
модификациями». У импрегнированных особей вида
подсчитано 80—90 кинет, длина исчерченной полосы
2/3 длины тела, имеются 3 секанты; перистомальные
сегменты кинет 2 типов. Изучение ультраструктуры
подтверждает отличия плагиопил от остальных трихо-
стомат.
Р. nyctotherus Poljansky et Golikova, 1959. Эндоби-
онты в кишечнике прибрежных морских ежей Мурма-
на {Strongylocentrotus droebachiensis), их нет в глубо-
ководном У pallidus', встречаются очень редко в отли-
чие от остальных симбионтов, поэтому не доказано,
что это облигатно-симбионтный вид. Размеры
79—120 мкм, внешний облик типичный для рода,
ядро, вероятно, крупнее, чем у других видов; на венте
примерно 40 кинет, на дорсуме 30, всего 70; ротовая
щель широкая, далеко растянута в стороны; секанты
не отмечены. Питание бактериями.
Р. stenostoma Alekperov et Asadullayeva, 1969 —
вид из Каспия, хорошо изучен при импрегнации.
Р. ovata Kahl, 1931. Морской вид величиной
110—130 мкм, с 75—85 кинетами; секанты в типич-
ном положении, правее и левее перистома у постерона.
Не исключено, что именно этот вид случайно заселяет
морских ежей — признаки вида совпадают у Р. ovata и
Р. nyctotherus.
Р. megastoma (= Tillina megastoma Smith, 1899).
Тело сильно сплющено, длиной 100—150 мкм; пе-
ристом без характерного для Р. nasuta валика; кинетом
с секантами; у вершины тело не сужается. Р. nasuta
названа так по наличию выступа верхнего валика
перистома; у Р. megastoma контуры перистома ров-
ные, без выступов. Каль переописал вид как валид-
ный, из пресных вод, но позже он никем не упоми-
нается.
ТИП CILIOPHORA. КЛАСС CONTOFRAGMEA
793
Р. simplex Wetzel, 1928. Величина 135—150 мкм;
около 80 кинет; тело книзу заострено (у Р. nasuta за-
круглено), сжатие тела незначительное. По диагнозу и
рисунку вида нет исчерченной полосы правее перисто-
ма, но она может быть очень узкой (3 мкм) и иногда
видна у видов отряда лишь после импрегнации. По
этому поводу Каль (Kahl, 1931) пишет, что за все время
работы никогда не видел плагиопил, пресноводных и
морских, без этой характерной полосы. Вид пока не
должен включаться в определительные таблицы ци-
лиат.
Р. vestita Kahl, 1928 — эстуарный (солоноватовод-
ный) вид величиной всего 35—40 мкм; кинет немного,
около 16 на дорсуме с ребрами между ними; нет исчер-
ченной полосы; на пелликуле слой мукуса с бактерия-
ми. Это вид неопределенного положения — не плагио-
пила, пока временно в Sonderia'. к Parasonderia припи-
сан без оснований, поскольку ротовая воронка не
округлая.
Р. wetzeli Kahl, 1931 (=Р. nasuta var. wetzeli). Пре-
сные воды; величина 70—90 мкм, тело узкое, вытяну-
тое, ядро растянуто по оси тела, кинеты немногочис-
ленные, исчерченная полоса четкая.
Род Lechriopyla Lynch,
1930
Типовой вид L. mystax Lynch, 1930 по моноти-
пии. Облигатные симбионты морских ежей на Тихо-
океанских берегах США и Канады — Strongylocentro-
tus droebachiensis, S. echinoides, S. franciscanus, S. pur-
puratus. Тщательно изученный вид; тело массивное,
до 250 мкм, очень широкое, с почти округлым кон-
туром, сплющено латерально, ядро округлое, вдали от
перистома. Кинеты многочисленные, не менее 200; се-
канты не отмечены, но без серебрения они часто не вы-
являются, тем более что у постерона кинетосомы в ки-
нетах разрежены и проследить топографию рядов ки-
нет трудно. Исчерченная полоса широкая с сотнями
поперечных фибрилл, вытянута до нижней трети тела.
Вакуоль и цитопиг в типичном для плагиопил положе-
нии. Основные родовые признаки — смещение пери-
стома далеко вниз по сравнению с Sonderia и Plagiopy-
la, его большее растяжение по горизонтали, и очень
сложное строение перистома. Окраска гематоксили-
ном выявляет вильчатый опорный аппарат, поддержи-
вающий складчатую воронку, идущую вверх и вниз от
устья перистома. Есть общие роды кишечных цилиат в
видах Strongylocentrotus по обеим сторонам Северной
Пацифики, например Entorhipidium, Entodiscus, Plagio-
pyliella, но Lechriopyla в наших дальневосточных ежах
не найдена.
Род Paraplagiopyla Thurston et Grain,
1971
Вид P. kiboko из носорогов Африки, к плагио-
пилам не относится, рассмотрен в отряде трихосто-
мат.
Отряд Trimyemida Jankowski, 1980
(рис. 355, б)
Этот таксон был предложен мной как отряд неясно-
го положения в системе (не включен ни в один класс
цилиат); родство с плагиопилами в то время не было
очевидно, хотя Trimyema, Sonderia и Plagiopyla были
хорошо изучены. Плагиопилы оставались в группе
Vestibulifera, тримием предлагали включить в состав
переднеротых (Gymnostomata). Лишь молекулярные
данные показали близкое родство этих форм (Lynn,
Small, 1997). От общего основания берут начало гиме-
ностоматы, пеникулины (Paramecium) и плагиопи-
лиды (Plagiopyla, Trimyema). Оба последних рода на-
столько несходны по всем признакам, что диагноз
общей группе дать невозможно; класс Contofragmea
характеризуется лишь деталями ультраструктуры ки-
нетосом. Ввести тримием в состав плагиопилид можно
только на уровне подотряда, вероятно, лучше считать
их самостоятельным отрядом в данном классе.
Мелкие каплевидные формы величиной 20—
60 мкм; тело не сплющено; соматические кинеты в ви-
де нескольких (3—5) концентрических колец по диаго-
нали вокруг тела, но при импрегнации серебром вид-
но, что это вторичные кинеты. Первичная кинета у ци-
лиат — это продольный ряд кинетосом, соединенных
аргентофильной фибриллой. Но часто кинетосомы
смежных рядов располагаются строго определенным
образом, координированы, и образуют «ложные кине-
ты» — диагональные или поперечные ряды кинето-
сом, не соединенных фибриллами. У парамеций, фрон-
тоний, дексиотрих и у множества других цилиат такие
ложные ряды видны у перистома и в передней части
тела. Они названы мной «адесмокинеты», термин не за-
метили, и позже ввели другой термин — «паратены».
Trimyema имеет продольные ряды, в которых со-
хранились лишь по 3—5 кинетосом, все кинетосомы
особи сгруппированы соответственно в 3—5 адесмо-
кинет. Эти инфузории легко серебрятся сухим мето-
дом Клейна, выявляющим кроме кинетосом сложную
систему ветвящихся фибрилл аргирома. Кроме сома-
тических адесмокинет имеются апикальные ротовые
ряды и каудальная ресничка.
Перистом в виде в неглубокого желобка, по спира-
ли огибающего тело субапикально. Нет характерного
для плагиопилид погружения вершин сомакинет в ро-
товую воронку, нет ресничного инфундибулюма.
Адесмокинеты легко выявляются, несут длинные рес-
нички, правильно зарисованы рядом авторов, а данные
по ротовой цилиатуре очень противоречивые. У пре-
сноводной Т. compressa выявляется дуговидный ряд
вплотную сближенных дисом (дикинетид), внутри бо-
лее короткий ряд, фрагмент такого же строения и груп-
па разрозненных пар дисом (Augustin et al., 1987). Эти
ряды идут дугой параллельно верхней адесмокинете,
огибая сверху перистомальный желобок. Глотка не-
большая, без немадесм и заметных фибрилл, ядро
округлое, слоя трихоцист нет, вакуоль в нижней трети
тела, без каналов. Полоска цитопига помогает ориен-
тировать особь у тримием — у родственных плагиопил
цитопиг расположен правее и ниже перистома. Нет ис-
черченной полосы, характерной для большинства пла-
гиопилид. Аргиром у плагиопилид сетчатый, из пра-
794
ALVEOLATA
вильных прямоугольников вдоль кинет, у тримием
лишь в виде продольных фибрилл, ветвящихся в по-
стесоме. Нужно учесть, что у кольподовых различие
типа аргирома — важный признак отряда.
Тримиемы встречаются в сапропеле и илах пре-
сных вод, склонны к анаэробиозу, распространены в
соленых озерах, эстуариях, в море. Част симбиоз с ме-
таногенными бактериями в цитоплазме, эпибактерий
на пелликуле нет. Тримием и метопусов нашли даже
во влаге городских свалок, в гниющей органике, насы-
щенной метаногенами, которыми они питаются.
Одновременно и независимо открыт симбиоз три-
мием с морскими ежами, где они поселяются в плот-
ной массе полупереваренных частиц водорослей в зад-
нем отделе кишечника; по Янковскому (1980. С. 117)
«тримиемы являются массовыми и регулярными сим-
бионтами морских ежей у берегов Сахалина (в кишеч-
ном тракте)»; вид определен не был; в Карибском бас-
сейне был описан новый вид тримием из местных мор-
ских ежей (Groliere et al., 1980).
Сем. Trimyemidae Kahl, 1933
(= Sciadostomatidae Kahl, 1926)
С признаками отряда.
Род Trimyema Lackey, 1925
Типовой вид T. compressa Lackey, 1925 по мо-
нотипии; с характеристикой отряда. Синоним Sciados-
toma Kahl, 1926, с типом S’. difficile Kahl, 1926. Виды
однотипны по строению, род не делится на подроды,
большинство видов плохо изучено, часть названий по-
этому нельзя считать валидными.
Т. alfredkahli Tucolesco, 1962 — морской вид вели-
чиной 60 мкм с большим числом адесмокинет, мелким
перистомом, узким вытянутым телом.
Т. claviformis Kahl, 1933; 40 мкм; в море.
Т. echinometrae Groliere, Puytorac et Grain, 1980.
27—40 мкм; эндобионты в кишечнике морских ежей
Карибского бассейна — Diadema antillarum, Echino-
metra lucunter, Trimyema sp. без описания отмечена
также в ежах Восточной Пацифики. Это вид с наиболь-
шим числом ресничных рядов (6—7).
Т. kahli Tucolesco, 1962 величиной 36—40 мкм с
5 рядами ресничек найден в приморских соленых озе-
рах Румынии.
Т. marina (= Sciadostoma marinum Kahl, 1933) — хо-
рошо изученный валидный морской вид величиной
40 мкм с 5—6 кольцами ресничек.
Т. compressa Lackey, 1925. Вид величиной
25—50 мкм, част в пресноводном детрите; рудимен-
тарные кинетосомы — 45—60 продольных кинет со-
браны в 3—4 разрозненных паратены. Синонимы —
Sciadostoma difficile Kahl, 1926 и «Т. marinum» in Fa-
ure-Fremiet, 1962.
T. minuta (Kahl, 1931 in Sciadostoma) Augustin et al.,
1987. Эвригалинный облигатно анаэробный вид вели-
чиной 20 мкм, в пресной воде (типовая раса) и в море.
Недавно вид найден в биоценозе «черных курильщи-
ков» (deep-sea vents) на больших глубинах в море, на-
сыщенном метаногенами, и тщательно переописан
(Baumgartner et al., 2002); это лучшая работа по морфо-
логии тримием, с применением 3 методов серебрения.
Оптимальная температура культивирования 28—52
(48) °C; время удвоения 6 ч. Показано различие моле-
кулярных характеристик этого вида и Т. compressa.
Т. pleurispiralis Borror, 1972. Вид с морской литора-
ли величиной 20—44 мкм с 4—5 ресничными кольца-
ми; детально изучен на импрегнированных препара-
тах.
Т. shoalsia Nerad et al., 1995; морской вид, после
уточнения морфологии типичных Т. minutum считает-
ся синонимом этого вида.
Тримиемы культивируются годами в ряде лабора-
торий, используются для электронной микроскопии,
выделения метаногенных бактерий, проверки устойчи-
вости к солям и температуре, для молекулярной фило-
гении. Trimyema — это консорциум (симбионтная сис-
тема), содержащий до 300 бактерий — метаногенов (в
клетке длиной не более 50 мкм) — новый вид рода
Methanocorpusculum.
Класс Oligohymenophorea De Puytorac et al., 1974
Этот таксон соответствует группе Tetrahymenophora Jankows-
ki, 1967, и приоритетное название можно было сохранить; дело не в
том, что мембранелл немного (oligo); в сущности, у всех отрядов
сохранен однотипный ротовой комплекс — тетрахимениум, уна-
следованный от нассулид Furgasonia (= Cyclogramma). Все 4 ком-
понента тетрахимениума легко узнать даже в сильно видоизменен-
ном перистоме перитрих. У части родов гименостомат одна из
мембранелл, обычно М2, удлинена и модифицирована, но и у та-
ких форм при делении в онтогенезе (процессе морфогенеза кинето-
ма) временно воспроизводится простой тетрахимениум с диаго-
нальным положением оснований мембранелл. Поэтому можно
было оставить первоначальное название. Ротовой ресничный аппа-
рат утерян у части эндопаразитических форм; когда имеется, со-
стоит из ундулирующей мембраны справа и 3 мембранелл слева от
рта; основание мембраны обозначается в последнее время как «pa-
roral dikinetid», основания мембранелл — «oral polykinetids». В ди-
соме ресничная кинетосома чередуется с безресничной; в основа-
ниях мембранелл все кинетосомы ресничные. Термин «поликине-
та» служит для обозначения сближения 2 и более кинет. Рот
погружен на дно ротовой полости; при серебрении обычно выяв-
ляются опорные ребра на стенках полости; иногда погружается
вспомогательный ресничный аппарат с образованием вестибулю-
ма (например, фронтонии и парамеции). Соматические кинеты
составлены монокинетидами (моносомами) с четкими кинето-
десмальными фибриллами, направленными вперед, дивергентны-
ми постцилиарными пучками и радиальными поперечными пучка-
ми (исключая пеникулид). В соматических дикинетидах (дисомах
по моей терминологии) задняя кинетосома несет весь этот комп-
лекс, а передняя — только диагональный поперечный пучок мик-
ротубул.
Крупная дивергентная группа, включает 6 подклассов. Сво-
бодноживущие формы, комменсалы и паразиты, обычные во всех
биотопах (почва, мох, озера, лагуны, море). Питание микро- и мак-
ротрофное, много хищников с крупным перистомом.
ТИП CILIOPHORA. КЛАСС OLIGOHYMENOPHOREA
795
Подкласс Peniculia Faure-Fremiet in Corliss, 1956
Такое обозначение группы дается в системе Линна (Lynn,
2002) и в Traite de Zoologie (Puytorac, 1994), но Форе-Фремье не
предлагал подкласса — им введен подотряд Peniculina в группе хо-
лотрих (Corliss, 1979).
Обычно это крупные формы с полимеризацией кинет, с круп-
ным перистомом; в сущности, это гименостоматы, но с четкой не-
мадесмальной корзинкой у низших форм, утраченной при эволю-
ции внутри подкласса и у всех тетрахименид и скутицид, которые
не выводятся от пеникулид, а скорее независимо произошли от
Urotrichidae (Prostomata). Правосторонняя ундулирующая мембра-
на четкая, длинная; слева обычно 3 поликинеты, параллельные оси
тела у низших форм; в основаниях мембранелл по 3 и более рядов
ресничек; традиционно мембранеллы у парамеций называются пе-
никулюсы (щеточки) — реснички не сливаются в единый комплекс
вдоль мембранеллы. Длинные фибриллы отходят от групп кинето-
сом, ротовых и ближайших соматических. Имеется слой трихоцист
такого типа, как у перидиней. Стоматогенез при делении с участи-
ем перикинет (специальные соматические ряды правее перистома)
или за счет основания мембраны и поля кинетосом. В основном
свободноживущие формы, более разнообразные в пресных водах;
несколько родов в море. Симбионтные виды встречаются как. иск-
лючение и мало видоизменены по сравнению со свободноживущи-
ми, редукции рта нет.
Отряд Peniculida Faure-Fremiet in Corliss,
1956 (рис. 356, a—359, a)
Приоритет в названиях отрядов и классов цилиат
не соблюдается, никаких обязательных ^правил нет;
фактически первым эту группу выделил Иожеф Гелей
(Gelei, 1934) — Trichohymenostomata Gelei, 1934, на-
звание можно было сохранить. По Гелей, ротовой ап-
парат парамеций сочетает признаки трихостомат (рес-
ничный вестибулюм) и гименостомат (мембрана и
3 мембранеллы), поэтому они не могут быть помеще-
ны в один из этих подотрядов и включаются в новый
подотряд холотрих с указанным названием. За одним
исключением, никто не упоминает эту группу. Отряд
Peniculida, с диагнозом подкласса, включает несколько
подотрядов.
Подотряд Frontoniina Jankowski, 1980
В новых сводках таксон приписывается Смоллу и
Линну (Small, Lynn, 1985), но он впервые предложен
мною, с кратким диагнозом: «Низшие пеникулиды, со-
храняющие циртум или пучки фибрилл вокруг глотки;
соматическая цилиатура хорошо развита; типовой род
Frontonia» (Янковский, 1980). Немадесмы у фронтони-
ид нескольких типов, тонкие и толстые, образуют в со-
вокупности массивную глоточную корзинку (циртум).
Тонкие немадесмы отходят от группы кинетосом пра-
восторонних вестибулярных кинет, более толстые —
от основания ундулирующей мембраны, особо тол-
стые — от оснований трех пеникулюсов левее рото-
вой щели. Пучки корневых фибрилл, соединяясь вмес-
те, дают начало немадесмам, в которых микротубулы
соединены септами (десмосами). У парамеций тоже
имеются фибриллы глотки, но тонкие, гибкие, не скле-
енные в палочки. Фронтонииды обычны в планктоне
и бентосе пресных вод, во мхах, почве, морском бен-
тосе; 2 вида — эндопаразиты морских беспозвоноч-
ных.
Сем. Frontoniidae Kahl, 1926
(рис. 356, а, б; 357, 6; 358, а)
Ротовые немадесмы не в кольце, особо заметны
сбоку и ниже рта; обычно имеются 3 длинные крупные
поликинеты в буккальной полости; несколько реснич-
ных рядов правее ротовой зоны специализированы, от-
личаются по строению от сомакинет; их нельзя назвать
вестибулярными, поскольку они не погружены в пред-
ротовую полость. Это одна из форм перикинет, и они
далее обозначаются этим термином; это мой термин
для участков или вершин сомакинет у цилиат, интег-
рированных в перистомальную цилиатуру в дополне-
ние, в случае гименостомат, к 4 компонентам тетрахи-
мениума. Обычные виды в морском и пресноводном
бентосе, нередки в пресноводном планктоне. Оба мор-
ских симбионтных вида пеникулин принадлежат к это-
му семейству.
Род Frontonia Ehrenberg, 1838
Типовой вид Bursaria {Frontonia) leucas Ehren-
berg, 1838; вначале род предложен как подрод бурса-
рий. Много видов в пресных водах (включая почву,
мох, болота) и в море. Тело вытянутое, с тенденцией к
полимеризации кинет и укрупнению ротовой зоны; со-
кратительных вакуолей 2 и больше, часто с каналами;
четко развиты швы — зоны схождения правых и левых
кинет (предротовой и длинный послеротовой); правее
рта 3 короткие перикинеты; рот щелевидный, слева от
него 3 длинных пеникулюса, из них внутренний тонь-
ше остальных. Возможно инцистирование (отсутству-
ющее у парамеций). Из состава рода удалено много ви-
дов, но род остается крупным и пока не делится на
подроды; в случае такого деления следует учесть ро-
довые синонимы — Cyrtostomum Stein, 1859 (С. leucas)
и Sigmostomum Gulati, 1925 (S. indicum). Первое на-
звание нередко встречается в старой литературе, a Sig-
mostomum был принят лишь одним автором; фронто-
ний относили также к Paramecium и к Panophrys.
Характерные виды для мхов и болот — F. minuta, F. el-
liptica, F. roquei, F. parvula, F. nigricans, в прудах и
озерах более крупные виды F. leucas, F. africana,
F. azerbaijanica, F. vesiculosa, F. ambigua, в море
F.fusca, F. arenaria, F. caneti, F. microstoma, F. maris-
albi и др. В жаберной полости ланцетников Amphioxus
(Branchiostoma) lanceolatum обитает облигатно-симби-
онтный вид F. branchiostomae Codreanu, 1928; в ки-
шечнике мелких норовых голотурий — синаптид на
Командорах мною найден второй симбионтный вид —
новый вид с прочным кортексом (в обработке).
Примеры видов: F. azerbaijanica Alekperov, 1983;
F. ambigua Dragesco, 1972; F. arenaria Kahl, 1933;
F. acuminata (Ehrenberg, 1833 in Ophryoglena)', F.bul-
lingtoni Dragesco, 1960; F. betica Arroyo et Perez-Silva,
1977; F. caneti D., 1960; F. elliptica Beardsley, 1902;
F. depressa (Stokes, 1886); F.fusca (Quennerstedt, 1869
in Panophrys)', F. elongata Burkovsky, 1970; F. canaden-
sis Roque et Puytorac, 1972; F.fibrillata D., 1978; F. ter-
ricola Foissner, 1986; F. roquei D., 1970; F. frontoniifor-
796
ALVEOLATA
Рис. 356, a. Peniculida.
Frontonia pallida (А, Б); F.frigida (B—ffy F. minuta (£); F. ambigua (Ж, 3); F. canadensis (И)', F. microstoma (X). (По: Оболкина, 1991 (A, 5); Petz et al., 1995
(В—Д); Dragesco, 1970 (£); 1972 (Ж, 3); Roque, 1961c (X); Roque, Puytorac, 1972 (И)).
Fig. 356, a. Peniculida.
me comb. n. (Disematostoma frontoniiforme Gelei, 1954);
F. tchibisovae Burkovsky, 1970; F. schaefferi Bullington,
1939; F. solea F., 1986; F. vacuolata D., 1960; F. nigri-
cans Penard, 1922; F. minuta D., 1960; F. parvula Penard,
1922; F. pallida Czapik, 1979; F. marina Fabre-Domer-
gue, 1891; F. maris-albi Burkovsky, 1970; F. macrostoma
Sramek-Husek, 1957; F. microstoma Kahl, 1931; F. indi-
ca comb. n. (Sigmostomum indicum Gulati, 1925) и мно-
гие другие виды.
Род Parafrontonia Dragesco
et Dragesco-Kerneis, 1986
Этот род не был замечен при каталогизации цилиат
(Aescht, 2001). У Frontonia fibrillata Dragesco, 1978 и
F. pallida Czapik, 1979, вероятно идентичных видов,
тело вытянутое, перистом небольшой, сильно развита
система вентральных фибрилл; особое развитие цир-
тума (корзинки немадесм) — признак нового рода. Род
введен неуверенно: «Вероятно, можно видеть в них
новый род Parafrontonia, с 2 видами Р. pallida и Р. fib-
rillata; но различия между этими „видами” не кажутся
достаточно важными» (Dragesco et Dragesco-Kerneis,
1986. Р. 329).
Род Disematostoma Lauterborn,
1894
Сборный род с разным планом строения. Типовой
вид D. buetschlii по монотипии; все виды пресновод-
ные. У D. buetschlii вентральный кинетом симметрич-
ный (если не считать вторичных рядов — адесмокинет
= паратен), послеротовая секанта продольная, апи-
кальный шов слегка изогнут; на дорсуме шов резко
изогнут, но нет спирализации тела, имеющего капле-
видную форму. У всех видов четкий циртум (корзинка
немадесм). Род был принят всеми авторами, иногда без
особо отклоняющихся видов, но сейчас высказано со-
мнение в валидности рода по морфологии типового
вида (Foissner et al., 2002), пока без аргументации. У
D. buetschlii особо удлинены швы (секанты), форма
тела нетипичная для крупных фронтоний; перистом
ТИП CILIOPHORA. КЛАСС OLIGOHYMENOPHOREA
797
Рис. 356, б. Peniculida.
Didieria ohioensis (Л); Frontonia terricola (Б—Г)', Marituja pelagica (Д—3). (По: Struder, 1991 (A); Foissner, 1994b (5—Г)\ Foissner et al., 1999 (Д—3)).
Fig. 356, 6. Peniculida.
однотипный. Как и фронтонии, виды Disematostoma
легко инцистируются.
Примеры видов: D. minor Kahl, 1926; D. buetschlii
Lauterbom, 1894 (много неправильных определений в
литературе под этим названием); D.profanti Small et
Lynn, 1985; D. parameciiformis Wenzel, 1953; D. inval-
latum Gelei, 1954; D. bengalensis Nair, 1971; D. gyrans
Dragesco, 1970; Leucophrys ovum Faure-Fremiet, 1924 —
синоним вида D. buetschlii. Если признак рода — за-
кручивание верхнего и нижнего вентрального шва в
разные стороны, то нужно исключить D. profanti и
D. frontoniiforme Gelei, 1954.
Род Parastokesia Jankowski, 1967
Типовой в и дР. tetraedrica (= Leucophrys tetra-
edrica Faure-Fremiet, 1924). Нижняя часть тела вытяну-
тая по оси, не спиральная, верхняя вздутая и широкая;
послеротовой шов (гипосеканта) удлиненный, предро-
товой (эписеканта) практически отсутствует; крупный
перистом примыкает к переднему концу тела, имеет
типичное для фронтониид строение. Пресноводный
планктон. Этот вид приводится обычно в составе рода
Disematostoma.
Род Wenrichia Jankowski, 1967
Типовой вид W. colpidioides (= Disematostoma
colpidioides Gelei, 1954) в эпибентосе пресных вод. Ро-
товой аппарат, как у дисематостомы; тело резко не-
симметричное, эписеканта сдвинута влево вниз при
аллометрическом удлинении правосторонних кинет,
гипосеканта смещена влево; тело как бы перекручено
по спирали; на дорсуме искривленный шов и складки
тела. Этот и предыдущий роды можно считать подро-
дами в составе Disematostoma sensu lato, но тогда роду
нельзя дать четкой характеристики.
Род Didieria Small et Lynn, 1985
Типовой вид D. ohioensis. Род описан очень
кратко, экология не указана (вероятно, пресновод-
ный); показана только вентральная сторона тела. Ки-
неты полимеризованы, послеротовая щель прямая, пе-
ристом обширный, до половины тела; справа дикинета
мембраны и группа видоизмененных сомакинет (пери-
кинет), слева 3 мембранеллы — Ml и М2 с 4 сближен-
ными кинетами в основании каждой, М3 с 4 разроз-
ненными рядами, как в квадрулюсе парамеций.
798
ALVEOLATA
Рис. 357, a. Peniculida.
Urocentrum turbo (А, Б); Stokesia vernalis (B—3); Maritujapelagica (И—Л). (По: Klein. 1927 (fi); Dragesco, 1966b (Г, E, 3); Dragesco, Dragesco-Kerneis, 1986 (A);
Packroff, Wilbert, 1991 (Ж, K); Foissner et al., 1999 (В, Д, И, 27)).
Fig. 357, a. Peniculida.
Род Frontoniella Wetzel, 1927
Типовой вид F. complanata из ила пресных
вод. Перистом включает мембрану справа; левее рта
только одна широкая мембранелла с крупной полики-
нетой в основании. Импрегнация не применялась, опи-
сание не основано на точных данных. Тело очень плос-
кое, короткое и широкое, по форме очень напоминает
виды F. acuminata и F. nigricans, и Каль (Kahl, 1931)
отождествляет F. complanata с первым видом. Ситуа-
ция с этим родом пока неясная.
Род Paraclathrostoma Small et Lynn,
1985
Типовой вид Р. marinum (= Frontoniella marina
Roque, 1961) из морского псаммона. В каталоге
Аэшт указано, что М. Рок в монографии пеникулид
упоминает только Frontoniella complanata, но у Рок
есть и краткая статья 1961 г. с описанием F. marina
(Roque, 1961а, 1961b). Неясно, относится ли к это-
му роду недостаточно изученная Frontonia aberrans
Dragesco, 1960. У F. marina форма тела, сплющен-
ность, расположение вентральных швов, как у фрон-
тоний, внешне сходен перистом, ротовая щель, име-
ются мембрана и перикинеты справа, но важное от-
личие — левее рта вместо 3 пеникулюсов видно
единое обширное поле кинетосом из множества ко-
ротких диагональных кинет. Этот вид не имеет ничего
общего с типовым видом пресноводного рода Fronto-
niella.
Род Marituja Gajewskaja,
1928
Типовой вид М. pelagica из пресноводного
планктона. Вначале вид считался эндемиком Байкала,
затем найден в Онежском оз., близ Ленинграда, в Гер-
мании. Переописан новыми методами (протаргол).
Массивные формы с широкой антесомой, лентовид-
ным ядром, крупным перистомом; кинеты расположе-
ны дугами вокруг буккальной полости. В отличие от
ТИП CILIOPHORA. КЛАСС OLIGOHYMENOPHOREA
799
Рис. 357, б. Peniculida.
Paraclalhrostoma gigas (A—В); P. (ранее Frontoniella) marina (Г, Д); Disematostoma invallatum (E); D. gyrans (Ж); D. tetraedrica (3). (По: Dragesco, 1996
(A—B); Gelei, 1954 (£); Roque, 1961a (3); 1961b (Г, Д); Dragesco, Dragesco-Kerneis, 1986 (Ж)).
Fig. 357, 6. Peniculida.
Numbers indicate kineties.
фронтоний с наружными сегментами кинет справа,
вестибулярные кинеты (перикинеты) погружены на
правую стенку перистома, где расположены вплот-
ную. Ундулирующая мембрана и 3 пеникулюса вы-
тянуты вдоль перистома. Очень развита система адес-
мокинет по всему телу. Инцистирование неизвестно.
Холодолюбивый вид; питание диатомеями и инфузо-
риями. Есть сомнение, что в Европе встречается, и
была описана как М. pelagica именно байкальская фор-
ма; онежскую форму выделяли в подвид М. pelagica
minor Majejkajte. Эта форма более узкая, более сим-
метричная и внешне похожа на виды рода Disemato-
stoma.
Трудная проблема — Marituja caudata Obolkina,
1995, вид с симметричным вытянутым телом, широ-
ким субапикальным перистомом; для вида как типово-
го выделяется новый подрод в составе Marituja — Ко-
tophrya subgen. п. В отличие от Disematostoma, пери-
стом доходит до вершины тела.
Род Stokesia Wenrich, 1929
Типовой вид S. vernalis (= Cyclotrichium verna-
lis Wang, 1928) из пресноводного планктона. Этот вид
и предыдущий выделялись в особые семейства Sto-
kesiidae и Maritujidae, но фактически это лишь абер-
рантные фронтонииды, с недостаточными отличия-
ми от фронтоний для ранга семейства. Каль (Kalil,
1931) включает в состав Stokesia также вид Disemato-
stoma tetraedrica (в данном каталоге — в роде Рага-
stokesia). У стокесий при виде с вентральной стороны
облик как у дисематостом — перистом смещен вниз
от апекса, оба шва (эпи- и гипосеканта) продольные;
имеется циртум; особые признаки — горбовид-
ное вздутие дорсума и модификация ротового аппа-
рата — справа налево расположены перикинеты, мем-
брана, квадрулюс (разрозненные ряды в М3), ком-
пактные М2 и Ml. Квадрулюс мы уже встречали у
Didieria.
800
ALVEOLATA
Рис. 358, a. Peniculida.
Disematostoma gyrans (А, E); D. invallatum (ВГ); Lembadion lucens (В,Д); L. bullinum (E, Ж); L. magnum (Г, 3). (По: Gelei, 1954 (//); Dragesco, 1970 (A, В—Д)',
Dragesco, Dragesco-Kerneis, 1986 (Б, 3); Foissner et al., 1994 (£, Ж)).
Fig. 358, a. Peniculida.
Род Apofrontonia Foissner et Song,
2002
Типовой ви д A. lametschwandtneri, также A. ob-
tusa из пресноводного фитона. Тело некрупное, слегка
сплющенное, с обширным перистомом, вытянутым яд-
ром; справа в перистомальной полости 9—10 перики-
нет, в основании мембраны число кинет увеличено;
3 пеникулюса, типичные для фронтоний, но с боль-
шим числом кинет в основании (до 6 рядов). Редкие
формы, вероятно, более частые в тропиках. Основной
признак рода — увеличение числа и погружение пери-
кинет в полость гигантского перистома.
Сем. Clathrostomatidae Kahl,
1926
Семейство принято во всех руководствах, но пока
не может получить диагноз — строение типового рода
неизвестно.
Род Clathrostoma Penard,
1922
Один аберрантный род с несколькими видами:
С. viminale (типовой вид); С. pseudoparamecium Kahl,
1926; С. salinum Small et Lynn, 1985; по Рок (Roque,
1961a) также C. ovum (Leucophrys ovum Faure-Fremiet,
1924), но последний вид в монографии планктона (Fo-
issner et al., 1999) числится синонимом видаDisematos-
toma buetschlii. Форма тела, как у фронтоний — вытя-
нутые слегка сплющенные особи с широкими плавно
закругленными концами тела; имеются оба осевых
вентральных шва; дорсальная цилиатура не описана.
Типовой вид почти не изучен, вероятно род выделен
по наличию крупного радиально исчерченного пери-
стома, имеющего вид присоски. У С. ovum, по описа-
нию Рок, соматическая цилиатура, как у парамеций,
фибриллы перистома, как у фронтоний, перистом име-
ет 2 мелких пеникулюса, расположенных нетипично
для фронтониид — над ротовой щелью поперек тела.
Рок сохранила сем. Clathrostomatidae именно для этого
вида, хотя он ничем не напоминает типовой вид С. vi-
ТИП CILIOPHORA. КЛАСС OLIGOHYMENOPHOREA
801
Рис. 358, б. Peniculida.
Paramecium caudatum (A,H);P. aurelia (5); P. jankowskii (В, M); P. calkinsi (Г, Д, P)', «Р. woodruffi» (P. nephridiatum) (E, Q; P. pseudotrichium (Ж, П); P. afri-
canum (3); P. polycaryum (И); P. bursaria (К, Л, О). (По: Агамалиев, 1983 (Г—E, P, Q; Dragesco, Dragesco-Kerneis, 1986 (4— В, Ж—П)).
Fig. 358, 6. Peniculida.
minale. Наконец, третий вид C. salinum имеет типично
фронтониидный облик, перикинеты не показаны, мем-
брана с дикинетой в основании, слева 6 дикинет вмес-
то обычных 3 пеникулюсов. Диагноз рода должен
быть основан только на признаках типового вида, а
строение перистома С. viminale пока неизвестно.
Подотряд Lembadionina Jankowski, 1980
(рис. 358, а)
Овальные формы с гигантским перистомом, зани-
мающим почти весь вент; ротовая цилиатура глубоко
видоизменена; циртума нет. Хищные пресноводные
формы из бентоса и планктона. Описание перисто-
ма — в диагнозе рода Lembadion.
Сем. Lembadionidae Jankowski
in Corliss, I979
С диагнозом подотряда.
Род Lembadion Perty, 1849
Род включает виды L. bullinum Perty, 1849 (типовой
вид); L. conchoides Faure-Fremiet, 1924; L. gabonensis
Dragesco, 1965; L. magnum (Stokes, 1887); L. hymeno-
phora (Stokes, 1884) (вероятный синоним вида L. bulli-
num)-, L. lucens (Maskell, 1887); последние 2 вида — ти-
повые виды родов Hymenostoma Stokes, 1884 и Thuro-
phora Maskell, 1887; если вводить подроды, пригодно
второе название. «Разновидность» L. bullinum var. are-
nicola Dragesco, 1960 обозначается как L. arenicola
sp. n., с диагнозом и рисунком у Дражеско (Dragesco,
1960). Описания и иллюстрации видов очень разнятся
у разных авторов.
Кинеты продольные, дорсального шва нет, пери-
стом растянут почти на всю длину тела и вентральные
швы почти неразличимы. Хищники с очень широким
перистомом, элементы которого трактуются по разно-
му. Нет типично фронтониидных вестибулярных ки-
нет (перикинет), но справа либо одна пароральная ки-
нета + перикинета, либо 2 парорали. Дно перистома с
аргентофильными линиями и сплошным полем попе-
51 Зак. №4163
802
ALVEOLATA
Рис. 359, a. Peniculida.
Apofrontonia (ранее в составе Frontonia') obtusa (A—B)\ Paramecium caudatum (Г, F); Neobursaridium gigas (Д—И). (По: Dragesco, 1966a (Д, E, 3, И"); 1968a (Ж);
Dragesco, Dragesco-Kerneis, 1986 (F); Song, Wilbert, 1989 (A—В); Г— ориг.).
Fig. 359, a. Peniculida.
речных ребер. Слева одна поликинета вдоль всего края
перистома, без подразделения на пеникулюсы. В этой
схеме нет ничего фронтониидного, поэтому нельзя
ввести род в состав подотряда фронтониид; нет и проч-
ного циртума.
Подотряд Urocentrina Jankowski,
1980
У Линна (Lynn, 2002) сем. Urocentridae отнесено к
подотряду Parameciina, у французских авторов (Puyto-
rac, 1994) дан диагноз нового отряда Urocentrida Puyto-
rac et al., 1987 без цитирования моего таксона, имею-
щего приоритет. Основной отличительный признак
подотряда — редукция значительной части соматиче-
ской цилиатуры, что совершенно нетипично для пени-
кулид, имеющих большое число сложно дифференци-
рованных кинет. Перистом мелкий, субэкваториаль-
ный, без вестибулярных перикинет, с мембраной и
3 пеникулюсами.
Молекулярный анализ показал принадлежность
рода Urocentrum не к пеникулинам, а к ветви Tetra-
hymenida; сем. Urocentridae — боковая ветвь от ствола,
дивергирующего далее на Tetrahymenidae и Ophryogle-
nidae, но нет родства со скутицидами (Strud6r-Kypke
et al., 1999; Фокин, 2001). Однако окончательное реше-
ние зависит от интерпретации филограмм.
Сем. Urocentridae Claparede
et Lachmann, 1859
С диагнозом подотряда. 1 род из пресноводного
эпибентоса.
Род Urocentrum Nitzsch,
1827
Типовой вид U. turbo (= Cercaria turbo Muller,
1786) (= U. trichocystus Smith, 1897). Один вид, много-
кратно описывавшийся под другими названиями;
по крайней мере 5 родовых названий цилиат являются
синонимами —Authadias Gistel, 1848 (Л. turbo)’, Cal-
ceolus Diesing, 1866 (Peridinium cypripedium James-
ТИП CILIOPHORA. КЛАСС OLIGOHYMENOPHOREA
803
Рис. 359, б. Tetrahymenida.
Tetrahymena edaphoni (A—В); T. pyriformis (Г—Ж); Т. limacis (3); Т. rostrata (И, К); макростом Т. paravorax (Л/), Tetrahymena sp. в тканях рыб (Л). (По: Шуль-
ман, 1984 (Л); Foissner, 1987а (А—В ); Nanney, 1972 (Д—Ж)\ Kazubski, 1958 (3—Д); Dragesco, Dragesco-Kerneis, 1986 (М)).
Fig. 359, б. Tetrahymenida.
Macrostome of T. paravorax (M); Tetrahymena sp. in fish tissues (JT).
Clark, 1865); Peridimum Clark, 1866; Peridinopsis Clark,
1866 (P. pseudocuirass = Peridinium cypripedium)', Tur-
binellaHory, 1824 (T. maculigera). Вначале различались
2 вида, с 2 узкими поперечными кольцами ресничек
(U. turbo) и со сплошной цилиатурой до верхнего коль-
ца (Р. cypripedium), но оба описания ошибочные, вид
один.
Обычный пресноводный вид из сапробных зон;
особи обычно стоят на месте и быстро вращаются во-
круг оси тела. Наружный кинетом, перистом и морфо-
генез изучены рядом авторов методами Клейна, Шат-
тона, Бодиана (протаргол) и Фернандеса-Гальяно (ам-
миачное серебро) (Klein, 1927; Faure-Fremiet, 1954;
Fernandez-Galiano, Guinea, 1971, и др.). Кинеты в двой-
ном кольце вокруг тела, исчезли в антесоме и постесо-
ме, кроме небольшой тигмозоны с пучком каудальных
ресничек. Кинеты продольные, но все кинетосомы ши-
рокого кольца группируются в псевдопоперечные
ряды (адесмокинеты = паратены). Ядро дуговидное в
постесоме; вакуоль с каналами у постерона. Перистом
очень мелкий, питание фильтрацией — не хищники;
нет перикинет. В буккальной полости обширное гер-
минальное (стоматогенное) поле кинетосом, парораль-
иая мембрана, фибриллы на всем дне перистома, слева
3 тонких пеникулюса примерно равной длины, с 3 ря-
дами кинетосом в каждом.
Подотряд Parameciina Fromentel,
1874
Авторство этой группы требует уточнения. В Traite
(Puytorac, 1994) — это Parameciina Small et Lynn, 1985;
у Линна (Lynn, 2002) — Parameciina Jankowski in Small
et Lynn, 1985; в моей статье по системе цилиат (Янков-
ский, 1980) — Parameciina Jankowski, 1980, subordon.;
но приоритет должен принадлежать Фроментелю (Fro-
mentel, 1874), который делит всех цилиат на 2 группы,
Paramecina и Vorticellina. Как обычно со старинными
таксонами, состав их непрерывно менялся, а названия
могут быть сохранены для более мелких групп с совре-
менными диагнозами. Это касается и второго назва-
ния — Vorticellina, поскольку это один из подотрядов
современных перитрих (у Фроментеля Vorticellina —
смесь разных групп, не только перитрихи).
Подотряд включает 2 рода, утерявшие немадесмы
и циртум; имеется вестибулюм со сложной системой
кинет — дополнительный фильтрационный комплекс;
в буккальной полости мембрана, квадрулюс (соответ-
ствует М3 тетрахимен) и 2 пеникулюса (Ml и М2); рот
не щелевидный, округлый, на дне полости.
804
ALVEOLATA
Сем. Parameciidae Dujardin, 1840
В литературе авторство семейства приписывается
Кенту, Гроббену, Штейну, Бючли. Подотряд включает
сем. Parameciidae (Paramecium) и Neobursaridiidae (Ne-
obursaridium), поэтому для диагноза парамециид нуж-
но указать признаки, которых нет у второго рода —
тело относительно узкое, превестибулюм умеренно
широкий, в квадрулюсе не более 4 кинет, ядро оваль-
ное, не гантелевидное, сомакинеты не столь полимери-
зованы и могут быть легко подсчитаны. Собственно,
нет причин для разграничения родов в разных семей-
ствах. В данной сводке сем. Neobursaridiidae Dragesco
et Tuffrau, 1967 не признается валидным, но может
иметь ранг подсемейства.
Род Paramecium Muller, 1773
(рис. 358, 6—359, а)
Типовой вид Р. aurelia. Фактическим автором
названия рода является Hill, 1752, но зоологическая
номенклатура начинается с 7-го издания книги Линнея
в 1758 г. Первоначальное название рода Paramaecium,
общепринятое в прежней литературе, было постепен-
но вытеснено современным вариантом названия.
Тело вытянутое, узкое, выпуклое на дорсальной
стороне и сплющенное вентрально. Перистом смещен
далеко от антерона (по сравнению с фронтониями);
различимы 3 зоны — буккальная полость (буккон), ве-
стибулюм и превестибулюм (термин автора). Рот рас-
положен на дне роговидного буккона, округлый, не
щелевидный; справа мембрана, слева квадрулюс (М3)
и 2 сближенных, но не слившихся пеникулюса М2 и
Ml; в основании их по 4 ряда ресничек. Вестибулюм с
короткими сомакинетами на стенках; превестибу-
люм — это обширная неглубокая полость от вестибу-
люма до антерона со сложной системой кинет и адес-
мокинет. Передний безресничный шов идет продольно
по краю превестибулюма, задний шов более узкий, с
цитопроктом. Зона трихоцист под всей поверхностью
тела; 2 и более сократимые вакуоли с мелкими вакуо-
лями или длинными каналами расположены в продо-
льной линии. Овальный макронуклеус различается по
форме и плотности у разных видов рода; один или не-
сколько мелких микронуклеусов также разнотипные,
их структура, размеры и положение в клетке — важ-
ный видовой признак. Зоохлореллы имеются только у
Р. bursaria. Большинство видов рода пресноводные,
несколько видов эвригалинные, но одни предпочитают
слабосоленые воды (лагуны), другие море. Род все-
светный, отмечен на всех материках, но многие виды
или отдельные сингены «космополитных» видов име-
ют ограниченный ареал. Много тепловодных видов,
отсутствующих в Европе.
Относительно крупный род, в котором можно раз-
личить группы видов — подроды. В схеме автора (Ян-
ковский, 1969) для европейских видов рода выделено
3 подрода.
Helianter Jank., 1969 — Р. putrinum = Р. trichium
(тип рода), Р. bursaria.
Cypreostoma Jank., 1969 — Р. woodruffi (тип рода),
Р. calkinsi, Р. polycaryum, Р. arcticum. Различия каса-
ются формы тела, степени сдвига рта от апекса, вели-
чины превестибулюма, типа ядер.
Paramecium s. str. — Р. aurelia (тип рода), Р. cauda-
tum, Р. multimicronucleatum, Р. jenningsi.
Различия касаются формы тела, степени сдвига рта
от апекса, величины превестибулюма, типа ядер. Гало-
фильные виды известны только в подроде Cypreo-
stoma.
Если учесть все известные сейчас виды рода, кар-
тина не столь четкая; кроме того, Фокин (2001, 2002)
не считает оба вида подрода Helianter родственными.
Неясно положение Р. polycaryum.
Дубинковидная форма тела у части высших ви-
дов — единственный признак рода Faurella Roque,
1966; как гомоним, это название было заменено но-
вым — Physanter Jankowski. Вначале у вида F. therma-
lis Roque, 1966 из теплого источника во Франции на-
шли нетипичную перистомальную цилиатуру, но при
повторном изучении его ротовой аппарат оказался
сходным с перистомом Paramecium', контур тела — не-
достаточный признак для сохранения рода или подро-
да. Сейчас это название забыто.
Фокин (2002) предлагает различать подроды Bursa-
rium (Р. bursaria), Putrinuim (Р. putrinum, Р. dubosqui),
Calkinsium (P. calkinsi, P. polycaryum, P. nephridiatum,
P. woodruffi, P. pseudotrichium) и Caudatum (комплекс
P. aurelia из 15 сингенов и остальные высшие виды с
узким вытянутым телом). При этом нарушены правила
систематики — новые названия даются без объясне-
ний для групп, уже имеющих подродовые латинские
названия (Helianter, Cypreostoma, Paramecium). Вы-
сшие парамеции включают также 2 новых вида, упо-
мянутые в списке Фокина (2002), как Р. schewiakoffi
Fokin et al., 2001 и P. brasilianum Fokin et al., 2002, од-
нако второй вид пока не описан, а первый описан как
Р. schewiakoffi Fokin, Przybos, Chivilev, Beier, Heim,
Skotarczyk, Wodecka et Fujishima, 2004.
В баварском янтаре в ФРГ найдены тестацеи и ин-
фузории, одна из которых описана как Paramecium tri-
assicum Foissner et Schonbom, 1999; это мелкие тонкие
клетки величиной 42—61 мкм с 2 вакуолями в локу-
сах, типичных для парамеций; сохранились 3 особи
вида. Среди современных парамеций с такой формой
тела нет столь мелких видов. Ниже приведен список
видов парамеций, включая часть неопределимых ви-
дов и синонимичные названия: Р. africanum Dragesco,
1970; Р. arcticum Doroszewski, 1957; Р. aurelia Ehren-
berg, 1832; P. brasilianum (Fokin in press); P. bursaria
(Loxodes bursaria Ehrenberg, 1832, Paramecium in Foc-
ke, 1853); P. calkinsi Woodruff, 1922; P. caudatum Eh-
renberg, 1832; P. chilodonides Kahl, 1931*; P. chlorelli-
gerum Kahl, 1931*; P.ficarium Kahl, 1928*; P. dubosqui
Chatton et Brachon, 1933 (f. bactrocaryon*, f. sphaeroca-
ryon* — разные виды парамеций); P. dragescoi Aliev,
1990; P.jankowskii Dragesco, 1972; P. jenningsi Diller et
Earl, 1958; P. multimicronucleatum Powers et Mitchell,
1910; P. nephridiatum Gelei, 1925; P. parabursaria Dra-
gesco, 1973; P. polycaryum Woodruff et Spencer, 1922;
P.porculus Wichterman, 1986; P. putrinum Claparede et
Lachmann, 1858; P. pyriforme Gourret et Roeser, 1886*;
* Звездочка означает непригодные названия.
ТИП CILIOPHORA. КЛАСС OLIGOHYMENOPHOREA
805
Р. pseudoputrinum Kahl, 1931*; P. pseudotrichium Dra-
gesco, 1971; P. schewiakoffi Fokin et al., 2004; P. silesia-
cum Sramek-Husek, 1947*; P. traunsteineri Kahl, 1931*;
P. trichium Stokes, 1885*; P. ugandae Dragesco, 1972;
P. wichtermani Helmy Mohammed et Nawal Nashed,
1970; P. woodruffi Wenrich, 1928. Вид P. pyriforme G. et
R., 1886 из моря у Марселя — это несомненно Р. cal-
kinsi и первое название имеет приоритет, но этот вид
никогда не цитируют и сейчас восстановить видовое
название поздно; у Фокина вид не упоминается.
Р. aurelia — надвид (superspecies), комплекс мор-
фологически сходных видов; номера сингенов заме-
нены латинскими названиями, среди которых к обще-
му недовольству не осталось названия Р. aurelia
(Р. primaurelia, Р. biaurelia, Р. triaurelia, Р. tetraurelia,
Р. pentaurelia, Р. someborni и т. д.). Сингены у Р. bur-
saria и Р. putrinum (= Р. trichium) сохраняют цифро-
вые обозначения; у Р. caudatum также, поскольку вид
считают единым по всем признакам (Stoeck et al.,
2000).
Род Neobursaridium Balech, 1941
(рис. 359, a)
Типовой вид N. gigas — тропический вид из
Южной Америки и Центральной Африки; первонача-
льно считался гетеротрихой, но Дражеско (Dragesco,
1968а) показал тесное родство с парамециями. Мас-
сивные мешковидные формы (до 650 мкм) с гантеле-
видным ядром, 2 вакуолями с длинными каналами, гу-
стой цилиатурой, с полимеризацией кинет. Обширный
превестибулюм, в принципе, как у парамеций; вторич-
ные ряды (паратены) на его краях были приняты вна-
чале за мембраиеллы гетеротрих.
В перистоме длинные параллельные Ml и М2, по-
лосы шириной 4 кинетосомы и квадрулюс — широкая
полоса беспорядочно расположенных кинетосом; на
дне длинная мембрана. Этот отдел усложнен наличием
добавочной роговидной полости.
Наличие вида по обеим сторонам южной Атланти-
ки — свидетельство разлома единого континента. Фи-
логения рода пока неясная; у низших парамеций нет
каналов вакуолей, как и у ряда видов Cypreostoma-,
промежуточные формы между высшими парамециями
и Neobursaridium пока неизвестны.
Подкласс Hymenostomatia Delage et Herouard, 1896
В системе Линна единая традиционная группа гименостомат
заменена 2 подклассами Scuticociliatia (Philasterida, Pleuronemati-
da) и Jtymenostomatia (тетрахимениды и офриоглениды в одном от-
ряде Hymenostomatida). Различия не столь четкие, локсоцефалиды
являются промежуточной группой, сохраняют типичный тетрахи-
мениум и часть послеротовых кинет. Важно выяснить, как протека-
ет морфогенез у всех родов локсоцефалид — только за счет группы
кинетосом ниже рта (скутикус) или с участием мембраны или од-
ной из укороченных послеротовых кинет. Здесь подкласс гимено-
стомат рассматривается в традиционном объеме для всех гимено-
стомат, кроме пеникулид, апостомат и астомат.
Тело обычно вытянутое, часто каплевидное, сужается к апексу;
кинеты продольные, перистом с мембраной справа и 3 мембранел-
лами слева. У примитивных тетрахименид сохранен четкий комп-
лекс ротовой цилиатуры — короткие диагональные мембраиеллы,
как у предковых нассулид Furgasonia и простомат Urotricha', сто-
матогенез происходит при участии одной из правых послеротовых
укороченных кинет. Далее послеротовые кинеты теряются, остает-
ся зачатковая группа или короткий ряд кинетосом (скутикус), акти-
вирующихся при делении особи. Меняется форма мембранелл,
их положение, число кинет в основании; все труднее провести
гомологию ротовой цилиатуры скутицид и тетрахименид. В одной
из групп удлиняются параллельные ряды — мембрана и М2, Ml
становится рудиментарной, небольшая полоса М3 лежит у рта или
погружена в буккон. Эта линия ведет к плейронематидам и тигмот-
рихам, и от тигмотрих через формы типа Hemispeira и Nucleocorbu-
la приводит к крупному дивергентному классу перитрих с кольце-
вой парой УМ + М2 и полосой М3 в глубокой предротовой во-
ронке.
У высокоспециализированных апостомат томиты напоминают
мелких скутицид; у червеобразных парастомат остается рудимент
перистома; у астомат нет ни следа перистомальных кинет, дивер-
генция последних и аберрантной группы фаготрофных гистероци-
нетид связана с развитием разных типов присоски, опорной систе-
мы и фиксаторных органелл.
Отряд Tetrahymenida Faure-Fremiet
in Corliss, 1956 (рис. 359, 6—361, a)
Первоначально предложен как подотряд в отряде
Hymenostomatida. Отряд включает группу родов при-
митивного типа, — перистом почти апикальный,
обычно не растянут по оси тела; мембраиеллы распо-
ложены ступеньками, не вытянуты в одну линию; со-
матическая цилиатура простая, сохранены послерото-
вые кинеты; нет их рудимента — группы кинетосом
ниже рта (scuticus), принимающей участие в стомато-
генезе у филастерид и локсоцефалид. При делении
особи трофонт сохраняет перистом и мембраиеллы, у
дочерней особи они формируются заново в медиаль-
ной части послеротовых кинет. Примитивность груп-
пы очевидна при сравнении с исходным родом нассу-
лид Cyclogramma (Furgasonia), имеющим сходную ци-
лиатуру перистома и группу послеротовых кинет. У
локсоцефалид сохраняется такой же тип мембранелл,
как у тетрахименид, но идет редукция послеротовых
кинет и стоматогенез происходит за счет скутикуса и
одной из оставшихся кинет, далее в эволюции после-
ротовые ряды окончательно исчезают. Дивергенцию и
очевидное тесное родство пленчаторотых цилиат (без
перитрих и эндопаразитов) лучше отражает следую-
щая схема:
Подкласс Hymenostomatia Delage et Herouard, 1896
Отряд Tetrahymenida Faure-Fremiet in Corliss, 1956
Отряд Ophryoglenida Canella, 1964
Отряд Scuticociliatida Small, 1967
Подотряд Loxocephalina Jankowski, 1980
Подотряд Philasterina Small, 1967
Подотряд Pleuronematina Faure-Fremiet in Corliss, 1956
Отряд Thigmotrichida Chatton et Lwoff, 1936
806
ALVEOLATA
Рис. 360, a. Tetrahymenida.
Colpidium colpoda (А, Б, Г); Jaocorlissia dragescui (/?): Glaucoma chattoni (Д}\ «Epenardia myriophylliv> in Dragesco, 1970 (E, Ж, ныне Glaucoma dragescui, тип
рода Jaocorlissia)', Glaucoma scintillans (3, И). (По: Struder, 1991 (В, Г)', Dragesco, 1970 (E—И); Dragesco, Dragesco-Kerneis, 1986 (Д); А, Б — ориг.).
Fig. 360, a. Tetrahymenida.
Первоначально все роды первого отряда включа-
лись в состав одного сем. Tetrahymenidae Corliss, 1952;
роды Spirozona, Stegochilum и Trichospira не считались
тетрахименидами. Затем на уровне семейства были от-
делены эндопаразитические виды, теряющие ротовую
цилиатуру—Curimostomatidae Jank., 1968. Когда было
доказано родство внешне несходных родов Colpidium
и Turaniella (ранее относимой к пеникулинам), эта
группа была обособлена — Turaniellidae Didier, 1971.
Оставшиеся роды также разбили на группы — Tetrahy-
menidae s. str. и Glaucomidae Corliss, 1971. Наконец,
при импрегнации выявили тетрахимениум у редких
цилиат Stegochilum и Spirozona', для них восстановлено
сем. Spirozonidae Kahl, 1926. Аберрантный род Espe-
joia из мукуса в кладках икры водных насекомых счи-
тался глаукомидой; родство их было точно доказано,
но по типу ротовой цилиатуры род был отделен от гла-
уком — Espejoiidae Puytorac et al., 1987. Отделен также
род Deltopylum, крупные хищники со сложным циклом
развития — сем. Deltopylidae Song et Wilbert, 1989 — и
объем первоначально крупного семейства теперь огра-
ничен 2 родами. Подсемейства в указанных семейст-
вах не выделяются.
Сем. Tetrahymenidae Corliss,
1952
Включает несколько родов с мелким субапикаль-
ным перистомом и ступенчатым расположением (по
диагонали) относительно коротких мембранелл. Арги-
ром простой — продольные и боковые фибриллы в
межкинетах, без четких рядов прямоугольников.
2 рода — Tetrahymena и Lambornella; перед их рас-
смотрением кратко отметим родовые синонимы.
Род Рагад/аисота Kahl,
1926
Типовой вид Р. rostrata по монотипии; ныне
это валидный вид тетрахимен. Точное строение пери-
стома не было известно, накопилось много описаний
подобных трудно определимых форм, и игнорировав
всю литературу Фургасон (Furgason, 1940), одним из
первых импрегнировавший этих цилиат серебром,
объявил изученный им вид новым видом и родом —
Tetrahymena geleii. В дальнейшем использовали оба
родовых названия, но в 1970 г. по заявке цилиатологов
ICZN официально обозначил Tetrahymena валидным
родом («nomen conservandum») с одновременным за-
претом использовать все названия, предложенные до
ТИП CILIOPHORA. КЛАСС OLIGOHYMENOPHOREA
807
Рис. 360, б. Tetrahymenida.
Spirozona caudata (А, Б); Turaniella (Turania) vitrea (В, Г)-, Espejoia mucicola (Д—3); Deltopylum rhabdoides (И, K)', Dexiostoma campyla (Л, M); Tetrahymenapy-
riformis (H ). (По: Foissner, 1986b (А, Б); Iftode, Versavel, 1968 (В, Г); Fryd-Versavel et al., 1974 (Д—3); Song, Wilbert, 1989 (И); Dragesco, Dragesco-Kerneis,
1986 (К); Л—H — ориг.).
Fig. 360, 6. Tetrahymenida.
статьи Фургасона, включая Paraglaucoma. Вероятно
по ошибке, в каталоге Аэшт род выделен жирным
шрифтом как валидное название.
Мюгард (Mugard, 1948) считает, что облигатно-гис-
тиотрофный вид Р. rostrata близок к Glaucoma pyri-
formis, но отличается от него по строению, в частно-
сти у второго вида есть аргиром между кинетами, у Р. ros-
trata нет, поэтому роды разные. Аргиром трудно
выявить; сейчас ясно, что он имеется и однотипен у
обоих видов.
Род Рагад1аисота Warren, 1932
Типовой вид Р. limacis по монотипии. Это так-
же валидный вид рода Tetrahymena, но род — гомоним
рода Каля, и оба названия отвергнуты в 1970 г. ICZN
для сохранения позднего названия Tetrahymena. Вид
паразитический, описан из печени наземных моллю-
сков Agriolimax agrestis в ЮАР; обычен и в Европе,
особенно в слизнях, реже во влаголюбивых раковин-
ных моллюсках.
Род Protobalantidium Abe, 1927
Типовой вид В. kno-wlesii Ghosh, 1925 по моно-
типии; паразиты из целомической жидкости личинок
комаров; плохо описанный вид, неопределимый, но
несомненно это тетрахимены. Родовое название отвер-
гнуто ICZN для сохранения названия Tetrahymena.
Род Prototravassosia Artigas de Toledo
et Unti, 1938
Типовой ви д P. costal по монотипии. Этот род
числится в каталоге Аэшт как валидный и даже как хо-
рошо изученный; в действительности вид совершенно
неопределимый, кинетом и перистом не описаны. Тело
каплевидное, поверхность покрыта рядами шестигран-
ных ячеек, цитоплазма полна пищевых вакуолей, ядро
с отдельной наружной оболочкой. Выделены из боль-
ного пациента в Бразилии. У Корлисса (Corliss, 1979) в
отряде Astomatida (Anoplophryidae), но это, конечно,
тетрахимениды — заражение тетрахименами отмена-
808
ALVEOLATA
Рис. 361, a. Tetrahymenida.
Stegochilum schoenborni (А—Д); Lambornella clarki (E), L. stegomyjae (Ж)\ Glaucomella sagitta (3, И); Espejoja culex (K, JT); Curinostoma renale (M); Glaucoma
(ранее Daliasia, Diplomestoma) frontata (H, О). (По: Foissner, 1986b (А—Д); Corliss, Coats, 1976 (E, Ж); Groliere, 1977 (3, И); Fryd-Versavel et al., 1974 (K; JT);
Struder, 1991 (Л7); Dragesco, Dragesco-Kerneis, 1986 (H, O)).
Fig. 361, a. Tetrahymenida.
ется нередко у позвоночных разных групп и у челове-
ка, проникновение их в нервную систему и мозг ле-
тально. На окрашенных препаратах тетрахимен ядра
нередко имеют такой вид, как на рисунках Р. costai.
Поскольку род не считали тетрахименидами, название
не было отвергнуто ICZN.
Род Leptoglena Grasse et Boissezon, 1929
Типовой вид Balantidium knowlesii Ghosh,
1925. Синоним рода Protobalantidium Abe, 1927, пред-
ложенного ранее; вид неопределимый, и уже по одной
этой причине род невалидный. Кроме того, название
Leptoglena официально отвергнуто комитетом ICZN.
Род Turchiniella Grasse et Boissezon, 1929
Типовой вид Т. culicis, целомический пара-
зит из комаров Culex pipiens, найден в гемоцеле одной
взрослой самки хозяина. Плохо описанный вид не чис-
лится сейчас в списке валидных видов тетрахимен, а
род был отвергнут ICZN как конкурентное название
более позднего рода Tetrahymena. В этих комарах
встречаются Т. pyriformis и Т. chironomi, вида Т. culicis
как неопределимого в современной литературе нет.
Род Cystidium Eberhard, 1862
Типовой вид С. titubans. Плохо описанный не-
определимый свободноживущий вид цилиат; родовое
название в ранней литературе не применялось, род
был признан синонимом Leucophrys sensu lato, кото-
рый включал и тетрахимен.
Род Leucophrydium Roux, 1899
Типовой вид L. putrinum. Свободноживущий
пресноводный вид величиной около 130 X 50 мкм;
судя по рисунку и размерам, это может быть вид типа
Tetrahymena vorax.
ТИП CILIOPHORA. КЛАСС OLIGOHYMENOPHOREA
809
Рис. 361, б. Ophryoglenida.
Ophryoglena singularis (А,Д, E); О. utriculariae (Б, В); О. pectans (Г); О. bacterocaryon (Ж). (По: Canella, Rocchi-Canella, 1976 (А, Г, Д, Е); Song, Wilbert, 1989
(Б, В); Puytorac, Paret, 1965 (Ж)).
Fig. 361, б. Ophryoglenida.
Род Leucophrys Ehrenberg, 1830
Типовой вид L. patula', этот вид сейчас валид-
ный, но комиссия ICZN запретила применение всех ро-
довых названий, предложенных для тетрахимен до
1940 г.
Род Roquea Jankowski, 1967
Типовой вид Tetrahymena vorax Kidder, Lilly et
Claff, 1940; название предложено как подрод тетрахи-
мен с диморфным жизненным циклом. Включает
Т. patula, Т. vorax и Т. paravorax. В зависимости от
типа питания, это микрофаги или макрофаги (хищни-
ки) с разным типом перистома.
Род Lambornella Keilin, 1921
Типовой вид L. stegomyjae по монотипии; это
название также было включено в список отвергнутых
родов (ICZN, 1970), но единственное из приведенных
выше было вновь восстановлено как валидное (Corliss,
Coats, 1976). Цилиаты из личинок и взрослых особей
москитов Aedes (Stegomyja) scutellaris (=А. (S.) albo-
pictus) в Малайзии вначале были описаны без латин-
ского названия вида, позже названы L. stegomyjae', их
находят в москитах рода Aedes разных подродов. Хозя-
ева типового вида — Aedes (Stegomyja) aegypti в Евро-
пе, Казахстане, Африке, также в A. flavescens. Второй
вид рода L. clarki Corliss et Coats, 1976 описан из Кали-
форнии в местных москитах Aedes (Ochlerotatus) sier-
rensis. Вначале первый вид был переведен в состав Tet-
rahymena (Т. stegomyjae), но позже род Lambornella
признали валидным. Оба хозяина выводят личинок не
в ручьях, как обычно у москитов, а в дуплах деревьев;
круг хозяев со временем расширяется.
Трофонты Lambornella напоминают тетрахимен —
тело каплевидное, перистом треугольный, субапикаль-
ный, вакуоль с 2 порами вентрально справа, ниже эк-
ватора; спереди небольшой ацилон, короткий предро-
товой шов, второй шов у постерона. Мембрана С-об-
разная, мембранеллы Ml и М2 почти равные,
изогнутые, М3 очень короткая. По этим признакам оба
вида соответствуют роду Tetrahymena, но при валида-
810
ALVEOLATA
ции рода учитывали 2 отличия — большое число по-
слеротовых кинет у Т. clarki (меньше у Т. stegomyjae) и
особый жизненный цикл, включающий стадию инва-
зионной цисты на кутикуле хозяина. Эксцистирую-
щийся теронт активно проникает сквозь кутикулу ли-
чинки и приступает к питанию в гемоцеле (стадия тро-
фонта).
При изучении богатой и во многом эндемичной
микрофауны в воде на бромелиях Южной Америки
(Foissner, 2003b) был открыт свободноживущий вид
L. trichoglossa'. тело очень крупное (200 мкм), вытяну-
тое, с 38—50 кинетами, включая 6—11 посторальных
рядов; аргиром — фибриллы, направленные влево от
кинетосом. В перистоме мембрана Ml > М2 > М3.
Пока не изучена столь же подробно типовая L. stego-
myjae, вид Фойсснера временно помещен в состав
Lambornella, может быть позже отнесен к новому роду.
Род Tetrahymena Furgason,
1940
Типовой вид Т. geleii; это синоним вида Leu-
cophryspyriformis Ehrenberg, 1830; вместо создания но-
вого рода можно было обозначить тип старинного
рода Leucophrys. Этот род упоминается во множестве
работ вплоть до 1960-х гг. как валидный, к нему отно-
сили много видов разного плана строения. Сейчас род
Leucophrys ушел в синонимику, но все еще пригоден
для обозначения подрода тетрахимен с диморфизмом
трофонтов вместо названия Roquea. Варианты написа-
ния — Tetrahymen, Tetrahymenia — помещены в спи-
сок отвергнутых названий ICZN. В одном из курсов
зоологии беспозвоночных указано, что Янковский
разделил род Tetrahymena на 3 подрода — Tetrahymena
s. str., Roquea и Praedator, но третье название мной не
предлагалось, автор неизвестен.
Типичные Т. pyriformis каплевидные, величиной
50—70 мкм, с 17—22 кинетами, включая всего 1—2
послеротовых ряда; передний ацилон едва выражен,
предротовой шов короткий, с вершинами 6—8 кинет.
Аргиром — длинная извитая аргиронема между кине-
тами, местами дающая боковые ветви; правильные ар-
гиронемы опоясывают кольцом антерон на уровне пе-
ристома. Аргиронемы идут от кинетосом к мукоци-
стам по ходу всех кинет. Вакуоль с 2 порами (как у
Lambornella) расположена над постероном. Перистом
мелкий, мембрана до вершины неглубокой полости;
верхние мембраиеллы почти равные, нижняя короче,
но не рудиментарная. Правая послеротовая кинета
служит стоматогенной, выделяет группу кинетосом, из
которой формируется новый ротовой комплекс; про-
тер сохраняет перистом без реорганизации.
Число видов рода возрастает по мере расширения
района работ, и по крайней мере Т. pyriformis является
надвидом — комплексом морфологически близких не
скрещивающихся биологических видов (сингенов).
Эти виды получают латинские видовые названия,
определить их можно биохимически или при скрещи-
вании с клонами, культивируемыми в разных лабора-
ториях. В отличие от Paramecium aurelia, когда при
введении латинских названий вместо цифр для син-
генов само название вида Р. aurelia исчезло, один из
биологических видов и сам надвид тетрахимен со-
храняют название Т. pyriformis, что удобно для фау-
нистов.
Род включает свободноживущие виды, факульта-
тивных и облигатных паразитов. Выделяется группа
видов Т. vorax, Т. paravorax и старинный вид Т. patula
(тип рода Leucophrys). Это крупные мешковидные
формы, которые легко разводятся в лаборатории на
бактериях и на культурах мелких цилиат, например на
Colpidium campylum. При бактериальном питании это
микрофаги с мелким перистомом, при голодании или
наличии мелких цилиат начинается перестройка, пери-
стом и мембраиеллы становятся непропорционально
крупными, формируется глубокий «перистомальный
мешок», начинается каннибализм или активное хищ-
ничество; при отсутствии крупной пищи — новая пе-
рестройка. Такое чередование стадий микро- и макро-
стомов (диморфизм) должно быть по крайней мере
подродовым признаком. Макростомы могут образо-
вать крупные цисты, где делятся несколько раз, произ-
водя мелких теронтов — микростомов.
Свободноживущие формы хорошо выносят сапроб-
ные условия, питаются бактериями или тканями по-
гибших водных животных, их можно найти в сброшен-
ных при линьке шкурках насекомых; тетрахимен легко
собрать, бросив в пруд на несколько дней раздавлен-
ных насекомых. В лаборатории хорошо развиваются
на рисе или при добавлении кусочка ткани, давая куль-
туры большой плотности. Осенью отмирающие губки
в ручьях насыщены тетрахименами.
Паразитические виды не коррелированы с подрода-
ми; нет паразитов у диморфных Leucophrys (Т. vorax,
Т. paravorax, Т. patula), но они есть в различаемых
Корлиссом (Corliss, 1972) группах «pyriformis» (Т. py-
riformis, Т. setifera, Т. chironomi) и «гоstrata» (Т. rostra-
ta, Т. limacis, Т. corlissi). Кроме того, большое число
хозяев разных классов беспозвоночных и позвоноч-
ных, даже бабочек и тараканов, можно заразить тетра-
хименами свободных видов комплекса Т. pyriformis.
Это более водный вид, Т. rostrata более почвенный,
поэтому первый чаще заражает водных животных, вто-
рой наземных, например дождевых червей, слизней и
раковинных моллюсков.
Гидры заражены видами «Paraglaucoma sp.» и Ba-
lantidium hydrae (Tetrahymena hydrae comb, n.), воз-
можно валидными, в Европе и на Байкале, где они
очень обычны, заражая эндемичных Hydra baikalensis
(только в полости тела и щупалец, не в тканях). Круп-
ные планарии дендроцелиды (Dugesia, Polycelis, Dend-
rocoelum) несут урцеолярий на покровах, заражены
астоматами в кишечнике, ткани их часто поражены
массой тетрахимен. Инфекции в целоме дождевых
червей отмечены в Чехии (Allolobophora caliginosa) и
в Крыму. Водные и наземные моллюски заражаются
видами Т. pyriformis и Т. rostrata, иногда одновремен-
но; вид Т. paedophthora (Berghe, 1935) из кладок икры
Planorbis и Physopsis неопределим, инфузории прони-
кают в икринки и там размножаются. Заражаются и
водные двустворчатки — мелкие сферииды и крупные
униониды. На суше часто заражены слизни (лимаци-
ды) 3 видами тетрахимен, включая облигатно-парази-
тических Т. limacis — тип рода Paraglaucoma Warren,
1932.
ТИП CILIOPHORA. КЛАСС OLIGOHYMENOPHOREA
811
Личинки насекомых заражаются случайными или
специфическими видами, среди последних Т. chirono-
mi из комаров и Т. sialidos из вислокрылки (Megalopte-
ra) Stalls lutaria, оба вида в гемоцеле, летальные для
хозяев. Balantidium knowlesii Ghosh, 1925 (типовой вид
2 родов) — это неопределимый вид из Culicoides реге-
grinus в Индии. Виды Holophrya в речных мошках (Si-
muliidae) — не простоматы, а тетрахимены. Симулии-
ды (Simulium damnosum и др.) разносят онхоцерк в Аф-
рике, вызывающих тяжелую болезнь, и они часто
заражены тетрахименами; предлагалось использовать
последних для борьбы с водными личинками перенос-
чиков. В ракообразных тетрахимены редкие, намного
чаще их заражают скутициды; отмечены инвазии в ев-
ропейских Gammarus, в речных раках Cherax quadrica-
rinatus в Австралии; в Cherax — это Т. pyriformis, но
этот вид распался сейчас примерно на 15 независи-
мых, морфологически неотличимых генетических ви-
дов, точное определение невозможно.
Тетрахимены нескольких видов легко проникают в
кровеносную систему рыб, оседают в разных органах и
проникают в нервную систему и мозг, вызывая гибель
рыб. Enchelys parasitica Dorier, 1926 — один из таких
паразитов, несомненно тетрахимена; сведения о неоп-
ределенных тетрахименах в тканях рыб публикуются
во многих странах. Автору не раз приходилось осмат-
ривать на Байкале бычков, вся кожа которых была на-
сыщена тетрахименами. Вид Т. corlissi предпочитает
позвоночных хозяев — рыб, амфибий, можно искусст-
венно заразить птиц. Balantidium struthionis из страу-
сов, вероятно тетрахимена; есть находки тетрахимен в
годубях, в опытах заражаются цыплята. Амфибии за-
ражаются тетрахименами в воде (тритоны, лягушки) и
на суше (саламандры), основная локализация — нер-
вная система и мозг, богатые липидами. Инфекции в
человеке (легкие, нервный ствол, мозг) трудно диагно-
стируются, но есть ряд достоверных описаний леталь-
ных инвазий. Вид «астомат» Prototravassossia costai
Artigas et Unti, 1938, выделенный из человека в Брази-
лии, судя по рисункам — тоже обычная тетрахимена
(Т. costai comb. n.).
Ниже дан список большинства видов Tetrahymena
s. str. и Leucophrys.
Т. pyriformis (Leucophrys pyriformis Ehrenb., 1830;
Glaucoma in Schewiakoff, 1889; синонимы — Tetrahy-
mena geleii Furgason, 1940; Colpidium glaucomaeforme
Gelei, 1938). Каплевидные формы с 15—25 кинетами,
без каудалии, аргиром — продольные извитые фиб-
риллы между кинетами и их боковые ветви, цист деле-
ния нет. Свободноживущий пресноводный вид, с тен-
денцией к гистиотрофии и факультативному парази-
тизму; в опытах заражает большой круг хозяев.
Т. parasitica (Glaucoma parasiticum Penard, 1922) —
в жаберных пластинках амфипод Gammarus в Женев-
ском оз.; вид плохо изучен и пока не был повторно
найден в гаммарусах; сомакинет, вероятно, больше,
чем у Т. pyriformis.
Т. rostrata (Paraglaucoma rostrata Kahl, 1926) — у
почвенных особей 28—37 кинет, при паразитизме
41—58; имеются цисты деления и цисты покоя, отсут-
ствующие у типового вида. Заражает олигохет (вод-
ных и почвенных) и моллюсков (водных и назем-
ных) — раковинных и безраковинных гастропод (ули-
ток и слизней), к примеру в Польше заражает гастро-
под Vallonia pulchella, Discus (Goniodiscus) rotundatus,
Arion circumscriptus, Vitrinapellucida, Cochlicopa lubri-
ca, Zonitoides nitidus, Iphigena latestriata и др.
T. limacis (Warren, 1932) Kozloff, 1946, паразит из
печени слизней Deroceras agreste в ЮАР, позже най-
ден в США в D. reticulatum и в Европе в разных слиз-
нях, но при определении вида нужно учесть и частую
инфекцию в слизнях другой тетрахимены Т. rostrata. В
одной местности много хозяев заражаются этим ви-
дом, например в Калифорний заражены Deroceras re-
ticulatum, Lehmannia poirrieri, Prophysaon andersoni,
Arion hortensis, Deroceras laeve, Limax flavus, L. maxi-
mus, Milaxgagates (включая интродуцентов); в Польше
отмечены в слизнях и раковинных моллюсках родов
Nesovitrea, Lehmannia, Trichia, Daudebardia, Vitrina', в
Крыму заражают Tandonia cristata, T. kaleniczenkoi и
слизней. Реже инвазии в двустворчатках (Sphaeriidae).
Вид Glaucoma paedophthora Van der Berge, вероятно,
T. rostrata или T. limacis из икры гастропод Planorbis и
Physopsis.
Т. rotunda Lynn, Molloy et LeBrun, 1981 — паразит в
гемолимфе мошек Simulium в США.
Т. empidokyrea Jerome, Simon et Lynn, 1996 — пара-
зит взрослых стадий комаров Aedes sp. в Канаде, нет в
личинках этого вида. Это предполагаемый предок рода
Lambornella, тоже паразитирующего в Aedes.
Т. sialidos Batson, 1985 — паразит водных личинок
мегалоптеры (вислокрылки) Sialis lutaria в Англии.
Т. dimorpha Batson, 1983 — паразит в гемоцеле мо-
шек Simuliidae, только в личинках и куколках Simulium
equinum в Англии.
Т. setifera Holz et Corliss, 1956 — вид типа Т. pyri-
formis, но с каудальной ресничкой; может быть сино-
нимом одного из старинных видов гименостомат.
Т. chironomi Corliss, 1960 — паразит в гемоцеле ли-
чинок комаров Chironomus plumosus (Франция).
Т. corlissi Thompson, 1955 — тканевой (не кишеч-
ный) паразит низших позвоночных (рыб и амфибий),
может быть выделен из больных тритонов, саламандр,
жаб и лягушек; типовой хозяин — личинки Pseudotri-
ton. Неопределенные летальные паразиты Glaucoma
sp. в мозгу личинок Ambystoma texanum в Техасе — не-
сомненно этот вид тетрахимен.
Т. farleyi Lynn, Grandsen, Wright et Josephson, 2000.
Найден в моче больной собаки в Канаде; очень близок
к Т. pyriformis, определен как новый вид только по дан-
ным молекулярного анализа.
Комплекс Т. pyriformis включает генетически изо-
лированные виды-двойники (siblings) Т. asiatica,
Т. malaccensis, Т. thermophila (ныне основной лабора-
торный объект), Т. furgasohi, Т. tropicalis, Т. borealis,
Т. canadensis, Т. mimbres, Т. silvana, Т. Iwoffi, Т. ameri-
canis, Т. australis, Т. hegewischi, Т. hyperangularis,
Т. nanneyi, Т. nipissingi, Т. pigmentosa, Т. sonneborni,
Т. capricorni's и др.; список непрерывно растет, многие
виды имеют ограниченный ареал.
Группа Т. patula (подрод Leucophrys или Roquea)
включает свободноживущие виды Т. patula (Ehrenb.,
1830) Corliss, 1951; Т. vorax (Kidder, Lilly et Claff, 1940)
Kidder, 1941 и T. paravorax Corliss, 1957; все виды с ди-
морфизмом на стадиях микростомов (бактериотрофы)
и макростомов (каннибалы и хищники).
812
ALVEOLATA
Сем. Deltopylidae Song et Wilbert, 1989
Крупные гистиотрофные пресноводные формы с
полимеризацией кинет и усложненным жизненным
циклом; перистом относительно небольшой, все
3 мембранеллы удлиненные и извитые, расположены
продольно; в цикле развития чередуются стадии тро-
фонта и томонта; теронты (продукты каждого из 2 по-
следовательных делений) имеют разную морфологию,
разный тип перистома. Ядра нетипичные для тетрахи-
менид — многочисленные фрагменты по всему телу;
нетипичен и аргиром — сеть шестиугольников в про-
дольных рядах, как у парамеций.
Род Deltopylum Faure-Fremiet et Mugard,
1946
Типовой вид D. rhabdoides по монотипии.
Тело крупное (100—120 мкм), цилиндрическое, посто-
янной формы, с прочным кортексом, с мелким ацило-
ном спереди; ядра в 25—35 мелких сферах рассеяны
по телу или в компактных агрегатах; вакуоль одна, ме-
диальная. Кинеты густые, лежат продольно, полиме-
ризованы (84—96), спереди длинный бисекантный
шов на месте сдвига рта, ниже рта швов нет; имеют-
ся 7—8 послеротовых рядов, остальные огибают пе-
ристом с обеих сторон. Перистом с длинной узкой
глоткой, мембранеллы очень длинные и узкие, почти
продольные, равной длины; мембрана УМ погружена;
вероятно, есть небольшой вестибулюм справа с участ-
ками соматических кинет.
В цикле развития типичный перистом образуется
после второго деления томонта, у 4 дочерних терон-
тов, а дериваты первого деления имеют «временный»
мелкий овальный перистом с мембранеллами другого
типа. При делении ядра собираются в общую массу,
затем фрагментируются вновь. Активно плавающие
хищники и сапротрофы, в лаборатории их можно куль-
тивировать на свежих тканях раздавленных водных
или наземных олигохет.
Раса Дражеско из Африки (Dragesco, Dragesco-Ker-
neis, 1986) не совпадает с типичной для Европы — раз-
меры крупнее (до 150 мкм), кинет меньше (70—76),
ядер больше (65—120), но возможно, что это изменчи-
вый вид. Несомненно D. rhabdoides описан раньше в
Швейцарии как Glaucoma cylindricum Penard, 1922 —
совпадение во всем, кроме формы ядра (цепочка из
многих не соединенных сферул), но, по Дражеско,
ядро у вида может принимать разные формы, а перед
делением элементы сближаются и сливаются в вытя-
нутое ядро. Поэтому названный вид переносится в со-
став данного рода — Deltopylum cylindricum (Penard,
1922) comb, n.; это название имеет приоритет и должно
использоваться вместо D. rhabdoides.
Сем. Turaniellidae Didier,
1971
Предротовой шов изогнутый, кинетом несиммет-
ричен, вершины правосторонних рядов отклонены
влево и сближены, образуя крупное обособленное рес-
ничное поле. Перистом продольный, мембранеллы
диагональные, крупные, М3 нормально развита и час-
то удлинена; у Turaniella перистом и мембранеллы не-
пропорционально крупные.
Род Colpidium Stein,
1860
Типовой вид Paramaecia colpoda Losana, 1829
(пес Paramecium kolpoda Ehr., 1831), синоним рода —
Doyerius Ormancey. Род включал много видов, сей-
час распределенных между 3 родами; кроме С. colpo-
da, включает С. singulare Vuxanovici, 1962; С. acu-
minatum-, С. kleini Foissner, 1969; С. striatum Stokes,
1886. Тип рода — крупный сапробный вид (90—
120 мкм) с широким телом, с 50—63 продольными ки-
нетами в тесно сближенных рядах; спереди мелкий
ацилон, предротовой шов извитой, передняя часть тела
как бы перекручена, на месте смещения виден широ-
кий желобок со специализированной цилиатурой. Вер-
шины правых кинет отогнуты налево, огибают пери-
стом и создают поле параллельных кинет для тигмо-
таксиса или для питания. Перистом относительно
небольшой, продольный, мембранеллы глубоко погру-
жены и выявляются только методом Шаттона; нет
редукции М3, частой у гименостомат, все мембранел-
лы удлинены и расположены продольно. Легко имп-
регнируется аргиром — 2 продольные аргиронемы
вдоль кинет, образующие многочисленные узоры раз-
ного типа по ходу кинеты (дополнительные ответвле-
ния к мукоцистам). Определить второй вид С. kleini
Foissner, 1969 можно только по некоторым деталям
при импрегнации — меньшее число кинет (35—40),
только 2 послеротовых ряда (3 у С. colpoda), разли-
чен аргиром.
Род Dexiostoma Jankowski,
1967
Типовой вид Colpidium campylum Stokes,
1886; род долгое время считался синонимом Colpidi-
um, но сейчас принят. Это обычный вид из сапроб-
ных вод, с узким цилиндрическим телом (55—70 мкм),
20—24 кинетами; предротовой шов незначительно
изогнут, тело спереди почти не искривлено, но вер-
шины правых кинет с тесно сближенными кинетосо-
мами образуют вторичную предротовую цилиатуру —
перикинеты. В целом кинетом простой, предротовой
шов короткий, имеются 2 послеротовые кинеты; арги-
ром тоже проще, чем у типового вида рода Colpidi-
um, — между кинетами только одна продольная арги-
ронема без сложного узора. Перистом продольный, от-
носительно крупный, мембранеллы почти продоль-
ные, М3 несколько укорочена; УМ вытянута почти до
вершины перистома. Colpidium в прежнем объеме
был признан полиморфным родом, и род Dexiostoma
был предложен для вида, промежуточного между Tet-
rahymena и крупным, особо сложным видом С. col-
poda. Описания у разных авторов незначительно
расходятся, вид легко определить in vivo, близких ви-
дов нет.
ТИП CILIOPHORA. КЛАСС OLIGOHYMENOPHOREA
813
Род Paracolpidium Ganner et Foissner, 1989
Типовой вид Colpidium truncatum Stokes,
1885 — редкий прудовой вид; размеры тела 40—
85 мкм, вакуоль над постероном, кинет немного
(22—27). Тело характерной формы, вид легко узнать
прижизненно — вздутое спереди, заостренное сзади;
пора вакуоли дорсальная; антесома скручена влево, с
полем кинет над ртом; спереди ацилон и короткий из-
витой предротовой шов. Перистом мелкий, глубоко
погружены 3 мембранеллы равной длины, но в Ml
уменьшено число кинетосом. Основные признаки
рода — мембрана УМ огибает только нижнюю часть
перистома, Ml тонкая, аргиром, как у тетрахимен, с
одной аргиронемой между смежными кинетами.
Ряд плохо описанных видов не находит места в сис-
теме; один из них Colpidium pannonicum Gelei — это
Dexiotricha (Loxocephalidae).
Род Turaniella Corliss, 1960
Типовой вид Turania vitrea Brodsky, 1925; за-
мещающее название для гомонима Turania Brodsky,
1925. Редкий вид из пресноводного планктона; открыт
в Узбекистане, отмечен в Чехии, переописан во Фран-
ции; сейчас хорошо изучена морфология, морфогенез,
ультраструктура, выяснено положение в системе. Род
всегда относили к пеникулинам из-за внешнего сход-
ства с Lembadion и наличия гигантских мембранелл в
перистоме; М3 разделена на 4 монокинеты, как у пара-
меций (так называемый quadrulus); позже выяснилось,
что этот род близок к Colpidium.
Трофонты веретеновидные, сужаются кзади, с боль-
шим числом кинет, субмедиальной вакуолью справа, с
коротким предротовым швом; антерон несимметри-
чен, правее перистома характерное для кольпидиев
поле диагональных кинет; у постерона длинный шов
вдоль цитопига. Перистом широко открытый, гигант-
ский, с глубокой мешковидной полостью; на дне ее
резко вытянутые продольно Ml, М2; вместо М3 —
4 разрозненные монокинеты, расходящиеся книзу —
подобие «квадрулюса» парамеций. Столь же велика
мембрана УМ. В связи с растяжением перистома по
оси и в стороны увеличено число послеротовых кинет
(общее число рядов около 66, послеротовых не менее
10). При делении одна из них выделяет поле кинето-
сом, образующих продольные поликинеты; к моменту
перешнуровки весь этот комплекс погружается в глубь
тела; одновременно реорганизуется материнский рото-
вой аппарат протера. Род Turaniella и диморфная Espe-
joia считались переходными формами между тетрахи-
менидами и пеникулидами, но у низших пеникулид
(фронтоний) нет такой модификации М3.
Сем. Spirozonidae Kahl, 1926
В списке Линна (Lynn, 2002) в составе семейства
2 рода: Stegochilum и Spirozona. Семейство было пред-
ложено для аберрантного рода Spirozona неясного по-
ложения в системе, только через полвека была прове-
дена импрегнация и выявлен тетрахимениум. Сейчас
ясно, что оба рода кольпидиидного типа, но Turanielli-
dae можно сохранить для кольпидиид, не сводить в си-
нонимы, поскольку 2 признака отделяют спирозонид
от кольпидиев — мембрана разделена на 2 сегмента
разного строения, и поле кинет правее рта обособилось
от соматической цилиатуры.
Род Stegochilum Schewiakoff, 1893
Типовой вид S. fusiforme описан из озера в Но-
вой Зеландии; по новым данным, тело очень узкое, вы-
тянутое, заостряется сзади, величиной 60—80 мкм; ки-
неты немногочисленные, биполярные, вакуоль субме-
диальная, спереди мелкий ацилон. Предротовой шов
почти продольный, поле тесно сближенных кинет и
кинетосом правее рта обособлено от остальной цилиа-
туры диагональным швом вентрально; дорсум только с
продольными рядами. Перистом небольшой, субапи-
кальный, мембрана в 2 сегментах — сплошной ряд снизу
и справа, разрозненные дисомы у вершины; длинные
мембранеллы вытянуты по оси в глубине полости. У
Каля (Kahl, 1932) в составе рода 3 вида: S. fusiforme,
S. ovale и S. acutunr, по ревизии Фойсснера (Foissner,
1986b) валидны 2 вида, типовой и S. schoenbomi Fois-
sner, 1986, другие виды исключены. Вид S. sphagneto-
rum Sramek-Husek, 1954 — цилиаты неясного положе-
ния в системе; S. acutum Burger, 1908 — синоним Tet-
rahymena pyriformis', S. ovale Ghosh, 1921 — синоним
Colpidium colpoda. Виды рода предпочитают сапроб-
ные зоны или черный ил (сапропель). Из почвы в Пе-
тергофе описан вид S. smalli Alekperov, 1993 с длиной
тела 80—100 мкм, 24 биполярными кинетами и 6 по-
слеротовыми; у типового вида 3 ряда ниже рта.
Род Spirozona Kahl, 1926
Типовой вид S. caudata из сапробных пресных
вод; тело вытянутое, ромбическое, вакуоль у постеро-
на, несущего пучок каудалий; перистом небольшой,
субапикальный. По Калю (Kahl, 1932), кинеты на пра-
вой стороне идут диагонально, на равных расстояниях,
с одним обособленным рядом тесно сближенных ко-
ротких ресничек от рта вниз к дорсальной стороне; на
венте топография сложная, ряды прерваны ртом и идут
к апексу. Вероятно, рисунки Каля ошибочные. По
Фойсснеру (Foissner, 1986b), имеются 2 зоны кинет —
полоса из 6—10 вплотную сближенных рядов со сбли-
женными кинетосомами в каждом, идущая от апекса
правее рта вниз на дорсум, и около 10 разрозненных
кинет, от апекса к постерону (2 ряда послеротовые).
Фактически обособилось и удлинилось поле кинет
правее рта Colpidium. Перистом мелкий, субапикаль-
ный, с небольшим предротовым швом; мембранеллы
длинные, особенно М3, почти продольные; мембрана в
2 сегментах — дикинета по всей длине, кроме верши-
ны, где видна линия разрозненных дисом. Глотка
очень длинная, почти до постерона; вакуоль субтерми-
нальная; секантных швов кинетома нет. Род Spirozona
не имел определенного места в системе, включался в
сборный отряд Trichostomata, Фойсснером включен
в состав гименостомат.
814
ALVEOLATA
Сем. Espejoiidae Puytorac, Grain
et Mignot, 1987
Мелкие пресноводные цилиаты с простой биполяр-
ной цилиатурой; крупный широко открытый перистом
с длинной мембраной, увеличением числа кинет в
основаниях мембранелл Ml и М2; 2 ряда в основании
М3 разошлись в стороны.
Род Espejoia Burger, 1908
Типовой вид Е. obtusa — мелкие, сплющенные,
очень гибкие формы из мукуса, покрывающего кладки
водных моллюсков и насекомых; в слизи обычно вид-
ны микроводоросли, диатомеи и многочисленные по-
движные цилиаты этого вида и гопотрихи Mucotrichi-
dium. Тело несимметричное, ромбическое, заостряется
книзу, расширено у вершины; вакуоль субмедиальная;
предродовой шов смещен на дорсум, все кинеты бипо-
лярные, кроме 6 послеродовых. Перистом субапикаль-
ный, гигантский, широко открытый, в виде глубокой
продольной полости; мембрана вытянута по всей пра-
вой стенке, мембранеллы на дне — М1 очень длинная,
М2 короче и шире; число кинет в них >3, поэтому они
обозначаются термином «пеникулюс» (как у параме-
ций и фронтоний). Вместо М3 видны 2 длинные моно-
кинеты с продолжением у вершины в виде серии ди-
сом. На дне перистома сложный узор аргентофильных
фибрилл. Деление в подвижном состоянии; продукты
деления имеют более мелкий рот и могут расти в клад-
ке или покинуть ее в поисках новой кладки. Фактиче-
ски вид диморфный, с чередованием стадий микро- и
макростомов. По морфологии, морфогенезу и ультра-
структуре ротовая цилиатура соответствует таковой у
Glaucoma, и род был включен в Glaucomidae, но ввиду
диморфизма и модификации М3 был выделен в новое
сем. Espejoiidae.
Макростомы Е. mucicola (Penard, 1922 in Balantiop-
horus) найдены в геле (мукусе) кладок насекомых и
моллюсков; вид изучен при импрегнации. У моллю-
сков более плотный мукус, вид предпочитает кладки
хирономид, встречается и в кладках икры лягушек.
Другие виды — Е. culex (Smith, 1897) и Е. chaetophorae
(Penard, 1922 in Balantiophorus').
Сем. Glaucomidae Corliss, 1971
Тело широкое, овальное, обычно с полимериза-
цией кинет; мембранеллы погружены в глубокий пе-
ристом; в основаниях Ml и М2 увеличено число кинет
(> 3 рядов), их можно обозначить термином «пенику-
люс», применяемым для ротовых органелл фронтоний
и парамеций. Послеротовые кинеты многочисленные.
Род Glaucoma Ehrenberg, 1830
Типовой вид G. scintillans по монотипии; сино-
нимы, по Аэшт, — Acomia, Ptyxidium (неопределимые
старинные роды) и 3 названия, рассмотренные ниже,
были предложены для одного вида — Dallasia, Diplo-
mastax и Diplomestoma. G. scintillans — одна из наибо-
лее обычных цилиат в прудах, часта у берегов с
гниющими водными растениями, выносит сапроб-
ность, легко разводится в лаборатории. Это один из
первых объектов импрегнации методом Клейна, позже
изучен всеми методами серебрения. Тело широкое,
овальное, предротовой шов короткий, ацилон незна-
чительный; кинеты до постерона, простой топографии,
многочисленные, ниже рта 6 рядов; аргиром, как у тет-
рахимен, с осевой аргиронемой между кинетами. Пе-
ристом относительно небольшой и глубокий, выше
справа — участки сомакинет со сближением кине-
тосом. Мембранеллы длинные, Ml и М2 массивные,
с поликинетой в основании; М2 с мелким фрагментом
у вершины; М3 из 2 сегментов, линия внизу и серия
разрозненных кинетосом в верхней половине; в осно-
ваниях Ml—М3 соответственно 5, 7 и 3 ряда кине-
тосом.
G. chattoni Corliss, 1959 — без аллометрического
удлинения правых кинет над ртом, с более симметрич-
ным кинетомом. Этот вид считают синонимом вида
G. reniforme.
Сомнительные виды — G. colpidium Schew., 1892;
G. elliptica Wang, 1940; G. macronuclei Sramek-Husek,
1957; валидация вида G. reniforme Schewiakoff, 1892 —
у Фойсснера с соавт. (Foissner et al., 1994).
G.ferox Savoie et Puytorac, 1970/1971 (дважды
предложен как новый вид) — аберрантная форма с не-
обычным способом питания — особи прикрепляются к
кольподам, парамециям и другим цилиатам и высасы-
вают цитоплазму; в жизненном цикле в зависимости от
типа питания различимы 3 формы — мелкие бакте-
риотрофы, промежуточная стадия и крупные хищники
и каннибалы с увеличением перистома и мембранелл.
Этот вид можно выделить в особый подрод Amphiglau-
сота subgen. п., типовой вид G.ferox', типичные глау-
комы составляют подрод Glaucoma s. str., subgen. n., c
типом G. scintillans.
Род Glaucomella Groliere, 1977
Типовой вид Glaucoma sagitta Kahl, 1926 из
сапробных вод; тело очень тонкое, вытянутое, стрело-
видное (70—90 мкм), вакуоль ниже экватора, кинетом
симметричный — несколько продольных рядов подхо-
дят к длинному предротовому бисекантному шву,
ниже рта 4 послеротовых ряда. Перистом удален от
апекса, узкий и вытянутый, неглубокий; мембрана
очень короткая, из 2 сегментов разного строения; Ml
из 2 половинок, толщиной 2 и 3 кинетосомы; М2 не
увеличена в размерах (не поликинета), с фрагментом у
вершины; М3 — ряд обособленных разрозненных
групп кинетосом.
Род Jaocorlissia Small et Lynn, 1985
Типовой вид Glaucoma dragescui Corliss, 1971;
это название дано для вида, ошибочно определенного
Дражеско (Dragesco, 1970) как Glaucoma myriophylli
Penard, 1922; настоящая G. myriophylli является типо-
вым видом рода Epenardia.
ТИП CILIOPHORA. КЛАСС OLIGOHYMENOPHOREA
815
Типовой вид описан при импрегнации из Африки,
Мексики, США; тело массивное, кинеты полимеризо-
ваны, предротовой шов диагональный, ниже рта
3—4 ряда ресничек; цитопиг расположен не вдоль ки-
нет, как у Glaucoma, и не поперек, как у Epenardia, а по
диагонали над постероном, справа его обходят и идут
параллельно нижние концы правых кинет, а все ряды
выше него укорочены и не достигают постерона.
Именно этим различиям придают основное значение
при диагностике родов глаукомид (Small, Lynn, 1985).
Перистом у G. dragescui мелкий, Ml длинная и тонкая,
М2 массивная, с фрагментом, М3 длиннее других, ган-
телевидная, мембрана С-образная.
Род Epenardia Corliss, 1971
Типовой вид Glaucoma myriophylli Penard,
1922. Тело массивное, величиной 90—200 мкм, очень
широкое, с 80—110 продольными кинетами; предро-
товой шов почти продольный, рот сдвинут далеко
вниз; ниже рта 7—10 послеротовых рядов. Цитопиг,
по Смоллу й Линну (Small, Lynn, 1985), лежит над по-
стероном поперек тела и пересекает примерно 13 ки-
нет, но этой картины нет в других описаниях вида и
нет на снимке импрегнированных особей испанским
методом, который не показывает аргирома, у других
авторов топография кинетома вентрально снизу не на-
рушена. Пока с этим неясно, но род выделен по друго-
му признаку — строению перистома. По результатам
импрегнации, Ml сверху поликинета, ниже дикинета;
М2 поликинета с неотделившимся фрагментом сверху;
М3 массивная поликинета, нетипичная для глаукомид;
мембранеллы лежат в глубокой полости с небольшим
наружным отверстием; мембрана цельная, не состоит
из 2 разнотипных сегментов. Вид Glaucoma macro-
nuclei Sramek-Husek, 1957 может быть синонимом ти-
пового вида.
Род Diplomestoma Stokes,
1886
В один год вышли 3 заметки Стокеса — предложен
новый род Diplomastax Stokes, 1886 для D. frontatus’,
это гомоним рода Diplomastax Kent, 1880 (Flagellata), и
поэтому название было сразу же заменено новым —
Diplomestoma Stokes, 1886; но это название не понра-
вилось автору, и он произвольно заменил его на но-
вое — Dallasia Stokes, 1886. Последнее название испо-
льзовалось в литературе, но оно невалидно и не может
применяться. Если вид считать типом особого подрода
или рода, нужно использовать второе название Diplo-
mestoma. Подобным образом у цилиат нередко заменя-
ли не понравившиеся родовые названия новыми —
Drepanomonas на Drepanoceras у микроторацид, Pseu-
doparafolliculina на более короткое Tapetofolliculina у
фолликулинид, Rhabdostyla на Rhabdostylus у перит-
рих, Kentrophoros на Centrophorella у кариореликтид,
Acineta на Autacineta и Periacineta на Peridiscophrya у
сукторий.
Типовой вид рода подробно изучен при импрегна-
ции; тело расширено у вершины, вытянутое, сужается
и заостряется кзади, предротовой шов сдвинут влево,
продольный; четко выражены параллельные кинеты
над ртом; ниже рта и на дорсуме бисекантные швы;
много послеротовых рядов. Перистом крупный, про-
дольный, глубокий, мембрана цельная, Ml узкая,
длинная, М2 массивная поликинета с обособленным
фрагментом, М3 тонкая, длинная, цельная. По типу
тетрахимениума род соответствует Glaucoma, но если
есть послеротовой шов, Diplomestoma можно считать
подродом глауком или родом; пока это неясно — по
рисунку Дражеско (Dragesco, Dragesco-Kemeis, 1986)
шва нет, кинеты параллельные.
Род Chasmatostoma Engelmann, 1862
Это название позже произвольно исправлено на
Chasmatostomum. Типовой вид Ch. reniforme найден в
пробе воды из канавы, покрытой ряской; описание по-
дробное, но рисунок примитивный — показаны конту-
ры тела, мелкий перистом вдали от апекса, мембрана
справа, вакуоль сзади, ядро с микронуклеусом под об-
щей оболочкой. Особь похожа на Glaucoma или на
Colpidium, но такой тип ядер — признак кольподид.
Род неопределимый.
Сем. Bromeliophryidae Foissner,
2003
Некрупные тетрахименины с частичной редукцией
соматической цилиатуры и сложным перистомальным
комплексом. Стоматогенез при делении, как у Glauco-
ma, но морфогенез соматической цилиатуры уникаль-
ный — часть левосторонних кинет фрагментируется и
их передние фрагменты мигрируют к левому краю пе-
ристома. Эндемики Южной Америки.
Род Bromeliophrya Foissner,
2003
Типовой вид В. brasiliensis из мелких водо-
емов на листьях бромелиевых растений; сейчас извест-
но около 3000 видов бромелиид, поэтому можно ожи-
дать открытия множества эндемичных цилиат (Fois-
sner, 2003а, 2003b). Особи широкие и короткие, кинеты
извитые, разрежены на дорсуме и сближены в сплош-
ное поле на венте; спереди, левее рта и внизу нет рес-
ничек, особо крупный средний ацилон. Аргиром — из-
витые фибриллы, не прямоугольники (аргироконты).
Буккон глубокий, с диагональной Ml и дуговидными
М2 и М3 снизу; к мембране добавляются специализи-
рованные фрагменты кинет (перикинеты) — правая
поликинета и 2 левых монокинеты.
Еще 2 новых рода в составе этого семейства будут
описаны также из бромелиид; у одного из них из До-
миниканы вентральная сторона тела такая же, как у
предкового рода Glaucoma, но есть небольшой ацилон
на дорсуме; у второго рода из Эквадора появляется уз-
кая безресничная полоса, пересекающая кинеты слева,
и расширяется апикальный ацилон. Эти процессы за-
вершаются у Bromeliophrya.
816
ALVEOLATA
Сем. Curimostomatidae Jankowski, 1968
Тетрахимениды, утерявшие ротовую цилиатуру
(мембрану и мембраиеллы) в связи с облигантым эндо-
паразитизмом в тканях турбеллярий и моллюсков.
Род Dogielella Poljansky, 1925
Типовой вид D. sphaerii по последующему
обозначению. Род дважды предложен как новый, но
второй раз в тезисах, и это второе название невалидное.
Мной были предложены 2 подрода, но в тезисах, а все
названия в тезисах сейчас считаются невалидными.
Типовой вид рода — паразит моллюсков, встреча-
ется в паренхиме мелких пресноводных двустворок
Sphaerium согпеит; тело грушевидное, сужено сзади,
величиной 40—100 мкм, с 30—40 продольными кине-
тами; перистома нет, на его положение указывают
фибриллы и кинеты, огибающие небольшой треуголь-
ный участок, где у предковых тетрахимен расположен
мелкий перистом. При серебрении вид изучил Лом
(Lorn, 1961), опубликовавший только тезисы доклада;
статьи с иллюстрациями нет. Вид обычен в сфериидах
прудов Петербурга, легко импрегнируется по Клейну;
описание кинетома и аргирома будет мною опублико-
вано. По Лому, имеются 47—54 кинеты, предротовой
шов, 3 посторальных ряда, вакуоль с 3—7 порами; на
месте рта — несколько аргентофильных рудиментов.
Первоначально к роду Dogielella были отнесены
также виды из паренхимы турбеллярий Castrada sp.
(D. globulifera Poljanski, 1925) и из Stenostomum leu-
cops (D. minuta Polj., 1925); они отличаются от типово-
го вида, имеют разный тип кинетома и аргирома и не
могут относиться к одному роду. В St. leucops цилиат
отмечали и раньше, к примеру вид типа тетрахимен с
треугольным ртом и 4 послеротовыми кинетами; из па-
ренхимы паразиты проникают во внутренние органы,
в частности в яичник, где особенно многочисленны.
Таких паразитов видели и раньше в мелких европей-
ских турбелляриях; в St. leucops в США описан вид
Holophrya virginica Kepner et Carroll, 1923 —до 50 осо-
бей в мелкой турбеллярий, величина тела 40—50 мкм;
особи глубоко проникают внутрь тела, но непатоген-
ны. D. minuta — вероятный синоним этого вида, но род
неясен. На рисунке Н. virginica показаны равномерные
биполярные кинеты без рудимента рта. Неизученные
цилиаты отмечены в эпителии кишечника наземных
планарий Artioposthia fletcheri в Австралии. Для типо-
вого вида Н. virginica без рудимента рта здесь выделя-
ется новый род Turiphaga Jankowski gen. п.; кроме вида
Т. virginica comb. n. (= T. minuta comb, n.) род включа-
ет также T. globulifera comb. n.
Род Curimostoma Kozloff, 1954
Типовой вид Dogielella renalis Kay, 1946 (no
Аэшт, правильно C. renale). Вид описан в США из поч-
ки пресноводной гастроподы Physella sp. и отнесен к
отряду безротых Astomata; позже их нашли в экскре-
торном канале гастроподы Ferrissia peninsulae. Внеш-
не трофонты похожи на Tetrahymena limacis-, тело кап-
левидное, спереди небольшой шов, к которому подхо-
дят все кинеты; небольшой апикальный ацилон помо-
гает ориентировать особь и найти предротовой шов.
Аргиром, как у тетрахимен, с аргиронемой между ки-
нетами. При импрегнации нет ни следа ротовой цилиа-
туры, топография кинет не нарушена.
Сем. Cepedellidae Cepede, 1910
Безротые формы с простыми продольными кинета-
ми, без следа ротовой цилиатуры и швов, указываю-
щих место сдвига рта. Кинетосомы сохранены только
в передней части кинет, остальная поверхность тела —
обширный ацилон. Систематическое положение груп-
пы неясное, здесь она приведена как приложение к тет-
рахименидам; другой вариант — простоматы или рин-
ходиды.
Род Cepedella Poyarkoff, 1909
Типовой вид С. hepatica, род монотипичный.
При вскрытии мелких пресноводных двустворчаток
сем. Sphaeriidae можно найти ринходид Hypocomatidi-
um и Sphenophrya, тетрахименид Dogielella, гимено-
стомат Conchophthirius, астомат Desmophrya-, в гепато-
панкреасе Sphaerium (Cyclas') согпеит и Pisidium (Eupi-
sidium) obtusale паразитируют мельчайшие светлые
цилиаты Cepedella hepatica. Под этим названием вна-
чале описали смесь разных видов, включая ринходид
и, возможно, Dogielella-, название вида сохранено толь-
ко для форм из печени, величиной 16—26 мкм, с
14—20 продольными кинетами в неглубоких желоб-
ках, без вакуоли; ядро центральное, с 1 микронуклеу-
сом. Вид изучен при импрегнации по Клейну; кинето-
сомы в рядах идут только до половины тела, оставляя
сзади обширный ацилон; спереди мелкая безресничная
площадка; аргиром сетевидный. Деление без цист, с
перешнуровкой кинет у экватора. Систематическое
положение рода всегда было загадкой; вначале его
включили в состав фиктивной группы Astomata, состо-
ящей тогда из множества неродственных форм (часть,
как позже выяснилось, с нормальным ротовым аппара-
том — Protophrya, Orchitophrya и др.); Шаттон и Львов
(Chatton, Lwoff, 1935) считали Cepedella ринходидой,
позже род перенесли в состав гименостомат, В филоге-
нетике и классификации цилиат сейчас большое значе-
ние уделяется аргирому; Cepedella имеет аргиром в
виде сплошной сети мельчайших ячеек, этого нет у
всех Tetrahymenida, но такой аргиром свойствен рин-
ходидам и части простомат. Возможно, род не отно-
сится к гименостоматам.
Отряд Ophryoglenida Canella, 1964
(рис. 361,6-362, б)
Характеристика отряда дается обычно для 2 вклю-
чаемых семейств, Ophryoglenidae и Ichthyophthiriidae;
подчеркивается наличие воронки вестибулюма в до-
полнение к буккальной полости со стандартным набо-
ром ресничных органелл, наличие пигментного тельца
ТИП CILIOPHORA. КЛАСС OLIGOHYMENOPHOREA
817
(глазка) близ мембранелл, сложный жизненный цикл
с чередованием нескольких стадий, тенденция к гисто-
фагии и паразитизму. С 1988 г. в состав подотряда
включается род Bursostoma, и характеристика группы
должна измениться. Общее — тенденция к полимери-
зации сомакинет, наличие вестибулюма с вершинами
части кинет, удлинение всех 3 мембранелл буккона и
особое развитие М2. В остальном способ питания и
размножения у включаемых родов различен; можно
сказать, что в процессе эволюции происходит переход
от хищничества к гистофагии и от гистофагии к пара-
зитизму, с соответственным усложнением жизненного
цикла.
Отряд включает 3 семейства, каждое с одним ва-
лидным родом и в двух также по одному спорно-
му роду — Bursostomidae (Bursostoma), Ophryoglenidae
(Ophryoglena-, спорный род Protophryoglena) и Ichthy-
ophthiriidae (Ichthyophthirius', спорный род Ichthy-
ophthirioides). В виде приложения дается диагноз ро-
да Neoichthyophthirius, кинетом которого совершенно
неизучен.
Сем. Bursostomidae Vorosvary, 1950
(рис. 362, а)
Обитатели пресных вод; мешковидные формы с
почти апикальной ротовой полостью, рудиментом
мембраны и хорошо развитыми мембранеллами
Ml—М3; особо укрупнена М2. Вестибулярная ворон-
ка с вершинами правых и левых кинет; ниже рта мно-
гочисленные послеротовые (стоматогенные) кинеты.
Деление в свободно-плавающем состоянии, без цист,
изотомическое; палинтомии нет, жизненный цикл про-
стой. Активные хищники, быстро плавают в поисках
цилиат; обитатели пресных вод. Единственный вклю-
чаемый род Bursostoma имеет общие признаки с Glau-
coma и с Ophryoglena, поэтому род, ранее неопреде-
ленного положения, нашел место в подотряде Ophry-
oglenina. Два других семейства стоят ближе одно к
другому, чем к Bursostomidae.
Род Bursostoma Vorosvary, 1950
Типовой вид В. bursaria «п. fam., n. g., n. sp.»
по монотипии — так в оригинале; само семейство не
было названо. По первоначальному диагнозу размеры
тела 80—120 мкм, тело огурцевидное; перистом апи-
кальный, глубокий, с узким наружным отверстием, с
2 поперечными полосами тесно сближенных кинето-
сом и широким полем из 7 поперечных кинет; ядро
толстое, вытянутое; вакуоль медиальная, с мелкими
вторичными вакуолями по периметру; аргиром — про-
дольные ряды прямоугольников. Сомакинеты много-
численные, входят в вестибулюм. Положение рода не
было выяснено, он считался переходным от Trichosto-
mata к Hymenostomata. По наличию 2 полей кинетосом
в перистоме род позже отнесли к Colpodida.
Типовой вид изучен при импрегнации протарголом
(Ganner et al., 1988); это редкий пресноводный вид ве-
личиной 123—185 мкм; массивное ядро с одним мик-
ронуклеусом, вакуоль с 2 порами, в кортексе слой три-
хоцист; аргиром, как у Ophryoglena (у родственной
глаукомы нет сети прямоугольников). Кинеты полиме-
ризованы, около 114, ниже рта 9—10 послеротовых ря-
дов; выражены 2 шва, латеральный (справа) и дорсаль-
ный; вдоль нижнего шва — группы каудальных ресни-
чек. Вершины 8—10 правых кинет идут по правой
стенке перистома, образуя полукруглую полосу тесно
сближенных рядов; слева в вестибулюм погружены
вершины большого числа кинет и имеется несколько
фрагментов кинет. Нет светопреломляющего тельца
(офриосомы) в отличие от других офриогленид. Чет-
кой ундулирующей мембраны (УМ) нет, но справа от
М3 идет С-образная аргентофильная полоска, возмож-
но рудимент УМ. УМ появляется на время в виде мо-
нокинеты при делении (стоматогенезе). На дне поло-
сти 3 адоральные мембраиеллы; Ml — длинная полоса
из 3 рядов ресничек, М2 — обширное поле кинетосом
с правильным расположением, М3 — полоса из 6 ря-
дов ресничек. Делятся свободноплавающие формы,
без цист; пролиферация кинетосом в зоне послерото-
вых кинет приводит к появлению 2 удлиненных зачат-
ков кинетосом. Морфогенез усложнен, начинается с
резорбции ротовых структур; исчезают вестибулярные
кинеты, фрагменты кинет и сам вестибулюм.
Сем. Ophryoglenidae Kent, 1881
(рис. 361, 6—362, а)
Тело вытянутое, ракетообразное, с полимериза-
цией кинет; перистом относительно небольшой, с вес-
тибулярной цилиатурой, в основном составленной
вершинами послеротовых кинет; хорошо развита бук-
кальная цилиатура сложной топографии; в зоне мемб-
ранелл всегда имеется пигментный глазок (офриосо-
ма). Активно плавающие формы, гистиофаги (на тка-
нях погибших водных животных) и паразиты; деление
в цистах, с образованием 2—8 томитов, несходных по
строению (в частности, по типу перистома) с трофон-
тами.
Род Protophryoglena Mugard, 1949
В составе рода Ophryoglena накопилось много ви-
дов однотипного строения, род пока нельзя разделить
на подроды; один из видов — О. macrostoma Kahl,
1928 — из солоноватых вод был отделен по незначи-
тельному признаку — у рта имеется пигментное пятно
близ офриосомы. Вид часто ошибочно датируют
1936 г. Это различие кажется несущественным, как и
наличие 2 вакуолей (они есть и у части офриоглен). В
остальном типовой вид рода — типичная офриоглена
по размерам, форме тела и ядра, по вакуолям; в цисте
2 деления. Рисунка перистома нет, поэтому трудно
представить его строение; по Мюгард (Mugard, 1948)
«ресничный предротовой аппарат типа Deltopylum
rhabdoides, но имеется также и крупный вестибулюм,
характерный для рода Ophryoglena, хотя и не такой
глубокий у этого вида». Пока данный род считают си-
нонимом Ophryoglena. О. macrostoma — свободножи-
вущий вид из солоноватых вод; апекс с зубцом, воз-
можно для внедрения в тело мелких беспозвоночных.
52 Зак. №4163
818
ALVEOLATA
Рис. 362, a. Ophryoglenida.
Bursostoma bursaria (A—Д); Ichthyophthirioides browni (E, Ж); Neoichthyophthirius schlotfeldti (?, 14). (По: Бауер, Юнчис, 2001 (3, Я); Ganner et al,, 1988 (А—Д);
Roque, Puytorac, 1968 (E, Ж)).
Fig. 362, a. Ophryoglenida.
Род phryoglena Ehrenberg, 1831
Типовой вид О. citreum C. et L., 1858 (правиль-
но О. citrea) по указанию Фроментеля (Fromentel,
1874), но тип рода может быть выбран только из пер-
воначально включенных видов. Много синонимов —
Glenopanophrys, Linza, Meniscostomum, Otostoma, Pa-
nophrys, Sisyridion, Protophryoglena. Род вначале был
плохо охарактеризован, поэтому его долгое время не
признавали. По Мюгард (Mugard, 1948), указанный
вид — это синоним валидного вида О. atra Ehr., 1838;
Эренберг вначале предложил род Ophryoglena для
O.flavicans и лишь позднее (Ehrenberg, 1838) добавил
новые виды О. atra и О. acuminata, плохо изученные и
трудные для определения. О. flavicans — стандартный
вид рода величиной 150—200 мкм, без трихоцист, с
овальным ядром и одной медиальной вакуолью.
Размеры видов рода крупные, 70—1500 мкм, но в
основном 100—400 мкм; ядро разной формы, от оваль-
ного до червеобразного, рядом с ним 1—16 мелких
микронуклеусов. 1—2 вакуоли открываются несколь-
кими порами. По ранним авторам, трихоцист нет у
О. flava, О. flavicans, О. citrea и других видов, но их
трудно наблюдать в плотной цитоплазме, обычно пол-
ной крупных липидных сферул; трихоцисты есть у
О. parasitica, О. atra и, возможно, у всех видов рода;
наличие мукоцист доказано в электронном микроско-
пе. Реснички длиной 6 мкм в 80—350 тесно сближен-
ных рядах, и сами реснички в рядах расположены
вплотную; это хороший объект для изучения метахро-
нальных волн ресничного движения. Сзади иногда
расположен пучок каудальных ресничек длиной
15—20 мкм.
Имеется 1—16 послеротовых кинет и 16—17 пред-
ротовых вдоль шва справа от него; предротовой шов
очень четкий, от апекса до вестибулюма; послерото-
вой шов, если имеется, начинается ниже рта, но часто
неразличим; нет скутикуса — группы стоматогенных
кинетосом, в этом отношении офриоглены близки к
тетрахименидам. Вестибулюм очень глубокий, с боль-
шим числом кинет, на его дне расположена офриосома
(мой термин для «тельца Либеркюна») — свето-
преломляющее тело с неясным значением, вероятно
светочувствительный глазок, величиной 4—10 X 1—
ТИП CILIOPHORA. КЛАСС OLIGOHYMENOPHOREA.
819
Рис. 362, б. Ophryoglenida.
Ichthyophthirius multifiliis’. трофонты (A—Г)’, мигранты (Д, Е); теронты (Ж, К—Л/); Ichthyophthirioides browni (3); Ml—М3 — ротовые мембранеллы. (По: Шу-
льман, 1984 (А—Г, Ж, И, МУ Canella, Rocchi-Canella, 1976 (Д, Е, К, Л)\ Roque, Puytorac, 1968 (3)).
Fig. 362, б. Ophryoglenida.
Ichthyophthirius multifiliis’. trophonts (А—Г); migrants (Д E); theronts (Ж, K—M).
3 мкм, лежит в эктоплазме между Ml и М2, содержит
фосфатные кристаллы и меланоидный пигмент, кра-
сится по Фельгену, содержит ДНК в поверхностном
слое. Кинеты входят в вестибулюм не со всех сторон, у
части видов только снизу (послеротовые ряды); кине-
тосомы вестибулюма имеют корневые фибриллы, при
соединении с соседними кинеторизами образуют мощ-
ные пучки длинных фибрилл. Глотка длинная, тонкая,
извитая. Ротовая цилиатура в принципе тетрахимено-
вая, видоизменена, ее трудно выявить под цилиатурой
вестибулярной воронки; мембраны нет, она появляет-
ся на одной стадии морфогенеза (Canella, Rocchi-Ca-
nella, 1976); по другим авторам, есть небольшая мемб-
рана с разрозненными кинетосомами и у трофонтов;
Сонг и Вильберт (Song, Wilbert, 1989) находят норма-
льную ундулирующую мембрану. В основании Ml
2—3 ряда кинетосом, М2 — 3 ряда, с резким расшире-
нием основания сзади; М3 — неподвижная псевдомем-
брана с монокинетой; имеется очень сложный опор-
ный комплекс перистома. М3 — нетипичная на ульт-
ратонких срезах, реснички имеют особые включения в
базальной части. Мембранеллы офриоглен одно время
называли «пеникулюсы» (как у парамеций), но сейчас
принято название «мембранеллы». Аргиром — продо-
льные ряды прямоугольников вдоль кинет, кинетосо-
мы расположены в центре каждого прямоугольника.
Стоматогенез паракинетальный, на одной из ста-
дий образуется и позже редуцируется УМ; у протера
УМ является стоматогенным рядом и дает начало но-
вому ротовому аппарату протера, у задней особи он
образуется за счет послеротовых сомакинет.
Жизненный цикл полиморфный, как правило, с
4 стадиями — теронт (распространение и оседание —
эксцистирующиеся томиты и непитающиеся мигран-
ты; «особи-охотники»), трофонт (гистиотрофы, пита-
ние с накоплением резервов); томонт (2—4 деления в
толстостенных мукозных цистах) и томит (продукт де-
ления); возможны отклонения, например образование
геронтами временных цист, наличие 6—7 делений с
мельчайшими томитами или превращение дериватов
второго деления в крупных геронтов с рудиментарным
перистомом. Детали цикла различаются у разных ви-
820
alveolata
дов — у О. catenula томонт образует 2,4 или 8 томитов
в цепочке; у О. pectans томонт секретирует обильный
мукус и томиты внутри образуют свои оболочки. Цис-
ты 2 типов, репродуктивные и цисты покоя. Томиты
паразитических видов имеют рострум (шипик). Тро-
фонты резко возрастают в размерах; в цистах у томон-
тов число кинет увеличено, меняется характер аргиро-
ма (видны продольные фибриллы, как у тетрахимен);
исчезает предротовая цилиатура, кроме мембраны
(стоматогенный ряд для протера).
Род в основном пресноводный, морские виды —
О. marina, О. frontonia и другие; несколько видов —
паразиты. Возможно культивирование в лаборатории
на жидкой среде в чистой воде на кусках олигохет,
планарий; аксенические культуры сохраняются меся-
цами. Род крупный, но достоверны лишь виды, у кото-
рых изучены ядра и кинетом; для унификации и опре-
деления сравниваются теронты. Разные стадии цикла
описывали как разные виды, поэтому часть видов не-
определима. Род относили одно время к Peniculina
вместе с парамециями и фронтониями, так как имеется
ресничный вестибулюм и М2 утолщена, в ее основа-
нии больше 2 рядов кинетосом, но это конвергенция,
вестибулюм у пеникулид другого типа.
Примеры свободноживущих видов — О. atra Ehr.,
1838; О. acuminata Ehr., 1838; О. butschlii (Burger, 1906
in Holophrya)-, O. bacterocaryon Roque, Puytorac et Sa-
voie, 1965; O. citreum C. etL., 1858; O. catenulopsis Dra-
gesco et Njine, 1972; O. cinerea Eberhard; O. catenula Sa-
voie, 1966; O. denticulistoma Sramek-Husek, 1954;
O.flava (Ehrenberg, 1838 in Bursaria)', O.flavicans Ehr.,
1831; O. gelifera Roque et Savoie, 1966; O. hypertrophica
Savoie, 1961; 0. kahli Tucolesco, 1962; O. inquietaY^aJn),
1931; O. media Mugard, 1949; O. mucifera'HEagaxA, 1949;
O. mucosa Roque et Savoie, 1966; O. multimicro nucleata
R. et S., 1966; O. minima Song et Wilbert, 1989; O. mu-
gardi Savoie, 1962; O. marina Burkovsky, 1970; O. mo-
nophthalma Gelei, 1950; O. octavia Mugard, 1949; O. ob-
longa Stein, 1860; O. oblonga Gajewskaja, 1928 (гомо-
ним; О. limis nom. n.); O. ovata Stokes, 1885;
O. polymicrocaryon Mugard, 1949; O. pectans Mugard,
1948; O. rhabdocaryon Mugard, 1949; O. singularis Ca-
nella et Rocchi-Canella, 1961; O. tigrina Penard, 1922;
O. utriculariae Kahl, 1931; O. viridis Penard, 1922. Часть
видов, приписываемых к офриогленам, относится к
роду Frontonia— О. griseovirens Leidy, 1852; О. panop-
hrys Perty, 1852; О. vorax Smith, 1891.
Паразитические виды обитают в кишечнике и тка-
нях планарий Байкала Planaria nigrofasciata, Baicaliel-
la fastigata, Sorocelis maculosa, Dicotylus bistriatus —
O. piriformis Rossolimo, 1926; O. intestinalis R., 1926 —
оба с нетипичной формой тела; кинетом и перистом не
изучены; О. parasitica Andre, 1909 заражает кишечник
обычных планарий Dendrocoelum lacteum. О. collini
Lichtenstein, 1921 — специфический паразит в гемоце-
ле личинок насекомых (веснянок Baetis и Oligoneuriel-
la rhenana — Ephemeroptera) — это гистофаг и гемо-
фаг, разрушает жировое тело, мускулы и гонады насе-
комых. Ophryoglena sp. в Италии заражает веснянок
Caenis luctuosa — теронты проникают в немногих хо-
зяев, 5 % популяции, но размножаются в них в массе;
локус — гемолимфа, откуда трофонты проникают в
придатки тела. О. ovariovora Codreanu, 1972 обитает в
личинках эфемерид Rhithrogena semicolorata-, жизнен-
ный цикл различен в самцах и самках хозяев, поража-
ются целом и гонады. Неопределенные виды
офриоглен отмечены в личинках мошек Simulium, в
моллюсках (включая вид из Dreissena polymorpha —
О. hemophaga Molloy et al., 2005), на коже и в тканях
рыб в США (в Micropterus, Lepomis и других рыбах).
Подробно описан необычный вид О. maligna Penard,
1922 — паразит более крупной Ophryoglena flava. Есть
даже паразиты микроскопических панцирных колов-
раток О. brachioni Li в Brachionus calyciflorus и В. игсе-
us в Китае; теронт проникает внутрь через экскретор-
ную пору, питается и делится внутри хозяина, уничто-
жая его. Паразиты дрейссены пока не описаны
таксономически, но ясно, что это новый вид, в частно-
сти по необычной локализации в пищеварительной же-
лезе моллюсков; кроме них в хозяине в США парази-
тирует еще мелкий вид цилиат неизвестного рода.
Родовые синонимы Ophryoglena-.
Cyclotrichia Kent, 1882.
Glenopanophrys Diesing, 1866, типовой вид O.flavi-
cans Ehr., 1831.
Otostoma Carter, 1856, типовой вид без латинского
названия (позже назван О. carteri Kent, 1881).
Panophrys Dujardin, 1841, типовой вид O.flavicans
Ehr., 1831.
Sisyridion Eberhard, 1862, типовой вид S. cochliosto-
ma Eberhard, 1862 — неопределимый вид офриоглен.
Aglenophrya Diesing, 1866, типовой вид Л. steinii Di-
esing, 1866 (новое название для вида Ophryoglena cae-
ca Stein, 1860 в связи с его переносом в другой род);
это скорее всего вид рода Frontonia.
Сем. Ichthyophthiriidae Kent, 1881
(рис. 362, а, б)
Трофонты и томонты массивные, с полимериза-
цией кинет и мелким субапикальным перистомом, с
вестибулярной воронкой, у одного рода (ichthyophthi-
rius) сохранена офриосома, легко видимая на стадии
теронта; ротовая цилиатура не столь сложна, как у оф-
риоглен в связи с паразитизмом (на рыбах). Число де-
лений в палинтомической цисте очень велико, выходят
сотни томитов; резче, чем у офриоглен, выражена раз-
ница морфологии томитов (похожих на тетрахимен) и
массивных трофонтов.
Род Ichthyophthirioides Roque
et Puytorac, 1968
Типовой вид I. brownv. датировка 1966 г. не-
верна — это тезисы доклада. Трудный род для систе-
матиков; по Канелла (Canella, Rocchi-Canella, 1976),
это «фиктивная инфузория». Найдены на коже гуппи
(Poecilia americana), изучены при импрегнации. Особи
крупные, цикл развития, как у ихтиофтириуса, пери-
стом без офриосомы, воронка с 8—10 вестибулярными
кинетами, ротовая цилиатура более напоминает тако-
вую офриоглен — три мембранеллы и УМ из несколь-
ких кинетосом; ядро овальное или удлиненное. Выска-
зывалось мнение, что это не теронты и не дефинитив-
ТИП CILIOPHORA. КЛАСС OLIGOHYMENOPHOREA
821
ные трофонты, а молодые трофонты в процессе
морфогенеза, сохраняющие цилиатуру теронта и уте-
рявшие офриосому. Размеры особей мелкие (150 мкм);
у трофонтов в начале роста 43-—45 кинет, у томонтов
около 300; в основании мембранелл по 3 кинеты; ваку-
оль с 4 порами; послеротовой шов, четкий у ихтиофти-
риуса, не выражен. Трофонты активно питаются в
суб-кутанных пустулах между клетками эпителия, по-
кидают хозяина, плавают и инцистируются; томиты
грушевидные, величиной 60—65 мкм.
Род Ichthyophthirius Fouquet, 1876
Типовой вид I. multifiliis заражает, вероятно,
всех пресноводных рыб. Трофонты расположены под
эпителием кожи и жабр, в этих местах легко видны бу-
горки (white spots, отсюда название болезни — whi-
te-spot disease). Величина трофонтов 100—1000 мкм,
теронта 70, томита 15—50 мкм, трофонты широкие,
почти сферические, томиты типа тетрахимен с ростру-
мом для проникновения под эпителий. Соматических
кинет несколько сотен, ряды продольные, сходятся у
апекса и вдоль предротового шва; местами топография
кинет нарушена при делинеации. Перистом относите-
льно небольшой (10—40 мкм), в вестибулярной ворон-
ке 4—6 кинет, левее рта — офриосома величиной
2 мкм (мельче, чем у офриоглен). У дефинитивного
трофонта перистом овальный, с 3 мембранеллами (по
2 кинеты в основании); мембрана УМ сильно редуци-
рована, только с 3—4 кинетосомами в основании, рас-
положена у конца М3. Много мелких вакуолей, рас-
сеяны по телу, или одна крупная лежит медиально, с
одной порой между рядами 4—6 или 3—4 порами
между рядами 17—20. Ядро колбасовидное, подково-
образное или эллипсоидное, с прилегающими 1—3 мик-
ронуклеусами.
Трофонты в пустулах между кожей и телом пита-
ются тканевой жидкостью или эпителием. Выросшие
трофонты прекращают питание, прорывают стенку па-
разитарной камеры и оседают на субстрат или редко
вновь на кожу рыб для инцистирования; после
10—11 делений образуется много сотен мелких томи-
тов с почти продольными мембранеллами и незначите-
льно развитой воронкой вестибулюма, с перфоратори-
ем на апексе; имеется офриосома и мембрана. Число
кинет уменьшается при делении до 40; вакуоль одна, с
3—4 порами. Стадия теронта безошибочно указывает
на родство с офриогленами. Массовое поражение
кожи рыб ведет к ее гибели, способствует проникнове-
нию бактерий, грибков (сапролегний) и тетрахимен в
язвы, снижает иммунитет; переболевшие рыбы, очи-
щенные в ваннах от паразитов, более устойчивы к по-
вторному заражению; иммунитет можно вызвать так-
же инъекцией культуры тетрахимен.
Как правило, патоген определяется как I. multifiliis
без импрегнации кинетома, но видовые различия у ци-
лиат могут быть незначительными. Поэтому не доказа-
но, что в мире есть только один вид рода. Расы с одних
рыб могут не заражать других; есть различия по форме
ядра, в частности виды из Конго с Etropiella debauwi и
Barilius christyi имеют спиральное ядро, это может
быть локальный вид. Кроме рыб, возможна инвазия
ихтиофтитрйуса в амфибиях; сомнительные случаи
поражения человека ихтиофтириусами, вероятно, пра-
вильнее считать церкариозным дерматитом в опасных
местах скопления гастропод, особенно лимней и би-
тиний.
Вид Ichthyophthirius cryptostomus Zacharias, 1894
описан по недоразумению; раньше ихтиофтириус
считался простоматой, а не гименостоматой, и в те-
чение века (нередко и сейчас) его рисовали с апикаль-
ным ртом; поэтому когда в Германии на Leuciscus ruti-
lus и Alburnus lucidus в аквариуме нашли только фор-
мы с боковым ртом, их приняли за новый вид. В
действительности это был первый правильный ри-
сунок вида. Другие отличия — меньшее число деле-
ний (всего 100—150 томитов). Белые точки с парази-
тами усеивают эпидермис, особенно плавники и
хвост хозяев.
Род Chromatophagus Kerbert, 1884
Типовой вид Ch. parasiticus с кожи большого
числа рыб из рыбоводных хозяйств в Амстердаме,
тоже с латеральным положением мелкого рта; вид
очень подробно описан, с зарисовками многих стадий
развития, но нет никаких отличий от I. multifiliis, род и
вид невалидные как синонимы.
Приложение
Род Neoichthyophthirius Bauer et Yunchis,
2000 (рис. 362, a)
Типовой вид Ichthyophthirius schlotfeldti Yunc-
his, 1997. Вид описан Юнчисом в тезисах, не в статье,
поэтому может быть признан невалидным. Предпола-
гается, что паразиты завезены с аквариумными рыбка-
ми непосредственно из стран юго-востока Азии или
через Германию; этот вид вызвал болезнь и гибель рыб
сем. Characidae, Cyprinidae и Cichlidae у аквариуми-
стов; с 1995 г. он широко распространяется по России
в частных аквариумах, может проникнуть в рыбовод-
ные пруды.
К сожалению, описание очень плохое, кинетом и
ротовой аппарат не изучены, акцент делается на форму
ядра — в виде замкнутого кольца с крупным микро-
нуклеусом. Сейчас нельзя ничего сказать о точном по-
ложении рода в системе; авторы отнесли его к Ophry-
oglenidae, но доказательства нет. Трофонты округлые,
мельче ихтиофтириуса (200—300 мкм); цилиатура
совпадает (но рисунка нет и импрегнация не проводи-
лась); перистом мелкий, округлый; других данных по
морфологии нет. Трофонты ихтиофтириуса покидают
хозяина для инцистирования с 10—12 повторными де-
лениями в цисте; трофонты (томонты) нового рода
остаются под кожей рыб и делятся до 10—60 томитов
без цисты; мигрантов не обнаружено. Вид тепловод-
ный, с оптимальной температурой развития 30 °C, осо-
би гибнут начиная с 18—19 °C. Для ихтиофтириуса
температура нормального развития от 3—4 до 26—
27 °C. Отличаются и сами зараженные рыбы, инвазия
822
ALVEOLATA
Рис. 363, a. Loxocephalina.
Dexiotricha raikovi (А, Гр D. colpidiopsis (Б, B)', D. granulosa = D. plagia (ДУ, Dexiotricha sp. (£); D. tranquilla (Ж—JJ)\ Urozona butschlii (M). (По: Gelei, 1940
(£); Augustin, Foissner, 1992 (Ж—JI); Dragesco, Dragesco-Kerneis, 1986 (Др А, В—Д, M — ориг.).
Fig. 363, a. Loxocephalina.
новым видом приводит к разрушению участков кожи,
рыба не кажется усеянной белыми шариками. Различа-
ются и методы лечения больных рыб.
Отряд Scuticociliatida Small, 1967*
Пленчаторотые цилиаты с тетрахименовым ро-
товым ресничным аппаратом, но без послеротовых
кинет; на их месте остался только рудимент цилиату-
ры — несколько кинетосом, разрозненных или в не-
большом ряду. Они участвуют в стоматогенезе, раз-
множаясь и образуя (вместе с основанием мембраны)
крупное поле кинетосом, дающее начало новому рото-
вому аппарату. В период, когда применяли в основном
методы Клейна и Шаттона (дающие прекрасные ре-
зультаты у гименостомат), хорошо выявлялись рес-
ничные ряды и перистомальный комплекс, но трудно
было заметить несколько безресничных кинетосом
ниже основания мембраны среди фибрилл, ячеек арги-
рома и пор трихоцист. Считалось, что у тетрахименид
новую цилиатуру образуют послеротовые кинеты, а у
форм без такой цилиатуры самовоспроизводится рото-
вой аппарат.
* Примечание об авторстве названия отряда Loxocephalida.
В сентябре 2006 г. в Интернете замечена статья, опубликованная в июле 2006 г.: Li L., Song W., Warren A., Wang Y., Ma H., Hu X.,
Chen Z. Phylogenetic position of the marine ciliate, Cardiostomatella vermiforme (Kahl, 1928) Corliss, 1960 inferred from the complete SSrRNA
gene sequence, with establishment of a new order Loxocephalida n. ord. (Ciliophora, Oligohymenophorea) // Eur. J. Protistol. 2006. Vol. 42.
P. 107—114. В этой статье продолжен новый отряд Loxocephalida с 2 семействами (Loxocephalidae и Cinetochilidae) в составе подкласса
Scuticociliatia, промежуточный между гименостоматами и типичными скутикоцилиатами. Однако значительно раньше отряд с таким на-
званием был предложен мной в статье, посвященной системе цилиат (Янковский, 1980, с. 113), в Трудах Зоологического института
АН СССР, с четкой характеристикой: «Отряд Loxocephalida ordo nov. Ротовая цилиатура хорошо развита, нет присоски. Расположение
мембранелл ступенчатое, не линейное. Ниже рта — резко укороченные послеротовые кинеты; послеротовой шов с бисекантным схожде-
нием право- и левосторонних кинет. Типовой род Loxocephalus. Этот отряд мы предлагаем для тетрахимено-образных форм, у которых
ввиду укорочения послеротовых кинет стоматогенез идет по филастеридному типу». Выделены 3 подотряда Loxocephalina, Cinetochilina и
Urozonina.
ТИП CILIOPHORA. КЛАСС OLIGOHYMENOPHOREA
823
Рис. 363, б. Loxocephalina.
Loxocephalus luridus (A—Гу Cardiostomatella minuta (Д), C. vermiforme (E, Ж, K); Paradexiotrichapuytoraci (3); Sathrophilus hovassei (И). На рис. А выделены
ядервый аппарат и кортекс. (По; Dragesco, 1965b (ф; Dragesco, Dragesco-Kerneis, 1986(5—Г); Al-Rasheid, 200 la (E, Ж,К)\ Groliere, 1975 (3, И); A — ориг.).
Fig. 363, 6. Loxocephalina.
Insertions show nuclei and cortex.
Подотряд Loxocephalina Jankowski, 1980
Это переходная группа между тетрахименидами и
финастеридами, часть родов сохраняет короткие после-
ротовые ряды, у других они исчезли, но в обоих случа-
ях имеется стоматогенная группа кинетосом — скути-
кус. Мембраиеллы не расположены в одну линию, ле-
жат по диагонали к оси тела, сохраняют ступенчатое
расположение, свойственное тетрахименам. Нет тен-
денции к удлинению перистома, УМ и одной из мемб-
ранелл; перистом обычно небольшой, овальный, в пе-
редней части тела, мембраиеллы лежат в неглубокой
полости. В основном пресноводная группа, как и
тетрахимениды, морские виды немногочисленные
(род Cardiostomatella)-, симбионтов (комменсалов и па-
разитов) нет. По типу перистомальной цилиатуры эта
группа близка к тетрахименидам, по способу стома-
тогенеза к скутицидам, поэтому не выделяется в осо-
бый отряд.
Сем. Loxocephalidae Jankowski, 1964
(рис. 363, а—364, а)
Тело вытянутое, с полной цилиатурой, перистом
относительно мелкий, субапикальный. У части форм
сохранены короткие послеротовые кинеты. В дополне-
ние к мелкому перистому хорошо развиты перикине-
ты — добавочные соматические ряды, в частности
ряд со сгущением кинетосом правее и выше унду-
лирующей мембраны.
Род Dexiotricha Stokes,
1885
Типовой вид D. plagia по монотипии; сейчас
этот вид считается синонимом вида Loxocephalus gra-
nulosus Kent, 1881, поэтому правильное название типо-
вого вида D. granulosa. Род Dexiotricha не признавался
валидным, виды рода относили к Loxocephalus, в част-
ности в определителе Каля (Kahl, 1931). По Аэшт
(Aescht, 2001), «Фойсснер (1994) восстановил валид-
ность рода» (Foissner et al., 1994), но это дезинформа-
ция — задолго до указанной работы род признали ва-
лидным Янковский, Форе-Фремье, Пек, Вильберт,
Фернандес-Г-альяно; более того, именно на примере
Dexiotricha и Loxocephalus Форе-Фремье (Faure-Fremi-
et, 1968) обосновал новую теорию эволюции родов ци-
лиат — увеличение числа кинет и укрупнение тела ве-
дут к общей структурной перестройке и возникнове-
нию нового рода. Подробная аргументация в пользу
валидности Dexiotricha и сравнение с Loxocephalus lu-
ridus (см.: Jankowski, 1964b).
824
ALVEOLATA
Рис. 364, a. Loxocephalina.
Sathrophilus hovassei (ныне Sphenostomella—A);S. muscorum (£>,E); Urozona butschlii (В, Г, 3, И); Cinetochilum margaritaceum (Д, Ж);Pseudocinetochilum sp.
(K, JT). (По: Оболкина, 19956 (К, JT); Groliere, 1975 (A, B); Dragesco, Dragesco-Kerneis, 1986 (Б, £); Puytorac et al., 1974 (Д Ж); Г, 3, И— ориг.).
Fig. 364, a. Loxocephalina.
В пробах гниющих камышей, в сапропеле можно
найти некрупных цилиат с цилиндрическим вытяну-
тым телом, почти черных от массы включений (лито-
сом); они легко культивируются в настоях кипяченых
листьев и как тетрахимены могут давать культуры бо-
льшой плотности, но пока никем не используются как
лабораторный объект. Виды рода однотипные; кинеты
многочисленные, на апексе и нижнем конце тела без-
ресничная площадка (ацилон); снизу лишь одна кауда-
льная ресничка; ниже перистома сохранено несколько
послеротовых кинет и имеются свободные кинетосо-
мы (скутикус) у конца мембраны, обычно в виде ко-
роткого ряда гранул. От рта или от субмедиальной
поры вакуоли вниз до постерона идет послеротовой
шов, уни- или бисекантный, часть сомакинет вента
укорочена. На уровне перистома и по краям апикаль-
ного ацилона парные кинетосомы смежных рядов пе-
реориентированы и располагаются кольцами — это ти-
пичные адесмокинеты (= паратены, если использовать
более поздний термин). Менее четкие кольцевые и
диагональные паратены видны по всему телу. УМ до-
стигает вершины М2; положение мембранелл — сту-
пеньками по диагонали, М2 > Ml > М3. Сгущаются
кинетосомы у вершины ряда, примыкающего к УМ,
образуется как бы добавочная мембрана М4, точнее,
перикинета. Аргиром с правильными прямоугольны-
ми ячейками (аргироконтами) вдоль кинет.
Систематика видов трудная, различия небольшие,
много видов плохо описаны ранними авторами. При-
меры видов (включая возможные синонимы) — Dexi-
otricha granulosa (Kent, 1881 in Loxocephalus) Foissner
et al., 1994 (типовой вид), D. plagia Stokes, 1885 (сино-
ним первого вида), D. lucida (Smith, 1897 in Loxocepha-
lus) (плохо описанный невалидный вид), D. simlex (Pe-
nard, 1922 in Uronema), D. pannonicum (Gelei, 1932 in
Colpidium), D. media Peck, 1974 (считается синонимом
первого вида), D. tranquilla (Kahl, 1926 in Loxocepha-
lus), D. polystyla Foissner, 1987, D. raikovi Jankowski,
1964, D. moniligranulata (Kalil, 1926 in Loxocephalus),
D. kahli (Tucolesco, 1962 In Loxocephalus).
ТИП CILIOPHORA. КЛАСС OLIGOHYMENOPHOREA
825
Род Balanonema Kahl, 1931
По Аэшт, род невалиден, так как не был указан ти-
повой вид. В первоописании 2 вида — В. biceps и
В. dubiunv. оба вида описаны Пенардом (Penard, 1922).
Здесь как тип рода предлагается первый вид Uronema
biceps Penard, 1922 (В. biceps comb, n.); второй вид
имеет сплошную цилиатуру, без экваториального аци-
лона, и не относится к этому роду. Внешне по форме
тела, положению мелкого перистома виды рода сход-
ны с Dexiotricha, но несколько сужены и оттянуты оба
конца тела с безресничными площадками; ротовая ци-
лиатура и сомакинеты, как у Dexiotricha. Родовой при-
знак — отсутствие ресничек в широком кольце медиа-
льно, но сохраняются инфракинеты и правильный ар-
гиром — ряды прямоугольников. Лучше изучен вид
В. sapropelica (Foissner, 1978) comb, п.; реснички есть
по всему телу, но более густые у обоих концов тела.
Если так, то родовой признак — узкие оттянутые кон-
цы тела с округлыми площадками.
Род Dexiotrichides Kahl, 1931
Типовой вид Dexiotricha centralis Stokes, 1885
по монотипии. Тело почковидное, бесцветное — без
характерной для дексиотрих массы литосом; реснички
равномерно покрывают все тело, включая оба конца,
но, по новым данным, имеется крупный ацилон спере-
ди. Вначале в диагнозе вида указывалась узкая кольце-
вая медиальная полоса без ресничек; но в антесоме
реснички густые и направлены вперед, ниже эквато-
ра разрежены и направлены назад. Апикальный аци-
лон переходит в предротовой, тело расширено спе-
реди, и ряды, обходящие перистом, не соединяются
вновь над его вершиной. Перистом крупный, мембра-
неллы диагональные, под мембраной 3 послеротовые
кинеты и 2 зоны кинетосом (скутикус). Вакуоль у
постерона, что не встречается у дексиотрих. Вероят-
ный синоним типового вида — Uronema microcrepis
Penard, 1922.
Род Paradexiotricha Groliere, 1975
Типовой вид Р. puytoraci, холодолюбивый вид
из мхов, с длинным телом, без широких площадок на
концах и с небольшим ацилоном спереди. Кинетосомы
в 20 сомакинетах разрознены, сохранен только один
послеротовой ряд и мелкий скутикус, секантного шва
вентрально нет. Кинетосомы в кольцевых поперечных
паратенах; имеется фрагмент кинеты справа у мембра-
ны (мелкая перикинета). Перистом крупный, почти до
апекса, мембранеллы сдвинуты к его вершине при уд-
линении УМ, две верхние мембранеллы крючковид-
ные, Ml > М2 > М3.
Род Paratetrahymena Thompson, 1963
Типовой вид Р. wassr, форма тела, кинетом
и перистом, как у Dexiotricha, но присутствует до-
полнительная перикинета слева, ацилон сужен, не по-
хож на широкую поперечную площадку; сохранены
продольные послеротовые кинеты; перистом выше,
чем у дексиотрих, предротовой шов едва выражен. Ри-
сунок (описания нет) в Guide (Small, Lynn, 2002) резко
отличается от иллюстраций Р. wassi — перистом и
мембранеллы очень широкие, последние сдвинуты
вверх к апексу. Не исключено, что это вид другого (но-
вого) рода.
В обоих изданиях Guide (Small, Lynn, 1985; Lynn,
Small, 2002) зарисован и кратко описан вид Р. souku-
рае Small et Lynn, 1985 с широким ацилоном, длинны-
ми мембранеллами и рядами фрагментов (скутикус?) в
дополнение к послеротовым кинетам.
Род Loxocephalus Eberhard, 1862
Типовой вид L. luridus по монотипии; Позже в
состав рода включали виды Dexiotricha Stokes, 1885 и
описанных позже форм такого типа. Очень крупный
вид из сапробных вод, тело черное от массы литосом
(минеральных телец), ядро окружено несколькими
микронуклеусами, вакуоль медиальная, осевой шов
удлинен почти на весь вент, с укорочением кинет. Ки-
неты полимеризованы, переднего ацилона нет; левые
ряды заворачивают направо, смещая диагональный
предротовой шов; ниже шва кинетосомы всех рядов
собраны в четкие вторичные ряды (паратены). Арги-
ром видоизменен — вдоль кинет шестиугольни-
ки пелликулы, в их центре 2 кинетосомы, на гранях
поры трихоцист. Сохранены послеротовые ряды. При
укрупнении размеров тела перистом остался очень
мелким, далеко удален от апекса, содержит 3 мембра-
неллы примерно равной длины и перикинету у верши-
ны мембраны.
L.foissneri Dragesco et Dragesco-Kerneis, 1991 —
псаммонный вид из больших озер, без литосом, с длин-
ным ядром. Вероятно, с этим видом может быть иден-
тичен L. luridus sensu Wilbert, 1986 из соленого оз. в
Канаде. Вид из Байкала, описанный Оболкиной (1991)
как L. luridus, тоже не имеет литосом и по деталям
морфологии является новым эндемичным псам-
монным видом (Loxocephalus Unis Jank. sp. n.). L. inter-
medius Kahl, 1928 — галофильный вид из солонова-
тых вод, мельче типового вида, пока не изучен при им-
прегнации.
Род Paraloxocephalus Small et Lynn,
1985
Типовой вид Р. coatsi — крупные формы
(260 мкм) с полимеризацией кинет, субмедиальной ва-
куолью, ядро с 3 крупными микронуклеусами; предро-
товой шов диагональный, рот смещен далеко вниз
от его нижнего конца, сохранено много послеротовых
кинет вдоль длинного шва, идущего от рта до постеро-
на. Перистом типичный для локсоцефалуса, с перикине-
той справа, 2 верхние мембранеллы изогнутые, при-
мерно равны по длине, М3 прямая, короткая. Стан-
дартного описания вида нет, только краткая аннотация
к рисунку, в которой не указан биотоп (пресные воды
или море).
826
ALVEOLATA
Род Cardiostomatella Corliss, 1960
Типовой вид Cardiostoma vermiforme Kahl,
1928; это замещающее название для гомонима Cardi-
ostoma Kahl, 1928. Длинные червеобразные формы
(200—500 мкм) из морского бентоса, отмечены во
многих морях; род долгое время не имел четкого поло-
жения в системе, числился среди тетрахименид, фрон-
тониид, циртофорид; хотя позже был четко выявлен
тетрахименовый аппарат, ввиду наличия мелкого цир-
тума (немадесм) род относили к фронтониидам; позже
род был отнесен предположительно к локсоцефали-
дам. Новейшие данные по типовому виду по материа-
лу из Красного моря представлены Аль Рашейдом
(Al-Rasheid, 1991а).
Тело резко вытянутое (до 300 мкм), широкое, ваку-
оли в продольном ряду слева с более крупной каудаль-
ной вакуолью; кинеты полимеризованы, сохранены
послеротовые ряды; спереди очень мелкий ацилон;
предротовой шов почти продольный, сдвигает рот
вниз; перистом очень мелкий, стандартного типа, с пе-
рикинетой и примерно равными мембранеллами с
3 рядами в основании каждой. Ниже рта 4—6 длинных
послеротовых кинет. Ядра в цепочке, микронуклеусы
многочисленные.
У С. minuta Dragesco, 1965 тело более короткое, с
одним ядром и одной вакуолью. Аргиром у этого вида
и у С. vermiforme прямоугольный, как у Dexiotricha, у
Loxocephalus шестиугольный; это можно использовать
для определения филогении рода. Вид С. mononucleata
(Dragesco, 1963) повторно не изучался. С. chesapeaken-
sis Small et Lynn, 1985 — вид с 2 ядрами, каждое с
5 микронуклеусами, с более крупным перистомом,
широким предротовым швом, мембранеллами резко
неравной длины. Сохранены 3 послеротовых ряда, вы-
явлен скутикус.
Род Sphenostomella Jankowski, 1980
Типовой вид Sathrophilus vernalis Dragesco et
Groliere, 1969. По Аэшт, авторы вида S. vernalis Grolie-
re et Dragesco, 1985. В Guide (Small, Lynn, 1985) род и
его типовой вид обозначены как Sphenostomella Jan-
kowski gen. n. с типовым видом S. hovassei', эта ошибка
повторена в Traite (Puytorac, 1994). Валидно первое
указание типа S. vernalis.
Тело вытянутое, цилиндрическое, с мелким ацило-
ном спереди; длина тела 70—120 мкм; по экватору
31—34 кинеты, включая 2 короткие послеротовые и
скутикус. Перистом обширный, почти достигает эква-
тора, с длинной перикинетой; Ml < М2 < М3. Мембра-
нелла М3 длинная, извитая. Аргиром, как у дексиот-
рих, с серией прямоугольников. Авторы вида отнесли
его к Cinetochilidae.
Род Zitheron Jankowski gen. n.
Типовой вид Sathrophilus hovassei Groliere,
1975 (Z. hovassei comb. n.). Мелкий болотный вид с
плоским несимметричным телом, небольшим числом
кинет, с безресничной площадкой у вершины тела; име-
ются 2 послеротовых ряда и скутикус в виде линии ди-
сом. Перистом непропорционально крупный, мембра-
неллы смещены вверх, примерно равны по длине, но М3
очень тонкая, нитевидная. Перистом в принципе, как у
Sphenostomella, но роды отличаются по форме тела,
степени сдвига перистома—у нового рода нет предро-
тового шва, у Sphenostomella шов длинный и широкий,
послеротовой шов четкий и длинный, бисекантный.
Род Platynematum Foissner, Berger
et Kohmann, 1994
Типовой вид Uronema sociale Penard, 1922;
это замещающее название для Platynema Kahl, 1931.
Каль сам заменил это название новым — Platynematum
Kahl, 1935, но оно невалидно, так как тип рода не
был обозначен. Р. sociale — редкий пресноводный вид;
тело мелкое (30—50 мкм), плоское, эллипсоидное, ки-
неты немногочисленные, межкинеты выпуклые в виде
ребер; кинетосомы разрежены, ниже рта короткие по-
слеротовые ряды и скутикус. Перистом субапи-
кальный, с перикинетой; мембранеллы как у дексиотрих,
Ml > М2 > М3. Концы тела зубчатые, сзади каудальная
ресничка. Только при импрегнации был обнаружен
тетрахименовый аппарат у Р. hyalinum, и род был вна-
чале включен в состав сем. Tetrahymenidae.
При установлении нового рода в него включены в
новой комбинации следующие виды, кроме типового
Р. solivagum (Kahl, 1926 in Uronema), Р. mirum (Penard,
1922 in Uronema), P. hyalinum (Kahl, 1931 in Platynema),
P. latifrons (Gourret et Roeser, 1888 in Colpodopsis), P. ma-
rinum (Kahl, 1933 in Platynema), P. denticulatum (Kahl,
1933 in Platynema). В основном виды морские, строение
их неизвестно, и отнесены они к этому роду условно.
По Аэшт (Aescht, 2001), со ссылкой на мнение Фойс-
снера, Colpodopsis Gourret et Roeser, 1888 — синоним
данного рода, но это монотипический род, следова-
тельно, это валидное, пригодное название для замены
гомонима Platynematum. Типовой вид С. latifrons —
морской вид, очень плохо описанный и зарисованный;
тело кзади заостряется, несет несколько каудалий; рот
почти медиальный; размеры не указаны; тело сплюще-
но латерально. Частый вид у Корсики в сапробных
зонах моря; тем не менее никем не переописан. Можно
предположить, что именно этот вид был позже описан
как Uronema pluricaudatum Noland, 1937 (единствен-
ное отличие — апикальный ацилон), но и это описание
непригодно, так как неясно строение перистома. Род
Colpodopsis следует признать неопределимым и вмес-
те с типом С. latifrons исключить из синонимии рода
Platynematum Foissner et al., 1994. Синонимика должна
быть основана на точном знании морфологии, в дан-
ном случае это невозможно.
Род Pseudoplatynematum Bock, 1952
Типовой вид Р. loricatum — морской вид с уд-
линенным телом, сплющенным дорсовентрально; кор-
текс рельефный, четко видны продольные и попереч-
ные линии — 20—24 продольных ребер маркируют
ряды ресничек и трихоцист; фактически имеется пан-
ТИП CILIOPHORA. КЛАСС OLIGOHYMENOPHOREA
827
цйрь с зубцами на постероне и на вершине тела, с ко-
роткими густыми ресничками и длинной каудалией.
Перистом мелкий, субапикальный; ротовая цилиатура
не изучена; вакуоль над постероном. Второй вид
Р. parvum Bock, 1952 вдвое мельче, с менее рельефным
панцирем и плоским телом.
Род Sathrophilus Corliss, 1960
Типовой вид Saprophilus agitatus Stokes, 1887;
это замещающее название для гомонима Saprophilus
Stokes, 1887. Тип рода — мелкие гименостоматы, рот
удален от антерона, тело метаболичное, особи встреча-
ются в гниющих водных беспозвоночных, например в
Gammarus; вид не переописан, и род фактически суще-
ствует без типового вида. Поэтому к роду приписыва-
ли различные формы, часть из которых относится, ве-
роятно, к роду Tetrahymena. Подробно изучен вид
S. muscorum Kahl, 1933, но нет уверенности, что он от-
носится к этому роду. Диагноз рода обычно дают по
видам S. muscorum или S. vernalis-, второй вид выделен
мною в особый ipOR'Sphenostomella. Хорошо изучен-
ный вид S. hovassei не соответствует типу по форме
тела и перистому, это вид другого рода (Zitheron).
Каль (Kahl, 1931) описал новые виды S. mobilis,
S. putrinus, S. ovatus, S. oviformis, S. chlorophagus,
S. muscorum; позже добавлены виды S. antarcticus
Thompson, 1972, S. granulatus Czapik, 1968 и др. Это
смесь видов тетрахимен, Pseudocohnilembus и других
родов. К примеру, вид S. granulatus — предполагае-
мый синоним вида Tetrahymena setifera Holz et Corliss,
1956; вид S. oviformis Kahl, 1926 — вероятный сино-
ним T. pyriformis. S. putrinus Kahl, 1926 тоже имеет об-
лик и перистом, как у тетрахимен, но отличается по на-
личию слоя трихоцист под пелликулой. S. mobilis Kahl,
1926 — тоже вид из группы Tetrahymena pyriformis,
точно неопределимый. Saprophilus sp. in Vuxanovici,
1962 не тетрахимена, поскольку имеет зоохлореллы.
Больше века род существует без типового вида, по-
этому Sathrophilus следует признать неопределимым, а
детально изученный современными методами импрег-
нации вид S. muscorum выделить в новый род.
Род Kariphilus Jankowski gen. n.
Типовой вид Saprophilus muscorum Kahl, 1931;
вид неоднократно переописан и получает четкую ха-
рактеристику. Типовая раса из мхов; в описании нет
точных данных о кинетоме, но вид можно опреде-
лить — рот крупный, реснички разрозненные и длин-
ные, под пелликулой трихоцисты, вакуоль субтерми-
нальная, с каналом. По разным авторам, размеры осо-
бей около 30 мкм и 16—17 Кинет, 40—50 мкм и
17—19 кинет. Наиболее подробное описание приво-
дится Фойсснером (Foissner et aL, 1994) — размеры
25—40 мкм, 12—17 кинет, слой трихоцист, каудалия
достигает длины тела. Кинеты продольные, биполяр-
ные, ниже рта ацилон без послеротовых кинет, с груп-
пой кинетосом (скутикус). Мембранеллы ступенчатые,
Ml > М2 > М3, М3 разбита на 2 фрагмента. Стоматоге-
нез — за счет скутикуса и одной из прилегающих ки-
нет. Аргиром — ряды квадратов с кинетосомой в
центре; в антесоме 2 кольцевые аргентофильные фиб-1
риллы, опоясывающие все тело на уровне основания и
вершины перистома.
Род Antameron Jankowski gen. n.
Типовой вид Sathrophilus antarcticus Thomp-
son, 1972 из растаявшего льда в Антарктике; тело тон-
кое, вытянутое, с 10—11 кинетами; один послеродовой
ряд справа и группа кинетосом у цитопига; перистом
длиной до трети длины тела, с короткой мембраной и
3 мембранеллами по 3 ряда кинетосом в основании.
Ml диагональная, чуть меньше поперечная М2, мелкая
поперечная М3; сзади длинная каудалия; размеры in
fixo 23—-28 мкм. Перистом субапикальный, Ml у апек-
са, предротового шва нет.
Род Cinetochilum Perty, 1849
Типовой вид Cyclidium margaritaceum Ehren-
berg, 1831; род был дважды предложен как новый.
Очень мелкий плоский вид из болот и мхов с медлен-
ным движением; размеры 20-—40 мкм, кортекс панци-
ревидный, прочный, с продольными ребрами вдоль ки-
нет. На дорсуме 6 кинет, на венте 5—6, все ряды про-
дольные, послеротовых рядов нет — в ацилоне только
несколько кинетосом (скутикус). Аргиром на обеих
сторонах в виде правильной сети прямоугольников.
Перистом смещен далеко вниз, относительно круп-
ный, субмедиальный, с длинной мембраной; мембра-
неллы сдвинуты к вершине перистома, Ml и М2 очень
длинные, диагональные, равной длины, М3 рудимен-
тарная. Рисунок ротовой цилиатуры у Петч (Patsch,
1974) неправилен, хотя выполнен с протарголовых
препаратов. Вероятно, это эвригалинный вид, отме-
чался в Балтике и Черном море. Вид легко импрегни-
руется, был одним из первых объектов для сухого ме-
тода импрегнации по Кляйну. Описано немного видов
рода, и часть их может быть идентична с типовым ви-
дом — С. buetschlii Schouteden, 1906, С. kahli Tucoles-
co, 1962; валидный пресноводный вид С. impatiens Pe-
nard, 1922 и морские виды С. marinum Kahl, 1931 и
С. australiense Foissner et aL, 1994 (для гомонима
С. marinum Pomp et Wilbert, 1988).
Род Cinetochilum выделяется в сем. Cinetochilidae
Perty, 1852; состав разный в разных сводках, у Линна в
последнем варианте (Lynn, 2002) включает также роды
Platynematum, Pseudoplatynematum, Sathrophilus и
Sphenostomella. Нет четкой границы с Loxocephalidae,
есть переходные формы; вероятно, единственный кри-
терий цинетохилид — панциревидный кортекс (но
есть и у Pseudoplatynematum) и отсутствие послерото-
вых кинет.
Род Pseudocinetochilum Obolkina, 1995
Типовой вид Р. pulchellum по монотипии; опи-
сан в каталоге байкальского планктона (Оболкина,
19956), но это бентосный вид. Тело крупное (около
828
ALVEOLATA
114 X 80 мкм), с овальным контуром, слегка сплюще-
но, с овальным ядром; около 40 кинет идут продольно
на дорсуме, часть их близ перистома укорочена на вен-
те, подходит к верхней и нижней секанте. Имеются
2 послеротовые кинеты и группа из 4—5 парных кине-
тосом (дисом) ниже перистома (скутикус). Аргиром —
ряды квадратов (как у дексиотрихи). Перистом, не-
смотря на укрупнение тела, остался непропорциональ-
но мелким и сохраняет организацию типа Cinetochi-
lum, но с некоторыми изменениями; удлинен фрагмент
сомакинеты над вершиной ундулирующей мембраны
справа, образовались дополнительные фрагменты сле-
ва от рта; пора вакуоли у цитопига. Род отнесен Обол-
киной к цинетохилидам, с возможностью выделения в
новое семейство. В одной из проб грунта близ Байка-
льской биостанции я видел особь с таким же обликом и
перистомом, но с сильным сплющиванием тела и
сплошным слоем зоохлорелл.
Род Cinetozona Olmo, Tellez et Esteban,
1998
Типовой род C.pyriformis, очень мелкий вид
из пруда в Мадриде; хорошо изучен с применением
импрегнации. Это род неопределенного положения —
имеется почти замкнутое кольцо ресничек вокруг эк-
ватора, как у Urozona, но перистомальная цилиатура
сходна с паттерном Cinetochilum. Открытие переход-
ной формы говорит о том, что Urozona не следует от-
делять на уровне подотряда (с упрощением ротовой
цилиатуры и значительной утратой соматической ци-
лиатуры). Род Cinetozona пока включается в состав
сем. Cinetochilidae.
Подотряд Philasterina Small, 1967
(рис. 364, 6—366, б)
Отряд Scuticociliatida Small, 1967 был предложен
для объединения цилиат, ранее относимых к подотря-
дам Pleuronematina (отряд Hymenostomatida) и Stomati-
па (отряд Thigmotrichida). В последнем отряде оставле-
ны лишь формы, не имеющие предротовой цилиатуры
(ринходиды), которые раньше ошибочно выводились
от анцистрид; сейчас это самостоятельный отряд. В
первом отряде оставлены виды типа Tetrahymena с по-
слеротовыми кинетами, одна из которых является сто-
матогенной.
Общее в организации Scuticociliatida — морфоло-
гия и морфогенез ротовой цилиатуры при делении. Ро-
товой комплекс скутицид — это видоизмененный тет-
рахимениум, в котором иногда трудно установить го-
мологию компонентов (мембранелл); поэтому вместо
традиционного обозначения мембранелл Ml, М2 и М3
Смолл (Small, 1967) предлагал различать «мембранои-
ды», обозначая их и мембрану греческими буквами;
это не принято, и в новом издании Guide (Lynn, Small,
2002) используются привычные обозначения. У скути-
цид обычно вытянуты УМ и М2, укорочены Ml и М3,
но со временем накапливается все больше исключе-
ний, и удлинение УМ и М2 уже не является признаком
отряда. Хотя стоматогенез у разных групп скутицид
протекает с некоторыми отличиями, в целом характер-
но образование «зачаткового крючка» (scuticum, позже
scuticus или scutica) у правостороннего изгиба УМ. Но-
вая ротовая цилиатура образуется левее, а не правее
линии тела, новые мембраноиды лежат под углом, а не
вдоль тела. Послеротовые кинеты, играющие у тетра-
хименид роль стоматогенных, у скутицид отсутству-
ют, зачатковую группу кинетосом выделяет основание
УМ, и она сохраняется как скутикус в интеркинезе
всех видов отряда.
В первоначальном варианте отряд скутицид вклю-
чал, по Смоллу, 3 подотряда — Pleuronematina Fa-
ure-Fremiet, 1956 (Pleuronematidae, Conchophthiriidae,
Hemispeiridae, Thigmocomidae, Hysterocinetidae), Pseu-
docohnilembina Small, 1967 (Pseudocohnilembidae,
Thigmophryidae) и Philasterina Small, 1967 (Philasteri-
dae, Cohnilembidae, Loxocephalidae, Uronematidae, En-
torhipidiidae, Cryptochilidae, Entodiscidae). Соседство
гистероцинет и плейронем, тигмофрий и Pseudocohni-
lembus сейчас кажется неестественным, в системе от-
ряда (поднятого в ранге до подкласса) произошли глу-
бокие изменения.-Гистероцинетиды обособлены в ран-
ге отряда и подкласса, подотряд Pseudocohnilembina
более не упоминается, сем. Hemispeiridae обособлено в
восстановленном отряде Thigmotrichida, ранг Pleurone-
matina и Philasterina поднят до отряда, локсоцефалиды
в Traite (Puytorac, 1994) считаются отрядом.
Теперь можно дать более четкую характеристику
отряду Scuticociliatida s. str. (в узком смысле — группе
Philasterina) — нет послеротовых кинет (укороченных,
но не исчезнувших у локсоцефалид), нет апикальной
присоски (имеющейся у гистероцинетид), нет крайне-
го удлинения М2 (свойственного плейронематидам);
основания мембранелл, как правило, расположены в
продольном ряду (у локсоцефалид ступеньками, у
плейронематид сложным образом, не в одну линию).
Основная масса видов отряда имеет вытянутое тело,
перистом незначительно погружен, вытянут по оси
тела; мембрана короткая, не достигает вершины пери-
стома; мембраиеллы расположены в линию и прижаты
к правому краю перистома. Такие виды встречаются в
пресной воде, почве, в солоноватых и морских водах;
много паразитов в беспозвоночных и рыбах.
У части паразитов наблюдается полимеризация ки-
нет, укрупнение размеров тела, сдвиг и уменьшение
перистома, образование вторичной ротовой цилиату-
ры (вестибулюма) за счет части сомакинет; такие
роды, как Thigmophrya, Conchophthirius, Myxophyllum,
внешне ничем не напоминают стандартных скутицид,
а родство Schizocaryum и скутицид смогли доказать
лишь применением молекулярных маркеров.
В этом обзоре тетрахимениды и скутициды не раз-
граничиваются в разных подклассах, как у Линна, по-
скольку имеется переходная группа — локсоцефали-
ды. Подкласс Hymenostomatia включает здесь отряды
Tetrahymenida, Scuticociliatida и Thigmotrichida; второй
отряд делится на подотряды Loxocephalina, Philasterina
и Pleuronematina.
Внутренняя структура отряда усложнена выделе-
нием многочисленных семейств, различия между ко-
торыми незначительные, а иногда и сомнительные;
имеется много переходных форм между типовыми ро-
дами семейств, и родство включаемых родов не дока-
ТИП CILIOPHORA. КЛАСС OLIGOHYMENOPHOREA
829
Рис. 364, б. Scuticociliatida.
Andreula conchophthirioides (A); Thigmocoma acuminata (Б, B); Calyptotrichapleuronemoides = C. lanuginosum (Г, Д); Biggaria echinometris (E, Ж); Caspionella
(ранее Cyclidium) bergeri (3, 77); Cyclidium sphagnetorum (K, JI); Ctedoctema acanthocrypta (M); Parauronema virginianum (H). (По: Raabe, 1938 (/1); Kazubski,
1963 (Б, В); Wilbert, Foissner, 1980 (Г, Д); Агамалиев, 1972 (3, И); Groliere et al., 1980b (£, Ж); Groliere, 1973 (К, JI); Wilbert, Buitkamp, 1973 (M); Wilbert, Ka-
han, 1981 (77)).
Fig. 364, 6. Scuticociliatida.
зано. Вероятно, исключая указанных выше аберран-
тов, остальные роды стандартного типа нужно сгруп-
пировать в 2—3 семейства. Картина тяжелая также на
родовом уровне; еще в 1960-е гг. Корлисс (Corliss,
1961) отметил выделение родов по незначительным
признакам и общую тенденцию к «инфляции» в систе-
ме родов гименостомат; этот процесс протекает бурно
и сейчас и привел к ситуации, когда разграничить
роды, определить их, отнести новый вид к какому-ли-
бо роду иногда оказывается невозможным. Пример —
паразиты крабов и рыб, кочующие из одного рода в
другой. В системе Линна (2002) принят следующий со-
став группы Scuticociliatida s. str.:
Отряд Philasterida Small, 1967
Сем. Cinetochilidae Perty, 1852 (Cinetochilum, Platynematum,
Pseudoplatynematum. Sathrophilus, Sphenostomella); рас-
смотрены выше в составе подотряда локсоцефалид.
Сем. Cohnilembidae Kahl, 1933 (Cohnilembus, Porpostoma) (вто-
рой род выделялся в сем. Helicostomidae).
Сем. Cryptochilidae Berger et Corliss, 1979 (Biggaria, Biggariel-
la, Cryptochilum, Metaxystomium = Velistoma, Metoikos, Ta-
nystomium, Thigmozoon, Yagiuia).
Сем. Entodiscidae Jankowski, 1973 (Cryptochilidium, Entodiscus,
Pectenita).
Сем. Entorhipidiidae Madsen, 1932 (Entorhipidium).
Сем. Loxocephalidae Jankowski, 1964 (Balanonema, Cardiosto-
matella, Dexiotricha, Loxocephalus, Paradexiotricha, Paralo-
xocephalus, Paratetrahymena); рассмотрено выше в составе
подотряда локсоцефалин.
Сем. Orchitophryidae Cepede, 1910 (Anophryoides, Mesanophrys,
Metanophrys, Mugardia, Orchitophrya, Paranophrys).
Сем. Paralembidae Corliss et Puytorac in Small et Lynn, 1985
(Anophrys, Cryptolembus, Magnalembus, Mesolembus, Ovo-
lembus, Paralembus).
Сем. Parauronematidae Small et Lynn, 1985 (Glattconema, Miami-
ensis, Parauronema, Potomacus).
Сем. Philasteridae Kahl, 1931 (Helicostoma, Madsenia, Paraphi-
laster, Philaster, Philasterides).
Сем. Pseudpcohnilembidae Evans et Thompson, 1964 (Pseudocoh-
nilembus).
Сем. Thigmophryidae Ch. etZw., 1926 (Cochliodomus, Cochliop-
hilus, Conchophyllum, Myxophyllum, Thigmophrya).
Сем. Thyrophylacidae Berger in Corliss, 1961 (Plagiopyliella,
Thyrophylax).
Сем. Uronematidae Thompson, 1964 (Homalogastra, Pseudurone-
ma, Urocyclon, Uronema, Uronemopsis, Uropedalium).
Сем. Urozonidae Groliere, 1975 (Urozona); рассмотрено в соста-
ве подотряда локсоцефалин.
830
ALVEOLATA
Рис. 365, a. Scuticociliatida.
Cryptochilum echini (A—Д); Entodiscus echini (E—3); Homalogastra setosa (И, К). (По: Foissner, 1985b (A—3); Dragesco, Dragesco-Kerneis, 1986 (И, K)).
Fig. 365, a. Scuticociliatida.
Роды неопределенного положения в составе отряда
Philasterida (в списке Линна): Kahlilembus, Andreula,
Bizonula, Colpodopsis, Cryptostomina, Eurychilum, Gul-
Imarella, Lembadionella, Ptyssostoma, Pusilloburius, Rhi-
nodisculus, Sertumia.
В данном обзоре из состава плейронематин исклю-
чено сем. Cyclidiidae, перенесенное в состав отряда
Philasterida:
Сем. Cyclidiidae Ehrenberg, 1838 (Abathostoma, Cristigera, Cyc-
lidium, Echinocyclidium, Isocyclidium, Mesogymnus, Paracyc-
lidium, Paurotricha, Pseudocyclidium).
Добавлено сем. Schizocaryidae Jankowski, 1979 (Schi-
zocaryum) — у Линна в числе групп неопреде-
ленного положения в составе подкласса. Различия
многих семейств незначительные, состав сборный, систе-
ма искусственная, поэтому сведения о родах филасте-
рин даны не по указанным семействам, а в алфавитном
порядке.
Род Abathostoma Berger, 1994
Типовой вид Cyclidium stercoris Powers, 1935.
Родовое название впервые приведено в книге Корлис-
са (Corliss, 1979) без диагноза, как nomen nudum; в Tra-
ite (Puytorac, 1994) дан диагноз (как подрод рода Cycli-
dium) и указан тип рода, но еще ранее для того же
типового вида был предложен новый род Echinocycli-
dium Jank., 1980. Название Abathostoma невалидно
как синоним.
Род Alyscum Dujardin, 1841
Типовой вид A. saltans. Вероятно, это синоним
рода Cyclidium типа С. glaucoma. Род точно неопреде-
лим, должен быть исключен из числа валидных родов
гименостомат. У Фроментеля (Fromentel, 1874) — Cyc-
lidium saltans.
ТИП CILIOPHORA. КЛАСС OLIGOHYMENOPHOREA
831
Рис. 365, б. Scuticociliatida.
Pseudocyclidium longum (A—В, Ky, Pseudocohnilembus putrinus (Г—3)', Protocyclidium terricola (pf); Uronema nigricans (JI, M); Schizocaryum dogieli (H). (По:
Xu, Song, 1998 (A—В, K); Foissner, Wilbert, 1981 (Г— 3); Foissner et al., 2002 (И); Thompson, Evans, 1968 (77); Wilbert, Kahan, 1981 (M); H— ориг.).
Fig. 365, 6. Scuticociliatida.
Род Andreula Kahl, 1934
Типовой вид Conchophthirus antedonis Andre,
1910 из «comatules» (морских лилий — иглокожих
группы Crinoidea) в Роскоффе, Франция; хозяин не
определен; паразиты обитают в массе в среднем и зад-
нем отделе пищевого канала, вначале приняты за гете-
ротрих с упрощенной зоной мембранелл вследствие
паразитизма. Размеры 70—ПО мкм, тело цилиндриче-
ское, слегка сплющено латерально, рот и глотка над
экватором, вакуоль субтерминальная. Еще раньше их
отмечали (без названия) в кишечнике Comatula medi-
terranea. Хозяин типового вида, по Раабе (Raabe,
1938), —Antedon bifida-, Раабе описал в Монако новые
виды A. conchophthirioides, A. subacuminata, A. kahli (в
Leptometra phalangium) и A. mediterranea (в Antedon).
Вероятно, один из них был описан ранее как Nyctothe-
rus comatulae Claparede et Lachmann, 1858 из кишечни-
ка и целома Comatula mediterranea {Andreula comatulae
comb. n.).
Тело вытянутое, кинеты многочисленные, простой
топографии; рот экваториальный, вакуоль субтерми-
нальная. Имеется длинный предротовой шов; пери-
стом узкий, вдоль ребра плоского тела. По Раабе,
видна исчерченная полоса от рта (в неглубокой поло-
сти) до начала предротового шва, далеко от апекса, с
особо длинными ресничками, не слитыми вместе; это
не зона мембранелл. Импрегнация не применялась,
точное строение стомокинет неизвестно. Вид A. conc-
hophthirioides резко отличается по форме тела от типо-
вого и остальных видов.
Род Anophryoides Puytorac et Groliere,
1979
Типов о-й вид Anophrys salmacida Mugard, 1949.
В каталоге Аэшт невалидный род — синоним родов
Mugardia и Paranophrys. Название Mugardia Small et
Lynn, 1985 дано позже для того же типового вида, это
действительно синоним, но тип рода Paranophrys
(Р. marina) отличается от A. salmacida, и род Anophryo-
ides может быть валидным. Другая сложность в том,
что вид, изученный как A. salmacida, позже назвали
832
ALVEOLATA
Рис. 366, a. Scuticociliatida.
Различия родов Parauronema (A); Paranophrys (Б); Mesanophrys (E); Metanophrys (Г); Miamiensis avidus (Д, E, 3—K); «Philasterides dicettfrarchi» (= Miamien-
sis avidus?') (Ж); Paurotricha cyclidiformis (JT); Pectenita golikowi (M, H). Ml—М3 — ротовые мембранеллы. (По: Song, Wilbert, 2000b (A—Г, E—K); Dragesco,
Dragesco-Kerneis, 1991 (JT); Thompson, Moewus, 1964 (Д); M, H—ориг.).
Fig. 366, a. Scuticociliatida.
Generic difference in philasterids (A—Г). Ml—М3 — oral membranelles.
Anophryoides puytoraci Small et Lynn, 1985. Добавлен
также вид A. soldoi S. et L., 1985.
Раса Мюгард (Mugard, 1948 — типовая A. salmaci-
da) — гистиофаг из солоноватых и морских вод; разме-
ры 80—85 мкм, вид имеет 20—22 биполярные кинеты,
мембрана достигает вершины М2 (это признак многих
филастерин, дальше не упоминается). Ml — острая,
длинная; М2 — прямоугольная, чуть крупнее; М3 — в
виде рудимента, положение мембранелл линейное, по-
слеротового шва нет. Многие авторы считали этот вид не
соответствующим диагнозу рода Anophrys.
Род Anophrys Cohn, 1866
Типовой вид A. sarcophaga, морской гистио-
фаг величиной 60—70 мкм; особи скапливаются на по-
гибших животных. По Мюгард, в перистоме Ml —
мелкая треугольная, М2 — длинная прямоугольная,
М3 — мелкий рудимент; тело заострено спереди, с ка-
удальной ресничкой. Точной картины ротовой цилиа-
туры до 1948 г. не было, и к роду относили любых мел-
ких сапрофагов и паразитов. Постепенно Anophrys
стал «складом» для разных видов, у которых точно не
изучался перистом; последний вид (Л. arenicola), изу-
ченный испанским методом импрегнации, отнесен к
Anophrys в 1986 г.
A. sarcophaga Cohn, 1866 — тип рода, после работы
Мюгард не переописан.
A. maggii Cattaneo, 1888 из крови краба Carcinus
maenas; после вторичного изучения этой инфекции
вид сведен в синонимы предыдущего вида.
A. echini Di Mauro, 1904 — в ежах Paracentrotus li-
vidus, Sphaerechinus granularis.
A. dogieli Poljansky et Golikova, 1962 • в кишеч-
нике ежей Strongylocentrotus droebachiensis на Мур-
мане.
A. elongata Biggar et Wenrich, 1932 — в морских
ежах CHIA (Echinometra lucunter, E. yanbrunti, Diade-
ma mexicanum, Tripneustes ventricosus, Toxopneustes sp„
Lytechinus variegatus и др. 26 видов 16 родов хозяев),
A. aglycus Powers, 1926 — в Echinometra vanbrunti.
ТИП CILIOPHORA. КЛАСС OLIGOHYMENOPHOREA
833
Рис. 366, б. Scuticociliatida.
Paranophrys magna (A—В); Paralembus digitiformis (Г—Е), Philaster digitiformis (Ж); Porpostoma grassei (3—K); Paracyclidiuni rhabdotectum (JT); Parauronema
antarctica (M); P. longum (H, О). (По: Song, Wilbert, 2000b (A—E); Puytorac et al., 1966 (Ж); Petz et al., 1995 (3—K); Groliere et al., 1980b (JT); Song, 1995b (H, 0);
Thompson, 1972 (Л/)).
Fig. 366, 6. Scuticociliatida.
A. arenicola Femandez-Galiano et Castro de Zaldum-
bide, 1986, в морском бентосе; схема перистома не со-
ответствует таковой у типового вида.
A. vermiformis Powers, 1926 — в 5 родах эхинид.
После изучения импрегнированных особей все виды
из морских ежей были 'удалены из состава рода
(см. Paranophrys, Metanophrys, Paraphilaster).
Неопределенные виды Anophrys постоянно отмеча-
ются в литературе в фаунистических и паразитологи-
ческих статьях, например в Sipunculus.
Род Aulax Gourret et Roeser, 1888
Типовой вид A.paucisetosa. Морской вид с ка-
удалией и 4 пучками соматических ресничек; вентра-
льный желобок делит тело на 2 части; перистом длин-
ный, щелевидный, с крупной мембраной; глотки нет,
вакуоль сзади. Принято считать род Aulax синонимом
рода Cristigera Roux, 1899, и поэтому его никогда не
принимали. В каталоге Аэшт Cristigera — валидный
род; синонимы — Aulaxella (для преоккупированного
Aulax) и Paurotricha. Но в аннотации к роду Aulax как к
синониму рода Cristigera Аэшт пишет, что это не го-
моним, и название Aulaxella предложено напрасно —
есть род Aylax, a Aulax — простая опечатка. Название
Cristigera принято всеми, и едва ли сейчас можно вос-
становить Aulax по правилу приоритета.
Род Biggaria Aescht, 2001
Типовой вид Cryptochilum bermudensis Biggar
et Wenrich, 1932. Род Biggaria Kahl, 1934 установлен
для 3 видов без обозначения типа, в основном для ви-
дов Cryptochilidium gracile Powers, 1933 и C. bermuden-
sisB>. et W., 1932. Аэшт выбрала типовой вид по прави-
лу элиминации — В. echinometris ранее была выделена
в новый род Velistoma, В. gracilis — тип рода Tanysto-
mium; остался один вид из включенных Калем. Позже
описанный вид Biggaria caryoselaginelloides выделен
Янковским (1980) в новый род Teremanticola-, Аэшт со
53 Зак. № 4163
834
ALVEOLATA
ссылкой на мнение Тюффро считает этот род невалид-
ным как синоним Biggaria-, но если так, то зачем было
вводить новое название? В таких случаях ищут сино-
ним, который заменяет непригодное название таксо-
на — вида или рода.
Тип рода В. bermudensis — наиболее видоизме-
ненный из прежних видов рода — тело листовидное,
предротовой шов удлинен, перистом небольшой, сме-
щен почти к постерону; УМ и М2 наполовину погру-
жены в небольшую полость, Ml вытянута в виде длин-
ной монокинеты. Зарисовки ротовой цилиатуры у раз-
ных авторов не совпадают. Вид обитает в морских
ежах на востоке США — Diadema antillarum, Lytechi-
nus variegatus, Echinometra lucunter, Tripneustes vent-
ricosus.
Род Biggariella Profant in Corliss,
1979
Приведен в книге Корлисса (Corliss, 1979) без диа-
гноза и указания типового вида, род невалиден.
Род Calyptotricha Phillips,
1882
Типовой вид С. pleuronemoides. Мелкие цили-
аты типа Cyclidium с каплевидым телом, длинной кау-
дальной ресничкой, крупным перистомом с большой
мембраной; цитоплазма часто с зоохлореллами. По
Калю (Kahl, 1931), единственное отличие от Cyclidi-
um — наличие домика, вздутой в середине тонкостен-
ной трубки с широким отверстием; базальная часть
прикреплена к субстрату. Каль еинонимизировал этот
вид с Diplospyla inhaesa Kellicott, 1885.
При импрегнации изучен другой вид — Calyptotric-
ha lanuginosum (Penard, 1922 in Cyclidium)', показано
отличие перистома калиптотрих и циклидиев. Размеры
30—40 мкм, домик длиной до 100 мкм, вакуоль терми-
нальная, кинетом с 21—25 продольными рядами, обо-
соблены длинные реснички на апексе и каудалия (до
20 мкм). В перистоме Ml вытянутая, короткая М2 при-
легает к Ml, короткая М3 обособлена, все мембранел-
лы лежат линейно; аргиром — ряды прямоугольников.
Третий вид — С. chesapeakensis Small et Lynn, 1985 с
другим типом М3. Мембрана до вершины перистома,
огибает рот снизу и слева — это признаки плейронема-
тид, но линейное положение мембранелл и короткая
М2 — признаки филастерид.
Род Caspionella Jankowski,
1980
Типовой вид Cyclidium bergeri Agamaliev,
1972, как Cyclidium, но с небольшим послеродовым
ресничным рядом; у Cyclidium в этой зоне — груп-
па кинетосом. Другой признак — нелинейное положе-
ние мембранелл — перистом относительно короткий,
монокинета Ml лежит слева от вершины вытянутой
треугольной М2; М3 — небольшой треугольник ниже
М2. У Cyclidium перистом крупнее, Ml лежит над М2,
состоит из треугольной группы кинетосом. Сомаки-
неты С. bergeri биполярные; у полюсов тела неболь-
шие безресничные площадки. Форма скутикуса пока
не учитывалась в системе родов подотряда; у С. ber-
geri он имитирует короткий послеродовой реснич-
ный ряд.
Род Cohnilembus Kahl, 1933
Типовой вид Lembus velifer Cohn, 1866; род
дважды предложен Калем как новый (Kahl, 1933,
1935). Замещающее название для гомонима Lembus
Cohn, 1866. Сейчас L. velifer считается синонимом
вида Vibrio verminus Muller, 1786, и принятое название
типа — Cohnilembus verminus. Каль считает род Sparot-
richa Entz, 1879 синонимом рода Lembus, и вместо но-
вого названия должен был использовать название си-
нонима как валидное. Поскольку Cohnilembus — об-
щепринятое название, сейчас название Sparotricha
восстановить нельзя. Второй синоним — Proboscella
Kent, 1881, тоже пригодное для замены гомонима, но
не использованное Калем.
Типовой вид обычен в морских пробах, особенно
из сапробных зон, хорошо изучен; тело червеобразное,
тонкое и длинное (70—120 мкм), с гибким антероном;
имеется 9—10 биполярных кинет; рот над экватором,
Ml вытянута на всю длину хоботка, нитевидная, М2 и
М3 — короткие, над ртом; положение мембранелл ли-
нейное, мембрана очень короткая, достигает М2. Ранее
у вида находили длинную двойную ундулирующую
мембрану, но это длинная Ml и смежный с ней левый
соматический ряд.
C.fusiformis (Kahl, 1926) — пресноводный вид; на-
ходки С. verminus в пресных водах относятся или к
этому виду, или к сходному роду Kahlilembus; С. vexil-
larius (Kahl, 1926) — пресноводный вид, пока не изу-
чен; вероятно, вид рода Kahlilembus-, С. cyclidium Wen-
zel, 1961 плохо изученный морской вид; С. elongatus
(Clap, et Lachin., 1859 in Cyclidium) — неотличим от
C. verminus; C. subulatus (Kent, 1881 m Lembus); C. pun-
ctatus (Kahl, 1928); C. stichotricha (Kahl, 1928); C. putri-
nus (Kahl, 1928); C. grassei Corliss et Snyder, 1986 —
cm. Porpostoma.
Род Colpodopsis Gourret et Roeser,
1888
Типовой вид C. latifrons; по Аэшт, синоним
рода Platynematum, но в таком случае это название
должно заменить Platynematum, предложенное для за-
мены гомонима Platynema. Вид никогда не переописы-
вался, имеется лишь один примитивный рисунок (вид
сбоку), вид неопределим, и поэтому нельзя считать
Colpodopsis синонимом рода Platynematum, который
остается валидным. Тип рода — мелкая морская цили-
ата; тело расширено спереди, плавно сужается к посте-
рону, несущему несколько каудалий; вакуоль сзади;
небольшой перистом без длинных мембран на эквато-
ре; кинеты продольные. Похожую форму рисуют по-
зже (Uronema pluricaudatum Noland, 1937), но и этот
вид не изучен.
ТИП CILIOPHORA. КЛАСС OLIGOHYMENOPHOREA 835
Род Cristigera Roux, 1899
Типовой вид С. pleuronemoides по монотипии;
синонимы, по Аэшт, — Aulax, Aulaxella, Paurotricha;
синонимия последнего рода не очевидна, это лишь
мнение в одной из публикаций; типовые роды Cristige-
ra и Paurotricha резко различаются по всем призна-
кам, имеют разный тип мембранелл. У С. pleuronemoi-
des, по описаниям в старой литературе, имеется про-
дольный вентральный желобок и нет ресничек в
широком кольце медиально вокруг всего тела. Такой
вид переописал Пенард (Penard, 1922) — реснички
имеются в широком апикальном кольце и в узком ко-
льце в нижней трети тела; желобок узкий, расширен у
постерона.
При импрегнации изучен вид С. minor Penard, 1922;
цилиатура равномерная, кинет мало и реснички разре-
жены; спереди реснички сближены в рядах и сами
ряды сближаются, как обычно у гименостомат. Пери-
стом очень крупный, мембраиеллы короткие, не распо-
ложены линейно, скорее диагонально. Желобок дейст-
вительно имеется — зона перистома продолжается в
виде желобка по оси-вента, расширенного сзади. Мем-
брана длинная, достигает вершины зоны мембранелл
(как у плейронематид). С. setosa имеет сходный сома-
тический кинетом и мембрану, но мембраиеллы (Ml и
М2?) слиты в единую полосу.
Примеры видов: С. vestita Kahl, 1928; С. phoenix Pe-
nard, 1922 (= Lembadion duriusculum Perty, 1852?);
C. minuta K., 1928; C. setosa K., 1928; C. fusiformis
Penard, 1922; C. cirrifera K., 1928; C. paucisetosa
(Aulax in Gourret et Roeser, 1888); C. media K., 1928;
C. cirrifera K., 1928; C. constricta Madsen, 1931; C. sul-
cata K., 1933.
Род Cryptochilidium Schouteden,
1906
Типовой вид Cryptochilum cuenoti Florentin,
1898 (в каталоге Аэшт по ошибке — Fiorentini, 1898).
Это паразит в пищеводе морских червей-сипункулид
Phascolosoma vulgare; крупные плоские формы
(130—200 мкм) с немногочисленными биполярными
кинетами, небольшим узким перистомом; при импрег-
нации вид не изучен, топография мембранелл неизве-
стна. По незначительному внешнему сходству к роду
относили также эндобионтов из кишечника морских
ежей — С. echini Maupas, С. minor Yagiu, С. gracile Po-
wers, C. caudatum Poljansky, C. sigmoides Yagiu. Ни
один из этих видов не относится к Cryptochilidium',
часть видов была перенесена в новый сборный род
Biggaria (Kahl, 1933), другими авторами выделены
роды Oreoctoma, Velistoma, Tanystomium. Синоним —
род Symbionecta.
Род Cryptochilum Maupas, 1883
Типовой вид Paramecium griseolum Perty, 1852
по недавнему обозначению (Petz et aL, 1995); вид пере-
описан при импрегнации. Выбор типа неудачный, этот
вид вначале был плохо описан и не числился валид-
ным; название рода всегда ассоциировалось с симби-
онтами морских ежей, и один из таких видов рода (к
примеру С. echini Maupas, 1883) следовало сделать ти-
повым.
Вид С. bermudense Biggar et Wenrich, 1932 сейчас
тип рода Biggaria', С. echinometris В. et W., 1932 — тип
рода Velistoma', С. gracile Powers, 1933 — тип рода Ta-
nystomium', С. sigmoides (Yagiu, 1934 in Cryptochilidi-
um) — тип рода Oreoctoma, Неясно положение видов
С. caudatum (Poljansky, 1951 in Cryptochilidium), C. mi-
nor (Yagiu, 1934 in Cryptochilidium) и C.fukuii (Uyemu-
ra, 1934 in Entorhipidium).
C. echini Maupas, 1883 (Uronema in Cuenot, 1891)
встречается в кишечнике ежей по обе стороны се-
верной Атлантики — в Strongylocentrotus lividus (ныне
Echinus и Paracentrotus), S. echinoides, Sphaerechinus
granularis, Echinometra lucunter, E. vanbrunti, Lytechi-
nus variegatus, Echinus miliaris. Тело листовидное,
плоское, величиной 70—150 мкм, с 32—42 кинетами,
группой каудалий; кинеты идут вдоль вентрального
шва и сходятся к длинной дорсальной бисеканте. Пе-
ристом небольшой, над экватором; УМ удлинена
до начала Ml; Ml — в виде вытянутого треугольника,
М2 — поперечная трапеция, М3 — фрагмент под
ней; линия мембранелл прижата к мембране. Второй
шов — на левой стороне тела снизу. Из свободных ви-
дов хорошо изучен С. reniforme Petz, Song et Wilbert,
1995 из антарктического льда. С. antarcticum Song,
Wilbert et Warren, 1999 из антарктических морских
ежей Heliocidaris и Hemicentrotus позже исключен
из состава рода.
Род Cryptolembus Gunderson, 1985
Типовой вид С. gongi — эндопаразит из ки-
шечника Ascidia ceratodes в Калифорнии. Тело верете-
новидное, заострено к вершине, крупное (82—
133 мкм), с 44 продольными кинетами; небольшой
шов на венте снизу. Перистом узкий и длинный, до
апекса; мембрана короткая, до начала М2; Ml •— в
виде мелкого треугольника, М2 — очень длинный тяж,
М3 — мелкий прямоугольник; мембраиеллы располо-
жены в линию и прижаты к мембране. Скутикус — не-
большая группа кинетосом. Этот род сближается с ро-
дами Anophrys, Paralembus и Magnalembus.
Род Cryptostoma Fedele, 1927
Типовой вид С. caliphyllae из гепатопанкреаса
морских моллюсков Caliphylla mediterranea. Как гомо-
ним название заменено на Cryptostomina Fedele, 1932.
Вид описан без точной схемы кинетома; после перво-
описания не изучался методом импрегнации.
Род Ctedoctema Stokes,
1884
Типовой вид С. acanthocrypta (по Аэшт, прави-
льно С. acanthocryptum). Очень мелкая пресноводная
цилиата с длинными ресничками, имеющими вид ще-
836
ALVEOLATA
тинок; кортекс бугорчатый в местах прикрепления
трихоцист; вакуоль под перистомом. Спереди ацилон,
кинеты биполярные, аргиром с крупными прямоуголь-
никами. Перистом непропорционально велик, занима-
ет весь вент; мембрана почти до вершины перистома,
Ml — в виде длинной дикинеты, М2 и М3 — короткие
поперечные трикинеты. Вид из ФРГ, описанный как
С. acanthocrypta (Wilbert, Buitkamp, 1973), позже был
назван С. wilberti Small et Lynn, 1985, но это ошибка,
название синонимичное. Неизученные сомнительные
виды рода — С. acanthocrypta var. brevivelata Kahl,
1931; C. ovalis Kahl, 1926.
Род Cyclidium Muller, 1773
Типовой вид C. glaucoma по обозначению Ян-
ковского (Jankowski, 1964а). Род предложен до Мюл-
лера {Cyclidium Hill, 1752), но до-Линнеевские назва-
ния не признаются валидными. Синонимы, по
Аэшт, — Acomia, Alyscum, Districha. С. glaucoma —
обычнейшая инфузория в настоях, часто массовая, вы-
носит сапробность, легко инцистируется. Вид изучен
всеми методами импрегнации, начиная с первых работ
Клейна (Klein, 1930). Размеры тела 14—30 мкм; тело
каплевидное, почти не сплющено, с апикальным аци-
лоном; вакуоль терминальная, кортекс с трихоциста-
ми, 10 (редко 11) кинет простой топографии; швов нет,
кинетосомы сгущаются спереди и разрежены ниже,
кроме 2 участков левых кинет. Мембрана до вершины
перистома; Ml—М3 — небольшие, ориентированы
диагонально, нет линейного расположения и вытяги-
вания одной из мембран, как у ряда скутицид. Легко
импрегнируется аргиром — кольцевые аргиронемы и
ряды прямоугольников.
В литературе описано несколько десятков видов
рода, начиная со старинных книг Мюллера и Дюжар-
дена; валидны не более 10 видов; часть видов от-
несена к другим родам, многие остаются неопредели-
мыми. Много путаницы в названиях видов; так, С. cit-
rullus постоянно отмечается в пресных водах, но,
по Фойсснеру (Foisser et al., 1994), это морской вид,
а в пресной воде част С. heptatrichum Schew., 1893.
Хорошо описаны виды С. muscicola, С. citrullus, С. si-
mile, С. varibonneti, С. heptatrichum. У внешне сход-
ных видов оказывается разная перистомальная цилиа-
тура, и постепенно выделяются новые роды цикли-
диид.
В особые роды выделены все виды из морских ежей
{Cyclidium rhabdotectum, С. ozakii, С. stercoris) и абер-
рантные морские виды С. plouneouri, С. bergeri (см.
Echinocyclidium, Paracyclidium, Caspionella). Примеры
видов Cyclidium (независимо от степени изученности):
С. citrullus Cohn, 1865; С. curvatum Mansfeld, 1923;
С. obliquum Kahl, 1926; C. terricola К., 1926; C. helgo-
landicum Mansfeld, 1922; C. litomesum Stokes, 1884;
C. deses Wenzel., 1961; C. muscicola K., 1931; C. vari-
bonneti Song, 2000; C. borrori Small et Lynn, 1985;
C. marinum Borror, 1963; C. sphagnetorum Sramek-Hu-
sek, 1949; C. banned Groliere, 1980; C. plouneouri Dra-
gesco, 1963; C. oligotrichum Kahl, 1928; C.fuscum Kahl,
1931; C. nigricans K., 1928; C. malibuensis Small et
Lynn, 1985 и мн. др.
Род Diplospyla Kellicot, 1885
Типовой вид D. inhaesa. Мелкие цилиатытипа
Lembus co сплошной цилиатурой, длинными каудалия-
ми, крупной мембраной на 2/3 длины тела, обитают в
гиалиновых тонкостенных трубках с узкими округлы-
ми устьями. По всем признакам род и вид идентичны с
Calyptotricha pleuronemoides Phillips, 1882; этот вид
был неизвестен автору рода Diplospyla.
Род Districha Fromentel, 1874
Род предложен для 2 новых видов — D. striata (ти-
пичный Microthorax — М. striatus comb, п.) и D. hirsu-
ta, типовой вид по обозначению Фроментеля (Fromen-
tel, 1874). Как и все виды в этой книге, D. hirsuta очень
примитивно описана и иллюстрирована — по рисунку
это мелкая цилиата типа Uronema с несплющенным те-
лом, апикальным ацилоном, каудалией и терминаль-
ной вакуолью. Перистом мелкий, продольный, субапи-
кальный; от его вершины отходит длинная изогнутая
крючковидная ресничка (это контуры мембраны). По
Фроментелю, новый род отличается от Cyclidium нали-
чием 2 щетинок — у рта и каудальной. Род Districha
невалидный, это синоним рода Uronema, предложен-
ного ранее.
Род Echinocyclidium Jankowski, 1980
Типовой вид Cyclidium stercoris Powers, 1935.
По ошибке название рода приведено в Guide (Small,
Lynn, 1985) как Echinocyclidium Jankowski gen. n. с ука-
занием этого типового вида. Синоним — Abathostoma
Berger, 1994 с тем же типом.
Вид обитает в кишечнике морских ежей Strongylo-
centrotus droebachiensis, S. nudus, S. pulchellus, S. echi-
noides, S. purpuratus, S. franciscanus и Allocentrotus fra-
gilis в северной Атлантике и Пацифике; не найден в бо-
гатой локальной фауне ежей Карибского бассейна.
Вероятный синоним — Uronema socialis Powers, 1933
{= U. powersi Kahl, 1934) {Echinocyclidium socialis
comb, n., E. powersi comb. n.). Обычны в сублитораль-
ных ежах на Мурмане. Мелкие каплевидные цилиаты с
немногочисленными продольными кинетами, субтер-
минальной вакуолью; перистом апикальный, мембра-
на достигает апекса, в нижней части с видоизменен-
ным сегментом; Ml — 2 монокинеты, М2 — вытяну-
тый треугольник, М3 — 2 разрозненные монокинеты.
Мембрана не огибает рот снизу; скутикус — полоска
кинетосом ниже рта; вероятно, нет ацилона, четко вы-
раженного у Cyclidium. Вид пока не изучен методом
Клейна или Шаттона, аргиром не выявлен. Перистом
относительно меньше, чем у циклидиев.
Род Echinomeron Jankowski,
1980
Типовой вид Cryptochilidium polynucleatum
Nie, 1934. Эндопаразит в кишечнике морских ежей Лп-
thocidaris {= Heliocidaris) crassispina (крупные формы
ТИП CILIOPHORA. КЛАСС OLIGOHYMENOPHOREA
837
вида), Diadema setosa (мелкие формы) в Китае, в Echi-
nometra mathaei и Tripneustes gratila на атолле Эневе-
так, в других хозяевах на Гавайях; вид распространен в
Восточной Индо-Пацифике. Родовой признак — боль-
шое число макронуклеусов, уникальный случай у эхи-
нофильных гименостомат. Расы (ксенодемы) из раз-
ных хозяев различаются по размерам (53—81 и
59—92 мкм); тело плоское, с несколькими ядрами (по
разным авторам до 8 или до 13); 35—43 кинеты рас-
пределены неравномерно, их наполовину больше на
правой стороне; перистом субмедиальный, в перисто-
ме 2 длинных ряда ресничек шириной 2—3 кинетосо-
мы, прижатые к правому краю неглубокой полости;
дифференцированы участки сомакинет, прилегающие
к перистому слева.
В каталоге Аэшт род Echinomeron числится нева-
лидным, с указанием «Синонимия с Metaxystomium и
описание типового вида: Berger, 1994, Р. 169». Но ти-
повой вид рода Metaxystomium Berger, 1994 — Cryptoc-
hilum echinometris Biggar et Wenrich, 1932; поэтому
Аэшт считает род Metaxystomium невалидным как си-
ноним рода Velistoma Jank., 1980 с типовым видом
С. echinometris. Род Echinomeron включает только вид
с ббльшим числом ядер и по этому признаку не может
быть синонимом других родов, имеющих одно стан-
дартное ядро. В состав рода переносится также вид
Cryptochilidium ozakii Yagiu, 1935 (Echinomeron ozakii
comb, n.), поскольку эти виды считаются идентичны-
ми, вид переносится в состав рода Echinomeron и уже
внутри рода объявляется синонимом типового вида
Е. polynucleatum.
Род Entodiscoides Song, Warren
et Wilbert, 1996
Типовой вид E. echini из кишечника морских
ежей Антарктики.
Род Entodiscus' Madsen,
1931
Типовой вид Cryptochilum boreale Hentschel,
1924 (Е. borealis) — паразит кишечника морских ежей;
в Европе очень обычен в Strongylocentrotus droebachi-
ensis, Psammechinus miliaris, Echinus acutus, E. esculen-
tus; в США и Канаде в S. droebachiensis, S. echinoides,
S. franciscanus, S. purpuratus, Lytechinus anamesus, Al-
locentrotus fragilis; в Карибском бассейне в Diadema
mexicanum, Echinometra vanbrunti; в Японском море в
S. nudus, S. pulchellus. Тело крупное (110—140 мкм),
незначительно сплющено, вакуоль субтерминальная,
кинеты многочисленные; апикальный шов на дорсуме;
перистом небольшой, неглубокий, субапикальный. У
Е. echini (Russo, 1914 in Colpidium) Foissner, 1985 мем-
брана с извитым основанием, короткая; Ml — корот-
кая продольная монокинета, М2 — небольшой прямо-
угольник, М3 — мелкий рудимент. По Бергеру (Berger,
1994), М3 у Е. borealis длиннее всех, но вероятно за
основание мембраны приняты аргентофильные ребра
дна перистома. Третий вид — Е. sabulonis Powers, 1935
из Diadema mexicanum и Clypeaster rosaceus. При имп-
регнации изучен вид Е. pseudoechini Song, Wilbert et
Warren, 1999 из неопределенных до вида ежей Helioci-
daris sp. и Hemicentrotus sp. из Антарктики.
Род Entorhipidium Lynch, 1929
Типовой вид Е. echini. Паразиты кишечника
Strongylocentrotus и других ежей Северной Пацифики,
нет видов в Атлантике; очень обычны в наших дальне-
восточных ежах от Посьета до Командор. Е. echini —
крупный вид с листовидным телом, расширенным у
вершины и резко суженным сзади; кинеты полимери-
зованы, сложной топографии, с длинным бисекантным
швом слева. Перистом мелкий, субапикальный, с
длинной мембраной; Ml — линия кинетосом, М2 —
вытянутый прямоугольник, М3 — короткий фрагмент.
Кортекс с трихоцистами. Мелкий узкий боковой пери-
стом резко контрастирует с массивным телом и густой
соматической цилиатурой. Род включает виды с узким
вытянутым телом с правильным расположением про-
дольных кинет, переходные формы (Е. echini) и виды с
массивным телом, с крайней полимеризацией и дезор-
ганизацией кинет (Е. multimicronucleatum); перистом
остается очень мелким. Ниже дан список хозяев изве-
стных видов рода, кроме E.fukuii Uyemura, 1935 (сей-
час в составе рода Cryptochilum).
Е. echini Lynch, 1929 — Strongylocentrotus purpura-
tus, S. nudus, S. pulchellus, S. intermedius, S. droebachi-
ensis (в этом хозяине только на западе США), Allocent-
rotus fragilis.
Е. pilatum Lynch, 1929 — S, purpuratus, S. echinoi-
des, S. franciscanus, S. droebachiensis, A. fragilis.
E. tenue Lynch, 1929 — S. purpuratus, S. nudus,
S. pulchellus, S. intermedius, S. echinoides, S. francisca-
nus, S. droebachiensis, A. fragilis, Echinometra vanbrunti.
E. triangularis Poljansky, 1951 — S. nudus, S. pulc-
hellus, S. intermedius — Японское море; S. droebachien-
sis, S. echinoides, S. franciscanus — США; Hemicentrots
pulcherrimus — Китай.
Род Epimecophrya Kahl, 1933
Типовой вид E. cylindrica — одна из загадок
старой литературы, цилиндрические формы величиной
70—100 мкм из морского песка; кинеты биполярные,
подходят к апикально-вентральному шву, вакуоль суб-
терминальная, ядро округлое; перистом очень мелкий,
в передней четверти тела, с мембранами по обеим сто-
ронам. Можно предположить, что это скутикоцилиаты
типа Cardiostomatella (Loxocephalidae): в составе рода
описывались не только червеобразные формы с фраг-
ментацией ядра, но и подобный вид (С. mononucleata
Dragesco), который можно выделить вместе с Е. cylind-
rica в подрод Epimecophrya по типу ядер.
Род Eurychilum Andre, 1910
Типовой вид Е. actiniae; очень плохо описан-
ный вид, но по некоторым признакам можно догадать-
ся, что это Porpostoma. Тело очень крупное (155 мкм),
838
ALVEOLATA
цилиндрическое, с тупыми закругленными концами и
множеством тесно Сближенных ресничек, вероятно с
большим числом кинет; крупная вакуоль над постеро-
ном; очень мелкий перистом выше экватора, с мелкой
мембраной справа; ядро длинное, извитое, вытянуто
на всю длину тела. Вид найден в гастроваскулярной
полости актиний Sagartia parasitica — симбионта ра-
ков-отшельников. По Калю (Kahl, 1931), это род сем.
Frontoniidae, но если сравнить рисунок Е. actiniae и Po-
rpostoma notatum Mobius, 1888, несомненна их полная
идентичность. Не была замечена узкая полоса ресни-
чек в перистоме от рта до антерона; это сапрофаг и гис-
тиотроф, тело заполнено вакуолями и липидными сфе-
рами, прижизненно узкой полоски ресничек можно не
заметить. В каталоге Аэшт Eurychilum — валидный
род без синонимов, но, по моему мнению, этот род не-
валиден как синоним Porpostoma.
Род Glauconema Thompson,
1966
Типовой вид G. trihymene. Мелкие (30—
40 мкм) овальные цилиаты из морского бентоса, с не-
большим числом разрозненных кинет (до 20) простой
топографии, без швов; вакуоль терминальная; пери-
стом относительно крупный, субапикальный, с корот-
кой мембраной; М3 — в виде мелкого фрагмента над
ртом; выше — массивное поле кинетосом (пенику-
люс), вероятно продукт слияния Ml + М2, между ними
едва намечена перемычка. У G. pacificum Small et
Lynn, 1985 крупная Ml отделена от более мелкой М2,
М3 представлена полоской кинетосом. Как и у уронем,
имеется ацилон спереди и каудалия.
Род Helicostoma Cohn,
1866
Типовой вид Н. oblongum из аквариума с мор-
ской водой; тело крупное (100—150, иногда до
240 мкм), цилиндрическое, с густой цилиатурой и
сближением ресничек в рядах, крупная вакуоль сзади,
перистом в виде узкого желобка почти от апекса до эк-
ватора, где закручен у рта; ядро округлое. Род отнесен
к Spirotricha. У Каля (Kahl, 1931) валидный род Heli-
costoma включает 3 вида — Н. oblongum Cohn, 1866;
Н. buddenbrockiKaM, 1931 и Н. notatum (Mobius, 1888
in Porpostoma}. Каль различает виды только по нали-
чию или отсутствию пигментного пятна. Мюгард (Mu-
gard, 1948) в ревизии гистиотрофных цилиат считает
Helicostoma валидным родом, а типовой вид идентич-
ным не с Porpostoma, а с Philaster digitiformis Fab-
re-Domergue, 1885; H. buddenbrocki — это синоним
вида Porpostoma notatum Mobius, 1888. У Дражеско
(Dragesco, Dragesco-Kemeis, 1986) — валидный род
Helicostoma с видом Н. (Porpostoma) notatum (Mobius).
Хотя все первоописания плохие, можно различить
виды и роды по типу ядра — округлое (Helicostoma)
или змеевидное (Eurychilum, Porpostoma). По Аэшт,
Helicostoma — валидный род, a Porpostoma — сино-
ним, но по типу ядра это невозможно. Хада (Hada,
1970) упоминает сем. Helicostomidae с видом Н. notata.
В Traite Helicostoma oblongum Cohn, 1866 — валидный
род и вид, приведен после диагноза Porpostoma. Веро-
ятно, прав Каль — типовой вид Helicostoma идентичен
с Philaster digitiformis сходных размеров. Сейчас вто-
рое название всеми принято, поэтому Helicostoma bud-
denbrocki должна быть объявлена неопределимой или
nomen oblitum.
Род Homalogastra Kahl,
1926
Типовой вид Н. setosa. Мелкие веретеновид-
ные формы (25—30 мкм) с апикальным ацилоном, не-
большим числом кинет с редкими ресничками, субтер-
минальной вакуолью; перистом растянут по вентраль-
ной стороне, рот ниже экватора; мембрана короткая,
извитая, не огибает рот снизу; Ml — мелкий фрагмент
у апекса, М2 — короткая продольная дикинета, М3 —
поперечный ряд над ртом. Все 3 мембранеллы —
очень короткие дикинеты. Вид встречается в пробах
мха и почвы.
Род Isocyclidium Esteban, Finlay
et Embley, 1993
Типовой вид I. globosum. Через год предложен
вновь без фамилии Эмблея — Isocyclidium Esteban et
Finlay, 1994, это название приведено в Traite (Puytorac,
1994). Это вид с крайней редукцией соматической ци-
лиатуры из пресноводного бентоса. Тело почти сфери-
ческое, не сплющено, в передней трети кольцо из верх-
них сегментов нескольких сохранившихся кинет, на
постероне дисома каудальной реснички в окружении
кольца из мелких фрагментов 7 сомакинет; под ртом
дисома (скутикус). Перистом от апекса до экватора, с 3
небольшими группами кинетосом в линейном ряду
(Ml—М3); между Ml и М2 ряд кинетосом.
Род Kahlilembus Groliere et Couteaux,
1984
Типовой вид Cohnilembus fusiformis Kahl, 1926.
Каль описал новые виды Lembus fusiformis К. 1926 и
L. vexillarius К. 1926; морфологию первого вида изу-
чил Фойсснер (Foissner et al., 1994) при импрегнации
протарголом, позже вид был повторно изучен во Фран-
ции и выделен в новый род Kahlilembus. Фойсснер свел
тип рода и L. vexillarius в синонимы валидного вида
Lembus attenuata Smith, 1897; поэтому название типо-
вого вида сейчас — Kahlilembus attenuatus (Smith,
1897) Foissner et al., 1994.
C. fusiformis имеет вид узкой змейки, слегка расши-
рен по экватору, концы тела оттянуты и заострены;
имеется 8—10 продольных кинет простой топографии,
вакуоль ниже экватора; перистом узкий, в верхней тре-
ти тела. УМ — короткая, Ml — треугольная, М2 — ко-
роче, М3 — в виде 1—2 фрагментов; положение мемб-
ранелл линейное. Вероятно, все указания вида Cohni-
lembus verminus jwtsi пресных вод относятся к этому
виду.
ТИП CILIOPHORA. КЛАСС OLIGOHYMENOPHOREA
839
Род Lembadionella Kahl, 1933
Типовой вид L. pusilia — очень мелкий мор-
ской вид (25 мкм); тело каплевидное, кинет немного,
сзади каудалия и субтерминальная вакуоль; перистом
непропорционально крупный, от постерона до апекса,
реснички по всему правому краю перистома. Послеро-
товых кинет нет, поэтому это явно филастерида.
Род Lemboides Kahl, 1931
Тип рода Калем не указан, поэтому Аэшт считает
род невалидным; кроме того, это гомоним. Название
Paralembus Kahl, 1933, предложенное для замены, по
Аэшт, тоже невалидно. Род Lemboides предложен для
2 новых морских видов — L. digitiformis и L. rostrata,
оба вида найдены в слизи актиний, питаются бактерия-
ми и жировыми капельками (см. Paralembus).
Род Lembus Cohn, 1866
Типовой вид L. velifer Cohn, 1866; гомоним
(см. Cohnilembus). Синоним, доступный для заме-
ны, — Proboscella — не был использован, и сейчас, во-
преки правилу приоритета, общепринято указанное
название Каля (Cohnilembus Kahl, 1933).
Род Lochus Delphy, 1938
Типовой вид L. mucicola. Как гомоним назва-
ние рода было заменено на Dellochus Corliss, 1960. Как
и все виды и роды этого автора, L. mucicola очень пло-
хо изучен, род в современной литературе не принят. В
слизи актиний у берегов Франции Дельфи (Delphy,
1938) нашел крупных (80—90 мкм) цилиат с узким вы-
тянутым телом, центральным ядром, большим числом
кинет; вакуоль над постероном; перистом — узкая по-
лоса ресничек от апекса до экватора. Судя по форме
ядра, это не Porpostoma, a Helicostoma = Philaster. Род
Lochus невалидный.
Род Madsenia Kahl, 1934
Типовой вид EntodiscusindomitusMadsen, 1931
из кишечника морских ежей. Описанный позже вид
М. hydractiniae Uyemura, 1940 с колониальных гидро-
идов Hydractinia echinata в Японии не относится к это-
му роду; третий вид М. cyclina Uyemura, 1938 из ман-
тийной полости морской двустворчатой Cyclina sinen-
sis относится к роду Pseudocyclidium.
Е. indomitus — обычный вид в наших северных
ежах Strongylocentrotus droebachiensis', встречается
также в дальневосточных ежах и по обоим берегам
США в S. nudus, S. pulchellus, S. intermedius, S. purpu-
ratus, S. franciscanus, Allocentrotus fragilis. Род не был
принят многими авторами, изучавшими цилиат из
ежей, но после изучения на импрегнированных препа-
ратах валидность рода Madsenia очевидна. Тело узкое,
вытянутое, веретеновидное, сплющено латерально;
кинет немного, предротовой шов небольшой, послеро-
тового шва нет; кинетосомы у постерона разрежены.
Перистом — узкая щель от апекса в верхней трети
тела; УМ — короткая, Ml и М2 — разной формы, рас-
положены в линию, М3 — мелкий фрагмент над ртом.
Вакуоль удалена от постерона; кинет около 15; ядро
медиальное.
Род Magnalembus Small et Lynn, 1985
Типовой вид М. oceanicus — узкие вытянутые
цилиндрические формы с удлиненным ядром; вакуоль
над постероном справа; перистом растянут на всю дли-
ну тела от апикального ацилона. Мембрана состоит из
3 сегментов разного строения (длинный ряд разроз-
ненных дисом, дикинета обычного типа и монокинета
левее рта); Ml — 2 мелких ряда кинетосом у апекса,
М2 — массивная широкая поликинета на 2/3 длины
тела; М3 — пеперечный ряд йад ртом.
Род Mesanophrys Small et Lynn in Aescht,
2001
Типовой вид Paranophrys carcini Groliere et
Leglise, 1977. В первом издании Guide (Small, Lynn,
1985) авторы установили новый род для Р. carcini и
Anophrys maggii Cattaneo, 1888 без указания типового
вида, хотя эти виды имеют перистом разного типа.
М. carcini — мелкие каплевидные цилиаты с несколь-
кими биполярными рядами ресничек, терминальной
вакуолью, крупным перистомом; мембрана короткая,
мембранеллы линейные, Ml — вытянутая полоса до
апекса, М2 — трапециевидное поле кинетосом, М3 —
поперечный фрагмент над ртом; мембрана не извитая,
достигает только этого фрагмента. У М. maggii пери-
стом относительно меньше, М2 неширокая, короче
Ml.
Новый вид М. pugettensis Morado et Small, 1994 —
паразит крабов Cancer magister, отличается деталями
ротовой цилиатуры. Паразиты крабов известны боль-
ше века, их описали в Италии как Anophrys maggii Cat-
taneo, 1888, но высказывалось мнение о том, что это
факультативные паразиты вида A. sarcophaga Cohn,
1866 (тип рода Anophrys). Позже они получили новое
название Paranophrys carcini, но вскоре от вида отказа-
лись и свели его в синонимы (Paranophrys maggii). Вид
Р. pugettensis считается факультативным паразитом
крабов, заражающим на северо-западе США Cancer
magister, С. productus и водорослевого краба Pugettia
producta. Можно заметить, что Линн и Смолл (Lynn,
Small, 2002) не считают М. carcini и М. maggii синони-
мами в отличие от других авторов. Инфекции цилиат в
крабах хорошо изучены патологами, без описания и
определения паразитов.
Род Mesogymnus Berger, 1964
Типовой вид М. interruptus. Паразит морских
ежей сем. Cyclidiidae; диагноз и рисунки в недоступ-
ной диссертации Бергера. Судя по названию вида и
840
ALVEOLATA
рода, это Paracyclidium типа Cyclidium rhabdotectum,
имеющий безресничное кольцо (ацилон) в середине
тела.
Род Mesolembus Small et Lynn, 1985
Типовой вид М.fecalis; подробного описания
нет, дан мелкий рисунок вида и краткая аннотация,
биотоп неизвестен (вероятно, в море). Очень мелкие
каплевидные формы с несколькими биполярными ки-
нетами, без ацилона спереди; перистом растянут на 2/3
длины вента, мембрана — лишь прямой ряд справа, не
огибает рот; Ml — мелкий безресничный фрагмент у
апекса, М2 — длинная дикинета, прижатая к основа-
нию мембраны; М3 — поперечная монокинета; сзади
каудальная ресничка. Сходство с перистомом Pseudo-
cohnilembus конвергентное.
Род Metanophrys Puytorac, Groliere,
Roque et Detcheva, 1974
Типовой вид M. durchoni. Эндопаразит в цело-
мической полости крупных полихет Nereis diversicolor
из морского песка. Тело очень тонкое, вытянутое, за-
остренное к апексу, с 11 биполярными кинетами, без
секантных швов, с терминальной вакуолью. Пери-
стом — узкая щель в передней четверти тела; мембра-
на короткая, извитая; Ml — длинная, нитевидная;
М2 — короче и шире; М3 — мелкий рудимент у рта.
Скутикус — линия кинетосом. Подробно изучен сто-
матогенез. Пока неясно, является ли вид случайным
или облигатным паразитом нереид; на Мурмане при
вскрытии около 70 нереисов цилиаты не найдены, как
и в сипункулидах, в целоме которых прежние авторы
тоже находили цилиат.
М. elongata (Biggar et Wenrich, 1932 in Anophrys) —
паразит морских ежей Strongylocentrotus echinoides в
США; в бассейне Карибского моря также в видах Echi-
nometra, Diadema, Echinothrix, Echinostrephus, Tripne-
ustes. М2 — вытянутая, утолщена, в остальном как ти-
повой вид. М. echini Small et Lynn, 1985 — вид с широ-
ким цилиндрическим телом и короткой М2, паразит
Strongylocentrotus purpuratus. М. diminuta Gomez-Sala-
din et Schaffer, 1994 — свободноживущий морской
вид; кинетом плохо описан, вид пока условно включен
в данный род. Другие виды — Metanophrys antarctica
Song et Wilbert, 2002; M. sinensis Song, Wilbert, 2000;
M. similis Song, Shang, Chen et Ma, 2002.
Род Metaxystomium Berger, 1994
Типовой вид Cryptochilum echinometris Biggar
et Wenrich, 1932. По Аэшт, род невалидный как сино-
ним рода Velistoma Jank., 1980, предложенного ранее
для того же вида. Название Metaxystomium Berger
впервые опубликовано в книге Корлисса (Corliss,
1979) как nomen nudum. Род установлен в диссертации
Бергера (1964), в основном оставшейся неопублико-
ванной. Левайн (Levine, 1972), по диссертации Берге-
ра, привел в главе о паразитических простейших род
Metaxystomium с видами М. echinometricum, М. ozakii,
М. polynucleatunr, диагноза нет, типовой вид не указан,
поэтому нельзя обозначить род как валидный. Сейчас
первый вид — тип рода Velistoma, второй также (как
синоним первого), третий — тип рода Echinomeron.
Род Miamiensis Thompson et Moewus,
1964
Типовой вид М. avidus — факультативный эк-
топаразит на коже морских коньков (рыбы сем. Syng-
nathidae) во Флориде, гистиофаги в наружных язвах
хозяев; легко культивируются в лаборатории на обыч-
ных средах, сохраняя способность к реинвазии хозяев
и специфичность только к этому виду рыб. В первых
публикациях вид обозначен как «морской вид рода
Tetrahymena». Мелкие формы (30—40 мкм) с острым
апексом, 10—13 биполярными кинетами простой то-
пографии; вакуоль терминальная. Перистом обшир-
ный, поверхностный (без полости), рот над экватором.
Мембрана только справа; левее 3 небольшие мембра-
неллы с линейным расположением — апикальная Ml,
широкая короткая М2 и стандартный для филастерид
рудимент М3.
Детально описанный вид Philasterides dicentrarchi,
тканевой паразит морских рыб, может быть синони-
мом М. avidus, но в таком случае нельзя говорить о
специфичности М. avidus только к сингнатидам.
М. blitzae Small et Lynn, 1985 похож на М. avidus,
но имеет больше кинет, дисомы которых расположены
в правильных кольцевых рядах (паратены). У обоих ви-
дов мембрана делится на 2 сегмента разного строения.
Род Mugardia Small et Lynn, 1985
Типовой вид Anophrys salmacida Mugard, 1949;
название рода приведено в книге Корлисса (Corliss,
1979) без указания типа и без диагноза как nomen nu-
dum. Одновременно опубликовано название Anophryo-
ides Puytorac et Groliere, 1979 с тем же типом, поэтому
не следовало использовать название Mugardia', Смолл
и Линн (Small, Lynn, 1985) обозначают вид, изученный
Пюйтораком, как Anophryoides puytoraci, а для «насто-
ящей» Anophrys salmacida сохраняют род Mugardia.
Это вытянутые формы, тело сужается к апексу, все ки-
неты биполярные, ниже рта длинный ряд кинетосом
(скутикус). Мембрана удлинена, но не достигает апек-
са; рот у экватора; треугольная Ml > прямоугольной
М2 > рудимента М3. У Anophryoidespuytoraci мембра-
ны выше, удалены от рта. У A. soldoi Small et Lynn,
1985 М2 сильно вытянутая, линия мембранелл распо-
ложена вплотную ко рту.
Род Orchitophrya Сёрёбе, 1907
Типовой вид О. stellarum. Специфический па-
разит в гонадах морских звезд (Asteroidea). Сепед и
другие авторы принимали эти формы за астомат, пита-
ющихся осмотически, выделив сем. Orchitophryidae в
отряде астомат, и лишь в недавнее время при импрег-
ТИП CILIOPHORA. КЛАСС OLIGOHYMENOPHOREA
841
нации выяснилось, что это обычная филастерида. Хо-
зяева — Asterias rubens (Франция)ъЛ. vulgaris (севе-
ро-восток Канады), A.forbesi (Нью-Йорк), Leptasterias
spp. (западный берег США) и др.; в западной Канаде
также в Pisaster ochraceus'. это не значит, что паразит
всюду один — О. stellarum. Подробно изучены инва-
зии в интродуцированном виде A. rubens, в А. атигеп-
sis из Японии и Кореи и в других хозяевах, показано
несходство видов, определяемых пока под одним на-
званием. Интерес к виду в Австралии объясняется про-
веркой возможности использования орхитофрий
для борьбы с разрушителем кораллов — «терновым
венцом» Acanthasterplanci. Паразиты чаще встречают-
ся в гонадах самцов хозяев, паразитизм уникального
типа — спермофагия.
Тело вытянутое, сужается к вершине, с мелким
апикальным ацилоном, около 20 кинет идут продоль-
но, без швов; сзади каудальная ресничка; перистом от-
носительно небольшой, в передней четверти тела.
Мембрана справа, не огибает рот снизу, достигает вер-
шины М2; Ml — у апекса, тонкая, М2 — шире и коро-
че, М3 — рудиментарная. Группа кинетосом (скути-
кус) лежит у нижнего конца мембраны.
Род Oreoctoma Jankowski,
1980
Типовой вид Cryptochilidium sigmoides Yagiu,
1934; по Аэшт, это синоним рода Cryptochilum (ссылка
на мнение Бергера). После статьи Бергера (Berger,
1994) как типовой вид рода Cryptochilum был обозна-
чен свободноживущий Paramecium griseolum Perty,
1852, резко отличающийся по форме тела и строению
от паразитов морских ежей. В свою очередь С. sigmoi-
des резко отличается от С. echini по описанию Фойс-
снера (Foissner, 1985). Родовое название Oreoctoma —
это опечатка, в рукописи было Oreostoma («ухоро-
тая»), но через 25 лет исправить написание нельзя. По
Аэшт, типовой вид — Cryptochilum sigmoides Yagiu,
1934, но в состав этого рода вид перенес Бергер.
С. sigmoides — узкие вытянутые формы; тело сужа-
ется к постерону, кинет немного, вакуоль ниже эквато-
ра, перистом апикальный, шва нет (у С. echini Maupas
рот экваториальный, с длинным предротовым швом).
Мембрана извитая, короткая; Ml удалена к апексу, ру-
диментарная, М2 крупнее, М3 особо велика, вытяну-
тая, что редко у филастерид (у С. echini — Ml > М2 >
> М3, мембрана М3 — рудиментарная). Как видно, к
одному роду Cryptochilum ранее приписывали виды
различного плана строения. Типовой вид первоначаль-
но описан в Японии из кишечника Anthocidaris crassis-
pina, затем отмечен в Китае (в Hemicentrotus pulcherri-
mus), в Калифорнии (в Allocentotus fragilis), на севе-
ро-западе США (в Strongylocenrotus droebachiensis,
S. purpuratus, S. echinoides, S. franciscanus).
Род Ovo/embus Small et Lynn, 1985
Типовой вид О. caronr, тело каплевидное, рас-
ширено сзади, кинеты биполярные, вакуоль под эква-
тором; перистом с относительно глубокой полостью,
занимает 2/3 длины вента; мембрана погружена, оги-
бает рот сзади, не удлинена справа; Ml — тонкая ли-
ния кинетосом, М2 — обширное поле кинетосом,
поликинета от рта до апекса; М3 — рудиментарная. По
авторам, реснички на левом краю «ротовой поликине-
тиды 2» действуют как мембрана (неясно, что имеется
в виду — край поликинеты или левый ресничный ряд
соматической цилиатуры).
Род Paracryptochilidium Song, Wilbert
et Hill, 1994
Типовой вид P. antarcticum из морских ежей
Paracentrotus sp. моря Уэдделла в Антарктике. Пока
доступна предпубликация, где род и вид обозначе-
ны «in press», а не как gen. et sp. п., хотя статья вышла
в научном журнале, содержит иллюстрации и под-
робное описание вида на китайском языке. Это мас-
сивные плоские цилиаты с овальным телом, расши-
ренным сзади, с большим числом кинет, причудливо
разветвленным ядром; кинеты сходятся к длинно-
му антеро-латеральному шву, у постерона поло-
жение кинет беспорядочное. Перистом виден с ле-
вой стороны тела — неширокая зона медиально сужа-
ющаяся к апексу. Ml — длинный ряд дисом вдоль
шва; М2 — более короткая полоса кинет шириной
в 3 кинетосомы (трикинета); М3 — рудимент. Мемб-
рана достигает вершины М2. Число кинет, как и
у крупных видов Entorhipidium, вероятно, максималь-
ное для филастерид. Возможно, есть не только внеш-
нее сходство, но и родство с аберрантным Schizoca-
гуит из ежей Северной Атлантики, который пока не
находил места в системе (см. выше также род Crypto-
chilum).
Род Paractedoctoma Small et Lynn,
1985
Типовой вид Р. minuta. Смолл и Линн (Small,
Lynn, 1985) неправильно приводили названия рода
Ctedoctema (как Ctedoctoma) и семейства (Ctedoctoma-
tidae) и поэтому свой новый род назвали Paractedocto-
ma — только так по всему тексту, в подписи к рисунку
и в индексе. Во втором издании Guide название дано
только как Paractedoctema, фактически это nomen cor-
rigendum. Удивительно, что в каталоге Аэшт ошибка
авторов не была отмечена и как валидные приводятся
2 рода — этот и следующий. В Traite (Puytorac, 1994)
еще до коррекции Смоллом и Линном род приведен
только как Paractedoctema.
Типовой вид — очень мелкая каплевидная ци-
лиата с 2 ядрами, терминальной вакуолью, неболь-
шим числом кинет с четкими кольцевыми паратенами;
перистом крупный, от постерона до апекса, справа
мембрана, вероятно с нижним сегментом другого стро-
ения; Ml — резко удлинена и смещена влево от мемб-
раны, М2 — короткая, диагональная, М3 — стандарт-
ный рудимент; все ряды — дикинеты. В отличие
от многих родов УМ удлинена почти до вершины тела.
Реснички длинные, щетинковидные; сзади длинная ка-
удалия.
842
ALVEOLATA
Род Paractedoctema Song et Wilbert, 2000
Типовой вид P. acruosa по монотипии. При
изучении цилиат из антарктических льдов (Song, Wil-
bert, 2000а) описан новый вид нового рода в сем. Cycli-
diidae, близкий к Ctedoctema по описанию Вильберта и
Бюйткампа (Wilbert, Buitkamp, 1973). В тексте ни сло-
вом не обсуждается проблема предыдущего названия,
в 1994 г. исправленного в Traite на Paractedoctema, но
без указания nom. сот, принятого в таких случях. Вто-
рично оно было исправлено в 2000 г., тоже без пот.
сот Можно ли считать эти 2 замены валидными? Яв-
ляется ли род Сонга и Вильберта гомонимом? Лучший
выход — считать первый вариант Paractedoctema и
род из Антарктики Paractedoctema двумя валидными
названиями и не исправлять ошибку в первом на-
звании.
Типовой вид — мелкие цилиаты (50—70 мкм) с ве-
ретеновидным телом; антерон заострен, постерон су-
жен; вакуоль и длинная ресничка сзади, апекс без рес-
ничек. 14—18 кинет биполярные, кинетосомы не раз-
режены, швов нет. Перистом вытянут по оси,
расположение мембранелл нетипичное — все 3 осно-
вания сдвинуты высоко вверх, к краю извитой право-
сторонней мембраны; Ml > М3 > М2. Скутикус — ко-
роткий ряд кинетосом; аргиром, как у Cyclidium.
Род Paracyclidium Groliere, Puytorac
et Grain, 1980
Типовой вид Cyclidium rhabdotectum Powers,
1935. В Guide-1 (Small, Lynn, 1985) род приводится как
Paracyclidium rhabdotectum n. gen. (стр. 423), хотя
текст и рисунки даны из статьи Грольера (Groliere et
al., 1980b). В морских ежах обитает несколько видов,
ранее относимых к Cyclidium (С. amoyensis Nie, 1934;
С. ozakii Yagiu, 1933; С. rhabdotectum Powers, 1935;
C. stercoris Powers, 1935), и у одного из них на рисун-
ках нет ресничек в кольцевой полосе по экватору. Все
виды покрыты эпибактериями, разными у каждой ци-
лиаты.
Типовой вид изучен при импрегнации (Groliere et
al., 1980b); внешний облик, как у Cyclidium, тело кап-
левидное, сзади каудальная ресничка, спереди очень
мелкий ацилон; размеры особей 20—25 мкм; все 9 ки-
нет прерваны ниже экватора, с широким кольцевым
ацилоном, от каждого ряда сохранен длинный верхний
сегмент и вдвое более короткий нижний. Мембрана
справа, не огибает рот полукольцом, достигает апекса;
рот у экватора; скутикус из нескольких кинетосом. От
мембранелл остались лишь 3 мелкие разрозненные мо-
нокинеты — в сущности 3 фрагмента. Вид обитает в
Echinometra lucunter, Diadema antillarum, Tripneustes
ventricosus и Clypeaster rosaceus в основном в Кариб-
ском бассейне.
Род Paralembus Kahl, 1933
Замещающее название для гомонима Lemboides
Kahl, 1931; по Аэшт, оба названия невалидны, по-
скольку в обоих случаях не был указан типовой вид.
Каль (Kahl, 1935) позже еще раз указал Paralembus
nom. п. Это создает сложную ситуацию, посколь-
ку виды Paralembus постоянно описываются в ли-
тературе. В состав рода Lemboides Каль включает 2 но-
вых вида — L. digitiformis и L. rostrata-, второй (L. rost-
rata) обозначается здесь как типовой (Paralembus
digitiformis comb, n., P. rostratus comb. n.). Оба вида
найдены на покровах актиний, как полифаги в слое
мукуса.
Размеры Р. digitiformis — 25—45 мкм, тело вытя-
нутое, на обоих концах тела ацилон, кинеты биполяр-
ные, с тесно сближенными дисомами. Перистом об-
ширный, мембранеллы сдвинуты вплотную к относи-
тельно длинной УМ; Ml — короткая, треугольная, у
апекса; М2 — в виде массивной длинной поликинеты,
на ее левом краю обособлены 2 продольные группы
кинетосом; М3 — рудиментарная. Скутикус — беспо-
рядочное поле кинетосом.
Второй вид Р. digitiformis (Kahl, 1931) comb. п. счи-
тается патогенным для рыб, в культурах молоди пал-
туса Paralichthys olivaceus в Китае отмечено массо-
вое развитие цилиат в наружных язвах, приводящее
к гибели рыб. Свободноживущий вид — Р. asturianus
(Femandez-Galiano et Castro de Zaldumbide, 1986)
comb. n.
Род Paranophrys Thompson et Berger,
1965
Типовой вид P. marina. По Аэшт, родовые си-
нонимы—Anophrys partim и Anophryoides. Паразиты в
тканях морских колониальных гидроидов на севе-
ро-западе США. Тело каплевидное, около 10 кинет би-
полярные, перистом длинный и узкий, рот над эквато-
ром; мембрана только справа, не огибает рот снизу, до-
стигает М2; Ml в виде длинной узкой полосы, М2 —
короче и шире, М3 — стандартный рудимент. Вакуоль
над постероном.
К этому роду приписан ряд пресноводных и мор-
ских видов: Р. magna Boror, 1972 (вероятно, не отно-
сится к Paranophrys)', Р. elongata Borror, 1972 (возмож-
ный синоним вида Anophrys salmacida)-, Р. carnivora
Czapik et Wilbert, 1986; P. thompsoni Didier et Wilbert,
1976 (в кладках икры хирономид); P. marina Thompson
et Berger, 1965; P. carcini Groliere et Leglise, 1977
(cm. Mesanophrys)', P. maggii (Cattaneo, 1888) (cm. Me-
sanophrys) и др.
Род Paraphilaster Groliere, Puytorac
et Grain, 1980
Типовой вид P. echini из кишечника морских
ежей Карибского бассейна Lytechinus variegatus и То-
xopneustes esculentus. Размеры тела 90—120 мкм, все
кинеты (32—34) биполярные, резко удлинен скутикус,
имеющий вид послеродовой кинеты. Перистом у апек-
са, длиной до трети тела; мембрана короткая, до вер-
шины М2; Ml и М2 превращены в гигантские поля ки-
нетосом, треугольные и ниже трапециевидные; М3 —
рудимент. Новый род сближен с Philaster и Philasteri-
des и отнесен к сем. Philasteridae.
ТИП CILIOPHORA. КЛАСС OLIGOHYMENOPHOREA
843
Род Parauronema Thompson, 1967
Типовой вид Р. virginianum. Мелкие морские
цилиаты (28—32 мкм) с тонким телом, 12—13 бипо-
лярными кинетами; перистом до 2/5 длины тела, суба-
пикальный; мембрана до середины М2, не огибает рот
снизу; М1 — вытянутый треугольник, М2 — широкая
полоса сходной длины, М3 — небольшое поле кинето-
сом. Фойсснер (Foissner et al., 1994) сомневается в ва-
лидности рода, очень близкого к Uronema', но у Urone-
ma Ml смещена далеко вверх от М2, оставшейся в ти-
пичном положении, и это может ограничить оба рода.
Примеры видов — Р. antarcticum Thompson, 1972;
Р. longum Song, 1995; Р. acutum (Buddenbrock, 1920 in
Uronema), последний вид сейчас вновь возвращен в со-
став Uronema.
Род Parauronemoides Song,
Wilbert et Hill, 1994
Типовой вид P. echini из морских ежей Рага-
centrotus sp. Антарктики. Как и род Paracryptochilidi-
ит (см. выше), подробно описан с многочисленными
иллюстрациями в научном журнале (на китайском
языке), но вместо gen. et sp. п. указано «in press» (Song
et al., 1994). Пока нет другой статьи, диагноз дан по
этой предпубликации. Тело удлиненное, широкое, ки-
неты слегка спиральные, на венте 3 шва — апикаль-
ный, предротовой и послеротовой (бисеканты). Ваку-
оль терминальная, кортекс с экструсомами. Перистом
мелкий, у ребра правой стороны незначительно сплю-
щенного тела; мембрана до вершины М2, только спра-
ва, не огибает рот снизу; скутикус в виде линии кине-
тосом. Перистом сдвинут вниз от вершины тела, Ml у
вершины перистома, в виде мелкой дикинеты; М2 зна-
чительно ниже, такой же формы; М3 — рудимент
(см. выше род Entodiscus).
Род Paurotricha Dragesco
et Dragesco-Kerneis, 1991
Типовой вид Р. cyclidiformis. По Аэшт, со
ссылкой на мнение в одной из статей, это синоним
вида Cristigera pleuronemoides, а род — синоним рода
Cristigera. Сейчас хорошо изучены разные виды, отно-
симые к Cristigera, кроме типового вида С. pleurone-
moides, фактически имеется лишь описание Пенарда
(Penard, 1922) без импрегнации, показывающего более
мелкий перистом и такую же цилиатуру, как у Paurot-
richa. Если это синонимы, остальные виды без ацилона
нужно исключить из состава Cristigera.
Р. cyclidiformis — мелкие овальные цилиаты с ши-
рокой плоской безресничной площадкой на апексе, с
кольцом относительно длинных сегментов кинет в пе-
редней трети и узким кольцом внизу; мембрана очень
крупная, до апекса, снизу заходит далеко за пределы
ресничного кольца, но мембранеллы расположены вы-
соко на уровне кольца; это мелкие рудименты, лежа-
щие по одной линии. Не отмечен вентральный жело-
бок, характерный для Cristigera. Пенард рисует при-
мерно такой же кинетом, мембрану с нижним концом
за пределами ресничного кольца; в безресничной
зоне — продольные ребра, вероятно при имрегнации
по Кляйну можно выявить аргиронемы на месте исчез-
нувших участков кинет.
Род Pectenita Jankowski, 1973
Типовой вид Р. golikowi. Паразит пищеварите-
льной железы крупной промысловой двустворчатки
Mizuhopecten yessoensis у берегов Сахалина и Кунаши-
ра. Тело широкое, с острым шипиком спереди, к кото-
рому сходятся вершины многочисленных сомакинет;
кортекс в зоне апикального шва утолщен. Перистом
небольшой, отделен длинным предротовым швом
от апекса, ниже начинается более длинный послерото-
вой шов. Вид был описан без импрегнации (in fixo, при
боковом освещении), выявлены 2 короткие мембра-
неллы на верхней стенке воронки; позже при импрег-
нации выявлены 3 мелкие мебранеллы и короткая мем-
брана. Как обычно у эндопаразитов, например у Entor-
hipidium, перистом мелкий и ротовая цилиатура
регрессирует.
Род Philaster Fabre-Domergue, 1885
Типовой вид Ph. digitiformis. Морской гистио-
фаг, первоначально обнаружен в тканях поврежден-
ных Asterias (Marthas ter ias) glacialis; предполагается,
что вид обитает в мукусе хозяев как комменсал и раз-
множается в массе при повреждении или гибели хозяи-
на. Каль (Kahl, 1931) собирал вид с актиний и губок;
мною осмотрена крупная особь мягкого коралла на
о-ве Беринга, все ткани которого были насыщены фи-
ластерами. В лаборатории вид культивируется на чис-
той морской воде с кусочками свежих тканей беспоз-
воночных. Род вначале не был принят, типовой вид пе-
ревели в состав Uronema, но валидность рода
восстановлена Калем.
Ph. digitiformis — крупные цилиаты (100—
150 мкм) с веретеновидным телом; около 25 кинет би-
полярные, спереди мелкий ацилон, сзади ацилон с кау-
дальной ресничкой, кинетосомы собраны в попереч-
ные кольца (паратены), вакуоль субтерминальная, в
зоне послеротового унисекантного шва. Перистом
крупный, от апекса до экватора; мембрана короткая,
верхняя половина обособлена в виде линии разрознен-
ных безресничных кинетосом; Ml — вытянутый треу-
гольник, М2 — очень крупная, сложной формы, дву-
ветвистая; М3 — продольная, небольшая. При стома-
тогенезе сохраняется ротовая цилиатура примонта,
новйя цилиатура задней особи образуется из крупного
поля кинетосом, выделенного нижней частью мембра-
ны УМ и длинным скутикусом в зоне послеротового
шва; кинетосомы скутикуса на всех стадиях, в частно-
сти у неделящихся особей, лишены ресничек.
Helicostoma oblongum Cohn, 1866 м. Paramecium та-
rinum Kent, 1881 — синонимы вида, но приоритетное
название Кона не было вовремя восстановлено, всеми
принято более позднее синонимичное название Philas-
ter digitiformis. Ph. bergeri Groliere, Puytorac et Grain,
1980 — симбионт морских ежей Карибского бассейна
844
ALVEOLATA
(Tripneustes esculentus), с небольшой М2. Ph. hiatti
Thompson, 1969 — хорошо изученный валидный вид;
Uronema botuliformis Wenzel, 1961 — возможный си-
ноним типового вида; Ph. resedaceus Tucolesco, 1962,
вероятно, не Philaster, Ph. salinus Tucolesco, 1962 —
морской вид из Румынии. 3 последних вида установле-
ны без импрегнации, даны рисунки in vivo, валидность
видов не доказана.
Род Philasterella Evans in Corliss, 1979
Типовой вид не указан, диагноза нет; позже в лите-
ратуре не описан.
Род Philasterides Kahl, 1931
Типовой вид Lembus armata Kahl, 1926 (Ph. ar-
matus). Пресноводный вид с узким вытянутым телом,
величиной 40—60 мкм; около 26 кинет продольные,
спереди ацилон, вакуоль субмедиальная, имеется кау-
дальная ресничка. Перистом очень узкий, в передней
четверти тела; УМ — извитая, только справа, не огиба-
ет рот; Ml — вытянутый треугольник, М2 — более ко-
роткий прямоугольник, М3 — узкий поперечный ряд.
Аргиром, как у тетрахимен. Скутикус в виде длинной
монокинеты до экватора тела. Вид неоднократно пере-
описан при импрегнации, в частности из морских
проб, вероятно эвригалинный. Пресноводная раса из
Франции крупнее, 65—100 мкм, имеет 27—32 кинеты.
Ротовая цилиатура четко различается на иллюстраци-
ях морской расы и вида из пресных вод. Возможно,
имеется комплекс близких видов, пока определяемых
как Ph. armata.
Ph. dicentrarchi Dragesco et al., 1995 — паразит мор-
ского окуня Dicentrarchus labrax, хорошо изучен при
импрегнации кинетома; это название было использо-
вано для паразитов морских рыб в серии работ, но сей-
час считается возможной синонимия с видом Miamien-
sis avidus (также паразитом рыб). По второму виду
очень мало иллюстраций кинетома и перистома, срав-
нение затруднено, поэтому первый вид решили опи-
сать как новый. Новые виды Сонга (Song, 2000) — Phi-
lasterides digitiformis и Ph. armatalis.
Род Plagiopyliella Poljansky, 1951
Типовой вид P. pacifica; эндопаразит в кишеч-
нике морских ежей Strongylocentrotus nudus и S. inter-
medius в Японском море; вначале отнесены к трихо-
стоматам Plagiopylidae, но после импрегнации ротовой
цилиатуры доказано родство с филастеридами. Мас-
сивные формы (до 300 мкм) с латерально сплющен-
ным телом и крайней полимеризацией кинет; секант-
ные швы в разных участках усложняют топографию
кинет. Особо удлинен предротовой шов, уходящий да-
леко на дорсум в виде бисеканты, и послеротовой шов,
идущий вправо вниз; положение сомакинет асиммет-
ричное. Перистом относительно небольшой, латераль-
ный, с глубокой полостью, ротовую цилиатуру трудно
выявить и гомологизировать с типичными филастери-
дами. В ротовую полость входят участки значительно-
го числа сомакинет, образуя вестибулюм.
После первоописания типовой вид найден в 4 ви-
дах хозяев в Северной Пацифике (S. pulchellus, S. palli-
dus, S. franciscanus, Allocentrotus fragilis), отсутствует
в Атлантике. Род монотипичный; вид Р. vorax отнесен
к близкому роду Thyrophylax, а третий вид — Conchop-
hthirus striatus Uyemura, 1934, ошибочно включенный
в состав Plagiopyliella (из ежей Allocentrotus fragilis,
S. franciscanus, S. droebachiensis, S. echinoides в Япо-
нии и Калифорнии), вероятно, принадлежит к новому
роду.
Род Porpostoma Mobius, 1888
Типовой вид Р. notatum. По Аэшт, синоним —
Helicostoma Cohn, 1866, но они различаются по яд-
рам — округлое у второго рода, червеобразное у
первого. Правильнее синонимом считать род Eurychi-
lum Andre, 1910. Поэтому частое в литературе обозна-
чение типа для этого рода как Helicostoma notata не-
верно.
Р. notatum — крупные цилиндрические цилиаты
длиной около 200 мкм с массой вплотную сближенных
кинет; это активный пловец и хищник, питается тканя-
ми раненых и погибших морских животных. При кон-
такте с ними секретирует сильную кислоту, вероятно
соляную. Для сбора материала достаточно положить
на сутки раздавленную двустворчатку. Реснички в ря-
дах тесно сближены, образуют сплошной войлок.
Ядро — извитая продольная лента, что редко у фила-
стерин; перед делением ядро сокращается, после деле-
ния быстро вытягивается; вакуоль терминальная, с
медленной пульсацией. Перистом узкий, вытянутый,
рот на экваторе; мембрана короткая, справа, не огибает
рот снизу; Ml — в виде очень длинной полосы, до
апекса; М2 — короткая трапеция; М3 — небольшое
поле кинетосом, не рудимент, как у многих филасте-
рид. Ml состоит из большого числа поперечных моно-
кинет, поэтому род вначале включили в состав Heterot-
richa. Деление в цистах, с образованием 4 томитов.
Р. grassei (Corliss et Snyder, 1986 in Cohnilembus) —
хорошо описанный вид из Антарктики, близок к Р. no-
tatum, но лишен пигментного пятна у апекса и отлича-
ется формой макронуклеуса и числом микронуклеу-
сов; включение его в Cohnilembus с крайне упрощен-
ным кинетомом — необъяснимая ошибка.
Под названием Helicostoma buddenbrocki Kahl, 1931
типовой вид описан как патоген морских рыб, питает-
ся тканями молоди в садках с Zoarces viviparus, Anguil-
la anguilla, Pleuronectes platessa в Англии; на Белом
море мною найден в массе в смывах с камбалы.
Род Potomacus Thompson, 1966
Типовой вид Р. pottsv, свободноживущий вид
из солоноватых вод с диморфизмом особей, близкий к
роду Miamiensis. Типичная форма (микростом) — мел-
кие каплевидные цилиаты с вытянутым телом, с
11—13 продольными биполярными кинетами, вакуоль
над постероном справа. Перистом в передней трети
ТИП CILIOPHORA. КЛАСС OLIGOHYMENOPHOREA
845
тела; мембрана справа, не огибает рот снизу, короткая,
с 2 сегментами; Ml — вытянутая дикинета у апекса,
М2 — более длинный продольный ряд, М3 — попереч-
ный рудимент. Скутикус — ряд кинетосом ниже рта.
Питание бактериями; при наличии цилиат в культурах
происходит метаморфоз, прежний ротовой комплекс
реорганизуется, образуются макростомы — хищники с
гигантским перистомом. Такой диморфизм известен у
3 видов (подрод Leucophrys) рода Tetrahymena.
Род Proboscella Kent, 1881
Типовой вид Vibrio verminus Muller, 1786. По
Аэшт, синоним рода Lembus, позже переименованного
в Cohnilembus-, Корлисс (Corliss, 1979) привел это на-
звание в списке nomina oblita без обсуждения и моти-
вации. Вид Мюллера позже описывался как Cyclidium
elongatum Clap, et Lachm., 1859; Lembus velifer Cohn,
1866 (это название принято всеми авторами XIX в.),
вероятно и как другие виды Lembus (L. striatus, L. inter-
medius, L. infusionum); когда выяснилось, что название
Lembus непригодно как гомоним, Каль заменил его но-
вым — Cohnilembus вместо использования доступных
синонимов Proboscella Kent и Sparotricha Entz. Сейчас
восстановление одного из этих забытых названий вме-
сто Cohnilembus не будет принято.
Род Protocyclidium Alekperov, 1993
Типовой вид Р. terrenum из почвы в парке Пе-
тербурга. Очень мелкие формы (20—25 мкм) с верете-
новидным телом, апикальным ацилоном, 11 биполяр-
ными кинетами; аргиром — ряды квадратов вдоль ки-
нет, аргиронемы в беспорядке на перистоме и ниже.
Перистом крупный, мембрана до вершины тела, осно-
вания мембранелл слились в одну линию, расширен-
ную у вершины и более широкую внизу. Ядро вытяну-
тое, вакуоль с порой около кинетосомы и с 10 каудаль-
ными ресничками. Родовой признак — модификация
ротовой цилиатуры, без дифференцировки на мембра-
неллы Ml—М3; род сближается с Cristigera. Нужно
заметить, что у видов Cyclidium основания мембранелл
обычно расположены рядом, и иногда трудно заметить
границу между ними; вероятно, у Protocyclidium вплот-
ную сближены все 3 мембранеллы. Род принят (Fois-
sner et al., 2002) и состав рода расширен.
Род Pseudocohnitembus Evans
et Thompson, 1964
Типовой вид Р. persalinus-, сейчас этот вид све-
ден в синонимы вида Lembus pusillus Quennerstedt,
1869, поэтому типовой вид рода — Р. pusillus, ранее в
составе рода Cohnilembus. Размеры тела 25—50 мкм,
тело каплевидное, узкое, вакуоль субтерминальная;
трихоцист нет; 8—11 кинет простой топографии, би-
полярные, с дисомами в верхних 2/3 тела, моносомами
в нижней трети. Перистом узкий, вытянутый, рот у эк-
ватора; раньше находили «двойную мембрану», при
импрегнации протарголом можно различить длинную
мембрану УМ, длинную монокинету М2 (прижата
вплотную к УМ), рудимент М3 и короткую монокине-
ту Ml над вершиной мембраны; это нетипично для фи-
ластерид, Ml должна прилегать к вершине М2 или рас-
полагаться левее. Вероятно, это эвригалинный вид, бо-
лее частый в пресных водах; вид многократно отмечен
в литературе, переописан при импрегнации. Авторы
рода предложили новое сем. Pseudocohnilembidae то-
лько для этого рода с 3 новыми видами, ресничный ап-
парат которых не тетрахименового типа, состоит из
2 мембран — «наружной и внутренней», с моноки-
нетами в основании. Позже другие авторы заметили
мелкий рудимент М3 у основания М2, a Ml у морских
видов либо тесно прилегает к вершине М2, либо от-
сутствует.
Формально род Pseudocohnilembus должен вклю-
чать все виды прежнего рода Lembus — L. pusillus Qu-
ennerstedt, 1869;L. moebiiKahX, 1926;L. longivelatusK.,
1931; A.putrinusK., 1928;A. vexillariusK., 1926;Z. atte-
nuates Smith, 1897; L. scaber Penard, 1922; L. fusiformis
K., 1926; L. verminus (= Vibrio verminus Muller, 1786);
L. velifer Cohn, 1866; L. subulatus Kent, 1882; A. reesiK.,
1931 и др.
Достоверных видов немного, к примеру Р. hargisi
Evans et Thompson, 1964; P. longisetus Evans et Thomp-
son, 1964; P. marinus Thompson, 1966 (Paralembus in
Borror, 1962); P. cantabricus Femandez-Leborans et Cas-
tro de Zaldumbide, 1984; P. persalinus subsp. hexakineta
Foissner et al., 2002. Вид P. caeci (Cohnilembus caeci in
Powers, 1935) — эндопаразит морских ежей, отмечен в
6 видах 5 родов хозяев; изучен Фойсснером (Foissner,
1985b); в перистоме параллельные монокинеты УМ и
М2, у вершины нет Ml, внизу короткий поперечный
ряд — остаток М3. У Р. evansi Small et Lynn, 1985 пе-
ристом растянут на всю длину тела, М2 — дикинета,
Ml и М3 четко видны у ее концов; если описание вер-
ное, это вид нового рода.
Род Sinocyclidium Jankowski
gen. n.
Типовой вид Pseudocyclidium longum Xu et
Song, 1998 из мантийной полости морской двуствор-
чатки Cyclina sinensis в районе Циндао (Китай). Тело
веретеновидное, некрупное (60—85 мкм), с апикаль-
ным ацилоном, 16—21 биполярными кинетами, без
швов; вакуоль над постероном. Перистом растянут на
2/3 длины тела, широкий; УМ достигает вершины пе-
ристома и огибает рот полукольцом снизу; ниже рта —
несколько кинетосом скутикуса. Все 3 мембранел-
лы — дикинеты; длинная Ml и короткая М2 в ряду
близ мембраны, короткий поперечный ряд М3 — над
ртом.
Авторы этого вида были мною информированы пи-
сьмом, что этот вид не новый — он уже описан в Япо-
нии из того же хозяина, как и Madsenia cyclina Uyemu-
ra, 1938; поэтому правильное название типового вида
Sinocyclidium cyclina (Uyemura, 1938 in Madsenia} Jan-
kowski comb. n. Раса из Японии имеет размеры
50—65 мкм, 8—10 дорсальных кинет и 11—12 вент-
ральных, всего 19—22 ряда; перистом достигает чет-
верти длины тела, ротовая цилиатура не изучена.
846
ALVEOLATA
В Японии описан также вид Madsenia hydractiniae
Uyemura, 1940, эпибионты на колониальном гидро-
иде Hydractinia sp.; оригинал недоступен; это фила-
стерид а типа Paranophrys величиной 75—100 мкм,
со слоем трихоцист.
Род Pseudocyclidium Small et Lynn,
1985
Типовой вид Р. marylandi. Мелкий вид
(40 мкм) типа Cyclidium с каудальной ресничкой, суб-
терминальной вакуолью, значительным числом бипо-
лярных кинет с дисомами по всей длине рядов. Пери-
стом обширный, мембрана достигает апекса и снизу
окружает рот полукольцом; Ml и М2 — дикинеты,
расположены в одну линию вдоль мембраны, Ml —
вдвое длиннее М2; М3 — в виде поперечного фрагмен-
та. Смолл и Линн (Small, Lynn, 1985) опубликовали ри-
сунок с краткой аннотацией, не указав экологию и чис-
ло кинет.
Род Pseuduronema Hoare, 1927
Типовой вид не указан; род предложен для
Uronema marina Dujardin, 1841 (partim), U. schewiakoffi
и U. ovale', как тип здесь указывается вид U. schewia-
koffi Buddenbrock, 1920 (название предложено для
Uronema marina sensu Schewiakoff, 1889). Это мелкие
овальные формы с густой цилиатурой, терминальной
вакуолью, каудальной ресничкой, с темной от включе-
ний цитоплазмой, без апикального ацилона; найдены в
пресной воде в настоях растений. Пока неясно, что мог
видеть Шевяков, но это не Uronema и не Dexiotricha,
имеющая ацилон и вакуоль в другом положении.
Род Ptyssostoma Hentschel, 1927
Типовой вид Р. thalassemae', паразит в кишеч-
нике морских червей эхиурид Thalassema neptuni в
Англии. Тело каплевидное, заострено спереди, очень
широкое, длиной 75—100 мкм; описание непрофес-
сиональное, рисунок упрощенный и без нужных дета-
лей. Ядро медиальное, вакуоль сзади, кинеты много-
численные, идут параллельно оси тела (такая топогра-
фия, как на оригинальном рисунке вида, невозможна).
Рот мелкий, погружен на дно небольшого округлого
атриума, ведет в короткую узкую глотку. Соматиче-
ская цилиатура очень густая, сзади пучок каудальных
ресничек. Пока точное строение и систематическое
положение вида и рода неизвестно, но это может быть
филастерида.
Род Pusilloburius Corliss, 1979
Типовой вид Pseudoglaucoma labiata Kahl,
1931; у Корлисса (Corliss, 1979) род неясного поло-
жения среди филастерин. У Каля (Kahl, 1931) 2 вида в
составе рода, один оставлен как типовой вид рода Pse-
udoglaucoma — Р. muscorum Kahl, 1931, вероятно от-
носящегося к кольподовым; второй вид Р. labiatus
Kahl, 1931 — тип рода Pusilloburius. Это плохо описан-
ный вид, временно в составе филастерид.
Род Schizocaryum Poljansky
et Golikowa, 1957
Типовой вид S', dogieli — паразиты пищевода
(не кишечника, где все остальные цилиаты) морских
ежей Strongylocentrotus droebachiensis на Мурмане; по-
зже найдены на северо-западе США в том же локусе у
S. franciscanus, S. echinoides и У. purpuratus. В резюме
другой статьи вид назван Schizocarium paradoxum. Раз-
меры особей очень изменчивые (46—270 мкм); тело
массивное, значительно сплющено, овальное, с боль-
шим числом кинет; ряды изогнутые в связи со смеще-
нием швов; задний шов смещен на дорсум, лежит по-
перек тела, к нему подходит большинство спиральных
кинет; от основного шва отходят 2 узких боковых шва.
На венте длинная перистомальная щель; левее ее кине-
ты идут продольно, правые ряды подходят под углом.
Строение перистома изучено не было; позже отметили
продольный ряд точек (кинетосом «ветибулярной» ци-
лиатуры); затем более сложную цилиатуру. Мной (не-
опубликовано) выявлен ряд циррусовидных ресничек
вдоль всей щели перистома и аргиром — продольные
ряды квадратов, видимый как рельеф кортекса. Рес-
нички не одиночные и не парные, как обычно у цилиат,
а собраны в пучки. Ядра своеобразные — один микро-
нуклеус и 5—6 макронуклеусов неправильной формы.
Систематическое положение рода было неясным, но
сейчас методами молекулярной филогении доказано
их родство с филастеридами (Lynn, Struder-Kypke,
2002). Вероятно, деление происходит в цистах вне.ки-
шечника, и мелкие томиты заселяют хозяев. Данные
световой микроскопии также подтверждают принад-
лежность к филастеридам (сетчатый аргиром, топогра-
фия кинет, разбивка длинной мембраны перистома на
поперечные пектинеллы).
Род Sertumia Tucolesco, 1962
Типовой вид S. tekirghiolica, мелкий вид из со-
леного приморского озера; внешний вид, как у Urone-
ma, имеется около 20 продольных кинет, 2 каудальные
реснички, звездчатый макронуклеус с тесно прилегаю-
щим удлиненным микронуклеусом (признак кольпо-
дид?). Кортекс рельефный, в бугорках вдоль каждой
кинеты. Перистом субапикальный, глубокий; ротовая
цилиатура не изучена. Род не упоминается в числе ва-
лидных родов цилиат в современной литературе.
Род Sparotricha Entz, 1879
Типовой вид S. vexilliger из соленого озера в
Венгрии. Размеры 60—100 мкм; тело резко вытянутое,
змеевидное, расширено медиально; имеются 3 ядра и
медиальная вакуоль; по телу разрозненные реснички,
не образующие четких рядов, в частности по краям уз-
кой передней части тела и вытянутого хвоста; пери-
ТИП CILIOPHORA. КЛАСС OLIGOHYMENOPHOREA
847
стом медиальный, широкий, с крупной боковой мемб-
раной; в передней четверти тела ротовых ресничек нет.
Род отнесен к Hypotricha. Каль (Kahl, 1931) признал
этот род синонимом Lembus — L. vexilliger in Kahl,
1931. Когда выяснилось, что Lembus — гомоним, Каль
дал роду новое название Cohnilembus, не использовав
пригодное название Sparotricha. Корлисс (Corliss,
1979) объявил Sparotricha nomen oblitum без анализа
и аргументации, поэтому такое обозначение неле-
гитимное.
Род Symbionecta Jankowski, 1973
У ->
Типовой вид Cryptochilum cuenoti Florentin,
1898. Синоним рода Cryptochilidium Schouteden, 1906.
Род Tanystomium Berger, 1994
Типовой вид Cryptochilidium gracile Powers,
1933 {Biggaria in Kahl, 1934). Род впервые упомянут в
книге Корлисса (Corliss, 1979) без диагноза, как nomen
nudum. Задолго до 1994 г. название Tanystomium по-
явилось в обзорах паразитических цилиат (Levine,
1972; Barel, Kramers, 1977), но без указания gen. и. и
без диагноза, поэтому это цитирование не является ва-
лидацией рода.
С. gracile — эндопаразит кишечника морских ежей
Strongylocentrotus droebachiensis, S. intermedius, S. echi-
noides, S. franciscanus, S. purpuratus, Echinometra van-
brunti, Diadema mexicanum, Allocentrotus fragilis, Lyte-
chinus anamesus в Северной Атлантике и Пацифике;
найден на Мурмане и на Дальнем Востоке России.
Тело крупное, грушевидное, кинеты многочисленные,
вакуоль над постероном; рот ниже экватора, перистом
вытянут до апекса; Ml — короткая монокинета у апек-
са, удалена от остальных мембранелл; М2 — треуголь-
ное поле кинетосом, М3 — более крупное поле у рта.
Мембрана извитая, короткая, только справа, не огиба-
ет рот снизу.
Род Teremanticola Jankowski, 1980
Типовой вид Biggaria caryoselaginelloides
Tchang, 1958. По Аэшт, это синоним рода Biggaria
(ссылка на Тюффро и Лаваль-Пейто, переописавших
вид). Сейчас форме ядра придают значение в система-
тике родов и подродов цилиат, поэтому этот аберрант-
ный вид нужно отделить от Biggaria хотя бы на уровне
подрода. Кроме того, они отличаются и по типу рото-
вой цилиатуры. Это эндопаразит в «накопительном
мешке» древоточца — двустворчатки Teredo adami из
мангров лагуны в западной Африке. Крупные формы
(150—300 мкм); тело плоское, с зубчатым дорсальным
ребром; число кинет (32—79) зависит от размеров
тела. Перистом очень длинный (90—135 мкм), на краю
вента, с длинной мембраной; Ml не отмечена, М2 и
М3 — крупные поля кинетосом. Уникальный признак,
кроме зубчатого дорсального ребра — сложная форма
ядра; макронуклеус звездчатый, неправильный, с се-
рией выростов.
Род Biggaria раньше был сборной группой, вклю-
чал только виды из морских ежей, сейчас монотипи-
чен. В. gracilis — это тип рода Tanystomium, В. echino-
metris — тип рода Velistoma. У В. bermudensis ротовые
мембраиеллы смещены почти к постерону, Ml ните-
видная, ядро округлое.
Род Thyrophylax Lynn et Berger, 1973
Типовой вид Plagiopyliella vorax Strelkow,
1959. Родовое название приведено в книге Корлисса
(Corliss, 1961) без диагноза и указания типа, поэтому
невалидно как nomen nudum. В обеих изданиях Guide
(Small, Lynn, 1985; Lynn, Small, 2002) род приводится
как Thyrophylax Berger in Corliss, 1961, это ошибка. В
обзоре паразитических цилиат (Levine, 1972) в списке
дан род Thyrophylax по диссертации Бергера без обо-
значения gen. п., без указания типа и без диагноза, с
2 видами — Т. strongylocentroti (в 5 видах 2 родов хо-
зяев) и Т. vorax (в 1 виде 1 рода). Это также нельзя счи-
тать валидацией родового названия. Нельзя также счи-
тать валидным сем. Thyrophylaxidae Berger, 1961, при-
веденное в книге Корлисса.
Th. vorax найден в кишечнике морских ежей Stron-
gylocentrotus intermedius на о-ве Итуруп; это гигант-
ский вид (320—557 мкм), активный хищник, заглаты-
вает других цилиат кишечника, даже таких крупных,
как Entodiscus. Тело широкое, незначительно сплю-
щенное, с сотнями сомакинет, сходящихся к очень
длинному переднему шву и к постерону, с боковыми
швами; ядро вытянутое. Перистом удален от апекса,
глубокий, почти продольный; на стенках — участки
сомакинет, образующие вестибулярную цилиатуру.
Мембраиеллы видоизменены, имеют вид узких по-
лос на дне полости; мембрана удлинена. Второй вид
Т. strongylocentroti Berger описан в диссертации, но
пока нет публикации с диагнозом и рисунками; вид
найден на западе США, от Калифорнии до границы с
Канадой, в S. droebachiensis, S. echinoides, S. francisca-
nus, S. purpuratus-, это гиганты величиной до 912 мкм.
Род Urocyclon Song et Wilbert,
2000
Типовой вид Urocyclon chesapeakensis Small et
Lynn, 1985. Род Urocyclon Small был впервые приведен
в книге Корлисса (Corliss, 1979) без диагноза, вторич-
но предложен как новый, с 2 авторами, в Guide (Small,
Lynn, 1985) для U. filificum Kahl и нового вида U. che-
sapeakensis с диагнозом и иллюстрациями, но без ука-
зания типа, поэтому признан невалидным. В Traite по
ошибке — род Urocyclon Small, 1985.
U. chesapeakensis — мелкая бочонковидная форма
с широким ацилоном спереди и сзади (последний с ка-
удальной ресничкой); около 18 кинет расположены
продольно, в верхней их половине кинетосомы сбли-
жены. Перистом растянут по венту, рот ниже экватора;
мембрана вытянута по правому краю, не достигает
вершины перистома; Ml в виде монокинеты сдвинут
далеко вверх к апексу, М2 — более короткая моноки-
нета, М3 — поперечный ряд кинетосом.
848
ALVEOLATA
U. ovatum Song et Wilbert, 2000 — вид из морского
льда в Антарктике; у этого вида левые ряды на венте
продольные, правые снизу подходят не к ацилону, а к
унисекантному шву, поэтому вид выделяется в новый
подрод Unisecana Jankowski subgen. n. с типовым ви-
дом Urocyclon (Unisecana) ovatum S. et W., 2000. Вид
U. cymruensis Perez-Uz et Hope, 1997 был перенесен в
состав Homalogastra (Song, Wilbert, 2000a).
Род Uronema Dujardin,
1841
Типовой вид U. marina (правильно U. mari-
num). По Аэшт, синоним — Uronemita, но это одно из
двух спорных названий следующего рода, не синоним
рода Uronema. Название Uronema есть у многоклеточ-
ных водорослей, это не гомоним. Виды рода широко
распространены в пресной воде и более часты в море,
где в массе развиваются в пробах, простоявших много
дней в лаборатории и начинающих загнивать; в них
много Uronema, Pseudocohnilembus, мелких хищных
простомат Chaenea и Euplotes. Строение у видов рода
однотипное — тело каплевидное или цилиндрическое,
мелкое, у обоих концов тела ацилон; кинеты биполяр-
ные, немногочисленные, дисомы в верхней половине
рядов, моносомы в нижней. При окраске моим мето-
дом (метил-виолет после фиксации спиртовым раство-
ром фосфорно-вольфрамовой кислоты) четко видны
парные реснички антесомы и одиночные в постесоме;
граница отделов варьирует у разных родов скутицид.
Аргиром — правильные ряды прямоугольников вдоль
кинет. Перистом слегка вдавлен, но без полости; мемб-
рана короткая, не идет к вершине тела; Ml — короткая
монокинета у апекса, М2 —прямоугольник шириной в
3 кинетосомы, М3 — мелкая дикинета. Мембрана не
огибает рот снизу и слева, в отличие от плейронематид
и ряда филастерид; вероятно, этот признак можно ис-
пользовать для систематики. Вакуоль субтерминаль-
ная, справа; нижний ацилон с одной каудальной рес-
ничкой.
К роду приписывали множество неродственных
форм, вплоть до крупных хищных филастерид с боль-
шим числом кинет; границы рода были неясными,
пока не была импрегнирована цилиатура (Клейн, Ге-
лей и последующие авторы; интенсивное изучение
уронематид предпринял Томпсон в 1960-е гг.). Из со-
става рода было исключено много видов, часть остав-
лена неопределимыми; в итоге валидны лишь несколь-
ко видов — U. marinum Dujardin, 1841; U. nigricans
(Muller, 1786); U. acutum Buddenbrock, 1920; U. elegans
(Maupas, 1883 in Cryptochilum)-, U. gallicum Perez-Uz et
Song, 1990; U. muscicola Tellez et Femandez-Galiano;
U. paramarinum Petz, Song et Wilbert, 1995; U. parduczi
Foissner, 1971; U. castellonensis Femandez-Leborans et
Castro de Zaldumbide, 1984. У вида U. parva Czapik,
1968 перистом сдвинут вниз, этот вид нетипичен для
рода.
Uronema — свободноживущие цилиаты, более час-
тые в море; спектр питания широкий, от бактериотро-
фии до гистиотрофиии и паразитизма. Накапливаются
достоверные данные о летальном паразитизме уронем
на морских рыбах; идентификация проверена на имп-
регнированных препаратах; пример — энцефалит и ги-
бель тунцов от Uronema nigricans, поражающих
головной мозг (Munday et al., 1997, и др.).
Род Uronemita Jankowski, 1980
Типовой вид Uronemafilificum Kahl, 1931; при
обозначении типа автором вида по ошибке указан
Фойсснер. По Аэшт, это синоним рода Uronema. Вид
был включен Смоллом и Линном (Small, Lynn, 1985) в
состав рода Urocyclon, невалидного в связи с отсутст-
вием фиксации типа. Сонг (Song, 2000) перенес U. fili-
ficum в состав рода Homalogastra, но позже вид U. che-
sapeakensis Сонг выделил в новый род с тем же назва-
нием (Urocyclon), а для второго вида U.filificum
предложил род Uronemella, заявив, что Uronemita дана
без диагноза — «так как нет определения и описания»
(Song, Wilbert, 2002). Для установления рода достаточ-
но указать хотя бы один отличительный признак, даже
ошибочный, тем более что многие роды различаются
по одному признаку. Для Uronemita признак был ука-
зан («без аргирома»), хотя это ошибка, аргиром был
найден; поэтому нельзя сказать, что род предложен без
указания отличий. На этом основании род Uronemella
Song et Wilbert, 2002 отвергается как синоним рода
Uronemita Jankowski, 1980.
Тип рода — легко определимый морской вид; в
чашках Петри обычные уронемы плавают, а особи
U. filificum собираются вокруг зерен риса, и вертятся
вокруг оси, касаясь ресничкой мукуса, оставаясь очень
долго на одном месте (как пеникулина Urocentrum).
Внешний облик, как у Uronema, концы тела с ацило-
ном, кинеты немногочисленные, перистом длиннее —
рот ниже экватора; ротовая цилиатура, как у Uronema,
но Ml дальше удалена от рта, осталась у апекса при
смещении рта и двух нижних мембранелл вниз. Вид
обычен у берегов Крыма, полисапробный, массовый в
чашках Петри с гниющим рисом.
Род Uronemopsis Kahl, 1931
Типовой вид Uronema kenti Kahl, 1926; круп-
ный вид (80—100 мкм) из пресных вод с удлиненным
веретеновидным телом, слоем трихоцист; ядро меди-
альное, вакуоль выше постерона вентрально; цилиату-
ра густая, равномерная, сзади каудалия. Рот в мелком
углублении, с очень мелкой мембраной с обеих сто-
рон. В современной литературе род не упоминается;
вид похож на Stegochilum (отряд Tetrahymenida).
Род Uropedalium Kahl, 1928
Типовой вид U.pyriforme Kahl, 1928 по обо-
значению Каля (Kahl, 1931); второй включенный вид в
первоописании — Uropedalium opisthostoma (Lepsi,
1926 in Uronema). Типовой вид очень плохо описан; по
Калю, это галобионт (в солоноватых водах и в море)
величиной 20—25 мкм, с 8—9 разрозненными спи-
ральными кинетами; рот небольшой, между кинетамц
над постероном, с «мембранным карманом»; вакуоль
ТИП CILIOPHORA. КЛАСС OLIGOHYMENOPHOREA
849
терминальная. Вид переописан при импрегнации; ки-
неты почти по всей длине с дисомами, перистом растя-
нут на всю длину клетки, мембрана короткая, справа;
Ml — длинная монокинета у левого края перистома,
М2 — треугольник, М3 — короткая поперечная дики-
нета. Другие виды— U. antarcticum Thompson, 1972 и
U. parvum (Czapik, 1968 in Uronema).
Род Velistoma Jankowski, 1980
Типовой вид Cryptochilum echinometris Biggar
et Wenrich, 1932 (K. echinometris). Паразит морских
ежей Карибского бассейна и островов Океании — Dia-
dema, Echinometra, Lytechinus, Tripneustes, Echinostre-
phus, Echinothrix, Heterocentrotus, Mespilia. Этот вид
всегда числился в роде Biggaria, но сейчас виды бигга-
рий распределены по разным родам филастерид. Тело
вытянутое, плоское, с небольшим хвостом, несущим
пучок каудалий; вакуоль у постерона; кинеты много-
численные, биполярные, с дисомами почти по всей
длине. Перистом смещен вниз, ниже экватора, на ме-
сте сдвига — широкая безресничная полоса. Мембрана
короткая, справа; слева видна крупная треугольная
мембранелла и мелкий рудимент у рта (М3). Вероятно,
мелкая Ml слита с более крупной М2. Скутикус в виде
продольной линии кинетосом.
Рдд Yagiua Profant, 1979
Род упомянут в списке Корлисса (Corliss, 1979)
без указания типа и без диагноза, вероятно для од-
ного из видов эхинофильных цилиат, изученных в
Японии. Виды Ягиу кроме «Conchophthirus» striatus
Yagiu, 1934 уже распределены по разным родам фи-
ластерид.
Приложение
Симбионтные гименостоматы
неясного положения из моллюсков
Род Cochliodomus Raabe, 1971
Типовой вид Cochliophilus oncomelaniae
Tchang, 1957 из пресноводных моллюсков — гастро-
под Oncomelania schmackeri (= Katayama tangi, = Hyp-
sobia nosophora) в Китае; этот хозяин широко распро-
странен в Японии, Китае и ю.-в. Азии. Тело овальное, с
полимеризацией сомакинет; перистом смещен к посте-
рону, ротовые кинеты погружены в глубокую канало-
видную полость; импрегнация выявила лишь наруж-
ные ряды, точная топография ротовой цилиатуры не-
известна. На месте сдвига рта остался длинный шов —
от апекса в обе стороны по краям плоского тела идут
швы, и третий бисекантный шов расположен диаго-
нально на выпуклой левой (верхней) стороне. Сходст-
во с Cochliophilus незначительное, перистом разного
типа. У типичных скутицид мембранеллы лежат на по-
верхности или в неглубокой полости. Этот род — не
эндемик Китая, новый вид (пока не описан) встречает-
ся и в России, у Владивостока, в приморской галофи-
льной пульмонатной гастроподе, определенной по
старой литературе как Cecina manchurica', точный хо-
зяин неизвестен, сейчас здесь различаются 3 вида —
С. manchurica, С. scarlatoi и С. tatarica.
Род Cochliophilus Kozloff, 1945
Типовой вид С. depressus', также С. minor. Оба
вида найдены одновременно при-вскрытии мелких га-
стропод-пульмонат Phytia setifer в Калифорнии, из
приморских соленых маршей. Хозяин — представи-
тель галофильных, но не морских пульмонат, обита-
ющих на линии моря по всему миру и родственных
обычным пресноводным гастроподам. Симбионты
типа Cochliophilus, однако, отсутствуют у облигатно
морских и пресноводных гастропод. В Европе хозяева
не осматривались, но в Крыму в пульмонате Alexia
(= Ovatella, Myosotella) myosotis (исчезающий вид, не
занесенный в Красную книгу Украины) мной найдены
симбионты, которых пока не удается отличить от
С. depressus.
Тело сплющено латерально, кинеты полимеризова-
ны, сгущены, но не образуют обособленной присоски;
присоской служит вся правая сторона тела, здесь кине-
ты расходятся дугами от оси, как в типичных присос-
ках никтотерид. Справа снизу диагональный бисекант-
ный шов, как у предыдущего рода; от апекса с широ-
ким безресничным швом идет по краю тела длинный
унисекантный шов. Ротовая цилиатура лежит на по-
верхности, снизу 2 длинные кинеты (мембрана и М2?)
погружены в неглубокую полость выше постерона,
глотка идет вверх. Импрегнация крымского вида вы-
явила сложный аргиром, который может помочь опре-
делению таксономического положения вида. У второ-
го вида, С. minor, рот ближе к постерону, кинет мень-
ше, ряды разрознены, ядро с волнистым контуром.
Род Thigmozoon Santhakumari et Nair,
1973
Типовой вид Т.fencheli, комменсалы из ман-
тийной полости морских моллюсков-древоточцев (Bi-
valvia) родов Teredo furcifera, Nausitora headleyi и Mar-
tesia striata в Индии. Некрупные (80—100 мкм) широ-
кие овальные формы с плоским листовидным телом,
полимеризацией кинет, резким удлинением швов; апи-
кальный и каудальный швы продолжаются также вент-
рально и дорсально, образуя единый замкнутый шов,
вдоль которого сходятся кинеты обеих сторон тела.
Обособленных тигмозон нет. Перистом небольшой,
смещен в нижнюю треть тела, лежит справа субмарги-
нально; это небольшая воронка с фрагментами кинет.
Точных данных о ротовой цилиатуре нет, хотя приме-
нена импрегнация. Ядро необычное для гименостомат,
ветвится. Авторы отнесли новый род к Thigmophryidae,
но это ничем не мотивировано; роды резко различают-
ся по топографии кинетома, форме ядра, форме тела,
положению сомакинет; не исключено родство Thigmo-
zoon и рода Myxophthirius из тропических морских
двустворок.
54 Зак. № 4163
850
ALVEOLATA
Род Gullmarella Fenchel, 1964
Типовой вид G.faurei из кишечника морских
двустворок Syndosmya nitida (типовой хозяин, зараже-
но большинство молллюсков), S. alba, Cultellus pelluci-
dus, Lucinopsis undata, реже встречается в Venus ovata
и в корбулидах Corbula gibba, отсутствует в Nucula и
в Leda в местах сбора зараженных хозяев; это вид
с «ограниченной специфичностью». Найден в зоне
проливов между Данией и Швецией. Крупный вид
(154—240 мкм) с вытянутым огурцевидным телом,
слегка сплющенным вентрально, с полимеризацией
кинет и длинными швами выше и ниже рта; ядро
овальное, вакуоль выше постерона справа. Применена
импрегнация, выявлен очень мелкий рудиментарный
перистом, короткая глотка с прочными стенками (по-
хожими на немадесмы); ротовая цилиатура — не-
сколько мелких кинет или одна полоска со сближен-
ными рядами; правее и левее рта дугами расходятся
тесно сближенные перикинеты. Изучение стоматоге-
неза не выявило возврата к тетрахимениуму, как у ску-
тицид. Провизорно род отнесен к гимностоматам (пе-
реднеротым) группы Cyrtophorina, по старой класси-
фикации цилиат, где сближен с Clathrostoma или
Paranassula только по наличию нечетких немадесм;
сомакинеты у Gullmarella, как у гименостомат.
Сем. Thigmocomidae Kazubski, 1958
Тело сплющено латерально, левая сторона вогну-
тая, со сложной цилиатурой, играет роль обширной
присоски: здесь четко выражены зоны редукции и спе-
циализации кинет; кинетом более полный на правой
стороне, но и здесь ниже экватора почти нет кинето-
сом. Четко выражен широкий ацилон по краю присос-
ки (дорсальный шов) и продольный шов от апекса до
перистома и от перистома до постерона; намечен и
шов снизу справа. Казубский (Kazubski, 1958b) приме-
нил лишь импрегнацию по Клейну, выявив на сухих
мазках фрагмент кинеты у рта; по моим препаратам то-
пография ротовой цилиатуры сложнее, имеется мемб-
рана и удлиненный ряд (М2) по правому краю почти не
погруженной перистомальной зоны; при делении вос-
произодится тетрахимениум, как у скутицид.
Род Thigmocoma Kazubski, 1958
Типовой вид Т. acuminata с признаками семей-
ства. Эндопаразиты в почках наземных влаголюбивых
гастропод рода Oxychilus (= Schistophallus), распро-
страненного в Европе и в странах Средиземноморья
(северная Африка, Турция); в Крыму встречается в
2 локальных видах — Oxychilus draparnaudi и О. cella-
rius; вид описан в Польше и в Украинских Карпатах из
О. orientalis, О. syriacus и О. duboisi. Четкий достовер-
ный монотипический род с тенденцией к редукции ки-
нет перистома и сомакинет; фактически цилиатура со-
хранена в основном в антесоме, ниже экватора лишь
отдельные кинетосомы и беспорядочное поле фраг-
ментов; обособлена и удлинена тигмотактическая по-
лоса по краю присоски; кинеты слева сверху плотно
сближены, кинетосомы в рядах лежат вплотную. Как у
ряда скутицид, имеется каудальная ресничка. Трактов-
ка перистома, принятая в литературе по рисунку Ка-
зубского, перикинета правее рта, изогнутая мембрана
и внутри перистома короткий ряд неясной гомологии
с мембранеллами скутицид; стомокинеты мелкие, ру-
диментарные по сравнению с размерами тела. Раабе
(Raabe, 1970а) относил этот род к сборному отряду
Thigmotrchida, рамки которого сейчас ограничены се-
мейством анцистрид.
Сем. Thigmophryidae Chatton et Lwoff,
1926 (рис. 367, б)
Тело крупное, узкое, вытянуто и сплющено, кине-
ты полимеризованы, перистом смещен далеко вниз,
рот погружен в вестибулюм; цилиатура полости — ча-
сти сомакинет, входящие в полость. Собственно рото-
вая цилиатура (мембрана и мембранеллы) не были вы-
явлены. Симбионты морских моллюсков и немертин.
Род Thigmophrya Chatton et Lwoff, 1923
Типовой вид Т. bivalviorum, комменсалы в
морских двустворчатках; вероятно, специфичные ви-
ды обитают в Масота, Tapes, в камнеточцах Hiatella =
Saxicava, неопределенные виды в других моллюсках.
Морфологически они близки и почти не отличаются,
систематика рода очень трудная.
Единственная находка в немертинах — вид Th. ап-
nella Fenchel, 1965 в кишечнике комменсальной немер-
тины Malacobdella grosa из мантийной полости дву-
створчатой Cyprina islandica-, этот симбионт поселяет-
ся в разных видах двустворчаток, не встречается в
бентосе. «Астомата» Orchitophrya malacobdellae Jen-
nings, 1968 (сем. Anoplophryidae), обнаруженная в ки-
шечнике Malacobdella grossa из мантона камнеточца
Zirfaea crispata, -— плохо описанный вид, но судя по
форме тела и размерам (120 X 50—60 мкм; у Th. annel-
la — 100—171 X 33—60 мкм), по числу кинет (30—
40) это несомненно синоним предыдущего вида —
Thigmophrya malacobdellae comb. n.
В Китае недавно описан вид из камнеточца Saxido-
muspurpuratus, определенье как Thigmophrya bivalvio-
rum, но при большом внешнем сходстве известных ви-
дов тигмофрий определение может быть неправиль-
ным.
У трофонтов видны лишь кинеты вестибулюма —
нижние концы группы сомакинет; при делении, по
Фенхелю (Fenchel, 1964, 1965а), видны зачатки мемб-
раны и трудные для трактовки группы кинетосом, ти-
пичного тетрахимениума нет. В Китае Key и Сонг (Хи,
Song, 2000b) провели импрегнацию протарголом; в
глубине ротовой полости под воронкой вестибулюма с
вершинами левых сомакинет выявлена короткая дуго-
видная мембрана и общее поле кинет, в котором нет
четкого деления на основания Ml, М2 и М3, это видо-
измененный перистом скутицид; найден и скутикус —
группа кинетосом у нижнего края полости.
Типичные тигмофрии — вытянутые узкие клетки с
косым апикальным ребром; это шов, к которому схо-
ТИП CILIOPHORA. КЛАСС OLIGOHYMENOPHOREA
851
дятся многочисленные продольные слегка изогнутые
сомакинеты. Перистом смещен далеко вниз вдоль осе-
вого шва (секанты); ниже перистома более короткий
продольный шов. Ядро медиальное, вакуоль над по-
стероном.
Известные виды и моллюски-хозяева (только дву-
створчатки, нет в гастроподах) — Т. bivalviorum Chatton
et Lwoff, 1923 {Mactra solida)', T. macomae Ch. et Lw.,
1926 (Macoma balthica)-, T. saxicavae Fenchel, 1964 (Hi-
atella = Saxicava arctica, H. striata)', T. tapetis {Tapes =
Venerupis pullastra)', неопределенные виды в европейских
хозяевах Cultellus pellucidus, Spisula elliptica, Cardium
ovale — нередки в наших дальневосточных моллюсках.
Сем. Myxophyllidae Raabe, 1968
(рис. 367, а)
Симбионты наземных гастропод; крупные плоские
формы с полимеризацией кинет, длинными швами, без
выраженной присоски; перистом смещен вниз по краю
тела, с обширной вестибулярной воронкой, кинетом
которой образован нижними концами правых кинет (у
тигмофриид — левыми рядами).
Род Myxophyllum Raabe, 1933
Типовой вид Conchophthirius steenstrupi Stein,
1861; симбионт в дыхательной полости и слизи назем-
ных гастропод, многих родов раковинных моллюсков
и слизней; выделено 2 морфотипа с небольшими отли-
чиями, но пока род монотипичный. Вид отмечен в мол-
люсках США, Европы, мною найден в Крыму, в При-
байкалье и у Владивостока.
Типовой вид — крупные овальные формы с поли-
меризацией кинет (до 125) на обеих сторонах тела;
апикальный шов удлиненный, дуговидный, снизу такой
же каудальный шов; рот смещен почти к постерону и
глубоко погружен. Вестибулюм с нижними концами
группы сомакинет, в глубине полости, по Казубскому
(Kazubski, 1973), — остаток ротовой цилиатуры; нет
очевидных гомологий строения этого рода и Concho-
phthirius, сходство с родом Thigmophrya незначительное.
Ядерный аппарат необычен — 7 макронуклеусов,
1 микронуклеус; такой набор имеют эксконъюганты
плейронематид, поэтому очевидно, что в результате
мутации у предка Myxophyllum произошла фиксация
фазы развития ядра — наследственно блокированы да-
льнейшие процессы (рост и сегрегация зачатков ядер).
Наиболее обычные хозяева — виды янтарок (Succi-
neidae); заражены также Helicidae, Limacidae, Arioni-
dae и другие семейства наземных моллюсков. По ре-
зультатам изучения в электронном микроскопе роды
Myxophyllum, Myxophthirius и Thigmophrya образуют
группу родственных форм, которую следует поме-
стить в состав скутицид подотряда Philasterina, a Con-
chophthirius родствен Pleuronematina, хотя внешне он
отличается от типичных плейронематид.
Список хозяев быстро возрастает; как типовой хо-
зяин здесь обозначается янтарка Succinea putris', при
первоописании как хозяева указаны неопределенные
виды Succinea, Clausilia, Сераеа и слизни Arion и Li-
max. В южной Европе отмечен в слизи Poiretia algira,
Helicella sp.; в США — в Oxyloma decampi, Anguispira
alternata, Triodopsis inultilineata. В пределах Польши
заселены виды родов Succinea, Cochlicopa, Iphigena,
Laciniaria, Discus, Eulota, Zenobiella, Perphoratella,
Trichia, Helicigona, Arianta, Cepaea, Isognomostoma
(Raabe, 1970a); в Крыму при обследовании всех ло-
кальных гастропод вид выявлен у Brephulopsis, Thoan-
teus, Chondrula, Cochlicopa, Peristoma, Helicopsis, Mo-
nacha, Cochlodina и Limax (Король, 1970).
«Расы» с отдельных хозяёв могут незначительно
отличаться, но в целом они группируются (только в
материале из Польши — Kazubski, 1977, 1978) в 2 так-
сона — более мелкую форму с меньшим числом кинет
(в Succinea и Discus) и более крупную форму с боль-
шим числом кинет (в Clausiliidae и Helicidae). В Интер-
нете замечено название Myxophyllum anadoni Perez,
Alonso, Estepar, A. Alvarez et R. Alvarez, 2003 в тезисах
конференции протозоологов в Италии (из раковинного
моллюска Portugala inchoata)', названия в тезисах нева-
лидные, статьи пока нет.
Род Myxophthirus Da Silva Neto, 1992
Типовой вид М. anomalocardiae из мантийной
полости морской двустворчатки Anomalocardia brasili-
апа в Бразилии; крупный вид (до 125 мкм) с полимери-
зацией кинет, присоской сверху слева (здесь сомакине-
ты сближены и закручены), с длинным апикальным
швом; перистом ниже экватора, импрегнация протар-
голом выявляет короткую мембрану и дуговидное
поле кинетосом в небольшой вестибулярной воронке.
Род отнесен к сем. Thigmophryidae sensu lato.
Род Hinoftirius Jankowski gen. n.
Типовой вид Myxophyllum magnum Xu et Song,
2000 из морских двустворок Sinonovacula constricta',
крупный вид с большим числом кинет, прямых бипо-
лярных на обеих сторонах плоского тела; перистом
мелкий, вестибулярная цилиатура образована погружени-
ем участков правых и левых кинет; собственно стомо-
кинеты (мембрана и мембранеллы) не выявлены. Этот
вид не может относиться к Myxophthirus, поскольку
нет характерной для последнего тигмозоны —
спиральных кинет сверху слева. Вид не принадлежит к
Myxophyllum по типу вестибулюма — кинеты идут ду-
гами, а у Myxophyllum вершины кинет компактным
пучком входят в воронку по прямой линии. Это вид но-
вого рода, несомненно родственного цилиатам из на-
земных моллюсков и аберрантному роду Myxophthirus.
Род Conchophyllum Raabe, 1936
Типовой вид Conchophthirus caryoclada Kid-
der, 1933 {Morgania in Kahl, 1934). Монотипиче-
ский достоверный род; комменсалы морских дву-
створок Siliqua patula на западе США (шт. Орегон).
Вытянутые крупные овальные формы с латераль-
но сплющенным телом, трихоцистами, продольными
852
ALVEOLATA
Рис. 367, a. Scuticociliatida — симбионты моллюсков.
Conchophthirus anodontae (А—Д, 3);Myxophyllum steenstrupi(E, Ж); Conchophthirus curtus(H). (По: Kazubski, 1973 (Ж); Antipa, Small, 1971 (Й); A—E,3— ориг.).
Fig. 367, a. Scuticociliatida. Symbionts of molluscs.
кинетами; перистом небольшой, смещен к постерону;
вестибулярной воронки нет. Кинетом методом импрег-
нации пока не изучен, неясно положение швов, тип ро-
товой цилиатуры. Ядро ветвистое в отличие от Thig-
mophrya. Это род неопределенного положения, воз-
можно родственный морским миксофиллидам.
Сем. Conchophthiriidae Kahl, 1929
(рис. 367, а)
Комменсалы пресноводных двустворок; крупные
плоские виды с полимеризацией кинет, небольшим пе-
ристомом на правой стороне тела; нет смещения рта к
постерону; ротовая цилиатура — мембрана и выше нее
3 параллельные короткие мембраиеллы с трикинетами
в основании.
Род Conchophthirius Stein, 1861
Типовой вид С. anodontae (= Leucophrys ano-
dontae Ehrenberg, 1838) из мантийной полости наяд
(Unionidae). Тело плоское, кинетом полный, кортекс
прочный, со сложным рельефом и четкими ряда-
ми прямоугольников аргирома; имеются боковые
швы; у постерона кинетосомы расположены в беспо-
рядке, у апекса сближены в рядах, образуя подобие
тигмозоны. Вестибулюм образован частью правых ки-
нет; ряды погружаются в воронку и выходят из нее,
подходя к предротовому шву. Буккальная цилиатура
была выявлена только при импрегнации протарго-
лом; для рода характерно смещение мембранелл к вер-
шине перистома, далеко от мембраны, и их параллель-
ное расположение (не в линию, как обычно у скути-
цид).
Виды рода немногочисленны, обитают в унио-
нидах Европы, Китая, США; в каталоге Раабе (Raa-
be, 1971) пропущен вид из Японии С. katayamae Oza-
ki, 1960 из Katayama nosophora. Особый вид С. acumi-
nata (Plagiotoma acuminata Clap, et Lachm., 1858)
заселяет Dreissena polymorpha из речных и озерных
сборов; неизвестно, заражены ли каспийские моллю-
ски этого и близких эвригалинных видов, например
«квагга» D. bugensis. В оз. Охрид С. acuminata встре-
чается в локальных дрейссенах, а вид С. klimentinus
Raabe, 1965 — только в охридской популяции D. poly-
morpha, если определение хозяина верное. В США вид
ТИП CILIOPHORA. КЛАСС OLIGOHYMENOPHOREA
853
Рис. 367, б. Scuticociliatida, Parastomatida — симбионты моллюсков.
Thigmophrya saxicavae (А—Г)', Myxophthirus anomalocardiae (Д); Protanoplophrya stomata (E, Ж, Л); P. bithyniae (3—К). (По: Raabe, 1972 (£—JI); Fenchel,
1965 (А—Г); Da Silva Neto, 1992 (Д)).
Fig. 367, 6. Scuticociliatida (Thigmophrya, Myxophthirus); Parastomatida (Protanoplophrya) — symbionts of molluscs.
из Anodonta grandis, Lampsilis siliquoidea и 10 других
хозяев определен как С. curtus, но видовые различия у
этого рода незначительные, определение может быть
неточным.
С. anodontae (Ehrenberg, 1838) Stein, 1861 (= С. raa-
bei Kahl, 1935; C. ochridensis Georgevitch, 1950, partim)
обитает в Anodonta cygnea в Европе, в Elliptio compla-
natus — в США, в Anodonta rubens — в Египте. Хозя-
ева других видов следующие: С. lamellidens Ghosh,
1918 и С. elongatus Ghosh, 1918 — в Lamellidens margi-
nalis, Индия; С. ишоий Raabe, 1932 — в Unio pictorum,
U. tumidus, Anodonta cygnea', C. cucumis Uyetnura, 1935 —
в Anodonta lauta, Япония; C. curtus (Engelmann, 1862) —
в Unio pictorum, U. spp., Anodonta cygnea, A. lauta,
A. grandis, A. marginata, A. implicata, Lampsilis radiosa,
L. cariosa, Alasmidonta undulata, Unio tumidus и в дру-
гих хозяевах в Европе, Японии и США; С. acuminatus
(Claparede et Lachmann, 1858 in Plagiotoma) — в Dreis-
sena (= Dreissensia) polymorpha, вместе с хозяином за-
везена в США и Канаду; С. klimentinus Raabe, 1965 —
в D. polymorpha (только в Югославии); С. magna Kid-
der, 1934 — в Elliptio complanatus, США; С. ochridensis
Georgevitch, 1950 — в Anodonta sp., Югославия. Назва-
ние без рисунка и диагноза С. lamellidens subsp. medio-
nucleus Gong, Xiao et Shen, 1990 невалидное. Вид
C. raabei Kahl, 1935 — вероятный синоним типового
вида С. anodontae. Много ложных определений —
С. curtus в Anodonta woodiana (Китай), в Lamellidens
marginalis (Индия) и т. д. Старинные виды Plagiotioma
difformis Perty, 1852 иР. concharum Perty, 1852 из Ano-
donta cellensis, A. rostrata и Unio batavus не восстанов-
лены как валидные.
Род Conchoscutum Raabe,
1947
Типовой вид С. inversum из двустворчаток; во
всем как Conchophthirius, но вестибулярная цилиатура
образована не правыми, а левыми кинетами. Число со-
макинет особенно велико, перистом кажется рудимен-
тарным. Хозяева — наяды Unio pictorum, U. crassus,
Anodonta cygnea', редкий вид, только в чистой воде
крупных озер Европы (Литва, Венгрия, Польша).
854
ALVEOLATA
Род Discoftirius Jankowski gen. n.
Один из видов рода Conchophthirius (С. discophorus
Mermod, 1914) из мелких пресноводных двустворок
Sphaerium corneum, Pisidium casertanum, Р. obtusale и
Musculium lacustre в Европе и Сибири — это вид с ши-
роким телом и большим числом кинет, имеет четкую
присоску — обширную вмятину с округлым контуром
на левой стороне тела, прилегающей к эпителию хозя-
ев. Здесь все сомакинеты сгущаются, кинетосомы в
них тесно сближены и тигмозона обособлена без фраг-
ментации кинет. Столь четкой присоски нет у других
видов рода, поэтому можно выделить новый род или
подрод для этого аберрантного вида. Вид не удалось
найти в осмотренных сфериидах Петербурга и энде-
миках Байкала, но он обычен в моллюсках из придо-
рожных канав Иркутской обл. Присоску легко видеть
прижизненно; при высушивании в коллоидном кра-
сителе — опаловой синьке и в нигрозине эта зона ин-
тенсивно красится в отличие от остальной поверх-
ности тела.
Отряд Parastomatida Jankowski ordo n.
(рис. 367, б)
Отряд введен ранее в тезисах (Parastomatida Jan-
kowski, 1978); диагноз дан в статье (Янковский, 1980).
Тезисы не считаются печатной работой, поэтому тот
же таксон предлагается здесь как новый.
Небольшая группа аберрантных симбионтных ци-
лиат; внешне напоминают астомат; тело червеобраз-
ное, крупное, с густой цилиатурой в многочисленных
вплотную сближенных сомакинетах. В отличие от ас-
томат имеется рудимент ротовой цилиатуры субапикаль-
но сбоку; перистом небольшой, с продольными стомо-
кинетами неясной гомологии, вероятно, это мембрана
и мембранелла М2. Эндопаразиты в кишечнике прес-
новодных гастропод. Этих форм нельзя отнести к асто-
матам, лишенным следа ротовой цилиатуры, и к тиг-
мотрихам, имеющим непропорционально крупный пе-
ристом с четкими компонентами тетрахимениума (но с
мелкой Ml).
В ревизии тигмотрих Раабе (Raabe, 1971) приведе-
но 2 вида из Японии и Польши; Раабе не знал статью с
подробным описанием третьего вида особого рода из
Египта (Rohrbach, 1936), не упоминались также наход-
ки видов в Индии. Раабе относил известные ему фор-
мы к отряду Thigmotrichida — смеси всевозможных
симбионтных групп, которой нельзя было дать общий
диагноз. По Раабе, единственный известный ему род
Protanoplophrya мог произойти независимо от астомат
и все признаки сходства появились конвергентно при
адаптации неизвестного предка к эндопаразитизму в
кишечнике — удлинение тела и ядра, полимеризация
кинет, увеличение числа вакуолей, регресс ротовой
цилиатуры.
Если выводить астомат от Hysterocinetidae (Scutico-
ciliatida), парастоматы не имеют отношения к этой ли-
нии; астоматы сохранили присоску и подстилающий
ее фибриллярный комплекс, рот находился на постеро-
не и исчез. Другой вариант — астоматы произошли от
парастомат, при полной утрате ротового рудимента.
Сейчас нет аргументов по обеим гипотезам, и в период
молекулярной филогенетики нет смысла решать нераз-
решимые задачи; достаточный материал для секвени-
рования ДНК легко собрать при вскрытиях обычной
гастроподы Bithynia tentaculata, основного хозяина па-
растомат в Европе, которого легче вскрывать, чем
крупных Viviparus.
Сем. Protanopiophryidae Miyashita, 1929
Впервые предложено как подсемейство в составе
Anoplophryidae, которое Мияшита (Miyashita, 1929)
считал наиболее примитивным среди астомат (без при-
соски и фиброма). Открытый им вид с рудиментом ци-
лиатуры как примитивный среди астомат был поме-
щен в указанное семейство, но обособлен от осталь-
ных родов астомат.
Раабе в своей ревизии неправильно пишет по все-
му тексту название рода (как Protoanoplophrya) и се-
мейства; в оригинале — Protanoplophrya. Единствен-
ное семейство в отряде с диагнозом отряда; включает
2 рода.
Род Protanoplophrya Miyashita, 1929
Типовой вид Р. stomata из кишечника пресно-
водных гастропод Viviparus japonicus и V. malleatus в
Японии; встречается вместе с гистероцинетами (такая
же пара — в европейских Bithynia). Локус — задняя
часть кишечника в отделе, примыкающем к желудку;
редко в ректуме, где обитают гистероцинеты. Тело
червеобразное, равной длины, узкое и необычайно
длинное, до 1.5 мм, ширина около 70 мкм; антерон
слегка сплющен; небольшая ямка (вдавленность) на
антероне играет роль прикрепительной органеллы
(присоска). Кутикула толстая, в кортексе масса трихо-
цист, не выстреливаемых из тела, особенно спереди у
присоски. По предположению Раабе, это мукоцисты;
однако у кишечных цилиат часты эндобактерии, они
могли быть приняты за трихоцисты у этого вида. Тело
гибкое, несократимое. Реснички длиной 5 мкм равно-
мерно покрывают все тело; хотя проведена импрегна-
ция серебром и дан рисунок перистома, нет рисунка и
описания топографии кинет, не указано их примерное
число, наличие швов, зон разрыва кинет.
Перистом — удлиненный участок тела, около
70 мкм; в центре по оси — ротовая щель, справа моно-
кинета (основание мембраны), слева непосредственно
вдоль щели двойной аргентофильный ряд; по всей зоне
сеть фибрилл; мембрана активная, у рта скопление ва-
куолей, красящихся нейтральротом, но гастриолей в
клетке слишком мало, и они мелкие, особи должны пи-
таться осмотически (по современной терминологии,
пиноцитозом). Ядро вытянуто на всю длину клетки,
микронуклеус один, величиной 20 мкм. Большое число
вакуолей, до 60, рассеяно по всему телу. Размножение
почкованием; обычно отделяются 1—2 почки, редко 3;
особи средних размеров делятся на 2 равные части;
длина мелких около 200 мк, плавающих цепочек нет.
Новый подрод Lanitophrya Jankowski subgen. n.
предлагается для типового вида Protanoplophrya bithy-
ТИП CILIOPHORA. КЛАСС OLIGOHYMENOPHOREA
855
niae Raabe, 1933 —P. (Lanitophrya) bithyniae. Вид част
в кишечнике битиний, в частности в Петербурге, пока
указан для Bithynia tentaculata, другие виды битиний
не проверены. Тело сплющено латерально, ланцето-
видное, заострено сзади, относительно короткое по
сравнению с Р. stomata-, размеры тела всего 130—
260 X 50—60 мкм; ядро червеобразное, вытянуто поч-
ти на всю длину клетки; 20—30 вакуолей в 2 продоль-
ных рядах. Раабе провел импрегнацию сухих мазков
по Клейну; вероятно, вид имеет около 60 кинет, число
их трудно установить из-за разрывов и фрагментации
рядов по всему телу, рядов меньше у апекса; дуговид-
ная предротовая щель ведет к субапикальному пери-
стому (положение рта и укорочение тела — признак
подрода), имеющему такое же строение, как у япон-
ского вида. Имеется короткая глотка, под ртом много
вакуолей без пищевых частиц; трихоцист нет. Размно-
жение только делением, не геммацией. Локус в хозяи-
не — задний сегмент кишечника, особей больше в от-
сутствие гистероцинет.
Род Paranoplophrya Rohrbach, 1936
Типовой вид Р. vivipari из кишечника Vivipa-
rus unicolor из Нила в Египте; локус — средняя часть
кишки и ректум, особенно на стыке этих отделов. Им-
прегнация кинетома и перистома не применена. Тело
удлиненно^, широкое, около 200 X 60 мкм, плавно за-
круглено на концах; апекс с плотным акроном, вероят-
но, это органелла прикрепления. Цилиатура полная,
равномерная. Перистом ниже, чем у вида из Bithynia,
это глубокая ямка в продольной щели; вдоль нее рас-
положена мембрана из большого числа склеенных рес-
ничек. Нет признаков функционирования рта, нет пи-
щевых вакуолей; весь этот комплекс считается руди-
ментом; вероятно, это зона активного осмотического
питания, поскольку вне этой зоны кутикула прочная.
20—30 вакуолей рассеяны в беспорядке по телу; ядро
вытянуто почти на всю длину особи. Размножение не
изучено.
Род отнесен Рорбахом (Rohrbach, 1936) к подсем.
Anoplophryinae подотряда Astomata, с изменением
диагноза группы. Статьи Мияшита и Раабе им не цити-
руются; в свою очередь Раабе в монографии тигмотрих
не упоминает род и вид Рорбаха. Рорбах не знал также
статьи Сонсино (Sonsino, 1892), в которой вид парасто-
мат из того же хозяина в Египте, у Каира, описан как
Opalina sp. (к опалинам вначале относили не только
современных протоцилиат, но и ряд астомат).
Другие находки парастомат упомянуты ниже. Пер-
вые три вида плохо описаны, только по форме тела и
по хозяину можно догадаться, что это парастоматы.
Anoplophrya elongata Ghosh, 1921 — в ректуме
«мелких пресноводных гастропод» в Индии; размеры
тела 150 X 30 мкм.
Anoplophrya cylindrica Ghosh, 1922 — из кишечни-
ка Bellamya bengalensis (= Viviparus}, Индия; размеры
тела около 230 мкм.
Leucophrys vermicularis Leidy, 1877 — США, в ки-
шечнике Paludina decisa (= Viviparus, = Campeloma}.
Сепед (Cepede, 1910) в монографии астомат включил
этот вид в состав рода Anoplophrya.
Protanoplophrya sp. in Kozloff, 1960 — мельком от-
мечена находка вида в вивипариде Campeloma genicu-
latum на северо-западе США, вместе с гистероцинета-
ми Ptychostomum campelomae.
Anoplophrya variabilis Ghosh, 1921 из неопределен-
ных мелких гастропод в Калькутте может быть гисте-
роцинетидой.
Подотряд Pleuronematina Faure-Fremiet
in Corliss, 1956 (отряд Scutikociliatida)
Перистом непропорционально велик, рот сдвинут в
нижнюю половину тела; мембрана УМ удлинена, до-
стигает вершины перистома; мембранеллы расположе-
ны не линейно и не ступенчато — М2 вытянута по оси
тела, Ml выше слева, М2 ниже справа.
Группа неопределенного состава; у Линна (Lynn,
2002) включает много мелких форм с короткой М2 и
почти линейным расположением мембранелл; если их
включить, будет неясна граница с остальными Scutico-
ciliatida и нельзя будет дать определенный диагноз
обеим группам. Лучше ограничить состав подотряда
родом Pleuronema й несколькими близкими, несо-
мненно родственными родами цилиат, часть которых
обитает в морских беспозвоночных. Обзор свободно-
живущих родов приводится в следующих работах
(Dragesco, 1968; Dragesco, Dragesco-Kerneis, 1986;
Struder, 1991; Foissner et al., 1994, 1999).
Сем. Pleuronematidae Kent, 1881
(рис. 368, a, 6)
Основания мембранелл узкие, не превращены в по-
ликинеты; в типичном тетрахимениуме у гименосто-
мат основания мембранелл с 3 кинетами в основании;
у плейронематид, несмотря на укрупнение мембра-
нелл, число рядов кинетосом в мембранеллах умень-
шено. М2 особо удлинена, продольная.
Род Pleuronema Dujardin, 1841
Типовой вид Р. chrysalis, по указанию Фро-
ментеля (Fromentel, 1874); это название можно встре-
тить как валидное в описаниях плейронем у многих
авторов вплоть до 1960-х гг., но ведущие цилиато-
логи от него отказались, сводя этот вид в синонимику
валидного вида Р. crassum Dujardin, 1841. Название
Pleuronema Dujardin, 1840 дано без диагноза, в следу-
ющем году с диагнозом; включены 2 вида — Р. crassa
и Р. marina-, вид Р. chrysalis был отнесен к роду Ра-
nophrys. В литературе авторство вида Р. chrysalis при-
писывают Штейну, Мюллеру, Эренбергу, Перти; пра-
вильно — Paramoecium chrysalis Muller, 1786 {Pleuro-
nema chrysalis in Perty, 1852 и у последующих
авторов).
Виды плейронем однотипные; тело сплющено дор-
совентрально, широкое при виде с вента, закруглено
сзади и сужается к вершине; вакуоль над постероном;
почти вся вентральная сторона занята гигантским пе-
ристомом, справа кинеты идут вдоль него, слева часть
856
ALVEOLATA
Рис. 368, a. Pleuronematina.
Histiobalantium bodamicum (A—B); Gajewskiella macrostoma (Г, Д); Sulcigera comosa (£); Histiobalantium majus (Ж); Schizocalyptra magna (3); H. natans (И).
(По: Foissner et al., 1999 (A—В ); Dragesco, 1968b (Ж, 3); Dragesco, Iftode, 1972 (77); Оболкина, 1989 (Г, ffy, 1995 (£)).
Fig. 368, a. Pleuronematina.
рядов заканчивается у перистома, остальные огибают
рот; на дорсуме кинеты продольные. Нет послерото-
вых рядов, кроме фрагментов слева. Вершина перисто-
ма почти достигает апекса или смещена вниз, тогда ви-
ден предротовой шов. УМ гигантская, до вершины пе-
ристома справа, огибает рот снизу и слева; Ml —
мелкая, сбоку от вершины резко удлиненной мембра-
неллы М2 с извитым нижним концом; М3 — сложной
формы, извитая, фрагментирована, лежит правее рта.
От рта к мембране идут аргентофильные линии — реб-
ра кортекса. Свободноживущие виды в пресной воде,
эстуариях и в море, где более разнообразны. Плейро-
нем легко узнать по гигантской парусовидной мембра-
не, длинным соматическим ресничкам; особи непо-
движны на субстрате или плавают, нередко перемеща-
ются прыжками с помощью группы особо удлиненных
каудальных ресничек, направленных назад и в сторо-
ны от постерона. Кортекс с трихоцистами. Аргиром
очень сложный, с продольными аргиронемами и пря-
моугольниками кортекса; в перистоме неправильная
сеть из мелких ячеек, вдоль кинет ровные ряды прямо-
угольников.
Glossa Corsica Gourret et Roeser, 1888 — типовой
вид рода Glossa G. et R., 1888. По Калю (Kahl, 1931),
вид невалидный как синоним вида Pleuronema corona-
tion; описание неграмотное, вид точно неопредели-
мый. Отсутствие каудальных ресничек — признак
вида, но они есть у всех плейронем.
Уже ранние авторы признали вид Pleuronema chry-
salis (Muller, 1786) валидным, сведя один или оба вида
Дюжардена в синонимы. Другие возражали, что Мюл-
лер зарисовал не плейронем, а парамеций (или, скорее,
фронтоний). Вероятно, правы те, кто не признал этот
вид валидным.
Р. crassum Dujardin, 1841 —пресноводный вид; не-
редко определялся как Р. chrysalis; описание кинетома
у Patsch, 1974.
Р. coronatum Kent, 1881 —пресноводный вид; мно-
гократные описания в море вызваны путаницей с
очень близкими и многочисленными морскими вида-
ми, которые описаны и названы лишь сравнительно
недавно. Этот вид считают надвидом — комплексом
валидных видов или подвидов Р. balli, Р. borrori,
Р. smalli, Р. arenaria, Р. coronatum. Поэтому рисунки и
ТИП CILIOPHORA. КЛАСС OLIGOHYMENOPHOREA
857
Рис. 368, б. Pleuronematina.
Pleuronema multinucleatum Agamaliev et Suleimanova, 2004 = «Р. marinum» у Агамалиева, 1983 (А, Б)-, P. marinum (Г, Д); перистом P. coronatum (K); Histioba-
lantium majus (Ж, И)', H. natans (5); Pleuronema coronatum (К). (По: Агамалиев, 1983 (A, Б); Dragesco, 1968b (B—E, K); Dragesco, Iftode, 1972 (3, Оболки-
на, 1991 (Ж)).
Fig. 368, 6. Pleuronematina.
описания «Р. coronatum» отличаются у разных авто-
ров, применивших точные методы импрегнации.
Другие виды: Р. glaciate Corliss et Snyder, 1986 (у
этого вида из льдов Антарктики показано разделение
УМ на 2 сегмента разного строения); Р. grassei Drages-
co, 1960 (по ядрам напоминает Histiobalantium}-, Р. ma-
rinum Dujardin 1841 (валидный, принятый вид; в лите-
ратуре много переописаний, но и этот вид считают
сборным — это надвид, под одним названием описы-
ваются разные морские виды); Р. lynni Femandez-Lebo-
rans etNovillo, 1994; Р. nolandi Small, 1967 (= P. setige-
ra in Borror, 1963); P. папа Tucolesco, 1962; P. oculata
Dragesco, 1960 (с пигментным пятном у апекса); Р. puy-
toraci Groliere et Detcheva, 1974; P. roscoffensis D.,
1968; P. salmastra Dragesco et Dragesco-Kemeis, 1986
(= P. coronatum in Dragesco, 1968); P. simplex D., 1960;
P. smalli D., 1968; P. setigera Calkins, 1903; P. arenicola
D., 1960 (вид с цельным или фрагментированным яд-
ром); Р. balli Small, 1968; Р. borrori D., 1968; P. tardum
Czapik et Jordan, 1977.
В книге Агамалиева (1983) из Каспия описаны
виды Р. marinum и Pleuronema sp., позже они получили
названия Р. multinucleatum Agamaliev et Suleimanova,
2004 и P. ovatum A. et S., 2004. У первого вида 7 округ-
лых мелких ядер в продольной линии — зарисован
явно эксконъюгантвида/5, marinum; у плейронематид,
тигмотрих и перитрих синкарион делится трижды до
стадии 7 мелких неделящихся макронуклеусов +
1 микронуклеус, затем начинается их сегрегация.
Загадкой остается Pleuronema anodontae Kahl,
1926, «редкий в Anodonta, но встречающийся регу-
лярно в видах Sphaerium»; никто его не видел; в ная-
дах есть тигмотрихи-анцистриды, но в сфериидах
их нет.
Род Pleurocoptes Wallengren, 1896
Типовой вид Р. hydractiniae — некрупные (до
100 мкм) плоские формы с широким телом, эктоком-
менсалы на гидроиде Hydractinia echinata, низкие ко-
лонии которого сплошным ковром покрывают устья
раковин гастропод, заселенных пагуридами. Гидрак-
тинии и близкие роды обитают на многих других бес-
позвоночных, много свободных видов, но цилиатологи
их не осматривали. Форе-Фремье (Faure-Fremiet,
1961b) переописал вид с гидрактиний — симбионтов
Eupagurus bernhardi; неотличимые формы найдены
858
ALVEOLATA
мной на локальных пагуридах биостанции Восток, что
резко расширяет ареал рода.
Тело плоское, овальное, очень широкое; перистом
короче, чем у плейронемы, хорошо выражены верхний
и нижний продольные швы на венте. Кинеты много-
численные (44—68), особо сгущены левее рта, образуя
фактически обширную присоску; вдоль дорсального
края идет полоса из 5 сближенных тигмокинет с более
густыми ресничками. На правой стороне кинеты раз-
режены. 5—6 рядов укорочены над ртом слева. Пери-
стом в целом такого же типа, как у плейронем, но
М2 — однородная по всей длине (у плеронем середина
М2 — один ряд кинетосом).
Р. furgasoni Small et Antipa, 1978 — вид с морских
звезд в США, по морфологии ближе к плейронеме; пе-
ристом крупный, в середине М2 — гаплокинета; отли-
чие — резкое удлинение ряда Ml.
Род Schizocalyptra Dragesco,
1968
Типовой вид S. magna', род монотипичен.
Очень крупный морской псаммонный вид (150—
300 мкм) с густой цилиатурой; по всему телу реснички
чередуются с длинными тактильными щетинками;
ядро гантелевидное, вакуоль субтерминальная, кор-
текс с трихоцистами. На венте четкие продольные
швы; число кинет 64—ПО, нет фрагментов кинет
выше и левее рта; предротовой шов продолжается на
дорсуме. Перистом крупный (75—102 мкм), мембрана
УМ до вершины перистома, но в нижней части фраг-
ментирована на 11 сегментов, по 5—10 пар кинетосом
в каждом. Мембраиеллы нитевидные, расположены,
как у плейронематид; Ml, М2 и оба сегмента М3 —ди-
кинеты в отличие от плейронемы; рот со всех сторон
окружен радиальными аргентофильными опорными
ребрами. Аргиром, как у плейронем, сеть в перистоме
и полосы прямоугольников разной формы вдоль ки-
нет. По Дражеско (Dragesco, 1968b), есть черты сход-
ства у Schizocalyptra и у одного из видов плейронем
(Р. simplex).
Род Hippocomos Czapik et Jordan,
1977
Типовой вид Н. loricatus', солоноватоводный
вид из польской Балтики; тело вытянутое, перистом
удален от концов тела, кинеты относительно немного-
численные (21) с аргиромом в виде правильных прямо-
угольников (отличие от плейронем с более сложной
Системой прямоугольников); хорошо выражены верх-
ний и нижний швы вента; нет фрагментов кинет выше
и левее рта. Мембрана почти до вершины перистома,
не загнута снизу, рот растянут; М2 удлинена, Ml — в
виде фрагмента на ее вершине, М3 — в 2 поперечных
сегментах.
У Н. salinus Small et Lynn, 1985 тело сильнее вытя-
нуто, ядро гантелевидное, кинет меньше (16), мембра-
на из 2 сегментов разного строения. Оба вида имеют
скутикус в виде линии кинетосом; вакуоль субтерми-
нальная.
Сем. Sulcigeridae Gajewskaja, 1928
= Сем. Histiobalantiidae Puytorac
et Corliss in Corliss, 1979
Внешний облик, как у плейронем, мембрана в
2 сегментах разного строения, с поликинетой в ниж-
ней части; мембранелла М2 не вытянута по оси, пре-
вращена в диагональную поликинету у вершины пе-
ристома.
Род Histiobalantium Stokes,
1886
Типовой вид Н. agile', крупные формы с боль-
шим числом кинет, длинным предротовым и послеро-
товым швами; ядро двойное, оба фрагмента с несколь-
кими микронуклеусами; вакуоль терминальная; кор-
текс с трихоцистами. Вид описан из пресных вод
США; ротовую цилиатуру смогли изучить только при
импрегнации этого и других видов рода. Мембрана
почти достигает вершины перистома, в нижней части
не фрагментирована на 2 части, но имеет другое стро-
ение — превращена в поликинету. Рот и все мембра-
неллы погружены в глубокую полость, ротовая зона с
ребрами аргирома растянута, и все мембраиеллы сме-
щены вверх. Ml — тонкий длинный диагональный
ряд, М2 — массивная поликинета с фрагментом парал-
лельно Ml, М3 — длинная монокинета по диагонали,
идущая от мембранелл вправо вниз. Положение М2 —
не линейное.
Н. agilis (Stokes, 1886), типовой вид; пресноводный
вид, вероятный синоним вида Pleuronema natans Cla-
parede et Lachmann, 1859 (H. natans).
Pleuronema inflatum Lauterborn, 1915, по Калю
(Kahl, 1931), это вероятный синоним вида Н. natans.
Н. majus Kahl, 1933; хорошо изученный валид-
ный вид из пресных вод, определение в море сомни-
тельное.
Н. majus in Agamaliev, 1972; из Каспия, резко отли-
чается от формы из пресных вод, почти нет нижнего
шва, определение неверное.
Н. natans (Claparede et Lachmann, 1859); валидный
пресноводный вид; у Каля 2 морфотипа — f. viridis и
f. nigricans.
Н. semisetatum Noland et Finley, 1937. Вид морской,
крупный (126—205 мкм), с одним ядром, без тактиль-
ных щетинок, сзади с разрозненными каудалиями; не-
обычный признак — 5 вакуолей в линию вдоль всего
тела. Нет сложной цилиатуры перистома типа Н. na-
tans, перистом, как у Pleuronema marinum. Родовой
статус неясен.
Другие виды — Н. marinum Kahl, 1933; Н. marinum
var. major К, 1933; массивный эндемичный вид най-
ден мною в Байкале в толще песка в прибойной зоне
(пока не назван). Вид Pleuronema grassei Dragesco,
1960 с 2 ядрами может относиться к Histiobalantium. В
особый подрод следует выделить пресноводный вид
Н. bodamicum Krainer et Muller, 1995 с почти округлым
телом, гигантским перистомом и нетипичным положе-
нием мембраны УМ и мембраиеллы М3 — Limnostoma
Jankowski subgen. п.; мною изучена фиксированная
проба из Байкала.
ТИП CILIOPHORA. КЛАСС OLIGOHYMENOPHOREA
859
Род Sulcigera Gajewskaja, 1928
Типовой вид S. comosa по монотипии; из планк-
тона Байкала; вид переописан с применением им-
прегнации Оболкиной (1995а, 19956). Длина тела
74—90 мкм; тело удлиненное, слегка сплющенное
вентрально, где на всю длину тела растянута узкая по-
лость перистома; ядро почковидное. Цилиатура густая,
длинные реснички в 80—88 рядах, спереди короткий
шов. Перистомальную цилиатуру можно понять толь-
ко при сравнении с Histiobalantium, несомненно родст-
венной плейронематидой. Мембрана УМ извитая, осо-
бо закручена снизу; верхние мембраиеллы Ml и М2 на
рисунках Оболкиной показаны как гаплокинеты, ниж-
няя М3 не выявлена. Вероятно, ротовая цилиатура
нуждается в повторном изучении. Оболкина не при-
знает сем. Sulcigeridae Gajewskaja, 1928 и числит род в
составе гистиобалантиид; но в таком случае название
Sulcigeridae имеет приоритет.
Род Gajewskiella Obolkina, 1989
Типовой вид G. macrostoma по монотипии; на-
звание рода (в честь Н. С. Гаевской) неграмотное,
должно быть Gajewskajella пот. согг. Бентосный вид
из прибрежной зоны Байкала; тело некрупное (около
80 мкм), вытянутое, с густой цилиатурой (50—55 рядов);
кинеты сходятся зеркально к длинному апикальному
шву, укорочены над перистомом вдоль латерального
шва и ниже перистома. Перистом относительно неболь-
шой по сравнению с Histiobalantium', мембрана харак-
терной сигмоидной формы, ее нижний сегмент на ри-
сунке Оболкиной (1989) представлен дугой моносом,
но в тексте подчеркивается, что мембрана цельная, с
двойным рядом кинетосом в основании. Мембраиеллы
Ml и М2 смещены вправо, имеют вид длинных парал-
лельных монокинет, или Ml — мелкий рудимент;
М2 — дикинета (гомология мембранелл неясная); от
М3 остался фрагмент справа; нет ребер пелликулы на
дне перистома. Ядро вытянутое, вакуоли многочислен-
ные, с выводными порами правее и левее перистома.
Сем. Mytilophilidae Jankowski fam. m.
Крупные формы с полимеризацией кинет; пери-
стом относительно небольшой, узкий, с уникальным
типом мембранелл — все мембраиеллы сдвинуты к
основанию мембраны, удлинены Ml и М2, М3 пре-
вращена в поле кинетосом. Род Mytilophilus был отне-
сен к Peniculistomatidae, но заслуживает как мини-
мум подсемейства.
Род Mytilophilus Antipa et Dolan, 1985
Типовой вид М. paciflcae, симбионт мидий My-
tilus californianus в штатах Калифорния и Орегон, на
западе США. Очертания тела, как у Peniculistoma myti-
li\ тело крупное, сплющено латерально, с полимериза-
цией кинет и резким удлинением обоих швов, особен-
но предротового; перистом относительно небольшой
для столь крупной формы, смещен ниже экватора.
Мембрана длинная, снизу изгибается и уходит в не-
большую полость; мембранелла Ml прижата к основа-
нию мембраны, удлинена, очень тонкая; М2 — про-
дольная поликинета вдоль мембраны; М3 — крупное
поле кинетосом в полости перистома. В мидиях Рос-
сии (Черное море, северные и дальневосточные моря)
этот род не отмечен. При внешнем сходстве с Penicu-
listoma mytili нет ничего общего в организации рото-
вой цилиатуры; если будут обнаружены переходные
формы, можно объединить Mytilophilus и Peniculistoma
в одном семействе.
Сем. Peniculistomatidae Fenchel, 1965
(рис. 369, а)
Массивные формы с полимеризацией кинет, сплю-
щенные латерально; мембраиеллы не прижаты к осно-
ванию мембраны, Ml в виде длинной узкой полосы,
М2 — параллельная поликинета, М3, как у плейронем,
но не поле кинетосом, обнаруженное у Mytilophilus. У
Линна (Lynn, 2002) в составе этого семейства 3 рода —
Echinosociella, Mytilophilus и Peniculistoma', все эти
формы имеют резко различный тип перистомальной
цилиатуры, и их родство неочевидно. Неясно также
положение рода Compsosomella. Вероятно, существует
еще немало симбионтных цилиат с аберрантным ти-
пом перистома, произошедших от более простых плей-
ронематид, и мы знаем пока лишь несколько видов с
совершенно несходным строением мембраны и мемб-
ранелл. В этой ситуации следует обособить эти роды
хотя бы на уровне подсемейств.
Род Peniculistoma Jankowski, 1964
Типовой вид Conchophthirus mytili Morgan,
1925; крупный вид (ПО—180 мкм) из мидий; отмечен
в мантийной полости Mytilus edulis, М. galloprovincia-
lis в Европе и на востоке США; пока не найден в миди-
ях Пацифики, хотя в наших дальневосточных морях
есть вид М. edulis\ преобладает крупная митилида Сге-
nomytilus grayanus с паразитическими тигмотрихами и
ринходидами. Тело массивное, сплющено дорсовент-
рально, очень широкое, с ~200 сомакинетами, сходя-
щимися к длинным швам — предродовому и послеро-
довому; перистом сдвинут далеко вниз от апекса, и по-
слеродовой шов смещен на расширенный постерон.
Авторы, первыми изучавшие С. mytili, дали совершен-
но неправильные рисунки перистома, воспроизведен-
ные у Раабе (Raabe, 1971), поэтому вопрос о система-
тическом положении рода не мог быть решен; Фенхель
(Fenchel, 1965а) и Янковский (1972а) получили сход-
ные результаты, изучая вид при импрегнации и в суле-
ме при рельефном боковом освещении. Перистом лате-
ральный, открыт с левой стороны, вытянут на треть
длины тела; в нижней части мелкий рот и воронковид-
ная глотка. Ml резко удлинена, идет вдоль всего лево-
го края неглубокой полости; М2 — массивная, толщи-
на ее уменьшается вниз; М3 — в виде поперечных
фрагментов справа; мембрана — до вершины перисто-
ма. В кортексе местами палочковидные мукоцисты.
860
ALVEOLATA
Рис. 369, a. Pleuronematina.
Peniculistoma mytili (А—Д), Pleurocoptes hydractiniae (E—3). (По: Fenchel, 1965 (A); Faure-Fremiet, 1961 (E—3); Б—Д— ориг.).
Fig. 369, a. Pleuronematina.
Этот вид вначале отнесли под вопросом к роду
Conchophthirius', Каль (Kahl, 1934) отметил несоответ-
ствие вида диагнозу рода и предложил новый род Мог-
gania Kahl, 1934; одновременно Раабе (Raabe, 1934),
изучивший вид в мидиях Балтики, предложил новый
popKidderia Raabe, 1934. Корлисс (Corliss, 1960) ука-
зал на гомонимию и непригодность обеих названий, но
не предложил замены, вероятно, не был уверен в необ-
ходимости нового рода для С. mytili. Янковский (Jan-
kowski, 1964b) предложил для этого вида новый род
Peniculistoma, принятый Фенхелем (Fenchel, 1965а) и
последующими авторами. Корлисс (Corliss, 1979) упо-
минает названия Demorgania и Ciliomorgania в сино-
нимии рода, но не приводит авторов и дат; в литерату-
ре найти их не удалось.
Сем. Echinosociellidae Jankowski fam. n.
По внешнему облику сходны с плейронемами, но
перистом короче, ближе к апексу, несходно строение
мембраны (нижний сегмент превращен в поликинету)
и всех мембранелл. М2 расположена диагонально,
смещена влево, с фрагментами у вершины.
Род Echinosociella Berger in Small et Lynn,
1985
Типовой вид E. striatus. Авторы рода воспро-
извели рисунок из диссертации Жака Бергера (инфузо-
рии из морских ежей) с краткой аннотацией, не указав
хозяина, локус и место сбора; это «эндосимбионты» (в
кишечнике?) ежей. Тело удлиненно-овальное, кинеты
слева идут вдоль перистома до заднего шва, правые
кинеты заканчиваются на униполярном послеротовом
шве; по краям от предротовой бисеканты — обособ-
ленные вершины кинет с удвоением и сближением ки-
нетосом. Перистом относительно короткий (по сравне-
нию с Pleuronema} и широкий; мембрана до вершины
перистома, снизу слева превращена в трикинету, если
правильно понять рисунок Бергера; либо это сегмент
одной из мембранелл. Ml — короткий прямоугольник
с 4 кинетами у вершины перистома; М2 — дуговидная,
лежит диагонально слева; под ней фрагменты тонкой
М3. У вершины М2 — группа аргентофильных телец,
возможно фрагменты основания. В северных и дальне-
восточных морях России в ежах рода Strongylocentro-
tus не найдены.
ТИП CILIOPHORA. КЛАСС OLIGOHYMENOPHOREA
861
Род неясного положения —
Compsosomella Small et Lynn, 1985
Типовой вид С. psammobia, вероятно из мор-
ского псаммона; дан лишь рисунок с краткой аннота-
цией (Small, Lynn, 1985). Длина тела 65 мкм; тело су-
жается книзу, расширено у апекса, вакуоль субтерми-
нальная, на венте короткий верхний шов и длинный
нижний (оба бисеканты). Кинеты немногочисленные,
обходят перистом; как у плейронем, обособлено поле
сегментов кинет (7) в левой части перистома. Пери-
стом вытянут на 2/3 длины тела; мембрана до вершины
перистома, в нижнем сегменте кинетосомы разреже-
ны; Ml и М2 — у вершины перистома, Ml — изогну-
тая, М2 — поперечная, М3 — в виде дуги внизу; вдоль
перистома — исчерченная аргентофильная полоса,
как у Histiobalantium. Скутикус — линия кинетосом.
Все мембранеллы — дикинеты; у Histiobalantium
в поликинеты превращены М2 и нижний сегмент
мембраны, объединение родов в одном семействе
нежелательно.
Род Corlissia Dragesco,
1960
Типовой вид Corlissia picta (Dragesco, 1954 in
Corlisia) по мнотипии. Первое название рода Corlisia
Dragesco, 19^54 ошибочное, было заменено новым. Ма-
лоизученный морской вид из псаммона; некрупные
цилиаты величиной 60—70 мкм с 70 продольными ки-
нетами, сходящимися зеркально к предротовому шву и
перистому. Вакуоль сзади у постерона, ядро вытяну-
тое, с несколькими микронуклеусами; кортекс с мел-
кими трихоцистами или мукоцистами. Перистом в
виде недлинной продольной щели; нет сведений о пе-
ристомальной цилиатуре. Этот род неясного положе-
ния включали в состав кариореликтид сем. Geleiidae
или предполагалось выделение его в смежное новое
семейство; но у гелеид другой тип ядер. Сложный ар-
гиром, показанный Дражеско (Dragesco, 1960), соот-
ветствует типу Pleuronema, поэтому в данном обзоре
род отнесен к подотряду Pleuronematina, пока условно
в составе сем. Corlissiidae Jankowski fam. n. с приве-
денным выше диагнозом рода.
Отряд Hysterocinetida Jankowski, 1973
(рис. 369, 6—370, а)
Крупные вытянутые формы со сплющиванием
тела, крупной апикальной присоской на нижней сторо-
не и перистомом у постерона, кишечные паразиты бес-
позвоночных. Размеры особей до 200 мкм, кинеты
продольные, многочисленные, в основном биполяр-
ные, топография цилиатуры нарушена наличием се-
кантных зон. Присоска дуговидная, овальная или
округлых очертаний, на ее поверхность продолжаются
вершины группы осевых сомакинет, образуя обособ-
ленный тигмотактический аппарат (тигмон). Импрег-
нация выявляет аргентофильную сеть — межкинети-
ческие фибриллы по всему телу — и мелкоячеистую
сеть на безресничной поверхности присоски. Под при-
соской сложнейшая система фибрилл; обособленные
пучки фибрилл направлены во все стороны, и всегда
есть особо четкая система поперечных дуговых фиб-
рилл; фибриллы видны при иммерсии, более четкие
при окраске гематоксилином. Система фибрилл может
занимать значительную часть антерона на присоске и
под ней.
Соматические кинеты с густо расположенными ки-
нетосомами, во многих участках тела образуются по-
перечные или диагональные вторичные ряды (парате-
ны), часты картины делинеации-кинет; к постерону ки-
нетосомы разрежены, топография нарушается, этот
отдел очень трудно зарисовать. У присоски, напротив,
сгущение кинетосом в правильных продольных рядах,
без фрагментации; здесь образуется характерное коль-
цо вокруг присоски; вершины всех кинет мелкие, рас-
положены вплотную, и кольцо состоит из сотен таких
обособленных сегментов, ограниченных кольцевой
фибриллой от сомакинет. Кольцо видно при импрегна-
, ции любым методом, ранними авторами не выявля-
лось.
Перистом смещен на широкий нижний конец тела;
это поперечный неглубокий желобок, в котором рань-
ше видели 2 параллельные мембраны. Вначале для
изучения пресноводных видов применяли только су-
хой метод Клейна и выявляли основания этих мемб-
ран; далее мембраны входят в узкую внутреннюю по-
лость (инфундибулюм) и здесь закручиваются спи-
ралью; она видна на живом материале, но, по Клейну,
не импрегнируется. Поэтому перистомальную цилиа-
туру долгое время представляли неточно, в упрощен-
ном виде. По новым данным, это сильно видоизменен-
ный тетрахимениум. В основании длинной УМ лежит
дикинета, идущая вдоль наружного желобка; в бук-
коне мембрана, дважды заворачивая, идет на внутрен-
ней стенке полости. В наружном желобке также па-
раллельно расположены УМ и одна над другой еще
2 мембраны Ml (до входа в буккон) и М2 (между УМ и
Ml) такой же длины и топографии, как УМ; в букконе
к ним добавляется извитая гаплокинета М3 (в основа-
нии УМ, Ml и М2 — дикинета). У типичных гимено-
стомат в основании Ml—М3 не менее 3 рядов кине-
тосом.
Ядро крупное, овальное, с одним микронуклеусом,
выше экватора; участок клетки между ядром и пери-
стомом занят трофоплазмой с множеством вакуолей,
этот участок красится прижизненно нейтральротом,
полон пищевых вакуолей и гранул. Удивительно, что
этих инфузорий долгое время считали безротыми (As-
tomata).
Недавно открыт род с аберрантным типом перисто-
ма (Paraptychostomum), выделяемый по этому призна-
ку в особое семейство; перистом обширный, с полиме-
ризацией кинетосом в массивной длинной полосе М2,
остальные компоненты имеют в основании типичный
набор кинетосом.
Деление монотомическое, полоса деления может
пройти под экватором, у части видов задняя особь на-
много меньше передней; если отделение томитов за-
держивается, образуются стробилы.
Все виды — эндопаразиты беспозвоночных, встре-
чаются в наземных и в крупных водных олигохетах,
часты в дождевых червях, встречаются у некоторых
862
ALVEOLATA
Рис. 369, 6. Hysterocinetida.
Ptychostomum gazawae (А, Б), фибриллы присоски Epicharocotyle grassei (Puytoracia in Raabe, гомоним, ныне Eminothigma) (В); Craticuloscuta gigas (Г); Pa-
raptychostomum .ahnae (Д); Elliptothigma limnodrili (E); Ptychostomum nkoldae (Ж); Epicharocotyle grassei (3). Цифрами обозначены уровни слоев фибрилл.
(По: Meier, 1954 (Е); Ngassam, Grain, 2000 (А, Б, Ж); Puytorac, 1968с (В, Гу, Raabe, 1972 (3); Ngassam et al., 1994 (ДУ).
Fig. 369, 6. Hysterocinetida.
Numbers indicate level of fibrillar layer.
моллюсков — только в гастроподах, нет в двуствор-
чатках. Группа в целом отмечена в Северной Амери-
ке (из Южной Америки пока известно лишь 2 вида), в
Европе, в северной Азии (включая Японию), в Афри-
ке (Египет, Габон, Камерун). В Байкале возникла груп-
па эндемичных видов, но родообразования нет; отме-
чено 6 видов рода Ptychostomum (Р. limnodrili, Р. elon-
gatum, Р. е. forma gigas, Р. pygostomum, Р. baicalensis,
Р. asymmetrica), все из олигохет, и вид из моллюсков
нового рода Ladopsis benedictiae в 2 видах Benedictia,
3 видах Baicalia и в Kobeltocochlea sp. «Эндемичный»
род Ladopsis сейчас не считается валидным, сведен в
синонимы рода Ptychostomum.
Систематическое положение группы до сих пор не-
ясное, взгляды специалистов противоречивые. Не-
сколько первых открытых видов отнесли к астоматам;
наличие «рудиментарного рта» заставило вывести сем.
Ptychostomidae из астомат, но оно не нашло определен-
ного места в системе. Опуская раннюю историю таксо-
на, отметим положение гистероцинетид в новых схе-
мах классификации. В системе Puytorac et al. (1974)
гистероцинеты не упоминаются, вероятно, включены
в Philasterina. В системе Янковского (1980) — в клас-
се Hymenostomata, подклассе Scuticostomata — отряд
Hysterocinetida Jank., 1973 с подотрядами Protoptycho-
stomatina (присоска без скелетного аппарата) и Hyste-
rocinetina (присоска со слоями фибрилл). В обеих изда-
ниях Guide (Small, Lynn, 1985; Lynn, Small, 2002) ранг
низкий, на уровне семейства скутицид. В Traite (Puyto-
rac, 1994) ранг неожиданно резко повышается до под-
класса Hysterocinetia Diesing, 1866 с одним отрядом
Hysterocinetida Diesing, 1866.
В статье по морфогенезу Ptychostomum (Njine,
Ngassam, 1993) авторы предложили повысить ранг се-
мейства внутри Oligohymenophora, в другой статье
(Ngassam, Grain, Njine, 1993) выделили подкласс Hys-
terocinetia в классе Oligohymenophora; в другом соста-
ве авторов (Ngassam, Puytorac, Grain, 1994) еще раз
выделяется тот же подкласс Hysterocinetia subcl. n. с
отрядом Hysterocinetida ordo п.; в Traite, как отмече-
но выше, авторство отряда и подкласса приписано
Дизингу, который ничего подобного не предлагал.
ТИП CILIOPHORA. КЛАСС OLIGOHYMENOPHOREA
863
Рис. 370, a. Hysterocinetida.
Ptychostomum vulgare (Л); Epicharocotyle kozloffi (F); Thurstonia kaczanowskii (S'): Protoptychostomum tertium (Г); Elliptothigma limnodrili (Д); Eminothigma
grassei (= Puytoracia) (E); Preptychostomum katashimae (Ж)\ Protoptychostomum simplex (3); Hysterocinetapaludinarum (И); H. pheretimae (Ky. Kozloffia catenu-
la (Л, M). (По: Raabe, 1972 (И, 3); Meier, 1954 (Д); Kaczanowski, 1963 (И); Puytorac, 1968b (А, В, Г, Ж, K—M); 1968c (Б, E)).
Fig. 370, a. Hysterocinetida.
Дизинг — автор сем. Hysterocinetina (в прежней транс-
крипции). Все это — результат поразительной неак-
куратности авторов Traite, делающей книгу источ-
ником дезинформации. Подкласс в данной сводке не
принимается, а отряд по приоритету назван Hysteroci-
netida Jank., 1973 (повторный диагноз см. Янковский,
1980).
Филогения группы намечена пока в общих чертах.
Связь с астоматами несомненна, предположение о род-
стве с тигмотрихами типа Ancistrum ошибочно. В каче-
стве возможного предка среди астомат раньше указы-
вали Eudrilophrya, а сейчас — недавно открытый род
и вид Hysterophrya enigmatica: апекс, присоска, как
у гистероцинет, но тело кзади заостряется и лишено
следов перистома. Астоматы и гистероцинеты обита-
ют в основном в олигохетах, где произошла данная
группа; гистероцинеты заселили позже и часть водных
моллюсков.
Сем. Hysterocinetidae Diesing, 1866
(= Ladidae Cepede, 1910;
= Ptychostomidae Cheissin, 1932)
Группа описана в монографии Раабе (Raabe, 1972b);
в данной сводке учтены все дополнения до 2002 г. С
диагнозом отряда. Ротовой аппарат 1-го типа — все
основания ротовых органелл (УМ, Ml, М2, М3) обра-
зованы дикинетами. К семейству относятся почти
все роды отряда, кроме Paraptychostomum, имеющего
широкий буккон и полосу М2 с поликинетой в осно-
вании.
Роды сгруппированы в несколько подсемейств, но
эта схема основана лишь на предполагаемом родстве
родов; нет никаких доказательств реальной филогении
форм, обитающих на всех континентах. Поэтому под-
семейства здесь не приняты.
По схеме Раабе (Raabe, 1972), Hysterocinetidae
включают подсем. Protoptychostomatinae (Protopty-
chostomum, Preptychostomum, Thurstonia, Kozloffia),
Hysterocinetinae (Hysterocineta, Taeniocineta, Drilocine-
864
ALVEOLATA
ta, Ptychostomum, Coelothigma, Elliptothigma), Epicha-
rocotylinae (Epicharocotyle, Puytoracia, Cotylothigma) и
Craticuloscutinae (Craticuloscuta, Kystothigma). В эти
подсемейства трудно ввести предложенные позже
роды, классификация станет еще более искусственной.
В Traite приняты 4 подсемейства, из которых реально
лишь первое (без фибрилл в безресничной зоне присо-
ски), но это не значит, что относимые к нему роды яв-
ляются родственными; у гистероцинетид множество
типов фиброма присоски.
Род Protoptychostomum Raabe,
1949
Типовой вид Anoplophrya simplex Andre, 1915
(Ptychostomum in Heidenreich, 1935) из галофильных
червей Eiseniella tetraedra (Oligochaeta); почти все гис-
тероцинетиды обитают в олигохетах, в основном в
дождевых червях, поэтому дальше таксономическое
положение хозяев не упоминается. Присоска неболь-
шая, V-образная, без подстилающих фибрилл; группа
осевых кинет входит в присоску без фрагментации.
Примитивные формы, близкие к предковым астома-
там. Другие виды — Р. davidis (= Hysterocineta davidis
Rees, 1962) в Allolobophora caliginosa, P. tertium Puyto-
rac, 1968 в Eminoscolex sp. (Габон).
Род Preptychostomum Puytorac,
1968
Типовой вид P. almae из Alma emini, Габон; до-
бавлено несколько новых видов из Alma (Ngassam,
Grain, Njine, 1993).
Тело бочонковидное, широкое, присоска дуговид-
ная, почти вся ее поверхность занята вершинами боль-
шого числа кинет, отделено лишь несколько фрагмен-
тов слева.
Род Afrothigma Jank. gen. n.
Типовой вид Preptychostomum katashimai Puy-
torac, 1968 из Alma emini, Габон (A. katashimai comb. n.).
Присоска гигантская, антерон резко расширен, кинеты
тигмона автономные — серия диагональных фрагмен-
тов, из которых лишь несколько осевых являются про-
должением осевых сомакинет. Система швов (секант)
пока плохо изучена, но на рисунках вида положение их
разное у этого и предыдущего рода.
Род Thurstonia Puytorac,
1968
Типовой вид Т. kaczanowskii из Alma emini, Г а-
бон. Тело вытянутое, сужено спереди, с мелкой округ-
лой присоской, имеющей радиальные кинетосомы или
фибриллы. Осевые кинеты входят в присоску симмет-
ричным пучком, без фрагментации; нет сложного фиб-
рома присоски. В предпубликации (в тезисах) вид был
назван Th. ranquei sp. n.
Род Kozloffia Puytorac, 1968
Типовой вид К. catenula из Alma emini, Габон.
В этом крупном виде тропических дождевых червей
взрывная эволюция гистероцинетид и астомат; сейчас
начинает изучаться Alma nilotica, хозяин большого
числа новых родов и видов этих паразитов (сем. Glos-
soscolecidae). Тип рода Kozloffia — вытянутая узкая
форма с широкой бобовидной присоской, по оси кото-
рой видно лишь несколько коротких фрагментов ки-
нет; почти вся поверхность присоски безресничная.
Нет никаких подстилающих фибрилл. Характерно об-
разование стробил — деление почкованием, почки
(протомиты) очень долго остаются без отделения, и в
итоге видны стробилы с примонтом и 1—10 почками в
длинной цепи, достигающей 690 мкм. Повторное опи-
сание вида и данные электронной микроскопии приво-
дятся в работе Нгасама с соавт. (Ngassam, Grain, Njine,
1997).
Род Hysterocineta Diesing, 1866
Типовой вид Ptychostomum paludinarum Stein,
1861 (= Lada bithyniae Nikolaeva, 1929, позже в составе
Ladopsis), обычный паразит мелких гастропод Bithynia
tentaculata в водах Европы. Осевые кинеты без фраг-
ментации глубоко входят в присоску, делая ее V-об-
разной; развиты дуговые фибриллы присоски. Хозя-
ева — Paludina impura (старинное название вида
В. tentaculata) и Р. similis Снътне В. leachi). Цилиаты
предпочитают особей хозяев, не зараженных массой
церкарий. Примеры видов:
Н. cheissini Raabe, 1949 в В. tentaculata, встречается
очень редко и никогда не совместно с предыдущим ви-
дом; это более мелкий вид с меньшим числом кинет.
Н. benedictiae (Cheissin, 1928), тип рода Ladopsis
Cheissin, 1928, обитает в байкальских моллюсках Вепе-
dictia baicalensis, В. limnaeoides, Baicalia ciliata, В, ca-
rinocostata, В. sp., Kobeltocochlea sp. Типовой хозяин,
по моему обозначению, Benedictia baicalensis; вид име-
ет 2 формы, раса из мелких литоральных моллюсков
рода Baicalia с длиной тела 200—250 мкм может отли-
чаться от паразитов крупных траловых гастропод Be-
nedictia (300—350 мкм),
Н. horvathi Raabe, 1950 — паразит гастропод Li-
thoglyphus naticoides; вид найден только в оз. Балатон
как локальный эндемик, хотя хозяин встречается по-
всеместно.
Н. pheretimae Puytorac, 1968 — в наземном черве
Pheretima sp. (Megascolecinae), Габон.
Н. perionyxi Jank, comb. n. (= Drilocineta perianyxi
Nair et Chakrabarti, 1975) — в Perionyx excavatus, Индия,
У этого вида тигмон присоски — продолжение группы
осевых кинет, а у типичных Drilocineta — узкая полоса
фрагментов кинет с диагональным расположением.
Род Taeniocineta Raabe, 1972
Типовой вид Hysterocineta eiseniae Beers, 1938
из Eisenia lonnbergi на востоке США. Родовой при-
знак— особо вытянутое тело, узкое и плоское; присос-
ТИП CILIOPHORA. КЛАСС OLIGOHYMENOPHOREA
865
ка в целом такого же типа, как у Hysterocineta, дуго-
видная, с вхождением большого числа кинет без фраг-
ментации (вид пока не изучен на серебряных
препаратах). Развита сложная система фибрилл под
присоской. Форма тела — недостаточный признак для
рода, род пока условно сохраняется до описания им-
прегнированных форм.
Род Drilocineta Raabe, 1972
(= Drilothigma (Raabe, 1972: 120, эрроним))
Типовой вид Hysterocineta libyodrili Puytorac,
1968 из Libyodrilus violaceus, Габон. Присоска листо-
видная, с радиальными рядами аргиросом и сложным
опорным комплексом и с узкой полосой диагональных
(ступенчатых) фрагментов кинет.
Вид D.pontodrila (Wichterman, 1942) — редкий
случай обнаружения гистероцинет в морских супрали-
торальных олигохетах — в Pontodrilus bermudensis,
Флорида, США. Хозяин живет в массе от уреза воды и
выше, среди остатков морской травы во влажном песке;
другие паразиты — 2 вида астомат (см. также в прило-
жении комментарий к статье Валовой, 1990). Точная
топография тигмона неизвестна, радиальных рядов
нет, принадлежность вида к этому роду и родство с ви-
дом из дождевых червей Африки сомнительные.
Род Ptychostomum Stein, 1860
Типовой вид Р. saenuridis Stein, 1860 изSaenu-
ris variegata (ныне Tubifex tubifex, донный вид водных
олигохет). Позже этот вид описывался под другими на-
званиями из данного и других хозяев; видовые синони-
мы — Lada issa Kijenskij, 1925; Ptychostomum iliodrili
Heidenreich, 1935. Хозяева в сумме — Tubifex tubifex,
T. albicola, T. barbatus, Ryacodrilus coccineus (= Tau-
podrilus), Ilyodrilus hamoniensis — обычные европей-
ские донные олигохеты из рек и озер. Присоска листо-
видная, без радиальных рядов аргиросом, со сложной
системой фибрилл; тигмон в виде длинной узкой по-
лоски, составленной короткими диагональными фраг-
ментами кинет. Правее присоски — четкий продоль-
ный шов, у разных видов типа унисеканты или бисе-
канты. Род крупный, такое строение имеет половина
известных видов небольшого отряда гистероцинет.
Виды и хозяева Ptychostomum: Р. chattoni Rossoli-
mo, 1925 (=Р. vejdovskyi Kijenskij, 1925; Lumbriculus
variegatus)', P. lumbriculi Heidenreich, 1935 (L. variega-
tus)', P. rossolimoi Studitsky, 1930 (Limnodrilus nevaen-
sis)',P. magnum Meier, 1954 (Tubifex tubifex, T. albicola)',
P. ohridanum Puytorac, 1968 (Ilyodrilus isochaetus);
P. meierae Puytorac, 1968 (= P. meieri; Stylodrilus leuco-
cephalus); P. lomi Puytorac, 1962 (Tubifex oligosetosus)',
P. stankovici Puytorac, 1958 (Tubifex ochridanus)', P. py-
gostomum (= Lada pygostoma Rossolimo, 1926) (Pelosco-
lex inflatus, Lamprodrilus sathyriscus в оз. Байкал);
P. asymmetricum (=Lada in Cheissin, 1932) (Clitellio ko-
rotneffi, C. multispinosus, Limnodrilus arenarius, L. dy-
bowskii в оз. Байкал); P. baicalensis (Lada in Cheissin,
1928) (Styloscolex chorioidalis, S. baicalensis, S. asym-
metricus, оз. Байкал); P. elongatum (Lada in Cheissin,
1928) (Lamprodrilus ammophagus, Teleuscolex korotnef-
fi, оз. Байкал); P. elongatus f. gigas (Cheissin, 1928)
(Limnodrilus sp., оз. Байкал); P. limnodrili Cheissin,
1932 (Limnodrilus baicalensis, Tubifex sp., оз. Байкал);
P. longinuclei Katashima, 1952 (Pheretima communissi-
ma, Япония); P. eminoscolecis Puytorac., 1968 (Eminos-
colex torentus, Габон); P. commune Puytorac, 1968 (Alma
emini, Габон); P. vulgare Puytorac, 1968 (Eminoscolex
sp., Габон); P. almae Puytorac, 1968 (Alma sp., Габон);
P. wrzesniowskii (Lada in Vejdovsky, 1882) (плохо опи-
санный недостоверный вид из Trichodrilus /= Phreatot-
hrix/ pragensisf, P. dichogasteri Tuzet et Zuber-Vogeli,
1955 (Dichogaster inermis, Африка); P.filiferum Kata-
shima, 1952 (в дождевом черве Limnodrilus gotoi, Япо-
ния). Виды из моллюсков: Р. campelomae Kozloff, 1960
(в вивипаридах Campeloma geniculum на востоке
США); Р. tanishi (Lada in Miyashita, 1927; в кишечнике
гастропод Viviparus japonicus). Гистероцинеты не
встречаются в Viviparus в Европе, из многочисленных
гастропод заражены битинии, но в одной из популяций
V connectus (ныне род Connectiana) в пос. Кипарисное
в Крыму постоянно обитают неопределенные парази-
ты этого рода.
В Alma nilotica в Камеруне описано 6 новых ви-
дов — Р. prolixus, Р. elongatum (Njine et Ngassam,
1993), P. sanagae, P. gazawae, P. ovoides, P. granulum
(Ngassam et Grain, 2000); в Alma emini 2 новых вида —
P. variabilis и P. nkoldae (Ngassam et Grain, 2000). Как
гомоним название Ptychostomum elongatum Njine et
Ngassam, 1993 пес P. elongatum (Cheissin, 1928) заме-
няется новым — P. camerunis Jank. nom. n.
Название Lada Vejdovsky, 1882 (типовой вид
L. wrzesniowskii) многократно использовалось в ран-
ней литературе, вплоть до 1930-х гг., но затем как го-
моним и как синоним было признано невалидным.
В оз. Байкал было найдено 6 новых видов и 1 новая
форма рода Ptychostomum, все из траловых олигохет;
7-й новый вид из гастропод резко отличался от них по
внешнему облику, имеет очень мелкую присоску и по-
этому был выделен в новый монотипический род La-
dopsis Cheissin, 1928 (L. benedictiae). Виды из червей
остались в составе Ptychostomum, но второй род был
ликвидирован как синоним рода Hysterocineta. Гисте-
роцинетиды обитают в заднем отделе кишечника оли-
гохет, астоматы в переднем отделе тех же хозяев; чаще
заражены крупные Lumbriculidae; иногда масса ин-
фузорий заполняет задний конец кишечника, прикреп-
ляясь присоской к эпителию без видимой патоло-
гии для хозяев.
Род Coelothigma Puytorac, 1968
Типовой вид Ptychostomum canalis Katashima,
1952, из олигохет Limnodrilus sp. в Японии. Диагноз
рода основан на неполном описании этого вида, не был
изучен кинетом и опорный аппарат присоски; присос-
ка V-образная с узкой продольной полосой, поэтому
можно ожидать наличия тигмона такого типа, как у
Ptychostomum (полоса диагональных фрагментов). Ро-
довой признак — наличие желобка, идущего вниз от
тигмона через все тело, с резким расширением над пе-
55 Зак. №4163
866
ALVEOLATA
ристомом. Кинеты биполярные, идут на дне желобка и
на краях тела вдоль желобка. Описание необычное и
требует тщательной проверки.
Род Elliptothigma Meier,
1954
Типовой вид Е. limnodrili Meier, 1954 из вод-
ных червей Limnodrilus udekemianus, L. hoffmeisteri,
L. claparedeanus. Присоска V-образная, с вхождением
значительного числа кинет и несколькими фрагмента-
ми слева; нет секанты правее присоски; опорный аппа-
рат присоски из большого числа пучков фибрилл, на-
правленных во все стороны. Размножение катенуляр-
ное (стробиляция), примонт несет сзади 2—4 мелкие
почки, медленно завершающие морфогенез.
Вид Е. filiferum (Ptychostomum in Katashima, 1952)
описан из червя Limnodrilus gotoi у Хиросимы, Япо-
ния. Это вид со стробиляцией, примонт несет несколь-
ко томитов примерно такой же формы, но намного
мельче. Имеются фибриллы присоски; тигмон в виде
полосы из большого числа фрагментов с их почти по-
перечным расположением. Имеются радиальные фиб-
риллы в безресничной зоне присоски. Вероятно, виды
неродственные и объединены в один род лишь по
сходству способа размножения, по типу тигмона не
могут быть в составе одного рода.
Род Epicharocotyle Kozloff,
1965
Типовой вид Е. kyburzi из Driocrilus breymanni
в Колумбии. Это один из 2 видов, описанных из Юж-
ной Америки, где гистероцинеты ранее не изучались.
Форма тела типичная для гистероцинетид, присоска с
сетчатым опорным аппаратом, который пока неиз-
вестен у других родов; по всей поверхности присос-
ки гематоксилином красится правильная решетка из
продольных и поперечных фибрилл. Края присоски
окаймлены полосой «толстых неактивных ресничек»,
у нижнего края присоски она расположена в глубоком
желобке. Тигмон не изучен.
Род Eminothigma Jankowski in Corliss,
1979
Типовой вид Epicharocotyle kozloffi Puytorac,
1968. Новое название заменяет гомоним Puytoracia Ra-
abe, 1972 (есть корненожки Puytoracia, датируемые
1970 г.). Род сейчас включает 3 вида, поэтому здесь да-
ются новые комбинации Eminothigma kozloffi, Е. raabei
и Е. grassei comb. nn. (= Epicharocotyle kozloffi, E. raa-
bei, E. grassei in Puytorac, 1968). В сводке Раабе (Raabe,
1972) перепутаны подписи под рисунками Puytoracia
kozloffi и Р. raabei. Присоска обширная, с радиальны-
ми фибриллами и сложнейшей системой опорных эле-
ментов, массивные пучки фибрилл направлены во все
стороны; тигмон в виде узкой полоски диагональных
фрагментов, оторвавшихся от сомакинет; нет длинно-
го шва (секанты) сверху справа. Типовой вид из олиго-
хет Libyodrilus violaceus, Е. raabei — из Eminoscolex to-
reutus, E. grassei из Buttneriodrilus congicus (все 3 вида
найдены в Габоне). Специфичность многих гистероци-
нет к хозяевам говорит о необходимости точного опре-
деления и сохранения фиксированных хозяев (ксено-
типов) для последующей проверки определения.
Род Cotylothigma Raabe, 1949
Типовой вид Ptychostomum rhynchelmis Hei-
dendeich, 1935 из Rhynchelmis limosella. Кинетом прак-
тически не изучен; присоска с радиальными фибрил-
лами и особым типом фиброма — по краям присоски
залегают массивные краевые пластинки, продолжа-
ющиеся вентрально до половины тела; к ним прикреп-
лены пучки тонких фибрилл, идущие поперек присос-
ки. Такое строение, необычное для гистероцинет, под-
тверждено при изучении второго вида С. heidenreichi
Puytorac, 1958 из Rhynchelmis komareki f. typica в
оз. Охрид.
Род Craticuloscuta Kozloff, 1965
Типовой вид С. escobari из Drilocrilus brey-
manni, Колумбия. Обитает совместно с Epicharocotyle
kyburzi и имеет столь же необычную присоску, с
правильной решеткой из поперечных и продольных
фибрилл; ресничного желобка вокруг присоски и сни-
зу нет, тигмон в виде диагональных кинет вдоль
нижнего края присоски. Фибриллярного опорного ап-
парата стандартного типа нет. Присоска гигантская,
до трети длины тела.
Род Coronothigma Jankowski,
1980
Типовой вид Craticuloscuta gigas Puytorac,
1968 из Libyodrilus violaceus, Габон. Наличие в Африке
вида того же рода Craticuloscuta, что и в Колумбии,
сомнительно; морфология у них разная, африканский
вид с несходной системой фибрилл, присоска дуго-
видная, кинеты полимеризованы, тигмон представлен
полосами справа и слева у вершины присоски и
обширным полем снизу, где кинеты идут без фраг-
ментации. Продольные и поперечные фибриллы созда-
ют видимость решетки, и если виды можно отнести
по этому признаку к одному роду, то по различию тиг-
мона для африканской формы должен быть выде-
лен особый род или подрод.
Род Kystothigma Raabe,
1949
Типовой вид Ptychostomum bacteriophilum
Miyashita, 1933 (позже в составе Hysterocineta) из вод-
ной олигохеты Criodrilus sp. в Японии. Очень плохо
описанный вид, без точной схемы соматической цили-
атуры, фибрилл, тигмона; родовые признаки, по Раабе
(Raabe, 1972), — наличие складки (выступа тела)
ТИП CILIOPHORA. КЛАСС OLIGOHYMENOPHOREA
867
вдоль нижней части присоски, погружение тигмона в
глубокий узкий веретеновидный желобок, идущий
продольно через всю присоску и не связанный с осевы-
ми сомакинетами. Для валидации рода нужно повтор-
ное изучение вида.
Род Amieta Ngassam in Puytorac et al.,
1994
Типовой вид A. prolifera из дождевых червей
Камеруна. Присоска смещена апикально, частично на
дорсум, очень широкая, незначительная часть ее по-
верхности занята вершинами нескольких осевых ки-
нет, идущих без фрагментации. Сомакинеты полиме-
ризованы, снизу слева мелкие швы, положение кинет
нарушено. По сравнению с типичными гистероцинети-
дами присоска непомерно велика, а перистом непро-
порционально мелкий, занимает у гистерицинетид
обычно весь постерон, но у Л. prolifera только полови-
ну очень широкого нижнего конца тела. В Traite при-
веден рисунок вида без диагноза, фибром не описан,
хозяева конкретно не-названы.
Род Proptychostomum Ngassam et Grain,
1997
Типовой вид Р. commune из олигохет Ка-
меруна. ТелЬ вытянутое, узкое, присоска относительно
небольшая, с радиальными фибриллами; перистом
необычный, основание УМ далеко удалено от мемб-
ранелл Ml и М2, в итоге образуется обширный аци-
лон, занимающий весь расширенный задний ко-
нец тела.
Род Hysterocinetoides Ngassam
in Puytorac, 1994
Типовой вид Н. sanagae из олигохет Камеруна.
Аэшт признает это название валидным, хотя в Traite
(Puytorac, 1994) нет описания вида; род описан как но-
вый позже — Hysterocinetoides Ngassam et Grain, 2002
для 2 новых видов Н. sanagae и Н. intermedius из Alma
nilotica. Это второе описание (Ngassam, Grain, 2002)
нужно считать валидным. Тип рода — массивные фор-
мы с полимеризацией кинет; тело сужается книзу, при-
соска обширная, дуговидная, смещена вентрально
вниз от апекса, к ней подходят все кинеты; большое
число рядов входит в поле присоски снизу без фраг-
ментации, исключая несколько краевых фрагментов
справа и слева в полосе тигмона; ядро поперечное; пе-
ристом стандартного типа.
Род Raabellocineta Puytorac, Groliere
et Grain, 1979
Типовой вид R. elongata, предположительно
из олигохет (хозяин, локус, место сбора не указаны).
Внешне очень напоминают астомат и могут отно-
ситься к возможным предкам Hoplitophryidae типа
Hysterophrya enigmatica. Тедо узкое, вытянутое, ядро
лентовидное, осевое; перистом мелкий, типичного
строения; присоска необычная — апекс ограничен ду-
говидной полосой из фрагментов кинет, присоска мел-
кая, дуговидная; справа топография кинет не наруше-
на, слева около 7 рядов особо удлинены и их вершины
составляют тигмон; безресничное поле незначитель-
ное, фибром не описан. Во всем типичная астомата, но
имеет мелкий рудиментарный перистом с очень корот-
ким букконом, возможно с редукцией внутренних
мембранелл.
Сем. Paraptychostomidae Ngassam,
Puytorac et Grain, 1994
Типичные гистероцинетиды по форме тела, поло-
жению присоски, но с резким расширением постерона
и буккальной полости; ресничный ротовой аппарат
имеет те же элементы, что у гистероцинетид, но осно-
вание М2 превращено в массивную длинную полосу
(поликинету) с полимеризацией кинетосом; у гистеро-
цинет в основаниях УМ, Ml, М2 и М3 по 2 ряда кине-
тосом (дикинеты). Модификация М2 является единст-
венным признаком семейства.
Род Paraptychostomum Ngassam,
Puytorac et Grain, 1994
Типовой вид P. almae из Alma nilotica в Каме-
руне. С признаками семейства. По сравнению с типич-
ными гистероцинетами имеет непропорционально
мелкую присоску и очень крупный, широко открытый
и глубокий перистом. Ядро поперечное, кинеты поли-
меризованы, присоска с фибриллами. В Traite (Puyto-
rac, 1994) автором рода указан Ngassam, авторами
вида — 3 вышеназванных автора; это обозначение
признано Аэшт невалидным, хотя дан диагноз и рису-
нок, поскольку нет указания gen. n., sp. п., и названия
даны с пометкой «inedit» — не опубликовано.
В приложении отметим 3 вида неясной родовой
принадлежности, которые не упоминаются в статьях и
обзорах по Hysterocinetida.
Balantidium gyrans Kellicott, 1888. Вид подробно
описан, с рисунками; это типичная гистероцинетида;
крупная присоска принята за перистом, служащий для
прикрепления; сзади густые массивные реснички (бук-
кальная цилиатура); ядро поперечное. Вид найден в
США «в кишечной полости водного червя, который
не был определен», в массе в заднем отделе кишечни-
ка. Подробно описано движение, тигмотаксис; предпо-
лагается сходство с Haptophrya (астоматы в планари-
ях и тритонах с крупной присоской). Условно здесь
вид переводится в состав Ptychostomum — Р. gyrans
comb. n.
Anoplophrya variabilis Ghosh, 1921. Описание внеш-
него облика без нужных деталей, рисунок примитив-
ный; вид найден «в кишечнике мелких пресноводных
гастропод» в Индии у Калькутты. Крупные формы (до
174 мкм), контуры тела, как у гистероцинет, сзади
2 цирруса — это УМ и мембрана у выемки перистома.
868
ALVEOLATA
Поскольку хозяин не назван, вид неопределим; это, ве-
роятнее всего, Ptychostomum sp.
Nyctotherus sp. Описание и рисунок приведены в
статье Валовой (1990) о цилиатах в кишечнике олиго-
хет-энхитреид в супралиторали Белого моря, под вы-
бросами водорослей. Вид найден в Enchytraeus albidus
и Lumbricillus pagenstecheri вместе с типичными асто-
матами. Размеры тела 40—60 мк (мельче типичных ги-
стероцинетид); особи прижаты к эпителию в переднем
отделе кишечника «удлиненной ротовой воронкой»
(явно присоска); постерон с желобком. Этот вид пока
неопределим до рода, но, вероятнее всего, это гистеро-
цинетиды ;— виды отряда, например Drilocineta роп-
todrila, встречаются в галофильных приморских бере-
говых олигохетах.
Отряд Thigmotrichida Chatton et Lwoff,
1922 (рис. 370, б—371, а, б)
Первоначально таксон «phylum des Thigmotriches»
включал смесь всевозможных симбионтов, в основном
на моллюсках; фильтраторы составляли подотряд соб-
ственно тигмотрих; тканевые паразиты, высасыва-
ющие покровы хозяев с помощью узкой трубки, —
подотряд Rhynchodina. Электронная микроскопия по-
казала родство последних с гипостоматидами, и сейчас
Hypostomatida и Rhynchodida являются смежными от-
рядами в классе Phyllopharyngia. Гистероцинетиды,
всегда включавшиеся в состав тигмотрих, отделены на
уровне отряда и даже подкласса. Оставшимся тигмо-
трихам невозможно дать характеристику — вклю-
чаются группы с резкими различиями по всем при-
знакам. Поэтому при разгрузке таксона часть родов
отнесена к Scuticociliatida (например, Cochliophilus,
Thigmocoma), один род выделен в новый отряд (Prota-
noplophrya), отделены также роды типа Conchophthiri-
us и Myxophyllum. В итоге тигмотрихи включают груп-
пу родов, впервые получающих четкую характеристи-
ку; раньше единственным общим признаком было
наличие тигмотактической цилиатуры у серии нерод-
ственных семейств. Для группы в новом объеме было
предложено новое название Hemispeirina Jank., 1980,
но, вероятно, лучше использовать традиционное при-
вычное название Thigmotrichida s. str.
Мелкие формы с незначительно сплющенным те-
лом, с хорошо развитой соматической цилиатурой, де-
лящейся на 3 зоны — собственно соматическую, око-
лоротовую и тигмотактическую. Кинеты диагональ-
ные или продольные, у апекса кинетосомы в левых
рядах и дорсально сгущаются, образуя тигмон; у части
родов обособлены фрагменты кинет в тигмозоне. Пе-
ристом обширный, растянут по оси тела, с резким уд-
линением средней мембранеллы М2; Ml и М3 — ко-
роткие; УМ также вытянутая вдоль всего правого края
перистома. В основании УМ — дикинета, в основании
М2 — трикинета. Имеется scuticus, как у всех Scutico-
ciliatida; при делении перистом образуется за счет ки-
нетосом УМ и скутикуса. Соматические кинеты состо-
ят из дисом. Ближайшие к перистому сомакинеты со
сгущением кинетосом, служат дополнительным ком-
понентом ротовой цилиатуры. Характерна тенденция к
смещению перистома вниз, к постерону, и к образова-
нию обособленного тигмона на вершине тела. Размно-
жение делением, конъюгация очень редкая, цист нет.
Ядро простое, овальное. Симбионты беспозвоночных,
более разнообразны в море; часть родов в пресных во-
дах, включая несколько эндемиков Байкала. Все
виды — фильтраторы, временно прикрепляются к тка-
ням жаберной полости с помощью ресничек тигмона,
используют токи воды для питания. Один из морких
родов подотряда (Nucleocorbula) — предшественник
крупной дивергентной группы Peritricha.
Состав группы разный в различных сводках; в Trai-
te (Puytorac, 1994) 3 семейства: Ancistridae, Hemispeiri-
dae и Nucleocorbulidae; в прежней литературе предла-
гались семейства Ancistridae Issel, 1903; Protophryidae
Cepede, 1910; Ancistrumidae Kahl, 1930; Boveridae Pa-
ckard, 1927; для открытого позже рода Dragescoa пред-
ложено сем. Dragescoidae Jank., 1980. Для распределе-
ния родов по семействам нужно точно знать филоге-
нию каждого рода, а мы пока далеки от этого. Поэтому
семейства могут включать неродственные конвергент-
но сходные формы; так, Hemispeiridae, по типовому
роду Hemispeira, должны включать все формы с обо-
соблением фрагментов кинет в апикальном тигмоне —
в Traite это роды Protospira, Ancistrospira, Plagiospira,
Cheissinia, Hemispeira. Байкальская Cheissinia — энде-
мик, произошла от более простых локальных анцист-
рид; родство с гемиспейрами, обитающими на мор-
ских иглокожих, совершенно исключено. Protospira с
пресноводных гастропод не имеет тенденции к смеще-
нию перистома вниз и могла произойти от форм типа
Ancistrina tihanyensis. Тигмон обособлен независимо у
ряда родов отряда.
В данном обзоре в составе отряда различаются се-
мейства Hemispeiridae sensu lato, Nucleocorbulidae
и Dragescoidae; большинство родов относится к пер-
вому семейству.
Род Ancistrum Maupas, 1883
Типовой вид Opalina mytili Quennerstedt, 1867,
по обозначению Раабе (Raabe, 1967). В номенклаторах
есть род иглокожих Ancistrus, но гомонимии нет, по-
этому замещающее название Ancistruma Strand, 1926,
использованное неоднократно, невалидное.
Тело вытянутое, сплющенное, узкое, с непропор-
ционально большим перистомом; кинеты сходятся к
апикальному шву; имеется дорсальная секанта; УМ и
М2 вытянуты на всю длину тела, смещая рот почти
к постерону. Это самый крупный род отряда, с боль-
шой перспективой роста. Симбионты моллюсков —
чаще всего в двустворчатках, реже в гастроподах.
Ниже перечислены основные виды с указанием хозяев,
без аннотаций по морфологии; сокращения: Biv. — Bi-
valvia, Gas. — Gastropoda.
A. abrarum Fenchel, 1965 —Abra nitida (Biv.).
A. arcopagiae Fenchel, 1965 — Arcopagia crassa
(Biv.).
A. barbata Issel, 1903 —Murex trunculus, Fusussyra-
cusanus (Gas.) в Средиземном море; тигмотрих нет в
мурицидах Дальнего Востока.
A. caudatum Fenchel, 1965 — Modiolus modiolus
(Biv.).
ТИП CILIOPHORA. КЛАСС OLIGOHYMENOPHOREA
869
Рис. 370, б. Thigmotrichida.
Ancistrum isseli (А, Б); A. mytili (B—Д, И, K); Ancistrumina limnica (£); Ancistrospira veneris (Ж, 3); Ancistrum crassum (Fenchelia crassa in Raabe, 1970a) (M H).
(По: Kidder, 1933 (А—Д); Raabe, 1970a (£); Chatton, Lwoff, 1949 (Ж, 3); Berger, Hatzidimitriou, 1978 (И, K); Xu et al., 1997 (JI—H)) .
Fig. 370, 6. Thigmotrichida.
A. cyclidioides Issel, 1903 — Tellina exigua, Tapes de-
cussata, Donax trunculus, Capsa fragilis (Biv.), Natica
hebraea (Gas.), Chiton olivaceus (Chitonida). Позже ука-
зан для южных гастропод Littorina neritoides и L. punc-
tata', Раабе различает лишь форму minima в двуствор-
чатках Муа arenaria Балтики. Типовым хозяином здесь
обозначается Tellina exigua. Сборный вид; даже без
импрегнации различали «варианты» разных разме-
ров — формы minima, lata, media, maxima в разных хо-
зяевах. Вид из литторин Melaraphe neritoides Черного
моря мною будет описан как новый. В наших северных
и дальневосточных литторинах только протофрии, ан-
цистрид нет.
A. nuculae Fenchel, 1965 — Nucula turgida (Biv.).
A. venerupis Fenchel, 1965 — Venerupis aurea (Biv.).
A. hydrobiae Raabe, 1936 —Hydrobia ulvae, H. vent-
rosa, отсутствуют в H.jenkinsi (Gas.); хотя хозяева
очень близки морфологически, первый вид сейчас от-
носят к другому роду -— Peringia.
А. тасотае Chatton et Lwoff, 1949 — Масота tenu-
is, М. baltica (Biv.).
A. tellinae Issel, 1903 —Tellina exigua (= Macoma te-
nuis} (Biv.), совместно c A. cyclidioides.
A. musculi Delphy, 1938 — Mytilus edulis (Biv.).
A. scrobiculariae Chatton et Lwoff, 1926 — Scrobicu-
laria plana (= S. piperata} (Biv.).
A. compressa Issel, 1903 — Capsa fragilis (Biv.).
A. bulgaricaRaabe, 1970—Mytilaster lineatus (Biv.).
A. dosiniae Chatton et Lwoff, 1926 — Dosinia exoleta
(Biv.).
A. japonica Uyemura, 1937 — Cyclina sinensis, Me-
retrix meretrix, Paphia philippinarum, Mactra venerifor-
mis, M. sulcataria, Dosinia bilnulata (Biv.), Япония. Ти-
повым хозяином здесь обозначается С. sinensis. В Ки-
тае вид указан для двустворчаток Dosinia japonica и
Caecella chinensis (Song, 2000).
A. kofoidi Bush, 1937 — Petricola pholadiformis
(Biv.).
A. subtruncata Issel, 1903 — Tapes decussata (Biv.).
A. tihanyensis Raabe, 1950—Lithoglyphus naticoides
(Gas.).
A. purpurae Chatton et Lwoff, 1926 — Purpura hae-
mastoma (Gas.).
A. nucellae Khan, 1970 — Nucella lapillus (Gas.).
Предыдущий вид кратко описан без рисунков в Нор-
мандии, второй вид подробно — в южной Англии; хо-
870
ALVEOLATA
Рис. 371, a. Thigmotrichida.
Syncilancistrumina elegantissima (А—Д-, Ancistrum caudatum (E); A. crassum (Fenchelia crassa, Ж); «Ancistrumina» nucellae (3); «Ancistruma» isseli (И); A. ma-
comae (К, Л). Цифрами обозначены кинеты. (По: Fenchel, 1965 (Е); Khan, 1970 (3); Kidder, 1933 (37); Knight, Thome, 1982 (А—Д; Chatton, Lwoff, 1949 (К, Л)',
Xu et al., 1997 (Ж)).
Fig. 371, a. Thigmotrichida.
Numbers indicate kineties.
зяин общий — супралиторальная хищная гастропода
Nucella (= Thais, Purpura) lapillus (= Thais haemasto-
ma). Поэтому название A. nucellae невалидно как сино-
ним предыдущего вида. Обычны на Мурмане.
A. modioli Raabe, 1970 — Modiolus modiolus (Biv.),
США.
A. venerisgallinae Maupas, 1883 — Venus gallina
(Biv.).
A. mytili (Quennerstedt, 1867) — Mytilus edulis,
M. galloprovincialis (Biv.). Раабе (Raabe, 1970a, 1970b)
различает «формы» вида в разных расах мидий — f. ty-
pica, elongata, claviformis, magna, longissima.
A. acutum Xu et Song, 1999 — Mactra chinensis,
M. veneriformis, Meretrix meretrix (Biv.), Китай.
A. haliotis Xu et Song, 1999 — Haliotis discus hannai
(Gas.), Китай.
Род Ancistrumina Raabe, 1959
Замещающее название для Ancistrina Cheissin, 1931
с сохранением типового вида Ancistrina ovata Ch.,
1931. Это мелкие формы величиной 30—48 мкм из
мантийной полости эндемичных байкальских гастро-
под Choanomphalus sp., Benedictia baicalensis и В. lim-
naeoides', типовым хозяином здесь обозначается обыч-
ный литоральный вид Choanomphalus amauronius.
Тело каплевидное, узкое, сплющено, число кинет не-
большое, 13—16 (5—6 справа и 10—11 слева); практи-
чески нет секантных зон; кинеты слева сближены, в
тигмозоне сближены все кинетосомы без фрагмента-
ции рядов. Перистом до 3/4 длины тела, рот удален от
постерона.
В непрерывном ряду морфотипов анцистрид этот
род можно условно сохранить для нескольких видов
из пресноводных гастропод. Такие же формы встре-
чаются в озерах и ручьях у берегов Байкала в обыч-
ных моллюсках-планорбидах родов Anisus, Planor-
ТИП CILIOPHORA. КЛАСС OLIGOHYMENOPHOREA
871
Рис. 371, б. Thigmotrichida.
Plagiospira crinita (A, 5); Dragescoa mirabilis (В, Г); Cheissinia (Tiarella, гомоним) baicalensis (ДУ, Protophrya ovicola (E, Ж); Hemispeira comatulae (3); H. aste-
riasi (И, K); Cotensicoma manticola (Л, M); Baikalothigma viridis (H, О). (По: Cheissin, 1931 (Д); Chatton, Lwoff, 1949 (А, Б, 3—K); Fenchel, 1965 (E, Ж); В, Г,
Л—О — ориг.).
Fig. 371, 6. Thigmotrichida.
bis, Segmentina. Кроме A. ovata валидны следующие
виды.
A. tihanyensis Raabe, 1950 — в Lithoglyphus naticoi-
des (Gas.).
A. limnica Raabe, 1967 — в гастроподах Spiralina
vortex, Bathyomphalus contortus, Pseudamnicola conso-
ciella, P. sturanyi, Horatia ochridana, H. brusinae, Lyhni-
dia gjorgjevici, Gocea ohridana (6 последних видов —
эндемики оз. Охрид). Находки в наядах Unio и Anodon-
ta могут относиться к другому виду.
A. anodontae (Kahl, 1926) comb. n. (= Pleuronema
anodontae), по Калю (Kahl, 1931), редкие в Anodonta,
но регулярно встречаются в видах Sphaerium. Это за-
гадка — никто не видел тигмотрих в сфериидах, засе-
ленных только ринходидами, сепеделлами, безротыми
тетрахименами и одним из видов скутицид Conchoph-
thirius (С. discophorus).
В моллюсках Байкала встречаются виды с зоохло-
реллами, которые будут описаны как новые виды. Ан-
цистриды хорошо видны сквозь прозрачную раковину
мелких планорбид без вскрытия хозяев, неподвижно
лежат на эпителии дыхательной зоны, временами
поворачиваются или движутся прыжками, в воде пла-
вают. При раздавливании хозяев десятки особей рас-
плываются в воде и вновь собираются на кусках
тканей и фрагментах раковины. Анцистриды легко им-
прегнируются серебром методом Кляйна на сухих маз-
ках, и при этом выявляется важное отличие от типо-
вого вида рода Ancistrum (A. mytili) — у последней
весь перистом занят аргентофильной сетью со мно-
жеством ячеек (Kidder, 1933), а у пресноводных анци-
стрид видно лишь несколько фибрилл, сети нет. По-
этому, хотя род Ancistrumina не признается в совре-
менной литературе, это может быть важным родовым
различием.
Род Ancistrospira Chatton et Lwoff,
1926
Типовой вид A. veneris; размеры 50—60 мкм,
перистом до 4/5 длины тела, рот смещен на постерон,
кинет немного; на дорсуме цилиатура зеркальная — в
передней трети тигмозона с 8 фрагментами кинет, пр а-
872
ALVEOLATA
вее и левее ее кинеты удлиняются, достигая постерона.
Шаттон и Львов (Chatton, Lwoff, 1950) считали такие
формы предками ринходид, утративших перистом и
развивших новый ротовой аппарат — апикальную
присоску. Хозяева — морские двустворчатки Venus
fasciata и Astarte fusca.
Род Boveria Stevens,
1901
Типовой вид В. subcylindrica по монотипии.
Тело вытянутое, нередко очень длинное, червеобраз-
ное; апекс сужен, к постерону тело расширяется; пери-
стом полностью смещен на постерон, УМ и М2 огиба-
ют края расширенной площадки, вверх от них идут не-
многочисленные соматокинеты. На вершине тела
нет фрагментации кинет, но тигмозона четкая и эффек-
тивная, особи неподвижно прикреплены к эпителию
хозяев, при отделении медленно плавают. Иногда
сгустки особей прикреплены концами к одному участ-
ку эпителия. При виде снизу заметно спиральное за-
кручивание ротовых кинет, нетипичное для тиг-
мотрих. Ранее особей ориентировали неправильно,
перистомом вверх.
В, subcylindrica Stevens, 1901 обычны в крупных
трепангах Holothuria californica (=Stichopus и Para-
stichopus) на западном берегу США, от Калифорнии до
канадской границы. Полянский (1951) под этим назва-
нием описал вид из трепангов Cucumaria sp. у Влади-
востока; мною боверии найдены в трепангах Курил и
Сахалина. Определение В. subcylindrica в крупной дву-
створчатке Pinna pectinata в Китае (Xu, Song, 2000)
очень сомнительно.
В. zenkevitchi Levinson, 1941 — в дыхательной сис-
теме корабельного червя Teredo navalis в Черном море.
Автор считает свой вид отличным от следующего,
обитающего в том же виде, хозяина в США.
В. teredinidi Nelson, 1923 — Teredo navalis, Bankia
setacea — корабельные черви (Bivalvia) в Калифорнии
и на востоке США.
В. labialis Ikeda et Ozaki, 1918 — в голотуриях Cu-
cumaria sp. (вероятно, C. japonica), Stichopus japonicus
(ныне Apostichopus) и в двустворчатках Tellina sp.,
Япония.
В. concharum stat. n. (= В. subcylindrica var. concha-
rum Issel, 1903). Тело значительно короче, чем у вида
из голотурий, поэтому это вид, а не подвид. Пока
условно к виду относятся формы из многих видов мор-
ских двустворок с разной длиной тела и разным чис-
лом кинет — Tellina exigua, Т nitida, Capsa fragilis,
Pinna nobilis (типовой хозяин), Loripes lacteus, Area
noae, Tapes fuscus, T. decussatus, и в аберрантных дву-
створчатках-обрастателях — Anomia ephippium и Мо-
та patelliformis.
Боверии, определенные как В. teredinidi, отмечены
в моллюсках-древоточцах Индии, в Xylotrya в США;
вероятно, род космополитный. В небольшой тередини-
де Zachsia zenkewitschi из ствола морской травы Phyl-
lospadix iwatensis у Владивостока описан новый вид
В. zachsiae Yakovlev, 1992.
Род Eupoterion Mac Lennan et Connell,
1931
Типовой вид E.pernix из пателлообразных га-
стропод Acmaea persona (типовой хозяин), A. digitalis,
A. cassis (США). По данным ряда авторов, эта тигмо-
триха обитает в кишечнике типового хозяина и A. cas-
sis. Род Астаеа обитает по обоим берегам северной
Пацифики, в Японском море вид такого типа найден
мною на жабрах, но не в кишечнике хозяев. Новый род
выделен без знания нужной литературы при сравнении
с совершенно неродственными формами; если же
сравнить с Ancistrum, различий почти нет. Часть авто-
ров считал род валидным, сейчас валидность отрица-
ют. Размеры тела 38—56 мкм, кинет немного, подхо-
дят к апикальному шву, расположение на венте зер-
кальное, вершина перистома значительно сдвинута
вниз, строение ротовых кинет типичное для анцист-
рид. Безресничный участок перистома (ацилон) уже,
чем у типа рода Ancistrum; необходимо использовать
импрегнацию — если в этой зоне нет сети аргирома,
род валиден.
Род Fenchelia Raabe, 1970
Типовой вид Ancistrim crassum Fenchel, 1965
(F. crassa) из двустворчаток Venerupis aurea и V. pul-
lastra. Тело узкое, вытянутое; кинеты продольные, не-
многочисленные, перистом смещен далеко вниз от ан-
терона и расширен, правее и левее рта сомакинеты
сходятся к вершине характерного выступа тела дор-
сально. Над перистомом унисеканта — левые кинеты
идут продольно до апекса, правые заканчиваются
вдоль шва. Аргиром перистома не изучен. Унисеканта
такого типа намечается у Ancistrum crassum и А. агсо-
pagiae.
Род Fenchelia всегда принимали как валидный, но в
недавних работах Key и Сонга (Xu, Song, 1999; Хи et
al., 1997; Song, 2000) род не признается, вид возвращен
в состав Ancistrum. Сложность в том, что в Китае изу-
чены анцистриды из Ruditapes philippinarum (ныне
культивируемой и в Европе) и морфология этого вида
не совпадает с обликом A. crassum; в частности, по-
казан бисекантный шов. Хозяева A. crassum в Китае
(Song, 2000) — Ruditapes philippinarum, Protothaca
jedoensis, Saxidomus purpuratus и Cyclina sinensis.
Виды из литоральных гастропод восточной Ин-
дии — F. sagarica Jamadar et Choudhury, 1988 и F. kapi-
li J. et Ch., 1988, оба в мантийной полости на ктениди-
ях Cerithidea obtusa.
Род Plagiospira Issel, 1903
Типовой вид Р. crinita Issel, 1903, из двуствор-
чаток Loripes lacteus (типовой хозяин), Cardita calycu-
lata, Nucula nucleus, Divaricella divaricata, Thyasira sar-
si, T. flectuosa, T. sp., Nucula turgida (в первоописании
из 2 первых хозяев; другие находки у Фенхеля (Fen-
chel, 1965). Тщательное переописание — из Lucina (Di-
varicella) divaricata, но эта раса имеет больше кинет,
чем в первоисточнике. Форма тела типичная для Ancis-
ТИП CILIOPHORA. КЛАСС OLIGOHYMENOPHOREA
873
trum, перистом смещен в нижнюю половину тела, на
его месте в антесоме остается длинный унисекантный
шов — правые кинеты идут до вершины тела, левые
заканчиваются вдоль шва. На дорсуме кинеты зеркаль-
ные, как у Ancistrospira, в антесоме обособлена круп-
ная тигмозона с 8—9 резко укороченными кинетами.
Механизм образования тигмозоны ясен, если сравнить
рисунки дорсума Р. crinita и Ancistrumina tihanyen-
sis, — при смещении перистома вентрально вниз ниж-
ний шов смещается дорсально вверх и подходящие к
нему с обеих сторон кинеты укорачиваются.
Род Proboveria Chatton et Lwoff, 1936
Тело каплевидное, кинет немного (20—25), ряды
идут продольно без секанты вентрально, не укорочены
и без тигмона дорсально; перистом начинает смещать-
ся вниз у Р. thyasirae и Р. triangularis и находится в
постесоме у Р. loripedis. Только у этого вида описаны
цисты и процесс инцистирования, у других тигмотрих
цисты не найдены. Известно несколько видов из мор-
ских двустворок — ~Р. loripedis Chatton et Lwoff,
1936 (типовой вид) из Loripes lacteus', Р. thyasirae Fen-
chel, 1965 {Thyasira sarsi, Thyasira sp.); P. triangularis
F., 1965 {Thyasira sp.); P. rangiae Puytorac, Grain, Groli-
ere et Lopez-Ochoterena, 1978 {Rangia cuneata в Мек-
сике).
Род Semiboveria Raabe, 1970
Типовой вид Boveria stevensi Issel, 1903 (S. ste-
vensae nom. corr.). Тело коническое, расширяется кни-
зу, с несколькими продольными кинетами простой то-
пографии на дорсуме, вероятно, с бисекантным швом
вентрально. Перистом смещен далеко вниз и развернут
вокруг расширенного нижнего конца тела, несет не-
пропорционально длинные реснички мембран и мемб-
ранелл, равные длине тела. Симбионты мелких дву-
створок-монтакутид Galeomma turtoni (Mackinnon et
Ray, 1931). Авторы обращали внимание на внешний
облик и положение перистома, точная топография ки-
нет не выяснена, поэтому валидность рода неясная; в
Traite (Puytorac, 1994) вид перенесен в состав Probove-
ria {Р. stevensi), род не признается. У Boveria и Semibo-
veria кинеты подходят ко всему периметру перистома,
но на рисунках Boveria (Chatton, Lwoff, 1949) нет се-
канты вентрально, а на рисунке В. stevensi есть бисе-
канта. По наличию и топографии секант сейчас разли-
чают роды цилиат, к примеру никтотерусов, поэтому
род Semiboveria может быть валидным. Бисеканты нет
и у типового вида рода Proboveria.
Род Syncilancistrumina Knight et Thorne,
1982
Типовой вид 5. elegantissima из двустворок —
камнеточцев Pholas dactylus в Англии. Тело вытяну-
тое, узкое, изогнутое, перистом вытянут на всю длину
тела. Родовое отличие от Ancistrum (A. mytili) — диф-
ференцировка соматического кинетома, укорочение
кинет левее рта с образованием характерного длинно-
го цирруса, направленного назад; заметно укорочены
и правосторонние кинеты; имеется шиповидная кау-
дальная ресничка. Морфология A. mytili детально из-
учена на протарголовых препаратах (Berger, Hatzidi-
mitrou, 1978); выявлено укорочение кинет справа, поэ-
тому родовым признаком Syncilancistrumina остается
лишь наличие цирруса снизу слева.
Род Protophryopsis Raabe,
1959
Типовой вид Ancistrum dautzenbergi Chatton
et Lwoff, 1926 с жабер мелкой псаммонной двустворки
Масота {Tellina) tenuis. Род предложен для описа-
ния вида у Шаттона, но рисунки в монографии тигмо-
трих (Chatton, Lwoff, 1949) очень противоречивые.
Это вытянутые узкие плоские формы с длинным пе-
редним бисекантным швом; перистом узкий, вытянут
вдоль тела, удален от заднего и еще больше от пе-
реднего конца тела. Мембранелла Ml на одном ри-
сунке подходит к вершине перистома, на другом эква-
ториальная. Ниже перистома — бисеканта; справа
от нее унисеканта, кинеты расположены нетипичным
образом для Ancistrum. Авторы Traite считают род
сомнительным — нужно повторное изучение пери-
стома и топографии сомакинет. Появление 3 швов мо-
жет быть связано с полимеризацией кинет (до 56)
у этого вида.
Род Protospirella Aescht, 2000
Типовой вид Protospira mazurica Raabe, 1968;
название рода Protospira Raabe, 1968, как гомоним за-
менено новым. Симбионты речных гастропод Theodo-
xus fluviatilis; мелкие формы (40—45 мкм) с сильно
сплющенным латерально телом, перистом занимает
часть ребровидного вентрального края тела, несколько
смещен вниз и достигает постерона. Справа от пери-
стома кинеты продольные, без швов, слева также, а на
дорсуме последовательно укорачиваются на длинном
бисекантном шве. Обособлена группа резко укорочен-
ных апикальных кинет — тигмозона, со сближением
кинетосом и кинет в единое густое поле ресничек. Род
вначале относили к гемиспейридам, но нет доказатель-
ства родства Protospirella и Hemispeira, возможна кон-
вергентная эволюция.
Род Ancistrella Cheissin, 1931
Типовой вид A. choanomphali из гастропод
Choanomphalus sp. в оз. Байкал. Встречается вместе с
Ancistrina ovata (ныне Ancistrumina)', эту пару видов
всегда имеет литоральный вид Ch. amauronius на
юго-западе оз. Байкал у истока Ангары, и этот вид сле-
дует считать типовым хозяином для обоих симбион-
тов. Указан Хейсиным (Cheissin, 1931) для мантийной
полости, но, по моим данным, обитает в кишечнике. В
монографии тигмотрих (Chatton, Lwoff, 1949. Р. 209)
род Ancistrella не признается, вид переведен в состав
874
ALVEOLATA
Ancistrum (A. choanomphali), но род признан последу-
ющими авторами. В действительности это одна из
наиболее аберрантных тигмотрих — особи плоские,
лентовидные, кинеты немногочисленные, биполяр-
ные, без швов; между кинетами — полосы гранул, ко-
торых нет у всех остальных тигмотрих, кроме Thigmo-
theron (из морских моллюсков в Бразилии). Эти поло-
сы Хейсиным не отмечены, но легко видны in vivo и
импрегнируются серебром. Перистом очень узкий,
краевой, относительно короткий — около трети длины
тела, нижний конец мембраны у постерона; редукция
перистома может быть связана с переходом в кишеч-
ник хозяев. Латеральных швов нет, но имеются конце-
вые швы у апекса и постерона. Второй вид такого типа
обнаружен мною у мелкого ярко-красного вида Choa-
nomphalus из сбора аквалангистов, пока не описан.
Род Baikalothigma Jankowski, 1982
Типовой вид В. viridis (по Аэшт, правильно
В. viride) из мантийной полости байкальских гастро-
под Choanomphalus amauronius из верхней сублитора-
ли озера; трофонты относительно крупные, с мешко-
видным телом неправильных очертаний, кинетом
асимметричен. Перистом С-образный, извитой, лате-
ральный, проходит диагонально по обоим краям тела.
Справа 20—24 кинеты, слева все эти ряды и около
24 укороченных тигмокинет подходят к широкому
прямому апикальному шву. Рот субтерминальный. Ци-
топлазма полна зоохлорелл, но питание фаготрофное.
Вследствие слабой минерализации воды раковина у
байкальских гастропод тонкая, пропускает свет, и
часть эндемичных тигмотрих имеет зоохлореллы.
Род Cotensicoma Jankowski, 1982
Типовой вид С. manticola из байкальских гаст-
ропод Choanomphalus amauronius', встречаются реже
других симбионтов. Трофонты некрупные, эллипсоид-
ные, плоские, с резкой асимметрией кинетома; справа
около 18—20 разрозненных кинет без ресничек в их
нижней части, слева густое тигмотактическое поле из
23—26 биполярных кинет, подходящих к узкому
длинному дуговидному апикальному шву. Перистом
очень узкий, краевой, вытянут на 3/4 длины тела, его
вершина удалена от апекса, рот у постерона. В безрес-
ничной зоне (снизу правее рта) окраска выявляет поло-
сы пелликулы, импрегнация серебром — продольные
фибриллы.
Род Cheissinia Chatton et Lwoff, 1949
Типовой вид Tiarella baicalensis Cheissin, 1931;
название Tiarella Cheissin, 1931 — гомоним. Симбионт
эндемичных крупных байкальских моллюсков (внеш-
не похожих на Viviparus) Benedictia baicalensis и
В. limnaeoides. Хейсин различал 2 формы вида — f. ty-
pica (оба хозяина) и f. elongata {В. limnaeoides). По
Аэшт, эти формы нужно считать подвидами Ch. b. typi-
са и Ch. b. elongata и далее нужно заменить первое на-
звание на видовое — Cheissinia baicalensis subsp. bai-
calensis. Однако у триходин «формы» не признаются
подвидами. Вид из В. limnaeoides здесь обозначается
как Cheissinia elongata Jank. sp. n.; диагноз и рисунки в
статье Хейсина (Cheissin, 1931).
Тело типовой формы, коническое, заострено и ото-
гнуто вбок сверху, ниже — цилиндрическое, с плоским
перистомом на заднем конце. Над постероном незна-
чительно подняты вершины мембраны и мембранеллы
М2. Топография кинет резко изменена, ряды идут диа-
гонально и кажутся кольцевыми, подходят к длинной
бисеканте вентрально и к более короткой бисеканте
(каудальному шву) левее рта. На вершине тела — об-
ширное поле фрагментов кинет с мелкими кинетосо-
мами, ряды и кинетосомы в них сближены вплотную,
реснички короткие, щетинковидные, малоподвижные;
аргентофильные фибриллы, видимые в соматической
зоне, не продолжаются в тигмозоне. В норме особи
прикреплены тигмозоной к эпителию жабер и в массе
заполняют узкие полости между смежными жабрами.
Левинсон (1941) считает этот род очень близким к
Boveria, другие авторы включают в состав Hemispeiri-
dae s. str. (только для форм с обособленным тигмоном),
но Cheissinia не может иметь отношения к морским
тигмотрихам, это продукт эволюции эндемичных тиг-
мотрих в Байкале. Примитивные формы (Ancistrumina)
обитают в Choanomphalus и в Benedictia, и в обоих ро-
дах они дали начало аберрантным родам Ancistrella,
Cotensicoma, Cheissinia и Baikalothigma. Такие же при-
митивные тигмотрихи обычны в мелких планорбидах
вокруг Байкала, а также в Choanomphalus из оз. Хубсу-
гул (Монголия), где они не дали более сложных родов.
Род Hemispeira Fabre-Domergue, 1888
Типовой вид Н. asteriasi с поверхности тела
морских звезд, обычен в амбулакральных желобках
Asterias rubens и Marthasterias glacialis (Франция); в
первоописании род отнесен к перитрихам. Валленгрен
(Wallengren, 1895) подробно переописал вид с М. gla-
cialis из Швеции и исключил из состава перитрих, пе-
ренеся в отряд холотрих. Точное описание кинетома
по импрегнированным препаратам приведено Шатто-
ном и Львовым (Chatton, Lwoff, 1949). Гемиспейры,
неотличимые от типовых, встречаются практически на
всех звездах разных родов в наших дальневосточных
морях от Владивостока до Камчатки; либо они неспе-
цифичны, либо отличия видов очень мелкие и пока не
выявлены. Типовой хозяин — A. rubens, всегда засе-
ленный на Мурмане и в Белом море. Особи очень мелкие
(20—30 мкм), бочонковидные, слегка сплющены, обычно
прикреплены к тканям хозяина четко обособленным
тигмоном — плотной массой прямых ресничек. Сома-
кинет мало, по 4 с каждой стороны, расположены в ви-
де поперечных дуг; на вершине тела обособлены 8—9
вплотную сближенных рядов — резко укороченные
кинеты, несущие специализированные тигмотактиче-
ские реснички. Перистом развернут спиралью на ниж-
ней стороне тела, находится в одной плоскости, от тиг-
мона к перистому идут длинные бисеканты. Строение
перистома стандартное для отряда — удлинены дуго-
видные УМ и М2, мембранеллы Ml и М3 представле-
ТИП CILIOPHORA. КЛАСС OLIGOHYMENOPHOREA
875
ны мелкими рудиментами. Специализированы сомати-
ческие ряды, примыкающие к перистому справа и сле-
ва. Длина ресничек перистома практически равна
длине тела, вид имеет эффективный фильтрационный
аппарат. Род выделялся в сем. Hemispeiridae, но обо-
собленный тигмон имеет и ряд других анцистрид, род-
ство которых с Hemispeira не доказано, поэтому семей-
ство в данном обзоре признается sensu lato.
Род Hemispeiropsis Копig, 1894
Типовой вид Н. comatulae с фильтрационных
желобков рук морских лилий Comatula mediterranea
(= Antedon). Возможно, вид идентичен с плохо описан-
ной Trichodina antedonis Cuenot, 1891 с Antedon rosacea и
правильное название вида Hemispeiropsis antedonis
Jank. comb. n. Внешний облик H comatulae идентичен
с Hemispeira asteriasi, особи мелкие, с таким же кине-
томом; родовым различием считали наличие одной
мембраны у Hemispeira, двух у Hemispeiropsis и наличие
безресничных ребер кортекса у второго рода. Ротовой
аппарат столь мелкой формы трудно изучить, и лишь
на импрегнированных препаратах (Chatton, Lwoff, 1949)
показана идентичность их перистома. Нет оснований
считать род валидным; вид следует обозначать как He-
mispeira antedonis (Cuenot) Hamburger et Buddenbrock,
1911. Фенхель (Fenchel, 1965a) подробно описывает/Z an-
tedonis с нового хозяина Antedon petasus в Швеции.
Род Protophrya Kofoid, 1903
Типовой вид P. ovicola. Тело резко сплющено
латерально, с почти округлым или эллипсоидным кон-
туром, с полимеризацией кинет, без обособленных
тигмозон; топография кинет простая, усложнена лишь
наличием небольшого бисекантного шва снизу справа
и слева. Перистом очень узкий, маргинальный, вытяну-
тый, предротовой шов резко удлинен, смещая перисто-
мальную полосу вниз. Апикальный шов в виде очень
длинной дуги, бисекантного типа, вершины всех кинет
подходят ко шву с обеих сторон. Перистом с удлине-
нием УМ и М2, рот ведет в узкую трубчатую глотку.
Вид был найден в 3 хозяевах в США; это симбионт
в зародышевой камере живородящего вида гастропод
Littorina rudis, на икринках с развивающимися личин-
ками, и в мантийной (жаберной) полости яйцекладу-
щих видов L. palliata и L. littorea, икра которых разви-
вается в наружной среде. Сравнения морфологии форм
с этих хозяев до сих пор нет. По Фенхелю, в норме это
симбионт мантийной полости хозяев, а у самок L. rudis
(= L. saxatilis) переходит в зародышевую камеру. На
Мурмане вид никогда не встречается в крупной L. litto-
rea, найден во всех особях L. saxatilis, род представлен
в мантоне L. obtusata (см. Isselina). Сейчас системати-
ка литторин изменилась, в северных морях находят
также L. arcana и другие виды, и распределение про-
тофрий по хозяевам нужно изучать заново. В Черном
море в L. neritoides протофрий нет, только анцистри-
ды, но этот вид гастропод выделяют в особый род Ме-
laraphe и иногда даже не включают в списки литтори-
нид. В литторинах Пацифики от Владивостока до
Командор всегда есть протофрии, видовой статус ко-
торых пока не выяснен.
Электронная микроскопия и переописание морфо-
логии Р. ovicola из L. saxatilis представлены Фокиным
(1993). По данным ряда авторов, особи могут прони-
кать внутрь икринок и зародыши развиваются ано-
мально или гибнут; однако при вскрытии хозяев видны
подвижные цилиаты на икре, как Allosphaerium на
икре талитрид, тканевой паразитизм невозможен.
Вид Р. indica Jamadar et Choudhury, 1988 описан
в восточной Индии (шт. Бенгал) из Littorina melanosto-
та и L. scabra-, локус — мантийная полость и «бук-
кальная масса»; импрегнации нет, топография кинето-
ма неизвестна.
Род Isselina Cepede, 1910
Типовой вид I. intermedia. Типовой хозяин
вида Р. ovicola — L. saxatilis (= L. rudis), вида I. inter-
media — L. obtusata, не имеющая зародышевой каме-
ры; у последнего тигмотрихи обитают в мантийной по-
лости. Род Isselina никем не признавался валидным, а
вид считался синонимом Р. ovicola. Сравнения морфо-
логии видов из разных литторин в литературе нет. На
Мурмане хозяева встречаются совместно, но несут
разных симбионтов; вид 1. intermedia, по моему мне-
нию, валидный, — не так сильно смещен перистом, ве-
роятно поэтому вид назван «intermedia». Первоописа-
ние вида очень краткое, рисунков нет; по моим дан-
ным, виды отличаются размерами, формой тела (более
узкое у Isselina), по форме ядра и степени сдвига пери-
стома. Это различия видового плана, и Isselina нельзя
сохранить как род, максимум как подрод прото-
фрий — Р. intermedia Jank. comb. n.
Сем. Dragescoidae Jankowski,
1980
В Guide семейство приводится как Dragescoidae
Jankowski n. fam. (in Small et Lynn, 1985), но диагноз
дан раньше. При изучении симбионтов морских ежей
внимание традиционно уделялось богатой фауне ки-
шечных цилиат; на покровах панциря северных ежей
мною были открыты новые олиготрихи (Strombidium)
и тигмотрихи (Dragescoa). D. mirabilis — очень мел-
кие плоские цилиаты с дисковидным телом, крупным
перистомом и несколькими кинетами сложной топо-
графии. Все тело огибает тигмотактическая полоса из
нескольких тесно сближенных кинет, в которых вплот-
ную сближены мелкие кинетосомы. Перистом с длин-
ными УМ и М2. Передний конец тела смещен вправо,
цилиатура несимметричная — удлинены правые ряды,
укорочены левые.
Род Dragescoa Jankowski, 1974
Типовой вид D. mirabilis Jank., 1974; также
D. magna Jank., 1974; с диагнозом семейства. Виды
изучены без импрегнации, при рельефном (боковом)
освещении фиксированных цилиат, схема организации
876
ALVEOLATA
кинетома может быть неточной. Виды рода в массе
обитают на сублиторальном еже Strongylocentrotus
droebachiensis на Мурмане, отсутствуют на 5. pallidus
из тралов, обычны и на дальневосточных видах мор-
ских ежей. Вероятно, этот род отмечен на Echinus escu-
lentus в Англии.
Сем. Nucleocorbulidae Santhakumari
et Balakrishnan Nair, 1970
Симбионты в мантийной полости древоточцев —
двустворчатых моллюсков Nausitora hedleyi и Teredo
furcifera (Bivalvia, Teredinidae) из древесины пирсов в
бухте Кочин, Индия, обитают здесь совместно с кос-
мополитным симбионтом терединид — Boveria teredi-
nidi. Гигантские (до 500 X 360 мкм) цилиндрические
инфузории с гибкой пелликулой, внешне очень напо-
минают примитивных перитрих типа Scyphidia и Apio-
soma. Прикрепляются к субстрату широким диском
(присоской), густо покрытой ресничками. Тело также
несет цилиатуру в спиральных, почти поперечных ря-
дах. Ротовая зона широкая, с кольцом длинных ресни-
чек, скленных в мембраиеллы; ядро подковообразное у
молодых форм, сетчатое у взрослых. Питание хищ-
ное — заглатываются другие инфузории из мантона
(Boveria, Urceolaria). При отделении от субстрата осо-
би активно плавают, ротовой диск втянут.
Морфологию рода можно понять лишь при сравне-
нии с Hemispeira. При укрупнении тела произошла по-
лимеризация кинет, расположенных вплотную в виде
поперечных колец на всем теле; должны быть найдены
секантные зоны, не показанные на рисунках вида. Уве-
личилось и число тигмокинет в четко обособленном
апикальном тигмоне. Удлинились кинеты перистома,
ставшие почти кольцевыми. Тело стало сократимым,
перистомальная зона может сжиматься. Обособился
прикрепительный диск с тигмоном. В сущности, лишь
один шаг отделяет Nucleocorbula от низших перитрих
типа Scyphidia — у последних утрачена соматическая
цилиатура, а кинетосомы в тигмоне расположены в
беспорядке, не в рядах.
Род Nucleocorbula Santhakumari
et Balakrishnan Nair, 1970
С диагнозом семейства; типовой вид S. adherens.
Приложение
Род Thigmotheron Jankowski gen. n.
Род предложен в тезисах и поэтому в каталоге
Аэшт признан невалидным; здесь предлагается вновь.
Бразильский протозоолог Чагас (Chagas, 1911) при
изучении симбионтов гастропод Littorina sp. на лито-
рали у Рио де Жанейро подробно описал и иллюстри-
ровал новый вид Balantidium (?) littorinae с 2 формами,
не получившими латинских названий. Форма В — это,
скорее всего, Protophrya, рисунок перевернут — вид
здесь обозначается как В. chagasi Jank. sp. п., диагноз и
рисунки 1—5 — в цитированной работе. Форма А —
это вид нового рода Thigmotheron littorinae comb. n.
(рис. 6—11 у Чагаса). Очень крупные формы с плос-
ким телом, продольными сомакинетами и зернистыми
тяжами между кинетами или с полосами кинетосом по
3—4 ряда в каждом (по первоисточнику неясно); пери-
стом смещен далеко вниз от апекса, занимает не боль-
ше четверти тела, узкий, вероятно с удлинением УМ и
М2, рот смещен на постерон. Ядро вытянутое; зарисо-
ванные у одной особи 7 мелких ядер — типичный на-
бор у плейронематид, тигмотрих и перитрих зачатков
ядер у эксконъюгантов. Рисунки этого вида в статье
Чагаса перевернуты, как и рисунки протофрий, поэто-
му интерпретированы неправильно. Вид хозяина и ло-
кализация симбионтов не указаны.
Подкласс Apostomatia Chatton et Lwoff, 1928 (рис. 372, a—374, a)
Комменсалы и паразиты беспозвоночных в основном ракооб-
разных и кишечнополостных. Жизненный цикл сложный, часто со
сменой хозяев, включает серию последовательных фаз, каждая с
определенной топографией кинетома, реализация которой требует
сложного метаморфоза. Чаще всего апостоматы фиксированы на
ракообразных в виде цисты (форонта), который освобождается при
линьке хозяина или его заглатывании другим беспозвоночным и
превращается в дефинитивного трофонта, с декстральным изгибом
соматической цилиатуры и с новообразованием ротового аппара-
та — розетки и рта для заглатывания жидкой или мелкодисперсной
пищи; у рта примитивная предротовая цилиатура, несколько фраг-
ментов кинет.
Закончив рост, трофонт инцистируется, сомакинеты становят-
ся продольными; это стадия протомонта, заканчивающего пищева-
рение. Томонт делится палинтомически (повторными делениями
без питания и роста между ними), продуцируя многочисленных
мелких протомитов, вступающих в сложный метаморфоз с образо-
ванием томитов; последние расплываются и инцистируются на по-
кровах ракообразных своего вида хозяев. Конъюгация связана с па-
линтомией (зигопалинтомия).
Это исходный цикл у форм, сохраняющих ротовой аппарат.
Пути эволюции многообразны, приводят к выпадению многих ста-
дий развития или, наоборот, к дальнейшему усложнению цикла, к
появлению одного и даже двух промежуточных хозяев, к утрате
рта у ряда родов. В целом это комплекс необычайно дивергентных
форм; многообразие объяснимо частой неотенией, фиксацией фаз
развития, выпадением стадии трофонта. Другая причина многооб-
разия — переход и адаптация от эпибиоза к эндопаразитизму, с пи-
танием кишечным содержимым, тканевой жидкостью, кровью и
даже органикой в хитиновом панцире хозяев; такое разнообразие
требует разных морфологических адаптаций. Трофонты исходной
группы (феттингерииды) имеют немногочисленные кинеты, гомео-
мерное ядро, рудименты ротовой цилиатуры; нет мембранелл, име-
ющихся у гименостомат и тигмотрих.
Филогения группы была неясной, но электронная микроскопия
показала идентичность корневого фиброма кинетосом с таковым
гименостомат. Конкретная предковая группа среди гименостомат
неизвестна; Янковским (1980) впервые высказано мнение о родст-
ве апостомат с тигмотрихами — анцистридами. Исходные апосто-
маты могли произойти от гемиспейрид типа Hemispeira или Dra-
gescoa, поскольку размеры, облик и кинетом томитов апостомат в
принципе сходен с названными родами. Askoella, род неясного по-
ложения, частый на амфиподах, может служить моделью переход-
ной формы.
Ротовой аппарат трофонтов трудно гомологизировать, но у то-
митов он сравним с тетрахимениумом гименостомат, включая мем-
брану УМ и мембраиеллы. Послеротовых кинет нет, это говорит о
родстве с Scuticociliatida, что подтверждает и молекулярный ана-
ТИП CILIOPHORA. КЛАСС OLIGOHYMENOPHOREA
877
Рис. 372, a. Apostomatia. Gymnodinioides inkystans (Л); Polyspira delagei (Б, Д); Gymnodinioides sp. в амфиподах Байкала (В, Г); Collinia or-
chestiae (E—К)', Hyalophysa Iwojfi (JT). (По: Chatton, Lwoff, 1930 (А, Е,Д); Bradbury, Clamp, 1973 (Z7); Puytorac, Grain, 1975 (E—K)\ В, Г—
ориг.).
Fig. 372, a. Apostomatia.
Gymnodinioides sp. in amphipods of lake Baikal (В, Г).
лиз вида Gymnodinioides sp. c Marinogammarus obtusatus (Lynn
et al., 2005); дивергенция базальная, обе ветви независимы в рам-
ках Oligohymenophora.
Беспримерное разнообразие плана строения и незнание фило-
гении родов внутри подкласса очень затрудняют классификацию
апостомат; многие роды заслуживают выделения в самостоятель-
ные подотряды или отряды, к примеру безротые Collinia, постоян-
но инцистированный Mycodinium, своеобразные почечные пара-
зиты осьминогов Chromidina или томитообразные Phoretophrya,
поедающие форонтов других апостомат. Изучено мало хозяев в
основном на биостанциях Франции; в последнее время значитель-
ны успехи протозоологов США, в других районах степень изучен-
ности группы невелика. Можно ожидать открытия новых типов ор-
ганизации и дальнейшего усложнения внутренней системы под-
класса.
В последней по времени классификации (Lynn, 2002) подкласс
Apostomatia включает отряды Apostomatida. Astomatophorida и Pili-
suctorida, представителями которых могут быть роды Gymnodinioi-
des, Chromidina и Conidophrys (Mycodinium). Первые включают
формы с ротовой цилиатурой и сомакинетами; у вторых (из голово-
ногих) ротовой аппарат исчез; у третьих нет соматических рес-
ничек и ротовых фрагментов кинет, питаются высасывая ткане-
вую жидкость. Эта четкость кажущаяся; в первом отряде есть род
Collinia, лишенный рта на стадии трофонта; не доказано родство
2 родов, составляющих второй отряд. Ряд родов не находит места в
системе.
В системе Янковского (1980) класс Apostomata делится на
отряды Foettingeriida, Colliniida, Chromidinida, Phthorophryida,
Conidophryida и Askoellida, которым можно дать четкие характе-
ристики. Возможно, часть этих групп следует понизить в ранге до
подотряда. Вместо Conidophryida здесь используется название
Mycodiniida, поскольку Conidophrys — синоним рода Mycodinium.
Нежелательно повторение в схеме Линна названия Apostomata для
отряда и подкласса.
Открытие апостомат связывают с работами Клапареда (Clapa-
rede, 1863) и Минкевича (Minkiewicz, 1912а, 1912b, 1913), но много
зарисовок Gymnodinioides дал Рентш (Rentsch, 1860) при изучении
симбионтов «Gammarus ornatus». Таксон Ciliata Chromatophora (по
новым правилам Chromatophorida Minkiewicz, 1912) имеет приори-
тет перед названием Apostomata.
Отряд Foettingeriida Jankowski,
1980
Фаготрофные формы с полным жизненным цик-
лом, без неотении — без фиксации фаз на одной из
ранних стадий развития. У всех остальных групп нет
стадии трофонта, гомологичной трофонту феттингери-
ид. Сюда относится большинство родов апостомат.
878
ALVEOLATA
Рис. 372, 6. Apostomatia.
(Л) Жизненный цикл Hyalophysa chattoni. (По: Bradbury, 1966). Питание в экзувии рачков, выход, инцистирование, палинтомия в цисте, образование массы
протомитов, их метаморфоз до стадии томитов (Б—М), инцистирующихся на жабрах и панцире слинявшего рачка.
Fig. 372, б. Apostomatia.
(Л) Life cycle of Hyalophysa chattoni. Feeding in crustacean exuvium, exit, encysting, palintomy inside cyst, formation of numerous protomites, their metamorphosis
to tomite stage (Б—M), encysting on branchiae and carapace of molted crustacean.
Сем. Foettingeriidae Chatton,
1911
Трофонты с развитым ротовым аппаратом — розет-
кой, ртом и рудиментом ротовых кинет; жизненный
цикл с чередованием стадий трофонта, томонта и
томита, с промежуточными фазами морфогенеза. Сим-
бионты в основном ракообразных, встречаются в прес-
ных водах (только один род) и в море. В схеме Пюйто-
рака (Puytorac, 1994) семейство включает 7 подсе-
мейств — Gymnodinioidinae (Gymnodinioides, Polyspira,
Hyalophysa, Phoretophrya), Spirophryinae (Spirophrya,
Vampyrophrya, Calospira, Traumatiophtora), Synophryi-
nae (Synophrya), Terebrospirinae (Terebrospira), Collinii-
nae (Collinia), Phthorophryinae (Phthorophrya) и Foettin-
geriinae {Foettingeria, Ophiuraespira, Pericaryon, Me-
taphrya).
Род Calospira Chatton et Lwoff,
1935
Типовой вид C. minkiewiczi. Тело трофонта
каплевидное, около 20 кинет подходят к апексу и про-
дольному унисекантному шву, закручены спиралью у
постерона; в метазоне (участок тела между апексом и
ртом) фрагменты кинет с двойным рядом кинетосом в
основании; рот с 3 короткими гаплокинетами чуть
выше экватора; от рта до постерона тянется узкая ар-
гентофильная полоса. Форонты инцистированы на по-
кровах тела бентосной копеподы Harpacticus gracilis,
выходят из цист и превращаются в трофонтов в погиб-
ших хозяевах. Моноксенные гистиотрофные формы.
Трофонты с аберрантным ядерным аппаратом в виде
необычайно длинной извитой ленты.
ТИП CILIOPHORA. КЛАСС OLIGOHYMENOPHOREA
879
Рис. 373, a. Apostomatia. Жизненный цикл Hyalophysa chattoni. (По: Bradbury, 1966).
Трофонт (А—В); форонт (Г, Др, начало метаморфоза при линьке хозяина (Е, Ж); превращение в быстро растущего трофонта (3, И); К— протомонт, прекра-
тивший питание.
Fig. 373, a. Apostomatia. Life cycle of Hyalophysa chattoni.
Trophont (A—Bp, phoront (Г, Д); beginning of metamorphosis at host molting (£, Ж); transformation into rapidly growing trophont (3, Я); K.—protomont, not-feeding
stage.
Род Foettingeria Caullery et Mesnil, 1903
Типовой вид Plagiotoma actiniarum Claparede,
1863 (Nyctotherus in Diesing, 1866; Conchophthirius in
Stein, 1867). На дефинитивной стадии 9 кинет трофон-
та закручены несколько раз вокруг тела; метазона уз-
кая, не шире межкинет, со ртом, розеткой и 4 фрагмен-
тами ротовых кинет в передней четверти тела. В про-
цессе метаморфоза томиты превращаются в трофонтов
типа Gymnodinioides, но начинается быстрое закручи-
вание кинет снизу вверх, метазона резко сужается. Вид
часто отмечается в гастроваскулярной полости сво-
бодных и симбионтных актиний во многих морях, ве-
роятно неспецифичен для хозяев; круг известных хозя-
ев включает роды Actinia, Anemonia, Tealia, Heliactis,
Sagartia, Adamsia, Bunodes, Actinoloba, Aiptasia, Calli-
actis, Bunodosoma и др.; вид обычен в морях России.
Описан второй вид из Cereus pedunculatus во Франции
(Foettingeria cerei Delphy, 1938) с 16 кинетами; вид
изучен без импрегнации и, как и F. tealiae, сомните-
лен. Предполагается наличие нового вида в Калифор-
нии в актинии Anthopleura xanthogrammatica с мелки-
ми трофонтами длиной тела до 250 мкм..
Форонты оседают вне актинии на любых ракооб-
разных (копеподы, остракоды, изоподы, амфиподы,
декаподы), эксцистируются при их заглатывании акти-
нией и здесь превращаются в трофонтов (до 0.5 мм) и
далее в массивных гипертрофонтов (до 1 мм) с спира-
лизацией всех кинет. В цикле развития необычно нали-
чие внутрицитоплазменных тяжей кинетосом — обыч-
но у цилиат кинетосомы расположены под пелликулой
на поверхности тела. Внутренняя спираль кинетосом
880
ALVEOLATA
Рис. 373, 6. Apostomatia.
Mycodinium (=Conidophrys): M. enkystotrophos (А, Б); M. pitelkae (В—Д); M.jaerae (E—3); Mycodinium sp. (И, Ку, M. pilisuctor (JI—О). (По: Bradbury, 1975
(S—Д); Jones, Khan, 1970 (E—3); Chatton, Lwoff, 1936 (И— О); А, Б — ориг.).
Fig. 373, 6. Apostomatia.
служит для сохранения всех кинетосом, которые будут
необходимы для взрослого трофонта. Вне хозяина тро-
фонты превращаются в томонтов, кинеты становятся
продольными, при многократном непрерывном деле-
нии образуются протомиты и далее томиты величиной
20 X 12 мкм. При линьке хозяина, в отличие от Gymno-
dinioides, форонты не выходят из цист и гибнут.
Род Gymnodinioides Minkiewicz, 1912
Типовой вид G.inkystans Minkiewicz, 1913
(вид был назван через год после публикации названия
рода) без указания типового хозяина; вероятнее всего,
это рак-отшельник Pagurus bernhardus. Виды рода од-
нотипны и отличаются мелкими деталями кинетома;
морские виды заселяют амфипод, пагурид, крабов,
пресноводные — изопод, амфипод, креветок. Жизнен-
ный цикл простой — это экзувиотрофные моноксен-
ные формы; форонты на покровах тела хозяев, трофон-
ты в экзувиях (сброшенном при линьке панцире), то-
монты на дне. Размножение палинтомией в цистах,
форонты выходят из цист с началом линьки. Кроме
G. inkystans род включает виды G. humorale Ch. et Lw.,
1935 с литоральных копепод Harpacticus gracilis (фо-
ронты на панцире рачков, выходят из цист и питают-
ся не в экзувиях, а в погибших рачках), G. calkinsi,
G. corophii Ch. et Lw., 1930 (с мелких амфипод из тру-
бок в перифитоне), G. cerebriformis (Qpalina in Fab-
re-Domergue, 1888), G. caridinae с креветок (Hyalospi-
ra), G. zonatum (Physophaga), G. aselli (Oospira),
G. kozloffi Landers, 2004 с травяной креветки Hippolyte
zostericola и др.; предполагается открытие новых ви-
дов на креветках и крабах на юге США (Landers, 2004).
Вероятный новый вид заражает пещерных амфипод
Niphargus aquilex в ФРГ (Schodel, 1998). На Мур-
мане виды рода встречаются в указанных хозяевах и в
шкурках (экзувиях) морских желудей Semibalanus
balanoides, которые легко собрать в приливной воде
(вид G. cerebriformis). В Байкале заселены все берего-
вые виды, а форонтов можно видеть и на основании
жабер и плеопод траловых гаммарид с глубин в сотни
метров. Форонты бесцветные или оранжевые, трофон-
ты ярко окрашены — фиолетовые, розовые, впиты-
вают пигменты сбрасываемого при линьке панциря
раков.
ТИП CILIOPHORA. КЛАСС OLIGOHYMENOPHOREA
881
Рис. 374. Apostomatia.
Метаморфоз Ascophrys rodor на панцире креветок (трофонт—томонт—томиты, А—Ж). (По: Deroux et al., 1975). Томиты микодиииид и загадочный род As-
koella (неотенический томит?): Ascophrys rodor (3, И)', Mycodinium pitelkae (Л, М); Askoella heliostoma (Н, ГГу, типичный томит апостомат (О). (По: Deroux
et al., 1975 (А—К, М, О); Bradbury, 1975 (Л); Н,П — ориг.).
Fig. 374. Apostomatia.
Metamorphosis of Ascophrys rodor on shrimp carapace (trophont—tomont—tomites). Tomites of Mycodiniids and enigmatic genus Askoella (neotenic tomite?).
Тело овальное, рот на границе передней трети, с ти-
пичным набором органелл (розетка, фрагменты рото-
вых кинет); число кинет невелико, около 9, метазона
широкая, ниже экватора кинеты закручены спиралью.
Томит плоский, на венте рот, ротовые ряды, полосы
кинетосом и продольные кинеты. Если это повторе-
ние филогенеза, полосы кинетосом можно считать
мембранами гименостомат, а фрагменты ниже рта —
частью УМ и скутикуса. Эта стадия консервативная
и повторяется в жизненном цикле многих родов отря-
да. Ряд родов апостомат, выделенных Шаттоном
и Львовым (Chatton, Lwoff, 1935), по морфологии
трофонтов идентичны с Gymnodinioides, но имеют
сложный жизненный цикл.
Род Hyalospira Miyashita, 1933
Типовой вид Н caridinae описан в Японии
с пресноводных креветок Xiphocaridina compressa,
позже найден на Palaemon sinensis, Leander paucidens,
Macrobrachium nipponense и других креветках; вид
недавно переописан заново на протарголовых пре-
паратах и переведен в состав Gymnodinioides, род не-
валидный (Bradbury et al., 1996). Нет заметных от-
личий между этими родами по морфологии всех ста-
дий цикла.
Род Oospira Chatton et Lwoff,
1930
Типовой вид О. aselli; род невалиден как гомо-
ним и синоним. Форонты на дыхательных пластинках
водяного ослика Asellus aquaticus, трофонты в ли-
нечном панцире. Трофонты по внешнему облику и ки-
нетому идентичны с Gymnodinioides, отличаются мел-
кими деталями кинетома; сами авторы вскоре пере-
несли О. aselli как валидный вид в состав рода
Gymnodinioides.
56 Зак. №4163
882 ALVEOLATA
Род Physophaga Percy,
1929
Типовой вид Ph. sappheira; комменсалы Gam-
marus pulex\ автор не знал, что вид уже описан ранее
как Larvulina zonata Penard, 1922; указанные отличи-
тельные признаки рода (ядро не ветвится, цисты па-
линтомонтов без микропиле) характерны и для Gymno-
dinioides. Род сначала' сохраняли, но позже тип рода
перевели как валидный вид в состав Gymnodinioides
(G. zonatum). Типовой вид рода Larvulina Penard,
1922 — L. variabilis, это аберрантная гименостомата
отряда скутицид.
Род Hyalophysa Bradbury, 1966
(рис. 372, а, 6—373, а)
Типовой вид Н. chattoni. Трофонты типа Gym?
nodinioides, с 9 кинетами, закрученными в постесоме;
метазона (ацилон) обширная, особо расширена выше
рта, где в беспорядке рассеяны парные кинетосомы
(дисомы). От рта до постерона идет аргентофильная
полоса. Рот и 3 мелких фрагмента кинет у рта типичные.
Томит, как у Gymnodinioides. Виды рода интенсивно
изучаются в США (морфология, хозяева, морфогенез,
ультраструктура, питание, зараженность вирусами),
это наиболее изученный род апостомат (Grimes, 1976;
Landers, 1986, 1997; Landers et al., 1999; Bradbury et al.,
1997, и др.); ожидается открытие новых видов
рода (Landers, 2004). Н. chattoni заселяет широкий
круг морских и пресноводных декапод — креветки,
пагуриды, крабы, вероятно эндемик северо-востока
США.
Н. Iwoffi Bradbury et Clamp, 1973 обитает только на
пресноводных креветках с востока и запада США, на-
пример на Palaemonetes paludosus', метазона более ши-
рокая, спереди рассеяны пары кинетосом.
Н. trageri Grimes, 1976 с крабов Uca и Sesarma име-
ет обширный ацилон с компактным сплошным полем
десятков одиночных кинетосом; отличие кинетома по-
зволяет выделить вид в особый подрод в рамках Hya-
lophysa.
Род Ophiuraespira Chatton et Lwoff,
1930
Типовой вид О. weilli из необычных для апо-
стомат хозяев — из офиур Amphipholis (= Amphiura)
squamata, Ophiothrix fragilis, возможно и в других хо-
зяевах; химотрофный вид из кишечника, пока найден
только во Франции. Томонты и томиты во внешней
среде, форонты и промежуточные хозяева неизвестны;
предположительно диксенный вид, заражает хозяев
при заглатывании добычи. Трофонты типа Gymnodi-
nioides, но с меньшей спирализацией кинет. Рот ближе
к антерону, чем у Gymnodinioides, метазона выше рта
узкая, спирализация кинет незначительная, нет полосы
из 3 вплотную сближенных рядов, спирально закру-
ченной у названного рода. Палинтомические цисты
только с 2—8 томитами в связи с мелкими размерами
трофонтов (всего 40—50 X 25—35 мкм).
Род Phoretophrya Chatton, A. Lwoff
et М. Lwoff, 1930
Типовой вид Ph. nebaliae. Трофонты типа
Gymnodinioides, с нешироким ацилоном, 9 кинетами,
характерной полосой из 3 сближенных кинет, с типич-
ным ротовым аппаратом и спирализацией кинет в по-
стесоме. Моноксенные формы; форонты и форетиче-
ские томонты (форо-томонты) на придатках тела фил-
локариды Nebalia geoffroyi (Leptostraca), трофонты в
экзувиях рачков. Жизненный цикл усложнен, и это яв-
ляется отличительным признаком рода. Кроме обыч-
ного для Gymnodinioides цикла (с чередованием фаз эк-
зувиального трофонта, инцистированного томонта вне
хозяина, томитов, форонтов на покровах хозяев) воз-
можно отклонение. Выплывая из экзувия, трофонт об-
разует цисту и там целиком превращается в гигантско-
го апотомита после сложного морфогенеза; апотомит
эксцистируется, оседает на покровах рачка, много-
кратно делится в форо-цисте путем обычной палинто-
мии; томиты эксцистируются и входят в экзувий. Вид
имеет фактически 2 цикла развития.
Род Spirophrya Chatton et Lwoff,
1924
Типовой вид 5. subparasitica. Трофонты с
16 кинетами, закрученными у постерона; в узкой мета-
зоне рассеяны парные кинетосомы; нет полосы из
3 сближенных кинет; ротовой комплекс и аргенто-
фильная полоса от рта до постерона типичные. Томи-
ты с мелкими отличиями от Gymnodinioides. Форонты
на панцире бентосной гарпактикоидной копеподы Idya
furcata-, трофонты в тканях тех же копепод, при их раз-
давливании или заглатывании хищниками, например
гидроидами Cladonema radiatum; томонты на стволе
этого и других хищных кишечнополостных. Род чет-
кий, с полимеризацией кинет (9—10 у перечисленных
выше родов), аберрантным строением трофонта и
с 2 типами циклов развития. Кроме типичного для эк-
зувиотрофов цикла возможен другой способ разви-
тия трофонтов. Молодые трофонты выходят из экзу-
вия, образуют гигантскую цисту, дедифференцируют-
ся (все кинеты, включая ротовые, выпрямляются по
оси тела, рот исчезает) и превращаются в апотомитов;
апотомит эксцистируется, вновь инцистируется на по-
кровах хозяев, образуя фороцисту; форонт выходит
из фороцисты при гибели хозяина и приступает к пи-
танию.
Род Vampyrophrya Chatton et Lwoff,
1931
Типовой вид V. aphanotypa по монотипии; поз-
же вид сведен в синонимы вида Spirophrya pelagica
Chatton et Lwoff, 1930, ставшего типовым. Второй
вид V. steueri — крупные форонты на копеподах Pleu-
romamma borealis, Р. gracilis, Р. robusta с глубины
200—2500 м, трофонты не изучены. V. bathypelagica
также условный вид, описан по форонтам фиксирован-
ных рачков Р. borealis и Р. gracilis из тех же фиксиро-
ТИП CILIOPHORA. КЛАСС OLIGOHYMENOPHOREA
883
ванных сборов. Форонты V. pelagica прикреплены к
панцирю Paracalanus parvus (Copepoda, Calanoida), ве-
роятно, встречаются также на Acartia, Centropages и на
других пелагических копеподах; трофонты в тканях
копепод-хозяев, заглоченных различными беспозво-
ночными пелагиали и бентоса (медузами, гребневика-
ми, сифонофорами и др.). Трофонты в целом типа
Gymnodinioides, с 10 кинетами, но с меньшей спирали-
зацией тела и кинет, без фрагментации предротовых
рядов, с обширной метазоной выше рта и узкой поло-
сой ниже рта; ядро лентовидное, извитое. Форонты
встречаются на ограниченном круге хозяев (каланои-
дах), а трофонты могут питаться в лаборатории также
в тканях кладоцер, в пелагических личинках крабов и
т. д. В неграмотной статье Пастернака и Копылова
(1983) этот вид описан как некрофаг на Paracalanus
parvus, Pseudocalanus elongatus и Acartia clausi в Чер-
ном море — как Colpoda sp.
Род Traumatiophtora Chatton et Lwoff,
1931
Типовой вид T. punctata. Трофонты с 11 кине-
тами, снизу закрученными спиралью, с группой из
3 сближенных кинет; метазона обширная выше и ниже
рта, сужается к постерону; по всей верхней половине
метазоны рассеяны дисомы — продукт фрагментации
одного из двойных рядов, расположенных здесь у
Gymnodinioides. Трофонты питаются в погибших или
заглоченных пелагических рачках Acartia clausi —
массовом виде планктона в морях Европы, вместе с
трофонтами Vampyrophrya pelagica-, форонты на по-
кровах этих копепод. Четкий моноксенный род с про-
стым циклом развития, вероятно близкий к Vampyro-
phrya.
Род Polyspira Minkiewicz,
1912
Типовой вид Р. delagei по монотипии. Трофон-
ты крупные, с обширной безресничной поверхностью;
в верхней части тела кинеты разрежены, на уровне рта
собраны в 2 узкие полосы справа и слева, идущие вниз
по спирали и смыкающиеся снизу, с 4 вплотную сбли-
женными рядами в левой полосе; мелкий рот с руди-
ментами ротовых кинет. У рта кинеты обеих полос
расходятся веером. Вид был открыт в экзувиях ра-
ков-отшельников (Eupagurus prideauxi)-, позже найден
в экзувиях других аномур (Galathea squamifera), кра-
бов Macropodia sp.; в лаборатории заселяет и панцири
крабов Portunus. Вид приурочен к Crustacea Decapoda,
возможно и к креветкам. При переходе к размножению
сложным путем меняется топография кинет, они рас-
прямляются и расходятся равномерно, плавающий то-
монт делится трижды, с образованием цепочек из 2,4 и
8 протомитов с простой продольной цилиатурой; на-
чинается метаморфоз и превращение в типичного для
апостомат плоского томита со стандарным кинетомом.
Томит оседает и инцистируется на жабрах хозяев (ста-
дия форонта), выходит при линьке и начинает мета-
морфоз.
Род Perikaryon Chatton, 1911
Типовой вид Р. cesticola; первоначальное на-
писание Perikaryon заменено на Pericaryon (Chatton,
Lwoff, 1935) и должно быть восстановлено. Симбион-
ты ктенофор Cestus veneris из морской пелагиали. Тро-
фонты удлиненные, с субапикальным перистомом; не-
многочисленные кинеты разрознены ниже рта и сбли-
жены, отогнуты вбок в антесоме.
Род Synophrya Chatton et Lwoff, 1926
Типовой вид S. hypertrophica, вид с необычно
сложным жизненным циклом; паразит декапод, веро-
ятно без узкой специфичности к хозяевам. К примеру,
осмотр 54 видов декапод в США показал наличие па-
разитов в жабрах 24 видов (Johnson, Bradbury, 1976) с
наибольшим заражением видов рода Ovalipes', в Испа-
нии обычны в видах Macropipus (= Portunus), вид ши-
роко распространен и заражает местных крабов. В тка-
нях жабер заметны крупные темные кисты — гипер-
трофонты гигантских размеров, питающиеся кровью
хозяев в окружении тонкостенной цисты. Экзувиаль-
ные трофонты и томонты вне хозяина совершенно
идентичны с Gymnodinioides, питаются экзувиальной
жидкостью, имеют 9 кинет; внутренняя двойная кине-
та метазоны не фрагментирована, имеется спиральная
полоса из 3 сближенных рядов. Развитие усложнено,
возможно, в экзувиях хозяев и в тканях живых крабов.
Форонты в цистах заселяют жаберные пластинки
крабов, выходят из цист без линьки хозяев (в отличие
от Gymnodinioides) и активно проникают сквозь тон-
кую кутикулу жабры; здесь они покрыты двойной обо-
лочкой, собственной и выделяемой хозяином, питают-
ся кровью, становятся аморфными, крупными; кинеты
не спиральные, при росте клетки далеко расходятся
одна от другой от общего полюса. Питание массивного
гипертрофонта продолжается до линьки хозяина; в
сброшенном панцире эти особи, теперь обозначаемые
как гипертомонты, делятся палинтомически, образуя
сотни мелких томитов, растущих и питающихся в эк-
зувиальных тканях. Именно эта стадия соответствует
трофонту рассмотренных выше родов и морфологиче-
ски идентична с Gymnodinioides. Далее следует обыч-
ная палинтомия в цисте, протомиты после сложного
морфогенеза превращаются в томитов, активно плава-
ют в толще воды и инцистируются на жабрах крабов, в
Европе в основном на Carcinus maenas, Macropipus
(= Portunus) depurator, M. puber, M. holsatus, M. pusil-
lus, M. tuberculatus, затем вновь эксцистирование и
спустя сутки переход к кровепаразитизму.
Род Terebrospira Debaisieux, 1960
Типовой вид Chattonia lenticularis Debaisieux,
1957; замещающее название для гомонима Chattonia
Debaisieux, 1957. Симбионты креветок Palaemonetes
varians в солоноватых водах западной Европы. Харак-
терно чередование паразитической и экзувиальной фаз
с 2 типами трофонтов, плавающими и сидячими. Луч-
ше изучен (с импрегнацией всех фаз) цикл развития
884
ALVEOLATA
T. chattoni Bradbury, Clamp et Lyon, 1974 из Palaemonetes
pugio на востоке США; частично циклы не совпадают.
При осмотре покровов креветок в кутикуле видны мел-
кие каналы, расходящиеся радиально от одной точки;
это признак заражения. На всех стадиях цикла Т. chat-
toni лишена рта, питается только растворяя кутикулу и
всасывая органические компоненты. Вид постоянно
ассоциирован с хозяином, несмотря на линьку — осо-
би переходят со сбрасываемого на новый панцирь.
Трофическая стадия — трофонты в узких галереях
(каналах) в толще панциря; кинетом упрощен, около
10 кинет прямые, сохранены и вытянуты 3 ротовых ря-
да, но рта и розетки нет; передний конец тела несет па-
пиллы с хитинолитическими ферментами. При линьке
нижний слой панциря растворяется, трофонты выпада-
ют в полость экзувия, кинеты спирализуются (стадия
свободноплавающего протомонта), оседают на новый
панцирь и инцистируются (стадия томонта). Следует
метаморфоз, спиральные кинеты выпрямляются (ста-
дия ортотомонта). После деления на 2—7 томитов
каждый покрывается собственной цистой внутри об-
щей цисты томонта (гомолог стадии форонта); томиты
растворяют узкий участок на дне своей цисты и эпи-
кутикулы хозяина и протискиваются внутрь (с по-
мощью вакуоли, без мионем) в еще не затвердевший
новый панцирь. Все томиты расходятся в стороны
от опустевшей цисты томонта, образуя очень узкие ка-
нальцы.
У типового вида Т. lenticularis питание трофонтов в
таких же каналах, но есть стадия массивного прикреп-
ленного зооида с палинтомией, стадии экзувиального
трофонта и томонта. Terebrospira sp. отмечены в Кры-
му на морских креветках Palaemon elegans и Р. adsper-
sus. Только этот род составляет подсем. Terebrospirinae
в классификации Пюйторака.
Род Metaphrya Ikeda, 1917
Типовой вид М. sagittae из пелагических ще-
тинкочелюстных (Chaetognatha) рода Sagitta — S. enf-
lata, S. nagae, S. pacifica в Японии; S. elegans в Канаде;
типовой хозяин из Мисаки не определен (Sagitta sp.);
локализация — в целоме хозяев. Трофонты крупные,
каплевидные, с 12 продольными кинетами в неглубо-
ких желобках, с сетевидным ядром, без рта; жизнен-
ный цикл не изучен, но в том же хозяине найдены и
очень мелкие трофонты. Импрегнация не проводилась;
по предположению Шаттона, должен быть найден рот,
поскольку имеется центральная пищевая масса, как у
фаготрофных апостомат. Отмечено сходство Meta-
phrya и Perikaryon из пелагических ктенофор по внеш-
нему облику и ядрам, но кинетом у них несходен. Мел-
кие трофонты величиной около 20 X 10 мкм, крупные
около 250 X 130 мкм; по мере роста аморфное ядро
ветвится и в итоге имеет вид сети, окружающей трофо-
сому. При первоописании род был отнесен к астома-
там (Anoplophryimorphes), позже к апостоматам сем.
Foettingeriidae; подсем. Pericaryoninae Шаттон исклю-
чил из этого семейства (incertae sedis), в схеме Пюйто-
рака — в подсем. Foettingeriinae. Sagitta — активный
хищник, в частности на копеподах; возможно, форон-
ты переносятся копеподами и вид диксенный.
Род Cyrtocaryum Faure-Fremiet et Mugard,
1949
Типовой вид С. halosydnae из кишечника по-
лихеты Halosydna gelatinosa во Франции; это единст-
венная апостомата из бентосных червей. Полихеты
обычно заселены астоматами, и в первоописании вида
отмечается сходство кинетома с Anoplophrya clignyi
(ныне Spirobuetschliella) из Pomatoceros. Только изуче-
ние цикла развития в хозяине позволило отнести род к
апостоматам; у Корлисса (Corliss, 1979) в особом сем.
Cyrtocaryidae Corliss, 1979, у Пюйторака (Puytorac, 1994) —
в Opalinopsidae, среди паразитов головоногих моллю-
сков. Трофонты грушевидные (90—120 мкм) с 60 би-
полярными спиральными кинетами, локализованы в
латеральных карманах кишечника. Нет рта, розетки и
ротовых кинет; ядро сетевидное. Трофонты размножа-
ются неравным делением в своих локусах; если изоли-
ровать в чистую воду, они без инцистирования делятся
палинтомически до цепочек с 9—16 полукруглыми
протомитами. Когда размеры томонтов уменьшаются
до 45 мкм, они образуют при делинеации одной кине-
ты полосу из 5—6 тесно сближенных продольных ря-
дов с мелкими кинетосомами, вероятно гомолог рото-
вых кинет. Томиты (20 X 16 мкм) с изогнутым ядром,
каудальной щетинкой, обширным ацилоном сзади, не-
сколькими продольными кинетами и рудиментами ро-
товой зоны (несколько кинетосом). Предполагается
наличие форонтов на рачках (бентосных копеподах).
Сем. Opalinopsidae Hartog, 1906
Паразиты пелагических цефалопод; тело овальное,
без признаков ротового аппарата, прикреплено к эпи-
телию широким вздутым антероном с мелкой папил-
лой. Ядро сетевидное, микронуклеус один, вакуоль
одна, трихоцист нет. Кинеты многочисленные, спираль-
ные, не достигают переднего и заднего концов клетки.
Размножение монотомией, деление медиальное, стро-
бил нет. Цикл развития неизвестен, допускается гете-
роксения — форонты могут быть прикреплены к круп-
ным пелагическим ракообразным, к примеру к мизи-
дам и эвфаузиидам.
Род Opalinopsis Foettinger, 1881
Типовой вид О. sepiolae из каракатиц Sepia, с
диагнозом семейства. Подробно изучены Хобергом
(Hochberg, 1971, 1983) в США, как и следующий род.
По Хобергу (Hochberg, 1982), наполненные органикой
ренальные и панкреатические полости («почки») голо-
воногих представляют собой идеальную среду для па-
разитов, среда богата нитрогенами и углеводами; эпи-
телий извилистых ренальных придатков удобен для
прикрепления, паразиты не смываются, ренальные
поры обеспечивают контакт с внешней средой. По ли-
тературе и новым данным Хоберга, из 62 родов Cepha-
lopoda инфузории встречены в 20 родах (Opalinopsis и
Chromidina'), в основном у пелагических хозяев (каль-
маров, каракатиц), дициемиды у 18 бентосных родов
(осьминоги). Совместное обитание отмечается при на-
ТИП CILIOPHORA. КЛАСС OLIGOHYMENOPHOREA
885
личин планктонной молоди у бентосных видов. Пора-
зительное сходство внешнего облика и двухфазный
цикл развития говорят о конвергенции в связи с общей
локализацией; в Японии сейчас высказывалось мне-
ние, что Dicyemida (ранее в составе Mesozoa) родст-
венны инфузориям.
Сем. Chromidinidae Poche,
1913
Трофонты и томонты в почках (почечных мешках)
или в рено-панкреатических кровяных лакунах пелаги-
ческих головоногих (Sepia, Loligo, Illex, Sepiola, Spiru-
la); промежуточные хозяева — рачки отряда Euphausi-
асеа. При многократном делении (линейной палинто-
мии) образуются длинные цепочки протомитов.
Род Chromidina Gonder,
1905
Типовой вид-С. elegans (Foettinger, 1881). Тро-
фонты крупные, с 14 кинетами, подходящими к апексу
и загнутыми спиралью на всей поверхности тела. Под
пелликулой трихоцисты вдоль рядов ресничек в посте-
соме. Деление без цист, повторное, с образованием це-
почек из 8—24 протомитов с небольшой спирализа-
цией кинет.4Томиты овальные, величиной 20—30 мкм,
сплющены дорсовентрально, сзади крупная вакуоль.
Кинетом томита — 14 продольных кинет и 6 сближен-
ных рядов, вероятно аналоги ротовых фрагментов, об-
разуемых при морфогенезе одной из сомакинет. Розет-
ки нет, но возможно наличие мелкого рта. Прикрепле-
ние к эпителию апикальной папиллой. Томиты
апостоматидного типа, но у дефинитивных трофонтов
рта нет, питание пиноцитозное (раньше такой тип пи-
тания называли «осмотическим»).
Вначале род Chromidina считали астоматой (в дру-
гом отряде цилиат), предлагалось также объединить их
в один род с Opalinopsis. Хоберг доказал независи-
мость этих родов и описал новые виды в обоих. Типо-
вой вид рода — Benedenia elegans Foettinger, 1881; так-
же Ch. coronata (Foettinger, 1881) и Ch. nipponica Jank.,
sp. n. для вида, ошибочно определенного Вермелем
(Wermel, 1928) из дальневосточных осьминогов как
Ch. elegans', это булавовидные формы с вздутым пе-
редним концом тела. Название Chromidina Gonder,
1905 предложено для замены Benedenia Foettinger,
1881; это гомоним не только рода моногенетических
трематод, как указано у Аэшт, но и рода китов.
Отряд Colliniida Jankowski, 1980
(= Sanguicolina Jankowski, 1978;
названия лучше давать по типовому роду)
Кровепаразиты ракообразных; безротые формы с
линейной палинтомией, вероятно неотенические то-
монты феттингериид, в жизненном цикле этих апосто-
мат выпала фаза экзувиального трофонта.
Сем. Colliniidae Cepede, 1910
(рис. 372, а)
С диагнозом отряда. Паразиты пресноводных и
морских высших ракообразных — изопод, амфипод,
мизид; нет в декаподах; мною найдены также в рачках
отряда Cumacea из тралов у Итурупа, вероятно это пер-
вая инфузория с грунтовых кумацей, лишенных экто-
комменсалов.
Род Collinia Cepede, 1910
По Аэшт, тип рода до сих пор не фиксирован, здесь
как типовой вид обозначается Anoplophrya circulans
Balbiani, 1885. Collinia — это новое названия для заме-
щения гомонима Hyalina Schneider, 1885, предложенного
только для Anoplophrya circulans. Сепед (Cepede, 1910)
в составе Collinia приводит 3 вида без указания типа, по-
этому логически тип рода Collinia — это тип рода Hyalina.
Точное обозначение важно потому, что род Collinia
может быть подразделен в будущем на несколько родов
по типу кинетома (см. далее Metacollinia nParacollinia).
Трофонты небольшие, имеют продольные или
изогнутые кинеты, лишены розетки и рта; томитогенез
палинтомический, без инцистирования и выхода из хо-
зяина во внешнюю среду; томиты стандартного для
апостомат типа, с ротовыми кинетами, но без розетки.
Хорошо изучен кинетом, ультраструктура и морфоге-
нез 2 видов рода, но хозяева и географическое распро-
странение пока мало изучены. К видам, относимым к
Collinia sensu lato, — С. circulans (Balbiani, 1885 in
Anoplophrya)', C. branchiarum (Stein, 1852); C. orches-
tiae Summers et Kidder, 1935; C. gammari (Cheissin,
1930); C. neoniphargi (Cepede, 1910) добавляется C. or-
chestium (Watson, 1916) comb. n. (= Balantidium orches-
tium) n C. luciensis comb. n. (= Balantidium luciensis
Poisson, 1921). Вид Collinia orchestiae (Kidder et Sum-
mers, 1935), вероятно, является синонимом C. orchesti-
ит. Вероятно, виды с изопод, гаммарид и талитрид
принадлежат к разным родам коллиниид, но пока изу-
чены лишь 3 из 7 названных видов. С. beringensis Сар-
riulo et Small, 1986 заражает эуфаузиид Thysanoessa
inermis в планктоне Берингова моря. В литературе от-
мечен, но пока не описан новый вид в подземном бо-
коплаве Bactrurus mucronatus в США.
В монографии апостомат (Chatton, Lwoff, 1935) род
Collinia не рассматривается; род перенесен из отряда
астомат в состав апостомат лишь сравнительно недав-
но. Не исключена возможность наличия экзувиальной
стадии в жизненном цикле коллиний. Если этой стадии
нет, можно предположить, что Collinia — это неотени-
ческая фаза в цикле развития предков типа Gymnodi-
nioides, с питанием и размножением на стадии про-
томонтов; фиксированы стадии поздних томонтов, при
палинтомии дающих протомитов; стадия экзувиаль-
ного трофонта выпала.
Типовой вид Collinia circulans заражает Asellus
aquaticus; трофонты с 10 спиральными кинетами, при
размножении ряды распрямляются, как у протомонтов
феттингериид, число рядов уменьшается, появляются
ротовые фрагменты и мелкий дефинитивный томит
резко отличается от трофонтов.
886
ALVEOLATA
Род Paracollinia Jankowski, 1980
Типовой вид Opalina branchiarum Stein, 1852,
позже в составе Anoplophrya и Collinia (Puytorac, Lom,
1962). Кинеты многочисленные, прямые, биполярные;
нет широкой безресничной полосе! (ацйлона), видной
у С. orchestiae. Паразиты пресноводных амфипод
Gammarus pulex. Кинеты Полимеризован!.! по сравне-
нию с С. circulans (до' 55—60), расположены с почти
равномерной густотой, не спиральные; в отличие от
Metacollinia нет Широкой безресничйой дорсальной
полосы. У Metacollinia кинеты заметно сгущены на од-
ной из сторон тела, у Collinia s. str. кинеты немного-
численные, разрозненные, спиральные, с равными
промежутками. Возможно, к роду Paracollinia отно-
сится Collinia neoniphargi Cepede, 1910 (JP. neoniphargi
comb. n.).
Автору обзора не удалось видеть коллиний в гам-
маридах вне Байкала, но в Байкале инвазии обычны,
особенно в Gmelinoides fasciatus и Pallasea cancelloi-
des; мною подробно изучено деление и томитогенез на
опаловых препаратах. Это вид, названный Хейсиным
(Cheissin, 1930) Anoplophrya gammari (Р. gammari
comb, n.); другие хозяева, по Хейсину, — литоральные
виды Eulimnogammarus cyaneus, Е. verrucosus, Е. viri-
dis и траловый Acanthogammarus godlewskii. Трофонты
относительно крупные, с массивным осевым ядром,
занимающим значительную часть тела; кинетом рав-
номерный, кинеты полимеризованы; по мере заполне-
ния гемолимфы хозяина особи мельчают, при делении
дают более мелкие формы и в итоге образуются плос-
кие томиты феттингериидного типа с несколькими со-
макинетами (около 9) и с короткими ротовыми рядами.
Последние соответствуют части особо сближенных
кинет томонта — число их с каждым делением умень-
шается, пока не останется 3 ряда. Если вскрыть рачка с
массой паразитов в воде, они набухают и гибнут, вы-
живают только в солевом растворе. Поэтому способ
передачи вида в природе неясен.
Род Metacollinia Jankowski, 1980
Типовой вид Balantidium luciensis Poisson,
1921 из амфипод сем. Talitridae Orchestia littorea во
Франции. В амфиподах нет балантидиев, по рисунку
это коллиния; кинетом не изучен. Род предложен фак-
тически для вида, определенного как Collinia orches-
tiae из Orchestia sp.; возможно, что определение Пюй-
торака и Грейна (Puytorac, Grain, 1975) неверное —
вид Anoplophrya orchestiae Summers et Kidder, 1935
описан из Orchestia agilis атлантического берега
США, в Вудс Холе, а Пюйторак и Грейн изучили
вид из Orchestia sp. в Роскоффе. Вид Balantidium ar-
ches tium Watson, 1916 был описан из Orchestia agilis и
Talorchestia longicornis в Нью-Йорке, вид В. luciensis
Poisson, 1921 — из Orchestia littorea (ныне О. gam-
marella') из Франции. Итак, тип рода — «Collinia or-
chestiae» sensu Puytorac et Grain, 1975 (нетоним?), ко-
торый мы отождествляем с В. luciensis — М. luciensis
comb. n.
Основные родовые признаки — полимеризация ки-
нет трофонта (65—70 рядов), наличие длинного попе-
речного шва, легкая спирализация кинет, наличие ши-
рокого ацилона вдоль тела до концов клетки; полоса
сохраняется при томитогенезе. Ротовые кинеты возни-
кают на стороне, противоположной ацилону. Этот вид
не может быть объединен в одном роде с С. circulans и
С. branchiarum, с 10—35 кинетами, расположенными
равномерно без ацилона.
Новые неописанные виды коллиниид отмечены
мною в кумацеях и в изоподах Idotea-, в последних на
Мурмане паразитируют червеобразные коллинииды
нового рода. Заражены также стайные прибрежные
мизиды в районе биостанции «Восток».
Отряд Conidophryida Jankowski,
1980
Прежнее название — Pilisuctorida; если называть
отряды по типовому роду, правильно название Мусо-
diniida. Небольшая группа видов, паразитирующих на
ракообразных; трофонты локализованы на кутикуле
или щетинках и высасывают тканевую жидкость. Нет
типичной для феттингериид типа Gymnodinioides ста-
дии трофонта, нет палинтомии вне хозяина; развитие
без переносчиков, виды моноксенные.
Сем. Conidophryidae Kirby, 1941
(= Pilisuctoridae)
Эта небольшая группа объединяет виды с апикаль-
ным почкованием, томонт имеет вид стробилы. В
основном сетобионты, высасывают тканевую жид-
кость хозяев через каналы щетинок. Решением IC N
(2005) использование названия Mycodinium запре-
щено.
Род Mycodinium Averintsev,
1916
Типовой вид М.fucatum. Валидное название,
оставшееся незмеченным (род был описан как вероят-
ная динофлагеллята); хозяин — амфиподы группы
Caprellidae — Caprella sp. в Италии; здесь особо часты,
например, С. linearis. Статью Аверинцева (1916) никто
не цитировал, поэтому Аэшт (Aescht, 2001) и Довгаль
(Dovgal, 2003) предлагают считать название nomen ob-
litum и пользоваться привычным названием Conido-
phrys Chatton et Lwoff, 1934 с типом С. pilisuctor С. et
L., 1934. Группе посвящено мало оригинальных работ,
поэтому первое название может быть восстановлено;
правило nomen oblitum применялось для таких основ-
ных родов цилиат, как Tetrahymena и Stentor, с запре-
том использования предложенных ранее валидных на-
званий.
Строение трофонтов изучено наиболее подробно
у С. pilisuctor и С. pitelkae (Bradbury, 1975; Bradbury,
Tyson, 1982, и материал автора). На щетинках зара-
женных раков, по оси или под углом, расположены вы-
тянутые огурцевидные паразиты, прикрепленные спе-
циальной секрецией так, что вершина щетинки контак-
тирует со ртом трофонта; заселены лишь щетинки с
ТИП CILIOPHORA. КЛАСС OLIGOHYMENOPHOREA
887
каналом. Трофонт постоянно инцистирован, но растет
вместе с цистой; ядро осевое с неровным контуром,
широкое; одна вакуоль в зоне кинетосом. Ресничек
нет, но сохранена инфрацилиатура — продольные
ряды (4 и 6) на обеих сторонах тела. Плоские томиты
отделяются на вершине тела, не уплывают сразу, и
в итоге образуются стробилы из трофо-томонта и се-
рии томитов. При линьке хозяина томитогенез уско-
ряется. Томиты имеют дуговидные краевые кинеты и
рот без розетки, после короткого плавания оседают на
вершины щетинок и приступают к питанию. Кинетом
у видов рода однотипен, виды различаются пока по
форме и размерам трофо-томонтов. Окраска нейтраль-
ротом выявляет много мелких водянистых вакуолей,
питание химотрофное. Внутри щетинок проходят сен-
сорные выросты, поглощается тканевая жидкость ка-
нала. Паразиты непатогенные, рачки могут быть усея-
ны сотнями трофонтов и сбрасывают их с панцирем
при линьке.
Род космополитный, заражения отмечены в Атлан-
тике, Пацифике, на фиксированных раках из Огненной
Земли и Субантарктики; материал можно собрать во
всех морях России, кроме Каспия.
С. fucatum (Averintsev, 1916) — паразит на абер-
рантных амфиподах (морских козочках) Caprella sp. в
Италии.
С. pilisuctor Chatton et Lwoff, 1934 — на мелкой ам-
фиподе Corophium acherusicum, живущей в трубках.
С. enkystotrophos Jankowski, 1966 — на литораль-
ных гаммаридах Мурмана Gammarus oceanicus и G. se-
tosus; определение вида на локальных гаммаридах
Черного моря неверное.
С. marinogammari Jankowski in press — на Marino-
gammarus obtusatus, Мурман.
C. pitelkae Bradbury, 1975 — на креветках Crangon
crangon, Франция.
C. guttipotor Chatton et Lwoff, 1935 — на панцире
изопод Sphaeroma serratum, Франция.
Другие хозяева неопределенных видов микодини-
ид, по литературе и сборам автора, — изоподы Idotea,
Limnoria, Gnorimosphaeroma, Jassa, Jaera-, амфиподы
Anisogammarus, Gammarellus, Parhyale, Hyale', мизиды,
раки-отшельники, креветки-чилимы. По крайней мере
в 4 регионах есть новые неописанные пресноводные
виды — на гаммарусах оз. Охрид, на креветках Япо-
нии (оз. Бива) и Бразилии и на пресноводных талитри-
дах Hyalella azteca в Мексике (определение последне-
го как С. pilisuctor ложное). Указание микодиниев для
калигоидных паразитических рачков Lepeophtheirus с
морских рыб ошибочно, это не конидофрисы, а икрин-
ки моногеней рода Udonella. На клещах это могут быть
не микодинии, а сжавшиеся оперкулярии. К сожале-
нию, видовых отличий мало, многие паразиты неопре-
делимы и условно отнесены к С. pilisuctor или к С. pi-
telkae-, без импрегнации томитов дальнейшее изучение
видов невозможно.
Для рода Conidophrys долгое время не находи-
ли места в системе, приписывали к трихостоматам;
по Янковскому (1966, 1972b), это неотенические
форонты моноксенных апостомат типа Gymnodinioi-
des, перешедшие от пассивной форезии к питанию
на щетинках; томиты сходны с томитами феттинге-
риид.
Сем. Ascophryidae Campillo et Deroux,
1974
Платибионты на панцире хозяев, не на щетинках;
размножение полиэндогеммией, все тело томонта пре-
вращается в многочисленных томитов одновременно.
Род Ascophrys Campillo et Deroux, 1974
Типовой вид рода A. rodor с панциря креветок
Palaemon serratus и Palaemon (Palaemonetes) varians.
Томиты дисковидные, оседают на панцире креветок
над мельчайшими изогнутыми щетинками с каналом,
начинают питание и рост; С-образное ядро томита,
разрастаясь, становится сетевидным под всем кортек-
сом; достигнув определенной длины, инцистирован-
ный трофонт делится одновременно на несколько де-
сятков томитов, выходящих при разрыве стенки цисты.
Это патогенный вид при массовом заражении. Предпо-
лагается, что питание у Ascophrys — не тканевой жид-
костью, а хитином, который локально растворяется для
выделения й поглощения нужных пищевых веществ.
Апостоматы неясного положения
Род Askoella Fenchel, 1965
Типовой вид A.janssoni Fenchel, 1965 с мор-
ских видов Gammarus в Дании; второй вид A. heliosto-
ma Jankowski, 1967 из мурманских Balanus. Это типич-
ные томиты апостомат, но особи подвижные, не оседа-
ют на хозяевах и встречаются постоянно, не только
при линьке рачков, как у Gymnodinioides. Тело оваль-
ное, плоское, дуговидные ресничные ряды по краям
тела на венте и дорсуме, рот спереди с несколькими
кинетами, сзади ямка с цилиатурой, ядро С-образное.
Фенхель (Fenchel, 1965b) отнес эти формы к гимено-
стоматам, Янковский (1967а) — к апостоматам, пред-
положив, что это неотенические томиты такого типа,
как у Gymnodinioides. Пока мало наблюдений, нужны
данные о питании и делении, чтобы убедиться в том, что
это неотенические томиты, не имеющие других стадий
цикла; сходство с томитами апостомат бесспорно.
Род Phthorophrya Chatton, A. Lwoff
et М. Lwoff, 1930
Типовой вид Ph. insidiosa. Томиты вида имеют
типичное для апостомат строение, с розеткой, фраг-
ментами послеротовых кинет, с 9 сомакинетами, об-
ширным ацилоном. Так выглядят томиты многих ро-
дов апостомат. Но эти томиты инцистируются не на
покровах нелиняющих раков (как форонты), а на личи-
ночных цистах (форонтах) Gymnodinioides. Проникнув
внутрь форонта, томит высасывает его содержимое,
растет, заполняет всю цисту форонта, имеет теперь вид
томонта (кинеты прямые, послеротовые кинеты резко
удлинены, рот исчез), делится путем палинтомии; око-
ло 10 новых томитов эксцистируются и ищут новых
форонтов. Это явно неотения, когда возможность пи-
888
ALVEOLATA
тания на стадии томита привела к утрате экзувиальной
стадии трофонта и томонта. Типовой вид — паразит на
Gymnodinioides corophii, Ph. mendax Ch., L. et L., 1930
и Ph.fallax Ch., L. et L., 1930 — на G. inkystans с крабов
Carcinus maenas, Ph. steueri Ch. et Lw., 1935 — на Vam-
pyrophrya steueri.
Род Rosea Puytorac, 1994
В Traite (Puytorac, 1994, P. 840) тип рода не. назван,
диагноз рода следующий — «Розе наблюдал апосто-
мат в масляной камере различных сифонофор (Galeo-
laria quadrivalvis, Abylopsis). Они представляют собой,
вероятно, новый род, цикл которого, согласно доку-
ментам автора, представляется следующим. Трофото-
монты дают при последовательных делениях томитов;
томиты, выходя из олеоцисты, оседают на столоне и
обращены ртом к гастрозооиду. Они инцистируются
на ракообразных. Когда рачки заглатываются, циста
открывается, давая трофонта со спиральными кинетами,
который накапливает темнокоричневую пищевую мас-
су и переходит к стадии свободного томонта (вне хозя-
ина)». Назовем типовой вид Rosea siphonica Jankowski
gen. et sp. n.; описание у Розе (Rose, 1937). Из текста
нельзя понять, чем и от кого отличается этот «новый
род»; возможно также, что рисунки в статье — смесь
нескольких видов апостомат. Типовой рисунок R. si-
phonica — рис. 8 в цитированной работе (Rose, 1937).
Род Perezella Cepede, 1910
Типовой вид Р. pelagica, эндопаразиты из це-
лома морских пелагических копепод группы Calanoi-
da — Clausia elongata, Acartia clausi, Paracalanus par-
vus. Мелкие овальные формы с вогнутой нижней по-
верхностью тела, равномерной цилиатурой (около
30 продольных биполярных кинет), крупным эллипсо-
идным ядром, без рта; вакуоль у постерона. Размноже-
ние делением надвое; на покровах хозяев часты очень
мелкие цисты, но, вероятно, они не относятся к Pere-
zella, это могут быть форонты Vampyrophrya или Trau-
matiophtora, переносимые пелагическими копеподами.
Автор рода сближал род с Collinia и выводил от фила-
стерины Uronema rabaudi, паразитирующей в тех же
хозяевах, что и Perezella. Кинетом не изучен, положе-
ние в системе неизвестно.
Род Jeppsia Corliss, 1960
Типовой вид Chattonella calani Jepps, 1937; ро-
довое название Chattonella Jepps, 1937 — гомоним. Па-
разиты пелагических копепод. Первоисточник недо-
ступен. Считается апостоматой, но рода нет в обзоре
Пюйторака (Puytorac, 1994).
Подкласс Astomatia Schewiakoff, 1896 (рис. 375, а—377, а)
Червеобразные безротые формы, кишечные паразиты беспо-
звоночных и низших позвоночных. Соматическая цилиатура хоро-
шо развита, кинеты продольные, многочисленные. Обособлена
тигмотактическая зона цилиатуры; в прикрепительном апикальном
отделе у большинства видов развит цитоскелет, нередко также
присоска. Питание пиноцитозное (ранее называлось осмотиче-
ским), без образования пищевых вакуолей. Размножение делени-
ем, изо- и анизотомическим, нередка стробиляция.
Первоначально таксон (отряд астомат) включал много нерод-
ственных цилиат, включая плохо изученные фаготрофные формы,
у которых не смогли заметить рот и буккальную цилиатуру узкого
длинного перистома, к примеру Protophrya из моллюсков-литто-
рин (ныне тигмотрихи) и Orchitophrya из морских звезд (ныне ску-
тициды). Относительно недавно из состава астомат удалены по-
следние чужеродные цилиаты (апостоматы рода Collinia) и под-
класс стал монофилетическим.
Астомат можно вывести от гистероцинет, частых в наземных и
водных олигохетах; это основные хозяева для обоих таксонов. Бук-
кальная цилиатура у гистероцинет смещена к постерону и малоак-
тивна, фагоплазма небольшая; модель переходной формы — род
астомат Hysterophrya. Но в этом случае простых астомат типа
Anoplophrya придется считать вторично упрощенными, утерявши-
ми присоску и ее фибром. Другой вариант — происхождение от па-
растомат типа Protanoplophrya (в гастроподах Bithynia и вивипари-
дах) при утрате субапикального рудимента перистома. Молекуляр-
ный анализ пока лишь в общих чертах показал родство
Anoplophrya с гименостоматами, которое всем давно уже очевидно
(Affaa et al., 2004). Крупных парастомат и гистероцинет легко со-
брать из раздавленных битиний для проверки их связей с автомата-
ми из олигохет, имеющими фибриллярную присоску (Radiophrya)
и без нее (Anoplophrya).
Все автоматы — кишечные паразиты в основном олигохет; за-
ражены водные люмбрикулиды, энхитреиды, тубифициды и наи-
диды, один вид поселяется даже в микроскопических Aelosoma,
другой — в коловратках. Почвенные энхитреиды, мегасколециды,
эудрилиды, люмбрициды и глоссосколециды — хозяева другой
эволюционной ветви астомат; находки в пиявках редки. Один вид
хозяина может содержать несколько видов астомат в разных отде-
лах кишечника; серия родов астомат и гистероцинет обитает в
крупных африканских дождевых червях рода Alma, пока изучены
A. emini и A. nilotica в Габоне и Камеруне. В море заражены поли-
хеты. Один род (Desmophrya) обитает в кишечнике мелких пресно-
водных двустворчаток Sphaeriidae. Небольшая группа родов адап-
тирована к наземным моллюскам (Clausilocolidae), к пресновод-
ным и морским планариям и к позвоночным (в лягушках, тритонах
и саламандрах).
Отряд Hoplitophryida Jankowski, 1980
В Traite (Puytorac, 1994) эта группа указана так: Ог-
dre des Hoplitophryida Cheissin, 1930, em. de Puytorac,
1972. Хейсин и Пюйторак не предлагали этого так-
сона — это дезинформация; подотряд предложен
Янковским (1980), здесь рассматривается как отряд ас-
томат.
Тело сплющенное или цилиндрическое. Фибриллы
цитоскелета у апекса на нижней стороне тела с харак-
терным основным элементом в виде буквы V, ориенти-
рованной сагиттально или под углом к оси тела. Даль-
нейшая эволюция — это упрощение и редукция цито-
скелета (Hoplitophryidae) почти до полного его
исчезновения; другая линия — с усложнением фибро-
ма, с сохранением элемента V (Radiophryidae) или с
развитием пластинки или кольца, несущего выступы
или шипы (Maupasellidae, Intoshellinidae). В зависимо-
сти от направления эволюции в семействе число кинет
ТИП CILIOPHORA. КЛАСС OLIGOHYMENOPHOREA
889
Рис. 375, a. Astomatia.
Durchoniella brasili (J); Anoplophrya lumbrici (Д); A. asymetrica (B)‘, Buetschliella inermis (PyAkidodes henleae (Д—3); Buetschliellopsis commune (Д); Delphyella
filum (И, К). (По: Puytorac, 1951 (Д В, Г), 1954 (Л); 1969a (И, K)\ Lom, 1959 (fl— 3)).
Fig. 375, a. Astomatia.
возрастает или уменьшается; возникают секантные
швы у антерона, разной топографии у разных родов.
Деление — анизотомия или стробиляция.
Сем. Hoplitophryidae Cheissin, 1930
Тело цилиндрическое, суженное сзади; антерон
обычно с утолщением кортекса (мукрон) и с цитоске-
летом, состоящим из фибрилл экто- и эндоплазмы,
прикрепленных к элементу V у низших родов семейст-
ва (в подсем. Mixtophryinae). Далее эволюция идет раз-
ными путями — или редукция фиброма с сохранением
элемента V (Juxtaradiophryinae), или полная утрата
всего фиброма в разных линиях. Вершины кинет рас-
положены сагиттально, с уменьшением числа кинет.
Ядро длинное, с 1 микронуклеусом; вдоль клетки ряд
сократимых вакуолей. Деление всегда неравное, с за-
держкой отделения томитов, обычно приводит к обра-
зованию стробил — цепочки из томонта и почек. В
основном паразиты водных олигохет, исключая род
Hoplitophrya из дождевых червей сем. Eudrilidae и
Glossoscolecidae.
В Traite различаются подсем. Hoplitophryinae, Mes-
nilellinae, Jirovecellinae, Juxtaradiophryinae и Mixto-
phryinae.
Род Hoplitophrya Stein, 1860
Типовой вид Opalina secans Stein, 1859. Ветви
элемента V ровные, с тонкими фибриллами; вершина
элемента с вздутием или крючком. Ветви неравной
длины, короткая ветвь может отсутствовать. Вдоль
кинет идут скелетные фибриллы, прикрепленные к
обеим ветвям V-элемента или, если короткая ветвь
утеряна, только к длинной ветви. У большинства видов
только один ряд вакуолей. Паразиты водных и почвен-
ных олигохет семейств Lumbriculidae, Tubificidae, En-
chytraeidae, Eudrilidae, Glossoscolecidae. Типовой вид
обычен в крупной прудовой олигохете Lumbriculus va-
riegatus вместе с Mesnilella clavata в средней части
кишечника. Астоматы обычно приурочены к опреде-
ленному участку кишечника хозяев. Крупный род;
примеры видов — Н. fissispiculata (Cheissin, 1930);
Н. werestschagini (Ch., 1930); Н. criodrili Miyashita,
890
ALVEOLATA
Рис. 375, 6. Astomatia.
Helellophrya (= Helella, гомоним) rhizodrili (A—Д), Acanthodiophrya almae (E); Hoplitophrya georgevitchi (Ж); Dicontophrya grassei (3), Hoplitophrya eminosco-
lecis (fl, JI); H. cheissini (К); H. acanthodes (M); H. libyodrili (H). (По: Kaczanowski, 1961 (A—Д); Puytorac, 1960 (Ж); 1969a (И—Н); Puytorac, Dragesco, 1969
(E, 3)).
Fig. 375, 6. Astomatia.
1933; H. minuta (M., 1933); H. variabilis Katashima,
1952; H. lumbriculi K., 1952; H. henleae Meier, 1954;
H. georgevitchi Puytorac, 1958; H. eminoscolecis P.,
1969; H. cheissini P., 1969; H. acanthodes P., 1969; H. li-
byodrili P., 1969; H. tubificis K., 1952; H. georgevitchi P.,
1958 и др.
Род Protoradiophrya Rossolimo
et Pertzewa, 1929
Типовой в и д Р. armata', также Р. fissispiculata,
Р. weretschagini, Р. minuta. Род предложен для форм с
простым кинетомом и фибромом; тип рода позже был
отождествлен с Hoplitophrya secans, поэтому род нева-
лиден как синоним рода Hoplitophrya.
Род Protoradiophryopsis Georgevitch,
1950
Типовой в и д Р. ochridensis из водных олигохет
Criodrilus ochridensis. Сохранена лишь одна ветвь
V-элемента на слегка вогнутом безресничном участке
у вершины тела; вакуоли в двух рядах по обеим сторо-
нам тела. Тело особо вытянутое, деление резко нерав-
ное. Скелетная ветвь лишена продольных фибрилл,
идущих вдоль кинет у видов близкого рода Hoplitoph-
rya. Эндопаразиты эндемичных Glossoscolecidae
оз. Охрид.
Род Mesnilella Cepede,
1910
Типовой вид Leucophrya clavata Leidy, 1855,
позже в составе Hoplitophrya и Anoplophrya. Тело
очень узкое и длинное, сужается к постерону, сплю-
щено; толстая и очень длинная спикула отходит от
апекса глубоко в цитоплазме по меньшей мере на по-
ловину длины тела, иногда почти до постерона. От
апекса могут отходить и более мелкие короткие спику-
лы, также в эндоплазме, разной длины; они могут быть
не связаны с осевой спикулой. Кинеты симметрично
подходят к переднему и заднему бисекантным швам.
Вакуоли обычно в одном ряду, редко в 2 рядах. Деле-
ние неравное, возможно образование цепочек. Эндопа-
разиты водных олигохет — Enchytraeidae, Naididae,
Lumbriculidae, Tubificidae. Типовой вид паразитирует
в Lumbriculus variegatus, L. tenuis, L. limosus (типо-
ТИП CILIOPHORA. КЛАСС OLIGOHYMENOPHOREA
891
Рис. 376, a. Astomatia.
Juxtaradiophrya kochi (A); Metaradiophrya almae (Б); Intoshellina wautieri (B); Metaradiophrya hovassei (Г); Mimophrya elegans (Д, И); M. acuta (E); Intoshellina
ochridana (Ж); Mixtophrya catenula (3). (По: Puytorac, 1951 (Г), 1954(A); 1960 (Ж); 1969a (Д, Е,3,И); Puytorac, Dragesco, 1968b (E); Puytorac, Juget, 1964(B)).
Fig. 376, a. Astomatia.
вой материал у Бостона, США); ранее включался в со-
став Anoplophrya. Это один из многих видов астомат,
живущий в симбиозе с эндобактериями. Синонимы
этого вида — М. securiformis (Stein, 1861); М. cepedei
Andre, 1911. Другие виды — M.fastigata (Mobius,
1888); М. spiculata (Warpachowsky, 1886); M. paranai-
dos (Pierantoni, 1909); M. trispiculata Kijenskij, 1925;
M. rostrata Rossolimo, 1926; M. bispiculata R., 1926;
M. beani Cheissin, 1930; M. stammeri Heidenreich, 1935;
M. hynnis Georgevitch, 1941; M. bohemica Lom, 1959
и др.; ряд видов рода обитает в эндемичных олигохе-
тах Байкала.
Род Jirovecella Lom,
1957
Типовой вид J. hegemonis из энхитреид Fride-
ricia hegemon. Тело цилиндрическое, короткое, посте-
рон сужен, спереди безресничная площадка; спикулы
расположены на границе экто- и эндоплазмы и идут
вдоль кинет, сходящихся спереди к короткому широ-
кому бисекантному шву; небольшая секанта у посте-
рона; ядро относительно короткое; один ряд вакуолей.
Нет V элемента; от переднего шва отходит большое
число длинных тончайших спикул в 2 перекрыва-
ющихся полях, правом и левом, всего 52—58 спикул
длиной до трети длины тела, все спикулы направлены
продольно.
Сходство цитоскелета с Desmophrya (из пресновод-
ных моллюсков — сфериид) незначительное и конвер-
гентное, род Jirovecella ближе к Mesnilella. В элект-
ронном микроскопе выявляются сгустки эндобактерий
2 типов, заполняющие цитоплазму.
Род Juxtamesnilella Puytorac,
1969
Типовой вид/, deronis из мелких водных оли-
гохет-найдид Dero digitata. Тело короткое или длин-
ное, ядро вытянуто почти на всю длину тела, число ки-
нет небольшое (24—26) в связи с мелкими размерами
паразита (до 120 мкм) и хозяина; вакуоли в одном про-
892
ALVEOLATA
Рис. 376, 6. Astomatia.
Metaradiophrya eminoscolecis (Л); M. euoplos (Б); Paracoelophrya intermedia (B—E); Radiophrya ochridana (Ж); R. pachydrili (3); R. sagittata (И, К); аргиром
Buetschliellopsis (Л). (По: Lom, 1959 (Л); Meier, 1954 (3—K); Puytorac, 1969a (A—E); 1972 (Ж)).
Fig. 376, 6. Astomatia.
дольном ряду. Спереди мелкий ацилон и продольный
бисекантный шов. От нижнего конца шва вдоль кинет
идут 4 толстые спикулы; нет V элемента. Вид описан
из тропической Африки (Габон); в Евразии, включая
Байкал, род представлен видами J. taupodrili (Kijenskij,
1925 in Macrophrya), J. depressa (Rossolimo, 1926), J.
variabilis (R., 1926), J. maritui (Cheissin, 1930), J. vermi-
cularis (Ch., 1928), J. ochridana (Puytorac, 1959),
J. ocevskii (P„ 1959) и др. Многие из этих видов раньше
относили к роду Juxtaradiophrya, имеющему апикаль-
ную фиксаторную спикулу. Названные виды рода
крупнее типового и имеют большее число спикул.
Род Akidodes Lom in Aescht, 2001
Типовой вид Akidodes symmetricus Lom, 1959.
Род предложен для 2 видов без указания типа и поэто-
му невалиден; то же название дано вторично. Мелкие
формы с незначительно вытянутым телом и апикаль-
ным рострумом в зоне ацилона; всего 17—19 кинет
идут симметрично, подходят к ацилону; у A. henleae
comb. n. (= Akidodes henleae Lom, 1959) кинет больше,
до 30, и спереди намечен секантный шов; вершины од-
ной или нескольких кинет входят в ацилон. Цитоскеле-
та нет. Паразиты энхитреид — A. symmetricus в
Mesenchytraeus flavidus, Enchytraeus argenteus, Mario-
nina sphagnetorum', A. henleae — в Henlea nasuta.
Род Delphyella Puytorac, 1969
Типовой вид Opalinafilum Claparede, 1861 из
энхитреид Clitellio arenarius', вид ранее обычно отно-
сили к Anoplophrya. Длинные узкие червеобразные
формы (до 500 X 60 мкм) без цитоскелета; расши-
ренный и закругленный антерон прикреплен к эпите-
лию кишечника хозяев без якорного аппарата. Кинеты
сходятся спереди у мелкого ацилона и вдоль бисе-
кантного шва, сзади на верхней стороне у второго
шва; вакуоли в одном ряду; ядро нитевидное, на всю
длину тела. Как Anoplophrya filum долгое время опре-
деляли виды из разных хозяев, не обращая внимания
на цитоскелет; вид специфичен только для указанного
хозяина, и определения в других олигохетах непра-
вильные.
ТИП CILIOPHORA. КЛАСС OLIGOHYMENOPHOREA
893
Рис. 377, a. Astomatia.
Steinella uncinata (Л—Г)’, Haptophrya (ранее Sieboldiellina) planariarum (Г—3); Haptophryopsis pheretimae {И, К). (По: Corliss et al., 1965 (Д, Ж, 3)\ Puytorac,
1957 (£); 1969 (Д K)-, Sikora, 1963 (А—ГУ).
Fig. 377, a. Astomatia.
Род Juxtaradiophrya Puytorac, 1954
Типовой вид Mesnilella kochi Heidenreich,
1935, ныне считаемый синонимом вида J. elongata
Puytorac, 1972, по Аэшт; точнее, это синоним вида
J. elongata (Delphy, 1922) Puytorac, 1957 = Anoplophrya
elongata Delphy, 1922. Тело относительно короткое
или червеобразное, с 1 рядом вакуолей, острое сзади,
антерон с мукроном, под нижней поверхностью тела
тонкие продольные спикулы, отходящие от V элемен-
та или от утолщенной дуги; обычно этот элемент не
выражен так четко, как у большинства астомат, посколь-
ку разница в толщине опорного элемента и фибрилл
невелика. Секантные зоны кинетома, как у Radio-
phrya — 2 боковых шва спереди, соответствующие
2 ветвям опорной дуги. Ацилон мелкий, в зоне мукро-
на. Деление неравное, но цепочки (стробилы) встреча-
ются редко. Тип рода J. elongata — в энхитреидах Рас-
hydrilus lineatus, Р. pagenstecheri. Другие виды —
J. styloscolecis (Heidenreich, 1935) (= Radiophrya proli-
fera Rossolimo, 1926, Styloscolex)', J. radiata Cheissin,
1930 (Clitellio); J. multispiculata (Ch., 1930, Lamprodri-
lus); J. rossolimoi (Ch., 1930, Branchiura); J. naisensis
Puytorac, 1954 (Nais); J. enchytraeoideiP, 1955 (Enchyt-
raeoides= Marionina); J. ocevskii P., 1958 (Rhynchel-
mis); J. ohridana P., 1958 (Stylodrilus).
В целом заражены люмбрикулиды, найдиды, ту-
бифициды и энхитреиды, включая ряд эндемич-
ных крупных люмбрикулид Байкала; ранее этих
паразитов относили к Anoplophrya, Mesnilella и Radio-
phrya.
Род Cheissinella Meier, 1954
Типовой вид С. enchytrei по монотипии, из Еп-
chytraeus buchholzi. Узкие червеобразные формы,
стробила с 3—4 томитами; спереди длинный попереч-
ный шов и дуговидный опорный аппарат (или V эле-
мент), поддерживающий длинные продольные утол-
щения (спикулы); много мелких вакуолей в одном
ряду; ядро на всю длину клетки. Аэшт указывает
этот род как синоним рода Juxtaradiophrya, но в спис-
ке видов и хозяев последнего рода (Puytorac, 1972)
вида С. enchytraei нет. Мы находим его в списке валид-
ных видов рода Radiophrya — R. enchytraei (Meier,
1954) Lom, 1959 (=R. elongata Puytorac, 1954). Если
Cheissinella — синоним рода Juxtaradiophrya, следо-
вало обсудить, какое название опубликовано рань-
ше (оба датированы 1954 г.). Название Cheissinella
потенциально валидно при разбивке рода Radiophrya
на подроды или роды.
894
ALVEOLATA
Рис. 377, 6. Sessilida.
Epistylis galea (A—B), Heteropolaria Iwoffi (Г-Ж), H. colisarum (3—Л). (По: Matthes, Scheubel, 1970 (A—B); Foissner, 1983 (Г—Ж); Foissner et al., 1985
(3-Л)).
Fig. 377, 6. Sessilida.
Род Radioph ryoides Lom,
1956
По Аэшт, тип рода R. komareki по монотипии.
Однако Лом предложил род для 2 видов — R. aelo-
somatis (Anderson, 1888) Lom, 1956 и R. komareki Lom,
1956, поэтому монотипии нет, тип рода не обозначен
и род невалиден. Для валидации принимаем указа-
ние типового вида у Аэшт и меняем автора рода — Ra-
diophryoides Aescht, 2001. Некрупные виды, не чер-
веобразные, со стробилами; ядро длинное, апекс за-
круглен, без швов, цитоскелета, с ацилоном; кинеты
немногочисленные, продольные. Неясны мотивы
включения простых форм в семейство со сложным
цитоскелетом; вероятно, род считается вторично
упрощенным. Оба вида — наиболее мелкие астоматы
в наиболее мелких хозяевах — в Aelosoma, ярко окра-
шенных мельчайших аннелидах, иногда исклю-
чаемых из класса олигохет; хозяева неприхотли-
вые, легко культивируются в чашках Петри на
рисе. R. aelosomatis (= Anoplophrya aelosomatis An-
derson, 1888; = A. maupasi Cepede, 1910), более круп-
ная, заселяет Aelosoma chlorostictum и A. hemprichi,
более мелкий вид Л. komareki (40—45 мкм, 18—19 ки-
нет) обитает в A. hemprichi (Aelosomatidae).
Род Buetschliellopsis Puytorac,
1954
Типовой вид В. enchytraei из 5 видов родаFri-
dericia', вид имеет ряд ранних синонимов {Anoplophrya
spiraliformis, A. minuta, A. enchytraei in Heidenreich,
1935), но они недостаточно хорошо описаны, чтобы
сменить название типового вида; суммарные хозяева
названных видов — энхитреиды Fridericia ratzeli,
F. lobifera, F. perrieri, F. hegemon, F. dura. Тело ци-
линдрическое, несколько сужено спереди, апекс плос-
кий или слегка вогнутый, лишен ресничек (с крупным
ацилоном) в округлой или овальной площадке, откло-
ненной на вент и имеющей эктоплазменное утолще-
ние, образующее скелетную шапочку. Ядро вытяну-
тое, несколько вакуолей в одном ряду. Описание неяс-
ное, нужна электронная микроскопия для изучения
ТИП CILIOPHORA. КЛАСС OLIGOHYMENOPHOREA
895
«апикальной опорной шапочки». Массовый материал
можно получить на берегах Байкала — над урезом
воды под камнями обитают сотни особей крупной бе-
лой олигохеты Mesenchytraeus bungei с В. torpediniformis
(Cheissin, 1930). Другие виды (все в энхитреидах) —
В. parumciliata Lom, 1954; В. janovicensis Lom, 1959;
В. commune Lom; 1959 в Henlea, Fridericia и Buchholzia.
Род Mixtophrya Puytorac, 1969
Типовой вид M. catenula из мелких найдид
Dero vaga (Габон, Африка). Тело широкое, не червеоб-
разное, спереди с небольшим мукроном; около 30 ки-
нет простой топографии, продольные; ядро на 3/4 дли-
ны тела; вакуоли в 2 рядах. Цитоскелет прекрасно раз-
вит — к мукрону сходятся правая и левая плечи
дуговидной поперечной фибриллы и длинная толстая
осевая структура (спикула), достигающая нижней чет-
верти тела. От ветвей дуги на короткое расстояние от-
ходят по 6 фибрилл длиной до 20 мкм. Стробилы дли-
ной до 500 мкм с 2 сателлитами. Этот род стоит особ-
няком от остальных в крупном сборном сем.
Hoplitophryidae и выделяется Пюйтораком (Puytorac,
1972) в подсем. Mixtophryinae. М. catenula — хозяин
паразитических микроспоридий.
Сем. Radiophryidae Rossolimo, 1926
Пюйторак (Puytorac, 1994) приводит названия fam.
Radiophryidae Puytorac, 1972 и subfam. Radiophryinae
Rossolimo, 1929 emend. Puytorac, 1972; упоминалось
также подсем. Radiophryinae (Rossolimo, 1929) nov.
comb. (Puytorac, 1972). По правилам номенклатуры, ав-
тор подсемейства является и автором семейства. В об-
зорах Пюйторака по астоматам семейство включает
большое число родов и делится на подсемейства Ra-
diophryinae, Metaradiophryinae, Metaracoelophryinae,
Anthonyellinae, Acanthodiophryinae, Durchoniellinae и
Eudrilophryinae, различаемые по типу цитоскелета.
Ниже роды семейства приведены без указания подсе-
мейств, поскольку и в пределах некоторых подсе-
мейств цитоскелет резко различен, например у Radiop-
hryopsis и Ochridanus, у Paracoelophrya и Dicoeloph-
гуа, у Hovasseiella и Durchoniella, но выделение новых
подсемейств нежелательно.
Семейство в целом включает овальные и цилинд-
рические формы, червеобразные виды редкие. Почти у
всех родов спереди четкий элемент V, от длинных бо-
ковых ветвей которого далеко вниз идет большое чис-
ло тонких параллельных спикул. Отсутствие их можно
объяснить вторичной модификацией. Хозяева — вод-
ные и наземные олигохеты семейств Naididae, Tubifi-
cidae, Enchytraeidae, Megascolecidae.
Род Radiophrya Rossolimo, 1926
По Аэшт, тип рода до сих пор не фиксирован; сино-
ним рода — Cheissinella. По ошибке тот же род приве-
ден Аэшт и как синоним рода Hoplitophrya-, это невоз-
можно, поскольку Cheissinella монотипический род.
Род предложен для 2 видов — R. prolifera n. g., n. sp.
и R. hoplites n. sp.; тип рода не назван; диагноза рода
нет, и только в конце текста дан диагноз подсем. «Radio-
phryinae mihi» в сем. Anoplophryidae. Поскольку род пред-
ложен до 1931 г., по правилам номенклатуры род ва-
лидный, достаточно указать типовой вид — R. prolifera.
Относительно крупный род с хорошей перспективой
роста, широко распространен, заселяет Naididae, Tubi-
ficidae и Enchytraeidae в пресных водах, почве и в море.
Тело вытянутое, иногда червеобразное, с расши-
ренным антероном, большим числом кинет, длинным
ядром; вакуоли в 2 краевых рядах. Четко выражен эле-
мент V с широкими длинными лучами, от которых от-
ходит большое число параллельных игольчатых фиб-
рилл. Иногда недоразвито (укорочено) одно плечо,
фибриллы идут от второго и от апикального мукрона.
Кинетом апекса с краевыми секантными швами. Поч-
кование с образованием стробил.
В каталоге астомат (Puytorac, 1972, 1994) дважды
указано — Radiophrya prolifera (Clap, et Lachm., 1858)
Rossolimo, 1926, хозяин Enchytraeus albidus', приведе-
но много синонимов. Однако это ошибка — вид Opali-
па prolifera (позже в составе Anoplophrya, Monodonto-
phrya, Radiophrya) был найден в морской олигохете,
живущей массами у уреза воды под камнями и выбро-
сами водорослей. Россолимо (Rossolimo, 1926) назвал
новый вид R. prolifera из мелких байкальских олигохет
Styloscolex baicalensis с глубины 10—15 м, где все бес-
позвоночные эндемичны для Байкала. Вероятно, он
плохо знал литературу и случайно дал то же название
для своего вида. Поэтому тип рода Radiophrya — R. ir-
капа nom. n. = R. prolifera Rossolimo, 1926 nec R. proli-
fera (C. et L., 1858). Основные виды и хозяева рода:
R. prolifera (С. et L., 1858) Meier, 1954 — Enchytraeus
albidus', R. pungens (Stein, 1861) — Tubifex tubifex (Sae-
nuris variegata в старой литературе = Hoplitophrya tu-
bificis)-, R. pachydrili (Claparede, 1861) — Pachydrilus li-
neatus, P. verrucosus, P. pagenstecheri', R. naidos
(Schmidt, 1846) — Nais elinguis, N. variabilis', R. limnod-
rili Cheissin, 1930 — Limnodrilus arenarius; R. deronis
Heidenreich, 1935 — Dero limosa = D. digitata', R. pelo-
scolecis Heidenreich, 1935 — Peloscolex ferox', R. tubifi-
cis (Katashima, 1952) — Tubifex hattai (как гомоним за-
меняется на Radiophrya corisun Jankowski nom. n.);
R. olivieri Puytorac, 1954 — Pachydrilus sp.; R. biacula
Puytorac, 1954 — Nais obtusa-, R. sagittata Meier, 1954 —
Tubifex tubifex, T. barbatus', R. ochridana Puytorac, 1958 —
Tubifex oligosetosus', R. enchytraei (Meier, 1954) — En-
chytraeus buccholzi (= R. elongata Puytorac, 1954 из
E. albidus) — это типовой вид синонимичного рода
Cheissinella', R. ozakii Katashima, 1952 — Pheretima sie-
boldi', R. гага K., 1952 — Ph. yamada', R. ovata K.,
1952 — Ph. hupeiensis-, видЛ. communissima K., 1952 —
Ph. communissima (ныне в составе Mimophrya) и др.
Род Mrazekiella Kijenskij, 1926
Типовой вид М. costata изтубифицидBranchi-
ura coccinea (= Rhyacodrilus coccineus). В каталоге
Пюйторака 2 валидных вида; синонимы типового
вида — М. nucleoramiformis Kij., 1928; М. intermedia
Cheissin, 1930; второй вид М. debaisieuxi (Delphy,
896
ALVEOLATA
1922) Cheissin, 1930 (= Anoplophrya) из Clitellio arena-
rius. Рисунки M. debaisieuxi плохие, хозяин морской,
вид едва ли относится к данному роду.
Типовой вид — крупные червеобразные формы,
размножение стробиляцией, вакуоли немногочислен-
ные, в 2 нечетких краевых рядах. Весь антерон резко
расширен, с острым апексом (мукроном), от которого
по всем направлениям радиально идут толстые четкие
фибриллы цитоскелета. Фактически имеется V эле-
мент, к которому со всех сторон прикреплены эти фиб-
риллы. Паразиты пресноводных тубифицид. Вид
М. intermedia из того же хозяина с мелкими отличиями
в числе и положении вакуолей вероятно невалиден.
Род Helellophrya Aescht, 2001
Типовой вид Helella rhizodrili Kaczanowski,
1961; название Helella заменено как гомоним. Хорошо изу-
ченный вид; тело очень широкое, плоское, ядро не-
обычной формы — вытянутое и ветвистое, с неровным
контуром; вакуоли в одном ряду вплотную к ядру. Ки-
неты многочисленные, аргиром в виде редких попе-
речных фибрилл. Нет секантной зоны у апекса. Апекс
с широким ацилоном, к которому подходят вершины
всех рядов. Цитоскелет — диагональная основная дуга
с острым мукроном, от которой отходят 30—40 ради-
альных фибрилл. Вероятно, редуцировано левое плечо
V элемента. Предполагалось, что род может иметь фи-
логенетическое значение — контуры тела как у гисте-
роцинетид, поэтому это, может быть, промежуточное
звено между гистероцинетами и астоматами. Однако у
гистероцинет ядро овальное.
Хозяин — олигохеты Rhizodrilus pilosus (Tubifici-
dae). По Аэшт, род Helella монотипичен, но в первоис-
точнике введен также вид Radiophrya intermedia Puyto-
rac, 1954 из Enchytraeoides, и Пюйторак (Puytorac,
1972) сохраняет второй вид в составе рода.
Род Desmophrya Raabe, 1933
Типовой вид D. contorta из нетипичного для
астомат хозяина — из мелкой пресноводной двуствор-
чатой Pisidium casertanum (Sphaeriidae) в Польше.
Пока вид повторно не найден и не изучен; особи Des-
mophrya были замечены мною в эндемичных байкаль-
ских сфериидах, но материал не сохранен. Это плоские
червеобразные формы с широкими концами тела, боль-
шим числом вакуолей в 2 рядах, длинным ядром, с рез-
ко неравным делением (типа монотомического почко-
вания). Число кинет необычайно велико, несколько со-
тен, ход рядов нарушен, много картин делинеации и
фрагментации. От апекса без заметного V элемента от-
ходят радиально (вентрально и вбок) десятки длинных
дуговидных фибрилл.
Род Mimophrya Puytorac, 1969
Типовой вид М. elegans из мегасколецид Emi-
noscolex sp. в Габоне. Тело широкое, овальное, с длинным
ядром и одним рядом вакуолей; у апекса V элемент с
острым мукроном, к которому подходит около 15 длин-
ных игольчатых фибрилл (до экватора тела). Кинеты
подходят к 2 передним секантам, незначительно выра-
женным. Сзади на нижней стороне третья секанта. Нет
боковых зон делинеации кинет. Деление анизотомией,
без почкования и стробиляции. Паразиты дождевых
червей Megascolecidae и Eudrilidae (Африка, Япония).
Примеры видов: М. acuta Puytorac, 1969 {Eminoscolex sp.),
M. ovata (Katashima, 1951) {Pheretima hupeiensis), M. com-
munissima (Katashima, 1951) {Pheretima communissima).
Род Anthonyella Delphy, 1936
Типовой вид Radiophrya hoplites Rossolimo,
1926, одна из самых обычных и повсеместно распро-
страненных астомат в эндемичных олигохетах Байка-
ла; суммарный список хозяев для R. hoplites и ее сино-
нима R. baicalensis Cheissin, 1928—Styloscolex, Teleus-
colex, Lamprodrilus, Agriodrilus, Lumbriculidae sp.;
крупная форма вида в Styloscolex, Lamprodrilus, Lumb-
riculidae sp. Внешний облик стандартный для асто-
мат — длинное червеобразное тело расширяется к
апексу, при делении имеет вид стробилы; апекс с
крючком, выдающимся над телом и направленным
вбок и вниз; ядро длинное, вакуоли в одном ряду. Крю-
чок — видоизмененный мукрон (выступ) вершины
V элемента, имеющего вид острого угла с большим
числом длинных тонких продольных фибрилл. Особи
постоянно прикреплены крючком и присоской к эпи-
телию кишечника, вырастают до 1 мм, крупная форма,
морфологически отличная от типовой, — до 1—2 мм,
особи видны без микроскопа. Второй вид —A. lumbri-
culi (Cheissin, 1930) из Styloscolex sp. в Байкале, длиной
до 1200 мкм, также с крючком на вершине тела.
Род Ochridanus Georgevitch, 1941
Типовой вид О. ocellatus из Tubifex ochridanus.
Тело широкое, с 1 рядом вакуолей; в стробиле
1—2 крупные почки. Цитоскелет очень сложный, с
дифференцировкой вентрального и дорсального отде-
лов. Имеется V элемент, вероятно двойной или трой-
ной, с характерными для рода сферическими утолще-
ниями; прямые фибриллы идут далеко вниз вентраль-
но от внутреннего элемента, а от наружного отходят
реже расположенные фибриллы по краям тела и по
всему дорсуму, идя вдоль всех кинет. Пюйторак (Puy-
torac, 1972) заново изучил цитоскелет типового вида и
открыл новый вид О. kozarovi Puytorac, 1958 в тубифи-
циде Limnodrilus hoffmeisteri. Глазчатые утолщения
спикул у первого вида, по Пюйтораку, — это локаль-
ные разрастания спикул у вершины V элемента; ветви
элемента равные, несут около 40 фибрилл на нижней
стороне тела. Деление с образованием цепочек.
Род Radiophryopsis Georgevitch, 1941
Типовой вид R. acanthostephanos из неопреде-
ленных олигохет в оз. Охрид; из люмбрикулид (Джор-
джевич) или тубифицид (Пюйторак). Тело червеобраз-
ТИП CILIOPHORA. КЛАСС OLIGOHYMENOPHOREA
897
ное, до 600 мкм, размножение неравным делением.
Цитоскелет резко видоизменен — у апекса дуговид-
ный V элемент без спикул, с зубцами по всей длине
спикул, направленными вперед. Мукрона нет, ветви
элемента сходятся плавно, по дуге, не под острым уг-
лом, как обычно у астомат. Род должен быть близок к
другим эндемикам оз. Охрид, где, как и в Байкале, про-
изошла взрывная эволюция олигохет; промежуточные
формы пока не открыты. Пюйторак помещает Radioph-
ryopsis вместе с Anthonyella и Ochridanus в подсем. Ап-
thonyellinae.
Род Metaradiophrya Heidenreich, 1935
По Аэшт, типовой вид не выделен при описании
рода или позже, поэтому название невалидно. Для ва-
лидации здесь как тип рода обозначается Opalina lumb-
rici Dujardin, 1841, и род меняет авторство — Metaradi-
ophrya Jankowski gen. п. Вид имеет характерный об-
лик, поэтому его легко определить; тело плоское и
очень широкое, короткое, с 2 рядами вакуолей, длин-
ным ядром. Спереди мощный крюк, показанный и в
первоописании; это видоизмененный V элемент с не-
равными плечами, короткое плечо особо утолщено и
изогнуто, оба несут фибриллы цитоскелета; по другим
данным, вдоль апикального шва нет выроста элемента,
а большое число дополнительных фибрилл отходят от
вершин кинетз Хотя первоописание вида достаточно
хорошее, он позже упоминается под двумя другими
названиями из тех же хозяев (Lumbricus rubellus,
L. herculeus, L. terrestris) — Opalina armata Stein, 1854
и Hoplitophrya hamata Cepede, 1910; вид относили к
Anoplophrya, но чаще к Hoplitophrya. Список хозяев по
Мейер (Meier, 1954) — виды Lumbricus, Octolasium,
Dendrobaena, Allolobophora, Eisenia, т. e., вероятно,
все обычные дождевые черви средней Европы. Другие
авторы, однако, различают расы (морфотипы) из раз-
ных хозяев, к примеру 3 четких морфотипа из Lumbri-
cus terrestris, L. rubellus и Dendrobaena subrubicunda в
Чехии; был обнаружен также редкий случай инцисти-
рования астомат в задней части кишечника люмбри-
цид. В Lumbricus castaneus морфотип настолько отли-
чается от нормы, что должен считаться новым видом.
Отличия — по размерам, форме тела, общему числу
кинет и числу кинет в тигмозоне. Род в целом обитает
в Lumbricidae, Glossoscolecidae и Megascolecidae — в
дождевых червях Европы и тропиков.
Основные виды и хозяева: М. falcifera (Stein, 1861)
(Allolobophora caliginosa, Octolasium lacteum, Lumbri-
cus rubellus, L. terrestris', у этого вида четко выявлена
длинная дуга цитоскелета вдоль шва, с большим чис-
лом прикрепленных фибрилл, в дополнение к стандар-
тному крюку у типового вида); М. asymmetrica Beers,
1938 (Eisenia lonnbergi, США); M. chlorotica Williams,
1942 (Allolobophora chlorotica)', M. lituiformis (Geor-
gevitch, 1943) (Criodrilus lacuum, C. ochridensis)', M. gi-
gas Puytorac, 1954 (Allolobophora gigas, A. savignyi);
M. heidenreichi Puytorac, 1954 (Helodrilus schneideri)',
M. varians Puytorac, 1954 (Eisenia foetida)', M. bifulta
Puytorac, 1954 (H. schneideri)', M. hovassei Puytorac,
1954 (Eisenia lonnbergi, Allolobophora chlorotica)',
M. gardneri Rees, 1961 (Eisenia foetida)', M. almae Puy-
torac et Dragesco, 1968 (Alma emini', вид с выростами no
всей длине ядра, что редко у астомат); М. eminoscolecis
Puytorac, 1969 (Eminoscolex sp.); M. euoplos Puytorac,
1969 (Alma sp.).
Род Cheissinophrya Puytorac et Dragesco,
1969
Типовой вид Ch. knoeppfleri из Alma emini в Га-
боне (Glossoscolecidae); в этом крупном африканском
дождевом черве много видов и родов астомат и гисте-
роцинетид. В каталоге Аэшт родовое название по
ошибке дано как Cheissiniophrya. Тело червеобразное,
резко сужается кзади, очень широкое спереди, булаво-
видное; вакуоли в 2 рядах; деление неравное. Цито-
скелет прекрасно развит — массивный V элемент с
крюком у вершины, короткая дополнительная ветвь от
вершины и многочисленные толстые дуговидные
опорные спикулы (фибриллы) от обеих ветвей элемен-
та до трети длины тела. На апикальной веточке корот-
кие фибриллы. Кинетом несимметричен, с секантами
вдоль ветвей элемента.
Род Acanthodiophrya Puytorac
et Dragesco, 1969
Типовой вид A. almae из Alma emini, Габон. Ро-
довое название предложено в тезисах (Puytorac, Dra-
gesco, 1968b) и поэтому невалидное, позже, в 1969 г.,
приводится в статье Пюйторака (Puytorac, Dragesco,
1969), поэтому датировка рода 1968 г. в книгах по ци-
лиатам неверна. По цитоскелету род резко отличается
от всех других астомат и составляет особое подсем.
Acanthodiophryinae в системе Пюйторака. Тело отно-
сительно короткое и широкое, с одним рядом вакуо-
лей, деление субэкваториальное, дочерние особи поч-
ти равной длины. Около 100 кинет подходят без выра-
женных швов к апикальному ацилону сложной формы,
с обособлением группы фрагментов кинет. Цитоскелет
уникальный — 2 длинных крюка на инфероне; 2 плеча
(ветви) элемента V поперек тела; на краях тела эти вет-
ви поворачивают и почти смыкаясь продолжаются в
виде массивных спикул с зубцами по всей их длине.
Около 30 тонких продольных спикул (фибриллы) от-
ходят на инфероне вдоль кинет от нижних плечей
V элемента.
Род Metaracoelophrya Puytorac
et Dragesco, 1969
Типовой вид М. intermedia из Alma emini в Га-
боне. Датировка 1968 г. неверна. Хозяин здесь отно-
сится к сем. Criddrilidae, сейчас это подсемейство в со-
ставе Glossoscolecidae; указание для монотипического
рода «в Megascolecidae» (Puytorac, 1972) — ошибка. В
первоописании название рода также Metacoelophrya.
Это крупные овальные формы с очень широким телом,
полимеризацией кинет (до 200 на каждой стороне
тела); вакуоли не в рядах, рассеяны по всему телу; де-
ление почти равное. Апикальный ацилон сложной
57 Зак. №4163
898
ALVEOLATA
формы, отсекает часть кинет; справа и слева очень
длинные бисекантные швы. В цитоскелете можно раз-
личить довольно тонкий V элемент с почти равными
плечами и толстым крюком у вершины; к его правому
плечу присоединены очень короткие фибриллы; от
основания крючка и от вентрального шва отходят не-
сколько дуговидных фибрилл. Число фибрилл, справа
налево, 25 + 7 + 10; публикуемый рисунок цитоскелета
упрощен (Puytorac, 1972).
Род Paracoelophrya Puytorac, 1969
Типовой вид Р. almae по обозначению в дан-
ной сводке; в оригинале род предложен для Р. almae и
Р. intermedia без указания типа и поэтому невалиден.
Род меняет авторство — Paracoelophrya Jankowski,
gen. n. (P. almae, тип рода и P. intermedia in Puytorac,
1969 comb. nn.). Тело овальное, плоское, ядро незначи-
тельно вытянутое, вакуоли в 2 рядах, деление почти
равное. Мелкий вид длиной около 80 X 50 мкм. Спере-
ди длинный поперечный шов, вентрально снизу 2 чет-
кие бисеканты. Обособлен небольшой участок кинето-
ма — фрагменты группы кинет под апикальным швом
(тигмозона). V элемент с неравными плечами, от длин-
ного правого плеча отходят короткие фибриллы, у вер-
шины крючок для фиксации на эпителии. Второй вид
Р. intermedia в том же хозяине, вдвое крупнее, с чет-
ким крючком.
Род Coelophrya Puytorac et Dragesco,
1969
Типовой вид С. roquei из Alma emini, Габон;
род вначале предложен в тезисах (Puytorac, Dragesco,
1968b). Тело овальное, деление неравное, вакуоли
в 2 рядах. Кинеты полимеризованы, до 130, с очень
сложной топографией — на антероне краевые бисе-
канты, дуговидные апикальные швы, длинный вент-
ральный шов и обособленная группа фрагментов ки-
нет. V элемент с неравными плечами, от более толс-
того и длинного правого плеча отходят короткие
продольные фибриллы; от вершины элемента вглубь
тела отходит длинная полоса из изогнутых попереч-
ных фибрилл, следуя вдоль вентрального шва. В ка-
кой-то мере они напоминают независимо возникшие
опорные элементы по краям тела у гипостомат Chla-
mydodon и у паразитов кенгуру Macropodinium. Самые
верхние дуги связаны с левым плечом элемента, ниже
они идут от шва и все более скручиваются в дугу и по-
лукольцо.
Род Dicoelophrya Puytorac et Dragesco,
1969
Типовой вид D. calliste (у Аэшт, по ошибке
D. callistes) из Alma emini. Род предложен в тезисах
(Puytorac, Dragesco, 1968b), через год в статье, и в обо-
их невалиден, поскольку род предложен для 2 видов
без указания типа. С обозначением типа D- calliste род
меняет авторство Dicoelophrya Aescht, 2001 с видами
D. calliste и D. almae (Р. et D., 1969) comb. п. Оба
вида — из Alma emini. Тело овальное, плоское, очень
широкое при виде снизу, с 2 рядами вакуолей; деление
почти равное. V элемент с массивным правым плечом
с апикальным крючком и длинной тонкой дугой лево-
го плеча, от обеих ветвей отходят короткие фибриллы.
Их вершины, изгибаясь, образуют обособленные дуги,
которые ниже V элемента появляются самостоятельно
под швами кортекса. Вид имеет 2 полосы этих дуг, с
большим числом полуколец в каждом, справа и слева,
они почти достигают постерона. Кинеты многочислен-
ные и топография их усложнена в зоне цитоскелета.
D. calliste длиной 85—120 мкм имеет 170—180 кинет
и 27—29 + 20—22 колец в желобках; D. almae длиной
120—180 мкм имеет 280 кинет и 70 + 72 колец в опор-
ных желобках. Подсем. Metaracoelophryinae в системе
Пюйторака (Puytorac, 1972) включает близкородствен-
ные роды Coelophrya, Dicoelophrya, Paracoelophrya и
Metaracoelophrya из одного хозяина.
Род Durchoniella Puytorac, 1954
Типовой вид Anoplophrya brasili Leger et Du-
boscq, 1904 sensu Cepede, 1910 из полихет Audouinia
tentaculata (Cirratulidae), позже в составе Hoplitophrya
и Radiophrya. Все другие виды рода — в хозяевах из
этого семейства подвижных морских полихет; в сидя-
чих полихетах (серпулидах, теребеллидах) другие
роды астомат. A. brasili — широкие овальные формы с
одним рядом вакуолей и неравным делением; около
80 кинет подходят без швов к звездчатому ацилону
спереди. Цитоскелет — компактный V элемент с мук-
роном и небольшим крючком, от коротких толстых
ветвей элемента отходят далеко вниз, до половины
тела, многочисленные параллельные продольные фиб-
риллы. Другие виды — D. legeriduboscqui Puytorac,
1954 {Audouinia tentaculata)', D. cirratuli Puytorac, 1954
{Cirratulus cirratus); D. dodecaceriae Puytorac et Schre-
vel, 1965 {Dodecaceria caulleryi и D. concharum).
Род Hovasseiella Puytorac, 1955
Типовой вид H. polydorae в мелких полихетах
Polydora giardi, живущих в трубках на дне моря; этот
род полихет (сем. Spionidae) включает также много
сверлильщиков камней и раковин, постоянно заражен
на Мурмане. Тело каплевидное, антерон сужен и оття-
нут в виде хоботка, ядро вытянуто на длину тела, име-
ется один ряд вакуолей; деление неравное, без цепо-
чек. Много кинет, до 140; топография рядов резко на-
рушена сзади, спереди ряды подходят к округлому
ацилону и к 2 длинным боковым бисекантным швам;
на дорсуме кинеты дезорганизованы, с фрагментацией
и делинеацией. Цитоскелет — массивный мукрон, ви-
доизмененная вершина V элемента, с 2 боковыми и од-
ним осевым короткими отростками; нет прикреплен-
ных к ним фибрилл. Особи изученной расы во Фран-
ции заражены микроспоридией Thelohania georgevichi.
Этот и предыдущий род объединены в подсем. Durcho-
niellinae — с компактным V элементом и утратой фиб-
рилл у Hovasseiella.
ТИП CILIOPHORA. КЛАСС OLIGOHYMENOPHOREA
899
Род Eudrilophrya Puytorac, 1970
Типовой вид Е. complanata из олигохетEudri-
lus eugeniae (Eudrilinae) на Мартинике. Внешний об-
лик нетипичен для астомат — тело плоское и очень
широкое, с клювом сверху, слева, срезанное поперек
снизу; многочисленные вакуоли рассеяны в беспоряд-
ке по всему телу. Около 200 кинет на супероне,
160—180 на инфероне. Спереди длинный поперечный
шов; нет V элемента, но почти до половины тела от
широкого антерона (от шва) идут многочисленные па-
раллельные фибриллы; они покрывают нижнюю по-
верхность тела; толщина фибрилл уменьшается слева
направо и вниз к экватору тела. Передний шов узкий и
длинный, спускается далеко вниз слева; спереди и сза-
ди по 2 шва. Только один этот род составляет подсем.
Eudrilophryinae в схеме Пюйторака (Puytorac, 1972).
Сем. Contophryidae Puytorac, 1972
Астоматы с овальным телом, не червеобразные; де-
ление почти равное?- ядро вытянутое, вакуоли в од-
ном ряду. Кинеты многочисленные, спереди подходят
к небольшому ацилону и к продольному шву. Цитоске-
лет сложный, с V элементом, несущим тонкие фибрил-
лы. По диагнозу Пюйторака и по морфологии 2 вклю-
чаемых сюда родов трудно найти принципиальные
различия этого и предыдущего семейств; может
быть оправдан лишь ранг подсемейства в составе Radi-
ophryidae.
Род Contophrya Puytorac et Dragesco,
1969
Типовой вид C. cachoni из Alma emini. Родовое
название годом раньше дано в тезисах (Puytorac, Dra-
gesco, 1968b). Тело вытянутое, с 62—64 кинетами,
подходящими к округлому апикальному ацилону с не-
большим швом на венте; цитоскелет включает V эле-
мент в виде 2 тонких поперечных фибрилл равной
длины, по инферону от них отходят в сумме около
20 тонких игольчатых фибрилл, до трети длины тела.
Второй V элемент имеет вид массивных дуг, соединен-
ных у вершины, где к ним примыкает изогнутый крю-
чок. Род монотипичен. Хозяин в оригинале—Alma sp.,
вероятный новый вид в Габоне, позже определен как
Alma emini.
Род Dicontophrya Puytorac et Dragesco,
1969
Типовой вид D. grassei из Alma emini. Годом
раньше род указан как новый в тезисах. Мелкие формы
(90 X 50 мкм) с 56 кинетами и 2—3 вакуолями в одном
ряду; V элемент в виде двух дуговидных массивных
спикул, направленных вниз вдоль инферона; кроме
них внутри аппарата имеется пара добавочных изогну-
тых спикул, а к вершине тела прикреплены 2 ветви
клыкообразных массивных спикул, от внутренней час-
ти которых отходят 2 крючка. Продольные фибриллы
немногочисленные, отходят от массивных спикул.
Второй вид — D. гага (= Radiophrya гага Katashima,
1951) из олигохет Pheretima yamada в Японии, гиганты
длиной до 1—2 мм X 30—60 мкм, не должен отно-
ситься к этому роду: в Alma идет бурная дивергентная
эволюция специфических астомат, не переходящих в
другие роды хозяев.
Сем. Maupasellidae Cepede, 1910
Червеобразные формы с узким телом; фиксатор-
ный аппарат состоит из подвижного шипа с фибрилла-
ми у основания, расположенными в почти замкнутом
кольце. Вероятно, это одна из модификаций исходного
типа опорного аппарата — элемента V. Нет тонких
игольчатых фибрилл, отходящих от ветвей элемента у
Hoplitophryidae, Radiophryidae и Contophryidae.
Род Maupasella Cepede, 1910
Типовой вид М. nova по монотипии; Пюйторак
(Puytorac, 1954) указывает другой вид М. cepedei, что
ошибочно. Внешний облик зависит от стадии цикла —
продукты деления мелкие, утолщенные, плавают в
толще кишечника; дефинитивные трофонты длинные,
червеобразные, прикреплены крючком к эпителию.
Кинетом простой, на апексе стандартный для астомат
ацилон и боковой шов. Деление неравное, с мелкими
почками. Спереди крупный подвижный крючок, осно-
вание которого упирается в шарнир. Вглубь тела от
этих элементов отходят толстые прямые палочковид-
ные спикулы. Детали строения цитоскелета отличают-
ся у разных видов, общее лишь наличие подвижного
крючка; у М. dichogasteri от его основания идут ради-
альные палочки в симметричной группе, у М. cepe-
dei — лишь несколько таких палочек.
Путаница с типовым видом вызвана тем, что Сепед
(Cepede, 1910) под одним названием М. nova описал
«очень изменчивый вид» по литературе (из Алжира) и
по своему материалу близ Парижа. Пюйторак для час-
ти этого сборного вида предложил название М. cepe-
dei, но не сохранил название М. nova-, это недопусти-
мо. Другие авторы использовали валидное название
М. nova и дали ряд описаний вида.
Основные виды и хозяева: М. dilatata Puytorac et
Rakotoarivelo, 1965 (Dichogaster inermis); M. dichogas-
teri P. et R., 1965 (£>. inermisy M. castanei Lom, 1961
(= M. cepedei f castanei-, Lumbricus castaneus); M. vacu-
olata Lom, 1959 {Pheretima rodericensis, Ph. hawayana);
M. multistriata Puytorac, 1954 (Allolobophora gigas,
A. savignyi); M. algeriana Puytorac, 1954 (Helodrilus
schneideri)-, M. herculei Puytorac, 1954 (Lumbricus her-
culeus); M. pheretimae Katashima, 1952 (Pheretima com-
munissima); M. cylindri K., 1952 (Pheretima communissi-
ma); M. lubeti Puytorac, 1952 (Glossoscolex grandis)-,
M. pontodrili Puytorac, 1972 (Pontodrilus bermudensis,
= Maupasella sp. in Wichterman, 1942); M. criodrili Hei-
denreich, 1935 (Criodrilus lacuum, C. ochridensis);
M. nova Bhatia et Gulati, 1927 (Pheretima posthuma,
Ph. hawayana; гомоним; M. indica nom. n.); M. eupoly-
toreuti Ngassam, 1983 (Eupolytoreutus sp.); M. nova
900
ALVEOLATA
Cepede, 1910, p. p. (= M. cepedei Puytorac, 1954) — толь-
ко паразиты Allolobophora terrestris, Helodrilus chloro-
ticus, Eisenia foetida, A. longa, A. caliginosa, Eiseniella
tetraedra, Dendrobaena illyrica, Lumbricus rubellus.
Вид M. mucronata (Cepede, 1910) из Eiseniella tetra-
edra (= Allurus tetraedrus) — это типовой вид рода
Schultzellina Cepede, 1910, который позже признан си-
нонимом рода Maupasella. Основное отличие родов в
первоначальном диагнозе — крюк направлен вверх у
Maupasella и отклонен вбок у Schultzellina, ядро у по-
следнего массивное, почковидное. Поскольку крючок
подвижный, важных родовых различий нет.
Род Buchneriella Heidenreich, 1935
Типовой вид В. criodrili из Criodrilus lacuum и
С. ochridanum. Очень крупные червеобразные формы,
вакуоли в продольном ряду, кинеты незначительно
спирализованы. На снимке импрегнированных особей
у Пюйторака (Puytorac, 1954) видна мелкая Maupasella
criodrili и массивная В. criodrili из одного хозяина; у
них разный аргиром — ряд прямоугольников в межки-
нетах у второго вида, двойной ряд у первого. Хотя
пока в систематике родов астомат этот признак не учи-
тывался, следует определять тип аргирома и вводить в
диагнозы родов. Деление резко неравное, с образова-
нием цепочек. Основание шипа с выемкой, в которой
расположен сходный внутренний крючок. Размеры
тела В. criodrili 140—160 мкм, имеются 37—42 кине-
ты, шип длиной всего 4 мкм дает начало дюжине фиб-
рилл длиной до 5 мкм; заражены водные олигохеты.
Массивный вид В. pheretimae Puytorac et Rakotoarivelo,
1965 из наземных червей Мадагаскара {Pheretima) ве-
личиной до 500 мкм, с 60 кинетами, может быть не
родствен с европейским видом и имеет явно лишь кон-
вергентное сходство.
Род Georgevitchiella Puytorac, 1957
Типовой вид Mesnilella aculeata Georgevitch,
1941 из Eiseniella. Тело вытянутое, до 280 мкм, вакуо-
ли в 2 рядах, деление со стробиляцией, в цепочке по
3—4 сателлита. Спереди узкий длинный «эктоплаз-
менный» (кортикальный) мукрон в виде шипа, у его
основания 4 спикулы — 2 короткие в середине и
2 длинные по краям. Эндемики оз. Охрид.
Род Acanthophrya Heidenreich, 1935
Типовой вид Opalina inermis Stein, 1859 (у
Аэшт, по ошибке — Ophryoglena inermis) из пиявок
Helobdella stagnalis. Как О. inermis вначале был описан
вид типа Mesnilella secans в кишечнике пиявки Clepsi-
пе binoculata-, его переводят позже в состав Anoploph-
rya, сохраняют в этом роде, затем переводят в состав
Buetschliella', другие авторы отождествляют вид с
A. naidos. Мелкие примитивные астоматы с простым
цитоскелетом; червеобразные формы величиной около
80—ПО X 20—25 мкм с 20 кинетами; вакуоли в 2 ря-
дах; деление неравное, фактически почкование, но
стробилы почти не встречаются. Спереди небольшой
шипик, мукрон, от которого под нижними кинетами
отходят не больше 20 тонких фибрилл на нижней сто-
роне тела. В системе Пюйторака только этот род вхо-
дит в подсем. Acanthophryinae.
Сем. Intoshellinidae Cepede, 1910
Включает, вероятно, неродственные формы, с раз-
ным типом цитоскелета; общее — спирализация ки-
нет, незначительная у Intoshellina и четкая у Spirobuet-
schliella', по типу цитоскелета общего диагноза не мо-
жет быть дано. Паразиты водных олигохет (Tubificidae
и Lumbriculidae) и полихет.
Род Intoshellina Cepede, 1910
Типовой вид I. maupasi из Tubifex tubifex. Уз-
кие вытянутые формы; тело сужается к антерону; ваку-
оли в 2 рядах; кинеты спирализованы — изогнутые, но
не закручены вокруг тела. Спереди ацилон, окружен-
ный почти замкнутой толстой спикулой с шипиками
апикально и вентрально. Концы боковых дуг заостре-
ны, конец правой ветви раздвоен; морфология цито-
скелета специфична для разных видов. Типовая раса
вида — из Алжира. Размножение стробиляцией.
Примеры видов: I. poljanskyi Cheissin, 1930 {Lim-
nodrilus arenarius в Байкале); I. sicyodes Georgevitch,
1943 (в неопределенных Limnodrilidae); I. limnodrili
Katashima, 1952 {Limnodrilus sp.); I. cheissini Puytorac,
1972 {Tubifex sp.); I. ochridana Puytorac, 1960 {Euilyod-
rilus ochridanus)', I. sapkarevi P., 1958 {E. isochaetus)',
I. wautieri Puytorac et Juget, 1964 {E. henscherij, E. mac-
rogongylos Georgevitch {E. ochridanus).
Род Monodontophrya Vejdovsky, 1892
Типовой вид M. longissima из Rhynchelmis li-
mosella. Червеобразные формы с одним рядом вакуо-
лей; базальная пластинка цитоскелета продолжается в
шипик и окружена расходящимися радиально фибрил-
лами. Вид плохо изучен, и строение рода обычно ил-
люстрируют на примере второго вида М. kijenskii Che-
issin, 1930 из байкальских траловых олигохет Tubifex
inflatus (см. ниже род Eumonodontophrya). Описанный
позже вид Intoshellina rhynchelmis Debaisieux, 1921 пе-
ревели в состав Monodontophrya и считали валидным,
но сейчас это синоним типового вида.
Pop, Eumonodontophrya Heidenreich, 1935
Род был предложен только для байкальского вида
Monodontophrya kijenskii Cheissin, 1930, строение кото-
рого отличается от типового вида рода Monodontoph-
rya. Вид найден в передней части кишечника Tubifex
inflatus в тралах с глубины 10—12 м в Байкале; вели-
чина 400—800 мкм, вакуоли в одном ряду, кортекс
спереди сильно утолщен, на апексе небольшая скелет-
ная пластинка под пелликулой с мелким шипом, выда-
ТИП CILIOPHORA. КЛАСС OLIGOHYMENOPHOREA
901
ютимся над телом; от пластинки отходят тонкие фиб-
риллы. Стробилы с 1—2 крупными томитами. Род не
считается валидным, хотя Хейсин (Cheissin, 1930) под-
черкивал отличие вида от остальных видов Monodon-
tophrya.
Род Spirobuetschliella Hovasse, 1950
Типовой вид 5. chattoni Hovasse, 1950 по моно-
типии из полихет Pomatoceros triqueter. Этот вид был
предложен как новый, но он ранее был уже описан как
Anoplophrya clignyi Cepede, 1922, поэтому правильное
название типа — S. clignyi (Cepede, 1922). Тело вытя-
нутое, веретеновидное, сужается к концам, особенно
кзади; различимы 2 формы вида — мелкая (50 X
27 мкм) и крупная (300—500 X 60 мкм), у обеих около
26 кинет закручены спиралью вокруг тела. Ядро осе-
вое, вакуоли в одном спиральном ряду; деление меди-
альное, без стробиляции. Спереди весь апекс занят
опорной пластинкой, типичный для астомат фибром
отсутствует; секантный шов у вершины тела. Изучен-
ная во Франции раса.заражена микроспоридией Gur-
leya nova. Некоторые особенности вида вызвали пред-
положение о том, что это апостомата — деление рав-
ное, но клетки остаются соединенными долгое время и
затем делятся еще раз, как при палинтомии апостомат;
находили и рудимент ротового аппарата у апекса. Ве-
роятно, это все же астомата, не имеющая никакого от-
ношения к данному семейству.
Отряд Anoplophryida Poche, 1913
Гетерогенная (сборная) группа; тело обычно оваль-
ное или умеренно вытянутое, нет развитого скелетного
аппарата у апекса. Кинеты сближены и иногда образу-
ют тигмотактическую площадку без фрагментации.
Деление чаще всего медиальное без образования цепо-
чек, за исключением Buetschliella. Паразиты наземных
олигохет (Anoplophryidae) и полихет (Buetschliellidae).
Пюйторак в Traite (Puytorac, 1994) приписывает автор-
ство отряда Сепеду — отряд Anoplophryida Cepede,
1910. Сепед никогда не предлагал подотряда или отря-
да, только сем. Anoplophryidae, поэтому автором так-
сона является Похе (Poche, 1913), предложивший
группу с диагнозом в ранге подотряда.
Сем. Anoplophryidae Cepede,
1910
Паразиты дождевых червей Lumbricidae, Glossos-
colecidae, Megascolecidae. Тело овальное, более или
менее сплющенное, с вогнутой или плоской передней
частью вента. Кинеты многочисленные, сближенные,
продольные, сходятся к продольной секанте спереди.
Дифференцирована тигмозона (тигмон), образованная
вершинами некоторых правых кинет инферона (Апор-
lophryinae), многими левыми кинетами на обеих сторо-
нах тела спереди (Lubetiellinae) или некоторыми кине-
тами верхней части тела (Corlissiellinae). По краям тела
спереди топография кинет нарушена, здесь часта фраг-
ментация и делинеация рядов (кроме примитивной
Anoplophrya). Обычно имеется 1 ряд вакуолей, иногда 2.
Деление медиальное или ниже экватора.
Род Anoplophrya Stein, 1860
По Аэшт, тип рода до сих пор не фиксирован. Вна-
чале астомат относили к сборному роду Opalina', типо-
вой вид по обозначению здесь — Opalina lumbrici
Schrank, 1803, обычный паразит европейских дожде-
вых червей, переведенный в состав Anoplophrya. Апи-
кальный шов в виде длинной дуги, уходящей краями к
инферону. Обычно имеется антеро-латеральная рес-
ничная зона (тигмон) справа, образованная короткими
сегментами кинет. По краям тела расположение кинет
не нарушено, нет делинеации. 2 секантные системы
спереди несимметричные; имеются также 2 шва сзади,
высоко над инфероном по краям тела. Чаще всего один
ряд вакуолей. Деление медиальное. Паразиты всех
3 семейств дождевых червей, указанных в диагнозе се-
мейства.
Типовой вид обитает в Eisenia foetida, Allolobopho-
ra caliginosa, A. terrestris, A. rosea, A. chlorotica, Dend-
robaena subrubicunda, Octolasium cyaneum, O. lacteum,
Lumbricus rubellus, L. herculeus и других обычных поч-
венных червях.
A. nodulata (Dujardin, 1841) — паразит Eiseniella
tetraedra-, вид долгое время не признавался, но сейчас
считается валидным. В составе рода немало плохо
описанных видов; более того, к роду приписывали гис-
тероцинетид и протаноплофриид; в старой литературе
было принято относить к Anoplophrya любых астомат,
ныне числящихся во многих родах подкласса. Находки
в морских олигохетах сомнительны (Валовая, 1990 —
в Enchytraeus albidus и Lumbricillus pagenstecheri).
Примеры видов и хозяев рода: A. eudrili (Eudrilus euge-
niae),A. criodrili (Criodrilus lacuum), A. baikalensis Ros-
solimo, 1926, A.foetidae Femandez-Galiano et Perez-Uz,
1990 (Eisenia foetida var. foetida), A. vulgaris Puytorac,
1954 (E.f var. andrei),A. nodulata (Dujardin, 1841 inZe-
ucophrys) (= A. alluri Cepede, 1907; Eiseniella tetraedri-
ca), A. pheretimii Raychaudhuri et al., 1969 (Pheretima =
Megaphireposthuma),A. tchadoviP., 1958 (Eiseniella oh-
ridana), A. pilosa Georgevitch, 1950, A. stromboides G.,
1943, A. cavernosa G., 1943, A.pelmatoida G., 1943,
A. longinuclea G., 1943, A. ochridensis G., 1943 (эти 6 ви-
дов в одном хозяине Criodrilus ochridensis), A. lloydi Ghosh,
1918 (Pheretima posthuma), A. aelosomatis Anderson, 1989
(Aelosoma chlorostichum в Индии), A. chaudhuri Muk-
herjee et Chakraborty, 1975 (Perionyx excavatus) и мн. др.
Род Eliptophrya Kijenskij, 1926
Типовой вид E. limnodrili; этот род сейчас счи-
тается синонимом рода Anoplophrya.
Род Macrophrya Kijenskij, 1926
Типовой ви д М. taupodrili из Rhyacodrilus сос-
cineus; также синоним рода Anoplophrya.
902
ALVEOLATA
Род Lomiella Puytorac, 1961
Типовой вид Anoplophrya gigantea Katashima,
1951. Вершины кинет спереди сходятся вдоль длинной
секанты субапикально; кинеты полимеризованы, мес-
тами неравномерно сближены, тигмозона справа спе-
реди, образована сегментами нескольких кинет. По
краям тела в связи с полимеризацией положение кинет
нарушено, много картин фрагментации и разветвления
рядов (делинеации) на одной или на обеих сторонах
тела. Многочисленные вакуоли разрознены. Деление
типа почкования. Паразиты Megascolecidae. Тип рода
описан из Pheretima в Японии, другие виды из Африки
и Мадагаскара — L. eminoscolecis Puytorac, 1969; L. ra-
abei P. et Rakotoarivelo, 1965; L. bergeri P. et R., 1965.
Род Sigmophrya Puytorac, 1971
Типовой вид 5. eudrili из мегасколецид Eudri-
lus eugeniae на о-ве Мартиника в Карибском море. Род
датируют также 1969 и 1970 гг., у Аэшт — 1971 г. То-
монты максимальной дины до 450 мкм; тело овальное,
особо расширено медиально, ядро осевое, вакуоли
многочисленные, рассеяны в беспорядке близ ядра.
90—100 кинет на инфероне, 85—90 на верхней сторо-
не; дуговидная секанта спереди, с узкими краевыми се-
кантами; сзади еще 2 шва. Задние и передние швы не
зеркальные, не соответствуют друг другу. Картины де-
линеации редкие. Деление суб-медиальное, томит
меньше примонта, но к концу деления их размеры вы-
равниваются. По многим признакам вид близок к Lo-
miella, но отличается по расположению швов, особен-
но у постерона.
Род Njinella Ngassam, 1983
Типовой вид N. prolifera из переднего отдела
кишечника олигохет Eupolytoreutus sp. в Камеруне.
Некрупные особи длиной 80—100 мкм с широким
овальным плоским телом; кинеты полимеризованы (до
143—164 рядов); ядро вытянутое, 13—20 вакуолей не
в рядах, ниже экватора; на инфероне (нижняя сторона
тела на субстрате) 2 длинных бисекантных зеркальных
шва; на верхней части тела швов нет, кинеты биполяр-
ные. Нет следа цитоскелета и присоски. Род близок к
Sigmophrya, отличается по топографии секантных
швов.
Род Almophrya Puytorac et Dragesco,
1969
Типовой вид A. almae из Alma emini по обозна-
чению Аэшт (2001); Аэшт указывает этот тип «по мо-
нотипии», но это ошибка, в первоисточнике подробно
описаны 2 новых вида из одного хозяина—A. bivacuo-
lata и A. laterovacuolata. Тем не менее указание типа
Аэшт валидно, и род меняет авторство — Almophrya
Aescht, 2001, с A. almae и с видом A. laterovacuolata
(Р. et D., 1969) comb. п. Статья на обложке журнала
(Puytorac, Dragesco, 1969) датируется 1968 г., по
Аэшт — 1969 г. Тело овальное, широкое, с необычай-
но большим числом кинет; все ряды подходят к очень
длинному дуговидному бисекантному шву спереди,
уходящему далеко вниз по левому краю тела; на пра-
вом краю шов переходит в зону делинеации кинет.
Нет обособленных верхних сегментов кинет (тигмозо-
ны). Вакуоли в 2 рядах, близ осевого ядра. В одном из
участков тела под верхним швом кинеты сближены
вплотную, это аналог тигмона из фрагментов кинет
аноплофрий. Деление медиальное. Паразиты тропиче-
ских Glossoscolecidae (в криодрилине Alma). Ядро не-
обычное, нередко в виде букв Н или X. Специальное
изучение (Dupy-Blanc, Ngassam, 1983) с учетом мор-
фологии и фотометрии ядер показало наличие в хозяе-
вах одновременно 3, а не 2 видов с разной длиной тела,
разным количеством ДНК в макронуклеусах и разной
степенью плоидности микронуклеуса; третий вид опи-
сан отдельно как A. mediovacuolata Ngassam, 1983 из
Alma sp. в Камеруне.
Род Lubetiella Jankowski gen. n.
По Аэшт, род Lubetiella Puytorac, 1959 невалиден,
так как был предложен для 2 видов без обозначения
типа — L. proditrix и L. micheli из мегасколецид Dicho-
gaster inermis на о-ве Маврикий. Дождевые черви ро-
дов Pheretima и Dichogaster здесь имеют богатую и ма-
лоизученную эндофауну астомат. Краткая заметка
Пюйторака (Puytorac, 1959) — не стандартное описа-
ние видов, акцент сделан на сравнении разных отря-
дов; дан общий диагноз рода, и снимки антерона обоих
видов. Как типовой вид в данной публикации автором
обозначается L. proditrix. Поэтому род меняет автор-
ство с comb. пи. для обоих видов на L. proditrix, L. mic-
heli. Тело овальное, не червеобразное; ядро осевое; ва-
куоли рассеяны в беспорядке; деление анизотомией,
томиты мелкие. Кинеты многочисленные (100—150),
подходят к дуговидной апикальной секанте и вдоль
нее отделяют четкую полосу фрагментов, как у трихо-
стомат типа Balantidium. В сегментах кинетосомы рас-
положены вплотную, поэтому эти ряды кажутся утол-
щенными. Полоса тигмокинет может располагаться у
разных видов с одной или с обеих сторон от шва.
Род Corlissiella Puytorac, 1960
Типовой вид Anoplophrya criodrili Heidenreich,
1935 из водных олигохет Criodrilus lacuum и С. ochri-
densis, эндемиков оз. Охрид. Тело овальное, широкое;
деление почти медиальное. Род близок к Anoplophrya,
но отличается наличием 2 длинных кинет, идущих че-
рез все тело от апекса к постерону на верхней стороне
тела и на левом краю, вероятно несущих специальную
функцию. Передняя секанта смещена непосредственно
к апексу; есть еще 3 секанты спереди на супероне, из
которых мидлатеральная левая состоит из 2 кинет, от-
личающихся от остальных. Зона без ресничек у посте-
рона продолжается в виде шва до вершины тела в виде
четкой межкинетной полосы. Пюйторак (Puytorac,
1960) сравнивает данный род с тигмотрихами типа
Protophrya, Lubetiella с трихостоматами, Sieboldiellina
ТИП CILIOPHORA. КЛАСС OLIGOHYMENOPHOREA
903
с Conchophthirius и приходит к выводу о гетерогенном
происхождении астомат. Позже этот взгляд им не вы-
сказывался, частичное сходство кинетома — результат
конвергенции у симбионтных цилиат. По мнению
Пюйторака, ряд видов Anoplophrya из Criodrilus
оз. Охрид, описанных Джорджевичем, должен быть
отнесен к Corlissiella.
Сем. Buetschliellidae Puytorac, 1994
По признанию Пюйторака (Puytorac, 1994), это ге-
терогенное семейство предложено условно для пара-
зитов полихет. Тело овальное или цилиндрическое, ки-
неты продольные, обычно сближены и с нарушенной
топографией, часта делинеация. Цитоскелета нет — это
единственный признак, объединяющий 4 включаемых
сюда рода.
Род Buetschliella Awerinzew, 1907
Типовой вид В. opheliae из полихет Ophelia Н-
macina, частый на Мурмане. Тело узкое, червеобраз-
ное, 10 кинет несколько спирализованы, нет делинеа-
ции, встречающейся только у видов с необычайно
большим числом кинет; ядро осевое, вакуоли в одном
ряду. Длина особей до 280—360 мкм. К данному роду
относили р виды из олигохет, например В. chaetogastri
Penard, 1922 из пищевода мелкой пресноводной олиго-
хеты Chaetogaster sp.; включались также виды из Enc-
hytraeus и других пресноводных и морских энхитреид.
Вероятно, Пюйторак ограничивает род лишь типовым
видом.
Род Rhizocaryum Caullery et Mesnil, 1907
Типовой вид Rh. concavum в Polydora caeca и
P.flava — это мелкие полихеты с апикальной кроной
щупалец, живущие в трубках на морской литорали, ме-
стами образуют скопления; всегда заражены на Мур-
мане. Вероятно, заражены и полидоры, сверлящие ра-
ковины крупных двустворок — в одной из статей
мельком отмечены «инфузории типа Rhizocaryum» в
Polydora websteri, обычном сверлильщике раковин
устриц в Мексиканском заливе. Rh. concavum подроб-
но изучил Сепед (Cepede, 1910), установивший новое
подсем. Rhizocaryinae; это значит, что сем. Butschlielli-
dae Puytorac, 1994 (включающее род Rhizocaryum) яв-
ляется синонимом, или валидно только в том случае,
если Rhizocaryidae ограничить типовым родом.
Тело овальное, широкое, вакуоли в одном ряду,
ядро осевое, с боковыми ветвями (более разветвлено,
чем у Helellophrya), кинеты полимеризованы, должны
подходить к длинной верхней секанте; вент вогнутый,
в виде обширной присоски, на дне которой кинеты
особо сближены. Данных по топографии швов нет. Де-
ление монотомическое; макронуклеус делится надвое
без предварительного слияния в сферу; в интеркинезе
особо утолщены концевые зоны ядра. Вентральная
присоска и ветвящееся дро, по Сепеду, признак нового
подсемейства, в остальном близкого к Anoplophryinae.
Род Anoplophryopsis Puytorac, 1954
Типовой вид Л. ovata из полихетLysidice nini-
etta (Eunicidae). Тело широкое, плоское, концы тела
расширены, с длинными секантными швами. Размеры
около 105—160 мкм; ядро осевое, несколько вакуолей
в одном ряду, деление косое медиальное. Около 70 ки-
нет продольные, подходят к широкому поперечному
шву (ацилону) с 2 небольшими краевыми секантами и
одним поперечным швом на постероне. Нижняя часть
антесомы слегка вогнута, образует нечеткую присоску
без фрагментации кинет.
Род Herpinella Puytorac, 1954
Типовой ви д Я enigmatica из полихет Cirratu-
lus filiformis. Крупный вид (250—375 мкм); тело вытя-
нутое, но не червеобразное, сужается кзади; нет ци-
тоскелета; вакуоли в 2 рядах; ядро на всю длину тела;
деление не отмечено. Около 80—100 кинет идут про-
дольно, подходят к 2 краевым секантам, к широкому
округлому ацилону спереди и к шву сзади; имеются
3 секанты спереди — дорсальная, левая латеровент-
ральная и латеро-дорсальная, по терминологии Пюй-
торака. Снизу сзади 2 секанты, здесь часты бифурка-
ция и фрагментация кинет. При первоописании род не
был отнесен к определенному семейству, в Traite (Puy-
torac, 1994) включен в состав сем. Buetschliellidae.
Роды астомат неясного положения
Род Hysterophrya Puytorac, Groliere
et Grain, 1979
Типовой вид H. enigmatica из неопределенной
олигохеты Гваделупы (Карибский бассейн). Тело вы-
тянутое, плавно сужается к постерону, ядро широкое и
длинное, осевое; кинеты полимеризованы, имеются
четкие длинные секанты сверху справа и снизу слева.
Передняя половина тела, как у гистероцинет, здесь
видна обширная безресничная субапикальная площад-
ка в виде поперечного полукольца, снизу в нее входят
около 20 медиальных кинет. У многих гистероцинетид
такая же топография антерона, но под присоской име-
ется цитоскелет, отсутствующий у Hysterophrya. По-
стерон сужен, нет ни следа перистома гистероцинет, и
топография рядов здесь не нарушена. Пюйторак отме-
чает несомненное родство гистероцинет и астомат,
вновь доказанное строением присоски и кинетома у
Hysterophrya, но это, конечно, не переходная форма.
Род Metastomum Georgevitch, 1943
Типовой вид М. ochridensis по монотипии,
очень редкий вид из кишечника эндемичных олигохет
в оз. Охрид. Тело грушевидное, величиной 60—80 X
40—50 мкм, с овальным ядром; кинетом не изучен,
присоски нет. Такой вид нетипичен для астомат, поэ-
тому допускалась возможность, что это не астоматы, а
904
ALVEOLATA
видоизмененные гистероцинеты, частые в олигохетах.
Второй вид М. vastum G., 1950 из неопределенных глу-
боководных олигохет Охриды, намного крупнее
(200—300 X 80—100 мкм), с каплевидным или слегка
вытянутым телом, 1—2 округлыми ядрами; у этого
вида кинетом также не был изучен.
Род Perseia.Rossolimo, 1928
Типовой вид Р. dogieli из переднего отдела ки-
шечника, у глотки, гефиреи (сипункулиды) Phascolo-
soma margaritaceum в тралах в Баренцевом море. Пер-
вое название рода Persea Rossolimo, 1926 по названию
корабля «Персей» как ошибочное было заменено но-
вым. Длина тела 114—205 мкм; тело вытянутое, сплю-
щено в антесоме, несимметричное, слегка скрученное.
Присоски и фиксаторного скелетного аппарата нет;
кинеты продольные (около 40), вероятно с короткой
апикальной секантой; ядро вытянутое; 1—2 вакуоли в
постесоме. Родство вида с ранее известными астомата-
ми не очевидно, и его находка подтверждала мнение о
гетерогенности сборного отряда.
Отряд Haptophryida Jankowski,
1980
Пюйторак (Puytorac, 1994) в Traite приписывает ав-
торство Сепеду — Haptophryida Cepede, 1910, но Се-
пед никогда не предлагал такого таксона. Янковский
включает в состав отряда только Haptophryidae, Пюй-
торак также Clausilocolidae, и в таком составе диагноз
отряда затруднителен. Клаузилоколиды из наземных
моллюсков, вероятно, неродственны гаптофриидам из
водных беспозвоночных и амфибий; это можно ре-
шить только методом молекулярной диагностики. Не-
трудно найти множество крупных дискофрий в пре-
сноводных планариях, но клаузилоколиды встречают-
ся единично, очень трудны для сбора, хозяева очень
редкие. Отряд sensu lato включает виды с разной фор-
мой тела, с расширенным антероном, на котором рас-
положена четкая присоска с зубцами или без них.
Сем. Clausilocolidae Puytorac in Corliss,
1979
Тело овальное или вытянутое, передний конец осо-
бо расширен и вогнут, функционирует как присоска.
Цитоскелета нет.
Род Clausilocola Lom, 1959
Типовой вид С. apostropha из наземных рако-
винных гастропод (не лимацид) Clausilia pumila; это
ксеробионты, встречающиеся на лугах на траве и под
камнями. Тело булавовидное, вздутое спереди и заост-
ряющееся кзади, величиной 240—330 мкм, с овальным
ядром (не лентовидным, как у других астомат); десят-
ки вакуолей рассеяны по всему телу, не собраны в про-
дольные ряды; деление без стробиляции. Кинеты по-
лимеризованы, подходят к очень длинному поперечно-
му переднему шву; заметных секант по краям от него
нет. Нет фрагментации кинет и обособления тигмозо-
ны; весь расширенный антерон вогнут и функциониру-
ет как присоска. Вид найден в Чехии и в Крыму; Ко-
роль (1990) при обследовании 48 видов, 34 родов,
18 семейств наземных моллюсков Крыма нашла этот
вид только в Mentissa canalifera, М. gracilicosta и Coch-
lodina laminata.
Род Proclausilocola Lom, 1959
Типовой в и д Р. complanata из того же хозяина;
в Чехии виды встречаются совместно в Clausilia pumi-
la, которая лишена других обычных симбионтов на-
земных моллюсков (Myxophyllum, Tetrahymena, Thig-
тосота, Semitrichodina'). Тело овальное, ядро почти
округлое, множество вакуолей рассеяно в беспорядке
по всему телу, размеры особей около 150 X 100 мкм.
Вогнута обширная часть тела, с образованием присос-
ки; удлинен дуговидный апикальный шов. Как и тип
предыдущего рода, вид найден в Крыму, но в других
моллюсках — в Brephulopsis bidens, В. cylindrica и Tho-
anteus gibber (Король, 1990).
Род Haptophryopsis Puytorac,
1971
Типовой вид Н. pheretimae из дождевых чер-
вей Африки Pheretima sp. Тело цилиндрическое, ядро
осевое, вакуоли в 2 рядах, размеры особей до
270—360 мкм. Вид с цефализацией — шейка отделяет
нижнюю цилиндрическую часть от вздутого антерона,
нижняя часть которого, обращенная к субстрату, обра-
зует крупную присоску. Кинет много, ПО—120 на
дорсуме, 90 на инфероне; все ряды, подходящие к
краю присоски, прерваны швом и продолжаются далее
до апикального шва. В сущности, апикальная секанта
непропорционально удлинилась слева, огибает тело и
возвращается направо, прерывая кинеты. Цитоскелета
нет; деление не изучено. Соседство клаузилоколид и
этого рода в одном семействе (в Traite) кажется неес-
тественным, хозяева не обитают вместе, и вновь без
молекулярной диагностики родство родов проверить
невозможно.
Сем. Haptophryidae Cepede, 1923
(рис. 377, а)
Удлиненные червеобразные формы с овальным яд-
ром, вакуоль в виде канала; антерон расширен в виде
крупной присоски, кинетом присоски четко обособлен
от соматических кинет. В обзоре гаптофриид (Corliss
et al., 1965) и в схеме Пюйторака (Puytorac, 1994) се-
мейство включает 3 подсемейства — Haptophryinae
Cepede, 1923 {Haptophrya), Cepediettinae Corliss, Puyto-
rac et Lom, 1965 (Cepedietta) и Lachmannellinae Cepede,
1923 (Annelophrya, Steinella, Lachmannelld); можно
ожидать отделения рода Annelophrya. Раннее название
сем. Discophryidae Cepede, 1910 невалидно.
ТИП CILIOPHORA. КЛАСС OLIGOHYMENOPHOREA
905
Род Haptophrya Stein, 1867
Типовой вид Opalina planariarum Siebold,
1839. Это замещающее название для Discophrya Stein,
1860 (астоматы) пес Discophrya Lachmann, 1859 (сук-
тории). Тип рода, нередко цитируемый как Н. planarium,
паразитирует в кишечнике пресноводных планарий —
белых Dendrocoelum lacteum, Planaria torva и черных
Polycelis nigra', в морских планариях обитает род Stei-
nella; в эндемичных планариях оз. Охрид — род Аппе-
lophrya. В Байкале обилие крупных планарий, но асто-
маты в них никем не были отмечены при специаль-
ном поиске (Россолимо, Хейсин, Янковский), лишь
изредка отмечаются паразитические гименостоматы
рода Ophryoglena-, нет также наружных мобилид родов
Trichodina и Urceolaria и инфекции тканевых тетра-
химен.
Родовое название Sieboldiellina Collin, 1911 было
предложено специалистом по сукториям Колленом
(Collin, 1911) для замещения Discophrya Stein, 1860 без
учета литературы — Коллен не знал, что гомонимия
уже ликвидирована. Тем не менее название Sieboldiel-
lina очень долго использовалось в литературе, вплоть
до недавнего времени, пока не был восстановлен прио-
ритет Штейна.
Типовой вид — очень крупная (до 1 мм) плос-
кая червеобразная астомата; тело очень метаболичное,
легко скручивается и покрывается складками; ядро уд-
линенно-овадьное; вдоль дорсума идет канал вакуоли
на всю длину тела. Деление неравное, томит наполови-
ну мельче примонта, один в стробиле. Тело заостряет-
ся кзади, в антесоме узкая шейка отделяет воронковид-
ную присоску от тела. Кинеты полимеризованы, сбли-
жены вплотную, в сумме около 145—165 рядов, на
верхней стороне тела 65—75, на нижней 80—90. Края
присоски прочные, очень четкие, присоска округлая,
слегка впячена внутрь; все вентральные кинеты про-
должаются на поверхности присоски, с перерывом по
ее нижнему краю; остальные кинеты подходят к секан-
те, образуемой боковыми и верхним краем присоски. В
присоске кинетосомы двойные, координированы у
смежных кинет, образуя множество паратен — корот-
ких поперечных рядов. Аргиром в виде сети развит на
теле и присоске. Дорсальные ряды расходятся ради-
ально к верхней секанте. При контакте с эпителием
трофонт прочно прикрепляется вогнутой присоской.
Паратены обильны и по всему телу, этот вид труден
для точной зарисовки. У постерона тело резко сужает-
ся, все кинеты не могут дойти до конца тела и здесь на
обширном участке положение кинетосом хаотическое.
Вид Sieboldiellina stankovici Puytorac, 1957 описан
из пресноводной планарии Fonticola ochridana', тело
веретеновидное, короткое и широкое, с 155—180 ки-
нетами; присоска гигантская, достигает половины дли-
ны тела, в принципе, как у Н. planariarum, но без цефа-
лизации. По внешнему облику можно различить 2 под-
рода — с червеобразным телом {Haptophrya s. str.,
типовой вид Н. planariarum) и с клиновидным телом
без цефализации {Klinophrya subgen. п., типовой вид
Haptophrya stankovici comb. n.). Другие виды — H. асе-
tabulifera (Georgevitch, 1941), Н. ohridensis (G., 1941),
H. oweni (Gillespie in Puytorac, 1963); 3 первых вида
могут принадлежать к Annelophrya.
Род Lachmannella Cepede, 1910
Типовой вид Opalina recurva Claparede et Lach-
mann, 1859 {Hoplitophrya in Kent, 1882; Lachmannella in
Cepede, 1910). Все источники до сих пор, включая спе-
циальный обзор гаптофриид (Corliss et al., 1965) и по-
следующие статьи и книги, указывают как хозяина
морскую планарию Planaria limacina у берегов Норве-
гии, но такого вида в литературе давно нет; это не пла-
нария, а похожий на нее моллюск — голожаберник Ы-
mapontia capitata. Этот мелкий плоский безраковин-
ный моллюск не имеет ветвистых наружных жабер,
легко видимых у большинства крупных голожаберни-
ков, поэтому был принят за планарий, и эту ошибку
повторяют уже полтора столетия. Трофонты некруп-
ные (200 мкм), тело огурцевидное, изогнутое, сужает-
ся к апексу; ядро овальное; имеется фиксаторный ап-
парат — один длинный крючок спереди у вершины ка-
нала вакуоли. Деление почти медиальное. В морях
России вид не отмечен. Неспециалисты по цилиатам
при изучении паразитов планарий отметили, что хозя-
ин вида Planaria limacina «без сомнения является ли-
максом рода Pontolimax» (т. е. это безраковинный мор-
ской моллюск — голожаберник), затем хозяина опре-
делили как Limapontia capitata, но эти определения не
были замечены цилиатологами.
Род Steinella Cepede, 1910
Типовой вид Opalina uncinata Schultze, 1851 из
морских литоральных планарий Procerodes ulvae. Та-
кие формы встречаются в планариях разных видов в
морях России (Белое, Баренцево, Черное, Японское,
Охотское, Берингово), но только у Владивостока опи-
сан новый вид S. armata Rybakov et Medvedev, 1990.
О. uncinata относили к Hoplitophrya по наличию спи-
кул у апекса, но цитоскелет этих родов не идентичен.
Ранние авторы находили вид также у Proceros sp. и
Gunda segmentata, вероятно этот и близкие виды спе-
цифичны для поликлад. Тело вытянутое, сужается у
постерона, ядро овальное, вакуоль в виде длинного
пульсирующего канала; деление почти изотомическое.
Присоска занимает часть антесомы, сверху ограничена
дуговидной секантой, с боков 2 короткими швами,
снизу кинеты переходят на присоску без фрагмента-
ции, образуя поле вплотную сближенных кинетосом.
Во многих местах кинетосомы собраны в поперечные
ряды (паратены). Цитоскелет в виде 2 изогнутых мас-
сивных крючьев, правый короче левого, между
ними — зона толстых паратен. У постерона топогра-
фия кинетосом нарушена. По отношению к длине тела
присоска относительно небольшая в сравнении с при-
веденными выше родами, но крючья обеспечивают
прочную фиксацию на эпителии.
Род Annelophrya Lom, 1959
Типовой вид Sieboldiellina sphaeronucleata
Georgevitch, 1948 из эндемичных планарий оз. Охрид.
Род включает также другие виды Джорджевича, ранее
относимые к Sieboldiellina — A. ochridensis, A. acetabu-
906
ALVEOLATA
lifera из триклад. Тело широкое, незначительно вытя-
нутое, сплющено, присоска небольшая субапикальная
у типового вида и A. ochridensis, резко расширена у
A. acetabulifera, занимает весь апекс, как у Haptophrya
planariarum, и в этом отношении можно различить
2 подрода в составе Annelophrya. Крючьев нет, присос-
ка окружена кольцом из мелких шипов; кинетом не
изучен; ядро округлое или овальное; вакуоль в виде
длинного канала. Вид с небольшой субапикальной
присоской A. sphaeronucleata — тип номинального
подрода Annelophrya s. str., вид с крупной апикальной
воронкой A. acetabulifera — тип подрода Tricladina
subgen. n..— А. (Т.) acetabulifera. В схеме Пюйторака
род Annelophrya относится вместе с Steinella и Lach-
mannella к Lachmannellinae, но родство первого рода с
морскими паразитами, имеющими крючья и иной тип
присоски, кажется невозможным. Annelophrya могла
произойти от Klinophrya со сходной формой тела, и
род лучше переместить в подсем. Haptophryinae.
Род Cepedietta Kay,
1942
Типовой вид С.fibrillata по монотипии, но в
обзоре гаптофриид (Corliss et al., 1965) указан как тип
валидный вид Haptophrya gigantea Maupas, 1879. Тело
длинное и узкое, червеобразное, расширено к апексу
без цефализации; гигантских размеров до 1—2 мм.
Ядро вытянутое (до 1/5 длины тела) или овальное; ва-
куоль в виде длинного канала; кинеты полимеризова-
ны. Расширенная антесома с небольшой округлой суб-
апикальной присоской снизу, без вооружения и опор-
ных структур. Передний секантный шов дуговидный,
не совпадает с верхним краем присоски. Под краями
присоски система поверхностных и глубоких микро-
фибрилл. Деление почкованием, томиты долгое время
остаются в контакте и в итоге образуются цепи с при-
митом и 15 сателлитами — таких стробил нет у осталь-
ных астомат.
Только этот род астомат заселяет низших позво-
ночных (амфибий разных отрядов). Ранее виды рода
относили к Haptophrya и Discophrya, но по типу присо-
ски они не могут относиться к этим родам. Хозяева ви-
дов следующие:
С. fibrillata Kay, 1942 — тритоны Eurycea bislinea-
ta, США.
С. virginiensis (Meyer, 1938 in Haptophrya) — Rana
palustris.
C. michiganensis (Woodhead, 1928 in Haptophrya) —
наземные тритоны (саламандры) Hemidactylium scuta-
tum, A. opacum, Desmognathus fuscus, D. phoca, Eurycea
bislineata, E. cirrigera, E. guttolineata, Plethodon cinere-
us, P. albagula, P. fourchensis, P. glutinosus, P.jordani,
P. ouachitae, P. punctatus, P. wehrlei, Pseudotriton mon-
tanus, Ambystoma jeffersonianum, лягушки Rana sylvati-
ca и R. clamitans, США.
C. gigantea (Maupas, 1879 in Haptophrya) — Bufo
pantherinus, Discoglossuspictus, редко в Rana esculenta,
Алжир. Первый вид здесь обозначается как типовой
хозяин.
С. discoglossi (Everts, 1879) — лягушки Discoglos-
sus pictus. Вид открыт одновременно и независимо от
предыдущего вида; возможна синонимия, если вид не-
специфичен.
Cepedietta sp. — в кладках икры саламандры Am-
bystoma maculatum, США.
С. tritonis (Certes, 1880 in Haptophrya) — Triton alpi-
nus, Франция.
C. plethodontis Lipscomb, 1941 in Haptophrya —
Plethodon cinereus, P. glutinosus, США. Вид описан в
неопубликованной диссертации; валидное название —
С. plethodontis (Lipscomb in Puytorac, 1963) Corliss
etal., 1965.
Подкласс Peritrichia Stein, 1859
Крупная группа цилиат с большой перспективой роста и с чет-
ким делением на 2 подгруппы — сидячие (сессилиды) и подвиж-
ные (мобилиды); в первом отряде есть несколько вторичноподвиж-
ных планктонных родов, сохраняющих типичное для сессилид
строение зооидов. Различие отрядов не в образе жизни, а в строе-
нии — у мобилид скопула превращена в гигантский базальный
диск, на всю ширину тела, и развит очень сложный радиально-сим-
метричный опорный аппарат; у сидячих и вторичноподвижных
планктонных родов скопула очень мелкая, простая, с полем кине-
тосом. Это объясняет одно из названий подгрупп, предложенных в
литературе, — Fibrodiscida и Dentodiscida.
Перистом апикальный, ротовая цилиатура развернута по кругу
или спирали вокруг эпидиска и уходит в полость, называемую
по-разному, — инфундибулюм, вестибулюм, буккальная полость
(буккон). Термин «вестибулюм» принято применять для участка
соматической цилиатуры в полости перед погруженным в буккон
тетрахимениумом, поэтому его нельзя применять к перитрихам.
Ротовая цилиатура в принципе тетрахименового типа, поэтому на-
звание Oligohymenophora как смена моего первоначального назва-
ния Tetrahymenophora в данном обзоре не признается. У перитрих
резко удлинена ундулирующая мембрана УМ с дикинетой в осно-
вании, с чередующимся, зигзагообразным положением кинетосом
(мой термин — зигокинета); в паре кинетосом только наружная не-
сет ресничку, и вся мембрана состоит из одного ряда ресничек (как
гаплокинета). Столь же резко удлинена и мембранелла М2; Ml —
рудиментарная (короткая гаплокинета сбоку от вершины М2), не-
сет узкий пучок длинных ресничек (эпистомальная мембрана) или
вообще не выявляется у начала спирали. Цилиатура буккона слож-
ная — к мембране добавляется длинный параллельный ряд, участ-
вующий в стоматогенезе при делении и поэтому носящий название
«герминальная кинета»; это монокинета (один ряд кинетосом), она
сопровождает основание мембраны на значительном расстоянии и
заканчивается выше рта; мембрана вплотную подходит ко рту. С
другой стороны мембрану сопровождает интенсивно импрегнируе-
мая лента, не поликинета.
Мембранелла снаружи — поликинета из 3 рядов кинето-
сом. При входе в буккон к ней подходит вершина длинной полики-
неты такого же типа, идущей вместе с мембранеллой М2 ко рту.
Выше рта находится более короткая прямая третья полоса такого
типа, вероятно М3. Итак, на поверхности тела перитрих распо-
ложены УМ, мембранелла М2 и рудимент Ml, ко рту на дне букко-
на подходят мембрана, М2, М3 и аргентофильная лента, а на диске
и частично в верхней части полости лежит герминальная моноки-
нета.
Степень закручивания наружных и внутренних полос видоспе-
цифична и может служить родовым признаком. В норме полоса
ресничек (мембрана + М2) начинается сбоку на эпидиске, обходит
его и идет по краю выступа тела (валика), достигает буккального
отверстия и, закручиваясь, входит в него. У ряда неродственных
родов в обоих отрядах произошло увеличение числа витков пред-
ротовой спирали — у стебельчатых перитрих Campanella, Uvelinus,
у аберрантного вида Ophrydium eutrophicum, у триходиниды Vauc-
homia и других родов; в полости буккона кинеты спирализуются у
Campanella и Termitophrya.
ТИП CILIOPHORA. КЛАСС OLIGOHYMENOPHOREA
907
Поверхность тела вне ротового кольца без ресничек; у всех
сессилид и у нескольких видов мобилид сохранены поперечные
кольца кортекса (циклонемы по моей терминологии), обычно легко
видимые без импрегнации, пелликула кажется гофрированной,
края тела волнистые. Это рудимент немногочисленных ресничных
рядов, располагавшихся кольцами у предков перитрих; число ко-
лец возрастает у многих видов сессилид, иногда до сотни и более,
тогда они видны лишь при иммерсии. Кольцевая локомоторная по-
лоса несет 3 кольца ресничек у мобилид, у сессилид сохраняются
безресничные кинетосомы в недифференцированной полоседо мо-
мента деления или до превращения зооида в мигранта, когда вновь
появляется цилиатура полосы. Как исключение, реснички полосы
сохраняются у одного сидячего рода (Ambiphrya) и у планктонтов
типа Opisthonecta. По телу рассеяны в беспорядке аргентофильные
точки — поры кортекса или безресничные кинетосомы.
В дополнение к кольцевым аргиронемам у ряда видов развиты
их продольные соединения, и аргиром имеет вид правильной сети
из квадратов или прямоугольников. У мобилид такой сети нет,
лишь у одного южноафриканского вида Trichodina xenopodos вид-
на возникшая вторично неправильная сеть кортекса; циклонем у
триходинид нет, но они сохранились у части видов урцеоляриид.
Среди сессилид сеть имеется в разных группах родов, и все такие
виды отделяются от форм с кольцами на уровне рода. Так образу-
ются пары родов, идентичных во всем, кроме аргирома: Vorticel-
la + Pseudovorticella, Haplocaulus + Pseudohaplocaulus, Zoothamni-
um + Zoothamnopsis, Carchesium + Epicarchesium, Parazoothamni-
um + Piesika, сеть имеет и аберрантная эпистилида Campanella ит-
bellaria; нет видов с сетью у крупного дивергентного сем. Opercu-
lariidae, нет у Ophrydiidae, у всех неколониальных планктонтов, у
всех лорикат в обоих подотрядах. Только 1 вид сессилид имеет
сеть на эпидиске перистома (Zoothamnium perlatum Stiller, 1946),
но это не проверено. Над кортикальной сетью может быть много
пузырьков с гликогеном (Pseudovorticella monilata) или вторая сеть
из высоких правильных ячеек с водой у Р. chlamydophora.
Тело всех сессилид (кроме лагенофрисов) и части урцеолярий
сократимое, развита мощная система мионем; скопула окружена
кольцом фибрилл, дающим отростки вверх под кортексом (не ме-
нее 10), которые начинают ветвиться и сходятся к валику вокруг
перистома — мускульному сфинктеру, который быстро реагирует
на раздражение или на фиксацию; практически всегда при фикса-
ции любым способом особи сжатые, с втянутым и закрытым пери-
стомом. Ограниченная сократимость — у Ambiphrya с пресновод-
ных рыб; при помещении мелких рыбок в разбавленный формалин,
йод-формол или пикро-ацето-формол (смесь Буэна) часто все ам-
бифрии остаются расправленными, но это исключение у сессилид.
Скопула сессилид — небольшая округлая площадка с импрег-
нируемыми гранулами (кинетосомами) по всей поверхности или
изредка только по периферии; иногда имеются и короткие непо-
движные щетинковидные реснички; у осевшего мигранта они бы-
стро секретируют фиксон разного типа — диск, короткий или
длинный стебелек или диск и раковину. На срезах стебелька видна
сплошная масса продольных фибрилл, только периферическое
кольцо фибрилл (Campanella) или полоса зернистой текоплазмы с
осевым мускулом (мионема, спазмонема) разной длины, не всегда
достигающим базодиска (фиксаторного диска). Мускул — продол-
жение в стебельке системы соматических миофибрилл, начинаю-
щихся от скопулы. Форма, длина мускула, характер ветвления —
родовые признаки. Очень короткий стебелек в отличие от плоской
подошвы или длинного стебелька можно назвать «стилоид» (sty-
loid).
Мобилиды всегда одиночные, среди сессилид много колони-
альных форм на общем стебельке. Инцистирование у мобилид не-
известно, у сессилид выявлено у части видов, вероятно не свойст-
венно всем без исключения видам. Для изучения цист и опытов с
ними можно собрать симбионтных перитрих — Allomeron на
остракодах, Heteropolaria на крабах, это колониальные формы с
быстрым инцистированием при ухудшении условий; и в то же вре-
мя в Крыму я выделял морской перифитонный вид Vorticella, кото-
рый затем культивировался годами на дне чашек Петри и ни при
каких обстоятельствах не давал цист, в частности при голодании,
при постепенном высыхании массовых культур или при смене
воды от черноморской (2 %) до пресной и до пересоленной мор-
ской.
Происхождение перитрих от Holotricha не вызывало сомнений;
еще в начале прошлого века Форе-Фремье (Faure-Fremiet, 1910)
правильно назвал конкретных предшественников — тигмотрих
типа Hemispeira, в современной системе это подотряд отряда Scuti-
cociliatida или самостоятельный отряд. Примитивные тигмотрихи
(Ancistrum) подвижные, но часто надолго остаются на месте, филь-
труя пищу; на дорсуме расположено поле тесно сближенных кинет
и кинетосом в них, несущих короткие неподвижные щетинки —
это тигмозона (мой термин — тигмон, thigmon) для фиксации на
субстрате. Постепенно у анцистрид перистом смещается к посте-
рону, а тигмон оказывается на вершине тела, тело удлиняется, ста-
новится бочонковидным. Переходной формой к перитрихам ранее
считалась Hemispeira, симбионт иглокожих, особо частая на мор-
ских звездах. Позже открыт более близкий к перитрихам род Nucle-
ocorbula, симбионт двустворчатых моллюсков — камнеточцев и
древоточцев в Индии. Среди примитивных перитрих, без стебелька
и раковины, с широкой скопулой, относимых к фиктивному сбор-
ному роду Scyphidia, много симбионтов пресноводных и морских
беспозвоночных, в частности иглокожих и моллюсков, несомненно
родственных высшим тигмотрихам; подкласс Peritrichia монофиле-
тичен и уже на самой ранней стадии началась взрывная эволюция,
от примитивных одиночных форм выводится много независимых
линий.
Для подкласса характерна также редкая у цилиат «массовая
штамповка» видов — обычно род у цилиат включает один или не-
сколько видов, но роды Vorticella, Pseudovorticella, Epistylis, Apio-
soma, Zoothamnium, Opercularia, Cothurnia, Trichodina принадле-
жат к числу крупнейших родов цилиат даже после выделения мно-
гих видов в самостоятельные роды, и ежегодно описываются
новые виды.
Определение видов и родов сессилид ведется на живом мате-
риале, среди мобилид не требуют импрегнации урцеолярии, а для
определения триходинид нужно импрегнировать базодиск с опор-
ным аппаратом методом Клейна на сухих нефиксированных маз-
ках, методом Шатгона-Львова для фиксированных осмием мор-
ских триходин. Прекрасные результаты дает испанский метод (им-
прегнация аммиачно-карбонатным серебром с пиридином) —
интенсивно красятся миофибриллы, цилиатура диска и буккона на
фоне желтой цитоплазмы; чаще применяют протаргол, но этот ме-
тод сложен и фирменный реактив малодоступен; при светлой окра-
ске (оранжевые или красные кинетосомы) можно зачернить их
хлорным золотом.
Известно много симбионтов (комменсалов и паразитов) сесси-
лид; у триходин лишь один род паразитов — критические виды
сукторий рода Endosphaera, условно определяемые для пресновод-
ных и морских хозяев как Е. engelmanni ввиду отсутствия обнару-
жимых морфологических различий. Стебельки, физоны и ракови-
ны сессилид часто покрыты бактериями; симбиоз со специфиче-
скими серобактериями на пелликуле тела характерен для крупных
колоний Zoothamnium в морском бентосе и пелагиали; один из
видов рода назван Z. omamentum по наличию палочковидных
бактерий на стебельке. Стволы и ветви колоний используют для
оседания хоанофлагеллаты, зеленые микроводоросли, диатомеи,
лорикаты, другие перитрихи, суктории; к примеру, Tokophrya qu-
adripartita легче найти на кустистых колониях Epistylis, чем в пери-
фитоне. На вортицеллах паразитирует суктория рода Sphaerophrya.
Для колоний Carchesium polypinum характерен наружный паразит
Tokophryella carchesii с несколькими апикальными щупальцами,
высасывающий зооидов; он обычен в Европе, но в Байкале его нет,
здесь, по моим данным, он замещается новым эндемичным родом
сукторий другого типа, а в горной реке близ истока Ангары нет
обоих паразитов, здесь на кархезии поселяется видоизмененная ра-
ковинная суктория Metacineta. На ветвях колонии С. polypinum
обитает облигатный симбионт — мелкий вид Vorticella, покрытый
палочковидными эпибактериями, прилегающими к пелликуле; на
зооидах кархезиев бактерий нет. Обычные длинные серобактерии
на стебельке эпистилиса с Gammarus pulex были приняты за защит-
ные выросты стебелька и вид был по этому признаку описан как
новый — Epistylispilosus Boitsova, 1974. Мукозный покров с бакте-
риями имеется у пресноводного перифитонного вида Vorticella
rhabdophora. Крупная перифитонная суктория Trichophrya epistyli-
dis неспецифична для Epistylis, но может встречаться на его сте-
бельках.
Эндопаразиты перитрих — цитоплазменные и ядерные бакте-
рии, грибки разного типа, суктории рода Endosphaera и даже мик-
роспоридии в крупных зооидах пресноводного рода Campanella,
вначале принятые за трихоцисты. По моим данным, на литорали
Байкала у истока Ангары массовые поселения вортицелл заражены
неизвестным грибком, убивающим клетку и растущим в виде круп-
ного прочного двурукого спорангия; рядом в дорожной канаве кле-
щи Limnozetes несут оперкулярий с длинными мобильными бакте-
риями в макронуклеусе; мелкие наружные суктории Manuelophrya
parasitica прикрепляются близ скопулы и высасывают зооидов
Epistylis в прибрежных прудах вдоль Ангары. Неродственная сук-
тория Pottsia parasitica высасывает цитоплазму фолликулинид и
908
ALVEOLATA
котурнид в море; другой вид рода паразитирует на сцифидиях с As-
terias. Грибок Melia harposporoides— специфический паразит вор-
тицелл, с ветвлением тела и серповидными конидиями. Котурниды
и лагенофрисы защищены раковиной, но и в них можно найти сфе-
рических сукторий рода Endosphaera.
Известны оперкулярии, обитающие как «раумпаразиты» или
«паройки» (нидиколы) только в колониях других оперкуляриид на
водных жуках (Opercularia eumelita, О. improbata, О. depellens,
О. inquilina, О. рагоеса), соответственно в колониях дихотомиче-
ских и раковинных видов (Orbopercularia catillicola, Orb. enochri,
Orb. exigata, Orb. femoralis й O. coxarum). Аналогия у эпистилид —
колонии мелкого вида Epistylis epibioticum Banina, 1983; на круп-
ном Carchesium batorligetiense, Ер. balatonica Stiller, 1931; факуль-
тативно на стебельках Е. entzii.
Симбиоз с микроводорослями известен у мобилид, обитающих
в моллюсках — зоохлореллы у вида из Theodoxus (= Nerita) в устье
Волги, у Trichodina tranquillis в планорбидах Польши, у эндемич-
ных триходин в физидах США, неопределенные водоросли в Urce-
olaria viridis из морских гастропод Астаеа в Калифорнии. Несмот-
ря на большое число видов сессилид, такой симбиоз в этом отряде
редок. Вид с гидроидов Aglaophenia (Spastostyla sertularium) и пе-
рифитонная Pseudovorticella zooxanthelligera из Адриатики имеют
несколько крупных зооксантелл рода Symbiodinium в цитоплазме;
типичные зоохлореллы отмечены у части рас Epistylis plicatilis на
обрастаниях планорбид, у Vorticella chlorellata с колоний (ценоби-
ев) планктонных цианофит, в ЮАР у симбионтов рыб Apiosoma vi-
ridis, A. curvinucleata, A. caulata, у части видов лорикат (Thuricola),
повсеместно у Ophrydium versatile, образующего гигантские свет-
лозеленые мукозные колонии, и у немногих других видов (Vorticel-
la marginata var. chlorelligera, Mantoscyphidia sp. с моллюска Gyra-
ulus в США, Orbopyxidiella strelkowi с остракод, Epistylis chlorelli-
gerum и др.).
В этой группе слишком много плохих описаний, неопредели-
мых видов, ложных определений, в частности неопределимы и не-
валидны типовые виды родов Scyphidia, Rhabdostyla, Telotrochidi-
ит и др.; для видов сессилид можно указывать только типовых хо-
зяев и нельзя суммировать последующих, эти определения могут
быть неправильными. К примеру, все определения перитрих рода
Epistylis на мексиканском речном раке Cambarellus patzcuarensis и
серии видов Scyphidia на морских двустворчатках Мексики лож-
ные. Не может пресноводный перифитонный вид Epistylis elongata
из США жить на жабрах морских двустворок Японии, не может
эпибионт полихет Адриатики Е. polenici в массе встречаться в ак-
тивном иле очистных станций, не может облигатный симбионт
морских гидроидов Aglaophenia (Spastostyla sertularium) жить на
головастиках лягушек и на глубоководных гаммаридах Байкала,
где он «имеет другую морфологию и лишен зооксантелл», не мо-
жет вид «сцифидий» с тритонов жить на личинках комаров. Таки-
ми фальсификациями в изобилии полна литература. При описании
видов сессилид нельзя ограничиваться одним рисунком, нужно ри-
совать ряд трофонтов в разных положениях и возможно больше де-
талей (пелликула, ядро, вакуоль, мигрант), чтобы уменьшить риск
неправильного определения вида последующими авторами.
В данном обзоре внимание концентрируется на родах и их ти-
повых видах; принято несколько семейств, другие кратко упомина-
ются в диагнозах некоторых родов (Intranstylidae, Rovinjellidae, Ве-
zedniellidae и другие). По традиции различаются 2 отряда, первый
(Sessilida) с 2 подотрядами по типу перистома — Vorticellina и
Operculariina, второй отряд Mobilida с 2 подотрядами по типу дис-
ка — Urceolariina и Trichodinina. По новым данным, мобилиды не
выводятся от сессилид и сходство групп — конвергенция.
Отряд Sessilida Kahl,
1933
Сидячие или вторично-подвижные планктонные
формы; тело колокольчатое, сужается к основанию, за-
нятому скопулой — округлой площадкой с полем ки-
нетосом. У примитивных форм скопула широкая,
окружена кольцевой складкой тела. У бесстебельча-
тых форм скопула секретирует фиксаторную массу —
прикрепительный диск; у стебельчатых видов узкая
скопула секретирует мелкий базальный диск, затем
зооид быстро выделяет стебелек, поднимаясь над суб-
стратом. Третий вариант — образование мелкого дис-
ка и раковины вместо стебелька.
Раковинные перитрихи — не единая группа, рако-
вины образуются независимо и неоднократно в груп-
пах эпистилид и оперкуляриид; в раковине помещает-
ся 1, 2 и более зооидов, иногда вся колония (у Syncyat-
hella), или у дихотомически ветвящихся форм каждая
пара зооидов находится в общей раковине (у Kindella).
Защитный и опорный аппарат не ограничивается
раковиной, есть и многие другие формы модификации
фиксаторного комплекса (фиксона). У Foissnerella
вздувается вершина стебелька, и продукты 1 деления
мигранта оказываются на вершине сферы, затем они
образуют собственные стебельки. Systylis образует
массивный стебелек с плоской вершиной, несущей
группу зооидов. У Cotensita и Allomeron стебелек спи-
ральный у вершины, у Discotheca и Craspedomyoschis-
ton дисковидный.
Стебельки, одиночные или ветвящиеся, могут быть
сократимыми — имеют мионему, толстую осевую ор-
ганеллу, пучок сократимых фибрилл в общем матрик-
се. При импрегнации протарголом видна система со-
кратимых фибрилл под пелликулой зооидов; сходясь к
скопуле, эти пучки продолжаются в стебельке в виде
мионемы. Мионема короткая у рода Monintranstylum,
достигает базодиска у Vorticella) у Carchesium каждый
зооид в колонии образует свою мионему, у Zoothamni-
um она ветвится.
Сессилиды обычны в почве, во всех типах водо-
емов, в бентосе и планктоне, иногда массовые. Симби-
онтные виды отмечены в большинстве родов, и немало
других родов облигатно симбионтные, не имеют сво-
бодноживущих видов. Хозяева — практически все
группы от микроводорослей и одноклеточных до рыб
и китов; особо дивергентная эволюция — на червях,
водных насекомых, ракообразных и рыбах; хозяева бу-
дут названы в аннотациях к каждому роду. Не освоен-
ная ниша в отличие от сукторий — губки, нематоды,
туникаты, наземные млекопитающие. Сессилиды
обычно эктокомменсалы, иногда с косвенным вредом
для хозяина, но это не критерий паразитизма; отдель-
ные виды обитают в ротовой полости жуков, лягушек,
в ноздрях и на жабрах рыб, в мантийной полости (ман-
тоне) моллюсков — к примеру, легко видеть крупных
сцифидий в дыхательной полости мелких прозрачных
плоских планорбид. Единичные указания находок в
кишечнике хозяев, например паравортицелл в червях,
не документированы.
Подотряд Vorticellina Fromentel, 1875
(рис. 377, 6—380, б)
Сессилиды очень дивергентные по многим призна-
кам, но отряд можно разделить на 2 группы родов по
типу перистома — вортицеллидного и оперкулярного
типа. Вздутый апикальный отдел (эпидиск) у Vorticel-
la, Epistylis и многих других родов широкий, прикреп-
лен к краям тела, при сокращении особи втягивается
внутрь вместе с краем тела (валиком). У Opercularia,
Ballodora и других родов эпидиск узкий, на обособлен-
ной ножке (стволе), валика по краю тела часто нет; при
сокращении особи сначала глубоко втягивается эпи-
ТИП CILIOPHORA. КЛАСС OLIGOHYMENOPHOREA
909
диск независимо от стенки тела; часто видны особи без
сокращения тела, но с втянутым перистомом.
Это консервативный признак, сохраняющийся не-
зависимо от типа стебелька и фиксона, от наличия и
отсутствия раковины. Название Vorticellina дано Ян-
ковским (1980) как новое, но позже было найдено в од-
ной из старинных книг (Fromentel, 1874, р. 135), где
все цилиаты делились на группы Paramaecina и Vorti-
cellina. По этой системе класс Infusoires делится на
2 отряда: Microzoa vorticosa (собственно инфузории) и
Microzoa nutantia (флагеллаты и цилиофлагеллаты);
инфузории включают 2 подотряда — Vorticellidae
(сем. Vorticellina, Vaginicolina, Stentorina с сократи-
мым вибратильным диском) и Paramecidae (все осталь-
ные кроме Spirochona, с сомнением отнесенной к вор-
тицеллидам). Как обычно у ранних авторов, это смесь
разных неродственных родов; в составе подотряда
Vorticellidae не только перитрихи, но также тинтинни-
ды, фолликулины и стенторы. Я признаю приоритет
Фроментеля и по новым правилам называю предло-
женный им подотряд Vorticellina; название второго
подотряда сохранено для пеникулид.
Сем. Epistylididae Kahl, 1933
Одиночные и колониальные формы; прикрепление
несократимым стебельком без мионемы, простым или
ветвящимся. Обычные формы во всех типах пресных
вод и в море, много специфических симбионтов. По-
скольку филогения родов неизвестна, в пределах подо-
тряда условно выделяются 2 семейства для бессте-
бельчатых и стебельчатых форм, несомненно сборных,
и в будущем статус каждого рода и число семейств
должны решаться молекулярными методами.
Род Rhabdostyla Kent,
1881
Род предложен для нескольких видов без указания
типа; по Аэшт (Aescht, 2001), тип рода до сих пор не
фиксирован, но это неверно. По Лому (Lom, 1977;
р. 43), тип рода Epistylis spheroides Fromentel, 1874 —
очень неудачный выбор, поскольку этот вид очень
плохо описан и зарисован Фроментелем (Fromentel,
1874), как и все цилиаты в его книге, и не числится в
фаунистических списках, не считается валидным. Вы-
бор такого вида фактически означает закрытие рода.
На рисунке Фроментеля показана широкая сфериче-
ская клетка с С-образным ядром, вздутым апексом (так
выглядят гибнущие зооиды перитрих с разбухшей от
гипотонии клеткой) на узком стебельке (около 2/3 дли-
ны тела) с расширенным толстым базодиском. Это
«очень редкий» пресноводный вид, скорее всего,
осмотрена лишь одна особь. В принципе род должен
включать одиночные (неколониальные) формы с проч-
ным стебельком разной длины. Следует помнить, что у
осевших мигрантов ряда родов мионема образуется не
сразу, иногда только непосредственно перед делением
особи, и такой вид может быть принят за Rhabdostyla',
так, как R. spheroides, могут выглядеть примонты ко-
лоний Epistylis (например R.ovum, ныне Epistylis
ovum). Хотя описано много видов рода, принятого бла-
годаря авторитету монографии Кента (Kent, 1881), род
все же сомнительный — пока не найден и не изучен
неопределимый вид R. spheroides, нельзя использовать
это родовое название. В сводках Фойсснера по бентосу
и планктону пресных вод нет видов рабдостилы. Воз-
можно, такие формы существуют, но мы классифици-
руем животных, а не диагнозы, нужное точное описа-
ние типового вида или его смена с разрешения ICZN.
Пока невозможна даже смена типа — нет видов рабдо-
стил с точно доказанной неколониальностью.
Вторично тип рода указал Гуль (Guhl, 1979) —
Rhabdostyla fromenteli Kent, 1880 (для Scyphidia rugosa
Fromentel nec Dujardin, 1841); показан зооид с широ-
ким коротким «стебельком» с продольной исчерчен-
ностью, не отграниченным от тела — явно постесома с
фибриллами у какого-то основателя колонии (примон-
та). Не может быть и речи об определении обоих типо-
вых видов по безграмотным рисункам; невозможно
сравнение новых видов с типом рода. Род Rhabdostyla
ликвидируется; если действительно существует оди-
ночный вид с прочным стебельком, его следует очень
тщательно изучить и объявить типом нового рода.
Неопределенность ситуации позволяет приписы-
вать к этому роду много свободных и симбионтных ви-
дов разного типа, о родстве которых не приходится го-
ворить; приведу здесь лишь несколько примеров —
R. libera Lom, 1977 (гомоним; прудовой вид с очень ко-
ротким стебельком и оперкулярным перистомом —
Propyxidium entenicum Jank., 2004), R. scyphoides Song,
1986 (бочонковидные особи на массивном вздутом ко-
ротком стебельке с морских креветок Penaeus orienta-
lis), R. dubia Foissner, 1979 (вид с остракод), R. vernalis
Stokes, 1887 (на циклопах, гарпактицидах и остракодах
в США), R. elongata Green, 1965 (на паразитических
копеподах Lernaea barnimiana с рыб Африки), R. cypri-
ni Sramek-Husek, 1953 (на покровах карпов), R. cylindrica
Stiller, 1935, R. hungarica S., 1935 (на рачке Leptodora
kindti), R. invaginata Stokes, 1888 (на остракоде Cypris
sp.), R. bosminae Levander, 1906 (на планктонных кла-
доцерах Bosmina), R. conipes Green, 1974 (на Daphnia и
Scapholeberis), R. libera Kahl, 1933 (солоноватоводный
вид из перифитона), R. pyriformis (Perty, 1852) (на даф-
ниях и других рачках и на диатомеях планктона),
R ovum Kent, 1882 (на дафниях, лептодоре и Simocephalus',
может образовать мелкие колонии, поэтому ныне в со-
ставе рода Epistylis)', известно еще много видов, отно-
симых к фиктивному роду Rhabdostyla. На водных
олигохетах находят Rh. inclinans (D’Udekem, 1864); на
них немало одиночных рабдостил нескольких видов,
но продукты их деления остаются вместе на общей
ножке или диске или коротком стебельке, виды коло-
ниальные. Rhabdostyla — такой же фиктивный род, как
и Scyphidia, оба без достоверного типового вида.
Часто дается лишь один рисунок одной особи пе-
ритрих, без учета всей популяции и стадий роста коло-
нии, обычны неграмотные рисунки низкого качества
без иммерсионного увеличения, литература засорена
множеством подобных публикаций, в частности по
рабдостилам. Невозможно определить Rhabdostyla pel-
lucida Gajewskaja, 1933 (на глубоководных гаммари-
дах Байкала), R. glomeriformis Boitsova, 1977 (на ко-
люшке), R. kahli Banina, 1977 (на циклопах), R. falcata
910
ALVEOLATA
Рис. 378, a. Sessilida.
Heteropolaria balanorum (A—Г, ориг.); H. Iwoffi (Д, E); H. colisarum (Ж, 3). Строение плоских асимметричных томитов. (По: Foissner, 1983 (ДУ Foissner et al.,
1985 (Ж, 3\, Foissner, Schubert, 1977 (£)).
Fig. 378, a. Sessilida.
Structure of flat asymmetric tomites of Heteropolaria.
Boitsova, 1977 (с хирономид), R. rotunda B., 1977 (на
гаммарусах), R. singularis B., 1977 (на Asellus), R. chi-
ronomi B., 1977 (на личинках комаров) и много видов с
олигохет, полихет, ракообразных всех групп, особенно
циклопов и остракод.
Род Rhabdostylus Dons, 1918
По правилам грамматики следует писать не Rhab-
dostyla, a Rhabdostylus, и поэтому было предложено
это название для замены предыдущего; это.пот. п., но
не gen. п. В животном мире есть валидные роды Meli-
certa и Melicertum, Urostyla и Urostylus и т. д.; менять
названия нельзя, это исключено, но сложность в том,
что как Rhabdostylus variabilis Dons, 1918 был описан
новый вид с морских червей (неопределенных трало-
вых полихет — теребеллид), который действительно
относится к особому роду с базальным диском и с воз-
можностью образования колонии из 2—4 зооидов на
диске, без его удлинения и ветвления (мои наблюде-
ния по симбионтам теребеллид на Командорах). Мож-
но ли считать этот вид типом рода Rhabdostylusl Этот
вид, первоначально отмеченный в Норвегии, обычен
на Мурмане и в морях Дальнего Востока, это одиноч-
ные формы со складчатым телом, почковидным ядром,
прикрепленные к эпителию щупалец и к телу хозяев не
длинным стебельком, а короткой ножкой. Такие фор-
мы позже описали как Paravorticella Kahl, 1933. Нуж-
но обсудить возможность валидации рода Rhabdostylus
вместо Paravorticella, но не вместо Rhabdostyla.
Род Spongostena Jankowski, 2004
Типовой вид 5. peteri с покровов корковых,
реже ветвящихся эндемичных губок Байкала Baicalos-
pongia bacillifera и Lubomirskia baicalensis', поверх-
ность губок неровная, с небольшими ямками, в кото-
рых поселяются симбионты. Одиночные формы, не об-
разующие ветвящихся колоний. Зооид типично
вортицеллоидный — тело колокольчатое, с четко вы-
раженным валиком; перистомальный диск не обособ-
лен от валика, в отличие от оперкулярий; цилиатура
ТИП CILIOPHORA. КЛАСС OLIGOHYMENOPHOREA
911
Рис. 378, б. Sessilida.
Pseudovorticella sphagni (Л); Pseudohaplocaulus anabaenae (Д); Pseudohaplocaulus infravacuolatus (B—3); Vorticella chlorellata (И, K). Pl—P3 — пеникулюсы.
(По: Foissner, Brozek, 1996 (A, В—3); Foissner et al., 1999 (Б)).
Fig. 378, 6. Sessilida.
Pl—P3 — peniculi.
диска стандартная; ядро С-образное. Прикрепление
стебельком особого типа — короче тела, полым внут-
ри, без мионемы и осевых фибрилл; стебелек обычно
неправильной формы, изогнутый, искривленный, ред-
ко почти прямой, несократимый при раздражении и
фиксации особи. Размеры тела 64—76 X 80—105 мкм.
Отмечена инфекция непатогенных сукторий (Endosp-
haera), вероятно, нового вида, поскольку томонты со-
держат по 2 томита. Статья по этому виду (Янковский,
2004) содержит обзор цилиат на пресноводных и мор-
ских губках, обсуждение рода Rhabdostyla и проблемы
с двойным обозначением его типового вида. Род Spon-
gostena без мионемы формально принадлежит к эпи-
стилидам, но зооид похож на вортицелл, не исключена
вторичная утрата мионемы.
Род Campanella Goldfuss, 1820
Типовой вид рода не был до сих пор фиксиро-
ван; это название считалось синонимом родов Carche-
sium, Opercularia, Epistylis и не использовалось ранни-
ми авторами; у Каля (Kahl, 1935) это подрод в составе
Epistylis, что невозможно, поскольку род Epistylis Eh-
renberg, 1830 предложен позже; в современной литера-
туре это валидный род. Название рода всегда ассоции-
руется только с видом С. umbellaria (= Hydra umbella-
ria Linne, 1758), и этот вид объявляется типовым. Вид
считался валидным, обычно в составе рода Epistylis, в
одной публикации — Opercularia umbellaria. Синони-
мия с Е. flavicans Ehrenberg, 1831, принятая у всех ран-
них авторов, может быть ошибочная, поскольку С. um-
bellaria не имеет желтой окраски.
Колонии крупные, дихотомически ветвятся, с
40—50 зооидами; зооиды очень крупные, вортицел-
лидного типа, длиной до 250 мкм, что резко контра-
стирует с тонким стебельком колонии; вид част в пре-
сноводном перифитоне, легко культивируется в про-
точном аквариуме. Целый ряд признаков отличает вид
от типичных эпистилисов, поэтому род бесспорно ва-
лидный. Поверхность тела неровная, бугорчатая, по-
крыта аргентофильной сеткой, которой нет у видов
Epistylis, имеющих кольцевые аргиронемы; стебелек
не прочный, с длинным базостилом (стволом до ветв-
912
ALVEOLATA
Рис. 379, a. Sessilida.
Carchesium limneticum (А, Б); Rugaecaulis (ранее Vorticella) conochili (В, Г); Delamurea loricata (Д)', Manloscyphidia fanthami (£); «Scyphidia sp.» (RiboscyphP
dia salmonis) (Ж); Apiosoma sp. (3, ориг.); Pseudocarchesium claudicans (И, К)-, мионема в стебельке Carchesium steini [JT). (По: Faure-Fremiet, 1948 (А, Б), 1949
(В, Г); Найденова, 1978 (Д); Basson et al., 1999 (£); Pickering et al., 1985 (Ж); Foissner, 1989 (И, K)\ Korfsmeier, 1949 (77)).
Fig. 379, a. Sessilida.
пения), с пустотой внутри и фибриллярной стенкой,
что также несвойственно роду Epistylis', ротовая цили-
атура не в одном обороте, а в 3—-4 (по некоторым авто-
рам даже 5 оборотов спирали) перед вхождением в
длинный узкий буккон, где также закручена значи-
тельно больше, чем обычно у перитрих. При виде зоо-
ида сбоку на краю валика видны 4 пары ресничек, а не
одна, как обычно. Ядро длинное, извитое. Вид удобен
для изучения перитрих, зооиды массивные, легко отде-
ляются от стебелька, хорошо видна компактная группа
ресничек на скопуле. Микроспоридии Glugea сатра-
nellae в цитоплазме были приняты ранее за трихоци-
сты. Формально к этому роду принадлежат Epistylis
tincta Stokes, 1887; Opisthostyla tritora Nenninger, 1948;
E. liebmanni N., 1948 (C. tincta, C. tritora, C. liebmanni
comb, nn.), вероятные синонимы типового вида, но
С. purneri (= Epistylis purneri N., 1948) с ручейников
несомненно неродственна и имеет массивный проч-
ный стебелек без внутренней полости.
Род Epistylis Ehrenberg, 1830
Типовой вид Е. plicatilis Ehr., 1831 по обозна-
чению Фроментеля (Fromentel, 1874); Гуль (Guhl,
1979) позже указал тип рода Е. digitalis, но менять ти-
повой вид нельзя. Синонимы, по Аэшт, Allomeron, Di-
gitalina, Indosphaera, Mespilina, Myrtilina, Nidula и Ort-
hochona. Часть этих названий предложена ранними ав-
торами и никогда не использовалась, Orthochona
ТИП CILIOPHORA. КЛАСС OLIGOHYMENOPHOREA
913
Рис. 379, б. Sessilida.
Allomeron (ранее Epistylis) helicostylum (A—Гу, Endogyrinella (ранее Orbopercularia) ominosa 1ДУ, E. gnathophila (E)\ Epistylis lacustris subsp. magna (Ж); Epi-
carchesium (ранее Carchesium)pectinatum (3, Ц); Foissnerella physonica (K, JT). (По: Vavra, 1962 (A—Г); Foissner, 1996a (Ж); Foissner et al., 1999 (3, И); Matthes,
Guhl, 1973 (Д, E); К, Л — ориг.).
Fig. 379, 6. Sessilida.
действительно синоним, а роды Allomeron и Nidula са-
мостоятельные.
Типовой вид очень част в прудах, канавах вдоль до-
рог, обрастает раковины подвижных моллюсков (мел-
ких планорбид), образует на них крупные скопления,
видимые без микроскопа в виде белого войлока. Ино-
гда встречается зеленый вид такого же типа (с зоохло-
реллами), неотличимый от бесцветной расы. Тело
очень узкое и длинное, стебельки и их ветви очень вы-
сокие, зооиды делятся многократно и расположены
вплотную единой полосой на вершине древовидного
стебелька. У других обычных пресноводных эписти-
лисов нет такого четкого «зонтичного» положения
зооидов, обычно деревца неправильные, заселены
нижние, боковые и верхние ветви. Зооиды эпистили-
сов колокольчатые, неширокие, ядро С-образное, эпи-
диск очень широкий, с четким боковым валиком, ино-
гда двойным. Стебельки равномерной толщины или с
локальными вздутиями, прочные, часто с видимым
фибриллярным строением. Род одинаково част в пре-
сной воде и в море.
В пресных водах обычны Е. chrysemidis Bishop et
Jahn, 1941 (первоначально описаны с панциря черепах
Chrysemis') с двойным валиком перистома; этот вид
можно спутать с оперкуляриями. Другие частые пери-
фитонные виды — Е. coronata Nusch, 1970; Е. entzii
Stiller, 1935; Е. hentscheli Kahl, 1935; E. nympharum En-
gelmann, 1862; E. a/pestra Foissner, 1978; много других
свободных и симбионтных видов в пресной воде и в
море. В пресноводном планктоне вид, обычно опреде-
ляемый как Е. rotans Svec, 1897 (ныне Е. procumbens
Zacharias, 1897); мигранты образуют колонии, не при-
крепляясь к субстрату, и крупные колонии вида (до
1 мм) активно плавают с помощью ротовой цилиатуры
зооидов, достигающих длины 140 мкм. Стебелек вет-
вится почти от основания в одной плоскости, зооиды с
узким псевдостилом, тело обычно отклонено вбок или
назад. Близкий планктонный вид — E.fluitans Fa-
ure-Fremiet, 1’924; основатель колонии не оседает на
детрите, образует блюдцевидный фиксон на пленке
воды, и, если колония погружается и плавает, она со-
храняет пузырек воздуха в чаше; правильно дихотоми-
ческая колония может достигать длины 3 мм.
Родовые синонимы — Digitalina Bory de St. Vin-
cent, 1824; Myrtilina Bory de St. Vincent, 1824 (типовые
виды не фиксированы). У Каля (Kalil, 1935) род делит-
58 Зак. № 4163
914
ALVEOLATA
Рис. 380, a. Sessilida.
Operculariella parasitica (A—B); Bezedniella prima (Г); Ballodora marceli (Д); B. dimorpha (E—Tf); Ambiphrya ameiuri (K, JT). (По: Stammer, 1948 (A—B);
Stloukal, Matis, 1994 (Г); Matthes, 1950 (Д—И); Thompson et al., 1947 (K, JT)).
Fig. 380, a. Sessilida.
ся на 4 подрода Epistylis, Campanella, Systylis и Orthoc-
hona; в данном обзоре Systylis и Campanella самостоя-
тельные роды, Orthochona не признается валидным по-
дродом или родом.
Трудно найти водных животных без Epistylis, засе-
лены практически все группы; на покровах могут быть
специфические и случайные симбионты. Ниже дано
лишь несколько примеров симбионтных видов Rhab-
dostyla и Epistylis. На микроводорослях — R. volvocis
Nenninger, 1948. На олигохетах — R. tubificis'Sl., 1948;
Е. jaroschenkowi Schubemetzky, 1978. На пиявках —
Е. glossiphoniae Gong, 1986; Е. thienemanni (N., 1948).
На коловратках — Е. rotatorium Kahl, 1935. На полихе-
тах — Е. poleneci Matthes, 1950; R. commensalis Mobi-
us, 1888; R. variabilis (Dons, 1917); R. arenicolae Fab-
re-Domergue, 1885. На пресноводных двустворчатых
моллюсках (наядах) — Е. anodontae Uyemura, 1938;
Е. urceolata Stiller, 1941; E. borysthenicus Boschko,
1987; E. unioi Gong, 1986; E. wenrichi Uyemura, 1938;
E. balatonica Stiller, 1961; E. longicorpora Uyemura,
1938; E. entzii Stiller, 1935. На циклопах большое число
рабдостил и эпистилисов; примеры — Е. umbellina Fa-
ure-Fremiet, 1905; Е. anastatica (Linne, 1767); Е. irregu-
laris Stiller, 1940; E. digitalis (Linne, 1758); E. cyclopi
Banina, 1977; R.cyclopis Kahl, 1935; R. kahli Banina,
1977; R. ovoides Sramek-Husek, 1946; E. lacustris f. ru-
gosa Imhoff, 1884. На диаптомусах, обычно необраста-
ющих — E. diaptomi Faure-Fremiet, 1905; E. longifda
Nenninger, 1948. На кладоцерах много мелких колоний
и одиночных зооидов ряда родов, включая Е. daphniae
Faure-Fremiet, 1905; Е. daphniae var. infundibula Nen-
ninger, 1948; E. ovum Kent, 1882 (часто в составе Rhab-
dostyla)', R. conipes Kalil, 1935. На бентосных копепо-
дах — E. nitocrae Precht, 1935; E. harpacticicola Kahl,
1933; вид Epistylis sp. на копеподах морской пелагиали
Acartia, Centropages и других пока не определен. На
копеподах — паразитах рыб — Е. solidus Solomatova,
1977; Е. epibarnimiana Van As et Viljoen, 1984; E. mag-
na V. A. et V., 1984; E. cyprinaceae V. A. et V., 1984. Ha
изоподах — E. stammeri Nenninger, 1948; E. elegans
Stiller, 1953; E. aselli 1941 -,E.jaerae Precht, 1935;
R. singularis Boitsova, 1977. На амфиподах, в основном
гаммаридах, — Е. gammari Precht, 1935; Е. oviformis
Gaj., 1933; E. thienemanni Sommer, 1951 (= E. somme-
ТИП CILIOPHORA. КЛАСС OLIGOHYMENOPHOREA
915
Рис. 380, б. Sessilida.
Zoothamnium pelagicum (А, Б); Z. penaei (B—Ж); Z. plumula (3—К). (По: Laval, 1968 (А, S); Song, 1992 (B—Ж); Song, Al-Rasheid, Hu, 2002 (3—K)).
Fig. 380, 5. Sessilida.
гае); E. vasta S., 1951; E. solitarius Boitsova, 1977; E. ro-
tunda B., 1977; E. obscurus B., 1977; R. pellucida Gaj.,
1933; E. amphithoe Naidenova, 1985 (вид до сих пор не
описан). На мизидах — Е. mysidae Schubemetski, 1978.
На крабах — Е. carcini Precht, 1935; Е. sevastopoli Na-
denova, 1985; E. telphusae Awerinzew, 1941. На кревет-
ках — E. stevcici Scheubel et Guhl, 1973; E. caridinae
Gong, 1986; E. macrostyla Gong, 1986. На речных ра-
ках— E. ovalis Biegel, 1954; E. niagarae Kellicott, 1883;
E. cambari K., 1883; E. crassicollis Stein, 1854; E. astaci
Nenninger, 1948. На водных клещах — E. obliqua Som-
mer, 1951. На личинках поденок — E. roux Boitsova,
1977 (rouxi nom; corn); E. ephemerae B., 1979; R. ephe-
merae Kalil, 1935. На личинках стрекоз — E. dreyeri
Guhl, 1972; E. agrionis Nenninger, 1948. На водных кло-
пах — R. dixae N., 1948. На водных жуках — E. invagi-
nata C. et L., 1859; E. plicatilis var. dytiscarum N., 1948.
На личинках Diptera — E. opercularia Stiller, 1941;
E. ovata N., 1948; E. ovata subsp. obtusa Gong, 1986;
E.fluitans var. incidens N., 1948; E. anophelis N., 1948;
E. anophelini Banina, 1977. На личинках ручейников —
E. brachium Boitsova, 1976; E. formosa N., 1948; E. cinc-
ta Sommer, 1950; E. curvus Boitsova, 1977; R. limnophili
Kahl, 1935 (ныне Epistylis limnophili).
Это лишь несколько примеров, с учетом хозяев в
первоописании видов; позже часть их находили на
других группах хозяев, и многие определения были не-
верными, полные суммарные списки хозяев по литера-
туре нельзя приводить — это дезинформация.
Подрод Mespilina Bory de St. Vincent,
1824
Типовой вид Vorticella umbellata, сейчас изве-
стный под названием Epistylis galea Ehrenberg, 1838.
По некоторым морфологическим признакам этот род
стоит в стороне от основного массива эпистилисов
(Matthes, Scheubel, 1970), и молекулярные данные
(Miao et al., 2004) подтверждают его давнее обособле-
ние от компактной группы других пресноводных форм
Е. plicatilis, Е. hentscheli, Е. urceolata, Е. chrysemydis и
Е. wenrichi. Вид образует крупные дихотомические ко-
лонии с длинным базостилом и почти вертикальными
ветвями; зооиды расположены в линию и соединены
отростками тела ниже кольца кинетосом; такие отрост-
ки отмечены только в одной из работ, я никогда их не
видел в колониях вида в пробах перифитона и в лабо-
916
ALVEOLATA
раторных культурах. В этих группах крайний зооид —
макронт, остальные микронты; это диморфный вид.
Нетипично положение макронуклеуса (вытянут вдоль
тела, извитой) и внешний вид перистома (диагональ-
ный), но это второстепенные признаки; признак под-
рода — слияние зооидов (требует подтверждения) и
диморфизм. Вид часто обитает во временных водо-
емах, образует узорчатые цисты. Другой диморфный
вид эпистилид — Systylis hoffl (сейчас в составе Episty-
lis), неродственный с Mespilina.
Род Orthochona Andre, 1910
Типовой вид О. anilocrae с морских изопод
Anilocraphysodes, паразитов рыб сем. Labridae; заселя-
ет жабры, реже максиллипеды, ноги и инкубаторные
пластинки хозяев. По Калю (Kahl, 1935), это 4-й под-
род в составе Epistylis (Е. anilocrae); по Корлиссу (Cor-
liss, 1979) — синоним рода Epistylis. Сейчас идет раз-
бивка родов, в частности Epistylis, на самостоятельные
роды, поэтому важны все родовые названия. Описание
очень плохое, живой материал не изучен, только in
fixo; зарисован полусокращенный зооид вида, типич-
ного для рода Epistylis, и поэтому обычно указывают
наличие особого типа перистома — широкий апикаль-
ный валик как родовой признак. В действительности
это обычная картина неполного сокращения тела,
когда перистом втянут, но еще не закрылся валик. Вид
может быть валидным, судя по интенсивному ветвле-
нию широкого стебелька, но род неприемлемый и дол-
жен быть исключен из определителей перитрих. Род
ликвидируется, вид принимается до переописания как
Epistylis anilocrae. Отсутствие мионемы должно быть
проверено на фиксированном музейном материале хо-
зяина.
Род Systylis Bresslau, 1919
Типовой вид 5. hoffi из пресноводного перифи-
тона; редкий вид, найден в Германии, Венгрии, США и
Мексике. Ствол и ветви стебелька массивные, длина
колонии до 1 см; дефинитивные зооиды относительно
мелкие, расположены на вершине колонии на плоских
площадках широких ветвей. У типичных эпистилисов
ветви колоний длинные и тонкие. В данном случае нет
принципиального структурного отличия от обычных
эпистилисов, у которых стебельки и ветви часто утол-
щаются. До сих пор не заметили, что такой же вид уже
был описан ранее в США как Opercularia rugosa Keli-
cott, 1885; это название должен носить типовой вид
(Systylis rugosus comb. п.). Вид отнесен к оперкуляриям
по ошибке, не показан сократимый узкий дискофор пе-
ристома, обособленный от стенок ротовой полости.
Хотя род обычно не признается, это диморфный вид, а
такие виды заслуживают ранга подрода; осевший мак-
ронт (примонт) образует массивный базальный ствол
колонии, а на плоских вершинах ветвей располагается
до 40—65 микронтов и 1—2 макронта; группы ветвей
с зооидами расположены симметрично, у колонии нео-
бычный, уникальный облик. Микроконъюганты обра-
зуются при быстром делении микронтов. Вид встреча-
ется, в частности, в натронных и временных водоемах,
легко инцистируется, образуя цисты с узорчатыми
стенками.
Род Allomeron Jankowski, 1967
Типовой вид Epistylis helicostylum Vavra,
1962 — симбионт крупной синезеленой остракоды
Eucypris virens, обычной весной в канавах и прудах;
колонии цилиат прикреплены к основанию ног внутри
панциря; вид часто встречается в пригородах Петер-
бурга. Он легко инцистируется, может быть объектом
изучения цист перитрих; цисты рельефные, сетчатые,
часто окрашены пигментом хозяина. Зооиды обычного
типа для сессилид, вазообразные, широкие; стебелек с
длинным стволом (базостилом); у вершины стебелек
резко расширяется, образует спирально завитую плас-
тинку, на которой расположены короткие стебельки
зооидов. Часто видны 2—3 вплотную прилегающие
широкие светлые диски с группой зооидов на верши-
не. Основатель колонии крупный, но разница размеров
меньше, чем у макронтов и микронтов Systylis. Статус
рода может быть снижен до подрода, но таких абер-
рантных форм, как и Systylis, желательно отделить от
основной массы эпистилисов со стандартным тонким
дихотомически ветвящимся стебельком; это адаптация
к обитанию в замкнутом пространстве внутри панциря
остракод. Поскольку название было предложено в те-
зисах и невалидно, оно предлагается вновь — Allome-
ron Jankowski gen. n. с тем же типовым видом и диа-
гнозом — A. helicostylum comb. п. Есть аналогия с об-
разованием широких складок у Cotensita и базального
диска у оперкулярий на водных жуках.
Род Uvelinus Jankowski,
1985
Типовой вид Epistylis puerneri Nenninger,
1948 — симбионт личинок ручейников; крупные коло-
нии с массивным стебельком покрывают тело хозяев в
основном цефалоторакс и ноги. Виды с таким стебель-
ком есть и среди эпистилисов, но для Е. puerneri харак-
терна полимеризация витков наружной спирали рото-
вых кинет, как у неродственного рода Campanella. При
виде сбоку над валиком эпидиска видны 2.5—3 пары
ресничек вместо одной. Род принят в современных
сводках, кроме Guide (Small, Lynn, 1985), где вид
включен в состав Campanella. Кампанелла — очень
широкие клетки типа Vorticella, а вид с ручейников —
стандартная эпистилида с узким телом, нешироким ва-
ликом; массивный складчатый стебелек с короткими
широкими ветвями резко отличается от длинного пус-
тотелого стебелька кампанеллы; очень важно и то, что
ротовые кинеты несколько раз закручены внутри пери-
стома кампанеллы, а у К puerneri этого нет, как у всех
эпистилид, спирализация только наружная. В состав
рода можно включить также U. ovatus (= Epistylis puer-
neri f. ovata Nenninger, 1948) с личинок эфемерид,
веснянок и ручейников и U. biseriatus (= Е. biseriata
Sommer, 1950) с Molanna angustata и Anabolia nervosa.
Хозяева типового вида — личинки ручейников Ыт-
ТИП CILIOPHORA. КЛАСС OLIGOHYMENOPHOREA
917
nophilus bipunctatus, Neuronia phalaenoides, Anabolia
nervosa. Нельзя исключить, что это род оперкуляриид
с массивным дискофором.
Род Cyclostipes Jankowski,
1976
Типовой вид Epistylis apiosomae Scheubel,
1973. Род предложен для вида с мелкими колониями,
прикрепленными базальным кольцом к зооидам перит-
рих Apiosoma на коже рыб. Тип рода — это одиночные
особи (редко 2 в колонии) на коротком кольцевидном
стебельке, облигатные гиперфоронты, оседают только
на апиосомах с покровов бычков-подкаменщиков Cot-
tas gobio, типовая раса на A. cotti с жабер, плавников и
хвоста хозяев; ни одна особь не поселяется на эпите-
лии рыб. Наличие прочного фиксаторного кольца —
общее у Heteropolaria Iwoffi и Cyclostipes apiosomae.
Фактически это название имеет приоритет перед сле-
дующим, но оно объявлено невалидным как предло-
женное в тезисах (Aescht, 2001) и здесь не заменяется
новым. Типовой вид можно числить в составе Hetero-
polaria (Н. apiosomae Jank. comb. n.). С этим видом не
все ясно, нет подробного переописания, нет уверенно-
сти, что доминирует стадия одного зооида, поэтому
сейчас не следует отделять его в самостоятельный род.
Род Heteropolaria Foissner et Schubert,
1977
Типовой вид Epistylis horizontalis Chatton, 1930
(в каталоге Аэшт датируется 1936 г.). Авторы рода де-
тально изучили симбионтов пресноводных рыб, но как
тип рода очень неудачно выбрали морской вид, специ-
фичный для усоножек Balanus (Cirripedia) — в США и
Европе разные виды балянусов несут разные роды пе-
ритрих, и неясно, имеет ли типовой вид мионему. На
части рисунков Е. horizontalis показаны тонкие фиб-
риллы или осевая мионема, идущая по всей колонии.
Такие формы я видел на балянусах Крыма, а на Мур-
мане в Semibalanus balanoides обитают только колонии
с прочным стебельком, без фибрилл и мионемы. Мне
неясно, что видел Шаттон на Balanus eburneus и В. am-
phitrite. Колонии перитрих можно найти на жаберных
пластинках и основании ног морских желудей. Зооиды
и колонии видов сходные, если не считать мионемы,
ничем другим не отличаются от обычных эпистилисов,
но мигранты особого типа — плоские, дисковидные,
стебелек прикреплен не в центре тела, а у одного из
краев. Перед линькой хозяина происходит массовый
переход зооидов в крупных тотальных мигрантов, и
тогда видно, что все они однотипны с мигрантами, об-
разуемыми при делении в интерфазной колонии.
Беломорский вид Epistylis balanorum Mereschkows-
ki, 1878 описан с Соловецких о-вов на жабрах лито-
ральных балянусов, не имеет мионемы; на биостан-
циях в Чупе и в Зеленцах я не нашел ни одной особи с
мионемой. Характерно узкое тело, высокий двойной
валик; узкий прочный стебелек без видимых фибрилл.
Вид с севера Германии назван так: Myoschiston bala-
norum (= lEpistylis balanorum Mereschkowsky, 1877)
(см. Precht, 1935), хозяинBalanus improvisus, каки мой
материал из Черного моря с тонкой мионемой. Это не-
тоним (ошибка определения), а не новый вид, поздней-
шее обозначение Myoschiston balanorum Precht, 1935
неверно; я обозначаю вид с мионемой как Myoschiston
ponticus Jank. sp. n. (диагноз и рисунки см.: Precht,
1935). На востоке США в В. balanoides нашли Е. hori-
zontalis, в В. eburneus — Е. nigrellii Arvy, Batisse et La-
combe, 1969, редкий вид с небольшими колониями.
Оставим пока нерешенным вопрос о типовом виде
Е. horizontalis', первоисточник-в библиотеках отсутст-
вует.
В состав рода перенесен обычный эпибионт пре-
сноводных рыб Epistylis Iwoffi Faure-Fremiet, 1943
(Н. Iwoffi'), описан новый вид Н. colisarum. Отныне все
известные виды Epistylidae должны быть проверены
по типу мигранта, хотя практически никогда форму
мигранта не рисовали. В случае Е. Iwoffi ситуация
усложнена тем, что это аберрантный вид, способен
прикрепляться кольцом к апиосомам и без кольца к
коже рыб; если это разные виды, первые должны быть
обособлены в особый род с новым названием вместо
непригодного названия Cyclostipes.
Вид Epistylis Iwoffi Faure-Fremiet, 1943 описан с ко-
люшек Gasterosteus aculeatus, встречается вместе с
Е. gasterostei, прикрепляющимся коротким стебель-
ком к покровам рыб или к жабрам (ныне в составе Api-
osoma). Первый вид никогда не прикрепляется к коже
рыб, только к Apiosoma piscicola, как и суктория Eras-
tophrya chattoni, с помощью кольцевидной секреции
вместо обычного стебелька. В колонии обычно 4—
6 зооидов, редко 8; тело тонкое, сильно расширено к
вершине. Позже наблюдалось прикрепление нормаль-
ным базодиском к покровам хозяина — вид диморф-
ный, или есть 2 сходных вида рода. Основной родовой
признак — образование несимметричных плоских зоо-
идов с гетерополярным положением перистома и ско-
пулы, образование фиксаторного кольца факультатив-
ное. Возможна фиксация на стебельках других особей
эпистилисов и даже на триходинах.
Вид Heteropolaria Iwoffi неспецифичен, заселяет
большое число рыб, в отличие от вида Н. colisarum
Foissner et Schuberg, 1977, специфичного для рыб Се-
верной Америки (типовой хозяин Colisa fasciata, сем.
Belontiidae), особенно для центрархид и белонтиид, но
не для сальмонид; встречается на разводимых рыбах
Ictalurus punctatus, Lepomis gibbosus и др. Это вид с
очень узким и длинным телом, толстым стебельком,
вероятно с максимальным для перитрих числом коль-
цевых аргентофильных ребер; число витков ротовой
спирали увеличено, мионема (сфинктер) перистома с
боковой ветвью только у этого рода (Foissner, Schu-
berg, 1977).
Для свободноживущего вида Н. lodensis Feman-
dez-Leborans et Moro, 1990 не показан тип мигранта.
Epistylis transvaalensis Viljoen et Van As, 1983 (с цих-
лид Pseudocrenilabrus philander и других рыб в ЮАР)
слишком кратко описан, способ прикрепления к субст-
рату и тип томита не упомянуты, ситуация с видом не-
ясная. Массовое поселение на рыбах США Epistylis ni-
agarae Kellicott, 1883 не документировано рисунками.
Находка Epistylis sp. в Южной Америке на лорикарии-
дах Hypostomus watwata иллюстрирована фотография-
918
ALVEOLATA
ми сжавшихся зооидов. Вид Epistylis horizontalis Tai Li
Sun, 1931 — гомоним, тоже симбионт рыб, найден в
Китае на «paradise fish» (Carassius auratusT); трофон-
ты, как у Н. Iwoffi, но стебельки длиннее; для замены
гомонима предлагается название Heteropolaria tais
Jank. nom. n. Плохо описаны виды с рыб Rhabdostyla
cyprini Sramek-Husek, 1953; Rh. glomeriformis Boitsova,
1977 (с колюшки); Epistylis kronverci Banina, 1962 (c
Phoxinus).
Род Opisthostyla Stokes, 1886
Типовой вид, по Аэшт, не фиксирован, но это
ошибка. Род предложен для 2 видов О. annulata S.,
1886 и О. pusilia S., 1886 (= Rhabdostyla pusilia in Sto-
kes, 1886); как тип подрода Epistylis (Opisthostyla) был
обозначен О. annulata («typicki druh» на чешском язы-
ке значит типовой вид — Sramek-Husek, 1953). Это
одиночные зооиды из прудового перифитона с узким
треугольным исчерченным телом (в поперечных коль-
цах) на тонком длинном стебельке равномерной тол-
щины, длиною с тело или чуть больше, на рисунках
прямом у первого вида и загнутым на конце у второго.
По диагнозу, стебелек гибкий, пружинистый, участву-
ет в сокращении зооида; но можно предположить, что
это плохо зарисованный Haplocaulus с ограниченной
сократимостью стебелька. Прочный стебелек эписти-
лид всегда неподвижен. По Бючли (Butschli, 1889), это
синоним рода Rhabdostyla, но это не очевидно. Род со-
мнительный и невалидный; родовое название ранее из-
редка использовалось для других видов, но в совре-
менной литературе почти не упоминается. Вид О. trito-
ra Nenninger, 1948 — это типичная Campanella
umbellaria, зарисована ранняя стадия роста основателя
колонии; О. thienemanni N., 1948 — начало роста не-
большой колонии симбионтных эпистилид с пиявок
Helobdella, Protoclepsis и Herpobdella. Rhabdostyla (по-
дрод Opisthostyla) boitzovae Banina, 1977 — вид с цик-
лопов, R. (О.) chironomi Boitsova, 1977 — вид с личи-
нок комаров, R. (O.)fusca Banina et Poljakova, 1977 —
перифитонный вид с массивным стеблем, явно при-
монт колониального вида. Странная трактовка в Traite
(Lom, Puytorac, 1994) — здесь род валидный, с наивно-
стью воспроизводится его первоначальный диагноз, и
род считается возможным потомком мелких видов
Vorticella «с инволюцией педонкулярного миоида» (с
потерей мионемы); это фантазии авторов. Род Opist-
hostyla нельзя принять как род или подрод.
Род Digitalina Bory, 1824
Типовой вид не фиксирован; по Бючли
(BUtschli, 1889), это синоним рода Epistylis.
Род Foissnerella Jankowski, 1986
Типовой в и д F. physonica, симбионт дальнево-
сточных морских изопод; небольшие колонии вида с
2—8 зооидами обитают на жабрах и плеоподах сферо-
матид Gnorimosphaeroma noblei в лагуне Буссе на юж-
ном Сахалине и у биостанции Восток (г. Находка), вы-
носят краткое опреснение в эстуариях рек. Зооиды
эпистилидного типа, с четким валиком перистома, со
стандартным кольцом ротовых кинет; ядро С-образ-
ное. Родовой признак в отличие от Epistylis — уни-
кальный тип стебелька. Примонт после оседания обра-
зует базодиск, базостил, затем гигантское локальное
вздутие стебелька — физон, сужающийся к вершине.
После его завершения примонт делится, и один или
оба дочерних зооида на коротких или длинных сте-
бельках могут образовать свои более мелкие физоны.
Мионемы нет; все отделы стебелька и физон с про-
дольными фибриллами, в физоне они расходятся в
стороны. Широкие и аморфные стебельки нередки у
перитрих, но здесь это правильная новая органелла
опорной функции. На изоподах возникло много абер-
рантных родов перитрих (Delamurea, Craspedomyosc-
histon, Entziella, Rovinjella, Foissnerella, Usconophrys)',
2 новых рода будут описаны мною с северных и черно-
морских лимнорий — оперкуляриида типа Entziella, но
с домиками зооидов, и котурнида с горизонтальным
положением узкой раковины.
Новый род (в подготовке)
Типовой вид Epistylis loricata Schodel, 1999 с
мелких пресноводных изопод Jaera istri (описание
вида см. Schodel, 1999). Хозяин — иммигрант (неозо-
он) из Дуная в системе р. Майн в ФРГ; на ногах найде-
ны колонии с 1—4 мелкими зооидами (40—50 X
21—27 мкм) с длинным ядром, не имеющие форму
зооидов раковинных котурний; перистом эпистилид-
ный. Прикрепление к очень короткому широкому сте-
бельку (ножке), при делении дочерние особи не дают
боковых ветвей; эта ножка расширяется в виде широко
открытой раковины, вмещающей лишь нижние части
зооидов, их нижнюю треть или половину длины тела.
Такого вида нет у Asellus aquaticus в тех же местах сбо-
ра и по литературе у Jaera marina. По аналогии с Nidu-
la и Allomeron, родовой статус которых в ФРГ отрица-
ют, для этого вида не был выделен новый род в перво-
описании. Симбионты изопод типа Epistylis loricata
могли быть предшественниками дизойных лорикат
типа Cothurnia.
Род Siphonocalyx Jankowski, 1976
Типовой вид 5. urnula Biegel, 1954 (= Epistylis
bimarginata var. urnula Nenninger, 1948). Это название
предложено в тезисах и поэтому не признается валид-
ным (Aescht, 2001); здесь пока не заменяется новым,
хотелось бы найти и изучить вид заново. Типовой хо-
зяин вида Е. bimarginata — пиявки; находки «var. ur-
nula» — на Asellus aquaticus, Gammarus roeseli и на ли-
чинках ручейников могут относиться к разным видам.
Зооид типовой расы стандартный, с двойным валиком,
но без спирализации ротовой цилиатуры; стебелек вет-
вится; особенность рода — полый стебелек без осевого
пучка фибрилл. Пока признак «строение стебелька» в
системе перитрих не учитывается; род Campanella от-
делен по типу цилиатуры, а не по стебельку, также пу-
ТИП CILIOPHORA. КЛАСС OLIGOHYMENOPHOREA
919
стому. Если описание вида подтвердится, можно обо-
значить типового хозяина и выделить подрод в составе
Epistylis.
Сем. Apiosomatidae Banina, 1977
Предложено как подсемейство эпистилид; может
быть принято для одиночных (не колониальных) видов
перитрих с эпистилидным перистомом, в норме без
стебелька (очень короткого у нескольких аберрантных
видов).
Род Glossatella BQtschli, 1889
Типовой вид Spirochona tintinnabulum Kent,
1881. Род был долгое время всеми принят для симби-
онтов тритонов и рыб (включая определитель Каля —
Kahl, 1935); лишь в недавнее время восстановлен род
Apiosoma Blanchard, 1885 с кожи рыб, и большое число
видов Glossatella перешло в состав апиосом. Вид
G. tintinnabulum обитает только на жабрах и коже во-
дной молоди тритонов с наружными ветвящимися
жабрами, открыт в Англии, найден в США на локаль-
ных тритонах; у взрослых тритонов сохраняется в ро-
товой полости. Тщательное изучение не выявило ника-
ких признаков, по которым можно сохранить данный
род хотя бы как подрод апиосом. Вид очень мелкий, с
вазообразным телом, узкой постесомой и с непропор-
ционально крупной мембраной, но в остальном типич-
ного для апиосом строения. Мигранты аксиальные, с
пояском длинных ресничек, вероятно с эпистомаль-
ным пучком ресничек. «Подвид» A. tintinnabulum var.
micromembranata Stiller, 1953 указан для тритонов и
для покровов головастиков Rana esculenta, «подвид»
var. astriatum Nenninger, 1948 — для головастиков.
Указания этого вида для олигохет Байкала (в частно-
сти Gajewskaja, 1933) ложные, на олигохетах обитают
мелкие виды нескольких родов других сессилид, зоо-
иды часто одиночные или в небольших низких колони-
ях на дисках или незаметных ножках (коротких сте-
бельках — стилоидах).
Род Cordylosoma Roth, 1909
Типовой вид С. glabrum с кожи рыб (= Apioso-
ma glabrum in Roth, 1909) найден в массе на плавниках
золотых рыбок, вероятно Carassius auratus в комнат-
ном аквариуме в Швейцарии. При первоописании вид
был упомянут одновременно в родах Cordylosoma и
Apiosoma, поэтому последующий перенос и новая ком-
бинация ошибочные — A. glabra (Roth, 1909) Lom,
1966. Автор рода знал описание Glossatella, но считал,
что у Glossatella имеются поперечные кольца кортек-
са, делающие пелликулу волнистой при виде сбоку, а у
Cordylosoma их нет, поэтому вид назван С. glabrum.
Циклонемы имеются у всех апиосоматид, не всегда
четко видны, и вообще незвестны перитрихи отряда
Sessilida без циклонем. В практике автора данной гла-
вы часто бывало, что циклонемы удавалось увидеть у
изучаемых видов других родов только при максималь-
ном иммерсионном увеличении с боковым пучком све-
та; есть и ввды, у которых пелликула ребристая при
минимальном увеличении, это зависит прежде всего от
числа ребер и степени их сближения. Поэтому описа-
ние нового рода Cordylosoma основано на ошибке.
Внешне по контурам тела и перистома это типичная
A. piscicola; в определителе Баниной (1984) (цит. по:
Шульман, 1984) среди валидных видов рода A. glab-
rum не числится и названия нет даже в синонимике.
Название Cordylosoma — синоним и гомоним, есть ко-
ловратки Cordylosoma Voigt, 1904.
Род Scopulata Viljoen et Van As,
1985
При изучении симбионтов рыб Трансвааля (район в
ЮАР) были найдены виды Apiosoma (A. piscicola,
A. nasalis и 7 новых видов), Ambiphrya (A. neobolae) и
нового рода Scopulata с 3 видами — У constricta V. et
V. А., 1985; S. dermata {Scyphidia in V. et V. A., 1983) и
S. epibranchialis {Scyphidia in V. et V. A., 1983). Хозяева
скопулат — Oreochromis mossambicus, Micropterus do-
lomieu (интродуцент), Tilapia rendalli, T. sparrmanii,
Micralestis acutidens, Marcusensius macrolepidotus, Bar-
bus trimaculatus, Pseudocrenilabrus philander.
Все 3 вида скопулат сходные — это виды с широ-
ким бочонковидным телом, с широкой подошвой, вы-
дающейся за края тела, как у Ambiphrya. Форма и поло-
жение крупного сердцевидного ядра, как у апиосом, у
которых описаны подобные виды (например, A. tretze-
li); в любом случае это не Scyphidia (фиктивный род с
несуществующим типовым видом ) и не Riboscyphidia
по форме макронуклеуса. Название рода вышло на год
позже определителя Баниной (1984), где для подобных
форм предложен подрод Extensiscopula. 2 вида Scopu-
lata были переведены мною в состав Apiosoma {A. der-
mata, A. epibranchialis — Янковский, 1986), и здесь пе-
реводится третий вид Apiosoma constricta comb. п. В
крупном роде Apiosoma есть много переходов от рюм-
ковидных форм до бочонковидных, контуры тела и
ширина подошвы — не родовой признак.
Действительно, новым родом может быть Apiosoma
sp. in Viljoen et Van As, 1983 с кожи рыб Pseudocreni-
labrus philander и других цихлид в ЮАР, найдена сре-
ди других апиосом, позже названа A. viridis Viljoen et
Van As, 1985. Это вид с зоохлореллами; тело узкое, вы-
тянутое, наклонено к субстрату, с овальным ядром в
медисоме и с широким скошенным прикрепительным
диском — неизвестно, частью тела (подошвой) или
прочной секрецией.
Род Apiosoma Blanchard, 1885
Типовой вид A. piscicola — крупный вид с уз-
ким колокольчатым телом, широким перистомом, тон-
ким псевдостилом (нижней частью тела), прикреплены
к коже рыб очень мелкой скопулой. Ядро каплевидное
или треугольное, вместе с микронуклеусом смещено в
нижнюю часть тела, находится под четким попереч-
ным кольцевым желобком (это кольцо кинетосом,
имеющееся у всех сессилид).
920
ALVEOLATA
Род крупный, но описания многих видов в ранней
литературе некачественные, многие виды неопредели-
мые, зарисованы с сжавшихся или фиксированных
особей, например все виды с рыб Байкала. Часто дают
один неточный рисунок, хотя эти изменчивые формы
нужно рисовать в разных положениях и отражать ва-
риацию формы тела. Тем не менее весь этот мусор
включен в определительную таблицу Баниной (1984),
различающую 12 подродов (9 своих и 3 из литературы)
и совершенно непригодную для точного определения
многих апиосом. Различия подродов касаются конту-
ров тела и только у 2 подродов признаки действитель-
но существенны — стебельки у Apiostyla и отростки
базодиска у Apiorhiza. В скобках указаны авторы ви-
дов, отнесенных ранее к роду Glossatella (считавшему-
ся валидным) и к Scyphidia.
Подрод Apiostyla Jankowski, 1976 — Apiosoma gas-
terostei (Faure-Fremiet, 1905); A. microstylum Scheubel,
1973; A. lomi S., 1973; A. pseudopiscicolum S., 1973. На-
звание подрода невалидно как предложенное в тезисах
и здесь предлагается вновь — Apiostyla Jankowski sub-
gen. п., типовой вид Epistylis gasterostei Faure-Fremiet,
1905 — стебельчатые апиосомы, хотя бы при опреде-
ленных условиях с секрецией короткого прочного сте-
белька, как правило неветвящегося. Оговорка вызвана
тем, что по некоторым авторам, стебельки образуются
у обычных апиосом при повышении температуры сре-
ды; это убедительно не доказано, и даже в хорошо про-
гретых прудах и канавах в летний зной нет стебельча-
тых особей среди множества особей и видов стандарт-
ных апиосом.
Подрод Campanuliapium Banina, 1984 — А. сатра-
nulatum (Timofeev, 1962); А. с. var. esoci S., 1973;
A. carpelli Banina, 1968; A. esocinum Lubarskaja, 1965;
A. conicum (T., 1962); A. cotti (Voigt, 1902); A. tintinna-
bulum (Kent, 1882). Типовой вид Glossatella campanula-
turn Timofeev, 1962. Если включен вид с тритонов
A. tintinnabulum (тип рода Glossatella'), это значит, что
нельзя было предлагать новое название для подрода.
Поэтому название Campanuliapium ликвидируется и
заменяется названием Glossatella Butschli, 1889 как по-
дрод для данной группы видов.
Подрод Coniapium Banina, 1984 — A. giganthum
(Kandiloff, 1964), A. longiciliare Mitenev, 1975 (типовой
вид), A. dallii (Zhukov, 1962), A. matthesi S., 1973.
Подрод Amoebapium Banina, 1984 — A. amoebae
(= Scyphidia amoebae Grenfell, 1887, типовой вид по-
дрода); Л. a. var. cryptomicronucleata В., 1968; A. a. var.
guhli S., 1973; A. schulmani (Kashkovski, 1965); A. pecu-
liforme (Zhukov, 1962); A. miniciliatum S., 1973.
Подрод Poteriapium Banina, 1984 — A. poteriforme
(Glossatella in Timofeev, 1962, тип подрода); A. const-
rictum Kashkovski, 1975; A. paracotti (Zaika, 1965);
A. mucusani (Z., 1965); A. robustum (Zhukov, 1962);
A. baikalense (Zaika, 1965).
Подрод Apiosoma Blanchard, 1885 s. str. —A. kurense
Banina, 1984 (-A. baninae Gogebaschwili, 1980); A. amu-
rense Banina et Yuchimenko, 1975; A. phoxini Lom, 1966;
A. lotae Chernysheva, 1976; A. olae Yunchis, 1975; A. pisci-
colum Blanchard, 1885 (тип подрода) c subspecies typica,
minor, magna, longa, minor, perci и cylindriformis.
Подрод Miniapium Banina, 1984 — A. minutum
(Chen, 1961); A. obscurum Pugachev, 1983; A. poculumi-
forme P., 1983; A. uschkani (Zaika, 1965). Тип подрода
Glossatella minuta Chen, 1961.
Подрод Baculiapium Banina, 1984 — A. baculum So-
lomatova, 1977 (тип подрода); A. fungiforme Banina et
Yuchimenko, 1975.
Подрод Cylindrapium Banina, 1984 —A. nasale (Ti-
mofeev, 1962); A. gobionis Lom, 1966; A. tretzeli Scheu-
bel, 1973; A. alburni S., 1973; A. leuciscus S., 1973; A. ba-
ninae S., 1973; A. kessleri (Zaika, 1965). Тип подрода
Glossatella nasale Timofeev, 1962.
Подрод Dolioliapium Banina, 1984 — A. doliare (Ti-
mofeev, 1962); A. baueri (Kashkovski, 1965); A. incertum
Pugachev, 1983; A. tenerum K., 1975; A. minimicronucle-
atum Banina, 1968; A. megamicronucleatum (Timofeev,
1962). Типовой вид Glossatella doliare Timofeev, 1962.
Подрод Extensiscopula Banina, 1984 — A. extensum
Scheubel, 1973 (тип подрода); A. compactum S., 1973;
A. maximum S., 1973; A. siewingi S., 1973; A. basilatum
Pugachev, 1983.
Подрод Apiorrhiza Jankowski, 1976 —A. basiramo-
sum (Timofeev, 1962) (тип подрода); A. lopuchinae Yun-
chis, 1975; A.filiforme Scheubel, 1973. Это название не-
пригодно как предложенное в тезисах, не признано
Аэшт валидным, поэтому здесь предлагается вновь —
Apiorhiza subgen. п. (с одним г) — нет цельного базаль-
ного диска, скопула в виде нескольких корневых отро-
стков разной длины у разных видов подрода; типовой
вид Apiosoma flliformis Scheubel, 1973.
Систематика видов усложнена изменением морфо-
логии до и после деления и различием признаков ксе-
нодем (популяций одного вида на разных рыбах и в
разных локусах); для симбионтов рыб доказана и се-
зонная вариация признаков. Стадии роста прикрепив-
шегося мигранта A. piscicola можно принять за разные
виды апиосом. Находки этого вида в ЮАР, Мексике,
Китае кажутся сомнительными.
В этой таблице нет ряда зарубежных видов, напри-
мер Apiosoma micropteri (Surber, 1940 in Scyphidia) из
США; A. triangularis Li et Desser, 1985 из Канады;
A. caulata Viljoen et Van As, 1985 и 6 других видов тех
же авторов из ЮАР — A. curvinucleata, A. micralesti,
A. mothlapistis, A. obliqua, A. phiala, A. viridis и др.; в
России опубликованы традиционно плохие рисунки
Apiosoma applanatum Schulman, 1987 с гольяна Phoxi-
nus. В этом списке 2 стебельчатых вида (A. micralesti,
A. caulata) и 3 вида с зоохлореллами (A. caulata, A. cur-
vinucleata, A. viridis). Первоначально род Apiosoma де-
лили на подроды Stylaria и Astyla; оба эти названия по
ряду причин непригодные. Тип подрода Apiostyla
(Epistylis gasterostei) требует особо тщательного изу-
чения — отмечались мелкие колонии на ветвящемся
стебельке, и у вида, названного Scyphidia gasterostei in
Precht, 1935 (с плавников Gasterosteus aculeatus) отме-
чены продольные ряды папилл, поэтому определение
вида условное.
Поскольку род Scyphidia мною не признается, лик-
видировано и общепринятое сем. Scyphidiidae, куда
было удобно помещать любых одиночных бесстебель-
чатых перитрих. Сейчас такую роль условного сборно-
го таксона может играть сем. Apiosomatidae, поэтому
перечисленные ниже роды переносятся в состав апио-
соматид, хотя таксон в таком составе полифилетиче-
ский.
ТИП CILIOPHORA. КЛАСС OLIGOHYMENOPHOREA
921
Род Scyphidia Dujardin,
1841
Типовой вид S. rugosa по указанию Каля (Kahl,
1935). Дюжарден зарисовал 2 клетки с ребристым гоф-
рированным телом («rugosa»), без стебелька, но явно
соединенные в основании тела, на общей подошве или
стебельке, этот участок скрыт детритом или показан
неправильно. Положение складок тела (по диагонали)
неправильное; тип перистома неизвестен (оперкуля-
рии или эпистилиды); форма ядра неизвестна. Это сво-
бодный пресноводный вид из детрита, не симбионт.
За полтора века не появилось точного описания
вида, хотя он часто упоминается в фаунистических
списках во многих странах и иногда столь же при-
митивно изображается. Совершенно неопределимый
вид 5. rugosa sensu Fromentel, 1874 со столь же убогим
рисунком был указан типом крупного рода Rhabdo-
styla, хотя можно было выбрать реальный вид. К ро-
ду Scyphidia принято относить пресноводных и мор-
ских, свободных и симбионтных форм с любым типом
прикрепительного аппарата, например с широкой со-
кратимой скопулой, которая не показана у 5. rugosa,
и любым типом ядра. Род с таким типовым видом
не может существовать. Можно предположить, что за-
рисован основатель колонии — особь на субстрате
перед образованием стебелька («примонт»), но не-
возможно догадаться, к какому роду перитрих он при-
надлежит. Вубор небольшой — это Epistylis, Propyxi-
dium или Opercularia. Сейчас точно описаны виды
всех валидных родов с применением 4 методов имп-
регнации, некоторые типовые виды описаны много-
кратно, но типовой сцифидии среди них нет и несо-
мненно никогда не будет. Одиночные перитрихи оби-
тают как специфические симбионты на пресноводных
моллюсках, рыбах и других хозяевах, но любой род
должен иметь достоверный типовой вид, а не диагноз
по другим видам, приписанным позже. Род и вид Дю-
жардена — ошибка, их нельзя было признавать валид-
ными и следовало с самого начала игнорировать род
Scyphidia. Подробный анализ проблемы приведен Ян-
ковским (1985).
Описан ряд свободных видов, ни один из которых
не кажется достоверным — S. ropschi Banina et Polja-
kova, 1977; S. minima B. et P., 1977; S. purniensis Ghosh,
1923; Rhabdostyla porculus Penad, 1922; S. pedunculata
Lepsi, 1965; S. indica Bhatia, 1936; S. fromentelii Kent,
1980 (для S. rugosa sensu Fromentel, 1874); S. crassipes
Lepsi, 1965; S. annulata Edmondson, 1912; 5. rhizopoda
Lepsi, 1923 и др.; 2 вида в этом списке с длинным сте-
бельком. Симбионтных Scyphidia можно найти и изу-
чить заново, если точно указан вид хозяина; как прави-
ло, при повторном изучении они удаляются из этого
рода (пример — S'. beebei Nenninger, 1948, ныне в со-
ставе Orbopercularia).
За прошедшие 20 лет ситуация резко ухудши-
лась — род по-прежнему всеми принят, типовому виду
уделено много места в авторитетной монографии пе-
ритрих (Foissner et al., 1992); отрицание валидности
Scyphidia вызывает резкое отношение (Song, Wilbert,
2002; см. далее род Mantoscyphidia). Между тем до
сих пор тип рода никем не найден и не переописан. Су-
ществует обширный мир одиночных перитрих, осо-
бенно морских симбионтов, их филогения и родст-
венные связи неизвестны, и фиктивный род Scyphidia
удобен тем, что избавляет цилиатологов от необходи-
мости различения реально существующих видовых
комплексов (родов) в этой сложной полифилетичной
группе.
Род Riboscyphidia Jankowski, 1980
(рис. 379, а)
Типовой вид Scyphidia scorpaenae Fabre-Do-
mergue, 1888; эпибионт морских рыб, обычный на жаб-
рах бычков; очень близкие виды на других рыбах в
море и пресных водах. Тело бочонковидное, с очень
широким валиком и перистомом, с относительно ши-
рокой скопулой, без заметной прикрепительной секре-
ции; ядро от С-образного до извитого, но не столь
длинное, как у амбифрии, в середине тела, не сдвинуто
к постерону, как у апиосом. В связи с ликвидацией
фиктивного рода Scyphidia группа родственных видов
с морских и пресноводных рыб выделена в новый род с
длинным ядром и широким базодиском. Первоописа-
ние S. scorpaenae плохое, но на Мурмане и Сахалине я
изучал рибосцифидий с бычков и других рыб и нашел
четкий фиксон — прикрепительную пластинку. В от-
личие от апиосом рибосцифидии довольно однотипны
и различать их виды будет трудно.
Riboscyphidia arctica (Zhukov, 1962) comb. n. —
комменсал Melletes papilio и Liparis gibbus в Беринго-
вом море у Камчатки; в США и Канаде найдена на Му-
oxocephalus octodecemspinosus, Radulinus asprellus, As-
terotheca infraspinata (но это вид с более крупным те-
лом и микронуклеусом). Вероятно новый вид с очень
широкой подошвой и низким телом (Scyphidia sp.) от-
мечен на Salmo trutta и Salvelinus fontinalis. Далее в ка-
талоге виды с амфибий и пресноводных рыб, зарисо-
ванные необычайно плохо, которых нельзя включать в
определительные таблицы и для валидации нужно изу-
чить заново.
Scyphidia (Gerda) acanthoclini Laird, 1953 (Acant-
hoclinus fuscus; Riboscyphidia acanthoclini comb, n.);
S. (Gerda) aduconucleata MacKenzie, 1969 (камбала
Pleuronectes platessa, R. adunconucleata comb, n.);
S. amnigena Solomatova, 1977 (Rutilus rutilus, Riboscyp-
hidia amnigena comb, n.); S. amphibiarum (Rana, Ribos-
cyphidia amphibiarum comb, n.); S. baninae Chernova,
1977 (Alosa caspia palaeostomi, R. baninae comb, n.);
S. calicula Solomatova, 1977 (Rutilus rutilus, Riboscyphi-
dia calicula comb, n.); S. doliaris Chernova, 1977 (Cypri-
nus carpio; R. doliaris comb, n.); S. donecae Solomatova,
1977 (Rutilus rutilus, Riboscyphidia donecae comb, n.);
S. ranae Banina, 1982; S. temporariae B., 1982 (Rana
temporaria; Riboscyphidia temporariae, R. ranae,
comb, nn.); S. schulmani Gogebaschvili, 1966 (Cyprinus,
R. schulmani comb, n.); S. siluri Kostenko, 1968 (Silurus
glanis, R. siluri comb, n.); S. trituri Stiller, 1953 (Triturus
vulgaris, R. trituri comb, n.); S. globularis Solomatova,
1977 (Rutilus, Carassius, Neogobius, Cyprinus; R. globu-
laris comb. n.). Вид Scyphidia pyriformis Tripathi, 1954
на пресноводных рыбах Индии — это Apiosoma.
922 ALVEOLATA
Род Ambiphrya Raabe, 1952 (рис. 380, a)
По Аэшт, типовой вид Л. miri по монотипии, но это
ложная информация. Раабе (Raabe, 1952) включил
3 вида без указания типа по всей статье — A. miri,
A. tholiformis и A. macropodia', Раабе не знал четвертый
вид Scyphidia ameiuri такого же типа. Типовой вид ука-
зан в каталоге Аэшт, поэтому род должен обозначаться
как Ambiphrya Aescht, 2001; но поиск в доступной ли-
тературе выявил более ранний источник: «Raabe
(1952) created the genus Ambiphrya with type species
A. miri Raabe, 1952» (Viljoen, Van As, 1985, p. 86). Нуж-
но продолжить поцск, много литературы недоступно,
включая ряд книг о паразитах, рыб; пока условно при-
мем название Ambiphrya Viljoen et Van As, 1985.
Типовой вид Л. miri с жабер рыб Nerophis ophiodon
(Syngnathidae) в польской Балтике; на других рыбах в
типовом локусе не обнаружен. Форма тела, как у Ri-
boscyphidia, тело вазообразное, длиной около 45 мкм, с
широкой скопулой и постоянным пояском ресничек
ниже экватора (вероятно, единственный случай у сес-
силид). В норме у перитрих реснички образуются на
постоянном пояске кинетосом у одной дочерней особи
после деления. Ядро очень длинное, червеобразное,
извитое, не смещено вниз. Прикрепление широкой по-
дошвой (расширенная плоская нижняя часть тела) без
заметной секреции (без фиксона); подошва шире, чем
у Л. tholiformis и уже, чем у остальных видов. Раабе
считал этот род промежуточным между сессилидами и
триходинами, но это нереально, урцеолярии могли
произойти от мигрантов неизвестных перитрих.
Ambiphrya ameiuri (Thompson, Kirkegaard et Jahn,
1947 in Scyphidia) comb. n. — симбионт на жабрах
Ameiurus melas (типовой хозяин — bullhead) и Ictalurus
punctatus (catfish, канальный сомик) в США, если это
определение цилиат правильное; в пересоленном озере
Сальтон в Калифорнии найден на интродуцированной
тиляпии Oreochromis mossambicus', в принципе все ам-
бифрии сходные и определения их могут быть оши-
бочными. Это бочонковидный вид длиной 35—45 мкм
с необычайно широкой подошвой.
Ambiphrya macropodia (Davis, 1947 in Scyphidia)
comb. n. — симбионт Ameiurus nebulosus и Lepomis
macrochirus в США. Тело бочонковидное, длиной 35—
46 мкм, подошва очень широкая.
Ambiphrya tholiformis (Surber, 1943 in Scyphidia)
comb. n. — симбионт Micropterus dolomieu и Huro
(= Micropterus) salmoides в США. Тело узкое, вытяну-
тое, особенно в нижней части, длиной до 59 мкм, с не-
большим базальным диском.
Ambiphrya neobolae Viljoen et Van As, 1985 — сим-
бионт Neobola brevianalis в ЮАР, только на покровах
тела, нет на жабрах; это самый крупный вид рода
(44—48 мкм), в остальном, как Л. macropodia, но подо-
шва не столь широкая.
Ambiphrya sp. отмечена на лососе Salmo salar в
США. В состав рода переведен вид Scyphidia arctica
Zhukov, 1962 {Ambiphrya in Hoffman, 1978), но это вид
без пояска ресничек. Предполагается, судя по змеевид-
ному ядру, что описанные в России виды Scyphidia glo-
bularis Solomatova, 1977, S. baninae Chernova, 1977,
S. doliaris Ch., 1977 и S. schulmani Evlanov, 1981, ри-
сунки которых выполнены на позорно низком уров-
не, — это амбифрци, но об определении этих видов не
может быть и речи. Сейчас амбифрии обычны на мел-
ких рыбах и молоди более крупных рыб в России — на
плотве, окуне, форели, карпе, гольяне и на привозных
рыбах из США, все больше расширяют свой ареал;
определения их как Л. ameiuri или Л. macropodia про-
извольные и не документированы точными рисунка-
ми. Эти названия могут быть синонимами, но пока в
США не проведено изучения изменчивости амбифрий
на типовых хозяевах.
Род Mantoscyphidia Jankowski, 1980
(рис. 379, а)
Типовой вид Scyphidia littorinae Issel, 1918 с
эпителия мантийной полости литоральных гастропод
рода Littorina. Тело высокое, цилиндрическое, нижняя
часть тела утолщена, складчатая, скоцула необычайно
широкая, сократимая; ядро компактное, овальное,
слегка сплющено. Такие виды обитают на морских и
пресноводных гастроподах вероятно повсеместно, от-
мечены в Европе, на Дальнем Востоке, в США, Мекси-
ке, Бразилии, Индии, в Антарктике. В одном виде пла-
норбисов могут обитать 2 вида рода — на голове и щу-
пальцах мелкий вид, в мантийной полости крупный, с
фиксоном разного типа. В море заселены гастроподы
обычного типа, со спиральной раковиной, и аберрант-
ные пателлы, гельционы и акмеи с конусовидной рако-
виной. Как исключение, близ Киева открыт вид в пре-
сноводных двустворчатках — сфериидах, в США от-
мечен вид в унионидах. Такое распространение
говорит о древности рода. В моллюсках у берегов
ЮАР — группа видов с компактным ядром, всегда
смещенным (как у апиосом) к постерону; их можно
выделить в особый подрод.
По утверждению Сонга и Вильберта (Song, Wilbert,
2002), я сохранил род Scyphidia для оперкулярных
форм (= Scyphidiella), а эпистилидные формы разделил
на 4 рода только по образу жизни и хозяевам; для сим-
бионтов моллюсков выделен род Mantoscyphidia. Все
это неверно, я признал типовой вид Scyphidia неопре-
делимым и несуществующим и ликвидировал этот
род, а другие роды выделены только по морфологиче-
ским признакам, не по хозяевам; подробную мотива-
цию (Янковский, 1985). На моллюсках живет не менее
3 родов «сцифидий»; в мелких прозрачных планорби-
дах одновременно видны сцифидии 2 родов в разных
локусах, с небольшим дисковидным фиксоном на от-
крытых частях тела и с обширной сократимой муску-
листой подошвой в дыхательной полости. Если совпа-
дает строение у видов с моллюсков, червей и иглоко-
жих, их всех можно включить в состав Mantoscyphidia.
Ниже дан список большинства видов рода и их хозяев.
Полезная информация о способах прикрепления к эпи-
телию хозяев приведена в следующих работах (Lom,
Corliss, 1968; Fish, Goodwin, 1976).
Scyphidia acanthophora Fish et Goodwin, 1976 (тро-
хиды Gibbula umbilicalis, Monodonta lineata', указана и
для Крыма в Gibbula = Steromphala divaricata)', Glossa-
tella australorbicola Machado Jr., 1965 (в гастроподах
Бразилии Australorbis glabratus, A. tenagophilus); Scyp-
hidia physarum f. capitis Boitsova, 1976 (на 10 видах га-
ТИП CILIOPHORA. КЛАСС OLIGOHYMENOPHOREA
923
стропод 7 родов) (=М. capitis Jank., 1985); S.fischeri
Vayssiere, 1885 (Truncatella truncatula', я нашел такие
формы в крымских Myosotella); Scyphidia sp. (вид с
зоохлореллами из Gyraulus parvus в США); S. hydro-
biae Kahl, 1933 (Hydrobia ventrosa); S. inclinata Lom
et Corliss, 1968 (Cincinnata cincinnatiensis в США);
S. limacina (Muller, 1773 in Vorticella-, Planorbis con-
tortus, Bulla = Physa fontinalis); S. littorinae Issel, 1918
(Littorina neritoides, L. punctata); S. nitidae Oishi, 1987
(non vidi); S. patellae Cuenot, 1891 (Patella vulgata;
= Mantoscyphidia lusitana Jank., 1985); S. patellae Hut-
ton, 1878 («Patella argentea» = Cellana radians в Но-
вой Зеландии), S. physarum Lachmann, 1856 (Physa
fontinalis; определения с других хозяев неверные);
S. ubiquita Hirshfield, 1949 (Acmaea, Lottia, Tegula, Fis-
surella — смесь разных видов в Калифорнии, ти-
повой хозяин по моему обозначению Acmaea pelta; в
литературе много ложных определений, например в
литторинах Европы и Индии); S. bengalensis Jamadar
et Choudhury, 1988 (Cerithidea cingulata), Scyphidia sp.
in Song et Wilbert, 2002 (Nacella concinna в Субан-
тарктике) (все виды сейчас в составе рода Mantoscy-
phidia).
Род Mantoscyphidia принят в литературе для видов
М. physarum Lachmann, 1856; М. radixi Boschko, 1993
(Radix auricularia, Peregriana ovata); M. theodoxis B.,
1993 (Theodoxus fluviatilis, Th. pallasi); M. sphaeriida-
rum B., 1993 (Shadinicyclas rivicola — редкая находка в
двустворчатках); М. capitis (Lymnaea, Planorbarius);
M. fanthami Basson, Botha, Van As, 1999 (5 видов Oxys-
tele); M. branchi Van As, Basson et Van As, 1998 (Patel-
la, Helcion, Cellana в ЮАР); M. marioni Van As, Basson
et Van As, 1998 (Nacella delesserti в Субантарктике);
M. spadiceae Botes, Basson et Van As, 2001 (Haliotis
spadicea); M. midae Botes, Basson et Van As, 2001 (Hali-
otis midae).
Род Baikaloscyphidia Jankowski, 1982
Типовой вид В. anteronis по монотипии. По
Аэшт, род невалиден, так как помещен только рисунок
без описания (диагноза) в тексте, но это неверно. В
подписи к рис. 5 в статье Янковского (1982, р. 27) ука-
зано Baikaloscyphidia anteronis gen. n., sp. n. Диагноз
имеется, но при компановке статьи редакция потеряла
строчку над ним с названием рода и вида: «Одиночные
(неколониальные) формы (см. рис. 5). Трофонты меш-
ковидные, расширены в постесоме. Перистом эписти-
лидного типа, с широким валиком, коническим диском
без дискофора. Ядро овальное. Прикрепление — мел-
кой ножкой и подошвой. При сокращении особи резко
отклоняются вбок, почти прилегая к субстрату. Разме-
ры особей 45—50 X 14—26 мкм. Обычный массовый
вид на щупиках и головной лопасти Choanomphalus
amauronius из сублиторали. Ксенотип В-23» (Янков-
ский, 1982, р. 28—29). Поскольку диагноз дан, я не
обязан вторично вводить род как новый. В. antero-
nis — эндемик Байкала, отличается от типового вида
Mantoscyphidia по типу прикрепительного аппарата
(фиксона). На литоральных видах Baikalia перитрих
нет, на крупных траловых Kobeltocochlea изредка
встречаются перитрихи другого типа, вытянутые, с
ножкой. У этого вида нет обширной сократимой при-
соски, в отличие от типового вида рода Mantoscyphi-
dia, и способ сокращения тела другой.
Род Myoscyphidia Jankowski, 1985
Типовой вид Scyphidia hyalina Biegel, 1954 из
пресноводного перифитона на растениях и в обраста-
нии стекол; не-колониальные виды перитрих с вытяну-
тым телом, эпистилидным диском, узкой скопулой,
С-образным ядром и осевым коническим пучком фиб-
рилл, действующим как мионема. При сокращении
тела резко сжимается мионема и псевдостил без откло-
нения особи (осевое сокращение). Различия в форме
ядра у Opercularia и Orbopercularia считаются родовы-
ми, поэтому вид с особой формой ядра обособлен от
мантосцифидии. Второй вид — М. pseudohyalina
(Scyphidia in Biegel, 1954). См. также роды Scyphidiella
и Speleoscyphidia в подотряде Operculariina.
Род Paravorticella Kahl, 1933
Типовой вид Scyphidia terebellaeFaure-Fremiet,
1920 по монотипии; симбионт на кроне щупалец сидя-
чих полихет Terebella lapidaria, обычен в северной Ат-
лантике и северной Пацифике. Тело очень узкое, на
длинном тонком псевдостиле, прикрепительный диск
мелкий, остается на субстрате после отделения особи;
ядро вытянутое, изогнутое. Особи очень сократимые,
особенно в нижней половине (псевдостиле). Сходный
вид — Р. clymenellae (Shumway, 1926 in Scyphidia) — t
из кишечника (?) подвижной полихеты Clymenella tor-
quata; в литературе такие формы отмечались в кишеч-
нике Arenicola, но это невозможно, на Мурмане арени-
колы несут много таких цилиат на поверхности и ни-
когда не в кишечнике.
Особи одиночные, но на теребеллидах могут быть в
розетках по 2—4 на одном диске, это колонии; поэто-
му все виды с червей должны быть изучены заново.
Пока в составе рода Paravorticella только виды с поли-
хет— Scyphidia terebellidis Precht, 1935 (с Terebellides
stroemii); Rhabdostylus variabilis Dons, 1917 (на щу-
пальцах неопределенных теребеллид; позднейшие
указания на Scoloplos armiger и Phyllodoce laminata
ошибочные); Scyphidia spionicola Precht, 1935 (Pygos-
pio elegans); Rhabdostyla nereicola Precht, 1935 (Nereis
dumerili); Paravorticella lycastis (Lycastis = Namalycas-
tis indica); Rh. commensalis Mobius, 1888 (Capitella ca-
pitata, Terebellides stroemii); Rh. arenicolae Fabre-Do-
mergue, 1888 (Arenicola piscatorum) (Paravorticella te-
rebellidis, P. variabilis, P. spionicola, P. nereicola,
P. commensalis, P. arenicolae comb. nn.). В монографии
перитрих Каля (Kahl, 1935) включены 3 вида — Р. te-
rebellae, Р. clymenellae (указаны выше) и Paravorticella
crassicaulis (Vorticella in Kent, 1880) — вид с длин-
ным гибким псевдостилом с Asellus aquaticus. Этот
вид очень плохо изучен, явно не замечена короткая
мионема в складчатом гибком стебельке — это Haplo-
caulus.
Большое число видов одиночных перитрих со ско-
пулой, диском или подошвой на субстрате с иглоко-
924
ALVEOLATA
жих, хитонов, полихет, олигохет пока трудно распре-
делить по родам, нужна электронная микроскопия
продольных срезов для точного определения типа
фиксона. В световом микроскопе нельзя получить точ-
ные данные о фиксоне. Классификация «сцифидий» из
всех групп хозяев — дело будущего. На хитонах оби-
тают неизученные мантосцифидии с мелким диско-
видным фиксоном; на иглокожих — очень плохо опи-
санные ранее виды Rhabdostyla arenaria Cuenot, 1891;
Vorticella amphiurae Cuenot, 1891 (это Haplocaulusj.
V. ophiocomae Giard, 1880; Rhabdostyla sertulariarum
var. amphiurae Andre, 1910; морские звезды несут в же-
лобках одиночных перитрих с дисковидным фиксо-
ном. Новый род с вздутым фиксоном будет описан
мною с синаптид из Японского моря.
Сем. Ellobiophryidae Chatton et Lwoff,
1923
Зооиды одиночные, с коротким широким телом,
эпидиском типа Epistylis, С-образным ядром; нет стан-
дартной скопулы, прикрепление кольцом — тело сни-
зу раздвоено и выросты тела огибают субстрат и срас-
таются в единое кольцо — cinctum по терминологии
Клампа (Clamp, 1982), ревизовавшего это семейство. В
качестве субстрата служат тонкие нити жабер морских
двустворчаток или щупальца морских мшанок. Пока
известно несколько видов 3 родов, один из которых
Кламп считает невалидным.
Род Ellobiophrya Chatton et Lwoff, 1923
Типовой вид Е. donacis с жабер сублитораль-
ных двустворчаток Donax vittatus, несколько особей
найдены на Lutraria sp. во Франции. Зооиды сцифиди-
идного типа, с мешковидным телом и относительно
небольшим перистомом; на постероне 2 длинных вы-
роста (трабекулы), огибающие жаберную нить и сое-
диненные дистально с помощью замкового аппара-
та — конец одного выроста срастается с другим. Выро-
сты тела отстоят далеко один от другого, это важное
отличие от форм с жабер рыб. Отростки с неровной по-
верхностью, гофрированы, вероятно несколько сокра-
тимые за счет периферических фибрилл, но внутрен-
него стержня нет, в отличие от Caliperia. Ядро слож-
ное, неправильной формы. Размножение неравным
делением («псевдо-почкованием»); томит долгое вре-
мя прикреплен к более крупной особи, образует по-
движную цилиатуру пояска и неподвижные реснички
по всей выпуклой скопуле, отделяется и после оседа-
ния на жабру выделяет 2 фиксаторных отростка.
Е. con viva Clamp, 1982 обитает на длинных щупаль-
цах мшанки Bugula neritina и В. turrita в США; тело
цилиндрическое, мешковидное, мелкое (47 X 27 мкм);
отростки сократимые, без осевой палочки, срастаются;
ядро вытянутое, почковидное. Мелкие почки временно
прикреплены к другой особи после деления (к томон-
ту) временным личиночным стебельком; он трудно за-
метен, погружен в зону почкования (эмбриофор); рес-
ничек на скопуле не заметили. Несомненна аналогия с
фиксаторным кольцом, секретируемым скопулой у Не-
teropolaria и с прикреплением отростками тела у моно-
геней Furcohaptor.
Третий вид — Ellobiophrya maliculiformis Peters,
Van As, Basson et Van As, 2004 — прикрепляется к
нижней части тела (постесоме) перитрих Mantoscyphi-
dia spadiceae, М. midae и М. branchi на жабрах круп-
ных аберрантных гастропод Haliotis spadicea и Н. mi-
dae и на Scutellastra spp. в ЮАР. Расы из разных хозяев
(ксенодемы) отличаются по морфометрии. Как и сци-
фидии-носители, вид имеет симбионтные водоросли.
Тело и ядро вытянутые, ниже миграторного кольца
тело вновь расширяется, образуя замкнутое кольцо с
единым почти кольцевым стержнем. Тем временем
был заново изучен вид Caliperia brevipes со ската Raja
erinacea', оказалось, что отростки тела соединены в
кольцо, а мионемы в них нет; сейчас это Ellobiophrya
brevipes, а в составе Caliperia временно остался вид
С. longipes с мионемой, и этот род может быть вообще
ликвидирован.
Род Caliperia Laird, 1953
Типовой вид С. longipes Laird, 1953; также
С. brevipes Laird, 1959. Тип рода открыт в Новой Зе-
ландии на прибрежных рыбах Oliverichtus melobesia и
Ericentrus rubrus, вид С. brevipes на скатах Raja erina-
cea в Канадской Атлантике. Выросты тела длинные,
иногда длиннее тела у первого вида и намного коро-
че у С. brevipes. Тело сужается к основанию, мелкое
(около 52 X 39 мкм), с вытянутым ядром. В постесоме
виден извитой обруч — плотный опорный стержень,
вероятно мионема; он продолжается на всю длину от-
ростков. Зооиды обоих видов зарисованы сокращен-
ными, с окрашенных гематоксилином препаратов;
форма эпидиска, валика, перистома неизвестна. Ста-
дии размножения не отмечны. Несмотря на плохое
описание обоих видов, род считается валидным с 2 от-
личиями от Ellobiophrya — отростки со стержнем, не
смыкаются в прочное постоянное кольцо.
Род Clausophrya Najdenova et Zaika, 1969
Типовой вид С oblida по монотипии; из слизи
на теле черного бычка и кругляка Proterorhinus тагто-
ratus у Севастополя; прикрепление кольцом к мелким
бугоркам на коже хозяев. Это самый крупный вид се-
мейства; длина тела без кольца 170—191 мкм, диаметр
кольца 31—33 мкм. Вид зарисован прижизненно, эпи-
диск и ротовая цилиатура обычного для эпистилид
типа, ядро лентовидное, продольное, выросты длин-
ные, сократимые, сомкнутые, но могут быть разведе-
ны; ядро С-образное; нет внутреннего стержня. Тело
очень сократимое, при раздражении легко сжимается,
причем фиксаторное кольцо также легко сжимается и
утолщается. Авторы рода знали литературу (роды Ca-
liperia и Ellobiophrya), но все же считали свой род но-
вым, так как С. oblida имеет мозаику признаков, не по-
зволяющих отнести к ним, например по форме ядра.
Вид перенесен мною в состав рода Caliperia (С. oblida
in Jankowski, 1976), род Clausophrya ликвидирован, но
Кламп перенес типовой вид в состав Ellobiophrya
ТИП CILIOPHORA. КЛАСС OLIGOHYMENOPHOREA
925
(Е. oblida in Clamp, 1982), также ликвидировав этот
род. В диагнозе Caliperia, оставленного в том же со-
ставе, подчеркивается — выросты тела несократимые,
прилегают один к другому, но не срастаются; имеется
стержень выростов.
В пробе мороженных атлантических замковых
рыб-спинорогов (grey trigger-fish) Balistes capriscus
(или В. carolinensis) из гастронома, размороженных в
формалине, я нашел в осадке много мелких особей эл-
лобиофриид с С-образным ядром, очень мелким коль-
цом, вне субстрата; выросты открытые или сомкнутые,
без стержня; вид новый, но родовой статус пока нея-
сен. На балистидах у Владивостока их нет, но найдены
триходины и редкий симбионт рыб — Licnophora в же-
лобках у основания всех плавников. Если род Caliperia
не будет признан, то это Ellobiophrya n. sp. с новой
группы хозяев.
Сем. Astylozoidae Kahl, 1935 (рис. 381, а)
Постоянно подвижные планктонные перитрихи без
цилиатуры на кольце кинетосом; плавание с помощью
мощной ротовой цилиатуры. Нет стебелька в отличие
от группы пелагических видов вортицелл. Это семей-
ство и два других (Opisthonectidae и Telotrochidiidae)
выделялись Янковским в подотряд Natantina, вначале
принятый, но со временем стало очевидно, что все
3 группы мдгли перейти к астилии независимо; кроме
того, телотрохидии принадлежат к группе оперкуля-
рий, а сейчас эпистилиды и оперкулярии принадлежат
к разным подотрядам. Группа описана в монографии
Фойсснера с соавт. (Foissner et al., 1999).
Род Astylozoon Engelmann, 1862
Типовой вид Л. fallax из пресноводного планк-
тона; в море бесстебельчатые планктонные перитрихи
неизвестны, за исключением отдельных стадий в цик-
ле Planeticovorticella. Тело сократимое, мешковидное,
широкое, длиной 41—100 мкм; ротовая цилиатура без
полимеризации витков спирали, стандартная для пе-
ритрих; ядро почковидное, короткое; кортекс с цикло-
немами, без аргентофильной сети; на изогнутом посте-
роне скопула с небольшим шипиком (склеенные или
разрозненные щетинковидные реснички); скопула
очень мелкая, почти редуцирована, в ямке. При движе-
нии перистом обращен вперед. Это редкий вид, несо-
мненно валидный, но морфология детально изучена у
A. faurei и A. enriquesi. Вид Л. oxypus Lepsi, 1960 — ве-
роятный синоним типового вида. Л. pyriforme Schewia-
koff, 1893 имеет более широкое тело и длинное тонкое
ядро, С-образное или извитое; размеры мельче, чем
у типового вида; вид валидный, но пока не изучен.
Л. amphoriforme Gelei et Szabados, 1950 не имеет каудаль-
ных щетинок и отличается формой тела от Л. pyrifor-
me, но все же был сведен в синонимы этого вида.
Л. enriquesi Foissner, 1977 — во всем, как Л. pyrifor-
me, но вакуоль открывается в буккон на левой стенке
полости, у двух первых видов на правой. Это постоян-
ные различия у многих рас Л. enriquesi. У этого вида
впервые изучены при импрегнации протарголом рото-
вая цилиатура (стандартная для перитрих), мионемы
кортекса, особо сильные у валика перистома, и район
скопулы, к которой сходятся все мионемы. Циклоне-
мы немногочисленные. Постоянно сохраняется без-
ресничный обруч кинетосом (telotrochal band), кото-
рый несет реснички у тотальных мигрантов или про-
дуктов деления других перитрих; отсутствие ресничек
у постоянно подвижного вида необъяснимо; вероятно,
это не поликинета, как обычно у перитрих — один ряд
дисом, т. е. нормальная поликинета у Astylozoon реду-
цирована. Ядро С-образное, расположено поперек
тела, по форме и положению ядра этот вид легко отли-
чить от следующего.
A. faurei Kalil, 1935 — мелкий вид с почковидным
ядром и вакуолью на правой (дорсальной) стенке бук-
кона; в остальном сходен с предыдущим видом; в от-
личие от A. fallax с плавным сужением тела, у этого и
предыдущего вида тело почти сферическое, с неболь-
шим каудальным отростком, несущим мельчайший ру-
димент скопулы. Форма тела и размеры обоих видов
сходные (35—65 мкм).
Род Geleiella Stiller, 1939
Типовой вид G. vagans, вид с типичным для
Astylozoon внешним обликом; ядро промежуточной
формы между почковидным и С-образным, дуговид-
ное; вакуоль слева от буккона. Особенность вида —
постоянная секреция слизи, мукозного слоя клетки
(«тектина»), покрывающего все тело, кроме перисто-
ма. Слизи особенно много на постероне, где она может
образовать подобие стебелька для прикрепления к суб-
страту, иногда даже ветвящегося, с 2 особями на вет-
вях общего мукозного стебелька; слизью покрыта и
циста. Вид найден в планктоне натронного (сернисто-
го) пруда в Венгрии вместе с Hastatella radians. Род
принят Калем (Kahl, 1935), но автор рода Йолан Штил-
лер позже сама отказалась от этого рода; Фойсснер
(Foissner et al., 1999) также включает Л. vagans как ва-
лидный вид в состав Astylozoon. Образование слизи
может быть реакцией на плохие условия среды (лужи
на грунте с частым высыханием, щелочные натроно-
вые водоемы, токсичные бытовые отходы); но такие
же формы описал позже Дингфельдер (Dingfelder,
1962) из чистых вод, и Фойсснер считает наличие по-
стоянной тектиновой оболочки видовым признаком.
Это значит, что род Geleiella может быть валидным по
крайней мере как подрод. Оболочки такого типа мож-
но встретить у перитрих (Vorticella microstoma f. elon-
gata, Zoothamnium affine var. vestita), у простомат
(Trachelophyllum), у кольподид, у некоторых сукторий
из моря (Luxophrya) и чистых вод Байкала (Cryptacine-
ta, Cryptophrya), у почвенно-моховой суктории Brac-
hyosoma', это действительно видовой признак, важный
для систематики.
Род Hastatella Erlanger, 1890
Типовой вид Н. radians по монотипии, обыч-
ный вид в пресноводном планктоне, зарисован многи-
ми авторами; лучшее описание (с импрегнацией) у
926
ALVEOLATA
Рис. 381, a. Sessilida.
Планктон пресных вод. Hastatella sp. (Л); H. radians (5); Opisthonecta henneguyi (В, Г, 3, JT); Astylozoon enriquesi (И); A. faurei (Д, K); Pelagovorticella mayeri
(E, Ж); Telotrochidium sp. (M). (По: Foissner et al., 1999 (A—Д, 3—M); Faure-Fremiet, 1924 (E, Ж)).
Fig. 381, a. Sessilida.
Fresh-water plancton.
Фойсснера (Foissner et al., 1999). Тело мелкое, длиной
40—60 мкм, колокольчатое, заострено сзади, где несет
такую же мельчайшую скопулу — ямку с валиком и
группой ресничек, как у Astylozoon-, ядро С-образное,
поперек тела; вакуоль правее буккона. Кортекс иногда
с тектиновой оболочкой, четкие кольцевые ребра (цик-
лонемы) немногочисленные и разрозненные. Валик и
зона ресничного обруча утолщены, несут радиальные
шипы, по 9—1.2 в каждом поясе; верхние шипы равны
нижним или короче, направлены вбок или вверх, ниж-
ние в стороны или вниз. Число шипов у особей измен-
чивое (5 + 5, 8 + 8 до 24 + 24); в кольце могут быть
шипы разной величины. При виде сверху тело звездча-
тое, видны оба пояса шипов, поэтому вид назван Н. ra-
dians.
Н. aesculacantha Jarocki et Jakubowska, 1927 — ва-
лидный вид с 4 кольцами длинных толстых шипов
(16—23 мкм), иногда достигающих длины тела; у ти-
пового вида шипы плотные, у данного вида зернистые
(с цитоплазмой). Дополнительные кольца расположе-
ны под верхним и нижним кольцами, имеющимися у
Н. radians. Вид очень редок и пока плохо изучен.
Н. microradians Gelei, 1954 (Н. radians forma micro-
radians in Stiller, 1971), редкий вид величиной 40 X
35 мкм, с 13—15 короткими шипами, по 4—5 в каждом
кольце — синоним вида Н. radians с изменчивым чис-
лом шипов.
Н. radians forma monilata Stiller, 1971 (вид описан
без рисунка) имеет сеть кортекса, как у Pseudovorticel-
la, и поэтому должна быть выделена в новый род, но
пока нет хорошего описания и рисунка вида. Возмож-
на и ошибка — аргиром линейный, но крупные поры
пелликулы, мионемы под кортексом или альвеолы мо-
гут производить впечатление сети в участках кортекса.
Сем. Ophrydiidae Ehrenberg, 1838
(рис. 381, б)
Пресноводные виды, прикреплены к водным расте-
ниям и любому другому доступному субстрату; сим-
бионтов животных нет. Одиночные или колониальные
формы с длинным узким телом; стомодиск эпистилид-
ного типа; прикрепление скопулой или нитевидным
ТИП CILIOPHORA. КЛАСС OLIGOHYMENOPHOREA
927
Fig. 381, 6. Sessilida.
тонким стебельком; секретируется тонкостенная му-
козная раковина, в крупных колониях домики объеди-
нены в единую массу — ценобий.
Род Gerda Claparede et Lachmann,
1859
Типовой вид G. glans', одиночные подвижные
формы длиной 200 мкм из торфяного болота, не при-
креплены к субстрату скопулой или стебельком; отли-
чие от сцифидий — отсутствие «заднего сфинктера
или фиксаторной присоски». Особи длинные и тонкие,
расширены в нижней части; вакуоль удалена от букко-
на и сообщается с ним узким длинным каналом. Вер-
шина тела с мускульным валиком; стомодиск поднят
над валиком, с широким буккальным отверстием, с ци-
лиатурой обычного для эпистилид типа; это не оперку-
лярии. Есть сходство перистома и антесомы с лбрика-
тами типа Cothurnia.
Вид не был достаточно хорошо описан, поэтому от-
ношение к этому роду было противоречивым — он не
признавался рядом авторов (как стадия развития офри-
диев или синоним сцифидий) или признавался, но в
него включали также неродственные формы, напри-
мер сцифидий из моллюсков. У Каля (Kahl, 1935), это
подрод рода Ophrydium, к примеру О. (Gerda) glans', у
других авторов подрод фиктивного рода Scyphidia, к
примеру вид из моллюсков Астаеа — Scyphidia (Ger-
da) ubiquita in Laird, 1961, или реже самостоятельный
род (Corliss, 1979; Puytorac, 1994). В современной ли-
тературе нет описания видов Gerdcr, часть их перенес-
ли в состав Ophrydium, часть видов явно невалид-
ные — неопределимые или синонимы; список видов
Gerda дан ниже вместе с видами Ophrydium.
Род Ophrydium Bory, 1824
Типовой вид Vorticella versatilis Muller, 1786.
В оригинале Ophrydia с типовым видом по монотипии
О. nasuta Bory, 1824; название изменено Эренбергом
(Ehrenberg, 1838) и в такой форме было всеми принято.
Синонимы — Echinella Bory, 1824 и Raphanella Bory,
1824, оба рода предложены без указания типа, первое
Эренберг считает синонимом Ophrydium, второе —
928
ALVEOLATA
смесь видов Ophrydium и Uroleptus. Третий род Linza
pruniformis Schrank, 1803 — валидное название для оф-
ридиев, но оно не было признано ранними авторами и
забыто.
Колониальные формы, живущие в трубчатых доми-
ках, образованных секрецией мукуса. Род сборный,
полиморфный по ряду признаков, но для анализа ди-
вергенции пока мало данных. Под одним названием
О. versatile обозначались любые крупные колонии
вида, но по Фойсснеру (Foissner et al., 1992) это 3 раз-
ных вида; кроме них есть и мелкие колонии, невиди-
мые без микроскопа, как минимум 2 видов.
Ophrydium flexile Song et Wilbert, 1989, вероятно,
соответствуют плохо описанному виду Кента Ophio-
nella picta. В колонии 2—6, редко 8 зооидов, прикреп-
ленных к центру низкой толстостенной мукозной ра-
ковины, точнее короткой и широкой трубки; йрикреп-
ление без стебелька и видимой секреции, узкой
скопулой. Ядро змеевидное, узкое и длинное, вытяну-
то вдоль тела, как у лорикат; тело веретеновидное в
нижней части, с длинной тонкой вытянутой шейкой,
внутри которой находится очень длинный буккон, ка-
нал вакуоли и вершина ядра. Поскольку нет стебелька,
вид может быть выделен в новый подрод с указанным
типом — Ophrydium flexile', Ophionella следует при-
знать неопределимым родом.
Ophrydium sessile Kent, 1882 — колонии крупные
(до 3—5 мм), полусферические, бесцветные зооиды
длиной 300 мкм прикреплены к центру дна широкой
раковины без стебелька; этот вид можно отнести к
подроду Apostonema.
О. versatile var. acaulis Roux, 1899 отличается от ти-
повой формы более мелкими размерами тела (240—
260 X 35—38 мкм) и отсутствием стебелька.
О. adae Evarts, 1880 — вероятный синоним вида
О. versatile, колониальный вид с зоохлореллами и же-
латиновой лорикой; длина тела 250 мкм, колоний 1—
4 мм; тело при растяжении не бутылковидное; имеется
длинный дихотомический стебелек с фибриллами.
Gerda ambigua Penard, 1922 — одиночные зооиды
длиной всего 65 мкм, с широкой подошвой, без зоо-
хлорелл; недостоверный вид, описан только по одной
особи.
О. boreale Penard, 1922 — одиночные зооиды вели-
чиной 80—200 мкм в тончайшей незаметной вазооб-
разной раковине; строение тела, как у типичных офри-
диев; прикрепление тонкой нитью от скопулы до дна
раковины; найдены в пробе мхов. Формально это Ger-
da — G. borealis.
О. ectatum Mast, 1944 — вид с желатиновой лори-
кой, близкий к О. versatile, зооиды крупные
(225—400 мкм), с зоохлореллами, размер колонии до
3 мм; стебелек с ветвящимися фибриллами; при растя-
жении тело не бутылковидное. Возможна синонимия с
О. adae.
О. eichhornii Ehrenberg, 1853 — колониальный вид
с желатиновой лорикой, обычно бесцветный, длина
зооидов 250—500 мкм, фибриллы скопулы не ветвят-
ся; колонии меньше 3 мм в диаметре.
Gerda fixa D’Udekem, 1864 (Ophrydium in Kahl,
1935) — одиночный бесцветный вид без раковины, с
очень коротким стебельком или без него; плохо опи-
санный вид типа G. glans.
О. hazele Lopez-Ochoterena et al., 1971 (non vidi; вид
из Мексики).
О. versatile hyalinum Wrzesniowski, 1877; колонии
мелкие, несколько миллиметров в диаметре, особи без
зоохлорелл.
О. insolitum Lepsi, 1957 — плохо описанный неоп-
ределимый вид, вероятно, рода Gerda.
О. lemnae Kahl, 1935 — мелкие особи без зоохло-
релл, без стебелька и раковины длиной 60—80 мк; это
вид рода Gerda, который Каль не признает.
Ophrydium naumanni Pejler, 1962 — «планктонная
модификация вида О. versatile» с относительно мелки-
ми зооидами (менее 100 мкм, у типового вида до
400 мкм); считается валидным видом, хорошо изучен в
Аргентине. Мелкие галлерты (мукозные домики) не
длиннее 200 мкм, включают немного зооидов на ко-
ротком тонком ветвистом стебельке или одну особь.
По этому виду пока имеются очень противоречивые
данные; в первоисточнике величина тела всего
40—50 X 10 мкм, ядро и вакуоль не зарисованы, пери-
стом не изучен.
Epistylis ophrydiiformis Nusslin, 1884 (Gerda, Ophry-
dium) — плохо описанный вид, вероятно плавающие
мигранты вида О. eichhornii или бесцветного штамма
О. versatile. Зооиды величиной 250 мкм с коротким ди-
хотомическим стебельком.
О. sigmoides Kellicott, 1885. Колониальный вид с
1—15 зооидами в галлерте длиной около 180 мкм (по:
Sommer, 1950); в оригинале зооиды длиной 135—
150 мкм, всегда парные, без стебелька, вероятно без
раковины.
О. vernale (Stokes, 1887) — одиночные бесцветные
особи длиной 250 мкм без лорики, с коротким стебель-
ком.
Ophionella picta Kent, 1882 — одиночные бесцвет-
ные бесстебельчатые зооиды длиной 170 мкм с галлер-
той необычной формы; это может быть лориката, но не
офридии (Ophrydium pictum in Kahl, 1935).
О. problematicum Herrick, 1884 — во всем, как
О. versatile, но мельче (160 мкм); описание очень пло-
хое, вид недостоверный.
Ophrydium crassicaule Penard, 1922 — до 5 зооидов
величиной 180—200 мкм в общей чашевидной ракови-
не, прикреплены ко дну тончайшим ветвистым стебель-
ком. Раковина мукозная, толстостенная, как у O.flexi-
lis.
Ophrydium versatile (Muller, 1786) — колонии ги-
гантские, шаровидные или аморфные до 10—15 см и
изредка крупнее (при слиянии смежных колоний; от-
мечалась длина массы 30—60 см), зеленые (это вид с
множеством зоохлорелл в цитоплазме, 400—500 в
каждой клетке) или коричневые от аккумуляции солей
железа; зооиды располагаются в один слой по перифе-
рии колонии, в трубчатых домиках (ячейках), вплот-
ную примыкающих друг к другу. От постерона с мел-
кой скопулой отходит тонкая длинная нить, возможно
пучок склеенных фибрилл или тонкий ветвящийся сте-
белек. Ротовая цилиатура стандартного типа, с 1.5 обо-
ротами спирали на стомодиске; в вестибулюме обыч-
ный набор кинет (Ml—М3) и герминальная кинета.
При плохих условиях в культуре, в природе осенью
зооиды покидают колонии и расплываются, или могут
инцистироваться на месте с образованием крупных
ТИП CILIOPHORA. КЛАСС OLIGOHYMENOPHOREA
929
гладкостенных цист с мукозным покровом; часть коло-
ний к зиме состоит из цист, другие колонии остаются;
часть зоохлорелл в цистах переваривается. Постоянная
темнота вызывает переваривание зоохлорелл и пере-
ход зооидов в тотального мигранта. Интересна консор-
ция микроорганизмов в галлертах — бактерии, водо-
росли всех групп, особенно диатомеи, солнечники (ге-
лиозои), цилиаты, в сумме более 50 видов, включая
загадочную неизученную сукторию Trichophrya ophry-
dii и метазоа — коловратки и нематоды.
Ophrydium eutrophicum Foissner, 1979 — колонии
такие же крупные, шаровидные, строение зооидов и
форма секреторной нити и трубковидных раковин
сходное с типовым видом, оба вида с зоохлореллами;
отличие — полимеризация витков спирали на стомо-
диске с 1.5 до 2.5 оборотов перед погружением в бук-
кон. Это важный отличительный признак у перитрих,
такие виды всегда выделяются в особые роды; чтобы
не усложнять определение офридиев, для этого вида
предлагается подрод Grinisfera Jankowski subgen n. с
указаным отличием, типовой вид Ophrydium (Grinisfe-
ra) eutrophicum Foissner, 1979.
Из этого списка валидны лишь виды О. hyalinum,
О. versatile, О. crassicaule, О. sessile, О. eutrophicum’,
вид О. flexile, вероятно, относится к бесстебельчатому
роду Ophionella {Ophionella flexile comb, n.), род Gerda,
вероятно, не существует.
Род 'Gonzeella Kufferath, 1953
Типовой вид G. coloniaris из озера в тропиче-
ской Африке (Конго). Как обычно у перитрих, это пло-
хо описанный вид, положение которого неясно; в Trai-
te (Lom, Puytorac, 1994) это валидный род в сем. Scyp-
hidiidae, к которому он не имеет никакого отношения;
рисунки перистома неправильные, их подробное опи-
сание (включая «кольцо ротовых циррусов») негра-
мотное и ничего не поясняет. Изучен только фиксиро-
ванный спиртовой материал, в пробе нашли 11 шари-
ков величиной 1.5—2 мм; зооиды располагаются
только по периферии, около 1000—1500 в одной коло-
нии; стебелька нет; прикрепление только к наружному
более плотному слою геля в колонии; макронуклеус
извитой. Отсутствие стебелька и образование коло-
ний — признак рода, помещенного в состав сем. Scyp-
hidiidae. У настоящих офридиев зооиды перифериче-
ские, тончайший стебелек трудно заметить, встреча-
ются бесцветные расы — не исключено, что Gonzeella
принадлежит к Ophrydiidae.
Подрод Indosphaera Jankowski,
1985
Типовой вид Conochilus arboreus Rajendran,
1971. Новый вид коловраток Conochilus, образующих
сферические мукозные колонии величиной 0.5—
2.5 мм, чаще 1.25 мм, с примерно 640 радиальными
зооидами (максимум 1000—2000) из эпибентоса мел-
кого пруда в южной Индии — это в действительности
колония перитрих неясного положения; я выделил для
них подрод Indosphaera в составе Epistylis, но как го-
моним заменяю новым — Indisphaera Jankowski sub-
gen. n. с тем же типовым видом — Epistylis (подрод
Indisphaera) arboreus comb. n.
Колонии подвижные, с вращением и пульсацией
при сокращении зооидов; длинные зооиды (320—
350 мкм) расположены компактным слоем только по
периферии, эпидиск явно эпистилидный, ядро показа-
но овальным, но так часто виден конец поперечного
С-образного ядра у перитрих. Особи прикреплены
очень тонкой длинной постесомой к вершинам длин-
ных кустовидных стебельков с правильной дихото-
мией, сходящихся в одну точку в центре сферы. Автор
рода мог не заметить мионемы, вид пока условно пере-
несен мной в состав Epistylis’, нельзя исключить и род-
ство с Ophrydium.
Сем. Opisthonectidae Foissner, 1976
(рис. 381, а)
Постоянно подвижные формы из толщи воды, от
дна до поверхности; плавание задним концом вперед с
помощью широкого венчика ресничек — полосы ко-
сых пектинелл по 6 ресничек в каждой; скопула почти
редуцирована, стебелька нет. Нет стадии сидячего тро-
фонта, цисты без стебельков. Объединить с Astylozoi-
dae в одном семействе нельзя, поскольку виды нерод-
ственны, несомненно произошли независимо от раз-
ных родов сессилид.
Род Opisthonecta Faure-Fremiet,
1906
Типовой вид О. henneguyi по монотипии; мас-
сивные бочонковидные формы с длинным С-образным,
почти кольцевым ядром; эпидиск плоский и очень ши-
рокий, всегда с «эпистомальной мембраной» — это
длинный узкий пучок ресничек, отходящий от группы
кинетосом у начала ресничного кольца, монокинета
сбоку от основания мембраны (вероятно, это предко-
вая мембранелла Ml). Спираль наружной ротовой ци-
лиатуры несколько длиннее стандартной и более за-
кручена в букконе; к правой и левой стенкам полости у
О. henneguyi прикреплены по две вакуоли с короткими
каналами. Апекс клетки сократимый, сфинктер может
полностью закрывать втянутый внутрь эпидиск с ци-
лиатурой. Аргиром — большое число вплотную сбли-
женных циклонем кортекса. У постерона скопление
гранул, как обычно у перитрих; скопулы практически
нет (рудимент с 8—10 кинетосомами в кольце), при
импрегнации и в электроскане видна мелкая пора без
ресничек. В локомоторном кольце в электроскане по
4 кинетосомы в пектинелле, в электронном микроско-
пе по 6 кинетосом. Тело сократимое, развита сложная
система мионем, выявляемая протарголом. Размеры
особей 73—170 мкм, цисты 55—88 мкм. Вид легко
разводится в лаборатории на сенном настое, особенно
в крупных сосудах с хорошей аэрацией,’ и поэтому хо-
рошо изучены все аспекты строения и биологии; особи
легко инцистируются, эктоциста без рельефа. Конъю-
гация анизогамная, микроконъюгант проникает в клет-
ку макроконъюганта и ядра синконъюганта делятся
59 Зак. №4163
930
ALVEOLATA
синхронно. Отмечена и хорошо изучена инфекция эн-
допаразитической суктории Endosphaera engelmanni
(но судя по вакуолям, хозяин — О. bivacuolata).
В схемах молекулярной филогении Opisthonecta
долгое время служила представителем перитрих, сей-
час проведен анализ других родов. Предполагается,
что вид произошел от крупных эпистилид — бентос-
ного вида Epistylis galea или планктонного E.fluitans.
Иногда вид считали мигрантом оперкулярий (Dingfel-
der, 1962).
Род включался ранее в состав сем. Telotrochidiidae,
но Telotrochidium имеет оперкулярный перистом; в
прежней литературе род Opisthonecta, предложенный
после Telotrochidium, часто отвергался и до недавнего
времени вид обычно цитировался как Т. henneguyi. Род
Telotrochidium с видом Т. henneguyi относили к Gyro-
coridae, Epistylidae, Astylozoonidae и даже K*Urceolarii-
dae (Mobilida).
Opisthonecta patula Foissner, 1975 с 3 вакуолями —
синоним типового вида, отличия несущественные.
О. bivacuolata Foissner, 1975 — валидный вид с 2 ваку-
олями, расположенными по обе стороны от вестибу-
люма. Ряд определений О. henneguyi в литературе в
действительности относится к О. bivacuolata (Foissner,
1975).
Другие виды — О. minima Foissner, 1975 и О. dubia
Foissner, 1975. Telotrochidium matthaii Gulati, 1925
{Opisthonecta matthaii comb, n.) — вид «с 1 или 2 ваку-
олями у рта»; по рисунку неясно, а без точной их топо-
графии вид нельзя определить. Vorticella vaga Romer,
1893 — плохо описанный вид, мигрант перитрих или
постоянно-планктонный вид.
Сем. Nidulidae Gajewskaja,
1933
На гаммаридах Байкала, число видов которых при-
ближается к 250, обитают эндемичные виды и роды
хонотрих и сукторий; перитрихи пока слабо изучены,
у Гаевской (Gajewskaja, 1933) много неправильных
определений; по моим данным на прибрежных гамма-
русах эндемичных родов безраковинных перитрих
(алорикат) нет, представлены виды обычных родов
Carchesium, Zoothamnium, Epistylis, Haplocaulus, Vorti-
cella-, на траловых видах с глубины от 30—50 м встре-
чаются 2 эндемика — роды Grainis и Nidula, первый с
мионемой. У Nidula группа зооидов погружена на дно
гигантской бокаловидной раковины, сужающейся к
основанию; мионемы нет.
Род Nidula Gajewskaja, 1933
Типовой вид N. multicapitata с панциря неоп-
ределенной «прозрачной» траловой гаммариды с глу-
бины 585 м; нет таких форм на береговых гаммарусах
7 родов, и пока повторно вид не найден. Редкий вид,
нашли лишь один раз 2 колонии на краю жабер рачка,
каждая с 6 зооидами. Рисунок Гаевской выполнен при
малом увеличении, понять строение раковины и зоо-
идов трудно. Показано 6 мелких особей величиной
45 X 25 мкм с очень узким коническим эпидиском,
С-образным ядром, в верхней части складчатой бо-
каловидной раковины величиной 150—200 X 80—
100 мкм; от скопулы каждого зооида ко дну раковины
идет широкий пучок фибрилл. Вероятно, особи сидят
на очень высоком дне раковины или подняты над ним
на выступах дна или коротких стебельках, дно четко
не показано. В стволе раковины фибриллы сливаются
в единый массивный осевой пучок. Вначале этот вид
был отнесен к роду Cothumia.
Строение перистома неясно, не изучено, и поэтому
род относили к эпистилидам и оперкуляриидам — к
разным семействам сессилид; но чаще род Nidula во-
обще не признавали, считая адаптивные признаки (об-
разование общей раковины) несущественными для
различения родов сессилид; вид упоминался как Epis-
tylis multicapitata или по ошибке как N. capitata. Но в
таком случае нужно ликвидировать все роды лорикат.
У Корлисса (Corliss, 1979), это синоним рода Epistylis.
В Traite (Puytorac, 1994) род приведен в составе Episty-
lis, с примечанием «лорика (рода Nidula) — это только
крайняя экологическая адаптация, гипертелия покрова
стебелька; похожие лорики имеются и в других родах
перитрих, сократимых и несократимых, которые не
выделяются в независимые роды». В Guide (Small,
Lynn, 1985) род Nidula валидный. В крайнем случае
это подрод эпистилисов, но таксон Nidula должен быть
сохранен. Едва ли это оперкулярии — они не представ-
лены в эпифауне байкальских гаммарид. Для рода
предложено подсем. Nidulinae Gaj., 1933 в составе Vor-
ticellidae Ehrenberg sensu lato (все перитрихи кроме ло-
рикат); позже оно было вновь предложено независимо
как сем. Nedulidae (sic) Najdenova, 1985 для раковин-
ных колониальных оперкуляриид Nedula (sic), Orbo-
percularia, Discotheca, Tauriella, Ballodora (последняя
здесь по ошибке). Родство Nidula с морскими родами
кажется невозможным, в Байкале нет морских цилиат,
и это не оперкуляриида по типу перистома. Позже Га-
евская сама отказалась от сем. Nidulidae, введя род в
состав Vaginicolidae.
Сем. Vorticellidae Ehrenberg,
1838
Одиночные и колониальные формы с длинным сте-
бельком, по оси которого проходит мионема; стебель-
ки сократимые, хотя бы частично. В списке Линна
(Lynn, 2002) 2 рода помещены в сем. Zoothamniidae
Sommer, 1951 — Craspedomyoschiston и Zoothamnium',
у последнего при сокращении стебелек не скручивает-
ся спиралью, как у вортицелл, становится коленчатым,
угловатым; сокращение первого указанного рода вооб-
ще не изучено. Vorticellidae включает роды не только
со спиральным сокращением стебелька, у Haplocaulus
сокращение частичное и стебелек также становится
коленчатым. Нежелательно различать семейства по
такому второстепенному признаку, но можно акцен-
тировать на другом отличии — у колониальных ворти-
целлид мионема не ветвится, у зоотамниид ветвится.
При такой диагностике вортицеллиды включают
одиночные формы, а из колониальных те роды, у кото-
рых каждый зооид после деления образует свою мио-
нему.
ТИП CILIOPHORA. КЛАСС OLIGOHYMENOPHOREA
931
Род Vorticella Linne, 1767 (рис. 378, б)
Типовой вид Hydra convallaria Linne, 1758.
Один из крупнейших родов цилиат, даже после пере-
носа многих видов в другие роды. Большинство видов
плохо описано, точное определение и синонимизация
невозможны, взгляды авторов противоречивы и часто
необоснованы; плохие описания и единичные рисун-
ки, на которых часто не показан весь стебелек и тем
более не отражена его вариация — причина вечных
конфликтов. Многие виды нужно официально объя-
вить неопределимыми. Тщательно изучены лишь око-
ло 30 пресноводных видов, по морским видам мало
точных работ. До сих пор неясно также имеются ли
специфические симбионты среди вортицелл, например
виды с черноморских ракообразных Vorticella idothea,
V. micra, V minima, V. sphaeroma, или это случайное
поселение перифитонных форм.
Типичная вортицелла — вид с колокольчатым те-
лом на длинном тонком стебельке, не расширенном у
вершины; мионема идет от скопулы до базодиска; кор-
текс с поперечными складками — циклонемы легко
видны, когда их мало, и только при иммерсии, когда
многочисленные; между ними редкие фибриллы и ар-
гиросомы. Виды с сетью аргирома относятся к Pseudo-
vorticella. Ротовая цилиатура без полимеризации вит-
ков спирали, типичная для сессилид, расположена на
очень широком антероне; у многих других родов анте-
рон незначительно расширенный или (у оперкулярий)
узкий. Пучок ресничек (эпистомальная мембрана) от-
мечен у немногих видов. Ядро С-образное, нет видов с
овальным компактным ядром. Вакуолей одна или две
(видовой признак), открываются узким канальцем в
полость буккона. Валик антесомы с мощной кольцевой
мионемой (сфинктер), в нижней части тела поясок с
короткими косыми рядами безресничных кинетосом
над скопулой.
Синонимы рода, по Аэшт, — Convallaria, Craterina,
Diceratelia, Ecclissa, Erythropsis, Ophrydia, Kerobalana,
Rinella, Spastostyla, Vorticellopsis — в основном это
роды из старинных работ, сведенные в синонимику
вортицелл Эренбергом. Ниже приведены примеры хо-
рошо изученных видов; ряд из них — это комплексы
почти неотличимых реальных видов V. chlorellata Stil-
ler, 1940; V. vernalis Stokes, 1887; V. astyliformis Fois-
sner, 1981; V. aquadulcis Stokes, 1887; V. infusionumDu-
jardin, 1841; V. fromenteli Kahl, 1935; V. convallaria
(Linne, 1767); V microstoma Ehrenberg, 1830; V. margi-
nata Stiller, 1931; V. picta (Ehrenberg, 1831); V campa-
nula Ehrenberg, 1831; V. octavaStdkss, 1885; V. bivacuo-
lum Song et Wilbert, 1989; V. alba Fromentel, 1874;
V. platysoma Stokes, 1887; V. lemnae Stokes, 1886;
V. aequilata Kahl, 1931; V. similis Stokes, 1887; V. limne-
tis Stokes, 1885; V. cupifera Kahl, 1931; V. spuripicta
Song et Wilbert, 1989; V. similis Stokes, 1887; V. se-
pulcreti Foissner et Schiffmann, 1975; вид, названный
V. conochili Stokes, 1888 in Song et Wilbert, 1989, опре-
делен неправильно. Для различения и валидации видов
рода сейчас используют новые признаки — соотноше-
ние числа циклонем выше и ниже пояска кинетосом,
наличие и положение апикального пучка ресничек
(эпистомальной мембраны), число и положение ва-
куолей.
Для пресноводных видов выделены группы (комп-
лексы видов) V. aquadulcis, V. infusionum, V. octava,
V. microstoma, V. convallaria с разным контуром тела; в
каждом из них — группа близких трудно различимых
видов. Начато сравнение культур видов вортицелл на
молекулярных филограммах, давшее неожиданные ре-
зультаты (Itabashi et al., 2002) — Opisthonecta henne-
guyi группируется с V. microstoma, разные штаммы
V. convallaria оказываются неродственными, род Vor-
ticella группируется с Epistylis, но не с Carchesium po-
lypinum. В другой схеме (Miao et aL, 2004) Opisthonecta
группируется с V. convallaria — это не потомок эпи-
стилид, как считали до сих пор, а постоянно плаваю-
щий бесстебельчатый трофонт вортицелл.
Аннотированный каталог рода с упрощенными ри-
сунками (схемами) видов приведен в работе Уорре-
на (Warren, 1986); исключены виды, перенесенные в
Pseudovorticella и Haplocaulus', несколько новых видов
добавлены в основном Сонгом и Вильбертом (Song,
Wilbert, 1989).
Общий признак рода, облигатный для всех ви-
дов, — мионема идет от скопулы до базодиска, мионе-
ма и стебелек скручиваются в плотную спираль по оси
тела, кортекс без сети аргирома, виды диморфные
(трофонт и мигрант). При делении одна особь не изме-
няется, вторая быстро превращается в мигранта, обра-
зуются реснички кольца кинетосом. На вершине сте-
белька не остается следа деления (зубцы, площадки), в
отличие от видов типа Haplocaulus.
Род Pseudovorticella Foissner
et Schiffmann, 1975
Типовой вид Vorticella monilata Tatem, 1870
(в первоисточнике V. convallaria var. monilata). Внеш-
ний облик, стебелек, перистом, форма ядра типич-
ные для вортицелл; различие родов — только по типу
аргирома. У вортицелл импрегнируются циклонемы,
аргентофильные ребра кортекса; среднее число их
выше и ниже пояса кинетосом — важный видовой
признак. Поверхность тела в беспорядке усеяна ар-
гетофильными точками, их принимали за кинето-
сомы, но это поры пелликулы. У Pseudovorticella
циклонемы сохранены, но между смежными рядами
видны четкие правильные прямоугольники, образо-
ванные фибриллами. Сеть, когда имеется, видна
прижизненно; у ряда видов прямоугольники вздутые,
образуют единый альвеолярный покров тела; другой
вариант — разрозненные пузырьки с гранулой глико-
гена в каждом у типового вида Р. monilata, рассеянные
по кортексу. При установлении рода кроме типового
вида включены Р. sphagni и Р. difficilis var. magni-
striata.
Род можно подразделить на 3 подрода — типовой
подрод Pseudovorticella s. str., Kiricella Jankowski sub-
gen. n., типовой вид P. sphagni (альвеолы кортекса
не вздутые, пузырьков нет) и Danicella Jankowski sub-
gen. п. (над телом сетчатый слой крупных прямоуголь-
ных альвеол, поверхность которых точно повторяет
сеть аргирома); типовой вид Р. chlamydophora (Penard,
1922); также включается Р. vestita (Stokes, 1885) и
Р. mutans (Vorticella in Penard, 1922).
932
ALVEOLATA
Основные виды Pseudovorticella sensu lato (с допол-
ненный no: Warren, 1987): P. chlorelligera (Kahl, 1935);
P. clampi Ji, Song, Al Rasheid et Li, 2005; P. difficilis
(Kahl, 1933); P. margaritata (Fromentel, 1874); P. micata
(Kahl, 1933); P. mollis (Stokes, 1887); P. monilata (Ta-
tem, 1870); P. mutans (Penard, 1922); P. nebulifera (Midler,
1786); P. papillata Jank., 1976 (= V. microstoma f. moni-
lata in Stiller, 1962); P. pseudocampanula Foissner, 1979;
P. punctata (Dons, 1918); P. subconica (Stiller, 1946);
P. quadrata Foissner, 1979; P. sauwaldensis Foissner et
Schiffmann, 1979; P. sphagni F. et S., 1974; P. stilleri
Warren, 1987; P. zooxanthelligera (Stiller, 1968); P. coni-
ca (Stokes, 1887) Jank. comb, n.; P. lockwoodi (Stokes,
1884) comb, n.; P. vestita (Stokes, 1883) Jank., 1976;
P. plicata (Gourret et Roeser, 1886) Jank., 1976; P. lima
(Kahl, 1935) Jank., 1976; P. chlamydophora, (Penard,
1922) Jank., 1976; P. pelagica (Stiller, 1968); P.nana
Song et Wilbert, 1989; P. perlata (Kahl, 1933); P. sinensis
Ji, Song, Al Rasheid, 2004; P.patellina (Muller, 1776)
Song et Warren, 2004; P. difficilis var. magnistriata F. et S.,
1974; P. paracratera Ji, Song et Warren, 2004; P. longa
Song, 1997 (= V. chydoridicoila in Song, 1991); P. elon-
gata (Fromentel, 1876) Leitner et Foissner, 1997; P. fasci-
culata (Muller, 1773) Foissner etBrozek, 1996. Вид Vorti-
cella infusionum Duj., 1841 считается валидным видом
своего рода, но на всех рисунках в первоисточнике
кортекс сетчатый — Pseudovorticella infusionum Jank.
comb. n. Иногда неправильно определяют виды, пу-
тая 2 рода, к примеру V. nebulifera Muller in Stiller,
1946 — морской вид с сеткой, поэтому мой перенос
вида V. nebulifera в состав Pseudovorticella невалиден.
Вид V. patellina у одних авторов с кольцами, у других
с сеткой.
Род Ascoidium Lindner, 1886 или Braun,
1887
Первый автор отметил частую потерю стебелька у
видов вортицелл, обитающих в грязной сточной воде
больниц; по его мнению, такие стадии обитают в
свиньях и в тифозных больных, цисты их заглатывают-
ся, остаются в тканях и вызывают очаги воспаления
(«тельца Мейшера»); этих патогенов он назвал Askoi-
dien или Ascoidien, а в реферате статьи второй автор
дал им название Ascoidium', это не поняли и позже в
ряде источников упоминали несуществующие таксо-
ны — вид Vorticella ascoidum Lindner, 1886 или род As-
coidium Lindner, 1886.
Род Pseudohaplocaulus Warren, 1988
Типовой вид Haplocaulus nicoleae Precht, 1935;
морской симбионтный вид с полихет Nicolea zosterico-
la в Германии; зооид эпистилидного типа по внешнему
облику, с нешироким телом и С-образным ядром; пел-
ликула с сетчатым орнаментом; стебелек относитель-
но короткий, не скручивается в спираль при сокра-
щении. Мионема расширена у вершины, идет вниз до
базодиска. На широком продольно исчерченном сте-
бельке видны зубцы — места отделения зооидов после
деления, колонии не образуются, на вершине стебель-
ка остается только одна особь. В составе рода Haploca-
ulus раньше были виды с обоими типами кортекса,
сейчас род разделен на два.
Лучше изучен пресноводный планктонный вид
Р. infravacuolatus Foissner et Brozek, 1996 (Foissner et
al., 1999) величиной 47—67 мкм, в массе обитающий
на ценобиях (сгустках нитей) планктонных цианофит
Anabaena в периоды цветения прудов и озер; над нитя-
ми синезеленых водорослей возвышаются клетки пе-
ритрих, их короткие прямые стебельки длиной до
200 мкм, но чаще ненамного длиннее тела, прочно
прикреплены, при сокращении изгибаются без скручи-
вания в спираль. Поверхность тела с сетью выпуклых
альвеол над сетчатым кортексом; сеть сохраняется
также и в полосе сближенных колец в инфрацилиатуре
мигранта; над скопулой ячейки мелкие. Ротовая спи-
раль снаружи более закручена, чем обычно у ворти-
целл, с пучком эпистомальных ресничек у начала спи-
рали. Другой вид с тех же водорослей — Р. anabaenae
(Stiller, 1940 in Vorticella'), очень близкий, отличается
иным положением вакуолей; контуры тела вортицел-
лидные (эпидиск очень широкий, тело резко сужается
к основанию); стебелек без апикальных зубцов, с ши-
рокой мионемой; при делении одна особь немедленно
уплывает. У сократившихся зооидов стебелек сжима-
ется продольно, но незначительно, становится склад-
чатым, трофонт осевой, не отклоняется вбок. На сине-
зеленых водорослях Anabaena этот вид перемешан с
зеленой Vorticella chlorellata. Вид из планктона Байка-
ла, названный Гаевской (Gajewskaja, 1933) Vorticella
monilata, в действительности может быть Р. infravacu-
olatus, хотя точно он не определим; настоящая V. moni-
lata — бентосный вид. Родство морского симбионтно-
го вида с полихет и пелагических прудовых форм ка-
жется странным и неестественным, и зубцы стебелька
на месте отделившихся зооидов у Р. nicoleae более ха-
рактерны для группы Intranstylum, у группы Vorticel-
la—Pseudovorticella их нет. Нет сомнения, что по мо-
лекулярному анализу род Pseudohaplocaulus окажется
двуфилетичным, сборным.
Род Baikalaster Jankowski,
1986
Типовой вид В. pelagicus из планктона Байка-
ла; зооиды одиночные, прикреплены относительно
длинным стебельком к нитям пелагических микрово-
дорослей Anabaena и Micrasterias. Ядро С-образное,
кортекс с циклонемами; стебелек при сокращении
скручивается в спираль. Тело у экватора расширено,
несет несколько (6—7) толстых массивных выростов,
далеко отходящих от тела и заполненных цитоплаз-
мой. Вид найден в фиксированных пробах планктона,
собранных вдали от берега; особи очень редкие среди
множества вортицелл обычного типа. Размеры тела in
fixo 46—57 X 78—109 мкм, длина отростков до
35 мкм. Позже мною была изучена инфекция патоген-
ных грибков в массовом перифитонном виде Vorticella
sp. на нижней стороне камней у берега Байкала; спо-
рангии крупные, с роговидными выростами, с толстой
стенкой; два отростка далеко выдаются за края тела.
Сейчас нет уверенности, что Baikalaster — валидный
ТИП CILIOPHORA. КЛАСС OLIGOHYMENOPHOREA
933
род, а не результат инфекции другого вида грибков,
бактерий или микроспоридий (как в случае кольподид
Cirrophrya) в обычных планктонных вортицеллах.
Род Rugaecaulis Lom et Puytorac, 1994
Типовой вид Vorticella conochili Stokes, 1888
по монотипии; специфический симбионт в колониях
пелагических коловраток Conochilus volvox, располо-
женных радиально в сферических студенистых коло-
ниях; стебельки перитрих погружены в мукозный слой
колонии, зооиды расположены снаружи. Идея рода не-
ясная, вероятно короткий стебелек неспособен к спи-
рализации, остается прямым и лишь частично сокра-
щается, покрываясь складками в своей верхней части (от-
сюда название рода: rugae — складки, caidus — стебелек).
Базодиска нет, мионема очень короткая, заостряется
книзу, и поэтому стебелек не может целиком сокра-
щаться или скручиваться в компактную спираль; сокра-
тим без спирализации лишь верхний отдел стебелька.
Вид, названный V. conochili, подробно описан Сон-
гом и Вильбертом (Song, Wilbert, 1989) с применением
импрегнации протарголом; стебелек в 2—3 раза длин-
нее тела, вид свободноживущий из перифитона, стан-
дартного для вортицелл строения; это определение не-
верное (нетоним). Второй вид — V conosoma Stokes,
1888 из того же хозяина в США {Rugaecaulis conosoma
Jank. сотЬ.дг); оба вида найдены в Conochilus unicor-
nis во Франции (Faure-Fremiet, 1949), и новый род
основан именно на этом повторном описании видов. У
V. conosoma стебелек несократимый и не складчатый,
сокращается лишь постесома зооида — вытянутая уз-
кая часть тела над скопулой (псевдостил). Нужно
включить также вид Vorticella dimorpha Stiller, 1940
(Rugaecaulis dimorphus Jank. comb, n.) с колоний Co-
nochilus unicornis, возможно синонимичный с назван-
ными выше видами; имеет 2 вакуоли, узкое вытянутое
коническое тело, стебелек в 1.5—2 раза длиннее тела,
очень тонкий и острый, мионема видна с трудом, ста-
дии сокращения не зарисованы. Есть сходство Rugae-
caulis и Pelagovorticella с таким же острым стебель-
ком, но с иным типом сокращения, эти роды могут
быть родственными.
Род Haplocaulus Warren, 1988
Род Haplocaulus Precht, 1935 был предложен для
2 видов без указания типового вида и поэтому невали-
ден (Aescht, 2001). Аэшт признает автором рода Уор-
рена (Warren, 1988), впервые указавшего тип рода —
Haplocaulus furcellariae Precht, 1935. По Аэшт, сино-
ним рода — Spastostyla, но в таком случае это название
должно стать родовым, a Haplocaulus Warren — сино-
нимом (см. диагноз рода Spastostyla}.
Типовой вид — внешне типичная вортицелла с от-
носительно коротким стебельком, эпибионт на мшан-
ке Furcellaria, вероятно перифитонный вид; выбор не-
удачный, вид лишь частично зарисован и кратко опи-
сан в нескольких строчках, не показан стебелек, его
мионема и способ сокращения. Диагноз вида следую-
щий (Precht, 1935, р. 457): «Величина 98 мкм; стебелек
до 400 мкм; мионема очень короткая, около 36 мкм;
этот вид я нашел только один раз на Furcellaria', он был
здесь в многочисленных особях; довольно постоянно
был выражен двойной валик перистома; ядро непра-
вильно извитое; этот вид годится для изучения сте-
белька». Кортекс с четкими циклонемами, без сетки.
У типичных видов рода при раздражении или фик-
сации стебелек изгибается один или несколько раз, но
не скручивается в спираль, мионема остается почти
прямой. Вероятно, большинство видов вортицелл с ко-
ротким стебельком относятся к этому роду.
Состав рода следующий (по: Warren, 1988, с изме-
нениями и дополнениями): Н. amphibiarum Banina,
1982; Н. amphiurae (Cuenot, 1891); Н. brehmi Lupkes,
1975; H. carinogammari (Stiller, 1963); H. chydoridae
Banina, 1977; H. ceriodaphniae Banina, 1977; H. sertula-
riarum subsp. cyclopi Banina, 1977; H. claudicans (Pe-
nard, 1922); H. conosomus (Stokes, 1889); H. crassicaulis
(Kent, 1881); H. contrahens Piesik et Piesik, 1978;//. dip-
neumon (Penard, 1922); H distinguendus Sommer, 1951;
H. eforianus (Tucolesco, 1962); H. elegans (Nenninger,
1948); H. elegans f. gammari Piesik, 1975; H epizoicus
(Sramek-Husek, 1948);//. extensus (Kahl, 1935); H fluvi-
atilis Schubemetskij et Chorik, 1977; H fusiformis (Ne-
nninger, 1948);//. languides Boitsova, 1977 (//. longuino-
ides ibidem); H. lentus Boitsova, 1977; H. kahlii (Stiller,
1931); H. leanderi (Stiller, 1968); H longinuclei Banina,
1982; H. macronucleatus (Nenninger, 1948); H. pelagicus
(Gajewskaja, 1933); H procerus (Nenninger, 1948); H.
sertulariarum (Entz, 1884); H stilleri Piesik, 1975
(H.stillerae nom. corr.); H terrenum Foissner, 1981;
H. vesicalis3&rda&, VF1T,H -walteri Guhl, 1985;//. heng-
sti Lupkes, 1976.
Ранее эти виды относили к Vorticella, реже к Intran-
stylum. Часть вортицелл имеет нетипичный способ со-
кращения, например, V. constricta Fromentel, 1874;
V. rhabdostyloides Kellicott, 1885 с зигзаговидным со-
кращением (Haplocaulus rhabdostyloides Jank.
comb. n.). Rhabdostyla nutans Gajewskaja, 1933 по ри-
сунку и описанию — тоже Haplocaulus (Н. nutans Jank.
comb. n.). Мелкий острый мускул показан в несократи-
мом стебельке Rh. arenicolae Fabre-Domergue, 1888
(Н. arenicolae Jank. comb. n.). Субстрат — перифитон,
копеподы, остракоды, офиуры, гаммарусы, креветки,
ручейники, водяной ослик, головастики лягушек;
большинство видов пресноводные. Род Monintransty-
lum (с короткой острой мионемой) усложняет ситуа-
цию и введен напрасно; к примеру, Vorticella claudi-
cans Penard, 1922 переведена в состав Haplocaulus,
предлагался ее перенос в Monintranstylum, но вместо
этого ее перенесли в состав Pseudocarchesium, как и
Н. crassicaulis, из этого списка часть видов оказывает-
ся колониальными. Из пресноводных видов хорошо
изучен Н. terrenum Foissner, 1981 — стебелек несколь-
ко короче тела, слегка изгибается при сокращении, ми-
онема остается почти прямой.
Род Tucolesca Lom in Corliss, 1979
Типовой вид Leptodiscus mirabilis Tucolesco,
1962 из приморского соленого озера (лимана) Текир-
гиоль в Румынии; вид очень редкий, отмечен дважды.
934
ALVEOLATA
Название Leptodiscus заменено новым как гомоним. На
рисунках — мелкая вортицелла величиной 27—30 X
19 мкм без сети кортекса с длинным стебельком
(80 мкм), изгибающимся при сокращении в виде не-
скольких широких далеко отстоящих колец, как базо-
стил зоотамния, но не в плотной спирали, как у ворти-
целл, и не в согнутом виде, как у Haplocaulus. Рисунок
и описание перистома (постоянно открытый и несо-
кратимый, без эпидиска, с необычно длинными мемб-
ранеллами) и четковидного ядра фантастические, не-
сомненно неправильные; возможно, 7 ядерных зачат-
ков у эксконъюганта, характерные для всех перитрих,
были приняты за цепочковидное ядро. Род пока недо-
стоверный, такой способ сокращения стебелька нужно
подтвердить при специальном изучении морских вор-
тицелл. Название рода в Traite (Puytorac, 1994 — дваж-
ды только как Tucolescoa) и указанная длина тела
(19 мкм) неправильные.
Род Spastostyla Entz, 1884
Типовой вид Rhabdostyla sertularium Kent,
1881 по моему указанию. По Аэпп\ род невалиден как
синоним рода Vorticella или Haplocaulus. Уоррен
(Warren, 1988) считает названия R. sertularium Kent,
1881 и S'. sertulariarum Entz, 1884 разными видами
2 родов, но это лишь неправильное написание (эрро-
ним), вид один, у Энтца (Entz, 1884) он описан и зари-
сован лучше, чем у Кента (Kent, 1881). Кент отметил
внутреннюю полость (светопреломляющую гомоген-
ную мионему) в стебельке, Энтц четко показал мионе-
му на рисунке, поэтому нельзя сказать, что у Кента это
вид без мионемы. Энтц исключил из состава Vorticella
также вид V. brevistyla Udekem, 1862 с таким же сте-
бельком, как у вида с гидроидов, но прямого переноса
в состав Spastostyla нет; поэтому род можно считать
монотипичным. Под названием «sertulariarum» вид пе-
реносили в состав Vorticella, Rhabdostyla, Opisthostyla
и Haplocaulus.
Типовой вид рода — специфический симбионт гид-
роидов рода Aglaophenia (кустовидные Plumulariidae),
широко распространенных в теплых морях; в Европе
больше 10 достоверных видов рода. Типовая раса Кен-
та найдена в массе на A. pluma у Нормандии, раса Энт-
ца у — Неаполя. Особи мелкие, полные зооксантелл
(перидиней рода Symbiodinium), с коротким широким
стебельком, мионема идет почти на всю длину сте-
белька. Строение вида и способ сокращения позже
специально не изучались, но можно осмотреть фикси-
рованный музейный материал Aglaophenia и опреде-
лить характер сокращения особи и стебелька; это точ-
но Haplocaulus с не-спиральным стебельком.
По Энтцу, изучавшему живых цилиат, стебелек ко-
роткий, гибкий, при сокращении особи сжимается не-
значительно и не образует спиральных витков; длина
его достигает длины тела, толщина равномерная, мес-
тами со складками; при сокращении число поперечных
складок увеличивается, они становятся кольцевыми.
Поскольку стебелек не спирализуется и не перегибает-
ся вбок, Кент решил, что он несократимый, и отнес вид
к Rhabdostyla. Нет отличий между этим и предыдущим
родом; все известные виды Haplocaulus нужно переве-
сти по приоритету в состав Spastostyla. В обзоре Haplo-
caulus Precht, 1935 (Warren, 1988) как валидный вид
включен Н. sertulariarum (Entz, 1884) Banina, 1982, но
если так, то название Haplocaulus должно быть анну-
лировано как синоним рода Spastostyla. Совершенно
недопустимо написание Spastostyla sertulariarum Entz,
1884 — в первоисточнике четко сказано «Rhabdostyla
sertulariarum Kent, р. 665, pl. 34» и «Spastostyla sertula-
riarum S. Kent sp.»; Энтц просто неправильно прочел
или запомнил название, данное Кентом, или намерен-
но изменил его написание по правилам грамматики
(Sertularia — гит); хозяина раньше определяли как
Sertularia. У Энтца это не новый вид, и данное им опи-
сание — это уточнение морфологии вида Кента, зари-
сованного очень мелко, без внутренних деталей. Пра-
вильное название типового вида — Spastostyla sertula-
rium (Kent, 1882) Entz, 1884. Мною готовится петиция
в ICZN об официальном запрете использования назва-
ния «sertulariarum».
В состав рода Spastostyla как comb. пп. переводятся
почти все виды из приведенного выше списка рода
Haplocaulus — Spastostyla amphiurae, S. brehmi, S. cari-
nogammari, S. chydoridae, S. ceriodaphniae, S. conosoma,
S. contrahens, S. dipneumon, S. distinguendus, S. eforianus,
S. elegans, S. epizoicus, S. extensus, S. fluviatilis, S.fusi-
formis, S. languides, S. lentus, S. kahlii, S. leanderi, S. longi-
nuclei, S. macronucleatus, S. pelagicus, S. procerus, S. stillerae,
S. terrenum, S. vesicalis, S. walteri, S. hengsti, S. rhabdos-
tyloides, S. nutans, S. arenicolae Jankowski comb. nn.
Литература полна ложных определений этого вида.
Находка вида Гаевской (Gajewskaja, 1933) в Байкале
на глубоководных гаммаридах, с другой формой тела
и без симбионтных водорослей — фикция, неправиль-
ное определение (нетоним), так же как и находка
вида Vorticella sertulariarum (Kent, 1881) на речных
раках Мексики, находка Haplocaulus sertulariarum
subsp. cyclopi на циклопах близ Петербурга, Н. sertula-
riarum на головастиках лягушек Rana temporaria,
Rhabdostyla sertulariarum var. amphiurae на офиурах
Amphiura squamata. Вид облигатно специфичен для
Aglaophenia и не встречается в пресной воде, повсюду
есть внешне сходные виды, которых определяют не-
правильно.
Род Spinivorticella Jankowski, 1993
Типовой вид Vorticella echina King, 1931; пери-
фитонный вид вортицелл с циклонемами (без сети ар-
гирома), типичным длинным стебельком со спираль-
ным сокращением; поверхность тела усеяна шипами
разной длины и толщины. Виды рода найдены в США,
на Мадагаскаре и в Африке. Сходство с планктонной
Hastatella незначительное, этот шипоносный род мог
произойти от Astylozoon.
Тот же вид независимо был выделен в новый по-
дрод Echinovorticella Foissner et al., 2002 в составе рода
Vorticella; дано подробное описание вида в культурах
из почвы в Намибии с применением протаргола; назва-
ние подрода невалидное как синоним. В состав подро-
да был включен также вид Vorticella voeltzkowi Sondhe-
im, 1929 {Spinivorticella voeltzkowii в моем варианте) с
14 кольцами шипов. У V. echina шипы отходят в бес-
ТИП CILIOPHORA. КЛАСС OLIGOHYMENOPHOREA
935
порядке местами от кольцевых ребер кортекса, не от
желобков между ребрами, сохраняются у мигрантов и
на наружной оболочке цисты; внутри содержат часть
цитоплазмы с митохондриями, это не плотные вырос-
ты панциря, а локальные выросты тела, кортекс здесь
не утолщен; число шипов варьирует от нескольких до
почти 70, изменчива их длина и толщина. Длина ши-
пов типовой расы до 10 мкм, диаметр цисты 10—
20 мкм, в Намибии соответственно 4 и 22—28 мкм,
возможно наличие 2 разных видов.
При описании вида (Foissner et al., 2002) подчерки-
вается, казалось бы, незначительный признак — нали-
чие 2 узких пучков (эпистомальных мембран) из не-
скольких длинных ресничек, расправленных у мигран-
тов несмотря на сжатие перистома; их основания с
несколькими кинетосомами удалены одно от другого у
свободного конца ундулирующей мембраны. По числу
и положению пучков предполагается дальнейший
сплиттинг рода Vorticella или по крайней мере разде-
ление на подроды, которые без сложной импрегнации
протарголом будут неопределимые.
Род Parazoothamnium Piesik, 1975
Типовой вид Р. stenotica по обозначению Уор-
рена (Warren, 1988). В каталоге Аэшт род валидный,
с сохранением авторства Песика, но это невозмож-
но — еслштип указан позже другим автором, а не в
первоначальном описании, нельзя считать Песика
автором рода в соответствии с правилами ICZN. Итак,
типовой вид Р. stenotica (Piesik, 1975) Warren, 1988,
род меняет автора — Parazoothamnium Warren, 1988.
Род был предложен для 2 разнотипных новых ви-
дов (Р. gammari и Р. stenotica) и поэтому не может
сохранить авторство Песика. Несмотря на название,
это одиночный (не-колониальный) вид — внешне
обычная вортицелла с нешироким телом, с малосокра-
тимым стебельком, покрытым тесными кольцевыми
складками. Редкий вид с пресноводных амфипод Gam-
marus pulex subsp. fossarum (подрод Rivulogammarus),
заселяет гнатоподы, переоподы и коксальные щитки
хозяев. Основной признак рода — двойное сокраще-
ние стебелька: сначала стебелек сжимается по всей
длине как гармошка, оставаясь прямым и покрываясь
множеством складок, далее отклоняется и частично
скручивается в 3—5 колец, как у вортицелл. У рас-
правленных форм мионема прямая, без волнистых из-
гибов, характерных для мионемы вортицелл. В состав
рода Уоррен включает и морской перифитонный вид
Vorticella claparedei Andrusova, 1886 предположитель-
но с таким же типом сокращения стебелька; это плохо
описанный недостоверный вид, возможно начало рос-
та колонии перитрих, вероятно Zoothamnium, он не
имеет никакого отношения к типовому виду рода
Р. stenotica.
Род Piesika Warren, 1988
Типовой вид Parazoothamnium gammari Piesik,
1975 по монотипии. Симбионт гаммарусов G. pulex
subsp. pulex (подрод Rivulogammarus) на гнатоподах,
переоподах и коксальных пластинках хозяев; форма
тела и стебелек, как у предыдущего вида, длина стебель-
ка до 240 мкм при длине тела около 70 мкм; кортекс с
кольцами мелких сферул, поэтому можно предполо-
жить наличие сети аргирома, как у видов Pseudovorti-
cella. При сокращении нет спирализации мионемы,
стебелек продольно сжимается и покрывается сплош-
ными поперечными складками; при сильном стимуле
стебелек сгибается в виде петель. Отмечено инцисти-
рование. У Уоррена (Warren, 1988) фальшивый рису-
нок вида, в оригинале нарисована не сеть, а ряды сфе-
рул кортекса.
Род Pelagovorticella Jankowski, 1980
(рис. 381, а)
Типовой вид Vorticella mayeri Faure-Fremiet,
1920. Род предложен для 2 видов вортицелл из пресно-
водного планктона; род принят в монографии планкто-
на Фойсснера (Foissner et al., 1999). У прикреплен-
ных вортицелл стебелек прирастает к субстрату с по-
мощью тонкого диска, мионема равной ширины по
всей длине; у пелагических видов мионема постепен-
но становится уже, как и стебелек, оба заостряются,
базодиска нет. Это различие — родовой признак.
Именно это различие послужило основой для выделе-
ния рода, а не образ жизни (плавание), как ошибочно
указывают в литературе. В остальном это типичные
вортицеллы, с небольшим числом циклонем, С-образ-
ным ядром; тело с характерным изгибом, стебелек на-
правлен вперед по оси тела, примерно в 3—4 раза
длиннее тела, может частично скручиваться близ тела
зооида; длина особей около 35 мкм, стебелька до
140 мкм. Как типовой вид из двух специально выбран
вид без спирализации стебелька, в этом отношении это
не Vorticella.
Второй вид — Vorticella convallaria var. natans Fa-
ure-Fremiet, 1924 — Pelagovorticella natans (Faure-Fre-
miet, 1924) comb, n., отличается деталями строения
стебелька и его способностью скручиваться в плотную
спираль в участке ниже тела зооида; длина стебелька
400—500 мкм при длине зооида 70 мкм. Вероятно,
правильное название вида V. natans Kahl, 1935—Pela-
govorticella natans (Kahl, 1935) comb, n., поскольку ла-
тинские названия для «varietas» невалидные. Общее —
отсутствие прикрепительного диска и заострение сте-
белька и мионемы. Морской аналог (следующий род)
имеет сложный полиморфный цикл развития; по
Клампу (Clamp, 1995) в культурах V. natans появляется
и сидячая стадия в виде стандартного стебельчатого
трофонта, его деление дает пару трофонт + мигрант
или трофонт + трофонт, во втором случае прикреплен-
ный стебельчатый трофонт отрывается и уплывает.
Деление пелагических форм дает 2 трофонтов. Седен-
тарная стадия вида могла определяться под 3 синони-
мичными названиями. Кламп неправ в том, что род Pe-
lagovorticella был предложен мной только в связи с
плаванием трофонтов — я четко указал 2 отличия сте-
белька планктонтов от стандартных бентосных ворти-
целл. Диморфизм стебельков отмечен Клампом у
V. striata, нетипичный цикл у V. oceanica (Clamp,
1998); можно ожидать новых родов для этой группы.
936
ALVEOLATA
2 типа стебелька по их сократимости у Р. mayeri и
Р. natans — признак подродов или даже самостоятель-
ных родов.
Род Planeticovorticella Clamp et Coats,
2000
Типовой вид P.-finleyv, морской вид из планк-
тона Чесапикского залива на востоке США, цикл изу-
чен в пробах планктона и в лабораторных культурах.
Кроме планктонной фазы с плавающими бесстебель-
чатыми трофонтами с открытым перистомом, без рес-
ничного кольца, в цикле развития есть и типичный для
вортицелл сидячий трофонт; тело колокольчатое, ши-
рокое, стебелек сократимый по типу вортицелл, в не-
сколько раз длиннее клетки, ядро С-образное, кортекс
без сетки. В этой фазе, если не знать о сложном цикле,
род неопределим. В планктоне трофонты плавают пе-
ристомом вперед; в культуре отмечены и особи с ко-
ротким прочным стебельком или вообще без стебель-
ка. Деление плавающей особи обычно дает не свобод-
ного мигранта, а 2 трофонтов, прикрепленных своими
скопулами к короткому прочному стебельку. Особи
некоторое время сохраняются в таких парах, затем
отделяются от стебелька и плавают самостоятельно.
Другой вариант деления в планктоне — образование
пары трофонт + мигрант, с их быстрым разъединением.
Вероятно, мигранты таких пар оседают на дно и растут
как стебельчатые трофонты. Конъюгация отмечена на
дне и в планктоне у подвижной и стебельчатой стадии.
Наличие прикрепленной стадии не является обязатель-
ным условием цикла, такие трофонты редки и случай-
ны, основная фаза цикла планктонная. Полиморфный
цикл развития — признак нового рода вортицеллид.
Бесстебельчатая подвижная стадия трофонта есть у
пресноводной Vorticella astyliformis, но неизвестно,
способны ли они к делению или конъюгации.
Род Cotensita Jankowski, 1982
Типовой вид С. commensalism обычный эпиби-
онт на каудальной части тела личинок ручейников Bai-
calina bellicosa, несущего комплекс перитрих 4 родов в
разных отделах тела—Opercularia, Carchesium, Baica-
lonis и Cotensita, нередко и раковинных Platycola. Оди-
ночные формы; трофонт типично вортицеллоидный, с
широким колокольчатым телом, плоским широким
стомодиском без дискофора и с узким валиком; ядро
С-образное. Стебелек примерно вдвое длиннее тела, у
вершины неправильно вздутый и извитой, иногда
скручен в этой зоне спирально (это не стадия сокраще-
ния, а нормальный вид стебелька). При сокращении
зооида стебелек слегка сжимается и отклоняется вбок,
сохраняя характерый облик своей верхней части, пол-
ное сокращение мионемы и ее спирализация не отме-
чены; зооид также сжимается и отклоняется вбок. Ми-
онема постепенно сужается и не достигает базодиска.
Вероятно, модификация стебелька — опорный аппа-
рат зооида, как у Allomeron, но это не колониальный
вид. Род принят Уорреном (Warren, 1988) и сближает-
ся с Haplocaulus.
Род Carchesium Ehrenberg, 1831
Типовой вид Sertulariapolypina Linne, 1758 по
обозначению Фроментеля (Fromentel, 1874). Синони-
мия с Campanella, не имеющей мионемы, с полимери-
зацией внутренней и наружной ротовой спирали (у
Aescht, 2001) — необъяснимая ошибка. Обычный пре-
сноводный вид; крупные колонии (до 3 мм) легко вид-
ны в воде на камнях, водных растениях, в колонии
иногда до сотни зооидов, ветви широкие, базальный
ствол длинный, многократно ветвится. Зооиды очень
крупные, с извитым тонким ядром и широким стомо-
диском вортицеллидного типа. Родство с Vorticella не-
сомненно, зооиды сходные. Колонии часто служат
приютом для других простейших и коловраток, среди
симбионтов можно найти мелких вортицелл и сукто-
рий 3 видов. Вид легко найти в ручьях и на берегу
крупных озер на нижней стороне валунов, на ветках
упавших в воду деревьев, в реках на макрофитах среди
зоотамниев и эпистилисов.
По традиции любые крупные кархезии определя-
ются как С. polypinum, но в ряде мест можно найти ко-
лонии с крупными или с более мелкими зооидами; ве-
роятно, есть 2 основных перифитонных вида — С. po-
lypinum и, вероятно, С. wassenum (описан в ЮАР).
Длина зооидов С. polypinum достигает 80—140 мкм, у
второго вида 230—280 мкм. При анализе колониаль-
ных форм в Китае нашли 2 типа колоний группы С. po-
lypinum, северная и южная, с границей по реке Янцзе; в
США выяснилось, что условно определяемые С. poly-
pinum в действительности соответствуют нескольким
видам.
Более мелкие колонии других видов обитают в пе-
рифитоне, на водных ракообразных. Общий при-
знак — наличие мионемы в стволе и в каждой ветви,
но без их контакта. Первичная мионема при делении
особи не ветвится, сохраняется у одной особи, другая
начинает секрецию мионемы, и это повторяется при
каждом делении. При раздражении и фиксации ствол и
ветви скручиваются спирально, сохраняется вортицел-
лидный способ сокращения. Зооиды в колонии обра-
щены в одну сторону от оси стебелька; их ветвь может
быть обособлена от основной септой, которой нет у
Zoothamnium.
Род Carchesium встречается в основном в пресной
воде, в море видов мало; много видов встречается на
пресноводных ракообразных и водных насекомых,
меньше — связаны с моллюсками. Примеры видов:
С. rarus Boitsova, 1977; С. aselli Engelmann, 1862;
С. batorligetiense Stiller, 1953; C. brevistylum Stiller,
1941; C. corymbosum Penard, 1922; C. cyclopidarum Ne-
nninger, 1948; C. duplicatum Precht, 1935; C. epistylis C.
et L., 1859; C. gammari Precht, 1935; C. inconjunctum
Korfsmeier, 1948; C.jaerae Precht, 1935; C. lachmanni
Kent, 1881; C. matthesi Szczepanowski, 1976; C. parae-
pistylidis Wang, 1935; C. prechti Banina, 1977; C. specta-
bile Ehrenberg, 1838; C. steiniVrechi, 1935; C. trichopte-
rarum Nenninger, 1948; C. umbilicatum Stiller, 1941;
C. wassenum Viljoen et Reinecke, 1988 и мн. др.
Хозяева симбионтных видов — коловратки, цикло-
пы, кладоцеры, пресноводные и морские гаммариды,
изоподы в пресной воде (Asellus') и в море (Jaera), ли-
чинки стрекоз, поденок, веснянок, ручейников, кревет-
ТИП CILIOPHORA. КЛАСС OLIGOHYMENOPHOREA
937
ки, реже другие хозяева. Аберрантный вид — Carche-
sium voigti Matthes, 1950 с береговых изопод-онискоид
Ligia oceanica в Адриатике; колония и ее мионемы ти-
пичные для кархезиев, но по форме тела и уменьше-
нию перистома это оперкулярии, хотя нет обособления
дискофора (конвергенция?). Этот вид заслуживает
специального изучения. Интересны также находки ви-
дов рода на морских моллюсках — С. abrae Precht,
1935 (на основании сифонов двустворчатки Abra alba в
Кильской бухте, ФРГ) и С. pisi Delphy, 1938 (на серд-
цевидках Cardium edule). Известны перитрихи на пре-
сноводных двустворчатках (унионидах), но существу-
ет и группа редко встречающихся видов в море, напри-
мер, по моему материалу на модиолах Мурмана. Прехт
(Precht, 1935) всегда правильно рисовал цилиат, поэто-
му можно верить, что С. abrae имеет сетчатый аргиром
и по аналогии с Pseudovorticella, Pseudohaplocaulus и
Zoothamnopsis переносится в состав следующего
рода — Epicarchesium abrae (Precht, 1935) Ji. Song et
Warren, 2004 независимо от того, родственный ли он с
пресноводными видами или это конвергенция.
Род Epicarchesium Jankowski, 1985
Типовой вид Carchesium granulatum Kellicott,
1887. У этого перифитонного вида с водных растений
и камбарид на поверхности тела были зарисованы мел-
кие вздутия лелликулы в правильных рядах, как у Vor-
ticella monilata', в колонии до 6 зооидов. Такой рельеф
имеется только у перитрих с сетчатым аргиромом, не с
линейным, поэтому вид был выделен мною в особый
род — как в случае псевдовортицелл или подобных
форм с мионемой. Род принят в новой литературе. Ко-
лонии относительно крупные, независимая мионема
имеется в стволе и в каждой ветви; в сущности это
двойник рода Carchesium во всем, кроме аргирома. Ко-
лонии с длинным стебельком, с неправильным ветвле-
нием; зооиды узкие и вытянутые, с 2 вакуолями, на
широких стебельках с крупной пластинчатой мионе-
мой, не соединенной с мионемой осевой особи. Ячей-
ки сети аргирома мелкие, альвеолы крупнее и их отно-
сительно мало, видны как разрозненные вздутия кор-
текса.
В планктоне озер обычно встречаются колонии
вида, который определялся как Zoothamnium limneti-
сит Svec, 1897; но Швец сам упоминает ранее описан-
ный вид Z. pectinatum Zacharias, 1897, поэтому пра-
вильное название вида — Epicarchesium pectinatum
(Foissner et al., 1999). Раньше знали об идентичности и
синонимии видов, но поскольку лучше был описан
Z. limneticum, предпочитали пользоваться этим назва-
нием. Колонии достигают длины 1—1.5 мм при длине
особей всего 70—80 мкм; это не зоотамнии, оба вида
были позже переведены в состав Carchesium-, на всем
теле — система аморфных, овальных или квадратных
вздутых альвеол; под ними при импрегнации или в
электроскане открывается правильная сеть прямо-
угольников кортекса. В разбавленном йоде альвеолы
красятся в сине-фиолетовый цвет (содержат гликоген).
Фойсснер (Foissner et aL, 1999) перевел Z. pectinatum
в состав рода Epicarchesium, но нужно перевести
и второй вид и уже в пределах рода Epicarchesium
объявить его синонимом — Е. limneticum comb. n.
Характерно боковое одностороннее расположение
длинных ветвей крупной колонии, редкое у перитрих;
на месте отделившихся зооидов видны зубцы у верши-
ны стебельков. При делении дочерняя особь секрети-
рует подошву и далее отделяется, оставляя зубец, или
образует новую ветвь.
Род Pseudocarchesium Sommer,
1951 '
По Аэшт, род невалиден, поскольку Зоммер не обо-
значила типовой вид. Род предложен ею для 3 видов —
Carchesium gammari Precht, 1935, С. steini Precht, 1935
и C. inconjunctum Korfsmeier, 1948. По Аэшт, Янков-
ский обозначил Carchesium aselli Engelmann, 1862 как
типовой вид рода, но этого вида нет в первоописа-
нии — он не был включен в состав рода, поэтому не
может быть обозначен как типовой. Аэшт не читала
статью Зоммер (Sommer, 1951), на которую ссылает-
ся — действительно, вначале были названы эти 3 вида,
но род ими не ограничен, далее включен и четвер-
тый — Pseudocarchesium aselli, и это название много-
кратно приводится по всей статье только в такой фор-
ме. Это значит, что включены 4 вида, а не 3, и Р. aselli
может быть обозначен как типовой вид. Более того, в
первоисточнике включены еще 2 вида — Ps. ovatum
Sommer, 1951 и Ps. erlangensis (Nenninger, 1948), т. e.
род предложен для 6 видов. Чтобы не было сомнений,
откроем с. 396 в статье Зоммер (Sommer, 1951): «5.
Gattung Pseudocarchesium gen. n. Pseudocarchesium
aselli (Engelmann) (= Carchesium aselli)... (далее диа-
гноз)... Carchesium aselli wird auf Grund der hier entwic-
kelten Systematik in die neue Gattung Pseudocarchesium
ubemommen». При смене авторства («принцип Венце-
ля») я оказываюсь автором рода, который не признаю
валидным — Pseudocarchesium Jankowski, 1993.
Колонии, зооиды, их ядра и мионемы идентичные с
Carchesium, стебелек ветвится, мионема длинная в
осевом стебельке примонта, короткая у ветвей; на вер-
шинах стебельков выступы — следы уплывших после
деления зооидов. Отличия 2 родов в способе сокраще-
ния — со спирализацией и без нее, с изгибом ствола
колонии. По этому признаку близкие роды распреде-
ляются по разным семействам (Vorticellidae и Zoo-
thamniidae). Вероятно, лучше определять разницу при
фиксации колоний формалином. Признак в целом ма-
лосущественный, трудно диагностируемый, могут
быть промежуточные формы; роды лучше предлагать
по отличиям морфологии, а не способа сокращения
стебелька. Нет никаких доказательств независимого
происхождения 2 родов в разных семействах, нет мо-
лекулярных филограмм специально для сравнения
этих 2 родов, хотя крупные колонии обоих родов мож-
но легко собрать в бентосе (С. polypinum) и планктоне
(Р. pectinatum). Постепенно часть видов уходит из со-
става Carchesium в Pseudocarchesium, и описываются
новые виды, род становится относительно крупным.
В составе рода числятся в новой комбинации
(comb, nn.) виды Р. amstelodamensis Bierhof et Roos,
1977; P. erlangensis (Nenninger, 1948); P. gammari
(Precht, 1935); P. steini (Precht, 1935); P. aselli (Engel-
938
ALVEOLATA
mann, 1862); P. ovatum Sommer, 1950; P. pyriformis Ba-
nina, 1977; P. amphibiarum (Nenninger, 1948); P. claudi-
cans (Penard, 1922); P. umbilicatum (Stiller, 1941);
P. rhyacophilae (Stiller); P. mirabilis Boitsova, 1977;
P. aselli var. ovatum (Nenninger, 1948); P. ephemera Sra-
mek-Husek, 1948; P. inconjunctum (Korfsmeier, 1948) и
другие виды; часть видов общая со списком рода Carc-
hesium, поскольку перевод в другой род не аргументи-
. рован. Я убежден, что оба рода должны находиться в
одном семействе (по приоритету в составе Vorticellidae
Ehrenberg, 1838).
Род Monintranstylum Banina, 1977
Типовой вид не обозначен, первоначально включе-
но несколько сходных видов. Мною указан тип М. ro-
tundus Banina, 1977, поэтому Аэшт сменила автор-
ство — Monintranstylum Jankowski, 1993. При такой
практике («принцип Венцеля») я снова оказываюсь ав-
тором рода, который не признаю валидным. Данный
род предложен для одиночных перитрих с коротким
стебельком и укороченной мионемой, около половины
длины стебелька; такая мионема не может скручивать-
ся спиралью, и при сокращении стебелек изгибается
под углом, зооид наклонен к субстрату. Нет уверенно-
сти, что зарисованы не основатели колоний (примон-
ты), а именно одиночные виды.
Первоначально включены виды М. rotundus Banina,
1977 (небольшие группы на панцире Daphnia longispi-
па) со сферическим телом, мелким перистомом, стебе-
лек до 2 раз длиннее тела, с короткой острой мионе-
мой; М. stammeri В., 1977 (многочисленные особи на
голове, на теле под панцирем и на выводковой сумке
Polyphemus pediculus, на панцире Daphnia pulex, Cerio-
daphnia quadrangulata и Cyclops sp.) с широким телом
на низком стебельке, в котором острая мионема почти
достигает его основания; М. sommeri В., 1977 (назва-
ние в честь Гертруды Зоммер, поэтому правильно
М. sommerae nom. согг.) — это вид с абдомена Еисус-
lops serrulatus и с панциря остракод Cypris sp., найде-
ны в многочисленных группах; тело рюмковидное,
стебелек длиной 10—80 мкм, мионема почти достига-
ет базодиска. Ядро у первого вида поперечное почко-
видное, у остальных С-образное. На остракодах свои
виды симбионтов, наличие их на циклопах невозмож-
но. Позже добавлен вид Intranstylum ranae Stiller, 1953
{Monintranstylum in Banina, 1982) с хвоста головасти-
ков лягушек.
По мнению Уоррена (Warren, 1988), род Monintran-
stylum сомнительный, скорее это виды рода Haplocau-
lus (но прямого переноса нет), поскольку мионема у
последних может дегенерировать и укорачивается. Во
всяком случае это стимул для тщательного изучения
мелких одиночных симбионтов дафний, циклопов и
остракод. Название рода Haplocaulus Precht, 1935 сей-
час сменило авторство {Haplocaulus Warren, 1988), по-
этому должно быть заменено по приоритету названием
Spastostyla Entz, 1884, а род Monintranstylum Banina,
1977 {Monintranstylum Jankowski, 1993) уходит в сино-
нимику. Нет четкой границы между формами с тупой
длинной мионемой {Haplocaulus) и короткой острой
{Monin transtylum).
Род Intranstylum Faure-Fremiet, 1904
Типовой вид I. contrahens {= Epistylis steinii
var. contrahens Faure-Fremiet, 1904) по моему обозна-
чению; этот род был предложен для указанного вида и
для Carchesium aselli Engelmann, 1862 (сейчас в соста-
ве Pseudocarchesium). «Var. contrahens» означает фор-
му с длинной массивной не заостряющейся мионемой,
это, конечно, особый вид, не Epistylis steinii. Род вклю-
чает колониальные формы с С-образным ядром и
очень короткими мионемами в стволе и стебельках
зооидов; мионемы обычно заострены к нижнему кон-
цу, от них или от скопулы вниз может отходить ком-
пактный длинный пучок фибрилл, который по ошибке
можно принять за мионему. В колонии каждый зооид
сокращается независимо от других. У I. duplicatum
ветвящийся пучок фибрилл производит впечатление
единой мионемы колонии, но мионемы зооидов корот-
кие. Характерно наличие зубцов в верхней части базо-
стила и ветвей колонии — следов отделения зооидов.
В основном симбионтные виды на пресноводных и
морских беспозвоночных. Для этого рода, а также для
Monintranstylum, Myoschiston и Craspedomyoschiston
предлагалось не принятое здесь сем. Intranstylidae Ba-
nina, 1977.
Примеры видов рода — Intranstylum duplicatum
Precht, 1935; I. coniferum P., 1935; I. brachymyon P.,
1935; I. longum P., 1935 — с разных участков тела мор-
ской амфиподы Gammarus locusta', другие виды и их
хозяева — I. arenicolae (Faure-Fremiet, 1910) — поли-
хеты рода Arenicola: I. asellicola Kahl, 1935 {Asellus
aquaticus); I. barendrechti Bierhof et Roos, 1977 {Gam-
marus tigrinus); I. crassicaulis (Kent, 1882 in Vorticella)
(это молодь вида I. asellicola)', I. eismondi Sommer,
1951 (G. pulex)', I. intermedium Song, 1986 (креветки Pe-
naeus orientalis)', I. invaginatum (Stokes, 1886) (Ento-
mostraca — Chydorus, Cyclops, Candona, Daphnia, Bos-
mina, Cypris, Scapholeberis', есть указания для Gamma-
rus)', I. ovulum Sommer, 1951 {Asellus)', I.steini
(Wrzesniowski, 1877 in Epistylis) {Asellus, Dikerogam-
marus, Rivulogammarus, Chaetogammarus, Carinogam-
marus); I. triformum Schodel, 1983 с несколькими мор-
фами («экотипами»; Gammarus pulex, Carinogammarus
roeselii)', I. variabilis Stiller, 1935 {Chironomus plumo-
sus); I. simulans (Plate, 1886; Asellus)-, I. rhabdostyla
(Eismond, 1895; Gammarus)', I. palaemoni Nie et Ho,
1943 {Palaemon = Macrobrachium nipponensis)', I. mac-
rostylum (D’Udekem, 1864 in Zoothamnium', Asellus)',
I. steinii f. nutans Boscolo, 1969 {Niphargus costozzae) и
др. виды.
Род Grainis Jankowski, 1997
Типовой вид G. dizoon, эндемик Байкала, сим-
бионт неопределенной траловой амфиподы, вероятно
рода Poeckilogammarus. По 2 особи помещаются на
дне широкой волнистой (с продольными и поперечны-
ми складками) раковины; в толщу дна погружены за-
остренные короткие мионемы. Примонт образует ши-
рокий гофрированный стебелек, он расширяется в
виде высокой толстостенной раковины в 2.5 раза длин-
нее стебелька, с неровной вершиной и краями; тро-
ТИП CILIOPHORA. КЛАСС OLIGOHYMENOPHOREA
939
фонт эпистилидного типа, с цилиндрическим телом,
широким эпидиском, С-образным ядром; от широкой
нижней части особи в толщу стебелька отходит тол-
стая мионема, почти до базодиска. При делении вторая
особь остается внутри раковины, образует короткую
толстую мионему. Стебелек и раковина с тонкой на-
ружной исчерченностью. Это как бы упрощенный ва-
риант рода Ruthiella, пока не найденного на гаммари-
дах России, в частности на литорали Байкала; поэтому
находка Grainis без переходных форм пока необъясни-
ма. Хозяева рода Ruthiella (Gammaruspulex и G. roese-
lii) вокруг Байкала отсутствуют, на обычном в Сибири
виде G. lacustris рутиелла пока не найдена; нет ее и у
7 литоральных видов гаммарид, включая Gmelinoides
fasciatus, проникшего на запад до Петербурга.
Род Ruthiella Schodel, 1983
Типовой вид R. gammari с пресноводных гам-
марид Gammarus pulex и G. roeselii (подрод Carino-
gammarus)', редкий малоизученный вид с максилл, на
которых обычно не осматривают симбионтов; не най-
дены на интродуценте G. tigrinus, распространившем-
ся в Европе. Близок к предыдущему роду; зооиды в об-
щей тонкостенной раковине, отходящей от широкого
ствола колонии; мионемы неравные по размерам,
острые и широкие, у основателя колонии толще и длин-
нее, чем у других особей, достигают половины длины
стебелька. Асимметричный домик может вмещать до
18—20 зооидов, но обычно 4—10; плавно сужаясь,
стенки домика переходят в стебелек длиной до
120 мкм, отогнутый вбок к субстрату, особо широкий
в верхней половине, с поперечными складками. Зооид
цилиндрический, с почковидным ядром и неясным ва-
ликом перистома. При большом числе зооидов они не
помещаются в раковине, перистом поднят над стенка-
ми домика. Вид занимает очень узкий локус на хозяи-
не — нижняя поверхность нижней губы максиллы (ла-
биум), другие участки заняты лорикатами Lagenophrys
matthesi. Поскольку я различаю не только одиночных и
колониальных перитрих, но также дизойных, Grainis
предлагается как самостоятельный промежуточный
род этой группы. Вначале вид считался вторым видом
Rovinjella, но был описан как самостоятельный род.
Автор рода (Schodel, 1983) сближает рутилеллу с Int-
ranstylum.
Род Kindella Jankowski, 1967
Типовой ви д К. pacifica по монотипии; с «Echi-
nogammarus» (Anisogammarus) spp. островов Кунашир
и Итуруп (Охотский берег) Первоописание основано
на фиксированном материале, ряд важных деталей
остался неясен; узкий апекс и перистом сокращенного
зооида в литературе приняли за признак Opercularia
(Puytorac, 1994); род Kindella сводили в синонимику
рода Opercularia (Aescht, 2001); валидность рода не
признавалась.
Детальное изучение типового вида проведено на
материале с жабер литоральных амфипод Anisogamma-
rus sp. типа A. locustoides на биостанции Восток. Вид
галофильный, встречается на рачках в море, лагунах и
устьях рек. Это не оперкулярии, перистом с широким
плоским не обособленным эпидиском и четким широ-
ким валиком; особи мелкие, ядро С-образное, обычно
вытянуто поперек тела. При оседании на субстрат зоо-
ид выделяет фибриллярный пучок, образует централь-
ную мионему и одновременно секретирует толсто-
стенную раковину с массивным дном, в которое погру-
жена мионема. Раковина становится складчатой,
смятой, широко открытой, со дна ее вновь растут такие
же раковины, как в начале pocfa примонта, с 1—2 зоо-
идами в каждой, но не больше; мионемы парных зоо-
идов короткие, не удлиняются и не контактируют. Де-
финитивные колонии широкие, обычно с 4 парами
зооидов в своих домиках, растущих от дна первичной
лорики. Иллюстрации пока не опубликованы. На сфе-
ромидах там же нет аналогичных родов, описанных в
морях Европы, но встречается уникальный род Fois-
snerella. В принципе схема строения колонии и мионе-
мы, как у Tauriella, со сферой из Черного моря, но, с
моей точки зрения, это оперкулярии; у Delamurea с та-
литроидных амфипод Крыма имеется массивный
длинный базостил (не базальная раковина), и мионемы
всех зооидов Delamurea и Craspedomyoschiston соеди-
нены воедино, как у Zoothamnium. Итак, все 4 рода ва-
лидные.
Сем. Zoothamniidae Sommer, 1951
Колониальные формы из бентоса и планктона, сво-
бодные и симбионтные виды, частые в пресных водах
и более разнообразные в море. Колонии дихотомиче-
ские, основатель колонии (примонт) секретирует об-
щий ствол, иногда массивный, позднее мионему при
делении зооидов; мионема ветвится и сохраняется в
ветвях у каждого зооида колонии. При различении ро-
дов и семейств сессилид сейчас главным признаком
становится способ сокращения стебелька, и в литера-
туре распределение родов по семействам Vorticellidae
и Zoothamniidae не совпадает с описанным; в частно-
сти, род Pseudocarchesium, морфологически идентич-
ный с Carchesium, отнесен к Zoothamniidae. Пока нет
молекулярных филограмм по всем родам, любые спо-
ры не имеют смысла; в данйом обзоре состав сем. Zoo-
thamniidae ограничен родами с единой ветвящейся ми-
онемой по всей колонии.
Род Delamurea Naidenova, 1978
Род предложен для 2 видов с одного хозяина —
сублиторальной изоподы Sphaeroma serratum из зали-
вов Черного моря у Севастополя — D. loricata (типо-
вой вид) и D. maeotica. Второй вид образует неболь-
шие колонии' из 2—6 зооидов, чаще одиночный или с
2—4 зооидами; колонии прикреплены к основанию пе-
реопод и к сгибам между члениками переопод. Коло-
ния состоит из короткого широкого фибриллярного
ствола и базальной толстостенной чаши, узкой у при-
монта до его деления, широко открытой в дефинитив-
ной колонии; от ее дна растут менее широкие короткие
стебельки с лориками для каждого зооида (не парны-
940
ALVEOLATA
ми); мионемы слиты воедино, как у Craspedomyoschis-
ton, сокращение зооидов гармошковидное (осевое).
Типовой вид D. loricata имеет длинный массивный
фибриллярный базостил, на вершине с чашей примон-
та, которая расширяется по мере роста колонии; от ее
дна отходит новый стебелек, затем ветвящийся; в ко-
лонии 2—32 особи. Ветви колонии несут на вершине
вторичные лорики с парой зооидов в каждой (чаще
1 зооид, реже 2—3) на очень коротких стебельках; на-
ружные и внутренние стенки домиков с продольными
складками; края домиков слегка волнистые, стенки не-
прочные, при сокращении зондов вершина лорики
смыкается; стебелек сократимый и растяжимый. Ино-
гда без деления особь образует второй внутренний до-
мик внутри наружного. Локус — абдомен сфером (вен-
тральная сторона грудных и брюшных сегментов). Со-
единение мионем зооидов в единую систему отличает
этот род от Kindella. При первоописаниии род Delamu-
геа отнесен к сем. Rovinjellidae, но мне неясны грани-
цы этого семейства.
Род Myoschiston Precht, 1935
Прехт предложил род, принятый всеми последую-
щими авторами, для нескольких видов; по правилам
номенклатуры валидны роды без указания типа, пред-
ложенные до начала 1931 г. Аэшт (Aescht, 2001) счита-
ет автором того, кто впервые указал типовой вид —
род Myoschiston Jankowski, 1985, р. 80 с типом М. dup-
lication Precht, 1935. Это одна из многих ошибок в ка-
талоге Аэшт. В моей статье (Янковский, 1985, р. 83)
ситуация комментируется так: «Типовой вид для рода
Myoschiston Прехтом не был указан, и мы не знаем по-
следующего выделения. По нашему обозначению в
данной работе, это — М. carcini Precht, 1935 с жабер
прибрежного краба Carcinus maenas. Выбор этого на-
звания вызван тем, что хозяин наиболее доступен для
изучения». Вид М. duplicatum был по ошибке назван
типовым позже (Jankowski, 1993b).
Виды рода распространены в основном в море;
много симбионтов, например на жабрах черноморских
балянусов, на паразитических изоподах Caligus с мор-
ских рыб, на крабах и т. д. Вид колониальный, колонии
без раковины; осевший примонт секретирует длинный
стебелек без мионемы, непосредственно перед делени-
ем образует мионему, общую для обеих дочерних осо-
бей, и после этого все зооиды имеют общую мионему.
Фактически это Zoothamnium без мионемы в общем
стволе колонии, с задержкой ее образования у примон-
та. У многих зоотамниев мионема тоже начинается не
от базодиска, иногда намного выше. Хотя бы у части
видов точка ветвления — не мионема, а плотная текоп-
лазма, мионемы образуются при росте дочерних осо-
бей. Мионема может быть тонкой (к примеру у вида с
циррипед) и колонии теряют сократимость. У М. carci-
ni примонты нормально сократимые, но дефинитив-
ные колонии почти теряют способность к сокраще-
нию, хотя мионема не изменена.
Пример хорошо изученного вида — М. simile
(Song, 1986) comb. n. с морских креветок Penaeus ori-
entalis в Китае. Вероятно, смена авторства рода требу-
ет переноса всех ранее включавшихся видов в состав
«нового» рода; в номенклатурном кодексе об этом ни-
чего не сказано, и мнения цилиатологов разные. Нуж-
но проверять у всех известных видов не только тип
аргирома, но и тип томита; не исключено, что плоские
асимметричные томиты гетерополярного типа, при-
знак рода Heteropolaria, встречаются и у других родов
сессилид. По Сонгу (Song, 1986), у М. simile томиты
сплющенные и симметричные, но ситуация усложнена
наличием вида с плоскими гетерополярными томита-
ми (крымский вид из Balanus).
Автор рода Прехт (Precht, 1935) описал в составе
рода Myoschiston вид М. duplicatum gen. et sp. n. (веро-
ятно, указав таким образом типовой вид) с изопод Idot-
hea viridis, I. tricuspidata и крабов Carcinus maenas
(позже найден на гидроидах и водорослях, в Крыму на
Idothea baltica subsp. hasten)', вид описан особо по-
дробно и признаки нового рода обсуждаются в его диа-
гнозе; также М. neomysidis Precht, 1935 с мизид Neomy-
sis vulgaris (с 2 типами стебельков, тонкими и массив-
ными, возможно это разные виды рода); М. carcini Р.,
1935 с жабер Carcinus maenas', М. centropagidarum Р.,
1935 с пелагических копепод Centropages hamatus и
Eurytemora hirundoides', М. balanorum (Mereschkowsky,
1879) c Balanus improvisus (Cirripedia); M. cypridicola
P., 1935 с первой пары ног морских остракод Cyprideis
littoralis', все виды переносятся здесь в состав «нового»
рода Myoschiston N 2 Jankowski, 1985—М. duplicatum,
М. neomysidis, М. carcini, М. centropagidarum, М. cypri-
dicola comb. nn. (ранее в составе рода Myoschiston N 1
Precht, 1935).
Epistylis balanorum Mereschkowsky, 1879 с север-
ных морских желудей всегда лишен мионемы, опреде-
ление Прехта неверное — это Myoschiston chattoni
(Jank., 1985) comb, n.; вид Myoschiston balanorum
Precht, 1935 in Korfsmeier, 1949 не существует, он не
предлагался Прехтом как новый. В большом числе ра-
бот, часто без иллюстраций, отмечался Zoothamnium
sp. или Z. intermedium Precht, 1935 на морских планк-
тонных копеподах родов Acartia, Centropages, Temora,
Eurytemora, Pseudocalanus, Isias, Calanipeda и на ли-
чинках стадии зоеа креветок Hippolyte longirostris', по
другим авторам, это вид Myoschiston centropagidarum
(Precht, 1935), образующий низкие кустистые колонии
с коротким базостилом. Неопределенные виды рода
(Myoschiston spp.) отмечены на морских декаподах.
Род Rovinjella Matthes, 1972 (рис. 382, а)
Типовой вид R. sphaeromae с изопод Sphaero-
та serratum в Адриатическом море. Вид занимает
очень узкий локус на хозяине — только 3-й членик
(ишиоподит) первых 3 пар грудных ножек; до 4 коло-
ний вида поселяется здесь в углублении у проксималь-
ного сустава членика. На сферомах, лимнориях и та-
литридах встречаются колониальные раковинные пе-
ритрихи разного типа, и это один из таких родов; если
можно установить их монофилию, такие роды можно
обособить в особом сем. Rovinjellidae Matthes, 1972
(принятом в Traite — Puytorac, 1994, где подчеркивает-
ся уникальность рода Rovinjella, а такой же род Craspe-
domyoschiston с того же хозяина вообще не признает-
ся), но только в том случае, если систематики цилиат
ТИП CILIOPHORA. КЛАСС OLIGOHYMENOPHOREA
941
признают право выделять все без исключения рако-
винные виды перитрих и сукторий в отдельные роды
(Syncyathella, Cyathopercularia, Craspedomyoschiston,
Kindella, Discotheca, Shellositon, Grainis, Nidula, Peria-
cineta и др.); если позволено выделить только Rovinjel-
la, такое семейство не нужно. В колонии 2—4 зооида в
общей широкой прочной раковине величиной около
100 X 100 мкм; особи расположены на небольшом вет-
вящемся стебельке (эндостиле) с мионемами; ракови-
на прикреплена к панцирю хозяев широким фибрил-
лярным стебельком (экзостилом) без мионемы. Это не
котурнии (Loricata), а видоизмененные миошистоны;
ветвление мионемы, как у Zoothamnium, с осевой мио-
немой примонта, которая ветвится при делениях зооида.
Трофонты эпистилидного типа, не оперкулярии. На сфе-
ромах Дальнего Востока, по моим данным, такого рода
нет; на сферомах и пагуридах Черного моря ровиньел-
ла отмечена С. Костенко (Киев, личное сообщение).
Род Shellositon Jankowski, 1993
(рис. 382, а)
Типовой вид Sh. branchialis-, крупная особь
расположена в раковине, прикрепленной непосредст-
венно к субстрату или, возможно, мелкой незаметной
ножкой; стенки раковины с правильной продольной
исчерченностью (гофрированы), особенно у вершины.
Раковина тонкостенная и широко открытая у вершины,
стенки ее быстро утолщаются и в светлую базальную
часть (толстое дно) погружена мионема зооида. Стен-
ки непрочные, могут быть согнуты и деформированы.
Перистом и валик узкие, но это не оперкулярии. После
деления дочерняя особь уплывает, вид не дизойный и
не колониальный. Хозяин и локус — жабры очень мел-
кой амфиподы из смыва с камней на литорали биостан-
ции Восток близ Находки, условно определенной как
Pontogeneia intermedia (сохранен материал для опреде-
ления — ксенотипы).
Род Craspedomyoshiston Precht, 1935
Типовой вид С. sphaeromae по монотипии; с
изопод Sphaeroma rugicaudatum на севере Германии;
нужно отметить, что этим названием Прехт обозначил,
вероятно, 2 вида с разным типом раковины. Типовой
обозначается форма на рис. 30 А в статье Прехта
(Precht, 1935) — относительно крупная колония с вет-
вящейся мионемой и толстым диском (раковиной) на
вершине короткого широкого стебелька; от уровня ди-
ска начинается правильное ветвление колонии с
2—8 зооидами; мионемы в базальном стебельке нет.
Тело зооидов бочонковидное, ядро С-образное, эпи-
диск эпистилидный, это не оперкулярии. Осевший зоо-
ид секретирует короткий широкий стебелек, затем
очень широкий чашевидный диск, и только тогда на-
чинается образование мионемы; трофонт делится, и
продукты деления сидят на вершине стебельков, их
мионемы соединены как у безраковинныхЛ/уо5с/гй?ол.
Несмотря на наличие мионемы, ветви колонии несо-
кратимые. Есть мнение, что мионема не начинается от
точки ветвления, это общая текоплазма, в которой по-
зже начнется секреция мионемы. В колонии могут
быть 1—2 дополнительных мелких раковины и 1 круп-
ная базальная. Род четкий, хотя не был признан рядом
авторов, поскольку это адаптивные, а не фундамен-
тальные признаки. Этого вида нет на сферомах Крыма
и Дальнего Востока, но в Черном море он заменяется
более сложным родом Delamurea, поэтому находка
вида здесь не исключена. Похожие формы я видел на
лимнориях с о-ва Путятин у Владивостока. В Traite
(Puytorac, 1994) род не признается — «поскольку такие
лорики существуют в других родах сессилин, нельзя
признать валидность этого рода»; вид назван Myoschis-
ton sphaeromae', в Guide (Small, Lynn, 1985) род валид-
ный, но по ошибке назван «Craspedomyoschiston Jan-
kowski gen. п.»
Род Zoothamnium Bory, 1824 (рис. 380, б)
• Подробный номенклатурный анализ рода приведен
Янковским (1985). В первоисточнике Zoothamnia-,
Эренберг (Ehrenberg, 1838) в монографии цилиат про-
извольно видоизменил название, и оно было принято
всеми последующими авторами. Типовой вид Vorticel-
la ovifera Modeer, 1790 (или V. ovifera Bruguieres), сей-
час этого названия в списках рода нет. Род следует
обозначать как Zoothamnium Ehrenberg, 1831, с типо-
вым видом Z. arbuscula Ehrenberg, 1831. Колонии
крупные, иногда гигантские, с общей мионемой по
всей колонии; кортекс зооидов с серией циклонем; в
процессе размножения могут быть образованы гигант-
ские зооиды (макронты = макрогонидии) и мелкие
микронты обычного типа, зооиды диморфные. Круп-
ные колонии можно встретить в перифитоне, в планк-
тоне; зоотамнии — частые симбионты беспозвоноч-
ных, особенно ракообразных, но это виды без димор-
физма. Для таких форм был выделен особый род
Mesothamnium Jankowski, 1985, с типовым видом Z. hi-
ketes Precht, 1935; это симбионт морских гаммарид
Gammarus locusta, G. duebeni и изопод Jaera marina в
ФРГ, с небольшими колониями — обычно 4—8, мак-
симум до 20 мономорфных особей. В принципе это ло-
гичное подразделение, но нет уверенности в монофи-
лии всех диморфных форм и монофилии мономорф-
ных видов, и у диморфных видов разные положения
макронтов и разное отношение их величины к микро-
нтам, поэтому до молекулярного анализа немногочис-
ленных видов с диморфными зооидами род или под-
род Mesothamnium не различается.
В гигантских древовидных колониях Z. alternans и
Z. arbuscula, до полусантиметра в длину, макронты
могут в 3—6 раз превышать длину обычных особей;
они располагаются у ствола, поодиночке или неболь-
шими группами; это основатели новых колоний, после
оседания на субстрат образуют, не питаясь, массивный
общий ствол-колонии. У видов с мелкими колониями
на тонком стебельке общий ствол небольшой и может
быть образован без диморфизма любым зооидом. То-
миты изучены у части видов, например у Z. penaei,
слегка сплющенные, но не гетерополярные. Для лио-
фильных крупных колоний Z. niveum характерен сим-
биоз с серобактериями на стебельке и кортексе зоо-
идов (Bauer-Nebelsick et al., 1996). Описание морского
942
ALVEOLATA
Рис. 382, a. «Loricata».
Rovinjella sphaeromae (A) (no: Matthes, 1972); Shellositon branchialis (Б, В, ориг.); Grainis dizoon (Г, ориг.).
Fig. 382, a. «Loricata».
пелагического диморфного вида Z. pelagicum Du Pie-
sis, 1891 приведено Лавалем (Laval, 1968). Пример пе-
реходной формы между моно- и полиморфным ви-
дом — Z. plumula Kalil, 1933 (Song et al., 2002); коло-
нии с укрупнением терминального зооида каждой
ветви. Морские зоотамнии Z. penaei Song, 1991 и
Z. chlamydis Hu et Song, 2001 — это виды с другим по-
ложением таких зооидов.
Виды с макронтами (подрод Zoothamnium s. str.) —
Z. niveum (Hemprich et Ehrenberg, 1828); Z. arbuscula
E., 1831; Z. alternans C. et L., 1859; Z. spirale Gosse,
1856; Z. geniculatum Ayrton, 1902; Z plumosum Wright,
1860; Z. dichotomum Wright, 1861; Z. infundibulum Stil-
ler, 1968 (включая синонимы); вероятно также Z. kenti
Leidy, 1874; Z. plumula Kahl, 1933 (для Z. plumosum Pe-
rejaslawzewa, 1886 с вершинным положением некруп-
ных макронтов на каждой ветви). Пелагический вид
Z. pelagicum Du Plessis, 1891 (= Z. steueri Kahl, 1935) c
гиперфоретизмом колоний и нетипичными макронта-
ми может быть выделен в новый подрод.
Кент (Kent, 1881) предложил группы Monomorpha
и Polymorpha не как подроды или роды, а для обозна-
чения 2 типов зоотамниев; это разумное предложение
прошло незамеченным.
Виды без диморфизма (подрод Mesothamnium Jan-
kowski, 1985) — Z. aselli C. et L., 1859; Z. affine Stein,
1859; Z. adamsi Stokes, 1885; Z. candelabrum Wailes,
1932; Z. carcini Kent, 1881; Z. cienkowskii Wrzesniowski,
1877; Z. commune Kahl, 1933; Z. duplicatum Kahl, 1933;
Z. elegans D’Udekem, 1864; Z.foissneri Ji, Song, Al Ras-
heid et Sun, 2005; Z. glesnicum C. et L., 1859; Z. hentsc-
heli Kahl, 1935; Z. hydrobiae Hofker, 1930; Z. macrosty-
lum D’Udekem, 1864; Z. marinum Mereschkowsky, 1877;
Z. mucedo Entz, 1884; Z. nanum Kahl, 1933; Z.parasiti-
cum Stein, 1859; Z. plicatum G. et R., 1886; Z. ponticum
Andrussova, 1886; Z.procerius Kahl, 1935; Z. simplex
Kent, 1881; Z. varians Stiller, 1933; Z. paragammari
Song, 1991; Z. paraentzii S., 1991; Z. ramosissimum Som-
mer, 1951; Z. kahli Caspers, 1951; Z. maximum Song,
1886; Z. rigidum Precht, 1935; Z. cupiferum S., 1986;
Z thiophilum Stiller, 1946; Z. intermedium Precht, 1935;
Z. sinensis Song, 1991 (=Z. truncatum S., 1986); Z. ver-
micola Precht, 1935; Z. astacicolae Schubemetzky, 1978;
Z. balticum Biemacka, 1963; Z. horae Khajuria et Pillay,
1952; Z haplocaulis Stiller, 1953 и мн. др.
Род Autochloe Joseph, 1882
Типовой вид A. proserpinae — плохо описан-
ный вид с пещерных амфипод рода Niphargus, по Бюч-
ли (Butschli, 1889), это синоним рода Zoothamnium',
описание неграмотное, без рисунков, трудно предста-
вить облик зооидов, тип мионемы. По ошибке Аэшт в
одном месте каталога родов приводит Anthochloe рго-
sperinae (sic) Joseph, 1882 как валидный род без сино-
нимии, в другом месте Autochloe proerpinae (sic) Jo-
seph, 1882 с тем же типом как невалидный род — сино-
ним рода Zoothamnium. Это колониальный вид,
морфология которого может быть изучена только при
сборе амфипод в типовом местонахождении или при
осмотре музейных фиксированных рачков.
Род Zoocladium Ehrenberg in Hemprich
et Ehrenberg, 1831
Такое авторство указано в каталоге Аэшт; по моему
каталогу авторы рода—Zoocladium Hemprich et Ehren-
berg, 1828. Типовой вид Z. niveum из перифитона в
Красном море; вид валидный, но род ушел в синони-
мику предложенного ранее рода Zoothamnium. Род
ТИП CILIOPHORA. КЛАСС OLIGOHYMENOPHOREA
943
Рис. 382, б. «Loricata».
Гарпактикоидный рачок с Cothurnia imberbis (А) (по: Ehrenberg, 1838); тот же вид, названный Cyclodonta bipartita (Б, В) (по: Matthes, 1958); примеры моно-
зойных и дизойных котурнид — Cothurnia sp. с морских гарпактицид (Г, ориг.) и Sincothurnia sp. с изопод (Д, ориг.).
Fig. 382, б. «Loricata».
Harpacticoid copepod with Cothurnia imberbis', same species was named Cyclodonta bipartita by Matthes, 1958. Examples of monozoic and dizoic cothumids — Cot-
hurnia sp. from marine harpacticoid, and Sincothurnia sp. from isopods.
Zoocladium предложен для крупного морского вида,
несомненно диморфного (с макронтами по оси коло-
нии), сходного с типом рода Zoothamnium-, позже был
включен второй вид Z. arbuscula Н. et Е., 1831. Типо-
вой вид рода Zoothamnium имеет макронты, поэтому
Zoocladium — синоним.
Род Crossothamnium Jankowski, 1976
Типовой вид Zoothamnium perlatum Stiller,
1946 — мономорфный вид (без крупных зооидов) с
сетчатым аргиромом и правильной сетью выпуклых
ячеек пелликулы. По Аэшт„род невалиден как предло-
женный в тезисах; это синоним следующего рода. Ти-
повой вид описан из перифитона на водоросли Entero-
morpha в Адриатическом море в местах с серными ис-
точниками; колонии высокие, с 10—12 грушевидными
зооидами; диморфизма нет, но более крупные зооиды
располагаются у вершины колонии. У этого вида сет-
чатый ретикулюм покрывает и эпидиск, что никогда не
встречается у перитрих с таким аргиромом; если это
верно, род валидный, но рисунок вида, скорее всего,
неправильный, это могут быть серные эпибактерии; до
проверки непригодное название рода (данное в тези-
сах) не заменяется новым, а вид включается в следую-
щий род.
Род Zoothamnopsis Song, 1997
Типовой вид Z. mengi из морского перифитона
в Китае; колонии мономорфные, с очень длинным ба-
зостилом и правильным ветвлением; зооиды вытяну-
тые, с массивным валиком, с кортексом такого типа,
как выше у Crossothamnium, без сетки на эпидиске пе-
ристома, но с намного большим числом поперечных
колец, сближенных вплотную и с вытянутыми по гори-
зонтали аргироконтами, по взаимному расположению
напоминающими кирпичную кладку. Сетчатый кор-
текс встречается у зоотамниид как исключение, пока
известен только у Zoothamnopsis mengi и Z. perlatum
(Stiller, 1946) Song, 1997. На рисунках Z. mengi не по-
казан аргиром диска, это важное различие 2 включен-
ных видов не комментируется.
Вид Zoothamnium stilleri (stillerae nom. corn) Ne-
nninger, 1948 — симбионт на панцире Carinogammarus
roeselii в Германии; замечена лишь одна колония с
944
ALVEOLATA
5 зооидами. Внешне, как Zoothamnium, показан учас-
ток колонии — 2 особи на складчатом (в сплошных
кольцах) стебельке с ветвлением мионемы. Обе особи
сплошь покрыты толстым исчерченным слоем, в точ-
ности, как альвеолы Vorticella vestita с жидким содер-
жимым. Этот вид пока переводится в состав Zootham-
nopsis (Z. stillerae Jank. comb, n.), но он может быть но-
вым родом по наличию слоя альвеол в дополнение к
ретикулюму кортекса.
Приложение
Род Vorticellopsis Dons,’1918
Типовой вид V. undulata по монотипии; по раз-
ным авторам, это синоним рода Vorticella (Kahl, 1935;
Corliss, 1979; Aescht, 2001) — Vorticella undulata in
Kahl, 1935, но фактически род невалидный и совер-
шенно неопределимый, ни о какой синонимии нет и
речи. Замечена и очень примитивно зарисована одна
особь на очень коротком широком стебельке, вероятно
с широким мускулом, в море у берега Норвегии на баг-
рянке Desmarestia. Длина зооида ПО мкм, ядро изви-
тое, перистом не зарисован; это, скорее всего, примонт
колониального вида, вероятно рода Zoothamnium,
обычного в море.
Уоррен (Warren, 1986) не включает вид в состав
Vorticella и правильно замечает — «вид так плохо опи-
сан, что сейчас его считают nomen dubium». Тем не ме-
нее в следующей публикации (Warren, 1988) этот
«вид» включен с описанием и произвольно изменен-
ным рисунком как валидный вид рода Baikalonis —
аберрантного байкальского эндемика группы оперку-
ляриид, обитающего только на личинках ручейников.
В таком случае Уоррен должен был использовать на-
звание Vorticellopsis для суммарного фиктивного рода
вместо Baikalonis. Конечно, между ними нет абсолют-
но ничего общего, род и вид Донса неопределимые,
это примонт неизвестного вида колониальных мор-
ских сессилид.
Род Vorticellida Lamarck, 1836
Род предложен для неназванного морского вида без
рисунка со следующим диагнозом: «Стебельчатые
вортицеллярии, собранные в деревца и расположен-
ные на общем стволе, верхняя часть которого сокраща-
ется рпирально, а низ имеет вид цилиндрического пря-
мого прочного ствола, слегка расширенного у верши-
ны и прикрепленного своим основанием»; далее
подробное описание зооидов и стебелька; вся колония
может сжиматься в плотную массу. Конечно это Zoo-
thamnium, но род невалиден (без названия типового
вида). В каталоге Аэшт название Vorticellida по ошиб-
ке считается вариантом названия сем. Vorticellina и од-
новременно синонимом рода Zoothamnium по Butschli,
1889; первоисточник не был просмотрен, поэтому та-
кая дезинформация.
Сем. Termitophryidae Lom in Corliss, 1979
Семейство неясного положения, дериваты неизве-
стного предка — эпистилид или оперкуляриид. Особи
крупные (ПО—200 X 38—63 мкм), одиночные, без
стебелька и раковины, тело очень сократимое; скопула
широкая, образует уникальный прикрепительный диск;
тело конусовидное, расширяется книзу. Нет широкого
наружного диска (стомодиска) с цилиатурой по пери-
ферии, ширина апекса всего 10 мкм; ротовая полость
(инфундибулюм) длинная и узкая, здесь перистомаль-
ные кинеты многократно закручены (4—5 оборотов).
В перистоме найдены 3 стандартных компонента —
зигокинета УМ, поликинета М2 и герминальный ряд;
первые 2 ряда закручены 1.5 раза вокруг мелкого эпи-
диска и в инфундибулюме дают типичные пеникулю-
сы. Циклокинета (поясок мигранта) не отмечена. Ядро
С-образное. Широкий скопулярный диск содержит ко-
роткие неподвижные реснички и секретирует прикре-
пительный диск — вогнутую аморфную массу с тонки-
ми канальцами и пучками фибрилл для фиксации на
кишечном эпителии; он не напоминает стебельки эпи-
стилид.
Эндобионты в заднем отделе кишечника афри-
канских гумитрофных (не ксилотрофных) высших
термитов Rostrotermes cornutus, Anoplotemes sp., Tri-
chotermes villifrons (сем. Termitidae, Apicotermitinae)
в саваннах и лесах средней Африки; реже в другом
локусе и в меньшем числе особей у вторичных хозяев
Pericapritermes urgens, Р. chiasognathus (Termitinae).
Эти хозяева приурочены к лесам и саваннам запад-
ной и средней Африки, образуют особую морфо-фи-
зиологическую группу среди термитов, в частности по
строению пищевого тракта. Редукция наружной цили-
атуры не отмечается у эпистилид, но встречается
у оперкуляриид, например у эндобионтов водных
жуков.
Род Termitophrya Noirot
et Noirot-Timothee, 1959
Типовой вид Т. africana; пока известен один
вид из заднего отдела кишечника рабочих особей
термита Jugositermes tuberculatus в западной Африке
(Габон), но предполагается наличие серии видов в тер-
митах Африки. Вид достигает биомассы, сравнимой
с жгутиконосцами в низших ксилотрофных термитах;
одновременно встречается Nyctotherus. Отмечено ин-
цистирование. Ранее род относили к Scyphidiidae и
к Epistylidae, поскольку при электронной микроско-
пии нашли прикрепительную секрецию, эквивалент
рудиментарного стебелька; наличие такой секреции
отрицали у сцифидий, хотя она легко видна у сцифи-
дий из моллюсков. У термитофрий постерон плоский
или вогнутый, от его краев вверх идут продольные
пучки фибрилл; тело очень сократимое, со склад-
ками и кольцевыми аргиронемами. По всем призна-
кам термитофрии принадлежат к особому валидному
семейству.
ТИП CILIOPHORA. КЛАСС OLIGOHYMENOPHOREA
945
Сем. Vaginicolidae Fromentel, 1874
(рис. 382, a—384, a)
Раковинные перитрихи; перистом эпистилидного
типа, поэтому семейство не включает лагенофрисов и
близких родов. В прочной раковине постоянной фор-
мы только 1 или 2 зооида; наружный стебелек, если
есть, не ветвится. Такое определение означает, что в
состав группы не включаются колониальные формы с
большим числом зооидов; раковинные колониальные
перитрихи рассматриваются в соответствующих се-
мействах. В раковине вагиниколид обитает только
один зооид у Pyxicola, Daurotheca, Parapyxicola и др.,
2 трофонта одновременно у Platycola, Thuricola, Semi-
cothurnia и др. В наиболее крупном роде Cothumia
есть виды с 1 и с 2 зооидами, т. е. род сборный, не дол-
жен существовать в таком составе. Эта проблема об-
суждается в его диагнозе. Виды с 4 и более зооидами,
например Rovinjella, имеют небольшой ветвящийся
внутренний стебелек и здесь не рассматриваются; они
образуются независимо в разных линиях перитрих. Та-
кое ограничение позволяет считать оставшихся лори-
кат монотипической группой, сем. Vaginicolidae не бу-
дет искусственным и сборным, и сохраняется возмож-
ность обособления его вместе с Platycolidae на уровне
подотряда Cothumina.
Оседая на субстрат, мигрант прикрепляется скопу-
лой (базодиском), начинает быстрое образование рако-
вины — прочной прозрачной оболочки строго опреде-
ленной формы, не окрашенной своими пигментами, но
часто накапливающей коллоидное железо до тем-
но-оранжевого и коричневого цвета. У котурний рако-
вина двойная. Форма раковины варьирует и служит ро-
довым признаком. У части родов она прилегает к суб-
страту одной из сторон, у других — прямая, поднята
над субстратом на ножке, диске или стебельке. Услож-
нения у части родов — замыкательный аппарат разно-
го типа у Pyxicola, Thuricola и Muscipula.
Зооид вытянутый, прикреплен скопулой ко дну ра-
ковины, в целом имеет однотипное строение, несмотря
на многообразие типов раковины; это говорит о цель-
ности и монофилии группы. Исключение — Rossonop-
hrys с модификацией перистома, но во всем остальном
это обычная Cothumia. Кортекс всегда с поперечными
кольцевыми ребрами, нет видов с сетчатой пеллику-
лой (типа Pseudovorticella'). Перистом, как у колони-
альных форм типа Epistylis, с четким валиком, без обо-
собления дискофора (отличие от Opercularia), обычно
не широкий. Ротовая ресничная спираль стандартного
типа, немного более 1 оборота, спускается в глубокий
буккон (инфундибулюм). Ядро С-образное или вытя-
нутое по длине клетки.
Как отмечено выше, в раковине 1 или 2 зооида.
Можно ли считать последних колониальными видами?
У первых после деления примонта (осевшего мигран-
та) одна дочерняя особь образует ресничный поясок,
не питается, перистом сжимается, мигрант отделяется
и уплывает. У вторых после деления обе особи иден-
тичные, остаются на общем диске или ножке (очень
короткий неветвящийся стебелек), в мигрантов пре-
вращаются их дочерние особи. В не-раковинных груп-
пах колониальные и одиночные виды не могут от-
носиться к одному роду. Вероятно лучшее решение
спора — обозначать виды с 2 зооидами на диске «ди-
зойными», не применяя термин «колониальные». По-
скольку это жесткий видовой признак, монозойные,
дизойные и колониальные виды нужно относить к раз-
ным родам перитрих.
Семейство в целом космополитное, лорикаты
обычны в любых пресных водах (болота, озера, пруды,
реки) и в морской воде любой солености. Трудно взять
пробу перифитона без лорикат. Лорикаты на корнях
ряски -— одни из первых инфузорий, открытых и хоро-
шо зарисованных Левенгуком. 'Ряд видов «cothumides
muscicoles» найден в террофитоне (мох, опавшие ли-
стья, лишайники, почва). Много случайных и облигат-
ных симбионтов, особенно на ракообразных; ряд не-
больших по объему или монотипических родов вклю-
чает только комменсальные виды (Cothumopsis,
Daurotheca, Parapyxicola, Dimorphocothurnia, Rosso-
nophrys и др.). Нет анаэробных видов, нет лорикат в
черном илу, сапропеле, предпочитается хорошо аэри-
руемый субстрат; часть видов в планктоне на водорос-
лях или рачках, но свободноплавающих лорикат (типа
тинтиннид) нет.
Для группы предлагались названия Cothurnina
Butschli, 1889 и Loricata Kahl, 1931 (последнее — го-
моним ряда таких же названий беспозвоночных); вто-
рое название объединяло вагиниколид с неродствен-
ными им лагенофрисами и применимо только в том
случае, если мы ограничим лорикат в виде одной мо-
нофилетической группы без лагенофриид.
Род Cothumia Ehrenberg, 1831
Типовой вид С. imberbisEhr., 1831. «Централь-
ный» род лорикат, от систематики которого (состав,
границы) зависит вся классификация семейства. Нуж-
но точно знать морфологию С. imberbis, но в литерату-
ре на эту тему лишь полная дезинформация. Общепри-
нято, что это мелкий пресноводный вид с ряски и мик-
роводорослей, с одним зооидом, коротким стебельком,
тонкостенной раковиной; может случайно встречаться
на циклопах, где их первоначально и нашел Эренберг
(Ehrenberg, 1838). В действительности С. imberbis —
облигатно симбионтный вид на гарпактицидах, а не на
циклопах, на которых никогда не бывает лорикат. У
Эренберга типовой хозяин Cyclops quadricorms — так
тогда обозначали любых циклопов; но на рисунке по-
казан вид, который в то время называли Cyclops minu-
tus, сейчас это гарпактицида Canthocamptus minutus.
Эренберг допустил большую ошибку — неправильно
определил и назвал вид хозяина типовой котурнии —
ныне космополитного и одного из крупнейших родов
перитрих (Warren, Paynter, 1991).
Поскольку никаких котурний на видах Cyclops
не находили, сложилось мнение, что Эренберг видел
случайно осевших на циклопе особей из пресно-
водного перифитона, где действительно встречаются
мелкие котурнии; поэтому на них перенесли название
С. imberbis. Но Эренберг показал группу котурний
на рачке; случайно могут осесть 1—2 особи, но не
больше. Признаки этих симбионтов — толстая рако-
вина, длинный широкий стебелек, отсутствие четкого
эндостила на границе наружной и внутренней ракови-
60 Зак. №4163
946
ALVEOLATA
Рис. 383, a. «Loricata» и Ellobiophrya.
Tauriella lomi (A, 5); Sincothumia compressa (В, стадия одного зооида); Rossonophrys vastus (Г); Corlissetta anivica (Д); Daurotheca ussurina (E); Syncyathel-
la — Orbopercularia lusti (Ж); Ellobiophrya conviva (3, И). (По: Найденова, 1985 (A, E); Matthes, 1955 (Ж); Clamp, 1982 (3, П); В—E — ориг.).
Fig. 383, a. «Loricata» and Ellobiophrya.
ны, одиночный зооид. Почти все остальные виды
крупного рода Cothurnia имеют четкий эндостил, обо-
собление вершины стебелька под дном внутренней ра-
ковины.
Тем временем накопилось много публикаций о на-
ходках лорикат на пресноводных и морских Copepoda
Harpacticoida, в частности на Canthocamptus minutus,
С. staphylinus, на видах Bryocamptus и других рачках
(см. ниже род Cyclodonta'j. Неужели никто не открыл
атлас цилиат Эренберга? Поскольку я заявляю, что хо-
зяин Cothurnia imberbis на рисунке Эренберга не цик-
лопы, a Canthocamptus, остается найти заселенную по-
пуляцию рачка и изучить морфологию прикрепленных
лорикат. Результаты будут опубликованы мною от-
дельно; этот вид не вполне типичен для котурний, нет
очень четкого обособления дна двойной раковины, нет
четкого деления стебелька на 3 отдела, которые я обо-
значаю как экзо-, мезо- и эндостил. Само наличие
двойной раковины под вопросом. Зооид в раковине
обычно один, но встречаются и по 2 филирующих
зооида, вероятно вид монозойный с задержкой отделе-
ния мигранта. Неудивительно, что этот вид был выде-
лен в принятый всеми род Cyclodonta Matthes, 1958.
Нужна электронная микроскопия продольного среза
раковины и стебелька у вида с гарпактикоид и для
сравнения у любого перифитонного вида Cothurnia из
пресной воды или моря, где их больше.
По крайней мере на уровне подрода нужно отде-
лить С. imberbis от тех видов котурний, которые сход-
ны по числу зооидов, но имеют четкое деление сте-
белька на 3 отдела и легко видимую внутреннюю рако-
вину. Если считать С. imberbis монозойным видом (это
пока спорно), все дизойные виды обособляются в осо-
бом подроде или роде Sincothumia, если вид дизой-
ный — в подроде Tesnotheca или любом другом сино-
ниме по выбору.
В определителе котурний (Warren, Paynter, 1991)
приводится 25 пресноводных видов и 36 морских в
основном свободноживущих; типовой вид Cothurnia
imberbis «прикреплен к различным растительным
и животным субстратам»; ряд видов не признается ва-
лидными; деление видов на монозойные и дизойные не
признается таксономически значимым признаком.
Если разделить котурнид этого списка на подроды или
роды, к монозойным видам можно отнести С. maritima
Ehrenberg, 1838; С. collaris Kahl, 1933; С. tekirghiolica
ТИП CILIOPHORA. КЛАСС OLIGOHYMENOPHOREA
947
Рис. 383, б. «Loricata». Раковина у оперкуляриид возникла независимо от Cothurnia и смежных родов лорикат.
Chilenophrys allendei (А, Б); Circolagenophrys incompta (В); С. oregonensis (Г, Д); Lagenophryspetila Clamp, 1994 (Stylohedra petila comb, n.) (E); Australana ka-
neis (Ж, 3). (По: Clamp, 1987 (В, Г, Д); 1994 (E); А, Б,Ж,3 — ориг.).
_ Fig. 383, 6. «Loricata».
Shelled forms evolved within Operculariina independently from Cothurnia and allied genera of loricates.
Tucolesco, 1962; C. membranoloricata Stiller, 1968 и не-
которые другие виды, но почти никто не обращал вни-
мание на число зооидов, и зарисовка одного трофонта
у большого числа видов не значит, что это именно мо-
нозойный вид. Нужно всегда искать и рисовать рако-
вины, содержащие трофонтов и мигрантов. На Мурма-
не водоросли и гидроиды обрастают котурниями 2 ти-
пов — мелкая С. maritima с длинным тонким
стебельком (трофонт + мигрант) и крупная С. sinuosa с
коротким стебельком (2 трофонта + 2 мигранта). Если
выводить котурнид от раковинных перитрих с 4 и бо-
лее зооидами (известны на морских изоподах), на-
пример от «.Epistylis loricata» Schodel, 1999 (вид нового
рода — см.: Schodel, 1999), примитивны виды лори-
кат с 2 зооидами, от них могли произойти (неодно-
кратно и независимо?) виды с 1 зооидом в раковине,
которых нужно обособить в отдельном сборном
(условном) роде.
Род Cyclodonta Matthes, 1958
Типовой вид Cothurnia bipartita Stokes, 1885,
облигатный симбионт Canthocamptus minutus. Ракови-
на широкая и плоская у вершины, с длинным желобко-
видным устьем, сужается и утолщается внизу и плавно
переходит в толстый поперечно складчатый массив-
ный стебелек, не длиннее 1/3 длины раковины. Часто
воспроизводят рисунок без мезостила и эндостила, со
слоистым дном раковины (Matthes, 1958). У Фойссне-
ра (Foissner, 1979с) рисунок точнее — двойной ракови-
ны нет, крупный зооид с нешироким перистомом при-
креплен ко дну раковины очень коротким продольно
исчерченным стебельком. Хорошие зарисовки вида у
Пенарда (Penard, 1922). Поскольку совпадает хозяин
этого вида и на нем не бывает других котурнид, и сход-
ный рисунок дал Эренберг, я заявляю об идентичности
типовых видов родов Cothurnia (С- imberbis) и Cyclo-
donta (С. bipartita). Название Cyclodonta ликвидирует-
ся как синоним. Тем самым прекращается фальсифи-
кация с типом первого рода — якобы перифитонным
видом с водорослей, который иногда случайно оседает
на циклопах.
На пресноводных и близких солоноватоводных (эс-
туарных) и морских гарпактикоидах типа Canthocamp-
tus и Harpacticus описаны виды Cothurnia bipartita Sto-
kes, 1885; С. plectostyla S., 1885 (оба c Canth. minutus)',
C. propinqua Kahl, 1933; C. affinis K., 1933; C. cantho-
campti S., 1886 (c Canth. minutus, C. staphylinus, C. mic-
rostaphylinus)', C. trilobata Sramek-Husek, 1957 (это
примонт в процессе образования раковины, вид неоп-
ределим и невалиден); С. rheotypica Stiller, 1935 (с
Canth. staphylinus)', С. voigti Kahl, 1935 (nom. n. для
C. longipes Voigt, 1902 c Canth. staphylinus, пес C. lon-
gipes Mereschkowsky, 1879); Cothurniopsis vaga
(Schrank) Blochmann — это неправильное определение
вида на Canth. Illinoisensis, C. rheticus, C. spp., в ориги-
нале это не симбионты. Никакой разницы между ними
нет, даны мелкие рисунки без иммерсии; пока на пре-
сноводных хозяевах валиден лишь один вид, а на мор-
ских гарпактикоидах встречается несколько морфоти-
пов котурнид, и среди них есть виды типа С. bipartita.
948
ALVEOLATA
Рис. 384, a. «Loricata».
Circolagenophrys anisogammari (A, ff); Usconophrys dauricus (B); Operculigeraparastacis (Г);Д— мигрант Circolagenophrys foxi с импрегнируемой мионемой
и кольцевым пучком фибрилл. (По: Clamp, 1987 (Д)\ рис. А—Г— ориг.).
Fig. 384, а. «Loricata».
Fig. Д — migrant of Circolagenophrys foxi with impregnated myoneme and circular ring of fibers.
Галофильные гарпактициды занесли такой предковый
вид в пресные воды. Сходный вид — Cothurnia lata
Kellicott, 1883, эндемик США (на Diaptomus}.
Кламп (Clamp, 1991) перевел Cyclodonta в состав
Usconophryidae, поскольку вид, по данным литерату-
ры, имеет оперкулярный перистом и не прикреплен к
краям устья; это ошибка, ресничный эпидиск не обо-
соблен круговым желобком и не сокращается самосто-
ятельно, как у оперкулярий и лагенофрисов.
Возвращаясь к роду Cothurnia, отметим несходство
практически всех видов с типом рода С. imberbis
(= Thuricola folliculata Muller, 1786, без рисунка — это
неопределимый вид лорикат на Canthocamptus minu-
tus}. Использование названия Т. folliculata для круп-
ных перифитонных лорикат с замковым аппаратом
устья и без наружного стебелька — еще одна недопус-
тимая фальсификация (см. род Thuricola}.
Род Baikalotheca Jankowski, 1985
Типовой вид В. cratera (= Cothurnia cratera
Swarczewsky, 1930). Раковина крупная, сплющенная,
с широким поперечным устьем, бесстебельчатая,
прикреплена широким основанием к субстрату; нет ти-
пичного для котурнид деления на экзосгил, мезостил и
эндостил (наружный, промежуточный и внутренний
стебельки зооида); в раковине по 2 зооида, прикреп-
ленные к короткому внутреннему стебельку (эндости-
лу). Облигатные симбионты байкальских амфипод, от
литорали до больших глубин, не встречаются в пери-
фитоне. Для С. cratera указаны хозяева Eulimnogam-
marus verrucosus, Е. lividus, Е. cyaneus, Pallasea kessle-
ri, P. grubei, Axelboeckia rubra, Parapallasea puzylli и
Acanthogammarus victorii (типовой хозяин по наше-
му обозначению). В состав рода переводятся также
С. elegans Sw., 1930 {В. elegans comb, п., типовой хо-
зяин Acanth. albus}-, Cothurniopsis aurea Gajewskaja,
1933 (B. aureus in Jankowski, 1985); C. urceus Gaj., 1933
(B. urceus comb, n.); Cothurnia crystallina in Swarczews-
ky, 1930 с E. verrucosus (типовой хозяин) — это ложное
определение вида Baikalotheca (В. endemica Jank. sp. n.).
Новый вид рода будет описан с Pallasea cancellus.
Род Cothurnopsis Entz, 1884
Типовой вид обозначен мною ранее как Cot-
hurnia astaci Stein, 1854, но в тезисах, и поэтому это
обозначение не признано в каталоге Аэшт; позже (Ян-
ковский, 1985) вновь повторено указание типа в жур-
нальной статье. Род Cothurnopsis был предложен для
группы видов котурний с панциря и жабер ракообраз-
ных без выделения типа — Cothurnopsis imberbis,
С. astaci, С. sieboldii, С. curva; эти виды были уже пе-
ренесены в состав Cothurnopsis при его установлении.
ТИП CILIOPHORA. КЛАСС OLIGOHYMENOPHOREA
949
Рис. 384, б. Mobilida.
Urceolaria elongata (И) (no: Fenchel, 1965); U. patellae (Б) (no: Raabe, 1961); U. karyodactyla (B) (no: Laird, 1961); U. kozloffi (Г) (no: Bradbury, 1970); Polycycla
synaptae (Д—Ж) (no: Faure-Fremiet, Czapik, 1966); U. heraldica (3—К, ориг.); Trichodinopsis paradoxa (= Urceolaria paradoxa (JT) (no: Beinbrech, 1967).
Fig. 384, 6. Mobilida.
Добавим виды Cothurnopsis bavarica comb. n. (= Cot-
hurnia bavarica Matthes et Guhl, 1973), C. pancerii
(= Vaginicola pancerii Ninni, 1866). Раковина на мас-
сивном стебельке, без четко видимого деления на 3 от-
дела стебелька, с 2 зооидами; трофонт и его ядро не
вытянуты, как зооиды в раковинах котурний; ядро по-
перечное, не лентовидное. Эпибионты на жабрах, пан-
цире, антеннах и ногах европейских речных раков; в
США и на Дальнем Востоке заменяются родом Daurot-
heca. Вид С. bavarica явно синонимичен с одним из
забытых старинных ввдов на раках в Италии. К сожа-
лению, типовой вид для Cothurnopsis выбран неудач-
но — пока неясно, монозойные ли мелкие виды С. as-
taci и С. curva или дизойные; у крупных видов всегда
по 2 зооида. На эстуарном раке Astacus pachypus всех
этих видов нет, встречается лишь Sincothurnia branchi-
cola.
Род Wesenbergia Н. Guhl et W. Guhl, 1993 не пред-
ложен должным образом, но по рисункам авторов
включает W. sieboldi, т. е. это синоним рода Cothurnop-
sis и гомоним; он не введен как новый («в печати»), но
позже авторы не публиковались. Вместо введения но-
вого рода достаточно было обозначить типовой вид у
старинного рода Cothurnopsis. Главный признак рода
по этим авторам — толстое поперечно расположенное
относительно короткое ядро.
Род Cystophrys Bresslau, 1922
Типовой вид С. gemmans из пресноводных на-
стоев; плохо описанный вид «нового рода вортицел-
лид» с мелкой (60 мк) почти закрытой двойной ракови-
ной, с общим устьем; размножение почкованием, при
котором делится и раковина; иллюстрации в недоступ-
ном журнале. Род не числится валидным в списках пе-
ритрих. Родовое название гомоним, заменено на Eily-
mophrys Corliss, 1979.
Род Da uro theca Jankowski, 1986
Типовой вид D. variabilis (= Cothurnia variabi-
lis Kellicott, 1883), также D. emarginata (K., 1883) c
Cambaridae Флориды и виды автора D. transoceanica,
D. tespa и D. ussurina (Янковский, 1985). Раковина
950
ALVEOLATA
асимметричная, устье отклонено вбок, фиксаторный
аппарат (фиксон) типичный для лорикат, с 3 отделами;
ядро компактное, не С-образное, не вытянуто по оси
тела, как у котурний, зооиды резко асимметричные; в
раковине один зооид. Род предложен для видов с тен-
денцией к образованию выступов и шипов на ракови-
не, и включает также исходные примитивные виды без
шипов, с угловатой раковиной. Все виды — симбион-
ты речных раков сем. Cambaridae (США, Япония, Ко-
рея, Дальний Восток России, должны быть также в Ка-
наде и Мексике). Раки с западного побережьк США
(Pacifastacus), не относящиеся к камбаридам, несут та-
кие же лорикаты; виды D. tespa и D. transoceanica опи-
саны с сигнального рака Pacifastacus leniuscuius, инт-
родуцированного в Литве. Один хозяин может нести
серию видов рода в разных локусах. В первоописании
зарисованы не один, а 2 или 3 разных вида под общим
названием (поэтому вид назван С. variabilis')-. как тип
вида и рода обозначаются сетобионты (Kellicott, 1883,
рис. 1—3). В обработке автора находятся около 10 но-
вых видов рода из США и новый род из Кореи.
Род Dimorphocothurnia Jankowski, 1980
Типовой вид D. nebaliae (= Cothumia nebaliae
Dons, 1928). Вид обитает на тельсоне филлокариды Ne-
balia bipes в Норвегии; серия сходных видов будет
описана с разных участков тела наших дальневосточ-
ных видов Nebalia, в основном с N. nemurensis. Ракови-
на кувшинчатая, вытянутая, вмещает только один зоо-
ид, внешне типичная котурния, с узким вытянутым те-
лом и продольным ядром; фиксон с 3 четкими
отделами. По форме зооида и типу раковины нет ника-
ких отличий от Cothumia sensu lato; родовой при-
знак — диморфизм фиксона. У примонта, осевшего на
покровах рачков, стебелек всегда длинный; мигранты
садятся на субстрат или на примонты, и в последнем
случае стебелек резко укорочен, может иметь вид дис-
ка или ножки. Так образуются колонии, до 4—5 эта-
жей на носителе («базобионте» по терминологии Фер-
нандеса-Леборанса, «базинте» по моей терминологии).
Это не случайность, а четкий диморфизм, зависящий
от субстрата. Раковины имеют разный облик у разных
видов рода из разных локусов на хозяине, но фиксон
всегда диморфный. У других родов лорикат возможно
случайное поселение одной особи на другой без ди-
морфизма стебельков.
Род Miculopodium Hadzi, 1940
Типовой вид М. cementatum с пещерной во-
дной мокрицы Microlistra spinosissima в Югославии;
предложен как подрод рода Vaginicola — V. (М.) се-
mentata, но вид не имеет никакого отношения к ваги-
николам. Раковина узкая, вытянутая, не сплющена, с
одним зооидом стандартного типа, судя по наличию
продольного ядра (in vivo вид не изучен). Точное стро-
ение фиксона не изучено; у всех особей вместо диска
или стебелька показана аморфная масса, клеящая рако-
вину к щетинкам плеопод рачков. Ранее без названия
вид отмечался в Италии на максиллах (ротовых при-
датках) пресноводных пещерных сфероматид рода
Monolistra (= Coecosphaeroma, Vireia, Typhlosphaero-
ma). Статус рода неясен, нужно провести изучение
фиксона.
Род Ophionella Kent, 1882
Типовой вид О. picta по монотипии; из пресно-
водного перифитона. Раковина очень широкая у осно-
вания, сужается к вершине, не сплющена; зооид один,
с длинным ядром, напоминает обычных котурний;
прикрепление к субстрату всем основанием раковины,
фиксона нет. Этот вид иногда считали офридиями, но,
вероятно он идентичен с хорошо описанным и зарисо-
ванным видом Cothumia ceratophylli Penard, 1922 (О. се-
ratophylli comb, п.), тоже из перифитона, с центральным
зооидом в раковине и толстым фиксаторным слоем на
субстрате. Этот вид относили к Vaginicola (V ceratop-
hylli), такие виды есть и в море (V amphora). Вероятно,
Ophionella не идентична с Vaginicola, последняя имеет
узкий высокий домик и 2 зооида в раковине; но поско-
льку вид О. picta плохо описан, род неприемлемый.
Возможно, что это зооид и раковина вида Ophrydium,
не образующего крупных колоний. Сходный вид —
Vaginicola tincta Ehrenberg, 1830 (О. tincta comb. n.).
Род Ophrydiopsis Penard, 1922
Типовой вид О. concava по монотипии. Еще
один плохо описанный вид, статус рода неопределен-
ный; допускалась синонимия с родом Scyphidiella, но
это безраковинный род перитрих. Вид непохож на зоо-
идов котурний, ядро овальное, перистом с обширной
полостью, на стенках перистома много ресничных ря-
дов; раковина тонкостенная, едва заметная, «мукоз-
ная». В Traite (Puytorac, 1994) род помещен в сем.
Scyphidiidae, но, возможно, это офридиида.
Род Rossonophrys Jankowski, 1989
Типовой вид R. vastus по монотипии; с основа-
ния каудальной фурки Nebalia nemurensis (Leptostraca).
Раковина вытянутая, почти не сплющена, с узким устьем,
отогнутым резко вбок; фиксон тройной — длинный эк-
зостил, короткий широкий мезостил и прикрепитель-
ный диск вместо эндостила; внизу раковина двойная, с
мезостилом между ними. Зооид один, с длинным изви-
тым ядром и небольшим эпидиском, с очень широким
телом, заполняющим всю раковину. Родовая особен-
ность — форма тела и аберрантный перистом, с систе-
мой полостей у основания узкого дискофора с мелким
эпидиском. У котурний перистом простой, с валиком и
боковым инфундибулярным отверстием.
Род Semicothumia Jankowski, 1976
Типовой вид Cothumia acuta Levander, 1915.
По Аэшт, название невалидно как предложенное в те-
зисах и как признанное синонимом рода Cothumia в
ТИП CILIOPHORA. КЛАСС OLIGOHYMENOPHOREA
951
определителе котурний (Warren, Paynter, 1991). Здесь
предлагается вторично Semicothurnia gen. п., типовой
вид рода — S. acuta comb. п. Синонимизация с котур-
ниями — не аргумент, поскольку тип рода котурний с
уникальной морфологией подменен в литературе дру-
гим видом. S. acuta — обычный, временами массовый
вид на щетинках параподий полихет — полиноид рода
Harmothoe в северной Европе (Балтика, Мурман, Бе-
лое море). Раковина коническая, резко сужается к
основанию; вид дизойный; внешний облик трофонтов
типичный для котурний. Родовой признак — фиксон;
нет привычного четкого деления на 3 отдела, нет двой-
ного дна раковины, и это исключает синонимию с ко-
турниями; прикрепление массивным асимметричным
фиксоном, зооиды прикреплены к диску на вершине
фиксона внутри раковины. Это очередной пример ро-
дообразования у узкоспецифичных симбионтов, когда
аберрантный род лорикат образуется только на одном
определенном роде хозяев.
Род Sincothurnia Jankowski, 1985
(рис. 382, 6—383, а)
Типовой вид Cothumia sinuosa Wailes, 1943 из
морского перифитона. Раковина высокая, сплющена,
устье сужено и отклонено вбок; трофонты типично ко-
турнидные, с длинным осевым ядром, небольшим эпи-
диском, в раковине всегда по 2 зооида. Вид обычен на
Мурмане, поэтому этот важный признак точно уста-
новлен, так же как и наличие только одного зооида у
С. maritima, столь же частого на водорослях Мурмана
(рисунки видов см.: Янковский, 1985). Уже отмечено,
что настоящий типовой вид котурний — С. imberbis —
это вид всеми признанного рода Cyclodonta, поэтому
последнее название уходит в синонимию, а котурний
нужно распределить по 2 родам — Sincothurnia (2 зоо-
ида) и новый род с 1 зооидом в раковине. При описа-
нии многих видов на этот признак не обращали ника-
кого внимания, и такие виды до повторного изучения
не получают точного родового статуса. Дизойные
виды котурнид часты в перифитоне и в симбиофауне
ракообразных. Примеры видов: S. auriculata (Stiller,
1939); S.flexa (Felinska, 1965); S. compressa (C. et L.,
1859); S. compressula (Felinska, 1965); S’, cyathiformis
(Stiller,1939); S. elongata (Fromentel, 1874); S.paguri
(Andre, 1910); S. rhabdota (Bock, 1952); S. patula (Fro-
mentel, 1874); 5. branchiata Boschko, 1995 и др.
Род Tesnotheca Jankowski, 1986
Типовой вид Cothumia limnoriae Dons, 1928 no
монотипии; синоним рода Cothumia no Warren et Payn-
ter, 1991. Вид обычен на теле и переоподах изо-
под-древоточцев Limnoria spp. во всех местах сбора —
Крым, Мурман, Дальний Восток от Владивостока до
Камчатки и Командор. В раковине один массивный
зооид, ядро С-образное, прикрепление стебельком,
фиксон с четкими 3 зонами. На фиксированных препа-
ратах перистом смещен несимметрично вбок, к устью
обращена вздутая правая часть тела; это и считалось
родовым признаком. У котурний зооид при сокраще-
нии остается симметричным. Но поскольку несокра-
тившийся зооид сходен с таковым котурний, это,
вероятно, не самостоятельный род, а подрод котурний.
Тем самым решается проблема статуса монозойных
видов котурний — их всех можно поместить в состав
рода Tesnotheca.
Род Vaginicola Lamarck, 1816
Часто пишут Vaginicola Lamarck — Ehrenberg,
1830, следуя Калю (Kahl, 1935). Род предложен для
3 неродственных видов цилиат без указания типа
(Т. inquilina, Т. ingenitan Т. tincta), один вид отделен от
перитрих как тиНтиннида, другой перенесен Эренбер-
гом в Cothumia, третий (тип рода Trichoda ingenita)
признан синонимом вида Vaginicola crystallina. Очень
трудный род, вместилище всевозможных лорикат
вплоть до мешковидных плаТикол; под V. crystallina
понимали любой вид без наружного стебелька. На
рисунках Эренберга (Ehrenberg, 1838) показано по
2 зооида в высокой вытянутой не сплющенной вазооб-
разной раковине с Поперечным округлым устьем; нет
никакого фиксона, раковина прикреплена закруглен-
ным нижним концом; зооиды очень длинные и узкие, с
зоохлореллами, похожие на Thuricola. Вид с внутрен-
ним стебельком — V. longistyla, с широкой раковиной
V. tincta. Род сборный, морфология не изучена дол-
жным образом; ранние авторы изучали цилиат без им-
мерсии и могли не заметить фиксона и замкового аппа-
рата, как у турйколы. Ясно, что это Thuricola, но дан-
ное синонимичное название общепринято и заменено
не будет.
Род Pyxicola Kent, 1882
Типовой вид Р. affinis Kent, 1882 по моему
обозначению. Относительно крупный род из пресно-
водного перифитона, немногие виды в море (Р. socia-
lis, Р. eforiana). Раковина не сплющена, с небольшим
округлым устьем, обычно оранжевая или коричневая
от солей железа, часто с кольцевыми утолщениями (ва-
ликами) стенки. Прикрепление стебельком, особо
длинным у Р. socialis, с четким делением на 3 зоны;
раковина двойная. Трофонты вытянутые, с длинным
ядром; у апекса левее перистома край тела разрас-
тается с образованием округлой пластинки с проч-
ным наружным слоем, легко впитывающим соли же-
леза и имеющим ржавый цвет; эта структура (opercu-
lum) служит для защиты сократившегося зооида. Виды
рода обычны на всех континентах; симбионтов нет,
кроме Р. psammata с пещерных изопод Югославии,
но очень близкие роды заселяют ракообразных. Опуб-
ликована ревизия рода — (Trueba, 1978). В сводке
не упомянуты подробные, хорошо иллюстрирован-
ные описания русских авторов. Из его состава выделен
род Stilleriana W. Guhl et Н. Guhl, 1993, без указания
типового вида, диагноза и рисунков, поэтому род не-
валидный. Примеры видов: Р. pyxidiformis (Dudekem,
1864 in Cothumia)', P. entzii (Stiller, 1931 in Cothurniop-
sis); P. pusilia (Wrzesniowsky, 1866 in Cothumia)',
P. carteri Kent, 1882; P. operculigera (Kent, 1869 in Cot-
952
ALVEOLATA
humid); P. socialis (Gruber, 1879 in Cothurnia)', P. psam-
mata Hadzi, 1940; P. eforiana Tucolesco, 1962; P. nolan-
di Finley et Bacon, 1965 и др. (не все названия ва-
лидные).
Род Donicola Jankowski gen. n.
Типовой вид D: thuricolae comb. n. (= Cothur-
nia thuricolae Shubemetzki, 1978), специфический сим-
бионт южных пресноводных гаммарид — на «эпи-
крийных пластинках» (на коксах) Rivulogammarus bal-
canicus в Молдавии и на Украине. Название от
скифского слова «дон» — река. Этот вид следовало
включить в состав Pyxicola sensu lato (Р. thuricolae
comb, n.); отличие от типичной пиксиколы — иное по-
ложение и форма защитной пластинки. Раковина не-
большая, рюмковидная, трофонт один, заполняет всю
раковину, не вытянут, как у котурний; нетипично по-
ложение и форма пластинки — щитовидная, тонкая,
прикреплена не только к валику перистома, но и к
участку тела под ним. Не исключено, что такая тончай-
шая пластинка имеется, но не была замечена у Cothur-
nia carinogammari Stiller, 1953 с такой же формой тела.
Род Pachytrocha Kent, 1882
Типовой вид Р. cothurnoides по монотипии. Во
всем как Pyxicola pusilia, но вместо четкого оперкулю-
ма видно локальное вздутие стенки валика в том же
участке перистома. Такие особи действительно встре-
чаются в пресноводном перифитоне, но это молодь
пиксиколы — начало роста щитка у осевшей особи,
образовавшей раковину. Род валидный у ряда авторов,
включая Traite, но все же это синоним рода Pyxicola.
Cothurnia asymmetrica Sommer, 1951 — такая же мо-
лодь пиксиколы, но отнесенная к другому роду.
Род Parapyxicola Jankowski, 1985
Типовой вид Cothurnia ligiae Cuenot, 1891, по-
зже в составе Pyxicola. Подробно изученный вид, спе-
цифический симбионт на жабрах морских изопод-они-
скоид (мокриц) Ligia oceanica, обитателей камней у
уреза воды во Франции; этого вида нет на крымских
лигиях L. italica, а на Дальнем Востоке на местной
L. cinerascens обитает другой вид без оперкулюма. В
принципе раковина и тело трофонта Р. ligiae, как у Py-
xicola, но ядро компактное (поэтому вид включали в
состав Cothurniopsis), и массивный оперкулюм с тол-
стым плотным щитком отличается от оперкулюма пик-
сиколы.
Род Caulicola Stokes, 1894
Типовой вид С. valvata по монотипии из гало-
фильного перифитона. Описано по крайней мере 3 ви-
да рода — Caulicola valvata Stokes, 1894; Cothurnia py-
xidiformis Dudekem, 1862 и Pyxicola nodosa Vuxanovici,
1961; небольшая округлая пластинка закрывает при
сокращении вход в раковину, прикреплена не к зоо-
иду, а к краю устья раковины. Трудно поверить таким
описаниям, вероятнее всего род предложен по ошибке,
основан на неправильном рисунке. За полтора века не
появилось достоверного описания таких форм.
Род Cothurniopsis Stokes, 1893
Типовой вид С. valvata с водорослей из соло-
новатых вод в США; зооиды типа Cothurnia, не пикси-
колы, на устье раковины имеют створку (продолжение
стенки раковины), закрывающую устье при сокраще-
нии особи внутри раковины. На рисунке показана ко-
роткостебельчатая раковина без такой крышки, зооид
не зарисован; видимо, это обычная котурния. В катало-
ге Аэшт род валидный (синоним — Pseudothuricola),
но с этим невозможно согласиться, вид неопредели-
мый, по раковине и стебельку несходен с фиктивным
видом Caulicola valvata Stokes, 1894.
Род Stylocola Fromentel, 1874
В разных местах книги (Fromentel, 1874) считается
подродом котурний или родом; включает виды Cothur-
nia только с очень коротким внутренним стебельком;
раковина прикреплена диском, без экзостила. Из 2 ви-
дов 5. ampulla F., 1874 и S. striata F., 1874 типовым я
обозначаю S. ampulla', оба вида у Каля (Kahl, 1935) в
составе Vaginicola, и род Stylocola не признается.
S. ampulla — мелкий вид котурний с очень коротким
стебельком или со случайным отрывом тонкого сте-
белька, но не Vaginicola = Thuricola.
Род Planicola Fromentel, 1874
Род (или подрод в составе Cothurnia) предложен
для видов без наружного и внутреннего стебельков ра-
ковины, включает у Фроментеля 3 известных вида
(P.folliculata, Р. ingenita, Р. crystallina) и 3 новых
(Р. vestita, Р. attenuata, Р. inclinata). Все рисунки пло-
хие, но в основном это виды рода Thuricola Kent, 1881;
вместо создания нового рода Кент мог бы использо-
вать название Planicola. Обозначим здесь типовым вид
Р. folliculata (Muller, 1876) sensu Fromentel, 1874 —
ложное использование названия симбионта гарпакти-
цид для крупной туриколы. Род имеет приоритет, но
название Thuricola использовано в сотнях публикаций
и не уйдет в синонимику.
Род Thuricola Kent, 1881
Типовой вид Vaginicola valvata Wright, 1838
(= Cothurnia operculata Gruber, 1879; Cothurnia valvata
in Dons, 1922); (Trueba, 1980). Раковина очень крупная,
цилиндрическая, с широким устьем, расширена у суб-
страта, без наружного стебелька, но, вероятно, с внут-
ренней раковиной; в раковине по 2 зооида, виды ди-
зойные; монозойные виды не могут относиться к это-
му роду. Зооиды очень сократимые, необычайно
ТИП CILIOPHORA. КЛАСС OLIGOHYMENOPHOREA
953
длинные при растяжении, далеко выдаются за устье
раковины. Очень тонкая пластинка ниже устья, ровная
или складчатая — это вершина внутренней раковины,
которую ранние авторы не замечали (к примеру,
тип рода Vaginicola — это явно плохо описанная Thu-
ricola'). Род распространен в основном в пресных во-
дах, в море встречается эвригалинный вид Т. valvata.
Примеры видов (валидные виды и вероятные синони-
мы): Т. aestuarii Biemacka, 1963; Т. amphora Sommer,
1951; Т. constricta Kusters, 1974; T. elegans Biemacka,
1963; T. gracilis Sommer, 1951; T. gruberi Vejdovsky,
1892; T. innixa Stokes, 1882; T. obconica Kahl, 1933;
T. obliqua Sommer, 1951; T. pediculata Sommer, 1951;
T. similis Bock, 1963; T.vasiformis Hammann, 1952;
T. viridis Sommer, 1951. Возможно, это сборный род с
разным типом фиксона. У «морской расы» Т. valvata
внутренний стебелек отсутствует. Vaginicola crystalli-
па Ehrenberg и Tubularia vaga Schrank — несомненные
туриколы.
Род Thuricolopsis Stokes, 1887
Типовой вид Т. kellicottiana', считается нева-
лидным родом, как синоним Thuricola. Род предложен
для Т. innixa и Т. kellicottiana из пресноводного пери-
фитона с длинным стебельком для прикрепления зооида
ко дну раковины; считалось, что у типичных турикол
такого фиксона нет. Хорошее описание у Пенарда (Penard,
1922) (Cothurnia kellicottiana = С. castellensis Penard,
1914). В раковине один зооид, нет экзостила и базального
диска, имеется эндотека, отделенная от экзотеки по всей
длине; зооид прикрепляется ко дну эндотеки очень
тонким длинным стебельком. Длина раковины до
200 мк, зооида до 400 мк. Род может быть валидным,
если у типа рода Thuricola нет внутреннего стебелька,
но вероятно Т. valvata имеет укороченный стебелек.
Род Pseudothuricola Kahl, 1935
Типовой вид Cothurniopsis dionysii Penard,
1914 (= Cothurnia crystallina in Entz, 1904) по моноти-
пии, из пресноводного перифитона. Валидный род в
современной литературе. Раковина, как у котурний,
ромбическая, не трубчатая, сплющенная; в раковине
только один зооид, размеры небольшие по сравнению
с Thuricola (100 X 35 мк). Имеется тонкостенная внут-
ренняя раковина, не прилегающая к наружной (важное
отличие от Cothurnia). Трофонт длинный, с вытянутым
ядром, как у котурний; дочерняя особь после деления
покидает раковину. Прикрепление классическим трой-
ным фиксоном — очень короткий незаметный эндо-
стил или диск, мезостил в расширении раковины, уз-
кий экзостил длиной 15—20 мкм. Редкий малоизучен-
ный бриофильный вид.
Сем. Platycolidae Jankowski fam. n.
Рассмотренные выше роды лорикат сводятся к од-
ному типу — Cothurnia (в традиционном широком
объеме) — раковины расположены вертикально, при-
креплены к субстрату тройным фиксоном или его мо-
дификациями. Многие роды с нетипичным внешним
обликом, с оперкулярной пластинкой, с обособленной
внутренней раковиной сохраняют внешнюю раковину
и фиксон или его отделы такие же, как у котурний. При
изучении видов Platycola невозможно выявить фик-
сон — ни типичный, ни модифицированный; раковина
сплющена, прилегает к субстрату одной из сторон,
трофонты прикреплены ко дну раковины и вытягива-
ются горизонтально. Такие формы редки среди лори-
кат; у фолликулинид, напротив', редки виды с верти-
кальными раковинами. Лагенофрисы и оперкулигеры
из другого подотряда перитрих тоже имеют раковины
типа Platycola без следа стебелька.
Род Platycola Kent, 1882
Типовой вид Vaginicola decumbens Ehr., 1830;
ревизия рода Platycola проведена Уорреном (Warren,
1982). Род включает около 20 валидных и сомнитель-
ных видов в основном в пресных водах, единичные
виды в море (Р. donsi, Р. hydrobiae). Почти все виды
перифитонные, как исключение, плохо изученные in
fixo комменсалы Л lageniformis Hadzi, 1940 и Л callis-
toma Н., 1940 на пещерных изоподах Югославии Mic-
rolistra spinosissima', 3 вида на жабрах гаммарид Байка-
ла — Р. pala Swarczewsky, 1930 (на Parapallaseapuzyl-
li), P. amphora Sw., 1930 (Brachyurops = Acanthogam-
marus reicherti) и P. baikalica Sw., 1930 (Brandtia lata,
B. latissima, Eulimnogammarus fuscus)', мой материал с
E. viridis. Строение однотипное, род не делится на под-
роды. Раковина сплющена и расширена на одной из
сторон, приклеена к субстрату, верхняя сторона вы-
пуклая, переходит в короткую широкую шейку; устье
расположено под углом к субстрату, в виде широкой
поперечной щели. Все виды дизойные — в раковине
2 зооида, прикрепленные к едва заметному диску; осо-
би длинные и узкие, изогнутые, с вытянутым ядром;
антерон неширокий, с округлым эпидиском и длин-
ным инфундибулюмом; внешний облик типичный для
Cothurnia. На раковине части видов видны поперечные
ребра и мелкие сферулы. В прудах и болотах раковины
накапливают железо и становятся коричневыми. Орга-
ническая компонента раковины пока неизвестна. Вы-
тянутые зооиды поднимают перистом высоко над
устьем, при сокращении полностью сжимаются внут-
ри раковины. Для изучения легче всего найти Р. de-
cumbens и Р. truncata на полупрозрачных раковинах
мелких пресноводных гастропод типа Anisus и Planor-
bis и растворить минералы раковины соляной кисло-
той. Из состава рода нужно исключить вид Р. circularis
Dons, 1940 с плеопод древоточцев Limnoria — по резуль-
татам изучения на Мурмане (недалеко от типового мес-
тонахождения в Норвегии) это типичный лагенофрис, на
лимнориях из наших северных и дальневосточных мо-
рей и берегов Крыма нет симбионтных платиколид.
Примеры свободноживущих видов (включая пред-
положительные синонимы): Р. butschlii (Nusslin,
1884); Р. coelochila Stokes, 1887; Р. decumbens (Vagini-
cola in Ehrenberg, 1830); P. gracilis Fromentel, 1874;
P. hydrobiae (Hofker, 1940); P. mollis (Fromentel, 1874);
P. steineri (Penard, 1922); P. dilatata (Fromentel, 1874).
954
ALVEOLATA
Род Muscipula W. Guhl et H. Guhl, 1993
Типовой вид M. sebastiani по монотипии из
пресноводного перифитона. В раковине только один
зооид; раковина более узкая, чем у Platycola, с неболь-
шим устьем. При виде сверху видна крестообразная
структура — ребра раковины и замковая пластинка в
глубине устья; при сокращении зооида меняется фор-
ма раковины и устье её закрывается. Зооид такой же,
как у Platycola, но с более коротким ядром. Раньше та-
кие формы отмечали, но определяли неправильно и не
замечали структуры раковины и устья.
Подотряд Operculariina Jankowski, 1980
При всем многообразии видов общий признак —
наличие автономного стомодиска — мембрана и мемб-
ранелла М2 огибают небольшой диск и уходят в бук-
кон по его стволу (дискофору), со всех сторон отграни-
ченному от краевого валика, который у оперкулярий
часто не выражен, хотя край тела содержит мускуль-
ное кольцо. Типичных оперкулярий можно найти в пе-
рифитоне {О. coarctatd), на раковинах мелких дву-
створчаток — сфериид; можно наблюдать независи-
мое сокращение дискофора при неподвижных стенках
тела, что невозможно у видов подотряда Vorticellina.
О целесообразности различения двух групп выска-
зался Дж. Кламп (Clamp, 1998); даже у аберрантных
раковинных лагенофриид автономный стомодиск на
дискофоре сохранен без изменений, это общий при-
знак большого числа родов, отделяемых от остальных
сессилид.
Сем. Entziellidae Jankowski, 1985
Этот таксон был предложен как подсем. Entziellinae
в составе сем. Operculariidae (Янковский, 1985, р. 98).
У вортицеллин виды с сократимой мионемой отделе-
ны от остальных на уровне семейства; по аналогии
следует обособить также роды оперкулярий с мионе-
мой в дихотомическом стебельке. К этому семейству я
отношу также Tauriella с талитрид Крыма; важно на-
личие мионем, а не их топография.
Род Entziella Stiller, 1951
Вначале род был отнесен к сем. Zoothamniidae.
Типовой вид Е. asellicola по монотипии; с го-
ловы, ротовых частей и передних переопод Asellus
aquaticus-, позже в состав рода перенесен вид Zootham-
nium aselli (С. et L., 1859), хотя давно уже известно его
сходство с Opercularia-, указания его для амфипод
Gammarus и Niphargus ошибочные; часть авторов до
сих пор считает Z. aselli видом рода Zoothamnium. Ко-
лонии некрупные, прикреплены к голове пресновод-
ных изопод — аселлот; стебелек мощный, высокий, с
правильной дихотомией; зооиды вытянутые, с удли-
ненным ядром и типичным для оперкулярий узким пе-
ристомом, практически без валика. Мионема необыч-
но толстая, идет от базодиска до скопулы зооидов, вет-
вится при делении особи. Z. aselli не был хорошо изу-
чен, но по некоторым деталям в первоописании можно
догадаться, что это Entziella (ветвление мионемы, не-
четкий валик, небольшой диск). Этот род был вторич-
но описан как новый подрод со стернитов и оснований
конечностей того же хозяина без знания прежней лите-
ратуры как Zoothamnium (подрод Operculariopsis) mi-
nus Boitsova, 1977; высота колоний 200—300 мкм при
длине зооида 65—72 мкм; в колонии 10—15 зооидов, в
одной из 5 найденных колоний отмечен макрозооид
(макронт), но фактически просто ненамного более
крупный зооид.
Новый вид Е. talitris Jankowski, 1993 с широким
стебельком и четкими фибриллами в толще стебелька
в дополнение к мионеме найден на прибрежных «мор-
ских блохах» — амфиподах сем. Talitridae в Крыму;
эти рачки обитают под камнями, в песке и под слоем
водорослей на берегу, активны ночью, в пресной воде
гибнут; симбионты живут только в морской воде; засе-
лены Orchestia bottae и О. montagui, в литературе отме-
чены на этих и 2 других хозяевах в Карадаге (<9. gam-
marella, О. mediterranea). Прежнее обычное название
О. bottae — О. cavimana (хозяин эвригалинных лаге-
нофрисов), сейчас невалидное как синоним. Возмож-
но, виды с талитрид и аселлот близкородственны. Де-
финитивные колонии могут состоять из 20—30 зоо-
идов, но обычно их 8—24; мионема базостила
достигает фиксаторного диска; форма базостила, вет-
вей и всей колонии очень изменчивая; на базостиле не-
редки зубцы — следы раннего отделения мигрантов.
Плохо описанный вид Opercularia raabei Dobrzanska,
1961 с талитрид Talitrus saltator польской Балтики
тоже принадлежит к Entziella (Е. raabei Jank. comb, n.),
но имеет широкое эллипсоидное ядро; на жабрах и но-
гах крымских талитрид живет и обычный вид Opercu-
laria сета Jank., 1993. Вероятно, подвид Zoothamnium
oviforme Sommer subsp. stenostomatum Gong, 1986 c
Asellus в Китае, с узким перистомом — тоже Entziella-,
в колонии 2—8 зооидов на длинном широком базости-
ле; этот вид не сравнивался с Entziella с таким же
внешним обликом зооидов и колонии (не более 5—
6 особей в колонии).
Род Tauriella Naidenova, 1985
(рис. 383, а)
Типовой вид Т. lomi по монотипии; в тезисах
был указан как Tanriella (эрроним) lomi Naidenova,
1980 in Naidenova et Mordvinova, 1981 с хозяином —
изоподой Sphaeroma serratum; низкие колонии с 2—
12 особями найдены на основании жабер, но позже в
статье (Найденова, 1985) этот новый род и вид указа-
ны в сем. Rovinjellidae Matthes, 1972 с жабр супралито-
ральных амфипод — талитрид Orchestia bottae и
О. montagui в Карадаге и Балаклаве. На жабрах немно-
го колоний, всего 3—5 найдены на хозяине, высота ко-
лонии 100—125 мкм при длине клеток 46—51 мкм,
каждая с 2—10 зооидами; клетки вытянутые, узкие, с
очень узкой вершиной, без вортицеллидного валика,
реснички на длинном узком автономном дискофоре;
ядро С-образное, вытянуто продольно. Примонт коло-
нии образует массивную базальную чашу (базотеку) с
ТИП CILIOPHORA. КЛАСС OLIGOHYMENOPHOREA
955
толстой конической фибриллярной внутренней зоной,
делится и от вершины этого домика растут широкие
ветви с парой зооидов на вершине каждой ветви. Резко
расширена гомогенная наружная часть стебелька, об-
разуя толстые прозрачные массивные стенки рюмковид-
ных домиков (лорики), мягкие и складчатые. Трофонт
прикреплен широким основанием ко дну домика и в
толщу его отходит коническая острая мионема, автоном-
ная у каждого зооида, примерно равной длины, по типу
Intranstylum, с ограниченной сократимостью. Различимы
первичный (базальный) домик и более мелкие вторичные
(дефинитивные) домики. В состав сем. Rovinjellidae
предложено включить Delamurea (sic), Craspedomyos-
chiston, Kindella, Allomeron и Rovinjella (с эпистилид-
ным перистомом); в состав «нового» сем. Nedulidae
(sic) — оперкулярные роды Nedula (sic), Orbopercula-
ria, Discotheca, Ballodora, TaurzeZ/a (Найденова, 1985).
Приложение
Род неясного положения Baikalonis
Jankowski, 1982
Типовой вид В.foissneri', симбионты на боко-
вых выростах (дыхательных нитях) сегментов тела ли-
чинок эндемичных литоральных байкальских ручей-
ников Baicalina bellicosa на камнях сублиторали. Оди-
ночные формы с узким цилиндрическим телом,
двойным валиком; стомодиск широкий, но оперкуляр-
ного типа, с дискофором; ядро удлиненное; стебелек
короткий, сократимый, с массивной мионемой, при со-
кращении особи сжимается без отклонения в сторону и
целиком втягивается внутрь тела — я называю это осе-
вым сокращением. Резко выражен фибриллярный ко-
нус в нижней части тела (постесоме), с толстыми мус-
кульными стенками этой зоны, тоже целиком сократи-
мый. Длина тела 56—60 мкм, стебелька 12—14 мкм.
На байкальских гаммаридах оперкулярий нет, но на
личинках эндемичных ручейников есть стандартные
оперкулярий, во всем несходные с Baikalonis', это мо-
жет быть локальный дериват перифитонной группы
Propyxidium.
Не заметив в диагнозе рода упоминания об оперку-
лярном диске, Уоррен (Warren, 1988) включил в состав
этого рода также Haplocaulus sp. in Bierhof et Roos,
1976 с гаммарид как Baikalonis gammari Warren, 1988 c
эпистилидным перистомом и фиктивный морской вид
Vorticellopsis undulata Dons, 1918 (В. undulata). Но это
тип рода Vorticellopsis, поэтому при его включении
род Baikalonis должен быть ликвидирован. Зарисован
примонт зоотамния, начавшего выделение стебелька с
широкой мионемой на субстрате; вид совершенно не-
определим, род Vorticellopsis невалиден, и это не опер-
кулярии, которых нет в морском перифитоне.
Сем. Operculariidae Faure-Fremiet
in Corliss, 1979
С диагнозом подотряда. Крупное полиморфное се-
мейство, включает одиночные и колониальные формы,
раковинные и безраковинные; виды с мионемой встре-
чаются как исключение (Entziella) и выделяются в осо-
бое сем. Entziellidae. Оперкулярий обычны в пресной
воде, в перифитоне и на беспозвоночных; в море в
основном симбионтные виды. Не всегда стомодиск
очень четко обособлен, независим от края тела с мионе-
мой; есть виды с широким диском и коротким диско-
фором, например на личинках ручейников; выше при-
веден вид такого типа Baicalonis foissneri с мионемой.
Род Opercularia Gdldfuss, 1820
Типовой вид О. articulata (Ehrenberg, 1838)
Stein, 1854; синонимы рода, по Аэшт, Valvularia, Орег-
culina, Cochlearia, Kindella, Discotheca', два первых
старинных названия непригодны и забыты, но три сле-
дующих валидные, один из родов (Kindella) не отно-
сится к оперкуляриям.
Как правило, тело оперкулярий цилиндрическое,
стенки тела прочные, с хорошо развитой системой
фибрилл и мионем; кортекс у всех оперкуляриид с
циклонемами, аргентофильной сети нет. Апекс узкий
или широкий в зависимости от ширины стомодиска и
дискофора; ядро С-образное. Имеется сфинктер, но ва-
лик обычно не выражен. Буккальная полость очень
крупная, глубокая; эпидиск с дискофором могут втяги-
ваться без сокращения стенок тела и без закрытия бук-
кона сфинктером. Стебелек с правильной дихотомией
у перифитонных форм, но у симбионтов может иметь
всевозможную форму, иногда низкий и короткий, или
в виде аморфной массы, на которой расположена груп-
па зооидов. Наличие раковины обычно не считают ро-
довым признаком, но по аналогии с лорикатами и сук-
ториями виды с дисковидным фиксоном или ракови-
ной не могут быть в одном роде с дихотомическими.
Ниже приведены как пример несколько свободножи-
вущих видов рода.
О. nutans (Ehrenberg, 1831) (вид с исчерченным сте-
бельком, зооиды отклоняются вниз при раздражении);
О. confusa Stiller, 1940; O.fischeri Guhl, 1985; О. venus-
ta Foissner, 1979; O. wallgreni Grier, 1916; O. coarctata
(Claparede et Lachmann, 1859) (вид с тонким стебель-
ком, много синонимов); О. arboricolum (Biegel, 1954 in
Pyxidium) Foissner, 1981 (с пустым стебельком по всей
колонии, вид должен быть обособлен в новый подрод).
Примеры симбионтных видов на водных насеко-
мых — Opercularia alta Boitsova, 1977 (Phryganea)',
О. doliiforma Nenninger, 1948 (Ilybius)', O. hydroi Mat-
thes et Guhl, 1975 (Hydrous)', O. tobsinella M. et G., 1975
(Laccobius)', O. medians Collin, 1909; O. archiorbopercu-
laria Foissner, 1979 (Hydrophilidae, с переходным ти-
пом ядра); О. chironomi Boitsova, 1977; О. chironomi
Schubemetsky, 1978 (гомоним); О. cylindrica Gong, 1989;
О. corisae (sic) Faure-Fremiet, 1906 (Corixa)', O.jumpi
Guhl, 1972 (личинки стрекоз); О. xinjiangensis Gong, 1989
(Hydaticus)', O.'rhanti Nenninger, 1948 (Rhantus)', O. phry-
ganea Kahl, 1935 (Phryganea)', O. nautonectae (sic) Fa-
ure-Fremiet, 1906 (Notonecta)', O. naucoris Faure-Fremi-
et, 1905 (Naucoris)', O. halipli Nenninger, 1948 и мн. др.
Примеры видов на других водных хозяевах —
О. asimmetrica Banina, 1977 (Mes осу clops)', О. asellicola
Kahl, 1935 (Asellus)', О. crustaceorum Biegel, 1954 (Astacus);
O. cylindrata Wrzesniowski, 1870 (Cyclops)', O. gammari
956
ALVEOLATA
Faure-Fremiet, 1906; О. protecta Penard, 1922 (Gamma-
rus); O. reichelei Matthes et Guhl, 1973 (Ast acus); 0. ste-
nostoma Stein, 1868 (Asellus)', О. cema Jank., 1993 (Or-
chestia)', O. interna Boitsova, 1979 (Unio)', 0. HgiaeMat-
thes, 1955 (Ligia)', O. hydrachnidarum Faure-Fremiet,
1905 (Hydracarina); 0. subcorethrae Sommer, 1951 (Hy-
dracarina); O. ovalis Banina, 1977 (Cyclops) и др.; засе-
лены олигохеты, моллюски, водные клещи, ракообраз-
ные; нередко совместно встречаются виды Opercularia
и Orbopercularia.
Род Operculina Bory de St Vincent, 1824; предложен
для 2 новых видов О. roeselii и О. bakerii, в сущности
это один вид колониальных оперкулярий, перистом
(ресничный диск на высоком узком дискофоре) пока-
зан спереди и сбоку; типовым видом я обозначаю
О. roeselii; род уходит в синонимику оперкулярий. Род
Tickel Oken, 1816 — синоним рода Opercularia.
Род Corixicola Jankowski, 1976
Типовой вид Opercularia coronata Lust, 1950
с передних ног водного клопа Corixa punctata; в ко-
лонии до 15 зооидов, внешне и по ядрам это типичные
оперкулярии; базостил превращен в обширную аморф-
ную массу, на которой расположены короткие стебель-
ки трофонтов. Родовое название невалидно, поскольку
предложено в тезисах, и здесь не заменяется новым,
так как вид недостаточно описан, нужно больше иллю-
страций, чтобы понять тип фиксона; если таксон счи-
тать подродом оперкулярий, нужно сменить название.
Род Ampullaster Jankowski, 1976
Типовой вид Pyxidium stammeri Lust, 1950 по
монотипии; мелкий (20—43 мкм) одиночный вид с
тонким стебельком, вершина которого погружена в
глубь тела; стомодиск и дискофор очень мелкие, без
краевого валика, в узкой полости, что нетипично для
оперкулярий с обширным букконом; ядро овальное
или почковидное; зарисовано подобие секреторных
ампул, как у скопулы хонотрих, поэтому род назван
Ampullaster. Это название предлагалось для неколони-
альных видов с округлым или эллипсоидным ядром,
но Аэшт объявила его невалидным как предложенное
в тезисах. Типовой вид может быть найден на тарсах
большого числа водных жуков Berosus spinosus, Апа-
саепа limbata, Philydrus spp., Helochares griseus, Cym-
biodyta marginella, Laccobius minutus, Coelostoma orbi-
culare и Cercyon unipunctatus; при повторном изучении
вида нужно обозначить типового хозяина.
Род Orbopyxidiella Guhl, 1979
Типовой вид Pyxidium stammeri Lust, 1950; род
предложен для 4 видов с указанием типа — О. stamme-
ri (Lust, 1950) (с жуков, см. род Ampullaster), О. minuta
(Lust, 1950) с Helochares griseus, О. matthesi (Guhl,
1972) с олигохет, нетипичный вид с полостью в сте-
бельке и О. helophori (Matthes et Guhl, 1975) с перед-
них ног жуков Helophorus; все виды — симбионты
пресноводных беспозвоночных; особи одиночные, на
коротком стебельке, ядро от округлого до трапецие-
видного, не вытянутое. Позже список увеличился,
были включены виды О. grelli (Matthes et Guhl, 1974) с
жука Platambus maculatus, О. kahli (Nenninger, 1948) c
олигохет Lumbriculus и Stylaria, вид с широким эпи-
диском и мелким стебельком и другие, ранее в составе
Pyxidium. Виды рода можно найти на олигохетах,
остракодах, водных жуках и т. д. В другой публикации
род Orbopyxidiella был введен как новый только с упо-
минанием вида О. matthesi; похожая форма, но с розет-
ками из 2—4 зооидов на коротком стебельке описана
как Orbopercularia oligochaetae Schubemetzky, 1978.
Вид с остракод Cypria ophthalmica (Orbopyxidiella su-
sannae Schodel, 2004) может быть идентичным c Pyxi-
dium strelkowi Schubemetzky et Chorik, 1977 с неопре-
деленных остракод Молдавии (Orbopyxidiella strelkowi
Jank. comb, n.; также Orb. spasskii Jank. comb. n. для Py-
xidium spasskii S. et Ch., 1977). Мой род Ampullaster
Jankowski, 1976 с тем же типовым видом предложен
раньше, но в тезисах конференции и поэтому признан
невалидным.
Род Orsomia Baer, 1952
Типовой вид О. mangenoti с олигохет Aspidod-
rilus eburneensis (Enchytraeidae); это мелкие черви ве-
личиной 2.5—3.6 мм, в большом числе поселяются на
покровах тела крупного почвенного дождевого червя
Dichogaster baeri в тропическом лесу в западной Аф-
рике; покровы червя насыщены секрецией и влагой,
полны бактерий; инфузории рассеяны по всему телу
A. eburneensis поодиночке или в мелких колониях на
низких широких стебельках с 4—5 особями. Рисунки
вида очень плохие, но автор рода сближал вид с Oper-
cularia, считая отличием длинный извитой макронук-
леус у нового рода; но судя по рисункам никаких отли-
чий на родовом уровне нет.
Род Propyxidium Corliss, 1979
Типовой вид Pyxidium cothurnoides Kent, 1882.
Название предложено для замены гомонимов Pyxidium
Kent, 1881 и Pyxidiella Corliss, 1960. Одиночные опер-
кулярии делятся на 2 рода по типу ядра, С-образное у
данного рода, округлое у Orbopyxidiella; стебелек
обычно небольшой, тонкий, короче тела. В состав рода
входят свободные виды и симбионты на разных груп-
пах хозяев — олигохетах, пиявках, низших и высших
ракообразных, почти все виды пресноводные, род быст-
ро укрупняется; примеры видов — Р. acaule (Kahl,
1935); Р. asymmetrica (Matthes et Guhl, 1973); P. aselli
(Penard, 1922); P. canthocampti Penard, 1922 (но зарисова-
на колония); P. longicollum Biegel, 1954; P. piscicolae
(Nenninger, 1948); P.collare (Kahl, 1935); P. ventriosa
(Nenninger, 1948) — вид c Corethra = Chaoborus, несо-
мненно примонт колоний; P.juliae Guhl, 1993; P. sinu-
osum Matthes et Guhl, 1972; P. tectiformis (Scheubel, 1973;
на рыбах, с пластинкой на вершине стебелька; см. Icht-
hyophyllum). Типовой вид Р. cothurnoides находят в пе-
рифитоне, на кладоцерах и на остракодах типа Cypris.
ТИП CILIOPHORA. КЛАСС OLIGOHYMENOPHOREA
957
Род Discophyson Jankowski, 1985
Типовой вид D. liberus из бактериальной плен-
ки и детрита прудов и лабораторных культур. Зооиды
тонкие, вытянутые, веретеновидные, с широким дис-
кофором и эпидиском перистома и узким псевдости-
лом, на очень узком стебельке, закрепленном в грунте
с помощью якорного вздутия (физона). Вид подробно
описан и иллюстрирован (Янковский, 1985), но может
быть у Opercularia coarctata или О. asymmetrica есть
такой физон, тогда это синоним рода Opercularia.
Именно таких форм, заякоренных в сгустке детрита
или бактерий, могли принять за типовой вид рода
Scyphidia — S. rugosa Dujardin, 1841.
Род Discotheca Jankowski, 1967
Типовой вид Opercularia cupulata Faure-Fremi-
et, 1948; вид описан с изопод Cymodoce truncata, обыч-
ных в гипосалинных литоральных водоемах у Конкар-
но (Франция), локализован в желобках крупных склад-
чатых жабр; колонии с несколькими зооидами (до 8)
на дихотомическом стебельке без мионемы; ствол ко-
лонии (базостил) низкий, продольно исчерчен, верши-
на его разрастается в стороны в виде обширного диска,
вогнутого снизу и у краев сверху; зооиды сидят на вы-
пуклой вершине в центре диска. Эпидиск перистома
башенковидный, мелкий, на четко обособленном дис-
кофоре; ядро поперечное, С-образное. Нет сомнения,
что это род группы Craspedomyoschiston, но формаль-
но он должен принадлежать к оперкуляриидам, а не к
Entziellidae, поскольку мионемы нет.
Род Speleoscyphidia Jankowski, 1980
Типовой вид Scyphidia husmanni Lupkes, 1974;
мелкий вид (67 X 20 мкм) из детрита и песка на дне чи-
стых подземных вод в Германии, добываемых насо-
сом. Вероятно, это не эпистилиды — показан узкий
диск и оперкулярный дискофор без мускульного коль-
цевого валика; специально подчеркивается, что это
одиночные оперкулярии. Неясно, как сокращается
диск — вместе с валиком или независимо. Ядро С-об-
разное, псевдостил узкий, складчатый, значительно
уже тела; базодиск не замечен, но этот отдел явно не
был изучен при иммерсии. В пределах рода Scyphidia
была обособлена группа видов с оперкулярным пери-
стомом — S. husmanni, S. dentata и 5. limacina (Lupkes,
1974); последний вид здесь по ошибке — это обычный,
хорошо изученный симбионт пресноводных гастропод
с эпистилидным перистомом.
Род Scyphidiella Guhl, 1979
Типовой вид Scyphidia dentata Matthes et Guhl,
1972; редкий симбионт на голове пресноводных жуков
Helochares lividus (Hydrophilidae) с длинным узким те-
лом, оперкулярным перистомом, С-образным ядром,
без стебелька, прикрепление неширокой подошвой.
Симбионты такого типа обитают на некоторых мор-
ских моллюсках, но возможна конвергенция; в ман-
тийной полости Truncatella truncatula обитает вид
Scyphidia fischeri Vayssiere, 1885, сходные формы так-
же в крымских гастроподах Myosotella. Типовой вид
рода пока плохо изучен и нуждается в тщательном по-
вторном исследовании, особенно важен тип фиксона;
нужно убедительно доказать, что это не примонт
(основатель колонии) оперкуляриид. В состав рода
при его первоописании включены кроме типового
вида и Scyphidia fischeri также вид с гастропод 5. phy-
sarum Lachmann, 1856 и вид е пиявок У helobdellae
Nenninger, 1948. Хотя фактически повторена ошибка
предыдущего автора (Lupkes, 1974), нет вида S. hus-
manni. Вид 5. physarum дан здесь по ошибке, на прес-
новодных гастроподах Европы нет одиночных оперку-
лярий. В таком составе род Scyphidiella сборный и не-
естественный — я исключаю У physarum и S. fischeri',
первоописание и рисунки последнего выполнены ма-
лакологом очень непрофессионально, но такая же фор-
ма в Myosotella не относится к оперкуляриям. На пияв-
ках я пока не встречал одиночных форм, перитрихи об-
разуют небольшие колонии, это не сцифидии.
В Traite (Lom, Puytorac, 1994), полном ошибок, я
указан автором рода Scyphidiella Jankowski, 1985, а
предыдущий род пишется как «Spoleoscyphidian.
Род Cochlearia Faure-Fremiet, 1905
Род предложен для нескольких видов Opercularia
без указания типа, невалиден как гомоним. По Корлис-
су (Corliss, 1979), это синоним родов Opercularia и Ру-
xidiella, но оперкулярии понимаются им в очень широком
смысле. Первоначально включены новые виды Oper-
cularia henneguyi, O.fabrei, О. gracilis и О. microdiscunr,
для замены гомонима я предложил название Insectini-
cola Jankowski, 1976, невалидное в связи с публикацией в
тезисах. Здесь подрод Insectinicola Jankowski subgen. n.
в составе рода Opercularia предлагается не для замены
гомонима, а для другого типового вида Opercularia
medians Collin, 1909; это необычный вид с ног и вента
крупного жука Hydrous piceus, с вытянутым телом и
псевдостилом (длина тела 290—470 мкм), в колонии
до 8 особей на широком длинном дихотомическом сте-
бельке; ядро С-образное. При виде сбоку перистом не-
типичный, вероятно увеличено число оборотов до 2 (в
норме 1 кольцо), и полоса ресничек проходит диагона-
льно по краю длинного дискофора; у следующего рода
спирализация продолжается до 5 оборотов.
Род Spirocochlearia Jankowski, 1976
Типовой вид Opercularia faurei Collin, 1909.
По Аэшт, род невалиден как предложенный в тезисах;
здесь заменяется новым — Spirocochlearia Jankowski
gen. n. с указанным типом. Редкий гигантский вид с не-
обычной морфологией, симбионт жуков Hydrous ater-
rimus, заселяет ротовые придатки и вент (простернум);
длина зооидов с перистомом до 500—800 мкм, в коло-
нии 6—8 клеток, стебелек короткий, <100 мкм, широ-
кий, с короткими боковыми ветвями. Тело узкое, вытя-
нутое, ядро С-образное, стомодиск высоко поднят на
958
ALVEOLATA
необычайно длинной ножке, ротовая цилиатура с
5 оборотами на диске и дискофоре; псевдостил очень
длинный, с внутренним пучком фибрилл. У триходин
виды с редукцией спирали или с увеличением числа
оборотов не могут принадлежать к одному роду; это
должно быть правилом и для сессилид.
Род Ichthyophyllum Jankowski, 1976
Типовой вид Pyxidiella tectiformis Scheubel,
1973. По Аэшт, род невалиден как предложенный в те-
зисах; здесь не предлагается вновь, поскольку есть со-
мнения в валидности вида. Зарисована одна особь, не
колония, с цилиндрическим телом, С-образным ядром,
широким стомодиском, со всех сторон отграниченным
от валика; прикрепление коротким стебельком, от вер-
шины которого на дорсум отходит вогнутая пластин-
ка. Защитного аппарата такого типа нет у других пе-
ритрих; я считал это признаком нового рода. Ранее вид
включался в состав Propyxidium-, найден на жабрах Le-
uciscus leuciscus-, позже не отмечался в списках симби-
онтов рыб и не был изучен заново. Частично похожая
картина отмечена в литературе у Opercularia coarctata,
растущей на стебельке после эксцистирования с сохра-
нением части стенки стебельчатой цисты. Неизвестно,
сколько особей видел автор вида Р. tectiformis, это мог-
ла быть лишь одна особь с остатком цисты. Интенсив-
ное изучение инфузорий рыб проводилось в России, и
никто не отметил форм с таким «защитным щитком».
Род Orbopercularia Lust, 1950
Типовой вид Vorticella berberina Linne, 1767.
По Аэшт, Люст (Lust, 1950) предложил этот род для се-
рии видов без указания типа, поэтому род невалиден;
впервые типовой вид рода, по мнению Аэшт, указал
Гуль (Guhl, 1979), поэтому род цитируется ею как Or-
bopercularia Guhl, 1979. Это значит, что все виды круп-
ного рода должны быть перенесены как comb. п. в со-
став Orbopercularia N 2. Это очень серьезная и необъ-
яснимая ошибка. Люст очень четко указал типовой
вид, подробно обсудил его признаки и мотивировал
выбор вида, затем дал список видов, включенных в но-
вый род. Такое обозначение типа является примером
для всех цилиатологов. В каталоге Линна (Lynn, 2002)
вслед за Аэшт род тоже приписан Гулю, но Гуль про-
сто повторил название типа вслед за Люстом, он не пи-
шет, что тип рода указан им впервые. Поэтому ника-
ких переносов видов в несуществующий род Orboper-
cularia Guhl, 1979 не требуется.
Род включает большое число видов в основном
симбионтов пресноводных насекомых, реже на других
хозяевах. Колонии стебельчатые, у типового вида с
правильной дихотомией тонкого стебелька, но воз-
можны разные типы фиксона; раковинных форм и
виды с дисковидным фиксоном нужно исключить из
состава рода. Ядро у Opercularia С-образное, у Orbo-
percularia компактное — сферическое, овальное, ред-
ко дисковидное (плоское, но с овальным контуром).
Граница родов нечеткая, в море есть и переходные
формы с вытянутым, но не С-образным ядром. В дру-
гих группах цилиат, например у гетеротрих и дилепту-
сов, различия в форме ядра считаются подродовыми.
Виды рода обычны на личинках и имаго водных
жуков, другие виды на водных клопах (Hemiptera), па-
уках, клещах, на астацидах (речных раках), острако-
дах, других мелких Entomostraca. Распространение
рода очень широкое — Европа, Китай, Африка, США;
в Китае на жуках описаны О. cylindrica, О. xinjiangensis и
другие виды, а также раковинные формы, выделяемые
в новый род Syncyathella. Нередко на одном хозяине
обитают виды оперкулярий и орбоперкулярий. Часть
видов Propyxidium оказывается колониальной, хотя бы
с 2—4 зооидами, и они переносятся в данный род.
Примеры видов Orbopercularia — О. astacicola
(Matthes et Guhl, 1950); О. acilii (Faure-Fremiet, 1950);
О. beebei (Nenninger, 1948 in Scyphidia)-, O. cylindrica
Gong, 1989; O. coxarum M. et G., 1975; O. corlissi M. et
G., 1975; O. carlae M. et G., 1975; O. dytiscidarum (Fa-
ure-Fremiet, 1906); O. oligochaetae Schubemetzky, 1978;
O. fusiformis Gong, 1989; O.finleyil>A. etG., 1977; O. ge-
rikei Guhl, 1985 (редкий пример перифитонного вида);
О. haliplorum Lust, 1950; О. simileberberina М. et G.,
1974; О. hebetata M. et G., 1974; О. gyrini (Nenninger,
1948); O. violacea (Monard, 1918); O. triangulata Lust,
1950; O. tobsinella M. et G., 1975; O. turgida Lust, 1950;
O. dominiki Schodel, 2004 и др. Вид с остракод Orb. tret-
zeli (Matthes, 1950) Guhl, 1991 вновь повторен как
comb. n. — Orb. tretzeli (Matthes, 1950) Schodel, 2004.
Подрод Toxopercularia Jankowski subgen. n. с типо-
вым видом Orbopercularia wetzeli Lust, 1950 предла-
гается для вида с вентральной части проторакса жука-
полоскуна Acilius sulcatus с очень длинным дискофо-
ром, ненамного короче тела, вероятно с увеличением
числа оборотов ресничной спирали; стомодиск высоко
поднят над телом. Ранее предлагался род Ophiodiscus
Jank., 1976 (гомоним; в тезисах, поэтому невалиден) и
новое название Toxopercularia Jank., 1980 для его заме-
ны, по Аэшт, также невалидное, поэтому здесь повто-
рено вновь, ранг снижен до подрода в составе Orboper-
cularia.
Подрод Thysanotheca Jankowski subgen. n. с типо-
вым видом Orbopercularia matthesi Lust, 1950 предло-
жен в тезисах и невалиден, предлагается вновь для
оперкулярий с жука Philydrus frontalis с особым типом
стебелька — зооиды расположены почти вплотную на
плоской аморфной площадке широкого массивного
стебелька, прикреплены едва заметными стебельками,
нет правильной дихотомии узкого длинного базости-
ла, как у типичных оперкулярий. Название ранее пред-
лагалось в тезисах {Thysanotheca Jank., 1976) и было
признано невалидным.
Подрод Endogyrinella Jankowski subgen. п. Включа-
ет 2 вида с почти полной редукцией дискофора —
очень мелкий диск расположен на столь же мелком ди-
скофоре в обширной ротовой полости; прикрепление
складчатой массой, не напоминающей обычный ветви-
стый стебелек; в колонии несколько особей. Название
предлагалось ранее в тезисах {Endogyrinella Jank.,
1976) и было признано Аэшт невалидным.
Orbopercularia {Endogyrinella) ominosa Lust, 1950
(тип подрода ) обитает в предротовой полости — кли-
пеальном отделе эпифаринкса вертячек Gyrinus mari-
nus и G. substriatus глубже, чем следующий вид в том
ТИП CILIOPHORA. КЛАСС OLIGOHYMENOPHOREA
959
же хозяине, и имеет более редуцированный перистом,
но диск и дискофор не исчезают полностью.
О. (£.) gnathophila Matthes et Scheubel, 1971 —
очень близкий вид с нижней части ротовых придатков
Gyrinus в предротовой полости и в лабральном отделе
эпифаринкса; это вид с непропорционально мелким
эпидиском и дискофором.
Подрод Basopercularia Jankowski
subgen. n.
Типовой вид Orbopercularia (В.) femoralis Mat-
thes et Guhl, 1975 с фемура передних ног жуков Enoch-
rus testaceus (Hydrophilidae). До 8 крупных вытянутых
зооидов располагаются на нешироком диске (эпиконе)
на вершине длинного базального стебелька; размеры
эпикона 40 X 60 мкм, длина базостила до 160 мкм; толь-
ко основания тела зооидов погружены в этот эпикон.
Род Bibopercularium Lom et Puytorac,
1994
Род не предложен должным образом, типовой вид
не указан, и вообще совершенно неясно, что имеется в
виду, к чему относится текст (Lom, Puytorac, 1994,
р. 712). Дословный перевод следующий: «Род Orbo-
percularia Lust, 1950. Opercularia со сферическим яд-
ром или в форме диска. Род Bibopercularium представ-
ляет собой линию эволюции к массивной или округлой
форме тела, воротничок становится очень толстым и
нерастяжимым, прикрепительный диск регрессирует
(перистомальный диск?). Иногда образуются группо-
вые раковины. Виды многочисленные, исключительно
эпизооны на мелких водных членистоногих и особен-
но на пресноводных жуках, с тенденцией к эндозойной
жизни (но это не тенденция, а редкое исключение!).
Пример: О. berberina (Lust, 1950)». Если ограничить
текст по Bibopercularium одной фразой в приведенном
тексте, то этот загадочный род, вероятно, соответству-
ет моему подроду Endogyrinella. Но без типового вида
и диагноза он невалиден.
Род Operculariella Stammer, 1948
(рис. 380, а)
Типовой вид О. parasitica из пищевода водных
жуков, вероятно без узкой сецифичности к хозяевам —
отмечен в Dytiscus marginalis, Acilius sulcatus, Hydati-
cus transversalis, Graphoderes zonatus, G. bilineatus
(Dytiscidae). Зооиды коричневатые, их стебелек окра-
шен зеленоватым секретом средней кишки хозяина.
Стебелек массивный, складчатый, дихотомический,
продольно исчерченный, с короткими третичными
ветвями, в колонии 20—40 зооидов; трофонты величи-
ной до 110—137 мкм, цилиндрические; ядро диско-
видное, толстое, заметно сплющено, сбоку кажется па-
лочковидным (не вполне типа Orboperculariay, вид мог
произойти от «мембранно-сессильных форм» с головы
жуков типа О. stillerae, О. quasiinvoluta или О. schrem-
meri. Валика перистома нет, стомодиск и дискофор
как автономные структуры внутри перистома почти
полностью редуцированы, на дне буккона — полоса
ресничек (3/4 оборота спирали, гаплокинета и поли-
кинета), спускающихся в длинную полость по спи-
рали; реснички не выдаются за край воронки. Импрег-
нация протарголом не проведена, точный тип изменений
не установлен. Крупные колонии с характерным попе-
речно-складчатым стебельком могут заполнять стенки
пищевода. Томиты сжатые, грибовидные, не вытянуты
в длину, как у оперкулярий. Этот род не является по-
томком Endogyrinella, проникновение в ротовую по-
лость шло независимо у Gyrinidae и Dytiscidae.
Род вначале признавали валидным, позже сводили
в синонимы рода Orbopercularia (О. parasitica in Mat-
thes et Guhl, 1973), сейчас по-прежнему единого мне-
ния нет; ненужной дискуссии можно избежать, снизив
ранг рода до подрода.
Род Ballodora Dogiel et Furssenko, 1921
(рис. 380, a)
Типовой вид В. dimorpha с жабр наземных изо-
под (мокриц) Oniscus asellus и Porcellio scaber; вид
В. marceli Remy, 1928 описан с жабр Trichoniscus (под-
род Spiloniscus)provisorius во Франции, позже отмечен
на Androniscus dentiger и Hyloniscus riparius. Низкие
колонии симбионтов обитают в тонкой водной пленке,
покрывающей жабры мокриц. Другие виды мокриц не-
сут очень близких симбионтов, а также виды Epistylis и
Opercularia, близкие к Ballodora. Этот род вначале
всеми признавался, но со временем был объявлен не-
валидным и виды рода перешли в состав Opercularia —
О. dimorpha и О. marceli. В каталоге Аэшт род невали-
ден как синоним оперкулярий.
Колонии Ballodora прикреплены очень низким вет-
вящимся стебельком, незаметным, если не отделить
зооидов от субстрата; в колонии по 2—8 зооидов. Тело
бочковидное, сужено к вершине, эпидиск и дискофор
очень мелкие, в широкой полости, незначительно вы-
даются над краем тела, автономные — дискофор со-
кращается независимо от стенки тела. Кутикула проч-
ная, панциревидная, дискофор растягивается и сокра-
щается без изменения формы тела особи. Зооиды в
колониях разных размеров, крупные и мелкие, вид ди-
морфный; ядро С-образное. Нормальные особи— мак-
ронты; при делении они могут образовать микронтов,
которые превращаются в мелких сплющенных бродя-
жек или в микроконъюгантов. У типичных оперкуля-
рий колонии мономорфные, поэтому можно отделить
баллодор хотя бы на уровне подрода. Линька хозяина
может.привести к гибели симбионтов, но описано про-
никновение трофонтов Opercularia ligiae и Ballodora
dimorpha сквозь кутикулу сбрасываемой шкурки и осе-
дание их на новом покрове жабры; сама Ballodora при
этом покрывается плотной оболочкой, которая остает-
ся после ее миграции. Томиты плоские, длинные, ско-
пула обращена вбок.
На жабрах морских мокриц атлантического берега
Европы (Ligia oceanica) обитает вид Carchesium voigti
с такой же формой тела зооидов, но без обособления
мелкого стомодиска; стебелек высокий, дихотомиче-
ский; форма тела не характерна для Carchesium, это
960
ALVEOLATA
могут быть видоизмененные оперкулярий типа Oper-
cularia ligiae Matthes, 1955, заселяющей L. italica в
Средиземном и Черном морях.
По моему опыту перитрихи есть на околоводных
лигиидах (Ligidium hypnorum)’, на онискоидах из влаж-
ных мест, прячущихся днем под стволами упавших де-
ревьев или под камнями; но никогда нет симбионтов на
ксерофильных армадиллидиях; у лигидий в затененных
берегах ручьев Крыма весь вент усеян колониями вида
Epistylis epistyliformis (Nemec, 1895 in Opercularia),
легко видимыми при витальной окраске нейтральротом,
у онискоид они приурочены к жабрам. Opercularia
stammeri Matthes, 1950 — симбионт Oniscus asellus, неиз-
вестный вид отмечен на Cylisticus convexus’, не осмот-
рены постоянно-водные онискоиды в пещерах Сербии.
Зона перистома Ballodora заметно сужена и откло-
нена вбок, тело несимметричное; эта особенность
свойственна и близким родам Bezedniella и Nuechterle-
inella с остракод, поэтому 2 последних рода были вы-
делены только по этому признаку и по округлой форме
ядра в новое сем. Bezedniellidae Schodel, 2004 (Schodel,
2004). У Ballodora такая же форма тела и длинное
ядро. Если принять сем. Bezedniellidae, то только для
всех родов оперкуляриид с круглым ядром независимо
от формы тела, наличия дисков или раковины (без рода
Ballodora, оставшегося в сем. Operculariidae).
Род Nuchterleinella Matthes, 1990
Типовой вид N. corneliae с придатков (фурки)
пресноводных остракод Cypria ophthalmica, не с внут-
ренней части раковины; зооиды одиночные, массив-
ные, резко асимметричные, с коротким широким фик-
соном, не напоминающим стебелек; ядро овальное;
эпидиск и дискофор небольшие. Четко выражена це-
фализация, перистомальная зона отогнута вбок за счет
аллометрического разрастания дорсума. Это действи-
тельно не-колониальный вид, не ранняя стадия разви-
тия колоний Bezedniella после линьки рачка. Видоиз-
мененные стебельки такого типа встречаются у коло-
ниальных форм. Достоверность вида подтверждена
Шоделем (Schodel, 2004) по материалу с Cypria opht-
halmica в Германии; в Англии вид найден на этом хозя-
ине и на Cyclocypris ovum. Пояска кинетосом мигранта
нет; при делении одна особь остается на диске, у вто-
рой перистом сжат, особь покидает диск.
Шодель предлагает новое сем. Bezedniellidae Schodel,
2004 для этого и следующего рода — несимметричные
симбионты остракод с резко изогнутым антероном,
фактически с цефализацией, с открытыми краями пе-
ристома независимо от движения эпидиска. Вероятно,
лучше включить всех оперкуляриид с овальным ядром
(как у фолликулинид), разделив сем. Operculariidae на
подсем. Operculariinae s. str. и подсем. Bezedniellinae.
Род Bezedniella Stloukal et Matis,1994
(рис. 380, a)
Типовой вид В. prima с ног остракод Cypria sp.
в Словакии (прикреплены внутри раковины), мной
найдены на Heterocypris sp. Колонии с 4—6 зооидами
прикреплены к основанию ног на длинном попе-
речно-складчатом (гофрированном) дихотомическом
стебельке; ствол до ветвления (базостил) продоль-
но исчерчен, не складчатый. Зооиды с овальным яд-
ром, с цефализацией — перистом расположен в су-
женном и изогнутом вбок переднем отделе тела; валик
перистома слабо выражен, эпидиск почти плоский,
на коротком узком дискофоре. В принципе это вид
рода Orbopercularia—диморфизм зооидов не показан,
различия морфологии родов незначительные, у опер-
кулярий много видов с асимметричным узким анте-
роном.
Второй вид В. bambergensis Schodel, 2004 описан с
Cypria ophthalmica в Германии; заселено 5 % остракод,
локус — внутренная поверхность створок. В колонии
до 10 особей; зооиды мелкие, асимметричные, взду-
тые, с небольшим изогнутым вбок перистомальным
отделом; валика перистома нет; эпидиск и дискофор
непропорционально мелкие. Зооиды расширены у ско-
пулы, вокруг вершины широкого стебелька без сплош-
ного гофрирования, с редкими складками; внутри сте-
белька тонкие продольные фибриллы. Не было замече-
но даже при импрегнации методом Клейна (на сухих
мазках) кольцо локомоторных кинетосом у зооидов, и
не нашли самих мигрантов.
Род Triacola Weitschat et Guhl,
1994
Типовой вид Т. ostracodarum.
Род Triadopercularia Weitschat et Guhl,
1994
Типовой вид T. spitzbergensis. Оба рода описа-
ны по ископаемому материалу; найдены раковины,
предположительно оперкулярий, на морских острако-
дах из нижнего Триаса Шпицбергена. Остракоды —
хозяева Triadocypris spitzbergensis из современной
группы Myodocopida обитали как сапротрофы в остат-
ке аммонита, быстро осели на дно и были минерализо-
ваны фосфатами. Первичный псевдохитиновый домик
цилиат сохранился, поскольку был постепенно заме-
щен апатитом. Локусы — эпиподиты максилл и внут-
ренняя поверхность створок панциря. По авторам, это
род современного семейства перитрих Epistylidae, под-
сем. Operculariinae (Triadopercularia) и лорикаты сем.
Vaginicolidae (Triacola). Вероятно все же, что это не
оперкулярий — в море род почти не представлен; не
исключено, что это крупные суктории. Зарисованная
раковина Triacola напоминает таковую Cothurnia (час-
тые в моих сборах остракод Мурмана) или, скорее все-
го, Acineta’, к сожалению, рисунок вида совершенно
не соответствует его микрофотографиям, и в этом ма-
териале ничего нельзя понять. Раковина Triadopercu-
laria выглядит, как у мелких сукторий Paracineta и
крупных эфелотид Podocyathus или Ephelota, сравне-
ния с современными раковинными колониальными
видами оперкулярий на жуках совершенно неубеди-
тельны.
ТИП CILIOPHORA. КЛАСС OLIGOHYMENOPHOREA
961
Подрод Patellonema Jankowski subgen. n.
Типовой вид Orbopercularia krauteri Matthes
et Guhl, 1972. Род предложен ранее в тезисах и признан
Аэшт невалидным {Patellonema Jank., 1976), поэтому
предлагается здесь вторично. Это симбионт жуков
Enochrus testaceus и Е. coarctatus (на фемуре средней
пары ног), в колонии немного зооидов (до 12); сте-
белек разрастается в виде широкого диска с диамет-
ром чаши до 135 мкм, зооиды прикреплены к его цент-
ру, без образования высокого ветвящегося стебель-
ка. Здесь род понижается в ранге до подрода в составе
Syncyathella — S. {Patellonema) krauteri comb, n.;
S. {P.) femoralis (M. et G., 1975) comb, n.; S. {P.) catilli-
cola (M. et G., 1975) comb, n.; хозяева 2 последних ви-
дов — Enochrus testaceus и E. coarctatus.
Род Serioscyphus Jankowski gen. n.
Типовой вид Orbopercularia erlangensis Mat-
thes et Guhl, 1972; как и предыдущий род, предложен в
тезисах и признан Аэшт невалидным {Serioscyphus Jan-
kowski, 1976). Симбионты водных жуков с уникальным
типом фиксона—осевший трофонт секретирует длинный
стебелек, затем широкий диск, над ним еще 1—2 дис-
ка, и зооиды сидят на верхнем диске, в колонии до
13 зооидов. Ядро овальное. Симбионты на ротовых при-
датках Dytiscidae — на мандибулах, лабиуме, пальпах
(щупиках) лабиума и максилл Hydroporus и Noterus.
Род Cyathopercularia Jankowski, 1980
Типовой вид Opercularia laccobii Matthes et
Guhl, 1972 {Cyathopercularia laccobii comb. n.). Этот
таксон был предложен как подрод оперкулярий, позже
поднят до ранга рода. Симбионты водных жуков Lac-
cobius sp.; в колонии много особей (до 18) на неболь-
шом широком фиксоне на дне широкой глубокой рако-
вины, вмещающей всю колонию — такого типа, как у
части видов Syncyathella. Раковина — модификация
стебелька, прикреплена к антеннам, максиллам, гла-
зам, нижней части головы и лабиуму жуков. Внешний
облик типичный для оперкулярий, ядро С-образное.
Домик очень широко открытый (диаметром до
108 мкм), не сужен, как у Syncyathella laccobii с того
же хозяина.
С. collegata comb. n. (= Opercularia collegata M. et
G., 1972) образует сходные домики на антеннах и щу-
пике лабиума гидрофилид Helochares lividus', до
20 зооидов прикреплены ко дну очень широкой ворон-
ковидной раковины с коротким широким базостилом.
Род Syncyathella Jankowski gen. n.
Типовой вид Orbopercularia lusti Matthes,
1955; как и предыдущие роды, род предложен мной
ранее при ревизии сессилид в тезисах {Syncyathella
Jankowski, 1976) и признан Аэшт невалидным.
Типовой вид рода — симбионт мелких полуводных
жуков Hydraena britteni (Hydrophilidae); крупные
сплющенные раковины, резко расширенные к вер-
шине, с поперечными складками, часто коричневые от
солей железа, прикреплены к краям и нижней поверх-
ности головы жуков небольшим четким стебельком с
базодиском; дно низкое, зооиды прикреплены неболь-
шими секрециями (ножками). Стенки раковины нерав-
ной высоты, защищают зооидов от механических по-
вреждений и от высыхания. Тело вытянутое, узкое,
колонии бывают многочисленные (до 9 зооидов),
крупные трофонты могут заполнять всю полость рако-
вины. Внешний вид, стомодиск й ядро типичные для
Orbopercularia.
Состав рода (только виды с овальным ядром) и хо-
зяева: S. assimilis (Gong, 1989) — Hydaticus sp., Helo-
chares sp.; S. calix (Matthes et Guhl, 1975) — Enochrus
testaceus', S. exigata (M. et G., 1975) — Laccobius', S. eno-
chri (M. et G., 1975) — E. testaceus', S. fusiformis (Gong,
1989) — Hydaticus sp.; S. hasenfussi (M. et G., 1975) —
Anacaena sp.; 5. helocharidis (M. et G., 1975) — Helo-
chares sp., Hydrobius sp.; S. laccobii (M. et G., 1972) —
Laccobius sp.; S. loricata (M. et G., 1975) — Helophorus
sp.; 5. macronucleata (M. etG., 1975) — Hydrobius fusci-
pes; S. oschei (M. et G., 1975) — Helochares sp.; S. ovalis
(Gong, 1989) — Hydaticus sp.; S.plachteri (M. et G.,
1975) — Helochares sp., E. testaceus, Cymbiodyta sp.;
S. quinquaginta (M. et G., 1975) — E. testaceus', S. rara
(M. et G., 1975) —E. testaceus, E. melanocephalus', S. si-
ewingi (M. et G., 1975) — E. testaceus', S. steffani (M. et
G., 1972) — E. coarctatus', S. scheloskei (M. et G., 1975) —
Laccobius sp.; S. scheubeli (M. et G., 1975) —E. testace-
us', S. scyphostyla (Nenninger, 1948) — сборный вид с
разных хозяев — Е. testaceus, Е. affinis и др. Для всех
названных видов это comb. nn. Jankowski, с датой вы-
хода книги (ранее в составе Orbopercularia).
Можно проследить начальные стадии образования
мелкой дисковидной чаши (S. scheubeli с 1—4 зооида-
ми), рюмковидной раковины (S’, calix с 1—2 зооидами)
и их развитие до гигантской чаши с 30 зооидами у
S. oschei и S. loricata, 40 — у S. macronucleata, с 60 — у
*У. scyphostyla, с 65 — у S. enochri. Ряд видов отмечен
на Enochrus testaceus, где они занимают разные локусы
на одном хозяине.
Сем. Telotrochidiidae Foissner, 1978
(рис. 381, а)
Роды Opisthonecta и Telotrochidium всегда рассмат-
ривались в составе одного сем. Vorticellidae; Фойсснер
(Foissner, 1978) отметил разницу в типе перистома и
выделил 2 семейства— Opisthonectidae и Telotrochidii-
dae; второе семейство включает планктонных пресно-
водных перитрих с оперкулярным типом перистома.
Род Telotrochidium Kent, 1881
Типовой вид Т. crateriforme {Vorticella crateri-
/or mis Muller, 1773) по монотипии; у валидного вида
Т. johanninae Faure-Fremiet, 1950 тело тонкое, вытяну-
тое, перистом постоянно открытый, не шире тела, с
широким стомодиском и коротким автономным диско-
фором; ядро почковидное, не вытянуто по оси тела;
61 Зак. №4163
962
ALVEOLATA
кортекс с циклонемами. Движение с помощью ротовой
цилиатуры и кольца ресничек вокруг скопулы; при
движении ротовая зона обращена назад, ресничное
кольцо мигранта вперед. Постоянно плавающие фор-
мы без фазы прикрепленного трофонта, деление и
конъюгация у плавающих форм; возможна временная
иммобилизация скопулой на субстрате без прикрепи-
тельной секреции. Пданктонные роды Astylozoon и
Hastatella соответствуют трофонтам перитрих, плава-
ют перистомом вперед, a Telotrochidium — предпола-
гаемая «вечная» бродяжка (телотрох). Это дериваты
оперкуляриид типа одиночных Propyxidium или коло-
ниальных Opercularia, сохраняющие типичный для
них перистом.
Типовой вид плохо описан, это широкие бочонко-
видные формы с продольным С-образным ядром, не-
сколькими вакуолями, широким перистомом; у Кента
(Kent, 1881) это явно типичная Opisthonecta, а у Мюл-
лера мог быть телотрох неизвестной перитрихи. Вид
признан неопределимым (Foissner, 1975), а род с таким
видом не имеет права считаться валидным. Синонимов
нет, поэтому родовое название нужно заменить новым.
В литературе неправильно обозначают вид как Т. сга-
teriformis Kent, 1881 — Кент не предложил новый вид,
он использовал старинное название Vorticella crateri-
formis Muller, 1773 с настолько плохим рисунком и
диагнозом, что об определении и валидации вида не
может быть речи. Фойсснер (Foissner, 1975) в этой си-
туации обозначает типом рода Т. johanninae Faure-Fre-
miet, 1950, что не упомянуто в каталоге Аэшт, где тип
рода — V. crateriformis. Для сохранения привычного
родового названия нужна петиция в ICZN о смене ти-
пового вида.
Второй валидный вид Т. cylindricum Foissner,
1978 — очень узкие вытянутые формы с широким
эпидиском, небольшой ротовой полостью (букконом);
узкое ядро вытянуто вдоль тела; число циклонем не-
обычно велико; широкий ресничный поясок распо-
ложен почти у постерона, с едва заметной скопулой.
Т. elongatum Foissner, 1975 — вид с цилиндриче-
ским телом, поперечным С-образным или почко-
видным ядром, мелким дискофором, с небольшой
скопулой и сильно развитой системой продольных
мионем.
Монозойные раковинные перитрихи
(«лорикаты») в группе Operculariina
Сем. Usconophryidae Clamp, 1991
Раковина плоская, округлая или овальная при виде
сверху, приклеена к субстрату. Трофонт один, не при-
креплен к устью раковины в отличие от видов Lage-
nophrys-, ядро овальное, эпидиск и дискофор узкие, как
у оперкулярий, при сокращении особи тело не сжима-
ется, а дискофор глубоко втягивается в тело. Упитан-
ный дисковидный трофонт до деления заполняет всю
полость раковины. Устье раковины утолщено, без
крышечки (отличие от Operculigera) и без стенок, сжи-
мающихся при сокращении у лагенофрисов. Строение
раковины простое, это может быть предшественник
рода Lagenophrys.
Род Usconophrys Jankowski, 1985
(рис. 384, а)
Типовой вид Lagenophrys aperta Plate, 1889 с
плеопод водяного ослика Asellus aquaticus и A. hilgen-
dorfl (Европа, Дальний Восток, США). С признаками
семейства. На аселлотах встречается совместно с ти-
пичными лагенофрисами, занимая разные локусы.
Второй вид U. dauricus Jank., 1986 с аселлот Сахалина
Кламп (Clamp, 1991) не считает валидным, это прояв-
ление диморфизма; но виды резко различаются морфо-
логически по форме раковины, размерам, строению
устья; этот вид никогда не отмечался на аселлотах
Евроцы, а диморфный вид цилиат (к примеру Tetrahy-
mena patula или виды рода Dimorphocothurnia) дол-
жен быть диморфным повсюду. Никаких дока-
зательств диморфизма вида U. aperta нет, вид U. dauri-
cus четкий и валидный, имеет, в частности, более
узкую раковину (отсюда название рода Usconophrys).
Кламп нашел и изучил этот редкий вид (как морфу
вида L, aperta) по материалу из Франции и США, и его
рисунки показывают четкие и бесспорные различия
типов раковины.
В состав рода Кламп перенес Lagenophrys rotunda
Precht, 1935, на морских остракодах Германии {Darwi-
nula stephensoni, Cyprideis litoralis, Candona angulata),
не изучив этот вид {U. rotunda in Clamp, 1991); описа-
ние и единственный рисунок у Прехта (Precht, 1935)
очень плохие, трофонт показан только при виде сбоку,
раковина не изучена при иммерсии, но ясно, что это не
Usconophrys. Прехт мог не заметить тонкой мионемы
устья, С-образное ядро вида с остракод отличается от
овального ядра типового вида U. aperta.
Еще один ложный вид рода — Lagenophrys gamma-
ri Z. Piesik et J, piesik, 1978 {Usconophrys gammari in
Boshko, 1995)- Вид очень плохо описан с Gammarus ro-
eselii в Польше; зарисован овальный трофонт далеко
от устья, свободно лежащий в раковине, без перисто-
ма; это предлинечная фаза в цикле любого лагенофри-
са. Вид невалиден в пределах рода Lagenophrys как си-
ноним малоспецифического жаберного вида с гамма-
русов L. ampulla.
Сем. Lagenophryidae Butschli, 1889
Раковина широкая, у большинства видов прикреп-
лена к субстрату одной из сторон, другая (верхняя)
сторона выпуклая; шейка короткая, устье раковины
(loricastome) узкое, поперечное, усложнено системой
складок и желобков, при сокращении особи стенки
устья смыкаются или устье закрывается крышечкой
(operculum). Зооид один в раковине, очень широкий,
заполняет полость раковины, прочно прикреплен спе-
циальными мускулами к основанию лорикастома
(устья). Ядро овальное или С-образное, перистом
оперкулярного типа — мелкий эпидиск на узком длин-
ном дискофоре, быстро втягивается глубоко в тело при
сокращении и при фиксации; сам трофонт несократи-
мый.
Питание фильтрацией. Размножение неравным де-
лением; трофонт сохраняет перистом, у томита плохо
развит ротовой комплекс, имеется локомоторное коль-
ТИП CILIOPHORA. КЛАСС OLIGOHYMENOPHOREA
963
цо ресничек; протарголь выявляет сложный фибрил-
лярный комплекс (пучки фибрилл с функцией мионе-
мы) по краям обширной скопулы. Возможны 2 типа
деления (не у всех видов семейства). На нелиняющих
рачках трофонт делится 1 раз, томит мельче, дедиффе-
ренцирован, после метаморфоза уплывает из раковины
в виде дисковидного мигранта с ресничным пояском.
При линьке хозяина трофонт делится дважды, по одно-
му мигранту после каждого деления уплывают; после
второго деления в пустой раковине остается рудимент
зооида.
Исключая один перифитонный вид, все виды се-
мейства облигатно симбионтные на ракообразных в
основном на высших (Malacostraca) в пресных водах и
в море. Заселены покровы тела, придатки (антенны,
максиллы, ноги, тельсон) или жабры хозяев — остра-
код, изопод, амфипод и декапод; число видов возраста-
ет, но остается ничтожным по сравнению с числом из-
вестных ракообразных. К примеру, на Мурманской
биостанции при изучении симбионтов большого числа
ракообразных, особенно амфипод, мне удалось найти
лишь 2 вида рода, известный вид на лимнориях и но-
вый на псаммонной амфиподе; на биостанции Восток
(у Находки) найден тот же вид на лимнориях и новый
на Anisogammarus; в Черном море пока найден лишь
один известный вид на талитридах рода Orchestia.
Род Lagenophrys Stein, 1852
Типовой вид/,, vaginicola Stein, 1852 (= L. obo-
vata Stokes, 1887); сетобионты на переоподах и кау-
дальной фурке пресноводных копепод отряда Harpacti-
coida — Canthocamptus staphylinus, С. minutus и близ-
ких видов; указания для Cyclops и Cambarellus
ошибочные. При виде сверху раковина грушевидная,
расширяется к вершине, зона прикрепления относи-
тельно небольшая по сравнению с другими видами. На
рисунках обычно показан лишь контур раковины, но
уже при малом увеличении видно утолщение стенки у
постерона с образованием фиксона; в этом отношении
вид отличается от всех остальных видов рода.
Род Lagenophrys все авторы понимают в очень ши-
роком объеме, у Клампа (Clamp, 1991) он включает
также старинный стебельчатый род Stylohedra, и отде-
ление остальных видов вызывает незаслуженно резкие
возражения Клампа. В данном обзоре я вынужден при-
нять Lagenophrys sensu lato в традиционном объеме, но
все же без стебельчатой Stylohedra, и разделить род на
2 четких бесспорных подрода — первый подрод Lage-
nophrys s. str. ограничен только типовым видом с гру-
шевидной раковиной и фиксоном у заднего конца ра-
ковины, это обитатели щетинок — сетобионты; второй
подрод для платибионтов (на ровном субстрате) с
округлой дисковидной раковиной.
Подрод Circolagenophrys Jankowski, 1980
(рис. 383, 6—384, а)
Типовой вид Lagenophrys ampulla Stein, 1852.
При виде сверху раковина округлая; нет утолщения на
конце, противоположном устью (нет фиксона); плати-
бионты в основном на жабрах и панцире ракообраз-
ных. Независимо от ранга этого таксона (род или
подрод) большинство видов лагенофрисов должно
быть обособлено от аберрантного типового вида со
щетинок копепод. Поскольку выделение подродов не
принято у цилиат, в будущем, вероятно, будет принят
ранг рода. Возможно дальнейшее подразделение Cir-
colagenophrys по форме ядра — С-образное или овальное,
как это принято у оперкуляриид. Хозяева — Ostracoda
из низших ракообразных, и многие группы Malacostra-
ca — изоподы, амфиподы, крабоиды, аеглиды, крабы,
креветки, танаидацеи, раки-отшельники; нет на мизидах,
кумацеях, омарах, лангустах, нет на пантоподах, мече-
хвостах (Xiphosura) и других морских членистоногих.
В Байкале заселены многие амфиподы, здесь несо-
мненна дивергентная эволюция рода; Сварчевский
(Swarczewsky, 1930) описал 13 видов рода — 4 видана
жабрах хозяев (/,. ampulla, L. similis, L. macrostoma,
L. stokesi), 5 на переоподах (L. solida, L. parva, L. orna-
ta, L. ovalis, L. simplex), 1 на плеоподах (/. inflata), 1 на
антеннах (£. oblonga), 1 на максиллах (Z. commensalis)
и 1 на переоподах и плеоподах (£. primitiva). Извест-
ный жаберный вид L. ampulla в Байкале указан для
52 видов хозяев 16 родов гаммарид, a L. nassa, обыч-
ный соматический симбионт в Европе, почему-то в
Байкале отсутствует, если верить Сварчевскому. Если
положить рядом жабры с L. ampulla с разных хозяев из
списка Сварчевского, к примеру Micruropus и Eulimno-
gammarus, лагенофрисы на них отличаются размера-
ми. Поэтому результаты этого автора требуют тща-
тельной проверки.
Виды Lagenophrys с Ostracoda в основном пресно-
водных (кроме L. rotunda) — L..stammeri Lust, 1950;
L. wallengreni Abonyi, 1928; L. rotunda Precht, 1935;
L. entocytheris Jank., 1986; L. labiata Wallengren, 1890
(гомоним); L. discoidea Kellicott, 1887 (=L. labiata,
L. wallengreni, L. entocytherisl).
Виды c Isopoda — L. aselli Plate, 1886; L. circularis
(Dons, 1940 in Platycola); L. platei Wallengren, 1890;
L. monolistrae Stammer, 1935; L. nivalis Kane, 1969; L. li-
tnnoria CJamp, 1988 (синоним или локальный вид на
древоточцах)^ Вид L. cochinensis Santhakumari et Gopalan,
1980 описан с изопод Sphaeroma и с танаид Apseudes.
Виды с амфипод-талитрид L. orchestiae Abonyi,
1928; L. crutchfieldi Clamp, 1993; L.patina Stokes, 1883.
Виды c Gammaridea — L. ampulla Stein, 1852; L. aniso-
gammari Jank., 1993; L. tattersalli Willis, 1942; L. ponto-
caspica Boshko, 1995; L. stygia Clamp, 1990; L. nassa
Stein, 1852; L.foxi Clamp, 1987; L. labiata Stokes, 1887;
L. matthesi Schodel, 1983; L.maxillaris Jank., 1993;
L. missouriensis Clamp, 1987; L.johnsoni Clamp, 1990;
L. gammari Z. Piesik et J. Piesik, 1978 (синоним); L. hok-
kaidos Jank., 1993.
Виды c Anomura — L. aeglae Mouchet-Bennati, 1932
(на пресноводном южноамериканском крабоиде Aeg-
la); L. eupagurus Kellicott, 1893.
Виды на креветках —L. articularis Nie et Ho, 1943;
L. branchiarum Nie et Ho, 1943; L. verecunda Felgenhau-
er, 1982;/,. lunatus Imamura, 1940; L. turneri Kane, 1969.
Виды L. lunatus и L. articulata Кламп (Clamp, 1991)
сводит в синонимы вида с пагурид L, eupagurus, засе-
ляющего морских и пресноводных хозяев разных
групп, что сомнительно.
964
ALVEOLATA
Виды на крабах в основном пресноводных (кроме
L. callinectes) — L. awerinzewi Abonyi, 1926; L. calli-
nectes Couch, 1967; L. metopauliadis Corliss et Brough,
1965; L. machaerigera Clamp, 1992.
Виды на Astacidea (Pacifastacus, Cambaridae и Pa-
rastacidae, нет на европейских Astacidae и на дальнево-
сточных Cambaroides)— L. andos Jank., 1986; L. antict-
hos Clamp, 1988; L. shiftus Jank., 1986; L. oregonensis
Clamp, 1987; L. novaezealandiae Clamp, 1994; L. incom-
pta Clamp, 1987; L. dennisi Clamp, 1987; L. diagenes
Jank., 1986; L. leviusculus Jank., 1986.
Часть видов списка может быть синонимами; часть
видов была предложена в составе рода (не подрода)
Circolagenophrys.
Подрод Samenophrys Jankowski
subgen. n.
Типовой вид Lagenophrys aegleae Mouc-
het-Bennati, 1932 с жабр пресноводной аномуры Aegla
sp. в Южной Америке. Все признаки, как у рода Lage-
nophrys, но ядро овальное, компактное, у лагенофри-
сов С-образное. К подроду относится также вид L. shif-
tus Jank., 1986, с жабер Parastacus (Чили) и, вероятно,
идентичный с ним вид L. anticthos Clamp, 1998, также с
чилийских Parastacus.
Род Paralagenophrys Clamp, 1987
Типовой вид Lagenophrys singularis Kellicott,
1887, единственный свободноживущий вид семейства;
пока найден только в США. Все признаки, как у Circo-
lagenophrys, но устье (лорикастом) расположено не по-
перечно, а по диагонали к оси раковины, вентральная
стенка устья с углом около 45°. В Traite высказано со-
мнение в валидности рода, но поскольку у всех осталь-
ных лагенофрисов устье поперечное, род можно счи-
тать валидным.
Род Clistolagenophrys Clamp, 1991
Типовой вид Lagenophrysprimitiva Swarczews-
ky, 1930 по монотипии; с переопод и плеопод Pallasea
cancellus (Amphipoda) в оз. Байкал. Сварчевский
(Swarczewsky, 1930) изучал только фиксированный
коллекционный материал, хотя хозяина легко собрать
в Байкале (в это время Сварчевский заведовал Бай-
кальской биостанцией); по его мнению, у этого вида
трубчатое простое устье раковины целиком втягивает-
ся внутрь тела при сокращении и фиксации. Мои сбо-
ры и изучение живых особей с типового хозяина в ти-
повом месте (южный Ольхон) показали, что это во
всем обычный вид лагенофрисов; никакого втягивания
стенок устья, которому придается столько внимания,
нет и быть не может. Препараты Сварчевского плохие,
залиты толстым слоем бальзама, иммерсия невозмож-
на; он неправильно понял картины у отдельных осо-
бей. Род здесь ликвидируется, но может быть исполь-
зован как подрод, поскольку важных отличий нет, за
исключением формы ядра (не С-образное, более ком-
пактное по сравнению с жаберным видом с того же хо-
зяина). Это стандартный соматический вид типа
L. nassa, каких много на разных амфиподах в Байкале,
включая литоральные виды Eulimnogammarus.
Род Setonophrys Jankowski, 1986
Типовой вид Lagenophrys seticola Kane, 1965
по монотипии; со щетинок австралийских речных ра-
ков Engaeus fultoni и Geocherax falcata. Переход с ров-
ного субстрата на щетинки придатков (сетобиоз) при-
вел к удлинению раковины, напоминающей грушевид-
ную раковину L. vaginicola (тип рода Lagenophrys).
Это конвергенция, в остальном указанный вид близок
к другим австралийским лагенофрисам; L. vaginicola в
Австралии неизвестна. Кламп (Clamp, 1991) принял
род Setonophrys в более широком смысле — включил
все австралийские виды с Parastacidae как валидные
виды или синонимы, с панциря, жабр и придатков па-
растацид Cherax, Engaeus, Euastacus, Geocherax и Aust-
roast acus. Форма раковины, перистом, ядра, типичные
для лагенофриид, особенность всех видов — разраста-
ние стенок устья с образованием шипов, зубцов, лопа-
стей. Более важный признак — мионема (сфинктер); у
всех видов Setonophrys — это кольцо вокруг основания
воротничка (устья), а у Lagenophrys — это дуга вдоль
верхнего края устья. Отличается и способ закрывания
лорикастома. По форме раковины род должен быть
подразделен на 2 подрода, с отделением типового вида
от остальных видов. Богатая фауна астацид Австра-
лии, Новой Гвинеи, Тасмании и Новой Зеландии несо-
мненно даст много новых видов рода.
Подрод Setonophrys s. str. включает только сетоби-
онтный вид L. seticola. Подрод Disconophrys Jankowski
subgen. п. включает остальные виды — S. darwinia
Kane, 1965; S. deserti К., 1965; 5. dungogi К., 1965;
S. engaei K., 1965; S. latispinosa K., 1965; S. lawrii K.,
1965; S. ligulata K., 1965; S. occlusa K., 1965; S. willisi
K., 1965; S. spinosa K., 1965 (типовой вид подрода);
S. bispinosa К., 1965; .S'. communis K., 1965; .S'. tricorni-
culata Clamp, 1991; Кламп считает валидными только
8 видов из этого списка.
Род Stylohedra Kellicott, 1884
Типовой вид S', lenticula по монотипии; вид
изучен в моем материале (коллекции ЗИНа). Этот род
не признан рядом авторов, валидный в Guide (Small,
Lynn, 1985). Раковина вздутая, высокая, не приклеена
стороной к субстрату, поднята на узком стебельке не-
равной ширины, с расширением у основания и верши-
ны. Зооид широкий, прикреплен к устью, с С-образ-
ным ядром; сфинктер незамкнутый, такого типа, как у
лагенофриса. Стебелек отделен от раковины или это
сужение стенок раковины. Вид обитает на пресновод-
ных талитридах (Amphipoda, Hyalidae) — Hyalella az-
teca, виде, распространенном от Аргентины до Кана-
ды, только на переоподах хозяев, на базальной части
массивных шипов и щетинок ног рачков; на жабрах
вид рода Lagenophrys. Включая столь аберрантные
формы в состав Lagenophrys, Кламп (Clamp, 1991) не
ТИП CILIOPHORA. КЛАСС OLIGOHYMENOPHOREA
965
выделяет для них даже подрода. Сетобионтов без сте-
белька можно объединить с дисковидными лагенофри-
сами, но стебельчатые формы должны составить осо-
бый род.
Подрод Tasmanophrys Jankowski
subgen. п. (рис. 383, б)
Типовой вид Lagenophrys petila Clamp, 1994
(Stylohedra petila comb. n.). По всем признакам типич-
ные Stylohedra, раковина более вытянутая; подродо-
вой признак — округлое ядро у L. petila и С-образное
у 5. lenticula. У сессилид такие различия считаются
родовыми (пример — роды Opercularia и Orbopercula-
ria)-, поэтому L. petila — вид особого подрода или
рода лагенофриид. Вид найден Клампом в массе на
щетинках жабр и на плеоподах Parastacoides tasma-
nicus.
Кане (Kane, 1969) описал без иллюстраций виды
Stylohedra jacobi и У reflexa, перенесенные позже в со-
став рода Lagenophrys. Поскольку все публикации но-
вых таксонов в тезисах невалидны (Aescht, 2001), для
сохранения этих видов они объявляются новыми в
данной сводке — У jacobi Kane in Jankowski sp. п. и
У reflexa Капе in Jankowski sp. п., с годом публикации
данной книги и с диагнозами в тезисах Конференции
протозоологов в Ленинграде (Капе, 1969).
Подрод Chilenophrys Jankowski, 1986
(рис. 383, б)
Типовой вид Ch. allendei по монотипии; с жабр
речных раков Parastacus chilensis в районе Вальпараи-
со, Чили. Раковина вытянутая, с массивной стенкой,
сужается в зоне устья, незначительно сплющена; стен-
ки устья прочные; лорикастом округлый. Зооид запол-
няет полость раковины, имеет небольшой оперкулюм
(крышечку) в зоне устья. Стенки устья простые, без
выростов и складок, не закрываются. Этот таксон был
предложен мной как род, но сейчас вводится как под-
род в состав следующего рода.
Род ОрегсиНдега Капе, 1969 (рис. 384, а)
Типовой вид, по Аэшт, О. montanea по моноти-
пии. Род валидный, хотя, «строго говоря, содержится в
неопубликованной работе» (в тезисах); принят Аэшт,
поскольку указан в Zoological Record. Все остальные
роды, предложенные для цилиат в тезисах, Аэшт объ-
являет невалидными. Аэшт ошибается при обозначе-
нии типа — у Кане в тезисах 2 вида, а не один —
О. montanea и О. zeehanensis', это значит, что род все
же невалидный. Типовой вид рода обозначил Кламп
(Clamp, 1991 — О. montanea) и поэтому считает себя
автором рода Operculigera Clamp, 1991 (Clamp, Kane,
1993).
Кламп имеет оттиск моей статьи (Янковский, 1986),
но, вероятно, не перевел текста — типовой вид для
Operculigera впервые указан мной: «Род установлен
австралийским исследователем Джоном Кане (Капе,
1969) для форм типа Lagenophrys, но с крышкой устья;
названы 2 вида: О. montanea с Colubotelson и О. zeeha-
nensis с Phreatoicoides', типовым мы обозначаем
О. montanea» (Янковский, 1986, р. 82). Род меняет ав-
торство — Operculigera Jankowski, 1986. Как правиль-
но замечает Кламп, нужно признать валидной научной
публикацией том трудов Конференции (мной готовит-
ся петиция в ICZN).
Раковина широкая, приклеена одной стороной к
субстрату, лагенофрисного типа; ядро обычно ком-
пактное или в виде небольшой дуги, по одну из сторон
перистома; дискофор типичный для лагенофрисов;
устье узкое, поперечное, обычно с разрастанием сте-
нок, обе стенки различные по форме (отличие от Chile-
nophrys), имеется оперкулярная крышечка, закрываю-
щая устье при сокращении зооида.
Состав рода Operculigera Jankowski, 1986
(comb, nn.): О. asymmetrica (Clamp, 1991), О. insolita
(Clamp, 1991), O. obstipa (Clamp, 1991), O. seticola
(Clamp, 1991), O. taura (Clamp, 1991), 0. madagasca-
rensis (Clamp, 1992), O. carcini (Clamp, 1992), O. paras-
tacis (Jank., 1986), O. striata (Jank., 1986), O. velata
(Jank., 1986); все виды ранее в составе Operculigera
Kane, 1969. Переносятся также виды О. haswelli
(Clamp et Kane, 2003), О. inornata (C. et К., 2003)
comb. nn. Круг хозяев рода — изоподы, пресноводная
аномура Aegla, речные раки и крабы на территории
Гондваны (Южная Америка, Мадагаскар, Австралия).
В Южной Америке заселены речные раки, но в Австра-
лии только Isopoda Phreatoicoida, которых здесь около
100 видов — роды Colubotelson, Phreatoicoides, Mesa-
canthotelson и др.
Род Australana Jankowski, 1986
Типовой вид A. kaneis по монотипии; с жабр
Euastacus australiensis в южной Австралии. Ракови-
на овальная, широкая и высокая, приклеена к субстра-
ту; устье вытянуто поперечно, сдвинуто далеко от
апекса, почти медиальное, низкое и прочное, без раз-
растания стенок. В раковине по 2 зооида (первый слу-
чай у лагенофриид, в целом монозойных). Ядро С-об-
разное, перистом и прикрепление зооида не были изу-
чены, неясны в фиксированном коллекционном
материале. Род принят, отнесен к группе усконофри-
ид; переописан типовой вид и предполагается наличие
нескольких новых видов на речных раках Австралии
(Clamp, 2001).
Отряд Mobilida Kahl, 1933
Трофонты постоянно подвижные, обычно сплю-
щенные, дисковидные, с несколько вогнутой нижней
поверхностью, несущей опорный аппарат (цитоске-
лет); эта сторона окаймлена кольцами ресничек. На
вершине тела, почти плоской или чаще вздутой, распо-
ложена ротовая цилиатура — периферическое кольцо
из двух концентрических кинет, уходящих в глубокий
роговидный инфундибулюм (буккон). Кольцо состоит
из наружной мембраны УМ и внутренней мембранел-
лы М2, непропорционально длинной у перитрих;
966
ALVEOLATA
очень трудно найти рудимент Ml у начала полосы, но
в букконе к закрученной М2 добавляется третья мемб-
ранелла и длинная аргейтофильная лента без кинето-
сом. При входе в буккон М2 расщепляется на разроз-
ненные параллельные ряды ресничек, а к основанию
мембраны добавляется короткий параллельный «гер-
минальный» ряд — монокинета. В принципе триходи-
ны сохранили ротовую цилиатуру сессилид без види-
мых изменений; мембрана и М2 огибают весь верхний
край тела, и, как И у сессилид, в пределах отряда име-
ются аберрантные виды с вторично видоизмененной
цилиатурой — укорочением наружного кольца (род
Semitrichodina), с увеличением числа наружных вит-
ков (Vauchomia) илй спирализацией пеникулюса и ар-
гентофильной полосы в букконе {Semitrichodina sphae-
ronuclea).
Поверхность апикального отдела всегда ровная, без
кольцевых ребер; поверхность тела между мембраной
и ресничками базальной части тоже почти всегда ров-
ная, известно лишь несколько исключений — отдель-
ные виды урцеолярий несут аргентофильные кольце-
вые складки (видны прижизненно), унаследованные от
сессилид, и у одной из триходин (из кишечника лягуш-
ки Xenopus в Африке) на теле и апексе видна сетка,
особенно в сканирующем микроскопе, не показываю-
щем кольцевых складок у всех осмотренных триходи-
нид, кроме Safrodina. Эта сетка не соответствует арги-
рому сессилид, этот род не примитивен. Кольцевые
ребра сохранены у части видов Urceolaria из моллю-
сков, являющихся переходными формами между 2 от-
рядами перитрих. Виды из трепангов и наземных мол-
люсков с такими кольцами усложнены и не примитив-
ны среди урцеоляриид.
Ядра разной формы, особенно у урцеолярий —
сферические, вытянутые, звездчатые, складчатые, с
боковыми отростками; постепенно складывается одна
определенная форма (С-образное ядро), характерное
для части урцеолярий и большинства видов триходин.
Микронуклеус один, мелкий. Динамика ядерных про-
цессов при конъюгации и реконструкция ядер у экс-
конъюгантов не изменены по сравнению с вортицел-
лидами.
Как и у сессилид, верхняя часть тела с перистомом
далее обозначается как эпидиск, нижняя с цитоскеле-
том как базодиск, или просто «диск». Базодиск несет
сложный опорный аппарат — кольцо зубцов у урцео-
лярий, кольцо пластинок с зубцевидными отростками
у большинства триходин. На срезах видны альвеолы
под пелликулой, краевая нересничная мембрана, коль-
цо ресничек, второй выступ (септа) и над ним полоса
шириной в 3 кинетосомы; от всех кинетосом к центру
диска идут корневые фибриллы. Реснички верхнего
кольца могут быть удлинены и слиты в разрозненные
циррусы, направленные вверх. Зубцы цитоскелета по-
гружены, под клеточной оболочкой, и поэтому в отли-
чие от астомат не могут повреждать эпителий хозяев;
повреждения могут наноситься краями диска или при
засасывании диском участка эпителия для прочного
оседания триходин. При импрегнации по периферии
диска выявляются радиальные полоски, у одного рода
(Trichodoxa) также кольцо с зубцами.
Деление в свободноплавающем состоянии; изредка
наблюдается конъюгация; цист покоя нет; питание
фильтрацией. При делении зубцы распределяются по-
ровну, дочерняя клетка получает половину набора; по
периферии диска возникает новый полный набор зуб-
цов, а в центре диска идет резорбция половинного на-
бора. Аргентофильный паттерн диска меняется, что
надо учитывать при определении видов.
Все виды отряда симбионтные в основном эктоби-
онты на беспозвоночных и рыбах, в редких случаях ки-
шечные паразиты трепангов, тритонов, лягушек, рыб,
есть и виды с необычной локализацией — в мочевом
пузыре или генитальной системе. Триходины и урцео-
лярии обычно медленно скользят диском по субстра-
ту (эпителию, слизи), или надолго остаются на месте,
непрерывно фильтруя пищу из толщи воды. Всех мо-
билид нельзя назвать паразитами, хотя такое обозначе-
ние общепринято для эпибионтных видов — это ком-
менсалы; косвенный вред для хозяев, особенно молоди
рыб с нежным эпителием, — не критерий паразитизма.
Паразиты — это и обитатели кишечника независимо
от способа питания, и наружные виды, питающиеся
хозяином. Косвенный вред для хозяев, особенно моло-
дых или ослабленных рыб, известен и документиро-
ван, но не сравним с инвазиями тетрахимен или их-
тиофтириуса.
Внутри отряда мобилид хорошо прослеживают-
ся эволюционные линии, намечена естественная сис-
тема родов и семейств, но происхождение отряда
пока остается загадкой. Вспомним, что сессилиды,
по единому мнению специалистов, произошли от тиг-
мотрих, но промежуточную форму случайно нашли
в Индии в морских древоточцах (род Nucleocorbula).
Изученность морских симбионтов ничтожна, и та-
кая промежуточная форма между сессилидами и моби-
лидами пока не найдена или вымерла вместе с хо-
зяином.
Гипотезы о происхождении мобилид не имеют убе-
дительности. По Шардезу (Chardez, 1979), намечается
ряд: Vorticella — Rhabdostyla — Apiosoma — Scyphi-
dia — Urceolaria mitra — Trichodinella — Trichodina',
по Раабе (Raabe, 1952), моделью переходной формы
является Ambiphrya, симбионт пресноводных и мор-
ских рыб с постоянным пояском ресничек над подо-
швой; но и в этом случае неясно, как появились зубцы
цитоскелета. У мигрантов перитрих нет видимых или
импрегнируемых структур, кроме колец кортекса, ко-
торые могли дать начало диску урцеолярий; неожи-
данно в этом плане замечание Клампа (Clamp, 1987) о
том, что плоские мигранты раковинных перитрих La-
genophrys имеют сложный фибром, выявляемый при
импрегнации протарголом, и изучение их может по-
мочь решению загадки. В пресной воде известна лишь
одна урцеолярия (на планариях), в море они разнооб-
разны и виды типа Urceolaria patellae с кольцами кор-
текса наиболее примитивные.
Симбионты мобилид — спирохеты в кольцевых ря-
дах у Polycycla из голотурий, карман с бактериями у
Trichodinopsis из наземных моллюсков, иногда бакте-
рии на кортексе триходин. Нередки случаи паразитиз-
ма сукторий без видимой патологии для хозяев в пре-
сноводных и морских триходинах; вид сукторий
условно обозначается как Endosphaera engelmanni, по-
скольку невозможно отличить их от паразитов пресно-
водных вортицеллид. Симбионтные водоросли отме-
ТИП CILIOPHORA. КЛАСС OLIGOHYMENOPHOREA
967
чены у Leiotrocha patellae из морских гастропод во
Франции и зеленые водоросли другого типа (не зоо-
хлореллы) у L. viridis из пресноводных гастропод в
США; у первого вида «расы» с водорослями и без них
приурочены к разным хозяевам, поэтому нужно отнес-
ти их к разным видам рода. Зоохлореллы имеются у
триходин из водных моллюсков Planorbis (Trichodina
tranquilla, Польша), Theodoxus (Т. theodoxi, дельта
Волги у Каспия) Physa (Т. viridis, США) и Physella
(Т. chlorophora, Т. breviradiosa, США).
Подотряд Urceolariina Jankowski
subordo п. (рис. 384, 6—385, a)
Триходины объединяются в одно семейство, урцео-
лярии в 3—4 семейства в разных схемах классифи-
кации, поэтому можно объединить их в один подо-
тряд. Внешний вид, ядра и форма перистома урцеоля-
рий очень разнообразны, общий признак — наличие
на диске кольца опорных ромбических пластинок
без внутренних и наружных отростков. Это цельная
монофилетическая группа, связанная в эволюции толь-
ко с беспозвоночными, в основном с морскими; в пре-
сных водах лишь один вид, который считают при-
митивным — Urceolaria mitra на ручьевых планари-
ях (нет триходин на сходных морских планариях).
Однако наиболее примитивны те морские виды, кото-
рые сохранили кольцевые ребра кортекса; это симби-
онты полихет, гастропод (Acmaea, Patella), брахиопод.
Эти группы могли быть хозяевами неизвестного пред-
кового вида мобилид. В отличие от цитированных
выше гипотез Шардеза и Раабе я считаю, что урцео-
лярии возникли на морских беспозвоночных, а не на
рыбах.
Сем. Urceolariidae Dujardin, 1840
Включает виды, не имеющие кольцевых ребер кор-
текса, видимых без окраски или импрегнируемых про-
тарголом, и имеющие стандартный вортицеллидный
перистом (поэтому без рода Polycycla с нетипичным
для мобилид ротовым аппаратом).
Род Urceolaria Stein, 1867
Типовой вид Trichodina mitra Siebold, 1850 по
монотипии. По Джонстону, Корлиссу и Аэшт (Johns-
ton, 1938; Corliss, 1979; Aescht, 2001), род Urceolaria
Lamarck, 1801 предложен только для коловратки U. ге-
diviva (вероятно, это обычный вид Rotifer vulgaris или
Callidina redivivaf, позже сам Ламарк и другие авторы
забыли об этом виде и стали включать в состав рода
цилиат самого разного типа, частично неопределимых,
иногда и триходин (U. discina Lamarck, 1816 = Tricho-
dina pediculus), но не урцеолярий в современном пони-
мании рода. Штейн (Stein, 1867), не предлагая нового
рода, использовал это название только для одного
вида, симбионта планарий, незадолго до этого описан-
ного в составе рода Trichodina, и поскольку этот автор
имел большой авторитет, никто не возражал против та-
кого в сущности совершенно недопустимого номенк-
латурного акта. Для Т. mitra нужно было создать
новый род.
Джонстон, впервые указавший на это противоре-
чие, не заменил название новым, поскольку уже есть
доступное название Leiotrocha', Корлисс вначале наме-
ревался ввести новое название Urceolariella Corliss,
1977 (указано в одной из статей без объяснения), но
позже отказался от такой замены. Это название отсут-
ствует в каталоге Аэшт, вероятно, не было замечено.
Поскольку род Urceolaria общепринят почти полтора
века, следует в петиции ICZN объявить его nomen соп-
servandum, сохранив авторство Ламарка, а не Штейна
и не сводить другие роды в синонимы, поскольку они
отличаются по многим признакам. Фактически речь
идет о замене типового вида, что в виде исключения
допускается Номенклатурным Комитетом.
U. mitra обычна на белых и черных планариях прес-
ных вод, круг хозяев широкий, ареал — север Евразии
(включая Японию) и Северная Америка. В Байкале
«взрывная» эволюция крупных планарий, но никто не
находил на них типичных для Dendrocoelum lacteum и
Polycelis nigra симбионтов — астомат Haptophrya, мо-
билид Urceolaria mitra и Trichodina steinii. В морских
планариях, массовых на литорали, обычны близкие к
Haptophrya астоматы Steinella, но на покровах тела ни-
когда нет мобилид. Тело U. mitra крупное, мешковид-
ное, складчатое, кортекс очень гибкий, оба диска (эпи-
диск и базодиск) очень крупные, ядро С-образное, как
у большинства перитрих. Пелликула ровная, циклоне-
мы не отмечались в литературе и не были найдены
мной при специальном поиске с применением 3 мето-
дов импрегнации. Поскольку это единственный прес-
новодный вид подотряда, предков мобилид нужно ис-
кать в море. Нет разницы в описаниях вида из отдален-
ных стран, круг хозяев широкий, типовым хозяином
здесь обозначается D. lacteum', другие хозяева — Pla-
naria lugubris, Р. (Dugesia) gonocephala, Р. torva, Р. ро-
lychroa, Р. alpina, Polycelis nigra.
Сем. Polycyclidae Poljansky, 1951
Мобилиды с крупным телом, расширенным у ба-
зодиска и суженным апикально; хорошо видны без
импрегнации циклонемы — поперечные кольце-
вые ребра кортекса. Перистом узкий и глубокий, в
виде канала; эпидиск при сокращении может втяги-
ваться в тело.
Род Polycycla Poljansky, 1951
Типовой вид Р. discophora из кишечника даль-
невосточного трепанга (крупной промысловой голо-
турии) Cucumaria obunca у Владивостока и южного
Сахалина. Размеры особей около 110 мкм, тело кони-
ческое, диск с 50—60 изогнутыми зубцами, сближен-
ными вплотную в виде единой опорной полосы; от
центра диска к периферии идут 100—120 парных фиб-
рилл. Ядро длинное, извитое, с неправильными суже-
ниями и вздутиями. В первоописании зарисованы рес-
нички, отходящие от большого числа (не менее 30)
968
ALVEOLATA
Рис. 385, a. Mobilida.
Urceolariapatellae (A—B) (no: Brouardel, 1951); U. karyodactyla (Г) (no: Laird, 1961); U. korschelti (Д) (no: Zick, 1928); U. кагуо1оЫа{Е)1ук>\ Hirshfield, 1949).
Fig. 385, a. Mobilida.
тесно сближенных поперечных колец на всей поверх-
ности тела, с дополнительным пучком в центре базо-
диска. Именно это послужило основанием для выделе-
ния нового рода и семейства. У мобилид есть сомати-
ческие кольца ресничек по краю базодиска на стороне,
обращенной к субстрату; по мнению Полянского
(1951), у Polycycla произошла полимеризация этих ко-
лец, перешедших на все тело.
Точно такой же вид, но без ресничек был описан
ранее как Trichodina synaptae Cuenot, 1891 (позже Cyc-
lochaeta synaptae in Cuenot, 1892 и затем U. synaptae
in Cuenot, 1912) из мелких норовых голотурий рода Sy-
napta — в основном в 5. inhaerens (= Leptosynapta)
и У galliennei, редко в S. digitata (= Labidoplax), все-
гда только в кишечнике; вид повторно изучили Форе-
Фремье и Чапик (Faure-Fremiet, Czapik, 1966). Длина
тела 80 мкм, имеется 30—36 зубцов диска и всего око-
ло 7 разрозненных циклонем кортекса. Диск несет
2 кольца ресничек, тонкое внутреннее (в основа-
нии монокинета) и толстое наружное (с поликине-
той); кроме них на удалении от краев диска распо-
ложено кольцо парных ресничек (циррусов); скопула
с особой цилиатурой — с длинными гибкими беспо-
рядочно расположенными ресничками. Реснички мел-
кого перистома неактивные, вероятно вид питается
осмотически. В США вид без соматических ресни-
чек, только с базальными, найден в трепанге Thyone
briareus.
Такие же формы без соматической цилиатуры со-
браны мною в синаптидах Сахалина и Командор; в
трепангах нашли лишь формы без ресничек. Это не
реснички, а эпибактерии — симбионтные спирохеты,
прикрепляющиеся к кольцевым складкам кортекса у
части популяций или видов рода Polycycla-, род и се-
мейство валидны по другим признакам — наличие
циклонем, редукция перистома, особое положение
кольца циррусов.
Сем. Trichodinopsidae Kent,
1881
Тело конусовидное, резко расширено снизу и суже-
но у вершины; кортекс со складками (циклонемы);
ядро дисковидное, в базальной части. Перистом особо-
го типа, не соответствует таковому Polycycla, виды
неродственные, их нельзя объединить в одном се-
мействе.
ТИП CILIOPHORA. КЛАСС OLIGOHYMENOPHOREA
969
Рис. 38S, б. Mobilida.
Различия родов триходинид по типу перистома и зубцов опорного диска (по: Basson, Van As, 1989): А — Vauchomia, Б— Trichodoxa, В — Tripartiella, Г—
Trichodinella^— Trichodina, E—Semitrickodina, Ж—Paratrichodina,3—Hemitrichodina, И— Dipartiella. Перистом Trichodinella epizootica (K); Triparti-
ella (Paratrichodina) phoxim (JT)\ Trichodina reticulata (M); Semitrichodina sphaeronuclea (H) (no: Lom, 1963a — К, M, H\ Lom, 1963b — Д); элементы опорно-
го диска Trichodinella epizootica (О, П) (no: Lom, 1973).
Fig. 385, 6. Mobilida.
Fig. A—И — generic differences in trichodinids by peristome type and dents of supporting ring.
Род Trichodinopsis Claparede
et Lachmann, 1858
Типовой вид T. paradoxa по монотипии. С диа-
гнозом семейства; диск обычного для урцеолярий
типа, 3 базальных кольца ресничек расположены ком-
пактно, верхнее кольцо не удалено вверх за край дис-
ка, как у Polycycla', реснички поликинеты длинные,
одиночные реснички верхнего кольца направлены
вверх. Эпидиска фактически нет, от узкого отверстия
ротовой полости внутрь идут незначительно изогну-
тые кинеты до экватора тела; в норме у типичных мо-
билид спираль ресничек развернута на краю очень ши-
рокого эпидиска. Каналовидный буккон Trichodinopsis
окружен особым «фарингеальным карманом» неясно-
го назначения, заполненным массой симбионтных бак-
терий (по срезам в электронном микроскопе). Ядро ди-
сковидное, прижато к базодиску. Вид обитает в кишеч-
нике и изредка в дыхательной полости наземной
улитки Cyclostoma (Pomatias) elegans (сем. Pomatiasi-
dae) в южной Европе; это теплолюбивый хозяин, род
Pomatias представлен несколькими видами в южной
Европе, вероятно все они служат хозяевами этих сим-
бионтов. Находок в России нет.
Род не признавался самостоятельным частью ав-
торов, и даже в каталоге Аэшт и в сводке Линна ука-
зано — «синоним рода Urceolaria»', в Traite (Puytorac,
1994) — род и семейство валидные. Род Urceolaria
привыкли понимать слишком широко, что приводит к
такой необоснованной синонимизации. Напомним, что
у типового вида урцеолярий нет циклонем, перистом
типичный для перитрих, ядро С-образное.
Сем. Leiotrochidae Johnston,
1938
Урцеолярий с широким эпидиском, несущим рото-
вую цилиатуру обычного для мобилид типа; у части
видов кортекс с циклонемами, которые можно выявить
при окраске или импрегнации серебром (не протар-
голом).
970 ALVEOLATA
Род Leiotrocha Fabre-Domergue,
1888
Типовой вид L. serpularum; симбионт на жаб-
рах сидячих полихет серпулид, живущих в известко-
вых трубках; мелкие формы величиной 25—40 мкм с
ядром сложной формы — от центральной массы вбок и
вверх отходят 2 отростка, несущие боковые ветви.
Вторичное указание типового вида U. korschelti Zick,
1928 для рода Leiotrocha в статье Хиршфельда (Hirsh-
field, 1949), не замеченное Аэшт, невалидно. Родовые
отличия, по литературе, — наличие циррусов на краю
диска у Leiotrocha и их отсутствие у Urceolaria mitra,
но кинетом родов однотипен.
L. patellae (Trichodinapatellae Cuenot, 1891; = Acyc-
lochaeta patellae in Zick, 1928) при импрегнации на су-
хих мазках имеет четкие вплотную сближенные цик-
лонемы. Вид сборный, разные виды, морфологически
почти идентичные, но с зооксантеллами или без них,
специфичны для 2 разных видов пателл; в Крыму на
жабрах Patella pontica встречается только вид без сим-
бионтных водорослей. Типовая раса без симбионтов,
найдена в южной Франции в Р. vulgata; новое название
должен получить вид с симбионтами из Р. coerulea или
Р. tarentina.
Leiotrocha viridis comb. n. (Urceolaria in Richards,
1971) обитает в мантийной полости пателлообразных
гастропод Астаеа digitalis в Калифорнии; ядро как у
L. serpularum, цитоплазма с необычными удлиненны-
ми симбионтными водорослями. Циклонемы не пока-
заны, но в акмеях у Владивостока урцеолярии без во-
дорослей, с такими же ядрами имеют циклонемы, поэ-
тому наличие их предполагается у U. viridis.
Leiotrocha kozloffi comb. n. (Uceolaria in Bradbury,
1970); возможно смесь 2 видов с разными типами ядер,
С- или Н-образными; как типовая форма вида здесь
фиксируется рис. 2 в статье Бредбери (Bradbury, 1970);
обе формы имеют циклонемы, видимые прижизненно
и при импрегнации. Вид специфичен для брахиопод,
обитает на лофофорах Terebratalia transversa и Hemit-
hyris psittacea.
Описано много видов урцеолярий без данных
по структуре кортекса; эти виды могут принадлежать
к Leiotrocha или к другим родам. В любом случае Lei-
otrocha включает лишь виды с ядром указанного
типа; как и в случае родов Opercularia (С-образное
ядро) и Orbopercularia (округлое ядро), виды с не-
типичной формой макронуклеуса должны быть обо-
соблены.
Род Orthurceolaria Jankowski,
1980
Типовой вид Urceolaria elongata Fenchel, 1965;
несократимые мешковидные формы с крупным оваль-
ным ядром; перистом нетипичный, ротовая ресничная
спираль лежит не в одной плоскости, начало и конец
спирали далеко удалены один от другого. Симбионт
морских двустворчаток Nuculana pernula и N. minuta
находится в северной Европе. Родовые признаки — от-
сутствие циклонем, форма ядра, необычный тип рото-
вой цилиатуры.
Род Anthurceolaria Jankowski,
1980
Типовой вид Urceolaria karyolobia Hirshfield,
1949 с ядром необычной формы — компактным и
складчатым по всей длине. Симбионт в мантийной по-
лости акмеид в Калифорнии — Астаеа pelta, A. digita-
lis, A. limatula, A. scabra, A. incessa, A. fenestrata, Lottia
gigantea. Нужно повторное изучение с указанием ти-
пового хозяина. Сходные перитрихи обитают в мелких
береговых и в крупных траловых акмеидах на биостан-
ции Восток.
Род Monurceolaria Jankowski, 1980
Типовой вид Urceolaria scolopontis Precht,
1935; симбионт псаммонных полихет Scoloplons armi-
ger, обычных у нас в Белом и Баренцевом морях. Со-
кратимый вид с плоским компактным ядром, без цик-
лонем. Тело высокое, массивное, бочонковидное, базо-
диск с крупными зубцами; без окраски хорошо видны
пучки фибрилл в цитоплазме.
Остальные известные виды урцеоляриид нужно
изучить заново, проверить наличие или отсутствие
циклонем, тип ядер и цилиатуру и распределить по ро-
дам по сочетанию этих признаков — U. cellanae Suzuki,
1950 (пателло-гастроподы Cellana eucosmia, С. toreu-
та), U. convexa Haider et Dietrich, 1977 (полихета Ana-
itides mucosa'), U. gaimardiae Johnston, 1938 (двуствор-
чатка Gaimardia coccinea), U. heraldica Jankowski,
1974 (дальневосточные морские ежи Strongylocentrotus
intermedius и S. polyacanthus), U. karyodactyla Laird,
1961 (хитон Ischnochiton ruber, = Lepidochiton, = Tra-
chydermon), U. korschelti Zick, 1928 (Chiton margina-
tus), U. lytechini Berger, 1964 (название в неопублико-
ванной диссертации; в еже Lytechinus variegatusT),
U. mirabilis Stein, 1974 (еж Str. nudus), U. ozakii Suzuki,
1950 (хитон Liolophura japonica), U. spinicola Beers,
1965 (ежи Str. purpuratus, S. franciscanus, S. echinoides,
S. droebachiensis, Lytechinus anamensis), U. strongylo-
centroti Berger, 1964 (в разных ежах, неопубликовано),
U. terebellidis (Precht, 1935 in Trichodina) (полихеты в
известковых трубках Terebellides stroemii, Terebella
pectoralis), U. urechi (Noble, 1940 in Trichodina) (эхиу-
рида Urechis caupo), U. viridis Richards, 1971 (пател-
ло-гастропода Астаеа digitalis), U. japonica stat. n.
(= U. urechi japonica Suzuki, 1950) (эхиурида Urechis
unicinctus), U. ophiocomae Giard, 1879 (неопубликова-
но? В офиуре Amphiura squamata = Ophiocoma neglec-
ta). Вид U. stammeri Haider, 1964 с пресноводных
рыб — густеры Blicca bjorkna очень плохо описан и не-
достоверный.
Подотряд Trichodinina Jankowski, 1980
(рис. 385, б—386, б)
Дисковидные формы со слегка вогнутым базоди-
ском и незначительно выпуклым эпидиском примерно
одинаковой ширины; ротовая цилиатура у наиболее
крупного рода Trichodina стандартного для сессилид
типа, с полным оборотом мембраны и мембранеллы
ТИП CILIOPHORA. КЛАСС OLIGOHYMENOPHOREA
971
Рис. 386, a. Mobilida.
Trichodina polycirra (А, 3) (по: Ergens, Lom, 1970); Т. helisodurya (Б, Ж) (по: Bovee, 1961); Т. multidentis (В) (по: Laird, 1953); Т. vancouverense (Г) (по: Laird,
1961): Г. urinaria (Д) (по: Ergens, Lom, 1970); Т. parabranchicola (Е) (по: Laird, 1953); Т. domerguei, Т. pediculus {И, К) (по: Foissner et al., 1999); Т. decipiens
(JT) (no: Laird, 1961).
Fig. 386, a. Mobilida.
М2 вокруг края тела перед погружением в буккон; иск-
лючение — полимеризация витков у Vauchomia и уко-
рочение спирали до дуги у Dipartiella, Paratrichodina,
Semitrichodina, Trichodinella и Tripartiella. Базальные
реснички в 3 кольцах, направлены вверх от верхнего
конца, иногда имеют вид циррусов. Базодиск с опор-
ными пластинками сложной формы: треугольные цен-
тральные части своим выступом вложены одна в дру-
гую; к краю диска идет крупная лопасть, к центру дис-
ка (скопуле) направлен зубец. Как исключение, нет
зубца у Dipartiella или он загнут у Trichodinella. Такое
различие дает возможность проследить путь эволюции
от примитивных урцеолярий. Кортекс всех видов без
кольцевых циклонем, но у вида из африканских шпор-
цевых лягушек Xenopus кортекс рельефный, и этот
аберрантный вид выделяется зесь в особый род Safro-
dina. Ядро в основном С-образное, очень редко сфери-
ческое.
Хозяева триходинид — беспозвоночные и в отли-
чие от урцеолярий также позвоночные. Из беспозво-
ночных заселены гидры, лимномедузы Craspedacusta,
пресноводные, морские и наземные моллюски, пелаги-
ческие ктенофоры, иглокожие (в основном морские
ежи); указаны находки в спонгиллах (бадягах) и на
пресноводных мшанках. Нет находок в рептилиях; за-
селены амфибии (лягушки, тритоны) и рыбы в прес-
ных, солоноватых и морских водах. На одной рыбе
можно встретить несколько видов триходин; это один
из основных субстратов эволюции рода.
Похе (Poche, 1913) разделил отряд Peritricha на
2 «трибы» Trichodinoidae nom. nov. для Discophora Enri-
ques, 1908 (Licnophoridae и Trichodinidae) и Vorticelloidae
Пот. nov. для Claudentia Enriquez, 1908 (Vorticellidae).
Триба — категория ниже ранга семейства, но здесь ис-
пользована для 2 надсемейств; Discophora отвергается
как гомоним названия отряда медуз (Scyphozoa). В
итоге валиден введенный мной подотряд Trichodinina.
Сем. Trichodinidae Claus, 1874
Долгое время различалось лишь одно семейство
для всех мобилид (Urceolariidae), триходины отделены
относительно недавно; авторство приписывалось Раа-
бе (Trichodinidae Raabe, 1963; предложено как новое
подсемейство в составе сем. Urceolariidae Dujardin,
972
ALVEOLATA
Рис. 386, 6. Mobilida.
Trichodina myicola (А, Б) (no: Uzmann, Stickney, 1954); Trichodina sp. (В, Г) (no: Chardez, 1979); T. urinicola (Д, E) (no; Favard et al., 1963); диск Trichodoxa ge-
nitalis (Ж) (no: Sirgel, 1983).
Fig. 386, 6. Mobilida.
1841), но ранее (Poche, 1913) был восстановлен прио-
ритет Клауса (в старинном учебнике зоологии). Одно
семейство, с признаками подотряда.
Род Trichodina Ehrenberg, 1830
Типовой вид Т. pediculus (Cyclidium in Muller,
1773). Прежде всего рассмотрим родовые синонимы,
поскольку в будущем возможна разбивка этого круп-
ного рода (более 100 видов) на подроды.
Род Acyclochaeta Zick, 1928
Типовой вид Т. steinii Claparede et Lachmann,
1858 по монотипии. Это обычный симбионт на пресно-
водных планариях (хозяева перечислены в диагнозе
Trichodina)-, родовой признак — отсутствие латераль-
ных ресничек (в названии рода a-cyclo значит без коль-
ца). Ранние авторы изучали цилиат без иммерсии, но
с объективом X 90 видны мелкие жесткие реснички
верхнего кольца, оно не утеряно. Оставляя в стороне
урцеоляриид, триходинид одно время делили на 2 рода
по наличию или отсутствию циррусов; род Acyclochae-
ta включал до 8 видов (A. steinii, A. baltica, A. bidentata,
A. urinicola и др.), но сейчас он окончательно забыт.
Если нет циррусов у эндобионтов из тритонов, жаб и
лягушек, как предполагают и сейчас, название Acyclo-
chaeta для них применить нельзя — такие реснички
есть у типового вида.
Род Anhymenia Fabre-Domergue, 1888
Предложен для 2 видов — Trichodina steinii С. et L.,
1858, и Т. scorpaenae Fabre-Domergue, 1888; тип рода
не фиксирован, по моему обозначению, Т. scorpaenae
(не идентичен с Cyclochaeta scorpaenae Robin, 1879?).
Вероятный синоним — Т. bidentata F.-D., 1888. Внеш-
не это типичная триходина, симбионт на жабрах мор-
ских рыб Scorpaena и Trigla, с дисковидным телом,
С-образным ядром, четкими циррусами верхнего рес-
ничного кольца, наличие которых в диагнозе Anhyme-
nia отрицается. Название рода использовалось редко,
сейчас забыто.
ТИП CILIOPHORA. КЛАСС OLIGOHYMENOPHOREA
973
Род Cyclochaeta Jackson, 1875
Типовой вид С. spongillae в Англии (локаль-
ный эндемик?); в каталоге Аэшт по ошибке указан как
синоним род Leiotrocha — морские урцеолярий, не
встречающиеся в пресных водах. Этот вид пока не най-
ден и не переописан, на пресноводных губках Spongil-
la fluviatilis (= S. lacustris) нет триходин. Первоописа-
ние подробное, но перистом показан неправильно (нет
адоральной спирали ресничек по краю эпидиска, толь-
ко вестибулюм — каково качество работы!), есть круг
моторных ресничек, как у мигрантов вортицелл, и над
этим кольцом около 16 очень длинных ресничек (ще-
тинок), намного длиннее тела. К этому роду позже
приписывали ряд видов (род принят, в частности, в
определителе Каля — Kahl, 1935), ныне в составе Tric-
hodina, Urceolaria и Polycycla', долгое время название
достаточно широко использовалось, считалось родом
или подродом разного состава, и сейчас забыто, как и
2 предыдущих. Важнее не длина циррусов, а тип зуб-
цов и форма ядер. Вторичное указание типового вида
Trichodina (Cyclochaeta) domerguei (Wallengren) Fa-
ure-Fremiet для подрода Cyclochaeta (Hirshfield, 1949)
незаконно.
Род Cyclocyrrha Fabre-Domergue, 1888 предложен
для 2 видов — С. ophiothricis F.-D., 1888 и С. asterisci
(= Trichodina asterisci Gruber, 1884) — соответственно
с офиур Ophiothrix fragilis и морских звезд рода Aste-
risks во Франции; тип рода не был обозначен, здесь
типовым считается Т asterisci. Родовой признак — на-
личие циррокинеты, в отличие от рода Anhymenia того
же автора, и отсутствие велюма. Вид с астерид мало-
изучен, но предположительно типичный для трихо-
дин; на астеридах нет урцеолярий. Название Cyclocyr-
rha в литературе практически не применялось.
Род Nummulella Carus, 1832
Типовой вид N. conchyliospermatica по моно-
типии — валидное название для вида Т. unionis Hampl,
1955 (Т. conchyliospermatica comb. п.). Вид описан и за-
рисован очень непрофессионально, найден при изуче-
нии эмбриологии наяд (унионид) в овариях. По ошиб-
ке этот вид считается синонимом вида Т. pediculus с
гидр, мшанок и рыб (также и в каталоге Аэшт), хотя
названный вид никогда не встречается в крупных дву-
створчатках типа Unio и Anodonta.
Род Paravauchomia Raabe,
1963
Типовой вид Trichodina urinaria Dogiel, 1940
по монотипии. Вид валидный, с необычным локусом
(мочевой пузырь пресноводных рыб), но название
рода не применяется даже как подродовое. Зубцы ба-
зодиска, как у триходин; перистом несколько видоиз-
менен: считалось, что увеличено число витков реснич-
ной спирали, но при импрегнации показан переход ди-
кинеты в монокинету или аргентофильную линию, это
не спирализация типа Vauchomia. Возможно сохране-
ние таксона как подрод триходин.
Род Poljanskina Raabe, 1963
Типовой вид Т. oviducti Poljansky, 1951 по моноти-
пии; из урогениталий скатов Raja radiata, R clavata,
R. ocellata, R. magellanica, R. brachirops, R. flavirostris,
R. scabina; типовой хозяин Raja radiata на Мурмане.
Род недостаточно четкий, не выше ранга подрода; от-
личия от триходин — кардиоидная форма перистома,
большое число зубцов с прямыми лопастями и шипа-
ми, очень крупные размеры особей.
Род Torquatina Gros, 1850
Описан без латинского названия вида, это название
никогда и никем не использовалось. Часть синонимов
обязана неправильным описаниям и рисункам видов в
литературе и ошибкам в зарисовке перистома и цирру-
сов локомоторных колец ресничек.
Типовой вид рода Trichodina — Т. pediculus
(Cyclidium pediculus Muller, 1773; Trichodina in Ehren-
berg, 1838) — вид с широким спектром хозяев, встре-
чается и в пробах планктона; доказана идентичность
триходин на гидрах, части видов лимномедуз и на ры-
бах, но в ЮАР описаны и специфические триходины
на местной лимномедузе. Триходин на пресноводных
рыбах определяли обычно как Т. domerguei Walleng-
ren, 1897; с применением импрегнации прежние под-
виды подняты до ранга видов, и началось описание
растущего числа новых видов. Привести полный спи-
сок видов и хозяев здесь невозможно, укажу лишь не-
сколько примеров; основные определители — Шуль-
ман, 1984; Guhl, Haider, 1988; Song et al., 2003 (nonvidi;
последняя сводка на китайском языке, но с полным
списком видов триходин и латинских названий их хо-
зяев всего мира). Виды с беспозвоночных:
1. Т. pediculus (М., 1773) — Hydra spp., лимноме-
дуза Craspedacusta sowerbii;
2. Т. hydrae Suzuki, 1950 — Hydra vulgaris subsp.
attenuate,
3. T zambeziensis Van As, Basson, 1986 —Limnoc-
nida tanganyikae',
4. Trichodina sp. — в полости тела и щупалец акти-
нии Pelocoetes exul;
5. Т. ctenophorii Estes, Reynolds et Moss, 1997 —
Mnemiopsis mccraydii',
6. T. steinii (C. et L., 1858) — планарии Dendrocoe-
lum lacteum, Polycelis cornuta, P. nigra, Planaria torva,
P. alpina, P. gonocephala, P. polychroa, Dugesia (Plana-
ria) lugubris, Bothrioplana alacris, Mesostoma tetrago-
num (= M. oscari);
7. T. oxystelis Sandon, 1965 — Oxystele impervia
(ныне Diloma sagittaria var. impervia)',
8. T. tegula Hirshfield, 1949 — Tegula funebralis,
T. Ungulata',
9. T. theodoxi Kurochkin, 1968 — Theodoxuspallasi',
10. T. baltica Quennerstedt, 1869 — Neritina fluviati-
lis (= Theodoxus)',
11. T viridis Smith, 1900 — Physa integra',
12. T. breviradiosat&daar&s, 1949, T. chlorophoraP.,
1949, T. physellarumP., 1949—PhyseUaspp.,Ph. ampu-
lacea, Ph. traskii',
974
ALVEOLATA
13. T. tranquillis Raabe, 1961 —Planorbis planorbis
(типовая раса с зоохлореллами);
14. T. helisodurya Bovee, 1961 —Helisoma (= Pla-
norbella) duryi;
15. T. helisomarum Richards, 1949—Helisoma tenue;
16. T planorbicola Machado Filho, 1965 — Austra-
lorbis tenagophilus, A. glabratus',
17. T achatinae Fantham, 1924 — Achatina fulica;
18. T. macomarum Raabe et Raabe, 1959 Macoma
balthica',
19. T. polandiae Fenchel, 1965 — Cardium lamarcki',
20. T. myicola Uzmann et Stickney, 1954 — Mya are-
naria',
21. T. pectenis Stein, 1974 — Pecten yessoensis;
22. T cardii (Delphy, 1938 in Cyclochaeta') — Cardi-
um edule',
23. T. mactrae Xu, Song et Warren, 2000 — Mactra
veneriformis;
24. T. ruditapicis X., S. et W., 2000 — Ruditapesphi-
lippinarum;
25. T. scapharcae X., S. et W., 2000 — Scapharca
subcrenata',
26. T. unionis Hampl, 1955 — Unio crassus batavum,
U. tumidus falcatus, U. pictorum, Anodonta cygnea pisci-
nalis и другие наяды;
27. T. gangetica Jamadar et Choudhury, 1988 — Mo-
diolus striatulus',
28. T. astericola (Precht, 1935 in Cyclochaeta) —As-
terias rubens, A. amurensis, Patiria pectinifera, Evasteri-
as echinosoma',
29. T. asterisci Gruber, 1884 — Asteriscus sp. {= Aste-
rina gibbosaT);
30. T. astropectinis Chatton et Villeneuve, 1937 — As-
tropecten bispinosus',
31. T. ophiothricis (Fabre-Domergue, 1888 in Cyclo-
chaeta) — Ophiothrix fragilis;
32. Trichodina sp. —Echinarachnius parma',
33. Trichodina sp. — Strongylocentrotus droebachien-
sis, S. purpuratus, S. echinoides, S. franciscanus',
34. T. domerguei subsp. megamicronucleata Haider,
1964 — Eudiaptomus zachariasi, E. gracilis, Diaptomus
vulgaris, D. castor,
35. T. diaptomi Basson et Van As, 1990 — Metadiap-
tomus meridionalis;
36. T pedicularis Jank. comb. n. для «?pedicularis sp.
n.» in Herrick, 1884 (род в первоисточнике не назван,
вид новый) — Diaptomus (= Skistodiaptomus) pallidus в
США;
37. Т. domerguei var. diaptomi Sramek-Husek,
1953 —Diaptomus sp.;
38. T. convictor Chardez, 1979 — вид на речных и
аквариумных рыбах, на Diaptomus sp., и на инфузори-
ях Bursaria, Spirostomum и Trichodina.
Здесь названы виды с гидр и лимномедуз (1—3), ак-
тиний (4), ктенофор (5), планарий (6), гастропод
(7—17), двустворчаток (18—27), морских звезд
(28—30), офиур (31), морских ежей (32—33), прес-
новодных каланоид сем. Diaptomidae (34—38); список
неполный, но дает представление о хозяевах рода.
Здесь не приведены многие находки неопределен-
ных видов Trichodina sp., или неправильных определе-
ний, например в морских древоточцах Teredo и Nausi-
tora.
Постепенно растет список видов Trichodina из три-
тонов, жаб и лягушек, с покровов головастиков и в мо- »
чевом пузыре или кишечнике взрослых особей; приме-
ры видов: Т xenopodos Fantham, 1924 (Xenopus laevis,
Bufo regulars)', T. bufonis F., 1924 (Bufo regulars)',
T. dilleri Canella, 1964 (Rana esculenta)', T. ranae Da |
Cunha, 1950 (R. eseulenta); T. entzii Bretschneider, 1934
(R. esculenta, R. temporaria); T. vesicola Suzuki, 1950
(R. rugosa); T. multidentata S., 1950 (R. rugosa); T urini-
cola Fulton, 1923 (Triturus spp.); T okajimae Ibara,
1931 (саламандра Hynobius tokyoensis в Японии); |
T. urinicola f. taeniatus Lom, 1958 (Triturus taeniatus); |
T u. f. typica Lom, 1958 (T. cristatus); T u. f. bohemica I
Lom, 1958 (T. cristatus); T. u. f. vesicularum Faure-Fremi- |
et, 1943 (T vulgaris, T palmatus, R. esculenta); T. dam-
panula Van der Bank, Basson et Van As, 1989 (Bufo guttu-
ralis). Виды T. pediculus, T. reticulata, T. leucisci,
T hydrae, T.fujitai нередко отмечаются на головасти-
ках лягушек, хотя в норме это виды с гидр и рыб. Три-
тоны и лягушки заселены триходинами в Евразии,
США, Африке, но при обилии саламандр в США и Ка-
наде нет сведений об их триходинах, и нет находок в
нашем сибирском углозубе Salamandrella keyserlingii.
Аберрантный вид Т. urinicola с глубоко вогнутым ба-
зодиском, не вполне типичным положением ротового
ресничного кольца и предположительно без циррусов
может быть типом нового рода.
Полный список триходинид на рыбах и их хозяев
(Song et al., 2003); здесь дано лишь несколько приме-
ров недавно описанных новых видов с пресноводных и
морских рыб: Т. labrisomi Rand, 1993; Т. japonica Imai,
Miyazaki et Nomura, 1991; T. rhinobatae Van As et Bas-
son, 1996; T. luba Basson, Van As et Fishelson, 1990;
T. circinantis Xu, Song et Warren, 2002; T. rectispina X.,
S. et W., 2002; T claviformis Dobberstein et Palm, 2000;
T. hippoglossi Nilsen, 1995; T. maritinkae Basson et Van
As, 1991; T. uretra Basson, 1989; T. porocephalusi As-
mat, 2001; T. cancilae A., 2001; T. canningensis A., 2001;
T cooper Poynton et Lom, 1989; T. carassii Lianxiang
Li, 1990; T. microspina Van As et Basson, 1992; T. laby-
rinthipiscis Van As et Basson, 2002; T. anabantidarum
Van As et Basson, 2002 и мн. др. Расширяется район ра-
бот, осматривается все большее число видов рыб,
включая локальных эндемиков, применяется статисти-
ческий анализ признаков в дополнение к морфологи-
ческому диагнозу; метод импрегнации сухих мазков
с пресноводных рыб адаптирован к морскому мате-
риалу.
Триходины локализованы на всей поверхно-
сти тела рыб, но чаще жаберные виды отличаются
от видов с плавников и чешуи; немногие виды — в мо-
чевом пузыре, известен и случай тканевой лока-
лизации неопределенного вида в крови, селезенке
и печени новозеландских пресноводных угрей Anguil-
la australis и A. dieffenbachii; это наиболее мелкий
вид с диаметром тела всего 10 мкм, отличающийся
от Т. anguillae на коже угрей. Патогенное действие
на молодь рыб продемонстрировано неоднократно,
к примеру в культурах Heterobranchus longifiliis, по- I
раженных Т. maritinkae Basson et Van As, 1991 в
ЮАР.
Типичные триходины имеют почти замкнутое
кольцо ротовых кинет (без их укорочения и полиме-
ТИП CILIOPHORA. КЛАСС OLIGOHYMENOPHOREA
975
ризации) и с «классическим» типом зубцов диска —
от центрального треугольника отходит широкая на-
ружная лопасть и узкий прямой внутренний шип раз-
ной длины и формы. Внутренняя безресничная зона
диска (ацилон) имеет характерный рельеф, выяв-
ляемый при импрегнации и важный для различения
видов.
Род Teretrichodina Jankowski, 1980
Типовой вид Т. balakrishnia (Trichodina in San-
thakumari et Nair, 1973). Симбионт в мантийной поло-
сти сверлильщиков дерева — двустворчатых моллю-
сков Nausitora hedleyi, Teredo furcifera (терединиды) и
Martesia striata (фоладиды) в Индии; встречается вмес-
те с триходинами обычного типа, неправильно опреде-
ленными как Т. macomarum. Диск стандартный для
триходин, с «классическими» опорными элементами;
тело необычайно длинное (до 120 мкм), перистомальная
зона (эпидиск) расширена, ядро уникального типа — у
всех триходин С-образное, у данного вида выявляются
по две двухветвистые полосы в клетке, идущие от од-
ного диска к другому. Если описание и рисунки пра-
вильные, это вид нового рода с учетом необычной
формы ядра. Внешний облик, как у Licnophora.
Род Trichodoxa Sirgel, 1983
Типовой вид Т. genitalis', также Т. phalli, оба
вида из генитальной системы мужских особей назем-
ных гастропод Trachycystis leucocarina, Т. contrasta
(типовой вид) и Т. тепкеапа (Т. phalli). Род и виды
описаны малакологом, нашедшим симбионтов при
вскрытии моллюсков, в ЮАР. Строение особей типич-
ное для триходин, кроме двух признаков — ротовая
ресничная спираль незамкнутая, укорочена до 3/4 кру-
га; по периферии базодиска видоизмененная краевая
мембрана — прочный обруч с шипами, примерно по
3 шипа на одну лопасть опорных элементов. Такое
строение диска не отмечалось у других триходин,
включая Т. achatinae из гигантских наземных гастро-
под ЮАР. Внутренние зубцы укорочены, но это не ро-
довой признак. Предполагаемое третье отличие
рода — наличие только одного аборального реснично-
го кольца (на краю базодиска). К этому роду может от-
носиться и малоизученный вид Т. achatinae Fantham,
1924, и неопределенный вид Trichodina sp. in Rajakris-
hna Menon, 1944 из капсулярной железы Ariophanta li-
gulata в Индии, также с гениталий гастропод, но друго-
го семейства наземных пульмонат. Оба вида Trichodo-
xa позже объединяли в один, валидность рода
отрицали, но сейчас эти таксоны приняты.
Род Semitrichodina Kazubski,
1958
Типовой вид Trichodinella sphaeronuclea Lom,
1956; симбионт наземных гастропод теплолюбивого и
влаголюбивого критического рода Oxychilus (= Schis-
tophallus) (Zonitidae), распространенного в южной Ев-
ропе, Средней Азии, в Турции, на южных берегах Сре-
диземноморья; вид встречается в Крыму в 2 местных
видах Oxychilus draparnaudi и О. cellarius', заражены
также безраковинные моллюски (слизни) Limax macu-
latus, Tandona cristata, T kaleniczenkoi. Ротовая спи-
раль укорочена наполовину, ядро овальное; к двум
стандартным кинетам перистомальной цилиатуры до-
бавляется короткий третий ряд.
Сравнение морфологии рас из разных хозяев пока-
зало наличие 2 форм вида — S. sphaeronuclea f. micro-
dentata Kazubski, 1971 (Oxychilus orientalis, очень ред-
ко в Aegopinella epipedostoma и Semilimax semilimax) и
f. macrodentata (Bielzia coerulans, слизни сем. Limaci-
dae). Зубцы у второй расы крупнее и их меньше, чем у
форм из зонитид; ее следует считать новым видом, со-
хранив название Т. sphaeronuclea для форм из Oxychi-
lus. Этот вид найден в Казахстане в Limax turkestanus
на церкариях Brachylaemus spinulosus. Валидный вид
также S. convexa Kazubski, 1961 из раковинных гастро-
под Cochlodina laminata.
Род Safrodina Jankowski gen. n.
Типовой вид Trichodina xenopodos Fantham,
1924; эндобионтный вид из кишечника шпорцевых ля-
гушек (clawed toad) ЮАР Xenopus laevis. Род Xenopus
крупный, распространен по всей Африке, это быстро
плавающие водные лягушки, обычный объект разведе-
ния в аквариумах и объект лабораторных опытов. Ни-
ктотерусы в кишечнике Xenopus принадлежат к особым
родам, и вид триходин также уникальный — в скани-
рующем микроскопе четко видна исчерченность кор-
текса, как у Pseudovorticella, имеется сеть прямоуголь-
ников, но не вполне правильных рядах. Вероятно,
укрупнены субпелликулярные альвеолы. Среди сесси-
лид подобная сеть имеется у многих родов, одиночных
и колониальных, с мионемой и с несократимым стебель-
ком; все эти виды выделены в особые роды. У триходи-
нид сеть найдена только у симбионтов Xenopus, и по
принципу «параллельных решений» следует выделить
для них новый подрод или род, несмотря на стандартное
для триходин строение перистома, диска и форму ядра.
Тип рода — мелкий вид (60 мкм) с вазообразным телом,
48—64 опорными элементами диска; ядро С-образное.
Род Vauc/7om/a Mueller, 1938
Типовой вид V. nephritica Mueller, 1938 из мо-
чевого пузыря американских щук Esox masquinongy;
также V. renicola (Mueller, 1931) в том же локусе у Esox
niger и в неопределенных видах Esox. Тело имеет вид
высокой башни, вход в инфундибулюм чуть выше эк-
ватора; ядро С-образное, лежит поперек тела медиаль-
но. Вместо привычного выпуклого эпидиска виден вы-
сокий конус, ресничные ряды начинаются на вершине
и спиралью спускаются вниз, входя в инфундибулюм
(буккон). Цилиатура описывает примерно 3 оборота
вместо одного у триходин. Базодиск триходин заметно
вогнутый; у Vauchomia он глубоко впячен внутрь тела,
зубцы удалены от субстрата; форма элементов типич-
ная для триходин.
976
ALVEOLATA
Род Dipartiella Stein, 1961
Типовой вид D. simplex (Raabe, 1959) с жабр
бычков Gobius niger польской Балтики. Внешний об-
лик типичен для триходин, но при импрегнации базо-
диска не выявлены внутренние зубцы опорных эле-
ментов; центральная часть не имеет вид треугольника,
здесь видна небольшая изогнутая пластинка, наложен-
ная краем на соседнюю. Лопасти широкие, отходят не-
посредственно от пластинок. Перистомальная цилиа-
тура редуцирована до дуги не длиннее 3/4 кольца три-
ходин. Название рода предложено для замены
гомонима Dogielina Raabe, 1959; род не всегда призна-
вался, сводился в синонимы Trichodinella или считался
подродом триходинелл, но сейчас валидный.
Род Trichodinella Sramek-Husek,
1953
Типовой вид Brachyspira epizootica Raabe,
1950 (синоним валидного вида Trichodina carassii Do-
giel, 1940) по монотипии. Родовое название заменяет
гомоним Brachyspira Raabe, 1950. Также внешне ти-
пичные триходины, но опорные элементы диска с тре-
угольным центром и широкими наружными лопастя-
ми; нет зубцов, отходящих к центру эпидиска. Род
всключает несколько видов с покровов пресноводных
и морских рыб, к примеру Т. inversa (Dogiel, 1948 in
Trichodina)', T. baltica (Stryjecka-Trembaczowska, 1953
in Brachyspira)', T. epizootica (Raabe, 1950); T. subtilis
(Lom, 1959); T. lomi Xu, Song et Warren, 1999; T. myak-
kae (Mueller, 1937); T. obtusa Ergens et Lom, 1970 и др.
Типовой вид имеет ряд синонимов, включая Т. регса-
rum (Dogiel, 1940); Т. maior Reichenbach-Klinke, 1962;
Т. lotae (Chan, 1961). Род подразделялся на несколько
подродов.
Род Tripartiella Raabe,
1963
Типовой вид Trichodinella copiosa Lom, 1959 с
горчака Rhodeus sericeus по обозначению Раабе. Род
обычно приписывается Лому, но в первоописании не
был указан тип рода, поэтому Раабе, впервые указав-
ший тип, автоматически становится автором валидно-
го рода. Таксон установлен Ломом как подрод в соста-
ве Trichodinella для 2 видов — Т. copiosa и Т. lata Lom,
1954. Внешний вид как у триходин, ядро С-образное;
различия в форме внутренних зубцов диска — толстые
у триходин, тонкие игольчатые у трипартиеллы, при
импрегнации чернится почти вся поверхность базоди-
ска внутри от кольца треугольников опорных элемен-
тов. Ротовая ресничная спираль укорочена до
180—270. Небольшой род с пресноводных и морских
рыб. В каталоге Линна (Lynn, 2002) — синоним рода
Semitrichodina, но это ошибка, род валидный. Приме-
ры видов: Т. bursiformis (Davis, 1947); Т. bulbosa (D.,
1947); Т. incisa Lom, 1959; T. rhombi Stein, 1961; T. me-
lanogrammi S., 1961; T. obtusa Lom, 1967; T. microcte-
nopomae Basson et Van As, 2002; T. ctenopomae Basson
et Van As, 2002.
Подрод Foliella Lom, 1959
Типовой вид Trichodinella (Foliella) subtilis
Lom, 1959 с карповых рыб родов Cyprinus, Carassius,
Tinea, Blicca, Rhodeus и др. Отличается от типичных
триходинелл формой зубца.
Род Pallitrichodina Van As et Basson,
in Aescht, 2001
Типовой вид P. rogenae Van As et Basson, 1993.
Название рода Pallitrichodina Van As et Basson, 1993
было предложено для 2 видов с пресноводных рыб в
ЮАР без указания типа и поэтому заменено новым как
невалидное. Цилиатура эпидиска в виде неполного
кольца, конец спирали не достигает входа в вестибу-
люм. Зубец с широкой наружной лопастью и относите-
льно коротким внутренним элементом, не имеющим
вид узкого шипа.
Род Hemitrichodina Basson et Van As,
1989
Типовой вид H. robusta по монотипии; из юж-
ноафриканского мормируса Marcusenius macrolepido-
tus. Расы с этого вида в 2 изолированных местообита-
ниях отличаются морфологически по размерам тела,
числу и форме зубцов, но пока считаются одним видом
триходинид. Локус — кожа, плавники, случайно на
жабрах. Крупные особи с удлинением адоральной спи-
рали, конец которой заходит за вестибулюм на 1/4 дли-
ны кольца; в зубце внутренняя часть имеет вид широ-
кой длинной лопасти (не шипа, как у триходин), а на-
ружная часть относительно редуцирована только у
этого рода в семействе, превращена в мелкую пластин-
ку с верхним зубцом.
Род Paratrichodina Lom,
1963
Типовой в и д Р. globonuclea (= Tripartiella (Pa-
ratrichodina) globonuclea), по Аэшт, Р. incissa (Lom,
1959) Lom 1963 (= Trichodinella (Tripartiella) incissa
Lom, 1959; Tripartiella incissa Lom, 1959; Tripartiella
(Paratrichodina) incissa Lom, 1959), no Basson et Van
As, 1989. Такая синонимика означает, что подроды Tri-
partiella и Paratrichodina были подняты в ранге до са-
мостоятельных родов. Типовой вид найден на Nema-
chilus barbatulus в Чехии; зубцы диска имеют крупные
наружные лопасти, широкие внутренние лучи; зона
контакта смежных зубцов в их центре ограничена, Ро-
товое кольцо укорочено почти наполовину или на
3/4 своей длины. Известно около 10 видов рода в
основном с жабр морских и пресноводных рыб;
3 вида — эндопаразиты в мочевом пузыре хозяев; род
отмечен в Евразии, Африке и США. Примеры видов:
Р. uralensis Kashkovsky et Lom, 1979; P, voikarensis K,
et L., 1979; P. corlissi Lom et Haidar, 1977; P. oblique
(Lom, 1963); P.phoxini (Lom, 1963); P. alburni (Lom,
1963) и др.
ТИП CILIOPHORA. КЛАСС OLIGOHYMENOPHOREA
977
PHYLUM CILIOPHORA DOFLEIN, 1901
SUMMARY
In the latest classification scheme of Lynn, 2 subphyla with 2 and
9 classes each are recognized within the monophyletic phylum Ciliop-
hora; structure of somatic and oral kineto-fibrillar complex serves as ba-
sis for regrouping of superficially similar forms in their proper natural
taxa, or for elevation of them as high-rank taxa irrespective of the num-
ber of included species and genera. Recent ciliate system is based on
morphological, ontogenetic and biochemical grounds.
In 1930th years, when Kahl summarized data on morphology and
taxonomy of ciliates in 4-volumes monograph, precise data on infra-ki-
netome (kinetosomal pattern of entire body) was known in no more than
several dozens of species; silvering methods had serious limitations and
were not suitable for some taxa, e. g. for marine planktonic oligotrichs
or benthic hypotrichs. Application of an universal protein-silver (protar-
gol) method, that permits staining cilia, kinetosomes, fibers, nuclei and
cortical extrusomes, revealed «protozoan fingerprint», as Thompson na-
med distinctive infra-kinetome pattern of ciliates, in nearly all known
and countless new post-Kahlian genera, and there is growing attention
to dynamics of kinetome during ciliate ontogenesis; main types of mor-
phogenesis, partly stomatogenesis were distinguished and are used for
phylogenetic classification at all levels.
Traditionally, several large well-limited taxa were separated as or-
ders from the rest, such as contractile peritrichs with mighty filtering ap-
paratus, sessile suctorians with their «forest of tentacles», or equally
motionless chonotrichs with their upper part transformed into extensive
rigid funnel; spirotrichs included more or less similar mobile genera
with long membranellar stripe on left edge of large peristome (neverthe-
less, now in 4 different classes). There was lack of due attention to nu-
merous genera without prominent or unique features, and in diagnosis
of large universally accepted order Holotricha one can simply write
«All others» instead of traditional diagnosis «With simple ciliature, wit-
hout adoral zone of membranelles» (in fact, there are none holotrich ci-
liates with undifferentiated kinetome, and AZM is present in at least
hundred of genera as synhymenium, tetrahymenium or polyhymenium,
as we call it today).
In our time, equal attention is paid to well-established higher taxa,
to reveal the degree of internal diversification and phylogenetic links of
included sub-groups, and to «all others», modestly hidden in soil, mari-
ne sand or black mud, such as anaerobic Trimyema or enigmatic armo-
red moss-dwelling Phacodinium. Growing number of such ciliates is
used in molecular phylograms.
Class Karyorelictea is most closely related to alveolate ancestor of
the phylum, unknown or extinct (not Stephanopogon as previously beli-
eved); near dozen of genera are grouped in 3 orders mainly by features
of oral and somatic ciliature. Its knowledge was retarded by difficulties
with silvering of fragile dark vermiform ciliates even by universal pro-
tein-silver method until Jean Dragesco developed a set of special fixati-
ves permitting perfect retention of cell shape; using these, he and Fois-
sner made first comparative study of infraciliature of included genera
and proposed or newly discovered (such as Apocryptopharynx or tropi-
cal Sultanophrys) a series of new genera. Previous diagnoses were ba-
sed mainly on nuclear features and presence or absence of longitudinal
cilia-free stripe (acilon — new term introduced in this chapter for any
cilia-free area) and its width; itself a wrong criterion, because at least
thin stripe is always present, and customary genus Trachelonema is not
more recognized. Now we can reveal and compare infra-kinetome of
any karyorelictid, as we compare other easily-impregnated ciliates on
protargol slides.
Order Protostomatida Small etLynn, 1985 has unproper name (re-
sembling Prostomatida Schewiakoff, 1896 within other class) and by
priority this namefriustbe replaced by Trachelocercida Jank., 1980 pro-
posed as new order for the same-group of genera. There are two included
families, one of these (Kentrophoridae) must be restricted to Kentrop-
horos with rudiments of oral ciliature, feeding by ingestion of epibacte-
ria of its symbiotic external garden. Long-neglected marine Cryptopha-
rynx was proved to be predecessor of better-known karyorelictid pleu-
rostomes, marine Remanella and freshwater Loxodes. Small separate
group of giant vermiform flat primitive ciliates, of which Geleia and
Avelia are better known, constitute separate order Protoheterotrichida
mainly by pattern of highly developed oral ciliature with unexpected
complexity for such otherwise primitive species.
Regretfully, there is desinformation regarding names, authors and
dates of accepted taxa, from suborder to class, especially in Traite de
Zoologie of Pierre Puytorac, where numerous high-rank taxa were gene-
rously ascribed to those who never proposed them; but in lesser degree
also in Lynn's scheme, a base of third edition of the book «The ciliated
Protozoa» jointly with John Corliss. In addition to above-mentioned
«Protostomatida» we must correct «Loxodida Jank. in Small et Lynn,
1985»; in fact, proposed in own article in 1980.
Class Heterotrichea, previously order within Spirotricha, was exc-
luded from that group as lateral branch of karyorelictids, always on the
margin of molecular phylograms, but remaining spirotrichs are not
far from separated heterotichs, as lowest branch on ciliophoran tree. In
geleiids within preceeding class buccal field is surrounded by special
longitudinal rows of pectinelles (the term is restored to denote any sepa-
rate compact row or group of cilia); rows of pectinelles of different ty-
pes may be at right, left or both sides of lateral subapical mouth, as an
attempt to find the most suitable and effective pattern of filtering sys-
tem.
This goal was achieved in their early branch, heterotrichs; here in
spite of extreme variety of body and peristomal shapes, there is single
basic pattern with minute secondary deviations — relatively long mem-
brane (continuous row of double kinetosomes) at right margin, and long
stripe of transversal or diagonal pectinelles at left side of widely open
peristome (adoral zone of membranelies, AZM). This stripe may be
straight, curved, spiral, ring-like or encircle wing-like lobes in folliculi-
nids, but this superficial diversity don’t shade basic unity of the pattern.
Transformation of undulating membrane (UM) into kinetosomal field in
Climacostomum, formation of somatic cirri to supplement right margin
of AZM in Condylostoma are minute secondary deviations. Many fami-
lies were established to reflect divergence within the class, but there
were almost no attempts to distinguish suborders, except for shelled fol-
liculinids, suborder Coliphorina, not accepted because its ancestor Sten-
tor includes species with mucous tube, except few planktonic species.
Blepharismidae may be basic family of the class, and it includes
benthic marine genera (Gruberia, Anigsteinia) sharing same biotope
with their supposed predecessor, geleiids. There was independent colo-
nization of fresh waters by blepharismids and condylostomatids and re-
markable independent evolution both in lakes and marine botopes lea-
ding to many unusual genera.
Folicullinids are marine, except several species, live in rigid loricas
comparable to those of cothumid and platycolid peritrichs; there is ten-
dency to gradual complication of loricas and dimorphic life cycle (with
dissimilar prostome migrant), thus their separation as suborder must not
be neglected.
Leaving two basic branches, united by kinetosomal pattern in subp-
hylum Postciliodesmatophora, we enter second subphylum named Int-
ramacronucleata.
The nearest group to heterotrichs is class Spirotrichea, cleaned of
numerous families but still large and diversified. There is single kine-
to-fibrillar pattern for each of all other 9 classes included in this subphy-
lum, but as exception 5 branches of spirotrichs are not united in a simi-
lar way, there are 4 types of that pattern. On a light-microscope level,
subcasses are united by the type of peristomal ciliature inherited from
heterotrichs (UM + AZM).
Small marine ciliate Protocruzia with few relatively large membra-
nelles, always of uncertain position, has ultimately found place in Spi-
rotrichs, in spite of its atypical nucleus; its ultrastructure is base for se-
paration at high-rank level, as monotypic subclass, from other spirot-
richs. It may be easily cultured on rice grains in marine or artificial sea
water; much work must be done with this aberrant ciliate that not long
ago was included in karyorelictids. It has atypical mode of division of
nuclear aggregate. Correct designation of the order is Protocruziida
Jank., 1980 not Jank. in Small et Lynn, 1985 of Lynn's checklist.
Subclass Phacodiniida is based on single moss-dwelling ciliate with
rigid ornamented armour, Phacodinium muscorum; here high rank is ex-
plained by atypical arrangement of cilia in somatic rows — as linear
plates of closely spaced kinetosomes, not like in cirral bases of hypot-
richs.
With subclass of hypotrichs, there are painful problems of both its
name and composition. There were continuous notes from both taxono-
mic specialists and biochemists that Euplotes does riot belong to hypot-
richs, in spite of astonishing similarity (except rigid armour and dissimi-
lar argyrome). Ulimately this resulted in separation of them in 2 diffe-
rent subclasses within spirotrichs. Euplotids include few «marginal»
genera, but Small and Lynn retained name Hypotricha only for this gro-
up, presenting countless others as subclass Stichotrichia. By «hypot-
rich» we imagine Oxytricha, Stylonychia or Urostyla, but not Euplotes.
In this review, Hypotrichia includes traditional genera, and Euplotia —
62 Зак. №4163
978
ALVEOLATA
only this small group. Discocephalids are intermediate, united both na-
med taxa together.
Within subclass Hypotrichia, there is gradual evolution from pri-
mitive kiitrichids to euplotids via Discocephalus and similar genera;
in main set of genera, there are many convergencies revealed by study
of division morphogenesis, for example formation of multiple so-
matic rows in oxytrichids and urostylids. Presence of double axial
row of cirri (diaxonema) separate group of otherwise dissimilar genera
in order Urostylida, with «all others» in one or two less distinctive or-
ders.
Earthworm parasite Plagiotoma was always united with nyctothe-
rids, but regular arrangement of ciliary tufts along the kineties, a kind of
pectinelles, does not occur in Nyctotherus-, although this type of ciliatu-
re is dissimilar to hypotrichs, they are united (as orders) within subclass
Hypotrichia.
Subclass Oligotrichia unites mostly pelagic swimmers with mighty
membranelles in unclosed or closed circle and regressed somatic ciliatu-
re; there are soft halteriids, strombidiids with rigid cortex and shelled
tintinnids. The last-named group and strobilidiids, without shell, are
united in subclass Choreotichia by presence of closed AZM (with UM
and mouth within a ring); they differ not only by presence or absence of
shell, but, more significant, by type of ciliature and its morphogenesis.
Groups named Strombidiina Petz et Foissner, 1992 and Strobilidiina
Small et Lynn, 1985 were proposed by Jankowski, 1985. First union of
tintinnids and strobilidiids in a single taxon, widely known innovation
of Small and Lynn, was made century ago in overlpok.ed article of Vic-
tor Sterki, retyped in England.
Within Heterotrichida, there was always bizzare marine genus Lic-
nophora-, even Simone Villeneuve-Brachon, who compared known he-
terotrichs on silvered slides, expressed no doubt as to legacy of its pre-
sence here in her basic monograph. In fact, nothing unites them, and
they are not hypotrichs by absence of cirri, body shape and presence of
curved monokineties on expanded basal sucker. Reorganization band,
passing through pre-dividing nucleus, a feature of hypotrichs, was
known in Licnophora but neglected, and this feature was underlined
again by Lynn, who proved by nucleic acid comparison that it belongs
to non-heterotrichid spirotrichs. Now, when relations are known, we
can evaluate all set of distinctive features and result was elevation to
subclass of spirotrichs or even to separate class (perhaps too high sta-
tus?). Licnophora inhabits marine cyanophytes and invertebrates, one
species on Chinese fishes.
Class Armophorea includes 3 subgroups (orders), one of these is
dissimilar to both others. Metopids, caenomorphids and odontostomes
are inhabitants of anaerobic black mud (sapropel) made on pond bottom
by plant remnants; outside of it, e. g. in psammon, they occur as excepti-
on. Main diversity is in fresh waters, but «initial» genus Metopus occurs
also in the sea, and here symbiotic species of closely related Parameto-
pidium inhabit dense mass of plant remains within sea urchin intestine.
This traditionally heterotrich group left named order and still found no
proper place in the system; its AZM may be convergence, and it has uni-
que type of stomatogenesis. Within the group, soft-bodied metopids du-
ring evolution become spiral, cortex becomes rigid, ciliature is reduced,
long syncilia or cirri appear in some areas. Small flat odontostomes are
independent line from Metopus.
Order Clevelandellida has unproper name — Clevelandella is lit-
tle-known symbiont of east-Asian xylotrophic cockroach Panesthia,
Nyctotherus with world-wide distribution in variety of hosts would be
better example. Again, traditional heterotrichs — with long AZM, com-
plete somatic ciliature and without cirri. Nevertheless, outside this order
by EM features of fibro-kinetome. Perhaps present union with metopids
is also mistake, although they both have (like Stylonychia) polytenic
chromosomes in postconjugant stages, moreover, very similar. Group
itself is parasitic, with significant divergence in terrestrial, freshwater
and marine hosts; quite possibly they inhabited dinosaurs. Predecessor
of nyctotherids is unknown or extinct with its hosts. Tropical areas give
continuous supply of new genera.
Class Litostomatea includes one of fragments of splitted traditional
Gymnostomata Butschli, 1889 (Foissner is right in restoring this name,
rejected by others). Characterization of the group may be made only on
EM level, as pattern of fibro-kinetome; internal divergence is uncompa-
rable to any other class of ciliates, and the name itself does not evoke
any definite image; we must ask — what genus is meant?
Subclass Haptoria includes prostomes, «slitostomes» of several
types and «rhynchostomes»; for characterization, we must imagine
unrelated prostome Urotricha, predecessor of nasssulids, and use ne-
gative diagnosis — without membranelies in thigmozone, without brea-
king of perioral ciliary ring, without rigid pharyngeal nemadesmes
(but with short longitudinal rows of thigmon, with intact dikinety aro-
und mouth, with fibers in one or more concentric apical baskets or along
oral slit). Body shape, location of mouth, mode of feeding are highly di-
verse.
Subclass Trichostomatia in Lynn’s scheme includes simple prosto-
mes, trichostomes with vestibulum and reduced ciliature and
well-known rumen ciliates, order Entodiniomorphida with armour and
highly complicated buccal ciliature; here entire evolutionary line comp-
rise single taxon, and this union may be questioned. At least in Puyto-
rac’s Traite prostomes (Buetschlliidae and Didesmidae) were separated
and are treated within a «free-living» order Haptorida. At least this gi-
ves possibility to give some definite characterization to the order Ento-
diniomorphida sensu Lynn (prostomes, trichostomes, entodiniids). Ba-
lantidium, Isotricha and some others are within trichostome order Ves-
tibuliferida.
Class Phyllopharyngea is diverse, but it's enough to imagine
cross-section of pharynx, with peculiar flat microtubular plates arran-
ged radially in the wall of circular endopharynx. In some hypostomes,
ectopharynx exists as basket of thick rigid nemadesmes, but other hy-
postomes lack it, and it is absent in all other included orders. Once aga-
in, we regret that universally used name Hypostomatida is rejected for
initial order of this class, and instead name Phyllopharyngia is repeated
for hypostomes; this name must be appied to entire class only. Order
name Hypostomatida is restored for chilodons and dysterians, like befo-
re, and aberrant Gymnozoum from marine pelagos, included directly in
hypostomes by Lynn, was separated because none structural feature uni-
tes them, except some details of stomatogenesis; it is enough to compare
complete ciliature of Gymnozoum and lack of dorsal kineties in flat chi-
lodons.
Subclass Rhynchodia is represented by prostome morphotype with
apical sucker and more modified sphenophryids; one group, hypocoma-
tids, was not recognized as rhynchodids by some authors and was ascri-
bed to hypostomes. The origin of suctorians is in or near hypocomids,
thus we must decide on their exact position in the system. Lynn's sche-
me cross this uncertainess by retaining order Hypocomatida of Gilbert
Deroux.
Subclass Chonotrichia includes crustacean symbionts (and one pe-
riphytonic genus) with extensive rigid funnel, with 2 freshwater species
outside Baikal and more in this lake. Lynn accept traditional scheme of
classification (Exogmmida + marsupial Cryptogemmida), but proposal
of Batisse to separate third order Chilodochonida have reason, and is ac-
cepted here. Chilodochones have almost complete funnel ciliature, two
other orders, especially marsupials, have 2 strongly reduced ciliary zo-
nes; their tomites also must be different.
Subclass Suctoria deserves higher rank, but its separation will cross
idea of«phyllopharyngeal» type of organization. It is difficult to imagi-
ne mobile benthic ciliated chilodon, or free swimming planktonic Gym-
nozoum and branching Dendrosoma with numerous tentacles in single
taxon. Perhaps on higher level we classify ideas and not animals. Subdi-
vision into exo-, endo- and evaginogemmids is archaic and does not ref-
lect astonishing internal diversity of subclass; new scheme of Dovgal is
preferred, but not on generic level to avoid polymorphic genera «sensu
lato». Exogemmes are not in single order, those with giant leech-like
vermiform tomites must be united in order Vermigenea. At least subor-
ders must be separated in traditional scheme used by Lynn for suctori-
ans; difference of systems in Traite and Guide, two main taxonomic bo-
oks on ciliates, is frustrating.
Class Nassophorea includes well-limited orders Synhymeniida, Na-
ssulida and Microthoracida, but Colpodidiids of Foissner are aberrant
and were initially included by their discoverer Wilbert into Colpodea.
They don’t have cyrtum, nor any of types of peristomal ciliature known
before within this group. This new guest must change idea of the class,
like discovery of hypostome-like kreyellids changed idea of Colpodea.
Perhaps at present Nassophorea may be characterized only by EM featu-
res — fibro-kinetal pattern.
Class Colpodea in recent years accepted some genera from other
groups, like Bursaria, Bryometopus, kreyellids, Cyrtolophosis. In Col-
poda peristome is equipped with 2 ciliary zones, right and left; in evolu-
tion, first one becomes a kind of membrane, second one is splitted into
pectinelles, that may be located in long left-sided band. This imitation
of spirotrich AZM explains wrong location of many genera in unrelated
taxa, and now they are gradually gathered in their proper place. «Hete-
rotrich» Bursaria is well-known example; but transfer to colpodids of
typical heterotrich Bryometopus is unexpected. Genus Pseudochlamy-
donella is exact mimics of many similar hypostomes, but with double
kinetosomes at entire surface and with smallest remnants of left field
overlooked by its discoverers. Order Sorogenida has unique life cycle,
more suitable for fungi, with formation of joint stalked sporangium by
hundreds of densely aggregated trophonts.
ТИП CILIOPHORA. ЛИТЕРАТУРА
979
Class Prostomatea is small fragment of previous Gymnostomata;
it includes mainly genera with nemadesmal cyrtum and with se-
veral small membranelles in thigmozone. Urotricha may represent this
group. On phylograms, Prostomatea and Haptorida are not aside, and
their EM features are different. This group includes possible predeces-
sor of primitive nassulids (line Urotricha — Furgasonia) that in turn
gave rise to primary hymenostomes, like Dexiotricha. 3 membranelles
of these genera correspond exactly to 3 thigmotactic pectinelles of
Urotricha.
Class Plagiopylea includes dissimilar genera united by EM pattern
of fibro-kinetome and by molecuar analysis; both Plagiopyla, Trimye-
ma and some relatives of the former are anaerobes living in black mud
in symbiosis with methanogenous bacteria. Like metopids, both have
relatives in sea-urchin intestine, and even specialized genus Lechriopy-
la living only as urchin symbiont.
Class Oligohymenophora Puytorac et al., 1974 must bear name Tet-
rahymenophora Jank., 1967 by priority. When present, buccal ciliature
is tetrahymenal — right UM + left M1—М3, a set inherited from nassu-
lid Furgasonia according to overlooked article of Jozsef Gelei. With all
seeming diversity in relative proportions and shapes of membranelles,
with possibility of their partial fragmentation, buccal complex remains
basically tetrahymenal in tetrahymenids, ioxocephalids, scuticids, their
symbiotic derivates (thigmotrichs, hysterocnetids) and in all subtaxa of
diverse peritrichs.
Peniculida may be apart by having pharyngeal rods (nemadesmes)
at least in Frontonia; they are not derivates of Furgasonia, perhaps of
some other nassulids; if so, the class is paraphyletic.
As usually, authors of taxa within the class are indicated wrongly in
Lynn’s checklist — suborder Frontoniina within peniculids was propo-
sed by Jankowski, 1980 not Small et Lynn, 1985; suborder Paramecina
S. et L., 1985 must bear name of Fromentel, 1874.
Tetrahymenids and scuticids are separated in different subclasses
by Lynn, but there is intermediate group, order Loxocephalida with scu-
ticus, but with postoral kineties, with shape and arrangement of buccal
membranelles exactly like in Dexiotricha and Tetrahymena, thus they
are not separated at high level in the present chapter.
Subclass Apostomatia in Lynn’s scheme includes orders Apostoma-
tida, Astomatophorida and Pilisuctorida. Duplication of names prefe-
rably must be avoided, better name for the first order is Foettingeriina,
reflecting name of family and genus Foettingeria, one of most common
marine apostomes (in gastral juice of actinians). Pilisuctoria were rena-
med by Mycodiniida to avoid name based on synonym. And the third or-
der Astomatophorida is classical taxonomic «all others» — there is
wonderful variety of morphologies, cycles, reproduction modes in sup-
posedly unrelated genera, and astomy appears independently in parasi-
tes of crustaceans (Collinia), chaetognaths {Metaphrya) and cephalo-
pods {Opalinopsis, which in turn is unrelated to cohabiting catenular
Chromidina). Better way is order with suborders.
Hysterocinetids were raised by Jean Grain and coauthors to subc-
lass level; they inhabit oligochetes and some freshwater gastropods
(common in local Bithynia), have extensive anterior sucker with sup-
porting fibers and transversal posterior peristomal slit with modified tet-
rahymenium. Ordinal rank is enough to reflect their distinctive charac-
ters.
Subclass Astomatia is supposedly monophyletic; Lynn's system in-
cludes one order; system of Puytorac, who contributed much to their
knowledge (including monograph) is complicated, with several orders
in a high-rank taxon (subclass Astomatia) — Hoplitophryida Cheissin,
1930, Anoplophryida Cepede, 1910 and Haptophryida Cepede, 1923;
this scheme better reflect diversity of the group, but Cheissin and
Cepede have not proposed these orders.
Astomes with remnant of supposedly inactive subanterior longitu-
dinal peristome, like Paranoplophrya in Bithynia, may disprove accep-
ted derivation of Astomatida from Hysterocinetida. They cannot be in-
corporated directly into Astomatida and require separate taxon, at least
new suborder.
Subclass Peritrichia retains traditional composition — Kahl’s or-
ders Sessilida and Mobilida, but the first one is subdivided into 2 dis-
tinct groups (suborders) Vorticellina Fromentel, 1874 and Opercularii-
na Jankowski, 1980 according to the presence of two types of peristome.
Both groups include shelled genera, thus single taxon Loricata Kahl
does not exists.
Order Mobilida includes one higher family (Trichodinidae) and
3 lower ones (Urceolariidae, Polycyclidae, Trichodinopsidae) accor-
ding to the type of supporting dents on the sucker, and they may be gro-
uped into 2 suborders, Urceolariina and Trichodinina.
ЛИТЕ
Аверинцев С. В. О новом организме из типа простейших //
Рус. зоол. журн. 1916. Т. 1. С. 180—185.
Агамалиев Ф. Г. Инфузории микробентоса островов Апше-
ронского и Бакинского архипелагов Каспийского моря // Acta Pro-
tozool. 1972. Vol. 10. Р. 1—28.
Агамалиев Ф. Г. Инфузории Каспийского моря. Систематика,
экология, зоогеография. Л., 1983.
Алекперов И. X. Ревизия семейства Bakuellidae (Hypotrichida,
Ciliophora) // Зоол. журн. 1992. Т. 71, вып. 12. С. 5—10.
Алекперов И. X., Мамаева Н. В. Планктонные инфузории
Чукотского и Берингова морей// Зоол. журн. 1992. Т. 71, вып. 3.
С. 5—14.
Бауер О. Н., Юнчис О. Н. Новый род паразитических рес-
ничных из тропических рыб// Паразитология. 2001. Т. 35.
С. 142—143.
Бурковский И. В. Изменчивость инфузорий Parafavella denti-
culate в Белом море// Зоол. журн. 1973. Т. 52. С. 1277—1285.
Бурковский И. В. Новые данные по тинтиннидам (Tintinnida,
Ciliata) Арктики и ревизия фауны И Зоол. журн. 1976. Т. 55.
С. 325—336.
Бурковский И. В., Замышляк Е. А., Поскрякова Н. П. Ре-
визия фауны Tintinnida (Ciliata) Белого моря // Зоол. журн. 1974.
Т. 53. С. 1757—1766.
Валовая М. А. Паразитические инфузории двух видов олиго-
хет беломорской супралиторали // Биол. ресурсы Белого моря / Сб.
тр. МГУ. 1990. Вып. 7. С. 107—112.
Гаврилова Н. Г. Инфузория Stentoropsis barbi — паразит ки-
шечника усачей из водоемов Средней Азии И Паразитология. 1969.
Т. 3. С. 393—398.
Довгаль И. В. Lecanophryella paraleptastaci (Vermigenea, Leca-
nophryidae) — новый род и вид сосущих инфузорий // Зоол. журн.
1985. Т. 64. С. 1256—1259.
Довгаль И. В. Эволюция, филогения и система щупальцевых
инфузорий (Ciliophora, Suctorea): Автореф. дис. ... докт. биол. наук.
2002. С. 1—44.
ТУРА
Зыков В. П. Материалы по фауне Волги и гидрофауне Сара-
товской губернии // Bull. Soc. Imper, Natur. Moscou, Nouv. Ser. An-
nee 1903 (ed. 1904). Vol. 17. P. 1—148.
Король Э. А. Паразиты наземных моллюсков Крыма: Авто-
реф. дис. ... канд. биол. наук. 1990. С. 1—19.
Ковальчук А. А., Бабко Р. В. Новый вид планктонной инфу-
зории из бассейна Днепра// Зоол. журн. 1989. Т. 68. С. 126—127.
Корнилова О. А. История изучения эндобионтных инфузорий
млекопитающих. СПб., 2004.
Левинсон Л. Б. Морфология и развитие Boveria zenkevitchi
sp. n. // Зоол. журн. 1941. Т. 20. С. 55—78.
Мирабдуллаев И. М. Foissneria viridis gen. et sp. n. (Synhyme-
nida, Furgasoniidae) — новая планктонная инфузория из рыбовод-
ных прудов Узбекистана // Зоол. журн. 1986. Т. 65. С. 928—929.
Найденова Н. Н. Два новых вида инфузорий — эпибионтов
ракообразных Черного моря// Биология моря. 1978. Т. 45.
С. 44—49.
Найденова Н. Н. Новый род и новые виды кругоресничных
инфузорий Peritrichidea (Sessilida) на ракообразных Черного моря //
Экология моря. 1985. Т. 20. С. 58—65.
Оболкина Л. A. Gajewskiella macrostoma gen. et sp. n. (Scutico-
ciliatida, Ciliophora) оз. Байкал // Фауна Байкала / Сб. научи, тр.
ЛИН. 1989. С. 5—7.
Оболкина Л. А. Морфология некоторых видов инфузорий из
Байкала // Морфология и эволюция беспозвоночных. Фауна Байка-
ла. Новосибирск, 1991. С. 53—63.
Оболкина Л. А. Новые представители семейства Colepidae
(Prostomatida, Ciliophora) из Байкала// Зоол. журн. 1995а. Т. 74.
С. 3—19.
Оболкина Л. A. Ciliophora// Атлас и определитель пелагоби-
онтов Байкала с краткими очерками по их экологии. Гл. 2 /
Ред. О. А. Тимошкин. Новосибирск, 19956. С, 182—250.
Пастернак А. Ф., Копылов А. И. О роли инфузорий — некро-
фагов Colpoda в планктонном сообществе прибрежных вод Черно-
го моря И Океанология. 1983. Т. 23. С. 320—324.
980
ALVEOLATA
Полянский Ю. И. О некоторых паразитических инфузориях
из морских моллюсков и голотурий // Паразитология / Сб. ЗИН АН
СССР. 1951. Т. 13. С. 355—370.
Стрелков А. А. Паразитические инфузории из кишечника не-
парнокопытных семейства Equidae // Учен. зап. Лен. гос. пед.
ин-та. 1939. Т. 17. С. 1—262.
Стрелков А. А. Класс Инфузории — Infusoria // Атлас беспоз-
воночных животных дальневосточных морей СССР / Ред.
П. В. Ушаков, Е. Н. Павловский. М.; Л., 1955. С. 39—44.
Фокин С. И. Морфология инфузории Protophrya ovicola // Ци-
тология. 1993. Т. 35. С. 11—14.
Фокин С. И. Paramecium (Ciliophora, Protista). Систематика и
филогенетические связи И Зоол. журн. 2001. Т. 80. С. 899—908.
Фокин С. И. Ревизия рода Paramecium О. F. Muller, 1773:
сравнительно-биологический анализ, систематика и филогенетиче-
ские связи: Автореф. дис.... докт. биол. наук. 2002. С. 1—32.
Ха Ки. Новые инфузории (Ciliata) из кишечника пресновод-
ных рыб Северного Вьетнама// Acta Protozool. 1971. Т. 8.
С. 261—282.
Шульман С. С. (ред.). Определитель паразитов пресноводных
рыб фауны СССР. Т. 1. Паразитические простейшие. Л., 1984.
Юнчис О. Н. Гиперпаразитические простейшие эктопарази-
тов рыб И Тез. докл. VIII Всесоюзн. совещ. по паразитол. и болез-
ням рыб, Астрахань. Л., 1985. С. 158—159.
Янковский А. В. Морфология Ciliophora. VI. Морфология и
цикл развития Conidophrys enkystotrophos sp. nov. в связи с пробле-
мой филогении и систематического положения сем. Conidophryi-
dae Guilcher, 1951 // Матер. IV конф. уч. Секц. зоол. Кишинев, 1966.
С. 123—129.
Янковский А. В. Новые роды классов Gymnostomea и Ciliosto-
mea // Матер. V конф. уч. Молдавии. Секц. зоол. и гидробиол. Ки-
шинев, 1967а. С. 36.
Янковский А. В. Инфузории из мантийной полости Balanus в
Баренцевом море// Паразитол. 19676. Т. 1. С. 82—93.
Янковский А. В. Морфология и филогения Nyctotherus cordi-
formis // Паразитология. 1968а. Т. 2. С. 261—272.
Янковский А. В. Классификация подотряда Nassulina Jank.,
1967 (Ciliophora, Ambihymenida)// Зоол. журн. 19686. Т. 47.
С. 990—1001.
Янковский А. В. Предлагаемая классификация рода Para-
mecium Hill, 1752 (Ciliophora) //Зоол. журн. 1969.Т. 48. С. 30—40.
Янковский А. В. Комменсологические очерки. Сообщение 1.
Хонотрихи (Ciliata) на эпибионтах китообразных// Зоол. журн.
1971. Т. 50. С. 1445—1456.
Янковский А. В. Комменсологические очерки. Сообщение 2.
Peniculistoma mytili — инфузория из Mytilus edulis // Зоол. журн.
1972а. Т. 51. С. 173—178.
Янковский А. В. Комменсологические очерки. Сообщение 3.
Новые роды Chonotricha Exogemmina, симбионты Isopoda, Amphi-
poda и Decapoda// Зоол. журн. 19726. Т. 51. С. 1617—1624.
Янковский А. В. Повторение филогенеза в онтогенезе ин-
фузорий // Проблемы эволюции. 1972в. Т. 2. Новосибирск. С. 95—
123.
Янковский А. В. Комменсологические очерки. Сообщение 4.
Новые роды Chonotricha Endogemmina — симбионты Leptostraca //
Зоол. журн. 1973а. Т. 52. С. 15—24.
Янковский А. В. Подкласс Chonotricha. Фауна СССР. Инфу-
зории. Т. 2. Л., 19736.
Янковский А. В. Комменсологические очерки. Сообщение 6.
Эктокомменсалы Strongylocentrotus intermedius в лагуне Буссе
(южный Сахалин)// Гидробиол. журн. 1974. Т. 10. С. 60—68.
Янковский А. В. Новые высшие таксоны ресничных простей-
ших (Ciliophora) // Морфология, систематика и эволюция живот-
ных / Сб. науч, работ ЗИН АН СССР. Л., 1978. С. 88—90.
Янковский А. В. Систематика и филогения отряда Hypotrichi-
da Stein, 1859 (Protozoa, Ciliophora) H Тр. Зоол. ин-та АН СССР.
1979. Т. 85. С. 48—85.
Янковский А. В. Конспект новой системы типа Ciliophora II
Тр. Зоол. ин-та. АН СССР. 1980. Т. 94. С. 103—121.
Янковский А. В. Новые виды, роды и семейства щупальцевых
инфузорий (класс Suctoria) // Тр. Зоол. ин-та АН СССР. 1981.
Т. 107. С. 80—115.
Янковский А. В. Новые роды симбионтных простейших фау-
ны Байкала// Новое о фауне Байкала. Новосибирск, 1982.
С. 25—32.
Янковский А. В. Жизненные циклы и систематика родов
групп Scyphidia, Heteropolaria, Zoothamnium и Cothumia (класс Ре-
ritricha) // Тр. Зоол. ин-та АН СССР. 1985. Т. 129. С. 74—100.
Янковский А. В. Новые и малоизученные роды ресничных
простейших (тип Ciliophora)// Тр. Зоол. ин-та АН СССР. 1986.
Т. 144. С. 72—88.
Янковский А. В. Новые родовые комбинации для некоторых
видов Ciliophora // Тез. докл. V Всесоюзн. съезда протозоол. Цито-
логия. 1992. Т. 34. С. 171.
Янковский А. В. Mistarcon parasiticus — эктопаразит перит-
рих озера Байкал и статус рода Manuelophrya (Ciliophora: Sucto-
ria) // Паразитол. 1997. Т. 31. С. 321—327.
Янковский А. В. Folliculina boltoni в перифитоне озера Байкал
и обзор пресноводных фолликулинид (Ciliophora, Spirotricha) //
Зоол. журн. 1998. Т. 77. С. 389—396.
Янковский А. В. Spongostena gen. n. (Peritricha), симбионт эн-
демичных губок озера Байкал // Сб. научн. тр. каф. зоол. Рос. гос.
пед. ун-та. СПб., 2004, вып. 4. С. 209—220.
Aescht Е. Catalogue of the generic names of ciliates (Protozoa, Ci-
liophora)// Denisia. 2001. Vol. 1. P. 1—350.
Affaa F. M. Neonyctotherus, un genre nouveau de cilies heterotric-
hes commensal de tetards d'amphibiens anoures du Cameroun H Protis-
tologica. 1983. Vol. 19. P. 141—147.
Affaa F. M., Hickey D. A., Struder-Kypke M., Lynn D. H. Phy-
logenetic position of species in the genera Anoplophrya, Plagiotoma,
and Nyctotheroides (phylum Ciliophora), endosymbiotic ciliates of an-
nelids and anurans// J. Euk. Microbiol. 2004. Vol. 51. P. 301—306.
Agatha S. A cladistic approach for the classification of oligotrichid
ciliates (Ciliophora: Spirotricha)// Acta Protozool. 2004. Vol. 43.
P. 201—217.
Agatha S., Foissner W. Metopus, Ciliophora incertae sedis: morp-
hogenesis does not support a relationship with haptorid gymnostomes
and heterotrich clevelandellids as indicated by gene sequence data // J.
Euk. Microbiol. 2000. Vol. 47. Supplement. P. 9-A.
Agatha S., Spindler M., Wilbert N. Ciliated Protozoa (Ciliopho-
ra) from Arctic sea ice// Acta Protozool. 1993. Vol. 32. P. 261—268.
Agatha S., Wilbert N., Spindler M., Elbrachter M. Euplotide ci-
liates in sea ice of the Weddell Sea (Antarctica) // Acta Protozool. 1990.
Vol. 29. P. 221—228.
Albaret J. L. Observations cytologiques sur les nyctotheres des
genres Prosicuophora de Puytorac et Oktem et Sicuophora de Puytorac
et Grain, cilies parasites de batraciens anoures d'Afrique Noire. Desc-
ription de deux especes nouvelles // Protistologica. 1970. Vol. 6.
P. 183—198.
Albaret J. L. Observations sur les nyctotheres des genres Sicuop-
hora de Puytorac et Grain, Metasicuophora gen. n. et Parasicuophora
Albaret, cilies parasites de batraciens anoures // J. Protozool. 1973.
Vol. 20. P. 51—57.,
Albaret J. L. Etude systematique et cytologique sur les cilies
heterotriches endocommensaux II Mem. Mus. Natn. Hist. Nat. Paris.
NS. 1975. Vol. 89. P. 1—114.
AI-Rasheid K. A. S. Some marine interstitial Prostomatida
and Haptorida (Ciliata) from the Jubail Marine Wildlife Sanctuary on
the Saudi Arabian Gulf shore// Fauna of Arabia. 2000a. Vol. 18.
P. 1—22.
Al-Rasheid K. A. S. First record of the marine ciliate Anigsteinia
Candida (Yagiu and Shigenaka, 1956) Isquith and Repak, 1974 from the
Arabian Gulf// Japanese J. Protozool. 2000b. Vol. 33. P. 35—38.
Al-Rasheid K. A. S. Redescription of the marine ciliate Cardiosto-
matella vermiforme (Kahl, 1928) Corliss, I960// Protistology. 2001a.
Vol. 2. P. 15—21.
Al-Rasheid K. A. S. Redescription of the rare heterotrichid ciliate
Copemetopus subsalsus Villeneuve-Brachon, 1940 // J. Euk. Microbiol.
2001b. Vol. 48. P. 188—193.
Al-Rasheid K. A. S., Nilsson J. R., Larsen H. F. Blepharisma in-
termedium Padmavathi, 1959 (Ciliophora: Heterotrichida) from
Al-Hassa inland hypersaline oasis in Saudi Arabia // Acta Protozool.
2001. Vol. 40. P. 63—69.
Ammermann D. Die Kemverhaltnisse des Ciliaten Protocruzia de-
pressa n. sp. // Arch. Protistenk. 1968. Vol. ПО. P. 434—438.
Antipa G. A., Small E. B. A redescription of Conchophthirus cur-
tus Engelmann, 1862 (Protozoa, Ciliatea) // J. Protozool. 1971. Vol. 18.
P. 491—503.
Augustin H., Foissner W. Morphologie einiger Ciliaten (Proto-
zoa: Ciliophora) aus dem Belebtschlamm II Lauterbornia. 1989. Vol. 1.
P. 38—59.
Augustin H., Foissner W. Morphologie und Okologie einiger Cili-
aten (Protozoa: Ciliophora) aus dem Belebtschlamm // Arch. Protistenk.
1992. Vol. 141. P. 243—283.
ТИП CILIOPHORA. ЛИТЕРАТУРА
981
Augustin Н., Foissner W., Adatn H. Revision of the genera Aci-
neria, Trimyema and Trochiliopsis (Protozoa, Ciliophora) // Bull. Brit.
Mus. (Nat. Hist.). Zool. Ser. 1987. Vol. 52. P. 197—224.
Barel C. D. N., Kramers P. G. N. A survey of the echinoderm as-
sociates of the North-East Atlantic area// Zool. Verhand. 1977.
Vol. 156. P. 1—159.
Basson L., Botha A., Van As J. G. Mantoscyphidia fanthami
sp. n., an ectosymbiont (Ciliophora: Peritrichia) from the gills of the
marine gastropod Oxystele Philippi, 1847 in South Africa // Acta Proto-
zool. Vol. 38. P. 75—81.
Basson L., Van As J. G. Differential diagnosis of the genera in the
family Trichodinidae (Ciliophora: Peritrichida) with the description of a
new genus ectoparasitic on freshwater fish from Southern Africa // Syst.
Parasitol. 1989. Vol. 13. P. 153—160.
Batisse A. Quelques infusoires holotriches parasites du coecum de
Thydrocheire (Hydrocheirus capybara L.) // Protistologica. 1966.
Vol. 2. P. 39—52.
Batisse A. Ultrastructure de la loge et du style chez Acineta tubero-
sa Ehrenberg et Paracineta homari Sand // Protistologica. Year 1966, ed.
1967. Vol. 2. P. 29—41.
Batisse A. Quelques aspects de 1'ultrastructure de Pseudogemma
pachystyla Collin II Protistologica. 1968a. Vol. 4. P. 271—282.
Batisse A. Les ultrastructures squelettiques chez certains Thecaci-
netidae // Protistologica. 1968b. Vol. 4. P. 477—492.
Batisse A. Les structures pedonculaires dans les genres Tokophrya
Butschli et Choanophrya Hartog (Ciliata, Suctorida) // Protistologica.
1969a. Vol. 5. P. 387—412.
Batisse A. Acinetiens nouveaux ou mal connus des cotes mediter-
raneennes franqaises. I. Ophryodendron hollandei n. sp. (Suctorida, Op-
hryodendridae) // Vie et Milieu. Ser. A. Biol. Marine. 1969. Vol. 20.
P. 251—277.
Batisse A. Premieres observations sur 1’ultrastructure de Tremato-
soma bocqueti (Guilcher) Batisse (Ciliata, Suctorida) // Protistologica.
1972. Vol. 8. P. 477—495.
Batisse A. Acinetiens nouveaux ou mal connus des cotes mediter-
raneennes franpaises. II. Dendrosomides grassei n. sp. (Suctorida, Oph-
ryodendrina)// Protistologica. 1986. Vol. 22. P. 11—21.
Batisse A. Sous-classe des Suctoria Claparede et Lachmann,
1858// Traite de Zoologie. Vol. 2. Part 2/ Ed. P. Puytorac. 1994.
P. 493—563.
Batisse A., Crumeyrolle J.-B. Sur deux chonotriches nouveaux de
1’Archipel Kerguelen (Ciliophora, Chonotrichida) // C. R. Acad. Sci.
Paris. S6r. III. 1988. Vol. 307. P. 635—640.
Bauer-Nebeisick M., Bardele C. F., Ott J. A. Redescription
of Zoothamnium niveum (Hemprich et Ehrenberg, 1831) Ehrenberg,
1838 (Oligohymenophora, Peritrichida), a ciliate with ectosymbiotic,
chemoautotrophic bacteria//Eur. J. Protistol. 1996. Vol. 32. P. 18—30.
Baumgartner M., Stetter К. O., Foissner W. Morphological,
small subunit rRNA and physiological characterization of Trimyema
minutum (Kahl, 1931), an anaerobic ciliate from submarine hydrother-
mal vents growing from 28C to 52C // J. Euk. Microbiol. 2002. Vol. 49.
P. 227—238.
Beinbrech G. Zur Morphologie, Fortpflanzung und Ubertragung
von Urceolaria paradoxa (Peritricha, Mobilina) // Arch. Protistenk.
1967. Vol. 110. P. 12—53.
Beran A. Different types of loricae built by Favella ehrenbergii
(Claparede et Lachmann 1858) // J. Protozool. 1993. Vol. 40. Supple-
ment. P. 28-A.
Berger H. Monograph of the Oxytrichidae (Ciliophora, Hypotric-
hia) II Monogr. Biol. 1999. Vol. 77. P. 1—1079.
Berger H. Redefinition of Holosticha Wrzesniowski, 1877 (Ciliop-
hora, Hypotricha)// Eur. J. Protistol. 2003. Vol. 39. P. 373—379.
Berger H. Amphisiella annulata (Kahl, 1928) Воггог, 1972 (Ciliop-
hora: Hypotricha): morphology, notes on morphogenesis, review of litera-
ture and neotypification // Acta Protozool. 2004. Vol. 43. P. 1—14.
Berger H., Foissner W. Morphology and morphogenesis of Para-
kahliella haideri nov. spec. (Ciliophora, Hypotrichida) // Bull. Brit.
Mus. (Nat. Hist.). Zool. Ser. 1989. Vol. 55. P. 11—17.
Berger J. The morphology, systematics, and biology of the ento-
commensal ciliates of echinoids. Ph. D. Thesis. University of Illinois,
Urbana. 1964. P. 1—534.
Berger J., Hatzidimitrou G. Multivariate morphometric analyses
of demic variation in Ancistrum mytili (Ciliophora: Scuticociliatida)
commensal in two mytilid pelecypods// Protistologica. 1978. Vol. 14.
P.133—154.
Blatterer H., Foissner W. Beitrag zur terricolen Ciliatenfauna
(Protozoa, Ciliophora) Australiens// Stapfia. Linz, 1988. Vol. 17.
P. 1—84.
Blatterer H., Foissner W. Morphology and infraciliature of some
cyrtophorid ciliates (Protozoa, Ciliophora) from freshwater and soil //
Arch. Protistenk. 1992. Vol. 142. P. 101—118.
Воггог A. C. Morphology and ecology of the benthic ciliated Pro-
tozoa of Alligator Harbor, Florida// Arch. Protistenk. 1963. Vol. 106.
P. 465—534.
Воггог A. C. Revision of the order Hypotrichida (Ciliophora, Pro-
tozoa) II J. Protozool. 1972. Vol. 19. P. 1—23.
Воггог A. C., Evans F. R. Cladotricha and phylogeny in the su-
border Stichotrichina (Ciliophora, Hypotrichida) // J. Protozool. 1979.
Vol. 26. P. 51—55.
Воггог A. C., Hill B. F. The order Euplotida (Ciliophora): taxono-
my, with division of Euplotes into several genera // J. Euk. Microbiol.
1995. Vol. 42. P. 457—466.
Bovee E. C. Inquilinic Protozoa from freshwater gastropods. I.
Trichodina helisoduria n. sp. from Helisoma duryi Say, in Florida // Qu-
art. J. Florida Acad. Sci. 1961. Vol. 24. P. 197—207.
Bradbury P. C. The life cycle and morphology of the apostomato-
us ciliate, Hyalophysa chattoni n. g., n. sp. // J. Protozool. 1966.
Vol. 13. P. 209—225.
Bradbury P. C. Urceolaria kozloffi sp. n., a symbiont of brachio-
pods// Acta Protozool. 1970. Vol. 7. P. 445—474.
Bradbury P. C. Conidophrys pitelkae, a new species of pilisuctori-
an from cuticular hairs of Crangon crangon (Linnaeus) // Acta Protozo-
ol. 1975. Vol. 14. P. 161—170.
Bradbury P. C., Clamp J. C. Hyalophysa Iwoffi sp. n. from the
fresh-water shrimp Palaemonetes paludosus and revision of the genus
Hyalophysa// J. Protozool. 1973. Vol. 20. P. 210—213.
Bradbury P. C., Song W., Zhang L. Stomatogenesis during the
formation of the tomite of Hyalophysa chattoni (Hymenostomatida: Ci-
liophora) // Eur. J. Protistol. 1997. Vol. 33. P. 409—419.
Bradbury P. C., Tyzon G. E. The fine structure of Conidophrys
pitelkae Bradbury related to its life cycle and taxonomic position in the
Apostomatida // J. Protozool. 1982. Vol. 29. P. 184—194.
Bradbury P. C., Zhang L.-M., Shi X.-B. A redescription of Gym-
nodinioides caridinae (Miyashita 1933) from Palaemonetes sinensis
(Sollaud 1911) in the Songhua river// J. Euk. Microbiol. 1996. Vol. 43.
p. 404—408.
Brouardel J. Recherches sur la biologie d’un infusoire peritriche
commensal des patelies: Urceolaria patellae (Cuenot) Ц Ann. Inst. Ocea-
nogr. 1951. Vol. 26. P. 115—254.
Buisson J. Les infusoires cilies du tube digestif de 1’homme et des
mammiferes //Trav. Labor. Parasitol. Fac. Med. Paris. 1923.P. 1—201.
Burreson E. M. Symbiotic ciliates from solitary ascidians in the
Pacific North-West, with a description of Parahypocoma rhamphisoka-
rya n. sp. H Trans. Amer. Microsc. Soc. 1973. Vol. 92. P. 517—522.
Butschinsky P. Die Protozoen-Fauna der Salzsee-Limane bei
Odessa// Zool. Anz. 1897. Vol. 20. P. 194—197.
Biitschli O. Infusoria und System der Radiolaria // H. G. Bronn’s
Klassen und Ordnungen des Their-Reichs, wissenschaftlich dargestellt
in Wort und Bild. Bd I. Protozoa. Abtheilung III. C. F. Winter. Leipzig,
1887. P. 1089—1280; 1888. P. 1281—1584; 1889. P. 1585—2035.
Cameron S. L., Adlard R. D., O’Donoghue P. J. Evidence for an
independent radiation of endosymbiotic litostome ciliates within Aust-
ralian marsupial herbivores II Molecular. Phylogenet. Evol. 2001.
Vol. 20. P. 302—310.
Cameron S. L., O’Donoghue P. J. Stomatogenesis in the ciliate
genus Macropodinium Dehority, 1996 (Litostomatea: Macropodinii-
dae)// Eur. J. Protistol. 2001. Vol. 37. P. 199—206.
Cameron S. L., O’Donoghue P. J. The ultrastructure of Amylo-
vorax dehorityi comb. nov. and erection of the Amylovoracidae fam.
nov. (Ciliophora: Trichostomatia) // Eur. J. Protistol. 2002a. Vol. 38.
P. 29—44.
Cameron S. L., O’Donoghue P. J. The ultrastructure of Macropo-
dinium moiri and revised diagnosis of the Macropodiniidae (Litostoma-
tea: Trichostomatia)// Eur. J. Protistol. 2002b. Vol. 38. P. 179—194.
Cameron S. L., O’Donoghue P. J. Trichostome ciliates from Aus-
tralian marsupials. I. Bandia gen. nov. (Litostomatea: Amylovoraci-
dae)// Eur. J. Protistol. 2002c. Vol. 38. P. 405—429.
Cameron S..L., O’Donoghue P. J. Trichostome ciliates from Aus-
tralian marsupials. II. Polycosta gen. nov. (Litostomatea: Polycostidae
fam. nov.) // Eur. J. Protistol. 2003. Vol. 39. P. 83—99.
Cameron S. L., O’Donoghue P. J. Morphometric and cladistic
analyses of the phylogeny of Macropodinium (Ciliophora: Litostoma-
tea: Macropodiniidae)// Acta Protozool. 2004a. Vol. 43. P. 43—53.
Cameron S. L., O’Donoghue P. J. Phylogeny and biogeography
of the «Australian» trichostomes (Ciliophora: Litostomata) // Protist
(Arch. Protistenk.). 2004b. Vol. 155. P. 215—235.
982
ALVEOLATA
Cameron S. L., O’D&noghue P. J., Adlard R. D. Novel isotrichid
ciliates endosymbiotic in Australian macropodid marsupials // Syst. Pa-
rasitol. 2000. Vol. 46. P. 45—47.
Cameron S. L., O’Donoghue P. J., Adlard R. D. Four new speci-
es of Macropodinium (Ciliophora: Litostomatea) from Australian wal-
labies andpademelons //J. Euk. Microbiol. 2001. Vol. 48. P. 542—555.
Cameron S. L., O’Donoghue P. J., Adlard R. D. Species diversi-
ty within Macropodinium (Litostomatea: Trichostomatia): endosymbio-
tic ciliates from Australian macropodid marsupials // Mem. Queensland
Museum. 2002. Vol. 48. P. 27—47.
Cameron S. L., Wright A. D. G., O’Donoghue P. J. An expan-
ded phylogeny of the Entodiniomorphida (Ciliophora: Litostomatea) //
Acta Protozool. 2003. Vol. 42. P. 1—6.
Canella M. F. Contributi alia conoscenza dei ciliati. III. Contribute
ad una revisione dei generi Amphileptus, Hemiophrys e Lionotus (Cilia-
ta, Holotricha, Gymnostomata) // Ann. Univ. Ferrara, N. S., Sezione III,
Biol. Anim. 1960. Vol. 2. P. 47—95.
Canella M. F., Rocchi Canella I. Biologie des Ophryoglenina (ci-
lies hymenostomes histiophages) II Ann. Univ. Ferrara. Ser. Biol. Anim.
1976. Vol. 3. P. 1—510.
Carey P. G. Marine interstitial ciliates. L.; N. Y., 1992.
Cepede C. Recherches sur les infusoires astomes. Anatomie, biolo-
gie, ethologie parasitaire, systematique // Arch. Zool. Exp. Gen. Ser. 5.
1910. Vol. 3. P. 341—609.
Chagas C. Sobre as variaqoes ciclicas do cariozoma em duas espe-
cies de ciliados parazitos. Contribuiqao para о estudo do nucleo nos in-
fuzorios // Mem. Inst. Oswaldo Cruz. Rio de Janeiro, 1911. Vol. 3.
P. 136—144.
Chardez D. Etude sur les trichodines d’eau douce (Protozoa, Cili-
ophora, Peritricha Mobilina, Trichodinidae) // Trav. Labor. Gembloux
Soc. Roy. Sci. Belgique. 1979. Numero Spec. P. 1—78.
Chatton E., Lwoff A. Sur une famille nouvelle d’acinetiens, les
Sphenophryidae, adaptes aux branchies des mollusques acephales //
C. R. Acad. Sci. Paris. 1921. Vol. 173. P. 1495—1498.
Chatton E., Lwoff A. Note preliminaire sur la systematique des ci-
lies Apostomea (Foettingeriidae et Opalinopsidae) // Bull. Soc. Zool.
France. 1930. Vol. 55. P. 296—327.
Chatton E., Lwoff A. Les cilies apostomes II Arch. Zool. Exp.
Gen. 1935. Vol. 77. P. 1—453.
Chatton E., Lwoff A. Les Piiisuctoridae Ch. et Lw. Cilies parasites
des poils secreteurs des crustaces edriophthalmes. Polarite, orientation
et desmodexie chez les infusoires // Bull. Biol. Fr. Belgique. 1936.
Vol. 70. P. 86—145.
Chatton E., Lwoff A. Recherches sur les cilies thigmotriches. I.
II// Arch. Zool. Exp. Gen. 1949—1950. Vol. 86. P. 169—253,
393—485.
Chatton E., Perard C. Nicollella ctenodactyli n. g., n. sp. et Colli-
nella gondii n. g., n. sp., cilies parasites intestinaux du gondi, Ctenodac-
tylus gundi Pallas (rongeur). La famille des Nicollellidae nov. fam. //
Bull. Soc. Zool. France. 1919. Vol. 44. P. 10—17.
Chatton E., Seguela J. Un hypotriche de la branchie de Ciona in-
testinalis L., intermediaire entre les Euplotidae et Aspidiscidae: Euplo-
taspis cionaecola n. g., n. sp. // Bull. Soc. Zool. France. 1936. Vol. 61.
P. 332—340.
Cheissin E. M. Morphologische und systematische Studien fiber
Astomata aus dem Baikalsee // Arch. Protistenk. 1930. Vol. 70.
P. 531—618.
Cheissin E. M. Infusorien Ancistridae und Boveridae aus dem Bai-
kalsee// Arch. Protistenk. 1931. Bd 73. S. 280—304.
Clamp J. C. Ellobiophrya conviva n. sp., a commensal of marine
ectoprocts, and a revision of the family Ellobiophryidae (Ciliophora,
Peritricha)// J. Protozool. 1982. Vol. 29. P. 149—156.
Clamp J. C. Five new species of Lagenophrys (Ciliophora, Perit-
richa, Lagenophryidae) from the United States with observations on
their developmental stages//J. Protozool. 1987. Vol. 34. P. 382—392.
Clamp J. C. Revision of the family Lagenophryidae Butschli,
1889 and description of the family Usconophryidae n. fam. (Ciliophora,
Peritricha)// J. Protozool. 1991. Vol. 38. P. 355—377.
Clamp J. C. New species of Lagenophrys (Ciliophora, Peritrichia)
from New Zealand and Australia// J. Euk. Micrbiol. 1994. Vol. 41.
P. 343—349.
Clamp J. C. The life cycle of the planktonic peritrich ciliate Vorti-
cella natans and its significance to the systematics of the genus Vorticel-
la // J. Euk. Microbiol. 1995. Vol. 42. Supplement. P. 39-A.
Clamp J. C. Specialization of life cycle stages of a peritrich ciliate
for planktonic and symbiotic existence // J. Euk. Microbiol. 1998.
Vol. 45. Supplement. P. 3-A.
Clamp J. C. Do sessiline peritrichs comprise two higher-order taxa
with fundamentally different oral structure? // J. Euk. Microbiol. 1999.
Vol. 46. Supplement. P. 3-A.
Clamp J. C. Morphology and systematics of peritrichs in the genus
Australana (Ciliophora, Oligohymenophora) // J. Euk. Microbiol. 2001.
Vol. 48. Supplement. P. 24-A.
Clamp J. C., Kane J. R. Redescription of four species of lagenop-
hryid peritrichs (Ciliophora) from Australia and New Guinea, with des-
criptions of two new species // Rec. Austral. Mus. 2003. Vol. 55.
P. 153—168.
Claparede E. Miscellanees zoologiques. VI. Sur les Licnophora,
nouveau genre voisin de la famille des urceolariens // Ann. Sci. Nat.,
Ser. V. Zool. 1867. Vol. 8. P. 30—34.
Claparede E., Lachmann J. Etudes sur les infusoires et les rhizo-
podes// Mem. Inst. Nat. Genevois. Vol. 5 (year 1857 — ed. 1858).
P. 1—260. Vol. 6 (year 1858 — ed. 1859). P. 261—482. Vol. 7 (dated
1860—1861, ed. 1859). P. 1—291. (Separate edition: Vol. 1. P. 1—
482; Vol. 2. P. 1—291).
Clement-Iftode F., Versavel Gh. Teutophrys trisulca (Chatton, de
Beauchamp), cilie planctonique rare// Protistologica. Year 1967, ed.
1968. Vol. 3. P. 457—464.
Collin B. Etude monographique sur les acinetiens. I // Arch. Zool.
Exp. Gen. 1911. Vol. 48. P. 421—497.
Collin B. Etude monographique sur les acinetiens. II. Morphologie,
physiologie, systematique// Arch. Zool. Exp. Gen. 1912. Vol. 51.
P. 1—457.
Conn H. W. A preliminary report on the protozoa of the fresh wa-
ters of Connecticut // Bull. Connect. State Geol. Nat. Hist. Survey. 1905.
N 2. P. 5—69.
Conn H. W., Edmondson С. H. Chapter IX. Flagellate and ciliate
Protozoa (Mastigophora and Infusoria) // Freshwater biology / Eds
H. B. Ward, G. Ch. Whipple 1918. N. Y. P. 238—300.
Corliss J. O. Nomenclatural history of the higher taxa in
the subphylum Ciliophora // Arch. Protistenk. 1957. Vol. 102. P. 113—
146.
Corliss J. O. The phylogenetic significance of the genus Pseudo-
microthorax in the evolution of holotrichous ciliates // Acta Biol. Acad.
Sci. Hung. 1958. Vol. 8. P. 367—388.
Corliss J. O. The problem of homonyms among generic names of
ciliated Protozoa, with proposal of several new names И J. Protozool.
1960. Vol. 7. P. 269—278.
Corliss J. O. The ciliated protozoa: characterization, classification
and guide to the literature. 1st ed. Oxford, 1961.
Corliss J. O. Tetrahymena and some thoughts on the evolutionary
origin of endoparasitism J' Trans. Amer. Microsc. Soc. 1972. Vol. 91.
P. 566—573.
Corliss J. O. History, taxonomy, ecology and evolution of species
of Tetrahymena // The biology of Tetrahymena I Ed. A. M. Elliott. Stro-
udsburg, 1973. P. 1—55.
Corliss J. O. The ciliated protozoa. Characterization, classification
and guide to the literature. 2nd ed. Oxford, 1979.
Corliss J. O., Coats D. W. A new cuticular cyst — producing tet-
rahymenid ciliate, Lambornella clarki n. sp., and the current status of ci-
liatosis in culicine mosquitoes// Trans. Amer. Microsc. Soc. 1976.
Vol. 95. P. 725—739.
Corliss J. O., Puytorac P., Lom J. Resolution of persistent taxo-
nomic and nomenclatural problems involving ciliate protozoa assignab-
le to the astome family Haptophryidae Cepede, 1923// J. Protozool.
1965. Vol. 12. P. 265—273.
Corliss J. O., Snyder R. A. A preliminary description of several
new ciliates from the Antarctica, including Cohnilembus grassei n. sp. //
Protistologica. 1986. Vol. 22. P. 39—46.
Curds C. R. A guide to the species of the genus Euplotes (Hypot-
richida, Ciliatea) // Bull. Brit. Mus. (Nat. Hist.). Zool. 1975. Vol. 28.
P. 1—61.
Curds C. R. Notes on the morphology and nomenclature of three
members of the Euplotidae (Protozoa: Ciliatea) ll Bull. Brit. Mus. (Nat.
Hist.). Zool. 1977. Vol. 31. P. 15—26.
Curds C. R. A revision of the Suctoria (Ciliophora, Kinetofragmi-
nophora). 1. Acineta and its morphological relatives// Bull. Brit. Mus.
(Nat. Hist.). Zool. 1985a. Vol. 48. P. 75—129.
Curds C. R. A revision of the Suctoria (Ciliophora, Kinetofragmi-
nophora). 3. Tokophrya and its morphological relatives // Bull. Brit.
Mus. (Nat. Hist.). Zool. 1985b. Vol. 49. P. 167—193.
Curds C. R. A revision of the Suctoria (Ciliophora, Kinetofragmi-
nophora). 5. The Paracineta and Corynophrya problem // Bull. Brit.
Mus. (Nat. Hist.). Zool. 1987. Vol. 52. P. 71—106.
ТИП CILIOPHORA. ЛИТЕРАТУРА
983
Curds С. R., Wu I. A review of the Euplotidae (Hypotrichida, Ci-
liophora) // Bull. Brit. Mus. (Nat. Hist.). Zool. 1983. Vol. 44.
P. 191—247.
Czapik A., Jordan A. Les cilies psammophiles de la mer Baltique
aux environs de Gdansk // Acta Protozool. 1976. Vol. 15. P. 423—446.
Da Cunha A. M., Freitas G. De. Division et reorganization chez
les cilies de la famille Cyathodiniidae // C. R. Soc. Biol. Paris. 1936.
Vol. 123. P. 711—713.
Da Cunha A. M., Freitas G. De. Ensaio monografico da familia
Cyathodiniidae // Mem. Inst. Oswaldo Cruz. 1940. Vol. 35.
P. 458—494.
Das N. On a parasitic ciliate from moorhen (Aves: Gallinula chlo-
ropsis indica) // Bull. Soc. Fr. Parasitol. 1990. 8. Supplement N 2.
P. 1006. (VII Congr. Intern. Parasitol. Paris, 1990).
Da Silva Neto I. D. Observations sur la structure et l'ultrastructure
du cilie Myxophthirus anomalocardiae gen. nov., sp. nov. (Scuticocilia-
tida, Thigmophryidae), parasite du bivalve Anomalocardia brasiliana
Gmelin, 1791 // Eur. J. Protistol. 1992. Vol. 28. P. 421—429.
Dehority B. A. Diplodinium (Ostracodinium) minorum sp. n., cili-
ate from the rumen of domestic sheep // J. Protozool. 1975. Vol. 22.
P. 328—330.
Dehority B. A. Ciliate Protozoa in the rumen of Brazilian water
buffalo, Bubalus bubalis Linnaeus // J. Protozool. 1979. Vol. 26.
P. 536—544.
Dehority B. A. Rumen ciliates of musk-oxen (Ovibos moschatus
Z.) from the Canadian Arctic // J. Protozool. 1985. Vol. 32.
P. 246—250.
Dehority B. A. Protozoa of the digestive tract of herbivorous mam-
mals II Insect Sci. Appl. 1986. Vol. 7. P. 279—296.
Dehority B. A. A new family of entodiniomorph protozoa from the
marsupial forestomach, with descriptions of a new genus and five new
species U J. Euk. Microbiol. 1996. Vol. 43. P. 285—295.
Delphy J. Etudes de morphologie et de physiologie sur la faune
d’Arcachon// Bull. Stat. Biol. Arcachon. 1938. Vol. 35. P. 49—75.
Deroux G. Origine des cineties anterieures, gauches et buccales
dans le genre Dysteria Huxley // C. R. Acad. Sci. Paris. 1965. Vol. 260.
P. 6689—6691.
Deroux G. Quelques precisions sur Strobilidium gyrans Schewia-
koff// Cah. Biol. Mar. 1974. Vol. 15. P. 571—588.
Deroux G. Les dispositifs adhesifs ciliaires chez les Cyrtophdrida
et la famille des Hypocomidae// Protistologica. Year 1974, ed. 1975.
Vol. 10. P. 379—396.
Deroux G. Le plan cortical des Cyrtophorida. Unite d'expression et
marges de variabilite. 1. — Le cas de Plesiotrichopidae, fam. nov., dans
la nouvelle systematique №Protistologica. 1976a. Vol. 12. P. 469—481.
Deroux G. Le plan corticlal des Cyrtophorida. Unite d'expression
et marges de variabilite. 2. Cyrtophorida a thigmotactisme ventral gene-
ralise// Protistologica. 1976b. Vol. 12. P. 483—500.
Deroux G. Plan cortical des Cyrtophorida. 3. Les structures diffe-
renciatrices chez les Dysteriina// Protistologica. 1976c. Vol. 12.
P. 505—538.
Deroux G. Les Cyrtophorida. Cilies thigmotactiques des parois im-
mergees // These Univ. Clermont-Ferrand. 1978a. Ser. E. N 260. Tome
I — Texte. P. 1—262; Tome II — Figures. P. 1—111.
Deroux G. The hypostome ciliate order Synhymeniida: from Chi-
lodontopsis of Blochmann to Nassulopsis of Faure-Fremiet/' Trans.
Amer. Microsc. Soc. 1978b. Vol. 97. P. 458—469.
Deroux G. Sous-classe des Nassulia Jankowski, 1967// Traite de
Zoologie / Ed. P. Puytorac. 1994. Vol. 2, fasc. 2. P. 585—600.
Deroux G., Campillo A., Bradbury P. C. Ascophrys rodor (Cam-
pillo et Deroux) parasite de la crevette rose Palaemon serratus en eleva-
ge// Rev. Trav. Inst. Peches Maritimes. 1975. Vol. 39. P. 359—379.
Deroux G., Dragesco J. Nouvelles donnees sur quelques cilies ho-
lotriches cyrtophores a ciliature ventrale // Protistologica. 1968. Vol. 4.
P. 365—403.
Deroux G., Tuffrau M. Aspidisca orthopogon n. sp. Revision
de certains mecanismes de la morphogenese a 1’aide d’une modification
de la technique au protargol // Cah. Biol. Mar. 1965. Vol. 6.
P. 293—310.
Dingfelder J. H. Die Ciliaten voriibergehender Gewasser // Arch.
Protistenk. 1962. Vol. 105. P. 509—658.
Dioni W. Un nuevo genero de Folliculinidae de agua dulce: Botti-
cula ringueleti nov. gen. nov. sp. del Rio Parana Medio // Acta Zool. Lil-
loana. 1972. Vol. 29. P. 309—315.
Dorjes J. Protozoische und mesozoische Parasiten in acoelen Tur-
bellarien // Senckenbergiana Maritima. 1979. Vol. 11. P. 139—169.
Dovgal I. V. Evolution, phylogeny and classification of Suctorea
(Ciliophora) // Protistology. 2002. Vol. 2. P. 194—270.
Dovgal I. V. Conidophrys Chatton et Lwoff, 1934 (Ciliophora, Pi-
lisuctorida): proposed conservation // Bull. Zool. Nomenci. 2003.
Vol. 60. P. 266—268. — Opinion 2106 (Case 3268). Conidophrys
Chatton et Lwoff, 1934 (Ciliophora, Pilisuctorida): conserved// Bull.
Zool. Nomenci. 2005. Vol. 62. Part 2.
Dovgal I. V., Grigorovich I. A. Spirochona americana sp. n. (Cili-
ophora, Chonotrichida) — a new North American freshwater chonot-
rich species from the amphipod Gammarus lacustris // Vestnik Zoologii
(Kiev). 2001. Vol. 35. P. 77—80.
Dragesco J. Diagnoses preliminaries de quelques cilies nouveaux
des sables // Bull. Soc. Zool. France. 1954. Vol. 79. P. 61—70.
Dragesco J. Les cilies mesopsammiques littoraux // Trav. Stat.
Biol. Roscoff. 1960. Vol. 12. P. 1—356.
Dragesco J. L’orientation actuelle de la systematique des cilies et
la technique d’impregnation au proteinate d’argent// Bull. Microsc.
Appl. Ser. 2. 1962. Vol. 12. P. 49—58.
Dragesco J. Complements a la connaissance des cilies mesopsam-
miques de Roscoff. I. Holotriches // Cah. Biol. Mar. 1963a. Vol. 4.
P. 91—119.
Dragesco J. Complements a la connaissance des cilies mesopsam-
miques de Roscoff. II. Heterotriches. III. Hypotriches // Cah. Biol. Mar.
1963b. Vol. 4. P. 251—275.
Dragesco J. Complements a la connaissance de Swedmarkia areni-
cola et Discocephalus ehrenbergi, cilies hypotriches // Annee Biologi-
que. 1965a. Vol. 4. P. 187—204.
Dragesco J. Cilies mesopsammiques d'Afrique Noire // Cah. Biol.
Mar. 1965b. Vol. 6. P. 357—399.
Dragesco J. Quelques cilies fibres du Gabon // Biologia Gabonica.
1966a. Vol. 2. P. 91—117.
Dragesco J. Cilies fibres de Thonon et ses environs // Protistologi-
ca. 1966b. Vol. 2. P. 59—95.
Dragesco J. A propos de Neobursaridium gigas Balech, 1941: ste-
nothermie, inclusions, ultrastructure des trichocystes // Protistologica.
1968a. Vol. 4. P. 157—167.
Dragesco J. Les genres Pleuronema Dujardin, Schizocalyptra nov.
gen. et Histiobalantium Stokes (cilies holotriches hymenostomes) //
Protistologica. 1968b. Vol. 4. P. 85—106.
Dragesco J. Metopus jankowskii n. sp., Sonderia sinuata Kahl et
Discocephalus minimus n. sp., cilies nouveaux ou mal connus // Ann.
Fac. Sci. Yaounde Cameroun. 1968c. Vol. 1. P. 77—88.
Dragesco J. Cilies fibres du Cameroun // Ann. Fac. Sci. Univ.
Feder. Yaounde Cameroun. 1970. Numero hors — serie. P. 1—141.
Dragesco J. Cilies fibres de 1’Ouganda // Ann. Fac. Sci. Cameroun.
1972a. Vol. 9. P. 87—126.
Dragesco J. Cilies fibres de la cuvette Tchadienne // Ann. Fac. Sci.
Cameroun. 1972b. Vol. 11. P. 71—91.
Dragesco J. Infraciliature et morphometrie de cinq especes de ci-
lies mesopsammiques mediterraneennes // Cah. Biol. Mar. 1996.
Vol. 37. P. 261—293.
Dragesco J. Revision des Geleiides (Ciliophora, Karyorelictea) //
Stapfia (Linz). 1999. Vol. 66. P. 1—91.
Dragesco J., Dragesco-Kerneis A. Cilies muscicoles nouveaux et
peu connus // Acta Protozool. 1979. Vol. 18. P. 401—416.
Dragesco J., Dragesco-Kerneis A. Cilies fibres de 1’Afrique Inter-
tropicale: Introduction a la connaissance et a I’etude des cilies // Editi-
ons de 1'ORSTOM, Paris. Collection Faune Tropicale. 1986. N 26.
P. 1—559.
Dragesco J., Dragesco-Kerneis A. Free-living ciliates from the
coastal area of lake Tanganyika// Eur. J. Protistol. 1991. Vol. 26.
P. 216—235.
Dragesco J., IftodeF. Histiobalantium natans. Morphologie,
infraciliature, morphogenese H Protistologica. 1972. Vol. 8. P. 347—
352.
Dragesco J., Iftode Fr., Fryd-Versavel Gh. Contribution a la
connaissance de quelques cilies holotriches rhabdophores. I. Prostomi-
ens II Protistologica. 1974. Vol. 10. P. 59—75.
Dragesco J., Njine Th. Complements a la connaissance des cilies
fibres du Cameroun // Ann. Fac. Sci. Cameroun. 1971. Vol. 7—8.
P. 97—140.
Earl P. R. Some protozoan endosymbionts of Ohio-frogs // Acta
Protozool. 1970. Vol. 7. P. 491—503.
Earl P. R. Synopsis of the Plagiotomoidea, new superfamily (Pro-
tozoa) // Acta Protozool. 1972. Vol. 9. P. 247—261.
Earl P. R. Kudoella hofstraensis n. sp. and Nyctotherus fonsecai
n. sp., of Periplaneta americana, and K. delta n. comb, of Parcoblatta
pennsylvanica// Revista de Biol. 1973. Vol. 9. P. 169—174.
Earl P. R. The nyctotheran Kudoella of Ciliophora // Rivista di Pa-
rasitol. 1980. Vol. 41. P. 135—137.
984
ALVEOLATA
Ehrenberg Chr. G. Die Infusionsthierchen als vollkommene Or-
ganismen. Ein Blick in das tiefere organische Leben der Natur. Leipzig,
1838.
Eigner P., Foissner W. Orthoamphisiella stramenticola nov. gen.,
nov. spec., a new hypotrichous ciliate (Ciliophora: Hypotrichida) occu-
ring in walnut leaflitter//Acta Protozool. 1991. Vol. 30. P. 129—133.
Eloff A. K., Van Hoven W. Intestinal Protozoa of the African
elephant Loxodonta africana (Blumenbach) // South Afr. J. Zool. 1980.
Vol. 15. P. 83—90.
Entz G. Uber Infusorien des Golfes von Neapel // Mitth. Zool. Sta-
tion zu Neapel. 1884. Vol. 5. P. 289—444.
Ergens R., Lom J. Puvodci parasitarnich nemoci ryb. Praha, 1970.
Esteban G., Fenchel T., Finlay B. Diversity of free-living morp-
hospecies in the ciliate genus Metopus // Arch. Protistenk. 1995.
Vol. 146. P. 137—164.
Esteban G., Tellez C., Munoz A. Infraciliature, morphogenesis
and life cycle of Endosphaera terebrans (Suctoria, Tokophridae)// J.
Protozool. 1991. Vol. 38. P. 483—488.
Faure-Fremiet E. Contribution a la connaissance des infusoires
planctoniques II Bull. Biol. Fr. Belg. 1924. Suppl. 4. P. 1—171.
Faure-Fremiet E. Strombidium calkinsi, a new thigmotactic speci-
es // Biol. Bull. 1932a. Vol. 62. P. 201—204.
Faure-Fremiet E. Division et morphogenese chez Folliculina am-
pulla O. F. Muller// Bull. Biol. Fr. Belg. 1932b. Vol. 66. P. 77—110.
Faure-Fremiet E. La famille des Folliculinidae (Infusoria Heterot-
richa)// Mem. Mus. Royal Hist. Nat. de Belg. 1936. Ser. 3. Vol. 2.
P. 1129—1175.
Faure-Fremiet E. Licnophora lyngbycola, a new species of infuso-
rian from Woods Hole // Biol. Bull. 1937. Vol. 72. P. 212—216.
Faure-Fremiet E. Croissance et morphogenese des colonies de
«Carchesium limneticum» Svec // Anais Acad. Brasil. Cienc. 1948.
Vol. 20. P. 103—115.
Faure-Fremiet E. Deux especes de Vorticella commensales des
Conochilus// Hydrobiologia. 1949. Vol. 1. P. 126—132.
Faure-Fremiet E. Morphogenese de bipartition chez Urocentrum
turbo (cilie holotriche) // J. Embryol. Exp. Morphol. 1954. Vol. 2.
P. 227—238.
Faure-Fremiet E. La position systematique du genre Balantidi-
um// J. Protozool. 1955. Vol. 2; P. 54—58.
Faure-Fremiet E. La famille des Nassulidae (Ciliata, Gymnosto-
mata) et le genre Nassulopsis n. gen. // C. R. Acad. Sci. Paris. 1959.
Vol. 249. P. 1429—1433.
Faure-Fremiet E. Remarques sur la morphologie comparee et la
systematique des Ciliata Hypotrichida// C. R. Acad. Sci. Paris. 1961a.
Vol. 252. P. 3515—3519.
Faure-Fremiet E. Pleurocoptes hydractiniae (Ciliata Pleuronema-
tina) et son adaptation structurale a la vie epizoique // Cah. Biol. Mar.
1961b. Vol. 2. P. 447—452.
Faure-Fremiet E. Le genre Trimyema Lackey et les caracteristiqu-
es structrales des cilies Trichotomatida// J. Protozool. 1962a. Vol. 9.
P. 146—149.
Faure-Fremiet E. Le genre Paranassula Kahl (Ciliata Cyrtophori-
na) // Cah. Biol. Mar. 1962b. Vol. 3. P. 61—77.
Faure-Fremiet E. Remarques sur la morphologie comparee des ci-
lies Trichostomatida// C. R. Acad. Sci. Paris. 1963. Groupe 12.
Vol. 257-D. P. 3089—3094.
Faure-Fremiet E. Morphologie des Dysteriidae (Ciliata Cyrtopho-
rina) U C. R. Acad. Sci. Paris. 1965. Vol. 260. P. 6679—6684.
Faure-Fremiet E. Le genre Cyclogramma Perty, 1852 // J. Proto-
zool. 1967a. Vol. 14. P. 456—464.
Faure-Fremiet E. La famille des Nassulidae (Ciliata Cyrtophori-
na) et ses possibility evolutives U C. R. Acad. Sci. Paris. 1967b.
Vol. 264. P. 68—72.
Faure-Fremiet E. Les genres Dexiotricha Stokes et Loxocephalus
Eberhard dans leurs relations auxomorphiques // Protistologica. 1968.
Vol. 4. P. 115—125.
Faure-Fremiet E. Le genre Parasonderia n. g. // C. R. Acad. Sci.
Paris. 1973. Vol. 276. P. 2011—2014.
Faure-Fremiet E. Le genre Nassulopsis et les cilies fondamentale-
ment hypostomiens // C. R. Acad. Sci. Paris. 1974. Vol. 278.
P. 2153—2156.
Faure-Fremiet E., Czapik A. Polycycla (Urceolaria) synaptae Cu-
enot// Cah. Biol. Mar. 1966. Vol. 7. P. 61—68.
Faure-Fremiet E., Tuffrau M. Sonderia labiata n. sp., cilie tric-
hostome psammobie// Hydrobiologia. 1955. Vol. 7. P. 210—218.
Favard P., Carasso N., Faure-Fremiet E. Ultrastructure de 1’ap-
pareil adhesif des urceolaires (cilies peritriches) // J. Microsc. 1963.
Vol. 2. P. 337—368.
Fenchel T. On the morphology, morphogenesis and systema-
tics of Thigmophrya Ch. Lw. (Ciliata, Thigmotrichida) with a des-
cription of T. saxicavae sp. n. // Acta Protozool. 1964. Vol. 2. P. 113—
121.
Fenchel T. Ciliates from Scandinavian molluscs // Ophelia. 1965a.
Vol. 2. P. 71—174.
Feuchel T. On the ciliate fauna associated with the marine species
of the amphipod genus Gammarus J. G. Fabricius // Ophelia. 1965b.
Vol. 2. P. 281—303.
Fenchel T. On «red water» in the Isefjord (inner Danish waters) ca-
used by the ciliate Mesodinium rubrum// Ophelia. 1968. Vol. 5.
P. 245—253.
Fernandez-Galiano D., Guinea A. La infraciliacion en Urocent-
rum turbo (Ciliata, Hymenostomatida) // Bol. Real Soc. Esp. Hist. Nat.
(Sec. Biol.). 1971. Vol. 69. P. 321—338.
Fernandez-Leborans G. The morphology and the taxonomic po-
sition of a protozoan of the genus Zosterodasys (Ciliophora, Nasso-
phorea)// Zool. Jahrb. Abt. Anat. Ontog. Tiere. 1990. Vol. 120.
P. 81—91.
Fernandez-Leborans G. A review of the species of protozoan epi-
bionts on crustaceans. III. Chonotrich ciliates // Crustaceana. 2001.
Vol. 74. P. 581—607.
Fernandez-Leborans G., Alekperov I. K. Revision of the genus
Zosterodasys with description of new species (Protozoa, Ciliophora) //
Zoosyst. Rossica. 1995 (ed. 1996). Vol. 4. P. 3—16.
Fernandez-Leborans G., Tato-Porto M. L. Distribution of the
protozoan epibiont Ophryodendron mysidacii (Ciliophora, Suctoria) on
the mysid Schistomysis parkei (Crustacea) // J. Nat. Hist. 2002. Vol. 36.
P. 505—513.
Fish J. D., Goodwin B. J. Observations on the peritrichous ciliate
Scyphidia ubiquita from the west coast of Wales and a description of a
new species // J. Zool. 1976. Vol. 179. P. 361—371.
Foissner W. Opisthonectidae (Ciliata, Peritrichida) nov. fam. und
Revision der Genera Telotrochidium (Kent) und Opisthonecta (Fa-
ure-Fremiet)// Protistologica. 1975. Vol. 11. P. 395—414.
Foissner W. Wallackia schiffmanni nov. gen., nov. sp. (Ciliophora,
Hypotrichida), ein alpiner hypotricher Ciliat // Acta Protozool. 1976.
Vol. 15. P. 387—392.
Foissner W. Opisthonecta bivacuolata nov. spec., Telotrochidium
cylindricum nov. spec, und Epistylis alpestris nov. spec., drei neue pe-
ritriche Ciliaten aus dem Hochgebirge//Ann. Naturhist. Mus. Wien.
1978. Vol. 81. P. 549—565.
Foissner W. Taxonomische Studien uber die Ciliaten des Gross-
glocknergebietes (Hohe Tauem, Osterreich). VIII. Familie Nassulidae //
Naturk. Jahrb. Stadt Linz. 1979a. Vol. 25. P. 199—208.
Foissner W. Morphologie, Infraciliatur und Silberliniensystem
von Phascolodon vorticella Stein, Chlamydonella apestris n. sp. und
Trochilia minuta (Roux) (Ciliophora Cyrtophorida) // Protistologica.
1979b. Vol. 15. P. 557—563.
Foissner W. Peritriche Ciliaten (Protozoa: Ciliophora) aus Alpinen
Kleingewassem // Zool. Jahrb. Abt. Syst. Geogr. Biol. Tiere. 1979c.
Vol. 106. P. 529—558.
Foissner W. Taxonomische Studien fiber die Ciliaten des Gross-
glocknergebietes (Hohe Tauem, Osterreich). Familien Microthoraci-
dae, Chilodonellidae und Furgasoniidae // Sitz.-Ber. Akad. Wiss. Wien.
1979d. Vol. 188. P. 27—43.
Foissner W. Die Infraciliatur und das Silberliniensystem von Sa-
gittaria hyalina n. sp., Chlamydonella polonica n. sp. und Spirozona ca-
udata// Arch. Protistenk. 1981a. Vol. 124. P. 361—377.
Foissner W. Morphologie und Taxonomie einiger neuer und wenig
bekannter Kinetofragminophorer Ciliaten (Protozoa: Ciliophora) aus al-
pinen Boden II Zool. Jahrb., Abt. Syst. Okol. Geogr. Tiere. 1981b.
Vol. 108. P. 264—297.
Foissner W. Morphologie und Infraciliatur zweier ectocommen-
saler Ciliaten (Protozoa; Ciliophora) von Cyprinus carpio L. (Pisces:
Cypriniformes): Heteropolaria Iwoffi (Faure-Fremiet, 1943) (Peritri-
chida: Epistylididae) und ihr Predator Pseudoamphileptus macro-
stoma (Chen, 1955) nqy. gen. (Pleurostomatida: Amphileptidae)//
Zool. Jahrb., Abt. Syst. Okol. Geogr. Tiere. 1983. Vol. 110. P. 399—
418.
Foissner W. Infraciliatur, Silberliniensystem und Biometrie eini-
ger neuer und wenig bekannter terrestrischer, limnischer und mariner
Ciliaten (Protozoa: Ciliophora) aus den Klassen Kinetofragminophora,
Colpodea und Polyhymenophora// Stapfia. Linz, 1984a. Vol. 12.
P. 1—165.
Foissner W. Morphologie und Infraciliatur einiger limnischer Cili-
aten (Protozoa: Ciliophora) // Schweiz. Zs. Hydrol. 1984b. Bd 46.
S. 210—223.
ТИП CILIOPHORA. ЛИТЕРАТУРА
985
Foissner W. The shape of the left polykinetid: a new character
for the discrimination of Colpoda aspera, C. elliotti, and Paracolpoda
steinii // J. Protozool. 1984c. Vol. 31. Supplement. P. 60-A.
Foissner W. Morphologie und Infraciliatur der Genera Microtho-
rax und Stammeridium und Klassifikation der Microthoracina Jankow-
ski, 1967 (Protozoa: Ciliophora)// Zool. Anz. 1985a. Vol. 214.
P. 33—53.
Foissner W. Die Morphologie und Infraciliatur einiger Ciliaten
(Protozoa: Ciliophora) aus dem Darm der Seeigel (Euechinoidea) Para-
centrotus lividus und Arbacia lixula// Arch. Protistenk. 1985b.
Vol. 130. P. 355—366.
Foissner W. Beitrag zur Kenntnis der Bodenciliaten (Protozoa: Ci-
liophora) des Himalaja // Zool. Jahrb., Abt. Syst. Okol. Geogr. Tiere.
1986a. Vol. 113. P. 45—53.
Foissner W. Revision der Gattung Stegochilum Schewiakoff,
1892 // Acta Protozool. 1986b. Vol. 25. P. 1—14.
Foissner W. Neue terrestrische und limnische Ciliaten (Protozoa,
Ciliophora) aus Osterreich und Deutschland // Sitz. Ber. Osterr. Akad.
Wiss., Math. Naturw. Klasse, Abth. I. 1987a. Vol. 195. P. 217—268.
Foissner W. Faunistische und taxonomische Notizen uber die Pro-
tozoen des Fuscher Tales (Salzburg, Osterreich) // Jahresber. Haus der
Natur, Salzburg. 1987b. Vol. 10. P. 56—68.
Foissner W. Neue und wenig bekannte hypotriche und colpodide
Ciliaten (Protozoa: Ciliophora) aus Boden und Moosen // Zool. Beitr.,
N. F. 1987c. Vol. 31. P. 187—282.
Foissner W. Taxonomie und Okologie einiger Ciliaten (Protozoa,
Ciliophora) des Saprobiensystems. II. Familie Chilodonellidae// Hyd-
robiologia. 1988a. Vol. 162. P. 21—45.
Foissner W. Gemeinsame Arten in der terricolen Ciliatenfauna
(Protozoa: Ciliophora) von Australien und Afrika // Stapfia. Linz,
1988b. Vol. 17. P. 85—133.
Foissner W. Morphologie und Infraciliatur einiger neuer und we-
nig bekannter terrestrischer und limnischer Ciliaten (Protozoa, Ciliop-
hora) // Sitz. Ber. Osterr. Akad. Wiss. Wien, Math. — Naturwiss. Klas-
se, Abth. I. Jahr 1987 (ed. 1989). Vol. 196. P. 173—247.
Foissner W. Systematic position of the enigmatic soil ciliate Col-
podidium caudatum Wilbert, 1982// J. Euk. Microbiol. 1990. Vol. 37.
Supplement. P. 60-A.
Foissner W. Colpodea // Matthes D. Hrsg. Protozoenfauna. Stutt-
gart, 1993. Vol. 4. Heft 1. P. 1—798.
Foissner W. Bryometopus hawaiiensis sp. n., a new colpodid cilia-
te from a terrestrial biotope of the Hawaiian Archipelago (Protozoa: Ci-
liophora) // Ann. Naturhist. Mus. Wien. 1994a. Vol. 96-D. P. 19—27.
Foissner W. Die Urtiere (Protozoen) des Bodens // Kataloge des
Ober — Osterreich. Landesmuseums, N. F. 1994b. Vol. 71.
P. 169—218.
Foissner W. Spetazoon australiense nov. gen., nov. spec., ein neu-
es Wimpertier (Protozoa, Ciliophora) von Australien// Kataloge des
Ober — Osterreich. Landesmuseums, N. F. 1994c. Vol. 71.
P. 267—278.
Foissner W. Kentrophoros (Ciliophora, Karyorelictida) has oral
vestiges: a reinvestigation of K. fistulosus (Faure-Fremiet, 1950) using
protargol impregnation // Arch. Protistenk. 1995a. Vol. 146.
P. 165—179.
Foissner W. Tropical protozoan diversity: 80 ciliate species (Pro-
tozoa, Ciliophora) in a soil sample from a tropial dry forest of Cos-
ta Rica, with descriptions of four new genera and seven new species II
Arch. Protistenk. 1995b. Vol. 145. P. 37—79.
Foissner W. Symphorionte Wimpertiere (Protozoa, Ciliophora)
auf grossen Kiemenfusskrebsen (Crustacea, Branchiopoda) // Kataloge
des Ober — Osterreich. Landesmuseums, N. F. 1996a. Vol. 100.
P. 59—69.
Foissner W. The infraciliature of Cryptopharynx setigerus Kahl,
1928 and Apocryptopharynx hippocampoides nov. gen., nov. spec. (Ci-
liophora, Karyorelictea), with an account on evolution in loxodid cilia-
tes // Arch. Protistenk. 1996b. Vol. 146. P. 309—327.
Foissner W. A redescription of Remanella multinucleata (Kahl,
1933) nov. gen., nov. comb. (Ciliophora, Karyorelictea), emphasizing
the infraciliature and extrusomes // Eur. J. Protistol. 1996c. Vol. 32.
P. 234—250.
Foissner W. The karyorelictids (Protozoa: Ciliophora), a unique
and enigmatic assemblage of marine, interstitial ciliates: a review emp-
hasizing ciliary patterns and evolution // Coombs G. H. et al. Evolutio-
nary relationships among Protozoa. L., 1998. Ch. 17. P. 305—325.
Foissner W. Notes on the soil ciliate biota (Protozoa, Ciliophora)
from the Shimba Hills in Kenya (Africa): diversity and description of
three new genera and ten new species // Biodiversity and Conservation.
1999. Vol. 8. P. 319—389.
Foissner W. Notes on ciliates (Protozoa, Ciliophora) from Espele-
tia trees and Espeletia soils of the Andean Paramo, with descriptions of
Sikorops espeletiae nov. spec, and Fragmocirrus espeletiae nov. gen.,
nov. spec. // Stud. Neotrop. Fauna and Environm. 2000a. Vol. 35.
P. 52—79.
Foissner W. A compilation of soil and moss ciliates (Protozoa, Ci-
liophora) from Germany, with new records and descriptions of new and
insufficiently known species // Eur. J. Protistol. 2000b. Vol. 36.
P. 253—283.
Foissner W. Revision of the genera Gastronauta Engelmann in
Butschli, 1889 and Paragastronauta nov. gen. (Ciliophora: Gastronauti-
dae) II Protozool. Monogr. 2001. Vol. 1. P. 63—101.
Foissner W. The Myriokarionidae fam. n., a new family of spathi-
diid ciliates (Ciliophora: Gymnostomatea) // Acta Protozool. 2003a.
Vol. 42. P. 113—143.
Foissner W. Morphology and ontogenesis of Lambomella trichog-
lossa nov. spec., a new tetrahymenid ciliate (Protozoa, Ciliophora) from
Brazilian tank bromeliads (Bromeliaceae) // Eur. J. Protistol. 2003b.
Vol. 39. P. 63—82.
Foissner W. Morphology and ontogenesis of Bromeliophrya brasi-
liensis gen. n., sp. n., a new ciliate (Protozoa: Ciliophora) from Brazili-
an tank bromeliads (Bromeliaceae) // Acta Protozool. 2003c. Vol. 42.
P. 55—70.
Foissner W. Some new ciliates (Protozoa, Ciliophora) from an
Austrian floodplain soil, including a giant red «flagship» Cyrtohymena
(Cyrtohymenides) aspoecki nov. subgen., nov. spec. // Denisia. 2004.
Vol. 13. P. 369—382.
Foissner W., Adam H., Foissner I. Morphologie und Infraciliatur
von Bryometopus pseudochilodon Kahl, 1932, Balantidioides dragescoi
nov. spec, und Kahliella marina nov. spec, und Revision des Genus Ba-
lantidioides Penard, 1930 (Protozoa, Ciliophora) // Protistologica. 1982.
Vol. 18. P. 211—225.
Foissner W., Adam H., Foissner I. Morphologie und Infraciliatur
von Ophrydium eutrophicum Foissner, 1979 und Ophrydium versatile
(O. F. Muller, 1786) (Ciliophora, Peritrichida)// Ber. Nat. Med. Ver.
Salzburg. 1984. Vol. 7. P. 43—54.
Foissner W., Agatha S., Berger H. Soil ciliates (Protozoa, Ciliop-
hora) from Namibia (Southwest Africa), with emphasis on two contras-
ting environments, the Etosha region and the Namib desert. Part I. Text
and line drawings. Part II. Photographs // Denisia. Linz, 2002. Vol. 5.
P. 1—1063 (text); P. 1064—1459 (fotografs).
Foissner W., Al-Rasheid K. A. S. Updating the trachelocercids
(Ciliophora, Karyorelictea). VI. A detailed description of Sultanophrys
arabica nov. gen., nov. spec. (Sultanophryidae nov. fam.) // Eur. J. Pro-
tistol. 1999. Vol. 35. P. 146—160.
Foissuer W., Berger H. Identification and ontogenesis of the no-
men nudum hypotrichs (Protozoa: Ciliophora) Oxytricha nova (= Ster-
kiella nova sp. n.) and O. trifallax (= S. histriomuscorum) II Acta Proto-
zool. 1999. Vol. 38. P. 215—248.
Foissner W., Berger H., Blatterer H., Kohmann F. Taxonomisc-
he und okologische Revision der Ciliaten des Saprobiensystems. Band
IV. Gymnostomatea, Loxodes, Suctoria // Inform. Ber. Bayer. Lande-
samtes fur Wass. Wirt. 1995. Vol. 1/95. P. 1—540.
Foissner W., Berger H., Kohmann F. Taxonomische und okolo-
gische Revision der Ciliaten des Saprobiensystems. Band II. Peritrichia,
Heterotrichida, Odontostomatida II Inform. Ber. Bayer. Landesamtes
fur Wass. Wirt. 1992. Vol. 5/92. P. 1—502.
Foissner W., Berger H., Kohmann F. Taxonomische und okolo-
gische Revision der Ciliaten des Saprobiensystems. Band III. Hymenos-
tomata, Prostomatida, Nassulida // Inform. Ber. Bayer. Landesamtes fur
Wass. Wirt. 1994. Vol. 1/94. P. 1—548.
Foissner W., Berger H., Schaumburg J. Identification and ecolo-
gy of limnetic plankton ciliates // Inform. Ber. Bayer. Landesamtes fur
Wass. Wirt. 1999. Vol. 3/99. P. 1—793.
Foissner W., Blatterer H., Berger H., Kohmann F. Taxono-
mische und Okologische Revision der Ciliaten des Saprobiensys-
tems. Band 1: Cyrtophorida, Oligotrichida, Hypotrichia, Colpodea//In-
form. Ber. Bayer. Landesamtes fur Wass. Wirt. 1991. Vol. 1/91. P. 1—
478.
Foissner W., Brozek S. Taxonomic characterization of Pseudo-
haplocaulus infravacuolatus nov. spec, and Vorticella chlorellata Stiller
1940, epiplanctonic peritrichs (Ciliophora, Peritrichia) attached to coe-
nobia of Anabaena (Cyanophyta), including a redescription of V. chlo-
rostigma (Ehrenberg, 1831)// Int. Rev. Ges. Hydrobiol. 1996. Vol. 81.
P. 329—351.
Foissner W., Cordeiro T. A new, peculiar colpodid ciliate from
the tanks of a Brasilian bromeliad// J. Euk. Microbiol. 2000. Vol. 47.
Supplement. P. 9-A.
986
ALVEOLATA
Foissner W., Dragesco J. Updating the trachelocercids (Ciliopho-
ra, Karyorelictea). I. A detailed description of the infraciliature of Trac-
helolophos gigas n. g., n. sp. and T. filum (Dragesco et Dragesco Kerne-
ls, 1968) n. comb. II J. Euk. Microbiol. 1996. Vol. 43. P. 12—25.
Foissner W., Foissner I. Fine structure and systematic position of
Enchelyomorpha vermicularis (Smith, 1899) Kahl, 1930, an anaerobic
ciliate (Protozoa, Ciliophora) from domestic sewage // Acta Protozool.
1995. Vol. 34. P. 21—34.
Foissner W., Hoffman G. L., Mitchell A. J. Heteropolaria co-
lisarum Foissner & Schubert, 1977 (Protozoa: Epistylididae) of
North American freshwater fish'es // J. Fish Dis. 1985. Vol. 8. P. 145—
160.
Foissner W., Kreutz M. Systematic position and phylogenetic re-
lationships of the genera Bursaridium, Paracondylostoma, Thylakidi-
um, Bryometopus, and Bursaria (Ciliophora: Colpodea) // Acta Protozo-
ol. 1998. Vol. 37. P. 227—240.
Foissner W., Leipe D. Morphology and ecology of Siroloxophyl-
lum utriculariae (Penard, 1922) n. gen., n. comb. (Ciliophora, Pleuros-
tomatida) and an improved classification of pleurostomatid ciliates // J.
Euk. Microbiol. 1995. Vol. 42. P. 476—490.
Foissner W., O’Donoghue P. J. Morphology and infraciliature of
some freshwater ciliates (Protozoa: Ciliophora) from Western and So-
uth Australia# Invert. Taxon. 1990. Vol. 3. P. 661—696.
Foissner W., Oleksiv I., Muller H. Morphologie und Infraciliatur
einiger Ciliaten (Protozoa: Ciliophora) aus stagnierenden Gewassem //
Arch. Protistenk. 1990. Vol. 138. P. 191—206.
Foissner W., Rieder N. Licht- und rasterelektronenmikroskopisc-
he Untersuchungen uber die Infraciliatur von Loxodes striatus (Engel-
mann, 1862) und Loxodes magnus Stokes, 1887 (Protozoa: Ciliopho-
ra) // Zool. Anz. 1983. Vol. 210. P. 3—13.
Foissner W., Schlegel M., Prescott D. M. Morphology and morp-
hogenesis of Onychodromus quadricomutus n. sp. (Ciliophora, Hypot-
richida) an extraordinarily large ciliate with dorsal horns // J. Protozool.
1987. Vol. 34. P. 150—159.
Foissner W., Schubert G. Morphologie der Zooide und Schwar-
mer von Heteropolaria colisarum gen. nov., spec. nov. (Ciliata, Peritri-
chida), einer symphorionten Epistylidae von Colisa fasciata (Anabanto-
idei, Belontiidae) // Acta Protozool. 1977. Vol. 16. P. 231—247.
Foissner W., Skogstad A., Pratt J. R. Morphology and infracilia-
ture of Trochiliopsis australis n. sp., Pelagohalteria viridis (Fromentel,
1876) n. g., n. comb., and Strobilidium lacustris n. sp. (Protozoa, Ciliop-
hora) // J. Protozool. 1988. Vol. 35. P. 489—497.
Foissner W., Striider-Kypke M., Van der Staay G. W. M.,
Moon-Van der Staay S.-Y., Hackstein J. H. P. Endemic ciliates (Pro-
tozoa: Ciliophora) from tank bromeliads (Bromeliaceae): a combined
morphological, molecular, and ecological study// Eur. J. Protistol.
2003. Vol. 39. P. 365—372.
Foissner W., Wilbert N. A comparative study of the infraciliature
and silverline system of the fresh-water scuticociliates Pseudocohni-
lembus putrinus (Kahl, 1928) nov. comb., P. pusillus (Quennerstedt,
1869) nov. comb., and the marine form P. marinus Thompson, 1966 // J.
Protozool. 1981. Vol. 28. P. 291—297.
Foissner W., Wolfl S. Revision of the genus Stentor Oken (Proto-
zoa, Ciliophora) and description of S. araucanus nov. spec, from South
American lakes// J. Plankton Res. 1994. Vol. 16. P. 255—289.
Fromentel E. Etudes sur les microzoaires ou infusoires proprement
dits. Paris, 1874 (P. 1—88), 1875 (P. 89—192), 1876 (P. 193—364,
plates 1—30).
Fryd-Versavel Gh., Iftode F., Deroux G. La famille des Nassuli-
dae et 1’ancien genre Nassula // J. Protozool. 1980. Vol. 27. Supplement.
P. 79-A.
Fryd-Versavel Gh., Iftode F., Dragesco J. Contribution a la con-
naissance de quelques cilies gymnostomes. II. Prostomiens, pleurosto-
miens: morphologie, stomatogenese // Protistologica. 1975. Vol. 11.
P. 509—530.
Fryd-Versavel Gh., Iftode F., Wilbert N. Le genre Espejoia Bur-
ger, 1908: morphologie et morphogenese dans deux especes, E. mucico-
la Penard 1922 et E. culex Smith 1897 // Protistologica. Year 1974, ed.
1975. Vol. 10. P. 301—309.
Fryd-Versavel Gh., Tuffrau M. Complements a la connaissance
du genre Transitella Gellert, 1950// Protistologica. 1978. Vol. 14.
P. 91—98.
Furgason W. H. The significant cytostomal pattern of the «Glau-
coma — Colpidium group», and a proposed new genus and species, Tet-
rahymena geleii // Arch. Protistenk. 1940. Vol. 94. P. 224—266.
Gajewskaja N. Zur Okologie, Morphologie und Systematik der In-
fusorien des .Bajkalsees// Zoologica, Stuttgart. 1933. Vol. 32.
P. 1—298.
Ganner B., Foissner W., Adam H. Morphology and morphogene-
sis of Bursostoma bursaria Vorosvary, 1950 (Ciliophora, Ophryogleni-
na) // Ann. Sci. Nat. Zool. 1988. Vol. 9. P. 3—11.
Gelei J. Uber den Bau, die Abstammung und die Bedeutung der
sog. Tastborsten bei den Ciliaten // Arch. Protistenk. 1933. Vol. 80.
P. 116—127.
Gelei J. Der feinere Bau des Cytopharynx von Paramecium und se-
ine systematische Bedeutung // Arch. Protistenk. 1934. Vol. 82.
P. 331—362.
Gelei J. Beitrage zur Ciliatenfauna der Umgebung von Szeged. X.
Nassula heterovesiculata n. sp. // Acta Biol. Szeged. Pars Zool. 1939.
Vol. 5. P. 92—98.
Gelei J. Korperbau und Erregungsleitung bei den Ciliaten. Eine
Studie an Loxocephalus und einige andere Ciliaten // Arch. Protistenk.
1940. Vol. 93. P. 273—316.
Gelei J. Die Marynidae der Sodagewasser in der Nahe von Szeged.
XIV. Beitrag zur Ziliatenfauna Ungams // Hidrol. Kozlem. 1950.
Vol. 30. P. 107—119, 157—158.
Gelei J. Uber die Lebensgemeinschaften einiger temporarer
Tiimpel auf einer Bergwiese im Borzsonygebirge (Oberungam). III. Ci-
liaten// Acta Biol. Hung. 1954. Vol. 5. P. 259—343.
Gong J., Song W. Description of a new marine cyrtophorid ciliate,
Dysteria derouxi nov. spec., with an updated key to 12 well-investigated
Dysteria species (Ciliophora, Cyrtophorida) // Eur. J. Protistol. 2004.
Vol. 40. P. 13—19.
Goussard B., Collet J.-Y., Garin Y., Tutin С. E. G., Fernan-
dez M. The intestinal entodiniomorph ciliates of wild lowland gorillas
(Gorilla gorilla gorilla) in Gabon, West Africa //1. Med. Primatol. 1983.
Vol. 12. P. 239—249.
Grain J. L’infraciliature d’Isotricha intestinalis Stein, cilie trichos-
tome de la panse des ruminants // C. R. Acad. Sci Paris, Ser. D. Sci. Nat.
1962. Vol. 254. P. 2221—2223.
Grain J. La stomatogenese chez les cilies trichostomes Isotricha
intestinalis et Paraisotricha colpoidea// Arch. Zool. Exp. Gen. 1964.
Vol. 104. P. 85—93.
Grain J. Etude cytologique de quelques cilies holotriches endo-
commensaux des ruminantes et des equides // Protistologica. 1965, ed.
1966. Vol. 2. Fasc. 1. P. 59—141. Fasc. 2. P. 5—51, 31 plates.
Grain J. Etude utrastructurale d’Halteria grandinella O. F. M. (ci-
lie oligotriche) et considerations phylogenetiques // Protistologica.
1972. Vol. 8. P. 179—197.
Grain J. Class Vestibuliferea de Puytorac et al., 1974 // Traite de
Zoologie. Anatomie, systematique, biologie. Infusoires cilies / Ed.
P. Puytorac. Paris, 1994. Vol. 2, fasc. 2. P. 311—379.
Grasse P.-P. Sur quelques Nyctotherus (infusoires heterotriches)
nouveaux ou peu connus// Annal. Protistologie. 1928. Vol. 1.
P. 55—68.
Grell K. G. Der Generationswechsel des parasitischen Suktors
Tachyblaston ephelotensis Martin // Zeitschr. Parasitenk. 1950. Vol. 14.
P. 499— 534.
Grimes В. H. Notes on the distribution of Hyalophysa and Gymno-
dinioides on crustacean hosts in coastal North Carolina and a descripti-
on of Hyalophysa trageri sp. n. // J. Protozool. 1976. Vol. 23.
P. 246—251.
Groliere C. A. Description de quelques especes de cilies hymenos-
tomes des genres Sathrophilus Coriss, 1960, Cyclidium O. F. Muler,
1786, Histiobalantium Stokes, 1886// J. Protozool. 1973. Vol. 20.
P. 369—376:
Groliere C. A. Etude comparee de la stomatogenese chez quelques
cilies hymenostomes des genres Paralembus Kahl, 1933, Philaster Fab-
re-Domergue, 1885, Parauronema Thompson, 1967, Tetrahymena Fur-
gason, 1940// Protistologica. 1974. Vol. 10. P. 319—331.
Groliere C. A. Etude de quelques cilies hymenostomes des eaux
acides de la region de Besse-en-Chandesse // Ann. Stat. Biol. Bes-
se-en-Chandesse. Year 1974, ed. 1975a. Vol. 9. P. 79—109.
Groliere C. A. Descriptions de quelques cilies hypotriches des to-
urbieres a sphaignes et des etendues d’eau acides// Protistologica.
1975b. Vol. 11. P. 481—498.
Groliere C. A. Contribution a I’etude des cilies des sphaignes des
etendues d’eau acides. I. Description de quelques especes de gymnosto-
mes, hypostomes, hymenostomes et heterotriches // Ann. Stat. Biol.
Besse-en-Chandesse. Annees 1975—1976, ed. 1977. Vol. 10.
P. 265—297.
Groliere C. A. Morphologie et stomatogenese chez deux cilies
Scuticociliatida des genres Philasterides Kahl, 1926 et Cyclidium
O. F. Muller, 1786// Acta Protozool. 1980. Vol. 19. P. 195—206.
Groliere C. A., Puytorac P., Detcheva R. A propos d’observati-
ons sur la stomatogenese et 1’ultrastructure du cilie Protocruzia tuzeti
ТИП CILIOPHORA. ЛИТЕРАТУРА
987
Villeneuve-Brachon, 1940// Protistologica. 1980a. Vol. 16. P. 453—
466.
Groliere C. A., Puytorac P., Grain J. Observations de quelqu-
es especes de cilies endocommensaux d’echinides du Golfe de Mexi-
que et de la mer des Antilles // Protistologica. 1980b. Vol. 16. P. 233—
239.
Guhl W. Beitrag zur Systematik, Biologie und Morphologie der
Epistylidae (Ciliata, Peritricha)// Arch. Protistenk. 1979. Vol. 121.
P. 417—483.
Guhl W., Haider G. Urceolariidae (Peritricha) // Hrsg D. Matthes.
Protozoenfauna. Stuttgart, 1988. Bd 7. Heft 1. P. 227—299.
Guide-1 — см. E. B. Small, D. H. Lynn. 1985.
Guide-2 — cm. D. H. Lynn, E. B. Small. 2002.
Guinea A., Fernandez-Galiano D. Observations on Opisthonecta
henneguyi Faure-Fremiet: infraciliature, argyrome and myoneme sys-
tem II J. Protozool. 1987. Vol. 34. P. 92—97.
Guiicher Y. Contribution a I’etude des cilies gemmipares, chonot-
riches et tentaculiferes// Ann. Sci. Nat. Zool. 1951. Vol. 13.
P. 33—134.
Hada Y. The protozoan plankton of the Antarctic and Subantarctic
seas И Jap. Antarct. Research Exped. (JARE). Scient. Rep. Ser. E. 1970.
N31. P. 1—51.
Hadzi J. Studien uber Follikuliniden // Dela Slov. Akad. Znan.
Umetnosti, Razred za Prirodoslov. in Medic. Vede. 1951. Vol. 4.
P. 1—391.
Hatzidimitriou G., Berger J. Morphology and morphogenesis of
Ancistrum mytili (Scuticociliatida: Thigmotrichina), a commensal ci-
liate of mytilid pelecypods// Protistologica. 1977. Vol. 13. P. 477—
495.
Hausman S. A. Parasites of the millipede Spirobolus marginatus //
Trans. Amer. Microsc. Soc. 1958. Vol. 77. P. 283—286.
Hausmann K., Bradbury P. C. (eds). Ciliates: cells as organisms.
Stuttgart, 1996.
Hemberger H. Revision der Ordnung Hypotrichida Stein (Ciliop-
hora, Protozoa) an Hand von Protargolpraparaten und Morphogenese-
darstellungen: JJokt. Dissertation, Universitat Bonn. 1982.
Hemberger H. Neue Gattungen und Arten hypotricher Ciliaten //
Arch. Protistenk. 1985. Vol. 130. P. 397—417.
HillerS., Bardele C. F. Prorodon aklitolophon n. spec, and the
«dorsal brush» as a character to identify certain subgroups in the genus
Prorodon// Arch. Protistenk. 1988. Vol. 136. P. 213—236.
Hirshfield H. The morphology of Urceolaria karyolobia, sp. nov.,
Trichodina tegula, sp. nov., and Scyphidia ubiquita, sp. nov., three new
ciliates from Southern California limpets and turbans// J. Morphol.
1949. Vol. 85. P. 1—33.
Hitchen E. T., Butler R. D. A redescription of Rhyncheta cyclo-
pum Zenker (Ciliatea, Suctorida)// J. Protozool. 1972. Vol. 19.
P. 597—601.
Hoare C. A. A new cycloposthiid ciliate (Triplumaria hamertoni
gen. n., sp. n.) parasitic in the Indian Rhinoceros // Parasitology. 1937.
Vol. 29. P. 559—569.
Hochberg F. G. Some aspects of the biology of cephalopod kidney
parasites. Doct. Dissertation. 1971. P. 1—272.
Hochberg F. G. The «kidneys» of cephalopods: a unique habitat
for parasites // Malacologia. 1982. Vol. 23. P. 121—134.
Hochberg F. G. The parasites of cephalopods: a review // Mem.
Natn. Mus. Victoria. 1983. Vol. 44. P. 108—145.
Hollande A., Batisse A. Contribution a I’etude des infusoires para-
sites du coecum de I’hydrocheire (Hydrocheirus capybara L.). I. La fa-
mille des Cycloposthiidae // Mem. Inst. Oswaldo Cruz. 1959. Vol. 57.
P. 1—16.
Hsiung T.-S. Suctoria of the large intestine of the horse: Allantoso-
ma intestinalis Gassovsky, A. dicomiger sp. nov., and A. brevicomiger
sp. nov. // Iowa State College J. Sci. 1928. Vol. 3. P. 101—102.
Hsiung T.-S. A general survey of the protozoan fauna of the rumen
of the Chinese cattle // Bull. Fan Memorial Inst. Biol. 1932. Vol. 3.
P. 87—107.
Hsiung T.-S. On some new ciliates from the mule, with the desc-
ription of a new genus // Bull. Fan Memorial Inst. Biol. 1935. Vol. 6.
P. 81—94.
Hu X., Song W. Redescription of the little — known marine ciliate,
Stichotricha marina Stein, 1867 (Ciliophora, Hypotrichida) from the
mantle cavity of cultured scallops // Hydrobiologia. 2001. Vol. 464.
P. 71—77.
Hu X., Song W. Redescription of two known species, Gastrocir-
rhus monilifer (Ozaki et Yagiu, 1942) and Gastrocirrhus stentoreus Bul-
lington, 1940, with reconsideration of the genera Gastrocirrhus and
Euplotidium// Acta Protozool. 2003. Vol. 42. P. 345—355.
Iftode Fr., Fryd-Versavel Gh., Wicklow B. J., Tuffrau M. Le
genre Transitella: stomatogenese, ultrastructure. Affmites de la famille
des Transitellidae // Protistologica. 1983. Vol. 19. P. 21—39.
Iftode Fr., Versavel Gh. Le genre Turaniella Brodsky et la diversi-
fication structurale des cilies Peniculina // C. R. Acad. Sci. Paris, Ser. D.
1968. Vol. 267. P. 1379—1382.
Itabashi T., Mikami K., Fang J., Asai H. Phylogenetic relation-
ships between Vorticella convallaria and another species inferred from
small subunit rRNA gene sequences // Zool. Science (Tokyo). 2002.
Vol. 19. P. 931—938.
Ito A., Imai S. Ciliates from the caecum of capybara (Hydrochoe-
rus hydrochaeris) in Bolivia. I. The families Hydrochoerellidae n. fam.,
Protohallidae and Pycnotrichidae// Eur. J. Protistol. 2000a. Vol. 36.
P. 53—84.
Ito A., Imai S. Ciliates from the caecum of capybara (Hydrochoe-
rus hydrochaeris) in Bolivia. II. The family Cycloposthiidae // Eur. J.
Protistol. 2000b. Vol. 36. P. 169—200.
Jacobson I. Fibrillare Differenzierungen bei Ciliaten // Arch. Pro-
tistenk. 1931. Vol. 75. P. 31—100.
Jankowski A. W. Morphology and evolution of Ciliopho-
ra. III. Diagnoses and phylogenesis of 53 sapropelebionts, mainly of
the order Heterotrichida// Arch. Protistenk. 1964a. Vol. 107. P. 185—
294.
Jankowski A. W. Morphology and evolution of Ciliophora.
IV. Sapropelebionts of the family Loxocephalidae fam. nova, their ta-
xonomy and evolutionary history // Acta Protozool. 1964b. Vol. 2.
P. 33—58.
Jankowski A. W. Taxonomy of Ciliophora. 1. Shellositon gen. n.
from littoral amphipods in the sea of Japan (Peritricha: Rovinjellidae) H
Zoosyst. Rossica. 1993a. Vol. 2. P. 211—216.
Jankowski A. W. Taxonomy of Ciliophora. 2. New species of
Opercularia, Entziella and Circolagenophrys from the Black Sea and
Pacific, and taxonomic notes on other peritrichs (Peritricha) // Zoosyst.
Rossica. 1993b. Vol. 2. P. 217—222.
Jankowski A. W. Vostonica gen. n. from psammonic copepods in
the Pacific (Suctoria Vermigenea)// Zoosyst. Rossica. 1994. Vol. 3.
P. 1—4.
Jerka-Dziadosz M. Morphogenesis of ciliature in division of
Urostyla weissei Stein // Acta Protozool. 1965. Vol. 3. P. 345—353.
Johnson C. A., Bradbury P. C. Observations on the occurrence
of the parasitic ciliate Synophrya in decapods in coastal waters off
the Southeastern United States// J. Protozool. 1976. Vol. 23.
P. 252—256.
Johnston T. H. Parasitic Infusoria from Macquariae Island // Sci.
Reports Australasian Antarctic Exped. 1911—1914. Ser. C. 1938.
Vol. 1—C-3. P. 1—13.
Jones M. B., Khan M. A. The occurrence of a Conidophrys speci-
es (Protozoa, Ciliata) on members of the Jaera albifrons Leach group //
Acta Protozool. 1970. Vol. 8. P. 149—153.
Kaczanowski A. Helella rhizodrili gen. n., sp. n. (Ciliata — Asto-
mata) // Acta Parasitol. Polon. 1961. Vol. 9. P. 247—255.
Kaczanowski A. Morphology and morphogenesis of the sucker
in Hysterocineta paludinarum Diesing (Ciliata, Thigmotricha) as ob-
served in living material# Acta Protozool. 1963. Vol. 1. P. 395—
401.
Kahl A. Urtiere Oder Protozoa. I: Wimpertiere Oder Ciliata (Infuso-
ria). 1. Allgemeiner Teil und Prostomata// Die Tierwelt Deutschlands.
1930. Teil 18. P. 1—180.
Kahl A. Urtiere Oder Protozoa. I: Wimpertiere Oder Ciliata (Infuso-
ria). 2. Holotricha ausser den im 1. Teil behandelten Prostomata // Die
Tierwelt Deutschlands. 1931. Teil 21. P. 181—398.
Kahl A. Urtiere Oder Protozoa. I: Wimpertiere Oder Ciliata (Infuso-
ria). 3. Spirotricha// Die Tierwelt Deutschlands. 1932. Teil 25.
P. 399—650.
Kahl A. Ciliata libera et ectocommensalia // E. Hrsg, G. Grimpe.
Wagler. Die Tierwelt der Nord- iind Ostsee. 1933. Teil 23. Teil II —
C —3. P. 29—146.
Kahl A. Suctoria// E. Hrsg, G. Grimpe. Wagler. Die Tierwelt der
Nord- und Ostsee. 1934a. Vol. 23. Teil II — C — 5. P. 184—226.
Kahl A. Ciliata ectocommensalia et parasitica // E. Hrsg, G. Grim-
pe. Wagler. Die Tierwelt der Nord- und Ostsee. 1934b. Vol. 26. Teil
II —C —4. P. 147—183.
Kahl A. Urtiere Oder Protozoa. I: Wimpertiere oder Ciliata (Infuso-
ria). 4. Peritricha und Chonotricha // Die Tierwelt Deutschlands. 1935.
Teil 30. P. 651—886.
Kalmus H. Bursalinus synspiralis, ein neues heterotriches Infusor
aus dem Salinenschlamm // Arch. Protistenk. 1929. Vol. 68.
P. 609—612.
988
ALVEOLATA
Kane J. R. The Lagenophryidae in Australia and South Africa //
Progress in Protozoology. Ill Intern. Congr. Protozool. Leningrad.
1969. P. 368—369.
Kazubski S. L. Trichia lubomirskii Slos. (Helicidae), a new host of
Tetrahymena limacis (Warren, 1932) Kozloff, 1946 (Ciliata) and Zoni-
toides nitidus Mull. (Zonitidae), a new host of T. rostrata (Kahl, 1926)
Corliss, 1952 in Poland // Bull. Acad. Polon. Sci. Cl. II, Ser. Sci. Biol.
1958a. Vol. 6. P. 247—252.
Kazubski S. L. Thigmocoma acuminata gen. nov., sp. nov. (Thig-
motricha — Thigmocomidae fam. nov.), a parasite of the renal organ of
Schistophallus orientalis Cless. (Pulmonata — Zonitidae) // Bull. Acad.
Polon. Sci., Cl. II. Ser. Sci. Biol. 1958b. Vol. 6. P. 167—172.
Kazubski S. L. Studies on the parasitic ciliate Thigmocoma acumi-
nata Kazubski (Thigmotricha — Thigmocomidae) // Acta Protozool.
1963. Vol. 1. P. 237—278.
Kazubski S. L. Buccal apparatus of Myxophyllum steenstrupi
(Stein, 1861) Raabe, 1934 (Thigmotricha)// Acta Protozool. 1973.
Vol. 12. P. 169—172.
Kazubski S. L. A study on morphological variability in ciliates of
the genus Myxophyllum // Abstracts of V Intemat. Congr. Protozool.
N. Y„ 1977. P. 34.
Kazubski S. L. Further investigation on morphological varia-
bility in ciliates Myxophyllum steenstrupi (Stein), parasite of land sna-
ils H Proc. IV Intern. Congr. Parasitol. Section B. Warszawa, 1978.
P. 8.
Kellicott D. S. On some Infusoria found on the cray-fish // Proc.
Amer. Soc. Microsc. 1883. Vol. 5. P. 105—111.
Kent W. S. A manual of the Infusoria: including a description of all
known flagellate, ciliate, and tentaculiferous Protozoa British and fore-
ign. L., 1880. Vol. 1. P. 1—432. 1881. Vol. 2, parti. P. 433—720.
1882. Vol. 2, part 2. P. 721—913. 1882. Vol. 3. Plates.
Khan M. A. On the morphology and biology of a new arhynchodi-
ne thigmotrichid ciliate (Protozoa) from the dog whelk Nucella lapil-
lus // J. Zool. 1970. Vol. 161. P. 39—48.
Kidder G. W. On the genus Ancistruma Strand (Ancistrum Mau-
pas). I. The structure and division of A. mytili Quenn. and A. isseli
Kahl II Biol. Bull. 1933. Vol. 64. P. 1—20.
King R. L. Two new Infusoria (Protozoa) from Iowa // Proc. Iowa
Acad. Sci. 1931. Vol. 38. P. 241—243.
Klein В. M. Die Silberliniensysteme der Ciliaten. Ihr Verhalten
wahrend Teilung und Konjugation, neue Silberbilder, Nachtrage//
Arch. Protistenk. 1927. Vol. 58. P. 55—142.
Klein В. M. Das Silberliniensystem der Ciliaten. Weitere Ergeb-
nisse. IV II Arch. Protistenk. 1930. Vol. 69. P. 235—326.
Knight R., Thorne J. Syncilancistrumina elegantissima (Scutico-
ciliatida, Thigmotrichina), a new genus and species of ciliated protozo-
on from Pholas dactylus (Mollusca, Bivalvia), the common piddock//
Protistologica. 1982. Vol. 18. P. 53—66.
Koch W. J. Thaxter’s Myrioblepharis // Mycologia. 1964. Vol. 56.
P. 436—440.
Kofoid C. A. On two remarkable ciliate protozoa from the caecum
of the Indian elephant// Proc. Nat. Acad. Sci. USA. 1935. Vol. 21.
P. 501—506.
Kofoid C. A., Campbell A. S. A conspectus of the marine and
fresh-water Ciliata belonging to the suborder Tintinnoinea, with desc-
riptions of new species principally from the Agassiz Expedition to the
Eastern Pacific 1904—1905 // Univ. Calif. Publ. Zool. 1929. Vol. 34.
P. 1—403.
Kopperi A. J. Uber die nicht — pathogene Protozoenfauna des
Blinddarmes einiger Nagetiere // Ann. Soc. Zool. — Bot. Fenn. Vana-
mo, Helsinki. 1935 (ed. 1937). Vol. 3. P. 1—90.
Korfsmeier K. Strukturen des Stieles und Kopfchens peritrichen
sessiler Ciliaten // Zool. Jahrb., Abt. Anat. Ontog. Tiere. 1949. Vol. 70.
P. 198—224.
Kormos J., Kormos K. Uber die Pseudogemma — Frage // Acta
Zool. Acad. Sci. Hung. 1958. Vol. 4. P. 157—166.
Kozloff E. N. Lwoffia cilifera gen. nov., sp. nov., a ciliated mem-
ber of the family Sphenophryidae (Holotricha: Thigmotricha) II Biol.
Bull. 1955. Vol. 108. P. 283—289.
Krainer К.-H., Foissner W. Revision of the genus Askenasia
Blochmann, 1895, with proposal of two new species, and description of
Rhabdoaskenasia minima n. g., n. sp. (Ciliophora, Cyclotrichida) // J.
Protozool. 1990. Vol. 37. P. 414—427.
Laird Ml. The Protozoa of New Zealand intertidal zone fishes//
Trans. Roy. Soc. New Zealand. 1953. Vol. 81. P. 79—143.
Laird M. Trichodinids and other parasitic Protozoa from the inter-
tidal zone at Nanaimo, Vancouver Island// Canad. J. Zool. 1961.
Vol. 39. P. 833—844.
Landers S. C. Studies of the phoront of Hyalophysa chattoni (Cili-
ophora, Apostomatida) encysted on grass shrimp // J. Protozool. 1986.
Vol. 33. P. 546—552.
Landers S. C. Exuviotrophic apostome ciliates from crustaceans
of St. Andrews Bay, Florida, and a description of Gymnodinioides koz-
loffi n. sp. // J. Euk. Microbiol. 2004. Vol. 51. P. 644—650.
Landers S. C., Confusione A., Drfee D. Hyalophysa bradburyae
sp. n., a new species of apostome ciliate from the grass shrimp Palaemo-
netes kadiakensis // Eur. J. Protistol. 1996. Vol. 32. P. 372—379.
Landers S. C., Zimlich M., Coate T. Variations in the ventral cili-
ature of the crustacean symbiont Hyalophysa (Ciliophora, Apostomati-
da) from Mobile Bay and Dauphin Island, Alabama // Gulf Research
Reports. 1999. Vol. 11. P. 57—64.
Lasek-Nesselquist E., Katz L. A. Phylogenetic position of Soro-
gena stoianovitchae and relationships within the class Colpodea (Cili-
ophora) based on SSU rDNA sequences // J. Euk. Microbiol. 2001.
Vol. 48. P. 604—607.
Latteur B. Contribution a la systematique de la famille des Ophry-
oscolecidae Stein// Ann. Soc. Roy. Zool. Belg. 1966. Vol. 96.
P. 117—144.
Latteur B., Dufey M. M. Reforme systematique de la famille des
Cycloposthiidae Poche 1913 // Acta Zool. Pathol. Antverp. 1967. Vol.
44. P. 125—139.
Latteur B., Tuffrau M., Wespes G. Triplumaria selenica n. sp.,
cilie spirotriche du colon de 1’elephant d'Afrique // Protistologica. 1970.
Vol. 6. P. 319—330.
Laval M. Zoothamnium pelagicum Du Plessis, cilie peritriche
planctonique: morphologie, croissance et comportement // Protistologi-
ca. 1968. Vol. 4. P. 333—363.
Laval-Peuto M. Reconstruction d’une lorica de forme Coxliella
par le trophonte nu de Favella ehrenbergii (Ciliata, Tintinnina) II
C. R. Acad. Sci. Paris. Ser. D. 1977. Vol. 284. P. 547—550.
Lee L.-S. Studies on a new ciliate, Balantidium polyvacuolum
sp. nov., from the intestine of fishes // Acta Hydrobiol. Sinica. 1963.
Vol. 14. P. 81—97.
Levine N. D. Relationship between certain Protozoa and other ani-
mals// Research in Protozoa. 1972. Vol. 4. P. 291—350.
Lipscomb D. L., Riordan G. R. The ultrastructure of Chaenea te-
res and an analysis of the phylogeny of the haptorid ciliates // J. Protozo-
ol. 1990. Vol. 37. P. 287—300.
Lobban C. S., Shefter M., Simpson A. G. B., Pochon A. X.,
Pawlowski J., Foissner W. Maristentor dinoferus n. gen., n. sp., a gi-
ant heterotrich ciliate (Spirotrichea: Heterotrichida) with zooxanthellae,
from coral reefs on Guam, Mariana Island// Marine Biology. 2002.
Vol. 140. P. 411—423. (Supplement — Marine Biology. 2002.
Vol. 141. P. 207—208).
Loeblich A. R., Tappan H. Annotated index to genera, subgenera
and suprageneric taxa of the ciliate order Tintinnida// J. Protozool.
1968. Vol. 15. P. 185—192.
Lom J. Pnspevek к morfologii nalevniku Balantidium elongatum a
B. duodeni // Ceskosl. Parasitol. 1957. Vol. 4. P. 209—217.
Lom J. Beitrage zur Kenntnis der parasitischen Ciliaten aus Ever-
tebraten. III. Neue Arten der Gattung Butschliellopsis de Puytorac 1954
und der Gattung Akidodes n. g.// Arch. Protistenk. 1959. Vol. 103.
P. 457—488.
Lom J. Dogielella sphaerii Polj., a tetrahymenine hymenostome //
J. Protozool. 1961. Vol. 8. Supplement. P. 18.
Lom J. On the buccal apparatus of peritrichous ciliates // Progress
in Protozoology, Proc. 1st Intern. Congr. Protozool., Praha, August
1961 (ed. 1963a). P. 91—95.
Lom J. Discovery of a Tripartiella in the urinary tract of Phoxinus
phoxinus L. II Acta Protozool. 1963b. Vol. 1. P. 1—4.
Lom J. The adhesive disc of Trichodinella epizootica — ultrastruc-
ture and injury to the host tissue // Folia Parasitol. 1973. Vol. 20.
P. 193—202.
Lom J. Rhabdostyla libera sp. n. and Pyxidiella limacidarum sp. n.,
two new species of solitary sessiline peritrichs // Vestn. Ceskosl. Zool.
Spolec. 1977. Vol. 41. P. 41—44.
Lom J., Corliss J. O. Observations on the fine structure of two
species of peritrich ciliates of the genus Scyphidia and on their mode of
attachement to their host // Trans. Amer. Microsc. Soc. 1968. Vol. 87.
P. 493—509.
Lom J., Corliss J. O. Morphogenesis and cortical ultrastructure of
Brooklynella hostilis, a dysteriid ciliate ectoparasite on marine fishes //
J. Protozool. 1971. Vol. 18. P. 261—281.
Lom J., Puytorac P. Sous-classe des Peritrichia Stein, 1859 // Tra-
ite de Zoologie. Anatomie, systematique, biologie / Ed. P. Puytorac.
Vol. 2. Fasc. 2. Infusoires cilies. Paris, 1994. P. 681—737.
ТИП CILIOPHORA. ЛИТЕРАТУРА
989
Lubinsky G. Studies on the evolution of the Ophryoscolecidae (Ci-
liata: Oligotricha). III. Phylogeny of the Ophryoscolecidae based on
their comparative morphology// Canad. J. Zool. 1957. Vol. 35.
P. 141—159.
Lund E. E. The neuromotor system of Oxytricha П J. Morphol.
1935. Vol. 58. P. 257—277.
Lupkes G. Drei neue stygobionte Peritrichen aus dem interstitiel-
len Grundwasser// Arch. Hydrobiol. 1974. Vol. 73. P. 394—402.
Lust S. Symphorionte Peritrichen auf Kafem und Wanzen// Zool.
Jahrb., Abt. Syst. Okol. Geogr. Tiere. 1950. Vol. 79. P. 353—436.
Lynn D. H. The implications of recent descriptions of kinetid
structure to the systematics of the ciliated protists II Protoplasma. 1991.
Vol. 164. P. 123—142.
Lynu D. H. My journey in ciliate systematics // J. Euk. Microbiol.
1996. Vol. 43. P. 253—260.
Lynn D. H. The ciliate resource archiv. Internet Home Page. 2002.
Lynn D. H. Morphology or molecules: how do we identify the ma-
jor lineages of ciliates (phylum Ciliophora)? // Eur. J. Protistol. 2003.
Vol. 39. P. 356—364.
Lynn D. H., Foissner W. The feet of Pseudochlamydonellopsis
plurivacuolata (Ciliophora, Cyrtophorida) and a brief review of tentac-
le-like structures of ciliates// Eur. J. Protistol. 1994. Vol. 30.
P. 423—430.
Lynn D. H., Gilron G. L. Strombidiid ciliates from coastal waters
near Kingston Harbour, Jamaica // J. Mar. Biol. Assoc. UK. 1993.
Vol. 73. P. 47—65.
Lynn D. H., Small E. B. A revised classification of the phylum Ci-
liophora Doflein, 1901 // Rev. Soc. Mexic. Hist. Nat. 1997. Vol. 47.
P. 65—78.
Lynn D. H., Small E. B. Phylum Ciliophora Doflein, 1901 // An il-
lustrated guide to the Protozoa. 2nd ed. / Eds J. J. Lee, G. F. Leedale,
P. C. Bradbury. Lawrence: Society of Protozoologists. 2000 (ed. 2002).
P. 371—656.
Lynn D. H., Struder-Kypke M. Phylogenetic position of Licnop-
hora, Lechriopyla and Schizocaryum, three unusual ciliates (phylum Ci-
liophora) endojymbiotic in echinoderms (phylum Echinodermata) // J.
Euk. Microbiol. 2002. Vol. 49. P. 460—468.
Lynn D. H., Struder-Kypke M., Bradbury P. C. Phylogenetic
position of the apostome ciliates tested using the small subunit rRNA
gene sequence // J. Euk. Microbiol. 2005. Vol. 51. Supplement. P. 7—S.
Lynn D. H., Wright A. D. G., Schlegel M., Foissner W. Phylo-
genetic relationships of orders within the class Colpodea (phylum Cili-
ophora) inferred from small subunit rRNA gene sequence // J. Molec.
Evol. 1999. Vol. 48. P. 605—614.
Mackinnon D. L., Ray H. N. Notes on the ciliate Boveria steven-
si Issel from Galeomma turtoni Sowerby at Plymouth // J. Mar. Biol.
Assoc. U. K. 1931. Vol. 17. P. 577—582.
Madrazo-Garibay M., Lopez-Ochoterena E. Protozoarios cilia-
dos de Mexico. XXXI. Siete especies del genero Scyphidia Dujar-
din (Peritrichida, Olygohymenophorea) у su asociacion con almejas co-
mestibles (Mollusca: Bivalvia) de Laguna Pom, Campeche // Anales
Inst. Cienc. Mar Limnol. Univ. Auton. Mex. 1988. Vol. 15. P. 223—
228.
Matthes D. Die Kiemenfauna unserer Landasseln // Zool. Jahrb.,
Abt. Syst. Okol. Geogr. Tiere. 1950. Vol. 78. P. 573—640.
Matthes D. Suktorienstudien. I. Beitrag zur Kenntnis der Gattung
Discophrya Lachmann // Arch. Protistenk. 1954a. Vol. 99.
P. 187—226.
Matthes D. Suktorienstudien. VI. Die Gattung Heliophrya Saede-
leer und Tellier 1929//Arch. Protistenk. 1954b. Vol. 100. P. 143—152.
Matthes D. Orbopercularia lusti, ein neues peritriches Infusor //
Mikrokosmos. 1955. Vol. 45. P. 57—59.
Matthes D. Suktorienstudien. VIII. Thecacineta calix (Schroder,
1907) (Thecacinetidae nov. fam) und ihre Fortpflanzung durch Vermo-
id-Schwarmer//Arch. Protistenk. 1956. Vol. 101. P. 477—52.8.
Matthes D. Das peritriche Ciliat Cyclodonta bipartita (Stokes) nov.
gen. II Arch. Protistenk. 1958. Vol. 102. P. 481—500.
Matthews D. C. The folliculinids (Protozoa) of Ago Bay, Japan,
and their relation to the epifauna of the pearl oyster (Pinctada rnarten-
sii) II Pacif. Sci. 1968. Vol. 22. P. 232—250.
Matthes D. Rovinjella spheromae nov. gen., nov. spec. (Rovinjelli-
dae nov. fam.), ein mariner Symphoriont // Zool. Anz. 1972. Vol. 189.
P. 266—272.
Matthes D. Suctoria (Sauginfusorien) II Protozoenfauna. Band 7,
Heft 1. Stuttgart; N. Y„ 1988. P. 1—226, 307—309.
Matthes D., Guhl W. Adaptive Reduktion des Wimperapparates
in der Gattung Orbopercularia (Ciliata, Peritricha) // Protistologica.
1973. Vol. 9. P. 349—352.
Matthes D., Scheubel J. Epistylis galea Ehrenberg, ein polymorp-
hes Peritrich// Arch. Protistenk. 1970. Vol. 112. P. 30—64.
Meier M. Parasitische Ciliaten bei Oligochaeten // Arch. Protis-
tenk. 1954. Vol. 100. P. 212—245.
Meunier A. Microplankton des mers de Barents et de Kara. Due
D’Orleans Campagne Arctique de 1907. Bruxelles, 1910. Vol. 1 (texte,
P. 1—355). Vol. 2 (planches).
Miao W., Fen W.-S., Yu Y.-H., Zhang X.-Y., Shen Y.-F. Phylo-
genetic relationships of the subclass Peritrichia (Oligohymenophorea,
Ciliophora) inferred from small subunit rRNA gene sequences // J. Euk.
Microbiol. 2004. Vol. 51. P. 180—186.
Minkiewicz R. Ciliata Chromatophora, nouvel ordre d’infusoires a
morphologie et reproduction bizarres // C. R. Acad. Sci. Paris. 1912a.
Vol. 155. P. 513—515.
Minkiewicz R. Un cas de reproduction extraordinaire chez un pro-
tiste, Polyspira delagei Minkiewicz // C. R. Acad. Sci. Paris. 1912b.
Vol. 155. P. 733—737.
Minkiewicz R. Etudes sur les infusoires syndesmogames, a ga-
montes et a gametes // Bull. Internal. Acad. Polon. Sci. Cracovie, Ser. B.
Sci. Nat. Anneau. 1913. P. 742—749.
Miyashita Y. Uber eine primitive Form von Infusorien — Astoma-
ta Protanoplophrya stomata n. g., n. sp. //Annot. Zool. Japon. 1929.
Vol. 12. P. 289—293.
Mogensen M. M., Butler R. D. Cytological studies of Trichoph-
rya rotunda (Hentschel) // J. Protozool. 1984. Vol. 31. P. 101—111.
Montagnes D. J. S., Lynn D. H. Taxonomy of choreotrichs, the
major marine planktonic ciliates, with emphasis on the aloricate forms //
Mar. Microb. Food Webs. 1991. Vol. 5. P. 59—74.
Montagnes D. J. S., Lynn D. H., Stoecker D. K., Small E. B. Ta-
xonomic descriptions of one new species and redescription of four spe-
cies in the family Strombidiidae (Ciliophora, Oligotrichida) // J. Proto-
zool. 1988. Vol. 35. P. 189—197.
Mugard H. Contribution a I’etude des infusoires hymenostomes
histiophages // Ann. Sci. Nat. Zool. 1948. Vol. 19. P. 173—268.
Mulisch M. Stomatogenesis during metamorphosis of Eufolliculi-
na uhligi (Ciliophora, Heterotrichida) // Eur. J. Protistol. 1987. Vol. 23.
P. 56—65.
Mulisch M., Harry O. G., Patterson D. J., Wyatt C. Folliculi-
nids (Ciliata: Heterotrichida) from Pontaferry, Co Down, including a
new species of MetafolliculinaDons, 1924 //Irish Nat. J. 1986. Vol. 22.
P. 18—25.
Mulisch M., Heep T., Sturm W., Borcherding J. Redescription
of Ascobius lentus, a rare freshwater folliculinid (Ciliophora: Heterot-
richida) from a pond in Germany// Acta Protozool. 1998. Vol. 37.
P. 29—39.
Mulisch M., Patterson D. J. Eufolliculina uhligi, new species, a
new member of the Folliculinidae (Ciliophora), with some comments
on the genus Eufolliculina// Protistologica. 1983. Vol. 19. P. 235—
244.
Munday B. L., O’Donoghue P. J., Watts M., Rough K., Haw-
kesford T. Fatal encephalitis due to the scuticociliate Uronema nigri-
cans in sea-caged, southern bluefin tuna Thunnus maccoyii // Dis. Aqu-
at. Org. 1997. Vol. 30. P. 17—25.
Nanney D. L. Cytogeometric integration in the ciliate cortex //
Ann. New York Acad. Sci. 1972. Vol. 193. P. 14—28.
Ngassam P., Grain J. Six new species of Hysterocinetidae belo-
nging to two new genera Metaptychostomum and Proptychostomum,
endocommensal ciliates of an oligochaete worm in Cameroons // Ann.
Sci. Nat. Zool. 1997. Vol. 18. P. 41—49.
Ngassam P., Grain J. Contribution to the study of the Hysteroci-
netidae ciliates of the genus Ptychostomum. Description of six new spe-
cies // Eur. J. Protistol. 2000. Vol. 36. P. 285—292.
Ngassam P., Grain J. Description of the new genus Hysterocineto-
ides (Ciiophora, Hysterocinetidae) and revision of the systematics of the
subclass Hysterocinetia// Eur. J. Protistol. 2002. Vol. 38. P. 11—17.
Ngassam P., Grain J., Njine Th. Contribution a I’etude des cilies
hysterocinetides: le genre Preptychostomum de Puytorac, 1968 // Ann.
Sci. Nat., Zool. Biol. Anim. 1993. Vol. 14. P. 127—135.
Ngassam P., Grain J., Njine Th. A morphological and ultrastruc-
tural study of Kozloffia catenula de Puytorac, 1968 (Ciliophora, Hyste-
rocinetidae) // Eur. J. Protistol. 1997. Vol. 33. P. 110—116.
Ngassam P., Puytorac P., Grain J. On Paraptychostomum almae
n. g., n. sp., a commensal ciliate from the digestive tract of oligochaetes
of the Cameroons, in a new subclass Hysterocinetia // J. Euk. Microbiol.
1994. Vol. 41. P. 155—162.
Nie D. Morphology and taxonomy of the intestinal protozoa of
the guinea-pig, Cavia porcella// J. Morphol. 1950. Vol. 86. P. 381—
493.
990
ALVEOLATA
Njine T., Ngassam P. Morphogenesis of bipartition in two species
of the genus Ptychostomum (Ciliophora, Hysterocinetidae) // Eur. J.
Protistol. 1994. Vol. 29. P. 396—406.
Noirot-Timothee C. Etude d’une famille des cilies: les Ophryosco-
lecidae. Structures et ultrastructures// Ann. Sci. Nat., Zool., Ser. 12.
Biol. Anim. 1960. Vol. 2. P. 527—718.
Nozawa K. A new primitive hypotrichous ciliate, Kiitricha marina
n. g., n. sp. // Annot. Zool. Japon. 1941. Vol. 20. P. 24—26.
Olmo J. L., Tellez C. An european population of Bryometopus ha-
waiiensis Foissner, 1994 (Protozoa: Ciliophora) // Acta Protozool. 1996.
Vol. 35. P. 317—320.
Orpin C. G., Mathiesen S. D. Microcetus lappus gen. nov.,
sp. nov.: new species of ciliated protozoon from the bovine rumen//
Appl. Environm. Microbiol. 1986. Vol. 52. P. 527—530.
Ozaki Y., Yagiu R. Studies on the marine ciliates of Japan, mainly
from the Setonaikai (the inland sea of Japan). II // J. Sci. Hiroshima
Univ. Ser. B. Div. 1. 1941. Vol. 9. P. 159—180.
Ozaki Y., Yagiu R. Studies on the marine ciliates of Japan, mainly
from the Setonaikai (the inland sea of Japan) // J. Sci. Hiroshima Univ.
Ser. B. Div. 1. 1943. Vol. 10. P. 21—52.
Packroff G., Wilbert N. Taxonomische Studie liber die Ciliatenfa-
una (Protozoa, Ciliophora) der Eifelmaare // Arch. Protistenk. 1991.
Vol. 140. P. 121—139.
Patsch B. Die Aufwuchsciliaten des Naturlehrparks Haus Wilden-
rath. Monographische Bearbeitung der Morphologie und Okologie //
Arb. Inst. Landwirt. Zool. Bienenk. 1974. Vol. 1. P. 1—82.
Paulin J. J. The resorption of cilia in Cyathodinium piriforme // J.
Protozool. 1973. Vol. 20. P. 281—285.
Paulin J. J., Corliss J. O. The somatic and oral infraciliature of
the enigmatic ciliate Cyathodinium piriforme // J. Protozool. 1964.
Vol. 11. P. 438—444.
Paulin J. J., Corliss J. O. Ultrastructural and other observations
which suggest suctorian affinities for the taxonomically enigmatic cilia-
te Cyathodinium// J. Protozool. 1969. Vol. 16. P. 216—223.
Peck R. K. Morphology and morphogenesis of Psuedomicrotho-
rax, Glaucoma and Dexiotricha, with emphasis on the types of stomato-
genesis in holotrichous ciliates// Protistologica. 1974. Vol. 10.
P. 333—369.
Penard E. Etudes sur les infusoires tentaculiferes // Mem. Soc.
Phys, et Hist. Nat. de Geneve. 1920. Vol. 39. P. 131—229.
Penard E. Etudes sur les infusoires d'eau douce. Geneve, 1922.
Petz W., Foissuer W. Morphology and morphogenesis of Strobili-
dium caudatum (Fromentel), Meseres corlissi n. sp., Halteria grandinel-
la (Muller), and Strombidium rehwaldi n. sp., and a proposed phyloge-
netic:system for oligotrich ciliates (Protozoa, Ciliophora) // J. Protozool.
1992. Vol. 39. P. 159—176.
Petz W., Song W., Wilbert N. Taxonomy and ecology of the cilia-
te fauna (Protozoa, Ciliophora) in the endopagial and pelagial of the
Weddell sea, Antarctica// Stapfia. Linz, 1995. Vol. 40. P. 1—223.
Pickering A. D., Strong A. J., Pollard J. Differences in the suc-
cessibility of brown trout, Salmo trutta L., and American brook trout,
Salvelinus fontinalis (Mitchill), to infestation by the peritrich ciliate,
Scyphidia sp. // J. Fish Biol. 1985. Vol. 26. P. 201—208.
Poche F. Das System der Protozoa // Arch. Protistenk. 1913.
Vol. 30. P. 125—321.
Precht H. Epizoen der Kieler Bucht // Nova Acta Leopoldina, N. F.
1935. Vol. 3. P. 405—474.
Prelie A. Contribution a I’etude de Leptopharynx costatus (Mer-
mod) (infusoire cilie) // Bull. Biol. Fr. Belg. 1961. Vol. 95.
P. 731—752.
Prelie A. Quelques aspects de 1’ultrastructure du cilie Leptopha-
rynx costatus Mermod// Protistologica. 1965, ed. 1966. Vol. 1.
P. 23—28.
Pritchard A. A history of the Infusoria, including the Desmidia-
ceae and Diatomaceae, British and foreign. 4th ed. Revised by J. T. Ar-
lidge. L., 1861.
Prost M. Badania nad pierwotniakami pasozytnymi skrzeli ryb. I.
Trichophrya intermedia sp. n. na skrzelach narybku lososia // Ann.
Univ. M. Curie-Sklodowska, Sect. C. 1952. Vol.,6. P. 379—386.
Puytorac P. Sur la presence d'une argyrome chez quelques cilies
astomes // Arch. Zool. Exp. Gen. Notes et Rev. 1951. Vol. 88.
P. 49—58.
Puytorac P. Contribution a I’etude cytologique et taxinomique des
infusoires astomes // Ann. Sci. Nat. Ser. 11. Zool. Biol. Anim. 1954.
Vol. 16. P. 85—270.
Puytorac P. L’infraciliature de quelques cilies Haptophryidae.
Comparaison avec celle de certains thigmotriches // C. R. Acad. Sci. Pa-
ris. 1957. Vol. 244. P. 1962—1965.
Puytorac P. Les Lubetiella nov. gen., cilies endoparasites des vers
Megascolecidae sont la preuve de 1'origine trichostomienne de certains
infusoires astomes // C. R. Acad. Sci. Paris. 1959. Vol. 248.
P. 1579—1582.
Puytorac P. Observations sur quelques cilies astomes des oligoc-
hetes du lac d’Ohrid (Yougoslavie). II. Families des Hoplitophryidae
(Hoplitophryinae et Maupasellinae), des Intoshellipidae et des Anop-
lophryidae // J. Protozool. 1960. Vol. 7. P. 278—289.
Puytorac P. Genres nouveaux des cilies Hysterocinetidae, endopa-
rasites d’Alma (oligochete Criodrilinae) // J. Protozool. 1968a. Vol. 15.
Supplement. P. 42.
Puytorac P. Sur quelques cilies Hysterocinetidae endoparasites de
vers oligochetes au Gabon. Revision de la famille // Biol. Gabonica.
1968b. Vol. 4. P. 241—279.
Puytorac P. Structure et ultrastructure de quatre nouvelles especes
de cilies Hysterocinetidae Diesing // Protistologica. 1968c. Vol. 4.
P. 453—467.
Puytorac P. Les cilies astomes Hoplitophryidae. I. Description de
nouvelles especes // Protistologica. 1969a. Vol. 5. P. 255—268.
Puytorac P. Nouvelles especes de cilies astomes endoparasites d'o-
ligochetes Megascolecidae// Rev. Soc. Mexic. Hist. Nat. 1969b.
Vol. 30. P. 79—95.
Puytorac P. Les cilies astomes Hoplitophryidae. II. Revision de la
systematique de ce groupe // Protistologica. 1972. Vol. 8. P. 5—42.
Puytorac P. (ed.).Traite de Zoogie. Anatomie, systematique, biolo-
gie. Tome 2. Infusoires cilies. Fasc. 2. Systematique. Paris, 1994.
P. 1—880.
Puytorac P., Batisse A., Bohatier J., Corliss J. O. et al. Proposi-
tion d’une classification du phylum Ciliophora Doflein, 1901. (Reunion
de Systematique, Clermont — Ferrand) // C. R. Acad. Sci. Paris. Ser. D.
1974. Vol. 278. P. 2799—2802.
Puytorac P., Didier P., Detcheva R., Groliere C. Sur la morpho-
genese de bipartition et 1’ultrastructure du cilie Cinetochilum margarita-
ceum Perty // Protistologica. 1974. Vol. 10. P. 223—238.
. Puytorac P., Dragesco J. Description de 5 genres nouveaux de ci-
lies astomes Hoplitophryidae endoparasites de vers Glossoscolecidae //
J. Protozool. 1968a. Vol. 15. Supplement. P. 42.
Puytorac P., Dragesco J. Quatre especes nouvelles de cilies asto-
mes chez les Alma emini (Mchlsn) (ver Criodrilinae) du Gabon // Ann.
Stat. Biol. Besse-en-Chandesse. 1968b. Vol. 3. P. 259—266.
Puytorac P., Dragesco J. Description de six genres nouveaux de
cilies astomes Hoplitophryidae endoparasites de vers Glossoscolecidae
au Gabon // Biologia Gabonica. 1969. Vol. 5. P. 5—27.
Puytorac P., Grain J. Structure et ultrastructure de Sicuophora xe-
nopi n. gen., n. sp., cilie heterotriche parasite du batracien Xenopus fra-
seri Boul. // Protistologica. 1968. Vol. 4. P. 405—413.
Puytorac P., Grain J. Etude de la tomitogenese et de 1’ultrastruc-
ture de Collinia orchestiae, cilie apostome sanguicole, endoparasite du
crustace Orchestia gammarella Pallas// Protistologica. 1975. Vol. 11.
P. 61—74.
Puytorac P., Grain J., Groliere C. A., Detcheva R. A propos
de 1'ultrastructure d'un cilie Sphenophryidae: conservatisme ultra-
structural du cortex chez les Infusoires et rameau des Phyllopha-
ryngiens // C. R. Acad. Sci. Paris. Ser. D. 1980. Vol. 290. P. 893—
896.
Puytorac P., Grain J., Mignot J.-P. Precis de protistologie. Paris:
Societe Nouvelle des Editions Boubec. 1987. P. 1—581.
Puytorac P., Juget J. Intoshellina wautieri, sp. nov., cilie astome
parasite de I’oligochaete: Euilyodrilus heuscheri // Bull. Soc. Zool.
France. 1964. Vol. 89. P. 258—263.
Puytorac P., Lom J. La tomitogenese des Collinia, cilies aposto-
mes sanguicoles endoparasites des crustaces // Ann. Paras. Hum. Comp.
1962. Vol. 37. P. 195—209.
Puytorac P., Njine Th. Sur 1’ultrastructure des Loxodes (cilies ho-
lotriches) // Protistologica. 1970. Vol. 6. P. 427—444.
Puytorac P., Oktem N. Observations cytologiques sur les nyctot-
heres des genres Nyctotherus Leidy et Prosicuophora n. gen., cilies pa-
rasites de batraciens anoures du Gabon // Biologia Gabonica; 1967.
Vol. 3. P. 223—243.
Puytorac P., Paret Y. Monstruosites provoquees chez une ophry-
oglene par action du formol sur les trophotomontes // Protistologica.
1965. Vol. 1. P. 67—80.
Puytorac P., Roque M., Tuffrau M. Etude cytologique du cilie
Philaster digitiformis (Fabre-Domergue 1885)// Protistologica. 1966.
Vol. 2. P. 5—16.
Raabe Z. Uber einige an den Kiemen von Mytilus edulis L. und
Macoma balthica (L.) parasitierende Ciliaten — Arten // Ann. Mus.
Zool. Polon. 1934. Vol. 10. P. 289—303.
ТИП CILIOPHORA. ЛИТЕРАТУРА
991
Raabe Z. Sur quelques especes nouvelles d'infusoires parasites des
comatules // Bull. Inst. Oceanogr. Monaco. 1938. N 756. P. 1—11.
Raabe Z. Ambiphrya miri g. n., sp. n. — forma pdsrednia miqdzy
Peritricha — Mobilia a Peritricha — Sessilia // Ann. Univ. Mariae Cu-
rie-Sklodowska. Sectio C. Lublin, 1952. Vol. 6. P. 339—358.
Raabe Z. On the unknown cortical structure in Urceolaria (Cilia-
ta — Peritricha) // Acta Parasitol. Polon. 1961. Vol. 9. P. 153—160.
Raabe Z. Zarys protozoologii. Warszawa, 1964.
Raabe Z. Ordo Thigmotricha (Ciliata — Holotricha). I. // Acta Pro-
tozool. 1967. Vol. 5. P. 1—36.
Raabe Z. Ordo Thigmotricha (Ciliata — Holotricha). II. Familia
Hemispeiridae// Acta Protozool. 1970a. Vol. 7. P. 117—180.
Raabe Z. Ordo Thigmotricha (Ciliata — Holotricha). III. Familiae
Ancistrocomidae et Sphenophryidae// Acta Protozool. 1970b. Vol. 7.
P. 385—463.
Raabe Z. Ordo Thigmotricha (Ciliata — Holotricha). IV. Familia
Thigmophryidae // Acta Protozool. 1971. Vol. 9. P. 121—170.
Raabe Z. Ordo Thigmotricha (Ciliata — Holotricha). V. Familiae
Hysterocinetidae et Protoanoplophryidae// Acta Protozool. 1972.
Vol. 10. P. 115—184.
Raikov I. B., Kovaleva V. G. Complements to the fauna of psam-
mobiotic ciliates of the Japan sea (Posjet Gulf) // Acta Protozool. 1968.
Vol. 6. P. 309—333.
Ray H. On the morphology of Balantidium sushilii n. sp. from
Rana tigrina Daud. //J. Roy. Microsc. Soc. 1932. Vol. 52. P. 374—384.
Rentsch S. Homoiogenesis. I. Gammarus omatus und seine
Schmarotzer. Wismar. 1860. P. 1—134, 1—31.
Rieder J. Critical revision of the literature and new communicati-
ons on the genus Metacineta Butschli (Protozoa, Suctoria) with propo-
sal of a consequentional taxonomy// Arch. Protistenk. 1985. Vol. 130.
P. 201—287.
Ringuelet R. A. Protozoos folliculinidos («Ciliata Heterotricha»)
de la Ant art i da // Notas Mus. Ciudad Eva Peron. Zool. 1953. Vol. 140.
P. 193—204.
Rohrbach F. Paranoplophrya vivipari n. gen. n. sp., ein neuer Cili-
at aus dem Darm von Viviparus unicolor Olivier// Senckenbergiana,
Frankfurt. 1936. Vol. 18. P. 134—143.
Roque M. Recherches sur les infusoires cilies: les hymenostomes
peniculiens // Bull. Biol. France Belg. 1961a. Vol. 95. P. 432—519.
Roque M. Frontoniella marina n. sp. (cilie hymenostome) // Bull.
Inst. Oceanogr. Monaco. 1961b. N 1222. P. 1—11.
Roque M. Frontonia microstoma, Kahl// J. Protozool. 1961c.
Vol. 8. P. 334—341.
Roque M., Puytorac P. Infraciliature d’un nouvel Ophryogleni-
dae: Ichthyophthirioides browni-n. g., n. sp. // Protistologica. 1967 (ed.
1968). Vol. 3. P. 465—473.
Roque M., Puytorac P. Frontonia canadensis sp. nov. (cilie hyme-
nostome peniculien) // Naturaliste Canad. 1972. Vol. 99. P. 411—416.
Rose M. Documents pour servir a I’etude des infusoires cilies apos-
tomes parasites des Siphonophores et des organismes pelagiques//
Arch. Zool. Exp. Gen., Notes et Revue. 1937. Vol. 78. P. 184—198.
Rossolimo L. Parasitische Infusorien aus dem Baikalsee // Arch.
Protistenk. 1926. Vol. 54. P. 468—509.
Rudzinska M. A. Pachystomos oisthus nov. gen., n. sp. 1! Trans.
Amer. Mier. Soc. 1952. Vol. 71. P. 157—158.
Schodel H. Drei neue Peritriche von Gammariden // Arch. Protis-
tenk. 1983. Vol. 127. P. 115—126.
Schodel H. Zwei interessante Epizoen auf dem Brunnen — Flohk-
rebs // Mikrokosmos. 1998. Vol. 87. P. 221—225.
Schodel H. Epistylis loricata n. sp. (Ciliophora, Peritrichia), eine
neue epizoisch auf Jaera istri (Isopoda) lebende Art aus der Main // Lau-
terbomia. 1999. Vol. 36. P. 75—79.
Schodel H. New and rare epizoic peritrichs (Protozoa, Ciliophora)
on ostracods (Arthropoda, Crustacea) with description of a new family,
Bezedniellidae fam. nov. // Lauterbomia. 2004. Vol. 49. P. 107—128.
Schrenk G. Vergleichend — morphologische und systematische
Untersuchungen der Ciliatengattungen Saprodinium und Mylestoma
(Odontostomatida) und ihre verwandtschaftlichen Beziehungen zu den
Heterotrichida// Diss. Fak. Biol. Tubingen. 1989. P. 1—148, ,,
Schrenk H.-G., Bardele C. F. The fine structure of Saprodinium
dentatum Lauterbom, 1908 as a representative of the Odontostomatida
(Ciliophora) // J. Protozool. 1991. Vol. 38. P. 278—293.
Senaud J., Grain J. Etude ultrastructurale preliminaire de Cochli-
atoxum periachtum Gassovsky, 1919, cilie entodiniomorphe endocom-
mensal du cheval // Protistologica. 1972. Vol. 8. P. 65—82.
Shin M. K., Hwang U. W., Kim W., Wright A. D. G., Krawc-
zyk C., Lynn D. H. Phylogenetic position of the ciliates Phacodini-
um (order Phacodiniida) and Protocruzia (subclass Protocruziidia) and
systematics of the spirotrich ciliates examined by small subunit rioso-
mal RNA gene sequences // Eur. J. Protistol. 2000. Vol. 36.
P. 293—302.
Sikama Y. Uber die Weisspunktchenkrankheit bei Seefischen // J.
Shanghai Sci. Inst., Sect. III. 1938. Vol. 4. P. 113—127.
Sikora J. Study on the parasitic ciliate Steinella uncinata (Schult-
ze) // Acta Protozool. 1963. Vol. 1. P. 13—20.
Silen L. On a new Stentor from the west coast of Sweden H Ark.
Zool. 1948. Vol. 40—A. N 8. P. 1—10.
Sirgel W. F. A new ciliate genus Trichodoxa n. g. (Ciliata, Peritric-
ha, Mobilina, Trichodinidae) with two new species from the genital sys-
tem of terrestrial pulmonates // J. Protozool. 1983. Vol. 30.
P. 118—125.
Small E. B. The Scuticociliatida, a new order of the class Ciliatea
(phylum Protozoa, subphylum Ciliophora) // Trans. Amer. Microsc.
Soc. 1967. Vol. 86. P. 345—370.
Small E. B., Lynn D. H. Phylum Ciliophora Doflein, 1901 // An
ilustrated guide to the Protozoa / Eds J. J. Lee, S. H. Hutner, E. C. Bo-
vee. Lawrence, 1985. P. 393—575.
Snoeyenbos-West O. L. O., Cole J., Campbell A., Coats D. W.,
Katz L. A. Molecular phylogeny of phyllopharyngean ciliates and their
group I introns // J. Euk. Microbiol. 2004. Vol. 51. P. 441—450.
Sola A., Guinea A., Longas J. F., Fernandez-Galiano D. Obser-
vations sur 1’infraciliature de Plagiopyla nasuta Stein, 1860 // Acta Pro-
tozool. 1988. Vol. 27. P. 279—286.
Sola A., Guinea A., Longas J. F., Fernandez-Galiano D. Nou-
velles donnees sur 1'infraciliature somatique et buccale de Caenomorpha
uniserialis Levander, 1894 (Ciliophora, Heterotrichida) // Arch. Protis-
tenk. 1990. Vol. 138. P. 233—238.
Sommer G. Die Peritrichen Ciliaten des Grossen Ploner Sees //
Arch. Hydrobiol. 1950. Vol. 44. P. 349—440.
Song W. Descriptions of seven new species of peritrichs on Penae-
us orientalis (Peritricha: Zoothamniidae, Epistylididae) // Acta Zoota-
xon. Sinica. 1986. Vol. 11. P. 225—235.
Song W. Litonotus yinae n. sp. (Protozoa, Ciliophora), a periphytic
and commensal species from Qingdao II Ophelia. 1991a. Vol. 34.
P. 181—189.
Song W. Morphologie und Infraciliatur von Pseudochilodonopsis
marina nov. spec. (Protozoa: Ciliophora), einem marinen Ciliaten aus
Qingdao (V. R. China) // Zool. Jahrb., Abt. Syst. Okol. Geogr. Tiere.
1991b. Vol. 118. P. 79—86.
Song W. A new marine ciliate, Zoothamnium penaei sp. nov. (Cili-
ophora, Peritrichida)// Oceanol. Limnol. Sinica. 1992. Vol. 23.
P. 9,0—94,
Song W. Faunistical studies on some soil ciliates from Qingdao. —
I. Kinetofragminophora, Oligohymenophora, Colpodea // J. Ocean
Univ. Qingdao. 1994. Vol. 24. P. 15—23.
Song W. Preliminary studies on the phylogenetic relationship of
genera within the family Euplotidae (Ciliophora, Hypotrichida) // Ocea-
nol. Limnol. Sinica. 1995a. Vol. 26. P. 527—534.
Song W. Morphological studies on the marine pathogenetic ciliate
Parauronema longum nov. spec. (Ciliophora, Scuticociliatida) // J. Oce-
an Univ, of Qingdao. 1995b. Vol. 25. P. 461—465.
Song W. Morhological and taxonomical studies on some marine
scuticociliates from China sea, with description of two new species,
Philasterides armatalis sp. n. and Cyclidium varibonneti sp. n. (Proto-
zoa: Ciliophora: Scuticociliatida) // Acta Protozool. 2000. Vol. 39.
P. 295—322.
Song W. (ed.). Pathogenic protozoa in mariculture. Qingdao, 2003.
P. 1—483.
Song W., Al-Rasheid Kh. A. S., Hu X. Notes on the poorly —
known marine peritrichous ciliate, Zoothamnium plumula Kahl, 1933
(Protozoa: Ciliophora), an ectocommensal organism from cultured scal-
lops in Qingdao, China // Acta Protozool. 2002. Vol. 41. P. 163—168.
Song W., Bradbury P. C. Studies on some new and rare reported
marine planktonic ciliates (Ciliophora: Oligotrichia) from coastal wa-
ters in North China // J. Mar. Biol. Assoc. U. K. 1998. Vol. 78. P. 767—
794. ...
Song W., Packroff G. Beitrag zur Morphogenese des marinen Ci-
liaten Diophrys scutum (Dujardin, 1841) // Zool. Jahrb., Abt. Anat. On-
tog. Tiere. 1993. Vol. 123. P. 85—95.
Song W., Warren A. A redescription of the marine ciliates Urolep-
tus retractilis (Claparede and Lachmann, 1858) comb. n. and Epiclintes
ambiguus (Muller, 1786) Butschli, 1889 (Ciliophora, Hypotrichida)//
Acta Protozool. 1996. Vol. 35. P. 227—234.
Song W., Warren A., Duode J. I., Wang M., Al-Rasheid Kh. A. S.
New contributions to two heterotrichous ciliates, Folliculina simplex,
Condylostoma curva, and one licnophorid, Licnophora lyngbycola
992
ALVEOLATA
(Protozoa, Ciliophora): descriptions of morphology and infraciliature //
J. Euk. Microbiol. 2003. Vol. 50. P. 449-^162.
Song W., Wilbert N. Taxonomische Untersuchungen an Aufwuc-
hsciliaten (Protozoa, Ciliophora) im Poppelsdorfer Weiher, Bonn // La-
uterbomia. 1989. Vol. 3. P. 2—221.
Song W., Wilbert N. Morphological studies on some free living ci-
liates (Ciliophora: Heterotrichida, Hypotrichida) from marine biotopes
in Qingdao, China, with descriptions of three new species: Holosticha
warreni nov. spec., Tachysoma ovata nov. spec, and T. dragescoi nov.
spec. // Eur. J. Protistol. 1997a. Vol. 33. P. 48—62.
Song W., Wilbert N. Morphological investigations on some free
living ciliates (Protozoa, Ciliophora) from China sea with descriptions
of a new hypotrichous genus, Hemigastrostyla nov. gen. // Arch. Protis-
tenk. 1997b. Vol. 148. P. 413—444.
Song W., Wilbert N. Ciliates from Antarctic sea ice // Polar Biolo-
gy. 2000a. Vol. 23. P. 212—222.
Song W., Wilbert N. Redefinition and redescription of some mari-
ne scuticociliates from China, with report of a new species, Metanoph-
rys sinensis nov. spec. (Ciliophora, Scuticociliatida) // Zool. Anz.
2000b. Vol. 239. P. 45—74.
Song W., Wilbert N. Faunistic studies on marine ciliates from the
Antarctic benthic area, including descriptions of one epizoic form, 6
new species and 2 new genera (Protozoa: Ciliophora) // Acta Protozool.
2002. Vol. 41. P. 23—61.
Song W., Wilbert N., Hill B. F. Description of three endocom-
mensal ciliates from sea urchins in the Weddell Sea, Antarctica (Proto-
zoa, Ciliophora) // Antarctic Research (Chinese Edition). 1994. Vol. 6.
P. 53—61.
Song W., Wilbert N., Warren A. Three new entocommensal ci-
liates from digestive tract of sea urchins of the Weddell Sea, Antarc-
tica (Protozoa, Ciliophora) // Polar Biology. 1999. Vol. 22. P. 232—
240.
Song W., Wilbert N., Warren A. New contribution to the morp-
hology and taxonomy of four marine hypotrichous ciliates from Qing-
dao, China (Protozoa: Ciliophora)// Acta Protozool. 2002. Vol. 41.
P. 145—162.
Sonsino P. Studi sui parassiti di molluschi di acqua dolce nei din-
tomi di Cairo in Egitto // Festchrift zum 70 Geburgstage Rudolf Leuc-
kart. Leipzig, 1892. P. 134—146.
Sramek-Husek R. Dva novi nalevnici z kuze kapra // Rozpra-
vy Ceskosl. Akad. Ved. Rada Mat. Prirodn. Ved. 1953. Vol. 63.
P. 37—43.
Stammer H.-J. Eine neue eigenartige entoparasitische Peritriche,
Operculariella parasitica n. g., n. sp. // Zool. Jahrb., Abt. Syst. Okol.
Geogr. Tiere. 1948. Vol. 77. P. 163—168.
Stein F. Der Organismus der Infusionsthiere nach eigenen Forsc-
hungen in systematischer Reihenfolge bearbeiten. I. Abtheilung. Allge-
meiner Theil und Naturgeschichte der hypotrichen Infusionsthiere. Le-
ipzig, 1859. P. 1—206.
Stein F. Der Organismus der Infusionsthiere nach eigenen Forsc-
hungen in systematischer Reihenfolge bearbeitet. II. Abtheilung. Leip-
zig, 1867. P. 1—355.
Sterki V. On the classification of ciliate Infusoria // Amer. Nat.
1898. Vol. 32. P. 425—428.
Stevens N. M. Further studies on the ciliate Infusoria, Licnophora
and Boveria// Arch. Protistenk. 1904. Vol. 3. P. 1—45.
Stloukal E., Matis D. A new morphological type of peritrich cilia-
tes and a description of Bezedniella prima n. g., n. sp. // Acta Zool.
Univ. Comenianae. 1994. Vol. 38. P. 79—82.
Stoeck Th., Welter H., Seitz-Bender D., Kusch J., Schmidt H. J.
ARDRA and RAPD — fingerprinting reject the sibling species concept
for the ciliate Paramecium caudatum (Ciliophora, Protoctista) // Zool.
Scripta. 2000. Vol. 29. P. 75—82.
Striider M. C. Klassifikation und Phylogenie der Klasse Oligohy-
menophorea de Puytorac et al., 1974 (Protozoa: Ciliophora). Bonn,
1991. P. 1—196.
Striider-Kypke M. C., Lynn D. H. Sequence analyses of the
small subunit rRNA gene confirm the paraphyly of oligotrich ciliates
sensu lato and support the monophyly of the subclasses Oligotrichia and
Choreotrichia (Ciliophora, Spirotrichea) // J. Zool. 2003. Vol. 260.
P. 87—97.
Striider-Kypke M. C., Wright A.-D. G., Fokin S. I., Lynn D. H.
Phylogenetic relationships of the genus Paramecium inferred from
small subunit rRNA gene sequences // Molec. Phylogenet. Evol. 2000a.
Vol. 14. P. 122—130.
Striider-Kypke M. C., Wright A.-D. G., Fokin S. I., Lynn D. H.
Phylogenetic relationships of the subclass Peniculia (Oligohymenopho-
rea, Ciliophora) inferred from small subunit rRNA gene sequences // J.
Euk. Microbiol. 2000b. Vol. 47. P. 419—429.
Striider-Kypke M. C., Wright A.-D. G., Lynn D. H. Small subu-
nit rDNA sequence data confirm the paraphyly of oligotrich ciliates // J.
Euk. Microbiol. 2000. Vol. 47. Supplement. P. 5-A—6-A.
Swarczewsky B. Zur Kenntnis der Baikalprotistenfauna. Die an
den Baikalgammariden lebenden Infusorien..IV. Acinetidae // Arch.
Protistenk. 1928. Vol. 63. P. 362—409.
Swarczewsky B. Zur Kenntnis der Baikalprotistenfauna. Die an
den Baikalgammariden lebenden Infusorien. VII. Lagenophrys, Vagini-
cola und Cothumia // Arch. Protistenk. 1930. Vol. 69. P. 455—532.
Taylor С. V., Furgason W. H. Structural analysis of Colpoda du-
odenaria sp. nov. // Arch. Protistenk. 1938. Vol. 90. P. 320—339,
Taylor D. M., Lynn D. H., Grandsen S. Vasichona opiliophila n.
sp., an ectosymbiotic ciliate (Chonotrichia; Exogemmida) on the maxil-
lae of the snow crab, Chionoecetes opilio // Canad. J. Zool. 1995.
Vol. 73. P. 166—172.
Thaxter R. Contributions from the Cryptogamic Laboratory of
Harvard University. XXVIII. New or peculiar aquatic fungi. 2. Gonapo-
dya Fischer and Myrioblepharis, nov. gen. // Botan. Gazzette. 1895.
Vol. 20. P. 477—485.
Thompson J. C. Ciliated Protozoa from the Antarctic Peninsula //
Antarctic Research Series. 1972. Vol. 20. P. 261—288.
Thompson J. C., Evans F. R. A redescription of Uronema nigri-
cans// J. Protozool. 1968. Vol. 15. P. 369—374.
Thompson J. C., Moewus L. Miamiensis avidus n. g., n. sp., a ma-
rine facultative parasite in the ciliate Oder Hymenostomatida // J. Proto-
zool. 1964. Vol. 11. P. 371—381.
Thompson S., Kirkegaard D., Jahn Th. L. Scyphidia ameiuri, n.
sp., a peritrichous ciliate from the gills of the bullhead, Ameiurus melas
melas// Trans. Amer. Microsc. Soc. 1947. Vol. 66. P. 315—317.
Thurston J. P., Noirot-Timothee C. Entodiniomorph ciliates
from the stomach of Hippopotamus amphibius, with descriptions of two
new genera and three new species // J. Protozool. 1973. Vol. 20.
P. 562—565.
Timoshenko O., Imai S. Eleven new ciliate species of the genus
Triplumaria (Ciliophora, Entodiniomorphida) from Asian elephant,
Elephas maximus, and African elephant, Loxodonta africana // J. Proto-
zool. Research. (Japan). 1995. Vol. 5. P. 157—175.
Timoshenko O., Imai S. Three new intestinal protozoan species of
the genus Latteuria n. g. (Ciliophora: Trichostomatia) from Asian and
African elephants// Paras. Intemat. 1997. Vol. 46. P. 297—303.
Traite. Cm.: Puytorac, 1994.
Trueba F. J. A taxonomic revision of the peritrich ciliate genus
Pyxicola // Beaufortia. 1978. Vol. 27. P. 219—243.
Trueba F. J. A taxonomic revision of the peritrich ciliate genera
Thuricola and Peudothuricola //Beaufortia. 1980. Vol. 30. P. 125—138.
Tuffrau M. Discotricha papillifera, n. g., n. sp., cilic psammobie
de la famille des Trichopelmidae// J. Protozool. 1954. Vol. 1.
P. 183—186.
Tuffrau M. Revision du genre Euplotes, fondee sur la comparaison
des structures superficielles // Hydrobiol. 1960. Vol, 15. P. 1—77.
Tuffrau M. La morphogenese de bipartition et les structures neuro-
motrices dans le genre Apidisca (cilies hypotriches). Revue de quelques
especes // Cah. Biol. Mar. 1964. Vol. 5. P. 173—199.
Tuffrau M. Les differenciations fibrillaires d’origine cinetosomi-
enne chez les cilies hypotriches // Arch. Zool. Exp. Gen. 1965. Vol. 105.
P. 83—96.
Tuffrau M. Les structures fibrillaires somatiques et buccales chez
les cilies heterotriches// Protistologica. Year 196/ (ed. 1968), Vol. 3.
P. 369—394.
Tuffrau M. L’origine du primordium buccal chez les cilies hypot-
riches // Protistologica. 1969. Vol. 5. P. 227—237.
Tuffrau M. Caracteres primitifs et structures evpluees chez des ei-
lies hypotriches: le genre Hypotrichidium// Protistologica. 1972.
Vol. 8. P. 257—266.
Tuffrau M. Une nouvelle espece du genre Euplotidium Noland,
1937: Euplotidium prosaltans n. sp. (cilie hypotriche) // Cah. Biol. Mar.
1985. Vol. 26. P. 53—62.
Tuffrau M., Fleury A. Classe des Hypotrichea Stein, 1859 // Traite
de Zoologie. Infusoires cilies. Vol. 2, fasc. 2 / Ed. P. Puytorac. 1994.
P. 83—151.
Uhlig G. Die Folliculiniden der Deutschen Bucht. I. Magnifollicu-
lina n. g., eine interessante Formengruppe der Epifauna des Sandgrun-
des// Helgol. Wiss. Meeresunters. 1964. Vol. 11. P. 92—109.
Uzmann I., Stickney P. Trichodina myicola n. sp. // J. Protozool.
1954. Vol. 1. P. 149—155.
ТИП CILIOPHORA. ЛИТЕРАТУРА
993
Van As L. L., Van As J. G., Basson L. Licnophora limpetae sp. n.
(Ciliophora: Heterotricha) ectosymbiont of South African limpets //
Acta Protozool. 1999. Vol. 38. P. 249—253.
Van Hoven W., Gilchrist F. M. C., Hamilton-Attwell V. L. In-
testinal ciliated protozoa of African rhinoceros: two new genera and
five new species from the white rhino (Ceratotherium simum Burchell,
1817) // J. Protozool. 1987. Vol. 34. P. 338—342.
Van Hoven W., Gilchrist F. M. C., Hamilton-Attwell V. L. A
new family, genus and seven new species of Entodiniomorphida (Proto-
zoa) from the gut of African rhinoceros // J. Protozool. 1988. Vol. 35.
P. 92—97.
Van Hoven W., Gilchrist F. M. C., Stenson M. O. Six new cilia-
ted protozoan species of Trichostomatida, Entodiniomorphida and Suc-
torida from the intestine of wild African rhinoceros // Acta Protozool.
1998. Vol. 37. P. 113—124.
Vavra J. Epistylis helicostylum n. sp., a new peritrichous ciliate
with an allometric stalk formation // J. Protozool. 1962. Vol. 9.
P. 469—473.
Viljoen S., Van As J. G. Sessile peritrichs (Ciliophora: Peritricha)
from freshwater fish in the Transvaal, South Africa // S. Afr. J. Zool.
1985. Vol. 20. P. 79—96.
Villeneuve-Brachon S. Recherches sur les cilies heterotriches.
Cinetome, argyrome, myonemes, formes nouvelles ou peu connues //
Arch. Zool. Exp. Gen. 1940. Vol. 82. P. 1—180.
Wailes G. H. Chapter 1. Protozoa. If. Ciliata. 1g. Suctoria// Cana-
dian Pacific fauna. Fisheries Research Board of Canada. Toronto, 1943.
P. 1—46.
Wallengren H. Studier dfver Ciliata Infusorier. II. Slagtet Helioc-
hona Plate; slagtet Chilodochona n. g.; slagtet Hemispeira Fabre-Do-
mergue // Lunds Univers. Arsskrift (= Acta Univ. Lund). 1895. Vol. 31.
P. 1—77.
Wang J., Xiao W., Li L. Taxonomical studies on parasitic nyctot-
herans from Chinese Anura amphibians. 2. Parasicuophora // Acta Hyd-
robiol. Sinica. 1998. Vol. 22. Supplement. P. 197—202.
Warren A. A taxonomic revision of the genus Platycola (Ciliopho-
ra: Peritrichida) // Bull. Brit. Mus. (Nat. Hist.). Zool. Ser. 1982. Vol. 43.
P. 95—108.
Warren A. A revision of the genus Vorticella (Ciliophora: Peritric-
hida) II Bull. Brit. Mus. (Nat. Hist.). Zool. Ser. 1986. Vol. 50. P. 1—57.
Warren A. A revision of the genus Pseudovorticella Foissner e't
Schiffmann, 1974 (Ciliophora: Peritrichida)// Bull. Brit. Mus. (Nat.
Hist.). Zool. Ser. 1987. Vol. 52. P. 1—12.
Warren A. A revision of Haplocaulus Precht, 1935 (Ciliophora:
Peritrichida) and its morphological relatives// Bull. Brit. Mus. (Nat.
Hist.). Zool. Ser. 1988. Vol. 54. P. 127—152.
Warren A., Paynter J. A revision of Cothumia (Ciliophora: Perit-
richida) and its morphological relatives // Bull. Brit. Mus. (Nat. Hist.).
Zool. Ser. 1991. Vol. 57. P. 17—59.
Waterhouse G. M. The true nature of Myrioblepharis Thaxter //
Trans. British Mycol. Soc. 1945. Vol. 28. P. 94-—100.
Wenzel F. Die Ciliaten der Moosrasen trockner Standorte // Arch.
Protistenk. 1953. Vol. 99. P. 70—141.
Wermel E. M. Untersuchungen uber Chromidina elegans (Foett.)
Gond. // Arch. Protistenk. 1928. Vol. 64. P. 419—445.
Wichterman R. A new ciliate from a coral of Tortugas and its sym-
biotic zooxanthellae//Pap. Tortugas Labor. 1942. Vol. 33.P. 105—111.
Wicklow B. The Discocephalina (n. subord.): ultrastructure, morp-
hogenesis and evolutionary implications of a group of endemic marine
interstitial hypotrichs (Ciliophora, Protozoa) // Protistologica. 1982.
Vol. 18. P. 299—330.
Wicklow B. J. Ultrastructure and cortical morphogenesis in the
euplotine hypotrich Certesia quadrinucleata Fabre-Domergue, 1885
(Ciliophora, Protozoa) // J. Protozool. 1983. Vol. 30. P. 256—266.
Wicklow B. J., Воггог A. C. Discotricha papillifera: structure and
morphogenesis of a marine interstitial ciliate// J. Protozool. .1977.
Vol. 24. P. 99—108.
Wilbert N. Die Infraciliatur von Marituja pelagica Gajewskaja,
1928 // J. Protozool. 1972. Vol. 19. P. 590—$92.
Wilbert N. Ein neuer colpodider Ciliat aus einer Grassteppe in
Ningerhar, Afghanistan: Colpodidium caudatum nov. gen., nov. spec. //
Arch. Protistenk. 1982. Vol. 125. P. 291—296.
Wilbert N., Buitkamp U. Eine Neubeschreibung von Ctedoctema
acanthocrypta Stokes, 1884 (Ciliata, Scuticociliatida)^ J- Protozool.
1973. Vol. 20. P. 208—210.
Wilbert N., Foissner W. Eine Neubeschreibung von Calyptotricha
lanuginosum Penard, 1922 (Ciliata, Scuticociliatida) // Arch. Protistenk.
1980. Vol. 123. P. 12—21.
Wilbert N., Kahan D. Ciliates of Solar lake on the Red sea shore //
Arch. Protistenk. 1981. Vol. 124. P. 70—95.
Wolska M. A rare case of Balantidium coli in the caecum of a hor-
se// Bull. Acad. Polon. Sci., Ser. Sci. Biol. 1962. Vol. 10. P. 425—
429.
Wolska M. Infraciliature of Didesmis ovalis Fior. and Blepharozo-
um trizonum (Hsiung), fam. Buetschliidae (Ciliata, Rhabdophorina) //
Acta Protozool. 1964a. Vol. 2. P. 153—157.
Wolska M. Studies on the representatives of the family Paraisotric-
hidae da Cunha (Ciliata, Trichostomata). I. Somatic infraciliature in the
genus Paraisotricha Fior. and Rhizotricha g. n. // Acta Protozool. 1964b.
Vol. 2. P. 213—224.
Wolska M. Division morphogenesis in the genus Didesmis Fior. of
the family Buetschliidae (Ciliata, Gymnostomata) // Acta Protozool.
1966a. Vol. 4. P. 15—18.
Wolska M. Study on the family Blepharocorythidae Hsiung. I. Pre-
liminary remarks // Acta Protozool. 1966b. Vol. 4. P. 97—103.
Wolska M. Study on the family Blepharocorythidae Hsiung.
III. Raabena bella gen. n., sp. n. from the intestine of the Indian elep-
hant // Acta Protozool. 1967. Vol. 4. P. 285—290.
Wolska M. Spirocorys indicus Wolska, 1969 a ciliate from the in-
testine of Indian elephant, its systematic position // Acta Protozool.
1970. Vol. 8. P. 143—147.
Wolska M. Studies on the family Blepharocorythidae Hsiung.
VI. Phylogenesis of the family and the description of the new genus Cir-
codinium gen. n. with the species C. minimum (Gassovsky, 1918)//
Acta Protozool. 1971. Vol. 9. P. 171—194.
Wolska M. Tripalmaria dogieli Gass., 1918 (Ciliata, Entodinio-
morphida). Structure and ultrastructure. Part I. Light — microscope in-
vestigations // Acta Protozool. 1978a. Vol. 17. P. 13—20.
Wolska M. Light and electron microscope studies on Ochoterenaia
appendiculata Chavarria (Ciliata, Blepharocorythida) // Acta Protozool.
1978b. Vol. 17. P. 483—492.
Wolska M. Studies on the genus Triadinium Fior. (Ciliata, Entodi-
niomorphida). Comparison of Triadinium galea Gass, and T. caudatum
Fior. // Acta Protozool. 1981. Vol. 20. P. 357—365.
Wright A.-D. G., Colorni A. Taxonomic re-assignment of Crypto-
caryon irritans, a marine fish parasite // Eur. J. Protistol. 2002. Vol. 37.
P. 375—378.
Wu I. С. H., Curds C. R. A guide to the species of the genus As-
pidisca// Bull. Brit. Mus. (Nat. Hist.). Zool. Ser. 1979. Vol. 36.
P. 1—34.
Xiao W.-H., Wang J.-G., Li L.-X. Taxonomic studies of parasitic
nyctotherans from Chinese Anura amphibians. III. Wichtermania II
Zool. Studies (Taiwan). 2002. Vol. 41. P. 69—76.
Xu K., Meng F., Cao J., Song W. Morphological studies on the
thigmotrichine ciliate, Ancistrum crassum Fenchel, 1965 on the gills of
short-necked clam// J. Ocean Univ. Qingdao. 1997. Vol. 27.
P. 466—470.
Xu K., Song W. Morphological studies on a commensal cilia-
te, Pseudocyclidium longum nov. spec. (Ciliophora, Scuticociliatida)
of the mantle cavity of marine mollusc Cyclina sinensis (Gmelin,
1791) from the coast of the Yellow Sea// Yellow Sea. 1998. Vol. 4.
P. 1—4.
Xn K., Song W. Study of some pathogenetic ciliates from the man-
tle cavity of marine molluscs// J. Fish. Sci. China. 1999. Vol. 6.
P. 41—45.
Xu K., Song W. Studies on pathogenetic ciliates from marine mol-
luscs. I. Rhynchodida ciliates (Protozoa, Ciliophora) // J. Ocean Univ.
Qingdao. 2000a. Vol. 30. P. 217—223.
Xu K., Song W. Studies on pathogenetic ciliates from marine mol-
luscs. III. Thigmotrichine ciliates (Protozoa, Ciliophora, Scuticociliati-
da) // J. Ocean Univ. Qingdao. 2000b. Vol. 30. P. 230—236.
Yagiu R. On the genus Ephelota (Ciliophora, Suctoria) from the
coasts of Izu Peninsula and Niijima. 1980. Edited by Biological Labora-
tory, Imperial Household. Tokyo. P. 1—15 (in English), 1—11 (in Japa-
nese).
Zick K. Urceolaria korschelti n. sp., eine neue marine Urceolarine,
nebst einem Uberblick fiber die Urceolarinen // Z. Wiss. Zool. 1928.
Vol. 132. P. 355—403.
63 Зак. №4163
994
ТИП MICROSPORIDIA
Тип MICROSPORIDIA Balbiani,
Высокоспециализированные одноклеточные ами-
тохондриальные эукариоты, паразитирующие в клет-
ках животных всех систематических типов. ГТре-
спорогональные стадии представлены амебоидными
клетками, которые размножаются бинарным или мно-
жественным делением. В процессе спорогонии образу-
ют сложно устроенные одноклеточные споры со свой-
ственным только микроспоридиям аппаратом экстру-
зии — комплексом органелл, осуществляющих выброс
полярной трубки и зародыша из споры и проведе-
ние зародыша по каналу трубки непосредственно
в клетку хозяина. Размножение большинства микро-
споридий происходит бесполым путем. Половой про-
цесс типа гаметоцитогамии описан у нескольких поли-
морфных диксенных микроспоридий, образующих
3 типа спор и паразитирующих в двукрылых насеко-
мых и ракообразных.
История изучения
История изучения микроспоридий насчитывает бо-
лее полутора веков. В 1838 г. Глюге (Gluge, 1838) опи-
сал микроспоридий как организмы неизвестной приро-
ды, вызывающие у рыб образование ксеном.* В после-
дующие сорок лет публиковались сообщения об их
находках у нематод (Bischoff, 1855) и у членистоногих,
в основном у насекомых (Leidig, 1858; Pasteur, 1870).
Однако природа и систематическое положение микро-
споридий определены не были.
В 1882 г. Бальбиани опубликовал работу о принад-
лежности микроспоридий к споровикам Sporozoa.
Впоследствии это положение было опровергнуто, но в
ту эпоху стало шагом вперед, так как после признания
микроспоридий одноклеточными организмами их ис-
следование приняло более целенаправленный харак-
тер. Уже на ранних этапах изучения микроспоридий
было выяснено огромное отрицательное значение этих
паразитов в таких отраслях хозяйственной деятельно-
сти человека, как шелководство и пчеловодство.
Наиболее продолжительный и продуктивный этап
светомикроскопических исследований микроспори-
дий длился с 1883 по 1960 г. Предположение Баль-
биани о родстве микроспоридий с миксоспоридиями
(также ошибочное) поддержал Телоан (Thelohan,
1895), первым обнаруживший у спор микроспоридий
полярные нити. Из-за несовершенства оптики многие
артефакты («швы» на оболочке спор вследствие фик-
сации, ложная многоядерность) трактовались в пользу
родства этих двух групп паразитов. Много внимания
уделялось жизненным циклам микроспоридий: были
описаны мерогония и спорогония, показано, что у по-
лиспоровых видов весь спорогональный плазмодий в
отличие от миксоспоридий превращается в споры.
В конце XIX в. Лаббе (Labbe, 1899) включает мик-
роспоридий вместе с актиномиксидиями, миксоспори-
* Ксенома — гипертрофированная вследствие инвазии микро-
споридий клетка или группа клеток животного-хозяина, окружен-
ная соединительно-тканной капсулой.
1882 — МИКРОСПОРИДИИ
днями и саркоспоридиями в один класс Cnidosporidia.
В свете современных данных интересно его предполо-
жение о возможной принадлежности микроспоридий к
дрожжевым грибам. Лаббе первым, суммируя опубли-
кованные данные, приводит в списке 3 рода и более
35 видов микроспоридий. Через 10 лет число видов
возрастет вдвое (Auerbach, 1910). Система в пределах
отряда микроспоридий, учитывающая особенности
спорогонии и морфологию спор, наиболее полно пред-
ставлена в монографии Кудо (Kudo, 1924). С неболь-
шими модификациями она не теряла своего значения
почти 50 лет. В эти же годы впервые были показаны
одноклеточный характер спор и наличие у них только
одного или двух ядер, а не нескольких, как это счита-
лось ранее (Jirovec, 1936).
С 1959 г. началось интенсивное изучение стадий
жизненного цикла микроспоридий и патологии инва-
зированной клетки животного-хозяина методами элек-
тронной микроскопии. Был выявлен уникальный план
тонкого строения спор, и показана обособленность
микроспоридий от других групп одноклеточных эука-
риотов. В результате ранг микроспоридий был поднят
от отряда до типа (Sprague, 1977; Weiser, 1977). Впер-
вые были описаны диксенные жизненные циклы с раз-
витием микроспоридий в двух хозяевах, образование
одним видом двух и даже трех типов спор, половой
процесс (Pilley, 1976; Sweney et al., 1985, 1988). Боль-
шое разнообразие тонкого строения клеток стадий
спорогонии и спор, жизненных циклов микроспори-
дий значительно расширило круг таксономических
признаков, сделав возможным описание новых форм,
что привело к увеличению числа родов в 10 раз, а ви-
дов — почти в 5 раз (преимущество получили моноти-
пцчные роды).
В 60-е гг. в России также началось изучение мик-
роспоридий, паразитирующих в насекомых сельско-
хозяйственного, медицинского и ветеринарного значе-
ния, а также в рыбах и многих гидробионтах, служа-
щих кормовой базой рыб (Исси, 1986; Воронин, 1986,
1999).
На основании особенностей тонкой организации
клеток стадий спорогонии, в первую очередь спор
(Исси, 1986) и жизненных циклов, в частности нали-
чия полового процесса (Sprague et al., 1992; Воронин,
2001), были предложены новые системы типа Микро-
споридии. Однако следует признать, что все современ-
ные системы носят временный (утилитарный) харак-
тер. По единодушному мнению микроспоридиологов,
действительный объем видов микроспоридий будет
многократно превышать объем уже описанных форм
и, следовательно, при новых описаниях будут выяв-
ляться и использоваться новые таксономические кри-
терии. Поэтому в современном, последнем по времени
издания определителе простейших характеристики ро-
дов микроспоридий приведены по алфавиту без указа-
ния их принадлежности к таксонам более высокого
ранга (Canning, Vavra, 2000).
В 80-е гг. прошлого столетия началось изучение
физиологии микроспоридий и процессов метаболиз-
ма в клетках паразитов и их хозяев в целях выяв-
ТИП MICROSPORIDIA
995
ления механизмов патогенности. Для определения
степени родства между отдельными группами мик-
роспоридий или между микроспоридиями и другими
организмами начали использовать биохимические
и молекулярно-биологические методы. Обобщающей
исследования этих лет стала монография «The Micro-
sporidia and Microsporidiosis» (Wittner, Weiss, 1999),
состоящая из обзорных статей микроспоридиологов,
работающих в разных странах, включая Россию.
В книгу вошли работы по молекулярной биологии и
филогении микроспоридий, по их биохимии и физио-
логии (Weiss, Vossbrinck, 1999 (Weidner et al., 1999).
Состояние исследований конца XX в. по микроспори-
диям насекомых отражено в обзоре Соколовой и Исси
(2001). Использование молекулярной биологии при
изучении филогенетических взаимоотношений мик-
роспоридий приводит к построению систем, значи-
тельно отличающихся от систем, созданных на основе
морфологических критериев. В то же время новые
методы подтвердили высказанные ранее предполо-
жения о разном происхождении некоторых морфо-
логически близких форм, как это происходит сейчас с
видами сборного рода Nosema. Эти перспективные на-
правления микроспоридиологии подошли к этапу ин-
тенсивного развития в наступившем новом веке.
Основная проблема, которую необходимо решить для
построения новой системы микроспоридий, наиболее
достоверно отражающей филогенетические связи
входящих в этот тип форм, — это совмещение данных,
полученных биохимическими и молекулярно-биоло-
гическими методами и методом морфологического
анализа.
Последний этап изучения микроспоридий как па-
разитических одноклеточных эукариотов, адаптиро-
ванных к развитию в клетках билатеральных жи-
вотных всех систематических типов (с единственным
пока известным случаем заражения животного с лу-
чевой симметрией — пресноводной гидры), поставил
перед исследователями вопросы о месте микроспори-
дий в системе живых организмов, о времени их про-
исхождения и о их родственных связях с другими орга-
низмами. На основании наличия у микроспоридий
хитина в оболочке спор, сходства последователь-
ностей альфа- и бета-тубулинов, а также у половины
известных форм — диплокариотического ядерного
аппарата,* что свойственно грибам, Кавалье-Смит (Ca-
valier-Smith, 1998) сделал заключение о происхожде-
нии микроспоридий от грибов. Однако при этом со-
временные данные не позволяют однозначно судить
о том, представляют ли собой микроспоридии по-
томков митохондриальных одноклеточных грибов
(близких дрожжевым), сильно редуцированных вслед-
ствие перехода к внутриклеточному паразитизму, или
же их сходство с грибами может быть объяснено про-
исхождением от общей предковой формы. Исходя
из этого Карпов (2000) поместил микроспоридий в
основание филогенетического древа, давшего начало
грибам.
Японские исследователи (Hashimoto, Nasegawa,
1996), изучавшие филогенетические взаимоотноше-
ния амитохондриальных протистов путем анализа
аминокислотных последовательностей трансляци-
онных факторов элонгации (EF-la и EF-2) и синтеза
изолейцил- и валил-ТРНК (ileRS и valRS) синтетаз,
пришли к выводу, что все исследованные ими груп-
пы представляют собой рано оформившиеся ветви
эукариотных организмов, причем к самой древней
группе они отнесли микроспоридий. Чуть позже у
микроспоридий выделили митохондриальный хит-шо-
ковый белок hsp70, что свидетельствует в пользу утери
ими митохондрий и вторичности их амитохондриаль-
ного статуса (Germot et aL, 1997). Однако даже данные
о возможном происхождении микроспоридий от гри-
бов не опровергают мнения о том, что микроспори-
дии — древнейшие из эукариотных паразитов, сохра-
нившие примитивные признаки, не связанные с редук-
цией вследствие паразитизма.
Классификация
На современном уровне описан незначительный, в
сравнении с ожидаемым, объем видов микроспоридий,
поэтому предлагаемые системы известных форм носят
временный и главным образом утилитарный характер.
Классификация микроспоридий подвергается непре-
рывным перестройкам на основе использования новых
таксономических признаков, полученных при изуче-
нии тонкого строения, жизненных циклов, цитохими-
ческих и молекулярно-биологических свойств как но-
вых, так и известных форм (Исси, 1986; Sprague et al,
1992; Baker et al., 1994; Воронин, 1999; Weiss, Voss-
brinck, 1999).
Общепризнано разделение типа на два класса, один
из которых включает формы микроспоридий, образу-
ющие в конце коротких жизненных циклов споры
с примитивным аппаратом экструзии, а другой — бо-
лее сложно организованные формы с моно- или дик-
сенными жизненными циклами, завершающимися об-
разованием одного-двух-трех типов спор с хорошо
развитым аппаратом экструзии. При подразделении
на отряды и семейства основное внимание уделено
строению в основном стадий спорогонии, типу ядер-
ного аппарата, хромосомным и жизненным циклам
(Воронин, 2001).
Тип MICROSPORIDIA Balbiani, 1882
Класс METCHNIKOVELLIDEA Weiser, 1977
Отряд Metchnikovellida Vivier, 1975
Класс MICROSPOREA Corliss et Levine, 1963
Подкласс HAPLOPHASEA Sprague, Becnel et Hazard, 1992
Отряд CHYTRIDIOPSIDA Weiser, 1977
Отряд GLUGEIDA Issi, 1986
Подкласс DIHAPLOPHASEA Sprague, Becnel et Hazard,
1992
Отряд MEIODIHAPLOPHASIDA Sprague, Becnel et
Hazard, 1992
Отряд DISSOCIODIHAPLOPHASEA Sprague, Becnel et
Hazard, 1992
* Следует отметить, что диплокарион микроспоридий и дика-
рион грибов существенно различаются: ядра первых считаются
инертными, ядра вторых — сексуально различны.
996
ТИП MICROSPORIDIA
Общие представления
о микроспоридиях
Микроспоридии (Microsporidia) — одноклеточные
эукариоты, паразитирующие в клетках животных поч-
ти всех систематических типов. Им свойственны свое-
образные черты организации, сочетающей эукариот-
ные и прокариотные признаки. Их споры содержат
уникальный комплекс органелл, известный только для
микроспоридий, — аппарат экструзии, который пред-
назначен для заражения клетки хозяина путем прокола
ее оболочки и вбрасывания зародыша непосредствен-
но в цитоплазму. Функционально спора микроспори-
дий превращена в живой шприц. Механический спо-
соб переноса зародыша из споры в клетку животно-
го-хозяина также неизвестен для других протистов и,
будучи примитивным, говорит о древности этих орга-
низмов. (Аналогичным способом попадают в клетку
бактерий наиболее примитивные вирусы — бактерио-
фаги, а также простейшие, паразитирующие в клетках
водорослей или высших растений).
Микроспоридии имеют морфологически оформ-
ленное ядро, но их геном — наименьший из известных
для других эукариот (он даже меньше генома некото-
рых бактерий), а митоз носит форму закрытого внут-
риядерного плевромитоза.
У микроспоридий нет митохондрий, гидрогеносом
и пероксисом, но наличие митохондриального шапе-
рона — хит-шокового белка hsp70 — свидетельствует
об утере ими митохондрий в процессе адаптации к об-
лигатному внутриклеточному паразитизму. Аппарат
Гольджи примитивного типа. Рибосомы зародыша
микроспоридий, спороплазмы, представлены монори-
босомами, не агрегированными в полирибосомы, и по
своим физическим (коэффициенту седиментации),
биохимическим и молекулярно-биологическим (по-
следовательности участков рРНК, устанавливаемой
сиквенированием) показателям соответствуют рибосо-
мам прокариотов по наличию субъединицы 70S и по
слиянию субъединицы 5.8S, свойственной эукариотам,
с большой субъединицей рРНК (Ishihara, Hayashi,
1968; VossbrincK, Woese, 1986). Кроме того, клет-
ка микроспоридий лишена лизосом, центриолей,
запасных питательных веществ, жгутиков и других
органелл движения. Наличие хитина, альфа- и бета-ту-
булинов, сходных с грибными (Hirt et al., 1997), дипло-
кариотический ядерный аппарат некоторых микроспо-
ридий, а также молекулярно-биологические характе-
ристики дали возможность предположить родство
этих протистов с дрожжевыми грибами. Но не сущест-
вует ни одного современного таксона царства Fungi, к
которому можно отнести микроспоридий. Давний пе-
реход микроспоридий к паразитическому образу жиз-
ни, глубокая адаптация к внутриклеточному парази-
тизму, обусловленные этим изменения в геноме и в об-
менных процессах, ультраструктурная перестройка их
клетки, по нашему мнению, рано увели микроспори-
дий в сторону от основного направления эволюции
эукариотных одноклеточных и многоклеточных орга-
низмов. Свободноживущие предки микроспоридий,
которые могли быть общими с грибами или с водорос-
лями, не известны.
О раннем переходе микроспоридий к паразитизму
свидетельствует их широкое распространение среди
животных всех систематических групп, от других про-
стейших до высших позвоночных, включая человека.
К настоящему времени описано более 140 родов и
1200 видов микроспоридий, преобладающее число ви-
дов паразитирует у членистоногих, в основном у насе-
комых и ракообразных, у некоторых из них выявлено
несколько видов паразитов разных родов. Например, у
личинок хирономуса Chironomus plumosus (Diptera),
частого объекта лабораторных исследований, описано
около 10 видов микроспоридий. Наиболее многочис-
ленны и разнообразны микроспоридии у гетеротопных
насекомых, сменяющих водный образ жизни на назем-
ный, — у кровососущих комаров Culicidae, кома-
ров-звонцов Chironomidae и мошек Simuliidae. Бурное
видообразование хозяев привело к не менее бурному
видообразованию паразитов. Предполагается, что пол-
ный объем видов микроспоридий будет превосходить
объемы видов насекомых и ракообразных взятых вме-
сте, достигнув нескольких миллионов. Поэтому один
из крупнейших микроспоридиологов XX в. Виктор
Спрэг (Sprague, 1977) назвал микроспоридий объектом
исследований XXI в.
Морфология и ультратонкое
строение стадий жизненного
цикла
Микроспоридии проходят развитие внутри клетки
животного-хозяина. Абсолютное большинство видов
локализуется в цитоплазме, в более редких случаях —
в ядре клетки, или в перинуклеарном пространстве
(между двух мембран), или в углублении ядра. Зараже-
ние клетки происходит путем механического прокола
ее оболочки полярной трубкой, выстреливаемой с
большой силой из споры, и ввода по ее каналу зароды-
ша микроспоридий — спороплазмы непосредственно
внутрь клетки. Вне организма хозяина микроспоридии
могут выжить какое-то время, только достигнув ста-
дии зрелой споры.
В процессе развития микроспоридии проходят ста-
дии спороплазмы, меронтов первой и второй мерого-
нии (преспорогональная часть цикла), споронта, спо-
робласта и споры (спорогональная часть цикла). При
светооптических исследованиях все внутриклеточные
преспорогональные стадии представлены амебоид-
ными клетками с одним, несколькими или многими
ядрами. Электронно-микроскопические исследования
также выявили чрезвычайную простоту строения пре-
спорогональных стадий и сложное строение спор, осо-
бенности которого широко используются в системати-
ке микроспоридий (рис. 387, 388, 399).
Спороплазма — инвазионная стадия, представле-
на одиночным ядром (или диплокарионом), окружен-
ным тонким слоем цитоплазмы с монорибосомами.
При нахождении в споре она не имеет собственной
оболочки и по каналу выброшенной из споры по-
лярной трубки «протискивается» ядро (диплокарион)
паразита (рис. 389). Можно сказать, что в клетку хозя-
ина вбрасывается геном микроспоридий. Но в клетке
ТИП MICROSPORIDIA
997
Рис. 387. Ультратонкое строение стадий развития микроспоридий (кроме спор). (По: Vavra, 1976а, 1976b).
Строение оболочки клетки: 1 — обычная плазматическая мембрана меронта; 2 — мембрана с пузырчатыми выростами меронтов Caudospora и Telomyxa;
3 — мембрана с волосовидными выростами Tuzetia debaisieuxi; 4 — оболочка споронта из двух мембран Inodosporus; 5 — секреция на поверхность оболочки
споронта электронноплотного секрета, образующего впоследствии оболочку спорофорного пузырька (Т. debaisieuxi); 6 — сформировавшиеся оболочки
споры и спорофорного пузырька Т. debaisieuxi (двухмембранный комплекс покрыт слоем электронноплотного вещества, образующего трубчатые выросты в
полость спорофорного пузырька); 7 — оболочка споронта Nosema algerae, состоящая из мембраны, толстого слоя умеренной электронной плотности и тон-
кого мембраноидного слоя; 8 — оболочка споронта N. apis (из зимующих пчел) с трубчатыми выростами мембраны экзоспоры; 9 — оболочка стадий споро-
гонии (двухмембранный комплекс покрыт тонким слоем гранул — Nosema, Caudospora)', 10 — оболочка клетки и сдиндосома Pleistophora sp. из дафнии;
11 — оболочка спорогонального плазмодия Amblyospora bracteata с секреторными гранулами в полости спорофорного пузырька; аг — атипичный аппарат
Гольджи; зэс — шероховатая эндоплазматическая сеть; кп — полость пузырька; мм — плазматическая мембрана меронта; мс — плазматическая мембрана
споронта; ос — оболочка споронта; on — оболочка спорофорного пузырька; сг — секреторные гранулы; ст — секреторные трубочки; сц — сдиндосома;
те — трубочки веретена; цп — центриолярная пластинка; цт — цитоплазматические трубочки; х — хромосома; эп — эндоплазматический пузырек; эр —
эндоплазматический ретикулум; я — ядро; ядр — ядрышко.
Fig. 387. Fine structure of microsporidian stages (except spore).
Structure of cell plasma membrane: 1 — ordinary plasmatic membrane of meront; 2 — plasmatic meront membrane with small blisters of Caudospora и Telomyxa-, 3 —
«hairy» plasmatic membrane of Tuzetia debaisieuxi meront; 4 — two-membranes wail of sporont of Inodosporus', 5 — electron-dense secretory material on external
side of sporont wall — future wall of sporophorous vesicle (Г. debaisieuxi)', 6—spore wall and envelope of sporophorous vesicle of T. debaisieuxi (2-membraned com-
plex covered with electron-dense layer with tubular structures lying in lumen of sporophorous vesicle); 7—a sporont wall of Nosema algerae, consisting of membrane,
thick electron-dense layer and thin membranoid layer; 8 — a sporont wall ofN. apis (from wintering bees) with tubular structures of exospore membrane; 9 — wall of
sporogonial stages (2-membranes complex cjvered with thin granular layer—Nosema, Caudospora)', 10— a cell wall Pleistophora sp. from Daphnia; 11 — a sporogo-
nial plasmodium wall of Amblyospora bracteata with secretory granules in episporontal space of sporophorous vesicle; аг — atypical Golgi apparatus; зэс — granular
endoplasmic reticulum; кп — lumenof vesicle; мм — plasmatic membrane of meront; мс — plasmatic membrane of sporont; oc — sporontal wall; on — membrane of
vesicle; сг — secretion granules; cm — secretion tubules; сц — scindosome; me — tubules of spindle; цт — cytoplasmatic tubules; x — chromosome; эп — endoplas-
matic vesicle; эр — endoplasmatic reticulum; я — nucleus; ядр — nucleolus.
хозяина спороплазма уже окружена собственной плаз-
матической мембраной толщиной около 7 нм, про-
исхождение которой составляет предмет дискуссии.
Размеры этой кратковременной стадии не превышают
0.5—1.0 мкм. Через несколько часов спороплазма уве-
личивается в размерах, в ее цитоплазме появляется
шероховатая эндоплазматическая сеть (ШЭР) — она
превращается в меронт, пролиферативную стадию жиз-
ненного цикла микроспоридий.
Меронт представляет собой округлую клетку с
одиночным или парным ядром, которая интенсивно
растет и размножается. После нескольких ядерных де-
лений образуются двухъ- или многоядерные формы.
Многоядерный плазмодий имеет либо сферическую
998
ТИП MICROSPORIDIA
Рис. 388. Ультратонкое строение споры микроспоридий (схема).
(По: Исси, 1986).
зв — задняя вакуоль, мс — плазматическая мембрана споры, п — постеро-
сома, пд — полярный якорный диск, nnl — передняя часть поляропласта,
пп2 — задняя часть поляропласта, пт — полярная трубка, эк — экзоспора,
энд — эндоспора, я — ядро.
Fig. 388. Fine structure of microsporidian spore.
зв — posterior vacuole, мс — plasmatic membrane of spore, n — posterosome,
nd — anchoring polar disc, nn — polaroplast, nnl — auterior part of polaroplast,
nn2 — posterior part of polaroplast, nm — polar tube, эк — exospore, энд — en-
dospore, я — nucleus.
Рис. 389. Экструзия полярной трубки и спороплазмы (схема).
1 — интактные споры, 2—5 — вывертывание полярной трубки и прохожде-
ние по ее каналу спороплазмы, 6 — экструзия спороплазмы, 7 — спороплаз-
ма после экструзии.
Fig. 389. Extrusion of polar tube and sporoplasm.
I — intact spores, 2—5 — polar tube everted and the sporoplasm passes through
the tube, 6 — extrusion of the sporoplasm, 7 — sporoplasm after extrusion.
ТИП MICROSPORIDIA
999
форму и ядра, расположенные по всему объему цито-
плазмы, либо лентовидную — с расположением ядер в
один-два ряда по всей его длине, либо форму «розет-
ки» (ромашки) с ядрами, расположенными по перифе-
рии в выступах плазмодия. После периода роста мно-
гоядерные клетки делятся, вновь образуя клетки с оди-
ночным или парным ядром (рис. 390, вкл.). У многих
видов, особенно при бинарном делении клеток, меро-
гония повторяется. Размножение происходит до пол-
ного заселения всей цитоплазмы клетки хозяина
(рис. 391, вкл.).
Плазматическая мембрана клетки меронта у боль-
шинства микроспоридий гладкая. Но в цитоплазме
клетки хозяина вокруг меронта часто видны трубчатые
структуры или мелкие вакуоли — свидетели интенсив-
ных обменных процессов и секреторной деятельности
паразитов. Цитоплазма меронтов содержит гладкую и
шероховатую эндоплазматическую сеть, рибосомы и
примитивный, состоящий из тонких трубчатых струк-
тур аппарат Гольджи. Другие органеллы в клетках ме-
ронтов микроспоридий не обнаружены.
У наиболее примитивных микроспоридий сем. Met-
chnikovellidae, паразитирующих в грегаринах, меро-
гония либо отсутствует, либо очень кратковременна.
У высокоорганизованных форм микроспоридий опи-
саны 2 последовательные мерогонии, которые завер-
шаются образованием мерозоитов. При световой мик-
роскопии меронты первой мерогонии имеют мелкие,
ярко окрашивающиеся ядра, клетки второй мерогонии
отличаются от них крупными (после фиксации углова-
тыми) и слабо окрашиваемыми ядрами и сильно разви-
той ШЭР, представленной многочисленными канала-
ми и цистернами. Закончив период пролиферации,
микроспоридии приступают к спорогонии.
Ядра микроспоридий — самые мелкие среди
эукариот. Меронты имеют от одного до нескольких
одинаковых ядер либо одиночного, либо парного рас-
положения. Одиночные ядра (монокарионы) сфери-
ческие, реже овальные или бобовидные, их диа-
метр варьирует у разных видов в пределах 1—3 мкм
(рис. 392, А, вкл.), достигая самых маленьких величин
(0.5—2 мкм) в споре. Ядра диплокариона имеют фор-
му двух полусфер, образующих при контакте единую
сферу (рис. 392, В, вкл.). В зоне контакта ядер ядерные
поры отсутствуют. Меронты первой и второй мерого-
нии могут различаться по организации ядерного аппа-
рата.
Строение ядерного аппарата по одиночному или
диплокариотическому типу — важный таксономиче-
ский признак, отличающий монокариотические и дип-
локариотические формы микроспоридий. На протяже-
нии всего развития 40 % родов микроспоридий имеют
одиночные ядра, 14 — диплокарионы, у 46 % родов
происходит перестройка ядерного аппарата.
Клетки микроспоридий лишены центриолей. Цент-
ры организации микротрубочек митотического верете-
на представлены у них центриолярными пластинками,
сходными с таковыми дрожжевых грибов. Это элект-
ронноплотные диски на внешней и внутренней сторо-
нах ядерной оболочки (рис. 392, Г, вкл.). В цитоплаз-
ме клетки, в непосредственной близости от пластинок,
расположены 3—6 мелких пузырьков, ограниченных
мембраной — NAO (nucleus associated organelles), функ-
ция которых неизвестна. Нуклеоплазма обычно гомо-
генна, ядрышки четко видны при переходе к споро-
гонии.
Деление ядер микроспоридий происходит по типу
закрытого внутриядерного плевромитоза, с сохранени-
ем ядерной мембраны и внутриядерным расположени-
ем веретена деления (рис. 392, Д, вкл.). Оба ядра дип-
локариона делятся синхронно. Синаптонемальные
комплексы, свидетельствующие о наличии редукцион-
ного деления и обнаруженные менее чем у половины
родов микроспоридий, выявлены при преобразовании
диплокариотических мерозоитов в монокариотиче-
ские стадии спорогонии (рис. 392, Е, вкл.). Они пред-
ставлены 2—3 электронноплотными пластинками око-
ло 100 нм ширины. Полйкомплекс обнаружен только у
одного вида. В то же время у микроспоридий, на всем
протяжении развития имеющих либо монокариотиче-
ский (Encephalitozoon), либо диплокариотический (No-
sema) ядерный аппарат, мейоз не выявлен и ген-маркер
мейоза не обнаружен (Logsdon et al., 1997).
В ядрах микроспоридий содержится небольшое
число слабоконденсированных хромосом, от 8 до 18, в
зависимости от вида.
Геном микроспоридий — самый маленький для
эукариотов, его размеры находятся в пределах 2.3—
19.5 м. п. н. Так, для паразита человека Encephalitozo-
оп intestinalis он равен 2.3 м. п. н. (Peyretaillade et al.,
1998), а для паразита сверчка Paranosema grylli —
3.5 м. п. н. (Насонова и др., 1998). В то же время ми-
нимальный размер генома эукариотной клетки —
20 м. п. н., а размеры геномов бактерий находятся в
пределах 0.8—-9.2 м. п. н. (Trewors, 1996).
В результате секвенирования генома Е. cuniculi
(Katinka et aL, 2001) выявлены общий размер, равный
2.9 м. п. н., наличие 11 хромосом и 1997 белок-кодиру-
ющих генов и отмечена тенденция к компактизации,
свойственная большинству внутриклеточных парази-
тов. На основе изучения последовательностей ДНК в
11 хромосомах зависимость микроспоридий от клетки
хозяина проиллюстрирована потерей генов в боль-
шинстве биосинтетических процессов. Многие муль-
тикопийные гены представлены одной или ограничен-
ным числом копий. Также показано, что у Е. cuniculi
отсутствуют тандемные повторы генов рибосомаль-
ных РНК, и на каждой хромосоме выявлено только по
две копии гена рРНК. Очень интересен факт выявле-
ния у микроспоридий гена обратной транскриптазы,
говорящий о возможности микроспоридий либо асси-
милировать гены своих хозяев, либо встраиваться в их
геном (Weidner et al., 1999). Кроме того, гены микро-
споридий, гомологичные генам других организмов,
значительно короче. В геноме микроспоридий прак-
тически отсутствуют интроны и имеется ген, коди-
рующий хитин-синтетазу, свойственную дрожжевым
грибам.
Споронт представляет собой начальную стадию
спорогонии. Его морфологическое отличие от предше-
ствующих стадий заключается в появлении вокруг
клетки паразита второй наружной мембраны, выяв-
ляемой только при электронном микроскопирова-
нии. Обычно она возникает в виде электронноплотно-
го материала, откладываемого на мембране меронта
(рис. 393, А, вкл.). Отдельные участки этого материала
1000
ТИП MICROSPORIDIA
постепенно смыкаются и плотным слоем покрывают
мембрану меронта. Этот слой может быть гладким, как
у Neoperezia chironomi, или покрытым рядами гранул,
как у Anncaliia meligethi (рис. 393, Б, В, вкл.). Для спо-
ронта характерно интенсивное функционирование ап-
парата Гольджи, играющего основную роль в процес-
сах спорогенеза, главным образом, в продуцировании
многочисленных мембранных образований в цито-
плазме клетки паразитов и в формировании аппарата
экструзии.
Споронты — единственная стадия спорогонии,
способная к размножению. (Крайне редко споронты
дают 2 поколения клеток). Ядро споронта претерпева-
ет от одного до многих делений. В результате деления
двухъ- или многоядерных спорогональных плазмоди-
ев образуются споробласты. Число ядерных делений
споронта и количество образующихся споробластов,
затем спор служат одними из важнейших таксономи-
ческих критериев рода.
У многих микроспоридий в период спорогонии
снаружи от оболочки споронта (чаще многоядерного)
закладывается еще одна, образующая оболочку споро-
форного пузырька (по старой терминологии — пан-
споробласта). Оболочка спорофорного пузырька по-
степенно отдаляется от оболочки спорогонального
плазмодия, между ними возникает полость, в которой
завершает свое развитие поколение клеток, образовав-
шихся из споронта (рис. 394, вкл.).
Оболочки спорофорных пузырьков у разных ро-
дов микроспоридий закладываются на разных этапах
развития и имеют достаточно сложное строение. По
времени закладки оболочки делятся на меронтогенети-
ческие и споронтогенетические. У микроспоридий ро-
дов Pleistophora и Vavraia они окружают паразитов
уже на стадии мерогонии (Canning, Hazard, 1982), но у
абсолютного большинства видов их появление совпа-
дает с началом спорогонии. В этом случае наружная
оболочка споронта образует серию мелких или круп-
ных пузырьков (блистеров), иногда трубчатых структур,
направленных в цитоплазму клетки хозяина (рис. 394,
вкл.). Мембрана этих образований постепенно смыка-
ется и либо отделяется от оболочки споронта, образуя
полость пузырька, либо остается плотно прижатой к
споронту до выхода спор паразита во внешнюю среду.
У микроспоридий Holobispora thermocyclopis до-
полнительная оболочка образуется на стадии споро-
бласта, а ее отслоение происходит после созревания
спор при их попадании в воду. Такую оболочку можно
назвать споробластогенетической. Эти три типа оболо-
чек различаются не только по времени образования, но
и функционально: первые два регулируют отношения
между клетками паразита и хозяина, третий — между
клеткой паразита и внешней средой. Сами оболочки
бывают однослойными или состоят из нескольких сло-
ев, имеющих мембраноидное, мембранное, трубчатое
или нитчатое строение.
Для многих микроспоридий характерна сфериче-
ская форма спорофорных пузырьков (рис. 395, вкл. и
399, В, Г, Д, К, Л, вкл.). У паразитов водных насекомых
пузырьки могут быть оснащены придатками в виде
длинных нитей {Trichoduboscqia), или остаются соеди-
ненными между собой {Pegmatheca, Parapleistophora),
или сильно разбухают в воде, образуя слизистые сфе-
ры {Neoperezia) (рис. 395, А, вкл.). Вероятно, при этом
повышается плавучесть спор (удельный вес спор
микроспоридий больше такового воды) или они луч-
ше удерживаются на водных растениях, что удлиняет
сроки возможных контактов паразита с новым хо-
зяином.
Полость спорофорных пузырьков либо абсолют-
но прозрачна, либо заполнена трубчатыми структу-
рами или гранулами секрета, форма и размеры кото-
рых характерны для каждого вида микроспоридий
(рис. 396, вкл.). Иногда секрет представлен плотными
скоплениями материала, образующего тельца почти
такого же размера, как споробласты паразита {Tabanis-
pora bacillifera). Эти признаки также имеют таксоно-
мическое значение.
Споробласт образуется в результате деления спо-
ронта и представляет собой переходную стадию от
этой морфологически просто устроенной клетки к
имеющей сложную организацию споре. Именно на
этой стадии происходит морфогенез органелл, свойст-
венных споре. Основная роль в морфогенезе аппарата
экструзии принадлежит аппарату Гольджи.
Аппарат Гольджи микроспоридий представлен
скоплениями тонких трубчатых структур, ограничен-
ных гладкой мембраной и соединенных с эндоплазма-
тической сетью (Sokolova et al., 2001) (рис. 397, вкл.).
На стадии меронтов трубчатые структуры аппарата
Гольджи не заполнены секретом и представляют собой
примитивный цис-Гольджи (рис. 397, А, вкл.), участ-
вующий в образовании внешней оболочки споронта
(Canning, Nicholas, 1980). В начале формирования ап-
парата экструзии сеть трубочек заполняется секретом
(рис. 397, Б, вкл.) и достигает значительных размеров,
занимая иногда до трети объема клетки споробласта.
В этот момент аппарат Гольджи имеет вид рыхлой
сферы (рис. 397, В, вкл.). Витки полярной трубки, об-
разующиеся внутри этой сферы, в «готовом виде» по-
ступают в цитоплазму клетки паразита. Таким обра-
зом, не вызывает сомнений, что основная роль аппара-
та Гольджи состоит в формировании аппарата
экструзии (Vavra, 1976в).
Одновременно с образованием полярной трубки к
переднему полюсу будущей споры от ядра мигрирует
зачаток полярного якорного диска, представленный
электронноплотным материалом, заключенным в ва-
куоль (рис. 398, вкл.). Достигнув полюса, он принима-
ет форму гриба или арбалета. В процессе дальнейшего
спорогенеза базальный прямой участок полярной
трубки своим основанием прикрепляется к якорному
диску, лежащему под наиболее тонким участком обо-
лочки споры, и соединяется со спиральными витками
трубки, расположенными под оболочкой в задней по-
ловине споры. Основание полярной трубки проходит
по центру плотно уложенных мембран, образующих
поляропласт. Поляропласт отделен от оболочки споры
полярным саком, в виде зонтика прикрывающим эту
структуру (рис. 398, вкл.). По окончании формирова-
ния аппарата экструзии образуются споры.
Спора — завершающая стадия в развитии микро-
споридий. Ее функции — сохранение (обычно кратко-
временное) инвазионного начала во внешней среде и
заражение новой особи хозяина. Споры микроспори-
дий, несмотря на очень мелкие размеры, представляют
ТИП MICROSPORIDIA
1001
собой сложно организованную клетку. Обязательными
компонентами спор микроспоридий любого уровня
организации являются зародыш, аппарат экструзии
(примитивный или сложный) и оболочка, состоящая у
большинства видов из трех слоев.
Форма спор у большинства видов овальная, реже
грушевидная, почковидная, кеглевидная, шаровидная
или палочковидная. Размеры спор преимущественно
укладываются в пределы от 2.5 до 5.5 мкм в длину и от
1.5 до 2.5 мкм в ширину (рис. 399, вкл.). Исключением
служат очень мелкие или очень длинные споры. Так,
например, диаметр сферических спор Enterocytozoon
bieneusi около 1 мкм, а длина спор Bacillidium filiferum
достигает 40 мкм. С учетом их размеров споры мик-
роспоридий лежат в пределах 1—40 мкм в длину и
0.2—5.4 мкм в ширину. В отличие от дрожжей, раз-
меры клеток которых сильно различаются, споры мик-
роспоридий одного вида имеют близкие размеры. Спо-
ра микроспоридий — единственная стадия, способная
выжить какое-то время вне организма хозяина. Однако
ее трудно назвать покоящейся стадией, так как она все-
гда готова к заражению восприимчивого хозяина.
Зародыш (спороплазма), расположенный в центре
споры между поляропластом и задней вакуолью, защи-
щен с боков витками полярной трубки, лежащими в
один или два слоя. Он представлен одиночным ядром
или диплокарионом, окруженным узкой зоной обезво-
женной цитоплазмы. В этой зоне тесно к ядру прилега-
ют 2—6 рядов спирально расположенных рибосом с
коэффициентом седиментации 70S, с субъединицами
50S и 30S. На стадии споры ядро имеет наименьшие
размеры, обычно не превышающие 1—2 мкм. Собст-
венной цитоплазматической мембраны у зародыша
нет (рис. 400, вкл.).
Аппарат экструзии состоит из полярной труб-
к и (ПТ) (ее наличие обязательно для всех представи-
телей типа), поляропласта, якорного диска,
полярного сака и задней вакуоли. Якорный
диск имеет форму шляпки гриба, арбалета, реже сферы
(Canningia) и расположен на переднем полюсе споры
(рис. 398, вкл.). К нему прикреплено основание ПТ,
проходящей через центр поляропласта. В световом
микроскопе у живых спор поляропласт виден как пе-
редняя вакуоль, занимающая от 1/4 до 1/2 объема спо-
ры. По данным электронной микроскопии, поляро-
пласт большинства видов представлен «кипой» плотно
уложенных мембран, образованных стенками сплю-
щенных пузырьков. Пластины ориентированы перпен-
дикулярно длинной оси споры. Кроме пластинчатого
поляропласта описаны геликоидальный и везику-
лярный (из крупных или мелких камер), а также гра-
нулярный, трубчатый или из концентрических сфер
(рис. 401, вкл.). Поляропласт часто состоит из двух
или трех участков, обычно передний образован плотно
уложенными мембранами, в то время как задний мо-
жет быть из рыхлых мембран, или из везикул, или
из трубочек. У высокоорганизованных микроспоридий
поляропласт сконцентрирован у переднего полюса
споры, у более примитивных форм сем. Chytridiopsi-
dae и у видов рода Thelohania он полностью или час-
тично расположен по длине ПТ, у самых примитивных
микроспоридий представлен несколькими вакуолями
(рис. 388).
Поляропласту приписывают две функции. Во-пер-
вых, создание высокого внутриспорового давления (до
30—60 атм.), необходимого для выворачивания «наиз-
нанку» и выброса ПТ. Предполагается, что высокое
давление создает процесс, сходный с надуванием воз-
душных шариков, — когда под влиянием внешнего
импульса мембраны сплющенных пузырьков раздви-
гаются и резко увеличивают свой объем, превращаясь
в вакуоли (Lom, Vavra, 1963). Во-вторых, участие в уд-
линении ПТ путем «надставки» ее мембранами поля-
ропласта (Weidner, 1972).
Самая характерная органелла микроспоридий —
ПТ различно устроена при нахождении внутри споры
и после выброса из нее. Внутри споры — это длинная
структура, ограниченная двумя мембранами и запол-
ненная по оси веществом умеренной электронной
плотности. После выброса из споры и выворачивания
наизнанку трубка становится полой (Vavra, 1976а, Ь).
Длина выброшенной ПТ колеблется от 2 до 400 мкм
(у большинства видов лежит в пределах 20—60 мкм),
т. е. может в десятки раз превосходить длину спо-
ры, а иногда и собственную длину при нахождении в
споре.
От якорного диска, к которому прикреплено ее
основание, ПТ идет назад и, не доходя до ядра, повора-
чивает к боковой стенке, ложась спиральными витка-
ми вокруг зародыша и в задней трети споры. Число
спиральных витков уменьшается по мере созревания
споры, и в зрелой споре большинства видов постоян-
но, служа надежным таксономическим признаком.
Преимущественно число витков колеблется в пределах
6—12, но у некоторых форм достигает 30—36. Витки
очень длинной ПТ лежат не в. один, а в два-три
слоя. Каждому виду также свойственен свой угол на-
клона передних витков к длинной оси споры, который
варьирует в пределах 30—90°. Однако имеются виды
микроспоридий, у которых длина ПТ не превышает
или незначительно превышает длину самой споры.
Это представители примитивных микроспоридий
сем. Metchnikovellidae, а также виды отряда Chytridio-
psida и сем. Cylindrosporidae.
По особенностям своего строения ПТ разделены на
несколько типов (рис. 402, вкл.). У большинства видов
ее диаметр по всей длине почти одинаков — это и з о -
филярная трубка. У видов сем. Amblyosporidae
диаметр первых витков значительно превышает диа-
метр последних с резким переходом от одного диамет-
ра к другому — это анизофилярная трубка. Незна-
чительная разница в диаметрах передних и последних
витков ПТ характеризует слабоанизофилярные
трубки. В сем. Mrazekidae толстый прямой участок
трубки — манубрий переходит в тонкий, образу-
ющий витки, хлыст. У микроспоридий из водных
членистоногих описаны трубки, у которых при близ-
ком по всей длине диаметре серии передних и задних
витков различаются внутренним строением, а один ви-
ток на границе между ними отличается от всех осталь-
ных — это гетерофилярные трубки (Воронин,
1989). У примитивных форм трубка имеет форму ма-
нубрия. У видов сем. Chytridiopsidae короткая толстая
трубка покрыта снаружи структурой, похожей на пче-
линые соты, вероятно камерами примитивного поляро-
пласта.
1002
ТИП MICROSPORIDIA
Стенка трубки состоит из двух мембран: наружной,
двухслойной, и внутренней из спирально лежащих
фибрилл. Ось трубки заполнена гликопротеинами, при
выворачивании трубки образующими вокруг нее до-
полнительный футляр. Возможно, что гликопротеины
содержат вещества, подавляющие защитные реакции
клеток хозяина (Weidner, 1972).
Задняя вакуоль образована одной или несколькими
камерами, ограничена оболочкой, имеет разные разме-
ры у разных видов, иногда в ее полости лежит постеро-
сома — рудимент аппарата Гольджи. В спорах некото-
рых видов задней вакуоли нет.
Трехслойная оболочка споры состоит из экзо-
споры, эндоспоры иплазматической мемб-
раны (рис. 403, вкл.). Экзоспора образована гранула-
ми гликопротеинов, реже представлена мембранами. У
некоторых родов (Atfvenia, Episeptum, Napamichum,
Trichotuzetia) экзоспора многослойная, у других (Cau-
dospora') образует выросты. Благодаря наличию вырос-
тов, придатков или слизистых капсул форма спор до-
стигает большого разнообразия. Особенно характерны
придатки для спор микроспоридий, паразитирующих
у водных и гетеротопных насекомых. Их роль такая
же, как у придатков спорофорных пузырьков. Удель-
ный вес спор микроспоридий значительно больше
удельного веса воды, а различные придатки или слизи-
стые капсулы способствуют увеличению объема и пла-
вучести спор или их задержанию в биотопе насекомо-
го, повышая надежность встречи с новыми особями
хозяина. Разрастания экзоспоры ведут к появлению та-
ких эписпоровых образований, как «хвосты» и «плав-
ники» (Caudospora, Jirovecia, Hrabeyia), гребни и реб-
ра (Amblyospora, Golbergia, Weiseria), пучки длинных
фибрилл на переднем и заднем полюсах (Cristulospo-
rd), или на заднем полюсе и по «экватору» (Hirsutospo-
ros), или только на заднем полюсе (Trichoctosporea),
или с одного бока вблизи заднего полюса (Larssoniel-
la), или же появляются одиночные фибриллы по всей
поверхности (Ringueletium). У других микроспоридий
две споры остаются соединенными вместе м е ж с п о -
ровой перемычкой (Gurleyides, Issia, Norlevinea)
или сферой, намного превышающей размеры спор (Se-
пота). Трубчатые эписпоровые выросты, заметные то-
лько при электронном микроскопировании, известны
для Ameson и Anncaliia.
Под экзоспорой лежит электронно-прозрачная эн-
доспора. Она достигает 0.4 мкм толщины и состоит в
основном из хитина, устойчивого ко многим фермен-
там. На переднем полюсе споры, восприимчивом к
внешним стимулам, ее слой более тонок и образуется
позже, чем по остальному объему споры (рис. 400).
Эндоспору следует рассматривать как одну из состав-
ляющих комплекса органелл аппарата экструзии. На-
личие толстой эндоспоры делает возможным поддер-
жание высокого внутриспорового давления, иниции-
рующего экструзию ПТ и зародыша. Действительно,
виды микроспоридий, споры которых имеют тонкую
эндоспору или лишены ее вообще, как правило, отли-
чаются короткими полярными трубками и слабо разви-
тым поляропластом.
Вследствие различий в толщине разных участков
экзоспоры и эндоспоры фиксация вызывает деформа-
цию спор, характерную для рода или вида. Особенно
сильно изменяется форма спор микроспоридий, пара-
зитирующих на водных насекомых (рис. 399, вкл. и
400, вкл.).
Самый внутренний слой оболочки спор — цито-
плазматическая мембрана, заключающая зародыш
вместе со всеми органеллами аппарата экструзии.
Большинство родов микроспоридий — мономорф-
ные формы, им свойственна одна спорогония и образо-
вание спор одного типа. 36 родов (около 20 %) микро-
споридий, паразитирующих на высших насекомых —
двукрылых (роды Amblyospora и Parathelohania), че-
шуекрылых (род Vairimorpha) и перепончатокрылых
(род Burenella) — диморфные или полиморфные фор-
мы с двумя или тремя типами спорогонии и образова-
нием двух или трех типов спор. Третий тип спор обра-
зуется в том же самом или в дополнительном хозяи-
не — циклопе.
Размножение микроспоридий
Основной тип размножения, свойственный микро-
споридиям, — это бесполое размножение на всем про-
тяжении их жизненного цикла, за исключением завер-
шающего этапа. Половой процесс описан у видов двух
полиморфных родов микроспоридий.
Бесполое размножение микроспоридий происхо-
дит на этапах мерогонии и в начале спорогонии либо
бинарным делением клетки, которое следует сразу же
за делением ядра на два дочерних, либо множествен-
ным делением многоядерного плазмодия (рис. 404).
Множественное деление происходит различным, ха-
рактерным для каждого вида, образом. При шизого-
нии ядра мигрируют на периферию плазмодия, выпя-
чивая оболочку с участком цитоплазмы и образуя пе-
ред делением розетковидную форму (розетковидное
деление). В отличие от классического почкования в
этом делении участвует вся цитоплазма материнской
клетки. При плазмотомии вокруг ядер, располо-
женных по всему объему плазмодия, обособляются
участки цитоплазмы. Плазмотомия бывает единовре-
менной или поэтапной. В первом случае плазмодий
сразу делится на число клеток, соответствующее числу
ядер или диплокарионов. Во втором — плазмодий по-
степенно делится на части со все меньшим числом
ядер. Вакуолетомия (вакуоляция) описана для
Nolleriapulicis (Beard et al., 1990). Она характеризуется
тем, что в центре плазмодия образуется вакуоль, кото-
рая, распространяясь к периферии плазмодия, посте-
пенно отделяет участки цитоплазмы с ядрами друг от
друга (Vavra, Larsson, 1999). Для микроспоридий, ин-
тенсивно размножающихся во время мерогонии, ха-
рактерно образование из одного споронта 1-—4 спор, а
для видов, процессы мерогонии которых дают неболь-
шое число особей, свойственна полиспоробластиче-
ская спорогония.
Половой процесс у микроспоридий описан по ста-
тичным картинам, полученным по данным световой и
электронной микроскопии видов со сложными цикла-
ми развития. Впервые кариогамия и мейоз установле-
ны для микроспоридий рода Amblyospora на этапе пе-
рехода от мерогонии к спорогонии (Hazard, Brookbank,
1984). В дальнейшем для нескольких видов этого рода
ТИП MICROSPORIDIA
1003
Рис. 404; Типы деления многоядерных плазмодиев микроспоридий (схема).
А — плазмотомия, Б — поэтапная плазмотомия, В — вакуолетомня, Г — розетковидное почкование.
Fig. 404. Types of dividing of multinucleated microsporidian plasmodia.
A — plasmotomy, Б — gradual plasmotomy, В — vacuoletomy, Г— shisogony (rosette budding).
показано на_этапе мерогонии, проходящей в гемоцитах
личинок насекомых, образование овальных клеток с
папиллой, сосочком на одном полюсе (или грушевид-
ных клеток), которые рассматриваются в настоящее
время как гаметы. В результате попарного слияния
цитоплазмы таких одноядерных клеток (плазмога-
мии) и тесного сближения их ядер образуется дипло-
кариотическая клетка. На следующих этапах развития
насекомых происходит, завершая половой процесс,
слияние ядер диплокариона. Эта форма полового про-
цесса названа гаметоцитогамией (Vavra, Larsson,
1999).
Физиология и биохимия
микроспоридий
При пероральной передаче паразитов экструзия ПТ
и зародышей микроспоридий из спор происходит под
воздействием пищеварительных ферментов хозина.
Факторы, инициирующие этот процесс при трансова-
риальной, трансплацентарной или перкутанной пе-
редачах, еще не изучены. Однако известно, что гонот-
рофический цикл у самок двукрылых насекомых
(слепней и комаров) — регулируемое гормонами со-
зревание партии яиц после каждого кровососания —
провоцирует также экструзию спороплазм у части
спор микроспоридий, развившихся в эпителии яични-
ков. В экспериментальных условиях экструзию можно
вызвать самыми разными реагентами. Сам процесс эк-
струзии до сих пор остается слабо изученным, предпо-
лагается, что он представляет собой крайне специали-
зированную модификацию процесса экзоцитоза.
Микроспоридии как облигатные внутриклеточные
паразиты относятся к анаэробам. Утеряв в процессе
адаптации к внутриклеточному паразитизму собствен-
ные митохондрии, микроспоридии с первых же минут
своего развития нуждаются в экзогенной АТФ, проду-
цируемой митохондриями хозяина, став, таким обра-
зом, паразитами на энергетических системах инвази-
рованной клетки. Показано наличие у микроспоридий
переносчиков, обеспечивающих транспорт АТФ хозя-
ина в клетку паразита (Katinka et al., 2001). Усиление
энергетического обмена зараженной клетки сопровож-
дается повышением концентрации фосфогексоз, АТФ,
соотношения АТФ/АДФ и снижением содержания
энергетических резервов (гликогена и триглицеридов)
(Долгих, 1997, 2002; Weidner et al., 1999).
Ярким свидетельством «бурных» взаимоотноше-
ний микроспоридий с клеткой хозяина служит наличие
вокруг пролиферативных стадий паразитов многочис-
ленных филаментов или трубочек различного диамет-
ра (а иногда и выростов цитоплазматической мембра-
ны), синтезируемых клеткой паразита. По данным им-
мунологии, они представляют собой промежуточные
филаменты класса кератинов, аналогичных кератинам
млекопитающих. В конце развития микроспоридий все
эти структуры исчезают, а на их месте в цитоплазме
клеток хозяина образуются «пустоты» — участки ми-
нимальной электронной плотности.
Во внешней среде споры вынуждены поддерживать
обмен самостоятельно. В качестве энергетического ре-
зерва микроспоридии используют дисахарид трегало-
зу. Высокая концентрация трегалозы служит, с одной
стороны, энергетическим резервом (Долгих, Семенов,
2003), а с другой — создает осмотическое давление,
необходимое для экструзии ПТ. Споры, завершающие
развитие микроспоридий, не представляют собой по-
коящиеся стадии, поскольку для них характерен высо-
кий уровень метаболической активности ферментов, в
1004
ТИП MICROSPORIDIA
частности ферментов гликолиза (Долгих и др., 1997).
Однако конечные продукты анаэробного катаболизма
трегалозы у микроспоридий остаются до настоящего
времени неизвестными.
Жизненные циклы
Заражение микроспоридиями обычно происходит
при попадании спор в пищеварительный тракт живот-
ного-хозяина, где воздействие ферментов приводит к
активации спор и экструзии ПТ и зародышей. Экстру-
зия по своей быстроте сравнима с выстрелом и вклю-
чает восприятие спорой импульса, создание высокого
внутриспорового давления, эвагинацию (выворачива-
ние) ПТ и проталкивание по ее каналу спороплазмы.
ПТ обладает определенной жесткостью и пробивает
стенку клетки хозяина (или клеток, если это происхо-
дит при заражении мелких членистоногих), вводя в нее
спороплазму. Заражение клетки хозяина осуществля-
ется механически, путем перфорации клеточной мемб-
раны, что не известно для других протистов, паразити-
рующих в животных (Weidner, 1976). Большинство
микроспоридий локализуется в цитоплазме клеток, но
несколько видов развивается в ядре или в перинукле-
арном пространстве. Спороплазмы, не попавшие в
клетку, погибают.
Развитие микроспоридий начинается с момента
проникновения зародыша в клетку определенной тка-
ни восприимчивого животного-хозяина. Обычно раз-
витие от спороплазмы до споры происходит в преде-
лах одной клетки или же клетки и ее потомства в том
случае, когда пролиферативные стадии паразитов при
делении зараженной клетки распределяются между
дочерними клетками, создавая очаг инвазии. У позво-
ночных животных в распространении паразитов участ-
вуют защитные клетки крови, которые транспортиру-
ют споры или спороплазмы по кровяному руслу. Осе-
дая на восприимчивых тканях, они создают первичные
очаги инвазии в непосредственной близости от крове-
носных сосудов.
Спороплазма растет и превращается в меронт —
пролиферативную стадию, которая размножается би-
нарным или множественным делением до тех пор,
пока это позволяет энергетика зараженной клетки
хозяина. По завершении мерогонии паразиты присту-
пают к спорогонии. Споронт у большинства микро-
споридий — последняя стадия жизненного цикла, спо-
собная к размножению. Как редкое исключение, из-
вестное только для рода Glugea, было описано
дополнительное бинарное деление споробластов (spo-
roblast mother cells) (Canning et al., 1982b). В одной из
последних работ (Canning, Vavra, 2000) такое дополни-
тельное деление на этапе спорогонии описывается и у
микроспоридии Pleistosporidium, но теперь эти стадии
названы первыми (материнскими) и вторыми (дочер-
ними) споронтами. Обычно ядра споронтов делятся от
одного до нескольких раз. Образовавшиеся спорого-
нальные плазмодии имеют лентовидную, розетковид-
ную или сферическую форму. Значительно реже из од-
ного споронта образуются один споробласт и одна
спора. Стадии спорогонии развиваются либо в прямом
контакте с цитоплазмой клетки хозяина, либо в поло-
сти спорофорного пузырька. Иногда стадии на всем
протяжении развития или на каком-то его этапе отде-
ляются от остального объема клетки хозяина ее струк-
турами, образующими паразитофорную вакуоль. Все
эти особенности спорогонии и число спор, образовав-
шихся из одного споронта, служат важными таксоно-
мическими признаками. Такова «синтетическая» схе-
ма жизненного цикла микроспоридий.
В то же время, по современным данным, жизнен-
ные циклы микроспоридий при соблюдении этой об-
щей схемы чрезвычайно разнообразны и только по
ядерным циклам могут быть разбиты на 5 основных
групп. Почти у 80 % родов развитие заканчивается од-
ной спорогонией с образованием одного типа спор.
При этом из них 40 % на всем протяжении развития
имеют монокариотический ядерный аппарат, 14 —
диплокариотический, а у 25 % родов на определенных
этапах развития один тип ядерного аппарата сменяется
другим. В отличие от этих форм около 20 % родов име-
ют 2 или 3 типа спорогонии, образуя 2 или 3 типа спор,
различающихся морфологически и функционально.
При наличии 2 спорогоний все стадии одной из них
представлены диплокариотическими формами, а у ста-
дий другой спорогонии происходит чередование типов
ядерного аппарата. В случае трех спорогоний цикл до-
полняется спорогонией, все стадии которой имеют мо-
нокариотический ядерный аппарат.
Среди микроспоридий с одиночными ядрами на
всем протяжении развития описаны 8 родов, паразити-
рующих у других протистов — грегарин, миксоспори-
дий и инфузорий, 2 рода из олигохет и по 1 из трема-
тод и щетинохвосток (первично бескрылых насеко-
мых). Многие представители этой группы относятся к
семействам Metchnikovellidae и Chytridiopsidae и ха-
рактеризуются примитивными аппаратами экструзии.
Но в эту же группу входят и микроспоридии сем. Pleis-
tophoridae с хорошо развитым аппаратом экструзии. У
большинства родов мейоз отрицается.
Жизненные циклы монокариотических форм мик-
роспоридий наиболее разнообразны. Здесь есть фор-
мы, которые развиваются в прямом контакте с цито-
плазмой клетки хозяина или в паразитофорной вакуо-
ли, окруженные шероховатым эндоплазматическим
ретикулумом клетки хозяина или оболочкой споро-
форного пузырька самого паразита: формы с ленто-
видными, розетковидными, сферическими спорогона-
льными плазмодиями или без них и заканчивающие
развитие образованием одной, нескольких или многих
спор из одного споронта. Различные сочетания особен-
ностей каждого этапа развития образуют не менее
10 типов жизненных циклов. Наиболее характерны из
них три.
Жизненный цикл Metchnikovella hovassei, парази-
тирующей в грегарине Lecudina sp., характеризуется
короткой (одним поколением клеток?) мерогонией
(одно время она вообще отрицалась) и развитием ста-
дий спорогонии без прямого контакта с цитоплазмой
клетки хозяина (рис. 405). В мерогонии образуются
клетки с 1—2 ядрами. Спорогония двух типов: либо в
тонкостенных пузырьках (вероятно, паразитофорных
вакуолях), либо в толстостенных удлиненных «цис-
тах», спорофорных пузырьках. Материал умеренной
электронной плотности откладывается на оболочке
ТИП MICROSPORIDIA
1005
Рис. 405. Жизненный цикл Metchnikovella hovassei.
en — паразитофорная вакуоль, ла — спорофорный пузырек, с — спора, ел — споронт; черные треугольники на эндоплазматическом ретикулуме клетки хо-
зяина.
Fig. 405. Life cycle of Metchnikovella hovassei.
en — parasitiphorous vacuole, ла — sporophorous vesicle, c — spore, cn — sporont; black triangles on endoplasmatic reticulum of the host cells.
спорогонального плазмодия, формируя стенку «цис-
ты». Споронт делится плазмотомией. Обе спорогонии
образуют морфологически одинаковые споры. В каж-
дом пузырьке развивается не менее 8 спор, слегка
сплюснутых с полюсов, с ПТ в виде короткого мануб-
рия и с очень тонкими эндо- и экзоспорой. Споры, раз-
вившиеся в паразитофорной вакуоли, предназначены
для дальнейшего заражения той же особи хозяина, а
споры из цист — для заражения новых особей.
Все стадии микроспоридии Nosemoides vivieri, так-
же паразитирующей в грегарине Lecudina linei, разви-
ваются в прямом контакте с цитоплазмой клетки хозя-
ина. Стадии мерогонии одноядерные, их деление не
описано. Многоядерный розетковидный спорогональ-
ный плазмодий дает начало спорам с хорошо развитым
аппаратом экструзии (рис. 406).
Значительно усложняется цикл микроспоридий,
паразитирующих в многоклеточных хозяевах. На всем
протяжении развития Pleistophora typicalis, паразита
скелетной мускулатуры рыбы Myoxocephalus scorpius,
стадии развития заключены в толстую аморфную обо-
лочку спорофорного пузырька. Многоядерные мерого-
нальные плазмодии в результате плазмотомии образу-
ют одноядерные стадии. Развивающиеся из них много-
ядерные спорогональные плазмодии проходят поэтап-
ную плазмотомию, образуя одноядерные споробласты
и микроспоры. Восьмиядерные плазмодии дают нача-
ло 8 макроспорам. Тонкое строение микро- и макрос-
пор одинаково (рис. 407).
У диплокариотических родов, типичным примером
которых служит Nosema, оба ядра не дифференцирова-
ны по полу и не участвуют, как предполагалось ранее,
в автогамии, представляя собой самый инертный ядер-
ный аппарат микроспоридий. Вавра (Vavra, 1976b)
предположил, что при каждом делении диплокариона
в дочерние клетки попадают половинки от разных
партнеров, что приводит к рекомбинации генов. По
мнению Исси (1986), диплокарион, функциониру-
ющий как одно ядро, как бы делит набор хромосом
клетки на 2 меньших набора, увеличивая частоту «со-
матических кроссинговеров». Примечательно то, что
формы микроспоридий с такой организацией ядерного
аппарата относятся к наиболее агрессивным и патоген-
ным паразитам, способным к заражению новых, часто
систематически далеких, хозяев. Поэтому появление
диплокарионов можно оценить как прогрессивное
1006
ТИП MICROSPORIDIA
Рис. 406. Жизненный цикл Nosemoides vivieri.
м — меронт, с — спора, сб — споробласт, си — споронт.
Fig. 406. Life cycle of Nosemoides vivieri.
м — meront, c — spore, сб — sporoblast, cn — sporont.
приобретение в эволюции микроспоридий, компенси-
рующее этим формам отсутствие кариогамии.
Однако развитие типично диплокариотических
форм происходит различным образом, что позволяет
выделить не менее 4 типов жизненных циклов. К дип-
локариотическим родам, развивающимся в прямом
контакте с цитоплазмой клетки хозяина и имеющим
диспоробластическую спорогонию, относятся Nosema
(рис. 408), Anncaliia, Bacillidium, Brachiola (паразит
человека), Hirsutosporos, Hrabeyia, Jirovecia, Mrazekia,
Rectispora.
В прямом контакте с цитоплазмой клетки хозяи-
на, образуя розетковидный споронт и затем много
спор, развиваются Caudospora (4—8),* Ringueletium
(8), Weiseria (16—22).
В прямом контакте с цитоплазмой клетки хозяина,
образуя лентовидный споронт и 8 спор, развивается
Vittaforma, паразитирующая в роговице глаз человека.
На всем протяжении развития клетки паразита окру-
* В скобках указано число споробластов и спор, образующихся
из одного споронта.
жены ШЭР клетки хозяина. Сходным образом в
клетках соединительной ткани рыб развивается Ichthy-
ospoidium. Но его развитие сопровождается образова-
нием ксеном и огромных опухолей, окружающих пара-
зитов.
И наконец, у таких полиспоробластических ро-
дов, как Binucleospora (16—32), Campanulospora (2, 4),
Octosporea (8), Pseudopleistophora (до 12) и Scipiono-
spora (4), стадии спорогонии отграничены от цито-
плазмы клетки хозяина оболочкой спорофорных пузы-
рьков.
Значительно большим единообразием характеризу-
ются жизненные циклы микроспоридий, мерозоиты и
споронты которых имеют диплокариотический аппа-
рат, а в результате мейоза образуется 8 (или число,
кратное 8) одноядерных споробластов и спор одного
типа. Спорогония большинства этих форм протекает в
спорофорных пузырьках (рис. 409), но несколько ро-
дов развивается "в прямом контакте с цитоплазмой
клетки хозяина.
Сложные жизненные циклы микроспоридий выяв-
лены недавно. Около 30 лет тому назад Пилли (Pilley,
ТИП MICROSPORIDIA
1007
Рис. 407. Жизненный цикл Pleistophora typicalis.
Mi, М2 — меронты; nat — спорофорные пузырьки полиспоровой спорогонии, па2 — спорофорные пузырьки октоспоровой спорогонии; С/, с2 — споры, сп —
споронты.
Fig. 407. Life cycle of Pleistophora typicalis.
mi,m2— meronts; na; — sporophorous vesicles of polysporous sporogony, na2— sporophorous vesicles of octosporous sporogony; ct, c2—spores, cn — sporonts.
1976) впервые описан цикл развития Vairimorpha пе-
catrix, завершающийся двумя спорогониями. А через
10 лет появилось описание полиморфного диксенного
жизненного цикла Amblyospora dyxenoides с двумя
спорогониями в основном хозяине — комаре Culex ап-
nulirostris (Diptera, Culicidae) и с третьей спорогонией
в дополнительном — циклопе Mesocyclops albicans
(Copepoda, Cyclopidae) (Sweeney et al., 1985).
У микроспоридий рода Vairimorpha доминируют
диплокариотические стадии и диспоробластическая
спорогония, все стадии находятся в прямом контакте с
цитоплазмой клетки хозяина, ничем не отличаясь от
стадий ноземы. Именно поэтому многие виды этого
рода ранее были отнесены к роду Nosema. Другой этап
жизненного цикла сходен с циклом развития рода The-
lohania. Диплокариотический споронт окружается
оболочкой спорофорного пузырька, в результате мейо-
за образуется 8-ядерный розетковидный плазмодий.
Он делится на 8 споробластов, затем на 8 одноядерных
спор (рис. 410). Оба типа спор с изофилярными ПТ.
Виды этого рода паразитируют в чешуекрылых на-
секомых, и 8-споровую спорогонию у них провоци-
рует осеннее понижение температуры. У такого вида,
как V. mesnili, 8-споровый этап развития наблюдается
один раз в 4—8 лет, что свидетельствует о процессе
его редукции (Sokolova et al., 1993; Соколова, Исси,
1997).
Полиморфные микроспоридии делятся на группу
родов с моноксенными жизненными циклами, разви-
тие которых с образованием спор трех типов проходит
в одном хозяине, и на группу родов с диксенными жиз-
ненными циклами, когда половой процесс и две споро-
гонии проходят в основном хозяине, комаре, а третья
спорогония — в дополнительном, циклопе.
Характерным примером первого типа развития
служит жизненный цикл видов рода Culicosporella,
развивающихся на начальных этапах в гемоцитах, за-
тем в жировом теле кровососущих комаров. В личин-
ках диплокариотические меронты образуют диплока-
риотические споронты двух типов. Вокруг споронтов
1008
ТИП MICROSPORIDIA
Рис. 408. Жизненный цикл Nosema sp.
Mi, м2 — меронты; с — спора; сб — споробласт; сп — споронт.
Fig. 408. Life cycle of Nosema sp.
Mi, Mi — meronts; c — spore; сб — sporoblast; cn — sporont.
первого типа возникает эфемерная оболочка споро-
форного пузырька. Спорогональный плазмодий розет-
ковидной формы дает начало 8 двухъядерным тонко-
стенным спорам, осуществляющим горизонтальную
передачу микроспоридий. Споронты второго типа,
также в спорофорном пузырьке, проходят кариогамию
и после мейоза образуют 2—8 одноядерных толсто-
стенных спор. В эпителии яичников самок взрослых
комаров образуются крупные двухъядерные (похожие
на нозему) споры трансовариальной передачи.
Второй тип жизненного цикла описан для родов
Amblyospora и Parathelohania. Развитие в копепо-
дах начинается с 1—2-ядерных гаплоидных меронтов
(рис. 411). Стадии спорогонии в спорофорных пузырь-
ках или без них. Розетковидный споронт делится, об-
разуя 4—8 одноядерных тонкостенных спор с изофи-
лярной ПТ. Эти споры, высвобождаясь, заражают ли-
чинок комаров. Одноядерные меронты в эндоцитах
личинок образуют клетки грушевидной формы — га-
меты, которые попарно сливаются, а их ядра, сближа-
ясь, образуют диплокарион. Предполагается, что позд-
нее сливаются и ядра диплокариона. Диплоидный спо-
ронт превращается в двухъядерные цилиндрические
споры трансовариальной передачи. В личинках 1—2
возрастов следующего поколения, выщедщих из зара-
женных яиц, диплоидные меронты развиваются в ге-
моцитах. С 3-го возраста развитие проходит в жировом
теле. Диплокариотический споронт после мейоза обра-
зует восемь гаплоидных мейоспор. Эти одноядерные
толстостенные споры с анизофилярной ПТ заключены
в спорофорный пузырек. После гибели личинок кома-
ров они, высвобождаясь, служат источником зараже-
ния для копепод. По нашим данным, часть популяции
паразитов постоянно поддерживается в популяции хо-
зяина путем трансовариальной передачи.
Современная ситуация в систематике микроспори-
дий не исключает того, что многие из известных ро-
дов, образующих один или два типа спор, в действи-
тельности представляют собой только один из этапов
жизненного цикла полиморфных диксенных родов.
Большинство микроспоридий описано на основании
морфологических и ультраструктурных признаков
спорогональных стадий, в то время как мерогония этих
форм, а также возможность развития в дополнитель-
ТИП MICROSPORIDIA
1009
Рис. 409. Жизненный цикл Thelo-
hania sp.
м — меронт, па — спорофорный пузы-
рек, с — спора, сб — споробласт, сп —
споронт.
Fig. 409. Life cycle of Thelohania sp.
м — meront, na — sporophorous vesicle,
c — spore, сб — sporoblast, cn — sporont.
Рис. 410. Жизненный цикл Vairimorpha mesnili.
м — меронт, мп — мерогональный плазмодий, on — оболочка спорофорного пузырька, с — спора, сб — споробласт, сп — споронт.
Fig. 410. Life cycle of Vairimorpha mesnili.
м — meront, мп — merogonial plasmodium, on — the wall of sporophorou vesicle; c — spore, сб — sporoblast, cn — sporont.
64 Зак. №4163
1010
ТИП MICROSPORIDIA
Рис. 411. Полиморфный жизненный цикл Amblyospora sp.
I—4 — развитие диплокариотических спор в яичниках самок комаров; 5—7 — диплокариотические стадии в личинках самок; 8—10 — развитие гаплоспор в
личинках самцов; 11—16 — развитие монокариотических спор в циклопах; 17—20 — заражение личинок комаров, гаметоцитогамия и образование диплока-
риотических споронтов.
Fig. 411. Polymorphic life cycle of Amblyospora sp.
1—4 — development ofdiplokaryotic spores in the mosquito ovaries; 5—7— diplokaryotic stadies in female larvae; 8—10 — development of haplospores in the male
larvae; 11—16 — development of monokaryotic spores in copepod hosts; 17—20 — invasion of mosquitoes larvae and gametocytogamia and production of diplokaryo-
tic sporonts.
ных хозяевах (которых трудно выявить из-за несовпа-
дения сроков развития основного и дополнительного
хозяев) остаются неизученными.
Продолжительность развития
У микроспоридий насекомых, длительность разви-
тия которых установлена экспериментальным путем,
самые короткие жизненные циклы — от споры до спо-
ры — выявлены у многих нозем чешуекрылых и равны
3—5 суткам. В тех случаях, когда спорообразование
паразита приурочено к определенной фазе развития
насекомых и регулируется, вероятно, гормонами хозя-
ина (часто отмечается для паразитов жуков), развитие
микроспоридии длится от момента заражения до до-
стижения насекомым этой фазы. В весенне-летний се-
зон оно может превышать месяц, а при уходе личинок
после заражения в диапаузу и на зимовку — достигать
нескольких месяцев. Самое длительное прохождение
полного жизненного цикла установлено для микроспо-
ридий рода Amblyospora, паразитирующих у моно-
вольтинных видов комаров. Споры, развившиеся в
рачках, заражают личинок ранневесенних комаров уже
на следующий год. В этих личинках у микроспоридий
происходит половой процесс, в результате которого
диплокариотические споры трансовариальной переда-
чи образуются только во взрослых самках. На следую-
щий год из отложенных этими самками зараженных
микроспоридиями яиц появляются личинки, в которых
развиваются гаплоидные октоспоры паразитов. После
гибели личинок комаров (в основном самцов) и выхо-
да в воду мейоспоры заражают циклопов в этот же или
часто на следующий год. Таким образом, на прохожде-
ние полного цикла развития этих паразитов уходит
2—3 года. Однако этим микроспоридиям свойственен
также «страховочный» вариант жизненного цикла —
постоянная передача паразитов от поколения к поколе-
нию трансовариальным путем.
Пути передачи микроспоридий. Основной путь
проникновения микроспоридий в организм хозяина —
пероральный, обычно вместе с пищей, загрязненной
спорами, или при поедании зараженных особей. Мик-
роспоридии беспозвоночных животных передаются
потомству трансовариальным, реже трансспермаль-
.ным путем, а микроспоридии высших позвоночных
животных — трансплацентарным путем. Некоторые
микроспоридии насекомых распространяются в попу-
ляции основного хозяина его паразитами. При этом эн-
томофаги либо сами заражаются микроспоридиями
своего хозяина, либо разносят споры механически, при
поочередном прокалывании яйцекладом кутикулы
больных и здоровых особей хозяина. Заражение мик-
роспоридиями теплокровных животных при укусах
ТИП MICROSPORIDIA
1011
кровососущих насекомых пока не установлено. Попав-
шие в кишечник, гемолимфу или кровеносный сосуд
споры выстреливают ПТ и вводят зародышей в клетки
хозяина. Наличие у некоторых видов микроспоридий
беспозвоночных нескольких путей передачи от одной
особи хозяина к другой и смена одного пути передачи
другим в зависимости от условий (главным образом
плотности популяции хозяина) — один из важнейших
механизмов стабилизации паразито-хозяинной систе-
мы на популяционном уровне взаимоотношений парт-
неров.
Локализация (гистотропия) микроспоридий.
Некоторые микроспоридии инвазируют все ткани и
органы своего хозяина, другие — только немногие или
одну ткань, значительно реже встречаются паразиты,
инвазия которых ограничена несколькими клетками
(обычно эноцитами). Наиболее предпочитаемыми для
микроспоридий являются клетки тканей и органов,
либо богатых энергетическими ресурсами (жировое
тело насекомых, клетки яичников, нервная система по-
звоночных), либо характеризующихся высоким уров-
нем обменных процессов (секретирующие эпителии
различных желез, опухолевые клетки позвоночных
животных). Некоторые из них (Pleistophora) избирают
мышечные ткани. Микроспоридии могут паразитиро-
вать в животном-хозяине на всем протяжении его раз-
вития либо только в определенной стадии его разви-
тия. Так, у насекомых есть виды, заражающие только
личинок (Gystosporogenes schubergi) или только взрос-
лых особей (Nosema apis) своего хозяина. Микроспо-
ридии трематод обычно паразитируют либо у редий и
спороцист, либо у марит.
Паразито-хозяинные
отношения микроспоридий
и животных-хозяев
Изучение паразито-хозяинных отношений микро-
споридий и заражаемых ими животных, оценка роли
паразитов в развитии патогенных процессов при мик-
роспоридиозах и в подавлении защитных реакций
животного-хозяина проводятся на всех уровнях орга-
низации живого — от субклеточного до биоценологи-
ческого.
Симптомы микроспоридиоза (рис. 412, вкл.). У
беспозвоночных животных с прозрачными покровами
очаги инвазии микроспоридий становятся белыми по-
сле образования спор. У позвоночных животных обра-
зуются ксеномы, заметные невооруженным глазом, а
инвазированные микроспоридиями волокна попереч-
но-полосатой мускулатуры при вскрытии животного
видны как белые штрихи. Вследствие влияния мик-
роспоридий на обменные процессы и гормональный
статус у зараженных насекомых могут изменяться
окраска тела и поведение, нарушаться метаморфоз и
диапауза.
Специфичность. Среди микроспоридий имеются
узкоспецифичные виды, развивающиеся в одном виде
хозяина (иногда даже только в одной из его стадий), и
виды, заражающие широкий круг хозяев, связанных
родственно (виды одного рода или представители од-
ного семейства) или экологически (насекомое-хозяин,
его паразиты и гиперпаразиты). Так, Vairimorpha mes-
nili заражает таких параксенных хозяев, как чешуекры-
лое насекомое — капустная белянка Pieris brassicae, ее
перепончатокрылые паразиты Pteromalus puparum и
Apanteles glomeratus и перепончатокрылый гиперпара-
зит последнего — Dibrachis cavus (рис. 413). Кроме ка-
пустной белянки она заражает и другие виды белянок с
их паразитами и гиперпаразитами, образуя сложную
паразитарную систему. Наиболее агрессивные и часто
менее специализированные формы представлены ви-
дами рода Nosema и обычно т’ех родов, в жизненном
цикле которых имеется спорогония ноземного типа.
Ярким представителем широко специализированного
вида микроспоридий можно назвать Nosema algeri
(Brachiola) из личинок кровососущих комаров, кото-
рая в эксперименте легко заражает чешуекрылых и же-
сткокрылых насекомых, а также бестимусных мышей.
Узкой специализацией отличаются виды, имеющие
сложные циклы развития, которые проходят в двух хо-
зяевах.
Взаимоотношения микроспоридий с клеткой.
Экологической нишей для таких крайне мелких пара-
зитов, как микроспоридии, служит клетка, вернее один
из ее компартментов. Они активно внедряются в клет-
ку путем механической перфорации клеточной мемб-
раны и введения зародыша непосредственно в клетку.
Если мембрана клетки после прокола натекает на труб-
ку, клетка выживает, но, если она не изменяется, как у
эритроцитов, клетка погибает. Микроспоридии на всех
этапах развития нуждаются в экзогенной АТФ, при-
сутствующей в цитоплазме клетки хозяина (Trager,
1974). Она необходима простейшему, не имеющему
собственных митохондрий, для функционирования
ферментов и транспорта веществ на мембранах, отде-
ляющих паразита от цитоплазмы клетки хозяина. Заро-
дыши, не попавшие в клетку хозяина, погибают.
Большинство микроспоридий развивается в цито-
плазме, но при сильном заражении клетки часть осо-
бей может проникнуть в ее ядро. Обычно это происхо-
дит при делении ядра и разрушении его оболочки.
Микроспоридии сем. Chytridiopsidae, паразитирую-
щие в жуках и мидиях, все свое развитие проходят в
тесном контакте с ядром клетки. На полутонких срезах
видно, что паразиты находятся либо в перинуклеарном
пространстве и отграничены и от ядра, и от цитоплаз-
мы клетки хозяина мембранами, составляющими про-
должение мембран ядра хозяина, либо, находясь в ци-
топлазме, лежат в чашевидном углублении ядра
(рис. 399, В; 414, А). Паразит рыб Nucleospora salmonis
развивается в ядрах гемопоэтических клеток.
Большинство микроспоридий в отличие от других
внутриклеточных паразитов животных развивается
в прямом контакте с цитоплазмой инвазированной
клетки. Классическая паразитофорная вакуоль описа-
на только для видов рода Encephalitozoon, паразитиру-
ющих в теплокровных животных. У рыб и беспозво-
ночных известно более 20 родов, развитие которых
проходит в вакуолях, значительно отличающихся от
паразитофорной вакуоли Е. cuniculi тем, что их стенки
представлены мембранным континуумом ШЭР или
другими мембранными образованиями (рис. 414, Г,
вкл.) (Исси и др., 2001). Учитывая то, что такие вакуо-
ли обычно образуются в эпителии кищечного тракта,
1012
ТИП MICROSPORIDIA
Рис. 413. Паразитарная система моноксенной микроспоридии Vairimorpha mesnili.
1—4 — популяции параксенных хозяев: 1 — Pieris brassicae, 2—Apanteles glomeratus, 3 — Dibrachis cavus, 4 — Pteromaluspuparum. I, II — 2 последователь-
ные генерации насекомых-хозяев: белые кружки — noninfested and черные кружки — diseased individuals. Белые стрелки — передача trans ovo, черные
стрелки — передача per os, тонкие стрелки — перкутанная передача.
Fig. 413. Parasitic system of monoxenic microsporidian Vairimorpha mesnili.
1—4—populations of paraxenic hosts: I — Pieris brassicae, 2 — Apantelesglomeratus, 3 — Dibrachis cavus, 4 — Pteromaluspuparum. 1, II — 2 succesive generati-
ons of insect hosts: white circle — noninfested and black circle — diseased individuals. White arrows — transmission! trans ovo, black arrows — transmission per os,
thin arrows — percutanic transmission.
месте первичной инвазии большинства паразитов,
можно предположить, что их образование свидетель-
ствует о недавнем становлении паразито-хозяинных
отношений. Об этом же говорит и то, что виды, не вы-
зывающие образования паразитофорной вакуоли у
своего хозяина, часто индуцируют ее в эксперимента-
льном хозяине.
Сразу после проникновения микроспоридий в клет-
ку явных изменений в окружающей паразита цито-
плазме не происходит. Затем ШЭР и митохондрии
клетки хозяина концентрируются вокруг паразитов,
при этом число митохондрий на единицу объема цито-
плазмы увеличивается (рис. 414, Б, вкл.). Одновремен-
но возрастает поглощение митохондриями зараженной
клетки кислорода (Бабурина и др., 1989), что говорит
об усилении активности энергетического обмена зара-
женной клетки. У двукрылых насекомых сем. Sciaridae
возрастают синтез нуклеиновых кислот (до 32 раз) и
политенность хромосом в зараженных клетках слюн-
ных желез (Roberts et al., 1967). Стимуляцию клетки на
начальных этапах инвазии можно рассматривать как
следствие ее компенсаторных и репаративных реак-
ций, поддержанных организмом.
Особенно интересны взаимоотношения микроспо-
ридий с митохондриями клетки хозяина, они варьиру-
ют от полного отсутствия видимой реакции этих орга-
нелл на инвазию паразитов до интеграции клетки пара-
зита с митохондриями клетки хозяина (Durfort,
Vallinitjana, 1982). На электронограммах многих мик-
роспоридий видны структурированные связи между
мембранами органеллы и клетки паразита. Микроспо-
ридии названы паразитами энергетических систем
клетки хозяина (Trager, 1974).
На этапе мерогонии в цитоплазме клетки хозяина
вокруг паразитов появляется сеть трубчатых структур
(tubular net), представляющих выросты плазматиче-
ской мембраны их клеток (рис. 414,5, вкл.). По мере
развития паразитов эти структуры видоизменяются и к
концу спорогонии исчезают. Их функциональное на-
значение не выяснено, наиболее вероятно участие в
обменных процессах между клетками паразита и хо-
зяина.
С началом спорогонии начинается гипертрофия
клеток хозяина. На этом этапе происходят деструктив-
ные изменения клетки хозяина: исчезают ШЭР, жиро-
вые и протеиновые гранулы, число рибосом уменьша-
ется в цитоплазме и одновременно увеличивается по
периферии ядра, деградируют митохондрии. Гипер-
трофированным клеткам свойственна гипертрофия
ядра с сильной инвагинацией его оболочки и образова-
нием лопастей, увеличивающих его поверхность, или
даже появление многоядерности. Наиболее сильные
патологические изменения свойственны клеткам мезо-
дермального происхождения (Исси, 1983). Заражен-
ные клетки, потеряв способность к автолизису, часто
живут дольше незараженных. При метаморфозе насе-
комых они, не подвергаясь апоптозу в отличие от нор-
мальных, трансфазно передаются от личинок взрос-
лым особям.
Взаимоотношения на организменном уровне.
Микроспоридии беспозвоночных, постепенно заселяя
определенную ткань, орган, или же весь организм хо-
ТИП MICROSPORIDIA
1013
зяина, в своем большинстве вызывают длительные
хронические заболевания с постоянной гибелью части
особей в критические периоды развития (при линьках,
метаморфозе, миграциях) или при любом отклонении
условий среды от оптимума (критические температу-
ры, засуха, нехватка корма). Эффект прямой смертности
от микроспоридиоза регистрируется реже, чем смерт-
ность вследствие падения жизнеспособности. Однако
некоторые микроспоридии постоянно служат причи-
ной как массовых эпизоотий, так и массовой гибели
своих хозяев. В первую очередь к ним относятся мик-
роспоридии, инвазирующие эпителий кишечника или
шелкоотделительных желез. В этих случаях основные
причины гибели проявляются либо диареей с обезво-
живанием организма, либо отравлением продуктами
метаболизма, которые не востребованы железами.
Заражение микроспоридиями жирового тела при-
водит к нарушениям метаморфоза и резкому падению
плодовитости больных насекомых. У многих личинок
не формируются имагинальные диски и зачатки поло-
вых желез или же их клетки теряют способность к
дифференциации, что накладывает запрет на нормаль-
ное развитие самих насекомых или их половой продук-
ции (Исси, Онацкий, 1984; Онацкий, Исси, 1982). Реже
микроспоридии вызывают паразитическую кастрацию
насекомых обоих полов, при этом репродуктивные
органы не развиваются вообще. При микроспоридиозе
обычен гормональный дисбаланс, выражающийся в
добавочных линьках, нарушениях метаморфоза и фото-
периодической реакции насекомых (Исси, Токарев, 2002).
Зараженные особи могут жить дольше незараженных,
погибая при появлении личинок следующего поколе-
ния. Такая особенность патологии хозяина способст-
вует сохранению паразитов в его популяции и их непо-
средственной передаче от одного поколения другому.
У бокоплавов рода Gammarus микроспоридии, по-
давляя функцию андрогенных желез, детерминируют
пол хозяина — из зараженных личинок развиваются
только самки, передающие паразитов следующему по-
колению трансовариальным путем. У некоторых насе-
комых под влиянием заражения изменяется поведе-
ние: они не спускаются с растений в дневные часы или
откладывают яйца в несвойственных этому виду хозя-
ина местах.
Биохимические исследования паразито-хозяинных
отношений микроспоридий и насекомых показали от-
клонения и в составе белков, и в ферментативной ак-
тивности зараженных особей. Изучение состава бел-
ков в жировом теле и гемолимфе двупятнистого сверч-
ка Gryllus bimaculatus, зараженного микроспоридией
Paranosema (Nosema) grylli, выявило исчезновение ре-
зервных личиночных белков с молекулярным весом
60 kDa, которым приписывается важная роль в процес-
сах линьки и метаморфоза (Селезнев и др., 1997). При
изучении активности ферментов энергетического и уг-
леводного обмена у зараженных насекомых показано
усиление активности глицерол 3-фосфатдегидрогена-
зы и пируваткиназы, говорящее об усилении энергети-
ческого обмена в зараженных клетках (Долгих и др.,
1996, 1997; Долгих, 1998, 2002).
Эксперименты по оценке влияния факторов среды
второго порядка (окружающей среды) на взаимоотно-
шения партнеров паразито-хозяинной системы пока-
зали, что температурный оптимум обоих партнеров
системы совпадает, а кормовой режим, наиболее бла-
гоприятный для хозяина, приводит к интенсивному
размножению и более быстрому спорообразованию
паразитов. Таким образом, пусковые механизмы массо-
вого размножения насекомого-хозяина (часто вредите-
ля) и его облигатного паразита — микроспоридии оди-
наковы, что приводит к одновременному росту чис-
ленности популяций обоих партнеров (Исси, 1986).
Популяционные взаимоотношения микроспо-
ридий и насекомых. Особенности отношений популя-
ций микроспоридий и животных-хозяев были изучены
только для паразитов насекомых. Для многих насеко-
мых, обитающих в природных биоценозах или в агро-
ценозах, характерны периоды с высокой числен-
ностью и, следовательно, с высокой плотностью осо-
бей. К таким насекомым относятся многие вредители
сельскохозяйственных культур, древесных насажде-
ний и леса, а также обитатели небольших или времен-
ных водоемов, в которых по мере высыхания воды рез-
ко возрастает плотность заселения. При наличии в та-
ких популяциях микроспоридий увеличение числа
контактов между особями хозяина может привести к
быстрой горизонтальной передаче паразитов и возник-
новению эпизоотий, что, однако, происходит не все-
гда. Рассмотрим два контрастных примера.
Многолетние наблюдения (Исси, 2002) за попу-
ляциями капустной белянки Pieris brassicae и микро-
споридии Vairimorpha mesnili, показали, что на Севе-
ро-Западе европейской части России и в Прибалтике
регулярно возникают очаги микроспоридиоза. Зара-
женность белянки не падает ниже 10—12 % на куль-
турных растениях и 1—4 % на диких крестоцветных.
С периодичностью один раз в четыре года заражен-
ность популяций к осени возрастает до 90—100%,
причем эпизоотия охватывает огромные территории
от Петрозаводска на севере через западные районы
Ленинградской и Псковской областей до Белоруссии,
включая Эстонию и Латвию. Анализ зараженности
популяций на изолированных участках — островах
в Балтийском море (о-в Саарема) или полях среди
лесных массивов Карелии —2 показал, что она близка
к тому уровню, что и на всей остальной территории.
Анализ погодных условий в эти годы показал, что
выход вредителя из-под контроля паразитов в при-
родных условиях провоцируется высоким уровнем и
продолжительностью солнечного сияния. В силу сов-
падения оптимумов пусковой механизм массового раз-
множения насекомых-хозяев служит и пусковым меха-
низмом массового размножения паразитов. Высокая
плотность популяции насекомых создает условия
для повышения вирулентности микроспоридий — пре-
имущество получают формы с короткими жизнен-
ными циклами, вызывающие быструю гибель хозяина,
вследствие которой споры попадают во внешнюю сре-
ду и заражают алиментарным путем новых насекомых.
Заболевание быстро распространяется среди насеко-
мых, контактирующих друг с другом. В течение одно-
го сезона зараженность популяции возрастает до
100 %, заканчиваясь массовой гибелью и хозяина, и
паразита.
При снижении плотности популяции преимущест-
во получают слабопатогенные формы, «позволяющие»
1014
ТИП MICROSPORIDIA
хозяину развиться до взрослого состояния и отложить
яйца, в которых микроспоридии перейдут к следующе-
му его поколению. Таким образом, смена путей пере-
дачи паразитов — Перорального при высокой плотно-
сти хозяина на трансовариальный при низкой — один
из механизмов, обеспечивающих динамическое равно-
весие партнеров паразитарной системы и стабильность
самой системы. Наличие у V. mesnili трех путей пере-
дачи (перорального, трансовариального и энтомофага-
мии) говорит о том, что данная система складывалась
в условиях низких численности и плотности насеко-
мого-хозяина. Действительно, за 20 лет наблюдений
зараженность белянки на диких крестоцветных не пре-
вышала 20 %. Введение в культуру высокопродук-
тивных сортов растений послужило причиной массо-
вых размножений фитофага, не свойственных ему в
природе. Из этого следует, что массовые эпизоотии
микроспоридиозов у вредителей культурных растений
могут быть таким же следствием человеческой дея-
тельности, как и массовые размножения насеко-
мых-вредителей.
Паразито-хозяинные отношения в дикой природе
даже при условии высоких численности и плотности
насекомых более устойчивы, так как в этих паразитар-
ных системах в ответ на регулярное повышение плот-
ности популяции хозяина (например, при высыхании
временных водоемов) в процессе эволюции возникли
механизмы, ограничивающие горизонтальное распро-
странение паразитов. У комаров к таким механизмам
можно отнести массовое образование спор в личинках
только самцов и непременное заражение ими допол-
нительного, часто менее массового хозяина. Сущест-
вующий у них же запасной вариант передачи мик-
роспоридий через зараженных самок обеспечивает
поддержание наименее вирулентных форм, поэтому
зараженность «диких» популяций редко превышает
8—12%. У многих жуков низкая зараженность популя-
ции микроспоридиями поддерживается созреванием
спор только во взрослых особях хозяина, ведущих оди-
ночный образ жизни, в отличие от личинок.
Практическое значение
микроспоридий
Практическое значение этих паразитов существен-
но. Вызываемые микроспоридиями заболевания име-
ют для человека как отрицательные, так и положитель-
ные последствия. Почти 150 лет отмечают значитель-
ные хозяйственные потери на шелководнях и пасеках
вследствие эпизоотий нозематозов у тутового ВотЪух
mori и дубового Antheraea penny шелкопрядов, у пчел
Apis mellifera'. описаны случаи массовой гибели других
полезных беспозвоночных животных: насекомых-эн-
томофагов, насекомых-опылителей; ракообразных —
речного рака Astacus astacus и крабов; моллюсков —
мидии Mytilus edulis при промышленном разведении.
Широко распространены микроспоридии у рыб,
инвазируя у них мускулатуру (Pleistophora), соеди-
нительную ткань и кишечник (Glugea), репродуктив-
ные органы (Glugea, Coccospora) и даже центральную
нервную систему (Spraguea lophii) (рис. 412). Зафикси-
рованы случаи массового заражения (до 70—100 %)
микроспоридией Glugea takedai икринок у производи-
телей горбуши Oncorhynchus gorbuscha и симы О. та-
sou, приводящие к резкому падению плодовитости
этих рыб (Вялова и Воронин, 1987).
Случаи заболевания микроспоридиозом птиц и
млекопитающих, в первую очередь хищников при
их содержании в неволе (в зоопарках или на пушных
фермах), как правило, заканчиваются гибелью боль-
ных животных или их потомства, трансплацентарно
зараженного микроспоридией Encephalitozoon cunicu-
Н. Постоянно болеют микроспоридиозом грызуны,
особенно живущие рядом с человеком (мыши, кролики).
Анализ состояния грызунов в городских условиях выя-
вил до 40 % особей, зараженных микроспоридиями, но
случаи гибели этих животных относительно редки.
Особую проблему представляют микроспоридиозы
человека. До недавнего времени были известны еди-
ничные случаи заражения микроспоридиями людей,
работающих в крольчатниках или на пушных фермах.
Микроспоридия Е. cuniculi, паразитирующая на кро-
ликах, способна заразить человека с нормальной им-
мунной системой. В настоящее время на фоне сниже-
ния иммунитета под воздействием иммунодепрессан-
тов или отрицательных факторов среды и главным
образом при заболевании СПИДом резко возросло зна-
чение микроспоридий как возбудителей оппортуни-
стических заболеваний человека. У больных СПИДом
уже выявлено 13 видов этих паразитов (Wittner, Weiss,
1999; Franzen, Muller, 2001), вызывающих разнообраз-
ные заболевания; поражение глаз — кератит и блефа-
рит, хроническую диарею или генерализованную мио-
патию с летальным исходом. По особенностям ультра-
структуры клетки одни микроспоридии представляют
собой формы со сложно устроенными спорами (Тгас-
hipleistophora), в то время как другие относятся к при-
митивным формам, образуя споры со слабо развитым
аппаратом экструзии (Enterocytozoon). В пользу разно-
го времени освоения микроспоридиями человеческого
организма говорит и то, что более примитивная микро-
споридия инвазирует ткани кишечника, а более высоко
организованная — мышечную ткань. Несомненно ин-
тересным можно считать и то, что эти виды ранее у че-
ловека обнаружены не были. Сейчас нет убедительных
доказательств ни в пользу того, что эти микроспори-
дии циркулируют в популяциях людей, не проявляя
патогенных свойств при нормальном иммунитете, ни
того, что они переходят к человеку с нарушенной им-
мунной системой от других животных. Все же этот на-
стораживающий факт заставляет исследователей ис-
кать в основном у кровососущих насекомых микро-
споридий, которые могут вызвать заражение человека
при попадании в кровь. Так, например, микроспоридией
Brachiola algeri (= Nosema algeri) из кровососущих ко-
маров в эксперименте удалось заразить бестимусных
мышей, внеся суспензию спор в глаза животных.
В связи с тем что для большинства микроспоридий
беспозвоночных температуры выше 30 °C сублеталь-
ны или задерживают их развитие, считается, что тем-
пература человеческого тела, достигающая 37—38 °C,
служит надежным барьером при заражении микроспо-
ридиями. Однако нельзя забывать, что близкую темпе-
ратуру имеют общественные перепончатокрылые на-
секомые (30—32 °C) и могут иметь некоторые виды
ТИП MICROSPORIDIA
1015
блох, развивающихся подкожно у грызунов с более
высокой, чем у человека, температурой тела.
В то же время высокие патогенные свойства микро-
споридий при паразитировании на вредных видах чле-
нистоногих или гельминтов позволяют рассматривать
этих паразитов как перспективных агентов биологиче-
ского метода борьбы с этими животными. В середине
XX в на микроспоридий обратили внимание ветерина-
ры, паразитологи и специалисты по биологическим
методам борьбы. К реализации идеи практического
использования микроспоридий против насекомых
сельскохозяйственного, медицинского и ветеринарно-
го значения одним из первых приступил чешский ис-
следователь Вайзер (Weiser, 1961, 1966). Эта идея при-
влекла ученых многих стран, что нашло выражение в
описании новых видов микроспоридий, их жизненных
циклов и особенностей взаимоотношений с животны-
ми-хозяевами.
Особый интерес представляют микроспоридии ко-
маров, которые не только вызывают высокую смерт-
ность личинок и снижают плодовитость взрослых самок,
но и при одновременном заражении малярийными плаз-
модиями подавляют развитие нескольких их видов.
Изучение массовых эпизоотий микроспоридиоза
в популяциях насекомых — вредителей сельского и
лесного хозяйства позволяет говорить о двух реальных
путях использования микроспоридий против вред-
ных видов. Это, во-первых, внесение в биоценоз спор,
полученных при массовом разведении микроспори-
дий на насекомых лабораторных линий, и, во-вторых,
прогноз естественных эпизоотий микроспоридиоза в
целях отмены обработок пестицидами, что не только
уменьшит затраты на выращивание культурных расте-
ний, но и снизит токсическую нагрузку на биоценоз.
Кроме того, микроспоридии представляют собой
уникальный обьект лабораторных исследований.
Во-первых, кроме микроспоридий нет других внутри-
клеточных паразитических эукариотов, распростра-
нившихся среди животных всех уровней организации.
Имея представления о том, что характер воздействия
микроспоридий на инвазированную клетку практи-
чески одинаков у всех животных-хозяев, мы можем
рассматривать их как группу, чрезвычайно инте-
ресную для сравнительных исследований защитных
реакций организма разных животных на внедре-
ние внутриклеточных паразитов. Во-вторых, клетка
микроспоридий, имеющая в сравнении с другими
эукариотами один из самых маленьких геномов и
утерявшая в процессе адаптации к паразитизму мно-
гие органеллы, как минимальная клеточная система
может быть интереснейшим объектом для цитологов
и молекулярных биологов.
Филогения
Микроспоридии как одноклеточные эукариотные
организмы относятся к типичным протистам. Уни-
кальность их строения указывает на то, что это моно-
филетичная группа, происхождение которой и родст-
венные связи с другими организмами продолжа-
ют оставаться предметом дискуссии. Кавалье-Смит
(Cavalier-Smith, 1998, 2001) на основании сходства
микроспоридий с грибами по таким признакам, как
диплокариотическая организация ядерного аппарата,
наличие хитина в оболочке спор, сходство последова-
тельностей а- и р-тубулинов, отнес их к царству гри-
бов Fungi сперва как группу сильно редуцированных
вследствие паразитизма организмов, близких к дрож-
жевым грибам, затем в качестве одной из примитив-
ных групп, не относящихся ни к одной современной
группе грибов.
Эта точка зрения находится в некотором противо-
речии с рядом биологических характеристик микро-
споридий. Кроме рРНК прокариотного типа и отсутст-
вия митохондрий, которые, как теперь установлено,
есть следствие редукции этих органелл в результате
переложения паразитами их функций на клетку хозяи-
на, микроспоридий характеризуют другие примитив-
ные признаки, которые, по нашему мнению, говорят
об их очень раннем становлении как самостоятельной
группы. К ним можно отнести: связь наиболее примитив-
ных форм с океаническими животными (микроспори-
дии сем. Metchnikovellidae известны как гиперпарази-
ты океанических многощетинковых червей Polychae-
ta); инициацию экструзии зародышей разнообразными
факторами, приводящую к их значительным потерям;
монокарион примитивных форм (более 40 % родов) на
всем протяжении жизненного цикла и отсутствие у
них мейоза; попадание в клетку хозяина путем механи-
ческого прокола ее оболочки — все это свидетельства
в пользу сохранения микроспоридиями древних при-
знаков на фоне высочайших биохимической и физио-
логической адаптаций к внутриклеточному паразитиз-
му, сопровождавшихся редукционными процессами.
Кроме того, освоение микроспоридиями в качестве
хозяев представителей всего царства животных также
отличает их от тех протистов, которые, перейдя к пара-
зитическому образу жизни позднее микроспоридий,
смогли освоить только какую-то определенную группу
животных. Вероятно, эта противоречивость характе-
ристик послужила поводом для сравнения микроспо-
ридий с основной группой грибов Chytridiomycota и
Zygomycota (а не с нерепрезентативными выборками
при небольшом числе видов базидио- и аскомицетов,
как у других авторов) по признакам, не использован-
ным ранее. Японские исследователи (Tanabe et al.,
2002) по результатам исследования RPBI (2-й большой
субъединицы ДНК-зависимой полимеразы РНК) и
EF-la (фактора трансляционной 1-а элонгации) у мик-
роспоридий и базальной группы грибов сделали вы-
вод, что сравнение последовательностей этих двух
белков свидетельствует не в пользу близких отноше-
ний микроспоридий и грибов. Более того, авторы пока-
зали, что для микроспоридий не характерна делеция
двух аминокислот в белке EF-la, имеющая диагности-
ческое значение для всех грибных сиквенсов.
Жизненные циклы микроспоридий и преобразова-
ния их ядерного аппарата позволяют представить воз-
можные взаимоотношения между различными группа-
ми. Самые примитивные микроспоридии (монокарио-
тические формы как с примитивным, так и с хорошо
развитым аппаратом экструзии) паразитируют на дру-
гих протистах (грегаринах или инфузориях, заражаю-
щих свободно живущих кольчатых червей или трема-
тод), на полихетах и на бескрылых насекомых.
1016
ТИП MICROSPORIDIA
Усложнение ядерного аппарата — появление дип-
локариона и мейоз при переходе от мерогонии к споро-
гонии — свидетельствует о прогрессивном развитии
этих форм при переходе к паразитированию на более
высоко организованных животных — членистоногих и
рыбах. За ядерными преобразованиями следует услож-
нение циклов и дополнение их этапом диплокариоти-
ческой спорогонии. Усложнение циклов связано с па-
разитированием микроспоридий на хозяевах, ведущих
гетеротопный (водно-наземный) образ жизни. Дипло-
кариотические особи микроспоридий, развивающиеся
в наземных стадиях этих насекомых, как наиболее аг-
рессивная форма жизненного цикла с возможностями
широкой специфичности и высокой лабильностью
своих реакций осуществили возможность завоевания
многих сухопутных хозяев и постепенно стали суще-
ствовать как самостоятельные виды. В этом отноше-
нии интересен диплокариотический род Nosema. Как
показали результаты молекулярно-биологических ис-
следований, одни виды нозем (главным образом из
чешуекрылых) близки к видам диморфного рода Vai-
rimorpha, в то время как другие (из прямокрылых и
жесткокрылых насекомых) родственны микроспо-
ридиям полиморфного рода Amblyospora из водных
насекомых (что стало обоснованием для вывода из
рода Nosema видов, паразитирующих на прямокры-
лых, и для описания нового рода Paranosema) (Sokolo-
va et al., 2003). Некоторые микроспоридии, в жизнен-
ном цикле которых преобладает диплокариотический
этап, сохраняют часть цикла с монокариотическими
формами, другие же его теряют. В этом отношении
очень показателен жизненный цикл такого вида, как
Vairimorpha mesnili (Nosema mesnili), у которого моно-
кариотический этап цикла выявляется один раз в
4—8 лет, он как бы постепенно редуцируется на на-
ших глазах.
Систематический обзор
Тип MICROSPORIDIA Balbiani, 1882
Древнейшие эукариотные внутриклеточные пара-
зиты, образующие в конце развития одноклеточные
споры, содержащие одно- или двухъядерный амебоид-
ный зародыш и уникальный по строению аппарат экс-
трузии, обязательным компонентом которого служит
полярная трубка (ПТ). Жгутики, центриоли, митохонд-
рии и лизосомы отсутствуют, РНК прокариотного
типа. Доспоровые стадии с однотипными ядрами, ко-
торые располагаются одиночно или попарно (диплока-
рион). Ядра гаплоидные или диплоидные. Возможен
половой процесс и участие в жизненном цикле проме-
жуточного хозяина. Заражение осуществляется путем
выброса под давлением из споры ПТ, через просвет ко-
торой зародыш вводится прямо в клетку хозяина. Раз-
витие обычно происходит в прямом контакте с гиало-
плазмой и органоидами клетки хозяина.
Круг хозяев микроспоридий необычайно широк —
от одноклеточных до позвоночных, включая человека.
Наибольшее число видов паразитирует у членистоно-
гих.
Класс Metchnikovellidea Weiser, 1977
Микроспоридии с одноядерными очень мелкими сферически-
ми или субсферическими спорами (редко цилиндрическими) и
примитивным аппаратом экструзии, состоящим из полярного якор-
ного диска и короткой толстой (редко тонкой) прямой или С-образ-
ной ПТ. Поляропласт, задняя вакуоль и эндоспора не развиты. Ме-
рогония, предшествующая спорогонии, кратковременна. Споры в
большом количестве заключены в удлиненные толстостенные спо-
рофорные пузырьки (СП), похожие на цисты, либо одновременно
(род Metchnikovella) лежат свободно в паразитофорных вакуолях.
Паразиты грегарин.
Отряд Metchnikovellida Vivier, 1975
Микроспоридии, имеющие споры с толстой глад-
кой ПТ, длина которой не превышает длину споры.
Трубка несет пластинчатое образование, отходящее от
ее дистального конца внутрь споры.
Сем. Metchnikovellidae Caullery et Mesnil,
1914
Диагноз семейства соответствует диагнозу отряда.
Семейство содержит 5 родов, различающихся по фор-
ме толстостенных спорофорных пузырьков, и один,
отличающийся по форме и строению спор. Все пред-
ставители семейства — гиперпаразиты грегарин, пара-
зитирующих у морских полихет, звездчатых червей
(сипункулид), реже у насекомых.
Род Metchnikovella Caullery et Mesnil, 1914
Микроспоридии с удлиненными, ладьевидной или
веретеновидной формы СП, стенка которых образует
на одном или каждом конце утолщение. Длина утол-
щения варьирует у разных видов. Споры сферические.
Типовой вид М. spionisCaullery etMesnil, 1897.
Споры слегка сплющенные, диаметром 1.5—2 мкм.
Типовой хозяин грегарина Polyrhabdina brasi-
li (Gregarinida, Lecudinidae) в кишечнике полихеты
Spio martinensis (Annelida, Polychaeta).
Род Amphiacantha Caullery et Mesnil, 1914
Микроспоридии с удлиненными, овальными, слег-
ка изогнутыми СП, стенка которых на концах оттянута
в тонкие нити. Споры сферические.
ТИП MICROSPORIDIA. КЛАСС MICROSPOREA
1017
Типовой вид A. longa Caullery et Mesnil, 1914.
Число спор в спорофорных пузырьках варьирует от 14
до 100 и более. Споры диаметром 3—8 мкм.
Типовой хозяин грегарина Ophioidina elonga-
ta (Apicomplexa, Gregarinida) из кишечника полихеты
Lumbriconereis tingens (Annelida, Polychaeta).
Род Amphiamblys Caullery et Mesnil,
1914
Микроспоридии с палочковидными СП, имеющи-
ми слабое расширение по центру и утолщения округ-
лой формы на концах. Споры сферические.
Типовой вид A. capitellides (Caullery et Mesnil,
1897) Caullery et Mesnil, 1914. Споры слегка грушевидной
или овальной формы, размером 1.9—2.0 X 1.5—1.6 мкм.
Типовой хозяин грегарина Ancora sp. (Api-
complexa, Gregarinida) из полихеты Capitellides giardi
(Annelida, Polychaeta).
Род Caulleryetta Dogiel, 1922
Микроспоридии с удлиненно-овальными СП, один
конец которых закруглен, а другой сужается, как гор-
лышко бутылки. Обычно образуется 5—10 СП, лежа-
щих в один ряд перед и за ядром клетки хозяина.
Типовой вид С. mesnili Dogiel, 1922. Каждый
СП содержит 8—12 округлых спор.
Типовой хозяин грегарина Selenidium sp.
(Apicomplexa, Gregarinida) из кишечника полихеты
Travisiaforbesi (Annelida, Poly chaeta).
Примечание. При ревизии сем. Metchnikovellidae этот род
был сведен в синоним рода Metchnikovella (Vivier, 1975).
Род Desportesia Issi et Voronin, 1986
Мерогональные плазмодии с 1—8 ядрами лежат в
тесном контакте с цитоплазмой клетки хозяина. Па-
лочковидные СП имеют слабое расширение по центру
и округлой формы утолщения на концах. Споры ци-
линдрические. ПТ тонкая, короткая, поляропласт со-
стоит из немногих пластин.
Типовой вид D. laubieri (Desportes et Theodori-
des, 1979) (= Amphiamblys laubieri Desportes et Theodo-
rides, 1979). Споры размером 10 X 0.9 мкм.
Типовой хозяин грегарина Lecudina sp. из
эхиурид (Annelida, Echiurida).
Примечание. Эта микроспоридия образует споры, ультра-
тонкое строение которых отличается от строения спор других
представителей семейства, имея сходство со строением цилиндри-
ческих спор более высоко организованных микроспоридий (Hel-
michia, Baculea, Striatospora). В связи с этим род помещен в
сем. Metchnikovellidae временно.
Класс Microsporea Corliss et Levine, 1963
Микроспоридии с хорошо развитым аппаратом экструзии. Во всем остальном диагноз класса соответствует диагнозу типа.
Подкласс Haplophasea Sprague, Becnel, Hazard, 1992
Мономорфные формы с монокариотическим ядерным аппара-
том на всем протяжении развития, включая споры. Ядра предполо-
жительно гаплоидные.
Отряд Chytridiopsida Weiser, 1977
Пролиферативные стадии, предшествующие спо-
рогонии, отсутствуют или кратковременны. Споры
округлые с ПТ, образующей несколько витков в задней
части споры. Поляропласт расположен по всей длине
трубки в виде особых структур. Эндоспора слабо раз-
вита или отсутствует. Преимущественно паразиты
эпителиальных клеток кишечника беспозвоночных.
Отряд включает 4 семейства: Chytridiopsidae, Bux-
tehudeidae, Burkeidae, Enterocytozoonidae.
Сем. Chytridiopsidae Sprague, Ormieres
et Manier, 1972
Аппарат экструзии с ПТ, образующей 2—4 витка и
покрытой сотовидной структурой. Споры сфериче-
ские, образуются в тонкостенных и толстостенных
спорофорных пузырьках.
Семейство включает 4 рода.
Род Chytridiopsis Schneider,
1884
Микроспоридии со сферическими (после фикса-
ции — овальными) спорами В группах от 16 до 30 в
толстостенных сферических спорофорных пузырьках
и в тонкостенных паразитофорных вакуолях.
Типовой вид С. socius Schneider, 1884. Споры
диаметром 1.5 мкм, эндоспора не развита. ПТ изофи-
лярная, делает 1—2 витка. В эпителии кишечника.
Типовой хозяин жук Blaps mortisaga (Coleo-
ptera, Tenebrionidae).
Род Chytridioides Tregouboff,
1913
Диагноз рода во многом совпадает с диагнозом
Chytridiopsis. Ввиду отсутствия современного описа-
ния валидность рода и его положение в системе нужда-
ются в уточнении.
Типовой вид С. schizophylli Tregouboff, 1913.
Споры диаметром 1.5 мкм. В эпителии кишечника.
Типовой хозяин многоножка Schizophyllum
mediterraneum Latzel (Myriapoda).
1018
ТИП MICROSPORIDIA
Род Intexta Larsson, Steiner et Bjornson,
1997
Мерогония предположительно отсутствует. Спо-
ронты многоядерные в толстой оболочке, сохраня-
ющейся во время спорогонии. В каждом спорофорном
пузырьке образуются споры 2 размерных групп и
сходного строения. У спор отсутствуют поляропласт и
полярный якорный диск.
Типовой вид I. acarivora Larsson, Steiner et
Bjornson. Споры размером 1.3 X 1.8 мкм или
1.5 X 2.3 мкм. ПТ анизофилярная, делает 2—3 витка
у микроспор и до 9 у макроспор. В эпителии кишеч-
ника.
Типовой хозяин клещ Tyrophagus putrescen-
tiae (Acari, Acaridae).
Род Nolleria Beard, Butler et Becnel,
1990
Все стадии развития заключены в паразитофорную
вакуоль. Одноядерные споронты развиваются в много-
ядерные спорогональные плазмодии, образующие до
200 споробластов и спор.
Типовой вид N. pulicis Beard, Butler et Becnel,
1990. Споры диаметром 1.9—2.5 мкм. ПТ делает 2 вит-
ка. В эпителии кишечника.
Типовой хозяин кошачья блоха Ctenocephalus
felis (Siphonaptera, Pulicidae).
Сем. Buxtehudeidae Larsson 1980
Микроспоридии co сферическими спорами. ПТ
длинная, покрыта спирально расположенными трубча-
тыми выростами, поляропласт не развит. Спорогония
полиспоровая в паразитофорной вакуоли.
В семействе 2 рода.
Род Buxtehudea Larsson, 1980
Мерогония не известна. Спорогональный плазмо-
дий развивается в вакуоли и образует 50—100 спор.
ПТ покрыта трубчатыми выростами и на поперечном
срезе имеет звездчатый вид. Поляропласт не развит.
Род монотипичен.
Типовой вид В. scaniae Larsson, 1980. Споры
размером 2.5—3.5 мкм. В эпителии кишечника.
Типовой хозяин щетинохвостка Petrobius bre-
vistylis (Thysanura, Machilidae).
Род Jiroveciana Larsson, 1980
Споры образуются по 20—40 вместе. Мерогония
неизвестна. Род монотипичен.
Типовой вид J. limnodrili (Jirovec, 1932)
(= Chytridiopsis limnodrili Jirovec, 1932). Споры диа-
метром 2 мкм. В эпителии кишечника.
Типовой хозяин кольчатый червь Limnodrilus
misionicus (Annelida, Polychaeta).
Сем. Burkeidae Sprague, 1977
Мерогония неизвестна. Спорогония полиспоровая.
Пластинчатый поляропласт не развит. ПТ без трубча-
тых выростов.
Известен один род.
Род Burkea (de Puytorac et Tourret, 1963)
Sprague, 1977
Спорогония в крупных круглых цистах диаметром
до 1.5 мм с образованием большого числа сфериче-
ских спор с тонкой полярной трубкой и пузырчатым
поляро пластом.
Типовой вид В. gatesi (de Puytorac et Tourret,
1963) Sprague, 1977. Споры размером 2.5—3.0 мкм. ПТ
делает 10 витков, лежащих в 2 ряда. В мышцах стенки
тела.
Типовые хозяева олигохеты Pheretima ha-
wayana и Р. californica (Oligochaeata, Megascolecidae).
Сем. Enterocytozoonidae Cali et Owen, 1990
Развитие в прямом контакте с цитоплазмой клетки
хозяина. Меронты с несколькими ядрами имеют
округлую или неправильную форму. Делению много-
ядерного споронта на споробласты предшествует за-
кладка возле каждого ядра зачатков органелл аппарата
экструзии. Спорогональный плазмодий делится на
споробласты розетковидным почкованием. Споры эл-
липсоидные.
Включает 2 рода.
Род Enterocytozoon Desportes,
Le Charpentier, Galian, Bernard,
Cochand-Priollet, Lavergne, Ravisse
et Modigliani, 1985
В многоядерном споронте вокруг каждого ядра
формируются зачатки органелл аппарата экструзии —
якорного диска, ПТ и поляропласта.
Типовой вид Е. bieneusi Desportes, Le Charpen-
tier, Galian, Bernard, Cochand-Priollet, Lavergne, Ravisse
et Modigliani, 1985. Споры размером 1.5 X 0.9 мкм. ПТ
делает 6 витков, лежащих в 2 ряда. В энтероцитах тон-
кого кишечника между ядром клетки и ворсинками, в
желчных протоках и пузыре, в эпителии носа и в лег-
ких при СПИДе.
Типовой хозяин человек Homo sapiens (Prima-
tes, Hominidae).
Род Nucleospora Hedrick, Groff et Baxa,
1991
Внутриядерный паразит. Одноядерные и двухъ-
ядерные меронты лежат в прямом контакте с нуклео-
плазмой.
Типовой вид N. salmonis Hedrick, Groff et Ваха,
1991. Споры размером 2.0 X 1.0 мкм. ПТ делает 8—
ТИП MICROSPORIDIA. КЛАСС MICROSPOREA
1019
12 витков, лежащих в 2 ряда. Плотно уложенные плас-
тины поляропласта окружают его сетчатый участок.
В ядрах гемопоэтических клеток, лимфобластов.
Типовой хозяин рыба чавыча Oncorhynchus
tschawytscha (Osteichthyes, Salmonidae).
Отряд Glugeida Issi,
1986
Мерогония имеется у всех форм. Споры овальные
или грушевидные с хорошо развитым поляропластом
и длинной свернутой в витки ПТ. Паразито-хозяинные
отношения на клеточном уровне и спорогония раз-
личные.
Надсем. Encephalitozoonoidea
Voronin, 2001
Споронт делится бинарно или розетковидным
почкованием. Спорогония без образования спорофор-
ного пузырька. Из одного споронта образуется 2—
8 спор.
Надсемейство включает 4 семейства: Encephalito-
zoonidae, Microfilidae, Tetramicridae и Unikaryonidae.
Сем. Encephalitozoonidae Voronin,
1989
Развитие всех стадий протекает в паразитофорной
вакуоли. Спорогония ди- или тетраспоробластическая.
Ксенома не образуется. Задняя вакуоль спор плохо вы-
ражена. Паразиты теплокровных позвоночных, глав-
ным образом млекопитающих.
Семейство включает один род.
Род Encephalitozoon Levaditi, Nicolau
et Schoen, 1923
Мерогония по типу бинарного деления. Цепочки
споробластов разделяются на отдельные клетки сразу
после деления ядер. Поляропласт пластинчатый.
Типовой вид Е. cuniculi Levaditi, Nicolau et
Schoen, 1923. Споры овальные, размером 2.5 X 1.0—
1.5 мкм. ПТ йзофилярная, делает 3—4 витка. Преиму-
щественно в клетках мозга и почек различных млеко-
питающих.
Типовой хозяин кролик Oryctolagus cuniculus
(Mammalia, Lagomorpha).
Примечание. Микроспоридия Encephalitozoon cuniculi ча-
сто присутствует у белых мышей в вивариях С.-Петербурга (Воро-
нин, 1986) и у хищных зверей в зоопарках и на пушных фермах.
Сем. Tetramicridae Matthews et Matthews,
1980
Меронты заключены в паразитофорную вакуоль,
которая в начале спорогонии исчезает. Зараженные
клетки трансформируются в ксеномы. Споры оваль-
ной или грушевидной формы. Задняя вакуоль боль-
шая, занимает до 1/3 объема споры. В споре имеется
одно или несколько крупных электронноплотных те-
лец. Паразиты рыб.
Семейство содержит два рода: Tetramicra и Micro-
gemma.
Род Tetramicra Matthews et Matthews,
1980
Ксеномы мелкие, до 200 мкм в диаметре, с одним
ядром клетки хозяина. Поверхность ксеномы покрыта
длинными отростками. Меронты цилиндрической фор-
мы с несколькими одиночными ядрами, лежат в па-
разитофорной вакуоли. Споронты с 4 ядрами делятся
розетковидным почкованием (образуя мальтийский
крест) на 4 споробласта.
Типовой вид Т. brevifilum Matthews et Matt-
hews, 1980. Споры овальные, размером 4.8 X 2.0 мкм.
ПТ изофилярная, делает 4 витка. В соединительной
ткани мускулатуры.
Типовой хозяин рыба Scophthalmus maximus
(Osteichthyes, Bothidae).
Род Microgemma Ralph et Matthews,
1986
Ксеномы до 500 мкм в диаметре, стенка ксеномы
состоит из трех хорошо различимых слоев. Мерогония
посредством почкования или плазмотомии. Спорого-
нальные плазмодии неправильной формы делятся ро-
зетковидным почкованием. У некоторых спор возле
ядра имеется одно крупное электронноплотное округ-
лое включение.
Типовой вид М. hepaticus Ralph et Matthews,
1986. Споры овальные или грушевидные, размером
4.2 X 2.4 мкм. ПТ изофилярная, делает 7—10 витков.
В клетках печени.
Типовой хозяин рыба Chelon labrosus (Osteich-
thyes, Migulidae).
Сем. Microfilidae Sprague, Becnel
et Hazard, 1992
Все стадии в прямом контакте с цитоплазмой клет-
ки хозяина. Образуется ксенома. ПТ толстая и корот-
кая (без витков). Паразиты рыб.
Включает один род Micrdfilum.
Род Microfilum Faye, Toguebaye
et Bouix, 1991
Меронты размножаются бинарным делением. Спо-
рогония в прямом контакте с цитоплазмой клетки хо-
зяина. Споронт делится розетковидным почкованием с
образованием 4 споробластов, затем спор. Базальная
часть ПТ толстая (манубриум), задняя — тонкая.
Типовой вид M.lutjani Faye, Toguebaye et
Bouix, 1991. Споры грушевидной формы (передний по-
1020
ТИП MICROSPORIDIA
люс шире), размером 5.0 X 2.5 мкм. В клетках крови
(моноцитах или гранулоцитах) в жабрах рыб.
Типовой хозяин рыбаLutjanusfulgens (Osteich-
thyes, Lutjanidae).
Сем. Ordosporidae Larsson, Ebert
et Vavra, 1997
Развитие в паразитофорной вакуоли. Ксенома не
образуется. Спорогония 4- или полиспоробластиче-
ская, плазмодий лентовидной (цилиндрической) формы.
Включает два рода.
Род Ordospora Larsson, Ebert et Vavra,
1997
Пролиферативные стадии развиваются на перифе-
рии, грушевидные споры по 4—8 образуются в центре
паразитофорной вакуоли. ПТ изофилярная. Поляро-
пласт пластинчатый.
Типовой вид О. colligata Larsson, Ebert et Vav-
ra, 1997. Споры размером 2.3—3.7 X 1.3—2.3 мкм (жи-
вые). ПТ с 5—6 витками в один ряд. В эпителии ки-
шечника.
Типовойхозяин рачок Daphnia magna (Crusta-
cea, Cladocera).
Род Pleistosporidium (Codreanu-Balcescu
et Codreanu, 1976) Codreanu-Balcescu
et Codreanu, 1982
Меронты 2—4-ядерные в прямом контакте с клет-
кой хозяина. Спорогония 2-ступенчатая. Первич-
ный (материнский) споронт делится на 4 вторичных
(дочерних) споронта, заключенных в паразитофор-
ную вакуоль. Многоядерные вторичные споронты
делятся розетковидным почкованием с образовани-
ем 12—16 спор. Поляропласт вакуолярно-пластин-
чатый.
Типовой вид Р. hyperparasitica (Codreanu-Bal-
cescu et Codreanu, 1976) Codreanu-Balcescu et Cod-
reanu, 1982. Споры удлиненно-грушевидные, размером
2.9 X 1.1 мкм. ПТ изофилярная с 3 витками.
Типовой хозяин грегарина Enterocystis rhyth-
rogenae (Apicomplexa, Gregarinidae) в кишечнике ли-
чинки поденки Rhythrogena semicolorata (Insecta, Ephe-
meroptera).
Примечание. Род включен в сем. Ordosporidae временно по
наличию паразитофорной вакуоли, в то время как 2-ступенчатая
спорогония и ряд других признаков не типичны.
Сем. Unikaryonidae Sprague,
1977
Все развитие паразитов проходит в прямом контак-
те с цитоплазмой клетки хозяина. Ксенома не образу-
ется. Преимущественно паразиты беспозвоночных.
Семейство содержит 9 родов.
Род Unikaryon Canning, Lai et Lie, 1974
Мерогония и спорогония представлены серией би-
нарных делений. Последний меронт трансформиру-
ется в удлиненный споронт. Паразиты трематод и на-
секомых. Инвазированные клетки не гипертрофиро-
ваны.
Типовой вид U. piriformis Canning, Lai et Lie,
1974. Споры грушевидные, размером 3.8 X 2.7 мкм. В
клетках паренхимы.
Типовой хозяин редии и церкарии эхиносто-
матидных трематод Echinoparyphium danni и Echino-
stoma audyi в моллюске Lymnaea rubiginosa.
Примечание. Электронно-микроскопическое изучение
U. legeri выявило вокруг двух спор оболочку спорофорного пу-
зырька (Azevedo, Canning, 1987), которой нет у паразитов насеко-
мых, что позволяет предположить сборный характер этого рода.
Род Canningia Weiser, Wegensteiner
et Zizka, 1995
Меронты одноядерные. Споронты делятся бинар-
но. Споры коротко-палочковидные. Якорный диск не-
обычной луковицевидной формы, расположен субапи-
кально.
Типовой вид С. spinidentis. Споры мелкие, раз-
мером 1.9—2.0 X 0.8—1.0 мкм. В жировом теле и маль-
пигиевых сосудах.
Типовой хозяин жук Pityokteines spinidens
(Coleoptera, Scolytidae).
Род Endoreticulatus Brooks, Becnel
et Kennedy, 1988
Многоядерные меронты лентовидной формы плот-
но окружены ШЭР клетки хозяина. Спорогония в па-
разитофорной вакуоли с образованием 30 и более
спор.
Типовой вид E.fidelis (Hostounsky et Weiser,
1975) Brooks, Becnel et Kennedy, 1988. Споры оваль-
ной или почковидной формы, размером 2.6 X 1.5 мкм.
ПТ изофилярная, делает до 6 витков. В клетках кишеч-
ника.
Типовой хозяин жукLeptinotarsa undecimline-
ata (Coleoptera, Chrysomelidae).
Род Larssoniella Weiser et David,
1997
От рода Unikaryon отличается наличием у споро-
бластов эксцентрично расположенного на заднем по-
люсе пучка трубчатых выростов экзоспоры. У зрелых
спор оболочка гладкая.
Типовой вид L. resinellae Weiser et David, 1997.
Споры коротко-палочковидной формы, размером
4.5—5.0 X 1.7 мкм. ПТ изофилярная, делает 10—
11 витков. В клетках различных тканей и органов.
Типовой хозяин бабочка Petnova resinella (Le-
pidoptera, Tortricidae).
ТИП MICROSPORIDIA. КЛАСС MICROSPOREA
1021
Род Nosemoides Vinckier, 1975
Меронты одноядерные. Многоядерный споронт де-
лится розетковидным почкованием с образованием не-
скольких споробластов. Споры двух размерных групп
сходного строения.
Типовой вид N. vivieri (Vinckier, Devauchelle et
Prensier, 1970) Vinckier, 1975. Макроспоры цилиндри-
ческие, размером 6.0 X 0.7 мкм, микроспоры оваль-
ные, 2.7—3.5 X 1.2 мкм. ПТ изофилярная.
Типовой хозяин грегаринаLecudina linei (Mo-
nocystidae) из немертины Lineus viridis (Nemertea).
Род Oligosporidium (Codreanu-Balcescu,
Codreanu etTraciuc, 1978)
Codreanu-Balcescu, Codreanu et Traciuc,
1981
В мерогонии и спорогонии бинарное деление. Раз-
витие проходит в компартментах клетки, окруженных
плотной зоной ШЭР хозяина.
Типовой вид О. arachnicolum (Codreanu-Bal-
cescu, Codreanu et Traciuc, 1978) Codreanu-Balcescu,
Codreanu et Traciuc, 1981. Споры продолговатые, раз-
мером 3.6 X 2.0 мкм. ПТ изофилярная, делает 7—
8 витков. В ооцитах.
Типовой хозяин клещ Xysticus cambridgei
(Aranea, Thomasidae).
Род Orthosomella Canning, Wigley
et Barker, 1991
Лентовидные спорогональные плазмодии с 4, 8 или
12 ядрами делятся на одноядерные споробласты, лежа-
щие цепочкой.
Типовой вид О. operophterae (Canning, 1960)
Canning, Wigley et Barker, 1991. Споры удлиненно-
овальные, вариабельных размеров, от 2.5 X 1.0 до
6.0 X 1.5 мкм. ПТ делает 6—7 витков. В различных
тканях и органах, вызывает гипертрофию клеток
слюнных желез.
Типовой хозяин гусеницы и бабочки Орего-
phtera brumata (Lepidoptera, Geometridae).
Примечание. Первоначальное название рода Orthosoma
было преоккупированным.
Род Ciliatosporidium Foissner et Foissner,
1995
Меронты делятся бинарно. Спорогония в прямом
контакте с цитоплазмой клетки хозяина. Споры палоч-
ковидные с прямой и короткой ПТ, длина которой со-
ставляет 5/8 длины споры.
Типовой вид С. platyophryae Foissner et Foiss-
ner, 1995. Споры паразита размером 4.0 X 2.0 мкм
иногда выступают на заднем полюсе инфузории в виде
коротких отростков.
Типовой хозяин инфузория Platyophrya terri-
cola (Ciliophora, Colpodea).
Род Nadelspora Olson, Tiekotter et Keno,
1994
Все стадии в прямом контакте с цитоплазмой клет-
ки хозяина. Меронты одноядерные, округлые, лежат
рядами. Удлиненные споронты делятся бинарно. Спо-
ры одноядерные, игловидные. ПТ тонкая, прямая, не
превышающая 3/4 длины споры. Поляропласт пла-
стинчатый.
Типовой вид N. canceri Olson, Tiekotter et Keno,
1994. Споры размером 7.1—11.8 X 0.2—0.3 мкм. В
скелетной мускулатуре.
Типовой хозяин краб Cancer magister (Crusta-
cea, Decapoda).
Примечание. Род включен в семейство временно по харак-
теру спорогонии, в то время как строение спор нетипично для этого
семейства.
Надсем. GLUGEOIDEA Thelohan, 1892
Споронт с большим вариабельным числом ядер (от
8 до 200). Многоядерный споронт делится поэтапно на
фрагменты со все меньшим числом ядер, затем бинар-
но. Завершается спорогония образованием одноядер-
ных споробластов и спор, удерживаемых вместе обо-
лочкой спорофорного пузырька. Последняя тонкая и
непрочная или толстая и субперсистентная. Споры од-
ной или двух размерных групп.
Надсемейство включает 3 семейства: Glugeidae,
Pleistophoridae и Glugoididae.
Сем. Glugeidae Thelohan, 1892
Оболочка спорофорного пузырька закладывается в
процессе спорогонии, тонкая и нестойкая. В результа-
те спорогонии образуется вариабельное число одно-
размерных спор с характерной большой задней ва-
куолью. Зараженная клетка трансформируется в круп-
ную ксеному. Паразиты рыб и амфибий.
Семейство содержит 5 роДов.
Род Glugea Thelohan, 1891
(emend. Canning, Lom et Nicholas, 1982)
Меронты цилиндрической формы заключены в до-
полнительную электронноплотную оболочку и окру-
жены ШЭР хозяина. Они делятся на одноядерные спо-
ронты, которые теряют оболочку меронта и окружают-
ся мембраной спорофорного пузырька. Плазмодий
делится в два этапа, образуя вначале одноядерные пре-
споробласты (или вторичные споронты), которые де-
лятся еще раз бинарно, образуя одноядерные споро-
бласты. Мерогония и спорогония происходят в пери-
ферической зоне ксеномы, зрелые споры лежат в ее
центре. Зрелая ксенома, достигающая нескольких мм,
заключена в многослойную капсулу, ядро клетки ста-
новится разветвленным. Почти все известные виды па-
разитируют у рыб.
Типовой вид G. anomala (Moniez, 1887) Gurley,
1893. Споры овальные, размером 3.3—5.0 X 2.1—
1022
ТИП MICROSPORIDIA
2.3 мкм (живые). ПТ изофилярная, с 13—15 витками,
лежащими в 1 ряд.
Типовой хозяин колюшка Gasterosteus aculea-
tus (Osteichthyes, Gasterosteidae).
Род Alloglugea Papema et Lainson,
1995
Многоядерные меронты округлой или овальной
формы. Споронты лентовидные с одним или двумя ря-
дами ядер, делятся сперва на 2-ядерные сегменты (вто-
ричные споронты), затем на одноядерные споробла-
сты. Спорофорный пузырек отсутствует.
Типовой вид A. bufonis Papema et Lainson,
1995. Споры яйцевидные, размером 1.3—1.6 X 0.6—
0.8 мкм (фиксированные). Поляропласт везикулярный.
ПТ изофилярная, делает 5—6 витков. Ксеномы диа-
метром до 250 мкм в lamina propria кишечника.
Типовой хозяин жабаBufo marinus (Amphibia,
Anura).
Род Loma Morrison et Sprague, 1981
Многоядерные меронты цилиндрической формы
делятся на одноядерные клетки вместе с окружающим
их ШЭР клетки хозяина. Спорогония 4-споробластиче-
ская с образованием спорофорного пузырька. Разные
стадии в ксеноме лежат вперемешку.
Типовой вид L. morhua Morrisonet Sprague, 1981.
Споры удлиненно-овальные, размером 4.3 X 2.1 мкм.
ПТ изофилярная с 14 витками, лежащими в 1 ряд. В
клетках вторичных жаберных лепестков рыб. Ксеномы
достигают 4 мм.
Типовой хозяин рыба Gadus morhua (Pisces,
Gadidae).
Род Pseudoloma Matthews, Brown, Larison,
Bishop-Stewart, Rogers et Kent, 2001
Микроспоридия в спинном и заднем мозгу рыб
продуцирует ксеномы, размером до 200 мкм, со споро-
форными пузырьками, содержащими 8—16 спор. По
секвенированию rDNA род помещен в один кластер с
Ichthyosporidium, имея с ним 12.1 % сходства.
Типовой вид Pseudoloma neurophilia Matthews,
Brown, Larison, Bishop-Stewart, Rogers, Kent, 2001. Од-
ноядерные споры яйцевидной или грушевидной фор-
мы, размером 5.4 X 2.7 мкм с крупной задней ва-
куолью без включений. ПТ с 13—16 витками.
Типовой хозяин рыба полосатый даниоDanio
rerio.
Род Johenrea Lange, Becnel,
Razafindratiana, Przybyszewski
et Razafindrafara, 1996
В мерогонии бинарное деление 2- или 4-ядерных
клеток. Спорогональный плазмодий с 8 или 16 ядрами,
окруженный оболочкой спорофорного пузырька, де-
лится поэтапной плазмотомией на 1-ядерные клетки.
Ксеномы образуются в жировом теле вокруг кишеч-
ника.
Типовой вид J. locustae Lange, Becnel, Razafin-
dratiana, Przybyszewski et Razafindrafara, 1996. Споры
удлиненно-овальные, размером 8.3 X 3.8 мкм. Сильно
развитый поляропласт состоит из пластинчатой и ве-
зикулярной частей. ПТ изофилярная с 12 витками в
один ряд.
Типовой хозяин саранча Locusta migratoria
capita (Orthoptera, Acrididae).
Примечание. Этот род включен в сем. Glugeidae временно,
так как хозяин — беспозвоночное, что не совпадает с диагнозом се-
мейства.
Сем. Pleistophoridae Doflein,
1901
Оболочка меронтогенетического спорофорного пу-
зырька толстая, стойкая. В результате спорогонии об-
разуются споры одного или двух размеров. Ксенома не
образуется.
Включает 6 родов.
Род Pleistophora Gurley, 1893 (emend
Canning, Lom et Nicholas, 1982)
Паразиты поперечнополосатой мускулатуры. Спо-
рогония двух типов. При доминирующей спорогонии
плазмодий, содержащий до 200 ядер, делится посред-
ством плазмотомии на споробласты, образуя мелкие
споры. Реже наблюдается спорогония, дающая начало
восьми крупным спорам, которые отличаются от мел-
ких числом витков ПТ.
Типовой вид Р. typicalis Gurley, 1983, паразитиру-
ет в скелетной мускулатуре. Микроспоры 4.4 X 2.3 мкм,
число витков ПТ до 22, в 1—3 ряда. Макроспоры
7.4 X 3.0 мкм, ПТ имеет до 33 витков.
Типовой хозяин рыба Cottus scorpius = Myo-
xocephalus scorpius (Osteichthyes, Cottidae).
Род Cystosporogenes Canning, Barker,
Nicholas et Page, 1985
Небольшой мерогональный плазмодий с несколь-
кими ядрами делится на одноядерные мерозоиты
вместе с окружающей его мембраной, возможно обра-
зованной хозяином. Спорогония в вакуоли, окружен-
ной прочной мембраной неизвестного происхожде-
ния. Образуется большое вариабельное число спор
(до 60).
Типовой вид С. operophterae (Canning, 1960)
Canning, Barker, Nicholas et Page, 1985. Споры удли-
ненно-овальные, размером 2.5 X 1.2 мкм. ПТ изофиляр-
ная, с 10—11 витками в 1 ряд. В кишечнике и других
органах. Клетки слюнных желез не гипертрофиро-
ваны.
Типовой хозяин бабочка Operophtera brumata
(Lepidoptera, Geometridae).
ТИП MICROSPORIDIA. КЛАСС MICROSPOREA
1023
Род Heterosporis Schubert, 1969
Мерогония и спорогония протекают в толстостен-
ных цистах («спорофороцистах») паразитарного про-
исхождения. Меронты делятся плазмотомией. Споро-
гония в спорофорных пузырьках внутри «спорофоро-
цист» с образованием 8 макроспор или 16 и более
микроспор (число спор у разных видов различно). ПТ
изофилярная.
Типовой вид H.finki Schubert, 1969. Споры
овальные с крупной задней вакуолью, макроспоры раз-
мером 7—9 X 2—3 мкм с 31—36 витками ПТ, микро-
споры — 3 X 1.5 мкм. ПТ с 8 витками. В соединитель-
ной ткани и пищеводе рыб.
Типовой хозяин рыба Pterophylum scalarе
(Ostheichthyes, Cichlidae).
Род Parapleistophora Issi, Kadyrova,
Pushkar, Khodzhaeva et Krylova, 1990
Мерогония не описана. Одноядерный споронт об-
разует многоядерный спорогональный плазмодий.
Спорогония завершается формированием 48—64 и бо-
лее спор в спорофорном пузырьке с толстой и прочной
оболочкой, от которой отходят 1—2 тонких отростка,
соединяющих вместе 2—3 пузырька.
Типовой вид Р. ectospora Issi, Kadyrova, Push-
kar, Khodzhaeva et Krylova, 1990. Споры овальные, раз-
мером 4.3—7.5 X 3.1—5.0 мкм, расположены непо-
средственно под оболочкой спорофорного пузырька.
ПТ до 30 мкм. В жировом теле личинок.
Типовые хозяева: мошки Tetisimulium deserto-
гит и Т. alajense (Diptera, Simuliidae).
Род Trachipleistophora Hollister, Canning,
Weidner, Field, Kench et Marriott, 1996
1-, 2- и 4-ядерные меронты окружены электронно-
плотной оболочкой (предположительно хозяинного
происхождения), примыкающей к плазмалемме и име-
ющей отростки, уходящие в окружающую цитоплазму
клетки хозяина. Эта оболочка делится, окружая од-
ноядерный споронт, как спорофорный пузырек. В спо-
рогонии путем бинарного деления образуется 2—
32 споры.
Типовой вид Т. hominis Hollister, Canning, Weid-
ner, Field, Kench et Marriott, 1996. Споры грушевидные
4.0 X 2.4 мкм, с задней вакуолью. ПТ изофилярная до
75 мкм с 11—12 витками. Поляропласт пластинчатый.
В скелетной мускулатуре.
Типовой хозяин человек Homo sapiens (Prima-
tes, Hominidae).
Род Vavra ia Weiser, 1977
Многоядерный меронт имеет дополнительную
аморфную оболочку, которая преобразуется в оболоч-
ку спорофорного пузырька. Спорогония одного типа.
Деление спорогонального плазмодия розетковидным
почкованием с образованием 8—32, реже большего
числа близких по форме и строению спор. Паразиты
комаров родов Anopheles и Culex.
Типовой вид V. culicis (Weiser, 1957). Споры
овальные, размером 4.0 X 2.5, реже 5.1 X 3.7 мкм. ПТ
изофилярная, образует до 15 витков. В жировом теле
личинок.
Типовой хозяин комар Culex pipiens (Insecta,
Diptera, Culicidae).
Сем. Glugoididae Voronin, 2001
Все стадии развития паразитов заключены в пара-
зитофорную вакуоль. Оболочка спорофорного пузырь-
ка тонкая и нестойкая. ПТ короткая прямая или Длин-
ная свернутая. Задняя вакуоль спор небольшая. Пара-
зиты эпителия кишечника беспозвоночных.
Содержит два рода.
Род Glugoides Larsson, Ebert, Vavra
et Voronin, 1996
Размножение в мерогонии и спорогонии посредст-
вом плазмотомии. В спорофорном пузырьке образует-
ся 16 и более мелких овальных спор. ПТ длинная и
свернутая. Паразитофорная вакуоль с паразитами за-
нимает часть зараженной клетки хозяина.
Типовой вид G. intestinalis (Chatton, 1907)Lars-
son, Ebert, Vavra et Voronin, 1996. Споры овальные,
размером 2.4—2.7 X 1.1—1.7 мкм. Поляропласт пла-
стинчатый, 2-частный. ПТ изофилярная, делает 5—
8 витков.
Типовые хозяева: рачки Daphnia magna и
D. pulex (Cladocera, Daphniidae).
Род Baculea Loubes et Akbarieh,
1978
Лентовидные меронты делятся на 1-ядерные дочер-
ние меронты, окруженные индивидуальной оболочкой
спорофорного пузырька (или мембраной ЭР). Путем
многократного бинарного деления «материнского»
споронта в спорофорном пузырьке образуются клетки,
бинарное деление которых завершается формировани-
ем двух палочковидных споробластов и спор. ПТ ко-
роткая и прямая.
Типовой вид В. daphniae Loubes et Akbarieh,
1978. Споры размером 2.8—3.0 X 0.2 мкм, эндоспора
слабо развита, поляропласт из немногих пластин. ПТ
без витков.
Типовой хозяин рачок Daphnia pulex (Clado-
cera, Daphniidae).
Надсем. Gurleyoidea Sprague,
1977
Спорогония ди- или полиспоробластическая, про-
текает в спорофорном пузырьке. Для каждого семейст-
ва характерно определенное число спор, образующих-
ся из споронта, и кратное двум, а именно — 2, 4, 6, 8,
1024
ТИП MICROSPORIDIA
12, 16 и 32. Паразитофорная вакуоль и ксенома не об-
разуются. Паразиты беспозвоночных.
Надсемейство включает 5 семейств: Gurleyidae, Cou-
gourdellidae, Flabelliformidae, Telomyxidae и Tuzetiidae.
Сем. Gurleyidae Sprague, 1977
Спорогония 4-споробластическая с одиночным или
попарным расположением спор в спорофорном пу-
зырьке. ПТ длинная, свернутая, разного строения.
Семейство включает 4 рода.
Род Gurleya Doflein, 1898
4 споры в спорофорном пузырьке лежат по отдель-
ности. Форма спор варьирует от сферической до удли-
ненно-грушевидной. ПТ различных типов.
Типовой вид G. tetraspora Doflein, 1898. Плохо
описан. Споры грушевидные, размер не указан. В ги-
подерме.
Типовой хозяин рачок Daphnia maxima (Cla-
docera, Daphniidae).
Род Gurleyides Voronin, 1986
Спорогония двух типов происходит в одной ткани.
В спорофорных пузырьках образуются 4 попарно со-
единенные споры или одиночные споры (в индиви-
дуальной оболочке, как у Tuzetia). Строение спор раз-
лично.
Типовой вид Gurleyides biformis Voronin, 1986.
Одиночные споры грушевидной формы, размером
4.2 X 2.4 мкм. ПТ гетерофилярная с 8 витками. Пар-
ные споры удлиненно-грушевидные, размером 4.5—
5.2 X 1.5—1.8 мкм (живые). ПТ анизофилярная, дела-
ет 7—8 (4 + 3—4) витков. В жировом теле.
Типовой хозяин рачок Ceriodaphnia reticulata
(Cladocera, Daphniidae).
Pop, Episeptum Larsson, 1986
Многоядерный мерогональный плазмодий делится
на одноядерные мерозоиты. Спорогония в спорофор-
ном пузырьке с тонкой стенкой завершается образова-
нием 4 спор. Многослойная экзоспора покрыта снару-
жи толстой сетчатой оболочкой. ПТ анизофилярная.
Типовой вид Е. inversum Larsson, 1986. Споры
грушевидные, размером 2.3 X 1.4 мкм. ПТ делает 5—6
(3 + 2—3) витков. Поляропласт пластинчатый. В жиро-
вом теле.
Типовой хозяин ручейник Holocentropus pici-
cornis (Trichoptera, Polycentropodidae).
Род Norlevinea Vavra, 1984
Спорогония одного типа с образованием спорофор-
ных пузырьков с четырьмя попарно соединенными
электронноплотным материалом спорами.
Типовой вид N. daphniae Vavra, 1984. Споры
удлиненно-овальные, размером 6x3 мкм. ПТ анизо-
филярная, делает 8 (4 + 4) витков. В ооцитах.
Типовой хозяин рачок Daphnia longispina
(Cladocera, Daphniidae).
Сем. Cougourdellidae Poisson, 1953
Спорогония полиспоробластическая с образовани-
ем от 4 до 16, обычно 8 спор. Оболочка спорофорного
пузырька разного строения. Форма спор булавовидная
или удлиненно-грушевидная. Передняя часть поляроп-
ласта крупнокамерная. ПТ изофилярного или анизофи-
лярного типов.
Семейство включает 3 рода.
Род Cougourdella Hesse, 1935
Многоядерные мерогональные плазмодии делятся
розетковидным почкованием. Спорогональные плаз-
модии с 2, 4, 8 или 16 ядрами. Споры длинные, тонко-
стенные, с пестиковидно расширенным задним кон-
цом, с большим геликоидальным поляропластом, за-
полненным мелкогранулированным материалом.
Типовой вид С. magna Hesse, 1935, Споры об-
разуются по 2.
Типовой хозяин рачок Megacyclops viridis
(Crustacea, Copepoda).
Примечание. Типовой вид описан плохо, описание рода
сделано по данным, полученным для С. polycentropi Weiser, 1965
(Larsson, 1989).
Род Marssoniella Lemmermann, 1900
Плохо описанный род. Предполагается, что споро-
гония проходит в тонкостенных нестойких спорофор-
ных пузырьках с образованием 4, редко 8 крупных
ланцетовидных спор, заключенных в слизистую массу,
В воде споры лежат в виде звезды, узкими концами на-
ружу.
Типовой вид М. elegans Lemmermann, 1900,
Споры слегка изогнуты, размером 6.0—7,0 X
2.3—3.0 мкм. Задняя вакуоль большая. В ооцитах,
Типовой хозяин рачок Cyclops strenuous
(Crustacea, Copepoda).
Примечание. Род отнесен к сем. Cougourdellidae временно,
Предполагается, что описан лишь один из этапов сложного жиз-
ненного цикла микроспоридии, так как попытка прямой передачи
паразита хозяину была безуспешной. Из-за зеленоватой окраски
спор при световом микроскопировании вид первоначально был от-
несен к синезеленым водорослям.
Род Pyrotheca Hesse, 1935
Меронты с одиночными ядрами делятся бинарно. В
ходе спорогонии из 4-ядерного споронта формируются
4 споры, лежащие в спорофорном пузырьке с тонкой
оболочкой. Зрелые споры удлиненно-грушевидной
формы, с заостренным передним концом.
Рис. 390. Меронты микроспоридий.
д _ Nosema grylli; Б, В — N. whiter, м — меронт; я — ядро; яд — ядро диплокариона.
Масштаб: А — 10 мкм, Б, В — 0.5 мкм.
Fig. 390. Microspoidian meronts.
А — Nosema grylli', Б, В —N. whiter, м — meront; я — nucleus; яд — nucleus of diplokaryon.
Рис. 391. Клетки насекомых, заселен-
ные микроспоридиями.
А — гемоцит гусеницы Pieris brassicae с
микроспоридиями Vairimorpha mesnili, Б —
клетка жирового тела жука с микроспориди-
ями.
Масштаб: А — 10 мкм, Б— 3 мкм.
Fig. 391. Insect cells invaded by micros-
poridians.
A —microsporidia Vairimorpha mesnili in ha-
emocyte of Pieris brassicae larva, Б — Annca-
liia meligethi in the cell of adipose tissues of
the beetle.
Рис. 392. Ультратонкое строение ядра микроспоридий.
А — одиночное ядро, Б — диплокарион, В — граница между ядрами диплокариона, Г— центриолярная пластинка ядра, Д— делящееся ядро, Е —- синапто-
немальные комплексы ядра; ск — синаптонемальный комплекс, х — хромосомы, я — ядро, яд — ядро диплокариона.
Масштаб: А—Е — 1 мкм.
Fig. 392. Ultrastructure of microsporidian nucleus.
A — monocaryon, Б— diplokaryon, В — border between nuclei of diplokaryon, Г— centriolar lamellae in the microsporidian nucleus, Д—dividing nucleus, E — sy-
naptonemal complexes in the microsporidian nucleus; ск — synaptonemal complex, x — chromosomes, я — nucleus, яд — diplokaryon.
Рис. 393. Образование споронта.
А — развитие внешней оболочки споронта поверх плазматической мембраны меронта, Б — споронт Neoperezia chironomi, В — споронт Anncaliia meligethi,
Г — строение оболочки Anncaliia meligethi.
Масштаб: А—В — 1 мкм, Г— 0.2 мкм.
Fig. 393. Formation of microsporidian sporont.
A — development of a sporontal surface coat over merontal plasmatic membrane, Б — sporont of Neoperezia chironomi, В — sporont of Anncaliia meligethi, Г—
structure of envelope of Anncaliia meligethi.
Рис. 394. Образование оболочки спорофорного пузырька.
А — зачаток (стрелка) оболочки спорофорного пузырька у споронта Neoperezia chironomi; Б — строение зачатка (стрелка) оболочки; В — многослойная
оболочка спорофорного пузырька N. chironomi; Г,Д — зачаток (стрелка) оболочки спорофорного пузырька у споронта Janacekia wilhelmiae; Е — споро-
бласт J. wilhelmiae в собственном спорофорном пузырьке; я — ядро.
Масштаб: А, В — 0.5 мкм; Б — 0.25 мкм; Г, Д — 1 мкм.
Fig. 394. Production of sporophorous vesicle envelope.
A — primordium (arrow) of sporophorous vesicle envelope around the sporont of Neoperezia chironomi; Б— structure of envelope primordium (arrow); В — multi-
layered envelope of N. chironomi sporophorous vesicle; Г, Д — primordium (arrow) of sporophorous vesicle envelope around the sporont of Janacekia wilhelmiae;
E — each sporoblast of J. wilhelmiae lies in own sporophorous vesicle; я — nucleus.
Рис. 395. Спорофорные пузырьки некото-
рых микроспоридий.
А — Neoperezia chironomi, Б — Gurleya corynone-
игае, В — Amblyospora macrococcus, Г—Micros-
poridium sp.
Масштаб: A—Г — 5 мкм.
Fig. 395. Sporophorous vesicles of some mic-
rosporidians.
A — Neoperezia chironomi, Б — Gurleya corynone-
urae, В — Amblyospora macrococcus, Г — Micros-
poridium sp.
Рис. 396. Секреторный материал в эписпоронтовой полости спорофорных пузырьков.
А — мелкие гранулы секреторного материала, Б— крупные гранулы секреторного материала, В — трубчатые структуры на оболочке спорофорного пузырь-
ка, Г— секрет разной формы, Д— трубчатые структуры и крупная гранула секреторного материала, Е — трубчатые структуры в полости пузырька; гс —
гранулы секрета, осп — оболочка спорофорного пузырька.
Масштаб: А, Ь\ Г, Е — 3 мкм, В. Д — 2 мкм.
Fig. 396. Metabolic granules in episporontal space of sporophorous vesicles of some microsporidians.
A — fine secretory granules, Б— large secretory granules, В — tubular structures on envelope of sporophorous vesicle, Г- secretory granules of variable forms, Д—
tubular structures and large rod of secretory material, E — tubular net in episporontal space of vesicle; гс — secretion granules; ocn envelope of sporophorous vesicle.
Рис. 397. Морфогенез аппарата Гольджи (чер-
ные стрелки) микроспоридий.
А — аппарат Гольджи у меронта Paranosema gryllv,
Б — аппарат Гольджи у раннего споронта Р. grylli;
В — аппарат Гольджи у споробласта Octotetraspora
paradoxa; Г— аппарат Гольджи, формирующий по-
лярную трубку у О. paradoxa', пт — полярная трубка,
я — ядро, яд — ядро диплокариона.
Масштаб: А, Б — 0.5 мкм; В, Г — 1 мкм.
Fig. 397. Morphogenesis of microsporidian Golgi
apparatus (black arrows).
A — Golgi apparatus in meront of Paranosema gryllv, Б—
Golgi apparatus in early sporont of P. gryllv, В — Golgi
apparatus in sporoblast of Octotetraspora paradoxa', Г—
Golgi apparatus, forming polar tube of O. paradoxa-,
nm — polar tube, я — nucleus, яд — diplokaryon.
Рис. 398. Морфогенез якорного диска микроспоридий.
А — зачаток якорного диска, движущийся к переднему полюсу споры; Б—он же у переднего полюса; В — якорный диск в молодой споре; Г— якорный диск
в зрелой споре; пв — перинуклеарная вакуоль, пд — полярный якорный диск, пп — поляропласт, пт — полярная трубка, эк — экзоспора, эн — эндоспора.
Масштаб: А, Б — 0.2 мкм; В, Г — 0.25 мкм.
Fig. 398. Morphogenesis of anchoring disc of microsporidia.
A — primordium of anchoring disc, moving to anterior pole of spore; Б — anchoring disc on anterior pole; В — anchoring disk of young spore; Г— anchoring disc of
mature spore; ne — perinucleare vacuole, nd — anchoring polar disc, nn — polaroplast, nm — polar tube, эк — exospore, эн — endospore.
Рис. 399. Споры разных видов микроспоридий.
А —Microsporidium chironomi, Б—Jirovecia brevicauda, В — Steinhausia mytilovum в ооците Mytilus edulis, Г— Striatospora chironomi, Д— Systenostrema co-
rethrae, E — Toxoglugea corynoneurae, Ж—Norlevinea dahpniae, 3 — Cougourdella coryniformis, И— Campanulospora denticulata, К — Gurleya corynoneurae,
JI — Microsporidium fluviatilis, M — Golbergia spinosa, H — Pyrotheca virgula, О — Senoma globulifera, П — Microsporidium cordiformis.
Масштаб: 5 мкм.
Fig. 399. Spores of some microsporidian species.
A — Microsporidium chironomi, Б—Jirovecia brevicauda, В — Steinhausia mytilovum in oocyte of Mytilus edulis, Г—Striatospora chironomi, Д—Systenostrema
corethrae, E — Toxoglugea corynoneurae, Ж — Norlevinea dahpniae, 3 — Cougourdella coryniformis, И— Campanulospora denticulata, К — Gurleya corynoneu-
rae, JI — Microsporidium fluviatilis, M — Golbergia spinosa, H — Pyrotheca virgula, О — Senoma globulifera, П — Microsporidium cordiformis.
Рис. 400. Тонкое строение спор микроспоридий.
А, Б— споры двух типов Semenovaia chironomi (А — с диплокариотическим ядерным аппаратом, Б— с одиночным ядром); В — Unikaryon sp.; Г—Amblyo-
spora dissimilis', Д — Crepidulospora beklemishevv, E — Parathelohania gav, nn — поляропласт; сэк — субэкзоспора; эк — экзоспора; эн — эндоспора; я —
ядро; яд — ядро диплокариона.
Масштаб: 1 мкм.
Fig. 400. Fine structure of microsporidian spores.
А, Б—two types of Semenovaia chironomi spores (A — spore with diplokaryon, Б—monokaryotic spore); В — Unikaryon sp.; Г— Amblyospora dissimilis, Д— Cre-
pidulospora beklemishevv, E — Parathelohania gai; nn — polaroplast; сэк — subexospore; эк — exospore; эн — endospore; я — nucleus; яд — nucleus of diplo-
karyon.
Рис. 401. Строение поляропластов у разных микроспоридий.
А — гранулярный поляропласт Cylindrospora chironomi, Б — крупнокамерный или геликоидальный поляропласт Pyrotheca cuneiformis, В — редкопластинча-
тый поляропласт Cougourdella coryniformis, Г — двухчастный поляропласт: крупнокамерный и пластинчатый Microsporidium fluviatilis.
Масштаб: А, Б, В — 0.5 мкм; Г— 0.25 мкм.
Fig. 401. Fine structure of polaroplasts of some microsporidia.
A — granular polaroplast of Cylindrospora chironomi, Б—partitioned (helicoidal) polaroplast of Pyrotheca cuneiformis, В — polaroplast with widely separated lamel-
lae Cougourdella coryniformis, Г — bipartite polaroplast with partitioned and lamellar parts of Microsporidium fluviatilis.
t
i
Рис. 402. Экструзия и строение полярных трубок разных микроспоридий.
А, Б, В — экструзия полярной трубки (А — начало, В— конец, В — выброшенная пт); полярные трубки: Г— короткая прямая;/?— манубрий (поперечный
срез); Е, 3 — анизофилярная; Ж, И — гетерофилярная; К, Л — изофилярная; пт — полярная трубка, я — ядро.
Масштаб: А, Б — 2 мкм; В — 10 мкм; Г— 1 мкм; Д, И, К— 0.125 мкм; Ж, 3, Л— 0.1 мкм.
Fig. 402. Extrusion and fine structure of polar tubes of some microsporidia.
А,Б, В — polar tube extrusion (A — beginning, Б—finish, В — extruded polar tube); polar tubes: Г— short and straight;/?— manubrium (across section); E, 3 — ani-
sofilar; Ж, И — heterofilar; К, Л — isofilar.
Рис. 403. Строение оболочки спор разных микроспоридий.
А — образование оболочки на переднем полюсе споры Octotetrasporaparadoxcr, Б—Amblyospora burlaki', В — Senoma globulifera-, Г—Amblyosporapilata.
Масштаб: А, В — 1 мкм; Б, Г — 0.25 мкм.
Fig. 403. Fine structure of spore wall of some microsporidia.
A — formation of spore wall on anterior pole of Octotetraspora paradoxa spore; Б — Amblyospora burlaki', В — Senoma globulifera', Г — Amblyospora pilata.
Рис. 412. Животные-хозяева, зараженные микроспоридиями.
А — коловратка Polyartra sp., зараженная Microsporidium sp.; К—рачок Daphnia pulex с Gurleya daphniae', В— Chironomusplumosus, зараженный Neoperezia
chironomi', Г — плавник налима Lota lota с ксеномами Glugea fennicae', Д — зрительный нерв морского черта Lophius piscatorius c Spraguea lophii', Д — ко-
люшка Gasterosteus aculeatus с ксеномой Glugea anomala; Ж — мышечные волокна корюшки Osmerus eperlanus c Glugea hertwigi. (A — материал Горбуно-
ва). Масштаб: Г, Д — 4 мм.
Fig. 412. Animal hosts, invadet by microsporidians.
A — Polyartra sp. Rotatoria., invaded Microsporidium sp.; Б — Daphnia pulex with Gurleya daphniae', В — Chironomusplumosus, invaded Neoperezia chironomi',
Г— fin of Lota lota with xenoma of Glugea fennicae', Д— optic nerve of Lophius piscatorius with xenoma of Spraguea lophii', Д— Gasterosteus aculeatus with Glu-
gea anomala xenoma; Ж — muscle fibers of Osmerus eperlanus with Glugea hertwigi.
Рис. 414. Патология клетки, инвазированной микроспоридиями.
А — деформация ядра клетки хозяина; Б—митохондрии клетки хозяина, окружившие паразитов; В — трубчатые структуры (tubular net), окружающие клет-
ки микроспоридий; Г—паразитофорная вакуоль Striatospora chironomi с несколькими спорофорными пузырьками (в каждом из них находятся микроспори-
дии одной стадии развития); вп — паразитофорная вакуоль; кх — клетка хозяина; мх — митохондрии клетки хозяина; осп — оболочка спорофорного пузырь-
ка; пвп — полость паразитофорной вакуоли; с — спора; сб — споробласт; сп — споронт; ст — секреторные трубочки; х — хроматин; ях — ядро клетки
хозяина. Масштаб: А, Б, В — 1 мкм; Г— 5 мкм.
Fig. 414. Pathological changes in invaded host cells.
A — deformation of host cell nucleus; Б — mitochondria of host cell around microsporidian cells; В — tubular net around microsporidian cells; Г— parasitophorous
vacuole with several sporophorous vacuoles of Striatospora chironomi (in every of sporophorous vesicles there are microsporidians of one of specific developmental
stages); en — parasitiphorous vacuole; кх — the host cell; мх — mitochondria of host cell; ocn — the wall of sporophorus vesicle; nen — cavity of parasitophorous va-
cuoles; c — spore; сб — sporoblast; cn — sporont; cm — secretion tubules; x — chromatin; ях — nucleus of host cell.
Рис. 416. Продольный срез через спору Myxobolus kawabatae под не-
большим углом к плоскости шовного валика (X 12 000). (По: Шуль-
ман, 1966).
1 — полярные капсулы, 2 — передний конец полярной нити, 3 — крышечка
капсулы, 4 — створка споры, 5 — шовный валик, 6 — амебоидный зародыш,
7 — ядро, 8 — митохондрии, 9 — аппарат Гольджи, 10 — капсулогенное ядро,
11 — полярная нить, 12 — шов.
Fig. 416. Ultrastructure of the myxosporean spore Myxobolus kawabatae
(X 12 000).
1 — polar capsules, 2 — base of the polar filament, 3 — cap-like structure, 4 — spore
valve, 5 — suture, 6 — ameboid germ, 7 — nucleus, 8 — mitochondria, 9 — Golgi
apparatus, 10 — capsulogenic nucleus, 11 — polar filament, 12 — suture line.
Рис. 417. СпораMyxidium giardi. (По: Hine, 1975,
с изменениями).
ш — шов; г — гребень.
Fig. 417. Spore of the Myxidium giardi.
ш — suture; г — ridge.
Рис. 418. Мукозная оболочка у створок миксоспоридий. (По: Lom, Vavra, 1963,
с изменениями).
А — Myxobolus muelleri, Б — Myxobolus sp.
Fig. 418. Myxosporean spores with mucous envelope.
Рис. 419. Продольный срез через полярную кап-
сулу споры Myxobolus magnus (X 28 000). (По:
Шульман, 1966).
1 — стенка полярной капсулы, 2 — крышечка, 3 — про-
бочка, 4 — основание полярной нити, 5 — полярная
нить.
Fig. 419. Ultrastructure of the polar capsules oi Myxo-
bolus magnus (X 28 000).
1 — capsules wall, 2 — cover (cap), 3 — stopper, 4 — polar
filament base, 5 — polar filament.
Рис. 420. Спора Myxidium giardi. (По: Шульман и др., 1997).
Стрелка указывает на выводное отверстие полярной капсулы.
Fig. 420. Spore of the Myxidium giardi.
Arrow points to pore of polar capsules.
Рис. 423. Актиноспоры Myxosoma cerebralis (Triactinomyxon). (По: Kent et al., 2001, с изменениями).
1 — несколько актиноспор на коже рыбы, 2 — полярные капсулы (А).
Fig. 423. Actinospores of Myxosoma cerebralis (Triactinomyxon).
1 — several actinispores on fish skin, 2 — polar capsules (Л).
Рис. 424. Buddenbrockia около зооида мшанки Plumatelia fungosa. (По: Montei-
ro et al., 2002, с изменениями).
Fig. 424. Living Buddenbrockia near a zooid of bryozoan Plumatella fungosa.
ТИП MICROSPORIDIA. КЛАСС MICROSPOREA
1025
Типовой вид Pyrotheca cyclopis (Leblanc, 1930)
Poisson, 1953. Споры размером 14x3 мкм. ПТ длиной
до 130 мкм.
Типовой хозяин рачок Cyclops albidus (Соре-
poda, Cyclopidae).
Примечание. Описание рода сделано по Р. hydropsycheae
(Xie et Canning, 1986).
Сем. Flabelliformidae Voronin, 2001
Спорогония полиспоробластическая. Число обра-
зующихся спор от 4 до 32, преимущественно 16. Обра-
зуется оболочка спорофорного пузырька. Форма спор
у большинства видов яйцевидная. Поляропласт плас-
тинчатого типа.
Семейство включает 4 рода.
Род Flabelliforma Canning, Killick-Kendrick
et Killick-Kendrick, 1991
Спорогональный плазмодий делится розетковид-
ным почкованием. Оболочка спорофорного пузырь-
ка тонкая, мембраноидная, непрочная, в конце споро-
гонии ее фрагменты окружают отдельные группы
спор.
Типовой вид F. montana Canning, Killick-Kend-
rick et Killick-Kendrick, 1991. Споры удлиненно-оваль-
ные, размером 2.9 X 1.9 мкм. Изофилярная ПТ делает
3.5 витка.
Типовой хозяин москит Phlebotomus ariasi
(Diptera, Psychodidae).
Род Agglomerata Larsson et Yan,
1988
Спорогональный плазмодий делится розетковид-
ным почкованием. Споры в спорофорном пузырьке
соединены между собой и стенкой спорофорного пу-
зырька тонкими фибриллами или трубочками секрета.
Оболочка спорофорного пузырька прочная или слабая.
В последнем случае при ее разрушении группа спор
или отдельные споры окружены ее остатками. Форма
спор грушевидная или яйцевидная.
Типовой вид A. sidae (Jirovec, 1942) Larsson et
Yan, 1988. Споры грушевидные, размером 2.5—3.5 X
1.5—2.0 мкм. Экзоспора многослойная. Поляропласт
3-частный, пластинчатый и трубчатый. ПТ гетерофи-
лярная, с 4—7 витками (1—3 + 3—4). В жировом теле
и гиподерме.
Типовыехозяева: рачки Sida crystallina и Holo-
pedium gibberum (Crustacea, Phyllopoda).
Род Geusia Ruhl et Korn, 1979
Мерогония не описана. Спорогония в споро форном
пузырьке с образованием 6—8 спор.
Типовой вид Geusia gamocystis Ruhl et Кот,
1979. Споры одноядерные, размером 2.6—3.1 X 1.5—
1.7 мкм. ПТ изофилярная с 4—5 витками.
Типовой хозяин грегарина Gamocystis ephe-
merae, из кишечника личинки поденки Ephemera dani-
са (Ephemeroptera, Ephemeridae).
Род Tardivesicula Larsson et Bylen, 1992
Меронты округлые или лентовидные с одиночны-
ми ядрами. Многоядерные споронты делятся розетко-
видным почкованием с образованием 16—32 споро-
бластов в тонкостенном спорофорном пузырьке. Спо-
ры палочковидные с изофилярной ПТ.
Типовой вид Т. duplicata Larsson et Bylen. Спо-
ры 3.7—4.2 X 1.3—1.4 мкм. ПТ образует 9—10 витков
в 1 ряд. Экзоспора 3-слойная. В жировом теле.
Типовой хозяин ручейник Limnephilus dupli-
cata (Trichoptera, Limnephilidae).
Сем. Telomyxidae Leger et Hesse, 1910
Спорогония диспоробластическая. Оболочка споро-
форного пузырька либо плотно прилегает к спорам, либо
отходит от них, формируя полость. Споры лежат свобод-
но или соединены попарно цементирующим веществом.
Семейство включает 4 рода.
Род Telomyxa Leger et Hesse, 1910
Одноядерный споронт секретирует тонкую оболоч-
ку спорофорного пузырька. После деления споронта
на 2 споробласта последние оказываются полностью
замурованными в мелкозернистый секрет экзоспоро-
вого происхождения. Парное соединение спор очень
прочное и постоянное.
Типовой вид Т. glugeiformis Leger etHesse, 1910.
Диплоспоры эллипсоидные, размером 5.8—6.0 X 3.9—
4.2 мкм. ПТ изофилярная, образует 8—14 витков в
один, редко в два слоя. В жировом теле личинок.
Типовой хозяин поденка Ephemera vulgata
(Ephemeroptera, Ephemeridae).
Род Abelspora Azevedo, 1987
Особенности мерогонии сходны с таковой рода
Unikaryon. В полости спорофорного пузырька заклю-
чены 2 споры. Оболочка спорофорного пузырька не
прилегает плотно к стенке спор. Зараженные клетки
гепатопанкреаса гипертрофированы.
Типовой вид A. portucalensis Azevedo, 1987.
Споры овальные, размером 3.1—3.2 X 1.2—1.4 мкм.
ПТ изофилярная с 6 витками. В панкреасе.
Типовой хозяин рак Carcinus maenas (Crusta-
cea, Decapoda).-
Род Berwardia Larsson, 1981
Спорогония диспоробластическая, каждая спора
заключена в индивидуальный спорофорный пузырек.
Оболочка пузырька двухслойная (мембраноидный
65 Зак. №4163
1026
ТИП MICROSPORIDIA
слой подстелен внутренним трубчатым) и прикрепле-
на к экзоспоре через интервалы. Споры лежат одиноч-
но, реже попарно.
Типовой вид В. singularis Larsson, 1981. Споры
эллипсоидные, размером 6x3 мкм. ПТ изофилярная 6
15—16 витками, лежащими в 1 ряд. В жировом теле,
яичниках и гиподерме.
Типовой хозяий рачок Daphnia pulex (Clado-
cera, Daphniidae).
Род Holobispora Voronin,
1986
В процессе спорогонии от оболочки споронта отде-
ляется каплевидный электронноплотный секрет, со-
храняющийся как эписпоровое образование и при пол-
ном созревании спор. Оболочка спорофорного пузырь?
ка тонкая, мембраноидная, плотно прилегает к спорам
при их нахождении в тканях хозяина и формирует по-
лость при попадании спор в воду. Споры соединены
попарно небольшим количеством электронноплотного
секрета.
Типовой вид Н. thermocyclopis Voronin, 1986.
Споры яйцевидные с заостренным передним полюсом,
размером 4.7—5.4 X 2.8-"-3,0 мкм. ПТ изофилярная,
делает 9—14 витков. В соединительной ткани яич-
ников.
Типовой хозяин рачок Thermocyclops oithono-
ides (Copepoda, Cyclopidae).
Сем, Tuzetiidae Sprague,
1977
Споронт делится на 4-—16 споробластов розетко-
видным почкованием вместе с оболочкой спорофорно-
го пузырька, в результате чего каждая спора окружает-
ся индивидуальной оболочкой.
Семейство включает 4 рода.
Род Tuzetia Maurand, Fize, Fenwick
et Michel, 1971
Поздние меронты развиваются в споронты, образу-
ющие спорогональный плазмодий, заключенный в
оболочку спорофорного пузырька. Один споронт про-
дуцирует до 8 спор. После деления оболочка споро-
форного пузырька заключает по отдельности каждый
споробласт, затем спору. Полость между спорой И обо-
лочкой пузырька заполнена трубчатым секретом.
Типовой вид Т. infirma (Kudo, 1921) Maurand,
Fize, Fenwick et Michel, 1971. Споры грушевидные,
размером 5.6—6.4 X 3.0 мкм. ПТ изофилярная, длиной
до 100 мкм, образует 15 витков. В жировом теле, мус-
кулатуре, гонадах.
Типовой хозяин циклоп Cyclops albidus (Co-
pepoda, Cyclopidae).
Примечание. Виды, паразитирующие в поденках и стреко-
зах, имеют 2-частный поляропласт, с передней пластинчатой и зад-
ней пузырчатой или трубчатой частью.
Род Lanatospora Voronin,
1986
Спорогональный плазмодий розетковидным поч-
кованис.м образует 6—16 спор. Типичный споро-
форный пузырек отсутствует, однако стенка споронта
снаружи покрывается электронноплотным каплевид-
ным секретом, который сохраняется и на стенке спо-
робластов. При созррвании спор секрет трансфор-
мируется в сплошное эписпоровое шерстевидное по-
крытие.
Типовой вид L, mqcrpcyclopis Voronin, 1986.
Споры яйцевидные, с заостренным передним полю-
сом, размером 3.2 X 2 мкм (живые). ПТ изофилярная, с
6—-8 витками.
Типовой хозяин рачок Macrocyclops albidus
(Copepoda, Cyclopidae).
Род Nelliemelba Larsson,
1983
Спорогональный плазмодий делится на 8 споро-
бластов, одновременно со спорофорным пузырьком.
При спорогенезе наружный слой экзоспоры отслаива-
ется и свободно окружает спору, В результате каждая
спора окружена 2 оболочками: тонкой внешней (спо-
рофорного пузырька) и толстой внутренней (экзоспо-
рового происхождения).
Типовой вид N. boeckellae (Milner et Mayer,
1982) Larsson, 1983. Споры грушевидные, размером
5 X 2,7 мкм. Преимущественно в мышцах, но иногда и
в других органах.
Типовой градин рачок Bqeckella triarticulata
(Copepoda, Calanpidea).
Род Trichotuzetia Vavra, Larsson et Barker,
1997
Многоядерные (8—10 ядер) меронты делятся пу-
тем поэтапной Плазмотомии на одноядерные мерозои-
ты. В результате розетковидного почкования много-
ядерного спорогонального плазмодия образуется 20—
30 спор, заключенных в индивидуальную оболочку
спорофорного пузырька. Экзоспора 4-слойная и у Мо-
лодой споры соединена с оболочкой спорофорного пу-
зырька многочисленными фибриллами, исчезающими
при созревании споры.
Типовой вид Т. guttata Vavra, Larsson et Barker,
1997, Споры грушевидные, размером 5.0 X 2.9 мкм.
ПТ изофилярная, делает 9—10 витков. Поляропласт
2-частный, передняя с редко и задняя часть с плотно
уложенными пластинами. Во всех тканях, кроме мус-
кулатуры и эпителия кишечника.
Типовой хозяин рачок Cyclops vicinus (Crusta-
cea, Copepoda).
ТИП MICROSPORIDIA. КЛАСС MICROSPOREA 1027
Подкласс Dihaplophasea Sprague, Becnel et Hazard, 1992
В жизненном цикле обязательно временное или постоянное на-
личие диплокариотического ядерного аппарата. Жизненные циклы
либо включают две или три чередующиеся по строению ядерного
аппарата генерации, либо представлены генерацией с постоянно
диплоидным состоянием ядра или генерацией с наличием диплока-
рионов только у определенных стадий развития.
Отряд Meiodihaplophasida Sprague,
Becnel et Hazard, 1992
Для представителей отряда характерна наличие
мейоза. Мейоз у большинства родов происходит во,
время октоспоробластической спорогонии, Ддд ряда
форм характерно наличие сложных жизненных циклов
со стадиями трансовариальной передачи и с участием
промежуточных хозяев, в которых спорогония парази-
тов протекает без мейоза и с образованием спор в спо-
рофорных пузырьках или без них.
Надсем. Cylindrosporioidea Issi
et Voronin, 1986
Микроспоридии с одним типом рпорогонии. Спо-
рогония у большинства родов начинается с расхожде-
ния ядер диплокарирна с последующим образованием
8 или обычно кратного восьми числа гаплоидных
спор, заключенных в спорофорный пузырек, Синапто-
немальные комплексы д делящихся ядрах споронтов
говорят о наличии мейоза. Споры палочковидные, от
коротко- до длинноцилиндрических, прямые или изог-
нутые. Эндоспора слабо развита. Строение поляро-
пласта губчатое или пластинчатое. ПТ прямые и ко-
роткие, не превышающие длину споры. Задняя ва-
куоль у большинства микроспоридий не развита.
Надсемейство включает 2 семейства: Cylindrospori-
dae и Striatosporidae.
Сем. Cylindrosporidae Issi et Voronin, 1986
В спорогонии образуется 8 или кратное 8 число
длинноцилиндрических спор. Поляропласт губча-
тый, без или с немногими пластинками. ПТ прямая,
короткая, сильно расширенная у основания, что придает
ей вид воронки. Образуется паразитофорная вакуоль.
Семейство включает один род.
Род Cylindrospora Issi et Voronin, 1986
Спорогония 8-споровая. Эндоспора слабо развита,
экзоспора гладкая, двухслойная. Поляропласт губча-
тый или с небольшим количеством пластин. Споры по-
крыты мукокаликсом.
Типовой вид С. chironomi Issi et Voronin, 1986.
Споры длинно-цилиндрической формы, размером
7.5 X 1.1 мкм, окружены толстой слизистой капсулой.
В жировом теле личинок.
Типовой хозяин комар-звонец Chironomus
plumosus L. (Diptera, Chironomidae).
Сем. Striatosporidae Issi et Voronin, 1986
Сцорогонид октоспоробластическая, в паразито-
форцой вакуоли или без нее. Споры коротко- или
длйнноцилиндрические, одноядерные, с тонкой ПТ,
рбычно не превышающей 2/3 длины споры. Поляро-
пласр губчатый, пластинчатый или камерный.
Семейство включает 4 рода, все, из водных насе-
комых.
Род Striatospora Issi et Voronin, 1986
В паразитофорной вакуоли одновременно развива-
ется несколько спорофорных пузырьков, каждый из
которых содержит паразитов на определенной стадии
спорогонии. В спорофорном пузырьке формируется
8 короткоцилиндрических спор. Эндоспора слабо раз-
вита. Внешняя мембрана экзооцрры покрыта продоль-
ными рядами электронноплотного материала.
Типовой ВИД $ chironomi Issi et Voronin, 1986.
Споры размером 4.2 X 0.9 мкм. ПТ тонкая, не превы-
шающая 2/3 длины споры. Поляропласт в молодой
споре пузырчатый, в зрелой — губчатый, без пластин.
В жировом теле личинок.
Типовой хозяин личинки комара-звонца Chi-
ronomus plumosus L. (Diptera, Chironomidae).
Род Helmichia Larsson, 1982
Споры короткопалочковидной формы, прямые или
слегка изогнутые. ПТ короткая и тонкая. Поляропласт со-
стоит из двух пластинчатых частей. Эндоспора слабо раз-
вита, экзоспора 2-слойная, толстая, слегка волнистая.
Типовой вид Helmichia aggregata Larsson,
1982. Споры размером 3.1—7.0 X 1.0—1.2 мкм.
Типовой хозяин личинки кровососущего ко-
мара Culexpipiens quinquefasciatus (Diptera, Culicidae).
Примечание. Утверждение в диагнозе рода о наличии двух
пластинчатых частей поляропласта очевидно ошибочно, так как в
описании типового вида задняя часть поляропласта указана как
губчатая.
Род Pernicivesicula Bylen et Larsson,
1994
Мерогональньш плазмодий с 3—8 диплокариона-
ми делится розетковидным почкованием, образуя не-
сколько диплокариотических споронтов. Спорогония
8-споровая в полости меронтогенетического споро-
форного пузырька, оболочку которого образует позд-
ний меронт и заключает, таким образом, несколько
споронтов вместе. В результате в спорофорном пу-
зырьке образуется от 24 до 64 палочковидных спор с
короткими прямыми ПТ, не доходящими до середины
длины споры.
Типовой вид Р. gracilis Bylen et Larsson, 1994.
Споры палочковидные, размером 14 X 1 мкм. По-
ляропласт с небольшим пластинчатым и большим
1028
ТИП MICROSPORIDIA
крупно-камерным участками. В жировом теле ли-
чинок.
Типовой хозяин комар-звонец Pentaneurella
sp. (Diptera, Chironomidae).
Род Toxospora Voronin, 1993
В спорофорном пузырьке 8-ядерный спорогональ-
ный плазмодий дает начало 8 дуговидно изогнутым
длинноцилиндрическим спорам. Ядро удлиненное.
Передняя часть поляропласта пластинчатая, задняя —
губчатая. ПТ короткая, не превышающая 1.5 длины
споры, не свернутая в спираль. Экзоспора 3-слойная.
Паразитофорная вакуоль отсутствует.
Типовой вид T.volgae Voronin, 1993. Споры
размером 6.0—7.0 X 0.8—1.0 мкм. В жировом теле ли-
чинок.
Типовой хозяин личинки комара-звонца Со-
rynoneura sp. (Diptera, Chironomidae).
Примечание. Предполагается (Canning, Vavra, 2000), что
этот род синоним Toxoglugea.
Надсем. Thelohanioidea Hazard
et Oldacre, 1975
Микроспоридии с одним типом спорогонии, кото-
рая начинается с расхождения ядер диплокариона с по-
следующим образованием 8—16 гаплоидных спор, за-
ключенных в спорофорный пузырек. Предполагается
мейоз. Споры различной формы (округлой, овальной,
грушевидной, короткопалочковидной). Эндоспора хо-
рошо развита. Поляропласт преимущественно плас-
тинчатый. ПТ длинные, в споре находятся в свернутом
состоянии, образуя витки спирали. Развитие обычно в
прямом контакте с цитоплазмой клетки хозяина без об-
разования паразитофорной вакуоли.
Надсемейство включает 3 семейства: Thelohanii-
dae, Duboscqiidae и Janacekiidae.
Сем. Thelohaniidae Hazard et Oldacre,
1975
Спорогония октоспоробластическая. Во всем ос-
тальном диагноз семейства соответствует диагнозу
надсемейства. Семейство включает 20 родов (Thelo-
hania, Agmasoma, Alfvenia, Bohuslavia, Chapmanium,
Coccospora, Cryptosporina, Hyalianocysta, Inodosporus,
Larssonia, Napamichum, Nudispora, Octotetraspora, Re-
siomeria, Spherospora, Spiroglugea, Stempellia, Systeno-
strema, Toxoglugea, Trichoctosporea), различающихся
по форме и строению спор, а также по ультраструк-
туре секрета, образующегося в полости спорофор-
ного пузырька.
Род Thelohania Henneguy, 1892
Меронты с одиночными ядрами. В конце мерого-
нии образуются диплокариотические клетки (ранние
споронты). Стадии спорогонии монокариотические,
спорогональный плазмодий делится розетковидным
почкованием. Спорофорные пузырьки содержат по 8
яйцевидных или грушевидных спор. Оболочка споро-
форного пузырька тонкая, субперсистентная, мембра-
ноидная, полость заполнена фибриллярными и трубча-
тыми структурами. Диффренциация ПТ начинается до
разделения споронта на споробласты. Экзоспора двух-
слойная, без эписпоровых покрытий или отростков.
ПТ изофилярная. Поляропласт двухчастный, пластин-
чатый и везикулярный.
Типовой вид Т. giardi Henneguy, 1892. Споры
грушевидные, длиной 5—6 мкм. В гемолимфе и
брюшной мускулатуре.
Типовой хозяин креветка Crangon vulgaris
(Decapoda, Crangonidae).
Род Agmasoma Hazard et Oldacre,
1975
Спорофорные пузырьки овальные с нестойкой обо-
лочкой. ПТ анизо филярная.
Типовой вид A.penaei (Sprague, 1950), Hazard
et Oldacre, 1975. Споры грушевидные, размером 4.0 X
2.2 мкм. ПТ анизофилярная с 8.5 (2.5 + 6) витками. В
ооцитах и брюшных мышцах.
Типовой хозяин креветка Penaeus setiferus
(Crustacea, Decapoda).
Примечание. Возможно, это часть цикла полиморфного
рода.
Род Alfvenia Larsson, 1983
Мерогональные стадии — диплокариотические.
Ранний диплокариотический споронт дает начало спо-
рогональному плазмодию с 4—8 одиночными ядрами.
Плазмодий делится на споробласты одновременно с
оболочкой спорофорного пузырька, в результате каж-
дая спора (редко 2) заключена в собственный пузырек,
лишенный трубчатых структур.
Типовой вид A. nuda Larsson, 1983. Споры яй-
цевидные, размером 3.5—3.9 X 2.5—2.8 мкм. ПТ изо-
филярная, делает 12—14 витков, лежащих в 1—2 ряда.
Поляропласт 2-частный, пластинчатый. Экзоспора
толстая, многослойная. В жировом теле и гиподерме.
Типовой хозяин рачок Acanthocyclops vernalis
(Copepoda, Cyclopidae).
Род Bohuslavia Larsson, 1985
Мерогональный плазмодий делится множествен-
ным розетковидным почкованием. Диплокариоти-
ческий споронт в спорофорном пузырьке образует
спорогональный плазмодий с одиночными ядрами, ко-
торый розетковидным почкованием образует 8 или
16 спор. Грушевидные споры с заостренным перед-
ним полюсом лежат радиально в спорофорном пу-
зырьке.
Типовой вид В. asterias (Weiser, 1963) Larsson,
1985. Споры размером 4.9—7.0 X 2.5—2.8 мкм слег-
ка асимметрично изогнуты. ПТ изофилярная, с
ТИП MICROSPORIDIA. КЛАСС MICROSPOREA
1029
10—11 витками, лежащими в 1 ряд. В жировом теле
личинок.
Типовой хозяин комар-звонец Endochirono-
mus sp. (Diptera, Chironomidae).
Род Chapmanium Hazard et Oldacre, 1975
В мерогонии бинарное деление диплокариотиче-
ских клеток. 8-споровая спорогония протекает в вере-
теновидном спорофорном пузырьке с прочной оболоч-
кой. Споры овальные или грушевидные. ПТ анизофи-
лярная.
Типовой вид С. cirritus Hazard et Oldacre. Спо-
ры размером 2.9—3.0 X 1.3—1.9 мкм (живые). ПТ де-
лает 7.5 (3.5 + 4) витков. В жировом теле личинок.
Типовой хозяин Corethrella brakeleyi (Diptera,
Chaoboridae).
Род Coccospora Kudo, 1925
Диплокариотические меронты делятся розетковид-
ным почкованием или плазмотомией. Спорогония
8-споровая в спорофорном пузырьке с нестойкой обо-
лочкой. Споры округлые и одноядерные. ПТ прямая и
короткая, не превышающая длину споры.
Типовой вид С. micrococcus (Leger et Hesse,
1921) Kudo^ 1925. Споры размером 1.8—2.0 мкм. ПТ
без витков. В жировом теле личинок.
Типовой хозяин комар-звонец Tanypus setiger
(Diptera, Chironomidae).
Род Cryptosporina Hazard
et Oldacre, 1975
Мерогония: неизвестна. В спорогонии образуются
стойкие спорофорные пузырьки яйцевидной формы,
полость которых заполнена секретом янтарного цвета,
маскирующим октоспоры.
Типовой вид С. brachyfila Hazard et Oldacre,
1975. Споры яйцевидные, размером 1.8—1.9 X 0.5—
0.8 мкм (фикс). ПТ изофилярная, делает 2—3 витка. В
жировом теле.
Типовой хозяин водяной клещ Fiona sp.
(Arachnoidea, Acarina).
Род Hyalinocysta Hazard et Oldacre,
1975
Меронты диплокариотические. Спорогония окто-
споробластическая в спорофорном пузырьке с проч-
ной оболочкой, полость которого не содержит включе-
ний. Споры овальные. Живые споры окружены тонкой
слизистой оболочкой. ПТ анизофилярная.
Типовой вид Н. chapmani Hazard et Oldacre,
1975. Споры размером 4.3—4.7 X 2.8 мкм. ПТ делает
7—8 (3.5 + 4.5) витков. Поляропласт пластинчатый. В
жировом теле личинок.
Типовой хозяин комар Culiseta melanura (Dip-
tera, Culicidae).
Род Inodosporus Overstreet et Weidner,
1974
Основной признак рода — наличие у спор экзоспо-
ровых отростков, 3—4 длинных на заднем полюсе и
двух коротких на переднем полюсе. При спорогенезе
эти отростки соединяют спору с оболочкой спорофор-
ного пузырька.
Типовой вид I.spraguei Overstreet et Weidner,
1974. Споры грушевидные, размером 2.9 X 2 мкм. ПТ
изофилярная, делает 4—5 витков. В брюшной муску-
латуре.
Типовые хозяева креветкиPalaemonetespugio
и Р. kadiakensis (Crustacea, Decapoda).
Род Larssonia Vidtmann et Sokolova,
1994
Меронты с одиночными ядрами. В конце мерого-
нии образуются диплокариотические клетки (поздние
меронты или ранние споронты). Стадии спорогонии и
споры с одиночными ядрами. Спорофорные пузырьки
содержат четные числа спор (4—32), формирующихся
в результате розетковидного почкования. Оболочка
спорофорного пузырька непрочная, мембраноидная, в
его полости находятся скопления трубчатого и плас-
тинчатого секретов.
Типовой вид L. obtusa (Moniez, 1887) Vidtmann
et Sokolova, 1994. Споры грушевидные, размером
4.3—4.6 X 2.6—3 мкм (живые). ПТ изофилярная, дела-
ет 6—8 витков.
Типовой хозяин рачок Daphnia pulex (Clado-
cera, Daphniidae).
Примечание. По данным Воронина, диплокариотические
клетки у этого вида отсутствуют, следовательно, систематическое
положение рода должно быть пересмотрено.
Род Napamichum Larsson, 1990
Мерогональный плазмодий диплокариотический.
Веретеновидный спорофорный пузырек содержит,
кроме 8 споробластов и затем 8 спор, нитчатые, труб-
чатые и кристалловидные включения. ПТ изо- или
анизофилярная. Поляропласт пузырчатый или трубча-
тый. Экзоспора 4- или 5-слойная. Предполагается
сборный характер рода (Canning, Vavra, 2000).
Типовой вид N. disperses (Larsson, 1984) Lars-
son, 1990. Споры грушевидной формы, размером 6 X
3.5 мкм. ПТ делает 12—15 (4—5 + 8—10) витков. В
жировом теле личинок.
Типовой хозяин комар-звонец Endochirono-
mus sp. (Diptera, Chironomidae).
Род Nudispora Larsson, 1990
Мерогональный плазмодий диплокариотический.
Спорогония в прямом контакте с цитоплазмой клетки
хозяина. Споронт делится розетковидным почковани-
ем на 8 споробластов.
1030
ТИП MICROSPORIDIA
Типовой вид N. biformis Larsson, 1990. Споры
овальные, размером 3 X 1.6 мкм. ПТ изофилярная, де-
лает 6—7 витков. Экзоспора 3-слойная. В жировом
теле и гиподерме личинок.
Типовой хозяин стрекоза CoendgriOn hastula-
tum (Ogonata, Coenagrionidae).
Примечание. Необычная Черта Этой микроспоридий — раз-
витие 8-споровой формы без образования спорофорйого пузырька.
Род Octotetraspora IsSi, Kadyrova,
Pushkar, Khodzhaeva et Krylova, 1990
Спорогональный плазмодий делится плазмотомией
на 4 или 8 споробластов и соответственно дает начало
4 макро- или 8 микроспорам, имеющим сходное стро-
ение.
Типовой вид О. paradoxa Issi, Kadyrova, Push-
kar, Khodzhaeva et Krylova, 1990. Споры яйцевидной
формы, макроспоры размером 5—6.2 X 3.7—5 мкм и
микроспоры 4—5.4 X 2.7—5.4 мкм (фиксированные).
ПТ изофилярная, делает 4 витка. Поляропласт плас-
тинчатый, затем, вбкруг первбго витка ПТ, из мелких
камер. В жировом теле личинок.
Типовой хозяин мопгка Wilhelmia mediterra-
пеа (Diptera, Simuliidae).
Род Ormieresia Vivares, Bouix et Manier,
1976
Микроспоридии с одноядерными длинно-цилинд-
рическими Спорами. Эндоспора развита. ПТ длиннее
споры, состоит из утолщенного участка (манубрия),
идущего до заднего полюса споры, и тонкого участка с
несколькими витками. Передняя часть поляропласта
губчатая, задняя — пластинчатая.
Типовой вид О. carcini Vivares, Bouix, Manier,
1976. Споры размером 19 X 2.4 мкм. В поперечно-по-
лосатой мускулатуре.
Типовой хозяин краб Carcinus mediterraneus
(Crustacea, Decapoda).
Примечание. По морфологии спор этот род значительно
отличается от других родов, занимая промежуточное положение
между семействами Thelohaniidae и Striatosporidae.
Род Resiomeria Larsson, 1986
Диплокариотические меронты делятся розетковид-
ным почкованием, образуя крупные (10 мкм) 4-доль-
чатые или мелкие (3—4 мкм) 8-дольчатые мерозоиты.
Диплокариотический споронт в спорофорном пузырь-
ке с прочной оболочкой образует 8 одноядерных спо-
робластов. Споры палочковидные. Поляропласт 2-ча-
стный: крупнокамерный и широко-пластинчатый. ПТ
анизофилярная.
Типовой вид R. odonata Larsson, 1986. Спо-
ры размером 6—7 X 2 мкм. ПТ образует по 8—10 как
толстых, так и тонких витков. В жировом теле ли-
чинок.
Типовой хозяин стрекоза Aeshna grandis
(Odonata, Aeshnidae).
Род Spherospora Garcia, 1991
Диплокариотические мелкие меронты делятся би-
нарно. Розетковидное почкование спорогонального
плазмодия приводит к образованию 8—16, редко 32
споробластов. Споры округлые. ПТ прямая и короткая,
без витков.
Типовой вид Spherospora audinae Garcia, 1991.
Споры диаметром 1.5—1.8 мкм. В различных тканях и
органах.
Типовой хозяин мошка Gigantodox chilense
(Diptera, Simuliidae).
Примечание. Возможно, это описание части сложного цикла.
Род Spiroglugea (Leger et Hesse, 1992)
Микроспоридии с длинно-цилиндрическими S-об-
разно изогнутыми спорами. Оболочка спор тонкая. В
каждом спорофорном пузырьке 8 спор, окруженных
трубчатым секретом.
Типовой вид S. octospora (Leger et Hesse,
1922). Споры размером 8.0—8.5 X 1 мкм. ПТ длиной
до 100 мкм.
Типовой хозяин мокрец Ceratopogon sp. (Dip-
tera, Ceratopogbnidae).
Род Stempellia Leger et Hesse, 1910
Единственное ядро споронта делится 2 или 3 раза,
образуя 4- и 8-ядерные плазмодии. Стадии 8-споровой
спорогонии заключены в паразитофорные вакуоли, об-
разованные ШЭР клетки хозяина. 4-споровая спорого-
ния проходит в спорофорном пузырьке, заполненном
гранулами. Обычно октоспоры мельче тетраспор. Оба
типа спор одноядерные.
Типовой вид 5. mutabilis Leger et Hesse, 1910.
Октоспоры удиненно-грушевидные, размером 3 X
1.3 мкм. ПТ изофилярная с 6—7 витками. Тетраспоры
овальные, 6 X 1.2—2 мкм. ПТ анизофилярная, делает
10 (6 + 4) витков. В жировом теле.
Типовой хозяин поденка Ephemera vulgata
(Insecta, Ephemeridae).
Род Systenostrema Hazard et Oldacre,
1975
Меронты и ранние споронты диплокариотиче-
ские, споры одноядерные. Розетковидное почкование
плазмодия в спорофорном пузырьке завершается обра-
зованием 8, реже 16 спор. Оболочка пузырька тонкая,
субперсистентная. Эписпоронтовое пространство мо-
жет содержать трубчатые, но не гранулярные или кри-
сталлоподобные включения. Споры грушевидные,
близкого размера и строения вне зависимости от числа
спор в спорофорном пузырьке. ПТ анизофилярная.
Типовой вид S. tabani ELazard et Oldacre, 1975.
Споры размером 3.3 X 2 мкм (живые). ПТ делает 13—
16 (9—11 + 4—5) витков. В жировом теле личинок.
Типовой хозяин слепень Tabanus lineola (In-
secta, Diptera, Tabanidae).
ТИП MICROSPORIDIA. КЛАСС MICROSPOREA
1031
Род Toxoglugea (Leger et Hesse, 1922)
Leger et Hesse, 1924
В результате мейоза 8-ядерный спорогональный
плазмодий образует 8 дуговидных спор, заключенных
в тонкую оболочку спорофорного пузырька.
Типовой вид Т. vibrio (Leger et Hesse, 1922).
Подкововидные споры размером 3.5 X 0.3 мкм. В жи-
ровом теле личинок.
Типовой хозяин личинки мокреца Ceratopo-
gon sp. (Diptera, Ceratopogonidae).
Род Trichoctosporea Larsson,
1994
Размножение в мерогонии и спорогонии ро'зет-
ковидным почкованием. Полость спорофорного Пу-
зырька большая, оболочка прочная и тонкая. На зад-
нем полюсе споры 5 пучков тонких нитей длиной до
13 мкм. Поляропласт 2-частный, пластинчатый и пу-
зырчатый.
Типовой вид Т. pygopellita Larsson, 1994. Спо-
ры овальные, размером 4.2—4.4 X 6.3—7.0 мкм. ПТ
длинная, анизофилярная, делает 7—9 (3—4 + 4—5)
витков. В жировом теле личйнбк.
Типовой хозяин комар Aedes vexans (Diptera,
Culicidae).
Сем. Duboscqiidae Sprague, 1977
Спорогония завершается образованием 16 спор в
спорофорном пузырьке, оболочка которого гладкая
или с отростками. Во всем остальном диагноз семейст-
ва соответствует диагнозу надсемейства.
Семейство включает 7 родов.
Род Duboscqia Perez, 1908
Округлый 16-ядерный меронт делится на одно-
ядерные мерозоиты розетковидным почкованием. Од-
ноядерный споронт образует 16 спор в споро форном
пузырьке со стойкой оболочкой.
Типовой вид D. legeri Perez, 1908. Споры эл-
липсоидные, размером 4.3—5.9 X 2.2—3 мкм. ПТ дли-
ной до 120 мкм. В жировом теле. Вызывает сильную
гипертрофию клеток жирового тела и появление раз-
ветвленных ядер.
Типовой хозяин термит Reticulotermes lucifu-
gus (Insecta, Isoptera).
Род Hessea Ormieres et Sprague, 1973
Диплокариотические меронты в прямом контакте с
цитоплазмой клетки хозяина. Спорогония в толсто-
стенных цистах, размером 10—15 мкм, покрытых мо-
заичными полигональными пластинками, завершается
образованием 16—32 спор. Споры одноядерные, эн-
доспора и поляропласт отсутствуют, изофилярная ПТ
делает 2—3 витка вокруг ядра.
Типовой вид Н. squamosa Ormieres et Sprague,
1973. Споры округлые, размером 2.5 X 1.5 мкм. В эпи-
телии кишечника.
Типовой хозяин личинки комарика Sciara sp.
(Diptera, Lycoridae).
Род Mitopleistophora Codreanu, 1966
В спорофорном пузырьке, имеющем форму остро-
угольного Треугольника, от каждого угла которого от-
хбдит короткая нить, образуется вариабельное, крат-
ное 8 число спор;
Типовой вид М. angularis Codreanu, 1966. Спо-
ры грушевидные, 4x2 мкм.
ТиповойхОзййН Поденка Ephemera danica (In-
seeta, Ephemeridae),
Род Ovavesicula Andreadis et Hanula, 1987
Диплокариотические меронты делятся бинарным
делением. В овальном спброфорном пузырьке со стой-
кой оболочкой образуется 32 споры.
Типовой вид О-popilliae Andreadis et Hanula,
1987. Споры овальнее или округлые, размером 2—
2.5 X 1.7—1.8 мкм. ПТ изофилярная, делает 6 витков.
В мальпигиевых сосудах.
Типовой хозяин жук Popillia japonica (Coleop-
tera, Scarabaeidae).
Примечание. Род включён в сем. Duboscqiidae временно,
так как число ёпор (32) в спорофорном пузырьке выходит за рамки
диагноза этого семейства.
Род Pegmatheca Hazard et Oldacre, 1975
Диплокариотические споронты дают начало 4—16
8-ядерным спорогональный плазмодиям в спорофор-
ных пузырьках, соединенных в виде «розетки».
Типовой вид Р. simulii Hazard et Oldacre, 1975.
Эллипсоидные споры размером 3—3.7 X 1.9—2.5 мкм
имеют изофилярную ПТ с 5 витками в один слой. В
жировом теле личинок.
Типовой хозяин мошка Simulium tuberosum
(Diptera, Simuliidae).
Род Pulicispora Vedmed, Krylova et Issi,
1991
Меронты с одиночными ядрами, диплокариотиче-
ский споронт дает начало многоядерному плазмодию.
Спорофорный пузырек, ограниченный толстой обо-
лочкой, содержит от 8 до 32 спор с одиночными подко-
вовидными ядрами.
Типовой вид Р. xenopsyllae Vedmed, Krylova et
Issi, 1991. Споры яйцевидные, размером 5—6 X 3 мкм.
ПТ слабо анизофилярная, делает 10 витков. Экзоспора
по экватору орнаментирована трубочками. В жировом
теле, мышцах и гиподерме куколок и имаго.
Типовой хозяин блоха Xenopsylla skrjabini
(Siphonaptera, Pulicidae).
1032
ТИП MICROSPORIDIA
Род Trichoduboscqia Leger,
1926
Мерогония плохо описана, но предположительно
диплокариотическая. Спорогония с образованием
8—32, чаще 16—32 спор в спорофорном пузырьке, от
поверхности которого отходят обычно 4 (реже 2—6)
длинных и тонких отростка.
Типовой вид Т. epeori Leger, 1926. Споры уд-
линенно-грушевидные, длиной 3.5—4 мкм. ПТ изофи-
лярная, делает 6—7 витков. В жировом теле личинок.
Типовой хозяин поденка Epeorus torrentium
(Ephemeroptera, Heptageniidae).
Сем. Janacekiidae Issi, Kadyrova, Pushkar
et Khodzhaeva, 1991
Первые деления ядер спорогонального плазмо-
дия — 2-ступенчатый мейоз, остальные — митоз. Ста-
дии спорогонии развиваются в спорофорном пузырь-
ке, споронтогенетическая оболочка которого окружает
либо совокупность спор, либо каждую спору отдельно.
Количество 1-ядерных спор, образующихся из одного
споронта, обычно кратно 8. ПТ изофилярная.
Семейство включает два рода: Janacekia и Polydis-
pyrenia.
Род, Janacekia Larsson, 1983
В мерогонии образуются диплокариотические ме-
розоиты. Споронт дает начало 12 и более споробла-
стам. Оболочка спорофорного пузырька делится при
спорогенезе и окружает каждую спору. Оболочка спо-
ры покрыта многочисленными трубчатыми структура-
ми, отходящими перпендикулярно от ее поверхности в
полость спорофорного пузырька.
Типовой вид J. debaisieuxi (Jirovec, 1943) Lars-
son, 1983. Споры овальные или грушевидные, разме-
ром 6—7 X 4—4.5 мкм. ПТ с 14—24 витками в
2—3 ряда. В жировом теле личинок.
Типовой хозяин мошка Simulium maculatum
(Diptera, Simulirdae).
Род Polydispyrenia Canning et Hazard,
1982
Меронты диплокариотические. В результате мейо-
за каждый диплокарион спорогонального плазмодия
дает начало 4 гаплоидным ядрам. Число спор равно
числу ядер спорогонального плазмодия. Оболочка
споро форного пузырька споронтогенетическая.
Типовой вид Р. simulii (Lutz et Splendore, 1908)
(= Pleistophora simulii Lutz et Splendore, 1908). Споры
яйцевидные, размером 4.5—5.5 X 2.5—3.5 мкм. Поля-
ропласт 2-частный: везикулярный и пластинчатый. ПТ
длиной до 50 мкм, образует 6 витков. В жировом теле.
Типовой хозяин мошка Simulium venustum
(Diptera, Simuliidae).
Примечание. Предполагается диморфизм или полимор-
физм рода.
Надсемейство PEREZIOIDEA Loubes,
Maurand, Comps et Campillo, 1977
Спорогония начинается с диплокариотической ста-
дии и протекает с образованием или без спорофорного
пузырька. Из одного споронта образуется вариабель-
ное (2—8) число спор. Споры с хорошо развитым ап-
паратом экструзии и длинной ПТ.
Надсемейство включает 3 семейства: Pereziidae,
Neopereziidae и Neonosemoidiidae.
Сем. Pereziidae Loubes, Maurand, Comps
et Campillo, 1977
Развитие в прямом контакте с цитоплазмой клет-
ки хозяина. Меронты диплокариотические, делятся
бинарно. Спорофорный пузырек отсутствует. Мно-
гоядерные споронты четковидной формы. ПТ изофи-
лярная.
Семейство включает 2 рода: Perezia и Ameson.
Род Perezia Leger et Duboscq, 1909
Спорогония начинается с расхождения ядер дипло-
кариона. При последующих делениях ядер образуются
цепочки обычно из 8 одноядерных споробластов, со-
единенных цитоплазматическими мостиками (иногда
попарно) до созревания спор. Споры с гладкой обо-
лочкой.
Типовой вид Р. lankesteriae Leger et Duboscq,
1909. Споры овальные, длиной 2.5 мкм. ПТ делает
13—14 витков.
Типовой хозяин грегаринаLankesteria ascidae
(Apicomplexa, Gregarinidae), паразит оболочника Ciona
intestinalis (Tunicata).
Род Ameson Sprague, 1977
В гемоцитах пазух соединительной ткани диплока-
риотические меронты делятся бинарно. Спорогония в
скелетных мышцах. Спорогональный плазмодий —
лентовидный с 8 одиночными ядрами, расположенны-
ми в один ряд, делится одновременно на 8 споробла-
стов. Экзоспора покрыта короткими волосовидными
выростами.
Типовой вид A. michaelis (Sprague, 1970) Spra-
gue, 1977. Споры овальные, размером 2.2 X 1.7 мкм
(живые). Поляропласт 2-частный, передняя образует
купол из плотных пластин, ПТ делает 10—И витков.
Типовой хозяин краб Callinectes sapidus
(Crustacea, Decapoda).
Сем. Neonosemoidiidae Fraye, Toguebaye
et Bouix, 1996
Все стадии развития в прямом контакте с цитоплаз-
мой клетки хозяина. Мерогония имеет два последова-
тельных этапа: на первом — диплокариотические ста-
дии делятся бинарно, на втором — образуется ленто-
ТИП MICROSPORIDIA. КЛАСС MICROSPOREA
1033
видный плазмодий с одиночными ядрами. Спорогония
полиспоробластическая, без образования спорофорно-
го пузырька.
Семейство включает один род Neonosemoides.
Род Neonosemoides Fraye et Toguebaye,
1996
Споры с одним ядром и крупной задней вакуолью.
ПТ анизофилярная. Поляропласт 2-частный, пластин-
чатый.
Типовой вид N. tilapiae (Sakiti et Bouix, 1987).
Споры грушевидные, 2.5—3.2 X 1.5—2.2 мкм. ПТ с
5 витками (1+4). Образует в желудке овальные ксено-
мы диаметром до 5 мм.
Типовые хозяева: рыбы Sarotherodon melanot-
heron, Tilapia guineensis, T. zilli (Pisces).
Сем. Neopereziidae Voronin,
2001
Спорогония начинается с деления диплокариотиче-
ских клеток. Образовавшиеся многоядерные плазмо-
дии (споронты I порядка) в результате деления дают
начало 2-ядерным клеткам (споронты II порядка), про-
дуцирующим 2, реже 4 одноядерные споры. На завер-
шающем этапе спорогонии формируется спорофорный
пузырек.
Семейство включает один род Neoperezia.
Род Neoperezia Issi et Voronin, 1979
Споры соединены попарно секретом и заключены в
необычные спорофорные пузырьки, тонкая мембрано-
идная оболочка которых образует многочисленные
складки.
Типовой вид N. chironomi Issi et Voronin, 1979.
Споры яйцевидные, размером 5.7—6.1 X 3.3—3.4 мкм
(живые). Поляропласт 2-частный. ПТ изофилярная с
22—27 витками в 2 ряда.
Типовой хозяин личинки комара Chironomus
plumosus L. (Diptera, Chironomidae).
Надсем. Burenelloidea Jouvenas
et Hazard, 1978
Развитие микроспоридий завершается образовани-
ем спор двух типов: одноядерных (мейоспор) и с дип-
локариотическим ядерным аппаратом. Оба типа спор
имеют пластинчатый поляропласт и тонкую изофиляр-
ную ПТ.
Надсемейство включает одно семейство.
Сем. Burenellidae Jouvenas et Hazard,
1978
С диагнозом надсемейства. Семейство включает
12 родов.
Род Burenella Jouvenaz et Hazard,
1978
Одноядерные, затем диплокариотические меронты
делятся бинарно. Спорогония 2 типов протекает одно-
временно, но в разных тканях. В гиподерме развивают-
ся Ммелш-подобные споры, в жировом теле развитие
идет по типу Thelohania, но оболочка спорофорного
пузырька нестойкая, поэтому зрелые октоспоры обыч-
но лежат свободно.
Типовой вид В. dimorpha'Jouvenaz et Hazard,
1978. Voje/иа-подобные споры удлиненно-овальные,
размером 6.4 X 2.9 мкм. ПТ делает до 26 витков. Ок-
тоспоры овальные, размером 6.1 X 4.2 мкм. ПТ делает
до 57 витков.
Типовой хозяин личинки 4-го возраста и
куколки муравья Solenopsis gemminata (Isoptera, For-
micidae).
Род Auraspora Weiser et Purrini,
1980
Мерогония неизвестна. В спорогонии образуются
как свободные диплокариотические споры, так и груп-
пы одноядерных спор в спорофорном пузырьке. Внеш-
ний слой экзоспоры диплокариотических спор имеет
вид пены.
Типовой вид A. canningae Weiser et Purrini,
1980. Двухъядерные споры грушевидной формы, раз-
мером 4—5 X 2—2.5 мкм. ПТ изофилярная, делает
8—9 витков. В семенниках.
Типовой хозяин ногохвостка Lepidocyrtus lig-
norum (Collembola, Tomoceridae).
Род Evlachovaia Voronin et Issi,
1986
Мерогония не известна. В одной спорогонии обра-
зуются одиночные Nosema-подобные споры, во вто-
рой — две более мелкие, тупояйцевидные, одноядер-
ные споры в спорофорном пузырьке. Электронномик-
роскопически род не изучен.
Типовой вид Е. chironomi Voronin et Issi,
1986. Одиночные споры овальные, размером 8.8 X
4.7 мкм. Одноядерные споры размером 5x4 мкм. В
жировом теле личинок.
Типовой хозяин комар-звонец Chironomus
plumosus L. (Diptera, Chironomidae).
Род Heterovesicula Lange, MacVean,
Henry et Streett, 1995
Диплокариотическая и монокариотическая споро-
гонии протекают в спорофорных пузырьках. Ленто-
видные споронты с диплокарионами дают начало
крупным диплокариотическим спорам, веретеновид-
ные монокариотические споронты образуют 8 одно-
ядерных спор.
Типовой вид Н. cowani Lange, MacVean, Henry
et Streett, 1995. 2-ядерные споры овально-цилиндриче-
1034
ТИП MICROSPORIDIA
ские, размером 5.4 X 2.3 мкм, ПТ делает до 11 витков.
Одноядерные споры грушевидные, размером 4 X
1.7 мкм, ПТ делает до 9 витков. В жировом теле и ма-
льпигиевых сосудах.
Типовой хозяин кузнечик Anabrus simplex
(Orthoptera, Tettigoniidae).
Род Issia (Weiser, 1977) Canning
et Vavra, 2000
Мерогония не описана. В одной спорогонии дип-
локариотичёские споронты делятся бинарно с обра-
зованием 2 диплокариотических спор, соединенных
попарно секретом, в другой — по 8 одноядерных
спор. Обе спорогонии протекают в спорофорных пу-
зырьках.
Типовой вид I. trichopterae (Weiser, 1946) Wei-
ser, 1977. Диплокариотические споры слегка груше-
видные, размером 3.5—4.0 X 2 мкм. ПТ изофилярная
до 300 мкм. В жировом теле личинок.
Типовой хозяин ручейник Plectrocnemia geni-
culata (Trichoptera, Plectrocnemidae).
Род Kinorhynchospora Adrianov
et Rybakov, 1991
Споры 2 морфологических типов образуются в од-
ном спорофорном пузырьке. Спорогональный плазмо-
дий делится путем асинхронного розетковидного поч-
кования.
Типовой вид К. japonica Adrianov et Rybakov,
1991. Мелкие бобовидные споры размером около
1 мкм, с одним ядром и изофилярной ПТ с 5 витками.
Более крупные подкововидные споры размером
1.6 мкм, с 2 ядрами (или одним подкововидным?) и
ПТ, делающей 7 витков. В эпителии кишечника.
Типовой хозяин киноринха Kinorhynchus jus-
hihi (Homalorhagida, Pycnohpyidae).
Примечание. Возможна паразитофорная вакуоль (Canning,
Vavra, 2000).
Род Merocinta Pell et Canning,
1993
Развитие с образованием одноядерных спор в ки-
шечном эпителии личинок и Мзтелга-подобных во
взрослых комарах. В личинках лентовидные диплока-
риотические меронты плотно окружены эндоплазма-
тической сетью (ШЭР) клетки хозяина. Диплокариоти-
ческий споронт дает начало многоядерному плазмо-
дию с одиночными ядрами, который поэтапно делится
на споробласты, заключенные по одному в ШЭР хо-
зяина.
Типовой вид М. davidi Pell et Canning, 1993.
Одноядерные эллипсоидные споры, размером 2.5 X
1.5 мкм, ПТ с одним витком. Почковидные Nosema-no-
добные диплокариотические споры имеют размеры
3.4 X 1.8 мкм.
Типовой хозяин комар Mansonia africana
(Diptera, Culicidae).
Род Parastempellia Khodzhaeva,
1988
Мерогония не описана. В спорогонии образуются
как одиночные 2-ядерные споры, так и мелкие одно-
ядерные споры, заключенные по 4, 8 или 16 в споро-
форные пузырьки.
Типовой вид Р. odagmiae Khodzhaeva, 1988.
Споры обоих типов овальные, в толстой оболочке.
Микроспоры 1.2—2.5 X 1.2—1.8 мкм, макроспоры
3.1—3.7 X 1.2—2.5 мкм (фиксированные). В жировом
теле, кишечнике и слюнных железах личинок.
Типовой хозяин мошка Odagmia ferganica
(Diptera, Simuliidae).
Род Pilosporella Hazard et Oldacre,
1975
Известно 2 типа спорогонии: в эноцитах взрослых
самцов и самок по типу Nosema с образованием тонко-
стенных одиночных грушевидных спор и в жировом
теле личинок по типу Thelohania с образованием 8
округлых спор и большого количества трубчатого и
гранулярного секрета в спорофорных пузырьках.
Типовой вид P.fishi Hazard et Oldacre, 1975.
Размеры одиночных спор — 3.18—5.14X1.4— 1.6 мкм,
октоспор — 2.33—3.13 мкм. Изофилярная ПТ образу-
ет 6 витков у первых и 4 у вторых.
Типовой хозяин личинки комара Wyeomyia
vanduzeci (Diptera, Culicidae).
Род Semenovaia Voronin et Issi,
1986
В спорогонии одновременно образуются споро-
форные пузырьки с 16 одноядерными спорами и круп-
ные одиночные 2-ядерные споры. Споры обоих типов
имеют длинную изофилярную ПТ и поляропласт с пе-
редней частью, состоящей из камер, заполненных вол-
нистыми фибриллами.
Типовой вид 5. chironomi Voronin et Issi, 1986.
2-ядерные споры удлиненно-овальные, размером
7.2 X 3.8 мкм. ПТ делает 19—26 витков. Одноядерные
споры овальной формы, размером 6 X 3.5 мкм. ПТ де-
лает 13—27 витков. В жировом теле.
Типовой хозяин личинки комара Chironomus
plumosus L. (Diptera, Chironomidae).
Род Tabanispora Bykova, Sokolova
et Issi, 1987
Микроспоридии с двумя типами спорогонии: пер-
вая — в прямом контакте с цитоплазмой клетки хозяи-
на с образованием одиночных 2-ядерных спор, вторая
протекает в спорофорных пузырьках с образованием 2,
4, реже 10 одноядерных спор и крупных палочковид-
ных электронноплотных телец.
Типовой вид Т. bacillifera Bykova, Sokolova et
Issi, 1987. Оба типа спор яйцевидной формы с изофи-
лярной ПТ. Размеры 2-ядерных спор 5.3 X 3.2 мкм, ПТ
ТИП MICROSPORIDIA. КЛАСС MICROSPOREA
1035
с 18—21 витками. Одноядерные споры размером 3.5 X
2.3 мкм, ПТ с 4—6 витками. В жировом теле личинок.
Типовой хозяин слепень Hybomitra arpadi
(Diptera, Tabanidae).
Род Vairimorpha Pilley, 1976
Доминирует Ммеша-подобцый тип спорогонии.
Второй тип развития, ТТге/о/гаиш-подобный, происхо-
дит при температурах ниже 25 °C. Спорогональные
плазмодии делятся розетковидным почкованием. В по-
лости спорофорного пузырька присутствуют много-
численные секреторные гранулы, трубочки и нити. ПТ
изофилярная.
Типовой вид V. necatrix (Kramer, 1965) Pilley,
1976. Споры с диплокарионом размером 5—6 X
2.3—2.8 мкм. ПТ делает 13 витков. Одноядерные спо-
ры размером 2.8—4х 1.7—2.4 мкм. ПТ делает
12—13 витков. В клетках гемолимфы и жирового тела.
Типовой хозяин бабочка Pseudaletia unipunc-
tata (Lepidoptera, Noctuidae).
Надоем. Culicosporoidea Weiser, 1977
Спорогония завершается образованием двухъядер-
ных и одноядерных спор, споры двух или трех морфо-
логических-типов. Слияние диплокариотических ядер
происходит сразу после попадания спороплазмы в
клетку хозяина. Споры одного из типов ланцетовид-
ные, с крупнокамерным (геликоидальным) поляропла-
стом. Жизненные циклы с участием промежуточного
хозяина — циклопа, либо без него.
Надсемейство включает 4 семейства: Culicospori-
dae, Culicosporellidae, Golbergiidae и Spragueidae.
Сем. Culicosporidae Weiser, 1977
Спорогония с образованием спор двух морфологи-
ческих типов. Двухъядерные споры типа Nosema ле-
жат раздельно. Одноядерные споры, образующиеся из
многоядерного (до 8) споронта, ланцетовидные, за-
ключены в тонкую индивидуальную оболочку.
Семейство включает 3 рода.
Род Culicospora Weiser, 1977
Жизненный цикл протекает в двух последователь-
ных поколениях одного хозяина. В первом- одно-
ядерные споры перорально заражают жировое тело и
эноциты личинок. В мерогонии плазмогамия гамет,
образовавшихся из многоядерного плазмодия (гамон-
та), происходит в личинке последнего возраста. Во
взрослых комарах имеет место кариогамия и формиро-
вание 2-ядерных спор с короткой изофилярной ПТ, за-
ражающих ооциты. Во втором поколении в жировом
теле монокариотические споронты бинарным или ро-
зетковидным делением продуцируют 2—8 и более од-
ноядерных спор в спорофорном пузырьке. ПТ изофи-
лярная.
Типовой вид С. magna (Kudo, 1920) Weiser,
1977. Диплокариотические споры цилиндрические,
размером 11 X 4.4 мкм. ПТ с 1—2 витками. Одноядер-
ные споры ланцетовидные, размером 12—16.5 X
4.6 мкм. ПТ с 10—13 витками.
Типовой хозяин комар Culex pipiens (Diptera,
Culicidae).
Род Edhazardia Becnel, Sprague
et Fukuda, 1989
Развитие протекает в двух последовательных гене-
рациях одного хозяина с образованием спор 3 типов. В
личинках первого поколения после заглатывания
1-ядерных спор проходит мерогония и гаметогония,
плазмогамия дает начало диплокариотическим меро-
нтам, во взрослых комарах образуются цилиндриче-
ские споры неземного типа. Эти споры инвазируют
ооциты. В следующем поколении в жировом теле ли-
чинок 2 разных мерогонии и спорогонии завершаются
образованием одноядерных спор 2 морфологических
типов: а) ланцетовидных в индивидуальных спорофор-
ных пузырьках для пероральной горизонтальной пере-
дачи и б) после кариогамии Amblyospora-тяобных
мейоспор с анизофилярной ПТ.
Типовой вид Е. aedis (Kudo, 1930) Becnel, Spra-
gue, Fukuda, 1989. Размеры Мхуеига-подобных спор —
9.1 X 3.4 мкм, ланцетовидных— 8.3 X 4.5 мкм, мейос-
пор — 7.6 X 6 мкм.
Типовой хозяин комар Aedes aegypti (Diptera,
Culicidae).
Род Aedispora Kilotchitzkyi, 1997
Известен один тип спорогонии, все споры одного
размера. Одноядерные удлиненно-грушевидные спо-
ры с большим геликоидальным поляропластом образу-
ются в группах по 8 путем поэтапной плазмотомии
спорогонального плазмодия. ПТ анизофилярная.
Типовой вид A. dorsalis Kilotchitzkyi, 1997.
В жировом теле личинок.
Типовой хозяин комар Aedes caspius dorsalis
(Diptera, Culicidae).
Семейство Culicosporellidae Becnel
et Fukuda, 1991
Споры трех морфологических типов образуются в
спорогониях, протекающих по типу Nosema, типу Am-
blyospora и с образованием 6—20 изолированно лежа-
щих 2-ядерных спор.
Семейство с одним родом Culicosporella.
Род Culicosporella Weiser,
1977
На разных стадиях развития одного хозяина обра-
зуются споры 3 морфологических типов. В личинках
диплокариотические споронты дают начало спорофор-
1036
ТИП MICROSPORIDIA
ным пузырькам либо с 8 ланцетовидными 2-ядерными
спорами, либо с 2—8 Л/иЬ/уо^ога-подобными спора-
ми. Ланцетовидные споры заражают личинок перо-
рально. Во взрослых самках образуются Nosema-no-
добные споры.
Типовой вид С. lunata (Hazard et Savage, 1970)
Weiser, 1977. Размеры Мие/па-подобных спор 2.4 X
1.4 мкм, ланцетовидных спор — 7.1 X 3.8 мкм (с изо-
филярной ПТ, делающей 10 витков), Amblyospora-i\o-
добных спор — 3.9 X 4.5 мкм (с анизофилярной ПТ,
делающей 7 витков).
Типовой хозяин комар Culex pilosus (Diptera,
Culicidae).
Сем. Golbergiidae Issi, 1986
Споры двух морфологических типов. Кроме споро-
гонии неземного типа, полиспоровая спорогония дает
начало разному числу (обычно 8) ланцетовидных или
длинно-грушевидных одноядерных спор с тонкими
стенками. Иногда образуются 2-ядерные округлые
тонкостенные споры. Полное развитие протекает в ли-
чинке хозяина.
Семейство включает 4 рода.
Род Golbergia Weiser, 1977
Все стадии в прямом контакте с цитоплазмой клет-
ки хозяина. В мерогонии бинарное деление дипло-
кариотических клеток. Спорогональный плазмодий
розетковидным почкованием образует 4—16 спороб-
ластов. «Летние» споры одноядерные, удлиненно-гру-
шевидные, с тонкой гладкой оболочкой. «Осенние»
споры с диплокарионом, грушевидные, с толстой обо-
лочкой, несущей несколько продольных ребер и тол-
стый шип на заднем полюсе.
Типовой вид G. spinosa (Golberg, 1971) Weiser,
1977. Диплокариотические споры размером 5.4—6.6 X
2.4—2.7 мкм. В слюнных железах и жировом теле ли-
чинок.
Типовой хозяин комар Culexpipiens (Diptera,
Culicidae).
Род Hazardia Weiser, 1977
Диплокариотические и одноядерные меронты раз-
множаются в гемоцитах. Спорогония в жировом теле
в прямом контакте с цитоплазмой клетки хозяина
с образованием спор 2 морфологических типов. При
розетковидном делении споронтов образуется 2—
16 (обычно 8) одноядерных грушевидных спор (перо-
ральной передачи) с тонкой оболочкой и изофилярной
ПТ. Плазмогамия дает начало диплокариотическим
меронтам, споронтам и 2 спорам с толстой оболочкой
и анизофилярной ПТ.
Типовой вид Н. milleri (Hazard et Fukuda, 1974)
Weiser, 1977. Размеры грушевидных спор 5 X 2.5 мкм.
ПТ изофилярная, делает 10—11 витков. Диплокарио-
тические споры размером 4.8—2.6 мкм. ПТ анизофи-
лярная с 10 (4 + 6) витками.
Типовой хозяин личинкиCulexpipiensquinqu-
efasciatus (Diptera, Culicidae).
Примечание. Предполагается (Sprague et al., 1992) наличие
третьего типа спорогонии.
Род Simuliospora Khodzhaeva, Krylova
et Issi, 1990
Поздние меронты — диплокариотические. Много-
ядерный споронт делится на 6—32 (обычно 12—24)
споробласта. Споры 2 типов образуются в спорофор-
ных пузырьках. Споры I типа клиновидные тонкостен-
ные одноядерные, с анизофилярной ПТ. Споры II типа
грушевидные, толстостенные, 2-ядерные с изофиляр-
ной короткой ПТ.
Типовой вид S. uzbekistanica Khodzhaeva, Kry-
lova et Issi, 1990. Размеры клиновидных спор 3.9 X
1.7 мкм, анизофилярная ПТ с 4 витками (1 +3). Двухъ-
ядерные грушевидные споры размером 3 X 1.8 мкм с
изофилярной ПТ длиной около 30 мкм. В жировом
теле.
Типовой хозяин мошка Tetisimulium alajense
(Diptera, Simuliidae).
Род Krishtalia Kilotchitzkyj,
1997
Одновременно формируются споры 2 типов: одно-
ядерные тонкостенные грушевидные с пластинчатым
поляропластом и билатерально симметричные 2-ядер-
ные споры, на оболочке которых имеются ребра и шип
на заднем полюсе. От родов Golbergia и Hazardia отли-
чается наличием у одноядерных спор пластинчатого,
а не геликоидального поляропласта.
Типовой вид К. pipiens Kilotchitzkyj, 1997. В
жировом теле.
Типовой хозяин комар Culex pipiens pipiens
(Diptera, Culicidae).
Сем. Spragueidae Weissenberg,
1976
Развитие в прямом контакте с цитоплазмой клетки
хозяина. Два типа спорогонии и образование спор двух
морфологических типов происходят в каждой зара-
женной клетке. Одноядерные споры развиваются по
периферии компартмента заселения по типу Nosemoi-
des, 2-ядерные — в его центре по типу Nosema, обе
зоны четко разграничены. Зараженные ганглии увели-
чены, образуя опухоли размером с горошину. Семей-
ство представлено одним родом.
Род Spraguea Weissenberg, 1976, emend.
Loubes, Maurand et Ormieres, 1979
С диагнозом семейства.
Типовой вид S. lophii (Doflein, 1898). Одно-
ядерные овальные споры размером 4.2 X 2.5 мкм.
Изофилярная ПТ с 5—6 витками. Диплокариотические
ТИП MICROSPORIDIA. КЛАСС MICROSPOREA
1037
споры цилиндрические, размером 3.7X1.4 мкм.
ПТ делает 3—4 витка. В ганглиях зрительного нерва.
Типовой хозяин рыбаLophiuspiscatorius (Pis-
ces, Lophiidae) и другие виды этого рода.
Надоем. Amblyosporoidea Weiser, 1977
Развитие микроспоридий происходит с участием
промежуточного хозяина — циклопа и завершается
образованием спор трех морфологических типов. В де-
финитивном хозяине формируются одноядерные
«мейоспоры» и споры с диплокарионом, в промежу-
точном хозяине — одноядерные ланцетовидные споры
с геликоидальным или вакуолярным поляропластом.
Надсемейство включает одно семейство.
Сем. Amblyosporidae Weiser, 1977
Октоспоровая спорогония завершается образовани-
ем в спорофорном пузырьке одноядерных толстостен-
ных мейоспор с анизофилярной ПТ, диспоробластиче-
ская спорогония — формирование одиночных дипло-
кариотических спор с изофилярной полярной трубкой.
Семейство включает 4 рода.
Род Amblyospora Hazard et Oldacre, 1975
Октоспоры (мейоспоры) образуются в личинках
самцов, одиночные диплокариотические споры в има-
го самок комаров. Октоспоры заражают промежуточ-
ных хозяев — циклопов, одиночными двухъядерными
спорами осуществляется трансовариальная передача
паразитов. В циклопах проходит гаплоидный этап цик-
ла, в спорогонии розетковидным почкованием пооди-
ночке или группами в спорофорных пузырьках образу-
ются ланцетовидные споры. Тонкая на переднем или
на обоих полюсах эндоспора октоспор утолщена по
бокам, что приводит при фиксации к характерной де-
формации спор — появлению вогнутости на переднем
или на обоих полюсах споры.
Типовой вид A. californica (Kellen etLipa, 1960)
Hazard et Oldacre, 1975. Диплокариотические цилинд-
рические споры размером 10.6 X 2.8 мкм. Овальные
октоспоры размером 6.3 X 4.1 мкм. ПТ анизофилярная
с 9 (3.5 + 6.5) витками. Ланцетовидные споры размером
12.5 X 4.6 мкм. ПТ изофилярная, делает до 12 витков.
Типовые хозяева: комар Culex tarsalis (Diptera, Cu-
licidae) и циклоп Mesocyclops leukarti (Copepoda, Cyc-
lopidae).
Род Becnelia Tonka et Weiser, 2000
Монокариотические меронты образуют в начале
мейоза диплокариотические стадии. Спорогония с
образованием розетки и 8 удлиненно-овальных или
овальных одноядерных спор в стойких спорофорных
пузырьках. Оба типа спор имеют поляропласт с плотно
уложенными пластинами на переднем и заднем участ-
ках и редко уложенными в середине и анизофилярную
ПТ. Ранние аутоинвазионные споры с более корот-
кой ПТ.
Типовой вид В. sigarae Tonka et Weiser, 2000.
Октоспоры размером 5 ± 0.5 X 2.5 ± 0.5 мкм. ПТ с 9—
11 (5—6 + 4—5) витками. Аутоинвазионные споры
размером 4 X 2.5—3 мкм, ПТ с 7 (4 + 3) витками. В се-
менниках клопов.
Типовой хозяин водяной клоп-гребляк Sigara
lateralis (Heteroptera, Corixidae).
Род Crepidulospora (Simakova, Pankova
et Issi, 2003)
В спорогонии образуются 8 мейоспор, оболочка
спорофорного пузырька непрочная. Эписпоронто-
вое пространство заполнено мелкофибриллярным сек-
ретом. Споры овальные, передний полюс слегка во-
гнут, задний образует большой выступ благодаря
утолщению субэкзоспоры и эндоспоры. Оболочка спо-
ры образована двухмембранной экзоспорой, толстой
субэкзоспорой, двухслойной эндоспорой и плазмати-
ческой мембраной. 3-частный поляропласт состоит
из крупнокамерной, мелкокамерной и пластинчатой
частей.
Типовой вид С. beklemishevi (Simakova, Panko-
va et Issi, 2003). Размер фиксированных спор 4.2 X
2.2 мкм. ПТ анизофилярная с 6—7 витками (2 + 4—5).
В жировом теле личинок.
Типовой хозяин личинки комара Anopheles
beklemishevi (Diptera, Culicidae).
Примечание. Первое название рода Crepidula, как преокку-
пированое, заменено на Crepidulospora (Simakova, Pankova, Issi,
2004).
Род Cristulospora Khodzhaeva et Issi, 1989
Мерогония не известна. Две спорогонии — по типу
Thelohania в личинках и по типу Nosema во взрослых
комарах. Октоспоры имеют на переднем и заднем по-
люсах волосовидные выросты экзоспоры в виде плю-
мажа.
Типовой вид С. sherbani Khodzhaeva et Issi,
1989. Октоспоры яйцевидные, размером 6x5 мкм, в
жировом теле. Диплокариотические споры оваль-
но-цилиндрические, размером 7.5 X 3.2 мкм, в стенках
яичников самок.
Типовой хозяин комар Culex modestus (Dipte-
ra, Culicidae).
Род Dimeiospora Simakova, Pankova
et Issi, 2003
Два типа спорогонии с розетковидным делением
споронта и образованием одноядерных октоспор двух
морфологических типов. Прочная оболочка спорофор-
ного пузырька длительно сохраняется вокруг спор.
Эписпоронтовое пространство заполнено крупными
гранулами секрета. Споры различаются формой, стро-
ением поляропласта и числом витков анизофилярной
ПТ. У яйцевидных спор поляропласт 3-частный: плас-
1038
ТИП MICROSPORIDIA
тинчатый, мелковезикулярный и крупновезикуляр-
ный, у широкоовальных — 2-частный: пластинчатый и
везикулярный.
Типовой вид D. palustris Simakova, Pankova et
Issi, 2003. Яйцевидные споры размером 6.1 X 4.9 мкм с
ПТ, делающей 9 витков (3 + 6). Широкоовальные спо-
ры размером 4.6 X 3.7 мкм, ПТ делает 13 витков (3 +
10). В жировом теле личинок.
Типовой хозяин 'комар Aedespunctor (Diptera,
Culicidae).
Род Parathelohania Codreanu, 1966
Два типа спорогонии в комарах и один в циклопах.
В личинках комаров одноядерные октоспоры имеют
после фиксации бочонковидную форму. Тонкая на пе-
реднем полюсе эндоспора значительно утолщена на
заднем, образуя большой выступ. Экзоспора толстая.
Типовой вид Р. legeri (Hesse, 1904) Codreanu,
1966. Диплокариотические споры размером 4.7—5.8 X
2.3—3.2 мкм. ПТ изофилярная с 4-—5 витками. Октос-
поры размером 5.2 X 3.2 мкм. ПТ анизофилярная с
6—7 витками. Одноядерные споры в циклопах ланце-
товидные, размером 11.3 X 3.1 мкм. ПТ изофилярная,
делает 4—5 витков.
Типовой хозяин комар Anopheles maculipennis
(Diptera, Culicidae).
Род Tricornia Pell et Canning, 1992
Меронты диплокариотические. Спорогония 8-спо-
ровая. Споры овальные, с 2 короткими роговидными
выступами на переднем и одним центральным корот-
ким на заднем полюсе. Передние выступы образованы
утолщениями эндоспоры, а задний — Преимуществен-
но экзоспоры. ПТ анизофилярная;
Типовой вид Т. muhezae Pell et Canning, 1992.
Октоспоры размером 3.1 X 2.1 мкм. ПТ делает 5 вит-
ков (2 + 3); В жировом теле личинок.
Типовой хозяин комар Mansonia africana
(Diptera, Culicidae).
Примечание. Предполагается полиморфизм вида (Canning,
Vavra, 2000).
Отряд DisSociodihaplophasea
Sprague, Becnel et Hazard, 1992
Диплокариотический ядерный аппарат характерен
для большинства стадий и спор. Редукционное деле-
ние, если имеет место, без типичного мейоза. Споры
одного или нескольких морфологических типов. От-
ряд включает 4 надсемейства.
Надсем. Mrazekioidea Leger et Hesse,
1922
Диплокариотический ядерный аппарат у всех ста-
дий жизненного цикла. Спорогония диспоробластиче-
ская без спорофорного пузырька в прямом контакте с
цитоплазмой клетки хозяина. Споры палочковидные,
без или с каудальным придатком. ПТ с манубрием и
тонким дистальным свернутым участком или без него.
Пластинчатая часть поляропласта слабо развита или
отсутствует. Удлиненные ядра лежат вытянутыми
вдоль длинной оси споры. Надсемейство включает
2 семейства: Mrazekiidae и Rectisporidae.
Сем. Mrazekidae Leger et Hesse,
1922
ПТ с манубриумом (длинной прямой и широкой ба-
зальной частью), резко переходящим в короткую и
тонкую часть — хлыст.
Семейство включает 3 рода.
Род Mrazekia Leger et Hesse, 1916
Микроспоридии, цилиндрические споры которых
не имеют каудального придатка.
Типовой вид М. argoisi Leger et Hesse, 1916.
Споры размером 13—23 X 3.5—5 мкм. Тонкая часть
ПТ образует 2—3 витка. В жировой и соединительной
ткани.
Типовой хозяин водяной ослик Asellus aquati-
cus (Crustaceae, Isopoda).
Род Bacillidium Janda, 1928
Споры палочковидные, без придатков. Экзоспора
споробласта образует вокруг споры дополнительную
оболочку, наподобие оболочки спорофорного пузырь-
ка. Тонкий участок ПТ либо образует 1—2 витка, либо
Изогнут к переднему полюсу.
Типовой вид В. criodrili Janda, 1928. Споры
размером 21.7-—24.4 X 2.1—2.7 мкм. В целоме.
Типовой хозяин малощетинковый червь Crio-
drilus lacuum (Annelida, Oligochaeta).
Род Jirovecia Weiser, 1977
Цилиндрические споры с каудальным придатком,
образованным экзоспорой.
Типовой вид J. caudata (Leger et Hesse, 1916)
(= Mrazekia caudata Leger et Hesse, 1916). Споры раз-
мером 16—18 X 1.3—1.4 мкм с придатком до 18 мкм.
В целомоцитах.
Типовой хозяин малощетинковый червь Tubi-
fex tubifex (Oligochaeta, Tubificidae).
Сем. Rectisporidae Voronin, 2001
Меронты и споронты делятся бинарно. Спорогония
в прямом контакте с цитоплазмой клетки хозяина. ПТ
с коротким широким базальным участком, плавно пе-
реходящим в тонкий и длинный дистальный участок,
свернутый в многочисленные витки.
Семейство включает 2 рода: Hrabyiea и Rectispora.
ТИП MICROSPORIDIA. КЛАСС MICROSPOREA
1039
Род Rectispora Larsson, 1990
Споры цилиндрические, без каудального при-
датка.
Типовой вид R. reticulata Larsson, 1990. Споры
размером 8—14 X 2 мкм, в сетчатой оболочке поверх
экзоспоры. Тонкий участок ПТ делает 10—13 витков.
В семенниках.
Типовой хозяин олигохета Pamatothrix ham-
moniensis (Oligochaeta, Tubificidae).
Род Hrabeyia Lom et Dykova,
1990
Споры с толстым каудальным отростком до 8 мкм,
образованным экзоспорой. Ядра разного размера, по-
ляропласт пенистого строения.
Типовой вид H.xerkophora Lom et Dykova,
1990. Споры удлиненно-овальные, размером 6 X
3 мкм. ПТ делает 7-^-10 витков, Постепенно сужаясь к
заднему концу. В целомоцитах.
Типовой хозяин олигохета Nais christinae
(Oligochaeta, Naididae).
Надсем. Nosematoidea Labbe,
1899
Микроспоридии с диплокариотическим ядерным
аппаратом у всех стадий жизненного цикла. Спорого-
ния ди- или полиспоробластичеСкая в прямом контак-
те с цитоплазмой клетки хозяина, иногда в спорофор-
ном пузырьке. Споры одного, редко двух морфологи-
ческих типов, преимущественно овальной формы. ПТ
тонкая, изофилярная, реже слабоанизофилярная, свер-
нута в витки. Основная часть поляропласТа пластинча-
того типа.
Надсемейство включает 4 семейства: Nosematidae,
CaudOsporidae, Ichthyosporidiidae и Pseudopleistopho-
ridae.
Сем. Nosematidae Labbe, 1899
Спорогония диспоробластическая в прямом кон-
такте с цитоплазмой клетки хозяина. Споры овальной
или грушевидной формы, с мощно развитым аппара-
том экструзии. Ксенома не образуется.
Семейство включает 9 родов.
Род Nosema Naegeli,
1857
Микроспоридии, образующие в начале спорого-
нии в кишечнике аутоинвазионные споры с тонкой
оболочкой и слабоанизофилярной ПТ, затем в других
тканях из одного споронта образуется Две споры с
гладкой толстой оболочкой, без придатков, с изофи-
лярной ПТ.
Типовой вид N. bombycis Naegeli, 1857. Ауто-
инвазионные споры грушевидные, ПТ с 3—5 витками.
Более поздние овальные споры размером 3—4 х
1.5—2 мкм, ПТ образует 10—12 витков. Заражение ге-
нерализованное и трансфазное.
Типовой хозяин тутовый шелкопряд Bombyx
mori L. (Lepidoptera, Bombycidae).
Примечание. Возможно, что разное строение спор обу-
словлено развитием паразита в разных тканях.
Род Paranosema Sokolova, Dolgikh,
Morzhina, Nassonova, Issi, Terry, Ironside,
Smith et Vossbrinck, 2003
Род выделен из рода Nosema, главным образом, на
основании молекулярно-биологических данных. Кро-
ме того, во второй мерогонии кратковременно сущест-
вует стадия с одиночными ядрами и обильным элект-
ронноплотным материалом в нуклеоплазме.
Типовой вид Р. grylli (= Nosema grylli). Споры
удлиненно-овальные, 4.5 х 2.2 мкм (живые), 3.3 X
1.4 мкм (фиксированные). ПТ С 15—18 витками в 1—
2 слоя. В жировом теле и гемоцитах. По rDNA вид бли-
зок Р. locustae.
Типовой хозяин двупятнистый сверчок Gryl-
lus bimaculatus Deg. (Orthoptera, Gryllidae).
Род Senoma Simakova, Pankova, Tokarev
et Issi, 2005
Мерогония и начало спорогонии, как у Nosema.
При диспоробластическом делении споронта на участ-
ке соединения двух споробластов интенсивно откла-
дывается материал, принимающий по завершении спо-
рогенеза форму сферы значительного размера. В конце
спорогонии две яйцевидные споры на 1/3 погружены
под острым углом в сферу гомогенного материала. В
эпителии кишечника личинок и куколок.
Типовой Вид S. globulifera comb, nov, (=Issia
globulifera) Issi et Pankova. Споры размером 3.6—4.2 X
2.4 мкм. Диаметр сферы может достигать 15 мкм.
Типовой хозяин малярийный комар Anopheles
messeae (Diptera, Culicidae).
Род Anncaliia Issi, Krylova et Nikolaeva,
1993
Меронты округлые с 1 или 2 диплокарионами.
Плазматическая мембрана меронтов и споронтов с до-
полнительным внешним слоем из параллельных рядов
тонких трубочек и мелкогранулированного материала.
Спорогония диспоробластическая, от стенки спороб-
ластов и по экватору спор в цитоплазму клеТки хозяи-
на отходят трубчатые структуры. ПТ слабоанизофй-
лярная. Поляропласт образован пластинчатой и Труб-
чатой частями.
Типовой вид A. meligethiIssi,KrylovaetNikola-
eva, 1993. Споры овальные, 4—4.8 X 2—3 мкм. ПТ с
13—14 витками (Последние 2—3 витка более тонкие),
лежащими в один слой.
Типовой хозяин жук Meligethes aeneus (Cole-
optera, Nutidulidae).
1040
ТИП MICROSPORIDIA
Род Antonospora Fries, Paxton, Tengo,
Slemenda, da Silva et Pieniazek, 1999
Род выделен из рода Nosema в основном по моле-
кулярно-биологическим характеристикам. В качестве
морфологического отличия от ноземы указана 4-слой-
ная экзоспора.
Типовой вид Antonospora scoticaeFries, Paxton,
Tengo, Slemenda, da Silva et Pieniazek, 1999. Споры
овально-цилиндрические, размером 6.8 X 2.7 мкм. ПТ
изофилярная, с 15—22 витками.
Типовой хозяин общественная пчела Andrena
scotica (Hymenoptera, Andrenidae).
Род Brachiola Cali, Takvorian, Lewin,
Rendel, Sian, Wittner, Tanowitz, Keohane
et Weis, 1998
Меронты с дополнительным везикулярно-труб-
чатым покрытием, делятся бинарно. Спорогония
диспоробластическая с потерей дополнительного
покрытия. В скелетной мускулатуре человека при
СПИДе.
Типовой вид В. vesicularum Cali et Weiss, 1998.
Споры размером 2.5—2.9 X 1.9—2 мкм (фиксирован-
ные). Слабоанизофилярная ПТ делает 7—10 витков, из
них 2—3 последних более тонкие.
Типовой хозяин человек Homo sapiens (Primal
tes, Hominidae).
Примечание. Морфологически вид идентичен АппасаШа
meligethi.
Род Campanulospora Issi, Radischeva
et Dolzhenko, 1983
Мерогония неизвестна. Спорогония диспоробласти-
ческая, редко тетраспоробластическая. Зрелые 2-ядер-
ные споры заключены в толстую (слизистую?) оболоч-
ку, придающую им форму колокола.
Типовой вид С. denticulata Issi, Radischeya et
Dolzhenko, 1983. Споры овальной формы, размером
4.8 X 2.8 мкм. Преимущественно в кишечнике куко-
лок и взрослых мух.
Типовой хозяин капустная муха Delia floralis
(Diptera, Muscidae).
Род Hirsutosporos Batson,
1983
Диплокариотические мерогональные плазмодии и
споронт делятся бинарно. У спор как производное эк-
зоспоры формируются многочисленные филаменты,
длиной до 11 мкм, образуя пучок на заднем полюсе и
поясок выше экватора спор.
Типовой вид Н. austrosimuliiBatson, 1983. Спо-
ры широкоовальные размером 7 X 4.5 мкм. ПТ изофи-
лярная, делает 23—26 витков. В жировом теле.
Типовой хозяин личинки мошек Austrosimuli-
ит sp. (Diptera, Simuliidae).
Род Vittaforma Silveira et Canning,
1994
Все стадии развития окружены эндоплазматиче-
ской сетью хозяина. Меронты делятся бинарно. Ленто-
видный споронт с 8 диплокарионами делится на 8 спо-
робластов.
Типовой вид V. согпеае (Shadduck, Meccoli,
Davis et Front, 1990) Silveira et Canning, 1994. Споры
удлиненно-цилиндрические, размером 3.7 X 1 мкм.
ПТ изофилярная, делает 6 витков. В роговице глаза.
Типовой хозяин человек Homo sapiens (Prima-
tes, Hominidae).
Сем. Ichthyosporidlidae Sprague, Becnel
et Hazard, 1992
Все стадии диплокариотические и в прямом кон-
такте с цитоплазмой клетки хозяина. Многочисленные
ксеномы и бурная ответная реакция хозяина приводят
к образованию больших брюшных опухолей, располо-
женных от головы до ануса рыбы.
Семейство включает один род.
Род Ichthyosporidium Caullery et Mesnil,
1905
Процесс мерогонии идет в мелких ксеномах, диа-
метром 0.1—0.2 мм. Меронты делятся бинарно. Спо-
рогония происходит в крупных ксеномах, диаметром
до 4 мм. Споронты четковидные, расположены пер-
пендикулярно к стенке, ксеномы делятся одновремен-
но на отдельные споробласты.
Типовой вид I. giganteum (Thelohan, 1895)
Swarzewsky, 1914. Споры опальные, размером 7—8 X
5 мкм. ПТ изофилярная, делает до 32 витков, уложен-
ных в несколько рядов. В подкожной соединительной
ткани.
Типовой хозяин рыба Crenilabrus melops (Os-
teichthyes, Labridae).
Сем. Caudosporidae Weiser, 1958
Спорогония подиспоробластическая с образова-
нием вариабельного числа спор. Споро форный пу-
зырек отсутствует, если присутствует, то его оболоч-
ка тонкая и нестойкая. Форма спор от овальной до
палочковидной. Оболочка спор гладкая ИДИ с отрост-
ками.
Семейство включает 6 родов.
Род Caudospora Weiser, 1946
Меронты цедятся бинарным делением. Спорофор-
ный пузырек не образуется. Спорогональные плазмо-
дии с 8 диплокарионами делятся розетковидным поч-
кованием на 8 споробластов. Экзоспрра Зрелых спор
образует каудальный придаток, а также латеральные
ТИП MICROSPORIDIA. КЛАСС MICROSPOREA
1041
разрастания в виде широких плавников или гребней и
передние отростки в виде «усиков».
Типовой вид С. simulii Weiser, 1946. Споры
овальные, размером 2.5 X 2 мкм. ПТ слабо анизофи-
лярная с 12—13 витками. В жировом теле личинок мо-
шек.
Типовой хозяин мошка Eusimulium latipes
(Diptera, Simuliidae).
Род Binucleospora Bronnvall et Larsson,
1995
Мерогональный плазмодий с большим числом дип-
локарионов делится пазмотомией. В процессе споро-
гонии округлый плазмодий с 16—32 мелкими дипло-
карионами становится лентовидным с одновременным
образованием спорофорного пузырька, фрагменты
оболочки которого видны вокруг спор. Два ядра в спо-
рах теряют диплокариотическое расположение.
Типовой вид В. elongata Bronnvall et Larsson,
1995. Споры в виде коротких, слегка изогнутых пало-
чек, размером 5.4—7.2 X 2—2.3 мкм (живые). ПТ изо-
филярная с 11—14 витками, лежащими в 1 ряд. Поля-
ропласт 3-частный. В гемоцитах, жировой и соедини-
тельной ткани.
Типовой хозяин рачок Candona sp. (Crustacea,
Cyprididae).
Род Octosporea Flu, 1911
Спорогональный плазмодий делится на споро-
бласты впячиванием плазматической мембраны во-
круг диплокарионов, лежащих на его периферии.
Спорогония октоспоровая, спорофорные пузырьки
с тонкой нестойкой оболочкой. Диплокариотиче-
ские споры короткоцилиндрической формы, слегка
изогнутые. Некоторые виды образуют большее число
спор.
Типовой вид О. muscaedomesticae Flu, 1911. Спо-
ры коротко-цилиндрические, 3.8—9.2 X 1.6—3.2 мкм.
ПТ изофилярная с 11—12 витками. Поляропласт 2-част-
ный, гранулярно-пластинчатый. В эпителии кишечни-
ка личинок и имаго.
Типовой хозяин комнатная муха Musca do-
mestica (Diptera, Muscidae).
Род Ringueletium Garcia,
1990
Меронты делятся бинарно. Спорогональный плаз-
модий делится розетковидным почкованием, образуя
8 спор в прямом контакте с цитоплазмой клетки хо-
зяина. От экзоспоры перпендикулярно к поверхности
отходят многочисленные длинные нитевидные от-
ростки.
Типовой вид R. apillosa Garcia, 1990. Споры
овальные, размером 8—9 X 5 мкм. ПТ изофилярная,
делает 16—17 витков. В жировом теле личинок.
Типовой хозяин мошка Gigantodax rufidulum
(Diptera, Simuliidae).
Род Scipionospora Bylen et Larsson, 1995
Мерогональный плазмодий делится поэтапной
плазмотомией. Спорогональный плазмодий в споро-
форном пузырьке розетковидным почкованием обра-
зует 4 споры. Оболочка спорофорного пузырька проч-
ная. Споры палочковидные, без отростков. ПТ изофи-
лярная, прямая, короткая, равная по длине споре.
Типовой вид S. tetraspora Bylen et Larsson,
1995. Споры размером 5.4—5.9 X 1.1—1.2 мкм. В жи-
ровом теле личинок.
Типовой хозяин комар-звонец Endochirono-
mus sp. (Diptera, Chironomidae).
Род Weiseria Doby et Saguez, 1964
Мерогония и спорогония в прямом контакте с цито-
плазмой клетки хозяина. Деление в мерогонии бинар-
ное, в спорогонии — розетковидное, с образованием
обычно 16, реже более спор. Оболочка споры образует
несколько продольных гребней и эксцентричный во-
ронковидный выступ на заднем полюсе, иногда на-
блюдаются шипики.
Типовой вид W. laurenti Doby et Saguez, 1964.
Яйцевидные споры размером 3.0—3.5 X 2—2.5 мкм
(фиксированные), на заднем полюсе несколько шипи-
ков. В жировом теле.
Типовой хозяин мошка Prosimulium inflatum
(Diptera, Simuliidae).
Сем. Pseudopleistophoridae Sprague,
1977
Спорогония ди- или полиспоробластическая, про-
текающая в спорофорном пузырьке.
Семейство включает 2 рода: Pseudopleistophora и
Steinhausia.
Род Pseudopleistophora Sprague,
1977
Поверхность спорогонального плазмодия интегри-
рована с цитоплазмой клетки хозяина посредством
пальцевидных выростов. Каждый споронт дает начало
большому числу спор. Деление плазмодия на спороб-
ласты происходит путем слияния мелких вакуолей.
Типовой вид Р. szollozi Sprague, 1977. Дип-
локариотические споры овальные, размером 3.6 X
2.3 мкм. ПТ изофилярная с 8 витками. Развивается в
ооцитах.
Типовой хозяин полихета Armandia brevis
(Annelida, Polychaeta).
Род Steinhausia Sprague, Ormieres,
Manier, 1972
Сферические споры в группах до 30 образуются в
тонкостенных спорофорных пузырьках. Паразиты раз-
виваются в контакте с ядром клетки хозяина, в пери-
66 Зак. № 4163
1042
ТИП MICROSPORIDIA
нуклеарной вакуоли. Ультратонкое строение спор та-
кое же, как у Chytridiopsis, но ПТ без сотовидного
слоя.
Типовой вид S. mytilovum (Field, 1924) (= Chit-
ridiopsis mytilovum Field, 1924). Споры овальные, раз-
мером 1.6-—1.8 X 1.3—1.6 мкм. ПТ изофилярная, с
6—7 витками в 2 слоя. В ооцитах.
Типовой хозяин моллюскMytilus edulis (Mol-
lusca, Mytilidae).
Taxa inserta sedis
(роды с неопределенным положением)
Род Kabataia Lom,
Dykova et Tonguthai 1999
Все стадии с одиночными ядрами, развиваются в
прямом контакте с цитоплазмой клетки хозяина, вызы-
вая деградацию тканей. Ксеномы не образуются. Мно-
гоядерные мерогональные плазмодии делятся плазмо-
томией. Могоядерный меронт трансформируется в
спорогональный плазмодий путем утолщения стенки.
Спорофорный пузырек отсутствует. Плазмодий делит-
ся на одноядерные клетки (sporoblast mother cells), ко-
торые бинарным делением образуют по 2 споробласта.
Зрелые споры с изофилярной ПТ и 2-частным поля-
ропластом. Внешний слой оболочки образует мозаич-
ные участки.
Типовой вид К. arthuri Lom, Dykova, Shaha-
rom, 1990 co спорами, размером 3.1 X 1.9 мкм, и обо-
лочкой, покрытой мозаичными участками. Паразит
мышц туловища.
Типовой хозяин рыбаPangasiussutchi (Panga-
siidae, Siluroidea).
Род Mariana (Thelohan,1895) Stempell, 1909
Данные об организации ядер р пролиферативных
стадиях и спорах отсутствуют, что не позволяет опре-
делить систематическое положение этого плохо опи-
санного рода.
Типовой вид М. marionis (Thelohan, 1895) Stem-
pell, 1909. Споры удлиненно-яйцевидные, размером
8x3 мкм (Thelohan, 1895).
Типовой хозяин миксоспоридия Ceratomyxa
coris (Bivalvulida, Ceratomyxidae) из желчного пузыря
рыбы Coris julis (Osteichthyes).
Род Myxocystis Mrazek, 1897
Данные об организации ядер в пролиферативных
стадиях и спорах отсутствуют, что не позволяет опре-
делить систематическое положение этого плохо опи-
санного рода. Зараженные клетки гипертрофируются,
достигая в диаметре 50—100 мкм.
Типовой вид М. ciliata Mrazek, 1897. Споры
овальные, 4 мкм.
Типовой хозяин малощетинковый червь Lim-
nodrilus claparedianus (Oligochaeta, Tubificidae).
Род Wittmannia Czaker, 1977
Стадии мерогонии с одиночными и диплокариоти-
ческими ядрами лежат в прямом контакте с цитоплаз-
мой клетки хозяина. Стадии спорогонии диплокарио-
тические. Споронты делятся на 2 споробласта. Во всех
стадиях, включая споры, присутствуют миелинопо-
добные включения. ПТ изофилярная. Поляропласт
пластинчато-пузырчатый
Типовой вид ЯК antarctica (Czaker, 1997). Спо-
ры элипсоидные, 4.3—6.0 X 1.7—2.3 мкм.
Типовой хозяин дициемидаKantharella antar-
ctica (Mesozoa, Dicyemida), паразитирующая у Parale-
done turqueti (Mollusca, Cephalopoda).
Род Trichonosema Canning, Refardt,
Vossbrinck, Okamura et Curry, 2002
Все стадии диплокариотические, в прямом контак-
те с цитоплазмой клетки хозяина. Споры крупные, с
большим числом витков ПТ, передние и задние в один
ряд, средние в 2—3 ряда. Пирамидальные гранулы на
экзоспоре споронта превращаются в заостренные во-
лосовидные придатки на экзоспоре споры.
Типовой вид Т. pectinatellae Canning, Refardt,
Vossbrinck, Okamura, Curry, 2002, в клетках-дериватах
мускулатуры. Споры размером 9.5 X 4.5 мкм. ПТ с 25
и более витками.
Типовой хозяин пресноводная мшанка Pecti-
natella magnifica (Bryozoa, Phylactolaemata).
Род Bryonosema Canning, Refardt,
Vossbrinck, Okamura et Curry, 2002
Все стадии диплокариотические, в прямом контак-
те с цитоплазмой клетки хозяина. Споры крупные, с
большим числом витков ПТ, передние и задние в один
ряд, средние в 2—3 ряда. Экзоспора.
Типовой вид В. plumatellae Canning, Refardt,
Vossbrinck, Okamura, Curry, 2002. Споры широко гру-
шевидные, 8.4 X 5.4 мкм. ПТ образует до 33 витков.
В свободно плавающих клетках целома.
Типовой хозяин пресноводная мшанка Plumatella
nitens (Bryozoa, Phylactolaemata).
Род Pseudonosema Canning, Refardt,
Vossbrinck, Okamura et Curry, 2002
Все стадии диплокариотические, в прямом контак-
те с цитоплазмой клетки хозяина. Споры крупные,
с большим числом витков ПТ, передние и задние в
один ряд, средние в 2—3 ряда. Экзоспора гранулиро-
ванная.
Типовой вид Р. cristatellae (Canning, Okamura,
Curry, 1997). Споры 7.3 X 5.1 мкм, с большой задней
вакуолью. Паразит эпителиальных клеток.
Типовой хозяин пресноводная мшанка Crista-
tella mucedo (Bryozoa, Phylactolaemata).
ТИП MICROSPORIDIA. ЛИТЕРАТУРА
1043
Род Tubulinosema Franzen, Fischer,
Schroeder, Schoelmerich et Schneuwly, 2005
Все стадии диплокариотические, в прямом контак-
те с цитоплазмой клетки хозяина. Морфологически
род близок АппсаШа, выделен на основании молеку-
лярных характеристик.
Типовой вид Т. ratisbonensis Franzen, Fischer,
Schroeder, Schoelmerich, Schneuwly, 2005. Споры слег-
ка грушевидные, 4.18 X2.48 мкм. ПТ слабоанизофи-
лярная, с 9—14 витками в один ряд. В жировом теле и
кишечнике.
Типовой хозяин личинки и имаго Drosophila
melanogaster (Diptera, Drosophilidae).
THE PHYLUM MICROSPORIDIA BALBIANI, 1882
SUMMARY
Microsporidia are small, spore-forming, primitive uni-
cellular eukaryotes, all of which are intracellular parasites.
The introductory part of the chapter «Phylum Microspori-
dia» treats the general ultrastructural organization of the
spore and the presporal stages, summarizes recent know-
ledge about life cycles, the evolution and the phylogeny of
microsporidia. The relationships of microsporidia and their
hosts at the cellular, tissue, organism and population levels
are briefly discussed. The classification of microsporidia is
presented according to Voronin, 1999.
ЛИТЕРАТУРА
Бабурина Г. H., Леей И. В., Ефименко Т. М., Клянь-
виньш М. С., Раппопорт Е. Г., Соколова Ю. Я. Дыхательная ак-
тивность митохондрий гусениц озимой совки Agrothis segetum при
микроспоридиозе // Бюлл. ВИЗР. 1989. Вып. 73. С. 7—10.
Быкова X. И., Исси И. В. Определитель микроспоридий слеп-
ней. 1991. Карел, филиал АН СССР. 102 с.
Быкова X. И., Соколова Ю. Я., Исси И. В. Особенности
ультраструктуры спорогональных стадий Tabanispora bacillifera
gen. n. И Тез. IV Паразитол. конгресса, Л., 1987. С. 20.
Воронин В. Н. Микроспоридии ракообразных И Микроспори-
дии. Сер. Протозоология. 1986. Вып. 10. С. 137—165.
Воронин В. Н. Микроспоридии пресноводных беспозвоноч-
ных и рыб России (фауна, систематика и биология): Автореф.
дис. ... докт. биол. наук. СПб., 1999. 47 с.
Воронин В. Н. О макросистеме типа Microsporidia Balbiani,
1882 И Паразитология. 2001. Т. 35. С. 35—44.
Вялова Г. П., Воронин В. Н. Микроспоридиоз лососевых Са-
халина: распространение и динамика зараженности И Паразитоло-
гия. 1987. Т. 21. С. 553—557.
Долгих В. В. Влияние микроспоридии Nosema grylli и кокци-
дии Adelina grylli на активность четырех ферментов энергетиче-
ского и углеводного обмена в жировом теле сверчков Gryllus bima-
culatus II Паразитология. 1998. Т. 32. С. 464—469.
Долгих В. В., Семенов П. Б. Особенности катаболизма трега-
лозы в спорах микроспоридии Nosema grylli И Паразитология. 2003.
Т. 37. С. 372—377.
Долгих В. В., Семенов П. Б., Григорьев М. В. Особенно-
сти энергетического обмена микроспоридии Nosema grylli при
внутриклеточном развитии // Паразитология. 2002. Т. 36. С. 493—
501.
(Долгих В. В., Соколова Ю. Я., Исси И. В.) Dolgikh V., Soko-
lova J., Issi I. Activities of enzymes of carbohydrate and energy meta-
bolism of the spores of the microsporidian Nosema grylli // J. Euk. Mic-
robiol. 1997. P. 246—249.
Исси И. В. Взаимоотношения микроспоридий с клеткой хозя-
ина // Паразитол. сб. ЗИН. 1983. Вып. 31. С. 121—143.
Исси И. В. Микроспоридии как тип паразитических простей-
ших // Микроспоридии. Сер. Протозоология. 1986. Вып. 10.
С. 6—135.
Исси И. В. Паразитарные системы микроспоридий. Описа-
ние и вопросы теминологии И Паразитология. 2002. Т. 36.
С. 478—492.
Исси И. В., Воронин В. Н. (см. Исси, 1986).
Исси И. В., Воронин В. Н., Соколова Ю. Я. О паразитофор-
ной вакуоли микроспоридий // Паразитология. 2001. Т. 35.
С. 45—59.
Исси И. В., Онацкий Н. М. Особенности взаимоотношений
микроспоридий и насекомых на ранних этапах заболевания // Пара-
зито-хозяинные отношения. Эволюция паразитизма у простейших.
Сер. Протозоология. 1984. Вып. 9. С. 102—113.
Исси И. В., Токарев Ю. С. Влияние микроспоридий на гормо-
нальное состояние насекомых-хозяев // Паразитология. 2002. Т. 36.
С. 405—421.
Карпов С. А. Система протистов И С-Петербург; Омск. Сер.
биология. Ч. 1. 2000. 215 с.
Насонова Е. С., Соколова Ю. Я., Скарлато С. О. Хромосом-
ные ДНК и размер генома микроспоридии Nosema grylli // ДАН
РАН 1998. Т. 361, № 4. С. 554—557.
Онацкий Н. М., Исси И. В. Ответные реакции насекомых на
инвазию микроспоридий как результат сопряженной эволюции па-
разита и хозяина И Современные проблемы протозоологии / Матер.
III съезда ВОПР. Вильнюс, 1982. С. 270.
Селезнев К. В., Антонова О. А., Исси И. В. Влияние микро-
споридиоза на состав белков в жировом теле и гемолимфе сверч-
ков // Паразитология. 1997. Т. 31. С. 181—185.
Соколова Ю. Я., Исси И. В. О роде Nosema (Microsporidia) в
связи с новыми данными по жизненному циклу N. mesnili И Пара-
зитология. 1997. Т. 31. С. 307—313.
Соколова Ю. Я., Исси И. В. Энтомопатогенные простейшие
и особенности патогенеза протозойных заболеваний насекомых //
Патогены насекомых: структурные и функциональные аспекты /
Под ред. В. В. Глупова. М., 2001. С. 76—188.
(Соколова Ю. Я.) Sokolova Y. Y., Issi I. V., Entzeroth R. One
more «Nosema» with two types of sporogony // IX Intern. Congress Pro-
tozool., Germany. 1993. Abstr. 472. S. 61.
(Соколова Ю. Я.) Sokolova Y., Snigirevskaya E., Morzhi-
na E., Skarlato S., Mironov A., Komissarchik Y. Visualization of
early Golgi compartments at proliferate and sporogenic stages of a mic-
rosporidian Nosema grylli // J. Euk. Microbiol. 2001. P. 86S—87S.
Auerbach M. Die Cnidosporidien: Eine monographische Studie:
Leipzig, 1910. 261 s.
Azevedo C., Canning E. U. Ultrastructure of a microsporidian hy-
perparasite, Unikaryon legeri (Microsporida), of trematode larvae // J.
Protozool. 1987. Vol. 73. P. 214—223.
Baker M. D., Vossbrinck C. R., Maddox J. V., Undeen A. H.
Phylogenetic relationships among Vairimorpha and Nosema species
(Microspora) based on ribosomal RNA sequence data // J. Invertebr.
Pathol. 1994. Vol. 64. P. 100—106.
Balbiani E. G. Sur les Microsporidies on Psorospermies des Arti-
cules U C. R. Acad. sci. 1882. T. 95. P. 1168—1171.
Batson B. S. A light and electron microscopic study of Hirsutospo-
ros austrosimulii gen. n., sp. n. (Microspora: Nosematidae), a parasite
of Austrosimulium sp. (Diptera, Simuliidae) in New Zealand # Protisto-
logica. 1983. Vol. 19. P. 263—280.
Beard С. B., Butler J. F., Becnel J. J. Nolleria pulicis n. gen.,
n. sp. (Microsporida: Chytridiopsidae) a microsporidian parasite of the
cat flea Ctenocephalides fellis (Siphonaptera: Pulicidae) // J. Protozool.
1990. Vol. 37. P. 90—99.
Bischoff Th. Uber die Ei- und Samenbildung bei Ascaris mystax //
Ztschr. wiss. Zool. 1855. Bd 6. S. 376—405.
Cali A., Takvorian P. M., Lewin S., Rendel M., Sian C. S., Wit-
tner M., Tanowitz H. B., Keohane E., Weiss L. Brachiola vesicula-
rum n. g., n. sp., a new microsporidium associated with AIDS and myo-
sitis // J. Euk. Microbiol. 1998. Vol. 45.
1044
ТИП MICROSPORIDIA
Canning E. U., Barker R. J., Nicholas J. P., Page A. M. The ult-
rastructure of three microsporidia from winter moth, Operophtera bru-
mata (L.), and the establishment of a new genus Cystosporogenes n. g.
for Pleistophora operophterae (Canning, I960) //Syst. Parasitol. 1985.
Vol. 7. P. 213—225.
Cannig E. U., Hazard E. I. Genus Pleistophora Gurley, 1893: an
assemblage of at least three genera // J. Protozool. 1982. Vol. 29.
P. 39—49.
Canning E. U., Lom J., Nicholas J. P. Genus Glugea Thelohan
1891 (Phylum Microspora): redescripiton of the type species Glugea
anomala (Moniez, 1887) and recognition ofits sporogonic development
within sporophorous vesicles (pansporoblastic membranes) // Protisto-
logica. 1982. Vol. 18. P. 193—210.
Canning E. U., Nicholas J. P. Genus Pleistophora (Phylum Mic-
rospora): redescription of the type species Pleistophora typicalis Gur-
ley, 1893 and ultrastructural characterization of the genus// J. Fish Dis.
1980. N3. P. 317—338.
Canning E. U., Vavra J. Phylum Microsporida Balbiani, 1882 //
An illustrated guide to the Protozoa. Second edition. Organisms traditi-
onally referred to as Protozoa, or newly discovered groups / Eds
J. J. Lee, G. F. Leedale, P. Bradbury. Kansas (USA). 2000. Vol. 1.
P. 39—126.
Cavalier-Smith T. A. A revised six-kingdom system of life // Biol.
Rev. Cambridge Philosophical Society. 1998. Vol. 73. P. 203—266.
Cavalier-Smith T. What are Fungi? In: Systematics and Evoluti-
on. The Mycota 2001. VII. Part А/ Eds McLaughlin, McLaughlin,
Lemke. Berlin, S. 1—37.
Codreanu-Balcescu D., Codreanu R. Ultrastructural aspects of a
microsporidian parasitizing the ovaries of an Araneid Xysticus camb-
ridgei // Progr. in Invertebr. Pathology, Int. Colloq. Invertebr. Pathol.
1979. P. 35—36.
Durfort M., Vallinitjana L. Ultrastructure of merontes and spores
of Unikaryon mytilicolae (Microspora, Unikarionidae), hyperparasite
of the copepoda Mytilicola intestinalis // Rev. Iberica Parasitol. 1982.
Vol. 42. P. 143—160.
Franzen C., Muller A. Microsporidiosis: human diseases and di-
agnosis II Microbes and infection. 2001. N 3. P. 389—400.
Germot A., Philippe H., Le Guyader H. Evidence for loss of
mitochondria in microsporidia from a mitochondrial-type HSP 70
in Nosema locustae II Mol. Biochem. Parasitol. 1997. T. 87. P. 159—
168.
Gluge G. Notice sur quelques points d'anatomie pathologique com-
paree, suivie de quelques observations sur la structure des branchies
dans epinoches // Bull. Acad. R. Belg. 1 1838. N 5. P. 771—772.
Gurley R. On the classification of the Myxosporidia, a group of
protozoan parasites infecting fishes // Bull. U. S. Fish Comm, for 1891.
1893. Vol. 11. P. 407-^120.
Hashimota T., Nasegawa M. Origin and early evolution of euka-
ryotes inferred from the amino acid sequences of translation elongation
factors alpha Tu and 2/G // Adv. Biophys. 1996. T. 32. P. 73—120.
Hazard E. I., Brookbank J. W. Karyogamy and meiosis an Amb-
lyospora sp. (Microspora) in the mosquito Culex salinarius // J. Inver-
tebr. Pathol. 1984. T. 44. N 1. P. 3—11.
Hazard E. I., Oldacre S. W. Revision of Microsporida (Protozoa)
close to Thelohania with descriptions of one new family, eight new ge-
nera and thirteen new species // U. S. D. A. Technical Bulletin N. 1530.
1975.104 р.
Hirt R. P., Healy B., Vossbrinck C. R., Canning E. U., Emb-
ley T. M. A mitochondrial Hsp70 orthologue in Vairimorpha necatrix:
molecular evidence that microsporidia once contained mitochondria //
Curr. Biol. 1997. N 7. P. 995—998.
Ishihara R., Hayashi Y. Some properties of ribosomes from spo-
roplasm of Nosema bombycis // J. Invertebr. Pathol. 1968. Vol. 11.
P. 377—385.
Janda V. Ueber Mikroorganismen aus der Leibeshohle von Criod-
rilus lacuum Hoffm. und eigenartige Neubildungen in der Korperwand
dieses Tieres // Arch. Protistenkd. 1928. Vol. 63. P. 84—93.
Jirovec O. Studien ueber Mikrosporidien II Vestn. Cs. spolec.
zool. 1 1936. N 4. P. 1—75.
Katinka M. D., Duprat S., Cornillot E., Metenier G., Thorma-
rat F., Prensier G., Barbe V., Peyretaillade E., Brottier P., Winc-
ker P., Delbac F., El Alaoui H., Saurin W., Gouy M., Weissen-
bach J., Vivares С. P. Genome sequence and gene compaction of the
eukaryote parasite Encephalitozoon cuniculi // Nature. 2001. T. 414.
P. 450—453.
Kudo R. A biologic and taxonomic study of the Microsporidia //
III. Biol, monogr, 1924. Vol. 9, N 2—3. 268 p.
Labbe A. Sporozoa// Das Tierreich. Berlin, 1899. 180 s.
Larsson R. On the cytology and life cycle of Courgourdella poly-
centropi Weiser, 1965, with comments on the taxonomy of the genus
Cougourdella Hesse, 1935 (Microspora, Cougourdellidae) // Europ. J.
Protistol. 1989. T. 25. P. 33—44.
Larsson R. Trichoctosporea pygopellita, gen. et sp. nov. (Micros-
pora: Thelohaniidae), microsporidian parasite of the mosquito Aedes
vexans (Diptera, Culicidae) // Arch. Protistenkd. 1994. Vol. 144.
P. 147—161.
Leydig F. Zum feineren Bau der Arthropoden // Arch. Anat. / Phy-
siol. und wiss. Medizin. 1858. Bd 22. S. 376—480.
Logsdon J. M., DoreyM., Ford Doolittle W. Molecular evolu-
tion of recA-homologous genes in protists // Program Abstr. 10th Int.
Congr. Protozool. 1997. Sydney / (Australia). P. 135.
Lom J., Vavra J. The mode of sporoplasm extrusion in microspo-
ridian spores // Acta Protozool. 1963. Vol. 1. P. 81—89.
Matthews R. A., Matthews B. F. Cell and tissue reactions of tur-
bot Scophthalmus maximus (L.) to Tetramicra brevifilum gen. n., sp. n.
(Microspora) // J. Fish Dis. 1980. Vol. 3. P. 495—515.
Morrison С. M., Sprague V. Electron microscope study of a new
genus and new species of microsporidia in the gill of Atlantic cod Gadus
morhua // J. Fish Dis. 1981. Vol. 4. P. 15—32.
Pasteur L. Etudes sur la maladie des vers a soie. Paris, 1870.
Peyretaillade E., Broussolle V., Peyret P., Metenier G., Couy M.,
Vivares C. Microsporidia, amitochondrial protists, possess a 70 rDa
heat shock protein gene mitochondrial evolutionary origin II Molec.
Biol. Evol. 1998. T. 15. P. 683—689.
Pilley В. M. A new genus Vairimorpha (Protozoa: Microsporida),
for Nosema necatrix Kramer 1965: pathogenicity and life cycle in Spo-
doptera exempta (Lepidoptera: Noctuidae) // J. Invertebr. Pathol. 1976.
Vol. 28. P. 177—183.
Poisson R. Ordre des Microsporidies // Traite de Zoologie / Ed.
P.-P. Grasse. Paris, 1953. P. 1042—1070.
Ralphs J. R., Matthews R. A. Hepatic microsporidiosis of juveni-
le grey mullet Chelon labrosus (Risso), due to Microgemma hepaticus
gen. nov., sp. nov // J. Fish Dis. 1986. Vol. 9. P. 225—242.
Roberts R. A., Kimball R. F., Pavan C. Response of Rhynchosci-
ara chromosomes to microsporidian infection: increased polyteny and
generalized puffing // Exp. Cell Res. 1967. Vol. 47. P. 408—422.
Ruhl H., Korn H. Ein Mikrosporidien, Geusia gamocysti n. gen.,
n. sp., als Hyperparasit bei Gamocystis ephemerae II Arch. Protistenk.
1979. Vol. 121. P. 349—355.
Schubert G. Ultracytologische Untersuchungen an der Spore der
Mikrosporidienart Heterosporis finki, gen. n., sp. n // Z. Parasitenkd.
1969. Vol. 32. P. 59—79.
Silveira H., Canning E. U. Vittaforma comeae n. comb, for the
human microsporidium Nosema comeum Shadduck, Meccoli, Davis
and Font, 1990, based on its ultrastructure in the liver of experimentally
infected athymicmice// J. Euk. Microbiol. 1995. Vol. 42. P. 158—165.
Sprague V. Systematics of the Microsporidia: Annotated list of
species II Comparative Pathobiology / Eds L. A. Bulla, T. C. Cheng.
New York, 1997. Vol. 2. P. 1—510.
Sprague V., Becnel J. J., Hazard E. I. Taxonomy of phylum Mic-
rospora // Critical Rev. in Microbiology. 1992. Vol. 18. P. 285—395.
Sweeney A. W., Hazard E. I., Graham M. F. Intermediate host
for an Amblyospora sp. (Microspora) infecting the mosquito, Culex an-
nulirostris // J. Invertebr. Pathol. 1985. Vol. 12. P. 98—102.
Sweeney A. W., Graham M. F., Hazard E. I. Life cycle of Amb-
lyospora dyxenoides sp. nov. in the mosquito Culex annulirostris and
copepod Mesocyclops albicans // J. Invertebr. Pathol. 1988. Vol. 51.
P. 46—57.
Tanabe Y., Watanabe M., Sugiyama J. Are Microsporidia really
related to Fungi?: a reappraisal based on additional gene sequences
from basal fungi // Mycol. Res. 2002. Vol. 106. P. 1380—1391.
Thelohan P. Recherches sur les Myxosporidies // Bull. Sci. France
et Belgique. 1895. T. 26. P. 100—394.
Trager W. Some aspects of intracellular parasitism // Science.
1974. Vol. 184. P. 269—273.
Trewors J. T. Genome size in bacteria // Anthonie van Leeuwen-
hoek. 1996. Vol. 6. P. 293—303.
Vavra J. Structure of the Microsporidia // Biology of the Microspo-
ridia. Comp. Pathobiol. 1976a. Vol. 1. P. 1—85.
Vavra J. Development of the Microsporidia И Biology of the Mic-
rosporidia. Comp. Pathobiol. 1976b. Vol. 1. P. 87—109.
Vavra J., Larsson J. I. R. Structure of the Microsporidia // The
Microsporidia and Microsporidiosis / Eds M. Wittner, L. M. Weiss.
Washington, 1999. P. 7—84.
Weidner E. Ultrastructural study of microsporidian invasion into
cells // Z. Parasitenkd. 1972. Vol. 40. P. 227—242.
ТИП MYXOZOA
1045
Weidner E. The microsporidian spore invasion tube // J. Cell Biol.
1976. Vol. 41. P. 23—34.
Weidner E., Findley A. M., Dolgikh V., Sokolova J. Microspori-
dian Biochemistry and Physiology // The Microsporidia and Microspori-
diosis / Eds M. Wittner, L.. M. Weiss. Washington, 1999. P. 172—195.
Weiser J. Die Mikrosporidien als Parasiten der Insekten // Monogr.
angew. Entomol. 1961. N 17. S. 1—149.
Weiser J. Microsporidia Balbiani // Nemoci Hmyzu. Praha, 1966.
S. 1—554.
Weiser J. Contribution to the classification of microsporidia //
Vest. Cesk. Spot. Zool. 1977. Vol. 41. P. 308—321.
Weiss L. M., Vossbrinck C. R. Molecular biology, molecular
phylogeny, and molecular diagnostic approaches to the Microsporidia II
The Microsporidia and Microsporidiosis I Eds M. Wittner, L. M. We-
iss. Washington, 1999. P. 129—171.
Wittner M., Weiss L. M. The Microsporidia and Microsporidio-
sis. 1999. Washington, P. 1—553.
Тип MYXOZOA GRASSE, 1970 — МИКСОЗОА
Общая часть
Краткая характеристика
Все представители данного типа ведут паразитиче-
ский образ жизни. Вегетативные стадии — многоядер-
ные, амебоидной или плазмодиальной формы трофо-
зоиты с вегетативными ядрами и генеративными клет-
ками, или в виде закрытого «мешка» с полостью. В
жизненном цикле характерно наличие многоклеточ-
ных спор с различным числом створок, амебоидных
зародышей (у большинства 1—2) и уникальными по-
лярными капсулами с выстреливающимися полярны-
ми нитями. Жгутиковая стадия отсутствует. Мито-
хондрии с трубчатыми кристами или кристами непра-
вильной формы. Аппарат Гольджи, как правило,
имеется. Гидрогеносомы и хлоропласты отсутствуют.
Характерно наличие стадии «клетка внутри клетки»,
которая возникает в результате эндогении, либо путем
охватывания одной клеткой другой клетки. Миксоспо-
роидная фаза цикла протекает в пойкилотермных по-
звоночных в основном в пресноводных и морских ры-
бах и очень редко в беспозвоночных. По крайней мере
некоторые виды проходят дополнительную фазу цикла
в кишечном эпителии или полости тела водных бес-
позвоночных, которая завершается либо формирова-
нием «актиноспороидной» споры, заражающей рыб,
либо спор особого строения (в мшанках). В типе,
по-видимому, два класса Myxosporea Butschli, 1881 и
Malacosporea Canning et aL, 2000.
История изучения
Миксоспоридии были обнаружены лишь в начале
XIX в. Первое упоминание о них имеется в работе Жю-
рина (Jurine, 1825), который обнаружил цисты в муску-
латуре сига из Женевского озера. Он обратил внима-
ние на наличие в цисте жидкости, напоминающей
сливки, и не согласился с предположениями рыбаков,
что эти цисты возникли в результате заболевания рыб
оспой. Таким образом, Жюрин, не заметив самих мик-
соспоридий, первый описал вызываемое ими заболева-
ние. В 1938 г. Майер обнаруживает споры в сетчатке
глаза карася, в 1840 г. — хвостатые споры на жабрах
окуня (цит. по: Mayer, 1864).
Более подробное описание спор дал в серии своих
работ Мюллер (Muller, 1841), которые он назвал «псо-
роспермии». Мюллер не обнаружил настоящих вегета-
тивных форм миксоспоридий и принял их за «псо-
роспермии», внутри которых, по его мнению, и долж-
ны были развиваться споры. Полярные капсулы он по-
считал зародышами, а панспоробласты принимал за
споры, в которых уже сформировались два новых ор-
ганизма. Оболочка панспоробласта рассматривалась
им как изменившаяся оболочка «зародыша». Исследо-
вания спор были продолжены Креплином (Creplin,
1842), который описал раскрытие створок и выход на-
ружу содержимого споры. Подобно Мюллеру, он при-
нимал споры миксоспоридий за их вегетативные ста-
дии. Креплин считал, что споры возникают в цистах
и что они образуются или из жидкости внутри цис-
ты, или из расположенных в ней телец, или из стенки
цисты.
Дюжарден (Dujardin, 1845) впервые обратил внима-
ние на плазмодии, признав их за основную вегетатив-
' ную стадию жизненного цикла, и выяснил, что так на-
зываемые псороспермии являются спорами, образую-
щимися внутри плазмодиев. Эти взгляды получили
развитие в работах ряда авторов (Leuckart, 1847; Ley-
dig, 1851, 1852; Lieberkuhn, 1854а, 1854b, 1855), кото-
рые установили образование спор внутри вегетатив-
ных стадий эндогенным путем из специальных клеток,
имеющих два округлых ядра, описали выход амебоид-
ного зародыша из спор, рост и развитие вегетативных
стадий.
В отличие от других исследователей Бальбиани
(Balbiani, 1863) считал споры дефинитивным образо-
ванием растительной природы. Он первый дал пра-
вильное описание полярных капсул и наблюдал вы-
стреливание полярных нитей, однако считал, что они
служат для половых процессов.
Первое правильное представление о миксоспори-
диях дал Бючли (Butschli, 1881). Он впервые предло-
жил название «миксоспоридии», дал правильное опи-
сание вегетативных стадий, наблюдал возникновение
в них многоядерных панспоробластов и образование в
последних спор. Он пришел к выводу, что полярные
капсулы не имеют отношения к половому процессу.
Пфейфер (Pfeiffer, 1895) считал, что амебоидные
зародыши выходят из спор, еще не покинувших тело
хозяина, и, внедряясь в ткани последнего, вызывают
массовую аутоинфекцию, что в дальнейшем не нашло
подтверждения.
Телоан (Thelohan, 1889, 1890, 1892, 1894,1895) пер-
вый разработал систему миксоспоридий на основе ха-
рактера строения спор. Он впервые установил, что за-
ражение происходит путем заглатывания рыбой спор и
что воздействие желудочного или кишечного соков
хозяина вызывает выстреливание полярных нитей,
раскрытие створок и выход амебоидного зародыша,
который проникает в кровяное русло через стенку ки-
1046
ТИП MYXOZOA
шечника хозяина. С током крови зародыш попадает в
окончательное место паразитирования, где происхо-
дит развитие вегетативных стадий. Телоан сравнитель-
но подробно описал возникновение панспоробластов и
спор, первый наблюдал образование полярной нити в
полярных капсулах и отметил, что споры являются
многоклеточными образованиями.
Кон (Cohn, 1896) впервые описал бесполое размно-
жение путем почкования и высказал правильное пред-
положение о том, что массовая аутоинфекция рыбы
связана с бесполым размножением. Лаверан и Мениль
(Laveran, Mesnil, 1902) описали другой способ беспо-
лого размножения миксоспоридий посредством плаз-
мотомии.
Дофлейн (Doflein, 1898, 1899, 1901, 1902) предпо-
ложил наличие в жизненном цикле миксоспоридий
двух типов размножения: бесполого (мультиплика-
тивного), путем различной плазмотомии, и полового
(пропагативного), приводящего к образованию спор, с
помощью которых происходит заражение нового хо-
зяина.
Большой вклад в изучение миксоспоридий внес
Ауэрбах (Auerbach, 1910, 1912). Он описал большое
количество видов, провел ряд блестящих эксперимен-
тов, проследив жизненный цикл миксоспоридий от мо-
мента попадания спор в нового хозяина и выхода из
споры амебоидного зародыша до спорообразования в
развившихся вегетативных стадиях, дал первое круп-
ное монографическое описание, подробно осветил
биологию этих протистов. Его изящные эксперименты
по прямому заражению рыб спорами миксоспоридий
не потеряли своей значимости и сегодня (см. раздел
«Жизненные циклы»). Несколько позднее Кудо (Kudo,
1919) опубликовал монографию по всем известным к
тому времени миксоспоридиям. Далее наступает
время первого интенсивного периода фаунистических
исследований. Особо следует отметить значение работ
Девиса (Davis, 1917) и Фудзиты (Fujita, 1923) по мор-
ским миксоспоридиям. Большое внимание уделялось
изучению заболеваний рыб, вызываемых миксоспори-
диями (Hofer, 1896, 1904; Plehn, 1906, 1924).
В начале 30-х гг. В. А. Догелем было обосновано
новое научное направление — экологическая парази-
тология — и начались планомерные исследования па-
разитов рыб СССР, в том числе и миксоспоридий (бо-
лее подробно см.: Шульман, 1966; Шульман и др.,
1997). Это дало возможность в 1962 г. опубликовать
первый «Определитель паразитов пресноводных рыб
СССР» (второе издание 1984—1987), а С. С. Шульма-
ну (1966) — монографию, в которой был подведен
итог очередному этапу изучения миксоспоридий, был
дан подробный морфо-функциональный анализ веге-
тативных форм и спор, предложена новая система мик-
соспоридий, сделана попытка осмыслить вопросы их
происхождения и филогении.
Во второй половине XX в. резко усилились фауни-
стические исследования и в пресноводных, и в мор-
ских акваториях. В морфологических исследованиях
широко примененялась электронная микроскопия,
были проведены исследования физиологии миксоспо-
ридий, а цитофотометрические данные позволили
установить момент мейотического деления и гаплоид-
ность всех клеток, составляющих спору (более по-
дробно см. Успенская, 1984; Шульман и др., 1997).
Появились первые работы по зоогеографии миксоспо-
ридий (Донец, 1979а, 19796), в водах Атлантики и Па-
цифики обнаружена фактически новая фауна миксос-
поридий. Появляются новые работы, посвященные
миксоспоридиозам, биологии возбудителей, мерам
борьбы с этими заболеваниями и их профилактике.
Публикуется ряд обзоров и монографий (Шульман и
др., 1997; Lom, Dykova, 1992, 1995; Moser, Kent, 1994;
Chen, Ma, 1998, и др.). Появляются каталоги, в кото-
рых подробно описывается распространение видов
миксоспоридий (см. например Пугачев, 2001).
Современный этап в изучении миксоспоридий на-
чинается с работ Вольфа и Маркив (Markiw, Wolf,
1983; Wolf, Markiw, 1984a, 1984b), которые предполо-
жили участие актиномиксидий в жизненном цикле
миксоспоридий. Далее в соответствующих разделах
рассмотрены современные данные о жизненных цик-
лах, эволюции и филогении миксоспоридий.
Классификация
Краткий исторический обзор
системы Myxozoa
Первую систему миксоспоридий предложил Тело-
ан (Thelohan, 1892, 1895). В основу систематики им
была положена форма спор, при этом использовались
и другие признаки: наличие йодофильной вакуоли и
полярных капсул. Практически все выделенные Тело-
аном роды и семейства сохранились и в современной
системе. Однако он ошибочно включил в отряд мик-
соспоридий также и микроспоридий под общим назва-
нии Glugeidae. Эту же ошибку повторили Герли (Gur-
ley, 1893) и Лаббе (Labbe, 1899). Следует отметить, что
очень длительное время миксоспоридии и микроспо-
ридии рассматривались в составе одного типа Cnidos-
poridia. Только в 1967 г. Исси и Шульман окончатель-
но обосновали выделение микроспоридий в отдель-
ную группу.
По иному принципу построил систематику миксос-
поридий Дофлейн (Doflein, 1899). В составе группы
Cnidosporidia он выделяет два отряда: Myxosporidia и
Microsporidia. Эти отряды делились им на легионы по
числу панспоробластов, образующихся в вегетатив-
ных формах. Так, миксоспоридии разделялись на два
легиона: Disporea, у которых образуется один панспо-
робласт и соответственно 2 споры, и Polysporea, в веге-
тативных стадиях которых образуются несколько пан-
споробластов и соответственно большое количество
спор. Ауэрбах (Auerbach, 1910) почти в точности по-
вторил систему Дофлейна, добавив в основу системы
признак количества спор в вегетативных стадиях
и включив в состав Cnidosporidia актиномиксидий.
В дальнейшем целый ряд исследователей предлагал
свою систему миксоспоридий (Poche, 1913; Davis,
1917; Kudo, 1919, 1933; Tripathi, 1948; Meglitsch, 1960).
Основной недостаток системы Дэвиса, а также после-
дователей Дофлейна, состоял в том, что принципы вы-
деления высших таксономических единиц — подотря-
дов или легионов — не совпадали с систематикой
хорошо различимых родов: первая опиралась на свой-
ТИП MYXOZOA
1047
ства вегетативных стадий, вторая — на форму и строе-
ние спор. Другие исследователи, начиная с Кудо, сно-
ва вернулись к архитектонике спор как основы систе-
мы миксоспоридий. Более подробный исторический
обзор вышеперечисленных систем можно найти у
Шульмана (1966) и Шульмана с соавт. (1997). В этих
же работах он предложил свою систему, включавшую
в себя наиболее ценные элементы систем Телоана,
Герли, Кудо, Трипати и даже Меглича, при этом она в
какой-то мере перекликается и с системами Дэвиса и
Дофлейна—Ауэрбаха, ибо каждому подотряду и даже
семейству свойственны как преобладание определен-
ных размеров и форм вегетативных стадий, так и сте-
пень их продуктивности. Принципы классификации
миксоспоридий по Шульману основаны преимущест-
венно на архитектонике спор «миксоспороидной»
фазы их жизненного цикла. В составе типа Myxozoa
выделяются два класса Myxosporidia и Actinomyxidia.
Обзор современной классификации
Myxozoa
В последние десятилетия были предприняты по-
пытки частично пересмотреть систему Шульмана.
Первая из них связана с пересмотром систематической
значимости йодофильной вакуоли в амебоидном заро-
дыше. Ахмеров (1960) полностью отвергал системати-
ческое значение этого образования и свел род Myxoso-
та в синоним рода Myxobolus. К нему в дальнейшем
присоединились Уолликер (Walliker, 1968), Лом (Lom,
1969), Митчелл (Mitchell, 1977) и др. Результаты по-
добного подхода можно увидеть в работе Ландсберга и
Лома (Landsberg, Lom, 1991). Основной довод в пользу
такого шага — трудность выявления йодофильной ва-
куоли. Этот органоид представляет собой депо, где
скапливается гликоген, который был определен как
Р-гликоген. Гликоген в процессе жизнедеятельности
миксоспоридий может быть использован амебоидным
зародышем, но в этих случаях пустая вакуоль хорошо
выявляется с помощью фазовой микроскопии. Изве-
стен и тот факт, что у некоторых спор видов рода My-
xobolus она может отсутствовать. Однако определение
видов этого и других родов редко возможно на основа-
нии изучения одной споры, а для миксоспоридий в це-
лом характерна большая изменчивость признаков
даже у спор из одной цисты. Поэтому принято разли-
чать нормальные и аномальные споры. При изучении
достаточного числа спор легко установить наличие
или отсутствие йодофильной вакуоли с помощью фа-
зово-контрастной микроскопии. Многочисленными
работами (Подлипаев, 1974; Donez et al., 1978; Podlipa-
ev, Shulman, 1978; Shulman et al., 1978) показано не
только реальное существование йодофильной вакуоли
у строго ограниченного круга видов, но и ее большая
роль в экологии и эволюции пресноводных миксо-
споридий. Миксоспоридии в целом не характеризуют-
ся большим количеством признаков, поэтому отказ
от использования даже одного, пусть и нелегко выявляе-
мого признака, представляется непродуктивным, тем бо-
лее что этот шаг ведет к серьезным систематическим
перестройкам в наиболее многочисленном роде Myxo-
bolus.
Лом и Нобль (Lom, Noble, 1984) предприняли по-
пытку значительно изменить систему миксоспоридий,
предложенную Шульманом (1966). Они выделили но-
вый подотряд Sphaeromyxina, что в дальнейшем было
признано (Шульман и др., 1997), но состав подотряда
был расширен. Наряду с сохранением подотряда Р1а-
tysporina они упразднили два других подотряда — Bi-
polarina и Eurysporina, объединив их в один подотряд
Variisporina. В результате получился подотряд с
огромным разнообразием видов и родов, так как авто-
ры искусственно объединили два очень отличающихся
друг от друга подотряда, включив в него большое чис-
ло родов и семейств, не связанных друг с другом ни по
форме, ни iio плану строения спор.
Большое влияние на систему Myxozoa оказало откры-
тие того, что актиномиксидии являются стадией жизнен-
ного цикла миксоспоридий (см. раздел «Жизненные
циклы»), К этому времени система класса Actinosporea
-представлялась следующим образом (Lom, 1990):
Отряд Actinorriyxida Stole, 1899
Сем. Tetractinomyxidae Poche, 1913
Род Tetractinomyxon Ikeda, 1912* (2)
Сем. Sphaeractirionlyxidae Janiszewska, 1957
Род Sphaeractinomyxon Caullery et Mesnil, 1904 (6)
Род Neoactinomyxon Granata, 1922* (3)
Сем. Triactinorhyxidae Kudo, 1931
Род Guyenotia Naville, 1930 (1)
Род Echinactinomyxorl Janiszewska, 1957* (2)
Род Triactinomyxon Stole, 1899* (9)
Род Raabeia Janiszewska, 1955* (3)
Род Aurantiactinomyxon Janiszewska, 1957* (4)
Сем. Hexactinomyxidae Sprague, 1982
Род Hexactinomyxon Stole, 1899* (2)
Сем. Synactinomyxidae Poche, 1913
Род Synactinomyxon Stoic, 1899 (2)
Род Siedleckiella Janiszewska, 1957* (1)
Род Anlonactinomyxon Janiszewska, 1957 (1)
Сем. Ormieractinomyxidae Marques in Lom, 1990
Род Ormieractinomyxon Marques in Lom, 1990 (1)
Примечание. Звездочкой отмечены группы, представители
которых участвуют в жизненном цикле миксоспоридий; в скоб-
ках — количество описанных видов в роде (по: Kent et al., 1994;
Kent et al., 2001).
Кент с соавт. (Kent et al.,1994) предложили:
1. Сохранить тип Myxozoa.
2. Сохранить один класс Myxosporea.
3. Закрыть единственный отряд Actynomixida, не
рассматривая его в качестве синонима какого-либо от-
ряда или подотряда оставшегося класса Myxosporea.
4. Закрыть семейства Sphaeractinomyxidae, Triacti-
nomyxidae, Hexactinomyxidae, Synactinomyxidae и Or-
mieractinomyxidae, не рассматривая их в качестве си-
нонимов существующих семейств или подсемейств
класса Myxosporea.
5. Перенести сем. Tetractinomyxidae с единствен-
ным родом Tetractinomyxon в отряд Multivalvulida
класса Myxosporea.
6. Считать все роды актиномиксидий невалидны-
ми, за исключением Tetractinomyxon, и рассматривать
их как названия сборных групп (collective-group na-
mes).
7. Условно сохранить виды актиномиксидий как
species inquirenda пока не установлена их миксоспо-
роидная стадия, после чего может быть установлена
валидность их видовых названий.
1048
ТИП MYXOZOA
8. Использовать названия сборных групп актино-
миксидий в качестве общеупотребительных для описа-
ния актиноспороидных стадий.
Эти предложения позволяют оставить валидными
младшие названия миксоспоридий, которые более ши-
роко известны, что способствует стабильности класси-
фикации. Поскольку этот вариант системы миксоспо-
ридий чаще встречается в зарубежной литературе (см.:
Kent et al., 2000а), то мы приводим его:
Тип Myxozoa Grasse, 1970
Класс Myxosporea Biitschli, 1881
Отряд Bivalvulida Schulman, 1959
Подотряд Sphaeromyxina Lom, Noble, 1984
Сем. Sphaeromyxidae Lom, Noble, 1984
Род Sphaeromyxa Thelohan, 1882
Подотряд Variisporina Lom, Noble, 1984
Сем. Myxidiidae Thelohan, 1892
Род Myxidium Biitschli, 1882
Род Coccomyxa Leger, Hesse, 1907
Род Zschokkella Auerbach, 1910
Сем. Fabesporidae Lom, Noble, 1984
Род Fabespora Naidenova, Zaika, 1969
Сем. Ortholineidae Lom, Noble, 1984
Род Ortholinea Schulman, 1962
Род Neomyxobolus Chen, Hsieh, 1960
Род Triangula Chen, Hsieh, 1984
Род Paramyxoproteus Wierzbicka, 1986
Сем. Sinuolineidae Schulman, 1959
Род Sinuolinea Davis, 1917
Род Davisia Laird, 1953
Род Myxoproteus Doflein, 1890
Род Schulmania Kovaljova, Zubtschenko, Krasin,
1983
Род Noblea Kovaljova, 1988
Род Bipteria Kovaljova, Zubtschenko, Krasin,
1983
Род Neobipteria Kovaljova, Krasin, Gajevskaja,
1985
Сем. Ceratomyxidae Doflein, 1899
Род Leptotheca Thelohan, 1892
Род Ceratomyxa Thelohan, 1892
Род Meglitschia Kovaljova, 1988
Сем. Sphaerosporidae Davis, 1917
Род Sphaerospora Thelohan, 1892
Род Polysporoplasma Sitja-Bobadilla, Alva-
rez-Pellitero, 1995
Род Wardia Kudo, 1919
Род Hoferellus Berg, 1898
Род Palliatus Schulman, Kovaljova, Dubina,
1979
Род Myxobilatus, Davis, 1944
Сем. Chloromyxidae Thelohan, 1892
Род Chloromyxum Mingazzini, 1890
Род Caudomyxum Bauer, 1948
Род ytgareZZa Dunkerly, 1915
Сем. Auerbachiidae Evdokimova, 1973
Род Auerbachia Meglitsch, 1986
Род Globospora Lom, Noble, Laird, 1975
Сем. Alatasporidae Schulman, Kovaljova, Dubina,
1979
Род Pseudalataspora Kovaljova, Gajevskaja,
1982
Род Alataspora Schulman, Kovaljova, Dubina,
1979
Сем. Parvicapsulidae Schulman, 1953
Род Parvicapsula Schulman, 1953
Род Neoparvicapsula Gajevskaja, Kovaljova,
Schulman, 1982
Подотряд Platysporina Kudo, 1919, emend. Schulman,
1959
Сем. Myxobolidae Thelohan, 1892
Род Myxobolus Biitschli, 1882
Род Spirosuturia Chen, Hsieh, 1984
Род Unicauda Davis, 1944
Род Laterocaudata Chen, Hsieh, 1984
Род Dicauda Hoffman, Waliker, 1978
Род Henneguya Thelohan, 1892
Род Hennegoides Lom, Tonguthai, Dykova, 1991
Род Tetrauronema Wu, Wang, Jang, 1988
Род Trigonosporous Hoshina, 1952
Род Neothelohanellus Das, Haidar, 1986
Род Phlogospora Qadri, 1962
Род Thelohanellus Kudo, 1933
Отряд Multivalvulida Schulman, 1959
Сем. Trilosporidae Schulman, 1959
Род Trilospora Noble, 1959
Род Unicapsula Davis, 1924
Сем. Tetractinomyxidae Poche, 1913
Род Tetractinomyxon Ikeda, 1912
Сем. Kudoidae Meglitsch, 1959
Род Kudoa Meglitsch, 1947
Сем. Pentacapsulidae Naidenova, Zaika, 1970
Род Pentacapsula Naidenova, Zaika, 1970
Сем. Hexacapsulidae Schulman, 1959
Род Hexacapsula Arai, Matsumoto, 1953
Сем. Septemcapsulidae Hsieh, Chen, 1984
Род Septemcapsula Hsieh, Chen, 1984
Самые последние изменения в системе Myxozoa
связаны с открытием факта паразитирования в прес-
новодных мшанках своеобразных «миксоспоридий»
Tetracapsula (Korotneff, 1892; Canning et al., 1996;
Okamura, 1996), а также установленного родства с
ними оригинального червеобразного спороформи-
рующего организма Buddenbrockia plumatellae (Du-
mortier, van Beneden, 1850; Schroder, 1910, 1912;
Monteiro et al., 2002; Okamura et al., 2002, и др.). Эти
данные, полученные с помощью молекулярно-генети-
ческих методов, привели к выделению нового класса
Malacosporea (Canning et al., 2000). Однако положе-
ние в системе Myxozoa этих своеобразных парази-
тов мшанок и рыб (см. раздел «Филогения и эволю-
ция») еще недостаточно обосновано. Поэтому в дан-
ной сводке эта группа обозначается как Myxozoa
incertae sedis.
Так как система протистов подвергается значитель-
ным быстрым изменениям, в особенности в связи с
развитием молекулярно-генетических методов иссле-
дования, и является недостаточно устоявшейся, в дан-
ной сводке принимается система миксоспоридий наи-
более близкая к традиционной (для сравнения см., на-
пример, Кусакин, Дроздов, 1998).
В настоящее время в составе типа Myxozoa Grasse,
1970 выделяются следующие таксоны:
Класс Myxosporea Biitschli, 1881
Отряд Bivalvulida Schulman, 1959
Подотряд Sphaeromyxina Lom, Noble, 1984
Сем. Sphaeromyxidae Lom, Noble, 1984
Род Sphaeromyxa Thelohan, 1882
Род Auerbachia Meglitsch, 1986
Сем. Meglitschiidae Kovaljova, 1988
Род Meglitschia Kovaljova, 1988
Подотряд Bipolarina Tripathi, 1949
Сем. Myxidiidae Thelohan, 1892
Род Myxidium Biitschli, 1882
Род Coccomyxa Leger, Hesse, 1907
Род Zschokkella Auerbach, 1910
Сем. Neomyxobobilidae Schulman, 1962
Род Neomyxobolus Chen, Hsieh, 1960
Род Cardimyxobolus Ma, Dong, Wang, 1982
Род Triangula Chen, Hsieh, 1984
Сем. Sinuolineidae Schulman, 1959
Род Sinuolinea Davis, 1917
Род Davisia Laird, 1953
Сем. Ortholineidae Lom, Noble, 1984
Род Ortholinea Schulman, 1962
Род Paraortholinea Kovaljova in Shulman et al., 1997
ТИП MYXOZOA
1049
Сем. Myxoproteidae Meglitsch, 1960
Род Myxoproteus Doflein, 1890
Род Schubnania Kovaljova, Zubtschenko, Krasin,
1983
Род Noblea Kovaljova, 1988
Род Bipteria Kovaljova, Zubtschenko, Krasin, 1983
VonNeobipteria Kovaljova, Krasin, Gajevskaja, 1985
Сем. Palliatidae Schulman, Kovaljova in Schulman et al.,
1997
Род Palliatus Schulman, Kovaljova, Dubina, 1979
Подотряд Eurysporina Kudo, 1919; emend. Schulman, 1959
Сем. Ceratomyxidae Doflein, 1899
Род Leptotheca Thelohan, 1892
Род Ceratomyxa Thelohan, 1892
Сем. Parvicapsulidae Schulman, 1953
Род Parvicapsula Schulman, 1953
Род Neoparvicapsula Gajevskaja, Kovaljova, Schul-
man, 1982
Сем. Sphaerosporidae Davis, 1917
Род Sphaerospora Thelohan, 1892
Род Globospora Lom, Noble, Laird, 1975
Род Wardia Kudo, 1919
Род Chloromyxum Mingazzini, 1890
Род Caudomyxum Bauer, 1948
Род Polysporoplasma Sitja-Bobadilla, Alvarez-Pelli-
tero, 1995
Сем. Alatasporidae Schulman, Kovaljova, Dubina, 1979
Род Alataspora Schulman, Kovaljova, Dubina, 1979
Род Pseudalataspora Kovaljova, Gajevskaja, 1982
Сем. Fabesporidae Lom, Noble, 1984
Род Fabespora Naidenova, Zaika, 1969
Сем. Myxobilatidae Schulman, 1953
Род Podospora Chen, Hsieh, 1984
Род Myxobilatus Davis, 1944
Подотряд Platysporina Kudo, 1919, emend. Schulman, 1959
Cefti. Myxobolidae Thelohan, 1892
Род Hoferellus Berg, 1898
Род Myxobolus Biitschli, 1882
Род Spirosuturia Chen, Hsieh, 1984
Род Unicauda Davis, 1944
Род Dicauda Hoffman, Waliker, 1978
Род Neohenneguya Tripathi, 1959
Род Henneguya Thelohan, 1892
Род Phlogospora Qadri, 1962
Род Tetrauronema Wu, Wang, Jang, 1988
Род Trigonosporous Hoshina, 1952
Род Thelohanellus Kudo, 1933
Род Neothelohanellus Das, Haidar, 1986
Род Laterocaudata Chen, Hsieh, 1984
Род Hennegoides Lom, Tonguthai, Dykova, 1991
Сем. Myxosomatidae Poche, 1913
Род Myxosoma Thelohan, 1882
Род Agarella Dunkerly, 1915
Отряд Multivalvulida Schulman, 1959
Сем. Trilosporidae Schulman, 1959
Род Trilospora Noble, 1959
Род Unicapsula Davis, 1924
Сем. Tetractinomyxidae Poche, 1913
Род Tetractinomyxon Ikeda, 1912
Сем. Spinavaculidae Hsiegh et Xiao, 1993
Род Octospina Hsiegh et Xiao, 1993
Сем. Kudoidae Meglitsch, 1959
Род Kudoa Meglitsch, 1947
Сем. Pentacapsulidae Naidenova, Zaika, 1970
Род Pentacapsula Naidenova, Zaika, 1970
Сем. Hexacapsulidae Schulman, 1959
Род Hexacapsula Arai, Matsumoto, 1953
Сем. Septemcapsulidae Hsieh, Chen, 1984
Род Septemcapsula Hsieh, Chen, 1984
Myxozoa incertae sedis
Malacosporea Canning et al., 2000
Отряд Malacovalvulida Canning et al., 2000
Сем. Saccosporidae Canning et al., 1996
Род Tetracapsula Canning et al., 1996
Морфофункциональная
организация
Для этих протестов характерно наличие в их жиз-
ненном цикле чередования разнообразных вегетатив-
ных стадий и многоклеточных спор разного строения.
Для удобства изложения будем называть часть
жизненного цикла, протекающего в рыбах — миксос-
пороидной, а в беспозвоночных — актиноспороидной
фазами.
Вегетативные стадии
Миксоспороидные вегетативные стадии — трофо-
зоиты — представлены в виде самых разнообразных
плазмодиев, форма которых в значительной степени
зависит от места паразитирования. Их размеры колеб-
лются от 15 мкм до нескольких сантиметров. Наиболее
разнообразна форма трофозоитов у миксоспоридий,
обитающих в различных полостях тела хозяина. Они
могут иметь вид мелких амебоидов (округлые, оваль-
но-треугольные, удлиненные, ветвящиеся) или очень
крупных округло-овальных «лепешек». Мелкие фор-
мы образуют разнообразные цитоплазматические вы-
росты в виде тупозакругленных, нитевидных, лучевид-
ных, ветвящихся псевдоподий, иногда анастомизиру-
ющих между собой (Успенская, 1984; Шульман и др.,
1997) (рис. 415).
В наиболее простых случаях плазмодии — округ-
лые овальные или неправильно-овальные амебоиды с
короткими широкими псевдоподиями типа лобоподий
(большинство видов родов Myxidium, Zschokkella и др.)
(рис. 415, 7). Лобоподии обычно с гладкими краями,
иногда с многочисленными заостренными выступами
по краю (рис. 415, 2). У некоторых видов плазмодии
сильно вытянутые, даже разветвленные (рис. 415, 5),
они снабжены разнообразными псевдоподиями. Это
может быть одна вытянутая в нить псевдоподия, либо
несколько в виде филлоподий или ветвящихся, иногда
соединенных между собой, рйзоподий (рис. 415, 4—
415, 6). В большинстве случаев псевдоподии могут
формироваться в любом участке тела плазмодия, реже
возникают в строго определенной зоне, как у паразита
мочевого пузыря щуки Myxidium lieberkuehni, крупные
плазмодии которого прикрепляются одним концом к
стенке этого органа, а другой направлен внутрь поло-
сти пузыря (рис. 415, 7). По мере увеличения размеров
плазмодиев их подвижность обычно уменьшается, а
форма заметно упрощается. Сравнительно крупные
(100—200 мкм) шаровидные плазмодии Myxidium
macrocapsulare сильно растягивают стенки желчного
протока, в результате чего возникает образование, на-
поминающее цисту, окруженную эпителиальной стен-
кой (рис. 415,S). У некоторых паразитов желчного и
мочевого пузырей (представители родов Myxidium,
Sphaeromyxa, Auerbachia, Zshokkella и др.) обнаруже-
ны гигантские плазмодии, размеры которых заметно
превышают 1 мм. Они обычно имеют форму шара,
«лепешки» или широкой пластины, выстилающей
стенку пузыря (рис. 415, 9). Иногда сравнительно не-
большие плазмодии, плотно прилегая друг к другу, об-
1050
ТИП MYXOZOA
разуют скопления, свободно плавающие в полости
пузыря (рис. 415,10). Такие скопления могут дости-
гать 3—7 мм (некоторые представители рода Palliatus
и др.).
Плазмодии тканевых паразитов менее разнообраз-
ны. Лишь у небольшого числа видов это мелкие фор-
мы, активно передвигающиеся в просветах разрушен-
ной ими ткани хозяина (например, Myxosoma cerebra-
lis). Большинство из них имеют более крупные
размеры по сравнению с полостными. Многие из них
достигают гигантских размеров и хорошо видны нево-
оруженным глазом. Они менее подвижны, особенно
если окружены капсулой, выработанной хозяином, и
имеют обычно округлую или овальную форму.
В результате спорогонии (см. раздел «Жизненные
циклы») образуется одна, две или много спор.
Более подробно сведения о физиологии вегетатив-
ных стадий миксоспороидной фазы приведены в раз-
деле «Паразито-хозяинные отношения и патогенное
влияние миксоспоридий».
Актиноспороидные вегетативные стадии гораздо
менее разнообразны по форме и размерам. Они пред-
ставлены мелкими плазмодиями, обитающими преи-
мущественно в эпителии кишечника, а также в поло-
сти тела и яичниках морских и пресноводных кольча-
тых червей, в основном олигохет. Об особенностях
взаимоотношений плазмодиев этой фазы цикла и бес-
позвоночным хозяином известно очень мало. По-види-
мому, плазмодии питаются при помощи эпителиаль-
ных клеток кишечника хозяина. Такой характер отно-
шений подтверждается на ультраструктурном уровне:
плазмодии имеют слаборазвитый эндоплазматический
ретикулюм и не имеют аппарата Гольджи (по крайней
мере, некоторые Aurantiactinomyxon и Raabeia), в то
время как железистые клетки обладают хорошо разви-
тым эндоплазматическим ретикулюмом. Пальцепо-
добные выросты мембраны плазмодия протягиваются
от него к эпителиальным и железистым клеткам ки-
шечника хозяина. Плазмодии располагаются между
клетками эпителия и иногда полностью окружаются
железистыми клетками (Oumouna et al., 2002). В ре-
зультате спорогонии (см. раздел «Жизненные циклы»)
образуется 4 или 8 спор.
Изучение ультраструктурной организации вегета-
тивных стадий не выявило отличий между таковыми
на миксоспороидной и актиноспороидной фазах жиз-
ненного цикла. У плазмодиев обеих фаз обнаружива-
ются одинаковые клеточные структуры: вегетативные
ядра; митохондрии иногда с плоскими или трубчаты-
ми кристами и различными включениями; аппарат
Гольджи (если имеется) типичной или несколько изме-
ненной формы; гладкий и шероховатый эндоплазмати-
ческий ретикулюм; рибосомы, иногда формирующие
спирали полирибосом; спороплазмосомы; фагосомы;
различные пузырьки; резервуары питательных и за-
пасных питательных веществ, такие как жировые тель-
ца и гранулы р-гликогена; типичные пучки микротру-
бочек — остатки митотического веретена; межклеточ-
ные контакты в виде разнообразных выростов или
десмосом, и псевдоподиеподобных выростов. Центри-
оли отсутствуют. Нет существенных различий по
основному для этого типа признаку — полярным
капсулам, их структуре и способам формирования.
Сходство включает даже наличие волокон размером
И—12 нм на поверхности формирующейся полярной
нити или филамента. Очень просто устроенная началь-
ная клетка с небольшим количеством цитоплазмы и
фрагментами шероховатого эндоплазматического ре-
тикулюма (внутренние клетки до спорообразования на
миксоспороидной фазе и инвазионные клетки спороп-
лазма на актиноспороидной фазе) дают начало специа-
лизированным клеткам, таким как споробласты или
плазмодии, которые обладают широким разнообрази-
ем составляющих их компонентов. Огромное разнооб-
разие клеточных структур обнаружено у плазмодиев
миксоспороидной фазы, включая разнообразные пу-
зырьки, фибриллярные структуры, различные моди-
фикации в строении поверхности. Уникальные моди-
фикации мембран эндоплазматического ретикулюма
обнаружены в клетках обеих фаз (Lom, Dykova, 1997).
В состав многоядерного плазмодия миксоспороидной
фазы, кроме вегетативных ядер, входят и генератив-
ные клетки, которые рассматривались как генератив-
ные ядра до электронно-микроскопических исследова-
ний. Плазмодий актиноспороидной фазы (панспороци-
ста) представляет собой многоклеточное образование
из вегетативных и генеративных клеток.
Представители второй ветви Myxozoa — малакос-
пореи демонстрируют значительные отличия от мик-
соспорей в морфофункциональной организации веге-
тативных стадий по крайней мере в мшанках. Они
представлены «мешками» округлой или червеобраз-
ной формы, свободно плавающими в полости тела хо-
зяина. Стенка таких мешков состоит из одного слоя
Рис. 415. Типы плазмодиев и строение споры миксоспороидной фазы.
/ — Ortholinea divergent 2 — Chloromyxum leydigi", 3 — Sphaerospora irregularis:, 4 — Myxoproteus caudatus', 5 — Leptotheca agilis", 6 — Ceratomyxa ramosa",
7—Myxidium lieberkuehni, 8—Myxidium macrocapsulare', 9—Sphaeromyxa sabrazesi", 10 — Ceratomyxa merlangi", Il — схема строения споры миксоспороид-
ной фазы: Л — в плоскости шва, Б—в плоскости, перпендикулярной шву, В— передний конец споры, аз — амебоидный зародыш, ив — йодофнльная ваку-
оль, ио — интеркапсулярный отросток, кя—капсулогенные ядра, пк— полярная капсула, с—створка, пн — полярная нить, ш — шов, шв — шовный валик,
яаз— ядро ямебоидного зародыша (по: Шульман и др., 1997, с изменениями); 12— типы полярных капсул: а — витки полярной нити расположены перпен-
дикулярно продольной оси капсулы, б — витки полярной нити расположены наискосок или почти поперек капсулы, в — имеется центральная незакручен-
ная часть нити, г—двойное закручивание нити (наружное и внутреннее), д — нить суживается от своего основания к концу, изгибается, но не закручивается
в спираль (по: Lom, Dykova, 1992, с изменениями).
Fig. 415. Types of the myxosporean plasmodia spore structure.
11 — principal structure of the myxosporean spore: A — in frontal view, Б—in side (sutural) view, В — apical spore pole, аз — ameboid infective germ (sporoplasm),
ив — iodinophilos vacuole, uo — intercapsular projection, кя — nuclei of the capsulogenic cells, пк—polar capsules, c — valve, пн — polar filament, ш — suture line,
шв — suture, яаз — ameboid germ nucleus; 12 — types of myxosporean polar capsules: a — coils of the polar filament disposed perpendicularly to the long axis of the
polar capsule, 6 — coils arranged slantwise or nearly across polar capsule, в — a straight central shaft of the filament, г — double filament twisting (inner and outer),
d — filament tapering from base to the tip, folded over, not coiled spirally.
ТИП MYXOZOA
1051
1052
ТИП MYXOZOA
уплощенных клеток, полость мешка заполнена зрелы-
ми многоклеточными спорами или спорами в стадии
формирования. Пока только для одного представителя
этой группы Tetracapsula renicola молекулярно-ге-
нетическими методами показано наличие двух фаз в
жизненном цикле — в рыбах и мшанках. В рыбах веге-
тативная стадия представлена многоклеточным обра-
зованием, состоящим из 7 дочерних клеток и единст-
венной одноядерной первичной клетки. Вызывает тя-
желое заболевание почек лососевых рыб (Kent et al.,
2000b), что дает основание для сомнений в облигатно-
сти рыбной фазы в цикле малакоспорей. Об этой груп-
пе в настоящее время известно еще меньше, чем об ак-
тиноспороидной фазе цикла миксоспорей. Некоторые
сведения о группе Malacosporea можно найти в следу-
ющих разделах: «Систематическая часть», «Филоге-
ния и эволюция», «Жизненные циклы».
Споры
Споры Myxozoa, несмотря на большое разнообра-
зие форм, построены по единому плану. Все они состо-
ят из трех основных элементов: створок, полярных
капсул и амебоидных зародышей (спороплазм). Каж-
дый из этих элементов — самостоятельная клетка, поэ-
тому спору следует рассматривать как настоящее мно-
гоклеточное образование с сильно дифференцирован-
ными клетками.
Споры миксоспороидной фазы цикла (рис. 428)
наиболее разнообразны по форме и размерам, которые
могут колебаться от 3.5 мкм (шаровидные споры Chlo-
готухит) до 970 мкм (в плоскости, перпендикулярной
шву у Ceratomyxa). Наиболее обычны споры размером
7—14 мкм. Число створок, полярных капсул и даже
амебоидных зародышей у различных видов также ва-
рьирует. Количество створок варьирует от 2 (Bivalvuli-
da) до 7 (Multivalvulida), количество полярных кап-
сул — от одной до 7.
Подавляющее большинство спор имеет один двух-
ядерный или 2 одноядерных амебоидных зародыша.
Исключение составляет род Polysporoplasma, у кото-
рого количество спороплазм варьирует от 4 до 12. В
некоторых двухядерных амебоидных зародышах (на-
пример, роды Myxobolus или Henneguya) запасные пи-
тательные вещества в виде частиц р-гликогена концен-
трируются в амебоидном зародыше в виде йодофиль-
ной вакуоли. Эта вакуоль может исчезать через
несколько дней после выхода споры из организма хо-
зяина во внешнюю среду. Под электронным микроско-
пом в амебоидном зародыше выявляются характерные
электронно-плотные тельца, спороплазмосомы, напо-
минающие гапласпоросомы гаплоспоридий. Обычно
впереди ядра располагается аппарат Гольджи в виде
3—5 волнообразных осмофильных мембран. В цито-
плазме также наблюдаются многочисленные митохон-
дрии, рибосомы, хорошо развитый эндоплазматиче-
ский ретикулюм как гладкий, так и шероховатый,
большое количество микротрубочек (рис. 416, вкл.).
Створки спор могут быть гладкими или снабжен-
ными различными гребнями, иногда образующими
сложные структуры (рис. 417, вкл.). Они могут образо-
вывать различные отростки, в том числе секретируе-
мые (рис. 428, 38), или покрываться мукозной оболоч-
кой (рис. 418, вкл.), которая исчезает через несколько
дней пребывания спор в воде. По-видимому, большин-
ство этих структур повышает плавучесть спор, обеспе-
чивая, таким образом, их распространение и повыше-
ние вероятности заражения новых хозяев. Створки
спор состоят из устойчивого некератинизированного
протеина.
Полярные капсулы имеют толстые стенки и содер-
жат скрученную вдоль стенок капсулы полярную нить,
способную к быстрому выстреливанию, в процессе ко-
торого сама нить выворачивается наизнанку. Нить
представляет собой спирально закрученную полую
трубку, закрытую на свободном конце (рис. 419). Нить
прикрепляет спору к поверхности кишечника хозяина.
Ее выстреливание может способствовать раскрытию
створок споры и выходу из нее амебоидного зароды-
ша. Стенки капсулы двухслойные. Внутренний слой
электронно-прозрачный, устойчивый к щелочной сре-
де. Второй слой состоит из белков. Оба этих слоя про-
должаются и в стенках полярной нити. Способ «упа-
ковки» нити в капсуле имеет важное значение в систе-
матике. Основные варианты «упаковки» представлены
на рис. 415,12. Иногда в одной споре встречаются раз-
ные ее варианты, например у Meglitschia. Проксималь-
ный конец полярной капсулы плотно охватывается об-
разованием, которое получило название «крышечки».
Ее сердцевина на электронограммах окрашена иначе,
чем остальная часть крышечки, и называется «пробоч-
кой». Эта структура может служить «затычкой», кото-
рая при ее растворении в кишечнике хозяина запускает
механизм выстреливания нити. Суженные передние
концы полярных капсул всегда имеют выход нару-
жу, обычно в непосредственной близости от шва
(рис. 420). Более подробно о механизме выстрелива-
ния нити см. у Шульмана с соавт. (1997) и у Лома и
Дыковой (Lom, Dykova, 1992).
Споры актиноспороидной фазы характеризуются
очень стабильной структурой (рис. 428). Все извест-
ные представители имеют три полярные капсулы, три
створки, хвостовые отростки могут быть хорошо выра-
жены, но могут и отсутствовать. Типичное строение
споры актиноспороидной фазы представлено на
рис. 421. Только Hexactinomyxon имеет шесть хвосто-
вых отростков, но три створки и три капсулы. Строе-
ние полярных капсул аналогично таковому спор мик-
соспороидной фазы. Имеется и «крышечка», которая
выступает наружу из створок. Спора содержит много-
ядерный, окруженный простой мембраной, плазмодий
(спороплазм) с многочисленными вторичными клетка-
ми, которые и представляют собой стадии, заражаю-
щие рыб. Кроме многочисленных ядер в цитоплазме
плазмодия находятся митохондрии, цистерны шерохо-
ватого эндоплазматического ретикулюма, множество
различных пузырьков, аппарат Гольджи, микрофила-
менты, гранулы гликогена (Lom, Dykova, 1997). Неко-
торые представители могут образовывать конгломе-
раты спор, которые соединяются вместе хвостовыми
отростками {Synactinomyxon, Siedleckiella, Antonactino-
тухоп).
Споры Malacosporea в мшанках — сферические с
четырьмя полярными капсулами, расположенными на
одном полюсе, и четырьмя створками. Клетки створок
ТИП MYXOZOA
1053
Рис. 421. Строение споры актиноспороидной фазы. (По: El-Mansy et al., 1998, с изменениями).
а — полярные капсулы, б — спороплазм, в — вторичные клетки в спороплазме, г—длина тела споры, б — длина стиля, е — стиль, ж — ядра вальвогенных
клеток, з — хвостовые отростки.
Fig. 421. Principal structure of the actinosporean spore.
a — polar capsules, 6 — sporoplasm, в — secondary cells in the sporoplasm, г — length of the spore body, d — length of the style, e — style, ж—nuclei of the valvo-
genic cells, з — caudal process.
не теряют своей клеточной организации, в отличие от
миксопорей, т. е. не превращаются в «твердые» створ-
ки. Они не покрывают отверстия полярных капсул, ко-
торые не имеют «крышечки». Две спороплазмы вклю-
чают в себя две вторичные клетки. В рыбах очень ред-
ко образуются не до конца сформированные споры с
двумя полярными капсулами, строение которых еще
плохо изучено (Canning et al., 2000; Kent et al., 2000b).
Жизненные циклы
Всего лишь двадцать лет тому назад казалось, что
наши знания о миксоспоридиях вообще и об йх жиз-
ненном цикле, в частности, сформированы и адекватно
отражают реальную картину (Шульман, Подлипаев,
1980). В таксономии это нашло отражение в делении
типа Cnidospora (Myxozoa) на два самостоятельных
класса — Myxosporea и Actinosporea. Оба эти класса
характеризовались жизненными циклами без проме-
жуточных хозяев, многоклеточными вегетативными
стадиями — плазмодиями, хорошо развитыми у мик-
соспоридий и слабо у актиномиксидий; многоклеточ-
ными спорами различного строения и паразитировани-
ем в разных группах хозяев: миксоспоридии — в
основном в рыбах, актиномиксидии — в олигохетах
(см.: Шульман и др., 1997). Казалось, что основное
место в исследованиях миксоспоридий теперь заняла
фаунистика и описание новых видов, в частности из
малоисследованных океанических рыб.
Ситуация коренным образом изменилась в 80-х гг.,
после двух пионерских работ, показавших, что актино-
миксидия Triactinomyxon, паразитирующая в обычном
пресноводном малощетинковом черве, является ста-
дией развития миксоспоридии Myxosoma (Myxobolus)
cerebralis, опасного паразита культивируемой лосо-
севой рыбы Oncorhynchus mykiss (Markiw, Wolf, 1983;
Wolf, Markiw, 1984a, 1984b). К настоящему времени
двуххозяинный жизненный цикл, включающий разные
виды рыб и олигохет, экспериментально показан для
25 видов из 9 родов миксоспоридий (Myxobolus, Hen-
neguya, Sphaerospora, Ceratomyxa, Myxidium, Zschokel-
la, Thelohannellus, Hoferellus и Tetracapsula) (cm.: Kent
et al., 2001).
Естественно, что целенаправленное исследование
олигохет, предпринятое после первых открытий их
роли в жизненном цикле миксоспоридий, реализова-
лось в описании актиноспороидных форм из многих
1054
ТИП MYXOZOA
видов червей, принадлежащих к семействам Naiidae,
Tubificidae и Lumbricidae. Из морских олигохет в Авст-
ралии были описаны различные актиноспоры, в том
числе предложены новые роды, а для рода Tetraspora,
отличающегося необычным способом развития акти-
носпор, предложено образовать отдельное семейство в
классе Myxosporea (Lester et aL, 1998). Однако номенк-
латурные трудности и неизвестность соотвествующих
миксоспороидных стадий не позволили включить
эти роды в последнюю систему Myxozoa (Kent et aL,
2000a).
В отличие от многочисленных находок в малоще-
тинковых червях только две актиноспореи были опи-
саны из полихет. Для миксоспоридии Ceratomyxa shas-
ta было показано, что актиноспоры развиваются в пре-
сноводной полихете Manaynkia speciosa (Bartolomew
et aL, 1997); а в морском многощетинковом черве Nere-
is diversicolor найдены актиноспоры, миксоспороид-
ная же часть цикла пока остается неизвестной (Koie,
2000). Кроме того, из сипункулид Petalostoma minutum
была давно описана актиномиксидия Tetractinomyxon
intermedium (Ikeda, 1912).
В дополнение к экспериментальным лабораторным
исследованиям сравнение последовательностей нуклео-
тидов генов рРНК позволило показать идентичность
миксоспороидной и актиноспороидной стадий внача-
ле для Myxosoma cerebralis (Andree et aL, 1997), а затем
и для нескольких других паразитов (Longshaw et aL,
1999; Lin et aL, 1999; Pote et aL, 2000). Проведенное
сравнение известных к настоящему времени данных о
взаимоотношениях тех или иных актиномиксидий с
теми или иными миксоспоридиями показало отсутст-
вие каких-либо соответствий между родами миксоспо-
ридий и актиномиксидий (Xiao, Desser, 2000).
В результате накопления экспериментальных дан-
ных было предложено (Kent et aL, 1994) упразднить
как класс Actinosporea, так и отряд Actinomyxida со
всеми подчиненными таксономическими категориями,
кроме сем. Tetractinomyxidae и его единственного рода
Tetractinomyxon, которые были перенесены в отряд
Multivalvulida единственного оставшегося класса My-
xozoa — Myxosporea.
Естественно, что пока лишь для небольшого числа
видов известны и миксоспороидная, и актиноспороид-
ная части жизненного цикла. Остается много вопро-
сов, и главный из них — все ли миксоспоридии имеют
двуххозяинный жизненный цикл? Этот вопрос в пер-
вую очередь касается тех рыб, контакты которых с
донными червями проблематичны или невозможны —
пресноводных рыб-планктофагов, и в особенности мор-
ских и океанических рыб открытых водных прост-
ранств, обитающих над большими глубинами (Шуль-
ман и др., 1997). Если двуххозяинный жизненный цикл
является правилом для миксоспоридий, то не только
бентосные черви (хотя многие из них и всплывают в
определенные моменты жизненного цикла, например
эпитокная форма полихет) должны выполнять роль од-
ного из хозяев, но и какие-то планктонные организмы.
Планктонных кольчатых червей немного, и трудно
представить их значительное участие в жизненных
циклах миксоспоридий. С одной стороны, привлече-
ние гидрологических данных, например поднятие глу-
бинных вод в зонах абвеллинга, может оказать влия-
ние на зараженность рыб актиноспорами, однако такие
зоны не являются частым явлением в океане. С другой
стороны, было высказано естественное предположе-
ние, что в морских червях могут развиваться лишь ак-
тиноспоры, и жизненный цикл завершается без учас-
тия рыб и миксоспор (Lester et aL, 1999). Как нам пред-
ставляется, в настоящий момент недостаточно данных
для решения этих вопросов, и дальнейшее их обсужде-
ние лишь приведет к увеличению количества чисто
умозрительных гипотез.
Наиболее детальные исследования (Шульман и др.,
1997) датируют время возникновения миксоспоридий
поздним мелом (сеноманом), временем одной из вели-
чайших в истории Земли трансгрессий моря, когда
огромные площади были покрыты мелководными во-
доемами. Такие условия, бесспорно, способствовали
тесным контактам рыб и бентосных червей, что делает
предположение об исходном характере двуххозяинно-
го жизненного цикла миксоспоридий, включающего
рыб (миксоспоры — миксоспороидная часть цикла) и
бентосных кольчатых червей (актиноспоры — акти-
носпороидная часть цикла) вполне логичным. Естест-
венно, исходя из общих паразитологических законо-
мерностей, мы можем предположить и сокращение
жизненного цикла, когда один из хозяев — позвоноч-
ный или беспозвоночный — утрачивается в процессе
эволюции, особенно в условиях обитания в глубоких
водоемах.
Нам представляется наиболее удобным рассмот-
реть двуххозяинный жизненный цикл Myxozoa. От-
дельные его части — в рыбах и червях — соответству-
ют тому, что известно для миксоспоридий и актино-
миксидий по отдельности, и что, вероятно, составляет
сохранившуюся часть жизненного цикла в гипотетиче-
ских случаях его редукции. К настоящему времени
наиболее исследован жизненный цикл Myxosoma (My-
xobolus) cerebralis, возбудителя вертежа — опасного
заболевания лососевых рыб (рис. 422).
Развитие миксоспор в рыбах. Рыбы получают пара-
зита или при контакте со спорами триактиномиксон в
воде, или при питании зараженными актиноспорами
олигохетами Tubifex tubifex (Wolf, Markiw, 1984a,
1984b). Актиноспоры своими отростками прикрепля-
ются к кожному эпителию в основном в месте выхода
мукозных клеток, оседают в ротовой полости или на
эпидермисе жабр (рис. 423). Полярная нить выстрели-
вается или прямо в отверстия мукозных клеток, или в
окружающий эпителий для закрепления спор. Спороп-
лазм выходит из споры и мигрирует по межклеточным
пространствам в эпидермис или эпителий жабр, после
чего амебоидные зародыши проникают в клетки эпи-
телия (рис. 422,1—3). В клетках рыбы проходит ряд
быстрых синхронных митозов, и паразит заполняет
практически всю клетку хозяина (рис. 422,4—5)
(El-Matbouli et'al., 1995). Возникшие так называемые
«вторичные клетки» делятся, давая клеточные дубле-
ты из покровной и внутренней клеток (рис. 422, б). В
свою очередь эти парные клетки проникают через
плазмалемму клетки хозяина и выходят в межклеточ-
ное пространство (рис. 422, 7). В дальнейшем эти дуб-
леты или проникают в соседние эпителиальные клет-
ки, или мигрируют вглубь эпителия, где уже и прони-
кают в новые клетки хозяина. В новых клетках цикл
ТИП MYXOZOA
1055
Гаметогония
Рис. 422. Жизненный цикл Myxozoa (на примере жизненного цикла Myxosoma cerebralis'). (По: Kent et al., 2001, с изменениями).
т Объяснения в тексте.
Fig. 422. Life cycle of the Myxozoa (based on the life cycle of Myxosoma cerebralis).
Explanation in the text.
размножения паразита повторяется (рис. 422, 7—13).
Приблизительно на 4-й день после заражения клетки
паразита попадают в нервные волокна, причем деле-
ние клеточных дублетов продолжается в течение всей
миграции в центральную нервную систему рыбы — в
спинной мозг и далее в головной. В хряще развивается
стадия плазмодия и начинается процесс образования
спор (рис. 422, 13—16). Одна клетка исходного дубле-
та растет, и ее ядро делится на множество так называе-
мых вегетативных ядер. . Другая — делится на
генеративные клетки. В результате сложного и до кон-
ца не изученного процесса образуется так называемый
панспоробласт, содержащий, в случае М. cerebralis,
две споры. В процессе развития споры две клетки об-
1056
ТИП MYXOZOA
разуют створки споры, которые окружают две поляр-
ные капсулы и один двухядерный или два одноядер-
ных амебоидных зародыша, являющихся генератив-
ными клетками, которые начинают следующую фазу
жизненного цикла. Сформированные споры тем или
иным путем попадают в воду и становятся инвазион-
ными для кольчатых червей.
Развитие актиноспор в олигохетах. Актиноспоро-
идная часть жизненного цикла М. cerebralis начинает-
ся с заглатывания спор олигохетами, например Tubifex
tubifex (El-Matbouli, Hoffman, 1998). В просвете кишки
червя полярные капсулы выстреливают полярные
нити, которыми спора прикрепляется к кишечному
эпителию (рис. 422,17). Створки споры раскрываются
по шву, и амебоидный зародыш (спороплазма) прони-
кает между клетками кишечного эпителия. Оба ядра
амебоидного зародыша претерпевают множественные
деления, и образуется многоядерная клетка, которая
делится с образованием многочисленных одноядер-
ных клеток, мигрирующих через кишечный эпителий
червя (рис. 422, 18—19). После нескольких циклов де-
лений формируются двухядерные клетки, с которых
начинается стадия гаметогонии (рис. 422, 20). Ядра
двухядерной клетки делятся, и образуется четырех-
ядерная клетка, которая вскоре делится на четыре
клетки, образующие Так называемую панспороцисту
из двух покровных вегетативных клеток и двух генера-
тивных (рис. 422, 21—23). Две генеративные клетки
проходят три митотических деления, и образовавшие-
ся 16 диплоидных гаметоцитов претерпевают мейоз с
образованием 16 гаплоидных клеток и 16 полярных те-
лец (рис. 422, 24, 25). Гаметогония заканчивается об-
разованием 8 зигот в каждой панспороцисте, окружен-
ных восемью соматическими покровными клетками
(рис. 422, 26). Каждая зигота проходит через два мито-
тических деления и образует четырехклеточную ста-
дию (рис. 422, 27). Три периферийные клетки делятся
и образуют три капсулогенные и три клетки створок, в
то время как четвертая центральная клетка подвергает-
ся множественным митотическим делениям и образует
спороплазм со многими амебоидными зародышами
(рис. 422, 28, 29). Капсулогенные клетки формируют
характерные выросты и образуют трехстворчатую ак-
тиноспору, инвазионную для рыб (рис. 422, 30).
Таков ход жизненного цикла в наиболее типичном,
как теперь считают, случае. Однако не только кольча-
тые черви могут служить одним из хозяев при разви-
тии миксоспоридий. Другим хозяином, вместо анне-
лид, могут служить мшанки (Bryozoa). Мы рассмот-
рим известные случаи паразитирования в мшанках
более подробно, так как из них следуют и достаточно
неожиданные филогенетические выводы.
Первая находка миксоспоридий в мшанках Pluma-
tella fungosa была сделана в позапрошлом веке (Korot-
neff, 1892), а вторая — более чем через столетие, когда
была описана миксоспоридия Tetracapsula bryozoides
из Cristatella mucedo (Canning et al., 1996; Okamura,
1996). Эти миксоспоридии весьма отличаются от оста-
льных тем, что образуют мягкие споры с четырьмя по-
лярными капсулами, которые находятся внутри об-
ширного мешковидного образования (Canning et al.,
2000). Сразу же после вторичного открытия миксоспо-
ридий в мшанках было отмечено сходство между Tet-
racapsula bryozoides и загадочным возбудителем
(известным под названием РКХ) заболевания почек
(proliferative kidney disease — PKD) лососевых рыб
(см.: Hedrick et al., 1993). Были высказаны предполо-
жения о принадлежности РКХ к нескольким родам
миксоспоридий (Sphaerospora и Parvicapsula), оказав-
шиеся ошибочными, после того как анализ последова-
тельностей гена 18S рРНК показал родство РКХ с тет-
ракапсулидами из мшанок, и загадочный возбудитель
получил название Tetracapsula bryosalmonae (Canning
et al., 1999). Следует отметить, что морфологические
критерии для сравнения тетракапсулид совершенно не
разработаны, и для этого используются практически
только молекулярные данные.
Смело можно предположить, что фауна тетракап-
сулид и в мшанках, и в рыбах еще ждет своего описа-
ния. Весьма вероятно, что не только лососи могут слу-
жить хозяевами для паразитов мшанок: стадии разви-
тия, сходные с РКХ, были обнаружены и у карпа
(Voronin, Chernysheva, 1993). Пока накоплено слиш-
ком мало данных, чтобы утверждать облигатность
двуххозяинного цикла мшанки—рыбы. До сих пор не
ясно, может ли РКХ заражать мшанок, или рыбы явля-
ются для него тупиковым хозяином (Canning et al.,
2000). Совершенно очевидно, что исследование мик-
соспоридий, связанных с мшанками и рыбами, прине-
сет еще много сюрпризов.
Поскольку двуххозяинный жизненный цикл коль-
чатые черви—рыбы пока продемонстрирован только
для двух с половиной десятков видов (Kent et al., 2001),
не следует забывать о вероятности прямой, без участия
актиноспор, передачи миксоспоридий между рыбами.
Так, было показано (Diamant, 1997), что Myxidium leei,
паразит кишечного эпителия нескольких морских рыб,
может передаваться прямо от рыбы к рыбе. Однако ме-
тодика эксперимента была небезупречна: заражение
новых рыб констатировалось после их совместного
обитания с зараженными особями. Экспериментально-
го же заражения миксоспорами проведено не было. Та-
ким образом, остается вероятность того, что заражение
осуществилось с помощью вегетативных стадий жиз-
ненного цикла, а для нормального хода жизненного
цикла все же необходимы вторые хозяева. Прямая пе-
редача Kudoa ovivora, паразита икринок губана Thalas-
soma bifasciatum, была постулирована для рыб, собран-
ных в природе (Swearer, Robertson, 1999), однако лабо-
раторные эксперименты не были проделаны, поэтому
выводы не могут быть признаны окончательными, Не
следует забывать и результаты экспериментов Ауэрба-
ха по прямому заражению рыб спорами миксоспори-
дий.
Заканчивая раздел о жизненных циклах, следует
подчеркнуть, что в настоящий момент мы находимся
на переломе, в процессе переоценки всего комплекса
знаний, добытых за полуторавековую историю изуче-
ния миксоспоридий. С одной стороны, базовые пред-
ставления, казавшиеся незыблемыми еще совсем не-
давно, не устояли перед экспериментом, но, с другой
стороны, многие экспериментальные данные еще
требуют проверки. Вполне вероятно, что в следующее
издание настоящего Руководства придется вносить
существенные поправки — очень бурно развивается
эта часть паразитологии, слишком драматичны столк-
ТИП MYXOZOA
1057
новения между классическими представлениями,
сформировавшимися только на морфологической
основе, с новыми данными, которые получены экспе-
риментальным путем и/или с помощью молекулярных
методов.
Филогения и эволюция
Миксоспоридии, или слизистые споровики — груп-
па парадоксальная. Может быть, самая парадоксальная
группа живых организмов, фигурировавшая в зоологи-
ческих дискуссиях последних десятилетий. Одно вре-
мя считавшиеся даже растениями (Balbiani, 1863),
миксоспоридии были помещены среди простейших
(см.: Шульман, 1966), и еще всего лишь несколько лет
тому назад в первом томе самой содержательной свод-
ки, когда-либо посвященной этим организмам (Шуль-
ман и др., 1997), в первой же строке введения они на-
званы, хотя и своеобразной, но «группой паразитиче-
ских простейших». И в последней мировой сводке,
охватывающей всех Protozoa, миксоспоридии нашли
свое место (Kent et al., 2000а).
Хотя первые сведения об этих организмах относят-
ся к началу XIX в., малые размеры наиболее типичной
стадии жизненного цикла — споры, распространен-
ность по преимуществу в водных животных — рыбах
и оказавшийся совершенно неожиданным жизненный
цикл, включающий других водных животных, привели
к тому, что истинная природа этих организмов стала
выясняться только в последние годы.
Отто Бючли (Biitschli, 1881), давший первое науч-
ное название этим организмам, поместил их среди про-
стейших в класс споровиков. Дофлейн (Doflein, 1901)
основал отряд Cnidosporidia среди споровиков, куда в
качестве подотрядов вошли имеющие полярные капсу-
лы миксоспоридии и микроспоридии. Позднее Гарт-
ман (Hartman, 1923) выделил Cnidosporidia из состава
Sporozoa, а впоследствии ранг интересующей нас
группы был поднят до класса (Jirovec et al., 1953, Хей-
син, 1956, и др.). Исси и Шульман (1967) логически за-
вершили этот процесс, отделив имевших многоклеточ-
ные споры и плазмодиии миксоспоридий и актиномик-
сидий от одноклеточных микроспоридий, оставив в
классе Cnidosporidia два подкласса — Myxosporidia и
Actinomyxidia. Многоклеточный характер как спор,
так и вегетативных стадий книдоспоридий, естествен-
но, вызывал понятные неудобства при расположении
этого таксона среди простейших, и его ранг был под-
нят до типа с присвоением названия Myxozoa Grasse,
1970, под которым эти организмы чаще всего и упоми-
наются в настоящее время. Отечественные зоологи
обоснованно сомневались в необходимости нового на-
звания и чаще использовали для типа название Cnidos-
pora Doflein, 1901.
История определения таксономического положе-
ния, происхождения и места в филеме живого миксо-
споридий — это история попыток примирить явно мно-
гоклеточное строение организмов и традиционное же-
лание поместить микроскопические организмы среди
простейших животных. Разрешению этого во многом
субъективного парадокса было посвящено большое
количество работ, обсуждавших в основном границы
понятия истинной многоклеточности. Вопрос же полу-
чил свое разрешение, как это обычно и бывает, не в
термино-теоретических дискуссиях, а с появлением
новых методов и накоплением новых эксперименталь-
ных данных.
В качестве протозойных предков книдоспоридий
указывали каких-то паразитических амеб (амебоидное
строение плазмодия миксоспоридий) или жгутиконос-
цев (наличие экструсом) (см.: Шульман и др., 1997).
Однако еще сто лет тому назад было высказано
предположение, что миксоспоридии не относятся к
протестам, так как имеют многоклеточные споры
(Stoic, 1899). Наличие экструсом — полярных капсул
со спирально свернутой стрекательной нитью — есте-
ственно должно было привести и привело к предполо-
жению о связи миксоспоридий и Cnidaria (Weill, 1938).
Более того, было отмечено сходство миксоспоридий с
наркомедузами, а именно с Polypodium hydriforme
(Weill, 1938). Эта точка зрения была подвергнута кри-
тике и надолго забыта, однако сходство нематоцист
Cnidaria и полярных капсул спор миксоспоридий на
ультраструктурном уровне вновь воскресило вопрос о
родстве этих групп животных (Lom, 1969, 1990).
Сторонники такой точки зрения в общем представ-
ляли книдоспоридий как кишечнополостных, сильно
упростившихся под влиянием паразитического образа
жизни. Их противники, сторонники протозойной при-
роды книдоспоридий, объявляли сходство в строении
экструсом конвергенцией, обусловленной одинаковым
принципом действия — выбрасыванием стрекатель-
ной нити (Шульман, 1966; Grasse, Lavette, 1978, и др.)
и несколько парадоксально считали, что миксоспори-
дии являются единственным крупным таксоном среди
Protozoa, который перешел в многоклеточное состоя-
ние (Шульман и др., 1997).
На этом аргументы с обеих сторон были исчерпа-
ны. Дискуссия зашла в тупик, который знаменовал со-
бой в значительной мере то нелегкое положение, в ко-
тором оказалась филогенетика, построенная лишь на
морфологических данных. Выбор между двумя точка-
ми зрения оказался невозможным внутри классиче-
ских зоологии и паразитологии. Эта патовая ситуация
стала разрешаться лишь с появлением и внедрением
новой биологической парадигмы — молекулярной
биологии вообще и молекулярной филогенетики, в ча-
стности. К традиционным светооптическим и ультра-
структурным данным прибавились методы, позволяю-
щие быстро и надежно определить наличие тех или
иных книдоспоридий у позвоночного или беспозво-
ночного хозяев, такие как ПЦР-типирование и in situ
гибридизации, лектиновый и иммунологические тес-
ты, и, наконец, определение последовательностей нук-
леотидов тех или иных участков ДНК.
Другим важным обстоятельством, приведшим к
резкому увеличению объема наших знаний о Myxozoa,
и последовавшему за этим определению их позиции на
филогенетическом древе, было экстенсивное развитие
аквакультуры, показавшее экономическую важность
этих паразитов и практическую необходимость приоб-
ретения фундаментальных знаний о миксоспоридиях.
Два открытия оказали огромное воздействие на иссле-
дования слизистых споровиков и практически сформи-
ровали современное представление об этой загадочной
67 Зак. №4163
1058
ТИП MYXOZOA
группе паразитов. В первую очередь фундаменталь-
ный характер имело выяснение в 80-х гг. того факта
(Wolf, Markiw, 1984а, 1984b), что жизненный цикл My-
xosoma cerebralis является двуххозяинным и включает
актиноспороидную стадию в олигохете Tubifex tubifex.
Подробнее жизненный цикл излагается в соответству-
ющем разделе. Здесь лишь напомним, что наиболее
смелая гипотеза, очевидно, и оказалась справедливой:
двуххозяинный жизненный цикл, включающий рыб и
олигохет, подтвержден, в том числе и молекулярными
данными, для 25 видов миксоспоридий, которые отно-
сят к бродам из четырех семейств (Kent et al., 1994;
Kent et al., 2001; Uspenskaja, 1995). Соответственно
Myxosporidia и Actinomyxidia, считавшиеся представи-
телями разных классов, являются не более чем разны-
ми стадиями жизненного цикла.
С развитием методов молекулярной систематики
миксоспоридии, естественно, привлекли внимание ис-
следователей, работающих в этой области. Для фило-
генетических построений был использован самый рас-
пространенный в молекулярной филогенетике на се-
годня признак — последовательность нуклеотидов
гена 18S рРНК. Первая работа, в которой были исполь-
зованы известные к тому времени сиквенсы 18S рДНК,
показала, что миксоспоридии относятся к Metazoa и
совершенно неожиданно позиционировала этих пара-
зитов как сестринскую группу Bilateria — нематод
(Smothers etal., 1994; Schlegel, Stechmann, 1996), Поч-
ти сразу после публикации этой необычной точки зре-
ния, с использованием комбинации молекулярных и
морфологических данных и новых 18S рДНК сиквен-
сов кишечнополостных, было показано, что на филоге-
нетическом древе миксоспоридии помещаются среди
Cnidaria (рис. 426), в качестве сестринской группы па-
разитов рыб — наркомедуз Polypodium hydriforme
(Siddall et al., 1995), что и было абсолютно точно пред-
сказано Вейлем (Weill, 1938). Как признаки многокле-
точных животных были отмечены десмосомы, продук-
ция коллагена и так называемые плотные контакты
(tight junctions), в качестве специфических признаков
книдарий — ультраструктурные особенности развития
полярных капсул миксоспоридий, практически неот-
личимые от картин развития нематоцист наркомедуз
(Siddall et al., 1995; Lom, Dykova, 1997).
В это же время было продемонстрировано, что мик-
соспоридии могут объединяться с ветвью трехслойных
животных (Triploblastica) при использовании для обра-
ботки данных алгоритма максимального сходства (ma-
ximum likelihood) и при исключении из анализа нарко-
медуз, которое было сделано для того, чтобы избавиться
от артефакта длинных ветвей, который, по мнению ав-
торов, имел место на полученной филогенетической
схеме (Hanelt et al., 1996). Вывод о близости миксоспо-
ридий и трехслойных животных был сделан и на осно-
вании выявления у первых Нох-гена, похожего на анало-
гичный ген Triploblastica (Anderson, 1998; Anderson et al.,
1998). Однако эти данные еще нуждаются в проверке.
Сюрпризом стали данные о том, что известный уже
более полутора веков (Dumortier, van Beneden, 1850) и
описанный в начале прошлого века (Schroder, 1910)
червеобразный, нематодоподобный паразит мшанок
Plumatella — Buddenbrockia plumatellae — оказался
принадлежащим к миксоспоридиям Tetracapsula. Не-
давно еще несколько похожих организмов были описа-
ны тоже из разных мшанок (Kent et al., 2001; Okamura
et al., 2002; Monteiro et al., 2002). Buddenbrockia
(рис. 424) является настолько своеобразным организмом,
что она была отнесена к числу пяти загадочных таксо-
нов животных (Nielsen, 1995) и, с одной стороны, ни-
когда не была отнесена к какому-либо типу животных,
а, с другой стороны, и монотипный таксон для нее так-
же никогда не был основан (Monteiro et al., 2002).
Ультраструктурное исследование Buddenbrockia
показало наличие у этого организма полярных капсул,
что заставило авторов поместить их среди миксоспо-
ридий, а строение этих капсул и некоторые другие осо-
бенности позволили отнести этих загадочных червей к
классу Malacosporea (Okamura et al., 2002). Но еще бо-
лее удивительным было обнаружение третьего, внут-
реннего клеточного слоя и четырех лент продольных
мышц, описанных, кстати, еще почти сто лет тому назад
(Schroder, 1912), что свидетельствует о принадлежно-
сти Buddenbrockia не только к миксоспоридиям, но и к
трехслойным, билатерально симметричным организ-
мам (Okamura et al., 2002). Это открытие хотя и являет-
ся совершенно неожиданным и необычным, но естест-
венным образом снимает противоречия молекулярных
филогений, на части из которых, в зависимости от спо-
соба обработки материала и набора сравниваемых ви-
дов, миксоспоридии оказывались то сестринской груп-
пой двуслойных Cnidaria (Siddall et al., 1995), то трехслой-
ных нематод (Smothers et al., 1994; Schlegel et al., 1996).
Хотя Buddenbrockia очевидно связана c Bilateria, она не
имеет ни кишечника, ни центральной нервной системы.
Исследование Buddenbrockia из разных мшанок
и из отдаленных местообитаний показало практиче-
скую идентичность последовательностей нуклеотидов
18S рДНК всех исследованных образцов с 18S рДНК
миксоспоридии Tetracapsula bryozoides из мшанок
(рис. 425). Говоря другими словами, Buddenbrockia
принадлежит к миксоспоридиям из класса Malacospo-
rea, скорее всего к виду Tetracapsula bryozoides, и
представляет собой новую стадию жизненного цикла
последнего (Monteiro et al., 2002). Авторы предлагают
следующий сценарий эволюции миксоспоридий. Об-
щий предок всех Myxozoa имел две стадии в своем
жизненном цикле: подвижную червеобразную и непо-
движную, специализировавшуюся на продукции спор.
После дивергенции на Myxosporea и Malacosporea пер-
вые утратили все следы билатеральной симметрии и
развились в бесформенные плазмодии, где и проходи-
ло формирование спор. От себя добавим, что на этой
стадии Myxosporea, вероятно, сменили прежнего хо-
зяина на кольчатых червей. По меньшей мере неко-
торые (а может быть и все) Malacosporea сохранили
обе анцестральные стадии — и червеообразную по-
движную, и мешковидную, продуцирующую споры.
Авторы предполагают, что споры, обнаруженные в
Buddenbrockia, образуются в червеобразной форме
лишь факультативно. Как мы уже несколько раз отме-
чали, очевидно, что эти предположения пока являются
весьма и весьма спекулятивными, для более серьезно-
го обсуждения необходимы дополнительные данные.
Главное, что тоже требует подтверждения, — это то,
что миксоспоридии оказались принадлежащими не
только к многоклеточным, но, возможно, и к трехслой-
ТИП MYXOZOA
1059
ным Bilateria. Если это так, то миксоспоридии демон-
стрируют, пожалуй, крайнюю степень редукции, к ко-
торой может привести паразитизм.
Использование большего количества таксонов для
анализа вновь вернуло миксоспоридий в одну группу с
Cnidaria (Siddall, Whiting, 1999). В этой работе обсуж-
дались достоинства и недостатки основных методов,
применяемых в молекулярной филогенетике, — мак-
симальной экономии (парсимоний) и максимального
сходства. Было сделано методологически чрезвычайно
важное заключение, что общие морфологические при-
знаки, в том числе наличие полярных капсул и сход-
ных стадий развития, не могут быть результатом арте-
факта длинных ветвей, как это может случиться при
сравнении нуклеотидных последовательностей. Мне-
ние о родстве Cnidaria и Myxozoa является в настоящее
время наиболее распространенной точкой зрения, хотя
еще относительно недавно некоторые исследователи
отказывались даже обсуждать возможную принадлеж-
ность миксоспоридий к многоклеточным организмам
как несерьезную (Cavalier-Smith, 1993).
Сделанные из работ этого периода выводы ни в
коем случае не могут быть расценены как последнее
слово в определении позиции миксоспоридий на фило-
генетическом древе. Увеличение количества исследо-
ванных организмов и число используемых молекуляр-
ных маркеров неизбежно принесет новые, возможно
совершенно неожиданные, открытия. Слишком нео-
бычна эта группа паразитических организмов, слиш-
ком велики изменения, которые наложил на них пара-
зитизм, слишком непредсказуемы изменения наших
представлений об этой группе животных.
Крупнейший исследователь миксоспоридий
С. С. Шульман (Шульман, 1966; Шульман и др., 1997)
считал, что первые их представители паразитировали в
желчном пузыре, а потом освоили и мочевой пузырь
морских костных рыб в конце мелового периода. Впо-
следствии паразиты освоили и другие органы хозяев, а
некоторые стали паразитировать и в тканях рыб. В ка-
честве исходных форм С. С. Шульман (1966) принимал
Bipolarina (Myxidium, Sphaeromyxa), которые в пресных
водах дали начало Platysporina (Myxobolus, Henneguya),
и связывал происхождение морских тканевых много-
створчатых миксоспоридий (Multivalvulida) с морски-
ми же полостными паразитами типа Ceratomyxa.
Сформулированные исключительно на морфологи-
ческих и эколого-паразитологических данных, фило-
генетические представления С. С. Шульмана нашли
полное подтверждение и в молекулярно-филогенети-
ческих схемах, построенных по сиквенсам 18S рДНК
(Kent et al., 2000b; Kent et al., 2001). Так, Ceratomyxa
объединяется с многостворчатыми Kudow, тканевой
паразитизм возникает по меньшей мере дважды: у пре-
сноводных Platysporina (Myxobolus и др.) и у морских
Multivalvulida (Kudoа). Морские и пресноводные
виды, за одним исключением, образуют отдельные
кластеры на филогенетическом древе миксоспоридий,
что прекрасно согласуется с представлениями
С. С. Шульмана (рис. 427). Исключением является Ce-
ratomyxa shasta — пресноводный паразит лососевых
рыб, оказавшийся на древе между морскими родами
Sinuolinea и Parvicapsula. Этот паразит в качестве
беспозвоночного хозяина использует пресноводную
полихету — редкого пресноводного представителя ти-
пично морской группы организмов. Все это делает воз-
можным предположение, что С. shasta вторично
перешла в пресные воды.
Паразиты мшанок Tetracapsula spp. и РКХ-орга-
низм образуют отдельную группу миксоспоридий в
базальной части древа, расположенную ближе всего к
Polypodium hydriforme (рис. 427), что поддерживает
образование отдельного класса для миксоспоридий,
паразитирующих в мшанках (Tetracapsula spp.) — Ma-
lacosporea (Canning et al., 2000):
В целом молекулярные данные на уровне родов и
семейств хорошо согласуются с классическими пред-
ставлениями, хотя можно отметить и несколько инте-
ресных несоответствий. Систематика миксоспоридий
основывается на морфологии спор, другие признаки
носят вспомогательный характер (Шульман, 1966;
Lom, Noble, 1984; Kent et al., 2001, и др.). Однако ис-
следованные пять видов морских миксоспоридий Ки-
doa объединяются в группы не по строению спор, а по
общим хозяевам и географическому распространению
(Hervio et al., 1997).
На филогенетическом древе, построенном по изве-
стным на сегодняшний день последовательностям нук-
леотидов 18S рДНК 59 миксоспоридий (Kent et al.,
2001), пожалуй, только Kudoa является, несомненно,
монофилетическим родом. Myxidium, Myxobolus, Неп-
neguya и Sphaerospora — пара- или полифилетичны.
Касательно других родов выводы делать пока прежде-
временно из-за недостатка исследованного материала
(рис. 427). Отметим лишь, что молекулярные данные
не подтверждают самостоятельность двух больших и
хорошо отличающихся морфологически родов — My-
xobolus и Henneguya (Smothers et al., 1994; Andree et al.,
1999). Таким образом, вполне вероятно, что такой чет-
кий морфологический признак, как хвостовые отрост-
ки, прекрасно диагностировавший два упомянутых
рода под микроскопом, мог возникать независимо и не
имеет таксономического веса по крайней мере на родо-
вом уровне. Актиноспороидные стадии (Triactinomy-
хоп и др.), для которых есть данные по сравниваемому
гену, располагаются в разных частях древа, образуя
тесные группы с теми или иными миксоспороидными
стадиями.
Характеризуя молекулярные филогении миксоспо-
ридий, опубликованные к настоящему времени, следу-
ет отметить, что многие ветви на филогенетическом
древе пока недостаточно достоверны и требуется изу-
чение большего количества видов как миксопор, так и
актиноспор, а также Cnidaria, для более определенных
выводов. Полученные филогенетические схемы бази-
руются на сравнении генов 18S рРНК. Для создания
более объективной картины необходимо исследование
и других молекулярных маркеров. Однако уже сейчас
некоторые заключения могут быть сделаны с высоким
уровнем достоверности: морские миксоспоридии фор-
мируют отдельные, рано обособившиеся ветви, кото-
рые расположены вблизи основания древа; миксоспо-
ридии формируют группы, объединенные не столько
строением спор, сколько локализацией в хозяине и
особенностями развития; тетракапсулиды образуют
самую раннюю дивергировавшую группу, что, воз-
можно, связано с включением мшанок, а не кольчатых
1060
ТИП MYXOZOA
----Diaphanoeca grandis
----Axinella polypoides
----Trichoplax adhaerens
Рис. 425. Молекулярная филогения по данным
сиквенса 18S rDNA. (По: Monteiro et al., 2002, с
изменениями).
Fig. 425. Molecular phylogeny based on an 18S
rDNA sequences.
Trichinella spiralis
-Tetracapsula bryosalmonae
100
100 Buddenbrockia plumateliae
----- 100
Tetracapsula bryozoides
СЛ
CO
CO
s
100
------Myxobolus pseudodispar
100
Henneguya salmonicola
100
Ceratomyxa shasta
69
СЛ
О
£
s
Kudoa paniformis
L— 92
Parvicapsula monibicornis
— Scypha
— Sycon
Anemonia
Tripedalia
Polypodium
— Myxidium
— Henneguya
— Myxobolus
f
О
s
— Hydra
— Cassiopea
— Trichoplax
Рис. 426. Молекулярная филогения по данным сиквенса 18S rDNA.
(По: Siddall et al., 1995, с изменениями).
Fig. 426. Molecular phylogeny based on an 18S rDNA sequences.
Strongyloides
Artemia
— Xenopus
ТИП MYXOZOA
1061
100
Tripedalia cystophora
•Polypodium hydriforme
100
98
95
96
- Tetracapsula briozoides
PKX organizm
- Sinuolinea sp.
Ceratomyxa shasta
— Parvicapsula minibicornis
97 -— Kudoa crumena
~'-----Kudoa amamiensis
I - Kudoa ciliatae
—1|~ Kudoa thyrsites
™ 1 - Kudoa paniformis
- Kudoa miniauriculata
------Raabeia В
Iqq _______|----Myxidium truttae
100 -----Myxidium sp.
Sphaerospora oncorhynchi
Myxidium lieberkuehni 2
Myxidium lieberkuehni 1
_______<------Echinactinomyxon D
I L j-----------Triactinomyxon F
- 70 ‘--------Myxobolus osburni
------Henneguya lesteri
100 |- Sphaeractinomyxom ersei
j L Myxobolus ichkuelensis
дд । -----Tetraspora discoidea
~ (__r — Myxobolus spinacurvatura
90 1 — Endocapsa rosulata
— Triactinomyxon marine
1001— Henneguya exilis
i I ।— Aurantiactinomyxon mississipiensis
-[ 100*- Henneguya ictaluri
I--------Neoactinomyxum
i___j- Aurantiactinomyxon
\r - Henneguya sp. 1
— Henneguya doori
Sphaerospora molnari
----Myxobolus algonquinensis
- Myxobolus bibullatus
^2 1 I— Synactinomyxon
100 ---Antonactinomyxon
100 [---Myxobolus sp. 1
—I г Myxobolus pendula
_ I Myxobolus pellicides
Myxobolus sp. 2
I----Triactinomyxon ignotum
100‘ Triactinomyxon C
100 I— Myxobolus squamalis
73 I •— Myxobolus sp. ex: rainbowtrout
I I--------Myxobolus sp. ex. whitesucker
99 ।--------Myxobolus portucalensis
_______г Henneguya zschokkei
100 L Henneguya salminicola
— Myxobolus cerebralis
------ “ Myxobolus insidiosus
100 L-j_ Myxobolus sandrae
86 j- Myxobolus neurobius
Myxobolus bramae
* Myxobolus ellipsoides
r Myxobolus djragini
*- Myxobolus arcticus
60 _______
95 ______
100
100
96
80 i
67
60
97
77
100
81 i
93
100
Рис. 427. Молекулярная филогения по данным снк-
венса 18S rDNA (наиболее экономное дерево). (По:
Kent et al., 2001).
Fig. 427. Molecular phylogeny based on an 18S rDNA
sequences (the tnost parsimonious tree).
червей в качестве эволюционно первого беспозвоноч-
ного хозяина миксоспоридий.
Половое размножение в жизненном цикле миксос-
поридий, очевидно, имеет место один раз — на акти-
носпороидной стадии в кольчатых червях. Исходя из
общих паразитологических представлений о том, что
половой процесс проходит в эволюционно первом хо-
зяине, следует, вероятно, предположить, что такими
хозяевами были кольчатые черви (или мшанки для тет-
ракапсулид), а двуххозяинный жизненный цикл с учас-
тием рыб сформировался позже. С другой стороны,
рыбы являются хозяевами для большинства миксоспо-
ридий из всех трех главных групп на филогенетиче-
ском древе (тетракапсулид, пресноводных и морских
миксоспоридий), в то время как различные таксоны
беспозвоночных (мшанки, олигохеты и полихеты) вы-
1062
ТИП MYXOZOA
полняют роль другого хозяина; и, наконец, ближай-
ший родственник миксоспоридий — Pofypodium — яв-
ляется паразитом рыб (Kent et al., 2001). Эти факты
свидетельствуют, Скорее, в пользу того, что эволюци-
онно первыми в жизненном цикле миксоспоридий
были рыбы. Нам представляется, что пока не настало
время для окончательного решения вопроса о том, кто
был исходным хозяином для миксоспоридий — рыбы
или беспозвоночные, и какие беспозвоночные были
освоены паразитами первыми. Недостаток данных по-
зволит лишь увеличить количество чисто умозритель-
ных, не поддающихся Проверке, предположений.
Паразито-хозяинные отношения
и патогенное влияние
миксоспоридий
Несмотря на то что к настоящему времени описано
около 1500 видов миксоспоридий, лишь немногие из
них известны как возбудители серьезных заболеваний.
Это связано с тем, что отношения между паразитом и
хозяином в природных экосистемах в той или иной
степени сбалансированы. Степень этой сбалансиро-
ванности зависит от самых разнообразных причин и
определяет патогенность миксоспоридий. Парази-
то-хозяинные отношения вообще характеризуются той
или иной степенью антагонизма, в случае миксоспори-
дий — вегетативных стадий паразита с Тканями и орга-
нами хозяина.
Для вегетативных стадий миксоспоридий показано
наличие всех возможных способов питания и типов
пищеварения, комбинирующихся в зависимости от ме-
ста обитания и от пищи, которую они могут получить в
данном органе или ткани хозяина: 1) внеклеточное
(дистантное) переваривание за счет ферментов, выде-
ляемых паразитом наружу; 2) пиноцитоз и фагоцитоз с
последующим внутриклеточным перевариванием;
3) мембранное пищеварение с последующим актив-
ным транспортом. В большинстве случаев сочетаются
два или все три типа пищеварения: дистантное, при-
стеночное и внутриклеточное. Чаще всего они допол-
няют друг друга. Например, у Myxosoma cerebralis —
дистантное, фагоцитоз, внутриклеточное; у Kudoa qu-
adratum — пиноцитоз, фагоцитоз, дистантное, присте-
ночное. В целом миксоспоридии не являются ни обли-
гатными анаэробами, ни облигатными аэробами
(Успенская, 1984).
Тяжесть заболевания даже при заражении патоген-
ными миксоспоридиями не одинакова. Это отражает
характер отношений между паразитом и хозяином.
В системе паразит—хозяин возможны три основных
типа взаимоотношений, между которыми существует
большое число переходов (Шульман и др., 1997).
1. Резистентность организма хозяина достаточно
сильна, чтобы подавить паразита. При этом или совсем
исключается возможность заражения, или имеет место
незначительное и недолговременное заражение, или,
наконец, интенсивность заражения может быть доста-
точно велика, но организм хозяина активно сопротив-
ляется, что приводит даже к гибели части паразитов.
В последнем случае наблюдается или недоразвитие па-
разитов, о чем свидетельствует наличие вегетативных
форм, в которых не происходит развития спор, или ци-
сты гибнут с уже сформировавшимися спорами (на-
пример, Myxidium rhodei, Kudoa alliaria, К. nova, К. ro-
senbuschi).
2. Резистентность хозяина недостаточна для того,
чтобы преодолеть патогенное влияние паразита.
В этом случае возможны сильнейшие эпизоотии (на-
пример, Myxosoma cerebralis, Ceratomyxa shastd).
3. Система паразит—хозяин находится в состоянии
динамического равновесия. Резистентность хозяина
достаточно велика для того, чтобы изолировать пара-
зита и ограничить его патогенное воздействие, однако
не настолько, чтобы полностью уничтожить его (на-
пример, Myxidium lieberkuehni).
Современные данные свидетельствуют, что имеет-
ся очень небольшой, если вообще имеется, гумораль-
ный ответ организма хозяина на заражение миксоспо-
ридиями (Griffin, Davis, 1978). Вероятно, в немалой
степени этому способствует и адсорбция миксоспори-
диями на своей поверхностной мембране антител хозя-
ина. Такая мимикрия избавляет паразита от выработки
собственных антител (Pauley, 1974; McArthur, Sen
Gupta, 1982).
При заражении миксоспоридиями можно наблю-
дать все основные патологические изменения в тканях
и органах, все категории регрессивных и прогрессив-
ных изменений и даже обратимые, такие как гиперэ-
мии, отеки и геморрагии. Регрессивные изменения
наиболее часто проявляются в виде дистрофии, напри-
мер эпителиальных оболочек желчных и мочевыводя-
щих Протоков, а также в виде атрофии, связанной с на-
личием больших или очень большого числа полостных
или тканевых плазмодиев. Часто наблюдается обызве-
ствление некротизирующих тканей. Некроз часто раз-
вивается в результате внутриклеточной локализации
стадий развития миксоспоридий, в особенности ло-
кальный некроз.
Среди наиболее частых прогрессивных изменений
наблюдаются гипертрофия или гиперплазия, или одно-
временно оба эти изменения. Гипертрофией может
быть охвачена либо часть органа (почечные клубочки
при паразитировании Myxidium rhodei и Sphaerospora
renicola), либо орган в целом (увеличенная головная
почка при паразитировании Sphaerospora tincae). Ги-
перплазия характерна для эпителиальных покровов.
Наблюдалась регенерация поврежденного эпителия, в
то время как явлений регенерации других типов тка-
ней не обнаружено.
Воспалительный процесс при заражении миксоспо-
ридиями обычно пролиферативного типа, являющийся
важным защитным механизмом. Он обычно начинает
проявляться, когда плазмодии уже содержат зрелые
споры. Процесс замещения грануломатозной тканью
поврежденных участков — один из способов возмеще-
ния вреда после разрушения цист и больших плазмо-
диев или после некроза. Инкапсуляция плазмодия или
скоплений спор также является результатом пролифе-
ративного воспалительного процесса, а не только про-
лиферации соединительно-тканных элементов.
Фагоцитоз также является важным элементом
системы контроля организма хозяина над паразитом.
Меланомакрофаги захватывают споры, выходящие в
ТИП MYXOZOA
1063
тканевое пространство, а также мелкие тканевые веге-
тативные формы и переносят их в меланомакрофаги-
альные центры в почках, селезенке или печени, где они
инкапсулируются и постепенно разрушаются (Lom,
Dykova, 1992).
Хорошим примером равновесной системы пара-
зит—хозяин служит Myxidium lieberkuehni. Воспали-
тельные явления, вызываемые им в мочевом пузыре
щуки, с одной стороны, улучшают питание паразита. С
другой стороны, болезненные явления почти всегда
носят локальный характер, что сохраняет в общем нор-
мальную жизнедеятельность рыбы, и в конечном счете
представляет выгоду и для самого паразита. Инкапсу-
ляция тканевых паразитов позволяет хозяину локали-
зовать их патогенное воздействие. В то же время появ-
ление вокруг капсул инфильтратов и разрастание ка-
пиллярной сети улучшает питание самого паразита.
Таким образом, образование цист есть также один из
путей выработки состояния равновесия между парази-
том и хозяином.
Равновесная система паразит—хозяин — результат
исторического преобразования. Раз возникнув, эта си-
стема подвергается отбору, в результате которого
остаются наиболее устойчивые системы. Если выра-
ботка устойчивости идет на организменном уровне, то
происходит закономерная смена трех разобранных
выше типов взаимоотношений паразита и хозяина.
Первый тип взаимоотношений возникает в том случае,
когда система паразит—хозяин или еще не сформиро-
валась, или находится в самой начальной стадии ста-
новления. Как только паразиту удается приспособить-
ся к существованию в новом хозяине, возможен пере-
ход ко второму типу, так как организм хозяина еще не
выработал систему защиты против относительно ново-
го для него паразита. В дальнейшем может произойти
постепенное приспосабливание хозяина к паразиту, в
результате чего наступает третий тип взаимоотноше-
ний с хозяином — состояние динамического равнове-
сия. Эта общая схема не отражает всего разнообразия
взаимоотношений паразита и хозяина. Само состояние
равновесия относительно и может приближаться или к
первому, или ко второму типам, а также весьма неу-
стойчиво и в зависимости от конкретных условий мо-
жет изменяться или в пользу хозяина, или во вред ему.
Соответственно в системе паразит—хозяин встреча-
ются все возможные типы взаимоотношений, от почти
безвредного паразитирования до тяжелейших заболе-
ваний. В тех случаях, когда имеет место подавление
паразита хозяином или полное равновесие между
ними, болезненные явления не наблюдаются или слабо
выражены. При сдвиге равновесия в сторону паразита
проявляются местные реакции, ограничивающиеся
данной тканью или органом. Еще более сильный сдвиг
сказывается на всем организме хозяина, существенно
нарушая ряд важных функций.
Часто болезненные проявления возникают вследст-
вие попадания паразита в нетипичную для него ткань
или орган. Это можно проиллюстрировать на примере
Myxidium rhodei и плотвы. Плазмодии, паразитирую-
щие в типичном для них месте (почечные клубочки)
атакуются хозяином только после образования в них
зрелых спор. Если же они паразитируют в интерстици-
альном пространстве почек, то быстро разрушаются.
В целом степень повреждения паразитом ткани или
органа зависит от вида паразита, стадии его жизненно-
го цикла, интенсивности заражения и реакций организ-
ма хозяина. Она может быть практически незаметна
или выражаться в летальных изменениях органов и
тканей. Миксоспоридии могут заражать практически
любой орган рыбы и наносить самый разнообразный
вред хозяину. Типичные примеры:
атрофия окружающих органов путем их сдавлива-
ния большими плазмодиями (Henneguya exilis, Мухо-
bolus pavlovskii и др.);
большие плазмодии (например, Thelohanellus pyri-
formis) вызывают деформацию не только зараженных,
но и соседних тканей. Раздражение трофозоитами эпи-
телия желчного пузыря и желчных протоков сопро-
вождается воспалением и в результате приводит к раз-
литию желчи и обызвествлению (например, Chloromy-
хит truttae, Myxidium truttae);
гипертрофия органа, например головной почки
линя Sphaerospora tincae;
расширение почечных канальцев и мочевых прото-
ков массами развивающихся стадий (например, Sphae-
rospora renicola) или печеночных протоков плазмо-
диями (Zschokkella nova), которое сопровождается
атрофией эпителия и другими регрессивными измене-
ниями;
разрушение хрящевой ткани в результате лизирую-
щей и фагоцитарной активности плазмодия (Myxosoma
cerebralis, Myxobolus aeglefini);
деформация позвоночника в результате разруше-
ния нервных волокон спинного мозга (например, My-
xobolus sandrae);
замещение тканей стадиями развития паразита (на-
пример, миоциты, зараженные Kudoa)',
разрушение ткани массой внедряющихся стадий
развития паразита (Ceratomyxa shasta)',
некроз паренхимы печени при проникновении тро-
фозоитов (Chloromyxum cristatum);
целые органы перестают функционировать, напри-
мер жабры карпа, зараженные Sphaerospora molnari,
которая вызывает гиперплазию эпителия и слипание
жаберных лепестков.
В целом полостные миксоспоридии менее патоген-
ны, чем тканевые (Шульман и др., 1997).
Возникновение заболеваний часто связано с па-
разитированием на необычном хозяине, что обычно
является результатом интродукции или введением в
аквакультуру новых объектов рыборазведения, в ре-
зультате чего возникают «молодые» системы пара-
зит—хозяин. Примерами таких заболеваний являются
болезни, вызываемые Myxosoma cerebralis и Ceratomy-
xa shasta. Интродукция обычного окуня в Австралию
привела к появлению нового заболевания, вызываемо-
го Triangula регсае. Этот вид впервые и был описан
именно от окуня в Австралии. При искусственном со-
держании рыб в прудах, и особенно в садках и бассейнах,
резко нарушается равновесное состояние систем пара-
зит—хозяин. Большая плотность посадки рыб обеспе-
чивает массовое скопление инвазионного начала на
сравнительно небольшом пространстве. Это способст-
вует интенсивному заражению рыб, что усиливает па-
тогенное воздействие паразита. Искусственное содер-
жание рыб и связанное с этим нарушение естественных
1064
ТИП MYXOZOA
для них условий приводят к уменьшению сопротивля-
емости организма хозяина. Это не только усиливает пато-
генное воздействие паразита, но и способствует освое-
нию последними новых хозяев, а также новых тканей и
органов (извращенная локализация) в основных хо-
зяевах. Возникающие при этом новые или функцио-
нально новые системы паразит—хозяин характеризу-
ются резким усилением патогенности паразита. Нару-
шение нормальных условий существования рыбы, не
всегда полноценная пища, стрессовое состояние еще
больше усиливают тяжесть заболевания. Этим комп-
лексом причин, по-видимому, объясняется тот факт,
что подавляющее большинство заболеваний (миксо-
споридиозов) и массовая гибель от них наблюдается
при искусственном выращивании рыб (Шульман и др.,
1997). В табл. 4 представлено большинство извест-
ных к настоящему времени возбудителей миксоспо-
ридиозов.
Таблица 4
Возбудители миксоспоридиозов и их воздействие на организм хозяина
Вид Тип пара- зитирования Хозяин Орган Воздействие
Myxidium lieberkuehni Полостной Щука Мочевой пузырь Патологическое изменение стенок
Myxidium folium » Fundulus heteroclitus Печеночные протоки Плазмодии вызывают закупорку прото- ков и атрофию их эпителия
Myxidium gasterostei » Колюшка Желчный пузырь Закупорка протоков и увеличение объе- ма печени
Myxidium giardi Тканевой Угри Жабры, кожа, почки, желчный и мочевой пузыри При сильном заражении почек развива- ется водянка, н наступает массовая смертность. Повреждения кожи сни- жают покупательную способность
Myxidium macrocapsu- lare Полостной Карповые Желчный пузырь, пече- ночные протоки Растяжение стенок протоков без соеди- нительно-тканных реакций
Myxidium minteri » Лососевые Почечные канальцы и желчный пузырь Дегенерация почечных канальцев
Myxidium rhodei Тканевой Карповые Почки (боуменовы кап- сулы) Разрушение боуменовых капсул и маль- пигиевых клубочков. Патогенность невысока
Myxidium truttae Полостной Лососевые, сиговые Желчный пузырь Воспаление печеночных протоков и омертвение печеночных тканей
Myxidium incurvatum » Разнообразные морские рыбы » » Закупорка печеночных протоков
Myxidium sphaericum » Морские рыбы » » Гипертрофия пузыря и полное прекра- щение его функций
Zschokkella nova » Карповые » » Желчные протоки раздуты, могут атро- фироваться
Zschokkella russelli » Mustelus mustelus, Gaid- ropsarus mediterraneus Желчный пузырь, пече- ночные протоки Разрастание и истончение печеночных протоков
Triangula percae Тканевой Perea fluviatilis в Авст- ралии Мозг Искривление тела
Leptotheca informe Полостной Mola mola Желчный пузырь Дегенерация желчного пузыря
Ceratomyxa shasta Тканевой Лососевые Стенки кишечного трак- та и другие органы Высокая смертность в аквакультуре и в естественных популяциях
Sphaerospora angulata Полостной Амурский сазан, караси Мочевые канальцы Закупорка мочевых канальцев
Sphaerospora cyprini » То же Мочевые канальцы, мо- четочники, мочевой пузырь То же
Sphaerospora renicola » Карп Мочевые канальцы Сильное заражение резко снижает функ- ции почек, смертность
Sphaerospora tincae Тканевой Линь Почки Замещение паренхимы органа массой стадий развития и спор, гибель
Sphaerospora pectinacea Полостной Окунь Мочевые канальцы Сильное заражение вызывает гистопато- логические изменения в почках и гибель
Sphaerospora truttae » Форель Мочевые канальцы и боуменовы капсулы Гипертрофия почечных клубочков и ат- рофия эпителия мочевых канальцев
Sphaerospora ictaluri Тканевой Ictalurus punctatus Жабры и другие органы Воспаление жабр
Sphaerospora molnari » Карп Жабры Воспаление, замещение жаберной тка- ни, ее разрушение и гибель молоди
Sphaerospora testicularis Полостной Dicentrarchus labrax Семявыносящие про- токи Значительно снижает плодовитость сам- цов
Hoferellus cyprini » Карп Мочевые канальцы, мочеточники Разрушение эпителиальных клеток, атрофия эпителия
Hoferellus carassii » Серебряный карась Мочевые канальцы Массовая гибель в результате гиперпла- зии почек
ТИП MYXOZOA
1065
Таблица 4 (продолжение)
Вид Тип пара- зитирования Хозяин Орган Воздействие
Chloromyxum coregoni Полостной Сиговые Желчный пузырь Гипертрофия желчного пузыря
Chloromyxum truttae » Форель, радужная форель, лосось » » Нарушение функции желчного пузыря, печени и кишечника, гибель
Neomyxobolus ophiocep- hali » Змееголов Мочевые канальцы Растяжение мочевых канальцев скопле- ниями плазмодиев
Myxobolus pavlovskii Тканевой Толстолобик, пестрый толстолобик Жабры Разрушение жаберного эпителия, гибель молоди
Myxobolus ellipsoides » Карповые Практически во всех органах и тканях У голавля вызывает повреждения скелета
Myxobolus dispar » Карп Жабры и другие органы и ткани Разрушение жаберных лепестков
Myxobolus exiguus = M. episquamalis » Карповые и Mugil Жабры и другие ткани То же
Myxobolus carassii » Серебряный карась Почки и мускулатура Образование горба спереди от спинно- го плавника, убытки в хозяйствах Китая
Myxobolus lintoni » Cyprinodon variegatus Мускулатура Формирует язвоподобные образования в подкожной мускулатуре
Myxobolus sandrae » Судак, окунь, ерш Жабры и другие органы и ткани Деформация скелета, снижает покупа- тельную способность
Myxobolus notemegoni » Notemigonus crysoleucas Подкожная соедини- тельная ткань Ерошение чешуи, снижение покупатель- ной способности
Myxobolus vanivilasae » Cirrhina mrigala То же То же
Myxobolus drjagini » Толстолобик Подкожная соединитель- ная ткань, центральная нервная система Беспорядочное движение, массовая гибель карпа в Китае
Myxobolus cephalis » Лобан Мозг, жабры и другие ткани Массовая гибель рыб во Флориде
Myxobolus buri » Seriola quinqueradiata Мозг Сколиоз в аквакультуре в Японии
Myxobolus aeglefini » Морские рыбы Хрящевая ткань, кости головы, глаза Атрофия и лизис хряща
Myxobolus pfeifferi » Усач Мышцы Перерождение мышц, опухоли, массо- вая гибель
Myxobolus talievi » Байкальская широко- лобка Дно и края глазной впадины Пучеглазие, полная слепота
Myxosoma cerebralis » Лососевые Хрящевая ткань Возбудитель вертежа, массовая гибель
Henneguya psorosper- mica » Щука, окунь, судак Жабры Деформация и слипание жаберных лепе- стков, гибель рыб при недостатке кис- лорода
Henneguya exilis » Ictalurus punctatus » Повышенная чувствительность к стрес- совым факторам, гибель
Henneguya shaharini » Oxyelotris marmoratus » Слипание лепестков, повышенная чувствительность к стрессовым факторам, гибель
Henneguya cutanea Тканевой Карповые Кожа, мышцы Сильно зараженные рыбы гибнут
Henneguya zschokkei » Сиговые, лососевые Мышцы Снижает покупательную способность
Henneguya cerebralis » Сибирский и монголь- ский хариусы Хрящевая ткань Повреждение хряща, деформация головы
Henneguya oviperda » Щука, окунь Яичники Снижает плодовитость
Thelohanellus pyriformis » Карповые, сиговые Жабры, мышцы, другие ткани и органы Образование больших цист в мышцах, гибель
Thelohanellus fuhrmanni » Карповые Жабры, мышцы Большие цисты в мышцах
Thelohanellus nikolskii » Карп Плавники Ампутация плавников
Thelohanellus kitauei » » Стенка кишечника Закрывают просвет кишечника, атрофия некоторых органов, гибель
Trilospora muscularis » Molva dipterigia Мышцы Зараженные мышечные волокна дегене- рируют
Unicapsula muscularis » Hippoglossus stenolepis » Зараженные мышечные волокна белые, напоминают червей, снижает покупа- тельную способность
Unicapsula seriolae » Seriola lalandi » При нагревании мясо превращается в дурно пахнущую пасту
Kudoa quadratum » Морские рыбы » Посмертное разжижение мускулатуры
Kudoa thyrsitis » » » » То же
Kudoa paniformis » » » » » »
1066
ТИП MYXOZOA
Таблица 4 (продолжение)
Вид Тип пара- зитирования Хозяин Орган Воздействие
Kudoa musculoliquefaci- ens Kudoa clupeidae Kudoa amamiensis Hexacapsula neothunni Тканевой » » - • » Морские рыбы Сельди Морские рыбы Neothunnus macropterus Мышцы » » » Посмертное разжижение мускулатуры Смертность Рыба теряет коммерческое значение Посмертное разжижение мускулатуры
Примечание. При составлении таблицы использованы данные из Шульмана и др. (1997), из Лома и Дыковой (Lom, Dykova, 1992).
Сравнительно недавно появились сообщения об обна-
ружении спор миксоспоридий в анализах стула чело-
века. Первое сообщение (McCleland et al., 1997) касает-
ся обнаружения спор Henneguya salminicola у пациен-
та с выраженными признаками диареи. При этом
споры этого вида были ошибочно приняты за сперма-
тозоиды. Во втором случае были обнаружены споры
Myxobolus plectroplites. который обычно встречается у
пресноводной рыбы Plectroplites ambiguus в Австра-
лии (Boreham et al., 1998). Наконец, были обнаружены
споры рода Myxobolus у двух ВИЧ инфецированных
пациентов в Колумбии (Moncada et al., 2001). По всей
вероятности, споры миксоспоридий попали в организм
пациента при питании зараженной рыбой.
Класс Myxosporea Biitschli, 1881 — Миксоспоридии
Систематическая часть
Паразиты пойкилотермных позвоночных, для кото-
рых характерно образование миксоспороидных спор
с жесткими створками. По крайней мере некоторые ви-
ды имеют в своем жизненном цикле дополнительного
хозяина. На настоящее время он представлен олиго-
хетами и полихетами, развитие в которых заканчивается
формированием актиноспороидных спор, обладающих
трирадиальной симметрией. Вегетативные стадии —
небольшие псевдоплазмодии или многоядерные плаз-
модии. Мейоз, гаметогония и формирование зиготы
приурочены к актиноспороидной части цикла, тогда
как все стадии миксоспоридной его части диплоидны.
Формирование полярных капсул обычно включает об-
разование выстреливающихся полярных нитей.
Характеристика таксонов приводится в основном
по Шульману с соавт. (1997), а также Лому и Дыковой
(Lom, Dykova, 1992).
Отряд Bivalvulida Schulman, 1959
Myxosporea с двустворчатыми спорами, содержа-
щими 1—2 или 4 полярные капсулы и обычно 1—2
амебоидных зародыша. Вегетативные формы разнооб-
разные. Преимущественно полостные или тканевые
паразиты костистых рыб (морских, пресноводных),
реже других рыб и водных позвоночных. Лишь два
вида паразитируют в трематодах из морских рыб. Со-
держит 4 подотряда, из которых 1 (Sphaeromyxina)
имеет примитивно устроенные споры.
Подотряд Sphaeromyxina Lom, Noble, 1984
Споры с примитивными полярными капсулами,
толстые нити которых не образуют правильных вит-
ков, перпендикулярных к продольной оси полярных
капсул или находящихся под определенным углом
к ней. Они не имеют правильного расположения внут-
ри полярных капсул, лишь в редких случаях уложе-
ны спирально в направлении продольной оси споры.
Иодофильная вакуоль отсутствует. Вегетативные фор-
мы — гигантские (до 11 мм) дисковидные многоспо-
ровые плазмодии. Паразиты желчного пузыря морских
рыб. Содержит два семейства.
Сем. Sphaeromyxidae Lom, Noble,
1984
Споры веретеновидной или булавовидной формы,
сильно вытянутые в продольном направлении, с одной
или двумя полярными капсулами, расположенными
вдоль продольной оси спор и открывающимися на ее
полюсах. Содержит два рода.
Род Sphaeromyxa Thelohan, 1882
(рис. 428, 7)
Споры веретеновидные, с притупленными кон-
цами и двумя полярными капсулами, расположенны-
ми на противоположных полюсах. Содержит около
30 видов.
РОД Auerbachia Meglitsch, 1986
(рис. 428, 2)
Споры неправильной булавовидной формы с су-
женным задним полюсом и расширенным передним,
на котором располагается единственная крупная по-
лярная капсула. Стенки створок сравнительно тонкие.
Шовная линия извилистая, благодаря чему створки не-
одинаковые. Содержит 2 вида.
ТИП MYXOZOA. КЛАСС MYXOSPOREA
1067
Сем. Meglitschiidae Kovaljova, 1988
Споры асимметричные, дуговидно изогнутые, силь-
но вытянутые в направлении, перпендикулярном шву,
их толщина превышает длину, в связи с чем она напо-
минает представителей рода Ceratomyxa. Створки не-
равные и неодинаковой формы. Две неравные поляр-
ные капсулы открываются у переднего края споры в
специальных выступах каждой створки по разные сто-
роны шва. Шов образует хорошо заметный шовный ва-
лик. Выступ большей полярной капсулы образует пе-
редний полюс споры. Содержит один род. Паразиты
желчного пузыря морских рыб.
Род Meglitschia Kovaljova, 1988
(рис. 428, 3)
Сохраняет признаки семейства. Содержит один вид.
Подотряд Bipolarina Tripathi, 1949
Споры более усовершенствованы, с менее грубы-
ми, чем у Sphaeromyxa, створками, с относительно тон-
кими полярными нитями, скрученными вокруг своей
оси и поэтому образующими спирально свернутые
петли, которые лежат под определенным углом (ино-
гда прямым) к продольной оси полярных капсул. Спо-
ры преимущественно радиально-симметричные, или
несколько уклоняются в сторону двубоковой или вин-
товой симметрии, или, наконец, совсем дисимметрич-
ны. Обычно веретеновидные или эллипсоидные, или
сферические и пирамидальные. Полярные капсулы от-
крываются на противоположных полюсах или сторо-
нах споры, лишь в редких случаях передние полюса
полярных капсул сближены. Они располагаются или
одновременно в плоскостях шва и перпендикулярной
ей, или вне плоскости шва, или у небольшого числа
(сем. Ortholineidae) только в плоскости шва. У пред-
ставителей рода Coccomyxa имеет место редукция од-
ной полярной капсулы. У предствителей исключитель-
но пресноводного сем. Neomyxobolidae в амебоидном
зародыше имеется йодофильная вакуоль. Преимуще-
ственно паразиты полостей желчного и мочевого пу-
зырей, реже мочеточников и мочевых канальцев мор-
ских и пресноводных костистых рыб. У отдельных ви-
дов рода Myxidium наблюдается переход к тканевому
паразитизму, где их вегетативные формы имеют вид
цист. Включает 6 семейств.
Сем. Myxidiidae Thelohan, 1892
Споры веретеновидной (реже эллипсоидной) фор-
мы, иногда сильно изогнутые. Полярные капсулы рас-
полагаются на противоположных полюсах споры; от-
крываются на полюсах споры или на некотором рас-
стоянии от них. Имеются формы с одной полярной
капсулой (род Coccomyxa). Амебоидный зародыш
обычно расположен между полярными капсулами.
Лишь у незначительного числа видов, у которых зад-
ние расширенные полюса полярных капсул сближены,
амебоидный зародыш сдвинут в сторону. Йодофиль-
ная вакуоль отсутствует. Вегетативные формы —
плазмодии — иногда очень крупные. У небольшого
числа видов отмечено паразитирование в тканях, в
этом случае вегетативные формы имеют вид цист. Па-
разиты желчного и мочевого пузырей, мочеточников и
мочевых канальцев морских и пресноводных кости-
стых и хрящевых рыб, амфибий и водных рептилий.
Содержит 3 рода.
Род Myxidium Biitschli, 1882 (рис. 428, 4)
Споры веретеновидной или близкой к ней формы,
иногда изогнуты в виде полумесяца или спирально
S-образно. Грушевидные (реже сферические) поляр-
ные капсулы расположены на разных полюсах споры
и открываются на них. Амебоидный зародыш располо-
жен между полярными капсулами и только в редких
случаях, когда полярные капсулы сильно сближены,
он находится сбоку от них. Вегетативные формы в по-
давляющем большинстве — плазмодии, у небольшого
числа видов — «цисты». Паразиты желчного и мочево-
го пузырей, мочеточников и мочевых канальцев кости-
стых, реже хрящевых морских и пресноводных рыб, а
также амфибий и водных рептилий. Небольшое число
видов паразитирует в тканях пресноводных рыб. Со-
держит более 110 видов.
Род Coccomyxa Leger, Hesse, 1907
(рис. 428, 5)
Споры овальной, яйцевидной, булавовидной, воз-
можно веретеновидной формы, содержащие только
1 полярную капсулу, которая открывается на одном из
их полюсов. Вегетативные формы — плазмодии. Пара-
зиты желчного пузыря морских костистых рыб. Содер-
жит 3 вида.
Род Zschokkella Auerbach, 1910
(рис. 428, 6)
Споры эллипсоидной, или овальной, или близкой
к ним формы, в большей или меньшей степени вы-
тянутые в продольном направлении, часто более или
менее изогнутые. Шовная линия обычно изогнутая.
Две полярные капсулы шаровидной или приближаю-
щейся к ней формы расположены на противопо-
ложных полюсах споры, однако открываются на оп-
ределенном расстоянии от них вблизи от шовной ли-
нии. Вегетативные формы — плазмодии. Паразиты
желчного и мочевого пузырей морских й пресновод-
ных костистых рыб и амфибий. Содержит около 50 ви-
дов.
Сем. Neomyxobilidae Schulman, 1962
Состав семейства по Чену и Ma (Chen, Ма, 1998).
Споры, близкие к треугольной или овальной фор-
ме, с двумя почти сферическими полярными капсу-
1068
ТИП MYXOZOA
Рис. 428. Споры родов миксоспоридий и групп актиномиксидий.
I — Sphaeromyxa, 2—Auerbachia, 3— Meglitschia,4— Myxidium, 5 — Соссотуха, 6—Zschokkella, 7 — Neomyxobolus, 8— Cardimyxobolus, 9— Triangula,
10 — Sinuolinea, 11 — Davisia, 12 — Ortholinea, 13 — Paraortholinea, 14 — Myxoproteus, 15 — Schulmania, 16 — Noblea, 17 — Bipteria, 18 — Neobipteria,
19 — Palliatus, 20 — Leptotheca, 21 — Ceratomyxa, 22 — Parvicapsula, 23 —Neoparvicapsula, 24 — Sphaerospora, 25— Globospora, 26— Wardia,27 — Chlo-
romyxum, 28 — Caudomyxum, 29 — Polysporoplasma, 30 — Alataspora, 31 — Pseudalataspora, 32 — Fabespora, 33 — Podospora, 34 — Myxobilatus, 35 — Ho-
ferellus, 36 — Myxobolus, 37 — Spirosuturia, 38 — Unicauda, 39 — Dicauda, 40 — Neohenneguya, 41 — Henneguya, 42 — Phlogospora, 43 — Tetrauronema,
44 — Trigonosporous, 45 — Thelohanellus, 46 — Neothelohanellus, 47 — Laterocaudata, 48 — Hennegoides, 49 — Myxosoma, 50 — Agarella, 51 — Trilospora,
52 — Unicapsula, 53 — Tetractinomyxon, 54 — Octospina, 55 — Kudoa, 56—Pentacapsula, 57 — Hexacapsula, 58 — Septemcapsula, 59 — Tetracapsula. Споры
актиномиксидий: 60 — Sphaeroactinomyxon, 61 — Triactinomyxon, 62 — Hexaciinomyxon, 63 — Neoactinomyxon, 64 — Aurantiactinomyxon, 65 — Raabeia,
66 — Echinactinomyxon, Ormieractinomyxon, 67 — Guyenotia, 68 — Synactinomyxon, 69 — Siedleckiella, 70 — Antonactinomyxon.
Fig. 428. Spores of the myxosporean genera and actinomyxidian groups.
ТИП MYXOZOA. КЛАСС MYXOSPOREA
1069
Рис. 428 {продолжение).
1070
ТИП MYXOZOA
Рис. 428 (продолжение).
ТИП MYXOZOA. КЛАСС MYXOSPOREA
1071
лами, расположенными на разных концах споры; от-
крываются на некотором расстоянии от ее полюсов.
Шовная линия прямая. Амебоидный зародыш с йодо-
фильной вакуолью. Вегетативные формы — плазмо-
дии. Паразиты мочевого пузыря, мочеточников и мо-
чевых канальцев, жабр и разных тканей пресноводных
костистых рыб. Содержит 3 рода.
Род Neomyxobolus Chen, Hsieh, 1960
(рис. 428, 7)
Споры, близкие к треугольной форме в плоскости
шва и овальные в плоскости, перпендикулярной плос-
кости шва. Имеются три ребрышка в плоскости, пер-
пендикулярной плоскости шва. Паразиты мочевого пу-
зыря, мочеточников и мочевых канальцев, пресновод-
ных костистых рыб. Содержит 3 вида.
Род Cardimyxobolus Ма, Dong, Wang,
1982 (рис. 428, 8)
Споры, близкие к треугольной или овальной фор-
ме, иногда сердцевидные, в плоскости шва и веретено-
видные в плоскости перпендикулярной плоскости
шва. Ребрышек нет. Паразиты жабр пресноводных ко-
стистых рыб. Содержит 2 вида.
Род Triangula Chen, Hsieh, 1984
(рис. 428, 9)
Споры треугольной с сильно закругленными вер-
шинами формы, с расширенной передней частью и
уплощенные в плоскости шва. На переднем полюсе
две округлые полярные капсулы, открывающиеся на
значительном расстоянии от переднего полюса, иногда
в разные стороны. Иодофильная вакуоль имеется. Тка-
невые паразиты пресноводных рыб. Род содержит
2 вида.
Сем. Sinuolineidae Schulman, 1959
Споры сферической или близкой к ней формы с бо-
лее или менее извилистой шовной линией. Створки
могут иметь латеральные отростки. 2 полярные капсу-
лы сферической или близкой к ней формы расположе-
ны на противоположных концах споры или несколько
сдвинуты в ту или иную сторону и открываются вбли-
зи или в некотором отдалении от шва. Вегетативные
формы в виде мелких (реже крупных) плазмодиев. Па-
разиты мочевого пузыря, мочеточников, или мочевых
канальцев морских костистых рыб, заметно реже —
желчного пузыря. Содержит 2 рода.
Род Sinuolinea Davis, 1917 (рис. 428, 10)
Сферические или близкой к ним формы споры с из-
вилистой шовной линией лишены латеральных отро-
стков. Сферические или несколько иной формы поляр-
ные капсулы открываются на противоположных полю-
сах споры в том или ином отдалении от шва или сдви-
нуты в сторону одного из ее полюсов. Вегетативные
формы — мелкие плазмодии. Паразиты мочевого пу-
зыря, мочеточников, мочевых канальцев, реже желч-
ного пузыря морских костистых рыб. Содержит более
10 видов.
Род Davisia Laird, 1953 (рис. 428, 11)
(= Sinuolinea Davis, .1917 part.)
Споры округлой или близкой к ней формы, снабже-
ны латеральными отростками, идущими от каждой из
двух створок. Шовная линия между створками прямая
или изогнутая. Полярные капсулы сферические, сдвину-
тые в одну половину полости споры. Открываются в
разные стороны. Вегетативные формы — плазмодии.
Паразиты мочевого пузыря, мочеточников и мочевых
канальцев морских костистых рыб. Содержит около
20 видов.
Сем. Ortholineidae Lom, Noble,
1984
Споры шаровидной, грушевидной или близкой к
ним формы, слегка сплюснутые в направлении, пер-
пендикулярном плоскости шва, с прямой шовной ли-
нией. Створки лишены латеральных отростков или
имеют их. Сферические, реже грушевидные полярные
капсулы в той или иной степени сдвинуты к переднему
полюсу, расположены в плоскости шва и открываются
на расстоянии друг от друга, в большинстве случаев в
разные стороны. Вегетативные формы —- плазмодии.
Паразиты мочевого пузыря, мочеточников или моче-
вых канальцев почек костистых морских рыб. Включа-
ет 2 рода.
Род Ortholinea Schulman, 1962
(рис. 428, 12)
Споры округлой, овальной или близкой к ним фор-
мы с гладкими или исчерченными створками, лишен-
ными латеральных отростков. Паразиты мочевого пу-
зыря, мочеточников и мочевых канальцев морских ко-
стистых рыб. Содержит около 10 видов.
Род Paraortholinea Kovaljova in Schulman
et aL, 1997 (рис. 428, 13)
(= Ortholinea Schulman, 1962 part.)
Споры грушевидной, пирамидальной (возможно,
овальной) формы с прямой шовной линией и с лате-
ральными отростками на каждой створке. Сфериче-
ские полярные капсулы, расположенные в плоскости
шва в передней части споры, открываются в разные
стороны. Паразиты мочевых канальцев, мочеточни-
ков, возможно .мочевого пузыря морских костистых
рыб. Пока известен лишь 1 представитель рода.
1072
ТИП MYXOZOA
Сем. Myxoproteidae Meglitsch, 1960
(= Myxoproteidae Kovaljova, Zubtschenko,
Krasin, 1983)
Споры пирамидальной или приближающейся к
ней формы с расширенным в той или иной степени
уплощенным передним и суженным задним полюса-
ми. У зрелых спор стенки створок и полярных капсул
утолщены, в них могут сохраняться капсулогенные и
вальвогенные ядра или их остатки. Поверхность ство-
рок гладкая или на них вдоль шва, или на вершинах
имеются килевидные выросты, или крыловидные мем-
браны, или утолщения. Шовная линия прямая или
изогнутая. Относительно крупные сферические поляр-
ные капсулы лежат в плоскости, перпендикулярной
шву или находящейся под некоторым углом к ней, и
часто открываются на противоположные стороны. Ве-
гетативные стадии — плазмодии. Паразиты мочевого
пузыря, мочеточников и мочевых канальцев, реже
желчного пузыря морских костистых рыб. В состав се-
мейства входят пять родов.
Род Myxoproteus Doflein, 1890
(рис. 428, 14)
(= Conispora Sankurathri, 1977;
Paramyxoproteus Wierzbicka, 1986)
Споры характерной для семейства пирамидальной
или приближающейся к ней (яйцевидной, грушевид-
ной) формы, с расширенным передним и суженным
задним полюсами. Килевидные выросты, крыловид-
ные мембраны или утолщения на переднем полюсе от-
сутствуют. Вегетативные стадии — плазмодии. Пара-
зиты мочевого пузыря, мочеточников, мочевых ка-
нальцев, реже желчного пузыря морских костистых
рыб. Содержит около 20 видов.
Род Schulmania Kovaljova, Zubtschenko,
Krasin, 1983 (рис. 428, 15)
Споры пирамидальной или приближающейся к ней
формы. Шов прямой или извилистый. Створки снаб-
жены продольно расположенными килевидными обра-
зованиями, обычно двух типов: боковыми, идущими
через вершины створок, и шовными, которые располо-
жены вдоль шва. В некоторых случаях или шовные
(Sch. simplicificatd), или боковые (Sch. cornutus) кили
могут отсутствовать. Шовный киль — двойной: состо-
ит из килей, образуемых каждой створкой. Толсто-
стенные сферические полярные капсулы расположены
в передней части споры и открываются в противопо-
ложные стороны. Вегетативные формы — плазмодии.
Паразиты мочевого пузыря морских костистых рыб.
Содержит около 10 видов.
Род Noblea Kovaljova, 1988 (рис. 428, 16)
Споры овальные или яйцевидные с расширенным
передним и суженным задним полюсами. Створки
снабжены продольными килевидными образованиями,
идущими вдоль изогнутого шва, и утолщениями,
расположенными на передней части створок в области
полярных капсул. Эти утолщения в виде двух уплот-
ненных крышечек своей наиболее широкой и толстой
частью прикрывают полярные капсулы и постепенно
сужаясь и утончаясь, спускаются дорсально вдоль спо-
ры до уровня ее первой трети. Как и у представителей
рода Schulmania шовный киль образован общими
створками. Сферические полярные капсулы лежат в
плоскости, перпендикулярной шву, и открываются в
разные стороны на значительном расстоянии от шва.
Вегетативные формы — плазмодии. Паразиты мочево-
го пузыря морских рыб. Пока известен только 1 пред-
ставитель этого рода.
Род Bipteria Kovaljova, Zubtschenko,
Krasin, 1983 (рис. 428, 17)
Споры широкой пирамидальной формы с за-
кругленными полюсами или уплощенным передним,
и в той или иной степени сужающимся задним полю-
сом. К передней поверхности каждой створки прик-
реплены широкие и длинные крыловидные мембраны,
в той или иной степени прикрывающие спору; в них
обычно располагаются вальвогенные ядра или их
остатки. Шовная линия обычно изогнутая. Полярные
капсулы сферические, размещаются ближе к перед-
нему полюсу и открываются в разные стороны споры.
Вегетативные формы — плазмодии. Паразиты мочево-
го пузыря, мочевых канальцев, почек, реже желчного
пузыря морских костистых рыб. Содержит 5 видов,
Род Neobipteria Kovaljova, Krasin,
Gajevskaja, 1985 (рис. 428, 18)
Споры широкой пирамидальной формы с расши-
ренным и уплощенным передним и несколько сужаю-
щимся задним полюсами. Передняя поверхность каж-
дой створки снабжена широкими крыловидными мем-
бранами, в которых могут сохраняться вальвогенные
ядра. Кроме того, каждая створка снабжена медиальным
килем, идущим вдоль слабо изогнутого шва. Этот шов-
ный киль — производное обеих створок. Толстостен-
ные сферические полярные капсулы размешены ближе
к переднему полюсу споры, открываются в противопо-
ложные стороны. Паразиты мочевого пузыря морских
костистых рыб. Пока известен только 1 вид.
Сем. Palliatidae Schulman, Kovaljova
in Schulman et al., 1997
Bipolarina co спорами сферической или близкой к
ней формой, снабженные широкой и тонкой прозрач-
ной мантией. Крупные полярные капсулы сфериче-
ской или грушевидной формы открываются в разные
стороны на некотором расстоянии от шва и друг от
друга.17 Вегетативные формы — длинные нитевидные
17 При первоописании рода его ошибочно отнесли к сем. Spha-
erosporidae.
ТИП MYXOZOA. КЛАСС MYXOSPOREA
1073
плазмодии с утолщением на одном конце. Плазмодии
часто образуют массовые скопления, переплетаясь
друг с другом. Паразиты желчного пузыря морских
костистых рыб. Содержат 1 род.
Род Palliatus Schulman, Kovaljova,
Dubina, 1979 (рис. 428, 19)
Сохраняет все признаки семейства. Плазмодии дву-
споровые. Содержит 3 вида.
Подотряд Eurysporina Kudo, 1919;
emend. Schulman, 1959
Споры разнообразной формы, с полярными кап-
сулами, лежащими в плоскости, перпендикулярной
плоскости шва, изредка с небольшими отступлениями.
Две или четыре (реже 1) полярные капсулы открыва-
ются обычно на одном полюсе споры, заметно реже на
противоположных полюсах. У 4 капсульных спор одна
пара спор может располагаться и в плоскости шва. Ве-
гетативные формы — плазмодии, очень редко круп-
ные, видимые невооруженным глазом. У небольшого
числа видов вегетативные стадии имеют форму цист.
Паразиты желчного и мочевого пузырей, мочеточни-
ков и мочевых канальцев морских и пресноводных
костистых и. хрящевых рыб, за исключением неболь-
шого числа видов, паразитирующих в тканях. Не-
сколько видов — паразиты амфибий и водных репти-
лий, миног и миксин, а два вида паразитируют в трема-
тодах морских костистых рыб. Содержит 6 семейств.
Сем. Ceratomyxidae Doflein, 1899
Споры более широкие в плоскости, перпендику-
лярной шву, чем в плоскости шва. Две округлые или
грушевидные полярные капсулы лежат в плоскости,
перпендикулярной шву; обычно открываются на од-
ном полюсе споры рядом друг с другом, иногда на
некотором расстоянии от переднего полюса и друг от
друга, а в отдельных случаях на противоположных
сторонах споры. Иодофильная вакуоль в амебоидном
зародыше отсутствует. Вегетативные формы — не-
большие плазмодии, обычно с небольшим числом спор.
Паразиты желчного и мочевого пузырей, мочеточни-
ков и мочевых канальцев морских и пресноводных ко-
стистых и отчасти хрящевых рыб, реже у миксин, ам-
фибий и водных рептилий. Только один вид паразити-
рует в тканях. Содержит два рода.
Род Leptotheca Thelohan, 1892
(рис. 428, 20)
Споры овальной или бобовидной формы с толщи-
ной, менее чем в два раза превышающей длину и шири-
ну. Створки спор с несколько оттянутыми и закруглен-
ными, реже заостренными вершинами, которые иногда
снабжены различными придатками. Паразиты желчно-
го и мочевого пузырей, мочеточников и мочевых ка-
нальцев морских, реже пресноводных костистых рыб.
Небольшое число видов встречается у миксин, хряще-
вых рыб и амфибий. Содержит около 40 видов.
Род Ceratomyxa Thelohan, 1892
(рис. 428, 21)
Споры сильно вытянуты в направлении, перпенди-
кулярном шву, их толщина более чем в два раза превы-
шает длину. Створки имеют вид двух полых конусов,
соединенных своими основаниями, или отступают от
этой формы. Их суженные вершины закруглены или
заострены, а в некоторых случаях заканчиваются отро-
стками или длинными нитями. Створки часто изогну-
ты назад, реже в сторону, в результате чего споры при-
обретают форму полумесяца. Паразиты желчного,
реже мочевого пузыря и мочеточников морских кости-
стых и хрящевых рыб, единичные виды — у миксин и
амфибий, лишь два вида паразитируют у пресновод-
ных рыб, причем один из них — в тканях. Содержит
около 130 видов.
Сем. Parvicapsulidae Schulman,
1953
Споры неправильной формы, удлиненные в про-
дольном направлении, с тонкостенными асимметрич-
ными створками, одна из которых обычно имеет от-
росток. Шовная линия обычно извилистая. Две или
четыре полярные капсулы очень малых размеров, рас-
полагаются на переднем полюсе в плоскости, перпен-
дикулярной шву, или несколько в стороне от нее
вследствие изогнутости как самих створок, так и всей
споры в целом. Поскольку капсулогенные клетки час-
то сохраняются, возникает впечатление, что полярные
капсулы лежат в пространстве, отделенном от полости
споры. Вегетативные формы — небольшие, непра-
вильной формы, иногда ветвистые, дву- или тетраспо-
ровые плазмодии. Паразиты преимущественно моче-
вого, реже желчного пузырей Морских костистых рыб.
Содержит 2 рода.
Род Parvicapsula Schulman, 1953
(рис. 428, 22)
Споры асимметричные, вытянутые в направлении
шва. Только один вид имеет ширину больше длины.
Две полярные капсулы грушевидной или шаровидной
формы расположены на переднем полюсе. Плазмодии
двуспоровые. Паразиты мочевого пузыря (реже желч-
ный) морских (реже проходные) костистых рыб. Со-
держит пять видов.
Род Neoparvicapsula Gajevskaja, Kovaljova,
Schulman, 1982 (рис. 428, 23)
Споры вытянутые в продольном направлении,
асимметричные, с изогнутой шовной линией. Четыре
полярные капсулы расположены на переднем полюсе в
68 Зак. №4163
1074
ТИП MYXOZOA
сохранившихся капсулогенных клетках. Плазмодии
дву- или тетраспоровые. Паразиты мочевого пузыря
морских костистых рыб. Содержит два вида.
Сем. Sphaerosporidae Davis, 1917
Споры сферической или близкой к ней формы. Две
или четыре полярные капсулы расположены на одном
полюсе споры, в плоскости, перпендикулярной плос-
кости шва. При наличии 4 полярных капсул одна пара
может располагаться и в плоскости шва. Вегетативные
формы большей частью в виде мелких плазмодиев,
реже в виде цист. Паразиты желчного и мочевого
пузырей, мочеточников и мочевых канальцев мор-
ских и пресноводных костистых рыб, морских хряще-
вых рыб, миног и амфибий. Несколько видов парази-
тируют в тканях пресноводных рыб. Содержит 5 ро-
дов.
Род Sphaerospora Thelohan, 1892
(рис. 428, 24)
Споры сферической или близкой к ней формы, две
полярные капсулы расположены на одном из полюсов
в плоскости, перпендикулярной плоскости шва. Шов-
ный валик слабо выражен и выступает в виде киля. На
заднем полюсе спор иногда имеются зубчики или ни-
тевидные отростки. Вегетативные формы большей
частью в виде небольших плазмодиев с варьирующим
числом продуцируемых спор (одно- или двуспоровые),
реже в виде цист. Споры обычно содержат два одно-
ядерных амебоидных зародыша. Паразиты желчного и
мочевого пузырей, мочеточников, мочевых канальцев,
реже тканей морских и пресноводных костистых рыб и
миног. Содержит около 50 видов.
Род Globospora Lom, Noble, Laird, 1975
(рис. 428, 25)
Споры сферические, с неравными створками, сое-
диненными прямым швом. Единственная грушевидная
полярная капсула открывается на некотором расстоя-
нии от шва. Вегетативные стадии — плазмодии. Пара-
зиты желчного пузыря морских костистых рыб. Содер-
жит один вид.
Род Wardia Kudo, 1919
(рис. 428, 26)
Споры сплющены в направлении плоскости шва,
благодаря чему они приобретают овальную форму при
рассмотрении в плоскости шва и трехгранную форму с
закругленными углами в плоскости, перпендикуляр-
ной шву. Полярные капсулы сферические или груше-
видные, расположены в средней части споры в плоско-
сти, перпендикулярной шву, и открываются не вблизи
шва, а на вершине створок. На уплощенном заднем по-
люсе споры часто бывает несколько коротких отрост-
ков, похожих на бахрому, которые являются продол-
жением тонких ребрышек на поверхности створок. Ве-
гетативные формы — цисты. Паразиты тканей пресно-
водных костистых рыб. Содержит 3 вида.
Род Chloromyxum Mingazzini, 1890
(рис. 428, 27)
Споры сферической или близкой к ней формы, с
4 полярными капсулами, расположенными на одном
полюсе. Полярные капсулы могут располагаться двоя-
ким образом: или одна пара в плоскости шва, а другая
в перпендикулярной ей плоскости, или обе пары вне
плоскости шва. Иногда одна пара полярных капсул,
расположенных по диагонали, больше другой. Поверх-
ность створок гладкая или исчерченная, или с ребрыш-
ками. Иногда на заднем полюсе споры имеются ните-
видные отростки. Вегетативные формы — различной
величины плазмодии с различным количеством спор,
реже цисты. Споры содержат один двухъядерный аме-
боидный зародыш, но встречаются и два одноядерных
зародыша в одной споре. Паразиты желчного и моче-
вого пузырей, мочеточников и мочевых канальцев,
реже тканей пресноводных и морских рыб, а также ам-
фибий. Содержит около 100 видов.
Род Caudomyxum Bauer, 1948
(рис. 428, 28)
Шаровидные споры с 4 полярными капсулами на
переднем полюсе и с 1 или 2 хвостовыми отростками
на заднем. Вегетативные формы — плазмодии и цис-
ты. Паразиты тканей пресноводных рыб и желчного
пузыря амфибий. Содержит два вида.
Род Polysporoplasma Sitja-Bobadilla,
Alvarez-Pellitero, 1995 (рис. 428, 29)
Споры сферической или близкой к ней формы.
Створки утолщенные, с несколькими тонкими реб-
рышками на заднем конце, идущими перпендикулярно
плоскости шва. Каждая створка на заднем конце имеет
дисковидное утолщение. Полярные капсулы сфери-
ческой или близкой к ней формы. В спорах от 4 до
12 амебоидных зародышей, что является исключени-
ем среди всех миксоспоридий. Плазмодии содержат
2 споры. Паразиты мочевых канальцев почек морских
рыб. Содержит два вида.
Сем. Alatasporidae Schulman, Kovaljova,
Dubina, 1979
Споры, сильно уплощенные в плоскости шва, тре-
угольные при рассматривании в плоскости, перпен-
дикулярной шву. Створки на вершинах снабжены ши-
рокими и длинными крыловидными отростками (оди-
нарными или раздвоенными), благодаря чему споры
напоминают крылатку клена. Очень маленькие поляр-
ные капсулы, лежащие в плоскости, перпендикуляр-
ной плоскости шва, открываются ближе к переднему
ТИП MYXOZOA. КЛАСС MYXOSPOREA
1075
полюсу, недалеко от шва. Амебоидный зародыш зани-
мает заднюю часть полости споры и лишен иодофиль-
ной вакуоли. Вегетативные формы — различные одно-
и двухспоровые плазмодии. Паразиты желчного пузы-
ря морских костистых рыб. Содержит 2 рода.
Род Alataspora Schulman, Kovaljova,
Dubina, 1979 (рис. 428, 30)
Крыловидные отростки на вершинах створок оди-
нарные. Плазмодии двуспоровые. Содержит около
10 видов.
Род Pseudalataspora Kovaljova,
Gajevskaja, 1982 (рис. 428, 31)
Двойные крыловидные отростки на вершинах ство-
рок соединены по переднему краю и раздвоены на зад-
нем конце. Плазмодии одно- и двухспоровые. Содер-
жит 5 видов.
Сем. Fabesporidae Lom, Noble, 1984
Эллипсоидные споры вытянуты в направлении,
перпендикулярном плоскости шва. Полярные капсулы
открываются на вершинах створок. Двухъядерный
амебоидный зародыш лежит между полярными кап-
сулами. Вегетативные формы — мелкие плазмодии.
Споры способны к движению при помощи сократи-
тельных нитей, прикрепленных к створкам спор. Со-
держит 1 род.
Род Fabespora Naidenova, Zaika, 1969
(рис. 428, 32)
Сохраняет все признаки семейства. Содержит 3 ви-
да. Один паразитирует в желчном пузыре морских кос-,
тистых рыб, 2 вида паразитируют в трематодах.
Сем. Myxobilatidae Schulman, 1953
Споры округлой, шлемовидной или овально-удли-
ненной в переднезаднем направлении формы. Шов
прямой, иногда с развитым шовным валиком. Створки
снабжены короткими выростами разнообразной фор-
мы или длинными хвостовыми нитями. Овальные или
грушевидные полярные капсулы, лежащие в плоско-
сти, перпендикулярной плоскости шва, расположены
на переднем полюсе или вблизи от него. В амебоидном
зародыше имеется иодофйльная вакуоль. Вегетатив-
ные стадии — плазмодии, реже цисты. Паразиты мо-
чевого пузыря, мочеточников, мочевых канальцев,
реже различных тканей пресноводных, солоновато-
водных, реже морских костистых рыб. Содержит
2 рода.
Род Podospora Chen, Hsieh, 1984
(рис. 428, 33)
Споры округлой или шлемовидной формы, с хоро-
шо выраженным прямым шовным валиком. Две оваль-
ные полярные капсулы расположены ближе к передне-
му полюсу и открываются на некотором расстоянии от
него. В задней части каждой створки имеется по одно-
му короткому выросту различной формы. Вегетатив-
ные стадии — крупные плазмодии или цисты. Парази-
ты тканей различных органов пресноводных кос-
тистых рыб. Содержит 3 вида. Лом и Дыкова (Lom,
Dykova, 1992) считают его синонимом рода Sphae-
rospora.
Род Myxobilatus Davis, 1944
(рис. 428, 34)
Споры овальной или близкой к ней формы, удли-
ненные в переднезаднем направлении, со створками,
снабженными хвостовыми отростками. Шовный валик
не выражен. Грушевидные полярные капсулы распо-
ложены на переднем полюсе. Амебоидный зародыш
двухъядерный. Вегетативные стадии — плазмодии
дву- или многоспоровые. Паразиты мочевого пузыря,
мочеточников и мочевых канальцев (изредка желчного
пузыря) пресноводных и солоноватоводных, реже
морских костистых рыб. Содержит более 20 видов.
Подотряд Platysporina Kudo, 1919,
emend. Schulman, 1959
Споры линзообразной или близкой к ней формы,
часто сильно вытянутые в направлении шва. 2 (реже 1
или 4) грушевидные полярные капсулы располагаются
в плоскости шва у переднего полюса. Споры билате-
рально симметричные. В месте соприкосновения ство-
рок последние образуют мощный прямой шовный ва-
лик. Лишь у спор рода Spirosuturia этот валик извитой.
На заднем полюсе споры у ряда родов имеются хвосто-
вые отростки или тонкие хвостовые нити. У предста-
вителей одного рода (Neohenneguya) отростки имеют-
ся и на заднем, и на переднем полюсах. На переднем
полюсе спор между выводными концами полярных
капсул расположен очень тонкий интеркапсулярный
отросток, отделяющий эти концы друга от друга в
направлении, перпендикулярном плоскости шва. Ве-
гетативные формы подавляющего большинства ви-
дов — цисты, достигающие иногда крупных размеров,
в которых формируется огромное число (до несколь-
ких миллионов) спор. Лишь несколько видов полост-
ных и тканевых паразитов имеют вегетативные формы
в виде плазмодиев. Преимущественно паразиты разно-
образных тканей пресноводных, гораздо реже морских
костистых рыб. Лишь представители самого прими-
тивного рода — Hoferellus — паразитируют в желч-
ном пузыре и мочевых канальцах. Включает 2 се-
мейства.
1076
ТИП MYXOZOA
Сем. Myxobolidae Thelohan, 1892
Споры округлой, овальной, грушевидной или вере-
теновидной формы, с 2 (иногда неравными по разме-
рам), реже с 1 полярной капсулой. Створки имеют
обычные хвостовые отростки или нити, или лишены
их, реже встречаются отростки иного типа. Шовный
валик прямой или извитой. Амебоидный зародыш име-
ет иодофильную вакуоль. Вегетативные формы у по-
давляющего большинства — многоядерные и много-
споровые цисты, реже плазмодии. Преимущественно
тканевые паразиты пресноводных костистых рыб. Со-
держит 14 родов.
Род Hoferellus Berg, 1898 (рис. 428, 35)
(=Mitraspora Fujita, 1912)
Споры пирамидальной формы, с более или менее
уплощенным задним полюсом, на котором могут нахо-
диться 2 боковых выроста и блюдцеобразное обра-
зование с отходящими от него тонкими хвостовыми
нитями. На переднем полюсе споры 2 грушевидные
полярные капсулы. Вегетативные формы — многоспо-
ровые плазмодии. Паразиты желчного и мочевого пу-
зырей, мочеточников и мочевых канальцев пресновод-
ных рыб. Род содержит 12 видов.
Род Myxobolus Butschli, 1882
(рис. 428, 36)
(=Disparospora Achmerov, 1954; Facieplatycauda Wyatt,
1979; Rudicapsula Kalavati, Narasimhamurti, 1984)
Споры округлые, овальные, грушевидные или близ-
кой к ним формы. Почти все виды имеют 2 полярные
капсулы, за исключением 2 видов, имеющих только
1 капсулу, не смещенную в медиальном направлении.
Створки лишены отростков. Вегетативные формы —
цисты, в которых обычно образуется огромное число
спор. Тканевые паразиты пресноводных костистых
рыб. Лишь очень немногие виды — паразиты морских
рыб и амфибий. Род содержит около 450 видов.
Род Spirosuturia Chen, Hsieh, 1984
(рис. 428, 37)
Споры овальной или близкой к ней формы, с хоро-
шо выраженным, волнисто извитым шовным валиком.
Вследствие этого плоскость шва у споры утрачена.
Створки лишены отростков. На переднем полюсе
2 грушевидные полярные капсулы. Вегетативные фор-
мы — плазмодии или цисты. Паразиты полости моче-
вого пузыря или тканей пресноводных костистых рыб.
Род содержит 2 вида.
Род Unicauda Davis, 1944 (рис. 428, 38)
Споры овальные, с 1 отростком, отходящим от
шовного валика и построенным из иного, чем створки,
материала. На переднем полюсе 2 грушевидные по-
лярные капсулы. Вегетативные формы — цисты. Тка-
невые паразиты пресноводных костистых рыб. Род
содержит около 10 видов (Cone, Melendy, 2000).
Род Dicauda Hoffman, Waliker, 1978
(рис. 428, 39)
Споры овальные, с 2 (реже больше) отростками, от-
ходящими от шовного валика и построенными, по-ви-
димому, из иного, чем створки, материала. На перед-
нем полюсе 2 полярные капсулы. Вегетативные фор-
мы — цисты. Тканевые паразиты пресноводных
костистых рыб. Монотипический род.
Род Neohenneguya Tripathi, 1959
(рис. 428, 40)
Споры веретеновидной формы, с 4 отростками —
2 хвостовыми и 2 на переднем полюсе. 2 сферические
полярные капсулы расположены в передней части спо-
ры, но несколько сдвинуты от переднего полюса и от-
крываются на некотором расстоянии от него. Вегета-
тивные формы — многоспоровые цисты. Паразиты
тканей пресноводных костистых рыб. Единственный
вид обнаружен только однажды, описание недостаточ-
но полное.
Род Henneguya Thelohan, 1892
(рис. 428, 41)
Споры округлой, овальной или веретеновидной
формы, со створками, у которых от заднего полюса от-
ходят хвостовые отростки (двойные или одинарные).
2 полярные капсулы открываются на переднем полю-
се. Вегетативные формы — многоспоровые цисты. Па-
разиты тканей пресноводных костистых рыб. В мор-
ских рыбах встречается лишь несколько видов. Род со-
держит около 150 видов (Eiras, 2002).
Род Phlogospora Qadri, 1962
(рис. 428, 42)
Споры веретеновидной формы, с 2 хвостовыми от-
ростками и 1 грушевидной полярной капсулой, откры-
вающейся на переднем полюсе. Вегетативные фор-
мы — многоспоровые цисты. Тканевые паразиты пре-
сноводных костистых рыб. Монотипический род.
Род Tetrauronema Wu, Wang, Jang, 1988
(рис. 428, 43)
Споры овальной или близкой к ней формы. В зад-
ней половине споры, на некотором расстоянии от ее
заднего полюса, отходят 4 хвостовых отростка: по 2 от
шовного валика каждой створки. На переднем полюсе
2 грушевидные полярные капсулы. Вегетативные фор-
мы — цисты. Тканевые паразиты пресноводных кости-
стых рыб. Монотипический род.
ТИП MYXOZOA. КЛАСС MYXOSPOREA
1077
Род Trigonosporous Hoshina, 1952
(рис. 428, 44)
Споры шлемообразной формы, с закругленными
передним и задним полюсами. От шовного валика
каждой створки, на некотором расстоянии как от пе-
реднего, так и от заднего полюса, отходят по 2 симмет-
рично направленных назад хвостовых отростка, попар-
но соединенных между собой тонкими филаментами.
Эти филаменты идут в направлении, примерно парал-
лельном задней поверхности споры. На переднем по-
люсе споры расположены 2 грушевидные полярные
капсулы. Вегетативные формы — цисты. Тканевые па-
разиты солоноватоводных костистых рыб. Монотипи-
ческий род.
Род Thelohanellus Kudo, 1933
(рис. 428, 45)
Овальные или грушевидные споры с гладкими,
лишенными отростков створками, с 1 полярной кап-
сулой, сместившейся к продольной оси споры в меди-
альном направлении, благодаря чему спора вторично
приобрела радиальную симметрию. Вегетативные
формы в виде многоспоровых цист. Паразиты тканей
пресноводных костистых рыб. Род содержит около
40 видов.
Род Neothelohanellus Das, Haidar, 1986
(рис. 428, 46)
(= Lomosporus Gupta, Khera, 1988)
Споры яйцевидной формы с одной полярной кап-
сулой, открывающейся сбоку от переднего полюса
споры. Тканевые паразиты пресноводных рыб. Род
содержит 2 вида. Валидность рода вызывает сомне-
ния.
Род Laterocaudata Chen, Hsieh, 1984
(рис. 428, 47)
Споры овальной формы, несколько сужающиеся к
переднему концу, с одним длинным тонким изогнутым
отростком, отходящим от шовного валика несколько
сбоку от заднего полюса. Отросток раздвоен на конце.
Две грушевидные полярные капсулы. Паразиты жабр
пресноводных рыб. Монотипический род (Kent et al.,
2000а).
Род Hennegoides Lom, Tonguthai, Dykova,
1991 (рис. 428, 48)
Споры асимметричные с раздвоенным отростком
на заднем конце. Две полярные капсулы с полярными
нитями, закрученными вдоль оси капсул. Род содер-
жит один вид, описанный из кишечника пресноводной
рыбы (Kent et al., 2000а).
Сем. Myxosomatidae Poche,
1913
Споры округлой, овальной, грушевидной или вере-
теновидной формы, с 2 или 4 грушевидными полярны-
ми капсулами на переднем полюсе. Створки лишены
хвостовых отростков или имеют их. Иодофильная ва-
куоль в амебоидном зародыше отсутствует. Вегетатив-
ные формы — многоспоровые цисты, лишь у единич-
ных видов — плазмодии. Тканевые паразиты пресно-
водных костистых рыб. Небольшое количество
паразитирует в морских рыбах. Включает 2 рода.
Род Myxosoma Thelohan, 1882
(рис. 428, 49)
(= Lentospora Plehn, 1905)
Споры округлой, овальной, яйцевидной или груше-
видной формы, лишенные хвостовых отростков. Веге-
тативные формы — многоспоровые цисты, лишь у
единичных видов — плазмодии. Паразиты пресновод-
ных костистых рыб; единичные виды паразитируют в
морских рыбах. Род содержит около 100 видов.
Род Agarella Dunkerly, 1915 (рис. 428, 50)
Споры веретеновидной формы, с 2 хвостовыми от-
ростками и 4 грушевидными полярными капсулами на
переднем полюсе. Вегетативные формы — многоспо-
ровые цисты. Единственный вид — тканевой паразит
двоякодышащей рыбы.
Отряд Multivalvulida Schulman, 1959
Миксоспоридии с многостворчатыми спорами, со-
стоящими из 3, 4, 5 или 6 створок и содержащими от
1 до 6 полярных капсул и 1, реже 2, амебоидных заро-
дыша. Как исключение у некоторых видов может быть
6—7 капсул и створок (Septemcapsula yasunagai Hsieh,
Chen, 1984). Все капсулы расположены на переднем
полюсе споры. Споры радиально симметричные. Веге-
тативные формы — плазмодии. Иодофильная вакуоль
отсутствует. Паразиты мышечных волокон, реже кле-
ток других тканей и органов морских рыб. Только еди-
ничные виды паразитируют в полости желчного и мо-
чевого пузырей. В тех случаях, когда плазмодий лизи-
рует сарколемму зараженного мышечного волокна, он
выходит в окружающую ткань и становится тканевым
паразитом. В этом случае паразиты или окружаются
соединительно-тканной капсулой хозяина, благодаря
чему образуется псевдоциста, либо продолжается ли-
зис. Включает 7 семейств.
Сем. Trilosporidae Schulman, 1959
Споры 3-створчатые, имеющие 1 или 3 полярные кап-
сулы. Внутриклеточные и тканевые паразиты, реже пара-
зиты желчного и мочевого пузырей. Содержит 2 рода.
1078
ТИП MYXOZOA
Род Trilospora Noble, 1959 (рис. 428, 51)
Споры с 3 полярными капсулами. Трофозоиты од-
но- или двуспоровые. Внутриклеточные или тканевые
паразиты, реже паразиты желчного пузыря. Род содер-
жит 3 вида.
Род Unicapsula Davis, 1924 (рис. 428, 52)
(=Pileispora Naidenova, Zaika, 1970;
Parapileispora Naidenova, Zaika, 1970)
Споры имеют только 1 полярную капсулу. От реду-
цированных полярных капсул сохранились только
капсулогенные ядра или недоразвитые капсулогенные
клетки. Одна из створок крупнее других. Внутрикле-
точные паразиты мышечных волокон или тканей, реже
мочевого пузыря. Род содержит 7 видов.
Сем. Tetractinomyxidae Poche, 1913
Паразиты сипункулид. Монотипическое семейство.
Первоначально это семейство относили к классу Acti-
nosporea. По строению спор в настоящее время его отно-
сят к отряду Multivalvulida (Kent et al., 1994). Однако по-
ложение семейства в системе остается дискуссионным.
Род Tetractinomyxon Ikeda, 1912
(рис. 428, 53)
Споры четырехгранные с тремя створками и тремя
овальными полярными капсулами, расположенными
на переднем конце. Один двухъядерный амебоидный
зародыш. Род содержит два вида (Kent et al., 2000а).
Сем. Spinavaculidae Hsieh et Xiao, 1993
Чен и Ma (Chen, Ma, 1998) выделяют это семейство
вместе с сем. Kudoidae в отдельный отряд Tetravalvuli-
da, отмечая его промежуточное положение между от-
рядами Bivalvulida и Multivalvulida. По количеству
створок — это несомненно Multivalvulida. Однако оваль-
ная форма спор, наличие иодофильной вакуоли, четырех
отростков на каждом полюсе споры, а также паразити-
рование в плавательном и желчном пузырях пресно-
водной рыбы (белый амур) отличают это монотипиче-
ское семейство от остальных представителей отряда
Multivalvulida. Положение семейства в системе миксо-
споридий остается дискуссионным. Содержит 1 род.
Род Octospina Hsieh et Xiao, 1993
(рис. 428, 54, а, б, в)
Споры с четырьмя створками и четырьмя поляр-
ными капулами на переднем полюсе споры, овальной
формы. На каждом полюсе имеются четыре отростка.
Отмечена иодофильная вакуоль. Паразиты плаватель-
ного и желчного пузырей белого амура. Описан 1 вид.
Сем. Kudoidae Meglitsch, 1959
Споры 4-створчатые, снабженные 4 полярными
капсулами. Вершины створок закруглены или заострены
и оттянуты, образуют роговидный выступ. Иногда одни
створки и полярные капсулы крупнее других. Два од-
ноядерных амебоидных зародыша, один из которых
окружает другой. Трофозоиты одно- и многоспоровые.
Вегетативные формы — плазмодии. Паразиты мышечных
волокон, реже клеток других тканей рыб, единично
желчного и мочевого пузырей. Содержит только 1 род.
Род Kudoa Meglitsch, 1947 (рис. 428, 55)
(= Tetraspina Xie, Chen, 1988)
Сохраняет все признаки семейства. Споры квадрат-
ные или с закругленными углами в фронтальной плос-
кости с нечеткими шовными валиками. Трофозоиты
маленькие, содержащие от одной до семи спор, или боль-
шие многоспоровые. Род содержит около 50 видов.
Сем. Pentacapsulidae Naidenova, Zaika,
1970
Споры 5-створчатые, снабженные 5 полярными
капсулами. Вегетативные формы в виде плазмодиев,
вначале паразитирующих в мышечных волокнах, а за-
тем располагающихся в соединительно-тканных кап-
сулах хозяина. Паразиты мышц, реже других органов
морских рыб.
Род Pentacapsula Naidenova, Zaika, 1970
(рис. 428, 56)
Сохраняет все признаки семейства. Споры звездооб-
разные пятилучевые в фронтальной плоскости. Большие
многоспоровые трофозоиты. Род содержит три вида.
Сем. Hexacapsulidae Schulman, 1959
Споры 6-створчатые, имеют 6 полярных капсул.
Вегетативные формы в виде плазмодиев. Вначале па-
разиты мышечных волокон, вызывающие затем лизис
мышечных тканей. Паразиты морских рыб. Монотипи-
ческое семейство.
Род Hexacapsula Arai, Matsumoto, 1953
(рис. 428, 57)
Сохраняет все признаки семейства. Споры полуокруглые
в латеральной плоскости. Монотипический род.
Сем. Septemcapsulidae Hsieh, Chen, 1984
Споры 7-створчатые, имеют 7 полярных капсул.
Паразиты морских рыб. Валидность этого семейст-
ва вызывает сомнения, поскольку у единствен-
ТИП MYXOZOA. INCERTAE SEDIS
1079
ного представителя этого семейства в одной псев-
доцисте имелись споры с 6 и 7 створками и капсу-
лами.
Род Septemcapsula Hsieh, Chen, 1984
(рис. 428, 58)
Сохраняет все признаки семейства. Споры с закруг-
ленной вершиной. Монотипический род. Паразиты го-
ловного мозга морских рыб.
Myxozoa incertae sedis
Malacosporea Canning et al.,
2000 — Малакоспореи
Паразиты пресноводных мшанок и рыб. Споры с «мяг-
кими» створками и 4 полярными капсулами, которые нахо-
дятся внутри обширного мешковидного образования.
Отряд Malacovalvulida Canning et al., 2000
Паразиты мшанок и рыб, в случае Tetracapsula bryo-
salmonae. Вегетативные стадии в виде закрытых мешков,
оболочка которых состоит из одного слоя уплощенных
клеток. Митохондрии с трубчатыми кристами. Споры
формируются внутри мешка либо путем агрегации клеток,
либо путем деления спорогенных клеток. Мейоз проис-
ходит в спороплазмогенных клетках (Tetracapsula bry-
osalmonae); ядро спороплазмы гаплоидное. Клетки, фор-
мирующие створки спор, не дегенерируют, не форми-
руют твердых створок и не покрывают места выхода
полярных нитей. Полярные нити не формируются кап-
сулогенными клетками на фазе развития в мшанках. Вы-
ходы из полярных капсул не запечатаны пробкоподоб-
ными структурами. В спороплазме имеются спороп-
лазмозомы — мембрановидные, электронно-плотные
структуры с прозрачными узкими инвагинациями. У од-
ного вида имеются гаплоспоросомы (Canning et al., 2000).
роплазмогенной клетки. Первые клетки продуцируют
створки и капсулогенные клетки, а последняя — де-
лится на две спороплазмы с гаплоидными ядрами.
Спороплазмы формируют вторичные клетки. Споры
сферические с четырьмя капсулами, расположенными
на одном полюсе споры. Клетки, формирующие створ-
ки, сохраняют клеточную целостность и не формиру-
ют твердых створок (Canning et al., 1996; Canning et al.,
2000). Род содержит два вида.
Вследствие упразднения класса Actinosporea, а так-
же всех отрядов и семейств, за исключением Tetracti-
nomyxidae, далее, вслед за Кентом с соавт. (Kent et al.,
1994; Kent et al., 2000a), приводим список сборных
групп актиномиксидий.
Sphaeroactinomyxon (рис. 428, 60)
Выделение спор происходит поодиночке. Отростки
отсутствуют. Споры трехстворчатые с 3 полярными
капсулами. К этой группе принадлежит и род Tetra-
spora, который отличается тем, что в панспороцисте
образуются четыре споры, а не восемь (Halett, Lester,
1999).
Triactinomyxon (рис. 428, 67)
Выделение спор происходит поодиночке. Имеются
3 отростка и стиль, сформированный слиянием отрост-
ков проксимально от полости споры.
Hexactinomyxon (рис. 428, 62)
Выделение спор происходит поодиночке. Имеются
6 отростков и стиль.
Neoactinomyxon (рис. 428, 63)
Выделение спор происходит поодиночке. Имеются
3 закругленных отростка. Стиль отсутствует.
Сем. Saccosporidae Canning et al., 1996
Сохраняет все признаки группы. Все одноядерные
клетки внутри мешка являются потенциальными спо-
рами или компонентами спор (Canning et al., 1996; Can-
ning et al., 2000). Содержит один род.
Род Tetracapsula Canning et al., 1996
(рис. 428, 59)
Разрастание мешка достигается путем деления кле-
ток в его стенке, при этом выделяются клетки внутрь
полости мешка, которые впоследствии становятся спо-
рами. Споры формируются путем деления одной спо-
рогенной клетки на 10 клеток (4 капсулогенные, 4 да-
ющие створки и две спороплазматические) или путем
агрегации восьми звездообразных клеток вокруг спо-
Aurantiactinomyxon (рис. 428, 64)
Выделение спор происходит поодиночке. Имеются
три боковых широких отростка. Стиль отсутствует.
Raabeia (рис. 428, 65)
Выделение спор происходит поодиночке. Имеются
три задних изогнутых заостренных отростка. Стиль от-
сутствует.
Echinactinomyxon (рис. 428, 66)
Выделение спор происходит поодиночке. Имеются
три задних прямых заостренных отростка. Стиль от-
сутствует.
1080
ТИП MYXOZOA
Guyenotia (рис. 428, 67)
Выделение спор происходит поодиночке. Имеются
три задних прямых пальцевидных отростка. Стиль от-
сутствует.
Synactinomyxon (рис. 428, 68, а, б)
Выделение спор происходит группами. Отростки
неравные: два длинных крыловидных и один короткий
конусовидный отросток. Стиль отсутствует. Споры со-
единяются вершинами конусовидных отростков.
Siedleckiella (рис. 428, 69, а, б)
Ormieractinomyxon (рис. 428, 66)
Выделение спор происходит группами. Споры со-
единяются в группы при помощи крючков на концах
отростков. Стиль отсутствует. Споры похожи на Echi-
nactinomyxon.
Antonactinomyxon
(рис. 428, 70, а, б)
Выделение спор происходит группами. Отростки
без крючков. Стиль отсутствует. Споры похожи на
Echinactinomyxon, но концы отростков закруглены.
Выделение спор происходит группами. Три равных
отростка, вершинами которых споры соединяются
в группы. Стиль имеется. Споры похожи на таковые
Triactinomyxon.
THE PHYLUM MYXOZOA GRASSE, 1970
SUMMARY
Myxozoa are obligatory parasites of several classes of vertebrates.
Last finding show that for many of Myxozoa if not for all of them the
life cycle include the second invertebrate host. This exiting discovery
attract attention to Myxozoa recently. The molecular phylogenies const-
ructed for these parasites placed them into Metazoa. The one hundred
years discussion about protozoan or metazoan nature of this organisms
finalized in Myxozoa position among Metazoa. The place is not precise-
ly determined between Coelentherata and even possible among Bilate-
ria. Such a big change in our knowledge about Myxozoa need to made a
major revision in taxonomy of this enigmatic parasites.
We tried to adapte the systematics of Myxozoa to that exiting disco-
veries. The cytology and life cycles of Myxozoa are largely discussed
and some changing in taxonomy are presented in this work.
Evolution of myxozoans followed from one hand the way of specia-
lization for propagation stages in vertebrate and invertebrate host and
for another way of specialization of invasive stages — spores. Spores
are producted in both vertebrate and invertebrate parts of life cycle and
display rather different morphology. The scale of spores adaptations to
infect vertebrate and invertebrate hosts are discussed.
ЛИТЕРАТУРА
Ахмеров A. X. Миксоспоридии рыб бассейна реки Амур И
Рыбное хозяйство внутренних водоемов Латвийской ССР. 1960.
Т. 5. С. 239—308.
(Воронин В. Н., Чернышева Н. Б.) Voronin V. N., Cherny-
sheva N. В. An intracellular gill parasite as the possible causative agent
of mortality during swim-bladder inflammation in common carp, Cypri-
nus carpio L. // J. Fish Dis. 1993. Vol. 16. P. 609—611.
Донец 3. С. Зоогеографический анализ миксоспоридий южных
водоемов СССР И Тр. ЗИН АН СССР. 1979а. Т. 87. С. 65—90.
Донец 3. С. Эволюция миксоспоридий // Тр. ЗИН АН СССР.
19796. Т. 87. С. 28—41.
(Донец 3. С., Подлипаев С. А., Шульман С. С.) Donez Z. S.,
Podlipaev S. A., Shulman S. S. Iodinophilous vacuole and ecology
of freshwater Myxosporidia // Acta Protozool. 1978. Vol. 17. P. 125—
132.
Исси И. В., Шульман С. С. О систематическом положении
миксоспоридий // Паразитология. 1967. Т. 1. С. 151—156.
Кусакин О. Г., Дроздов А. Л. Филема органического мира.
Ч. 2. СПб., 1998.
Определитель паразитов пресноводных рыб СССР/ Ред.
Б. Е. Быховский. М.; Л., 1962.
Определитель паразитов пресноводных рыб СССР. Паразити-
ческие простейшие / Ред. С. С. Шульман. Л., 1984. Т. 1.
Определитель паразитов пресноводных рыб СССР. Паразити-
ческие многоклеточные. Ч. 1 / Ред. А. В. Гусев. Л., 1985. Т. 2.
Определитель паразитов пресноводных рыб СССР. Паразити-
ческие многоклеточные. Ч. 2 / Ред. О. Н. Бауер. Л., 1987. Т. 3.
Подлипаев С. А. Полисахариды в спорах миксоспоридий се-
мейства Myxobolidae // Паразитология. 1974. Т. 8. С. 535—542.
(Подлипаев С. А., Шульман С. С.) Podlipaev S. A., Shul-
man S. S. The nature of the iodinophilous vacuole in Myxosporidia //
Acta Protozool. 1978. Vol. 17. P. 109—124.
Пугачев О. H. Каталог паразитов пресноводных рыб Север-
ной Азии. Простейшие. СПб., 2001.
Успенская А. В. Цитология миксоспоридий. Л., 1984.
(Успенская А. В.) Uspenskaja А. V. Alternation of actinospore-
an and myxosporean phases in the life cycle of Zschokkella nova (My-
xozoa) // J. Euk. Microbiol. 1995. Vol. 42. P. 665—668.
Хейсин E. M. О системе споровиков (класс Sporozoa, тип Pro-
tozoa) И Зоол. журн. 1956. Т. 35. С. 1281—1298.
Шульман С. С. Миксоспоридии фауны СССР. Л., 1966.
Шульман С. С., Донец 3. С., Ковалева А. А. Класс миксоспо-
ридий мировой фауны. СПб., 1997.
Шульман С. С., Подлипаев С. А. Положение Cnidosporidia в
системе Protozoa И Тр. ЗИН АН СССР. 1980. Т. 94. С. 85—102.
(Шульман С. С., Донец 3. С., Подлипаев С. A.) Shul-
man S. S., Donez Z. S., Podlipaev S. A. The use of iodinophilous va-
cuole in taxonomy of Myxosporidia // Acta Protozool. 1978. Vol. 17.
P. 133—140.
Anderson C. L. Phylogenetic relationships of the Myxozoa // Evo-
lutionary Relationships among Protozoa / Eds G. H. Coombs, K. Vic-
kerman, M. A. Sleigh, A. Warren. London, 1998. P. 341—350.
Anderson C. L., Canning E. U., Okamura B. A triploblast origin
for Myxozoa? // Nature. 1998. Vol. 392. P. 346.
Andree К. B., Gresoviac S. J., Hedrick R. P. Small subunit ri-
bosomal RNA sequences unite alternate actinosporean and myxospo-
rean stages of Myxobolus cerebralis, the causative agent of whirling
disease in salmonid fish // J. Euk. Microbiol. 1997. Vol. 44. P. 208—
215.
Andree К. B., Szekeiy C., Molnar K., Gresoviac S. J., Hed-
rick R. P. Relationships among members of the genus Myxobolus (My-
ТИП MYXOZOA. ЛИТЕРАТУРА
1081
xozoa: Bivalvulida) based on small subunit ribosomal DNA sequences //
J. Parasitol. 1999. Vol. 85. P. 68—74.
Auerbach M. Die Cnidosporidien (Myxosporidien, Actynomyxidi-
en, Microsporidien): Eine monographische Studie. Leipzig, 1910.
Auerbach M. Die Sporenbildung der Myxosporidien // Zool. Anz.
1912. Bd49. S. 145—157.
Balbiani E. G. Sur organization et la nature des psorospermies //
C. r. Acad. Sci. 1863. Vol. 57. P. 158—161.
Bartolomew J. L., Whipple M. J., Stevens D. G., Fryer J. L.
The life cycle of Ceratomyxa shasta, a myxosporean parasite of salmo-
nids, requires a freshwater polychaete as an alternate host // J. Parasitol.
1997. Vol. 83. P. 859—868.
Boreham R. E., Hendrick S., O'Donoghue P. J., Stenzel D. J.
Incidental finding of Myxobolus spores (Protozoa: Myxozoa) in stool
samples from patients with gastrointestinal symptoms // J. Clin. Micro-
biol. 1998. Vol. 36. P. 3728—3730.
Biitschli O. Myxosporidien//Zool. Jahrb. 1881. Bd 1. S. 162—164.
Canning E. U., Curry A., Feist S. W., Longshaw M., Okamu-
ra B. A new class and order of myxozoans to accommodate parasi-
tes of bryozoans with ultrastructural observations on Tetracapsula bryo-
salmonae (PKX organism) // J. Euk. Microbiol. 2000. Vol. 47. P. 456—
468.
Canning E. U., Okamura B., Curry A. Development of a myxo-
zoan parasite Tetracapsula bryozoides gen. n. et sp. n. in Cristatella mu-
cedo (Bryozoa: Phylactolaemata) II Folia Parasitol. 1996. Vol. 43.
P. 249—261.
Canning E. U., Curry A., Feist S. W., Longshaw M., Okamu-
ra B. Tetracapsula bryosalmonae n. sp. for PKX organism, the cause of
PKD in salmonid fish // Bull. Eur. Assoc. Fish Pathol. 1999. Vol. 19.
P. 203—206.
Cavalier-Smith T. Kingdom Protozoa and its 18 phyla // Micro-
biol. Rev. 1993. Vol. 57. P. 953—994.
Chen C., Ma C. Myxozoa, Myxosporea. Beijing, 1998.
Cohn L. Uber die Myxosporidien von Esox licius und Perea fluvia-
tilis // Zool. Jahrb. Abt. Anat. Ontog. 1896. Bd 9. S. 227—272.
Cone D. E., Melendy J. S. Infections of Unicauda clavicauda
(Kudo, 1934) (Myxozoa) in the skin of Notropis hudsonius (Cyprini-
dae) from Montana, with a synopsis of the genus Unicauda Davis,
1944 II Folia Parasitol. 2000. Vol. 47. P. 273—278.
Creplin J. С. H. Beschreibung der Psorospermiendes Kaulbars-
ches nebst sinigen Bemerkungen iiber die der Plotze und anders // Arch.
Naturg. 1842. Bd 8. S. 61—66.
Davis H. S. Myxosporidia of the Beaufort Region: A systematic
and biological study // Wasch. Bull. U. S. Bur. Fish. 1917. Vol. 35.
P. 203—243.
Diamant A. A new pathogenic histozoic Myxidium (Myxosporea)
in cultured gilt-head sea bream Spares aurata L. // Bull. Eur. Assoc.
Fish. Pathol. 1992. Vol. 12. P. 64—66.
Diamant A. Fish-to fish transmission of a marine myxosporean //
Dis. Aquat. Org. 1997. Vol. 20. P. 99—105.
Doflein F. Das System der Protozoen // Arch. Protistenk. 1902.
Bd 1. S. 169—192.
Doflein F. Die Protozoen als Parasiten und Krankheitserreger nach
biologischen Gesichtspunkten dargestelt. Jena, 1901.
Doflein F. Fortschritte auf dem Gebiete der Myxosporidienkunde.
Zusammenfassende Uebersicht // Zool. Zentrbl. 1899. Bd6.
S. 361—379.
Doflein F. Studien zur Naturgeschichte der Protozoen. III. Uber
Myxosporidien // Zool. Jahrb., Anat. 1898. Bd 11. S. 281—350.
Dujardin M. F. Histroire naturelie des Helminthes ou vers intesti-
naux. Paris, 1845.
Dumortier В. C., van Beneden P. J. Histoire naturelle des poly-
pes composes d'eau douce // Nouv. Memoir. Acad. Royal. Sci. et Bel-
les-Lettres de Bruxelles. 1850. Vol. 16. P. 33—96.
Eiras J. C. Synopsis of the species of the genus Henneguya Thelo-
han, 1892 (Myxozoa: Myxosporea: Myxobolidae) // Syst. Parasitol.
2002. Vol. 53. P. 43—54.
El-Mansy A., Molnar K., Szekely C. Development of Myxobolus
portucalensis Saraiva & Molnar, 1990 (Myxosporea: Myxobolidae) in
the oligochaete Tubifex tubifex (Mueller) // Syst. Parasitol. 1998.
Vol. 41. P. 95—103.
El-Matbouii M., Hoffmann R. W. Light and electron microscopic
study on the chronological development of Myxobolus cerebralis in Tu-
bifex tubifex to the actinosporean stage triactinomyxon // Int. J. Parasi-
tol. 1998. Vol. 28. P. 195—217.
El-Matbouli M., Hoffmann R. W., Mandok C. Light and elect-
ron microscopic observations on the route of the triactinomyxon-spo-
roplasm of Myxobolus cerebralis from epidermis into rainbow trout car-
tilage // Fish Biol. 1995. Vol. 46. P. 919—935.
Fujita T. Studies on myxosporidia of Japan // J. Coll. Agr. Hokkai-
do Imp. Univ. 1923. Vol. 10. P. 190—253.
Grasse P.-Р., Lavette A. La Myxosporidie Sphaeromyxa sabrazei
et le nouvel embranchement de Myxozoaires (Myxozoa). Recherches
sur 1'etat pluricellulaire primitif et considerations phylogenetiques //
Ann. Sci. Nat. Zool. Paris. 1978. Vol. 20. P. 193—285.
Griffin B., Davis E. Myxosoma cerebralis: Detection of circula-
ting antibodies in infected rainbow trout (Salmo gairdneri) // J. Fish.
Res. Bd. Canada. 1978. Vol. 35. P. 1186—1190.
Gurley R. R. On the classification of the Myxosporidia a group of
Protozoan parasites infesting Fishes // Bull. U. S. Fish. Comm. 1893.
Vol. 11. P. 402—407.
Halett S. L., Lester R. J. G. Actinosporeans (Myxozoa) with four
developing spores within a pansporocyst: Tetraspora discoidea n. g.
n. sp. and Tetraspora rotundum n. sp. // Int. J. Parasitol. 1999. Vol. 29.
P. 419—427.
Hanelt B., Van Schyndel D., Adema С. M., Lewis L., Lo-
ker E. S. The phylogenetic position of Rhopalura ophiocomae (Ortho-
nectida) based on 18S ribosomal DNA sequence analysis II Mol. Biol.
Evol. 1996. Vol. 13. P. 1187—1191.
Hartmann M. Sporozoa // Handb. d. Zoologie von Kiiken-
thal-Krumbach. Bd 1. Berlin, Leipzig, 1923—1925. S. 186—192.
Hedrick R. P., Mac Connell E., de Kinkelin P. Proliferative kid-
ney disease of salmonid fish II Ann. Rev. Fish Dis. 1993. Vol. 3.
P. 277—290.
Hervio D. M., Kent M. L., Khattra J., Sakanari J., Yokoha-
ma H., Devlin R. H. Taxonomy of Kudoa species (Myxosporea) using
small subunit ribosomal DNA sequence // Can. J. Zool. 1997. Vol. 75.
P. 2112—2119.
Hine P. M. Three new species of Myxidium (Protozoa: Myxospori-
dia) parasitic in Anguilla australis Richardson, 1848 and A. dieffenba-
chiaGray, 1842 in New Zealand//J. R. Soc. New Zealand. 1975. Vol. 5.
P. 153—161.
Hofer B. Die infection der Fische mit Myxosporidien // Allg. Fisch.
Zeits. 1896. Bd21. S. 38—39.
Hofer B. Handbuch der Fischkrankheiten. Stuttgart, 1904.
Ikeda I. Studies on some Sporozoans parasites of Sipunculoids. I.
The life history of a new Actinomyxidian. Tetractinomyxon intermedi-
um g. and sp. n. // Arch. Protistenk. 1912. Vol. 25. P. 240—272.
Jirovec O., Wenig K., Fott B., Bartos E., Weiser J., Sra-
mek-Husek R. Protozoology. Praha, 1953.
Jurine L. L. Histoire des poissons du lec Leman // Soc. Phys. Hist.
Nat. 1825. Vol. 3. P. 42—45.
Kent M. L., Andree К. B., Bartholomew J. L. et al. Recent ad-
vances in our knowledge of the Myxozoa II J. Euk. Microbiol. 2001.
Vol. 48. P. 395—413.
Kent M. L., Moser M., Marques A., Lom J. Phylum Myxozoa
Grasse, 1970 // The illustrated guide of Protozoa. Vol. 1 / Eds J. J. Lee,
G. F. Leedale, P. Bradbary. Lawrence, 2000a. P. 127—148.
Kent M. L., Khattra J., Hedrick R. P., Devlin R. H. Tetracapsu-
la renicola n. sp. (Myxozoa: Saccosporidae); The PKX myxozoan —
the cause of proliferative kidney disease of salmonid fishes // J. Parasi-
tol. 2000b. Vol. 86. P. 103—111.
Kent M. L., Margolis L., Corliss J. O. The demise of a class
of protists: taxonomic and nomenclatural revisions proposed for pro-
tist phylum Myxozoa, Grasse // Can. J. Zool. 1994. Vol. 72. P. 932—
937.
Koie M. First record of an actinosporean (Myxozoa) in a marine
polychaete annelid // J. Parasitol. 2000. Vol. 86. P. 871—872.
Korotneff A. Myxosporidium bryozoides // Zeitsch. Wiss. Zool.
1892. Bd53. S. 591—596.
Kudo R. Studies on Myxosporidia. A synopsis on genera and spe-
cies of Myxosporidia. III. Biol. Monogr. 1919. Vol. 5, N 3—4.
Kudo R. A taxonomic consideration of the Myxosporidia // Trans.
Amer. Mier. Soc. 1933. Vol. 52. P. 195—216.
Labbe A. Sporozoa. Das Tierreich. Bd 5. 1899.
Landsberg J. H., Lom J. Taxonomy of the genera of the Myxobo-
lus / Myxosoma group (Myxobolidae: Myxosporea), current listing of spe-
cies and revision of synonyms//Syst. Parasitol. 1991. Vol. 18.P. 165—186.
Laveran F.,’Mesnil F. Sur la multiplication endogene des Myxo-
sporidie U C. R. Soc. Biol. 1902. Vol. 54. P. 469—472.
Lester B., Hallett S., El-Matbouli M., Canning E. Can a new
species of Myxozoa be described based solely on their actinosporean
stage. Reply // Parasitol. Today. 1999. Vol. 15. P. 508.
Lester R. J. G., Hallett S. L., El-Matbouli M., Canning E. U.
The case for naming actinosporeans using the Zoological Code // Parasi-
tol. Today. 1998. Vol. 14. P. 476—477.
Leuckart R. Psorospermien // Gbttingische gelehrte Anz. 1847.
Bd 2. S. 1032—1033.
1082
ТИП MYXOZOA
Leydig F. Einige Bemerkungen uber Psorospermien und Gregari-
nen // Frorieps. Tagesber. Fortschr. Natur. und Heilkunde, Abb. Zool.
1852. Bd 305. S. 73—74.
Leydig F. Uber Psorospermien und Gregarinen // Arch. Anat. Phy-
siol. und Wissensch. Med. 1851. Bd 18. S. 221—234.
Lieberkuhn L. Notice sur les psorospermies // Bull. Acad. Roy.
Belg. 1854. A. D. Vol. 21. P. 21—23.
Lieberkiihn L. Les psorospermies des poissons H Mem. Cour.
Mem. Sav. Etrang. Acad. Roy. Belg. 1855. Vol. 26. P. 36—38.
Lieberkiihn L. Sur les Psorospermies // Bull. Acad. Roy. Belg.
1854. В. C. Vol. 21. P. 160—168.
Lin D., Hanson L. A., Pote L. M. Small subunit ribosomal RNA
sequence of Henneguya exilis (Class Myxosporea) identifies the acti-
nosporean stage from an oligochaete host // J. Euk. Microbiol. 1999.
Vol. 46. P. 66—68.
Lom J. Notes on the ultrastructure and sporoblast development in
fish parasiting Myxosporidia of the genus Sphaeromyxa // Z. Zellforsh.
1969. Vol. 97. P. 416—437.
Lom J. On a new taxonomic character in Myxosporidia, as demon-
strated in descriptions of two new species of Myxobolus // Folia parasi-
tol. 1969. Vol. 16. P. 97—183.
Lom J. Phylum Myxozoa // Handbook of Protoctista / Eds L. Mar-
golis, J. O. Corliss, M. Melkonian, D. J. Chapman. Boston, 1990.
P. 36—52.
Lom J., Dykova I. Myxosporea (Phylum Myxozoa) // Fish Disea-
ses and Disorders. Vol. 1 / Eds P. T. K. Woo. Wallingford, 1995.
P. 97—128.
Lom J., Dykova I. Protozoan parasites of fishes. Amsterdam,
1992.
Lom J., Dykova I. Ultrastructural features of the actinosporean
phase of Myxosporea (phylum Myxozoa): a comparative study // Acta
Protozool. 1997. Vol. 36. P. 83—103.
Lom J., Noble E. R. Revised classification of the class Myxospo-
rea Btitschli, 1881 // Folia Parasitol. 1984. Vol. 31. P. 193—205.
Lom J., Vavra J. Mucous envelopes of spores of the subphylum
Cnidospora // Vest. CsI. zool. Spol. 1963. Vol. 27. P. 4—6.
Longshaw M., Feist S. W., Canning E. U., Okamura B. First
identification of PKX in Bryozoans from the United Kingdom- molecu-
lar evidence // Bull. Eur. Assoc. Fish Pathol. 1999. Vol. 19.
P. 146—148.
Markiw M. E., Wolf K. Myxosoma cerebralis (Myxozoa: Myxo-
sporea) etiologic agent of salmonid whirling disease requires tubificid
worms (Annelida: Oligochaetea) in its life cycle // J. Protozool. 1983.
Vol. 30. P. 561—564.
Mayer A. F. Ober Psorospermien // Arch. Anat. Physiol. Wis-
sensch. Med. 1864.
McArthur С. P., Sengupta S. Antigenic mimicry of eel tissues by
myxosporidian parasite // Z. Parasitenkd. 1982. Vol. 66. P. 249—255.
McClelland R. S., Murphy D. M., Cone D. K. Report of spores of
Henneguya salminicola (Myxozoa) in human stool specimens: possible
source of confusion with human spermatozoa// J. Clin. Microbiol. 1997.
Vol. 35. P. 2815—2818.
Meglitsch P. A. Some coelozoic Myxosporidia from New Zealand
fishes. I. General and family Ceratomyxidae // Trans. Roy. Soc. New
Zealand. 1960. Vol. 88. P. 265—356.
Miiller J. Uber Psorospermien // Arch. Anat. Physiol. Wissensch.
Med. 1841. S. 477—496.
Mitchell L. G. Myxosporidia // Parasitic Protozoa. Vol. 4 / Eds
J. P. Kreier. New York, 1977. P. 115—154.
Moncada L. I., Lopez M. C., Murcia M. I. et al. Myxobolus sp.,
another opportunistic parasite in immunosuppressed patients? // J. Clin.
Microbiol. 2001. Vol. 39. P. 1938—1940.
Monteiro A. N., Okamura B., Holland P. W. H. Orphan worms
finds a home: Buddenbrockia is a myxozoan // Mol. Biol. Evol. 2002.
Vol. 19. P. 968—971.
Moser M., Kent M. L. Myxosporea // Parasitic Protozoa. Vol. 8 /
Eds J. P. Kreier. New York, 1994. P. 265—318.
Nielsen C. Animal evolution. Interrelationships of the living phyla.
Oxford, 1995.
Okamura B. Occurrence, prevalence, and effects of the myxozoan
Tetracapsula bryozoides parasitic in the freshwater bryozoan Cristatella
mucedo (Bryozoa: Phylactolaemata) // Folia Parasitol. 1996. Vol. 43.
P. 262—266.
Okamura B., Curry A., Wood T. S., Canning E. U. Ultrastruc-
ture of Buddenbrockia identifies it as a myxozoan and verifies the bila-
terian origin of the Myxozoa // Parasitology. 2002. Vol. 124.
P. 215—223.
Oumouna M., Hallett S. L., Hoffmann R. W., El-Matbouli M.
Early developmental stages of two actinosporeans, Raabeia and Auran-
tiactinomyxon (Myxozoa), as detected by light and electron microsco-
py // J. of Invertebrate Pathology. 2002. Vol. 79. P. 17—26.
Pauley G. Fish sporozoa: Extraction of antigens from Myxosoma
cerebralis which mimic tissue antigens of rainbow trout (Salmo gairdne-
ri Rafmesque) // J. Fish. Res. Bd. Canada. 1974. Vol. 31. P. 1481—
1484.
Pfeiffer L. Die Protozoen als Krankheitserreger. Jena, 1895
Plehn M. Die Drehkrankheit der Salmoniden // Allg. Fisch. 1906.
Bd31. S. 465—470.
Plehn M. Praktikum der Fischkrankheiten // Handbuch der Binnen-
fischerei Mitteleuropas. Stuttgart, 1924. Bd 1. S. 301—470.
Poche F. Das System der Protozoen // Arch. Protistenk. 1913.
Bd30. S. 125—321.
Pote L. M., Hanson L. A., Shivaji R. Small subunit ribosomal
RNA sequences link the cause of proliferative gill disease in channel
catfish to Henneguya n. sp. (Myxozoa: Myxosporea) // J. Aquat. Animal
Health. 2000. Vol. 12. P. 230—240.
Schlegel M., Lom Y., Stechmann A. Phylogenetic analysis of
complete small subunit ribosomal RNA coding region of Myxidium lie-
berkuehni: evidence that Myxozoa are Metazoa and related to Bilate-
ria // Arch. Protistenkd. 1996, Vol. 147. P. 1—9.
Schroder O. Buddenbrockia plumateliae, eine neue Mesozoenart
aus Plumatella repens L. und Pl. fungosa Pall, II Ztschr. Wiss. Zool.
1910. Bd 1056. S. 525—537.
Schroder O. Weitere Mitteilungen zur Kenntnis der Buddenbro-
ckia plumatellae 01. Schroder // Verb. Nat.-med. Ver. Heidelb. N. F.
1912. Bdll. S. 230—237.
Siddall M. E., Martin D. S., Bridge D., Desser S. S., Cone D. K.
The demise of a phylum of protists: phylogeny of Myxozoa and other
parasitic cnidaria // J. Parasitol. 1995. Vol. 81. P. 255—304.
Siddall M. E.,Whiting M. F. Long-branch abstractions // Cladis-
tics. 1999. Vol. 15. P. 9—24.
Smothers J. F., van Dohlen C. D., Smith L. H., jr, Spall R. D.
Molecular evidence that the myxozoan protists are metazoans // Science.
1994. Vol. 265. P. 1719—1721.
StoIC A. Actinomyxidies, nouveau groupe de Mesozoaires parent
des Myxosporidies // Bull. Inti. Acad. Sci. Boheme. 1899. Vol. 22.
P. 1—12.
Swearer S. E., Robertson D. R. Life history, pathology, and des-
cription of Kudoa ovivora n. sp. (Myxozoa, Myxosporea): an ovarian
parasite of Caribbean labroid fishes // J. Parasitol. 1999. Vol. 85.
P. 337—353.
Thelohan P. Observation sur les myxosporidies et essai de classifi-
cation de ces organismes // Bull. Soc. Philom. 1892. Vol. 4.
P. 165—178.
Thelohan P. Recherches sur le developement des spores chez les
Myxosporidies // C. R. Soc. biol. 1890. Vol. 2. P. 602—604.
Thelohan P. Recherches sur les Myxosporidies // Bull. Sci. Fr.
Belg. 1895. Vol. 26. P. 100—394.
Thelohan P. Sur la constitution des Spores des Myxosporidies //
C. R. Acad. sci. 1889. Vol. 109. P. 919—922.
Thelohan P. Sur les affinites reciproques des Myxosporidies //
C. R. Acad. sci. 1894. Vol. 118. P. 428—430.
Tripathi Y. R. Some new Myxosporidia from Plymouth with a
proposed new classification of the order // Parasitology. 1948. Vol. 39.
P. 110—118.
Walliker D. The nature of the iodinophilous vacuole of myxospori-
dian spores, and a proposal to synonymize the genus Myxosoma Thelo-
han, 1892 with the genus Myxobolus Butschli, 1882 // J. Protozool.
1968. Vol. 15. P. 571—575.
Weill R. L'enterpretation des Cnidosporidies et la valeur taxohomi-
que de leur cnidomes. Leur cycle compare a la phase larvaire des Narco-
meduses Cuninides // Trav. Stat. Zool. Wimpereux. 1938. Vol. 13.
P. 727—744.
Wolf K., Markiw M. E. Biology contravenes taxonomy in the My-
xozoa: new discoveries show alternation of the invertebrate and verte-
brate hosts // Science. 1984a. Vol. 225. P. 1449—1452.
Wolf K., Markiw M. E. Salmonid whirling disease: new findings
indicate that infective stage produced in and released by tubificid oli-
gochaete is a Triactinomyxon 11 Fish Health News. 1984b. Vol. 10.
P.2-4.
Xiao C., Desser S. S. Cladistic analysis of myxozoan species with
known alternating life-cycles II Syst. Parasitol. 2000. Vol. 46.
P. 81—91.
УКАЗАТЕЛЬ ЛАТИНСКИХ НАЗВАНИЙ*
Abathostoma рис. 11 (вкл.), 830, 836
abdominalis, Tipula 180
Abelspora 1025
Abylopsis 188
abyssinicus, Turtur 269
Acanthocystis 721
Acanthodactylus 203, 345
Acanthodiophrya 897
Acanthodiophryinae 895, 897
Acanthogammarus 726
Acanthogregarina 119
Acanthophrya SOO, 900
Acanthophrinae 61, 132, 900
Acanthospora 74, 132
Acanthosporidium 134
Acanthosporinae 83, 96
Acanthostomella 516, 517
acarivora, Intexta 1018
Acarogregarina 102
Acartia 883, 914, 940
Acaryophrya 577
acervulina, Eimeria 218, 219, 345
achaetaeabbreviatae, Gregarina 120
Achromaticus 366
aciculata, Garnhamia 112, 113, 116
aciculata, Gregarina 116
Acidophorus 739, 740
Acilius 130
Acineria 571, 573, 583, 585, 587
Acineta 389, 679, 682, 687, 693, 705—709, 711, 815, 960
Acinetella 707
Acinetida 705
Acinetidae 705
Acinetides 711
Acinetoides 660
Acinetopsidae 708
Acinetopsis 681, 708
Acmaea 499, 872, 908, 923, 927, 967
Acoelophthirius 716
Acomia 814, 836
Acroloxus 658
Acropisthiidae 549
Acropisthiina 547
Acropisthium 548, 549
Actinia 879
* Курсивом выделены названия родов и видов.
Actinichona 673
Actinichonidae 672
Actinobolina 559, 569
Actinobolinidae 569
Actinobolus 548
Actinobranchiidae 716
Actinobranchium 716
Actinocephalidae 22, 25,45,48, 59, 61, 66, 74, 79, 83, 96,102,122,
126, 128, 132
Actinocephalus 126
Actinocyathula 698
Actinocyathus 698
Actinoloba 879
Actinomyxida 1047, 1054
Actinomyxidia 1047, 1057, 1058
Actinorhabdos 550
Actinosporea 1053, 1054, 1079
aculeatus, Gasterosteus 1022, рис. 412 (вкл.)
acuminata, Frontonia рис. 233 (вкл.), рис. 250 (вкл.)
acus, Actinocephalus 132
acus, Gregarina 132
Acuta 136
acuta, Gregarina 62
Acutidae 25, 136
Acutispora 123
acutum, Parauronema 391, 399
Acyclochaeta 972
adami, Haemoproteus (Polychromophilus) 276
Adamsia 879
Adelea 179
Adeleida 11, 149, 178, 258, 345
Adeleidae 179
Adelina 179
Adelphocystis 105
adersi, Culicoides 272
adiei paddae, Haemogregarina 207
adiei, Atoxoplasma 207
adiei, Lankesterella 207
Adocia 690
Aduncuperistomatus 536
adustus, Canis (Thos) 361
Aedes 25, 50, 276, 288, 297, 809, 811
aedis, Edhazardia 1035
Aedispora 1035
Aegla 964, 965
aegleflni, Myxobolus 1063, 1065
aegypti, Aedes 32, 74, 76, 102, 1035
aegypti, Hepatozoon 190, 191, 193
1084
УКАЗАТЕЛЬ ЛАТИНСКИХ НАЗВАНИЙ
aegyptium, Hyalomma 348
Aegyria 643, 647
Aegyriana 647
Aegyrianidae 643
aeikineta, Adelphocystis 105
Aelosoma 888, 894
aeneus, Meligethes 1039
Aeschna 96
aeschnae, Syncystis 56
aestivus, Rhizotrogus 118
aethiops, Cercopithecus 224, 272
Aethomys 309
africana, Mansonia 1034, 1038
africana, Wenyonella 224
africanus, Stylocephalus 44
Afroamphisiella 460
Afrothigma 864
Afrothrix 480
Agamococcidiida 149, 171
Agarella 1048, 1049, 1068, 1077
Agglomerate 1025
Aggregata 152, 196, 197
aggregata, Helmichia 1027
Aggregatidae 196, 197
agilis, Darevskia 192
agilis, Legeria 128, 129
agilis, Leptotheca 1050
agilis, Mabuya 277, 279
agilis, Monocystis 41, 43, 62, 81, 105, 107
Aglaophenia 908, 934
Agmasoma 1028
Agnathodysteria 644
agrestis, Microtus 236, 247, 248
agriocnemidis, Levinea 132
Agriocnemis 235
Agriodrilus 896
Agriolimax 807
Agrion 135
Agrionemys 132, 592
Agrippina 131
Agrypnia 127
ahsata, Eimeria 220
Aikinetocystis 104, 108
Aiptasia 879
Akiba 259, 321, 323
Akidodes 889, 892
Akis 125
alajense, Tetisimulium 1023, 1036
Alaspora 131
Alatasporidae 1048, 1049, 1094
Alataspora 1048, 1049, 1068, 1075
alaudae, Haemoproteus 288
alba, Tyto 246
Albaretia 543
Albertisella 107
albidus, Cyclops 1025, 1026
albidus, Macrocyclops 1026
albimanus, Anopheles 319
albissima, Planaria 101
albogularis, Gonatodes 230, 313
albogularis, Isospora 230
albolabris, Triodopsis 207
Alburnus 821
Alderia 705
Alexandria 778, 781
Alexandrina 438
Alexia 849
Alfvenia 1002, 1028
algerianus, Cystocephalus 33, 120, 121, 125
Alinostoma 636
Allantocystidae 24, 109
Allantocystis 110
Allantosoma 695, 700
Allantosomatidae 610, 694
Allantoxena 695
alliaria, Kudoa 1062
Alligatoridae 319
Allocentrotus 836
Alloglugea 1022
Alloiozona 588, 598, 599, 610
Allolobophora 897
Allomeron 907, 908, 912, 913, 916, 918, 936, 955
Allosphaerium 650, 876
Allotrica 463
Allurus 900
Alma 864, 865, 888, 897, 899, 902
Almophrya 902
Alveocystis 163, 196, 208, рис. 88 (вкл.)
Alveolata 5, 6, 82, 402
Alyscum 830, 836
amamiensis, Kudoa 1066
amaroucii, Merogregarina 88
Amaroucium 88
ambiguus, Plectroplites 1066
ambiguum, Spirostomum 372, рис. 232 (вкл.), рис. 240 (вкл.),
рис. 253 (вкл.), 428, 430, 432
Ambiphrya 907, 914, 919, 922, 966
Amblyospora 997, 1002, 1008, 1010, 1016, 1035—1037
Amblyosporidae 1001, 1037
Amblyosporoidea 1037
Ambystoma 906
Ameiurus 922
ameiva, Ameiva 238, 279
americana reperticia, Mazama 353
americanum, Blepharisma 404
americanus, Bufo 259
A meson 1002, 1032
Amieta 867
ammon, Ovis 345, 357
Amoebapium 920
Amphacanthus 611, 613
Amphiacantha 1016
Amphiamblys 1017
Amphibothrella 567
Amphiglaucoma 814
amphiglenae, Myriosporides 177
Amphileptida 571, 573
Amphileptidae 583
Amphileptina 583
Amphileptiscus 571, 585
Amphileptus 373, 547, 570—573, 583—586
Amphipholis 882
Amphiplatyspora 124
Amphiplatysporidae 124
Amphipoda 399, 526, 964
Amphisia 476—478
Amphisiella 451, 454, 460, 482, 483
Amphisiellidae 451, 459, 460
Amphisiellides 451
Amphiura 882
Amphorella 130, 522
Amphorellopsis 522
УКАЗАТЕЛЬ ЛАТИНСКИХ НАЗВАНИЙ
1085
amphorellus, Amphorocephalus 131
Amphorides 522
Amphorocephalus 131
Amphoroides 130
Amplectella 521
Amplectellopsis 521
ampulla, Folliculina 440
ampullacea, Eufolliculina 440
Ampullacula 588, 598
Ampullariidae 494
Ampullaster 955
Ampullofolliculina 438
Amylophorus 598
Amylovoracidae 610, 627
Amylovorax 627
Anabaena 932
Anacharon 609
Anaplasma 369
Anarma 722, 723
anaspidis, Ganymedes 56, 108, 109
anatolicum excavatum, Hyalomma 332, 350, 351
anatolicum, Hyalomma 346, 348, 350, 360
Anatoliocirrus 468
anchi, Gigaductus 69, 117
Anchus 117
Ancistrella 873, 874
Ancistridae 868
Ancistrina 870
Ancistrocoma 653, 658
Ancistrocomtdae 652
Ancistrocomina 652
Ancistrospira 868, 869, 871, 873
Ancistrum 863, 868—873
Ancistruma 868, 870
Ancistrumidae 868
Ancistrumina 869—871, 873, 874
Ancistrus 868
Ancora 74, 101, 1017
Ancyrophora 74, 84, 132
Ancystropodium 467
andersoni, Cryptosporidium 213
andersoni, Dermacentor 361
Andreula 829—831
Androniscus 959
Andrusoviella 713
Anemadesma 647
Anemonia 879, 1060
Anepicytaria 79, 81, 86
Angeiocystidae 174, 177
Angeiocystis 177
Anguidae 277
Anguilla 844
anguilla, Anguilla 221
anguillae, Eimeria 221
anguillae, Epieimeria 221
Anguillidae 210
Anguillula 202
angularis, Mitopleistophora 1031
angulata, Sphaerospora 1064
angusta, Colpodella 14, 16, 19, 20
angusta, Heteromita 13, 19
angusta, Spiromonas 13
Angustofolliculina 439
anhinga, Anhinga 317
Anhymenia 972, 973
Anictostoma 751, 761
Anigsteinia 426, 428, 429, 977
Anilocra 916
Anisocomides 654
Anisogammarus 726, 887, 939, 963
Anisoloboides 115
Anisolobus 115
Anisus 871, 953
Anncaliia 1002, 1006, 1039, 1043
Annelophrya 904—906
annulata, Culiseta 294
annulata, Gonderia 346
annulata, Theileria 331, 332, 335, 336, 339—341, 345, 348—350
annulatum, Piroplasma 331, 348
annulatus, Botophilus 352, 353
Anodonta 857, 871, 973
anomala, Glugea 1021, рис. 412 (вкл.)
Anomalocardia 851
Anomia 872
Anopheles 288, 297, 305, 307, 309—311
Anophryoides 831, 840, 842
Anophrys 832, 833, 835, 839, 840, 842
Anoplodinium 611, 613
Anoplophrya 885, 886, 888—892, 895—897, 900—903
Anoplophryida 901
Anoplophryidae 608, 807, 850, 854, 895, 901
Anoplophryimorphes 884
Anoplophryinae 855
Anoplophryopsis 903
Anser 221
anser, Anser 221, 345
Antameron ZTl
antarctica, Kantharella 1042
antarctica, Wittmannia 1042
Antedon 831, 875
Anteholosticha 478
antennata, Phleoba 122
Anthacineta 707
Anthemosoma 332, 364
Anthemosomatidae 331, 332, 335, 363
Anthocephalus 130
Anthochloe 942
Anthocidaris 841
Anthonyella 896, 897
Anthonyellinae 895, 897
Anthopleura 879
Anthorhynchus 130
Anthostrombidium 503, 509, 511
Anthropoidea 309
Anth urceolaria 970
antiqua, Ademsmia 124
Antonactinomyxon 1047, 1052, 1068, 1080
Antonospora 1040
Aperthospathula 565
Apgaria 427, 428
aphiochaetae, Caulleryella 93
Apicomplexa 6,10,11,18,23,24,32, 66,82, 365,380,402,1017
Apicystis 24, 76, 97
Apigregarina 136
apillosa, Rungeuletiam 1041
Apionidium 577
Apiorhiza 920
Apiosoma 331, 352, 583, 715, 876, 907, 912, 917, 919—921, 966
Apiosomatidae 919, 920
Apiostyla 920
apis, Monoica 136
apis, Nosema 1011
1086
УКАЗАТЕЛЬ ЛАТИНСКИХ НАЗВАНИЙ
Apoamphileptus 585
Apoamphisiella 459
Apobryophyllum 567, 569
Apocolpoda 750, 758
Apocolpodidium 733, 741
Apocryptopharynx 422, 977
Apoenchelys 553—555
Apolocystis 57, 60, 63, 64, 71, 105
Apospathidium 564
Apostichopus 499, 872
Apostomata 877
Apostomatia 379, 396, 402, 406, 876—881, 888—893
Apostomatida 379, 403
Apostonema 928
Apourosomoida 468
appendiculate, Slavinia 179
appendiculatus, Rhipicephalus 332, 346, 353
Apsiktrata 775
Apsiktratidae 775
aquaticus, Asellus 1038
arabica, Sultanophiys 419
Arachnella 511, 512, 518
arachnicolum, Oligosporidium 1021
Arachnidium 511, 512
Arachnidiumia 511, 512
Arachnocystis 118
Arachnodinella 622
Arachnodinium 615, 622
Arachnoidea 345
arachnoidea, Arachnocystis 118
araeoceri, Epicavus 43, 45, 131
Araeocerus 131
arakawae, Culicoides 325
arator, Heteronychus 179
arboricola, Culicoides 263
Arborocystis 108
Area 872
Arcacineta 692
Archaeolacerta 192
Archiastomata 753, 765
Archigregarina 22, 24, 79, 80, 83, 85
Archigregarinida 23, 24, 40, 84
Archigregarinina 24, 25, 33, 41, 61, 86, 87, 89
Archigregarinorida 23
Archinassula 740
Archistomatida 588, 589, 598
Archistomatina 547, 603
archiuli, Gibbsia 183
archosauriae, Progarnia (Progarnia) 319, 320
Arcopagia 868
Arcosoma 695
Arcostrombidium 503
arctica, Johansonia 187
Arcuospathidium 565, 568, 569
Arenicola 74, 923
arenicola, Ciliofaurea 422, 423
arenicolae, Gonospora 25, 74, 75
argentina, Babebsia 352
argentina, Babesiella 352
argentina, Francaiella 352
argentina, Microbabesia 352
argentinum, Piroplasma 352
argoisi, Mrazekia 1038
ariosi, Phlebotomus 1025
aries, Ovis 245, 353, 350, 357, 359
Aristerostoma 768
arloingi, Eimeria 220, 345
armata, Corycella 128, 129, 132
armatus, Ascocephalus 131
Armiacineta 709, 710
Armichona 670, 674
Armidallis 627
armiger, Scoloplos 138, 140, 177
Armonyctea 523
Armophorea 372, 400, 404, 415, 523, 978
Armophorida 379, 390, 404, 528, 529
arndti, Monocystella 101
arnee, Bubalus 346, 348, 352, 353
arpadi, Hybomitra 1035
Arthrocystis 240
arthuri, Kabataia 1042
Artiodactyla 272, 345, 346
arvalis, Microtus 236, 246, 343, 352
Ascampbelliella 515
Ascampbelliellidae 514
ascidiae, Lankesteria 21, 25, 28, 50, 75, 101, 1032
ascidiae, Monocystis 101
Ascobius 439—439, 441, 443
Ascocephalus 131
Ascocystis 45, 81, 102
Ascogregarina 73—75
Ascoidium 932
Ascophryidae 887
Ascophrys 881, 887
Asellarcon 642
Asellus 583, 936, 938, 954, 955
Aseptata 23—25, 33, 39, 77, 79, 81, 86, 97, 138
Aseptatorina 86
Asiamoeba 259, 286
asiaticum, Hyalomma 348
Asida 124
asinus, Equus 350, 360
asio, Phrynosoma 283
Askenasia 547, 555—557, 580, 581
Askoella 876, 881, 887
Askoellida 877
Ascogregarina 37, 45, 97, 102
Aspergillus 763
Aspidisca 396, рис. 223 (вкл.), 480, 484, 487—490, 494
Aspidiscidae 488, 494
Aspidiscina 480
Aspidiscopsis 489
Aspidochirota 499
aspis, Vipera 226
Astacus 583, 955
Astarte 872
Asterias 908
asterias, Bohuslavia 1028
Asterifer 686, 688
Asterina 498
Asteriscus 498, 973
Asteroidea 840
Asterophora 127
Astomata 376, 508, 816, 855, 861
Astomatia 379, 386, 387, 406
Astomatida 379, 389, 403, 415, 807
Astomatophorida 877, 979
astreoide, Porites 172
Astrocystella 107
Astropecten 498
Astrophrya 719
Astylosternus 546
УКАЗАТЕЛЬ ЛАТИНСКИХ НАЗВАНИЙ
1087
Astylozoidae 925, 929, 930
Astylozoon 925, 926, 934, 962
Astylus 119
Atelepithites 641, 650
atheruri, Plasmodium (Vinckeid) 309
Athripsodes 127
atomaria, Herpobdella 179
Atopochilodon 636, 638
Atopodinium 530, 538
Atopospira 528
Atoxoplasma 196, 202, 206
Atoxoplasmatidae 196, 206
Atractos 471
atrata, Silpha 133
Atriofolliculina 438, 439, 444
attenuatum, Cygnicollum 98
attenuatum, Plasmodium (Carinamoeba) 279
Atyidae 686
auburnensis, Eimeria 219
audaciosa, Fallisi (Fallisia) 315
audinae, Spherospora 1030
audoboni, Sylvilagus 352
Audouinia 47
audouiniae, Angeiocystis 177,. 178
Auerbachia 1048, 1049, 1066, 1068
Auerbachiidae 1048
Aulacophora 118, 119, 127
Aulax 833, 835
Aulaxella 833, 835
Aulofolliculina 438, 439
Aurantiactinornyxon 1047, 1050, 1068, 1079
Auraspora 1033
auratus, Mesocricetus 343
aureum, Simulium 323
aureus, Canis 361
Aurichona 666
auricularia, Forflcula 21, 115
auritus, Hemiechinus 343
Australana 947, 965
australis, Boophilus 352, 353
Australocirrus 464
Australothrix 453, 455, 476
austrosimulii, Hirsutosporos 1040
Authadias 302
Autochloe 942
Avelia 425, 426, 977
Aveliidae 416, 425
Aves 366
Avestina 761
avicularia, Ornithomyia 271
Ay lax 833
babaulti, Cyclospora 224
Babesia 331, 332, 343, 345, 345, 352, 366, 368, 369
Babesiella 331, 352
Babesiidae 331, 332, 335, 341, 343, 346, 352, 366
Babesiosoma 186, 195, 345, 365
Bacillidium 1006, 1038
bacillifera, Tabanispora 1000, 1034
bactrianus, Camelus 213, 350
Baculea 1017, 1023
Baculiapium 920
Baeonidium 577
Baetis 820
Baicalia 862
Baicalina 936
Baikalaster 932
Baikalocoleps 778, 780
Baikalodendron 719
Baikalonis 955
Baikalophrya 719
Baikaloscyphidia 923
Baikalotheca 948
Baikalothigma 871, 874
baileyi, Cryptosporidium 213, 215
bainae, Haemoproteus (Hepatocystis) 272
baiyeri, Endomycola 119
Bakuella 473, 474, 457
Bakuellidae 474, 475
bakuensis, Eimeria рис. 128 (вкл.), 220
balani, Gregarina 114
balani, Pyxinioides 53, 112—114
Balanion 776, 777
Balanionidae 777
Balanitozoon 787
'Balanonema 579, 825
Balanophrya 577
Balantidiida 590, 591
Balantidiidae 587, 598
Balantidioides 449, 592, 598, 754
Balantidiopsis 449, 589, 590, 593
Balantidium 400, 494, 588—591, 788, 902, 978
Balantiophorus 768, 814
Balanus 112, 114—116, 887, 917, 940
Balblania 240
balfouri, Hepatozoon 189
Batistes 925
balli, Haemogregarina 187, 194
balti, Schellackia 206
Ballodora 908, 914, 930, 955, 959, 960
Bananella 216
Bandia 612, 627
Bankia 872
barbatus, Gypaetus 366
Bardetiella 751, 762
Bardeliellidae 762
barretti, Ascogregarina 45, 47
Baritius 821
Barrouxia 196, 210
Barrouxidae 196, 209
Basitiscus 238
Basitokophrya 709, 710
Basopercularia 959
Bathyomphalus 871
baznosanui, Lankesterella 203
Beccaricystis 107
Becnetia 1037
beecheyi, Spermophilopsis 352
Beersena 734, 736
Beggiatoa 790
beklemishevi, Anopheles 1037
beklemishevi, Crepidula 1037
beklemishevi, Crepidulospora 1037, рис. 400 (вкл.)
belli, Isospora 229
Belonophrya 559, 569, 577
Belonophryina 547
beltrani, Plasmodium (Sauramoeba) 277
Benedenia 197, 885
Benedictia 862, 874
benedictia, Ladopsis рис. 232 (вкл.)
bengalensis, Pythonella 228
1088
УКАЗАТЕЛЬ ЛАТИНСКИХ НАЗВАНИЙ
Bennettinia 259, 299
berbera, Babebsia 352
berbera, Babesiella 352
berbera, Francaiella 352
berghei, Plasmodium (Vinckeia) 309
Berghophrya 559, 568
berglax, Macrourus 211
bertii, Plasmodium (Novyella) 295
Bertolinella 624
bertrami, Sarcocystis 245
berus, Vipera 224
Berwardia 2025
beryllina, Mendia 212
besnoiti, Besnoitia 238, рис. 135 (вкл.), рис. 136 (вкл.)
besnoiti, Globidium 238
besnoiti, Sarcocystis 238
Besnoitia 152, 196, 238—241
Betella 624
Bezedniella 100, 911, 960
bhatiasetnai, Caulocephahts 127
biaurelia, Paramecium рис. 236 (вкл.), рис. 246 (вкл.), рис. 247
(вкл.)
Bibio 122
Bibopercularium 959
bibrovlii, Pachydactylus 230
bicarinatus, Neusticurus 315
bicolor, Gallerucida 119
bicornis, Ophelia 172
Bicoronella 456, 473
bieneusi, Enterocytozoon 1001, 1018
bifasciatum, Thalassoma 1056
Bijilida 115
biformis, Gurleyides 1024
biformis, Nudispora 1030
bigemina, Apiosoma 353
bigemina, Babesia 331, 332, 335—337, 341, 343, 345, 352—356,
359, 360, 368
bigemina, Isospora 230, 231
bigemina, Pintospora 119
bigemina, Pyrosoma 6, 330, 353
bigeminum, Piroplasma 331, 353
bigenetica, Caryospora 226
Biggaria 829, 833—835, 847
Biggariella 834
Biguetiella 273
Bilamellophrya 560
Bilateria 1058, 1059
Billbraya 277
binucleata, Dobellia 178
Binucleospora 141, 1006
Bioccala 276
Bipolarina 1047, 1048, 1059, 1067
Bipteria 1048, 1049, 1068, 1072
bipunctulata, Argia 133
birmanica, Nellocystis 107, 108
Birojimia 476
bison, Bison 244, 348, 353
Bithynia 854, 855, 888, 979
bitis, Plasmodium (Ophidielld) 288
Bitricha 612, 627
Bivalvia 876
Bivalvulida 1042, 1048, 1052, 1066, 1078
biziurae, Proteosoma 288
Bizonula 830
blaberae, Gregarina 32, 40, 41, 43, 45, 50, 51, 54, 64, 66, 72, 73,
75, 84
blandingi, Emys 260
Blaps 39, 69, 93
Blastogregarinida 11, 24, 25, 138
Blastogregarinorina 23, 86
blattarum, Gregarina 56, 74
Blattidae 538
Blennidae 210
Blepharisma 378, 386, 388—390, 396, рис. 223 (вкл.), 426—429,
527
Blepharismidae 427, 436
Blepharocodon 598
Blepharoconus 588, 599, 600
Blepharocorys 604—607, 620
Blepharocorythida 603—605
Blepharocorythidae 604
Blepharocorythina 603
Blepharomonas 599
Blepharoplanum 599
Blepharoprosthium 599
Blepharosphaera 599
Blepharostoma 447
Blepharozoum 589, 598, 599
blochmanni, Furgasonia 405
boa, Sthenelais 171, 172
boeckella, Nelliemelba 1026
Bohuslavia 1028
bolivari, Schellackia 203, 206, 345
Bolivia 116
bombi, Apicystis 39, 97
bombi, Mattesia 39, 97
bombycis, Nosema 1039
bonasia, Tetrastes 263
bonelliae, Gregarina 102
bonelliae, Ophioidina 102
borealis, Buteo 247
borneensis, Gonyocephalus 279
Bothriopsides 128
Bothriopsis 128
Bothrostoma 524, 527
Botticula 436, 438, 439
Boveria 872—874, 876
bovicanis, Sarcocystis 165, 230, рис. 56 (вкл.), рис. 135 (вкл.),
рис. 142 (вкл.)
bovifelis, Sarcocystis 230, 245
bovihominis, Sarcocystis 230
bovis, Babebsia 331, 332—337, 341, 343, 352, 353, 356
bovis, Eimeria 155, 157, 159, 165, 220, рис. 90 (вкл.)
bovis, Haematococcus 330, 352
bovis, Microbabesia 356
Bozasella 621
Brachiola 1006, 1011, 1040
Brachionella 527
Brachonella 524—529
brachyfila, Cryptosporina 1029
Brachyosoma 712
Brachythemis 135
bradae, Mastigorhynchus 41, 98, 100
brakeleyi, Corethrella 1029
Branchiocoma 654
Branchioecetes 548, 568
Branchiura 893
Brandtiella 523
Brantha 221
brasili, Lecudina 62, 66
brasili, Polyrhabdina 1016
brasiliensis, Dirhynchocystis 107
УКАЗАТЕЛЬ ЛАТИНСКИХ НАЗВАНИЙ
1089
brassicae, Pieris 1011—1013
brayi, Haemoproteus (Hepatocystis) 272, 273
Bresslaua 759
Bresslauides 750, 761
brericauda, Jirovecia рис. 399 (вкл.)
brevifilum, Tetramicra 1019
brevis, Armandia 1041
brevistylis, Petrobius 1018
Brooklynella 644, 650
brucechwatti, Haemoproteus (Nycteria) 273
brucei, Heteroxyrax 363
brumata, Operophtera 1021, 1022
brunetti, Eimeria 151, 152, 218, 345
Brustiospora 135
Brustiosporidae 25, 135
brygoi, Schellackia 206
brygooi, Plasmodium (Lacertamoeba) 281
Bryometopida 379, 771
Bryometopidae 772
Bryometopus 523, 758, 772, 978
Biyonosema 1042
Bryophrya 767
Bryophryida 379, 766
Bryophryidae 766
Bryophyllidae 567
Bryophyllum 548, 552, 567, 585
bryosalmonae, Tetracapsula 1056, 1060, 1079
Bryozoa491, 531, 1042, 1056
bryozoides, Tetracapsula 1058, 1060
bubalis, Plasmodium (Vinckeia) 307
bubonis, Caryospora 227
bubonis, Leucocytozoon 323
Buchneriella 900
Buddenbrockia 1058, рис. 424 (вкл.)
Buetschlia 599
Buetschliella 600, 602, 889, 900, 901, 903
Buetschliellidae 901, 903, 978
Buetschliellopsis 889, 892, 894
Buetschliidae 598, 603
Bufo 259, 538, 546
bufonis, Alloglugea 1022
Buissonella 600
Buitkampia 768
Bulbocephalus 125
bulbus, Orbocephalus 126
bullinum, Lembadion 386, 405
Bundleia 600
Bunodes 879
Bunodosoma 879
bunoi, Haemoproteus (Polychromophilus) 276
Burenella 1002, 1033
Burenellidae 1033
Burenelloidea 1033
buri, Myxobolus 1065
Burkea 1018
Burkeidae 1017, 1018
burlaki, Amblyospora рис. 403 (вкл.)
bursa, Rhipicephalus 334—336, 350—353, 356—360
Bursaopsis 522
Bursaria 387, 389, 390, 396, 404, 473, 758, 784, 974, 978
bursaria, Paramecium 377, 388, 398—400, рис. 241 (вкл.),
рис. 244 (вкл.), рис. 246 (вкл.), рис. 248 (вкл.), рис. 257
(вкл.)
Bursariamorphida 764
Bursaridiidae 765
Bursaridium 753, 754, 765
Bursariidae 764
Bursariina 760
Bursariomorphida 379
Bursarium 804
Bursellopsis 579, 780, 784, 787
Bursostoma 766, 817, 818
Bursostomidae 817
burti, Colepismatophila 126
burti, Zeylanocystis 41, 108
Buschiella 522
buteo, Buteo 247
buteonis, Isospora 230
biitschlii, Ophryocystis 21, 93
Buxtehudea 1018
Buxtehucleidae 1017, 1018
Buxtonella 591
caballi, Babebsia 351, 356, 360, 361
caballi, Piroplasma 360
caballus, Equus 343, 350, 360
caeca, Talpa 368
Caedibacter 399
Caenis 400
Caenomorpha 523, 527—529, 531
Caenomorphidae 404, 528
Caenomorphina 526
caerulea, Hyla 202, 203
caffer, Syncerus 346, 353
Calanoida 883
calcaratus, Boophilus 352, 354
Calcaria 531
Calceolus 802
californica, Amblyospora 1037
californica, Pheretima 1018
californicus insignis, Peromyscus 352
californicus, Microtus 352
Caligicola 649
Caligus 940
Caliperia 499, 924, 925
calkinsi, Paramecium рис. 244—248 (вкл.)
Calkinsium 804
Calliactis 879
Callidina 449, 716
callidus, Chrysops 260, 263
callospermophili, Eimeria 157, 159
Callynthrochlamys 114
Calopteryx 135
Caloscolex 611
Calospira 878
Calpionellidae 518, 519
calvum, Peliolepisma 126
Calyptospora 196, 211
Calyptosporidae 196, 211
Calyptotricha 829, 834
Cambaridae 949
Cambolopsis 120
cambolopsis, Hyalosporina 120
cambridgei, Xysticus 1021
camelensis, Theileria 350
cameli, Sarcocystis 245
Camelotricha 595
Cameronyctus 538, 591
Campanacephalus 125
Campanella 906, 907, 911, 914, 916, 918, 936
Campanuliapium 920
69 Зак. № 4163
1090
УКАЗАТЕЛЬ ЛАТИНСКИХ НАЗВАНИЙ
Campanulospora 1006, 1040
Campeloma 855
Campylodinium 611
Campylodon 641
Campylopus 494
canachites, Haemoproteus 263
canadensis, Canachites 265
canaria, Isospora 230
canaria, Serinus 302
canariensis, Pseudolynchia 271
canceri, Nadelspora 1021
Candona 938, 1041
canestrini, Ornithodoros 357
caninum, Neospora 239, 240, рис. 137 (вкл.), рис. 138 (вкл.)
Canis 189
canis, Achroinaticus 361
canis, Babebsia 335, 336, 341, 343, 345, 361—363
canis, Hepatozoon 189, 190
canis, Isospora 152; 157, 229
canis, Toxoplasma 233
canningae, Auraspora 1033
Canningia 1001, 1020
Canthariella 522
Canthocamptus 946, 947
capensis, Rhipicephalus 346
capistrani, Plasmodium 288
capitata, Cometoides 62
capitatus, Cometoides 128, 129
Capitella 74
capitellides, Amphiamblys 1017
capito, Anolis 279
capracanis, Sarcocystis 245, рис. 72 (вкл.)
Caprella 886, 887
Caprellidae 886
capreoli, Babebsia 345
capreolus, Capreolus 345, 356
Capriniana 699, 717
Caprinianidae 717
caprofelis, Sarcocystis 245
Capsa 498
captiva, Chlamydocystis 101
capucinus, Cebus 309
Carabus 133
carassii, Hoferellus 1064
carassii, Myxobolus 1065
Carchesium 373, 385, 907, 908, 911—913, 930, 936—939, 959
carcini, Ormieresia 1030
Carcinoecetes 111
Carcinus 197
Cardiomyxobolus 1048, 1068, 1071
Cardiostoma 826
Cardiostoniatella 823, 826, 837
Caridohabitans 112
Carinamoeba 259, 277, 279
Carinichona 672
carinii, Plasmodium 279
Carinogammarus 938, 939
Carinoposthium 625
Carnivora 345, 346
carnivoralis, Rhipicephalus 346
carophis, Madagas 192
Carpiodes 585
caryolytica, Cyclospora 224
Caryophagus 216
Caryospora 150, 162, 196, 224, рис. 131 (вкл.)
Caryotricha 481
Caryotropha 196, 201
Caryotrophidae 196, 201
caseosa, Goussia (Plagula) 211
Caspionella 829, 834, 836
caspius dorsalis, Aedes 1035
castaneus, Tribolium 93, 118, 119, 179
Castrada 816
catenatus, Sistrurus 226
catenigera, Placobdella 186
catesbeiana, Rana 202
cathemerium, Plasmodium (Haemamoeba) 288
catus, Felis 168, 213, 237, 238, 245, 343
caucasica, Francaiella 356
caucasica, Haemoproteus (Simondia) 260
caudata, Jirovecia 1038
caudata, Nematocystis 105
Caudatum 804
caudatum, Paramecium 384, 385, 388, 396, 399, 405, рис. 230—
233 (вкл.), рис. 235 (вкл.), рис. 236 (вкл.), рис. 241 (вкл.),
рис. 243 (вкл.), рис. 244 (вкл.), рис. 246—249 (вкл.), рис. 251
(вкл.), рис. 252 (вкл.), рис. 256 (вкл.)
caudatus, Bodo 13
caudatus, Myxoproteus 1050
caudatus, Priapulus 208, рис. 88 (вкл.)
Caudiholosticha 478
Caudomyxum 1048, 1049, 1068, 1074
Caudospora 997, 1002, 1006, 1040
Caudosporidae 1039, 1040
Caulicola 952
Caulleryella 38, 92
Caulleryellidae 24, 25, 30, 69, 80, 90, 92, 96
Caulleryetta 1017
caulleryi, Leucocytozoon (Akiba) 323, 325, 327—329
caulleryi, Selenidium 30
Caulopephalus 127
cavernosa, Montastraea 172
caviae, Toxoplasma 233
Cavichona 668, 669
cavus, Dibrachis 1011, 1012
cayetanensis, Cryptosporidium 224
cayetanensis, Cyclospora 224
Cebidae 272
celer, Bodo 13
Celeritia 577
Centropages 883, 914, 940
Centrophorella 387, 419, 420, 815
Centrophorus 419
Cepedella 816
Cepedellidae 816
Cepedietta 904, 906
Cepediettinae 904
cephalis, Myxobolus 1065
Cephalocystis 105
Cephaloidophora 25, 54, 66, 76, 112
Cephaloidophoridae 25, 74, 112
Cephalolobidae 25, 114
Cephalolobus 114
Cephalopoda 884, 1042
Cephalorhynchus 571
Cephalospathula 568
Cephalotrichium 504, 511
Ceratochona 6TL, 676
Ceratomyxa 1048, 1049, 1052, 1053, 1059, 1067, 1068, 1073
Ceratomyxidae 1042, 1048, 1049, 1073
Ceratophyllus 131
Ceratopogon 130, 1030, 1031
УКАЗАТЕЛЬ ЛАТИНСКИХ НАЗВАНИЙ
1091
Ceratopogonidae 259, 263, 272, 277, 281, 320, 323, 325
Ceratospora 104
Cercocebus 111
cercopitheci, Cyclospora 224
Cercopithecus 272
cerebralis, Henneguya 1065
cerebralis, Myxosoma 1050, 1054—1056, 1058, 1062, 1063, 1065,
рис. 423 (вкл.)
Ceriagrion 134
cernae, Sarcocystis 246
Certesia 484, 486, 488
Certesiidae 487
chabaudi, Plasmodium (Vinckeia) 309
Chaenea 548—550, 557, 848
Chaetogaster 903
Chaetognatha 402
Chaetospirina 480
Chagasella 179
Chakravartiella 102, 104
chalcides, Choleoeimeria 221
chalcides, Tyzzeria 221
chalidicolubris, Sarcocystis 246
chapmani, Hyalinocysta 1029
Chapmanium 1028, 1029
Characidae 821
Charon 605
Charonella 605
Charonina 605—607
Charonnautes 606
Chasmatostoma 749, 815
Chattonella 888
chattoni, Glaucoma 405
Chattonia 883
Chattonidiidae 431
Chattonidium 426, 431
chaudefouri, Didymophyes 37
Cheissinella 893, 895
Cheissinia 868, 871, 874
Cheissinophrya 897
chelodinae, Haemoproteus (Simondia) 260
chelonia, Tunetella 365
Chenophrya 714
Cherax8\\, 964
Chilenophrys 947, 965
chilense, Gigantodox 1030
Chiliodonella 373
Chilodina 732
Chilodochona 664
Chilodochonida 664
Chilodochonidae 664
Chilodon 728, 743
Chilodonatella 637
Chilodonella 389, 390, рис. 223 (вкл.), 631, 632, 634
Chilodonellidae 632
Chilodonopsis 743
Chilodontopsis 728, 729, 734
Chilogregarina 131
Chilophrya 785
chinchillae, Eimeria 167, 219
chinensis, Pileocephalus 127—129
chione, Macrobrachium 212
chiricahuae, Plasmodium (Paraplasmodium) 283
chiridotae, Urospora 25, 31, 41, 52, 53, 104
chironomi, Cylindrospora 1027, рис. 401 (вкл.)
chironomi, Evlachovaia 1033
chironomi, Microsporidium рис. 399 (вкл.)
chironomi, Neoperezia 1000, 1033, рис. 393—395 (вкл.), рис. 412
(вкл.)
chironomi, Semenovaia 1034, рис. 400 (вкл.)
chironomi, Striatospora 1027, рис. 399 (вкл.), рис. 414 (вкл.)
Chiroptera 272, 273, 276, 307
Chitinoidella 523
Chitonella 638
Chitonellidae 638
Chitonida 869
chitonis, Pseudoklossia 223
Chlaenius 131, 133
Chlamydobundleia 600
Chlamydocystis 101
Chlamydodon 635, 640, 898
Chlamydodontida 379, 387, 632
Chlamydodontidae 640
Chlamydodontopsis 633
Chlamydomonas 13
Chlamydonella 636, 638, 644
Chlamydonellopsis 638
Chlamydonyx 637, 647
Chlorella 391, 400
Chloromyxidae 1048
Chloromyxum 1048, 1049, 1052, 1068, 1074
chloropsidis, Plasmodium 288
Choanocystella 108
Choanocystis 108
Choanocystoides 108
Choanomphalus 870, 873, 874
Choanophrya 697, 712, 717
Choanostoma 577
Choleoeimeria 216
Chonosaurus 671, 676
Chonotricha 385, 393, 395, 397, 400, 401, 663—676
Chonotrichia 379, 380
Choreotrichia 379, 386, 406
Choreotrichida 379, 403, 510
christinae, Nats 1039
Chromatophagus 821
Chromidina 877, 884, 885, 979
Chromidinida 877
Chromidinidae 885
Chromidotilapia 538
chthamali, Pyxinioides 112
chukar, Alectoris 263
Chytridioides 1017
Chytridiopsida 1001, 1017
Chytridiopsidae 1001, 1004, 1011, 1017
Chytridiopsis 1017, 1042
Chytridium 570
Cichlidae 538, 821
cichlidarum, Goussia 211
cichlidarum, Goussia (Goussia) 211
Cichlidotherus 535, 538, 539
Ciconiiformes 317
ciliata, Myxocystis 1042
Ciliatosporidium 1021
Ciliofaurea 416, 421, 422, 424
Ciliomorgania 860
Ciliophora 371, 372, 376—379, 386, 391, 398, 402, 415
Ciliospina 512
cincinnatus, Thelepus 101
cinerea, Nepa 96, 130, 210
cinereoniger, Limax 229
cinereus, Graphoderes 130
Cinetochilidae 822, 827, 828
1092
УКАЗАТЕЛЬ ЛАТИНСКИХ НАЗВАНИЙ
Cinetochilum 824, 827, 828
Cinetozona 828
cionae, Gregarina 101
cionae, Urospora 101
circi, Amphoroides 33, 48
Circinella 459
Circodinium 604—607
Circolagenophrys 947, 948, 963, 964
circumflexum, Plasmodium (Giovannalaid) 292, 294, 295, 297
circumflexum, Proteosoma 294
circumscriptus, Culicoides 325
Cirranter 528, 530
cirratuli, Ditrypanocystis 89
Cirratulidae 89, 898
cirratulus, Nerine 87
Cirrhogaster 491
Cirrigregarina 116
Cirripedia 112, 940
cirritus, Chapmanium 1029
Cirrophrya 769, 933
Cistelides 132
citrina, Phyllodoce рис. 12 (вкл.)
Cladonema 498
Cladotricha 461
Cladotrichidae 460
clamitans, Rana 203
Claparedia 461
claparedianus, Limnodrilus 1042
clarissimum, Blepharisma 428
Clathrostoma 800, 850
Clathrostomatidae 800
clausii, Cephaloidophora 116
Clausilia 851
Clausilocola 904
Clausilocolidae 888, 904
Clausophrya 924
Claustrofolliculina 438, 439
Clavicephalus 126
claviformis, Rhabdocystis 105
Clavoplites 549
cleava, Deuteromera 117
clelandi, Plasmodium (Asiamoeba) 286
clethrionomyobuteonis, Frenkelia 247
Clethrionomys 73
Clevea 521
Clevelandella 541, 542, 545, 978
Clevelandellida 379, 404, 523, 533, 534, 536, 537, 542—545, 978
Clevelandellidae 404, 535, 541, 542
Clevelandelloidea 534
Climacocylis 516, 519
Climacostomidae 432
Climacostomum 385, 391, 398, 426, 431, 432, 496, 977
Clistolagenophrys 964
Clitellio 893
clupearum, Coccidium 211
clupearum, Eimeria 211
clupearum, Goussia 211
clupearum, Goussia (Goussia) 211
clupeidae, Kudoa 1066
Clypeolum 504
Clypta 487
cnemidophori, Plasmodium (Sauramoeba) 1T1
Cnemidospora 122
Cnemidosporidae 25, 48, 120
Cnidaria 402, 1059, 1060
Cnidosporidia 1057
coatneyi, Plasmodium (Plasmodium) 305
Coccidea 11, 149
Coccidiazina 149
Coccidiomorpha 21, 22, 149
Coccidium 229
Coccomyxa 1048, 1067, 1068
Coccospora 1014, 1028, 1029
Coccudina 489
Cochlearia 955, 957
Cochleomeritus 100
Cochliatoxum 615, 623
Cochliodomus 849
Cochliophilus 849, 868
Codonaria 518
Codonella 513, 518, 523
Codonellidae 516
Codonellopsidae 518
Codonellopsis 514, 516—518
Codonopsis 518
Coecosphaeroma 950
Coelogregarina 24, 96, 97
Coeloperix 636, 639
Coelophrya 898
Coelosoma 576
Coelosomides 576
Coelothigma 864, 865
Coelotropha 152
Coelotrophidae 174
Cognettiella 117
Cohnilembidae 828
Cohnilembus 834, 839, 844, 845, 847
colchica, Francaiella 352
colchicus, Phasianus 263
Coleophora 130
coleopterata, Scutigera 123
Coleorhynchus 130
Colepidae 778
Colepismatophila 126
Coleps 373, 374, 380, рис. 223 (вкл.), 778, 788
colesi, Nicollia 9
Coliphorina 436, 977
collaris, Crotaphytus 283, 284
collaris, Helenophorus 125
colligata, Ordospora 1020
Colligocineta 654
Collinia 593, 877, 878, 885, 886, 888, 979
Colliniida 877, 885
Colliniidae 885
Colliniinae 878
Collinina 596
Collinophrya 685
colobi, Cyclospora 224
Colobus 272
colombiense, Plasmodium (Lacertamoeba) 281
Colomiellidae 518
Colpidium 373, 381, 383, 806, 812, 813, 815, 837
Colpoda 19, 81, 390, 401, рис. 223 (вкл.), 749, 750, 883, 978
Colpodea 372, 378, 379, 384, 388, 396, 406, 415, 745, 749—759
Colpodella 6, 8, 11—14, 18—20, 76, 77, 82, 752
Colpodellea 5, 11—13, 19, 20
Colpodellida 11—13, 19, 20
Colpodellidae 12, 13, 19, 20
Colpodelliodes 12
Colpodia 749
Colpodida 379, 403, 404, 749, 817
Colpodidae 389, 749
УКАЗАТЕЛЬ ЛАТИНСКИХ НАЗВАНИЙ
1093
Colpodidiida 740
Colpodidiidae 740
Colpodidium 733, 740
Colpodopsis 826, 830, 834
Coluber 246
Colubridae 288
columbae, Haemoproteus (Haemoproteus) 259,267,268,270, 271
columbiae, Psorophora 75
Columbidae 269, 317
Columbiformes 269, 317
Colymbetes 128, 130
cometa, Zygocystis 41, 43, 52, 53, 105
Cometodendron 1T1
Cometoides "14, 133
communis, Cephaloidophora 112, 113
communis, Panorpa 93
complanata, Glossiphonia 117
complanatum, Octolasium 105
compositus, Rhipicephalus 346
composticola, Mononchus 183
Compsosomella 859, 861
Conchacineta 707
Conchophthiriidae 828, 852
Conchophthirius 381,385, 494, 816, 828, 851—854, 860, 868, 871,
879, 903
Conchophyllum 851
Conchoscutum 853
concolor, Pteronemobius 124
concolor, Puma 237
Condylostentar 426, 428, 434
Condylostoma 428—430, 433, 434, 531, 977
Condylostomatidae 433
Condylostomides 433
congolensis, Haemoproteus (Nycteria) TTi
conica, Gregarina 126
Coniculoslomum 463, 465
conicus, Actinocephalus 126, 128, 129
conicus, Lateroprotomeritus 203
Conidophryida 877, 886
Conidophryidae 886
Conidophrys 877, 880, 887
Conispora 1072
Connectiana 865
Conochilus 929
Conocylis 505, 507
conoidea, Clepsidrina 115
Contofragmea 788
Contophrya 899
Contophryidae 899
contorta, Eimeria \ 61, 219
Contortiocorpa 101
contortipes, Strongylosoma 122
Contospora 134
copemani, Fallisi (Fallisia) 315
Copemetopus 430, 433, 525
Copepoda 883, 946, 1007
Corallocolpoda 761
cordiformis, Microsporidium рис. 399 (вкл.)
cordyli, Plasmodium (Carinamoeba) 279
Cordylosoma 919
coregoni, Chloromyxum 1065
corethrae, Systenostrema рис. 399 (вкл.)
Corethria 688
coris, Ceratomyxa 1042
Corixicola 956
Corlissetta 946
Corlissia 416, 426, 861
Corlissiella 902, 903
Corlissiellinae 901
corneae, Vittaforma 1040
corneus, Planorbaris 207
Cornimeritus 127
cornucephala, Ferraria 100
cornutus, Notropis 228
cornutus, Schulmania 1072
corolla, Acarogregarina 102
corolla, Gregarina 102
coronata, Liposcelisus 119
coronata, Monocystis 107
coronata, Stomatophora 107
Coronochona 675
Coronocyatus 704
Coronodiscophrya 724
Coronoepimeritus 133
Coronothigma 866
corradettii, Haemoproteus (Polychromophilus) 276
corsac, Vulpes 246
Corticocolpoda 758
Corycella 132
coryniformis, Cougourdella рис. 399 (вкл.), рис. 401 (вкл.)
Corynacineta 701
Corynoneura 1028
corynoneurae, Gurleya рис. 395 (вкл.), рис. 399 (вкл.)
corynoneurae, Toxoglugea рис. 399 (вкл.)
Corynophrya 699, 700, 713
Corynophryidae 713
Cosmetophilus 134
Cosmocolpoda 751, 760
costaricensis, Choanocystoides 107, 108
Cotensicoma 871, 874
Cotensita 908, 916, 936
Cothurnia 442, 444, 693, 907, 918, 927, 930, 943, 945—948, 950,
951, 953, 960
Cothumina 945
Cothurniopsis 945, 948, 949, 952
Cottidae 210
Cotylothigma 864, 866
Cougourdella 2024
Cougourdellidae 1024
cowani, Heterovesicula 1033
Coxliella 514, 516, 517, 519, 521, 523
Coxliellidae 519
Coxliellina 523
crandallis, Eimeria 220
Cranotheridium 566, 568
Craspedacusta 971
Craspedomyoschiston 908, 918, 930, 938—941, 955, 957
Craspedonotana 561
Craspedonotus 561
Craspedothorax 743
Crassichona 671, 673
Crassicollaria 523
crassus, Euplotes 396, 398
crater, Albertisella 107
Craterella 515
Craterina 931
Crateristoma 662, 663
Craterocystis 107
Crateromorpha 487
Craticuloscuta 862, 864, 866
Craticuloscutinae 864
Crebricoma 653, 655
1094 УКАЗАТЕЛЬ ЛАТИНСКИХ НАЗВАНИЙ
crenatus, Caulocephalus 127
Crepidula 1037
Crepidulospora 1037
Crevicometes 687
Cricocoleps 779
Cricundella 521
crinita, Thriptera 125
crinitus, Cometoides 133
Crinoidea 831
criodrili, Bacillidium 1038
Criodrilidae 897
criodrilii, Trigonepimerus 105
criodrilii, Trigonocephalus 105
Criodrilus 866, 903
cristatellae, Pseudonosema 1042
cristatum, Chloromyxum 1063
cristatus, Cristatus 236
Cristichona 672
Cristigera 830, 833, 835, 843, 845
Cristulospora 1002
Crobylura 577
Qrocodilia 319
crocodilus, Caiman 319
Crossacineta 707
Crossothamnium 943
Crucocephalus 132
cruzi, Orcheobius 179
cruzi, Sarcocystis 169, 244
Cryptacineta 711, 925
Cryptocaryon 402, 550, 577, 788
Cryptocaryonidae 788
cryptocerci, Adelina 179
Cryptocercus 542
Cryptochilidae 828
Cryptochilidium 835
Cryptochilum 830, 835, 837, 841
Cryptochona 664
Cryptocystidium 212
Cryptogemmida 379, 669
Cryptogemmina 663
Cryptolembus 835
Cryptonyctus 537
Cryptophagus 20
Cryptopharyngidae 421
Cryptopharynx 416, 421, 422, 977
Cryptophrya 712, 925
Cryptops 123
Cryptosporidiidae 196, 212
Cryptosporidium 81, 82, 149, 151, 152, 162, 163, 183, 196, 212,
215, 281
Cryptosporina 1028, 1029
Cryptostoma 835
Cryptostomina 830, 835
Cryptosymbion 420
crysoleucas, Notemigonus 1065
crystallina, Sida 1025
crystalloides, Coccidium 210
crystalloides, Crystallospora 210
crystalloides, Eimeria 210
Crystallospora 196, 210
Ctedoctema 829, 835, 842
Ctenochona 671, 675
Ctenoctophrys 577
ctenolepismae, Gregarina 116
Ctenostomata 531
Cucumaria 25, 872
Cucumophrya 684
Cucurbella 600
cuenoti, Cephaloidophora 114
cuenoti, Pleurocystis 105, 107
cuenoti, Uradiophora 62, 114
Culex 288, 295, 297, 299, 302, 592, 1023
Culicidae 45, 74, 277, 281, 288, 294, 295, 299, 302, 309, 319, 320.
1007
culicidis, Gregarina 102
culicis, Ascocystis 45, 81, 102
culicis, Ascogregarina 25, 32, 43, 47, 50, 74, 76, 81, 98
culicis, Lankesteria 32, 43, 86, 102
culicis, Vavraia 1023
Culicospora 1035
Culicosporella 1007, 1035
Culicosporellidae 1035
Culicosporidae 1035
Culicosporoidea 1035
Culiseta 288, 294, 295
Cultellothrix 566
cultrifera, Perinereis 47, 104
cuneata, Gregarina 45, 52, 74
cuneiformis, Monocystis 107
cuneiformis, Pyrotheca рис. 401 (вкл.)
Cunhaia 611
Cunhamunizia 609
cuniculi, Encephalitozoon 999, 1011, 1014, 1019
cuniculus, Oryctolagus 343, 1019
Curimostoma 415, 816
Curimostomatidae 816
Curinostoma 808
Curviperistomatus 535
cutanea, Henneguya 1065
Cyamichona 671, 6T1
cyanescens, Anoplogenius 131
Cyathodinium 400, 608, 697, 728
Cyathodiscophrya 724
Cyathopercularia 941, 961
Cyclas 816
Cyclidiidae 830, 839, 842
Cyclidium 13,372,373,549, 829,830, 834, 836, 842, 845, 846,872
Cyclochaeta 9Ti, 974
Cyclocyrrha 973
Cyclodonta 943, 946, 947
Cyclogramma 730, 740, 794, 805
Cyclophrya 727
Cyclophryidae 727
cyclopis, Pyrotheca 1025
Cycloposthiidae 623
Cycloposthium 605, 615, 617, 623, 625
Cyclops 938, 945, 955, 956, 963
Cyclospora 196, 224
Cyclostipes 917
Cyclotrichida 379, 547, 580
Cyclotrichiidae 582
Cyclotrichium 556, 581, 582, 777
Cygnicollum 81, 98
Cylindrapium 920
Cylindrospora 1027
Cylindrosporidae 1027
Cylindrosporioidea 1027
cylindrus, Dendrogyra 172
cylindrus, Gemmocystis 172, 173
Cymatocylis 514, 519
cynocephalus, Papio 245
Cyphon 122
УКАЗАТЕЛЬ ЛАТИНСКИХ НАЗВАНИЙ
1095
Cypreostoma 804, 805 Cypridium 643, 645 cyprini, Hoferellus 1064 cyprini, Sphaerospora 1064 Cyprinidae 821 Cypris 909, 938, 956 Cyrilia 186, 187 Cyrtocaryidae 884 Cyrtocaryum 884 cyrtocephala, Lankesteria рис. 12 (вкл.), 98 Cyrtohymena 452, 463 Cyrtohymenostoma 642 Cyrtolophosidida 379, 388, 767 Cyrtolophosididae 767 Cyrtolophosis 746, 759, 765, 768, 779, 978 Cyrtophoron 640, 644 Cyrtostomum 795 Cyrtostrombidium 505 Cystidium 808 Cystobia 103 Cystocephaloides 126 Cystocephalus 125 Cystoisospora 150, 152, 196, 231 Cystophrys 949 Cystosporogenes 1022 Cytauxzoon 346 Cytharoides 484, 491, 492 Cytophagus 216 Cytospermium 216 Cyttarocylididae 520 Cyttarocylis 520 Davisia 1048, 1068, 1071 deanei, Haemoproteus (Polychromophilus) 216 debaisieuxi, Janacekia 1032 decemarticulatum, Prosimulium 323 decoloratus, B'oophilus 352, 353, 361 Defretinella 196, 210 deguisti, Eimeria 218 Dehornia 152, 172 Delamurea 912, 918, 939, 940, 955 delineatus,Nemertes 103 Delphyella 892 Deltacineta 699 Deltopylidae 806, 812 Deltopylum 806, 807, 812 demersus, Spheniscus 363 Demorgania 860 Dendrobaena 897 Dendr 'ocoelum 810 Dendrocometes рис. 223 (вкл.), 683, 718, 726 Dendrocometidae 726 Dendrocometides 726 Dendrorhynchus 132 Dehdrosoma 699, 7.16, 719, 978 Dendrosomidae 719 Dendrosomides 681, 685 dendrpstomi, Extremocystis 103 Denithorax 746 Dentacineta 681 Dentacinetidae 681 Dentichona 671, 674 denticulata, Campanulospora 1040, рис. 399 (вкл.) denticulata, Mastocystis 105 Denticycloposthium 623
dacnecola, Anisolobus 112, 113, 115 Dactylochlamys 578 Dactylophoridae 22, 25, 35, 40, 48, 49, 52, 59, 61, 64, 66, 74, 83, 120, 123, 124, 132 Dactylophorus 48, 123 Dactylophrya 707, 712 Dactylosoma 6, 186, 345 Dactylosomatidae 178, 195 Dactylostoma 712 Dadayiella 522 daghestanicus, Dermacentor 350, 360 Dallasia 808, 814, 815 dama, Cervus 345, 356, 357, 359 danica, Ephemera 1025, 1031 Danicella 931 danilewskii, Haemoproteus (Parahaemoproteus) 263 danilewskyi, Haemamoeba 206 danilewskyi, Laverania 267 danilewskyi, Leucocytozoon 321 danilewskyi, Leucocytozoon (Leucocytozoon) 323—326 Dapedophrya 774 daphniae, Baculea 1023 daphniae, Gurleya рис. 412 (вкл.) daphniae, Norlevinea 1024, рис. 399 (вкл.) Darevskia 192 darlingi, Besnoitia 238 dasyhelei, Allantocystis 109, 110 Dasytricha 593—595, 627 Dasytrichidae 593 Daturella 516, 521, 522 Daturellina 523 Daurotheca 945, 946, 949 davidi, Merocinta 1034 Dentodiscida 906 depressa, Alaspora 131 depurator, Portunis 197 Dermestes 128, 132 Derodontopsis 729 . desertorum, Tetisimulium 1023 Desicaryon 470 Destnophrya 816, 888, 891, 896 Desseria 186, 188 Desserobdella 194 detritum, Hyalomma 348, 350, 360 Deuteromera 117 Deviata 461 Dexiostoma 807, 812 Dexiotricha 813, 822, 823, 825, 846, 979 Dexiotrichides 825 Diacilon 729 Diadema 840, 849 Diafolliculina 438, 439 diaphana, Epitolliculina 440 Diaphanosoma 772 Diaxonella 476 Dicauda 1048, 1049, 1068, 1076 Dicella 527 Dicer as 578 Diceratella 931- Diceratula 564, 578 Dichogaster 902 Dicoelophrya 895, 898 Dicontophrya 890, 899 Dictyocoleps 779, 782 Dictyocysta 516, 519 Dictyocystidae 519
1096
УКАЗАТЕЛЬ ЛАТИНСКИХ НАЗВАНИЙ
Dicycloposthium 624
Dicyemida 885, 1042
Didesmis 588, 600, 602, 603
Didieria 797, 799
Didiniidae 548, 569
Didiniina 547
Didinium 388, рис. 224 (вкл.), 548, 549, 558, 569, 570
Didymophyes 117
Didymophyidae 25, 83, 112, 117, 138
Digitalina 913, 918, 919
Digitophrya 720
Digyalum 89
Dihaplophasea 995, 1027
Dikerogammarus 938
Dileptida 575
Dileptina 570
Dileptus 373, 383, 385, 388, 398, 548, 570—573, 575, 576, 584
Dilleria 590
Dimacrocaryon 570—573
Dimaspidisca 489
Dimeiospora 1037
dimorpha, Burenella 1033
Dimorphocothurnia 945, 950, 962
Dinematospora 133
Dingensia 13
dingleyi, Eimeria 217
dinoferus, Maristentor 435
dinophili, Eucoccidium 175, 217
dinophili, Grellia 162, 175, 176, 178, 217
Dinophrya 549
Dinozoa 5, 6, 11, 19
Dionisia 276
Diophryinae 492
Diophryopsis 492, 493
Diophrys 480, 484, 487, 488, 492, 493
Dioplitophrya 551
Dipartiella 969, 971, 976
Diplagiotricha 461
Diplauxis 31, 32, 35, 41, 52, 54, 57, 61, 63, 69, 72, 79, 104, 136
Diplites 550
Diplocystidae 24, 109
Diplocystis 56, 86, 109
Diplodina 103
Diplodinium 611, 612, 614, 615
diploglossi, Plasmodium (Sauramoeba) 277, 278
Diplogmus 436, 447
Diplolophus 610, 625
Diplomastax 815
Diplomestoma 808, 814, 815
Diploplastron 612
Diplopoda 130, 535
Diplospora 229
Diplospyla 836
Diptera 256, 258, 996, 1007
dipterigia, Molva 1065
Dirhynchocystis 107
Discephelota 704
Discocephalida 450
Discocephalidae 481
Discocephalina 481—483
Discocephalinae 481
Discocephalus 128, 480, 483, 484, 978
Discoftirius 854
Discoglossus 544
Discomorpha 534
Discomorphella 532, 534
Discomorphellidae 534
Discophrya 683, 711, 712, 723, 905, 906
Discophryidae 722
Discophyson 957
Discorhynchus 128
Discosoma 718
Discotheca 908, 939, 991, 955, 957
Discotricha 742, 745, 749
Discotrichidae 748
Disematostoma 385, 796, 797, 799, 800
dispar, Gonderia 348
dispar, Myxobolus 1065
dispar, Theileria 348
Disparospora 1076
dispersa, Eimeria рис. 55 (вкл.), 219
dispersa, Sarcocystis рис. 135 (вкл.), рис. 139 (вкл.), 246
disperses, Napamichum 1029
dispora, Mattesia 57, 95, 96
dissanaikei, Plasmodium (Novyella) 295
dissimilis, Amblyospora рис. 400 (вкл.)
Dissociodihaplophasea 995, 1038
Dissothigma 786
Distarcon 699
Districha 836
Ditoxidae 606, 620
Ditoxum 616, 620
Ditrypanocystis 38, 87, 88, 136
Divaricella 872
divergens, Babebsia 332, 343, 345, 356, 357
divergens, Microbabesia 356
divergens, Ortholinea 1050
diversicolor, Nereis 174, 1054
Dixa 123
Dizonyctus 538
Dobellidae 178
Dogielella 415, 816
Dolioliapium 920
Doliospora 134
Dolithorax 742, 743
Dolyocystis 97
Domadracunculus 135
domerguei, Hepatozoon 190—192, 194
domestica, Musca 1041
domestica, Thermobia 126
domesticus, Passer 203, 207
Donax 223
Donicola 952
Donsia 438, 440, 443
Dorcus 126
Doris 498
Dorisa 196, 224
Dorisiella 196, 202
dorsalis, Aedispora 1035
douxi, Asterophora 123
douxi, Neoschneideria 33, 34, 123
Doyerius 812
Dragescoa 506, 871, 875, 876
Dragescoidae 868, 875
Dragescozoon 760
Dreissena 400
Drepanidia 202
Drepanidium 6, 202, 206
Drepanoceras 815
Drepanomonas 743, 746—748, 815
Drepanostoma 421
Drilocineta 863—865
УКАЗАТЕЛЬ ЛАТИНСКИХ НАЗВАНИЙ
1097
Drilothigma 865
drjagini, Myxobolus 1065
dromedari, Theileria 350
dromedarius, Camelus 350
dubius, Pseudomicrothorax 386, 405, рис. 237 (вкл.), рис. 242
(вкл.)
Duboscqia 1031
Duboscqiidae 1028, 1031
dubosequi, Cephaloidophora 112, 113
dubosequi, Ophryocystis 62
dubosequi, Paramecium 393, 396, 399, 405, рис. 233 (вкл.),
рис. 241 (вкл.), рис. 246—248 (вкл.)
dubosequi, Eleutheroschizon \Т1
dufouri, Crucocephalus 132
Dufouria 128
dugon, Dugong 213
dujardini, Actinocephalus 45
Dumbbellicephalus 118
dunwoodyi, Steganorhynchus 135
duplicate, Limnephilus 1025
duplicate, Tardivesicula 1025
durae, Plasmodium (Giovannolaia) 292
durchoni, Coelotropha рис. 62 (вкл.), 162, 174, 175, 178
durchoni, Eucoccidium 174
Durchoniella 889, 895, 898
Durchoniellinae 895, 898
dureni, Anopheles 309
Dysteria 643, 644, 646
Dysteriida 642
Dysteriidae 641, 643
Dysteriina 643
Dysterioides 641, 643
Dysteropsis 649
dytisci, Spinispora 116
eberthi, Aggregata 151, 155, 160, 162, 197, 199, 200, 201
Ecclissa 931
echidninus, Laelaps 189
Echinactinomyxon 1047, 1068, 1079, 1080
Echinella 927
Echinichona 670, 675
Echinichonidae 675
Echinocyclidium 830, 836
Echinqfolliculina 438, 440
echinogammari, Cephaloidophora 112
Echinomera 48, 52, 123
Echinomeron 836, 837, 840
Echinometra 840, 849
Echinoocysta 134
Echinophrya 712
Echinosociella 859, 860
Echinosociellidae 860
Echinospora 210
Echinostrephus 840, 849
Echinothrix 840
Echinozoon 332, 362
Echinus 835
Echiurocystis 102, 104
ectospora, Parapleistophora 1023
edax, Alphamonas 13
edax, Bodo 13, 14, 19
edax, Colpodella 13—17, 19, 20
edax, Spiromonas 19
edeni, Culicoides 263, 265
Edhazardia 1035
edomensis, Haemoproteus (Haemocystidium) 259
edulis, Mytilus 223, 1014, 1042, рис. 369 (вкл.)
effusa, Fallisia (Fallisia) 315, 317
Eilymophrys 949
Eimeria 69, 150—153, 154—161, 164, 165—167, 196, 216, 218,
220
Eimeriida 11, 149, 196, 345
Eimeriidae 196, 216
Eirmocystis 118
Eisenia 897
Eiseniella 900
elaphus bactrianus, Cervus 348
elaphus elaphus, Cervus 345, 359
elaphus, Cervus 356, 357
Elatodiscophrya 124
Electostoma 433
Electothiama 527
elegans, Asterophora 128, 129
elegans, Gregarina 124
elegans, Marssoniella 1024
elegans, Pseudemis 260
elegans, Seticephalus 120, 121, 124
Elleipsisoma 368
elektroscirrha, Ophryocystis 81, 93
Eleodes 126
Elephantophilus 610, 615, 619
Eleutherochona 666
Eleutheroschizon i'll
Eleutheroschizonidae 174, 177
eliptica, Sepia 197
Eliptophrya 901
Elitarcon 689
ellipsoides, Pfeifferinella 207
ellipsoides, Myxobolus 1065
Elliptocystis 119
Elliptothigma 862—864, 866
Ellobiophrya 499, 924, 925, 946
Ellobiophryidae 924
elongata, Apolocystis 105
elongata, Binucleospora 1041
elongata, Lecudina 34
elongata, Ophioidina 1017
elongatum, Plasmodium (Huffia) 301—3Q3, 305
Elytroplastron 611, 612
Eminoscolex 864, 896, 897
Eminothigma 862, 863, 866
emynae, Peritromus 445
Emmaninius 541
emydis, Tunetella 365
Enallagma 134
Encephalitozoon 999, 1011, 1019
Encephalitozoonidae 1019
Encephalitozoonoidea 1019
Enchelaria 565
Enchelydium 552, 579
Enchelyidae 553, 578
Enchelyodon 550—552, 557, 565, 580
Enchelyodontidae 551., 563
Enchelyomorpha 686, 700, 714
Enchelyomorphidae 714
Enchelyotricha 562
Enchelys ’iTi, 376, 383, 551, 553—555, 565
enchytraei, Gregarina 138
enchytraei, Monocystis 138
enchytraei, Schaudinnella 31, 138
Enchytraeidae 138, 889, 890, 895
70 Зак. №4163
1098
УКАЗАТЕЛЬ ЛАТИНСКИХ НАЗВАНИЙ
Enchytraeoides 893, 896
Enchytraeus 903
Епсутоп 119
Endocryptella 117
Endogemmina 663
Endogenia 705
Endogenida 379
Endogyrinella 913, 958, 959
Endomycola 119
Endoralium 620, 621 1
Endoreticulatus 1020
Endorimospora 240, 247
Endosphaera 415, 715, 716, 907, 908, 911
Enerthecoma 655
Engaeus 964
Engelmanniella 461
Enigmocoma 622
Enigmostoma 733, 770
Еппеатегоп 732, 733, 737
Enoploplastron 611, 612
ensis, Enterocystis 109
Enterocystidae 24, 31, 74, 108, Ю9
Enterocystis 31, 74, 108
EnterocytOzoon 1014, 1018
Enterocytozoonidae 1017, 1018
Enterophrya 607, 608
Enterophryidae 608
Entodiniomorphida 379, 390, 403, 603, 610, 614, 6l§
Entodinium 610—612, 614
Entodiscidae 828
Entodiscoides 837
Entodiscus 793, 830, 837, 843, 847
Entopolypoides 368
Entorhipidiidae 828
Entorhipidium 793, 835, 837, 841, 843
Entziella 918, 954, 955
Entziellidae 954, 955, 957
Eodinium 611, 613 '
Eometopus 527
Epalxella 523, 530—533
Epalxellidae 531
Epalxis 530, 531, 534
Epenardia 806, 814, 815
epeori, Trichoduboscqia 1032
Ephelota 391, 701, 703, 704, 960
Ephelotida 703
Ephelotidae 703
ephemerae, Gamocystis 1025
ephestiae, Coelogregarina 96
Epicancella 520
Epicarchesium 907, 913, 934
Epicavus 45, 131
Epicharocotyle 862—864, 866
Epicharocotylinae 864
Epiclintes 457, 460, 461
Epiclintidae 460
Epicranella 522
Epicytaria 79, 81, 86
Epiderites 461
Epidinium 612, 613, 614
Epidiophrys 493
Epidiscophrya 723
Epieimeria 196, 221, 222
Epifollicultna 438, 440
Epimecophrya 837
Epiphyllum 585
Epiplastron 611
Epiplocylididae 520
Epiplocylis 516, 520
Epiplocyloides 520
Epirhabdonella 520
Episeptum 1,002, 1024
Epispathidium 552, 564, 565
episquamalis, Myxobolus 1065
gpjstylididae 909, 930, 960
Epistylis 373, 385,894, 907—909, 911—914, 916—919, 921, 924,
929—931,945
Epitholiplus 56Q
equi, Eabebsicf -3§Q
equi, Nicollia 332, 350
equi, Nuttalia 350, 360
equi, Piroplasma 350, 360
equi, Theileria 332, 335, 350—352, 368
equicanis, Sarcocystis 230, 245
erardi, Haemoproteus (Nycteria) 273
Erastophrya 385, 714, 717
Erastophryidae 714
Eremoplastron 615
erinacei, Gousseffia 228
Eriocharon 608
Eriochona 674
Erionella 454, 461, 483
Erionellidae 481
erratica, Leidyana 120, 121
errqtfcq, Stenophora 120
Ervilia .643, ,645,647
Erythrocebus 272
fyythrppsis 931
/erylhrgifrus, fyferiqfies.343
Eschpneustyla 479
esculenta, Rqna 194
Esox 975
Espejoia 8O6-=§08, 813, 814
Espejoiidae 806, 814
Estuaricola 469,470
Etoschophrya 756, 770
Euastacus 964
Eueamptocerca 130
Euchaeta 720
Eucoccidium 175, 197
Eudiplodinium 611, 614, 615
Eudrilidae 889, 896
Eudrilinae 899
Eudrilophrya 869, 899
Eudrilophryinae 895
Eudrilus 899
Eufolliculina 387, 391, 437, 438, 440
Eufolliculininae 436
Eugregarina 21, 22, 24, 79, 80, 83, 86
Eugregarinaria 21
Eugregarinida 7, 11, 22, 24—27, 30, 31, 33, 36, 39^11,43, 52, 70,
71,79,83,84,86,89,96,137,138
Eugregarinorida 23
Euilyodrilus 900
Eulalia 137, 138
eulaliae, Defretinella 210
eulaliae, Heterospora 138
Eulimnogammarus 716, 963, 964
Eumonodontophrya 900
Eunice 117
Eunicidae 100, 903
Euophryodendron 686
УКАЗАТЕЛЬ ЛАТИНСКИХ НАЗВАНИЙ
1099
Eupagurus 442
Euphausiacea 885
Eupisidium 816
Euploea 486
Euplotaspis 480, 486, 488, 494
Euplotes 373, 380, 388—391, 396, 398, 400, 401, 406, 448, 450,
480, 485, 489, 492, 495, 848
Euplotia 480, 977
Euplotida 379, 480, 485, 486
Euplotidae 451, 484, 491, 494
Euplotidium 399, 480, 484, 487, 491, 492
Euplotina 480, 484
Euplotoides 485
Euplotopsis 485, 486
Eupolyporeutus 899, 902
Eupoterion 872
Eurhabdonella 520
europaea, Talpa 224, 368
europeus, Erinaceus 228, 343
Eurycea 906
Eurychilum 830, 837, 838, 844
Eurychona 671, 675
Eurysporina 1047, 1049, 1073
Eurytemora 940
Eurythenes 688
Euspora 118
Eutintinnus 521
Evaginogenea 721
evansi, Prismatospora 128, 129, 133
evertsi, Rhipicephalus 346, 351, 353
Evlachovaia 1033
excavatum, Hyalomma 346, 348, 350, 360
exiguus, Myxobolus 1065
exilis, Henneguya 1063, 1065
Exocolpoda 760
Exocolpodidae 760
Exogemmida 379, 665
Exogemffiiha 663
Exogenida 379, 622
Exoschizon 30, 90
Exoschizonidae 24, 89
Extensiscopula 920
Extremocystis 103
Fabespora 1048, 1049, 1068, 1075
Fabesporidae 1048, 1049, 1075
Fabrea 426, 431—433
Facieplaty cauda 1076
falcatulata, Sarcocystis 246
falciforme, Ematozoo 309
falciforme, Haematozoon 309
falciformis, Eimeria 217, 219
falciparum, Eimeria 167
falciparum, Haematozoon 309
falciparum, Plasmodium 6, 8, 335
falciparum, Plasmodium (Laveranla) 306, 309, 313
Falconiforrpes 317
Falconyctus 538
fallax, Euspora 118
fallax, Plasmodium (Giovannolaia) 292
Fallisia 259, 313, 315, 317
familiaris, Canis 237, 239, 243, 245, 343, 361
Farinocystis 31, 39, 54, 57, 63, 69, 80, 85, 93
fasciatus, Diploglossus 277
fasciculate, Nosodendron 116
fasciolata, Prototrachelocerca 418
fasciolatum, Kentrophoros 419
fastigata, Mesnilella рис. 255 (вкл.)
fatigans, Culex 6
Faucispora 116
Faurella 804
Favella 513, 514, 516, 517, 519
Favelloides 523
febris irregularis, Haemamoeba 309
Felidae 168, 231
Felis 168, 231
felis, Babebsia 332, 336
felis, Cryptosporidium 213
felis, Ctenocephalus 1018
felis, Cystoisospora 157, 163, 231, рис. 55 (вкл.)
felis, Isospora 229—231
Fenchelia 869, 870, 872
fennicae, Elugea рис. 412 (вкл.)
ferganica, Odagmia 1034
ferrariperezi, Sceloporus 289
Fibrillobundleia 600
Fibrodiscida 906
fidelis, Endoreticulatus 1020
Filellum 440
Filichona 666
Filichonidag 6.66
Filip.ofliwm 25, 73, 136, 137
FiliS:t$nF>r 43.4
finki, ftetcrosporis 1023
Fio,rentinus 600—603
firmus, Pyxinia 43,—45,
fishi, Pilosporella 1034
Fissuretla 923
fistulosum, Kentrophoros 420
Fixcmatus 572, 584
Flabellifartna 1025
Flabellifbrrnidae 1024, 1025
flavicollis, Apodemus 236
flaviviridis, Goussia (Goussia) 211
flavum, Kentrophoros 420
Flectacineta 698
Flectichona 674
Flectocarina 639
Flexiphyllum 561
floralis, Delia 1040
floridense, Plasmodium (Lacertamoeba) 281
florodus, Tapes 223
fluviatilis, Microsporidium рис. 399 (вкл.), рис. 401 (вкл.)
fluviatilis, Perea 1064
Foettingeria 878, 879, 979
Foettingeriida 877
Foettingeriidae 878, 884
Foettingeriinae 878, 884
Foissnerella 908, 913, 918, 939
Foissneria 741
Foissnerides 553, 555
foliata, Selenocystis 87
foliatum, Selenidium 87
Foliella 976 '
folium, Myxidium 1064
Folliculina 373, 387, 394, рис. 232 (вкл.), 437, 438, 440, 441
Folliculinidae 427, 436—438
Folliculininae 436
Folliculinopsinae 438
Folliculinopsis 438, 440, 442, 443
Fonsecaia 120
1100
УКАЗАТЕЛЬ ЛАТИНСКИХ НАЗВАНИЙ
fontinalis, Salvelinus 247
forbesii, Travisia 25, 1017
forficatus, Lithobius 123, 124, 179
forskalii, Holothuria 25
fragilis, Pilidophora 127
Fragmocirrus 462
francisci, Gamocystis 112, 113
Freia 441
Frenkelia 149, 152, 157, 196, 241, 247
Freya 441
Fridericia 895
fringillae, Haemoproteus (Parahaemoproteus) 263
Fringillidae 302
Frontonia 385, 388, 393, 405, рис. 257 (вкл.), 795—797, 802, 820,
979
Frontoniella 798, 799
Frontoniidae 795
Frontoniina 795
fuhrmanni, Thelohanellus 1065
julgens, Lutjanus 1020
fuliginosa, Scolelepis 30, 87, 100, 202
Fundenia 578
funduli, Calyptospora 212
fimduli, Eimeria 212
fungicola, Triseptata 115
Fungiphrya 764
fungoides, Enterocystis 37, 54, 109
fungosa, Plumatella 1056, рис. 424 (вкл.)
Furgasonia 730, 736, 737, 745, 794, 805, 979
Furgasoniidae 736, 737
fusca, Alouatta 309
Fuscheria 548, 549, 551
Fuscheriidae 549
fusciceps, Ateles 309
fuscus, Stenopelmatus 118
fusifex, Hepatozoon рис. 55 (вкл.), 190
fusiformis, Nematoides 114
fusiformis, Sarcocystis 241, 245, рис. 140 (вкл.)
Fusiona 136
Fusionicae 136
Fusionidae 25, 136
gabaldoni, Plasmodium (Giovannolaia) 292
gabonensis, Haemoproteus (Nycteria) TTi
gadi, Eimeria 218
Gajewskajophrya 695
Gajewskiella 856, 859
gai, Parathalohania рис. 400 (вкл.)
gallerucidae, Quadruhyalodiscus 112, 113, 119
Galliformes 263, 299, 325
gallinaceum, Haemamoeba 9
gallinae, Dermonyssus 203
Gallinula 592
gallirae, Ceratophyllus 183
gallopavo, Meleagris 213, 263
galloprovincialis, Mytilus 111, 223
galoti, Gallotia 246
galoti, Sarcocystis 246
gambianus, Cricetomys 345
Gammarellus 857
gammari, Acanthosporidium 134
gammari, Gregarina 112, 114
gammari, Monocystis 114
gammari, Rotundula 112, 113
gammari, Uradiophora 114
Gammarus 111, 400, 583, 811, 827, 938, 1013
Gamocystis 115
gamocystis, Geusia 1025
ganapati, Chagasella 180
Ganapatiella 183
Ganymedes 103, 108
Ganymedidae 24, 108, 109
Gargarius 655, 659
garnhami, Anthemosoma 332, 336, 364, 365
garnhami, Atoxoplasma 203, 206
garnhami, Gregarina 70, 71, 74—76, 84
garnhami, Hoarella 228
garnhami, Lankesterella 203, 204, 206
garnhami, Triboliocystis 93
Garnhamia 115
Garnia 259, 313
Gamiidae 257, 259, 313
Gasconyctus 540, 544
Gassovskiella 606, 610, 620
gasterostei, Myxidium 1064
Gastrochaeta 646
Gastrocirrhidae 490
Gastrocirrhina 480
Gastrocirrhus 480, 484, 489, 491, 492
Gastronauta 631, 634, 639
Gastronautidae 639
Gastronecta 640
Gastrostyla 467
Gastrotricha 586
gatesi, Burkea 1018
Geimania 536, 543, 545, 592
Gekkonidae 259, 313
Geleia 416, 424, 425, 977
Geleiella 925
Geleiidae 416, 424, 861
Gellertia 425
geminata, Mattesia 16
Gemmicephalus 127
gemminata, Solenopsis 1033
Gemmocystidae 112, 171
Gemmocystis 172
Geneiorhynchus 127
geniculata, Plectrocnemia 1034
Geochelone 545
geochelonis, Haemoproteus (Simondia) 260
Geocherax 964
geojfroyi, Saguinus 309
geographica, Graptemys 260
geophili, Rhopalonia 120, 121, 124
Geophilus 123, 124
Georgevitchiella 900
Gerda 921, 927—929
geusi, Fusiona 56
Geusia 1025
giardi, Capitellides 1017
giardi, Myxidium 1064, рис. 417 (вкл.), рис. 420 (вкл.)
giardi, Thelohania 1028
gibberum, Holopedium 1025
gibbosum, Zygosoma 101
Gibbsia 183
gibbus, Olocrates 94
Gigaductidae 25, 31, 66, 69, 83, 116, 117
Gigaductus 26, 31, 32, 50, 69, 73, 80, 85, 86, 116, 117
gigantea, Didymophyes 36, 41, 43, 50, 52, 57, 85, 112, 113, 116,
138
gigantea, Gregarina 52, 111, 218
УКАЗАТЕЛЬ ЛАТИНСКИХ НАЗВАНИЙ
1101
gigantea, Porospora 20, 111
gigantea, Sarcocystis 245
giganteum, Ichthyosporidium 1040
giganteum, Plasmodium (Sauramoeba) 277
giganteus, Cordylus 365
gigantinum, Phleobum 122
gigas, Trachelolophos 417, 418
Giovannolaia 259, 292
girardi, Plasmodium (Vinckeia) 309
girellae, Goussia (Goussia) 211
gladiator, Stylocephalus 125
gladiator, Xiphocephalus 120, 121, 125
glareoli, Clethrionomys 247
glareoli, Frenkelia 247, 248, рис. 135 (вкл.)
glareolus, Clethrionomys 236, 247
Glaucoma 383, 396, 806, 808, 811, 814, 815, 817
Glaucomella 808, 814
Glaucomidae 814
Glauconema 838
Glenopanophrys 818
Glenotrochilia 647
Globidium 216
Globospora 1048, 1049, 1068, 1074
globosum, Zygosoma 98
globulifera, Senoma 1039, рис. 399 (вкл.), рис. 403 (вкл.)
Globulocephalus 131
glomerata, Pseudoklossia 223
glomeratus, Apanteles 1011, 1012
glomericola, Cyclospora 224
Glomeris 122, 224
Glossa 856
Glossatella 919, 920
Glossoscolecidae 889, 890, 897, 901, 902
Glugea 1004, 1014, 1021
Glugeidae 1019, 1021
glugeiformis, Telomyxa 1025
Glugoides 1023
Glugoididae 1023
Gnorimosphaeroma 887
Gobiesocidae 210
Gobiidae 210
Golbergia 1002, 1032
Golbergiidae 1035, 1036
gomesi, Cyrillia 187, 188
gomesi, Haemogregarina 187
gonadipertha, Urospora 25
Gonatodes 313
gonatodi, Garnia (Garnia) 313, 314
gonderi, Colpodella 19, 20, 752
gonderi, Spiromonas 19, 752
Gonderia 346
Gonderiidae 346
gondi, Ctenodactylus 6, 232
gondii, Isospora 233
gondii, Leishmania 233
gondii, Toxoplasma 6, 9, 149—165, 168, 170, 232—237, 337,
рис. 59 (вкл.), рис. 71 (вкл.), рис. 132—134 (вкл.)
Goniocoma 653, 656
Gonospora 103
Gonostomum 463, 464
Gonzeella 923
gopalai, Myriospora 177, 178
Gopaliella 117
Gordonella 203
Gorgonosoma 719
Gorillophilus 610, 620
Gousselfia 228
Goussia 151, 196, 210
gracilis, Ancyrophora 62, 128, 129, 133
gracilis, Grebnickiella 33, 48, 49, 59, 60, 64, 120, 121, 123
gracilis, Nina 123
gracilis, Orthomorpha 120
gracilis, Pernicivesicula 1027
graciosus, Sceloporus 283
grahami, Haemoproteus (Haemocystidium) 259
Grainis 930, 938, 939, 941, 942
grammicus, Sceloporus 283
grandis, Aeshna 1030
grandis, Fundulus 212
grandis, Mattesia 39, 54, 56, 57, 63, 67
Grandoria 763
Grandoriidae 763
Grasseella 196, 223
grassei, Dinematospora 134
grassei, Neohirmocystis 118
grassii, Proteosoma 288
Grayallia 107
Grebnickiella 52, 57, 59, 61
gregaria, Schistocerca 74, 84
Gregarina 21, 45, 50, 52, 54, 56, 70, 71, 74, 79, 115, 116
Gregarinea 20, 24—26, 31, 76, 80, 87, 97
Gregarinidae 22, 25, 31, 61, 66, 69, 74, 83, 112, 115—117
Gregarinicae 25, 52, 83, 86, 192
gregarinoides, Schizocystis 90, 91
Gregarinomorpha 22, 24, 87
Grellia 175
Grellidae 174
Grenoblia 132
grifflthsi, Plasmodium (Haemamoeba) 288
Grinisfera 929
griseus, Limax 229
Grossglockneria 752, 763
Grossglocknerida 763
Gruberia 424, 428, 430, 977
Gruvelina 416
grylli, Nosema рис. 390 (вкл.)
grylli, Paranosema 999, 1013, 1039, рис. 397 (вкл.)
Gryllotalpa 131
gryllotalpae, Hirmocystis 62
Gryllotalpia 131
Gryllus 116, 120
guereza, Colobus 224
gugleri, Pfeifferinella 207, 209
guineensis, Tilapia 1033
Gullmarella 830, 850
Gurleya 1024
Gurleyidae 1024
Gurleyides 1002, 1024
Gurleyoidea 1023
guttata, Elaphe 213
guttata, Trichotuzetia 1026
guyannense, Plasmodium (Sauramoeba) 277
Guyenotia 1047, 1068, 1080
Gymnodinioides 876—883, 885—887
Gymnopithus 578, 579
Gymnospora 115
Gymnostomata 375, 376, 403
Gymnostomatea 547
Gymnostomatida 547, 587
Gymnozoida 629, 630
Gymnozoidae 629
Gymnozoonidae 629
1102
УКАЗАТЕЛЬ ЛАТИНСКИХ НАЗВАНИЙ
Gymnozoum 563, 629, 630, 978 gyrina, Physa 207 gyriniformis, Rhabdocystis 107 Gyrinus 132 gyrociliatus, Dinophilus 176 Gyrocorida 528, 930 Gyrocorina 528 Gyrocorys 471, 500, 528, 531 Gyrocorythidae 528 Hartmannulopsis 643, 646 harvathi, Sarcocystis 246 Hastarcon 687 Hastatella 325, 326, 934, 962 hastulatum, Coenagrion 1030 hatti, Diplauxis 41, 53, 57, 59, 64, 75, 104 Hausmanniella 761 Hausmariniellidae 761 hawayana, Pheretima 1018 Hazardia 1036
haeckeli, Ganymedes 102 haeckeli, Paraophioidina 102 haeckelii, Ophioidina 102 Haemamoeba 259, 277, 288 Haematophagus 578, 775 Haematoxenus 346 Haematozoa 6 Haemocystidium 258, 259 Haemogregarina 149, 186, 232 Haemogregarinidae 77, 178, 185, 195 Haemogregarinidea 178 Haemohormidiidae 365 Haemohormidlum 195, 365 Haemomenas 277 Haemoproteidae 257—259 Haemoproteus 258, 259, 267, 269, 345, 346 Haetnosporida 11, 149, 256—258, 273, 345 Haemosporidium 277 hagenmillleri, Ophryocystis 94 haldari, Dumbbellicephalus 118 Hallezia 720 Hallia 609 Halofolliculina 438, 441 halotis, Pseudoklossia 223 Halteria 389, 390, 451, 495, 498—502, 569 Halteridium 259 Halteriida 379, 500 Halteriidae 450, 500 Halterioforma 785 Halteroides 427 hamiltoni, Leucocytozoon (Leucocytozoon) 321 hammondi, Hammondia 236, 237 hammondi, Isospora 236 hammondi, Toxoplasma 236 Hammondia 196, 230, 236 handai, Haemoproteus (Parahaemoproteus) 263 Haplocaulus 907, 918, 923, 924, 930—934, 936, 938, 955 Haplophasea 995, 1017 Haptophrya 867, 893, 904—906, 967 Haptophryida 904 Haptophryidae 904 Haptophryinae 904 Haptophryopsis 893, 904 Haptoria 379, 547, 603 Haptorida 379, 390, 403, 547, 550—559, 575 Harendraria 132 harengus, Clupea 211 Harmodirus 574 Harmothoe 951 harmothoe, Loxomorpha 98 Harpalus 117 hartmanni, Chagasella 180 Hartmannula 643, 646, 647 Hartmannulidae 643, 646 Hartmaimulina 643 heathi belangeri, Scotophilus 366 hebraeum, Amblyomma 357 heischi, Plasmodium (Sauramoeba) 277 Helella 830, 896 Helellophrya 890, 896, 903 Heliactis 879 Helianter 804 Helicidae 851 helicina, Klossia 180, 182, 195, рис. 102 (вкл.) Helicoprorodon 547, 548, 554, 563 Helicoprorodontidae 563 Helicostoma 838, 839, 844 Helicostomella 516, 517, 519 Helicostomidae 838 Helicozoster 626 Heliochona 667, 668 Heliochonidae 667 Heliocidaris 835, 836, 837 Heliocometes 721 Heliophrya 699, 717 Heliophryidae 717 Heliospora 114 Helioptheca 701 Helmichia 1017, 1027 helminthorum, Legerella 163 Helochares 961 Helodermatidae 283 Hemiamphisiella 451 Hemicentrotus 835, 837 Hemicyclium 747 Hemidactylus 259 Hemiholosticha 470 Heminotus 583, 587 Hemiophrys 574, 583—586, 716 Hemiprorodon 600 Hemisincirra 461 Hemispeira 805, 868, 871, 873—876, 907 Hemispeiridae 228, 868, 874 Hemispeiropsis 875 Hemitrichodina 969, 976 Hemolivia 193 Henlea 138, 895 henleae, Schaudinnella 138 Hennegoides 1046, 1049, 1068, 1077 Henneguya 1048, 1049, 1052, 1053, 1059, 1060, 1068, 1076 henneguyi, Rhytidocystis 171, 172 Hentschelia 66, 101 hepaticus, Microgemma 1019 Hepatocystis 269, 271, 273 Hepatozoidae 178 Hepatozoon 154, 155, 183, 186, 189 herbsti, Panopeus 110 herculea, Monocystis 41, 43 hermani, Plasmodium (Huffia) 301 heroni, Plasmodium 294 heros, Coleophora 130
УКАЗАТЕЛЬ ЛАТИНСКИХ НАЗВАНИЙ
1103
heros, Coleorhynchus 130
herpailuri, Babebsia 345
Herpinella 903
herpobdellae, Orcheobius 179
hertwigi, Glugea рис. 412 (вкл.)
Hessea 1031
Heterocentrotus 849
Heterochona 667, 668
Heterocinetopsis 654, 656
heteroclitus, Fundulus 1064
Heterocypris 960
Heteropolaria 583, 894, 907, 910, 917, 924, 940
Heteroptera 481
Heterospora 25, 137, 138
Heterosporis 1023
Heteroctentor 441
Heterostrombidium 504, 506
Heterotricha 375
heterotricha, Gellertia 425
Heterotrichea 379, 387, 396, 398, 404, 406, 415, 416, 426, 977
Heterotrichida 379, 389, 390, 403, 426—432, 435, 523, 589
Heterotrichina 427
Heterovesicula 1033
hexacantha, Odonaticola 135
Hexacapsula 1048, 1049, 1068, 1078
Hexacapsulidae 1048, 1049
Hexactinomyxidae 1047
Hexactinomyxon 1047, 1052, 1068, 1079
hexagonus, Ixodes 356
hexamerium, Plasmodium (Novyella) 295
heydorni, Hammondia 237, 240
heydorni, Isospora 152, 237
Hiatella 850
Himantophorus 487
Himantopus 487
hinmani, Culicoides 263
Hinoftirius 851
Hippoboscidae 259, 267
hippocampoides, Apocryptopharynx 422
Hippocomos 858
hirci, Babebsia 357
hirci, Gonderia 350
hirci, Piroplasma 357
hirci, Theileria 350
hircicanis, Sarcocystis 245
hircus, Capra 343, 350, 357, 359
Hirmocystidae 25, 83, 102, 112, 116, 122
Hirmocystis 118
hirsuta, Sarcocystis 241, 244, 245
Hirsutosporos 1002, 1006, 1040
hispanicus, Psammodromus 203
hispaniolensis, Passer 288
hispanus, Oocephalus 125
hispida, Echinomera 64, 120, 121, 123
hispidus, Echinocephalus 123
Histiobalantiidae 858
Histriculus 466
Histiobalantium 856—859, 861
histrio, Bothriopsides 126—130
hoard, Dorisa 224
Hoarella 196, 228, 624
Hoareosporidium 240
Hoferellus 1048, 1049, 1053, 1068, 1075, 1076
hollandei, Selenidium 30, 37, 55, 67, 72, 88
Holobispora 1026
Holocoma 653, 654, 656
Holophrya 548, 569, 779, 783—787
Holophryidae 783
Holophryoides 601
Holophryozoon 601
Holospora 399
Holosticha 451, 456, 465, 470, 473, 476-478, 481
Holostichidae 475
Holostichina 460
Holotricha 375, 376, 402, 907, 977
holstii, Prolamnohyx 127
Homalogastra 830, 838, 848
Homalozoon 548, 549, 554, 561
Homalozoonidae' 561
Homarus 197, 198
Hominidae 305, 309, 1018
hominis, Crypiosporidium 213—215
hominis, Isospora 230
hominis, Sarcocystis 230, 245
hominis, Toxoplasma 233
hominis, TrachipleistophOra 1023
hoogstraali, Echinozoon 362, 364
Hoplitophrya 889, 890, 895, 898, 905
Hoplitophryida 888
Hoplitophryidae 867, 888, 889, 895, 899
Hoplitophiyinae 889
Hoplorhynchus 135
Horocoritus 643, 650
horridus, Crotalus 226
horridus, Sceloponls 283
hortensis, Helix 180
hoshidei, Acanthogregarbia 119
hovassei, Metchnikovella 1004, 1005
hovassei, Pomania 130
Hovasseiella 895, 898
Hrabeyia 1002, 10'06, 1036, 1039
Hsiungella 601
Hsiungia 601
hudsonius bovis, Babebsia 353
huffl, Plasmodium (Huffia) 301
Huffia 259, 301
Huxleya 643, 650
Hyale 887
Hyalidae 964
hyalina, Goussia (Goussia) 211
Hyalinocysta 1028, 1029
Hyaloklossia 229
Hyalophysa 877—879, 882
Hyalospira 880, 881
Hyalospora 118
Hyalosporina 120
Hydaticus 955, 961
Hydra 973, 1060
Hydrachna 96
hydrachnae, Menzbieria 96
Hydractinia 846
Hydranthosoma 686
hydriforme, Polypodium 1057, 1058, 1059
Hydrobius 133, 961
Hydrochoerella 608
Hydrophilidae 955, 957, 959, 961
Hydrophilus 132
Hydrophrya 686
hydropori, Legerella 183
Hydropsyche 131
hydropsyches, Globulocephalus 131
Hydrous 128, 955
1104
УКАЗАТЕЛЬ ЛАТИНСКИХ НАЗВАНИЙ
hylae, Lankesterella 202, 203 Hylarana 546 hylobati, Plasmodium (Plasmodium) 305 Hyloplotes 493 Hymenostoma 801 Hymenostomata 403, 817 Hymenostomatia 379, 389, 402, 805 Hymenostomatida 379, 403, 587, 788, 805, 828 Hyperidion 101 hyperparasitica, Pleistosporidium 1020 hypnorum, Aplexa 207 Hypocoma 548, 657, 660—662 Hypocomagalma 654, 656 Hypocomatida 379, 387, 661, 662 Hypocomatidium 659, 816 Hypocomatophora 656 Hypocomella 653, 656—658 Hypocomidae 660 Hypocomides 653, 654, 657, 658 Hypocomidium 657 Hypocomina 655, 657 Hypophrya 709, 711, 723 Hypostomatia 629 Hypotrichia 379, 396, 406, 450, 972 Hypotrichida 389, 403, 451—458, 480, 535 Hypotrichidium 458, 471—473 Hysterocineta 528, 863—866 Hysterocinetia 862 Hysterocinetida 861—863 Hysterocinetidae 828, 854, 863 Hysterocinetina 862 Hysterocinetinae 863 Hysterocinetoides 867 Hysterophrya 863, 888, 903 Inermichona 672 infernalis, Oedaleus 133 Inferostoma 535, 537, 541 Inferostomatidae 541 Inferostomatinae 535 infirma, Tuzetia 1026 inflation, Prosimulium 1041 informe, Leptotheca 1064 Infundibulorium 596, 597 Inodosporus 997, 1028, 1029 inopinata, Sycia 33, 47, 98, 100 Insecta 256, 258 Insignicoma 657 insignis, Lophocephalus 120, 121, 125 insignis, Trichocephalus 123 intermediarum, Selenoaccidium 197, 198 intermedium, Tetractinomyxon 1054 intestinalis, Alveocystis 208, 209 intestinalis, Ciona 25, 28, 50, 101, 1032 intestinalis, Eimeria 152, 217, 345, рис. 55 (вкл.), рис. 126 (вкл.) intestinalis, Glugoides 1023 Intexta 1018 Intoshellina 891, 900 Intoshellinidae 888, 900 Intramacronucleata 379, 404, 415, 416 Intranstylum 936, 938, 939, 955 intricata, Harendraria 132 Inversochonidae 675 inversum, Episeptum 1024 iroquoina, Eimeria 217, 218 irregularis, Gonospora 25 irregularis, Sphaerospora 1050 irus, Macaca 369 Isochona 671 Isochonidae 670
Ichthyonyctus 533, 535, 540 Ichthyophthiriidae 817, 820 Ichthyophthirioides 817—820 Ichthyophthirius 372, 394, 400, 402, 577, 716, 788, 817, 819—821 Ichthyophyllum 956, 958 Ichthyosporidiidae 1039, 1040 Ichthyosporidium 1006, 1022, 1040 ictaluri, Sphaerospora 1064 Ictalurus 585 Ictiobus 585 Idiocolpoda 760 Idotea 886, 867 Iduna 643, 646 Ignotocoma 657 iguana, Iguana 279 Iguanidae 281, 283 Ileonema 578 I Ilex 885 Ilsiella 751, 762 immaculata, Haemamoeba 309 Immanoplasma 369 impressum, Hyalomma 346 impudica, Pfeifferinella 207 inconstans, Plasmodium 288 incurvatum, Myxidium 1064 indica, Chitra 260 indicola, Brustiospora 135 Indonyctus 538 Indosphaera 912, 929 Isochonopsidae 671 Isochonopsis 671 Isochrysis 507 Isocomides 658 Isocyclidium 830, 838 Isopoda 436, 965 Isopodarcon 689 Isospora 149, 150, 152, 160, 189, 196, 229, 230, 232 Isosporidae 196, 229 Isosporinae 240 Isotricha 480, 593—595, 978 Isotrichida 594, 595, 612 Isotrichidae 593, 601 Isselina 875 Issia 1002, 1034 Ithania 180 itoi, Euplotidium 399 Ixodoidea 345 Ixorheida 11, 149, 173 Ixorheidae 171, 173 Ixorheis YTi jacksoni, Praomys 185 Jaera 887, 936 jahni, Babesiosoma 195 jahni, Dactylosoma 195 jakimovi, Piroplasma 353 jakulus, Jakulus 189 Janacekia 1032 Janacekiidae 1028, 1032
УКАЗАТЕЛЬ ЛАТИНСКИХ НАЗВАНИЙ
1105
janovy, Domadracunculus 135
Jaocorlissia 806, 814
japonica, Kinorhynchospora 1034
japonica, Popillia 1031
japonica, Soronia 118
japonicum, Blepharisma 398, рис. 238 (вкл.)
japonicum, Plasmodium 299
japonicus, Coronoepimeritus 133
japonicus, Oxya 133
Jaroschia 755, 773
Jaroschiidae 773
Jarrina 216
Jassa 887
jenningsi, Paramecium 396, 397, 405, рис. 246 (вкл.), рис. 247
Jeppsia 888
Jirovecella 891
Jirovecellinae 889
Jirovecia 1002, 1006, 1038
Jiroveciana 1018
Johenrea 1022
joliveti, Anisdoboides 115
juli, Gregarina 120
jali, Stenophora 120
Julidae 535
julis, Coris 1042
Julus 120
jushihi, Kinorhynchus 1034
Juxtamesnilella 891
juxtanucleare, Plasmodium (Bennettinia) 299, 301, 302
Juxtaradiophrya 891—893
Juxtaradiophryinae 889
kabatai, Margolisiella 223
Kabataia 1042
kadiakensis, Palaemonetes 212, 1029
Kahlia 461
Kahliella 461, 462, 472, 475
Kahliellidae 451, 461
Kahlilembus 830, 834, 838
Kahlisonderia 789
Kahlophrya 568
Kalometopia 761
Kalpidorhynchus 103
Kamptocephalus 98
Kariphilus 827
karnataki, Tetrameridionospinospora 135
Karyolysidae 178
Karyolysus 155, 186, 192, рис. 59—61 (вкл.), рис. 77—78 (вкл.),
рис. 107—110 (вкл.)
Karyorelictea 372, 379, 380, 387, 389, 396, 398, 404, 415, 416
Karyorelictida 387, 403, 404, 417, 420, 422—425, 523
kathae, Merocystis 201
Katharina 723
kawabatae, Myxobolus рис. 416 (вкл.)
keilini, Meroselenidium 62, 87
kelschi, Pontesia 100
kempi, Plasmodium (Novyella) 295
Kenguruna 627
Kentrochona 500, 676
Kentrochonopsis 673, 676
Kentrophoridae 416, 419, 977
Kentrophoros 386, 387, 399, 419, 420, 587, 815, 977
Kentrophyllum 571, 574, 583, 585—587
kermogati, Eimeria 219
Kerobalana 931
Kerona 373, рис. 224 (вкл.), 450, 451, 469
Keronella 474, 475
Keronidae 451, 469
Keronina 480
Keronopsis 454, 455, 456, 469, 470, 473, 478, 479, 481
Kidderia 860
Kiitricha 480, 481
Kiitrichida 379
Kiitrichidae 481
Kiitrichina 481
Kindella 908, 939—941, 955
Kinorhynchospora 1034
Kiricella 931
kitauei, Thelohanellus 1065
Klinophrya 905, 906
Klonostricha 476
Klossia 152, 178, 180, 183, рис. 56 (вкл.)
Klossiella 178, 183, 184, рис. 102 (вкл.)
Klossiellidae 178, 184
knowlesi, Plasmodium (Plasmodium) 305
knowltoni, Culicoides 263
kobayae, Klossiella 185
Kobeltocochlea 862, 864, 923
kochi, Piroplasma 346
kochi, Rhipicephalus 346
kochi, Theileria 346
kocki, Haemoproteus (Hepatocystis) 272, 274
Kofoidina 102
Kofoidinidae 102
Koidzumiella 220
kolenatii, Nycteribia 276
kollei, Babebsia 353
Kolpoda 641, 749
kopki, Haemoproteus (Haemocystidium) 259
Kopperia 601
korlei, Sarcocystis 246
Kormosia 725
korogi, Gregarina 63, 66
Kotinia 778, 781
Kovalevaia 417, 418
Kozloffia 863, 864
Kozloffiella 658
Krassniggia 759
Kreyella 759, 773
Kreyellidae 772
Krishtalia 1036
krylovi, Haemoproteus (Haemoproteus) 267
Kryoprorodon 629, 630, 632
Kryoprorodontidae 629
Kudoa 1046, 1049, 1059, 1063, 1068, 1078
Kudoella 538, 539
kudoi, Aggregata 197
Kudoidae 1048, 1049, 1078
Kuehneltiella 750, 760
kuhli, Verperugo 366
Kuklikophrya 733, 756, 770
kumanense, Siphonosoma 30, 32, 73, 90, 136, 137
Kyaroikeidae 649
Kyaroikeus 649
Kystopus 692
Kystothigma 864, 866
Laackmanniella 518
Laboea 505, 507
labrax, Dicentrarchus 1064
7
1106 УКАЗАТЕЛЬ ЛАТИНСКИХ НАЗВАНИЙ
Labridae 210, 1040 labrosus, Chelon 1019 labyrinthica, Aulofalliculina 439 lacacei, Goussia (Goussia) 211 lacazei, Isospora 206 lacazei, Karyolysus 192 lacerata, Tramea 133 lacertae, Karyolysus 192 Lacertamoeba 259, 279 lacertarum, Haemogregarina 192 lacertarum, Karyolysus 192 lacertinus, Crocodilurus 321 Lacerus 566 Lachmannella 904—906 Lacifer 499 Lacrymaria 373, 389, 548, 553, 561, 562 Lacrymariidae 561, 563 Lacrymariina 547 lacuum, Criodrilus 1038 Lada 865 Ladidae 863 Ladopsis 862, 864, 865 Lagenophryidae 962 Lagenophrys 947, 962—965 Lagomorpha 1019 lagopus, Lagopus 263 Lagotia 437, 438, 440, 441, 443, 437 Lagotinae 436 Lagynidae 563, 784 Lagynophrya 550, 551, 556 Lagynophryidae 556 Lagynurus 578 Lagynus 563, 784 lahorensis, Ornithodoros 357 lainsoni, Garnia (Garnia) 313 lalandi, Seriola 1065 lamblia, Giardia 229 Lambornella 806, 808—811 Lamprodrilus 893, 896 Lamtostyla 460 Lanatospora 1026 landaue, Schellackia 204, 206 Lanitophrya 854, 855 Lankesterella 196, 202, 206, 232 Lankesterellidae 186, 195, 196, 202 lankesteri, Cygnicollum 33, 47 Lankesteria 37, 45, 52, 63, 74, 101, 102 lankesteriae, Perezia 1032 lanoraiea, Haemoproteus 259 lar, Hylobates 309 Larssonia 1028, 1029 Larssoniella 1002, 1020 larvata, Stenophora 120, 121 larvatus, Hipposideros 273 Larvulina 882 latericeus, Notomastus 175 Laterocaudata 1043, 1049, 1068, 1077 Lateroprotomeritus 103 Latifolliculina 438, 441 latipes, Eusimulium 1041 latipes, Simulium 323 latrans frustar, Canis 244, 345 latrans, Canis 237, 361 Latteuria 604, 608 latus, Karyolysus 192 laubieri, Desportesia 1017 laubieri, Pachyporospora 112 laurenti, Weiseria 1041 laurentiae, Haemoproteus 259 Laurentiella 453, 465, 466 lavalaei, Lycoides 187 laverani var. quart ana, Haemamoeba 305 laverani, Haemamoeba 309 Laverania 259, 277, 309 Lavierella 620, 621 lawrencei, Theileria 335, 340 leachi, Haemaphysalis 361 Leboransia 680, 687 Lecanodiscus 711 Lecanophrya 665 Lecanophryella 681, 684 Lecanophryidae 685 Lechriopyla 527, 793, 979 Lecudina 47, 52, 57, 74, 79, 81, 97, 98, 1004, 1017 Lecudinidae 22, 24, 25, 28, 47, 61, 66, 74, 79, 83, 86, 97, 100, 102, 104, 117, 137, 1016 Lecythion 66, 101 Leda 850 1 Leegaardiella 506, 511 Leegaardiellidae 511 । Leegaardiellina 510 leei, Myxidium 1056 Legendrea 548, 566 Legerella 183 Legerellidae 178, 183 legeri, Cognettiella 33, 34, 117 1 legeri, Duboscqia 1031 legeri, Grenoblia 132 legeri, Lecudina 56 legeri, Mecistophora 124 legeri, Nematopsis 111 legeri, Parathelohania 1038 legeri, Taeniocystis 117 Legeria 128 Legerina 197 Leidyana 120 Leidyanidae 25, 120 i? Leionota 586 | Leiotrocha 967, 970, 973 t Leiotrochidae 969 * Lembadion 481, 484, 800, 801, 813 Lembadionella 830, 839 * Lembadionidae 801 f Lembadionina 801 f Lemboides 839, 842 ' I Lembus 834, 836, 839, 845, 897 lemniscatus, Cnemidophorus 228 Lemuridae 307 Lentophyllum 587 Lentospora 1077 lepida lepida, Neotoma 352 Lepidotrachelophyllum 560 Lepismatophila 126 leprosa, Emys 365 Leprotintinnus 517, 518 Leptodactylodon 539 Leptodactylus 538 leptodactylus, Astacus (Poramobius) 223 leptodactylus, Spermophilopsis 345 leptodera, Henlea 31 Leptodesmus 561 Leptodiscus 934
УКАЗАТЕЛЬ ЛАТИНСКИХ НАЗВАНИЙ
1107
Leptoglena 592, 808
Leptopharynx 744, 745, 747, 748
Leptostraca 882, 950
Leptotheca 1048, 1049, 1068, 1073
Lernaeophrya 716
leschenaulti, Hemidactylus 259
leucas, Frontonia 386, рис. 231 (вкл.), рис. 233 (вкл.), рис. 256—
257 (вкл.)
Leucocytogregarina 189, 206
Leucocytozoidae 257, 259, 320
Leucocytozoon 259, 321, 345, 346
Leucophrydium 808
Leucophrys 809—811, 845
leukarti, Mesocyclops 1037
Levanderella 601
Levinea 131, 231
levinei, Haemoproteus (Hepatocystis) 273
leydigi, Chloromyxum 1050
Libelhda 127
libyca, Felis 238
Licnophora 495—497, 500, 925, 975, 978
Licnophorida 379, 450, 495, 497
Licnophoridae 496, 971
lieberkuehni, Myxidium 1049, 1050, 1062—1064
Ligia 956
ligniersi, Cyrilia 187
Liliimorpha 556, 582
Limacidae 851, 975
limacina, Ophelia 177
limnocharis, Rana 259
limnodrili, Jiroveciana 1018
Limnodrilidae 900
Limnodrilus 865, 900
Limnodysteria 645
Limnoria 442, 887, 951, 953
Limnoricus 697, 699
Limnostrombidium 504, 507
Limulus 443
lindemanni, Sarcocystis 245
lineatus, Boedon 224
lineatus, Lumbricillus 177
linei, Lecudina 1005, 1021
lineola, Tabanus 1030
Linostoma 430
Linostomella 426, 430, 434
lintoni, Myxobolus 1065
Linza 818
Liogryllus 819
lionatum, Plasmodium (Asiamoeba) 286
Lionotopsis 587
Liosiphon 571, 740
Liposcelis 93, 119
Liposcelisus 119
Lipotropha 33, 93, 96
Lipotrophidae 24, 25, 30, 31, 35, 39, 54, 59, 66, 80, 90, 93, 94, 96,
97
Lissacineta 680, 681
Lissostrombidium 507
Listarcon 699, 711
Litacineta 681
literatus, Naso 213
lithobii, Echinomera 49
lithobii, Neomonocystis 102
Lithobius 123, 127, 211
Lithocystis 35, 103, 104, 137
Litonotidae 583, 585
Litonotus 571, 572, 583—586
Litosolenus 583, 584, 586
Litostomata 547
Litostomatea 379,380,385, 386,396,400,404,406,415, 546, 603
Littorina 876, 922
livia, Columba 268, 269, 317, 343
Lobochona 665
Lobochonidae 665
Lobochonina 665
Lochus 839
locustae, Johenrea 1022
locustae, Paranosema 1039
locustra, Gammarus 400
Lohmanniella 511, 513
Lohmanniellidae 511
Lohmanniellina 510
Loligo 885
Loma 1022
Lomiella 902
Lomosporus 1077
lonchurae, Sivatoshella 228
longa, Amphiacantha 1017
longicauda, Psychropotes 173
longicollis, Stylocephalus 57, 59—61, 120, 121
longicollis, Trachelonema 418
longicollis, Umbracephalus 127
longicomis, Haemaphysalis 361
Longifragma 776, 779, 782, 787
longispina, Daphnia 1024
longissima, Didymophyes 114
longissima, Gregarina 114
longissima, Heliospora 112—114
longissima, Uradiophora 114
longissima, Urospora 35, 71, 75
Longitricha 787
Lopezoterenia 747
lophii, Spraguea 1014, 1036, рис. 412 (вкл.)
Lophocephaloides 125
Lophocephalus 125
Lophophorina 622
Lophorhynchus 125
lophortyx, Haemoproteus (Parahaemoproteus) 263
lophurae, Plasmodium 10, 292
loriai, Beccaricystis 107
Loricata 942, 943, 945—948
Loricodendron 682, 688, 689
Loricophrya 678, 702
lotor, Procyon 244
Lottia 923
Loxocephalidae 813, 823, 837
Loxocephalina 822—824
Loxocephalus 822—826
Loxocineta 474
Loxodes 372, 390, рис. 224 (вкл.), 416, 420—413, 977
Loxodida 379,416,419
Loxodidae 420
Loxomorpha 98
Loxophyllidae 583
Loxophyllum рйс. 224 (вкл.), 549, 568, 571, 572, 574, 583, 584,
586, 587
Lubetiella 902
Lubetiellinae 901
lucani, Actinocephalus 126
lucani, Gregarina 126
lucani, Stephanophora 126
lucanus, Actinocephalus 126
1108
УКАЗАТЕЛЬ ЛАТИНСКИХ НАЗВАНИЙ
Lucetina 229, 231 lucifugus, Reticulotermes 1031 Ludio 528 Ludioidae 528 lumbrici olidi, Monocystis 105 Lumbricidae 889, 890, 901, 1051 lumbricilli, Mackinnonia 177 lumbriciolidi, Apolocystis 105 Lumbriculidae 865, 896, 897, 900 Lumbriculus 956 Lumbricus 897 Lumbrineris 81 Luminella 519 lunata, Culicosporella 1036 lunatus, Monoductus 62, 120—122 lupus, Canis 244, 361 lutea, Cnemidospora 33, 48, 120—122 lutjani, Microfilum 1019 Lutraria 924 lutzi, Haementeria 187, 188 lutzi, Leucocytozoon 323 Luxiella 516 Luxophrya 700, 925 luzonica, Gallicolumba 269 Lwoffia 659 Lycosella 130 lygosomae, Plasmodium {Asiamoeba) 286 Lymphotropha 90 Lynchella 636, 638, 639 Lynchellidae 638 Lynchellodon 639 Lyngbya 497 lysidici, Cochleomeritus 100 Lytechinus 849 maculatum, Simulium 1032 maculipennis, Anopheles 369, 1038 madagascarensus, Sanzinia 213 madagascariensis, Clavicephalus 120, 121, 126 madagascariensis, Zonozaurus 365 Madsenia 839, 845 maenas, Carcinus 442, 1025 maetzi, Uradiophora 44, 47, 48 magister, Cancer 1021 magna, Cougourdella 1024 magna, Culicospora 1035 magna, Daphnia 1020, 1023 magna, Eimeria 217, рис. 55 (вкл.), рис. 126 (вкл.) magna, Gregarina 105 magna, Monocystis 105 magna, Nematocystis 41, 43, 62, 73, 105 Magnalembus 835, 839 magnificus, Petaurista 271 Magnifolliculina 437, 441, 443, 444 magnus, Myxobolus рис. 419 (вкл.) maior, Plasmodium 281 major, Babesiella 352 major, Francaiella 352 major, Microbabesia 352 majoris, Haemamoeba 288 majoris, Leucocytozoon {Leucocytozoon) 321 malabarica, Lonchura 228 Malacosoma 601 Malacosporea 1045, 1048, 1049, 1052, 1058, 1059, 1079 Malacostraca 963 Malacovalvulida 1049, 1079 malariae irregularis, Plasmodium 309 malariae quartanae, Plasmodium 305, 308, 309 malariae, Haemamoeba 305 malariae, Haemophylium 6 malariae, Laverania 309
mabokensis, Klossiella 184, 185 mabouja, Hemidactylus 277 mabouya, Mabuya 277, 279 Mabuia 228 mabuiae, Octosporella 228 mabuiae, Plasmodium (Carinamoeba) 279 mabuyi, Leucocytozoon {Saurocytozoon) 321 macaci, Entopolypoides 368, 369 maccallumi, Haemoproteus 267 Machadoella 36, 38, 90 Mackinnoniidae 174 Mackinnonia 177 Macoma 850 macrocapsulare, Myxidium 1049, 1050, 1064 macrocephala, Acutispora 124 macrococcus, Amblyospora рис. 395 (вкл.) Macrocoleps 781 macrocoronata, Alveocystis 208, 209 macrocoronata, Klossia 208 macrocyclopis, Lanatospora 1026 Macrocytopharynxa 540, 541 Macrophrya 892, 901 Macropipus 197, 883 Macropodinium 613, 628, 898 Macroprotodon 246 macropterus, Neothunnus 1066 macroratus, Plychrus 204 macrospora, Lipotropha 93, 95 macroura, Zenaida 269 maculata, Cephaloidophora 52 malariae, Mesnilium 258 malariae, Oscillaria 309 malariae, Plasmodium 277, 309 malariae, Plasmodium {Plasmodium) 305, 306 maldaneorum, Pterospora 104 maligna, Caulleryella 92 Mammalia 345, 366, 368, 369, 1019 mansoni, Haemoproteus {Parahaemoproteus) 263, 264, 266, 267, 269 Mansonia 294 Mantonella 196, 223 Mantoscyphidia 908, 912, 921—923 Manuelophrya 702, 907 Manuelophryidae 702 marchouxi, Leucocytozoon 257 marchouxi, Leucocytozoon {Leucocytozoon) 321 Margariscus 585 marginalis, Dytiscus 116 marginata, Hemiclepsis 117, 202 marginatum, Hyalomma 350, 360, 361 marginatus, Dermacentor 350, 352, 357, 360, 361 marginatus, Limax 207 Marginotricha 482, 483 Margolisiella 223 marina, Frontonia рис. 230 (вкл.), рис. 235 (вкл.), рис. 243 (вкл.), рис. 251 (вкл.) Marinecta 700, 721 marinum, Dermocystidium 10 marinus, Bufo 193, 1022 Mariana 1042
УКАЗАТЕЛЬ ЛАТИНСКИХ НАЗВАНИЙ
1109
Marionina 893
marionis, Mariana 1042
Maristentoridae 435, 436
Maristentor 434, 435, 436
maritimus, Holomachilis 118
Marituja 797—799
marmoratus, Oxyelotris 1065
marmoratus, Phyllodactylus 277
marmoratus, Synbranchus 167
Marotelia 216
Marphysa 117
marphysae, Bhatiella 100
marphysae, Gopaliella 112, 113, 117
marphysae, Viviera 100
Marssoniella 1024
marsupialis, Didelphis 238
Martesia 499
Marthasterias 843
martinensis, Spio 1016
martinicense, Avelia 426
Maryna 751, 762
Marynidae 762
Mastigorhynchus 98
Mastigothrix 579
Mastocystis 105
Mattesia 31, 36, 39, 56, 57, 69, 76, 79, 80, 85, 93, 97
matutinum, Plasmodium (Haemamoeba) 288
Maupasella 899, 900
Maupasellidae 888, 899
Maupasia 579
maxima, Daphnia 1024
maxima, Eimeria 218, 345
maximae, Tipulocystis 96
maximus, Scophthalmus 167, 1019
meandrides, Meandria 172
Mecistophora 124
medierranea, Wilhelmia 1030
mediterraneum, Schizophyllum 1017
mediterraneus, Carcinus 1030
mediterraneus, Gaidropsarus 1064
niedusiformis, Haemoproteus (Nycteria) 273, 274
medusiformis, Sarcocystis 246
megacephala, Gregarina 123
Megadinium 618
megalhaesi, Gryllotalpia 131
megalops, Nematoscelis 103
Megascolecidae 895—897, 901
Megavestibulum 593, 628
Meglitschia 1048, 1052, 1067, 1068
Meglitschiidae 1048, 1067
Meiodihaplophasida 995, 1027
Meiostoma 598, 626
Meischeria 240
melanipherus, Haemoproteus (Polychromophilus) 274, 276
Melanocratus 126
melanoleuca, Plasmodium (Ophidiella) 288
melanophi, Gregarina 37
melanosticta, Sardina 211
melanotheron, Sarotherodon 1033
melanura, Culiseta 1029
meleagridis, Cryptosporidium 212, 213
meleagridis, Haemoproteus 263
meleagris, Loxaphyllum рис. 250
meligethi, Anncaliia 1000, 1039, рис. 391 (вкл.), рис. 393 (вкл.)
mellifera, Apis 136, 1014
Melolontha 130
melopeliae, Haemoproteus 267
melops, Crenilabrus 1040
Membranicola 513, 515
Meniscostomum 818
Menospora 135
Menosporinae 135
Menzbieria 96
mephitis, Babebsia 343
mephitis, Maphitis 247
mephitis, Mephitis 343
merlangi, Ceratomyxa 1050
Merocinta 1034
Merocystis 196, 201
Merogregarina 21, 88
Meroselenidium 30, 64, 87
merula, Turdus 297
merulae, Plasmodium 295
Mesanophrys 832, 839, 842
Meseres 501—503
Mesnilella 890
Mesnilellinae 869
mesnili, Caryotropha 178, 201
mesnili, Caulleryetta 1017
mesnili, Haemoproteus 259
mesnili, Vairimorpha 1007, 1009, 1011—1014, 1016, рис. 391
(вкл.)
Mesnilium 258
Mesodiniidae 580, 581
Mesodinium 547, 555, 580, 581
Mesogymnus 830, 839
Mesolembus 840
Mesothamnium 941
Mesozoa 885, 1042
Mespilia 499, 849
Mespilina 912, 915, 916
messae, Anopheles 1039
Metabakuella 474, 475
Metacineta 692, 693, 907
Metaclevelandella 541
Metacollinia 885, 886
Metacylididae 519
Metacylis 519
Metacystidae 563, 775
Metacystis 775
Metadinium 611, 616
Metafolliculina 438, 441, 444
Metamera 86, 117
Metameridae 25, 112, 117
metamorphosa, Paraschneideria 122
metamorphosa, Schneideria 122
Metanophrys 832, 833, 840
Metanyctotherus 536, 537, 539, 540, 543
Metaphrya 878, 884, 979
Metaracoelophrya 897, 898
Metaracoelophryinae 895, 898
Metaradiophrya 891, 892, 897
Metaradiophryinae 895
Metasicuophora 542, 545
Metastoma 632 •
Metastomum 903
Metastrombidium 507, 508
Metaurostyla 475, 476
Metaurostylopsis 479, 455
Metaxystomium 837, 840
Metazoa 38, 335, 1058
Metchnikovella 1016, 1017
1110
УКАЗАТЕЛЬ ЛАТИНСКИХ НАЗВАНИЙ
Metchnikovellida 995, 1016
Metchnikovellidae 76, 1001, 1004, 1015—1017
Metchnikovellidea 1016
metchnikovi, Haemoproteus (Simondia') 260, 262
Metephelota 704
Methanobacterium 399
Methanocorpusculum 794
Methanoplanus 399
Metopa 525
Metopida 523, 524, 525
Metopidae 404, 523, 525, 531
Metopides 527
Metopoides 526
Metopus 397, рис. 224 (вкл.), 523—527, 529, 549, 978
mexicanum, Plasmodium (Paraplasmodium) 277, 281, 283—285
Miamiensis 832, 840, 844
mlchaelis, Ameson 1032
michikoa, Plasmodium (Lacertamoeba) 281
Microbabesia 331, 352
Microcardiosoma 578
Microcetella 601
Microcetus 601, 602
Microchoanostoma 578
Microdiaphanosoma 772
Microfilidae 1019
Microfilum 1019
Microgemma 1019
Micromidas 436, 442
Micromitra 471
Micronyctus 539
Micropithus 578
microplus, Boophilus 352, 353
Micropoculum 518
Micropterus 922
micropus, Etrumeus 211
Microregma 578
Microsoma 352
microsomi, Grasseella 223
Microspiretta 471
Microsporea 995, 1017
Microsporidia 994, 995, 996, 1016, 1043, 1046
Microsporidium рис. 395 (вкл.), рис. 412 (вкл.)
Microthoracida 379, 741—743
Microthoracidae 742—744
Microthorax рис. 229 (вкл.), рис. 237 (вкл.), 741, 743—746, 836
microti, Babesia 9, 331, 332, 335, 337, 343
microti, Frenkelia 247
microti, Nicollia 352
microti, Nuttalia 352
microti, Smithia 352
microti, Theileria 331, 332, 335, 337, 343
microti, Toxoplasma 247
Microxysma 643, 646
Micrundella 521
Miculopodium 950
Mideuplotes 486
miescheriana, Sarcocystis 241, 245, рис. 141 (вкл.)
migrator, Leidyana 81, 82
migratoria, Locusta 74, 84, 138, 1022
migratorius, Turdus 295
millaria, Gregarina 114
milleri, Hazardia 1036
Mimeticus 784
Mimophrya 891, 895, 896
minasense, Plasmodium (Carinamoeba) 279, 281
minchini, Gonospora 25
minchini, Lithocystis 25
Miniapium 920
Minicoma 657
minima, Lankesterella 202, 203
Miniopterus 276
minor, Karyolysus 192
minor, Nuttalia 350
minteri, Myxidium 1064
minuta, Biguetiella 273
minuta, Euplotes 397, 398
minuta, Haemoproteus (Nycteria) 273
minus, Spirostomum рис. 229 (вкл.), рис. 234—235 (вкл.),
рис. 242 (вкл.), рис. 245 (вкл.), рис. 255 (вкл.)
minutum, Petalostoma 1054
mira, Taeniocystis 33, 34, 130
mirabilis, Ceratospora 28, 61, 62, 104
mirabilis, Donsia 440
mirabilis, Syncystis 96
Mirodysteria 645
Mirofolliculina 436, 438, 442, 444
misionicus, Limnodrilus 1018
Mistarcon 702
mitis, Cercopithecus 246
Mitopleistophora 1031
Mitra 460, 461
Mitraspora 1076
Mixtophrya 891, 895
Mixtophryinae 889, 895
Mobilida 379, 385, 401, 908, 930, 949, 965, 968, 971, 972
mobilis, Kamptocephalus 41, 98
mocassini, Hepatozoon 190
modesta, Fallisi (Fallisia) 315
modestus, Culex 1037
modestus, Microtus 247
mola, Mola 1064
molitor, Tenebrio 74, 81, 128
Mollusca 1042
Molluskocystis 116
molnari, Sphaerospora 1063, 1064
Moneuplotes 485, 486
Monilicaryon 572
Monilidiophrys 493
Monintranstylum 908, 933, 938
monnieri, Geneiorhynchus 127
Monocystella 74, 101
Monocystidae 24, 25, 31, 33, 37, 40, 41, 43, 46, 52, 59—61, 64,
71—74, 76, 79, 81, 83, 85, 97, 102, 104, 107, 1021
Monocystis 41, 60, 62, 70, 71, 104, 105, 136
monodi, Stylocephaloides 124
Monodinium 385, 558, 569, 570, 580
Monodontophrya 895, 900, 901
Monoductidae 25, 66, 120, 122
Monoductus 122
Monoica 136
Monoicidae 25, 136
Monolistra 950
Monomastix 578
MonoposthiumGH), 615, 622
Monostylus 490
montana, Flabelliforma 1025
Monurceolaria 970
Moredinium 581
moreleti, Archiulus 183
Morgania 851..
morhua, Gadus 1022
morhua, Loma 1022
УКАЗАТЕЛЬ ЛАТИНСКИХ НАЗВАНИЙ
1111
mori, Bombyx 1014, 1039
Morica 125
morsitans, Culiseta 297
mortisaga, Blaps 1017
morula, Garnia (Garnia) 313
moseleyi, Peripatopsis 223
moshkowskii, Sogdianella 366
motasi, Babebsia 358, 359
moulei, Sarcocystis 245
Mrazekia 1006, 1038
Mrazekiella 895
Mrazekidae 1001, 1038
Mrazekioidea 1038
mrigala, Cirrhina 1065
mucedo, Cristatella 1042, 1056
Mucophrya 721
Mucor 763
Mucoraceae 763
Mucotrichidium 457, 471, 814
mucronata, Asterophora 127
mucronata, Schneideria 120—122
muelleri, Myxobolus рис. 418 (вкл.)
maelleri, Stentor 434
Mugardia 831, 840
muhezae, Tricornia 1038
Mukundaella 134
mulatto, Macaca 245, 246, 309
multicarinatus, Gerrhonotus 283
multifasciata, Mabuya 286
Multifasciculatum 723
multiformis, Garnia (Garnia) 313
multimicronucleatum, Paramecium 385, 396, 405, рис. 240 (вкл.),
рис. 247 (вкл.)
multinucleata, Remanella 421
multisuctores, Allantosoma 400
Multivalvulida 1047—1049, 1052, 1059, 1077, 1078
munieri, Gregarina 64
Muniziella 596, 597
Munnopsis 436
muralis, Lacerta 192
Muridae 309
murinus, Haemoproteus (Polychromophilus) 274, 276
muris, Cryptosporidium 212, 213
muris, Hepatozoon 189
muris, Klossiella 185
muris, Sarcocystis 230, 244, рис. 71 (вкл.), рис. 142 (вкл.)
murmanicum, Eleutheroschizon 177
Musajevella 481
muscaedomesticae, Octosporea 1041
Muscipula 945, 954
Muscophrya 713
muscularis, Trilospora 1065
muscularis, Unicapsula 1065
musculi, Babebsia 343, 345
musculi, Hepatozon 189
musculoliquefaciens, Kudoa 1066
musculus albinus, Mus 364
musculus, Mus 185, 213, 217, 226, 227, 231, 237, 343
musimon, Ovis 345 +.
mustelus, Mustelus 1064
mutabilis, Gemmicephalus 127
mutabilis, Stempellia 1030
mutabilis, Trochocochlea 111
mutans, Theileria 335, 339, 340
Mycodiniida 886
Mycodinium 877, 880, 881, 886
Mycterothrix 762
mydas, Chelonia 365
mykiss, Oncorhynchus 1053
Mykophagophrys 764
Mylestoma 531, 532, 534
Mylestomatidae 533
Myoschiston 938, 940, 941
Myoscyphidia 923
Myosotella 849, 923
Myotis 276
myoxocephali, Haemogregarina 194
Myoxocephalus 1022
Myrioblepharis 766
Myriokaryon 549, 554, 568
Myriokaryonidae 568, 576
Myrionecta 547, 555, 580, 581
Myriospora 176
Myriosporidae 174
Myriosporides 177
Myrtilina 912, 913
Mytilophilidae 859
Mytilophilus 859
mytilovum, Steinhausia 1042, рис. 399 (вкл.)
mytilus, Stylonychia рис. 236 (вкл.), рис. 254—255 (вкл.)
Myxidiidae 1048, 1067
Myxidium 1048, 1049, 1053, 1059, 1060, 1067, 1068
Myxobilatidae 1049
Myxobilatus 1048, 1049, 1061, 1075
Myxobolidae 1048, 1049, 1075, 1076
Myxobolus 1047—1049, 1052—1054, 1059, 1060, 1066, 1068,
1076, рис. 418 (вкл.)
myxocephali, Desseria 188
Myxocephalus 188
Myxocystis 1042
Myxophthirus 849, 851, 853
Myxophyllidae 851
Myxophyllum 828, 851, 852, 868, 904
Myxoproteidae 1048, 1072
Myxoproteus 1048, 1049, 1068, 1072
Myxosoma 1047, 1049, 1053, 1068, 1077
Myxosomatidae 1049, 1077
Myxosporea 1045, 1047, 1048, 1053, 1054, 1066
Myxosporidia 1046, 1047, 1057, 1058
Myxozoa 1045—1050, 1053, 1054, 1057, 1059, 1060, 1079, 1080
Nadelspora 1021
Naididae 890, 895, 1039
Naiidae 1054
Nais 893
naja, Naja 259
najae, Haemoproteus 259
najae, Serpentoplasma 365, 366
Nannophrya 579
nanny la, Rasajeyna 183
Napamichum 1002, 1028, 1029
nasicqrnis, Oryctes 36, 118
nasorum, Cryptosporidium 213
Nassophorea 37.9, 384, 386^387, 405, 406, 415, 728
Nassula 380, 388, 571, 729—732, 734—736, 738
Nassulida 379, 403, 404, 733
Nassulidae,73O, 738
Nassulides 734, 739
Nassulopsida 734
Nassulopsidae 735
Nassulopsina 734
1112
УКАЗАТЕЛЬ ЛАТИНСКИХ НАЗВАНИЙ
Nassulopsis 730, 732, 734—736
Natantina 925
Nathella 593, 596, 597
Nausitora 499, 974
Naxella 738
Nebalia 950
nebraskensis, Nubenocephalus 133
nebulosa, Polymnia 201
necatrix, Eimeria 218, 219, 335
necatrix, Vairimorpha 1007, 1035
neglecta, Ophelia 172
neitzi, Eimeria 219
Nelliemelba 1026
Nellocystis 104, 108
Nematocystis 71, 75, 76, 105
Nematoides 114
nematoides, Siedleckia 140
Nematopsis 63, 110, 111
nemertis, Gregarina 103
nemertis, Monocystis 103
nemertis, Urospora 103
Nemertodendron 683
Nemertodendronidae 683
nemestrina, Macaca 309
Neoactinomyxon 1047, 1068, 1079
Neobipteria 1048, 1049, 1068, 1072
Neobursaridiidae 804
Neobursaridiwn 387, 802, 804, 805
Neogeneia 462
Neogregarina 22, 24, 80
Neogregarinida 24, 84
Neogregarinina 25, 26, 30, 31, 33, 86, 96, 97
Neoichthyophthirius 818, 821
Neogregarinorida 23
Neohenneguya 1049, 1068, 1075, 1076
Neohirmocystis 118
Neomonocystis 102, 104
Neomyxobilidae 1048, 1067
Neomyxobolus 1048, 1068, 1071
Neonosemoides 1033
Neonosemoidiidae 1032
Neonyctotherus 536, 542, 546
Neoparvicapsula 1048, 1049, 1068, 1073
Neoperezia 1000, 1033
Neopereziidae 1032, 1033
Neoschneideria 123
Neospora 196, 239
Neothelohanellus 1048, 1049, 1068, 1077
neothunni, Hexacapsula 1066
neotropicalis, Fallisi (Plasmodioides') 317, 318
nepae, Eimeria 210
nephridiatum, Paramecium 399, 405, рис. 233 (вкл.), рис. 241
(вкл), рис. 245—247 (вкл.), рис. 249 (вкл.), рис. 255—256
(вкл.), рис. 258 (вкл.)
Nephrocerca 416
nephropis, Porospora 52
neptuni, Hyperidion 101
neptuni, Thalassema 66, 101, 223
nereidis, Gregarina 98
nereidis, Monocystis 98
Nereis 100
Nerita 908
nesbiti, Sarcocystis 246
Netaspidisca 489
Neteuplotes 486
nettionis, Haemoproteus (Parahaemoproteus) 263
neurophilia, Pseudoloma 1022
Nezamidan 641
Nicollella 596
Nicollia 331, 366
Nidula 912, 913, 916, 930, 941
nidula, Spirocystis 197
Nidulidae 930
Niemarshallia 516
nigra, Gymnospora 115
nigricana, Girella 211
nigricollis, Naja 259, 366
nigricornis, Potamophylax 130
nigriplantare, Leiolopisma 169
nigrirostris, Macropygia 269
nigropunctatus, Tupinambis 321
nikolskii, Thelohanellus 1065
ninakohlyakimovae, Eimeria 219
ninense, Babebsia 343
niphandrodes, Gregarina 74, 81, 82
Niphargus 942
Nipponarcon 700
nocens, Eumeria рис, 59 (вкл.), рис. 63—64 (вкл,), рис. 67 (вкл.),
рис. 76 (вкл,), рис, 80—82 (вкл,), рис, 90—91 (вкл.)
nitens, Dermacentor 360
Nitidulidae 127
Nivaliella 312, 764
niveum, Zoothamnium 399
niveus, Dermacentor 350
Njinella 902
nobilis, Pterocephalus 123
Noblea 1048, 1049, 1068, 1072
Niscometes 727
noctuae, Athene 323
noctula, Nyctalus 366, 367
noctula, Vesperugo 366, 367
Nolandia 780
Nolleria 1018
Noracineta 706
Nor dicoma 658
Norlevinea 1Q02, 1024
norvegicus, Rattus 189, 236, 238, 343
Nosema 997, 999, 1005—1008, 1011, 1016, 1038—1037, 1039,
1040
Nosematidae 1039
Nosematoidea 1039
Nosemoides 1021, 1036
Notocephalus 477
Notohymena 463
notomegoni, Myxobolus 1065
Nothopleurotricha 467
Notoxoma 755, 767
notropis, Qctosporella 228
nova, Kudoa 1062
nova, Legerella 183
nova, Zschokkella 1063, 1064
Novistrombidium 508
Novyella 259, 295
Nubenocephalus 133
Nuchterleinella 960
Nucleocorbula 805, 876, 907, 966
Nucleocorbulidae 868, 876
Nucleospora 1018
Nucula 850
nuda, Alfenia 1028
Nudiamphisiella 460
Nudispora 1028, 1029
УКАЗАТЕЛЬ ЛАТИНСКИХ НАЗВАНИЙ
1113
nudus, Sipunculus 83 Nummulella 973 nuttalli, Dermacentor 350, 360 Nycteria 259, 273 Nycteribiidae 259, 276 Nycthoterus 535, 593, 753, 868, 944, 978 Nyctibates 546 Nyctotheridae 404, 535, 593, 598 Nyctotherinae 535 Nyctotheroides 372, 533, 535—537, 539, 545, 546 Nyctotherus 396,400, 494, 523, 535, 536, 538—540, 543, 545, 879, 978 Oligosporidium 1021 Oligotrichea 499 Oligotrichia 379, 393, 396, 406, 451, 499, 978 Oligotrichida 389, 403, 498, 499, 501—506 Omegastrombiclium 508 ornata, Glomeris 183 Omoplus 132 Oncosonderia 789, 790 Onychaspis 489 Onychodactylus 646 Onychodromopsis 464 Onychodromus 451, 466, 472 Oocephalus 125 Oospira 880, 881
Obertrumia 731, 732, 735, 738, 739 obesus, Odontotermes 180, 183 Obliguostoma 550, 553, 565 oblongata, Gregarina 124 oblongata, Rhizinia 124 oblongata, Sporadina 124 oblongatus, Stylocephalus 124 obtusa, Larssonia 1029 obtusata, Littorina 89 occidentalis, Francaiella 356 occidentalis, Sceloporus 283 ocellatus, Chalcides 221 Ochlerotatus 809 Ochoterenaia 605—607 Ochridanus 895—897 octacantha, Ancyrophora 84 octocarinatus, Euplotes 396 Octolasium 897 octopiana, Aggregata 197 Octoplasma 240 Octospina 1049, 1068, 1078 octospora, Adelina 179 octospora, Spiroglugea 1030 Octosporea 1006, 1041 Octosporella 196, 228 Octotetraspora 1028, 1030 oculata, Rhynchocystis 107 odagmiae, Parastempellia 1034 odibilis, Culicoides 325 odonata, Resiomeria 1030 Odonaticola 135 Odontochlamys 634, 635 Odontophorella 522 Odontostomatida 379, 390, 404, 530—532 odontotermi, Ganapatiella 183 oenas, Columba 269 Oenophorachona 665, 666 officinalis, Sepia 197 Ogimotoa 609 Ogimotopsis 609 ohioensis, Isospora 231 oithonoides, Thermocyclops 1026 Oldesloeria 784 oligacantha, Actinocephalus 135 oligacantha, Gregarina 135 oligacanthus, Hoplorhynchus 135 Oligochaeta 74, 864 Oligochaetocystis 108 Oligohymenophora 382, 384, 403, 404, 788, 862, 979 Oligohymenophorea 372, 379, 381, 387, 396, 400—402, 404, 406, 415, 794 Oligoisotricha 601, 602 Opalina 118,494,880, 901 Opalinopsidae 884 Opalinopsis 884, 885, 979 Opalnia 134 opalniae, Contospora 134 Opercularia 907, 908, 911, 921, 923, 936, 939, 945, 955—957, 959, 960, 962, 965, 970 Operculariella 914, 959 Operculariidae 955, 960 Operculariina 923, 954, 962 Operculigera 948, 965 Operculina 955, 956 operophterae, Cystosporogenes 1022 operophterae, Orthosomella 1021 Ophelia 172 opheliae, Rhytidocystis 171, 172 Ophidiella 259, 286 ophiocephali, Neomyxobolus 1065 Ophiodiscus 958 ophioides, Sphaerorhynchus 125 Ophioidina 102 Ophionecta 576 Ophionella 928, 929, 950 Ophiothrix 498 Ophistreptus 537 Ophiuraespira 878, 862 Ophiurephelota 701, 705 Ophrydiidae 926, 929 Ophrydinium 373 Ophrydiopsis 950 Ophrydium 927—929, 950 Ophryocephalus 696 Ophryocerca 574 Ophryocystidae 24, 29, 30, 31, 59, 69, 90, 93, 94, 57 Ophryocystis 26,30,31,33,35,36, 38,56, 57,59, 63,67, 69,80, 81, 85, 93, 94 Ophryodendridae 688 Ophryodendron 682, 683, 686—690 Ophryoglena 378, 400, рис. 256 (вкл.), 795, 809, 817, 818, 820, 905 Ophryoglenidae 817, 821 Ophryoglenida 809, 816, 818, 819 Ophryoglenina 400, 402, 817 Ophiyoscolecidae 378, 400, 610, 611, 802 Ophryoscolex рис. 224 (вкл.), 616 Ophryotrocha 176 ophryotrochae, Eucoccidium 176 ophryotrochae, Grellia 176 opilio, Phalangium 130, 134 Opisthodon 571, 583, 584, 586 Opisthonecta 715, 907, 926, 929—931, 961, 962 Opisthonectidae 925, 929
71 Зак. №4163
1114
УКАЗАТЕЛЬ ЛАТИНСКИХ НАЗВАНИЙ
Opisthostomatella 762
Opisthostomum 762
Opisthostyla 918, 934
Opisthotrichum 617
orbicularis, Emys 186, 365
orbis, Parduczia 426
Orbocephalus 126
Orbopercularia 913, 921, 923, 930, 946, 955, 956, 958—961, 965,
970
Orbopyxidiella 956
Orcavia 579
Orcheobius 179
Orchestia 956, 963
Orchitophrya 816, 840, 888
Orcula 690
Ordospora 1020
Ordosporidae 1020
Oreochromis 211
Oreoctoma 835, 841
orientate, Selenidium рис. 11—12 (вкл.), 38, 72
Ormieractinomyxidae 1047
Ormieractinomyxon 1047, 1066, 1080
Ormieresia 1030
Ormosella 523
ornata, Barrouxia 210
ornata, Phialoides 128, 129
ornata, Placopbdella 187
Orsomia 956
Orthoamphisiella 451, 453
Orthochona 912, 914, 916
Orthodon 730
Orthodonella 730, 731, 734
Orthodonellidae 728
Orthofolliculina 442, 444
Orthokreyella 773
Ortholinea 1048, 1068, 1071
Ortholineidae 1048, 1067, 1071
Orthosomella 1021
Orthospora 216
Orthotrochilia 647, 648
Orthurceolaria 970
oryctofelis, Besnoitia 238
oryzaephili, Mattesia 39, 76
Ostracoda 963
Ostracodinium 611, 612, 614, 615, 617
ostrearum, Nematopsis 110, 111
otophila, Haemaphysalis 357, 359
Otostoma 818, 820
Ottowphrya 769
otus, Asia 246
ovale, Plasmodium (Plasmodium) 305
Ovalipes 883
ovalis, Cornimeritus 127
ovalis, Gregarina 128
ovalis, Haemoproteus 259
ovalis, Steinina 128
ovalis, Urospora 103
Ovalorhabdos 558
ovata, Adelea 179
ovata, Clepsidrina 115
ovata, Gregarina 21, 64, 112, 113, 115
ovata, Kofoidina 102
Ovatella 849
Ovavesicula 1031
ovicanis, Sarcocystis 230, 245
ovicola, Prothophrya рис, 234 (вкл.), рис. 245 (вкл.)
ovifelis, Sarcocystis 230, 242, 243, 245, рис. 70 (вкл.), рис. 144
(вкл.), рис. 146 (вкл.)
ovina, Eimeria 219, 220
ovinoidalis, Eimeria 219, 220
oviperda, Henneguya 1065
ovis, Babebsia 331, 332, 334—336, 345, 356—359
ovis, Babesiella 357
ovis, Francaiella 357
ovis, Haematococcus 330, 357
ovis, Microbabesia 357
ovis, Piroplasma 357, 359
Ovivora 196, 223
ovivora, Kudoa 1056
Ovolembus 841
oweni, Digyalum 87, 89
Oxychilus 850, 975
Oxychona 670, 674
Oxychonina 676, 674
Oxytricha 390, 448, 451, 463^165, 477, 478, 496, 500, 977
Oxytrichida 450
Oxytrichidae 451, 459, 460, 462, 467, 484, 500
Oxytrichina 480
ozakii, Filipodium 73, 136, 137
ozakii, Ramicephalus 133
pachidrilii, Gonospora 108
pachidrilii, Monocystis 108
pachydactyli, Isospora 230
pachydrilii, Oligochaetocystis 108
Pachydrilus 895
Pachyfolliculina 436, 438, 442
Pachyporospora 112
Pachysoma 103
Pachystomos 495—497
Pachytrocha 952
Pacifastacus 950, 964
padarcicolubris, Sarcocystis 246
paddae, Plasmodium 288
Paguridae 499
Pagurus 442
Palaemon 938
Palaemonetes 887
Pallasea 726
Palliatidae 1049, 1072
Palliatus 1048—1050, 1068, 1073
pallidus, Thamnodynastes 286
Pallitrichoclila 976
Palmarella 528
Palmarium 528
paludosa, Tipula 183
paludosus, Palaemonetes 212
palumbis, Haemoproteus (Haemoproteus) 267
palustris, Dimeiospora 1038
palustris, Hydroporus 183
polydorae, Sycia 98
Pamplota 493
Panesthia 535, 541, 978
paniformis, Kudoa 1060, 1065
panomensis, Besnoitia 238
Panophrys 795, 818, 820, 855
papernai, Haemoproteus (Haemocystidium) 259, 260
Papillorhabdos 553, 555
papua, Craterocystis 107
Parabakuella 474, 475
Parablepharisma 429
УКАЗАТЕЛЬ ЛАТИНСКИХ НАЗВАНИЙ
1115
Parabryophrya 767
Parabryophryidae 767
Parabundleia 602
Paracentrotus 835, 843
Parachaenia 653, 658
Parachilodonella 648, 650
Parachoanocystoides 108
Paracichlidotherus 535, 539
Paracineta 678, 697, 718, 960
Paracinetidae 696
Paraclathrostoma 798, 799
Paraclevelandia 542, 545
Paracoccidium 216
Paracoelophrya 892, 895, 898
Paracollinia 885, 886
Paracolpidium 813
Paracolpoda 754
Paracondylostoma 754, 765
Parauronemoides 843
Paractedoctema 841, 842
Paractedoctoma 841, 842
Paracunhamunizia 609
Paracyclidium 830, 833, 840, 842
Paracycloposthium 625
Paradentacineta 702
Paradexiotricha 823, 825
Paradileptus 573, 574, 576
Paradiophrys 492, 493
Paradiscophrya 724
paradoxa, Octotetraspora 1030, рис. 397 (вкл.), рис. 403 (вкл.)
paradoxus, Dendrocometes 400
Paraenchelys 559
Paraeuplotes 480, 488, 490
Paraeuplotidae 490
Paraeuplotidium 492
Parafavella 513, 516, 517, 521, 523
Parafolliculina 438, 442
Parafrontonia 796
Parafurgasonia 730, 736
Paragastronauta 640
Paragastrostyla 459
Paraglaucoma 806, 807, 810
Paragonospora 104
Parahaemoproteus 258, 263
Paraheliophrya 718
Paraholosticha 469, 470, 478
Parahypocoma 661, 662
Paraisotricha 601, 604, 607, 608
Paraisotrichidae 598, 603, 607
Paraisotrichopsis 596, 603
Parakahliella 455, 462
Paralagenophrys 964
Paralembus 833, 835, 839, 842
Parallelostrombidium 508
Paraloricophria 702
Paraloxocephalus 825
Paralynchella 639
Paramaecidium 4T3
Paramaecina 909
Parameciidae 804
Parameciina 803
Paramecina 803
Paramecium 373, 378, 380, 383, 385—393, 396, 397, 399, 400,
рис. 224 (вкл.), рис. 227 (вкл.), 795, 801, 802, 804
Parametopella 525
Parametopidium 527, 978
Parametopus 525, 527
Paramitrella 479
Paramphisiella 459
Paramyxoproteus 1048, 1072
Paranassula 732, 737, 850
Paranassulidae 737
Paranophrys 831—833, 842, 846
Paranoplophrya 855, 979
Paranosema 1016, 1039
Paranyctotherus 538, 590, 591
Paraophioidina 102
Paraortholinea 1048, 1068, 1071
Paraoxychona 674
Parapetalotricha 520
Paraphilaster 833, 842
Parapileispora 1078
Paraplagiopyla 609, 793
Paraplagiopylidae 609
Paraplasmodium 259, 281
Parapleistophora 1000, 1023
Parapodophrya 692
Parapodophryidae 692
Paraptychastomidae 867
Paraptorodon 786
Paraptychostomum 861—863, 867
Parapyxicola 945, 952
Pararaabena 606, 607
Paraschneideria 122
Parasicuophora 540, 542—544
Parasonderia 789—791
Paraspathidium 551, 575
Parasphaerophrya 660, 692
Parastacus 964
Parastempellia 1034
Parastentor 435
Parastichopus 499, 872
Parastokesia 797, 799
Parastomatida 853, 854
Parastrombidium 508, 511
Parastylonychia 452, 466
Parastylophrya 720
Paratetrahymena 825
Parathelohania 1002, 1008, 1038
Paratontonia 509, 510
Paratrichodina 969, 971, 976
Paratrochilia 648
Parauronema 829, 832, 833, 843
Parauronemoides 843
Paraurostyla 385, 454, 467
Paraurotricha 785
Paravauchomia 973
Paravorticella 910, 923
Parazoothamnium 907, 935
pardalis, Felis 237
pardalis, Hammondia 237
pardalis, Toxoplasma 237
Parduczia 425, 426
Parentocirrus 468
Parentodinium 606, 610, 615, 620, 621
Parhyale 887
Parundella 520
Paruroleptus 453, 477, 479
Parurosoma 465
parva, Legerella 183
parva, Lepismatophila 62
parva, Theileria 331, 332, 335, 336, 339, 340, 346—349
1116
УКАЗАТЕЛЬ ЛАТИНСКИХ НАЗВАНИЙ
Parvicapsula 1048, 1049, 1056, 1068, 1073
Parvicapsulidae 1048, 1049, 1073
Parvilucifera 6, 10, И, 18, 19
parvula, Eimeria 221
parvula, Tyzzeria 221
parvum, Cryptosporidium 212—215, рис. 79 (вкл.), рис. 83 (вкл.),
рис. 122—123 (вкл.), рис. 125 (вкл.)
parvum, Piroplasma 331, 346
parvus, Gigaductus 117
parvus, Rhipicephalus 346
Passeridae 288
Passeriformes 288, 294, 295, 302
passeris, Plasmodium 288
passeris, Toxoplasma 207
Patella 967
patellae, Pseudoklossia 2T3
Patellonema 961
patens, Condylosmoma 433
patos, Erythrocebus 246
Patonella 352
Patronella 511, 512
Patschia 787
Pattersoniella 467
Paurotricha 830, 832, 833, 835, 843
pavlovskii, Myxobolus 1059, 1065
Pebrilla 436, 438, 442
Pecten 498
Pectenita 832, 843
pectinacea, Sphaerospora 1064
pectinatellae, Trichonosema 1042
pediepiscopalis, Gregarina 114
Pedifolliculina 438, 443, 444
Pediostomum 435
Pedohymena 733, 740
Pegmatheca 1000, 1031
Pelagacineta 713, 720
Pelagodileptus 573, 574
Pelagohalteria 498, 500
Pelagolacrymaria 553, 561, 562
Pelagostrobilidium 505, 512
Pelagostrombidium 505, 508
Pelagothrix 780, 787
Pelagotrichidium 458, 473
Pelagovasicola 582, 777
Pelagovorticella 926, 933, 935
Pelatractus 776
Pelecaniformes 317
Pelecida 421
Pelecyophrya 659
pellitum, Parablepharisma 429
pellucida, Dolyocystis 98
pellucida, Gregarina 98
pellucida, Lecudina рис. 11—12 (вкл.), 37,40,41,47,70,71,74,98
pellucida, Monocystis 98
Pelodinium 531
pelseneeri, Hyaloklossia 2T3
pelseneeri, Pseudoklossia 223
Peltacineta 713
penaei, Agmasoma 1028
penaeus, Cephalolobus 114
Penardiella 566, 567
pendula, Selenidium 30, 52, 96, 87, 88, 89
Penicillium 763
Peniculia 379, 384, 387, 795
Peniculida 379, 406, рис. 230 (вкл.), рис. 233 (вкл.), 795—797,
799, 979
Peniculina 795
Peniculistoma 859, 860
Peniculistomatidae 859
pennatum, Selenidium рис. 11 (вкл.), 38, 54, 88
penneri, Floridobolus 122
penneri, Stenoductus 122
Pentacapsula 1048, 1049, 1078
Pentacapsulidae 1048, 1049, 1078
Pentahymena 774
Pentatomidae 461
percae, Triangula 1063, 1064
percivali, Acomys 364
Perezella 888
Perezia 1032
Pereziidae 1032
Perezioidea 1032
perforans, Colpodella 12, 15, 16, 19, 20
perforans, Selysina 201
perforans, Spiromonas 12, 19
Periacineta 725, 815, 941
Periacinetidae 725
Pericaryon 878, 883
Pericaryoninae 884
pericrocoti, Plasmodium 288
Peridinium 803
Peridinopsis 803
Peridiscophiya 723, 725
Perifolliculina 438, 443
Periholosticha 459
peripati, Mantonella T13
Periplaneta 119
Perisineirra 461
Perispira 567
Peristrombidium 508
Peritricha 375, 385, 403, 405
Peritrichia 379, 385, 393, 397, 401, 906, 979
Peritromida 444
Peritromidae 444
Peritromoides 472
Peritromus 435, 445, 446
Perkinsea 10
Perkinsus 6, 10, 11, 18, 19, 82
perniciosa, Tyzzeria 220, 221
perniciosum, Hepatozoon 189
Pernicivesicula 1027
Pereia 904
persicinum, Plephorisma 427
persulcatus, Ixodes 356, 357
Pessoaella 108
pessoai, Plasmodium (Ophidiella) 288
petaloprocti, Myriospora 117
petaloprocti, Pterospora 35
Petaloproctus 177
Petalotricha 520
pfeifferi, Myxobolus 1065
Pfeifferinella 152, 196, 207, 216
Pfeifferinellidae 196, 207
Phacodiniida 379, 448, 523
Phacodiniidae 449
Phacodiniidia 406, 758
Phacodiniina 450
Phacodinium 446, 448, 450, 484, 758, 977
Phagoon 741
Phalacrocleptes 700, 703
Perisineirra 461
phalangii, Echinoocysta 134
УКАЗАТЕЛЬ ЛАТИНСКИХ НАЗВАНИЙ
1117
phalangii, Echinospora 134
phalangii, Sciadiophora 128—130
Phalodinium 615, 622
Phascolodon рис. 224—225 (вкл.), 637
Phascolodontinae 637
Phasianidae 263, 299, 325
Phasmatopsis TSA—736
Pheretima 107, 900, 902, 904
Phialina 548, 562
Phialinides 562
Phialis 127
Phialoides 127
Philaster 833, 839, 842—844
Philasterella 844
Philasterida 379, 400, 805, 830
Philasteridae 842
Philasterides 838, 842, 844
Philasterina 828, 851, 862
philiplevinei, Wenyonella 224
Phlebotomidae 277, 283
Phleobum 322
Phlogospora 1048, 1049, 1068, 1076
phoeniceus, Agelaius 297
phoenicopterus, Tracheloraphis 418
Phoretophrya 877, 878, 882
Phormidium 497
Phragelliorhynchus 571
phronimae, Callynthrochlamys 37, 114
Phryganea 116, 955
phryganeae, Diplocystis 116
phryganeae, Faucispora 116
Phthorophryinae 878
Phthorophrya 878, 887
Phycolimnoria 442
Phyllacineta 698, 708
Phyllochona 669
Phyllochonidae 666
Phyllopharyngea 379, 380, 387, 389, 393, 396, 401, 403, 405, 415
Physanter 804
Physella 816, 967, 973
Physochona 666, 667
Physophaga 880, 882
Physopsis 810, 811
Phytophthora 766
picicomis, Holocentropus 1024
picta, Batracobdella 195, 202, 203
picta, Chrysemys 260
picta, Desserobdella 195, рис. 112—114 (вкл.)
pictus, Dermacentor 348, 350, 360, 361
pictus, Stenopelmatus 118
Piesika 907, 935
pifanoi, Plasmodium (Paraplasmodium) 283
pilaris, Turdus 294
pilata, Amblyospora рис. 403 (вкл.)
pilchardus, Sardina (Clupea) 211
pileata, Acanthospora 128, 129, 132
Pileispora 1078
Pileocephalus 127
Pilidophora 127
Pilisuctorida 379, 877, 886, 979
Pilisuctoridae 886
Pilonyctus 540
Pilopharynx 422
pilosa, Monocystis 107
pilosa, Rhynchocystis 41, 43, 48, 107
Pilosporella 1034
pilosus, Culex 1036
Pimelia 124, 125
Pinacocoleps 780
Pingius 601, 602
Pintospora 119
Pionosyllis 498
pipiens quinquefasciatus, Culex 1027, 1036
pipiens, Culex 189,204,288,290,297,305,321,1023,1035,1036
pipiens, Rana 189, рис. 122 (вкл.)
pipientis, Caulleryella 92
pipieus pipieus, Culex 1036
pipieus, Krishtalia 1036
pipistrellus, Pipistrellus 343, 366
Pirhemocytor 369
piriformis, Arborocystis 108
piriformis, Dendrocystis 108
piriformis, Unikaryon 1020
Piroplasma 331, 332
Piroplasmia 11, 330, 332, 345, 346, 369
Piroplasmida 11, 332, 368
Piroplasmidae 352
piscatorius, Lophius 1037, рис. 412 (вкл.)
Pithites 644, 650
pithonis, Plasmodium (Ophidiella) 288
Pithothorax 578, 579
Placidae 784
Placus 574, 781, 784, 785
Plagiocampa 776, 785
Plagiocampidae 785
Plagiopogon 773, 782
Plagiocampides 785
Plagiopyla 383, 527, 609, 788—790, 792, 793, 979
Plagiopylea 379, 404-406, 415, 788, 979
Plagiopylia 404, 406, 788
Plagiopylida 379, 783, 788—790
Plagiopylidae 609, 788, 789, 844
Plagiopyliella 793, 844
Plagiospira 868, 871, 872
Plagiotoma 448, 491, 494, 495, 535, 540, 589, 853, 978
Plagiotomida 379, 451, 491, 494
Plagiotomidae 494
Plagiotricha 464
Plagula 211
Planaria 973
planctonis, Tricystis 131
plancus, Polyborus 317
Planeticovorticella 925, 936
Planicola 952
Planicoleps 780
Planifolliculina 438, 443
Planiplotes 493
Planorbis 810, 811, 871, 953, 967
Plasmodiidae 257, 259, 276, 277, 366
Plasmodioides 259, 315, 317
Plasmodium 149, 163, 257—259, 273, 277, 305, 317, 345, 346
Pla9
Platycola 442, 444, 936, 945, 953, 954, 963
Platycolidae 945, 953
Platyfolliculina-438, 443
Platynema 826, 834
Platynematum 826, 827, 834
platynereidis, Lecudina 53
Platyophrya 768
platyophryae, Ciliatosporidium 1021
Platyophryidae 768
Platyophryides 769
1118
УКАЗАТЕЛЬ ЛАТИНСКИХ НАЗВАНИЙ
Platysporina 1047—1049, 1059, 1075
platytardia, Ocypoda 197
Platytrichotus 477, 479
plectroplites, Myxobolus 1066
Pleistophora 478, 997, 1000, 1011, 1014, 1022
Pleistophoridae 1004, 1022
Pleistosporidium 1004, 1020
Pleochona 671, 676
Plesicaryon 768
Plesiotricha 462
Plesiotrichopidae 643, 649
Plesiotrichopus 649
Pleurocoptes 499, 857, 860
Pleurocystis 105
Pleurofragma 783, 784
Pleuronema 527, 855, 857, 860, 861
Pleuronematida 379, 805
Pleuronematidae 855
Pleuronematina 851, 855—857, 860, 861
Pleurophryodendron 690
Pleuroplites 550, 557
Pleuroplitidae 556
Pleuroplitoides 557
Pleurostomatida 379, 403, 582, 583
Pleurotricha 466
Plexobundleia 588, 602
Plicophrya 706
Plistophora 478
ploceii, Plasmodium 288
Ploesconia 487
Plumatelia 1058
plumateliae, Gryonosema 1042
plumatellae, Buddenbrockia 1048, 1058, 1060
plumbeum, Hyalomma 350, 352, 356, 360, 361
plumosus, Chironomus 1027, 1033, 1034, рис. 412 (вкл.)
Podocyathus 704, 960
Podophrya 678, 690, 691, 700, 710, 712, 722
Podophryida 690
Podophryidae 690
Podospora 1049, 1068, 1075
polare, Plasmodium (Giovannolaia') 292
Poljanskina 973
polyacantha, Menospora 62, 128, 129, 135
polycaryum, Paramecium 396, 397, 405, рис. 246 (вкл.)
Polycelis 810
Polychromophilus 259, 276
Polycoccon 484
Polycosta 628
Polycycla 949, 966—969, 973
Polycyclidae 967, 979
polydesmi, Amphorella 130
polydesmi, Amphoroides 62, 128—130
Polydesmus 130
Polydiniellidae 619
Polydinium 619
Polydiophrys 493
Polydispyrenia 1032
polydorae, Myriospora 178
Polymorpha 602, 942
polymorpha, Clepsidrina 128
polymorpha, Fonsecaia 120
polymorpha, Gregarina 46, 50, 52, 54, 74, 76, 128
polymorpha, Hirmocystis 53
polymorpha, Lecudina 81, 82
Polymorphella 602
Polyplastron 611, 612, 614, 618
polyporum, Kerona 401
Polyrhabdina 100
Polyspira 877, 878, 883
polyspora, Lipocystis 93
Polysporoplasma 1048, 1049, 1052, 1068, 1074
Ротасеа 540
Pomania 130
Pomatias 969
Pontesia 100
pontica, Colpodella 14—16, 19, 20
Pontolimax 905
Ponturostyla 468
popilliae, Ovavesicula 1031
porcellus, Cavia 213
porcifelis, Sarcocystis 245
porites, Parties 172
Poroecus 518
Porospora 110
Porosporidae 25, 26, 33, 64, 76
Porosporicae 25, 86, 110
Porpostoma 833, 834, 837—839, 844
portucalensis, Abelspora 1025
Portunus 883
Postciliodesmatophora 379, 404, 415, 416, 977
potamillae, Selenidium 62, 87
potamobii, Mantonella 223
potamobii, Yakimovella 223
Poteriapium 920
Potomacus 844
Pottsia 702
Pottsiocles 702, 715
poutassou, Micromesistius 211
praecox var. muniae, Plasmodium 288
praecox, Haemamoeba 309
praecox, Plasmodium 6, 206
praecox, Stylocystis 130
Praedator 810
Praethecacineta 682, 697
Praethecacinetidae 682
prashadi, Contortiocorpa 101
Predurostyla 439
Preptychostomum 863, 864
Primates 272, 305, 309, 1018
Prionotheca 124
prionothecae, Cystocephaloides 126
Priscofolliculina 448
Prismatospora 133
Proamphorella 522
Proboscella 834, 839, 845
Proboscidium 579
Proboveria 873
Proclausilocola 904
Procondybostoma 433
procyonoides, Nyctereutes 361
Prodiscocephalus 483
Prodiscophrya 683, 722
Prodiscophryidae 722
Progarnia 259, 313, 319
Prolicnophora 496
prolifera, Ancora 32, 101
Pronyctotherus 537, 539, 544
Proophryodendron 688
Prooxytricha 475
Proplectella 521
Proptychostomum 867
Propygocirrus 436, 447
УКАЗАТЕЛЬ ЛАТИНСКИХ НАЗВАНИЙ
1119
Propyxidium 921, 955, 956, 958, 962
Prorodon 383, рис. 231—232 (вкл.), рис. 237 (вкл.), рис. 243
(вкл.), рис. 246 (вкл.), 559, 779, 789, 784, 786
Prorodonopsis 549, 662
Prorodontida 777
Prorodontidae 786
Prosicuophora 536, 542, 543, 546
Prostelidiella 523
Prostomata 376, 776—782, 795
Prostomatea 379, 385, 386, 404, 415, 546, 774, 979
Prostomatida 379, 403, 404, 563, 775, 977
Protanoplophrya 853—855, 868, 888
Protanoplophryidae 854
Proteosoma 277
Protoanoplophrya 854
Protobalantidium 591, 592, 867, 868
Protocaviella 608
Protocaviellidae 608
Protococcidiida 7, 11, 114, 174
Protococcidiorida 174
Protocrucia 446, 447
Protocruzia 416, 446—448, 977
Protocruziida 379, 446, 447, 977
Protocruziidae 446
Protocruziidia 379, 406
Protocyclidium 831, 845
Protocymatocylis 519
Protohallia 609
Protohalliidae 609
Protoheterotrichida 379, 416, 423, 977
Protoisotricha 593
Protomagalhaensia 119
Protonassula 738
Protophrya 816, 871, 875, 876, 888, 902
Protophryoglena 817, 818
Protophryopsis 873
Protoptychostomatina 862
Protoptychostomatinae 863
Protoptychostomum 863, 864
Protoradiophrya 890
Protoradiophry opsis 890
Protorhabdonella 520
Protospathidium 552, 565
Protospira 868, 873
Protospirella &T3
Protostomatida 379, 416
Prototapirella 625
Prototrachelocerca 418
Prototrachelocercidae 416, 418
Prototravassosia 807
Protrichophora 416
provincialis, Stictospora 128, 129, 130
Psammocephalus 482, 483
Psammodromus 345
Psammomitra 471
Psammophrya 576
Pseudarcella 523
Pseudalataspora 1048, 1049, 1068, 1075
Pseudoamphileptus 571, 574, 582, 583, 585
Pseudoamphisiella 477
Pseudobakuella 475
Pseudobalanion 776, 778
Pseudoblepharisma 427, 429, 431
Pseudobuetschlia 600, 602
Pseudocarchesium 912, 933, 937—939
Pseudochilodonopsis 631, 635, 636
Pseudochlamydonella 757, 771, 978
Pseudochlamydonellidae 771
Pseudocinetochilum 824, 827
Pseudocohnilembidae 828, 845
Pseudocohnilembina 828
Pseudocohnilembus 549, 828, 831, 840, 845, 846
Pseudocolpoda 749, 750
Pseudocolpodidium 741
Pseudocorynophrya 713
Pseudocristigera 747, 748
Pseudocyclidium 830, 831, 899, 846
Pseudocyrtolophosis 768
Pseudodileptus 573
Pseudoenchelys 553, 579
Pseudoentodinium 620
Pseudofolliculina 438, 443, 444
Pseudogemma 415, 698, 700, 714
Pseudogemmidae 714
Pseudogemmides 694, 715
Pseudoglaucoma 764, 846
Pseudohaplocaulus 907, 911, 932, 937
Pseudoholophrya 558
Pseudoholophryidae 558, 559, 568
Pseudokahliella 462
Pseudokeronopsidae 473, 475
Pseudokeronopsis 453, 456, 473, 476, 478
Pseudoklossia 196, 223
Pseudokreyella 759
Pseudoloma 1022
Pseudomaryra 760
Pseudometacylis 519
Pseudomicrothoracidae 742
Pseudomicrothorax рис. 225 (вкл.), 742, 744, 748
Pseudomonilicaryon 572
Pseudonosema 1042
Pseudonyctotherus 539
Pseudoparafolliculina 443, 444, 815
Pseudoplagiopyla 791
Pseudoplatynematum 826, 827
Pseudoplatyophrya 763
Pseudopleistophora 1006, 1041
Pseudopleistophoridae 1039, 1041
Pseudoprorodon 559, 568, 576, 786
Pseudostrombidium 465
Pseudothuricola 952, 953
Pseudotontonia 510
Pseudotrachelocerca 548, 551, 557
Pseudotrachelocercidae 557
Pseudouroleptus 451, 459
Pseudourostyla 388, рис. 225 (вкл.), 455, 475
Pseudourostylidae 475
Pseudovorticella 715, 907, 911, 926, 931, 932, 935, 937, 945,
975
Pseuduronema 846
Psilotricha 470
Psilotrichidae 470
psorospermica, Henneguya 1065
Psorospermium 216, 229
psychropotae,. Ixorheis 173, 174
Pterochona 670, 674
pteroclis, Haemoproteus (Haemoproteus) 267
Pterodiniella 619
Pterodinium 619
Pteropoda 471
Pterospora 104
Pterosyllis 498
1120
УКАЗАТЕЛЬ ЛАТИНСКИХ НАЗВАНИЙ
Pterotrachea 116
pterotracheae, Gregarina 116
pterotracheae, Molluskocystis 116
pterotracheae, Zygocystis 116
Ptinus 132
Ptychocylididae 519
Ptychocylis 517, 519
Ptychostomidae 862
Ptychostomum 862—868
Ptyssostoma 830, 846
Ptyxidium 814
pugio, Palaemonetes 212, 1029
pugnax, Colpodella 13—16, 19, 20
pulchellus, Rhipicephalus 346
pulcher, Trichorhynchus 33, 41, 45, 56, 64, 66, 120, 121, 123
pulex, Daphnia 1023, 1026, 1029, рис. 412 (вкл.)
pulex, Gammarus 112, 114, 400
pulicis, Nolleria 1002, 1018
Pulicispora 1031
pulmonalis, Urospora 25
punctata, Haemaphysalis 352, 353, 359
punctata, Lysidice 100
punctatus,Ictalurus 1064, 1065
punctatus, Ophicephalus 258
punctifrons, Mecistocephalus 124
punctor, Aedes 1038
punctulata punctulata, Lonchura 828
punctulatus, Cryptocercus 179
puparum, Pteromabus 1011, 1012
Purpura 870
purpurescens, Procrustes 133
Pusilloburius 830, 846
putrescentiae, Tyrophagus 1018
Putrinum 804
putrinum, Paramecium 386, 388, 389, 405, рис. 241 (вкл.),
рис. 246 (вкл.), рис. 250 (вкл.)
puytoraci, Ancyrophora 43, 45, 84
Puytoracia 862—864, 866
Puytoraciella 755, 767
Pycnothrix 593, 596
Pycnotrichida 596
Pycnotrichidae 596
Pycnotrichidea 596
pygeritus, Cercopithecus 369
Pygmotheroides 539
pygopellita, Trichoctosporea 1031
pyriformis, Thelohanellus 1063, 1065
Pyromonas 507
Pyrosoma 331, 352
Pyrotheca 1024
Pythium 766
Pythonella 196, 228
Pyxicola 945, 951, 952
Pyxidiella 957
Pyxidium 955, 956
Pyxinia 46, 61—63, 66, 128
Pyxinioides 114
quadratum, Kudoa 1062, 1065
quadrispina, Grayallia 107
Quadruhyalodiscus 119
Quadruspinospora 133
quartanae, Plasmodium 305
Quasillagilis 579
quatuorlineata sauromates, Elaphe 224
quettaensis, Haemoproteus (Haemocystidium) 260
quinqueradiata, Seriola 1065
Raabeia 1047, 1050, 1068, 1079
Raabella 654, 658
Raabellocineta 867
Raabena 604, 606, 607
racovitzai, Enterocystis 54
Radiophrya 888, 892, 893, 895, 898
Radiophryidae 838, 895, 899
Radiophryinae 895
Radiophryoides 894
Radiophryopsis 895—897
radiosa, Stephanophora 126
Ramicephalus 133
ramosa, Ceratomyxa 1050
Rana 195, 921
ranarum, Dactylosoma 194, рис. Ill (вкл.)
ranarum, Drepanidium 194
ranarum, Haemogregarina 194
ranarum, Laverania 194
ranarum, Undulina 6
Rangelia 352
Raphanella 927
Raphidopalpa 119
raphidopalpae, Retractocephalus 119
rar a, Bifllida 115
rara, Isospora 229
rarefaciens, Hepatozoon 190
Rasajeyna 183
Rastrimonas 6, 10, 11, 18, 19
ralisbonensis, Tubulinosema 1043
rattus, Rattus Tib
rauschorum, Sarcocystis 246
Rayella 271
rayi, Haemoproteus (Hepatocystis) 272
Rectiperistomatus 536
Rectispora 1006, 1038, 1039
Rectisporidae 1038
Reichenowella 449
Reichenowellidae 449
reichenovi, Plasmodium (Laverania) 309
Reikostomatida 613 -
reinhardtii, Chlamydomonas 72
Relicolpoda 750, 754
relicta, Haemamoeba 288
relictum var. spheniscidae, Plasmodium 288
relictum, Plasmodium 6
relictum, Plasmodium (Haemamoeba) 288, 290—292
Remanella 421—424, 587, 977
renicola, Sphaerospora 1062—1064
renicola, Tetracapsula 1052
reniformis, Potamilla 87
repelini, Acanthospora 134
repelini, Doliospora 134
Repoma 749, 755
Reptilia 365, 366
resinella, Petnova 1020
resinellae, Larssoniella 1020
Resiomeria 1028, 1030
restuans, Culex 305
Retepora 440, 444
reticulata, Ceriodaphnia 1024
reticulata, Rectispora 1039
reticulatus, Dermacentor 350, 361, 362
УКАЗАТЕЛЬ ЛАТИНСКИХ НАЗВАНИЙ
1121
Reticulowoodruffia 471
Reticulowoodruffiidae 771
Retractocephalus 119
Rhabdoaskenasia 555, 557, 580, 581
Rhabdocystis 105
Rhabdodon 731
Rhabdonella 520
Rhabdonellidae 520
Rhabdonelloides 523
Rhabdonellopsis 520
Rhabdophora 404
Rhabdophrya 684
Rhabdophryidae 684
Rhabdosella 522
Rhabdostyla 815, 908, 909, 911, 914, 916, 921, 934, 966
Rhabdostylus 815, 910
Rhabdothorax 625
Rhacophorus 538
rhadinurum, Plasmodium (Carinamoeba) 279
Rhagadostoma 786
Rhinakis 738
Rhinodisculus 830
Rhinolophus 276
Rhinozeta 614, 618
Rhinozetidae 618
Rhipicephalus 369
Rhipidostoma 609
Rhizionella 84, 133
Rhizobranchium 701, 716
Rhizocaryum 903
Rhizochona 673
Rhizodomus 517, 519
Rhizotricha 607
rhodei, Myxidium 1062—1064
Rhopalonia 123
Rhopalophrya 579
Rhyacophila 127
Rhynchelmis 893
Rhyncheta 659
Rhynchocoma 661
Rhynchocystis 105
Rhynchodia 651
Rhynchodida 379, 403, 652—655, 868
Rhynchophrya 660, 725
Rhynchophryidae 725
rhyparobiae, Gregarina 54
Rhyposophrya 770
rhythrogenae, Enterocystis 1020
Rhytidocystidae 171, 172
Rhytidocystis 171, 172
Riboscyphidia 715, 912, 921, 922
richaedsoni, Dicrostonyx 246
ricinus, Ixodes 354, 356, 357, 359
/?ifte415, 697,711
Rigchostoma 764
rigida, Gregarina 54
Rigidocortex 452, 466
Rimacineta 698, 707
Rimaleptus 571, 573
Rimostrombidium 502—504, 512
Rinella 931
Ringueletium 1002, 1006, 1041
rivolta, Cystoisospora 231
rivolta, Isospora 157, 230, 231
rivolta, Levinea 231
Rivulogammarus 935, 938
robusta, Dactylophora 123
robustus, Dactylophorus 120, 121, 123
Rocinela 436
Rodentia 272, 307, 309, 345, 346
rodentifelis, Sarcocystis 243
rodhaini, Babebsia 343, 345
rodhaini, Plasmodium 305
Rondosomides 685
Rondostoma 784
Roquea 810, 811
roscoviana, Hyalospora 118
Rosea 888
rosenbuschi, Kudoa 1062
rossi, Piroplasma 361
rossi, Rossiella 361
rossicus, Rhipicephalus 353
Rossonophrys 945, 986, 950
rostrata, Tetrahymena 397, 398
Rostrophrya 750, 757, 769
Rostrophryides 756, 769
rostrum Loxodes 420, 421
Rotundula 112
rousseaui, Acuta 136
rouxi, Plasmodium (Novyella) 295
Rovinjella 918, 939—942, 945, 955
rubecola, Pyxinia 128
rubicundulum, Sympetrum 133
rubiginosa, Lymnaea 1020
Rubrioxytricha 464
Rudicapsula 1076
ruficollia, Dysdercus 180
rufidulum, Gigantodax 1041
ruflpes, Aphiochaeta 93
Rugaecaulis 912, 933
Ruminotricha 593—595
russelli, Zschokkella 1064
Ruthiella 939
sabellariae, Selenidium 52
Sabellidae 87
sabrazesi, Sphaeromyxa 1050
sabulosum, Schizophyllum 120
sabulosus,Julus 120
saccharina, Lepisma 116
Saccosporidae 1049, 1079
sachai, Haemogregarina 187
sacharovi, Haemoproteus (Haemoproteus) 267
saenuridis, Gregarina 108
Safrodina 975
Safrodon 552
Sagartia 879
Sagitta 131, 884
sagitta, Trachelocerca 417
Sagittaria 770
Sagittariidae 770
sagittata, Anchorina 101
sagittata, Ancora 98, 101
sagittata, Gregarina 101
sagittata, Monocystis 101
salina, Fabrea 432
salminicola, Henneguya 1060, 1066
salmonis, Nucleospora 1011, 1018
Salpa 131, 716
salpae, Gregarina 131
salpae, Thalicola 131
1122
УКАЗАТЕЛЬ ЛАТИНСКИХ НАЗВАНИЙ
Salpingacantha 513, 522
Salpingella 516, 517, 522, 523
Salpingellinae 521
Salpingelloides 522
salvelini, Sarcocystis 247
Salvelinus 247
Samenophrys 964
sandrae, Myxobolus 1063, 1065
Sanguicolina 885
sanguineus, Rhipicephalus 189, 351, 360—362
sapiens, Homo 213, 224, 229, 245, 305, 309, 352, 353, 356, 1018,
1023, 1040
Sapphirina 103
Saprodinium 530, 532
Saprophilus 827
Sarcocystinae 196
Sarcocystis 149, 150, 152, 154, 157, 160, 162, 170, 171, 196, 240,
345, рис. 147 (вкл.)
Sargassephelota 704
Sathrophilus 823, 824, 827
Sauramoeba 259, 277, 279
saurarum, Liponissus 203, 345
saurarum, Sauronyssus 192
Sauria 259, 277, 279, 281, 283, 286, 313, 315, 321
saurocaudatum, Plasmodium (Asiamoeba) 286, 287
Saurocytozoon 259, 321
Sauroplasma 365
savignyi, Hyalomma 350
Saxicava 850
sayi, Vonones 134
scalare, Pterophylum 1023
scandiaca, Nyctea 246
scaniae, Buxtehudea 1018
Scaphidiodon Ti\, Til, 734
Scaphidiodontidae 731
Scaphiostreptus 537
scelopori, Pythonella 229
Sceloporus 229
Schaudinnella 22, 25, 138
Schaudinnellidae 25, 97, 138
schaudinniana, Goussia (Goussia) 211
Schedotrochilia 647
Schellackia 152, 168, 169, 196, 203
Schewiakoffia 579
Schistophallus 850, 975
Schistophrya 740
Schizactinia 689
Schizocalyptra 856, 858
Schizocaryum 828, 830, 831, 841, 846
Schizocystidae 24, 25, 30, 38, 39, 69, 80, 90
Schizocystis 21, 36, 38, 39, 83, 90
Schizogregarina 21, 22, 77, 86
Schizogregarinaria 21
Schizogregarinida 11, 24, 25, 33, 86, 87
schizophylli, Chytridioides 197
Schizopus 493
schneiderae, Schneideria 25, 75, 76
schneideri, Diplocystis 57, 109
schneideri, Lithocystis 62, 71, 104
schneideri, Ophryocystis 39, 69
Schneideria 25, 50, 73, 83, 122
schreibersi, Miniopterus 276
schreveli, Diplauxis 41, 62
schubergi, Metamera 112, 113, 117
schuffneri, Leucocytozoon 325
Schulmania 1068, 1072
schultzei, Culicoides 325
Schultzellina 900
Sciadiophora 130
Sciara 122, 133, 1031
sciarae, Tetraedrospora 133
Scincidae 279, 283, 286
Scipionospora 1006, 1041
Sciurella 602
sciureus, Saimiri 309
Sciurula 602
scololepidis, Dorisiella 178, 202
Scolopendra 123, 124, 131
scomber, Scomber 211
Scopulata 919
scorpi, Malmiana 188, 194
scorpius, Cottus 1022
scorpius, Myxocephalus 1005
scoticae, Antonospora 1040
scoticus, Lagopus 263
scrofa domestica, Sus 229, 361
scrqfa scrofa, Sus 229
scuiri, Hepatozoon 189
scupense, Hyalomma 348, 350, 360
Scuticociliatida 379, 403, 405, 822, 828—833, 352—354, 868
Scuticostomata 862
Scyphidia 496, 876, 907, 908, 919—923, 927, 957, 958, 966
Scyphidiella 922, 923, 950, 957
Scyphidiidae 910, 944, 950
secundus, Rhipicephalus 351
sedecimanae, Haemosporidium 309
sedentaria, Phronima 114
sedgwicki, Peripatopsis 223
segmentata, Gregarina 33
Segmentina 871
Segmentochona 665, 666
Selenidiidae 24, 25, 30, 39, 69, 71, 87, 89
Selenidioides 25, 87
Selenidioididae 25, 86, 87, 89, 90, 97
Selenidium 21, 23, 25, 28, 30, 32, 33, 37, 38, 47, 57, 61, 64, 70, 72,
74, 76, 79,81,83, 136, 138, 1017
Selenococcidiidae 196, 197
Selenococcidium 196, 197
Selenocystis 87
Selysina 196, 201
Semenovaia 1034
Semiacineta 711
Semiboveria ZTi
semicolorata, Rhythrogena 1020
Semicothurnia 945, 950
Semifolliculina 443
Semifolliculininae 436
semiluna, Pseudoklossia 223
Seminassula 739
Semiplatyophrya 756, 771
Semispathidium 564
Semitrichodina 904, 966, 969, 971, 975, 976
semnopitheci, Haemoproteus (Hepatocystis) 272
Senoma 1002, 1039
separata, Eimeria 219
Sepia 884, 885
Sepiola 885
Sepoides 648
Septata 23, 24, 25, 33, 39, 40, 43, 52, 79, 81, 86, 97, 110
Septatorina 23, 86
Septemcapsula 1048, 1049, 1068, 1079
Septemcapsulidae 1048, 1049, 1078
УКАЗАТЕЛЬ ЛАТИНСКИХ НАЗВАНИЙ
1123
septentrionalis, Rana 203
Sericostoma 128
serini, Isospora 207
seriolae, Unicapsula 1065
Serioscyphus 961
Serpentes 288
Serpentichona 669
serpentina, Chelydra 187
serpentis, Cryptosporidium 213
Serpentoplasma 365
serpentula, Gregarina 119
serpentula, Protomagalhaensia 119
Sertumia 830, 846
Sessilida 379, 894, 908, 910—915, 926, 927
Setarcon 689
setcnse, Chattonidium 431
Seticephalus 124
setiferus, Penaeus 1028
setigerus, Cryptopharynx 421
setnai, Caridohabitans 112, 113
Setonophrys 964
Severonis 695, 701
shaharini, Henneguya 1065
shasta, Ceratomyxa 1054, 1059, 1060, 1062—1064
Shellephelota 701, 704
Shellositon 941, 942
sherbani, Cristulospora 1032
Siagonophorus 549
siamense, Fallisi {Fallisia) 315
Sibiracineta 710
sibirica, Francaiella 352
sicula, Lacerta 192
Sicuophora 535, 537, 542—546
Sicuophoridae 404, 541, 542
Sicuophorides 544
Sicuophorinae 535
sidae, Agglomerata 1025
sieboldi, Acanthocephalus 135
sieboldi, Actinocephalus 135
sieboldi, Gregarina 135
Sieboldiellina 893, 902, 905
Siedleckia 22, 23, 25, 31, 32, 138—140
Siedleckiidae 140
Siedleckiella 1047, 1052, 1068, 1080
sigarae, Becnelia 1037
Sigmaperistomatus 536
Sigmocineta 647
Sigmophrya 902
Sigmostomum 795
Sikorops 549
sillasenorum, Metamera 74
Simithorax 746
simondi, Haemoproteus (Haemocystidium) 259, 261
simondi, Leucocytozoon 257
Simondia 258, 260
Simotricha 787
simplex, Anabrus 1034
simplex, Caryospora 226, рис. 131 (вкл.)
simplex, Fallisi (Fallisia) 315
simplex, Sphaerocystis 120—122
simpliciflcata, Shulmania 1072
simulii, Caudospora 1041
simulii, Pegmatheca 1031
simulii, Polydispyrenia 1032
Simuliidae 320, 321, 323, 996
Simuliospora 1036
Simulium 811, 820
simus, Rhipicephalus 346
Sincothumia 946, 951
singularis, Aikinetocystis 107, 108
singularis, Berwardia 1026
singularis, Cephalocystis 105
Sinocyclidium 845
Sinuolinea 1048, 1059, 1068, 1071
Sinuolineidae 1048, 1071
sipedon, Nerodia 189
sipedon, Hepatozoon 189, 190
Siphonocalyx 918
siphonosomae, Exoschizon 30, 32, 90
sipunculi, Schizocystis 83
sipunculi, Urospora 62
Sipunculus 833
Siroloxophyllum 571, 573, 583, 586
Sisyridion 818, 820
sitiens, Culex 301
Sivatoshella 196, 228
skrjabini, Xenopsylla 1031
Slitarcon 708
smithi, Leucocytozoon (Leucocytozoon) 321
socialis, Gregarina 52, 53
socialis, Stolonica 201
socius, Chytridiopsis 1017
Sogoliambla 360
Solenophrya 686, 727
solitaria, Leidyana 120
Sonderia 783, 789, 792, 793
Sonderiella 792
Songophrya 559, 568
sophiae, Anthocephalus 130
Soracineta 707
Sorex 73
Sorogena 404, 752, 766
Sorogenida 379, 766
Sorogenidae 766
sorokini, Bodo 16
soroniae, Tintinospora 118
sororcula, Anabolia 127
sororculae, Cardiocephalus 127
Sparotricha 834, 845—847
Sparsacineta 708
Spasmostoma 579
Spastostyla 831, 933, 934
spatiformis, Urnaepimeritus 127
Spathidiella 566, 579
Spathidiida 547
Spathidiidae 563
Spathidiina 547, 563
Spathidiodes 565, 566, 579
Spathidioides 566
Spathidiopsis 564, 782, 785
Spathidiosus 577, 579
Spathidium 383, 548, 549, 564, 565, 568, 577, 578
Spathocyathus 686
speciosa, Manaynkia 1054
Spelaeophrya 686
Spelaeophryidae 686
Speleoscyphidia 957
Spetazoon 553, 560
Spaeracineta 718
Sphaeractinomyxidae 1047
sphaericum, Myxidium 1064
Sphaeriidae 811, 816, 886, 896
1124
УКАЗАТЕЛЬ ЛАТИНСКИХ НАЗВАНИЙ
Sphaerium 857, 871
Sphaeroactinomyxon 1047, 1068, 1079
Sphaerobactrum 579
Sphaerocystidae 25, 120, 122
Sphaerocystis 122
Sphaeromyxa 1048, 1049, 1059, 1066—1068
Sphaeromyxidae 1048, 1066
Sphaeromyxina 1048, 1066
Sphaerophrya 400, 463, 466, 484, 549, 678, 679, 691, 721
Sphaerorhynchus 125
Sphaerospora 1048, 1049, 1053, 1056, 1059, 1068, 1074, 1075
Sphaerosporidae 1048, 1049, 1074
Sphaerotherium 539
Sphaerotrichium 511, 513
sphagnumensis, Culicoides 263, 269
Sphenophrya 655, 659, 660, 816
Sphenophryidae 659
Sphenophryina 659
Sphenostomella 824, 826, 827
Spherospora 1028, 1030
Spinarcon 685
Spinavaculidae 1078
Spinichona 674
spinidens, Pityokteines 1020
spinidentis, Canningia 1020
Spinispora 116
Spinivorticella 934
spinosa, Golbergia 1036, рис. 399 (вкл.)
spinulosus, Haematopinus 189
spinulosus, Halicryptus 208
Spionidae 30, 898
spionis, Metchnikovella 1016
spionis, Polyrhabdina 100
spionis, Selenidium 30
Spiratella 471
Spiratellidae 471
Spiretella 471
Spiretta 458, 471
Spirobolidae 535
Spirobuetschliella 884, 900, 901
Spirochona рис. 225 (вкл.), 668, 669, 909
Spirochonidae 667
Spirochonina 667
Spirocochlearia 957
Spirocorys 604, 607
Spirocystidae 196
Spirocystis 196, 197
Spirocytopharynxa 540
Spirodiniidae 622
Spirodinium 616, 622
Spirodysteria 645
Spirofilidae 471
Spirofilopsis 471
Spirofilum 471, 472
Spirofragma 739
Spiroglugea 1030
Spirogonella 431
spirogyrae, Spiromonas 13
Spiromonas 13, 76
Spiromorphina 12
Spironectum 431
Spiroperistomatus 536, 537, 540, 546
Spirophrya 753, 878, 882
Spirophryinae 878
Spiroprorodon 563, 630, 631
Spirorbis 439
Spirorhynchus 526
Spirostomatidae 430
Spiro stomidae 430
Spirostomum 383, 389, 391, 399, 426, 428, 430—432, 460, 974
Spirostreptus 535, 537
Spirostrombidium 505, 506, 508
Spirosuturia 1048, 1049, 1068, 1075, 1076
Spirotontonia 510
Spirotrachelostyla 457
Spirotricha 375, 402—404, 589
Spirotrichea 379, 380, 384, 387, 401, 405, 406, 415, 446, 495
Spiroxystonella 521
Spirozona 806, 807, 813
Spirozonidae 813
Spirula 885
spissa, Cirrigregarina 116
spissa, Gregarina 116
Splitofolliculina 443
Spongiarcon 690
Spongiocirrhus 492
Spongiphrya 720
Sporadotrichida 379, 451
Sporozoa 5—12,18,19,21,22,24,76,77,79,90,256,336,337,365
Spraguea 1036
Spongistena 910
Spragueidae 1035, 1036
spraguuei, Inodosporus 1029
sprattus, Sprattus (Clupea) 211
Squalorophrya 723
Squamata 277, 279, 281,288
squamipennis, Aedeomyia 319
squamosa, Hessea 1031
stableri, Babesiosoma 195, рис. Ill—114 (вкл.)
staminea, Protothaca 223
stammeri, Apigregarina 136
stammeri, Torogregarina 112, 113, 116
Stammeridium 744, 747
Stammeriella 747
Stappersia 782
Staurophrya 699, 720
Steenstrupiella 516, 522
Steganorhynchus 135
Stegochilum 806, 808, 813, 848
Stegomyja 809
Stegotricha 659
Steinella 893, 904—906, 967
Steinhausia 1041
steini, Gregarina 45, 52, 74
Steinia 452, 463, 465
Steinina 128
Stelidiella 522, 523
Stelidiellinae 522
Stella, Hylomyscus 343
stellata, Hemolivia 193
Stempellia 1028, 1030
Stenoductus 122
stenolepis, Hippoglossus 1065
stenopelmati, Coccospora 118
stenopelmati, Hirmocystis 118
stenopelmati, Tettigonospora 138
Stenophaga 692
Stenophora 120
Stenophoricae 25, 52, 83, 86, 119, 120
Stenophoridae 25, 61, 120
Stenosemella 516—519
Stenosemellinae 518
УКАЗАТЕЛЬ ЛАТИНСКИХ НАЗВАНИЙ
1125
Stenotricha 460
Stentofolliculina 438, 444
Stentor 373, 378, 383, 385—390,404,428,432 434,435,441,444,
496, 497, 886
Stentoridae 434, 436
Stentorina 969
Stentoropsis 590, 591
stepanowi, Haemogregarina 186
Stephanidina 580
Stephanopogon 387, 416, 977
stephensi, Anopheles 309
Sterkiella 451, 452, 463, 466
sterkii, Paraholosticha 389
steropi, Gigaductus 25, 68, 69, 75, 117
Stethorus 135
stewarti, Lutzomyia 283
sthenelais, Dehornia 171, рис. 61 (вкл.)
sthenelais, Rhytidocystis 172, рис. 61 (вкл.)
Stichopus 25, 499, 872
Stichotricha 450, 457, 472
Stichotrichia 379, 451
Stichotrichida 379, 451
Stichotrichina 450
Stictospora 130
stiedae, Eimeria 6, 155, 219, 345
stoianovitchae, Sorogena 401
Stokesia 798, 799
Stomatina 828
Stomatophora 107
Stomophyllum 587
Stravolaema 562
Strelkowella 695
strenuous, Cyclops 1024
striata, Amphiplatyspora 124
striata, Chilogregarina 131
Striatospora 1017, 1027
Striatosporidae 1027
striatus, Actinocephalus 131
striatus, Metopus рис. 239 (вкл.)
Strigidae 323
Strigiformes 323
strigosa, Diploria 172
Strobilia 499
Strobilidiida 510
Strobilidiidae 511
Strobilidiina 510
Strobilidium 500, 502, 504, 511—513, 875
Strombidiida 379, 502, 510
Strombidiidae 450, 500, 503
Strombidinopsidae 510
Strombidinopsina 510
Strombidinopsis 502, 505, 508, 510, 512
Strombidium 448, 501, 503, 504—510, 512
stromi, Terebellides 104
Strongylidium 450, 454, 460, 472
Strongylocentrotus 484, 793, 837, 860
Stylarcon 584
Stylicauda 519
Stylocephalidae 22, 25, 33, 61, 66, 120, 124
Stylocephaloides 124
Stylocephalus 26, 27, 32, 37, 41, 45, 50, 52, 54, 57, 59, 66, 124
Stylochona 666, 673
Stylochonidae 673
Stylocola 952
Stylocometes 718, 726
Stylocometaidae 726
Stylocoma 498
Stylocystis 130
Stylodrilus 893
Stylogemma 684
Stylohedra 941, 963, 965
Stylonychia 376, 388—390, 396,451,452,463,465,495,977,978
Stylophryodendron 690
Styloplotes 493
Stylorhynchus 124
Styloscolex 893, 896
Stylostoma 687
Stylostomatidae 686
Styxophrya 458, 466
subocularis, Elaphe 213
subpraecox, Plasmodium (Haemamoeba) 288
subtilis, Rastrimonas 18
Succineidae 851
suckeriformes, Chakravartiella 102
Suctoria 64, 374, 375, 379, 385, 389, 391, 397, 400, 401, 403,
676—705
• Suctorida 705
sugereiformes, Chakravartiella 102
suicanis, Sarcocystis 230, 245
suihominis, Sarcocystis 158, 245, рис. 72 (вкл.)
suis, Isospora 229
sulcata, Kovalevaia 418
sulcatus, Microcosmus 223
Sulcigera 856, 859
Sulcigeridae 858, 859
Sulcoarcus 596, 603
Sulfonecta 530
Sultanophryidae 416, 419
Sultanophrys 417, 419, 977
Supraspathidium 564
surdaster, Thamnomys 309, 343, 345
surinamensis, Ameiva 277
surinamensis, Pycnoscelus 136
Swedmarkia 484, 486, 491, 492
Sycia 83, 86, 97, 100, 118
Syllarcon 689
Syllis 498
sylvaticus, Apodemus 236
Symbiodinium 436, 934
Symbionecta 835, 847
Synactinomyxidae 1047
Synactinomyxon 1047, 1052, 1068, 1080
Synchrytium 240
Syncilancistrumina 870, 873
Syncyathella 908, 941, 958, 961
Syncystidae 24, 25, 30, 35, 39, 54, 59, 80, 90, 96
Syncystis 39, 56, 57, 59, 69, 80, 85, 96, 103
Synhymenia 729, 735
Synhymeniida 379, 728, 734, 735
Synophrya 878, 883
Synophryinae 878
syriacus, Heteroxyrax 363
Syringopharynx 653, 659
systeni, Dendrorhynchus 128, 129, 132
Systenostrema 1028, 1030
Systenus 95, 132
Systylis 908, 914, 916
szollozi, Pseudopleistophora 1041
tabani, Systenostrema 1030
Tabanidae 259, 260, 1030
1126
УКАЗАТЕЛЬ ЛАТИНСКИХ НАЗВАНИЙ
Tabanispora 1034
Tachyblaston 415, 703
Tachyblastonida 703
Tachyblastonidae 703
Tachysoma 460, 463, 464, 477
Taeniocineta 863, 864
Taeniocystis 130
tarwanensis, Ascogregarina 45, 47
Taliaferria 626
talievi, Myxobolus 1065
talitri, Cephaloidophora 52
Talitrochilodon 641
Talizona 712.
Tanypus 130
Tanystomiutn 833, 835, 847
Tapes 850, 851
Tapetofolliculina 438, 443, 444, 815
tarandus, Rangifer 345, 356
Tardivesicula 1025
tarentolae, Haemoproteus (Haemocystidium) 259
tarsalis, Culex рис. 55 (вкл.), 1037
Tasmanophrys 965
Taupodrilus 865
Tauriella 930, 939, 946, 954, 955
taurus, Bos 213, 238, 244, 245, 343, 346, 348, 352, 353, 356
Tealia 879
Tectohymena 755, 773
Tectohymenidae 773
teguixin, Tupinambis 321
Tegula 923
Teiidae315, 321
tejerai, Plasmodium (Haemamoeba) 288
Telamodiniidae 618
Telamodinium 618
Teleuscolex 896
telfordi, Garnia (Garnia) 313
Tellina 223, 498, 872, 873
tellinovum, Pseudoklossia 223
Telomyxa 997, 1025
Telomyxidae 1024, 1025
Telostoma 767
Telostomatella 766, 767
Telotrochidiidae 925, 930, 961
Telotrochidium 908, 930, 961, 962
temporaria, Rana 343
tenax, Gamocystis 115
tenella, Eimeria 155, 218, 219
tenella, Sarcocystis 241, 242, 245, рис. 143 (вкл.)
tentaculata, Audoinia 47, 89, 100, 177
tentaculata, Choanocystella 108
tentaculata, Cirriformia 89, 100
tentaculata, Choanocystis 108
tentaculata, Parachoanocystoides 107, 108
Tentaculifera 375, 514
tenue, Plasmodium 295
tenuis, Haemamoeba 295
tenuis, Machilis 134
tenuis, Plasmodium 295
tenuis, Pseudoblepharisma 429
tenuis, Rhizionella 84, 133
Teratodinium 618
Terebella 104
terebellae, Gonospora 104
terebellae, Selenidium 81, 88
Terebrospira 878, 883, 884
Terebrospirinae 878
Teredo 499, 977
Teremanticola 833, 847
Teretrichodina 975
Termitophrya 906, 944
Termitophryidae 944
termophila, Tetrahymena 389
Ternecineta 710
Teronyctus 539
terranowae, Haemohormidium 365
terricola, Platyophrya 1021
territans, Ctdex 189
Territricha 477
Tesnospira 526
Tesnotheca 946, 951
testicularis, Sphaerospora 1064
testiculi, Gonospora 28, 57
Testudines 260
Testudinicola 722
testudinis, Haemoproteus (Simondia) 260
Tetmemena 465
Tetracapsula 1048, 1049, 1053, 1058, 1059, 1068, 1079
Tetractinomyxidae 1047—1049, 1078, 1079
Tetractinomyxon 1047—1049, 1054, 1068, 1078
Tetractinospora 134
Tetmedrophrya 721
Tetraedrospora 133
Tetrahymena 378, 381, 386—391, 393, 396—398, 400, рис. 225
(вкл.), 592, 803, 806, 807, 810—812, 827, 828, 836, 845
Tetrahymenia 810
Tetrahymenida 802, 803, 806—808, 816, 848
Tetrahymenidae 802, 806, 826
Tetrameridionospinospora 134
Tetramicra 149
Tetramicridae 1019
Tetraspina 1078
tetraspora, Gurley a 1024
tetraspora, Scipionospora 1041
Tetrastyla 460
Tetratoxum 620
tetraurelia, Paramecium 385, 396, 405, рис. 241 (вкл.)
Tetrauronema 1048, 1049, 1068, 1076
Tetravalvulida 1078
Tettigonospora 118
Teuthophrys 570, 575, 576
Thais 870
thalassemae, Hentschelia 101
thalassemae,Hyperidion 101
thalassemae, Lecythion 98, 101
thalassemae, Monocystis 2T3
thalassemae, Ovivora 223
Thalassiomastix 580
Thalassochona 671, 672
Thalicola 131
Thaumatophrya 704
thebaica, Nycteris 273
Thecacineta 679, 680, 682, 701, 702
Thecacinetidae 679
Theileria 331, 332, 345, 346, 366
Theileriidte 331, 332, 335, 337, 339, 346, 366
Thelohanellus 1048, 1049, 1053, 1068, 1077
Thelohania 1001, 1007, 1009, 1028, 1033—1035, 1037
Thelohaniidae 1028
Theodoxus 908, 967, 973
thermobiae, Lepismatophila 126
thermocyclopis, Holobispora 1000, 1026
Thigmocoma 829, 850, 868, 904
УКАЗАТЕЛЬ ЛАТИНСКИХ НАЗВАНИЙ
1127
Thigmocomidae 828, 850
Thigmogaster 635
Thigmokeronopsis 474
Thigmophrya 828, 850—853
Thigmophryidae 828, 850, 851
Thigmotheron 874, 876
Thigmotrichida 379, 390, 828, 854, 868—871
Thigmozoon 849
Thisarcon 667
thomasi, Sauroplasma 365
thomseni, Diafolliulina 439
thomsoni, Elleipsisoma 368
Thoracodinium 619
Thoracophrya 785
thripterae, Lophocephaloides 125
Thuricola 444, 908, 915, 948, 951—953
Thuricolopsis 953
Thurophora 801
Thurstonia 863, 864
Thyasira 873
Thylakidium 759, 772
Thyrophylax 847
thyrsitis, Kudoa 1065
Thysanomorpha 566
Thysanotheca 958
Thysanozoon 498
Tiarella 871, 874
Tiarina 782
Tiarinella 781
tilapiae, Neonosemoides 1033
Tillina 389, 749, 756
tincae, Sphaerospora 1062—1064
tingens, Lumbriconereis 1017
tinnunculus, Falco 246
Tintinnida 379, 500, 513—517
Tintinnidiidae 518, 521
Tintinnidium 510, 513—518
Tintinninae 522if
Tintinnopsis 515—519, 523
Tintinnus 505, 513, 522
Tintinospora 118
Tipula 118
Tipulocystis 24, 96
toddi, Leucocytozoon {Leucocytozoon) 321
Tokophrya 396, 696, 697, 709
Tokophryella 415, 696, 710, 907
Tokophryidae 709
Tokophryona 709
tomodoni, Plasmodium {Ophidiella) 288
Tongitheca 562
Tontonia 506, 509
Torodysteria 646
Torogregarina 116
Torquatella 511, 512
Torquatina 973
torquatus, Sceloporus 283, 284
torquatus, Tropidurus 277
torrentium, Epeorus 1032
Toxoehona 666
Toxodinium 623
Toxoglugea 1028, 1031
Toxopercularia 958'
Toxoplasma 126, 206, 232, 345
Toxoplasminae 196, 229
Toxopneustes 832
Toxospora 1028
Tracheliidae 568, 570
Trachelius 570, 573, 574, 576
Trachelocerca 416, 419
Trachelocercidae 416
Trachelochaeta 469
Trachelolophos 417, 418
Trachelonema 416, 418, 419, 977
Trachelophyllidae 560, 563
Trachelophyllina 547
Trachelophyllum 548, 553, 560—562, 587, 925
Tracheloraphis 416—418
Trachelotractus 563
Trachipleistophora 1014, 1023
Transitella 449, 754
Transitellidae 449
Traumatiophtora 278, 883, 888
trautmanni, Babebsia 341, 361, 362
trautmanni, Piroplasma 361
travisiae, Urospora 25, 163
Trematosoma 698, 707
Triacola 960
Triactinomyxidae 1047
Triactinomyxon 1047, 1053, 1059, 1068, 1079, 1080
Triadinium 605, 607, 610, 620
Triadopercularia 960
Triangula 1048, 1068, 1071
triarticulata, Boeckella 1026
triassicum, Paramecium 402, 415
triatomae, Machadoella 90
tribolii, Elliptocystis 119
tribolii, Farinocystis 39, 54, 56, 57, 63, 74, 76, 93
tribolii, Lymphotropha 92
Triboliocystis 93
Tribolium 118, 119
Tricaudalia 624
Trichochona 670
Trichoctosporea 1002, 1028, 1031
Trichoda 731
Trichoderum 747
Trichodina 385, 401, 495, 498, 715, 905, 907, 966, 967, 969—
976
Trichodinella 966, 969, 971, 976
Trichodinidae 979
Trichonosema 1042
Trichodinopsidae 968, 979
Trichodinopsis 949',-966, 969
Trichodon 634 >'
Trichodoxa 966, 969, 972, 975
Trichoduboscqia 1000, 1032
Trichogaster 475
Tricholeptus 479
Trichomecium 427
Trichonosema 1042
Trichopelma 797, 798
Trlchophrya 716—718
Trichophryidae 718 1
Trichopodiella 651
trichopter'ae, Issia 1034
Trichopus 651 ,
Trichorhynchidae 25, 123
Trichorhynchus 72, 123, 762
Trichosia 25
Trichospira 567, 806
Trichostomata 375, 376, 813, 817
Trichostomatia 379, 587, 603, 978
Trichotaxis 478
1128
УКАЗАТЕЛЬ ЛАТИНСКИХ НАЗВАНИЙ
Trichototaxis 478, 479
Trichotuzetia 1002, 1026
Tricladina 906
Tricornia 1038
Tricoronella 473
Tricystis 131
Trifascicularia 624
Trigonepimerus 105
Trigonosporous 1048, 1049, 1068, 1077
Trihymena 759, 773
Trihymenidae 773
Trilospora 1048, 1049, 1068, 1078
Trilosporidae 1048, 1049, 1077
Trimyema 525, 527, 753, 788, 789, 791, 793, 794, 977, 979
Trimyemida 791, 793
Trimyemidae 794
Trinacineta 709, 710
Trionychidae 260
Trionychoidea 260
trionyxii, Haemoproteus (Simondia) 260
Tripalmaria 605, 624
Tripartiella 969, 971, 976
Tripleurocoma 659
Triploblastica 1058
Triplumaria 615, 616, 624
Tripneustes 840, 849
Triseptata 115
triserialis, Helobdella 74
Trithigmostoma 631, 633, 634
Triturus 974
trivirgatus, Aotus 305, 309
Trochella 529
Trochilia 637, 647, 649
Trochiliidae 643
Trochilioides 637, 644, 646, 648
Trochilioididae 643
Trochiliopsis 742, 747
Trochochilodon 641
Troglodytella 615, 619
Troglodytellidae 619
troglodytes, Pan 245, 305, 309, 393, 356
trogodermae, Mattesia 76
Trophogemma 681, 684
trophoniae, Myriospora 177, 178
tropica, Plasmodium 309
Tropidoatractus 528
tropiduri, Plasmodium (Lacertamoeba) 281
trossulus, Mytilus 223
truncata, Eimeria 219, 345
truncatella, Bursaria 372, 405
truncates, Discorhynchus 128
truncatum, Hyalomma 346, 348
truncatus, Discocephalus 128
truttae, Chloromyxum 1063, 1065
truttae, Myxidium 1063, 1064
truttae, Sphaerospora 1064
Trypanococcus 716
tschawytscha, Oncorhynchus 1019
tuberosum, Simulium 1031
Tubifex 900
tubifex, Tubifex 177, 1038, 1054, 1055, 1058
Tubificidae 889, 890, 895, 896, 900, 1038, 1042, 1054
tubificis, Mackinnonia 177
Tubidinosema 1043
Tucolesca 933, 934
tumbayaensis, Proteosoma 295
Tunetella 365
Tunicophrya 703, 705
tupinambi, Leucocytozoon (Saurocytozoon) 321, 322
Turania 807, 813
turanicus, Rhipicephalus 351, 361
Turaniella 807, 812, 813
Turaniellidae 812
Turbilina 511, 512
Turbinella 803
Turdidae 294, 295
turkestanica, Theileria 348
turpis, Colpodella 14, 16, 19, 20
turqueti, Paraledone 1042
turtur, Haemoproteus 267
turtur, Haemoproteus (Haemoproteus) 267
turtur, Streptopelia 269
tuzetae, Lecudina 53, 56, 57, 59, 60, 81, 82
tuzetae, Nematocystis 107
Tuzetia 997, 1024, 1026
Tuzetiidae 1024, 1026
Typhlosphaeroma 950
typica, Paragonospora 104
typicalis, Pleistophora 1005, 1007, 1022
Tytthocorys 523
Tyzzeria 152, 196, 220
Udisoma 772
Udonella 887
uhligi, Eufolliculina 401
Ulivina 83, 100
umbelliformus, Ancyrophora 84
umbellus, Bonasa 263, 265
umbra, Plica 281
Umbracephalus 127
umushii, Enterocystis 102
uncinata, Ancyrophora 34, 84, 132
uncinata, Cyrilia 187
uncinata, Haemogrerarina 187
undatum, Buccinium 201
undecimanae, Haemosporidium 309
undecimlineata, Leptinotarsa 1020
Undella 517, 521
Undellidae 521
Undellopsis 521
undulatus, Mukundaella 134
undulatus, Sceloporus 283, 284
Unicapsula 1048, 1049, 1068, 1078
Unicauda 1048, 1049, 1068, 1076
Unikaryon 1020, 1025, рис. 400 (вкл.)
Unikaryonidae 1019, 1020
uninucleata, Gruberia 430
Unio 871, 956, 973
Unionidae 852
unipunctata, Pseudaletia 1035
Uradiophora 53, 54, 61, 66, 114
Uradiophoridae 25, 112, 114
uralense, Hyalomma 350
Urceolaria 876, 905, 949, 966—940, 973
Urceolariidae 930, 967, 969, 979
Urceolariina 908, 967, 979
Urliella 730, 737
Urliellidae 737
Urnaepimeritus 127
Urnula 694, 715, 720
Umulidae 694
УКАЗАТЕЛЬ ЛАТИНСКИХ НАЗВАНИЙ
1129
Urobarrouxia 210
Urocentrida 379
Urocentridae 406, 802
Urocentrina 802
Urocentrum 398, рис. 225 (вкл.), 798, 802, 848
Urochaenia 580
Urocyclon 847, 846
urogallus, Tetrao 263
Uroleptoides 459
Uroleptopsis 461, 477
Uroleptus 400, 461, 462, 477, 479, 928
Uronema 389, 548, 549, 826, 831, 836, 843, 846, 848, 849
Uronematidae 828
Uronemella 848
Uronemita 848
Uronemopsis 848
Uronychia 396, 480, 484, 487, 488, 492, 493
Uronychiidae 492
Uropedalium 848
Uropogon 609
Urosoma 453, 464
Urosomoida 463
Urospina 471
Urospinula 471
Urospora 103
Urosporidae 24—26,28, 31, 32, 35, 56, 61,71,74, 76, 83, 97,101,
103, 104
Urostomides 526
Urostrongylum 472
Urostyla 397, 400, 455, 475, 476, 910, 977
Urostylida 379, 450, 451, 473
Urostylidae 451, 459, 472, 475
Urotricha 548, 775, 782, 787, 805, 978, 979
Urotrichidae 786, 795
Urotrichopsis 787
Urozona 822, 824, 828
urticae, Vanessa 115
Usconophryidae 946, 962
Usconophrys 918, 948, 962
utingensis, Garnia {Garnia) 313
Uvelinus 906, 916
uzbekistanica, Simuliospora 1036
vacuolatum, Plasmodium {Lacertamoeba) 281, 282
Vaginicola 950—953
Vaginicolidae 930, 945
vahlii, Lycoides 187
Vairimorpha 1002, 1007, 1016, 1035
Valletofolliculina 441, 444
Valvularia 955
Vampyrophrya 402, 878, 882, 883, 888
vanduzeci, Wyeomyia 1034
Vanhovenia 695
vanivilasae, Myxobolus 1065
varia, Gonospora 35, 62, 75, 104
variabilis, Coccidium 210
variabilis, Eimeria 210, 217, 218
variabilis, Goussia {Goussia) 210
variabilis, Keffla 105
variegates, Cyprinodon 1065
variegatus, Lumbriculus 197
Variisporina 1047, 1048
variolaris, Macropodia 125
Vartospathidium 565
Vasacineta 708
Vasichona 664
Vasicola 578, 776
vassali, Haemoproteus {Hepatocystis) Til
vastator, Plasmodium {Asiamoeba) 286
Vauchomia 906, 966, 969, 971, 973, 975
vaughani merulae, Plasmodium 295, 297
vaughani, Plasmodium {Novyella) 295, 299
Vavraia 1000, 1023
Velistoma 833, 835, 840, 847, 849
vellardi, Bolivia 112, 115, 116
velox, Oxya 133
ventricosa, Hirmocystis 112, 113, 118
venustum, Simulium 1032
venustus, Dermacentor 361
Ver acineta 768
Vennigemmida 679
vernalis, Acanthocyclops 1028
versatilis, Euplotes 401
verticalis, Ischnura 135
vesicularum, Brachiola 1040
Vesonyctus 540
Vespertilionidae 276
vespertilionis, Argas 366
vespertilionis, Pteroptus 366
vesperuginis, Achromaticus 366, 367
Vestibuliferida 379, 390, 587, 603
Vestibulongum 593, 596—598
Vestonyctus 540, 543
vexans, Aedes 1031
vexatrix, Lutzomyia 283, 284
vibrio, Toxoglugea 1031
vicinus, Cyclops 1026
victoris, Tetractinospora 134
vigesimotertianae, Haemosporidium 309
villiersi, Campanacephalus 125
villosa, Alouatta 309
Vinarcon 689
vinckei, Plasmodium {Vinckeia) 309, 310
Vinckeia 259, 307
virens, Climacostomum рис. 231 (вкл.), 431, 432
virginianus chiriquensis, Odocoileus 353
virginianus, Bubo 227
virginica, Crassostera 10
virginous, Tapes 223
virgula, Pyrolleca рис. 399 (вкл.)
viridescens, Trituris 195
viridis, Eulalia 210
viridis, Lineus 1021
viridis, Megacyclops 1024
Viridysteria 645
Vittaforma 1006, 1040
vivax, Plasmodium {Plasmodium) 305
vivax, Selenidium 37, 81, 82, 87, 89
viveri, Nosema 76
Viviera 100
vivieri, Coelotropha 175
vivieri, Nosemoides 1005, 1006, 1021
vivipara, Darevskia 192
vivipara, Lacerta 203, 343
Viviparus 723, 854, 855, 865, 874
volgae, Toxospora 1028
volgen.se, Hyalomma 351
volubilis, Spiromonas 13
vonones, Cosmetophilus 134
vorax, Colpodella 13—15, 18—20
vorax, Dinomonas 13, 19
72 Зак. №4163
1130
УКАЗАТЕЛЬ ЛАТИНСКИХ НАЗВАНИЙ
vorax, Tetrahymena 401
Vorticella 373, 376, 385, рис. 257 (вкл.), 715, 907, 908, 911, 912,
916, 923, 930—936, 944, 966
Vorticellida 944
Vorticellidae 909, 930, 938, 939, 961, 971
Vorticellina 803, 908, 909
Vorticellopsis 931, 944, 955
Vostonica 680, 685
vulgaris, Crangon 1028
vulgaris, Octopus 197
vulgaris, Palaemonetes 212
vulgata, Ephemera 1025, 1030
vulpes, Vulpes 237, 244, 245, 343, 361
Wagneria 570
Wailesia 520
wallacei, Besnoitia 238
wallacei, Isospora 238
Wallachia 469, 454
Wangiella 518
war di, Bulbocephalus 120, 121, 125
Wardia 1048, 1049, 1068, 1074
wardsi, Pilopharynx 422
Weiseria 1002, 1006, 1041
wenrichi, Ithania 180, 181
Wenrichia 797
Wenyonella 126, 224
wenyoni, Plasmodium (Qphidiella) 288, 289
Wesenbergia 949
Wichtermania 545
wickhami, Orchopeas 189
Wilbertella 637, 650
wilhelmiae, Lanacekia рис. 394 (вкл.)
Wittmannia 1042
Wolfkosia 737
Wolskana 603
Woodania 509
Woodruffia 387, 757, 770
Woodruffides ПО
Woodruffiidae 769
wrairi, Cryptosporidium 213
xanthina xanthina, Vipera 226
xenopsyllae, Pulicispora 1031
Xenopus 966, 971, 975, 1060
xerkophora, Hrabeyia 1039
Xiphocephalus 125
Xiphodysteria 645
Xylotrya 872
Xystonella 521
Xystonellidae 520
Xystonellopsis 521
Yagiua 849
yagouaroundi, Felis 237, 345
Yakimovella 196, 228
yasunagai, Septemcapsula 1077
yumushii, Echiurocystis 102
yumushii, Enterocystis 102
Zelothorax 746
Zeylanocystis 71, 108
ziemanni var. bubonis, Leucocytozoon 323
ziemanni var. nebraskensis, Leucocytozoon 323
ziemanni, Haemamoeba 323
ziemanni, Leucocytozoon 323
zilli, Tilapia 1033
Zitheron 826, 827
zoea, Gnathophausia 48
Zoocladium 942
Zoothamniidae 930, 939
Zoothamnium 373, 399, 907, 908, 915, 930, 935, 936, 938—944,
954
Zoothamnopsis 907, 937, 943, 944
Zosterodasys TL9, 730, 733—735
Zosterograptus 731, 739
zschokkei, Henneguya 1065
Zschokkella 1048, 1049, 1053, 1067, 1068
zuernii, Eimeria 220
Zygocystis 23, 105
Zygosoma 101
СЛОВАРЬ ТЕРМИНОВ
аборальный — находящийся на стороне, противоположной рту
автогамия — разновидность полового процесса у инфузорий,
при котором ядерная реорганизация происходит в пределах
одной клетки и приводит к гомозиготизации по всем призна-
кам
автотрофия — способность строить органические вещества из
неорганических компонентов путем фотосинтеза или хемо-
синтеза
адоральная зона — участок кортекса, связанный с ротовым ап-
паратом и несущий метаморфизированный ресничный по-
кров: адоральную мембрану (мембранеллы)
акариомастигонт — мастигонтная система, не объединенная с
ядром (см.: мастигонтная система и кариомастигонт)
акронема — тонкий нитевидный вырост на дистальном конце
жгутика
аксеническая культура — культура, свободная от других орга-
низмов
аксонема — внутренний элемент ундулиподии реснички или
жгутика, образован обычно 9 парами периферических мик-
ротрубочек и 2 центральными (формула 9 + 2); иногда
встречаются значительные отклонения от этой схемы
аксоподии — укрепленные упорядоченно расположенными
микротрубочками псевдоподии
аксосома — электронно-плотное тело, с которым связаны осно-
вания центральной пары микротрубочек аксонемы
аксостиль — осевой скелет некоторых жгутиконосцев, состоящий
из микротрубочек, организованных в виде ленты или пучка
альвеолы — пузырьковидные или уплощенные структуры, об-
разованные мембранами ретикулума, расположенные под
плазмалеммой простейшего и в совокупности образующие
так называемый альвеолярный слой. Характерны для инфу-
зорий, споровиков и динофлагеллят, объединяемых по это-
му признаку в группу Alveolata
амебоидное движение — способ движения при помощи псевдо-
подий
амебоидный зародыш — см.: спороплазма
амебула — см.: спороплазма
амитоз — деление ядра без участия митотического аппарата
амфитрофия — способность одного и того же организма (в за-
висимости от внешних условий) либо к чисто автотрофно-
му, либо к чисто гетеротрофному способу питания
анастомоз — частичное слияние структур друг с другом
анаэробные организмы — организмы, способные жить и раз-
виваться при отсутствии в среде свободного кислорода
анизогамия — тип полового процесса, при котором происходит
слияние половых клеток, различающихся по размеру, форме
или поведению при копуляции
анизофилярная полярная трубка микроспоридий — трубка с
витками разного диаметра, с резким переходом от большого
диаметра передних витков к малому диаметру задних
апикальное кольцо — см.: полярное кольцо
апикальные арки — электронно-плотные структуры, залегаю-
щие в вершинах эпицитарных гребней эугрегарин между
плазмалеммой и внутренним мембранным комплексом пел-
ликулы
апикальные филаменты — 10—12 нм микрофиламенты, зале-
гающие продольно в вершинах эпицитарных гребней эугре-
гарин; примыкают к внутренней мембране пелликулы со
стороны цитоплазмы
аппарат Гольджи (= Гольджи комплекс) — элемент эндомемб-
ранной системы клетки; обычно представлен диктиосомой
(стопкой уплощенных цистерн), функция связана с упаков-
кой, синтезом и транспортировкой продуктов клеточного
синтеза
аппарат экструзии — комплекс органелл споры микроспори-
дий, осуществляющий выброс полярной трубки и зародыша
из споры и введение его по каналу полярной трубки непо-
средственно в клетку животного-хозяина
аппошизогония — деление многоядерного синцития на много-
ядерные фрагменты, которые продолжают делиться, форми-
руя одноядерные дочерние клетки (мерозоиты)
аргиром — система аргентофильных линий. Совокупность кор-
тикальных структур (в особенности у цилиофор), выявляе-
мая импрегнацией серебром и окраской протарголом
асептатная грегарина — грегарина, тело которой не поделе-
но септами на сегменты, то же, что «моноцистидная грега-
рина»
аттенуированный (ослабленный)" — термин используется
для обозначения штаммов возбудителей различных болез-
ней, вирулентность которых ослаблена различными спо-
собами (ионизирующей радиацией, химическими вещества-
ми, направленной селекцией, пассированием через организм
гетерогенных хозяев, культивированием на искусственных
питательных средах, эмбрионах и культурах тканей)
ацидосома — род пузырьковидных микротелец, обнаруженных
в цитоплазме Paramecium и некоторых других инфузорий и
несущих кислый секрет. Сливаются с первичными пищева-
рительными вакуолями (фагосомами) в течение 1—5 минут
после образования последних и являются необходимым
компонентом процесса пищеварения
аэробные организмы — организмы, способные жить и разви-
ваться только при наличии в среде свободного кислорода
базальное тельце — см.: кинетосома
блефаропласт — см.: кинетосома
брадизоит — медленно развивающийся мерозоит; термин ис-
пользуется для обозначения мерозоитов, находящихся в ци-
стах токсоплазм и в последней генерации меронтов хаммон-
дий; синоним цистозоит. Ранее термин использовался для
1132
СЛОВАРЬ ТЕРМИНОВ
обозначения мерозоитов последней генерации в саркоцис-
тах у саркоспоридий, сейчас показано, что это гамонты
бродяжка — см.: телотрох
буккальная полость — углубление на апикальной и (или) вент-
ральной поверхности тела цилиофор, снабженное специаль-
ной ротовой (оральной) цилиатурой
буккальный аппарат (= ротовой аппарат) — совокупность
структур и органелл (буккальная полость, системы
филаментов, цитостом, цитофаринкс), служащих для
заглатывания пищи
вакуолетомия — тип деления многоядерного плазмодия мик-
роспоридий, при котором участки цитоплазмы с ядром или
диплокарионом (дочерние клетки) обособляются в результа-
те разрастания образующейся в центре плазмодия вакуоли
вертикальная передача паразитов — передача паразитов от
особей материнского поколения особям дочернего
поколения животного-хозяина
вестибулюм — углубление на апикальном полюсе некоторых
жгутиконосцев, из которого выходят жгутики; ротовое
углубление у цилиофор
возвратный (рекуррентный) жгутик — см.: рулевой жгутик
гаметогамия (= сингамия) — слияние гаплоидных гамет или
половых клеток в половом процессе и формирование дипло-
идной зиготы (см.: зигота)
гаметогенез — процесс развития и формирования половых
клеток — гамет
гаметогония (= гамогония) — формирование гамет; иногда в
качестве синонима используется термин гамогония, хотя
этот термин включает в себя не только формирование гамет,
но еще и развитие гамонтов
гаметоциста — стадия жизненного цикла грегарин: циста,
формирующаяся вокруг сизигия, внутри которой в даль-
нейшем происходит формирование гамет, их копуляция,
а также формирование и развитие ооцист
гаметоцит — см.: гамонт
гаметы — половые или репродуктивные клетки, обеспе-
чивающие передачу наследственной информации от роди-
телей потомкам и дающие при слиянии начало новой особи
гамогония — см.: гаметогония
гамонт (= гаметоцит) — стадия в жизненном цикле
простейших, формирующая одну или более гамет
гамонтоциста — у грегарин то же, что гаметоциста
гамоны — химические вещества, с помощью которых особи
комплементарных типов спаривания узнают друг друга
перед конъюгацией
гаплоидный — имеющий только один (п)набор хромосом
гемозоин — остаточный пигмент в эритроцитарных меронтах и
гаметоцитах некоторых гемоспоридий
геном — полный набор генов какого-либо организма; этот
термин также употребляется для обозначения совокупности
генов гаплоидного набора хромосом
гетер одинамные жгутики — жгутики, имеющие разный тип
биения
гетероконтный — с двумя неодинаковыми жгутиками, разно-
направленными и гетеродинамными
гетероксенный жизненный цикл — жизненный цикл,
протекающий в организме двух или более хозяев
гетеротрофия — питание органическими веществами, образо-
ванными другими организмами
гетерофилярная полярная трубка микроспоридий — трубка с
витками близкого диаметра, но разного строения. Обычно
между передними витками одного строения и задними
другого строения расположены 1—2 промежуточных витка
третьего строения
гидрогеносома — род цитоплазматических органелл, окру-
женных двойной мембраной, у некоторых анаэробных прос-
тейших. Функционально замещают митохондрии
гипнозоит (= дормозоит) — спорозоит, переживающий дли-
тельное время в латентном состоянии в промежуточном
хозяине
гликокаликс — наружный гликопротеидный комплекс, ассо-
циированный с белками и липидами плазматической
мембраны клетки
гликолиз — ферментативный анаэробный процесс негидро-
литического распада углеводов (главным образом глюкозы)
до молочной кислоты
Гольджи комплекс — см.: аппарат Гольджи
гомоксенный жизненный цикл — жизненный цикл,
протекающий в организме одного хозяина
горизонтальная передача паразитов — распространение
паразитов среди особей одного поколения животного-
хозяина
дейтомерит — задний сегмент септатных грегарин содержит
ядро
дефекация (= экскреция) — выведение непереваренного
материала из клетки путем экзоцитоза
диагностический признак — признак, по которому данный
таксон четко отличается от прочих таксонов
дикинеты — ресничный ряд, имеющий в основании парные
кинетосомы
диморфный жизненный цикл микроспоридий — цикл, вклю-
чающий две, обычно одновременно протекающие спорого-
нии с образованием спор двух типов, различающихся мор-
фологически и функционально
диплоидный — имеющий двойной (2п) набор хромосом
диплокарион (дикарион) — ядерный аппарат микроспоридий,
характеризующийся парным расположением и тесным
контактом двух морфологически одинаковых ядер
дицистидная грегарина — грегарина, тело которой состоит из
двух отделов: протомерита и дейтомерита
дормозоит — см.: гипнозоит
жгутик (ресничка) эукариотной клетки — бичевидный вы-
рост, выполняющий у протистов в основном функцию дви-
гательной органеллы; состоит из ундулиподии и кинетосо-
мы (базального тельца); см.: ундулиподия, кинетосома
жгутиковые волоски — см.: мастигонемы
задняя вакуоль — органелла аппарата экструзии микроспори-
дий, расположенная на заднем полюсе споры, в ее полости
часто лежит постеросома — рудимент аппарата Гольджи
зигота — диплоидная клетка, формирующаяся путем слияния
двух гаплоидных клеток (гамет) при половом процессе
зоит — собирательное название для мерозоитов различных
генераций или спорозоита
зооноз — заболевание, передающееся в естественных условиях
между человеком и животными
изогамия — тип полового процесса, при котором сливающиеся
гаметы не различаются морфологически, но имеют различ-
ные биохимические и физиологические свойства; широко
распространена у протистов
изоконтный — обладающий двумя одинаковыми жгутиками
СЛОВАРЬ ТЕРМИНОВ
1133
изофилярная полярная трубка микроспоридий — трубка с
витками одинакового строения и близкого диаметра, незна-
чительно уменьшающегося к дистальному концу
импрегнация протарголом — см.: аргиром
инкубационный период — время между заражением хозяина и
появлением у него первых клинических признаков забо-
левания
Incertae sedis — о таксоне неопределенного систематического
положения
инфрацилиатура — совокупность кинетосом и их микротру-
бочковых и микрофиламентозных дериватов у инфузорий
кариомастигонт — морфологически единый комплекс жгути-
ков с ядром (см.: мастигонтная система, акариомасти-
гонт)
кариосома — старый термин, используемый в некоторых рабо-
тах для обозначения единичного компактного тела, которое
занимает центральное положение в ядре у некоторых про-
стейших (см.: хромоцентр)
кариотип — совокупность признаков хромосомного набора
(число, размер, форма хромосом), характерных для того или
иного вида
кинета — у цилиофор, продольный ряд состоящий из несколь-
ких (многих) ресничек
кинетида — совокупность поверхностно расположенной рес-
нички (ундулиподии) и ее кортикальных составляющих (пе-
реходной зоны, кинетосомы и ее дериватов). В зависимости
от количества кинетосом, входящих в это образование, у ин-
фузорий различают монокинетиды, дикинетиды и полики-
нетиды
кинетодесма (= кинетодесмальная фибрилла) — совокупность
поперечно исчерченных фибрилл, расположенных справа
каждой кинетосомы в ресничном ряду инфузорий и отходя-
щих (от триплетов № 5—7) параллельно этому ряду к перед-
нему концу клетки, налагаясь друг на друга
кинетом — совокупность всех кинетид клетки инфузории, об-
ладающая, как правило, устойчивой топографией у всех
представителей группы ранга отряда—класса
кинетопласт — часть единой митохондрии, содержащей ДНК
у кинетопластид
кинетосома (=базалъное тельце, блефаропласт) — основание
реснички или жгутика — обычно представлена цилиндром
из 9 триплетов микротрубочек, из которых берут начало пе-
риферические микротрубочки аксонемы
клон — клеточная популяция, происходящая в результате бес-
полого размножения одной клетки; у простейших одной
особи
комменсализм — большой класс взаимоотношений между раз-
ными видами организмов, при котором один организм полу-
чает выгоду, для второго (активного партнера) первый не
вреден и не полезен
конкрементная вакуоль — небольшой комплекс субпеллику-
лярных цитоплазматических включений у некоторых цили-
офор, содержащий рефрактивные гранулы (кристаллы кар-
боната кальция?), не имеет отверстия, окружен микротру-
бочками, функция этой «вакуоли» не ясна
коноид — электронно-плотная органелла, сформированная
спирально скрученными микротрубочками на переднем
конце тела у большинства споровиков
конъюгация у цилиофор — половой процесс, при котором две
особи частично или полностью соединяются; микронуклеу-
сы делятся, формируя путем мейоза женские и мужские по-
ловые ядра; мужские ядра мигрируют в тело партнера, где
сливаются с женскими ядрами, образуя синкарион
корковая плазма — см.: кортекс
кортекс (= кортикальная плазма, корковая плазма) — в широ-
ком смысле слова — слой поверхностно расположенных
(I—4 мкм) структур клетки инфузорий, включает пеллику-
лу, инфрацилиатуру, реснички, слой фибрилл, альвеол и
связанные с пелликулой органеллы
кортикальная плазма — см.: кортекс
криптозоит — первый экзоэритроцитарный меронт (= шизонт)
у гемоспоридий, формирующийся прямо из спорозоита и
развивающийся в тканях позвоночного хозяина
кристы митохондрий — складки внутренней митохондриаль-
ной мембраны
ксенома — клетка животного-хозяина, сильно гипертрофиро-
ванная в результате инвазии внутриклеточных паразитов и
заключенная в соединительно-тканную капсулу
ламеллоподия — лопастная псевдоподия
лизосома — пузырьки, производные аппарата Гольджи, окру-
женный одинарной мембраной, содержащие набор гидроли-
тических ферментов, активных в слабокислой среде
лобоподия — широкая, обычно закругленная на конце псевдо-
подия
лорика — защитное образование (футляр), выделяемое некото-
рыми инфузориями
макрогамета — женская гамета; женская половая клетка
макрогаметоцит — см.: макрогамонт
макрогамонт (= макрогаметоцит) — половая стадия разви-
тия, дающая начало женской гамете
макронуклеус — крупное, разнообразной формы соматическое
ядро инфузорий, транскрипционно активное в период веге-
тативной жизни клетки. В ходе ядерной реорганизации при
половом процессе, как правило, деградирует и заменяется
дериватом микронуклеуса (продуктом деления синкариона)
малярийный пигмент (см.: гемозоин)
манубрий — прямой базальный участок полярной трубки мик-
роспоридий, имеющий большой диаметр
мастигонемы — тонкие волоски на поверхности жгутиков, об-
разованные полисахаридами или гликопротеинами
мегаломеронт (= мегалошизонт) — большой меронт цитомер-
ной структуры
мегалошизонт — см.: мегаломеронт
межмембранные частицы — микрочастицы, по-видимому
белковой природы, с неясной функцией, в определенном по-
рядке (различающимся в разных группах инфузорий) распо-
ложенные между слоями плазматической мембраны
мезомитоз — митоз у простейших, при котором центриоль ло-
кализована в периферической части ядра, а хроматин —
либо там же, либо в кариосоме; деление происходит внутри-
ядерно
мейоз — особый способ деления клеток, в результате которого
происходит редукция числа хромосом
мерогония — процесс бесполого размножения споровиков,
приводящий к образованию мерозоитов; обычно характери-
зуется специфическими морфогенетическими процессами, в
результате которых de novo воспроизводится характерный
план строения зоитов
мерозоит — клетка, образующаяся в результате мерогонии у
споровиков
меронт — особь бесполого поколения, размножающаяся путем
деления (мерогонии) и формирующая мерозоиты
меронтогенетическая оболочка спорофорного пузырька —
оболочка, образованная меронтами и отделяющая стадии
мерогонии микроспоридий от цитоплазмы клетки животно-
го-хозяина
1134
СЛОВАРЬ ТЕРМИНОВ
мероцист — большой меронт у некоторых гемоспоридий рас-
падается на отдельные многоядерные фрагменты (цитоме-
ры) перед тем как сформировать мерозоиты
метакриптозоит — мерозоит — стадия развития в жизненном
цикле гемоспоридий, формирующийся путем мерогонии из
криптозоита; метакриптозоит может развиться в другой
криптозоит или превратиться в эритроцитарную стадию
(см.: криптозоит)
метамерная грегарина — грегарина, тело которой состоит из
многих (больше, чем трех) отделов, разграниченных септа-
ми
метамитоз — митоз у простейших, соответствующий нор-
мальному митозу высших животных; центриоль локализова-
на вне клеточного ядра
метахрония — последовательность биения ресничек или жгу-
тиков с определенным фазовым сдвигом
метроцит — клетка, формирующаяся в последней генерации
меронтов у саркоспоридий и френкелий, трансформирую-
щаяся в брадизоит (цистозоит) по старым представлениям и
в гамонт по новым данным
микрогамета — мужская гамета, мужская половая клетка
микрогаметоцит — см.: микрогамонт
микрогамонт (= микрогаметоцит) — гамонт, продуцирующий
микрогаметы путем бинарного или множественного деле-
ния; синоним микрогаметоцит
микронемы — мелкие электронно-плотные структуры у споро-
виков, морфологически и функционально связанные с ропт-
риями
микронуклеус — как правило, мелкое везикулярное генератив-
ное ядро инфузорий, дающее в ходе полового процесса на-
чало новому ядерному аппарату. Его размеры (1—10 мкм)
значительно уступают соматическому ядру (макронуклеу-
су), а функциональная активность в вегетативной жизни ин-
фузорий ограничена и связана с поддержанием нормального
хода стоматогенеза и клеточного морфогенеза
микропиле — отверстие в стенке или утончение стенки на од-
ном из полюсов ооцисты. Термин используется также для
обозначения отверстия в плотных яйцевых оболочках у жи-
вотных, через которые сперматозоит проникает в яйцо
микропора (= ультрацитостом) — инвагинация пелликулы у
споровиков; базальная часть микропоры образована плазма-
леммой
микроспоридии — тип одноклеточных организмов, представ-
ленный одними из наиболее древних внутриклеточных па-
разитов животных
микротрубочки — цилиндрические субклеточные структуры
24 ± 2 нм в диаметре, длина от 100 нм до 1 млн нм, толщина
стенки 4.5 нм; основной компонент макромолекулы тубули-
на; кроме того, в состав входят около 20 различных белков;
этим термином обозначаются гетерогенные, морфологиче-
ски сходные структуры
микрофибрилла — общий термин для обозначения сократи-
тельных и опорных структур клетки. Часто образованы мик-
рофиламентами — тонкими нитями 4—10 нм диаметром
микрофиламент — сократимые или опорные белковые нити в
цитоплазме, 4—10 нм в диаметре. Будучи собраны в пучки,
формируют микрофибриллы. По толщине условно различа-
ют тонкие, промежуточные и толстые микрофиламенты
миксотрофия — в основном автотрофный образ жизни, при ко-
тором, однако, организм нуждается в органических вещест-
вах
минихромосома — функциональная единица генома макронук-
леуса в некоторых группах инфузорий (прежде всего Spirot-
richea), в состав которой входит, как правило, лишь один ген
мионема — филаментозный тяж, способный сокращаться. Ми-
онемы, встречающиеся прежде всего у цилиофор, могут ана-
стомозировать, берут начало от кинетосом, пелликулы или
других структур
митоз — процесс деления ядра, при котором происходит удво-
ение и расхождение гомологичных хромосом
митохондрии — энергетические органеллы эукариотных кле-
ток; основная функция синтез АТФ; оболочка построена из
двух мембран; имеют собственную ДНК и систему синтеза
белков
моноксенный жизненный цикл — жизненный цикл, протекаю-
щий в организме одного хозяина
мономорфный жизненный цикл микроспоридий — цикл, завер-
шающийся одной спорогонией и образованием одного типа
спор
моноцистидная грегарина — грегарина, тело которой не поде-
лено септами на сегменты
морфогенез — формообразование, возникновение и разви-
тие структур как в онтогенезе, так и в филогенезе организ-
мов
мукоцисты — род удлиненных везикулярных огранелл (экст-
русом), расположенных в кортексе и распространенных у
многих инфузорий и жгутиконосцев
мукрон — обычно: прикрепительное приспособление моноцис-
тидных грегарин, не отграниченное резко от остального
тела; в этой книге — прикрепительное приспособление ар-
хигрегарин
мутуализм — большой класс взаимоотношений между разны-
ми видами организмов, при которых оба партнера получают
выгоду
немадесма (= трихит) — пучок гексагонально упакованных
микротрубочек, армирующий стенку глотки у ряда протис-
тов
нематодесмы — структуры, состоящие из связанных между
собой микротрубочек и, как правило, отходящие от кинето-
сом оральной части кортекса в глубь цитоплазмы. Служат
важной составляющей ротового аппарата многих инфузо-
рий
неогамная грегарина — грегарина, формирующая сизигий на
самых ранних этапах развития гамонтов
нозодемы — штаммы трипаносом, вызывающие различное кли-
ническое проявление болезни
Nomen nudum — латинский термин, относящийся к названию,
которое, будучи опубликовано до 1931 г., не удовлетворяет
условиям ст. 12 или, будучи опубликованным после 1930 г.,
не соответствует положениям ст. 13. Пригодным названием
nomen nudum не является. Международный кодекс зоологи-
ческой номенклатуры, 2000
нуклеола — см.: ядрышко
оогамия — тип полового процесса, при котором женская поло-
вая клетка содержит большое количество питательных ве-
ществ; мужские и женские гаметы резко различаются по
размерам, форме и поведению
оокинета — подвижная червеобразная зигота; стадия, предше-
ствующая формированию ооцисты в жизненном цикле неко-
торых споровиков
ооциста — инцистированная зигота; стадия в жизненном цик-
ле споровиков
остаточное тело в ооцисте — материал, состоящий из гранул,
оставшийся в ооцисте после формирования спороцист и
спорозоитов
остаточное тело в спороцисте — материал, состоящий из гра-
нул, оставшийся в спороцисте после формирования споро-
зоитов
СЛОВАРЬ ТЕРМИНОВ
1135
панспоробласт — старое название спорофорного пузырька
микроспоридий, использованное по аналогии с панспоро-
бластом миксоспоридий
парабазалъное тело (=парабазалы1ый аппарат) — у трихомо-
над и гипермастигин комплекс парабазальных фибрилл и
диктиосом аппарата Гольджи
парабазалъные фибриллы — исчерченные фибриллярные жгу-
тиковые корешки трихомонад и гипермастигин
паразитофорная вакуоль — вакуоль, образованная мембрана-
ми клетки животного-хозяина, заключающая внутриклеточ-
ные стадии паразитов
паразиты — организмы, живущие на/или в другом организ-
ме — хозяине, питающиеся за счет хозяина и ничего не даю-
щие хозяину взамен; взаимоотношения между паразитами и
хозяином антагонистические, обычно паразиты реально или
потенциально патогенны для своих хозяев
параксиальный пучок — филаментозный тяж, проходящий ря-
дом с аксонемой в жгутиках некоторых протистов
парасомальный сак — мешковидное впячивание плазматиче-
ской мембраны у инфузорий, расположенное в пелликуле
рядом с каждой соматической моно- или дикинетидой. В по-
ликинетидах часто могут присутствовать только у краевых
кинетосом
пароральная (эндоральная) мембрана — ряд сдвоенных ресни-
чек, расположенных зигзагообразно (стиходиада) на правой
стороне глоточного углубления, под углом к остальным
оральным ресничным структурам (мембранеллам). Наибо-
лее выражена у представителей Oligohymenophorea. Воз-
можна и другая организация парорали — стихомонада, дип-
ло- и полцстихомонада
патентный период — время между началом и окончанием вы-
деления ооцист у зараженного кокцидиями хозяина
педогамия — см.: автогамия
пелликула — поверхностный слой клетки ряда протистов (око-
ло 1 мкм), включающий плазматическую мембрану, альвео-
лярный слой, эпиплазму и ассоциированные с ними микро-
трубочки
пелта — полумесяцеподобная структура; состоит из микротру-
бочек; ассоциирована с головкой аксостиля
передняя вакуоль — см.: поляропласт Хугера
переносчик — организм, переносящий возбудителя заболева-
ния от одного хозяина к другому
переходная зона жгутиков (ресничек) — участок кинетиды
простейших, обычно расположенный на уровне вхождения
последней в клетку, соединяющий ундулиподию с кинето-
сомой. Часто включает дополнительные внутренние элемен-
ты типа поперечных пластинок, колец, спирально располо-
женных фибрилл разной степени сложности. Служит хоро-
шим таксономическим, а в ряде случаев филогенетическим
маркером групп протистов высокого ранга
перилемма — дополнительный мембраноподобный слой на по-
верхности плазмалеммы некоторых инфузорий, возможно
представляющий собой артефакт, возникающий при фикса-
ции гликокалекса
период незрелости — начальная часть жизненного цикла инфу-
зорий (после конъюгации), в течение которого клетка не об-
ладает способностью вступать в половой процесс
перистом — ротовая зона инфузорий; включает рот, предрото-
вую полость (или ровное «перистомальное поле») и всю спе-
циализированную предротовую цилиатуру; термин тради-
ционно применяется к высшим классам цилиофор; в широ-
ком смысле — синоним буккальной полости
перифрагмон — предротовой ресничный комплекс, состоя-
щий из фрагментов соматических кинет у рта, несущих рес-
нички
персистирующий — длительно существующий
пиноцитоз — избирательный прием извне жидкости и ионов
путем впячивания плазматической мембраны и последую-
щего отделения мелких пузырьков; между пиноцитозом и
фагоцитозом имеются все переходы
плазмалемма — покров клетки, состоит из плазматической
мембраны и наружного слоя гликокаликса
плазматическая мембрана — наружная мембрана клетки
плазмогамия — половой процесс микроспоридий, заключаю-
щийся в слиянии цитоплазмы двух одноядерных гамет и
формировании диплокариотической клетки
плазмотомия — см.: цитомерия
планонт — см.: спороплазма
подстилающий слой — слой, примыкающий к пелликуле грега-
рин со стороны цитоплазмы; состоит, по всей видимости, из
переплетенных фибрилл неизвестной природы
поликинеты — ресничные ряды, в основании которых имеется
более двух рядов кинетосом
полиморфный жизненный цикл микроспоридий — цикл, вклю-
чающий обычно три последовательные спорогонии и обра-
зование трех типов спор, различающихся морфологически и
функционально
полицистидная грегарина — грегарина, тело которой поделено
септами и/или перетяжками на отделы
полярная гранула — см.: светопреломляющая гранула
полярная нить — см.: полярная трубка
полярная трубка (нить) — главная органелла аппарата экстру-
зии, характерная для всех микроспоридий. В споре это обра-
зование заполнено по оси гранулированным материалом и
ограничено мембранной оболочкой и слоем спирально рас-
положенных фибрилл. При экструзии из споры трубка выво-
рачивается наизнанку и становится полой
полярная шапочка — см.: полярный якорный диск
полярное кольцо — электронно-плотные кольца на переднем и
заднем полюсах спорозоитов, мерозоитов и некоторых дру-
гих стадий развития споровиков. Переднее апикальное коль-
цо, вероятно, является центром организации субпеллику-
лярных микротрубочек
полярный сак — органелла аппарата экструзии микроспоридий,
представляющая уплощенную вакуоль на переднем полюсе
споры между ее оболочкой и поляропластом
полярный якорный диск — органелла аппарата экструзии мик-
роспоридий, фиксирующая основание полярной трубки на
переднем полюсе споры
поляропласт — органелла аппарата экструзии микроспоридий,
представленная у большинства видов кипой мембран, плот-
но уложенных на переднем полюсе споры
поляропласт Хугера (= передняя вакуоль) — пластинчатая
структура в спорах микроспоридий, может разбухать (и тем
самым, возможно, вызывает выстреливание полярной труб-
ки) или способствовать этому процессу, входит в аппарат
экструзии
пора сократительной вакуоли — выводной проток (часто
укороченный), соединяющий поверхность клетки и цент-
ральный резервуар (ампулу) сократительной вакуоли.
Обычно располагается в строго определенной зоне кортекса
и выявляется при импрегнации структур последнего се-
ребром
порошица — см.: цитопрокт, цитопиг
постеросома — рудимент аппарата Гольджи микроспоридий, в
зрелой споре обычно расположена в задней вакуоли
постцилиарные микротрубочки — система микротрубочек, от-
ходящих от триплета № 9 кинетосомы, которые направлены
к заднему концу тела инфузории и образуют у некоторых
инфузорий выраженную постцилиарную ленту. Особенно
хорошо развиты у представителей подтипа Postciliodesma-
tophora
1136
СЛОВАРЬ ТЕРМИНОВ
почкование — тип деления, при котором от материнской клетки
отшнуровывается одна или несколько более мелких дочер-
них клеток; встречается эндогенный, экзогенный и эвагина-
тивный способы почкования
поэтапная плазмотомия — деление многоядерного плазмодия
микроспоридий на участки со все меньшим числом ядер
премуниция — нестерильный иммунитет
препатентный период — время между первичным заражением
и первой регистрацией размножившегося инфекционного
начала
прикрепленный трофозоит — трофозоит, находящийся в дли-
тельном тесном контакте с клеткой хозяина и снабженный
для этого специальным прикрепительным приспособлением
(мукрон, эпимерит и т. п.)
примит — передняя особь в каудофронтальных сизигиях гре-
гарин
прокариоты — организмы, у которых нет обособленного ядра
промитоз — митоз с сохранением ядерной оболочки и пере-
шнуровкой ядрышка. Термин предложен Шаттоном (Chat-
ton, 1910), используется в большинстве случаев для обозна-
чения митоза у небольшой группы «голых» амеб
пронуклеусы — гаметические ядра, образующиеся в результате
мейотического деления микронуклеуса инфузорий в конце
прогамной фазы конъюгации
протисты — эукариоты с не более, чем 1 типом ткани; преи-
мущественно одноклеточные и микроскопические формы;
макроскопические формы редки; отсутствует дифференци-
ровка тканей; широко распространены формы, обладающие
жгутиковым, ресничным или амебоидным движением; ха-
рактеризуются разными способами питания (авто-, гетеро- и
миксотрофия), гаметическим, зиготическим и споровым ти-
пами мейоза; форма крист в митохондриях различная (дис-
ковидная, пластинчатая, трубчатая); синтез лизина идет как
через амидоадипиновую, так и через диаминопимелиновую
кислоты
протомерит — отдел тела септатных грегарин, находящийся
между эпимеритом и дейтомеритом, отделен от последнего
септой
псевдоподия — временный подвижный вырост тела клетки; ис-
пользуются для движения и фагоцитоза. Различают по фор-
ме и строению — лобоподии, филоподии, ретикулоподии,
аксоподии, флагеллоподии
псевдоциста — (1) — устаревшее название для остаточного
тела в гаметоцистах грегарин; (2) — цистоподобная стадия
или структура, часто состоящая из большого числа клеток
паразитических простейших; стенка состоит из мемб-
ран (ы), которые формируются клетками хозяина
псевдоцитомер — отдельная многоядерная часть внутри расту-
щего меронта, которая не отделена от цитоплазмы меронта
своей собственной плазматической мембраной
псевдоцитомер — отдельная многоядерная часть внутри расту-
щего меронта, которая не отделена от цитоплазмы меронта
своей собственной плазматической мембраной
ресничка — см.: жгутик эукариотной клетки
рибосомы — мелкие нуклеопротеидные образования в клетке,
на которых происходит синтез бепков
ризопласт — видимый в световой микроскоп жгутиковый ко-
решок; обычно соответствует поперечно-исчерченному ко-
решку из микрофиламентов
ризоподии (= ретикулоподии) — разветвленные псевдоподии,
часто образующие анастомозы и содержащие в качестве
структурного компонента микротрубочки
розетковидное почкование — деление многоядерного плазмо-
дия микроспоридий путем миграции ядер с цитоплазмой на
периферию плазмодия. При этом делении дочерними клет-
ками используется вся цитоплазма материнского плазмодия
роптрии — парные извилистые булавовидные электрон-
но-плотные структуры у зоитов споровиков и динофлагел-
лят, сужающиеся к переднему полюсу, выполняющие секре-
торную функцию, способствующие проникновению парази-
та в клетку хозяина
ростеллум — хоботообразное выпячивание переднего конца
тела у некоторых паразитических флагеллят (в том числе у
оксимонад), функционирующее как прикрепительная орга-
нелла и способное расширять свой передний кончик в виде
бокалообразной присоски
рострум — хоботообразное выпячивание переднего конца тела
у флагеллят, на вершине или у основания которого распола-
гается ротовое отверстие
ротовой аппарат — см.: буккальный аппарат, цитостом
саркоцисты — последняя генерация меронтов у саркоспори-
дий в мышцах промежуточного хозяина
сателлит — задняя особь в каудофронтальных сизигиях гре-
гарин
светопреломляющая гранула (= полярная гранула) — структу-
ры, формирующиеся в ооцистах некоторых видов кокцидий
при первом (редукционном) делении зиготы, синоним «по-
лярная гранула»
свободный трофозоит — трофозоит, прекративший контакт с
клетками хозяина, в том числе отбросивший прикрепитель-
ное приспособление
селфинг — конъюгация в пределах клона
септа — поперечная фибриллярная перегородка, обычно отде-
ляет протомерит от дейтомерита
септатная грегарина — грегарина, тело которой поделено сеп-
тами и перетяжками на два или более отдела — обычно на
эпимерит, протомерит и дейтомерит; то же, что «полицис-
тидная грегарина»
сизигий — стадия жизненного цикла грегарин, представляющая
собой предшествующее гаметогенезу объединение гамон-
тов (обычно двух)
симбиоз — одни исследователи понимают под симбиозом по-
стоянную обоюдовыгодную ассоциацию двух организмов,
относящихся к разным видам, при которой один организм не
может существовать без другого в естественных условиях;
другие исследователи вкладывают в этот термин более ши-
рокий смысл, считая симбиозом любую ассоциацию двух
различных в систематическом отношении организмов
симбионт — часто этим термином определяют организм, нахо-
дящийся с другим организмом в отношениях, выгодных для
обоих
синген — часть клеток, принадлежащих к одному морфологи-
ческому виду у инфузорий, в пределах которой возможно
свободное скрещивание, дающее жизнеспособное потомст-
во (биологический вид)
синкарион — продукт слияния мигрирующего и стационарного
пронуклеусов (зигота), образующийся в конце метагамной
фазы конъюгации у инфузорий. В результате деления дает
начало новому ядерному аппарату: макро- и микронуклеу-
сам
синоним — каждое из двух или нескольких названий, данных
одному и тому же таксону
синфрагмон — ресничная полоса, образованная при фрагмента-
ции группы соматических кинет и тесном сближении отделив-
шихся фрагментов; так образуется ротовой ресничный аппа-
рат у Colpodida, Entodiniida, Blepharocorythida, Didesmida
скопула, скопулойд — органоиды прикрепления у некоторых
инфузорий
СЛОВАРЬ ТЕРМИНОВ
1137
слабо анизофилярная полярная трубка микроспоридий — труб-
ка, у которой несколько последних витков имеют меньший
диаметр, чем остальные
сократительная вакуоль — эндомембранная система пресно-
водных простейших, выполняющая осморегуляционную и
выделительную функции. Представлена обычно в виде рит-
мично сокращающегося пузырька с системой приводящих
канальцев (см.: спонгиом)
соматокинета — ресничный ряд на теле цилиофор, вне пери-
стомальной зоны; соматокинеты служат для движения или
обеспечивают тигмотаксис
сорокарп — форма плодового тела, обычная для низших водо-
рослей и грибов. Среди инфузорий обнаружена лишь у Soro-
gena stoianovitchae
спонгиом — совокупность мембранных и микротубулярных
компонентов в цитоплазме, окружающей сократительные
вакуоли
спора микроспоридий — завершающая жизненный цикл или
один из его этапов одноклеточная стадия, толстая оболочка
которой заключает зародыш и аппарат экструзии
спорадина — то же, что «свободный трофозоит»
споробласт микроспоридий — переходная стадия между мор-
фологически просто устроенными клетками пролифератив-
ных стадий и сложно организованными спорами
спорогенез — процесс формирования органелл споры и ее со-
зревания
спорогония — (1) — этап жизненного цикла, завершающийся
образованием спор (например, у микроспоридий); (2) —
формирование спорозоитов из зиготы (у споровиков)
спородукт — трубка в гаметоцистах некоторых грегарин, слу-
жащая для вывода ооцист наружу
спорозоиты — стадии споровиков, формирующиеся в резуль-
тате спорогонии
спорокиста (фр. sporokyste, не путать со спороцистой (sporo-
cyste)) — во франкоязычной литературе — гаметоциста, со-
держащая «споры» — ооцисты
споронт — (1) — начальная стадия спорогонии микроспори-
дий, характеризующаяся образованием дополнительной
оболочки; (2) — по отношению к грегаринам употребляется
редко — то же, что «спорадина» и «.свободный трофозоит»;
(3) — у споровиков зигота внутри ооцисты
споронтогенетическая оболочка спорофорного пузырька
микроспоридий — оболочка, продуцируемая споронтом и
отделяющая стадии спорогонии от цитоплазмы клетки хозя-
ина
спороплазма (= планонт, амебула, амебоидный зародыш). За-
родыш микроспоридий; у большинства видов микроспори-
дий локализуется в цитоплазме клетки хозяина, реже в ядре
или перенуклеарном пространстве
спорофорный пузырек — ограниченная оболочкой материн-
ской клетки вакуоль, в которой развиваются дочерние поко-
ления клеток
спорофороциста — толстостенная циста паразитарного проис-
хождения, в которой происходит полное развитие микро-
споридии
спороциста — циста, со спорозоитами у споровиков
споруляция — см.: спорогония
стадия «парашюта» — специфическая морфологическая фор-
ма профазы первого мейотического деления микронуклеуса
у ряда инфузорий
стадия «серпа» — специфическая морфологическая форма
профазы первого мейотического деления микронуклеуса у
большинства инфузорий
стадия розетки микроспоридий — стадия незавершенного
почкования, при котором сформировавшиеся дочерние
клетки еще соединены друг с другом
стигма (= глазное пятно, глазок) — внутрипластидное или ле-
жащее в цитоплазме скопление красных или оранжевых, бо-
гатых каратиноидами липидных глобул; встречается у авто-
трофных жгутиконосцев, участвует в фоторецепции
сток (Stalk) — общий, широко используемый термин для раз-
личного рода стебельков или нитеподобных структур, игра-
ющих опорную функцию
стоматогенез — процесс воссоздания ротовых структур у ин-
фузорий в ходе клеточного деления
субпелликулярные микротрубочки — микротрубочки, распо-
лагающиеся под пелликулой у различных групп простей-
ших
субэкзоспора — слой оболочки споры микроспоридий, распо-
ложенный между экзоспорой и эндоспорой и имеющий сла-
бую электронную плотность
таксис — реакция на раздражение в форме перемещения в про-
странстве
таксон — любая таксономическая единица, как например от-
дельное семейство, род или вид
тахизоит (= эндозоит) — первая генерация быстро развиваю-
щихся мерозоитов; термин используется для обозначения
мерозоитов токсоплазм, формирующихся в острой стадии
заболевания, и для ранних генераций саркоспоридий, разви-
вающихся в эндотелиальных и других клетках организма хо-
зяина
тека — в широком смысле прозрачный плотный домик у про-
тистов
телотрох (= бродяжка) — свободно плавающая стадия с рес-
ничками в жизненном цикле сидячих цилиофор Peritrichida
теронт (томит) — подвижные мелкие формы в жизненном
цикле паразитических инфузорий, служащие для заражения
новых хозяев
тетрахимениус — одна из формУгеристомальной цилиатуры —
4 органеллы вокруг рта (ундулирующая мембрана + 3 мемб-
ранеллы); на этой основе возможны модификации, напри-
мер удлинение и фрагментация одной из мембранелл, но в
онтогенезе у таких видов всегда повторяется классический
(типичный) тетрахимениум
тигмотактильная зона цилиатуры — участок соматической
цилиатуры некоторых инфузорий (прежде всего паразитиче-
ских и эндокомменсальных), специализированный в связи с
прикрепительной функцией
тигмофрагмон — специальный участок соматической цилиа-
туры, служащий для временного прикрепления к субстрату;
обычно представлен фрагментами дорсальных кинет
типовой вид — номинальный вид, являющийся типом таксона
родовой группы
типовой хозяин — вид-хозяин, с которым был связан номен-
клатурный тип номинального вида
типы спаривания — внутрисингенные группы у инфузорий,
между клетками которых возможна конъюгация
токсицисты — род кортикальных экструсом токсического
действия, расположенных, как правило, в связи с ротовым
аппаратом инфузорий-хищников
томит (теронт) — непитающиеся, но подвижные формы в
жизненном цикле некоторых инфузорий, служащие для рас-
селения вида
томонт — непитающиеся, но делящиеся или почкующиеся
формы в жизненном цикле некоторых инфузорий (напри-
мер, Chonotricha)
трансверсальные микротубочки — микротрубочковый дери-
ват кинетосом, обычно расположенный слева и отходящий
от триплетов № 3 и 4 трансверсально
трихит — см.: немадесма
1138
СЛОВАРЬ ТЕРМИНОВ
трихоцисты — род кортикальных веретеновидных или амфо-
ровидных экструсом защитной функции, распространенный
у представителей Nassophorea и Oligohymenophorea
трицистидная грегарина — грегарина, тело которой подразде-
лено на три отдела — эпимерит, протомерит и дейтомерит
трофозоит — питающаяся вегетативная стадия развития про-
стейших
трофонт — активно питающаяся и размножающаяся вегета-
тивная клетка инфузории
трубчатые структуры (тубулярная сеть) микроспоридий —
характерные для стадий спорогонии секреторные образова-
ния, отходящие от оболочек их клеток в цитоплазму клетки
хозяина или в полость спорофорного пузырька
ультрацитостом — см.: микропора
ундулиподия — от лат. unda — волна и podia — основание,
нога, постамент; свободная часть эукариотного жгутика
(реснички), совершающая волнообразное движение (унду-
лирующая); снаружи покрыта плазматической мембраной,
внутри расположен матрикс и аксонема
ундулирующая мембрана — (1) — у жгутиконосцев — складка
плазматической мембраны, прикрепленная к жгутику; (2) —
у некоторых цилиофор — ресничная область, идущая вдоль
правой стороны или по краю буккальной полости
уроид — задняя часть у «голых» амеб, часто оставляющая за со-
бой липкий след; область интенсивного пиноцитоза у неко-
торых амеб, также может быть зоной дефекации и выделе-
ния воды через сократительные вакуоли; позволяет опреде-
лить полярность организма
фагоцитоз — захват оформленных веществ в пищевые вакуо-
ли; имеются плавные переходы между фагоцитозом и пино-
цитозом
фанерозоит — стадия развития (меронт) малярийных парази-
тов птиц, формирующаяся в эритроците и расселяющаяся в
другие клетки организма хозяина, где она трансформирует-
ся в экзоэритроцитарную стадию развития
фенотип — вся совокупность признаков организма, обуслов-
ленных взаимодействием генотипа и внешней среды
фибрилла — см.: микрофибрилла
филамент — см.: микрофиламент
филоподия — нитевидная псевдоподия; может ветвиться и об-
разовывать анастомозы; отличается от аксоподий и ретику-
лоподий отсутствием микротрубочек
фрагмокинеты — соматические кинеты, разбившиеся на фраг-
менты (обычны у паразитических цилиат отрядов Thigmot-
richida, Astomatida)
хозяин дефинитивный — хозяин, в котором паразит размножа-
ется половым путем
хозяин промежуточный — хозяин, в котором паразит размно-
жается бесполым путем и партеногенетически; эта часть
жизненного цикла обязательна для дальнейшего развития
паразита в дефинитивном хозяине
хозяин резервуарный — хозяин, в котором паразит не претерпе-
вает развития, а просто переживает в каких-либо органах
или тканях длительное время в инвазионном состоянии
хозяин типовой — вид хозяина, с которым был связан номенк-
латурный тип номинального вида
хозяин транспортный — см.: хозяин резервуарный
хозяин — вид организма, в/или/на котором развивается орга-
низм другого вида
хондриом — вся совокупность митохондрий в клетке
хроматиновые гранулы — мелкие оптические и электрон-
но-плотные тела, обычно расположенные по периферии под
ядерной мембраной у некоторых амеб
хроматиновые тела — скопление плотных масс РНК в цито-
плазме у некоторых «голых» и раковинных амеб
хромоцентр (= кариосома) — гетерохроматиновый участок
хромосомы, сохраняющий в интерфазном ядре клетки спи-
рализованную структуру хромонемы; под микроскопом при
окрашивании ядерными красителями имеет вид глыбки
центриоль — органелла эукариотных клеток, может входить в
состав митотического аппарата клетки; во время митоза цен-
триоли представляют собой центры, от которых звездооб-
разно расходятся нити митотического веретена
центриолярные пластинки — серия электронно-плотных дис-
ков, расположенных на внутренней и наружной мембранах
ядра микроспоридий
цефалина — трофозоит, снабженный прикрепительным при-
способлением; то же, что «прикрепленный трофозоит»
циклоз — перемещение пищеварительных вакуолей в цитоплаз-
ме, которое сопровождается перевариванием пищи
цилиатура — совокупность ресничек и их дериватов (мембра-
ны, мембранеллы, циррусы) у цилиофор
цилиостом — комплекс специализированной предротовой ци-
лиатуры вокруг рта у цилиофор
цирра — комплекс ресничек в виде пучка
циртос — сложная корзинкообразная структура ротового аппа-
рата представителей класса Phyllophagyngea
циста — неподвижная, дегидративная, резистентная, неактив-
ная, спящая стадия в жизненном цикле многих простейших,
основная роль которой сохранение и распространение вида;
наиболее типичная форма круглая или овальная, стенка цис-
ты состоит из одной или нескольких оболочек, в большинст-
ве случаев стенка достаточно толстая, с наличием или отсут-
ствием пор
цистозоит — стадия развития у многих споровиков. См.: бра-
дизоит, метроцит
цитогены — морфогенетически активные факторы, встречаю-
щиеся в цитоплазме
цитомер — отдельная многоядерная часть внутри растущего
меронта (мероцита), которая отделена от цитоплазмы ме-
ронта своей собственной плазматической мембраной
цитомерия (= плазмотомия) — деление многоядерного синци-
тия на многоядерные фрагменты или цитомеры, каждый ци-
томер прямо без предварительного деления ядер, распадает-
ся на одноядерные клетки (мерозоиты)
цитопиг — см.: цитопрокт
цитоплазма — матрикс клетки, в котором находятся различные
сложные структуры — органеллы, выполняющие специаль-
ные функции
цитопрокт (= цитопиг, порошица) — клеточный анус: посто-
янное место дефекации остатков пищеварения или автофа-
гии у инфузорий, расположенное в определенной области
кортекса
цитостом — клеточный рот: отверстие на поверхности клет-
ки протистов, обычно ведущее в глоточное углубление
(см.: цитофарингс)
цитофарингс — клеточная глотка: канал, идущий от дна цито-
стома к месту образования пищеварительных вакуолей, час-
то сложной архитектоники и пространственной организации
шизогония — общий термин, характеризующий множествен-
ное деление (мерогонию, гамогонию, спорогонию), в старых
работах синонимизируется только с мерогонией
СЛОВАРЬ ТЕРМИНОВ
1139
шизонт — многоядерная стадия в жизненном цикле споро-
виков, формируется в результате шизогонии (см.: шизо-
гония)
штидовские тельца — кнопко- или крышечкообразные тельца
на одном из полюсов спороцисты у кокцидий
щупальца — отросток цитоплазмы, укрепленный кольцевидно
расположенными микротрубочками (не псевдоподия). У
Suctoria известны щупальца для питания и щупальца для
удерживания добычи
экзогенная часть жизненного цикла — часть жизненного цикла
(например, у споровиков), протекающая вне организма хозя-
ина
экзоспора — наружный слой оболочки споры микроспоридий,
имеющий мембранное или мембраноидное строение
экзоцитоз — процесс, с помощью которого осуществляются
все типы выделения веществ из клетки
экзоэритроцитарная стадия — стация в жизненном цикле ге-
моспоридий, развивающаяся в клетках тканей хозяина, но не
в эритроцитах
экскреция — см.: дефекация
экструзия — процесс введения спороплазмы микроспоридий в
клетку хозяина или выстреливание экструсом
экструсомы — окруженные мембраной органеллы (около
10 различных типов), которые в ответ на различные раздра-
жения выбрасывают свое содержимое из клетки путем экзо-
цитоза; в ходе экзоцитоза, который в определенных случаях
может происходить взрывообразно, секрет экструсом изме-
няется характерным для каждого их типа образом (см.: му-
коцисты, токсицисты)
эксфлагелляция — формирование микрогамет из микрогамонта
у гемоспоридий, происходит в пищеварительном тракте на-
секомых-переносчиков
эктоплазма — часть цитоплазмы, прилегающая к плазмалем-
ме; термин используется в тех случаях, когда цитоплазма
четко дифференцирована на экто- и эндоплазму
эктополигения — формирование нескольких дочерних клеток
организмов путем наружного (краевого) почкования у спо-
ровиков
эндогенная часть жизненного цикла — часть жизненного цик-
ла, протекающая в организме хозяина
эндодиогения — формирование двух дочерних клеток (мерозо-
итов или метроцитов) путем внутреннего почкования у спо-
ровиков
эндодиоцит — трофозоит у споровиков, сформировавшийся в
результате эндодиогении
эндозоит — см.: тахизоит
эндомитоз — удвоение числа хромосом, под ядерной обо-
лочкой, без разрушения ядрышка и без образования митоти-
ческого веретена
эндоплазма — внутренняя, обычно гранулированная часть ци-
топлазмы
эндоплазматическая сеть {ретикулум) — система эндоплаз-
матических каналов и пузырьков в клетке; на мембранах
«шероховатой» эндоплазматической сети в отличие от «глад-
кой» находится множество рибосом
эндополигения — формирование нескольких дочерних клеток
путем внутреннего почкования у споровиков
эндосома — термин, обозначающий единичное РНК-содержа-
щее тело; непосредственно не связана с хромосомами; со-
храняется и делится во время митоза; частично синоним яд-
рышка
эндоспора — средний электронно-прозрачный слой оболочки
споры микроспоридий
эндоцитоз — общее понятие, обозначающее получение ве-
ществ клеткой извне; включает мембранный транспорт, пи-
ноцитоз, фагоцитоз
энтероциты (отгреч. enteron — кишка) — клетки призматиче-
ского эпителия, расположенные в один слой на поверхности
ворсинок тонкого кишечника животных и человека. Энтеро-
циты в свою очередь покрыты плотной каемкой из микро-
ворсинок
эпимерит — прикрепительное приспособление, которое, как
правило, утрачивается трофозоитом по окончании периода
роста; обычно — прикрепительное приспособление септат-
ных грегарин. Эпимерит часто имеет сложную морфологию
эпиплазма — фиброзный или филаментозный слой, залегаю-
щий у инфузорий под пелликулярными альвеолами. Пред-
ставлен в разных группах в неодинаковой степени. Служит
элементом клеточного (кортикального) скелета
эписпоровое пространство — обычно полость спорофорного
пузырька со спорами микроспоридий
эписпоровые образования — структуры, образованные спороб-
ластами или молодыми спорами в результате экзоцитоза и
сохраняющие контакт с их оболочкой (главным образом это
тубулярная сеть — секрет, лежащий в полости спорофорно-
го пузырька или в окружающем клетку паразита слое цито-
плазмы клетки хозяина)
эписпоронтовое пространство — обычно полость спорофор-
ного пузырька, окружающая споронт
эписпоронтовые образования — структуры, продуцируемые
споронтами (главным образом это секрет различной струк-
туры, лежащий в полости спорофорных пузырьков)
эпицит — совокупность эпицитарных гребней; иногда также
употребляется для обозначения самого внешнего слоя цито-
плазмы у грегарин
эпицитарный гребень — элемент покровов Eugregarinida, пред-
ставляющий собой узкую продольную складку пелликулы, в
вершине которой залегают апикальные арки и апикальные
филаменты
эритроцитарная стадия — часть жизненного цикла паразити-
ческих простейших, протекающая в красных клетках крови
хозяина
эруптивная волна — переднее выпячивание эктоплазмы в виде
полушария, формирующая псевдоподии у некоторых сво-
бодноживущих и паразитических амеб
эукариоты — организмы, имеющие окруженное оболочкой
ядро с нуклепротеидными хромосомами
ядерный гетероморфизм {ядерный дуализм) — одновременное
наличие в клетке соматических и генеративных ядер, харак-
терен для определенных стадий жизненного цикла некото-
рых фораминифер, а также для всех цилиофор
ядро — обязательная для всех эукариотных организмов состав-
ная часть клетки, содержащая хромосомы и продукты их
жизнедеятельности, окруженная двумембранной ядерной
оболочкой
ядрышко {= нуклеола) — термин используется для определения
РНК-содержащих тел, локализующихся в ядре; место транс-
крипции рибосомальных генов, у большинства видов про-
стейших исчезает при митозе
якорный диск (см.: полярный якорный диск)
СПИСОК СОКРАЩЕНИЙ
БиНИИ СПбГУ — ВИЗР — ЗИН — ГОСНИОРХ — Биологический научно-исследовательский институт СПбГУ Всероссийский институт защиты растений (Санкт-Петербург) Зоологический институт РАН (Санкт-Петербург) Государственный научно-исследовательский институт озерного и речного рыбного хозяйства (Санкт-Петербург)
МГУ — РАН — цин — Московский государственный университет им. М. В. Ломоносова Российская академия наук Институт цитологии РАН (Санкт-Петербург)
АДФ — аденозиндифосфат СВ — сократительная вакуоль
АЗМ — адоральная зона мембранелл см — световая микроскопия
АТФ — аденозинтрифосфат сот — стенкообразующие тела
БЦ — буккальные циррусы СТЦ — субтрансверзальные циррусы
ВЦ — вентральные циррусы ТВ — типовой вид
ДНК — дезоксирибонуклеиновая кислота ТЦ — трансверзальные циррусы
КЦ — каудальные циррусы УМ — ундулирующая мембрана
МА — макронуклеус ФВЦ — фронтовентральные циррусы
МВЦ — мидвентральные циррусы ФЦ — фронтальные циррусы
МИ — микронуклеус цомт — центр организации микротрубочек
МЦ — маргинальные циррусы Шер — шероховатая эндоплазматическая с
рРНК — рибосомальная рибонуклеиновая кислота ЭМ — электронная микроскопия
РЭС — ретикуло-эндотелиальная система ЭПР — эндоплазматический ретикулум
СВЕДЕНИЯ ОБ АВТОРАХ
I БЕЙЕР ТАМАРА ВЛАДИМИРОВНА^, Институт цитологии
РАН.
194064 Санкт-Петербург, Тихорецкий пр., 4.
Научные интересы: внутриклеточный паразитизм, пара-
зитические простейшие, споровики, кокцидии, клеточная биоло-
гия, жизненные циклы.
Основные публикации
Бейер Т. В., Шибалова Т. А., Костенко Л. А. Цитология кокци-
дий. Л.: Наука, 1978.
Бейер Т. В. Клеточная биология споровиков — возбудителей
протозойных болезней животных и человека. Л.: Наука, 1989.
Beyer Т. V., Svezhova N. V., Radchenko A. I., Sidorenko N. V. Pa-
rasitophorous vacuole: morphofunctional diversity in different coccidi-
an genera (a short insight into the problem) // Cell Biology International.
2002. Vol. 206. P. 861—871.
БЕЛОВА ЛАРИСА МИХАЙЛОВНА, Зоологический инсти-
тут РАН.
199034 Санкт-Петербург, Университетская наб., 1.
Научные интересы: фауна, систематика, распростране-
ние, морфофункциональная организация и жизненные циклы пара-
зитических простейших.
Основные публикации
Белова Л. М., Крылов М. В. Множественные формы малатде-
гидрогеназы (К. Ф.1.1.1.37) у Crithidia asclepii и С. oncopelti (Masti-
gophora, Trypanosomatidae) // Паразитология. 1984. T. 28, вып. 6.
С. 425—429.
Крылов М. В., Белова Л. М. Полиморфизм малатдегидрогена-
зы у критидий (Protozoa, Mastigophora) // Докл. АН СССР. 1985.
Т. 280, № 6. С. 1426—1428.
Белова Л. М. Мировая фауна и морфофункциональная органи-
зация бластоцист (Protista, Rhizopoda) // Тр. ЗИН РАН. 1992. Т. 244.
С. 58.
Belova L. М. Blastocystis galli (Rhizopoda, Lobosea) — a parasite
or a commensal? 11 Arch. Protistenk. 1992. Bd 141. S. 215—218.
Белова Л. M. Фауна Blastocystis // Паразитология. 1995. T. 29,
вып. 3. C. 208—213.
ВАЛЬКЮНАС ГЕДИМИНАС, Институт экологии Вильнюс-
ского университета.
Литва, LT— 08412, Вильнюс — 21, ул. Академиес, 2.
E-mail: gedvalk@ekoi.lt
Научные интересы: фауна, систематика,экология, морфо-
функциональная организация, жизненные циклы, эволюция про-
стейших крови позвоночных животных.
Основные публикации
Валькюнас Г. Гемоспоридии птиц // Acta Zoologica Lituanica.
1997. Vol. 3—5 (a monograph). P. 1—607.
Valkiunas G. Avian malaria parasites and other haemosporidia.
London; New York, 2004.
ВОРОНИН ВЛАДИМИР НИКОЛАЕВИЧ, Государственный
научно-исследовательский институт озерного и речного рыбного
хозяйства.
199053 Санкт-Петербург, наб. Макарова, 26.
E-mail: niorkh@mail.dux.ru
Научные интересы: паразитология, протозоология, болез-
ни рыб.
Основные публикации
Воронин В. И., Бурякина А. В., Колесникова И. Д., Тютин А. В.
Сравнительная морфология спор микроспоридий рода Glugea из
рыб России // Паразитология. 1997. Т. 31. С. 260—264.
Larsson R. J. I., Voronin V. N. Light and electron microscopic stu-
dy of Agglomerata volgensae n. sp. (Microspora: Dubosqiidae), a new
microsporidian parasite of Daphnia magna (Crustacea: Daphniidae) //
Europ. J. Protistol. 2000. Vol. 36. P. 89—99.
Воронин В. И. О макросистеме типа Microsporidia // Паразито-
логия. 2001. Т. 35. С. 35—44.
ИССИ ИРМА ВИКТОРОВНА, Всероссийский научно-иссле-
довательский институт защиты растений РАСХН.
189620 Санкт-Петербург, г. Пушкин, ш. Подбельского, 3.
E-mail: ISSI@2275.spb.edu
Научные интересы: микроспоридии, систематика, таксо-
номия, специфичность, ультраструктура, паразито-хозяинные сис-
темы, экология.
Основные публикации
Исси И. В., Воронин В. И. Микроспоридии// Определитель
паразитов пресноводных рыб. 1984. С. 73—87.
Исси И. В. Микроспоридии как тип паразитических простей-
ших // Сер. Протозоология. 1986. Вып. 10. С. 6—135.
Исси И. В., Кадырова М. К., Пушкарь Е. И., Ходжаева Л. Ф.,
Крылова С. В. Микроспоридии мошек (определение и краткое опи-
сание видов мировой фауны). Узбекистан, 1991.
Быкова X. И., Исси И. В. Определитель микроспоридий слеп-
ней. Карел, филиал АН СССР, 1991.
Issi I. V. Microsporidia as a phylum of parasitic Protozoa // Society
of Invertebrate Pathology (SIP). 1994.
Соколова Ю. Я., Исси И. В. Энтомопатогенные простейшие и
особенности патогенеза протозойных заболеваний насекомых //
Патогены насекомых: структурные и функциональные аспекты /
Под ред. В. В. Глупова. М., 2001. С. 76—188.
КРЫЛОВ МСТИСЛАВ ВЛАДИМИРОВИЧ, Зоологический
институт РАН.
199034 Санкт-Петербург, Университетская наб., 1.
E-mail: protozoa@zin.ru
1142
СВЕДЕНИЯ ОБ АВТОРАХ
Научные интересы: протозоология, паразитология, систе-
матика, эволюция, филогения, фауна, жизненные циклы.
Основные публикации
Крылов М. В. Пироплазмиды (фауна, систематика, эволюция).
Л., 1981.
Крылов М. В. Возбудители протозойных болезней домашних
животных и человека // Тр. ЗИН РАН в двух томах. 1994.
Крылов М. В. Определитель паразитических простейших 11
ЗИН РАН. 1996.
|ПОДЛИПАЕВ СЕРГЕЙ АНАТОЛЬЕВИЧ, , Зоологический
институт РАН.
199034 Санкт-Петербург, Университетская наб., 1.
Научные интересы: зоология, эволюция, возникновение
паразитизма, филогения, миксоспоридии, трипаносоматиды.
Основные публикации
Подлипаев С. А. Каталог мировой фауны простейших семейст-
ва Trypanosomatidae // Тр. ЗИН АН СССР. Т. 217. Л., 1990.
Подлипаев С. А., Фролов А. О., Колесников A. A. Proteomonas
inconstans nov. gen., nov. sp. (Kinetoplastida, Trypanosomatidae) —
паразит клопа Calocoris sexguttatus (Hemiptera, Miridae) // Паразито-
логия. 1990. T. 24. C. 339—345.
Podlipaev S. The more insect trypanosomatids under study — the
more diverse Trypanosomatidae appears // Intern. J. Parasitology. 2001.
Vol. 31. P. 648—652.
Merzlyak E., Yurchenko V. V., Kolesnikov A., Alexandrov K, Mas-
lov D., Podlipaev S. Diversity and Phylogeny of Insect Trypanosoma-
tids Based on Small Subunit rRNA Genes: Polyphyly of Leptomonas
andBlastocrithidia//J. of Euk. Microbiol. 2001. Vol. 48. P. 161—169.
Maslov D. A., Podlipaev S. A., Lukes J. Phylogeny of the Kine-
toplastida: taxonomic problems and insights into the evolution of pa-
rasitism H Memorias Institute Oswaldo Cruz. 2001. Vol. 96. P. 397—
402.
ПУГАЧЕВ ОЛЕГ НИКОЛАЕВИЧ, Зоологический институт
РАН.
199034 Санкт-Петербург, Университетская наб., 1.
E-mail: admin@zin.ru
Научные интересы: зоология, паразитология, экология,
зоогеография.
Основные публикации
Пугачев О. Н. Зоогеографические особенности паразитофау-
ны рыб Ледовитоморской провинции И Паразиты и болезни гидро-
бионтов Ледовитоморской провинции. Новосибирск, 1990.
С. 5—15.
Пугачев О. Н., Хохлов П.П. Миксоспоридии рода Myxobu-
lus — паразиты головного и спинного мозга лососевидных рыб //
Систематика и экология рыб континентальных водоемов Дальнего
Востока. Владивосток, 1979. С. 137—139.
СИМДЯНОВ ТИМУР ГЕННАДЬЕВИЧ, Московский госу-
дарственный университет им. М. В. Ломоносова, биологический
факультет.
119899 Москва, Воробьевы горы, биологический факультет.
E-mail: tim@soil.msu.ru
Научные интересы: протесты, споровики,ультраструкту-
ра, систематика, филогения.
Основные публикации
Симдянов Т. Г. Selenidium pennatum sp. n. — новый вид архи-
грегарин из Flabelligera affinis (Polychaeta: Flabelligeridae) И Пара-
зитология. 1992. Т. 26. С. 344—347.
Симдянов Т. Г. Два новых вида грегарин с аберрантным строе-
нием эпицита из полихет Белого моря// Паразитология. 1995. Т. 29.
С. 305—315.
Симдянов Т. Г. Ультраструктура двух видов грегарин рода
Lankesteria (Eugregarinida: Lecudinidae) И Паразитология. 1995.
Т. 29. С. 424—432.
ФОКИН СЕРГЕЙ ИВАНОВИЧ, Биологический научно-ис-
следовательский институт Санкт-Петербургского государственно-
го университета.
198504 Санкт-Петербург, Старый Петергоф, Ораниенбаум-
ское ш., 2.
E-mail: fokin@peterlink.ru
Научные интересы: инфузории, систематика, филогения,
морфология, симбионты простейших, клеточная биология, исто-
рия зоологии.
Основные публикации
Фокин С. И. Бактериальные эндобионты и их использование в
экспериментальной протозоологии И Цитология. 1993. Т. 35.
С. 59—91.
Фокин С. И. Морфология переходной зоны ресничек инфузо-
рий (Ciliophora). I. Представители класса Oligohymenophora И Ци-
тология. 1994. Т. 36. С. 345—351.
Fokin S. 1. The rise and development of protistology in St. Peters-
burg, Russia // Protistology. 2001. Vol. 2. P. 68—72.
Фокин С. И. Ревизия рода Paramecium О. F. Muller, 1773: срав-
нительно-биологический анализ, систематика и филогенетические
связи: Автореф. дис. ... докт. биол. наук. СПб., 2002.
ФРОЛОВ АЛЕКСАНДР ОЛЕГОВИЧ, Зоологический инсти-
тут РАН.
199034 Санкт-Петербург, Университетская наб., 1.
E-mail: frolal@online.ru
Научные интересы: фауна, сравнительная морфология,
происхождение и эволюция паразитических простейших.
Основные публикации
Фролов А. О. Мировая фауна грегарин. Семейство Monocysti-
dae И Тр. ЗИН АН СССР. Л., 1991.
Фролов А. О. Происхождение трипаносоматид // Паразитоло-
гия. 1993. Т. 27, вып. 2. С. 97—107.
Frolov А. О., KarpovS. A. Comparative morphology of kineto-
plastids // Cytology (Russia). St. Petersburg, 1995. T. 37. P. 1072—
1096.
Фролов А. О., Скарлато С. О. Тонкое строение и механизмы
адаптации низших трипаносоматид в полужесткокрылых насеко-
мых // Цитология. 1995. Т. 37. С. 539—560.
Frolov A., Skarlato S. Unusual pattern of mitosis in free-living fla-
gellate Dimastigella mimosa (Kinetoplastida) // Protoplasma. 1998.
Vol. 201. P. 110—114.
ЯНКОВСКИЙ АНАТОЛИЙ ВИКТОРОВИЧ, Зоологиче-
ский институт РАН.
199034 Санкт-Петербург, Университетская наб., 1.
E-mail: protozoa@zin.ru
Научные интересы: гидробиология, протозоология, инфу-
зории, систематика, паразитология.
Основные публикации
Янковский А. В. Инфузории. Подкласс Chonotricha // Фауна
СССР. 1973. Т. 2 (1). С. 1—355.
Янковский А. В. Систематика и филогения отряда Hypotrichida
Stein, 1859 (Protozoa, Ciliophora) //Морфология и экология инфузо-
рий, фораминифер и акантарий. 1979. С. 48—85 (Тр. ЗИН АН
СССР, Т. 86).
Янковский А. В. Жизненные циклы и система родов групп
Scyphidia, Heteropolaria, Zoothamnium и Cothumia (класс Peritri-
cha) // Жизненные циклы простейших. 1985. С. 74—100 (Тр. ЗИН
АН СССР, Т. 129).
СОДЕРЖАНИЕ
Alveolata Cavalier-Smith, 1991 (M. В. Крылов, А. О. Фролов).............................................. 5
Тип Sporozoa Leuckart, 1879— Споровики (М. В. Крылов, А. О. Фролов) ..................................... 5
Класс Colpodellea (Kussakin, Drozdov, 1998) (А. О. Фролов).............................................. 12
Summary ................................................................................................ 20
Литература ............................................................................................. 20
Класс Gregarinea Dufour, 1828 — Грегарины (Т. Г. Симдянов) ............................................. 20
Summary ............................................................................................... 140
Литература ....................................................................................... 141
Класс Coccidea Leuckart, 1879 — Кокцидии (| Т. В. Бейер)\) ............................................ 149
Отряд Agamococcidiida Levine, 1979 — Агамококцидии .................................................. 171
Отряд Protococcidiida Cheissin, 1956 — Протококцидии .................................................. 174
Отряд Eimeriida Leger, 1911............................................................................ 196
Summary ............................................................................................... 248
Литература ............................................................................................ 248
Отряд Haemosporida Danilewsky, 1885 {Г. Валькюнас) — Гемоспоридии ..................................... 256
Summary ............................................................................................... 329
Литература ............................................................................................ 329
Подкласс Piroplasmia Levine, 1961 (Л. М. Белова, М. В. Крылов) — Пироплазмы............................ 330
Summary ................................................................................................ 369
Литература ............................................................................................. 369
Тип Ciliophora-Doflein, 1901—Инфузории ................................................................. 371
Общая часть (С. И. Фокин) .............................................................................. 371
Summary ................................................................................................ 406
Литература ............................................................................................. 407
Систематический обзор (А. В. Янковский)................................................................. 415
Summary .............................................................................................. 977
Литература ............................................................................................ 979
Тип Microsporidia Balbiani, 1882 — Микроспоридии (И. В. Исси, В. Н. Воронин) .......................... 994
Класс Metchnikovellidea Weiser, 1977 .................................................................. 1016
Отряд Metchnikovellida Vivier, 1975 .................................................................. 1016
Класс Microsporea Corliss et Levine, 1963 ............................................................. 1017
Подкласс Haplophasea Sprague, Becnel, Hazard, 1992 .................................................... 1017
Отряд Chytridiopsida Weiser, 1977 ..................................................................... 1017
Отряд Glugeida Issi, 1986 ............................................................................. 1019
Подкласс Dihaplophasea Sprague, Becnel et Hazard, 1992 ............................................ 1027
Отряд Meiodihaplophasida Sprague, Becnel et Hazard, 1992 1027
Отряд Dissociodihaplophasea Sprague, Becnel et Hazard, 1992 .......................................... 1038
Summary .............................................................................................. 1043
Литература ........................................................................................ 1043
Тип Myxozoa Grasse, 1970 — Миксозоа (О. H. Пугачев, |с, А. Подлипаев\)................................ 1045
Класс Myxosporea Biitschli, 1881—Миксоспоридии ....................................................... 1066
Отряд Bivalvulida Schulman, 1959 ..................................................................... 1066
Отряд Multivalvulida Schulman, 1959 ................................................................. 1077
Отряд Malacovalvulida Canning et al., 2000 ........................................................... 1079
Summary .............................................................................................. 1080
Литература . ......................................................................................... 1080
Указатель латинских названий ......................................................................... 1083
Словарь терминов (М В. Крылов)........................................................................ 1131
Список сокращений..................................................................................... 1140
Сведения об авторах . . .............................................................................. 1141
CONTENTS
Alveolata Cavalier-Smith, 1991 (Л1. V. Krylov, A. O. Frolov)................................................. 5
Phylum Sporozoa Leuckart, 1879 (M. V. Krylov, A. O. Frolov) ................................................. 5
Class Colpodellea (Kussakin, Drozdov, 1998) (A. O. Frolov).................................................. 12
Summary .................................................................................................... 20
References ................................................................................................ 20
Class Gregarinea Dufour, 1828 (T. G. Simdianov)............................................................. 20
Summary .................................................................................................... 140
References................................................................................................ 141
Class Coccidea Leuckart, 1879 (I T. V. Beie>\).............................................................. 149
Order Agamococcidiida Levine, 1979 ......................................................................... 171
Order Protococcidiida Cheissin, 1956 ....................................................................... 174
Order Eimeriida Leger, 1911 ............................................................................... 196
Summary ................................................................................................... 248
References.................................................................................................. 248
Order Haemosporida Danilewsky, 1885 (G. Valkiunas) ......................................................... 256
Summary .................................................................................................... 329
References.................................................................................................. 329
Subclass Piroplasmia Levine, 1961 (L. M. Belova, M. V. Krylov)............................................. 330
Summary .................................................................................................... 369
References.................................................................................................. 369
Phylim Ciliophora Doflein, 1901 371
General description (5.1. Fokin) ............................................................................ Ш
Summary .................................................................................................... 406
References.................................................................................................. 407
Review of taxa (A. V. Jankowski)............................................................................ 415
Summary .................................................................................................... 977
References.................................................................................................. 979
Phylum Microsporida Balbiani, 1882 (7. V. Issi, V. N. Voronin)............................................. 994
Class Metchnikovellidea Weiser, 1977 .......................................................... 1016
Order Metchnikovellida Vivier, 1975 .......................................................... 1016
Class Microsporea Corliss et Levine, 1963 1017
Subclass Haplophasea Sprague, Becnel, Hazard, 1992 ................................................... 1017
Order Chytridiopsida Weiser, 1977 ........................................................................ 1017
Order Glugeida Issi, 1986 1019
Subclass Dihaplophasea Sprague, Becnel et Hazard, 1992 ................................................... 1027
Order Meiodihaplophasida Sprague, Becnel et Hazard, 1992 ................................................. 1027
Order Dissociodihaplophasea Sprague, Becnel et Hazard, 1992 1038
Summary ................................................................................................... 1043
References............................................................................................. 1043
Phylum Myxozoa Grasse, 1970 (O. N. Pugachev, |S. A. Podlipaev\) .......................................... 1045
Class Myxosporea Butschli, 1881 ......................................................................... 1066
Order Bivalvulida Schulman, 1959 ......................................................................... 1066
Order Multivalvulida Schulman, 1959 .......................................................... 1077
Order Malacovalvulida Canning et al., 2000 ....................................................... 1079
Summary .................................................................................................. 1080
References................................................................................................. 1080
Index of Latin names...................................................................................... 1083
Glossary (M. V. Krylov) ................................................................................... 1131
List of abbreviations ..................................................................................... 1140
List of authors............................................................................................ 1141
Научное издание
ПРОТИСТЫ:
РУКОВОДСТВО ПО ЗООЛОГИИ.
ЧАСТЬ 2
Утверждено к печати
Зоологическим институтом РАН
Редактор издательства И. Л. Песенко
Художник Е. В. Кудина
Технический редактор Е. Г. Коленова
Корректоры О. И. Буркова, Т. С. Павлова, А. К. Рудзик, М. Н. Сенина и Я. Л. Сухова
Компьютерная верстка Л. Н. Наполъской
Лицензия ИД № 02980 от 06 октября 2000 г. Сдано в набор 24.03.06.
Формат 60 X 90 1/8. Гарнитура Таймс. Подписано к печати 04.10.07.
Бумага офсетная. Печать офсетная. Усл. печ. л. 156. Уч.-изд. л. 158.9.
Тираж 1000 экз. (1-й завод 500 экз.). Тип. зак. № 4163. С 139
Санкт-Петербургская издательская фирма «Наука» РАН
199034, Санкт-Петербург, Менделеевская линия, 1
main@nauka.nw.ru
www.naukaspb.spb.ru
Первая Академическая типография «Наука»
199034, Санкт-Петербург, 9 линия, 12